CN1123338C - 奥美拉唑的药物制剂 - Google Patents
奥美拉唑的药物制剂 Download PDFInfo
- Publication number
- CN1123338C CN1123338C CN98805564A CN98805564A CN1123338C CN 1123338 C CN1123338 C CN 1123338C CN 98805564 A CN98805564 A CN 98805564A CN 98805564 A CN98805564 A CN 98805564A CN 1123338 C CN1123338 C CN 1123338C
- Authority
- CN
- China
- Prior art keywords
- omeprazole
- cloud point
- preparation
- mixed solution
- binding agent
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/28—Dragees; Coated pills or tablets, e.g. with film or compression coating
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/4427—Non condensed pyridines; Hydrogenated derivatives thereof containing further heterocyclic ring systems
- A61K31/4439—Non condensed pyridines; Hydrogenated derivatives thereof containing further heterocyclic ring systems containing a five-membered ring with nitrogen as a ring hetero atom, e.g. omeprazole
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/14—Particulate form, e.g. powders, Processes for size reducing of pure drugs or the resulting products, Pure drug nanoparticles
- A61K9/16—Agglomerates; Granulates; Microbeadlets ; Microspheres; Pellets; Solid products obtained by spray drying, spray freeze drying, spray congealing,(multiple) emulsion solvent evaporation or extraction
- A61K9/167—Agglomerates; Granulates; Microbeadlets ; Microspheres; Pellets; Solid products obtained by spray drying, spray freeze drying, spray congealing,(multiple) emulsion solvent evaporation or extraction with an outer layer or coating comprising drug; with chemically bound drugs or non-active substances on their surface
- A61K9/1676—Agglomerates; Granulates; Microbeadlets ; Microspheres; Pellets; Solid products obtained by spray drying, spray freeze drying, spray congealing,(multiple) emulsion solvent evaporation or extraction with an outer layer or coating comprising drug; with chemically bound drugs or non-active substances on their surface having a drug-free core with discrete complete coating layer containing drug
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/48—Preparations in capsules, e.g. of gelatin, of chocolate
- A61K9/50—Microcapsules having a gas, liquid or semi-solid filling; Solid microparticles or pellets surrounded by a distinct coating layer, e.g. coated microspheres, coated drug crystals
- A61K9/5073—Microcapsules having a gas, liquid or semi-solid filling; Solid microparticles or pellets surrounded by a distinct coating layer, e.g. coated microspheres, coated drug crystals having two or more different coatings optionally including drug-containing subcoatings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/04—Drugs for disorders of the alimentary tract or the digestive system for ulcers, gastritis or reflux esophagitis, e.g. antacids, inhibitors of acid secretion, mucosal protectants
Landscapes
- Health & Medical Sciences (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Pharmacology & Pharmacy (AREA)
- Veterinary Medicine (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Epidemiology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Organic Chemistry (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicinal Preparation (AREA)
Abstract
一种口服肠衣药物制剂,它包含一种化合物作为活性组分,所述化合物选自奥美拉唑、奥美拉唑的碱性盐、(-)-奥美拉唑对映体及(-)-奥美拉唑对映体碱性盐,其中,所述制剂包含活性组分和可有可无的碱反应化合物的芯材,所述活性组分是在与可药用赋形剂如粘合剂的混合物中,并且在所述芯材上包有隔离层和肠衣层。利用具有特定浊点的低粘度羟丙基甲基纤维素来制备药物制剂。此外,申请者描述了其制备方法和所述权利要求的制剂在药物中的应用。
Description
技术领域
本发明涉及一种口服药物制剂,它包含不耐酸H+,K+-ATP酶抑制剂奥美拉唑。该制剂以多个单位剂量形式存在,每个剂量单位包含具有肠衣层的奥美拉唑单位。尤其是,该单位包含与一种或多种可药用赋形剂如粘合剂、填充剂和/或崩解剂混合的芯材奥美拉唑,和可有可无的碱反应物质。此外,各单位包含将肠衣层与芯材隔离开的隔离层。该隔离层和/或可有可无的粘合剂是由特定特性的羟丙基甲基纤维素(HPMC),和可有可无的药物赋形剂构成的。尤其是,该HPMC的特性为具有特定的浊点。
而且,本发明涉及该特殊特性HPMC在制备包含奥美拉唑的药物制剂中的应用以及该药物制剂在医疗中的应用。
背景技术
奥美拉唑及其碱性盐、(-)-奥美拉唑对映体及(-)-奥美拉唑对映体碱性盐、下文称作奥美拉唑的所有化合物都可用于治疗与胃酸相关的疾病。在EP5129中描述了奥美拉唑及其可药用盐,并且在EP124495和WO95/01977中描述了某些特定的奥美拉唑碱性盐。在WO94/27988中描述了某些单一奥美拉唑对映体的盐及其制剂。
通常已知,奥美拉唑通过在酸分泌途径的最后步骤控制胃酸分泌,用于抑制哺乳动物和人的胃酸分泌。因此,一般来说,它可用于预防和治疗哺乳动物和人与胃酸相关的疾病,包括消化性食管炎、胃炎、十二指肠炎、胃溃疡和十二指肠溃疡。此外,它可用于治疗其它需要胃酸抑制作用的胃肠疾病,例如NSAID治疗的病人、非溃疡性消化不良的病人、具有胃-食管反流疾病症状的病人和gastrinomas病人。它也可以用于需要加强护理的病人、急性上胃肠道出血的病人、手术前后用于预防吸入胃酸及预防和治疗紧张状态溃疡形成。此外,它可用于治疗银屑病,治疗螺杆菌感染及相关疾病,治疗或预防哺乳动物包括人炎性疾病。
然而,奥美拉唑在酸性或中性介质中易于降解或转化。该降解可被酸性化合物催化并且在与碱性化合物的混合物中是稳定的。奥美拉唑的稳定性也受潮湿、热、有机溶剂的影响并且在某种程度上受光的影响。
显然,考虑到奥美拉唑的稳定性,口服剂型的奥美拉唑必须避免与酸性胃液接触并且必须将奥美拉唑以完整的形式转移到pH接近中性并且可迅速吸收的胃肠道部分中。
通过肠衣层可有效地防止药用口服剂型的奥美拉唑与酸性胃液接触。在EP 247 983中描述了该肠衣奥美拉唑制剂。该制剂中包含片芯单位形式的奥美拉唑,其中包含奥美拉唑和一种碱性盐或者包含奥美拉唑的碱性盐,可有可无地和一种碱性盐,将该片芯单位包隔离层和肠衣层。在WO96/01623中描述了多单位奥美拉唑片剂。
在EP247 983中描述的口服制剂和在WO96/01623中描述的片剂是肠衣制剂,它包含或可以包含一隔离层以便将酸性肠衣物质与易受酸影响的物质奥美拉唑隔离。低粘度的HPMC可用作芯材中的粘合剂或者用作上述制剂中将芯材与肠衣层隔离开的隔离层。在药物制剂中所使用的所有组分包括HPMC的性质必须符合严格的标准,如药典专题论文中所规定的要求。
奥美拉唑从药物剂型中释放的速度可影响奥美拉唑吸收到体循环中的总的程度(Pilbrant and Cederberg,Scand.J.Gastroenterology 1985;20(suppl.108)p.113-120)。因此,在产品销售审批中规定了对奥美拉唑从药物制剂中释放速度的限制。
意外地发现,在含奥美拉唑片芯的制剂中用作粘合剂或用作奥美拉唑肠衣制剂隔离层物质的、符合药典要求的、不同批号的低粘度HPMC,对奥美拉唑在USP体外模拟肠液中释放速度的影响可能不同。在HPMC影响释放速度的因素中,一个关键的参数是水溶性。
随着温度的升高,由于聚合物相分离,HPMC的水溶性降低。这可通过温度升高时聚合物溶液混浊观察到。浊点是该聚合物产生相分离的温度。通过测定光通过聚合物溶液的传播来测定浊点。将光通过溶解有聚合物的指定系统(为透明的不混浊溶液)传播规定为透光率100%。在本专利申请中,当使用Mettler的商用仪器时,将浊点规定为指定系统透光率为96%时的温度。就其它浊点和仪器来说,可规定各系统的其它透光率。
通过新制剂和使用特殊性质HPMC可避免的一个问题是可减少产品丢弃的量。从经济角度来说,它对于指定和控制HPMC性质并保持所生产的药品丢弃量低是有利的。
发明内容
发明概述
已发现,具有浊点不低于45.6℃特性的HPMC是含奥美拉唑的肠衣药物制剂所需要的,其中,在所述温度下,用Mettler FP90/FP 81C仪器测定时,指定系统透光率为96%。或者,当使用其它仪器测定时,指定浊点不低于44.5℃,其中,在该温度下,用分光光度计测定时,透光率为95%。在下列实施例中将更详细地描述浊点测定中所使用的两种不同的仪器。浊点的上限是不重要的并因此不需要指定它。
HPMC用作粘合剂和/或用作将芯材与肠衣层隔离开的隔离层组分。本专利申请中所规定的HPMC的性质是满足有关奥美拉唑释放速度的标准所需要的并且适用于口服给予奥美拉唑。
附图的详细说明
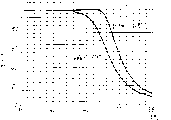
图1显示的是两条曲线,代表两批不同低粘度的HPMC,分别称作A型和B型HPMC。该曲线表明下列实施例1中所描述的用作隔离层组分的两批HPMC浊点的测定。具有含A型HPMC的隔离层,奥美拉唑的释放不适用于药品,具有含B型HPMC的隔离层,未出现所讨论的有关口服制剂中奥美拉唑释放速度的问题。
图2显示的是下列实施例1中所描述的与图1相同的试验,但用另一仪器测定浊点。
图3显示的是实施例3中所描述的两条曲线,代表奥美拉唑从芯材中释放,其中,在所述芯材中包含用作粘合剂的两批不同低粘度的HPMC。棒形图代表平均标准误差。用分光光度计在302nm测定奥美拉唑的释放,曲线表明,与含B型HPMC相比,含A型HPMC粘合剂时,奥美拉唑的释放延迟。
发明详述芯材
优选地,将具有式Ia结构的奥美拉唑制成可药用盐形式的口服组合物,所述盐如碱性盐,它选自Mg2+,Ca2+,Na+和K+盐,更优选Mg2+盐。奥美拉唑也可以以(-)-奥美拉唑对映体或(-)-奥美拉唑对映体碱性盐的形式使用。
可按照EP247 983和WO96/01623中所描述的不同的原理构成和配制各肠衣片的芯材,将所述文献引入本文供参考。例如,将奥美拉唑与药物组分混合以便得到更好的操作性和加工性以及在最终混合物中适宜的奥美拉唑浓度。可使用药物组分如填充剂、粘合剂、润滑剂、崩解剂、表面活性剂和其它可药用添加剂。
优选地,在与或未与碱性化合物混合后,将奥美拉唑与适宜的组分包括粘合剂混合并制成芯材。所述芯材可通过利用不同的加工设备挤塑/团成团、成球或压片来制备。所制成的芯材的大小可小于大约2mm。所制成的芯材可进一步用包含或不含活性物质的其它组分包衣,和/或用于进一步加工。
或者,可将用活性物质(该活性物质可以与或不与碱性物质混合)包衣的惰性芯作为芯材用于进一步加工。用活性物质包衣的该惰性芯可以是包含不同的氧化物、纤维素、有机聚合物和其它物质中单一组分或其混合物的水不溶性芯,或者是包含不同的无机盐、糖、non-pareils和其它物质中单一组分或其混合物的水溶性芯。
例如,在通过使用制粒或喷雾包衣/层化设备将该惰性芯包衣前,将奥美拉唑与粘合剂和可有可无的其它组分一起混合。所述其它组分可以是粘合剂、表面活性剂、填充剂、崩解剂、碱性添加剂或其它可药用组分中的单一组分或其混合物。
例如,所述粘合剂为纤维素如羟丙基甲基纤维素、羟丙基纤维素、微晶纤维素和羧甲基纤维素钠、聚乙烯吡咯烷酮、糖、淀粉和其它具有内聚性的可药用物质。如果用羟丙基甲基纤维素作为粘合剂,那么优选地,它是具有不低于45.6℃浊点的HPMC,在该温度下,当用Metter FP90/FP81C仪器测定时,指定系统的透光率为96%,或者该HPMC具有不低于44.5℃浊点,在该温度下,当用分光光度计测定时,透光率为95%。已发现,适宜的表面活性剂是可药用非离子型或离子型表面活性剂如月桂基硫酸钠。
也可以将活性物质与一种可药用碱性物质(或多种可药用碱性物质)混合。所述物质可选自但不限于下列物质,如磷酸、碳酸、枸橼酸或其它弱无机或有机酸的钠、钾、钙、镁和铝盐;氢氧化铝/碳酸氢钠共沉淀物;通常在抗酸制剂中使用的物质如氢氧化铝、氢氧化钙和氢氧化镁;氧化镁或复合物如Al2O3.6MgO.CO2.12H2O,Mg6Al2(OH)16CO3.4H2O,MgO.Al2O3.2SiO2.nH2O或类似的化合物;有机pH-缓冲物质如三羟甲基氨基甲烷,碱性氨基酸及其盐或其它类似的可药用pH-缓冲物质。
或者,可通过利用喷雾干燥或喷雾冻凝技术制备上述芯材。隔离层
按照EP 247 983,必须将含奥美拉唑的芯材与含游离羧基的肠衣聚合物隔离,否则,在包衣过程中或者在贮存期间可能引起奥美拉唑降解/脱色。
按照本发明,所述隔离层包含特定质量的低粘度HPMC,特别是在2%水溶液中,优选地粘度小于7.2cps的HPMC。优选地,当用Mettler仪器测定时,该特定质量的HPMC应该具有至少45.6℃的浊点。如实验部分详细所述,该浊点的测定可用另一仪器进行。在0.235M磷酸氢二钠缓冲液和pH1.2模拟胃液4∶5的混合溶液中测定该浊点。用于浊点测定的该混合溶液pH值为6.75-6.85。用Mettler测定时,混合溶液中HPMC的浓度为1.2%(w/w)。关于混合溶液组分更详细的资料见下列试验部分。
或者,通过与上述方法相关的方法,例如NIR分光光度法测定HPMC的质量。
在隔离层中也可以包含添加剂如增塑剂、着色剂、色素、添加剂、抗粘着(anti-tacking)和抗静电剂如硬脂酸镁、二氧化钛、滑石粉和其它添加剂。肠衣层
通过使用适宜的包衣技术,可以将一种或多种肠衣层包在包隔离层的芯材上。肠衣层物质可以分散或溶解在水或适宜的有机溶剂中。可单独或联合使用一种或多种下列物质作为肠衣层聚合物;例如异丁烯酸共聚物、醋酸邻苯二甲酸纤维素、醋酸丁酸纤维素、邻苯二甲酸羟丙基甲基纤维素、醋酸琥珀酸羟丙基甲基纤维素、聚醋酸邻苯二甲酸乙烯酯、醋酸三苯甲酸纤维素、羧甲基乙基纤维素、虫胶或其它适宜的肠衣层聚合物的溶液或分散体。就环境原因来说,可优选含水包衣方法。在该含水包衣方法中,异丁烯酸共聚物是最优选的。
该肠衣层可包含药用增塑剂以便获得所需要的机械特性如肠衣层的弹性和硬度。例如所述增塑剂可包括但并不限制于甘油三乙酸酯、枸橼酸酯、邻苯二甲酸酯、癸二酸二丁酯、鲸蜡醇、聚乙二醇、聚山梨糖醇或其它增塑剂。各肠衣层配方中增塑剂的最佳量与所选择的肠衣层聚合物、所选择的增塑剂和所应用的所述聚合物的量有关。在该肠衣层中也可以包含添加剂如分散剂、着色剂、色素、聚合物如聚(丙烯酸乙酯,异丁烯酸甲酯)、抗粘着和抗发泡剂。也可以加入其它化合物来增加膜的厚度和降低酸性胃液向酸敏感活性物质中扩散。
为了保护酸敏感活性物质,优选地,肠衣层的厚度至少大约为10μm。所应用肠衣层的最大厚度通常仅受操作条件的限制。
用肠衣层包衣的小药粒或单位可再用一种或多种外衣层包衣。可通过包衣或层化方法,在适宜的设备如包衣锅、包衣制粒机中或在流化床中,用水和/或有机溶剂进行层化,将外衣层包在包肠衣层的小药粒上。最终剂型
可将所制成的小药粒填充在硬明胶胶囊中或与适宜的片剂赋形剂一起压成片剂多单位制剂。最终剂型包括泡腾片和奥美拉唑与其它活性组分如抗菌物质NSAID(s)、助流剂(motility)或抗酸剂的组合物。
具体实施方式
实施例1和2:用两种作为隔离层组分的低粘度HPMC包衣奥美拉唑小药粒的试验。
将按照EP 247 983中所描述的方法制备的奥美拉唑小药粒(相当于Losec胶囊中的小药粒)进行奥美拉唑释放速度试验。
按照市场销售的Losec胶囊制剂的规定,在缓冲液中,在30分钟内,单位剂量中至少75%的奥美拉唑释放出来。
将小药粒预先暴露在37℃模拟胃液USP(不含酶)中2小时。然后,通过液相色谱法测定药物在30分钟内,在pH6.8缓冲液中的释放。所述pH6.8缓冲液是100.0份模拟胃液USP(不含酶)和80.0份0.235M磷酸氢二钠溶液的混合物,pH应该在6.75-6.85之间。通过将2.0g NaCl 7.0ml浓HCl溶解并加水至1000ml制备模拟胃液USP(不含酶)。通过将41.8g Na2HPO4.2H2O溶解并加水至1000ml制备0.235M磷酸氢二钠溶液。
试验用奥美拉唑小药粒的组分如下。
I、制备含有下列组分的芯材。
芯材
奥美拉唑 10.4 kg
甘露糖醇 74.3 kg
羟丙基纤维素 3.1 kg
微晶纤维素 2.1 kg
无水乳糖 4.2 kg
磷酸氢二钠 0.41 kg
月桂基硫酸钠 0.26 kg
水 大约 19 kg
II、将所制备的芯材用A型或B型HPMC组成的隔离层包衣。按照所述量来应用含有下列组分的隔离层。
隔离层
上述未包衣小药粒 120 kg
羟丙基甲基纤维素6cps 4.8 kg
水 96 kg
III、将所制备的含有隔离层的芯材进一步用含下列组分的肠衣层包衣。
肠衣层
上述小药粒 120 kg
异丁烯酸共聚物 27.3 kg
聚乙二醇 2.7 kg
水 150 kg
按照上述说明,对所制备的含两种不同质量HPMC即A型和B型HPMC隔离层的奥美拉唑小药粒进行试验。小药粒是由同一批奥美拉唑制备的并且具有相同的肠衣物质。测定在缓冲液中,在30分钟内奥美拉唑的释放。
用两种不同的设备进行浊点测定。在实施例1中,使用由Mettlers提供的商业用设备,在实施例2中,使用安装有加热线圈和搅拌功能的分光光度计。试验条件和所使用的设备如下所述。
| 含HPMC的小药粒 | 浊点〔℃〕实施例1(n=2) 实施例2(n=1) | 奥美拉唑从包肠衣的小药粒中的释放[%] | |
| A型 | 44.4 | 42.5 | 69(60-84) |
| B型 | 47.5 | 47.2 | 93(93-94) |
关于两种HPMC质量,其浊点测定的结果显示于图1和2中。如上表所见,含A型HPMC,奥美拉唑的释放不适用于药品,而含B型HPMC,不出现所讨论的口服制剂中奥美拉唑释放速度的问题。
用不同批HPMC进行大量试验的结果表明,当使用商业用Mettler设备进行浊点测定时,具有至少45.6℃浊点的HPMC是满足关于奥美拉唑释放速度的规定所需要的。
在下列方法中,用Mettler设备进行各种HPMC浊点的测定。在0.23 5M磷酸盐缓冲液和pH1.2模拟胃液4∶5的混合液中测定各种HPMC的浊点。该混合溶液pH值为6.75-6.85。混合溶液中HPMC 6cps的浓度为1.2%(w/w)。对于浊点测定的专一性来说,在所选择的设备上使用该系统是必要的。Mettler设备包括下列部分:Mettler FP90中央处理器,FP81C测量单位和ME-18572沸点管。所使用的温度范围为35.0-55.0℃并且加热速度为1.0℃/分钟。结果显示于图1。
或者,使用安装有加热线圈和搅拌功能的分光光度计进行浊点测定。HPMC在缓冲液中的浓度为1.0%(w/w)。该设备用于测定相应的温度和传播值。浊点(interest)的温度间隔随所分析的HPMC的特性而变化。对于大多数样品来说,温度范围为35-50℃。在进行传播值读数前,在新设定的各温度下,所使用迟滞时间为5分钟。结果显示于图2。
实施例3:在小药粒芯材制备中用作粘合剂的各种不同低粘度HPMC的试验。
I、通过在流化床上喷雾层化制备含下列组分的芯材。将奥美拉唑镁盐和HPMC的含水悬浮液喷雾到糖粒(sugar sphere)上。分别用A型和B型HPMC制备两批小药粒。在两试验中使用同一批奥美拉唑-Mg。
糖粒 200 g
奥美拉唑-Mg 200 g
羟丙基甲基纤维素6cps 30 g
水 920 g
在37℃,如实施例1所述,在完全相同组分、pH6.8缓冲液中测定所制备小药粒中奥美拉唑的释放,搅拌速度为100rpm。通过分光光度计测定方法(302nm)测定奥美拉唑的释放,结果显示于图3。曲线表明,与B型HPMC相比,含A型HPMC,奥美拉唑的释放延迟。因为小药粒没有用隔离层和肠衣层包衣,所以,不必将它们预先暴露在模拟胃液中。
Claims (20)
1、一种口服肠衣药物制剂,它包含一种化合物作为活性组分,所述化合物选自奥美拉唑、奥美拉唑的碱性盐、(-)-奥美拉唑对映体及(-)-奥美拉唑对映体碱性盐,其中,所述制剂包含活性组分和可有可无的碱反应化合物芯材,所述活性组分是在与一种或多种可做为药用赋形剂的粘合剂、填充剂和/或崩解剂的混合物中,并且在所述芯材上包有隔离层和肠衣层,其特征在于,将浊点至少为45.6℃、并且在该温度下测定时该系统的透光率为96%的低粘度羟丙基甲基纤维素用作粘合剂和/或隔离层组分,其中,用下列方法测定该浊点:将羟丙基甲基纤维素以1.2%(w/w)浓度溶解在0.235M磷酸盐缓冲液和pH1.2模拟胃液4∶5的混合溶液中,该混合溶液的pH为6.75-6.85,或者用作粘合剂和/或隔离层组分的羟丙基甲基纤维素具有浊点至少为44.5℃、并且在该温度下测定时系统的透光率为95%的低粘度,其中用下列方法测定该浊点:将该低粘度的羟丙基甲基纤维素以1%(w/w)的浓度溶解在0.235M磷酸盐缓冲液和pH1.2模拟胃液4∶5的混合溶液中,该混合溶液的pH为6.75-6.85。
2、权利要求1的制剂,其中低粘度羟丙基甲基纤维素用作隔离层的组分。
3、权利要求2的制剂,其中肠衣层包含异丁烯酸共聚物。
4、权利要求1的制剂,其中低粘度羟丙基甲基纤维素用作粘合剂。
5、权利要求1的制剂,其中低粘度羟丙基甲基纤维素在其2%水溶液中的粘度低于7.2cps。
6、权利要求1的制剂,其中活性组分为奥美拉唑。
7、权利要求1的制剂,其中活性组分为奥美拉唑的镁盐。
8、权利要求1的制剂,其中活性组分为(-)-奥美拉唑对映体的镁盐。
9、浊点至少为45.6℃、并且在该温度下系统的透光率为96%的低粘度羟丙基甲基纤维素在制备一种口服肠衣药物制剂中的应用,该制剂包含一种化合物作为活性组分,所述化合物选自奥美拉唑、奥美拉唑的碱性盐、(-)-奥美拉唑对映体及(-)-奥美拉唑对映体碱性盐,其中,所述制剂包含活性组分,和可有可无的碱反应化合物芯材,所述活性组分是在与一种或多种可做为药用赋形剂的粘合剂、填充剂和/或崩解剂的混合物中,并且在所述芯材上包有隔离层和肠衣层,其特征在于,所述隔离层包含具有上述浊点的低粘度羟丙基甲基纤维素并且用下列方法测定该浊点:将羟丙基甲基纤维素以1.2%(w/w)浓度溶解在0.235M磷酸盐缓冲液和pH1.2模拟胃液4∶5的混合溶液中,该混合溶液的pH为6.75-6.85。
10、浊点至少为44.5℃并且在该温度下、系统的透光率为95%的低粘度羟丙基甲基纤维素在制备一种口服肠衣药物制剂中的应用,该制剂包含一种化合物作为活性组分,所述化合物选自奥美拉唑、奥美拉唑的碱性盐、(-)-奥美拉唑对映体及(-)-奥美拉唑对映体碱性盐,
其中,所述制剂包含活性组分,和可有可无的碱反应化合物芯材,所
述活性组分是在与一种或多种可做为药用赋形剂的粘合剂、填充剂和/或崩解剂的混合物中,并且在所述芯材上包有隔离层和肠衣层,其特征在于,所述隔离层包含具有上述浊点的低粘度羟丙基甲基纤维素并且用下列方法测定该浊点:将羟丙基甲基纤维素以1%(w/w)浓度溶解在0.235M磷酸盐缓冲液和pH1.2模拟胃液4∶5的混合溶液中,该混合溶液的pH为6.75-6.85。
11、浊点至少为45.6℃、并且在该温度下系统的透光率为96%的低粘度羟丙基甲基纤维素在制备一种口服肠衣药物制剂中的应用,该制剂包含一种化合物作为活性组分,所述化合物选自奥美拉唑、奥美拉唑的碱性盐、(-)-奥美拉唑对映体及(-)-奥美拉唑对映体碱性盐,
其中,所述制剂在至少与一种粘合剂的混合物中包含活性组分,和可有
可无的碱反应化合物芯材,并且在所述芯材上至少包有肠衣层,其特点是,所述粘合剂为具有上述浊点的低粘度羟丙基甲基纤维素并且用下列方法测定该浊点:将羟丙基甲基纤维素以1.2%(w/w)浓度溶解在0.235M磷酸盐缓冲液和pH1.2模拟胃液4∶5的混合溶液中,该混合溶液的pH为6.75-6.85。
12、浊点至少为44.5℃、并且在该温度下系统的透光率为95%的低粘度羟丙基甲基纤维素在制备一种口服肠衣药物制剂中的应用,该制剂包含一种化合物作为活性组分,所述化合物选自奥美拉唑、奥美拉唑的碱性盐、(-)-奥美拉唑对映体及(-)-奥美拉唑对映体碱性盐,其中,所述制剂在至少与一种粘合剂的混合物中包含活性组分,和可有可无的碱反应化合物芯材,并且在所述芯材上至少包有肠衣层,其特点是,所述粘合剂为具有上述浊点的低粘度羟丙基甲基纤维素并且用下列方法测定该浊点:将羟丙基甲基纤维素以1%(w/w)浓度溶解在0.235M磷酸盐缓冲液和pH1.2模拟胃液4∶5的混合溶液中,该混合溶液的pH为6.75-6.85。
13、权利要求9的应用,其中羟丙基甲基纤维素在2%水溶液中的粘度低于7.2cps。
14、权利要求10的应用,其中羟丙基甲基纤维素在2%水溶液中的粘度低于7.2cps。
15、权利要求11的应用,其中羟丙基甲基纤维素在2%水溶液中的粘度低于7.2cps。
16、权利要求12的应用,其中羟丙基甲基纤维素在2%水溶液中的粘度低于7.2cps。
17、制备权利要求1所定义的口服肠衣药物制剂的方法,其中将与或未与一种碱反应化合物和/或粘合剂混合的活性物质制成芯材并且在所述芯材上包隔离层,然后包肠衣层,其特点是,所述隔离层包含浊点至少为45.6℃并且在该温度下测定时、系统的透光率为96%的低粘度羟丙基甲基纤维素,并且用下列方法测定该浊点:将HPMC以1.2%(w/w)浓度溶解在0.235M磷酸盐缓冲液和pH1.2模拟胃液4∶5的混合溶液中,该混合溶液的pH为6.75-6.85。
18、制备权利要求1所定义的口服肠衣药物制剂的方法,其中将与或未与一种碱反应化合物和/或粘合剂混合的活性物质制成芯材并且在所述芯材上包隔离层,然后包肠衣层,其特点是,所述隔离层包含浊点至少为44.5℃并且在该温度下测定时、系统的透光率为95%的低粘度羟丙基甲基纤维素,并且用下列方法测定该浊点:将羟丙基甲基纤维素以1%(w/w)浓度溶解在0.235M磷酸盐缓冲液和pH1.2模拟胃液4∶5的混合溶液中,该混合溶液的pH为6.75-6.85。
19、制备权利要求1所定义的口服肠衣药物制剂的方法,其中将与或未与一种碱反应化合物混合的活性物质与粘合剂混合并制成芯材,在所述芯材上至少包肠衣层,其特点是,所述粘合剂包含浊点至少为45.6℃并且在该温度下测定时、系统的透光率为96%的低粘度羟丙基甲基纤维素,并且用下列方法测定该浊点:将羟丙基甲基纤维素以1.2%(w/w)浓度溶解在0.235M磷酸盐缓冲液和pH1.2模拟胃液4∶5的混合溶液中,该混合溶液的pH为6.75-6.85。
20、制备权利要求1所定义的口服肠衣药物制剂的方法,其中将与或未与一种碱反应化合物混合的活性物质与粘合剂混合并制成芯材,在所述芯材上至少包肠衣层,其特点是,所述粘合剂包含浊点至少为44.5℃并且在该温度下测定时、系统的透光率为95%的低粘度羟丙基甲基纤维素,并且用下列方法测定该浊点:将羟丙基甲基纤维素以1%(w/w)浓度溶解在0.235M磷酸盐缓冲液和pH1.2模拟胃液4∶5的混合溶液中,该混合溶液的pH为6.75-6.85。
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| SE97020002 | 1997-05-28 | ||
| SE9702000A SE9702000D0 (sv) | 1997-05-28 | 1997-05-28 | New pharmaceutical formulation |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| CN1258217A CN1258217A (zh) | 2000-06-28 |
| CN1123338C true CN1123338C (zh) | 2003-10-08 |
Family
ID=20407122
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN98805564A Expired - Fee Related CN1123338C (zh) | 1997-05-28 | 1998-05-18 | 奥美拉唑的药物制剂 |
Country Status (41)
| Country | Link |
|---|---|
| US (1) | US6090827A (zh) |
| EP (1) | EP0984773B1 (zh) |
| JP (1) | JP4649001B2 (zh) |
| KR (1) | KR100540721B1 (zh) |
| CN (1) | CN1123338C (zh) |
| AR (1) | AR012698A1 (zh) |
| AT (1) | ATE234078T1 (zh) |
| AU (1) | AU722879B2 (zh) |
| BR (1) | BR9809484A (zh) |
| CA (1) | CA2290531C (zh) |
| CZ (1) | CZ298972B6 (zh) |
| DE (1) | DE69812089T2 (zh) |
| DK (1) | DK0984773T3 (zh) |
| DZ (1) | DZ2494A1 (zh) |
| EE (1) | EE03903B1 (zh) |
| EG (1) | EG24044A (zh) |
| ES (1) | ES2195342T3 (zh) |
| HK (1) | HK1025744A1 (zh) |
| HR (1) | HRP980260B1 (zh) |
| HU (1) | HU229154B1 (zh) |
| ID (1) | ID24654A (zh) |
| IL (1) | IL132895A0 (zh) |
| IS (1) | IS2856B (zh) |
| MA (1) | MA26497A1 (zh) |
| MY (1) | MY122298A (zh) |
| NO (1) | NO328100B1 (zh) |
| NZ (1) | NZ500886A (zh) |
| PL (1) | PL194634B1 (zh) |
| PT (1) | PT984773E (zh) |
| RS (1) | RS49629B (zh) |
| RU (1) | RU2207121C2 (zh) |
| SA (1) | SA98190304B1 (zh) |
| SE (1) | SE9702000D0 (zh) |
| SI (1) | SI0984773T1 (zh) |
| SK (1) | SK286625B6 (zh) |
| TN (1) | TNSN98068A1 (zh) |
| TR (1) | TR199902890T2 (zh) |
| TW (1) | TW575435B (zh) |
| UA (1) | UA71541C2 (zh) |
| WO (1) | WO1998053803A1 (zh) |
| ZA (1) | ZA984178B (zh) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN1311824C (zh) * | 2004-04-21 | 2007-04-25 | 常州市第四制药厂有限公司 | 奥美拉唑肠溶微粒制剂及制备方法 |
Families Citing this family (47)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6645988B2 (en) * | 1996-01-04 | 2003-11-11 | Curators Of The University Of Missouri | Substituted benzimidazole dosage forms and method of using same |
| US6699885B2 (en) | 1996-01-04 | 2004-03-02 | The Curators Of The University Of Missouri | Substituted benzimidazole dosage forms and methods of using same |
| US6489346B1 (en) | 1996-01-04 | 2002-12-03 | The Curators Of The University Of Missouri | Substituted benzimidazole dosage forms and method of using same |
| US5840737A (en) | 1996-01-04 | 1998-11-24 | The Curators Of The University Of Missouri | Omeprazole solution and method for using same |
| US6174548B1 (en) * | 1998-08-28 | 2001-01-16 | Andrx Pharmaceuticals, Inc. | Omeprazole formulation |
| US6096340A (en) | 1997-11-14 | 2000-08-01 | Andrx Pharmaceuticals, Inc. | Omeprazole formulation |
| WO1999053918A1 (fr) * | 1998-04-20 | 1999-10-28 | Eisai Co., Ltd. | Compositions stabilisees contenant des composes du type benzimidazole |
| SE9803772D0 (sv) | 1998-11-05 | 1998-11-05 | Astra Ab | Pharmaceutical formulation |
| SE9902386D0 (sv) * | 1999-06-22 | 1999-06-22 | Astra Ab | New formulation |
| US6245913B1 (en) | 1999-06-30 | 2001-06-12 | Wockhardt Europe Limited | Synthetic procedure for 5-methoxy-2-[(4-methoxy-3,5-dimethyl-2-pyridinyl)-methylthio]-IH-benzimidazole hydrochloride and its conversion to omeprazole |
| ES2168043B1 (es) | 1999-09-13 | 2003-04-01 | Esteve Labor Dr | Forma farmaceutica solida oral de liberacion modificada que contiene un compuesto de bencimidazol labil en medio acido. |
| WO2001028559A1 (fr) | 1999-10-20 | 2001-04-26 | Eisai Co., Ltd. | Procede de stabilisation de composes benzimidazoles |
| US20040092511A1 (en) * | 1999-12-10 | 2004-05-13 | Billstein Stephan Anthony | Pharmaceutical combinations and their use in treating gastrointestinal and abdominal viscera disorders |
| US20020192299A1 (en) * | 2000-12-28 | 2002-12-19 | Rajneesh Taneja | Pharmaceutical compositions of a non-enteric coated proton pump inhibitor with a carbonate salt and bicarbonate salt combination |
| JP2002234842A (ja) * | 2001-02-09 | 2002-08-23 | Kyowa Yakuhin Kogyo Kk | 内服腸溶性製剤 |
| MXPA04007169A (es) * | 2002-01-25 | 2004-10-29 | Santarus Inc | Suministro transmucosal de inhibidores de bomba de protones. |
| US20040082618A1 (en) * | 2002-07-03 | 2004-04-29 | Rajneesh Taneja | Liquid dosage forms of acid labile drugs |
| FR2843121B3 (fr) | 2002-08-02 | 2004-09-10 | Rhodia Chimie Sa | Agent ignifugeant, procede de preparation et l'utilisation de cet agent |
| US20070243251A1 (en) * | 2002-12-20 | 2007-10-18 | Rajneesh Taneja | Dosage Forms Containing A PPI, NSAID, and Buffer |
| US20040121004A1 (en) * | 2002-12-20 | 2004-06-24 | Rajneesh Taneja | Dosage forms containing a PPI, NSAID, and buffer |
| US20040146558A1 (en) * | 2003-01-28 | 2004-07-29 | Kyowa Pharmaceutical Co., Ltd. | Oral enteric-coated preparation |
| BRPI0407074A (pt) * | 2003-01-29 | 2006-01-24 | Takeda Pharmaceutical | Método para produção de uma preparação revestida, preparação revestida, e, método para melhorar a dissolução do cloridreto de pioglitazona de uma preparação revestida com cloridreto de pioglitazona |
| JP4567340B2 (ja) * | 2003-01-29 | 2010-10-20 | 武田薬品工業株式会社 | 被覆製剤の製造方法 |
| ZA200506397B (en) * | 2003-01-29 | 2006-11-29 | Takeda Pharmaceutical | Process for producing coated preparation |
| CA2517005A1 (en) * | 2003-02-20 | 2004-09-02 | Santarus, Inc. | A novel formulation, omeprazole antacid complex-immediate release for rapid and sustained suppression of gastric acid |
| US8993599B2 (en) | 2003-07-18 | 2015-03-31 | Santarus, Inc. | Pharmaceutical formulations useful for inhibiting acid secretion and methods for making and using them |
| US20070292498A1 (en) * | 2003-11-05 | 2007-12-20 | Warren Hall | Combinations of proton pump inhibitors, sleep aids, buffers and pain relievers |
| US8815916B2 (en) * | 2004-05-25 | 2014-08-26 | Santarus, Inc. | Pharmaceutical formulations useful for inhibiting acid secretion and methods for making and using them |
| US8906940B2 (en) * | 2004-05-25 | 2014-12-09 | Santarus, Inc. | Pharmaceutical formulations useful for inhibiting acid secretion and methods for making and using them |
| ES2324354T3 (es) * | 2005-07-29 | 2009-08-05 | Rottapharm S.P.A. | Combinacion terapeutica de itriglumida e inhibidores de la bomba de protones en el tratamiento de trastornos gastrointestinales y relacionados. |
| AU2007266574A1 (en) * | 2006-06-01 | 2007-12-06 | Dexcel Pharma Technologies Ltd. | Multiple unit pharmaceutical formulation |
| KR101436516B1 (ko) * | 2007-07-23 | 2014-09-02 | 주식회사태평양제약 | 코팅된 펠렛을 함유하는 현탁정 및 이의 제조방법 |
| EP2205218A4 (en) * | 2007-09-28 | 2010-11-17 | Ctc Bio Inc | ESOMEPRAZOLE-CONTAINING PHARMACEUTICAL COMPOSITION |
| DK2273985T3 (en) * | 2008-03-28 | 2016-04-25 | Ferrer Int | Capsule for the prevention of cardiovascular diseases |
| PL2334378T3 (pl) | 2008-08-19 | 2014-09-30 | Xenoport Inc | Proleki wodorofumaranu metylu, ich kompozycje farmaceutyczne i sposoby zastosowania |
| US10945984B2 (en) | 2012-08-22 | 2021-03-16 | Arbor Pharmaceuticals, Llc | Methods of administering monomethyl fumarate and prodrugs thereof having reduced side effects |
| JP2015526477A (ja) | 2012-08-22 | 2015-09-10 | ゼノポート,インコーポレイティド | メチル水素フマレートの経口剤形およびそのプロドラッグ |
| CN102961356A (zh) * | 2012-12-11 | 2013-03-13 | 山西云鹏制药有限公司 | 一种含奥美拉唑的蓝色肠溶片剂的制备方法 |
| US10179118B2 (en) | 2013-03-24 | 2019-01-15 | Arbor Pharmaceuticals, Llc | Pharmaceutical compositions of dimethyl fumarate |
| US9416096B2 (en) | 2013-09-06 | 2016-08-16 | Xenoport, Inc. | Crystalline forms of (N,N-Diethylcarbamoyl)methyl methyl (2E)but-2-ene-1,4-dioate, methods of synthesis and use |
| WO2015042294A1 (en) * | 2013-09-18 | 2015-03-26 | Xenoport, Inc. | Nanoparticle compositions of dimethyl fumarate |
| US9999672B2 (en) | 2014-03-24 | 2018-06-19 | Xenoport, Inc. | Pharmaceutical compositions of fumaric acid esters |
| EP3288556A4 (en) | 2015-04-29 | 2018-09-19 | Dexcel Pharma Technologies Ltd. | Orally disintegrating compositions |
| US10076494B2 (en) | 2016-06-16 | 2018-09-18 | Dexcel Pharma Technologies Ltd. | Stable orally disintegrating pharmaceutical compositions |
| WO2021153525A1 (ja) | 2020-01-27 | 2021-08-05 | 東和薬品株式会社 | エソメプラゾール経口製剤およびその製造方法 |
| KR102432084B1 (ko) | 2021-11-16 | 2022-08-12 | 알리코제약(주) | S-오메프라졸을 함유하는 안정성이 개선되고 소형화된 정제 |
| WO2024075017A1 (en) | 2022-10-04 | 2024-04-11 | Zabirnyk Arsenii | Inhibition of aortic valve calcification |
Family Cites Families (11)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| SE7804231L (sv) * | 1978-04-14 | 1979-10-15 | Haessle Ab | Magsyrasekretionsmedel |
| SE8301182D0 (sv) * | 1983-03-04 | 1983-03-04 | Haessle Ab | Novel compounds |
| GB2189698A (en) * | 1986-04-30 | 1987-11-04 | Haessle Ab | Coated omeprazole tablets |
| JPH05255088A (ja) * | 1991-11-05 | 1993-10-05 | Yoshitomi Pharmaceut Ind Ltd | 抗潰瘍剤含有製剤 |
| JP2669446B2 (ja) * | 1992-03-23 | 1997-10-27 | 信越化学工業株式会社 | 医薬品コーティング液用原料粉粒体 |
| JPH0733659A (ja) * | 1992-07-17 | 1995-02-03 | Yoshitomi Pharmaceut Ind Ltd | 抗潰瘍剤含有製剤 |
| SE9301830D0 (sv) * | 1993-05-28 | 1993-05-28 | Ab Astra | New compounds |
| SE9302395D0 (sv) * | 1993-07-09 | 1993-07-09 | Ab Astra | New pharmaceutical formulation |
| SE9302396D0 (sv) * | 1993-07-09 | 1993-07-09 | Ab Astra | A novel compound form |
| EP0723436B1 (en) * | 1994-07-08 | 2001-09-26 | AstraZeneca AB | Multiple unit tableted dosage form i |
| SE9500422D0 (sv) * | 1995-02-06 | 1995-02-06 | Astra Ab | New oral pharmaceutical dosage forms |
-
1997
- 1997-05-28 SE SE9702000A patent/SE9702000D0/xx unknown
-
1998
- 1998-05-14 AR ARP980102246A patent/AR012698A1/es not_active Application Discontinuation
- 1998-05-14 HR HR980260A patent/HRP980260B1/xx not_active IP Right Cessation
- 1998-05-15 MA MA25077A patent/MA26497A1/fr unknown
- 1998-05-15 TW TW87107541A patent/TW575435B/zh not_active IP Right Cessation
- 1998-05-18 HU HU0002182A patent/HU229154B1/hu not_active IP Right Cessation
- 1998-05-18 EE EEP199900540A patent/EE03903B1/xx not_active IP Right Cessation
- 1998-05-18 TR TR1999/02890T patent/TR199902890T2/xx unknown
- 1998-05-18 DE DE69812089T patent/DE69812089T2/de not_active Expired - Lifetime
- 1998-05-18 IL IL13289598A patent/IL132895A0/xx not_active IP Right Cessation
- 1998-05-18 AU AU76803/98A patent/AU722879B2/en not_active Ceased
- 1998-05-18 SI SI9830433T patent/SI0984773T1/xx unknown
- 1998-05-18 ID IDW991448A patent/ID24654A/id unknown
- 1998-05-18 EP EP98924700A patent/EP0984773B1/en not_active Expired - Lifetime
- 1998-05-18 KR KR1019997011083A patent/KR100540721B1/ko not_active IP Right Cessation
- 1998-05-18 DZ DZ980104A patent/DZ2494A1/xx active
- 1998-05-18 ES ES98924700T patent/ES2195342T3/es not_active Expired - Lifetime
- 1998-05-18 AT AT98924700T patent/ATE234078T1/de active
- 1998-05-18 JP JP50056299A patent/JP4649001B2/ja not_active Expired - Fee Related
- 1998-05-18 UA UA99116247A patent/UA71541C2/uk unknown
- 1998-05-18 PT PT98924700T patent/PT984773E/pt unknown
- 1998-05-18 US US09/077,717 patent/US6090827A/en not_active Expired - Lifetime
- 1998-05-18 ZA ZA984178A patent/ZA984178B/xx unknown
- 1998-05-18 RU RU99126869/14A patent/RU2207121C2/ru not_active IP Right Cessation
- 1998-05-18 CA CA002290531A patent/CA2290531C/en not_active Expired - Lifetime
- 1998-05-18 WO PCT/SE1998/000922 patent/WO1998053803A1/en active IP Right Grant
- 1998-05-18 PL PL98337237A patent/PL194634B1/pl unknown
- 1998-05-18 DK DK98924700T patent/DK0984773T3/da active
- 1998-05-18 CZ CZ0420299A patent/CZ298972B6/cs not_active IP Right Cessation
- 1998-05-18 CN CN98805564A patent/CN1123338C/zh not_active Expired - Fee Related
- 1998-05-18 SK SK1590-99A patent/SK286625B6/sk not_active IP Right Cessation
- 1998-05-18 RS YUP-608/99A patent/RS49629B/sr unknown
- 1998-05-18 NZ NZ500886A patent/NZ500886A/en not_active IP Right Cessation
- 1998-05-18 BR BR9809484-0A patent/BR9809484A/pt not_active Application Discontinuation
- 1998-05-21 TN TNTNSN98068A patent/TNSN98068A1/fr unknown
- 1998-05-25 EG EG56898A patent/EG24044A/xx active
- 1998-05-27 MY MYPI98002355A patent/MY122298A/en unknown
- 1998-07-19 SA SA98190304A patent/SA98190304B1/ar unknown
-
1999
- 1999-11-11 IS IS5245A patent/IS2856B/is unknown
- 1999-11-26 NO NO19995809A patent/NO328100B1/no not_active IP Right Cessation
-
2000
- 2000-08-10 HK HK00105002A patent/HK1025744A1/xx not_active IP Right Cessation
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN1311824C (zh) * | 2004-04-21 | 2007-04-25 | 常州市第四制药厂有限公司 | 奥美拉唑肠溶微粒制剂及制备方法 |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN1123338C (zh) | 奥美拉唑的药物制剂 | |
| CN1160062C (zh) | 包含奥美拉唑的药用制剂 | |
| CN1243547C (zh) | 新的制剂 | |
| RU2207114C2 (ru) | Пероральный фармацевтический препарат, содержащий соединение, обладающее противоязвенным действием, и способ получения указанного препарата | |
| EP0502556B1 (en) | Use of specific core material and layers to obtain pharmaceutical formulations stable to discolouration of acid labile compounds | |
| JPH09511767A (ja) | 新規な経口用の医薬使用形態 | |
| JP2001199878A (ja) | 酸に不安定ベンズイミダゾールを含有する修飾された放出特性の経口用固形製剤 | |
| CN100425235C (zh) | 奥美拉唑肠溶微丸及其制备方法 | |
| JP2004175768A (ja) | 安定なオメプラゾール腸溶錠の製造法 | |
| CN1169676A (zh) | 含有奥美拉唑镁盐的新口服药物制剂 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| C06 | Publication | ||
| PB01 | Publication | ||
| C10 | Entry into substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| C14 | Grant of patent or utility model | ||
| GR01 | Patent grant | ||
| C56 | Change in the name or address of the patentee |
Owner name: ASTRAZENECA AB Free format text: FORMER NAME: ASTRA AKTIEBOLAG |
|
| CP01 | Change in the name or title of a patent holder |
Address after: Swedish Sodertalje Patentee after: Astrazeneca (Sweden) AB Address before: Swedish Sodertalje Patentee before: Astra Aktiebolag |
|
| CF01 | Termination of patent right due to non-payment of annual fee |
Granted publication date: 20031008 Termination date: 20160518 |
|
| CF01 | Termination of patent right due to non-payment of annual fee |