RU2010143901A - Способ получения композиций дабигатрана для перорального введения - Google Patents
Способ получения композиций дабигатрана для перорального введения Download PDFInfo
- Publication number
- RU2010143901A RU2010143901A RU2010143901/15A RU2010143901A RU2010143901A RU 2010143901 A RU2010143901 A RU 2010143901A RU 2010143901/15 A RU2010143901/15 A RU 2010143901/15A RU 2010143901 A RU2010143901 A RU 2010143901A RU 2010143901 A RU2010143901 A RU 2010143901A
- Authority
- RU
- Russia
- Prior art keywords
- dabigatran
- pellets
- suspension
- methanesulfonate
- etexilate
- Prior art date
Links
- 238000000034 method Methods 0.000 title claims abstract 27
- 239000000203 mixture Substances 0.000 title claims abstract 3
- YBSJFWOBGCMAKL-UHFFFAOYSA-N dabigatran Chemical compound N=1C2=CC(C(=O)N(CCC(O)=O)C=3N=CC=CC=3)=CC=C2N(C)C=1CNC1=CC=C(C(N)=N)C=C1 YBSJFWOBGCMAKL-UHFFFAOYSA-N 0.000 title 1
- 229960003850 dabigatran Drugs 0.000 title 1
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 claims abstract 32
- 239000000725 suspension Substances 0.000 claims abstract 19
- KSGXQBZTULBEEQ-UHFFFAOYSA-N dabigatran etexilate Chemical compound C1=CC(C(N)=NC(=O)OCCCCCC)=CC=C1NCC1=NC2=CC(C(=O)N(CCC(=O)OCC)C=3N=CC=CC=3)=CC=C2N1C KSGXQBZTULBEEQ-UHFFFAOYSA-N 0.000 claims abstract 13
- 229960000288 dabigatran etexilate Drugs 0.000 claims abstract 13
- 239000000454 talc Substances 0.000 claims abstract 12
- 229910052623 talc Inorganic materials 0.000 claims abstract 12
- AFVFQIVMOAPDHO-UHFFFAOYSA-N Methanesulfonic acid Chemical class CS(O)(=O)=O AFVFQIVMOAPDHO-UHFFFAOYSA-N 0.000 claims abstract 11
- 229920002153 Hydroxypropyl cellulose Polymers 0.000 claims abstract 10
- 239000001863 hydroxypropyl cellulose Substances 0.000 claims abstract 10
- 235000010977 hydroxypropyl cellulose Nutrition 0.000 claims abstract 10
- 239000013543 active substance Substances 0.000 claims abstract 5
- 239000008188 pellet Substances 0.000 claims 16
- FEWJPZIEWOKRBE-UHFFFAOYSA-N Tartaric acid Natural products [H+].[H+].[O-]C(=O)C(O)C(O)C([O-])=O FEWJPZIEWOKRBE-UHFFFAOYSA-N 0.000 claims 8
- 235000002906 tartaric acid Nutrition 0.000 claims 8
- 239000011975 tartaric acid Substances 0.000 claims 8
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 claims 6
- 239000001866 hydroxypropyl methyl cellulose Substances 0.000 claims 3
- 229920003088 hydroxypropyl methyl cellulose Polymers 0.000 claims 3
- 235000010979 hydroxypropyl methyl cellulose Nutrition 0.000 claims 3
- UFVKGYZPFZQRLF-UHFFFAOYSA-N hydroxypropyl methyl cellulose Chemical compound OC1C(O)C(OC)OC(CO)C1OC1C(O)C(O)C(OC2C(C(O)C(OC3C(C(O)C(O)C(CO)O3)O)C(CO)O2)O)C(CO)O1 UFVKGYZPFZQRLF-UHFFFAOYSA-N 0.000 claims 3
- 239000004205 dimethyl polysiloxane Substances 0.000 claims 1
- 235000013870 dimethyl polysiloxane Nutrition 0.000 claims 1
- 238000004519 manufacturing process Methods 0.000 claims 1
- 239000000463 material Substances 0.000 claims 1
- 229920000435 poly(dimethylsiloxane) Polymers 0.000 claims 1
- 239000007921 spray Substances 0.000 claims 1
- 238000005507 spraying Methods 0.000 claims 1
- 239000007858 starting material Substances 0.000 abstract 1
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/14—Particulate form, e.g. powders, Processes for size reducing of pure drugs or the resulting products, Pure drug nanoparticles
- A61K9/16—Agglomerates; Granulates; Microbeadlets ; Microspheres; Pellets; Solid products obtained by spray drying, spray freeze drying, spray congealing,(multiple) emulsion solvent evaporation or extraction
- A61K9/1605—Excipients; Inactive ingredients
- A61K9/1617—Organic compounds, e.g. phospholipids, fats
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/48—Preparations in capsules, e.g. of gelatin, of chocolate
- A61K9/50—Microcapsules having a gas, liquid or semi-solid filling; Solid microparticles or pellets surrounded by a distinct coating layer, e.g. coated microspheres, coated drug crystals
- A61K9/5089—Processes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/4427—Non condensed pyridines; Hydrogenated derivatives thereof containing further heterocyclic ring systems
- A61K31/4439—Non condensed pyridines; Hydrogenated derivatives thereof containing further heterocyclic ring systems containing a five-membered ring with nitrogen as a ring hetero atom, e.g. omeprazole
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/14—Particulate form, e.g. powders, Processes for size reducing of pure drugs or the resulting products, Pure drug nanoparticles
- A61K9/16—Agglomerates; Granulates; Microbeadlets ; Microspheres; Pellets; Solid products obtained by spray drying, spray freeze drying, spray congealing,(multiple) emulsion solvent evaporation or extraction
- A61K9/1605—Excipients; Inactive ingredients
- A61K9/1611—Inorganic compounds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/14—Particulate form, e.g. powders, Processes for size reducing of pure drugs or the resulting products, Pure drug nanoparticles
- A61K9/16—Agglomerates; Granulates; Microbeadlets ; Microspheres; Pellets; Solid products obtained by spray drying, spray freeze drying, spray congealing,(multiple) emulsion solvent evaporation or extraction
- A61K9/1605—Excipients; Inactive ingredients
- A61K9/1629—Organic macromolecular compounds
- A61K9/1641—Organic macromolecular compounds obtained otherwise than by reactions only involving carbon-to-carbon unsaturated bonds, e.g. polyethylene glycol, poloxamers
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/14—Particulate form, e.g. powders, Processes for size reducing of pure drugs or the resulting products, Pure drug nanoparticles
- A61K9/16—Agglomerates; Granulates; Microbeadlets ; Microspheres; Pellets; Solid products obtained by spray drying, spray freeze drying, spray congealing,(multiple) emulsion solvent evaporation or extraction
- A61K9/1605—Excipients; Inactive ingredients
- A61K9/1629—Organic macromolecular compounds
- A61K9/1652—Polysaccharides, e.g. alginate, cellulose derivatives; Cyclodextrin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/48—Preparations in capsules, e.g. of gelatin, of chocolate
- A61K9/4816—Wall or shell material
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/48—Preparations in capsules, e.g. of gelatin, of chocolate
- A61K9/4841—Filling excipients; Inactive ingredients
- A61K9/485—Inorganic compounds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/48—Preparations in capsules, e.g. of gelatin, of chocolate
- A61K9/4841—Filling excipients; Inactive ingredients
- A61K9/4858—Organic compounds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/48—Preparations in capsules, e.g. of gelatin, of chocolate
- A61K9/4841—Filling excipients; Inactive ingredients
- A61K9/4866—Organic macromolecular compounds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
- A61P7/02—Antithrombotic agents; Anticoagulants; Platelet aggregation inhibitors
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- General Health & Medical Sciences (AREA)
- Pharmacology & Pharmacy (AREA)
- Medicinal Chemistry (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- Epidemiology (AREA)
- Inorganic Chemistry (AREA)
- Organic Chemistry (AREA)
- Biophysics (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Molecular Biology (AREA)
- Heart & Thoracic Surgery (AREA)
- Hematology (AREA)
- Vascular Medicine (AREA)
- Urology & Nephrology (AREA)
- Diabetes (AREA)
- Cardiology (AREA)
- Medicinal Preparation (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
Abstract
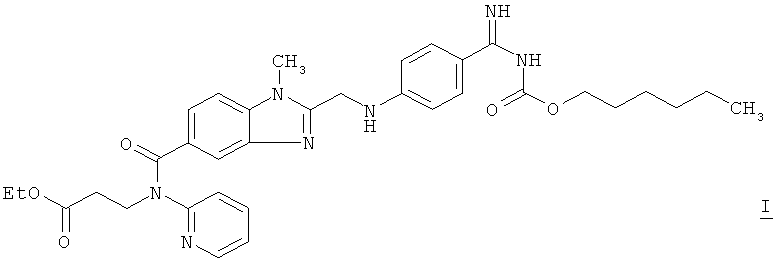
1. Способ получения суспензии полиморфной формы I соли метансульфоновой кислоты и дабигатрана-этексилата формулы I ! ! отличающийся тем, что ! полиморфную форму I метансульфоната дабигатрана-этексилата суспендируют в смеси с тальком в растворе гидроксипропилцеллюлозы в изопропаноле, ! суспензию получают при температуре не более 30°С. ! 2. Способ по п.1, отличающийся тем, что прежде всего гидроксипропилцеллюлозу растворяют в изопропаноле, а затем в указанном растворе суспендируют полиморфную форму I метансульфоната дабигатрана-этексилата. ! 3. Способ по п.1 или 2, отличающийся тем, что в 1 кг подаваемого изопропанола добавляют от 0,05 до 0,5 кг метансульфоната дабигатрана-этексилата. ! 4. Способ по п.1 или 2, отличающийся тем, что в 1 кг подаваемого изопропанола добавляют от 0,01 до 0,1 кг гидроксипропилцеллюлозы. ! 5. Способ по п.3, отличающийся тем, что в 1 кг подаваемого изопропанола добавляют от 0,01 до 0,1 кг гидроксипропилцеллюлозы. ! 6. Способ по п.1 или 2, отличающийся тем, что в 1 кг подаваемого изопропанола добавляют от 0,005 до 0,07 кг талька. ! 7. Способ по п.3, отличающийся тем, что в 1 кг подаваемого изопропанола добавляют от 0,005 до 0,07 кг талька. ! 8. Способ по п.5, отличающийся тем, что в 1 кг подаваемого изопропанола добавляют от 0,005 до 0,07 кг талька. ! 9. Суспензия , полученная способом по одному из пп.1-8. ! 10. Суспензия по п.9, отличающаяся тем, что концентрация активного вещества составляет 10-25 мас.% ! 11. Суспензия по п.9 или 10, отличающаяся тем, что общая концентрация компонентов: активного вещества, гидроксипропилцеллюлозы и талька составляет 14-40 мас.% ! 12. Применение суспензии по одному из пп.9-11 в качестве исходного материала для получения п
Claims (20)
1. Способ получения суспензии полиморфной формы I соли метансульфоновой кислоты и дабигатрана-этексилата формулы I
отличающийся тем, что
полиморфную форму I метансульфоната дабигатрана-этексилата суспендируют в смеси с тальком в растворе гидроксипропилцеллюлозы в изопропаноле,
суспензию получают при температуре не более 30°С.
2. Способ по п.1, отличающийся тем, что прежде всего гидроксипропилцеллюлозу растворяют в изопропаноле, а затем в указанном растворе суспендируют полиморфную форму I метансульфоната дабигатрана-этексилата.
3. Способ по п.1 или 2, отличающийся тем, что в 1 кг подаваемого изопропанола добавляют от 0,05 до 0,5 кг метансульфоната дабигатрана-этексилата.
4. Способ по п.1 или 2, отличающийся тем, что в 1 кг подаваемого изопропанола добавляют от 0,01 до 0,1 кг гидроксипропилцеллюлозы.
5. Способ по п.3, отличающийся тем, что в 1 кг подаваемого изопропанола добавляют от 0,01 до 0,1 кг гидроксипропилцеллюлозы.
6. Способ по п.1 или 2, отличающийся тем, что в 1 кг подаваемого изопропанола добавляют от 0,005 до 0,07 кг талька.
7. Способ по п.3, отличающийся тем, что в 1 кг подаваемого изопропанола добавляют от 0,005 до 0,07 кг талька.
8. Способ по п.5, отличающийся тем, что в 1 кг подаваемого изопропанола добавляют от 0,005 до 0,07 кг талька.
15. Способ получения пеллет метансульфоната дабигатрана-этексилата по п.13 или 14, отличающийся тем, что стандартизированная скорость распыления, с которой распыляют суспензию активного вещества на пеллеты винной кислоты 3, находится в диапазоне от 0,05 до 0,15 кг/ч на 1 кг используемых пеллет винной кислоты .
17. Способ получения пеллет метансульфоната дабигатрана-этексилата по п.13 или 14, отличающийся тем, что подаваемые пеллеты винной кислоты получают при распылении изолирующей суспензии , на ядра винной кислоты , причем суспензия представляет собой этанольную суспензию, содержащую гидроксипропилметилцеллюлозу.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| EP08153667 | 2008-03-28 | ||
| EP08153667.4 | 2008-03-28 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| RU2010143901A true RU2010143901A (ru) | 2012-05-10 |
Family
ID=39705326
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2010143901/15A RU2010143901A (ru) | 2008-03-28 | 2009-03-24 | Способ получения композиций дабигатрана для перорального введения |
Country Status (17)
| Country | Link |
|---|---|
| US (2) | US20110129538A1 (ru) |
| EP (1) | EP2288335A1 (ru) |
| JP (1) | JP2011515439A (ru) |
| KR (1) | KR20100129281A (ru) |
| CN (1) | CN101980697A (ru) |
| AR (1) | AR071569A1 (ru) |
| AU (1) | AU2009228795B2 (ru) |
| BR (1) | BRPI0907598A2 (ru) |
| CA (1) | CA2711766A1 (ru) |
| CL (1) | CL2009000771A1 (ru) |
| IL (1) | IL206718A0 (ru) |
| MX (1) | MX2010010647A (ru) |
| NZ (1) | NZ586868A (ru) |
| RU (1) | RU2010143901A (ru) |
| TW (1) | TW200944513A (ru) |
| WO (1) | WO2009118322A1 (ru) |
| ZA (1) | ZA201004550B (ru) |
Families Citing this family (31)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE102005061623A1 (de) | 2005-12-21 | 2007-06-28 | Boehringer Ingelheim Pharma Gmbh & Co. Kg | Verbessertes Verfahren zur Herstellung von 4-(Benzimidazolylmethylamino)-Benzamidinen und deren Salzen |
| HUE025533T2 (en) | 2008-06-16 | 2016-05-30 | Boehringer Ingelheim Int | A process for preparing an intermediate of dabigatran etexylate |
| BRPI0915942A2 (pt) * | 2008-07-14 | 2019-04-09 | Boehringer Ingelheim International Gmbh | método para produção de compostos medicinais contendo dabigatrana |
| BRPI0921479A2 (pt) | 2008-11-11 | 2016-01-12 | Boehringer Ingelheim Int | método para tratamento ou prevenção de trombose usando etexilato de dabigatran ou um sal do mesmo com aprimorado perfil de segurança em relação à terapia convencional com varfarina |
| US8399678B2 (en) | 2009-11-18 | 2013-03-19 | Boehringer Ingelheim International Gmbh | Process for the manufacture of dabigatran etexilate |
| EA022969B1 (ru) | 2010-07-01 | 2016-03-31 | Крка, Товарна Здравил, Д.Д., Ново Место | Пероральные фармацевтические лекарственные формы, содержащие дабигатрана этексилат и его фармацевтически приемлемые соли |
| JP2015500853A (ja) | 2011-12-22 | 2015-01-08 | ベーリンガー インゲルハイム インターナショナル ゲゼルシャフト ミット ベシュレンクテル ハフツング | 即時放出マルチユニットペレットシステム |
| EP3858337A3 (en) | 2012-02-21 | 2021-09-29 | Towa Pharmaceutical Europe, S.L. | Oral pharmaceutical compositions of dabigatran etexilate |
| CN103420984B (zh) * | 2012-05-24 | 2015-07-08 | 天津药物研究院 | 作为前药的达比加群酯衍生物及其制备方法和用途 |
| CN103420982B (zh) * | 2012-05-24 | 2015-07-08 | 天津药物研究院 | 达比加群酯衍生物及其制备方法和用途 |
| CN103420985B (zh) * | 2012-05-24 | 2015-09-23 | 天津药物研究院 | 作为前药的达比加群酯衍生物及其制备方法和用途 |
| CN103420983B (zh) * | 2012-05-24 | 2015-07-08 | 天津药物研究院 | 达比加群酯衍生物及其制备方法和用途 |
| US20130345262A1 (en) | 2012-06-25 | 2013-12-26 | Boehringer Ingelheim International Gmbh | Method for prevention of stroke |
| CN103127109B (zh) * | 2013-02-05 | 2014-08-13 | 南京华威医药科技开发有限公司 | 含达比加群酯或其盐和水合物的药用组合 |
| CN104224754A (zh) * | 2013-06-21 | 2014-12-24 | 四川海思科制药有限公司 | 一种达比加群酯药物组合物及其制备方法 |
| CN104274410B (zh) * | 2013-07-04 | 2019-04-26 | 江苏豪森药业集团有限公司 | 一种含达比加群酯或其盐的药物组合物 |
| WO2015071841A1 (en) | 2013-11-12 | 2015-05-21 | Druggability Technologies Holdings Limited | Complexes of dabigatran and its derivatives, process for the preparation thereof and pharmaceutical compositions containing them |
| CN104095830A (zh) * | 2014-05-22 | 2014-10-15 | 万特制药(海南)有限公司 | 一种甲磺酸盐达比加群酯胶囊的制备方法 |
| WO2016020471A1 (en) * | 2014-08-07 | 2016-02-11 | Boehringer Ingelheim International Gmbh | Method for producing dabigatran etexilate methanesulphonate |
| CN105560206A (zh) * | 2014-10-13 | 2016-05-11 | 重庆圣华曦药业股份有限公司 | 一种达比加群酯胶囊的制备 |
| CN105640909B (zh) * | 2014-11-14 | 2019-09-20 | 正大天晴药业集团股份有限公司 | 一种含有达比加群酯的药用组合物 |
| WO2017111637A1 (en) | 2015-12-23 | 2017-06-29 | Zaklady Farmaceutyczne Polpharma Sa | Pharmaceutical composition comprising dabigatran or a pharmaceutically acceptable salt thereof |
| CN106727414B (zh) * | 2016-12-27 | 2019-06-07 | 哈药集团技术中心 | 一种甲磺酸达比加群酯微丸及制备方法 |
| CN108261409A (zh) * | 2017-01-02 | 2018-07-10 | 齐鲁制药有限公司 | 一种达比加群酯的口服药物组合物及其制备方法 |
| CN109276569B (zh) * | 2017-07-21 | 2020-09-29 | 四川海思科制药有限公司 | 一种稳定的晶型药物组合物及其制备方法和用途 |
| CN111840245B (zh) * | 2019-04-28 | 2023-07-18 | 成都倍特药业股份有限公司 | 一种达比加群酯药物组合物及其制备方法 |
| EP3771465A1 (en) | 2019-08-01 | 2021-02-03 | Zaklady Farmaceutyczne Polpharma SA | Pharmaceutical composition comprising dabigatran etexilate |
| CN111150714A (zh) * | 2020-03-17 | 2020-05-15 | 南京嘉晨医药科技有限公司 | 一种甲磺酸达比加群酯固体药物制剂及其制备方法 |
| WO2023139243A1 (en) | 2022-01-21 | 2023-07-27 | Adamed Pharma S.A | A process for preparation of tartaric acid cores for dabigatran pellets and the pellets containing dabigatran |
| WO2024217830A1 (en) | 2023-03-30 | 2024-10-24 | Adamed Pharma S.A | A process for preparation of hard capsules filled with dabigatran pellets |
| CN120938941A (zh) * | 2025-10-17 | 2025-11-14 | 杭州高成生物营养技术有限公司 | 一种酒石酸微丸及其制备方法 |
Family Cites Families (27)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6087380A (en) * | 1949-11-24 | 2000-07-11 | Boehringer Ingelheim Pharma Kg | Disubstituted bicyclic heterocycles, the preparations and the use thereof as pharmaceutical compositions |
| US4145308A (en) * | 1977-07-07 | 1979-03-20 | General Electric Company | Anti-foam silicone emulsion, and preparation and use thereof |
| US4191741A (en) * | 1978-09-22 | 1980-03-04 | Eli Lilly And Company | Removable drug implant |
| US5422121A (en) * | 1990-11-14 | 1995-06-06 | Rohm Gmbh | Oral dosage unit form |
| US6414008B1 (en) * | 1997-04-29 | 2002-07-02 | Boehringer Ingelheim Pharma Kg | Disubstituted bicyclic heterocycles, the preparation thereof, and their use as pharmaceutical compositions |
| GB0003782D0 (en) * | 2000-02-17 | 2000-04-05 | Dumex Ltd As | Process |
| US20030181488A1 (en) * | 2002-03-07 | 2003-09-25 | Boehringer Ingelheim Pharma Gmbh & Co. Kg | Administration form for the oral application of 3-[(2-{[4-(hexyloxycarbonylamino-imino-methyl)-phenylamino]-methyl}-1-methyl-1H-benzimidazol-5-carbonyl)-pyridin-2-yl-amino]-propionic acid ethyl ester and the salts thereof |
| EA009664B1 (ru) * | 2002-03-07 | 2008-02-28 | Бёрингер Ингельхайм Фарма Гмбх Унд Ко. Кг | Предназначенная для перорального применения лекарственная форма для этилового эфира 3-[(2-{[4-(гексилоксикарбониламиноиминометил)фениламино]метил}-1-метил-1h-бензимидазол-5-карбонил)пиридин-2-иламино]пропионовой кислоты и его солей |
| DE10337697A1 (de) * | 2003-08-16 | 2005-03-24 | Boehringer Ingelheim Pharma Gmbh & Co. Kg | Tablette enthaltend 3-[(2-{[4-(Hexyloxycarbonylamino-imino-methyl)-phenyl-amino]-methyl}-1-methyl-1H-benzimidazol-5-carbonyl)-pyridin-2-yl-amino]-propionsäure-ethylester oder dessen Salze |
| DE10339862A1 (de) * | 2003-08-29 | 2005-03-24 | Boehringer Ingelheim Pharma Gmbh & Co. Kg | 3-[(2-{[4-(Hexyloxycarbonylamino-imino-methyl)- phenylamino]-methyl}-1-methyl-1H-benzimidazol-5-carbonyl)-pyridin-2-yl-amino]-propionsäure-ethylester-Methansulfonat und dessen Verwendung als Arzneimittel |
| US20050107438A1 (en) * | 2003-09-03 | 2005-05-19 | Boehringer Ingelheim International Gmbh | Pharmaceutical composition comprising 3-[(2-{[4-(Hexyloxycarbonylaminoiminomethyl) phenylamino]-methyl}-1-methyl-1H-benzimidazol-5-carbonyl)-pyridin-2-yl-amino]-propionic acid ethyl ester or a salt therefore |
| EP1609784A1 (de) * | 2004-06-25 | 2005-12-28 | Boehringer Ingelheim Pharma GmbH & Co.KG | Verfahren zur Herstellung von 4-(Benzimidazolylmethylamino)-Benzamidinen |
| DE102005020002A1 (de) * | 2005-04-27 | 2006-11-02 | Boehringer Ingelheim Pharma Gmbh & Co. Kg | Physiologisch verträgliche Salze von 3-[(2-{[4-(Hexyloxycarbonylamino-imino-methyl)-phenylamino]-methyl}-1-methyl-1H-benzimidazol-5-carbonyl)-pyridin-2-yl-amino]-propionsäure-ethylester |
| DE102005025728A1 (de) * | 2005-06-04 | 2006-12-07 | Boehringer Ingelheim Pharma Gmbh & Co. Kg | Polymorphe von 3-[(2-{[4-(Hexyloxycarbonylamino-imino-methyl)-phenylamino]-methyl}-1-methyl-1H-benzimidazol-5-carbonyl)-pyridin-2-yl-amino]-Propionsäure-ethylester |
| DE102005061624A1 (de) * | 2005-12-21 | 2007-06-28 | Boehringer Ingelheim Pharma Gmbh & Co. Kg | Verbessertes Verfahren zur Herstellung von Salzen von 4-(Benzimidazolylmethylamino)-Benzamidinen |
| DE102005061623A1 (de) * | 2005-12-21 | 2007-06-28 | Boehringer Ingelheim Pharma Gmbh & Co. Kg | Verbessertes Verfahren zur Herstellung von 4-(Benzimidazolylmethylamino)-Benzamidinen und deren Salzen |
| AR062058A1 (es) * | 2006-07-17 | 2008-10-15 | Boehringer Ingelheim Int | Nuevas indicaciones pediatricas para los inhibidores directos de la trombina |
| CA2657269A1 (en) * | 2006-07-17 | 2008-01-24 | Boehringer Ingelheim International Gmbh | New indications for direct thrombin inhibitors |
| JP2010505906A (ja) * | 2006-10-10 | 2010-02-25 | ベーリンガー インゲルハイム インターナショナル ゲゼルシャフト ミット ベシュレンクテル ハフツング | 3−[(2−{[4−(ヘキシルオキシカルボニルアミノ−イミノ−メチル)−フェニルアミノ]−メチル}−1−メチル−1h−ベンゾイミダゾール−5−カルボニル)−ピリジン−2−イル−アミノ]−プロピオン酸エチルエステルの生理学的に許容される塩 |
| DE102006054005A1 (de) * | 2006-11-16 | 2008-05-21 | Boehringer Ingelheim Pharma Gmbh & Co. Kg | Neue Polymorphe von 3-[(2-{[4-(Hexyloxycarbonylamino-imino-methyl)-phenylamino]-methyl}-1-methyl-1H-benzimidazol-5-carbonyl)-pyridin-2-yl-amino]-propionsäure-ethylester |
| EP1956018A1 (de) * | 2007-02-06 | 2008-08-13 | Boehringer Ingelheim Pharma GmbH & Co. KG | Verfahren zur Herstellung eines Benzimidazolderivats |
| HUE025533T2 (en) * | 2008-06-16 | 2016-05-30 | Boehringer Ingelheim Int | A process for preparing an intermediate of dabigatran etexylate |
| WO2009153214A1 (en) * | 2008-06-16 | 2009-12-23 | Boehringer Ingelheim International Gmbh | Process for the manufacture of an intermediate in the synthesis of dabigatran |
| BRPI0915942A2 (pt) * | 2008-07-14 | 2019-04-09 | Boehringer Ingelheim International Gmbh | método para produção de compostos medicinais contendo dabigatrana |
| CA2750976C (en) * | 2009-02-02 | 2018-10-23 | Boehringer Ingelheim International Gmbh | Lyophilised dabigatran |
| US8399678B2 (en) * | 2009-11-18 | 2013-03-19 | Boehringer Ingelheim International Gmbh | Process for the manufacture of dabigatran etexilate |
| WO2012027543A1 (en) * | 2010-08-25 | 2012-03-01 | Teva Pharmaceuticals Usa, Inc. | Solid state forms of dabigatran etexilate, dabigatran etexilate mesylate and processes for preparation thereof |
-
2009
- 2009-03-24 AU AU2009228795A patent/AU2009228795B2/en not_active Ceased
- 2009-03-24 CN CN2009801113752A patent/CN101980697A/zh active Pending
- 2009-03-24 EP EP09725292A patent/EP2288335A1/en not_active Ceased
- 2009-03-24 RU RU2010143901/15A patent/RU2010143901A/ru unknown
- 2009-03-24 WO PCT/EP2009/053469 patent/WO2009118322A1/en not_active Ceased
- 2009-03-24 KR KR1020107018919A patent/KR20100129281A/ko not_active Ceased
- 2009-03-24 NZ NZ586868A patent/NZ586868A/en not_active IP Right Cessation
- 2009-03-24 BR BRPI0907598-4A patent/BRPI0907598A2/pt not_active IP Right Cessation
- 2009-03-24 US US12/934,727 patent/US20110129538A1/en not_active Abandoned
- 2009-03-24 CA CA2711766A patent/CA2711766A1/en not_active Abandoned
- 2009-03-24 MX MX2010010647A patent/MX2010010647A/es not_active Application Discontinuation
- 2009-03-24 JP JP2011501204A patent/JP2011515439A/ja active Pending
- 2009-03-27 CL CL2009000771A patent/CL2009000771A1/es unknown
- 2009-03-27 AR ARP090101103A patent/AR071569A1/es unknown
- 2009-03-27 TW TW098110299A patent/TW200944513A/zh unknown
-
2010
- 2010-06-28 ZA ZA2010/04550A patent/ZA201004550B/en unknown
- 2010-06-30 IL IL206718A patent/IL206718A0/en unknown
-
2013
- 2013-05-20 US US13/897,949 patent/US20130251810A1/en not_active Abandoned
Also Published As
| Publication number | Publication date |
|---|---|
| CA2711766A1 (en) | 2009-10-01 |
| BRPI0907598A2 (pt) | 2015-07-21 |
| US20110129538A1 (en) | 2011-06-02 |
| US20130251810A1 (en) | 2013-09-26 |
| EP2288335A1 (en) | 2011-03-02 |
| AU2009228795A1 (en) | 2009-10-01 |
| WO2009118322A1 (en) | 2009-10-01 |
| NZ586868A (en) | 2012-02-24 |
| JP2011515439A (ja) | 2011-05-19 |
| KR20100129281A (ko) | 2010-12-08 |
| CN101980697A (zh) | 2011-02-23 |
| CL2009000771A1 (es) | 2010-03-05 |
| IL206718A0 (en) | 2010-12-30 |
| MX2010010647A (es) | 2010-10-20 |
| ZA201004550B (en) | 2011-03-30 |
| AR071569A1 (es) | 2010-06-30 |
| TW200944513A (en) | 2009-11-01 |
| AU2009228795B2 (en) | 2014-02-13 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| RU2010143901A (ru) | Способ получения композиций дабигатрана для перорального введения | |
| RU2011105056A (ru) | Способ получения лекарственных соединений, содержащих дабигатран | |
| CN102365270B (zh) | 新的氧肟酸衍生物、其制备方法以及包含它的药物组合物 | |
| EA200900658A1 (ru) | Производные индазолилэфиров или -амидов для лечения расстройств, опосредованных глюкокортиодными рецепторами | |
| MX378717B (es) | Acidos carboxilicos heterociclicos como activadores de guanilato ciclasa soluble. | |
| PE20120307A1 (es) | Derivados de indazol como antagonistas del receptor ccr4 | |
| CY1111429T1 (el) | 1,3-διυποκατεστημενα αμιδια 4-μεθυλο-1η-πυρρολο-2-καρβονικου οξεος και η χρησιμοποιηση τους για την παρασκευη φαρμακων | |
| EA201990688A1 (ru) | Полиморфные формы соединения, представляющего собой ингибитор киназ, содержащая их фармацевтическая композиция, способ их получения и их применение | |
| MX350862B (es) | Acidos de piperidinil naftilacetico. | |
| MX2011012479A (es) | Moduladores de los receptores 5-ht y metodos de uso de los mismos. | |
| NO20070952L (no) | Formuleringer av suberoylanilidhydroksaminsyre og fremgangsmate for fremstilling av slike | |
| TW200604178A (en) | New substituted thiophene carboxamides, process for their preparation and their use as medicaments | |
| EA201490363A1 (ru) | Новые составы на основе (триметоксифениламино)пиримидинилов | |
| WO2015113321A1 (zh) | 二氨基胍衍生物及其在制备动物饲用生长促进剂中的应用 | |
| EA201001170A1 (ru) | Соли карбоновой и серной кислот сложных эфиров 3-(2,2,2-триметилгидразиниум) пропионата и их использование для синтеза дигидрата 3-(2,2,2-триметилгидразиниум) пропионата | |
| CN104402793A (zh) | 一种3-取代氧化吲哚衍生物及其合成方法和应用 | |
| PE20091735A1 (es) | Derivados del acido 4-dimetilaminobutirico | |
| CN102633741A (zh) | 噻唑类化合物在淡水藻杀藻方面的应用 | |
| BR112020001775A2 (pt) | composto e processo para a preparação do mesmo, composição farmacêutica. | |
| BR112019016775A2 (pt) | Compostos moduladores de receptor delta-opioide contendo aza-heterocíclico com 7 membros, métodos de uso e produção dos mesmos | |
| WO2016131201A1 (zh) | 异丙氧苯胍的系列盐及其在制备饲用生长促进剂中的应用 | |
| RU2015132458A (ru) | Пленочное покрытие препаративных форм, содержащих биологически активные вещества, суспензия для его формирования и способ его нанесения | |
| ATE533758T1 (de) | Verfahren zur herstellung von enantiomerenreinem esomeprazol | |
| EP3221307A1 (en) | Novel 1,3,5 -triazine based pi3k inhibitors as anticancer agents and a process for the preparation thereof | |
| WO2015000555A3 (en) | A novel process for the preparation of tetralin and naphthalene derivatives |