KR20160106200A - 부작용 프로파일을 최소화하면서 편두통의 빠른 완화를 가능하게 하는 dhe의 치료적 투여 방법 - Google Patents
부작용 프로파일을 최소화하면서 편두통의 빠른 완화를 가능하게 하는 dhe의 치료적 투여 방법 Download PDFInfo
- Publication number
- KR20160106200A KR20160106200A KR1020167023885A KR20167023885A KR20160106200A KR 20160106200 A KR20160106200 A KR 20160106200A KR 1020167023885 A KR1020167023885 A KR 1020167023885A KR 20167023885 A KR20167023885 A KR 20167023885A KR 20160106200 A KR20160106200 A KR 20160106200A
- Authority
- KR
- South Korea
- Prior art keywords
- dhe
- migraine
- administration
- receptor
- cmax
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/007—Pulmonary tract; Aromatherapy
- A61K9/0073—Sprays or powders for inhalation; Aerolised or nebulised preparations generated by other means than thermal energy
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/095—Sulfur, selenium, or tellurium compounds, e.g. thiols
- A61K31/10—Sulfides; Sulfoxides; Sulfones
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/47—Quinolines; Isoquinolines
- A61K31/48—Ergoline derivatives, e.g. lysergic acid, ergotamine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/4985—Pyrazines or piperazines ortho- or peri-condensed with heterocyclic ring systems
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/007—Pulmonary tract; Aromatherapy
- A61K9/0073—Sprays or powders for inhalation; Aerolised or nebulised preparations generated by other means than thermal energy
- A61K9/0075—Sprays or powders for inhalation; Aerolised or nebulised preparations generated by other means than thermal energy for inhalation via a dry powder inhaler [DPI], e.g. comprising micronized drug mixed with lactose carrier particles
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/10—Dispersions; Emulsions
- A61K9/12—Aerosols; Foams
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/06—Antimigraine agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Pharmacology & Pharmacy (AREA)
- Life Sciences & Earth Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Epidemiology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- Otolaryngology (AREA)
- Pulmonology (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Organic Chemistry (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Pain & Pain Management (AREA)
- Biomedical Technology (AREA)
- Rheumatology (AREA)
- Neurosurgery (AREA)
- Neurology (AREA)
- Medicinal Preparation (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
- Dispersion Chemistry (AREA)
Abstract
디히드로에르고타민(DHE)을 함유하는 제약 조성물, 및 부작용이나 역효과 없이 편두통을 치료하기 위해 DHE를 환자에게 투여하는 방법이 개시된다. DHE를 사용한 신속한 편두통 치료 방법이 개시되며, 이 방법은 피크 혈장 농도(Cmax)를 억지하여 피크를 약간 유예시킴으로써, 예를 들어 도파민성 수용체 및 아드레날린성 수용체의 활성화는 피하면서 세로토닌 수용체와는 충분한 활성 결합을 달성하여 편두통 증상의 신속한 해결을 가능케 하는 시간 범위 안에 편두통 증상의 완화를 제공하는 것을 포함한다. 이들 방법에 적합한 흡입기 장치가 개시된다. 본 발명의 방법을 실시하기 위한 키트가 개시된다.
Description
본 발명은 편두통 치료 방법에 관한 것이다. 특히, 본 발명은 편두통 증상을 완화하는 의약의 투여와 관련된 부작용, 또는 역효과를 최소화하면서 편두통 및 관련 증상들을 치료하는 방법에 관한 것이다. 더 구체적으로, 본 발명은 디히드로에르고타민(DHE)을 함유하는 제약 조성물, 및 부작용 없이 편두통을 치료하기 위해 환자에게 이런 제약 조성물을 투여하는 방법에 관한 것이다.
편두통은 환자가 의사에게 상담하는 가장 흔한 두통이다. American Migraine Study II에 따르면, 미국에서는 12세 이상의 사람 중 약 2800만 명(인구의 약 13%)이 국제두통학회(International Headache Society)에 의해 확립된 편두통의 의학적 정의에 부합하는 두통을 앓고 있다. 이것은 미국에서 4가구마다 1명의 편두통 환자가 있다는 얘기이다. 편두통의 의학적 정의에 부합하는 두통으로 진단되는 환자의 퍼센트는 10년 전과 비교하여 증가했다. 전체 편두통 환자의 대다수(53%)는 통증으로 인해 심각한 손상이 일어나거나 이따금 한번에 며칠씩 침대에 누워있게 된다고 설명한다. 지난 10년간 편두통의 치료에 있어서 의사들의 접근 방식에는 획기적인 변화가 없었다(Lipton, R.B., et al., Headache. (2001) 41:638-645, 646-657).
편두통의 진단을 위한 임상판정 규칙인 3-문항 편두통 확인법(ID Migraine)이 개발되었다(Stewart, W.F., et al., Neurology. 1994; 44(6 suppl 4):S17-23). 편두통은 일종의 일차성 두통으로서, 일부 사람들은 경시적으로 반복 경험하게 된다. 편두통은 메스꺼움, 구토 또는 광과민증 등의 증상과 함께 발생한다는 점에서 다른 두통과는 다르다. 대부분의 사람은 머리 한쪽에만 고동치는 듯한 통증을 느낀다. 편두통은 "전조가 있는 편두통" 또는 "전조가 없는 편두통"으로 분류된다. 전조는 일련의 신경학적 증상으로서, 일반적으로 경고 신호로서 작용하는 시각 교란이다. 전조를 경험하는 환자에게는 전형적으로 두통으로 인한 통증이 시작되기 직전에 밝게 빛나는 유색 빛의 번쩍임이나 또는 깜박거리는 빛이 보인다. 그러나, 대부분의 사람에게는 이러한 경고 신호가 없다.
다수의 체액성 물질들이 편두통의 주 요인일 것으로 추측된다. 이들은 세로토닌, 히스타민, 프로스타글란딘류, 혈소판 인자들, 엔돌핀류, 및 혈관작용성 신경펩티드들을 포함한다. 많은 연구자들이 편두통의 병인을 연구했다. 현재의 연구는 혈관성 두통의 혈관확장제/혈관수축제 메커니즘, 즉 동맥 확장이 통증을 일으키고 수축이 통증을 완화한다는 것을 더 이상 충분히 뒷받침하지 않는다. 또한, 혈관성 두통의 원인 인자로서 경뇌막에서 발생할 수 있는 무균성 염증을 관련시키는 연구가 현재 진행되고 있다. 미지의 촉발제가 혈관작용성 신경펩티드(섭스턴스 P, 칼시토닌 유전자-관련 펩티드 등)를 방출하는 혈관주위의 삼차신경 축삭을 활성화한다. 이들 물질은 국소 염증, 즉 혈관 확장, 혈장의 혈관외유출, 비만세포 탈과립을 야기하며, 이로써 뇌줄기와 고위 중추로 충격이 전달되어 두통으로서 등재된다(Moskowitz, M.A.(1992) Neurogenic versus vascular mechanisms of sumatriptan and ergot alkaloids in migraine. Trends Pharmacol. Sci. 13, 307-311).
편두통 치료법은 예방적이거나 대증적이다. 예방적 약물치료는 한 달에 2회 내지 4회 이상의 두통을 경험하는 환자에 대해서 일상생활을 방해받을 만큼 충분히 심각할 경우 선택될 수 있다. 프로파놀롤(INDERAL®)과 같은 베타 차단제가 가장 흔히 사용된다. 자주 사용되는 다른 의약들은 메티세르자이드 말레에이트(SANSERT®), 칼슘 채널 차단제(VERAPAMIL®), 아미트립틸라인(ELAVIL®), 및 벨라도나 알 칼로이드와 페노바르비탈을 함유한 에르고타민 조제 등의 세로토닌 길항제들을 포함한다. 이들 의약은 모두 진정작용, 에너지와 정력의 상실, 구강 건조, 변비, 체중 증가, 및 위장 경련과 통증을 포함하는 상당한 부작용을 가진다. 대증적 치료에는 카페인을 함유하는 에르고타민(CAFERGOT®)이 흔히 사용된다. 편두통을 치료하는데 사용되는 다른 의약들은 이소메텝텐 뮤케이트(MIDRIN®), 비-스테로이드성 항염제(NSAID 류, MOTRIN®, NAPROXEN® 등), 디히드로에르고타민 및 신규 트립판류, 예를 들어 수마트립탄(IMITREX®) 등을 포함한다. FIORTNAL WITH CODEINE®(코데인과 함께 부타비탈) 같은 마약류가 주로 사용되는 경우, 반동성 두통 및 습관성 두통이 발생할 상당한 가능성을 포함하여, 추가의 위험에 직면하게 된다.
편두통 치료에는 세로토닌 효현제(agonist)의 투여가 잘 확립되어 있다. 가장 널리 사용되는 세로토닌 효현제는 트립판류로서, 수마트립판, 졸미트립판, 나라트립판, 리자트립판, 엘레트립판, 프로바트립판 및 알모트립판을 포함한다. 이들 화합물은 세로토닌 5-HT1D /1B 수용체와 특이적으로 결합한다. 또한, 정도는 덜하지만, 에르고타민 타르트레이트(본원에서는 에르고타민이라고 한다) 및 디히드로에르고타민 메실레이트(디히드로에르고타민 또는 DHE라고 한다)와 같은 에르고트 알칼로이드가 급성 편두통의 치료 등을 포함하여, 다양한 질환 상태에 사용된다.
에르고타민 및 DHE는 직장, 경구, 설하 및 비강내 생체이용율이 매우 낮다(투여된 용량의 단지 2% 내지 10%만이 전신 순환계에 도달한다). 또한, 이들 투여 경로는 치료 효능의 개시가 비교적 느려서 비강내 송달의 경우 45분에서부터 경구 또는 설하 송달의 경우에는 2시간까지 걸린다. 정맥내 투여는 생체이용률이 높은 한편, 일반적으로 30분 미만으로 치료 효능의 개시도 빠르다. 그러나, 주사는 통증이 있고, 국소 염증을 일으키며, 순응성이 낮고, 정맥 투여가 고비용의 임상 감독을 필요로 하기 때문에, 에르고트 알칼로이드는 폐 흡입에 의해서 투여하는 것이 매우 바람직하다. 에르고트 알칼로이드의 폐 흡입은, 폐포 상피로부터 모세관 순환계로의 수송이 빠르고, 폐에는 대사 메커니즘이 비교적 부족하기 때문에 순환계에 약물이 도달하기 전의 대사를 최소화할 것이다. 폐 송달은 에르고타민 타르트레이트의 경우 92%까지의 생체이용률을 가져오는 것으로 증명되었다. 또한, 폐 흡입 투여는 편두통 약물치료에 전형적으로 나타나는 위장 장애를 피할 수 있고, 에르고트 알칼로이드의 쓴맛으로 인하여 코나 설하 투여시 경험하게 되는 불쾌한 맛이 최소화될 것이다. 폐 흡입은 주사의 침습성 및 임상 감독 비용과 관련된 치료제 투여의 꺼림칙함을 최소화할 것이다. 또한, 폐 흡입은 주사의 침습적 성질 없이 약물이 전신 순환계에 정맥내 일시 송달 정도로 빨리, 30분 미만 안에 송달되므로 편두통 증상의 빠른 완화가 가능할 것이다.
디히드로에르고타민(DHE)은 거의 50년 전에 효과적인 편두통 치료제라고 확인되었다(Raskin, Neurology. 36:995-997(1986); Silberstein, et al., Headache. 30:334-339(1990); Saadah, Headache. 32:18-20(1992); 및 Winner, Headache. 33: 471-475(1993)). 많은 참고문헌이 에르고타민이라고도 하는 에르고타민 타르트레이트의 에어로졸 송달은 설명하고 있지만, 폐 흡입의 경우, 폐 흡입에 의한 DHE의 송달과 관련된 교시는 거의 없다. 에르고타민 타르트레이트와 동일한 방식에 의한 DHE의 송달은 DHE를 상기 제제 중에 안정화하는 것이 매우 어렵기 때문에 쉽게 달성되지 않는다. DHE(D.H.E.45®-Novartis)는 50년간 근육내 주사 또는 정맥내(IV) 주사에 의해 투여되었다(Belgrade, et al., Neurology. 39:590-592(1989); Winner, Headache. 33:471-475(1993)). DHE(MIGRANAL®-Novartis)는 10년 동안 비강 투여에 의해 투여되었다. 또한, DHE는 피하 투여했을 때 효과적이다(Klapper, et al., Headache. 32:21-23(1992); Winner, et al., Arch. Neurol. 53:180-184(1996); 및 Becker, et al., Headache. 36:144-148(1996)). 그러나, DHE의 투여는 바람직하지 않은 부작용 프로파일과 관련되었으며, DHE의 사용시 메스꺼움, 구토, 흉부 압박감 및 관련 심혈관 효과, 예를 들어 혈압 불안정 및 동맥 수축이 기록되었다.
DHE의 투여는 편두통의 치료에는 효과적이지만 종종 메스꺼움, 구토 및 흉부 통증 같은 부작용을 동반한다(Winner, et al., Arch. Neurol. 53:180-184(1996)). D.H.E.45®(디히드로에르고타민 메실레이트) 주사(USP)를 받은 환자들에서 시판 후 조사에서 관찰된 다른 부작용들은 혈관경련, 이상감각, 고혈압, 현기증, 불안, 호흡곤란, 두통, 홍조, 설사, 발진, 발한 증가, 심장판막질환, 및 디히드로에르고타민의 장기간의 사용 후에 보이는 늑막 및 후복막 섬유화증을 포함한다. 최소한 하나의 부작용, 즉 메스꺼움은 근육내 투여 또는 비강내 투여보다 정맥내 투여 후에 더 자주 발생한다. 불과 1.5mM의 농도로 피하 투여한 경우에도 DHE는 치료된 환자 중 거의 16%에서 메스꺼움을 유발하는 것으로 기록되었다(Winner, et al., Arch. Neurol. 53:80-184(1996)). DHE의 주사 또는 IV 사용에 대하여 현재 수용되는 치료 알고리즘(도 6 참조)은 메스꺼움을 예방하기 위해 DHE의 투여 전이나 DHE의 투여와 동시에 항구토제를 투여를 요한다. 기지의 심혈관 질환을 가진 환자는 DHE 치료를 받을 수 있는 자격이 되지 않는다.
이런 바람직하지 않은 부작용에도 불구하고 DHE는 여전히 중증 편두통, 군집성 두통, 만성 일과성 두통의 치료를 위한 "우수한 표준"이라고 간주된다. DHE는 수마트립판보다 작용 지속기간이 길며, 그래서 DHE의 사용시 두통 재발률이 낮아진다(Winner, P., et al., A double blind study of subcutaneous dihydroergotamine versus subcutaneous sumatriptan in the treatment of acute migraine. Arch. Neurol.(1996) 53:180-184). 따라서, DHE의 투여와 관련된 종래의 부작용 없이 치료적 유효량의 DHE를 시간-민감성 방식으로 송달하기 위한 과정이 필요하다.
발명의 개요
본 발명은 (a) 하나 이상의 제 1 수용체에 결합하며, 제 1 수용체와 화합물의 결합이 질환 또는 상태를 완화하고, (b) 하나 이상의 제 2 수용체에 결합하며, 제 2 수용체와 화합물의 결합이 부작용을 일으키는 화합물을 사용하여 개체의 질환 또는 상태를 신속히 치료하는 방법에 관한 것으로서, 상기 방법은 화합물이 제 1 수용체에 대한 효현제로서 작용하여 질환 또는 상태의 완화가 제공될 수 있는 화합물의 순환 혈장 농도 수준이 발현되기에 충분한 속도로 일정량의 화합물을 개체에게 투여하는 단계를 포함하며, 이때 화합물의 순환 혈장 농도 수준은 제 2 수용체와 결합하여 부작용을 야기하는데 필요한 수준 미만으로 유지된다.
한 구체예에서, 본 발명은 부작용을 최소화하면서 DHE를 사용하여 편두통을 신속히 치료하는 방법에 관한 것으로서, 상기 방법은 피크 혈장 농도(Cmax)를 억지하여 피크를 약간 유예시킴으로써, 예를 들어 도파민성 수용체 및 아드레날린성 수용체의 포화는 피하면서 세로토닌 수용체와는 충분한 결합을 달성하여 편두통 증상의 신속한 해결을 가능케 하는 시간 범위 안에 편두통 증상을 완화하는 것을 포함한다.
한 구체예에서, 본 발명은 필요한 환자에게 DHE 또는 그것의 염, 수화물, 다형체, 프로드러그, 이온쌍 및 대사산물을 부작용의 유발 없이 2시간 이내에 편두통 증상이 감소되기에 충분한 양으로 투여하는 방법에 관한 것이다.
본 발명은 DHE가 편두통 증상의 완화와 관련된 세로토닌 수용체에 대한 효현제로서 작용할 수 있는 효과적인 DHE의 순환 혈장 농도 수준이 발현되기에는 충분한 양이지만, 메스꺼움 및 다른 부작용들과 관련된 아드레날린성 수용체 또는 도파민성 수용체와의 활성 결합에는 불충분한 양의 DHE를 개체에게 제공하는 방법에 관한 것이다.
어떤 구체예에서, DHE는 D2와 같은 도파민성 수용체에서 활성 결합의 감소(< 50%) 또는 부재(<20%)를 나타낸다. 어떤 구체예에서, DHE는 5-HT3 수용체에서 활성 결합의 부재(<20%)를 나타낸다. 어떤 구체예에서, DHE는 아드레날린성 수용체에서 활성 결합의 감소(<60%) 또는 부재(<20%)를 나타낸다.
한 구체예에서, DHE는 사람의 순환 혈장에서 Cmax가 40,000pg/mL 농도 미만이고, 피크 혈장 농도가 얻어지는 투여 후 시간(Tmax)이 투여 후 30분 이내에 발생되는 속도로 어떤 방법에 의해 투여된다.
본 발명의 어떤 구체예에서, 순환 혈장에서 DHE의 Cmax는 20,000pg/mL 미만, 또는 15,000pg/mL 미만, 또는 10,000pg/mL 미만, 또는 7,500pg/mL 미만이다. 어떤 구체예에서, 순환 혈장에서 DHE의 Tmax는 바람직하게 20분 미만이고, 가장 바람직하게는 15분이다.
본 발명의 한 양태에 따라서, 본 발명의 방법에 의해서 투여된 DHE의 Cmax는 직접 정맥내 송달 또는 서방형 일시 정맥내 송달에 의해 투여된 DHE의 Cmax에 비해 적어도 5배, 10배 또는 15배 감소된다.
본 발명의 한 양태에 따라서, 본 발명의 방법에 의해서 투여된 DHE의 Tmax는 직접 정맥내 송달에 의해 투여된 DHE의 Tmax에 비해 1분 이상 지연되고, 본 발명의 방법에 의해서 송달된 약물의 AUC(또는 시간에 대한 전신 순환계 중 약물 농도 곡선의 면적)는 비교가능한 용량을 정맥내 송달한 경우의 75% 이내이다.
본 발명의 한 양태에 따라서, DHE 제제는 호흡 활성화 방식의 정량 흡입기에 의해 개체에게 투여되며, 이때 DHE는 사람의 순환 혈장에서 피크 혈장 농도(Cmax)가 10,000pg/mL 미만이고, 피크 혈장 농도가 얻어지는 투여 후 시간(Tmax)이 투여 후 20분 미만이 되는 속도로 투여되며, 또한 DHE 제제는 개체에게 항구토제를 투여하지 않고 투여된다.
본 발명의 방법에 따라서, 상기 설명된 Cmax 및 Tmax를 달성할 수 있는 DHE의 투여는 30분 이내에 통증, 메스꺼움, 고성공포증 및 광선공포증 등을 포함하는 편두통 증상의 적어도 부분적인 완화를 가져오고, 완화는 24시간 지속되며, 약물에 의한 메스꺼움, 심혈관 부작용 또는 다른 역효과는 유발하지 않는다.
한 구체예에 따라서, 편두통 증상의 적어도 부분적인 완화는 DHE의 투여 시점에서 편두통 증상에 대한 "0"을 초과하는 IHS 점수가 투여 30, 60, 90 또는 120분 후에 ≤1의 점수로 하락하는 것에 의해서 측정된다.
본 발명의 방법에 따라서, 8-히드록시 디히드로에르고타민 등을 포함하는 주 활성 대사산물의 피크 혈장 농도가 Cmax에서 40,000pg/mL 미만이 되도록 투여된다. 어떤 구체예에서, 순환 혈장에서 주 대사산물의 Cmax는 바람직하게 1,000pg/mL 미만, 더 바람직하게 500pg/mL 미만, 가장 바람직하게 200pg/mL 미만이다. 어떤 구체예에서, 순환 혈장에서 주 대사산물의 Tmax는 바람직하게 90분 미만, 가장 바람직하게 60분이다.
본 발명의 한 양태에서, 방법은 DHE 또는 그것의 염, 수화물, 다형체, 프로드러그, 이온쌍 및 대사산물의 3.0mg 미만의 단위 용량을 전신 순환계에 투여하는 것을 포함한다. 바람직한 구체예에서, 1.0mg의 단위 용량이 투여된다.
또한, 본 발명은 개체에게 투여되었을 때 바람직한 송달 프로파일을 달성하는 적합한 DHE 제제에 관한 것이다.
본 발명의 방법에 따라서, DHE 제제는, 제한되는 것은 아니지만, 정맥내, 동맥내, 복강내, 폐내, 경구, 설하, 구강, 비강내, 경구 흡입, 소포내, 근육내, 기관내, 피하, 이온삼투요법, 안내, 경막내, 경점막, 및 경피 송달을 포함하는 어떤 방식에 의해 투여될 수 있다.
바람직한 방식에서, 투여 방법은 에어로졸, 건조 분말 흡입기, 네뷸라이저, 기화기, 압력식 정량 흡입기(pMDI) 등을 이용하는 폐 흡입이다. 더 바람직한 구체예에서, 호흡 활성화 방식 정량 흡입기(예를 들어, TEMPO™ 흡입기, 캘리포니아 마운틴뷰 소재 Map Pharmaceuticals 제조)와 같은 pMDI를 사용하여 DHE를 투여한다.
또한, 본 발명은 DHE 제제 및 그것의 사용설명서를 포함하는 키트에 관한 것이다. 바람직한 구체예에서, 흡입기 장치가 포함된다. 이런 키트의 한 구체예에서, DHE 제제가 흡입기 장치에 로딩된다. 다른 구체예에서, 키트는 DHE 제제의 단위 용량을 하나 이상 포함한다. 한 구체예에서, 흡입기 장치는 호흡 활성화 방식 정량 흡입기(TEMPO™ 흡입기)와 같은 pMDI이다.
또한, 본 발명은 DHE 제제의 단위 용량을 하나 이상 포함하는 흡입기 장치에 관한 것으로서, 이때 각 단위 용량은 사람의 순환 혈장에서 피크 혈장 농도(Cmax)가 10,000pg/mL 미만이고, 피크 혈장 농도가 얻어지는 투여 후 시간(Tmax)이 투여 후 30분 미만이 되는 속도로 투여된다.
하기 발명의 상세한 설명 및 첨부한 도면과 구체예에서 본 발명 및 본 발명의 다른 목적, 특징 및 이점들이 더 명백해질 것이다.
도 1은 위약에 대하여 DHE를 사용했을 때 통증이 완화된 피험자의 퍼센트를 나타낸다.
도 2는 최소한의 부작용으로 통증 완화를 달성하기 위한 약동학적 프로파일을 나타낸다.
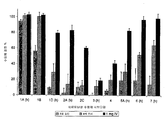
도 3은 세로토닌성 수용체 서브타입에 대한 방사성 리간드 수용체 결합 프로파일을 용량 및 투여 경로에 기초하여 나타낸다. 20% 미만을 불활성 결합으로 분류하였고, "(h)"는 클로닝된 사람 수용체 서브타입을 나타낸다.
도 4는 아드레날린성 수용체 및 도파민성 수용체 서브타입에 대한 방사성 리간드 수용체 결합 프로파일을 용량 및 투여 경로에 기초하여 나타낸다. 20% 미만을 불활성 결합으로 분류하였고, "(h)"는 클로닝된 사람 수용체 서브타입을, "NS"는 비-특이적 결합을 나타낸다.
도 5는 다양한 농도의 DHE의 5-HT1B 및 5-HT2B 수용체에서의 선택적 효현작용을 나타낸다.
도 6은 DHE의 주사 또는 정맥내 투여에 대한 현재 수용되는 치료 알고리즘을 나타낸다.
도 7은 흡입 및 정맥내(IV) 경로에 의한 DHE의 투여 후 시간 경과에 따른 8'OH-DHE 농도의 기하 평균을 나타낸다.
도 2는 최소한의 부작용으로 통증 완화를 달성하기 위한 약동학적 프로파일을 나타낸다.
도 3은 세로토닌성 수용체 서브타입에 대한 방사성 리간드 수용체 결합 프로파일을 용량 및 투여 경로에 기초하여 나타낸다. 20% 미만을 불활성 결합으로 분류하였고, "(h)"는 클로닝된 사람 수용체 서브타입을 나타낸다.
도 4는 아드레날린성 수용체 및 도파민성 수용체 서브타입에 대한 방사성 리간드 수용체 결합 프로파일을 용량 및 투여 경로에 기초하여 나타낸다. 20% 미만을 불활성 결합으로 분류하였고, "(h)"는 클로닝된 사람 수용체 서브타입을, "NS"는 비-특이적 결합을 나타낸다.
도 5는 다양한 농도의 DHE의 5-HT1B 및 5-HT2B 수용체에서의 선택적 효현작용을 나타낸다.
도 6은 DHE의 주사 또는 정맥내 투여에 대한 현재 수용되는 치료 알고리즘을 나타낸다.
도 7은 흡입 및 정맥내(IV) 경로에 의한 DHE의 투여 후 시간 경과에 따른 8'OH-DHE 농도의 기하 평균을 나타낸다.
발명의 상세한 설명
본 발명의 방법에 따라서, 용어 "디히드로에르고타민(DHE)"의 사용은 DHE 또는 그것의 염, 수화물, 다형체, 프로드러그, 이온쌍 및 대사산물을 포함한다.
본 발명은 필요한 환자에게 DHE 또는 그것의 염, 수화물, 다형체, 프로드러그, 이온쌍 및 대사산물을 부작용을 유발하지 않고 특정된 시간 기간 안에 편두통 증상을 감소시키기에 충분한 양으로 투여하는 방법에 관한 것이다.
특정된 시간 기간 안에 편두통 증상을 감소시키기 위하여, 30, 60, 90, 120 또는 180분의 기간 이내에 통증, 메스꺼움, 고성공포증 및 광선공포증 등을 포함하는 적어도 하나의 편두통 증상의 부분적인 완화를 제공하는 것을 포함할 수 있다. 또한, 편두통 증상의 감소는 6, 12, 18, 24 또는 36시간의 지속적인 완화를 제공하는 것을 포함할 수 있다.
편두통 증상 중 어느 것의 완화는 DHE의 투여 시점에서 "0"을 초과하는 IHS 점수(통증에 대해서는 >1의 점수)가 투여 30, 60, 90, 120 또는 180분 후에 ≤1의 점수로 하락하는 것에 의해서 측정된다. 그러나, 통증(또는 다른 중증 증상)의 소멸은 그 증상의 등급이 처음의 >0의 결과(통증에 대해서는 >1의 점수)에서 해당 시점에서는 0으로 내려가는 것이 필요하다.
부작용을 유발하지 않고 편두통 증상을 감소시키기 위해서, 약물에 의한 메스꺼움, 구토, 흉부 압박감 및 관련 심혈관 효과, 예를 들어 혈압 불안정 및 동맥 수축, 또는 DHE를 사용한 편두통의 치료와 관련된다고 알려진 어떤 다른 역효과를 유발하지 않는 치료적 유효량의 DHE를 투여하는 것을 포함할 수 있다
본 발명은 DHE가 편두통 증상의 완화와 관련된 세로토닌 수용체에 대한 효현제로서 작용할 수 있는 효과적인 DHE의 순환 혈장 농도 수준이 발현되기에 충분한 양으로 DHE를 개체에게 제공하는 방법에 관한 것으로서, 이때 Cmax는 30, 60, 90, 120 또는 180분의 기간 이내에 통증, 메스꺼움, 고성공포증 및 광선공포증 등을 포함하는 적어도 하나의 편두통 증상의 부분적 완화를 제공하기에 충분하거나, 또는 6, 12, 18, 24 또는 36시간의 지속적인 완화를 제공하기에 충분한 시간 기간(Tmax) 안에 얻어진다.
더욱이, 본 발명의 투여 방법에 따라서 시간 기간(Tmax) 안에 얻어진 Cmax는 DHE와 아드레날린성 수용체 또는 도파민성 수용체가 활성 결합하여 메스꺼움 및 다른 부작용을 야기하기에는 불충분하다.
DHE와 아드레날린성 수용체 또는 도파민성 수용체의 결합이 메스꺼움 및 다른 부작용을 야기하는데 불충분한 경우, DHE는 D2와 같은 도파민성 수용체에서 결합의 감소(50% 미만) 또는 부재(20% 이하)를 나타내고, DHE는 아드레날린성 수용체에서 결합의 감소(60% 미만) 또는 부재(20% 이하)를 나타낸다.
본 발명에 따라서, DHE는 사람의 순환 혈장에서 Cmax가 5,000, 10,000, 20,000, 30,000, 40,000, 50,000 또는 60,000pg/mL 농도 미만이고, 피크 혈장 농도가 얻어지는 투여 후 시간(Tmax)이 투여 후 10, 15, 20, 30, 45 또는 60분 이내에 발생되는 속도로 어떤 방법에 의해 투여된다.
본 발명의 방법에 따라서, 8-히드록시 디히드로에르고타민 등을 포함하는 주 활성 대사산물의 피크 혈장 농도가 Cmax에서 5,000, 10,000, 20,000, 30,000, 40,000, 50,000, 60,000, 100,000 또는 200,000pg/mL 미만이 되도록 투여된다. 주 대사산물의 Tmax는 투여 후 30분, 45분, 60분, 90분 또는 120분 미만이다.
본 발명의 한 양태에 따라서, 본 발명의 방법에 의해서 투여된 DHE의 Cmax는 직접 정맥내 송달에 의해 투여된 DHE의 Cmax보다 적어도 5배, 10배 또는 15배 감소된다.
본 발명의 한 양태에 따라서, 본 발명의 방법에 의해서 투여된 DHE의 Tmax는 직접 정맥내 송달에 의해 투여된 DHE의 Tmax보다 1, 2, 5, 10 또는 15분 이상 지연되고, 본 발명의 방법에 의해서 송달된 약물의 AUC(또는 시간에 대한 전신 순환계 중 약물 농도 곡선의 면적)는 비교가능한 용량을 정맥내 송달한 경우의 75% 이내이다.
본 발명의 한 양태에서, 방법은 약 0.5, 1.0, 2.0, 3.0 또는 5.0mg의 DHE 또는 그것의 염, 수화물, 다형체, 프로드러그, 이온쌍 및 대사산물을 포함하는 단위 용량의 투여를 포함한다.
본 발명은 DHE의 단위 용량을 하나 이상 포함하는 패키지 형태의 바이알, 캐니스터, 앰플, 팩, 또는 패치에 관한 것이다. 단위 용량은 정맥내, 동맥내, 복강내, 폐내, 경구, 설하, 구강, 비강내, 경구 흡입, 소포내, 근육내, 기관내, 피하, 이온삼투요법, 경피 송달에 의한 투여에 적합한 방식으로 제제화되어 패키지될 수 있다. 바람직한 구체예에서, DHE의 용량은 정맥내 송달 또는 폐 흡입에 적합한 방식으로 패키지된다.
또한, 본 발명은 적합한 조건 하에서 포유동물에 투여되었을 때 상기 서술된 AUC, Cmax 및 Tmax 값에 의해서 정의된 바람직한 송달 프로파일을 달성하는 적합한 고체, 액체 또는 에어로졸 DHE 제제에 관한 것이다.
본 발명의 방법에 따라서, DHE 제제는 상기 서술된 Cmax 및 Tmax 값에 의해서 정의된 바람직한 송달 프로파일을 달성하는데 필요한 어떤 방식으로 투여될 수 있으며, 이러한 방식은, 제한되는 것은 아니지만, 정맥내, 동맥내, 복강내, 폐내, 경구, 설하, 구강, 비강내, 경구 흡입, 소포내, 근육내, 기관내, 피하, 이온삼투요법, 경피 투여를 포함한다.
전형적으로, DHE 제제는 투여 키트 형태로 클리닉, 의사 또는 환자에게 유통될 것이며, 본 발명은 이러한 편두통 치료 키트를 제공한다. 이러한 키트는 하나 이상의 투여 장치(예를 들어, 주사기와 바늘, 흡입기 등)와 복수의 단위 용량 또는 상기 설명된 조성물의 복수의 단위 용량을 송달하도록 구성된 저장소 또는 저장고를 포함한다. 한 구체예에서, DHE 제제가 투여 장치에 로딩된다. 키트는 담체 또는 희석제, 케이스 및 적절한 투여 장치의 채택을 위한 설명서를 추가로 포함할 수 있다. 어떤 구체예에서, 흡입기 장치가 포함한다. 이 키트의 한 구체예에서, DHE 제제를 함유하는 저장소가 흡입기 장치에 로딩된다. 다른 구체예에서, 키트는 DHE 제제의 단위 용량을 하나 이상 포함한다. 한 구체예에서, 흡입기 장치는 pMDI, 예를 들어 호흡 활성화 방식 정량 흡입기(TEMPO™ 흡입기)이다.
편두통의 치료를 위한 디히드로에르고타민(
DHE
)
디히드로에르고타민(DHE)은 반합성 에르고트 알칼로이드로서, 1946년부터 편두통의 치료에 사용되고 있다. DHE는 생리학적 분자와의 구조적 유사성으로 인하여 생체 아민 수용체 - 구체적으로 세로토닌(5-HT) 서브타입, 아드레날린성(α 및 β) 서브타입 및 도파민성(D) 서브타입에 대한 효과에 의해 매개되는 광범한 약리작용(표 1)을 가진다.
디히드로에르고타민은 군집성 편두통, 소아 편두통, 지속성 편두통 및 이전에는 변형 편두통이라고 했던 만성 일과성 편두통의 치료에 널리 사용된다. DHE는 현재 경구 및 비강내 경로에 의해 투여된다(MIGRANAL®-Novartis, US 5942251, EP 0865789 A3 및 BE 1006872 A). 그러나, 임상 환경에서는 DHE를 근육내/피하 주사 또는 정맥내 주사(D.H.E.45®-Novartis)에 의해서 투여하는 것이 가장 일반적이다 (Raskin, N.H., Neurol Clin. 1990 Nov; 8(4):857-65).
디히드로에르고타민은 5-HT1D α 및 5-HT1D β 수용체와 높은 친화성으로 결합한다. 또한, 디히드로에르고타민은 세로토닌 5-HT1A, 5-HT2A 및 5-HT2C 수용체, 노르아드레날린 α2A, α2B 및 α1 수용체, 및 도파민 D2L 및 D3 수용체와 높은 친화성으로 결합한다.
편두통에서 디히드로에르고타민의 치료적 활성은 일반적으로 5-HT1D 수용체에서의 효현제 효과에 의한 것이다. 현재 두 가지 이론이 편두통에서 5-HT1D 수용체 효현제의 효능을 설명하기 위해 제안되었다. 한 가지 이론은 동정맥 연결부 상의 것들을 포함하여, 두개내 혈관에 위치한 5-HT1D 수용체의 활성화가 혈관 수축을 일으키고, 이것이 편두통의 완화와 관련된다고 제안한다. 다른 가설은 삼차신경계의 감각신경 종말 상의 5-HT1D 수용체의 활성화가 전-염증성 신경펩티드 방출을 억제한다고 제안한다. 이에 더하여, 디히드로에르고타민은 분만촉진 특성을 지닌다.
에르고트 알칼로이드류는 5-HT1D, 5-HT1A, 5-HT2A, 5-HT2C, 노르아드레날린 α2A, α2B 및 α, 도파민 D2L 및 D3 수용체와 결합할 때 트립판보다 덜 선택적이다. 급성 편두통 치료법에서 DHE는 그 효과를 5-HT1B 수용체(두개내 뇌외 혈관의 수축) 및 5-HT1D 수용체(삼차신경 신경전달의 억제)를 통해 매개하는 것으로 생각된다.
DHE는 표 1에 나타낸 수용체들과 특이적으로 결합한다고 알려져 있다. 표 1은 특정 생체 아민 수용체들에 대한 DHE의 친화성(IC50으로서 측정됨)을 나타낸다. 5-HT1B 및 5-HT1D 수용체에서의 강한 활성과 광범한 수용체-결합 활성이 DHE에서 관찰된다(Silberstein, S.D., McCrory, D.C., Ergotamine and dihydroergotamine: history, pharmacology, and efficacy. Headache. (2003) 43:144-166).
DHE의 화학구조를 아래에 나타낸다:
[표 1]
제제 및 제형
정맥내 DHE의 효능 및 안전성을 증명하기 위한 많은 연구가 성인을 대상으로 하여 수행되었다. DHE의 정맥내 용량을 반복 사용하여 중증 편두통을 치료하는 현재의 정맥내 DHE 투여 방법은 Raskin에 의해 도입되었다(Raskin, N.H., Repetitive intravenous dihydroergotamine as therapy for intractable migraine. Neurology. 1986; 36:995-997). 본 명세서에서 "직접 정맥내 송달"이란 Raskin(Neurology 36: 995-997(1986))이 제시한 과정에 따른 DHE의 직접 IV 투여를 말하는 것으로 이해된다.
최근, DHE 제제가 단독으로 그리고 비-스테로이드성 진통제와 조합하여 근육내 자기-주사기용으로 개발되었다(US 20030040537, US 6077539, WO 005781 A3, EP 1165044 A2, CN 1347313 T 및 AU 0038825 A5). 또한, 강력한 진통제와 조합된 DHE가 비강내 투여에 의한 치료를 위해 제제화되었다(US 5756483, EP 0689438 A1, AU 6428894 A1 및 WO 9422445 A3). 또한, 스프레이 제제 또는 에어로졸 제제가 DHE의 설하 투여용으로 개발되었다(US 20030017994). 에르고타민 타르트레이트는 주사, 좌약을 이용한 직장 경로, 및 정량 흡입기(MEDIHALER-ERGOTAMINE®; 캘리포니아 노스릿지 소재 3M Health Care 제조)를 사용한 흡입에 의해서 투여되지만, 경구 또는 설하 경로로 투여되는 것이 가장 일반적이다.
최근, 흡입 투여용 에르고타민 타르트레이트 제제(US 6488648, US 6451287, US 6395300, US 6395299, US 6390291, US 6315122, US 6179118, US 6119853, US 6406681), 특히 추진제 기반 정량 흡입기(MDI)용 제제(US 5720940, US 5683677, US 5776434, US 5776573, US 6153173, US 6309624, US 6013245, US 6200549, US 6221 339, US 6236747, US 6251368, US 6306369, US 6253762, US 6149892, US 6284287, US 5744123, US 5916540, US 5955439, US 5992306, US 5849265, US 5833950, US 58 17293, US 6143277, US 6131566, US 5736124, US 5696744)가 많이 인용되고 있다. 1980년대 후반 3M은 에르고타민 타르트레이트 폐 흡입 제제(MEDIHALER-ERGOTAMINE®)를 개발하여 승인받아 시판하였다. 이 제품은 일관성 없는 제제로 인한 어려움 때문에 1990년대에 시장에서 사라졌다.
또한, 에르고타민 타르트레이트를 사용한 건조 분말 흡입장치의 흡입용 분말이 설명되었다(US 6200293, US 6120613, US 6183782, US 6129905, US 6309623, US 5619984, US 4524769, US 5740793, US 5875766, US 6098619, US 6012454, US 59723 88, US 5922306). 또한, 폐 투여를 위한 수성 에어로졸 에르고타민 타르트레이트 제제가 설명되었다(US 5813597).
본 발명은 하나 이상의 단위 용량을 환자에게 투여했을 때 편두통의 대증적 치료에 효과가 있는 양으로 DHE를 함유하는 단위 용량 형태의 제약 조성물에 관한 것이다. 조성물은 부형제를 함유할 수 있다. 조성물의 산화성 분해 속도를 지연시키기 위해서 하나 이상의 항산화제가 첨가될 수 있다. DHE의 어떤 염이라도 사용될 수 있으며, 메실레이트 염이 바람직하다. 모든 경우 제제는 본 분야의 표준 방법을 사용하여 제조될 수 있다(예를 들어, Remington: The Science and Practice of Pharmacy, 21st ed., Lippincott Williams & Wilkins (2005) 참조). 일반적으로, 환자는 편두통 발작 1번마다 0.1 내지 10.0mg, 바람직하게 0.5 내지 5.0mg, 또는 더 바람직하게 1.0 내지 2.0mg의 총 용량을 받는다. 예를 들어, 부작용이나 역효과의 촉발 없이 편두통을 치료하는데 필요한 생체 아민 수용체 결합 프로파일이 달성될 수 있도록, 특정 조성물 및 투여 방법에 따라서 개체(예를 들어, 사람)에게 투여되는 DHE 제제의 용량이 변할 것이다.
용어 "단위 제형"은 개체를 위한 단위 용량으로서 적합한 물리적으로 분리된 단위를 말하며, 각 단위 제형은 적합한 제약 담체, 희석제 또는 부형제와 함께 바람직한 치료 효과를 야기하도록 계산된 정해진 양의 활성 물질을 함유한다. 이런 단위 제형은 1개의 단위 용량씩 또는 복수의 단위 용량씩 적절히 패키지하여 보관할 수 있으며, 더 나아가 멸균 밀봉될 수도 있다.
또한, 적절한 패키지 형태의 여기 설명된 조성물을 포함하는 제조 물품이 제공된다. 여기 설명된 조성물에 알맞은 적합한 패키지는 본 분야에 공지되어 있으며, 예를 들어 바이알(밀봉 바이알), 계량 밸브가 있는 캐니스터, 베슬, 앰플, 보틀, 자르, 가요성 패키지(예를 들어, 밀봉 마일라 또는 플라스틱 백) 등을 포함한다. 이런 제조 물품은 추가로 멸균 및/또는 밀봉될 수 있다.
또한, 조성물은 추가의 성분들, 예를 들어 보존제, 완충제, 장성조절제, 항산화제 및 안정제, 비-이온성 습윤 또는 청징제, 점도증가제, 흡수증진제 등을 포함할 수 있다.
적합한 흡수증진제는 N-아세틸시스테인, 폴리에틸렌글리콜류, 카페인, 시클로덱스트린, 글리세롤, 알킬당류, 지질류, 레시틴, 디메틸술폭시드 등을 포함한다.
용액에 사용되는 적합한 보존제는 폴리쿼터늄-1, 염화 벤잘코늄, 티메로살, 클로로부탄올, 메틸파라벤, 프로필파라벤, 페닐에틸알콜, 에데트산 이나트륨, 소르브산, 염화 벤제토늄 등을 포함한다. 전형적으로(반드시 그렇지는 않다), 이러한 보존제는 중량 기준으로 0.001% 내지 1.0%의 수준으로 사용된다.
적합한 완충제는 붕산, 중탄산나트륨 및 중탄산칼륨, 붕산나트륨 및 붕산칼륨, 탄산나트륨 및 탄산칼륨, 아세트산나트륨, 이인산나트륨 등을 포함하며, 약 pH 6 내지 pH 8, 바람직하게는 약 pH 7 내지 pH 7.5로 pH를 유지하기에 충분한 양으로 사용된다.
적합한 장성조절제는 덱스트란 40, 덱스트란 70, 덱스트로스, 글리세린, 염화칼륨, 프로필렌글리콜, 염화나트륨 등이며, 안과용 용액과 등가인 염화나트륨은 0.9 +/- 0.2% 범위이다.
적합한 항산화제 및 안정제는 나트륨 바이술파이트, 나트륨 메타바이술파이트, 나트륨 티오술파이트, 티오유레아, 카페인, 크로모글리케이트 염류, 시클로덱스트린류 등을 포함한다. 적합한 습윤 및 청징제는 폴리소르베이트 80, 폴리소르베이트 20, 폴록사머 282 및 티록사폴을 포함한다. 적합한 점도증가제는 덱스트란 40, 덱스트란 70, 젤라틴, 글리세린, 히드록시에틸셀룰로오스, 히드록시메틸프로필셀룰로오스, 라놀린, 메틸셀룰로오스, 페트롤라튬, 폴리에틸렌글리콜, 폴리비닐알콜, 폴리비닐피롤리돈, 카르복시메틸셀룰로오스 등을 포함한다.
투여 방식
본원에 설명된 조성물은 여러 경로를 통해서 개체(예를 들어, 사람)에 투여될 수 있으며, 예를 들어 정맥내, 동맥내, 복강내, 폐내, 경구, 흡입, 소포내, 근육내, 기관내, 피하, 안내, 경막내, 경점막, 및 경피 경로를 포함한다. 본 발명의 한 구체예에서, 본 발명의 화합물의 나노입자(약물과 함께 제제화된 단백질 또는 탄수화물 나노입자를 포함)가, 제한되는 것은 아니지만, 경구, 근육내, 경피, 정맥내 경로, 흡입기 또는 다른 공기 운반 송달 시스템을 통한 경로 등을 포함하는 어떤 허용되는 경로에 의해 투여될 수 있다.
주사용 조성물, 특히 정맥내 송달용 조성물을 제조할 경우, 연속상은 약 4 내지 약 8.5의 pH 범위로 완충된 장성조절제의 수성 용액을 포함하는 것이 바람직하다. 또한, pH는 7 미만 또는 6 미만일 수 있다. 어떤 구체예에서, 조성물의 pH는 약 6 이상이며, 예를 들어 약 6.5, 7, 또는 8 이상이다(예를 들어, 약 7.5 또는 8).
바람직한 구체예에서, DHE는 흡입 요법을 이용하여 송달된다. 흡입된 화합물에 대한 많은 전임상 연구와 임상 연구에 의하여 폐 내에서는 물론 전신적으로도 효능이 달성될 수 있음이 증명되었다. 더욱이, 폐 송달과 관련된 이점이 많이 있는데, 예를 들어 빠른 개시, 환자의 자기-투여의 편리함, 약물 부작용의 감소 가능성, 흡입에 의한 송달의 용이성, 바늘 미사용 등이다.
건조 분말 흡입기, 네뷸라이저, 기화기 및 압력식 정량 흡입기의 흡입 에어로졸은 전형적으로 에어로졸 형태인 이들 약물의 안정성 또는 송달성을 증가시키기 위해 부형제 또는 용매를 포함한다. 추가로, 본 발명의 방법에 부합하는 흡수 특성이 제공되도록 약물 에어로졸의 입자 크기가 조절될 수 있다. 전형적으로, 입자 크기는 당업자에게 공지된 바람직한 크기로 조절된다. 예를 들어, 건조 분말 흡입기(DPI)를 사용할 경우, 분쇄, 마이크로화, 밀링 등의 연마 과정에 의해, 또는 분무건조, 용액 침전, 초임계 추출/침전 또는 동결건조 등의 다상 침전 과정에 의해서 벌크 약물로부터 분말이 수득되고, 이 분말이 추진제 중에 분산되어 폐로의 송달을 허용하는 입자 크기가 획득됨으로써 약물 입자가 만들어진다. 건조 분말 제제는 응집하려는 경향이 있고 유동성이 낮아서 효능이 저하될 수 있기 때문에, 건조 분말 에어로졸이 폐로의 송달에 적합한 입자 크기 분포를 가지고 확실히 송달되도록 하기 위해서는 밀링, 블렌딩, 분말 유동, 충전, 그리고 심지어 투여 과정에서도 세심한 주의가 필요하다.
네뷸라이저는, 일부는 액체 분출물의 분산에 의해서, 일부는 액체의 초음파 진동에 의해서 액체를 에어로졸로 만들며, 노즐을 사용하기도 한다. 액체 제제는 미생물의 잠복 가능성이 있으므로 무균 또는 멸균 조건 하에서 제조되어 보관된다. 보존제 및 단위 용량 패키지의 사용이 고려된다. 추가하여, 약물 제제를 안정화하기 위해 용매, 세제 및 기타 작용제들이 사용된다.
압력식 정량 흡입기, 또는 pMDI는 특수한 부류의 에어로졸 디스펜싱 장치이다. pMDI는 화합물을 가압 하에 용매 및 추진제 혼합물, 일반적으로 클로로플루오로카본류(CFC), 또는 히드로플루오로알칸류(HFA)와 함께 캐니스터에 넣은 것이다. 디스펜싱될 때 혼합물의 분출물이 밸브와 노즐을 통해 배출되며, 추진제가 갑자기 터지면서 화합물의 에어로졸이 남는다. 노즐로부터 에어로졸이 고속 분출되기 때문에, 약물의 일부는 혀, 구강 및 인후에 탄도적 충격을 줄 수 있으며, 폐에는 도달하지 못한다.
폐 흡입을 위한 에르고타민 타르트레이트의 에어로졸 송달은 널리 알려져 있지만, 폐 송달에 적합한 제제로 DHE를 안정화하는 것이 매우 어렵기 때문에 폐 흡입을 통한 DHE의 송달은 거의 사용되지 않고 있다. DHE의 효능 및 활성을 유지하기 위해 DHE는 안정화될 수 있는 용액, 분말 또는 현탁액 형태로 제제화되어야 하며, 폐에 독성이 없는 부형제가 사용되기도 한다. DHE는 극도로 민감하며, 빛, 산소, 열에 노출되면 분해되고, 의약 제제에 통상 사용되는 많은 화학적 화합물들에 의해서도 분해되므로 안정화하는 것이 쉽지 않다. 수성 비강 스프레이 또는 주사에 의해 DHE를 송달하는 현재의 제제는 용액 중에서 DHE를 안정화하기 위해서 덱스트란 또는 시클로덱스트린과 같은 킬레이트화제 또는 착화제가 필요하다. DHE 용액의 분해를 방지하기 위해, DHE 용액은 복잡한 개봉장치를 사용하여 개봉해야 하는 사용하기 어려운 불투명 유리 바이알에 넣어져 밀봉되며, 사용 직전에 주사기나 스프레이 적용장치로 옮겨진다. 최근, DHE의 폐 송달을 위한 안정한 제제가 미국출원 제10/572,012호 및 WO 2005/025506 A2에 설명되었다.
WO 2005/025506 A2는 폐 에어로졸 흡입 또는 비강 스프레이 흡입을 통한 건조 분말과 추진제 현탁액을 투여할 수 있는, 디히드로에르고타민 또는 그것의 제약학적으로 허용되는 염의 적합하고도 안정한 제제를 설명한다. 한 구체예에서, DHE는 메실레이트 염으로서 사용된다. 이 DHE 분말은 흡입 송달되는 DHE 입자의 제조에 있어서 상당한 이점을 제공하며, 단일 단계에서 바람직한 크기의 호흡에 알맞은 입자를 생성하는 초임계 유체 과정을 사용하여 만들어진다. 미국출원 제10/572,012호 및 WO 2005 /025506 A2의 명세서는 그 전문이 참고자료로 본원에 포함된다.
바람직한 구체예에서, 흡입 투약은 TEMPO™ 흡입기(Map Pharmaceuticals, 캘리포니아 마운틴뷰)와 같은 호흡 가동식 흡입기를 사용하여 수행된다. TEMPO™ 흡입기는 표준 pMDI 흡입기의 한계였던 일관성 없는 투약과 비효율적 약물 송달을 해결한 압력식 정량 흡입기(pMDI)이다. TEMPO 흡입기는 환자 순응성이 높은 호흡 가동식이며, 흡입 유속과 무관하게 효과적인 확실한 용량 일관성을 제공한다. 호흡 동기식 촉발장치 및 사용하기 간편한 소형 유속 제어 챔버 및 용량 계량기/잠금장치와 같은 독점적인 특징들을 조합함으로써 이러한 이점들이 달성된다. 이런 진보된 공기역학적 제어 요소는 환자의 호흡에 의해서만 구동되므로, 고가의 전력 소비형 전자장치가 필요 없는 적당한 가격의 신뢰할 수 있는 일회용 플랫폼이다.
DHE
투여 효능의 측정
본 발명은 부작용을 최소화하거나 제거하면서, 동시에 편두통의 4가지 주요 증상인 통증, 메스꺼움, 고성공포증 및 광선공포증의 효과적이며 신속한 완화를 제공하기에 충분한 투약 프로파일을 달성하는 DHE의 투여 방법을 교시한다. 본 발명자들에 의하여 수행된 임상 시험에서 놀라운 현상이 관찰되었다. 전술한 방식으로 DHE가 투여되었을 때, 예상외로 피크 혈장 농도에서 매우 높은 "스파이크"가 나타나지 않았고, 편두통 증상은 여전히 빨리 완화되면서도 메스꺼움, 흉부 압박감이나 통증, 혈압 변동, 구토는 최소화되거나 완전히 사라졌다.
편두통 치료법의 효능은 1차 및 2차 종점에 기초하여 평가될 수 있다. 1차 효능 종점은 투약 약 2시간 후에 통증이 사라졌다는 응답 비율일 수 있다. 2차 효능 종점은, 투약 후 2시간 이내의 시간 지점에서 통증이 사라졌다는 응답; 두통 진행의 멈춤; 및 정상 생활에 대한 영향의 3개 부분을 시험한다.
모두 4가지의 편두통 징후, 즉 통증, 메스꺼움, 고성공포증 및 광선공포증을 국제두통학회(IHS; International Headache Society Committee on Clinical Trials in Migraine. Guidelines for controlled clinical trials of drugs in migraine, 1st ed. Cephalalgia 1991; 11:1-12)에 의해 개발된 4점 스케일에 따라서 각 시간 지점에서 기록한다.
0 = 없음
1 = 경증, 정상적인 일상생활을 방해하지 않음
2 = 중간 정도의 증상, 정상적인 생활에 일부 제약이 생김
3 = 중증, 정상적인 일상생활을 수행할 수 없음
두통 통증 강도는 4점 중증도 스케일(0 = 통증 없음, 1 = 경증, 2 = 중간 정도, 3 = 중증)에 따라서 측정된다. 두통의 개선에 걸린 시간(원래 강도보다 낮아진 한 지점), 경증의 두통이 되는데 걸린 시간, 및 두통이 없어지는데 걸린 시간을 측정한다. 효과적인 편두통 치료법은 1.5 내지 2시간 이내에 두통 증상을 경증 또는 증상 없음으로 감소시킬 것이다.
4가지 증상 중 어느 것의 완화는 편두통 발작의 개시가 기록된 시점에서 >0의 점수(통증에 대해서는 >1의 점수)가 해당 시간 지점에서는 ≤1의 점수로 하락해야 한다. 그러나, 통증(또는 다른 증상)의 소멸은 그 증상의 등급이 처음의 >0의 결과(통증에 대해서는 >1의 점수)에서 해당 시간 지점에서는 0으로 내려가야 한다.
기능적 무능력(평범한 일상생활을 수행하는 능력)은 4점 스케일에 따라서 측정된다:
0 = 전혀 손상 없음
1 = 약간 손상됨
2 = 중간 정도로 손상됨
3 = 심하게 또는 완전히 손상됨
어떤 시간 지점에서 연구 의약의 "전반적인 효과"를 평가하기 위해 환자에게 (연구 약물치료가 얼마나 효과가 있는지) 추가로 질문하는 항목이 있는데, 이것은 7점 범주의 스케일을 이용한다:
0 = 매우 훨씬 나아짐
1 = 훨씬 나아짐
2 = 약간 나아짐
3 = 변화 없음
4 = 약간 악화됨
5 = 훨씬 악화됨
6 = 매우 훨씬 악화됨
작용 메커니즘
실시예 2 및 3에 상세히 설명된 Cmax 농도에서 수용체 결합의 조사는 부작용 프로파일에서 관찰된 차이점들에 대한 이론적 근거를 제공했다. 이론에 결부되지는 않지만, 부작용의 촉발 없이 DHE를 사용하여 편두통을 치료하는 방법은 도파민성 수용체 및 아드레날린성 수용체와의 결합이 최소화되도록 Cmax 농도를 조절하여 부작용을 피하는 동시에, 편두통 증상을 치료하는데 효과적인 충분한 세로토닌 수용체 결합을 달성함으로써 달성될 수 있다고 가정된다.
임상 데이터(표 2)는 흡입된 디히드로에르고타민이 정맥내 투여에 비하여 메스꺼움의 발생을 줄인다는 것을 나타낸다(각각 8% 대 63%). 5-HT3 수용체가 메스꺼움에 관련된다고 알려져 있다. 온단세트론 및 그라니세트론과 같은 이들 수용체의 길항제가 화학요법에 의해 유발되는 메스꺼움 및 구토를 방지한다. 그러나, 조사된 모든 DHE 송달 경로에서 5-HT3 수용체에서 DHE의 잠재적인 효현제 역할은 결합을 불활성화(<20%)시킴으로써 배제될 수 있다(도 3). 또한, 이어진 기능적 분석에서도 5-HT3 수용체에서의 효현제 또는 길항제 활성의 결여가 확인되었다.
DHE의 가능한 부작용 프로파일은 5-HT1A, 5-HT2A, 및 도파민 D2 수용체에서의 효현제 활성에 따른 것이다(Silberstein, S.D., McCrory, D.C., Ergotamine and dihydroergotamine: history, pharmacology, and efficacy. Headache. (2003) 43: 144-166). 모든 용량 및 투여 경로에서 유사한 수준의 5-HT1A 수용체 결합은 이 수용체가 상이한 부작용 프로파일, 특히 현기증의 원인일 수 있음을 배제한다. 사실상, 5-HT1A 수용체는 DHE-매개 편두통의 예방에 있어서 어떤 역할을 할 것으로 생각된다(Hanoun, N., et al., Dihydroergotamine and its metabolite, 8-hydroxy-dihydroergotamine, as 5-HT1A receptor agonists in the rat brain. British Journal of Pharmacology. 2003; 139:424-434).
DHE는 혈관 α-아드레날린성 수용체에서는 흥분 작용을 하고, 수축제인 5-HT2A 수용체에서는 효현제 활성을 가진다. 이러한 작용들은 말초혈관 수축 효과, 특히 관상동맥 평활근에 대한 효과의 근간을 이룬다. 이와 같이, DHE 및 관련 에르고트 화합물은 관상동맥 및 말초혈관 질환에서는 금기시된다. 그러나, 5-HT2A 수용체에서 Cmax 결합 활성이 정맥내 투약(83%)에 비해 더 많은 흡입 투약(14%)에서 낮아졌다는 것을 주목한다. 부작용 프로파일에 대한 다른 세로토닌성 서브타입 및 아드레날린성 타입의 효과는 분명하지 않다. 그러나, 정맥내 투여 후 Cmax에서의 결합은 흡입시의 Cmax에 비해서 상당히 더 많은 결합이 얻어지며(도 3-5), 이것은 메스꺼움에서, 특히 아드레날린성 차단에 있어서 어떤 역할을 할 수 있다.
편두통에서 5-HT의 작용에 대한 근거로서 신경 메커니즘과 혈관 메커니즘이 모두 제안되었다. 편두통의 혈관 확장 이론은 발작 동안 두개외 동맥의 확장이 편두통 통증과 관련된다고 제안한다. 편두통의 신경성 뇌경막 염증 이론에서는 뇌를 둘러싼 뇌경막의 염증이 1차 감각신경 종말로부터 뉴로펩티드가 방출되는 원인이라고 한다. 섭스턴스 P, 칼시토닌 유전자-관련 펩티드 및 NO가 모두 뇌경막 염증 연속반응에서 어떤 역할을 한다. NO 도너가 몇 가지 편두통성 특성을 가진 용량-의존성 두통을 야기하므로 NO는 편두통에서 중요한 역할을 할 것으로 짐작된다. 편두통의 원인은 NO에 의하여 촉발된 연속반응에서 효소의 양 및/또는 효능의 증가일 수 있다(Olesen, et al., Trends Pharmacol. Sci. 1994; 15:149-153).
5-HT2B 수용체는 셀라인에서 NO 생산(Manivet, P., et al., PDZ-dependent activation of nitric-oxide synthases by the serotonin 2B receptor. J. Biol. Chem. 2000; 275:9324-9331) 및 돼지 대뇌 동맥의 이완(Schmuck, et al., Eur. J. Neurosci. 1996; 8:959-967)을 자극한다고 알려져 있다. 따라서, 수막 혈관의 내피세포에 위치한 5-HT2B 수용체에 의한 NO의 형성을 통해 편두통이 촉발된다고 제안되었다. DHE의 반감기가 길기 때문에 적어도 부분적으로는 DHE의 주 활성 대사산물인 8'-OH-DHE에 의한 혈관 5-HT2B-의존성 2차 메신저(NO)의 영구적인 억제를 통해 두통 재발률이 낮아진다고 할 수 있다(Schaerlinger, B., et al., British Journal of Pharmacology. (2003) 140, 277-284).
D2 수용체 길항제들, 즉 메토클로프라미드 및 돔페리돈은 효과적인 메스꺼움 방지 치료법이다. 정맥내 용량의 Cmax 수준에서 DHE는 D2 분석에 따르면 50% 수용체 결합을 나타내며(도 5), 따라서 효현제 활성을 통해 매개되는 메스꺼움과 현기증이 임상 보고될 수 있다. 반대로, 흡입 투약 후에는 결합 친화성이 보고되지 않았다. 여기 보고된 데이터에 더하여, DHE는 또한 무스카린(M) 수용체에서 최소 결합 활성을 가지며, 따라서 화학수용체 촉발 구역 M 수용체-매개 메스꺼움이 배제된다(McCarthy, B.G., Peroutka, S.J., Comparative neuropharmacology of dihydro-ergotamine and sumatriptan(GR 43175). Headache. 1989; 29:420-422).
실시예 2 및 3에 설명된 수용체-결합 연구가 부작용을 최소화한 채로 DHE를 사용하여 편두통을 신속하게 치료하는 신규 방법의 놀라운 결과를 설명할 수 있다. 이 방법은 피크 혈장 농도(Cmax)를 억지하여 피크를 약간 유예시킴으로써 도파민성 수용체 및 아드레날린성 수용체의 포화는 피하면서 세로토닌 수용체와는 충분한 결합을 달성하여 편두통을 치료하는데 바람직한 치료 효과를 갖도록 한다.
[
실시예
]
더 이상의 설명 없이도 당업자라면 전술한 설명에 따라서 본 발명을 충분한 정도로 이용할 수 있다고 믿는다. 다음의 실시예는 본 발명을 예시할 뿐이며, 어떤 식으로도 본 명세서의 나머지 부분을 제한하지 않는다.
실시예
1
통증 완화를 달성하는데 필요한
DHE
의 약동학적 프로파일
도 1은 도 2에 나타낸 2개의 낮은 피크 혈장 농도 프로파일을 달성하는 방법에 의하여 DHE를 투여함으로써 달성된 신속한 통증 완화(10분 이내)를 나타낸다.
도 2는 각각 DHE의 6회 흡입(1.22mg 흡입/미세 입자 용량), 4회 흡입(0.88mg 흡입/미세 입자 용량) 및 2회 흡입(0.44mg 흡입/미세 입자 용량)과 비교된 IV-투여된 1mg DHE에 대한 DHE 혈장 프로파일을 나타낸다. IV에 의한 DHE 투여 후에는 큰 혈장 스파이크가 관찰되었지만, DHE의 흡입 송달에서는 관찰되지 않았다. 1mg IV 투여된 DHE와 0.88mg 흡입 투여된 DHE에서 AUC의 차이는 작지만, 이런 혈장 스파이크의 차이(적어도 "10"배)가 감소된 부작용 프로파일과 관련된다고 가정된다.
도 7은 DHE의 정맥내 송달 및 흡입 송달 후, DHE의 주 대사산물인 8'-OH 디히드로에르고타민의 혈장 프로파일을 나타낸다. IV에 의한 DHE 투여 후에는 8'-OH 디히드로에르고타민에서 큰 혈장 스파이크가 관찰되었지만, DHE의 흡입 송달에서는 관찰되지 않았다. 이런 혈장 스파이크 차이는 역시 감소된 부작용 프로파일과 관련된다고 가정된다. 흡입 투여의 결과로서, 8-히드록시-디히드로에르고타민의 피크 혈장 농도는 순환 혈장에서 Cmax에서 1,000pg/mL 미만, 바람직하게 500pg/mL 미만, 더 바람직하게 200pg/mL 미만이 된다. 또한, 흡입 투여의 결과로서, 순환 혈장에서 주 대사산물(예를 들어, 8'-OH 디히드로에르고타민)의 Tmax는 90분 미만이 된다.
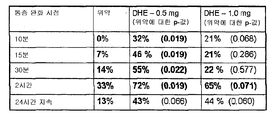
본 발명자들은 이런 약간 유예된 낮아진 피크 약동학적 프로파일이 최소화된 부작용과 관련된다는 것을 발견하였다. 이런 투여 프로파일에 의해 도출되는 부작용을 표 2에 나타낸다. 도 2에서 0.88mg 및 0.44mg DHE에 해당하는 2개의 아래쪽 곡선은 30분 이내에 치료 효능을 달성했으며, 0.88mg 용량에서는 아주 적은 부작용만이 도출되었고, 0.44mg 용량에서는 부작용이 관찰되지 않았다. 오늘날 클리닉에서 실시되는 전형적인 치료법인 1.0mg IV DHE에 해당하는 가장 위쪽 곡선은 메스꺼움과 구토를 포함하는 상당한 부작용을 유발했다. IV보다 약 10배 낮은 것으로 관찰된 낮아진 Cmax, 또는 피크 혈장 농도 차이가 관찰된 상이한 부작용 프로파일과 관련된다고 이론화되었으며, 1mg IV 투여와 0.88mg 흡입 투여에서 "1.2"배의 차이에 불과한 AUC의 적은 차이는 치료 효능의 달성을 가능하게 했다. 이 예에서 도 2에 나타낸 송달 프로파일은 흡입 투여에 의해 달성되었지만, 유사한 AUC를 달성하면서 피크 혈장 농도에 도달하는데 있어서 유사한 약간의 유예와 피크 농도의 유사한 억지를 제공하도록 맞춤 제작된 주입 펌프, 비강, 또는 이온삼투 경피 또는 그외 경로나 투여에 의해서도 달성될 수 있다.
[표2]
실시예
2
Cmax
농도에서의 수용체 결합
1mg IV 투여된 DHE와 흡입 투여된 DHE를 비교한 임상 연구에서 상이한 부작용 프로파일이 보고되었다(표 2). IV 투약 후에 더 많은 부작용이 발생하는 것이 분명했다. 디히드로에르고타민 메실레이트(DHE)의 (1) 정맥내 투여와 (2) 흡입 투여 간의 약리학적으로 매개된 부작용의 차이를 조사하기 위하여, 디히드로에르고타민 메실레이트의 생체 아민 수용체 결합(세로토닌(5-HT), 아드레날린성, 도파민성)을 임상 연구에서 흡입 투약 및 정맥내(IV) 투약 후 보고된 Cmax 수준에 상응하는 농도에 기초하여 시험관내 측정하였다.
낮아진 DHE 스파이크가 상이한 수용체 결합 프로파일을 유도함으로써 부작용을 피하면서 효능을 달성했을 것이라는 놀라운 결과를 조사하기 위하여, Cmax 농도에서의 수용체 결합에 대한 임상 조사를 수행하였다.
3분에 걸친 주입에 의한 정맥내 투여(1mg) 후의 혈장 샘플(LC-MS/MS)과 흡입 투약(0.88mg 및 0.44mg 용량) 후의 혈장 샘플(LC-MS/MS)로부터 피크 혈장 DHE 농도 (Cmax)를 측정하였으며, 이때 흡입 용량은 2-4분의 시간에 걸쳐 흡입기로부터 다중 가동 방식에 의해 제공되었다. 흡입 용량은 예상된 전신 송달 용량으로서, 가동장치로부터 송달되는 미세 입자 용량으로부터 추정하였다. DHE에 대해 관찰된 Cmax 데이터를 도 2에 제시한다. 주 대사산물인 8'-OH-DHE에 대해서도 유사한 접근법을 취하였다.
표 3은 Cmax와 동등한 시험관내 농도를 표시한다. 이들 농도가 DHE 및 8'-OH-DHE에 대한 수용체-결합 조사를 위해 선택되었다.
[표 3]
실시예
3
피크 혈장 농도와 동등한 농도에서의 DHE 에 의한 세로토닌, 아드레날린성 및 도파민성 수용체 결합
방사성 리간드 수용체 결합 분석은 다수의 수용체 부위에서 DHE가 광범한 약리작용을 나타낸다는 것을 분명히 나타낸다(도 3-5). 대부분의 수용체에서 DHE는 IV Cmax와 동등한 농도에서는 상당한 결합을 달성하지만, 흡입 방식에서는 각 용량에서의 결합이 상이한 프로파일을 나타낸다. 대부분의 예에서는 비-IV 방법을 사용하여 투여했을 때 결합이 감소된다.
DHE의 항-편두통 효과는 5-HT1B 및 5-HT1D 수용체에서의 효현제 활성으로 인한 것이다. 도 3은 여러 세로토닌성 수용체 서브타입에서의 수용체 결합 데이터를 나타내며, 이것은 정맥내 투여시에는 Cmax에서 몇몇 서브타입에서의 반응이 더 크다는 것을 시사한다. "(h)" 표시는 클로닝된 사람 수용체 서브타입을 표시한다. 아드레날린성 및 도파민성 서브타입에 대해서도 유사한 경향이 관찰되었다. 이들 수용체에서의 결합은 1mg 정맥내 투약은 물론 0.88mg 흡입 투약 후에 5-HT1B에서 100% 결합과 함께 나타낸다(도 3). 그러나, 흡입 후에는 5-HT1D 수용체에서의 겉보기 결합은 IV에 비하여 낮다. 순환계에서 Cmax를 넘는 DHE의 긴 지속기간은 아마도 이중소실 때문인 것 같다(Wyss, P.A., Rosenthaler, J., Nuesch, E., Aellig, W.H., Pharmacokinetic investigation of oral and IV dihydroergotamine in healthy subjects. Eur. J. Clin. Pharmacol. 1991; 41:597-602). 이들 결과는 임상 반응의 지속에 있어서 최대 수용체 결합이 전반적으로 필요하지 않음을 시사한다.
도 3-5에 보이는 대로, 부작용을 유발하는 높은 Cmax가 수반되는 IV 투여 방법은 IV 투여 방법의 결과인 피크 혈장 스파이크(Cmax)와 동등한 농도에서 도파민성 수용체 및 아드레날린성 수용체에서 광범한 결합을 나타냈다. 도 4는 아드레날린성 수용체(좌측 패널)와 도파민성 수용체(우측 패널)에서의 수용체 결합 데이터를 나타내며, 이것은 정맥내 투여시에는 Cmax에서 몇몇 서브타입에서의 반응이 더 크다는 것을 시사한다. "(h)" 표시는 클로닝된 사람 수용체 서브타입을 표시하고, "NS"는 비-특이적 결합을 표시한다.
도파민성 수용체 D1 및 D2는 주로 메스꺼움과 구토를 초래한다. 도 2에 나타낸 대로, 피크를 억지하여 유예시킨 신규 투여 방법의 결과인 피크 혈장 스파이크(Cmax)와 동등한 농도에서는, 도 4에 나타낸 대로, 도파민성 수용체 결합, 특히 D2 및 D1에서의 결합이 상당히 저하되었으며, 궁극적으로 환자에서 메스꺼움과 구토가 감소되었다.
유사하게, 도 4에 나타낸 저하된 아드레날린성 결합은 환자에서 감소된 혈관 수축과 저하된 혈압 또는 심혈관 변동에 상응했다. 신규 투여 방법의 결과인 피크 혈장 스파이크(Cmax)와 동등한 농도에서는 아드레날린성 수용체와 도파민성 수용체에서의 수용체 결합은 저하되었지만, 이들 투여 방법에 의해서 달성된 세로토닌 수용체, 특히 5-HT1a /d에서의 결합은 편두통의 치료에 충분히 효과적이었다(도 3).
5-HT1B 서브타입 수용체의 효현제가 편두통 및 관련 증상의 치료에 유용하다고 알려져 있다. 5-HT2B 수용체는 편두통의 개시를 촉발하는 역할을 한다고 알려져 있다. 도 5는 고농도 대조군(5μm), Cmax(77.6nM)의 IV, Cmax(6.25nM)와 현저히 감소된 농도(0.25nM)의 4회 흡입 후 5-HT1B 및 5-HT2B 수용체에서의 선택적 효현작용을 나타낸다. 5-HT1B 효현작용은 강한 효능을 나타내면서 모든 농도에서 유지되지만, 경구 흡입된 DHE의 경우 5-HT2B 수용체에서 효현작용이 존재하지 않는다.
3가지 투여 방법이 모두 세로토닌 수용체와 결합하기에 충분한 농도로 20분 이내에 신속한 혈장 수준을 달성하며, 신속한 편두통 치료를 달성한다는 것을 주지한다(도 2).
실시예
4
TEMPO™ 흡입기를 사용한
DHE
제제의 폐 투여
흡입 송달되는 DHE 입자의 제조에 있어서 상당한 이점을 제공하며, 단일 단계에서 바람직한 크기의 호흡에 알맞은 입자가 제조되는 초임계 유체 과정을 사용하여 DHE 분말을 만든다(WO 2005/025506 A2 참조). 초임계 유체 처리된 결정이 표면 에너지가 낮은 상당히 매끄러운 표면을 가지므로 추진제 기반 시스템 중에 효과적으로 분산되려는 경향을 가진다는 것이 가공된 DHE 약물 물질의 특성이다. DHE의 상당 부분이 폐에 침착되도록 하기 위하여 미세결정으로 조절된 입자 크기가 선택되었다.
약물 제품을 위한 제제 개발의 일부로서 2가지 불활성 비-가연성 HFA 추진제의 블렌드를 선택했는데, 바로 HFA 134a(1,1,1,2-테트라플루오로에탄)과 HFA 227ea (1,1,1,2,3,3,3-헵타플루오로프로판)이다. 최종 제품은 70:30 FHA 227ea:HFA 134a를 함유했으며, 이것은 DHE 결정의 밀도와 잘 조화되어 pMDI 현탁액의 물리적 안정성을 증대시켰다. 얻어진 현탁액은 침전물이나 크림 상태(이것은 비가역적 응집물을 침전시킬 수 있다)는 아니었고, 흔들었을 때 쉽게 분산되는 약하게 응결된 현탁 시스템으로서 존재했다. 약하게 응결된 시스템은 pMDI 캐니스터를 위한 최적의 안정성을 제공할 것으로 생각된다. 이러한 제제의 특성으로 인하여 이 제제는 에탄올 및 계면활성제/안정제를 함유하지 않았다.
새로운 호흡 가동식 정량 흡입기인 TEMPO™을 사용하여 DHE 제제를 환자에게 투여하였다. TEMPO™는 표준 압력식 정량 흡입기(pMDI)와 관련된 변동성을 극복하며, 약물이 전신 흡수될 수 있는 폐 주변으로 약물을 일정하게 송달한다. 이렇게 하기 위해, TEMPO™에는 4가지 새로운 특징이 결합된다: 1) 호흡 동기식 촉발장치 - 다양한 약물에 맞춰 조정될 수 있고, 들숨 주기의 특정 부분에 약물을 송달하려는 집단을 대상으로 한다, 2) 플럼 조절 - 가동장치 안에서 에어로졸 플럼의 속도를 늦추는 충돌 제트, 3) 와동 챔버 - 다공성 벽과 이 배벽 상의 공기 유입구로 구성, 다공성 벽은 속도가 늦춰진 에어로졸 플럼을 현탁 상태로 유지시키는 공기 쿠션을 제공하고, 공기 유입구는 속도가 늦춰진 에어로졸 플럼을 와동 패턴으로 만들어 에어로졸을 현탁 상태로 유지하고, HFA 추진제가 증발됨에 따라서 입자 크기가 줄어들도록 한다, 4) 용량 계량기 - 남은 용량을 측정하고, 어느 한 캐니스터로부터 의도된 최대 용량 이상으로 투여되지 않도록 방지한다. 2번과 3번 특징은 미세 입자 분획(FPF)을 증가시킴으로써 침착을 극히 느리게 하여 방출 용량(ED)의 폐 침착을 개선하는 것으로 나타났다.
본 명세서에서 인용된 모든 간행물 및 특허출원은 각각의 간행물 또는 특허출원이 구체적으로 그리고 개별적으로 참고자료로서 포함된다고 한 것과 마찬가지로 이들의 전문이 참고자료로서 본원에 포함된다.
전술한 발명은 명확한 이해를 위하여 예시 및 실시예의 방식으로 일부 상세히 설명되었지만, 본 발명의 교시에 비추어 첨부된 청구항의 사상 또는 범위를 벗어나지 않는 어떤 변화 및 변형이 만들어질 수 있다는 것이 당업자에게 자명할 것이다.
Claims (1)
- 편두통 증상의 완화를 획득하기에 충분한 속도로 일정량의 DHE 제제를 개체에게 투여하는 단계를 포함하며, 이때 DHE 투여량 및 투여 속도가 부작용의 현저한 감소를 야기하는 것을 특징으로 하는, DHE 또는 그것의 염, 수화물, 다형체, 프로드러그, 이온쌍 및 대사산물을 사용하여 부작용을 최소화하면서 개체에서 편두통을 신속히 치료하는 방법.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US90085007P | 2007-02-11 | 2007-02-11 | |
| US60/900,850 | 2007-02-11 | ||
| PCT/US2008/001829 WO2008097664A1 (en) | 2007-02-11 | 2008-02-11 | Method of therapeutic administration of dhe to enable rapid relief of migraine while minimizing side effect profile |
Related Parent Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020157007681A Division KR20150041804A (ko) | 2007-02-11 | 2008-02-11 | 부작용 프로파일을 최소화하면서 편두통의 빠른 완화를 가능하게 하는 dhe의 치료적 투여 방법 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20160106200A true KR20160106200A (ko) | 2016-09-09 |
Family
ID=39400937
Family Applications (3)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020097019032A KR20090129998A (ko) | 2007-02-11 | 2008-02-11 | 부작용 프로파일을 최소화하면서 편두통의 빠른 완화를 가능하게 하는 dhe의 치료적 투여 방법 |
| KR1020157007681A KR20150041804A (ko) | 2007-02-11 | 2008-02-11 | 부작용 프로파일을 최소화하면서 편두통의 빠른 완화를 가능하게 하는 dhe의 치료적 투여 방법 |
| KR1020167023885A KR20160106200A (ko) | 2007-02-11 | 2008-02-11 | 부작용 프로파일을 최소화하면서 편두통의 빠른 완화를 가능하게 하는 dhe의 치료적 투여 방법 |
Family Applications Before (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020097019032A KR20090129998A (ko) | 2007-02-11 | 2008-02-11 | 부작용 프로파일을 최소화하면서 편두통의 빠른 완화를 가능하게 하는 dhe의 치료적 투여 방법 |
| KR1020157007681A KR20150041804A (ko) | 2007-02-11 | 2008-02-11 | 부작용 프로파일을 최소화하면서 편두통의 빠른 완화를 가능하게 하는 dhe의 치료적 투여 방법 |
Country Status (19)
| Country | Link |
|---|---|
| US (10) | US8148377B2 (ko) |
| EP (3) | EP2120875B1 (ko) |
| JP (4) | JP5825757B2 (ko) |
| KR (3) | KR20090129998A (ko) |
| CN (2) | CN101677954A (ko) |
| AU (3) | AU2008214205B2 (ko) |
| CA (1) | CA2677838C (ko) |
| CY (1) | CY1116546T1 (ko) |
| DK (2) | DK2425820T3 (ko) |
| ES (2) | ES2538082T3 (ko) |
| HK (1) | HK1204918A1 (ko) |
| HU (1) | HUE026884T2 (ko) |
| IL (1) | IL200333A (ko) |
| MX (1) | MX2009008582A (ko) |
| PL (1) | PL2425820T3 (ko) |
| PT (1) | PT2425820E (ko) |
| SI (1) | SI2425820T1 (ko) |
| WO (1) | WO2008097664A1 (ko) |
| ZA (1) | ZA200905628B (ko) |
Families Citing this family (31)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US8022095B2 (en) * | 1996-08-16 | 2011-09-20 | Pozen, Inc. | Methods of treating headaches using 5-HT agonists in combination with long-acting NSAIDs |
| EP1663159A4 (en) * | 2003-09-10 | 2010-06-09 | Map Pharmaceuticals Inc | AEROSOL FORMULATIONS FOR THE DELIVERY OF DIHYDROERGOTAMINE TO THE SYSTEMIC CIRCULATION BY PULMONARY INHALATION |
| KR20090129998A (ko) | 2007-02-11 | 2009-12-17 | 맵 파마슈티컬스, 인코포레이티드 | 부작용 프로파일을 최소화하면서 편두통의 빠른 완화를 가능하게 하는 dhe의 치료적 투여 방법 |
| ES2648196T3 (es) | 2008-02-07 | 2017-12-29 | The University Of Washington | Dispositivo aerosol circunferencial |
| US20110082150A1 (en) * | 2008-02-11 | 2011-04-07 | Robert Owen Cook | Headache pre-emption by dihydroergotamine treatment during headache Precursor events |
| WO2010151804A1 (en) * | 2009-06-26 | 2010-12-29 | Map Pharmaceuticals, Inc. | Administration of dihydroergotamine mesylate particles using a metered dose inhaler |
| WO2011079313A1 (en) * | 2009-12-23 | 2011-06-30 | Map Pharmaceuticals, Inc. | Novel ergoline analogs |
| AU2012223160B2 (en) | 2011-03-03 | 2016-08-18 | Impel Pharmaceuticals Inc. | Nasal drug delivery device |
| CA2835208C (en) | 2011-05-09 | 2019-08-20 | Impel Neuropharma, Inc. | Nozzles for nasal drug delivery |
| CN103827113A (zh) | 2011-06-23 | 2014-05-28 | Map药物公司 | 新型氟麦角碱类似物 |
| CA2859173A1 (en) | 2011-12-19 | 2013-06-27 | Map Pharmaceuticals, Inc. | Novel iso-ergoline derivatives |
| WO2013095708A1 (en) | 2011-12-21 | 2013-06-27 | Map Pharmaceuticals, Inc. | Novel neuromodulatory compounds |
| US9012640B2 (en) | 2012-06-22 | 2015-04-21 | Map Pharmaceuticals, Inc. | Cabergoline derivatives |
| CA2895834A1 (en) * | 2012-12-21 | 2014-06-26 | Map Pharmaceuticals, Inc. | Novel ergoline derivatives and uses thereof |
| WO2014100353A1 (en) * | 2012-12-21 | 2014-06-26 | Map Pharmaceuticals, Inc. | 8'-hydroxy-dihydroergotamine compounds and compositions |
| CA2895816C (en) * | 2012-12-21 | 2021-02-23 | Map Pharmaceuticals, Inc. | 8'-hydroxy-dihydroergotamine compounds and compositions |
| CA2909954C (en) | 2013-04-28 | 2021-03-23 | Impel Neuropharma, Inc. | Medical unit dose container |
| IL257845B (en) | 2015-09-10 | 2022-07-01 | Impel Neuropharma Inc | Lined nasal delivery device |
| WO2019104192A1 (en) | 2017-11-21 | 2019-05-31 | Impel Neuropharma, Inc. | Intranasal device with inlet interface |
| EP3713628A4 (en) | 2017-11-21 | 2021-08-18 | Impel Neuropharma Inc. | INTRA-NASAL DEVICE WITH DIVER TUBE |
| BR112020013744A8 (pt) * | 2018-01-05 | 2022-10-18 | Impel Neuropharma Inc | Dispensação intranasal de di-hidroergotamina por dispositivo olfativo de precisão |
| CN111836615A (zh) | 2018-01-05 | 2020-10-27 | 英倍尔药业股份有限公司 | 通过精密鼻装置的奥氮平的鼻内递送 |
| US11083712B1 (en) | 2018-03-20 | 2021-08-10 | Relevale, Inc. | Low concentration delivery of an ergoline derivative for treatment of a headache |
| CN112955134A (zh) | 2018-07-19 | 2021-06-11 | 英倍尔药业股份有限公司 | 用于治疗帕金森氏病的左旋多巴和多巴脱羧酶抑制剂的呼吸道递送 |
| CN113423400A (zh) * | 2018-12-11 | 2021-09-21 | 小蜜橘制药公司 | 用于治疗或预防头痛的组合物、装置和方法 |
| AU2019418744B2 (en) | 2019-01-03 | 2023-08-03 | Impel Pharmaceuticals Inc. | Nasal drug delivery device |
| KR20220010011A (ko) | 2019-05-17 | 2022-01-25 | 임펠 뉴로파마 인코포레이티드 | 일회용 비강 전달 장치 |
| US11786512B2 (en) | 2019-09-23 | 2023-10-17 | Slayback Pharma Llc | Stable pharmaceutical compositions of dihydroergotamine mesylate |
| JP2023507890A (ja) * | 2019-12-23 | 2023-02-28 | サイエンチュア, インコーポレイテッド | メシル酸ジヒドロエルゴタミン製剤およびその治療的送達のための事前充填注射器 |
| AU2021207626A1 (en) * | 2020-01-14 | 2022-09-01 | Impel Pharmaceuticals Inc. | Repeated administration of dihydroergotamine for treatment of frequent migraine headaches |
| KR20230152083A (ko) * | 2021-03-03 | 2023-11-02 | 풀매트릭스 오퍼레이팅 컴퍼니, 인크 | 다이하이드로에르고타민 건조 분말 제형 및 사용 방법 |
Family Cites Families (360)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US147389A (en) * | 1874-02-10 | Improvement in sawing-machines | ||
| US605674A (en) | 1898-06-14 | Combined pencil-case and comb-case | ||
| BE555319A (ko) | 1956-03-21 | 1900-01-01 | ||
| US2885427A (en) | 1956-11-15 | 1959-05-05 | Dow Chemical Co | Fluorination of trichloroethylene |
| BE556587A (ko) | 1957-01-31 | 1957-04-11 | ||
| US2865427A (en) | 1957-05-10 | 1958-12-23 | Robert E Garfield | Sliding automobile seat attachment |
| BE629985A (ko) | 1962-11-29 | |||
| US3320125A (en) | 1964-04-28 | 1967-05-16 | Merck & Co Inc | Inhalation aerosol composition |
| US3261748A (en) | 1964-07-17 | 1966-07-19 | Dow Chemical Co | 1,1,1,2-tetrafluoroethane anesthetic |
| GB1200886A (en) | 1966-09-23 | 1970-08-05 | Allen & Hanburys Ltd | Phenylaminoethanol derivatives |
| GB1429184A (en) | 1972-04-20 | 1976-03-24 | Allen & Hanburys Ltd | Physically anti-inflammatory steroids for use in aerosols |
| US4044126A (en) | 1972-04-20 | 1977-08-23 | Allen & Hanburys Limited | Steroidal aerosol compositions and process for the preparation thereof |
| US3809294A (en) | 1973-06-27 | 1974-05-07 | American Cyanamid Co | Dispensing lung contacting powdered medicaments |
| US3897779A (en) | 1973-06-27 | 1975-08-05 | American Cyanamid Co | Triamcinolone acetonide inhalation therapy |
| US3994421A (en) | 1975-09-29 | 1976-11-30 | American Cyanamid Company | Unitary therapeutic aerosol dispenser |
| US4405598A (en) | 1976-01-30 | 1983-09-20 | Fisons, Limited | Composition for treating asthma |
| FI770215A (ko) | 1976-01-30 | 1977-07-31 | Fisons Ltd | |
| NL7708731A (nl) | 1976-08-13 | 1978-02-15 | Montedison Spa | Werkwijze voor de bereiding van nieuwe drijf- middelsamenstellingen voor aerosolen. |
| JPS5325284A (en) | 1976-08-19 | 1978-03-08 | Daikin Ind Ltd | Aerosol composition |
| DE2750090A1 (de) | 1976-11-19 | 1978-06-01 | Sandoz Ag | Neue verabreichungsformen fuer organische verbindungen |
| GB2001334B (en) | 1977-07-19 | 1982-03-03 | Fisons Ltd | Pressurised aerosol formulation |
| US4129603A (en) | 1978-02-07 | 1978-12-12 | Imperial Chemical Industries Limited | Manufacture of halogenated compounds |
| US4241048A (en) | 1979-05-01 | 1980-12-23 | Bristol-Myers Company | Suspension composition of benzocaine |
| IT1121513B (it) | 1979-05-28 | 1986-04-02 | Chiesi Farma Spa | Processo per la conversione di umo steroide antiinfiammatorio in una forma suscettibile di essere somministarta come aerosol |
| JPS6034925B2 (ja) | 1979-07-31 | 1985-08-12 | 帝人株式会社 | 持続性鼻腔用製剤およびその製造法 |
| US4335121A (en) | 1980-02-15 | 1982-06-15 | Glaxo Group Limited | Androstane carbothioates |
| US4352789A (en) | 1980-03-17 | 1982-10-05 | Minnesota Mining And Manufacturing Company | Aerosol compositions containing finely divided solid materials |
| WO1981002975A1 (en) | 1980-04-21 | 1981-10-29 | Univ California | Prolonged action drug formulation |
| EP0039369B1 (en) | 1980-05-02 | 1983-06-15 | Schering Corporation | Beclomethasone ester solvates, process for their preparation, and preparation of a formulation |
| DE3017101C2 (de) | 1980-05-03 | 1983-07-21 | PS Pharma Maschinen und Geräte GmbH, 6800 Mannheim | Dragierwand |
| FI63672C (fi) | 1980-05-19 | 1983-08-10 | Orion Yhtymae Oy | Foerfarande foer framstaellning av en blandning av beklometasondipropionat och triklorfluormetan eller diklordifluormetan |
| US4311863A (en) | 1980-06-11 | 1982-01-19 | E. I. Du Pont De Nemours & Company | Process for the manufacture of 1,1,1,2-tetrafluoroethane |
| GB2078422B (en) | 1980-06-19 | 1983-12-21 | Standard Telephones Cables Ltd | Matrix addressing of display devices |
| US4710495A (en) | 1980-07-10 | 1987-12-01 | Otsuka Pharmaceutical Co., Ltd. | Soft steroids having anti-inflammatory activity |
| US4423099A (en) | 1980-07-28 | 1983-12-27 | Ciba-Geigy Corporation | Membrane modified hydrogels |
| NL8103769A (nl) | 1980-08-12 | 1982-03-01 | Glaxo Group Ltd | Heterocyclische verbindingen, werkwijze ter bereiding daarvan alsmede farmaceutische preparaten die deze verbindingen als actieve component bevatten. |
| CY1492A (en) | 1981-07-08 | 1990-02-16 | Draco Ab | Powder inhalator |
| EP0072046B1 (en) | 1981-07-24 | 1986-01-15 | FISONS plc | Inhalation drugs, methods for their production and pharmaceutical formulations containing them |
| GB2105189B (en) | 1981-07-24 | 1985-03-20 | Fisons Plc | Inhalation drugs |
| KR890000664B1 (ko) | 1981-10-19 | 1989-03-22 | 바리 안소니 뉴우샘 | 미분된 베클로메타손 디프로피오네이트 일수화물의 제조방법 |
| US4659696A (en) | 1982-04-30 | 1987-04-21 | Takeda Chemical Industries, Ltd. | Pharmaceutical composition and its nasal or vaginal use |
| JPS5921613A (ja) | 1982-07-28 | 1984-02-03 | Takeda Chem Ind Ltd | 直腸投与製剤 |
| US4582731A (en) | 1983-09-01 | 1986-04-15 | Battelle Memorial Institute | Supercritical fluid molecular spray film deposition and powder formation |
| HU196752B (en) | 1983-12-06 | 1989-01-30 | Glaxo Group Ltd | Process for production of medical compositions containing indole-derivatives and these compounds |
| US4514574A (en) | 1984-01-09 | 1985-04-30 | The Dow Chemical Company | Process for separating isomeric mixtures |
| JPS60224638A (ja) | 1984-04-23 | 1985-11-09 | Kao Corp | 経皮吸収促進剤およびこれを含有する外用剤 |
| JPS60227805A (ja) | 1984-04-26 | 1985-11-13 | Mitsubishi Plastics Ind Ltd | 複合ダイヤフラム |
| US4629478A (en) | 1984-06-22 | 1986-12-16 | Georgia Tech Research Corporation | Monodisperse aerosol generator |
| NO163899C (no) | 1984-07-25 | 1990-08-08 | Hovione Int Ltd | Fremgangsmaate for fremstilling av diisopropyletersolvatetav beclometason-17,21-dipropionat. |
| GB8432063D0 (en) | 1984-12-19 | 1985-01-30 | Riker Laboratories Inc | Physically modified steroids |
| GB8501015D0 (en) | 1985-01-16 | 1985-02-20 | Riker Laboratories Inc | Drug |
| US5069911A (en) | 1985-02-05 | 1991-12-03 | Sandoz Ltd. | Pharmaceutical 9,10-dihydrogenated ergot alkaloid containing compositions |
| US5192528A (en) * | 1985-05-22 | 1993-03-09 | Liposome Technology, Inc. | Corticosteroid inhalation treatment method |
| US5021428A (en) | 1985-07-02 | 1991-06-04 | Merrell Dow Pharmaceuticals Inc. | Novel chemical compounds for the prophylactic treatment of migraine |
| US4737384A (en) | 1985-11-01 | 1988-04-12 | Allied Corporation | Deposition of thin films using supercritical fluids |
| ES2053549T3 (es) | 1986-08-11 | 1994-08-01 | Innovata Biomed Ltd | Un proceso para la preparacion de una formulacion farmaceutica apropiada para inhalacion. |
| US5200413A (en) | 1987-01-05 | 1993-04-06 | Beecham Group P.L.C. | Indolyl carboxamides useful treating migraine, cluster headache, trigeminal neuralgia or emesis |
| US4767612A (en) | 1987-01-23 | 1988-08-30 | Rorer Pharmaceutical Corporation | Triamcinolone acetonide for the treatment of allergic rhinitis |
| US4851595A (en) | 1987-07-07 | 1989-07-25 | E. I. Du Pont De Nemours And Company | Liquid phase halogen exchange process for the manufacture of 1,1,1,2-tetrafluoroethane |
| IT1222509B (it) | 1987-08-17 | 1990-09-05 | Miat Spa | Insufflatore per la somministrazione di farmaci sotto forma di polvere predosata in opercoli |
| US5364863A (en) | 1987-09-08 | 1994-11-15 | Eli Lilly And Company | Specific 5-HT3 antagonists |
| US4963557A (en) | 1987-09-28 | 1990-10-16 | Smithkline Beecham Corporation | Immunomodulatory azaspiranes |
| DE3787533T2 (de) | 1987-12-21 | 1994-01-20 | Union Carbide Corp | Verwendung von superkritischen Flüssigkeiten als Verdünner beim Aufsprühen von Überzügen. |
| DE3744329A1 (de) | 1987-12-28 | 1989-07-06 | Schwarz Pharma Gmbh | Verfahren zur herstellung einer mindestens einen wirkstoff und einen traeger umfassenden zubereitung |
| JPH01176437A (ja) | 1987-12-29 | 1989-07-12 | Ono Pharmaceut Co Ltd | 有機物質の微粒化方法 |
| DE3823378A1 (de) | 1988-07-09 | 1990-01-11 | Knoll Ag | (s)-emopamil zur anwendung bei der behandlung von migraene |
| US5066522A (en) | 1988-07-14 | 1991-11-19 | Union Carbide Chemicals And Plastics Technology Corporation | Supercritical fluids as diluents in liquid spray applications of adhesives |
| US5206268A (en) | 1988-08-16 | 1993-04-27 | Burroughs Wellcome Co. | Medicaments |
| GB8820398D0 (en) | 1988-08-27 | 1988-09-28 | Fisons Plc | Pharmaceutical formulation |
| AU624421B2 (en) | 1988-10-05 | 1992-06-11 | Pharmacia & Upjohn Company | Finely divided solid crystalline powders via precipitation into an anti-solvent |
| US5707634A (en) | 1988-10-05 | 1998-01-13 | Pharmacia & Upjohn Company | Finely divided solid crystalline powders via precipitation into an anti-solvent |
| US5225183A (en) | 1988-12-06 | 1993-07-06 | Riker Laboratories, Inc. | Medicinal aerosol formulations |
| GB8828477D0 (en) | 1988-12-06 | 1989-01-05 | Riker Laboratories Inc | Medical aerosol formulations |
| US5766573A (en) | 1988-12-06 | 1998-06-16 | Riker Laboratories, Inc. | Medicinal aerosol formulations |
| GB8828544D0 (en) | 1988-12-07 | 1989-01-11 | Ici Plc | Chemical process |
| GB8900267D0 (en) | 1989-01-06 | 1989-03-08 | Riker Laboratories Inc | Narcotic analgesic formulations and apparatus containing same |
| US5011678A (en) | 1989-02-01 | 1991-04-30 | California Biotechnology Inc. | Composition and method for administration of pharmaceutically active substances |
| DE3905726A1 (de) | 1989-02-24 | 1990-08-30 | Hoechst Ag | Druckgaspackung und treibmittel fuer aerosole |
| GB8904370D0 (en) | 1989-02-25 | 1989-04-12 | Cosmas Damian Ltd | Liquid delivery compositions |
| SE466684B (sv) | 1989-03-07 | 1992-03-23 | Draco Ab | Anordning vid en inhalator samt foerfarande foer att med anordningen registrera medicinering med inhalator |
| GB8908250D0 (en) | 1989-04-12 | 1989-05-24 | Fisons Plc | Formulations |
| GB8909891D0 (en) | 1989-04-28 | 1989-06-14 | Riker Laboratories Inc | Device |
| ES2087911T3 (es) | 1989-04-28 | 1996-08-01 | Riker Laboratories Inc | Dispositivo de inhalacion de polvo seco. |
| US4945119A (en) | 1989-05-10 | 1990-07-31 | The Dow Chemical Company | Foaming system for rigid urethane and isocyanurate foams |
| US4940171A (en) | 1989-05-18 | 1990-07-10 | Gilroy Gordon C | Aerosol package having compressed gas propellant and vapor tap of minute size |
| US5176878A (en) | 1989-05-23 | 1993-01-05 | Teledyne Industries, Inc. | Zirconium-hafnium separation process |
| AU633584B2 (en) | 1989-06-15 | 1993-02-04 | Tokyo Tanabe Company Limited | Aerosols of pyrido(1,2-a)pyrimidine compounds |
| US5232707A (en) | 1989-07-10 | 1993-08-03 | Syntex (U.S.A.) Inc. | Solvent extraction process |
| US4916125A (en) | 1989-07-11 | 1990-04-10 | Sandoz Ltd. | Method of treating migraine |
| US5130137A (en) | 1989-08-09 | 1992-07-14 | The General Hospital Corporation | Continuous delivery of luteinizing hormone releasing hormone compositions in combination with sex steroid delivery for use in treating benign ovarian secretory disorders |
| WO1991002645A1 (en) | 1989-08-18 | 1991-03-07 | Foster-Miller, Inc. | Vessel construction |
| GB8918879D0 (en) | 1989-08-18 | 1989-09-27 | Danbiosyst Uk | Pharmaceutical compositions |
| US5225163A (en) | 1989-08-18 | 1993-07-06 | Angenics, Inc. | Reaction apparatus employing gravitational flow |
| US5238920A (en) | 1989-08-22 | 1993-08-24 | Abbott Laboratories | Pulmonary surfactant protein fragments |
| US5270305A (en) | 1989-09-08 | 1993-12-14 | Glaxo Group Limited | Medicaments |
| GB2235627B (en) | 1989-09-08 | 1993-09-01 | Glaxo Group Ltd | Inhalation medicaments for treating respiratory disorders |
| GB8921222D0 (en) | 1989-09-20 | 1989-11-08 | Riker Laboratories Inc | Medicinal aerosol formulations |
| US5178878A (en) | 1989-10-02 | 1993-01-12 | Cima Labs, Inc. | Effervescent dosage form with microparticles |
| US5223264A (en) | 1989-10-02 | 1993-06-29 | Cima Labs, Inc. | Pediatric effervescent dosage form |
| US5106659A (en) | 1989-10-04 | 1992-04-21 | Nordson Corporation | Method and apparatus for spraying a liquid coating containing supercritical fluid or liquified gas |
| US5439670A (en) | 1989-11-28 | 1995-08-08 | Riker Laboratories, Inc. | Medicinal aerosol formulations |
| GB9001635D0 (en) | 1990-01-24 | 1990-03-21 | Ganderton David | Aerosol carriers |
| US5376386A (en) | 1990-01-24 | 1994-12-27 | British Technology Group Limited | Aerosol carriers |
| DE4003270A1 (de) | 1990-02-03 | 1991-08-08 | Boehringer Ingelheim Kg | Neue treibgase und ihre verwendung in arzneimittelzubereitungen |
| IL97065A (en) | 1990-02-02 | 1994-01-25 | Fisons Plc | Repellent preparations for aerosol |
| DE4003272A1 (de) | 1990-02-03 | 1991-08-08 | Boehringer Ingelheim Kg | Neue treibgasmischungen und ihre verwendung in arzneimittelzubereitungen |
| DE4004904A1 (de) | 1990-02-16 | 1990-09-13 | Gerhard Brendel | Trommel-applikator |
| US5118494A (en) | 1990-03-23 | 1992-06-02 | Minnesota Mining And Manufacturing Company | Use of soluble fluorosurfactants for the preparation of metered-dose aerosol formulations |
| CA2077354A1 (en) | 1990-03-23 | 1991-09-24 | Minnesota Mining And Manufacturing Company | Use of soluble fluorosurfactants for the preparation of metered-dose aerosol formulations |
| US4970093A (en) | 1990-04-12 | 1990-11-13 | University Of Colorado Foundation | Chemical deposition methods using supercritical fluid solutions |
| US5123924A (en) * | 1990-04-25 | 1992-06-23 | Spire Corporation | Surgical implants and method |
| JP3122671B2 (ja) | 1990-05-23 | 2001-01-09 | 協和醗酵工業株式会社 | 複素環式化合物 |
| SK281621B6 (sk) | 1990-06-07 | 2001-05-10 | Astrazeneca Ab | Indolové deriváty, spôsob ich prípravy, farmaceutické kompozície s ich obsahom a ich použitie |
| EP0461930B1 (en) | 1990-06-15 | 1995-09-13 | Merck & Co. Inc. | A crystallization method to improve crystal structure and size |
| US5273579A (en) | 1990-06-19 | 1993-12-28 | Mitsubishi Mining And Cement Co., Ltd. | Quick setting compositions |
| CA2020018A1 (en) | 1990-06-27 | 1991-12-28 | Don L. Simmons | Method and composition for treating the migraine complex |
| CA2086096A1 (en) | 1990-06-27 | 1991-12-28 | Robert A. Moris | Use of soluble fluorosurfactants for the preparation of metered-dose aerosol formulations |
| US5126123A (en) | 1990-06-28 | 1992-06-30 | Glaxo, Inc. | Aerosol drug formulations |
| AU649702B2 (en) | 1990-06-28 | 1994-06-02 | Glaxo Inc. | Aerosol drug formulations |
| EP0536235B1 (en) | 1990-06-29 | 1997-01-22 | FISONS plc | Pressurised aerosol compositions |
| ATE187839T1 (de) | 1990-06-29 | 2000-01-15 | Sony Corp | Aufzeichnungs-/wiedergabesystem für eine magneto- optische platte |
| GB9017155D0 (en) | 1990-08-03 | 1990-09-19 | Ici Plc | Spray drying |
| US5230884A (en) | 1990-09-11 | 1993-07-27 | University Of Wales College Of Cardiff | Aerosol formulations including proteins and peptides solubilized in reverse micelles and process for making the aerosol formulations |
| US5292499A (en) | 1990-09-11 | 1994-03-08 | University Of Wales College Of Cardiff | Method of preparing medical aerosol formulations including drug dissolved in reverse micelles |
| MX9203481A (es) | 1990-10-18 | 1992-07-01 | Minnesota Mining & Mfg | Formulaciones. |
| DE69105212T2 (de) | 1990-10-18 | 1995-03-23 | Minnesota Mining & Mfg | Aerosolzubereitung, die beclometason 17,21-dipropionat enthält. |
| GB9024366D0 (en) | 1990-11-09 | 1991-01-02 | Glaxo Group Ltd | Medicaments |
| US5919435A (en) | 1990-11-09 | 1999-07-06 | Glaxo Group Limited | Aerosol formulation containing a particulate medicament |
| GB9024365D0 (en) | 1990-11-09 | 1991-01-02 | Glaxo Group Ltd | Medicaments |
| US5254755A (en) | 1990-12-04 | 1993-10-19 | Allied-Signal Inc. | Partially fluorinated alkanols having a tertiary structure |
| DE4118230A1 (de) | 1990-12-20 | 1992-06-25 | Bayer Ag | Verfahren zur isolierung von polymeren aus ihren loesungsmitteln mit kohlendioxid-haltigen fluessigkeiten |
| US6006745A (en) | 1990-12-21 | 1999-12-28 | Minnesota Mining And Manufacturing Company | Device for delivering an aerosol |
| US5290539A (en) | 1990-12-21 | 1994-03-01 | Minnesota Mining And Manufacturing Company | Device for delivering an aerosol |
| DE4041563A1 (de) | 1990-12-22 | 1992-06-25 | Sanol Arznei Schwarz Gmbh | Verfahren zur herstellung wirkstoffhaltiger mikropartikel aus hydrolytisch abbaubaren polymeren |
| US5317103A (en) | 1991-01-15 | 1994-05-31 | Merck Sharp & Dohme Limited | Indole-substituted five-membered heteroaromatic compounds as 5-HT1 agonists |
| US5145684A (en) | 1991-01-25 | 1992-09-08 | Sterling Drug Inc. | Surface modified drug nanoparticles |
| US5190029A (en) | 1991-02-14 | 1993-03-02 | Virginia Commonwealth University | Formulation for delivery of drugs by metered dose inhalers with reduced or no chlorofluorocarbon content |
| US5182097A (en) | 1991-02-14 | 1993-01-26 | Virginia Commonwealth University | Formulations for delivery of drugs by metered dose inhalers with reduced or no chlorofluorocarbon content |
| EP0504112A3 (en) | 1991-03-14 | 1993-04-21 | Ciba-Geigy Ag | Pharmaceutical aerosol formulations |
| US5186164A (en) | 1991-03-15 | 1993-02-16 | Puthalath Raghuprasad | Mist inhaler |
| US5182040A (en) | 1991-03-28 | 1993-01-26 | E. I. Du Pont De Nemours And Company | Azeotropic and azeotrope-like compositions of 1,1,2,2-tetrafluoroethane |
| GB9107628D0 (en) | 1991-04-10 | 1991-05-29 | Moonbrook Limited | Preparation of diagnostic agents |
| US5491148A (en) | 1991-04-26 | 1996-02-13 | Syntex (U.S.A.) Inc. | Isoquinolinone and dihydroisoquinolinone 5-HT3 receptor antagonists |
| DE4117751A1 (de) | 1991-05-30 | 1992-12-03 | Bayer Ag | Verfahren zur isolierung von polycarbonaten |
| ES2158911T5 (es) | 1991-06-10 | 2009-12-09 | Schering Corporation | Formulaciones en aerosol sin clorofluorocarbonos. |
| DE69231991T2 (de) | 1991-06-10 | 2002-04-04 | Schering Corp | Fluorchlorkohlenwasserstofffreie Aerosolformulierungen |
| AU2178392A (en) | 1991-06-12 | 1993-01-12 | Minnesota Mining And Manufacturing Company | Albuterol sulfate suspension aerosol formulations |
| GB9113802D0 (en) | 1991-06-26 | 1991-08-14 | Smithkline Beecham Plc | Medicaments |
| ATE359842T1 (de) | 1991-07-02 | 2007-05-15 | Nektar Therapeutics | Abgabevorrichtung für nebelförmige medikamente |
| US5464632C1 (en) | 1991-07-22 | 2001-02-20 | Prographarm Lab | Rapidly disintegratable multiparticular tablet |
| US6123924A (en) | 1991-09-25 | 2000-09-26 | Fisons Plc | Pressurized aerosol inhalation compositions |
| NZ244439A (en) | 1991-09-25 | 1994-01-26 | Fisons Plc | Pressurised aerosol compositions comprising hydrofluoroalkane, dispersed |
| US6063910A (en) | 1991-11-14 | 2000-05-16 | The Trustees Of Princeton University | Preparation of protein microparticles by supercritical fluid precipitation |
| US5916540A (en) | 1994-10-24 | 1999-06-29 | Glaxo Group Limited | Aerosol formulations containing P134A and/or P227 and particulate medicament |
| JP3280974B2 (ja) | 1991-12-12 | 2002-05-13 | グラクソ、グループ、リミテッド | 医 薬 |
| CA2125666C (en) | 1991-12-12 | 2002-07-16 | Rachel Ann Akehurst | Medicaments |
| IL104068A (en) | 1991-12-12 | 1998-10-30 | Glaxo Group Ltd | Pharmaceutical preparations in a spray without surfactant containing 1, 1, 1, 2 tetrafluoroethane or 1,1,2,3,3 petafluor N propane as propellant |
| US5683676A (en) | 1991-12-12 | 1997-11-04 | Glaxo Group Limited | Canister containing aerosol formulations containing P134a and particulate medicaments |
| US5736124A (en) | 1991-12-12 | 1998-04-07 | Glaxo Group Limited | Aerosol formulations containing P134a and particulate medicament |
| US5658549A (en) | 1991-12-12 | 1997-08-19 | Glaxo Group Limited | Aerosol formulations containing propellant 134a and fluticasone propionate |
| US5674471A (en) | 1991-12-12 | 1997-10-07 | Glaxo Group Limited | Aerosol formulations containing P134a and salbutamol |
| US5744123A (en) | 1991-12-12 | 1998-04-28 | Glaxo Group Limited | Aerosol formulations containing P134a and particulate medicaments |
| NZ246421A (en) | 1991-12-18 | 1996-05-28 | Minnesota Mining & Mfg | Aerosol formulation containing a drug and a propellant and which is substantially free of surfactant |
| CA2084531A1 (en) | 1991-12-19 | 1993-06-20 | David W. Smith | Antimigraine 4-pyrimidinyl and pyridinyl derivatives of indol-3yl-alkyl piperazines |
| GB9200148D0 (en) | 1992-01-06 | 1992-02-26 | Minnesota Mining & Mfg | Aerosol valves |
| US5320094A (en) | 1992-01-10 | 1994-06-14 | The Johns Hopkins University | Method of administering insulin |
| US5202110A (en) | 1992-01-22 | 1993-04-13 | Virginia Commonwealth University | Formulations for delivery of beclomethasone diproprionate by metered dose inhalers containing no chlorofluorocarbon propellants |
| GB9202519D0 (en) | 1992-02-06 | 1992-03-25 | Glaxo Group Ltd | Medicaments |
| US5196575A (en) | 1992-02-19 | 1993-03-23 | Hoechst Celanese Corp. | Supercritical separation of isomers of functional organic compounds at moderate conditions |
| US5639441A (en) | 1992-03-06 | 1997-06-17 | Board Of Regents Of University Of Colorado | Methods for fine particle formation |
| US5242949A (en) | 1992-03-13 | 1993-09-07 | Rugby-Darby Group Companies, Inc. | Treating classic migraine |
| JPH05280282A (ja) | 1992-03-31 | 1993-10-26 | Kubota Corp | 埋設管の地中引き込み装置 |
| EP0611567B1 (en) | 1992-06-12 | 2002-08-28 | Teijin Limited | Ultrafine powder for inhalation and production thereof |
| US5376359A (en) | 1992-07-07 | 1994-12-27 | Glaxo, Inc. | Method of stabilizing aerosol formulations |
| MX9304585A (es) | 1992-07-31 | 1994-03-31 | Glaxo Group Ltd | Formulacion farmaceutica en aerosol, lata adecuada para liberar la formulacion e inhalador de dosis dosificada que comprende la lata. |
| US5833950A (en) | 1992-07-31 | 1998-11-10 | Glaxo Group Limited | Aerosol formulations containing beclomethasone dipropionate-1, 1, 1, 2-tetrafluoroethane solvate |
| US5314682A (en) | 1992-09-21 | 1994-05-24 | Great Lakes Chemical Corp. | Ozone friendly sterilant mixture |
| DE69332105T2 (de) | 1992-09-29 | 2003-03-06 | Inhale Therapeutic Systems San | Pulmonale abgabe von aktiven fragmenten des parathormons |
| WO1994008599A1 (en) | 1992-10-14 | 1994-04-28 | The Regents Of The University Of Colorado | Ion-pairing of drugs for improved efficacy and delivery |
| AU678788B2 (en) | 1992-11-02 | 1997-06-12 | Ferro Corporation | Method of preparing coating materials |
| GB9226474D0 (en) | 1992-12-18 | 1993-02-10 | Ici Plc | Production of particulate materials |
| DK154092D0 (da) | 1992-12-23 | 1992-12-23 | Neurosearch As | Imidazolforbindelser, deres fremstilling og anvendelse |
| US5364838A (en) | 1993-01-29 | 1994-11-15 | Miris Medical Corporation | Method of administration of insulin |
| US5354934A (en) | 1993-02-04 | 1994-10-11 | Amgen Inc. | Pulmonary administration of erythropoietin |
| DE59308043D1 (de) | 1993-02-24 | 1998-02-26 | Sulzer Chemtech Ag | Reinigung von salzbeladenem Abwasser durch Nassoxidation bei superkritischen Bedingungen |
| US6162234A (en) | 1993-03-23 | 2000-12-19 | Freedland; Yosef | Adjustable button cinch anchor orthopedic fastener |
| PT689438E (pt) | 1993-03-26 | 2003-10-31 | Franciscus Wilhelmus He Merkus | Composicoes farmaceuticas para administracao intranasal de apomorfina |
| BE1006872A6 (nl) | 1993-03-26 | 1995-01-10 | Merkus Franciscus W H M | Nasale farmaceutische preparaten met dihydroergotamine (dhe). |
| US5492688A (en) | 1993-04-28 | 1996-02-20 | The Center For Innovative Technology | Metered dose inhaler fomulations which include the ozone-friendly propellant HFC 134a and a pharmaceutically acceptable suspending, solubilizing, wetting, emulsifying or lubricating agent |
| IL105658A (en) | 1993-05-11 | 1995-10-31 | Ultrasonic Dryer Ltd | Spray drying system |
| TW402506B (en) | 1993-06-24 | 2000-08-21 | Astra Ab | Therapeutic preparation for inhalation |
| DE4322181A1 (de) | 1993-06-29 | 1995-01-12 | Hottinger Adolf Masch | Vorrichtung und Verfahren zum Greifen eines Gießereikerns, insbesondere eines Sohlenkerns |
| GB9313642D0 (en) | 1993-07-01 | 1993-08-18 | Glaxo Group Ltd | Method and apparatus for the formation of particles |
| GB9313650D0 (en) | 1993-07-01 | 1993-08-18 | Glaxo Group Ltd | Method and apparatus for the formation of particles |
| JP3750872B2 (ja) | 1993-07-14 | 2006-03-01 | 株式会社小松製作所 | 車両用エンジンの過給装置およびその制御方法 |
| EP0728037B1 (en) | 1993-11-08 | 1999-01-13 | The Gillette Company | Method of forming particles using a supercritical fluid, aerogel particles formed thereby, and antiperspirants containing aerogel particles |
| EP0655237A1 (de) | 1993-11-27 | 1995-05-31 | Hoechst Aktiengesellschaft | Medizinische Aerosolformulierung |
| IT1265473B1 (it) | 1993-12-30 | 1996-11-22 | Otefal Srl | Procedimento per la produzione di polveri a granulometria controllata e prodotto in polvere cosi' ottenuto |
| US5468768A (en) | 1994-01-06 | 1995-11-21 | Bristol-Myers Squibb Company | Antimigraine derivatives of indolylcycloalkanylamines |
| US5595761A (en) | 1994-01-27 | 1997-01-21 | The Board Of Regents Of The University Of Oklahoma | Particulate support matrix for making a rapidly dissolving tablet |
| US5635210A (en) | 1994-02-03 | 1997-06-03 | The Board Of Regents Of The University Of Oklahoma | Method of making a rapidly dissolving tablet |
| SI9400079B (sl) | 1994-02-15 | 2003-02-28 | Dr. Weidner Eckhard, Dipl. Ing. | Postopek in naprava za pridobivanje in frakcioniranje majhnih delcev iz raztopin nasičenih s plinom |
| MX9603936A (es) | 1994-03-07 | 1997-05-31 | Inhale Therapeutic Syst | Metodos y composiciones para el suministro pulmonar de insulina. |
| GB9404945D0 (en) | 1994-03-15 | 1994-04-27 | Glaxo Group Ltd | Pharmaceutical composition |
| US5508023A (en) | 1994-04-11 | 1996-04-16 | The Center For Innovative Technology | Pharmaceutically acceptable agents for solubilizing, wetting, emulsifying, or lubricating in metered dose inhaler formulations which use HFC-227 propellant |
| AU696387B2 (en) | 1994-05-18 | 1998-09-10 | Inhale Therapeutic Systems, Inc. | Methods and compositions for the dry powder formulation of interferons |
| JPH0817132A (ja) | 1994-06-30 | 1996-01-19 | Rohm Co Ltd | 円盤状情報記録担体の再生装置 |
| GB9413202D0 (en) | 1994-06-30 | 1994-08-24 | Univ Bradford | Method and apparatus for the formation of particles |
| DE4425255A1 (de) | 1994-07-16 | 1996-01-18 | Asta Medica Ag | Formulierung zur inhalativen Applikation |
| US6290991B1 (en) | 1994-12-02 | 2001-09-18 | Quandrant Holdings Cambridge Limited | Solid dose delivery vehicle and methods of making same |
| US5560543A (en) | 1994-09-19 | 1996-10-01 | Board Of Regents, The University Of Texas System | Heat-resistant broad-bandwidth liquid droplet generators |
| GB9419536D0 (en) | 1994-09-28 | 1994-11-16 | Glaxo Inc | Medicaments |
| US6117455A (en) | 1994-09-30 | 2000-09-12 | Takeda Chemical Industries, Ltd. | Sustained-release microcapsule of amorphous water-soluble pharmaceutical active agent |
| DE4438978A1 (de) | 1994-10-31 | 1996-05-02 | Helmut Wurzer | Elektrochirurgiegerät und Verfahren zu dessen Betrieb |
| DE59509057D1 (de) | 1994-11-07 | 2001-04-05 | Eupec Gmbh & Co Kg | Brücken-Modul |
| US5693609A (en) | 1994-11-17 | 1997-12-02 | Eli Lilly And Company | Acylated insulin analogs |
| GB9425160D0 (en) | 1994-12-10 | 1995-02-08 | Glaxo Group Ltd | Medicaments |
| MX9504934A (es) | 1994-12-12 | 1997-01-31 | Morton Int Inc | Revestimientos en polvo de pelicula delgada lisa. |
| GB9426252D0 (en) | 1994-12-24 | 1995-02-22 | Glaxo Group Ltd | Pharmaceutical composition |
| US6013245A (en) | 1995-01-26 | 2000-01-11 | Glaxo Group Limited | Aerosol formulation containing beclomethasone dipropionate and 1,1,1,2,3,3,3-heptafluoro-n-propane as propellant |
| US5639475A (en) | 1995-02-03 | 1997-06-17 | Eurand America, Incorporated | Effervescent microcapsules |
| GEP20002266B (en) | 1995-04-14 | 2000-10-25 | Glaxo Wellcome Inc | Metered Dose Inhaler, the Inhaler System Comprising the Same and Method for Treatment of Respiratory Disturbances |
| EP1166811B1 (en) | 1995-04-14 | 2006-12-06 | SmithKline Beecham Corporation | Metered dose inhaler for fluticasone propionate |
| WO1996032150A1 (en) | 1995-04-14 | 1996-10-17 | Glaxo Wellcome Inc. | Metered dose inhaler for salmeterol |
| DK0820279T3 (da) | 1995-04-14 | 2002-10-07 | Smithkline Beecham Corp | Dosisudmålende inhalator til Albuterol |
| US5607697A (en) | 1995-06-07 | 1997-03-04 | Cima Labs, Incorporated | Taste masking microparticles for oral dosage forms |
| CA2234957C (en) | 1995-10-17 | 2006-12-19 | Inge B. Henriksen | Insoluble drug delivery |
| US5807578A (en) | 1995-11-22 | 1998-09-15 | Lab Pharmaceutical Research International Inc. | Fast-melt tablet and method of making same |
| GB9526392D0 (en) | 1995-12-22 | 1996-02-21 | Glaxo Group Ltd | Medicaments |
| AU709384B2 (en) | 1996-03-01 | 1999-08-26 | University Of Kansas, The | Methods and apparatus for particle precipitation and coating using near-critical and supercritical antisolvents |
| US5874029A (en) | 1996-10-09 | 1999-02-23 | The University Of Kansas | Methods for particle micronization and nanonization by recrystallization from organic solutions sprayed into a compressed antisolvent |
| GB9606677D0 (en) | 1996-03-29 | 1996-06-05 | Glaxo Wellcome Inc | Process and device |
| US5875776A (en) | 1996-04-09 | 1999-03-02 | Vivorx Pharmaceuticals, Inc. | Dry powder inhaler |
| US5776573A (en) | 1996-04-16 | 1998-07-07 | Cd Magic, Inc. | Compact disc revitalizer formulations and revitalizer |
| US5648004A (en) | 1996-04-19 | 1997-07-15 | Simpson; Claudie | Kit and method to retrofit heating elements for curling iron holder |
| DE19617487A1 (de) | 1996-05-02 | 1997-11-06 | Merck Patent Gmbh | Geschmacksverbesserung von Arzneimittelwirkstoffen |
| US6503480B1 (en) | 1997-05-23 | 2003-01-07 | Massachusetts Institute Of Technology | Aerodynamically light particles for pulmonary drug delivery |
| US5874064A (en) | 1996-05-24 | 1999-02-23 | Massachusetts Institute Of Technology | Aerodynamically light particles for pulmonary drug delivery |
| US6054488A (en) | 1996-06-11 | 2000-04-25 | 3M Innovative Properties Company | Medicinal aerosol formulations of formoterol |
| US6284267B1 (en) | 1996-08-14 | 2001-09-04 | Nutrimed Biotech | Amphiphilic materials and liposome formulations thereof |
| WO1998007414A1 (en) | 1996-08-22 | 1998-02-26 | Research Triangle Pharmaceuticals Ltd. | Compositions comprising microparticles of water-insoluble substances and method for preparing same |
| US6068832A (en) | 1996-08-29 | 2000-05-30 | Schering Corporation | Chlorofluorocarbon-free mometasone furoate aerosol formulations |
| FR2753639B1 (fr) | 1996-09-25 | 1998-12-11 | Procede de preparation de microcapsules de matieres actives enrobees par un polymere et nouvelles microcapsules notamment obtenues selon le procede | |
| EP1007012A4 (en) | 1996-10-01 | 2006-01-18 | Cima Labs Inc | TASTE-MASKED MICRO-CAPSULE COMPOSITION AND MANUFACTURING PROCESS |
| US5891885A (en) | 1996-10-09 | 1999-04-06 | Algos Pharmaceutical Corporation | Method for treating migraine |
| US5813597A (en) | 1996-10-15 | 1998-09-29 | Ethicon Endo-Surgery, Inc. | Dual orientation dispenser carton |
| GB9622173D0 (en) | 1996-10-24 | 1996-12-18 | Glaxo Group Ltd | Particulate Products |
| US6077539A (en) | 1996-11-12 | 2000-06-20 | Pozen, Inc. | Treatment of migraine headache |
| GB9702799D0 (en) | 1997-02-12 | 1997-04-02 | Scherer Corp R P | Process for preparing solid pharmaceutical dosage forms |
| IT1291779B1 (it) | 1997-02-17 | 1999-01-21 | Magnetek Spa | Procedimento per la realizzazione di circuiti stampati e circuiti stampati cosi'ottenuti |
| GB9703673D0 (en) | 1997-02-21 | 1997-04-09 | Bradford Particle Design Ltd | Method and apparatus for the formation of particles |
| US6236747B1 (en) | 1997-02-26 | 2001-05-22 | Acuity Imaging, Llc | System and method for image subtraction for ball and bumped grid array inspection |
| US6024981A (en) | 1997-04-16 | 2000-02-15 | Cima Labs Inc. | Rapidly dissolving robust dosage form |
| US6129905A (en) | 1997-04-21 | 2000-10-10 | Aeropharm Technology, Inc. | Aerosol formulations containing a sugar as a dispersant |
| US5916125A (en) | 1997-05-16 | 1999-06-29 | Allison Engine Company, Inc. | Forced purge wave rotor |
| US6120752A (en) | 1997-05-21 | 2000-09-19 | 3M Innovative Properties Company | Medicinal aerosol products containing formulations of ciclesonide and related steroids |
| SE9701956D0 (sv) | 1997-05-23 | 1997-05-23 | Astra Ab | New composition of matter |
| US6315122B1 (en) | 1997-05-29 | 2001-11-13 | Mitsubishi Polyester Film, Llc | Palletless packaging system |
| US6236647B1 (en) | 1998-02-24 | 2001-05-22 | Tantivy Communications, Inc. | Dynamic frame size adjustment and selective reject on a multi-link channel to improve effective throughput and bit error rate |
| US6200293B1 (en) | 1997-08-27 | 2001-03-13 | Science Incorporated | Fluid delivery device with temperature controlled energy source |
| US6309623B1 (en) | 1997-09-29 | 2001-10-30 | Inhale Therapeutic Systems, Inc. | Stabilized preparations for use in metered dose inhalers |
| WO1999017742A2 (en) | 1997-10-03 | 1999-04-15 | Elan Corporation, Plc | Taste masked formulations |
| US5954047A (en) | 1997-10-17 | 1999-09-21 | Systemic Pulmonary Development, Ltd. | Methods and apparatus for delivering aerosolized medication |
| US6089911A (en) | 1997-12-05 | 2000-07-18 | The Whitaker Corporation | Apparatus and method for mounting a plurality of surface mount contacts |
| GB9804379D0 (en) | 1998-03-02 | 1998-04-22 | Bradford Particle Design Ltd | Method of particle formation |
| US6120613A (en) | 1998-04-30 | 2000-09-19 | Micell Technologies, Inc. | Carbon dioxide cleaning and separation systems |
| SE9801287D0 (sv) | 1998-04-14 | 1998-04-14 | Astra Ab | Incorporation of active substances in carrier matrixes |
| SE9801288D0 (sv) | 1998-04-14 | 1998-04-14 | Astra Ab | Vaccine delivery system and metod of production |
| GB9808802D0 (en) | 1998-04-24 | 1998-06-24 | Glaxo Group Ltd | Pharmaceutical formulations |
| GB9810126D0 (ko) | 1998-05-13 | 1998-07-08 | Glaxo Group Ltd | |
| GB9810559D0 (en) | 1998-05-15 | 1998-07-15 | Bradford Particle Design Ltd | Method and apparatus for particle formation |
| SE9802073D0 (sv) | 1998-06-11 | 1998-06-11 | Astra Ab | New use |
| CA2336139C (en) | 1998-06-24 | 2008-10-14 | Advanced Inhalation Research, Inc. | Large porous particles emitted from an inhaler |
| NZ509328A (en) | 1998-07-24 | 2002-11-26 | Jago Res A | Medicinal aerosol formulations |
| SE513162C2 (sv) | 1998-07-24 | 2000-07-17 | Allgon Ab | Antennanordning |
| US6387410B1 (en) | 1998-09-10 | 2002-05-14 | Norton Healthcare Ltd | Anti-inflammatory pharmaceutical formulations |
| US6190029B1 (en) | 1998-09-25 | 2001-02-20 | Stanley Electric Co., Ltd. | Headlamp with beam distribution switch mechanism |
| US5992306A (en) | 1998-10-15 | 1999-11-30 | Century Machinery Corp. | Structure of a hand holding net basket for frying |
| SE9804001D0 (sv) | 1998-11-23 | 1998-11-23 | Astra Ab | New process |
| SE9804003D0 (sv) | 1998-11-23 | 1998-11-23 | Astra Ab | A method of producing drug particles |
| CA2351720C (en) | 1998-11-25 | 2006-11-21 | Cima Labs Inc. | Taste masking rapid release coating system |
| GB9825883D0 (en) | 1998-11-27 | 1999-01-20 | Aea Technology Plc | Formation of monodisperse particles |
| US6390291B1 (en) | 1998-12-18 | 2002-05-21 | Smithkline Beecham Corporation | Method and package for storing a pressurized container containing a drug |
| US6119853A (en) | 1998-12-18 | 2000-09-19 | Glaxo Wellcome Inc. | Method and package for storing a pressurized container containing a drug |
| CA2323739C (en) | 1999-01-14 | 2008-08-05 | Teijin Limited | Device and method for feeding a constant amount of powder body |
| JP4812167B2 (ja) | 1999-02-12 | 2011-11-09 | モレキュラー インサイト ファーマスーティカルズ インコーポレイテッド | 薬物輸送用マトリックス、ならびにその作成方法および使用方法 |
| SI1165044T1 (en) | 1999-03-26 | 2004-10-31 | Pozen, Inc. | High potency dihydroergotamine compositions |
| SE9901667D0 (sv) | 1999-05-07 | 1999-05-07 | Astra Ab | Method and device for forming particles |
| US6395300B1 (en) | 1999-05-27 | 2002-05-28 | Acusphere, Inc. | Porous drug matrices and methods of manufacture thereof |
| US6858199B1 (en) | 2000-06-09 | 2005-02-22 | Advanced Inhalation Research, Inc. | High efficient delivery of a large therapeutic mass aerosol |
| GB9915975D0 (en) | 1999-07-07 | 1999-09-08 | Bradford Particle Design Ltd | Method for the formation of particles |
| US20020081266A1 (en) | 1999-08-20 | 2002-06-27 | Norton Healthcare Ltd. | Spray dried powders for pulmonary or nasal administration |
| US7678364B2 (en) | 1999-08-25 | 2010-03-16 | Alkermes, Inc. | Particles for inhalation having sustained release properties |
| GB9920558D0 (en) | 1999-08-31 | 1999-11-03 | Bradford Particle Design Ltd | Methods for particle formation and their products |
| WO2001038002A1 (en) | 1999-09-13 | 2001-05-31 | Sheffield Pharmaceuticals, Inc. | Aerosol airflow control system and method |
| US6346323B1 (en) | 1999-10-07 | 2002-02-12 | Sig Pack Systems Ag | Multi-layer synthetic film |
| US6264981B1 (en) | 1999-10-27 | 2001-07-24 | Anesta Corporation | Oral transmucosal drug dosage using solid solution |
| US6367471B1 (en) | 1999-11-01 | 2002-04-09 | Sheffield Pharmaceuticals, Inc. | Internal vortex mechanism for inhaler device |
| AU4305101A (en) * | 1999-11-22 | 2001-06-04 | Research Foundation Of The State University Of New York, The | Magnetic nanoparticles for selective therapy |
| KR100311975B1 (ko) * | 1999-12-16 | 2001-10-17 | 윤종용 | 반도체소자 및 그 제조방법 |
| KR20010088139A (ko) | 2000-03-10 | 2001-09-26 | 백승헌 | 텍스트 데이터 입력에 대응한 입모양 출력장치 및 그 방법 |
| PE20011227A1 (es) | 2000-04-17 | 2002-01-07 | Chiesi Farma Spa | Formulaciones farmaceuticas para inhaladores de polvo seco en la forma de aglomerados duros |
| GB0011807D0 (en) | 2000-05-16 | 2000-07-05 | Quadrant Holdings Cambridge | Formulation for inhalation |
| US6316029B1 (en) | 2000-05-18 | 2001-11-13 | Flak Pharma International, Ltd. | Rapidly disintegrating solid oral dosage form |
| US6620351B2 (en) | 2000-05-24 | 2003-09-16 | Auburn University | Method of forming nanoparticles and microparticles of controllable size using supercritical fluids with enhanced mass transfer |
| US6451287B1 (en) | 2000-05-26 | 2002-09-17 | Smithkline Beecham Corporation | Fluorinated copolymer surfactants and use thereof in aerosol compositions |
| US6656492B2 (en) | 2000-06-30 | 2003-12-02 | Yamanouchi Pharmaceutical Co., Ltd. | Quick disintegrating tablet in buccal cavity and manufacturing method thereof |
| FR2812040B1 (fr) | 2000-07-18 | 2003-02-07 | Cit Alcatel | Carter monobloc pour pompe a vide |
| US20040137424A1 (en) | 2000-07-24 | 2004-07-15 | Tan Yin Hwee | Nucleic acids and methods for detecting viral infection, uncovering anti-viral drug candidates and determining drug resistance of viral isolates |
| US6941569B2 (en) | 2000-08-18 | 2005-09-06 | Hewlett-Packard Development Company, L.P. | System and method utilizing a conductive brush for providing power signals to a cartridge access device |
| US6406681B1 (en) | 2000-08-21 | 2002-06-18 | Aeropharm Technology, Inc. | Method of treating a systemic disease |
| CA2419623A1 (en) | 2000-08-30 | 2002-03-07 | Lilly Icos Llc | Method for treatment of migraine using pde5 inhibitors |
| US6514482B1 (en) | 2000-09-19 | 2003-02-04 | Advanced Inhalation Research, Inc. | Pulmonary delivery in treating disorders of the central nervous system |
| US6613308B2 (en) | 2000-09-19 | 2003-09-02 | Advanced Inhalation Research, Inc. | Pulmonary delivery in treating disorders of the central nervous system |
| FR2815540B1 (fr) | 2000-10-19 | 2005-06-10 | Separex Sa | Procede de fabrication de tres fines particules constituees d'un principe insere dans une molecule hote |
| GB0027357D0 (en) | 2000-11-09 | 2000-12-27 | Bradford Particle Design Plc | Particle formation methods and their products |
| US6932861B2 (en) | 2000-11-28 | 2005-08-23 | Fmc Corporation | Edible PGA coating composition |
| GB0102075D0 (en) | 2001-01-26 | 2001-03-14 | Astrazeneca Ab | Process |
| JP2005503425A (ja) | 2001-05-24 | 2005-02-03 | アレックザ モレキュラー デリヴァリー コーポレイション | 所定の吸入ルートによる薬剤エステルの送出 |
| US20030198669A1 (en) * | 2001-07-05 | 2003-10-23 | R.T. Alamo Ventures I, Llc | Compositions and methods for rapid dissolving formulations of dihydroergotamine and caffeine for the treatment of migraine |
| US20030017175A1 (en) * | 2001-07-05 | 2003-01-23 | R.T. Alamo Ventures I, Inc. | Sublingual administration of dihydroergotamine for the treatment of migraine |
| US6685951B2 (en) | 2001-07-05 | 2004-02-03 | R. T. Alamo Ventures I, Inc. | Administration of dihydroergotamine as a sublingual spray or aerosol for the treatment of migraine |
| US20030022910A1 (en) | 2001-07-05 | 2003-01-30 | R.T. Alamo Ventures I, Inc. | Compositions and methods for sublingual formulations of dihydroergotamine for the treatment of migraine |
| US20030008005A1 (en) * | 2001-07-05 | 2003-01-09 | R.T. Alamo Ventures, Inc. | Sublingual administration of dihydroergotamine for the treatment of migraine |
| GB0208742D0 (en) | 2002-04-17 | 2002-05-29 | Bradford Particle Design Ltd | Particulate materials |
| TW586963B (en) | 2001-07-20 | 2004-05-11 | Nektar Therapeutics Uk Ltd | Method and apparatus for preparing target substance in particulate form and fluid inlet assembly for said apparatus |
| GB0117696D0 (en) | 2001-07-20 | 2001-09-12 | Bradford Particle Design Plc | Particle information |
| US20030181462A1 (en) | 2001-08-17 | 2003-09-25 | Boehringer Ingelheim Pharma Kg | Use of BIBN4096 in combination with other antimigraine drugs for the treatment of migraine |
| US20030091513A1 (en) * | 2001-10-03 | 2003-05-15 | Mohsen Nahed M. | Method to generate water soluble or nonwater soluble in nanoparticulates directly in suspension or dispersion media |
| AU2003208761A1 (en) | 2002-02-21 | 2003-09-09 | Amarin Development Ab | A method for releasing nanosized particles of an active substance from a diffusion-controlled pharmaceutical composition for oral use |
| AU2003209475A1 (en) | 2002-03-07 | 2003-09-16 | Vectura Limited | Fast melt multiparticulate formulations for oral delivery |
| WO2003075829A2 (en) | 2002-03-08 | 2003-09-18 | M/S. Ind-Swift Limited | Tasteless directly compressible fast-dissolving complexes and pharmaceutical formulations thereof |
| DE10212564B4 (de) * | 2002-03-12 | 2007-04-19 | Neurobiotec Gmbh | 1-Allyl-ergotalkaloid-Derivate und ihre Verwendung zur Prophylaxe und Therapie von Migräne |
| US7582284B2 (en) | 2002-04-17 | 2009-09-01 | Nektar Therapeutics | Particulate materials |
| JP2004184809A (ja) | 2002-12-05 | 2004-07-02 | Nitto Denko Corp | 偏光板の製造方法、偏光板およびそれを用いた画像表示装置 |
| GB0300338D0 (en) | 2003-01-08 | 2003-02-05 | Bradford Particle Design Ltd | Particle formation |
| AU2003900081A0 (en) | 2003-01-08 | 2003-01-23 | George Moore | Drilling jig |
| GB0300339D0 (en) | 2003-01-08 | 2003-02-05 | Bradford Particle Design Ltd | Particle formation |
| GB0304636D0 (en) | 2003-02-28 | 2003-04-02 | Britannia Pharmaceuticals Ltd | Pharmaceutical composition for nasal delivery |
| US20060147389A1 (en) * | 2004-04-14 | 2006-07-06 | Vectura Ltd. | Devices and pharmaceutical compositions for enhancing dosing efficiency |
| US7354601B2 (en) | 2003-05-08 | 2008-04-08 | Walker Stephen E | Particulate materials |
| EP1663159A4 (en) | 2003-09-10 | 2010-06-09 | Map Pharmaceuticals Inc | AEROSOL FORMULATIONS FOR THE DELIVERY OF DIHYDROERGOTAMINE TO THE SYSTEMIC CIRCULATION BY PULMONARY INHALATION |
| JP2007516259A (ja) | 2003-12-09 | 2007-06-21 | メッドクリスタルフォームズ、エルエルシー | 活性剤との混合相共結晶の調製方法 |
| US20070020299A1 (en) | 2003-12-31 | 2007-01-25 | Pipkin James D | Inhalant formulation containing sulfoalkyl ether cyclodextrin and corticosteroid |
| US20060246070A1 (en) | 2004-09-30 | 2006-11-02 | Heavner George A | Methods and compositions for treating renal cell carcinoma related pathologies |
| US20060240043A1 (en) | 2004-10-08 | 2006-10-26 | Meyerson Laurence R | Methods and compositions for treating migraine pain |
| WO2006103407A2 (en) | 2005-03-28 | 2006-10-05 | Orexo Ab | New pharmaceutical compositions useful in the treatment of migraine |
| US7219664B2 (en) * | 2005-04-28 | 2007-05-22 | Kos Life Sciences, Inc. | Breath actuated inhaler |
| EP1906919A4 (en) | 2005-07-15 | 2012-12-26 | Map Pharmaceuticals Inc | MULTIPLE ACTIVE PHARMACEUTICAL PRINCIPLES COMBINED IN DISCRETE INHALATION PARTICLES AND THEIR FORMULATIONS |
| SE530445C2 (sv) | 2006-10-23 | 2008-06-10 | Volvo Lastvagnar Ab | Hyttupphängningssystem |
| EP2117506A2 (en) | 2006-12-13 | 2009-11-18 | Stephen M. Tuel | Methods of making pharmaceutical components for customized drug products |
| KR20090129998A (ko) * | 2007-02-11 | 2009-12-17 | 맵 파마슈티컬스, 인코포레이티드 | 부작용 프로파일을 최소화하면서 편두통의 빠른 완화를 가능하게 하는 dhe의 치료적 투여 방법 |
| GB2448183A (en) | 2007-04-05 | 2008-10-08 | Optinose As | Nasal powder delivery device |
| EP2235627A1 (en) | 2007-12-07 | 2010-10-06 | Krass, Maren | Using function calls as compiler directives |
| TW200938236A (en) | 2008-03-13 | 2009-09-16 | Fei-Peng Lin | Deodorization material composition, manufacturing method thereof, and deodorization method |
| EP2105189A1 (de) | 2008-03-27 | 2009-09-30 | Siemens Aktiengesellschaft | Verfahren und Vorrichtung zum Abtrennen von Kohlendioxid aus Rauchgas einer fossilbefeuerten Kraftwerksanlage |
| EP2829265B1 (en) | 2008-04-28 | 2016-08-24 | Zogenix, Inc. | Novel formulations for treatment of migraine |
| CN102089027A (zh) * | 2008-07-11 | 2011-06-08 | Map药物公司 | 用于输送气雾剂药物的容器 |
| US20110053913A1 (en) * | 2009-06-25 | 2011-03-03 | Khem Jhamandas | Methods and Therapies for Alleviating Pain |
| EP2322326A1 (en) | 2009-11-13 | 2011-05-18 | Frederik Daniël Nossbaum | Multifunctional tool |
-
2008
- 2008-02-11 KR KR1020097019032A patent/KR20090129998A/ko not_active Application Discontinuation
- 2008-02-11 AU AU2008214205A patent/AU2008214205B2/en active Active
- 2008-02-11 DK DK11191794.4T patent/DK2425820T3/en active
- 2008-02-11 JP JP2009549138A patent/JP5825757B2/ja active Active
- 2008-02-11 HU HUE11191794A patent/HUE026884T2/en unknown
- 2008-02-11 KR KR1020157007681A patent/KR20150041804A/ko not_active Application Discontinuation
- 2008-02-11 DK DK08725456.1T patent/DK2120875T3/en active
- 2008-02-11 PT PT111917944T patent/PT2425820E/pt unknown
- 2008-02-11 KR KR1020167023885A patent/KR20160106200A/ko not_active Application Discontinuation
- 2008-02-11 SI SI200831425T patent/SI2425820T1/sl unknown
- 2008-02-11 ES ES11191794.4T patent/ES2538082T3/es active Active
- 2008-02-11 EP EP08725456.1A patent/EP2120875B1/en active Active
- 2008-02-11 CN CN200880011629A patent/CN101677954A/zh active Pending
- 2008-02-11 ES ES08725456.1T patent/ES2691033T3/es active Active
- 2008-02-11 CN CN201410379903.5A patent/CN104188907A/zh active Pending
- 2008-02-11 CA CA2677838A patent/CA2677838C/en active Active
- 2008-02-11 MX MX2009008582A patent/MX2009008582A/es active IP Right Grant
- 2008-02-11 US US12/069,667 patent/US8148377B2/en active Active
- 2008-02-11 EP EP11191794.4A patent/EP2425820B1/en active Active
- 2008-02-11 WO PCT/US2008/001829 patent/WO2008097664A1/en active Application Filing
- 2008-02-11 PL PL11191794T patent/PL2425820T3/pl unknown
- 2008-02-11 EP EP20110191793 patent/EP2425819A1/en not_active Withdrawn
-
2009
- 2009-08-11 IL IL200333A patent/IL200333A/en active IP Right Grant
- 2009-08-13 ZA ZA2009/05628A patent/ZA200905628B/en unknown
- 2009-08-26 US US12/548,304 patent/US20100081664A1/en not_active Abandoned
- 2009-08-26 US US12/548,292 patent/US7994197B2/en active Active
-
2010
- 2010-07-19 US US12/839,190 patent/US8119639B2/en active Active
-
2012
- 2012-02-27 US US13/406,391 patent/US20120245179A1/en not_active Abandoned
-
2013
- 2013-08-05 JP JP2013162032A patent/JP5908439B2/ja active Active
-
2014
- 2014-06-23 AU AU2014203389A patent/AU2014203389B2/en active Active
- 2014-10-14 US US14/514,322 patent/US20150057287A1/en not_active Abandoned
-
2015
- 2015-06-08 HK HK15105429.3A patent/HK1204918A1/xx unknown
- 2015-06-26 CY CY20151100551T patent/CY1116546T1/el unknown
- 2015-10-23 US US14/921,860 patent/US9833451B2/en active Active
- 2015-12-03 JP JP2015236886A patent/JP2016040317A/ja active Pending
- 2015-12-03 JP JP2015236885A patent/JP6209198B2/ja active Active
-
2016
- 2016-11-04 AU AU2016253689A patent/AU2016253689B2/en active Active
-
2017
- 2017-03-28 US US15/471,334 patent/US10172853B2/en active Active
-
2018
- 2018-09-11 US US16/127,734 patent/US20190247393A1/en not_active Abandoned
-
2019
- 2019-12-05 US US16/704,867 patent/US20200352939A1/en not_active Abandoned
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US10172853B2 (en) | Method of therapeutic administration of DHE to enable rapid relief of migraine while minimizing side effect profile | |
| EP1449528A1 (en) | Treatment of respiratory diseases | |
| WO2014205030A1 (en) | Pulmonary administration of rotigotine |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A107 | Divisional application of patent | ||
| A201 | Request for examination | ||
| E902 | Notification of reason for refusal | ||
| E601 | Decision to refuse application |