KR20120140658A - Iap bir 도메인 결합 화합물 - Google Patents
Iap bir 도메인 결합 화합물 Download PDFInfo
- Publication number
- KR20120140658A KR20120140658A KR1020127023798A KR20127023798A KR20120140658A KR 20120140658 A KR20120140658 A KR 20120140658A KR 1020127023798 A KR1020127023798 A KR 1020127023798A KR 20127023798 A KR20127023798 A KR 20127023798A KR 20120140658 A KR20120140658 A KR 20120140658A
- Authority
- KR
- South Korea
- Prior art keywords
- compound
- mmol
- formula
- added
- saturated aqueous
- Prior art date
Links
- 0 Cc1cnc(*)[s]1 Chemical compound Cc1cnc(*)[s]1 0.000 description 4
- IHNKMJLDBGGAOD-UHFFFAOYSA-N Cc1c[n](CCCC2)c2n1 Chemical compound Cc1c[n](CCCC2)c2n1 IHNKMJLDBGGAOD-UHFFFAOYSA-N 0.000 description 1
- NDQACJBDAQZPCW-UHFFFAOYSA-N Cc1nnc(-c2ccccc2)[o]1 Chemical compound Cc1nnc(-c2ccccc2)[o]1 NDQACJBDAQZPCW-UHFFFAOYSA-N 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D487/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00
- C07D487/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00 in which the condensed system contains two hetero rings
- C07D487/04—Ortho-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K5/00—Peptides containing up to four amino acids in a fully defined sequence; Derivatives thereof
- C07K5/04—Peptides containing up to four amino acids in a fully defined sequence; Derivatives thereof containing only normal peptide links
- C07K5/06—Dipeptides
- C07K5/06008—Dipeptides with the first amino acid being neutral
- C07K5/06017—Dipeptides with the first amino acid being neutral and aliphatic
- C07K5/06026—Dipeptides with the first amino acid being neutral and aliphatic the side chain containing 0 or 1 carbon atom, i.e. Gly or Ala
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/4353—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom ortho- or peri-condensed with heterocyclic ring systems
- A61K31/437—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom ortho- or peri-condensed with heterocyclic ring systems the heterocyclic ring system containing a five-membered ring having nitrogen as a ring hetero atom, e.g. indolizine, beta-carboline
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/505—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim
- A61K31/519—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim ortho- or peri-condensed with heterocyclic rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D403/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00
- C07D403/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings
- C07D403/12—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D471/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00
- C07D471/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00 in which the condensed system contains two hetero rings
- C07D471/04—Ortho-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K5/00—Peptides containing up to four amino acids in a fully defined sequence; Derivatives thereof
- C07K5/04—Peptides containing up to four amino acids in a fully defined sequence; Derivatives thereof containing only normal peptide links
- C07K5/06—Dipeptides
- C07K5/06008—Dipeptides with the first amino acid being neutral
- C07K5/06017—Dipeptides with the first amino acid being neutral and aliphatic
- C07K5/06034—Dipeptides with the first amino acid being neutral and aliphatic the side chain containing 2 to 4 carbon atoms
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Medicinal Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Biochemistry (AREA)
- Biophysics (AREA)
- Molecular Biology (AREA)
- Genetics & Genomics (AREA)
- Veterinary Medicine (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Epidemiology (AREA)
- Immunology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- Pain & Pain Management (AREA)
- Rheumatology (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Heterocyclic Carbon Compounds Containing A Hetero Ring Having Oxygen Or Sulfur (AREA)
Abstract
화학식 1의 화합물 또는 이의 염, 뿐만 아니라 화학식 1의 화합물의 제조방법, 암과 같은 증식성 장애를 치료하기 위해 화학식 1의 화합물을 사용하는 방법, 및 관련 화합물들, 조성물 및 방법들이 기재된다.
화학식 1
화학식 1
Description
관련 출원의 상호 참조
본 출원은 2010년 2월 12일자로 출원된 미국 가특허 출원 제61/303,809호 및 2010년 11월 19일자로 출원된 미국 가특허 출원 제61/415,638호에 대해 우선권을 주장한다.
아폽토시스(apoptosis) 또는 예정된 세포 사멸(programmed cell death)은 다세포 유기체 내의 건강한 조직의 정상적 발달 및 유지 과정에서 통상적으로 일어난다. 이는, 염증 또는 괴사의 징후 없이, 손상되거나 병에 걸리거나 과다발육된 세포의 제거를 이끌어내는 복잡한 과정이다.
내인성 아폽토시스 경로는 암 및 림프증식성 장애, 신경퇴행성 질환, 및 자가면역 및 염증성 상태, 예를 들면, 다발성 경화증 및 류머티스성 관절염을 포함하는 각종 장애에서 조절이 곤란한 것으로 공지되어 있다. 예컨대, 암 세포는 강력한 아폽토시스 촉진 신호들, 예를 들면, 저산소증, 내인성 사이토킨, 방사선 요법 및 화학요법에도 불구하고, 아폽토시스를 극복하거나 회피하고 부적절한 증식을 지속하는 능력을 얻는다. 비정상적인 아폽토시스 저항성 세포들은 자가면역 및 염증성 질환에도 연관되어 있다. 예를 들면, 아폽토시스-저항성은 류머티스성 관절염(RA)과 관련하여 섬유아세포-유사 활막세포에서, 그리고 건선과 관련하여 케라티노사이트에서 관찰되어 왔다. 또한, 비정상적인 아폽토시스 저항성 T-세포가 몇몇 자가면역 또는 염증성 질환, 예를 들면, 다발성 경화증, 류머티스성 관절염, 특발성 혈소판감소성 자반증 및 원형 탈모증에서 관찰되어 왔다. 병원성 효과기 세포들도 정상적인 아폽토시스 신호에 대한 저항성을 나타내어 왔다. 정상적인 아폽토시스에 대한 저항성은, 적어도 부분적으로는, 항-아폽토시스 경로의 증가된 활성 또는 항-아폽토시스 유전자의 발현에 의해 야기되는 것으로 사료된다.
카스파제(caspase)는 아폽토시스 경로의 필수적 부분이다. 카스파제는 아폽토시스를 개시하고 수행하는 것으로 공지되어 있는 시스테인 프로테아제 부류로부터의 단백질분해 효소들의 부류이다. 정상 세포에서, 카스파제는 불활성 효소원으로서 존재하지만, 수개의 외부 신호들 중의 어느 것에 의해 촉매적으로 활성화된다. 카스파제-활성화 신호에는, 예를 들면, 리간드-구동된 사멸 수용체 활성화 후의 사이토킨 또는 면역제의 방출, 또는 유전독성, 화학독성 또는 방사선-유도된 세포 손상 후의 사이토크롬 C와 같은 미토콘드리아 인자들의 방출이 포함된다.
아폽토시스 단백질의 억제제(IAP: Inhibitor of Apoptosis Protein)는 카스파제를 억제시키고 이에 따라 세포 아폽토시스를 저지시키는 단백질들의 부류를 구성한다. 상기 IAP는, 카스파제 활성을 조절하는 데에 중추적 역할을 하기 때문에, 다양한 촉발인자(trigger)들로부터의 계획된 세포 사멸을 억제시킬 수 있다. 상기 IAP는 항상성 또는 내인성 세포 성장 제어 메커니즘의 손실, 뿐만 아니라 화학치료 약물 및 방사선 요법에 대한 저항을 담당하는 것으로 사료된다.
상기 IAP는 바큘로바이러스 IAP 반복(BIR: baculovirus IAP repeat) 도메인으로 공지된 1개 내지 3개의 상동 구조 도메인을 함유한다. 이들은 또한 이의 E3 리가제 기능을 통해 IAP-결합 분자들의 유비퀴틴화를 유도하는 능력을 갖는 RING 징크 핑거(zinc finger) 도메인을 C-말단에 함유한다. XIAP, HIAP1(cIAP2라고도 함) 및 HIAP2(cIAP1)로 공지된 사람 IAP들은 각각 3개의 BIR 도메인, 및 카복시 말단 RING 징크 핑거를 갖는다. NAIP로 공지된 또다른 IAP는 3개의 BIR 도메인(BIR1, BIR2 및 BIR3)을 갖지만, RING 도메인을 갖지 않는다. 리빈(Livin), TsIAP 및 MLIAP로 공지된 또다른 IAP들은 오로지 단일 BIR 도메인 및 단일 RING 도메인만을 갖는다.
X 염색체-링크된 아폽토시스의 억제제(XIAP: X chromosome-linked inhibitor of apoptosis)는 카스파제-9로 공지된 개시자 카스파제, 및 카스파제-3 및 카스파제-7로 공지된 효과기 카스파제를 직접 결합에 의해 억제시킬 수 있는 IAP의 일례이다. XIAP가 카스파제-9에 결합하여 이를 억제시키는 것은 BIR3 도메인을 통해서다. XIAP의 링커(linker)-BIR2 도메인은 카스파제-3 및 카스파제-7의 활성을 억제시킨다. 상기 BIR 도메인들은 또한, NFkB 활성화를 통한 생존 신호전달을 수행하는 어댑터 단백질들로서, 종양 괴사 인자-수용체 관련 인자(TRAF: tumor necrosis factor-receptor associated factor)-1 및 TRAF-2, 및 TAB1과 IAP의 상호작용과도 관련되어 있다. XIAP는 또한 유비퀴틴화-매개된 프로테아솜 분해를 유도하는, RING 징크 핑거 도메인의 E3 리가제 활성을 통해 카스파제의 제거를 유도할 수 있다.
이와 같이, 상기 IAP는, 활성 카스파제를 억제시키고 세포 신호전달을 생존 촉진 모드로 다시 설계함으로써 아폽토시스 캐스캐이드의 직접적 제동장치로서 기능한다. 따라서, 상기 IAP 단백질 부류의 하나 이상의 구성원의 지속적 과발현은 병든 세포, 예를 들면, 암 세포 및 자가면역 질환에 연루된 세포가 아폽토시스를 회피하는 것을 가능하게 한다. 실제로, IAP 과발현은 다수의 암에서 불량한 임상 결과의 예후인자인 것으로 입증되어 왔다. 추가로, RNA 안티센스 또는 siRNA 전략을 통한 IAP 발현의 저지는 화학요법, 방사선요법, 및 사멸 수용체들의 리간드-매개된 활성화를 포함하는 다양한 아폽토시스적 손상에 종양 세포들을 감작시킨다. XIAP의 경우, 이는 백혈병 및 난소암과 같이 다양한 암들에서 나타나고 있다. cIAP1 및 cIAP2의 과발현이 또한 수모세포종, 신세포 암종, 교아종 및 위 암종을 포함하는 다양한 각종 악성종양들에서 관찰되고 있다. 이러한 이유로, 상기 IAP는 유효한 치료 표적이며, 이들의 발현 또는 기능을 억제시키는 화합물들은 암, 자가면역 및 염증 질환을 포함하는, 조절이 곤란한 아폽토시스와 관련된 증식성 질환의 치료에서 상당한 유용성을 갖는 것으로 사료된다.
발명의 개요
본원에서는 화학식 1의 화합물 또는 이의 염이 제공된다.
화학식 1
상기 화학식 1에서,
R1은 H 또는 알킬이고;
R2는 메틸 또는 에틸이고;
R3은 알킬, 사이클로알킬, 헤테로사이클릴, 헤테로아릴 또는 아릴이고, 이들 중의 어느 것은 임의로 아미노, 알킬아미노 또는 알콕시로 추가로 치환될 수 있고;
R4 및 R5는, 각각 독립적으로, H 또는 알킬이고;
R6은 H, 할로겐 또는 알콕시이고;
X는 O, S, CH2, -(CH2)2- 또는 CH-R7이고, 여기서, R7은 NR8, OR8, NC(O)OR8, NHC(O)R8 또는 NHSO2R8이고, 여기서, R8은 알킬, 사이클로알킬, 헤테로사이클릴, 아릴, 아릴알킬 또는 헤테로아릴(이들 중의 어느 것은 임의로 알킬 또는 할로겐으로 추가로 치환될 수 있다)이고;
G는,
(2) 치환되거나 치환되지 않은 아릴, 헤테로아릴, 사이클로알킬 또는 헤테로사이클릴에 임의로 융합된, 치환되거나 치환되지 않은 아졸 또는 피롤 환이다.
또한, 본원에서는 화학식 1의 화합물 또는 이의 염의 제조방법, 뿐만 아니라 화학식 1의 화합물 또는 이의 염의 제조에서 중간체로서 유용한 화합물들도 제공한다.
또다른 측면에서, 본 발명은 화학식 1의 화합물 또는 이의 염 및 약제학적으로 허용되는 담체를 포함하는 약제학적 조성물, 뿐만 아니라 화학식 1의 화합물 또는 이의 염을 약제학적으로 허용되는 담체와 배합함을 포함하는 상기 약제학적 조성물의 제조방법을 제공한다.
본 발명은 추가로, 세포에서의 아폽토시스를 증진시키는 방법을 제공하며, 상기 방법은, 세포를 화학식 1의 화합물 또는 이의 염과 접촉시킴을 포함한다. 불충분한 아폽토시스가 특징인 질환 또는 장애의 치료 방법도 본원에서 제공되며, 상기 방법은, 상기 질환 또는 장애의 치료를 필요로 하는 개체(subject)에게 상기된 바와 같은 화합물 또는 약제학적 조성물을 투여하여 상기 질환 또는 장애를 치료함을 포함한다.
또한, 본원에서는 화학식 1의 화합물 또는 이의 염 및 검출가능한 표지를 포함하는 프로브, 뿐만 아니라, IAP BIR 도메인에 결합하는 화합물을 식별하기 위해 상기 프로브를 사용하는 방법도 제공되며, 상기 방법은, (a) IAP BIR 도메인을 상기 프로브와 접촉시켜 프로브:BIR 도메인 복합체를 형성하고(상기 프로브는 시험 화합물에 의해 변위될 수 있다); (b) 상기 프로브로부터의 신호를 측정하여 기준 레벨을 확립하고; (c) 상기 프로브:BIR 도메인 복합체를 시험 화합물과 접촉시키고; (d) 상기 프로브로부터의 신호를 측정하고; (e) 단계 (d)로부터의 신호를 상기 기준 레벨과 비교함을 포함하고, 여기서, 상기 신호의 변조(예를 들면, 상기 기준 레벨에 대한 상기 신호의 증가 또는 감소)는 상기 시험 화합물이 상기 BIR 도메인에 결합한다는 것을 나타낸다.
발명의 상세한 설명
본원에서는 화학식 1의 화합물 또는 이의 염이 제공된다.
화학식 1
본 발명은 화학식 1에 의해 기술된 모든 화합물들 및 이의 염들을 제한 없이 포함한다. 그러나, 추가로 예시하기 위한 목적으로, 본 발명의 바람직한 측면들 및 요소들이 본원에서 논의된다.
화학식 1에 따르면, G는 의 구조를 갖는 그룹일 수 있고, 여기서, R9는 치환되거나 치환되지 않은 알킬, 사이클로알킬, 헤테로사이클릴, 아릴 또는 헤테로아릴이다. 예를 들면, R9는, 할로겐 또는 알콕시로 임의로 치환된 페닐 그룹일 수 있다.
대안적으로, G는, 치환되거나 치환되지 않은 아릴, 헤테로아릴, 사이클로알킬 또는 헤테로사이클릭 환에 임의로 융합된, 치환되거나 치환되지 않은 아졸 또는 피롤 환일 수도 있다. 예를 들면, G는,
일 수 있고, 여기서, X1은 CH 또는 N이고, R10은 H, 할로겐, 하이드록실, 알킬, 알콕시, 아릴, 아미노 또는 NHC(O)-알킬이고, R11은 수소, 알킬 또는 NHC(O)CH3이다. G는 또한,
일 수 있고, 여기서, X2는 NH, NR12, O 또는 S이고, R12는 각각 독립적으로 수소, 알킬, 사이클로알킬, 헤테로사이클릴, NHC(O)CH3 또는 페닐(이는 하나 이상의 알킬, 알콕시 또는 할로겐 그룹으로 임의로 치환된다)이다.
하나의 양태에 따르면, G는,
치환되거나 치환되지 않은 피롤(이의 특정예에는, 제한 없이,
치환되거나 치환되지 않은 이미다졸(이의 특정예에는, 제한 없이,
치환되거나 치환되지 않은 피라졸(이의 특정예에는, 제한 없이,
치환되거나 치환되지 않은 트리아졸(이의 특정예에는, 제한 없이,
치환되거나 치환되지 않은 티아졸(이의 특정예에는, 제한 없이,
치환되거나 치환되지 않은 테트라졸(이의 특정예에는, 제한 없이,
치환되거나 치환되지 않은 옥사졸(이의 특정예에는, 제한 없이,
치환되거나 치환되지 않은 이속사졸(이의 특정예에는, 제한 없이,
치환되거나 치환되지 않은 옥사디아졸(이의 특정예에는, 제한 없이,
치환되거나 치환되지 않은 인돌(이의 특정예에는, 제한 없이,
치환되거나 치환되지 않은 이미다조[1,2-a]피리딘(이의 특정예에는, 제한 없이,
R1은 임의의 알킬, 예를 들면, C1-C3 알킬(예: 메틸, 에틸, 또는 이소프로필을 포함하는 프로필), 바람직하게는 메틸일 수 있고, R2는 메틸 또는 에틸이다.
R3은 알킬, 사이클로알킬, 헤테로사이클릴, 헤테로아릴 또는 아릴일 수 있고, 임의로 아미노, 알킬아미노 또는 알콕시로 추가로 치환될 수 있다. 적합한 R3 그룹의 비제한적 예에는 C1-C6 또는 C1-C4 알킬(예: 메틸, 에틸, 프로필, 이소프로필, 부틸, 이소부틸, 3급-부틸 등), 사이클로헥실, 사이클로프로필 및 테트라하이드로-2H-피라닐이 포함된다. 예를 들면, R3은,
R4 및 R5는, 독립적으로, 수소 또는 알킬, 예를 들면, C1-C6 알킬이다. R6은 수소, 할로겐 또는 알콕시, 예를 들면, C1-C6 알콕시일 수 있다. 바람직하게는, R6은 수소, 불소 또는 C1-C3 알콕시, 예를 들면, 메톡시 또는 에톡시이다.
X는 O, S, CH2, -(CH2)2- 또는 CH-R7일 수 있고, 여기서, R7은 NR8, OR8, NHC(O)OR8, NHC(O)R8 또는 NHSO2R8이고, R8은 알킬, 사이클로알킬, 헤테로사이클릴, 아릴, 아릴알킬 또는 헤테로아릴이다. R8은 알킬, 알콕시, 할로알킬 또는 할로겐으로 추가로 치환될 수 있다. 몇몇 양태에 따르면, X는 CH2이다. 다른 양태에서, X는 CH-NHC(O)R8이고, R8은 알킬, 아릴, 아릴알킬, 알콕시 또는 헤테로아릴(이들 중의 어느 것은 임의로 알킬, 알콕시, 할로알킬 또는 할로겐으로 추가로 치환될 수 있다)이다. 또다른 양태에서, X는 CH-OR8이고, R8은, 임의로 할로겐으로 추가로 치환될 수 있는, 아릴 또는 아릴알킬이다. X의 특정예에는, 제한 없이,
또는, 더욱 특히,
일반적 측면 및 바람직한 측면 둘 다에서, 상기 치환체 그룹들 중의 어느 것은 임의의 조합으로 사용되어 화학식 1의 화합물 또는 이의 염을 제공할 수 있다. 화학식 1의 화합물 또는 이의 염의 특정 예가 표 1 및 실시예들에 제공된다.
구조의 원자의 개수 범위를 나타낼 때(예: C1-C8, C1-C6, C1-C4 또는 C1-C3 알킬, 할로알킬, 알킬아미노, 알케닐 등), 특정하게는 상기 지시된 범위 내에 포함되는 탄소 원자들의 임의의 하위범위 또는 개별적 수치가 또한 사용될 수 있는 것으로 고려된다. 따라서, 예를 들면, 본원에서 언급된 임의의 화학 그룹(예: 알킬, 할로알킬, 알킬아미노, 알케닐 등)과 관련하여 사용된, 1개 내지 8개의 탄소 원자(예: C1-C8), 1개 내지 6개의 탄소 원자(예: C1-C6), 1개 내지 4개의 탄소 원자(예: C1-C4), 1개 내지 3개의 탄소 원자(예: C1-C3) 또는 2개 내지 8개의 탄소 원자(예: C2-C8)는, 적절한 경우, 1개, 2개, 3개, 4개, 5개, 6개, 7개 또는 8개의 탄소 원자, 뿐만 아니라, 이의 임의의 하위범위(예를 들면, 적절한 경우, 1개 내지 2개의 탄소 원자, 1개 내지 3개의 탄소 원자, 1개 내지 4개의 탄소 원자, 1개 내지 5개의 탄소 원자, 1개 내지 6개의 탄소 원자, 1개 내지 7개의 탄소 원자, 1개 내지 8개의 탄소 원자, 2개 내지 3개의 탄소 원자, 2개 내지 4개의 탄소 원자, 2개 내지 5개의 탄소 원자, 2개 내지 6개의 탄소 원자, 2개 내지 7개의 탄소 원자, 2개 내지 8개의 탄소 원자, 3개 내지 4개의 탄소 원자, 3개 내지 5개의 탄소 원자, 3개 내지 6개의 탄소 원자, 3개 내지 7개의 탄소 원자, 3개 내지 8개의 탄소 원자, 4개 내지 5개의 탄소 원자, 4개 내지 6개의 탄소 원자, 4개 내지 7개의 탄소 원자, 4개 내지 8개의 탄소 원자, 5개 내지 6개의 탄소 원자, 5개 내지 7개의 탄소 원자, 5개 내지 8개의 탄소 원자, 6개 내지 7개의 탄소 원자, 또는 6개 내지 8개의 탄소 원자)를 포함하고 이를 특정하게 기술한다.
달리 특정되지 않는 한, 본원에서 사용된 용어 "치환된"은 1개 내지 4개 또는 그 이상의 치환체들에 의해 치환된 그룹을 의미한다. 치환체의 예에는, 예를 들면, 알킬, 알케닐, 알키닐, 사이클로알킬, 사이클로알케닐, 아로일, 할로, 할로알킬(예: 트리플루오로메틸), 할로알콕시(예: 트리플루오로메톡시), 하이드록시, 알콕시, 알킬티오에테르, 사이클로알킬옥시, 헤테로사이클로옥시, 옥소, 알카노일, 아릴, 아릴알킬, 알킬아릴, 헤테로아릴, 헤테로아릴알킬, 알킬헤테로아릴, 헤테로사이클로, 아릴옥시, 알카노일옥시, 아미노, 알킬아미노, 아릴아미노, 아릴알킬아미노, 사이클로알킬아미노, 헤테로사이클로아미노, 일치환된 아미노 및 이치환된 아미노(여기서, 아미노 그룹 위의 2개의 치환체들은 알킬, 아릴 또는 아릴알킬로부터 선택된다), 알카노일아미노, 아로일아미노, 아르알카노일아미노, 치환된 알카노일아미노, 치환된 아릴아미노, 치환된 아르알카노일아미노, 티올, 알킬티오, 아릴티오, 아릴알킬티오, 사이클로알킬티오, 헤테로사이클로티오, 알킬티오노, 아릴티오노, 아릴알킬티오노, 알킬설포닐, 아릴설포닐, 아릴알킬설포닐, 설폰아미도(예: SO2NH2), 치환된 설폰아미도, 니트로, 시아노, 카복시, 카바밀(예: CONH2), 치환된 카바밀(예: CONH-알킬, CONH-아릴, CONH-아릴알킬 또는, 질소 위에 알킬 또는 아릴알킬로부터 선택된 2개의 치환체가 존재하는 경우들), 알콕시카보닐, 아릴, 치환된 아릴, 구아니디노, 치환되거나 치환되지 않은 헤테로사이클로알킬, 치환되거나 치환되지 않은 헤테로아릴(예를 들면, 인돌릴, 이미다졸릴, 푸릴, 티에닐, 티아졸릴, 피롤리딜, 피리딜, 피리미딜 등)이 포함된다.
본원에서 사용된 용어 "아졸"은 적어도 하나의 기타 환-구성원인 질소, 황 또는 산소를 함유하는 5원 질소-함유 환을 포함하는 것으로 의도된다. 아졸의 비제한적 예에는 피라졸, 이미다졸, 트리아졸, 테트라졸, 펜타졸, 티아졸, 이소티아졸, 옥사졸 및 이속사졸이 포함된다.
본원에서 사용된 용어 "피롤"은 하나의 질소 원자를 함유하는 5원 방향족 헤테로사이클릭 환을 포함하는 것으로 의도된다. 본원에서 사용된 피롤은 수소화된 유도체 1-피롤린, 2-피롤린 및 3-피롤린도 포함한다.
본원에서 사용된 용어 "알킬"은 특정 개수의 탄소 원자를 갖는 분지쇄 및 직쇄 포화 지방족 탄화수소 그룹 둘 다를 포함하는 것으로 의도된다(예: C1-C20 알킬, C1-C8 알킬, C1-C6 알킬 등). 예를 들면, C1-C6-알킬은 1개, 2개, 3개, 4개, 5개 또는 6개의 탄소를 직쇄 또는 분지쇄 배열로 갖는 알킬 그룹들을 포함한다. 유사하게, C1-C4 알킬은 1개, 2개, 3개 또는 4개의 탄소를 직쇄 또는 분지쇄 배열로 갖는 알킬 그룹들을 포함하고, C1-C20-알킬은 1개, 2개, 3개, 4개, 5개, 6개, 7개, 8개, 9개, 10개, 11개, 12개, 13개, 14개, 15개, 16개, 17개, 18개, 19개 또는 20개의 탄소를 직쇄 또는 분지쇄 배열로 갖는 알킬 그룹들을 포함한다. 대표적인 포화 직쇄 알킬에는 -메틸, -에틸, -n-프로필, -n-부틸, -n-펜틸, -n-헥실, -n-헵틸, -n-옥틸, -n-노닐 및 -n-데실이 포함되고; 대표적인 포화 분지쇄 알킬에는 -이소프로필, -2급-부틸, -이소부틸, -3급-부틸, -이소펜틸, 2-메틸부틸, 3-메틸부틸, 2-메틸펜틸, 3-메틸펜틸, 4-메틸펜틸, 2-메틸헥실, 3-메틸헥실, 4-메틸헥실, 5-메틸헥실, 2,3-디메틸부틸, 2,3-디메틸펜틸, 2,4-디메틸펜틸, 2,3-디메틸헥실, 2,4-디메틸헥실, 2,5-디메틸헥실, 2,2-디메틸펜틸, 2,2-디메틸헥실, 3,3-디메틸펜틸, 3,3-디메틸헥실, 4,4-디메틸헥실, 2-에틸펜틸, 3-에틸펜틸, 2-에틸헥실, 3-에틸헥실, 4-에틸헥실, 2-메틸-2-에틸펜틸, 2-메틸-3-에틸펜틸, 2-메틸-4-에틸펜틸, 2-메틸-2-에틸헥실, 2-메틸-3-에틸헥실, 2-메틸-4-에틸헥실, 2,2-디에틸펜틸, 3,3-디에틸헥실, 2,2-디에틸헥실, 3,3-디에틸헥실 등이 포함된다. 알킬 그룹은 치환되지 않거나 치환될 수 있다. 본 발명을 기술하기 위한 목적으로, 용어 "알킬"은 적절한 경우 "알킬렌"을 포함한다.
본원에서 사용된 용어 "알케닐"은 특정 개수의 탄소 원자를 갖는 불포화된 직쇄 또는 분지쇄 탄화수소 그룹을 의미하는 것으로 의도되고, 여기서, 상기 탄소 원자들 중의 적어도 2개는 이중 결합에 의해 서로 결합되며, E 또는 Z 위치화학 및 이들의 조합을 갖는다. 예를 들면, C2-C6 알케닐 그룹은 2개, 3개, 4개, 5개 또는 6개의 탄소를 직쇄 또는 분지쇄 배열로 갖는 탄화수소 그룹들을 포함하고, 상기 탄소 원자들 중의 적어도 2개는 이중 결합에 의해 함께 결합된다. C2-C6 알케닐의 예에는 에테닐(비닐), 1-프로페닐, 2-프로페닐, 1-부테닐, -2-부테닐, -이소부틸레닐, -1-펜테닐, -2-펜테닐, -3-메틸-1-부테닐, -2-메틸-2-부테닐, -2,3-디메틸-2-부테닐, -1-헥세닐, -2-헥세닐, -3-헥세닐, -1-헵테닐, -2-헵테닐, -3-헵테닐, -1-옥테닐, -2-옥테닐, -3-옥테닐, -1-노네닐, -2-노네닐, -3-노네닐, -1-데세닐, -2-데세닐, -3-데세닐 등이 포함된다. 알케닐 그룹은 치환되지 않거나 치환될 수 있다. 본 발명을 기술하기 위한 목적으로, 용어 "알케닐"은 적절한 경우 "알케닐렌"을 포함한다.
본원에서 사용된 용어 "알키닐"은 특정한 개수의 탄소 원자를 갖는 불포화된 직쇄 탄화수소 그룹을 의미하는 것으로 의도되고, 여기서, 적어도 2개의 탄소 원자들은 삼중 결합에 의해 함께 결합된다. 예를 들면, C2-C4 알키닐에서 C2-C4는 쇄 내에 2개, 3개 또는 4개의 탄소 원자를 갖는 그룹들을 포함하도록 정의되고, 상기 탄소 원자들 중의 적어도 2개는 삼중 결합에 의해 함께 결합된다. 이러한 알키닐의 예에는 에티닐, 1-프로피닐, 2-프로피닐, -1-부티닐, -2-부티닐, -1-펜티닐, -2-펜티닐, -3-메틸-1-부티닐, -4-펜티닐, -1-헥시닐, -2-헥시닐, -5-헥시닐, -1-헵티닐, -2-헵티닐, -6-헵티닐, -1-옥티닐, -2-옥티닐, -7-옥티닐, -1-노니닐, -2-노니닐, -8-노니닐, -1-데시닐, -2-데시닐, -9-데시닐 등이 포함된다. 알키닐 그룹은 치환되지 않거나 치환될 수 있다. 본 발명을 기술하기 위한 목적으로, 용어 "알키닐"은 "알키닐렌"을 포함한다.
본원에서 사용된 용어 "사이클로알킬"은 특정 개수의 탄소 원자를 갖는 모노사이클릭 포화 지방족 탄화수소 그룹을 의미하는 것으로 의도되고, 예를 들면, C3-C7 사이클로알킬에서 C3-C7은 3개, 4개, 5개, 6개 또는 7개의 탄소를 모노사이클릭 배열로 갖는 그룹들을 포함하도록 정의된다. 상기 정의된 바와 같은 C3-C7 사이클로알킬의 예에는, 사이클로프로필, 사이클로부틸, 사이클로펜틸, 사이클로헥실 및 사이클로헵틸이 비제한적으로 포함된다. 본 발명을 기술하기 위한 목적으로, 용어 "사이클로알킬"은 "사이클로알킬렌"을 포함한다.
본원에서 사용된 용어 "사이클로알케닐"은 특정 개수의 탄소 원자를 갖는 모노사이클릭 불포화 지방족 탄화수소 그룹을 의미하는 것으로 의도되고, 예를 들면, C3-C7 사이클로알케닐에서 C3-C7은 3개, 4개, 5개, 6개 또는 7개의 탄소를 모노사이클릭 배열로 갖는 그룹들을 포함하도록 정의된다. 상기 정의된 바와 같은 C3-C7 사이클로알케닐의 예에는, 사이클로펜테닐 및 사이클로헥세닐이 비제한적으로 포함된다. 본 발명을 기술하기 위한 목적으로, 용어 "사이클로알케닐"은 "사이클로알케닐렌"을 포함한다.
본원에서 사용된 용어 "할로" 또는 "할로겐"은 불소, 염소, 브롬 및 요오드를 의미하는 것으로 의도된다.
본원에서 사용된 용어 "할로알킬"은, 각각의 수소 원자가 할로겐 원자에 의해 연속적으로 대체될 수 있는, 상기 정의된 바와 같은 알킬을 의미하는 것으로 의도된다. 할로알킬의 예에는, CH2F, CHF2 및 CF3이 비제한적으로 포함된다.
본원에서 사용된 용어 "아릴"은, 단독으로 또는 또다른 라디칼과 조합되어, 방향족, 포화 또는 불포화일 수 있는 제2 또는 제3의 5원 또는 6원 카보사이클릭 그룹에 추가로 융합될 수 있는, 6개의 탄소 원자를 함유하는 카보사이클릭 방향족 모노사이클릭 그룹을 의미한다. 아릴에는, 페닐, 인다닐, 1-나프틸, 2-나프틸, 테트라하이드로나프틸, 1-안트라세닐, 2-안트라세닐, 9-안트라세닐, 1-페난트릴, 2-페난트릴, 3-페난트릴, 4-페난트릴 및 5-페난트릴이 비제한적으로 포함된다. 상기 아릴은 상기 사이클로알킬 환 또는 상기 방향족 환의 적합한 위치에서 또다른 그룹에 연결될 수 있다. 예를 들면, 다음과 같다:
상기 화살표들과 같이, 환의 구성원들 사이의 결합에 수직으로 그려진 선들은 적합한 환 원자들 중의 임의의 원자에 부착될 수 있는 결합(예를 들면, 상기 환의 임의의 적합한 구성원에서의 부착점)을 나타낸다. 본 발명을 기술하기 위한 목적으로, 용어 "아릴"은 적절한 경우 "아릴렌"을 포함한다.
본원에서 사용된 용어 "헤테로아릴"은 10개 이하의 원자의 모노사이클릭 또는 바이사이클릭 환 시스템을 의미하는 것으로 의도되고, 여기서, 적어도 하나의 환은 방향족이며, O, N 및 S로 이루어진 그룹으로부터 선택되는 1개 내지 4개의 헤테로 원자를 함유한다. 상기 헤테로아릴 치환체는 환 탄소 원자 또는 상기 헤테로원자들 중의 하나를 통해 부착될 수 있다. 헤테로아릴 그룹의 예에는, 티에닐, 벤즈이미다졸릴, 벤조[b]티에닐, 푸릴, 벤조푸라닐, 피라닐, 이소벤조푸라닐, 크로메닐, 크산테닐, 2H-피롤릴, 피롤릴, 이미다졸릴, 피라졸릴, 피리딜, 피라지닐, 피리미디닐, 피리다지닐, 인돌리지닐, 이소인돌릴, 3H-인돌릴, 인돌릴, 인다졸릴, 푸리닐, 4H-퀴놀리지닐, 이소퀴놀릴, 퀴놀릴, 프탈라지닐, 나프티리디닐, 퀴녹살리닐, 퀴나졸리닐, 신놀리닐, 프테리디닐, 이소티아졸릴, 이소크로마닐, 크로마닐, 이속사졸릴, 푸라자닐, 인돌리닐, 이소인돌리닐, 티아졸로[4,5-b]-피리딘 및 플루오로세인 유도체, 예를 들면,
본원에서 사용된 용어 "헤테로사이클릴"은 O, N 및 S로 이루어진 그룹으로부터 선택되는 1개 내지 4개의 헤테로원자를 함유하는 5원, 6원 또는 7원 비-방향족 환 시스템을 의미하는 것으로 의도된다. 헤테로사이클의 예에는, 피롤리디닐, 테트라하이드로푸라닐, 피페리딜, 피롤리닐, 피페라지닐, 이미다졸리디닐, 모르폴리닐, 이미다졸리닐, 피라졸리디닐, 피라졸리닐 및 이 비제한적으로 포함된다. 본 발명을 기술하기 위한 목적으로, 용어 "헤테로사이클릴"은 "헤테로사이클릴렌"을 포함한다.
본원에서 사용된 용어 "헤테로바이사이클"은, 단독으로 또는 또다른 라디칼과 조합되어, 또다른 사이클릭 그룹(이는 본원에서 정의된 헤테로사이클, 아릴 또는 임의의 기타 사이클릭 그룹이다)에 융합된, 상기 정의된 바와 같은 헤테로사이클을 의미하는 것으로 의도된다. 이러한 헤테로바이사이클의 예에는, 쿠마린, 벤조[d][1,3]디옥솔, 2,3-디하이드로벤조[b][1,4]디옥신 및 3,4-디하이드로-2H-벤조[b][1,4]디옥세핀이 비제한적으로 포함된다.
본원에서 사용된 용어 "헤테로원자"는 O, S 또는 N을 의미하는 것으로 의도된다.
임의의 지시된 치환체 그룹이 본원에 기술된 합성 방법과 상용불가능할 수 있는 경우, 상기 치환체는 이들 방법에 사용되는 반응 조건에 안정한 적합한 보호 그룹(PG)으로 보호될 수 있다. 상기 보호 그룹은 상기 방법의 반응 순서에서 적합한 시점에서 제거되어 바람직한 중간체 또는 표적 화합물을 제공할 수 있다. 적합한 보호 그룹 및 이러한 적합한 보호 그룹을 사용하여 상이한 치환체들을 보호 및 탈보호시키는 방법은 당업자들에게 익히 공지되어 있고, 이의 예는 전문이 본원에 참조로 인용된 문헌[참조: T. Greene and P. Wuts, Protecting Groups in Chemical Synthesis(3rd ed.), John Wiley & Sons, NY (1999)]에서 찾을 수 있다. 전체에 걸쳐 사용되는 보호 그룹의 예에는, Fmoc, Bn, Boc, CBz 및 COCF3이 비제한적으로 포함된다. 몇몇 경우, 치환체는 본 발명의 방법에 사용되는 반응 조건하에서 반응성인 것으로 특정하게 선택될 수 있다. 이들 환경하에, 상기 반응 조건은, 선택된 치환체를, 본 발명의 방법의 중간체 화합물에 유용하거나 표적 화합물의 목적하는 치환체인 또다른 치환체로 전환시킨다.
본 발명은 본원에 기술된 화합물의 임의의 염, 특히 약제학적으로 허용되는 염을 포함한다. 약제학적으로 허용되는 염에는 산 부가염 및 염기 부가염이 둘 다 포함된다. 산 부가염은, 예를 들면, 염산, 브롬화수소산, 황산, 질산, 인산 등과 같은 무기산, 또는 아세트산, 트리플루오로아세트산, 프로피온산, 글리콜산, 피루브산, 옥살산, 말레산, 말론산, 석신산, 푸마르산, 타르타르산, 시트르산, 벤조산, 신남산, 만델산, 메탄설폰산, 에탄설폰산, p-톨루엔설폰산, 살리실산 등과 같은 유기산으로 형성되는 염을 포함한다. 염기 부가염은 무기 염기 또는 유기 염기를 유리 산에 가하여 제조된 것들을 포함한다. 무기 염기로부터 유도된 염에는, 나트륨염, 칼륨염, 리튬염, 암모늄염, 칼슘염, 마그네슘염, 철염, 아연염, 구리염, 망간염, 알루미늄염 등이 비제한적으로 포함된다. 유기 염기로부터 유도된 염에는, 1급, 2급 및 3급 아민; 천연-발생 치환된 아민을 포함하는 치환된 아민; 사이클릭 아민; 및 염기성 이온 교환 수지, 예를 들면, 이소프로필아민, 트리메틸아민, 디에틸아민, 트리에틸아민, 트리프로필아민, 에탄올아민, 2-디메틸아미노에탄올, 2-디에틸아미노에탄올, 디사이클로헥실아민, 리신, 아르기닌, 히스티딘, 카페인, 프로카인, 하이드라바민, 콜린, 베타인, 에틸렌디아민, 글루코사민, 메틸글루카민, 테오브로민, 푸린, 피페라진, 피페리딘, N-에틸피페리딘, 폴리아민 수지 등의 염이 비제한적으로 포함된다. 바람직하게는, 상기 염은 당해 화합물의 유리 산 또는 염기 형태의 바람직한 생물학적 효과 및 특성을 보유한다.
화학식 1의 화합물 또는 이의 염은 바람직하게는 IAP의 BIR 도메인을 결합시킨다. BIR 결합 단백질의 예에는, 카스파제, 및 미토콘드리아 유도된 BIR 결합 단백질들, 예를 들면, Smac, Omi/WTR2A 등이 비제한적으로 포함된다. IAP의 예에는, 사람 또는 마우스 NAIP(Birc 1), HIAP-1(cIAP2, Birc 3), HIAP-2(cIAP1, Birc 2), XIAP(Birc 4), 수르비빈(survivin)(Birc 5), 리빈(ML-IAP, Birc 7), ILP-2(Birc 8) 및 아폴론(Apollon)/BRUCE(Birc 6)가 비제한적으로 포함된다(참조예: 미국 특허 제6,107,041호; 제6,133,437호; 제6,156,535호; 제6,541,457호; 제6,656,704호; 제6,689,562호; Deveraux and Reed, Genes Dev. 13, 239-252, 1999; Kasof and Gomes, J. Biol. Chem., 276, 3238-3246, 2001; Vucic et al., Curr. Biol. 10, 1359-1366, 2000; Ashab et al. FEBS Lett., 495, 56-60, 2001, 이들의 전문은 본원에 참조로 인용된다). 상기 IAP의 BIR 도메인들은 관련 문헌에 기록되어 있고, 이들은 통상적으로, 보존된 시스테인 및 하나의 보존된 히스티딘 잔기를 특정한 서열 내에 포함하는 다수의 불변성 아미노산 잔기에 의해 확인된다. 몇몇 사람 IAP를 위한 BIR 도메인 잔기들은, 예를 들면, XIAP의 잔기 21 내지 93(BIR1), 159 내지 230(BIR2), 및 258 내지 330(BIR3)(참조 Swiss-Prot P98170), HIAP-1의 잔기 41 내지 113(BIR1), 179 내지 250(BIR2), 및 264 내지 336(BIR3)(참조 XP-006266), 및 HIAP-2의 잔기 24 내지 96(BIR1), 164 내지 235(BIR2), 및 250 내지 322(BIR3)(참조 XP-006267)를 포함한다[참조: Verhagen et al., Genome Biology, 2(7): reviews 3009.1-3009.10 (2001)].
바람직하게는, 화학식 1의 화합물 또는 이의 염은 XIAP, 더욱 바람직하게는 사람 XIAP의 BIR 도메인에 결합한다. BIR 도메인 결합은 임의의 적합한 기술에 의해 검출될 수 있다. 예를 들면, BIR 도메인 결합은 공지된 BIR-도메인 결합 단백질의 결합과 경쟁하는(예를 들면, 공지된 BIR-도메인 결합 단백질이 소정의 BIR 도메인에 결합하는 것을 억제하거나 방지하는) 시험 화합물의 능력을 기준으로 검출될 수 있다. 천연-발생 및 합성 BIR 도메인 결합 단백질들이 당업계에 공지되어 있다. 몇몇 양태에서, 화학식 1의 화합물 또는 이의 염은 하나 이상의 IAP(예: NAIP, HIAP-1, HIAP-2, XIAP, 수르비빈, 리빈, ILP-2 또는 아폴론/BRUCE)를 약 500μM, 250μM, 100μM, 50μM, 25μM, 10μM, 1μM, 500nM, 250nM, 100nM 또는 50nM 이하의 Ki를 가지면서 결합시킨다(여기서, 더 낮은 Ki 값은 더 큰 결합 친화력을 나타낸다). 몇몇 양태에서, 화학식 1의 화합물 또는 이의 염은 하나 이상의 IAP를 약 500μM 내지 약 50nM, 예를 들면 약 250μM 내지 약 50nM, 약 100μM 내지 약 1μM, 또는 약 1μM 내지 약 50nM의 Ki를 가지면서 결합시킨다. 몇몇 양태에서, 화학식 1의 화합물 또는 이의 염은 XIAP 및 HIAP2 둘 다를 상기 범위들 중의 하나의 Ki를 가지면서 결합시킨다.
본원에 기술된 화합물들은 하나 이상의 비대칭 중심, 키랄 축 및 키랄 면을 함유할 수 있다. 따라서, 이들 화합물은 에난티오머, 부분입체이성체 및 기타 입체이성체 형태들을 발생시킬 수 있고, (R)- 또는 (S)-, 또는 아미노산의 경우 (D)- 또는 (L)-과 같은 입체화학, 및/또는 (+) 및 (-)와 같은 광학 활성에 의해 정의될 수 있다. 본 발명은, 순수한 또는 실질적으로 순수한 형태(예를 들면, 광학적으로 순수한 형태) 또는, 라세미 혼합물을 포함하는 임의의 비율의 이성체들의 혼합물로서 존재하는, 임의의 및 모든 가능한 입체이성체들을 포함하는 것으로 의도된다. 광학 활성 (+) 및 (-), (R)- 및 (S)-, 또는 (D)- 및 (L)-이성체는, 광학 활성 시약, 기질, 촉매 또는 용매(키랄 신톤(synthon) 또는 키랄 시약)를 사용하여 키랄 (비대칭) 합성에 의해 제조될 수 있거나, 하나의 에난티오머를 비대칭 변형에 의해 또다른 에난티오머로 전환시켜서 제조될 수 있다. 대안적으로, 역상 HPLC; 결정화, 기체-액체 또는 액체 크로마토그래피에 의해 분리될 수 있는 부분입체이성체성 염의 형성; 하나의 입체이성체와 에난티오머-특이적 시약과의 선택적 반응을 제한 없이 포함하는 통상의 기술들을 사용하여, 이성체 형태들의 혼합물(예: 라세미 혼합물)로부터 이성체들을 분할시킬 수도 있다. 목적하는 에난티오머를 분리 기술에 의해 또다른 화학 물질로 전환시키는 경우, 목적하는 에난티오머 형태를 형성하기 위해 추가의 단계가 요구될 수 있다.
본 발명의 특정 화합물들은 또한 특정 조건하에서 음이온성, 양이온성 또는 쯔비터이온성 형태로 존재할 수 있다. 화학식 1의 화합물들 및 본원에 기술된 기타 화학식의 화합물들은 구체적으로 이러한 또다른 형태들을 포함한다.
바람직한 양태에 따르면, 화학식 1의 화합물 또는 이의 염은 포유동물, 특히 사람에게 투여되었을 때 경구 생체이용률을 제공한다. 바람직하게는, 화학식 1의 화합물 또는 이의 염은 약 10% 이상, 약 15% 이상, 또는 약 20% 이상의 경구 생체이용률을 나타낸다. 더욱 바람직하게는, 화학식 1의 화합물 또는 이의 염은 약 25% 이상, 약 30% 이상, 약 50% 이상, 또는 심지어 약 75% 이상(예를 들면, 약 80% 이상, 약 90% 이상, 또는 약 95% 이상)의 경구 생체이용률을 나타낸다. 몇몇 양태에서, 화학식 1의 화합물 또는 이의 염은 약 25% 내지 약 50%, 약 50% 내지 약 75%, 또는 약 75% 내지 약 100%의 경구 생체이용률을 나타낸다.
합성 방법
본원에 기술된 본 발명의 화합물들은 다수의 기술들 중의 어느 것에 의해 제조될 수 있다. 본 발명의 하나의 측면에 따르면, 상기 화합물들은 반응식 1 내지 4에 의해 예시된 방법 A 내지 C 중의 어느 것에 따라 제조될 수있다.
방법 A는 화학식 1의 화합물 또는 이의 염의 제조방법, 뿐만 아니라 이와 관련된 중간체 화합물들의 제조방법을 제공하며, 상기 방법은 하기 단계들 중의 하나 이상을 포함한다: (1) 화학식 1-i의 프롤리날 유도체를 화학식 의 아민과 배합한 다음, 하이드라이드로 환원시켜 화학식 1-ii(여기서, PG1은 보호 그룹이다)의 중간체 화합물을 제공하는 단계; (2) 화학식 1-ii의 중간체 화합물의 아민 그룹을 PG1과 상이한 보호 그룹(PG2)으로 보호시킨 다음, PG1을 탈보호시켜 화학식 1-iii의 중간체 화합물을 제공하는 단계; (3) 화학식 1-iii의 중간체 화합물을 아미노산 커플링제를 사용하여 PG3(H)N(R3)CHCO2H(여기서, PG3은 PG2와 상이한 보호 그룹이다)와 커플링시킨 다음, PG3을 탈보호시켜 화학식 1-iv의 중간체 화합물을 제공하는 단계; (4) 화학식 1-iv의 중간체 화합물을 아미노산 커플링제를 사용하여 PG4(R1)N(R2)CHCO2H(여기서, PG4는 PG2와 상이한 보호 그룹이다)와 커플링시켜 화학식 1-v의 중간체 화합물을 제공하는 단계; (5) 화학식 1-v의 중간체 화합물의 PG2를 탈보호시켜 화학식 1-vi의 중간체 화합물을 제공하는 단계; 및 (6) 화학식 1-vi의 중간체 화합물을 화학식 LG-C(O)-G(여기서, "LG"는 이탈 그룹이다)의 화합물과 배합하여 화학식 1-vi의 중간체 화합물을 아실화시킨 다음, PG4를 탈보호시켜 화학식 1의 화합물 또는 이의 염을 제공하는 단계. 방법 A는 하기 반응식 1에 예시되어 있다. 방법 A의 각각의 중간체 화합물, 뿐만 아니라 상기 중간체 화합물을 제조하기 위한 각각의 개별 공정 단계는 본 발명의 추가의 측면인 것으로 간주된다. 따라서, 본원에서는 반응식 1의 화학식 1-i 내지 1-v의 화합물들 중의 어느 하나의 화합물 및 이의 염이 제공된다. 또한, 본원에서는 상기된 방법 A의 단계 (1) 내지 (6) 중의 하나 이상을 포함하는, 화학식 1의 화합물 또는 이의 염, 또는 화학식 1-i 내지 1-vi의 중간체 화합물들 중의 어느 것 및 이의 염의 제조방법도 제공된다.
반응식 1
방법 B는 화학식 1의 화합물 또는 이의 염의 또다른 제조방법, 뿐만 아니라 이와 관련된 중간체 화합물들의 제조방법을 제공하며, 상기 방법은 하기 단계들 중의 하나 이상을 포함한다: (1) 프롤리놀 유도체(화학식 2-i의 중간체 화합물)를 아미노산 커플링제를 사용하여 화학식 PG3(H)N(R3)CHCO2H(여기서, PG3은 보호 그룹이다)의 화합물과 커플링시킨 다음, PG3을 탈보호시켜 화학식 2-ii의 중간체 화합물을 제공하는 단계; (2) 화학식 2-ii의 중간체 화합물을 화학식 PG4(R1)N(R2)CHCO2H(여기서, PG4는 보호 그룹이다)의 화합물과 커플링시켜 화학식 2-iii의 중간체 화합물을 제공하는 단계; (3) 화학식 2-iii의 중간체 화합물을 산화시켜 상응하는 알데히드인 화학식 2-iv의 중간체 화합물을 제공하는 단계; (4) 화학식 2-iv의 화합물을 환원적 아민화시켜(예를 들면, 화학식 2-iv의 화합물을 아민과 배합한 다음, 적절한 하이드라이드로 환원시킴) 화학식 1-vi의 중간체 화합물을 제공하는 단계; (5) 화학식 1-vi의 화합물을 화학식 LG-C(O)-G(여기서, LG는 이탈 그룹이다)의 화합물과 배합하여 화학식 1-vi의 화합물을 아실화시킨 다음, PG4를 탈보호시켜 화학식 1의 화합물 또는 이의 염을 제공하는 단계. 방법 B는 하기 반응식 2에 예시되어 있다. 방법 B의 각각의 중간체 화합물, 뿐만 아니라 상기 중간체 화합물을 제조하기 위한 각각의 개별 공정 단계는 본 발명의 추가의 측면인 것으로 간주된다. 따라서, 본원에서는 반응식 2의 화학식 2-i 내지 2-iv 또는 화학식 1-vi의 화합물들 중의 어느 하나의 화합물 및 이의 염이 제공된다. 또한, 본원에서는 상기된 방법 B의 단계 (1) 내지 (5) 중의 하나 이상을 포함하는, 화학식 1의 화합물 또는 이의 염, 또는 반응식 2의 화학식 2-i 내지 2-iv 또는 화학식 1-vi의 중간체 화합물들 중의 어느 것 및 이의 염의 제조방법도 제공된다.
반응식 2
방법 C는 화학식 1의 화합물 또는 이의 염의 대안적인 제조방법, 뿐만 아니라 이와 관련된 중간체 화합물들의 제조방법을 제공하며, 상기 방법은 하기 단계들 중의 하나 이상을 포함한다: (1) 화학식 1-ii의 중간체 화합물(방법 A에 기술된 바와 같이, 또는 기타 방법들에 의해 제조됨)을 화학식 LG-C(O)-G(여기서, PG1은 보호 그룹이다)의 화합물과 배합하여 화학식 1-ii의 중간체 화합물을 아실화시킨 다음, PG1을 탈보호시켜 화학식 4-i의 중간체 화합물을 제공하는 단계; (2) 화학식 4-i의 화합물을 아미노산 커플링제를 사용하여 화학식 PG3(H)N(R3)CHCO2H(여기서, PG3은 보호 그룹이다)의 화합물과 커플링시킨 다음, PG3을 탈보호시켜 화학식 4-ii의 중간체 화합물을 제공하는 단계; (3) 화학식 4-ii의 중간체 화합물을 아미노산 커플링제를 사용하여 화학식 PG4(R1)N(R2)CHCO2H(여기서, PG4는 보호 그룹이다)의 화합물과 커플링시켜 화학식 1-vi의 중간체 화합물을 제공한 다음, PG4를 탈보호시켜 화학식 1의 화합물 또는 이의 염을 제공하는 단계. 방법 C는 하기 반응식 3에 예시되어 있다. 방법 C의 각각의 중간체 화합물, 뿐만 아니라 상기 중간체 화합물을 제조하기 위한 각각의 개별 공정 단계는 본 발명의 추가의 측면인 것으로 간주된다. 따라서, 본원에서는 반응식 3의 화학식 4-i 또는 4-ii의 화합물 및 이의 염이 제공된다. 또한, 본원에서는 상기된 방법 C의 단계 (1) 내지 (3) 중의 하나 이상을 포함하는, 화학식 1의 화합물 또는 이의 염, 또는 반응식 3의 화학식 4-i 또는 4-ii의 중간체 화합물 및 이의 염의 제조방법도 제공된다.
반응식 3
용도
본 발명의 화합물들은 임의의 목적으로 사용될 수 있다. 그러나, 본원에 제공된 바와 같은 화학식 1의 화합물 및 이의 염은 IAP BIR 도메인 결합 화합물로서 특히 유용한 것으로 사료된다. 따라서, 본원에 기술된 화학식 1의 화합물 및 이의 염은 세포 또는 개체에서, 특히, 비정상적으로 낮은 수준의 아폽토시스를 나타내는 세포에서, 또는 불충분한 아폽토시스와 관련된 질환 또는 상태를 앓고 있거나 상기 질환 또는 상태에 대한 소인을 갖는 개체에서 아폽토시스를 증진시키는 데 사용될 수 있다. 불충분한 아폽토시스란, 주어진 조건하에서 비정상적이거나, 아니면 병적 상태를 유도하거나 야기하는 수준 또는 정도의 아폽토시스를 의미한다. 따라서, 불충분한 아폽토시스는, 예를 들면, 개체에게 유해한 세포가 아폽토시스되지 않기 때문에 질환이 발생하거나 지속되는 상태를 포함한다. 불충분한 아폽토시스와 관련된 상태 또는 질환은 암, 자가면역 질환, 염증성 장애를 제한 없이 포함하는 세포-증식성 질환 및 장애, 및 수술, 혈관형성술 등을 비제한적으로 포함하는 의학적 절차에 의해 유도된 세포 증식을 포함한다.
따라서, 본원에서는, 화학식 1의 화합물 또는 이의 염을 세포에 투여함을 포함하는, 세포에서의 아폽토시스를 증진시키거나 유도시키는 방법이 제공된다. 화학식 1의 화합물 또는 이의 염은 임의의 적합한 방법에 의해 세포에 투여될 수 있는데, 예를 들면, 상기 세포를 화학식 1의 화합물 또는 이의 염, 또는 화학식 1의 화합물 또는 이의 염을 포함하는 조성물과 접촉시킴으로써 투여될 수 있다. 표적 세포는 암 세포 및 염증 세포를 비제한적으로 포함하는, 불충분한 아폽토시스를 나타내거나(다시 말해, 아폽토시스에 대한 저항성이 특징이거나) 아폽토시스에 의해 소멸될 수 있는 병적 기능을 발휘하는 임의의 타입의 세포들을 포함할 수 있다. 암 세포는 난소암, 대장암, 혈액암, 유방암, 폐암 또는 췌장암 세포들을 비제한적으로 포함하는 임의의 타입의 악성종양 세포일 수 있다. 염증 세포는 B-세포, T-세포, 대식세포, 수지상 세포 및 과립구를 비제한적으로 포함하는 임의의 타입의 세포일 수 있다. 표적 세포의 추가의 예에는 이소성 자궁내막 세포 및 건선성 케라티노사이트가 포함된다.
화학식 1의 화합물 또는 이의 염의 부재하에 나타난 아폽토시스의 수준에 비해, 화학식 1의 화합물 또는 이의 염의 존재하의 아폽토시스의 수준이 임의의 정도로 증가되었다면, 세포 또는 세포 군집의 아폽토시스가 증진된 것이다. 따라서, 아폽토시스의 증진은, 그렇지 않으면, 아폽토시스되지 않았을 세포에서 아폽토시스를 유도시키는 것, 뿐만 아니라 세포가 아폽토시스를 일으키는 속도를 증가시키는 것, 세포 군집에서 아폽토시스되는 세포의 수를 증가시키는 것, 또는 아폽토시스 자극에 대한 세포의 감도를 증가시키는 것을 포함한다. 세포 군집에서 측정되었을 때, 아폽토시스를 일으키는 세포의 수는 바람직하게는 적어도 약 25%, 더욱 바람직하게는 적어도 약 50%, 적어도 약 75%, 또는 적어도 약 100% 증가된다(예를 들면, 적어도 1배 또는 2배 증가). 세포에서 아폽토시스의 수준을 측정하고 비교하기 위한 임의의 기술이, 아폽토시스의 증진을 검출하는 데 사용될 수 있다. 이러한 기술은, 예를 들면, 세포 증식의 변화, 세포막 투과성의 증가, 미토콘드리아의 대사 활성의 감소, DNA의 단편화(DNA 래더링) 또는 크로마틴 응축, 막 비대칭의 변경(예를 들면, 세포질로부터 막의 세포외측으로의 포스파토일세린의 이동), 아폽토시스 카스파제의 활성화, 미토콘드리아에 의한 세포질 내로의 사이토크롬 C 또는 아폽토시스 억제 인자(AIF)의 방출, 또는 아폽토시스의 지표인 것으로 공지된 임의의 기타 기준에 기초할 수 있다.
화학식 1의 화합물 및 이의 염은 또한 면역 시스템 세포로부터의 염증성 사이토킨의 방출을 변화시키고, 이에 의해 상기 세포의 염증 가능성을 감소시키는 데에도 사용될 수 있다. 염증성 사이토킨에는 전-염증성 사이토킨 및 항-염증성 사이토킨이 포함된다. 화학식 1의 화합물 또는 이의 염의 존재하의 임의의 하나 이상의 사이토킨의 방출의 양 또는 속도가, 화학식 1의 화합물 또는 이의 염의 부재하의 동일한 하나 이상의 사이토킨의 방출의 양 또는 속도에 비해 어느 정도 증가되거나 감소되었다면, 사이토킨의 방출이 변화된 것이다. 바람직하게는, 임의의 하나 이상의 사이토킨의 방출의 양 또는 속도는 적어도 약 25%, 더욱 바람직하게는 적어도 약 50%, 적어도 약 75%, 또는 적어도 약 100% 변화(증가 또는 감소)된다(예를 들면, 적어도 1배 또는 2배 증가). 세포에서 사이토킨 방출의 수준을 측정하고 비교하기 위한 임의의 기술이, 염증성 사이토킨의 방출의 변화를 검출하는 데 사용될 수 있다. 이러한 기술은, 예를 들면, 시료 또는 세포 배양물 내의 사이토킨의 양의 변화에 직접 기초할 수 있거나, 증가 또는 감소된 사이토킨 농도에 대한 세포 반응을 검출하는 것에 간접적으로 기초할 수 있다.
어떠한 특정 이론 또는 메커니즘에 결부시키고자 하는 것은 아니나, 화학식 1의 화합물은 XIAP, cIAP-1 및/또는 cIAP-2에 결합하거나 이와 다르게 이들을 억제시키는 것으로 사료된다. 따라서, 관련된 측면에서, 본 발명은 세포에서의 XIAP, cIAP-1 및/또는 cIAP-2의 활성 또는 단백질 수준을 감소시키는 방법을 제공하며, 상기 방법은 상기 세포를 화학식 1의 화합물 또는 이의 염과 접촉시킴을 포함한다. XIAP, cIAP-1 및/또는 cIAP-2의 활성 및 단백질 수준은 공지된 검정들 및 단백질 정량화 기술들에 의해 측정될 수 있다. 당해 방법의 모든 다른 측면들은 앞서 기술된 바와 같다.
본원에 기술된 본 발명의 화합물들은 시험관내 세포에 투여될 수 있다. 본원에서 사용된 용어 "시험관내"는 상기 세포가 살아있는 유기체 내에 있지 않음을 나타낸다. 본 발명의 화합물들은 또한 생체내 또는 생체외 세포에 투여될 수 있다. 본원에서 사용된 용어 "생체내"는 상기 세포가 살아있는 유기체의 일부임을 의미한다(예를 들면, 상기 세포가 숙주 개체 내에 있을 때). 본원에서 사용된 용어 "생체외"는, 시험관내 세포 또는 세포 군집에 화합물을 투여한 후, 상기 세포 또는 세포 군집을 숙주 개체에게 투여함을 나타낸다. 종종 상기 세포는 상기 개체의 자가세포이다.
당해 화합물이 개체 내의 세포에 투여되는 경우, 상기 개체는 바람직하게는 포유동물, 특히 사람이다. 본 발명의 이러한 측면에 따르면, 당해 방법은, 불충분한 아폽토시스와 관련된 질환 또는 자가면역 또는 염증성 질환을 앓고 있거나 상기 질환이 발병할 위험이 있는 개체에 대해 사용되는 것이 가장 적합하다. 상기 세포가 개체 내에 존재하는 경우, 화학식 1의 화합물 또는 이의 염, 또는 이를 포함하는 조성물(예: 약제학적 조성물)을 상기 개체에게 투여함으로써, 화학식 1의 화합물 또는 이의 염을 투여할 수 있다. 바람직하게는, 불충분한 아폽토시스와 관련된 질환 또는 자가면역 또는 염증성 질환을 앓고 있는 개체 내의 세포에 화학식 1의 화합물 또는 이의 염을 투여하는 것이 상기 질환을 치료하는 데 효과적이다. 따라서, 본 발명은 또한, 불충분한 아폽토시스와 관련된 질환 또는 자가면역 또는 염증성 질환의 치료를 필요로 하는 개체에게 화학식 1의 화합물 또는 이의 염을 투여함을 포함하는, 상기 질환의 치료방법도 제공한다. 본원에서 사용된 용어 "치료한다"는 상기 질환 또는 상태의 임의의 증상을 어느 정도 완화시키거나 상기 증상의 발현을 예방하는 것을 포함하는 것으로 의도된다. 용어 "치료한다"는 또한 병든 세포의 성장 또는 증식 또는 상기 질환 또는 상태의 진행 또는 확산(전이)을 억제, 저지 또는 역전시키거나, 염증성 사이토킨의 방출을 변화시키는 것도 포함한다. 치료는, 암 또는 종양 세포의 제거 수술 후에 암 또는 종양의 재성장을 예방하기 위한 환자의 치료, 또는, 예를 들면, 천식, MS 등과 같은 질환을 초래하는 상태하의 병적인 세포-생존을 방지하기 위한 치료와 같은 예방적 치료를 포함한다.
불충분한 아폽토시스와 관련된 질환 또는 상태는 부적절하게 높은 수준의 세포 분열, 부적절하게 낮은 수준의 아폽토시스, 또는 이들 둘 다를 특징으로 하는 증식성 질환을 포함한다. 이러한 질환에는, 정상적으로 계획된 세포 사멸 또는 세포 아폽토시스 체계(TRAIL, FAS, 아폽토솜)에 결함이 존재하는 질환들이 포함될 수 있다.
아폽토시스 저항성이 병적이상의 원인이거나, 증가된 아폽토시스가 치료학적으로 유리할 수 있는 자가면역 또는 염증성 장애의 예로는, 다발성 경화증, 죽상동맥경화증, 관절염(예: 류머티스성 관절염(RA)) 등이 포함된다. 본 발명의 또다른 측면은, 단독의, 또는 사이토킨 또는 사멸-수용체 리간드(예를 들면, Fas, TRAIL 또는 TRAIL-수용체 작용제 항체)와 병용되는 화학식 1의 화합물 또는 이의 염에 의해, 류머티스성 관절염 섬유아세포-유사 활막세포와 같은 세포에서 아폽토시스를 유도하는 방법을 제공한다.
아폽토시스 저항성이 병적이상의 원인이거나, 증가된 아폽토시스가 치료학적으로 유리할 수 있는 질환에는, 폐암, 대장암, 유방암 및 전립선암을 포함하는 모든 타입의 암이 포함된다. 본 발명의 화합물, 조성물 및 방법에 의해 치료될 수 있는 다른 암에는, 하기 표에 열거된 것들이 비제한적으로 포함된다.
화학식 1의 화합물 또는 이의 염은 순수한 형태 또는 실질적으로 순수한 형태로 사용될 수 있거나, 화학식 1의 화합물 또는 이의 염 및 적합한 담체를 포함하는 조성물의 부분으로서 사용될 수 있다. 상기 조성물이 개체 또는 환자, 특히 사람 개체 또는 환자에게 투여되는 경우, 상기 담체는 약제학적으로 허용되는 담체여야 한다. 본원에서 사용된 용어 "개체" 및 "환자"는 사람, 뿐만 아니라 사람이 아닌 포유동물, 예를 들면, 영장류, 고양이, 개, 돼지, 소, 양, 염소, 말, 토끼, 래트, 마우스 등을 의미하는 것으로 의도된다.
본 발명의 약제학적 조성물은 본 발명의 화합물을 적절한 담체와 배합함으로써 제조될 수 있다. 상기 담체는 통상적으로 사용되는 것들 중의 어느 것일 수 있고, 물리화학적 고려사항들, 예를 들면, 용해도, 및 활성 화합물과의 반응성 결여, 및 투여 경로에 의해서만 한정된다. 당업자는, 아래에 기술된 약제학적 조성물 이외에도, 본 발명의 방법의 활성 화합물들은 내포 복합체, 예를 들면 사이클로덱스트린 내포 복합체, 또는 리포솜으로서 제형화될 수 있음을 이해할 것이다.
본원에 기술된 약제학적으로 허용되는 담체, 예를 들면, 비히클, 애쥬번트, 부형제 및 희석제는 당업자들에게 익히 공지되어 있고, 시중에서 용이하게 구입될 수 있다. 상기 약제학적으로 허용되는 담체는 활성제(들)에 화학적으로 불활성인 것과, 사용 조건하에서 유해한 부작용 또는 독성을 갖지 않는 것이 바람직하다.
본 발명의 방법의 약제학적 조성물의 각종 적합한 제형들이 존재한다. 상기 제형은, 예를 들면, 정제, 캡슐제, 산제, 과립제, 연고제, 용액제, 좌제, 주사제, 흡입제, 겔제, 미소구체 및 에어로졸제를 포함하는, 고체, 반고체 또는 액체일 수 있다.
이러한 용량형을 제조하는 실제적 방법은 공지되어 있거나, 당업자들에게 명백할 것이다[참조예: Remington's Pharmaceutical Sciences, 18th Ed., (Mack Publishing Company, Easton, Pa., 1990)]. 투여되는 조성물은, 어떠한 경우라도, 상기된 바와 같은 질환 상태를 치료하기 위한 본 발명의 화합물 또는 이의 약제학적으로 허용되는 염의 치료적 유효량을 함유할 것이다.
상기 약제학적 조성물은, 예를 들면, 경구, 국소, 경피, 경점막, 에어로졸/흡입, 비경구(피하, 정맥내, 근육내, 흉골내, 복강내, 뇌내, 악골내 및 피내를 제한 없이 포함함), 직장, 설하, 안구, 비강내 및 질내 투여를 포함하는 임의의 투여 경로를 위해 제형화될 수 있다. 당업자는, 본 발명의 화합물의 이들 투여 경로는 공지되어 있고, 특정 화합물을 투여하는 데 하나 이상의 경로가 사용될 수 있다 하더라도, 특정 경로가 또다른 경로에 비해 더 즉각적이고 더 효과적인 반응을 제공할 수 있다는 것을 이해할 것이다. 하기 제형들은 추가의 예시를 목적으로 기술되며, 어떤 식으로든 본 발명을 제한하려는 의도가 아니다.
본 발명에 따라 적합할 수 있는 제형들 중에는 주사가능한 제형이 있다. 주사가능한 제형을 위한 효과적인 약제학적 담체에 대한 요건은 당업자들에게 익히 공지되어 있다[참조예: Pharmaceutics and Pharmacy Practice, J.B. Lippincott Company, Philadelphia, PA, Banker and Chalmers, eds., pages 238-250 (1982), 및 ASHP Handbook on Injectable Drugs, Toissel, 4th ed., pages 622-630 (1986)]. 비경구 투여에 적합한 제형에는, 산화방지제, 완충제, 세균 발육 저지제, 및 상기 제형을 의도된 수용자의 혈액과 등장성이 되도록 하는 용질을 함유하는 수성 및 비-수성의 등장성 멸균 주사 용액제, 및 현탁제, 가용화제, 증점제, 안정제 및 보존제를 포함할 수 있는 수성 및 비-수성 멸균 현탁액제가 포함된다. 본 발명의 화합물은, 약제학적으로 허용되는 계면활성제, 예를 들면, 비누 또는 세제, 현탁제, 예를 들면, 펙틴, 카보머, 메틸셀룰로스, 하이드록시프로필메틸셀룰로스 또는 카복시메틸셀룰로스, 또는 유화제 및 기타 약제학적 애쥬번트(페길화되거나 지방산 개질된 글리세롤 및 트리글리세라이드를 포함함)가 첨가되거나 첨가되지 않은 약제학적 담체, 예를 들면, 물, 염수, 수성 덱스트로스 및 관련 당 용액, 알코올, 예를 들면, 에탄올, 이소프로판올 또는 헥사데실 알코올, 글리콜, 예를 들면, 프로필렌 글리콜 또는 폴리에틸렌 글리콜, 디메틸설폭사이드, 글리세롤 케탈, 예를 들면, 2,2-디메틸-1,3-디옥솔란-4-메탄올, 에테르, 예를 들면, 폴리(에틸렌글리콜) 400, 오일, 지방산, 지방산 에스테르 또는 글리세라이드 또는 아세틸화된 지방산 글리세라이드 중에서, 생리학적으로 허용되는 희석액으로 투여될 수 있다.
비경구 제형에 사용될 수 있는 오일에는, 석유, 동물성 오일, 식물성 오일 또는 합성 오일이 포함된다. 오일의 특정예에는, 땅콩유, 대두유, 참깨유, 면실유, 옥수수유, 올리브유, 석유 및 광유가 포함된다. 비경구 제형에 사용하기에 적합한 지방산에는, 올레산, 스테아르산 및 이소스테아르산이 포함된다. 적합한 지방산 에스테르의 예는 에틸 올레에이트 및 이소프로필 미리스테이트이다.
비경구 제형에 사용하기에 적합한 비누에는, 지방 알칼리 금속염, 암모늄염 및 트리에탄올아민염이 포함되고, 적합한 세제에는, (a) 양이온성 세제, 예를 들면, 디메틸 디알킬 암모늄 할라이드 및 알킬 피리디늄 할라이드, (b) 음이온성 세제, 예를 들면, 알킬, 아릴 및 올레핀 설포네이트, 알킬, 올레핀, 에테르 및 모노글리세라이드 설페이트, 및 설포석시네이트, (c) 비이온성 세제, 예를 들면, 지방 아민 옥사이드, 지방산 알칸올아미드 및 폴리옥시에틸렌폴리프로필렌 공중합체, (d) 양쪽성 세제, 예를 들면, 알킬-b-아미노프로피오네이트 및 2-알킬-이미다졸린 4급화 암모늄염, 및 (e) 이들의 혼합물이 포함된다.
상기 비경구 제형은 통상적으로 용액 중에 활성 성분을 약 0.01중량% 내지 약 10중량%로 함유할 것이다. 보존제 및 완충제가 사용될 수 있다. 주사 부위에서의 자극을 최소화하거나 없애기 위해, 이러한 조성물은, 약 12 내지 약 17의 친수성-친유성 밸런스(HLB: hydrophile-lipophile balance)를 갖는 하나 이상의 비이온성 계면활성제를 함유할 수 있다. 이러한 제형 중의 계면활성제의 양은 통상적으로 약 5중량% 내지 약 15중량% 범위일 것이다. 적합한 계면활성제에는, 폴리에틸렌 소르비탄 지방산 에스테르, 예를 들면, 소르비탄 모노올레에이트, 및 프로필렌 옥사이드를 프로필렌 글리콜과 축합하여 형성된, 에틸렌 옥사이드와 소수성 염기의 고분자량 부가물이 포함된다. 상기 비경구 제형은 단위-용량 또는 다중-용량 밀폐 용기, 예를 들면, 앰풀 및 바이알 중에 존재할 수 있고, 사용 직전에, 주사를 위해, 멸균성 액체 부형제(예: 물)의 첨가만이 요구되는 동결-건조(freeze-dried(lyophilized))된 상태로 저장될 수 있다. 즉석 주사 용액제 및 현탁액제는 상기 기술된 종류의 멸균성 산제, 과립제 및 정제로부터 제조될 수 있다.
국소 제형은 당업자들에게 익히 공지되어 있다. 이러한 제형은, 본 발명의 맥락에서, 피부에 적용하기에 특히 적합하다. 상기 담체는 적합하게는 용액, 유화액, 연고 또는 겔 베이스를 포함할 수 있다. 예컨대, 상기 베이스는, 석유, 라놀린, 폴리에틸렌 글리콜, 밀랍, 광유, 희석제(예: 물 및 알코올), 및 유화제 및 안정제 중 하나 이상을 포함할 수 있다. 증점제는 국소 투여를 위한 약제학적 조성물 중에 존재할 수 있다. 경피 투여에 의도된 경우, 당해 조성물은 경피 패치 또는 이온영동 장치를 포함할 수 있다. 국소 제형은 약 0.1% 내지 약 10% w/v(단위 용적당 중량)의 본 발명의 화합물의 농도를 함유할 수 있다.
경구 투여에 적합한 제형은, (a) 액체 용액제, 예를 들면, 희석제에 용해된 당해 활성 화합물의 유효량; (b) 각각 소정량의 활성 성분을 고체 또는 과립으로서 함유하는, 캡슐제, 사쉐, 정제, 로젠지 및 트로키; (c) 산제; (d) 적절한 액체 중의 현탁액제; 및 (e) 적합한 유액제로 이루어질 수 있다. 액체 제형은, 약제학적으로 허용되는 계면활성제가 첨가되거나 첨가되지 않은 희석제, 예를 들면, 물, 염수 및 알코올, 예를 들면, 에탄올, 벤질 알코올 및 폴리에틸렌 알코올을 포함할 수 있다. 캡슐제 형태는, 예를 들면, 계면활성제, 윤활제 및 불활성 충전제, 예를 들면, 락토스, 수크로스, 칼슘 포스페이트 및 옥수수 전분을 함유하는 통상의 경질- 또는 연질-쉘 젤라틴 타입의 것일 수 있다. 정제 형태는 락토스, 수크로스, 만니톨, 옥수수 전분, 감자 전분, 알긴산, 미세결정성 셀룰로스, 아카시아, 젤라틴, 구아 검, 콜로이드성 이산화규소, 크로스카멜로스 나트륨, 활석, 마그네슘 스테아레이트, 칼슘 스테아레이트, 아연 스테아레이트, 스테아르산, 및 기타 부형제, 착색제, 희석제, 완충제, 붕해제, 습윤제, 보존제, 풍미제, 및 약물학적으로 상용가능한 부형제 중의 하나 이상을 포함할 수 있다. 로젠지 형태는 향미료, 일반적으로 수크로스 및 아카시아 또는 트라가칸트 중에 활성 성분을 포함할 수 있고, 뿐만 아니라, 향정은, 활성 성분에 더하여, 당업계에 공지된 부형제들을 함유하는 불활성 베이스, 예를 들면, 젤라틴 및 글리세린, 또는 수크로스 및 아카시아, 유액, 겔 등에 활성 성분을 포함한다. 상기 경구 제형은 통상적으로 약 0.1중량% 내지 약 70중량%의 활성 성분을 함유할 것이다.
본 발명의 화합물들은, 단독으로 또는 기타 적합한 성분들과 병용되어, 흡입을 통해 투여되는 에어로졸 제형으로 제조될 수 있다. 이들 에어로졸 제형은 가압된 허용가능한 분사제, 예를 들면, 디클로로디플루오로메탄, 프로판, 질소 등에 혼입될 수 있다. 이들은 또한, 분무기(nebulizer 또는 atomizer)에서와 같은, 가압되지 않은 제제를 위한 약제로서 제형화될 수도 있다. 이러한 스프레이 제형은 점막에 뿌리는 데 사용될 수 있다.
추가적으로, 본 발명의 화합물들, 또는 이러한 화합물들을 포함하는 조성물들은 유화 베이스 또는 수용성 베이스와 같은 각종 베이스들과 혼합됨으로써 좌제로 제조될 수 있다. 질내 투여에 적합한 제형은, 활성 성분에 더하여, 당업계에 적절한 것으로 공지된 담체를 함유하는, 페서리, 탐폰, 크림, 겔, 페이스트, 폼 또는 스프레이 제형으로서 존재할 수 있다.
달리, 본원에 기술된 본 발명의 화합물들은, 상기 본 발명의 화합물이 투여된 체내로 상기 화합물이 방출되는 방식을 체내의 시간 및 위치에 대해 제어하도록데포 형태로 변형될 수도 있다(참조예: 미국 특허 제4,450,150호). 상기 활성 화합물의 데포 형태는, 예를 들면, 상기 화합물 및 다공성 재료(예: 중합체)를 포함하는 이식가능한 조성물일 수 있고, 상기 화합물은 상기 다공성 재료에 의해 캡슐화되거나 상기 다공성 재료 전체에 걸쳐 확산된다. 이어서, 상기 데포는 체내의 목적하는 위치에 이식되고, 상기 화합물은 상기 다공성 재료를 통한 확산에 의해 소정의 속도로 상기 이식물로부터 방출된다.
일부 맥락에서, 본 발명의 화합물들은 유리하게는 척수강내 전달을 허용하는 이식 펌프를 통해 투여될 수 있다. 이러한 전달 방법은, 이렇게 하지 않는다면 투여된 약물이 혈액-뇌 장벽을 충분하게 투과하지 않을 경우에, 약물을 CNS에 전달하기에 특히 유용하다.
이러한 용량형을 제조하는 실제적 방법은 공지되어 있거나, 당업자들에게 명백할 것이다[참조예: Remington's Pharmaceutical Sciences, 18th Ed., (Mack Publishing Company, Easton, Pa., 1990)]. 투여되는 조성물은, 어떠한 경우라도, 상기된 바와 같은 질환 상태를 치료하기 위한 본 발명의 화합물 또는 이의 약제학적으로 허용되는 염의 치료적 유효량을 함유할 것이다.
당업자는, 본원에 기술된 본 발명의 화합물들이 당해 화합물의 치료적 효능을 증가시키기 위해 임의의 개수의 방식으로 변형될 수 있다는 것을 쉽게 이해할 것이다. 예를 들면, 당해 화합물 또는 억제제는 링커를 통해 표적 잔기에 직접 또는 간접적으로 공액될 수 있다. 화합물 또는 억제제를 표적 잔기에 공액시키는 실시방법은 당업계에 공지되어 있다. 본원에서 사용된 용어 "표적 잔기"는, 세포-표면 수용체를 특이적으로 인식하고 상기 수용체에 결합하는 임의의 분자 또는 약제를 나타내며, 이로 인해 상기 표적 잔기는 표면에서 상기 수용체가 발현되는 세포 군집에 대한 당해 화합물 또는 억제제의 전달을 유도한다. 표적 잔기에는, 세포 표면 수용체에 결합하는, 항체 또는 이의 단편, 펩타이드, 호르몬, 성장 인자, 사이토킨 및 임의의 기타 천연 또는 비-천연 리간드가 비제한적으로 포함된다. 본원에서 사용된 용어 "링커"는 상기 화합물 또는 억제제를 상기 표적 잔기에 브릿징시키는 임의의 약제 또는 분자를 나타낸다. 당업자는, 상기 화합물 또는 억제제의 기능에 필수적이지 않은, 상기 화합물 또는 억제제의 부위들이 링커 및/또는 표적 잔기를 부착시키기 위한 이상적 부위이며, 단, 상기 링커 및/또는 표적 잔기는 일단 상기 화합물 또는 억제제에 부착되면 상기 화합물 또는 억제제의 기능을 방해하지 않는다는 것을 인식하고 있다.
치료적으로 유효한 것으로 간주되는 양은, 사용되는 특정 화합물, 치료하고자 하는 상태의 정확한 타입 및 중증도, 및 환자의 연령, 체중, 전반적 건강상태, 성별 및 식이, 및 투여 방식을 포함하는 다수의 인자들에 따라 달라질 것이다. 일반적으로, 치료학적으로 유효한 1일 용량은 약 0.1mg 내지 약 40mg/kg(체중) 1일 1회 또는 1일 2회일 수 있다.
병용 요법
화학식 1의 화합물 또는 이의 염, 또는 이들을 포함하는 조성물은 본원에 기술된 방법들에 따라 하나 이상의 추가의 활성 성분과 병용하여 사용될 수 있다. 예를 들면, 둘 이상의 상이한 화학식 1의 화합물 또는 이의 염이 함께 사용될 수 있거나, 하나 이상의 화학식 1의 화합물 또는 이의 염이 하나 이상의 기타 치료학적 유효 화합물과 병용하여 사용될 수 있다. 화학식 1의 화합물 또는 이의 염이 하나 이상의 추가의 활성 화합물(또다른 화학식 1의 화합물이거나, 상이한 화합물임)과 병용하여 사용되는 경우, 상기 하나 이상의 추가의 화합물은 화학식 1의 화합물 또는 이의 염의 투여와 동시에 투여될 수 있거나, 화학식 1의 화합물 또는 이의 염을 투여하기 전 또는 후에 투여될 수 있다. 또한, 동시에 투여되는 경우, 상기 하나 이상의 추가의 화합물은 화학식 1의 화합물 또는 이의 염과 동일한 조성물로서 투여될 수 있거나, 상이한 조성물로서 투여될 수 있다.
화학식 1의 화합물 또는 이의 염과 병용하여 사용하기 위한 추가의 치료제들의 선택은, 적어도 부분적으로는, 치료하고자 하는 특정 질환 또는 상태에 좌우될 것이다. 본 발명의 하나의 측면에 따르면, 화학식 1의 화합물 또는 이의 염은 사멸 수용체 아폽토시스 경로를 직접 또는 간접적으로 자극하는 약제와 병용하여 투여된다. 어떠한 특정 이론에 결부시키고자 하는 것은 아니나, 화학식 1의 화합물 또는 이의 염과 사멸 수용체 아폽토시스 경로를 자극하는 약제(예: 사멸 수용체 작용제)의 병용은, 증진된, 그리고 몇몇 경우에는 상승적인 효과를 생성하는 것으로 사료된다. 상기 사멸 수용체 작용제는 상기 사멸-수용체들에 의해 매개되는 아폽토시스 촉진 반응을 자극시킬 수 있는 임의의 약제일 수 있다. 이러한 약제에는, 용해성 TRAIL, TRAIL 수용체 작용제, 및 개체에서의 TRAIL의 순환 농도를 증가시키는 임의의 약제(면역 시스템 조절제, 예를 들면 인터페론-알파 또는, 인터류킨 또는 TNF와 같은 사이토킨의 방출을 유도할 수 있는 이온화 방사선(예: UVB)을 포함함)가 포함된다.
TRAIL 수용체 작용제에는, TRAIL 사멸 수용체를 자극시킴으로써 TRAIL을 모사하는 임의의 화합물이 포함된다. 이러한 화합물에는, 예를 들면, 상기 TRAIL 수용체의 소분자 또는 항체 작용제가 포함될 수 있다. 사멸 수용체 TRAIL-R1 및/또는 TRAIL-R2에 대해 유도되는 작용제 항체, 특히 HGS-ETR1 및 HGS-ETR2로서 공지된 항체가 바람직하다. 예시적 작용제 항체에는, 미국 특허 제7,244,429호; 미국 특허 출원 공보 제2007/0179086호, 제2002/0004227호, 제2006/0269554호, 제2005/0079172호, 제2007/0292411호, 제2006/0270837호(현 미국 특허 제7,361,341호), 제2009/0026429호, 제2006/0269555호, 제2004/0214235호 및 제2007/0298039호; 및 국제 특허 공보 WO 제2006/017961호 및 WO 제98/51793호에 기술된 것들이 포함된다. 이들 공보는 각각 이의 전문이 본원에 참조로 인용된다. 바람직한 양태에서, 본 발명의 화합물들은 암 및 기타 신생물형성의 치료를 위한 이들 TRAIL 수용체 작용제 항체들 중의 하나 이상과 병용하여 사용된다.
화학식 1의 화합물 또는 이의 염과 병용하기에 유용한 기타 약제에는, 예를 들면, 에스트로겐 수용체 조절제, 안드로겐 수용체 조절제, 레티노이드 수용체 조절제, 세포독성제, 항증식제, 프레닐-단백질 트랜스퍼라제 억제제, HMG-CoA 리덕타제 억제제, HIV 프로테아제 억제제, 역 트랜스크립타제 억제제, 혈관신생 억제제, PPAR-γ 작용제, PPAR-δ 작용제, 고유 다중약물 내성의 억제제, 항구토제, 빈혈 또는 호중구감소증을 치료하는 데 사용되는 약제, 면역-증진 약물, 프로테아솜 억제제, 예를 들면, Velcade 및 MG132(7-Leu-Leu-알데히드)[참조: He at al., Oncogene (2004) 23, 2554-2558], HDAC 억제제, 예를 들면, 나트륨 부티레이트, 페닐 부티레이트, 하이드로암산, 사이클린 테트라펩타이드 등[참조: Rosato et al., Molecular Cancer Therapeutics (2003), 1273-1284], 프로테아솜에서의 키모트립신-유사 활성의 억제제, 및 E3 리가제 억제제가 포함된다. 기타 이러한 약제들은 WO 제03/099211호(PCT/US03/15861호)에 기술되어 있다.
기타 공지된 화학치료제들이, 특히 암 또는 화학요법에 민감한 기타 증식성 질환의 치료를 위해 화학식 1의 화합물 또는 이의 염과 병용하여 사용될 수 있다. 임의의 화학치료제가 화학식 1의 화합물 또는 이의 염과 병용하여 사용될 수 있다. 화학치료제의 선택은, 부분적으로는, 치료하고자 하는 특정 타입의 암 또는 증식성 질환에 좌우될 수 있다. 예시적 화학치료제가 아래 단락에 기술되어 있다. 본원에 기술된 화학치료제들은 단지 예시적이며, 어떤 식으로든 제한하려는 것이 아니다.
빈카 알칼로이드 및 미세소관-붕괴 화합물: 빈카 알칼로이드에는 빈크리스틴, 빈블라스틴, 빈데신, 빈플루닌, 비노렐빈 및 안하이드로빈블라스틴이 포함된다. 돌라스타틴은 주로 빈카 알칼로이드 결합 도메인에서 튜불린을 방해하는 올리고펩타이드이다. 돌라스타틴에는 돌라스타틴-10(NCS 376128), 돌라스타틴-15, ILX651, TZT-1027, 심플로스타틴 1, 심플로스타틴 3, 및 LU103793(세마도틴(cemadotin))이 포함된다. 크립토피신(예: 크립토피신 1 및 크립토피신 52(LY355703))은 빈카 알칼로이드-결합 도메인 내의 튜불린을 결합시키고 G2/M 정지 및 아폽토시스를 유도한다.
기타 미세소관 붕괴 화합물은 미국 특허 제6,458,765호; 제6,433,187호; 제6,323,315호; 제6,258,841호; 제6,143,721호; 제6,127,377호; 제6,103,698호; 제6,023,626호; 제5,985,837호; 제5,965,537호; 제5,955,423호; 제5,952,298호; 제5,939,527호; 제5,886,025호; 제5,831,002호; 제5,741,892호; 제5,665,860호; 제5,654,399호; 제5,635,483호; 제5,599,902호; 제5,530,097호; 제5,521,284호; 제5,504,191호; 제4,879,278호; 및 제4,816,444호, 및 미국 특허 출원 공보 제2003/0153505 A1호; 제2003/0083263 A1호; 및 제2003/0055002 A1호에 기술되어 있다.
탁산 및 기타 미세소관 안정화 화합물: 탁산에는, 파클리탁셀, 도세탁셀, RPR 109881A, SB-T-1213, SB-T-1250, SB-T-101187, BMS-275183, BRT 216, DJ-927, MAC-321, IDN5109 및 IDN5390이 포함된다. 탁산 유사체에는, BMS-184476, BMS-188797, 및 에포틸론(예: 에포틸론 A, 에포틸론 B(EPO906), 데옥시에포틸론 B 및 에포틸론 B 락탐(BMS-247550)), 엘류테로빈, 디스코더몰리드, 2-에피-디스코더몰리드, 2-데스-메틸디스코더몰리드, 5-하이드록시메틸디스코더몰리드, 19-데스-아미노카보닐디스코더몰리드, 9(13)-사이클로디스코더몰리드 및 라울리말리드를 포함하는 기능적으로 관련된 비-탁산이 포함된다.
기타 미세소관 안정화 화합물은 미국 특허 제6,624,317호; 제6,610,736호; 제6,605,599호; 제6,589,968호; 제6,583,290호; 제6,576,658호; 제6,515,017호; 제6,531,497호; 제6,500,858호; 제6,498,257호; 제6,495,594호; 제6,489,314호; 제6,458,976호; 제6,441,186호; 제6,441,025호; 제6,414,015호; 제6,387,927호; 제6,380,395호; 제6,380,394호; 제6,362,217호; 제6,359,140호; 제6,306,893호; 제6,302,838호; 제6,300,355호; 제6,291,690호; 제6,291,684호; 제6,268,381호; 제6,262,107호; 제6,262,094호; 제6,147,234호; 제6,136,808호; 제6,127,406호; 제6,100,411호; 제6,096,909호; 제6,025,385호; 제6,011,056호; 제5,965,718호; 제5,955,489호; 제5,919,815호; 제5,912,263호; 제5,840,750호; 제5,821,263호; 제5,767,297호; 제5,728,725호; 제5,721,268호; 제5,719,177호; 제5,714,513호; 제5,587,489호; 제5,473,057호; 제5,407,674호; 제5,250,722호; 제5,010,099호; 및 제4,939,168호; 및 미국 특허 출원 공보 제2003/0186965 A1호; 제2003/0176710 A1호; 제2003/0176473 A1호; 제2003/0144523 A1호; 제2003/0134883 A1호; 제2003/0087888 A1호; 제2003/0060623 A1호; 제2003/0045711 A1호; 제2003/0023082 A1호; 제2002/0198256 A1호; 제2002/0193361 A1호; 제2002/0188014 A1호; 제2002/0165257 A1호; 제2002/0156110 A1호; 제2002/0128471 A1호; 제2002/0045609 A1호; 제2002/0022651 A1호; 제2002/0016356 A1호; 제2002/0002292 A1호에 기술되어 있고, 이들 문헌은 각각 본원에 참조로 인용된다.
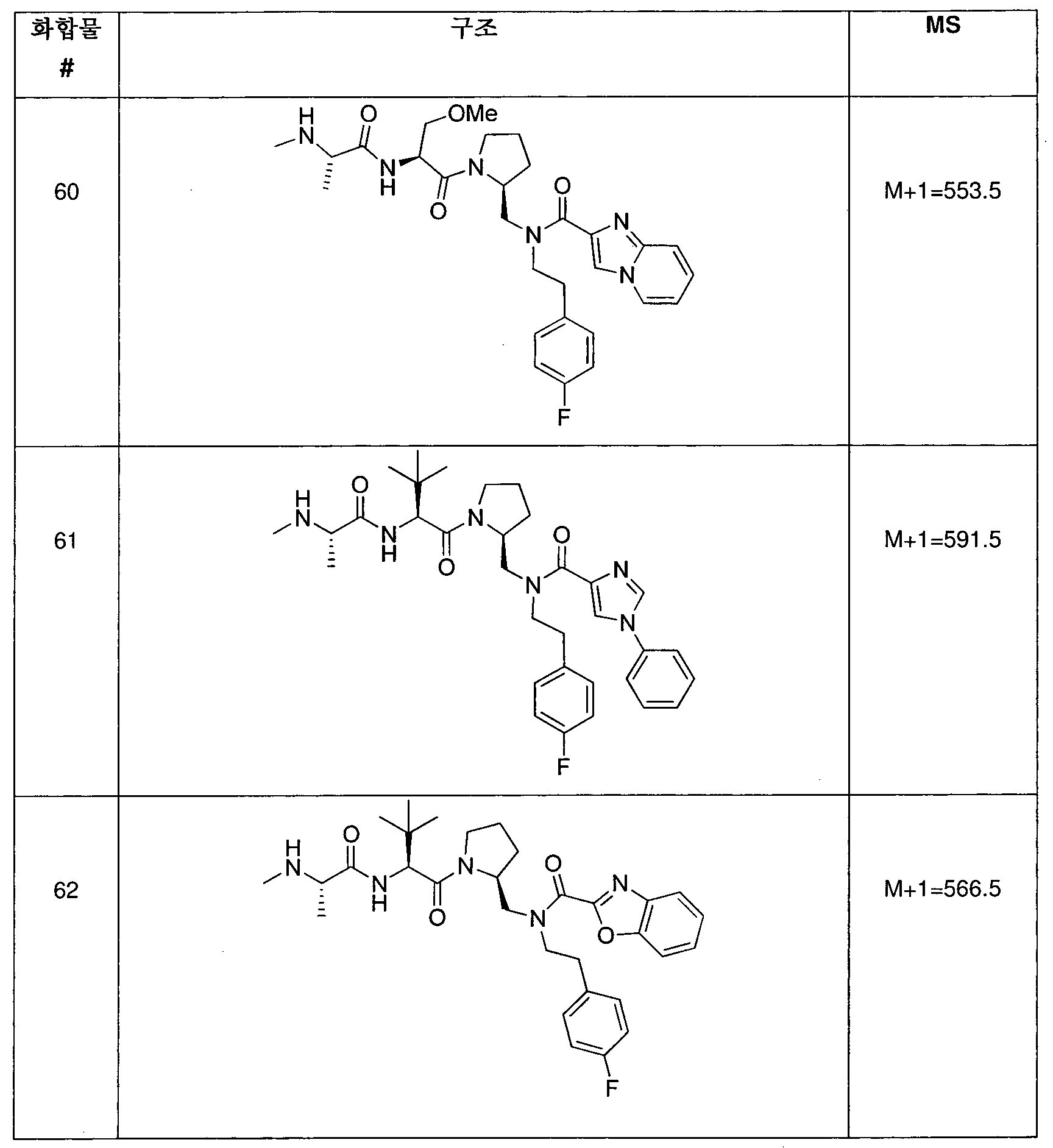
본 발명의 화합물과 함께 투여될 수 있는 기타 화학치료제가 하기 표에 열거되어 있다:
치료하고자 하는 질환 또는 장애가 염증성 또는 자가면역 장애, 특히 류머티스성 관절염(RA)인 경우, 화학식 1의 화합물 또는 이의 염은 하나 이상의 비-스테로이드성 항-염증 약물(NSAID), 진통제, 코르티코스테로이드 및 질환-개선 항류머티스 약물과 병용하여 투여될 수 있다. 이러한 용도를 위해 화학식 1 또는 이의 염과 병용하는 데 유용할 수 있는 기타 제제에는, 인터류킨-1(IL-1) 수용체 길항제 요법, 예를 들면, 아나킨라(Kineret™), 토실리주맙(Actemra™), 하이드록시클로로퀸(Plaquenil™), 설파살라진(Azulfidine™), 레플루노미드(Arava™), 종양 괴사 인자 억제제, 예를 들면, 에타네르셉트(Enbrel™), 아달리무맙(Humira™) 및 인플릭시맙(Remicade™), T-세포 동시자극 차단제, 예를 들면, 아바타셉트(Orencia™), B 세포 제거제, 예를 들면, 리툭시맙(Rituxan™), 나탈리주맙(Tysabri™), 근육내 금 제제 및 기타 면역조절제 및 세포독성제, 예를 들면, 아자티오프린(Imuran™), 사이클로포스파미드 및 사이클로스포린 A(Neoral™, Sandimmune™)가 포함된다.
RA의 치료를 위해 화학식 1 또는 이의 염과 병용하는 데 유용할 수 있는 또다른 제제에는, 메토트렉세이트, 알렘투주맙(Campath™), 항-RANKL MAb(데노수맙), 항-Blys MAb 벨리무맙(LymphoStat-B™), 세르톨리주맙 페골(Cimzia™), p38 억제제, JAK 억제제, 항-TNF 제제, 항-CD20 MAbs, 항-IL/ILR 표적화 제제, 예를 들면, IL-1, IL-5, IL-6(토클리주맙), Il-4, IL-13 및 IL-23을 표적화하는 것들이 포함된다.
추가의 병용물들은 또한, 상기 언급된 제제의 독성, 예를 들면, 간 독성, 신경 독성, 신장 독성 등을 감소시키는 제제를 포함할 수 있다.
스크리닝 검정
본 발명의 화합물들은 또한 IAP BIR 도메인에 결합하는 기타 화합물들을 스크리닝하는 방법에 사용될 수 있다. 일반적으로 말하면, IAP BIR 도메인에 결합하는 화합물들을 식별하는 방법에 본 발명의 화합물들을 사용하기 위해, 상기 IAP가 지지체에 결합되고, 본 발명의 화합물이 당해 검정에 첨가된다. 달리, 본 발명의 화합물이 상기 지지체에 결합되고 상기 IAP가 첨가될 수도 있다.
상기 BIR 도메인에 대한 본 발명의 화합물의 결합을 측정하는 방법들이 다수 존재한다. 예를 들면, 하나의 방법에서는, 본 발명의 화합물을 형광 또는 방사선 표지화시키고 결합을 직접 측정할 수 있다. 예를 들면, 이는, 상기 IAP를 고형 지지체에 부착시키고, 검출가능하게 표지화된 본 발명의 화합물을 첨가하고, 과량의 시약을 세척하고, 상기 고형 지지체에 존재하는 검출가능한 표지의 양이 존재하는지를 측정함으로써 수행될 수 있다. 당업자들에게 공지된 다수의 차단 및 세척 단계들이 사용될 수 있다.
몇몇 경우, 상기 성분들 중의 하나만이 표지화된다. 예를 들면, BIR 도메인 내의 특정 잔기들이 표지화될 수 있다. 이와 달리, 둘 이상의 성분이 상이한 표지들에 의해 표지화될 수도 있는데, 예를 들면, BIR 도메인의 경우 I125를 사용하고, 프로브의 경우 형광 표지를 사용하여 표지화될 수 있다.
본 발명의 화합물들은, 추가의 약물 후보자 또는 시험 화합물을 스크리닝하기 위한 경쟁자로서 사용될 수도 있다. 본원에서 사용된 용어 "약물 후보자" 또는 "시험 화합물"은 상호교환적으로 사용되며, 생물활성에 대해 시험하고자 하는 임의의 분자, 예를 들면, 단백질, 올리고펩타이드, 소형 유기 분자, 폴리사카라이드, 폴리뉴클레오티드 등을 말한다. 당해 화합물들은 IAP 생물학적 활성을 직접 또는 간접적으로 변형시킬 수 있다.
약물 후보자는 통상적으로 분자량 100달톤 초과 및 약 2,500달톤 미만의 소형 유기 분자이지만, 약물 후보자는 각종 화학적 부류들을 포함할 수 있다. 후보자 제제는 통상적으로 단백질과의 구조적 상호작용에 필요한 관능 그룹들, 예를 들면, 수소 결합 및 친유성 결합을 포함하며, 통상적으로는 적어도 아민, 카보닐, 하이드록실, 에테르 또는 카복실 그룹을 포함한다. 상기 약물 후보자는 종종 하나 이상의 관능 그룹으로 치환된 사이클릭 탄소 또는 헤테로사이클릭 구조 및/또는 방향족 또는 폴리방향족 구조를 포함한다.
약물 후보자는 합성 또는 천연 화합물들의 라이브러리를 포함하는 임의의 개수의 공급원으로부터 수득될 수 있다. 예를 들면, 무작위화된 올리고뉴클레오티드의 발현을 포함하는, 다양한 유기 화합물 및 생물분자의 랜덤 및 유도 합성을 위한 다수의 수단들이 이용될 수 있다. 달리, 세균, 진균, 식물 및 동물 추출물 형태의 천연 화합물들의 라이브러리가 이용될 수 있거나 용이하게 제조된다. 추가적으로, 천연 또는 합성 제조된 라이브러리 및 화합물은 통상의 화학적, 물리적 및 생화학적 수단을 통해 용이하게 변형된다.
경쟁 스크리닝 검정은, 제1 시료에서 IAP BIR 도메인과 프로브를 배합하여 프로브:BIR 도메인 복합체를 형성한 다음, 제2 시료로부터 시험 화합물을 첨가함으로써 수행될 수 있다. 상기 시험 화합물의 결합을 측정하고, 상기 2개의 시료 사이의 결합의 변화 또는 차이는, BIR 도메인에 결합하고 IAP의 활성을 잠재적으로 변조시킬 수있는 시험 화합물의 존재를 나타낸다.
따라서, 본원에서는, 본 발명의 하나의 측면으로서, 본 발명의 화합물 및 검출가능한 표지 또는 친화력 태그를 포함하는 프로브가 제공된다. 검출가능한 표지에는, 본 발명의 화합물에 링크되어, 상기 표지를 포함하는 상기 화합물이 BIR 도메인과 연합되었을 때 상기 표지가 상기 화합물의 직접적 또는 간접적 검출을 가능 할 수 있는 임의의 화학적 성분이 포함된다. 바람직하게는, 상기 표지는 또한 정량화를 가능하게 한다. 친화력 태그는 이들이 부착된 화합물의 단리 또는 정제를 용이하게 하는 잔기이다.
본원에서 사용된 용어 "프로브"는, 검출가능한 표지 또는 친화력 태그로 표지되고, IAP BIR 도메인에 공유 또는 비공유 결합될 수 있는 화학식 1의 화합물 또는 이의 염을 의미하는 것으로 의도된다. 예를 들어, 상기 프로브가 비공유 결합되는 경우, 이는 시험 화합물에 의해 변위될 수 있다. 예를 들어, 상기 프로브가 공유 결합되는 경우, 이는, 시험 화합물에 의해 정량화되고 억제될 수 있는, 가교결합된 부가물을 형성하는 데 사용될 수 있다.
하나의 경우, 상기 시험 화합물의 결합은 경쟁 결합 검정을 사용함으로써 측정된다. 본 양태에서, 프로브는 형광 표지로 표지된다. 특정 환경하에서, 시험 화합물과 프로브 사이의 경쟁 결합이 존재할 수 있다. 프로브를 표출시켜서, 대조군에 비해 형광의 변화를 이끌어내는 시험 화합물들은 BIR 영역에 결합한 것으로 간주된다.
하나의 경우, 상기 시험 화합물은 표지될 수 있다. 상기 시험 화합물 또는 본 발명의 화합물 또는 이들 둘 다를 먼저 충분한 시간 동안 IAP BIR 도메인에 첨가하여 복합체를 형성하도록 결합하게 한다.
상기 프로브:BIR 도메인 복합체의 형성은 고속 대량 스크리닝(high-throughput screening)이 허용되도록 통상적으로 4℃ 내지 40℃에서 10분 내지 약 1시간 동안 항온처리를 필요로 한다. 임의의 과량의 시약은 일반적으로 제거되거나 세척된다. 이어서, 상기 시험 화합물이 첨가되고, 상기 BIR 도메인에 대한 결합을 나타내기 위해, 표지된 성분의 존재 또는 부재가 뒤따른다.
하나의 경우, 상기 프로브를 먼저 첨가하고, 이어서 상기 시험 화합물을 첨가한다. 상기 프로브의 변위는, 상기 시험 화합물이 상기 BIR 도메인에 결합해 있고, 이에 따라 IAP에 결합할 수 있고, 잠재적으로 IAP의 활성을 변조시킬 수 있다는 것을 나타내는 표시이다. 두 성분들 중 어느 것이든 표지될 수 있다. 예를 들어, 세척액 내의 프로브의 존재는 상기 시험 화합물에 의한 변위를 나타낸다. 이와 달리, 상기 시험 화합물이 표지되면, 지지체 위에서의 상기 프로브의 존재가 변위를 나타낸다.
하나의 경우, 상기 시험 화합물을 항온처리 및 세척과 함께 먼저 첨가하고, 이어서 상기 프로브를 첨가할 수 있다. 상기 프로브에 의한 결합의 부재는 상기 시험 화합물이 더 높은 친화력으로 상기 BIR 도메인에 결합된다는 것을 나타낼 수 있다. 따라서, 상기 프로브가 지지체 위에서 검출되면, 시험 화합물 결합의 부족과 연계되어, 상기 시험 화합물이 BIR 도메인에 결합할 수 있다는 것을 나타낼 수 있다.
변조(modulation)는 IAP의 활성을 변조시키는 시험 화합물의 능력을 스크리닝함으로써 시험되고, 이는 상기된 바와 같이 시험 화합물을 IAP BIR 도메인과 배합하고, 상기 IAP의 생물학적 활성의 변화를 측정함을 포함한다. 따라서, 이 경우, 상기 시험 화합물은 상기 BIR 도메인에 결합해야 하고(이것이 필수적이지 않을 수 있더라도), 뿐만 아니라 본원에 정의된 바와 같이 이의 생물학적 활성도 변화시켜야 한다.
상기 검정에서 양성 대조군 및 음성 대조군이 사용될 수 있다. 모든 대조군 및 시험 시료들은 통계학적으로 유의한 결과를 수득하기 위해 여러 차례 수행된다. 항온처리 후, 모든 시료들은 비특이적으로 결합된 재료가 없도록 세척되고, 결합된 프로브의 양이 측정된다. 예를 들어, 방사선표지가 사용되는 경우, 상기 시료들은 결합된 화합물의 양을 측정하기 위해 섬광 계수기로 계수될 수 있다.
통상적으로, 상기 검정에서 검출되는 신호에는, 상기 표지의 성질에 따라, 형광, 공명 에너지 전달체, 시분할 형광, 방사능, 형광 편광, 플라즈마 공명 또는 화학발광 등이 포함될 수 있다. 본 발명에서 스크리닝 검정을 수행하는 데 유용한 검출가능한 표지에는, 형광 표지, 예를 들면, 플루오레세인, 오레곤 그린(Oregon green), 단실, 로다민, 테트라메틸 로다민, 택사스 레드, Eu3+; 화학발광 표지, 예를 들면, 루시퍼라제; 비색 표지; 효소 마커; 또는 방사성 동위원소, 예를 들면, 삼중 수소, I125 등이 포함된다. 본 발명의 스크리닝 검정을 수행하는 데 유용할 수 있는 친화력 태그에는, 비오틴, 폴리히스티딘 등이 포함된다.
실시예
하기 용어 및 약어, 구조 및 일반 공정이 실시예에서 사용된다:
약어 및 용어
Boc: 3급-부톡시카보닐;
Boc-Chg-OH: Boc-L-2(사이클로헥실)글리신;
Boc-N-MeAla-OH: N-Boc-N-메틸알라닌;
CBz: 벤질옥시카보닐;
DIPEA: 디이소프로필에틸아민;
DMAP: 4-(디메틸아미노)피리딘;
DMF: N,N-디메틸포름아미드;
DTT: 디티오트레이톨;
EDC: 3-(디메틸아미노프로필)-3-에틸카보디이미드 하이드로클로라이드;
EDTA: 에틸렌디아민테트라아세트산;
Fmoc: N-(9-플루오레닐메톡시카보닐);
HBTU: O-(벤조트리아졸-1-일)-N,N,N',N'-테트라메틸우로늄 헥사플루오로포스페이트;
HCl: 염산
HOAc: 아세트산;
HOBt: 1-하이드록시벤조트리아졸;
HPLC: 고성능 액체 크로마토그래피;
LCMS: 액체 크로마토그래피-질량 분석계;
MeOH: 메탄올;
MgSO4: 황산마그네슘;
MS: 질량 스펙트럼;
Ms: 메탄설포닐;
NaHCO3: 탄산수소나트륨;
Pd/C: 탄소 상 팔라듐;
TEA: 트리에틸아민;
TFA: 트리플루오로아세트산;
THF: 테트라하이드로푸란;
TMEDA: N,N,N,N-테트라메틸에틸렌디아민;
Ts: 파라-톨루엔설포닐.
IC50: 최대 반응의 50%를 달성하는 특정 화합물의 양, 농도 또는 용량.
EC50 세포 생존의 50% 억제를 달성하는 특정 화합물의 양, 농도 또는 용량.
발현을 위한 분자 구조
GST-XIAP 링크된 BIR3RING: XIAP 암호화 서열 아미노산 246-497을 BamH1 및 AVA I를 통해 PGEX4T3에 클로닝하였다. 상기 플라스미드를 단백질 발현 및 정제에 사용하기 위해 이. 콜라이(E. coli) DH5α에 형질전환시켰다.
GST-HIAP2(cIAP-1) 링커 BIR 3: 아미노산 251-363으로부터의 HIAP2 암호화 서열을 BamH1 및 XhoI를 통해 PGex4T3에 클로닝하였다. 상기 플라스미드를 단백질 발현 및 정제에 사용하기 위해 이. 콜라이 DH5α에 형질전환시켰다.
GST-HIAP1(cIAP-2) 링커 BIR 3: 아미노산 236-349로부터의 HIAP1 암호화 서열을 BamH1 및 XhoI를 통해 PGex4T3에 클로닝하였다. 상기 플라스미드를 단백질 발현 및 정제에 사용하기 위해 이. 콜라이 DH5α에 형질전환시켰다.
GST-링커 BIR 2 BIR3Ring: 아미노산 93-497로부터의 XIAP 암호화 서열을 BamH1 및 XhoI를 통해 PGex4T1에 클로닝하였다. 표준 PCR 조건을 사용하여, 프라이머 TTAATAGGATCCATCAACGGCTTTTATC 및 GCTGCATGTGTGTCAGAGG를 사용하여, 아미노산 93-497을 pGex4t3 내의 전장 XIAP로부터 증폭시켰다. PCR 단편을 pCR-2.1(invitrogen)에 TA 클로닝하였다. 링커 BIR 2 BIR 3Ring을 BamHI/XhoI 소화에 의해 pGex4T1에 서브클로닝하였다. 상기 플라스미드를 단백질 발현 및 정제에 사용하기 위해 이. 콜라이 DH5α에 형질전환시켰다.
전장 사람 XIAP, AEG 플라스미드 번호 23. XIAP 암호화 서열 아미노산 1-497을 BamH1 및 Xho I 제한 부위를 통해 GST 융합 벡터, PGEX4T3에 클로닝하였다. 상기 플라스미드를 단백질 정제에 사용하기 위해 이. 콜라이 DH5α에 형질전환시켰다.
GST-XIAP 링커 BIR 2: 아미노산 93-497로부터의 XIAP 링커 BIR 2 암호화 서열을 BamHI 및 XhoI를 통해 pGex4T3에 클로닝하였다. 상기 플라스미드를 단백질 발현 및 정제에 사용하기 위해 이. 콜라이 DH5α에 형질전환시켰다.
재조합 단백질의 발현
글루타티온 S-트랜스퍼라제(GST) 태그(tagged) 단백질을 에쉐리키아 콜라이(Escherichia coli) 균주 DH5-알파에서 발현시켰다. 전장 XIAP의 발현을 위해, XIAP-BIR 도메인, cIAP-1, cIAP-2 및 리빈 형질전환 박테리아 각각 또는 이들의 병용물을, 암피실린 50㎍/ml로 보강된 루리아 브로쓰(LB: Luria Broth) 배지에서 밤새 37℃에서 배양하였다. 이어서, 밤새 배양한 배양물을 새로운 LB 암피실린 보강 배지 중에서 25배로 희석시키고, 박테리아를 A600 = 0.6까지 성장시킨 다음, 3시간 동안 1mM 이소프로필-D-1-티오갈락토피라노사이드로 유도시켰다. 유도되었을 때, 세포를 5000RPM에서 10분 동안 원심분리시키고, 배지를 제거하였다. 용해 완충액(50mM Tris-HCl, 200mM NaCl, 1mM DTT, 1mM PMSF, 2mg/ml 리소자임, 100㎍/ml) 10ml가 제공된 배양물 1ℓ로부터 수득된 펠릿 각각을 4℃에서 온화한 진탕하에 항온처리하였다. 20분 동안의 항온처리 후에, 상기 세포 현탁액을 -80℃에서 밤새 또는 필요할 때까지 두었다.
재조합 단백질의 정제
재조합 단백질의 정제를 위해, 상기 펠릿을 얼음 위에서 해동시키고, 25ml의 용해 완충액(50mM Tris-HCl, pH 7.6, 0.1mM EDTA, 100mM NaCl, 100㎍/ml의 리소자임)/500ml의 초기 배양물로 다시 현탁시키고, 15분 동안 얼음 위에서 항온처리하고, 액체 질소 및 37℃ 수조에서 5주기의 동결/해동 주기를 수행하였다. 상기 혼합물을, 현탁액이 더 이상 점성을 띠지 않을 때까지 프로브 초음파 발생장치를 사용하여 초음파 처리하고, 20분 동안 13000g에서 원심분리하여 용해성 분획물(상청액)을 수집하였다.
수득된 상청액을 4℃에서 20분 동안 글루타티온-세파로즈 비드(Pharmacia) 3ml와 혼합하였다. 이어서, 상기 비드를 1X 트리스-완충 염수(TBS)로 3회 세척하여 비결합 단백질을 제거하였다. 보유된 단백질을, 10mM 환원 글루타티온을 함유하는 50mM 트리스(pH 8.0) 1ml로 2회 세척하여 용리시켰다. 용리된 단백질을 개별적으로 유지시키고, -80℃에서의 저장을 위해 적절한 시약을 이들에 가하였다. SDS-PAGE에 의해 판단된 바와 같이, 정제된 단백질은 >90% 순수하였다. 정제된 단백질의 단백질 농도는 브래드포드 방법(Bradford method)으로 측정하였다.
His-태그 단백질을 pet28ACPP32 구조를 사용하여 이. 콜라이 AD494 세포 중의 이. 콜라이 균주에서 발현시켰다. 가용성 단백질 분획물을 상기된 바와 같이 제조하였다. 단백질 정제를 위해, 상청액을, 제조업자의 지시에 따라 NiSO4로 충전된 킬레이팅-세파로즈(Pharmacia)를 사용하여 친화 크로마토그래피에 의해 정제하였다. 간략하게, 상기 상청액을 4℃에서 20분 동안 세파로즈 2ml와 함께 상기 NiSO4 충전된 세파로즈에 부하시켰다. 이어서, 상기 비드를 500mM NaCl을 함유하는 10mM MOPS(pH 7.0)로 3회 세척하여 비결합 단백질을 제거하였다. 보유된 단백질을, 용리 완충액(트리스 중의 500mM 이미다졸, pH 8.0) 2ml로 용리시키고, -80℃에서 저장을 위해 적절한 시약을 이들에 가하였다. 정제된 단백질은 SDS-PAGE에 의해 측정된 바와 같이 >90% 순수하였다. 정제된 단백질의 단백질 농도는 브래드포드 검정으로 측정하였다.
프로브 P1 및 P2의 제조
형광 펩타이드 프로브 P1, Fmoc-Ala-Val-Pro-Phe-Tyr(t-Bu)-Leu-Pro-Gly(t-Bu)-Gly-OH를 표준 Fmoc 화학을 사용하여 2-클로로트리틸 클로라이드 수지 상에서 제조하였다(참조: Int. J. Pept. Prot. Res. 38:555-561, 1991). 상기 수지로부터의 개열은 디클로로메탄(디클로로메탄) 중의 20% 아세트산을 사용하여 수행하였으며, 이로써 측쇄는 여전히 차단된 채로 남아있었다. 실온에서 과량의 디메틸포름아미드(DMF) 중의 디이소프로필카보디이미드(DIC)를 사용하여, C-말단 보호된 카복실산을 4'-(아미노메틸)플루오레세인(참조: Molecular Probes, A-1351; Eugene, Oreg.)에 커플링시키고, 실리카 겔 크로마토그래피(디클로로메탄 중의 10% 메탄올)로 정제하였다. N-말단 Fmoc 보호 그룹을 DMF 중의 피페리딘(20%)을 사용하여 제거하고, 실리카 겔 크로마토그래피(디클로로메탄 중의 20% 메탄올, 0.5% HOAc)로 정제하였다. 마지막으로, 2.5% 물 및 2.5% 트리이소프로필 실란을 함유하는 95% 트리플루오로아세트산을 사용하여, 3급-부틸 측쇄 보호 그룹을 제거하여, 프로브 P1(>95% 순도, HPLC)을 제공하였다.
프로브 P2는 WO 제2007/131,366호에 기술된 바와 같은 방법들을 사용하여 제조되었다.
실시예 1
하기 실시예는, 화학식 1의 화합물 또는 이의 염의 제조에서 중간체로서 사용될 수 있는 화합물 5-e의 제조를 예시한다.
반응식 5: 중간체 5-e의 합성
단계 1: 0℃로 냉각된 DMF 중의 Boc-Chg-OH(9.16g, 35.6mmol)의 용액에 DIPEA(10.33ml, 59.3mmol), HOBt(4.81g, 35.6mmol) 및 HBTU(13.50g, 35.6mmol)를 순차적으로 첨가하였다. 10분 동안 교반한 후, (S)-프롤리놀(3.0g, 29.7mmol)을 첨가하고, 상기 반응 혼합물을 실온에서 밤새 교반하였다. 물 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 10% 시트르산, 수성 NaHCO3 및 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켰다. 실리카 겔 크로마토그래피로 정제하여 중간체 5-a를 무색 오일로서 제공하였다.
단계 2: 1,4-디옥산 중의 4N HCl(30ml)을 중간체 5-a(10.10g, 29.7mmol)에 첨가하고, 상기 용액을 실온에서 1시간 동안 교반하였다. 휘발 물질을 감압하에 제거하고, 잔류물을 디에틸 에테르로 연화시켜, 중간체 5-bㆍHCl을 백색 고체로서 제공하였다. MS (m/z) M+1= 240.2
단계 3: 0℃로 냉각된 DMF 중의 Boc-N-Me-Ala-OH(6.02g, 29.6mmol)의 용액에 DIPEA(20.70ml, 118mmol), HOBt(6.35g, 41.5mmol) 및 HBTU(14.61g, 38.5mmol)를 순차적으로 첨가하였다. 10분 동안 교반한 후, 중간체 5-bㆍHCl(8.20g, 29.6mmol)을 첨가하고, 상기 반응 혼합물을 실온에서 밤새 교반하였다. 물 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 10% 시트르산, 수성 NaHCO3 및 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켰다. 실리카 겔 크로마토그래피로 정제하여 중간체 5-c를 무색 오일로서 제공하였다.
단계 4: 0℃로 냉각된 CH2Cl2 중의 중간체 5-c(1.20g, 2.82mmol)의 용액에 탄산수소나트륨(2.36g, 28.2mmol) 및 데스-마르틴 페리오디난(1.49g, 3.52mmol)을 순차적으로 첨가한 다음, 상기 반응물을 10℃에서 2시간 동안 교반하였다. 수성 NaHCO3 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켜, 중간체 5-d를 무색 오일로서 제공하였다.
단계 5: CH2Cl2 중의 중간체 5-d(500mg, 1.18mmol)의 용액에 페네틸아민(283㎕, 1.88mmol)을 첨가하였다. 실온에서 2시간 동안 교반한 후, 트리아세톡시수소화붕소나트륨(300mg, 1.41mmol) 및 메탄올을 첨가하고, 상기 반응물을 실온에서 밤새 교반하였다. 포화 수성 NaHCO3 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 염수로 세척하고, MgSO4로 건조시키고, 여과하고, 진공하에 농축시켜, 중간체 5-e를 무색 오일로서 제공하였다. MS (m/z) M+1=528.4
실시예 2
하기 실시예는, 화학식 1의 화합물 또는 이의 염의 제조에서 중간체로서 사용될 수 있는 화합물 6-h의 제조를 예시한다.
반응식 6: 중간체 6-h의 합성
단계 1: 디클로로메탄(300ml) 중의 N-(3급-부톡시카보닐)-L-프롤리날(6-a)(10.0g, 50.2mmol)의 용액에 페네틸아민(6.52ml, 50.2mmol)을 첨가하였다. 실온에서 2시간 동안 교반한 후, 상기 반응물을 0℃로 냉각시키고, 트리아세톡시수소화붕소나트륨(21.0g, 100.3mmol)을 분획으로 첨가한 다음, 상기 반응 혼합물을 실온에서 밤새 교반하였다. 10% 수성 Na2CO3을 첨가하고, 유기 층을 분리하고, 수성 상을 디클로로메탄으로 추출하고, 합한 유기 추출물을 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켜, 중간체 6-b를 무색 오일로서 제공하였다. 중간체 6-b를 디에틸 에테르(125ml)에 용해시키고, 상기 용액을 0℃로 냉각시키고, 디에틸 에테르 중의 1N HCl(50.0ml, 50.0mmol)을 첨가하였다. 형성된 침전물 및 중간체 6-bㆍHCl을 여과에 의해 백색 고체로서 수집하였다. MS (m/z) M+1= 305.2
단계 2: 0℃로 냉각된 1,4-디옥산(50.0ml) 및 물(50ml) 중의 중간체 6-b(6.11g, 20.08mmol)의 용액에 NaHCO3(8.43g, 100.0mmol)을 첨가하였다. 15분 동안 교반한 후, 벤질 클로로포르메이트(3.43ml, 24.10mmol)를 첨가한 다음, 상기 반응물을 실온에서 2시간 동안 교반하였다. 물 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켰다. 실리카 겔 크로마토그래피로 정제하여, 중간체 6-c를 무색 오일로서 제공하였다.
단계 3: 1,4-디옥산 중의 4N HCl(67.1ml)을 0℃에서 중간체 6-c(8.41g, 19.18mmol)에 첨가하고, 상기 용액을 실온에서 2시간 동안 교반하였다. 휘발 물질을 감압하에 제거하고, 잔류물을 디에틸 에테르로 연화시켜, 중간체 6-dㆍHCl을 베이지색 고체로서 제공하였다. MS (m/z) M+1= 339.3
단계 4: 0℃로 냉각된 DMF 중의 중간체 6-d(394mg, 1.05mmol)의 용액에 (S)-2-Boc-2-(테트라하이드로-2H-피란-4-일)아세트산(300mg, 1.15mmol), HATU(520mg, 1.36mmol), HOAt(48㎕, 0.21mmol) 및 DIPEA(733㎕, 4.21mmol)를 순차적으로 첨가한 다음, 상기 반응물을 실온에서 밤새 교반하였다. 포화 수성 염화암모늄 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 포화 수성 염화암모늄, 포화 수성 NaHCO3 및 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켰다. 실리카 겔 크로마토그래피로 정제하여, 예상되는 중간체 6-e를 황색을 띠는 오일로서 제공하였다.
단계 5: 1,4-디옥산 중의 4N HCl(3.68ml)을 0℃에서 중간체 6-e(610mg, 1.05mmol)에 첨가하고, 상기 용액을 0℃에서 4시간 동안 교반하였다. 휘발 물질을 감압하에 제거하고, 잔류물을 디에틸 에테르로 연화시켜, 예상되는 중간체 6-fㆍHCl을 백색 고체로서 제공하였다. MS (m/z) M+1= 480.4
단계 6: 0℃로 냉각된 DMF 중의 중간체 6-fㆍHCl(271mg, 0.52mmol)의 용액에 Boc-N-Me-Ala-OH(117mg, 0.58mmol), HATU(240mg, 0.63mmol), HOAt(175㎕, 0.10mmol) 및 DIPEA(366㎕, 2.10mmol)를 순차적으로 첨가한 다음, 상기 반응물을 실온에서 2시간 동안 교반하였다. 포화 수성 염화암모늄 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 포화 수성 염화암모늄, 포화 수성 NaHCO3 및 염수로 세척하고, MgSO4로 건조시키고, 여과하고, 진공하에 농축시켰다. 실리카 겔 크로마토그래피로 정제하여, 예상되는 중간체 6-g를 담황색 오일로서 제공하였다.
단계 7: N2하에 교반된, THF 중의 중간체 6-g(277mg, 0.41mmol)의 용액에 10% Pd/C(50% w/w 함수량)(89mg)를 첨가하였다. 상기 반응 혼합물을 H2로 퍼징시키고, 3시간 동안 교반하였다. 이어서, 상기 반응물을 셀라이트를 통해 여과하고, 여액을 진공하에 농축시켰다. 실리카 겔 크로마토그래피로 정제하여, 중간체 6-h를 무색 오일로서 제공하였다. MS (m/z) M+1= 531.5.
실시예 3
하기 실시예는, 화학식 1의 화합물 또는 이의 염의 제조에서 중간체로서 사용될 수 있는 화합물 7-d의 제조를 예시한다.
반응식 7: 중간체 7-d의 합성
단계 1: 0℃로 냉각된 DMF(1300ml) 중의 중간체 6-dㆍHCl(95.90g, 256mmol)의 용액에 Boc-tBu-gly-OH(65.10g, 281mmol), HOAt(42.6ml, 25.6mmol), HATU(107g, 281mmol) 및 DIPEA(179ml, 1023mmol)를 순차적으로 첨가한 다음, 상기 반응물을 0℃에서 30분 동안 교반하였다. 포화 수성 염화암모늄 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 포화 수성 염화암모늄, 포화 수성 NaHCO3 및 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켰다. 실리카 겔 크로마토그래피로 정제하여, 예상되는 중간체 7-a를 무색 오일로서 제공하였다.
단계 2: 1,4-디옥산 중의 4N HCl(480ml)을 0℃에서 메탄올(130ml) 중의 중간체 7-a(141.00g, 256mmol)에 첨가하고, 상기 용액을 0℃에서 30분 동안에 이어, 실온에서 3시간 동안 교반하였다. 휘발 물질을 감압하에 제거하고, 잔류물을 디에틸 에테르로 연화시켜, 중간체 7-bㆍHCl을 백색 고체로서 제공하였다. MS (m/z) M+1= 452.4
단계 3: 0℃로 냉각된 DMF(870ml) 중의 중간체 7-bㆍHCl(85.00g, 174mmol)의 용액에 Boc-N-Me-Ala-OH(38.90g, 192mmol), HOAt(37.70, 22.64mmol), HATU(72.80g, 56.3mmol) 및 DIPEA(122ml, 192mmol)를 순차적으로 첨가한 다음, 상기 반응물을 0℃에서 1시간 동안 교반하였다. 포화 수성 염화암모늄 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 포화 수성 염화암모늄, 포화 수성 NaHCO3 및 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켰다. 실리카 겔 크로마토그래피로 정제하여, 예상되는 중간체 7-c를 백색 발포체로서 제공하였다.
단계 4: N2하에 교반된, 메탄올 중의 중간체 7-c(1.56g, 2.45mmol)의 용액에 10% Pd/C(50% w/w 함수량)(500mg)를 첨가하였다. 상기 반응 혼합물을 H2로 퍼징시키고, 3시간 동안 교반하였다. 이어서, 상기 반응물을 셀라이트를 통해 여과하고, 여액을 진공하에 농축시켜, 중간체 7-d를 무색 오일로서 수득하였다. MS (m/z) M+1= 503.5.
실시예 4
하기 실시예는, 화학식 1의 화합물 또는 이의 염인 화합물 5의 제조를 예시한다.
반응식 8: 화합물 5의 합성
단계 1: 0℃로 냉각된, DMF 중의 중간체 5-e(150mg, 0.28mmol)의 용액에 이미다조[1,2-a]피리미딘-2-카복실산(56mg, 0.34mmol), HATU(162mg, 0.42mmol) 및 DIPEA(500㎕, 2.87mmol)를 순차적으로 첨가하였다. 상기 반응 혼합물을 실온에서 2시간 동안 교반하였다. 물 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 포화 수성 염화암모늄, 포화 수성 NaHCO3 및 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켰다. 실리카 겔 크로마토그래피로 정제하여, 중간체 8-a를 백색 고체로서 제공하였다.
단계 2: 1,4-디옥산 중의 4N HCl(1.8ml)을 에틸 아세테이트(0.5ml) 중의 중간체 8-a(99mg, 0.14mmol)에 첨가하고, 상기 용액을 실온에서 1시간 동안 교반하였다. 휘발 물질을 감압하에 제거하고, 잔류물을 디에틸 에테르로 연화시켜, 화합물 5ㆍ2HCl을 백색 고체로서 제공하였다. MS (m/z) M+1= 574.4.
실시예 5
하기 실시예는, 화학식 1의 화합물 또는 이의 염인 화합물 3의 제조를 예시한다.
반응식 9: 화합물 3의 합성
단계 1: 0℃로 냉각된 DMF 중의 중간체 6-h(221mg, 0.41mmol)의 용액에 이미다조[1,2-a]피리미딘-2-카복실산(74.7mg, 0.45mmol), HATU(206mg, 0.54mmol) 및 DIPEA(218㎕, 1.24mmol)를 순차적으로 첨가하였다. 상기 반응 혼합물을 실온에서 2시간 동안 교반하였다. 포화 수성 염화암모늄 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 포화 수성 염화암모늄, 포화 수성 NaHCO3 및 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켰다. 실리카 겔 크로마토그래피로 정제하여, 중간체 9-a를 무색 오일로서 제공하였다.
단계 2: 1,4-디옥산 중의 4N HCl(554㎕)을 0℃에서 에틸 아세테이트(0.5ml) 중의 중간체 9-a(107mg, 0.15mmol)에 첨가하고, 상기 용액을 0℃에서 1시간 동안 교반하였다. 휘발 물질을 감압하에 제거하고, 잔류물을 디에틸 에테르로 연화시켜, 화합물 3ㆍ2HCl을 백색 고체로서 제공하였다. MS (m/z) M+1= 576.4.
실시예 6
하기 실시예는, 화학식 1의 화합물 또는 이의 염인 화합물 6의 제조를 예시한다.
반응식 10: 화합물 6의 합성
단계 1: 0℃로 냉각된 DMF 중의 중간체 7-d(1.97g, 3.94mmol)의 용액에 이미다조[1,2-a]피리미딘-2-카복실산(642mg, 3.94mmol), HATU(1.94g, 5.12mmol) 및 DIPEA(2.05ml, 11.81mmol)를 순차적으로 첨가하였다. 상기 반응 혼합물을 실온에서 2시간 동안 교반하였다. 포화 수성 염화암모늄 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 포화 수성 염화암모늄, 포화 수성 NaHCO3 및 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켰다. 실리카 겔 크로마토그래피로 정제하여, 중간체 10-a를 백색 고체로서 제공하였다.
단계 2: 1,4-디옥산 중의 4N HCl(9.40ml)을 0℃에서 에틸 아세테이트(5ml) 중의 중간체 10-a(1.74g, 2.69mmol)에 첨가하고, 상기 용액을 0℃에서 3시간 동안 교반하였다. 휘발 물질을 감압하에 제거하고, 잔류물을 디에틸 에테르로 연화시켜, 화합물 6ㆍ2HCl을 백색 고체로서 제공하였다. MS (m/z) M+1= 548.4
실시예 7
하기 실시예는, 화학식 1의 화합물 또는 이의 염인 화합물 9의 제조를 예시한다.
반응식 11: 화합물 9의 합성
단계 1: 0℃로 냉각된 디클로로메탄 중의 중간체 7-d(200mg, 0.39mmol)의 용액에 DIPEA(174㎕, 0.99mmol) 및 에틸 2-클로로-2-옥소아세테이트(109mg, 0.79mmol)를 순차적으로 첨가하였다. 상기 반응 혼합물을 실온에서 3시간 동안 교반하였다. 1N HCl 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 포화 수성 NaHCO3 및 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켰다. 실리카 겔 크로마토그래피로 정제하여, 중간체 11-a를 백색 고체로서 제공하였다.
단계 2: 0℃로 냉각된 THF 중의 중간체 11-a(215mg, 0.35mmol)의 용액에 2N 수성 LiOH(1.0ml, 2.0mmol)를 첨가하고, 상기 반응물을 실온에서 1시간 동안 교반하였다. 1N HCl 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켜, 중간체 11-b를 백색 고체로서 제공하였다.
단계 3: 0℃로 냉각된 DMF 중의 중간체 11-b(200mg, 0.34mmol)의 용액에 아닐린(41㎕, 0.45mmol), DIPEA(61㎕, 0.34mmol) 및 HATU(172mg, 0.45mmol)를 순차적으로 첨가하고, 상기 반응 혼합물을 0℃에서 2시간 동안 교반하였다. 물 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 1N 수성 HCl, 포화 수성 NaHCO3 및 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켰다. 실리카 겔 크로마토그래피로 정제하여, 중간체 11-c를 백색 고체로서 제공하였다.
단계 4: 0℃로 냉각된 디클로로메탄(2ml) 중의 중간체 11-c(230mg, 0.35mmol)의 용액에 TFA(2ml)를 첨가한 다음, 상기 반응물을 0℃에서 1시간 동안 교반하였다. 휘발 물질을 감압하에 제거하고, 잔류물을 디에틸 에테르로 연화시켜, 화합물 9ㆍTFA를 백색 고체로서 제공하였다. MS (m/z) M+1=550.1
실시예 8
하기 실시예는, 화학식 1의 화합물 또는 이의 염의 제조에서 중간체로서 사용될 수 있는 화합물 12-g의 제조를 예시한다.
반응식 12: 중간체 12-g의 합성
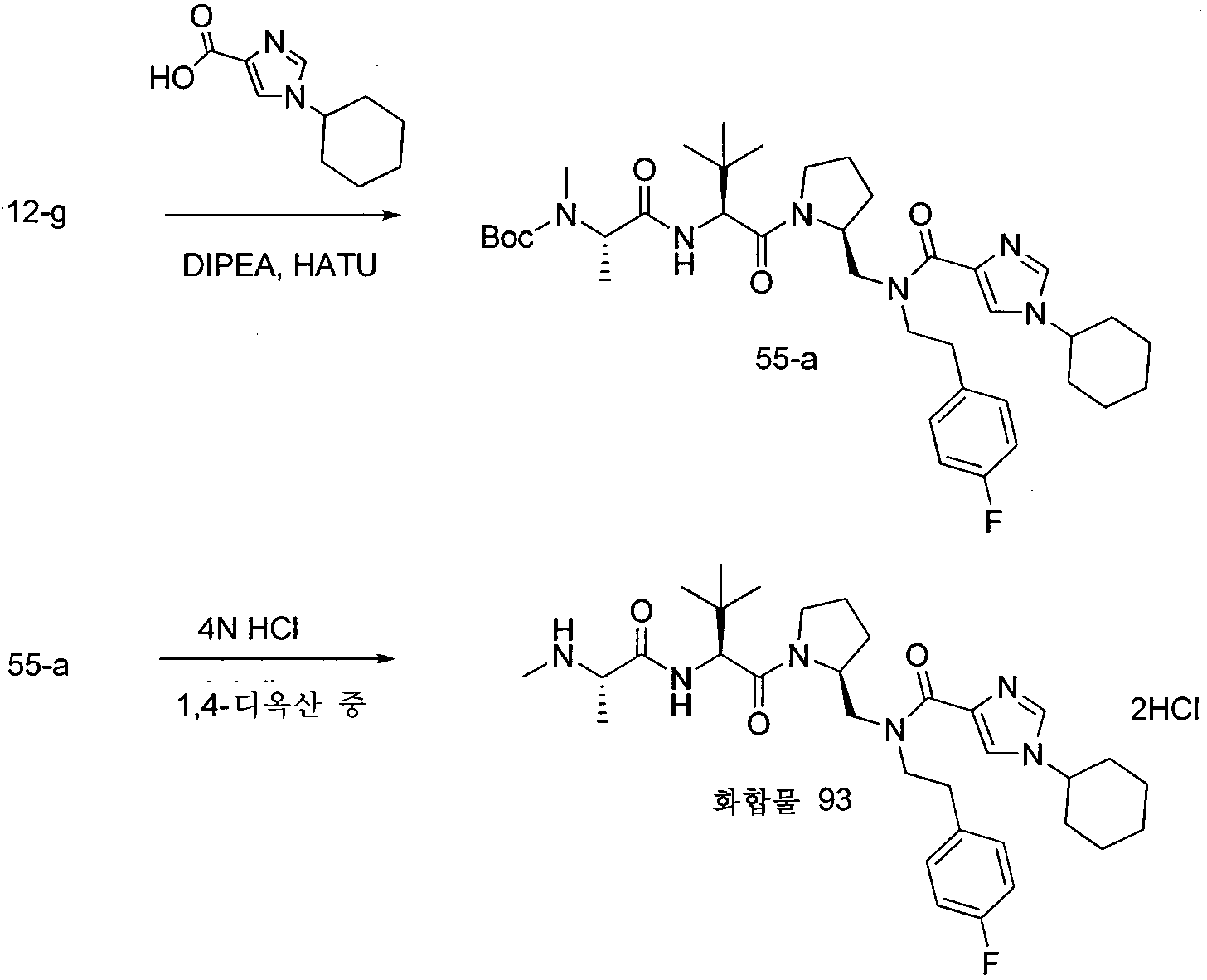
단계 1: 디클로로메탄(1000ml) 중의 N-(3급-부톡시카보닐)-L-프롤리날(6-a)(30.0g, 151.0mmol)의 용액에 2-(4-플루오로페닐)에탄아민(19.79ml, 151.0mmol)을 첨가하였다. 실온에서 2시간 동안 교반한 후, 상기 반응물을 0℃로 냉각시키고, 트리아세톡시수소화붕소나트륨(38.3g, 181.0mmol)을 분획으로 첨가한 다음, 상기 반응 혼합물을 실온에서 밤새 교반하였다. 10% 수성 Na2CO3(800ml)을 첨가하고, 유기 층을 분리하고, 수성 상을 디클로로메탄으로 추출하고, 합한 유기 추출물을 염수로 세척하고, MgSO4로 건조시키고, 여과하고, 진공하에 농축시켜, 중간체 12-a를 무색 오일로서 제공하였다. 중간체 12-a를 디에틸 에테르(400ml)에 용해시키고, 상기 용액을 0℃로 냉각시키고, 디에틸 에테르 중의 1N HCl(151.0ml, 151.0mmol)을 첨가하였다. 형성된 침전물 및 중간체 12-aㆍHCl을 여과에 의해 백색 고체로서 수집하였다. MS (m/z) M+1= 323.3
단계 2: 0℃로 냉각된 1,4-디옥산(300ml) 및 물(300ml) 중의 중간체 12-aㆍHCl(40.0g, 111.0mmol)의 용액에 NaHCO3(46.8g, 557.0mmol)을 첨가하였다. 15분 동안 교반한 후, 벤질 클로로포르메이트(17.50ml, 123.0mmol)를 첨가한 다음, 상기 반응물을 실온에서 1.5시간 동안 교반하였다. 물 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켜, 중간체 12-b를 무색 오일로서 제공하였다.
단계 3: 1,4-디옥산 중의 4N HCl(139ml)을 0℃에서 중간체 12-b(50.7g, 111.0mmol)에 첨가하고, 상기 용액을 0℃에서 2.5시간 동안 교반하였다. 휘발 물질을 감압하에 제거하고, 잔류물을 디에틸 에테르 및 헥산으로 연화시켜, 중간체 12-cㆍHCl을 백색 발포체로서 제공하였다. MS (m/z) M+1= 357.3
단계 4: 0℃로 냉각된 DMF 중의 중간체 12-cㆍHCl(38.9g, 99.0mmol)의 용액에 Boc-tBu-gly-OH(15.07g, 65.1mmol), HATU(48.9g, 129.0mmol), HOAt(24.75ml, 14.85mmol) 및 DIPEA(69.0ml, 396.0mmol)를 30분에 걸쳐 순차적으로 적가한 다음, 상기 반응물을 0℃에서 1시간 동안 교반하였다. 포화 수성 염화암모늄 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 포화 수성 염화암모늄, 포화 수성 NaHCO3 및 염수로 세척하고, MgSO4로 건조시키고, 여과하고, 진공하에 농축시켰다. 실리카 겔 크로마토그래피로 정제하여, 예상되는 중간체 12-d를 백색 발포체로서 제공하였다.
단계 5: 1,4-디옥산 중의 4N HCl(108ml)을 0℃에서 에틸 아세테이트(10ml) 중의 중간체 12-d(49.0g, 86.0mmol)의 용액에 첨가하고, 상기 반응 혼합물을 0℃에서 4시간 동안 교반하였다. 휘발 물질을 감압하에 제거하고, 잔류물을 디에틸 에테르로 연화시켜, 중간체 12-eㆍHCl을 백색 발포체로서 제공하였다. MS (m/z) M+1= 470.5
단계 6: 0℃로 냉각된 DMF 중의 중간체 12-eㆍHCl(10.4g, 20.55mmol)의 용액에 Boc-NMe-Ala-OH(5.01g, 24.66mmol), HATU(10.94g, 28.8mmol), HOAt(5.14ml, 3.08mmol) 및 DIPEA(14.32ml, 82.0mmol)를 30분에 걸쳐 순차적으로 적가한 다음, 상기 반응물을 0℃에서 1시간 동안 교반하였다. 포화 수성 염화암모늄 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 포화 수성 염화암모늄, 포화 수성 NaHCO3 및 염수로 세척하고, MgSO4로 건조시키고, 여과하고, 진공하에 농축시켰다. 실리카 겔 크로마토그래피로 정제하여, 예상되는 중간체 12-f를 백색 발포체로서 제공하였다.
단계 7: N2하에 MeOH(100ml) 중의 중간체 12-f(8.50g, 16.32mmol)의 용액에 10% Pd/C(50% w/w 함수량)(3.4g)를 첨가하였다. 상기 반응 혼합물을 H2로 퍼징시키고, 1시간 동안 교반하였다. 이어서, 상기 반응물을 셀라이트를 통해 여과하고, 여액을 진공하에 농축시켰다. 실리카 겔 크로마토그래피로 정제하여, 중간체 12-g를 무색 오일로서 제공하였다. MS (m/z) M+1= 521.5
실시예 9
하기 실시예는, 화학식 1의 화합물 또는 이의 염인 화합물 40의 제조를 예시한다.
반응식 13: 화합물 40의 합성
단계 1: 0℃로 냉각된, DMF 중의 중간체 12-g(610mg, 1.17mmol)의 용액에 1-메틸-1H-이미다졸-4-카복실산(177mg, 1.40mmol), HATU(624mg, 1.64mmol) 및 DIPEA(816㎕, 4.69mmol)를 순차적으로 첨가하고, 상기 반응 혼합물을 0℃에서 2시간 동안 교반하였다. 포화 수성 염화암모늄 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 포화 수성 염화암모늄, 포화 수성 NaHCO3 및 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켰다. 실리카 겔 크로마토그래피로 정제하여, 중간체 13-a를 백색 발포체로서 제공하였다.
단계 2: 1,4-디옥산 중의 4N HCl(2.3ml)을 에틸 아세테이트(0.5ml) 중의 중간체 13-a(590mg, 0.93mmol)의 용액에 첨가하고, 상기 혼합물을 0℃에서 3시간 동안 교반하였다. 휘발 물질을 감압하에 제거하고, 잔류물을 디에틸 에테르로 연화시켜, 화합물 40ㆍ2HCl을 백색 고체로서 제공하였다. MS (m/z) M+1= 529.5
실시예 10
하기 실시예는, 화학식 1의 화합물 또는 이의 염인 화합물 50의 제조를 예시한다.
반응식 14: 화합물 50의 합성
단계 1: 0℃로 냉각된, DMF 중의 중간체 12-g(400mg, 0.76mmol)의 용액에 1-페닐-1H-1,2,3-트리아졸-4-카복실산, 리튬 염(226mg, 1.15mmol), HATU(467mg, 1.23mmol) 및 DIPEA(535㎕, 3.07mmol)를 순차적으로 첨가하고, 상기 반응 혼합물을 0℃에서 2시간 동안 교반하였다. 포화 수성 염화암모늄 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 포화 수성 염화암모늄, 포화 수성 NaHCO3 및 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켰다. 실리카 겔 크로마토그래피로 정제하여, 중간체 14-a를 백색 발포체로서 제공하였다.
단계 2: 1,4-디옥산 중의 4N HCl(1.0ml)을 에틸 아세테이트(1.0ml) 중의 중간체 14-a(282mg, 0.40mmol)에 첨가하고, 상기 용액을 0℃에서 5시간 동안 교반하였다. 휘발 물질을 감압하에 제거하고, 잔류물을 디에틸 에테르로 연화시켜, 화합물 50ㆍ2HCl을 백색 고체로서 제공하였다. MS (m/z) M+1= 592.5
실시예 11
하기 실시예는, 화학식 1의 화합물 또는 이의 염인 화합물 63의 제조를 예시한다.
반응식 15: 화합물 63의 합성
단계 1: 0℃로 냉각된, DMF 중의 중간체 12-g(15.17g, 29.1mmol)의 용액에 6-플루오로이미다조[1,2-a]피리미딘-2-카복실산, HBr 염(86-c)(9.16g, 35.0mmol), HATU(13.29g, 35.0mmol) 및 DIPEA(20.0ml, 117mmol)를 순차적으로 첨가하고, 상기 반응 혼합물을 0℃에서 2시간 동안 교반하였다. 포화 수성 염화암모늄 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 포화 수성 염화암모늄, 포화수성 NaHCO3 및 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켰다. 실리카 겔 크로마토그래피로 정제하여, 중간체 15-a를 백색 발포체로서 제공하였다.
단계 2: 1,4-디옥산 중의 4N HCl(82.0ml)을 에틸 아세테이트(11ml) 중의 중간체 15-a(14.96g, 21.88mmol)에 첨가하고, 상기 용액을 0℃에서 3시간 동안 교반하였다. 디에틸 에테르를 첨가하고, 형성된 침전물 및 화합물 63ㆍ2HCl을 여과에 의해 백색 고체로서 수집하였다. MS (m/z) M+1= 584.5.
실시예 12
하기 실시예는, 화학식 1의 화합물 또는 이의 염인 화합물 66의 제조를 예시한다.
반응식 16: 화합물 66의 합성
단계 1: 0℃로 냉각된, DMF 중의 중간체 12-g(350mg, 0.67mmol)의 용액에 1-(4-플루오로페닐)-1H-이미다졸-4-카복실산, 리튬 염(88-e)(208mg, 1.0mmol), HATU(435mg, 1.14mmol) 및 DIPEA(468㎕, 2.69mmol)를 순차적으로 첨가하고, 상기 반응 혼합물을 0℃에서 1시간 동안 교반하였다. 포화 수성 염화암모늄 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 포화 수성 염화암모늄, 포화 수성 NaHCO3 및 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켰다. 실리카 겔 크로마토그래피로 정제하여, 중간체 16-a를 백색 발포체로서 제공하였다.
단계 2: 1,4-디옥산 중의 4N HCl(1.0ml)을 MeOH(0.5ml) 중의 중간체 16-a(515mg, 0.78mmol)에 첨가하고, 상기 용액을 0℃에서 2시간 동안 교반하였다. 휘발 물질을 감압하에 제거하고, 잔류물을 디에틸 에테르로 연화시켜, 화합물 66ㆍ2HCl을 백색 고체로서 제공하였다. MS (m/z) M+1= 609.5
실시예 13
하기 실시예는, 화학식 1의 화합물 또는 이의 염인 화합물 67의 제조를 예시한다.
반응식 17: 화합물 67의 합성
단계 1: 0℃로 냉각된, DMF 중의 중간체 12-g(856mg, 1.64mmol)의 용액에 6,7-디하이드로-5H-피롤로[1,2-a]이미다졸-2-카복실산, 리튬 염(87-e)(340mg, 2.13mmol), HATU(875mg, 2.30mmol) 및 DIPEA(859㎕, 4.93mmol)를 순차적으로 첨가하고, 상기 반응 혼합물을 0℃에서 30분 동안 교반하였다. 포화 수성 염화암모늄 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 포화 수성 염화암모늄, 포화 수성 NaHCO3 및 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켰다. 실리카 겔 크로마토그래피로 정제하여, 중간체 17-a를 백색 발포체로서 제공하였다.
단계 2: 1,4-디옥산 중의 4N HCl(1.0ml)을 에틸 아세테이트(0.5ml) 중의 중간체 17-a(515mg, 0.78mmol)에 첨가하고, 상기 용액을 0℃에서 2시간 동안 교반하였다. 휘발 물질을 감압하에 제거하고, 잔류물을 디에틸 에테르로 연화시켜, 화합물 67ㆍ2HCl을 백색 고체로서 제공하였다. MS (m/z) M+1= 555.6
실시예 14
하기 실시예는, 화학식 1의 화합물 또는 이의 염인 화합물 68의 제조를 예시한다.
반응식 18: 화합물 68의 합성
단계 1: 0℃로 냉각된, DMF 중의 중간체 12-g(300mg, 0.57mmol)의 용액에 인돌리진-2-카복실산(107mg, 0.66mmol), HATU(285mg, 0.75mmol) 및 DIPEA(301㎕, 1.72mmol)를 순차적으로 첨가하고, 상기 반응 혼합물을 0℃에서 30분 동안 교반하였다. 포화 수성 염화암모늄 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 포화 수성 염화암모늄, 포화 수성 NaHCO3 및 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켰다. 실리카 겔 크로마토그래피로 정제하여, 화합물 18-a를 백색 발포체로서 제공하였다.
단계 2: 1,4-디옥산 중의 4N HCl(1.0ml)을 에틸 아세테이트(0.5ml) 중의 중간체 18-a(360mg, 0.54mmol)에 첨가하고, 상기 용액을 0℃에서 2시간 동안 교반하였다. 휘발 물질을 감압하에 제거하고, 잔류물을 디에틸 에테르로 연화시켜, 화합물 68ㆍHCl을 백색 고체로서 제공하였다. MS (m/z) M+1= 564.5
실시예 15
하기 실시예는, 화학식 1의 화합물 또는 이의 염인 화합물 62의 제조를 예시한다.
반응식 19: 화합물 62의 합성
단계 1: 0℃로 냉각된, DMF 중의 중간체 12-g(300mg, 0.57mmol)의 용액에 나트륨 벤조[d]옥사졸-2-카복실레이트(139mg, 0.74mmol), HATU(263mg, 0.69mmol) 및 DIPEA(401㎕, 2.30mmol)를 순차적으로 첨가하고, 상기 반응 혼합물을 0℃에서 2시간 동안 교반하였다. 포화 수성 염화암모늄 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 포화 수성 염화암모늄, 포화 수성 NaHCO3 및 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켰다. 실리카 겔 크로마토그래피로 정제하여, 중간체 19-a를 백색 발포체로서 제공하였다.
단계 2: 1,4-디옥산 중의 4N HCl(1.20ml)을 중간체 19-a(294mg, 0.44mmol)에 첨가하고, 상기 용액을 0℃에서 2시간 동안 교반하였다. 휘발 물질을 감압하에 제거하고, 잔류물을 디에틸 에테르로 연화시켜, 화합물 62ㆍHCl을 백색 고체로서 제공하였다. MS (m/z) M+1= 566.5
실시예 16
하기 실시예는, 화학식 1의 화합물 또는 이의 염인 화합물 53의 제조를 예시한다.
반응식 20: 화합물 53의 합성
단계 1: 0℃로 냉각된 THF 중의 (2S,4S)-1-(3급-부톡시카보닐)-4-페녹시피롤리딘-2-카복실산(20-a)(1.40g, 4.56mmol)의 용액에 보란 테트라하이드로푸란 복합물(18.22ml, 18.2mmol)을 첨가하고, 상기 반응물을 0℃에서 15분 동안 및 실온에서 밤새 교반하였다. 포화 수성 염화암모늄 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 포화 수성 염화암모늄, 포화 수성 NaHCO3 및 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켜, 중간체 20-b를 무색 오일로서 제공하였다.
단계 2: DMSO(5.24ml, 73.9mmol) 및 디클로로메탄(10ml) 중의 중간체 20-b(1.33g, 4.53mmol)의 용액에 TEA(2.53ml, 18.13mmol) 및 피리딘-삼산화황 복합물(1.44g, 9.07mmol)을 첨가한 다음, 상기 반응물을 0℃에서 30분 동안 및 실온에서 30분 동안 교반하였다. 물 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 10% 수성 시트르산, 포화 수성 NaHCO3 및 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켜, 중간체 20-c를 무색 오일로서 제공하였다.
단계 3: 디클로로메탄 중의 중간체 20-c(1.32g, 4.53mmol)의 용액에 2-(4-플루오로페닐)에탄아민(595㎕, 4.53mmol)을 첨가하였다. 30분 동안 교반한 후, 0℃에서 트리아세톡시수소화붕소나트륨(1.21g, 5.44mmol)을 첨가한 다음, 상기 반응 혼합물을 실온에서 밤새 교반하였다. 물 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 1N 수성 NaOH, 물 및 염수로 세척하고, MgSO4로 건조시키고, 여과하고, 진공하에 농축시켜, 중간체 20-d를 무색 오일로서 제공하였다.
단계 4: 0℃로 냉각된, DMF 중의 중간체 20-d(1.87g, 4.51mmol)의 용액에 이미다조[1,2-a]피리미딘-2-카복실산(1.21g, 4.96mmol), HATU(2.05g, 5.41mmol) 및 DIPEA(2.36ml, 13.53mmol)를 순차적으로 첨가한 다음, 상기 반응 혼합물을 실온에서 밤새 교반하였다. 포화 수성 염화암모늄 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 포화 수성 염화암모늄, 포화 수성 NaHCO3 및 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켰다. 실리카 겔 크로마토그래피로 정제하여, 중간체 20-e를 백색 발포체로서 제공하였다.
단계 5: 1,4-디옥산 중의 4N HCl(1.0ml)을 중간체 20-e(800mg, 1.43mmol)에 첨가하고, 상기 용액을 0℃에서 1시간 동안 교반하였다. 휘발 물질을 감압하에 제거하고, 잔류물을 디에틸 에테르로 연화시켜, 중간체 20-fㆍ2HCl을 백색 고체로서 제공하였다. MS (m/z) M+1=460.4
단계 6: 0℃로 냉각된 DMF 중의 중간체 20-fㆍ2HCl(709mg, 1.43mmol)의 용액에 Boc-tBu-gly-OH(397mg, 1.71mmol), HOAt(357㎕, 0.21mmol), HATU(707mg, 1.85mmol) 및 DIPEA(1.0ml, 5.72mmol)를 순차적으로 첨가한 다음, 상기 반응물을 실온에서 1시간 동안 교반하였다. 포화 수성 염화암모늄 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 포화 수성 염화암모늄, 포화 수성 NaHCO3 및 염수로 세척하고, MgSO4로 건조시키고, 여과하고, 진공하에 농축시켰다. 실리카 겔 크로마토그래피로 정제하여, 예상되는 중간체 20-g를 백색 발포체로서 제공하였다.
단계 7: 1,4-디옥산 중의 4N HCl(1.0ml)을 중간체 20-g(651mg, 0.96mmol)에 첨가하고, 상기 용액을 0℃에서 1시간 동안 교반하였다. 휘발 물질을 감압하에 제거하고, 잔류물을 디에틸 에테르로 연화시켜, 중간체 20-hㆍ2HCl을 백색 고체로서 제공하였다. MS (m/z) M+1=573.5
단계 8: 0℃로 냉각된 DMF 중의 중간체 20-hㆍ2HCl(300mg, 0.49mmol)의 용액에 Boc-NMe-Ala-OH(140mg, 0.69mmol), HOAt(123㎕, 0.07mmol), HATU(281mg, 0.73mmol) 및 DIPEA(344㎕, 1.97mmol)를 순차적으로 첨가한 다음, 상기 반응물을 실온에서 밤새 교반하였다. 포화 수성 염화암모늄 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 포화 수성 염화암모늄, 포화 수성 NaHCO3 및 염수로 세척하고, MgSO4로 건조시키고, 여과하고, 진공하에 농축시켰다. 실리카 겔 크로마토그래피로 정제하여, 예상되는 중간체 20-i를 백색 발포체로서 제공하였다.
단계 9: 1,4-디옥산 중의 4N HCl(1.0ml)을 중간체 20-i(348mg, 0.45mmol)에 첨가하고, 상기 용액을 0℃에서 1시간 동안 교반하였다. 휘발 물질을 감압하에 제거하고, 잔류물을 디에틸 에테르로 연화시켜, 화합물 53ㆍ2HCl을 백색 고체로서 제공하였다. MS (m/z) M+1= 658.5
실시예 17
하기 실시예는, 화학식 1의 화합물 또는 이의 염의 제조에서 중간체로서 사용될 수 있는 화합물 21-k의 제조를 예시한다.
반응식 21: 중간체 21-k의 합성
단계 1: 0℃로 냉각된 1,4-디옥산(89ml) 및 물(89ml) 중의 중간체 21-aㆍHCl(10.0g, 35.6mmol)의 용액에 중탄산나트륨(8.98g, 107.0mmol) 및 벤질 클로로포르메이트(6.72g, 37.4mmol)를 순차적으로 첨가한 다음, 상기 반응물을 실온에서 3시간 동안 교반하였다. 디에틸 에테르(200ml)를 첨가하고, 유기 층을 분리하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켜, 중간체 21-b를 무색 오일로서 제공하였다.
단계 2: 1,4-디옥산 중의 4N HCl(30.0ml)을 중간체 21-b(13.0g, 34.4mmol)에 첨가하고, 상기 용액을 0℃에서 1시간 동안 교반하였다. 휘발 물질을 감압하에 제거하고, 잔류물을 디에틸 에테르로 연화시켜, 중간체 21-cㆍHCl을 백색 고체로서 제공하였다. MS (m/z) M+1= 279.3
단계 3: 0℃로 냉각된 DMF 중의 중간체 21-cㆍHCl(10.52g, 33.4mmol)의 용액에 Boc-tBu-gly-OH(8.50g, 36.8mmol), HOAt(5.57ml, 3.34mmol), HATU(13.98g, 36.8mmol) 및 DIPEA(23.35ml, 134.0mmol)를 순차적으로 첨가한 다음, 상기 반응물을 실온에서 3시간 동안 교반하였다. 포화 수성 염화암모늄 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 포화 수성 염화암모늄, 포화 수성 NaHCO3 및 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켰다. 실리카 겔 크로마토그래피로 정제하여, 예상되는 중간체 21-d를 무색 오일로서 제공하였다.
단계 4: 1,4-디옥산 중의 4N HCl(30.0ml)을 중간체 21-d(15.8g, 32.1mmol)에 첨가하고, 상기 용액을 0℃에서 1시간 동안 교반하였다. 휘발 물질을 감압하에 제거하고, 잔류물을 디에틸 에테르로 연화시켜, 중간체 21-eㆍHCl을 백색 고체로서 제공하였다. MS (m/z) M+1= 392.5
단계 5: 0℃로 냉각된 DMF 중의 중간체 21-eㆍHCl(15.2g, 35.5mmol)의 용액에 Boc-NMe-Ala-OH(7.58g, 37.3mmol), HOAt(5.92ml, 3.55mmol), HATU(14.86g, 39.1mmol) 및 DIPEA(24.8ml, 142.0mmol)를 순차적으로 첨가한 다음, 상기 반응물을 실온에서 2시간 동안 교반하였다. 포화 수성 염화암모늄 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 포화 수성 염화암모늄, 포화 수성 NaHCO3 및 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켰다. 실리카 겔 크로마토그래피로 정제하여, 예상되는 중간체 21-f를 백색 발포체로서 제공하였다.
단계 6: 0℃로 냉각된 THF 중의 중간체 21-f(20.2g, 35.0mmol)의 용액에 수소화붕소리튬(1.60g, 73.6mmol)을 첨가하고, 상기 반응물을 실온에서 1시간 동안 교반하였다. 물 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 10% 수성 시트르산, 포화 수성 NaHCO3 및 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켰다. 실리카 겔 크로마토그래피로 정제하여, 중간체 21-g를 백색 발포체로서 제공하였다.
단계 7: 0℃로 냉각된 DMSO(5.23ml, 73.6mmol) 및 디클로로메탄(184ml) 중의 중간체 21-g(10.1g, 18.41mmol)의 용액에 DIPEA(11.22ml, 64.4mmol) 및 피리딘 삼산화황 복합물(8.79g, 55.2mmol)을 첨가한 다음, 상기 반응물을 0℃에서 2시간 동안 교반하였다. 물 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 10% 수성 시트르산, 포화 수성 NaHCO3 및 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켜, 중간체 21-h를 백색 발포체로서 제공하였다.
단계 8: 디클로로메탄 중의 중간체 21-h(10.60g, 19.39mmol)의 용액에 2-(4-플루오로페닐)에탄아민(2.70g, 19.39mmol)을 첨가하였다. 실온에서 밤새 교반한 후, 0℃에서 트리아세톡시수소화붕소나트륨(4.93g, 23.27mmol)을 분획으로 첨가한 다음, 상기 반응 혼합물을 실온에서 2시간 동안 교반하였다. 포화 수성 NaHCO3을 첨가하고, 유기 층을 분리하고, 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켜, 중간체 21-i를 백색 발포체로서 제공하였다. MS (m/z) M+1= 670.6
단계 9: 0℃로 냉각된, DMF 중의 중간체 21-i(10.0g, 14.93mmol) 및 이미다조[1,2-a]피리미딘-2-카복실산, HBr 염(84-c)(3.64g, 14.93mmol)의 용액에 HATU(6.24g, 16.42mmol) 및 DIPEA(10.43ml, 59.70mmol)를 순차적으로 첨가하고, 상기 반응 혼합물을 실온에서 2시간 동안 교반하였다. 포화 수성 염화암모늄 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 포화 수성 염화암모늄, 포화 수성 NaHCO3 및 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켰다. 실리카 겔 크로마토그래피로 정제하여, 중간체 21-j를 베이지색 발포체로서 제공하였다.
단계 10: TEA(4.0ml, 28.7mmol) 중의 중간체 21-j(2.75g, 3.37mmol)의 용액에 염화팔라듐(II)(60mg, 0.34mmol) 및 트리에틸실란(1.34ml, 8.45mmol)을 순차적으로 첨가하였다. 상기 반응 혼합물을 H2로 퍼징시키고, 실온에서 2시간 동안 교반하였다. 이어서, 상기 반응물을 셀라이트를 통해 여과하고, 여액을 진공하에 농축시켜, 중간체 21-k를 베이지색 고체로서 제공하였다. MS (m/z) M+1= 681.7
실시예 18
하기 실시예는, 화학식 1의 화합물 또는 이의 염인 화합물 55의 제조를 예시한다.
반응식 22: 화합물 55의 합성
단계 1: 0℃로 냉각된 디클로로메탄(2.0ml) 중의 중간체 21-k(420mg, 0.61mmol)의 용액에 DIPEA(385㎕, 2.20mmol), DMAP(4.50mg, 0.03mmol) 및 아세틸 클로라이드(63㎕, 0.88mmol)를 순차적으로 첨가하고, 상기 반응물을 실온에서 18시간 동안 교반하였다. 물 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 10% 수성 시트르산, 포화 수성 NaHCO3 및 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켜, 중간체 22-a를 백색 고체로서 제공하였다.
단계 2: 1,4-디옥산 중의 4N HCl(2.0ml)을 중간체 22-a(230mg, 0.32mmol)에 첨가하고, 상기 용액을 0℃에서 1시간 동안 교반하였다. 휘발 물질을 감압하에 제거하고, 잔류물을 디에틸 에테르로 연화시켜, 화합물 55ㆍ2HCl을 백색 고체로서 제공하였다. MS (m/z) M+1= 623.5
실시예 19
하기 실시예는, 화학식 1의 화합물 또는 이의 염인 화합물 59의 제조를 예시한다.
반응식 23: 화합물 59의 합성
단계 1: 0℃로 냉각된 피리딘(4.0ml) 중의 중간체 21-k(420mg, 0.61mmol)의 용액에 DIPEA(323㎕, 1.85mmol), DMAP(3.8mg, 0.03mmol) 및 벤젠설포닐 클로라이드(79㎕, 0.61mmol)를 순차적으로 첨가하고, 상기 반응물을 실온에서 밤새 교반하였다. 물 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 10% 수성 시트르산, 포화 수성 NaHCO3 및 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켜, 중간체 23-a를 백색 고체로서 제공하였다.
단계 2: 1,4-디옥산 중의 4N HCl(2.0ml)을 중간체 23-a(100mg, 0.12mmol)에 첨가하고, 상기 용액을 0℃에서 1시간 동안 교반하였다. 휘발 물질을 감압하에 제거하고, 잔류물을 디에틸 에테르로 연화시켜, 화합물 59ㆍ2HCl을 백색 고체로서 제공하였다. MS (m/z) M+1= 721.5
실시예 20
하기 실시예는, 화학식 1의 화합물 또는 이의 염의 제조에서 중간체로서 사용될 수 있는 화합물 24-d의 제조를 예시한다.
반응식 24: 중간체 24-d의 합성
단계 1: -10℃로 냉각된 DMF 중의 중간체 12-cㆍHCl(13.7g, 34.9mmol)의 용액에 Boc-Thr(Me)-OH(8.1g, 34.9mmol), HATU(14.6g, 38.4mmol), HOAt(63.9ml, 38.4mmol) 및 DIPEA(24.4ml, 139.0mmol)를 순차적으로 첨가한 다음, 상기 반응물을 0℃에서 1시간 동안 교반하였다. 포화 수성 염화암모늄 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 포화 수성 염화암모늄, 포화 수성 NaHCO3 및 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켰다. 실리카 겔 크로마토그래피로 정제하여, 예상되는 중간체 24-a를 백색 발포체로서 제공하였다.
단계 2: 1,4-디옥산 중의 4N HCl(94.0ml)을 0℃에서 에틸 아세테이트(10ml) 중의 중간체 24-a(10.8g, 18.9mmol)에 첨가하고, 상기 용액을 0℃에서 3시간 동안 교반하였다. 휘발 물질을 감압하에 제거하고, 잔류물을 디에틸 에테르로 연화시켜, 중간체 24-bㆍHCl을 백색 발포체로서 제공하였다. MS (m/z) M+1= 472.5
단계 3: 0℃로 냉각된 DMF 중의 중간체 24-bㆍHCl(25.0g, 49.2mmol)의 용액에 Boc-NMe-Ala-OH(12.0g, 59.0mmol), HATU(26.2g, 68.9mmol), HOAt(12.3ml, 7.38mmol) 및 DIPEA(34.3ml, 197mmol)를 순차적으로 첨가한 다음, 상기 반응물을 0℃에서 1시간 동안 교반하였다. 포화 수성 염화암모늄 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 포화 수성 염화암모늄, 포화 수성 NaHCO3 및 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켰다. 실리카 겔 크로마토그래피로 정제하여, 예상되는 중간체 24-c를 백색 발포체로서 제공하였다.
단계 4: N2하에 MeOH(118ml) 중의 중간체 24-c(15.88g, 23.67mmol)의 용액에 10% Pd/C(50% w/w 함수량)(3.53g)를 첨가하였다. 상기 반응 혼합물을 H2로 퍼징시키고, 5시간 동안 교반하였다. 이어서, 상기 반응물을 셀라이트를 통해 여과하고, 여액을 진공하에 농축시켜, 중간체 24-d를 무색 오일로서 제공하였다. MS (m/z) M+1= 537.5
실시예 21
하기 실시예는, 화학식 1의 화합물 또는 이의 염인 화합물 58의 제조를 예시한다.
반응식 25: 화합물 58의 합성
단계 1: 0℃로 냉각된, DMF 중의 중간체 24-d(15.0g, 28.7mmol)의 용액에 이미다조[1,2-a]피리딘-2-카복실산, 리튬 염(85-d)(5.79g, 34.40mmol), HATU(13.10g, 34.40mmol) 및 DIPEA(20.0ml, 115.0mmol)를 순차적으로 첨가하고, 상기 반응 혼합물을 0℃에서 3시간 동안 교반하였다. 포화 수성 염화암모늄 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 포화 수성 염화암모늄, 포화 수성 NaHCO3 및 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켰다. 실리카 겔 크로마토그래피로 정제하여, 중간체 25-a를 백색 발포체로서 제공하였다.
단계 2: 1,4-디옥산 중의 4N HCl(69.20ml)을 에틸 아세테이트(9.20ml) 중의 중간체 25-a(12.30g, 18.45mmol)에 첨가하고, 상기 용액을 0℃에서 3시간 동안 교반하였다. 디에틸 에테르를 첨가하고, 형성된 침전물 및 화합물 58ㆍ2HCl을 여과에 의해 백색 고체로서 수집하였다. MS (m/z) M+1= 567.5
실시예 22
하기 실시예는, 화학식 1의 화합물 또는 이의 염인 화합물 72의 제조를 예시한다.
반응식 26: 화합물 72의 합성
단계 1: 0℃로 냉각된, DMF 중의 중간체 24-d(400mg, 0.76mmol)의 용액에 1-(4-플루오로페닐)-1H-이미다졸-4-카복실산, 리튬 염(88-e)(212mg, 1.0mmol), HATU(437mg, 1.14mmol) 및 DIPEA(400㎕, 2.29mmol)를 순차적으로 첨가하고, 상기 반응 혼합물을 실온에서 30분 동안 교반하였다. 포화 수성 염화암모늄 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 포화 수성 염화암모늄, 포화 수성 NaHCO3 및 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켰다. 실리카 겔 크로마토그래피로 정제하여, 중간체 26-a를 백색 발포체로서 제공하였다.
단계 2: 1,4-디옥산 중의 4N HCl(1.30ml)을 에틸 아세테이트(0.5ml) 중의 중간체 26-a(385mg, 0.54mmol)에 첨가하고, 상기 용액을 0℃에서 2시간 동안 교반하였다. 휘발 물질을 감압하에 제거하고, 잔류물을 디에틸 에테르로 연화시켜, 화합물 72ㆍ2HCl을 백색 고체로서 제공하였다. MS (m/z) M+1= 611.5
실시예 23
하기 실시예는, 화학식 1의 화합물 또는 이의 염인 화합물 73의 제조를 예시한다.
반응식 27: 화합물 73의 합성
단계 1: 0℃로 냉각된, DMF 중의 중간체 24-d(580mg, 1.11mmol)의 용액에 1-메틸-1H-이미다졸-4-카복실산(168mg, 1.33mmol), HATU(591mg, 1.55mmol) 및 DIPEA(581㎕, 3.33mmol)를 순차적으로 첨가하고, 상기 반응 혼합물을 0℃에서 1시간 동안 교반하였다. 포화 수성 염화암모늄 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 포화 수성 염화암모늄, 포화 수성 NaHCO3 및 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켰다. 실리카 겔 크로마토그래피로 정제하여, 중간체 27-a를 백색 발포체로서 제공하였다.
단계 2: 1,4-디옥산 중의 4N HCl(2.0ml)을 에틸 아세테이트(0.5ml) 중의 중간체 27-a(510mg, 0.81mmol)에 첨가하고, 상기 용액을 0℃에서 3시간 동안 교반하였다. 휘발 물질을 감압하에 제거하고, 잔류물을 디에틸 에테르로 연화시켜, 화합물 73ㆍ2HCl을 백색 고체로서 제공하였다. MS (m/z) M+1= 531.5
실시예 24
하기 실시예는, 화학식 1의 화합물 또는 이의 염인 화합물 75의 제조를 예시한다.
반응식 28: 화합물 75의 합성
단계 1: 0℃로 냉각된, DMF 중의 중간체 24-d(1.8g, 3.44mmol)의 용액에 6,7-디하이드로-5-H-피롤로[1,2-a]이미다졸-2-카복실산, 리튬 염(87-e)(743mg, 4.48mmol), HATU(2.0g, 5.51mmol) 및 DIPEA(1.80ml, 10.33mmol)를 순차적으로 첨가하고, 상기 반응 혼합물을 0℃에서 1시간 동안 교반하였다. 포화 수성 염화암모늄 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 포화 수성 염화암모늄, 포화 수성 NaHCO3 및 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켰다. 실리카 겔 크로마토그래피로 정제하여, 중간체 28-a를 백색 발포체로서 제공하였다.
단계 2: 1,4-디옥산 중의 4N HCl(6.17ml)을 에틸 아세테이트(1.0ml) 중의 중간체 28-a(1.62g, 2.46mmol)에 첨가하고, 상기 용액을 0℃에서 2시간 동안 교반하였다. 디에틸 에테르를 첨가하고, 형성된 침전물 및 화합물 75ㆍ2HCl을 여과에 의해 백색 고체로서 수집하였다. MS (m/z) M+1= 557.4
실시예 25
하기 실시예는, 화학식 1의 화합물 또는 이의 염인 화합물 74의 제조를 예시한다.
반응식 29: 화합물 74의 합성
단계 1: 0℃로 냉각된, DMF 중의 중간체 24-d(956mg, 1.82mmol)의 용액에 6-플루오로이미다조[1,2-a]피리미딘-2-카복실산, HBr 염(86-c)(575mg, 2.19mmol), HATU(1.04g, 2.74mmol) 및 DIPEA(958㎕, 5.49mmol)를 순차적으로 첨가하고, 상기 반응 혼합물을 0℃에서 1시간 동안 교반하였다. 포화 수성 염화암모늄 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 포화 수성 염화암모늄, 포화 수성 NaHCO3 및 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켰다. 실리카 겔 크로마토그래피로 정제하여, 중간체 29-a를 백색 발포체로서 제공하였다.
단계 2: 1,4-디옥산 중의 4N HCl(3.65ml)을 에틸 아세테이트(1.0ml) 중의 중간체 29-a(1.0g, 1.45mmol)에 첨가하고, 상기 용액을 0℃에서 2시간 동안 교반하였다. 디에틸 에테르를 첨가하고, 형성된 침전물 및 화합물 74ㆍ2HCl을 여과에 의해 백색 고체로서 수집하였다. MS (m/z) M+1= 586.4
실시예 26
하기 실시예는, 화학식 1의 화합물 또는 이의 염의 제조에서 중간체로서 사용될 수 있는 화합물 30-d의 제조를 예시한다.
반응식 30: 중간체 30-d의 합성
단계 1: -10℃로 냉각된 DMF 중의 중간체 12-cㆍHCl(13.7g, 34.9mmol)의 용액에 Boc-Thr(Et)-OH(8.1g, 34.9mmol), HATU(14.6g, 38.4mmol), HOAt(63.9ml, 38.4mmol) 및 DIPEA(24.4ml, 139.0mmol)를 순차적으로 첨가한 다음, 상기 반응물을 0℃에서 1시간 동안 교반하였다. 포화 수성 염화암모늄 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 포화 수성 염화암모늄, 포화 수성 NaHCO3 및 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켰다. 실리카 겔 크로마토그래피로 정제하여, 예상되는 중간체 30-a를 백색 발포체로서 제공하였다.
단계 2: 1,4-디옥산 중의 4N HCl(94.0ml)을 0℃에서 에틸 아세테이트(10ml) 중의 중간체 30-a(10.8g, 18.9mmol)에 첨가하고, 상기 용액을 0℃에서 3시간 동안 교반하였다. 휘발 물질을 감압하에 제거하고, 잔류물을 디에틸 에테르로 연화시켜, 중간체 30-bㆍHCl을 백색 발포체로서 제공하였다. MS (m/z) M+1= 486.5
단계 3: 0℃로 냉각된 DMF 중의 중간체 30-bㆍHCl(25.0g, 49.2mmol)의 용액에 Boc-NMe-Ala-OH(12.0g, 59.0mmol), HATU(26.2g, 68.9mmol), HOAt(12.3ml, 7.38mmol) 및 DIPEA(34.3ml, 197mmol)를 순차적으로 첨가한 다음, 상기 반응물을 0℃에서 1시간 동안 교반하였다. 포화 수성 염화암모늄 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 포화 수성 염화암모늄, 포화 수성 NaHCO3 및 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켰다. 실리카 겔 크로마토그래피로 정제하여, 예상되는 중간체 30-c를 백색 발포체로서 제공하였다.
단계 4: N2하에 MeOH(118ml) 중의 중간체 30-c(15.88g, 23.67mmol)의 용액에 10% Pd/C(50% w/w 함수량)(3.53g)를 첨가하였다. 상기 반응 혼합물을 H2로 퍼징시키고, 1시간 동안 교반하였다. 이어서, 상기 반응물을 셀라이트를 통해 여과하고, 여액을 진공하에 농축시켜, 중간체 30-d를 무색 오일로서 제공하였다. MS (m/z) M+1= 537.5
실시예 27
하기 실시예는, 화학식 1의 화합물 또는 이의 염인 화합물 76의 제조를 예시한다.
반응식 31: 화합물 76의 합성
단계 1: 0℃로 냉각된, DMF 중의 중간체 30-d(2.0g, 3.73mmol)의 용액에 1-메틸-1H-이미다졸-4-카복실산(564mg, 4.47mmol), HATU(1.70g, 4.47mmol) 및 DIPEA(2.60ml, 14.91mmol)를 순차적으로 첨가하고, 상기 반응 혼합물을 0℃에서 2시간 동안 교반하였다. 포화 수성 염화암모늄 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 포화 수성 염화암모늄, 포화 수성 NaHCO3 및 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켰다. 실리카 겔 크로마토그래피로 정제하여, 중간체 31-a를 백색 발포체로서 제공하였다.
단계 2: 1,4-디옥산 중의 4N HCl(11.05ml)을 중간체 31-a(1.90g, 2.95mmol)에 첨가하고, 상기 용액을 0℃에서 3시간 동안 교반하였다. 휘발 물질을 감압하에 제거하고, 잔류물을 디에틸 에테르로 연화시켜, 화합물 76ㆍ2HCl을 백색 고체로서 제공하였다. MS (m/z) M+1= 545.5
실시예 28
하기 실시예는, 화학식 1의 화합물 또는 이의 염인 화합물 78의 제조를 예시한다.
반응식 32: 화합물 78의 합성
단계 1: 0℃로 냉각된, DMF 중의 중간체 30-d(2.0g, 3.73mmol)의 용액에 이미다조[1,2-a]피리딘-2-카복실산, 리튬 염(85-d)(752mg, 4.47mmol), HATU(1.70g, 4.47mmol) 및 DIPEA(2.60ml, 14.91mmol)를 순차적으로 첨가하고, 상기 반응 혼합물을 0℃에서 2시간 동안 교반하였다. 포화 수성 염화암모늄 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 포화 수성 염화암모늄, 포화 수성 NaHCO3 및 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켰다. 실리카 겔 크로마토그래피로 정제하여, 중간체 32-a를 백색 발포체로서 제공하였다.
단계 2: 1,4-디옥산 중의 4N HCl(8.81ml)을 에틸 아세테이트(0.783ml) 중의 중간체 32-a(1.60g, 2.35mmol)에 첨가하고, 상기 용액을 0℃에서 3시간 동안 교반하였다. 휘발 물질을 감압하에 제거하고, 잔류물을 디에틸 에테르로 연화시켜, 화합물 78ㆍ2HCl을 백색 고체로서 제공하였다. MS (m/z) M+1= 581.4
실시예 29
하기 실시예는, 화학식 1의 화합물 또는 이의 염인 화합물 79의 제조를 예시한다.
반응식 33: 화합물 79의 합성
단계 1: 0℃로 냉각된, DMF 중의 중간체 30-d(1.6g, 2.98mmol)의 용액에 1-(4-플루오로페닐)-1H-이미다졸-4-카복실산, 리튬 염(88-e)(632mg, 2.98mmol), HATU(1.36g, 3.58mmol) 및 DIPEA(2.10ℓ, 11.93mmol)를 첨가하고, 상기 반응 혼합물을 0℃에서 2시간 동안 교반하였다. 포화 수성 염화암모늄 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 포화 수성 염화암모늄, 포화 수성 NaHCO3 및 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켰다. 실리카 겔 크로마토그래피로 정제하여, 중간체 33-a를 백색 발포체로서 제공하였다.
단계 2: 1,4-디옥산 중의 4N HCl(6.62ml)을 중간체 33-a(1.28g, 1.76mmol)에 첨가하고, 상기 용액을 0℃에서 3시간 동안 교반하였다. 휘발 물질을 감압하에 제거하고, 잔류물을 디에틸 에테르로 연화시켜, 화합물 79ㆍ2HCl을 백색 고체로서 제공하였다. MS (m/z) M+1= 625.5
실시예 30
하기 실시예는, 화학식 1의 화합물 또는 이의 염인 화합물 80의 제조를 예시한다.
반응식 34: 화합물 80의 합성
단계 1: 0℃로 냉각된, DMF 중의 중간체 30-d(1.60g, 2.98mmol)의 용액에 6-플루오로이미다조[1,2-a]피리미딘-2-카복실산, HBr 염(86-c)(937mg, 3.58mmol), HATU(1.36g, 3.58mmol) 및 DIPEA(2.07ml, 11.93mmol)를 순차적으로 첨가하고, 상기 반응 혼합물을 0℃에서 2시간 동안 교반하였다. 포화 수성 염화암모늄 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 포화 수성 염화암모늄, 포화 수성 NaHCO3 및 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켰다. 실리카 겔 크로마토그래피로 정제하여, 중간체 34-a를 백색 발포체로서 제공하였다.
단계 2: 1,4-디옥산 중의 4N HCl(7.93ml)을 중간체 34-a(1.48g, 2.11mmol)에 첨가하고, 상기 용액을 0℃에서 3시간 동안 교반하였다. 디에틸 에테르를 첨가하고, 형성된 침전물 및 화합물 80ㆍ2HCl을 여과에 의해 백색 고체로서 수집하였다. MS (m/z) M+1= 600.5
실시예 31
하기 실시예는, 화학식 1의 화합물 또는 이의 염인 화합물 81의 제조를 예시한다.
반응식 35: 화합물 81의 합성
단계 1: 0℃로 냉각된, DMF 중의 중간체 30-d(1.6g, 2.98mmol)의 용액에 6,7-디하이드로-5-H-피롤로[1,2-a]이미다졸-2-카복실산, 리튬 염(87-e)(566mg, 3.58mmol), HATU(1.36g, 3.58mmol) 및 DIPEA(2.0ml, 11.93mmol)를 순차적으로 첨가하고, 상기 반응 혼합물을 0℃에서 2시간 동안 교반하였다. 포화 수성 염화암모늄 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 포화 수성 염화암모늄, 포화 수성 NaHCO3 및 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켰다. 실리카 겔 크로마토그래피로 정제하여, 중간체 35-a를 백색 발포체로서 제공하였다.
단계 2: 1,4-디옥산 중의 4N HCl(6.48ml)을 중간체 35-a(1.45g, 2.16mmol)에 첨가하고, 상기 용액을 0℃에서 3시간 동안 교반하였다. 디에틸 에테르를 첨가하고, 형성된 침전물 및 화합물 81ㆍ2HCl을 여과에 의해 백색 고체로서 수집하였다. MS (m/z) M+1= 571.5
실시예 32
하기 실시예는, 화학식 1의 화합물 또는 이의 염의 제조에서 중간체로서 사용될 수 있는 화합물 36-h의 제조를 예시한다.
반응식 36: 중간체 36-h의 합성
단계 1: 0℃로 냉각된 디클로로메탄 중의 중간체 21-aㆍHCl(15.0g, 53.4mmol)의 용액에 DIPEA(37.3ml, 214.0mmol), DMAP(326mg, 2.67mmol) 및 벤조일 클로라이드(6.82ml, 58.8mmol)를 순차적으로 첨가한 다음, 상기 반응물을 실온에서 밤새 교반하였다. 물 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 10% 수성 시트르산, 포화 수성 NaHCO3 및 염수로 세척하고, MgSO4로 건조시키고, 여과하고, 진공하에 농축시켰다. 실리카 겔 크로마토그래피로 정제하여, 예상되는 중간체 36-a를 백색 고체로서 제공하였다.
단계 2: 1,4-디옥산 중의 4N HCl(141.0ml)을 중간체 36-a(19.6g, 56.3mmol)에 첨가하고, 상기 용액을 0℃에서 1시간 동안 교반하였다. 휘발 물질을 감압하에 제거하고, 잔류물을 디에틸 에테르로 연화시켜, 중간체 36-bㆍHCl을 백색 고체로서 제공하였다. MS (m/z) M+1=249.2
단계 3: 0℃로 냉각된 DMF 중의 중간체 36-bㆍHCl(14.7g, 51.6mmol)의 용액에 Boc-tBu-Gly-OH(13.13g, 56.8mmol), HOAt(8.60ml, 5.16mmol), HATU(21.59g, 56.8mmol) 및 DIPEA(36.1ml, 207.0mmol)를 순차적으로 첨가한 다음, 상기 반응물을 실온에서 3시간 동안 교반하였다. 포화 수성 염화암모늄 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 포화 수성 염화암모늄, 포화 수성 NaHCO3 및 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켰다. 실리카 겔 크로마토그래피로 정제하여, 예상되는 중간체 36-c를 무색 오일로서 제공하였다.
단계 4: 1,4-디옥산 중의 4N HCl(130.0ml)을 중간체 36-c(24.0g, 52.0mmol)에 첨가하고, 상기 용액을 0℃에서 1시간 동안 교반하였다. 휘발 물질을 감압하에 제거하고, 잔류물을 디에틸 에테르로 연화시켜, 중간체 36-dㆍHCl을 백색 고체로서 제공하였다. MS (m/z) M+1= 362.2
단계 5: 0℃로 냉각된 DMF 중의 중간체 36-dㆍHCl(10.73g, 52.8mmol)의 용액에 Boc-NMe-Ala-OH(10.73g, 52.8mmol), HOAt(8.80ml, 5.28mmol), HATU(22.07g, 58.1mmol) 및 DIPEA(36.9ml, 211.0mmol)를 순차적으로 첨가한 다음, 상기 반응물을 실온에서 3시간 동안 교반하였다. 포화 수성 염화암모늄 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 포화 수성 염화암모늄, 포화 수성 NaHCO3 및 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켰다. 실리카 겔 크로마토그래피로 정제하여, 예상되는 중간체 36-e를 백색 발포체로서 제공하였다.
단계 6: 0℃로 냉각된 THF 중의 중간체 36-e(29.0g, 53.0mmol)의 용액에 수소화붕소리튬(2.42g, 111.0mmol)을 첨가하고, 상기 반응물을 실온에서 1시간 동안 교반하였다. 물 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 10% 수성 시트르산, 포화 수성 NaHCO3 및 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켰다. 실리카 겔 크로마토그래피로 정제하여, 중간체 36-f를 백색 발포체로서 제공하였다.
단계 7: 0℃로 냉각된 DMSO(14.13ml, 199.0mmol) 및 디클로로메탄(200ml) 중의 중간체 36-f(25.8g, 49.7mmol)의 용액에 DIPEA(30.3ml, 174.0mmol) 및 피리딘 삼산화황 복합물(23.75g, 149.0mmol)을 첨가한 다음, 상기 반응물을 0℃에서 1시간 동안 교반하였다. 물 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 10% 수성 시트르산, 포화 수성 NaHCO3 및 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켜, 중간체 36-g를 백색 발포체로서 제공하였다.
단계 8: 디클로로메탄 중의 중간체 36-g(25.7g, 49.7mmol)의 용액에 2-(4-플루오로페닐)에탄아민(6.21ml, 47.4mmol)을 첨가하였다. 실온에서 밤새 교반한 후, 0℃에서 트리아세톡시수소화붕소나트륨(21.14g, 95.0mmol)을 분획으로 첨가한 다음, 상기 반응 혼합물을 실온에서 2시간 동안 교반하였다. 포화 수성 NaHCO3을 첨가하고, 유기 층을 분리하고, 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켜, 화학식 36-h의 중간체를 백색 발포체로서 제공하였다. 디에틸 에테르(500ml) 중의 화학식 36-h의 중간체(27.4g, 42.8mmol)의 용액에 디에틸 에테르 중의 1N HCl(52.1ml, 52.1mmol)을 첨가하고, 형성된 침전물 및 중간체 36-hㆍHCl을 여과에 의해 백색 고체로서 수집하였다. MS (m/z) M+1= 640.6
실시예 33
하기 실시예는, 화학식 1의 화합물 또는 이의 염인 화합물 49의 제조를 예시한다.
반응식 37: 화합물 49의 합성
단계 1: 0℃로 냉각된, DMF 중의 중간체 36-hㆍHCl(2.0g, 2.96mmol)의 용액에 이미다조[1,2-a]피리미딘-2-카복실산(507mg, 3.11mmol), HATU(1.23g, 3.25mmol) 및 DIPEA(2.06ml, 11.83mmol)를 순차적으로 첨가하고, 상기 반응 혼합물을 실온에서 2시간 동안 교반하였다. 포화 수성 염화암모늄 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 포화 수성 염화암모늄, 포화 수성 NaHCO3 및 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켰다. 실리카 겔 크로마토그래피로 정제하여, 중간체 37-a를 백색 발포체로서 제공하였다.
단계 2: 1,4-디옥산 중의 4N HCl(3.19ml)을 중간체 37-a(1.0g, 1.27mmol)에 첨가하고, 상기 용액을 0℃에서 1시간 동안 교반하였다. 휘발 물질을 감압하에 제거하고, 잔류물을 디에틸 에테르로 연화시켜, 화합물 49ㆍ2HCl을 백색 고체로서 제공하였다. MS (m/z) M+1=685.5
실시예 34
하기 실시예는, 화학식 1의 화합물 또는 이의 염인 화합물 69의 제조를 예시한다.
반응식 38: 화합물 69의 합성
단계 1: 0℃로 냉각된, DMF 중의 중간체 36-hㆍHCl(2.0g, 2.96mmol)의 용액에 이미다조[1,2-a]피리딘-2-카복실산, 리튬 염(85-d)(525mg, 3.11mmol), HATU(1.23g, 3.25mmol) 및 DIPEA(2.06ml, 11.83mmol)를 순차적으로 첨가하고, 상기 반응 혼합물을 실온에서 3시간 동안 교반하였다. 포화 수성 염화암모늄 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 포화 수성 염화암모늄, 포화 수성 NaHCO3 및 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켰다. 실리카 겔 크로마토그래피로 정제하여, 중간체 38-a를 백색 발포체로서 제공하였다.
단계 2: 1,4-디옥산 중의 4N HCl(3.19ml)을 중간체 38-a(1.24g, 1.58mmol)에 첨가하고, 상기 용액을 0℃에서 1시간 동안 교반하였다. 휘발 물질을 감압하에 제거하고, 잔류물을 디에틸 에테르로 연화시켜, 화합물 69ㆍ2HCl을 백색 고체로서 제공하였다. MS (m/z) M+1=684.4
실시예 35
하기 실시예는, 화학식 1의 화합물 또는 이의 염인 화합물 86의 제조를 예시한다.
반응식 39: 화합물 86의 합성
단계 1: 0℃로 냉각된, DMF 중의 중간체 36-hㆍHCl(2.0g, 2.96mmol)의 용액에 1-메틸-1H-이미다졸-4-카복실산(448mg, 3.55mmol), HATU(1.23g, 3.25mmol) 및 DIPEA(2.06ml, 11.83mmol)를 순차적으로 첨가하고, 상기 반응 혼합물을 실온에서 3시간 동안 교반하였다. 포화 수성 염화암모늄 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 포화 수성 염화암모늄, 포화 수성 NaHCO3 및 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켰다. 실리카 겔 크로마토그래피로 정제하여, 중간체 39-a를 백색 발포체로서 제공하였다.
단계 2: 1,4-디옥산 중의 4N HCl(4.68ml)을 중간체 39-a(1.40g, 1.87mmol)에 첨가하고, 상기 용액을 0℃에서 1시간 동안 교반하였다. 휘발 물질을 감압하에 제거하고, 잔류물을 디에틸 에테르로 연화시켜, 화합물 86ㆍ2HCl을 백색 고체로서 제공하였다. MS (m/z) M+1=648.5
실시예 36
하기 실시예는, 화학식 1의 화합물 또는 이의 염인 화합물 87의 제조를 예시한다.
반응식 40: 화합물 87의 합성
단계 1: 0℃로 냉각된, DMF 중의 중간체 36-hㆍHCl(2.0g, 2.96mmol)의 용액에 1-(4-플루오로페닐)-1H-이미다졸-4-카복실산, 리튬 염(88-e)(662mg, 3.11mmol), HATU(1.23g, 3.25mmol) 및 DIPEA(2.06ml, 11.83mmol)를 순차적으로 첨가하고, 상기 반응 혼합물을 실온에서 3시간 동안 교반하였다. 포화 수성 염화암모늄 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 포화 수성 염화암모늄, 포화 수성 NaHCO3 및 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켰다. 실리카 겔 크로마토그래피로 정제하여, 중간체 40-a를 백색 발포체로서 제공하였다.
단계 2: 1,4-디옥산 중의 4N HCl(5.92ml)을 중간체 40-a(1.40g, 1.87mmol)에 첨가하고, 상기 용액을 0℃에서 1시간 동안 교반하였다. 휘발 물질을 감압하에 제거하고, 잔류물을 디에틸 에테르로 연화시켜, 화합물 87ㆍ2HCl을 백색 고체로서 제공하였다. MS (m/z) M+1=728.5
실시예 37
하기 실시예는, 화학식 1의 화합물 또는 이의 염인 화합물 89의 제조를 예시한다.
반응식 41: 화합물 89의 합성
단계 1: 0℃로 냉각된, DMF 중의 중간체 36-hㆍHCl(2.0g, 2.96mmol)의 용액에 6,7-디하이드로-5-H-피롤로[1,2-a]이미다졸-2-카복실산, 리튬 염(87-e)(589mg, 3.55mmol), HATU(1.23g, 3.25mmol) 및 DIPEA(2.06ml, 11.83mmol)를 순차적으로 첨가하고, 상기 반응 혼합물을 실온에서 3시간 동안 교반하였다. 포화 수성 염화암모늄 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 포화 수성 염화암모늄, 포화 수성 NaHCO3 및 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켰다. 실리카 겔 크로마토그래피로 정제하여, 중간체 41-a를 백색 발포체로서 제공하였다.
단계 2: 1,4-디옥산 중의 4N HCl(3.29ml)을 중간체 41-a(1.02g, 1.32mmol)에 첨가하고, 상기 용액을 0℃에서 1시간 동안 교반하였다. 휘발 물질을 감압하에 제거하고, 잔류물을 디에틸 에테르로 연화시켜, 화합물 89ㆍ2HCl을 백색 고체로서 제공하였다. MS (m/z) M+1=674.5
실시예 38
하기 실시예는, 화학식 1의 화합물 또는 이의 염의 제조에서 중간체로서 사용될 수 있는 화합물 42-h의 제조를 예시한다.
반응식 42: 중간체 42-h의 합성
단계 1: 0℃로 냉각된 DMF 중의 (2S,4R)-메틸 4-하이드록시피롤리딘-2-카복실레이트, HCl 염(42-a)(4.0g, 22.02mmol)의 용액에 Boc-tBu-Gly-OH(6.11g, 26.4mmol), HOAt(5.51ml, 3.30mmol), HATU(10.89g, 28.6mmol) 및 DIPEA(15.39ml, 88.0mmol)를 순차적으로 첨가한 다음, 상기 반응물을 실온에서 3시간 동안 교반하였다. 포화 수성 염화암모늄 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 포화 수성 염화암모늄, 포화 수성 NaHCO3 및 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켰다. 실리카 겔 크로마토그래피로 정제하여, 예상되는 중간체 42-b를 베이지색 고체로서 제공하였다.
단계 2: 1,4-디옥산 중의 4N HCl(80ml)을 중간체 42-b(7.89g, 22.0mmol)에 첨가하고, 상기 용액을 0℃에서 3시간 동안 교반하였다. 휘발 물질을 감압하에 제거하고, 잔류물을 디에틸 에테르로 연화시켜, 중간체 42-cㆍHCl을 백색 발포체로서 제공하였다. MS (m/z) M+1= 259.1
단계 3: 0℃로 냉각된 DMF 중의 Boc-NMe-Ala-OH(7.16g, 35.2mmol)의 용액에 HOBt(5.73g, 37.4mmol), HBTU(14.19g, 37.4mmol) 및 DIPEA(19.23ml, 40.0mmol)를 순차적으로 첨가하였다. 10분 동안 교반한 후, 중간체 42-c(6.49g, 25.1mmol)를 첨가한 다음, 상기 반응물을 실온에서 밤새 교반하였다. 물 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 10% 수성 시트르산, 포화 수성 NaHCO3 및 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켰다. 실리카 겔 크로마토그래피로 정제하여, 예상되는 중간체 42-d를 백색 고체로서 제공하였다.
단계 4: THF 중의 중간체 42-d(2.32g, 5.23mmol), 4-플루오로페놀(704mg, 6.28mmol) 및 트리페닐포스핀(1.92g, 7.32mmol)의 용액에 DIAD(1.42ml, 7.32mmol)를 적가한 다음, 상기 반응물을 실온에서 2일 동안 교반하였다. 디에틸 에테르 및 헥산을 첨가하고, 형성된 침전물 및 트리페닐포스핀 옥사이드를 여과에 의해 제거하였다. 휘발 물질을 감압하에 제거하고, 잔류물을 실리카 겔 크로마토그래피로 정제하여, 예상되는 중간체 42-e를 무색 오일로서 제공하였다.
단계 5: 0℃로 냉각된 THF 중의 중간체 42-e(4.6g, 8.56mmol)의 용액에 수소화붕소리튬(559mg, 25.7mmol)을 첨가하고, 상기 반응물을 실온에서 3시간 동안 교반하였다. 물 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 10% 시트르산, 포화 수성 NaHCO3 및 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켰다. 실리카 겔 크로마토그래피로 정제하여, 중간체 42-f를 무색 오일로서 제공하였다.
단계 6: 0℃로 냉각된 DMSO(2.33ml, 33.0mmol) 및 디클로로메탄(80ml) 중의 중간체 42-f(4.2g, 8.24mmol)의 용액에 DIPEA(5.04ml, 28.8mmol) 및 피리딘 삼산화황 복합물(3.94g, 24.72mmol)을 첨가한 다음, 상기 반응물을 0℃에서 1시간 동안 교반하였다. 물 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 10% 시트르산, 포화 수성 NaHCO3 및 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켜, 중간체 42-g를 베이지색 고체로서 제공하였다.
단계 7: 디클로로메탄 중의 중간체 42-g(3.8g, 7.49mmol)의 화합물에 2-(4-플루오로페닐)에탄아민(935㎕, 7.13mmol)을 첨가하였다. 실온에서 밤새 교반한 후, 0℃에서 트리아세톡시수소화붕소나트륨(3.18g, 14.26mmol)을 분획으로 첨가한 다음, 상기 반응 혼합물을 실온에서 2시간 동안 교반하였다. 포화 수성 NaHCO3을 첨가하고, 유기 층을 분리하고, 염수로 세척하고, MgSO4로 건조시키고, 여과하고, 진공하에 농축시켜, 중간체 42-g를 황색 오일로서 제공하였다. 디에틸 에테르(100ml) 중의 화학식 42-g의 중간체의 용액에 디에틸 에테르 중의 1N HCl(7.84ml, 7.84mmol)을 첨가하고, 형성된 침전물 및 중간체 42-hㆍHCl을 여과에 의해 베이지색 고체로서 수집하였다. MS (m/z) M+1= 631.5
실시예 39
하기 실시예는, 화학식 1의 화합물 또는 이의 염인 화합물 82의 제조를 예시한다.
반응식 43: 화합물 82의 합성
단계 1: 0℃로 냉각된, DMF 중의 중간체 42-hㆍHCl(1.50g, 2.24mmol)의 용액에 1-메틸-1H-이미다졸-4-카복실산(397mg, 3.15mmol), HATU(1.19g, 3.15mmol) 및 DIPEA(1.57ml, 8.99mmol)를 순차적으로 첨가하고, 상기 반응 혼합물을 실온에서 2시간 동안 교반하였다. 포화 수성 염화암모늄 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 포화 수성 염화암모늄, 포화 수성 NaHCO3 및 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켰다. 실리카 겔 크로마토그래피로 정제하여, 중간체 43-a를 백색 발포체로서 제공하였다.
단계 2: 1,4-디옥산 중의 4N HCl(4.50ml)을 중간체 43-a(1.10g, 1.48mmol)에 첨가하고, 상기 용액을 0℃에서 2시간 동안 교반하였다. 휘발 물질을 감압하에 제거하고, 잔류물을 디에틸 에테르로 연화시켜, 화합물 82ㆍ2HCl을 백색 고체로서 제공하였다. MS (m/z) M+1=639.5
실시예 40
하기 실시예는, 화학식 1의 화합물 또는 이의 염인 화합물 83의 제조를 예시한다.
반응식 44: 화합물 83의 합성
단계 1: 0℃로 냉각된, DMF 중의 중간체 42-hㆍHCl(1.40g, 2.01mmol)의 용액에 6,7-디하이드로-5-H-피롤로[1,2-a]이미다졸-2-카복실산, 리튬 염(87-e)(447mg, 2.94mmol), HATU(1.12g, 2.94mmol) 및 DIPEA(1.46ml, 8.39mmol)를 순차적으로 첨가하고, 상기 반응 혼합물을 실온에서 2시간 동안 교반하였다. 포화 수성 염화암모늄 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 포화 수성 염화암모늄, 포화 수성 NaHCO3 및 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켰다. 실리카 겔 크로마토그래피로 정제하여, 중간체 44-a를 백색 발포체로서 제공하였다.
단계 2: 1,4-디옥산 중의 4N HCl(6.69ml)을 중간체 44-a(1.02g, 1.33mmol)에 첨가하고, 상기 용액을 0℃에서 2시간 동안 교반하였다. 휘발 물질을 감압하에 제거하고, 잔류물을 디에틸 에테르로 연화시켜, 화합물 83ㆍ2HCl을 백색 고체로서 제공하였다. MS (m/z) M+1=665.5
실시예 41
하기 실시예는, 화학식 1의 화합물 또는 이의 염인 화합물 84의 제조를 예시한다.
반응식 45: 화합물 84의 합성
단계 1: 0℃로 냉각된, DMF 중의 중간체 42-hㆍHCl(2.0g, 2.96mmol)의 용액에 이미다조[1,2-a]피리딘-2-카복실산, 리튬 염(85-d)(494mg, 2.94mmol), HATU(1.11g, 2.94mmol) 및 DIPEA(1.46ml, 8.39mmol)를 순차적으로 첨가하고, 상기 반응 혼합물을 실온에서 3시간 동안 교반하였다. 포화 수성 염화암모늄 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 포화 수성 염화암모늄, 포화 수성 NaHCO3 및 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켰다. 실리카 겔 크로마토그래피로 정제하여, 중간체 45-a를 백색 발포체로서 제공하였다.
단계 2: 1,4-디옥산 중의 4N HCl(5.97ml)을 중간체 45-a(926mg, 1.19mmol)에 첨가하고, 상기 용액을 0℃에서 2시간 동안 교반하였다. 휘발 물질을 감압하에 제거하고, 잔류물을 디에틸 에테르로 연화시켜, 화합물 84ㆍ2HCl을 백색 고체로서 제공하였다. MS (m/z) M+1=675.5
실시예 42
하기 실시예는, 화학식 1의 화합물 또는 이의 염인 화합물 10의 제조를 예시한다.
반응식 46: 화합물 10의 합성
단계 1: 0℃로 냉각된 DMF 중의 중간체 12-aㆍHCl (25.0g, 69.7mmol)의 용액에 이미다조[1,2-a]피리미딘-2-카복실산(13.64g, 84.0mmol), HATU(34.4g, 91.0mmol) 및 DIPEA(48.5ml, 279.0mmol)를 45분에 걸쳐 순차적으로 적가한 다음, 상기 반응물을 0℃에서 30분 동안 교반하였다. 포화 수성 염화암모늄 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 포화 수성 염화암모늄, 포화 수성 NaHCO3 및 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켰다. 실리카 겔 크로마토그래피로 정제하여, 중간체 46-a를 베이지색 발포체로서 제공하였다.
단계 2: 1,4-디옥산 중의 4N HCl(171ml)을 중간체 46-a(32.0g, 68.4mmol)에 첨가하고, 상기 용액을 0℃에서 1시간 동안 교반하였다. 디에틸 에테르를 첨가하고, 중간체 46-bㆍ2HCl을 여과에 의해 백색 고체로서 수집하였다. MS (m/z) M+1= 368.3
단계 3: 0℃로 냉각된 DMF 중의 중간체 46-bㆍ2HCl(25.0g, 56.8mmol)의 용액에 Boc-tBu-gly-OH(14.44g, 62.5mmol), HATU(28.1g, 73.8mmol), HOAt(14.19ml, 8.52mmol) 및 DIPEA(39.6ml, 227.0mmol)를 30분에 걸쳐 순차적으로 적가한 다음, 상기 반응물을 0℃에서 45분 동안 교반하였다. 포화 수성 염화암모늄 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 포화 수성 염화암모늄, 포화 수성 NaHCO3 및 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켰다. 실리카 겔 크로마토그래피로 정제하여, 예상되는 중간체 46-c를 백색 발포체로서 제공하였다.
단계 4: 1,4-디옥산 중의 4N HCl(62.4ml)을 중간체 46-c(14.5g, 24.97mmol)에 첨가하고, 상기 용액을 0℃에서 2시간 동안 교반하였다. 디에틸 에테르를 첨가하고, 중간체 46-dㆍ2HCl을 여과에 의해 백색 고체로서 수집하였다. MS (m/z) M+1= 481.5
단계 5: 0℃로 냉각된 DMF 중의 중간체 46-dㆍ2HCl(13.8g, 26.7mmol)의 용액에 Boc-NMe-Ala-OH(5.97g, 29.4mmol), HATU(13.19g, 34.7mmol), HOAt(6.67ml, 4.0mmol) 및 DIPEA(18.6ml, 107.0mmol)를 30분에 걸쳐 순차적으로 적가한 다음, 상기 반응물을 0℃에서 30분 동안 교반하였다. 포화 수성 염화암모늄 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 포화 수성 염화암모늄, 포화 수성 NaHCO3 및 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켰다. 실리카 겔 크로마토그래피로 정제하여, 예상되는 중간체 46-e를 백색 발포체로서 제공하였다.
단계 6: 1,4-디옥산 중의 4N HCl(58.2ml)을 에틸 아세테이트(5ml) 중의 중간체 46-e(15.5g, 23.28mmol)에 첨가하고, 상기 용액을 0℃에서 1.5시간 동안 교반하였다. 디에틸 에테르를 첨가하고, 화합물 10ㆍ2HCl을 여과에 의해 백색 고체로서 수집하였다. MS (m/z) M+1= 566.5
실시예 43
하기 실시예는, 화학식 1의 화합물 또는 이의 염의 제조에서 중간체로서 사용될 수 있는 화합물 47-d의 제조를 예시한다.
반응식 47: 중간체 47-d의 합성
단계 1: 0℃로 냉각된 DMF 중의 중간체 12-cㆍHCl(29.57g, 75.0mmol)의 용액에 Boc-Chg-OH(22.27g, 87.0mmol), HATU(42.9g, 113.0mmol), HOAt(18.82ml, 11.29mmol) 및 DIPEA(41.4ml, 226.0mmol)를 30분에 걸쳐 순차적으로 첨가한 다음, 상기 반응물을 실온에서 1시간 동안 교반하였다. 포화 수성 염화암모늄 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 포화 수성 염화암모늄, 포화 수성 NaHCO3 및 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켰다. 실리카 겔 크로마토그래피로 정제하여, 예상되는 중간체 47-a를 백색 발포체로서 제공하였다.
단계 2: 1,4-디옥산 중의 4N HCl(188ml)을 0℃에서 에틸 아세테이트(10ml) 중의 중간체 47-a(44.7g, 75.0mmol)에 첨가하고, 상기 용액을 0℃에서 4시간 동안 교반하였다. 휘발 물질을 감압하에 제거하고, 잔류물을 디에틸 에테르로 연화시켜, 중간체 47-bㆍHCl을 백색 발포체로서 제공하였다. MS (m/z) M+1= 596.4
단계 3: 0℃로 냉각된 DMF 중의 중간체 47-bㆍHCl(25.8g, 48.50mmol)의 용액에 Boc-NMe-Ala-OH(11.33g, 55.8mmol), HATU(25.8g, 67.9mmol), HOAt(8.08ml, 4.85mmol) 및 DIPEA(33.8ml, 194.0mmol)를 30분에 걸쳐 순차적으로 적가한 다음, 상기 반응물을 0℃에서 1시간 동안 교반하였다. 포화 수성 염화암모늄 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 포화 수성 염화암모늄, 포화 수성 NaHCO3 및 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켰다. 실리카 겔 크로마토그래피로 정제하여, 예상되는 중간체 47-c를 백색 발포체로서 제공하였다.
단계 4: N2하에 MeOH(100ml) 중의 중간체 47-c(23.7g, 34.8mmol)의 용액에 10% Pd/C(50% w/w 함수량)(7.4g)를 첨가하였다. 상기 반응 혼합물을 H2로 퍼징시키고, 2시간 동안 교반하였다. 이어서, 상기 반응물을 셀라이트를 통해 여과하고, 여액을 진공하에 농축시켜, 중간체 47-d를 백색 발포체로서 제공하였다. MS (m/z) M+1= 547.4
실시예 44
하기 실시예는, 화학식 1의 화합물 또는 이의 염인 화합물 20의 제조를 예시한다.
반응식 48: 화합물 20의 합성
단계 1: 0℃로 냉각된 DMF 중의 중간체 47-d(17.9g, 32.7mmol)의 용액에 이미다조[1,2-a]피리미딘-2-카복실산, HBr 염(84-c)(9.59g, 39.3mmol), HATU(18.67g, 49.1mmol) 및 DIPEA(17.11ml, 98.0mmol)를 30분에 걸쳐 순차적으로 첨가하고, 상기 반응 혼합물을 0℃에서 1시간 동안 교반하였다. 포화 수성 염화암모늄 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 포화 수성 NaHCO3 및 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켰다. 실리카 겔 크로마토그래피로 정제하여, 중간체 48-a를 백색 발포체로서 제공하였다.
단계 2: 1,4-디옥산 중의 4N HCl(44.5ml)을 0℃에서 에틸 아세테이트(10ml) 중의 중간체 48-a(12.32g, 17.81mmol)에 첨가하고, 상기 용액을 0℃에서 4시간 동안 교반하였다. 휘발 물질을 감압하에 제거하고, 잔류물을 디에틸 에테르로 연화시켜, 화합물 20ㆍ2HCl을 백색 고체로서 제공하였다. MS (m/z) M+1= 592.4
실시예 45
하기 실시예는, 화학식 1의 화합물 또는 이의 염인 화합물 103의 제조를 예시한다.
반응식 49: 화합물 103의 합성
단계 1: 0℃로 냉각된, DMF 중의 중간체 47-d(500mg, 0.91mmol)의 용액에 6-플루오로이미다조[1,2-a]피리미딘-2-카복실산, HBr 염(86-c)(276mg, 1.05mmol), HATU(522mg, 1.37mmol) 및 DIPEA(478㎕, 2.74mmol)를 순차적으로 첨가하고, 상기 반응 혼합물을 0℃에서 1시간 동안 교반하였다. 포화 수성 염화암모늄 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 포화 수성 염화암모늄, 포화 수성 NaHCO3 및 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켰다. 실리카 겔 크로마토그래피로 정제하여, 중간체 49-a를 백색 발포체로서 제공하였다.
단계 2: 1,4-디옥산 중의 4N HCl(882㎕)을 에틸 아세테이트(500㎕) 중의 중간체 49-a(250mg, 0.35mmol)에 첨가하고, 상기 용액을 0℃에서 2시간 동안 교반하였다. 휘발 물질을 감압하에 제거하고, 잔류물을 디에틸 에테르로 연화시켜, 화합물 103ㆍ2HCl을 백색 고체로서 제공하였다. MS (m/z) M+1= 610.3
실시예 46
하기 실시예는, 화학식 1의 화합물 또는 이의 염인 화합물 18의 제조를 예시한다.
반응식 50: 화합물 18의 합성
단계 1: 0℃로 냉각된, DMF 중의 중간체 47-d(303mg, 0.55mmol)의 용액에 DIPEA(483㎕, 2.77mmol) 및 이미다조[1,2-a]피리미딘-2-카보닐 클로라이드(250mg, 1.38mmol)를 순차적으로 첨가하고, 상기 반응 혼합물을 실온에서 30분 동안 교반하였다. 포화 수성 염화암모늄 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 포화 수성 염화암모늄, 포화 수성 NaHCO3 및 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켰다. 실리카 겔 크로마토그래피로 정제하여, 중간체 50-a를 백색 발포체로서 제공하였다.
단계 2: 1,4-디옥산 중의 4N HCl(1.85ml)을 메탄올(200㎕) 중의 중간체 50-a(366mg, 0.53mmol)에 첨가하고, 상기 용액을 0℃에서 2시간 동안 교반하였다. 휘발 물질을 감압하에 제거하고, 잔류물을 디에틸 에테르로 연화시켜, 화합물 18ㆍ2HCl을 백색 고체로서 제공하였다. MS (m/z) M+1= 591.4
실시예 47
하기 실시예는, 화학식 1의 화합물인 화합물 120의 제조를 예시한다.
반응식 51: 화합물 120의 합성
단계 1: 0℃로 냉각된, DMF 중의 중간체 47-d(500mg, 0.91mmol)의 용액에 1-메틸-1H-이미다졸-4-카복실산(138mg, 1.09mmol), HATU(522mg, 1.37mmol) 및 DIPEA(478㎕, 2.74mmol)를 순차적으로 첨가하고, 상기 반응 혼합물을 0℃에서 1시간 동안 교반하였다. 포화 수성 염화암모늄 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 포화 수성 염화암모늄, 포화 수성 NaHCO3 및 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켰다. 실리카 겔 크로마토그래피로 정제하여, 중간체 51-a를 백색 발포체로서 제공하였다.
단계 2: 1,4-디옥산 중의 4N HCl(918㎕)을 에틸 아세테이트(500㎕) 중의 중간체 51-a(240mg, 0.37mmol)에 첨가하고, 상기 용액을 0℃에서 2시간 동안 교반하였다. 휘발 물질을 감압하에 제거하고, 잔류물을 디에틸 에테르로 연화시켜, 화합물 120ㆍ2HCl을 백색 고체로서 제공하였다. MS (m/z) M+1= 555.3
실시예 48
하기 실시예는, 화학식 1의 화합물인 화합물 113의 제조를 예시한다.
반응식 52: 화합물 113의 합성
단계 1: 0℃로 냉각된, DMF 중의 중간체 47-d(500mg, 0.91mmol)의 용액에 6,7-디하이드로-5-H-피롤로[1,2-a]이미다졸-2-카복실산, 리튬 염(87-e)(152mg, 915mmol), HATU(522g, 1.37mmol) 및 DIPEA(478㎕, 2.74mmol)를 순차적으로 첨가하고, 상기 반응 혼합물을 0℃에서 1시간 동안 교반하였다. 포화 수성 염화암모늄 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 포화 수성 염화암모늄, 포화 수성 NaHCO3 및 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켰다. 실리카 겔 크로마토그래피로 정제하여, 중간체 52-a를 백색 발포체로서 제공하였다.
단계 2: 1,4-디옥산 중의 4N HCl(1.37ml)을 에틸 아세테이트(500㎕) 중의 중간체 52-a(373mg, 0.54mmol)에 첨가하고, 상기 용액을 0℃에서 2시간 동안 교반하였다. 디에틸 에테르를 첨가하고, 형성된 침전물 및 화합물 113ㆍ2HCl을 여과에 의해 백색 고체로서 수집하였다. MS (m/z) M+1= 581.3
실시예 49
하기 실시예는, 화학식 1의 화합물인 화합물 104의 제조를 예시한다.
반응식 53: 화합물 104의 합성
단계 1: 0℃로 냉각된, DMF 중의 중간체 47-d(500mg, 0.91mmol)의 용액에 1-(4-플루오로페닐)-1H-이미다졸-4-카복실산, 리튬 염(88-e)(224mg, 1.05mmol), HATU(522mg, 1.37mmol) 및 DIPEA(478㎕, 2.74mmol)를 순차적으로 첨가하고, 상기 반응 혼합물을 0℃에서 1시간 동안 교반하였다. 포화 수성 염화암모늄 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 포화 수성 염화암모늄, 포화 수성 NaHCO3 및 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켰다. 실리카 겔 크로마토그래피로 정제하여, 중간체 53-a를 백색 발포체로서 제공하였다.
단계 2: 1,4-디옥산 중의 4N HCl(886㎕)을 에틸 아세테이트(0.5ml) 중의 중간체 53-a(260mg, 0.35mmol)에 첨가하고, 상기 용액을 0℃에서 2시간 동안 교반하였다. 휘발 물질을 감압하에 제거하고, 잔류물을 디에틸 에테르로 연화시켜, 화합물 104ㆍ2HCl을 백색 고체로서 제공하였다. MS (m/z) M+1= 635.3
실시예 50
하기 실시예는, 화학식 1의 화합물인 화합물 91의 제조를 예시한다.
반응식 54: 화합물 91의 합성
단계 1: 0℃로 냉각된, DMF 중의 중간체 12-g(1.50g, 2.88mmol)의 용액에 1-사이클로펜틸-1H-이미다졸-4-카복실산, 리튬 염(831mg, 4.47mmol), HATU(1.31g, 3.46mmol) 및 DIPEA(2.0ml, 11.52mmol)를 순차적으로 첨가하고, 상기 반응 혼합물을 0℃에서 2시간 동안 교반하였다. 포화 수성 염화암모늄 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 포화 수성 염화암모늄, 포화 수성 NaHCO3 및 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켰다. 실리카 겔 크로마토그래피로 정제하여, 중간체 54-a를 백색 발포체로서 제공하였다.
단계 2: 1,4-디옥산 중의 4N HCl(8.79ml)을 에틸 아세테이트(500㎕) 중의 중간체 54-a(1.20g, 1.75mmol)에 첨가하고, 상기 용액을 0℃에서 1.5시간 동안 교반하였다. 휘발 물질을 감압하에 제거하고, 잔류물을 디에틸 에테르로 연화시켜, 화합물 91ㆍ2HCl을 백색 고체로서 제공하였다. MS (m/z) M+1= 583.5
실시예 51
하기 실시예는, 화학식 1의 화합물인 화합물 93의 제조를 예시한다.
반응식 55: 화합물 93의 합성
단계 1: 0℃로 냉각된, DMF 중의 중간체 12-g(1.40g, 2.69mmol)의 용액에 1-사이클로헥실-1H-이미다졸-4-카복실산(783mg, 4.03mmol), HATU(1.23g, 3.23mmol) 및 DIPEA(1.87ml, 10.76mmol)를 순차적으로 첨가하고, 상기 반응 혼합물을 0℃에서 1시간 동안 교반하였다. 포화 수성 염화암모늄 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 포화 수성 염화암모늄, 포화 수성 NaHCO3 및 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켰다. 실리카 겔 크로마토그래피로 정제하여, 중간체 55-a를 백색 발포체로서 제공하였다.
단계 2: 1,4-디옥산 중의 4N HCl(5.17ml)을 에틸 아세테이트(1.0ml) 중의 중간체 55-a(960mg, 1.37mmol)에 첨가하고, 상기 용액을 0℃에서 1.5시간 동안 교반하였다. 휘발 물질을 감압하에 제거하고, 잔류물을 디에틸 에테르로 연화시켜, 화합물 93ㆍ2HCl을 백색 고체로서 제공하였다. MS (m/z) M+1= 597.4
실시예 52
하기 실시예는, 화학식 1의 화합물인 화합물 94의 제조를 예시한다.
반응식 56: 화합물 94의 합성
단계 1: 0℃로 냉각된, DMF 중의 중간체 12-g(1.60g, 3.07mmol)의 용액에 1-이소프로필-1H-이미다졸-4-카복실산, 리튬 염(734mg, 4.76mmol), HATU(1.40g, 3.69mmol) 및 DIPEA(2.14ml, 12.29mmol)를 순차적으로 첨가하고, 상기 반응 혼합물을 0℃에서 1시간 동안 교반하였다. 포화 수성 염화암모늄 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 포화 수성 염화암모늄, 포화 수성 NaHCO3 및 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켰다. 실리카 겔 크로마토그래피로 정제하여, 중간체 56-a를 백색 발포체로서 제공하였다.
단계 2: 1,4-디옥산 중의 4N HCl(4.14ml)을 에틸 아세테이트(1.0ml) 중의 중간체 56-a(850mg, 1.10mmol)에 첨가하고, 상기 용액을 0℃에서 2시간 동안 교반하였다. 휘발 물질을 감압하에 제거하고, 잔류물을 디에틸 에테르로 연화시켜, 화합물 94ㆍ2HCl을 백색 고체로서 제공하였다. MS (m/z) M+1= 557.4
실시예 53
하기 실시예는, 화학식 1의 화합물인 화합물 95의 제조를 예시한다.
반응식 57: 화합물 95의 합성
단계 1: 0℃로 냉각된, DMF 중의 중간체 12-g(1.30g, 2.49mmol)의 용액에 1-(테트라하이드로-2H-피란-4-일)-1H-이미다졸-4카복실산, 리튬 염(89-d)(656mg, 3.25mmol), HATU(1.23g, 3.25mmol) 및 DIPEA(1.74ml, 10.0mmol)를 순차적으로 첨가하고, 상기 반응 혼합물을 0℃에서 2시간 동안 교반하였다. 포화 수성 염화암모늄 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 포화 수성 염화암모늄, 포화 수성 NaHCO3 및 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켰다. 실리카 겔 크로마토그래피로 정제하여, 중간체 57-a를 백색 발포체로서 제공하였다.
단계 2: 1,4-디옥산 중의 4N HCl(4.43ml)을 에틸 아세테이트(1.0ml) 중의 중간체 57-a(960mg, 1.18mmol)에 첨가하고, 상기 용액을 0℃에서 2시간 동안 교반하였다. 휘발 물질을 감압하에 제거하고, 잔류물을 디에틸 에테르로 연화시켜, 화합물 95ㆍ2HCl을 백색 고체로서 제공하였다. MS (m/z) M+1= 599.4
실시예 54
하기 실시예는, 화학식 1의 화합물인 화합물 61의 제조를 예시한다.
반응식 58: 화합물 61의 합성
단계 1: 0℃로 냉각된, DMF 중의 중간체 12-g(350mg, 0.67mmol)의 용액에 1-페닐-1H-이미다졸-4-카복실산, 리튬 염(190mg, 1.0mmol), HATU(435mg, 1.14mmol) 및 DIPEA(468㎕, 2.69mmol)를 순차적으로 첨가하고, 상기 반응 혼합물을 0℃에서 1시간 동안 교반하였다. 포화 수성 염화암모늄 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 포화 수성 염화암모늄, 포화 수성 NaHCO3 및 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켰다. 실리카 겔 크로마토그래피로 정제하여, 중간체 58-a를 백색 발포체로서 제공하였다.
단계 2: 1,4-디옥산 중의 4N HCl(1.25ml)을 메탄올(500㎕) 중의 중간체 58-a(345mg, 0.50mmol)에 첨가하고, 상기 용액을 0℃에서 2시간 동안 교반하였다. 휘발 물질을 감압하에 제거하고, 잔류물을 디에틸 에테르로 연화시켜, 화합물 61ㆍ2HCl을 백색 고체로서 제공하였다. MS (m/z) M+1= 591.5
실시예 55
하기 실시예는, 화학식 1의 화합물인 화합물 122의 제조를 예시한다.
반응식 59: 화합물 122의 합성
단계 1: 0℃로 냉각된, DMF 중의 중간체 12-g(213mg, 0.41mmol)의 용액에 1-페닐-1H-피롤-3-카복실산(90-c)(100mg, 0.53mmol), HATU(203mg, 0.53mmol) 및 DIPEA(286㎕, 1.64mmol)를 순차적으로 첨가하고, 상기 반응 혼합물을 0℃에서 1시간 동안 교반하였다. 포화 수성 염화암모늄 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 포화 수성 염화암모늄, 포화 수성 NaHCO3 및 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켰다. 실리카 겔 크로마토그래피로 정제하여, 중간체 59-a를 백색 발포체로서 제공하였다.
단계 2: 1,4-디옥산 중의 4N HCl(1.22ml)을 에틸 아세테이트(325㎕) 중의 중간체 59-a(244mg, 0.32mmol)에 첨가하고, 상기 용액을 0℃에서 2시간 동안 교반하였다. 휘발 물질을 감압하에 제거하고, 잔류물을 디에틸 에테르로 연화시켜, 화합물 122ㆍ2HCl을 백색 고체로서 제공하였다. MS (m/z) M+1= 590.2
실시예 56
하기 실시예는, 화학식 1의 화합물인 화합물 109의 제조를 예시한다.
반응식 60: 화합물 109의 합성
단계 1: 0℃로 냉각된, DMF 중의 중간체 12-g(229mg, 0.44mmol)의 용액에 5-페닐-1H-이미다졸-2-카복실산(195mg, 0.87mmol), HATU(220mg, 0.57mmol) 및 DIPEA(310㎕, 1.78mmol)를 순차적으로 첨가하고, 상기 반응 혼합물을 0℃에서 1시간 동안 교반하였다. 포화 수성 염화암모늄 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 포화 수성 염화암모늄, 포화 수성 NaHCO3 및 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켰다. 실리카 겔 크로마토그래피로 정제하여, 중간체 60-a를 백색 발포체로서 제공하였다.
단계 2: 1,4-디옥산 중의 4N HCl(2.22ml)을 에틸 아세테이트(445㎕) 중의 중간체 60-a(307mg, 0.44mmol)에 첨가하고, 상기 용액을 0℃에서 2시간 동안 교반하였다. 휘발 물질을 감압하에 제거하고, 잔류물을 디에틸 에테르로 연화시켜, 화합물 109ㆍ2HCl을 백색 고체로서 제공하였다. MS (m/z) M+1= 591.2
실시예 57
하기 실시예는, 화학식 1의 화합물인 화합물 90의 제조를 예시한다.
반응식 61: 화합물 90의 합성
단계 1: 0℃로 냉각된, DMF 중의 중간체 12-g(598mg, 0.44mmol)의 용액에 1-페닐-1H-피라졸-4-카복실산(217mg, 1.15mmol), HATU(526mg, 1.38mmol) 및 DIPEA(803㎕, 4.61mmol)를 순차적으로 첨가하고, 상기 반응 혼합물을 0℃에서 2시간 동안 교반하였다. 포화 수성 염화암모늄 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 포화 수성 염화암모늄, 포화 수성 NaHCO3 및 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켰다. 실리카 겔 크로마토그래피로 정제하여, 중간체 61-a를 백색 발포체로서 제공하였다.
단계 2: 1,4-디옥산 중의 4N HCl(3.13ml)을 에틸 아세테이트(500㎕) 중의 중간체 61-a(577mg, 0.83mmol)에 첨가하고, 상기 용액을 0℃에서 2시간 동안 교반하였다. 휘발 물질을 감압하에 제거하고, 잔류물을 디에틸 에테르로 연화시켜, 화합물 90ㆍ2HCl을 백색 고체로서 제공하였다. MS (m/z) M+1= 591.4
실시예 58
하기 실시예는, 화학식 1의 화합물인 화합물 88의 제조를 예시한다.
반응식 62: 화합물 88의 합성
단계 1: 0℃로 냉각된, DMF 중의 중간체 12-g(1.2g, 2.30mmol)의 용액에 5-페닐-1H-피라졸-3-카복실산(455mg, 2.42mmol), HATU(1.0g, 2.77mmol) 및 DIPEA(1.60ml, 9.22mmol)를 순차적으로 첨가하고, 상기 반응 혼합물을 0℃에서 2시간 동안 교반하였다. 포화 수성 염화암모늄 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 포화 수성 염화암모늄, 포화 수성 NaHCO3 및 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켰다. 실리카 겔 크로마토그래피로 정제하여, 중간체 62-a를 백색 고체로서 제공하였다.
단계 2: 1,4-디옥산 중의 4N HCl(6.15ml)을 에틸 아세테이트(500㎕) 중의 중간체 62-a(850mg, 1.23mmol)에 첨가하고, 상기 용액을 0℃에서 1.5시간 동안 교반하였다. 휘발 물질을 감압하에 제거하고, 잔류물을 디에틸 에테르로 연화시켜, 화합물 88ㆍ2HCl을 백색 고체로서 제공하였다. MS (m/z) M+1= 591.4
실시예 59
하기 실시예는, 화학식 1의 화합물인 화합물 117의 제조를 예시한다.
반응식 63: 화합물 117의 합성
단계 1: 0℃로 냉각된, DMF 중의 중간체 12-g(1.0g, 1.92mmol)의 용액에 5-페닐-1,3,4-옥사디아졸-2-카복실산 나트륨 염(91-c)(1.36g, 6.41mmol), HATU(2.19g, 5.76mmol) 및 DIPEA(1.34ml, 7.68mmol)를 순차적으로 첨가하고, 상기 반응 혼합물을 실온에서 밤새 교반하였다. 포화 수성 염화암모늄 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 포화 수성 염화암모늄, 포화 수성 NaHCO3 및 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켰다. 실리카 겔 크로마토그래피로 정제하여, 중간체 63-a를 백색 고체로서 제공하였다.
단계 2: 1,4-디옥산 중의 4N HCl(10.0ml)을 중간체 63-a(453mg, 0.65mmol)에 첨가하고, 상기 용액을 0℃에서 3시간 동안 교반하였다. 휘발 물질을 감압하에 제거하고, 잔류물을 디에틸 에테르로 연화시켜, 화합물 117ㆍ2HCl을 백색 고체로서 제공하였다. MS (m/z) M+1= 593.2
실시예 60
하기 실시예는, 화학식 1의 화합물인 화합물 115의 제조를 예시한다.
반응식 64: 화합물 115의 합성
단계 1: 0℃로 냉각된, DMF 중의 중간체 12-g(847g, 1.62mmol)의 용액에 5-페닐이속사졸-3-카복실산(431mg, 2.27mmol), HATU(1.05g, 2.77mmol) 및 DIPEA(1.13ml, 6.51mmol)를 순차적으로 첨가하고, 상기 반응 혼합물을 실온에서 밤새 교반하였다. 포화 수성 염화암모늄 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 포화 수성 염화암모늄, 포화 수성 NaHCO3 및 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켰다. 실리카 겔 크로마토그래피로 정제하여, 중간체 64-a를 백색 발포체로서 제공하였다.
단계 2: 1,4-디옥산 중의 4N HCl(5.0ml)을 중간체 64-a(356mg, 0.51mmol)에 첨가하고, 상기 용액을 0℃에서 2시간 동안 교반하였다. 디에틸 에테르를 첨가하고, 형성된 침전물 및 화합물 115ㆍ2HCl을 여과에 의해 백색 고체로서 수집하였다. MS (m/z) M+1= 592.1
실시예 61
하기 실시예는, 화학식 1의 화합물 또는 이의 염의 제조에서 중간체로서 사용될 수 있는 화합물 65-i의 제조를 예시한다.
반응식 65: 중간체 65-i의 합성
단계 1: THF 중의 (2S,4R)-1-Boc-2-메틸-4-하이드록시피롤리딘-2-카복실레이트(18.0g, 73.4mmol), 4-플루오로페놀(9.05g, 81.0mmol) 및 트리페닐포스핀(21.17g, 81.0mmol)의 용액에 THF(20ml) 중의 DIAD(17.07g, 84.0mmol)를 적가한 다음, 상기 반응물을 실온에서 2일 동안 교반하였다. 디에틸 에테르 및 헥산을 첨가하고, 형성된 침전물 및 트리페닐 포스핀 옥사이드를 여과에 의해 제거하였다. 휘발 물질을 감압하에 제거하고, 잔류물을 실리카 겔 크로마토그래피에 의해 정제하여, 예상되는 중간체 65-b를 황색 고체로서 제공하였다.
단계 2: 1,4-디옥산 중의 4N HCl(78ml, 312mmol)을 중간체 65-b(21.2g, 62.5mmol)에 첨가하고, 상기 용액을 0℃에서 1시간 동안에 이어, 실온에서 30분 동안 교반하였다. 디에틸 에테르를 첨가하고, 형성된 침전물 및 중간체 65-cㆍHCl을 여과에 의해 백색 고체로서 수집하였다. MS (m/z) M+1= 240.0
단계 3: 0℃로 냉각된 DMF 중의 중간체 65-cㆍHCl(14.2g, 51.5mmol)의 용액에 Boc-Thr(Me)-OH(13.22g, 56.7mmol), HATU(21.54g, 56.7mmol), HOAt(8.58ml, 5.15mmol) 및 DIPEA(36.0ml, 206mmol)를 순차적으로 첨가한 다음, 상기 반응물을 실온에서 3시간 동안 교반하였다. 포화 수성 염화암모늄 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 포화 수성 염화암모늄, 포화 수성 NaHCO3 및 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켰다. 실리카 겔 크로마토그래피로 정제하여, 예상되는 중간체 65-d를 백색 발포체로서 제공하였다.
단계 4: 1,4-디옥산 중의 4N HCl(63.3ml)을 중간체 65-d(23.0g, 50.6mmol)에 첨가하고, 상기 용액을 0℃에서 1시간 동안에 이어, 실온에서 30분 동안 교반하였다. 디에틸 에테르를 첨가하고, 형성된 침전물 및 중간체 65-eㆍHCl을 여과에 의해 백색 고체로서 수집하였다. MS (m/z) M+1= 355.2
단계 5: 0℃로 냉각된 DMF 중의 중간체 65-eㆍHCl(16.2g, 41.4mmol)의 용액에 Boc-NMe-Ala-OH(9.27g, 45.6mmol), HATU(1734g, 45.6mmol), HOAt(6.91ml, 4.14mmol) 및 DIPEA(29.0ml, 166.0mmol)를 순차적으로 첨가한 다음, 상기 반응물을 실온에서 3시간 동안 교반하였다. 포화 수성 염화암모늄 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 포화 수성 염화암모늄, 포화 수성 NaHCO3 및 염수로 세척하고, MgSO4로 건조시키고, 여과하고, 진공하에 농축시켰다. 실리카 겔 크로마토그래피로 정제하여, 예상되는 중간체 65-f를 백색 발포체로서 제공하였다.
단계 6: 0℃로 냉각된 THF 중의 중간체 65-f(23.0g, 42.6mmol)의 용액에 수소화붕소리튬(1.95g, 90.0mmol)을 첨가하고, 상기 반응물을 실온에서 밤새 교반하였다. 물 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 10% 수성 시트르산, 포화 수성 NaHCO3 및 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켰다. 실리카 겔 크로마토그래피로 정제하여, 중간체 65-g를 백색 발포체로서 제공하였다.
단계 7: 0℃로 냉각된 DMSO(4.83ml, 68.0mmol) 및 디클로로메탄(150ml) 중의 중간체 65-g(8.7g, 17.01mmol)의 용액에 DIPEA(10.40ml, 59.5mmol) 및 피리딘 삼산화황 복합물(8.12g, 51.0mmol)을 첨가한 다음, 상기 반응물을 실온에서 밤새 교반하였다. 물 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 10% 시트르산, 포화 수성 NaHCO3 및 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켜, 중간체 65-h를 백색 발포체로서 제공하였다.
단계 8: 디클로로메탄 중의 중간체 65-h(8.0g, 15.70mmol)의 용액에 2-(4-플루오로페닐)에탄아민(1.87ml, 14.3mmol)을 첨가하였다. 실온에서 2시간 동안 교반한 후, 트리아세톡시수소화붕소나트륨(6.37g, 28.5mmol)을 분획으로 첨가한 다음, 상기 반응 혼합물을 실온에서 2시간 동안 교반하였다. 포화 수성 NaHCO3을 첨가하고, 유기 층을 분리하고, 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켜, 중간체 65-i를 황색 오일로서 제공하였다. 디에틸 에테르(100ml) 중의 중간체 65-i의 용액에 디에틸 에테르 중의 1N HCl(15.7ml)을 첨가하고, 형성된 침전물 및 중간체 65-iㆍHCl을 여과에 의해 베이지색 고체로서 수집하였다. MS (m/z) M+1= 633.4
실시예 62
하기 실시예는, 화학식 1의 화합물인 화합물 100의 제조를 예시한다.
반응식 66: 화합물 100의 합성
단계 1: 0℃로 냉각된 DMF 중의 중간체 65-iㆍHCl(1.5g, 2.24mmol)의 용액에 이미다조[1,2-a]피리미딘-2-카복실산(464mg, 2.84mmol), HATU(992mg, 2.61mmol) 및 DIPEA(1.65ml, 9.48mmol)를 순차적으로 첨가하고, 상기 반응 혼합물을 실온에서 밤새 교반하였다. 포화 수성 염화암모늄 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 포화 수성 NaHCO3 및 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켰다. 실리카 겔 크로마토그래피로 정제하여, 중간체 66-a를 백색 발포체로서 제공하였다.
단계 2: 1,4-디옥산 중의 4N HCl(2.0ml)을 0℃에서 중간체 66-a(760mg, 0.97mmol)에 첨가하고, 상기 용액을 0℃에서 1시간 동안에 이어, 실온에서 30분 동안 교반하였다. 에틸 아세테이트를 첨가하고, 형성된 침전물 및 화합물 100ㆍ2HCl을 여과에 의해 백색 고체로서 수집하였다. MS (m/z) M+1= 678.5
실시예 63
하기 실시예는, 화학식 1의 화합물인 화합물 102의 제조를 예시한다.
반응식 67: 화합물 102의 합성
단계 1: 0℃로 냉각된 DMF 중의 중간체 65-iㆍHCl(2.0g, 2.98mmol)의 용액에 이미다조[1,2-a]피리딘-2-카복실산 리튬 염(85-d)(641mg, 3.79mmol), HATU(1.32g, 3.48mmol) 및 DIPEA(2.20ml, 12.64mmol)를 순차적으로 첨가하고, 상기 반응 혼합물을 실온에서 밤새 교반하였다. 포화 수성 염화암모늄 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 포화 수성 NaHCO3 및 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켰다. 실리카 겔 크로마토그래피로 정제하여, 중간체 67-a를 백색 발포체로서 제공하였다.
단계 2: 1,4-디옥산 중의 4N HCl(3.0ml)을 0℃에서 중간체 67-a(900mg, 1.16mmol)에 첨가하고, 상기 용액을 0℃에서 1시간 동안에 이어, 실온에서 30분 동안 교반하였다. 에틸 아세테이트를 첨가하고, 형성된 침전물 및 화합물 102ㆍ2HCl을 여과에 의해 백색 고체로서 수집하였다. MS (m/z) M+1= 677.5
실시예 64
하기 실시예는, 화학식 1의 화합물인 화합물 99의 제조를 예시한다.
반응식 68: 화합물 99의 합성
단계 1: 0℃로 냉각된, DMF 중의 중간체 65-iㆍHCl(2.0g, 2.98mmol)의 용액에 1-메틸-1H-이미다졸-4-카복실산(478mg, 3.79mmol), HATU(1.32g, 3.48mmol) 및 DIPEA(2.20ml, 12.64mmol)를 순차적으로 첨가하고, 상기 반응 혼합물을 0℃에서 1시간 동안 및 실온에서 밤새 교반하였다. 포화 수성 염화암모늄 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 포화 수성 염화암모늄, 포화 수성 NaHCO3 및 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켰다. 실리카 겔 크로마토그래피로 정제하여, 중간체 68-a를 백색 발포체로서 제공하였다.
단계 2: 1,4-디옥산 중의 4N HCl(3.0ml)을 0℃에서 중간체 68-a(900mg, 1.16mmol)에 첨가하고, 상기 용액을 0℃에서 1시간 동안에 이어, 실온에서 30분 동안 교반하였다. 에틸 아세테이트를 첨가하고, 형성된 침전물 및 화합물 99ㆍ2HCl을 여과에 의해 백색 고체로서 수집하였다. MS (m/z) M+1= 641.4
실시예 65
하기 실시예는, 화학식 1의 화합물인 화합물 114의 제조를 예시한다.
반응식 69: 화합물 114의 합성
단계 1: 0℃로 냉각된, DMF 중의 중간체 65-iㆍHCl(600mg, 0.90mmol)의 용액에 6,7-디하이드로-5-H-피롤로[1,2-a]이미다졸-2-카복실산, 리튬 염(87-e)(236mg, 1.42mmol), HATU(397mg, 1.04mmol) 및 DIPEA(662㎕, 3.79mmol)를 순차적으로 첨가하고, 상기 반응 혼합물을 0℃에서 1시간 동안 및 실온에서 2시간 동안 교반하였다. 포화 수성 염화암모늄 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 포화 수성 염화암모늄, 포화 수성 NaHCO3 및 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켰다. 실리카 겔 크로마토그래피로 정제하여, 중간체 69-a를 백색 발포체로서 제공하였다.
단계 2: 1,4-디옥산 중의 4N HCl(750㎕)을 0℃에서 중간체 69-a(230mg, 0.30mmol)에 첨가하고, 상기 용액을 0℃에서 1시간 동안에 이어, 실온에서 30분 동안 교반하였다. 에틸 아세테이트를 첨가하고, 형성된 침전물 및 화합물 114ㆍ2HCl을 여과에 의해 백색 고체로서 수집하였다. MS (m/z) M+1= 667.1
실시예 66
하기 실시예는, 화학식 1의 화합물인 화합물 107의 제조를 예시한다.
반응식 70: 화합물 107의 합성
단계 1: 0℃로 냉각된, DMF 중의 중간체 65-iㆍHCl(600mg, 0.87mmol)의 용액에 6-플루오로이미다조[1,2-a]피리미딘-2-카복실산, HBr 염(86-c)(298mg, 1.13mmol), HATU(397mg, 1.04mmol) 및 DIPEA(662㎕, 3.79mmol)를 순차적으로 첨가하고, 상기 반응 혼합물을 0℃에서 1시간 동안 및 실온에서 밤새 교반하였다. 포화 수성 염화암모늄 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 포화 수성 염화암모늄, 포화 수성 NaHCO3 및 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켰다. 실리카 겔 크로마토그래피로 정제하여, 중간체 70-a를 백색 발포체로서 제공하였다.
단계 2: 1,4-디옥산 중의 4N HCl(1.41ml)을 0℃에서 중간체 70-a(450mg, 0.56mmol)에 첨가하고, 상기 용액을 0℃에서 1시간 동안 교반하였다. 에틸 아세테이트를 첨가하고, 형성된 침전물 및 화합물 107ㆍ2HCl을 여과에 의해 백색 고체로서 수집하였다. MS (m/z) M+1= 696.3
실시예 67
하기 실시예는, 화학식 1의 화합물인 화합물 108의 제조를 예시한다.
반응식 71: 화합물 108의 합성
단계 1: 0℃로 냉각된, DMF 중의 중간체 65-iㆍHCl(600mg, 0.87mmol)의 용액에 1-(4-플루오로페닐)-1H-이미다졸-4-카복실산, 리튬 염(88-e)(303mg, 1.42mmol), HATU(397mg, 1.04mmol) 및 DIPEA(662㎕, 3.79mmol)를 순차적으로 첨가하고, 상기 반응 혼합물을 0℃에서 1시간 동안 및 실온에서 밤새 교반하였다. 포화 수성 염화암모늄 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 포화 수성 염화암모늄, 포화 수성 NaHCO3 및 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켰다. 실리카 겔 크로마토그래피로 정제하여, 중간체 71-a를 백색 발포체로서 제공하였다.
단계 2: 1,4-디옥산 중의 4N HCl(670㎕)을 0℃에서 중간체 71-a(220mg, 0.26mmol)에 첨가하고, 상기 용액을 0℃에서 1시간 동안 교반하였다. 에틸 아세테이트를 첨가하고, 형성된 침전물 및 화합물 108ㆍ2HCl을 여과에 의해 백색 고체로서 수집하였다. MS (m/z) M+1= 721.1
실시예 68
하기 실시예는, 화학식 1의 화합물 또는 이의 염의 제조에서 중간체로서 사용될 수 있는 화합물 72-d의 제조를 예시한다.
반응식 72: 중간체 72-d의 합성
단계 1: 0℃로 냉각된 DMF 중의 중간체 42-d(18.0g, 40.6mmol)의 용액에 이미다졸(3.32g, 48.7mmol), DMAP(496mg, 4.06mmol) 및 3급-부틸클로로디메틸실란(6.73ml, 44.6mmol)을 순차적으로 첨가하고, 상기 반응 혼합물을 실온에서 밤새 교반하였다. 물 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 포화 수성 NaHCO3 및 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켰다. 실리카 겔 크로마토그래피로 정제하여, 중간체 72-a를 무색 오일로서 제공하였다.
단계 2: 0℃로 냉각된 THF 중의 중간체 72-a(6.0g, 10.76mmol)의 용액에 수소화붕소리튬(1.17g, 53.8mmol)을 첨가하고, 상기 반응물을 실온에서 밤새 교반하였다. 포화 수성 염화암모늄 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 10% 수성 시트르산, 포화 수성 NaHCO3 및 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켰다. 실리카 겔 크로마토그래피로 정제하여, 중간체 72-b를 백색 발포체로서 제공하였다.
단계 3: 0℃로 냉각된 DMSO(3.0ml, 42.3mmol) 및 디클로로메탄(80ml) 중의 중간체 72-b(5.6g, 10.57mmol)의 용액에 TEA(5.89ml, 42.3mmol) 및 피리딘 삼산화황 복합물(5.05g, 31.7mmol)을 첨가한 다음, 상기 반응물을 0℃에서 30분 동안 및 실온에서 1시간 동안 교반하였다. 포화 수성 염화암모늄 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 10% 수성 시트르산, 포화 수성 NaHCO3 및 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켜, 중간체 72-c를 백색 발포체로서 제공하였다.
단계 4: 디클로로메탄 중의 중간체 72-c(3.0g, 5.68mmol)의 용액에 2-(4-플루오로페닐)에탄아민(746㎕, 5.68mmol)을 첨가하였다. 실온에서 밤새 교반한 후, 상기 반응물을 -5℃로 냉각시키고, 트리아세톡시수소화붕소나트륨(2.54g, 11.37mmol)을 분획으로 첨가한 다음, 상기 반응 혼합물을 실온에서 2시간 동안 교반하였다. 포화 수성 NaHCO3을 첨가하고, 유기 층을 분리하고, 염수로 세척하고, MgSO4로 건조시키고, 여과하고, 진공하에 농축시켜, 중간체 72-d를 황색 발포체로서 제공하였다. 디에틸 에테르(100ml) 중의 중간체 72-d의 용액에 디에틸 에테르 중의 1N HCl(5.68ml)을 첨가하고, 형성된 침전물 및 중간체 72-dㆍHCl을 여과에 의해 베이지색 고체로서 수집하였다. MS (m/z) M+1= 651.6
실시예 69
하기 실시예는, 화학식 1의 화합물 또는 이의 염의 제조에서 중간체로서 사용될 수 있는 화합물 73-b의 제조를 예시한다.
반응식 73: 중간체 73-b의 합성
단계 1: 0℃로 냉각된 DMF 중의 중간체 72-dㆍHCl(7.02g, 10.78mmol)의 용액에 이미다조[1,2-a]피리딘-2-카복실산, 리튬 염(85-d)(3.08g, 18.33mmol), HATU(6.97g, 18.33mmol) 및 DIPEA(7.53ml, 43.1mmol)를 순차적으로 첨가하고, 상기 반응 혼합물을 실온에서 밤새 교반하였다. 포화 수성 염화암모늄 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 포화 수성 NaHCO3 및 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켰다. 실리카 겔 크로마토그래피로 정제하여, 중간체 73-a를 백색 발포체로서 제공하였다.
단계 2: 0℃로 냉각된 THF 중의 중간체 73-a(6.14g, 7.72mmol)의 용액에 THF 중의 1.0M TBAF 용액(10.04ml, 10.04mmol)을 첨가하고, 상기 반응 혼합물을 실온에서 2시간 동안 교반하였다. 물 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켰다. 실리카 겔 크로마토그래피로 정제하여, 중간체 73-b를 백색 발포체로서 제공하였다.
실시예 70
하기 실시예는, 화학식 1의 화합물인 화합물 111의 제조를 예시한다.
반응식 74: 화합물 111의 합성
단계 1: THF 중의 중간체 73-b(1.95g, 2.86mmol), 4-(트리플루오로메톡시)페놀(561mg, 3.15mmol) 및 트리페닐포스핀(901mg, 3.44mmol)의 용액에 DIAD(724㎕, 3.72mmol)를 적가한 다음, 상기 반응물을 실온에서 2일 동안 교반하였다. 디에틸 에테르 및 헥산을 첨가하고, 형성된 침전물 및 트리페닐 포스핀 옥사이드를 여과에 의해 제거하였다. 휘발 물질을 감압하에 제거하고, 잔류물을 실리카 겔 크로마토그래피로 정제하여, 예상되는 중간체 74-a를 무색 오일로서 제공하였다.
단계 2: 1,4-디옥산 중의 4N HCl(6.85ml)을 에틸 아세테이트(500㎕) 중의 중간체 74-a(921mg, 1.09mmol)에 첨가하고, 상기 용액을 0℃에서 2시간 동안 교반하였다. 디에틸 에테르를 첨가하고, 형성된 침전물 및 화합물 111ㆍ2HCl을 여과에 의해 백색 고체로서 수집하였다. MS (m/z) M+1= 741.3
실시예 71
하기 실시예는, 화학식 1의 화합물인 화합물 106의 제조를 예시한다.
반응식 75: 화합물 106의 합성
단계 1: THF 중의 중간체 73-b(2.30g, 3.38mmol), 피리딘-4-올(353mg, 3.72mmol) 및 트리페닐포스핀(1.06g, 4.05mmol)의 용액에 DIAD(854㎕, 4.39mmol)를 적가한 다음, 상기 반응물을 실온에서 2일 동안 교반하였다. 디에틸 에테르 및 헥산을 첨가하고, 형성된 침전물 및 트리페닐 포스핀 옥사이드를 여과에 의해 제거하였다. 휘발 물질을 감압하에 제거하고, 잔류물을 실리카 겔 크로마토그래피로 정제하여, 예상되는 중간체 75-a를 무색 오일로서 제공하였다.
단계 2: 1,4-디옥산 중의 4N HCl(9.24ml)을 에틸 아세테이트(500㎕) 중의 중간체 75-a(1.12g, 1.47mmol)에 첨가하고, 상기 용액을 0℃에서 2시간 동안 교반하였다. 디에틸 에테르를 첨가하고, 형성된 침전물 및 화합물 106ㆍ3HCl을 여과에 의해 백색 고체로서 수집하였다. MS (m/z) M+1= 658.1
실시예 72
하기 실시예는, 화학식 1의 화합물인 화합물 105의 제조를 예시한다.
반응식 76: 화합물 105의 합성
단계 1: THF 중의 중간체 73-b(1.79g, 2.63mmol), 4-메톡시페놀(359mg, 2.89mmol) 및 트리페닐포스핀(828mg, 3.16mmol)의 용액에 DIAD(665㎕, 3.42mmol)를 적가한 다음, 상기 반응물을 실온에서 2일 동안 교반하였다. 디에틸 에테르 및 헥산을 첨가하고, 형성된 침전물 및 트리페닐 포스핀 옥사이드를 여과에 의해 제거하였다. 휘발 물질을 감압하에 제거하고, 잔류물을 실리카 겔 크로마토그래피로 정제하여, 예상되는 중간체 76-a를 무색 오일로서 제공하였다.
단계 2: 1,4-디옥산 중의 4N HCl(4.05ml)을 에틸 아세테이트(500㎕) 중의 중간체 76-a(510mg, 0.64mmol)에 첨가하고, 상기 용액을 0℃에서 2시간 동안 교반하였다. 디에틸 에테르를 첨가하고, 형성된 침전물 및 화합물 105ㆍ2HCl을 여과에 의해 백색 고체로서 수집하였다. MS (m/z) M+1= 687.1
실시예 73
하기 실시예는, 화학식 1의 화합물 또는 이의 염의 제조에서 중간체로서 사용될 수 있는 화합물 77-b의 제조를 예시한다.
반응식 77: 중간체 77-b의 합성
단계 1: 0℃로 냉각된 DMF 중의 중간체 72-dㆍHCl(3.0g, 4.61mmol)의 용액에 1-N-메틸이미다졸 카복실산(988mg, 7.83mmol), HATU(2.98g, 7.83mmol) 및 DIPEA(3.22ml, 18.43mmol)를 순차적으로 첨가하고, 상기 반응 혼합물을 실온에서 밤새 교반하였다. 포화 수성 염화암모늄 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 포화 수성 NaHCO3 및 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켰다. 실리카 겔 크로마토그래피로 정제하여, 중간체 77-a를 백색 발포체로서 제공하였다.
단계 2: 0℃로 냉각된 THF 중의 중간체 77-a(570mg, 0.75mmol)의 용액에 THF 중의 1.0M TBAF 용액(970㎕, 0.97mmol)을 첨가하고, 상기 반응 혼합물을 실온에서 2시간 동안 교반하였다. 물 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켰다. 실리카 겔 크로마토그래피로 정제하여, 중간체 77-b를 백색 발포체로서 제공하였다.
실시예 74
하기 실시예는, 화학식 1의 화합물인 화합물 97의 제조를 예시한다.
반응식 78: 화합물 97의 합성
단계 1: THF 중의 중간체 77-b(700mg, 1.08mmol), 4-(트리플루오로메톡시)페놀(445mg, 2.49mmol) 및 트리페닐포스핀(712mg, 2.71mmol)의 용액에 DIAD(549㎕, 2.82mmol)를 첨가한 다음, 상기 반응물을 실온에서 2일 동안 교반하였다. 디에틸 에테르 및 헥산을 첨가하고, 형성된 침전물 및 트리페닐 포스핀 옥사이드를 여과에 의해 제거하였다. 휘발 물질을 감압하에 제거하고, 잔류물을 실리카 겔 크로마토그래피로 정제하여, 예상되는 중간체 78-a를 무색 오일로서 제공하였다.
단계 2: 1,4-디옥산 중의 4N HCl(6.0ml)을 에틸 아세테이트(500㎕) 중의 중간체 78-a(450mg, 0.56mmol)에 첨가하고, 상기 용액을 0℃에서 2시간 동안 교반하였다. 디에틸 에테르를 첨가하고, 형성된 침전물 및 화합물 97ㆍ2HCl을 여과에 의해 백색 고체로서 수집하였다. MS (m/z) M+1= 705.4
실시예 75
하기 실시예는, 화학식 1의 화합물인 화합물 96의 제조를 예시한다.
반응식 79: 화합물 96의 합성
단계 1: THF 중의 중간체 77-b(484mg, 0.75mmol), 4-메톡시페놀(214mg, 1.72mmol) 및 트리페닐포스핀(492mg, 1.87mmol)의 용액에 DIAD(379㎕, 195mmol)를 첨가한 다음, 상기 반응물을 실온에서 2일 동안 교반하였다. 디에틸 에테르 및 헥산을 첨가하고, 형성된 침전물 및 트리페닐 포스핀 옥사이드를 여과에 의해 제거하였다. 휘발 물질을 감압하에 제거하고, 잔류물을 실리카 겔 크로마토그래피로 정제하여, 예상되는 중간체 79-a를 베이지색 고체로서 제공하였다.
단계 2: 1,4-디옥산 중의 4N HCl(2.80ml)을 에틸 아세테이트(500㎕) 중의 중간체 79-a(420mg, 0.56mmol)에 첨가하고, 상기 용액을 0℃에서 2시간 동안 교반하였다. 디에틸 에테르를 첨가하고, 형성된 침전물 및 화합물 96ㆍ2HCl을 여과에 의해 백색 고체로서 수집하였다. MS (m/z) M+1= 651.4
실시예 76
하기 실시예는, 화학식 1의 화합물인 화합물 123의 제조를 예시한다.
반응식 80: 화합물 123의 합성
단계 1: 0℃에서 DMF 중의 중간체 12-g(0.478g, 0.919mmol)의 용액에 5-페닐옥사졸-2-카복실산, 나트륨 염(92-d)(0.194g, 0.919mmol), HATU(1.05g, 2.76mmol) 및 DIPEA(0.642ml, 3.68mmol)를 순차적으로 첨가하고, 상기 반응 혼합물을 실온에서 밤새 교반하였다. 에틸 아세테이트 및 포화 수성 염화암모늄을 첨가하고, 유기 층을 분리하고, 포화 수성 염화암모늄, 포화 수성 NaHCO3 및 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켰다. 실리카 겔 크로마토그래피로 정제하여, 중간체 80-a를 백색 고체로서 제공하였다.
단계 2: 1,4-디옥산 중의 4N HCl(5ml, 20.0mmol)을 0℃에서 중간체 80-a(390mg, 0.564mmol)에 첨가하고, 상기 용액을 0℃에서 3시간 동안 교반하였다. 디에틸 에테르를 첨가하고, 형성된 침전물 및 화합물 123ㆍ2HCl을 여과에 의해 백색 고체로서 수집하였다. MS m/z M+1= 592.2
실시예 77
하기 실시예는, 화학식 1의 화합물인 화합물 125의 제조를 예시한다.
반응식 81: 화합물 125의 합성
단계 1: 0℃에서 DMF 중의 중간체 12-g(316mg, 0.608mmol)의 용액에 1-(4-플루오로페닐)-1H-1,2,3-트리아졸-4-카복실산, 나트륨 염(93-c)(0.2g, 0.790mmol), HATU(0.347g, 0.912mmol) 및 DIPEA(0.423ml, 2.431mmol)를 순차적으로 첨가하고, 상기 반응 혼합물을 실온에서 밤새 교반하였다. 에틸 아세테이트 및 포화 수성 염화암모늄을 첨가하고, 유기 층을 분리하고, 포화 수성 염화암모늄, 포화 수성 NaHCO3 및 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켰다. 실리카 겔 크로마토그래피로 정제하여, 중간체 81-a를 백색 고체로서 제공하였다.
단계 2: 1,4-디옥산 중의 4N HCl(1.5ml, 6.06mmol)을 에틸 아세테이트(1.2ml) 중의 중간체 81-a(0.43g, 0.606mmol)의 용액에 첨가하고, 상기 용액을 0℃에서 2시간 동안 교반하였다. 휘발 물질을 감압하에 제거하고, 잔류물을 디에틸 에테르로 연화시켜, 화합물 125ㆍ2HCl을 회백색 고체로서 제공하였다. MS m/z M+1= 610.1
실시예 78
하기 실시예는, 화학식 1의 화합물인 화합물 119의 제조를 예시한다.
반응식 82: 화합물 119의 합성
단계 1: 0℃에서 DMF 중의 중간체 42-h(250mg, 0.396mmol)의 용액에 2-(4-플루오로페닐)-2H-1,2,3-트리아졸-4-카복실산(94-d)(130mg, 0.630mmol), HATU(271mg, 0.713mmol) 및 DIPEA(207㎕, 1.189mmol)를 순차적으로 첨가하였다. 상기 반응 혼합물을 0℃에서 3시간 동안 및 실온에서 밤새 교반하였다. 에틸 아세테이트 및 포화 수성 염화암모늄을 첨가하고, 유기 층을 분리하였다. 수성 상을 에틸 아세테이트로 추출하고, 합한 유기 추출물을 포화 수성 염화암모늄, 포화 수성 NaHCO3 및 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켰다. 실리카 겔 크로마토그래피로 정제하여, 중간체 82-a를 백색 고체로서 제공하였다.
단계 2: 1,4-디옥산 중의 4N HCl(924㎕, 3.70mmol)을 중간체 82-a(303mg, 0.370mmol)에 첨가하고, 상기 용액을 0℃에서 1시간 동안 교반하였다. 휘발 물질을 감압하에 제거하고, 잔류물을 디에틸 에테르로 연화시켜, 화합물 119ㆍ2HCl을 백색 고체로서 제공하였다. MS m/z M+1= 720.1
실시예 79
하기 실시예는, 화학식 1의 화합물인 화합물 126의 제조를 예시한다.
반응식 83: 화합물 126의 합성
단계 1: 0℃에서 DMF 중의 중간체 12-g(300mg, 0.576mmol)의 용액에 2-(4-플루오로페닐)-2H-테트라졸-5-카복실산, 나트륨 염(95-d)(190mg, 0.749mmol), HATU(329mg, 0.864mmol) 및 DIPEA(400㎕, 2.305mmol)를 순차적으로 첨가하였다. 상기 반응 혼합물을 0℃에서 1시간 동안 교반하였다. 에틸 아세테이트 및 포화 수성 염화암모늄을 첨가하고, 유기 층을 분리하였다. 수성 상을 에틸 아세테이트로 추출하고, 합한 유기 추출물을 포화 수성 염화암모늄, 포화 수성 NaHCO3 및 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켜, 중간체 83-a를 수득하였다.
단계 2: 1,4-디옥산 중의 4N HCl(1.76ml, 7.03mmol)을 중간체 83-a(303mg, 0.370mmol)의 용액에 첨가하고, 상기 용액을 0℃에서 2시간 동안 교반하였다. 휘발 물질을 감압하에 제거하였다. 역상 크로마토그래피로 정제하여, 화합물 126ㆍ2HCl을 백색 고체로서 제공하였다. MS m/z M+1= 611.1
실시예 80
하기 실시예는 이미다조[1,2-a]피리미딘-2-카복실산, HBr 염(84-c)의 제조를 예시한다.
반응식 84: 화합물 84-c의 합성
단계 1: 0℃로 냉각된 DMF(375ml) 중의 2-아미노피리미딘(84-a)(50.00g, 526mmol)의 용액에 3-브로모-2-옥소프로판산(88.00g, 526mmol)을 첨가하였다. 상기 반응물을 0℃에서 2시간 동안 교반한 다음, 2시간에 걸쳐 실온으로 승온시키고, 18시간 동안 교반하였다. 아세토니트릴(650ml)을 첨가하였고, 침전물이 형성되었으며, 이것을 여과에 의해 수집하였다. 상기 침전물을 아세토니트릴 및 디에틸 에테르로 세정하고, 진공하에 건조시켜, 중간체 84-bㆍHBr을 백색 고체로서 수득하였다. MS m/z M+1=182.0
단계 2: THF(600ml) 중의 중간체 84-bㆍHBr(98.80g, 377mmol)의 현탁액에 N,N-디메틸아세트아미드(48ml)를 첨가하였다. 상기 반응물을 80℃에서 48시간 동안 교반하고, 실온으로 냉각시키고, 아세토니트릴(700ml)에 부었다. 침전물이 형성되었으며, 이것을 여과에 의해 수집하고, 아세토니트릴 및 디에틸 에테르로 세정하고, 진공하에 건조시켜, 이미다조[1,2-a]피리미딘-2-카복실산, HBr 염(84-c)을 베이지색 고체로서 수득하였다. MS m/z M+1= 164.2
실시예 81
하기 실시예는 이미다조[1,2-a]피리딘-2-카복실산, 리튬 염(85-d)의 제조를 예시한다.
반응식 85: 화합물 85-d의 합성
단계 1: THF(417ml) 중의 2-아미노피리딘(85-a)(20.00g, 213mmol)의 용액에 에틸 브로모피루베이트(30.0ml, 215mmol)를 첨가하였다. 상기 반응 혼합물을 실온에서 18시간 동안 교반하였다. 침전물이 형성되었으며, 이것을 여과에 의해 수집하고, THF로 세정하여, 중간체 85-bㆍHBr을 황색 고체로서 제공하였다.
단계 2: 에탄올(550ml) 중의 중간체 85-bㆍHBr의 현탁액에 AcOH(5ml)를 첨가하고, 상기 혼합물을 3시간 동안 환류하에 가열하여 투명한 용액을 수득하였다. 상기 용액을 진공하에 농축시키고, 형성된 침전물을 디에틸 에테르로 연화시키고, 중간체 85-cㆍHBr을 여과에 의해 베이지색 고체로서 수집하고, 물(0.5ℓ)에 용해시키고, NaOH 펠릿을 사용하여 pH 8로 염기성화시켰다. 이 용액을 에틸 아세테이트로 4회 추출하고, 합한 유기 층을 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켜, 중간체 85-c를 회백색 고체로서 제공하였다.
단계 3: 에탄올(140ml) 중의 중간체 85-c(26.40g, 0.139mmol)의 용액에 2M 수성 LiOH(70ml, 140mmol)를 첨가하고, 상기 반응물을 실온에서 5시간 동안 교반하였다. 상기 반응 혼합물을 0℃로 냉각시키고, 형성된 침전물을 여과에 의해 수집하고, 디에틸 에테르로 세정하여, 이미다조[1,2-a]피리딘-2-카복실산, 리튬 염(85-d)을 백색 고체로서 수득하였다. 1H NMR (200 MHz, CD3OD), δ ppm 8.41 (d, J= 6.6 Hz, 1H), 8.11 (s, 1H), 7.53 (d, J= 9.2 Hz, 1H), 7.29 (dd, J= 8.0 Hz, J= 7.3 Hz, 1H), 6.90 (dd, J= 6.7 Hz, J= 6.7 1H)
실시예 82
하기 실시예는 6-플루오로이미다조[1,2-a]피리미딘-2-카복실산, HBr 염(86-c)의 제조를 예시한다.
반응식 86: 화합물 86-c의 합성
단계 1: 0℃에서 DMF(14ml) 중의 5-플루오로피리미딘-2-아민(86-a)(3.17g, 28.0mmol)의 용액에 브로모피루브산(7.73g, 53.4mmol)을 첨가하였다. 상기 반응 혼합물을 0℃에서 2시간 동안에 이어, 실온에서 2일 동안 교반하였다. 상기 반응물을 아세톤으로 희석시키고, 형성된 침전물 및 중간체 86-bㆍHBr을 여과에 의해 베이지색 고체로서 수집하였다.
단계 2: THF(100ml) 및 AcOH(10ml) 중의 중간체 86-bㆍHBr(8.40g, 30.0mmol)의 현탁액을 70℃에서 72시간 동안 교반하였다. THF를 첨가하고, 침전물을 여과에 의해 수집하고, THF 및 디에틸 에테르로 세정하고, 진공하에 건조시켜, 6-플루오로이미다조[1,2-a]피리미딘-2-카복실산, HBr 염(86-c)을 엷은 베이지색 고체로서 제공하였다. MS m/z M+1= 182.0
실시예 83
하기 실시예는 6,7-디하이드로-5H-피롤로[1,2-a]이미다졸-2-카복실산, 리튬 염(87-e)의 제조를 예시한다.
반응식 87: 화합물 87-e의 합성
단계 1: THF 중의 중간체 87-a(5.00g, 70.3mmol)의 용액에 10℃에서 에틸 프로피올레이트(6.90g, 70.3mmol)를 첨가하였다. 상기 반응 혼합물을 실온에서 1시간 동안 교반하고, 진공하에 농축시켜, 중간체 87-b를 황색 오일로서 제공하였다.
단계 2: 아세토니트릴(1400ml) 중의 중간체 87-b(11.90g, 70.3mmol)의 용액에 4-니트로벤젠디아조늄 테트라플루오로보레이트(16.66g, 70.3mmol)를 첨가하고, 상기 반응물을 실온에서 1시간 동안 교반하여, 중간체 87-c의 용액을 제공하였다.
단계 3: 중간체 87-c의 용액에 TEA(19.0ml, 141mmol)를 첨가하고, 상기 반응 혼합물을 2시간 동안 환류하에 가열하고, 실온으로 냉각시키고, 진공하에 농축시켰다. 실리카 겔 크로마토그래피로 정제하여, 중간체 87-d를 갈색 고체로서 제공하였다. MS m/z M+Na= 202.9
단계 4: THF 중의 중간체 87-d(5.36g, 29.7mmol)의 용액에 2N 수성 LiOH(32.7ml, 65.4mmol)를 첨가하였다. 상기 반응 혼합물을 실온에서 48시간 동안 교반하고, 진공하에 농축시켜, 6,7-디하이드로-5H-피롤로[1,2-a]이미다졸-2-카복실산, 리튬 염(87-e)을 엷은 베이지색 고체로서 수득하였다. MS m/z M+1= 153.0
실시예 84
하기 실시예는 1-(4-플루오로페닐)-1H-이미다졸-4-카복실산, 리튬 염(88-e)의 제조를 예시한다.
반응식 88: 화합물 88-e의 합성
단계 1: 0℃에서 포름산(20.7ml, 540mmol) 중의 아연 옥사이드(7.32g, 90mmol)의 용액에 4-플루오로아닐린(88-a)(20.00g, 180mmol)을 첨가하였다. 상기 반응 혼합물을 70℃에서 1시간 동안 교반하고, 실온으로 냉각시키고, 에틸 아세테이트로 희석하고, 셀라이트 패드로 여과하였다. 상기 여액을 물, 10% 수성 Na2CO3 및 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켜, 중간체 88-b를 베이지색 고체로서 제공하였다. MS m/z M+1= 140.0
단계 2: 디클로로메탄(111ml) 중의 중간체 88-b(8.35g, 60.0mmol)의 용액에 트리페닐포스핀(17.79g, 67.8mmol), TEA(8.32ml, 60.0mmol) 및 사염화탄소(6.21ml, 64.2mmol)를 순차적으로 첨가하였다. 실온에서 72시간 동안 교반한 후, 상기 반응 혼합물을 0℃로 냉각시켰다. 침전물이 형성되었고, 이것을 여과에 의해 수집하고 폐기시켰다. 여액을 농축시키고, 차가운 디에틸 에테르에 현탁시켰다. 불용성 잔류물을 여과에 의해 수집하고 폐기시켰다. 여액을 진공하에 농축시켜, 중간체 88-c를 갈색 오일로서 제공하였다.
단계 3: 질소로 퍼징된 THF(400ml) 중의 구리 옥사이드(1.20g, 8.40mmol) 및 1,10-페난트롤린(3.03g, 16.80mmol)의 현탁액에 중간체 88-c(7.27g, 60.0mmol) 및 에틸 이소시아노아세테이트(9.2ml, 84mmol)를 순차적으로 첨가하였다. 70℃에서 18시간 동안 교반한 후, 상기 반응 혼합물을 실온으로 냉각시키고, 셀라이트 패드로 여과하였다. 여액을 진공하에 농축시켰다. 실리카 겔 크로마토그래피로 정제하여, 중간체 88-d를 담황색 고체로서 제공하였다. MS m/z M+1= 235.0
단계 4: THF 중의 중간체 88-d(10.47g, 44.7mmol)의 용액에 2N 수성 LiOH(24.6ml, 49.2mmol)를 첨가하였다. 실온에서 밤새 교반한 후, 상기 반응 혼합물을 진공하에 농축시켰다. 수득된 잔류물을 물로 희석시키고, 디클로로메탄으로 추출하였다. 유기 분획물을 폐기시키고, 수성 층을 진공하에 농축시켜, 1-(4-플루오로페닐)-1H-이미다졸-4-카복실산, 리튬 염(88-e)을 담황색 고체로서 제공하였다. MS m/z M+1= 207
실시예 85
하기 실시예는 1-(테트라하이드로-2H-피란-4-일)-1H-이미다졸-4-카복실산, 리튬 염(89-d)의 제조를 예시한다.
반응식 89: 화합물 89-d의 합성
단계 1: 0℃에서 무수 에탄올(50ml) 중의 에틸 2-이소시아노아세테이트(89-a)(5g, 44.2mmol)의 용액에 1,1-디메톡시-N,N-디메틸메탄아민(10.53g, 88mmol)을 첨가하였다. 실온에서 밤새 교반한 후, 상기 반응 혼합물을 진공하에 농축시켰다. 중성 알루미늄 상에서 크로마토그래피로 정제하여 중간체 89-b를 황색 오일로서 제공하였다.
단계 2: 밀폐된 관에 중간체 89-b(1.00g, 5.95mmol) 및 테트라하이드로-2H-피란-4-아민(1.80g, 17.84mmol)을 가하였다. 상기 관을 질소로 충전시키고, 밀폐시키고, 2시간 동안 70℃에서 가열하였다. 실온으로 냉각시킨 후, 상기 반응 혼합물을 실리카 겔 크로마토그래피로 정제하여, 중간체 89-c를 베이지색 고체로서 제공하였다.
단계 3: 메탄올/물 3:1 혼합물 중의 중간체 89-c(0.72g, 3.22mmol)의 용액에 LiOH(0.116g, 4.83mmol)를 첨가하였다. 실온에서 18시간 동안 교반한 후, 상기 반응 혼합물을 진공하에 농축시켜, 1-(테트라하이드로-2H-피란-4-일)-1H-이미다졸-4-카복실산, 리튬 염(89-d)을 백색 발포체로서 수득하였다. MS m/z M+1= 197.0
실시예 86
하기 실시예는 1-페닐-1H-피롤-3-카복실산, 리튬 염(90-c)의 제조를 예시한다.
반응식 90: 화합물 90-c의 합성
단계 1: 건조된 밀폐-관에 메틸 1H-피롤-3-카복실레이트(90-a)(150mg, 1.199mmol), 요오드화구리(I)(11.4mg, 0.060mmol), K3PO4(534mg, 2.52mmol), 요오도벤젠(160㎕, 1.439mmol) 및 톨루엔(1.2ml)을 가하였다. 상기 혼합물을 통해 5분 동안 질소를 버블링시킨 후, N1,N2-디메틸에탄-1,2-디아민(21mg, 0.240mmol)을 첨가하였다. 상기 관을 밀폐시키고, 상기 반응물을 100℃에서 밤새 교반하였다. 이어서, 이것을 에틸 아세테이트로 희석시키고, 셀라이트 패드로 여과하였다. 상기 여액을 포화 수성 염화암모늄 및 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켜, 중간체 90-b를 수득하였다. MS m/z M+1= 202.2
단계 2: THF/물 2:1 혼합물 중의 중간체 90-b(241mg, 1.198mmol)의 용액에 LiOH(92mg, 3.832mmol)를 첨가하였다. 상기 반응 혼합물을 50℃에서 밤새 가열하고, 진공하에 농축시켰다. 상기 잔류물을 물에 용해시키고, 디클로로메탄 및 디에틸 에테르로 추출하고, 유기 추출물을 폐기시켰다. 수성 상을 37% 수성 HCl을 사용하여 pH 2로 산성화시키고, 디클로로메탄으로 2회 추출하였다. 합한 유기 추출물을 무수 MgSO4로 건조시키고, 진공하에 농축시켜, 1-페닐-1H-피롤-3-카복실산, 리튬 염(90-c)을 백색 고체로서 수득하였다. MS m/z M+Na= 210.2
실시예 87
하기 실시예는 5-페닐-1,3,4-옥사디아졸-2-카복실산, 나트륨 염(91-c)의 제조를 예시한다.
반응식 91: 화합물 91-c의 합성
단계 1: 톨루엔 중의 에틸 2-클로로-2-옥소아세테이트(91-a)(5.61g, 41.1mmol)의 용액에 5-페닐-1H-테트라졸(6.00g, 41.1mmol)을 첨가하였다. 환류하에 2시간 동안 교반한 후, 상기 반응 혼합물을 에틸 아세테이트 및 물로 희석시켰다. 유기 층을 1N 수성 HCl, 물 및 염수로 2회 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켰다. 실리카 겔 크로마토그래피로 정제하여, 중간체 91-b를 황색 고체로서 제공하였다. MS m/z M+1= 219.1
단계 2: THF 중의 중간체 91-b(1.40g, 6.42mmol)의 용액에 0℃에서 1N 수성 NaOH(6.7ml, 6.74mmol)를 첨가하였다. 상기 반응 혼합물을 실온에서 2시간 동안 교반하고, 진공하에 농축시켜, 5-페닐-1,3,4-옥사디아졸-2-카복실산, 나트륨 염(91-c)을 백색 고체로서 제공하였다. MS m/z M+1= 191.1
실시예 88
하기 실시예는 5-페닐옥사졸-2-카복실산, 나트륨 염(92-d)의 제조를 예시한다.
반응식 92: 화합물 92-d의 합성
단계 1: 0℃에서 디클로로메탄 중의 글리신 에틸 에스테르 하이드로클로라이드(92-a)(4.64g, 33.2mmol)의 용액에 벤조일 클로라이드(3.22ml, 27.7mmol) 및 TEA(11.49ml, 83mmol)를 순차적으로 첨가하였다. 상기 반응 혼합물을 0℃에서 2시간 동안 및 실온에서 밤새 교반하였다. 에틸 아세테이트 및 물을 첨가하고, 유기 층을 분리하고, 1N 수성 HCl로 2회 세척한 후, 물 및 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켜, 중간체 92-b를 오일로서 수득하였다.
단계 2: 톨루엔(5.0ml) 중의 중간체 92-b(1.10g, 4.68mmol)의 용액에 옥시염화인(2.18ml, 23.38mmol)을 첨가하였다. 상기 반응 혼합물을 밤새 환류하에 가열하고, 실온으로 냉각시켰다. 에틸 아세테이트 및 포화 수성 NaHCO3을 첨가하고, 유기 층을 분리하고, 포화 수성 NaHCO3, 물 및 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켰다. 실리카 겔 크로마토그래피로 정제하여, 중간체 92-c를 백색 고체로서 제공하였다. MS m/z M+1= 218.1
단계 3: THF 중의 중간체 92-c(200mg, 0.921mmol)의 용액에 0℃에서 1N 수성 NaOH(1.1ml, 1.105mmol)를 첨가하였다. 실온에서 3시간 동안 교반한 후, 상기 반응 혼합물을 진공하에 농축시켜, 5-페닐옥사졸-2-카복실산, 나트륨 염(92-d)을 백색 고체로서 수득하였다. MS m/z M+1= 190.2
실시예 89
하기 실시예는 1-(4-플루오로페닐)-1H-1,2,3-트리아졸-4-카복실산, 나트륨 염(93-c)의 제조를 예시한다.
반응식 93: 화합물 93-c의 합성
단계 1: DMSO(4.0ml) 및 물(0.44ml) 중의 1-플루오로-4-요오도벤젠(93-a)(0.926g, 4.17mmol)의 용액에 아지드화나트륨(0.325g, 5.01mmol), 탄산나트륨(0.088g, 0.833mmol), L-프롤린(0.096g, 0.833mmol), 에틸 프로피올레이트(0.409g, 4.17mmol), 나트륨 L-아스코르베이트(0.207g, 1.043mmol) 및 황산구리(II)(0.052g, 0.208mmol)를 순차적으로 첨가하였다. 상기 반응 혼합물을 65℃에서 18시간 동안 교반하고, 실온으로 냉각시켰다. 수성 암모니아(1ml), 에틸 아세테이트(25ml) 및 물(20ml)을 첨가하였다. 상들을 분리하고, 수성 상을 에틸 아세테이트로 추출하였다. 합한 유기 추출물을 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켰다. 역상 크로마토그래피로 정제하여, 중간체 93-b를 제공하였다. MS m/z M+1= 236.1
단계 2: THF 중의 중간체 93-b(200mg, 0.850mmol)의 용액에 2N 수성 NaOH(0.425ml, 0.850mmol)를 첨가하였다. 실온에서 18시간 동안 교반한 후, 상기 반응 혼합물을 진공하에 농축시켜, 1-(4-플루오로페닐)-1H-1,2,3-트리아졸-4-카복실산, 나트륨 염(93-c)을 황색 고체로서 제공하였다. MS m/z M+Na= 230.0
실시예 90
하기 실시예는 2-(4-플루오로페닐)-2H-1,2,3-트리아졸-4-카복실산, 나트륨 염(94-d)의 제조를 예시한다.
반응식 94: 화합물 94-d의 합성
단계 1: 에탄올(16ml) 중의 화합물 94-a(1.75g, 15.08mmol)의 용액에 4-플루오로페닐하이드라진(1.90g, 15.08mmol)을 첨가하고, 상기 반응물을 70℃에서 30분 동안 교반하였다. 물(16ml)을 첨가하고, 상기 반응 혼합물을 85℃로 가열하고, 1/3로 농축시키고, 얼음욕에서 냉각시켰다. 황색 침전물이 형성되었고, 이것을 여과에 의해 수집하였다. 상기 침전물을 25% 에탄올/톨루엔 혼합물(40ml)에 용해시켰다. 상기 플라스크에 응축기 및 딘-스타크 트랩을 장착시키고, 상기 반응 혼합물을, 모든 에탄올이 상기 딘-스타크 트랩에 수집될 때까지 환류하에 가열하였다. 상기 혼합물을 실온으로 냉각시키고, 형성된 침전물 및 중간체 94-b를 여과에 의해 갈색 고체로서 수집하였다.
단계 2: 아세트산 무수물(13.8ml, 146mmol) 중의 중간체 94-b(1.64g, 7.32mmol)의 용액을 실온에서 30분 동안 교반하였다. 상기 반응물을 물(60ml)로 희석시키고, 30분 동안 교반하고, 수득된 침전물을 여과에 의해 수집하였다. 상기 고체를 에틸 아세테이트와 물 사이에 분배시켰다. 층들을 분리하고, 유기 층을 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켰다. 상기 잔류물을 THF에 용해시키고, 탄산세슘(2.62g, 8.05mmol)을 첨가하였다. 상기 혼합물을 실온에서 30분 동안 교반하고, 여과하였다. 상기 여액을 진공하에 농축시키고, 상기 잔류물을 디에틸 에테르에 용해시키고, 물로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켰다. 수득된 고체를 2M 수성 HCl(50ml)에 용해시키고, 파라포름알데히드(0.433g, 14.41mmol)를 첨가하고, 상기 반응 혼합물을 2시간 동안 환류하에 가열하였다. 실온으로 냉각되었을 때, 상기 혼합물을 디에틸 에테르로 추출하였다. 유기 층을 분리하고, 물로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켰다. 실리카 겔 크로마토그래피로 정제하여, 중간체 94-c를 담황색 고체로서 제공하였다.
단계 3: 0℃에서 메탄올(15ml) 중의 중간체 94-c(300mg, 1.569mmol)의 용액에 시안화칼륨(171mg, 2.62mmol) 및 산화망간(IV)(1078mg, 12.40mmol)을 첨가하였다. 상기 반응 혼합물을 실온에서 18시간 동안 교반하고, 셀라이트 패드로 여과하고, 상기 케익을 메탄올로 세정하였다. 여액을 진공하에 농축시켰다. 실리카 겔 크로마토그래피로 정제하여, 2-(4-플루오로페닐)-2H-1,2,3-트리아졸-4-카복실산, 나트륨 염(94-d)을 담황색 고체로서 제공하였다. MS m/z M+1= 244.2
실시예 91
하기 실시예는 2-(4-플루오로페닐)-2H-테트라졸-5-카복실산, 나트륨 염(95-e)의 제조를 예시한다.
반응식 95: 화합물 95-e의 합성
단계 1: 에탄올(5.7ml) 및 물(2.0ml) 중의 4-플루오로아닐린(95-a)(2.00g, 18.00mmol)의 용액에 37% 수성 HCl(3.7ml, 45.0mmol)을 첨가하고, 상기 반응 혼합물을 -5℃로 냉각시켰다. 상기 혼합물에 5N 수성 아질산나트륨(3.96ml, 19.80mmol)을 적가한 다음, 6N 수성 나트륨 아세테이트(9.0ml, 54.0mmol)를 첨가하였다. 상기 반응 혼합물을 0℃에서 10분 동안 교반한 다음, 에틸 2-클로로-3-옥소부타노에이트(2.96g, 18.00mmol)를 첨가하고, 27℃에서 밤새 계속 교반하였다. THF(20ml)를 첨가하고, 상기 반응 혼합물을 40℃까지 승온시키고, 분리 깔대기에 옮겼다. 수성 층을 분리하고 폐기시켰다. 유기 층은 중간체 95-b를 THF 용액으로서 함유하였다. MS m/z M+Na= 267.1
단계 2: THF 중의 중간체 95-b(4.40g, 18mmol)의 용액에 0℃에서 25% 수성 NH4OH(16ml, 108mmol)를 첨가하였다. 상기 반응 혼합물을 실온에서 3시간 동안 교반하고, 분리 깔대기에 옮겼다. 수성 층을 분리하고 폐기시켰다. 유기 층을 농축시키고, 상기 잔류물을 디에틸 에테르/헥산 혼합물로 연화시켰으며, 침전물이 형성되었고, 중간체 95-c가 적벽돌색 고체로서 수집되었다.
단계 3: THF(27ml) 중의 중간체 95-c(1.36g, 6.04mmol)의 용액에 아세트산 (1.1ml, 18.12mmol)을 첨가하고, 상기 반응 혼합물을 85℃까지 승온시켰다. 상기 반응물에 2.6N 수성 아질산나트륨(2.8ml, 7.25mmol)을 첨가하고, 상기 혼합물을 85℃에서 4시간 동안 교반하고, 진공하에 농축시켰다. 상기 잔류물을 에틸 아세테이트에 용해시키고, 포화 수성 NaHCO3으로 세척하고, 층들을 분리하고, 수성 상을 에틸 아세테이트로 추출하였다. 합한 유기 층을 염수로 세척하고, 무수 MgSO4로 건조시키고, 여과하고, 진공하에 농축시켰다. 실리카 겔 플래시 크로마토그래피로 정제하여, 중간체 95-d를 황색 고체로서 제공하였다. MS m/z M+Na= 258.9
단계 4: THF 중의 중간체 95-d(840mg, 3.56mmol)의 용액에 2N 수성 NaOH(1.78ml, 3.56mmol)를 첨가하였다. 상기 반응 혼합물을 50℃에서 18시간 동안 교반하고, 진공하에 농축시켜, 2-(4-플루오로페닐)-2H-테트라졸-5-카복실산, 나트륨 염(95-e)을 황색 고체로서 제공하였다. MS m/z M+1= 209.1
상기 공정에 따라 제조된 화합물들, 또는 이의 소수의 변형물들이 표 1에 예시되어 있다. 상기 공정에 대한 소수의 변형물들, 및 표 1의 화합물에 도달하기 위해 필요한 적절한 출발 재료들의 사용은 당업자에게 자명할 것이다.
표 1
실시예 9
하기 실시예는 화학식 1의 화합물 또는 이의 염의 용도를 예시한다.
형광 분극에 기초하는 경쟁 검정
표적 BIR 도메인으로의 화학식 1의 화합물의 결합을 형광-분극(FP) 검정을 사용하여 측정하였다. 형광-분극은 485nm로 설정된 여기 필터 세트 및 535nm로 설정된 발광 필터 세트를 갖는 GENios 마이크로플레이트 판독기(TECAN) Pro 기기를 사용하여 평가하였다. 상기 검정에 사용된 단백질의 최종 양은 P1 또는 P2 형광(FITC) 프로브 포화 실험에서 최대 FP 값의 80%를 수득하는 데 필요한 단백질의 양에 상응한다. 화합물 효능(IC50) 및 선택도는, 확립된 표적 단백질의 양, 형광 프로브, 및 선택된 화합물들의 검정 완충액(50mM Hepes, pH 7.5, 250 mcg/mL γ-글로불린, 2mM DTT, 1% DMSO) 중의 10개 포인트 연속 희석물의 존재하에 평가되었다.
검정은, 검정 완충액 중 최종 농도 2nM의 형광 프로브 25㎕, 희석된 화합물 25㎕, 검정 완충액 중의 BIR 단백질 25㎕ 및 검정 완충액 25㎕를 함유하는, 총 용적 100㎕의 미처리 블랙 96-웰 플레이트(Corning #3915)를 사용하여 2회씩 수행되었다. 완충액 단독(블랭크) 또는 완충액 중의 프로브 단독(G-인자)이 보정을 위한 대조군으로서 사용되었다. 상기 플레이트를 실온의 암실에서 1시간 동안 항온처리하고, 밀리분극(mP: millipolarization) 단위의 FP 값을 Genios Pro FP 판독기를 사용하여 기록하였다.
이어서, 측정된 FP 값(mP)을 화합물 농도에 대해 플로팅하고, 윈도우즈용 GraphPad Prism 버전 4.02(GraphPad Software, San Diego California USA) 및/또는 CambridgeSoft BioAssay Enterprise 버전 10.1을 사용하는 S자형 용량-반응(가변-기울기) 곡선 피팅에 기초하여 IC50 값을 산출하였다. IC50 값은 트레이서(tracer)의 50%가 전위될 때의 시험 화합물의 농도이다. ki 값은 상기된 바와 같이 산출된 IC50 값으로부터 문헌[참조: Nikolovska-Coleska, Z. (2004) Anal Biochem 332, 261-273]에 기술된 방정식에 따라 유도되었다. 그 결과가 표 2에 기재되어 있고, 여기서, A = 25nM 미만; B = 250nM 미만; C = 1000nM 미만; 및 D = 1000nM 초과이다. 화합물들은 표 1에 기재된 화합물 번호에 따라 표 3에서 식별된다. 이들 결과가 보여주는 바와 같이, 화학식 1의 화합물은 양호한 결합 친화력을 나타낸다.
표 2
세포 배양 및 세포 사멸 검정
대장 암종 HCT116 세포를, 2.2g/ℓ 중탄산나트륨, 10% FBS(HyClone) 및 1% 페니실린/스트렙토마이신(HyClone)으로 보강된 맥코이(McCoy) 5a 배지(HyClone) 중에서 웰당 2000개 세포의 밀도로 96웰 플레이트에 단층으로 배양하였다. 24시간 후, 3개씩의 웰을 화합물과 병용하여 HGS ETR1(30ng/ml)로 처리하였다. 세포를 화합물 및 HGS 작용성 트레일(Trail) 수용체 항체, ETR1(Mapatumamab, 30ng/ml)의 존재하에 72시간 동안 항온배양하였다. 잔존하는 세포의 대사 생존능력을 MTT(티아졸릴 블루 테트라졸륨 브로마이드, Sigma) 검정에 의해 평가하였다.
EC50 값(미처리 대조군에 비해 화합물의 존재하에서 50% 세포 생존율)을 BioAssay 소프트웨어(CambridgeSoft) 및 GraphPad Prism(Graph Pad Software Inc.)을 사용하여 생존 곡선으로부터 산출하였다. 그 결과가 하기 표 3에 제시되어 있고, 여기서, A = 50nM 미만; B = 250nM 미만; C= 1000nM 미만; D = 1000nM 초과이다. 화합물들은 표 1에 기재된 화합물 번호에 따라 표 3에서 식별된다. 이들 결과가 보여주는 바와 같이, 시험된 화학식 1의 화합물은 강력한 효능을 나타낸다.
표 3
애쥬번트 유도된 관절염(AIA: Adjuvant Induced Arthritis) 모델
수컷 루이스 래트(Charles River, 125 내지 150g)를, 합성 애쥬번트 지질 아민(LA)으로 챌린징시키는 날 이전에 1주일 동안 동물 시설에 순응시켰다. 실험일(d=0)에, 상기 집단의 평균 체중(BW)이 165 내지 200g일 때, 래트를 이소플루란으로 마취시키고, 하배부를 면도하고 알코올로 닦아낸 다음, 완전 프로인츠 애쥬번트(CFA: Complete Freunds Adjuvant)에 용해된 LA 0.1ml(CFA 중 50mg/mL LA)를 꼬리 기저부에서 피하 주사하였다. 실험일 d=7에, 각각의 동물에 대해 BW를 기록하고, 전자 캘리퍼(QuantuMike micrometer; Mitutoyo)를 사용하여 발목 폭을 측정하였다. 발목 폭을 기준으로 균형 그룹들을 형성하고, 치료를 시작하였다. 동물들은 d=7로부터 d=14까지 경구(PO)로 1일 1회(QD) 또는 1일 2회(BID), 시험 화합물 5, 6, 7 또는 10(표 1 참조)(10, 30 및 60mg/kg, PO), 덱사메타손(0.15mg/kg, PO) 또는 비히클 단독(5ml/kg, PO)으로 치료되었으며, BW 및 발목 폭을 매일 기록하였다.
최고 용량에서의 시험 화합물들은 대조군에 비해 발 팽창에서 50% 초과의 감소를 나타내었다. 몇몇 화합물들은 더 낮은 시험 용량에서 유사한 효력을 나타내었다. 이들 결과는 상기 적응증(indication)에 대한 시험 화합물들의 유효성을 시사한다.
콜라겐-유도된 관절염(CIA: Collagen-Induced Arthritis): 절반-치료 용량
수컷 B10 RIII 마우스(7 내지 8주령, Jackson Labs)를 1주일 동안 동물 시설에 순응시켰다. 이어서, 이들을, 실험 0일 및 15일 째에, 마이코박테리움 투베르쿨로시스(mycobacterium tuberculosis)로 보강된 CFA에 유화된 콜라겐으로 첼린징시켰다. 실험 12일 째부터, 동물에게 시험 화합물 6, 7 또는 10(표 1 참조)(3, 10, 30mg/kg, PO BID) 또는 덱사메타손(0.2mg/kg, 양성 대조군)을 투약하였다. 확립된 평점 시스템을 사용하여 연구 기간 동안 임상 관절염 중증도를 평가하였다.
시험 화합물들은 최고 용량에서의 관절염 점수에서 50% 초과의 감소를 나타내었다. 몇몇 화합물들은 더 낮은 시험 용량에서 유사한 효력을 나타내었다. 이들 결과는 상기 적응증에 대한 시험 화합물들의 유효성을 시사한다.
CIA: 치료 용량
수컷 B10 RIII 마우스(7 내지 8주령, Jackson Labs)를 1주일 동안 동물 시설에 순응시켰다. 이어서, 이들을, 실험 0일 및 15일 째에, 마이코박테리움 투베르쿨로시스로 보강된 CFA에 유화된 콜라겐으로 첼린징시켰다. 실험 15일 째부터, 동물에게 시험 화합물 10, 40, 45 또는 66(표 1 참조)(3, 10, 30mg/kg, PO BID) 또는 덱사메타손(0.2mg/kg, 양성 대조군)을 투여하였다. 확립된 평점 시스템을 사용하여 연구 기간 동안 임상 관절염 중증도를 평가하였다.
시험 화합물들은 최고 용량에서 비히클(물) 대조군에 비해 처리 동물들에서의 평균 관절염 점수를 감소시켰다.
MDA-MB-231 화합물 + 마파투바맙 이종이식 연구
암컷 누드 마우스에게 실험 0일째에 5×106 MDA-MB-231(CD) 세포를 우측 옆구리(0.1ml 용적)에서 피하로 제공하였다. 평균 종양 크기가 약 100㎣에 도달했을 때, 종양 크기를 기준으로 하는 균형 설계를 사용하여 그룹들을 형성하고, 투약을 시작하였다. 시험 화합물 10 또는 7(표 1 참조)(또는 상응하는 비히클 단독)은 매일 제공하였고, 마파투바맙(또는 상응하는 비히클 단독)은 주 2회 제공하였다. 종양 크기 및 체중을 연구 전체에 걸쳐 주 2회 측정하였다.
화합물 10 및 7은 마파투바맙(10mg/kg, IV)과 병용하여 30 및 60mg/kg(PO, QD)로 투약되었을 때, 대조군에 비해 종양 크기를 50% 감소시켰으며, 이는 시험 화합물과 마파투바맙의 병용 효과를 나타내는 것이다.
MDA-MB-231 화합물 + 탁솔 이종이식 연구
암컷 CD-1 누드 마우스에게 실험 1일째에 5×106 MDA-MB-231(CD) 세포를 우측 옆구리(0.1ml 용적, 무혈청 배지에 현탁된 세포)에서 피하로 제공하였다. 평균 종양 크기가 약 100㎣에 도달했을 때, 종양 크기를 기준으로 하는 균형 설계를 사용하여 그룹들을 형성하였다. 이어서, 화합물 10, 7, 20, 40, 45, 58, 63 및 66을 2주 동안 30 및 100mg/kg(PO)으로 주 2회 투여하였다. 탁솔(20mg/kg, IP)을 시험 화합물의 초기 치료와 함께 동시 투여한 후, 시험 기간 동안 주 1회 투여하였다. 종양 크기 및 체중을 주 2회 측정하였다.
시험 화합물은 당해 이종이식 연구에서 정체 또는 종양 회귀를 달성하였다.
최대 허용 용량(MTD: Maximum tolerated Dose) 연구
수컷 CD-1 마우스(도착시 20 내지 25g, Charles River)를 4일 동안 동물 시설에 순응시킨 후, 처리 그룹들에 무작위로 할당하였다. 동물들에게 시험 화합물 63, 58, 45, 10, 20, 40 및 66(물 중 15, 70 또는 350mg/kg, PO) 또는 물 단독(5ml/kg, PO)을 경구 위관영양에 의해 주 2회, 총 6회 처리로 투약하였다. 실험 전체에 걸쳐 체중 및 전반적 건강상태를 모니터링하였다. 최종 투약 후 24시간 후(19일 째)에, 동물을 이소플루란으로 마취시키고, 혈청 생화학을 위해 혈액을 수집하였다. 혈청 생화학 파라미터들은 무작위 글루코스, 우레아, 크레아티닌, 전체 단백질, 알부민, 글로불린, A:G 비, 전체 빌리루빈, AST, ALT, 알칼리성 포스파타제, GGT 및 아밀라제로 한정되었다. 방혈되면, 동물들을 완전 해부시키고, 뇌, 심장, 간, 비장, 신장, 위(비어있음) 및 장(비어있음, 위로부터 맹장까지)에 대해 장기 중량을 기록하였다. 몇몇 처리는 중량 증가를 억제시키기 때문에(아래 참조), 장기 중량을 뇌 중량에 규격화시킨 다음, 비히클 처리된 대조 그룹으로부터의 변화(%)로서 표시하였다.
마우스는, 처리 결과로서, 양성 성장 곡선을 나타내었고 임상 징후를 최소한으로 나타내거나 전혀 나타내지 않았으며, 화합물 63 및 40의 경우는 350mg/kg 용량에서 약간의 중량 감소가 있었다.
혈장 내 화합물의 약동학(PK)
CD-1 마우스에게 화합물 5, 6, 7, 10, 17, 34, 58, 63, 66, 77, 78, 80, 81, 86, 87, 99 및 114를 IV 또는 경구 투여에 의해 투약하였다. 투여 후, 처리된 마우스의 혈장 내 약물 농도를 HPLC-질량 분광법에 의해 측정하고, 시험 화합물들의 표준 곡선에 대해 약물 농도를 추정하였다. 혈장 농도로부터 시간-농도 곡선하 면적(AUC)을 측정하고, 경구 생체이용률(%F)을 산출하였다.
화학식 1의 시험 화합물들은 CD-1 마우스에서 양호한 경구 생체이용률(19% 내지 100% F)을 나타내었다. 추가적으로, 시험 화합물들의 그룹으로부터 선택된 화합물들은 사람 등가 용량에 대해 양성 알로메트릭 스케일링(allometric scaling)을 나타내었다.
본원에 인용된, 공보, 특허출원 및 특허를 포함하는 모든 참조문헌들은, 각각의 문헌이 개별적으로 및 구체적으로 참조로 인용되고 이의 전문이 기술되는 것과 동일한 정도로 본원에서 참조로 인용된다.
본 발명을 기술하는 문맥에서(특히 하기 특허청구범위의 문맥에서) 용어 하나("a" 및 "an") 및 상기("the") 및 유사 관계어들은, 본원에서 달리 지시되거나 문맥상 명백하게 모순되지 않는 한, 단수 형태와 복수 형태를 둘 다 포함하는 것으로 간주되어야 한다. 용어 "포함하는(comprising)", "갖는(having)", "포함하는(including)" 및 "함유하는(containing)"은, 달리 언급되지 않는 한, 오픈-엔드(open-end) 용어(즉, "비제한적으로 포함하는"의 의미)인 것으로 간주되어야 한다. 본원에서 값의 범위의 인용은, 본원에서 달리 지시되지 않는 한, 해당 범위 내에 속하는 각각의 분리된 값을 개별적으로 언급하는 약칭 방법으로서 사용되도록 의도될 뿐이며, 각각의 분리된 값은 이것이 본원에서 개별적으로 인용된 것처럼 본 명세서에 기재된다. 본원에 기술된 모든 방법들은, 본원에서 달리 지시되거나 문맥상 명백하게 모순되지 않는 한, 임의의 적합한 순서로 수행될 수 있다. 본원에 제공된 임의의 및 모든 예들, 또는 예시적 표현(예: "와 같은(such as)")의 사용은 단지 본 발명을 더 잘 예시하도록 의도된 것이며, 달리 청구되지 않는 한, 본 발명의 범위를 제약하지 않는다. 본 명세서의 어떠한 표현도, 청구되지 않은 임의의 요소가 본 발명의 실시에 필수적이라는 것을 나타내는 것으로 간주되어서는 안된다.
본 발명자들에게 공지된 본 발명을 수행하는 최상의 방식을 포함하는, 본 발명의 바람직한 양태들이 본원에 기술되어 있다. 이들 바람직한 양태의 변형들은 상기 기술내용을 읽었을 때 당업자들에게 명백해질 수 있다. 본 발명자들은 숙련자들이 이러한 변형들을 적절하게 사용할 것으로 예측하며, 본 발명자들은 본 발명이 본원에 특정하게 명시된 것과 다르게 실시될 것으로 사료한다. 따라서, 본 발명은, 적용가능한 법에 의해 허용되는 바와 같은, 본원에 첨부된 특허청구범위에 인용된 주제의 모든 변형들 및 동등물들을 포함한다. 또한, 본원에서 달리 지시되거나 문맥상 명백하게 모순되지 않는 한, 이의 모든 가능한 변형들에서의 상기된 요소들의 임의의 조합도 본 발명에 포함된다.
Claims (34)
- 화학식 1의 화합물 또는 이의 염:
화학식 1
상기 화학식 1에서,
R1은 H 또는 알킬이고;
R2는 메틸 또는 에틸이고;
R3은 알킬, 사이클로알킬, 헤테로사이클릴, 헤테로아릴 또는 아릴이고, 이들 중의 어느 것은 임의로 아미노, 알킬아미노 또는 알콕시로 추가로 치환될 수 있고;
R4 및 R5는, 각각 독립적으로, H 또는 알킬이고;
R6은 H, 할로겐 또는 알콕시이고;
X는 O, S, CH2, -(CH2)2- 또는 CH-R7이고, 여기서, R7은 NR8, OR8, NC(O)OR8, NHC(O)R8 또는 NHSO2R8이고, 여기서, R8은 알킬, 사이클로알킬, 헤테로사이클릴, 아릴, 아릴알킬 또는 헤테로아릴(이들 중의 어느 것은 임의로 알킬 또는 할로겐으로 추가로 치환될 수 있다)이고;
G는,
(1) (여기서, R9는 치환되거나 치환되지 않은 알킬, 사이클로알킬, 헤테로사이클릴, 아릴 또는 헤테로아릴이다); 또는
(2) 치환되거나 치환되지 않은 아릴, 헤테로아릴, 사이클로알킬 또는 헤테로사이클릴에 임의로 융합된, 치환되거나 치환되지 않은 아졸 또는 피롤 환이다. - 제1항 내지 제4항 중 어느 한 항에 있어서, R6이 H, F 또는 메톡시인, 화합물.
- 제1항 내지 제5항 중 어느 한 항에 있어서, X가 -CH2-인, 화합물.
- 제1항 내지 제5항 중 어느 한 항에 있어서, X가 CH-NHC(O)R8이고, R8이 알킬, 아릴, 아릴알킬, 알콕시 또는 헤테로아릴(이들 중의 어느 것은 임의로 알킬 또는 할로겐으로 추가로 치환될 수 있다)인, 화합물.
- 제1항 내지 제5항 중 어느 한 항에 있어서, X가 CH-OR8이고, R8이, 임의로 할로겐으로 추가로 치환될 수 있는, 아릴 또는 아릴알킬인, 화합물.
- 제1항 내지 제9항 중 어느 한 항에 있어서, R4 및 R5가 둘 다 수소인, 화합물.
- 제1항 내지 제10항 중 어느 한 항에 있어서, R1 및 R2가 둘 다 메틸인, 화합물.
- 세포를 제1항 내지 제13항 중 어느 한 항의 화합물과 접촉시킴을 포함하는, 세포에서의 아폽토시스를 증진시키는 방법.
- 제14항에 있어서, 상기 세포가 암 세포인, 방법.
- 세포를 제1항 내지 제13항 중 어느 한 항의 화합물과 접촉시킴을 포함하는, 세포로부터의 염증성 사이토킨의 방출을 변화시키는 방법.
- 제16항에 있어서, 상기 세포가 림프구, 과립구 또는 항원 제시 세포인, 방법.
- 제14항에 있어서, 상기 세포가 개체(subject) 내에 존재하고, 상기 개체에게 제1항 내지 제13항 중 어느 한 항의 화합물을 투여함으로써, 상기 세포가 제1항 내지 제13항 중 어느 한 항의 화합물과 접촉되는, 방법.
- 제14항 내지 제18항 중 어느 한 항에 있어서, 제1항 내지 제13항 중 어느 한 항의 화합물을 투여하기 전에, 이와 동시에 또는 이후에 상기 개체에게 화학치료제를 투여함을 추가로 포함하는, 방법.
- 제14항 내지 제19항 중 어느 한 항에 있어서, 제1항 내지 제13항 중 어느 한 항의 화합물을 투여하기 전에, 이와 동시에 또는 이후에 상기 개체에게 사멸 수용체 작용제를 투여함을 추가로 포함하는, 방법.
- 제20항에 있어서, 상기 사멸 수용체 작용제가 TRAIL인, 방법.
- 제21항에 있어서, 상기 사멸 수용체 작용제가 TRAIL 수용체 항체인, 방법.
- 제20항 내지 제22항 중 어느 한 항에 있어서, 상기 사멸 수용체 작용제가 상승 효과를 생성하는 양으로 투여되는, 방법.
- 제14항 내지 제23항 중 어느 한 항에 있어서, 상기 개체가 사람인, 방법.
- 제24항에 있어서, 상기 개체가 증식성 질환을 앓고 있는, 방법.
- 제25항에 있어서, 상기 증식성 질환이 암인, 방법.
- 제25항에 있어서, 상기 증식성 질환이 자가면역 질환 또는 염증성 장애인, 방법.
- 제1항 내지 제13항 중 어느 한 항에 있어서, 제14항 내지 제27항 중 어느 한 항의 방법에 따라서 세포에서의 아폽토시스를 증진시키기 위한, 화합물.
- 제1항 내지 제13항 중 어느 한 항에 있어서, 증식성 질환 치료용 약제로서 사용하기 위한, 화합물.
- 증식성 질환 치료용 약제를 제조하기 위한, 제1항 내지 제13항 중 어느 한 항의 화합물의 용도.
- 화학식 1-i 내지 1-vi, 2-i 내지 2-iv, 4-i 또는 4-ii 중의 어느 하나의 화합물.
- 화학식 1-vi의 화합물을 화학식 LG-C(O)-G의 화합물과 배합한 다음(여기서, LG는 이탈 그룹이고, PG4는 보호 그룹이다), PG4를 탈보호시켜 화학식 1의 화합물을 제공함을 포함하는, 제1항의 화합물의 제조방법으로서:
;
상기 방법은 임의로,
(a) 화학식 1-v의 화합물의 PG2(여기서, PG2는 보호 그룹이다)를 탈보호시켜 화학식 1-vi의 화합물을 제공함을 추가로 포함하고:
상기 방법은 임의로,
(b) 화학식 1-iv의 화합물을 PG4(R1)N(R2)CHCO2H(여기서, PG4는 PG2와 상이한 보호 그룹이다)와 커플링시켜 화학식 1-v의 화합물을 제공함을 추가로 포함하고:
상기 방법은 임의로,
(c) 화학식 1-iii의 화합물을 PG3(H)N(R3)CHCO2H(여기서, PG3은 PG2와 상이한 보호 그룹이다)와 커플링시킨 다음, PG3을 탈보호시켜 화학식 1-iv의 화합물을 제공함을 추가로 포함하고:
;
상기 방법은 임의로,
(d) 화학식 1-ii의 화합물의 아민 그룹을 PG1과 상이한 보호 그룹(PG2)으로 보호시킨 다음, PG1을 탈보호시켜 화학식 1-iii의 화합물을 제공함을 추가로 포함하고:
상기 방법은 임의로,
(e) 화학식 1-i의 화합물을 화학식 를 갖는 아민과 배합한 다음, 하이드라이드로 환원시켜 화학식 1-ii의 화합물(여기서, PG1은 보호 그룹이다)을 제공함을 추가로 포함하는, 방법:
- 화학식 1-vi의 화합물을 화학식 LG-C(O)-G(여기서, LG는 이탈 그룹이다)의 화합물과 배합한 다음, PG4를 탈보호시켜 화학식 1의 화합물을 제공함을 포함하는, 제1항의 화합물의 제조방법으로서:
;
상기 방법은 임의로,
(a) 화학식 2-iv의 화합물을 환원적 아민화시켜 화학식 1-vi의 화합물을 제공함을 추가로 포함하고:
;
상기 방법은 임의로,
(b) 화학식 2-iii의 화합물을 산화시켜 화학식 2-iv의 화합물을 제공함을 추가로 포함하고:
;
상기 방법은 임의로,
(c) 화학식 2-ii의 화합물을 화학식 PG4(R1)N(R2)CHCO2H(여기서, PG4는 보호 그룹이다)의 화합물과 커플링시켜 화학식 2-iii의 화합물을 제공함을 추가로 포함하고:
;
상기 방법은 임의로,
(d) 화학식 2-i의 화합물을 화학식 PG3(H)N(R3)CHCO2H(여기서, PG3은 보호 그룹이다)의 화합물과 커플링시킨 다음, PG3을 탈보호시켜 화학식 2-ii의 중간체 화합물을 제공함을 추가로 포함하는, 방법:
- 화학식 1-vi의 화합물을 탈보호시켜 화학식 1의 화합물을 제공함을 포함하는, 제1항의 화합물의 제조방법으로서:
;
상기 방법은 임의로,
(a) 화학식 4-ii의 화합물을 화학식 PG4(R1)N(R2)CHCO2H(여기서, PG4는 보호 그룹이다)를 갖는 화합물과 커플링시켜 화학식 1-vi의 화합물을 제공함을 추가로 포함하고:
;
상기 방법은 임의로,
(b) 화학식 4-i의 화합물을 화학식 PG3(H)N(R3)CHCO2H(여기서, PG3은 보호 그룹이다)를 갖는 화합물과 커플링시킨 다음, PG3을 탈보호시켜 화학식 4-ii의 화합물을 제공함을 추가로 포함하고:
;
상기 방법은 임의로,
(c) 화학식 1-ii(여기서, PG1은 보호 그룹이다)의 화합물을 화학식 LG-C(O)-G의 화합물과 배합한 다음, PG1을 탈보호시켜 화학식 4-i의 중간체 화합물을 제공함을 추가로 포함하는, 방법:
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US30380910P | 2010-02-12 | 2010-02-12 | |
| US61/303,809 | 2010-02-12 | ||
| US41563810P | 2010-11-19 | 2010-11-19 | |
| US61/415,638 | 2010-11-19 | ||
| PCT/IB2011/000264 WO2011098904A1 (en) | 2010-02-12 | 2011-02-11 | Iap bir domain binding compounds |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20120140658A true KR20120140658A (ko) | 2012-12-31 |
Family
ID=44367332
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020127023798A KR20120140658A (ko) | 2010-02-12 | 2011-02-11 | Iap bir 도메인 결합 화합물 |
Country Status (14)
| Country | Link |
|---|---|
| US (1) | US9284350B2 (ko) |
| EP (2) | EP2534170B1 (ko) |
| KR (1) | KR20120140658A (ko) |
| CN (1) | CN102985439B9 (ko) |
| AU (1) | AU2011214057B2 (ko) |
| BR (1) | BR112012020113A2 (ko) |
| ES (1) | ES2625637T3 (ko) |
| IL (1) | IL221069A0 (ko) |
| MX (1) | MX340870B (ko) |
| NZ (1) | NZ602368A (ko) |
| RU (1) | RU2567544C2 (ko) |
| SG (2) | SG10201501095WA (ko) |
| WO (1) | WO2011098904A1 (ko) |
| ZA (1) | ZA201206802B (ko) |
Families Citing this family (15)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| NZ602368A (en) * | 2010-02-12 | 2014-10-31 | Pharmascience Inc | Iap bir domain binding compounds |
| UY33794A (es) | 2010-12-13 | 2012-07-31 | Novartis Ag | Inhibidores diméricos de las iap |
| JP2014528409A (ja) | 2011-09-30 | 2014-10-27 | テトラロジック ファーマシューティカルズ コーポレーション | 増殖性疾患(がん)の治療において使用するためのSMAC模倣体(ビリナパント(birinapant)) |
| EP3682873B1 (en) | 2013-06-25 | 2024-06-12 | The Walter and Eliza Hall Institute of Medical Research | Smac mimetics for use in the treatment of persistent hiv infection |
| CN103360367A (zh) * | 2013-07-31 | 2013-10-23 | 西北大学 | 一种脯氨酸衍生的手性胺及其制备方法 |
| JP6498672B2 (ja) | 2013-12-20 | 2019-04-10 | エステベ ファーマシューティカルズ,ソシエダッド アノニマEsteve Pharmaceuticals,S.A. | 疼痛に対して多重モードの活性を有するピペリジン化合物 |
| RU2709482C1 (ru) | 2013-12-20 | 2019-12-18 | Эстеве Фармасьютикалз, С.А. | Производные пиперазина, характеризующиеся мультимодальной активностью в отношении боли |
| JP2017502010A (ja) | 2013-12-20 | 2017-01-19 | ラボラトリオス・デル・デエレ・エステベ・エセ・ア | 疼痛に対して多重モードの活性を有するピペリジン誘導体 |
| WO2016079527A1 (en) | 2014-11-19 | 2016-05-26 | Tetralogic Birinapant Uk Ltd | Combination therapy |
| WO2016097773A1 (en) | 2014-12-19 | 2016-06-23 | Children's Cancer Institute | Therapeutic iap antagonists for treating proliferative disorders |
| EP3831811A4 (en) * | 2018-07-31 | 2022-04-20 | Fimecs, Inc. | HETEROCYCLIC COMPOUND |
| JP2022523916A (ja) | 2019-01-30 | 2022-04-27 | モンテリノ・セラピューティクス・インコーポレイテッド | アンドロゲン受容体を標的とするユビキチン化のための二官能性化合物および方法 |
| CN112142823B (zh) * | 2019-06-28 | 2022-08-05 | 深圳翰宇药业股份有限公司 | 一种zp-1609的合成方法 |
| WO2021020585A1 (ja) | 2019-07-31 | 2021-02-04 | ファイメクス株式会社 | 複素環化合物 |
| US20230233691A1 (en) | 2021-10-22 | 2023-07-27 | University Of Houston System | Methods and compositions for treating chronic inflammatory injury, metaplasia, dysplasia and cancers of epithelial tissues |
Family Cites Families (174)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4450150A (en) | 1973-05-17 | 1984-05-22 | Arthur D. Little, Inc. | Biodegradable, implantable drug delivery depots, and method for preparing and using the same |
| JPH0680077B2 (ja) | 1985-02-08 | 1994-10-12 | サントリー株式会社 | プロリンエンドペプチダ−ゼインヒビタ−活性を有する新規ペプチド化合物 |
| US4816444A (en) | 1987-07-10 | 1989-03-28 | Arizona Board Of Regents, Arizona State University | Cell growth inhibitory substance |
| US5750646A (en) | 1987-09-24 | 1998-05-12 | The Administrators Of The Tulane Educational Fund | Bradykinin analogs with non-peptide bond |
| US4879278A (en) | 1989-05-16 | 1989-11-07 | Arizona Board Of Regents | Isolation and structural elucidation of the cytostatic linear depsipeptide dolastatin 15 |
| US5010099A (en) | 1989-08-11 | 1991-04-23 | Harbor Branch Oceanographic Institution, Inc. | Discodermolide compounds, compositions containing same and method of preparation and use |
| US4939168A (en) | 1989-08-11 | 1990-07-03 | Harbor Branch Oceanographics Institution, Inc. | Discodermolide compounds, compositions containing same and methods of preparation and use |
| GB9016810D0 (en) | 1990-07-31 | 1990-09-12 | Wellcome Found | Peptides |
| JPH04208299A (ja) | 1990-11-30 | 1992-07-29 | Ajinomoto Co Inc | プロリルエンドペプチターゼ阻害ペプチド |
| US5387671A (en) | 1990-12-27 | 1995-02-07 | Abbott Laboratories | Hexa- and heptapeptide anaphylatoxin-receptor ligands |
| ATE190983T1 (de) | 1991-08-09 | 2000-04-15 | Teikoku Hormone Mfg Co Ltd | Neue tetrapeptidderivate |
| US5728725A (en) | 1991-09-23 | 1998-03-17 | Florida State University | C2 taxane derivaties and pharmaceutical compositions containing them |
| US5721268A (en) | 1991-09-23 | 1998-02-24 | Florida State University | C7 taxane derivatives and pharmaceutical compositions containing them |
| US5399726A (en) | 1993-01-29 | 1995-03-21 | Florida State University | Process for the preparation of baccatin III analogs bearing new C2 and C4 functional groups |
| US5714513A (en) | 1991-09-23 | 1998-02-03 | Florida State University | C10 taxane derivatives and pharmaceutical compositions |
| US6011056A (en) | 1991-09-23 | 2000-01-04 | Florida State University | C9 taxane derivatives and pharmaceutical compositions containing them |
| US5990325A (en) | 1993-03-05 | 1999-11-23 | Florida State University | Process for the preparation of 9-desoxotaxol, 9-desoxobaccatin III and analogs thereof |
| IT1254515B (it) | 1992-03-06 | 1995-09-25 | Indena Spa | Tassani di interesse oncologico, loro metodo di preparazione ed uso |
| US5831002A (en) | 1992-05-20 | 1998-11-03 | Basf Aktiengesellschaft | Antitumor peptides |
| US5635483A (en) | 1992-12-03 | 1997-06-03 | Arizona Board Of Regents Acting On Behalf Of Arizona State University | Tumor inhibiting tetrapeptide bearing modified phenethyl amides |
| IT1261667B (it) | 1993-05-20 | 1996-05-29 | Tassano ad attivita' antitumorale. | |
| US5955423A (en) | 1993-12-21 | 1999-09-21 | The University Of Hawaii | Cryptophycins |
| US5952298A (en) | 1993-12-21 | 1999-09-14 | The University Of Hawaii | Cryptophycins |
| US5530097A (en) | 1994-08-01 | 1996-06-25 | Arizona Board Of Regents Acting On Behalf Of Arizona State University | Human cancer inhibitory peptide amides |
| US5521284A (en) | 1994-08-01 | 1996-05-28 | Arizona Board Of Regents Acting On Behalf Of Arizona State University | Human cancer inhibitory pentapeptide amides and esters |
| US5504191A (en) | 1994-08-01 | 1996-04-02 | Arizona Board Of Regents Acting On Behalf Of Arizona State University | Human cancer inhibitory pentapeptide methyl esters |
| US6500858B2 (en) | 1994-10-28 | 2002-12-31 | The Research Foundation Of The State University Of New York | Taxoid anti-tumor agents and pharmaceutical compositions thereof |
| US6100411A (en) | 1994-10-28 | 2000-08-08 | The Research Foundation Of State University Of New York | Taxoid anti-tumor agents and pharmaceutical compositions thereof |
| WO1996013495A1 (en) | 1994-10-28 | 1996-05-09 | The Research Foundation Of State University Of New York | Taxoid derivatives, their preparation and their use as antitumor agents |
| US6458976B1 (en) | 1994-10-28 | 2002-10-01 | The Research Foundation Of State University Of New York | Taxoid anti-tumor agents, pharmaceutical compositions, and treatment methods |
| EP0738265A1 (en) | 1994-11-04 | 1996-10-23 | PHARMACIA S.p.A. | Taxane derivatives |
| US5473057A (en) | 1994-11-09 | 1995-12-05 | The Regents Of The University Of California | Eleutherobin and analogs thereof |
| US5599902A (en) | 1994-11-10 | 1997-02-04 | Arizona Board Of Regents Acting On Behalf Of Arizona State University | Cancer inhibitory peptides |
| US5580899A (en) | 1995-01-09 | 1996-12-03 | The Liposome Company, Inc. | Hydrophobic taxane derivatives |
| US6156535A (en) | 1995-08-04 | 2000-12-05 | University Of Ottawa | Mammalian IAP gene family, primers, probes, and detection methods |
| FI101923B1 (fi) | 1995-12-05 | 1998-09-15 | Nokia Telecommunications Oy | Puheenvuorojen jakaminen suorakanavalla liikennöiville matkaviestimille |
| US5681847A (en) | 1995-12-05 | 1997-10-28 | Harbor Branch Oceanographic Institution, Inc. | Methods of using discodermolide compounds |
| US5767297A (en) | 1997-02-05 | 1998-06-16 | Ensuiko Sugar Refining Co., Ltd. | Taxoid derivative and method of producing thereof |
| WO1997033552A1 (en) | 1996-03-12 | 1997-09-18 | Pg-Txl Company, L.P. | Water soluble paclitaxel prodrugs |
| US6441025B2 (en) | 1996-03-12 | 2002-08-27 | Pg-Txl Company, L.P. | Water soluble paclitaxel derivatives |
| US6133437A (en) | 1997-02-13 | 2000-10-17 | Apoptogen, Inc. | Modulation of IAPs for the treatment of proliferative diseases |
| IT1283633B1 (it) | 1996-05-10 | 1998-04-23 | Indena Spa | Derivati tassanici loro sintesi e formulazioni che li contengono |
| US5919815A (en) | 1996-05-22 | 1999-07-06 | Neuromedica, Inc. | Taxane compounds and compositions |
| BR9710366A (pt) | 1996-07-15 | 1999-08-17 | Yakult Honsha Kk | Derivados de taxane e drogas que os contêm |
| US5939527A (en) | 1996-07-30 | 1999-08-17 | Basf Aktiengesellschaft | Tetrapeptides as antitumor agents |
| US5741892A (en) | 1996-07-30 | 1998-04-21 | Basf Aktiengesellschaft | Pentapeptides as antitumor agents |
| WO1998008833A1 (en) | 1996-08-26 | 1998-03-05 | Bristol-Myers Squibb Company | Sulfenamide taxane derivatives |
| CA2273083C (en) | 1996-12-03 | 2012-09-18 | Sloan-Kettering Institute For Cancer Research | Synthesis of epothilones, intermediates thereto, analogues and uses thereof |
| US6380394B1 (en) | 1996-12-13 | 2002-04-30 | The Scripps Research Institute | Epothilone analogs |
| US6441186B1 (en) | 1996-12-13 | 2002-08-27 | The Scripps Research Institute | Epothilone analogs |
| NZ337195A (en) | 1997-02-25 | 2001-05-25 | Biotechnolog Forschung Gmbh | Epothilones with a modified side chain |
| US5886025A (en) | 1997-03-06 | 1999-03-23 | Baylor University | Anti-mitotic agents which inhibit tubulin polymerization |
| US5965537A (en) | 1997-03-10 | 1999-10-12 | Basf Aktiengesellschaft | Dolastatin 15 derivatives with carbonyl and heterocyclic functionalities at the C-terminus |
| US6103698A (en) | 1997-03-13 | 2000-08-15 | Basf Aktiengesellschaft | Dolastatin-15 derivatives in combination with taxanes |
| FR2761990B1 (fr) | 1997-04-10 | 1999-06-25 | Pf Medicament | Derives halogenes antimitotiques d'alcaloides de vinca |
| PT1860187E (pt) | 1997-05-15 | 2011-10-04 | Genentech Inc | Receptor apo-2 |
| US6605599B1 (en) | 1997-07-08 | 2003-08-12 | Bristol-Myers Squibb Company | Epothilone derivatives |
| US6143721A (en) | 1997-07-18 | 2000-11-07 | Basf Aktiengesellschaft | Dolastatin 15 derivatives |
| DK1005465T3 (da) | 1997-08-09 | 2007-11-05 | Bayer Schering Pharma Ag | Nye epothilon-derivater, fremgangsmåde til fremstilling heraf og deres farmaceutiske anvendelse |
| JPH1192468A (ja) | 1997-09-17 | 1999-04-06 | Yakult Honsha Co Ltd | 新規なタキサン誘導体 |
| JP4153660B2 (ja) | 1997-10-08 | 2008-09-24 | 株式会社横浜国際バイオ研究所 | タキソイド誘導体およびその製造方法 |
| US5965718A (en) | 1997-10-24 | 1999-10-12 | The Scripps Research Institute | Analogs of sarcodictyin and eleutherobin |
| CN1221539C (zh) | 1997-12-19 | 2005-10-05 | 株式会社益力多本社 | 紫杉烷衍生物 |
| US6423689B1 (en) | 1997-12-22 | 2002-07-23 | Warner-Lambert Company | Peptidyl calcium channel blockers |
| US6302838B1 (en) | 1998-02-25 | 2001-10-16 | Novartis Ag | Cancer treatment with epothilones |
| US6498257B1 (en) | 1998-04-21 | 2002-12-24 | Bristol-Myers Squibb Company | 2,3-olefinic epothilone derivatives |
| US6399638B1 (en) | 1998-04-21 | 2002-06-04 | Bristol-Myers Squibb Company | 12,13-modified epothilone derivatives |
| US6252050B1 (en) | 1998-06-12 | 2001-06-26 | Genentech, Inc. | Method for making monoclonal antibodies and cross-reactive antibodies obtainable by the method |
| US6258841B1 (en) | 1998-06-29 | 2001-07-10 | Parker Hughes Institute | Tubulin binding compounds (COBRA) |
| US5985837A (en) | 1998-07-08 | 1999-11-16 | Basf Aktiengesellschaft | Dolastatin 15 derivatives |
| DE19843730A1 (de) | 1998-09-24 | 2000-03-30 | Sueddeutsche Kalkstickstoff | Stabilisierte, wasserlösliche Polymerpulver auf Basis von Polyoxyalkylenglykol-Carboxylaten und Verfahren zu deren Herstellung |
| US6127406A (en) | 1998-10-09 | 2000-10-03 | Harbor Branch Oceanographic Institution, Inc. | Discodermolide compounds and methods of use |
| EP1135470A2 (en) | 1998-11-20 | 2001-09-26 | Kosan Biosciences, Inc. | Recombinant methods and materials for producing epothilone and epothilone derivatives |
| AU2190700A (en) | 1998-12-17 | 2000-07-03 | Tularik Inc. | Tubulin-binding agents |
| ATE248175T1 (de) | 1998-12-22 | 2003-09-15 | Novartis Pharma Gmbh | Epothilonderivate und ihre verwendung als antitumormittel |
| HUP0105478A3 (en) | 1999-02-18 | 2002-08-28 | Schering Ag | 16-halogen-epothilone derivatives, method for producing them and their pharmaceutical use |
| MXPA01008374A (es) | 1999-02-22 | 2003-06-06 | Squibb Bristol Myers Co | Epotilonas c-21 modificadas. |
| US6291684B1 (en) | 1999-03-29 | 2001-09-18 | Bristol-Myers Squibb Company | Process for the preparation of aziridinyl epothilones from oxiranyl epothilones |
| US6323315B1 (en) | 1999-09-10 | 2001-11-27 | Basf Aktiengesellschaft | Dolastatin peptides |
| US6110691A (en) | 2000-01-06 | 2000-08-29 | Board Of Regents, The University Of Texas System | Activators of caspases |
| US6414015B1 (en) | 2000-01-28 | 2002-07-02 | Utah State University | Laulimalide microtubule stabilizing agents |
| WO2001062239A2 (en) | 2000-02-24 | 2001-08-30 | Harbor Branch Oceanographic Institution, Inc. | Novel compositions and uses of dictyostatin compounds |
| ATE286890T1 (de) | 2000-03-01 | 2005-01-15 | Harbor Branch Oceanographic | Biologisch wirksame, analoge verbindungen von discodermoliden |
| US6362217B2 (en) | 2000-03-17 | 2002-03-26 | Bristol-Myers Squibb Company | Taxane anticancer agents |
| US6489314B1 (en) | 2001-04-03 | 2002-12-03 | Kosan Biosciences, Inc. | Epothilone derivatives and methods for making and using the same |
| US6589968B2 (en) | 2001-02-13 | 2003-07-08 | Kosan Biosciences, Inc. | Epothilone compounds and methods for making and using the same |
| TWI318983B (en) | 2000-05-02 | 2010-01-01 | Uab Research Foundation | An antibody selective for a tumor necrosis factor-related apoptosis-inducing ligand receptor and uses thereof |
| US20020045609A1 (en) | 2000-05-26 | 2002-04-18 | Gary Ashley | Epothilone derivatives and methods for making and using the same |
| UA75365C2 (en) | 2000-08-16 | 2006-04-17 | Bristol Myers Squibb Co | Epothilone analog polymorph modifications, a method for obtaining thereof (variants), a pharmaceutical composition based thereon |
| US6608026B1 (en) | 2000-08-23 | 2003-08-19 | Board Of Regents, The University Of Texas System | Apoptotic compounds |
| US6624317B1 (en) | 2000-09-25 | 2003-09-23 | The University Of North Carolina At Chapel Hill | Taxoid conjugates as antimitotic and antitumor agents |
| AU2001293189A1 (en) | 2000-09-29 | 2002-04-08 | Trustees Of Princeton University | Compositions and methods for regulating apoptosis |
| US6992063B2 (en) | 2000-09-29 | 2006-01-31 | The Trustees Of Princeton University | Compositions and method for regulating apoptosis |
| WO2002030959A2 (en) | 2000-10-13 | 2002-04-18 | Abbott Laboratories | Peptides derived from smac (diablo) and methods of use therefor |
| US20070292411A1 (en) | 2000-11-08 | 2007-12-20 | Human Genome Sciences, Inc. | Antibodies That Immunospecifically Bind to TRAIL Receptors |
| JP2004518728A (ja) | 2001-02-09 | 2004-06-24 | コーサン バイオサイエンシーズ, インコーポレイテッド | ラウリマリド誘導体 |
| US6893859B2 (en) | 2001-02-13 | 2005-05-17 | Kosan Biosciences, Inc. | Epothilone derivatives and methods for making and using the same |
| CA2438598A1 (en) | 2001-02-20 | 2002-08-29 | Francis Y. F. Lee | Epothilone derivatives for the treatment of refractory tumors |
| US20030083263A1 (en) | 2001-04-30 | 2003-05-01 | Svetlana Doronina | Pentapeptide compounds and uses related thereto |
| US20030023082A1 (en) | 2001-05-15 | 2003-01-30 | Gary Ashley | Epothilone derivatives and methods for making and using the same |
| US7115717B2 (en) | 2001-05-18 | 2006-10-03 | Kirin Beer Kabushiki Kaisha | Anti-TRAIL-R antibodies |
| US7361341B2 (en) | 2001-05-25 | 2008-04-22 | Human Genome Sciences, Inc. | Methods of treating cancer using antibodies that immunospecifically bind to trail receptors |
| US20050176649A1 (en) | 2001-05-31 | 2005-08-11 | Mclendon George | Iap binding peptides and assays for identifying compounds that bind iap |
| JP2004532888A (ja) | 2001-06-01 | 2004-10-28 | ブリストル−マイヤーズ スクイブ カンパニー | エポチロン誘導体 |
| US6737409B2 (en) | 2001-07-19 | 2004-05-18 | Hoffmann-La Roche Inc. | Dolastatin 10 derivatives |
| US20060258581A1 (en) | 2001-11-21 | 2006-11-16 | Reed John C | Methods and composition for derepressions of IAP-inhibited caspase |
| WO2003045324A2 (en) | 2001-11-26 | 2003-06-05 | Kosan Biosciences, Inc. | 14-methyl-epothilones |
| US20030180296A1 (en) | 2001-12-20 | 2003-09-25 | Theodora Salcedo | Antibodies that immunospecifically bind to trail receptors |
| DE10164592A1 (de) | 2001-12-21 | 2003-07-03 | Schering Ag | C1-C6-Epothilon-Fragmente und Verfahren für die Herstellung von C1-C6-Fragmenten von Epothilonen und deren Derivaten |
| WO2003074521A1 (en) | 2002-03-01 | 2003-09-12 | University Of Notre Dame | Derivatives of epothilone b and d and synthesis thereof |
| US7211593B2 (en) | 2002-03-12 | 2007-05-01 | Bristol-Myers Squibb Co. | C12-cyano epothilone derivatives |
| WO2003086470A2 (en) | 2002-04-17 | 2003-10-23 | Deutsches Krebsforschungszentrum | Smac-peptides as therapeutics against cancer and autoimmune diseases |
| EP1509507A4 (en) | 2002-05-23 | 2006-09-13 | Merck & Co Inc | INHIBITORS OF MITOTIC KINESIN |
| EP1519918A1 (en) | 2002-07-02 | 2005-04-06 | Novartis AG | Peptide inhibitors of smac protein binding to inhibitor of apoptosis proteins (iap) |
| ATE415413T1 (de) | 2002-07-15 | 2008-12-15 | Univ Princeton | Iap-bindende verbindungen |
| BR0316737A (pt) | 2002-11-27 | 2005-12-13 | Irm Llc | Métodos e composições para induzir apoptose em células cancerosas |
| WO2004066958A2 (en) | 2003-01-30 | 2004-08-12 | The Trustees Of Princeton University | Caspase-9:bir3 domain of xiap complexes and methods of use |
| CA2553871A1 (en) | 2004-01-16 | 2005-08-04 | The Regents Of The University Of Michigan | Smac peptidomimetics and the uses thereof |
| WO2005074989A2 (en) | 2004-02-05 | 2005-08-18 | Novartis Ag | Combination of a dna topoisomerase inhibitor and an iap inhibitor |
| AU2005218555B2 (en) | 2004-03-01 | 2008-01-03 | Board Of Regents, The University Of Texas System | Dimeric small molecule potentiators of apoptosis |
| AU2005228950B2 (en) | 2004-03-23 | 2012-02-02 | Genentech, Inc. | Azabicyclo-octane inhibitors of IAP |
| AR048927A1 (es) | 2004-04-07 | 2006-06-14 | Novartis Ag | Compuestos heterociclicos como inhibidores de proteinas de apoptosis (iap); composiciones farmaceuticas que los contienen y su uso en el tratamiento de una enfermedad proliferativa |
| CA2570321C (en) | 2004-07-02 | 2013-10-08 | Genentech, Inc. | Inhibitors of iap |
| US7674787B2 (en) | 2004-07-09 | 2010-03-09 | The Regents Of The University Of Michigan | Conformationally constrained Smac mimetics and the uses thereof |
| WO2006017295A2 (en) | 2004-07-12 | 2006-02-16 | Idun Pharmaceuticals, Inc. | Tetrapeptide analogs |
| CA2574040C (en) | 2004-07-15 | 2014-05-06 | Tetralogic Pharmaceuticals Corporation | Iap binding compounds |
| CN100427505C (zh) | 2004-08-19 | 2008-10-22 | 中国医学科学院基础医学研究所 | 抗人肿瘤坏死因子相关凋亡诱导配体的受体dr5单克隆抗体(ad5-10)及其制法与用途 |
| EA019420B1 (ru) | 2004-12-20 | 2014-03-31 | Дженентех, Инк. | Пирролидиновые ингибиторы иап (ингибиторов апоптоза) |
| US8029783B2 (en) | 2005-02-02 | 2011-10-04 | Genentech, Inc. | DR5 antibodies and articles of manufacture containing same |
| CN103083644B (zh) | 2005-02-25 | 2014-05-28 | 泰特拉洛吉克药业公司 | Iap二聚体抑制剂 |
| US20070003535A1 (en) | 2005-03-17 | 2007-01-04 | Reed John C | Methods and compositions for derepression of IAP-inhibited caspase |
| GB0506589D0 (en) | 2005-03-31 | 2005-05-04 | British Telecomm | Optical fibre installation apparatus |
| DE102005017116A1 (de) | 2005-04-13 | 2006-10-26 | Novartis Ag | Hemmstoffe für Inhibitoren von Apoptose Proteinen (IAP) |
| JP4954983B2 (ja) * | 2005-05-18 | 2012-06-20 | ファーマサイエンス・インコーポレイテッド | Birドメイン結合化合物 |
| AU2006254538A1 (en) | 2005-05-25 | 2006-12-07 | 2Curex Aps | Compounds modifying apoptosis |
| MX2007015419A (es) | 2005-06-08 | 2008-02-21 | Novartis Ag | Compuestos organicos. |
| US20070042428A1 (en) | 2005-08-09 | 2007-02-22 | Stacy Springs | Treatment of proliferative disorders |
| PE20071101A1 (es) | 2005-08-31 | 2007-12-21 | Amgen Inc | Polipeptidos y anticuerpos |
| CN101360728A (zh) * | 2005-10-25 | 2009-02-04 | 艾吉拉医疗股份有限公司 | Iap bir结构域结合化合物 |
| KR20080067357A (ko) | 2005-10-25 | 2008-07-18 | 에게라 쎄라퓨틱스 인코포레이티드 | Iap bir 도메인 결합 화합물 |
| US8247557B2 (en) | 2005-12-19 | 2012-08-21 | Genentech, Inc. | IAP inhibitors |
| WO2007075525A2 (en) | 2005-12-20 | 2007-07-05 | Novartis Ag | Combination of an iap-inhibitor and a taxane7 |
| WO2007101347A1 (en) | 2006-03-07 | 2007-09-13 | Aegera Therapeutics Inc. | Bir domain binding compounds |
| TWI504597B (zh) | 2006-03-16 | 2015-10-21 | Pharmascience Inc | 結合於細胞凋亡抑制蛋白(iap)之桿狀病毒iap重複序列(bir)區域之化合物 |
| CN101443309B (zh) * | 2006-03-16 | 2013-04-24 | 埃格拉医疗公司 | Iap bir域结合化合物 |
| BRPI0708942A2 (pt) | 2006-03-21 | 2011-06-14 | Joyant Pharmaceuticals Inc | composto promotor de apoptose, uso e mÉtodo de produÇço do mesmo e composiÇço farmacÊutica |
| PL2019671T3 (pl) | 2006-05-05 | 2015-02-27 | Univ Michigan Regents | Związki pośrednie do wytwarzania dwuwartościowych mimetyków Smac |
| BRPI0711591A2 (pt) | 2006-05-16 | 2011-11-16 | Aegera Therapeutics Inc | composto de ligação de domìnio bir da iap |
| WO2008014240A2 (en) | 2006-07-24 | 2008-01-31 | Tetralogic Pharmaceuticals Corporation | Dimeric iap inhibitors |
| US20100144650A1 (en) | 2006-07-24 | 2010-06-10 | Tetralogic Pharmaceuticals Corporation | Dimeric iap inhibitors |
| WO2008014236A1 (en) | 2006-07-24 | 2008-01-31 | Tetralogic Pharmaceuticals Corporation | Dimeric iap inhibitors |
| JP5452223B2 (ja) | 2006-07-24 | 2014-03-26 | テトラロジック ファーマシューティカルズ コーポレーション | Iap阻害剤 |
| US7985735B2 (en) | 2006-07-24 | 2011-07-26 | Tetralogic Pharmaceuticals Corporation | Dimeric IAP inhibitors |
| US20100143499A1 (en) | 2006-07-24 | 2010-06-10 | Tetralogic Pharmaceuticals Corporation | Dimeric iap inhibitors |
| PE20110224A1 (es) | 2006-08-02 | 2011-04-05 | Novartis Ag | PROCEDIMIENTO PARA LA SINTESIS DE UN PEPTIDOMIMETICO DE Smac INHIBIDOR DE IAP, Y COMPUESTOS INTERMEDIARIOS PARA LA SINTESIS DEL MISMO |
| WO2008045905A1 (en) | 2006-10-12 | 2008-04-17 | Novartis Ag | Pyrrolydine derivatives as iap inhibitors |
| RU2009118487A (ru) | 2006-10-19 | 2010-11-27 | Новартис АГ (CH) | Органические соединения |
| AU2007325280B2 (en) | 2006-11-28 | 2011-03-10 | Dana-Farber Cancer Institute, Inc. | Combination of IAP inhibitors and FLT3 inhibitors |
| KR20090083412A (ko) | 2006-11-28 | 2009-08-03 | 노파르티스 아게 | 급성 골수성 백혈병의 치료를 위한 iap 억제제의 용도 |
| WO2008073306A1 (en) | 2006-12-07 | 2008-06-19 | Novartis Ag | Organic compounds |
| CA2671607A1 (en) | 2006-12-19 | 2008-07-03 | Genentech, Inc. | Imidazopyridine inhibitors of iap |
| AU2008240153B2 (en) | 2007-04-12 | 2013-01-31 | Joyant Pharmaceuticals, Inc. | SMAC mimetic dimers and trimers useful as anti-cancer agents |
| NZ580468A (en) | 2007-04-13 | 2012-02-24 | Univ Michigan | Diazo bicyclic smac mimetics and the uses thereof |
| JP5368428B2 (ja) | 2007-04-30 | 2013-12-18 | ジェネンテック, インコーポレイテッド | Iapのインヒビター |
| US20100203012A1 (en) | 2007-05-30 | 2010-08-12 | Aegera Therapeutics, Inc. | Iap bir domain binding compounds |
| EP2058312A1 (en) | 2007-11-09 | 2009-05-13 | Universita' degli Studi di Milano | SMAC mimetic compounds as apoptosis inducers |
| US20110117081A1 (en) * | 2008-05-05 | 2011-05-19 | Aegera Therapeutics, Inc. | Functionalized pyrrolidines and use thereof as iap inhibitors |
| AU2009246347A1 (en) | 2008-05-16 | 2009-11-19 | Dana Farber Cancer Institute, Inc. | Immunomodulation by IAP inhibitors |
| TW201011006A (en) | 2008-06-16 | 2010-03-16 | Nuevolution As | IAP binding compounds |
| AU2009261919A1 (en) * | 2008-06-27 | 2009-12-30 | Pharmascience Inc. | Bridged secondary amines and use thereof as IAP BIR domain binding compounds |
| WO2010015090A1 (en) | 2008-08-07 | 2010-02-11 | Aegera Therapeutics Inc. | Functionalized pyrrolidines and use thereof as iap inhibitors |
| NL2001882C2 (nl) | 2008-08-12 | 2010-02-15 | Heineken Supply Chain Bv | Tapkop, tapinrichting en werkwijze voor gebruik van een tapinrichting. |
| WO2010031171A1 (en) | 2008-09-19 | 2010-03-25 | Aegera Therapeutics, Inc. | Iap bir domain binding compounds |
| NZ602368A (en) * | 2010-02-12 | 2014-10-31 | Pharmascience Inc | Iap bir domain binding compounds |
-
2011
- 2011-02-11 NZ NZ602368A patent/NZ602368A/en not_active IP Right Cessation
- 2011-02-11 AU AU2011214057A patent/AU2011214057B2/en not_active Ceased
- 2011-02-11 RU RU2012139033/04A patent/RU2567544C2/ru not_active IP Right Cessation
- 2011-02-11 US US13/578,574 patent/US9284350B2/en not_active Expired - Fee Related
- 2011-02-11 SG SG10201501095WA patent/SG10201501095WA/en unknown
- 2011-02-11 CN CN201180019057.0A patent/CN102985439B9/zh not_active Expired - Fee Related
- 2011-02-11 EP EP11741951.5A patent/EP2534170B1/en not_active Not-in-force
- 2011-02-11 EP EP17166670.4A patent/EP3263583A1/en not_active Withdrawn
- 2011-02-11 ES ES11741951.5T patent/ES2625637T3/es active Active
- 2011-02-11 MX MX2012009342A patent/MX340870B/es active IP Right Grant
- 2011-02-11 WO PCT/IB2011/000264 patent/WO2011098904A1/en active Application Filing
- 2011-02-11 SG SG2012055117A patent/SG182724A1/en unknown
- 2011-02-11 BR BR112012020113A patent/BR112012020113A2/pt not_active IP Right Cessation
- 2011-02-11 KR KR1020127023798A patent/KR20120140658A/ko not_active Application Discontinuation
-
2012
- 2012-07-23 IL IL221069A patent/IL221069A0/en unknown
- 2012-09-11 ZA ZA2012/06802A patent/ZA201206802B/en unknown
Also Published As
| Publication number | Publication date |
|---|---|
| RU2567544C2 (ru) | 2015-11-10 |
| CN102985439B9 (zh) | 2016-08-03 |
| SG182724A1 (en) | 2012-08-30 |
| RU2012139033A (ru) | 2014-03-20 |
| NZ602368A (en) | 2014-10-31 |
| EP2534170A4 (en) | 2014-04-30 |
| SG10201501095WA (en) | 2015-04-29 |
| CN102985439B (zh) | 2016-06-15 |
| ZA201206802B (en) | 2013-05-29 |
| MX340870B (es) | 2016-07-27 |
| AU2011214057B2 (en) | 2016-11-17 |
| US20130040892A1 (en) | 2013-02-14 |
| CN102985439A (zh) | 2013-03-20 |
| AU2011214057A1 (en) | 2012-10-04 |
| EP3263583A1 (en) | 2018-01-03 |
| BR112012020113A2 (pt) | 2016-06-07 |
| ES2625637T3 (es) | 2017-07-20 |
| IL221069A0 (en) | 2012-09-24 |
| EP2534170B1 (en) | 2017-04-19 |
| EP2534170A1 (en) | 2012-12-19 |
| MX2012009342A (es) | 2012-11-29 |
| US9284350B2 (en) | 2016-03-15 |
| WO2011098904A1 (en) | 2011-08-18 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR20120140658A (ko) | Iap bir 도메인 결합 화합물 | |
| JP5419468B2 (ja) | Iapのbirドメインに結合する化合物 | |
| JP5419685B2 (ja) | Iapbirドメイン結合タンパク質 | |
| JP4954983B2 (ja) | Birドメイン結合化合物 | |
| RU2401840C2 (ru) | Ингибиторы iap | |
| WO2010015090A1 (en) | Functionalized pyrrolidines and use thereof as iap inhibitors | |
| EP1951698A1 (en) | Iap bir domain binding compounds | |
| WO2009136290A1 (en) | Functionalized pyrrolidines and use thereof as iap inhibitors | |
| WO2009155709A1 (en) | Bridged secondary amines and use thereof as iap bir domain binding compounds | |
| WO2008144925A1 (en) | Iap bir domain binding compounds | |
| WO2007101347A1 (en) | Bir domain binding compounds | |
| EA012810B1 (ru) | Димерные ингибиторы ингибиторов белков апоптоза (iap) | |
| JP2009503084A (ja) | C型肝炎セリンプロテアーゼ阻害剤およびその使用 | |
| WO2010031171A1 (en) | Iap bir domain binding compounds | |
| RU2446170C2 (ru) | Соединения, связывающиеся с bir доменом iap | |
| MX2008005477A (en) | Iap bir domain binding compounds |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A201 | Request for examination | ||
| E902 | Notification of reason for refusal | ||
| E601 | Decision to refuse application |