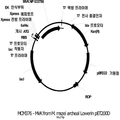
KR20120047908A - 이소프렌 유도체들을 포함하는 연료 조성물들 - Google Patents
이소프렌 유도체들을 포함하는 연료 조성물들 Download PDFInfo
- Publication number
- KR20120047908A KR20120047908A KR1020127001228A KR20127001228A KR20120047908A KR 20120047908 A KR20120047908 A KR 20120047908A KR 1020127001228 A KR1020127001228 A KR 1020127001228A KR 20127001228 A KR20127001228 A KR 20127001228A KR 20120047908 A KR20120047908 A KR 20120047908A
- Authority
- KR
- South Korea
- Prior art keywords
- isoprene
- certain embodiments
- cells
- polypeptides
- hour
- Prior art date
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C10—PETROLEUM, GAS OR COKE INDUSTRIES; TECHNICAL GASES CONTAINING CARBON MONOXIDE; FUELS; LUBRICANTS; PEAT
- C10L—FUELS NOT OTHERWISE PROVIDED FOR; NATURAL GAS; SYNTHETIC NATURAL GAS OBTAINED BY PROCESSES NOT COVERED BY SUBCLASSES C10G, C10K; LIQUEFIED PETROLEUM GAS; ADDING MATERIALS TO FUELS OR FIRES TO REDUCE SMOKE OR UNDESIRABLE DEPOSITS OR TO FACILITATE SOOT REMOVAL; FIRELIGHTERS
- C10L1/00—Liquid carbonaceous fuels
- C10L1/10—Liquid carbonaceous fuels containing additives
- C10L1/14—Organic compounds
- C10L1/16—Hydrocarbons
-
- C—CHEMISTRY; METALLURGY
- C10—PETROLEUM, GAS OR COKE INDUSTRIES; TECHNICAL GASES CONTAINING CARBON MONOXIDE; FUELS; LUBRICANTS; PEAT
- C10L—FUELS NOT OTHERWISE PROVIDED FOR; NATURAL GAS; SYNTHETIC NATURAL GAS OBTAINED BY PROCESSES NOT COVERED BY SUBCLASSES C10G, C10K; LIQUEFIED PETROLEUM GAS; ADDING MATERIALS TO FUELS OR FIRES TO REDUCE SMOKE OR UNDESIRABLE DEPOSITS OR TO FACILITATE SOOT REMOVAL; FIRELIGHTERS
- C10L1/00—Liquid carbonaceous fuels
- C10L1/04—Liquid carbonaceous fuels essentially based on blends of hydrocarbons
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J23/00—Catalysts comprising metals or metal oxides or hydroxides, not provided for in group B01J21/00
- B01J23/38—Catalysts comprising metals or metal oxides or hydroxides, not provided for in group B01J21/00 of noble metals
- B01J23/40—Catalysts comprising metals or metal oxides or hydroxides, not provided for in group B01J21/00 of noble metals of the platinum group metals
- B01J23/44—Palladium
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C11/00—Aliphatic unsaturated hydrocarbons
- C07C11/12—Alkadienes
- C07C11/173—Alkadienes with five carbon atoms
- C07C11/18—Isoprene
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C9/00—Aliphatic saturated hydrocarbons
- C07C9/14—Aliphatic saturated hydrocarbons with five to fifteen carbon atoms
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Oil, Petroleum & Natural Gas (AREA)
- Engineering & Computer Science (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Materials Engineering (AREA)
- Preparation Of Compounds By Using Micro-Organisms (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
- Production Of Liquid Hydrocarbon Mixture For Refining Petroleum (AREA)
- Low-Molecular Organic Synthesis Reactions Using Catalysts (AREA)
- Catalysts (AREA)
Abstract
본 발명은 다양한 탄화수소 연료들 및 연료 첨가물들의 생산을 위해, 재생가능한 (renewable) 탄소로부터 유래한 바이오이소프렌 (bioisoprene)을 사용하는 방법들, 조성물들 및 시스템들을 제공한다.
Description
본 발명은 다양한 탄화수소 연료들 및 연료 첨가물들의 생산을 위해, 재생가능한 탄소로부터 유래한 바이오이소프렌 (bioisoprene)을 사용하는 방법들, 조성물들 및 시스템들을 제공한다.
재생가능한 운송 (transportation) 연료의 개발은 21세기의 중요한 도전 과제의 하나이다. 최근의 시장은 슈크로스와 전분의 효모 발효로부터 유래한 에탄올이 또한 약간의 정도는 트리글리세라이드 (triglycerides)로부터 유래한 바이오디젤 (지방산 에스테르들)이 점유하고 있다. 에탄올은 탄화수소에 비해 더 낮은 에너지 밀도를 가지는 액체 연료로서 한계점을 가진다. 또한, 에탄올은 그의 물에 대한 친화성 및 부식 특성으로 인해 통상적인 기반 (infrastructure)으로는 운송될 수 없다. 재생가능한 탄소원 (바이오매스, 슈가, 오일)의 탄화수소로의 전환 공정은 바이오에탄올 (bioethanol)에 대한 매력적인 대안을 제시한다.
이소프렌 (2-메틸-1,3-부타디엔)은 합성 고무의 생산에 주로 사용되는 중요한 산업적 화합물이다. 최근 들어, 이소프렌은 직접적으로 나프타 및 기타 다른 석유 분획의 열분해 (cracking)에 의해, 또는 간접적으로 화학적 합성에 의해 석유화학적 출처로부터 유래한다 (예를 들어, H. Pommer and A. Nurrenbach, Industrial Synthesis of Terpene Compounds, Pure Appl. Chem., 1975, 43, 527-551; H. M. Weitz and E. Loser, Isoprene, in Ullmann's Encyclopedia of Industrial Chemistry, 제 7판, Electronic Release, Wiley-VCH Verlag GMBH, Weinheim, 2005; and H.M. Lybarger, Isoprene in Kirk-Othmer Encyclopedia of Chemical Technology,제 4판, 윌리 (Wiley) 출판사, 뉴욕 (1995), 14, 934-952을 참조하라). 그 결과 나온 조 (crude) 이소프렌 수증기는 전형적으로 수많은 화학적으로 유사한 불순물들을 제거하도록 철저한 (extensive) 정제 공정을 거쳐야 하는 데, 이들의 많은 수가 중합체 및 다른 화합물로의 이소프렌의 연속적 변환 (transformation)을 방해할 수도 있다.
대조적으로, 생물학적 출처로부터 유래한 이소프렌은 매우 적은 탄화수소 불순물을 포함하는 대신 에탄올, 아세트알데하이드 및 아세톤과 같은 많은 산화된 화합물들을 포함한다. 이들 화합물의 많은 수는 물과 접촉에 의해 또는 알루미나 또는 다른 흡착제 (adsorbents)에 의해 쉽게 제거될 수 있다.
산업은 이소프렌의 생산을 위해 석유화학적 공급원료에 의존하고 이소프렌이 중합체 및 다른 화합물들로 변환될 수 있기 이전에 철저한 정제 공정이 필요하다. 생물학적으로 생산된 이소프렌을 고순도 (high purity) 및/또는 이소프렌의 독특한 불순도 프로파일 (unique impurity profiles)을 장점으로 하는 소중한 화학적 제품으로 전환하기 위해서는 비용이 저렴한 방법이 바람직하다.
본 명세서에서 인용되는 모든 특허들, 특허 출원들, 서류들, 및 논문들은 전부가 본 명세서에서 참고문헌으로 통합되어 있다.
매우 순수한 이소프렌으로부터 연료 성분 (fuel constituents)을 생산하는 방법들 및 시스템들 또한 매우 순수한 이소프렌으로부터 생산된 연료 조성물들 (fuel compositions)이 기재되어 있다.
한 가지 관점에서, 본 발명은 바이오이소프렌 조성물 (bioisoprene composition)에서 이소프렌의 실질적인 부분을 비-이소프렌 화합물들로 화학적으로 변환시키는 것을 포함하는 바이오이소프렌 조성물로부터 연료 성분을 생산하는 방법을 제공한다. 한 가지 구현예에서, 본 바이오이소프렌 조성물은 이소프렌 이중합 (dimerization)에 적합한 가열 (heat) 또는 촉매적 조건에 바이오이소프렌 조성물을 맡겨두어 이소프렌 이중체 (isoprene dimer)를 생산한 다음, 이소프렌 이중체를 촉매적으로 수소화하여 포화된 C10 연료 성분을 형성하는 것에 의해 화학적으로 변환된다. 또 다른 구현예에서, 본 바이오이소프렌 조성물은 (i) 바이오이소프렌 조성물을 부분적으로 수소화하여 이소아밀렌 (isoamylene)을 생산하고, (ii) 이소아밀렌을 이소아밀렌, 프로필렌 및 이소부텐으로 이루어진 그룹으로부터 선택되는 모노-올레핀과 이중합하여 디메이트 (dimate)를 형성하고, 또한 (iii) 디메이트를 완전하게 수소화하여 연료 성분을 생산하는 것에 의해 화학적으로 변환된다. 일정 구현예에서, 바이오이소프렌 조성물에서 적어도 약 95%의 이소프렌은 화학적 변환 과정 (chemical transformation) 동안 비-이소프렌 화합물들로 전환된다. 일정 구현예에서, 바이오이소프렌 조성물은 약 150℃ 내지 약 250℃로 가열되어 불포화된 고리형 (unsaturated cyclic) 이소프렌 이중체를 생산하고, 불포화된 고리형 이소프렌 이중체는 촉매적으로 수소화되어 포화된 고리형 (saturated cyclic) 이소프렌 이중체의 연료 성분을 생산한다. 일정 구현예에서, 본 방법은 (i) 바이오이소프렌 조성물을 이소프렌의 고리-이중합 (cyclo-dimerization)을 촉매 작용하는 촉매와 접촉시켜서 불포화된 고리형 이소프렌 이중체를 생산하고, 상기 불포화된 고리형 이소프렌 이중체는 촉매적으로 수소화되어 포화된 고리형 이소프렌 이중체의 연료 성분을 생산하는 것을 포함한다. 일정 구현예에서, 이소프렌의 고리-이중합을 촉매 작용하는 촉매는 니켈 (nickel) 촉매, 철 (iron) 촉매 및 크롬 (chromium) 촉매로 이루어진 그룹으로부터 선택되는 촉매를 포함한다. 일정 구현예에서, 바이오이소프렌 조성물을 부분적으로 수소화하는 단계는 바이오이소프렌 조성물을 수소 기체 및 이소프렌의 부분적 수소화를 촉매 작용하는 촉매와 접촉시키는 것을 포함한다. 일정 구현예에서, 이소프렌의 부분적 수소화를 촉매 작용하는 촉매는 팔라듐 (palladium) 촉매를 포함한다. 일정 구현예에서, 이소아밀렌을 모노-올레핀 (mono-olefins)과 이중합하는 단계는 이소아밀렌을 모노-올레핀의 이중합을 촉매 작용하는 촉매의 존재 시 모노-올레핀과 접촉시키는 것을 포함한다. 일정 구현예에서, 모노-올레핀의 이중합을 촉매 작용하는 촉매는 산 (acid) 촉매를 포함한다. 일정 구현예에서, 본 방법은 상기에 더하여 바이오이소프렌 조성물을 연료 성분으로 화학적으로 변환시키기 이전에 상기 바이오이소프렌 조성물로부터 이소프렌을 정제하는 것을 포함한다.
한 가지 관점에서, 본 발명은 바이오이소프렌 조성물에서 이소프렌의 실질적인 부분을 비-이소프렌 화합물로 화학적으로 전환시키는, 바이오이소프렌 조성물로부터 연료 성분을 생산하는 시스템을 제공하고, 본 시스템은 바이오이소프렌 조성물 또한 (a)(i) 바이오이소프렌 조성물에서 이소프렌을 이중합할 수 있는 하나 이상의 화합물 또는 바이오이소프렌 조성물에서 이소프렌을 이중합할 수 있는 가열원 (source of heat); 및 (ii) 이소프렌 이중체를 수소화하여 포화된 C10 연료 성분을 형성할 수 있는 촉매; 또는 (b)(i) 바이오이소프렌 조성물에서 이소프렌을 부분적으로 수소화하여 이소아밀렌을 생산할 수 있는 화합물, (ii) 이소아밀렌을 이소아밀렌, 프로필렌 및 이소부텐으로 이루어진 그룹으로부터 선택되는 모노-올레핀으로 이중합하여 디메이트를 형성할 수 있는 화합물, 및 (iii) 디메이트를 완전하게 수소화하여 연료 성분을 생산할 수 있는 화합물을 포함한다.
본 시스템의 일정 구현예에서, 바이오이소프렌 조성물은 약 2 mg 이상의 이소프렌을 포함하고, 상기 조성물에서의 모든 C5 탄화수소의 전체 무게에 대비한 무게로 약 99.94% 이상의 이소프렌을 포함한다. 시스템의 일정 구현예에서, 이소프렌을 이중합할 수 있는 하나 이상의 화합물은 루테늄 (ruthenium) 촉매, 니켈 촉매, 철 촉매 및 크롬 촉매로 이루어진 그룹으로부터 선택되는 촉매를 포함하는 이소프렌의 고리-이중합 (cyclo-dimerization)을 촉매 작용하는 촉매를 포함한다. 시스템의 일정 구현예에서, 불포화된 이소프렌 이중체를 수소화하는 촉매는 팔라듐 촉매, 니켈 촉매, 루테늄 촉매 및 로듐 (rhodium) 촉매로 이루어진 그룹으로부터 선택되는 촉매를 포함한다. 시스템의 일정 구현예에서, 이소프렌을 부분적으로 수소화할 수 있는 화합물은 팔라듐 촉매를 포함한다. 시스템의 일정 구현예에서,이소아밀렌을 모노-올레핀으로 이중합할 수 있는 화합물은 산 촉매를 포함한다.
한 가지 관점에서, 본 발명은 본 명세서에서 기술된 방법에 의해 생산되는 연료 성분을 포함하는 연료 조성물을 제공한다. 일정 구현예에서, 연료 조성물은 실질적으로 이소프렌이 없다. 일정 구현예에서, 연료 조성물은 -22‰ 이상 또는 -32‰ 내지 -24‰의 범위 이내인 δ13C 값을 가진다.
일정 관점에서, 본 발명은 시판되는 유리한 양의 매우 순수한 이소프렌의 적어도 일부분이 화학적 변환을 거치는, (a) 시판되는 유리한 양의 매우 순수한 이소프렌; 및 (b) 매우 순수한 이소프렌의 적어도 일부분으로부터 생산된 연료 성분:을 포함하는 이소프렌으로부터 연료 성분을 생산하는 시스템을 제공한다.
본 시스템의 일정 구현예에서, 시판되는 유리한 양의 매우 순수한 이소프렌은 약 2 mg 이상의 이소프렌을 포함하고, 상기 조성물에서의 모든 C5 탄화수소의 전체 무게에 대비하여 무게로 약 99.94% 이상의 이소프렌을 포함한다. 일정 구현예에서, 시판되는 유리한 양의 매우 순수한 이소프렌은 약 2 mg 이상의 이소프렌을 포함하고, 에탄올, 아세톤, C5 프레닐 알코올 (C5 prenyl alcohols), 및 10개 이상의 탄소 원자를 가지는 이소프레노이드 화합물 (isoprenoid compounds)로 이루어진 그룹으로부터 선택되는 하나 이상의 화합물을 포함한다. 일정 구현예에서, 시판되는 유리한 양의 매우 순수한 이소프렌은 약 2 mg 이상의 이소프렌을 포함하고, 에탄올, 아세톤, 메탄올, 아세트알데하이드, 메타크롤레인 (methacrolein), 메틸 비닐 케톤 (methyl vinyl ketone), 2-메틸-2-비닐옥시란 (2-methyl-2-vinyloxirane), 시스- 및 트랜스-3-메틸-1,3-펜타디엔 (cis- and trans-3-methyl-1,3-pentadiene), C5 프레닐 알코올, 2-헵탄온 (2-heptanone), 6-메틸-5-헵텐-2-온 (6-methyl-5-hepten-2-one), 2,4,5-트리메틸피리딘 (2,4,5-trimethylpyridine), 2,3,5-트리메틸피라진 (2,3,5-trimethylpyrazine), 시트로넬랄 (citronellal), 메탄티올 (methanethiol), 메틸 아세테이트 (methyl acetate), 1-프로판올 (1-propanol), 디아세틸 (diacetyl), 2-부탄온 (2-butanone), 2-메틸-3-부텐-2-올 (2-methyl-3-buten-2-ol), 에틸 아세테이트 (ethyl acetate), 2-메틸-1-프로판올 (2-methyl-1-propanol), 3-메틸-1-부탄알 (3-methyl-1-butanal), 3-메틸-2-부탄온 (3-methyl-2-butanone), 1-부탄올 (1-butanol), 2-펜탄온 (2-pentanone), 3-메틸-1-부탄올 (3-methyl-1-butanol), 에틸 부틸레이트 (ethyl isobutyrate), 3-메틸-2-부텐알 (3-methyl-2-butenal), 부틸 아세테이트 (butyl acetate), 3-메틸부틸 아세테이트 (3-methylbutyl acetate), 3-메틸-3-부텐-1-일 아세테이트 (3-methyl-3-buten-1-yl acetate), 3-메틸-2-부텐-1-일 아세테이트 (3-methyl-2-buten-1-yl acetate), 3-헥센-1-올 (3-hexen-1-ol), 3-헥센-1-일 아세테이트 (3-hexen-1-yl acetate), 리모넨 (limonene), 게라니올 (트랜스-3,7-디메틸-2,6-옥타디엔-1-올)(geraniol (trans-3,7-dimethyl-2,6-octadien-1-ol)), 시트로넬롤 (3,7-디메틸-6-옥텐-1-올) (citronellol (3,7-dimethyl-6-octen-1-ol)), (E)-3,7-디메틸-1,3,6-옥타트리엔 ((E)-3,7-dimethyl-1,3,6-octatriene), (Z)-3,7-디메틸-1,3,6-옥타트리엔 ((Z)-3,7-dimethyl-1,3,6-octatriene), 및 2,3-사이클로헵텐올피리딘 (2,3-cycloheptenolpyridine)로 이루어진 그룹으로부터 선택되는 하나 이상의 두 번째 화합물을 포함하고; 이소프렌의 양에 대비한 두 번째 화합물의 양은 약 0.01% (w/w) 이상이 된다. 일정 구현예에서, 시판되는 유리한 양의 매우 순수한 이소프렌은 약 2 mg 이상의 이소프렌을 포함하고, 이소프렌의 다중합 (polymerization)을 저해하는 조성물에서의 화합물이라면 모두는 화합물 당 약 0.5 μg/L 이하를 포함한다. 일정 바람직한 구현예에서, 시판되는 유리한 양의 매우 순수한 이소프렌은 생물학적 공정에 의해 생산된다.
본 시스템의 일정 구현예에서, 연료 성분은 고리형 이소프렌 이중체 (dimers) 및 삼중체 (trimers), 직선형 이소프렌 올리고머 (oligomers), 방향족 (aromatic) 및 비-고리형 (alicyclic) 이소프렌 유도체, 및 산화된 이소프렌 유도체로 이루어진 그룹으로부터 선택되는 하나 이상의 화합물을 포함한다. 일정 구현예에서, 산화된 이소프렌 유도체는 이소프렌으로부터 유래한 알코올, 케톤, 에스테르 및 에테르로 이루어진 그룹으로부터 선택되는 화합물이다.
일정 구현예에서, 연료 성분은 고리형 이소프렌 이중체를 포함하고 화학적 변환은 이소프렌의 이중합 반응을 포함한다. 일정 구현예에서, 이중합 반응은 시판되는 유리한 양의 매우 순수한 이소프렌을 가열하여 수행된다. 일정 구현예에서, 이소프렌의 이중합 반응은 불포화된 이소프렌 이중체를 포함하는 산물을 생산하고 화학적 변환은 불포화된 이소프렌 이중체의 수소화 반응 (hydrogenation reaction)을 포함한다. 일정 구현예에서, 시스템은 좀 더 나아가 불포화된 이소프렌 이중체의 수소화 반응을 촉매 작용하는 촉매를 포함한다. 일정 구현예에서, 불포화된 이소프렌 이중체의 수소화 반응을 촉매 작용하는 촉매는 팔라듐 촉매, 니켈 촉매, 루테늄 촉매 및 로듐 (rhodium) 촉매로 이루어진 그룹으로부터 선택되는 촉매를 포함한다.
일정 구현예에서, 이중합 반응은 시판되는 유리한 양의 매우 순수한 이소프렌을 이소프렌의 고리-이중합을 촉매 작용하는 촉매와 접촉하여 수행된다. 일정 구현예에서, 이소프렌의 고리-이중합을 촉매 작용하는 촉매는 루테늄 촉매, 니켈 촉매, 철 촉매 및 크롬 촉매로 이루어진 그룹으로부터 선택되는 촉매를 포함한다. 일정 구현예에서, 이소프렌의 고리-이중합을 촉매 작용하는 촉매는 니켈 촉매이고, 연료 성분은 8개-구성원으로 된 하나 이상의 이소프렌의 고리 이중체를 포함한다.
일정 구현예에서, 연료 성분은 이소프렌의 직선형 및/또는 고리형 삼중체를 포함하고 화학적 변환은 이소프렌의 촉매적 삼중합 (trimerization)을 포함한다.
한 가지 관점에서, 본 발명은 (a) 시판되는 유리한 양의 매우 순수한 이소프렌을 획득하고; 또한 (b) 시판되는 유리한 양의 매우 순수한 이소프렌의 적어도 일부분을 연료 성분으로 화학적으로 변환하는 것:을 포함하는 이소프렌으로부터 연료 성분을 생산하는 방법을 제공한다. 일정 구현예에서, 시판되는 유리한 양의 매우 순수한 이소프렌은 바이오이소프렌 (bioisoprene)을 포함한다.
일정 구현예에서, 시판되는 유리한 양의 매우 순수한 이소프렌은, (i) 세포가 (1) 약 400 nmole/gwem/시간 이상의 이소프렌을 생산하거나, (2) 세포 배양 배지로부터 연소하는 탄소의 0.02 몰라 퍼센트 이상을 이소프렌으로 전환시키거나, (3) 약 0.1 mg/L액체배지/시간 이상 이소프렌의 이소프렌의 평균 부피측정 생산도를 가지는, 이소프렌 합성효소 폴리펩타이드 (isoprene synthase polypeptide)를 인코딩하는 이종유래 (heterologous) 핵산을 포함하는 세포를 이소프렌의 생산에 적합한 배양 조건 하에서 배양하고; 또한 (ii) 이소프렌을 생산하는 것:을 포함하는 단계에 의해 획득된다. 일정 구현예에서, 세포는 좀 더 나아가 이소프렌 합성효소 폴리펩타이드 또는 MVA 경로 폴리펩타이드를 인코딩하는 이종유래 핵산을 포함한다.
본 명세서에서 기술된 방법의 일정 구현예에서, 시판되는 유리한 양의 매우 순수한 이소프렌의 적어도 일부분을 연료 성분으로 화학적으로 변환시키는 것은 (i) 시판되는 유리한 양의 매우 순수한 이소프렌을 약 150℃ 내지 약 250℃로 가열하고; (ii) 시판되는 유리한 양의 매우 순수한 이소프렌의 적어도 일부분을 불포화된 고리형 이소프렌 이중체로 전환시키고; (iii) 불포화된 고리형 이소프렌 이중체를 수소화하여 포화된 고리형 이소프렌 이중체를 생산하고; 또한 (iv) 연료 성분을 생산하는 것:을 포함한다. 일정 구현예에서, 시판되는 유리한 양의 매우 순수한 이소프렌에서 적어도 약 20% 내지 약 100%의 이소프렌은 불포화된 고리형 이소프렌 이중체로 전환된다.
본 방법의 일정 구현예에서, 시판되는 유리한 양의 매우 순수한 이소프렌의 적어도 일부분을 연료 성분으로 화학적으로 변환하는 것은 (i) 시판되는 유리한 양의 매우 순수한 이소프렌을 이소프렌의 고리-이중합을 촉매 작용하는 촉매와 접촉시키고; (ii) 시판되는 유리한 양의 매우 순수한 이소프렌의 적어도 일부분을 고리형 이소프렌 이중체로 전환시키고; 또한 (iii) 연료 성분을 생산하는 것:을 포함한다.
본 방법의 일정 구현예에서, 시판되는 유리한 양의 매우 순수한 이소프렌의 적어도 일부분을 연료 성분으로 화학적으로 변환하는 것은 (i) 시판되는 유리한 양의 매우 순수한 이소프렌을 이소프렌의 고리-이중합을 촉매 작용하는 촉매와 접촉시키고; (ii) 시판되는 유리한 양의 매우 순수한 이소프렌의 적어도 일부분을 불포화된 고리형 이소프렌 이중체로 전환시키고; (iii) 불포화된 고리형 이소프렌 이중체를 수소화하여 포화된 고리형 이소프렌 이중체를 생산하고; 또한 (iv) 연료 성분을 생산하는 것:을 포함한다. 본 방법의 일정 구현예에서, 이소프렌의 고리-이중합을 촉매 작용하는 촉매는 니켈 촉매, 철 촉매 및 크롬 촉매로 이루어진 그룹으로부터 선택되는 촉매를 포함한다.
본 방법의 일정 구현예에서, 시판되는 유리한 양의 매우 순수한 이소프렌의 적어도 일부분을 연료 성분으로 화학적으로 변환하는 것은 (i) 매우 순수한 이소프렌을 촉매 시스템과 접촉시키고; (ii) 시작 (starting) 이소프렌 조성물의 적어도 일부분을 불포화된 이소프렌 이중체 및/또는 삼중체로 전환시키고; (iii) 불포화된 이중체 및/또는 삼중체를 수소화하여 포화된 C10 및/또는 C15 탄화수소를 생산하는 것:을 포함한다.
일정 구현예에서, 이소프렌으로부터 연료 성분을 생산하는 방법은 (a) 본 명세서에서 기술된 매우 순수한 이소프렌의 시작 조성물이라면 모두의 시판되는 유리한 양을 획득하고; (b) 시작 이소프렌 조성물의 적어도 일부분을 산화된 이소프렌 유도체로 전환시키고; 또한 임의적으로 (c) 불포화된 산화된 이소프렌 유도체를 수소화하여 포화된 산화물을 생산하는 것:을 포함한다. 일정 구현예에서, 산화된 이소프렌 유도체는 이소프렌으로부터 유래한 알코올, 케톤, 에스테르, 및 에테르로 이루어진 그룹으로부터 선택되는 화합물이다.
일정 구현예에서, 본 명세서에서 기술된 방법이라면 모두는 좀 더 나아가 적어도 일부분의 시판되는 유리한 양의 매우 순수한 이소프렌을 연료 성분으로 화학적으로 변환하기 이전에 시판되는 유리한 양의 매우 순수한 이소프렌을 정제하는 것을 포함한다.
한 가지 관점에서, (a) 시판되는 유리한 양의 매우 순수한 이소프렌을 연속적으로 생산하고; 또한 (b) 시판되는 유리한 양의 매우 순수한 이소프렌의 적어도 일부분을 연료 성분으로 연속적으로 변환하는 것:을 포함하는 이소프렌으로부터 연료 성분을 생산하는 연속적 방법 (continuous process)이 제공된다. 일정 구현예에서, 시판되는 유리한 양의 매우 순수한 이소프렌은 이소프렌을 포함하는 기체 상 (gas phase)을 포함한다. 일정 구현예에서, 본 방법은 좀 더 나아가 적어도 일부분의 시판되는 유리한 양의 매우 순수한 이소프렌을 화학적으로 변환시키도록 이소프렌을 포함하는 기체 상을 반응기 (reactor)에 통과시키는 것을 포함한다. 바람직한 구현예에서, 시판되는 유리한 양의 매우 순수한 이소프렌은 바이오이소프렌을 포함한다.
또한 본 명세서에서 기술된 방법이라면 모두에 의해 생산된 연료 성분을 포함하는 연료 조성물이 제공된다. 일정 구현예에서, 연료 성분은 본 명세서에서 기술된 방법에 따른 단계를 거친 이후에 이소프렌이 아닌 C5 탄화수소로부터 나온 약 0.5 μg/L 이하의 산물을 포함한다. 일정 구현예에서, 연료 성분은 본 명세서에서 기술된 방법에 따른 단계를 거친 이후에 에탄올, 아세톤, 메탄올, 아세트알데하이드, 메타크롤레인, 메틸 비닐 케톤, 2-메틸-2-비닐옥시란, 시스- 및 트랜스-3-메틸-1,3-펜타디엔, C5 프레닐 알코올, 2-헵탄온, 6-메틸-5-헵텐-2-온, 2,4,5-트리메틸피리딘, 2,3,5-트리메틸피라진, 시트로넬랄, 메탄티올, 메틸 아세테이트, 1-프로판올, 디아세틸, 2-부탄온, 2-메틸-3-부텐-2-올, 에틸 아세테이트, 2-메틸-1-프로판올, 3-메틸-1-부탄알, 3-메틸-2-부탄온, 1-부탄올, 2-펜탄온, 3-메틸-1-부탄올, 에틸 부틸레이트, 3-메틸-2-부텐알, 부틸 아세테이트, 3-메틸부틸 아세테이트, 3-메틸-3-부텐-1-일 아세테이트, 3-메틸-2-부텐-1-일 아세테이트, 3-헥센-1-올, 3-헥센-1-일 아세테이트, 리모넨, 게라니올 (트랜스-3,7-디메틸-2,6-옥타디엔-1-올), 시트로넬롤 (3,7-디메틸-6-옥텐-1-올), (E)-3,7-디메틸-1,3,6-옥타트리엔, (Z)-3,7-디메틸-1,3,6-옥타트리엔, 및 2,3-사이클로헵텐올피리딘로 이루어진 그룹으로부터 선택되는 하나 이상의 화합물로부터 나온 하나 이상의 산물을 포함한다.
일정 구현예에서, 연료 조성물은 -22‰ 이상인 δ13C 값을 가지는 연료 조성물을 포함한다. 일정 구현예에서, 연료 조성물은 -22‰ 내지 -10‰ 또는 -34‰ 내지 -24‰ 범위 이내인 δ13C 값을 가진다. 일정 구현예에서, 연료 조성물은 0.9 이상이 되는 fM 값을 가진다. 전체 연료 조성물의 전체 무게 또는 부피를 기초로 하여 무게 또는 부피로 약 1%로부터 약 95%까지의 양으로 석유를 기초로 하는 연료와 본 명세서에서 기술된 연료 조성물이라면 모두의 혼합물도 또한 제공된다.
본 출원은 기재 내용이 본 명세서에서 참고문헌으로 전부 통합되어 있는, 2009년 06월 17일자로 제출된 미국 가특허출원 번호 제 61/187,959호에 대한 우선권을 주장한다.
본 발명은 그 중에서도 특히 이소프렌으로부터 연료 성분을 생산하는 조성물들 및 방법들을 제공한다. 본 명세서에서는 연료 성분 또는 첨가제, 예를 들어 고리형 이소프렌 이중체 (dimers) 및 삼중체 (trimers), 직선형 이소프렌 올리고머 (oligomers), 방향족 (aromatic) 및 비고리형 (acyclic) 이소프렌 유도체 및 산화된 (oxygenated) 이소프렌 유도체가 제공된다. 본 연료 성분은 시판되는 유리한 양의 매우 순수한 이소프렌을 포함하는 시작 물질의 화학적 변환에 의해 생산될 수 있다. 한 가지 관점에서, 시판되는 유리한 양의 매우 순수한 이소프렌은 바이오이소프렌 (bioisoprene)을 포함한다. 또 다른 관점에서, 시판되는 유리한 양의 매우 순수한 이소프렌은 이종유래 이소프렌 합성효소를 발현하는 세포를 배양하여 생산되는 매우 순수한 이소프렌 조성물일 수 있다. 다른 관점에서, 매우 순수한 이소프렌은 올리고중합 (oligomerization)를 거쳐서 고리형 이중체 또는 삼중체 및 직선형 올리고머와 같은 불포화된 이소프렌 올리고머를 형성한다. 불포화된 올리고머는 수소화되어 포화된 탄화수소 연료 성분을 생산할 수 있다. 일정 구현예에서, 산 촉매의 존재 시 매우 순수한 이소프렌의 알코올과 반응은 연료 산화물 (fuel oxygenates)을 생산한다. 또 다른 관점에서, 매우 순수한 이소프렌은 부분적으로 수소화되어 이소아밀렌 (isoamylenes)을 생산한다. 일정 구현예에서, 매우 순수한 이소프렌으로부터 유래한 이소아밀렌 산물은 이중합을 거쳐서 이소데센 (isodecenes)을 형성한다. 일정 구현예에서, 매우 순수한 이소프렌으로부터 유래한 이소아밀렌 산물은 산 촉매의 존재 시 알코올과 반응하여 연료 산화물을 생산한다.
재생가능한 탄소 (renewable carbon)로부터 유래한 바이오이소프렌은 화학적 촉매작용 (catalysis)에 의해 다양한 탄화수소 연료들로 전환될 수 있다. 본 명세서에서는 더 높은 분자량의 화합물에 대한 화학적 촉매작용에 의해 발효 및 이어지는 탄화수소 연료로의 전환으로부터 이소프렌을 회수하는 방법들이 제공된다. 이들 방법은 이에 제한되는 것은 아니지만, 발효 배출-기체 및 이어지는 기체 상 또는 액상 촉매작용으로부터 연료값 (fuel value)을 가지는 화합물을 제공하도록 이소프렌을 회수하고 정제하는 것을 포함한다. 연속식 및 회분식 공정은 둘 다 본 발명의 범위 이내인 것으로 고려될 수 있다.
본 명세서에서 보다 상세하게 기술되는 바, 바이오이소프렌 조성물은 보통 석유-이소프렌 (petro-isoprene) 조성물에 존재하는, 이에 제한되는 것은 아니지만 1,3-사이클로펜타디엔 (1,3-cyclopentadiene), 트랜스-1,3-펜타디엔 (trans-1,3-pentadiene), 시스-1,3-펜타디엔 (cis-1,3-pentadiene), 1,4-펜타디엔 (1,4-pentadiene), 1-펜틴 (1-pentyne), 2-펜틴 (2-pentyne), 3-메틸-1-부틴 (3-methyl-l-butyne), 펜트-4-엔-1-인 (pent-4-ene-1-yne), 트랜스-펜트-3-엔-1-인 (tans-pent-3-ene-1-yne), 및 시스-펜트-3-엔-1-인 (cis-pent-3-ene-1-yne)과 같은 오염시키는 불포화된 C5 탄화수소라면 모두가 실질적으로 없어서 석유-이소프렌 조성물과는 구별된다.
본 명세서에서 기술된 바이오이소프렌 시작 물질에서 오염시키는 불포화된 C5 탄화수소라면 모두가 존재하지 않는 경우는, 그들이 석유-이소프렌 조성물에서 보다 낮은 수준으로 존재하는 것이다. 따라서, 본 명세서에서 기술된 바이오이소프렌 조성물로부터 유래한 연료 산물이라면 모두가 오염시키는 불포화된 C5 탄화수소 또는 이러한 오염시키는 불포화된 C5 탄화수소로부터 유래한 산물이라면 모두가 본질적으로 없거나, 석유-이소프렌으로부터 유래한 연료 산물에서보다 낮은 수준으로 포함한다. 또한, 바이오이소프렌 조성물에서 황 수준은 석유-이소프렌 조성물에서의 황 수준보다 낮다. 바이오이소프렌 조성물로부터 유래한 연료 산물은 석유-이소프렌으로부터 유래한 연료 산물에서보다 낮은 수준의 황을 포함한다.
바이오이소프렌은 알코올, 알데하이드, 케톤 등과 같은 석유-이소프렌 조성물에서 존재하지 않거나 보다 더 낮은 수준으로 존재하는 다른 바이오-부산물들 (bio-byproducts) (바이오이소프렌과 함께 획득되는 생물학적 출처 및/또는 관련 생물학적 공정로부터 유래한 화합물들)과 함께 바이오이소프렌이 생산되는 점에서 석유-이소프렌과 구별된다. 바이오-부산물로는 이에 제한되는 것은 아니지만, 에탄올, 아세톤, 메탄올, 아세트알데하이드, 메타크롤레인, 메틸 비닐 케톤, 2-메틸-2-비닐옥시란, 시스- 및 트랜스-3-메틸-1,3-펜타디엔, C5 프레닐 알코올, 2-헵탄온, 6-메틸-5-헵텐-2-온, 2,4,5-트리메틸피리딘, 2,3,5-트리메틸피라진, 시트로넬랄, 메탄티올, 메틸 아세테이트, 1-프로판올, 디아세틸, 2-부탄온, 2-메틸-3-부텐-2-올, 에틸 아세테이트, 2-메틸-1-프로판올, 3-메틸-1-부탄알, 3-메틸-2-부탄온, 1-부탄올, 2-펜탄온, 3-메틸-1-부탄올, 에틸 부틸레이트, 3-메틸-2-부텐알, 부틸 아세테이트, 3-메틸부틸 아세테이트, 3-메틸-3-부텐-1-일 아세테이트, 3-메틸-2-부텐-1-일 아세테이트, 3-헥센-1-올, 3-헥센-1-일 아세테이트, 리모넨, 게라니올 (트랜스-3,7-디메틸-2,6-옥타디엔-1-올), 시트로넬롤 (3,7-디메틸-6-옥텐-1-올), (E)-3,7-디메틸-1,3,6-옥타트리엔, (Z)-3,7-디메틸-1,3,6-옥타트리엔, 2,3-사이클로헵텐올피리딘, 또는 직선형 이소프렌 중합체 (복수의 이소프렌 단위의 다중합으로부터 유래한 직선형 이소프렌 이중체 또는 직선형 이소프렌 삼중체와 같음)를 포함할 수 있다. 바이오이소프렌으로부터 유래한 연료 산물은 하나 이상의 바이오-부산물 또는 바이오-부산물이라면 모두로부터 유래한 화합물들을 포함한다. 또한, 바이오이소프렌으로부터 유래한 연료 산물은 이어지는 화학적 전환 과정 동안 이들 바이오-부산물로부터 형성되는 화합물을 포함할 수 있다. 이러한 화합물의 예로는 이소프렌 또는 그의 연료 유도체로 친디엔체 (dienophiles)의 디엘-알더 고리첨가 (Diels-Alder cycloaddition), 이소프렌 또는 그의 연료 유도체의 산화로부터 유래한 것을 포함한다.
좀 더 나아가, 바이오이소프렌은 탄소 지문분석 (finger-print)에 의해 석유-이소프렌과 구별된다. 한 가지 관점에서, 바이오이소프렌은 석유-이소프렌보다 높은 방사성 탄소-14 (14C) 함량 또는 14C/12C 비율을 가진다. 바이오이소프렌은 재생사능한 탄소원으로부터 생산되고, 따라서 바이오이소프렌에서 14C 함량 또는 14C/12C 비율은 현재 대기에서의 수치와 동일하다. 한편, 석유-이소프렌은 수십 억년 전에 퇴적된 화석 연료로부터 유래하고, 따라서 14C 함량 또는 14C/12C 비율은 방사성 붕괴로 인해 감소된다. 본 명세서에서 보다 상세하게 기술되는 바, 바이오이소프렌으로부터 유래한 연료 산물은 석유-이소프렌으로부터 유래한 석유 산물보다 높은 14C 함량 또는 14C/12C 비율을 가진다. 한 가지 구현예에서, 본 명세서에서 기술된 바이오이소프렌으로부터 유래한 연료 산물은 대기에서의 수치와 유사한 14C 함량 또는 14C/12C 비율을 가진다. 또 다른 관점에서, 바이오이소프렌은 안정한 탄소 동위원소 비율 (13C/12C)에 의해 석유-이소프렌과 분석적으로 구별될 수 있고, 이는 기호 δ13C로 표시되는 "델타 값 (delta values)"으로서 보고될 수 있다. 예를 들어, 석유 정련 장치로부터 나온 C5 스트림의 추출적 증류 (extractive distillation)로부터 유래한 이소프렌의 경우, δ13C 값은 약 -22‰ 내지 -24‰이다. 이 범위는 석유로부터 유래한 가벼운 불포화된 탄화수소의 경우 전형적이고, 석유-기초 이소프렌으로부터 유래한 산물은 전형적으로 동일한 δ13C 값을 가진 이소프렌 단위를 포함한다. 최소량의 다른 탄소-포함 영양분 (예로, 효모 추출물)을 사용하여 옥수수-유래 포도당 (δ13C -10.73‰)의 발효에 의해 생산된 바이오이소프렌은 δ13C - 14.66‰ 내지 -14.85‰를 가진 폴리이소프렌으로 다중합될 수 있는 이소프렌을 생산한다. 이러한 바이오이소프렌으로부터 생산된 산물은 석유-기초 이소프렌으로부터 유래한 것보다 음성인 δ13C 값을 가질 것으로 기대된다.
이들 방법에 의해 제조된 화합물은 고리형 이소프렌 이중체 및 삼중체, 직선형 올리고머, 방향족 및 비고리형 유도체를 포함한다. 디이소아밀렌 (diisoamylene)은 바이오이소프렌 조성물의 부분적 수소화를 포함하는 방법에 의해 제조된다. 이소프렌의 이들 화학적 유도체는 액체 운송 연료 (이소퓨얼TM (IsoFuelsTM))로서 및 연료 첨가제로서 유용하다.
본 명세서에서는 알코올, 케톤, 에스테르 및 에테르를 포함하는 이소프렌의 산화된 유도체의 생산 방법도 역시 제공된다. 이소프렌의 산화된 유도체의 합성 방법도 역시 균질 및 비균질 촉매를 사용하여 액상 또는 기체 상에서 수행될 수 있다. 본 화학적 부류의 화합물도 역시 액체 운송 원료로서 유용하고, 방출 감소를 위한 연료 산화물로서 또한 예를 들어 디젤을 위한 세탄 자극제 (cetane boosters)와 같은 연료 변형제 (fuel modifiers)로서 연료 혼합물 (fuel blends)에 사용될 수 있다.
이소프렌이 석유를 분획하여 획득될 수 있는 반면, 이 물질의 정제는 비싸고 시간이 많이 든다. 탄화수소의 C5 스트림의 석유 열분해 (cracking)는 약 15%의 이소프렌만을 생산한다. 이소프렌은 또한 다양한 미생물, 식물 및 동물 종에 의해서도 자연적으로 생산된다. 상세하게는, 두 가지 경로가 이소프렌의 생합성에 대해 확인되어 왔다: 메발로네이트 (MVA) 경로 및 비-메발로네이트 (DXP) 경로. 생물반응기 (bioreactors)에서 유전적으로 조작된 세포의 배양은, 예로 참고문헌으로 그의 내용 전부가 통합되어 있는 2007년 12월 13일자로 제출된 미국 가특허출원 제 61/013,386호 및 제 61/013,574호, 국제특허출원 제 WO 2009/076676호, 2008년 7월 2일자로 제출된 미국 가특허출원 제 61/134,094호, 제 61/134,947호, 제 61/134,011호 및 제 61/134,103호, 국제특허출원 제 WO 2010/003007호, 2008년 9월 15일자로 제출된 미국 가특허출원 제 61/097,163호, 국제특허출원 제 WO 2010/031079호, 2008년 9월 15일자로 제출된 미국 가특허출원 제 61/097,186호, 국제특허출원 제 WO 2010/031062호, 2008년 9월 15일자로 제출된 미국 가특허출원 제 61/097,189호, 국제측허출원 제 WO 2010/031077호, 2008년 9월 15일자로 제출된 미국 가특허출원 제 61/097,200호, 국제특허출원 제 WO 2010/031068호, 2008년 9월 15일자로 제출된 미국 가특허출원 제 61/097,204호, 국제특허출원 제 WO 2010/031076호, 2008년 12월 30일자로 제출된 미국 가특허출원 제 61/141,652호, 국제특허출원 제 PCT/US09/069862호, 2008년 12월 15일자로 제출된 미국 특허출원 제 12/335,071호 (미국 특허공개 제 US 2009/0203102 A1호) 및 2009년 4월 23일 제출된 미국 특허 제 12/429,143호 (미국 특허공개 제 US 2010/0003716 A1호)에 기술되어 있는 바와 같이, 이소프렌을 더 많은 양으로, 더 높은 순도로 및/또는 독특한 불순도 프로파일을 가지고 보다 효율적으로 생산하여 왔다.
정의
본 명세서에서 달리 정의되지 않는 경우라면, 본 명세서에서 사용되는 모든 기술적 및 과학적 용어의 의미는 본 발명이 속하는 기술분야의 당업자에 의해 보편적으로 이해되는 바와 동일한 의미를 가진다. 본 명세서에서 기술된 것과 유사하거나 동등한 방법들 및 물질들은 본 발명의 관행에서의 용도를 발견할지라도, 바람직한 방법들 및 물질들은 본 명세서에서 기술될 수 있다. 따라서, 하기에 바로 정의된 용어는 보다 상세하게 본 명세서에 대한 참고문헌으로 전체적으로 기술된다. 모든 인용된 서류가 적절한 부분에서 본 명세서에서 참고문헌으로 통합되어 있다. 그러나, 모든 서류의 인용이 본 발명에 관한 선행 기술이라는 승인으로서 참작되지는 않는다.
본 명세서에서 사용되는 바, 단수적 용어 "하나 (a)", "하나 (an)" 및 "그 (the)"는 문맥 상 명백하게 달리 표시되지 않는 경우라면, 복수의 표현을 포함한다.
본 명세서를 통하여 주어진 최대의 수적 제한 (numerical limitation) 모두는 더 낮은 수적 제한 모두를, 마치 본 명세서에서 이러한 더 낮은 수적 제한이 명백하게 기재되어 있은 것과 같이 포함한다. 본 명세서를 통하여 주어진 최소의 수적 제한 모두는 더 높은 수적 제한 모두를, 마치 본 명세서에서 이러한 더 높은 수적 제한이 명백하게 기재되어 있은 것과 같이 포함할 것이다. 본 명세서를 통하여 주어진 수적 범위 모두는 이러한 더 넓은 수적 범위 이내에 속하는 더 좁은 수적 범위 모두를, 마치 본 명세서에서 이러한 더 좁은 수적 범위가 명백하게 기재되어 있은 것과 같이 포함할 것이다.
용어 "이소프렌 (isoprene)"은 2-메틸-1,3-부타디엔 (2-methyl-1,3-butadiene) (CAS# 78-79-5)를 말하고, 이는 3,3-디메틸아릴 피로포스페이트 (3,3-dimethylallyl pyrophosphate, DMAPP)로부터 피로포스페이트의 제거로부터 나온 직접적 및 최종 휘발성 C5 탄화수소 산물이고, (하나의) DMAPP 분자(들)에 (하나의) IPP 분자(들)의 연결 (linking) 또는 다중합은 관여하지 않는다. 용어 "이소프렌"은 일반적으로 본 명세서에서 달리 표시되지 않는 경우라면 그의 생산방법을 제한하도록 의도되지 않는다.
본 명세서에서 사용되는 바, "생물학적으로 생산된 이소프렌 (biologically produced isoprene)" 또는 "바이오이소프렌 (bioisoprene)"은 유전적으로 조작된 세포 배양, 천연 미생물, 식물 또는 동물과 같은 생물학적 수단이라면 모두에 의해 생산된 이소프렌이다.
"바이오이소프렌 조성물 (bioisoprene composition)"은 이소프렌을 생산하도록 조작된 시스템 (예로, 세포)와 같은 생물학적 수단이라면 모두에 의해 생산될 수 있는 조성물을 말한다. 이것은 이소프렘 및 이소프렌과 함께 공동-생산되고 및/또는 분리된 다른 화합물 (불순물 포함)을 포함한다. 바이오이소프렌 조성물은 보통 석유화학적 출처로부터 생산된 이소프렌보다 적은 탄화수소 불순물을 포함하고, 종종 다중합 등급 (polymerization grade)이 되도록 최소의 처리를 요구한다. 본 명세서에서 상술된 바, 바이오이소프렌 조성물은 또한 석유화학적으로 생산된 바이오이소프렌 조성물과는 서로 다른 불순도 프로파일을 가진다.
본 명세서에서 사용되는 바, 이소퓨얼TM (IsoFuelsTM)은 이소프렌으로부터 유래한 액체 운송 연료를 포함하는 연료를 말한다. 바이오이소퓨얼TM (BioIsoFuelsTM)은 바이오이소프렌으로부터 유래한 액체 운송 연료를 포함하는 연료를 말한다.
본 명세서에서 사용되는 바, 용어 "올리고중합 (oligomerization)"은 둘 이상의 단일체 단위를 조합하는 화학적 공정을 말한다. 이소프렌의 "올리고중합"은 이소프렌의 직선형 이중체, 이소프렌의 고리형 이중체, 이소프렌의 직선형 삼중체, 및 이소프렌의 고리형 삼중체 등과 같은 둘 이상의 이소프렌 분자로부터 유래한 이소프렌의 유도체를 생산한다.
"완전한 수소화 (complete hydrogenation)", "완전하게 수소화하다 (completely hydrogenate)" 또는 "전부 수소화하다 (fully hydrogenate)"은 전형적으로 수소화 촉매의 존재 시, 전부 포화된 산물 화합물을 만들도록 전구 화합물 (precursor compound) 안에 있는 탄소-탄소 이중 결합과 같은 불포화된 기능기 모두에 수소 (H2)의 첨가로서 정의된다. 예를 들어, 이소프렌의 완전한 수소화는 이소펜탄을 형성하고 여기에서 이소프렌 몰 당 2몰의 H2가 소모된다.
"부분적 수소화 (partial hydrogenation)" 또는 "부분적으로 수소화하다 (partially hydrogenate)"는 전형적으로 수소화 촉매의 존재 시, 전구 화합물 안에 있는 탄소-탄소 이중 결합과 같은 불포화된 기능기 모두는 아니지만 적어도 하나에 수소 (H2)의 첨가로서 정의된다. 분분적 수소화의 산물(들)은 좀 더 나아가 전부 포화된 산물 화합물을 만들도록 완전하게 수소화될 수 있다. 디엔 (diene)의 부분적 수소화는 하나 이상의 모노-올레핀을 형성한다. 예를 들어 이소프렌의 부분적 수소화는 3가지의 이성질체 이소펜텐 (isomeric isopentenes) (2-메틸부트-1-엔, 2-메틸부트-2-엔, 및 3-메틸부트-1-엔)을 형성할 수 있고 여기에서 이소프렌 몰 당 1몰의 H2가 소모된다.
"선택적 수소화 (selective hydrogenation)" 또는 "선택적으로 수소화하다 (selectively hydrogenate)"는 전형적으로 수소화 촉매의 존재 시, 전구체 화합물 안에 있는 탄소-탄소 이중 결합과 같은 불포화된 기능기 모두는 아니지만 적어도 하나에 수소 (H2)의 첨가로서 정의되고, 여기에서 소정의 불포화된 기능기는 바람직하게 선택된 조건 하에서 다른 불포화된 그룹 위에서 수소화된다. 예를 들어, 이소프렌의 선택적 수소화는 바람직하게 2-메틸-2-부텐, 2-메틸-1-부텐, 3-메틸-1-부텐 또는 그의 혼합물을 형성할 수 있다.
본 명세서에서 사용되는 바, 용어 "폴리펩타이드 (polypeptides)"는 폴리펩타이드, 단백질, 펩타이드, 폴리펩타이드의 단편, 및 융합 폴리펩타이드를 포함한다.
본 명세서에서 사용되는 바, "분리된 폴리펩타이드 (isolated polypeptide)"는 2, 5, 10, 20, 또는 50개 이상의 서로 다른 폴리펩타이드의 라이브러리와 같은 폴리펩타이드 라이브러리의 일부가 아니고 그것이 자연적으로 발생하게 된 성분의 적어도 하나로부터 분리된다. 분리된 폴리펩타이드는 예를 들어 폴리펩타이드를 인코딩하는 재조합 핵산의 발현에 의해 획득될 수 있다.
"이종유래 폴리펩타이드 (heterologous polypeptide)"에 의하여, 아미노산 서열이 동일한 숙주세포에서 자연적으로 발현되는 또 다른 폴리펩타이드의 서열과 일치하지 않는 폴리펩타이드를 의미한다. 상세하게, 이종유래 폴리펩타이드는 동일한 숙주세포에서 자연적으로 발견되는 야생형 폴리펩타이드와 일치하지 않는다.
"코돈 반복성 (codon degeneracy)"은 인코드되는 폴리펩타이드의 아미노산 서열에 영향을 주지 않고 뉴클레오타이드 서열의 변화를 허용하는 유전적 코드에서의 다양성을 말한다. 당업자라면 주어진 아미노산을 특정하도록 뉴클레오타이드 코돈의 사용 시 특이 숙주세포에 의해 나타나는 코돈-편향성 (codon-bias)을 잘 인식하고 있다. 따라서 일정 구현예에서, 숙주세포에서 개선된 발현을 하는 핵산을 합성할 때, 그의 코돈 사용의 빈도가 숙주세포에서 바람직한 코돈 사용의 빈도에 근접하도록 핵산을 설계하는 것이 바람직하다.
본 명세서에서 사용되는 바, "핵산 (nucleic acid)"은 단일 또는 이중-가닥 형태로 공유적으로 함께 결합된 둘 이상의 데옥시리보뉴클레오타이드 (deoxyribonucleotides) 및/또는 리보뉴클레오타이드 (ribonucleotides)를 말한다.
"재조합 핵산 (recombinant nucleic acid)"에 의하여, 관심 있는 핵산이 유래한 생물의 자연적으로 발생되는 게놈에서 관심 있는 핵산에 끼어있는 하나 이상의 핵산 (예로, 유전자)이 아닌 관심 있는 핵산을 의미한다. 따라서 용어는 예를 들어 벡터 내, 자발적으로 복제하는 플라스미드 또는 바이러스 내, 또는 원핵생물 또는 진핵생물의 게놈 DNA 내로 도입되거나, 개별 분자 (예로, cDNA, 게놈 DNA 단편, 또는 PCR 또는 제한효소 소화에 의해 생산된 cDNA 단편)로서 존재하는 재조합 DNA를 포함한다.
"이종유래 핵산 (heterologous nucleic acid)"에 의하여, 핵산 서열이 동일한 숙주세포에서 자연적으로 발견되는 또 다른 핵산의 서열과 일치하지 않는 핵산을 의미한다. 상세하게는, 이종유래 핵산은 동일한 숙주세포에서 자연적으로 발견되는 야생형 핵산과 일치하지 않는다.
본 명세서에서 사용되는 바, "벡터 (vector)"는 숙주세포에서 관심 있는 하나 이상의 핵산을 운반하고 바람직하게 발현할 수 있는 제작물 (construct)을 의미한다. 벡터의 예로는, 이에 제한되는 것은 아니지만 플라스미드, 바이러스성 벡터, DNA 또는 RNA 발현 벡터, 코스미드, 및 파지 벡터를 포함한다.
본 명세서에서 사용되는 바, "발현 조절 서열 (expression control sequence)"은 관심 있는 핵산의 전사를 지향하는 핵산 서열을 의미한다. 발현 조절 서열은 전신발현 (constitutive) 또는 유도가능한 (inducible) 프로모터, 또는 인핸서 (enhancer)와 같은 프로모터일 수 있다. "유도가능한 프로모터"는 환경적 또는 발생적 조절 하에서 활성을 가진 프로모터이다. 발현 조절 서열은 전사될 핵산 분절과 작동적으로 연결되어 있다.
용어 "선택적 마커 (selective marker)" 또는 "선택가능한 마커 (selectable marker)"는 도입된 핵산 또는 벡터를 포함하는 숙주세포의 선별 용이성을 허용하는 숙주세포에서 발현될 수 있는 핵산을 말한다. 선별 마커의 예로는, 이에 제한되는 것은 아니지만 항생제 저항성 핵산 [예로, 카나마이신 (kanamycin), 앰피실린 (ampicillin), 카베니실린 (carbenicillin), 젠타마이신 (gentamicin), 하이그로마이신 (hygromycin), 플레오마이신 (phleomycin), 블레오마이신 (bleomycin), 네오마이신 (neomycin), 또는 클로로암페니콜 (chloramphenicol)] 및/또는 영양적 유익과 같은 숙주세포에 대사적 유익을 부여하는 핵산을 포함한다. 대표적인 영양성 선별 마커 (nutritional selective markers)로는 amdS, argB, 및 pyr4와 같이 당해 기술분야에 알려진 이들 마커를 포함한다.
조성물 및 시스템
일반적으로 석유화학적 출처로부터 유래한 이소프렌은 물질이 다중합 또는 다른 화학적 변환에 적합하기 이전에 철저한 정제 과정을 요구하는 불순한 C5 탄화수소 분획이다. 여러 가지 불순물이 상세하게는 이소프렌과 그들의 구조적 유사도 및 그들이 다중합 촉매 독 (poisons)으로 작용할 수 있는 사실 때문에 문제가 된다. 이러한 화합물은 이에 제한되는 것은 아니지만, 1,3-사이클로펜타디엔, 시스- 및 트랜스-1,3-펜타디엔, 1,4-펜타디엔, 1-펜틴, 2-펜틴, 3-메틸-1-부틴, 펜트-4-엔-1-인, 트랜스-펜트-3-엔-1-인, 및 시스-펜트-3-엔-1-인을 포함한다. 하기에 상술한 바와 같이, 생물학적으로 생산된 이소프렌은 철저한 정제 과정을 거치지 않고도 오염시키는 불포화된 C5 탄화수소가 실질적으로 없을 수 있다. 일정의 생물학적으로 생산된 이소프렌은 에탄올, 아세톤, 및 C5 프레닐 알코올을 포함한다. 이들 성분은 석유화학적 출처로부터 유래한 이소프렌 조성물에 존재하는 이성질체 C5 탄화수소보다 용이하게 이소프렌 스트림으로부터 제거될 수 있다. 좀 더 나아가, 이들 불순물은 예를 들어 생산 균주의 유전적 변형, 탄소 공급원료, 대안의 발효 조건, 회수 공정 변형 및 추가적인 또는 대안의 정제 방법에 의해 생물공정 (bioprocess)에서 해결될 수 있다.
한 가지 관점에서, 본 발명은 (a) 매우 순수한 이소프렌의 시작 조성물의 시판되는 유리한 양; 및 (b) 매우 순수한 이소프렌 시작 물질의 적어도 일부분으로부터 생산된 연료 성분:을 포함하는 조성물들 및 이들을 포함하는 이소프렌으로부터 연료 성분을 생산하는 시스템들을 특징으로 하고, 여기에서 시판되는 유리한 양의 매우 순수한 이소프렌의 적어도 일부분은 화학적 변환을 거친다. 매우 순수한 이소프렌 시작 물질은 연료를 만드는 데 유용한 시판되는 유리한 양의 산물을 생산하도록 화학적 반응에 맡긴다. 한 가지 관점에서, 시판되는 유리한 양의 매우 순수한 이소프렌은 바이오이소프렌을 포함한다. 한 가지 관점에서, 시판되는 유리한 양의 매우 순수한 이소프렌은 바이오이소프렌일 수 있다.
대표적인 시작 이소프렌 조성물
일정 구현예에서, 시판되는 유리한 양의 매우 순수한 이소프렌 시작 조성물은 약 2, 5, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 200, 300, 400, 500, 600, 700, 800, 900, 또는 1000 mg 이상의 이소프렌을 포함한다. 일정 구현예에서, 시작 이소프렌 조성물은 약 2, 5, 10, 20, 30, 40, 50, 60, 70, 80, 90, 또는 100 g 이상의 이소프렌을 포함한다. 일정 구현예에서, 시작 이소프렌 조성물은 약 0.2, 0.5, 1, 2, 5, 10, 20, 50, 100, 200, 500, 또는 1000 kg 이상의 이소프렌을 포함한다. 일정 구현예에서, 시작 조성물에서 이소프렌의 양은 약 2 내지 약 100 mg 사이, 약 100 내지 약 500 mg 사이, 약 500 내지 약 1,000 mg 사이, 약 1,000 내지 약 2,000 mg 사이, 또는 약 2,000 내지 약 5,000 mg 사이와 같은, 약 2 내지 약 5,000 mg 사이의 범위이다. 일정 구현예에서, 시작 조성물에서 이소프렌의 양은 약 100 내지 약 5,000 mg 사이, 약 200 내지 약 2,000 mg 사이, 약 200 내지 약 1,000 mg 사이, 약 300 내지 약 1,000 mg 사이, 또는 약 400 내지 약 1,000 mg 사이와 같은, 약 20 내지 약 5,000 mg 사이의 범위이다. 일정 구현예에서, 시작 조성물에서 이소프렌의 양은 약 2 내지 약 100 g 사이, 약 100 내지 약 500 g 사이, 약 500 내지 약 1,000 g 사이, 약 1,000 내지 약 2,000 g 사이, 또는 약 2,000 내지 약 5,000 g 사이와 같은, 약 2 내지 약 5,000 g 사이의 범위이다. 일정 구현예에서, 시작 조성물에서 이소프렌의 양은 약 2 내지 약 5,000 kg 사이, 약 10 내지 약 2,000 kg 사이, 약 20 내지 약 1,000 kg 사이, 약 20 내지 약 500 kg 사이, 약 30 내지 약 200 kg 사이, 또는 약 40 내지 약 100 kg 사이의 범위이다. 일정 구현예에서, 시작 조성물의 휘발성 유기 분획의 약 20, 25, 30, 40, 50, 60, 70, 80, 90, 또는 95% (w/w) 이상은 이소프렌이다.
일정 구현예에서, 매우 순수한 이소프렌 시작 조성물은 시작 조성물에 있는 모든 C5 탄화수소의 전체 무게에 대비한 무게로 약 98.0, 98.5, 99.0, 99.5, 또는 100% 이상의 이소프렌을 포함한다. 일정 구현예에서, 매우 순수한 이소프렌 시작 조성물은 시작 조성물에 있는 모든 C5 탄화수소의 전체 무게에 대비한 무게로 약 99.90, 99.92, 99.94, 99.96, 99.98, 또는 100% 이상의 이소프렌을 포함한다. 일정 구현예에서, 시작 조성물은 시작 조성물에 있는 모든 C5 탄화수소에 대한 검출기 반응에 대비하여 이소프렌을 위한 약 98.0, 98.5, 99.0, 99.5, 또는 100% 이상의 상대적인 검출기 반응을 가진다. 일정 구현예에서, 시작 조성물은 시작 조성물에 있는 모든 C5 탄화수소에 대한 검출기 반응에 대비하여 이소프렌을 위한 약 99.90, 99.91, 99.92, 99.93, 99.94, 99.95, 99.96, 99.97, 99.98, 99.99, 또는 100% 이상의 상대적인 검출기 반응을 가진다. 일정 구현예에서, 시작 이소프렌 조성물은 시작 조성물에 있는 모든 C5 탄화수소의 전체 무게에 대비한 무게로 약 98.0 내지 약 98.5, 약 98.5 내지 약 99.0, 약 99.0 내지 약 99.5, 약 99.5 내지 약 99.8, 약 99.8 내지 약 100% 사이의 이소프렌을 포함한다. 일정 구현예에서, 시작 이소프렌 조성물은 시작 조성물에 있는 모든 C5 탄화수소의 전체 무게에 대비한 무게로 약 99.90 내지 약 99.92, 약 99.92 내지 약 99.94, 약 99.94 내지 약 99.96, 약 99.96 내지 약 99.98, 약 99.98 내지 약 100% 사이의 이소프렌을 포함한다.
일정 구현예에서, 매우 순수한 이소프렌 시작 조성물은 시작 조성물에 있는 모든 C5 탄화수소의 전체 무게에 대비한 무게로 약 2.0, 1.5, 1.0, 0.5, 0.2, 0.12, 0.10, 0.08, 0.06, 0.04, 0.02, 0.01, 0.005, 0.001, 0.0005, 0.0001, 0.00005, 또는 0.00001% 이하의 이소프렌이 아닌 C5 탄화수소 (1,3-사이클로펜타디엔, 시스-1,3-펜타디엔, 트랜스-1,3-펜타디엔, 1,4-펜타디엔, 1-펜틴, 2-펜틴, 1-펜텐, 2-메틸-1-부텐, 3-메틸-1-부틴, 펜트-4-엔-1-인, 트랜스-펜트-3-엔-1-인, 또는 시스-펜트-3-엔-1-인과 같음)를 포함한다. 일정 구현예에서, 시작 조성물은 시작 조성물에 있는 모든 C5 탄화수소에 대한 검출기 반응에 대비하여 이소프렌이 아닌 C5 탄화수소를 위한 약 2.0, 1.5, 1.0, 0.5, 0.2, 0.12, 0.10, 0.08, 0.06, 0.04, 0.02, 0.01, 0.005, 0.001, 0.0005, 0.0001, 0.00005, 또는 0.00001% 이하의 상대적인 검출기 반응을 가진다. 일정 구현예에서, 시작 조성물은 시작 조성물에 있는 모든 C5 탄화수소에 대한 검출기 반응에 대비하여 1,3-사이클로펜타디엔, 시스-1,3-펜타디엔, 트랜스-1,3-펜타디엔, 1,4-펜타디엔, 1-펜틴, 2-펜틴, 1-펜텐, 2-메틸-1-부텐, 3-메틸-1-부틴, 펜트-4-엔-1-인, 트랜스-펜트-3-엔-1-인, 또는 시스-펜트-3-엔-1-인를 위한 약 2.0, 1.5, 1.0, 0.5, 0.2, 0.12, 0.10, 0.08, 0.06, 0.04, 0.02, 0.01, 0.005, 0.001, 0.0005, 0.0001, 0.00005, 또는 0.00001% 이하의 상대적인 검출기 반응을 가진다. 일정 구현예에서, 매우 순수한 이소프렌 시작 조성물은 시작 조성물에 있는 모든 C5 탄화수소의 전체 무게에 대비한 무게로 약 0.02 내지 약 0.04%, 약 0.04 내지 약 0.06%, 약 0.06 내지 약 0.08%, 약 0.08 내지 약 0.10%, 또는 약 0.10 내지 약 0.12% 사이의 이소프렌이 아닌 C5 탄화수소 (1,3-사이클로펜타디엔, 시스-1,3-펜타디엔, 트랜스-1,3-펜타디엔, 1,4-펜타디엔, 1-펜틴, 2-펜틴, 1-펜텐, 2-메틸-1-부텐, 3-메틸-1-부틴, 펜트-4-엔-1-인, 트랜스-펜트-3-엔-1-인, 또는 시스-펜트-3-엔-1-인과 같음)를 포함한다.
일정 구현예에서, 매우 순수한 이소프렌 시작 조성물은 이소프렌의 다중합을 저해하는 시작 조성물에 있는 화합물이라면 모두의 경우 약 50, 40, 30, 20, 10, 5, 1, 0.5, 0.1, 0.05, 0.01, 또는 0.005 μg/L 이하의 이소프렌의 다중합을 저해하는 화합물을 포함한다. 일정 구현예에서, 시작 이소프렌 조성물은 이소프렌의 다중합을 저해하는 시작 조성물에 있는 화합물이라면 모두의 경우 약 0.01 내지 약 10, 약 0.01 내지 약 5, 약 0.01 내지 약 1, 약 0.01 내지 약 0.5, 또는 약 0.01 내지 약 0.005 μg/L와 같은 약 0.005 내지 약 50 μg/L 사이의 이소프렌의 다중합을 저해하는 화합물을 포함한다. 일정 구현예에서, 시작 이소프렌 조성물은 약 50, 40, 30, 20, 10, 5, 1, 0.5, 0.1, 0.05, 0.01, 또는 0.005 μg/L 이하의 이소프렌이 아닌 (1,3-사이클로펜타디엔, 시스-1,3-펜타디엔, 트랜스-1,3-펜타디엔, 1,4-펜타디엔, 1-펜틴, 2-펜틴, 1-펜텐, 2-메틸-1-부텐, 3-메틸-1-부틴, 펜트-4-엔-1-인, 트랜스-펜트-3-엔-1-인, 또는 시스-펜트-3-엔-1-인과 같음) 탄화수소를 포함한다. 일정 구현예에서, 시작 이소프렌 조성물은 약 0.01 내지 약 10, 약 0.01 내지 약 5, 약 0.01 내지 약 1, 약 0.01 내지 약 0.5, 또는 약 0.01 내지 약 0.005 μg/L와 같은 약 0.005 내지 약 50 μg/L 사이 범위의 이소프렌이 아닌 탄화수소를 포함한다. 일정 구현예에서, 시작 이소프렌 조성물은 약 50, 40, 30, 20, 10, 5, 1, 0.5, 0.1, 0.05, 0.01, 또는 0.005 μg/L 이하의 단백질 또는 지방산 (자연적으로 천연 고무와 관련되어 있는 단백질 또는 지방산과 같음)을 포함한다.
일정 구현예에서, 매우 순수한 이소프렌 시작 조성물은 약 10, 5, 1, 0.8, 0.5, 0.1, 0.05, 0.01, 또는 0.005 ppm 이하의 알파 아세틸렌 (alpha acetylenes), 피페릴렌 (piperylenes), 아세토니트릴 (acetonitrile), 또는 1,3-사이클로부타디엔 (1,3-cyclopentadiene)을 포함한다. 일정 구현예에서, 매우 순수한 이소프렌 시작 조성물은 약 5, 1, 0.5, 0.1, 0.05, 0.01, 또는 0.005 ppm 이하의 황 또는 알렌 (allens)을 포함한다. 일정 구현예에서, 매우 순수한 이소프렌 시작 조성물은 약 30, 20, 15, 10, 5, 1, 0.5, 0.1, 0.05, 0.01, 또는 0.005 이하의 아세틸렌 모두 (1-펜틴, 2-펜틴, 3-메틸-1-부틴, 펜트-4-엔-1-인, 트랜스-펜트-3-엔-1-인, 및 시스-펜트-3-엔-1-인와 같음)를 포함한다. 일정 구현예에서, 매우 순수한 이소프렌 시작 조성물은 약 2000, 1000, 500, 200, 100, 50, 40, 30, 20, 10, 5, 1, 0.5, 0.1, 0.05, 0.01, 또는 0.005 ppm 이하의 고리형 이소프렌 이중체 (예로, 두 개의 이소프렌 단위의 이중합으로부터 유래한 고리형 C10 화합물)와 같은 이소프렌 이중체를 포함한다.
일정 구현예에서, 매우 순수한 이소프렌 시작 조성물은 에탄올, 아세톤, 메탄올, 아세트알데하이드, 메타크롤레인, 메틸 비닐 케톤, 2-메틸-2-비닐옥시란, 시스- 및 트랜스-3-메틸-1,3-펜타디엔, C5 프레닐 알코올 (3-메틸-3-부텐-1-올 또는 3-메틸-2-부텐-1-올), 또는 상기의 둘 이상이라면 모두를 포함한다. 상세한 구현예에서, 시작 이소프렌 조성물은 0.005, 0.01, 0.05, 0.1, 0.5, 1, 5, 10, 20, 30, 40, 60, 80, 100, 또는 120 μg/L 이상의 에탄올, 아세톤, 메탄올, 아세트알데하이드, 메타크롤레인, 메틸 비닐 케톤, 2-메틸-2-비닐옥시란, 시스- 및 트랜스-3-메틸-1,3-펜타디엔, C5 프레닐 알코올 (3-메틸-3-부텐-1-올 또는 3-메틸-2-부텐-1-올), 또는 상기의 둘 이상이라면 모두를 포함한다. 일정 구현예에서, 이소프렌 조성물은 약 0.01 내지 약 80, 약 0.01 내지 약 60, 약 0.01 내지 약 40, 약 0.01 내지 약 30, 약 0.01 내지 약 20, 약 0.01 내지 약 10, 약 0.1 내지 약 80, 약 0.1 내지 약 60, 약 0.1 내지 약 40, 약 5 내지 약 80, 약 5 내지 약 60, 또는 약 5 내지 약 40 사이와 같은 약 0.005 내지 약 120 사이 범위의 에탄올, 아세톤, 메탄올, 아세트알데하이드, 메타크롤레인, 메틸 비닐 케톤, 2-메틸-2-비닐옥시란, 시스- 및 트랜스-3-메틸-1,3-펜타디엔, C5 프레닐 알코올, 또는 상기의 둘 이상이라면 모두를 포함한다.
일정 구현예에서, 매우 순수한 이소프렌 시작 조성물은 하나 이상의 다음의 성분을 포함한다: 2-헵탄온, 6-메틸-5-헵텐-2-온, 2,4,5-트리메틸피리딘, 2,3,5-트리메틸피라진, 시트로넬랄, 메탄티올, 메틸 아세테이트, 1-프로판올, 디아세틸, 2-부탄온, 2-메틸-3-부텐-2-올, 에틸 아세테이트, 2-메틸-1-프로판올, 3-메틸-1-부탄알, 3-메틸-2-부탄온, 1-부탄올, 2-펜탄온, 3-메틸-1-부탄올, 에틸 부틸레이트, 3-메틸-2-부텐알, 부틸 아세테이트, 3-메틸부틸 아세테이트, 3-메틸-3-부텐-1-일 아세테이트, 3-메틸-2-부텐-1-일 아세테이트, 3-헥센-1-올, 3-헥센-1-일 아세테이트, 리모넨, 게라니올 (트랜스-3,7-디메틸-2,6-옥타디엔-1-올), 시트로넬롤 (3,7-디메틸-6-옥텐-1-올), (E)-3,7-디메틸-1,3,6-옥타트리엔, (Z)-3,7-디메틸-1,3,6-옥타트리엔, 2,3-사이클로헵텐올피리딘, 또는 직선형 이소프렌 중합체 (복수의 이소프렌 단위의 다중합으로부터 유래한 직선형 이소프렌 이중체 또는 직선형 이소프렌 삼중체와 같음). 다양한 구현예들에서, 무게로 단위 퍼센트의 이소프렌 양에 대비한 이들 화합물 하나의 양 (예로, 이소프렌의 무게로 나눈 성분의 무게 곱하기 100)은 약 0.01, 0.02, 0.05, 0.1, 0.5, 1, 5, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 또는 110% (w/w) 이상이다. 일정 구현예에서, 이소프렌에 대한 검출기 반응에 대비한 두 번째 화합물에 대한 상대적인 검출기 반응은 약 0.01, 0.02, 0.05, 0.1, 0.5, 1, 5, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 또는 110% (w/w) 이상이다. 다양한 구현예들에서, 무게로 단위 퍼센트의 이소프렌 양에 대비한 이들 화합물 하나의 양 (예로, 이소프렌의 무게로 나눈 성분의 무게 곱하기 100)은 약 0.01 내지 약 90, 약 0.01 내지 약 80, 약 0.01 내지 약 50, 약 0.01 내지 약 20, 약 0.01 내지 약 10, 약 0.02 내지 약 50, 약 0.05 내지 약 50, 약 0.1 내지 약 50, 또는 약 0.1 내지 약 20% (w/w) 사이와 같은, 약 0.01 내지 약 105% (w/w) 사이의 범위이다.
일정 구현예에서, 매우 순수한 이소프렌 시작 조성물의 적어도 일부분은 기체 상으로 있다. 일정 구현예에서, 매우 순수한 이소프렌 시작 조성물의 적어도 일부분은 액상으로 있다 (농축물 (condensate)과 같음). 일정 구현예에서, 매우 순수한 이소프렌 시작 조성물의 적어도 일부분은 고체 상에 있다. 일정 구현예에서, 매우 순수한 이소프렌 시작 조성물의 적어도 일부분은 실리카 (silica) 및/또는 활성 탄소 (activated carbon)를 포함하는 지지체 (support)와 같은 고체 지지체에 흡착된다. 일정 구현예에서, 시작 이소프렌 조성물은 하나 이상의 용매와 혼합된다. 일정 구현예에서, 시작 이소프렌 조성물은 하나 이상의 기체와 혼합된다.
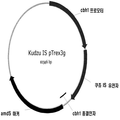
일정 구현예에서, 시판되는 유리한 양의 매우 순수한 이소프렌 시작 조성물은 생물학적 공정에 의해 생산된다. 일정 바람직한 구현예에서, 매우 순수한 이소프렌 시작 조성물은 세포의 습윤 무게/시간 (nmole/gwem/시간)의 이소프렌으로 약 400 nmole 이소프렌/세포 그램수 이상을 생산하는 세포를 배양하여 생산된 바이오이소프렌 조성물이다. 일정 구현예에서, 바이오이소프렌 조성물은 세포 배양 배지에 있는 탄소의 약 0.002% 이상을 이소프렌으로 전환시키는 세포를 배양하여 생산된다. 일정 구현예에서, 세포는 이소프렌 합성효소 폴리펩타이드, 예로 자연적으로 생기는 푸엘라리아 (Pueraria)와 같은 식물로부터 나온 폴리펩타이드를 인코드하고, (ii) T7 프로모터와 같은 프로모터에 작동적으로 연결되어 있는 이종유래 핵산을 가진다. 예를 들어 포풀라 및 자연적으로 생기는 부모 이소프렌 합성효소의 변형체로부터 나온 다른 이소프렌 합성효소 폴리펩타이드는 바이오이소프렌을 생산하는 데 사용될 수 있다. 사용될 수 있는 이소프렌 합성효소 및 그의 변형체의 예는 본 명세서에서 전부가 통합되어 있는 미국 특허출원 제 12/429,143호에 기술되어 있다.
일정 구현예에서, 세포는 이에 제한되는 것은 아니지만 탄소화물, 글리세롤, 글리세린, 디하이드록시아세톤, 일-탄소원, 오일, 동물 지방, 동물 오일, 지방산, 지질, 인지질, 글리세롤 지질, 모노글리세라이드, 디글리세라이드, 트리글리세라이드, 재생가능한 탄소원, 폴리펩타이드 (예로, 미생물 또는 식물 단백질 또는 펩타이드), 효모 추출물, 효모 추출물로부터 나온 성분, 또는 상기 둘 이상의 조합이라면 모두와 같은 탄소원을 포함하는 배양 배지에서 배양된다. 일정 구현예에서, 세포는 제한된 포도당 배지에서 배양된다. 일정 구현예에서, 세포는 좀 더 나아가 IDI 폴리펩타이드를 인코딩하는 이종유래 핵산을 포함한다. 일정 구현예에서, 세포는 좀 더 나아가 MVD 경로 폴리펩타이드를 인코딩하는 이종유래 핵산을 포함한다. 일정 구현예에서, 시작 이소프렌 조성물은 2008년 7월 2일자로 제출된 미국 가특허출원 제 61/134,094호, 국제특허출원 제 WO 2010/003007호, 및 2008년 12월 12일자로 제출된 미국 특허출원 제 12/335,071호 (US 2009/0203102 A1)에서 기술된 바와 같은 이소프렌 조성물이거나, 이에 기술된 세포라면 모두를 배양하여 생산된다.
일정 구현예에서, 매우 순수한 이소프렌 시작 조성물은 이소프렌을 생산하는 배양의 세포에 의해 생산되는 기체 상 (배출-기체)을 포함한다. 일정 구현예에서, 기체 상은 이소프렌의 비발화성 농도를 가진다. 일정 구현예에서, 기체 상은 약 9.5% (부피) 이하의 산소를 포함한다. 일정 구현예에서, 기체 상은 약 9.5% (부피) 이상의 산소를 포함하고, 기체 상에서의 이소프렌의 농도는 저부 발화도 한계 (lower flammability limit) 이하이거나 고부 발화도 한계 (upper flammability limit) 이상이다. 일정 구현예에서, 이소프렌이 아닌 기체 상의 부분은 약 10% 내지 약 100% (부피) 산소 사이와 같은 약 0% 내지 약 100% (부피) 산소 사이의 범위를 포함한다. 일정 구현예에서, 이소프렌이 아닌 기체 상의 부분은 약 0% 내지 약 99% (부피) 질소 사이의 범위를 포함한다. 일정 구현예에서, 이소프렌이 아닌 기체 상의 부분은 약 1% 내지 약 50% (부피) CO2 사이의 범위를 포함한다.
일정 구현예에서, 매우 순수한 이소프렌 시작 조성물은 다음의 하나 이상을 포함한다: 알코올, 알데하이드, 케톤, 또는 에스테르 (본 명세서에 기술된 알코올, 알데하이드, 케톤, 또는 에스테르라면 모두와 같음). 일정 구현예에서, 이소프렌 조성물은 (i) 알코올 및 알데하이드, (ii) 알코올 및 케톤, (iii) 알데하이드 및 케톤, 또는 (iv) 알코올, 알데하이드 및 케톤을 포함한다. 일정 구현예에서, 이소프렌 조성물이라면 모두 좀 더 나아가 에스테르를 포함한다.
일정 구현예에서, 생물학적 출처 (세포 배양과 같음)로부터 유래한 매우 순수한 이소프렌 시작 조성물은 다음의 하나 이상을 포함한다: 메탄올, 아세트알데하이드, 에탄올, 메탄티올, 1-부탄올, 3-메틸-1-프로판올, 아세톤, 아세트산, 2-부탄온, 2-메틸-1-부탄올, 또는 인돌. 일정 구현예에서, 시작 이소프렌 조성물은 1 ppm 이상의 다음의 하나 이상을 포함한다: 메탄올, 아세트알데하이드, 에탄올, 메탄티올, 1-부탄올, 3-메틸-1-프로판올, 아세톤, 아세트산, 2-부탄온, 2-메틸-1-부탄올, 또는 인돌. 일정 구현예에서, 다음의 하나 이상의 농도는: 메탄올, 아세트알데하이드, 에탄올, 메탄티올, 1-부탄올, 3-메틸-1-프로판올, 아세톤, 아세트산, 2-부탄온, 2-메틸-1-부탄올, 또는 인돌, 시작 이소프렌 조성물에서 (정제되기 이전의 배출-기체와 같음) 약 1 내지 약 10,000 ppm 사이의 범위이다. 일정 구현예에서, 시작 이소프렌 조성물은 (하나 이상의 정제 단계를 거치기 이전의 배출-기체와 같음) 다음의 하나 이상을: 메탄올, 아세트알데하이드, 에탄올, 메탄티올, 1-부탄올, 3-메틸-1-프로판올, 아세톤, 아세트산, 2-부탄온, 2-메틸-1-부탄올, 또는 인돌, 약 1 내지 10 ppm, 약 10 내지 20 ppm, 약 20 내지 30 ppm, 약 30 내지 40 ppm, 약 40 내지 50 ppm, 약 50 내지 60 ppm, 약 60 내지 70 ppm, 약 70 내지 80 ppm, 약 80 내지 90 ppm, 또는 약 90 내지 100 ppm 사이와 같은 약 1 내지 100 ppm 사이의 농도로 포함한다. 일정 구현예에서, 시작 이소프렌 조성물은 1 ppm 이하의 메탄티올 (강력한 촉매 독 및 최종 연료 산물에서의 황원 (source of sulfur))을 포함한다. 세포 배양으로부터 나온 휘발성 유기 화합물 (세포 배양의 상부공간에서의 휘발성 유기 화합물과 같음)은 본 명세서에서 기술된 것과 같은 표준 방법들 또는 양성자 전이 반응-질량 분광측정법 (proton transfer reaction-mass spectrometry)과 같은 다른 표준 방법들을 사용하여 분석될 수 있다 (예를 들어, Bunge et al., Applied and Environmental Microbiology, 74(7): 2179-2186, 2008을 참조하고, 이는 본 명세서에서 참고문헌으로 전부 상세하게는 휘발성 유기 화합물의 분석에 관하여 통합되어 있다).
또한 본 발명은 이소프렌과 수소를 공동-생산하고 생물학적 출처 (세포 배양과 같음)로부터 유래한 매우 순수한 이소프렌 시작 조성물의 용도에 관한 것이다. 일정 구현예에서, 시작 이소프렌 조성물은 3 몰라 퍼센트의 수소마다 적어도 1 몰라 퍼센트의 이소프렌으로부터 4 몰라 퍼센트의 수소마다 적어도 1 몰라 퍼센트의 이소프렌까지의 범위를 가지는 비율로 이소프렌과 수소를 포함한다. 일정 구현예에서, 시작 이소프렌 조성물은 약 1 내지 9, 2 내지 8, 3 내지 7, 4 내지 6, 5 내지 5, 6 내지 4, 7 내지 3, 8 내지 2, 또는 9 내지 1의 몰라 비율로 이소프렌과 수소를 포함한다. 일정 구현예에서, 조성물은 좀 더 나아가 1 부터 11 몰라 퍼센트까지의 이소프렌 및 4 부터 44 몰라 퍼센트까지의 수소를 포함한다. 일정 구현예에서, 조성물은 좀 더 나아가 산소, 이산화탄소, 또는 질소를 포함한다. 일정 구현예에서, 조성물은 좀 더 나아가 0 부터 21 몰라 퍼센트까지의 산소, 18 부터 44 몰라 퍼센트까지의 이산화탄소, 또한 1 부터 78 몰라 퍼센트까지의 질소를 포함한다. 일정 구현예에서, 조성물은 좀 더 나아가 1.0 x 10-4 몰라 퍼센트 이하의 비-메탄성 휘발성 불순물을 포함한다. 일정 구현예에서, 비-메탄성 휘발성 불순물은 다음의 하나 이상을 포함한다: 2-헵탄온 (2-heptanone), 6-메틸-5-헵텐-2-온 (6-methyl-5-hepten-2-one), 2,4,5-트리메틸피리딘 (2,4,5-trimethylpyridine), 2,3,5-트리메틸피라진 (2,3,5-trimethylpyrazine), 시트로넬랄 (citronellal), 아세트알데하이드 (acetaldehyde), 메탄티올 (methanethiol), 메틸 아세테이트 (methyl acetate), 1-프로판올 (1-propanol), 디아세틸(diacetyl), 2-부탄온(2-butanone), 2-메틸-3-부텐-2올 (2-methyl-3-buten-2-ol), 에틸 아세테이트 (ethyl acetate), 2-메틸-1-프로판올 (2-methyl-1-propanol), 3-메틸-1-부탄알 (3-methyl-1-butanal), 3-메틸-2-부탄온 (3-methyl-2-butanone), 1-부탄올 (1-butanol), 2-펜탄온 (2-pentanone), 3-메틸-1-부탄올 (3-methyl-1-butanol), 에틸 이소부틸레이트 (ethyl isobutyrate), 3-메틸-2-부텐알 (3-methyl-2-butenal), 부틸 아세테이트 (butyl acetate), 3-메틸부틸 아세테이트 (3-methylbutyl acetate), 3-메틸-3-부텐-1-일 아세테이트 (3-methyl-3-buten-1-yl acetate), 3-메틸-2-부텐-1-일 아세테이트 (3-methyl-2-buten-1-yl acetate), 3-헥센-1-올 (3-3-hexen-1-ol), 3-헥센-1-일 아세테이트 (3-hexen-1-yl acetate), 리모넨 (limonene), 제라니올 (geraniol, 트랜스-3,7-디메틸-2,6-옥타디엔-1-올 (trans-3,7-dimethyl-2,6-octadien-1-ol)) 및 시트로넬롤 (citronellol, 3,7-디메틸-6-옥텐-1-올 (3,7-dimethyl-6-octen-1-ol)), (E)-3,7-디메틸-1,3,6-옥타트리엔 ((E)-3,7-dimethyl-1,3,6-octatriene), (Z)-3,7-디메틸-1,3,6-옥타트리엔 ((Z)-3,7-dimethyl-1,3,6-octatriene), 2,3-사이클로헵텐올피리딘 (2,3-cycloheptenolpyridine), 또는 직선상 이소프렌 중합체 (복수의 이소프렌 단위의 다중합로부터 유래한 직선상 이소프렌 이중체 또는 직선상 이소프렌 삼중체와 같음). 일정 구현예에서, 이소프렌 조성물은 다음의 하나 이상을 포함한다: 알코올, 알데하이드, 또는 케톤 (본 명세서에 기술된 알코올, 알데하이드, 또는 케톤이라면 모두와 같음). 일정 구현예에서, 이소프렌 조성물은 (i) 알코올 및 알데하이드, (ii) 알코올 및 케톤, (iii) 알데하이드 및 케톤, 또는 (iv) 알코올, 알데하이드 및 케톤을 포함한다. 일정 구현예에서, 비-메탄성 휘발성 불순물은 다음의 하나 이상을 포함한다: 메탄올, 아세트알데하이드, 에탄올, 메탄티올, 1-부탄올, 3-메틸-1-프로판올, 아세톤, 아세트산, 2-부탄온, 2-메틸-1-부탄올, 또는 인돌.
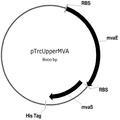
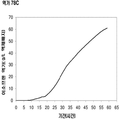
이소프렌을 생산하는 세포의 배양에서 이소프렌을 생산하는 기법들은 2007년 12월 13일자로 제출된 미국 가특허출원 제 61/013,386호 및 제 61/013,574호, 국제특허출원 제 WO 2009/076676호, 2008년 7월 2일자로 제출된 미국 가특허출원 제 61/134,094호, 제 61/134,947호, 제 61/134,011호 및 제 61/134,103호, 국제특허출원 제 WO 2010/003007호, 2008년 9월 15일자로 제출된 미국 가특허출원 제 61/097,163호, 국제특허출원 제 WO 2010/031079호, 2008년 9월 15일자로 제출된 미국 가특허출원 제 61/097,186호, 국제특허출원 제 WO 2010/031062호, 2008년 9월 15일자로 제출된 미국 가특허출원 제 61/097,189호, 국제측허출원 제 WO 2010/031077호, 2008년 9월 15일자로 제출된 미국 가특허출원 제 61/097,200호, 국제특허출원 제 WO 2010/031068호, 2008년 9월 15일자로 제출된 미국 가특허출원 제 61/097,204호, 국제특허출원 제 WO 2010/031076호, 2008년 12월 30일자로 제출된 미국 가특허출원 제 61/141,652호, 국제특허출원 제 PCT/US09/069862호, 2008년 12월 15일자로 제출된 미국 특허출원 제 12/335,071호 (미국 특허공개 제 US 2009/0203102 A1호) 및 2009년 4월 23일 제출된 미국 특허 제 12/429,143호 (미국 특허공개 제 US 2010/0003716 A1호)에 기술되어 있고, 그들의 교육 내용은 이러한 공정에 의해 이소프렌을 생산하고 회수하는 교육적 기법들의 목적으로 본 명세서에서 참고문헌으로 통합되어 있다. 어떠한 경우라도, 2007년 12월 13일자로 제출된 미국 가특허출원 제 61/013,386호 및 제 61/013,574호, 국제특허출원 제 WO 2009/076676호, 2008년 7월 2일자로 제출된 미국 가특허출원 제 61/134,094호, 제 61/134,947호, 제 61/134,011호 및 제 61/134,103호, 국제특허출원 제 WO 2010/003007호, 2008년 9월 15일자로 제출된 미국 가특허출원 제 61/097,163호, 국제특허출원 제 WO 2010/031079호, 2008년 9월 15일자로 제출된 미국 가특허출원 제 61/097,186호, 국제특허출원 제 WO 2010/031062호, 2008년 9월 15일자로 제출된 미국 가특허출원 제 61/097,189호, 국제측허출원 제 WO 2010/031077호, 2008년 9월 15일자로 제출된 미국 가특허출원 제 61/097,200호, 국제특허출원 제 WO 2010/031068호, 2008년 9월 15일자로 제출된 미국 가특허출원 제 61/097,204호, 국제특허출원 제 WO 2010/031076호, 2008년 12월 30일자로 제출된 미국 가특허출원 제 61/141,652호, 국제특허출원 제 PCT/US09/069862호, 2008년 12월 15일자로 제출된 미국 특허출원 제 12/335,071호 (미국 특허공개 제 US 2009/0203102 A1호) 및 2009년 4월 23일 제출된 미국 특허 제 12/429,143호 (미국 특허공개 제 US 2010/0003716 A1호)은 세포 배양에서 증가된 양의 이소프렌의 조성물들 및 이들을 생산하는 방법들을 가르치고 있다. 2008년 12월 15일자로 제출된 미국 특허출원 제 12/335,071호 및 제 US 2009/0203102 A1호는 좀 더 나아가 배양된 세포로부터 이소프렌과 수소의 조성물들 및 이들을 공동-생산하는 방법들을 가르치고 있다. 상세하게는, 이들 조성물 및 방법은 이소프렌 생산률을 증가시키고 생산되는 이소프렌의 전체량을 증가시킨다. 예를 들어, 4.8 x 104 nmole/gwcm/시간의 이소프렌을 생성하는 세포 배양 시스템이 생산되어 왔다 (표 1). 이들 시스템의 효율은 세포가 세포 배양 배지로부터 이소프렌으로 연소되는 약 2.2%의 탄소의 전환에 의해 드러난다. 실시예 및 표 2에 나타난 바와 같이, 액체배지 리터 당 대략 3 g의 이소프렌이 생성되었다. 원하는 경우, 훨씬 더 많은 이소프렌이 본 명세서에서 기술된 것과 같은 기타 조건을 사용하여 획득되었다. 일정 구현예에서, 재생가능한 탄소원이 이소프렌의 생산에 사용되었다. 일정 구현예에서, 이소프렌의 생산은 세포의 성장과 관련되지 않는다. 일정 구현예에서, 이소프렌과 산화제라면 모두의 농도는 이소프렌 생산 또는 회수 기간 동안 화재가 발생될 수 있는 위험성을 감소하거나 없앨 수 있도록 발화가능하지 않는 범위 이내에 있다. 본 발명의 조성물 및 방법은 그들이 세포 당 높은 이소프렌 수율, 높은 탄소 수율, 높은 이소프렌 정제도, 높은 생산도, 낮은 에너지 사용, 낮은 생산 비용과 투자, 및 최소의 부작용을 가능하게 하기 때문에 바람직하다. 본 이소프렌 생산을 위한 효율적, 대규모, 생합성 방법은 합성 이소프렌-기초한 고무를 위한 이소프렌 출처를 제공하고 천연 고무를 사용하는 것에 바람직한 저-비용의 대안을 제공한다.
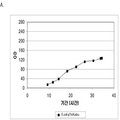
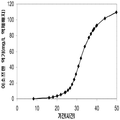
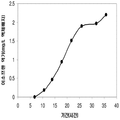
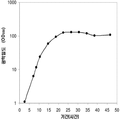
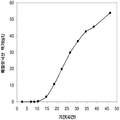
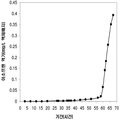
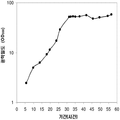
좀 더 나아가 하기에 논의된 바와 같이, 세포에 의해 생산된 이소프렌량은 이소프렌 합성효소 폴리펩타이드 (예로, 식물 이소프렌 합성효소 폴리펩타이드)를 인코딩하는 이종유래 핵산을 세포 내로 도입함에 의해 크게 증가될 수 있다. 이소프렌 합성효소 폴리펩타이드는 디메틸아릴 디포스페이트 (DMAPP)을 이소프렌으로 전환시킨다. 실시예들에서 보여진 바와 같이, 이종유래 푸엘라리아 몬타나 (쿠쥬) [Pueraria Montana (kudzu)] 이소프렌 합성효소 폴리펩타이드는 에스케리키아 콜라이, 판토테오아 시트레아, 바실러스 섭틸리스, 야로위야 리포리티카, 및 트리코더마 리세이 와 같은 다양한 숙주세포에서 발현되었다. 이들 세포 모두는 이종유래 이소프렌 합성효소 폴리펩타이드가 없는 해당되는 세포보다 더 많은 이소프렌을 생산하였다. 표 1 및 표 2에서 설명된 바와 같이, 많은 양의 이소프렌이 본 명세서에서 기술된 방법을 사용하여 생산된다. 예를 들어, 이종유래 이소프렌 합성효소 폴리펩타이드 핵산을 가진 B. subtilis 세포는 이종유래 핵산이 없는 해당되는 대조군 B. subtilis 세포보다 14 리터 발효기에서 대략 10배 더 많은 이소프렌을 생산하였다 (표 2). 발효기에서 대장균에 의한 액체배지 리터 당 300 mg의 이소프렌 (mg/L, 여기에서 액체배지의 부피는 세포 배지의 부피 및 세포의 부피 둘 다를 포함함) 또한 B. subtilis 에 의한 30 mg/L은 이소프렌이 유의한 양으로 생성될 수 있는 것을 표시한다 (표 2). 원하는 경우, 이소프렌은 훨씬 더 큰 규모로 생산될 수 있거나 본 명세서에서 기술된 조건은 이소프렌량을 좀 더 증가시키는 데 사용될 수 있다. 표 1 및 표 2에 나열된 벡터 및 실험적 조건은 하기 및 실시예 섹션에서 좀 더 상세히 기술된다.
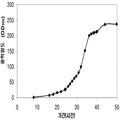
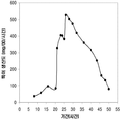
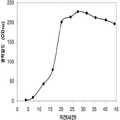
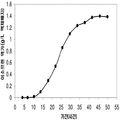
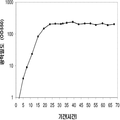
표 1은 본 발명의 세포 배양 및 방법을 사용한 진탕 플라스트로부터 이소프렌의 대표적인 수율을 나타낸다. 이소프렌 생산을 측정하는 분석법은 실시예 1, 제 II부에 기술되어 있다. 본 분석법을 위해, 시료가 진탕 플라스크로부터 하나 이상의 시간대에 수집되고 30분 동안 배양되었다. 그 다음 본 시료에서 생산된 이소프렌량이 측정되었다. 상부공간 농도 및 특이 이소프렌 생산률은 표 1에 나열되어 있고 본 명세서에서 좀 더 기술된다.
| 균주 | 상부공간 바이알에서 이소프렌 생산* | |
| 상부공간 농도μg/ L gas |
특이 생산률
mg /L 액체배지 /시간/ OD ( nmol / g wcm /시간) |
|
| E. coli BL21/pTrcKudzu IS | 1.40 | 53.2 (781.2) |
| E. coli BL21/ pCL DXS yidi Kudzu IS | 7.61 | 289.1 (4.25 x 103) |
| kudzu IS 및 전체 MVA 경로를 가진 E. coli BL21/MCM127 with | 23.0 | 874.1 (12.8 x 103) |
| E. coli BL21/ pET N-HisKudzu IS | 1.49 | 56.6 (831.1) |
| Pantoea citrea /pTrcKudzu IS | 0.66 | 25.1 (368.6) |
| E. coli w/ Poplar IS [Miller (2001)] |
- | 5.6 (82.2) |
| Bacillis licheniformis Fall US 5849970 | - | 4.2 (61.4) |
| 쿠쥬 이소프렌 합성효소를 가진 Yarrowia lipolytica | ~0.05 mg/L | ~2 (~30) |
| 쿠쥬 이소프렌 합성효소를 가진 Trichoderma reesei | ~0.05 mg/L | ~2 (~30) |
| 쿠쥬 IS 및 하부 MVA 경로를 가진 E. coli BL21/ pTrcKKDyIkIS | 85.9 | 3.2 x 103 (4.8 x 104) |
* OD600 1의 1 mL로 정상화되고, 액체를 넣은 밀봉된 상부공간 바이알에서 1 : 19의 상부공간 부피 비율까지 1시간 동안 배양됨.
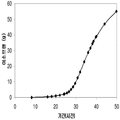
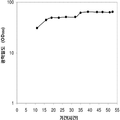
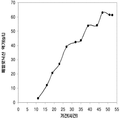
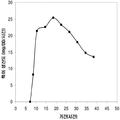
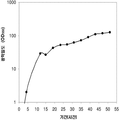
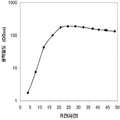
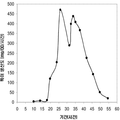
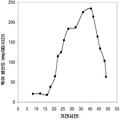
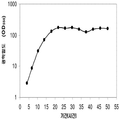
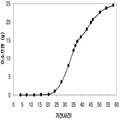
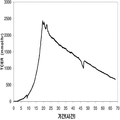
표 2는 본 발명의 세포 배양 및 방법을 사용한 발효기로부터의 이소프렌의 대표적인 수율을 나타낸다. 이소프렌 생산을 측정하는 분석법은 실시예 1, 제 II부에 기술되어 있다. 본 분석법을 위해, 발효기의 배출기체의 시료가 수집되고 이소프렌량이 분석되었다. 피크 상부공간 농도 (발효 기간 동안 가장 높은 상부공간 농도), 역가 (액체배지 리터 당 생산된 이소프렌의 누적된 전체량), 및 이소프렌 생산의 피크 특이 생산률 (발효 기간 동안 가장 높은 특이 생산률)는 표 2에 나열되어 있고 본 명세서에서 좀 더 기술된다.
| 균주 | 발효기에서 이소프렌 생산 | ||
|
피크 상부공간 농도**
(μg/L gas ) |
역가
(mg/L 액체배지 ) |
피크 특이 생산률 μg/L
액체배지
/시간/OD
(nmol/g wcm /시간) |
|
| 쿠쥬 IS를 가진 E. coli BL21 /pTrcKudzu | 52 | 41.2 | 37 (543.3) |
| E. coli FM5/pTrcKudzu IS | 3 | 3.5 | 21.4 (308.1) |
| E. coli BL21/ 삼중 균주 (DXS, yidi, IS) | 285 | 300 | 240 (3.52 x 103) |
| E. coli FM5/ 삼중 균주(DXS, yidi, IS) | 50.8 | 29 | 180.8 (2.65 x 103) |
| 쿠쥬 IS 와 전체 MVA 경로를 가진 E. coli/MCM127 | 3815 | 3044 | 992.5 (1.46 x 104) |
| E. coli BL21/pCLPtrc UpperPathway gi1.2 통합된 하부 경로 pTrcKudzu | 2418 | 1640 | 1248 (1.83 x 104) |
| E. coli BL21/MCM401 2 x 50 μM IPTG |
13991 | 23805 | 3733 (5.49 x 104) |
| E. coli BL21/MCM401 2 x 1000 μM IPTG |
22375 | 19541 | 5839.5 (8.59 x 104) |
| E. coli BL21/pCLPtrc UpperPathwayHGS2 -pTrcKKDyIkIS | 3500 | 3300 | 1088 (1.60 x 104) |
|
야생형
바실러스
섭틸리스
|
1.5 | 2.5 | 0.8 (11.7) |
| Bacillus pBS Kudzu IS | 16.6 | ~30 (100시간 초과) |
5 (73.4) |
| Bacillus Marburg 6051 [ Wagner and Fall (1999)] | 2.04 | 0.61 |
24.5
(359.8) |
| Bacillus Marburg 6051 Fall US 5849970 | 0.7 | 0.15 | 6.8 (100) |
| E. coli BL21/ pCLPtrcUpperPathway 및 gil.2KKDyI 및 pTrcAlba-mMVK | 2.03 x 104 | 3.22 x 104 | 5.9 x 103 (8.66 x 104) |
| E. coli BL21/pCLPtrcUpper Pathway 및 gi1.2KKDyI 및 pTrcAlba-mMVK 더한 pBBRCMPGI1.5pgl |
3.22 x 104 | 6.05 x 104 | 1.28 x 104 (1.88 x 105) |
** 배출기체 유속 1 vvm (분 당 1 L액체배지 당 1 부피 배출기체)으로 정상화됨.
추가적으로, 이종유래 이소프렌 합성효소 핵산을 포함하는 세포에 의한 이소프렌의 생산은 세포에 의해 생산되는 1-데옥시-D-자일루로스-5-포스페이트 합성효소 (DXS) 폴리펩타이드 및/또는 이소펜테닐 디포스페이트 이소머라제 (IDI)의 양을 증가시켜서 증진될 수 있다. 예를 들어, DXS 핵산 및/또는 IDI 핵산은 세포 내로 도입될 수 있다. DXS 핵산은 이종유래 핵산 또는 내재성 핵산의 이중 사본일 수 있다. 유사하게, IDI 핵산은 이종유래 핵산 또는 내재성 핵산의 이중 사본일 수 있다. 일정 구현예에서, DXS 및/또는 IDI 폴리펩타이드의 양은 내재성 DXS 및/또는 IDI 프로모터 또는 조절 부위를 DXS 및/또는 IDI 핵산의 더 큰 전사를 가져오는 다른 프로모터 및/또는 조절 부위로 대체함에 의해 증가된다. 일정 구현예에서, 세포는 이소프렌 합성효소 폴리펩타이드 를 인코딩하는 이종유래 핵산 (예로, 식물 이소프렌 합성효소 핵산) 및 이소프렌 합성효소 폴리펩타이드를 인코딩하는 내재성 핵산의 이중 사본) 둘 다를 포함한다.
인코드된 DXS 및 IDI 폴리펩타이드는 이소프렌 생합성을 위한 DXP 경로의 일부이다 (도 19A). DXS 폴리펩타이드는 피루베이트 및 D-글루타르알데하이드-3-포스페이트를 1-데옥시-D-자일루로스-5-포스페이트로 전환시킨다. 상세한 이론으로 설명하려고 의도하지는 않지만, DXS 폴리펩타이드의 양을 증가시키는 것은 DXP 경로를 통한 탄소의 유량을 증가시키고, 더 많은 이소프렌 생산을 유발하는 것으로 여겨진다. IDI 폴리펩타이드는 이소펜테닐 디포스페이트 (IPP) 및 디메틸아릴 디포스페이트 (DMAPP)의 상호전환을 촉매한다. 상세한 이론으로 설명하려고 의도하지는 않지만, 세포에서 IDI 폴리펩타이드의 양을 증가시키는 것은 DMAPP로 전환되어 다시 이소프렌으로 전환되는 IPP양 (및 전환율)을 증가시키는 것으로 여겨진다.
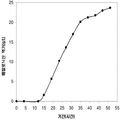
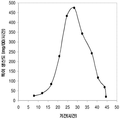
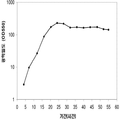
예를 들어, 쿠쥬 이소프렌 합성효소, S. cerevisia IDI, 및 E. coli DXS 핵산을 가지는 대장균 세포의 발효가 이소프렌을 생산하는 데 사용되었다. 이소프렌의 수준은 50으로부터 300 μg/L까지 15시간의 기간 동안 다양하다 (실시예 7, 제 VII부).
일정 구현예에서, 이종유래 또는 별도의 내재성 이소프렌 합성효소, IDI, 및 DXS 핵산의 존재는 세포가 이들 이종유래 또는 별도의 내재성 이소프렌 합성효소의 하나 이상만을 가진 해당되는 세포와 비교하여, 더 재현적으로 (reproducibly) 성장하도록 유도하거나 더 오래 생존가능하게 유지한다. 예를 들어, 이종유래 이소프렌 합성효소, IDI, 및 DXS 핵산을 포함하는 세포는 이종유래 이소프렌 합성효소 및 DXS 핵산만을 가지는 또는 이종유래 이소프렌 합성효소 핵산만 가지는 세포보다 더 잘 자란다. 또한, 이종유래 이소프렌 합성효소, IDI, 및 DXS 핵산은 대장균 세포에 의해 유지되었던 높은 사본수 플라스미드 상에서 성공적으로 강한 프로모터에 작동적으로 연결되었고, 많은 양의 이들 폴리펩타이드가 세포에 과다한 양의 독성을 유발하지 않고도 세포에서 발현될 수 있는 것을 제시한다. 상세한 이론으로 설명하려고 의도하지는 않지만, 이종유래 또는 별도의 이소프렌 합성효소, IDI, 및 DXS 핵산의 존재가 세포에서 단지 이종유래 또는 별도의 내재성 DXS핵산이 존재하는 경우 축적될 잠재적으로 독성을 가진 하나 이상의 중간산물의 양을 감소시킬 수 있는 것으로 여겨진다.
일정 구현예에서, 이종유래 이소프렌 합성효소 핵산을 포함하는 세포에 의한 이소프렌의 생산은 세포에 의해 발현되는 MVA 폴리펩타이드의 양을 증가시킴에 의해 증대된다 (도 19A 및 19B). 대표적인 MVA 경로 폴리펩타이드는 하기 폴리펩타이드를 포함한다: 아세틸-CoA 아세틸전이효소 (AA-CoA 티올라제) 폴리펩타이드, 3-하이드록시-3-메틸글루타릴-CoA 합성효소 (HMG-CoA 합성효소) 폴리펩타이드, 3-하이드록시-3-메틸글루타릴-CoA 환원효소 (HMG-CoA 환원효소) 폴리펩타이드, 메발로네이트 키나제 (MVK) 폴리펩타이드, 포스포메발로네이트 키나제 (PMK) 폴리펩타이드, 디포스포메발로네이트 키나제 (MVD) 폴리펩타이드, 포스포메발로네이트 탈탄산화효소 (PMDC) 폴리펩타이드, 이소펜테닐 포스페이트 키나제 (IPK) 폴리펩타이드, IDI 폴리펩타이드, 및 둘 이상의 MVA 경로 폴리펩타이드의 활성을 가진 폴리펩타이드 (예로, 융합 폴리펩타이드). 예를 들어, 하나 이상의 MVA 경로 핵산은 세포 내로 도입될 수 있다. 일정 구현예에서, 세포는 상부 MVA 경로를 포함하고, 이는 AA-CoA 티올라제, HMG-CoA 합성효소, 및 HMG-CoA 환원효소 핵산을 포함한다. 일정 구현예에서, 세포는 하부 MVA 경로를 포함하고, 이는 MVK, PMK, MVD, 및 IDI 핵산을 포함한다. 일정 구현예에서, 세포는 전체 MVA 경로를 포함하고, 이는 AA-CoA 티올라제, HMG-CoA 합성효소, HMG-CoA 환원효소, MVK, PMK, MVD, 및 IDI 핵산을 포함한다. 일정 구현예에서, 세포는 전체 MVA 경로를 포함하고, 이는 AA-CoA 티올라제, HMG-CoA 합성효소, HMG-CoA 환원효소, MVK, PMDC, IPK, 및 IDI 핵산을 포함한다. MVA 경로 핵산은 이종유래 핵산 또는 내재성 핵산의 이중 사본일 수 있다. 일정 구현예에서, 하나 이상 MVA 경로 폴리펩타이드의 양은 MVA 경로에 대한 프로모터 또는 조절 부위를 MVA 경로 핵산의 더 큰 전사를 가져오는 다른 프로모터 및/또는 조절 부위로 대체함에 의해 증가된다. 일정 구현예에서, 세포는 이소프렌 합성효소 폴리펩타이드를 인코딩하는 이종유래 핵산 (예로, 식물 이소프렌 합성효소 핵산) 및 이소프렌 합성효소 폴리펩타이드를 인코딩하는 내재성 핵산의 이중 사본) 둘 다를 포함한다.
예를 들어, 쿠쥬 이소프렌 합성효소 폴리펩타이드를 인코딩하는 핵산 및 Saccharomyces cerevisiae MVK, PMK, MVD, 및IDI 폴리펩타이드를 인코딩하는 핵산을 포함하는 대장균은 6.67 x 10-4 mol/L액체배지/OD600/시간으로 이소프렌을 생산하였다 (실시예 8을 참조하라). 추가적으로, Enterococcus faecalis AA-CoA 티올라제, HMG-CoA 합성효소, 및HMG-CoA 환원효소 폴리펩타이드를 인코딩하는 핵산을 가진 대장균의 14리터 발효는 22 그램의 메발론산 (MVA 경로의 중간산물)을 생산하였다. 이들 세포의 진탕 플라스크는 리터 당 2-4 그램 메발론산을 생산하였다. 이들 결과는 이종유래 MVA 경로 핵산은 대장균에서 활성을 가지는 것을 표시한다. 상부 MVA 경로 및 하부 MVA 경로 둘 다뿐만 아니라 쿠쥬 이소프렌 합성효소 (MCM 127 균주)에 대한 핵산을 포함하는 세포는 단지 하부 MVA 경로 및 쿠쥬 이소프렌 합성효소 (MCM 131 균주)에 대한 핵산을 가진 대장균과 비교하여 유의하게 더 많은 이소프렌 (874 μg/L)을 생산하였다 (표 3 및 실시예 8, 제 VIII부를 참조하라).
일정 구현예에서, 세포의 적어도 일정량은 이종유래 이소프렌 합성효소, DXS, IDI, 및/또는 MVA 경로 핵산을 적어도 약 5, 10, 20, 50, 75, 100, 200, 300, 이상의 세포분열 동안 연속식 배양에서 유지된다. 본 발명의 관점이라면 모두의 일정 구현예에서, 이종유래 또는 이소프렌 합성효소, DXS, IDI, 및/또는 MVA 경로 핵산의 이중 사본을 포함하는 핵산은 또한 카나마이신 (kanamycin), 앰피실린 (ampicillin), 카베니실린 (carbenicillin), 젠타마이신 (gentamicin), 하이그로마이신 (hygromycin), 플레오마이신 (phleomycin), 블레오마이신 (bleomycin), 네오마이신 (neomycin), 또는 클로로암페니콜 (chloramphenicol) 항생제 저항성 핵산과 같은 선별 마커를 포함한다.
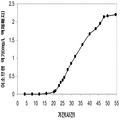
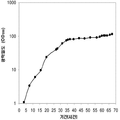
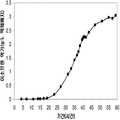
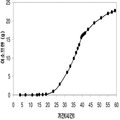
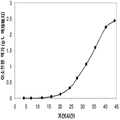
실시예 7, 제 VI 부에 나타난 바와 같이, 생산된 이소프렌량은 효모 추출물을 세포 배양배지에 첨가하여 좀 더 증가될 수 있다. 본 실시예에서, 생산된 이소프렌량은 테스트된 농도의 세포 배지에서 효모추출물의 양에 직선적으로 비례하였다 (도 48C). 추가적으로, 액체배지 리터 당 대략 0.11 그램의 이소프렌이 효모추출물과 포도당을 가진 세포 배지로부터 생산되었다 (실시예 7, 제 VIII부). 이들 실험 둘 다는 이소프렌을 생산하도록 쿠쥬 이소프렌 합성효소, S. cerevisia IDI, 및 E. coli DXS 핵산을 가지는 대장균을 사용하였다. 효모추출물의 양을 포도당 존재 시 증가시키는 것은 포도당의 양을 효모추출물 존재 시 증가시키는 것보다 더 많은 생산된 이소프렌량을 가져왔다. 또한, 효모추출물의 양을 증가시키는 것은 세포가 더 오랜 기간 동안 높은 수준의 이소프렌을 생산하도록 하고 세포의 건강을 개선시켰다.
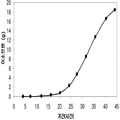
이소프렌의 생산도 역시 탄소원으로서 세 가지 유형의 가수분해된 바이오매스 (바가스, 옥수수 스토버, 및 연목질 펄프)를 사용하여 기술되었다 (도 46A 내지 46C). 쿠쥬 이소프렌 합성효소, S. cerevisia IDI, 및 E. coli DXS 핵산을 가지는 대장균은 동등한 양의 포도당 (예로, 1% 포도당, w/v)으로부터 나온 것만큼 이들 가수분해된 바이오매스 탄소원으로부터 이소프렌을 생산하였다. 원하는 경우, 어떠한 바이오매스 탄소원이라도 본 발명의 조성물 및 방법에 사용될 수 있다. 바이오매스 탄소원은 그들이 많은 통상적인 세포 배지보다 저렴하여 이소프렌의 경제적인 생산을 용이하게 하기 때문에 바람직하다.
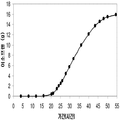
추가적으로, 역슈가가 이소프렌의 생산을 위한 탄소원으로서 기능하는 것을 보여주었다 (도 47C 및 도 96 내지 도 98). 예를 들어, 2.4 g/L의 이소프렌이 MVA 경로 폴리펩타이드 및 쿠쥬 이소프렌 합성효소 폴리펩타이드를 발현하는 세포로부터 생산되었다 (실시예 8, 제 XV부). 글리세롤도 역시 쿠쥬 이소프렌 합성효소를 발현하는 세포로부터 2.2 mg/L의 이소프렌을 생산하는 탄소원으로서 사용되었다 (실시예 8, 제 XIV부). 이소프렌 합성효소 핵산에 추가하여, DXS 핵산, IDI 핵산 및/또는 하나 이상의 MVA 경로 핵산 (전체 MVA 경로를 인코딩하는 핵산과 같음)은 글리세롤로부터 이소프렌의 생산을 증가시킬 수 있다.
일정 구현예에서, 오일이 세포 배지에 포함된다. 예를 들어, 쿠쥬 이소프렌 합성효소 핵산을 포함하는 B. subtilis 세포는 오일과 포도당원을 포함하는 세포에서 배양될 때 이소프렌을 생산한다 (실시예 4, 제 III부). 일정 구현예에서, 하나 이상의 오일 (2, 3, 4, 5개 이상의 오일과 같음)이 세포 배지에 포함된다. 상세한 이론으로 설명하려고 의도하지 않지만, (i) 오일은 세포에서 이소프렌의 전환에 사용가능한 탄소의 양을 증가시킬 수 있고, (ii) 오일은 세포에서 아세틸-CoA의 양을 증가시키고 따라서 MVA 경로를 통한 탄소 유량을 증가시킬 수 있으며, 및/또는 (iii) 오일은 과다 영양을 세포로 공급할 수 있고, 이는 세포에서 많은 탄소가 다른 산물보다는 이소프렌으로 전환되기 때문에 바람직하다. 일정 구현예에서, 오일을 포함하는 세포 배지에서 배양된 세포는 이소프렌을 생산하도록 전체 MVA 경로를 자연적으로 사용하거나 전체 MVA 경로에 대한 핵산을 포함하도록 유전적으로 변형된다. 일정 구현예에서, 오일은 세포 배양 배지에 첨가되기 이전에 숙주세포에 의한 오일의 사용을 용이하게 하도록 부분적으로 또는 완전하게 가수분해된다.
세포 (예로, 박테리아)에서 이소프렌과 같은 작은 분자의 상업적 생산에 대한 주요한 장애물 하나는 세포의 성장으로부터 분자의 생산을 자연적으로 분리시키는 (decoupling) 것이다. 이소프렌의 상업적으로 생존가능한 생산을 위한 일정 구현예에서, 공급원료로부터 유의한 양의 탄소가 세포의 성장 및 유지보다는 오히려 이소프렌으로 전환된다 ("탄소 효율 (carbon efficiency)"). 다양한 구현예에서, 세포는 세포 배양 배지에서 탄소의 약 0.0015, 0.002, 0.005, 0.01, 0.02, 0.05, 0.1, 0.12, 0.14, 0.16, 0.2, 0.3, 0.4, 0.5, 0.6, 0.7, 0.8, 0.9, 1.0, 1.2, 1.4, 1.6, 1.8, 2.0, 2.5, 3.0, 3.5, 4.0, 5.0, 6.0, 7.0, 또는 8.0% 이상을 이소프렌으로 전환시킨다. 상세한 구현예에서, 하류 산물로 전환되는 공급원료으로부터 나온 탄소의 유의한 일정량은 이소프렌으로 전환된다. 실시예 11에서 좀 더 기술된 바와 같이, MVA 경로 및 쿠쥬 이소프렌 합성효소 핵산을 발현하는 대장균 세포는 이소프렌 또는 중간산물 메발론산의 생산을 성장과 분리하여 높은 탄소 효율을 가져오는 것을 보여주었다. 상세하게, 메발론산은 Enterococcus faecalis로부터 나온 상부 MVA 경로를 발현하는 세포로부터 형성되었다. 이소프렌은 Enterococcus faecalis로부터 나온 상부 MVA 경로를 발현하는 세포, Saccharomyces cerevisiae로부터 나온 상부 MVA 경로, 및 Pueraria montana (Kudzu)로부터 나온 이소프렌 합성효소로부터 형성되었다. 이러한 이소프렌 또는 메발론산 생산과 성장의 분리는 네 가지 서로 다른 균주 E. coli: BL21(LDE3), BL21(LDE3) Tuner, FM5, 및 MG1655에서 나타났다. 처음 두 가지 E. coli 균주는 B 균주이고, 후자 두 가지는 K12 균주이다. 또한 생산과 성장의 분리는 결실된 ack 및 pta 유전자를 가진 MG1655 변이체에서도 나타났다. 본 변이체도 역시 더 적은 아세테이트의 생산을 나타냈다.
대표적인 폴리펩타이드 및 핵산
다양한 이소프렌 합성효소, DXS, IDI, MVA 경로, 수소화효소, 수소화효소 돌연변이 또는 전사인자 폴리펩타이드 및 핵산이 본 명세서에서 기술된 조성물들 및 방법들에 사용될 수 있다.
일정 구현예에서, 융합 폴리펩타이드는 첫 번째 폴리펩타이드 (예로, 이소프렌 합성효소, DXS, IDI, MVA 경로, 수소화효소, 수소화효소 돌연변이 또는 전사인자 폴리펩타이드 또는 그의 촉매적으로 활성을 가진 단편)의 일부 또는 전부를 포함하고, 임의적으로 두 번째 폴리펩타이드 (예로, 히스-태그 (His-tag)와 같은 융합 폴리펩타이드의 정제 또는 검출을 용이하게 하는 펩타이드)의 일부 또는 전부를 포함할 수 있다. 일정 구현예에서, 융합 폴리펩타이드는 둘 이상의 MVA 경로 폴리펩타이드의 활성을 가진다 (AA-CoA 티올라제 및HMG-CoA 환원효소 폴리펩타이드와 같음). 일정 구현예에서, 폴리펩타이드는 둘 이상의 MVA 경로 폴리펩타이드의 활성을 가지는 자연적으로-발생하는 폴리펩타이드이다.
다양한 구현예에서, 폴리펩타이드는 적어도 또는 약 50, 100, 150, 175, 200, 250, 300, 350, 또는 400개 이상의 아미노산을 가진다. 일정 구현예에서, 폴리펩타이드 단편은 전장의 폴리펩타이드로부터 나온 적어도 또는 약 25, 50, 75, 100, 150, 200, 또는 300개 이상의 연속된 아미노산을 가지고, 해당되는 전장 폴리펩타이드의 적어도 또는 약 5%, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95%, 또는 100%의 활성을 가진다. 상세한 구현예에서, 폴리펩타이드는 자연적으로 발생하는 이소프렌 합성효소, DXS, IDI, MVA 경로, 수소화효소, 수소화효소 돌연변이 또는 전사인자 폴리펩타이드라면 모두의 분절 또는 전장 아미노산 서열을 포함한다.
일정 구현예에서, 폴리펩타이드는 야생형 (예로, 자연적으로 발생하는 서열) 이소프렌 합성효소, DXS, IDI, MVA 경로, 수소화효소, 수소화효소 돌연변이 또는 전사인자 폴리펩타이드의 서열과 비교하여 하나 이상의 돌연변이를 가진다.
일정 구현예에서, 핵산은 재조합 핵산이다. 일정 구현예에서, 이소프렌 합성효소, DXS, IDI, MVA 경로, 수소화효소, 수소화효소 돌연변이 또는 전사인자 핵산은 또 다른 폴리펩타이드의 전부 또는 일부를 인코딩하는 또 다른 핵산과 작동적으로 연결되어 있어서, 재조합 핵산은 이소프렌 합성효소, DXS, IDI, MVA 경로, 수소화효소, 수소화효소 돌연변이 또는 전사인자 폴리펩타이드 및 또 다른 폴리펩타이드의 전부 또는 일부 (예로, 히스-태그와 같은 융합 폴리펩타이드의 정제 또는 검출을 용이하게 하는 펩타이드)를 포함하는 융합 폴리펩타이드를 인코드한다. 일정 구현예에서, 재조합 핵산의 일부 또는 전부는 화학적으로 합성된다.
일정 구현예에서, 핵산은 이종유래 핵산이다. 상세한 구현예에서, 핵산은 자연적으로 발생하는 이소프렌 합성효소, DXS, IDI, MVA 경로, 수소화효소, 수소화효소 돌연변이 또는 전사인자 핵산이라면 모두의 분절 또는 전체 핵산서열을 포함한다. 일정 구현예에서, 핵산은 야생형 (예로, 자연적으로 발생하는 서열) 이소프렌 합성효소, DXS, IDI, MVA 경로, 수소화효소, 수소화효소 돌연변이 또는 전사인자 핵산의 서열과 비교하여 하나 이상의 돌연변이를 가진다. 일정 구현예에서, 핵산은 이소프렌 합성효소, DXS, IDI, MVA 경로, 수소화효소, 수소화효소 돌연변이 또는 전사인자 핵산의 전사 또는 해독을 증가시키는 하나 이상의 돌연변이 (예로, 침묵 돌연변이 (silent mutation))를 가진다. 일정 구현예에서, 핵산은 이소프렌 합성효소, DXS, IDI, MVA 경로, 수소화효소, 수소화효소 돌연변이 또는 전사인자 폴리펩타이드를 인코딩하는 핵산이라면 모두의 반복 변형체 (degenerate variant)이다.
대표적인 이소프렌 합성효소, DXS, IDI, 및/또는 MVA 경로 폴리펩타이드 및 핵산의 기탁번호가 별첨 1에 나열되어 있다 (별첨 1의 기탁번호 및 그들의 해당 서열은 본 명세서에서 참고문헌으로 전부, 상세하게는 이소프렌 합성효소, DXS, IDI, 및/또는 MVA 경로 폴리펩타이드 및 핵산에 관하여 통합되어 있다). 케그 데이터베이스 (Kegg database)도 역시 수많은 대표적인 이소프렌 합성효소, DXS, IDI, 및/또는 MVA 경로 폴리펩타이드 및 핵산의 아미노산 및 핵산 서열을 포함한다 (예를 들어, 전세계적 웹 "genome.jp/kegg/pathway/map/map00100.html" 및 여기에서 서열들을 참조하고, 이들은 각각 본 명세서에서 참고문헌으로 전부, 상세하게는 이소프렌 합성효소, DXS, IDI, 및/또는 MVA 경로 폴리펩타이드 및 핵산에 관하여 통합되어 있다). 일정 구현예에서, 하나 이상의 이소프렌 합성효소, DXS, IDI, 및/또는 MVA 경로 폴리펩타이드 및/또는 핵산은 별첨 1에서 기탁번호라면 모두 또는 케그 데이터베이스에 존재하는 서열이라면 모두에 해당하는 서열이라면 모두와 같은2007년 12월 12일 또는 2008년 9월 14일에 공개적으로 사용가능한 서열과 일치하는 서열을 가진다. 추가적인 대표적 이소프렌 합성효소, DXS, IDI, 및/또는 MVA 경로 폴리펩타이드 및 핵산은 하기에 좀 더 기술된다.
대표적인 이소프렌 합성효소 폴리펩타이드 및 핵산
상기 주목된 바와 같이, 이소프렌 합성효소 폴리펩타이드는 디메틸아릴 디포스페이트 (DMAPP)를 이소프렌으로 전환시킨다. 대표적인 이소프렌 합성효소 폴리펩타이드는 이소프렌 합성효소 폴리펩타이드의 적어도 하나의 활성을 가지는 폴리펩타이드, 폴리펩타이드의 단편, 펩타이드, 및 융합 폴리펩타이드를 포함한다. 표준 방법이 폴리펩타이드가 시험관내 (in vitro), 세포추출물에서 또는 생체내 (in vivo)에서 DMAPP를 이소프렌으로 전환하는 활성을 측정하여 폴리펩타이드가 이소프렌 합성효소 폴리펩타이드의 활성을 가지는지 여부를 결정하는 데 사용될 수 있다. 대표적인 분석법에서, 세포 추출물은 균주 (예로, 본 명세서에서 기술된 E. coli/pTrcKudzu 균주)를 실시예 1에 기술된 바와 같이 진탕 플라스크 방법으로 성장시켜서 제조된다. 유도가 끝난 이후, 대략 10 mL의 세포를 7000 x g에서 10분 동안 원심분리하여 펠렛으로 만들고, 글리세롤이 없는 5 ml의 PEB에 재현탁시킨다. 세포는 표준 절차를 사용하는 프렌치 프레스기를 사용하여 용해시킨다. 대안으로 세포는 -80˚C에서 냉동/해동 이후에 라이소자임 (Ready-Lyse lysozyme solution; EpiCentre)으로 처리된다.
세포 추출물에서 이소프렌 합성효소 폴리펩타이드의 활성이, 예를 들어 Silver et al., J. Biol. Chem. 270:13010-13016, 1995 및 여기에서의 문헌들에 기술된 바와 같이 측정될 수 있고, 이들은 각각 본 명세서에서 참고문헌으로 전부, 상세하게는 이소프렌 합성효소 폴리펩타이드 활성에 관하여 통합되어 있다. DMAPP (Sigma)는 질소 스트림 하에서의 증발 건조되고 100 mM 의 농도로 100 mM 포타슘 포스페이트 완충용액 pH 8.2에 재수화되며 -20℃에서 저장된다. 분석법을 수행하기 위하여, 5 mL의 1M MgCl2, 1 mM (250 mg/ml) DMAPP, 65 mL의 식물 추출물 완충용액 (Plant Extract Buffer, PEB) (50 mM Tris-HCl, pH 8.0, 20 mM MgCl2, 5% 글리세롤 및 2 mM DTT)이 금속 회전 뚜껑과 테프론 코팅된 실리콘 격막을 가진 20 ml 상부공간 바이알 (애질런트 테크놀로지사 (Agilent Technologies))에 넣은 25 mL의 세포 추출물에 첨가되고 37℃에서 15분 동안 진탕하면서 배양된다. 반응은 200 mL의 250 mM EDTA 를 첨가하여 정지되고 실시예 1, 제 II부에 기술된 바와 같은 GC/MS에 의해 정량된다.
대표적인 이소프렌 합성효소 핵산은 이소프렌 합성효소 폴리펩타이드의 적어도 하나의 활성을 가지는 폴리펩타이드, 폴리펩타이드의 단편, 펩타이드, 또는 융합 폴리펩타이드를 인코드하는 핵산을 포함한다. 대표적인 이소프렌 합성효소 폴리펩타이드 및 핵산은 본 명세서에서 기술된 출처 생물이라면 모두로부터 나온 자연적으로-발생하는 폴리펩타이드 및 핵산 뿐만 아니라 본 명세서에서 기술된 출처 생물이라면 모두로부터 유래한 돌연변이 폴리펩타이드 및 핵산을 포함한다.
일정 구현예에서, 이소프렌 합성효소 폴리펩타이드 또는 핵산은 파보이대 아과 (Faboideae subfamily)과 같은 파바시애과 (Fabaceae family)로부터 나온다. 일정 구현예에서, 이소프렌 합성효소 폴리펩타이드 또는 핵산은 푸엘라리아 몬타나 (쿠쥬) (Sharkey et al., Plant Physiology 137: 700-712, 2005), 푸엘라리아 로바타, 포풀라 (포풀러스 알바, 포풀러스 니그라, 포풀러스 트리코카르파, 또는 포풀러스 알바 x 트레물라 (CAC35696) 와 같음; Miller et al., Planta 213: 483-487, 2001) 아스펜 (Populus tremuloides와 같음; Silver et al., JBC 270(22): 13010-1316, 1995), 또는 영국 오크 (English Oak, Quercus robur) (Zimmer et al., 국제특허출원 제 WO 98/02550호)로부터 나오고, 이들은 각각 본 명세서에서 참고문헌으로 전부, 상세하게는 이소프렌 합성효소 핵산 및 이소프렌 합성효소 폴리펩타이드의 발현에 관하여 통합되어 있다. 적합한 이소프렌 합성효소는, 이에 제한되는 것은 아니지만 진뱅크 기탁번호 AY341431, AY316691, AY279379, AJ457070, 및 AY182241로 확인된 것들을 포함하고, 이들은 각각 본 명세서에서 참고문헌으로 전부, 상세하게는 이소프렌 합성효소 핵산 및 폴리펩타이드의 서열에 관하여 통합되어 있다. 일정 구현예에서, 이소프렌 합성효소 폴리펩타이드 또는 핵산은 자연적으로-발생하는 쿠에르쿠스 로바르 (Quercus robur) 로부터 나온 폴리펩타이드 또는 핵산이 아니다 (예로, 이소프렌 합성효소 폴리펩타이드 또는 핵산은 자연적으로 발생하는 쿠에르쿠스 로바르로부터 나온 폴리펩타이드 또는 핵산가 아닌 이소프렌 합성효소 폴리펩타이드 또는 핵산이다). 일정 구현예에서, 이소프렌 합성효소 핵산 또는 폴리펩타이드는 자연적으로-발생하는 포풀라로부터 나온 폴리펩타이드 또는 핵산이다. 일정 구현예에서, 이소프렌 합성효소 핵산 또는 폴리펩타이드는 또는 핵산은 자연적으로 발생하는 포풀라로부터 나온 폴리펩타이드 또는 핵산이 아니다.
대표적인 DXS 폴리펩타이드 및 핵산
상기 주목된 바와 같이, 1-데옥시-D-자일루로스-5-포스페이트 합성효소 (DXS) 폴리펩타이드는 피루베이트 및 D-글루타르알데하이드-3-포스페이트를 1-데옥시-D-자일루로스-5-포스페이트로 전환시킨다. 대표적인 DXS 폴리펩타이드는 DXS 폴리펩타이드의 적어도 하나의 활성을 가지는 폴리펩타이드, 폴리펩타이드의 단편, 펩타이드, 및 융합 폴리펩타이드를 포함한다. 표준 방법 (본 명세서에서 기술된 것과 같음)이 폴리펩타이드가 시험관내 (in vitro), 세포추출물에서 또는 생체내 (in vivo)에서 피루베이트 및 D-글루타르알데하이드-3-포스페이트를 1-데옥시-D-자일루로스-5-포스페이트로 전환하는 활성을 측정하여 폴리펩타이드가 DXS 폴리펩타이드의 활성을 가지는지 여부를 결정하는 데 사용될 수 있다. 대표적인 DXS 핵산은 DXS 폴리펩타이드의 적어도 하나의 활성을 가지는 폴리펩타이드, 폴리펩타이드의 단편, 펩타이드, 또는 융합 폴리펩타이드를 인코딩하는 핵산을 포함한다. 대표적인 DXS 폴리펩타이드 및 핵산은 본 명세서에서 기술된 출처 생물이라면 모두로부터 나온 자연적으로-발생하는 폴리펩타이드 및 핵산뿐만 아니라 본 명세서에서 기술된 출처 생물이라면 모두로부터 유래한 돌연변이 폴리펩타이드 및 핵산을 포함한다.
대표적인 IDI 폴리펩타이드 및 핵산
이소펜테닐 디포스페이트 이소머라제 폴리펩타이드 (이소펜테닐-디포스페이트 델타-이소머라제 또는 IDI)는 이소펜테닐 디포스페이트 (IPP) 및 디메틸아릴 디포스페이트 (DMAPP)의 상호전환을 촉매한다 (예로, DMAPP로의 IPP 전환 및/또는 IPP로 DMAPP의 전환). 대표적인 IDI 폴리펩타이드는 IDI 폴리펩타이드의 적어도 하나의 활성을 가지는 폴리펩타이드, 폴리펩타이드의 단편, 펩타이드, 및 융합 폴리펩타이드를 포함한다. 표준 방법 (본 명세서에서 기술된 것과 같음)이 폴리펩타이드가 IDI 폴리펩타이드의 활성을 가지는지 여부를 폴리펩타이드가 시험관내 (in vitro), 세포추출물에서 또는 생체내 (in vivo)에서 IPP와 DMAPP가 상호전환하는 활성을 측정하여 결정하는 데 사용될 수 있다. 대표적인 IDI 핵산은 IDI 폴리펩타이드의 적어도 하나의 활성을 가지는 폴리펩타이드, 폴리펩타이드의 단편, 펩타이드, 또는 융합 폴리펩타이드를 인코딩하는 핵산을 포함한다. 대표적인 IDI 폴리펩타이드 및 핵산은 본 명세서에서 기술된 출처 생물이라면 모두로부터 나온 자연적으로 발생하는 폴리펩타이드 및 핵산 뿐만 아니라 본 명세서에서 기술된 출처 생물이라면 모두로부터 유래한 돌연변이 폴리펩타이드 및 핵산을 포함한다.
대표적인 MVA 경로 폴리펩타이드 및 핵산
대표적인 MVA 경로 폴리펩타이드는 아세틸-CoA 아세틸전이효소 (AA-CoA 티올라제) 폴리펩타이드, 3-하이드록시-3-메틸글루타릴-CoA 합성효소 (HMG-CoA 합성효소) 폴리펩타이드, 3-하이드록시-3-메틸글루타릴-CoA 환원효소 (HMG-CoA 환원효소) 폴리펩타이드, 메발로네이트 키나제 (MVK) 폴리펩타이드, 포스포메발로네이트 키나제 (PMK) 폴리펩타이드, 디포스포메발로네이트 키나제 (MVD) 폴리펩타이드, 포스포메발로네이트 탈탄산화효소 (PMDC) 폴리펩타이드, 이소펜테닐 포스페이트 키나제 (IPK) 폴리펩타이드, IDI 폴리펩타이드, 및 둘 이상의 MVA 경로 폴리펩타이드의 활성을 가진 폴리펩타이드 (예로, 융합 폴리펩타이드)를 포함한다. 상세하게, MVA 경로 폴리펩타이드는 MVA 경로 폴리펩타이드의 적어도 하나의 활성을 가지는 폴리펩타이드, 폴리펩타이드의 단편, 펩타이드, 및 융합 폴리펩타이드를 포함한다. 대표적인 MVA 경로 핵산은 MVA 경로 폴리펩타이드의 적어도 하나의 활성을 가지는 폴리펩타이드, 폴리펩타이드의 단편, 펩타이드, 또는 융합 폴리펩타이드를 인코딩하는 핵산을 포함한다. 대표적인 MVA 경로 폴리펩타이드 및 핵산은 본 명세서에서 기술된 출처 생물이라면 모두로부터 나온 자연적으로-발생하는 폴리펩타이드 및 핵산 뿐만 아니라 본 명세서에서 기술된 출처 생물이라면 모두로부터 유래한 돌연변이 폴리펩타이드 및 핵산을 포함한다.
상세하게, 아세틸-CoA 아세틸전이효소 폴리펩타이드 (AA-CoA 티올라제 또는 AACT)는 두 분자의 아세틸-CoA를 아세토아세틸-CoA로 전환시킨다. 표준 방법 (본 명세서에서 기술된 것과 같음)이 폴리펩타이드가AA-CoA 티올라제 폴리펩타이드 활성을 가지는지 여부를 폴리펩타이드가 시험관내 (in vitro), 세포추출물에서 또는 생체내 (in vivo)에서 아세틸-CoA를 아세토아세틸-CoA로 전환하는 활성을 측정하여 결정하는 데 사용될 수 있다.
3-하이드록시-3-메틸글루타릴-CoA 합성효소 (HMG-CoA 합성효소 또는 HMGS) 폴리펩타이드는 아세토아세틸-CoA를 3-하이드록시-3-메틸글루타릴-CoA 로 전환한다. 표준 방법 (본 명세서에서 기술된 것과 같음)이 폴리펩타이드가HMG-CoA 합성효소 폴리펩타이드 활성을 가지는지 여부를 폴리펩타이드가 시험관내, 세포추출물에서 또는 생체내에서 아세토아세틸-CoA를 3-하이드록시-3-메틸글루타릴-CoA로 전환하는 활성을 측정하여 결정하는 데 사용될 수 있다.
3-하이드록시-3-메틸글루타릴-CoA 환원효소 (HMG-CoA 환원효소 또는 HMGR) 폴리펩타이드는 3-하이드록시-3-메틸글루타릴-CoA를 메발로네이트로 전환한다. 표준 방법 (본 명세서에서 기술된 것과 같음)이 폴리펩타이드가HMG-CoA 환원효소 폴리펩타이드 활성을 가지는지 여부를 폴리펩타이드가 시험관내, 세포추출물에서 또는 생체내에서 3-하이드록시-3-메틸글루타릴-CoA를 메발로네이트로 전환하는 활성을 측정하여 결정하는 데 사용될 수 있다.
메발로네이트 키나제 (MVK) 폴리펩타이드는 메발로네이트를 인산화하여 메발로네이트-5-포스페이트를 형성한다. 표준 방법 (본 명세서에서 기술된 것과 같음)이 폴리펩타이드가 메발로네이트 키나제 (MVK) 폴리펩타이드 활성을 가지는지 여부를 폴리펩타이드가 시험관내, 세포추출물에서 또는 생체내에서 메발로네이트를 메발로네이트-5-포스페이트로 전환하는 활성을 측정하여 결정하는 데 사용될 수 있다.
포스포메발로네이트 키나제 (PMK) 폴리펩타이드는 메발로네이트-5-포스페이트를 인산화하여 메발로네이트-5-디포스페이트를 형성한다. 표준 방법 (본 명세서에서 기술된 것과 같음)이 폴리펩타이드가 PMK폴리펩타이드 활성을 가지는지 여부를 폴리펩타이드가 시험관내, 세포추출물에서 또는 생체내에서 메발로네이트-5-포스페이트를 메발로네이트-5-디포스페이트로 전환하는 활성을 측정하여 결정하는 데 사용될 수 있다.
디포스포메발로네이트 탈탄산화효소 (MVD 또는 DPMDC) 폴리펩타이드는 메발로네이트-5-디포스페이트를 인산화하여 이소펜테닐 디포스페이트 (IPP)를 형성한다. 표준 방법 (본 명세서에서 기술된 것과 같음)이 폴리펩타이드가 MVD폴리펩타이드 활성을 가지는지 여부를 폴리펩타이드가 시험관내, 세포추출물에서 또는 생체내 에서 메발로네이트-5-디포스페이트를 IPP로 전환하는 활성을 측정하여 결정하는 데 사용될 수 있다.
포스포메발로네이트 탈탄산화효소 (PMDC) 폴리펩타이드는 메발로네이트-5-포스페이트를 인산화하여 이소펜테닐 포스페이트 (IP)를 형성한다. 표준 방법 (본 명세서에서 기술된 것과 같음)이 폴리펩타이드가 PMCD폴리펩타이드 활성을 가지는지 여부를 폴리펩타이드가 시험관내, 세포추출물에서 또는 생체내에서 메발로네이트-5-포스페이트를 IP로 전환하는 활성을 측정하여 결정하는 데 사용될 수 있다.
이소펜테닐 포스페이트 키나제 (IPK) 폴리펩타이드는 이소펜테닐 포스페이트 (IP)를 인산화하여 이소펜테닐 디포스페이트 (IPP)를 형성한다. 표준 방법 (본 명세서에서 기술된 것과 같음)이 폴리펩타이드가 IPK폴리펩타이드 활성을 가지는지 여부를 폴리펩타이드가 시험관내, 세포추출물에서 또는 생체내에서 IP를 IPP로 전환하는 활성을 측정하여 결정하는 데 사용될 수 있다.
대표적인 IDI 폴리펩타이드 및 핵산은 상기에 기술된다.
대표적인 수소화효소 폴리펩타이드 및 핵산
수소화효소 폴리펩타이드는 반응 2H+ + 2e - <-> H2:을 촉매 작용한다. 시험관내 반응은 가역적이지만, 소정의 수소화효소는 생체내에서 H2를 산화하거나 H+를 환원하는 어느 한쪽 방향으로만 작용할 수 있다. 수소화효소 폴리펩타이드는 산소-민감성일 수 있고 복합체 금속 보조인자 (cofactors)를 그들의 촉매적 중심의 일부로서 포함하며 '성숙 (maturation)'인자 또는 전사조절인자 (예로, 활성인자 (activators) 또는 억제인자 (repressors))와 같은 때로 부가적인 부속 폴리펩타이드가 연루된 수소화효소 유전자의 발현을 가지는 다수의 소단위 (multiple subunits)로 구성될 수 있다. 수소화효소는 그들의 촉매적 중심에 금속 보조인자의 유형에 근거하여 적어도 세 가지의 광범위한 그룹으로 분류된다: (1) 니켈-철 ("NiFe" 수소화효소는 니켈/철 보조인자를 가지고; (2) 철-철 수소화효소 ("FeFe"는 철/철 보조인자를 가지며; 또한 (3) 철/황-없는 ("Fe" 수소화효소, 이는 (1)과 (2) 그룹에서 발견되는 4Fe4S 집합이 결여되어 있고, 철 보조인자 및 메테닐-테트라하이드로메탄노프테린 전자 운반체 (methenyl-tetrahydromethanopterin electron carrier). 예로, Chung-Jung Chou et al., "Hydrogenesis in hyperthermophilic microorganisms: implications for biofuels," Metabol. Eng. 10:394-404 (2008), 또한 Gonul Vardar-Schara et al.,"Metabolically engineered bacteria for producing hydrogen via fermentation," Microbial Biotechnol. 1(2):107-125 (2008)를 참조하고, 이들 둘 다는 본 명세서에서 참고문헌으로 전부, 상세하게는 수소화효소의 다양한 유형 및 클래스에 관하여 통합되어 있다. 많은 생물이 다수의 수소화효소를 포함하긴 하지만, 소수만이 NiFe 및 FeFe 수소화효소 둘 다에 대한 유전자를 포함한다.
NiFe 수소화효소의 촉매적 중심은 니켈 원자 및 철 원자로 구성되고 각각은 두 개의 일산화탄소 (CO) 및 두 개의 시아나이드 (cyanide, CN-) 리간드를 가진다. NiFe 수소화효소 모두는 촉매적 중심까지 및 이로부터의 전자 전달을 위한 다수의 철-황 (Fe-S) 중심을 포함하는 적어도 두 번째 소단위를 포함한다. NiFe 수소화효소는 네 가지의 주요 클래스로 다시 나눌 수 있다: (1) 호흡 효소, 이는 혐기성 조건 하에서 H2 산화와 SO4 2- 또는 NO3 - 와 같은 말단 전자 수용체의 환원을 결합시키거나, 호기성 조건 하에서 O2 를 결합시키는 다중효소 시스템의 일부분이며; (2) H2 센서, 이는 대사적으로 활성을 가진NiFe 수소화효소의 발현을 활성화시키고; (3) NADP+를 사용할 수 있는 다수의 소단위를 포함하는 세포질 수소화효소, 이는 시험관내 에서는 바로 가역적이지만 생체내 에서는 단지 H2만을 산화할 수 있으며; 또한 (4) 막-부착, 에너지-보존 다중효소 복합체, 이것도 역시 박테리아와 알키아 (Archaea)에서 발견된다. Chung-Jung Chou et al., "Hydrogenesis in hyperthermophilic microorganisms: implications for biofuels," Metabol. Eng. 10:394-404 (2008).
FeFe 수소화효소의 촉매적 중심은 단일 단백질 (시스테인) 리간드에 의해 이중핵 (binuclear) (FeFe) 부위를 [4Fe-4S] 중심에 조화롭게 연결시키는 촉매적 "H 집합 (H cluster)"을 포함한다. 이중핵 중심은 각각 두 개의 일산화탄소 (CO) 및 두 개의 시아나이드 (CN-) 리간드를 가지고, 작은 유기 분자의 일부인 두 개의 황 원자에 의해 또한 연결된다. 대부분의 FeFe 수소화효소는 약 50 킬로달톤 (kDa)의 모노머 효소이고, 생체내에서 주로 양성자를 수소 기체로 환원시켜 과다 환원 동등물을 버리는 기능을 가지는 것으로 보인다. Chung-Jung Chou et al., "Hydrogenesis in hyperthermophilic microorganisms: implications for biofuels," Metabol. Eng. 10:394-404 (2008).
Fe 수소화효소의 촉매적 중심은 원래는 관여된 금속이 전혀 없는 유기적 보조인자에 기초하는 활성 부위를 가진 것으로 생각되었지만, 이후에 단핵 Fe 원자를 포함하는 것으로 밝혀졌다. 세 가지 유형의 수소화효소 간의 계통학적 차이점에도 불구하고 적어도 하나의 철 원자에 더하여, 수소화효소의 세 가지 그룹 모두도 역시 철 원자에 대한 적어도 하나의 일산화탄소 (CO) 리간드를 그들의 활성 부위에 포함하고, H2 의 촉매적 산화 및 양성자의 환원을 용이하게 한다. Chung-Jung Chou et al., "Hydrogenesis in hyperthermophilic microorganisms: implications for biofuels," Metabol. Eng. 10:394-404 (2008).
대표적인 수소화효소 폴리펩타이드로는 이에 제한되는 것은 아니지만, E. coli 수소화효소 -1 (Hyd-1) 폴리펩타이드, E. coli 수소화효소-2 (Hyd-2) 폴리펩타이드, E. coli 수소화효소 -3 (Hyd-3) 폴리펩타이드, E. coli 수소화효소 -4 (Hyd-4) 폴리펩타이드, 포르메이트 및 CO2 로부터 산성 pH의 혐기성 조건 하에서 수소 기체를 생산하는 E. coli 포르메이트 수소 용해효소 (FHL) 복합체 (예로, Akihito Yoshida et al., "Efficient induction of formate hydrogen lyase of aerobically grown Escherichia coli in a three-step biohydrogen production process," Appl. Microbiol. Biotechnol. 74:754-760 (2007)를 참조하고, 이는 본 명세서에서 참고문헌으로 전부, 상세하게는 대장균에서 포르메이트 수소 용해효소의 유도 및 발현에 관하여 통합되어 있다), 랄스토니아 유트로파 H16 수소화효소 (R. eutropha HoxH), 로도코커스 오파쿠스 MR11 수소화효소 (R. opacus HoxH) 폴리펩타이드, 시네코스티스 종 PCC 6803 수소화효소 (Syn. PCC 6803 HoxH) 폴리펩타이드, 디설포비브리오 기가스 수소화효소 (D. gigas) 폴리펩타이드, 및 디설포비브리오 디설퓨리칸스 ATCC 7757 수소화효소 (D. desulfuricans) 폴리펩타이드 (예로, Gonul Vardar-Schara et al., "Metabolically engineered bacteria for producing hydrogen via fermentation," Microbial Biotechnol. 1(2):107-125 (2008)를 참조하고, 이는 본 명세서에서 참고문헌으로 전부, 상세하게는 다양한 유형 및 클래스의 수소화효소에 관하여 통합되어 있다), 또한 둘 이상의 수소화효소 폴리펩타이드의 활성을 가진 폴리펩타이드 (예로, 융합 폴리펩타이드)를 포함한다. 대표적인 수소화효소 핵산은 수소화효소 폴리펩타이드의 적어도 하나의 활성을 가지거나 수소화효소 폴리펩타이드의 발현, 프로세싱, 또는 성숙에 필요한 적어도 하나의 활성을 가지는 폴리펩타이드, 폴리펩타이드의 단편, 펩타이드, 또는 융합 폴리펩타이드를 인코드하는 핵산을 포함한다. 대표적인 수소화효소 폴리펩타이드 및 핵산은 본 명세서에서 기술된 출처 생물이라면 모두로부터 나온 자연적으로-발생하는 폴리펩타이드 및 핵산 뿐만 아니라 본 명세서에서 기술된 출처 생물이라면 모두로부터 유래한 돌연변이 폴리펩타이드 및 핵산을 포함한다.
E. coli Hyd-3는 혐기성 포르메이트 수소 용해효소 (FHL) 복합체의 일부분이고, hyc 오페론 (hycA, hycB, hycC, hycD, hycE, hycF, hycG, hycH, 및 hycI 유전자를 포함함)에 의해 인코드된다. E. coli Hyd-4는 hyf 오페론 (hyfA, hyfB, hyfC, hyfD, hyfE, hyfF, hyfG, hyfH, hyfI, hyfJ, 및 hyfR 유전자를 포함함)에 의해 인코드된다. E. coli FHL는 hyc 오페론으로부터 나온 여섯 개의 유전자 (hycB, hycC, hycD, hycE, hycF 및 hycG) 및 fdhF 유전자 (포르메이트 탈수소화효소 H (Fdh-H)를 인코드함)에 의해 인코드된다. FHL 복합체의 발현은 좀 더 나아가 피루베이트 포르메이트 용해효소 (pfl), FhlA, fdhF 와 hyc 오페론의 전사를 활성화하는 전사인자, 또는 FHL의 전사를 음성적으로 조절하는 hycA 유전자에 의해 인코드되는 전사인자인 HycA의 결실/불활성화와 관련될 수 있다. 이소프렌과 수소의 공동-생산은 수소화효소 및 기타효소, 예를 들어 철-황 복합체 전자 조절인자 (iscR) (Kalim-Akhtar et al., "Deletion of iscR stimulates recombinant Clostridial Fe/Fe hydrogenase activity and H2-accumulation in Escherichia coli BL21(DE3)," Appl. Microbiol. Biotechnol. 78:853-862 (2008) 를 참조하고, 이는 본 명세서에서 참고문헌으로 전부, 상세하게는 클로스트리듐 Fe/Fe 수소화효소 활성의 자극 및 대장균에서 iscR 유전자의 결실에 의한 수소 축적에 관하여 통합되어 있다)와 같은 것의 유전자 발현의 조절에 관여하는 부가적인 단백질의 발현 또는 불활성화/결실에 의해 개선될 수 있다.
대표적인 페로레독신-의존성 수소화효소 폴리펩타이드는, 이에 제한되는 것은 아니지만 크로스트리듐 아세토부툴리쿰 수소화효소 A (HydA) (예로, P.W. King et al., "Functional studies of [FeFe] hydrogenase maturation in an Escherichia coli biosynthetic system," J. Bacteriol. 188(6):163-172 (2006)을 참조하고, 이는 본 명세서에서 참고문헌으로 전부, 상세하게는 HydA 및 세 가지HydA-관련 성숙 효소 (HydE, HydG, 및 HydF)에 의한 수소 생산에 관하여 통합되어 있다), 이는 단독으로 또는 하기 하나 이상과 조합하여 발현될 수 있고: (1) 바실러스 섭틸리스 페로레독신 산화환원효소 (NFOR) (예로, Viet et al., (2008)를 참조하고, 이는 본 명세서에 참고문헌으로 전부 상세하게는 NFOR에 의한 수소 생산에 관하여 통합되어 있으며; PCT 국제특허출원 제 WO/2007/089901호도 역시 참조하고, 이는 본 명세서에 참고문헌으로 전부 상세하게는 수소 생산하기 위한 대장균 균주의 최적화에 관하여 통합되어 있다), 클로스트리듐 클루이베리 (Clostridium kluyveri) NADH 페로레독신 산화환원효소 (RnfCDGEAB) (Henning Seedorf et al., "The genome of Clostridium kluyveri, a strict anaerobe with unique metabolic features," Proc. Nat'l Acad. Sci. U.S.A. 105(6):2128-2133 (2008), 이는 본 명세서에 참고문헌으로 전부 상세하게는 NADH 페로레독신 산화환원효소에 관하여, 또한 혐기성 에탄올-아세테이트 발효 경로의 성분에 관하여 통합되어 있다) 또는 클로스트리듐 파스퇴라니움 (Clostridium pasteuranium) ferredoxin oxidoreductase (Fdx); (2) 글리세르알데하이드-3-포스페이트 페로레독신 산화환원효소 ("GAPOR"); 또는 (3) 피루베이트 페로레독신 산화환원효소 (pyruvate oxidoreductase, "POR"), 및 둘 이상의 수소화효소 폴리펩타이드, 또는 하나 이상의 수소화효소 폴리펩타이드의 활성 및 하나 이상의 페로레독신-의존성 산화환원효소의 활성을 가지는 폴리펩타이드 (예로, 융합 폴리펩타이드)을 포함한다. 상세하게, 페로레독신-의존성 수소화효소 폴리펩타이드는 페로레독신-의존성 수소화효소 폴리펩타이드의 적어도 하나의 활성을 가지는 폴리펩타이드, 폴리펩타이드의 단편, 펩타이드, 및 융합 폴리펩타이드를 포함한다.
대표적인 NADPH-의존성 수소화효소 폴리펩타이드로는, 이에 제한되는 것은 아니지만 Pyrococcus furiosus 수소화효소 (예로, J. Woodward et al., "Enzymatic production of biohydrogen," Nature 405(6790):1014-1015 (2000)를 참고하라)와 같은 열친화성 수소화효소 폴리펩타이드 및 둘 이상의 NADPH-의존성 수소화효소 폴리펩타이드의 활성을 가지는 폴리펩타이드 (예로, 융합 폴리펩타이드)를 포함한다. 상세하게, NADPH-의존성 수소화효소 폴리펩타이드는 NADPH-의존성 수소화효소 폴리펩타이드는 적어도 하나의 활성을 가지는 폴리펩타이드, 폴리펩타이드의 단편, 펩타이드, 및 융합 폴리펩타이드를 포함한다.
대표적인 산소-내성 또는 산소-비민감성 수소화효소로는, 이에 제한되는 것은 아니지만 Rubrivivax gelatinosus 수소화효소 (예로, P.C. Maness et al., "Characterization of the oxygen tolerance of a hydrogenase linked to a carbon monoxide oxidation pathway in Rubrivivax gelatinosus," Appl. Environ. Microbiol. 68(6):2633-2636 (2002)를 참조하고, 이는 본 명세서에서 참고문헌으로 전부, 상세하게는 R. gelatinosus 수소화효소에 관하여 통합되어 있다), 및 Ralstonia eutropha 수소화효소 폴리펩타이드 (예로, T. Burgdorf et al., "[NiFe]-hydrogenases of Ralstonia eutropha H16: modular enzymes for oxygen-tolerant biological hydrogen oxidation,"J. Mol. Microbiol. Biotechnol. 10(2-4):181-196 (2005)를 참조하고, 이는 본 명세서에서 참고문헌으로 전부, 상세하게는 R. eutropha 수소화효소 폴리펩타이드에 관하여 통합되어 있다)를 포함한다. 대안으로, 수소화효소 폴리펩타이드를 인코딩하는 이종유래 핵산은 표준 방법 및 분석법 (예로, L.E. Nagy et al., "Application of gene-shuffling for the rapid generation of novel [FeFe]-hydrogenase libraries," Biotechnol. Letts. 29(3)421-430 (2007)를 참조하고, 이는 본 명세서에서 참고문헌으로 전부, 상세하게는 돌연변이화 및 산소 내성 수소화효소 폴리펩타이드에 대한 검색에 관하여 통합되어 있다)을 사용하여 돌연변이화될 수 있고O2-내성 또는 O2-비민감성에 대해 검색될 수 있다.
표준 방법이 (본 명세서에서 기술된 것과 같음) 폴리펩타이드가 수소화효소 폴리펩타이드의 활성을 가지는지 여부를 폴리펩타이드가 시험관내, 세포추출물에서 또는 생체내 수소 기체를 생산하는 활성을 측정하여 결정하는 데 사용될 수 있다.
발효 부산물과 관련된 유전자에 대한 대표적인 폴리펩타이드 및 핵산
대장균에서 이종유래 또는 자연 그대로의 수소화효소를 발현하거나 과다-발현하는 것과 더불어, 이소프렌과 수소의 공동-생산은 혐기성 생합성 경로의 불활성화에 의해 개선될 수 있고, 따라서 산소-제한되거나 혐기성 조건 하에서 생산되는, 이에 제한되는 것은 아니지만 락테이트, 아세테이트, 피루베이트, 에탄올, 숙시네이트, 및 글리세롤를 포함하는 다양한 대사물 (예로, 발효 부산물)로의 탄소 유량을 차단시킨다. 발효 부산물의 생산과 관련된 대표적인 폴리펩타이드는 포르메이트 탈수소화효소 N, 알파 소단위 ( fdnG), 포르메이트 탈수소화효소 O, 큰 소단위 (fdoG), 나이트레이트 환원효소 (narG), 포르메이트 전달자 A (formate transporter A, focA), 포르메이트 전달자 B (focB), 피루베이트 산화효소 (poxB), 피루베이트 탈수소화효소 E1 성분 ackA/pta (aceE), 알코올 탈수소화효소 (adhE), 푸마레이트 환원효소 막 단백질 (frdC), 및 락테이트 탈수소화효소 (ldhA)를 포함한다. 예로, Toshinori Maeda et al., "Enhanced hydrogen production from glucose by metabolically engineered Escherichia coli," Appl. Microbiol. Biotechnol. 77(4):879-890 (2007)를 참조하고, 이는 본 명세서에서 참고문헌으로 전부, 상세하게는 변형된 포도당 대사를 가지는 대장균 균주의 생산에 관하여 통합되어 있다. 이소프렌과 수소의 공동-생산을 개선하도록 불활성화도 역시 될 수 있는 발효 부산물의 생산과 관련된 유전자의 조절 또는 발현과 관련된 대표적인 폴리펩타이드는, 이에 제한되는 것은 아니지만 포르메이트 수소 용해효소 (hycA)의 억제인자 (repressor), 푸마레이트 환원효소 조절인자 (fumarate reductase regulator, fnr), 아세틸-코엔자임 A 합성효소 (acs), 및 포르메이트 탈수소화효소 조절 단백질 (hycA)를 포함하고, 이는 전사 조절인자 fhlA (포르메이트 수소 용해효소 전사 활성인자)의 발현을 조절한다.
수소 재흡수와 관련된 유전자에 대한 대표적인 폴리펩타이드 및 핵산
이소프렌과 수소의 공동-생산을 개선하도록 불활성화도 될 수 있는 수소 재흡수에 관여하는 대표적인 폴리펩타이드는, 이에 제한되는 것은 아니지만 E. coli 수소화효소-1 (Hyd-1) (hya 오페론) 및 E. coli 수소화효소-2 (Hyd-2) (hyb 오페론)를 포함한다. E. coli Hyd-1은 hya 오페론 (hyaA, hyaB, hyaC, hyaD, hyaE, 및 hyaF 유전자를 포함함)에 의해 인코드된다. E. coli Hyd-2은 hyb 오페론 (hybA, hybB, hybC, hybD, hybE, hybF, hybG, 및 hybO 유전자를 포함함)에 의해 인코드된다.
핵산을 분리하는 대표적인 방법
이소프렌 합성효소, DXS, IDI, MVA 경로, 수소화효소, 수소화효소 성숙 및/또는 전사인자 핵산은 표준 방법을 사용하여 분리될 수 있다. 관심 있는 출처 생물 (예로, 박테리아 게놈)로부터 원하는 핵산을 획득하는 방법은 보편적이고 분자생물학의 기술분야에서 잘 알려져 있다 (예를 들어, 국제특허출원 제 WO 2004/033646호 및 본 명세서에서 인용된 참고문헌들을 참조하고, 이들은 각각 본 명세서에서 참고문헌으로 전부, 상세하게는 관심 있는 핵산의 분리에 관하여 통합되어 있다). 예를 들어, 핵산의 서열이 알려져 있는 경우라면 (본 명세서에서 기술된 기지의 핵산 모두와 같음), 적합한 게놈 라이브러리가 제한효소 소화에 의해 만들어질 수 있고 원하는 핵산 서열에 상보적인 탐침으로 검색될 수 있다. 일단 서열이 분리되면, DNA는 적절한 벡터를 사용한 형질전환에 적합한 DNA 양을 획득하도록 중합효소 연쇄반응 (PCR)과 같은 (미국특허 제 US 4,683,202호, 이는 본 명세서에서 참고문헌으로 전부, 상세하게는 PCR 방법에 관하여 통합되어 있다) 표준 프라이머 지향된 증폭법을 사용하여 증폭될 수 있다.
대안으로, 이소프렌 합성효소, DXS, IDI, MVA 경로, 수소화효소, 수소화효소 성숙 및/또는 전사인자 핵산 (기지의 핵산 서열을 가진 이소프렌 합성효소, DXS, IDI, MVA 경로, 수소화효소, 수소화효소 성숙 및/또는 전사인자 핵산과 같음)은 표준 방법을 사용하여 화학적으로 합성될 수 있다.
본 명세서에서 기술된 조성물 및 방법에서의 용도로 적합할 수 있는 추가적인 이소프렌 합성효소, DXS, IDI, MVA 경로, 수소화효소, 수소화효소 성숙 및/또는 전사인자 폴리펩타이드 및 핵산은 표준방법을 사용하여 확인될 수 있다. 예를 들어, 이소프렌을 자연적으로 생산하는 것으로 알려진 생물의 염색체 DNA의 코스미드 라이브러리가 대장균과 같은 생물에서 제작된 다음 이소프렌 생산에 대해 검색될 수 있다. 상세하게, 코스미드 라이브러리는 게놈 DNA (35-45 kb)의 큰 분절이 벡터 내로 포장되는 곳에서 만들어져서 적절한 숙주를 형질전환하는 데 사용될 수 있다. 코스미드는 많은 양의 DNA를 수용할 수 있는 점에서 독특하다. 일반적으로 코스미드 벡터는 포장 (packaging)과 이어지는 이종유래 DNA의 고리화 (circularization)에 필요한 적어도 하나의 코스 DNA 서열 사본을 가진다. 코스 서열에 더하여, 이들 벡터도 역시 ColEI과 같은 복제 원점 및 앰피실린 또는 네오마이신에 대한 저항성 핵산과 같은 약물 저항성 마커를 포함한다. 적합한 박테리아 숙주의 형질전환을 위한 코스미드 벡터를 사용하는 방법은 샘브룩 등 (Sambrook et al.), 분자적 클로닝: 실험실 매뉴얼 (Molecular Cloning: A Laboratory Manual), 제 2판, 콜드 스트링 하버 연구소 (Cold Spring Harbor), 1989에 잘 기술되어 있고, 이는 본 명세서에서 참고문헌으로 전부, 상세하게는 형질전환 방법에 관하여 통합되어 있다.
전형적으로 코스미드를 클론하기 위하여, 이종유래 DNA는 적절한 제한효소를 사용하여 분리되고 적절한 라이게이즈를 사용하여 코스미드 벡터의 코스 부위 근처에 결찰된다. 직선화된 이종유래 DNA를 포함하는 코스미드 벡터는 다시 박테리오파지와 같은 DNA 포장 운반체 (packaging vehicle)와 함께 반응시킨다. 포장 과정 동안 코스 부위는 절단되고 이종유래 DNA는 박테리아 바이러스 입자의 상부 내로 포장된다. 이들 입자는 그 다음 대장균과 같은 적합한 숙주세포를 형절전환시키는 데 사용된다. 일단 세포 내로 주입되면, 이종유래 DNA는 코스 점착성 말단 (cos sticky ends)의 영향 하에서 고리화된다. 본 방식으로, 많은 분절의 이종유래 DN가 도입되어 숙주세포에서 발현될 수 있다.
이소프렌 합성효소, DXS, IDI, MVA 경로, 수소화효소, 수소화효소 성숙 및/또는 전사인자 핵산을 획득하는 추가적인 방법은 분석법 (본 명세서에서 기술된 상부공간 분석법과 같음)에 의한 또는 보존되는 아미노산의 길이 (예를 들어, 적어도 3개의 보존되는 아미노산)를 인코딩하는 뉴클레오타이드에게로 유도되는 프라이머를 사용하는 PCR에 의한 메타게놈 라이브러리 (metagenomic library)의 검색을 포함한다. 보존되는 아미노산은 기지의 이소프렌 합성효소, DXS, IDI, MVA 경로, 수소화효소, 수소화효소 성숙 및/또는 전사인자 폴리펩타이드의 아미노산 서열 정렬하여 확인될 수 있다. 이소프렌 합성효소 폴리펩타이드에 대한 보존되는 아미노산은 기지의 이소프렌 합성효소 폴리펩타이드의 정렬된 서열에 근거하여 확인될 수 있다. 이소프렌을 자연적으로 생산하는 것으로 밝혀진 생물은 표준 단백질 정제 방법 (당해 기술분야에 잘 알려져 있음)에 적용될 수 있고, 그 결과 나온 정제된 폴리펩타이드는 표준 방법을 사용하여 서열결정될 수 있다. 기타 방법은 참고문헌에 밝혀져 있다 (예를 들어, Julsing et al., Applied. Microbiol. Biotechnol. 75: 1377-84, 2007; Withers et al., Appl Environ Microbiol. 73(19):6277-83, 2007를 참조하고, 이들은 각각 본 명세서에서 참고문헌으로 전부, 상세하게는 이소프렌의 합성에 관여하는 핵산의 확인에 관하여 통합되어 있다).
추가적으로, 표준 서열 정렬 및/또는 구조 예측 프로그램은 추가적인 DXS, IDI, MVA 경로, 수소화효소, 수소화효소 성숙 및/또는 전사인자 폴리펩타이드 및 핵산을 그들의 일차 및/또는 예측된 폴리펩타이드 이차구조의 유사도에 근거하여 기지의 DXS, IDI, MVA 경로, 수소화효소, 수소화효소 성숙 및/또는 전사인자 폴리펩타이드 및 핵산의 것과 함께 확인하는 데 사용될 수 있다. 스위스프로트-트럼블 데이터베이스 (swissprot-trembl database) (전세계적인 웹 "expasy.org", Swiss Institute of Bioinformatics Swiss-Prot group CMU - 1 rue Michel Servet CH-1211 Geneva 4, 스위스)와 같은 표준 데이터베이스도 역시 이소프렌 합성효소, DXS, IDI, MVA 경로, 수소화효소 성숙 및/또는 전사인자 폴리펩타이드 및 핵산을 확인하는 데 사용될 수 있다. 이소프렌 합성효소, DXS, IDI, MVA 경로, 수소화효소, 수소화효소 성숙 및/또는 전사인자 폴리펩타이드의 이차 및/또는 삼차 구조는 프리딕트프로테인 (PredictProtein) (630 West, 168 Street, BB217, New York, N.Y. 10032, USA)과 같은 표준 구조 예측 프로그램의 디폴트 세팅을 사용하여 예측될 수 있다. 대안으로, 이소프렌 합성효소, DXS, IDI, MVA 경로, 수소화효소, 수소화효소 성숙 및/또는 전사인자 폴리펩타이드의 실제적 이차 및/또는 삼차 구조는 표준 방법을 사용하여 결정될 수 있다. 추가적인 이소프렌 합성효소, DXS, IDI, MVA 경로, 수소화효소, 수소화효소 성숙 및/또는 전사인자 핵산도 역시 기지의 이소프렌 합성효소, DXS, IDI, MVA 경로, 수소화효소, 수소화효소 성숙 및/또는 전사인자 핵산으로부터 생성된 탐침에 대한 혼성화 (hybridization)에 의해 확인될 수 있다.
대표적인 프로모터 및 벡터
본 명세서에서 기술된 이소프렌 합성효소, DXS, IDI, MVA 경로, 수소화효소, 수소화효소 성숙 및/또는 전사인자 핵산이라면 모두가 하나 이상의 벡터에 포함될 수 있다. 따라서, 본 명세서에서 기술된 이소프렌 합성효소, DXS, IDI, MVA 경로, 수소화효소, 수소화효소 성숙 및/또는 전사인자 핵산이라면 모두를 인코딩하는 하나 이상의 핵산을 가진 벡터도 또한 본 명세서에서 기술되어 있다. 일정 구현예에서, 벡터는 발현 조절 서열의 통제 하에서의 핵을 포함한다.
일정 구현예에서, 벡터는 선별 마커 또는 선별가능한 마커를 포함한다. 트리코더마 (Trichoderma)의 형질전환을 위한 벡터 시스템에 유용한 마커는 당해 기술분야에 알려져 있다 (예로, Finkelstein, Chapter 6 in Biotechnology of Filamentous Fungi, Finkelstein et al., Eds. Butterworth-Heinemann, Boston, MA, Chap. 6., 1992; 및 Kinghorn et al., Applied Molecular Genetics of Filamentous Fungi, Blackie Academic and Professional, Chapman and Hall, London, 1992을 참조하고, 이들은 각각 본 명세서에서 참고문헌으로 전부, 상세하게는 선별 마커에 관하여 통합되어 있다). 일정 구현예에서, 선별 마커는 amdS 핵산이고, 이는 아세트아미다제 (acetamidase) 효소를 인코드하고 형질전환된 세포가 질소원으로서 아세트아마이드 상에서 성장하도록 허용한다. 선별 마커로서 A. 니둘란스 (A. nidulans) amdS 핵산의 용도는 Kelley et al., EMBO J. 4: 475-479, 1985 및 Penttila et al., Gene 61:155-164, 1987에 기술되어 있다 (이들은 각각 본 명세서에서 참고문헌으로 전부, 상세하게는 선별 마커에 관하여 통합되어 있다). 일정 구현예에서, 이소프렌 합성효소, DXS, IDI, MVA 경로, 수소화효소, 수소화효소 성숙 및/또는 전사인자 핵산은 선별 마커 없이도 세포의 염색체 내로 도입된다.
적합한 벡터는 사용되는 숙주세포와 양립가능한 (compatible) 것이다. 적합한 벡터는, 예를 들어 박테리아, 바이러스 (박테리오파지 T7 또는 M-13 유래 파지), 코스미드, 효모, 또는 식물로부터 유래할 수 있다. 이러한 벡터를 획득하고 사용하는 프로토콜은 당해 기술분야에 숙지되어 있다 (예를 들어, 샘브룩 등, 분자적 클로닝: 실험실 매뉴얼, 제 2판, 콜드 스트링 하버 연구소, 1989를 참조하고, 이는 본 명세서에서 참고문헌으로 전부, 상세하게는 벡터의 사용에 관하여 통합되어 있다).
프로모터는 당해 기술분야에 잘 숙지되어 있다. 숙주세포에서 기능하는 프로모터라면 모두가 숙주세포에서 이소프렌 합성효소, DXS, IDI, MVA 경로, 수소화효소, 수소화효소 성숙 및/또는 전사인자 핵산의 발현에 사용될 수 있다. 다양한 숙주세포에서 이소프렌 합성효소, DXS, IDI, MVA 경로, 수소화효소, 수소화효소 성숙 및/또는 전사인자 핵의 발현을 진행하는 데 유용한 개시 조절 부위 (initiation control regions) 또는 프로모터는 많이 있고 당업자에게는 친숙하다 (예를 들어, 국제특허출원 제 WO 2004/033646호 및 본 명세서에서 인용된 참조문헌들을 참조하고, 이들은 각각 본 명세서에서 참고문헌으로 전부, 상세하게는 관심 있는 핵산의 발현을 위한 벡터에 관하여 통합되어 있다). 실제적으로, 이들 핵산을 진행시킬 수 있는 프로모터라면, 이에 제한되는 것은 아니지만 CYC1, HIS3, GAL1, GAL10, ADH1, PGK, PHO5, GAPDH, ADCI, TRP1, URA3, LEU2, ENO, 및 TPI (사카로마이세스 (Saccharomyces)에서 발현에 유용함); AOX1 (피키아 (Pichia)에서 발현에 유용함); and lac, trp, SPL, SPR, T7, tac, 및 trc (대장균에서 발현에 유용함)를 포함하여 모두가 본 발명에 적합하다.
일정 구현예에서, 포도당 이소머라제 프로모터가 사용된다 (예를 들어, 미국특허 제 US 7,132,527호 및 본 명세서에 인용된 참조문헌들을 참조하고, 이들은 각각 본 명세서에서 참고문헌으로 전부, 상세하게는 관심 있는 폴리펩타이드의 발현을 위한 프로모터 및 플라스미드 시스템에 관하여 통합되어 있다). 보고된 포도당 이소머라제 프로모터 돌연변이가 포도당 이소머라제 프로모터에 작동적으로 연결된 핵산에 의해 인코드되는 폴리펩타이드의 발현 수준을 변화시키는 데 사용될 수 있다 (미국 특허 제 US 7,132,527호). 다양한 구현예에서, 포도당 이소머라제 프로모터가 낮은, 중간 또는 높은 사본수 플라스미드에 포함된다 (미국 특허 제 US 7,132,527호).
다양한 구현예에서, 이소프렌 합성효소, DXS, IDI, MVA 경로, 수소화효소, 수소화효소 성숙 및/또는 전사인자 핵산이 낮은 사본수 플라스미드 (예로, 세포 당 약 1개 내지 약 4개의 사본수로 유지되는 플라스미드), 중간 사본수 플라스미드 (예로, 세포 당 약 10개 내지 약 15개의 사본수로 유지되는 플라스미드), 또는 높은 사본수 플라스미드 (예로, 세포 당 약 15개 이상의 사본수로 유지되는 플라스미드)에 포함된다. 일정 구현예에서, 이종유래 또는 별도의 이소프렌 합성효소, DXS, IDI, MVA 경로, 수소화효소, 수소화효소 성숙 및/또는 전사인자 핵산은 T7 프로모터에 작동적으로 연결된다. 일정 구현예에서, T7 프로모터에 작동적으로 연결된 이종유래 또는 별도의 이소프렌 합성효소, DXS, IDI, MVA 경로, 수소화효소, 수소화효소 성숙 및/또는 전사인자 핵산은 중간 또는 높은 사본수 플라스미드에 포함된다. 일정 구현예에서, 이종유래 또는 별도의 이소프렌 합성효소, DXS, IDI, MVA 경로, 수소화효소, 수소화효소 성숙 및/또는 전사인자 핵산은 Trc 프로모터에 작동적으로 연결된다. 일정 구현예에서, Trc 프로모터에 작동적으로 연결된 이종유래 또는 별도의 이소프렌 합성효소, DXS, IDI, MVA 경로, 수소화효소, 수소화효소 성숙 및/또는 전사인자 핵산은 중간 또는 높은 사본수 플라스미드에 포함된다. 일정 구현예에서, 이종유래 또는 별도의 이소프렌 합성효소, DXS, IDI, MVA 경로, 수소화효소, 수소화효소 성숙 및/또는 전사인자 핵산은 Lac 프로모터에 작동적으로 연결된다. 일정 구현예에서, Lac 프로모터에 작동적으로 연결된 이종유래 또는 별도의 이소프렌 합성효소, DXS, IDI, MVA 경로, 수소화효소, 수소화효소 성숙 및/또는 전사인자 핵산은 낮은 사본수 플라스미드에 포함된다. 일정 구현예에서, 이종유래 또는 별도의 이소프렌 합성효소, DXS, IDI, MVA 경로, 수소화효소, 수소화효소 성숙 및/또는 전사인자 핵산은 대장균 (Escherichia), 판테오아 (Panteoa), 바실러스 (Bacillus), 야로위아 (Yarrowia), 스트렙토마이세스 (Streptomyces), 또는 트리코더마 (Trichoderma) 프로모터와 같은 내재성 프로모터에 또는 내재성 알칼라인 세린 프로테아제, 이소프렌 합성효소, DXS, IDI, MVA 경로, 수소화효소, 수소화효소 성숙 및/또는 전사인자 프로모터에 작동적으로 연결된다. 내재성 프로모터에 작동적으로 연결된 이종유래 또는 별도의 이소프렌 합성효소, DXS, IDI, MVA 경로, 수소화효소, 수소화효소 성숙 및/또는 전사인자 핵산은 높은 사본수 플라스미드에 포함된다. 일정 구현예에서, 벡터는 세포에서 염색체 내로 통합되지 않는 복제하는 플라스미드이다. 일정 구현예에서 벡터의 일부 또는 전부는 세포에서 염색체 내로 통합된다.
일정 구현예에서, 벡터는 곰팡이 숙주세포 내로 도입될 때 숙주세포 내로 도입되어 복제하는 벡터라면 모두이다. 벡터의 리스트를 위해 곰팡이 유전학 스톡 센터 균주 카탈로그 (Fungal Genetics Stock Center Catalogue of Strains, FGSC) 가 참고문헌으로 작성되어 있다 (전세계적인 웹 "fgsc.net" 및 본 명세서에서 인용된 참고문헌들을 참조하고, 이들은 각각 본 명세서에서 참고문헌으로 전부, 상세하게는 벡터에 관하여 통합되어 있다). 적합한 발현 및/또는 삽입 벡터의 추가적인 예가 샘브룩 등, 분자적 클로닝: 실험실 매뉴얼, 제 2판, 콜드 스트링 하버 연구소, 1989; 분자생물학에서의 최신 프로토콜 (Current Protocols in Molecular Biology) (F. M. Ausubel et al. (eds) 1987, 부록 30 (Supplement 30), 섹션 7.7.18); van den Hondel et al. in Bennett and Lasure (Eds.) More Gene Manipulations in Fungi, 아카데믹 프레스사 (Academic Press) pp. 396-428, 1991; 및 미국 특허 제 US 5,874,276호에 제공되어 있고, 이들 각각은 본 명세서에서 참고문헌으로 전부, 상세하게는 벡터에 관하여 통합되어 있다. 상세하게, 유용한 벡터는 pFB6, pBR322, PUC18, pUC100, 및 pENTR/D를 포함한다.
일정 구현예에서, 이소프렌 합성효소, DXS, IDI, MVA 경로, 수소화효소, 수소화효소 성숙 및/또는 전사인자 핵산은 곰팡이 숙죽세포에서 전사적 활성을 보여주는 적합한 프로모터에 작동적으로 연결된다. 프로모터는 숙주세포에 내재성 또는 이종유래 둘 중 하나인 폴리펩타이드를 인코딩하는 핵산 하나 이상으로부터 유래할 수 있다. 일정 구현예에서, 프로모터는 트리코더마 (Trichoderma) 숙주에서 유용한다. 적합한 프로모터의 제한되지 않는 예로는 cbh1, cbh2, egl1, egl2, pepA, hfb1, hfb2, xyn1, 및 amy를 포함한다. 일정 구현예에서, 프로모터는 숙주세포에서 나온 것이다. 예를 들어, 일정 구현예에서 T. reesei 가 숙주일 때 천연 (native) T. reesei 프로모터이다. 일정 구현예에서 프로모터는 T. reesei cbh1이고, 이는 유도성 프로모터이고 진뱅크 기탁번호 제 D86235호 하로 기탁되었으며, 이는 본 명세서에서 참고문헌으로 전부, 상세하게는 프로모터에 관하여 통합되어 있다. 일정 구현예에서, 프로모터는 곰팡이 숙주세포에서 이종유래인 것이다. 유용한 프로모터의 기타 다른 예로는 A. awamori의 유전자로부터 나온 프로모터 및 A. niger 글루코아밀라제 (glaA) (Nunberg et al., Mol. Cell Biol. 4:2306-2315, 1984 및 Boel et al., EMBO J. 3:1581-1585, 1984, 이들 각각은 본 명세서에서 참고문헌으로 전부, 상세하게는 프로모터에 관하여 통합되어 있다); 아스퍼질러스 니거 (Aspergillus niger) 알파 아밀라제, 아스퍼질러스 오리자이 (Aspergillus oryzae) TAKA 아밀라제, T. reesei xln1, 및 T. reesei 셀로바이오하이드롤라제 1 (cellobiohydrolase 1) (유럽특허 제 EP 137280호, 이는 본 명세서에서 참고문헌으로 전부, 상세하게는 프로모터에 관하여 통합되어 있다)을 포함한다.
일정 구현예에서, 발현 벡터는 또한 종결 서열 (termination sequence)을 포함한다. 종결 조절 부위는 숙주세포에서 천연의 다양한 유전자들로부터 유래할 수 있다. 일정 구현예에서, 종결 서열 및 프로모터 서열은 동일한 출처로부터 유래할 수 있다. 또 다른 구현예에서, 종결 서열은 숙주세포에서 내재성이다. 상세하게, 적합한 종결 서열은 트리코더마 균주 (T. reesei와 같음)로부터 유래한 cbh1이다. 기타 유용한 곰팡이 종결인자는 A. niger 또는 A. awamori 글루코아밀라제 핵산으로부터 나온 종결인자를 포함한다 (Nunberg et al., Mol. Cell Biol. 4:2306-2315, 1984 및 Boel et al., EMBO J. 3:1581-1585, 1984; 이들은 각각 본 명세서에서 참고문헌으로 전부, 상세하게는 곰팡이 종결인자에 관하여 통합되어 있다). 임의적으로, 종결 부위가 포함될 수 있다. 폴리펩타이드의 효과적인 발현을 위해, 폴리펩타이드를 인코딩하는 DNA는 개시 코돈을 통해 선택된 발현 조절 부위에 작동적으로 연결될 수 있어 발현은 적정한 메신저 RNA의 형성을 가져온다.
일정 구현예에서, 프로모터, 코딩 부위 및 종결인자는 모두 발현될 이소프렌 합성효소, DXS, IDI, MVA 경로, 수소화효소, 수소화효소 성숙 및/또는 전사인자 핵산으로부터 유래된다. 일정 구현예에서, 이소프렌 합성효소, DXS, IDI, MVA 경로, 수소화효소, 수소화효소 성숙 및/또는 전사인자 핵산에 대한 코딩 부위는 일반적인-목적의 발현 벡터 내에 삽입되어, 이것은 발현 제작 프로모터 및 종결인자 서열의 전사 조절 하에 놓여진다. 일정 구현예에서, 그의 유전자 또는 일부는 강력한 cbh1 프로모터의 하류에 삽입된다.
이소프렌 합성효소, DXS, IDI, MVA 경로, 수소화효소, 수소화효소 성숙 및/또는 전사인자 핵산은 표준 기법 (샘브룩 등, 분자적 클로닝: 실험실 매뉴얼, 콜드 스트링 하버 연구소, 1982, 이는 본 명세서에서 참고문헌으로 전부, 상세하게는 적절한 DNA 서열의 검색 및 벡터의 제작에 관하여 통합되어 있다)을 사용하여 발현 벡터와 같은 벡터 내에 도입될 수 있다. 관심 있는 핵산 (이소프렌 합성효소, DXS, IDI, MVA 경로, 수소화효소, 수소화효소 성숙 및/또는 전사인자 핵산과 같음)을 포함하는 DNA 제작물, 프로모터, 종결인자, 및 기타 서열을 결찰하는 데 또한 그들을 적합한 벡터 내에 삽입하는 데 사용되는 방법들은 당해 기술분야에 잘 숙지되어 있다. 예를 들어, 제한효소가 이소프렌 합성효소, DXS, IDI, MVA 경로, 수소화효소, 수소화효소 성숙 및/또는 전사인자 핵산 및 벡터를 절단하는 데 사용될 수 있다. 다음으로 절단된 이소프렌 합성효소, DXS, IDI, MVA 경로, 수소화효소, 수소화효소 성숙 및/또는 전사인자 핵산 및 절단된 벡터의 양립가능한 말단은 결찰될 수 있다. 연결 (linking)은 일반적으로 편리한 제한효소 부위에서 라이게이션에 의해 수행된다. 이러한 부위가 존재하지 않는 경우라면, 합성 올리고뉴클레오타이드 링커 (oligonucleotide linkers)가 통상적인 관행에 따라 사용된다 (샘브룩 등, 분자적 클로닝: 실험실 매뉴얼, 제 2판, 콜드 스트링 하버 연구소, 1989, 및 Bennett and Lasure, More Gene Manipulations in Fungi, 아카데믹 프레스사, 샌디에고, pp 70-76, 1991을 참조하고, 이들은 각각 본 명세서에서 참고문헌으로 전부, 상세하게는 올리고뉴클레오타이드 링커에 관하여 통합되어 있다). 추가적으로, 벡터는 기지의 재조합 기법 (예로, 인비트로겐 라이프 테크놀로지사 (Invitrogen Life Technologies), 게이트웨이 테크놀로지사 (Gateway Technology))을 사용하여 제작될 수 있다.
일정 구현예에서, 이소프렌 합성효소, DXS, IDI, MVA 경로, 수소화효소, 수소화효소 성숙 및/또는 전사인자 핵산은 자연적으로 발생하는 세포에서 최근 발견되는 것보다 훨씬 더 높은 수준으로 과다-발현하는 것이 바람직할 수 있다. 본 결과는 이들 폴리펩타이드를 인코딩하는 핵산의 복수 사본 플라스미드 내로의 선별적인 클로닝에 의해 또는 이들 핵산을 강력한 유도성 또는 전신성 프로모터 조절 하에 배치하여 달성될 수 있다. 원하는 폴리펩타이드를 과다-발현하는 방법은 보편적이고 분자생물학의 기술분야에서 잘 알려져 있으며 예들이 샘브룩 등, 분자적 클로닝: 실험실 매뉴얼, 제 2판, 콜드 스트링 하버 연구소, 1989에서 발견될 수 있고, 이는 명세서에서 참고문헌으로 전부, 상세하게는 클로닝 기법에 관하여 통합되어 있다.
일정 구현예에서, 이소프렌 합성효소, DXS, IDI, MVA 경로, 수소화효소, 수소화효소 성숙 및/또는 전사인자 폴리펩타이드-인코딩 핵산은 자연적으로 발생하는 세포에서 최근 들어 발견되는 것보다 훨씬 더 낮은 수준으로 과소-발현 (예로, 돌연변이, 불활성화 또는 결실)하는 것이 바람직할 수 있다. 본 결과는 이소프렌 합성효소, DXS, IDI, MVA 경로, 수소화효소, 수소화효소 성숙 및/또는 전사인자 핵산의 발현에 필요한 전사 조절 단백질의 돌연변이 또는 불활성화에 의해, 이소프렌 합성효소, DXS, IDI, MVA 경로, 수소화효소, 수소화효소 성숙 및/또는 전사인자 핵산의 결실에 의해, 또는 이들 핵산을 강력한 억제가능한 프로모터의 조절 하에 배치하여 달성될 수 있다. 원하는 폴리펩타이드를 돌연변이화, 불활성화, 도는 결실시키는 방법은 보편적이고 분자생물학의 기술분야에서 잘 숙지되어 있으며 예로는 샘브룩 등, 분자적 클로닝: 실험실 매뉴얼, 제 2판, 콜드 스트링 하버 연구소, 1989에서 발견될 수 있고, 이는 본 명세서에서 참고문헌으로 전부, 상세하게는 클로닝 및 돌연변이화 기법에 관하여 통합되어 있다.
다음의 재원 (resources)은 본 발명에 따라 유용한 추가적인 일반 방법론의 기술내용을 포함한다: Kreigler, 유전자 전달 및 발현: 실험실 매뉴얼 (Gene Transfer and Expression; A Laboratory Manual), 1990 및 Ausubel et al., Eds. 분자생물에서의 최신 프로토콜 (Current Protocols in Molecular Biology), 1994, 이들은 각각 본 명세서에 참고문헌으로 전부, 상세하게는 분자생물학 및 클로닝 기법에 관하여 통합되어 있다
대표적인 출처 생물
이소프렌 합성효소, DXS, IDI, MVA 경로, 수소화효소, 수소화효소 성숙 및/또는 전사인자 핵산 (및 그들의 인코드된 폴리펩타이드)는 자연적으로 이소프렌 합성효소, DXS, IDI, MVA 경로, 수소화효소, 수소화효소 성숙 및/또는 전사인자 핵산을 포함하는 생물이라면 모두로부터 획득될 수 있다. 상기에서 주목된 바와 같이, 이소프렌은 박테리아, 효모, 식물, 및 동물과 같은 다양한 생물에 의해 자연적으로 형성된다. 생물은 이소프렌을 생산하기 위해 MVA 경로, DXP 경로, 또는 MVA 및 DXP 경로 둘 다를 포함한다 (도 19A 및 19B). 따라서, DXS 핵산은, 예로 DXP 경로를 포함하거나 MVA 및 DXP 경로 둘 다를 포함하는 생물이라면 모두로부터 획득될 수 있다. IDI 및 이소프렌 합성효소 핵산은, 예로 MVA 경로, DXP 경로, 또는 MVA 및 DXP 경로 둘 다를 포함하는 생물이라면 모두로부터 획득될 수 있다. MVA 경로 핵산은, 예로 MVA 경로, 또는 MVA 및 DXP 경로 둘 다를 포함하는 생물이라면 모두로부터 획득될 수 있다. 수소화효소 핵산은, 예로 수소를 산화하거나 수소 이온을 환원하는 생물이라면 모두로부터 획득될 수 있다. 발효 부산물 유전자는, 예로 당분해와 같은 산소-제한된 또는 혐기성 호흡을 하는 생물이라면 모두로부터 획득되거나 확인될 수 있다.
일정 구현예에서, 이소프렌 합성효소, DXS, IDI, MVA 경로, 수소화효소, 수소화효소 성숙 및/또는 전사인자의 핵산 서열은 자연적인 하기 생물이라면 모두에 의해 생산되는 핵산의 서열과 일치한다. 일정 구현예에서, 이소프렌 합성효소, DXS, IDI, MVA 경로, 수소화효소, 수소화효소 성숙 및/또는 전사인자 폴리펩타이드의 아미노산 서열은 자연적인 하기 생물이라면 모두에 의해 생산되는 폴리펩타이드의 서열과 일치한다. 일정 구현예에서, 이소프렌 합성효소, DXS, IDI, MVA 경로, 수소화효소, 수소화효소 성숙 및/또는 전사인자 핵산 또는 폴리펩타이드는 본 명세서에서 기술된 생물이라면 모두로부터 유래한 돌연변이 핵산 또는 폴리펩타이드이다. 본 명세서에서 사용되는 바, "로부터 유래한 (derived from)"은 하나 이상의 돌연변이가 도입된 핵산 또는 폴리펩타이드의 출처를 말한다. 예를 들어, "식물 폴리펩타이드로부터 유래한 (derived from a plant polypeptide)"은 하나 이상의 돌연변이를 야생형 (예로, 자연적으로 발생하는 서열) 식물 폴리펩타이드의 서열 내로 도입한 결과 얻어지는 관심 있는 폴리펩타이드를 말한다.
일정 구현예에서, 출처 생물은 곰팡이이고, 그의 예로는 A. oryzae 및 A. niger와 같은 아스퍼질러스 (Aspergillus) 종, S. cerevisiae와 같은 사카로마이세스 (Saccharomyces) 종, S. pombe와 같은 스키조사카로마이세스 (Schizosaccharomyces) 종, 또한 T. reesei와 같은 트리코더마 (Trichoderma) 종이 있다. 일정 구현예에서, 출처 생물은 필라멘트성 곰팡이 세포이다. 용어 "필라멘트성 곰팡이 (filamentous fungi)"는 유마이코티나 아문 (Eumycotina subdivision)의 필라멘트성 형태를 말한다 (Alexopoulos, C. J. (1962), 곰팡이학 입문 (Introductory Mycology), Wiley, New York를 참조하라). 이들 곰팡이는 키틴, 셀룰로스 및 기타 복잡한 폴리사카라이드로 구성된 세포벽을 가진 무성생식 균사체 (mycelium)을 특징으로 한다. 필라멘트성 곰팡이는 형태적으로, 생리적으로, 및 유전적으로 효모와는 구별된다. 필라멘트성 곰팡이에 의한 무성생식 성장은 균사 확장에 의하고 탄소 대사는 절대적 호기성을 가진다. 필라멘트성 곰팡이의 부모 세포는, 이에 제한되는 것은 아니지만 트리코더마 (예로, 트리코더마 리세이 (Trichoderma reesei), 하이포크레아 제코리나 (Hypocrea jecorina)의 무성생식 형태로 이전에는 T. longibrachiatum, Trichoderma viride, Trichoderma koningii, Trichoderma harzianum로 분류됨) (Sheir-Neirs et al., Appl. Microbiol. Biotechnol 20: 46-53, 1984; ATCC 기탁번호 제 56765호 및 ATCC 기탁번호 제 26921호); 페니실리움 종 (Penicillium sp.), 휴미콜라 종 (Humicola sp.) (예로, H. insolens, H. lanuginose, 또는 H. grisea); 크립소스포리움 종 (Chrysosporium sp.) (예로, C. lucknowense), 글리오클라디움 종 (Gliocladium sp.), 아스퍼질러스 종 (예로, A. oryzae, A. niger, A sojae, A. japonicus, A. nidulans, 또는 A. awamori) (Ward et al., Appl. Microbiol. Biotechnol. 39: 7380743, 1993 및 Goedegebuur et al., Genet 41: 89-98, 2002), 푸사리움 종 (Fusarium sp.) (예로, F. roseum, F. graminum F. cerealis, F. oxysporuim, 또는 F. venenatum), 뉴로스포라 종 (Neurospora sp.) (예로, N. crassa), 하이포크레아 종 (Hypocrea sp.), 뮤코 종 (Mucor sp.) (예로, M. miehei), 라이조푸스 종 (Rhizopus sp.) 및 에메리셀라 종 (Emericella sp.) (또한, Innis et al., Sci. 228: 21-26, 1985를 참조하라)의 종 세포일 수 있다. 용어 "트리코더마 (Trichoderma)" 또는 "트리코더마 종 (Trichoderma sp)" 또는 "트리코더마 종들 (Trichoderma spp.)"은 이전에 또는 최근에 트리코더마로 분류된 곰팡이 속이라면 모두를 말한다.
일정 구현예에서, 곰팡이는 A. nidulans, A. awamori, A. oryzae, A. aculeatus, A. niger, A. japonicus, T. reesei, T. viride, F. oxysporum, or F. solani 이다. 아스퍼질러스 (Aspergillus) 균주가 Ward et al., Appl. Microbiol. Biotechnol. 39:738-743, 1993 및 Goedegebuur et al., Curr Gene 41:89-98, 2002에 기재되어 있고, 이들은 각각 본 명세서에서 참고문헌으로 전부, 상세하게는 곰팡이에 관하여 통합되어 있다. 상세한 구현예에서, 곰팡이는 T. reesei의 균주와 같은 트리코더마 균주이다. T. reesei 균주가 알려져 있으며, 비제한적인 예로는 ATCC 기탁번호 제 13631호, ATCC 기탁번호 제 26921호, ATCC 기탁번호 제 56764호, ATCC 기탁번호 제 56765호, ATCC 기탁번호 제 56767호, 및 NRRL 기탁번호 제 15709호를 포함하고, 이들은 각각 본 명세서에서 참고문헌으로 전부, 상세하게는 T. reesei 균주에 관하여 통합되어 있다. 일정 구현예에서, 숙주 균주는 RL-P37의 유도체이다. RL-P37는 Sheir-Neiss et al., Appl. Microbiol. Biotechnology 20: 46-53, 1984에 기재되어 있고, 이는 본 명세서에서 참고문헌으로 전부, 상세하게는 T. reesei 균주에 관하여 통합되어 있다.
일정 구현예에서, 출처 생물은 사카로마이세스 종 (Saccharomyces sp.), 스키조사카로마이세스 종 (Schizosaccharomyces sp.), 피키아 종 (Pichia sp.), 또는 칸다다 종 (Candida sp.)와 같은 효모이다. 일정 구현예에서, 사카로마이세스 종 은 사카로마이세스 세레비시아애 (Saccharomyces cerevisiae)이다.
일정 구현예에서, 출처 생물은 박테리아이고, B. lichenformis 또는B. subtili와 같은 바실러스 균주, P. citrea와 같은 판토에아 균주, P. alcaligenes, P. putida,또는 P. fluorescens와 같은 슈도모나스 균주, S. lividans 또는 S. rubiginosus와 같은 스트렙토마이세스 균주, 코리네박테리움 글루타미쿰 (Corynebacterium glutamicum)과 같은 코리네박테리움 종 균주, 로도슈도모나스 팔루스트리스 (Rhodopseudomonas palustris)와 같은 로도슈도모나스 종 (Rhodopseudomonas sp.) 균주 또는 E. coli와 같은 에스케리키아 (Escherichia) 균주이다.
본 명세서에서 사용되는 바, "바실러스 속 (genus Bacillus)"은 당업자가 알고 있는 바와 같이 "바실러스" 속 내의 모든 종을 포함하고, 이에 제한되는 것은 아니지만 B. subtilis, B. licheniformis, B. lentus, B. brevis, B. stearothermophilus, B. alkalophilus, B. amyloliquefaciens, B. clausii, B. halodurans, B. megaterium, B. coagulans, B. circulans, B. lautus, 및 B. thuringiensis를 포함한다. 바실러스 속은 분류적 재구성이 계속 진행되는 것으로 알려져 있다. 따라서 속은 재분류되었던 종을 포함하도록 하고, 이에 제한되는 것은 아니지만 현재는 "제오바실러스 스테아로써모필러스 (Geobacillus stearothermophilus)"라고 명명되는 B. stearothermophilus와 같은 생물을 포함한다. 산소 존재 시, 저항성 내생포자의 생산이 바실러스 속의 특징을 정의하는 것이라고 생각되지만, 본 특징은 최근에 명명된 알리사이클로바실러스 (Alicyclobacillus), 엠피바실러스 (Amphibacillus), 어뉴리니바실러스 (Aneurinibacillus), 아녹시바실러스 (Anoxybacillus), 브레비바실러스 (Brevibacillus), 필로바실러스 (Filobacillus), 그라실리바실러스 (Gracilibacillus), 할로바실러스 (Halobacillus), 패니바실러스 (Paenibacillus), 살리바실러스 (Salibacillus), 써모바실러스 (Thermobacillus), 우레이바실러스 (Ureibacillus) 및 버지바실러스 (Virgibacillus)에도 역시 적용된다.
일정 구현예에서, 출처 생물은 그램-양성 박테리아이다. 비제한적 예는 스트렙토마이세스 (예로, S. lividans, S. coelicolor, 또는 S. griseus) 및 바실러스 균주를 포함한다. 일정 구현예에서, 출처 생물은 대장균 (E. coli.), 로도슈도모나스 팔루스트리스 (Rhodopseudomonas palustris)와 같은 로도슈도모나스 종,또는 P. alcaligenes, P. putida, 또는 P. fluorescens와 같은 슈도모나스 종과 같은 그램-음성 박테리아이다.
일정 구현예에서, 출처 생물은 파보이대 (Faboideae) 아과와 같은 파바시애 (Fabaceae)과로부터 나온 식물과 같은 식물이다. 일정 구현예에서, 출처 생물은 쿠쥬 (Kudzu), 포풀라, (포풀라 알바 x 트레물라 (Populus alba x tremula) CAC35696와 같음), 아스펜 (포풀러스 트레물로이데스 (Populus tremuloides)와 같음), 또는 쿠에르커스 로바르 (Quercus robur)이다.
일정 구현예에서, 출처 생물은 녹조류, 적조류, 글라코파이트 (glaucophytes), 클로르아라크니오파이트 (chlorarachniophytes), 유글레니드 (euglenids), 크로미스타 (chromista), 또는 디노플라젤레이트 (dinoflagellates)와 같은 조류이다.
일정 구현예에서, 출처 생물은 형태에 근거하여 다음의 그룹이라면 모두로 분류되는 시아노박테리아와 같은 시아노박테리아 (cyanobacteria)이다: 클로오코칼레스 (Chroococcales), 플루로캅살레스 (Pleurocapsales), 오실라토리알레스 (Oscillatoriales), 노스토칼레스 (Nostocales), 또는 스티고네마탈레스 (Stigonematales).
일정 구현예에서, 출처 생물은 혐기성 생물이다. 혐기성 생물은, 이에 제한 되는 것은 아니지만 절대적 혐기성 미생물, 조건부 혐기성, 및 공기내성 (aerotolerant) 혐기성 미생물을 포함할 수 있다. 이러한 생물은 상기에 나열된 생물, 박테리아, 효모 등이라면 모두일 수 있다. 한 가지 구현예에서, 절대적 혐기성 미생물은 크로스트리듐 엘정다리 (Clostridium ljungdahlii), 크로스트리듐 오토에타노게눔 (Clostridium autoethanogenum), 유로박테리움 리모섬 (Eurobacterium limosum), 크로스트리듐 카르복시디보란스 (Clostridium carboxydivorans), 펩토스트렙토코커스 프로닥투스 (Peptostreptococcus productus), 및 부티리박테리움 메틸로트로피쿰 (Butyribacterium methylotrophicum)으로 이루어진 그룹으로부터 선택되는 하나 또는 조합이라면 모두일 수 있다.
대표적인 숙주세포
다양한 숙주세포가 이소프렌 합성효소, DXS, IDI, MVA 경로, 수소화효소, 수소화효소 성숙 및/또는 전사인자 폴리펩타이드를 발현하고, 본 명세서에서 기술된방법으로 이소프렌과 수소를 생산하는 데 사용될 수 있다. 대표적인 숙주세포는 이전의 섹션에서 "대표적인 출처 생물"이라는 제목 하에서 나열된 생물이라면 모두로부터 나온 세포를 포함한다. 숙주세포는 자연적으로 이소프렌을 생산하는 세포 또는 자연적으로는 이소프렌을 생산하지 못하는 세포일 수 있다. 일정 구현예에서, 숙주세포는 DXP 경로를 사용하여 이소프렌을 자연적으로 생산하고, 또한 이소프렌 합성효소, DXS, 및/또는 IDI 핵산이 본 경로를 사용하여 이소프렌의 생산을 증진시키도록 첨가된다. 일정 구현예에서, 숙주세포는 MVA 경로를 사용하여 이소프렌을 자연적으로 생산하고, 또한 이소프렌 합성효소, 및/또는 하나 이상의 MVA 경로 핵산이 본 경로를 사용하여 이소프렌의 생산을 증진시키도록 첨가된다. 일정 구현예에서, 숙주세포는 DXP 경로를 사용하여 이소프렌을 자연적으로 생산하고, 또한 하나 이상의 MVA 경로 핵산이 MVA 경로 일부 또는 전부뿐만 아니라 DXP 경로를 사용하여 이소프렌의 생산하도록 첨가된다. 일정 구현예에서, 숙주세포는 DXP 및 MVA경로 둘 다를 사용하여 이소프렌을 자연적으로 생산하고, 또한 하나 이상의 이소프렌 합성효소, DXS, IDI, 또는 MVA 경로 핵산이 이들 경로의 하나 또는 둘 다에 의해 이소프렌의 생산을 증진시키도록 첨가된다.
일정 구현예에서, 숙주세포는 DXP 및 MVA 경로 둘 다를 사용하여 이소프렌을 자연적으로 생산하고, 하나 이상의 이소프렌 합성효소, DXS, IDI 또는MVA 경로 핵산이 이들 경로의 하나 또는 둘 다에 의해 이소프렌의 생산을 증진시키도록 첨가되며, 하나 이상의 수소화효소 핵산이 수소 생산을 증진시키도록 첨가되고 또한 하나 이상의 발효 부산물-생산 유전자가 발효 부산물의 생산을 제한하도록 불활성화되거나 결실된다. 일정 구현예에서, 숙주세포는 DXP 및 MVA 경로 둘 다를 사용하여 이소프렌과 수소를 자연적으로 공동-생산하고, 하나 이상의 이소프렌 합성효소, DXS, IDI 또는MVA 경로 핵산이 이들 경로의 하나 또는 둘 다에 의해 이소프렌의 생산을 증진시키도록 첨가되며, 하나 이상의 수소화효소 핵산이 수소 생산을 증진시키도록 첨가되고, 하나 이상의 발효 부산물-생산하는 유전자가 발효 부산물의 생산을 제한하도록 불활성화되거나 결실되며, 또한 하나 이상의 수소 재흡수 유전자가 수소 생산을 증가시키도록 불활성화되거나 결실된다. 일정 구현예에서, 숙주세포는 DXP 및 MVA 경로 둘 다 및 수소화효소를 사용하여 이소프렌과 수소를 자연적으로 공동-생산하고, 하나 이상의 이소프렌 합성효소, DXS, IDI 또는MVA 경로 핵산이 이들 경로의 하나 또는 둘 다에 의해 이소프렌의 생산을 증진시키도록 첨가되며, 하나 이상의 수소화효소 핵산이 수소 생산을 증진시키도록 첨가되고, 하나 이상의 수소화효소 성숙 핵산이 수소 생산을 증진시키도록 첨가되며, 하나 이상의 발효 부산물-생산 유전자가 발효 부산물의 생산을 제한하도록 불활성화되거나 결실되고, 또한 하나 이상의 수소 재흡수 유전자가 수소 생산을 증가시키도록 불활성화되거나 결실된다. 일정 구현예에서, 숙주세포는 DXP 및 MVA 경로 둘 다를 사용하여 이소프렌과 수소를 자연적으로 공동-생산하고, 하나 이상의 이소프렌 합성효소, DXS, IDI 또는MVA 경로 핵산이 이들 경로의 하나 또는 둘 다에 의해 이소프렌의 생산을 증진시키도록 첨가되며, 하나 이상의 수소화효소 핵산이 수소 생산을 증진시키도록 첨가되고, 하나 이상의 수소화효소 성숙 핵산이 수소 생산을 증진시키도록 첨가되며, 하나 이상의 전사인자 핵산이 수소화효소 생산을 증진시키도록 첨가되거나 불활성화되거나 결실되며, 하나 이상의 발효 부산물-생산하는 유전자가 발효 부산물의 생산을 제한하도록 불활성화되거나 결실되고, 또한 하나 이상의 수소 재흡수 유전자가 수소 생산을 증가시키도록 불활성화되거나 결실된다.
대표적인 형질전환 방법
다양한 숙주세포가 이소프렌 합성효소, DXS, IDI, MVA 경로, 수소화효소, 수소화효소 성숙 및/또는 전사인자 핵산 또는 이들을 포함하는 벡터가 인코드된 다양한 숙주세포가 이소프렌 합성효소, DXS, IDI, MVA 경로, 수소화효소, 수소화효소 성숙 및/또는 전사인자 폴리펩타이드의 발현을 위한 표준 기법을 사용하여 숙주세포 내로 (예로, 본 명세서에서 기술된 식물 세포, 곰팡이 세포, 효모 세포, 또는 박테리아 세포) 삽입될 수 있다. 숙주세포 내로 DNA 제작물의 도입은 형질전환, (transformation), 전기천공 (electroporation), 핵 미세주입 (nuclear microinjection), 형질감염 (transduction), 형질전환 (transfection) (예로, 리포펙션-매개성 또는 DEAE-덱스트란 매개성 형질전환 또는 재조합 파지 바이러스를 사용한 형질전환), 칼슘 포스페이트 DNA 침전물로의 배양, DNA-코팅된 미세주사로의 높은 속도 충돌, 및 원형질 융합 (protoplast fusion)과 같은 기법을 사용하여 수행될 수 있다. 일반적인 형질전환 기법은 당해 기술분야에 숙지되어 있다 (예로, 분자생물학에 있어서 최신 프로토콜 (F. M. Ausubel et al. (eds) 제 9장, 1987; 샘브룩 등, 분자적 클로닝; 실험실 매뉴얼, 제 2판, 콜드 스프링 하버 연구소, 1989; 또한 Campbell et al., Curr. Genet. 16:53-56, 1989을 참조하고, 이들은 각각 본 명세서에서 참고문헌으로 전부, 상세하게는 형질전환 방법에 관하여 통합되어 있다). 트리코더마에서 이종유래 폴리펩타이드의 발현은 미국 특허 제 US 6,022,725호; 제 US 6,268,328호; 제 US 7,262,041호; 국제특허출원 제 WO 2005/001036호; Harkki et al., Enzyme Microb. Technol. 13:227-233, 1991; Harkki et al., Bio Technol. 7:596-603, 1989; EP 244,234; EP 215,594; 및 Nevalainen et al., "The Molecular Biology of Trichoderma and its Application to the Expression of Both Homologous and Heterologous Genes," in Molecular Industrial Mycology, Eds. Leong and Berka, Marcel Dekker Inc., NY pp. 129 148, 1992에 기술되어 있고, 이들은 각각 본 명세서에서 참고문헌으로 전부, 상세하게는 형질전환 및 발현 방법에 관하여 통합되어 있다. 아스퍼질러스 균주의 형질전환을 위해 카오 등 (Cao et al., Sci. 9:991-1001, 2000); 유럽 특허 제 EP 238023호; 및 Yelton et al., Proceedings. Natl. Acad. Sci. USA 81: 1470-1474, 1984 (이들은 각각 본 명세서에서 참고문헌으로 전부, 상세하게는 형질전환 방법에 관하여 통합되어 있다)의 참고문헌이 또한 작성되어 있다. 도입된 핵산은 염색체 DNA 내로 통합되거나 염색체외 복제 서열 (extrachromosomal replicating sequences)로서 유지될 수 있다.
당해 기술분야에서 기지의 방법이라면 모두가 형질전환체를 선별하는 데 사용될 수 있다. 하나의 비제한적 예에서, amdS 마커를 포함하는 안정한 형질전환체가 그들의 빠른 상장율과 아세트아마이드를 포함하는 고형 배양 배지 상에서 울퉁불퉁한 외관이 아닌 매끄러운 윤곽선을 가진 원형 콜로니의 형성에 의해 불안정한 형질전환체와 구별된다. 추가적으로 일정 사례에서, 심화된 안정성 테스트가 고형의 비-선택적 배지 (예로, 아세트아미이드가 결핍된 배지) 상에서 형질전환체를 성장시키고, 본 배양 배지로부터 포자를 수확하며, 이어서 아세트아마이드를 포함하는 선택적 배지 상에서 발아시키고 성장하는 이들 포자의 퍼센트를 결정하여 시행될 수 있다.
일정 구현예에서, 곰팡이 세포는 원형질체 형성 및 원형질체의 형질전환과 이어지는 기지의 방식으로 세포의 재생을 포함하는 방법에 의해 형질전환된다. 하나의 특정한 구현예에서, 형질전환을 위한 트리코더마 종의 제조는 곰팡이 균사체로부터 원형질체의 제조가 관여되어 있다 (Campbell et al., Curr. Genet. 16:53-56, 1989을 참고하고, 이는 본 명세서에서 참고문헌으로 전부, 상세하게는 형질전환 방법에 관하여 통합되어 있다). 일정 구현예에서, 균사는 발아된 무성생식 포자로부터 획득된다. 균사체는 원형질체가 될 세포벽을 소화하는 효소로 처리된다. 그 다음 원형질체는 현탁된 배지에서 삼투압 안정제의 존재에 의해 보호된다. 이들 안정제로는 소비톨, 만니톨, 포타슘 클로라이드, 마그네슘 설페이트 등등을 포함한다. 보통 이들 안정제의 농도는 0.8 M 및 1.2 M 범위 사이에서 변화한다. 현탁 배지에서는 소비톨의 약 1.2 M 용액을 사용하는 것이 바람직하다.
숙주 트리코더마 종 균주 내로의 DNA 흡수는 칼슘 이온 농도에 의존한다. 일반적으로, 약 10 mM CaCl2 및 50 mM CaCl2 사이의 범위가 흡수 용액 (uptake solution)에서 사용된다. 흡수 용액에서는 칼슘 이온에 더하여, 일반적으로 포함되는 다른 화합물은 TE 완충용액 (10 Mm 트리스, pH 7.4; 1 mM EDTA) 또는 10 mM MOPS (morpholinepropanesulfonic acid), pH 6.0 완충용액 및 폴리에틸렌글리콜 (PEG)과 같은 완충 시스템이다. 상세한 이론으로 설명하려고 의도하지는 않지만, 폴리에틸렌 글리콜은 세포막을 융합하도록 작용하여, 배지의 내용물이 트리코더마 종 균주의 세포질 내로 운반되고 플라스미드 DNA가 핵 내로 움직이도록 허용하는 것으로 여겨진다. 본 융합은 빈번히 숙주 염색체 내로 통합된 복수 사본의 플라스미드를 남긴다.
보통 105 내지 107/mL (2 x 106/mL와 같음)의 밀도로 투과성 (permeability) 처리가 되었던 트리코더마 종 원형질체 또는 세포를 포함하는 현탁액이 형질전환에 사용된다. 이들 적절한 용액 (예로, 1.2 M 소비톨 및 50 mM CaCl2)에 녹인 원형질체 또는 세포의 100 μL 부피가 원하는 DNA와 혼합된다. 일반적으로 고농도의 PEG가 흡수 용액에 첨가된다. 0.1로부터 1까지 부피의 25% PEG 4000가 원형질체 현탁액에 첨가된다. 일정 구현예에서, 약 0.25 부피가 원형질체 현탁액에 첨가된다. 디메틸 설포옥사이드, 헤파린, 스퍼미딘, 포타슘 클로라이드 등과 같은 첨가물도 역시 흡수 용액에 첨가될 수 있고 형질전환을 도와준다. 유사한 절차가 다른 곰팡이 숙주 세포에 대해서 사용가능하다 (예로, 미국 특허 제 US 6,022,725호 및 제US 6,268,328호를 참조하고, 이들은 각각 본 명세서에서 참고문헌으로 전부, 상세하게는 형질전환 방법에 관하여 통합되어 있다).
일반적으로, 혼합물이 다시 대략 0℃에서 10 내지 30분의 기간 동안 배양된다. 그 다음 추가적인 PEG가 좀 더 원하는 핵산 서열의 흡수를 증진시키도록 혼합물에 첨가된다. 25% PEG 4000는 일반적으로 형질전환 혼합물의 5 내지 15배의 부피로 첨가된다; 그러나, 더 크거나 작은 부피도 적합할 수 있다. 25% PEG 4000는 바람직하게 형질전환 혼합물의 약 10배의 부피이다. PEG가 첨가된 이후, 형질전환 혼합물은 다음으로 소비톨과 CaCl2를 첨가하기 이전에 상온에서 또는 얼음 위에서 배양된다. 그 다음 원형질체 현탁액은 성장 배지의 녹은 (molten) 일정량에 좀 더 첨가된다. 성장 배지가 성장 선별액 (예로, 아세트아마이드 또는 항생제)을 포함할 때, 이것은 형질전환체의 성장만을 허용하다.
박테리아 세포의 형질전환은 통상적인 방법에 따라서, 예로 샘브룩 등, 분자적 클로닝; 실험실 매뉴얼, 제 2판, 콜드 스프링 하버 연구소, 1982에 기술된 바와 같이 수행될 수 있고, 이는 본 명세서에서 참고문헌으로 전부, 상세하게는 형질전환 방법에 관하여 통합되어 있다.
대표적인 세포 배양 배지
본 발명은 또한 이소프렌과 수소를 공동-생산하는 배양에서 세포 또는 세포의 집단을 포함한다. "배양에서 세포 (cells in culture)"에 의하여, 세포가 한 번 이상의 세포 분열을 겪도록 허용하는 용액 (예로, 세포 성장 배지)에서 둘 이상의 세포를 의미한다. "배양에서 세포"는 식물 조직으로 분화된 세포를 포함하는 살아있고 다중세포 (multicellular) 식물의 일부인 식물세포를 포함하지 않는다. 다양한 구현예에서, 세포 배양은 적어도 또는 약 10, 20, 50, 100, 200, 500, 1,000, 5,000, 10,000개 이상의 세포를 포함한다.
"산소-제한된 배양에서 세포 (cells in oxygen-limited culture)"는 세포가 한 번 이상의 세포 분열을 겪도록 허용하는, 제한된 양의 산소를 포함하는 용액 (예로, 세포 성장 배지)에서 둘 이상의 세포를 의미한다. 용어 "산소-제한된 배양 (oxygen-limited culture)"은 무산소이거나 동등물을 산소로 환원하는 생물학적 전달을 통해 호흡을 유지하여 필요한 양 이하의 산소를 포함하고, 혐기성 배양도 역시 포괄한다. 산소-제한된 배양 조건 하에서는, 탄소 대사로부터 유래한 일정 전자가 산소 농도가 너무 낮기 때문에 수용될 수 없어, 세포가 그들이 적절한 대사적 경로를 포함하고 있는 경우라면 수소 생산을 하도록 전환을 유도한다. 산소-제한된 배양 조건은 산소 전달율 (oxygen transfer rate, ("OTR")이 배양 배지에서 영점에 접근하는 용존 산소 농도로 표시되는 산소 흡수율 (oxygen uptake rate, ("OUR") 이하일 때 발생될 수 있다.
탄소원이라면 모두가 숙주세포를 배양하는 데 사용될 수 있다. 용어 "탄소원 (carbon source)"은 숙주세포 또는 생물에 의해 대사될 수 있는 하나 이상의 탄소를 포함하는 화합물을 말한다. 예를 들어, 숙주세포를 배양하는 데 사용되는 세포 배지는 생존도를 유지하거나 숙주세포를 성장시키는 데 적합한 탄소원이라면 모두를 포함할 수 있다.
일정 구현예에서, 탄소원은 탄수화물 (예로, 모노사카라이드, 디사카라이드, 올리고사카라이드, 또는 폴리사카라이드), 역슈가 (예로, 효소적으로 처리된 슈크로스 시럽), 글리세롤, 글리세린 (예로, 바이오디젤 또는 비누-제조 공정의 글리세린 부산물), 디하이드로아세톤, 일-탄소원, 오일 (예로, 옥수수, 팜, 또는 콩 오일과 같은 식물 또는 식물성 오일), 동물 지방, 동물 오일, 지방산 (예로, 포화 지방산, 불포화 지방산, 또는 폴리불포화 지방산), 지질, 인지질, 글리세롤지질, 모노글리세라이드, 디글리세라이드, 트리글리세라이드, 폴리글리세라이드 (예로, 미생물 또는 식물 단백질 또는 펩타이드), 재생가능한 탄소원 (예로, 가수분해된 바이오매스 탄소원과 같은 바이오매스 탄소원), 효모 추출물, 효모 추출물로부터 나온 성분, 중합체, 산, 알코올, 알데하이드, 케톤, 아미노산, 숙시네이트, 락테이트, 아세테이트, 에탄올, 또는 상기 둘 이상의 조합이라면 모두를 포함한다. 일정 구현예에서, 탄소원은 광합성의 산물이고, 이에 제한되는 것은 아니지만 포도당을 포함한다.
대표적인 모노사카라이드 (monosaccharides)는 포도당 및 과당을 포함하고, 대표적인 올리고사카라이드 (oligosaccharides)는 락토스 및 슈크로스를 포함하며, 대표적인 폴리사카라이드 (polysaccharides)는 전분 및 셀룰로스를 포함한다. 대표적인 탄수화물은 C6 당 (예로, 과당, 만노스, 갈락토스, 또는 포도당) 및 C5 당 (예로, 자일로스 또는 아라비노스)를 포함한다. 일정 구현예에서, 세포 배지는 탄수화물뿐만 아니라 탄수화물 이외에 하나 이상의 탄소원 (예로, 글리세롤, 글리세린, 디하이드로아세톤, 일-탄소원, 오일, 동물 지방, 동물 오일, 지방산, 지질, 인지질, 글리세롤지질, 모노글리세라이드, 디글리세라이드, 트리글리세라이드, 폴리글리세라이드, 재생가능한 탄소원, 효모 추출물, 효모 추출물로부터 나온 성분). 일정 구현예에서, 세포 배지는 탄소화물뿐만 아니라 폴리펩타이드 (예로 미생물 또는 식물 단백질 또는 펩타이드)를 포함한다. 일정 구현예에서, 식물 폴리펩타이드는 콩, 옥수수, 카놀라, 자트로파, 팜, 땅콩, 해바라기, 코코넛, 머스타드, 평지종자 (rapeseed), 목화종자 (cottonseed), 팜 줄기, 올리브, 잇꽃 (safflower), 참깨, 또는 아마종자 (linseed)로부터 나온 폴리펩타이드를 포함한다.
일정 구현예에서, 탄수화물의 농도는 적어도 또는 약 10, 15, 20, 30, 40, 50, 60, 80, 100, 150, 200, 300, 또는 400 g/L 이상과 같은 액체배지 리터 당 (g/L, 여기에서 액체배지의 부피는 세포 배지의 부피와 세포의 부피 둘 다를 포함함) 적어도 또는 약 5 그램이다. 일정 구현예에서, 탄수화물의 농도는 약100 및 약 360 g/L 사이, 약 120 및 약 360 g/L 사이, 또는 약 200 및 약 300 g/L 사이와 같은 약 50 및 약 400 g/L 범위 사이이다. 일정 구현예에서, 탄수화물의 농도는 숙주세포의 배양 이전에 및/또는 배양 중에 첨가되는 탄수화물의 전체량을 포함한다.
일정 구현예에서, 세포는 제한된 포도당 조건 하에서 배양된다. "제한된 포도당 조건 (limited glucose conditions)"에 의하여, 첨가된 포도당의 양은 세포에 의해 연소되는 포도당의 양이 약 105% (약 100%와 같음) 이하인 것을 의미한다. 상세한 구현예에서, 배양 배지에 첨가된 포도당의 양은 특정 기간 동안 세포에 의해 연소되는 포도당의 양과 대략 동일하다. 일정 구현예에서, 세포 성장률은 첨가된 포도당의 양을 제한하여 조절되고, 세포는 세포 배지에 들어있는 포도당의 양에 의해 지원될 수 있는 속도로 성장한다. 일정 구현예에서, 포도당은 세포가 배양되는 기간 동안 축적되지 않는다. 다양한 구현예에서, 세포는 제한된 포도당 조건 하에서 약 1, 2, 3, 5, 10, 15, 20, 25, 30, 35, 40, 50, 60, 또는 70시간 이상 동안 배양된다. 다양한 구현예에서, 세포는 제한된 포도당 조건 하에서 세포가 배양되는 기간의 전체 길이의 약 5, 10, 15, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 95, 또는 100% 이상의 시간 동안 배양된다. 상세한 이론으로 설명하려고 의도하지는 않지만, 제한된 포도당 조건은 세포의 더욱 바람직한 조절을 가능하게 할 수 있다.
일정 구현예에서, 세포는 과다한 포도당의 존재 시 배양될 수 있다. 상세한 구현예에서, 첨가되는 포도당의 양은 약 105% 이상 (약 110, 120, 150, 175, 200, 250, 300, 400, 또는 500% 이상과 같음)이고 특정 기간 동안 세포에 의해 연소되는 포도당의 양 이상이다. 일정 구현예에서 포도당은 세포가 배양되는 기간 동안 축적된다.
대표적인 지질은 포화된, 불포화된, 또는 가지상인 C4 초과 지방산이 되는 하나 이상의 지방산을 포함하는 물질이라면 모두이다.
대표적인 오일은 상온에서 액체인 지질이다. 일정 구현예에서, 지질은 하나 이상의 C4 초과의 지방산을 포함하고 (예로, 네 개 이상의 탄소를 가지는 하나 이상의 포화된, 불포화된, 또는 가지상 지방산을 포함한다). 일정 구현예에서, 오일은 콩, 옥수수, 카놀라, 자트로파, 팜, 땅콩, 해바라기, 코코넛, 머스타드, 평지종자, 목화종자, 팜 줄기, 올리브, 잇꽃, 참깨, 아마종자, 오일성 미생물 세포, 중국 수지 (Chinese tallow), 또는 상기 둘 이상의 조합이라면 모두로부터 획득된다.
대표적인 지방산은 화학식 RCOOH의 화합물을 포함하고, 여기에서 "R"은 탄화수소이다. 대표적인 불포화 지방산은 "R"이 적어도 하나의 탄소-탄소 이중결합을 포함하는 화합물을 포함한다. 대표적인 불포화 지방산은, 이에 제한되는 것은 아니지만 올레익산, 바세닉산 (vaccenic acid), 리놀레익산, 팔미토익산 및 아라키도닉산을 포함한다. 대표적인 다중불포화 지방산은 "R"이 다수의 탄소-탄소 이중결합을 포함하는 화합물을 포함한다. 대표적인 포화 지방산은 "R"이 포화된 지방족 그룹인 화합물을 포함한다. 일정 구현예에서, 탄소원은 C12 포화된 지방산, C14 포화된 지방산, C16 포화된 지방산, C18 포화된 지방산, C20 포화된 지방산, 또는 C22 포화된 지방산과 같은 하나 이상의 C12 내지 C22 지방산을 포함한다. 대표적인 구현예에서, 지방산은 팔미트산이다. 일정 구현예에서, 탄소원은 지방산의 염 (예로, 불포화 지방산), 지방산의 유도체 (예로, 불포화 지방산), 또는 지방산의 유도체 염 (예로, 불포화 지방산)이다. 적합한 염은, 이에 제한되는 것은 아니지만 리튬 염, 포타슘 염, 소듐 염 등을 포함한다. 디- 및 트리글리세롤은 글리세롤의 지방산 에스테르이다.
일정 구현예에서, 지질, 오일, 지방, 지방산, 모노글리세라이드, 디글리세라이드, 또는 트리글리세라이드의 농도는 적어도 또는 약 10, 15, 20, 30, 40, 50, 60, 80, 100, 150, 200, 300, 또는 400 g/L 이상과 같은 액체배지 리터 당 (g/L, 여기에서 액체배지의 부피는 세포 배지의 부피와 세포의 부피 둘 다를 포함함) 적어도 또는 약 5 그램이다. 일정 구현예에서, 지질, 오일, 지방, 지방산, 모노글리세라이드, 디글리세라이드, 또는 트리글리세라이드의 농도는 약 25 및 약 300 g/L 사이, 약 60 및 약 180 g/L 사이, 또는 약 75 및 약 150 g/L 사이와 같은 약 10 및 약 400 g/L 사이의 범위이다. 일정 구현예에서, 농도는 숙주세포의 배양 이전에 및/또는 배양 동안 첨가되는 지질, 오일, 지방, 지방산, 모노글리세라이드, 디글리세라이드, 또는 트리글리세라이드의 전체량을 포함한다. 일정 구현예에서, 탄소원은 (i) 지질, 오일, 지방, 지방산, 모노글리세라이드, 디글리세라이드, 또는 트리글리세라이드 또한 (ii) 포도당과 같은 탄수화물, 둘 다를 포함한다. 일정 구현예에서, 지질, 오일, 지방, 지방산, 모노글리세라이드, 디글리세라이드, 또는 트리글리세라이드의 비율은 탄소 기준으로 (예로, 탄수화물 탄소 당 지질, 오일, 지방, 지방산, 모노글리세라이드, 디글리세라이드, 또는 트리글리세라이드에서의 일 탄소) 약 1 : 1이다. 상세한 구현예에서, 지질, 오일, 지방, 지방산, 모노글리세라이드, 디글리세라이드, 또는 트리글리세라이드의 양은 약 60 및 약 180 g/L 사이의 범위이고 탄수화물의 양은 약 120 및 약 360 g/L 사이의 범위이다.
대표적인 미생물 폴리펩타이드 탄소원은 효모 또는 박테리아로부터 나온 하나 이상의 폴리펩타이드를 포함한다. 대표적인 식물 폴리펩타이드 탄소원은 콩, 옥수수, 카놀라, 자트로파, 팜, 땅콩, 해바라기, 코코넛, 머스타드, 평지종자, 목화종자, 팜 줄기, 올리브, 잇꽃, 참깨, 또는 아마종자로부터 나온 하나 이상의 폴리펩타이드를 포함한다.
대표적인 재생가능한 탄소원은 치즈 유장 투과액 (cheese whey permeate), 옥수수 음료 (cornsteep liquor), 슈가 비트 당밀 (sugar beet molasses), 보리맥주 (barley malt), 및 상기 모두로부터 나온 성분을 포함한다. 또한 대표적인 재생가능한 탄소원은 옥수수, 스위치풀, 사탕수수, 발효 공정의 세포 잔여물, 및 콩, 옥수수, 또는 밀의 제분과정으로부터 나온 단백질 부산물과 같은 바이오매스에 존재하는 포도당, 육탄당, 오탄당 및 자일로스를 포함한다. 일정 구현예에서, 바이오매스 탄소원은, 이에 제한되는 것은 아니지만 잔디, 밀, 밀 줄기, 바가스, 사탕수수, 연목질 펄프, 옥수수, 옥수수 껍질, 옥수수 줄기, 옥수수 줄기로부터 나온 섬유, 옥수수 스토버, 스위치풀, 쌀 산물, 또는 곡물의 습식 또는 건조 제분으로부터 나온 부산물 (예로, 옥수수, 수수, 호밀, 트리티케이트, 보리, 밀, 및/또는 증류 곡물)과 같은 리그노셀룰로스, 헤미셀룰로스 또는 셀룰로스 물질이다. 대표적인 셀룰로스 물질은 나무, 종이 및 펄프 잔여물, 허브성 식물, 및 과일 펄프를 포함한다. 일정 구현예에서, 탄소원은 줄기, 곡물, 뿌리, 또는 괴경과 같은 식물 일부라면 모두를 포함한다. 일정 구현예에서, 하기 식물의 전부 또는 일부는 탄소원으로서 사용될 수 있다: 옥수수, 밀, 호밀, 수수, 트리티케이트, 쌀, 기장, 보리, 카사바, 콩과 완두와 같은 콩류, 감자, 고구마, 바나나, 사탕수수, 및/또는 타피오카. 일정 구현예에서, 탄소원은 자일로스와 포도당을 둘 다 포함하거나 슈크로즈와 포도당을 둘 다 포함하는 바이오매스 가수분해물과 같은 바이오매스 가수분해물이다.
일정 구현예에서, 재생가능한 탄소원 (바이오매스와 같음)은 세포 배양 배지에 첨가되기 이전에 전처리된다. 일정 구현예에서, 전처리 과정은 효소적 전처리, 화학적 전처리, 또는 효소적 및 화학적 전처리 둘 다의 조합을 포함한다 (예를 들어, Farzaneh et al., Bioresource Technology 96 (18): 2014-2018, 2005; 미국 특허 제 US 6,176,176호; 제 US 6,106,888호를 참조하고; 이들은 각각 본 명세서에서 참고문헌으로 전부, 상세하게는 재생가능한 탄소원의 전처리에 관하여 통합되어 있다). 일정 구현예에서, 재생가능한 탄소원은 세포 배양 배지에 첨가되기 이전에 부분적으로 또는 완전히 가수분해되어 있다.
일정 구현예에서, 재생가능한 탄소원 (옥수수 스토버와 같음)은 세포 배양 배지에 첨가되기 이전에 암모니아 섬유 확장 (AFEX) 전처리를 받는다 (예를 들어, Farzaneh et al., Bioresource Technology 96 (18): 2014-2018, 2005를 참조하라). AFEX 전처리하는 동안, 재생가능한 탄소원은 액체 무수 암모니아로 적당한 온도(약60 내지 약 100℃와 같음) 및 높은 압력 (약 250 내지 약 300 psi와 같음) 에서 5분 동안 처리된다. 다음으로 압력은 신속히 방출된다. 본 공정에서, 리그닌 용액화, 반셀룰로스 가수분해, 셀룰로스 탈결정화, 및 증가된 표면적이라는 조합된 화학적 및 물리적 효과는 발효가능한 당으로 셀룰로스와 헤미셀룰로스의 거의 완전한 효소적 전환을 가능하게 한다. AFEX 전처리는 거의 모든 암모니아가 회수되어 재사용될 수 있는 한편, 잔여물은 미생물에게 하류 공정에서 질소원으로서 제공되는 장점을 가진다. 또한, 세척 공정이 AFEX 전처리에는 요구되지 않는다. 따라서, AFEX 전처리에 이어지는 건조 물질 회수는 반드시 100%이다. AFEX는 기본적으로 건조 대 건조 공정이다. 처리된 재생가능한 탄소원은 장기간 동안 안정하고 효소적 가수분해 또는 발효 공정에서 매우 높은 고형체 투입으로 첨가될 수 있다. 셀룰로스 및 헤미세룰로스는 AFEX 공정에서 분해가 거의 없거나 전혀 없이 잘 보존된다. AFEX-전처리 과정을 겪은 재생가능한 탄소원의 효소적 가수분해 이전에 중화 과정은 전혀 필요없다. AFEX-전처리된 탄소원의 효소적 가수분해는 연속적인 발효 용도를 위해 깨끗한 당 스트림을 제공한다.
일정 구현예에서, 탄소원 (예로, 재생가능한 탄소원)의 농도는 적어도 또는 약 0.1, 0.5, 1, 1.5 2, 3, 4, 5, 10, 15, 20, 30, 40, 또는 50% 포도당 (w/v)과 동등하다. 포도당의 동등한 양은 탄소원으로부터 생성된 포도당의 양을 측정하도록 포도당을 기준으로 하는 표준 HPLC 방법을 사용하여 결정될 수 있다. 일정 구현예에서, 탄소원(예로, 재생가능한 탄소원)의 농도는 약 0.1 및 약 10% 포도당 사이, 약 0.5 및 약 10% 포도당 사이, 약 1 및 약 10% 포도당 사이, 약 1 및 약 5% 포도당 사이 또는 약 1 및 약 2% 포도당 사이와 같은 약 0.1 및 약 20% 포도당 사이의 범위와 동등하다.
일정 구현예에서, 탄소원은 효모 추출물 또는 효모 추출물의 하나 이상의 성분을 포함한다. 일정 구현예에서, 효모 추출물의 농도는 적어도 또는 약 5, 10, 15, 20, 30, 40, 50, 60, 80, 100, 150, 200, 또는 300 g/L 이상과 같은 액체배지 리터 당 (g/L, 여기에서 액체배지의 부피는 세포 배지의 부피와 세포의 부피 둘 다를 포함함) 적어도 약 1 그램이다. 일정 구현예에서, 효모 추출물의 농도는 약 1 및 약 200 g/L 사이, 약 5 및 약 200 g/L 사이, 약 5 및 약 100 g/L 사이, 약 5 및 약 60 g/L 사이와 같은 약 1 및 약 300 g/L 사이의 범위이다. 일정 구현예에서, 농도는 숙주세포의 배양 이전에 및/또는 배양 중에 첨가되는 효모 추출물의 전체량을 포함한다. 일정 구현예에서, 탄소원은 효모 추출물 (또는 그의 하나 이상의 성분) 및 포도당과 같은 또 다른 탄소원 둘 다를 포함한다. 일정 구현예에서, 효모 추출물과 기타 탄소원의 비율은 약 1:5, 약 1:10, 또는 약 1:20 (w/w)이다.
추가적으로, 탄소원은 이산화탄소, 또는 메탄올과 같은 일-탄소 물질일 수도 있다. 단일 탄소원 (예로, 메탄올, 포름알데하이드, 또는 포르메이트)으로부터 글리세롤 생산은 메틸영양성 효모 (Yamada et al., Agric. Biol. Chem., 53(2) 541-543, 1989, 이는 본 명세서에서 참고문헌으로 전부, 상세하게는 탄소원에 관하여 통합되어 있다) 및 박테리아 (Hunter et. al., Biochemistry , 24, 4148-4155, 1985, 이는 본 명세서에서 참고문헌으로 전부, 상세하게는 탄소원에 관하여 통합되어 있다)에서 보고된 바 있었다. 이들 생물은 산화 상태에서 메탄올로부터 포르메이트까지 분포하는 단일 탄소 화합물을 동화시킬 수 있다. 탄소 동화의 경로는 리불로스 모노포스페이트를 통해, 세린을 통해, 또는 자일룰로스 모노포스페이트를 통해 진행될 수 있다 (Gottschalk, 박테리아 대사 (Bacterial Metabolism), 제 2판, 스프링거-버라그 출판사 (Springer-Verlag): 뉴욕, 1986, 이는 본 명세서에서 참고문헌으로 전부, 상세하게는 탄소원에 관하여 통합되어 있다). 리불로스 모노포스페이트 (ribulose monophosphate) 경로는 과당이 되고 결국에는 세 개의 탄소 산물인 글리세르알데하이드-3-포스페이트가 되는 여섯 개의 탄소당을 형성하도록 리불로스-5-포스페이트를 사용하여 포르메이트의 농축에 관여한다. 마찬가지로, 세린 경로는 일-탄소 화합물을 메틸렌테트라하이드로폴레이트를 통해 당분해 경로 내로 동화시킨다.
한 개 및 두 개의 탄소 물질에 더하여, 메틸영양성 생물도 역시 메틸아민, 글루코사민 및 대사적 활성을 위한 다양한 아미노산과 같은 화합물을 포함하는 많은 기타 탄소를 사용하는 것으로 알려져있다. 예를 들어, 메틸영양성 효모는 트레할로스 또는 글리세롤을 형성하도록 메틸아민으로부터 탄소를 사용하는 것으로 알려져있다 (Bellion et al., Microb. Growth Cl Compd., [Int. Symp.], 제 7판, 415-32. Editors: Murrell et al. , Publisher: Intercept, Andover, UK, 1993, 이는 본 명세서에서 참고문헌으로 전부, 상세하게는 탄소원에 관하여 통합되어 있다). 유사하게, 칸디다의 다양한 종들도 알라닌 또는 올레익산을 대사작용하고 있다 (Sulter et al., Arch. Microbiol. 153(5), 485-9, 1990, 이는 본 명세서에서 참고문헌으로 전부, 상세하게는 탄소원에 관하여 통합되어 있다).
일정 구현예에서, 세포는 생리학적 염과 영양분을 포함하는 표준 배지에서 배양된다 (예로, Pourquie, J. et al., Biochemistry and Genetics of Cellulose Degradation, eds. Aubert et al., Academic Press, pp. 71-86, 1988, 및 Ilmen et al., Appl. Environ. Microbiol. 63:1298-1306, 1997, 이들은 각각 본 명세서에서 참고문헌으로 전부, 상세하게는 세포 배지에 관하여 통합되어 있다). 대표적인 성장 배지는 보편적이고 상업적으로 제조되는 루리아 버타니 (LB) 액체배지, 사부로드 덱스트로스 (Sabouraud Dextrose, SD) 액체배지, 또는 효모 배지 (YM) 액체배지와 같은 배지이다. 기타 다른 정의된 또는 합성 성장 배지도 역시 사용될 수 있고, 특정한 숙주 세포의 성장을 위한 적절한 배지는 미생물학 또는 발효과학의 기술분야에서 당업자라면 알고 있다.
적절한 탄소원에 더하여, 세포 배지는 바람직하게 적합한 미네랄, 염, 공인자, 완충용액, 및 당업자에게 배양액의 성장 또는이소프렌 생산의 증진에 적합한 것으로 알려져 있는 기타 성분을 포함한다 (예를 들어, 국제특허출원 제 WO 2004/033646호 및 본 명세서에서 인용된 참고문헌들 또한 국제특허출원 제 WO 96/35796 호 및 본 명세서에서 인용된 참고문헌들을 참조하고, 이들은 각각 본 명세서에서 참고문헌으로 전부, 상세하게는 세포 배지 및 세포 배양 조건에 관하여 통합되어 있다). 이소프렌 합성효소, DXS, IDI, 및/또는 MVA 경로 핵산이 유도성 프로모터 조절 하에 있는 일정 구현예에서, 유도제 (inducing agent)는 (예로 당, 금속염 또는 항미생물제)는 바람직하게 이소프렌 합성효소, DXS, IDI, 및/또는 MVA 경로의 발현을 유도하는 데 효과적인 농도로 배지가 첨가된다. 일정 구현예에서, 세포 배지는 하나 이상의 이소프렌 합성효소, DXS, IDI, 및/또는 MVA 경로 핵산을 가지는 벡터 상에서 항생제 저항성 핵산 (카나마이신 저항성 핵산과 같음)에 해당하는 항생제 (카나마이신과 같음)를 가진다.
대표적인 세포 배양 조건
박테리아 배양액의 유지 및 성장에 적합한 재료 및 방법은 당해 기술분야에 잘 알려져 있다. 대표적인 기법은 Manual of Methods for General Bacteriology Gerhardt et al., eds), 미국 미생물학회 (American Society for Microbiology), 워싱턴, D.C. (1994) 또는 Brock in Biotechnology: A Textbook of Industrial Microbiology, 제 2판 (1989) Sinauer Associates, Inc., Sunderland, MA에서 확인될 수 있고, 이들은 각각 본 명세서에서 참고문헌으로 전부, 상세하게는 세포 배양 기법에 관하여 통합되어 있다. 일정 구현예에서, 세포는 숙주세포 내로 삽입된 핵산에 의해 인코드되는 하나 이상의 이소프렌 합성효소, DXS, IDI, 및/또는 MVA 경로 폴리펩타이드의 발현을 허용하는 조건 하 배양 배지에서 배양된다.
표준 세포 배양 조건이 세포를 배양하는 데 사용될 수 있다 (예를 들어, 국제특허출원 제 WO 2004/033646호 및 본 명세서에 기술된 참고문헌들을 참조하고, 이들은 각각 본 명세서에서 참고문헌으로 전부, 상세하게는 세포 배양 및 발효 조건에 관하여 통합되어 있다). 세포는 적절한 온도, 기체 혼합물, 및 pH (약 20℃ 내지 약 37℃, 약 6% 내지 약 84% CO2, 및 pH 약 5 내지 약 9)에서 성장하고 유지된다. 일정 구현예에서, 세포는 적절한 배지로 35℃에서 성장한다. 일정 구현예에서, 예로 배양액은 대략 28℃에서 적절한 배지로 원하는 양의 이소프렌과 수소 공동-생산이 달성될 때까지 진탕 배양기 또는 발효기에서 배양된다. 일정 구현예에서, 발효를 위한 pH 범위는 약 pH 5.0 내지 약 pH 9.0 사이 (약 pH 6.0 내지 약 pH 8.0 또는 약 pH 6.5 내지 pH 7.0)이다. 반응은 숙주세포의 요구조건을 근거로 하여 호기성, 무산소, 또는 혐기성 조건 하에서 수행될 수 있다. 일정 구현예에서, 세포는 산소-제한된 조건 하에서 배양된다. 일정 구현예에서, 세포는 산소 존재 시 생산된 이소프렌 당 0.5 몰의 산소가 흡수되는 조건 하에서 배양된다. 일정 구현예에서, 세포는 혐기성 조건 하에서 배양된다. 주어진 필라멘트상 곰팡이를 위한 대표적인 배양 조건은 당해 기술분야에 알려져 있고, 과학문헌에서 및/또는 미국 타입배양 수집기관 (American Type Culture Collection) 및 곰팡이유전학 스톡 센터 (Fungal Genetics Stock Center)와 같은 곰팡이 출처로부터 확인될 수 있다.
다양한 구현예에서, 세포는 회분식 (batch), 사료첨가-회분식 (fed-batch), 또는 연속식 공정과 같은 기지의 발효방식이라면 모두를 사용하여 배양될 수 있다. 일정 구현예에서, 발효의 회분식 방법이 사용된다. 고전적인 회분식 발효는 배지의 조성이 발효 시작 시점에 설정되고 발효되는 동안 인위적인 변화가 가능하지 않은 폐쇄 시스템이다. 따라서, 발효 시작 시점에 세포 배지가 원하는 숙주세포와 함께 접종되고 시스템에 첨가하는 것이 전혀 허용되지 않으면서 발효가 진행된다. 그러나 전형적으로는, "회분식 (batch)" 발효가 탄소원의 첨가에 관하여 회분이고 종종 pH와 산소 농도와 같은 인자를 조절하려고 시도된다. 회분식 시스템에서, 시스템의 대사물과 바이오매스 조성물은 발효가 정지되는 시간까지 계속적으로 변화된다. 회분식 배양 내에서, 세포는 래그 정지기를 통해 높은 로그 성장기로 진행되고, 최종적으로 성장율이 감소되거나 멈추는 안정기로 진행된다. 일정 구현예에서, 로그기에 있는 세포는 이소프렌의 벌크 생산을 부여한다. 일정 구현예에서, 안정기에 있는 세포는 이소프렌을 생산한다.
일정 구현예에서, 표준 회분식 시스템에 대한 다양한 변화가 사료첨가-회분식 시스템 (Fed-Batch system)와 같이 사용될 수 있다. 사료첨가-회분식 발효 공정은 탄소원이 발효가 진행되면서 점차 첨가되는 것을 제외하고는 전형적인 회분식 시스템을 포함한다. 사료첨가-회분식 시스템은 분해대사물 억제가 세포의 대사를 저해하기 쉬울 때, 또한 세포 배지에서 제한된 양의 탄소원을 가지는 것이 바람직한 곳에서 유용하다. 사료첨가-회분식 발효는 제한되거나 과다한 양의 탄소원 (예로, 포도당)으로 수행될 수 있다. 사료첨가-회분식 시스템에서 실제적 탄소원 농도의 측정은 어렵고 따라서 pH, 용존 산소, 및 CO2와 같은 잔여 기체의 부분압과 같은 측정가능한 인자의 변화를 근거로 하여 평가된다. 회분식 및 사료첨가-회분식 발효는 보편적이고 당해 기술분야에 잘 숙지되어 있으며 예들이 Brock, Biotechnology: A Textbook of Industrial Microbiology, 제 2판 (1989) Sinauer Associates, Inc.에서 확인될 수 있고, 이는 본 명세서에서 참고문헌으로 전부, 상세하게는 세포 배양 및 발효 조건에 관하여 통합되어 있다.
일정 구현예에서, 연속식 발효방법이 사용된다. 연속식 발효는 정의된 발효 배지가 생물반응기로 계속하여 첨가되는 개방 시스템이고 동일한 양의 조정된 배지 (conditioned medium)가 프로세싱을 위해 동시에 제거된다. 연속식 발효는 일반적으로 세포가 일차적으로 로그기 성장에 있는 일정한 높은 밀도에서 배양을 유지시킨다.
연속식 발효는 세포 성장 또는 이소프렌 생산에 영향을 주는 하나의 인자 또는 많은 인자들의 조정을 허용한다. 예를 들어, 한 가지 방법은 탄소원 또는 질소 수준과 같은 제한 영양분을 고정된 속도로 유지시키고 모든 기타 매개변수는 적당해지도록 한다. 다른 시스템에서, 세포 농도 (예로, 배지 혼탁도에 의해 측정되는 농도)가 일정하게 유지되는 반면 성장에 영향을 주는 많은 인자는 계속하여 변화될 수 있다. 연속식 시스템은 지속된 상태로 성장 조건을 유지하려고 한다. 따라서, 배출되는 배지로 인한 세포 소실은 발효에서 세포 성장율에 대해 맞추어진다. 연속식 발효 공정을 위해 영양분 및 성장인자를 조정하는 방법뿐만 아니라 산물 생산율을 최대화하는 기법은 산업미생물학의 기술분야에 잘 숙지되어 있고, 다양한 방법이 Brock, Biotechnology: A Textbook of Industrial Microbiology, 제 2판 (1989) Sinauer Associates, Inc.에 상세히 기술되어 있으며, 이는 본 명세서에서 참고문헌으로 전부, 상세하게는 세포 배양 및 발효 조건에 관하여 통합되어 있다.
일정 구현예에서, 세포는 전체 세포 촉매인 기질 상에 고정되어 있고 이소프렌 생산을 위한 발효 조건이 주어진다.
일정 구현예에서, 액체 배양액의 용기는 액체에 산소를 도입하고 배양액의 균일도를 유지시키기 위해 진탕기에 놓여진다. 일정 구현예에서, 배양기가 배양액이 자라는 온도, 습도, 진탕 속도, 및/또는 기타 조건을 조절하는 데 사용된다. 가장 단순한 배양기는 전형적으로 ~ 65℃까지 올라가는 조절가능한 히터를 가진 밀폐된 박스이다. 좀 더 정교한 배양기는 또한 온도를 강하하는 능력 (냉장고에 의해), 또는 습도 또는 CO2 수준을 조절하는 능력을 포함할 수 있다. 가장 좋은 배양기는 타이머를 포함하고; 일부는 또한 서로 다른 온도, 습도 수준 등을 통해 순환하도록 프로그램될 수 있다. 배양기는 탁자 위로부터 작은 방 크기의 유닛까지 크기가 다양해질 수 있다.
원하는 경우라면, 세포 배지의 일정량 또는 전부가 영양분을 보충하고 및/또는 잠재적으로 해로운 대사 부산물 및 죽은 세포의 생성을 피하도록 변화될 수 있다. 현탁 배양의 경우, 세포는 현탁 배양을 원심분리하거나 여과한 다음 세포를 새로운 배지에 재현탁함에 의해 배지로부터 분리될 수 있다. 부착 배양의 경우, 배지는 흡입 (aspiration)에 의해 직접적으로 제거되어 대체될 수 있다. 일정 구현예에서, 세포 배지는 적어도 일정량의 세포가 연속식 배양에서 (희석이 없는 연속식 배양과 같음) 적어도 또는 약 5, 10, 20, 40, 50, 60, 65회 이상의 세포분열 동안 분열하도록 허용한다.
일정 구현예에서, 전신 발현 또는 누출 (leaky) 프로모터 (Trc 프로모터와 같음)가 사용되고 화합물 (IPTG와 같음)이 프로모터에 작동적으로 연결된 이소프렌 합성효소 DXS, IDI, 또는MVA 경로 핵산(들)의 발현을 유도하도록 첨가되지 않는다. 일정 구현예에서, 화합물 (IPTG와 같음)이 프로모터에 작동적으로 연결된 이소프렌 합성효소 DXS, IDI, 또는 MVA 경로 핵산(들)의 발현을 유도하도록 첨가된다.
이소프렌 생산을 세포 성장과 분리하는 대표적인 방법
바람직하게, 공급원료로부터 나온 탄소는 세포의 성장 및 유지로 진행하기보다는 이소프렌으로 전환된다. 일정 구현예에서, 세포는 낮은 OD600에서 중간 OD600으로 성장한 다음 이소프렌의 생산을 시작하거나 이를 증가시킨다. 본 전략은 탄소의 많은 부분이 이소프렌으로 전환되도록 한다.
일정 구현예에서, 세포는 더 이상 분열하지 않거나 극히 천천히 분열하는 광학 농도에 도달하지만 수 시간 동안 (약2, 4, 6, 8, 10, 15, 20, 25, 또는30시간 이상과 같음) 이소프렌을 계속 생산한다. 예를 들어, 도 60A 내지 67C는 세포가 더 이상 분열하지 않거나 극히 천천히 분열하는 광학 농도에 도달한 이후에 실질적인 양의 메발론산 또는 이소프렌을 계속 생산할 수 있는 것을 설명하고 있다. 일정 경우에서, 550 nm에서 광학 밀도는 시간 경과 시 감소되고 (세포가 지수적 성장기를 지나서 광학 밀도에서의 감소와 같음), 세포는 계속하여 실질적인 양의 메발론산 또는 이소프렌을 생산한다. 일정 구현예에서, 세포의 550 nm에서 광학 밀도는 소정의 기간 경과 시 (약 5, 10, 15, 20, 25, 30, 40, 50 또는 60시간 이하와 같음) 약 50% 이하까지 (약 0, 30, 20, 10, 5, 또는 0% 이하까지와 같음) 감소되고, 세포는 본 기간 경과 시 약 1, 10, 25, 50, 100, 150, 200, 250, 300, 400, 500, 600, 700, 800, 900, 1,000, 1,250, 1,500, 1,750, 2,000, 2,500, 3,000, 4,000, 또는 5,000 nmole 이상의 세포의 습윤무게/시간에 대한 세포의 이소프렌/그램 (nmole/gwcm/시간)으로 이소프렌을 생산한다. 일정 구현예에서, 이소프렌량은 약 2 내지 약 100 nmole/gwcm/시간, 약 100 내지 약 500 nmole/gwcm/시간, 약 150내지 약 500 nmole/gwcm/시간, 약 500 내지 약 1000 nmole/gwcm/시간, 약 1,000 내지 약 2000 nmole/gwcm/시간 또는 약 2,000 내지 약 5,000 nmole/gwcm/시간과 같은 약 2 내지 약 5000 nmole/gwcm/시간 사이의 범위이다. 일정 구현예에서, 이소프렌량은 약 20 내지 약 5000 nmole/gwcm/시간, 약 100 내지 약 5,000 nmole/gwcm/시간, 약 200내지 약 2,000 nmole/gwcm/시간, 약 200 내지 약 1,000 nmole/gwcm/시간, 약 300 내지 약 1,000 nmole/gwcm/시간 또는 약 400 내지 약 1,000 nmole/gwcm/시간 사이의 범위이다.
일정 구현예에서, 세포의 550 nm에서 광학 밀도는 소정의 기간 경과 시 (약 5, 10, 15, 20, 25, 30, 40, 50 또는60시간 이하와 같음) 약 50% 이하까지 (약40, 30, 20, 10, 5 또는 0% 이하까지와 같음) 증가되고, 세포는 본 기간 동안 약 1, 10, 25, 50, 100, 150, 200, 250, 300, 400, 500, 600, 700, 800, 900, 1,000, 1,250, 1,500, 1,750, 2,000, 2,500, 3,000, 4,000, 5,000, 10,000, 50,000, 100,000 mg 이상의 이소프렌/액체배지 L로 (mg/L액체배지, 여기에서 액체배지의 부피는 세포와 세포 배지의 부피를 포함함) 이소프렌의 누적 역가 (전체량)를 생산한다. 일정 구현예에서, 이소프렌량은 약 2 내지 약 100 mg/L액체배지, 약 100 내지 약 500 mg/L액체배지, 약 500 내지 약 1,000 mg/L액체배지, 약 1,000 내지 약 2,000 mg/L액체배지, 또는 약 2,000 내지 약 5,000 mg/L액체배지 사이와 같은 약 2 내지 약 5,000 mg/L액체배지 사이의 범위이다. 일정 구현예에서, 이소프렌량은 약 20 내지 약 5,000 mg/L액체배지, 약 100 내지 약 5,000 mg/L액체배지, 약 200 내지 약 2,000 mg/L액체배지, 약 200 내지 약 1,000 mg/L액체배지, 약 300 내지 약 1,000 mg/L액체배지, 또는 약 400 내지 약 1,000 mg/L액체배지 사이의 범위이다.
일정 구현예에서, 세포의 550 nm에서 광학 밀도는 소정의 기간 경과 시 (약 5, 10, 15, 20, 25, 30, 40, 50 또는60시간 이하와 같음) 약 50% 이하까지 (약 40, 30, 20, 10, 5 또는 0% 이하까지와 같음) 증가되고, 세포는 본 기간 동안 세포 배양 배지에서 약 0.0015, 0.002, 0.005, 0.01, 0.02, 0.05, 0.1, 0.12, 0.14, 0.16, 0.2, 0.3, 0.4, 0.5, 0.6, 0.7, 0.8, 0.9, 1.0, 1.2, 1.4, 1.6, 1.8, 2.0, 2.5, 3.0, 3.5, 4.0, 5.0, 6.0, 7.0, 또는 8.0% 이상의 탄소를 이소프렌으로 전환한다. 일정 구현예에서, 탄소의 이소프렌으로의 전환 퍼센트는 약 0.002 내지 약 4.0%, 약 0.002 내지 약 3.0%, 약 0.002 내지 약 2.0%, 약 0.002 내지 약 1.6%, 약 0.002 내지 약 0.005%, 약 0.005 내지 약0.01%, 약 0.01 내지 약 0.05%, 약 0.05 내지 약 0.15%, 약 0.15 내지 약 0.2%, 약 0.2 내지 약 0.3%, 약 0.3 내지 약 0.5%, 약 0.5 내지 약 0.8%, 약 0.8 내지 약 1.0%, 또는 약 1.0 내지 약 1.6% 와 같은 사이의 범위이다. 일정 구현예에서, 탄소의 이소프렌으로의 전환 퍼센트는 약 0.002 내지 약 4.0%, 약 0.002 내지 약 0.16%, 약 0.04 내지 약 0.16%, 약 0.005 내지 약 0.3%, 약 0.01 내지 약 0.3%, 또는 약 0.05 내지 약 0.3% 사이의 범위이다.
일정 구현예에서, 이소프렌은 안정기 (stationary phase)에서만 생산된다. 일정 구현예에서, 이소프렌은 성장기 및 안정기 둘 다에서만 생산된다. 다양한 구현예에서, 안정기 동안 생산되는 이소프렌량은 (생산되는 이소프렌의 전체량 또는 OD600당 시간당 액체배지 리터 당 생산되는 이소프렌량과 같음)은 동일 기간 동안 생산되는 이소프렌량보다 약 2, 3, 4, 5, 10, 20, 30, 40, 50배 이상이다. 다양한 구현예에서, 생산되는 이소프렌의 전체량 (발효 시 20시간 정도의 소정의 기간 동안 이소프렌의 생산과 같음)의 약 5, 10, 20, 30, 40, 50, 60, 70, 80, 90, 95, 99% 이상이 세포가 안정기에 있을 때 생산된다. 다양한 구현예에서, 생산되는 이소프렌의 전체량 (발효 시 20시간 정도의 소정의 기간 동안 이소프렌의 생산과 같음)의 약5, 10, 20, 30, 40, 50, 60, 70, 80, 90, 95, 99% 이상이 세포가 천천히 분열하거나 안정기에 있을 때 생산되지만, 세포의 550 nm에서 광학 밀도가 약 50% 이하까지 (약40, 30, 20, 10, 5 또는 0% 이하까지와 같음) 증가될 때는 전혀 생산되지 않는다.
일정 구현예에서, 하나 이상의 MVA 경로, IDI, DXP, 또는 이소프렌 합성효소 핵산은 성장기보다는 안정기에 활성이 더 큰 프로모터 또는 인자의 조절 하에 놓여진다. 예를 들어, 하나 이상의 MVA 경로, IDI, DXP, 또는 이소프렌 합성효소 핵산은 RpoS와 같은 안정기 시그마 인자 (sigma factor)의 조절 하에 놓여질 수 있다. 일정 구현예에서, 하나 이상의 MVA 경로, IDI, DXP, 또는 이소프렌 합성효소 핵산은 안정기에 활성이 있는 반응 조절인자에 의해 유도가능한 프로모터와 같은 안정기에 유도가능한 프로모터의 조절 하에 놓여진다.
안전한 작동 범위 내의 이소프렌 생산
발화성 특성에 따른 안전한 작동 수준 이내에서의 이소프렌의 생산은 상업적 시설의 설계 및 제작을 단순화하고, 안전하게 작동하는 능력을 크게 개선시키며, 화재가 일어날 가능성을 제한시킨다. 상세하게, 이소프렌의 생산을 위한 최적의 범위는 예로 이소프렌 농도의 발화가능하지 않은 범위인 안전 영역 (safe zone) 이내이다. 이러한 한 가지 관점에서, 본 명세서에서는 발화가능하지 않은 범위의 이소프렌 농도 이내에서 (이소프렌의 발화도 경계 외부) 이소프렌의 생산 방법이 기술되어 있다.
따라서, 컴퓨터 모델링 및 실험적 테스트가 공정 안전성을 보장하는 이소프렌의 (O2, N2, CO2, 또는 둘 이상의 상기 기체의 조합이라면 모두 존재 시 이소프렌과 같음) 발화도 한계를 결정하는 데 사용되었다. 발화도 경계 (flammability envelope)는 저부 발화도 한계 (lower flammability limit, LFL), 고부 발화도 한계 (upper flammability limit, UFL), 제한 산소농도 (limiting oxygen concentration, LOC), 및 제한 온도에 의해 특징지워진다. 발화가능한 시스템의 경우, 최소량의 연료 (이소프렌과 같음)는 최소량의 산화제, 전형적으로 산소가 존재해야 한다. LFL는 연소를 유지하기 위해 존재해야 하는 이소프렌의 최소량인 한편, UFL은 존재할 수 있는 이소프렌의 최대량이다. 본 한계를 넘으면, 혼합물은 연료 초과가 되고 산소의 분획은 너무 낮아 발화가능한 혼합물을 가질 수 없다. LOC는 발화가능한 혼합물을 가지기 위해 존재해야 하는 산소의 최소 분획을 표시한다. 제한 온도는 이소프렌의 점화점에 근거를 두고 이소프렌의 연소가 전파될 수 있는 가장 낮은 온도이다. 이들 한계는 이소프렌의 농도, 산화제의 유형 및 농도, 시스템에 존재하는 불활성 물질, 온도, 및 시스템의 압력에 대해 특이적이다. 발화도 경계의 한계 이내 있는 조성물은 연소를 전파시키고 공정 시설의 설계 및 작동에 추가적인 안전성 유의사항을 요구한다.
다음의 조건은 컴퓨터 시뮬레이션과 수학적 분석 및 실험적 테스트를 사용하여 시험되었다. 원하는 경우, 기타 다른 조건 (다른 온도, 압력, 및 영구적 기체 조성)이 LFL, UFL, 및 LOC 농도를 결정하도록 본 명세서에서 기술된 방법을 사용하여 시험될 수 있다.
(1) 컴퓨터 시뮬레이션과 수학적 분석
테스트 1조:
이소프렌: 0 wt% - 14 wt%
O2: 6 wt% - 21 wt%
N2: 79 wt% - 94 wt%
테스트 2조:
이소프렌: 0 wt% - 14 wt%
O2: 6 wt% - 21 wt%
N2: 79 wt% - 94 wt%
H2O로 포함됨
테스트 3조:
이소프렌: 0 wt% - 14 wt%
O2: 6 wt% - 21 wt%
N2: 79 wt% - 94 wt%
CO2: 5 wt% - 30 wt%
(2) 발화도 한계의 최종 결정을 위한 실험적 테스트
테스트 1조:
이소프렌: 0 wt% - 14 wt%
O2: 6 wt% - 21 wt%
N2: 79 wt% - 94 wt%
테스트 2조:
이소프렌: 0 wt% - 14 wt%
O2: 6 wt% - 21 wt%
N2: 79 wt% - 94 wt%
H2O로 포화됨
시뮬레이션 소프트웨어가 여러가지 서로 다른 시험 조건에 대한 시스템의 발화도 특성을 평가하는 데 사용되었다. CO2 는 시스템의 발화도 한계에 미치는 유의한 영향을 나타내지 않았다. 테스트 1조 및 2조는 실험적 테스트에 의해 입증되었다. 모델링 결과는 실험적 테스트 결과와 일치하였다. 약간의 변화 (variation)만이 물의 첨가로 확인되었다.
LOC는 40℃, 1기압 하에서 이소프렌, O2, N2, 및CO2 혼합물의 경우 9.5 vol%인 것으로 결정되었다. 30% CO2까지의 첨가는 이소프렌, O2, 및 N2 혼합물의 발화도 특성에 유의한 영향을 주지 않았다. 발화도 특성의 약간의 변화만이 건조 및 물 포화된 이소프렌, O2, 및 N2시스템 간에 나타났다. 제한 온도는 약 -54℃이었다. 약 -54℃ 미만의 온도는 너무 낮아 이소프렌의 연소를 전파시키지 못한다.
일정 구현예에서, 이소프렌의 LFL는 시스템에서 산소의 양에 따라 약 1.5 vol%로부터 약 2.0 vol%까의지 범위이고 이소프렌의 UFL는 약 2.0 vol%로부터 12.0 vol%까지의 범위이다. 일정 구현예에서, LOC는 약 9.5 vol% 산소이다. 일정 구현예에서, 온도가 25℃ 내지 약 55℃ 사이 (약 40℃와 같음)이고 압력이 약 1 기압 및 3기압 사이일 때 이소프렌의 LFL는 약 1.5 vol.% 내지 약 2.0 vol% 사이이고, 이소프렌의 UFL는 약 2.0 vol.% 내지 약 12.0 vol.% 사이이며, 또한, LOC는 약 9.5 vol% 산소이다.
일정 구현예에서, 이소프렌은 약 9.5 vol% 이하의 산소 존재 시 (즉, 이소프렌의 발화가능한 혼합물을 가지는 데 요구되는 LOC 미만) 생산된다. 이소프렌이 약 9.5% 이상의 산소 존재 시 생산되는 일정 구현예에서, 이소프렌 농도는 LFL 미만 (약 1.5 vol.% 미만과 같음)이다. 예를 들어, 이소프렌량은 불활성 기체를 가지는 이소프렌 조성물을 희석하여 (예로, 이소프렌 조성물을 LFL 미만으로 유지하도록 질소와 같은 불활성 기체를 연속적으로 또는 정기적으로 첨가하여) LFL 미만으로 유지될 수 있다. 이소프렌이 약 9.5% 이상의 산소 존재 시 생산되는 일정 구현예에서, 이소프렌의 농도는 UFL 초과 (약 12 vol% 초과와 같음)이다. 예를 들어, 이소프렌량은 이소프렌을 UFL 초과 농도로 생산하는 시스템을 사용하여 (본 명세서에서 기술된 세포 배양 시스템이라면 모두와 같음) UFL 초과로 유지될 수 있다. 원하는 경우, 상대적으로 낮은 산소 수준이 사용될 수 있어 UFL도 상대적으로 낮다. 본 경우에서, 더 낮은 이소프렌 농도가 UFL 초과로 남아있는 데 필요하다.
이소프렌이 약 9.5% 이상의 산소 존재 시 생산되는 일정 구현예에서, 이소프렌 농도는 발화도 한계 이내 (LFL 및 UFL 사이의 범위와 같음)이다. 이소프렌 농도가 발화도 한계 이내에 놓여질 수 있는 일정 구현예에서, 하나 이상의 단계가 화재 또는 폭발의 가능성을 감소시키도록 수행된다. 예를 들어, 하나 이상의 점화원 (스파크를 생성할 수 있는 물질이라면 모두와 같음)을 피해야 한다. 일정 구현예에서, 하나 이상의 단계가 이소프렌의 농도가 발화도 한계 이내에 남아있는 시간량을 감소시키도록 수행된다. 일정 구현예에서, 이소프렌의 농도가 발화도 한계에 근접하거나 이내일 때 센서가 검출하는 데 사용된다. 원하는 경우, 이소프렌의 농도는 세포를 배양하는 동안 하나 이상의 시점에서 측정될 수 있고, 세포 배양 조건 및/또는 불활성 기체의 양은 이소프렌의 농도가 발화도 한계에 근접하거나 이내인 경우라면 표준 방법을 사용하여 조정될 수 있다. 상세한 구현예에서, 세포 배양 조건 (발효와 같음)은 이소프렌의 농도를 LFL 미만으로 감소시키기거나 이소프렌의 농도를 UFL 초과로 증가시키도록 조정된다. 일정 구현예에서, 이소프렌량은 불활성 기체를 가지는 이소프렌 조성물을 희석하여 (이소프렌 조성물을 LFL 미만으로 유지하도록 질소와 같은 불활성 기체를 연속적으로 또는 정기적으로 첨가하는 것과 같음) LFL 미만으로 유지된다.
일정 구현예에서, 이소프렌이 아닌 발화가능한 휘발성 물질 (하나 이상의 당)의 양은 생산된 이소프렌량보다 적어도 약 2, 5, 10, 50, 75, 또는 100배이다. 일정 구현예에서, 이소프렌이 아닌 기체상의 부분은 약 0% 내지 약 10%, 약 10% 내지 약 20%, 약 20% 내지 약 30%, 약 30% 내지 약 40%, 약 40% 내지 약 50%, 약 50% 내지 약 60%, 약 60% 내지 약 70%, 약 70% 내지 약 80%, 약 80% 내지 약 90%, 약 90% 내지 약100% (부피) 산소 사이와 같은 약 0% 내지 약100% (부피) 산소 사이의 범위를 포함한다. 일정 구현예에서, 이소프렌이 아닌 기체상의 부분은 약 0% 내지 약10%, 약 10% 내지 약 20%, 약 20% 내지 약 30%, 약 30% 내지 약 40%, 약 40% 내지 약 50%, 약 50% 내지 약 60%, 약 60% 내지 약 70%, 약 70% 내지 약 80%, 약 80% 내지 약 90%, 약 90% 내지 약 99% (부피) 질소 사이와 같은 약 0% 내지 약 99% (부피) 질소 사이의 범위를 포함한다.
일정 구현예에서, 이소프렌이 아닌 기체상의 부분은 약 1% 내지 약 10%, 약 10% 내지 약 20%, 약 20% 내지 약 30%, 약 30% 내지 약 40%, 약 40% 내지 약 50% (부피) CO2 사이와 같은 약 0% 내지 약 50% (부피) CO2 사이의 범위를 포함한다.
일정 구현예에서, 이소프렌 조성물은 또한 에탄올을 포함한다. 예를 들어, 에탄올은 이소프렌의 추출적 증류를 위해 사용될 수 있고, 에탄올과 이소프렌을 둘 다 포함하는 조성물 (중간 산물 스트림과 같음)을 가져온다. 바람직하게, 에탄올의 양은 에탄올에 대한 발화도 한계 외부이다. 약 1 기압 및 약 60˚F와 같은 (NFPA 69 Standard on Explosion Prevention Systems, 2008년판, 이는 본 명세서에서 참고문헌으로, 상세하게는 LOC, LFL, 및 UFL 값에 관하여 통합되어 있다) 표준 조건에서, 에탄올의 LOC는 약 8.7 vol%이고, 에탄올에 대한 LFL은 약 3.3 vol%이다. 일정 구현예에서, 이소프렌과 에탄올을 포함하는 조성물은 에탄올의 발화가능한 혼합물을 가지는 데 필요한 LOC 이하로 존재 시 (약 8.7 vol% 이하와 같음) 생산된다. 일정 구현예에서, 이소프렌과 에탄올을 포함하는 조성물은 에탄올의 발화가능한 혼합물을 가지는 데 필요한 LOC 이상으로 존재 시 생산될 때, 에탄올의 농도는 LFL 미만 (약 3.3 vol% 이하와 같음)이다.
다양한 구현예에서, 산화제 (산소와 같음)의 양은 시스템에서의 연료라면 모두의 LOC 미만이다. 다양한 구현예에서, 산화제 (산소와 같음)의 양은 이소프렌 또는 에탄올의 LOC의 약 60, 40, 30, 20, 10, 또는 5% 이하이다. 다양한 구현예에서, 산화제 (산소와 같음)의 양은 이소프렌 또는 에탄올의 LOC보다 적어도 2, 4, 5 이상의 절대 퍼센트 값 (vol%) 더 적다. 상세한 구현예에서, 산소의 양은 이소프렌 또는 에탄올의 LOC보다 (이소프렌의 LOC가 9.5vol%일 때 7.5 vol% 이하의 산소 농도와 같음) 적어도 2의 절대 퍼센트 값 (vol%) 더 적다. 다양한 구현예에서, 연료 (이소프렌 또는 에탄올과 같음)의 양은 해당 연료에 대한 LFL의 약 25, 20, 15, 10, 또는 5% 이하이다.
발효에 의한 휘발성 탄화수소, 이소프렌의 고효율 생산 및 회수
본 명세서에서는, 1) 세포를 이소프렌의 생산에 적합한 조건 하에서 배양하고; 또한 2) 이소프렌을 생산하는 단계를 포함하는 이소프렌을 생산하는 방법이 제공되고, 여기에서, 이소프렌의 액상 농도는 약 200 mg/L이하이다. 일정 구현예에서, 배양액에서의 이소프렌의 액상 농도는 약 175 mg/L, 150 mg/L, 125 mg/L, 100 mg/L, 75 mg/L, 50 mg/L, 25 mg/L, 20 mg/L, 15 mg/L, 10 mg/L, 5 mg/L, 또는 2.5 mg/L 이하이다. 일정 구현예에서, 배양액에서의 이소프렌의 액상 농도는 약 0.1 mg/L 내지 200 mg/L, 1 mg/L 내지 200 mg/L, 1 mg/L 내지 150 mg/L, 1 mg/L 내지 100 mg/L, 1 mg/L 내지 50 mg/L, 1 mg/L 내지 25 mg/L, 1 mg/L 내지 20 mg/L, 또는 10 mg/L 내지 20 mg/L 사이 범위이다. 일정 구현예에서, 생산된 이소프렌은 "대표적인 이소프렌의 생산"이라는 제목으로 된 섹션에서 기재된 농도 또는 양이라면 모두이다. 일정 구현예에서, 액상 농도는 이소프렌의 용해도 한계 미만이다.
본 방법의 일정 구현예에서, 세포는 약 400 nmole/gwcm/시간 이상의 이소프렌을 생산한다. 일정 구현예에서, 이소프렌량은 약 400 nmole/gwcm/시간 내지 1 mole/gwcm/시간, 400 nmole/gwcm/시간 내지 1 mmole/gwcm/시간, 400 nmole/gwcm/시간 내지 40 mmole/gwcm/시간, 400 nmole/gwcm/시간 내지 4 mmole/gwcm/시간, 1 mmole/gwcm/시간 내지 1.5 mmole/gwcm/시간, 1.5 mmole/gwcm/시간 내지 3 mmole/gwcm/시간, 3 mmole/gwcm/시간 내지 5 mmole/gwcm/시간, 5 mmole/gwcm/시간 내지 25 mmole/gwcm/시간, 25 mmole/gwcm/시간 내지100 mmole/gwcm/시간, 100 mmole/gwcm/시간 내지 500 mmole/gwcm/시간, 또는 500 mmole/gwcm/시간 to 1000 mmole/gwcm/시간 사이의 범위이다. 일정 구현예에서, 이소프렌량은 약1 mmole/gwcm/시간, 1.5 mmole/gwcm/시간, 2 mmole/gwcm/시간, 3 mmole/gwcm/시간, 4 mmole/gwcm/시간, 또는 5 mmole/gwcm/시간이다.
헨리 계수 (Henry's coefficient)(M atm-1 단위에서)에 대한 낮은 값은 이소프렌이 낮은 살포율, 예를 들어 0.01 vvm 내지 2 vvm 로 기체 제거 (stripping)에 의해 발효 배지로부터 회수될 수 있는 것을 의미한다. 일정 구현예에서, 기체 살포율은 약0.1 vvm 내지 1 vvm, 0.01 vvm 내지 0.5 vvm, 0.2 vvm 내지 1 vvm, 또는 0.5 vvm 내지 1 vvm이다. 일정 구현예에서, 기체 살포율은 약 0.1 vvm, 0.25 vvm, 0.5 vvm, 0.75 vvm, 1 vvm, 1.25 vvm, 1.5 vvm, 1.75 vvm, 또는 2 vvm이다. 일정 구현예에서, 낮은 기체 살포율은 발효의 전체 진행 과정 동안, 성장기 동안, 또는 안정기 동안 유지된다. 일정 구현예에서, 낮은 기체 살포율은 약 1 시간 내지 5 시간, 5 시간 내지 10 시간, 10 시간 내지 20 시간, 20 시간 내지 30 시간, 30 시간 내지 40 시간, 40 시간 내지 50 시간, 또는 50 시간 내지 60 시간 사이의 범위 동안 유지된다. 더 낮은 바람직한 기체 살포율 한계는 수성상 (aqueous phase)이 이소프렌과 액체 유기상 형태로 포화되는 시점에 의해 정의된다. 이것은 액체 이소프렌 상이 전혀 형성되지 않을 이소프렌의 비등점 (1 기압에서 34.1℃) 미만에서만 일어날 수 있다. 이소프렌의 비등점 미만의 온도에서, 액상의 형성은 이소프렌의 물 용해도에 의해 정의되고, 이는 25℃에서 대략 650 mg/L이다. 이것이 액상 이소프렌의 형성을 피하기 위하여 매우 바람직한 반면, 세포가 독성 효과 없이 액체 이소프렌의 존재를 견뎌낼 수 있는 경우라면 당연히 필요하지 않다.
일정 구현예에서, 산소, CO2, 및 이소프렌은 "안전한 작동 범위 내의 이소프렌의 생산 방법"이라는 제목으로 된 섹션에서 논의된 양 또는 농도라면 모두이다. 일정 구현예에서, 모든 산소는 호기성 대사를 전적으로 유지하면서 세포에 의해 연소된다. 일정 구현예에서, 산소 첨가는 세포의 산소 요구를 만족시키도록 사용된다. 배출기체에서 산소의 바람직한 범위는 20%이하, 또는 15% 이하 또는 10% (v/v) 이하이다. 상세하게 이소프렌의 연소를 위해 요구되는 (1 기압에서 9.5% v/v) 한계 산소 농도 미만의 산소 수준이 바람직하다. 일정 구현예에서, 산소-풍부 공기는 세포의 산소 요구를 만족시키면서 최소의 기체 제거율을 허용할 목적으로 사용된다. 일정 구현예에서, 제거 기체의 기체상 부분은 약 0.1% 내지 약 10%, 약 10% 내지 약20%, 또는 약 20% 내지 30% (부피) 산소 사이의 범위를 포함한다. 일정 구현예에서, 이소프렌 발효는 녹아있는 필요한 산소 수준을 액상으로 유지하는 데 요구되는 산소 첨가량을 최소화하도록 높은 압력 하에서 수행된다.
일정 구현예에서, 발효기를 통한 기체 제거율의 감소는 이러한 조건이 배출기체 이소프렌 수준을 약 30,000 ug/L (약 1% v/v)까지 세포의 생리학에 역효과를 주지 않고 높이는 통합된 이소프렌 생산 공정에 유리하다.
일정 구현예에서, 감소된 기체-제거율은 세포의 생리학에 역효과를 유의하게 주지 않는다. 일정 구현예에서, 감소된 기체 제거율을 가지는 배양에서 세포의 이산화탄소 발생율은 약 1 x 10-18 mmol/L/시간 내지 약 1 mol/L/시간, 1 mmol/L/시간 내지 1 mol/L/시간, 25 mmol/L/시간 내지 750 mmol/L/시간, 25 mmol/L/시간 내지 75 mmol/L/시간, 250 mmol/L/시간 내지 750 mmol/L/시간, 또는 450 mmol/L/시간 내지 550 mmol/L/시간 사이의 범위이다. 일정 구현예에서, 이산화탄소 발생율은 약 50 mmol/L/시간, 100 mmol/L/시간, 150 mmol/L/시간, 200 mmol/L/시간, 250 mmol/L/시간, 300 mmol/L/시간, 350 mmol/L/시간, 400 mmol/L/시간, 450 mmol/L/시간, 또는 500 mmol/L/시간이다. 일정 구현예에서, 감소된 기체-제거율을 가진 세포 생존도는 약 1.75배, 1.5배, 1.25배, 1배, 0.75배, 0.5배, 또는 0.25배 이하로 감소된다. 일정 구현예에서, 감소된 기체-제거율을 가진 세포 생존도는 약 2배로 감소된다. 일정 구현예에서, MVA 경로 및/또는 DXP 경로 핵산의 하나 이상의 이종유래 및/또는 이중 사본으로부터 나온 MVA 경로 및/또는 DXP 경로RNA 및/또는 단백질을 발현하는 세포의 감소된 기체-제거율을 가진 세포 생존도는 MVA 경로 및/또는 DXP 경로 핵산의 하나 이상의 이종유래 및/또는 이중 사본이 결여된 감소된 기체-제거율을 가진 대조군 세포와 대비된다. 일정 구현예에서, MVA 경로 및/또는 DXP 경로 핵산의 하나 이상의 이종유래 및/또는 이중 사본으로부터 나온 MVA 경로 및/또는 DXP 경로RNA 및/또는 단백질을 프로모터가 유도되는, 유도가능한 (inducible) 프로모터 하에서 발현하는 세포의 감소된 기체-제거율을 가진 세포 생존도가 MVA 경로 및/또는 DXP 경로 핵산의 하나 이상의 이종유래 및/또는 이중 사본을 프로모터가 유도되지 않는, 유도가능하지 않는 (uninducible) 프로모터 하에서 포함하는 감소된 기체-제거율을 가진 대조군 세포와 대비된다. 일정 구현예에서, 유도성 프로모터는 베타-갈락토시다제 프로모터 (beta-galactosidase promoter)이다.
일정 구현예에서, 유전적으로 변형된 숙주 생물의 발효는 생물에 의해 연소되는 전체 탄소의 적어도 5%를 휘발성, 불포화 탄화수소로 전환시킨다. 일정 구현예에서, 불포화 탄화수소의 생산은 적어도 약 100 μg/L, 500 μg/L, 1000 μg/L, 2, 500 μg/L, 5,000 μg/L, 7,500 μg/L, 또는 10,000 μg/L의 수준으로 발효 배출기체에 존재하는 정도이다.
일정 구현예에서, 불포화 탄화수소는 높은 생산율에 적합한 방식으로 배출기체 유량으로부터 회수되고, 이는 배출기체에서의 농도, 적어도 약 100 μg/L, 500 μg/L, 1000 μg/L, 2,500 μg/L, 5,000 μg/L, 7,500 μg/L, 또는 10,000 μg/L에 해당한다. 일정 구현예에서, 발효 배출기체로부터 불포화 탄화수소의 추출 및 회수는, 상세하게 낮은 기체 제거율에서는 이로부터 얻은 배출기체는 관심 있는 휘발성 성분이 풍부하다. 일정 구현예에서, 본 방법에 의한 휘발성 탄화수소의 회수는 휘발물질의 증가된 농도에 의존한다. 예를 들어, 압축/농축 또는 추출식 증류 기법의 사용을 통한 발효 배출기체에서 이소프렌의 효율적인 포집을 들 수 있다. 또한 실리카겔 흡착제에 더하여 활성화된 탄소 카트리지의 사용, 탄소 카트리지로부터 이소프렌의 탈착과 농축, 및/또는 약 5% 이상의 포도당 기질을 이소프렌으로 전환시킬 수 있고 약 15,000 μg/L 이상의 배출기체 농도를 가져올 수 있는 대장균 균주와 같은 숙주 생물의 제작과 발효도 고려된다. 회수 방법은 본 명세서에 기술된 방법이라면 모두를 포함한다.
또한 본 명세서에서는 (a) 약 250 M/atm 이하의 헨리의 법칙 계수 및 (b) 약 100 g/L 이하의 물 용해도로 이루어진 그룹으로부터 선택되는 하나 이상의 특징을 가지는 화합물을 생산하는 방법이 제공된다. 일정 구현예에서, 방법은 a) 기체가 약 0.01 vvm 내지 약 2.0 vvm 사이의 기체 살포율로 첨가되는 (발효 시스템과 같은 시스템에 기체의 첨가와 같음), 화합물의 생산에 적합한 조건 하에서 세포를 배양하고; 또한 b) 화합물을 생산하는 단계:를 포함한다.
일정 구현예에서, 세포 질량 내로 배분되는 화합물의 양은 액상 수용성 값에 포함되지 않는다. 일정 구현예에서, 액상 농도는 화합물의 수용성 한계 미만이다.
일정 구현예에서, 화합물은 발효 액체배지로부터 적당 (moderate) 내지 낮은 기체 살포율 (gas sparging rates)로 기체의 비워냄 (gas stripping)에 의해 계속적으로 회수될 수 있고, 상세하게는 이들 화합물은 약 250 M/atm, 200 M/atm, 150 M/atm, 100 M/atm, 75 M/atm, 50 M/atm, 25 M/atm, 10 M/atm, 5 M/atm, 또는 1 M/atm 이하의 헨리의 법칙 계수를 가진다. 예로는 아세트알데하이드 (15 M/atm)와 같은 알데하이드, 아세톤 (30 M/atm) 또는 2-부탄온 (20 M/atm)과 같은 케톤, 또는 메탄올 (220 M/atm), 에탄올 (200 M/atm), 1-부탄올 (120 M/atm) 또는 3-메틸-3-부텐-1-올 및 3-메틸-2-부텐-1올 (50 - 100 M/atm)을 포함하는 C5 알코올을 포함하는 알코올을 포함한다. 알코올의 에스테르, 예를 들어 C5 알코올의 에틸아세테이트 (6 - 9 M/atm) 또는 에틸에스테르 (< 5 M/atm)는 일반적으로 각각의 알코올보다 더 낮은 헨리의 상수를 가진다. 상세하게는 1 M/atm 이하의 헨리의 법칙 계수를 가진 화합물이 바람직하다. 예로는 C1 내지 C5 탄화수소 (예로, 메탄, 에탄, 에틸렌, 또는 프로필렌)와 같은 기타 탄화수소에 더하여 헤미테르펜 (hemiterpenes), 모노테르펜 (monoterpenes), 또는 세스퀴테르펜 (sesquiterpenes)을 포함한다. 일정 구현예에서, C1 내지 C5 탄화수소와 같은 탄화수소는 포화, 불포화, 또는 가지상이다.
일반적으로, 헨리의 법칙 계수 및 물 수용성 간의 상호관련성이 있고, 매우 낮은 계수를 가지는 화합물은 물에 조금 녹는다 (sparingly soluble) (실질적으로는 물에 녹지 않음). 물에서 무한한 수용성을 가지는 휘발성 물질 (예로, 아세톤 또는 에탄올)은 기체 비워냄에 의해 제거될 수 있지만, 바람직한 수용성 한계는 약 100 g/L, 75 g/L, 50 g/L, 25 g/L, 10 g/L, 5 g/L, 또는 1 g/L 이하의 범위이다.
상기 기술된 화합물이라면 모두를 생산하는 방법이라면 모두의 일정 구현예에서, 기체 살포율은 약 0.1 vvm to 1 vvm, 0.2 vvm to 1 vvm, 또는 0.5 vvm 내지 1 vvm 사이의 범위이다. 일정 구현예에서, 기체 살포율은 약 0.1 vvm, 0.25 vvm, 0.5 vvm, 0.75 vvm, 1 vvm, 1.25 vvm, 1.5 vvm, 1.75 vvm, 또는 2 vvm 사이의 범위이다. 일정 구현예에서, 낮은 살포율은 발효 진행의 전 과정 동안, 성장기 동안, 또는 안정기 동안 유지된다. 일정 구현예에서, 낮은 기체 살포율은 1 시간 내지 5 시간, 5 시간 내지 10 시간, 10 시간 내지 20 시간, 20 시간 내지 30 시간, 30 시간 내지 40 시간, 40 시간 내지 50 시간, 또는 50 시간 내지 60 시간 사이의 기간 동안 유지된다.
본 명세서에서 기술된 시스템이라면 모두가 상기 기술된 화합물을 생산하는 방법에 사용될 수 있다. "대표적인 정제 방법"이라는 제목으로 된 섹션에 기술된 것과 같은 표준 방법이 정제하는 데 사용될 것이다. 분리는 회수-이후 (post-recovery), 예를 들어 증류 또는 선택적 흡착 기법에 의해 수행될 수 있다.
대표적인 바이오이소프렌의 생산
일정 구현예에서, 세포는 세포에 의한 이소프렌의 생산을 허용하는 조건 하에 세포 배지에서 배양된다.
"피크 절대 생산도 (peak absolute productivity)"에 의하여, 특정한 기간의 시간 동안 세포를 배양할 때 (예로, 특정한 발효 진행 동안 세포의 배양) 배출-기체에서 이소프렌의 절대적 최대량을 의미한다. "피크 절대 생산도 시점 (peak absolute productivity time point)"에 의하여, 특정한 기간의 시간 동안 세포를 배양할 때 (예로, 특정한 발효 진행 동안 세포의 배양) 배출-기체에서 이소프렌의 절대량이 최대가 되는 발효 동안의 시점을 의미한다. 일정 구현예에서, 이소프렌량은 피크 절대 생산도 시점에서 측정된다. 일정 구현예에서, 세포에 대한 피크 절대 생산도는 본 명세서에서 기재된 이소프렌량이라면 모두의 정도이다.
"피크 특이 생산도 (peak specific productivity)"에 의하여, 특정한 기간의 시간 동안 세포를 배양할 때 (예로, 특정한 발효 진행 동안 세포를 배양함) 세포 당 생산된 이소프렌의 최대량을 의미한다. "피크 특이 생산도 시점 (peak specific productivity time point)"에 의하여, 특정한 기간의 시간 동안 세포를 배양할 때 (예로, 특정한 발효 진행 동안 세포를 배양함) 세포 당 생산된 이소프렌량이 최대가 되는 시점을 의미한다. 피크 특이 생산도는 600 nm에서 광학 밀도 (OD600)에 의해 결정된 바와 같이 전체 생산도를 세포량으로 나누어 결정된다. 일정 구현예에서, 이소프렌량은 피크 특이 생산도 시점에서 측정된다. 일정 구현예에서, 세포에 대한 피크 특이 생산도는 본 명세서에서 기재된 시간 당 세포 당 이소프렌량이라면 모두의 정도이다.
"평균 부피측정 생산도 (average volumetric productivity)"에 의하여, 특정한 기간의 시간 동안 세포를 배양할 때 (예로, 특정한 발효 진행 동안 세포를 배양함) 액체배지의 부피 당 (세포 및 세포 배지의 부피를 포함함) 생산된 이소프렌의 최대량을 의미한다. "피크 특이 부피측정 생산도 시점 (peak volumetric productivity time point)"에 의하여, 특정한 기간의 시간 동안 세포를 배양할 때 (예로, 특정한 발효 진행 동안 세포를 배양함) 액체배지의 부피 당 생산된 이소프렌량이 최대가 되는 시점을 의미한다. 피크 특이 부피측정 생산도는 전체 생산도를 액체 배지의 부피 및 시간량으로 나누어 결정된다. 일정 구현예에서, 이소프렌량은 피크 특이 부피측정 생산도 시점에서 측정된다. 일정 구현예에서, 세포에 대한 피크 특이 부피측정 생산도는 본 명세서에서 기재된 시간 당 세포 당 이소프렌량이라면 모두의 정도이다.
"피크 농도 (peak concentration)"에 의하여, 특정한 기간의 시간 동안 세포를 배양할 때 (예로, 특정한 발효 진행 동안 세포를 배양함) 생산된 이소프렌의 최대량을 의미한다. "피크 농도 시점 (peak concentration time point)"에 의하여, 특정한 기간의 시간 동안 세포를 배양할 때 (예로, 특정한 발효 진행 동안 세포를 배양함) 세포 당 생산된 이소프렌량이 최대가 되는 시점이다. 일정 구현예에서, 이소프렌량은 피크 농도 시점에서 측정된다. 일정 구현예에서, 세포에 대한 피크 농도는 본 명세서에서 기재된 이소프렌량이라면 모두의 정도이다.
"평균 부피측정 생산도 (average volumetric productivity)"에 의하여, 특정한 기간의 시간 동안 세포를 배양할 때 (예로, 특정한 발효 진행 동안 세포를 배양함) 액체배지의 부피 당 (세포 및 세포 배지의 부피를 포함함) 생산된 이소프렌의 평균량을 의미한다. 평균 부피측정 생산도는 전체 생산도를 액체 배지의 부피 및 시간량으로 나누어 결정된다. 일정 구현예에서, 세포에 대한 평균 특이 부피측정 생산도는 본 명세서에서 기재된 시간 당 부피 당 이소프렌량이라면 모두의 정도이다.
"전체 누적 생산도 (cumulative total productivity)"에 의하여, 특정한 기간의 시간 동안 세포를 배양할 때 (예로, 특정한 발효 진행 동안 세포를 배양함) 생산된 이소프렌의 누적 전체량을 의미한다. 일정 구현예에서, 이소프렌의 전체 누적 생산도는 측정된다. 일정 구현예에서, 세포에 대한 전체 누적 생산도는 본 명세서에서 기재된 이소프렌량이라면 모두의 정도이다.
본 명세서에서 사용되는 바, "상대적 검출기 반응 (relative detector response)"은 하나의 화합물 (이소프렌과 같음)에 대한 검출기 반응 (GC/MS 면적과 같음) 내지 하나 이상의 화합물 (모든 C5 탄화수소와 같음)의 검출기 반응 (GC/MS 면적과 같음) 사이의 비율을 말한다. 검출기 반응은, 애질런트(Agilent) HP-5MS GC/MS 컬럼 (30 m x 250 μm; 0.25 μm 필름 두께)이 장착된 애질런트 6890 GC/MS 시스템에 의해 수행된 GC/MS 분석법과 같은 본 명세서에서 기술된 바와 같이 측정될 수 있다. 원하는 경우, 상대적 검출기 반응은 각 화합물의 반응인자를 사용하여 무게 퍼센트로 전환될 수 있다. 본 반응인자는 특정한 화합물의 주어진 양에 대해 생성되는 신호량의 척도이다 (즉, 검출기가 특정 화합물에 대해 민감한 정도). 본 반응인자는 검출기가 비교되는 화합물에 대해 서로 다른 민감도를 가질 때 상대적 검출기 반응을 무게 퍼센트로 전환시키는 교정인자로서 사용될 수 있다. 대안으로, 무게 퍼센트는 반응인자가 비교되는 화합물과 동일한 점을 가정하여 근접될 수 있다. 따라서, 무게 퍼센트는 상대적 검출기 반응과 대략 동일한 것으로 가정될 수 있다.
일정 구현예에서, 배양에서의 세포는 약 1, 10, 25, 50, 100, 150, 200, 250, 300, 400, 500, 600, 700, 800, 900, 1,000, 1,250, 1,500, 1,750, 2,000, 2,500, 3,000, 4,000, 5,000, 10,000, 12,500, 20,000, 30,000, 40,000, 50,000, 75,000, 100,000, 125,000, 150,000, 188,000 이상 mole 이소프렌/세포의 습윤 무게에 대한 세포의 그램수/시간 (nmole/gwcm/시간)으로 이소프렌을 생산한다. 일정 구현예에서, 이소프렌량은 약 2 내지 약 100 nmole/gwcm/시간, 약 100 내지 약 500 nmole/gwcm/시간, 약 150 내지 약 500 nmole/gwcm/시간, 약 500 내지 약 1,000 nmole/gwcm/시간, 약 1,000 내지 약 2,000 nmole/gwcm/시간, 약 2,000 내지 약 5,000 nmole/gwcm/시간, 약 5,000 내지 약 10,000 nmole/gwcm/시간, 약 10,000 내지 약 50,000 nmole/gwcm/시간, 약 50,000 내지 약 100,000 nmole/gwcm/시간, 약 100,000 내지 약 150,000 nmole/gwcm/시간, 또는 약 150,000 내지 약 200,000 nmole/gwcm/시간과 같은 약 2 내지 약 200,000 nmole/gwcm/시간 사이의 범위이다. 일정 구현예에서, 이소프렌량은 약 20 내지 약 5,000 nmole/gwcm/시간, 약 100 내지 약 5,000 nmole/gwcm/시간, 약 200 내지 약 2,000 nmole/gwcm/시간, 약 200 내지 약 1,000 nmole/gwcm/시간, 약 300 내지 약 1,000 nmole/gwcm/시간, 약 400 내지 약 1,000 nmole/gwcm/시간, 약 1,000 내지 약 5,000 nmole/gwcm/시간, 약 2,000 내지 약 20,000 nmole/gwcm/시간, 약 5,000 내지 약 50,000 nmole/gwcm/시간, 약 10,000 내지 약 100,000 nmole/gwcm/시간, 약 20,000 내지 약 150,000 nmole/gwcm/시간, 또는 약 20,000 내지 약 200,000 nmole/gwcm/시간 사이의 범위이다.
이소프렌량은 nmole/gwcm/시간 단위로 미국 특허 제 US 5,849,970호에 기재된 바와 같이 측정될 수 있고, 이는 본 명세서에서 참고문헌으로 상세하게는 이소프렌 생산의 측정에 관하여 통합되어 있다. 예를 들어, 2 mL의 상부공간 (예로, 밀봉된 바이알에서 32℃에 200 rpm으로 진탕하면서 대략 3 시간 동안 배양된 2 ml의 배양액과 같은 배양액으로부터 나온 상부공간)이 n-옥탄/포라실 C 컬럼 (n-octane/porasil C column; Alltech Associates, Inc., Deerfield, Ill)을 사용하는 등온적으로 작동하고 (85℃) RGD2 머큐릭옥사이드 환원기체 검출기 (Trace Analytical, Menlo Park, CA)과 연결된 시스템과 같은 표준 기체 크로마토그래피 시스템을 사용하여 이소프렌에 대해 분석된다 (예를 들어, Greenberg et al, Atmos. Environ. 27A: 2689-2692, 1993; Silver et al., Plant Physiol. 97:1588-1591, 1991를 참조하고, 이들은 각각 본 명세서에서 참고문헌으로 전부, 상세하게는 이소프렌 생산의 측정에 관하여 통합되어 있다). 기체 크로마토그래피 면적 단위는 표준 이소프렌 농도 측정 곡선 (calibration curve)을 통해 이소프렌 nmol로 전환된다. 일정 구현예에서, 세포의 습윤 무게에 대한 세포의 그램수는 세포 배양액 시료에 대한 A600 값을 획득한 다음 본 A600 값을 기지의A600 값을 가지는 세포 배양액에 대한 습윤 무게의 측정 곡선에 근거하여 세포의 그램수로 전환시킴에 의해 계산된다. 일정 구현예에서, 세포의 그램은 A600 값 1을 가진 액체배지 일 리터 (세포 배지 및 세포를 포함함)가 1 그램의 습윤 세포 무게를 가지는 것으로 가정하여 평가된다. 또한 본 값은 배양액이 배양되었던 시간, 3시간과 같은 수로 나눈다.
일정 구현예에서, 배양에서의 세포는 약 1, 10, 25, 50, 100, 150, 200, 250, 300, 400, 500, 600, 700, 800, 900, 1,000, 1,250, 1,500, 1,750, 2,000, 2,500, 3,000, 4,000, 5,000, 10,000, 또는 100,000 이상 ng 이소프렌/세포의 습윤 무게에 대한 세포의 그램수/시간 (ng/gwcm/시간)으로 이소프렌을 생산한다. 일정 구현예에서, 이소프렌량은 약 2 내지 약 100 ng/gwcm/시간, 약 100 내지 약 500 ng/gwcm/시간, 약 500 내지 약 1000 ng/gwcm/시간, 약 1,000 내지 약 2,000 ng/gwcm/시간, 약 2,000 내지 약 5,000 ng/gwcm/시간 사이와 같은 약 2 내지 약 5,000 ng/gwcm/시간 사이의 범위이다. 일정 구현예에서, 이소프렌량은 약 20 내지 약 5,000 ng/gwcm/시간, 약 100 내지 약 5,000 ng/gwcm/시간, 약 200 내지 약 2,000 ng/gwcm/시간, 약 200 내지 약 1,000 ng/gwcm/시간, 약 300 내지 약 1,000 ng/gwcm/시간, 또는 약 400 내지 약 1,000 ng/gwcm/시간 사이의 범위이다. 이소프렌의 ng/gwcm/시간으로 표현된 양은 상기 논의된 nmole/gwcm/시간의 단위에서의 이소프렌 생산의 수치를 68.1로 곱하여 계산될 수 있다 (하기 공식 5에서 기술된 바와 같음).
일정 구현예에서, 배양에서 세포는 약 1, 10, 25, 50, 100, 150, 200, 250, 300, 400, 500, 600, 700, 800, 900, 1,000, 1,250, 1,500, 1,750, 2,000, 2,500, 3,000, 4,000, 5,000, 10,000, 50,000, 또는 100,000 이상 mg 이소프렌/액체배지 L (mg/L액체배지, 여기에서 액체배지의 부피는 세포 및 세포 배지의 부피를 포함함)로 이소프렌의 누적 역가를 생산한다. 일정 구현예에서, 이소프렌량은 약 2 내지 약 100 mg/L 액체배지, 약 100 내지 약 500 mg/L 액체배지, 약 500 내지 약 1,000 mg/L 액체배지, 약 1,000 내지 약 2,000 mg/L 액체배지, 또는 약 2,000 내지 약 5,000 mg/L 액체배지 사이과 같은 약 2 내지 약 5,000 mg/L 액체배지 사이의 범위이다. 일정 구현예에서, 이소프렌량은 약 2 내지 약 5,000 mg/L 액체배지, 약 100 내지 약 5,000 mg/L 액체배지, 약 200 내지 약 2,000 mg/L 액체배지, 약 200 내지 약 1,000 mg/L 액체배지, 약 300 내지 약 1,000 mg/L 액체배지 또는 약 400 내지 약 1,000 mg/L 액체배지 사이의 범위이다.
이소프렌 mg/진탕 플라스크 또는 유사한 배양으로부터 상부공간 L에서의 이소프렌의 특이 생산도는 대략 1의 OD600 값에서 세포 배양액으로부터 1 ml 시료를 얻어 이를 20 mL 바이알에 넣고 30 분 동안 배양한 다음, 상부공간에서의 이소프렌량을 측정하여 측정될 수 있다 (예를 들어, 실시예 1, 제 1부에 기술된 바와 같음). OD600 값이 1.0이 아닌 경우라면, 측정은 OD600 값으로 나누어 OD600 값이 1로 정상화될 수 있다. 이소프렌 mg/상부공간 L의 값은 38의 팩터로 곱하여 mg/L액체배지/시간/액체배지의 OD600으로 전환될 수 있다. mg/L액체배지/시간/OD600 단위의 수치는 이소프렌 mg/ L액체배지 단위의 누적 역가를 얻기 위하여 시간 및 OD600 값으로 곱해질 수 있다.
일정 구현예에서, 배양에서의 세포는 약 0.1, 1.0, 10, 25, 50, 100, 150, 200, 250, 300, 400, 500, 600, 700, 800, 900, 1,000, 1100, 1200, 1300, 1,400, 1,500, 1,600, 1,700, 1,800, 1,900, 2,000, 2,100, 2,200, 2,300, 2,400, 2,500, 2,600, 2,700, 2,800, 2,900, 3,000, 3,100, 3,200, 3,300, 3,400, 또는 3,500 이상 mg 이소프렌/액체배지 L/시간 (mg/L액체배지/시간, 여기에서 액체배지의 부피는 세포 및 세포 배지의 부피를 포함함)의 이소프렌의 평균 부피측정 생산도를 가진다. 일정 구현예에서, 이소프렌의 평균 부피측정 생산도는 약 0.1 내지 약 100 mg/L액체배지/시간, 약 100 내지 약 500 mg/L액체배지/시간, 약 500 내지 약 1,000 mg/L액체배지/시간, 약 1,000 내지 약 1,500 mg/L액체배지/시간, 약 1,500 내지 약 2,000 mg/L액체배지/시간, 약 2,000 내지 약 2,500 mg/L액체배지/시간, 약 2,500 내지 약 3,000 mg/L액체배지/시간, 또는 약 3,000 내지 약 3,500 mg/액체배지/시간과 같은 약 0.1 내지 약 3,500 mg/L액체배지/시간 사이의 범위이다. 일정 구현예에서, 이소프렌의 평균 부피측정 생산도는 약 10 내지 약 3,500 mg/L액체배지/시간, 약 100 내지 약 3,500 mg/L액체배지/시간, 약 200 내지 약 1,000 mg/L액체배지/시간, 약 200 내지 약 1,500 mg/L액체배지/시간, 약 1,000 내지 약 3,000 mg/L액체배지/시간, 또는 약 1,500 내지 약 3,000 mg/L 사이의 범위이다.
일정 구현예에서, 배양에서 세포는 약 0.5, 1.0, 10, 25, 50, 100, 150, 200, 250, 300, 400, 500, 600, 700, 800, 900, 1,000, 1100, 1200, 1300, 1,400, 1,500, 1,600, 1,700, 1,800, 1,900, 2,000, 2,100, 2,200, 2,300, 2,400, 2,500, 2,600, 2,700, 2,800, 2,900, 3,000, 3,100, 3,200, 3,300, 3,400, 3,500, 3,750, 4,000, 4,250, 4,500, 4,750, 5,000, 5,250, 5,500, 5,750, 6,000, 6,250, 6,500, 6,750, 7,000, 7,250, 7,500, 7,750, 8,000, 8,250, 8,500, 8,750, 9,000, 9,250, 9,500, 9,750, 10,000, 12,500, 또는 15,000 이상 mg 이소프렌/액체배지의 L/시간 (mg/L액체배지/시간, 여기에서 액체배지의 부피는 세포 및 세포 배지의 부피를 포함함)의 이소프렌의 피크 부피측정 생산도를 가진다. 일정 구현예에서, 이소프렌의 피크 부피측정 생산도는 약 0.5 내지 약 10 mg/L액체배지/시간, 약 1.0 내지 약 100 mg/L액체배지/시간, 약 100 내지 약 500 mg/L액체배지/시간, 약 500 내지 약 1,000 mg/L액체배지/시간, 약 1,000 내지 약 1,500 mg/L액체배지/시간, 약 1,500 내지 약 2,000 mg/L액체배지/시간, 약 2,000 내지 약 2,500 mg/L액체배지/시간, 약 2,500 내지 약 3,000 mg/L액체배지/시간, 약 3,000 내지 약 3,500 mg/L액체배지/시간, 약 3,500 내지 약 5,000 mg/L액체배지/시간, 약 5,000 내지 약 7,500 mg/L액체배지/시간, 약 7,500 내지 약 10,000 mg/L액체배지/시간, 약 10,000 내지 약 12,500 mg/L액체배지/시간, 약 12,500 내지 약 15,000 mg/L액체배지/시간과 같은 약 0.5 내지 약 15,000 mg/L액체배지/시간 사이의 범위이다. 일정 구현예에서, 이소프렌의 피크 부피측정 생산도는 약 10 내지 약 15,000 mg/L액체배지/시간, 약 100 내지 약 2,500 mg/L액체배지/시간, 약 1,000 내지 약 5,000 mg/L액체배지/시간, 약 2,500 내지 약 7,500 mg/L액체배지/시간, 약 5,000 내지 약 10,000 mg/L액체배지/시간, 약 7,500 내지 약 12,500 mg/L액체배지/시간, 또는 약 10,000 내지 약 15,000 mg/L액체배지/시간 사이의 범위이다.
발효기에서 일시적 이소프렌 생산률 mg/L액체배지/시간 단위는 발효기 배출-기체의 시료를 수집하고, 예를 들어 실시예 1, 제 II부에 기술된 바와 같이 이를 이소프렌량에 대해 (L기체 당 이소프렌 mg 단위로) 분석하며, 본 값을 배출-기체가 액체배지의 각 리터를 통과하는 속도 (예로, 1 vvm (공기의 부피/ 액체배지의 부피/분)에서 이것은 시간 당 60 Lgas이다)로 곱하여 측정될 수 있다. 따라서, 1 mg/Lgas 의 배출-기체 수준은 1 vvm의 공기유동에서 60 mg/L액체배지/시간의 일시적 생산률에 해당한다. 원하는 경우, mg/L액체배지/시간 단위의 값은 mg/L액체배지/시간/OD 단위의 특이 생산률을 획득하도록 OD600 값으로 나눌 수 있다. 이소프렌 mg/L기체의 평균값은 본 평균 배출-기체 이소프렌 농도를 발효과정 동안 발효 배지 리터 당 살포된 배출-기체의 전체량으로 곱하여 전체 산물 생산도 (발효 액체배지 리터 당 이소프렌 그램, mg/L액체배지)로 전환될 수 있다. 따라서, 1vvm에서 10시간 경과 시 평균 배출-기체 이소프렌 농도 0.5 mg/L액체배지/시간 는 전체 산물 농도300 mg 이소프렌/L액체배지 에 해당한다.
일정 구현예에서, 배양에서의 세포는 약 0.0015, 0.002, 0.005, 0.01, 0.02, 0.05, 0.1, 0.12, 0.14, 0.16, 0.2, 0.3, 0.4, 0.5, 0.6, 0.7, 0.8, 0.9, 1.0, 1.2, 1.4, 1.6, 1.8, 2.0, 2.2, 2.4, 2.6, 3.0, 4.0, 5.0, 6.0, 7.0, 8.0, 9.0, 10.0, 11.0, 12.0, 13.0, 14.0, 15.0, 16.0, 17.0, 18.0, 19.0, 20.0, 21.0, 22.0, 23.0, 23.2, 23.4, 23.6, 23.8, 24.0, 25.0, 30.0, 31.0, 32.0, 33.0, 35.0, 37.5, 40.0, 45.0, 47.5, 50.0, 55.0, 60.0, 65.0, 70.0, 75.0, 80.0, 85.0, 또는 90.0 몰라% 이상의 세포 배양 배지에서의 탄소를 이소프렌으로 전환시킨다. 일정 구현예에서, 이소프렌으로 탄소의 전환 퍼센트는 약 0.002 내지 약 0.005%, 약 0.005 내지 약 0.01%, 약 0.01 내지 약 0.05%, 약 0.05 내지 약 0.15%, 약 0.15 내지 약 0.2%, 약 0.2 내지 약 0.3%, 약 0.3 내지 약 0.5%, 약 0.5 내지 약 0.8%, 약 0.8 내지 약 1.0%, 약 1.0 내지 약 1.6%, 약 1.6 내지 약 3.0%, 약 3.0 내지 약 5.0%, 약 5.0 내지 약 8.0%, 약 8.0 내지 약 10.0%, 약 10.0 내지 약 15.0%, 약 15.0 내지 약 20.0%, 약 20.0 내지 약 25.0%, 약 25.0 내지 약 30.0%, 약 30.0 내지 약 35.0%, 약 35.0 내지 약 40.0%, 약 45.0 내지 약 50.0%, 약 50.0 내지 약 55.0%, 약 55.0 내지 약 60.0%, 약 65.0 내지 약 70.0%, 약 70.0 내지 약 75.0%, 약 75.0 내지 약 80.0%, 약 80.0 내지 약 85.0%, 또는 약 85.0 내지 약 90.0%과 같은 약 0.002 내지 약 90.0 몰라% 사이의 범위이다. 일정 구현예에서, 이소프렌으로 탄소의 전환 퍼센트는 약 0.002 내지 약 0.4 몰라%, 약 0.002 내지 약 0.16 몰라%, 약 0.04 내지 약 0.16 몰라%, 약 0.005 내지 약 0.3 몰라%, 약 0.01 내지 약 0.3 몰라%, 약 0.05 내지 약 0.3 몰라%, 약 0.1 내지 약 0.3 몰라%, 약 0.3 내지 약 1.0 몰라%, 약 1.0 내지 약 5.0 몰라%, 약 2 내지 약 5.0 몰라%, 약 5.0 내지 약 10.0 몰라%, 약 7 내지 약 10.0 몰라%, 약 10.0 내지 약 20.0 몰라%, 약 12 내지 약 20.0 몰라%, 약 16 내지 약 20.0 몰라%, 약 18 내지 약 20.0 몰라%, 약 18 내지 약 23.2 몰라%, 약 18 내지 약 23.6 몰라%, 약 18 내지 약 23.8 몰라%, 약 18 내지 약 24 몰라%, 약 18 내지 약 25 몰라%, 약 20 내지 약 30.0 몰라%, 약 30 내지 약 40.0 몰라%, 약 30 내지 약 50.0 몰라%, 약 30 내지 약 60.0 몰라%, 약 30 내지 약 70.0 몰라%, 약 30 내지 약 80.0 몰라%, 또는 약 30 내지 약 90.0 몰라% 사이의 범위이다.
탄소의 이소프렌으로 전환 퍼센트 ("% 탄소 수율 (% carbon yield)"이라고도 약칭됨)는 생산된 이소프렌에서 탄소 몰을 탄소원에서 탄소 몰 (회분식 및 포도당 및 효모추출물 사료첨가-회분식에서 탄소의 몰과 같음)로 나누어서 측정될 수 있다. 본 수치는 퍼센트 값을 주도록 100%를 곱한다 (공식 1에 표시된 바와 같음).
공식 1
% 탄소 수율 = (생산된 이소프렌에서 탄소 몰)/(탄소원에서 탄소 몰) * 100
본 계산을 위해, 효모추출물은 50% w/w 탄소를 포함하는 것으로 가정될 수 있다. 예로서 실시예 7, 제 VIII부에 기술된 500 리터의 경우, 이소프렌으로 탄소의 전환 퍼센트는 공식 2에 나타난 바와 같이 계산될 수 있다.
공식 2
% 탄소 수율 = (39.1 g 이소프렌 * 1/68.1mol/g * 5 C/mol)/[(181221 g 포도당 * 1/180 mol/g * 6 C/mol) + (17780 g 효모추출물 * 0.5 * 1/12 mol/g)] * 100 = 0.042%
본 명세서에서 기술된 두 개의 500 리터 발효의 경우 (실시예 7, 제 VII 부 및 제 VIII부), 이소프렌으로 탄소의 전환 퍼센트는 0.04 - 0.06% 사이의 범위이었다. 0.11-0.16% 탄소 수율은 본 명세서에서 기술된 바와 같이 14리터 시스템을 사용하여 달성되었다. 실시예 11, 제 V부는 이소프렌으로 탄소의 전환이 본 명세서에서 기술된 방법을 사용하여 1.53% 인 것을 기술하고 있다.
당업자라면 이소프렌 생산률 또는 생산된 이소프렌량을 기타 다른 단위로 바로 전환할 수 있다. 대표적인 공식은 단위들 간 상호전환을 위해 하기에 나열된다.
이소프렌 생산률의 단위 (전체 및 특이)
공식 3
1 g 이소프렌/L액체배지/시간 = 14.7 mmol 이소프렌/L액체배지/시간 (전체 부피측정률)
공식 4
1 nmol 이소프렌 /gwcm/시간 = 1 nmol 이소프렌 /L액체배지/시간/OD600
(본 전환은 OD600 값 1을 가진 액체배지 1 리터가 1 그램의 습윤 세포 무게를 가지는 것을 가정한다.)
공식 5
1 nmol 이소프렌/gwcm/시간 = 68.1 ng 이소프렌/gwcm/시간
(이소프렌의 분자량이 주어짐)
공식 6
1 nmol 이소프렌/Lgas O2/시간 = 90 nmol 이소프렌/L액체배지/시간
(배양 액체배지 리터 당 90 L/시간의 O2 유속에서)
공식 7
1 μg 이소프렌/L기체 배출-기체에서 이소프렌 = L액체배지 당 60 L기체의 유속 (1 vvm)에서 60 μg 이소프렌/L액체배지/시간
역가에 대한 단위 (전체 및 특이)
공식 8
1 nmol 이소프렌/mg 세포 단백질 = 150 nmol 이소프렌/L액체배지/OD600
(본 전환은 OD600 값 1을 가진 액체배지 1 리터가 대략 150 mg의 전체 세포 단백질을 가지는 것으로 가정한다)(특이 생산도)
공식 9
1 g 이소프렌/L
액체배지
= 14.7 mmol 이소프렌/L
액체배지
(전체 역가)
원하는 경우, 공식 10은 세포의 습윤 무게를 포함하는 단위라면 모두를 세포의 건조 무게를 포함하는 해당하는 단위로 전환시키는 데 사용될 수 있다.
공식 10
세포의 건조 무게 = (세포의 습윤 무게)/3.3
원하는 경우, 공식 11은 단위 ppm 및 μg/L 간을 전환하는 데 사용될 수 있다. 상세하게는, "ppm"은 μg/g (w/w)의 표현으로 정의된 백만 당의 부분을 의미한다. 기체의 농도도 역시 μg/L (vol/vol)의 표현으로 정의된 "ppmv"(부피에 의한 백만 당 부분)를 사용하고 부피측정 기초로 하여 표현될 수 있다. ppm (예로, 기체 g 당 분석물의 μg)으로 μg/L의 전환은 배출-기체 L 당 질량 (예로, 기체의 밀도)을 결정하여 수행될 수 있다. 예를 들어, 표준 온도 및 압력에서 공기의 리터 (STP; 101.3 kPa (1 bar) 및 273.15 K)는 대략 1.29 g/L의 밀도를 가진다. 따라서, 1 ppm (μg/g)의 농도는 STP에서 1.29 μg/L와 동등하다 (공식 11). ppm (μg/g)의 μg/L로 전환은 압력, 온도, 및 배출-기체의 전체 조성 모두의 함수이다.
공식 11
표준 온도와 압력에서 1 ppm (μg/g)은 1.29 mg/L와 동등하다 (STP; 101.3 kPa (1 bar) 및 273.15K).
ppmv (예로, 기체 L 당 분석물 μL)로 μg/L의 전환은 보편적인 기체 법칙 (공식 12)를 사용하여 수행될 수 있다. 예를 들어, 1000 μg/Lgas의 배출-기체 농도는 14.7 mol/L기체에 해당한다. 보편적인 기체 상수는 0.082057 L.atm K-1mol-1이고, 공식 12를 사용하여 STP 에서 14.7 mol의 HG에 의해 채워진 부피는 0.329 mL와 동등하다. 따라서. 1000 μg/L HG의 농도는 STP 에서 329 ppmv 또는 0.0329% (v/v)와 동등하다.
공식 12
PV = nRT, 여기에서 "P"는 압력이고, "V"는 부피이며, "n"은 기체의 몰수, "R"은 보편적인 기체 상수이고 또한 "K"는 켈빈 온도이다.
이소프렌 조성물에 있는 불순물의 양은 μg/L 과 같은 단위로 부피 당 무게 (w/v)를 기초로 하여 전형적으로 본 명세서에서 측정된다. 원하는 경우, μg/L 단위로의 측정은 공식 13을 사용하여 mg/m3 단위로 전환될 수 있다.
공식 13
1 ug/L = 1 mg/m3
본 명세서에서 기술되는 일정 구현예에서, 이소프렌 합성효소 폴리펩타이드를 인코딩하는 이종유래 핵산을 포함하는 세포는 이소프렌 합성효소 폴리펩타이드를 인코딩하는 이종유래 핵산은 없이 필수적으로 동일한 조건 하에서 성장한 해당하는 세포로부터 생산된 이소프렌량보다 적어도 약 2배, 3배, 5배, 10배, 25배, 50배, 100배, 150배, 200배, 400배 이상의 이소프렌량을 생산한다.
본 명세서에서 기술되는 일정 구현예에서, 이소프렌 합성효소 폴리펩타이드를 인코딩하는 이종유래 핵산 또한 DXS, IDI, 및/또는 MVA 경로 폴리펩타이드를 인코딩하는 하나 이상의 이종유래 핵산을 포함하는 세포는 이종유래 핵산은 없이 필수적으로 동일한 조건 하에서 성장한 해당하는 세포로부터 생산된 이소프렌량보다 적어도 약 2배, 3배, 5배, 10배, 25배, 50배, 100배, 150배, 200배, 400배 이상의 이소프렌량을 생산한다.
일정 구현예에서, 이소프렌 조성물은 조성물 내의 모든 C5 탄화수소의 전체 무게와 대비한 무게로 약 99.90, 99.92, 99.94, 99.96, 99.98, 또는 100% 이상의 이소프렌을 포함한다. 일정 구현예에서, 조성물은 조성물 내의 모든 C5 탄화수소에 대한 검출기 반응과 대비하여 이소프렌에 대해 약 99.90, 99.91, 99.92, 99.93, 99.94, 99.95, 99.96, 99.97, 99.98, 99.99, 또는 100% 이상의 상대적 검출기 반응을 가진다. 일정 구현예에서, 이소프렌 조성물은 조성물 내의 모든 C5 탄화수소의 전체 무게와 대비한 무게로 약 99.90 내지 약 99.92, 약 99.92 내지 약 99.94, 약 99.94 내지 약 99.96, 약 99.96 내지 약 99.98, 약 99.98 내지 약 100% 사이 범위의 이소프렌을 포함한다.
일정 구현예에서, 이소프렌 조성물은 조성물 내의 모든 C5 탄화수소의 전체 무게와 대비한 무게로 약 0.12, 0.10, 0.08, 0.06, 0.04, 0.02, 0.01, 0.005, 0.001, 0.0005, 0.0001, 0.00005, 또는 0.00001% 이하의 이소프렌이 아닌 C5 탄화수소 (1,3-사이클로펜타디엔, cis-1,3-펜타디엔, trans-1,3-펜타디엔, 1,4-펜타디엔, 1-펜틴, 2-펜틴, 1-펜틴, 2-메틸-1-부텐, 3-메틸-l-부틴, 펜트-4-엔-1-인, trans-펜트-3-엔-1-인, 또는 cis-펜트-3-엔-1-인과 같음)를 포함한다. 일정 구현예에서, 조성물은 조성물 내의 모든 C5 탄화수소에 대한 검출기 반응과 대비하여 이소프렌이 아닌 C5 탄화수소에 대해 약 0.12, 0.10, 0.08, 0.06, 0.04, 0.02, 0.01, 0.005, 0.001, 0.0005, 0.0001, 0.00005, 또는 0.00001% 이하의 상대적 검출기 반응을 가진다. 일정 구현예에서, 조성물은 조성물 내의 모든 C5 탄화수소에 대한 검출기 반응과 대비하여 이소프렌이 아닌 C5 탄화수소에 대해 약 0.12, 0.10, 0.08, 0.06, 0.04, 0.02, 0.01, 0.005, 0.001, 0.0005, 0.0001, 0.00005, 또는 0.00001% 이하의 상대적 검출기 반응을 가진다. 일정 구현예에서, 조성물은 조성물 내의 모든 C5 탄화수소에 대한 검출기 반응과 대비하여 1,3-사이클로펜타디엔, cis-1,3-펜타디엔, trans-1,3-펜타디엔, 1,4-펜타디엔, 1-펜틴, 2-펜틴, 1-펜틴, 2-메틸-1-부텐, 3-메틸-l-부틴, 펜트-4-엔-1-인, trans-펜트-3-엔-1-인, 또는 cis-펜트-3-엔-1-인에 대해 약 0.12, 0.10, 0.08, 0.06, 0.04, 0.02, 0.01, 0.005, 0.001, 0.0005, 0.0001, 0.00005, 또는 0.00001% 이하의 상대적 검출기 반응을 가진다. 일정 구현예에서, 이소프렌 조성물은 조성물 내의 모든 C5 탄화수소의 전체 무게와 대비한 무게로 약 0.02 내지 약 0.04%, 약 0.04 내지 약 0.06%, 약 0.06 내지 약 0.08%, 약 0.08 내지 약 0.10%, 또는 약 0.10 내지 약 0.12% 사이 범위의 이소프렌이 아닌 C5 탄화수소 (1,3-사이클로펜타디엔, cis-1,3-펜타디엔, trans-1,3-펜타디엔, 1,4-펜타디엔, 1-펜틴, 2-펜틴, 1-펜틴, 2-메틸-1-부텐, 3-메틸-l-부틴, 펜트-4-엔-1-인, trans-펜트-3-엔-1-인, 또는 cis-펜트-3-엔-1-인과 같음)를 포함한다.
일정 구현예에서, 이소프렌 조성물은 이소프렌의 다중합을 저해하는 조성물에 있는 화합물이라면 모두에 대해 약 50, 40, 30, 20, 10, 5, 1, 0.5, 0.1, 0.05, 0.01, 또는0.005 μg/L 이하의 이소프렌의 다중합을 저해하는 화합물을 포함한다. 일정 구현예에서, 이소프렌 조성물은 이소프렌의 다중합을 저해하는 조성물에 있는 화합물이라면 모두에 대해 약 0.01 내지 약 10, 약 0.01 내지 약 5, 약 0.01 내지 약 1, 약 0.01 내지 약 0.5, 약 0.01 내지 약 0.005와 같은 약 0.005 내지 약 50 μg/L 사이 범위의 이소프렌의 다중합을 저해하는 화합물을 포함한다. 일정 구현예에서, 이소프렌 조성물은 약 50, 40, 30, 20, 10, 5, 1, 0.5, 0.1, 0.05, 0.01, 또는0.005 μg/L 이하의 이소프렌이 아닌 탄화수소 (1,3-사이클로펜타디엔, cis-1,3-펜타디엔, trans-1,3-펜타디엔, 1,4-펜타디엔, 1-펜틴, 2-펜틴, 1-펜틴, 2-메틸-1-부텐, 3-메틸-l-부틴, 펜트-4-엔-1-인, trans-펜트-3-엔-1-인, 또는 cis-펜트-3-엔-1-인과 같음)를 포함한다. 일정 구현예에서, 이소프렌 조성물은 약 0.01 내지 약 10, 약 0.01 내지 약 5, 약 0.01 내지 약 1, 약 0.01 내지 약 0.5, 약 0.01 내지 약 0.005와 같은 약 0.005 내지 약 50 μg/L 사이 범위의 이소프렌이 아닌 탄화수소 (1,3-사이클로펜타디엔, cis-1,3-펜타디엔, trans-1,3-펜타디엔, 1,4-펜타디엔, 1-펜틴, 2-펜틴, 1-펜틴, 2-메틸-1-부텐, 3-메틸-l-부틴, 펜트-4-엔-1-인, trans-펜트-3-엔-1-인, 또는 cis-펜트-3-엔-1-인과 같음)를 포함한다. 일정 구현예에서, 이소프렌 조성물은 약 50, 40, 30, 20, 10, 5, 1, 0.5, 0.1, 0.05, 0.01, 또는 0.005 μg/L 이하의 단백질 또는 지방산 (자연적으로 천연 고무와 관련된 단백질 또는 지방과 같음)을 포함한다.
일정 구현예에서, 이소프렌 조성물은 약 10, 5, 1, 0.8, 0.5, 0.1, 0.05, 0.01, 또는 0.005 ppm 이하의 알파 아세틸렌, 피페릴렌, 아세토니트릴, 또는 1,3-사이클로펜타디엔을 포함한다. 일정 구현예에서, 이소프렌 조성물은 약 5, 1, 0.5, 0.1, 0.05, 0.01, 또는 0.005 ppm 이하의 황 또는 알렌 (allenes)을 포함한다. 일정 구현예에서, 이소프렌 조성물은 약 30, 20, 15, 10, 5, 1, 0.5, 0.1, 0.05, 0.01, 또는 0.005 ppm 이하의 모든 아세틸렌 (1-펜틴, 2-펜틴, 3-메틸-l-부틴, 펜트-4-엔-1-인, trans-펜트-3-엔-1-인, 및 cis-펜트-3-엔-1-인과 같음)을 포함한다. 일정 구현예에서, 이소프렌 조성물은 약 2000, 1000, 500, 200, 100, 50, 40, 30, 20, 10, 5, 1, 0.5, 0.1, 0.05, 0.01, 또는 0.005 ppm 이하의 사이클릭 이소프렌 이중체 (dimers) (예로, 두 개의 이소프렌 단위의 이중합으로부터 유래한 사이클릭 C10 화합물)과 같은 이소프렌 이중체를 포함한다.
일정 구현예에서, 이소프렌 조성물은 에탄올, 아세톤, C5 프레닐 알코올 (3-메틸-3-부텐-1-올, 또는 3-메틸-2-부텐-1-올과 같음), 또는 상기의 둘 이상이라면 모두를 포함한다. 상세한 구현예에서, 이소프렌 조성물은 약 0.005, 0.01, 0.05, 0.1, 0.5, 1, 5, 10, 20, 30, 40, 60, 80, 100, 또는 120 μg/L 이상의 에탄올, 아세톤, C5 프레닐 알코올 (3-메틸-3-부텐-1-올, 또는 3-메틸-2-부텐-1-올과 같음), 또는 상기의 둘 이상이라면 모두를 포함한다. 일정 구현예에서, 이소프렌 조성물은 약 0.01 내지 약 80, 약 0.01 내지 약 60, 약 0.01 내지 약 40, 약 0.01 내지 약 30, 약 0.01 내지 약 20, 약 0.01 내지 약 10, 약 0.1 내지 약 80, 약 0.1 내지 약 60, 약 0.1 내지 약 40, 약 5 내지 약 80, 약 5 내지 약 60, 또는 약 5 내지 약 40과 같은 약 0.005 내지 약 120 μg/L사이 범위의 에탄올, 아세톤, C5 프레닐 알코올 또는 상기 둘 이상이라면 모두를 포함한다.
일정 구현예에서, 이소프렌 조성물은 다음의 성분의 하나 이상을 포함한다: 2-헵탄온, 6-메틸-5-헵텐-2-온, 2,4,5-트리메틸피리딘, 2,3,5-트리메틸피라진, 시트로넬랄 (citronellal), 아세트알데하이드, 메탄티올, 메틸 아세테이트, 1-프로판올, 디아세틸, 2-부탄온, 2-메틸-3-부텐-2-올, 에틸 아세테이트, 2-메틸-1-프로판올, 3-메틸-1-부탄알, 3-메틸-2-부탄온, 1-부탄올, 2-펜탄온, 3-메틸-1-부탄올, 에틸 이소부틸레이트, 3-메틸-2-부텐알, 부틸 아세테이트, 3-메틸부틸 아세테이트, 3-메틸-3-부텐-1-일 아세테이트, 3-메틸-2-부텐-1-일 아세테이트, 3-헥센-1-올, 3-헥센-1-일 아세테이트, 리모넨, 게라니올 (트랜스-3,7-디메틸-2-부텐-1-일 아세테이트), 시트로넬롤 (3,7-디메틸-6-옥텐-1-올), (E)-3,7-디메틸-1,3,6-옥타트리엔, (Z)-3,7-디메틸-1,3,6-옥타트리엔, 2,3-사이클로헵텐올피리딘, 또는 직선상 이소프렌 중합체 (복수의 이소프렌 단위의 다중합으로부터 유래한 직선상 이소프렌 이중체 또는 직선상 이소프렌 삼중체와 같음). 다양한 구현예에서, 무게에 의한 퍼센트 단위로 이소프렌량에 상대적인 이들 성분 하나의 양 (예로, 이소프렌의 무게로 나눈 성분의 무게 곱하기 100)은 약 0.01, 0.02, 0.05, 0.1, 0.5, 1, 5, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 또는 110% (w/w) 이상이다. 일정 구현예에서, 두 번째 성분에 대한 상대적인 검출기 반응은 이소프렌에 대한 검출기 반응과 대비하여 약 0.01, 0.02, 0.05, 0.1, 0.5, 1, 5, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 또는 110% (w/w) 이상이다. 다양한 구현예에서, 무게에 의한 퍼센트 단위로 이소프렌량에 상대적인 이들 성분 하나의 양 (예로, 이소프렌의 무게로 나눈 성분의 무게 곱하기 100)은 약 0.01 내지 약 90, 약 0.01 내지 약 80, 약 0.01 내지 약 50, 약 0.01 내지 약 20, 약 0.01 내지 약 10, 약 0.02 내지 약 50, 약 0.05 내지 약 50, 약 0.1 내지 약 50, 또는 약 0.1 내지 약 20% (w/w)와 같은 약 0.01 내지 약 105% 사이의 범위이다.
일정 구현예에서, 이소프렌 조성물은 하기의 하나 이상을 포함한다: 알코올, 알데하이드, 또는 케톤 (본 명세서에서 기술된 알코올, 알데하이드, 또는 케톤이라면 모두와 같음). 일정 구현예에서, 이소프렌 조성물은 (i) 알코올 및 알데하이드, (ii) 알코올 및 케톤, (iii) 알데하이드 및 케톤, 또는 (iv) 알코올, 알데하이드, 및 케톤을 포함한다.
일정 구현예에서, 이소프렌 조성물은 다음의 하나 이상을 포함한다: 메탄올, 아세트알데하이드, 에탄올, 메탄티올, 1-부탄올, 3-메틸-1-프로판올, 아세톤, 아세트산, 2-부탄온, 2-메틸-1-부탄올, 또는 인돌. 일정 구현예에서, 이소프렌 조성물은 1 ppm 이상의 다음의 하나 이상을 포함한다: 메탄올, 아세트알데하이드, 에탄올, 메탄티올, 1-부탄올, 3-메틸-1-프로판올, 아세톤, 아세트산, 2-부탄온, 2-메틸-1-부탄올, 또는 인돌. 일정 구현예에서, 이소프렌 조성물 (정제되기 이전의 배출-기체와 같음)에 있는 다음의 하나 이상, 메탄올, 아세트알데하이드, 에탄올, 메탄티올, 1-부탄올, 3-메틸-1-프로판올, 아세톤, 아세트산, 2-부탄온, 2-메틸-1-부탄올, 또는 인돌:의 농도는 약 1 내지 약 10,000 ppm 사이의 범위이다. 일정 구현예에서, 이소프렌 조성물 (하나 이상의 정제 단계를 거친 이후의 배출-기체와 같음)은 다음의 하나 이상, 메탄올, 아세트알데하이드, 에탄올, 메탄티올, 1-부탄올, 3-메틸-1-프로판올, 아세톤, 아세트산, 2-부탄온, 2-메틸-1-부탄올, 또는 인돌:을 약 1 내지 약 10 ppm, 약 10 내지 약 20 ppm, 약 20 내지 약 30 ppm, 약 30 내지 약 40 ppm, 약 40 내지 약 50 ppm, 약 50 내지 약 60 ppm, 약 60 내지 약 70 ppm, 약 70 내지 약 80 ppm, 약 80 내지 약 90 ppm, 또는 약 90 내지 약 100 ppm과 같은 약 1 내지 약 100 ppm 사이 범위의 농도로 포함한다. 세포 배양액으로부터 나온 휘발성 유기 화합물 (세포 배양액의 상부공간에 있는 휘발성 유기 화합물과 같음)은 본 명세서에서 기술된 것과 같은 표준 방법 또는 양성자 전달 반응-질량 분광측정법 (proton transfer reaction-mass spectrometry)과 같은 기타 표준 방법 (예를 들어, Bunge et al., Applied and Environmental Microbiology, 74(7):2179-2186, 2008를 참조하고, 이는 본 명세서에서 참고문헌으로 전부, 상세하게는 휘발성 유기 화합물의 분석에 관하여 통합되어 있다)을 사용하여 분석될 수 있다.
일정 구현예에서, 조성물은 약 5, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 200, 300, 400, 500, 600, 700, 800, 900, 또는 1000 mg 이상의 이소프렌과 같은 약 2 mg 이상의 이소프렌을 포함한다. 일정 구현예에서, 조성물은 약 2, 5, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100 g 이상의 이소프렌을 포함한다. 일정 구현예에서, 조성물에 있는 이소프렌량은 약 2 내지 약 100 mg, 약 100 내지 약 500 mg, 약 500 내지 약 1,000 mg, 약 1,000 내지 약 2,000 mg, 또는 약 2,000 내지 약 5,000 mg과 같은 약 2 내지 약 5,000 mg 사이의 범위이다. 일정 구현예에서, 조성물에 있는 이소프렌량은 약 20 내지 약 5,000 mg, 약 100 내지 약 5,000 mg, 약 200 내지 약 2,000 mg, 약 200 내지 약 1,000 mg, 약 300 내지 약 1,000 mg, 또는 약 400 내지 약 1,000 mg 사이의 범위이다. 일정 구현예에서, 휘발성 유기 분획의 무게로 약 20, 25, 30, 40, 50, 60, 70, 80, 90, 또는 95% 이상이 이소프렌이다.
일정 구현예에서, 조성물은 에탄올을 포함한다. 일정 구현예에서, 조성물은 에탄올을 무게로 약 75 내지 약 80%, 약 80 내지 약 85%, 약 85 내지 약 90% 사이와 같은 에탄올을 무게 약 75 내지 약 90% 사이 범위로 포함한다. 조성물이 에탄올을 포함하는 일정 구현예에서, 조성물은 또한 이소프렌을 무게로 약 4 내지 약 8%, 약 8 내지 약 12%, 약 12 내지 약 15% 사이와 같은 에탄올을 무게 약 4 내지 약 15% 사이의 범위로 포함한다.
본 명세서에서 기술된 일정 구현예에서, 이소프렌 합성효소 폴리펩타이드, DXS 폴리펩타이드, IDI 폴리펩타이드, 및/또는 MVA 경로 폴리펩타이드를 인코딩하는 하나 이상의 이종유래 핵산을 포함하는 세포는 이소프레노이드 화합물 (하나 이상의 DMAPP 분자와 하나 이상의 IPP 분자의 반응으로부터 형성되고 10개 이상의 탄소 원자를 가진 화합물과 같음)을 하나 이상의 이종유래 핵산은 없지만 필수적으로 동일한 조건 하에서 성장한 해당하는 세포로부터 생산된 이소프레노이드 화합물의 양보다 약 2배, 3배, 5배, 10배, 25배, 50배, 100배, 150배, 200배, 또는 400배 이상의 양으로 생산한다. 본 명세서에서 기술된 일정 구현예에서, 이소프렌 합성효소 폴리펩타이드, DXS 폴리펩타이드, IDI 폴리펩타이드, 및/또는 MVA 경로 폴리펩타이드를 인코딩하는 하나 이상의 이종유래 핵산을 포함하는 세포는 C5 프레닐 알코올 (3-메틸-3-부텐-1-올 또는 3-메틸-2-부텐-1-올과 같음)을 하나 이상의 이종유래 핵산은 없지만 필수적으로 동일한 조건 하에서 성장한 해당하는 세포로부터 생산된 C5 프레닐 알코올의 양보다 약 2배, 3배, 5배, 10배, 25배, 50배, 100배, 150배, 200배, 또는 400배 이상의 양으로 생산한다.
대표적인 바이오이소프렌 및 수소의 공동-생산
일정 구현예에서, 프로모터에 작동적으로 연결된 이소프렌 합성효소 폴리펩타이드, DXS 폴리펩타이드, IDI 폴리펩타이드, 및/또는 MVA 경로 폴리펩타이드를 인코딩하는 하나 이상의 이종유래 핵산을 포함하는 본 명세서에서 기술된 이소프렌-생산하는 세포라면 모두가 좀 더 나아가 하나 이상의 수소화효소 폴리펩타이드 또는 수소화효소 폴리펩타이드의 조절 및 발현에 관여하는 하나 이상의 폴리펩타이드(예로, 수소화효소 성숙 단백질 또는 전사인자)를 인코딩하고 프로모터에도 역시 작동적으로 연결된 이종유래 핵산을 포함한다. 일정 구현예에서, 프로모터에 작동적으로 연결된 이소프렌 합성효소 폴리펩타이드, DXS 폴리펩타이드, IDI 폴리펩타이드, MVA 경로 폴리펩타이드, 하나 이상의 수소화효소 폴리펩타이드 또는 수소화효소 폴리펩타이드의 조절 및 발현에 관여하는 하나 이상의 폴리펩타이드를 인코딩하는 하나 이상의 이종유래 핵산을 포함하는 본 명세서에서 기술된 이소프렌-생산하는 세포라면 모두가 좀 더 나아가 발효 부산물의 생산에 관여하는 하나 이상의 폴리펩타이드, 발효 부산물의 생산을 위한 유전자의 조절 또는 발현에 관여하는 하나 이상의 폴리펩타이드, 또는 수소 재흡수에 관여하는 하나 이상의 폴리펩타이드를 불활성화하는 돌연변이 또는 결실을 포함한다. 이러한 세포는 이소프렌과 수소를 공동-생산할 수 있다.
본 명세서에서 기술된 관점이라면 모두의 일정 구현예에서, 세포는 그램-양성 박테리아 세포와 같은 박테리아 세포이다 (예로, 바실러스 섭틸리스와 같은 바실러스 세포, 또는 스트렙토마이세스 리비단스 (Streptomyces lividans), 스트렙토마이세스 실리컬러 (Streptomyces coelicolor), 또는 스트렙토마이세스 그리서스 (Streptomyces griseus) 세포와 같은 스트렙토마이세스 세포). 본 명세서에서 기술된 관점이라면 모두의 일정 구현예에서, 세포는 그램-음성 박테리아 세포이다 (예로, 에스케리키아 콜라이 (Escherichia coli) 세포와 같은 에스케리키아 (Escherichia) 세포, 로도슈도모나스 팔루스트리스 세포와 같은 로도모나스 종 세포, 슈도모나스 플루오레센스 (Pseudomonas fluorescens) 세포 또는 슈도모나스 푸티다 세포와 같은 슈도모나스 종 세포, 또는 판토에아 시트레아 세포와 같은 판토에아 세포). 본 명세서에서 기술된 관점이라면 모두의 일정 구현예에서, 세포는 필라멘트성 곰팡이 세포와 같은 곰팡이 세포 (예로, 트리코더마 리세이 세포와 같은 트리코더마 세포 또는 아스퍼질러스 오리자이 (Aspergillus oryzae) 및 아스퍼질러스 니거 (Aspergillus niger)와 같은 아스퍼질러스 세포) 또는 효모 세포 (예로, 야로위야 리포리티카 (Yarrowia lipolytica)와 같은 야로위야 세포 또는 사카로마이세스 세레비시애와 같은 사카로마이세스 세포)이다.
본 명세서에서 기술된 관점이라면 모두의 일정 구현예에서, 이소프렌 합성효소 폴리펩타이드는 푸엘라리아 (Pueraria) (예로, 푸엘라리아 몬타나 (Pueraria montana) 또는 푸엘라리아 로바타 (Pueraria lobata)) 또는 포풀러스 (Populus) (예로, 포풀러스 트레물로이데스 (Populus tremuloides), 포풀러스 알바 (Populus alba), 포풀러스 니그라 (Populus nigra), 포풀러스 트리코카르파 (Populus trichocarpa), 또는 하이브리드 포풀러스 알바 x 포풀러스 트레물라 (Populus alba x Populus tremula))로부터 나온 폴리펩타이드이다.
본 명세서에서 기술된 관점이라면 모두의 일정 구현예에서, 세포는 좀 더 나아가 IDI 폴리펩타이드를 인코딩하는 이종유래 핵산을 포함한다. 본 명세서에서 기술된 관점이라면 모두의 일정 구현예에서, 세포는 좀 더 나아가 IDI 폴리펩타이드를 인코딩하는 이종유래 핵산의 사본의 삽입을 포함한다. 본 명세서에서 기술된 관점이라면 모두의 일정 구현예에서, 세포는 좀 더 나아가 DXS 폴리펩타이드를 인코딩하는 이종유래 핵산을 포함한다. 본 발명의 관점이라면 모두의 일정 구현예에서, 세포는 좀 더 나아가 DXS 폴리펩타이드를 인코딩하는 이종유래 핵산 사본의 삽입을 포함한다. 본 명세서에서 기술된 관점이라면 모두의 일정 구현예에서, 세포는 좀 더 나아가 IDI 폴리펩타이드 및 DXS 폴리펩타이드를 인코딩하는 하나 이상의 핵산을 포함한다. 본 명세서에서 기술된 관점이라면 모두의 일정 구현예에서, 하나의 핵산은 이소프렌 합성효소 폴리펩타이드, IDI 폴리펩타이드, 및 DXS 폴리펩타이드를 인코드한다. 본 명세서에서 기술된 관점이라면 모두의 일정 구현예에서, 하나의 벡터는 이소프렌 합성효소 폴리펩타이드, IDI 폴리펩타이드, 및 DXS 폴리펩타이드를 인코드한다. 일정 구현예에서, 벡터는 항생제 저항성 핵산과 같은 선별 마커 (selective marker) 또는 선별가능한 (selectable marker) 마커를 포함한다.
본 명세서에서 기술된 관점이라면 모두의 일정 구현예에서, 세포는 좀 더 나아가 MVA 경로 폴리펩타이드 (사카로마이세스 세레비시애 또는 엔테로코커스 페칼리스 (Enterococcus faecalis)로부터 나온 MVA 경로 폴리펩타이드)를 인코딩하는 이종유래 핵산을 포함한다. 본 명세서에서 기술된 관점이라면 모두의 일정 구현예에서, 세포는 좀 더 나아가 MVA 경로 폴리펩타이드 (사카로마이세스 세레비시애 또는 엔테로코커스 페칼리스로부터 나온 MVA경로 폴리펩타이드)를 인코딩하는 이종유래 핵산 사본의 삽입을 포함한다. 본 명세서에서 기술된 관점이라면 모두의 일정 구현예에서, 세포는 이소프렌 합성효소, DXS, 및 MVA 경로 핵산을 포함한다. 본 명세서에서 기술된 관점이라면 모두의 일정 구현예에서, 세포는 이소프렌 합성효소 핵산, DXS 핵산, IDI 핵산 및 MVA 경로 핵산을 포함한다.
일정 구현예에서, 본 명세서에서 기술된 이소프렌-생산하는 세포는 좀 더 나아가 프로모터에 작동적으로 연결된 수소화효소 폴리펩타이드를 인코딩하는 이종유래 핵산을 포함한다. 일정 구현예에서, 수소화효소 폴리펩타이드는 E. coli 수소화효소-1 (Hyd-1), E. coli 수소화효소-2 (Hyd-2), E. coli 수소화효소-3 (Hyd-3), E. coli 수소화효소-4 (Hyd-4), 산성 pH의 혐기성 조건 하에서 포르메이트와 CO2 로부터 수소 기체를 생산하는 E. coli 포르메이트수소 용해효소 (formate hydrogen lyase, FHL) 복합체, 로도코커스 오파쿠스 (Rhodococcus opacus) MR11 수소화효소 (R. opacus HoxH), 시네코시스티스 종 (Synechosystis sp.) PCC 6803 수소화효소 (Syn. PCC 6803 HoxH), 디설포비브리오 기가스 (Desulfovibrio gigas) 수소화효소 (D. gigas), 및 디설포비브리오 디설퓨리칸스 (Desulfovibrio desulfuricans) ATCC 7757 (D. desulfuricans) 수소화효소를 포함한다. 일정 구현예에서, 프로모터에 작동적으로 연결된 수소화효소 폴리펩타이드를 인코딩하는 이종유래 핵산을 좀 더 나아가 포함하는 이소프렌-생산하는 세포는 좀 더 나아가 E. coli 수소화효소 -3 (Hyd-3), E. coli 피루베이트 포르메이트 용해효소 (pyruvate formate lyase, pfl), 및 E. coli 포르메이트 수소 용해효소 (FHL) 복합체를 포함한다.
일정 구현예에서, 수소화효소 폴리펩타이드는 페로레독신-의존성 수소화효소 폴리펩타이드를 인코드한다. 일정 구현예에서, 페로레독신-의존성 수소화효소 폴리펩타이드는 크로스트리듐 아세토부툴리쿰 수소화효소 A (HydA)를 포함하고, 이는 하기 하나 이상의 (1) 바실러스 섭틸리스 NADPH 페로레독신 산화환원효소 (NFOR), 크로스트리듐 클루이베리 NADH 페로레독신 산화환원효소 (RnfCDGEAB), 또는 클로스트리듐 파스퇴라니움 페로레독신 산화환원효소 (Fdx); (2) 글리세르알데하이드-6-포스페이트 페로레독신 산화환원효소 (GAPOR); 또는 (3) 피루베이트 페로레독신 산화환원효소 (POR):와 결합하여 발현될 수 있다. 일정 구현예에서, 페로레독신-의존성 수소화효소 폴리펩타이드 크로스트리듐 아세토부툴리쿰 수소화효소 A (HydA)는 세 가지의 HydA-관련 성숙 효소 (HydE, HydG, 및 HydF)와 함께 발현되고, 좀 더 나아가 하나 이상의: (1) 바실러스 섭틸리스 NADPH 페로레독신 산화환원효소 (NFOR), 크로스트리듐 클루이베리 NADH 페로레독신 산화환원효소 (RnfCDGEAB), 또는 크로스트리듐 파스퇴라니움 페로레독신 산화환원효소 (Fdx); (2) 글리세르알데하이드-6-포스페이트 페로레독신 산화환원효소 (GAPOR); 또는 (3) 피루베이트 페로레독신 산화환원효소 (POR):와 결합하여 발현된다.
일정 구현예에서, 수소화효소 폴리펩타이드는 NADPH-의존성 수소화효소 폴리펩타이드를 인코드한다. 일정 구현예에서, NADPH-의존성 수소화효소 폴리펩타이드는 파이로코커스 푸리오서스 (Pyrococcus furiosus) 수소화효소를 포함한다. 일정 구현예에서, 수소화효소 폴리펩타이드는 산소-내성 수소화효소를 인코드한다. 일정 구현예에서, 산소-내성 수소화효소는 루브리비박스 젤라티노서스 (Rubrivivax gelatinosus) 수소화효소 및 랄스토니아 유트로파 (Ralstonia eutropha) 수소화효소를 포함한다.
일정 구현예에서, 본 명세서에 기술된 이소프렌-생산하는 세포는 좀 더 나아가 철-황 복합체 전사인자 (iscR) 와 같은 수소화효소 활성의 조절에 관여하는 유전자를 불활성화하는 돌연변이 또는 결실을 포함한다 (Kalim-Akhtar et al., "Deletion of iscR stimulates recombinant Clostridial Fe/Fe hydrogenase activity and H2-accumulation in Escherichia coli BL21(DE3)," Appl. Microbiol. Biotechnol. 78:853-862 (2008), 이는 본 명세서에서 참고문헌으로 상세하게는 iscR 유전자의 결실에 의한 대장균에서 크로스트리디아 Fe/Fe 수소화효소 활성의 촉진 및 수소 축적에 관하여 통합되어 있다).
일정 구현예에서, 본 명세서에 기술된 이소프렌-생산하는 세포는 좀 더 나아가 락테이트, 아세테이트, 피루베이트, 에탄올, 숙시네이트, 및 글리세롤과 같은 발효 부산물의 생산에 관여하는 하나 이상의 세포성 폴리펩타이드를 인코딩하는 유전자를 불활성화하는 돌연변이 또는 결실을 포함한다. 일정 구현예에서, 발효 부산물의 생산에 관여하는 불활성화된 폴리펩타이드는 포르메이트 탈수소화효소 N, 알파 소단위 (fdnG), 포르메이트 탈수소화효소 O, 큰 소단위 (fdoG), 나이트레이트 환원효소 (narG), 포르메이트 전달자 A (formate transporter A, focA), 포르메이트 전달자 B (focB), 피루베이트 산화효소 (poxB), 피루베이트 탈수소화효소 E1 성분 ackA/pta (aceE), 알코올 탈수소화효소 (adhE), 푸마레이트 환원효소 막 단백질 (frdC), 또는 락테이트 탈수소화효소 (ldhA)를 인코딩하는 하나 이상의 폴리펩타이드를 포함한다.
일정 구현예에서, 본 명세서에 기술된 이소프렌-생산하는 세포는 좀 더 나아가 발효 부산물의 생산에 관여하는 유전자의 조절 또는 발현에 관여하는 하나 이상의 세포성 폴리펩타이드를 인코딩하는 유전자를 불활성화하는 돌연변이 또는 결실을 포함한다. 일정 구현예에서, 발효 부산물의 생산에 관여하는 유전자의 조절 또는 발현에 관여하는 불활성화된 폴리펩타이드는 포르메이트 수소 용해효소 (hycA)의 억제인자 (repressor), 푸마레이트 환원효소 조절인자 (fumarate reductase regulator, fnr), 아세틸-코엔자임 A 합성효소 (acs), 및 포르메이트 탈수소화효소 조절 단백질 (hycA)를 포함한다.
일정 구현예에서, 본 명세서에 기술된 이소프렌-생산하는 세포는 좀 더 나아가 수소 재흡수에 관여하는 하나 이상의 세포성 폴리펩타이드를 인코딩하는 유전자를 불활성화하는 돌연변이 또는 결실을 포함한다. 일정 구현예에서, 수소 재흡수에 관여하는 불활성화된 폴리펩타이드는 E. coli 수소화효소-1 (Hyd-1) (hya 오페론) 및 E. coli 수소화효소-2 (Hyd-2) (hyb 오페론)를 포함한다.
본 명세서에서 기술된 관점이라면 모두의 일정 구현예에서, 이종유래 이소프렌 합성효소, DXS폴리펩타이드, IDI 폴리펩타이드, MVA 경로, 수소화효소, 수소화효소 성숙 또는 전사인자 폴리펩타이드 또는 핵산은, 중간 또는 높은 사본수 플라스미드에 포함되는 T7 프로모터와 같은 T7 프로모터에 작동적으로 연결된다. 본 명세서에서 기술된 관점이라면 모두의 일정 구현예에서, 이종유래 이소프렌 합성효소, DXS폴리펩타이드, IDI 폴리펩타이드, MVA 경로, 수소화효소, 수소화효소 성숙 또는 전사인자 핵산은, 중간 또는 높은 사본수 플라스미드에 포함되는 Trc 프로모터와 같은 Trc 프로모터에 작동적으로 연결된다. 본 명세서에서 기술된 관점이라면 모두의 일정 구현예에서, 이종유래 이소프렌 합성효소, DXS폴리펩타이드, IDI 폴리펩타이드, MVA 경로, 수소화효소, 수소화효소 성숙 또는 전사인자 핵산은, 낮은 사본수 플라스미드에 포함되는 Lac 프로모터와 같은 Lac 프로모터에 작동적으로 연결된다. 본 명세서에서 기술된 관점이라면 모두의 일정 구현예에서, 이종유래 이소프렌 합성효소, DXS폴리펩타이드, IDI 폴리펩타이드, MVA 경로, 수소화효소, 수소화효소 성숙 또는 전사인자 핵산은, 내재성 알칼라인 세린 프로테아제 프로모터와 같은 내재성 프로모터에 작동적으로 연결된다. 본 명세서에서 기술된 관점이라면 모두의 일정 구현예에서, 이종유래 이소프렌 합성효소, DXS폴리펩타이드, IDI 폴리펩타이드, MVA 경로, 수소화효소, 수소화효소 성숙 또는 전사인자 핵산은 선별 마커가 없거나 선별가능한 마커가 없는 세포의 염색체 내로 도입된다.
일정 구현예에서, 하나 이상의 MVA 경로, IDI, DXS, 이소프렌 합성효소, 수소화효소, 수소화효소 성숙 또는 전사인자 핵산은 성장기보다는 안정기에 활성이 더 큰 프로모터 또는 인자의 조절 하에 놓인다. 예를 들어, 하나 이상의 MVA 경로, IDI, DXS, 이소프렌 합성효소, 수소화효소, 수소화효소 성숙 또는 전사인자 핵산은 RopS와 같은 안정기 시그마인자 (stationary phase sigma factor)의 조절 하에 놓인다. 일정 구현예에서, 하나 이상의 MVA 경로, IDI, DXS, 이소프렌 합성효소, 수소화효소, 수소화효소 성숙 또는 전사인자 핵산은 안정기에 활성이 있는 반응 조절인자에 의해 유도가능한 프로모터와 같은, 안정기에 유도가능한 프로모터의 조절 하에 놓인다.
본 명세서에서 기술된 관점이라면 모두의 일정 구현예에서, 적어도 세포의 일정 부분은 이종유래 이소프렌 합성효소, DXS폴리펩타이드, IDI 폴리펩타이드, MVA 경로, 수소화효소, 수소화효소 성숙 또는 전사인자 핵산을 연속식 배양 (희석이 없는 연속식 배양과 같음)에서 적어도 또는 약 5, 10, 20, 40, 50, 60 또는 65회 이상의 세포 분열 동안 유지시킨다. 본 명세서에서 기술된 관점이라면 모두의 일정 구현예에서, 이종유래 이소프렌 합성효소, DXS폴리펩타이드, IDI 폴리펩타이드, MVA 경로, 수소화효소, 수소화효소 성숙 또는 전사인자 핵산을 포함하는 핵산도 또한 항생제 저항성 핵산과 같은 선별 마커 또는 선택가능한 마커를 포함한다.
본 명세서에서 기술된 관점이라면 모두의 일정 구현예에서, 이소프렌과 수소를 공동-생산하는 세포는 본 명세서에서 기술된 배양 배지라면 모두에서 세포에 의한 이소프렌과 수소의 공동-생산을 용이하게 하는 산소-제한된 조건 하에서 배양된다. 일정 구현예에서, 세포는 산소-제한된 배양에서 성장된다. 일정 구현예에서, 세포는 이소프렌 몰 당 0.5 몰의 산소 존재 시 성장된다. 일정 구현예에서, 세포는 산소 부재 시 혐기적으로 성장된다.
일정 구현예에서, 본 명세서에서 기술된 세포라면 모두는 산소-제한된 배양에서 성장되고 이소프렌과 수소를 공동-생산한다. 일정 구현예에서, 산소-제한된 배양에서의 세포는 약 400 nmole/gwcm/시간보다 큰 속도로 이소프렌을 생산하고, 약 125 nmole/gwcm/시간보다 큰 속도로 수소를 생산한다. 일정 구현예에서, 산소-제한된 배양에서의 세포는 약 400 nmole/gwcm/시간 내지 약 2.0 x 105 nmole/gwcm/시간 사이의 속도로 이소프렌을 생산하고, 약125 nmole/gwcm/시간 내지 약 1.25 x 104 nmole/gwcm/시간 사이의 속도로 수소를 생산한다. 일정 구현예에서, 산소-제한된 배양에서의 세포는 약 400 nmole/gwcm/시간 내지 약 2.0 x 105 nmole/gwcm/시간 사이, 약 500 nmole/gwcm/시간 내지 약 1.5 x 105 nmole/gwcm/시간 사이, 약 750 nmole/gwcm/시간 내지 약 1 x 105 nmole/gwcm/시간 사이, 약 1,000 nmole/gwcm/시간 내지 약 1 x 105 nmole/gwcm/시간 사이, 약 2500 nmole/gwcm/시간 내지 약 1 x 105 nmole/gwcm/시간 사이, 약 5000 nmole/gwcm/시간 내지 약 1 x 105 nmole/gwcm/시간 사이, 약 7500 nmole/gwcm/시간 내지 약 1 x 105 nmole/gwcm/시간 사이, 및 약 1 x 104 nmole/gwcm/시간 내지 약 1 x 105 nmole/gwcm/시간 사이의 속도로 이소프렌을 생산한다. 일정 구현예에서, 산소-제한된 배양에서의 세포는 약 400, 500, 600, 700, 800, 900, 1,000, 1,250, 1,500, 1,750, 2,000, 2,500, 3,000, 4,000, 또는 5,000 이상 nmole/gwcm/시간으로 이소프렌을 생산한다. 일정 구현예에서, 산소-제한된 배양에서의 세포는 약 125 nmole/gwcm/시간 내지 약 1.25 x 104 nmole/gwcm/시간 사이, 약 250 nmole/gwcm/시간 내지 약 1.25 x 104 nmole/gwcm/시간 사이, 약 500 nmole/gwcm/시간 내지 약 1.25 x 104 nmole/gwcm/시간 사이, 약 750 nmole/gwcm/시간 내지 약 1.25 x 104 nmole/gwcm/시간 사이, 약 1,000 nmole/gwcm/시간 내지 약 1.25 x 104 nmole/gwcm/시간 사이, 약 1,250 nmole/gwcm/시간 내지 약 1.25 x 104 nmole/gwcm/시간 사이, 약 2,500 nmole/gwcm/시간 내지 약 1.25 x 104 nmole/gwcm/시간 사이, 약 5,000 nmole/gwcm/시간 내지 약 1.25 x 104 nmole/gwcm/시간 사이, 약 7,500 nmole/gwcm/시간 내지 약 1.25 x 104 nmole/gwcm/시간 사이, 및 약 1.00 x 104 nmole/gwcm/시간 내지 약 1.25 x 104 nmole/gwcm/시간 사이의 속도로 수소를 생산한다. 일정 구현예에서, 산소-제한된 배양에서의 세포는 약 125, 250, 500, 750, 1000, 1,250, 1,500, 1,750, 2,000, 2,500, 3,000, 4,000, 5,000, 7,500, 또는 10,000 이상 nmole/gwcm/시간으로 수소를 생산한다.
일정 구현예에서, 본 명세서에서 기술된 세포라면 모두는 산소-제한된 배양에서 성장되고 이소프렌과 수소를 공동-생산한다. 일정 구현예에서, 산소-제한된 배양에서의 세포는 약 0.1 mg/L액체배지/시간 이상의 이소프렌의 평균 부피측정 생산도 및 약 0.005 mg/L액체배지/시간 이상의 수소의 평균 부피측정 생산도를 가진다. 일정 구현예에서, 산소-제한된 배양에서의 세포는 약 1,000 mg/L액체배지/시간 이상의 이소프렌의 피크 부피측정 생산도 및 약 5 mg/L액체배지/시간 이상의 피크 부피측정 생산도를 가진다. 일정 구현예에서, 산소-제한된 배양에서의 세포는 약 3,000 mg/L액체배지/시간 이상의 이소프렌의 피크 부피측정 생산도 및 약 5 mg/L액체배지/시간 이상의 피크 부피측정 생산도를 가진다. 일정 구현예에서, 산소-제한된 배양에서의 세포는 약 5,000 mg/L액체배지/시간 이상의 이소프렌의 피크 부피측정 생산도 및 약 5 mg/L액체배지/시간 이상의 피크 부피측정 생산도를 가진다. 일정 구현예에서, 산소-제한된 배양에서의 세포는 약 0.1 mg/L액체배지/시간 및 약 5,000 mg/L액체배지/시간 사이의 이소프렌의 평균 부피측정 생산도 및 약0.005 mg/L액체배지/시간 및 약 5 mg/L액체배지/시간 사이의 수소의 평균 부피측정 생산도를 가진다. 일정 구현예에서, 산소-제한된 배양에서의 세포는 약 1 mg/L액체배지/시간 및 약 5,000 mg/L액체배지/시간, 약 5 mg/L액체배지/시간 및 약 5,000 mg/L액체배지/시간, 약 10 mg/L액체배지/시간 및 약 5,000 mg/L액체배지/시간, 약 25 mg/L액체배지/시간 및 약 5,000 mg/L액체배지/시간, 약 50 mg/L액체배지/시간 및 약 5,000 mg/L액체배지/시간, 약 100 mg/L액체배지/시간 및 약 5,000 mg/L액체배지/시간, 약 250 mg/L액체배지/시간 및 약 5,000 mg/L액체배지/시간, 약 500 mg/L액체배지/시간 및 약 5,000 mg/L액체배지/시간, 약 1,000 mg/L액체배지/시간 및 약 5,000 mg/L액체배지/시간, 및 약 2500 mg/L액체배지/시간 및 약 5,000 mg/L액체배지/시간 사이의 이소프렌의 평균 부피측정 생산도, 또한 약0.01 mg/L액체배지/시간 및 약 5 mg/L액체배지/시간 사이, 약0.025 mg/L액체배지/시간 및 약 5 mg/L액체배지/시간 사이, 약0.05 mg/L액체배지/시간 및 약 5 mg/L액체배지/시간 사이, 약0.1 mg/L액체배지/시간 및 약 5 mg/L액체배지/시간 사이, 약0.25 mg/L액체배지/시간 및 약 5 mg/L액체배지/시간 사이, 약0.5 mg/L액체배지/시간 및 약 5 mg/L액체배지/시간 사이, 약1 mg/L액체배지/시간 및 약 5 mg/L액체배지/시간 사이, 및 약2.5 mg/L액체배지/시간 및 약 5 mg/L액체배지/시간 사이 의 수소의 평균 부피측정 생산도를 가진다.
일정 구현예에서, 본 명세서에서 기술된 세포라면 모두는 산소-제한된 배양에서 성장되고 이소프렌과 수소를 공동-생산한다. 일정 구현예에서, 산소-제한된 배양에서의 세포는 세포가 세포 배양 배지로부터 이소프렌으로 연소되는 탄소의 약 0.002 몰라 퍼센트 이상을 이소프렌으로 전환시키고, 또한 세포가 세포 배양 배지로부터 연소하는 탄소의 약0.024 몰라 퍼센트 이상과 동등한 수소를 생산한다. 일정 구현예에서, 산소-제한된 배양에서의 세포는 세포가 세포 배양 배지로부터 이소프렌으로 연소되는 탄소의 약 0.002 몰라 퍼센트 이상을 이소프렌으로 전환시키고, 또한 세포가 세포 배양 배지로부터 연소하는 탄소의 약 400 몰라 퍼센트 이상과 동등한 수소를 생산한다.
일정 구현예에서, 본 명세서에서 기술된 세포라면 모두는 산소-제한된 배양에서 성장되고 이소프렌과 수소를 공동-생산한다. 일정 구현예에서, 산소-제한된 배양에서의 세포는 3 몰라 퍼센트의 수소마다 적어도 1 몰라 퍼센트의 이소프렌으로부터 4 몰라 퍼센트의 수소마다 적어도 1 몰라 퍼센트의 이소프렌까지의 범위에 이르는 비율로 이소프렌과 수소를 포함한다. 일정 구현예에서, 산소-제한된 배양에서의 세포는 1부터 11 몰라 퍼센트까지의 이소프렌, 또한 3부터 33 몰라 퍼센트까지의 수소를 포함하는 배출-기체를 생산한다. 일정 구현예에서, 세포는 1부터 11 몰라 퍼센트까지의 이소프렌, 또한 4부터 44 몰라 퍼센트까지의 수소를 생산한다. 일정 구현예에서, 산소-제한된 배양에서의 세포는 산소, 이산화탄소, 또는 질소를 포함하는 배출-기체를 생산한다. 일정 구현예에서, 산소-제한된 배양에서의 세포는 0부터 21몰라 퍼센트까지의 산소, 18부터 44 몰라 퍼센트까지의 이산화탄소, 및 1부터 78 몰라 퍼센트까지의 질소를 포함하는 배출-기체를 생산한다.
또 다른 관점에서, 본 명세서에서는 이소프렌 합성효소 폴리펩타이드를 인코딩하는 이종유래 핵산을 포함하는 이소프렌 및 수소를 공동-생산하는 세포가 제공되고, 여기에서 세포는: (i) 이소프렌을 약 400 nmole/gwcm/시간 이상으로 생산하고 수소를 약 125 nmole/gwcm/시간 이상으로 생산하며; (ii) 약 0.1 mg/L액체배지/시간 이상의 이소프렌의 평균 부피측정 생산도 및 약 0.005 mg/L액체배지/시간 이상의 수소의 평균 부피측정 생산도를 가지고; 또는 (iii) 세포가 세포 배양 배지로부터 연소하는 탄소의 약 0.002 몰라 퍼센트 이상을 이소프렌으로 전환시키고, 또한 세포가 세포 배양 배지로부터 연소하는 탄소의 약 0.024 몰라 퍼센트 이상과 동등한 수소를 생산한다.
일정 구현예에서, 산소-제한된 배양에서 세포는 이소프렌 합성효소 폴리펩타이드를 인코딩하는 이종유래 핵산을 포함하고, 여기에서 이종유래 핵산은 프로모터에 작동적으로 연결되고, 세포는 이소프렌을 약 400 nmole/gwcm/시간 이상으로 및 수소를 약 125 nmole/gwcm/시간 이상으로 생산한다. 일정 구현예에서, 산소-제한된 배양에서 세포는 이소프렌 합성효소 폴리펩타이드를 인코딩하는 이종유래 핵산을 포함하고, 여기에서 이종유래 핵산은 프로모터에 작동적으로 연결되고, 세포는 약 0.1 mg/L액체배지/시간 이상의 이소프렌의 평균 부피측정 생산도 및 약 0.005 mg/L액체배지/시간 이상의 수소의 평균 부피측정 생산도를 가진다. 일정 구현예에서, 산소-제한된 배양에서 세포는 이소프렌 합성효소 폴리펩타이드를 인코딩하는 이종유래 핵산을 포함하고, 여기에서 이종유래 핵산은 프로모터에 작동적으로 연결되고, 세포는 세포가 세포 배양 배지로부터 연소하는 탄소의 약 0.002 몰라 퍼센트 이상을 이소프렌으로, 또한 세포가 세포 배양 배지로부터 연소하는 탄소의 약 0.024 몰라 퍼센트 이상과 동등한 수소로 전환시킨다. 일정 구현예에서, 이소프렌 합성효소 폴리펩타이드는 식물 이소프렌 합성효소 폴리펩타이드이다.
일정 구현예에서, 이소프렌 합성효소 폴리펩타이드를 인코딩하는 이종유래 핵산을 포함하는 산소-제한된 배양에서 세포는 약 400 nmole/gwcm/시간 내지 약 2.0 x 105 nmole/gwcm/시간 사이, 약 500 nmole/gwcm/시간 내지 약 1.5 x 105 nmole/gwcm/시간 사이, 약 750 nmole/gwcm/시간 내지 약 1 x 105 nmole/gwcm/시간 사이, 약 1,000 nmole/gwcm/시간 내지 약 1 x 105 nmole/gwcm/시간 사이, 약 2500 nmole/gwcm/시간 내지 약 1 x 105 nmole/gwcm/시간 사이, 약 5000 nmole/gwcm/시간 내지 약 1 x 105 nmole/gwcm/시간 사이, 약 7500 nmole/gwcm/시간 내지 약 1 x 105 nmole/gwcm/시간 사이, 및 약 1 x 104 nmole/gwcm/시간 내지 약 1 x 105 nmole/gwcm/시간 사이의 속도로 이소프렌을 생산하고, 약 125 nmole/gwcm/시간 내지 약 1.25 x 104 nmole/gwcm/시간 사이, 약 250 nmole/gwcm/시간 내지 약 1.25 x 104 nmole/gwcm/시간 사이, 약 500 nmole/gwcm/시간 내지 약 1.25 x 104 nmole/gwcm/시간 사이, 약 750 nmole/gwcm/시간 내지 약 1.25 x 104 nmole/gwcm/시간 사이, 약 1,000 nmole/gwcm/시간 내지 약 1.25 x 104 nmole/gwcm/시간 사이, 약 1,250 nmole/gwcm/시간 내지 약 1.25 x 104 nmole/gwcm/시간 사이, 약 2,500 nmole/gwcm/시간 내지 약 1.25 x 104 nmole/gwcm/시간 사이, 약 5,000 nmole/gwcm/시간 내지 약 1.25 x 104 nmole/gwcm/시간 사이, 약 7,500 nmole/gwcm/시간 내지 약 1.25 x 104 nmole/gwcm/시간 사이, 및 약 1.00 x 104 nmole/gwcm/시간 내지 약 1.25 x 104 nmole/gwcm/시간 사이의 속도로 수소를 생산한다.
일정 구현예에서, 본 명세서에서는 이소프렌 및 수소를 공동-생산하는 방법이 제공되고, 방법은 (a) 이소프렌과 수소의 공동-생산에 적합한 조건 하에서 세포를 배양하고; 또한 (b) 이소프렌과 수소를 공동-생산하는 것을 포함하며, 여기에서 세포는 약 400 nmole/Lwem/시간 이상의 이소프렌을 생산하고 약 125 nmole/Lwem/시간 이상의 수소를 생산한다.
일정 구현예에서, 이소프렌 합성효소 폴리펩타이드를 인코딩하는 이종유래 핵산을 포함하는 산소-제한된 배양에서 세포는 약 400 nmole/gwcm/시간 내지 약 2.0 x 105 nmole/gwcm/시간 사이, 약 500 nmole/gwcm/시간 내지 약 1.5 x 105 nmole/gwcm/시간 사이, 약 750 nmole/gwcm/시간 내지 약 1 x 105 nmole/gwcm/시간 사이, 약 1,000 nmole/gwcm/시간 내지 약 1 x 105 nmole/gwcm/시간 사이, 약 2500 nmole/gwcm/시간 내지 약 1 x 105 nmole/gwcm/시간 사이, 약 5000 nmole/gwcm/시간 내지 약 1 x 105 nmole/gwcm/시간 사이, 약 7500 nmole/gwcm/시간 내지 약 1 x 105 nmole/gwcm/시간 사이, 및 약 1 x 104 nmole/gwcm/시간 내지 약 1 x 105 nmole/gwcm/시간 사이의 속도로 이소프렌을 생산하고, 약 125 nmole/gwcm/시간 내지 약 1.25 x 104 nmole/gwcm/시간 사이, 약 250 nmole/gwcm/시간 내지 약 1.25 x 104 nmole/gwcm/시간 사이, 약 500 nmole/gwcm/시간 내지 약 1.25 x 104 nmole/gwcm/시간 사이, 약 750 nmole/gwcm/시간 내지 약 1.25 x 104 nmole/gwcm/시간 사이, 약 1,000 nmole/gwcm/시간 내지 약 1.25 x 104 nmole/gwcm/시간 사이, 약 1,250 nmole/gwcm/시간 내지 약 1.25 x 104 nmole/gwcm/시간 사이, 약 2,500 nmole/gwcm/시간 내지 약 1.25 x 104 nmole/gwcm/시간 사이, 약 5,000 nmole/gwcm/시간 내지 약 1.25 x 104 nmole/gwcm/시간 사이, 약 7,500 nmole/gwcm/시간 내지 약 1.25 x 104 nmole/gwcm/시간 사이, 및 약 1.00 x 104 nmole/gwcm/시간 내지 약 1.25 x 104 nmole/gwcm/시간 사이의 속도로 수소를 생산한다.
일정 구현예에서, 본 명세서에서는 이소프렌 및 수소를 공동-생산하는 방법이 제공되고, 방법은 (a) 이소프렌과 수소의 공동-생산에 적합한 조건 하에서 세포를 배양하고; 또한 (b) 이소프렌과 수소를 공동-생산하는 것을 포함하며, 여기에서 세포는 약 0.1 mg/L액체배지/시간 이상의 이소프렌의 평균 부피측정 생산도 및 0.005 mg/L액체배지/시간 이상의 수소의 평균 부피측정 생산를 가진다.
일정 구현예에서, 본 명세서에서는 이소프렌 및 수소를 공동-생산하는 방법이 제공되고, 방법은 (a) 이소프렌과 수소의 공동-생산에 적합한 조건 하에서 세포를 배양하고; 또한 (b) 이소프렌과 수소를 공동-생산하는 것을 포함하며, 여기에서 세포는 세포가 세포 배양 배지로부터 소비하는 탄소의 약 0.002 몰라 퍼센트 이상을 이소프렌으로 전환시키고, 세포가 세포 배양 배지로부터 소비하는 탄소의 약 0.024 몰라 퍼센트 이상과 동등한 수소를 생산한다.
일정 구현예에서, 본 명세서에서는 이소프렌과 수소를 3 몰라 퍼센트의 수소마다 적어도 1 몰라 퍼센트의 이소프렌으로부터 4 몰라 퍼센트의 수소마다 적어도 1 몰라 퍼센트의 이소프렌까지의 범위에 이르는 비율로 이소프렌과 수소, 또한 0.1 몰라 퍼센트 이하의 휘발성 불순물을 포함하는 조성물이 제공된다. 일정 구현예에서, 조성물은 좀 더 나아가 1부터 11몰라 퍼센트까지의 이소프렌 및 4부터 44까지의 몰라 퍼센트까지의 수소를 포함한다. 일정 구현예에서, 조성물은 좀 더 나아가 산소, 이산화탄소, 또는 질소를 포함한다. 일정 구현예에서, 조성물은 좀 더 나아가 0부터 21몰라 퍼센트까지의 산소, 18부터 44 몰라 퍼센트까지의 이산화탄소, 및 1부터 78 몰라 퍼센트까지의 질소를 포함한다. 일정 구현예에서, 조성물은 좀 더 나아가 1.0 x 10-4 몰라 퍼센트 이하의 비-메탄 휘발성 불순물을 포함한다. 일정 구현예에서, 비-메탄 휘발성 불순물은 다음의 하나 이상을 포함한다: 2-헵탄온 (2-heptanone), 6-메틸-5-헵텐-2-온 (6-methyl-5-hepten-2-one), 2,4,5-트리메틸피리딘 (2,4,5-trimethylpyridine), 2,3,5-트리메틸피라진 (2,3,5-trimethylpyrazine), 시트로넬랄 (citronellal), 아세트알데하이드 (acetaldehyde), 메탄티올 (methanethiol), 메틸 아세테이트 (methyl acetate), 1-프로판올 (1-propanol), 디아세틸(diacetyl), 2-부탄온(2-butanone), 2-메틸-3-부텐-2올 (2-methyl-3-buten-2-ol), 에틸 아세테이트 (ethyl acetate), 2-메틸-1-프로판올 (2-methyl-1-propanol), 3-메틸-1-부탄알 (3-methyl-1-butanal), 3-메틸-2-부탄온 (3-methyl-2-butanone), 1-부탄올 (1-butanol), 2-펜탄온 (2-pentanone), 3-메틸-1-부탄올 (3-methyl-1-butanol), 에틸 이소부틸레이트 (ethyl isobutyrate), 3-메틸-2-부텐알 (3-methyl-2-butenal), 부틸 아세테이트 (butyl acetate), 3-메틸부틸 아세테이트 (3-methylbutyl acetate), 3-메틸-3-부텐-1-일 아세테이트 (3-methyl-3-buten-1-yl acetate), 3-메틸-2-부텐-1-일 아세테이트 (3-methyl-2-buten-1-yl acetate), 3-헥센-1-올 (3-hexen-1-ol), 3-헥센-1-일 아세테이트 (3-hexen-1-yl acetate), 리모넨 (limonene), 제라니올 (geraniol, 트랜스-3,7-디메틸-2,6-옥타디엔-1-올 (trans-3,7-dimethyl-2,6-octadien-1-ol)), 시트로넬롤 (citronellol, 3,7-디메틸-6-옥텐-1-올 (3,7-dimethyl-6-octen-1-ol)), (E)-3,7-디메틸-1,3,6-옥타트리엔 ((E)-3,7-dimethyl-1,3,6-octatriene), (Z)-3,7-디메틸-1,3,6-옥타트리엔 ((Z)-3,7-dimethyl-1,3,6-octatriene), 2,3-사이클로헵텐올피리딘 (2,3-cycloheptenolpyridine), 또는 직쇄상 이소프렌 중합체 (다수의 이소프렌 단위의 다중합반응으로부터 유래된 직쇄상 이소프렌 이중체 또는 직쇄상 이소프렌 삼중체와 같음). 일정 구현예에서, 비-메탄 휘발성 불순물은 다음의 하나 이상을 포함한다: 이소프렌 조성물은 하기의 하나 이상을 포함한다: 알코올, 알데하이드, 또는 케톤 (본 명세서에서 기술된 알코올, 알데하이드, 또는 케톤이라면 모두와 같음). 일정 구현예에서, 이소프렌 조성물은 (i) 알코올 및 알데하이드, (ii) 알코올 및 케톤, (iii) 알데하이드 및 케톤, 또는 (iv) 알코올, 알데하이드 및 케톤을 포함한다. 일정 구현예에서, 비-메탄 휘발성 불순물은 다음의 하나 이상을 포함한다: 메탄올, 아세트알데하이드, 에탄올, 메탄티올, 1-부탄올, 3-메틸-1-프로판올, 아세톤, 아세트산, 2-부탄온, 2-메틸-1-부탄올, 또는 인돌.
또한 본 명세서에서는 이소프렌 및 수소를 공동-생산하는 방법이 제공되고, 방법은 (a) 이소프렌과 수소의 공동-생산에 적합한 조건 하에서 세포를 배양하고; 또한 (b) 이소프렌과 수소를 공동-생산하는 것을 포함하며, 여기에서 산소-제한된 배양에서의 세포에 의해 생산된 이소프렌의 피크 농도는 약 10 ng/L액체배지 이상이고, 세포의 수소 발생율은 약 0.0025 mmol/L액체배지/시간 이상이다. 이들 방법이라면 모두의 일정 구현예에서, 수소 발생율은 약 0.0025 mmol/L액체배지/시간 및 약 10 mmol/L액체배지/시간 사이, 약 0.0025 mmol/L액체배지/시간 및 약 5 mmol/L액체배지/시간 사이, 약 0.0025 mmol/L액체배지/시간 및 약 2.5 mmol/L액체배지/시간 사이, 약 0.0025 mmol/L액체배지/시간 및 약 1 mmol/L액체배지/시간 사이, 약 0.0025 mmol/L액체배지/시간 및 약 0.5 mmol/L액체배지/시간 사이, 약 0.0025 mmol/L액체배지/시간 및 약 0.25 mmol/L액체배지/시간, 약 0.0025 mmol/L액체배지/시간 및 약 0.025 mmol/L액체배지/시간 사이, 약 0.025 mmol/L액체배지/시간 및 약 0.5 mmol/L액체배지/시간 사이, 약 0.025 mmol/L액체배지/시간 및 약 1 mmol/L액체배지/시간 사이, 약 0.025 mmol/L액체배지/시간 및 약 2.5 mmol/L액체배지/시간 사이, 약 0.025 mmol/L액체배지/시간 및 약 5 mmol/L액체배지/시간 사이, 약 0.025 mmol/L액체배지/시간 및 약 10 mmol/L액체배지/시간 사이, 약 0.25 mmol/L액체배지/시간 및 약 1 mmol/L액체배지/시간 사이, 0.25 mmol/L액체배지/시간 및 약 2.5 mmol/L액체배지/시간 사이, 약 0.25 mmol/L액체배지/시간 및 약 5 mmol/L액체배지/시간 사이, 약 0.025 mmol/L액체배지/시간 및 약 10 mmol/L액체배지/시간 사이의 범위이다.
또한 본 명세서에서는 (a) 이소프렌과 수소의 공동-생산에 적합한 조건 하에서 세포를 배양하고; 또한 (b) 이소프렌과 수소를 공동-생산하는 것을 포함하는, 이소프렌과 수소를 공동-생산하는 방법이 제공되고, 여기에서 이소프렌의 액상 농도는 약 200 mg/L이하이고, 세포는 이소프렌을 약 400 nmole/gwcm/시간 이상으로 생산하며, 세포의 수소 발생율은 약 0.0025 mmol/L/시간 이상이다. 일정 구현예에서, 배양에서 이소프렌의 액상 농도는 약 175 mg/L, 150 mg/L, 125 mg/L, 100 mg/L, 75 mg/L, 50 mg/L, 25 mg/L, 20 mg/L, 15 mg/L, 10 mg/L, 5 mg/L, 또는 2.5 mg/L 이하이다. 일정 구현예에서, 배양에서 이소프렌의 액상 농도는 약 0.1 mg/L 내지 200 mg/L, 1 mg/L 내지 200 mg/L, 1 mg/L 내지 150 mg/L, 1 mg/L 내지 100 mg/L, 1 mg/L 내지 50 mg/L, 1 mg/L 내지 25 mg/L, 1 mg/L 내지 20 mg/L, 또는 10 mg/L 내지 20 mg/L 사이의 범위이다. 이들 방법이라면 모두의 일정 구현예에서, 수소 발생율은 약 0.0025 mmol/L액체배지/시간 및 약 10 mmol/L액체배지/시간 사이, 약 0.0025 mmol/L액체배지/시간 및 약 5 mmol/L액체배지/시간 사이, 약 0.0025 mmol/L액체배지/시간 및 약 2.5 mmol/L액체배지/시간 사이, 약 0.0025 mmol/L액체배지/시간 및 약 1 mmol/L액체배지/시간 사이, 약 0.0025 mmol/L액체배지/시간 및 약 0.5 mmol/L액체배지/시간 사이, 약 0.0025 mmol/L액체배지/시간 및 약 0.25 mmol/L액체배지/시간 사이, 약 0.0025 mmol/L액체배지/시간 및 약 0.025 mmol/L액체배지/시간 사이, 약 0.025 mmol/L액체배지/시간 및 약 0.5 mmol/L액체배지/시간 사이, 약 0.025 mmol/L액체배지/시간 및 약 1 mmol/L액체배지/시간 사이, 약 0.025 mmol/L액체배지/시간 및 약 2.5 mmol/L액체배지/시간 사이, 약 0.025 mmol/L액체배지/시간 및 약 5 mmol/L액체배지/시간 사이, 약 0.025 mmol/L액체배지/시간 및 약 10 mmol/L액체배지/시간 사이, 약 0.25 mmol/L액체배지/시간 및 약 1 mmol/L액체배지/시간 사이, 약 0.25 mmol/L액체배지/시간 및 약 2.5 mmol/L액체배지/시간 사이, 및 약 0.25 mmol/L액체배지/시간 및 약 10 mmol/L액체배지/시간 사이의 범위이다.
한 가지 관점에서, 본 명세서에서는 이소프렌 및 수소를 공동-생산하는 산소-제한된 배양에서의 세포가 제공된다. 일정 구현예에서, 산소-제한된 배양은 혐기성이다. 일정 구현예에서, 산소-제한된 배양에서의 세포는 약 400 nmole/gwem/시간 이상의 이소프렌 또한 약 125 nmole/gwem/시간 이상의 수소를 생산한다. 일정 구현예에서, 세포는 (i) 이소프렌 합성효소 폴리펩타이드를 인코드하고 (ii) 프로모터에 작동적으로 연결된 이종유래 핵산을 포함한다. 일정 구현예에서, 세포는 이에 제한되는 것은 아니지만 탄소화물, 글리세롤, 글리세린, 디하이드록시아세톤, 일-탄소원, 오일, 동물 지방, 동물 오일, 지방산, 지질, 인지질, 글리세롤지질, 모노글리세라이드, 디글리세라이드, 트리글리세라이드, 재생가능한 탄소원, 폴리펩타이드 (예로, 미생물 또는 식물 단백질 또는 펩타이드), 효모 추출물, 또는 효모 추출물로부터 나온 성분, 또는 전술한 둘 이상의 조합이라면 모두와 같은 탄소원을 포함하는 배양 배지에서 배양된다. 일정 구현예에서, 세포는 제한된 포도당 조건 하에서 배양된다.
일정 구현예에서, 본 명세서에서는 세포 배양 배지에서 약 0.002% 이상의 탄소를 이소프렌으로 전환시키고, 또한 세포가 세포 배양 배지로부터 연소하는 탄소의 약0.024 몰라 퍼센트 이상과 동등한 수소를 생산하는 산소-제한된 배양에서의 세포가 제공된다. 일정 구현예에서, 산소-제한된 배양은 혐기성이다. 일정 구현예에서, 세포는 (i) 이소프렌 합성효소 폴리펩타이드를 인코드하고 또한 (ii) 프로모터에 작동적으로 연결된 이종유래 핵산을 가진다. 일정 구현예에서, 세포는 이에 제한되는 것은 아니지만 탄소화물, 글리세롤, 글리세린, 디하이드록시아세톤, 일-탄소원, 오일, 동물 지방, 동물 오일, 지방산, 지질, 인지질, 글리세롤지질, 모노글리세라이드, 디글리세라이드, 트리글리세라이드, 재생가능한 탄소원, 폴리펩타이드 (예로, 미생물 또는 식물 단백질 또는 펩타이드), 효모 추출물, 또는 효모 추출물로부터 나온 성분, 또는 전술한 둘 이상의 조합이라면 모두와 같은 탄소원을 포함하는 배양 배지에서 배양된다. 일정 구현예에서, 세포는 제한된 포도당 조건 하에서 배양된다.
일정 구현예에서, 본 명세서에서는 이소프렌 합성효소 폴리펩타이드를 인코딩하는 이종유래 핵산을 포함하는 산소-제한된 배양에서의 세포가 제공된다. 일정 구현예에서, 산소-제한된 배양은 혐기성이다. 일정 구현예에서, 세포는 (i) 이소프렌 합성효소 폴리펩타이드를 인코드하고 또한 (ii) 프로모터에 작동적으로 연결된 이종유래 핵산을 가진다. 일정 구현예에서, 세포는 이에 제한되는 것은 아니지만 탄소화물, 글리세롤, 글리세린, 디하이드록시아세톤, 일-탄소원, 오일, 동물 지방, 동물 오일, 지방산, 지질, 인지질, 글리세롤지질, 모노글리세라이드, 디글리세라이드, 트리글리세라이드, 재생가능한 탄소원, 폴리펩타이드 (예로, 미생물 또는 식물 단백질 또는 펩타이드), 효모 추출물, 또는 효모 추출물로부터 나온 성분, 또는 전술한 둘 이상의 조합이라면 모두와 같은 탄소원을 포함하는 배양 배지에서 배양된다. 일정 구현예에서, 세포는 제한된 포도당 조건 하에서 배양된다.
한 가지 관점에서, 본 명세서에서는 이소프렌과 수소를 공동-생산하는 본 명세서에서 기술된 세포라면 모두를 사용하는 방법과 같은, 또 다른 화합물과 함께 이소프렌을 공동-생산하는 방법이 제공된다. 일정 구현예에서, 방법은 약 400 nmole/gwem/시간 이상의 이소프렌을, 또한 약 125 nmole/gwem/시간 이상의 수소를 생산하는 데 충분한 산소-제한된 조건 하에서 세포를 배양하는 것을 포함한다. 일정 구현예에서, 산소-제한된 배양은 혐기성이다. 일정 구현예에서, 방법은 또한 세포에 의해 생산된 이소프렌과 수소를 회수하는 것을 포함한다. 일정 구현예에서, 방법은 좀 더 나아가 세포에 의해 생산된 이소프렌과 수소를 정제하는 것을 포함한다. 일정 구현예에서, 방법은 이소프렌을 다중합하는 것을 포함한다. 일정 구현예에서, 세포는 (i) 이소프렌 합성효소 폴리펩타이드를 인코드하고 (ii) 프로모터에 작동적으로 연결된 이종유래 핵산을 가진다. 일정 구현예에서, 세포는 이에 제한되는 것은 아니지만 탄소화물, 글리세롤, 글리세린, 디하이드록시아세톤, 일-탄소원, 오일, 동물 지방, 동물 오일, 지방산, 지질, 인지질, 글리세롤지질, 모노글리세라이드, 디글리세라이드, 트리글리세라이드, 재생가능한 탄소원, 폴리펩타이드 (예로, 미생물 또는 식물 단백질 또는 펩타이드), 효모 추출물, 또는 효모 추출물로부터 나온 성분, 또는 전술한 둘 이상의 조합이라면 모두와 같은 탄소원을 포함하는 배양 배지에서 배양된다. 일정 구현예에서, 세포는 제한된 포도당 조건 하에서 배양된다. 다양한 구현예에서, 안정기 동안 생산된 이소프렌량 (생산된 이소프렌의 전체량 또는 OD600 당 시간 당 액체배지 리터 당 생산된 이소프렌량과 같음)은 동일한 기간에 성장기 동안 생산된 이소프렌량보다 약 2배 이상이다.
일정 구현예에서, 방법은 세포 배양 배지에서 약 0.002% 이상의 탄소를 이소프렌으로 전환시키고, 세포가 세포 배양 배지로부터 연소하는 탄소의 약 0.024 몰라 퍼센트 이상과 동등한 수소를 생산하는 데 충분한 산소-제한된 배양에서 세포를 배양하는 것을 포함한다. 일정 구현예에서, 산소-제한된 배양은 혐기성이다. 일정 구현예에서, 방법은 또한 세포에 의해 생산된 이소프렌과 수소를 회수하는 것을 포함한다. 일정 구현예에서, 방법은 좀 더 나아가 세포에 의해 생산된 이소프렌과 수소를 정제하는 것을 포함한다. 일정 구현예에서, 방법은 이소프렌을 다중합하는 것을 포함한다. 일정 구현예에서, 세포는 (i) 이소프렌 합성효소 폴리펩타이드를 인코드하고 (ii) 프로모터에 작동적으로 연결된 이종유래 핵산을 가진다. 일정 구현예에서, 세포는 이에 제한되는 것은 아니지만 탄소화물, 글리세롤, 글리세린, 디하이드록시아세톤, 일-탄소원, 오일, 동물 지방, 동물 오일, 지방산, 지질, 인지질, 글리세롤지질, 모노글리세라이드, 디글리세라이드, 트리글리세라이드, 재생가능한 탄소원, 폴리펩타이드 (예로, 미생물 또는 식물 단백질 또는 펩타이드), 효모 추출물, 또는 효모 추출물로부터 나온 성분, 또는 전술한 둘 이상의 조합이라면 모두와 같은 탄소원을 포함하는 배양 배지에서 배양된다.
본 명세서에서 기술된 관점이라면 모두의 일정 구현예에서, 미생물 폴리펩타이드 탄소원은 효모 또는 박테리아로부터 나온 하나 이상의 폴리펩타이드를 포함한다. 본 명세서에서 기술된 관점이라면 모두의 일정 구현예에서, 식물 폴리펩타이드 탄소원은 콩, 옥수수, 카놀라, 자트로파, 팜, 땅콩, 해바라기, 코코넛, 머스타드, 평지종자, 목화종자, 팜 줄기, 올리브, 잇꽃, 참깨, 또는 아마종자로부터 나온 하나 이상의 폴리펩타이드를 포함한다.
일정 구현예에서, 이소프렌과 수소는 안정기에만 공동-생산된다. 일정 구현예에서, 이소프렌과 수소는 성장기 및 안정기 둘 다에서 공동-생산된다. 다양한 구현예에서, 안정기 동안 생산된 이소프렌량 (생산된 이소프렌의 전체량 또는 OD600당 시간 당 액체배지 리터 당 생산된 이소프렌량과 같음)은 동일한 기간에 성장기 동안 생산된 이소프렌량보다 약 2, 3, 4, 5, 10, 20, 30, 40, 또는 50배 이상이다. 다양한 구현예에서, 안정기 동안 생산된 수소량 (생산된 수소의 전체량 또는 OD600당 시간 당 액체배지 리터 당 생산된 수소량과 같음)은 동일한 기간에 성장기 동안 생산된 수소량보다 약 2, 3, 4, 5, 10, 20, 30, 40, 또는 50배 이상이다.
일정 구현예에서, 본 명세서에서 제공된 조성물은 조성물 내의 모든 C5 탄화수소의 전체 무게와 대비한 무게로 약 99.90, 99.92, 99.94, 99.96, 99.98, 또는 100% 이상의 이소프렌 및 수소를 포함한다. 일정 구현예에서, 조성물은 조성물 내의 모든 C5 탄화수소의 전체 무게와 대비한 무게로 약 0.12, 0.10, 0.08, 0.06, 0.04, 0.02, 0.01, 0.005, 0.001, 0.0005, 0.0001, 0.00005, 또는 0.00001% 이하의 이소프렌이 아닌 C5 탄화수소 (1,3-사이클로펜타디엔, cis-1,3-펜타디엔, trans-1,3-펜타디엔, 1-펜틴, 2-펜틴, 1-펜틴, 2-메틸-1-부텐, 3-메틸-l-부틴, trans-피페릴렌, cis-피페릴렌, 펜트-4-엔-1-인, trans-펜트-3-엔-1-인, 또는 cis-펜트-3-엔-1-인과 같음)를 포함한다. 일정 구현예에서, 조성물은 1,3-사이클로펜타디엔, cis-1,3-펜타디엔, trans-1,3-펜타디엔, 1-펜틴, 2-펜틴, 1-펜틴, 2-메틸-1-부텐, 3-메틸-l-부틴, 펜트-4-엔-1-인, trans-펜트-3-엔-1-인, 또는 cis-펜트-3-엔-1-인에 대하여 조성물 내의 모든 C5 탄화수소의 전체 무게와 대비한 무게로 약 0.12, 0.10, 0.08, 0.06, 0.04, 0.02, 0.01, 0.005, 0.001, 0.0005, 0.0001, 0.00005, 또는 0.00001% 이하로 가진다. 상세한 구현예에서, 조성물은 약 2 mg이상의 이소프렌을 가지고, 조성물 내의 모든 C5 탄화수소의 전체 무게와 대비한 무게로 약 99.90, 99.92, 99.94, 99.96, 99.98, 또는 100% 이상의 이소프렌을 가진다. 일정 구현예에서, 이소프렌 조성물은 이소프렌의 다중합을 저해하는 조성물에 있는 화합물이라면 모두에 대해 약 50, 40, 30, 20, 10, 5, 1, 0.5, 0.1, 0.05, 0.01, 또는0.005 μg/L 이하의 이소프렌의 다중합을 저해하는 화합물을 포함한다. 상세한 구현예에서, 조성물은 또한 약 2 mg 이상의 이소프렌 및 약 0.48 mg 이상의 수소를 포함한다.
일정 구현예에서, 기체상의 휘발성 유기 분획은 이소프렌의 다중합을 저해하는 기체상의 휘발성 유기 분획에 있는 화합물이라면 모두에 대해 약 50, 40, 30, 20, 10, 5, 1, 0.5, 0.1, 0.05, 0.01, 또는0.005 μg/L 이하의 이소프렌의 다중합을 저해하는 화합물을 포함한다. 일정 구현예에서, 기체상의 휘발성 유기 분획은 또한 약 2 mg 이상의 이소프렌 및 약 0.48 mg 이상의 수소를 포함한다.
일정 구현예에서, 본 시스템은 본 명세서에서 기술된 세포 및/또는 조성물이라면 모두를 포함한다. 일정 구현예에서, 본 시스템은 체임버가 약 400, 500, 600, 700, 800, 900, 1,000, 1,250, 1,500, 1,750, 2,000, 2,500, 3,000, 4,000, 또는 5,000 이상 nmole/gwcm/시간의 이소프렌을 또한 약 125, 250, 500, 750, 1000, 1,250, 1,500, 1,750, 2,000, 2,500, 3,000, 4,000, 5,000, 7,500, 또는 10,000 이상 nmole/gwcm/시간의 수소를 생산하는 산소-제한된 배양에서의 세포를 포함하는 반응기를 포함한다. 일정 구현예에서, 시스템은 폐쇄된 시스템이 아니다. 일정 구현예에서, 적어도 이소프렌의 일부분은 시스템으로부터 제거된다. 일정 구현예에서, 시스템은 이소프렌과 수소를 포함하는 기체상을 포함한다. 다양한 구현예에서, 기체상은 본 명세서에서 기술된 조성물이라면 모두를 포함한다.
한 가지 관점에서, 본 명세서에서는 본 명세서에서 기술된 조성물 또는 방법이라면 모두에 의해 생산되는 산물을 특징으로 한다.
이소프렌 고역가에서 세포 생존도
이소프렌은 많은 식물, 동물, 및 미생물에 의해 분비되는 소수성 분자이다. 바실러스와 같은 박테리아는 매우 낮은 수준으로 이소프렌을 생산한다. 식물이 열보호 (thermoprotection)를 도와주도록 이소프렌을 분비한다는 일정 증거가 존재하고 있고, 이소프렌이 시아노박테리아 또는 곰팡이에 길항적으로, 또는 항미생물 제제로서 작용할 수 있는 것이 가설로 주장되어 왔다. 예로, Ladygina et al., Process Biochemistry 41:1001-1014 (2006)를 참조하고, 이는 본 명세서에서 참조문헌으로 전부, 상세하게는 길항적으로 작용하는 이소프렌에 관하여 통합되어 있다. 자연에서 발생하는 매우 낮은 생산 수준이 항-미생물 작용으로는 충분하기 때문에, 이소프렌의 상업화에 필요한 이소프렌의 역가 및 생산도 수준은 숙주 미생물을 죽일 것이라고 많이 우려된다.
본 발명자들은 이산화탄소 발생율 또는 전체 이산화탄소 발생율에 의해 표시되는 세포 생존도 및/또는 대사적 활성을 유지하면서 이소프렌의 상업화에 필요한 이소프렌의 역가 및 생산도 수준을 생산하는 방법을 발견하였다.
본 명세서에서는 (a) 이소프렌의 생산에 적합한 조건 하에서 세포를 배양하고; 또한 (b) 이소프렌을 생산하는 것을 포함하는 이소프렌을 생산하는 방법이 제공되고, 여기에서 세포는 이소프렌을 약 400 nmole/gwcm/시간 이상으로 생산하고, 이산화탄소 발생율은 약 1 x 10-18 mmol/L/시간 이상이다. 일정 구현예에서, 생산된 이소프렌은 "대표적인 이소프렌의 생산"이라는 제목으로 된 섹션에 기술된 농도 또는 양이라면 모두이다. 일정 구현예에서, 이소프렌량은 약 400 nmole/gwcm/시간 내지 1 mole/gwcm/시간, 약 400 nmole/gwcm/시간 내지 1 mmole/gwcm/시간, 약 400 nmole/gwcm/시간 내지 40 mmole/gwcm/시간, 약 400 nmole/gwcm/시간 내지 4 mmole/gwcm/시간, 약 1 mmole/gwcm/시간 내지 1.5 mmole/gwcm/시간, 약 1.5 mmole/gwcm/시간 내지 3 mmole/gwcm/시간, 약 3 mmole/gwcm/시간 내지 5 mmole/gwcm/시간, 약 5 mmole/gwcm/시간 내지 25 mmole/gwcm/시간, 약 25 mmole/gwcm/시간 내지 100 mmole/gwcm/시간, 약 100 mmole/gwcm/시간 내지 500 mmole/gwcm/시간, 또는 약 500 mmole/gwcm/시간 내지 1000 mmole/gwcm/시간 사이의 범위이다. 일정 구현예에서, 이소프렌량은 약 1 nmole/gwcm/시간, 1.5 nmole/gwcm/시간, 2 nmole/gwcm/시간, 3 nmole/gwcm/시간, 4 nmole/gwcm/시간, 또는 5 nmole/gwcm/시간이라면 모두이다. 일정 구현예에서, 이산화탄소 발생율은 약 1 x 10-18 mmol/L/시간 내지 1 mol/L/시간, 1 mmol/L/시간 내지 1 mol/L/시간, 25 mmol/L/시간 내지 750 mmol/L/시간, 25 mmol/L/시간 내지 75 mmol/L/시간, 250 mmol/L/시간 내지 750 mmol/L/시간, 또는 450 mmol/L/시간 내지 550 mmol/L/시간 사이의 범위이다. 일정 구현예에서, 이산화탄소 발생율은 약 50 mmol/L/시간, 100 mmol/L/시간, 150 mmol/L/시간, 200 mmol/L/시간, 250 mmol/L/시간, 300 mmol/L/시간, 350 mmol/L/시간, 400 mmol/L/시간, 450 mmol/L/시간, 또는500 mmol/L/시간이라면 모두이다.
또한 본 명세서에서는 (a) 이소프렌의 생산에 적합한 조건 하에서 세포를 배양하고; 또한 (b) 이소프렌을 생산하는 것을 포함하는 이소프렌을 생산하는 방법이 제공되고, 여기에서 세포는 이소프렌을 약 400 nmole/gwcm/시간 이상으로 생산하고, 세포 생존도는 약 두 배 이하로 감소된다. 일정 구현예에서, 생산된 이소프렌은 "대표적인 이소프렌의 생산"이라는 제목으로 된 섹션에 기술된 농도 또는 양이라면 모두이다. 일정 구현예에서, 이소프렌량은 약 400 nmole/gwcm/시간 내지 1 mole/gwcm/시간, 약 400 nmole/gwcm/시간 내지 1 mmole/gwcm/시간, 약 400 nmole/gwcm/시간 내지 40 mmole/gwcm/시간, 약 400 nmole/gwcm/시간 내지 4 mmole/gwcm/시간, 약 1 mmole/gwcm/시간 내지 1.5 mmole/gwcm/시간, 약 1.5 mmole/gwcm/시간 내지 3 mmole/gwcm/시간, 약 3 mmole/gwcm/시간 내지 5 mmole/gwcm/시간, 약 5 mmole/gwcm/시간 내지 25 mmole/gwcm/시간, 약 25 mmole/gwcm/시간 내지 100 mmole/gwcm/시간, 약 100 mmole/gwcm/시간 내지 500 mmole/gwcm/시간, 또는 약 500 mmole/gwcm/시간 내지 1000 mmole/gwcm/시간 사이의 범위이다. 일정 구현예에서, 이소프렌량은 약 1 nmole/gwcm/시간, 1.5 nmole/gwcm/시간, 2 nmole/gwcm/시간, 3 nmole/gwcm/시간, 4 nmole/gwcm/시간, 또는 5 nmole/gwcm/시간이라면 모두이다. 일정 구현예에서, 세포 생존도는 약 1.75배, 1.5배, 1.25배, 1배, 0.75배, 0.5배, 또는 0.25배 이하라면 모두로 감소된다. 일정 구현예에서, 세포 생존도는 약 2배로 감소된다.
좀 더 나아가 본 명세서에서는 (a) 이소프렌의 생산에 적합한 조건 하에서 세포를 배양하고; 또한 (b) 이소프렌을 생산하는 것을 포함하는 이소프렌을 생산하는 방법이 제공되고, 여기에서 배양액에서 세포에 의해 생산된 이소프렌의 전체 누적 생산도는 약 0.2 mg/L액체배지/시간 이상이고, 세포의 이산화탄소 발생율은 약 1 x 10-18 mmol/L/시간 이상이다. 일정 구현예에서, 이소프렌의 전체 누적 생산도는 "대표적인 이소프렌의 생산"이라는 제목으로 된 섹션에 기술된 농도 또는 양이라면 모두이다. 일정 구현예에서, 이소프렌의 전체 누적 생산도는 약 0.2 mg/L액체배지/시간 내지 약 5 g/L액체배지/시간, 약 0.2 mg/L액체배지/시간 내지 약 1 g/L액체배지/시간, 약 1 mg/L액체배지/시간 내지 약 2.5 g/L액체배지/시간, 약 2.5 g/L액체배지/시간 내지 약 5 g/L액체배지/시간 사이의 범위이다. 일정 구현예에서, 이산화탄소 발생율은 약 1 x 10-18 mmol/L/시간 내지 1 mol/L/시간, 1 mmol/L/시간 내지 1 mol/L/시간, 25 mmol/L/시간 내지 750 mmol/L/시간, 25 mmol/L/시간 내지 75 mmol/L/시간, 250 mmol/L/시간 내지 750 mmol/L/시간, 또는 450 mmol/L/시간 내지 550 mmol/L/시간 사이의 범위이다. 일정 구현예에서, 이산화탄소 발생율은 약 50 mmol/L/시간, 100 mmol/L/시간, 150 mmol/L/시간, 200 mmol/L/시간, 250 mmol/L/시간, 300 mmol/L/시간, 350 mmol/L/시간, 400 mmol/L/시간, 450 mmol/L/시간, 또는 500 mmol/L/시간이라면 모두이다.
본 명세서에서는 (a) 이소프렌의 생산에 적합한 조건 하에서 세포를 배양하고; 또한 (b) 이소프렌을 생산하는 것을 포함하는 이소프렌을 생산하는 방법이 제공되고, 여기에서 배양액에서 세포에 의해 생산된 이소프렌의 전체 누적 생산도는 약 0.2 mg/L액체배지/시간 이상이고, 세포 생존도는 약 두 배 이하로 감소된다. 일정 구현예에서, 이소프렌의 전체 누적 생산도는 "대표적인 이소프렌의 생산"이라는 제목으로 된 섹션에 기술된 농도 또는 양이라면 모두이다. 일정 구현예에서, 이소프렌의 전체 누적 생산도는 약 0.2 mg/L액체배지/시간 내지 약 5 g/L액체배지/시간, 약 0.2 mg/L액체배지/시간 내지 약 1 g/L액체배지/시간, 약 1 mg/L액체배지/시간 내지 약 2.5 g/L액체배지/시간, 약 2.5 g/L액체배지/시간 내지 약 5 g/L액체배지/시간 사이의 범위이다. 일정 구현예에서, 세포 생존도는 약 1.75배, 1.5배, 1.25배, 1배, 0.75배, 0.5배, 또는 0.25배 이하라면 모두로 감소된다.
또한 본 명세서에서는 (a) 이소프렌의 생산에 적합한 조건 하에서 세포를 배양하고; 또한 (b) 이소프렌을 생산하는 것을 포함하는 이소프렌을 생산하는 방법이 제공되고, 여기에서 배양액에서 세포에 의해 생산된 이소프렌의 피크 농도는 약 10 ng/L액체배지 이상이고, 세포의 이산화 발생율은 약 1 x 10-18 mmol/L/시간 이상이다. 일정 구현예에서, 이소프렌의 피크 농도는 "대표적인 이소프렌의 생산"이라는 제목으로 된 섹션에 기술된 농도 또는 양이라면 모두이다. 일정 구현예에서, 이소프렌의 피크 농도는 약 10 ng/L액체배지 내지 500 ng/L액체배지, 500 ng/L액체배지 내지 1 μg/L액체배지, 1 μg/L액체배지 내지 5 μg/L액체배지, 5 μg/L액체배지 내지 50 μg/L액체배지, 5 μg/L액체배지 내지 100 μg/L액체배지, 5 μg/L액체배지 내지 250 μg/L액체배지, 250 μg/L액체배지 내지 500 μg/L액체배지, 500 μg/L액체배지 내지 1 mg/L액체배지, 1 mg/L액체배지 내지 50 mg/L액체배지, 1 mg/L액체배지 내지 100 mg/L액체배지, 1 mg/L액체배지 내지 200 mg/L액체배지, 10 mg/L액체배지 내지 200 mg/L액체배지, 5 μg/L액체배지 내지 100 mg/L액체배지, 또는 5 μg/L액체배지 내지 200 mg/L액체배지 사이의 범위이다. 일정 구현예에서, 이소프렌의 피크 농도는 약 10 ng/L액체배지, 100 ng/L액체배지, 1 μg /L액체배지, 5 μg /L액체배지, 1 mg /L액체배지, 30 mg /L액체배지, 100 mg /L액체배지, 또는 200 mg /L액체배지 이라면 모두이다. 일정 구현예에서, 이산화탄소 발생율은 약 1 x 10-18 mmol/L/시간 내지 1 mol/L/시간, 1 mmol/L/시간 내지 1 mol/L/시간, 25 mmol/L/시간 내지 750 mmol/L/시간, 25 mmol/L/시간 내지 75 mmol/L/시간, 250 mmol/L/시간 내지 750 mmol/L/시간, 또는 450 mmol/L/시간 내지 550 mmol/L/시간 사이의 범위이다. 일정 구현예에서, 이산화탄소 발생율은 약 50 mmol/L/시간, 100 mmol/L/시간, 150 mmol/L/시간, 200 mmol/L/시간, 250 mmol/L/시간, 300 mmol/L/시간, 350 mmol/L/시간, 400 mmol/L/시간, 450 mmol/L/시간, 또는 500 mmol/L/시간이라면 모두이다.
또한 본 명세서에서는 (a) 이소프렌의 생산에 적합한 조건 하에서 세포를 배양하고; 또한 (b) 이소프렌을 생산하는 것을 포함하는 이소프렌을 생산하는 방법이 제공되고, 여기에서 배양액에서 세포에 의해 생산된 이소프렌의 피크 농도는 약 10 ng/L액체배지 이상이고, 세포 생존도는 약 두 배 이하로 감소된다. 일정 구현예에서, 이소프렌의 피크 농도는 "대표적인 이소프렌의 생산"이라는 제목으로 된 섹션에 기술된 농도 또는 양이라면 모두이다. 일정 구현예에서, 이소프렌의 피크 농도는 약 10 ng/L액체배지 내지 500 ng/L액체배지, 500 ng/L액체배지 내지 1 μg/L액체배지, 1 μg/L액체배지 내지 5 μg/L액체배지, 5 μg/L액체배지 내지 50 μg/L액체배지, 5 μg/L액체배지 내지 100 μg/L액체배지, 5 μg/L액체배지 내지 250 μg/L액체배지, 250 μg/L액체배지 내지 500 μg/L액체배지, 500 μg/L액체배지 내지 1 mg/L액체배지, 1 mg/L액체배지 내지 50 mg/L액체배지, 1 mg/L액체배지 내지 100 mg/L액체배지, 1 mg/L액체배지 내지 200 mg/L액체배지, 10 mg/L액체배지 내지 200 mg/L액체배지, 5 μg/L액체배지 내지 100 mg/L액체배지, 또는 5 μg/L액체배지 내지 200 mg/L액체배지 사이의 범위이다. 일정 구현예에서, 이소프렌의 피크 농도는 약 10 ng/L액체배지, 100 ng/L액체배지, 1 μg /L액체배지, 5 μg /L액체배지, 1 mg /L액체배지, 30 mg /L액체배지, 100 mg /L액체배지, 또는 200 mg /L액체배지 이라면 모두이다. 일정 구현예에서, 세포 생존도는 약 1.75배, 1.5배, 1.25배, 1배, 0.75배, 0.5배, 또는 0.25배 이하라면 모두로 감소된다. 일정 구현예에서, 세포 생존도는 약 2배로 감소된다.
또한 본 명세서에서는 이소프렌 합성효소 폴리펩타이드를 인코딩하는 핵산을 포함하는 배양에서의 세포가 제공되고, 여기에서 세포는 이소프렌을 약 400 nmole/gwcm/시간 이상으로 생산하고, 이산화탄소 발생율은 약 1 x 10-18 mmol/L/시간 이상이다. 일정 구현예에서, 생산된 이소프렌은 "대표적인 이소프렌의 생산"이라는제목으로 된 섹션에 기술된 농도 또는 양이라면 모두이다. 일정 구현예에서, 이소프렌량은 약 400 nmole/gwcm/시간 내지 1 mole/gwcm/시간, 약 400 nmole/gwcm/시간 내지 1 mmole/gwcm/시간, 약 400 nmole/gwcm/시간 내지 40 mmole/gwcm/시간, 약 400 nmole/gwcm/시간 내지 4 mmole/gwcm/시간, 약 1 mmole/gwcm/시간 내지 1.5 mmole/gwcm/시간, 약 1.5 mmole/gwcm/시간 내지 3 mmole/gwcm/시간, 약 3 mmole/gwcm/시간 내지 5 mmole/gwcm/시간, 약 5 mmole/gwcm/시간 내지 25 mmole/gwcm/시간, 약 25 mmole/gwcm/시간 내지 100 mmole/gwcm/시간, 약 100 mmole/gwcm/시간 내지 500 mmole/gwcm/시간, 또는 약 500 mmole/gwcm/시간 내지 1000 mmole/gwcm/시간 사이의 범위이다. 일정 구현예에서, 이소프렌량은 약 1 nmole/gwcm/시간, 1.5 nmole/gwcm/시간, 2 nmole/gwcm/시간, 3 nmole/gwcm/시간, 4 nmole/gwcm/시간, 또는 5 nmole/gwcm/시간이라면 모두이다. 일정 구현예에서, 이산화탄소 발생율은 약 1 x 10-18 mmol/L/시간 내지 1 mol/L/시간, 1 mmol/L/시간 내지 1 mol/L/시간, 25 mmol/L/시간 내지 750 mmol/L/시간, 25 mmol/L/시간 내지 75 mmol/L/시간, 250 mmol/L/시간 내지 750 mmol/L/시간, 또는 450 mmol/L/시간 내지 550 mmol/L/시간 사이의 범위이다. 일정 구현예에서, 이산화탄소 발생율은 약 50 mmol/L/시간, 100 mmol/L/시간, 150 mmol/L/시간, 200 mmol/L/시간, 250 mmol/L/시간, 300 mmol/L/시간, 350 mmol/L/시간, 400 mmol/L/시간, 450 mmol/L/시간, 또는 500 mmol/L/시간이라면 모두이다.
또한 본 명세서에서는 이소프렌 합성효소 폴리펩타이드를 인코딩하는 핵산을 포함하는 배양에서의 세포가 제공되고, 여기에서 배양액에서 세포에 의해 생산된 이소프렌의 전체 누적 생산도는 약 0.2 mg/L액체배지/시간 이상이고, 세포의 이산화탄소 발생율은 약 1 x 10-18 mmol/L/시간 이상이다. 일정 구현예에서, 이소프렌의 전체 누적 생산도는 "대표적인 이소프렌의 생산"이라는 제목으로 된 섹션에 기술된 농도 또는 양이라면 모두이다. 일정 구현예에서, 이소프렌의 전체 누적 생산도는 약 0.2 mg/L액체배지/시간 내지 약 5 g/L액체배지/시간, 약 0.2 mg/L액체배지/시간 내지 약 1 g/L액체배지/시간, 약 1 mg/L액체배지/시간 내지 약 2.5 g/L액체배지/시간, 약 2.5 g/L액체배지/시간 내지 약 5 g/L액체배지/시간 사이의 범위이다. 일정 구현예에서, 이산화탄소 발생율은 약 1 x 10-18 mmol/L/시간 내지 1 mol/L/시간, 1 mmol/L/시간 내지 1 mol/L/시간, 25 mmol/L/시간 내지 750 mmol/L/시간, 25 mmol/L/시간 내지 75 mmol/L/시간, 250 mmol/L/시간 내지 750 mmol/L/시간, 또는 450 mmol/L/시간 내지 550 mmol/L/시간 사이의 범위이다. 일정 구현예에서, 이산화탄소 발생율은 약 50 mmol/L/시간, 100 mmol/L/시간, 150 mmol/L/시간, 200 mmol/L/시간, 250 mmol/L/시간, 300 mmol/L/시간, 350 mmol/L/시간, 400 mmol/L/시간, 450 mmol/L/시간, 또는500 mmol/L/시간이라면 모두이다.
또한 본 명세서에서는 이소프렌 합성효소 폴리펩타이드를 인코딩하는 핵산을 포함하는 배양에서의 세포가 제공되고, 여기에서 배양액에서 세포에 의해 생산된 이소프렌의 피크 농도는 약 10 ng/L액체배지 이상이고, 세포의 이산화탄소 발생율은 약 1 x 10-18 mmol/L/시간 이상이다. 일정 구현예에서, 이소프렌의 피크 농도는 "대표적인 이소프렌의 생산"이라는 제목으로 된 섹션에 기술된 농도 또는 양이라면 모두이다. 일정 구현예에서, 이소프렌의 피크 농도는 약 10 ng/L액체배지 내지 500 ng/L액체배지, 500 ng/L액체배지 내지 1 μg/L액체배지, 1 μg/L액체배지 내지 5 μg/L액체배지, 5 μg/L액체배지 내지 50 μg/L액체배지, 5 μg/L액체배지 내지 100 μg/L액체배지, 5 μg/L액체배지 내지 250 μg/L액체배지, 250 μg/L액체배지 내지 500 μg/L액체배지, 500 μg/L액체배지 내지 1 mg/L액체배지, 1 mg/L액체배지 내지 50 mg/L액체배지, 1 mg/L액체배지 내지 100 mg/L액체배지, 1 mg/L액체배지 내지 200 mg/L액체배지, 10 mg/L액체배지 내지 200 mg/L액체배지, 5 μg/L액체배지 내지 100 mg/L액체배지, 또는 5 μg/L액체배지 내지 200 mg/L액체배지 사이의 범위이다. 일정 구현예에서, 이소프렌의 피크 농도는 약 10 ng/L액체배지, 100 ng/L액체배지, 1 μg /L액체배지, 5 μg /L액체배지, 1 mg /L액체배지, 30 mg /L액체배지, 100 mg /L액체배지, 또는 200 mg /L액체배지 이라면 모두이다. 일정 구현예에서, 이산화탄소 발생율은 약 1 x 10-18 mmol/L/시간 내지 1 mol/L/시간, 1 mmol/L/시간 내지 1 mol/L/시간, 25 mmol/L/시간 내지 750 mmol/L/시간, 25 mmol/L/시간 내지 75 mmol/L/시간, 250 mmol/L/시간 내지 750 mmol/L/시간, 또는 450 mmol/L/시간 내지 550 mmol/L/시간 사이의 범위이다. 일정 구현예에서, 이산화탄소 발생율은 약 50 mmol/L/시간, 100 mmol/L/시간, 150 mmol/L/시간, 200 mmol/L/시간, 250 mmol/L/시간, 300 mmol/L/시간, 350 mmol/L/시간, 400 mmol/L/시간, 450 mmol/L/시간, 또는 500 mmol/L/시간이라면 모두이다.
본 명세서에서 기술된 방법 및 세포라면 모두의 일정 구현예에서, MVA 경로 및/또는 DXP 경로 핵산의 이종유래 및/또는 이중 사본의 하나 이상으로부터 나온 MVA 경로 및/또는 DXP 경로 RNA 및/또는 단백질을 발현하는 세포의 이산화탄소 발생율 및/또는 세포 생존도는 MVA 경로 및/또는 DXP 경로 핵산의 이종유래 및/또는 이중 사본의 하나 이상이 결여된 대조군 세포와 대비된다. 일정 구현예에서, MVA 경로 및/또는 DXP 경로 핵산의 이종유래 및/또는 이중 사본의 하나 이상으로부터 나온 MVA 경로 및/또는 DXP 경로 RNA 및/또는 단백질을 유도성 프로모터의 조절 하에서 발현하는 세포의 이산화탄소 발생율 및/또는 세포 생존도는 프로모터가 유도될 때, MVA 경로 및/또는 DXP 경로 핵산의 이종유래 및/또는 이중 사본의 하나 이상을 유도성 프로모터의 조절 하에서 프로모터가 유도되지 않을 때 (uninduced) 이를 포함하는 대조군 세포와 대비된다. 일정 구현예에서, 유도성 프로모터는 베타-갈락토시다제 프로모터이다.
일정 구현예에서, 이소프렌을 생산하는 방법은 (a) 이소프렌의 생산에 적합한 조건 하에서 세포를 배양하고; 또한 (b) 이소프렌을 생산하는 것:을 포함하고, 여기에서 세포는 이소프렌을 약 400 nmole/gwcm/시간 이상으로 생산하고, 세포의 이산화탄소 발생율은 약 1 x 10-18 mmol/L/시간 이상이다. 좀 더 나아가 본 명세서에서는 (a) 이소프렌의 생산에 적합한 조건 하에서 세포를 배양하고; 또한 (b) 이소프렌을 생산하는 것:을 포함하는 이소프렌을 생산하는 방법이 제공되고, 여기에서 배양액에서 세포에 의해 생산된 이소프렌의 전체 누적 생산도는 약 0.2 mg/L액체배지/시간 이상이고, 세포의 이산화탄소 발생율은 약 1 x 10-18 mmol/L/시간 이상이다. 또한 본 명세서에서는 (a) 이소프렌의 생산에 적합한 조건 하에서 세포를 배양하고; 또한 (b) 이소프렌을 생산하는 것:을 포함하는 이소프렌을 생산하는 방법이 제공되고, 여기에서 배양액에서 세포에 의해 생산된 이소프렌의 피크 농도는 약 10 ng/L액체배지 이상이고, 세포의 이산화 발생율은 약 1 x 10-18 mmol/L/시간 이상이다. 이들 방법이라면 모두의 일정 구현예에서, 이산화탄소 발생율은 약 1 x 10-18 mmol/L/시간 내지 1 mol/L/시간, 1 mmol/L/시간 내지 1 mol/L/시간, 25 mmol/L/시간 내지 750 mmol/L/시간, 25 mmol/L/시간 내지 75 mmol/L/시간, 250 mmol/L/시간 내지 750 mmol/L/시간, 또는 450 mmol/L/시간 내지 550 mmol/L/시간 사이의 범위이다. 일정 구현예에서, 이산화탄소 발생율은 약 50 mmol/L/시간 또는 500 mmol/L/시간이다.
본 명세서에서는 좀 더 나아가 이소프렌 합성효소 폴리펩타이드를 인코딩하는 핵산을 포함하는 배양되는 세포가 제공되고, 여기에서 세포는 이소프렌을 약 400 nmole/gwcm/시간 이상으로 생산하고, 세포의 이산화탄소 발생율은 약 1 x 10-18 mmol/L/시간 이상이다. 또한 본 명세서에서는 이소프렌 합성효소 폴리펩타이드를 인코딩하는 핵산을 포함하는 배양에서의 세포가 제공되고, 여기에서 배양액에서 세포에 의해 생산된 이소프렌의 전체 누적 생산도는 약 0.2 mg/L액체배지/시간 이상이고, 세포의 이산화탄소 발생율은 약 1 x 10-18 mmol/L/시간 이상이다. 또한, 본 명세서에서는 이소프렌 합성효소 폴리펩타이드를 인코딩하는 핵산을 포함하는 배양에서의 세포가 제공되고, 여기에서 배양되는 세포에 의해 생산된 이소프렌의 피크 농도는 약 10 ng/L액체배지 이상이고, 세포의 이산화 발생율은 약 1 x 10-18 mmol/L/시간 이상이다. 이들 배양에서의 세포라면 모두의 일정 구현예에서, 이산화탄소 발생율은 약 1 x 10-18 mmol/L/시간 내지 1 mol/L/시간, 1 mmol/L/시간 내지 1 mol/L/시간, 25 mmol/L/시간 내지 750 mmol/L/시간, 25 mmol/L/시간 내지 75 mmol/L/시간, 250 mmol/L/시간 내지 750 mmol/L/시간, 또는 450 mmol/L/시간 내지 550 mmol/L/시간 사이의 범위이다. 일정 구현예에서, 이산화탄소 발생율은 약 50 mmol/L/시간 또는 500 mmol/L/시간이다.
본 명세서에서는 또한, a) 세포를 이소프렌의 생산에 적합한 조건 하에서 배양하고; 또한 b) 이소프렌을 생산하는 것을 포함하는 이소프렌을 생산하는 방법이 제공되고, 여기에서, 이소프렌의 액상 농도는 약 200 mg/L 이하이고 세포는 이소프렌을 약 400 nmole/gwcm/시간 이상으로 생산한다. 일정 구현예에서, 배양액에서의 이소프렌의 액상 농도는 약 175 mg/L, 150 mg/L, 125 mg/L, 100 mg/L, 75 mg/L, 50 mg/L, 25 mg/L, 20 mg/L, 15 mg/L, 10 mg/L, 5 mg/L, 또는2.5 mg/L 이하이다. 일정 구현예에서, 배양에서의 이소프렌의 액상 농도는 약 0.1 mg/L 내지 200 mg/L, 1 mg/L 내지 200 mg/L, 1 mg/L 내지 150 mg/L, 1 mg/L 내지 100 mg/L, 1 mg/L 내지 50 mg/L, 1 mg/L 내지 25 mg/L, 1 mg/L 내지 20 mg/L, 또는 10 mg/L 내지 20 mg/L 사이 범위이다.
또한 본 명세서에서는 (a) 약 250 M/atm 이하의 헨리의 법칙 계수 및 (b) 약 100 g/L 이하의 물 용해도로 이루어진 그룹으로부터 선택되는 하나 이상의 특징을 가지는 화합물을 생산하는 방법이 제공된다. 일정 구현예에서, 본 방법은 a) 기체가 약 0.01 vvm 내지 약 2.0 vvm 사이의 기체 살포율로 첨가되는 (발효 시스템과 같은 시스템에서 기체의 첨가와 같음), 화합물의 생산에 적합한 조건 하에서 세포를 배양하고; 또한 b) 화합물을 생산하는 것:을 포함한다. 일정 구현예에서, 화합물의 헨리의 법칙 계수는 약 250 M/atm, 200 M/atm, 150 M/atm, 100 M/atm, 75 M/atm, 50 M/atm, 25 M/atm, 10 M/atm, 5 M/atm, 또는 1 M/atm 이하라면 모두이다. 일정 구현예에서, 화합물의 물 용해도는 약 75 g/L, 50 g/L, 25 g/L, 10 g/L, 5 g/L, 또는 1 g/L 이하라면 모두이다. 일정 구현예에서, 화합물은 이소프렌, 알데하이드 (예로, 아세트알데하이드), 케톤 (예로, 아세톤 또는 2-부탄온), 알코올 (예로, 메탄올, 에탄올, 1-부탄올 또는 3-메틸-3-부텐-1-올 또는 3-메틸-2-부텐-1올과 같은 C5알코올), 알코올의 에스테르 (에틸아세테이트 또는 C5 알코올의 에틸에스테르), 헤미테르펜 (hemiterpenes), 모노테르펜 (monoterpenes), 세스퀴테르펜 (sesquiterpenes) 및 C1 내지 C5 탄화수소 (예로, 메탄, 에탄, 에틸렌, 또는 프로필렌)로 이루어진 그룹으로부터 선택된다. 일정 구현예에서, C1 내지 C5 탄화수소는 포화, 불포화, 또는 가지상이다. 상세한 구현예에서, 화합물은 이소프렌이다. 상기 기술된 화합물이라면 모두를 생산하는 방법의 일정 구현예에서, 기체 살포율은 약 0.1 vvm 내지 1 vvm, 0.2 vvm 내지 1 vvm, 또는 0.5 vvm 내지 1 vvm 사이라면 모두의 범위이다.
한 가지 관점에서, 배양에서의 세포가 이소프렌을 생산하는 데 사용된다. 일정 구현예에서, 본 배양에서의 세포는 약 400 nmole 이소프렌/세포의 습윤 무게에 대한 세포의 그램수/시간 (nmole/gwem/시간) 이상의 이소프렌을 생산한다. 일정 구현예에서, 세포는 (i) 이소프렌 합성효소 폴리펩타이드를 인코드하고 (ii) 프로모터에 작동적으로 연결된 이종유래 핵산을 포함한다. 일정 구현예에서, 세포는 이에 제한되는 것은 아니지만 탄소화물, 글리세롤, 글리세린, 디하이드록시아세톤, 일-탄소원, 오일, 동물 지방, 동물 오일, 지방산, 지질, 인지질, 글리세롤지질, 모노글리세라이드, 디글리세라이드, 트리글리세라이드, 재생가능한 탄소원, 폴리펩타이드 (예로, 미생물 또는 식물 단백질 또는 펩타이드), 효모 추출물, 효모 추출물로부터 나온 성분, 또는 전술한 둘 이상의 조합이라면 모두과 같은 탄소원을 포함하는 배양 배지에서 배양된다. 일정 구현예에서, 세포는 제한된 포도당 조건 하에서 배양된다.
일정 구현예에서, 본 배양에서의 세포는 세포 배양 배지에서 약 0.002% 이상의 탄소를 이소프렌으로 전환시킨다. 일정 구현예에서, 세포는 (i) 이소프렌 합성효소 폴리펩타이드를 인코드하고 또한 (ii) 프로모터에 작동적으로 연결된 이종유래 핵산을 가진다. 일정 구현예에서, 세포는 이에 제한되는 것은 아니지만 탄소화물, 글리세롤, 글리세린, 디하이드록시아세톤, 일-탄소원, 오일, 동물 지방, 동물 오일, 지방산, 지질, 인지질, 글리세롤지질, 모노글리세라이드, 디글리세라이드, 트리글리세라이드, 재생가능한 탄소원, 폴리펩타이드 (예로, 미생물 또는 식물 단백질 또는 펩타이드), 효모 추출물, 효모 추출물로부터 나온 성분, 또는 전술한 둘 이상의 조합이라면 모두과 같은 탄소원을 포함하는 배양 배지에서 배양된다. 일정 구현예에서, 세포는 제한된 포도당 조건 하에서 배양된다.
일정 구현예에서, 본 배양에서의 세포는 이소프렌 합성효소 폴리펩타이드를 인코딩하는 이종유래 핵산을 포함한다. 일정 구현예에서, 세포는 (i) 이소프렌 합성효소 폴리펩타이드를 인코드하고 또한 (ii) 프로모터에 작동적으로 연결된 이종유래 핵산을 가진다. 일정 구현예에서, 세포는 이에 제한되는 것은 아니지만 탄소화물, 글리세롤, 글리세린, 디하이드록시아세톤, 일-탄소원, 오일, 동물 지방, 동물 오일, 지방산, 지질, 인지질, 글리세롤지질, 모노글리세라이드, 디글리세라이드, 트리글리세라이드, 재생가능한 탄소원, 폴리펩타이드 (예로, 미생물 또는 식물 단백질 또는 펩타이드), 효모 추출물, 또는 효모 추출물로부터 나온 성분, 또는 전술한 둘 이상의 조합이라면 모두과 같은 탄소원을 포함하는 배양 배지에서 배양된다. 일정 구현예에서, 세포는 제한된 포도당 조건 하에서 배양된다.
한 가지 관점에서, 본 명세서에서는 이소프렌을 생산하도록 본 명세서에서 기술된 세포라면 모두를 사용하는 방법과 같은, 이소프렌을 생산하는 방법이 기술된다. 일정 구현예에서, 방법은 이소프렌을 약 400 nmole/gwem/시간 이상으로 생산하는 데 충분한 조건 하에서 세포를 배양하는 것을 포함한다. 일정 구현예에서, 본 방법은 또한 세포에 의해 생산된 이소프렌을 회수하는 것을 포함한다. 일정 구현예에서, 방법은 좀 더 나아가 세포에 의해 생산된 이소프렌을 정제하는 것을 포함한다. 일정 구현예에서, 본 방법은 이소프렌을 다중합하는 것을 포함한다. 일정 구현예에서, 세포는 (i) 이소프렌 합성효소 폴리펩타이드를 인코드하고 (ii) 프로모터에 작동적으로 연결된 이종유래 핵산을 가진다. 일정 구현예에서, 세포는 이에 제한되는 것은 아니지만 탄소화물, 글리세롤, 글리세린, 디하이드록시아세톤, 일-탄소원, 오일, 동물 지방, 동물 오일, 지방산, 지질, 인지질, 글리세롤지질, 모노글리세라이드, 디글리세라이드, 트리글리세라이드, 재생가능한 탄소원, 폴리펩타이드 (예로, 미생물 또는 식물 단백질 또는 펩타이드), 효모 추출물, 또는 효모 추출물로부터 나온 성분, 또는 전술한 둘 이상의 조합이라면 모두과 같은 탄소원을 포함하는 배양 배지에서 배양된다. 일정 구현예에서, 세포는 제한된 포도당 조건 하에서 배양된다. 다양한 구현예에서, 안정기 동안 생산된 이소프렌량 (생산된 이소프렌의 전체량 또는 OD600당 시간 당 액체배지 리터 당 생산된 이소프렌량과 같음)은 동일한 기간에 성장기 동안 생산된 이소프렌량보다 약 2배 이상이다. 일정 구현예에서, 기체상은 약 9.5% (부피) 산소 이상을 포함하고, 기체상에서 이소프렌의 농도는 저부 발화도 한계 이하이고, 고부 발화도 한계 이상이다. 상세한 구현예에서, (i) 기체상에서 이소프렌의 농도는 저부 발화도 한계 이하이고, 고부 발화도 한계 이상이고, 또한 (ii) 세포는 이소프렌을 약 400 nmole/gwcm/시간 이상으로 생산한다.
일정 구현예에서, 본 방법은 세포 배양 배지에서 약 0.002% 이상의 탄소 (mol/mol)를 이소프렌으로 전환시키는 데 충분한 조건 하에서 세포를 배양하는 것을 포함한다. 일정 구현예에서, 방법은 또한 세포에 의해 생산된 이소프렌을 회수하는 것을 포함한다. 일정 구현예에서, 방법은 세포에 의해 생산된 이소프렌을 정제하는 것을 포함한다. 일정 구현예에서, 방법은 이소프렌을 다중합하는 것을 포함한다. 일정 구현예에서, 세포는 (i) 이소프렌 합성효소 폴리펩타이드를 인코드하고 또한 (ii) 프로모터에 작동적으로 연결된 이종유래 핵산을 가진다. 일정 구현예에서, 세포는 이에 제한되는 것은 아니지만 탄소화물, 글리세롤, 글리세린, 디하이드록시아세톤, 일-탄소원, 오일, 동물 지방, 동물 오일, 지방산, 지질, 인지질, 글리세롤지질, 모노글리세라이드, 디글리세라이드, 트리글리세라이드, 재생가능한 탄소원, 폴리펩타이드 (예로, 미생물 또는 식물 단백질 또는 펩타이드), 효모 추출물, 또는 효모 추출물로부터 나온 성분, 또는 전술한 둘 이상의 조합이라면 모두과 같은 탄소원을 포함하는 배양 배지에서 배양된다. 일정 구현예에서, 세포는 제한된 포도당 조건 하에서 배양된다.
일정 구현예에서, 이소프렌은 안정기에만 생산된다. 일정 구현예에서, 이소프렌은 성장기 및 안정기 둘 다에서 공동-생산된다. 다양한 구현예에서, 안정기 동안 생산된 이소프렌량 (생산된 이소프렌의 전체량 또는 OD600당 시간 당 액체배지 리터 당 생산된 이소프렌량과 같음)은 동일한 기간에 성장기 동안 생산된 이소프렌량보다 약 2, 3, 4, 5, 10, 20, 30, 40, 또는 50배 이상이다.
한 가지 관점에서, 본 명세서에서는 이소프렌을 포함하는 조성물들 및 시스템들이 기술된다. 일정 구현예에서, 조성물은 약 2, 5, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 200, 300, 400, 500, 600, 700, 800, 900, 또는 1000 mg 이상의 이소프렌을 포함한다. 일정 구현예에서, 조성물은 약 2, 5, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100 g 이상의 이소프렌(w/w)을 포함하고, 조성물의 휘발성 유기 분획은 이소프렌이다.
일정 구현예에서, 조성물은 조성물 내의 모든 C5 탄화수소의 전체 무게와 대비한 무게로 약 99.90, 99.92, 99.94, 99.96, 99.98, 또는 100% 이상의 이소프렌을 포함한다. 일정 구현예에서, 조성물은 조성물 내의 모든 C5 탄화수소의 전체 무게와 대비한 무게로 약 0.12, 0.10, 0.08, 0.06, 0.04, 0.02, 0.01, 0.005, 0.001, 0.0005, 0.0001, 0.00005, 또는 0.00001% 이하의 이소프렌이 아닌 C5 탄화수소 (1,3-사이클로펜타디엔, 시스-1,3-펜타디엔, 트랜스-1,3-펜타디엔, 1,4-펜타디엔, 1-펜틴, 2-펜틴, 1-펜텐, 2-메틸-1-부텐, 3-메틸-l-부틴, 펜트-4-엔-1-인, 트랜스-펜트-3-엔-1-인, 또는 시스-펜트-3-엔-1-인과 같음)를 포함한다. 일정 구현예에서, 조성물은 1,3-사이클로펜타디엔, 시스-1,3-펜타디엔, 트랜스-1,3-펜타디엔, 1,4-펜타디엔, 1-펜틴, 2-펜틴, 1-펜텐, 2-메틸-1-부텐, 3-메틸-l-부틴, 펜트-4-엔-1-인, 트랜스-펜트-3-엔-1-인, 또는 시스-펜트-3-엔-1-인에 대하여 조성물 내의 모든 C5 탄화수소의 전체 무게와 대비한 무게로 약 0.12, 0.10, 0.08, 0.06, 0.04, 0.02, 0.01, 0.005, 0.001, 0.0005, 0.0001, 0.00005, 또는 0.00001% 이하로 가진다. 상세한 구현예에서, 조성물은 약 2 mg이상의 이소프렌을 가지고, 조성물 내의 모든 C5 탄화수소의 전체 무게와 대비한 무게로 약 99.90, 99.92, 99.94, 99.96, 99.98, 또는 100% 이상의 이소프렌을 가진다.
일정 구현예에서, 조성물은 이소프렌의 다중합을 저해하는 조성물에 있는 화합물이라면 모두에 대해 약 50, 40, 30, 20, 10, 5, 1, 0.5, 0.1, 0.05, 0.01, 또는 0.005 μg/L 이하의 이소프렌의 다중합을 저해하는 화합물을 포함한다. 상세한 구현예에서, 조성물은 또한 약 2 mg 이상의 이소프렌을 포함한다.
일정 구현예에서, 조성물은 에탄올, 아세톤, C5 프레닐 알코올, 및 10개 이상의 탄소 원자를 가진 이소프레노이드 화합물로 이루어진 그룹으로부터 선택된 하나 이상의 화합물을 가진다. 일정 구현예에서, 조성물은 약 0.005, 0.01, 0.05, 0.1, 0.5, 1, 5, 10, 20, 30, 40, 60, 80, 100, 또는 120 μg/L 이상의 에탄올, 아세톤, C5 프레닐 알코올 (3-메틸-3-부텐-1-올, 또는 3-메틸-2-부텐-1-올과 같음), 또는 전술한 둘 이상이라면 모두를 포함한다. 상세한 구현예에서, 조성물은 약 2 mg 이상의 이소프렌을 가지고, 에탄올, 아세톤, C5 프레닐 알코올, 및 10개 이상의 탄소 원자를 가진 이소프레노이드 화합물로 이루어진 그룹으로부터 선택된 하나 이상의 화합물을 가진다.
일정 구현예에서, 조성물은 이소프렌과 하기 성분으로 이루어진 그룹으로부터 선택된 하나 이상의 두 번째 화합물을 포함한다: 2-헵탄온, 6-메틸-5-헵텐-2-온, 2,4,5-트리메틸피리딘, 2,3,5-트리메틸피라진, 시트로넬랄 (citronellal), 아세트알데하이드, 메탄티올, 메틸 아세테이트, 1-프로판올, 디아세틸, 2-부탄온, 2-메틸-3-부텐-2-올, 에틸 아세테이트, 2-메틸-1-프로판올, 3-메틸-1-부탄알, 3-메틸-2-부탄온, 1-부탄올, 2-펜탄온, 3-메틸-1-부탄올, 에틸 이소부틸레이트, 3-메틸-2-부텐알, 부틸 아세테이트, 3-메틸부틸 아세테이트, 3-메틸-3-부텐-1-일 아세테이트, 3-메틸-2-부텐-1-일 아세테이트, 3-메틸-2-부텐-1-일 아세테이트, 3-헥센-1-올, 3-헥센-1-일 아세테이트, 리모넨, 게라니올 (트랜스-3,7-디메틸-2,6-옥타디엔-1-올), 시트로넬롤 (3,7-디메틸-6-옥텐-1-올), (E)-3,7-디메틸-1,3,6-옥타트리엔, (Z)-3,7-디메틸-1,3,6-옥타트리엔, 및 2,3-사이클로헵텐올피리딘. 다양한 구현예에서, 무게에 의한 퍼센트 단위로 이소프렌량에 상대적인 이들 두 번째 성분 하나의 양 (예로, 이소프렌의 무게로 나눈 성분의 무게 곱하기 100)은 약 0.01, 0.02, 0.05, 0.1, 0.5, 1, 5, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 또는 110% (w/w) 이상이다.
일정 구현예에서, 조성물은 (i) 이소프렌을 포함하는 기체상 및 (ii) 이소프렌을 약 400 nmole/gwcm/시간 이상으로 생산하는 배양에서의 세포를 포함하는 조성물을 포함한다. 일정 구현예에서, 조성물은 폐쇄 시스템을 포함하고, 기체상은 OD600이 1인 1 mL로 정상화될 때 이소프렌을 약 5. 10, 20, 30, 40, 50, 60, 70, 80, 90, 100 ug/L 이상으로 포함한다. 일정 구현예에서, 조성물은 개방 시스템을 포함하고, 기체상은 1 vvm의 속도로 살포될 때 이소프렌을 약 5. 10, 20, 30, 40, 50, 60, 70, 80, 90, 100 ug/L 이상으로 포함한다. 일정 구현예에서, 기체상의 휘발성 유기 분획은 이소프렌을 휘발성 유기 분획 내의 모든 C5 탄화수소의 전체 무게와 대비한 무게로 약 99.90, 99.92, 99.94, 99.96, 99.98, 또는 100% 이상으로 포함한다. 일정 구현예에서, 기체상의 휘발성 유기 분획은 휘발성 유기 분획 내의 모든 C5 탄화수소의 전체 무게와 대비한 무게로 약 0.12, 0.10, 0.08, 0.06, 0.04, 0.02, 0.01, 0.005, 0.001, 0.0005, 0.0001, 0.00005, 또는 0.00001% 이하의 이소프렌이 아닌 C5 탄화수소 (1,3-사이클로펜타디엔, cis-1,3-펜타디엔, trans-1,3-펜타디엔, 1,4-펜타디엔, 1-펜틴, 2-펜틴, 1-펜틴, 2-메틸-1-부텐, 3-메틸-l-부틴, 펜트-4-엔-1-인, trans-펜트-3-엔-1-인, 또는 cis-펜트-3-엔-1-인과 같음)를 포함한다. 일정 구현예에서, 기체상의 휘발성 유기 분획은 1,3-사이클로펜타디엔, cis-1,3-펜타디엔, trans-1,3-펜타디엔, 1,4-펜타디엔, 1-펜틴, 2-펜틴, 1-펜틴, 2-메틸-1-부텐, 3-메틸-l-부틴, 펜트-4-엔-1-인, trans-펜트-3-엔-1-인, 또는 cis-펜트-3-엔-1-인에 대하여 휘발성 유기 분획 내의 모든 C5 탄화수소의 전체 무게와 대비한 무게로 약 0.12, 0.10, 0.08, 0.06, 0.04, 0.02, 0.01, 0.005, 0.001, 0.0005, 0.0001, 0.00005, 또는 0.00001% 이하로 가진다. 상세한 구현예에서, 기체상의 휘발성 유기 분획은 약 2 mg 이상의 이소프렌을 가지고, 휘발성 유기 분획 내의 모든 C5 탄화수소의 전체 무게와 대비한 무게로 약 99.90, 99.92, 99.94, 99.96, 99.98, 또는 100% 이상의 이소프렌을 가진다.
일정 구현예에서, 기체상의 휘발성 유기 분획은 이소프렌의 다중합을 저해하는 기체상의 휘발성 유기 분획에 있는 화합물이라면 모두에 대해 약 50, 40, 30, 20, 10, 5, 1, 0.5, 0.1, 0.05, 0.01, 또는0.005 μg/L 이하의 이소프렌의 다중합를 저해하는 화합물을 포함한다. 상세한 구현예에서, 기체상의 휘발성 유기 분획은 또한 약 2 mg 이상의 이소프렌을 포함한다.
일정 구현예에서, 기체상의 휘발성 유기 분획은 에탄올, 아세톤, C5 프레닐 알코올, 및 10개 이상의 탄소 원자를 가진 이소프레노이드 화합물로 이루어진 그룹으로부터 선택된 하나 이상의 화합물을 가진다. 일정 구현예에서, 기체상의 휘발성 유기 분획은 약 0.005, 0.01, 0.05, 0.1, 0.5, 1, 5, 10, 20, 30, 40, 60, 80, 100, 또는 120 μg/L 이상의 에탄올, 아세톤, C5 프레닐 알코올 (3-메틸-3-부텐-1-올, 또는 3-메틸-2-부텐-1-올과 같음), 또는 전술한 둘 이상이라면 모두를 포함한다. 상세한 구현예에서, 기체상의 휘발성 유기 분획은 약 2 mg 이상의 이소프렌을 가지고, 에탄올, 아세톤, C5 프레닐 알코올, 및 10개 이상의 탄소 원자를 가진 이소프레노이드 화합물로 이루어진 그룹으로부터 선택된 하나 이상의 화합물을 가진다.
일정 구현예에서, 기체상의 휘발성 유기 분획은 이소프렌과, 2-헵탄온, 6-메틸-5-헵텐-2-온, 2,4,5-트리메틸피리딘, 2,3,5-트리메틸피라진, 시트로넬랄 (citronellal), 아세트알데하이드, 메탄티올, 메틸 아세테이트, 1-프로판올, 디아세틸, 2-부탄온, 2-메틸-3-부텐-2-올, 에틸 아세테이트, 2-메틸-1-프로판올, 3-메틸-1-부탄알, 3-메틸-2-부탄온, 1-부탄올, 2-펜탄온, 3-메틸-1-부탄올, 에틸 이소부틸레이트, 3-메틸-2-부텐알, 부틸 아세테이트, 3-메틸부틸 아세테이트, 3-메틸-3-부텐-1-일 아세테이트, 3-메틸-2-부텐-1-일 아세테이트, 3-헥센-1-올, 3-헥센-1-일 아세테이트, 리모넨, 게라니올 (트랜스-3,7-디메틸-2,6-옥타디엔-1-올), 시트로넬롤 (3,7-디메틸-6-옥텐-1-올), (E)-3,7-디메틸-1,3,6-옥타트리엔, (Z)-3,7-디메틸-1,3,6-옥타트리엔, 및 2,3-사이클로헵텐올피리딘으로 이루어진 그룹으로부터 선택된 하나 이상의 두 번째 화합물을 포함한다. 다양한 구현예에서, 무게에 의한 퍼센트 단위로 이소프렌량에 상대적인 이들 두 번째 성분 하나의 양 (예로, 이소프렌의 무게로 나눈 성분의 무게 곱하기 100)은 기체상의 휘발성 유기 분획에서 약 0.01, 0.02, 0.05, 0.1, 0.5, 1, 5, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 또는 110% (w/w) 이상이다.
본 명세서에서 기술된 조성물이라면 모두의 일정 구현예에서, 적어도 이소프렌 일부분은 기체상으로 있다. 일정 구현예에서, 적어도 이소프렌 일부분은 액상 (농축물과 같음)으로 있다. 일정 구현예에서, 적어도 이소프렌 일부분은 기체상으로 있다. 일정 구현예에서, 적어도 이소프렌 일부분은 실리카 및/또는 활성화 탄소를 포함하는 지지체와 같은 고체 지지체에 흡착되어 있다. 일정 구현예에서, 조성물은 에탄올을 포함한다. 일정 구현예에서, 조성물은 에탄올의 무게로 약 75 내지 약 80%, 약 80 내지 약 85%, 또는 약 85 내지 약 90%와 같은 에탄올을 무게로 약 75 내지 약 90% 사이의 범위로 포함한다. 일정 구현예에서, 조성물은 이소프렌의 무게로 약 4 내지 약 8%, 약 8 내지 약 12%, 또는 약 12 내지 약 15%와 같은 이소프렌을 무게로 약 4 내지 약 15% 사이의 범위로 포함한다.
일정 구현예에서, 본 시스템은 본 명세서에서 기술된 세포 및/또는 조성물이라면 모두를 포함한다. 일정 구현예에서, 시스템은 체임버가 이소프렌을 약 400, 500, 600, 700, 800, 900, 1,000, 1,250, 1,500, 1,750, 2,000, 2,500, 3,000, 4,000, 또는 5,000 nmole/gwcm/시간 이상으로 생산하는 배양에서의 세포를 포함하는 반응기를 포함한다. 일정 구현예에서, 시스템은 폐쇄된 시스템이 아니다. 일정 구현예에서, 적어도 이소프렌의 일부분은 시스템으로부터 제거된다. 일정 구현예에서, 시스템은 이소프렌을 포함하는 기체상을 포함한다. 다양한 구현예에서, 기체상은 본 명세서에서 기술된 조성물이라면 모두를 포함한다.
본 명세서에서 기술된 조성물들, 시스템들, 및 방법들이라면 모두의 일정 구현예에서, 기체상에서 발화가능하지 않은 농도의 이소프렌이 생성된다. 일정 구현예에서, 기체상은 약 9.5% (부피) 이하의 산소를 포함한다. 일정 구현예에서, 기체상은 약 9.5% (부피) 이상의 산소를 포함하고, 기체상에서 이소프렌의 농도는 저부 발화도 한계 이하이고, 고부 발화도 한계 이상이다. 일정 구현예에서, 이소프렌이 아닌 기체상의 부분은 약 10% 내지 약 100% (부피) 사이의 산소와 같은 약 0% 내지 약 100% (부피) 사이 범위의 산소를 포함한다. 일정 구현예에서, 이소프렌이 아닌 기체상의 부분은 약 0% 내지 약 99% (부피) 사이 범위의 질소를 포함한다. 일정 구현예에서, 이소프렌이 아닌 기체상의 부분은 약 1% 내지 약 50% (부피) 사이 범위의 CO2를 포함한다.
본 명세서에서 기술된 관점이라면 모두의 일정 구현예에서, 배양에서의 세포는 이소프렌을 약 400, 500, 600, 700, 800, 900, 1,000, 1,250, 1,500, 1,750, 2,000, 2,500, 3,000, 4,000, 또는 5,000 nmole/gwcm/시간 이상으로 생산한다. 본 명세서에서 기술된 관점이라면 모두의 일정 구현예에서, 배양에서의 세포는 세포 배양 배지에서 탄소의 약 0.002, 0.005, 0.01, 0.02, 0.05, 0.1, 0.12, 0.14, 0.16, 0.2, 0.3, 0.4, 0.5, 0.6, 0.7, 0.8, 0.9, 1.0, 1.2, 1.4, 1.6% 이상을 이소프렌으로 전환시킨다. 본 명세서에서 기술된 관점이라면 모두의 일정 구현예에서, 배양에서의 세포는 이소프렌을 약 1, 10, 25, 50, 100, 150, 200, 250, 300, 400, 500, 600, 700, 800, 900, 1,000, 1,250, 1,500, 1,750, 2,000, 2,500, 3,000, 4,000, 5,000, 10,000, 100,000 ng/세포의 습윤 무게에 대한 세포의 그램수/시간 (ng/gwcm/h) 이상으로 생산한다. 본 발명의 관점이라면 모두의 일정 구현예에서, 배양에서의 세포는 이소프렌의 누적 역가 (전체량)을 약 1, 10, 25, 50, 100, 150, 200, 250, 300, 400, 500, 600, 700, 800, 900, 1,000, 1,250, 1,500, 1,750, 2,000, 2,500, 3,000, 4,000, 5,000, 10,000, 50,000, 100,000 mg 이소프렌/L 액체배지 (mg/L액체배지, 여기에서 액체배지의 부피는 세포 및 세포 배지의 부피를 포함한다) 이상으로 생산한다. 기타 대표적인 이소프렌 생산의 속도 및 이소프렌 생산의 전체량은 본 명세서에 기재되어 있다.
본 명세서에서 기술된 관점이라면 모두의 일정 구현예에서, 세포는 좀 더 나아가 IDI 폴리펩타이드를 인코딩하는 이종유래 핵산을 포함한다. 본 명세서에서 기술된 관점이라면 모두의 일정 구현예에서, 세포는 좀 더 나아가 IDI 폴리펩타이드를 인코딩하는 이종유래 핵산의 사본의 삽입을 포함한다. 본 명세서에서 기술된 관점이라면 모두의 일정 구현예에서, 세포는 좀 더 나아가 DXS 폴리펩타이드를 인코딩하는 이종유래 핵산을 포함한다. 본 명세서에서 기술된 관점이라면 모두의 일정 구현예에서, 세포는 좀 더 나아가 DXS 폴리펩타이드를 인코딩하는 이종유래 핵산 사본의 삽입을 포함한다. 본 명세서에서 기술된 관점이라면 모두의 일정 구현예에서, 세포는 좀 더 나아가 IDI 폴리펩타이드 및 DXS 폴리펩타이드를 인코딩하는 하나 이상의 핵산을 포함한다. 본 명세서에서 기술된 관점이라면 모두의 일정 구현예에서, 하나의 핵산은 이소프렌 합성효소 폴리펩타이드, IDI 폴리펩타이드, 및 DXS 폴리펩타이드를 인코드한다. 본 명세서에서 기술된 관점이라면 모두의 일정 구현예에서, 하나의 벡터는 이소프렌 합성효소 폴리펩타이드, IDI 폴리펩타이드, 및 DXS 폴리펩타이드를 인코드한다. 일정 구현예에서, 벡터는 항생제 저항성 핵산과 같은 선별 마커를 포함한다.
본 명세서에서 기술된 관점이라면 모두의 일정 구현예에서, 이종유래 이소프렌 합성효소는 중간 또는 높은 사본수 플라스미드에 포함되는 T7 프로모터와 같은 T7 프로모터에 작동적으로 연결된다. 본 명세서에서 기술된 관점이라면 모두의 일정 구현예에서, 이종유래 이소프렌 합성효소 핵산은, 중간 또는 높은 사본수 플라스미드에 포함되는 Trc 프로모터와 같은 Trc 프로모터에 작동적으로 연결된다. 본 명세서에서 기술된 관점이라면 모두의 일정 구현예에서, 이종유래 이소프렌 합성효소 핵산은, 낮은 사본수 플라스미드에 포함되는 Lac 프로모터와 같은 Lac 프로모터에 작동적으로 연결된다. 본 명세서에서 기술된 관점이라면 모두의 일정 구현예에서, 이종유래 이소프렌 합성효소 핵산은, 내재성 알칼라인 세린 프로테아제 프로모터와 같은 내재성 프로모터에 작동적으로 연결된다. 본 명세서에서 기술된 관점이라면 모두의 일정 구현예에서, 이종유래 이소프렌 합성효소 핵산은 선별 마커가 없이 세포의 염색체 내로 통합된다.
일정 구현예에서, 하나 이상의 MVA 경로, IDI, DXP, 또는 이소프렌 합성효소, 핵산은 성장기보다는 안정기에 활성이 더 큰 프로모터 또는 인자의 조절 하에 놓인다. 예를 들어, 하나 이상의 MVA 경로, IDI, DXP, 또는 이소프렌 합성효소 핵산은 RopS와 같은 안정기 시그마인자의 조절 하에 놓인다. 일정 구현예에서, 하나 이상의 MVA 경로, IDI, DXP, 이소프렌 합성효소 핵산은 안정기에 활성이 있는 반응 조절인자에 의해 유도가능한 프로모터와 같은, 안정기에 유도가능한 프로모터의 조절 하에 놓인다.
본 명세서에서 기술된 관점이라면 모두의 일정 구현예에서, 적어도 세포의 일부분은 이종유래 이소프렌 합성효소 핵산을 연속식 배양 (희석이 없는 연속식 배양과 같음)에서 적어도 또는 약 5, 10, 20, 40, 50, 60 또는 65번 이상의 세포 분열 동안 유지시킨다. 본 명세서에서 기술된 관점이라면 모두의 일정 구현예에서, 이종유래 이소프렌 합성효소, IDI, 또는 DXS 핵산을 포함하는 핵산도 또한 항생제 저항성 핵산과 같은 선별 마커를 포함한다.
본 명세서에서 기술된 관점이라면 모두의 일정 구현예에서, 세포는 좀 더 나아가 MVA 경로 폴리펩타이드 (사카로마이세스 세레비시아애 또는 엔테로코커스 페칼리스 로부터 나온 MVA경로 폴리펩타이드와 같음)를 인코딩하는 이종유래 핵산을 포함한다. 본 명세서에서 기술된 관점이라면 모두의 일정 구현예에서, 세포는 좀 더 나아가 MVA경로 폴리펩타이드 (사카로마이세스 세레비시아애 또는 엔테로코커스 페칼리스 로부터 나온 MVA경로 폴리펩타이드와 같음)를 인코딩하는 이종유래 핵산 사본의 삽입을 포함한다. 본 명세서에서 기술된 관점이라면 모두의 일정 구현예에서, 세포는 이소프렌 합성효소, DXS, 및 MVA 경로 핵산을 포함한다. 본 명세서에서 기술된 관점이라면 모두의 일정 구현예에서, 세포는 이소프렌 합성효소 핵산, DXS 핵산, IDI 핵산 및 MVA 경로 핵산 (IDI 핵산에 추가함)을 포함한다.
본 명세서에서 기술된 관점이라면 모두의 일정 구현예에서, 이소프렌 합성효소 폴리펩타이드는 푸엘라리아 (Pueraria) (예로, 푸엘라리아 몬타나 (Pueraria montana) 또는 푸엘라리아 로바타 (Pueraria lobata)) 또는 포풀러스 (Populus) (예로, 포풀러스 트레물로이데스 (Populus tremuloides), 포풀러스 알바 (Populus alba), 포풀러스 니그라 (Populus nigra), 포풀러스 트리코카르파 (Populus trichocarpa), 또는 하이브리드 포풀러스 알바 x 포풀러스 트레물라 (Populus alba x Populus tremula))로부터 나온 폴리펩타이드이다.
본 명세서에서 기술된 관점이라면 모두의 일정 구현예에서, 세포는 그램-양성 박테리아 세포와 같은 박테리아 세포이다 (예로, 바실러스 섭틸리스와 같은 바실러스 세포, 또는 스트렙토마이세스 리비단스 (Streptomyces lividans), 스트렙토마이세스 실리컬러 (Streptomyces coelicolor), 또는 스트렙토마이세스 그리서스 (Streptomyces griseus) 세포와 같은 스트렙토마이세스 세포). 본 명세서에서 기술된 관점이라면 모두의 일정 구현예에서, 세포는 그램-음성 박테리아 세포이다 (예로, 에스케리키아 콜라이 (Escherichia coli) 세포와 같은 에스케리키아 세포, 로도슈도모나스 팔루스트리스 세포와 같은 로도모나스 종 세포, 슈도모나스 플루오레센스 세포 또는 슈도모나스 푸티다 세포와 같은 슈도모나스 종 세포, 또는 판토에아 시트레아 세포와 같은 판토에아 세포). 본 명세서에서 기술된 관점이라면 모두의 일정 구현예에서, 세포는 필라멘트성 곰팡이 세포와 같은 곰팡이 세포 (예로, 트리코더마 리세이 세포와 같은 트리코더마 세포 또는 아스퍼질러스 오리자이 및 아스퍼질러스 니거와 같은 아스퍼질러스 세포) 또는 효모 세포 (예로, 야로위야 리포리티카와 같은 야로위야 세포 또는 사카로마이세스 세레비시애와 같은 사카로마이세스 세포)이다.
본 명세서에서 기술된 관점이라면 모두의 일정 구현예에서, 미생물 폴리펩타이드 탄소원은 효모 또는 박테리아로부터 나온 하나 이상의 폴리펩타이드를 포함한다. 본 발명의 관점이라면 모두의 일정 구현예에서, 식물 폴리펩타이드 탄소원은 콩, 옥수수, 카놀라, 자트로파, 팜, 땅콩, 해바라기, 코코넛, 머스타드, 평지종자, 목화종자, 팜 줄기, 올리브, 잇꽃, 참깨, 또는 아마종자로부터 나온 하나 이상의 폴리펩타이드를 포함한다.
합성 기체를 에너지원으로 사용하여 혐기성 미생물에서 이소프렌의 생산
일정 구현예에서, 바이오이소프렌 조성물은 2009년 12월 22일자로 제출되고 본 명세서에서 내용 전부가 참고문헌으로 통합되어 있는 미국 가특허출원 제 61/289,347호 및 제 61/289,355호에서 기술된 바와 같이, 합성 기체를 에너지원으로 사용하여 혐기성 미생물에서 생산된다.
합성가스 (syngas)로부터 혐기성 생물에 의한 이소프렌의 생산은 호기성 생물에 의한 슈가로부터 이소프렌의 생산보다 많은 장점을 제공할 수 있다. 먼저, 이소프렌의 최대 이론적 질량 수율은 좀 더 나아가 하기에 논의된 바와 같이 호기성 생물의 경우 더 클 수 있다. 둘째, 혐기성 생물은 세포 성장, 부산물 (글리세롤, 젖산, 또는 에탄올)의 형성 또는 분자적 산소를 사용한 산화에 의해 전환되어야만 하는 NAD(P)H의 형태에서 과잉 환원력을 가지지 않는다. 이러한 NAD(P)H 전환 (turnover) 요구가 없더라도, 혐기성 생물은 더 높은 에너지 수율, 더 낮은 산소 요구도, 더 낮은 발효 열, 및 더 낮은 사용 비용을 가지고 공정을 진행할 수 있다. 셋째, 혐기성 생물은 시스템에서의 산소 결핍으로 인해 배출 기체에서 더 높은 이소프렌 농도, 발화가능한 이소프렌-산소 혼합물을 만드는 더 낮은 가능성, 보다 쉬운 회수, 및 더 높은 이소프렌 품질을 가질 수 있다. 네째, 혐기성 생물은 기존의 바이오에탄올의 생산을 위해 설계된 공장과 같은 기존의 기반시설을 사용하여 보다 용이하게 성장될 수 있다.
이소프렌 생산에 유용한 혐기성 생물로는 절대적 혐기성 생물 (obligate anaerobes), 조건부 혐기성 생물 (facultative anaerobes) 및 공기내성 혐기성 생물 (aerotolerant anaerobes)를 포함할 수 있다. 절대적 혐기성 생물은 크로스트리듐 엘정다리 (Clostridium ljungdahlii), 크로스트리듐 오토에타노게늄 (Clostridium autoethanogenum), 유로박테리움 리모슘 (Eurobacterium limosum), 크로스트리듐 카르복시디보란스 (Clostridium carboxydivorans), 펩토스트렙토코커스 프로닥투스 (Peptostreptococcus productus), 및 부티리박테리움 메틸로트로피쿰 (Butyribacterium methylotrophicum)으로 이루어진 그룹으로부터 선택되는 하나 이상의 조합이라면 모두일 수 있다. 이소프렌의 생산에 에너지원으로서 유용한 합성가스는 메탄 재형성 (methane reforming), 석탄 액화 (coal liquefaction), 보조-발화 (co-firing), 발효적 반응 (fermentative reactions), 효소적 반응 (enzymatic reactions), 및 바이오매스 기체화 (biomass gasification)를 포함하는 다양한 공정에 의해 공급원료로부터 유래할 수 있다.
대표적인 정제 방법
일정 구현예에서, 본 발명에서 기술된 방법이라면 모두는 좀 더 나아가 공동-생산된 화합물을 회수하는 것을 포함한다. 일정 구현예에서, 본 발명에서 기술된 방법이라면 모두는 좀 더 나아가 이소프렌을 회수하는 것을 포함한다. 일정 구현예에서, 본 발명에서 기술된 방법이라면 모두는 좀 더 나아가 수소를 흡착 매트릭스-기초한 분리 방법인 저온발생 막 (cryogenic membrane)에 의해 회수하는 것을 포함한다. 일정 구현예에서, 본 발명에서 기술된 방법이라면 모두는 좀 더 나아가 에탄올을 회수하는 것을 포함한다. 일정 구현예에서, 본 발명에서 기술된 방법이라면 모두는 좀 더 나아가 1,3-프로판디올을 회수하는 것을 포함한다.
본 명세서에서 기술된 조성물 및 방법을 사용하여 생산된 이소프렌과 수소는 기체 비워냄법 (gas stripping), 막 증진된 분리법 (membrane enhanced separation), 분획법 (fractionation), 흡착/탈착법 (adsorption/desorption), 증발법 (pervaporation), 고체 상으로부터 이소프렌의 열 또는 증기 탈착법, 또는 용매로 고체 상에 고정되거나 흡수된 이소프렌의 추출법과 같은 표준 방법을 사용하여 회수될 수 있다 (예를 들어, 미국특허 제 4,703,007호, 제 4,570,029호, 및 제 4,740,222호 ("정련 및 석유화학적 배출-기체 스트림으로부터 수소의 회수 및 정제 (Recovery and Purification of Hydrogen from Refinery and Petrochemical Off-gas Streams)")을 참조하고, 이들은 각각 본 명세서에서 참조문헌으로 전부, 상세하게는 이소프렌 회수 및 분리 방법 ('007 및 '029 특허) 및 수소 회수 및 분리 방법 ('222 특허)에 관하여 통합되어 있다). 상세한 구현예에서, 알코올 (에탄올, 메탄올, 프로판올 또는 그의 조합과 같음)을 사용한 추출적 증류법이 이소프렌을 회수하는 데 사용된다. 일정 구현예에서, 이소프렌의 회수는 액체 형태 (이소프렌의 순수 용액 또는 용매에 녹인 이소프렌 용액과 같음)로 이소프렌의 분리를 포함한다. 기체 비워냄은 연속적 방식으로 발효 배출-기체 증기로부터 이소프렌 증기의 제거를 포함한다. 이러한 제거는, 이에 제한되는 것은 아니지만 고체 상에 대한 흡착, 액상 내로 분배 (partition), 또는 직접적인 농축 (농축 코일에 노출로 인한 또는 압력의 증가로 인한 농축과 같음)을 포함하는 여러 가지 다른 방식으로 달성될 수 있다. 일정 구현예에서, 증기의 이슬점 이상에서 희석된 이소프렌 증기의 막 농축 (membrane enrichment)은 액체 이소프렌의 농축을 가져온다. 일정 구현예에서, 이소프렌은 압축되고 농축된다.
이소프렌의 회수는 한 단계 또는 복수의 단계를 포함할 수 있다. 일정 구현예에서, 발효 배출-기체로부터 이소프렌 증기의 제거 및 액상으로 이소프렌의 전환은 동시적으로 수행된다. 예를 들어, 이소프렌은 액체를 형성하도록 배출-기체로부터 직접 농축될 수 있다. 일정 구현예에서, 발효 배출-기체로부터 이소프렌 증기의 제거 및 액상으로 이소프렌의 전환은 연속적으로 수행된다. 예를 들어, 이소프렌은 고체 상에 흡착된 다음 용매를 사용하여 고체 상으로부터 추출될 수 있다.
수소의 회수는 한 단계 또는 복수의 단계를 포함할 수 있다. 일정 구현예에서, 발효 배출-기체로부터 수소 증기의 제거 및 액상으로 수소의 전환은 동시적으로 수행된다. 일정 구현예에서, 발효 배출-기체로부터 수소 증기의 제거 및 액상으로 수소의 전환은 연속적으로 수행된다. 예를 들어, 수소는 고체 상에 흡착된 다음 압력 스윙 (pressure swing)에 의해 고체 상으로부터 탈착된다. 일정 구현예에서, 회수된 수소는 농축되고 압축된다.
일정 구현예에서, 본 명세서에서 기술된 방법이라면 모두는 좀 더 나아가 이소프렌을 정제하는 것을 포함한다. 예를 들어, 본 명세서에서 기술된 조성물 및 방법을 사용하여 생산된 이소프렌은 표준 기법을 사용하여 정제될 수 있다. 정제는 이소프렌을 생산할 때 존재하는 하나 이상의 성분으로부터 이소프렌이 분리되는 과정을 말한다. 일정 구현예에서, 이소프렌은 실질적으로 순수한 액체로서 획득된다. 정제 방법의 예로는 (i) 액체 추출물로 있는 용액으로부터 증류 및 (ii) 크로마토그래피를 포함한다. 본 명세서에서 사용되는 바, "정제된 이소프렌 (purified isoprene)"은 이소프렌을 생산할 때 존재하는 하나 이상의 성분으로부터 분리되었던 이소프렌을 의미한다. 일정 구현예에서, 이소프렌은 무게로 이소프렌을 생산할 때 존재하는 하나 이상의 성분으로부터 떨어져 나온 것의 적어도 약 20%이다. 다양한 구현예에서, 이소프렌은 무게로 순수한 것의 적어도 또는 약 25%, 30%, 40%, 50%, 60%, 70%, 75%, 80%, 90%, 95%, 또는 99%이다. 정제도는 적절한 방법이라면 모두, 예로 컬럼 크로마토그래피, HPLC 분석법, 또는 GC-MS 분석법에 의해 분석될 수 있다.
일정 구현예에서, 본 명세서에서 기술된 방법이라면 모두는 좀 더 나아가 수소를 정제하는 것을 포함한다. 예를 들어, 본 명세서에서 기술된 조성물 및 방법을 사용하여 생산된 수소는 표준 기법을 사용하여 정제될 수 있다. 정제는 수소를 생산할 때 존재하는 하나 이상의 성분으로부터 수소가 분리되는 과정을 말한다. 일정 구현예에서, 수소는 실질적으로 순수한 기체로서 획득된다. 일정 구현예에서, 수소는 실질적으로 순수한 액체로서 획득된다. 본 정제 방법의 예로는 (i) 냉동발생 농축 및 (ii) 고체 매트릭스 흡착을 포함한다. 본 명세서에서 사용되는 바, "정제된 수소 (purified hydrogen)"는 수소를 생산할 때 존재하는 하나 이상의 성분으로부터 분리되었던 수소를 의미한다. 일정 구현예에서, 수소는 무게로 수소를 생산할 때 존재하는 하나 이상의 성분으로부터 떨어져 나온 것의 적어도 약 20%이다. 다양한 구현예에서, 수소는 무게로 순수한 것의 적어도 또는 약 25%, 30%, 40%, 50%, 60%, 70%, 75%, 80%, 90%, 95%, 또는 99%이다. 정제도 (purity)는 적절한 방법이라면 모두, 예로 컬럼 크로마토그래피, 또는 GC-MS 분석법에 의해 분석될 수 있다.
일정 구현예에서, 이소프렌의 제거를 위하여 하나 이상의 회수 단계 이후에 남아있는 기체 상의 적어도 일부분은 기체 상을 이소프렌의 생산을 위한 세포 배양 시스템에 도입하여 재순환된다.
바이오이소프렌 조성물의 발효기 배출-기체로부터 정제를 위한 방법들 및 장치들은 2009년 12월 18일자로 제출된 미국 가특허출원 제 61/88,142호에 기술되어 있고, 이는 본 명세서에서 내용 전부가 참고문헌으로 통합되어 있다.
발효기 배출-기체로부터 나온 바이오이소프렌 조성물은 휘발성 분순물 및 바이오-부산물 불순물을 가진 바이오이소프렌을 포함할 수 있다. 일정 구현예에서, 바이오이소프렌 조성물은 (a) 발효기 배출-기체를 첫 번째 컬럼에서 용매와 접촉시켜서 용매, 대부분의 이소프렌, 대부분의 바이오-부산물 분순물을 포함하는 이소프렌-풍부 용액을 형성하고; (b) 이소프렌-풍부 용액을 첫 번째 컬럼으로부터 두 번째 컬럼으로 전달하고; 또한 (c) 이소프렌을 두 번째 컬럼에서의 이소프렌-풍부 용액으로부터 비워내어 대부분의 바이오-부산물 분순물을 포함하는 이소프렌-빈약 용액을 형성하는 것:을 포함하는 방법을 사용하여 정제된다.
도 169는 이소프렌을 정제하는 대표적인 방법 및 대표적인 장치를 도시하고 있다. 이소프렌을 포함하는 발효기 배출-기체는 재생가능한 자원 (예로, 탄소원)으로부터, 예를 들어 이의 내용이 본 명세서에서 참고문헌으로, 상세하게는 이소프렌을 포함하는 발효기 배출-기체를 생성하는 방법에 관하여 통합되어 있는 미국 가특허출원 제 61/187,944호에 기술된 바와 같이, 당해 기술분야에서의 방법이라면 모두에 의해 생성될 수 있다. 하나 이상의 개별적 발효기 12 (예로, 일련으로 및/또는 평행으로 연결된 1, 2, 3, 4, 5, 6, 7, 8개 이상의 발효기)로부터 생성된 발효기 배출-기체는 첫 번째 컬럼 14로 인도될 수 있다. 하기에 기술된 바와 같이, 발효기 배출-기체는 분리 유닛 16을 통하여 인도될 수 있고 및/또는 압축 시스템 18과 같은 압축 수단에 의해 압축될 수 있다. 추가적으로, 발효기 배출-기체의 온도는 임의적으로 예를 들어 용매 (이소프렌과 같은 하나 이상의 배출-기체의 용해 (solubilization)를 도울 수 있음)와 접촉하기 이전에 농축물 또는 부분적 농축물을 형성하도록 일정 시점으로 내릴 수 있다. 발효기 배출-기체는 컬럼 14에서 용매 (예로, 비극성 고비등점 용매와 같은 본 명세서에서 기술된 용매라면 모두)와 접촉 (예로, 흡수)될 수 있다. 용매에서 (상세하게는, 비극성 고비등점 용매로) 흡수 경향성이 적은 휘발성 불순물은 남아있는 용매/발효기 배출-기체 혼합물로부터 분리되어, 대부분의 휘발성 불순물 (예로, 포트 20에 존재함)을 포함하는 증기 또한 대부분의 이소프렌 및 대부분의 바이오-부산물 불순물을 가지는 이소프렌-풍부 용액 (예로, 포트 22에서)이 된다. 임의적으로 용매는 발효기 배출-기체와의 접촉 이전에 및/또는 이후에 적합한 수단이라면 모두에 의해 (예로, 수증기에 의해) 동시적으로 가열될 수 있고, 이는 남아있는 용액으로부터 휘발상 불순물의 분리를 도와줄 수 있다. 수증기는 컬럼을 통하여 인도되어 (도 169에 나타난 바와 같이 배출-기체의 입구 근처 및/또는 휘발성 불순물 출구의 반대쪽 말단과 같은 적합한 위치라면 모두에서) 휘발성 불순물의 제거를 도와줄 수 있는 일소하는 (sweeping) 증기 상을 제공한다.
대부분의 이소프렘 및 대부분의 바이오-부산물 불순물을 가지는 이소프렌-풍부 용액 (예로, 포트 22에서)는 두 번째 컬럼 24로 인도될 수 있다. 두 번째 컬럼은 첫 번째 컬럼 14로부터 분리될 수 있거나 (도 169에 나타난 바와 같음) 첫 번째 및 두 번째 컬럼 둘 다를 포함하는 단일 컬럼의 일부일 수 있다 (예로, 용매가 첫 번째 컬럼을 한쪽 말단 또는 그 근처로 들어가고 두 번째 컬럼을 한쪽 말단 또는 그 근처로 나오는 나란히 배열된 컬럼). 이소프렌은 두 번째 컬럼에서 이소프렌-풍부 용액으로부터 비워져서 정제된 이소프렌 조성물 (예로, 포트 26에서) 및 대부분의 바이오-부산물 불순물 (예로, 포트 28에서)을 포함하는 이소프렌-빈약 용액을 생성한다. 이소프렌-풍부 용액은 적합한 수단이라면 모두에 의해 (예로, 수증기에 의해) 가열될 수 있고, 이는 남아있는 용액으로부터 이소프렌의 분리 (stripping)를 도와줄 수 있다. 수증기는 컬럼을 통하여 인도된다 (도 169에서 나타난 바와 같이 이소프렌-풍부 용액의 입구 근처 및/또는 이소프렌-빈약 용액 출구의 반대쪽 말단과 같은 적합한 위치라면 모두에서).
본 명세서에서 기술된 바와 같이, 컬럼은 통상적인 것이고 적합한 크기라면 모두가 된다. 대표적인 유형의 컬럼은 코흐 모듈 프로세스 시스템사 (Koch Modular Process Systems. 파라무스 (Paramus), NJ), 플루오르사 (Fluor Corporation, 어바인, TX), 미국 쿠흐니사 (Kuhni) (Mount Holly, NC)를 포함하는 제조사로부터 시판되고 있다. 일반적으로, 컬럼은 증기/액체 접촉을 최대화하도록 설계되어 원하는 효율을 달성한다. 이것은 컬럼을 충전 물질 (packing material) 또는 컬럼을 따라 규칙적인 간격으로 공간 배치된 선반 (trays) 둘 중 하나로 컬럼을 채우는 것에 의해 달성된다. 적합한 충전 물질로는 금속, 유리, 중합체 및 세라믹 물질을 기초로 하는 무작위 (random) 및 구조화된 (structured) 유형 둘 다를 포함한다. 대표적인 무작위 충전 유형으로는 라쉬그 고리 (Raschig rings), 팰 고리 (Pall rings), 에이-팩 고리 (A-PAK rings), 새들 고리 (Saddle rings), 프로-팩 (Pro-Pak), 헬리-팩 (Heli-Pak), 세라믹 새들 (Ceramic saddles) 및 플렉시링스®(FLEXIRINGS®)을 포함한다. 구조화된 충전으로는 와이어 메쉬 및 천공된 금속판 유형 물질을 포함한다. 컬럼 충전에서 전문화된 제조사로는 ACS 세퍼레이션 & 매스-트랜스퍼 프로덕트사 (ACS Separations & Mass-Transfer Products, 휴스톤, TX), 존슨 브로스. 금속 성형사 (Johnson Bros. Metal Forming Co., 버클리, IL) 및 고흐 글리치사의 나이트 지사 (Koch Glitsch, Inc. Knight Div., 이스트캔튼, OH)를 포함한다. 기체 분리 컬럼 (gas stripping column)의 효율은 이론적인 판의 높이 및 컬럼에서 판의 전체 숫자로 표현된다. 일반적으로, 존재하는 이론적인 판의 숫자가 더 많아지면, 컬럼의 효율은 더 커진다. 실험실 규모의 컬럼은 에이스 글라스사 (Ace Glass, 바인랜드, NJ), 시그마-알드리치사 (Sigma-Aldrich, 세인트루이스, MO) 및 켐글라스사 (Chemglass, 바인랜드, NJ)로부터 구입할 수 있다. 적합한 유형의 유리 컬럼으로는 비그류 (Vigreux), 스나이더 (Snyder), 헴플 및 천공된-판형 컬럼을 포함한다. 컬럼은 충전 물질을 포함하거나 증기/액체 접촉을 최대화하도록 설계된 특징을 가질 수 있다. 실험실 규모의 기체 분리 유닛 (gas scrubber unit) (부분 # CG-1830-10)이 켐글라스사로부터 입수가능하고 이는 충전된 유리 컬럼, 용매 저장고 (solvent reservoir) 및 용매 재순환 펌프 (solvent recirculation pump)로 구성된다.
두 번째 컬럼 24로부터 나온 정제된 이소프렌 조성물 (예로, 포트 26에 존재함)은 좀 더 나아가 적합한 수단이라면 모두에 의해 (예로, 환류 농축기 (reflux condenser) 34 및/또는 실리카 흡착 시스템과 같은 흡착 시스템 (adsorption system) 36을 사용하는 것에 의해) 정제될 수 있다. 환류는 이소프렌 산물에서 용매 조성물을 감소시킨다. 이소프렌-빈약 용액은 재사용을 위해 첫 번째 컬럼으로 재순환될 수 있다 (예로, 도 169에서 포트 30으로 나타난 바와 같음). 이소프렌-빈약 용액은 바이오-부산물의 양을 감소하도록 첫 번째 컬럼 14로 재순환되기 이전에 적합한 수단이라면 모두에 의해 (예로, 액체-액체 추출 및/또는 실리카 흡착 시스템과 같은 흡착 시스템 32에 의해) 정제될 수 있다. 추가적으로, 이소프렌-빈약 용액의 온도는 첫 번째 컬럼 14로 재순환되기 이전에 적합한 수단이라면 모두에 의해 (예로, 임의적으로 이소프렌 용액을 정제하기 이전에 및/또는 이후에 동시적으로) 강하될 수 있다. 도 169는 이소프렌-빈약 용액을 정제하기 이전에 포트 40에서 이소프렌-빈약 용액의 온도를 강하하는 예를 나타내고 있다 (이 경우에, 온도 강하를 위해 냉각제 (coolant)를 사용함).
대부분의 휘발성 불순물을 포함하는 증기 (예로, 도 169에서 포트 20에 존재하는 증기)는 소수 일부분의 이소프렌 (예로, 이소프렌-풍부 용액에 남아있지 않은 잔존 이소프렌)을 포함할 수 있다. 잔존 이소프렌은 적합한 수단이라면 모두에 의해 (활성 탄소 흡착 시스템과 같은 흡착 시스템 38) 대부분의 휘발성 불순물을 포함하는 증기로부터 사용 시 재수집될 수 있고, 일정 경우 도 169에 나타난 바와 같이 정제된 이소프렌 조성물과 조합될 수 있다 (시스템 36과 유사한 흡착 시스템과 같은 추가적인 정제 이전에, 기간 동안, 또는 이후에). 도 169도 역시 증기로부터 대기 내로 방출되는 바람직하지 않은 성분의 양을 감소시킬 수 있는 임의적 포획 장치 (capture device) 42 (예로, 열 산화기 (thermal oxidizer) 및/또는 CO2 포획 시스템)를 나타내고 있다.
이소프렌의 대표적인 화학적 변환
이소프렌의 최근의 산업적 용도가 합성 고무의 생산에 있어 선호되기는 하지만, 이소프렌은 반응성 있는 결합된 디엔 (conjugated diene)이고 다양한 화학적 변환을 거쳐서 산화물 및 더 높은 분자량의 탄화수소를 형성한다. 예를 들어, 팔라듐(0) 복합체 (Pd(acac)2-Ph3P 및 Pd(OAc)2-Ph3P)는 알코올 용매에서 이소프렌의 이중합 및 말단중합 (telomerization)을 촉매하여 직선형 이소프렌 이중체 (예로, 2,7-디메틸-1,3,7-옥타트리엔 (2,7-dimethyl-1,3,7-octatriene)) 및 메톡시디메틸옥타디엔 (methoxydimethyloctadienes) (Zakharkin, L. I. and Babich, S. A. Russ. Chem. Bull. (1976), pp 1967-1968.)을 준다. 아담스 및 클랩은 이가 및 삼가 전이 금속-교환 몬트모릴로나이트 (montmorillonites) (예로, Cr3+-몬트모릴로나이트) 위에 이소프렌의 반응이 이소프렌 이중체 및 메탄올과의 부가물 (adducts)을 주는 것을 보고하였다 (Adams, J. M. and Clapp, T. V., Clay and Clay Minerals (1986), 34(3), 287-294). Ni(0)-아미노포스피나이트 (Ni(0)-aminophosphinite) 시스템에 의해 촉매된 이소프렌의 직선형 이중합은 경쟁적 고리이중합 (cyclodimerization) 반응에 의해 수반되는 부위선택적 꼬리-꼬리 (regioselective tail-to-tail) 직선형 이중체를 유도한다 (Denis, Philippe; Croizy, Jean Francois; Mortreux, Andre; Petit, Francis, Journal of Molecular Catalysis (1991), 68(2), 159-75. Denis, Philippe; Jean, Andre; Croizy, Jean Francois; Mortreux, Andre; Petit, Francis, Journal of the American Chemical Society (1990), 112(3), 1292-4.). 새로운 키랄성 아미노포스피나이트 (chiral aminophosphinite) 리간드, 예로, (+)-MeCH2CHMeCH(NH2)CH2OPPh2가 이소프렌의 직선형 이중합에서 균질 촉매로서 연구되었고, 50% 초과하는 전환율을 유도하였다 (Masotti, Henriette; Peiffer, Gilbert; Siv, Chhan; Courbis, Pierre; Sergent, Michelle; Phan Tan Luu, Roger, Bulletin des Societes Chimiques Belges (1991), 100(1), 63-77).
이소프렌의 다중합 저해제로서의 디니트로크레졸 (dinitrocresol)의 존재 시 110 - 250℃에서 열 이중합은 고수율의 이중체 및 매우 적은 중합체를 낸다 (미국 특허 제 4,973,787호). 이소프렌의 Ni-촉매된 이중합은 80%의 1,5-디메틸-1,5-사이클로옥타디엔 및 20%의 1,6-디메틸-1,5-사이클로옥타디엔으로 이루어진 디메틸-1,5-사이클로옥타디엔 혼합물을 수득한다 (Doppelt, Pascal; Baum, Thomas H.; Ricard, Louis, Inorganic Chemistry (1996), 35(5), 1286-91). 이소프렌은 촉매적 양의 Cp*Ru(η-이소프렌)Cl 및 AgOTf를 사용하여 디메틸사이클로옥타디엔으로 전환된다 (Itoh, Kenji; Masuda, Katsuyuki; Fukahori, Takahiko; Nakano, Katsumasa; Aoki, Katsuyuki; Nagashima, Hideo, Organometallics (1994), 13(3), 1020-9.). 일본 특허공개 제 JP59065026A호 (1984)는 Fe 카복실레이트 또는 β-디케톤 화합물, 오가노-Al 또는 Mg 화합물, 및 전자-공여기를 가지는 2,2'-디피리딜 유도체를 포함하는 촉매의 존재 시 이소프렌의 고리형 이중합에 의한 1,6-디메틸-1,5-사이클로옥타디엔의 제조를 보고한 바 있었다. 디메틸사이클로옥타디엔은 Ni-카복실레이트 또는 β-케톤, 오가노알루미늄 또는 오가노마그네슘 화합물 및 치환된 트리페닐포스파이트 (일본 특허공개 제 JP58055434A호, 1983)를 포함하는 3개-성분 촉매 위에 이소프렌의 고리이중합에 의해 제조되었다. 1,5-디메틸-1,5-사이클로옥타디엔은 Fe(3) 염 오가노알루미늄 화합물 및 활성인자를 포함하는 균질 촉매의 존재 시 (특허공개 제 SU615056A1호, 1978), Ni 아세틸아세토네이트, 트리아릴포스파이트 및 퍼하이드로알루모페놀렌 (perhydroalumophenolene)을 포함하는 균질 촉매의 존재 시 (특허공개 제 SU493455A1호, 1975), Ni 카복실레이트 또는 Ni의 카복실레이트 또는 킬레이트 화합물 및 1-하이드록시-3-카르보닐 화합물, 트리알킬알루미늄, 디알킬마그네슘 또는 결합된 디엔으로부터 획득된 활성을 가진 유기-Mg 화합물, Mg, 트리아릴 포스파이트 및 삼차 아민의 혼합물을 포함하는 촉매의 존재 시 (일본 특허공개 제 JP48064049A호, 1973), 또는 Ni 나프테네이트 (Ni naphthenate), Et3Al, 및 트리-o-크레실 포스페이트로 구성되는 촉매의 존재 시 (Suga, K.; Watanabe, S.; Fujita, T.; Shimada, T., Israel Journal of Chemistry (1972), 10(1), 15-18) 불활성 유기 용매로 100 - 300℃에서 이소프렌의 고리 이중합에 의해 제조되었다. 미국 특허 제 3,954,665호는 Fe, Co, 또는 Ni 카르보닐과 [(η3-C6H5)NiBr]2 또는 [M(NO)2X]2 (M = Fe, Co; X = Cl, I, Br)의 반응 산물의 존재 시 이소프렌의 이중합을 기재하였다. 유럽 특허 제 2411호 (1981)는 -5℃로부터 +20℃까지에서 Fe(NO)2Cl-비스(1,5-(1,5-사이클로옥타디엔)니켈 촉매 위에 이소프렌의 고리이중합으로 1-메틸- 및 2-메틸-4-이소프로페닐-1-사이클로헥센 또한 1,4- 및 2,4-디메틸-4-비닐-1-사이클로헥센을 주는 것을 기재하였다. 미국 특허 제 4,189,403호는 트리스 (치환된 하이드로카빌)포스파이트, 아세나이트 (arsenite), 또는 안티모나이트 (antimonite) 및 그룹 VIII 금속(0) 화합물 (예로, Ni 아세틸아세토네이트)의 혼합 촉매와 이소프렌을 접촉시켜서 1,5-디메틸-1,5-사이클로옥타디엔 및 1,4-디메틸-4-비닐-1-사이클로헥센의 제조를 기재하였다. Jackstell, R.; Grotevendt, A.; Michalik, D.; El Firdoussi, L.; Beller, M. J. Organometallic Chem. (2007) 692(21), 4737-4744은 이소프렌 이중합을 위한 팔라듐/카벤 촉매의 용도를 인용하고 있다. Bowen, L.; Charernsuk, M.; Wass, D.F. Chem. Commun. (2007) 2835-2837은 이소프렌의 직선형 및 고리형 삼중체의 생산을 위한 크롬 N,N-비스(디아릴포스피노)아민 촉매의 용도를 기술하고 있다.
이소프렌은 보고된 대로 Ni 촉매의 존재 시 이중합되어 시스-2-이소프로페닐-1-메틸비닐사이클로부탄을 수득한다 (Billups, W. E.; Cross, J. H.; Smith, C. V., Journal of the American Chemical Society (1973), 95(10), 3438-9). 전자 공여자로서 다양한 포스파이트의 존재 시 니켈 나프테네이트 및 이소프렌마그네슘에 의해 촉매된 이소프렌의 올리고중합 [78-79-5]은 디메틸사이클로옥타디엔 [39881-79-3]을 포함하는 고리형 이중체를 주었고; 상세하게는, 1,1,1-트리스(하이드록시메틸)프로판 포스파이트 [39865-19-5]는 선택적으로 트리메틸사이클로도데카트리엔 [39881-80-6]을 주었다 (Suga, Kyoichi; Watanabe, Shoji; Fujita, Tsutomu; Shimada, Takashi, Journal of Applied Chemistry & Biotechnology (1973), 23(2), 131-8). 국제특허출원 제 WO2006/051011호는 Ni 및/또는 Ti, 하나 이상의 오가노금속 화합물, 및 그룹 VA 화합물을 포함하고 반응이 하이드록시기-포함 용매에서 시행되는 촉매 시스템의 존재 시 이소프렌의 삼중합에 의해 향수 및 방향제로서 유용한 트리메틸사이클로옥타디엔의 제조를 기재하고 있다. Ligabue, R. A.; Dupont, J.; de Souza, R. F., Alegre, R.S. J. Mol. Cat. A: Chem. (2001), 169(1-2), 11-17은 이온성 액체에서 철 니트로실 촉매를 사용하여 6개-구성원으로 된 이중체로의 이소프렌의 선택적 이중합을 기술하고 있다. Huchette, D.; Nicole, J.; Petit, F., Tetrahedron Letters (1979), (12), 1035-8은 철 니트로실 촉매의 전기화학적 생성 또한 이어지는 이소프렌의 사이클로헥센 이중체로 이중합을 위한 용도를 기술하고 있다. Zakharkin, L. I.; Zhigareva, G. G.; Pryanishnikov, A. P. Zhurnal Obshchei Khimii (1987), 57(11), 2551-6는 복합 니켈 및 철 촉매 상에서 이소프렌의 고리올리고중합 (cyclooligomerization)을 기술하고 있다.
본 명세서에서 기술된 매우 순수한 이소프렌 시작 조성물은 각각의 촉매 시스템 및 인용된 참고문헌들에 기재된 반응 조건을 사용하여 화학적으로 변환된다. 1,3-부타디엔의 화학적 변환에 적용되는 촉매 및 반응 조건과 같은 당해 기술분야에 알려진 기타 다른 촉매 및 반응 조건들은 당업자에 의해 본 이소프렌 시작 조성물에 적응될 수 있다.
이중합 및 삼중합
일정 구현예에서, 시판되는 유리한 양의 매우 순수한 이소프렌 시작 물질은 촉매적 화학적 변환을 거쳐서 이중체 및 삼중체를 준다. 촉매 시스템은 당해 기술분야에 알려진 방법을 사용하여 확인된다. 바람직한 촉매로는 고효율로 이소프렌을 이중체 및 삼중체로 전환하는 것으로 알려진 것들을 포함한다. 예로는 팔라듐, 니켈, 코발트, 철 및 크롬에 기초하는 것들을 포함한다.
일정 구현예에서, 시판되는 유리한 양의 매우 순수한 이소프렌 시작 물질은 열 또는 촉매적 이중합을 거친다. 이소프렌 시작 조성물은 압력 하에서 시작 조성물을 가열하여 불포화된 6개 및 8개-구성원으로 된 고리를 포함하는 이중체의 혼합물로 전환된다. 일정 구현예에서, 시작 이소프렌 물질은 압력 하에서 약 100, 125, 150, 175, 200, 225 또는 250℃ 또는 이의 초과 온도로 가열된다. 일정 구현예에서, 시작 이소프렌 물질은 라디칼-매개성 다중합을 방지하도록 항산화제 (예로, 2,6-디-터르-부틸-4-메틸페놀)의 존재 시 가열된다. 일정 구현예에서, 반응은 이소프렌의 고리형 이중합을 촉매 작용하는 기술분야에 알려진 촉매들로부터 선택되는 하나 이상의 촉매, 예로 미국 특허 제 4,144,278호, 제 4,181,707호, 제 5,545,789호 및 유럽 특허공개 제 EP0397266A2호에서 기술된 철 니트로실 할로겐화물 촉매에 의해 가속된다. 이온성 액체에서 철 니트로실 촉매의 사용은 Ligabue et al. (2001) J. Mol. Catalysis A: Chemical, 169 (2), 11-17에 의해 기술되어 있다. 촉매의 예로는 이에 제한되는 것은 아니지만, Fe(NO)2Cl2 및 Cr3+-몬트모릴로나이트를 포함한다. 또 다른 예에서, 이소프렌 시작 조성물은 루테늄 촉매를 사용하여 C10 고리형 이중체 (예로, 디메틸-사이클로옥타디엔의 혼합물)로 전환된다 (Itoh, Kenji; Masuda, Katsuyuki; Fukahori, Takahiko; Nakano, Katsumasa; Aoki, Katsuyuki; Nagashima, Hideo, Organometallics (1994), 13(3), 1020-9).
특정한 구현예에서, 액상의 이소프렌 시작 조성물은 압력 하에서 산화제의 존재 시 100℃ 초과 온도로 가열되어 6개- 및 8개-구성원으로 된 고리를 포함하는 이중체의 혼합물, 예를 들어 Organometallics (1994), 13(3), 1020-9에 기술된 바와 같이 리모넨(1-메틸-4-(프로프-1-엔-2-일)사이클로헥스-1-엔), 1-메틸-5-(프로프-1-엔-2-일)사이클로헥스-1-엔, 1,4-디메틸-4-비닐사이클로헥센, 2,4-디메틸-4-비닐사이클로헥센, 1,5-디메틸사이클로옥타-1,5-디엔, 1,6-디메틸사이클로옥타-1,5-디엔, 2,6-디메틸-1,3-사이클로옥타디엔, 2,6-디메틸-1,4-사이클로옥타디엔, 3,7-디메틸-1,5-사이클로옥타디엔, 3,7-디메틸-1,3-사이클로옥타디엔, 3,6-디메틸-1,3-사이클로옥타디엔 및 기타 8개-구성원으로 된 고리형 이소프렌 이중체를 생산한다. 이들 화합물의 입체이성질체 모두가 고려된다. 이소프렌의 이중체로 전환은 바람직하지 않은 반응 산물의 생산을 피하도록 산소의 부재 시 최고로 잘 수행된다.
일정 구현예에서, 시판되는 유리한 양의 매우 순수한 이소프렌 시작 물질은 광-이중합 (photo-dimerization)을 거쳐서 4개-구성원으로 된 고리 이중체를 준다. 이소프렌 시작 조성물은 하나 이상의 1,2-디(프로프-1-엔-2-일)사이클로부탄, 1,3-디(프로프-1-엔-2-일)사이클로부탄, 1-메틸-1-비닐-3-(프로프-1-엔-2-일)사이클로부탄, 1-메틸-1-비닐-2-(프로프-1-엔-2-일)사이클로부탄, 1,3-디메틸-1,3-디비닐사이클로부탄, 1,2-디메틸-1,2-디비닐사이클로부탄 및 그들의 입체이성질체들을 포함하는 혼합물에 광 조사 (light irradiation)에 의해 전환된다. 일정 구현예에서, 매우 순수한 이소프렌 시작 물질은 촉매 (예로, 니켈 촉매) 또는 광민감화제 (photosensitizer) (예로, 벤조페논)의 존재 시 이중합되어 6개- 및 8개-구성원으로 된 고리에 추가하여 4개-구성원으로 된 고리 이중체, 예로 시스-2-이소프로페닐-1-메틸비닐사이클로부탄을 수득한다 [Hammond, J.S. ;Turro, N.J. ; Liu, R.S.H. (1963) Mechanisms of Photochemical Reactions in Solution. XVI. Photosensitized Dimerization of Conjugated Dienes. J. Org. Chem., 28, 3297-3303를 참고하라] .
일정 구현예에서, 시판되는 유리한 양의 매우 순수한 이소프렌 시작 물질은 촉매 시스템의 존재 시 고리형 삼중체로 전환된다. 일정 구현예에서, 고리형 삼중체는 트리메틸사이클로도데카트리엔이다. 일정 구현예에서, 촉매 시스템은 니켈 촉매를 포함한다. 일정 구현예에서, 촉매 시스템은 티타늄 (titanium) 화합물을 포함한다. 일정 구현예에서, 촉매 시스템은 니켈 촉매 및 티타늄 화합물을 포함한다. 일정 구현예에서, 촉매 시스템은 하나 이상의 오가노금속 화합물 및 그룹 VA 화합물을 포함한다. 일정 구현예에서, 촉매적 변환은 하이드록시기-포함 용매에서 시행된다. 상세한 구현예에서, 시작 이소프렌 조성물은 Ni 및/또는 Ti, 하나 이상의 오가노금속 화합물 및 그룹 VA 화합물을 포함하고 반응이 하이드록시기-포함 용매에서 시행되는 촉매 시스템의 존재 시 트리메틸사이클로도데카트리엔으로 전환된다.
일정 구현예에서, 시판되는 유리한 양의 매우 순수한 이소프렌 시작 물질은 C2 내지 C5 불포화된 탄화수소로 처리하여 C7 내지 C14 범위에 있는 탄화수소로의 열 또는 촉매적 전환을 거친다. C2 내지 C5 탄화수소는 알켄, 디엔 또는 알킨일 수 있다. 예를 들어 일정 구현예에서, 이소프렌은 에틸렌 및 적절한 촉매와 접촉하여 C7 화합물을 생산한다. 또 다른 구현예에서, 이소프렌은 1,3-부타디엔과 접촉하여 고리형 C9 화합물을 생산한다. C7 내지 C14 탄화수소의 수소화는 제트 연료 및 기타 항공 연료로서 사용에 적합한 조성물을 가져온다. 보다 또 다른 구현예에서, 이소프렌으로부터 유래한 불포화된 C7 내지 C14 탄화수소 및 하나 이상의 불포화된 탄화수소는 탈수소화를 거쳐서 제트 연료 및 기타 항공 연료로서 또는 이러한 연료를 위한 혼합원료 (blendstocks)로서 사용에 적합한 방향족 유도체를 형성한다.
일정 구현예에서, 시판되는 유리한 양의 매우 순수한 이소프렌 시작 물질은 알코올 용매에 있는 촉매 시스템을 사용하여 직선형 이중체 및 삼중체의 혼합물로 전환된다. 본 반응도 역시 메탄올 또는 에탄올에서 수행될 때 알콕시 유도체를 생산한다. 일정 구현예에서, 촉매 시스템은 팔라듐-기초 촉매 시스템, 예로 팔라듐 아세틸아세토네이트 - 트리페닐포스파인 시스템 또는 팔라듐 아세데이트-트리페닐포스파인 시스템이다. 일정 구현예에서, 알코올 용매는 메탄올, 에탄올 또는 이소프로필 알코올이다. 산물의 특성 (nature)은 사용된 촉매 및 용매에 의존한다. 예를 들어, 팔라듐-기초 촉매 시스템 예로 Pd(acac)2-Ph3P 및 Pd(OAc)2-Ph3P가 이소프로필 알코올 용매에서 사용될 때, 이소프렌의 직선형 이중체 예로 2,7-디메틸-1,3,7-옥타트리엔 및 2,7-디메틸-2,4,6-옥타트리엔이 형성된다. 본 반응이 메탄올에서 수행될 때, 디메틸옥타트리엔과 같은 직선형 이소프렌 이중체에 추가하여 메톡시디메틸옥타디엔 (예로, 1-메톡시-2,7-디메틸-2,7-옥타디엔 및 3-메톡시-2,7-디메틸-1,7-옥타디엔)이 형성된다. 일정 반응은 α-파네센 (α-farnescene)(3,7,11-트리메틸-1,3,6,10-도데카테트라엔), β-파네센 (7,11-디메틸-3-메틸렌-1,6,10-도데카트리엔) 및 기타 다른 자리 (positional) 이성질체 (예로, 이소프렌 단위의 꼬리로부터 꼬리까지 및 머리로부터 머리까지 첨가)와 같은 이소프렌의 직선형 삼중체를 생산한다. 또 다른 예에서, 이소프렌은 크롬 N,N-비스(디아릴포스피노)아민 촉매를 사용하여 이소프렌의 직선형 및 고리형 삼중체로 전환된다 (Bowen, L.; Charernsuk, M.; Wass, D.F. Chem. Commun. (2007) 2835-2837).
산화물로의 전환
일정 구현예에서, 시판되는 유리한 양의 매우 순수한 이소프렌 시작 물질은 산 촉매의 존재 시 에탄올 및 기타 알코올과 반응에 의해 연료 산화물로 전환된다. 일정 구현예에서, 산 촉매는 황산이다. 또 다른 구현예에서, 산촉매는 고체 상 황산 (예로, 도웩스 마라톤 (Dowex Marathon))이다. 다른 촉매로는 액상 및 고체-상 플루오로설폰 산 둘 다, 예를 들어 트리플루오로메탄설폰산 및 나피온-H (Nafion-H, 듀퐁사)를 포함한다. 제올라이트 (zeolite) 예를 들어 베타-제올라이트도 역시 리모넨 및 관련 모노테르펜의 메톡시화 (methoxylation)에 관해 헨셀 등에 의해 기술된 것과 유사한 조건 하에서 사용될 수 있다 [Hensen, K.; Mahaim, C.; Holderich, W.F., Applied Catalysis A: General (1997) 140(2), 311-329]. 일정 구현예에서, 매우 순수한 이소프렌 시작 물질은 하이드록시화/에스테르화 공정 또는 당해 기술분야에 알려진 다른 알켄 반응, 예를 들어 퍼아세트산 및 3-클로로퍼벤조산과 같은 과산 (peracids)을 사용한 에폭사이드로의 과산화 (peroxidation); 또한 i) 물 및 산 촉매 ii) 붕소수화 (hydroboration) 방법을 사용하여 알코올 및 디올을 주는 수화 (hydration)에 의해 알코올 및 에스테로로 전환된다. 이러한 반응은 예를 들어 Michael B. Smith 및 Jerry March, Advanced Organic Chemistry: Reactions, Mechanisms, and Structure, 제 6판, John Wiley & Sons, 2007에 기술되어 있다. 도 3 및 도 4는 시작 이소프렌 조성물로부터 생산될 수 있는 알코올 및 산화물의 예를 나타내고 있다.
부분적 수소화
일정 구현예에서, 시판되는 유리한 양의 매우 순수한 이소프렌 시작 물질은 모노-올레핀 (예로, 2-메틸부트-1-엔, 3-메틸부트-1-엔 및 2-메틸부트-2-엔)으로 부분적으로 수소화된다. 일정 구현예에서, 모노-올레핀은 이소부틸렌을 이소옥탄으로 전환하는 데 사용되는 것과 같은, 전통적인 탄화수소 양이온성 촉매작용을 사용하는 기타 다른 올레핀과 이중합 또는 반응을 거친다. 예를 들어, H.M. Lybarger. Isoprene in Kirk-Othmer Encyclopedia of Chemical Technology, 제 4판, 윌리 출판사, 뉴욕 (1995), 14, 934-952를 참조하라. 일정 바람직한 구현예에서, 매우 순수한 이소프렌 시작 물질은 바이오이소프렌 조성물이다.
일정 구현예에서, 시판되는 유리한 양의 매우 순수한 이소프렌 시작 물질은 부분적 수소화를 거쳐서 모노-올레핀 (예로, 2-메틸부트-1-엔, 3-메틸부트-1-엔 및 2-메틸부트-2-엔)을 형성한다. 일정 바람직한 구현예에서, 매우 순수한 이소프렌 시작 물질은 바이오이소프렌 조성물이다. 일정 구현예에서, 이소프렌 시작 물질의 부분적 수소화는 이소펜탄으로 최소의 전환 및 잔존 이소프렌의 낮은 수준으로 고수율의 모노-올레핀을 생산한다. 일정 구현예에서, 모노-올레핀 및 이소펜탄의 혼합물이 낮은 수준의 잔존 이소프렌으로 생산된다. 일정 구현예에서, 부분적 수소화는 2-메틸부트-2-엔, 2-메틸부트-1-엔, 또는 3-메틸부트-1-엔과 같은 특정한 모노-올레핀이 선호적으로 생산되는 선택적인 수소화이다. 바람직한 수소화 촉매는 높은 촉매 활성을 주고, 시간 경과 시 촉매적 활성을 유지하며, 이소프렌의 모노-올레핀으로 전환을 위해 매우 선택적이다.
이소프렌 시작 조성물의 부분적 수소화에 적합한 촉매는 백금, 팔라듐, 로듐, 또는 루테늄과 같은 백금-그룹 금속, 또는 니켈, 코발트, 구리, 철, 몰리브덴과 같은 전이 금속, 또는 원소 형태로 은 또는 금과 같은 고귀한 금속, 또는 유기 및 무기 리간드를 가지는 염 또는 복합체를 포함한다. 이들 금속의 합금도 역시 일정 상황에서 사용될 수 있다. 이들 금속 및 그들의 유도체는 순수하거나 다른 활성 및 불활성 물질과 혼합될 수 있다. 촉매는 유효한 표면적을 최대화하도록 지지 물질 (support material) (예로, 활성 탄소, 알루미나, 또는 실리카)에 흡착될 수 있다. 수소화 촉매의 물리적 형상은 그의 성적 (performance)에 상당한 영향을 미치는 것으로 알려져 있다. 바람직한 수소화 촉매는 지지 물질에 대비하여 0.1% Pd로부터 20% Pd (w/w)까지 범위의 등급으로 탄소 상의 팔라듐 (Pd/C), 알루미나 상의 팔라듐 (Pd/Al2O3), 실리카 상의 팔라듐 (Pd/SiO2)과 같은 균질 팔라듐 촉매를 포함한다. 적합한 선택적 수소화 촉매의 예로는 LD 2773, 알루미나 상의 황 내성 촉진된 Pd (프랑스 Rueil-Malmaison Cedex, 아센)이다. 이소펜탄으로 최소의 전환으로 이소프렌의 이소아밀렌으로 전환을 허용하는 부분적 수소화 촉매는 린드라 촉매 (Lindlar catalyst, 퀴놀린으로 처리된 Pd/BaSO4), 그룹 15 원소 (N, P, As)의 트리페닐 유도체로 처리된 Pd/C, 황-포함 화합물로 처리된 Pd/C, 몰리브덴 설파이드, 및 Pd/Fe 합금을 포함한다. 한 가지 바람직한 촉매는 달걀-껍질 알루미나 (δ-Al2O3)에 흡착된 팔라듐을 포함한다. 상세하게는, 열분해 가솔린으로부터 디올레핀 및 알킨의 제거를 위해 정련 산업에 사용되는 촉매가 바람직하고, 예를 들어 Ni/Al2O3 및 Pd/Al2O3 기초한 촉매이다. 이소아밀렌으로 이소프렌의 전환을 위한 또 다른 적합한 부류의 촉매는 열분해 가솔린의 수화처리 (hydrotreating) 산업에 사용되는 것들이다. 예를 들어, 미국 특허 제 7,014,750호 및 제 6,9949,686호 또한 본 명세서에서 인용된 참고문헌을 참조하라. 일반적으로, 열분해 기체 수화처리에 사용되는 촉매는 모노올레핀으로 아세틸렌 및 디올레핀 (예로, 이소프렌 및 피페릴렌)의 선택적 전환을 허용한다.
수소원 (hydrogen source)은 수소 기체 또는 이에 제한되는 것은 아니지만 수소 기체 (H2), 포름산, 하이드라진, 또는 이소프로판올을 포함하는 수소원일 수 있다. 수소원은 화학적으로 또는 생물학적으로 유래할 수 있다. 일정 구현예에서, 수소화에 사용되는 수소는 발효 과정 동안 이소프렌과 공동-생산된다. 수소화는 0.5 기압으로부터 200 기압까지 범위 이상이 되는 수소 압력에서 수행된다. 온도는 0℃로부터 200℃까지 범위일 수 있다.
바이오이소프렌 조성물의 부분적 수소화로부터 나온 산물은 시작 이소프렌 조성물에 원래 존재하는 소정의 불순물 및/또는 아세톤, 에탄올, 아밀 알코올, 에틸 아세테이트, 이소아밀 아세테이트, 메틸 에틸케톤 및 기타 포화된 극성 불순물과 같은 불순물의 수소화된 유도체를 포함한다.
일정 구현예에서, 이소프렌 시작 조성물은 팔라듐 촉매의 존재 시 부분적 수소화 또는 선택적 수소화를 거친다. 예를 들어 Pd/CaCO3, Pd/BaSO4, Pd/C, Pd black, Pd/SiO3, Pd/Al2O3, 또는 Pd/SiO2와 같은 팔라듐 촉매는 전부 환원된 C5 알칸 위에 95% 이상의 선택도로 이소프렌을 모노-올레핀으로 전환하는 것으로 관찰되었다. 이들 팔라듐 촉매의 사용은 3-메틸부트-1-엔에 대한 가장 큰 선택도를 가지는 5% Pd/CaCO3 및 2-메틸부트-2-엔에 대한 가장 큰 선택도를 가지는 5% Pd/SiO2를 사용하여 모노-올레핀 산물의 혼합물을 주었다 (G.C. Bond and A.F. Rawle. J. Mol. Catalysis A: Chemical 109 (1996) 261-271를 참조하라). 본드 및 라울 (Bond and Rawle)도 역시 팔라듐-금 및 팔라듐-은 촉매 (예로, Pd-Au/SiO2 및 Pd-Ag/SiO2)가 전부 환원된 C5 알칸 위에 이소프렌의 모노-올레핀으로 환원하는 높은 선택도를 가지는 것을 관찰하였다. 일정 구현예에서, 실리카-지지된 폴리아미도아민 (PAMAM) 덴드리머 (dendrimer)-팔라듐 복합체가 모노-올레핀 혼합물에 고리형 및 비고리형 디엔의 환원을 선택적으로 촉매 작용하는 데 사용되어 왔다. 다양한 모노-올레핀 이성질체에 대한 선택도는 촉매에 사용되는 정확한 PAMAM 리간드에 의존적이다 (P.P. Zweni and H. Alper. Adv. Synth. Catal. 348 (2006) 725-731를 참조하라). 일정 구현예에서, 모노-올레핀으로 이소프렌의 환원은 무기 지지체 (예로, 금속 제올라이트) 상의 그룹 VIB 금속을 촉매로서 사용하여 수행될 수 있다. 예를 들어, Mo/Al2O3 촉매가 1,3-부타디엔을 각각의 모노-올레핀으로 선택적으로 환원하는 데 사용되었다 (미국 특허공개 제 6,235,954 B1호를 참조하라). 일정 구현예에서, 이소프렌은 그룹 IB, VIB, VIIB, 또는 아연으로부터 나온 금속에 의해 촉진된 그룹 VIII 금속 촉매를 사용하여 모노-올레핀으로 환원될 수 있다 (미국 특허공개 제 6,949,686 B2호를 참조하라). 일정 구현예에서, 이소프렌은 단암의 (monolithic) 촉매 베드를 사용하여 모노-올레핀으로 환원될 수 있고, 이에는 니켈, 백금, 팔라듐, 로듐, 루테늄, 은, 철, 구리, 코발트, 크롬, 이리듐, 주석, 및 합금 또는 그들의 혼합물과 같은 금속을 포함할 수 있다 (미국 특허 제 US 7,014,750 B2호를 참조하라). 일정 구현예에서, 이소프렌은 달걀 껍질 Pd/δ-Al2O3 촉매를 사용하여, 상세하게는 반응에 물이 없는 경우 모노-올레핀으로 환원될 수 있다. 달걀 껍질 Pd/δ-Al2O3 촉매는 전부 환원된 알칸 위의 모노-올레핀에 대해 선택적이고, 2-메틸부트-2-엔은 열역학적으로 바람직한 이성질체이다 (J.-R. Chang and C.-H. Cheng. Ind. Eng. Chem. Res. 36 (1997) 4094-4099를 참조하라).
가벼운 올레핀 (C3 - C6)은 산 촉매를 사용하여 바로 이중합되어 디메이트 (dimate)라고도 알려진 고차 올레핀 (C6 - C12)을 낸다. 예를 들어, 이소부틸렌 (2-메틸프로펜)의 이소옥텐으로 전환은 황산, 인산, 및 기타 무기질 산, 설폰산, 플루오로설폰산, 제올라이트 및 산성 클레이를 포함하는 다양한 산 촉매를 사용하는 것으로 당해 기술분야에서 잘 기술되어 있다.
일정 구현예에서, 이소프렌 시작 조성물은 부분적 수소화 또는 선택적 수소화를 거쳐서 모노-올레핀을 형성하고, 모노-올레핀은 이소부틸렌을 이소옥탄으로 전환하는 데 사용되는 것인, 예로 황산, 인산, 및 기타 무기질 산, 설폰산, 플루오로설폰산, 제올라이트 및 산성 클레이와 같은 전통적인 탄화수소 양이온성 촉매작용을 사용하여 이중합 또는 다른 올레핀과의 반응을 거친다. 예를 들어, H.M. Lybarger. Isoprene in Kirk-Othmer Encyclopedia of Chemical Technology, 4th ed., Wiley, New York (1995), 14, 934-952를 참조하라. 일정 바람직한 구현예에서, 매우 순수한 이소프렌 시작 물질은 바이오이소프렌 조성물이다. 액체 및 고체 형태 둘 다에서 산 촉매가 사용될 수 있다. 산 레진이 바람직하고 이로는 앰버리스트 (Amberlyst) 15, 35, XE586, XN1010 (롬 및 하스사 (Rohm and Haas)) 및 유사한 산성 이온-교환 레진을 포함한다. ZSM-5, 페리에라이트 (ferrierite), ZSM-22 및 ZSM-23과 같은 중간-공극의 산 분자적 체 (medium-pore acid molecular sieve)를 포함하는 산성의 분자적 체도 역시 바람직한 촉매이다.
일정 구현예에서, 이소프렌 시작 조성물은 부분적 수소화 또는 선택적 수소화를 거쳐서 이소아밀렌을 형성한다. 일정 구현예에서, 이소아밀렌은 이중합되어 이소데센과 같은 C10 디메이트를 준다. 일정 구현예에서, 이소아밀렌은 프로필렌, 부탄 또는 이소부텐과 같은 올레핀과 이중합되어 C8 - C10 디메이트를 준다. 일정 구현예에서, 모노-올레핀은 레진 촉매 (예로, 앰버리스트, 앰버리스트 35, 앰버리스트 15, 앰버리스트 XN1010, 앰버리스트 XE586)를 사용하는 이중합을 거쳐서 디이소아밀렌을 생산한다. 이러한 레진 촉매의 사용은 열 분해 (cracking) 및 좀 더 나아가 올리고중합 반응을 최소화하는 것으로 관찰되어 왔고, 최적의 조건 하에서 레진 촉매는 8% 이하의 삼중체 형성과 함께 92% 이상의 이중체에 대한 선택도를 제공한다. 예를 들어, M. Marchionna et al. Catalysis Today 65 (2001) 397-403를 참조하라. 일정 구현예에서, 모노-올레핀은 제올라이트 구조, ZSM-5, 페리에라이트, ZSM-22 및 ZSM-23에 박힌 중간공극 (mesoporous) 체와 같은 산성의 중간공극 분자적 체를 포함하는 촉매 물질을 사용하는 이중합을 거친다. 상세한 구현예에서, 촉매 물질은 고온에서 (예로, 적어도 900℃)에서 열적으로 안정하다. 또 다른 상세한 구현예에서, 모노-올레핀은 이소프렌과 같이 다중-불포화된 탄화수소가 실질적으로 없다. 이중합을 위해 산성의 중간공극 분자적 체를 포함하는 촉매 물질의 사용은 80% 초과의 이중체에 대한 선택도를 유도할 수 있다. 예를 들어, 미국 특허공개 제 2007/0191662 A1호를 참조하라. 일정 구현예에서, 모노-올레핀은 고체 산성 촉매 (예로, 고체 인산 촉매, 산성의 이온 교환 레진)를 사용하는 이중합을 거친다. 고체 인산 촉매를 사용하는 이중체에 대한 선택도는 적어도 75%, 적어도 85% 또는 적어도 90%일 수 있다. 예를 들어, 미국 특허공개 제 2009/0099400 A1호 및 제 6,660,898 B1호를 참조하라.
효율적인 이중합은 때로 공급 스트림에서 물 및 산화된 화합물과 같은 극성 성분(들)의 존재를 요구할 수 있다. 예로는 메탄올, 에탄올 및 t-부탄올과 같은 알코올, 메틸 t-부틸 에테르 (MTBE) 및 메틸 t-아밀 에테르 (TAME)와 같은 에테르 또는 C1 내지 C5 아세테이트와 같은 에스테르를 포함한다. 일정 구현예에서, 이소아밀렌은 산 촉매의 존재 시 알코올로 처리에 의해 TAME과 같은 에테르로 전환될 수 있다.
일정 구현예에서, 본 명세서에서 기술된 방법이라면 모두에 의해 생산된 모노-올레핀의 C10 이중체는 전부 포화된 C10 알킬레이트로 환원될 수 있다 (예로, 수소화에 의함). 상세한 구현예에서, 이소프렌 또는 모노-올레핀은 폴리아크릴레이트와 같은 중합체 성분과 혼합된, 황산, 플루오로설폰산, 퍼할로알킬설폰산, 이온성 액체, 또는 브론스태드 산 및 루이스 산의 혼합물과 같은 산 성분을 포함하는 촉매를 사용하여 알킬레이트로 환원될 수 있다 (미국 특허공개 제 2010/0094072 A1호를 참조하라).
일정 구현예에서, 시판되는 유리한 양의 매우 순수한 이소프렌 시작 물질은 산 촉매의 존재 시 올리고중합을 거쳐서 이중체, 삼중체, 고차 (higher) 올리고머, 방향족 산물, 및/또는 중합 산물 (polymeric products)을 생산한다. 반응의 동적 (kinetic) 조절은 검 형성 (gum formation) 및 코크 형성 (coking)이 촉매 탈활성 (deactivation)을 유도하는 문제점이 보고되긴 했더라도, 소정의 산물 예를 들어 저차 (lower) 올리고머를 선호할 수 있다.
대표적인 불포화된 이소프렌 유도체
일정 구현예에서, 이소프렌으로부터 연료 성분을 생산하는 조성물 및 시스템은 좀 더 나아가 이소프렌 시작 조성물의 연료 성분으로 화학적 변환을 위한 불포화된 탄화수소 또는 산화물 중간체를 포함한다. 일정 구현예에서, 불포화된 탄화수소 중간체는 1,2-디(프로프-1-엔-2-일)사이클로부탄, 1,3-디(프로프-1-엔-2-일)사이클로부탄, 1-메틸-1-비닐-3-(프로프-1-엔-2-일)사이클로부탄, 1-메틸-1-비닐-2-(프로프-1-엔-2-일)사이클로부탄, 1,3-디메틸-1,3-디비닐사이클로부탄, 1,2-디메틸-1,2-디비닐사이클로부탄, 1-메틸-4-(프로프-1-엔-2-일)사이클로헥스-1-엔, 1-메틸-5-(프로프-1-엔-2-일)사이클로헥스-1-엔, 1,4-디메틸-4-비닐사이클로헥센, 2,4-디메틸-4-비닐사이클로헥센, 1,5-디메틸사이클로옥타-1,5-디엔, 1,6-디메틸사이클로옥타-1,5-디엔, 1,4-디메틸-4-비닐-1-사이클로헥센, 2,4-디메틸-4-비닐-1-사이클로헥센, 2,7-디메틸-1,3,7-옥타트리엔, 2,7-디메틸-2,4,6-옥타트리엔, 2,6-디메틸-1,3-사이클로옥타디엔, 2,6-디메틸-1,4-사이클로옥타디엔, 3,7-디메틸-1,5-옥타디엔, 3,7-디메틸-1,3-사이클로옥타디엔 및 3,6-디메틸-1,3-사이클로옥타디엔으로 이루어진 그룹으로부터 선택되는 하나 이상의 이소프렌의 불포화된 이중체를 포함한다. 일정 구현예에서, 불포화된 탄화수소 중간체는 α-파네센, β-파네센 , 트리메틸사이클로도데카트리엔 (예로, 1,5,9-트리메틸-(1E,5E,9E)-사이클로도데카테트라엔 및 그의 자리 이성질체 및 기하 이성질체) 및 트리메틸사이클로도데카테트라엔 등과 같은 하나 이상의 불포화된 삼중체를 포함한다. 일정 구현예에서, 불포화된 산화물 중간체는 1-메톡시-2,7-디메틸-2,7-옥타디엔 및 3-메톡시-2,7-디메틸-1,7-옥타디엔 등과 같은 하나 이상의 불포화된 메틸 에스테르를 포함한다. 일정 구현예에서, 불포화된 산화물 중간체는 에틸 3-메틸-3-부테닐 에테르, 에틸 1,1-디메틸-2-프로페닐 에테르, 에틸 1,2-디메틸-2-프로페닐 에테르, 에틸 2-메틸-2-부테닐 에테르 등과 같은 하나 이상의 불포화된 에틸 에스테르를 포함한다. 일정 구현예에서, 불포화된 산화물 중간체는 3-메틸-3-부텐-1-올, 2-메틸-3-부텐-2-올, 3-메틸-3-부텐-2-올, 2-메틸-3-부텐-1-올 등과 같은 하나 이상의 불포화된 알코올을 포함한다. 일정 구현예에서, 불포화된 산화물 중간체는 3-메틸-3-부텐-1-일 아세테이트, 2-메틸-3-부텐-2-일 아세테이트, 3-메틸-3-부텐-2-일 아세테이트, 2-메틸-3-부텐-1-일 아세테이트 및 기타 C3 - C18 지방족 카르복실산의 에스테르 등과 같은 하나 이상의 불포화된 에스테르를 포함한다. 일정 구현예에서, 불포화된 탄화수소 중간체는 하나 이상의 이소아밀렌, 예로 2-메틸부트-1-엔, 3-메틸부트-1-엔 및 2-메틸부트-2-엔을 포함한다. 일정 구현예에서, 불포화된 탄화수소 중간체는 이소아밀렌의 이중합으로부터 유래한 하나 이상의 이소아밀렌을 포함한다.
화학식 I.
대표적인 불포화된 6개- 및 8개-구성원으로 된 고리 중간체
화학식 II.
대표적인 불포화된 4개-구성원으로 된 고리 중간체
화학식 III.
대표적인 불포화된 이소프렌 텔로머 및 산화물 중간체
화학식 IV.
대표적인 불포화된 에틸 에테르 중간체
화학식 V.
대표적인 불포화된 알코올 중간체
화학식 VI.
대표적인 불포화된 에스테르 중간체
대표적인 불포화된 중간체의 수소화
불포화된 이소프렌 중간체는 수소화 촉매의 존재 시 수소화되어 포화된 화합물을 생산한다. 포화된 화합물은 특성분석되고 그들의 연료로서의 가치는 측정된다. 일정 구현예에서, 수소화를 위한 수소원은 수소 기체이다. 일정 구현예에서, 수소 기체는 2008년 12월 30일자로 제출된 미국 가특허출원 제 61/141,652호 및 미국 특허공개 제 2009/0203102 A1호에 기술된 바와 같이 바이오이소프렌과 함께 공동-생산된다. 일정 구현예에서, 수소화 촉매는 Pd/C (예로, 5% (wt.) Pd/C)와 같은 팔라듐 기초한 촉매이다. 일정 구현예에서, 수소화 촉매는 라니 (Raney) 니켈 촉매이다. 일정 구현예에서, 수소화 촉매는 루테늄 또는 로듐 기초한 균질 수소화 촉매와 같은 균질 촉매이다. 일정 구현예에서, 불포화된 이소프렌 이중체 및 삼중체는 수소화되어 연료를 만드는 데 적합한 포화된 C10 및 C15 탄화수소를 생산한다. 일정 구현예에서, 불포화된 고리형 이중체는 수소화되어 1,2-비스(이소프로필)사이클로부탄, 1,2-비스(이소프로필)사이클로부탄, 1-메틸-4-이소프로필사이클로헥산, 1-메틸-3-이소프로필사이클로헥산, 1-에틸-1,4-디메틸사이클로헥산, 1-에틸-1,3-디메틸사이클로헥산, 1,5-디메틸사이클로옥탄 및 1,4-디메틸사이클로옥탄과 같은 포화된 고리형 C10 탄화수소를 생산한다. 일정 구현예에서, 불포화된 고리형 삼중체는 수소화되어 1,5,9-트리메틸사이클로도데칸 및 1,5,10-트리메틸사이클로도데칸과 같은 포화된 고리형 C15 탄화수소를 생산한다 (화학식 VII를 참조하라). 일정 구현예에서, 불포화된 직선형 이중체는 수소화되어 2,6-디메틸옥탄, 2,7-디메틸옥탄 및 3,6-디메틸옥탄과 같은 포화된 지방족 C10 탄화수소를 생산한다. 일정 구현예에서, 불포화된 직선형 삼중체는 수소화되어 2,6,10-트리메틸도데칸, 2,7,10-트리메틸도데칸 및 3,7,10-트리메틸도데칸과 같은 포화된 지방족 C15 탄화수소를 생산한다 (화학식 VIII를 참조하라). 일정 구현예에서, 이소아밀렌의 이중합의 산물 (디아밀렌 또는 C10 디메이트)은 이소파라핀 (예로, 2,3,4,4-테트라메틸헥산, 2,2,3,4-테트라메틸헥산, 2,3,3,4-테트라메틸헥산 및 3,3,5-테트라메틸헥산)으로 전부 수소화된다 (화학식 VIIIa를 참조하라). 일정 구현예에서, 시판되는 유익한 양의 매우 순수한 이소프렌 시작 조성물은 수소화되어 2-메틸부탄을 포함하는 산물을 생산한다. 일정 구현예에서, 불포화된 이소프렌 수산화물은 C5 알코올 및 디올 (예로, 3-메틸-부탄-1-올, 2-메틸-부탄-1-올 및 2-메틸-부탄-2-올, 3-메틸-부탄-1,3-디올 및 2-메틸-부탄-2,3-디올), C-10 알코올 및 디올 (예로, 3,7-디메틸옥탄-1-올, 2,7-디메틸옥탄-1-올, 2,7-디메틸옥탄-2-올 및 2,7-디메틸옥탄-2,7-디올), 및 고리형 C-10 알코올 (예로, 2-(4-메틸사이클로헥실)프로판-2-올, 2-(4-메틸사이클로헥실)프로판-1-올, 2-(1,4-메틸사이클로헥실)에탄올 및 4-에틸-1,4-디메틸사이클로헥산올과 같은 포화된 수산화물을 생산한다 (화학식 IX를 참조하라). 일정 구현예에서, 불포화된 이소프렌 산화물은 수산화되어 1,3-디에톡시-3-메틸부탄, 1-에톡시-3-메틸부탄, 1-메톡시-2,7-디메틸옥탄 및 3-메톡시-2,7-디메틸옥탄과 같은 포화된 에테르를 생산한다 (화학식 X를 참조하라). 알켄 소부분 (moiety)은 수소화될 때, 하나 이상의 입체 이성질체가 생산되는 것으로 이해된다. 입체 이성질체 간의 상대적 비율은 반응 조건 및 사용된 촉매에 의존한다. 적용가능할 때, 각각 및 모든 입체 이성질체는 본 명세서에서 기술된 포화된 탄화수소 및 산화물에 대한 것으로 의도된다.
화학식 VII.
이소프렌으로부터 유래한 고리형 탄화수소의 예
화학식 VIII.
이소프렌으로부터 유래한 지방족 탄화수소의 예
화학식 VIIIa.
이소아밀렌으로부터 유래한 이소데칸의 예
화학식 IX.
이소프렌으로부터 유래한 이소퓨얼TM 알코올의 예
화학식 X.
이소프렌으로부터 유래한 이소퓨얼TM 산화물의 예
일정 구현예에서, 시판되는 유익한 양의 매우 순수한 이소프렌 시작 조성물의 화학적 변환에 의해 생산되는 연료 성분은 포화된 이소프렌 유도체를 포함한다. 일정 구현예에서, 연료 성분은 이소프렌으로부터 유래한 포화된 C10 및 C15 탄화수소를 포함한다. 일정 구현예에서, 연료 성분은 1,2-비스(이소프로필)사이클로부탄, 1,2-비스(이소프로필)사이클로부탄, 1-메틸-4-이소프로필사이클로헥산, 1-메틸-3-이소프로필사이클로헥산, 1-에틸-1,4-디메틸사이클로헥산, 1-에틸-1,3-디메틸사이클로헥산, 1,5-디메틸사이클로옥탄 및 1,4-디메틸사이클로옥탄으로 이루어진 그룹으로부터 선택되는 하나 이상의 포화된 고리형 C10 탄화수소를 포함한다. 일정 구현예에서, 연료 성분은 1,5,9-트리메틸사이클로도데칸 및 1,5,10-트리메틸사이클로도데칸으로 이루어진 그룹으로부터 선택되는 하나 이상의 포화된 고리형 C15 탄화수소를 포함한다. 일정 구현예에서, 연료 성분은 2,6-디메틸옥탄, 2,7-디메틸옥탄 및 3,6-디메틸옥탄으로 이루어진 그룹으로부터 선택되는 하나 이상의 포화된 지방족 C10 탄화수소를 포함한다. 일정 구현예에서, 연료 성분은 2,6,10-트리메틸도데칸, 2,7,10-트리메틸도데칸 및 3,7,10-트리메틸도데칸으로 이루어진 그룹으로부터 선택되는 하나 이상의 포화된 지방족 C15 탄화수소를 포함한다. 일정 구현예에서, 연료 성분은 2-메틸부탄을 포함한다. 일정 구현예에서, 연료 성분은 2,3,4,4-테트라메틸헥산, 2,2,3,4-테트라메틸헥산, 2,3,3,4-테트라메틸헥산 및 3,3,5-테트라메틸헥산으로 이루어진 그룹으로부터 선택되는 하나 이상의 이소파라핀을 포함한다. 일정 구현예에서, 연료 성분은 3-메틸-부탄-1-올, 2-메틸-부탄-1-올 및 2-메틸-부탄-2-올, 3-메틸-부탄-1,3-디올, 2-메틸-부탄-2,3-디올, 3,7-디메틸옥탄-1-올, 2,7-디메틸옥탄-1-올, 2,7-디메틸옥탄-2-올, 2,7-디메틸옥탄-2,7-디올, 2-(4-메틸사이클로헥실)프로판-2-올, 2-(4-메틸사이클로헥실)프로판-1-올, 2-(1,4-메틸사이클로헥실)에탄올 및 4-에틸-1,4-디메틸사이클로헥산올로 이루어진 그룹으로부터 선택되는 하나 이상의 포화된 수산화물을 포함한다. 일정 구현예에서, 연료 성분은 1,3-디에톡시-3-메틸부탄, 1-에톡시-3-메틸부탄, 1-메톡시-2,7-디메틸옥탄 및 3-메톡시-2,7-디메틸옥탄으로 이루어진 그룹으로부터 선택되는 하나 이상의 포화된 에테르를 포함한다. 일정 구현예에서, 연료 성분은 3-메틸테트라하이드로퓨란, 3-메틸-2-부탄온 및 이소펜틸 아세테이트로 이루어진 그룹으로부터 선택되는 하나 이상의 이소프렌의 산화물을 포함한다.
일정 구현예에서, 이소프렌으로부터 나온 조성물 및 이로부터 연료 성분을 생산하는 시스템은 좀 더 나아가 이소프렌 시작 조성물의 연료 성분 또는 연료 성분을 만드는 중간체로의 화학적 변환을 촉매 작용하는 촉매를 포함한다. 일정 구현예에서, 이소프렌으로부터 나온 조성물 및 이로부터 연료 성분을 생산하는 시스템은 좀 더 나아가 포화된 연료 성분을 생산하도록 불포화된 중간체의 수소화를 촉매 작용하는 촉매를 포함한다. 일정 구현예에서, 촉매는 기술된 촉매라면 모두 또는 본 명세서에서 기술된 하나 이상의 촉매의 조합이다.
연료를 생산하는 방법 및/또는 공정
본 발명은 (a) 시판되는 유리한 양의 매우 순수한 이소프렌을 획득하고; 또한 (b) 시판되는 유리한 양의 매우 순수한 이소프렌 시작 물질의 적어도 일부분을 연료 성분으로 화학적으로 변환하는 것:을 포함하는 이소프렌으로부터 연료 성분을 생산하는 방법 및/또는 공정을 제공한다. 일정 구현예에서, 매우 순수한 이소프렌조성물은 연속적인 화학적 공정에서 연료 성분으로 변환된다. 또 다른 구현예에서, 매우 순수한 이소프렌은 좀 더 나아가 연료 조성물로의 화학적 변환 이전에 정제된다. 보다 또 다른 구현예에서, 매우 순수한 이소프렌은 중간체 조성물로 화학적으로 변환되고; 중간체 조성물은 다 나아가 화학적 변환을 거쳐서 연료 또는 연료 성분을 생산한다. 더 나아간 구현예에서, 생산된 연료 성분은 석유 증류물 (distillate) 및 다른 임의적 첨가제와 혼합되어 연료를 생산한다. 일정 바람직한 구현예에서, 매우 순수한 이소프렌은 바이오이소프렌 조성물일 수 있다.
일정 구현예에서, 이소프렌으로부터 연료 성분을 생산하는 방법은 시판되는 유리한 양의 매우 순수한 이소프렌 조성물을 획득하는 것을 포함한다. 일정 구현예에서, 본 발명에 유용한 매우 순수한 이소프렌 조성물은 약 2, 5, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 200, 300, 400, 500, 600, 700, 800, 900, 또는 1000 mg 이상의 이소프렌을 포함한다. 일정 구현예에서, 매우 순수한 이소프렌 조성물은 약 2, 5, 10, 20, 30, 40, 50, 60, 70, 80, 90, 또는 100 g 이상의 이소프렌을 포함한다. 일정 구현예에서, 시작 이소프렌 조성물은 약 0.2, 0.5, 1, 2, 5, 10, 20, 50, 100, 200, 500, 또는 1000 kg 이상의 이소프렌을 포함한다.
일정 구현예에서, 이소프렌으로부터 연료 성분을 생산하는 방법은 시판되는 유리한 양의 매우 순수한 이소프렌 조성물을 획득하는 것을 포함한다. 일정 구현예에서, 매우 순수한 이소프렌 시작 조성물은 시작 조성물에 있는 모든 C5 탄화수소의 전체 무게에 대비한 무게로 약 98.0, 98.5, 99.0, 99.5, 또는 100% 이상의 이소프렌을 포함한다. 일정 구현예에서, 본 발명에서 유용한 매우 순수한 이소프렌 시작 조성물은 조성물에 있는 모든 C5 탄화수소의 전체 무게에 대비한 무게로 약 99.90, 99.92, 99.94, 99.96, 99.98, 또는 100% 이상의 이소프렌을 포함한다. 일정 구현예에서, 매우 순수한 이소프렌 조성물은 조성물에 있는 모든 C5 탄화수소의 전체 무게에 대비한 무게로 약 2.0, 1.5, 1.0, 0.5, 0.2, 0.12, 0.10, 0.08, 0.06, 0.04, 0.02, 0.01, 0.005, 0.001, 0.0005, 0.0001, 0.00005, 또는 0.00001% 이하의 이소프렌이 아닌 C5 탄화수소 (1,3-사이클로펜타디엔, 시스-1,3-펜타디엔, 트랜스-1,3-펜타디엔, 1,4-펜타디엔, 1-펜틴, 2-펜틴, 1-펜텐, 2-메틸-1-부텐, 3-메틸-1-부틴, 펜트-4-엔-1-인, 트랜스-펜트-3-엔-1-인, 또는 시스-펜트-3-엔-1-인과 같음)를 포함한다. 일정 구현예에서, 매우 순수한 이소프렌 조성물은 조성물에 있는 모든 C5 탄화수소의 전체 무게에 대비한 무게로 1,3-사이클로펜타디엔, 시스-1,3-펜타디엔, 트랜스-1,3-펜타디엔, 1,4-펜타디엔, 1-펜틴, 2-펜틴, 1-펜텐, 2-메틸-1-부텐, 3-메틸-1-부틴, 펜트-4-엔-1-인, 트랜스-펜트-3-엔-1-인, 또는 시스-펜트-3-엔-1-인에 대해 약 2.0, 1.5, 1.0, 0.5, 0.2, 0.12, 0.10, 0.08, 0.06, 0.04, 0.02, 0.01, 0.005, 0.001, 0.0005, 0.0001, 0.00005, 또는 0.00001% 이하를 가진다. 상세한 구현예에서, 매우 순수한 이소프렌 조성물은 약 2 mg 이상의 이소프렌을 가지고, 조성물에 있는 모든 C5 탄화수소의 전체 무게에 대비한 무게로 약 98.0, 98.5, 99.0, 99.5. 99.90, 99.92, 99.94, 99.96, 99.98, 또는 100% 이상의 이소프렌을 가진다.
일정 구현예에서, 이소프렌으로부터 연료 성분을 생산하는 방법은 시판되는 유리한 양의 매우 순수한 이소프렌 조성물을 획득하는 것을 포함한다. 일정 구현예에서, 본 발명에서 유용한 매우 순수한 이소프렌 조성물은 이소프렌의 다중합을 저해하는 조성물에 있는 화합물이라면 모두의 경우 약 50, 40, 30, 20, 10, 5, 1, 0.5, 0.1, 0.05, 0.01, 또는 0.005 μg/L 이하의 이소프렌의 다중합을 저해하는 화합물을 포함한다. 상세한 구현예에서, 매우 순수한 이소프렌 조성물은 약 2 mg 이상의 이소프렌을 가진다.
일정 구현예에서, 이소프렌으로부터 연료 성분을 생산하는 방법은 시판되는 유리한 양의 매우 순수한 이소프렌 조성물을 획득하는 것을 포함한다. 일정 구현예에서, 본 발명에서 유용한 매우 순수한 이소프렌 시작 조성물은 에탄올, 아세톤, C5 프레닐 알코올 및 10개 이상의 탄소 원자를 가지는 이소프레노이드 화합물을 포함하는 그룹으로부터 선택되는 하나 이상의 화합물을 포함한다. 일정 구현예에서, 매우 순수한 이소프렌 조성물은 0.005, 0.01, 0.05, 0.1, 0.5, 1, 5, 10, 20, 30, 40, 60, 80, 100, 또는 120 μg/L 이상의 에탄올, 아세톤, C5 프레닐 알코올 (3-메틸-3-부텐-1-올 또는 3-메틸-2-부텐-1-올와 같음), 또는 상기의 둘 이상이라면 모두를 포함한다. 일정 구현예에서, 매우 순수한 이소프렌 조성물은 약 2 mg 이상의 이소프렌을 가지고, 에탄올, 아세톤, C5 프레닐 알코올 및 10개 이상의 탄소 원자를 가지는 이소프레노이드 화합물을 포함하는 그룹으로부터 선택되는 하나 이상의 화합물을 가진다.
일정 구현예에서, 이소프렌으로부터 연료 성분을 생산하는 방법은 시판되는 유리한 양의 매우 순수한 이소프렌 조성물을 획득하는 것을 포함한다. 일정 구현예에서, 본 발명에서 유용한 매우 순수한 이소프렌 조성물은 이소프렌 또한 2-헵탄온, 6-메틸-5-헵텐-2-온, 2,4,5-트리메틸피리딘, 2,3,5-트리메틸피라진, 시트로넬랄, 메탄티올, 메틸 아세테이트, 1-프로판올, 디아세틸, 2-부탄온, 2-메틸-3-부텐-2-올, 에틸 아세테이트, 2-메틸-1-프로판올, 3-메틸-1-부탄알, 3-메틸-2-부탄온, 1-부탄올, 2-펜탄온, 3-메틸-1-부탄올, 에틸 부틸레이트, 3-메틸-2-부텐알, 부틸 아세테이트, 3-메틸부틸 아세테이트, 3-메틸-3-부텐-1-일 아세테이트, 3-메틸-2-부텐-1-일 아세테이트, 3-헥센-1-올, 3-헥센-1-일 아세테이트, 리모넨, 게라니올 (트랜스-3,7-디메틸-2,6-옥타디엔-1-올), 시트로넬롤 (3,7-디메틸-6-옥텐-1-올), (E)-3,7-디메틸-1,3,6-옥타트리엔, (Z)-3,7-디메틸-1,3,6-옥타트리엔, 및 2,3-사이클로헵텐올피리딘으로 이루어진 그룹으로부터 선택되는 하나 이상의 두 번째 화합물을 포함한다. 다양한 구현예들에서, 무게로 단위 퍼센트의 이소프렌 양에 대비한 이들 두 번째 화합물 하나의 양 (예로, 이소프렌의 무게로 나눈 성분의 무게 곱하기 100)은 약 0.01, 0.02, 0.05, 0.1, 0.5, 1, 5, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 또는 110% (w/w) 이상이다. 일정 구현예에서, 무게로 단위 퍼센트의 이소프렌 양에 대비한 메탄티올의 양은 0.01% (w/w) 이하이다.
일정 구현예에서, 이소프렌으로부터 연료 성분을 생산하는 방법은 시판되는 유리한 양의 매우 순수한 이소프렌 조성물을 획득하는 것을 포함한다. 일정 구현예에서, 본 방법은 (a) 이소프렌 합성효소 폴리펩타이드를 인코딩하는 이종유래 핵산을 포함하는 상기 세포를 이소프렌의 생산에 적합한 배양 조건 하에 배양하고, (a) 상기 세포가 (i) 약 400 nmole/ggem/시간 이상의 이소프렌을 생산하고, (ii) 세포 배양 배지로부터 세포가 연소하는 탄소의 약 0.002 몰라 퍼센트 이상을 이소프렌으로 전환시키고, (iii) 약 0.1 mg/L액체배지/시간의 이소프렌 이상의 이소프렌의 평균 부피측정 생산도를 가지며, 또한 (b) 이소프렌을 생산하는 것:을 포함하는 생물학적 공정으로부터 시판되는 유리한 양의 매우 순수한 이소프렌 조성물을 획득하는 것을 포함한다. 일정 구현예에서, 세포는 이소프렌 합성효소 폴리펩타이드, 예로 자연적으로 생기는 푸엘라리아 (Pueraria)와 같은 식물로부터 나온 폴리펩타이드를 인코드하고, (ii) T7 프로모터와 같은 프로모터에 작동적으로 연결되어 있는 이종유래 핵산을 가진다. 일정 구현예에서, 세포는 이에 제한되는 것은 아니지만 탄소화물, 글리세롤, 글리세린, 디하이드록시아세톤, 일-탄소원, 오일, 동물 지방, 동물 오일, 지방산, 지질, 인지질, 글리세롤 지질, 모노글리세라이드, 디글리세라이드, 트리글리세라이드, 재생가능한 탄소원, 폴리펩타이드 (예로, 미생물 또는 식물 단백질 또는 펩타이드), 효모 추출물, 효모 추출물로부터 나온 성분, 또는 상기 둘 이상의 조합이라면 모두와 같은 탄소원을 포함하는 배양 배지에서 배양된다. 일정 구현예에서, 세포는 제한된 포도당 조건 하에서 배양된다. 일정 구현예에서, 세포는 좀 더 나아가 IDI 폴리펩타이드를 인코딩하는 이종유래 핵산을 포함한다. 일정 구현예에서, 세포는 좀 더 나아가 MVD 경로 폴리펩타이드를 인코딩하는 이종유래 핵산을 포함한다. 일정 구현예에서, 본 방법은 2008년 7월 2일자로 제출된 미국 가특허출원 제 61/134,094호, 국제특허출원 제 WO 2010/003007호, 및 2008년 12월 12일자로 제출된 미국 특허출원 제 12/335,071호 (미국 특허공개 제 2009/0203102 A1호)에서 기술된 방법을 사용하여 이소프렌을 생산하는 것을 포함한다.
일정 구현예에서, 본 방법은 이소프렌을 생산하는 배양의 세포에 의해 생산되는 기체 상 (배출-기체)을 포함한다. 일정 구현예에서, 배양에서의 세포는 약 400 nmole/ggem/시간 이상의 이소프렌을 생산한다. 일정 구현예에서, 기체 상은 1 vvm의 속도로 살포될 때 약 5, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100 μg/L 이상의 이소프렌을 포함한다. 일정 구현예에서, 기체 상의 휘발성 유기 분획은 휘발성 유기 분획에 있는 모든 C5 탄화수소의 전체 무게에 대비한 무게로 약 99.90, 99.92, 99.94, 99.96, 99.98, 또는 100% 이소프렌을 포함한다. 일정 구현예에서, 기체 상의 휘발성 유기 분획은 휘발성 유기 분획에 있는 모든 C5 탄화수소의 전체 무게에 대비한 무게로 약 2.0, 1.5, 1.0, 0.5, 0.2, 0.12, 0.10, 0.08, 0.06, 0.04, 0.02, 0.01, 0.005, 0.001, 0.0005, 0.0001, 0.00005, 또는 0.00001% 이하의 이소프렌이 아닌 C5 탄화수소 (1,3-사이클로펜타디엔, 시스-1,3-펜타디엔, 트랜스-1,3-펜타디엔, 1,4-펜타디엔, 1-펜틴, 2-펜틴, 1-펜텐, 2-메틸-1-부텐, 3-메틸-1-부틴, 펜트-4-엔-1-인, 트랜스-펜트-3-엔-1-인, 또는 시스-펜트-3-엔-1-인과 같음)를 포함한다. 일정 구현예에서, 기체 상의 휘발성 유기 분획은 휘발성 유기 분획에 있는 모든 C5 탄화수소에 대비한 무게로 1,3-사이클로펜타디엔, 시스-1,3-펜타디엔, 트랜스-1,3-펜타디엔, 1,4-펜타디엔, 1-펜틴, 2-펜틴, 1-펜텐, 2-메틸-1-부텐, 3-메틸-1-부틴, 펜트-4-엔-1-인, 트랜스-펜트-3-엔-1-인, 또는 시스-펜트-3-엔-1-인에 대해 약 2.0, 1.5, 1.0, 0.5, 0.2, 0.12, 0.10, 0.08, 0.06, 0.04, 0.02, 0.01, 0.005, 0.001, 0.0005, 0.0001, 0.00005, 또는 0.00001% 이하를 가진다. 상세한 구현예에서, 기체 상의 휘발성 유기 분획은 약 2 mg 이상의 이소프렌을 가지고, 휘발성 유기 분획에 있는 모든 C5 탄화수소의 전체 무게에 대비한 무게로 약 99.90, 99.92, 99.94, 99.96, 99.98, 또는 100% 이상의 이소프렌을 가진다.
일정 구현예에서, 본 방법은 이소프렌을 생산하는 배양에서 세포에 의해 생산되는 기체 상 (배출-기체)를 획득하는 것을 포함한다. 일정 구현예에서, 기체 상의 휘발성 유기 분획은 이소프렌의 다중합을 저해하는 기체 상의 휘발성 유기 분획에 있는 화합물이라면 모두의 경우 약 50, 40, 30, 20, 10, 5, 1, 0.5, 0.1, 0.05, 0.01, 또는 0.005 μg/L 이하의 이소프렌의 다중합을 저해하는 화합물을 포함한다. 상세한 구현예에서, 기체 상의 휘발성 유기 분획도 또한 약 2 mg 이상의 이소프렌을 가진다. 일정 구현예에서, 기체 상의 휘발성 유기 분획은 에탄올, 아세톤, C5 프레닐 알코올 및 10개 이상의 탄소 원자를 가지는 이소프레노이드 화합물을 포함하는 그룹으로부터 선택되는 하나 이상의 화합물을 포함한다. 일정 구현예에서, 기체 상의 휘발성 유기 분획은 0.005, 0.01, 0.05, 0.1, 0.5, 1, 5, 10, 20, 30, 40, 60, 80, 100, 또는 120 μg/L 이상의 에탄올, 아세톤, C5 프레닐 알코올 (3-메틸-3-부텐-1-올 또는 3-메틸-2-부텐-1-올과 같음), 또는 상기의 둘 이상이라면 모두를 포함한다. 일정 구현예에서, 기체 상의 휘발성 유기 분획은 약 2 mg 이상의 이소프렌을 가지고, 에탄올, 아세톤, C5 프레닐 알코올 및 10개 이상의 탄소 원자를 가지는 이소프레노이드 화합물을 포함하는 그룹으로부터 선택되는 하나 이상의 화합물을 가진다. 일정 구현예에서, 기체 상의 휘발성 유기 분획은 이소프렌 또한 2-헵탄온, 6-메틸-5-헵텐-2-온, 2,4,5-트리메틸피리딘, 2,3,5-트리메틸피라진, 시트로넬랄, 메탄티올, 메틸 아세테이트, 1-프로판올, 디아세틸, 2-부탄온, 2-메틸-3-부텐-2-올, 에틸 아세테이트, 2-메틸-1-프로판올, 3-메틸-1-부탄알, 3-메틸-2-부탄온, 1-부탄올, 2-펜탄온, 3-메틸-1-부탄올, 에틸 부틸레이트, 3-메틸-2-부텐알, 부틸 아세테이트, 3-메틸부틸 아세테이트, 3-메틸-3-부텐-1-일 아세테이트, 3-메틸-2-부텐-1-일 아세테이트, 3-헥센-1-올, 3-헥센-1-일 아세테이트, 리모넨, 게라니올 (트랜스-3,7-디메틸-2,6-옥타디엔-1-올), 시트로넬롤 (3,7-디메틸-6-옥텐-1-올), (E)-3,7-디메틸-1,3,6-옥타트리엔, (Z)-3,7-디메틸-1,3,6-옥타트리엔, 및 2,3-사이클로헵텐올피리딘으로 이루어진 그룹으로부터 선택되는 하나 이상의 두 번째 화합물을 포함한다. 다양한 구현예들에서, 무게로 단위 퍼센트의 이소프렌 양에 대비한 이들 두 번째 화합물 하나의 양 (예로, 이소프렌의 무게로 나눈 성분의 무게 곱하기 100)은 기체 상의 휘발성 유기 분획에서 약 0.01, 0.02, 0.05, 0.1, 0.5, 1, 5, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 또는 110% (w/w) 이상이다. 일정 구현예에서, 본 방법은 좀 더 나아가 기체 상으로부터 이소프렌을 회수하는 것을 포함한다. 예를 들어, 이소프렌을 포함하는 기체 상에서의 이소프렌은 기체 비워냄법 (gas stripping), 막 증진된 분리법 (membrane enhanced separation), 분획법 (fractionation), 흡착/탈착법 (adsorption/desorption), 증발법 (pervaporation), 고체 상으로부터 이소프렌의 열 또는 증기 탈착법, 또는 용매로 고체 상에 고정되거나 흡수된 이소프렌의 추출법과 같은 표준 방법을 사용하여 회수될 수 있다 (예를 들어, 미국특허 제 4,703,007호 및 제 4,570,029호을 참조하고, 이들은 각각 본 명세서에서 참조문헌으로 전부, 상세하게는 이소프렌 회수 및 정제 방법에 관하여 통합되어 있다). 상세한 구현예에서, 알코올 (에탄올, 메탄올, 프로판올 또는 그의 조합과 같음)로의 추출 증류법이 이소프렌을 회수하는 데 사용된다. 일정 구현예에서, 이소프렌의 회수는 액체 형태 (이소프렌의 순수 (neat) 용액 또는 용매에 녹인 이소프렌 용액과 같음)로 이소프렌의 분리를 포함한다. 기체 비워냄은 연속적 방식으로 발효 배출-기체 증기로부터 이소프렌 증기의 제거를 포함한다. 이러한 제거는, 이에 제한되는 것은 아니지만 고체 상에 대한 흡착, 액상 내로 분배, 또는 직접적인 농축 (농축 코일에 노출로 인한 또는 압력의 증가로 인한 농축과 같음)을 포함하는 여러 가지 다른 방식으로 달성될 수 있다. 일정 구현예에서, 증기의 이슬점 이상에서 희석된 이소프렌 증기의 막 농축은 액체 이소프렌의 농축을 가져온다. 일정 구현예에서, 이소프렌은 압축되고 농축된다.
이소프렌의 회수는 한 단계 또는 복수의 단계를 포함할 수 있다. 일정 구현예에서, 발효 배출-기체로부터 이소프렌 증기의 제거 및 액상으로 이소프렌의 전환은 동시적으로 수행된다. 예를 들어, 이소프렌은 액체를 형성하도록 배출-기체로부터 직접적으로 농축될 수 있다. 일정 구현예에서, 발효 배출-기체로부터 이소프렌 증기의 제거 및 액상으로 이소프렌의 전환은 연속적으로 수행된다. 예를 들어, 이소프렌은 고체 상에 흡착된 다음 용매를 사용하여 고체 상으로부터 추출될 수 있다.
일정 구현예에서, 순수 바이오이소프렌을 포함하는 이소프렌의 고리형 이중체를 생산하는 방법이 제공된다. 생산된 이소프렌의 고리형 이중체는 6개-구성원으로 된 고리 이중체 (예로, 리모넨과 같은 [2+4] 전기고리화 (electrocyclization) 산물) 또는 8개-구성원으로 된 고리 이중체 또는 그의 혼합물일 수 있다. 6개-구성원으로 된 고리 이중체의 예로는 이에 제한되는 것은 아니지만, 1-메틸-4-(프로프-1-엔-2-일)사이클로헥스-1-엔, 1-메틸-5-(프로프-1-엔-2-일)사이클로헥스-1-엔, 1,4-디메틸-4-비닐사이클로헥센, 2,4-디메틸-4-비닐사이클로헥센 등을 포함한다. 8개-구성원으로 된 고리 이중체의 예로는 1,5-디메틸사이클로옥타-1,5-디엔, 1,6-디메틸사이클로옥타-1,5-디엔 등을 포함한다. 일정 구현예에서, 순수 생물학적으로 생산된 이소프렌은 약 100℃ 내지 약 300℃, 바람직하게는 약 150℃ 내지 약 250℃의 온도로 가열하여 이중합된다. 압력은 약 2 내지 3 atm에서 유지된다. 또 다른 구현예에서, 결합된 디엔의 이중합을 촉매 작용하는 데 적합한 촉매가 사용될 수 있다. 산물 혼합물에 있는 다양한 이중체들의 비율은 촉매 및 다른 반응 조건에 의해 조절될 수 있다. 예를 들어, 니켈 촉매는 8개-구성원으로 된 고리 이중체의 형성을 촉진할 수 있다.
일정 구현예에서, 바이오이소프렌의 광-이중합을 포함하는 이소프렌의 고리형 이중체를 생산하는 방법이 제공된다. 생산된 이소프렌의 고리형 이중체는 4개-구성원으로 된 고리 이중체 또는 그의 혼합물일 수 있다. 4개-구성원으로 된 고리 이중체의 예로는 이제 제한되는 것은 아니지만 1,2-디(프로프-1-엔-2-일)사이클로부탄, 1,3-디(프로프-1-엔-2-일)사이클로부탄, 1-메틸-1-비닐-3-(프로프-1-엔-2-일)사이클로부탄, 1-메틸-1-비닐-2-(프로프-1-엔-2-일)사이클로부탄, 1,3-디메틸-1,3-디비닐사이클로부탄, 1,2-디메틸-1,2-디비닐사이클로부탄 등을 포함한다. 일정 구현예에서, 순수 생물학적으로 생산된 이소프렌은 UV 광으로 조사되어, 바람직하게는 벤조페논과 같은 광민감화제의 존재 시 이중합된다.
이소프렌 이중체는 수소화되어 포화된 연료로서 작용하거나 연료 내로 혼합되는 C10 탄화수소를 형성한다. 일정 구현예에서, 포화된 이소프렌 이중체는 촉매적 수소화되어 부분적으로 수소화된 및/또는 전부 수소화된 산물을 생산한다. 전부 수소화된 산물의 예로는 이에 제한되는 것은 아니지만, 1-메틸-4-이소프로필사이클로헥산, 1-메틸-5-이소프로필사이클로헥산, 1,4-디메틸-4-에틸사이클로헥산, 2,4-디메틸-4-에틸사이클로헥산, 1,2-디이소프로필사이클로부탄 및 1,3-디이소프로필사이클로부탄,1-메틸-1-비닐-3-(프로프-1-엔-2-일)사이클로부탄, 1-메틸-1-비닐-2-(프로프-1-엔-2-일)사이클로부탄, 1,3-디메틸-1,3-에틸사이클로부탄, 1,2-디메틸-1,2-에틸사이클로부탄, 1,5-디메틸사이클로옥탄, 1,6-디메틸사이클로옥탄 등을 포함한다.
일정 구현예에서, 이소프렌으로부터 연료 성분을 생산하는 방법은 (a) 본 명세서에서 기술된 매우 순수한 이소프렌 시작 조성물이라면 모두의 시판되는 유리한 양을 획득하고; 또한 (b) (i) 매우 순수한 이소프렌 조성물을 압력 하에서 약 100℃ 또는 이의 초과 온도로 가열하고; (ii) 시작 이소프렌 조성물의 적어도 일부분을 불포화된 고리형 이소프렌 이중체로 전환시키고; 또한 (iii) 불포화된 고리형 이소프렌 이중체를 수소화하여 포화된 고리형 이소프렌 이중체를 생산하는 것:을 포함하는 매우 순수한 이소프렌 시작 조성물의 적어도 일부분을 연료 성분으로 화학적으로 변환하는 것:을 포함한다. 일정 구현예에서, 시작 이소프렌 물질은 압력 하에서 약 100, 125, 150, 175, 200, 225 또는 250℃ 또는 이의 초과 온도로 가열된다. 일정 구현예에서, 시작 이소프렌 물질은 라디칼-매개성 다중합을 방지하도록 항산화제 (예로, 2,6-디-터르-부틸-4-메틸페놀)의 존재 시 가열된다. 일정 구현예에서, 이소프렌의 열적 이중합은 다중합 저해제로서 디니트로크레졸의 존재 시 수행된다. 적합한 산화제가 다중합 저해제 (polymerization inhibitors)로서 사용될 수 있다. 일정 구현예에서, 시작 이소프렌 조성물의 적어도 일부분은 6개 및 8개-구성원으로 된 고리, 예를 들어 리모넨 (1-메틸-4-(프로프-1-엔-2-일)사이클로헥스-1-엔), 1-메틸-5-(프로프-1-엔-2-일)사이클로헥스-1-엔, 1,4-디메틸-4-비닐사이클로헥센, 2,4-디메틸-4-비닐사이클로헥센, 1,5-디메틸사이클로옥타-1,5-디엔, 1,6-디메틸사이클로옥타-1,5-디엔, 2,6-디메틸-1,3-사이클로옥타디엔, 2,6-디메틸-1,4-사이클로옥타디엔, 3,7-디메틸-1,5-사이클로옥타디엔, 3,7-디메틸-1,3-사이클로옥타디엔 및 3,6-디메틸-1,3-사이클로옥타디엔을 포함하는 불포화된 이중체의 혼합물이다. 일정 구현예에서, 시작 이소프렌 조성물에서 약 20, 30, 40, 50, 60, 70, 75, 80, 85, 90, 95, 98, 99 또는 100% 이상의 이소프렌이 불포화된 고리형 이소프렌 이중체로 전환된다. 일정 구현예에서, 포화된 고리형 이소프렌 이중체는 1-메틸-4-이소프로필사이클로헥산, 1-메틸-3-이소프로필사이클로헥산, 1-에틸-1,4-디메틸사이클로헥산, 1-에틸-1,3-디메틸사이클로헥산, 1,5-디메틸사이클로옥탄 및 1,4-디메틸사이클로옥탄으로 이루어진 그룹으로부터 선택되는 하나 이상의 C10 탄화수소를 포함한다. 일정 구현예에서, 시작 이소프렌 조성물은 바이오이소프렌 조성물이다.
일정 구현예에서, 이소프렌으로부터 연료 성분을 생산하는 방법은 (a) 본 명세서에서 기술된 매우 순수한 이소프렌 시작 조성물이라면 모두의 시판되는 유리한 양을 획득하고; 또한 (b) (i) 매우 순수한 이소프렌 조성물을 촉매 시스템과 접촉시키고; (ii) 시작 이소프렌 조성물의 적어도 일부분을 불포화된 고리형 이소프렌 이중체 및/또는 삼중체로 전환시키고; 또한 (iii) 불포화된 이중체 및/또는 삼중체를 수소화하여 포화된 C10 및/또는 C15 탄화수소를 생산하는 것:을 포함하는 매우 순수한 이소프렌 시작 조성물의 적어도 일부분을 연료 성분으로 화학적으로 변환하는 것:을 포함한다. 일정 구현예에서, 시작 이소프렌 조성물에서 약 20, 30, 40, 50, 60, 70, 75, 80, 85, 90, 95, 98, 99 또는 100% 이상 이소프렌의 불포화된 이소프렌의 이중체 및/또는 삼중체로 전환된다. 일정 구현예에서, 시작 이소프렌 조성물은 당해 기술분야에 알려져 있는 적절한 촉매 시스템과 접촉시켜서 1,2-디(프로프-1-엔-2-일)사이클로부탄, 1,3-디(프로프-1-엔-2-일)사이클로부탄, 1-메틸-1-비닐-3-(프로프-1-엔-2-일)사이클로부탄, 1-메틸-1-비닐-2-(프로프-1-엔-2-일)사이클로부탄, 1,3-디메틸-1,3-디비닐사이클로부탄, 1,2-디메틸-1,2-디비닐사이클로부탄, 1-메틸-4-(프로프-1-엔-2-일)사이클로헥스-1-엔, 1-메틸-5-(프로프-1-엔-2-일)사이클로헥스-1-엔, 1,4-디메틸-4-비닐사이클로헥센, 2,4-디메틸-4-비닐사이클로헥센, 1,5-디메틸사이클로옥타-1,5-디엔, 1,6-디메틸사이클로옥타-1,5-디엔, 1,4-디메틸-4-비닐-1-사이클로헥센, 2,4-디메틸-4-비닐-1-사이클로헥센, 2,7-디메틸-1,3,7-옥타트리엔, 2,7-디메틸-2,4,6-옥타트리엔, 2,6-디메틸-1,3-사이클로옥타디엔, 2,6-디메틸-1,4-사이클로옥타디엔, 3,7-디메틸-1,5-옥타디엔, 3,7-디메틸-1,3-사이클로옥타디엔 및 3,6-디메틸-1,3-사이클로옥타디엔으로 이루어진 그룹으로부터 선택되는 하나 이상의 불포화된 고리형 이소프렌 이중체를 수득한다. 일정 구현예에서, 시작 이소프렌 조성물은 당해 기술분야에 알려져 있는 적절한 촉매 시스템과 접촉시켜서 트리메틸사이클로도데카트리엔 및 트리메틸사이클로도데카테트라엔 등과 같은 하나 이상의 불포화된 고리형 이소프렌 삼중체를 수득한다. 일정 구현예에서, 시작 이소프렌 조성물은 당해 기술분야에 알려져 있는 적절한 촉매 시스템과 접촉시켜서 디메틸옥타트리엔 (예로, 2,7-디메틸-1,3,7-옥타트리엔 및 2,7-디메틸-2,4,6-옥타트리엔) 및 트리메틸도데카테트라엔 (예로, 2,6,10-트리메틸-1,5-9,11-도데카테트라엔, α-파네센, 및 β-파네센)과 같은 하나 이상의 이소프렌의 불포화된 직선형 이중체 및/또는 삼중체를 수득한다. 일정 바람직한 구현예에서, 시작 이소프렌 조성물은 바이오이소프렌 조성물이다.
일정 구현예에서, 이소프렌으로부터 연료 성분을 생산하는 방법은 매우 순수한 이소프렌 조성물을 촉매 시스템과 접촉시켜서 시작 이소프렌 조성물의 적어도 일부분을 불포화된 이소프렌 이중체 및/또는 삼중체로 전환하는 것을 포함한다. 일정 구현예에서, 촉매 시스템은 Ni, Fe 또는 Co 촉매를 포함하고 시작 조성물에서 이소프렌은 1,5-디메틸사이클로옥타-1,5-디엔 및 1,6-디메틸사이클로옥타-1,5-디엔과 같은 디메틸사이클로옥타디엔을 포함하는 8개-구성원으로 된 고리 이소프렌 이중체로 전환된다. 일정 구현예에서, 촉매 시스템은 니켈 화합물을 포함한다. 이소프렌의 Ni-촉매된 이중합은 1,5-디메틸사이클로옥타-1,5-디엔 대비 1,6-디메틸사이클로옥타-1,5-디엔의 90 내지 10, 80 내지 20, 70 내지 30, 60 내지 40, 50 내지 50, 40 내지 60, 30 내지 70, 80 내지 20 및 10 내지 90 비율로 구성되는 디메틸-1,5-사이클로옥타디엔 혼합물을 수득한다. 일정 구현예에서, 촉매 시스템은 디메틸사이클로옥타디엔은 Ni-카복실레이트 또는 β-케톤, 오가노알루미늄 또는 오가노마그네슘 화합물 및 치환된 트리페닐포스파이트를 포함하는 3개-성분 촉매를 포함한다. 예를 들어, 무수 톨루엔에 녹인 매우 순수한 이소프렌 시작 조성물의 탈기된 (degassed) 용액은 질소 대기 하에서 Ni(acac)2, Et3Al 및 트리스(3,4-비스(디메틸아미노)페닐)포스파이트와 혼합되고 혼합물은 95℃로 가열되어 디메틸사이클로옥타디엔을 낸다. 또 다른 구현예에서, 촉매 시스템은 Fe 카복실레이트 또는 β-디케톤 화합물, 오가노-Al 또는 Mg 화합물, 및 전자-공여기를 가지는 2,2'-디피리딜 유도체를 포함한다. 예를 들어, 시작 이소프렌 조성물은 톨루엔에 녹인 Fe 아세틸아세토네이트, 4,4'-디메틸-2,2'-디피리딜 및 Et3Al의 혼합물과 함께 가열되어 좋은 수율로 1,6-디메틸-1,5-사이클로옥타디엔을 낸다. 일정 바람직한 구현예에서, 시작 이소프렌 조성물은 바이오이소프렌 조성물이다.
일정 구현예에서, 이소프렌으로부터 연료 성분을 생산하는 방법은 매우 순수한 이소프렌 조성물을 촉매 시스템과 접촉시켜서 시작 이소프렌 조성물의 적어도 일부분을 불포화된 이소프렌 이중체 및/또는 삼중체로 전환하는 것을 포함한다. 일정 구현예에서, 촉매 시스템은 Ru, Fe, Ni 또는 Pd 촉매 또는 그의 조합을 포함하고, 시작 조성물에서 이소프렌은 6개-구성원으로 된 고리 이소프렌 이중체를 포함하는 혼합물로 전환된다. 일정 구현예에서, 촉매 시스템은 Fe(NO)2Cl-비스(1,5-사이클로옥타디엔)니켈 촉매 시스템이고 시작 조성물에서 이소프렌은 낮은 온도 (예로, -5℃로부터 +20℃까지)에서 고리이중합되어 1-메틸- 및 2-메틸-4-이소프로페닐-1-사이클로헥센 또한 1,4- 및 2,4-디메틸-4-비닐-1-사이클로헥센을 준다. 또 다른 구현예에서, 트리스 (치환된 하이드로카빌)포스파이트, 아세나이트 (arsenite), 또는 안티모나이트 (antimonite) 및 그룹 VIII 금속(0) 화합물 (예로, Ni 아세틸아세토네이트)의 혼합 촉매와 접촉시키는 것은 시작 조성물에서의 이소프렌을 1,4-디메틸-4-비닐-1-사이클로헥센 및 1,5-디메틸-1,5-사이클로옥타디엔으로 전환시킨다. 또 다른 구현예에서, 이소프렌 시작 조성물을 루테늄 촉매와 접촉시키는 것은 (Itoh, Kenji; Masuda, Katsuyuki; Fukahori, Takahiko; Nakano, Katsumasa; Aoki, Katsuyuki; Nagashima, Hideo, Organometallics (1994), 13(3), 1020-9) 이소프렌을 C10 고리형 이중체 (예로, 디메틸-사이클로옥타디엔의 혼합물)로 전환시킨다. 루테늄 촉매는 RuCl3 및 펜타메틸사이클로펜타디엔 (C5Me5H)으로부터 두 단계로 합성될 수 있다. 공정은 회분식으로 수행될 수 있고, 촉매는 회수되어 재순환될 수 있다. 일정 바람직한 구현예에서, 시작 이소프렌 조성물은 바이오이소프렌 조성물이다. 본 방법의 하나의 구현예가 화학식 XI에 묘사되어 있다.
일정 구현예에서, 이소프렌으로부터 연료 성분을 생산하는 방법은 매우 순수한 이소프렌 조성물을 촉매 시스템과 접촉시켜서 시작 이소프렌 조성물의 적어도 일부분을 불포화된 이소프렌 이중체 및/또는 삼중체로 전환하는 것을 포함한다. 일정 구현예에서, 촉매 시스템은 Ni, Ti, Al, 또는 Mg 촉매 또는 그의 혼합물을 포함하고, 시작 조성물에서 이소프렌은 트리메틸사이클로도데카트리엔과 같은 고리형 이소프렌 삼중체를 포함하는 혼합물로 전환된다. 일정 구현예에서, 이소프렌의 삼중합을 위한 촉매 시스템은 Ni 및/또는 Ti, 하나 이상의 오가노금속 화합물, 및 그룹 VA 화합물을 포함한다. 반응은 하이드록시기-포함 용매에서 시행될 수 있다. 또 다른 구현예에서, 전자 공여자로서 다양한 포스파이트의 존재 시 니켈 나프테네이트 및 이소프렌마그네슘에 의해 촉매된 이소프렌의 올리고중합은 디메틸사이클로옥타디엔을 포함하는 고리형 이중체를 주고; 상세하게는, 1,1,1-트리스(하이드록시메틸)프로판 포스파이트는 선택적으로 트리메틸사이클로도데카트리엔을 준다.
화학식 XI
일정 구현예에서, 이소프렌으로부터 연료 성분을 생산하는 방법은 매우 순수한 이소프렌 조성물을 촉매 시스템과 접촉시켜서 시작 이소프렌 조성물의 적어도 일부분을 불포화된 이소프렌 이중체 및/또는 삼중체로 전환하는 것을 포함한다. 일정 구현예에서, 촉매 시스템은 Ni, Pd 또는 Cr 촉매 또는 그의 혼합물을 포함하고, 시작 조성물에서 이소프렌은 말단체 또는 직선형 이중체 및/또는 삼중체로 전환된다. 한 가지 구현예에서, Pd(0) 복합체 (Pd(acac)2-Ph3P 및 Pd(OAc)2-Ph3P)를 포함하는 촉매 시스템은 이소프렌의 이중합 및 말단중합 (telomerization)을 촉매하여 직선형 이소프렌 이중체 (예로, 2,7-디메틸-1,3,7-옥타트리엔)을 준다. 한 가지 다양성에서, 반응은 용매로서 메탄올에서 수행되고 메톡시디메틸옥타디엔 (예로, 1-메톡시-2,7-디메틸-2,7-옥타디엔 및 3-메톡시-2,7-디메틸-1,7-옥타디엔)과 같은 메틸 에테르가 생산된다. 또 다른 구현예에서, 촉매 시스템은 이가 및 삼가 전이 금속-교환 몬트모릴로나이트 (예로, Cr3+-몬트모릴로나이트)를 포함한다. 또 다른 구현예에서, 촉매 시스템은 Ni(0)-아미노포스피나이트 (Ni(0)-aminophosphinite) 촉매를 포함하고 시작 조성물에서 이소프렌은 부위선택적 꼬리-꼬리 직선형 이중체로 전환된다. 일정 다양성에서, 직선형 이중체 형성이 경쟁적 고리이중합 반응에 의해 수반된다. 또 다른 구현예에서,촉매 시스템은 크롬 N,N-비스(디아릴포스피노)아민 촉매 (Bowen, L.; Charernsuk, M.; Wass, D.F. Chem. Commun. (2007) 2835-2837)를 포함하고 이소프렌은 직선형 및 고리형 C15 삼중체로 전환된다. 한 가지 다양성에서 크롬 촉매는 CrCl3(THF)3 및 PNP 포스파인 리간드로부터 제자리에서 (in situ) 만들어진다.
일정 구현예에서, 바이오이소프렌 조성물로부터 연료 성분을 생산하는 방법은 (i) 바이오이소프렌 조성물을 이소프렌의 삼중합을 촉매 작용하는 촉매와 접촉시켜서 불포화된 이소프렌 삼중체를 생산하고 또한 (ii) 이소프렌 삼중체를 수소화하여 연료 성분을 생산하는 것에 의해, 바이오이소프렌 조성물에서 이소프렌의 실질적인 부분을 화학적으로 변환하는 것을 포함한다. 일정 구현예에서, 바이오이소프렌 조성물에서 적어도 약 95%의 이소프렌이 화학적 변환과정 동안 비-이소프렌 화합물로 전환된다.
일정 구현예에서, 이소프렌으로부터 연료 성분을 생산하는 방법은 (a) 본 명세서에서 기술된 매우 순수한 이소프렌 시작 조성물이라면 모두의 시판되는 유익한 양을 획득하고; (b) 시작 이소프렌 조성물의 적어도 일부분을 불포화된 이소프렌 유도체로 전환하고; 또한 (c) 불포화된 이소프렌 유도체를 수소화하여 포화된 화합물을 생산하는 것:을 포함한다. 일정 구현예에서, 불포화된 이소프렌 유도체의 포화된 화합물로의 수소화는 회분식 방식으로 수행된다. 일정 구현예에서, 불포화된 이소프렌 유도체의 포화된 화합물로의 수소화는 연속식 방식으로 수행된다. 본 방법의 한 가지 구현예는 화힉식 XII에 묘사되어 있다.
화학식 XII
일정 구현예에서, 이소프렌으로부터 연료 성분을 생산하는 방법은 (a) 본 명세서에서 기술된 매우 순수한 이소프렌 시작 조성물이라면 모두의 시판되는 유익한 양을 획득하고; (b) 시작 이소프렌 조성물의 적어도 일부분을 산화된 이소프렌 유도체로 전환하고; 또한 임의적으로 (c) 산화된 이소프렌 유도체를 수소화하여 포화된 화합물을 생산하는 것:을 포함한다. 일정 구현예에서, 이소프렌 시작 조성물은 알코올 (예로, 메탄올 또는 에탄올 또는 그의 혼합물)의 존재 시 촉매와 접촉하여 하나 이상의 불포화된 또는 포화된 에테르 (예로, 메틸 에테르 또는 에틸 에테르 또는 그의 혼합물)을 포함하는 산화된 이소프렌 유도체를 형성한다. 일정 구현예에서, 촉매는 황산, 고체 상 황산 (예로, 도웩스 마라톤 ), 액상 및 고체-상 플루오로설폰산 (예로, 트리플루오로메탄설폰산 및 나피온-H (듀퐁사))과 같은 산 촉매이다. 제올라이트 예를 들어 베타-제올라이트도 역시 리모넨 및 관련 모노테르펜의 메톡시화에 관해 헨셀 등에 의해 기술된 것과 유사한 조건 하에서 사용될 수 있다 [Hensen, K.; Mahaim, C.; Holderich, W.F., Applied Catalysis A: General (1997) 140(2), 311-329]. 일정 구현예에서, 이소프렌 시작 조성물 또는 불포화된 이소프렌 이중체 또는 삼중체는 산화/수소화를 거쳐서 C5, C10 및 C15 알코올 및 디올과 같은 하나 이상의 알코올을 포함하는 수산화된 이소프렌 유도체를 형성한다. 일정 구현예에서, 이소프렌 시작 조성물은 하이드록시화/에스테르화를 거쳐서 알코올 및 에스테를 형성한다. 예를 들어, 바이오이소프렌 또는 불포화된 중간체는 퍼아세트산 및 3-클로로퍼벤조산과 같은 과산 (peracids)을 사용한 에폭사이드로의 과산화; 또한 i) 물 및 산 촉매 및 ii) 붕소수화 (hydroboration) 방법을 사용하여 알코올 및 디올을 주는 수화 (hydration)를 거친다. 이러한 반응은 예를 들어 Michael B. Smith 및 Jerry March, Advanced Organic Chemistry: Reactions, Mechanisms, and Structure, 제 6판, John Wiley & Sons, 2007에 기술되어 있다. 일정 바람직한 구현예에서, 시작 이소프렌 조성물은 바이오이소프렌 조성물이다.
일정 구현예에서, 이소프렌으로부터 연료 성분을 생산하는 방법은 (a) 본 명세서에서 기술된 매우 순수한 이소프렌 시작 조성물이라면 모두의 시판되는 유익한 양을 획득하고; (b) 시작 이소프렌 조성물을 모노-올레핀 (예로, 2-메틸부트-1-엔, 3-메틸부트-1-엔 및 2-메틸부트-2-엔)으로 부분적으로 수소화하고; 또한 (c) 모노-올레핀으로부터 연료 성분을 생산하는 것:을 포함한다. 일정 구현예에서, 모노-올레핀은 이소부틸렌을 이소옥탄으로 전환하는 데 사용되는 것과 같은 전통적인 탄화수소 양이온성 촉매작용을 사용하여 다른 올레핀과 반응시킨다. 그 다음 다른 올레핀과의 이중합 또는 반응의 산물은 수소화를 거쳐서 포화된 연료 성분을 준다. 일정 바람직한 구현예에서, 매우 순수한 이소프렌은 바이오이소프렌 조성물이다. 일정 구현예에서, 시작 이소프렌 조성물은 Pd/CaCO3, Pd/BaSO4, Pd/C, Pd black, Pd/SiO3, Pd/Al2O3, 또는 Pd/SiO2와 같은 팔라듐 촉매를 사용하여 부분적으로 수소화된다. 일정 구현예에서, 시작 이소프렌 조성물은 실리카-지지된 폴리아미도아민 (PAMAM) 덴드리머-팔라듐 복합체를 사용하여 부분적으로 수소화된다. 일정 구현예에서, 시작 이소프렌 조성물은 팔라듐-금 및 팔라듐-은 촉매 (예로, Pd-Au/SiO2 및 Pd-Ag/SiO2)를 사용하여 부분적으로 수소화되고, 전부 환원된 C5 알칸 위에 이소프렌의 모노-올레핀으로 환원하는 높은 선택도를 가진다. 일정 구현예에서, 시작 이소프렌 조성물은 무기 지지체 (예로, 금속 제올라이트) 상의 그룹 VIB 금속을 촉매 예로 Mo/Al2O3 촉매로서 사용하여 부분적으로 수소화된다. 일정 구현예에서, 시작 이소프렌 조성물은 단암의 (monolithic) 촉매 베드를 사용하여 부분적으로 수소화되고 이는 벌집 모양이 될 수 있다. 단암의 촉매 베드를 위한 촉매 지지체 물질은 니켈, 백금, 팔라듐, 로듐, 루테늄, 은, 철, 구리, 코발트, 크롬, 이리듐, 주석, 및 합금 또는 그들의 혼합물과 같은 금속을 포함할 수 있다. 일정 구현예에서, 시작 이소프렌 조성물은 달걀 껍질 Pd/δ-Al2O3 촉매를 사용하여, 상세하게는 반응에 물이 없는 경우 부분적으로 수소화된다. 일정 구현예에서, 시작 이소프렌 조성물은 그룹 IB, VIB, VIIB, 또는 아연으로부터 나온 금속에 의해 촉진된 그룹 VIII 금속 촉매를 사용하여 부분적으로 수소화되어 촉매 독을 감소시킨다. 이소프렌을 이소아밀렌 (모노-올레핀)으로 전환하는 방법은 균질 또는 비균질 촉매 둘 다를 사용하여 연속식 또는 회분식 방식으로 수행될 수 있다. 본 발명의 한 가지 구현예는 화학식 XIII에 묘사되어 있다.
일정 구현예에서, 이소프렌의 부분적 수소화로부터 생산된 이소아밀렌은 이온 교환 레진 및 제올라이트 위에 액상으로 삼중합을 거친다. GranGranollers, Ind. Eng. Chem. Res., 49 (8), pp 3561-3570 (2001)을 참조하라.
화학식 XIII
일정 구현예에서, 이소프렌으로부터 연료 성분을 생산하는 방법은 (a) 본 명세서에서 기술된 매우 순수한 이소프렌 시작 조성물이라면 모두의 시판되는 유익한 양을 획득하고; (b) 시작 이소프렌 조성물을 모노-올레핀 (예로, 2-메틸부트-1-엔, 3-메틸부트-1-엔 및 2-메틸부트-2-엔)으로 부분적으로 수소화하고; (c) 모노-올레핀을 모노-올레핀의 이중합을 위한 촉매와 접촉시켜서 또 다른 모노-올레핀과 디메이트를 형성하고; (d) 이중합의 산물 (디메이트)를 수소화하여 포화된 탄화수소 연료 성분을 생산하는 것:을 포함한다. 일정 바람직한 구현예에서, 매우 순수한 이소프렌은 바이오이소프렌 조성물이다. 일정 구현예에서, 다른 모노-올레핀은 매우 순수한 이소프렌 시작 조성물로부터 유래한 이소아밀렌이다. 일정 구현예에서, 다른 모노-올레핀은 프로필렌, 부탄 또는 이소부탄과 같은 또 다른 출처로부터 나온 올레핀이다. 일정 구현예에서, 이중합을 위한 촉매는 레진 촉매 (예로, 앰버리스트, 앰버리스트 35, 앰버리스트 15, 앰버리스트 XN1010, 앰버리스트 XE586)이다. 일정 구현예에서, 이중합을 위한 촉매는 제올라이트 구조, ZSM-5, 페리에라이트, ZSM-22 및 ZSM-23에 박힌 중간공극 체와 같은 산성의 중간공극 분자적 체를 포함하는 촉매 물질이다. 일정 구현예에서, 이중합을 위한 촉매는 고온에서 (예로, 적어도 900℃)에서 열적으로 안정한 촉매 물질이다. 일정 구현예에서, 이중합을 위한 촉매는 산성의 중간공극 분자적 체를 포함하는 촉매 물질이다. 일정 구현예에서, 이중합을 위한 촉매는 고체 산성 촉매 (예로, 고체 인산 촉매, 산성의 이온 교환 레진)이다. 본 방법의 한 가지 구현예는 화학식 XIV에 묘사되어 있다.
화학식 XIV
일정 구현예에서, 이소프렌으로부터 연료 성분을 생산하는 방법은 (a) 본 명세서에서 기술된 매우 순수한 이소프렌 시작 조성물이라면 모두의 시판되는 유익한 양을 획득하고; (b) 시작 이소프렌 조성물을 이소아밀렌 (예로, 2-메틸부트-1-엔, 3-메틸부트-1-엔 및 2-메틸부트-2-엔)으로 부분적으로 수소화하고; (c) 이소아밀렌을 알코올 및 촉매와 접촉시켜서 산화물을 형성하고; (d) 이소아밀렌 산화물로부터 연료 성분을 생산하는 것:을 포함한다. 일정 바람직한 구현예에서, 매우 순수한 이소프렌은 바이오이소프렌 조성물이다. 일정 구현예에서, 이소아밀렌은 에탄올과 접촉시키고 형성된 연료 산화물은 TAME과 같은 에테르이다.
일정 구현예에서, 본 명세서에서 기술된 방법이라면 모두는 좀 더 나아가 화학적 변환 이전에 시작 이소프렌 조성물을 정제하는 것을 포함한다. 예를 들어, 본 명세서에서 기술된 조성물 및 방법을 사용하여 생산된 이소프렌은 표준 기법을 사용하여 정제될 수 있다. 정제는 이소프렌을 생산할 때 존재하는 하나 이상의 성분으로부터 이소프렌이 분리되는 과정을 말한다. 일정 구현예에서, 이소프렌은 실질적으로 순수한 액체로서 획득된다. 정제 방법의 예로는 (i) 액체 추출물 (extractant)로 있는 용액으로부터 증류 및 (ii) 크로마토그래피를 포함한다. 본 명세서에서 사용되는 바, "정제된 이소프렌 (purified isoprene)"은 이소프렌을 생산할 때 존재하는 하나 이상의 성분으로부터 분리되었던 이소프렌을 의미한다. 일정 구현예에서, 이소프렌은 무게로 이소프렌을 생산할 때 존재하는 하나 이상의 성분으로부터 떨어져 나온 것의 적어도 약 20%이다. 다양한 구현예에서, 이소프렌은 무게로 순수한 것의 적어도 또는 약 25%, 30%, 40%, 50%, 60%, 70%, 75%, 80%, 90%, 95%, 또는 99%이다. 정제도는 적절한 방법이라면 모두, 예로 컬럼 크로마토그래피, HPLC 또는 GC-MS 분석법에 의해 분석될 수 있다. 일정 구현예에서, 바이오이소프렌은 탈착 및 농축이 이어지는 활성 탄소의 초기 흡착에 의해 발효 배출-기체로부터 회수되어 연료 성분으로 화학적 변환을 위한 액체 이소프렌 조성물을 준다.
연료를 생산하는 연속식 공정
본 발명은 또한 (a) 시판되는 유리한 양의 매우 순수한 이소프렌을 연속적으로 생산하고; 또한 (b) 시판되는 유리한 양의 매우 순수한 이소프렌의 적어도 일부분을 연료 성분으로 연속적으로 변환하는 것:을 포함하는 이소프렌으로부터 연료 성분을 생산하는 연속적인 방법이 제공된다. 본 발명에 따른 연속식 공정에서, 매우 순수한 이소프렌의 수증기는 예를 들어 생물학적 공정 (예로, 이소프렌을 생산하는 세포를 배양하는 것)에 의해 연속적으로 생산되고 화학적 변환을 위해 반응기를 통과시킨다. 일정 구현예에서, 발효 배출-기체로부터 나온 이소프렌은 추출적 증류, 농축, 흡착 또는 연속적 정제 유닛을 사용하여 물 및 다른 영구적 기체 (예로, O2, N2 및 CO2)로부터 분리되고, 여기에서 산소 수준은 ppm 범위로 낮아지고 다른 우려되는 불순물은 제거되고; 이소프렌 증기는 불균질 촉매를 사용하여 이중체 (C10) 및 삼중체 (C15)로 촉매적으로 전환되고; 원하는 산물은 분리되고 미반응된 (unreacted) 이소프렌은 심화된 전환을 위해 반응기로 돌아간다. 일정 구현예에서, 촉매적 이중합은 기체 상에서 바람직한 C10 탄화수소의 수준을 측정하여 감시된다.
일정 구현예에서, 생물학적으로 생산된 이소프렌의 수증기는 약 100℃ 내지 약 300℃의 온도에서 유지되는 화학적 반응기 (예로, 반응 튜브)를 관통하고, 여기에서 생물학적으로 생산된 이소프렌은 이중합 반응을 거친다. 한 가지 구현예에서, 이소프렌 이중체는 산물 스트림으로부터 분리되고 미반응된 이소프렌의 적어도 일부분은 화학적 반응기 내로 다시 재순환된다. 한 가지 다양성에서, 생산된 불포화된 이소프렌 이중체는 두 번째 화학적 반응기에서 수소화 촉매 및 수소원과 접촉되어 부분적으로 수소화된 및/또는 전부 수소화된 산물을 생산한다. 본 공정은 좀 더 나아가 이소프렌을 생산하는 생물-반응기의 배출-기체로부터 이소프렌을 회수하는 단계를 포함할 수 있다.
일정 구현예에서, 공동-생산된 수소를 포함하는 바이오이소프렌의 스트림은 먼저 수소 기체로부터 분리되고, 바이오이소프렌의 스트림은 약 100℃ 내지 약 300℃의 온도에서 유지되는 화학적 반응기 (예로, 반응 튜브)를 관통하고, 여기에서 생물학적으로 생산된 이소프렌은 이중합 반응을 거친다. 한 가지 다양성에서, 이소프렌 이중체는 산물 스트림으로부터 분리되고 미반응된 이소프렌의 적어도 일부분은 화학적 반응기 내로 다시 재순환된다. 한 가지 구현예에서, 생산된 불포화된 이소프렌 이중체는 두 번째 화학적 반응기에서 수소화 촉매 및 수소원과 접촉되어 부분적으로 수소화된 및/또는 전부 수소화된 산물을 생산한다. 한 가지 다양성에서, 이소프렌-수소 공동-생산으로부터 분리된 수소 스트림은 수소화 단계에서 사용된다. 본 공정은 좀 더 나아가 이소프렌을 생산하는 생물-반응기의 배출-기체로부터 이소프렌을 회수하는 단계를 포함할 수 있다. 본 공정은 좀 더 나아가 냉동발생 농축 및 고체 매트릭스 흡착과 같은 당해 기술분야에서 알려져 있는 정제 방법을 사용하여 이소프렌-수소 공동-생산으로부터 분리된 수소 스트림을 정제하는 단계를 포함할 수 있다.
연료 산물로부터 디엔 및 중합체의 제거
연료 조성물은 시간 경과 시 검, 레진, 중합체 및 기타 다른 원치않는 부산물을 형성할 수 있는 불포화된 화합물 (올레핀, 디올레핀 및 폴리올레핀)을 종종 포함한다 (예를 들어, Pereira and Pasa (2006) Fuel, 85, 1860-1865 및 본 명세서에서 참고문헌들을 참조하라). 일반적으로, 주어진 화합물의 불포화도가 증가하면서, 화합물은 이러한 부산물을 형성하기가 더욱 쉽다. 이소프렌은 연료 조성물에 존재할 때 원치않는 중합 부산물을 바로 형성하는 1,3-디엔이다. 부산물 형성의 정도를 감소시킬 수 있는 연료 첨가제 (항-산화제, 라디칼 제거제 (radica quenchers) 등)가 존재하면서도, 이러한 부산물은 시간 경과시 여전히 형성될 수 있다. 올레핀도 역시 연료로부터 증발 시 대기 내로 방출될 때, 또는 올레핀-포함 연료의 불완전한 연소의 결과로서 기저 수준 (ground level) 오존의 형성에 기여할 수 있다.
따라서, 전적으로 또는 부분적으로 이소프렌으로부터 유래한 연료 조성물은 자유 이소프렌을 거의 또는 전혀 포함하지 않아야 한다. 여러 가지의 방법이 증류에 의한 정제, 에테르를 형성하는 알코올과의 반응 또는 이소프렌을 포화된 유도체로 전환하는 수소화와 같이 연료 조성물로부터 이소프렌을 제거하는 데 사용될 수 있다. 대안으로, 이소프렌은 원치않는 부산물의 형성에 기여하지 않는 불활성 부가물 (adducts)을 생산하는 말릭 안하이드라이드와 같은 디엔 친화기 (dienophile)로 처리될 수 있다.
실질적으로 이소프렌이 없는 이소프렌 유도체를 포함하는 연료 조성물이 제공된다. 일정 구현예에서, 연료 조성물은 0.01%, 0.1%, 1%, 2%, 3%, 4%, 5%, 10% 또는 15% 이하의 이소프렌을 포함한다. 또한 바이오이소프렌 조성물을 실질적으로 이소프렌이 없는 이소프렌 유도체를 포함하는 연료 조성물로 화학적으로 변환하는 방법이 제공된다. 일정 구현예에서, 바이오이소프렌 조성물로부터 나온 이소프렌의 실질적인 일부분이 연료 성분으로 전환된다. 일정 구현예에서, 바이오이소프렌 조성물로부터 나온 이소프렌의 실질적인 일부분이 좀 더 나아가 연료 성분을 생산하도록 전환될 수 있는 중간체로 전환된다. 일정 구현예에서, 바이오이소프렌 조성물로부터 나온 이소프렌의 실질적인 일부분이 이소프렌이 아닌 화합물로 전환된다. "실질적인 일부분 (substantial portion)"은 99.99%, 99.9%, 99%, 98%, 97%, 96%, 95%, 90%, 85% 또는 80%이다.
일정 경우에, 이소프렌 및 다른 결합된 디엔은 원하는 산물의 수율을 감소시키고 및/또는 촉매를 탈활성화할 수 있는 검-유사 경도 (gum-like consistency)를 가지는 중합 산물을 형성할 수 있다 (R.C.C. Pereira and V.M.D. Pasa. Fuel 85 (2006) 1860-1865). 일정 구현예에서, 산물 혼합물에 존재하는 결합된 디엔의 양을 결정하는 방법이 제공된다. 안드레이드 등은 존재하는 결합된 디엔의 양을 결정하는 다양한 방법들을 기술하고 있고, (D.F. Andrade et al., Fuel (2010), doi:10.106/j.fuel/2010.01.003) 다음을 포함한다: 1) 디엔과의 디엘-알더 반응에 의해 연소되는 말레익 안하이드라이드의 양이 측정되는 반-정량적 방법인 UOP-326 방법 (말레익 안하이드라이드 방법); 2) 편광 기록법 (polarography); 3) 디엔이 4-메틸-1,2,4-트리아졸린-3,5-디온 (MTAD) 또는 4-페닐-1,2,4-트리아졸린-3,5-디온 (PTAD)과 같은 유도체화 제제와 반응될 수 있는, 기체 크로마토그래피 (gas chromatography); 4) HPLC; 5) 초임계 유체 크로마토그래피 (supercritical fluid chromatography); 6) NMR; 7) UV 및 IR 근방 분광분석법 (spectroscopy); 또한 8) p-니트로벤젠디아조니움 플루오로보레이트 (p-nitrobenezenediazonium fluoroborate)로 디엔을 먼저 유도체화하는 것을 포함할 수 있는 다른 분광분석법들.
본 명세서에서는 검-형성을 최소화하고 및/또는 생산되었던 검의 양을 감소시키는 방법이 제공된다. 일정 구현예에서, 항-산화제는 검-형성을 최소화하는 데 사용된다. 일정 구현예에서, 중합 부산물은 공정 스트림으로 다시 재순환된다. 일정 구현예에서, 중합 부산물의 탈중합 (depolymerization)이 올레핀 상호교환 (metathesis)에 의해 수행된다. 올레핀 상호교환은 2,6-디이소프로필페닐이미도 네오필리덴 몰리브덴 비스(2-터르부틸페녹사이드)(2,6-diisopropylphenylimido neophylidene molybdenum bis(2-tertbutylphenoxide))와 같은 몰리브덴 또는 텅스텐 촉매를 사용하여 수행될 수 있다 (미국 특허 제 US 5,446,102호를 참조하라).
일정 구현예에서, 본 명세서에서 기술된 방법이라면 모두는 좀 더 나아가 이들 반응의 산물을 특성 분석하고 잠재적인 연료값을 평가하는 것을 포함한다. 예를 들어, 산물은 당해 기술분야에 알려져 있는 표준 방법, 예로 GC/MS, NMR, UV-Vis 및 IR 분광분석법, 비등점, 밀도 및 기타 물리적 성질에 의해 특성 분석된다. 산물은 좀 더 나아가 이중적 탄소-동위원소 지문분석법 (dual carbon-isotopic fingerprinting)에 의해 특성 분석될 수 있다 (미국 특허 제 US 7,169,588호를 참조하라). 산물의 잠재적인 연료값은 에너지 밀도, 가열값 (heating value), 물 용해도, 옥탄/세탄 수, 밀도, 점도, 표면 장력, 증발 엔탈피, 증기 분산도 (vapor diffusivity), 점화점, 자가점화점 (autoignition point), 발화도 한계, 구름점 (cloud point) 및 화학적 안정도와 같은 연료 성질을 측정을 측정하는 변수에 의해 평가된다.
시판되는 석유 연료들과 마찬가지로, 바이오이소퓨얼TM (BioIsoFuelTM) 산물은 그들의 산성도, 밀도, 미량 무기질 함량, 벤젠, 전체 방향족 물질 함량, 물 함량 및 부식성 (corrosivity)에 대해 테스트될 수 있다. 바이오이소퓨얼TM에 있는 소수의 불순물이 그들의 물질 특성에 나쁜 영향을 주는지 확인하기 위하여, 시료도 또한 부식성을 위한 물과 구리 스트립에 대한 칼 피셔 (Karl Fischer)와 같은 표준 ASTM 테스트에 의해 그들의 부식성 및 연료 시스템과의 양립성에 대해 테스트될 수 있다.
연료 조성물
본 발명은 본 명세서에서 기술된 방법 및 공정이라면 모두에 의해 생산된 연료 성분을 포함하는 연료 조성물을 제공한다. 일정 구현예에서, 연료 성분은 이소프렌 및 이소프렌의 산화된 유도체로부터 유래한 포화된 C10 및 C15 탄화수소로 이루어진 그룹으로부터 선택되는 하나 이상의 탄화수소를 포함한다. 탄화수소 바이오이소퓨얼TM 산물은 석유 가솔린 및 디젤과 완전하게 양립가능할 것으로 기대된다. 시판되는 석유 연료와 바이오이소퓨얼TM의 혼합물은 그들이 산, 황, 방향족 물질, 또는 기타 다른 원치않는 분순물을 포함하지 않기 때문에 더욱 바람직한 특성을 가질 것으로 기대된다.
일정 바람직한 구현예에서, 연료 성분은 바이오이소프렌의 유도체를 포함한다. 재생가능한, 비-석유화학 기초한 자원으로부터 만들어진 바이오이소프렌으로부터 유래한 연료에 대한 중대한 필요성이 있을 것으로 예상된다. 산업적 고객 및 소비자는 석유화학적 공정으로부터 유래한 이소프렌으로 만들어진 것보다 이러한 환경 친화적인 출처로부터 유래한 연료 성분을 구입하도록 바랄 것으로 여겨진다. 좀 더 나아가 고객은 재생가능한 자원으로 만들어진 이러한 환경 친화적인 산물을 위해 추가 비용을 기꺼이 지불할 것으로 여겨진다. 본 명세서에서 기술된 바이오이소프렌 조성물로부터 유래한 연료 성분은 비-석유화학 기초한 자원으로부터 유래한 것을 입증하는 유익을 제시한다.
일정 구현예에서, 연료 성분은 1,2-비스(이소프로필)사이클로부탄, 1,2-비스(이소프로필)사이클로부탄, 1-메틸-4-이소프로필사이클로헥산, 1-메틸-3-이소프로필사이클로헥산, 1-에틸-1,4-디메틸사이클로헥산, 1-에틸-1,3-디메틸사이클로헥산, 1,5-디메틸사이클로옥탄 및 1,4-디메틸사이클로옥탄과 같은 하나 이상의 포화된 고리형 C10 탄화수소를 포함한다. 일정 구현예에서, 연료 성분은 1,5,9-트리메틸사이클로도데칸 및 1,5,10-트리메틸사이클로도데칸과 같은 하나 이상의 포화된 고리형 C15 탄화수소를 포함한다. 일정 구현예에서, 연료 성분은 2,6-디메틸옥탄, 2,7-디메틸옥탄 및 3,6-디메틸옥탄과 같은 하나 이상의 포화된 지방족 C10 탄화수소를 포함한다. 일정 구현예에서, 연료 성분은 2,6,10-트리메틸도데칸, 2,7,10-트리메틸도데칸 및 3,7,10-트리메틸도데칸과 같은 하나 이상의 포화된 지방족 C15 탄화수소를 포함한다. 일정 구현예에서, 연료 성분은 2-메틸부탄을 포함한다. 일정 구현예에서, 연료 성분은 1,2-비스(이소프로필)사이클로부탄, 1,2-비스(이소프로필)사이클로부탄, 1-메틸-4-이소프로필사이클로헥산, 1-메틸-3-이소프로필사이클로헥산, 1-에틸-1,4-디메틸사이클로헥산, 1-에틸-1,3-디메틸사이클로헥산, 1,5-디메틸사이클로옥탄, 1,4-디메틸사이클로옥탄, 1,5,9-트리메틸사이클로도데칸, 1,5,10-트리메틸사이클로도데칸, 1,6-디메틸옥탄, 2,7-디메틸옥탄, 3,6-디메틸옥탄, 2,6,10-트리메틸도데칸, 2,7,10-트리메틸도데칸, 3,7,10-트리메틸도데칸 및 2-메틸부탄으로 이루어진 그룹으로부터 선택되는 하나 이상의 탄화수소를 포함한다.
일정 구현예에서, 연료 성분은 C5 알코올 및 디올 (예로, 3-메틸-부탄-1-올, 2-메틸-부탄-1-올 및 2-메틸-부탄-2-올, 3-메틸-부탄-1,3-디올 및 2-메틸-부탄-2,3-디올), C-10 알코올 및 디올 (예로, 3,7-디메틸옥탄-1-올, 2,7-디메틸옥탄-1-올, 2,7-디메틸옥탄-2-올, 2,7-디메틸옥탄-2,7-디올), 및 고리형 C-10 알코올 (예로, 2-(4-메틸사이클로헥실)프로판-2-올, 2-(4-메틸사이클로헥실)프로판-1-올, 2-(1,4-메틸사이클로헥실)에탄올 및 4-에틸-1,4-디메틸사이클로헥산올)과 같은 하나 이상의 포화된 수산화물을 포함한다. 일정 구현예에서, 연료 성분은 1,3-디에톡시-3-메틸부탄, 1-에톡시-3-메틸부탄, 1-메톡시-2,7-디메틸옥탄 및 3-메톡시-2,7-디메틸옥탄과 같은 하나 이상의 포화된 에테르를 포함한다. 일정 구현예에서, 연료 성분은 3-메틸-부탄-1-올, 2-메틸-부탄-1-올, 2-메틸-부탄-2-올, 3-메틸-부탄-1,3-디올, 2-메틸-부탄-2,3-디올, 3,7-디메틸옥탄-1-올, 2,7-디메틸옥탄-1-올, 2,7-디메틸옥탄-2-올, 2,7-디메틸옥탄-2,7-디올, 2-(4-메틸사이클로헥실)프로판-2-올, 2-(4-메틸사이클로헥실)프로판-1-올, 2-(1,4-메틸사이클로헥실)에탄올, 4-에틸-1,4-디메틸사이클로헥산올, 1,3-디에톡시-3-메틸부탄, 1-에톡시-3-메틸부탄, 1-메톡시-2,7-디메틸옥탄 및 3-메톡시-2,7-디메틸옥탄으로 이루어진 그룹으로부터 선택되는 하나 이상의 이소프렌 유래한 산화물을 포함한다.
일정 구현예에서, 연료 성분은 본 명세서에서 기술된 방법 및 공정이라면 모두에 따른 단계를 거친 이후에 이소프렌이 아닌 C5 탄화수소로부터 나온 약 0.5 μg/L 이하 산물을 포함한다. 한 가지 구현예에서, 연료 성분은 본 명세서에서 기술된 방법 및 공정이라면 모두에 따른 단계를 거친 이후에 이소프렌이 아닌 C5 탄화수소로부터 나온 산물이 실질적으로 없다. 일정 구현예에서, 연료 성분은 시작 조성물에 있는 모든 C5 탄화수소의 전체 무게에 대비한 무게로 0.2, 0.12, 0.10, 0.08, 0.06, 0.04, 0.02, 0.01, 0.005, 0.001, 0.0005, 0.0001, 0.00005, 또는 0.00001% 이하의 이소프렌이 아닌 C5 탄화수소 (1,3-사이클로펜타디엔, 시스-1,3-펜타디엔, 트랜스-1,3-펜타디엔, 1,4-펜타디엔, 1-펜틴, 2-펜틴, 1-펜텐, 2-메틸-1-부텐, 3-메틸-1-부틴, 펜트-4-엔-1-인, 트랜스-펜트-3-엔-1-인, 또는 시스-펜트-3-엔-1-인과 같음)를 포함한다. 일정 구현예에서, 연료 성분은 이소프렌이 아닌 C5 탄화수소 (1,3-사이클로펜타디엔, 시스-1,3-펜타디엔, 트랜스-1,3-펜타디엔, 1,4-펜타디엔, 1-펜틴, 2-펜틴, 1-펜텐, 2-메틸-1-부텐, 3-메틸-1-부틴, 펜트-4-엔-1-인, 트랜스-펜트-3-엔-1-인, 또는 시스-펜트-3-엔-1-인과 같음)를 100, 10, 1, 0.1 또는 0.01 ppm 이하의 농도로 포함한다.
본 명세서에서 기술된 바이오이소프렌 조성물에서 이소프렌이 아닌 성분은 본 명세서에서 기술된 다양한 공정을 거친 이후에 서로 다른 산물로 전환될 것이다. 본 방법/공정에 사용되는 금속-기초 촉매의 이소프렌이 아닌 성분에 대한 민감도는 이들 성분의 성질 및 수준에 의존하여 서로 달라진다. 열적 이중합 공정의 경우, 보다 더 넓은 범위의 화합물을 인내할 수 있다. 일정 경우에, 이소프렌이 아닌 성분은 이소프렌과 반응하여 부가물을 생산하고, 예를 들어 이소프렌과의 메타크롤레인 및 메틸 비닐 케톤의 디엘-알더 반응은 6개-구성원으로 된 산물을 준다. 불포화된 부가물은 좀 더 나아가 연료 성분 및 조성물에 존재하는 포화된 유도체, 예로 1,4-디메틸-1-(하이드록시메틸)사이클로헥산 및 1-(1-하이드록시에틸)-4-메틸사이클로헥산으로 수소화될 수 있다 (화학식 XV를 참조하라).
화학식 XV
일정 구현예에서, 연료 성분은 본 명세서에서 기술된 방법 및 공정이라면 모두에 따른 단계를 거친 이후에 에탄올, 아세톤, C5 프레닐 아코올, 및 10개 이상의 탄소 원자를 가지는 이소프레노이드 화합물로 이루어진 그룹으로부터 선택되는 화합물로부터 나온 산물을 포함한다. 일정 구현예에서, 연료 성분은 본 명세서에서 기술된 방법 및 공정이라면 모두에 따른 단계를 거친 이후에 에탄올, 아세톤, 메탄올, 아세트알데하이드, 메타크롤레인, 메틸 비닐 케톤, 2-메틸-2-비닐옥시란, 시스- 및 트랜스-3-메틸-1,3-펜타디엔, C5 프레닐 알코올 (3-메틸-3-부텐-1-올 또는 3-메틸-2-부텐-1-올과 같음), 2-헵탄온, 6-메틸-5-헵텐-2-온, 2,4,5-트리메틸피리딘, 2,3,5-트리메틸피라진, 시트로넬랄, 메탄티올, 메틸 아세테이트, 1-프로판올, 디아세틸, 2-부탄온, 2-메틸-3-부텐-2-올, 에틸 아세테이트, 2-메틸-1-프로판올, 3-메틸-1-부탄알, 3-메틸-2-부탄온, 1-부탄올, 2-펜탄온, 3-메틸-1-부탄올, 에틸 부틸레이트, 3-메틸-2-부텐알, 부틸 아세테이트, 3-메틸부틸 아세테이트, 3-메틸-3-부텐-1-일 아세테이트, 3-메틸-2-부텐-1-일 아세테이트, 3-헥센-1-올, 3-헥센-1-일 아세테이트, 리모넨, 게라니올 (트랜스-3,7-디메틸-2,6-옥타디엔-1-올), 시트로넬롤 (3,7-디메틸-6-옥텐-1-올), (E)-3,7-디메틸-1,3,6-옥타트리엔, (Z)-3,7-디메틸-1,3,6-옥타트리엔, 및 2,3-사이클로헵텐올피리딘으로 이루어진 그룹으로부터 선택되는 하나 이상의 화합물로부터 나온 하나 이상의 산물을 포함한다. 일정 구현예에서, 연료 성분은 1,4-디메틸-1-(하이드록시메틸)사이클로헥산, 1-(1-하이드록시에틸)-4-메틸사이클로헥산, 2-메틸부탄, 3-메틸펜탄, 2-프로판올, 2-메틸-1-프로판올, 2-부탄올, 3-메틸-1-부탄올, 에틸 아세테이트 및 3-메틸-1-부틸 아세테이트로 이루어진 그룹으로부터 선택되는 하나 이상의 화합물을 포함한다. 일정 구현예에서, 연료 성분은 1,4-디메틸-1-(하이드록시메틸)사이클로헥산, 1-(1-하이드록시에틸)-4-메틸사이클로헥산, 2-메틸부탄, 3-메틸펜탄, 2-프로판올, 2-메틸-1-프로판올, 2-부탄올, 3-메틸-1-부탄올, 에틸 아세테이트 및 3-메틸-1-부틸 아세테이트로 이루어진 그룹으로부터 선택되는 하나 이상의 화합물을 약 10 ppm, 1 ppm, 100 ppb 또는 1 ppb 이상의 수준으로 포함한다.
일정 구현예에서, 연료 성분은 에탄올, 아세톤, 메탄올, 아세트알데하이드, 메타크롤레인, 메틸 비닐 케톤, 2-메틸-2-비닐옥시란, 시스- 및 트랜스-3-메틸-1,3-펜타디엔, C5 프레닐 알코올 (3-메틸-3-부텐-1-올 또는 3-메틸-2-부텐-1-올과 같음), 2-헵탄온, 6-메틸-5-헵텐-2-온, 2,4,5-트리메틸피리딘, 2,3,5-트리메틸피라진, 시트로넬랄, 메탄티올, 메틸 아세테이트, 1-프로판올, 디아세틸, 2-부탄온, 2-메틸-3-부텐-2-올, 에틸 아세테이트, 2-메틸-1-프로판올, 3-메틸-1-부탄알, 3-메틸-2-부탄온, 1-부탄올, 2-펜탄온, 3-메틸-1-부탄올, 에틸 부틸레이트, 3-메틸-2-부텐알, 부틸 아세테이트, 3-메틸부틸 아세테이트, 3-메틸-3-부텐-1-일 아세테이트, 3-메틸-2-부텐-1-일 아세테이트, 3-헥센-1-올, 3-헥센-1-일 아세테이트, 리모넨, 게라니올 (트랜스-3,7-디메틸-2,6-옥타디엔-1-올), 시트로넬롤 (3,7-디메틸-6-옥텐-1-올), (E)-3,7-디메틸-1,3,6-옥타트리엔, (Z)-3,7-디메틸-1,3,6-옥타트리엔, 및 2,3-사이클로헵텐올피리딘으로 이루어진 그룹으로부터 선택되는 하나 이상의 화합물을 약 10 ppm, 1 ppm, 100 ppb 또는 1 ppb 이상의 수준으로 포함한다.
탄소 지문분석법
바이오이소프렌으로부터 유래한 바이오이소퓨얼은 이중적 탄소-동위원소 지문분석법을 기초로 하여 석유화학적 탄소로부터 유래한 연료와 구별될 수 있다. 추가적으로, 생물로부터 나온 (biosourced) 탄소의 특정한 출처 (예로, 포도당 대비 글리세롤)는 이중적 탄소-동위원소 지문분석법에 의해 결정될 수 있다 (미국 특허 제 7,169,588호를 참조하고, 이는 본 명세서에서 참고문헌으로 통합되어 있다).
본 방법은 유용하게도 화학적으로-일치하는 물질을 구별하고, 생물환경적 (식물) 성분의 성장원 (source of growth) (및 가능하게는 햇수)에 의해 산물에서 탄소를 배분한다. 동위원소 14C 및 13C는 이 문제에 대한 보완적인 정보를 가져온다. 5730년의 핵 반감기를 가지는 방사성탄소 연대측정 동위원소 (radiocarbon dating isotope, 14C)는 화석 ("죽은") 및 생물환경적 ("살아있는") 공급원료 간 표본 탄소를 배분하도록 허용한다 [Currie, L. A. "대기 입자의 출처 분배 (Source Apportionment of Atmospheric Particles)," 환경적 입자의 특성분석 (Characterization of Environmental Particles), J. Buffle and H. P. van Leeuwen, IUPAC 환경 분석 화학 시리즈 (Environmental Analytical Chemistry Series)의 초판 제 1권 (루이스 출판사) (1992) 3 74]. 방사성탄소 연대측정에서 기본 가정은 대기에서 14C 농도의 항존도 (constancy)는 살아있는 생물에서 14C 의 항존도를 유도한다. 분리된 시료를 다룰 때, 시료의 연대는 t = (-5730/0.693)ln(A/AO) (공식 14) 관련성에 의해 대략적으로 추론될 수 있고, 여기에서 t = 연대, 5730 년은 방사성탄소의 반감기이고, A 및 AO 는 각각 시료 및 표준 모뎀의 특이적 14C 활성이다 [Hsieh, Y., Soil Sci. Soc. Am J., 56, 460, (1992)]. 그러나 1950년 이래 대기의 핵 실험 및 1850 이래 화석 연료의 연소 때문에, 14C는 두 번째 지질화학적 시간 특징을 획득하게 되었다. 대기적 CO2에서의 - 또한 살아있는 생물환경 (biosphere)에서 - 그의 농도는 1960년대 중반에 핵 실험의 피크 시기에 대략적으로 두 배가 되었다. 이것은 그 이래로 약 1.2 x 1012의 안정기 우주생성 (cosmogenic) (대기적) 지저선 동위원소 비율 (14C/12C)로 점차 회귀되어 왔으며 7 - 10 년의 대략적 완화 "반감기"를 가진다. (본 후자의 반감기는 문자 그대로 고려되어서는 안되고; 오히려 핵 나이의 시작 이후에 상세한 대기의 핵 유입/붕괴 함수를 사용하여 대기적 및 생물환경적 14C의 다양성을 추적해야 한다.) 이것은 최근의 생물환경적 탄소의 매년 연대측정의 전망을 후퇴시키는 이러한 후자의 생물환경적 14C 시간의 특징이다. 14C는 "모뎀 탄소의 분획 (fraction of modem carbon)" (fM)의 단위로 주어지는 결과를 가지고 가속기 질량 분광분석법 (accelerator mass spectrometry, AMS)에 의해 측정될 수 있다. fM 은 옥살산 표준 HOxI 및 HOxII으로서 알려져 있는 국립표준기술연구소 (National Institute of Standards and Technology, NIST) 표준 기준 물질 (Standard Reference Materials, SRMs) 4990B 및 4990C에 의해 각각 정의된다. 기본적인 정의는 14C/12C 동위원소 비율 HOxI (AD 1950 기준) 곱하기 0.95에 관한 것이다. 이것은 대략적으로 붕괴-교정된 산업혁명 이전의 나무와 동등하다. 현재 살아있는 생물환경 (식물 물질)의 경우 fM 1.1이다.
안정한 탄소 동위원소 비율 (13C/12C)은 출처 구분 및 배분에 보완적인 경로를 제공한다. 주어진 생물출처의 물질에서 14C/12C 비율은 이산화탄소가 고정된 시기에 대기적 이산화탄소에 있는 14C/12C 비율의 결과이고 대사 과정도 역시 반영하고 있다. 지역적인 다양성도 또한 발생한다. 석유, C3 식물 (잎이 넓음), C4 식물 (초목), 및 해양 카보네이트는 모두 14C/12C 및 이에 해당하는 δ13C에서 유의한 차이를 보여준다. 또한, C3 및 C4 식물의 지질 물질은 대사 과정의 결과로서 동일한 식물의 탄수화물 성분으로부터 유래한 물질과는 다르게 분석하고 있다. 측정의 정확성 범위 이내에서, 13C는 동위원소 분획 효과로 인해 큰 다양성을 보여주고 있으며 본 발명의 경우에 이들 중 가장 중요한 것은 광합성 기작이다. 식물에서 탄소 동위원소에서 차이의 주요한 원인은 식물에서 광합성적 탄소 대사의 경로에서, 상세하게는 일차적인 카복시화 예로 대기적 CO2의 초기 고정 과정 동안 발생하는 반응에서 차이와 밀접하게 연관되어 있다. 증식 (vegetation)의 두 가지 큰 부류는 "C3" (또는 칼빈-벤슨 (Calvin-Benson)) 광합성 순환을 사용하는 것 및 "C4" (또는 해치-슬랙 (Hatch-Slack)) 광합성 순환을 사용하는 것이다. 단단한 나무 및 칩엽수와 같은 C3 식물은 적당한 기후 지역에 우세하다. C3 식물에서, 일차적인 CO2 고정 및 카복시화 반응에는 효소 리불로스-1,5-디포스페이트 카복시화제 (ribulose-1,5-diphosphate carboxylase)가 관여하고 첫 번째 안정한 산물은 3개-탄소 화합물이다. 한편 C4 식물은 열대성 초목, 옥수수 및 사탕수수와 같은 식물을 포함한다. C4 식물에서, 또 다른 효소 포스페놀-피루베이트 카복시화제 (phosphoenol-pyruvate carboxylase)가 관여하는 추가적인 카복시화 반응은 일차적인 카복시화 반응이다. 첫 번째 안정한 탄소 화합물은 연속적으로 탈카복시화되는 4개-탄소산이다. 따라서 방출되는 CO2는 C3 순환에 의해 재고정된다.
C4 및 C3 식물은 13C/12C 동위원소 비율의 범위를 나타내지만, 전형적인 값은 밀리그램 당 약 -10 내지 -14 (C4) 및 밀리그램 당 -21 to -26 (C3)이다 [Weber et al., J. Agric. Food Chem., 45, 2942 (1997)]. 석탄과 석유는 일반적으로 본 후자의 범위에 속한다. 13C 측정 척도 (scale)는 원래 피디 전석 (pee dee belemnite, PDB) 석회암에 의한 영점 설정 (zero set)에 의해 원래 정의되었고, 여기에서 수치는 본 물질로부터 일천 오차 (thousand deviations) 당 부분으로 주어진다. "δ13C" 값은 (밀리그램 당) 일천 당 부분, 약어로는 ‰이며, 다음의 (공식 15)과 같이 계산된다:
(공식 15)
PDB 기준 물질 (RM)이 소진된 이후에도, 대안의 RMs이 IAEA, USGS, NIST 및 기타 선택된 국제 동위원소 연구소들과 협력하여 개발되어 왔다. PDB로부터 밀리그램 당 오차에 대한 표시는 δ13C이다. 측정은 질량 44, 45 및 46의 분자적 이온 상에서 고성능 안정한 비율 질량 분광분석법 (IRMS)에 의해 시행된다.
석유 정련으로부터 나온 C5 스트림의 추출적 증류로부터 유래한 이소프렌의 경우, δ13C가 약 -22‰ 내지 약 -24‰이다. 본 범위는 석유로부터 유래한 가볍고 불포화된 탄화수소에 전형적이고 석유-기초 이소프렌으로부터 유래한 산물은 전형적으로 동일한 δ13C를 가진 이소프렌 단위를 포함한다. 최소량의 다른 탄소-포함 영양분 (예로, 효모 추출물)을 가지는 옥수수-유래 포도당 (δ13C - 10.73‰)의 발효에 의해 생산된 바이오이소프렌은 δ13C - 14.66‰ 내지 -14.85‰를 가진 폴리이소프렌으로 다중합될 수 있는 이소프렌을 생산한다. 이러한 이소프렌으로부터 생산되는 산물은 석유-기초 이소프렌으로부터 유래한 것보다 더 음성인 δ13C 값을 가질 것으로 예상된다. 이소프렌의 포름알데하이드와 반응으로부터 유래한 이소프렌의 경우, δ13C 값은 포름알데하이드가 종종 보다 더 음성인 δ13C 값을 가진 공급원료로부터 유래하기 때문에 약 -34.4‰이 될 수 있다.
생물-재생가능한 탄소원을 사용하는 세포 배양으로부터 나온 이소프렌으로 만들어지는 본 발명의 연료 및 연료 성분은 그들의 δ13C 값 및 기타 다른 특징에 의해 마찬가지로 확인될 수 있다. 일정 구현예에서, 바이오이소프렌으로부터 유래한 연료 성분은 -22‰ 이상의 (덜 음성인) δ13C 값을 가진다. 일정 구현예에서, 바이오이소프렌으로부터 유래한 연료 성분은 -20, -18, -16, -14, -12, 또는 -10‰ 이상의 δ13C 값을 가진다. 일정 구현예에서, 바이오이소프렌으로부터 유래한 연료 성분은 -22 내지 -10, -21 내지 -12, 또는 -20 내지 -14‰의 범위 이내에 있는 δ13C 값을 가진다. 일정 구현예에서, 바이오이소프렌으로부터 유래한 연료 성분은 -34 내지 -24, -34 내지 -25, -33 내지 -25, -32 내지 -24, -32 내지 -25, -31 내지 -25, -30 내지 -29, -30.0 내지 -29.5, -29.5 내지 -28.5, 또는 -29.0 내지 -28.5‰의 범위 이내에 있는 δ13C 값을 가진다.
일정 구현예에서, 바이오이소프렌으로부터 유래한 연료 성분은 방사성 탄소-14를 포함한다. 일정 구현예에서, 14C/12C 비율은 약 1.0 x 10-12, 1.05 x 10-12, 1.1 x 10-12, 1.15 x 10-12,또는 1.2 x 10-12 이상이다. 일정 구현예에서, 바이오이소프렌으로부터 유래한 연료 성분은 약 0.9, 0.95, 1.0, 1.05 또는 1.1 이상의 fM 값을 가진다. 일정 구현예에서, 바이오이소프렌으로부터 유래한 연료 성분은 약 0.9, 0.95, 1.0, 1.05 또는 1.1 이상의 fM 값을 가지고, -22‰ 이상의 (덜 음성인) δ13C 값을 가진다. 일정 구현예에서, 바이오이소프렌으로부터 유래한 연료 성분은 약 0.9, 0.95, 1.0, 1.05 또는 1.1 이상의 fM 값 및 -22‰ 이상의 (덜 음성인) δ13C 값을 가진다. 일정 구현예에서, 바이오이소프렌으로부터 유래한 연료 성분은 약 0.9, 0.95, 1.0, 1.05 또는 1.1 이상의 fM 값, 또한 -22 내지 -10, -21 내지 -12, 또는 -20 내지 -14‰의 범위 이내에 있는 δ13C 값을 가진다. 일정 구현예에서, 바이오이소프렌으로부터 유래한 연료 성분은 약 0.9, 0.95, 1.0, 1.05 또는 1.1 이상의 fM 값, 또한 -34 내지 -24, -34 내지 -25, -33 내지 -25, -32 내지 -24, -32 내지 -25, -31 내지 -25, -30 내지 -29, -30.0 내지 -29.5, -29.5 내지 -28.5, 또는 -29.0 내지 -28.5‰의 범위 이내에 있는 δ13C 값을 가진다.
바이오이소프렌 유도체 및 관련된 바이오이소퓨얼, 중간체 및 혼합물은 14C (fM) 및 이중적 탄소-동위원소 지문분석법을 기초로 하여 그들의 석유화학적 유래의 물질과는 완벽하게 구별될 수 있고, 물질의 새로운 조성을 표시하고 있다.
일정 구현예에서, 본 발명의 연료 성분은 에탄올의 것보다 높은 에너지 밀도를 가진다. 일정 구현예에서, 연료 성분은 연료, 예로 석유-기초 연료의 세탄 수를 변화시킨다 (boost). 일정 구현예에서, 연료 성분은 석유 기초한 연료의 방출을 감소시킨다. 일정 구현예에서, 연료 성분은 약 80 내지 약 120 사이의 범위에 있는 옥탄 수를 가진다. 일정 구현예에서, 연료 성분은 약 30 내지 약 130 사이의 범위에 있는 세탄 수를 가진다.
일정 구현예에서, 본 발명의 연료 조성물은 하나 이상의 디메틸사이클로옥탄 화합물을 포함한다. 일정 구현예에서, 본 발명의 연료 조성물은 치환된 사이클로헥산과 같은 하나 이상의 C10 탄화수소를 포함한다. 일정 구현예에서, 본 발명의 연료 조성물은 본 명세서에서 기술된 하나 이상의 이소프렌 유래한 산화물을 포함한다. 일정 구현예에서, 본 발명에서 기술된 연료 조성물이라면 모두는 좀 더 나아가 모든 연료 조성물의 전체 무게 또는 부피를 기초로 한 무게 또는 부피로 약 1%로부터 약 95%까지의 양으로 석유 기초한 연료를 포함한다.
본 발명은 좀 더 나아가 석유 증류물을 획득하고 본 발명의 연료 성분을 첨가하는 것을 포함하는 연료 조성물을 제조하는 방법을 제공한다.
본 발명은 다음의 실시예들을 참고하여 좀 더 이해될 수 있으며, 이는 설명하려고 제공된 것이고 제한하려는 것은 아니다.
도 1은 대장균 (E. coli)에서 발현을 위해 코돈-최적화된 쿠쥬 이소프렌 합성효소 (kudzu isoprene synthase) 유전자의 뉴클레오타이드 서열을 나타낸 것이다 (서열번호 1). atg 시작 코돈은 이탤릭체로 표시되고, 종결 코돈은 굵은 문자로 표시되며, 첨가된 PstI 부위는 밑줄로 표시된다.
도 2는 pTrcKudzu의 지도를 나타낸 것이다.
도 3A 내지 3C는 pTrcKudzu (서열번호 2)의 뉴클레오타이드 서열을 나타낸 것이다. RBS는 밑줄로 표시되고, 쿠쥬 이소프렌 합성효소의 시작 코돈은 굵은 대문자로 표시되며 종결 코돈도 굵은 대문자로 표시된다. 벡터 골격은 pTrcHis2B이다.
도 4는 pETNHisKudzu의 지도를 나타낸 것이다.
도 5A 내지 5C는 pETNHisKudzu의 뉴클레오타이드 서열 (서열번호 3)을 나타낸 것이다.
도 6은 pCL-lac-Kudzu의 지도를 나타낸 것이다.
도 7A 내지 7C는 pCL-lac-Kudzu의 뉴클레오타이드 서열 (서열번호 4)을 나타낸 것이다.
도 8A는 벡터가 없는 대장균 BL21 에서 이소프렌의 생산을 보여주는 그래프를 나타낸 것이다.
도 8B는 pCL-lac-Kudzu 를 사용하여 대장균 BL21 에서 이소프렌의 생산을 보여주는 그래프를 나타낸 것이다.
도 8C는 pTrcKudzu를 사용하여 대장균 BL21 에서 이소프렌의 생산을 보여주는 그래프를 나타낸 것이다.
도 8D는 pETN-HisKudzu 를 사용하여 대장균 BL21 에서 이소프렌의 생산을 보여주는 그래프를 나타낸 것이다.
도 9A 는 14 리터 사료첨가 회분식 발효 (fed batch fermentation)에서 대장균 BL21/pTrcKudzu 발효의 OD 오버타임을 보여주는 그래프를 나타낸 것이다.
도 9B는 14 리터 회분식 발효에서 대장균 BL21/pTrcKudzu 발효의 이소프렌 생산 오버타임을 보여주는 그래프를 나타낸 것이다.
도 10A는 판테오아 시트레아 (Panteoa citrea)에서 이소프렌의 생산을 보여주는 그래프를 나타낸 것이다. 대조군 세포는 재조합 쿠쥬 이소프렌 합성효소가 없음. 회색 다이아몬드는 이소프렌 합성효소를 나타내고, 검은색 네모는 OD600을 나타낸다.
도 10B 는 pCL-lac Kudzu를 발현하는 판테오아 시트레아에서 이소프렌의 생산을 보여주는 그래프를 나타낸 것이다. 회색 다이아몬드는 이소프렌 합성효소를 나타내고, 검은색 네모는 OD600을 나타낸다.
도 10C 는 pTrcKudzu 를 발현하는 판테오아 시트레아에서 이소프렌의 생산을 보여주는 그래프를 나타낸 것이다. 회색 다이아몬드는 이소프렌 합성효소를 나타내고, 검은색 네모는 OD600을 나타낸다.
도 11은 재조합 이소프렌 합성효소를 발현하는 바실러스 섭틸리스 (Bacillus subtilis)에서 이소프렌의 생산을 보여주는 그래프를 나타낸 것이다. BG3594comK 는 플라스미드 (천연 그대로의 이소프렌 생산)가 없는 B. 섭틸리스 균주이다. CF443 는 pBSKudzu (재조합 이소프렌 생산)을 가지는 B. 섭틸리스 균주 BG3594comK이다. Y-축 상의 IS는 이소프렌을 표시한다.
도 12A 내지 12C 는 pBS Kudzu #2의 뉴클레오타이드 서열 (서열번호 5)를 나타낸 것이다.
도 13은 야로위야 (Yarrowia)에서 발현을 위해 코돈-최적화된 쿠쥬 이소프렌 합성효소 유전자의 뉴클레오타이드 서열 (서열번호 6)을 나타낸 것이다.
도 14는야로위야에서 발현을 위해 코돈-최적화된 쿠쥬 이소프렌 합성효소 유전자를 포함하는 pTrex3g의 지도를 나타낸 것이다.
도 15A 내지 15C는 벡터pSPZ1(MAP29Spb)의 뉴클레오타이드 서열 (서열번호 7)을 나타낸 것이다.
도 16은 는야로위야에서 발현을 위해 코돈-최적화된 합성 쿠쥬 (푸에라리아 몬타나 (Pueraria montana)) 이소프렌 합성효소 유전자의 뉴클레오타이드 서열 (서열번호 8)을 나타낸 것이다.
도 17은 합성 하이브리드 포풀라 (포풀라 알바 (Populus alba) x 포풀라 트레물라 (Populus tremula)) 이소프렌 합성효소 유전자의 뉴클레오타이드 서열 (서열번호 9)을 나타낸 것이다. ATG 시작 코돈은 굵은 문자로 표시하고 종결 코돈은 밑줄로 표시한다.
도 18A (도 18A1 및 18A2)는 벡터 pYLA 1, pYL1 및 pYL2의 도식적 윤곽 제작 (서열번호 75, 73, 72, 71, 70, 69)을 나타낸 것이다.
도 18B는 벡터 pYLA(POP1)의 도식적 윤곽 제작을 나타낸 것이다.
도 18C는 벡터 pYLA(KZ1)의 도식적 윤곽 제작을 나타낸 것이다.
도 18D는 벡터 pYLI(KZ1)의 도식적 윤곽 제작을 나타낸 것이다.
도 18E는 벡터 pYLI(MAP29)의 도식적 윤곽 제작을 나타낸 것이다.
도 18F는 벡터 pYLA(MAP29)의 도식적 윤곽 제작을 나타낸 것이다.
도 19A는 이소프렌을 위한 MVA 및 DXP 대사 경로 (F. Bouvier et al., Progress in Lipid Res. 44: 357-429, 2005에 근거하고 있음)를 나타낸 것이다. 하기 기술내용은 경로에 있는 각 폴리펩타이드에 대한 대안의 명칭 및 표시된 폴리펩타이드의 활성을 측정하는 분석법을 기재하고 있는 참고문헌을 포함한다 (이들 참고문헌의 각각은 본 명서세에서 전부, 상세하게는 MVA 및 DXP 경로에서의 폴리펩타이드를 위한 폴리펩타이드 활성 분석법에 관하여 참고문헌으로 통합되어 있다). 메발로네이트 경로: AACT; 아세틸-CoA 아세틸전이효소 (MvaE), EC 2.3.1.9. 분석법: J. Bacteriol., 184: 2116-2122, 2002; HMGS; 하이드록시메틸글루타릴-CoA 합성효소, MvaS, EC 2.3.3.10. 분석법: J. Bacteriol., 184: 4065-4070, 2002; HMGR; 3-하이드록시-3-메틸글루타릴-CoA 환원효소, MvaE, EC 1.1.1.34. 분석법: J. Bacteriol., 184: 2116-2122, 2002; MVK; 메발로네이트 키나제, ERG12, EC 2.7.1.36. 분석법: Curr Genet 19:9-14, 1991. PMK; 포스포메발로네이트 키나제, ERG8, EC 2.7.4.2, 분석법: Mol Cell Biol., 11:620-631, 1991; DPMDC; 디포스포메발로네이트 탈탄산화효소, MVD1, EC 4.1.1.33. 분석법: Biochemistry, 33:13355-13362, 1994; IDI; 이소펜테닐-디포스페이트 델타-이소머라제, IDI1, EC 5.3.3.2. 분석법: J. Biol. Chem. 264:19169-19175, 1989. DXP Pathway: DXS; 1-디옥시자일루로스-5-포스페이트 합성효소, dxs, EC 2.2.1.7. 분석법: PNAS, 94:12857-62, 1997; DXR; 1-디옥시-D-자일루로스 5-포스페이트 환원이소머라제, dxr, EC 2.2.1.7. 분석법: Eur. J. Biochem. 269:4446-4457, 2002; MCT; 4-디포스포사이티딜-2C-메틸-에리트리톨 합성효소, IspD, EC 2.7.7.60. 분석법: PNAS, 97: 6451-6456, 2000; CMK; 4-디포스포사이티딜-2-C-메틸-D-에리트리톨 키나제, IspE, EC 2.7.1.148. 분석법: PNAS, 97:1062-1067, 2000; MCS; 2C-메틸-D-에리트리톨 2,4-사이클로디포스페이트 합성효소, IspF, EC 4.6.1.12. 분석법: PNAS, 96:11758-11763, 1999; HDS; 1-하이드록시-2-메틸-2-(E)-부테닐 4-디포스페이트 합성효소, ispG, EC 1.17.4.3. 분석법: J. Org. Chem., 70:9168-9174, 2005; HDR; 1-하이드록시-2-메틸-2-(E)-부테닐 4-디포스페이트 환원효소, IspH, EC 1.17.1.2. 분석법: JACS, 126:12847-12855, 2004.
도 19B는 고전적 및 변형된 MVA 경로를 나타낸 것이다. 1. 아세틸-CoA 아세틸전이효소 (AACT); 2, HMG-CoA 합성효소 (HMGS); 3, HMG-CoA 환원효소 (HMGR); 4, 메발로네이트 키나제 (MVK); 5, 포스포메발로네이트 키나제 (PMK); 6, 디메발로네이트 키나제 (MVD 또는 DPMDC); 7, 이소펜테닐 디포스페이트 이소머라제 (IDI); 8, 포스포메발로네이트 탈탄산화효소 (PMDC); 9, 이소펜테닐 포스페이트 키나제 (IPK). 고전적 MVA 경로는 반응 1로부터 반응 5 및 반응 6을 통해 반응 7까지 진행되는 한편, 변형된 MVA 경로는 반응 8 및 반응 9를 통과한다. 구조 화학식에서 P 및 PP는 각각 포스페이트 및 피로포스페이트이다. 본 도면은 고가 및 모리 문헌 Koga and Morii, Microbiology and Mol. Biology Reviews, 71:97-120, 2007으로부터 가져왔고, 이는 본 명세서에서 전부, 상세하게는 변형된 MVA 경로의 핵산 및 폴리펩타이드에 관하여 참고문헌으로 통합되어 있다. 변형된 MVA 경로는 예를 들어 메타노사르시나 마제이 (Methanosarcina mazei)와 같은 일부 고생물에서 존재한다.
도 20 (도 20A 및 20B)은 쿠쥬 이소프렌 합성효소 유전자가 없거나 (왼쪽) 이를 가지는 (오른쪽) 재조합 Y. 리포리티카 (Y. lipolytica) 균주에 의한 이소프렌 생산의 GC-MS 분석 결과를 보여주는 그래프를 나타낸 것이다.
도 21은 pTrcKudzu yIDI DXS Kan의 지도를 나타낸 것이다.
도22A 내지 22D는 pTrcKudzu yIDI DXS Kan의 뉴클레오타이드 서열 (서열번호 10)을 나타낸 것이다.
도23A는 대장균 BL21/pTrcKudzukan에서 포도당으로부터 이소프렌의 생산을 보여주는 그래프를 나타낸 것이다. 시간 0는 IPTG (400 μmol)로 유도한 시간이다. x-축은 유도 이후 시간이고; y-축은 OD600이며 y2-축은 이소프렌의 전체 생산도 (μg/L 상부공간) 또는 특이 생산도 (μg/L 상부공간/OD)이다. 다이아몬드는 OD600을 표시하고, 원은 전체 이소프렌 생산도 (μg/L)를 표시하며 네모는 이소프렌의 특이 생산도 (μg/L/OD)를 표시한다.
도23B는 대장균 BL21/pTrcKudzu yIDI kan에서 포도당으로부터 이소프렌의 생산을 보여주는 그래프를 나타낸 것이다. 시간 0는 IPTG (400 μmol)로 유도한 시간이다. x-축은 유도 이후 시간이고; y-축은 OD600이며 y2-축은 이소프렌의 전체 생산도 (μg/L 상부공간) 또는 특이 생산도 (μg/L 상부공간/OD)이다. 다이아몬드는 OD600을 표시하고, 원은 전체 이소프렌 생산도 (μg/L)를 표시하며 네모는 이소프렌의 특이 생산도 (μg/L/OD)를 표시한다.
도23C는 대장균 BL21/pTrcKudzu DXS kan에서 포도당으로부터 이소프렌의 생산을 보여주는 그래프를 나타낸 것이다. 시간 0는 IPTG (400 μmol)로 유도한 시간이다. x-축은 유도 이후 시간이고; y-축은 OD600이며 y2-축은 이소프렌의 전체 생산도 (μg/L 상부공간) 또는 특이 생산도 (μg/L 상부공간/OD)이다. 다이아몬드는 OD600을 표시하고, 원은 이소프렌의 전체 생산도 (μg/L)를 표시하며 네모는 이소프렌의 특이 생산도 (μg/L/OD)를 표시한다.
도23D는 대장균 BL21/pTrcKudzu yIDI DXS kan에서 포도당으로부터 이소프렌의 생산을 보여주는 그래프를 나타낸 것이다. 시간 0는 IPTG (400 μmol)로 유도한 시간이다. x-축은 유도 이후 시간이고; y-축은 OD600이며 y2-축은 이소프렌의 전체 생산도 (μg/L 상부공간) 또는 특이 생산도 (μg/L 상부공간/OD)이다. 다이아몬드는 OD600을 표시하고, 원은 전체 이소프렌 생산도 (μg/L)를 표시하며 네모는 이소프렌의 특이 생산도 (μg/L/OD)를 표시한다.
도23E는 대장균 BL21/ pCL PtrcKudzu에서 포도당으로부터 이소프렌의 생산을 보여주는 그래프를 나타낸 것이다. 시간 0는 IPTG (400 μmol)로 유도한 시간이다. x-축은 유도 이후 시간이고; y-축은 OD600이며 y2-축은 이소프렌의 전체 생산도 (μg/L 상부공간) 또는 특이 생산도 (μg/L 상부공간/OD)이다. 다이아몬드는 OD600을 표시하고, 원은 전체 이소프렌 생산도 (μg/L)를 표시하며 네모는 이소프렌의 특이 생산도 (μg/L/OD)를 표시한다.
도23F는 대장균 BL21/ pCL PtrcKudzu yIDI에서 포도당으로부터 이소프렌의 생산을 보여주는 그래프를 나타낸 것이다. 시간 0는 IPTG (400 μmol)로 유도한 시간이다. x-축은 유도 이후 시간이고; y-축은 OD600이며 y2-축은 이소프렌의 전체 생산도 (μg/L 상부공간) 또는 특이 생산도 (μg/L 상부공간/OD)이다. 다이아몬드는 OD600을 표시하고, 원은 전체 이소프렌 생산도 (μg/L)를 표시하며 네모는 이소프렌의 특이 생산도 (μg/L/OD)를 표시한다.
도23G는 대장균 BL21/ pCL PtrcKudzu DXS에서 포도당으로부터 이소프렌의 생산을 보여주는 그래프를 나타낸 것이다. 시간 0는 IPTG (400 μmol)로 유도한 시간이다. x-축은 유도 이후 시간이고; y-축은 OD600이며 y2-축은 이소프렌의 전체 생산도 (μg/L 상부공간) 또는 특이 생산도 (μg/L 상부공간/OD)이다. 다이아몬드는 OD600을 표시하고, 원은 전체 이소프렌 생산도 (μg/L)를 표시하며 네모는 이소프렌의 특이 생산도 (μg/L/OD)를 표시한다.
도23H는 대장균 BL21/pTrcKudzuIDIDXSkan에서 포도당으로부터 이소프렌의 생산을 보여주는 그래프를 나타낸 것이다. 시간 0는 IPTG (400 μmol)로 유도한 시간이다. x-축은 유도 이후 시간이고; y-축은 OD600이며 y2-축은 이소프렌의 전체 생산도 (μg/L 상부공간) 또는 특이 생산도 (μg/L 상부공간/OD)이다. 다이아몬드는 OD600을 표시하고, 원은 전체 이소프렌 생산도 (μg/L)를 표시하며 네모는 이소프렌의 특이 생산도 (μg/L/OD)를 표시한다.
도 24는 pTrcKKDyIkIS kan의 지도를 나타낸 것이다.
도 25A 내지 25D는 pTrcKKDyIkIS kan의 뉴클레오타이드 서열 (서열번호 11)을 나타낸 것이다.
도 26은 pCL PtrcUpperPathway의 지도를 나타낸 것이다.
도 27A 내지 27D는 pCL PtrcUpperPathway의 뉴클레오타이드 서열 (서열번호 12)를 나타낸 것이다.
도 28은 B. 섭틸리스 (B. subtilis) 염색체의 nprE 좌위 (locus) 내로 도입하기 위한 하부 MVA 경로 및 효모 idi를 포함하는 카세트의 지도를 나타낸 것이다. 상류 (upstream)/하류 (downstream) nprE는 도입을 위한 nprE 좌위로부터 각 1kb의 서열을 표시한다. aprE 프로모터 (알칼라인 세린 프로테아제 프로모터 (alkaline serine protease promoter))는 aprE 유전자의 프로모터 (-35, -10, +1 전사 시작 부위, RBS)를 표시한다. MVK1는 효모 메발로네이트 키나제 유전자를 표시한다. RBS-PMK는 바실러스의 시작 부위의 RBS 상류를 가진 효모 포스포메발로네이트 키나제 유전자를 표시한다. RBS-MPD는 바실러스의 시작 부위의 RBS 상류를 가진 효모 디포스포메발로네이트 탈탄산화효소 유전자를 표시한다. RBS-IDI는 바실러스의 시작 부위의 RBS 상류를 가진 효모 idi 유전자를 표시한다. 종결인자 (terminator)는 B. 아밀리크파시엔스 (B. amyliquefaciens)로부터 나온 종결인자 알칼라인 세린 프로테아제 전사 종결인자를 표시한다. SpecR은 스펙티노마이신 저항성 마커 (spectinomycin resistance marker)를 표시한다. "amp을 위한 nprE 상류 반복서열 (nprE upstream repeat for amp)"는 증폭 (amplification)하는 데 사용되는 상류 부위의 직접 반복서열 (direct repeat)을 표시한다.
도 29A 내지 29D는 B. 섭틸리스 염색체의 nprE 좌위 내로 도입하기 위한 하류 MVA 경로 및 효모 idi를 포함하는 카세트의 뉴클레오타이드 서열 (서열번호 13)을 나타낸 것이다.
도 30은 p9796-poplar의 지도를 나타낸 것이다.
도 31A 및 31B는 p9796-poplar의 뉴클레오타이드 서열 (서열번호 14)을 나타낸 것이다.
도 32는 pTrcPoplar의 지도를 나타낸 것이다.
도 33A 내지 33C는 pTrcPoplar의 뉴클레오타이드 서열 (서열번호 15)을 나타낸 것이다.
도 34는 pTrcKudzu yIDI Kan의 지도를 나타낸 것이다.
도 35A 내지 35C는 pTrcKudzu yIDI Kan의 뉴클레오타이드 서열 (서열번호 16)을 나타낸 것이다.
도 36은 pTrcKudzuDXS Kan의 지도를 나타낸 것이다.
도 37A 내지 37C는 pTrcKudzuDXS Kan의 뉴클레오타이드 서열 (서열번호 17)을 나타낸 것이다.
도 38은 pCL PtrcKudzu의 지도를 나타낸 것이다.
도 39A 내지 39C는 pCL PtrcKudzu의 뉴클레오타이드 서열 (서열번호 18)을 나타낸 것이다.
도 40은 pCL PtrcKudzu A3의 지도를 나타낸 것이다.
도 41A 내지 41C는 pCL PtrcKudzu A3의 뉴클레오타이드 서열 (서열번호 19)을 나타낸 것이다.
도 42는 pCL PtrcKudzu yIDI의 지도를 나타낸 것이다.
도 43A 내지 43C는 pCL PtrcKudzu yIDI의 뉴클레오타이드 서열 (서열번호 20)을 나타낸 것이다.
도 44는 pCL PtrcKudzu DXS의 지도를 나타낸 것이다.
도 45A 내지 45D는 pCL PtrcKudzu DXS의 뉴클레오타이드 서열 (서열번호 21)을 나타낸 것이다.
도 46A 내지 46E는 바이오매스 공급원료로부터 이소프렌의 생산을 보여주는 그래프를 나타낸 것이다. 패널 A는 옥수수 스토버 (corn stover)으로부터 이소프렌의 생산을 보여주고, 패널 B는 사탕수수 찌꺼기 (baggasse)로부터 이소프렌의 생산을 보여주며, 패널 C는 연목질 펄프 (softwood pulp)로부터 이소프렌의 생산을 보여주고, 패널 D는 포도당으로부터 이소프렌의 생산, 또한 패널 E는 추가적인 공급원료가 전혀 없이 세포로부터 이소프렌의 생산을 보여준다. 회색 네모는 접종후 지정된 시간에서 배양의 OD600 측정을 표시하고 검은색 세모는 접종-이후 지정된 시간에서 이소프렌의 생산을 표시한다.
도 47A는 첨가된 포도당이 전혀 없는 배양에서 대장균 BL21 (λDE3) pTrcKudzu yIDI DXS (kan)에 의한 이소프렌 생산을 보여주는 그래프를 나타낸 것이다. 네모는 OD600를 표시하고, 세모는 생산된 이소프렌 (μg/ml)을 표시한다.
도 47B는 1% 포도당 공급원료인 역슈가 (invert sugar)으로부터 대장균 BL21 (λDE3) pTrcKudzu yIDI DXS (kan)에 의한 이소프렌 생산을 보여주는 그래프를 나타낸 것이다. 네모는 OD600를 표시하고, 세모는 생산된 이소프렌 (μg/ml)을 표시한다.
도 47C는 1% 역 설탕 공급원료로부터 대장균 BL21 (λDE3) pTrcKudzu yIDI DXS (kan)에 의한 이소프렌 생산을 보여주는 그래프를 나타낸 것이다. 네모는 OD600를 표시하고, 세모는 생산된 이소프렌 (μg/ml)을 표시한다.
도 47D는 1% AFEX 옥수수 스토버 공급원료로부터 대장균 BL21 (λDE3) pTrcKudzu yIDI DXS (kan)에 의한 이소프렌 생산을 보여주는 그래프를 나타낸 것이다. 네모는 OD600를 표시하고, 세모는 생산된 이소프렌 (μg/ml)을 표시한다.
도 48A 내지 48C는 이소프렌 생산에서 효모 추출물의 효과를 보여주는 그래프를 나타낸 것이다. 패널 A는 다양한 양의 효모 추출물을 첨가한 발효기 내의 광학 밀도의 시간 경과를 보여준다. 패널 B는 다양한 양의 효모 추출물을 첨가한 발효기 내의 이소프렌 역가의 시간 경과를 보여준다. 역가는 발효 액체배지 리터 당 생산된 이소프렌량으로서 정의된다. 패널 C는 사료첨가-회분식 배양 (fed-batch culture)에서 자란 대장균에서 이소프렌 생산에 미치는 효모 추출물의 효과를 보여준다.
도 49A 내지 49C는 pTrcKudzu + yIDI + DXS 플라스미드를 포함하는 대장균 세포를 사용하여 500-L 생물반응기 (bioreactor)로부터 이소프렌의 생산을 보여주는 그래프를 나타낸 것이다. 패널 A는 포도당 및 효모 추출물을 첨가한 500-L 생물반응기 내의 광학 밀도의 시간 경과를 보여준다. 패널 B는 포도당 및 효모 추출물을 첨가한 500-L 생물반응기 내의 이소프렌 역가의 시간 경과를 보여준다. 패널 C는 포도당 및 효모 추출물을 첨가한 500-L 생물반응기 로부터 생산된 전체 이소프렌의 시간 경과를 보여준다.
도 50은 pJMupperpathway2의 지도를 나타낸 것이다.
도 51A 내지 51C는 pJMupperpathway2의 뉴클레오타이드 서열 (서열번호 22)을 나타낸 것이다.
도 52는 pBS Kudzu #2의 지도를 나타낸 것이다.
도 53A는 14 리터 회분식 발효에서 재조합 쿠쥬 이소프렌 합성효소를 발현하는 바실러스의 발효 시간 동안의 성장을 보여주는 그래프를 나타낸 것이다. 검은색 다이아몬드는 재조합 이소프렌 합성효소가 없는 (천연 그대로의 이소프렌 생산) 대조군 균주 (BG3594comK)를 표시하고 회색 세모는 pBSKudzu를 가진CF443, 바실러스 균주 BG3594comK (재조합 이소프렌 생산)을 표시한다.
도 53B는 14 리터 회분식 발효에서 재조합 쿠쥬 이소프렌 합성효소를 발현하는 바실러스의 발효 시간 동안의 이소프렌 생산을 보여주는 그래프를 나타낸 것이다. 검은색 다이아몬드는 재조합 이소프렌 합성효소가 없는 (천연 그대로의 이소프렌 생산) 대조군 균주 (BG3594comK)를 표시하고 회색 세모는 pBSKudzu를 가진CF443, 바실러스 균주 BG3594comK (재조합 이소프렌 생산)을 표시한다.
도 54는 포도당을 첨가한 15-L 생물반응기 내의 광학 밀도의 시간 경과를 나타낸 것이다.
도 55는 포도당을 첨가한 15-L 생물반응기 내의 이소프렌 역가의 시간 경과를 나타낸 것이다.
도 56은 포도당을 첨가한 15-L 생물반응기로부터 생산된 전체 이소프렌의 시간 경과를 나타낸 것이다.
도 57은 글리세롤을 첨가한 15-L 생물반응기 내의 광학 밀도의 시간 경과를 나타낸 것이다.
도 58은 글리세롤을 첨가한 15-L 생물반응기 내의 이소프렌 역가의 시간 경과를 나타낸 것이다. 역가는 발효 액체배지 리터 당 생산된 이소프렌량으로서 정의된다.
도 59는 글리세롤을 첨가한 15-L 생물반응기로부터 생산된 전체 이소프렌의 시간 경과를 나타낸 것이다.
도 60A 내지 60C는 포도당을 첨가한 150-L 생물반응기 내의 광학 밀도, 메발론산 역가, 및 특이 생산도의 시간 경과를 나타낸 것이다.
도 61A 내지 61C는 포도당을 첨가한 150-L 생물반응기 내의 광학 밀도, 메발론산 역가, 및 특이 생산도의 시간 경과를 나타낸 것이다.
도 62A 내지 62C는 포도당을 첨가한 150-L 생물반응기 내의 광학 밀도, 메발론산 역가, 및 특이 생산도의 시간 경과를 나타낸 것이다.
도 63A 내지 63C는 포도당을 첨가한 150-L 생물반응기 내의 광학 밀도, 메발론산 역가, 및 특이 생산도의 시간 경과를 나타낸 것이다.
도 64A 내지 64C는 포도당을 첨가한 150-L 생물반응기 내의 광학 밀도, 메발론산 역가, 및 특이 생산도의 시간 경과를 나타낸 것이다.
도 65A 내지 65C는 포도당을 첨가한 150-L 생물반응기 내의 광학 밀도, 메발론산 역가, 및 특이 생산도의 시간 경과를 나타낸 것이다.
도 66A 내지 66C는 포도당을 첨가한 150-L 생물반응기 내의 광학 밀도, 메발론산 역가, 및 특이 생산도의 시간 경과를 나타낸 것이다.
도 67A 내지 67C는 포도당을 첨가한 150-L 생물반응기 내의 광학 밀도, 메발론산 역가, 및 특이 생산도의 시간 경과를 나타낸 것이다.
도 68은 A 시리즈를 위한 계산된 단열 발화 온도 (adiabatic flame temperatures)의 그래프를 다양한 산소 수준에 대한 연료 농도의 함수로서 나타낸 것이다. 도면 설명은 그래프로 표현된 곡선을 순서대로 나열하고 있다. 예를 들어, 도면 설명의 첫 번째 순서 (40℃에서 대기 내의 이소프렌)는 그래프에서 가장 높은 곡선에 해당한다.
도 69는 A 시리즈를 위한 계산된 단열 발화 온도의 그래프를 4% 물을 가진 다양한 산소 수준에 대한 연료 농도의 함수로서 나타낸 것이다. 도면 설명은 그래프로 표현된 곡선을 순서대로 나열하고 있다.
도 70은 A 시리즈를 위한 계산된 단열 발화 온도의 그래프를 5% CO2를 가진 다양한 산소 수준에 대한 연료 농도의 함수로서 나타낸 것이다. 도면 설명은 그래프로 표현된 곡선을 순서대로 나열하고 있다.
도 71은 A 시리즈를 위한 계산된 단열 발화 온도의 그래프를 10% CO2를 가진 다양한 산소 수준에 대한 연료 농도의 함수로서 나타낸 것이다. 도면 설명은 그래프로 표현된 곡선을 순서대로 나열하고 있다.
도 72는 A 시리즈를 위한 계산된 단열 발화 온도의 그래프를 15% CO2를 가진 다양한 산소 수준에 대한 연료 농도의 함수로서 나타낸 것이다. 도면 설명은 그래프로 표현된 곡선을 순서대로 나열하고 있다.
도 73은 A 시리즈를 위한 계산된 단열 발화 온도의 그래프를 20% CO2를 가진 다양한 산소 수준에 대한 연료 농도의 함수로서 나타낸 것이다. 도면 설명은 그래프로 표현된 곡선을 순서대로 나열하고 있다.
도 74는 A 시리즈를 위한 계산된 단열 발화 온도의 그래프를 30% CO2를 가진 다양한 산소 수준에 대한 연료 농도의 함수로서 나타낸 것이다. 도면 설명은 그래프로 표현된 곡선을 순서대로 나열하고 있다.
도 75A는 A 시리즈에 대한 무게 퍼센트 대 부피 퍼센트로부터 나온 CAFT 모델 결과의 전환 (conversion) 표를 나타낸 것이다.
도 75B는 부피 퍼센트로서 좌표 표시된 도 69에서 A 시리즈에 대한 CAFT 모델로부터 나온 발화도 (flammability) 결과의 그래프를 나타낸 것이다.
도 76A는 B 시리즈에 대한 무게 퍼센트 대 부피 퍼센트로부터 나온 CAFT 모델 결과의 전환 표를 나타낸 것이다.
도 76B는 부피 퍼센트로서 좌표 표시된 도 69에서 B 시리즈에 대한 CAFT 모델로부터 나온 발화도 결과의 그래프를 나타낸 것이다.
도 77은 발화도 테스트 용기를 묘사한 도면을 나타낸 것이다.
도 78A는 테스트 시리즈 1에 대한 발화도 곡선의 그래프를 나타낸 것이다: 0% 스트림, 0 psig, 및 40℃.
도 78B는 테스트 시리즈 1에 대한 폭발 및 비-폭발 데이터 좌표를 요약한 표를 나타낸 것이다.
도 78C는 CAFT 모델과 비교한 테스트 시리즈 1에 대한 발화도 곡선의 그래프를 나타낸 것이다.
도 79A는 테스트 시리즈 2에 대한 발화도 곡선의 그래프를 나타낸 것이다: 4% 스트림, 0 psig, 및 40℃.
도 79B는 테스트 시리즈 2에 대한 폭발 및 비-폭발 데이터 좌표를 요약한 표를 나타낸 것이다.
도 79C는 CAFT 모델과 비교한 테스트 시리즈 2에 대한 발화도 곡선의 그래프를 나타낸 것이다.
도 80A 및 80B는 상세한 실험적 조건 및 테스트 시리즈 1에 대한 결과의 표를 나타낸 것이다.
도 81은 상세한 실험적 조건 및 테스트 시리즈 2에 대한 결과의 표를 나타낸 것이다.
도 82는 3기압에서 다양한 질소/산소 비율에 대한 연료 농도의 함수로서 좌표 표시된 계산된 단열 발화 온도의 그래프를 나타낸 것이다.
도 83은 1기압에서 다양한 질소/산소 비율에 대한 연료 농도의 함수로서 좌표 표시된 계산된 단열 발화 온도의 그래프를 나타낸 것이다.
도 84는 도 82으로부터 나온 데이터 및 실시예 13에 기술된 방법론을 사용하여 제작된 발화도 한계의 그래프를 나타낸 것이다. 실험적 데이터 좌표 (원)은 본 명세서에 기술된 테스트로부터 나오고 1 기압의 초기 시스템 압력에서 수행되었다.
도 85는 도 83으로부터 나온 데이터 및 실시예 13에 기술된 방법론을 사용하여 제작된 발화도 한계의 그래프를 나타낸 것이다. 실험적 데이터 좌표 (원)은 본 명세서에 기술된 테스트로부터 나오고 1기압의 초기 시스템 압력에서 수행되었다.
도 86A는 발효 배출-기체의 GC/MS 크로마토그램을 나타낸 것이다.
도 86B은 발효 배출-기체에 존재하는 소수의 휘발성 물질을 보여주는 도 86A의 연장선이다.
도 87A는 -78℃에서 냉동-포획에 이어서 배출-기체에 존재하는 소량 휘발성 물질의 GC/MS 크로마토그램을 나타낸 것이다.
도 87B는 -196℃에서 냉동-포획에 이어서 배출-기체에 존재하는 소량 휘발성 물질의 GC/MS 크로마토그램을 나타낸 것이다.
도 87C는 도 87B의 연장선을 나타낸 것이다.
도 87D는 도 87C의 연장선을 나타낸 것이다.
도 88A 및 88B는 석유-유래 이소프렌 (도 88A)로부터 나온 C5 탄화수소와 생물학적으로 생산된 이소프렌 (도 88B)를 비교하는 GC/MS 크로마토그램을 나타낸 것이다. 표준은 주요 이소프렌 피크 주변에서 용출되는 세 가지의 D5 탄화수소 불순물을 포함한다 (도 88A). 대조적으로, 생물학적으로 생산된 이소프렌은 많은 에탄올 및 아세톤 (3.41분의 진행 시간)을 포함한다 (도 88A).
도 89는 쿠쥬 이소프렌 합성효소를 발현하고 3 g/L 효모 추출물과 함께 포도당으로 배양된 대장균 BL21(DE3) pTrcIS 균주의 발효 배출-기체 분석의 그래프를 나타낸 것이다.
도 90은 이소프렌과 구조적으로 유사하고 또한 다중합반응 촉매 독 (catalyst poisons)으로서 작용하는 여러 가지 분순물들의 구조를 나타낸 것이다.
도 91은 pTrcHis2AUpperPathway (pTrcUpperMVA라고도 명명됨)의 지도를 나타낸 것이다.
도92A 내지92C는 pTrcHis2AUpperPathway (pTrcUpperMVA라고도 명명됨)의 뉴클레오타이드 서열 (서열번호 23)을 나타낸 것이다.
도 93은 포도당을 첨가한 15-L 생물반응기 내의 광학 밀도의 시간 경과를 나타낸 것이다.
도 94는 포도당을 첨가한 15-L 생물반응기 내의 이소프렌 역가의 시간 경과를 나타낸 것이다. 역가는 발효 액체배지 리터 당 생산된 이소프렌량으로서 정의된다.
도 95는 포도당을 첨가한 15-L 생물반응기로부터 생산된 전체 이소프렌의 시간 경과를 나타낸 것이다.
도 96은 역슈가를 첨가한 15-L 생물반응기 내의 광학 밀도의 시간 경과를 나타낸 것이다.
도 97은 역슈가를 첨가한 15-L 생물반응기 내의 이소프렌 역가의 시간 경과를 나타낸 것이다. 역가는 발효 액체배지 리터 당 생산된 이소프렌량으로서 정의된다.
도 98은 역슈가를 첨가한 15-L 생물반응기로부터 생산된 전체 이소프렌의 시간 경과를 나타낸 것이다.
도 99는 포도당을 첨가한 15-L 생물반응기 내의 광학 밀도의 시간 경과를 나타낸 것이다.
도 100은 포도당을 첨가한 15-L 생물반응기 내의 이소프렌 역가의 시간 경과를 나타낸 것이다. 역가는 발효 액체배지 리터 당 생산된 이소프렌량으로서 정의된다.
도 101은 포도당을 첨가한 15-L 생물반응기로부터 생산된 전체 이소프렌의 시간 경과를 나타낸 것이다.
도 102는 pCLPtrcUpperPathwayHGS2의 지도를 나타낸 것이다.
도103A 내지103C는 pCLPtrcUpperPathwayHGS2의 뉴클레오타이드 서열 (서열번호 24)을 나타낸 것이다.
도 104는 포도당을 첨가한 15-L 생물반응기 내의 광학 밀도의 시간 경과를 나타낸 것이다.
도 105은 포도당을 첨가한 15-L 생물반응기 내의 이소프렌 역가의 시간 경과를 나타낸 것이다. 역가는 발효 액체배지 리터 당 생산된 이소프렌량으로서 정의된다.
도 106은 포도당을 첨가한 15-L 생물반응기로부터 생산된 전체 이소프렌의 시간 경과를 나타낸 것이다.
도 107은 플라스미드 MCM330 (attTn7에서 FRT-cm-FRT-gi1.2-KKDy)의 지도를 나타낸 것이다.
도108A 내지108C는 플라스미드 MCM330의 뉴클레오타이드 서열 (서열번호 25)을 나타낸 것이다.
도 109는 pET24D-Kudzu의 지도를 나타낸 것이다.
도110A 및 110B는 pET24D-Kudzu의 뉴클레오타이드 서열 (서열번호 26)을 나타낸 것이다.
도 111A는 포도당을 첨가한 15-L 생물반응기 내의 광학 밀도의 시간 경과를 나타낸 것이다.
도 111B는 포도당을 첨가한 15-L 생물반응기 내의 이소프렌 역가의 시간 경과를 나타낸 것이다. 역가는 발효 액체배지 리터 당 생산된 이소프렌량으로서 정의된다.
도 111C는 포도당을 첨가한 15-L 생물반응기로부터 생산된 전체 이소프렌의 시간 경과를 나타낸 것이다.
도 112A는 M. 마제이 고대 하부 경로 오페론 (archaeal Lower Pathway operon)의 지도를 나타낸 것이다.
도 112B 내지 112C는 M. 마제이 고대 하부 경로 오페론의 뉴클레오타이드 서열 (서열번호 27)을 나타낸 것이다.
도 113A는 MCM382 -pTrcKudzuMVK(mazei)의 지도를 나타낸 것이다.
도113B 내지 113C는 MCM382 - pTrcKudzuMVK(mazei)의 뉴클레오타이드 서열 (서열번호 28)을 나타낸 것이다.
도 114A는 pET200D에서 M. 마제이 고대 하부로부터 나온 MCM376 - MVK의 지도를 나타낸 것이다.
도 114B 및 114C는pET200D에서 M. 마제이 고대 하부로부터 나온 MCM376 - MVK의 뉴클레오타이드 서열 (서열번호 29)을 나타낸 것이다.
도 115A 내지 115D는 MVK및 이소프렌 합성 효소의 과다-발현이 증가된 이소프렌의 생산을 유도하는 것을 나타낸 것이다. 이소프렌 생산 시 100 및 200 μM IPTG 유도를 사용하여 100 mL 생물반응기에서 포도당으로 성장하는 동안 MCM401 및 MCM343으로부터 나온 축적된 이소프렌 및 CO2는 22시간 시간 경과를 통하여 측정되었다. 도 115A는 MCM343로부터 나온 축적된 이소프렌 (%)의 그래프이다. 도 115B는 MCM401로부터 나온 축적된 이소프렌 (%)의 그래프이다. 도 115C는 MCM343로부터 나온 축적된 CO2 (%)의 그래프이다. 도 115D는 MCM401로부터 나온 축적된 CO2 (%)의 그래프이다.
도 116은 포도당을 첨가한 15-L 생물반응기 내의 광학 밀도의 시간 경과를 나타낸 것이다.
도 117은 포도당을 첨가한 15-L 생물반응기 내의 이소프렌 역가의 시간 경과를 나타낸 것이다. 역가는 발효 액체배지 리터 당 생산된 이소프렌량으로서 정의된다.
도 118은 포도당을 첨가한 15-L 생물반응기로부터 생산된 전체 이소프렌의 시간 경과를 나타낸 것이다.
도 119는 포도당을 첨가한 15-L 생물반응기 내의 전체 이산화탄소 발생율 (carbon dioxide evolution rate, TCER), 또는 대사활성 프로파일의 그래프를 나타낸 것이다.
도 120은 포도당을 첨가한 15-L 생물반응기 내에서 이소프렌 생산 동안 세포 생존도의 그래프를 나타낸 것이다. TVC/OD는 광학 밀도 단위 (OD550) 당 1 mL의 액체배지에서 전체 생존가능 계수 (콜로니 형성 단위)이다.
도 121은 포도당을 첨가한 15-L 생물반응기 내의 광학 밀도의 시간 경과를 나타낸 것이다.
도 122는 포도당을 첨가한 15-L 생물반응기 내의 이소프렌 역가의 시간 경과를 나타낸 것이다. 역가는 발효 액체배지 리터 당 생산된 이소프렌량으로서 정의된다.
도 123은 포도당을 첨가한 15-L 생물반응기로부터 생산된 전체 이소프렌의 시간 경과를 나타낸 것이다.
도 124는 포도당을 첨가한 15-L 생물반응기 내의 부피측정 생산도의 시간 경과를 나타낸 것이다. 부피측정 생산도는 시간 당 액체배지 리터 당 생산된 이소프렌량으로서 정의된다.
도 125는 포도당을 첨가한 15-L 생물반응기 내의 일시적 수득율 (instantaneous yield)의 시간 경과를 나타낸 것이다. 일시적 수득율은 데이터 좌표들 간 시간 간격 동안 생물반응기 (w/w)에 첨가된 포도당량 (그램)당 생산된 이소프렌량으로서 정의된다.
도 126은 포도당을 첨가한 15-L 생물반응기 내의 전체 이산화탄소 발생율 (TCER), 또는 대사활성 프로파일의 그래프를 나타낸 것이다.
도 127은 포도당을 첨가한 15-L 생물반응기 내에서 이소프렌 생산 동안 세포 생존도의 그래프를 나타낸 것이다. TVC/OD는 광학 밀도 단위 (OD550) 당 1 mL의 액체배지에서 전체 생존가능 계수 (콜로니 형성 단위)이다.
도 128은 포도당을 첨가한 15-L 생물반응기 내의 광학 밀도의 시간 경과를 나타낸 것이다.
도 129는 포도당을 첨가한 15-L 생물반응기 내의 이소프렌 역가의 시간 경과를 나타낸 것이다. 역가는 발효 액체배지 리터 당 생산된 이소프렌량으로서 정의된다.
도 130은 포도당을 첨가한 15-L 생물반응기로부터 생산된 전체 이소프렌의 시간 경과를 나타낸 것이다.
도 131은 포도당을 첨가한 15-L 생물반응기 내의 전체 이산화탄소 발생율 (TCER), 또는 대사활성 프로파일의 그래프를 나타낸 것이다.
도 132는 생물반응기로의 공기 유동 (airflow)에서 일시적 감소가 대사활성 (TCER)에서 급격한 감소를 유발하지 않았던 배출-기체에서 이소프렌 농도의 스파이크 (spike)를 유도하였던 것을 보여주는 그래프를 나타낸 것이다. TCER, 또는 대사활성은 전체 이산화탄소 발생율이다.
도 133은 포도당을 첨가한 15-L 생물반응기 내에서 이소프렌 생산 동안 세포 생존도의 그래프를 나타낸 것이다. TVC/OD는 광학 밀도 단위 (OD550) 당 1 mL의 액체배지에서 전체 생존가능 계수 (콜로니 형성 단위)이다.
도 134는 포도당을 첨가한 15-L 생물반응기 내의 광학 밀도의 시간 경과를 나타낸 것이다. 점선으로 된 수직선은 이소프렌이 1 g/L/시간으로 생물 반응기 내에 도입되었던 때 시간 간격을 표시한다.
도 135는 포도당을 첨가한 15-L 생물반응기 내의 전체 이산화탄소 발생율 (TCER), 또는 대사활성 프로파일의 그래프를 나타낸 것이다. 점선으로 된 수직선은 이소프렌이 1 g/L/시간의 속도로 생물 반응기 내에 도입되었던 때 시간 간격을 표시한다.
도 136은 포도당을 첨가한 15-L 생물반응기 내에서 이소프렌 생산 동안 세포 생존도를 나타낸 것이다. TVC/OD는 광학 밀도 단위 (OD550) 당 1 mL의 액체배지에서 전체 생존가능 계수 (콜로니 형성 단위)이다. 점선으로 된 수직선은 이소프렌이 1 g/L/시간으로 생물 반응기 내에 도입되었던 때 시간 간격을 표시한다.
도 137A 및 137B는 굵은 문자로 강조된 포풀러스 알바 (Populus alba) pET24a: 이소프렌 합성효소 유전자의 서열 (서열번호 30)을 나타낸 것이다.
도 137C 및 137D는 굵은 문자로 강조된 포풀러스 니그라 (Populus nigra) pET24a: 이소프렌 합성효소 유전자의 서열 (서열번호 31)을 나타낸 것이다.
도 137E 및 137F는 굵은 문자로 강조된 포풀러스 트레물로이데스 (Populus tremuloides) pET24a의 서열 (서열번호 32)을 나타낸 것이다.
도 137G는 포풀러스 트레물로이데스 (Populus tremuloides) 이소프렌 합성효소 유전자의 아미노산 서열 (서열번호 33)을 나타낸 것이다.
도 137H 및 137I는 굵은 문자로 강조된 포풀러스 트리코카르파 (Populus trichocarpa) pET24a: 이소프렌 합성효소 유전자의 서열 (서열번호 34)을 나타낸 것이다.
도 137J 및 137K는 굵은 문자로 강조된 포풀러스 트레물라 x 포풀러스 알바 pET24a: 이소프렌 합성효소 유전자의 서열 (서열번호 35)을 나타낸 것이다.
도 137L 은 pCR2.1 골격에 쿠쥬 IspS 코딩 서열을 포함하는 MCM93의 지도를 나타낸 것이다.
도 137M 및 137 N은 MCM93의 서열 (서열번호 36)을 나타낸 것이다.
도 137O는 pET24D-Kudzu의 지도를 나타낸 것이다.
도 137P 및 137Q 는 pET24D-Kudzu의 서열 (서열번호 37)을 나타낸 것이다.
도 138은 전체 세포 상부공간 분석법에서 측정된 바와 같은 다양한 포풀라 종에 대한 이소프렌 합성효소 발현 데이터를 나타낸 것이다. Y-축은 IPTG로 유도된 0.2 mL 배양에 의해 생산된 이소프렌의 μg/L/OD이다.
도 139는 DMAPP 분석법에 의해 측정된 바와 같이 포풀라 이소프렌 합성효소의 상대적 활성을 나타낸 것이다. 포풀라 효소는 쿠쥬로부터 나온 이소프렌 합성효소보다 유의하게 더 높은 활성을 가진다. 포풀라 [알바 x 트레물라]는 적은 (< 1%) 활성만을 가지고 좌표에 표시되지는 않는다.
도 140은 pDONR221:19430 - hybrid_HGS의 지도를 나타낸 것이다.
도 141는 pDONR221:19430 - hybrid_HGS, 효모에 코돈-최적화된 쿠쥬 이소프렌 합성효소의 서열 (서열번호 38)을 나타낸 것이다.
도 142A는 pDW14의 지도를 나타낸 것이다.
도 142B 및 142C는 pDW14의 완전한 뉴클레오타이드 서열 (서열번호 39)을 나타낸 것이다.
도 143은 pDW14 또는 pYES-DEST52을 보유하는 유도된 INVSc-1 균주를 나타낸 것이다. 도 143A. 갈락토스로 유도되고 심플리블루 세이프스테인 (SimplyBlue SafeStain, Invitrogen)으로 염색된 INVSc-1 균주로부터 생성된 용출액의 4-12% 비스 트리스 젤 (Novex, Invitrogen). 도 143B. 웨스턴브리즈 키트 (WesternBreeze kit, Invitrogen)를 사용한 동일한 균주의 웨스턴 블럿 분석. 레인 설명은 다음과 같다: 1, INVSc-1 + pYES-DEST52; 2, INVSc-1 + pDW14 (분리물 1); 3, INVSc-1 + pDW14 (분리물 2). MW가 (kDa으로) (시블루 플러스2 (SeeBlue Plus2) 분자량 기준을 사용하여) 표시된다.
도 144 (도 144A 및 144B)는 pDW14 또는 pYES-DEST52를 보유하는 유도된 INVSc-1 균주를 나타낸 것이다. 도 144A. 용해 이전 갈락토스-유도된 균주의 OD600. y-축은 OD600이다. 도 144B. 대조군 및 이소프렌 합성효소-보유 균주에서 이소프렌 합성효소 상부공간의 DMAPP 분석법. 특이 활성은 μg HG/L/OD로서 계산되었다. 시료는 다음과 같다: 대조군, INVSc-1 + pYES-DEST52; HGS-1, INVSc-1 + pDW14 (분리물 1); HGS-2, INVSc-1 + pDW14 (분리물 2).
도 145A는 코돈 최적화된 이소프렌 합성효소 fluo-opt2v2의 지도를 나타낸 것이다.
도 145B는 코돈 최적화된 이소프렌 합성효소 fluo-opt2v2 (서열번호 40)의 뉴클레오타이드 서열을 나타낸 것이다.
도 146A는 pBBR1MCS5의 지도를 나타낸 것이다.
도 146B 및 146C는 pBBR1MCS5 (서열번호 41)의 뉴클레오타이드 서열을 나타낸 것이다.
도 147A는 pBBR5HGSOpt2_2의 지도를 나타낸 것이다.
도 147B 및 147C는 pBBR5HGSOpt2_2 (서열번호 42)의 뉴클레오타이드 서열을 나타낸 것이다.
도 148은 CER 대 IPTG (4 x 50 μmol) 또는 IPTG (2 x 100 μmol)로 유도되거나, 유도되지 않은 MCM401 균주에 대한 발효 시간의 그래프를 나타낸 것이다.
도 149는 pH 조정되거나 조정되지 않은 사탕수수 용액에서 포도당의 농도를 살균 횟수 (cycles)의 함수 (일회 = 30분)로서 나타낸 것이다.
도 150은 포도당, 사탕수수, 및 전환된 사탕수수에서 슈도모나스 푸티다 F1 (Pseudomonas putida F1) 및 슈도모나스 플루오레센스 ATCC13525 (Pseudomonas fluorescens ATCC13525)의 성장 곡선 (시간의 함수로서 OD600 )을 나타낸 것이다.
도 151은 포도당, 사탕수수, 및 전환된 사탕수수에서 대장균 BL21(DE3), MG1655, ATCC11303 및 B REL 606의 성장 곡선 (시간 함수로서OD600 )을 나타낸 것이다.
도 152는 플라스미드 pET24 P.alba HGS의 지도를 나타낸 것이다.
도 153A 및 153B는 플라스미드 pET24 P.alba HGS의 뉴클레오타이드 서열 (서열번호 43)을 나타낸 것이다.
도 154는 플라스미드 EWL230를 제작하기 위하여 엔도뉴클레아제 소화에 사용되는 제한효소 부위 또한 BspHI 및 NcoI 부위 간 양립가능한 점착성 (cohesive) 말단을 보여주는 모식도를 나타낸 것이다.
도 155는 플라스미드 EWL230의 지도를 나타낸 것이다.
도 156A 및 156B는 플라스미드 EWL230의 뉴클레오타이드 서열 (서열번호 44)을 나타낸 것이다.
도 157은 플라스미드 EWL244를 제작하기 위하여 엔도뉴클레아제 소화에 사용되는 제한효소 부위 또한 NsiI 및 PstI 부위 간 양립가능한 점착성 말단을 보여주는 모식도를 나타낸 것이다.
도 158은 플라스미드 EWL244의 지도를 나타낸 것이다.
도 159A 및 159B는 플라스미드 EWL230의 뉴클레오타이드 서열 (서열번호 45)을 나타낸 것이다.
도 160A는 M. 마제이 고대 하부 경로 오페론의 지도를 나타낸 것이다.
도160B 및 도 160C는 M. 마제이 고대 하부 경로 오페론의 뉴클레오타이 서열 (서열번호 46)을 나타낸 것이다.
도 161A는 pET200D에서 M. 마제이 고대 하부로부터 나온 MCM376-MVK의 지도를 나타낸 것이다.
도 161B 및 161C는 pET200D에서 M. 마제이 고대 하부로부터 나온 MCM376-MVK의 뉴클레오타이드 서열 (서열번호 47)을 나타낸 것이다.
도 162는 플라스미드 pBBRCMPGI1.5-pgl의 지도를 나타낸 것이다.
도 163A 및 163B는 플라스미드 pBBRCMPGI1.5-pgl의 뉴클레오타이드 서열 (서열번호 48)을 나타낸 것이다.
도 164A 내지 164F는 M. 마제이 메발로네이트 키나제, P. 알바 이소프렌 합성효소, 및 pgl (RHM111608-2)을 발현하고, 15-L 규모의 회분식 배양에서 자라는 대장균 균주에 의한 이소프렌 생산의 그래프를 나타낸 것이다. 도 164A는 포도당을 첨가한 15-L 생물반응기 내의 광학 밀도의 시간 경과를 보여준다. 도 164B는 포도당을 첨가한 15-L 생물반응기 내의 이소프렌 역가의 시간 경과를 보여준다. 역가는 발효 액체배지 리터 당 생산된 이소프렌량으로서 정의된다. 이소프렌을 계산하는 방법: 59시간에서 생산된 누적 이소프렌, g/59시간에서 발효기 부피, L [=] g/L 액체배지. 도 164C도 역시 포도당을 첨가한 15-L 생물반응기 내의 이소프렌 역가의 시간 경과를 보여준다. 이소프렌을 계산하는 방법: t = 0 로부터 59시간까지 ∫(일시적 이소프렌 생산율, g/L/시간)dt [=] g/L 액체배지. 도 164D는 포도당을 첨가한 15-L 생물반응기로부터 생산된 전체 이소프렌의 시간 경과를 보여준다. 도 164E는 포도당을 첨가한 15-L 생물반응기 내 부피측정 생산도를 보여준다. 도 164F는 포도당을 첨가한 15-L 생물반응기 내의 이산화탄소 발생율 (CER), 또는 대사활성 프로파일을 보여준다.
도 165A 및 165B는 15L 생물반응기에서 발효로부터 나온 배출기체의 분석을 보여주는 그래프를 나타낸 것이다. 시료 A는 64.8 시간에 수집된 균주 RM111608-2이다. 시료 B는 34.5시간에 수집된 균주 EWL256이고 이는 대장균 BL21 (DE3), pCL 상부, cmR-gi1.2-yKKDyI, pTrcAlba-mMVK이었다. 수소는 시료 둘 다의 경우 기저선 (baseline) 이상으로 검출된다.
도 166A는 대표적인 바이오이소프렌TM 회수 유닛을 나타낸 것이다.
도 166B는 대표적인 바이오이소프렌TM 탈착/농축 설정을 나타낸 것이다.
도 167은 바이오이소프렌TM 산물의 GC/FID 크로마토그램을 나타낸 것이다. 물질은 99.7% 순수한 것으로 측정되었다.
도 168A 내지 도 168C는 알루미나 (B) 또는 실리카 (C)로의 처리 이전에 (A) 및 이후 (B)에 바이오이소프렌TM 시료의 GC/FID 크로마토그램을 나타낸 것이다. 이들 크로마토그램에서 이소프렌 피크는 도시되지 않는다.
도 169는 발효 배출-기체로부터 이소프렌을 정제하는 방법 및 관련 장치의 모식도를 나타낸 것이다.
도 170은 부분적으로 수소화된 바이오이소프렌TM 단일체 (monomer)의 GC/FID 크로마토그램을 나타낸 것이다. 화합물 1 (RT = 12.30분) = 3-메틸-1-부텐, 화합물 2 (RT = 12.70분) = 2-메틸부탄, 화합물 3 (RT = 13.23분) = 2-메틸-1-부텐, 화합물 4 (RT = 13.53분) = 이소프렌, 화합물 5 (RT = 14.01분) = 2-메틸-2-부텐.
도 171은 2-메틸-2-부텐의 앰버리스트-15 (Amberlyst-15) 산 레진-촉매된 이중합으로부터 유래한 산물에 대한 GC/MS 전체 이온 크로마토그램을 나타낸 것이다.
도 172는 바이오이소프렌TM 단일체의 앰버리스트-15 산 레진-촉매된 올리고중합 (oligomerization)으로부터 유래한 산물을 위한 GC/MS 전체 이온 크로마토그램을 나타낸 것이다.
도 173은 이중합 반응기를 사용한 C5 스트림의 C10/C15 산물 스트림으로 전환을 위한 공정 (process flow) 모식도를 나타낸 것이다. C5 스트림은 바이오이소프렌TM 단일체 및/또는 바이오이소프렌TM 단일체의 C5 유도체를 포함한다.
도 2는 pTrcKudzu의 지도를 나타낸 것이다.
도 3A 내지 3C는 pTrcKudzu (서열번호 2)의 뉴클레오타이드 서열을 나타낸 것이다. RBS는 밑줄로 표시되고, 쿠쥬 이소프렌 합성효소의 시작 코돈은 굵은 대문자로 표시되며 종결 코돈도 굵은 대문자로 표시된다. 벡터 골격은 pTrcHis2B이다.
도 4는 pETNHisKudzu의 지도를 나타낸 것이다.
도 5A 내지 5C는 pETNHisKudzu의 뉴클레오타이드 서열 (서열번호 3)을 나타낸 것이다.
도 6은 pCL-lac-Kudzu의 지도를 나타낸 것이다.
도 7A 내지 7C는 pCL-lac-Kudzu의 뉴클레오타이드 서열 (서열번호 4)을 나타낸 것이다.
도 8A는 벡터가 없는 대장균 BL21 에서 이소프렌의 생산을 보여주는 그래프를 나타낸 것이다.
도 8B는 pCL-lac-Kudzu 를 사용하여 대장균 BL21 에서 이소프렌의 생산을 보여주는 그래프를 나타낸 것이다.
도 8C는 pTrcKudzu를 사용하여 대장균 BL21 에서 이소프렌의 생산을 보여주는 그래프를 나타낸 것이다.
도 8D는 pETN-HisKudzu 를 사용하여 대장균 BL21 에서 이소프렌의 생산을 보여주는 그래프를 나타낸 것이다.
도 9A 는 14 리터 사료첨가 회분식 발효 (fed batch fermentation)에서 대장균 BL21/pTrcKudzu 발효의 OD 오버타임을 보여주는 그래프를 나타낸 것이다.
도 9B는 14 리터 회분식 발효에서 대장균 BL21/pTrcKudzu 발효의 이소프렌 생산 오버타임을 보여주는 그래프를 나타낸 것이다.
도 10A는 판테오아 시트레아 (Panteoa citrea)에서 이소프렌의 생산을 보여주는 그래프를 나타낸 것이다. 대조군 세포는 재조합 쿠쥬 이소프렌 합성효소가 없음. 회색 다이아몬드는 이소프렌 합성효소를 나타내고, 검은색 네모는 OD600을 나타낸다.
도 10B 는 pCL-lac Kudzu를 발현하는 판테오아 시트레아에서 이소프렌의 생산을 보여주는 그래프를 나타낸 것이다. 회색 다이아몬드는 이소프렌 합성효소를 나타내고, 검은색 네모는 OD600을 나타낸다.
도 10C 는 pTrcKudzu 를 발현하는 판테오아 시트레아에서 이소프렌의 생산을 보여주는 그래프를 나타낸 것이다. 회색 다이아몬드는 이소프렌 합성효소를 나타내고, 검은색 네모는 OD600을 나타낸다.
도 11은 재조합 이소프렌 합성효소를 발현하는 바실러스 섭틸리스 (Bacillus subtilis)에서 이소프렌의 생산을 보여주는 그래프를 나타낸 것이다. BG3594comK 는 플라스미드 (천연 그대로의 이소프렌 생산)가 없는 B. 섭틸리스 균주이다. CF443 는 pBSKudzu (재조합 이소프렌 생산)을 가지는 B. 섭틸리스 균주 BG3594comK이다. Y-축 상의 IS는 이소프렌을 표시한다.
도 12A 내지 12C 는 pBS Kudzu #2의 뉴클레오타이드 서열 (서열번호 5)를 나타낸 것이다.
도 13은 야로위야 (Yarrowia)에서 발현을 위해 코돈-최적화된 쿠쥬 이소프렌 합성효소 유전자의 뉴클레오타이드 서열 (서열번호 6)을 나타낸 것이다.
도 14는야로위야에서 발현을 위해 코돈-최적화된 쿠쥬 이소프렌 합성효소 유전자를 포함하는 pTrex3g의 지도를 나타낸 것이다.
도 15A 내지 15C는 벡터pSPZ1(MAP29Spb)의 뉴클레오타이드 서열 (서열번호 7)을 나타낸 것이다.
도 16은 는야로위야에서 발현을 위해 코돈-최적화된 합성 쿠쥬 (푸에라리아 몬타나 (Pueraria montana)) 이소프렌 합성효소 유전자의 뉴클레오타이드 서열 (서열번호 8)을 나타낸 것이다.
도 17은 합성 하이브리드 포풀라 (포풀라 알바 (Populus alba) x 포풀라 트레물라 (Populus tremula)) 이소프렌 합성효소 유전자의 뉴클레오타이드 서열 (서열번호 9)을 나타낸 것이다. ATG 시작 코돈은 굵은 문자로 표시하고 종결 코돈은 밑줄로 표시한다.
도 18A (도 18A1 및 18A2)는 벡터 pYLA 1, pYL1 및 pYL2의 도식적 윤곽 제작 (서열번호 75, 73, 72, 71, 70, 69)을 나타낸 것이다.
도 18B는 벡터 pYLA(POP1)의 도식적 윤곽 제작을 나타낸 것이다.
도 18C는 벡터 pYLA(KZ1)의 도식적 윤곽 제작을 나타낸 것이다.
도 18D는 벡터 pYLI(KZ1)의 도식적 윤곽 제작을 나타낸 것이다.
도 18E는 벡터 pYLI(MAP29)의 도식적 윤곽 제작을 나타낸 것이다.
도 18F는 벡터 pYLA(MAP29)의 도식적 윤곽 제작을 나타낸 것이다.
도 19A는 이소프렌을 위한 MVA 및 DXP 대사 경로 (F. Bouvier et al., Progress in Lipid Res. 44: 357-429, 2005에 근거하고 있음)를 나타낸 것이다. 하기 기술내용은 경로에 있는 각 폴리펩타이드에 대한 대안의 명칭 및 표시된 폴리펩타이드의 활성을 측정하는 분석법을 기재하고 있는 참고문헌을 포함한다 (이들 참고문헌의 각각은 본 명서세에서 전부, 상세하게는 MVA 및 DXP 경로에서의 폴리펩타이드를 위한 폴리펩타이드 활성 분석법에 관하여 참고문헌으로 통합되어 있다). 메발로네이트 경로: AACT; 아세틸-CoA 아세틸전이효소 (MvaE), EC 2.3.1.9. 분석법: J. Bacteriol., 184: 2116-2122, 2002; HMGS; 하이드록시메틸글루타릴-CoA 합성효소, MvaS, EC 2.3.3.10. 분석법: J. Bacteriol., 184: 4065-4070, 2002; HMGR; 3-하이드록시-3-메틸글루타릴-CoA 환원효소, MvaE, EC 1.1.1.34. 분석법: J. Bacteriol., 184: 2116-2122, 2002; MVK; 메발로네이트 키나제, ERG12, EC 2.7.1.36. 분석법: Curr Genet 19:9-14, 1991. PMK; 포스포메발로네이트 키나제, ERG8, EC 2.7.4.2, 분석법: Mol Cell Biol., 11:620-631, 1991; DPMDC; 디포스포메발로네이트 탈탄산화효소, MVD1, EC 4.1.1.33. 분석법: Biochemistry, 33:13355-13362, 1994; IDI; 이소펜테닐-디포스페이트 델타-이소머라제, IDI1, EC 5.3.3.2. 분석법: J. Biol. Chem. 264:19169-19175, 1989. DXP Pathway: DXS; 1-디옥시자일루로스-5-포스페이트 합성효소, dxs, EC 2.2.1.7. 분석법: PNAS, 94:12857-62, 1997; DXR; 1-디옥시-D-자일루로스 5-포스페이트 환원이소머라제, dxr, EC 2.2.1.7. 분석법: Eur. J. Biochem. 269:4446-4457, 2002; MCT; 4-디포스포사이티딜-2C-메틸-에리트리톨 합성효소, IspD, EC 2.7.7.60. 분석법: PNAS, 97: 6451-6456, 2000; CMK; 4-디포스포사이티딜-2-C-메틸-D-에리트리톨 키나제, IspE, EC 2.7.1.148. 분석법: PNAS, 97:1062-1067, 2000; MCS; 2C-메틸-D-에리트리톨 2,4-사이클로디포스페이트 합성효소, IspF, EC 4.6.1.12. 분석법: PNAS, 96:11758-11763, 1999; HDS; 1-하이드록시-2-메틸-2-(E)-부테닐 4-디포스페이트 합성효소, ispG, EC 1.17.4.3. 분석법: J. Org. Chem., 70:9168-9174, 2005; HDR; 1-하이드록시-2-메틸-2-(E)-부테닐 4-디포스페이트 환원효소, IspH, EC 1.17.1.2. 분석법: JACS, 126:12847-12855, 2004.
도 19B는 고전적 및 변형된 MVA 경로를 나타낸 것이다. 1. 아세틸-CoA 아세틸전이효소 (AACT); 2, HMG-CoA 합성효소 (HMGS); 3, HMG-CoA 환원효소 (HMGR); 4, 메발로네이트 키나제 (MVK); 5, 포스포메발로네이트 키나제 (PMK); 6, 디메발로네이트 키나제 (MVD 또는 DPMDC); 7, 이소펜테닐 디포스페이트 이소머라제 (IDI); 8, 포스포메발로네이트 탈탄산화효소 (PMDC); 9, 이소펜테닐 포스페이트 키나제 (IPK). 고전적 MVA 경로는 반응 1로부터 반응 5 및 반응 6을 통해 반응 7까지 진행되는 한편, 변형된 MVA 경로는 반응 8 및 반응 9를 통과한다. 구조 화학식에서 P 및 PP는 각각 포스페이트 및 피로포스페이트이다. 본 도면은 고가 및 모리 문헌 Koga and Morii, Microbiology and Mol. Biology Reviews, 71:97-120, 2007으로부터 가져왔고, 이는 본 명세서에서 전부, 상세하게는 변형된 MVA 경로의 핵산 및 폴리펩타이드에 관하여 참고문헌으로 통합되어 있다. 변형된 MVA 경로는 예를 들어 메타노사르시나 마제이 (Methanosarcina mazei)와 같은 일부 고생물에서 존재한다.
도 20 (도 20A 및 20B)은 쿠쥬 이소프렌 합성효소 유전자가 없거나 (왼쪽) 이를 가지는 (오른쪽) 재조합 Y. 리포리티카 (Y. lipolytica) 균주에 의한 이소프렌 생산의 GC-MS 분석 결과를 보여주는 그래프를 나타낸 것이다.
도 21은 pTrcKudzu yIDI DXS Kan의 지도를 나타낸 것이다.
도22A 내지 22D는 pTrcKudzu yIDI DXS Kan의 뉴클레오타이드 서열 (서열번호 10)을 나타낸 것이다.
도23A는 대장균 BL21/pTrcKudzukan에서 포도당으로부터 이소프렌의 생산을 보여주는 그래프를 나타낸 것이다. 시간 0는 IPTG (400 μmol)로 유도한 시간이다. x-축은 유도 이후 시간이고; y-축은 OD600이며 y2-축은 이소프렌의 전체 생산도 (μg/L 상부공간) 또는 특이 생산도 (μg/L 상부공간/OD)이다. 다이아몬드는 OD600을 표시하고, 원은 전체 이소프렌 생산도 (μg/L)를 표시하며 네모는 이소프렌의 특이 생산도 (μg/L/OD)를 표시한다.
도23B는 대장균 BL21/pTrcKudzu yIDI kan에서 포도당으로부터 이소프렌의 생산을 보여주는 그래프를 나타낸 것이다. 시간 0는 IPTG (400 μmol)로 유도한 시간이다. x-축은 유도 이후 시간이고; y-축은 OD600이며 y2-축은 이소프렌의 전체 생산도 (μg/L 상부공간) 또는 특이 생산도 (μg/L 상부공간/OD)이다. 다이아몬드는 OD600을 표시하고, 원은 전체 이소프렌 생산도 (μg/L)를 표시하며 네모는 이소프렌의 특이 생산도 (μg/L/OD)를 표시한다.
도23C는 대장균 BL21/pTrcKudzu DXS kan에서 포도당으로부터 이소프렌의 생산을 보여주는 그래프를 나타낸 것이다. 시간 0는 IPTG (400 μmol)로 유도한 시간이다. x-축은 유도 이후 시간이고; y-축은 OD600이며 y2-축은 이소프렌의 전체 생산도 (μg/L 상부공간) 또는 특이 생산도 (μg/L 상부공간/OD)이다. 다이아몬드는 OD600을 표시하고, 원은 이소프렌의 전체 생산도 (μg/L)를 표시하며 네모는 이소프렌의 특이 생산도 (μg/L/OD)를 표시한다.
도23D는 대장균 BL21/pTrcKudzu yIDI DXS kan에서 포도당으로부터 이소프렌의 생산을 보여주는 그래프를 나타낸 것이다. 시간 0는 IPTG (400 μmol)로 유도한 시간이다. x-축은 유도 이후 시간이고; y-축은 OD600이며 y2-축은 이소프렌의 전체 생산도 (μg/L 상부공간) 또는 특이 생산도 (μg/L 상부공간/OD)이다. 다이아몬드는 OD600을 표시하고, 원은 전체 이소프렌 생산도 (μg/L)를 표시하며 네모는 이소프렌의 특이 생산도 (μg/L/OD)를 표시한다.
도23E는 대장균 BL21/ pCL PtrcKudzu에서 포도당으로부터 이소프렌의 생산을 보여주는 그래프를 나타낸 것이다. 시간 0는 IPTG (400 μmol)로 유도한 시간이다. x-축은 유도 이후 시간이고; y-축은 OD600이며 y2-축은 이소프렌의 전체 생산도 (μg/L 상부공간) 또는 특이 생산도 (μg/L 상부공간/OD)이다. 다이아몬드는 OD600을 표시하고, 원은 전체 이소프렌 생산도 (μg/L)를 표시하며 네모는 이소프렌의 특이 생산도 (μg/L/OD)를 표시한다.
도23F는 대장균 BL21/ pCL PtrcKudzu yIDI에서 포도당으로부터 이소프렌의 생산을 보여주는 그래프를 나타낸 것이다. 시간 0는 IPTG (400 μmol)로 유도한 시간이다. x-축은 유도 이후 시간이고; y-축은 OD600이며 y2-축은 이소프렌의 전체 생산도 (μg/L 상부공간) 또는 특이 생산도 (μg/L 상부공간/OD)이다. 다이아몬드는 OD600을 표시하고, 원은 전체 이소프렌 생산도 (μg/L)를 표시하며 네모는 이소프렌의 특이 생산도 (μg/L/OD)를 표시한다.
도23G는 대장균 BL21/ pCL PtrcKudzu DXS에서 포도당으로부터 이소프렌의 생산을 보여주는 그래프를 나타낸 것이다. 시간 0는 IPTG (400 μmol)로 유도한 시간이다. x-축은 유도 이후 시간이고; y-축은 OD600이며 y2-축은 이소프렌의 전체 생산도 (μg/L 상부공간) 또는 특이 생산도 (μg/L 상부공간/OD)이다. 다이아몬드는 OD600을 표시하고, 원은 전체 이소프렌 생산도 (μg/L)를 표시하며 네모는 이소프렌의 특이 생산도 (μg/L/OD)를 표시한다.
도23H는 대장균 BL21/pTrcKudzuIDIDXSkan에서 포도당으로부터 이소프렌의 생산을 보여주는 그래프를 나타낸 것이다. 시간 0는 IPTG (400 μmol)로 유도한 시간이다. x-축은 유도 이후 시간이고; y-축은 OD600이며 y2-축은 이소프렌의 전체 생산도 (μg/L 상부공간) 또는 특이 생산도 (μg/L 상부공간/OD)이다. 다이아몬드는 OD600을 표시하고, 원은 전체 이소프렌 생산도 (μg/L)를 표시하며 네모는 이소프렌의 특이 생산도 (μg/L/OD)를 표시한다.
도 24는 pTrcKKDyIkIS kan의 지도를 나타낸 것이다.
도 25A 내지 25D는 pTrcKKDyIkIS kan의 뉴클레오타이드 서열 (서열번호 11)을 나타낸 것이다.
도 26은 pCL PtrcUpperPathway의 지도를 나타낸 것이다.
도 27A 내지 27D는 pCL PtrcUpperPathway의 뉴클레오타이드 서열 (서열번호 12)를 나타낸 것이다.
도 28은 B. 섭틸리스 (B. subtilis) 염색체의 nprE 좌위 (locus) 내로 도입하기 위한 하부 MVA 경로 및 효모 idi를 포함하는 카세트의 지도를 나타낸 것이다. 상류 (upstream)/하류 (downstream) nprE는 도입을 위한 nprE 좌위로부터 각 1kb의 서열을 표시한다. aprE 프로모터 (알칼라인 세린 프로테아제 프로모터 (alkaline serine protease promoter))는 aprE 유전자의 프로모터 (-35, -10, +1 전사 시작 부위, RBS)를 표시한다. MVK1는 효모 메발로네이트 키나제 유전자를 표시한다. RBS-PMK는 바실러스의 시작 부위의 RBS 상류를 가진 효모 포스포메발로네이트 키나제 유전자를 표시한다. RBS-MPD는 바실러스의 시작 부위의 RBS 상류를 가진 효모 디포스포메발로네이트 탈탄산화효소 유전자를 표시한다. RBS-IDI는 바실러스의 시작 부위의 RBS 상류를 가진 효모 idi 유전자를 표시한다. 종결인자 (terminator)는 B. 아밀리크파시엔스 (B. amyliquefaciens)로부터 나온 종결인자 알칼라인 세린 프로테아제 전사 종결인자를 표시한다. SpecR은 스펙티노마이신 저항성 마커 (spectinomycin resistance marker)를 표시한다. "amp을 위한 nprE 상류 반복서열 (nprE upstream repeat for amp)"는 증폭 (amplification)하는 데 사용되는 상류 부위의 직접 반복서열 (direct repeat)을 표시한다.
도 29A 내지 29D는 B. 섭틸리스 염색체의 nprE 좌위 내로 도입하기 위한 하류 MVA 경로 및 효모 idi를 포함하는 카세트의 뉴클레오타이드 서열 (서열번호 13)을 나타낸 것이다.
도 30은 p9796-poplar의 지도를 나타낸 것이다.
도 31A 및 31B는 p9796-poplar의 뉴클레오타이드 서열 (서열번호 14)을 나타낸 것이다.
도 32는 pTrcPoplar의 지도를 나타낸 것이다.
도 33A 내지 33C는 pTrcPoplar의 뉴클레오타이드 서열 (서열번호 15)을 나타낸 것이다.
도 34는 pTrcKudzu yIDI Kan의 지도를 나타낸 것이다.
도 35A 내지 35C는 pTrcKudzu yIDI Kan의 뉴클레오타이드 서열 (서열번호 16)을 나타낸 것이다.
도 36은 pTrcKudzuDXS Kan의 지도를 나타낸 것이다.
도 37A 내지 37C는 pTrcKudzuDXS Kan의 뉴클레오타이드 서열 (서열번호 17)을 나타낸 것이다.
도 38은 pCL PtrcKudzu의 지도를 나타낸 것이다.
도 39A 내지 39C는 pCL PtrcKudzu의 뉴클레오타이드 서열 (서열번호 18)을 나타낸 것이다.
도 40은 pCL PtrcKudzu A3의 지도를 나타낸 것이다.
도 41A 내지 41C는 pCL PtrcKudzu A3의 뉴클레오타이드 서열 (서열번호 19)을 나타낸 것이다.
도 42는 pCL PtrcKudzu yIDI의 지도를 나타낸 것이다.
도 43A 내지 43C는 pCL PtrcKudzu yIDI의 뉴클레오타이드 서열 (서열번호 20)을 나타낸 것이다.
도 44는 pCL PtrcKudzu DXS의 지도를 나타낸 것이다.
도 45A 내지 45D는 pCL PtrcKudzu DXS의 뉴클레오타이드 서열 (서열번호 21)을 나타낸 것이다.
도 46A 내지 46E는 바이오매스 공급원료로부터 이소프렌의 생산을 보여주는 그래프를 나타낸 것이다. 패널 A는 옥수수 스토버 (corn stover)으로부터 이소프렌의 생산을 보여주고, 패널 B는 사탕수수 찌꺼기 (baggasse)로부터 이소프렌의 생산을 보여주며, 패널 C는 연목질 펄프 (softwood pulp)로부터 이소프렌의 생산을 보여주고, 패널 D는 포도당으로부터 이소프렌의 생산, 또한 패널 E는 추가적인 공급원료가 전혀 없이 세포로부터 이소프렌의 생산을 보여준다. 회색 네모는 접종후 지정된 시간에서 배양의 OD600 측정을 표시하고 검은색 세모는 접종-이후 지정된 시간에서 이소프렌의 생산을 표시한다.
도 47A는 첨가된 포도당이 전혀 없는 배양에서 대장균 BL21 (λDE3) pTrcKudzu yIDI DXS (kan)에 의한 이소프렌 생산을 보여주는 그래프를 나타낸 것이다. 네모는 OD600를 표시하고, 세모는 생산된 이소프렌 (μg/ml)을 표시한다.
도 47B는 1% 포도당 공급원료인 역슈가 (invert sugar)으로부터 대장균 BL21 (λDE3) pTrcKudzu yIDI DXS (kan)에 의한 이소프렌 생산을 보여주는 그래프를 나타낸 것이다. 네모는 OD600를 표시하고, 세모는 생산된 이소프렌 (μg/ml)을 표시한다.
도 47C는 1% 역 설탕 공급원료로부터 대장균 BL21 (λDE3) pTrcKudzu yIDI DXS (kan)에 의한 이소프렌 생산을 보여주는 그래프를 나타낸 것이다. 네모는 OD600를 표시하고, 세모는 생산된 이소프렌 (μg/ml)을 표시한다.
도 47D는 1% AFEX 옥수수 스토버 공급원료로부터 대장균 BL21 (λDE3) pTrcKudzu yIDI DXS (kan)에 의한 이소프렌 생산을 보여주는 그래프를 나타낸 것이다. 네모는 OD600를 표시하고, 세모는 생산된 이소프렌 (μg/ml)을 표시한다.
도 48A 내지 48C는 이소프렌 생산에서 효모 추출물의 효과를 보여주는 그래프를 나타낸 것이다. 패널 A는 다양한 양의 효모 추출물을 첨가한 발효기 내의 광학 밀도의 시간 경과를 보여준다. 패널 B는 다양한 양의 효모 추출물을 첨가한 발효기 내의 이소프렌 역가의 시간 경과를 보여준다. 역가는 발효 액체배지 리터 당 생산된 이소프렌량으로서 정의된다. 패널 C는 사료첨가-회분식 배양 (fed-batch culture)에서 자란 대장균에서 이소프렌 생산에 미치는 효모 추출물의 효과를 보여준다.
도 49A 내지 49C는 pTrcKudzu + yIDI + DXS 플라스미드를 포함하는 대장균 세포를 사용하여 500-L 생물반응기 (bioreactor)로부터 이소프렌의 생산을 보여주는 그래프를 나타낸 것이다. 패널 A는 포도당 및 효모 추출물을 첨가한 500-L 생물반응기 내의 광학 밀도의 시간 경과를 보여준다. 패널 B는 포도당 및 효모 추출물을 첨가한 500-L 생물반응기 내의 이소프렌 역가의 시간 경과를 보여준다. 패널 C는 포도당 및 효모 추출물을 첨가한 500-L 생물반응기 로부터 생산된 전체 이소프렌의 시간 경과를 보여준다.
도 50은 pJMupperpathway2의 지도를 나타낸 것이다.
도 51A 내지 51C는 pJMupperpathway2의 뉴클레오타이드 서열 (서열번호 22)을 나타낸 것이다.
도 52는 pBS Kudzu #2의 지도를 나타낸 것이다.
도 53A는 14 리터 회분식 발효에서 재조합 쿠쥬 이소프렌 합성효소를 발현하는 바실러스의 발효 시간 동안의 성장을 보여주는 그래프를 나타낸 것이다. 검은색 다이아몬드는 재조합 이소프렌 합성효소가 없는 (천연 그대로의 이소프렌 생산) 대조군 균주 (BG3594comK)를 표시하고 회색 세모는 pBSKudzu를 가진CF443, 바실러스 균주 BG3594comK (재조합 이소프렌 생산)을 표시한다.
도 53B는 14 리터 회분식 발효에서 재조합 쿠쥬 이소프렌 합성효소를 발현하는 바실러스의 발효 시간 동안의 이소프렌 생산을 보여주는 그래프를 나타낸 것이다. 검은색 다이아몬드는 재조합 이소프렌 합성효소가 없는 (천연 그대로의 이소프렌 생산) 대조군 균주 (BG3594comK)를 표시하고 회색 세모는 pBSKudzu를 가진CF443, 바실러스 균주 BG3594comK (재조합 이소프렌 생산)을 표시한다.
도 54는 포도당을 첨가한 15-L 생물반응기 내의 광학 밀도의 시간 경과를 나타낸 것이다.
도 55는 포도당을 첨가한 15-L 생물반응기 내의 이소프렌 역가의 시간 경과를 나타낸 것이다.
도 56은 포도당을 첨가한 15-L 생물반응기로부터 생산된 전체 이소프렌의 시간 경과를 나타낸 것이다.
도 57은 글리세롤을 첨가한 15-L 생물반응기 내의 광학 밀도의 시간 경과를 나타낸 것이다.
도 58은 글리세롤을 첨가한 15-L 생물반응기 내의 이소프렌 역가의 시간 경과를 나타낸 것이다. 역가는 발효 액체배지 리터 당 생산된 이소프렌량으로서 정의된다.
도 59는 글리세롤을 첨가한 15-L 생물반응기로부터 생산된 전체 이소프렌의 시간 경과를 나타낸 것이다.
도 60A 내지 60C는 포도당을 첨가한 150-L 생물반응기 내의 광학 밀도, 메발론산 역가, 및 특이 생산도의 시간 경과를 나타낸 것이다.
도 61A 내지 61C는 포도당을 첨가한 150-L 생물반응기 내의 광학 밀도, 메발론산 역가, 및 특이 생산도의 시간 경과를 나타낸 것이다.
도 62A 내지 62C는 포도당을 첨가한 150-L 생물반응기 내의 광학 밀도, 메발론산 역가, 및 특이 생산도의 시간 경과를 나타낸 것이다.
도 63A 내지 63C는 포도당을 첨가한 150-L 생물반응기 내의 광학 밀도, 메발론산 역가, 및 특이 생산도의 시간 경과를 나타낸 것이다.
도 64A 내지 64C는 포도당을 첨가한 150-L 생물반응기 내의 광학 밀도, 메발론산 역가, 및 특이 생산도의 시간 경과를 나타낸 것이다.
도 65A 내지 65C는 포도당을 첨가한 150-L 생물반응기 내의 광학 밀도, 메발론산 역가, 및 특이 생산도의 시간 경과를 나타낸 것이다.
도 66A 내지 66C는 포도당을 첨가한 150-L 생물반응기 내의 광학 밀도, 메발론산 역가, 및 특이 생산도의 시간 경과를 나타낸 것이다.
도 67A 내지 67C는 포도당을 첨가한 150-L 생물반응기 내의 광학 밀도, 메발론산 역가, 및 특이 생산도의 시간 경과를 나타낸 것이다.
도 68은 A 시리즈를 위한 계산된 단열 발화 온도 (adiabatic flame temperatures)의 그래프를 다양한 산소 수준에 대한 연료 농도의 함수로서 나타낸 것이다. 도면 설명은 그래프로 표현된 곡선을 순서대로 나열하고 있다. 예를 들어, 도면 설명의 첫 번째 순서 (40℃에서 대기 내의 이소프렌)는 그래프에서 가장 높은 곡선에 해당한다.
도 69는 A 시리즈를 위한 계산된 단열 발화 온도의 그래프를 4% 물을 가진 다양한 산소 수준에 대한 연료 농도의 함수로서 나타낸 것이다. 도면 설명은 그래프로 표현된 곡선을 순서대로 나열하고 있다.
도 70은 A 시리즈를 위한 계산된 단열 발화 온도의 그래프를 5% CO2를 가진 다양한 산소 수준에 대한 연료 농도의 함수로서 나타낸 것이다. 도면 설명은 그래프로 표현된 곡선을 순서대로 나열하고 있다.
도 71은 A 시리즈를 위한 계산된 단열 발화 온도의 그래프를 10% CO2를 가진 다양한 산소 수준에 대한 연료 농도의 함수로서 나타낸 것이다. 도면 설명은 그래프로 표현된 곡선을 순서대로 나열하고 있다.
도 72는 A 시리즈를 위한 계산된 단열 발화 온도의 그래프를 15% CO2를 가진 다양한 산소 수준에 대한 연료 농도의 함수로서 나타낸 것이다. 도면 설명은 그래프로 표현된 곡선을 순서대로 나열하고 있다.
도 73은 A 시리즈를 위한 계산된 단열 발화 온도의 그래프를 20% CO2를 가진 다양한 산소 수준에 대한 연료 농도의 함수로서 나타낸 것이다. 도면 설명은 그래프로 표현된 곡선을 순서대로 나열하고 있다.
도 74는 A 시리즈를 위한 계산된 단열 발화 온도의 그래프를 30% CO2를 가진 다양한 산소 수준에 대한 연료 농도의 함수로서 나타낸 것이다. 도면 설명은 그래프로 표현된 곡선을 순서대로 나열하고 있다.
도 75A는 A 시리즈에 대한 무게 퍼센트 대 부피 퍼센트로부터 나온 CAFT 모델 결과의 전환 (conversion) 표를 나타낸 것이다.
도 75B는 부피 퍼센트로서 좌표 표시된 도 69에서 A 시리즈에 대한 CAFT 모델로부터 나온 발화도 (flammability) 결과의 그래프를 나타낸 것이다.
도 76A는 B 시리즈에 대한 무게 퍼센트 대 부피 퍼센트로부터 나온 CAFT 모델 결과의 전환 표를 나타낸 것이다.
도 76B는 부피 퍼센트로서 좌표 표시된 도 69에서 B 시리즈에 대한 CAFT 모델로부터 나온 발화도 결과의 그래프를 나타낸 것이다.
도 77은 발화도 테스트 용기를 묘사한 도면을 나타낸 것이다.
도 78A는 테스트 시리즈 1에 대한 발화도 곡선의 그래프를 나타낸 것이다: 0% 스트림, 0 psig, 및 40℃.
도 78B는 테스트 시리즈 1에 대한 폭발 및 비-폭발 데이터 좌표를 요약한 표를 나타낸 것이다.
도 78C는 CAFT 모델과 비교한 테스트 시리즈 1에 대한 발화도 곡선의 그래프를 나타낸 것이다.
도 79A는 테스트 시리즈 2에 대한 발화도 곡선의 그래프를 나타낸 것이다: 4% 스트림, 0 psig, 및 40℃.
도 79B는 테스트 시리즈 2에 대한 폭발 및 비-폭발 데이터 좌표를 요약한 표를 나타낸 것이다.
도 79C는 CAFT 모델과 비교한 테스트 시리즈 2에 대한 발화도 곡선의 그래프를 나타낸 것이다.
도 80A 및 80B는 상세한 실험적 조건 및 테스트 시리즈 1에 대한 결과의 표를 나타낸 것이다.
도 81은 상세한 실험적 조건 및 테스트 시리즈 2에 대한 결과의 표를 나타낸 것이다.
도 82는 3기압에서 다양한 질소/산소 비율에 대한 연료 농도의 함수로서 좌표 표시된 계산된 단열 발화 온도의 그래프를 나타낸 것이다.
도 83은 1기압에서 다양한 질소/산소 비율에 대한 연료 농도의 함수로서 좌표 표시된 계산된 단열 발화 온도의 그래프를 나타낸 것이다.
도 84는 도 82으로부터 나온 데이터 및 실시예 13에 기술된 방법론을 사용하여 제작된 발화도 한계의 그래프를 나타낸 것이다. 실험적 데이터 좌표 (원)은 본 명세서에 기술된 테스트로부터 나오고 1 기압의 초기 시스템 압력에서 수행되었다.
도 85는 도 83으로부터 나온 데이터 및 실시예 13에 기술된 방법론을 사용하여 제작된 발화도 한계의 그래프를 나타낸 것이다. 실험적 데이터 좌표 (원)은 본 명세서에 기술된 테스트로부터 나오고 1기압의 초기 시스템 압력에서 수행되었다.
도 86A는 발효 배출-기체의 GC/MS 크로마토그램을 나타낸 것이다.
도 86B은 발효 배출-기체에 존재하는 소수의 휘발성 물질을 보여주는 도 86A의 연장선이다.
도 87A는 -78℃에서 냉동-포획에 이어서 배출-기체에 존재하는 소량 휘발성 물질의 GC/MS 크로마토그램을 나타낸 것이다.
도 87B는 -196℃에서 냉동-포획에 이어서 배출-기체에 존재하는 소량 휘발성 물질의 GC/MS 크로마토그램을 나타낸 것이다.
도 87C는 도 87B의 연장선을 나타낸 것이다.
도 87D는 도 87C의 연장선을 나타낸 것이다.
도 88A 및 88B는 석유-유래 이소프렌 (도 88A)로부터 나온 C5 탄화수소와 생물학적으로 생산된 이소프렌 (도 88B)를 비교하는 GC/MS 크로마토그램을 나타낸 것이다. 표준은 주요 이소프렌 피크 주변에서 용출되는 세 가지의 D5 탄화수소 불순물을 포함한다 (도 88A). 대조적으로, 생물학적으로 생산된 이소프렌은 많은 에탄올 및 아세톤 (3.41분의 진행 시간)을 포함한다 (도 88A).
도 89는 쿠쥬 이소프렌 합성효소를 발현하고 3 g/L 효모 추출물과 함께 포도당으로 배양된 대장균 BL21(DE3) pTrcIS 균주의 발효 배출-기체 분석의 그래프를 나타낸 것이다.
도 90은 이소프렌과 구조적으로 유사하고 또한 다중합반응 촉매 독 (catalyst poisons)으로서 작용하는 여러 가지 분순물들의 구조를 나타낸 것이다.
도 91은 pTrcHis2AUpperPathway (pTrcUpperMVA라고도 명명됨)의 지도를 나타낸 것이다.
도92A 내지92C는 pTrcHis2AUpperPathway (pTrcUpperMVA라고도 명명됨)의 뉴클레오타이드 서열 (서열번호 23)을 나타낸 것이다.
도 93은 포도당을 첨가한 15-L 생물반응기 내의 광학 밀도의 시간 경과를 나타낸 것이다.
도 94는 포도당을 첨가한 15-L 생물반응기 내의 이소프렌 역가의 시간 경과를 나타낸 것이다. 역가는 발효 액체배지 리터 당 생산된 이소프렌량으로서 정의된다.
도 95는 포도당을 첨가한 15-L 생물반응기로부터 생산된 전체 이소프렌의 시간 경과를 나타낸 것이다.
도 96은 역슈가를 첨가한 15-L 생물반응기 내의 광학 밀도의 시간 경과를 나타낸 것이다.
도 97은 역슈가를 첨가한 15-L 생물반응기 내의 이소프렌 역가의 시간 경과를 나타낸 것이다. 역가는 발효 액체배지 리터 당 생산된 이소프렌량으로서 정의된다.
도 98은 역슈가를 첨가한 15-L 생물반응기로부터 생산된 전체 이소프렌의 시간 경과를 나타낸 것이다.
도 99는 포도당을 첨가한 15-L 생물반응기 내의 광학 밀도의 시간 경과를 나타낸 것이다.
도 100은 포도당을 첨가한 15-L 생물반응기 내의 이소프렌 역가의 시간 경과를 나타낸 것이다. 역가는 발효 액체배지 리터 당 생산된 이소프렌량으로서 정의된다.
도 101은 포도당을 첨가한 15-L 생물반응기로부터 생산된 전체 이소프렌의 시간 경과를 나타낸 것이다.
도 102는 pCLPtrcUpperPathwayHGS2의 지도를 나타낸 것이다.
도103A 내지103C는 pCLPtrcUpperPathwayHGS2의 뉴클레오타이드 서열 (서열번호 24)을 나타낸 것이다.
도 104는 포도당을 첨가한 15-L 생물반응기 내의 광학 밀도의 시간 경과를 나타낸 것이다.
도 105은 포도당을 첨가한 15-L 생물반응기 내의 이소프렌 역가의 시간 경과를 나타낸 것이다. 역가는 발효 액체배지 리터 당 생산된 이소프렌량으로서 정의된다.
도 106은 포도당을 첨가한 15-L 생물반응기로부터 생산된 전체 이소프렌의 시간 경과를 나타낸 것이다.
도 107은 플라스미드 MCM330 (attTn7에서 FRT-cm-FRT-gi1.2-KKDy)의 지도를 나타낸 것이다.
도108A 내지108C는 플라스미드 MCM330의 뉴클레오타이드 서열 (서열번호 25)을 나타낸 것이다.
도 109는 pET24D-Kudzu의 지도를 나타낸 것이다.
도110A 및 110B는 pET24D-Kudzu의 뉴클레오타이드 서열 (서열번호 26)을 나타낸 것이다.
도 111A는 포도당을 첨가한 15-L 생물반응기 내의 광학 밀도의 시간 경과를 나타낸 것이다.
도 111B는 포도당을 첨가한 15-L 생물반응기 내의 이소프렌 역가의 시간 경과를 나타낸 것이다. 역가는 발효 액체배지 리터 당 생산된 이소프렌량으로서 정의된다.
도 111C는 포도당을 첨가한 15-L 생물반응기로부터 생산된 전체 이소프렌의 시간 경과를 나타낸 것이다.
도 112A는 M. 마제이 고대 하부 경로 오페론 (archaeal Lower Pathway operon)의 지도를 나타낸 것이다.
도 112B 내지 112C는 M. 마제이 고대 하부 경로 오페론의 뉴클레오타이드 서열 (서열번호 27)을 나타낸 것이다.
도 113A는 MCM382 -pTrcKudzuMVK(mazei)의 지도를 나타낸 것이다.
도113B 내지 113C는 MCM382 - pTrcKudzuMVK(mazei)의 뉴클레오타이드 서열 (서열번호 28)을 나타낸 것이다.
도 114A는 pET200D에서 M. 마제이 고대 하부로부터 나온 MCM376 - MVK의 지도를 나타낸 것이다.
도 114B 및 114C는pET200D에서 M. 마제이 고대 하부로부터 나온 MCM376 - MVK의 뉴클레오타이드 서열 (서열번호 29)을 나타낸 것이다.
도 115A 내지 115D는 MVK및 이소프렌 합성 효소의 과다-발현이 증가된 이소프렌의 생산을 유도하는 것을 나타낸 것이다. 이소프렌 생산 시 100 및 200 μM IPTG 유도를 사용하여 100 mL 생물반응기에서 포도당으로 성장하는 동안 MCM401 및 MCM343으로부터 나온 축적된 이소프렌 및 CO2는 22시간 시간 경과를 통하여 측정되었다. 도 115A는 MCM343로부터 나온 축적된 이소프렌 (%)의 그래프이다. 도 115B는 MCM401로부터 나온 축적된 이소프렌 (%)의 그래프이다. 도 115C는 MCM343로부터 나온 축적된 CO2 (%)의 그래프이다. 도 115D는 MCM401로부터 나온 축적된 CO2 (%)의 그래프이다.
도 116은 포도당을 첨가한 15-L 생물반응기 내의 광학 밀도의 시간 경과를 나타낸 것이다.
도 117은 포도당을 첨가한 15-L 생물반응기 내의 이소프렌 역가의 시간 경과를 나타낸 것이다. 역가는 발효 액체배지 리터 당 생산된 이소프렌량으로서 정의된다.
도 118은 포도당을 첨가한 15-L 생물반응기로부터 생산된 전체 이소프렌의 시간 경과를 나타낸 것이다.
도 119는 포도당을 첨가한 15-L 생물반응기 내의 전체 이산화탄소 발생율 (carbon dioxide evolution rate, TCER), 또는 대사활성 프로파일의 그래프를 나타낸 것이다.
도 120은 포도당을 첨가한 15-L 생물반응기 내에서 이소프렌 생산 동안 세포 생존도의 그래프를 나타낸 것이다. TVC/OD는 광학 밀도 단위 (OD550) 당 1 mL의 액체배지에서 전체 생존가능 계수 (콜로니 형성 단위)이다.
도 121은 포도당을 첨가한 15-L 생물반응기 내의 광학 밀도의 시간 경과를 나타낸 것이다.
도 122는 포도당을 첨가한 15-L 생물반응기 내의 이소프렌 역가의 시간 경과를 나타낸 것이다. 역가는 발효 액체배지 리터 당 생산된 이소프렌량으로서 정의된다.
도 123은 포도당을 첨가한 15-L 생물반응기로부터 생산된 전체 이소프렌의 시간 경과를 나타낸 것이다.
도 124는 포도당을 첨가한 15-L 생물반응기 내의 부피측정 생산도의 시간 경과를 나타낸 것이다. 부피측정 생산도는 시간 당 액체배지 리터 당 생산된 이소프렌량으로서 정의된다.
도 125는 포도당을 첨가한 15-L 생물반응기 내의 일시적 수득율 (instantaneous yield)의 시간 경과를 나타낸 것이다. 일시적 수득율은 데이터 좌표들 간 시간 간격 동안 생물반응기 (w/w)에 첨가된 포도당량 (그램)당 생산된 이소프렌량으로서 정의된다.
도 126은 포도당을 첨가한 15-L 생물반응기 내의 전체 이산화탄소 발생율 (TCER), 또는 대사활성 프로파일의 그래프를 나타낸 것이다.
도 127은 포도당을 첨가한 15-L 생물반응기 내에서 이소프렌 생산 동안 세포 생존도의 그래프를 나타낸 것이다. TVC/OD는 광학 밀도 단위 (OD550) 당 1 mL의 액체배지에서 전체 생존가능 계수 (콜로니 형성 단위)이다.
도 128은 포도당을 첨가한 15-L 생물반응기 내의 광학 밀도의 시간 경과를 나타낸 것이다.
도 129는 포도당을 첨가한 15-L 생물반응기 내의 이소프렌 역가의 시간 경과를 나타낸 것이다. 역가는 발효 액체배지 리터 당 생산된 이소프렌량으로서 정의된다.
도 130은 포도당을 첨가한 15-L 생물반응기로부터 생산된 전체 이소프렌의 시간 경과를 나타낸 것이다.
도 131은 포도당을 첨가한 15-L 생물반응기 내의 전체 이산화탄소 발생율 (TCER), 또는 대사활성 프로파일의 그래프를 나타낸 것이다.
도 132는 생물반응기로의 공기 유동 (airflow)에서 일시적 감소가 대사활성 (TCER)에서 급격한 감소를 유발하지 않았던 배출-기체에서 이소프렌 농도의 스파이크 (spike)를 유도하였던 것을 보여주는 그래프를 나타낸 것이다. TCER, 또는 대사활성은 전체 이산화탄소 발생율이다.
도 133은 포도당을 첨가한 15-L 생물반응기 내에서 이소프렌 생산 동안 세포 생존도의 그래프를 나타낸 것이다. TVC/OD는 광학 밀도 단위 (OD550) 당 1 mL의 액체배지에서 전체 생존가능 계수 (콜로니 형성 단위)이다.
도 134는 포도당을 첨가한 15-L 생물반응기 내의 광학 밀도의 시간 경과를 나타낸 것이다. 점선으로 된 수직선은 이소프렌이 1 g/L/시간으로 생물 반응기 내에 도입되었던 때 시간 간격을 표시한다.
도 135는 포도당을 첨가한 15-L 생물반응기 내의 전체 이산화탄소 발생율 (TCER), 또는 대사활성 프로파일의 그래프를 나타낸 것이다. 점선으로 된 수직선은 이소프렌이 1 g/L/시간의 속도로 생물 반응기 내에 도입되었던 때 시간 간격을 표시한다.
도 136은 포도당을 첨가한 15-L 생물반응기 내에서 이소프렌 생산 동안 세포 생존도를 나타낸 것이다. TVC/OD는 광학 밀도 단위 (OD550) 당 1 mL의 액체배지에서 전체 생존가능 계수 (콜로니 형성 단위)이다. 점선으로 된 수직선은 이소프렌이 1 g/L/시간으로 생물 반응기 내에 도입되었던 때 시간 간격을 표시한다.
도 137A 및 137B는 굵은 문자로 강조된 포풀러스 알바 (Populus alba) pET24a: 이소프렌 합성효소 유전자의 서열 (서열번호 30)을 나타낸 것이다.
도 137C 및 137D는 굵은 문자로 강조된 포풀러스 니그라 (Populus nigra) pET24a: 이소프렌 합성효소 유전자의 서열 (서열번호 31)을 나타낸 것이다.
도 137E 및 137F는 굵은 문자로 강조된 포풀러스 트레물로이데스 (Populus tremuloides) pET24a의 서열 (서열번호 32)을 나타낸 것이다.
도 137G는 포풀러스 트레물로이데스 (Populus tremuloides) 이소프렌 합성효소 유전자의 아미노산 서열 (서열번호 33)을 나타낸 것이다.
도 137H 및 137I는 굵은 문자로 강조된 포풀러스 트리코카르파 (Populus trichocarpa) pET24a: 이소프렌 합성효소 유전자의 서열 (서열번호 34)을 나타낸 것이다.
도 137J 및 137K는 굵은 문자로 강조된 포풀러스 트레물라 x 포풀러스 알바 pET24a: 이소프렌 합성효소 유전자의 서열 (서열번호 35)을 나타낸 것이다.
도 137L 은 pCR2.1 골격에 쿠쥬 IspS 코딩 서열을 포함하는 MCM93의 지도를 나타낸 것이다.
도 137M 및 137 N은 MCM93의 서열 (서열번호 36)을 나타낸 것이다.
도 137O는 pET24D-Kudzu의 지도를 나타낸 것이다.
도 137P 및 137Q 는 pET24D-Kudzu의 서열 (서열번호 37)을 나타낸 것이다.
도 138은 전체 세포 상부공간 분석법에서 측정된 바와 같은 다양한 포풀라 종에 대한 이소프렌 합성효소 발현 데이터를 나타낸 것이다. Y-축은 IPTG로 유도된 0.2 mL 배양에 의해 생산된 이소프렌의 μg/L/OD이다.
도 139는 DMAPP 분석법에 의해 측정된 바와 같이 포풀라 이소프렌 합성효소의 상대적 활성을 나타낸 것이다. 포풀라 효소는 쿠쥬로부터 나온 이소프렌 합성효소보다 유의하게 더 높은 활성을 가진다. 포풀라 [알바 x 트레물라]는 적은 (< 1%) 활성만을 가지고 좌표에 표시되지는 않는다.
도 140은 pDONR221:19430 - hybrid_HGS의 지도를 나타낸 것이다.
도 141는 pDONR221:19430 - hybrid_HGS, 효모에 코돈-최적화된 쿠쥬 이소프렌 합성효소의 서열 (서열번호 38)을 나타낸 것이다.
도 142A는 pDW14의 지도를 나타낸 것이다.
도 142B 및 142C는 pDW14의 완전한 뉴클레오타이드 서열 (서열번호 39)을 나타낸 것이다.
도 143은 pDW14 또는 pYES-DEST52을 보유하는 유도된 INVSc-1 균주를 나타낸 것이다. 도 143A. 갈락토스로 유도되고 심플리블루 세이프스테인 (SimplyBlue SafeStain, Invitrogen)으로 염색된 INVSc-1 균주로부터 생성된 용출액의 4-12% 비스 트리스 젤 (Novex, Invitrogen). 도 143B. 웨스턴브리즈 키트 (WesternBreeze kit, Invitrogen)를 사용한 동일한 균주의 웨스턴 블럿 분석. 레인 설명은 다음과 같다: 1, INVSc-1 + pYES-DEST52; 2, INVSc-1 + pDW14 (분리물 1); 3, INVSc-1 + pDW14 (분리물 2). MW가 (kDa으로) (시블루 플러스2 (SeeBlue Plus2) 분자량 기준을 사용하여) 표시된다.
도 144 (도 144A 및 144B)는 pDW14 또는 pYES-DEST52를 보유하는 유도된 INVSc-1 균주를 나타낸 것이다. 도 144A. 용해 이전 갈락토스-유도된 균주의 OD600. y-축은 OD600이다. 도 144B. 대조군 및 이소프렌 합성효소-보유 균주에서 이소프렌 합성효소 상부공간의 DMAPP 분석법. 특이 활성은 μg HG/L/OD로서 계산되었다. 시료는 다음과 같다: 대조군, INVSc-1 + pYES-DEST52; HGS-1, INVSc-1 + pDW14 (분리물 1); HGS-2, INVSc-1 + pDW14 (분리물 2).
도 145A는 코돈 최적화된 이소프렌 합성효소 fluo-opt2v2의 지도를 나타낸 것이다.
도 145B는 코돈 최적화된 이소프렌 합성효소 fluo-opt2v2 (서열번호 40)의 뉴클레오타이드 서열을 나타낸 것이다.
도 146A는 pBBR1MCS5의 지도를 나타낸 것이다.
도 146B 및 146C는 pBBR1MCS5 (서열번호 41)의 뉴클레오타이드 서열을 나타낸 것이다.
도 147A는 pBBR5HGSOpt2_2의 지도를 나타낸 것이다.
도 147B 및 147C는 pBBR5HGSOpt2_2 (서열번호 42)의 뉴클레오타이드 서열을 나타낸 것이다.
도 148은 CER 대 IPTG (4 x 50 μmol) 또는 IPTG (2 x 100 μmol)로 유도되거나, 유도되지 않은 MCM401 균주에 대한 발효 시간의 그래프를 나타낸 것이다.
도 149는 pH 조정되거나 조정되지 않은 사탕수수 용액에서 포도당의 농도를 살균 횟수 (cycles)의 함수 (일회 = 30분)로서 나타낸 것이다.
도 150은 포도당, 사탕수수, 및 전환된 사탕수수에서 슈도모나스 푸티다 F1 (Pseudomonas putida F1) 및 슈도모나스 플루오레센스 ATCC13525 (Pseudomonas fluorescens ATCC13525)의 성장 곡선 (시간의 함수로서 OD600 )을 나타낸 것이다.
도 151은 포도당, 사탕수수, 및 전환된 사탕수수에서 대장균 BL21(DE3), MG1655, ATCC11303 및 B REL 606의 성장 곡선 (시간 함수로서OD600 )을 나타낸 것이다.
도 152는 플라스미드 pET24 P.alba HGS의 지도를 나타낸 것이다.
도 153A 및 153B는 플라스미드 pET24 P.alba HGS의 뉴클레오타이드 서열 (서열번호 43)을 나타낸 것이다.
도 154는 플라스미드 EWL230를 제작하기 위하여 엔도뉴클레아제 소화에 사용되는 제한효소 부위 또한 BspHI 및 NcoI 부위 간 양립가능한 점착성 (cohesive) 말단을 보여주는 모식도를 나타낸 것이다.
도 155는 플라스미드 EWL230의 지도를 나타낸 것이다.
도 156A 및 156B는 플라스미드 EWL230의 뉴클레오타이드 서열 (서열번호 44)을 나타낸 것이다.
도 157은 플라스미드 EWL244를 제작하기 위하여 엔도뉴클레아제 소화에 사용되는 제한효소 부위 또한 NsiI 및 PstI 부위 간 양립가능한 점착성 말단을 보여주는 모식도를 나타낸 것이다.
도 158은 플라스미드 EWL244의 지도를 나타낸 것이다.
도 159A 및 159B는 플라스미드 EWL230의 뉴클레오타이드 서열 (서열번호 45)을 나타낸 것이다.
도 160A는 M. 마제이 고대 하부 경로 오페론의 지도를 나타낸 것이다.
도160B 및 도 160C는 M. 마제이 고대 하부 경로 오페론의 뉴클레오타이 서열 (서열번호 46)을 나타낸 것이다.
도 161A는 pET200D에서 M. 마제이 고대 하부로부터 나온 MCM376-MVK의 지도를 나타낸 것이다.
도 161B 및 161C는 pET200D에서 M. 마제이 고대 하부로부터 나온 MCM376-MVK의 뉴클레오타이드 서열 (서열번호 47)을 나타낸 것이다.
도 162는 플라스미드 pBBRCMPGI1.5-pgl의 지도를 나타낸 것이다.
도 163A 및 163B는 플라스미드 pBBRCMPGI1.5-pgl의 뉴클레오타이드 서열 (서열번호 48)을 나타낸 것이다.
도 164A 내지 164F는 M. 마제이 메발로네이트 키나제, P. 알바 이소프렌 합성효소, 및 pgl (RHM111608-2)을 발현하고, 15-L 규모의 회분식 배양에서 자라는 대장균 균주에 의한 이소프렌 생산의 그래프를 나타낸 것이다. 도 164A는 포도당을 첨가한 15-L 생물반응기 내의 광학 밀도의 시간 경과를 보여준다. 도 164B는 포도당을 첨가한 15-L 생물반응기 내의 이소프렌 역가의 시간 경과를 보여준다. 역가는 발효 액체배지 리터 당 생산된 이소프렌량으로서 정의된다. 이소프렌을 계산하는 방법: 59시간에서 생산된 누적 이소프렌, g/59시간에서 발효기 부피, L [=] g/L 액체배지. 도 164C도 역시 포도당을 첨가한 15-L 생물반응기 내의 이소프렌 역가의 시간 경과를 보여준다. 이소프렌을 계산하는 방법: t = 0 로부터 59시간까지 ∫(일시적 이소프렌 생산율, g/L/시간)dt [=] g/L 액체배지. 도 164D는 포도당을 첨가한 15-L 생물반응기로부터 생산된 전체 이소프렌의 시간 경과를 보여준다. 도 164E는 포도당을 첨가한 15-L 생물반응기 내 부피측정 생산도를 보여준다. 도 164F는 포도당을 첨가한 15-L 생물반응기 내의 이산화탄소 발생율 (CER), 또는 대사활성 프로파일을 보여준다.
도 165A 및 165B는 15L 생물반응기에서 발효로부터 나온 배출기체의 분석을 보여주는 그래프를 나타낸 것이다. 시료 A는 64.8 시간에 수집된 균주 RM111608-2이다. 시료 B는 34.5시간에 수집된 균주 EWL256이고 이는 대장균 BL21 (DE3), pCL 상부, cmR-gi1.2-yKKDyI, pTrcAlba-mMVK이었다. 수소는 시료 둘 다의 경우 기저선 (baseline) 이상으로 검출된다.
도 166A는 대표적인 바이오이소프렌TM 회수 유닛을 나타낸 것이다.
도 166B는 대표적인 바이오이소프렌TM 탈착/농축 설정을 나타낸 것이다.
도 167은 바이오이소프렌TM 산물의 GC/FID 크로마토그램을 나타낸 것이다. 물질은 99.7% 순수한 것으로 측정되었다.
도 168A 내지 도 168C는 알루미나 (B) 또는 실리카 (C)로의 처리 이전에 (A) 및 이후 (B)에 바이오이소프렌TM 시료의 GC/FID 크로마토그램을 나타낸 것이다. 이들 크로마토그램에서 이소프렌 피크는 도시되지 않는다.
도 169는 발효 배출-기체로부터 이소프렌을 정제하는 방법 및 관련 장치의 모식도를 나타낸 것이다.
도 170은 부분적으로 수소화된 바이오이소프렌TM 단일체 (monomer)의 GC/FID 크로마토그램을 나타낸 것이다. 화합물 1 (RT = 12.30분) = 3-메틸-1-부텐, 화합물 2 (RT = 12.70분) = 2-메틸부탄, 화합물 3 (RT = 13.23분) = 2-메틸-1-부텐, 화합물 4 (RT = 13.53분) = 이소프렌, 화합물 5 (RT = 14.01분) = 2-메틸-2-부텐.
도 171은 2-메틸-2-부텐의 앰버리스트-15 (Amberlyst-15) 산 레진-촉매된 이중합으로부터 유래한 산물에 대한 GC/MS 전체 이온 크로마토그램을 나타낸 것이다.
도 172는 바이오이소프렌TM 단일체의 앰버리스트-15 산 레진-촉매된 올리고중합 (oligomerization)으로부터 유래한 산물을 위한 GC/MS 전체 이온 크로마토그램을 나타낸 것이다.
도 173은 이중합 반응기를 사용한 C5 스트림의 C10/C15 산물 스트림으로 전환을 위한 공정 (process flow) 모식도를 나타낸 것이다. C5 스트림은 바이오이소프렌TM 단일체 및/또는 바이오이소프렌TM 단일체의 C5 유도체를 포함한다.
실시예
실시예 1: 재조합 쿠쥬 이소프렌 합성효소를 발현하는 대장균에서 이소프렌의 생산
I. 대장균에서 쿠쥬 이소프렌 합성효소를 발현하는 벡터의 제작
쿠쥬 (푸에라리아 몬타나 (Pueraria montana)) 이소프렌 합성효소 유전자 (IspS)에 대한 단백질 서열은 진뱅크 (GenBank, AAQ84170)로부터 획득되었다. 쿠쥬 이소프렌 합성효소 유전자는 대장균 (E. coli) 코돈 사용에 최적화되어 있고 DNA2.0로부터 구입되었다 (서열번호 1). 이소프렌 합성효소 유전자는 BspLU11I /PstI를 사용한 제한효소 소화에 의해 공급된 플라스미드로부터 제거되었고, 젤로 정제되었으며, NcoI/PstI 를 사용하여 소화되었던 pTrcHis2B (Invitrogen) 내로 라이게이션되었다. 제작물 (construct)은 이소프렌 합성효소 유전자 5'에 있는 종결 코돈이 PstI 부위에 위치하도록 설계되었다. 그 결과, 제작물이 발현되었을 때 히스-태그 (His-Tag)가 이소프렌 합성효소 단백질에 부착되지 않는다. 그 결과 나온 플라스미드 pTrcKudzu는 서열결정법 (sequencing)에 의해 확인되었다 (도 2 및 도 3; 서열번호 2).
이소프렌 합성효소 유전자도 역시 pET16b (Novagen) 내에 클론되었다. 이 경우에, 이소프렌 합성효소 유전자는 재조합 이소프렌 합성효소 단백질이 N-말단 히스 태그를 포함하도록 pET16b 내에 삽입되었다. 이소프렌 합성효소 유전자는pTrcKudzu로부터 프라이머 세트인 pET-His-Kudzu-2F: 5'-CGTGAGATCATATGTGTGCGACCTCTTCTCAATTTAC (서열번호 49) 및 pET-His-Kudzu-R: 5'-CGGTCGACGGATCCCTGCAGTTAGACATACATCAGCTG (서열번호 50)을 사용한 PCR에 의해 증폭되었다. 이들 프라이머에는 유전자의 5' 말단에 NdeI 부위를 또한 3' 말단에 BamH1 부위를 각각 첨가시켰다. 상기에서 기술된 플라스미드 pTrcKudzu는 주형으로 사용되었고, 허큘라제 중합효소 (Herculase polymerase, Stratagene)는 제조사의 지침에 따라 사용되었으며, 프라이머는 10 pMol 농도로 첨가되었다. PCR은 전체 부피 25 μl에서 수행되었다. PCR 산물은 NdeI/BamH1로 소화되었고 동일한 효소로 소화된 pET16b 내에 클론되었다. 라이게이션 믹스 (mix)가 대장균 Top10 (Invitrogen) 내로 형질전환되었고 정확한 클론이 서열결정법에 의해 선별되었다. 그 결과 나온 플라스미드는 쿠쥬 이소프렌 합성효소 유전자가 T7 프로모터로부터 발현되었으며, pETNHisKudzu 라고 명명되었다 (도 4 및 도 5; 서열번호 51).
쿠쥬 이소프렌 합성효소 유전자도 역시 낮은 사본수 플라스미드 pCL1920 내에 클론되었다. 프라이머가 상기 기술된 pTrcKudzu로부터 쿠쥬 이소프렌 합성효소 유전자를 증폭시키는 데 사용되었다. 정방 프라이머는 HindIII 부위와 대장균 동일 (consensus) RBS를 5' 말단에 첨가하였다. PstI 클로닝 부위는 이미 pTrcKudzu의 3, 종결 코돈에 존재하였고 역방 프라이머가 그렇게 제작되었으며 최종 PCR 산물은 PstI 부위를 포함한다. 프라이머의 서열은 다음과 같았다: HindIII-rbs-Kudzu F: 5'-CATATGAAAGCTTGTATCGATTAAATAAGGAGGAATAAACC (서열번호 51) 및 BamH1-Kudzu R: 5'-CGGTCGACGGATCCCTGCAGTTAGACATACATCAGCTG (서열번호 50). PCR 산물은 10 pmol농도의 프라이머 및 1 ng의 주형 DNA (pTrcKudzu)와 함께 헤르큘라제 중합효소를 사용하여 증폭되었다. 증폭 프로토콜은 (95℃에서 1 분, 60℃에서 1분, 72℃에서 2분)의 30회 사이클을 포함하였다. 산물은 HindIII 및 PstI으로 소화되었고 이미 HindIII 및 PstI으로 역시 소화되어 있던 pCL1920 내로 라이게이션시켰다. 라이게이션 혼합액은 대장균 Top10 내로 형질전환되었다. 여러가지 형질전환제가 서열결정법에 의해 검토되었다. 그 결과 나온 플라스미드는 pCL-lac-Kudzu라고 명명되었다 (도 6 및 도 7; 서열번호 4).
II. 이소프렌 생산의 결정
플라스크 진탕 배양을 위해, 1 ml의 배양액을 진탕 플라스크로부터 20 ml CTC 상부공간 바이알 (Agilent 바이알 cat# 5188 2753; 뚜껑 cat# 5188 2759)로 이동시켰다. 뚜껑은 단단히 돌려막았고 바이알을 250 rpm에서 진탕하면서 동등한 온도에서 배양하였다. 30분 이후에 바이알은 배양기로부터 옮겼고 하기에 기술된 바와 같이 분석되었다 (본 분석법으로부터 나온 일정 실험값은 표 1을 참조하라).
발효기에서 이소프렌 생산이 결정된 경우에서, 시료는 발효기의 배출기체로부터 가져왔고 하기에 기술된 바와 같이 직접 분석되었다 (본 분석법으로부터 나온 일정 실험값은 표 1을 참조하라).
상부공간 방식으로 작동하는CTC 분석학 (스위스) 콤비PAL (CTC Analytics CombiPAL) 자동시료수집기를 내장한 애질런트 6890 GC/MS 시스템을 사용하여 분석이 수행되었다. 애질런트 HP-5MS GC/MS 컬럼 (30 m x 0.25 mm; 0.25 μm 필름 두께)이 분석물의 분리를 위해 사용되었다. 시료수집기는 500 μL의 상부공간 기체를 주입하도록 설정되었다. GC/MS 방법은 헬륨을 운반 기체로서 1 ml/분의 유속에서 사용하였다. 주입 포트는 250℃에서 50 : 1의 분리율로 유지되었다. 오븐 온도는 37℃에서 분석의 2분 지속 기간 동안 유지되었다. 애질런트 5793N 질량 선택 검출기 (mass selective detector)는 단일 이온 감시 (SIM) 방식으로 m/z 67상에서 작동되었다. 검출기는 1.4분으로부터 1.7분까지 영속적 기체의 용출이 가능하도록 전원을 껐다. 이들 조건 하에서 이소프렌 (2-메틸-1,3-부타디엔)은 1.78분에서 용출되는 것이 관찰되었다. 측정 (calibration) 표가 이소프렌의 절대적 양을 정량하는 데 사용되었고 1 μg/L으로부터 70,000 μg/L까지 직선상인 것이 관찰되었다. 검출 한계는 이 방법을 사용하여 50 내지 100 ng/L인 것으로 평가되었다.
III. 재조합 이소프렌 합성효소를 발현하는 대장균 세포를 포함하는 진탕 플라스크에서 이소프렌의 생산
상기 기술된 벡터는 대장균 균주 BL21/ptrcKudzu, BL21/pCL-lac-Kudzu 및 BL21/pETHisKudzu를 생산하도록 대장균 균주 BL21 (Novagen)에 도입되었다. 균주는 LA (루리아 아가배지) + 카베니실린 (carbenicillin, 50 μg/ml) 상에서 분리를 위해 도말되었고 37℃에서 하룻밤 동안 배양되었다. 단일 콜로니를 20 ml 루리아 버타니 (Luria Bertani) 액체배지 (LB) 및 카베니실린 (100 μg/ml)를 포함하는 250 ml의 진탕 플라스크 내에 접종하였다. 배양액은 20℃에서 200 rpm으로 진탕하면서 하룻밤 동안 성장시켰다. 밤샘 배양액의 OD600가 측정되었고 배양액은 30 ml 매직미디아 (MagicMedia, Invitrogen) + 카베니실린 (100 μg/ml)을 포함하는 250 ml의 진탕 플라스크 내에 OD600 ~ 0.05까지 희석시켰다. 배양액은 30℃에서 200 rpm으로 진탕하면서 배양되었다. OD600 ~ 0.5 - 0.8로 될 때, 400 μM IPTG가 첨가되었고 세포는 추가로 6시간 동안 30℃에서 200 rpm으로 진탕하면서 배양되었다. IPTG 유도하고 0, 2, 4 및 6 시간에, 1 ml의 배양액 일정량이 수집되었고, OD600가 결정되었으며 생산된 이소프렌량이 상기 기술된 바와 같이 측정되었다. 결과는 도 8에 나타나있다.
IV. 14 리터 발효에서 대장균 BL21/ptrcKudzu 로부터 이소프렌의 생산
재조합 쿠쥬 이소프렌 합성효소 유전자를 포함하는 대장균으로부터 이소프렌의 대량 생산은 회분식 배양으로부터 결정되었다. 발효 배지의 리터 당 발효 배지 (TM2)를 위한 레시피는 다음과 같다: K2HPO4 13.6 g, KH2PO4 13.6 g, MgSO4 * 7H2O 2 g, 시트르산 모노하이드레이트 2 g, 철 암모늄 사이트레이트 0.3 g, (NH4)2SO4 3.2 g, 효모추출물 5 g, 1000X 변형된 미량 금속 용액 1 ml. 모든 성분은 다같이 첨가되었고 diH2O에 녹였다. pH는 포타슘 하이록사이드 (KOH)로 6.8에 조정하고 부피를 q.s.맞춘다. 최종 산물은 0.22μ 필터로만 여과 멸균되었다 (고압멸균 (autoclave)하지 말라). 1000X 변형된 미량 금속 용액은 다음과 같다: 시트르산 * H2O 40 g, MnSO4 * H2O 30 g, NaCl 10 g, FeSO4 * 7H2O 1 g, CoCl2 * 6H2O 1 g, ZnSO * 7H2O 1 g, CuSO4 * 5H2O 100 mg, H3BO3 100 mg, NaMoO4 * 2H2O 100 mg. 각 성분은 HCl/NaOH으로 pH 3.0으로 맞춘 di H2O에 한 번에 하나씩 녹인 다음 부피를 맞추었고 0.22 μ 필터로 여과 멸균하였다.
본 실험은 14 L 생물반응기에서 수행되었고 pH 6.7 및 온도 34℃의 원하는 발효에서 포도당으로부터 이소프렌 형성을 감시하였다. 냉동 바이알로부터 가져온 대장균 균주BL21/ptrcKudzu 는 소이톤-효모추출물-포도당 배지에 제조되었다. 접종액이 OD550 = 0.6까지 성장한 이후, 두 개의 600 ml 플라스크가 원심분리 되었고 내용물이 70 ml 상청액에 재현탁 되었으며 세포 펠렛 (OD 3.1 물질 70 ml)으로 생물반응기로 이동되었다. 접종 이후 다양한 시간에, 시료는 제거되었고 생산된 이소프렌량이 상기 기술된 바와 같이 결정되었다. 결과는 도 9에 나타나있다 (70 ml의 OD 3.1 물질)
실시예 2: 재조합 포풀라 이소프렌 합성효소를 발현하는 대장균에서 이소프렌의 생산
포풀라 (포풀라 알바 (Populus alba) x 포풀라 트레물라 (Populus tremula)) 이소프렌 합성효소에 대한 단백질 서열 (Schnitzler, J-P, et al. (2005) Planta 222:777-786)은 진뱅크 (GenBank, CAC35696)로부터 획득되었다. 대장균에 코돈 최적화된 유전자는 DNA2.0 (p9796-poplar, 도 30 및 도 31; 서열번호 14)로부터 구입되었다. 이소프렌 합성효소 유전자는 BspLU11I/PstI 를 사용한 제한효소 소화에 의해 공급된 플라스미드로부터 제거되었고, 젤로 정제되었으며, NcoI/PstI 를 사용하여 소화되었던 pTrcHis2B (Invitrogen) 내로 라이게이션되었다. 제작물은 삽입 유전자에 있는 종결 코돈이 PstI 부위 이전에 있도록 클론되었고, 이는 히스-태그 (His-Tag)가 이소프렌 합성효소 단백질에 부착되지 않는 제작물을 만든다. 그 결과 나온 플라스미드 pTrcpoplar는 서열결정법 (sequencing)에 의해 확인되었다 (도 32 및 도 33; 서열번호 15).
실시예 2B: 여러가지
포풀러스
이소프렌 합성효소로부터 이소프렌 합성효소 활성의 조사
하기 이소프렌 합성효소가 조사되었다; 포풀러스 알바 (Populus alba) (기탁번호 BAD98243; 도 137A 및 137B; 서열번호 30), 포풀러스 니그라 (Populus nigra (기탁번호 CAL69918; 도 137C 및 137D; 서열번호 31), 포풀러스 트레물로이데스 (Populus tremuloides) (기탁번호 AAQ16588; 도 137E, 137F, 및 137G; 서열번호 32-33), 포풀러스 트리코카르파 (Populus trichocarpa) (기탁번호 ACD70404; 도137H 및 137I; 서열번호 34), 포풀러스 알바 (Populus alba) x 포풀러스 트레물라 (Populus tremula) (기탁번호 CAJ29303; 도 137J 및 137K; 서열번호 35), 및 MCM112-Kudzu.
pET24Kudzu (MCM112라고도 명명함)가 다음과 같이 제작되었다: 쿠쥬 이소프렌 합성효소 유전자는 pCR2.1 벡터 (Invitrogen)로부터 pET24d 벡터 (Novagen) 내로 서브클론되었다. 쿠쥬 IspS 유전자는 pTrcKudzu 주형DNA로부터 프라이머 MCM50 5'-gatcatgcat tcgcccttag gaggtaaaaaaacatgtgtgcgacctcttc tcaatttact (서열번호 52); 및 MCM53 5'-CGGTCGACGGATCCCTGCAG TTAGACATAC ATCAGCTG (서열번호 52)를 사용하여 증폭되었다. PCR 반응은 Taq DNA 중합효소 (Invitrogen)를 사용하여 수행되었고, 그 결과 나온 PCR 산물은 pCR2.1-TOPO TA 클로닝 벡터 내로 클론되었으며 화학적으로 능력있는 (competent) E. coli Top10 내로 형질전환되었다. 형질전환체는 카베니실린 (50 mg/ml)을 포함하는 L-아가 상에 도말되었고 37℃에서 하룻밤 동안 성장시켰다. 다섯 개의 콜로니가 1 ml의 액체 배양액 (루리아 액체배지)으로부터 분리된 플라스미드 DNA의 서열결정에 의해 정확한 삽입물로 검색되었고 QIA프렙 스핀 미니-프렙 키트 (QIAprep Spin Mini-prep Kit, Qiagen)를 사용하여 정제되었다. 그 결과 나온 MCM93이라고 명명되는 플라스미드는 pCR2.1 골격에 쿠쥬 IspS 코딩 서열을 포함한다 (도 137L). MCM93의 서열 (서열번호 36)은 도 137M 및 137N에 나타나있다.
쿠쥬 코딩 서열은 PciI 및 BamH1 (Roche)로 제한효소 소화에 의해 제거되었고 QIA퀵 젤 추출 키트 (QIAquick Gel Extraction kit, Qiagen)를 사용하여 젤 정제되었다. pET24d 벡터 DNA는 NcoI 및BamHI (Roche)으로 소화되었고 새우 알칼라인 포스파타제 (Roche)로 처리되었으며, QIA프렙 스핀 미니-프렙 키트 (Qiagen)를 사용하여 정제되었다. 쿠쥬 IspS 단편은 NcoI/BamH1 소화된 pET24d 에 래피드DNA 라이게이션 키트 (Rapid DNA Ligation Kit, Roche)를 사용하여 5 : 1의 단편 대 벡터 비율로 20 ml의 전체 부피에서 라이게이션되었다. 라이게이션 혼합액의 일부 (5 ml)는 화학적으로 능력있는 E. coli Top10 내에 형질전환되었고 카나마이신 (50 mg/ml)을 포함하는 L 아가 상에 도말되었다. 정확한 형질전환체는 서열결정법에 의해 확인되었고 화학적으로 능력있는 대장균 BL21(lDE3)pLysS cells (Novagen) 내로 형질전환되었다. 단일 콜로니는 밤샘 성장 이후에 37℃에서 카나마이신 (50 mg/ml)을 포함하는 L 아가 상에 도말되었다. 그 결과 나온 pET24D-Kudzu로서 명명된 플라스미드의 지도는 도 137O에 나타나있다. pET24D-Kudzu (서열번호 37)의 서열은 도 137P 및 137Q에 나타나 있다.
포풀러스 트레물로이데스, 포풀러스 알바, 포풀러스 니그라, 및 포풀러스 트리코카르파를 위해 pET24a 발현 벡터 (Novagen)에 클론된 대장균 (Escherichia coli) 최적화된 이소프렌 합성효소 유전자가 DNA2.0 (Menlo Park, CA)로부터 구입되었다. 유전자는 엽록체 이동 펩타이드 서열 (chloroplast transit peptide sequence)이 제거되어 성숙한 단백질의 발현이 되도록 합성되었다.
본 실시예에서 쿠쥬 이소프렌 합성효소를 위한 제작물은 대조군으로서 사용되었다. 플라스미드는 대장균 발현 숙주 BL21(DE3)plysS 내에 형질전환되었고 형질전환체는 0.6 ml TM3 배지에서 성장시켰다. TM3 배지를 위한 레시피는 다음과 같다: K2HPO4 (13.6 g/l), KH2PO4 (13.6 g/l), MgSO4 * 7H2O (2 g/L), 시트르산 모노하이드레이트 (2 g/L), 철 암모늄 사이트레이트 (0.3 g/L), (NH4)2SO4 (3.2 g/L), 효모추출물 (0.2 g/L), 1 ml의 1000x 미량 원소 용액을 암모늄 하이록사이드로 pH 6.8에 조정하였고 부피를 멸균된 diH2O로 q.s. 맞추었으며 0.22 마이크론 필터로 여과 멸균되었다. 1000X 변형된 미량 원소 용액은 다음과 같다: 시트르산 * H2O (40 g/L), MnSO4 * H2O (30 g/L), NaCl (10 g/L), FeSO4 * 7 H2O (1 g/L), CoCl2 * 6 H2O (1 g/L), ZnSO4 * 7 H2O (1 g/L), CuSO4 * 5 H2O (100 mg/L), H3BO3 (100 mg/L), NaMoO4 * 2 H2O (100 mg/L). 각 성분은 HCl/NaOH을 사용하여 pH 3.0으로 맞춘 diH2O에 한 번에 하나씩 녹였고 부피를 맞추었으며 0.22 마이크론 필터로 여과 멸균하였다.
배양액은 400 μM IPTG로 유도되었고 성장은 OD600 의 약 5까지 계속되었다. 배양액의 분량이 깊은 유리 웰 플레이트에 이동되었고 웰은 알루미늄 플레이트 밀봉제로 밀봉되었다. 플레이트는 25℃에서 30분 동안 450 rpm으로 진탕하면서 배양되었다. 그 다음은 반응은 온도를 70℃까지 올려서 5분 동안 불활성화되었다. 전체 세포 상부공간은 실시예 1, 제 II부에 기술된 바와 같이 GCMS 방법에 의해 측정되었다.
Km 값은 유사한 방식으로 성장시킨 배양액으로부터 획득되었지만 세포는 수확되었고 냉동/해동 (freeze/thaw) 라이소자임 프로토콜에 의해 용해되었다. 부피 400 μL의 배양액은 새로운 96-웰 플레이트 (Perkin Elmer, 카탈로그 번호 6008290) 내로 이동되었고 세포는 벡크만 쿨터 알레그라 (Beckman Coulter Allegra) 6R 원심분리기에서 2500 x g로 원심분리에 의해 수확되었다. 펠렛은 200 mL의 저장성 완충용액 (5 mM MgCL2, 5 mM 트리스 HCl, 5 mM DTT pH 8.0)에 재현탁시켰고 플레이트는 -80℃에서 60분의 최소시간 동안 냉동시켰다. 세포 용출액은 플레이트를 해동시키고 32 mL의 이소프렌 합성효소DMAPP 분석 완충용액 (57 mM 트리스 HCl, 19 mM MgCl2, 74 mg/mL DNase I (시그마사 카탈로그 번호 DN-25), 2.63 x 105 U/mL의 래디 라이소자임 (ReadyLyse lysozyme) 용액 (Epicentre Catalog No. R1802M), 및 5 mg/mL의 분자생물학 등급 BSA를 첨가하여 제조되었다. 플레이트는 25℃에서 30분 동안 진탕하면서 배양된 다음 얼음 위에 두었다. DMAPP 및 용출액은 원하는 농도로 밀봉된 깊은 유리 웰 블록에 상기 기술된 전체 세포 상부공간 분석법 (whole cell head space assay)을 위해 첨가되었다. 반응은 1시간 동안 진행되도록 한 다음 상기 기술된 열 단계에 의해 종결되었고 상부공간 활성도 역시 기술된 바와 같이 측정되었다.
대안의 접근법에서는, 효소의 활성이 25 mL 부피에서 배양되고 상기 기술된 바와 유사하게 유도된 세포로부터 측정되었다. 세포는 원심분리에 의해 수확되었고 펠렛은 프렌치 프레싱 (French pressing)에 의해 50% 글리세롤과 1 : 1로 혼합된 20 mM 트리스/HCl pH 7.4, 20 mM MgCl2, 200 mM KCl, 1 mM DTT를 포함하는 완충용액에서 용해되었다. 25 μL부피의 용출액은 75 μL의 분석 완충용액 (66.6 mM 트리스/HCl pH 8, 6.66 mM DMAPP, 43 mM, MgCl2)을 포함하는 2 mL 회전 뚜껑 바이알에서 이소프렌 합성효소 활성에 대해 분석되었다. 반응은 15 분 동안 30℃에서 배양되었고 100 μL의 250 mM EDTA를 바이알의 벽을 통해 첨가하여 정지되었다. 이소프렌은 실시예 1, 제 II부에서 기술된 바와 같이 GC/MS에 의해 측정되었다.
활성을 측정하는 모든 방법은 순수하게 키운 포풀라로부터 유래한 포풀라 효소가 포풀러스 [알바 x 트레물라]보다 여러 배 더 높은 것을 보여주었다. 도 138 및 도 139는 전체 세포 상부공간 분석법 및 DMAPP 분석법에 대한 이들 결과를 각각 보여주었고, 놀랍게도 P. nigra, P. tremuloides, P. trichocarpa, and P. alba로부터 나온 효소는 모두 하이브리드 [P. 알바 x P.트레물라]보다 유의하게 더 높은 활성을 가지는 것을 표시한다.
DMAPP 분석법은 다음과 같이 수행되었다: 부피 400 μL의 배양액은 새로운 96-웰 플레이트 (퍼킨엘머사, 카탈로그 번호 6008290) 내로 이동되었고 세포는 벡크만 쿨터 알레그라 (Beckman Coulter Allegra) 6R 원심분리기에서 2500 x g로 원심분리에 의해 수확되었다. 펠렛은 200 mL의 저장성 완충용액 (5 mM MgCL2, 5 mM 트리스 HCl, 5 mM DTT pH 8.0)에 재현탁시켰고 플레이트는 -80℃에서 60분의 최소시간 동안 냉동시켰다. 세포 용출액은 플레이트를 해동시키고 32 mL의 이소프렌 합성효소 DMAPP 분석 완충용액 (57 mM 트리스 HCl, 19 mM MgCl2, 74 mg/mL DNase I (시그마사 카탈로그 번호 DN-25), 2.63 x 105 U/mL의 래디 라이소자임 용액 (에피센트르사 카탈로그 번호 R1802M), 및 5 mg/mL의 분자생물학 등급 BSA를 첨가하여 제조되었다. 플레이트는 25℃에서 30분 동안 진탕하면서 배양된 다음 얼음 위에 두었다. 이소프렌 생산을 위해 80 mL 분량의 용출액이 96-웰 깊은 유리 플레이트 (Zinsser 카탈로그 번호 3600600)에 이동시켰고 100 mM K2HPO4, pH 8.2 (Cayman Chemical 카탈로그 번호 63180)에 녹인 20 mL의 10 mM DMAPP 용액이 첨가되었다. 플레이트는 알루미늄 플레이트 밀봉제 (Beckman Coultor Catalog No. 538619)로 밀봉되었고 30℃에서 60분 동안 진탕하면서 배양되었다. 효소적 반응은 유리 블록을 가열하여 (70℃에서 5분) 종결되었다. 각 웰의 세포 상부 공간은 실시예 1, 제 II부에 기술된 바와 같이 정량적으로 분석되었다.
명확하게, P. alba, P. tremuloides, P. trichocarpa는 쿠쥬로부터 나온 이소프렌 합성효소보다 더 높은 활성을 가졌다. P. 알바로부터 나온 효소는 모든 테스트된 효소의 가장 큰 활성으로 발현되었다. 전체 세포 상부공간 분석법과 비교하여 세포 용출액으로 관찰된 더 높은 활성은 이들 효소의 기질이고 세포의 내재성 데옥시자일루로스 5-포스페이트 (DXP) 경로에 의해 운반된 DMAPP에서의 제한으로 인한 것 같았다.
Km 동적 매개변수는 이 값이 결정된 모든 효소에서 약 2 내지 3 mM인 것으로 측정되었다.
실시예 3: 재조합 쿠쥬 이소프렌 합성효소를 발현하는
판테오아 시트레아
에서 이소프렌의 생산
실시예 1에 기술된 pTrcKudzu 및 pCL-lac Kudzu 플라스미드는 P. citrea (미국 특허 제 7,241,587호) 내로 전기천공되었다. 형질전환체는 카베니실린 (200μg/ml) 또는 스펙트로마이신 (spectinomycin, 50 μg/ml)을 각각 포함하는 LA 상에서 선별되었다. 진탕 플라스크로부터 이소프렌의 생산 및 생산된 이소프렌 양의 결정은 쿠쥬 이소프렌 합성효소를 발현하는 E. coli 균주에 대하여 실시예 1에 기술된 바와 같이 수행되었다. 결과는 도 10에 나타나있다.
실시예 4: 재조합 쿠쥬 이소프렌 합성효소를 발현하는
바실러스 섭틸리스
에서 이소프렌의 생산
I. 쿠쥬 이소프렌 합성효소의 발현을 위한 B. subtilis 복제 플라스미드의 제작
쿠쥬 이소프렌 합성효소 유전자는 바실러스 섭틸리스 (Bacillus subtilis) aprEnprE Pxyl-comK 균주 (BG3594comK)에서 aprE 프로모터 조절 하에 복제 플라스미드 (클로로암페니콜 저항성 카세트를 가진 pBS19)를 사용하여 발현되었다. 이소프렌 합성효소 유전자, aprE 프로모터 및 전사 종결인자 (transcription terminator)가 분리되어 증폭되었고 PCR을 사용하여 융합되었다. 그 다음 제작물은 pBS19 내로 클론 되었고 B. subtilis 내로 형질전환되었다.
a) aprE 프로모터의 증폭
aprE 프로모터는 하기 프라이머를 사용하여 Bacillus subtilis 로부터 나온 염색체 DNA로부터 증폭되었다.
CF 797 (+) 시작 aprE 프로모터 MfeI
5'-GACATCAATTGCTCCATTTTCTTCTGCTATC (서열번호 53)
CF 07-43 (-) aprE 프로모터를 쿠쥬 ispS에 융합
5'-ATTGAGAAGAGGTCGCACACACTCTTTACCCTCTCCTTTTA (서열번호 54)
b) 이소프렌 합성효소 유전자의 증폭
쿠쥬 이소프렌 합성효소 유전자는 플라스미드 pTrcKudzu (서열번호 2)로부터 증폭되었다. 유전자는 먼저 대장균에 코돈 최적화되었고 DNA 2.0에 의해 합성되었다. 하기 프라이머가 사용되었다:
CF 07-42 (+) aprE 프로모터를 쿠쥬 이소프렌 합성효소 유전자에 융합
(GTG 시작 코돈)
5'-TAAAAGGAGAGGGTAAAGAGTGTGTGCGACCTCTTCTCAAT (서열번호 55)
CF 07-45 (-) 쿠쥬 이소프렌 합성효소 유전자의 3'말단을 종결인자에 융합
5'-CCAAGGCCGGTTTTTTTTAGACATACATCAGCTGGTTAATC (서열번호 56)
c) 전사 종결인자의 증폭
바실러스 아밀리크파시엔스 (Bacillus amyliquefaciens)의 알칼라인 세린 프로테아제로부터 나온 종결인자가 하기 프라이머를 사용하여 미리 서열결정된 플라스미드 pJHPms382로부터 증폭되었다:
CF 07-44 (+) 쿠쥬 이소프렌 합성효소 유전자의 3' 말단을 종결인자에 융합
5'-GATTAACCAGCTGATGTATGTCTAAAAAAAACCGGCCTTGG (서열번호 57)
CF 07-46 (-) B. amyliquefaciens 종결인자의 말단 (BamHI)
5'-GACATGACGGATCCGATTACGAATGCCGTCTC (서열번호 58)
쿠쥬 단편은 하기 프라이머로 된 PCR을 사용하여 종결인자 단편에 융합되었다:
CF 07-42 (+)(+) aprE 프로모터를 쿠쥬 이소프렌 합성효소 유전자에 융합
(GTG 시작 코돈)
5'-TAAAAGGAGAGGGTAAAGAGTGTGTGCGACCTCTTCTCAAT (서열번호 55)
CF 07-46 (-) B. amyliquefaciens 종결인자의 말단 (BamHI)
5'-GACATGACGGATCCGATTACGAATGCCGTCTC (서열번호 58)
쿠쥬-종결인자 단편은 하기 프라이머로 된 PCR을 사용하여 프로모터 단편에 융합되었다:
CF 797 (+) 시작 aprE 프로모터 MfeI
5'-GACATCAATTGCTCCATTTTCTTCTGCTATC (서열번호 53)
CF 07-46 (-) B. amyliquefaciens 종결인자의 말단 (BamHI)
5'-GACATGACGGATCCGATTACGAATGCCGTCTC (서열번호 58)
융합 PCR 단편은 퀴아젠 (Qiagen) 키트를 사용하여 정제되었고 제한효소 MfeI 및 BamHI으로 소화되었다. 본 소화된 DNA 단편은 퀴아젠 키트를 사용하여 젤 정제되었고 미리 EcoRI 및 BamHI으로 소화되었고 젤 정제되었던 pBS19라도 알려진 벡터에 결찰되었다.
라이게이션 혼합액은 대장균 Top10 세포 내에 형질전환되었고 콜로니가 LA+50 카베니실린 플레이트 상에서 선별되었다. 전부 여섯 개의 콜로니가 선택되었고 LB+50 카베니실린에서 하룻밤 동안 키운 다음 퀴아젠 키트를 사용하여 분리되었다. 플라스미드는 삽입물 (inserts)를 검토하기 위해 EcoRI 및 BamHI으로 소화되었고 세 개의 정확한 플라스미드가 하기 프라이머로 서열결정하기 위해 보내졌다:
CF 149 (+) aprE 프로모터의 EcoRI 시작
5'-GACATGAATTCCTCCATTTTCTTCTGC (서열번호 59)
CF 847 (+) pXX 049에서의 서열 (aprE 프로모터의 말단)
5'-AGGAGAGGGTAAAGAGTGAG (서열번호 60)
CF 07-45 (-)쿠쥬 이소프렌 합성효소 유전자의 3' 말단을 종결인자에 융합
5'-CCAAGGCCGGTTTTTTTTAGACATACATCAGCTGGTTAATC (서열번호 56)
CF 07-48 (+) 쿠쥬 이소프렌 합성효소를 위한 서열결정 프라이머
5'-CTTTTCCATCACCCACCTGAAG (서열번호 61)
CF 07-49 (+) 쿠쥬 이소프렌 합성효소에서 서열결정
5'-GGCGAAATGGTCCAACAACAAAATTATC (서열번호 62)
pBS Kudzu #2 (도 52 및 도 12; 서열번호 5)라고 명명된 플라스미드는 서열결정에 의해 정확성이 바실러스 섭틸리스 숙주 균주인 BG 3594 comK 내로 형질전환되었다. 선별은 LA + 5 클로로암페니콜 플레이트 상에서 이루어졌다. 형질전환체가 선택되었고 LA + 5 클로로암페니콜 상에 단일 콜로니로 키운 다음 LB + 5 클로로암페니콜에서 OD600 1.5가 될 때까지 성장시켰다. 이것은 바이알에 넣어 글리세롤 존재 시 -80℃에서 냉동 저장되었다. 그 결과 나온 균주는 CF 443라고 명명되었다.
II. 재조합 이소프렌 합성효소를 발현하는
B. 섭틸리스
세포를 포함하는 진탕 플라스크에서 이소프렌의 생산
밤샘 배양액이 LA + 클로로암페니콜 (Cm, 25 μg/ml)로부터 나온 CF 443 의 단일 콜로니로 접종되었다. 배양액은 LB + Cm을 사용하여 37℃에서 200 rpm으로 진탕하면서 성장시켰다. 이들 밤샘 배양액 (1 ml)은 25 ml 그랜트 II 배지 및 클로로암페니콜을 25 μg/ml 농도로 포함하는 250 ml의 진탕 플라스크를 접종하는 데 사용되었다. 그랜트 II 배지 레시피는 10 g 소이톤, 3 ml 1M K2HPO4, 75 g 포도당, 3.6 g 우레아, 100 ml 10X MOPS가 pH 7.2 H2O를 사용하여 1 L로 q.s 맞춰졌고; 10X MOPS 레시피는 83.72 g MOPS, 7.17 g 트리신 (tricine), 12 g KOH 펠렛, 10 ml 0.276M K2SO4 용액, 10 ml 0.528M MgCl2 용액, 29.22 g NaCl, 100 ml 100X 미량영양소 (micronutrients)가 H2O를 사용하여 1 L로 q.s 맞춰졌으며; 또한 100X 미량영양소 레시피는 1.47 g CaCl2*2H2O, 0.4 g FeSO4*7H20, 0.1 g MnSO4*H20, 0.1 g ZnSO4*H2O, 0.05 g CuCl2*2H2O, 0.1 g CoCl2*6H2O, 0.1 g Na2MoO4*2H2O가 H2O를 사용하여 1 L로 q.s 맞춰졌다. 진탕 플라스크는 37℃에서 배양되었고, 시료는 18, 24, 및 44 시간에 가져왔다. 18 시간에서 CF443 및 대조군 균주의 상부공간이 채취되었다. 이것은 이소프렌 축적의 18시간을 보여주었다. 이소프렌량은 실시예 1에 기술된 바와 같이 기체 크로마토그래피에 의해 결정되었다. 이소프렌량은 재조합 이소프렌 합성효소를 발현함에 의해 유의하게 증진되었다 (도 11).
III. 14 L 발효에서 CF443에 의한 이소프렌의 생산
복제 플라스미드 상에 재조합 이소프렌 합성효소 유전자를 포함하는 B. subtilis 로부터 이소프렌의 대량 생산은 회분식 배양으로부터 결정되었다. 쿠쥬 이소프렌 합성효소 유전자를 발현하는 바실러스 균주 CF 443, 또는 쿠쥬 이소프렌 합성효소 유전자를 발현하지 않는 대조군 균주는 소이밀 (soy meal, Cargill), 소듐과 포타슘 포스페이트, 마그네슘 설페이트 및 시트르산, 염화 철 및 염화 망간의 용액을 포함하는 영양 배지에서 통상적인 회분식 배양에 의해 배양되었다. 발효 이전에, 배지는 셀루라제 (cellulases), 헤미셀룰라제 (hemicellulases) 및 펙티나제 (pectinases)를 포함하는 효소 혼합물 (국제특허출원 제 WO 95/04134호를 참조하라)을 사용하여 90분 동안 부드럽게 만들었다. 14-L 회분식 발효는 60% wt/wt 포도당 (Cargill DE99 덱스트로스, ADM 베르사덱스 그린 (Versadex greens) 또는 Danisco 역슈가) 및 99% wt/wt 오일 (세포 배양배지에 첨가되지 이전에 오일 농도가 99% wt/wt인 웨스턴 패밀리 콩 오일)이 첨가되었다. 배양은 포도당이 회분에서 검출 가능하지 않을 때 시작되었다. 배양 속도는 여러 시간 동안 시도하여 동일한 탄소 조성 상에 오일을 첨가하도록 조절되었다. pH 는 28% w/v 암모늄 하이드록사이드를 사용하여 6.8 - 7.4로 조절되었다. 거품이 나는 경우, 항거품 제제가 배지에 첨가되었다. 발효 온도는 37℃로 조절되었으며 발효 배양은 750 rpm으로 진탕되었다. pH, DO%, 공기유동 및 압력과 같은 다양한 기타 변수들이 전 공정을 통하여 감시되었다. DO%는 20 이상으로 유지되었다. 시료는 36시간 경과 동안 가져왔고 세포 성장 (OD550) 및 이소프렌 성장에 대해 분석되었다. 이들 실험의 결과는 도 53A 및 53B에 나타나있다.
IV. B. 섭틸리스에서 쿠쥬 이소프렌 합성효소 (ispS)의 통합
쿠쥬 이소프렌 합성효소 유전자는 삽입되는 플라스미드 (pJH101-cmpR)에 aprE 프로모터의 조절 하에 클론되었다. 테스트된 조건 하에서, 이소프렌은 전혀 검출되지 않았다.
실시예 5:
트리코더마
에서 이소프렌의 생산
I. 트리코더마 리세이 (Trichoderma reesei)에서 쿠쥬 이소프렌 합성효소의 발현을 위한 벡터의 제작
야로위야 리포리티카 (Yarrowia lipolytica) 코돈-최적화된 쿠쥬 IS 유전자는 DNA 2.0 (서열번호 6) (도 13)에 의해 합성되었다. 본 플라스미드는 하기 PCR 반응을 위한 주형으로서 제공되었다: 1 μl 플라스미드 주형 (20 ng/μl), 1 μl 프라이머 EL-945 (10 μM) 5'-GCTTATGGATCCTCTAGACTATTACACGTACATCAATTGG (서열번호 63), 1 μl 프라이머 EL-965 (10 μM) 5'-CACCATGTGTGCAACCTCCTCCCAGTTTAC (서열번호 64), 1 μl dNTP (10 mM), 5 μl 10x PfuUltra II 융합 HS DNA 중합효소 완충용액, 1 μl PfuUltra II 융합 Fusion HS DNA 중합효소, 40 μl 물에 녹여 전체 50 μl의 반응 부피. 전방 프라이머는 5' 말단에 Y. lipolytica 코돈-최적화된 쿠쥬 이소프렌 합성효소 유전자에 해당하지 않았지만 pENTR/D-TOPO 벡터를 위해서는 필요한 4개의 부가적인 뉴클레오타이드를 포함하였다. 역방 프라이머는 5'말단에 Y. lipolytica 코돈-최적화된 쿠쥬 이소프렌 합성효소 유전자에 해당하지 않았지만 다른 벡터 골격 내 클로닝을 위해 삽입되었던 21개의 부가적인 뉴클레오타이드를 포함하였다. MJ 리서치 PTC-200 열순환기 (MJ Research PTC-200 Thermocycler)를 사용하여, PCR 반응이 다음과 같이 수행되었다: 95℃ 2분 (최초 사이클만), 95℃ 30초, 55℃ 30초, 72℃ 30 초 (27회 사이클 반복), 마지막 사이클 이후 72℃ 1분. PCR 산물은 1.2% E-젤 상에서 Y. lipolytica 코돈-최적화된 쿠쥬 이소프렌 합성효소 유전자의 성공적인 증폭을 검증하기 위하여 분석되었다.
그 다음 PCR 산물은 TOPO pENTR/D-TOPO 클로닝 키트의 하기 제조사의 지침을 사용하여 클로닝되었다: 1 μl PCR 반응, 1 μl 염 용액, 1 μl TOPO pENTR/D-TOPO 벡터 및 3 μl 물에 녹인 전체 6 μl의 반응 부피. 반응은 상온에 5분 동안 배양되었다. 1 마이크로리터의 TOPO 반응은 TOP10 화학적으로 능력있는 E. coli 세포 내로 형질전환되었다. 형질전환체는 LA + 50 μg/ml 카나마이신 플레이트 상에서 선별되었다. 여러가지 콜로니가 찍혔고 각각은 LB + 50 μg/ml 카나마이신을 포함하는 5 ml 튜브 내에 접종되었으며 배양액은 37℃에서 200 rpm으로 진탕하면서 하룻밤 동안 성장시켰다. 플라스미드는 제조사의 프로토콜에 따라 QIA프렙 스핀 미니프렙 키트를 사용하여 밤샘 배양 튜브로부터 분리되었다. 여러가지 플라스미드가 DNA 서열이 정확한지 확인하기 위해 서열결정되었다.
Y. lipolytica 코돈-최적화된 쿠쥬 이소프렌 합성효소 유전자를 인코딩하는 단일 pENTR/D-TOPO 플라스미드가 주문-제작된 pTrex3g 벡터 내에 게이트웨이 클로닝 (Gateway Cloning)을 위해 사용되었다. pTrex3g의 제작은 국제특허출원 공개번호 제 WO 2005/001036 A2호에 기술되어 있다. 반응은 게이트웨이LR 클로나제II 효소 믹스 키트 (Gateway LR Clonase II Enzyme Mix Kit, Invitrogen)에 대한 제조사의 프로토콜에 따라 수행되었다: 1 μl Y. lipolytica 코돈-최적화된 쿠쥬 이소프렌 합성효소 유전자 pENTR/D-TOPO 공여자 벡터, 1 μl pTrex3g 목적 벡터, 6 μl TE 완충용액에 녹인 전체 8 μl의 반응 부피. 반응은 상온에서 1시간 동안 배양된 다음 1 μl 프로테나제 K 용액이 첨가되었으며 반응은 37℃에서 10분 동안 계속되었다. 그 다음 1 μl의 반응액은 화학적으로 능력있는 TOP10 E. coli 세포에 형질전환되었다. 형질전환체는 LA + 50 μg/ml 카베니실린 플레이트 상에서 선별되었다. 여러가지 콜로니가 찍혔고 각각은 LB + 50 μg/ml 카베니실린을 포함하는 5 ml 튜브 내로 접종되었으며 배양액은 37℃에서 200 rpm으로 진탕하면서 하룻밤 동안 성장시켰다. 플라스미드는 제조사의 프로토콜에 따라 QIA프렙 스핀 미니프렙 키트를 사용하여 밤샘 배양 튜브로부터 분리되었다. 여러가지 플라스미드가 DNA 서열이 정확한지 확인하기 위해 서열결정되었다.
Y. lipolytica 코돈-최적화된 쿠쥬 이소프렌 합성효소 pTrex3g 플라스미드 (도 14)의 quad 결실 트리코더마 리세이 (Trichoderma reesei) 균주 내로의 바이올리스틱 형질전환은 바이올리스틱 PDS-1000/HE 입자 전달 시스템 (Biolistic PDS-1000/HE Particle Delivery System) (국제특허출원 공개번호 제 WO 2005/001036 A2호)을 사용하여 수행되었다. 안정한 형질전환체의 분리 및 진탕 플라스크 평가는 국제특허 공개번호 제 WO 2005/001036 A2호의 실시예 11에 나열된 프로토콜을 사용하여 수행되었다.
II. T.리세이 재조합 균주에서 이소프렌의 생산
상기에서 기술된 이소프렌 합성효소 형질전환체의 오래된 15 및 36 시간 배양액 1 ml이 상부공간 바이알로 이동되었다. 바이알은 밀봉되었고 30℃에서 5시간 동안 배양되었다. 상부공간 지체가 측정되었고 이소프렌이 실시예 1에 기술된 방법에 의해 확인되었다. 두 개의 형질전환체가 미량의 이소프렌을 보여주었다. 이소프렌량은 14시간 배양까지 증가될 수 있었다. 두 개의 양성 시료가 14시간 배양 동안 약 0.5 μg/L의 수준에서 이소프렌을 보여주었다. 형질전환되지 않은 대조군은 검출 가능한 수준의 이소프렌을 전혀 보여주지 못하였다. 본 실험은 T. reesei 가 외재성 이소프렌 합성효소와 함께 공급될 때 내재성 전구체로부터 이소프렌을 생산할 수 있는 것을 보여준다.
실시예 6:
야로위야
에서 이소프렌의 생산
I. 야로위야 리포리티카 에서 쿠쥬 이소프렌 합성효소의 발현을 위한 벡터의 제작
야로위야 리포리티카 (Yarrowia lipolytica)에서 쿠쥬 이소프렌 합성효소의 발현을 위한 벡터의 제작을 위한 시작점은 pSPZ1(MAP29Spb)이었다. 본 벡터의 완전한 서열 (서열번호 7)은 도 15에 나타나있다.
하기 단편은 주형으로서: URA3 유전자의 프로모터 없는 형태, 18S 리보좀 RNA 유전자의 단편, Y. lipolytica XPR2 유전자의 전사 종결인자 및 프로모터 XPR2와 ICL1 유전자를 포함하는 두 개의 DNA 단편인 Y. lipolytica 균주 GICC 120285의 염색체 DNA를 사용하여 PCR에 의해 증폭되었다. 하기 PCR 프라이머가 사용되었다:
ICL1 3
5'-GGTGAATTCAGTCTACTGGGGATTCCCAAATCTATATATACTGCAGGTGAC (서열번호 65)
ICL1 5
5'-GCAGGTGGGAAACTATGCACTCC (서열번호 66)
XPR 3
5'-CCTGAATTCTGTTGGATTGGAGGATTGGATAGTGGG (서열번호 67)
XPR 5
5'-GGTGTCGACGTACGGTCGAGCTTATTGACC (서열번호 68)
XPRT3
5,-GGTGGGCCCGCATTTTGCCACCTACAAGCCAG (서열번호 69)
XPRT 5
5'-GGTGAATTCTAGAGGATCCCAACGCTGTTGCCTACAACGG (서열번호 70)
Y18S3
5'-GGTGCGGCCGCTGTCTGGACCTGGTGAGTTTCCCCG (서열번호 71)
Y18S 5
5'-GGTGGGCCCATTAAATCAGTTATCGTTTATTTGATAG (서열번호 72)
YURA3
5'-GGTGACCAGCAAGTCCATGGGTGGTTTGATCATGG (서열번호 73)
YURA 50
5'-GGTGCGGCCGCCTTTGGAGTACGACTCCAACTATG (서열번호 74)
YURA 51
5'-GCGGCCGCAGACTAAATTTATTTCAGTCTCC (서열번호 75)
PCR 증폭을 위해 PfuUltraII 중합효소 (Stratagene), 공급자-제공 완충용액 및 dNTPs 또한 표시된 주형 DNA가 제조사의 지침에 따라 사용되었다. 증폭은 하기 사이클을 사용하여 수행되었다: 95℃ 1분; 34회 (95℃ 30초; 55℃ 30초; 72℃ 3분) 4℃ 배양에 이어서 10분 72℃.
야로위야에서 발현을 위해 코돈-최적화된 쿠쥬 이소프렌 합성효소를 인코딩하는 합성 DNA 분자는 DNA 2.0 (도 16; 서열번호 8)로부터 획득되었다. 각각 XPR2 및 ICL1 프로모터의 조절 하에 합성 쿠쥬 이소프렌 합성효소 유전자를 보유하는 플라스미드 pYLA(KZ1) 및 pYLI(KZ1)의 제작 도식의 상세한 사항 전부는 도 18에 나타나있다. 메이팅 인자 (mating factor) 유전자 (MAP29)가 이소프렌 합성효소 유전자의 자리에 삽입된 대조군 플라스미드도 역시 제작되었다 (도 18E 및 18F).
유사한 클로닝 과정이 포풀라 (Populus alba x Populus tremula) 이소프렌 합성효소 유전자를 발현하는 데 사용될 수 있다. 포풀라 이소프렌의 서열은 Miller B. et al. (2001) Planta 213, 483-487에 기술되어 있고 도 17 (서열번호 9)에 보여진다. 각각 XPR2 및 ICL1 프로모터의 조절 하에 합성 쿠쥬 이소프렌 합성효소 유전자를 보유하는 플라스미드 pYLA(POP1) 및 pYLI(POP1)의 제작 도식은 도 18A 및 18B에 나타나있다.
II. 재조합 Y. 리포리티카 균주에 의한 이소프렌의 생산
벡터 pYLA(KZ1), pYLI(KZ1), pYLA(MAP29) 및 pYLI(MAP29)가 SacII로 소화되었고 표준 리튬 아세테이트/폴리에틸렌 글리콜 과정에 의해 Y. lipolytica CLIB 122 균주를 우리딘 원형영양성 (uridine prototrophy)으로 형질전환시켰다. 간략하게, YEPD (1% 효모추출물, 2% 펩톤, 2% 포도당)에서 하룻밤 동안 자란 효모 세포는 원심분리 (4000 rpm, 10 분)에 의해 수확되었으며, 멸균된 물로 한 번 세척되었고 pH 6.0의 0.1 M 리튬 아세테이트에 현탁되었다. 200 μl 분량의 세포 현탁액은 직선화 플라스미드 DNA 용액 (10 - 20 μg)과 혼합되었고, 상온에서 10분 동안 배양되었으며 1 ml의 50% PEG 4000과 동일한 완충용액에서 혼합되었다. 현탁액은 좀 더 나아가 42℃에서 2분 열 충격에 이어서 상온에서 1시간 동안 배양되었다. 그 다음 세포는 SC 히스 루이 플레이트 (0.67% 효모 질소 베이스, 2% 포도당, 각각 100 mg/L의 루이신 및 히스티딘) 상에 도말되었다. 형질전환체는 30℃에서 3 - 4일의 배양 이후에 나타났다.
pYLA(KZ1) 형질전환으로부터 세 개의 분리물, pYLI(KZ1) 형질전환으로부터 세 개의 분리물, pYLA(MAP29) 형질전환으로부터 두 개의 분리물 및 pYLI(MAP29) 형질전환으로부터 두 개의 분리물을 24시간 동안 YEP7 배지 (1% 효모추출물, 2% 펩톤, pH 7.0)로 30℃에서 진탕하면서 성장시켰다. 10 ml 의 배양액으로부터 나온 세포는 원심분리에 의해 수집되었고 3ml의 새로운 YEP7에 재현탁시켰으며 15 ml 회전 뚜껑 바이알 내에 넣었다. 바이알은 상온에서 부드럽게 진탕하면서 (60 rpm) 하룻밤 동안 상온에서 배양되었다. 이들 바이알의 상부공간에서 이소프렌 내용물은 실시예 1에 기술된 바와 같이 질량-분광측정 검출기 (mass-spectrometric detector)를 사용하여 기체 크로마토그래피에 의해 분석되었다. pYLA(KZ1) 및 pYLI(KZ1)로 획득된 모든 형질전환체는 즉시 검출가능한 양의 이소프렌을 생산하였다 (0.5 μg/L 내지 1 μg/L, 도 20). 이소프렌 합성효소 유전자 대신 파이타제 (phytase) 유전자를 보유하는 대조군 균주의 상부공간에서는 이소프렌이 전혀 검출되지 않았다.
실시예 7: 쿠쥬 이소프렌 합성효소 및 idi, 또는 dxs, 또는 idi 및 dxs를 발현하는 대장균에서 이소프렌의 생산
I. 대장균에서 이소프렌의 생산을 위한 쿠쥬 이소프렌 합성효소 및 idi, 또는 dxs, 또는 idi 및 dxs를 인코딩하는 벡터의 제작
i) pTrcKudzuKan의 제작
pTrcKudzu (실시예 1에 기술됨)의 bla 유전자가 카나마이신 저항성을 부여하는 유전자와 대체되었다. bla 유전자를 제거하기 위하여, pTrcKudzu가 BspHI으로 소화되었고, 새우 알칼라인 포스파타제 (SAP)로 처리되었으며, 65℃에서 열 사멸된 다음 클레노 조각효소 및 dNTPs을 사용하여 말단이 채워졌다. 5 kbp 큰 단편은 아가로스 젤로부터 정제되었고 pCR-Blunt-II-TOPO 로부터 프라이머 MCM22 5'- GATCAAGCTTAACCGGAATTGCCAGCTG (서열번호 76) 및 MCM23 5'- GATCCGATCGTCAGAAGAACTCGTCAAGAAGGC (서열번호 77)을 사용하여 PCR 증폭되었고 HindIII 및 PvuI으로 소화되었으며 말단이 채워졌던 kanr 유전자에 결찰되었다. 카나마이신 저항성을 부여하는 플라스미드 (pTrcKudzuKan)를 보유하는 형질전환체는 카나마이신 50 μg/ml을 포함하는 LA 상에서 선별되었다.
ii) pTrcKudzu yIDI Kan의 제작
pTrcKudzuKan은 PstI으로 소화되었고, SAP으로 처리되었으며, 열 사멸되어 젤 정제되었다. 이것은 S. cerevisiae 로부터 합성 RBS와 함께 idi 를 인코딩하는 PCR 산물에 결찰되었다. PCR을 위한 프라이머는 NsiI-YIDI 1 F 5'- CATCAATGCATCGCCCTTAGGAGGTAAAAAAAAATGAC (서열번호 78) 및 PstI-YIDI 1 R 5'- CCTTCTGCAGGACGCGTTGTTATAGC (서열번호 79)이었고; 또한 주형은 S. cerevisiae 게놈DNA이었다. PCR 산물은 NsiI 및 PstI으로 소화되었고 결찰 이전에 젤 정제되었다. 라이게이션 혼합액은 화학적으로 능력있는 TOP10 세포 내에 형질전환되었고 50 μg/ml 카나마이신을 포함하는 LA 상에서 선별되었다. 여러가지 형질전환체가 분리되었고 서열결정 되었으며 그 결과 나온 플라스미드는 pTrcKudzu-yIDI(kan)라고 명명되었다 (도 34 및 도 35; 서열번호 16).
iii) pTrcKudzu DXS Kan의 제작
플라스미드 pTrcKudzuKan는 PstI으로 소화되었고, SAP으로 처리되었으며, 열 사멸되어 젤 정제되었다. 이것은 대장균으로부터 합성 RBS와 함께 dxs 를 인코딩하는 PCR 산물에 결찰되었다. PCR을 위한 프라이머는 MCM13 5'-GATCATGCATTCGCCCTTAGGAGGTAAAAAAACATGAGTTTTGATATTGCCAAATACCCG (서열번호 80) 및 MCM14 5'-CATGCTGCAGTTATGCCAGCCAGGCCTTGAT (서열번호 81); 또한 주형은 PCR 산물은 NsiI 및 PstI으로 소화되었고 결찰 이전에 젤 정제되었다. 그 결과 나온 라이게이션 반응은 TOP10 세포 내에 형질전환되었고 50 μg/ml 카나마이신을 포함하는 LA 상에서 선별되었다. 여러가지 형질전환체가 분리되었고 서열결정 되었으며 그 결과 나온 플라스미드는 pTrcKudzu-DXS(kan)라고 명명되었다 (도 36 및 도 37; 서열번호 17).
iv) pTrcKudzu-yIDI-dxs (kan)의 제작
pTrcKudzu-yIDI(kan)는 PstI으로 소화되었고, SAP으로 처리되었으며, 열 사멸되어 젤 정제되었다. 이것은 합성 RBS와 함께 대장균dxs 를 인코딩하는 NsiI 및 PstI로 이미 소화되었고 젤 정제되었던 PCR 산물에 결찰되었다 (프라이머 MCM13 5'-GATCATGCATTCGCCCTTAGGAGGTAAAAAAACATGAGTTTTGATATTGCCAAATACCCG (서열번호 80) 및 MCM14 5'-CATGCTGCAGTTATGCCAGCCAGGCCTTGAT (서열번호 81); 주형 TOP10 세포). 최종 플라스미드는 pTrcKudzu-yIDI-dxs (kan)라고 명명되었다 (도 21 및 도 22; 서열번호 10).
v) pCL PtrcKudzu의 제작
실시예 1로부터 나온 프로모터, 구조 유전자 및 종결인자를 포함하는 DNA 단편은 pTrcKudzu로부터 SspI 사용하여 소화되었고 젤 정제되었다. 이것은 이미 PvuII로 소화되었고 SAP으로 처리되었으며 열 사멸되었던 pCL1920에 결찰되었다. 그 결과 나온 라이게이션 혼합액은 TOP10 세포 내로 형질전환되었고 50 μg/ml 스펙티노마이신을 포함하는 LA 상에서 선별되었다. 여러가지 클론이 분리되었고 서열결정되었으며 두 개가 선별되었다. pCL PtrcKudzu 및 pCL PtrcKudzu (A3)는 반대 방향으로 된 삽입물을 가진다 (도 38 내지 도 41; 서열번호 18 내지 19).
vi) pCL PtrcKudzu yIDI의 제작
상기 (ii)로부터 나온 NsiI-PstI 소화되고, 젤 정제된 IDI PCR 증폭자 (amplicon) 는 이미 PstI으로 소화되었고 SAP으로 처리되었으며 열 사멸되었던 pCL PtrcKudzu 내에 결찰되었다. 라이게이션 혼합액은 TOP10 세포 내에 형질전환되었고 50 μg/ml 스펙티노마이신을 포함하는 LA 상에서 선별되었다. 여러가지 클론이 분리되었고 서열결정되었으며 그 결과 나온 플라스미드는 pCL PtrcKudzu yIDI라고 명명되었다 (도 42 및 도 43; 서열번호 20).
vii) pCL PtrcKudzu DXS의 제작
상기 (iii)로부터 나온 NsiI-PstI 소화되고, 젤 정제된 DXS PCR 증폭자는 이미 PstI으로 소화되었고 SAP으로 처리되었으며 열 사멸되었던 pCL PtrcKudzu (A3) 내에 결찰되었다. 라이게이션 혼합액은 TOP10 세포 내에 형질전환되었고 50 μg/ml 스펙티노마이신을 포함하는 LA 상에서 선별되었다. 여러가지 클론이 분리되었고 서열결정되었으며 그 결과 나온 플라스미드는 pCL PtrcKudzu DXS라고 명명되었다 (도 44 및 도 45; 서열번호 21).
II.
쿠쥬 이소프렌 합성효소,
idi
, 및/또는
dxs
를 서로 다른 사본수로 발현하는 배양으로부터 나온 상부공간 이소프렌의 측정
플라스미드 pTrcKudzu(kan) (A), pTrcKudzu-yIDI kan (B), pTrcKudzu-DXS kan (C), pTrcKudzu-yIDI-DXS kan (D)로 이전에 형질전환되었던 E. coli BL21(λDE3)을 LB 카나마이신 50 μg/mL에서 성장시켰다. pCL PtrcKudzu (E), pCL PtrcKudzu, pCL PtrcKudzu-yIDI (F) 및 pCL PtrcKudzu-DXS (G)의 배양액은 LB 스펙트로마이신 50 μg/mL에서 성장시켰다. 배양액은 400 μM IPTG을 사용하여 0 시간 (대략 0.5의 OD600)에서 유도시켰고 시료는 이소프렌 상부공간 측정을 위해 수집되었다 (실시예 1 참조하라). 결과는 도 23A 내지 23G에 나타나 있다.
플라스미드 pTrcKudzu-yIDI-dxs (kan)가 E. coli 균주 BL21에 형질전환에 의해 도입되었다. 그 결과 나온 균주 BL21/pTrc Kudzu IDI DXS는 카나마이신 (50 μg/ml)을 포함하는 LB 상에 하룻밤 동안 20℃에서 성장시켰고 TM3 (13.6 g K2PO4, 13.6 g KH2PO4, 2.0 g MgSO4*7H2O), 2.0 g 시트르산 모노하이드레이트, 0.3 g 철 암모늄 사이트레이트, 3.2 g (NH4)2SO4, 0.2 g 효모추출물, 1.0 ml 1000 x 변형된 미량 금속 용액, pH 6.8로 조절되어 물로 q.s. 맞추어지고 여과 멸균됨)의 진탕 플라스크를 접종하는 데 사용되었다. 플라스크는 OD600 0.8이 될 때까지 30℃에서 배양된 다음 400 μM IPTG를 사용하여 유도되었다. 시료는 유도 이후 다양한 시간대에 가져왔고 상부공간에서 이소프렌량은 실시예 1에 기술된 바와 같이 측정되었다. 결과는 도 23H에 나타나 있다.
III. E. coli/pTrcKudzu yIDI DXS에서 바이오매스로부터 이소프렌의 생산
대장균 BL21 pTrcKudzuIDIDXS 균주가 세 가지 유형의 바이오매스 로부터 이소프렌을 생성하는 능력에 대해 테스트되었다; 대조군으로서 포도당과 함께 바가스 (bagasse), 옥수수 스토버 및 연목질 펄. 바이오매스의 가수분해물은 효소적 가수분해에 의해 제조되었고 (Brown, L and Torget, R., 1996, NREL standard assay method Lap-009 "Enzymatic Saccharification of Lignocellulosic Biomass" 포도당 동등물에 기초한 희석에서 사용되었다. 본 실시예에서, 포도당 동등물은 1% 포도당과 동일하다. 플레이트로부터 나온 단일 콜로니인 대장균 BL21 (λDE3) pTrcKudzu yIDI DXS (kan)의 새로이 형질전환된 세포가 카나마이신 (50 μg/ml)을 더한 5 ml LB에 접종하는 데 사용되었다. 배양액은 하룻밤 동안 25℃에서 진탕하면서 배양되었다. 다음 날 밤샘 배양액은 OD600 0.05까지 25 ml의 TM3 + 0.2% YE + 1% 공급원료로 희석시켰다. 공급원료는 옥수수 스토버, 바가스 또는 연목질 펄프이었다. 포도당은 양성 대조군으로서 사용되었고 무포도당은 음성 대조군으로서 사용되었다. 배양액은 30℃에서 180 rpm으로 진탕하면서 배양되었다. 배양액이 OD600에 대해 감시되었고 이것이 OD600 ~0.8이 될 때, 실시예 1에 기술된 바와 같이 배양액은 1 및 3시간에서 이소프렌 생산에 대해 분석되었다. 배양액은 유도되지 않는다. 첨가된 공급원료을 포함하는 모든 배양액은 포도당 양성 대조군의 것과 동등한 이소프렌을 생산한다. 실험은 이중으로 수행되었고 도 46에 나타나있다.
IV. E. coli/pTrcKudzuIDIDXS에서 역슈가로부터 이소프렌의 생산
플레이트로부터 나온 단일 콜로니인 대장균 BL21 (λDE3) pTrcKudzu yIDI DXS (kan)의 새로이 형질전환된 세포가 5 ml LB + 카나마이신 (50 μg/ml)을 접종하는 데 사용되었다. 배양액은 하룻밤 동안 25℃에서 진탕하면서 배양되었다. 다음 날 밤샘 배양액은 OD600 0.05까지 25 ml의 TM3 + 0.2% YE + 1% 공급원료로 희석시켰다. 공급원료는 포도당, 역 포도당 또는 옥수수 스토버이었다. 역슈가 공급원료 (Danisco Invert Sugar)은 효소적으로 처리된 슈크로스 시럽에 의해 제조되었다. AFEX 옥수수 스토버는 하기에 기술된 바와 같이 제조되었다 (제 V부). 세포는 30℃에서 성장시켰고 첫 번째 시료는 배양액이 OD600 ~0.8-1.0 (0시간)이 될 때 측정되었다. 배양액은 성장을 위해 OD600 에 의해 측정된 바와 같이 또한 이소프렌 생산을 위해 실시예 1에서와 같이 1, 2 및 3시간대에서 분석되었다. 결과는 도 47에 나타나 있다.
V. AFEX 전처리된 옥수수 스토버로부터 가수분해물의 제조
AFEX 전처리된 옥수수 스토버는 미시간 생물공학연구소 (Michigan Biotechnology Institute)로부터 획득되었다. 전처리 조건은 60% 수분, 1 : 1 암모니아 로딩, 및 90℃에서 30분 동안 처리한 다음 공기 건조되었다. AFEX 전처리된 옥수수 스토버에서 수분 함량은 21.27%이었다. AFEX 전처리된 옥수수 스토버에서 글루칸 (glucan) 및 자일란 (xylan)의 함량은 각각 31.7% 및 19.1% (건조 기준)이었다. 당화 (saccharification) 공정은 다음과 같았다; 20 g 의 AFEX 전처리된 옥수수 스토버가 500 ml 플라스크 내로 5 ml의 1 M 소듐 사이트레이트 완충용액 pH 4.8, 2.25 ml의 아셀러라제 (Accellerase) 1000, 0.1 ml의 그린다밀 (Grindamyl) H121 (빵-제조업을 위한 아스퍼질러스 니제르 (Aspergillus niger)로부터 나온 대니스코 자일라나제 제품), 및 72.65 ml의 DI물과 함께 첨가되었다. 플라스크는 궤도 교반기에 넣었고 50℃에서 96시간 동안 배양되었다. 한 시료를 교반기로부터 가져왔고 HPLC를 사용하여 분석되었다. 가수분해물은 38.5 g/l의 포도당, 21.8 g/l의 자일로스, 및 10.3 g/l의 포도당 및/또는 자일로스의 올리고머를 포함하였다.
VI. 회분식 배양에서 자란 대장균에서 이소프렌 생산에 미치는 효모추출물의 효과.
발효는 상기 기술된 pTrcKudzu yIDI DXS 플라스미드를 포함하는 대장균 세포를 사용하여 이전에 기술된 바와 같이 14-L 규모로 수행되었다. 효모추출물 (Bio Springer, Montreal, Quebec, Canada)은 지수적 속도로 첨가되었다. 발효기에 운반된 효모추출물의 전체 양은 40시간 동안 70-830 g 사이에서 변화되었다. 발효 액체배지의 광학 밀도는 550 nm의 파장에서 측정되었다. 발효기 내의 최종 광학 밀도는 첨가된 효모추출물의 양과 비례하였다 (도 48A). 발효기로부터 나온 배출기체에서 이소프렌 수준은 이전에 기술된 바와 같이 결정되었다. 이소프렌 역가는 발효 과정 내내 증가되었다 (도 48B). 생산된 이소프렌량은 첨가된 효모추출물의 양과 직선상으로 비례하였다 (도 48C).
VII. pTrcKudzu DXS yIDI의 500 L 발효에서 이소프렌의 생산
쿠쥬 이소프렌 합성효소, S. cerevisiae IDI, 및 E. coli DXS 핵산 (E. coli BL21 (λDE3) pTrc Kudzu dxs yidi)을 가진 대장균 세포의 500 리터 발효가 이소프렌을 생산하는 데 사용되었다. 이소프렌의 수준은 15시간의 기간 동안 50으로부터 300 μg/L까지 변화되었다. 평균 이소프렌 농도, 장치를 통과하는 평균 유량 및 이소프렌 통과의 정도를 근거로 하여, 수집된 이소프렌량이 17 g인 것으로 계산되었다.
VIII. 회분식 배양에서 자란 대장균의 500 L 발효에서 이소프렌의 생산
배지 레시피 (발효 배지 리터 당):
K2HPO4 7.5 g, MgSO4 * 7H2O 2 g, 시트르산 모노하이드레이트 2 g, 철 암모늄 시트르산 0.3 g, 효모추출물 0.5 g, 1000X 변형된 미량 금속 용액1 ml. 모든 성분은 다같이 첨가되었고 diH2O에 녹였다. 본 용액은 고압 멸균되었다. pH는 7.0으로 암모늄 기체 (NH3)를 사용하여 조정되었고 부피는 q.s. 맞추었다. 포도당 10 g, 티아민 (thiamine) * HCl 0.1 g, 및 항생제가 멸균 및 pH 조정 이후에 첨가되었다.
1000X 변형된 미량 금속 용액:
시트르산 * H2O 40 g, MnSO4 * H2O 30 g, NaCl 10 g, FeSO4 * 7H2O 1 g, CoCl2 * 6H2O 1 g, ZnSO * 7H2O 1 g, CuSO4 * 5H2O 100 mg, H3BO3 100 mg, NaMoO4 * 2H2O 100 mg. 각 성분은 DIH2O에 한 번에 하나씩 녹이고, pH는 3.0으로 HCl/NaOH를 사용하여 조정한 다음 부피를 q.s. 맞추고 0.22 마이크론 필터로 여과 살균된다.
발효는 pTrcKudzu yIDI DXS를 포함하는 대장균 세포를 사용하여 500-L 생물반응기에서 수행되었다. 본 실험은 원하는 발효 pH 7.0 및 온도 30℃에서 포도당 및 효모로부터 이소프렌 형성을 감시하도록 수행되었다. 냉동 바이알로부터 가져온 대장균 균주의 접종액 (inoculums)은 소이톤-효모추출물-포도당 배지에서 제조되었다. 접종액이 550 nm에서 측정된 OD 0.15까지 된 이후에, 20 ml이 2.5-L 소이톤-효모추출물-포도당 배지를 포함하는 생물반응기에 접종하는 데 사용되었다. 2.5-L 생물반응기를 30℃에서 OD 1.0까지 성장시켰고 2.0-L은 500-L 생물반응기로 이동시켰다.
효모추출물 (Bio Springer, Montreal, Quebec, Canada)과 포도당은 지수적 속도로 첨가되었다. 50시간 발효 동안 생물반응기로 운반된 포도당과 효모추출물의 전체 양은 각각 181.2 kg 및 17.6 kg이었다. 이 시간에 생물반응기 내 광학 밀도는 도 49A에 나타나있다. 생물반응기로부터 나온 배출기체에서 이소프렌 수준은 이전에 기술된 바와 같이 결정되었다. 이소프렌 역가는 발효 과정 내내 증가되었다 (도 49B). 50시간 발효 동안 생산된 이소프렌의 전체 양은 55.1 g이었고 생산의 시간 과정은 도 49C에 나타나있다.
실시예 8: 쿠쥬 이소프렌 합성효소 및 재조합 메발론산 경로 유전자를 발현하는 대장균에서 이소프렌의 생산
I. 하부 MVA 경로의 클로닝
하부 메발론산 경로를 클로닝하는 전략은 다음과 같다. 메발론산 생합성 경로의 네 가지 유전자; 메발로네이트 키나제 (MVK), 포스포메발로네이트 키나제 (PMK), 디포스포메발로네이트 탈탄산화효소 (MVD) 및 이소펜테닐 디포스페이트 이소머라제 유전자가 S. cerevisiae 염색체 DNA로부터 PCR에 의해 증폭되었고 개별적으로 pCR BluntII TOPO 플라스미드 (Invitrogen) 내로 클론되었다. 일정 경우에, idi 유전자는 대장균 염색체 DNA로부터 증폭되었다. 프라이머는 대장균 동일 RBS (AGGAGGT (서열번호 82) 또는 AAGGAGG (서열번호 83))가 시작 코돈의 8 bp 상방 5'-말단에 삽입되고 PstI 부위가 3'-말단에 첨가되도록 설계되었다. 그 다음 유전자는 pTrcHis2B 벡터 내로 하나씩 전체 경로가 모일 때까지 클론되었다.
S. cerevisiae S288C로부터 나온 염색체 DNA가 ATCC (ATCC 204508D)로부터 획득되었다. MVK 유전자는 제조사의 지침과 같이 PfuTurbo를 사용하는 프라이머 MVKF (5'-AGGAGGTAAAAAAACATGTCATTACCGTTCTTAACTTCTGC, 서열번호84) 및 MVK-Pst1-R (5'-ATGGCTGCAGGCCTATCGCAAATTAGCTTATGAAGTCCATGGTAAATTCGTG, 서열번호 85)를 사용하여 S. cerevisiae 의 염색체로부터 증폭되었다. 정확한 크기의 PCR 산물 (1370 bp)이 1.2% E-젤 (Invitrogen)을 통한 전기영동에 의해 확인되었고 pZeroBLUNT TOPO 내로 클론되었다. 그 결과 나온 플라스미드는 pMVK1라고 명명되었다. 플라스미드 pMVK1는 SacI 및 Taq1 제한효소로 소화되었고 단편은 젤 정제되었으며 SacI 및 BstBI으로 소화된 pTrcHis2B 내로 결찰되었다. 그 결과 나온 플라스미드는 pTrcMVK1라고 명명되었다.
메발론산 생합성 경로, PMK에서 두 번째 유전자는 프라이머: PstI-PMK1 R (5'-GAATTCGCCCTTCTGCAGCTACC, 서열번호 86) 및 BsiHKA I-PMK1 F (5'-CGACTGGTGCACCCTTAAGGAGGAAAAAAACATGTCAG, 서열번호 87)를 사용하는 PCR에 의해 증폭되었다. PCR 반응은 제조사의 지침과 같이 Pfu Turbo 중합효소 (Stratagene)를 사용하여 수행되었다. 정확한 크기의 산물 (1387 bp)은 PstI 및 BsiHKI으로 소화되었고 PstI으로 소화된 pTrcMVK1 내로 결찰되었다. 그 결과 나온 플라스미드는 pTrcKK라고 명명되었다. MVD 및 idi 유전자도 동일한 방식으로 클론되었다. PCR은 MVD 유전자를 증폭하도록 프라이머 쌍 PstI-MVD 1 R (5'-GTGCTGGAATTCGCCCTTCTGCAGC, 서열번호 88) 및 NsiI-MVD 1 F (5'-GTAGATGCATGCAGAATTCGCCCTTAAGGAGG, 서열번호 89)를, 또한 yIDI 유전자를 증폭하도록 프라이머 쌍 PstI-YIDI 1 R (5'-CCTTCTGCAGGACGCGTTGTTATAGC, 서열번호 79) 및 NsiI-YIDI 1 F (5'-CATCAATGCATCGCCCTTAGGAGGTAAAAAAAAATGAC, 서열번호 78)을 사용하여 수행되었다. 일정 경우에, 대장균으로부터 나온 IPP 이소머라제 유전자, idi 가 사용되었다. 대장균으로부터 idi 를 증폭하기 위해, 다음과 같은 프라이머 세트가 사용되었다: PstI-CIDI 1 R (5'-GTGTGATGGATATCTGCAGAATTCG, 서열번호 90) 및 NsiI-CIDI 1 F (5'-CATCAATGCATCGCCCTTAGGAGGTAAAAAAACATG, 서열번호 91). 주형 DNA는 표준 방법에 의해 E. coli FM5로부터 분리된 염색체 DNA이었다 (국제특허출원 제 WO 96/35796호 및 제 WO 2004/033646호, 이들은 각각 본 명세서에서 참고문헌으로 전부, 상세하게는 핵산의 분리에 관하여 통합된다). 최종 플라스미드는 효모 idi 유전자를 인코딩하는 제작물을 pKKDIy 또한 E. coli idi 유전자를 인코딩하는 제작물을 pKKDIc라고 명명하였다. 플라스미드는 연속되는 분석을 위해 대장균 숙주 BL21 내로 형질전환되었다. 일정 경우에 쿠쥬로부터 나온 이소프렌 합성효소는 pKKDIy 수득 플라스미드pKKDIyIS 내로 클론되었다.
하부 MVA 경로도 역시 카나마이신 항생제 저항성 마커를 포함하는 pTrc 내로 클론되었다. 플라스미드 pTrcKKDIy는 제한효소 ApaI 및 PstI로 소화되었고, 5930 bp 단편이 1.2% 아가로스 E-젤 상에서 분리되었으며 제조사의 지침에 따라 퀴아젠 젤 정제 키트 (Qiagen Gel Purification kit)를 사용하여 정제되었다. 실시예 7에서 기술된 플라스미드 pTrcKudzuKan는 제한효소 ApaI 및 PstI으로 소화되었고, 벡터를 포함하는3338 bp 단편은1.2% 아가로스 E-젤 로부터 퀴아젠 젤 정제 키트를 사용하여 정제되었다. 3338 bp 벡터 단편과 5930 bp 하부 MVA 경로 단편이 로슈 퀵 라이게이션 키트 (Roche Quick Ligation kit)를 사용하여 결찰되었다. 라이게이션 혼합액은 E. coli TOP10 세포 내로 형질전환되었고 형질전환체는 37℃에서 하룻밤 동안 카나마이신 (50 μg/ml)을 포함하는 LA 상에서 선별하면서 배양되었다. 형질전환체는 제한효소 소화에 의해 확인되었고 한 개는 스톡으로서 냉동되었다. 플라스미드는 pTrcKanKKDIy라고 명명되었다.
II. 쿠쥬 이소프렌 합성효소 유전자의 pTrcKanKKDIy 내로 클로닝
쿠쥬 이소프렌 합성효소 유전자는 PCR에 의해 실시예 1에 기술된 pTrcKudzu로부터 프라이머 MCM50 5'-GATCATGCATTCGCCCTTAGGAGGTAAAAAAACATGTGTGCGACCTCTTCTCAATTTACT (서열번호 52) 및 MCM53 5'-CGGTCGACGGATCCCTGCAGTTAGACATACATCAGCTG (서열번호 50)를 사용하여 증폭되었다. 그 결과 나온 PCR 단편은 pCR2.1 내로 클론되었고 E. coli TOP10 내로 형질전환되었다. 본 단편은 쿠쥬 이소프렌 합성효소 및 대장균으로부터 나온 RBS를 포함하는 상류 부위에 대한 코딩 서열을 포함한다. 형질전환체는 37℃에서 하룻밤 동안 카베니실린 (50 μg/ml)을 포함하는 LA 상에서 선별하면서 배양되었다. 단편의 정확한 삽입이 서열결정법에 의해 확인되었고 본 균주는 MCM93라고 명명되었다.
MCM93 균주로부터 나온 플라스미드는 제한효소 NsiI 및 PstI로 소화되어 RBA 및 쿠쥬 이소프렌 합성효소 유전자를 포함하는 1724 bp 삽입자을 만들었다. 내놓았다. 1724 bp 단편은 1.2% 아가로스 E-젤 상에서 분리되었고 퀴아젠 젤 정제 키트를 사용하여 제조사의 지침에 따라 정제되었다. 플라스미드 pTrcKanKKDIy는 제한효소 PstI로 소화되었고, SAP으로 30분 동안 37℃에서 처리되었으며 퀴아젠 PCR 세척 키트 (Qiagen PCR cleanup kit)를 사용하여 정제되었다. 플라스미드 및 이소프렌 합성효소를 인코딩하는 DNA 단편은 로슈 퀵 라이게이션 키트를 사용하여 결찰되었다. 라이게이션 혼합액은 E. coli TOP10 세포 내로 형질전환되었고 형질전환체는 37℃에서 하룻밤 동안 카나마이신 50 μg/ml을 포함하는 LA 상에서 선별하면서 배양되었다. 정확한 형질전환체는 제한효소 소화에 의해 확인되었고 플라스미드는 pTrcKKDyIkISKan (도 24 및 도 25; 서열번호 11)라고 명명되었다. 본 플라스미드는 대장균 BL21(λDE3) (Invitrogen) 세포 내로 형질전환되었다.
III. 재조합 하부 메발로네이트 경로 및 쿠쥬로부터의 이소프렌 합성효소를 발현하는 대장균에서 메발로네이트로부터 이소프렌의 생산
대장균 균주 BL21/pTrcKKDyIkISKan는 pH 7.1로 조정되고 0.5% 포도당 및 0.5% 메발론산이 보충된 MOPS 배지 (Neidhardt et al., (1974) J. Bacteriology 119:736-747) 에서 배양되었다. 대조군 배양액도 역시 0.5% 메발론산의 첨가하지 않은 동일한 조건을 사용하여 설정되었다. 배양액은 밤샘 종자 배양으로부터 1% 접종액으로 시작되었고 배양액이 OD600 0.3 내지 0.5가 될 때 500 μM IPTG로 유도되었다. 배양액은 30℃에서 250 rpm으로 진탕하면서 배양되었다. 이소프렌의 생산은 유도한지 3시간 이후에 실시예 1에 기술된 상부공간 분석법을 사용하여 분석되었다. 이소프렌의 최대 생산은 6.67 x 10-4 mol/L액체배지/OD600/시간이었고, 여기에서 L액체배지 는 액체배지의 부피이고 세포 배지의 부피와 세포의 부피를 둘 다 포함한다. 메발론산이 보충되지 않은 대조군 배양액은 측정 가능한 이소프렌을 생산하지 않았다.
IV. 상부MVA 경로의 클로닝
세 가지 효소적 활성을 인코딩하는 두 개의 유전자를 포함하는 상부 메발로네이트 ㅎ합성 경로는 엔테로코커스 페칼리스 (Enterococcus faecalis)로부터 클론되었다. mvaE 유전자는 경로의 첫 번째 및 세 번째 단백질인 아세틸-CoA 아세틸전이효소 (acetyl-CoA acetyltransferase) 및 3-하이드록시-3-메틸글루타릴-CoA(HMG-CoA) 환원효소 (3-hydroxy-3-methylglutaryl-CoA (HMG-CoA) reductase) 둘 다의 효소적 활성을 가진 단백질을 인코드하고, mvaS 유전자는 경로의 두 번째 효소인 HMG-CoA 합성효소를 인코드한다. mvaE 유전자는 대장균 리보좀 결합 부위 및 전방 공간자를 가진 E. faecalis 게놈 DNA (ATCC 700802D-5)로부터 하기 프라이머를 사용하여 증폭되었다:
CF 07-60 (+) mvaE 시작 w/ RBS + ATG 시작 코돈 SacI
5'- GAGACATGAGCTCAGGAGGTAAAAAAACATGAAAACAGTAGTTATTATTG (서열번호 93)
CF 07-62 (-) 둘 사이 RBS로 mvaE 및 mvaS의 융합
5' TTTATCAATCCCAATTGTCATGTTTTTTTACCTCCTTTATTGTTTTCTTAAATC (서열번호 94)
mvaS 유전자는 RBS 및 대장균으로부터의 전방 공간자를 가진 E. faecalis 게놈 DNA (ATCC 700802D-5)로부터 하기 프라이머를 사용하여 증폭되었다:
CF 07-61 (+) 둘 사이 RBS로 mvaE 및 mvaS 의 융합
5'-GATTTAAGAAAACAATAAAGGAGGTAAAAAAACATGACAATTGGGATTGATAAA (서열번호 95)
CF 07-102 (-) mvaS 유전자의 말단 BglII
5'-GACATGACATAGATCTTTAGTTTCGATAAGAACGAACGGT (서열번호 96)
PCR 단편은 하기 프라이머를 사용하여 PCR로 융합되었다:
CF 07-60 (+) mvaE의 시작w/ RBS + ATG 시작 코돈 SacI
5'-GAGACATGAGCTCAGGAGGTAAAAAAACATGAAAACAGTAGTTATTATTG (서열번호 93)
CF 07-102 (-) mvaS 유전자의 말단 BglII
5'-GACATGACATAGATCTTTAGTTTCGATAAGAACGAACGGT (서열번호 96)
융합 PCR 단편은 퀴아젠 키트를 사용하여 정제되었고 제한효소 SacI 및 BglII로 소화되었다. 본 소화된 DNA 단편은 퀴아젠 키트를 사용하여 젤 정제되었고 미리 SacI 및 BglII로 소화되었고 젤 정제되었던 시판되는 벡터 pTrcHis2A 내로 결찰되었다.
라이게이션 혼합액은 E. coli Top 10 세포 내로 형질전환되었고 콜로니가 LA+ 50 μg/ml 카베니실린 플레이트 상에서 선별되었다. 모두 여섯 개의 콜로니가 선택되었고 하룻밤 동안 LB+ 50 μg/ml 카베니실린에서 배양되었으며 플라스미드는 퀴아젠 키트를 사용하여 분리되었다. 플라스미드는 삽입물을 검토하도록 SacI 및 BglII 로 소화시켰으며 한 개의 정확한 플라스미드는 하기 프라이머로 서열결정되었다:
CF 07-58 (+) mvaE 유전자의 시작
5'-ATGAAAACAGTAGTTATTATTGATGC (서열번호 97)
CF 07-59 (-) mvaE 유전자의 말단
5'-ATGTTATTGTTTTCTTAAATCATTTAAAATAGC (서열번호 98)
CF 07-82 (+) mvaS 유전자의 시작
5'-ATGACAATTGGGATTGATAAAATTAG (서열번호 99)
CF 07-83 (-) mvaS 유전자의 말단
5'-TTAGTTTCGATAAGAACGAACGGT (서열번호 100)
CF 07-86 (+) mvaE 서열
5'-GAAATAGCCCCATTAGAAGTATC (서열번호 101)
CF 07-87 (+) mvaE 서열
5'-TTGCCAATCATATGATTGAAAATC (서열번호 102)
CF 07-88 (+) mvaE 서열
5'-GCTATGCTTCATTAGATCCTTATCG (서열번호 103)
CF 07-89 (+) mvaS 서열
5'-GAAACCTACATCCAATCTTTTGCCC (서열번호 104)
pTrcHis2AUpperPathway#1 라고 명명된 플라스미드는 서열결정법에 의해 정확하였고 시판되는 E. coli strain BL21 내에 형질전환되었다. 선별이 LA+ 50 μg/ml 카베니실린 상에서 이루어졌다. 두 개의 형질전환체가 선택되었고 LB+ 50 μg/ml 카베니실린에서 OD600 1.5가 될 때까지 성장시켰다. 균주 둘 다는 바이알에 -80℃로 글리세롤 존재 시 냉동시켰다. 균주는 대장균 BL21에서 pTrcHis2AUpperPathway#1, 분리물 #1은 CF 449라고 또한 대장균 BL21에서 pTrcHis2AUpperPathway#1, 분리물 #2는 CF 450라고 명명되었다. 클론 둘 다는 분석되었을 때 동일하게 행동하는 것으로 관찰되었다.
V. pCL1920 내로 UpperMVA 경로의 클로닝
플라스미드pTrcHis2AUpperPathway는 제한효소 SspI으로 pTrc-mvaE-mvaS-(His tag)-terminator를 방출하였다. 본 단편에서. 히스-태그는 해독되지 않는다. 본 무딘 말단을 가진 4.5 kbp 단편은 퀴아젠 젤 정제 키트를 사용하여 1.2% E-젤로부터 정제되었다. pCL1920 로부터 나온 탈인산화된 무딘 말단을 가진 4.2 kbp 단편은 제한효소 PstII로 벡터를 소화시키고 SAP으로 처리하며 퀴아젠 젤 정제 키트를 사용하여 1.2% E-젤로부터 젤 정제함에 의해 제조되었다. 두 가지 단편이 로슈 퀵 라이게이션 키트를 사용하여 결찰되었고 화학적으로 능력있는 TOP10 세포에 형질전환되었다. 형질전환체는 스펙티노마이신 (50 μg/ml)을 포함하는 LA 상에서 선별되었다. 정확한 콜로니가 PCR에 의해 삽입물의 존재를 검색하여 확인되었다. 플라스미드는 pCL PtrcUpperPathway (도 26 및 도 27A 내지 27D; 서열번호 12)라고 명명되었다.
VI. 조합된 상부 및 하부 메발론산 경로를 발현하는 균주
쿠쥬 이소프렌 합성효소를 더한 완전한 메발론산 경로를 가진 균주를 얻기 위하여, 플라스미드 pTrcKKDyIkISkan 및 pCLpTrcUpperPathway가 둘 다 능력있는 대장균 BL21(λDE3) 세포 (Invitrogen) 내로 형질전환 되었고 형질전환체는 카나마이신 (50 μg/ml) 및 스펙티노마이신 (50 μg/ml)을 포함하는 LA 배지 상에서 선별되었다. 형질전환체는 플라스미드 둘 다가 숙주에 보유되어 있는 것을 검증하기 위해 플라스미드 프렙에 의해 검토되었다. 균주는 MCM127이라고 명명되었다.
VII. E. coli/pUpperpathway에서 포도당으로부터 메발론산의 생산
대장균 BL21/pTrcHis2A-mvaE/mvaS 또는 FM5/p pTrcHis2A-mvaE/mvaS 가 LB + 카베니실린 (100 μg/ml) 내에 접종되었고 37℃에서 200 rpm으로 진탕하면서 성장되었다. 이들 배양액은 250 ml 진탕 플라스크에 넣어 50 ml 배지로 OD600 0.1까지 희석시켰다. 배지는 TM3 + 1 또는 2% 포도당 + 카베니실린 (100 μg/ml) 또는 TM3 + 1% 포도당 + 가수분해된 콩 오일 + 카베니실린 (100 ug/ml) 또는 TM3 + 바이오매스 (제조된 바가스, 옥수수 스토버 또는 스위치풀)이었다. 배양액은 30℃에서 200 rpm으로 진탕하면서 대략 2-3 시간 동안 OD600 0.4가 될 때까지 성장시켰다. 이 때 mvaE mvaS 제작물로부터 발현은 IPTG (400 μM) 첨가에 의해 유도되었다. 배양액은 유도 이후 6시간까지 2시간 간격으로 또한 다시 필요한 경우 24, 36 및 48시간대에 모아진 시료로 추가로 20 또는 40시간 동안 배양되었다. 시료 수집은 1 ml 배양액을 덜어 OD600를 측정하고 세포를 마이크로 원심분리기 (microfuge)에서 펠렛으로 만들며 상청액을 제거하고 이를 메발론산에 대해 분석하여 이루어졌다.
엔테로코커스 페칼리스 AA-CoA 티올라제, HMG-CoA 합성효소, 및 HMG-CoA 환원효소를 인코딩하는 핵산을 가진 대장균 세포의 14 리터 발효는 TM3 배지 및 2% 포도당을 세포 배지로 하여 22 그램의 메발론산을 생산하였다. 이들 세포의 진탕 플라스크는 LB 배지 및 1% 포도당을 세포 배양 배지로서 하여 리터 당 2-4 그램의 메발론산을 생산하였다. 이들 균주에서 메발론산의 생산은 MVA 경로가 대장균에서 기능적인 것을 나타내었다.
VIII. 쿠쥬 이소프렌 합성효소를 더한 상부 및 하부 MVA 경로를 포함하는 E. coli BL21로부터 이소프렌의 생산
하기 균주는 상기 기술된 바와 같이 상부와 하부 MVA 경로 및 쿠쥬 이소프렌 합성효소를 포함하는 플라스미드의 또한 실시예 7에 기술된 idi, dxs, dxr 및 이소프렌 합성효소 유전자를 포함하는 플라스미드의 다양한 조합으로 형질전환하여 만들어졌다. 숙주세포는 화학적으로 능력있는 대장균 BL21(λDE3)이었고 형질전환은 표준 방법에 의해 이루어졌다. 형질전환체는 카나마이신 (50 μg/ml) 또는 스펙티노마이신을 더한 카나마이신 (둘 다 농도 50 μg/ml로)을 포함하는 L 아가 상에서 선별되었다. 플레이트는 37℃에서 성장시켰다. 그 결과 나온 균주는 다음과 같이 명명되었다:
스펙티노마이신을 더한 카나마이신 상에서 성장 (각각 50 μg/ml)
MCM127 - pCL Upper MVA + pTrcKKDyIkIS (kan) in BL21(λDE3)
MCM131 - pCL1920 + pTrcKKDyIkIS (kan) in BL21(λDE3)
MCM125 - pCL Upper MVA + pTrcHis2B (kan) in BL21(λDE3)
카나마이신 상에서 성장 (50 μg/ml)
MCM64 - BL21(λDE3)에 있는 pTrcKudzu yIDI DXS (kan)
MCM50 - BL21(λDE3)에 있는 pTrcKudzu (kan)
MCM123 - BL21(λDE3)에 있는 pTrcKudzu yIDI DXS DXR (kan)
상기 균주는 냉동 스톡으로부터 LA + 적절한 항생제 상에 뿌려졌고 (streaked) 37℃에서 하룻밤 동안 성장되었다. 각 플레이트로부터 나온 단일 콜로니는 진탕 플라스크 (25 ml LB + 적절한 항생제)를 접종하는 데 사용되었다. 플라스크는 22℃에서 하룻밤 동안 200 rpm으로 진탕하면서 배양되었다. 다음날 아침 플라스크는 37℃ 배양기로 이동되었고 추가로 4.5 시간 동안 200 rpm으로 진탕하면서 배양되었다. 25 ml 배양액은 세포를 펠렛을 만들도록 원심분리되었고 세포는 5 ml LB + 적절한 항생제에 재현탁되었다. 그 다음 배양액은 25 ml LB + 1% 포도당 + 적절한 항생제로 OD600 0.1까지 희석되었다. 각 균주에 대한 두 개 플라스크가 설정되어 한 세트는 IPTG (800 μM)로 유도되고 다른 세트는 유도되지 않았다. 배양액은 37℃에서 200 rpm으로 진탕하면서 배양되었다. 한 세트의 배양액은 1.50 시간 이후 (시료수집 시간대 1에 이어서 즉시) 유도되었다. 각 시료수집 시간대에, OD600이 측정되었고 이소프렌량이 실시예 1에 기술된 바와 같이 결정되었다. 결과는 표 1에 나타나있다. 제조된 이소프렌량은 특정 균주의 생산 피크에서의 양으로서 표시된다. 표 3은 E. coli 균주에서 이소프렌의 생산을 나타낸다.
| 균주 |
이소프렌 (μg/리터/OD/시간) |
| MCM50 | 23.8 |
| MCM64 | 289 |
| MCM125 | ND |
| MCM131 | 미량 |
| MCM127 | 874 |
ND: 검출되지 않음
미량: 표시는 있지만 합산가능하지 않은 피크.
IX. 메발론산의 분석.
메발로노락톤 (mevalonolactone, 1.0 g, 7.7 mmol) (CAS# 503-48-0)은 물 (7.7 mL)에 녹인 시럽으로 시그마-알드리치사 (WI, USA)로부터 공급되었고 메발론산의 포타슘 염을 생성하도록 포타슘 하이드록사이드 (7.7 mmol)로 처리되었다. 메발론산의 전환은 1H NMR 분석에 의해 검증되었다. HPLC 분석을 위한 시료는 4,000 rpm으로 5 분 동안 원심분리하여 세포를 제거하였고 이어서 900 μl H2O에 300 μl 분량의 상청액을 첨가하다. 그 다음 과염산 (36 μl의 70% 용액)이 첨가되었고 혼합하여 얼음 위에서 5분 동안 식혔다. 그 다음 시료는 다시 원심분리되었고 (14,000 rpm 5분) 상청액은 HPLC로 옮겨졌다. 메발론산 표준용액 (20, 10, 5, 및 0.5 g/L)이 동일한 방식으로 제조되었다. 메발론산의 분석 (20 μL 주입 부피)은 반발 지수 (refractive index, RI) 검출로 5 mM 황산에 0.6 mL/분 속도로 용출되는 바이오래드 아미넥스 87-H+ 컬럼 (BioRad Aminex 87-H+ column) (7.0 mm 씩 300 mm)을 사용한 HLPC에 의해 수행되었다. 이들 조건 하에서 메발론산은 18.5분에 락톤 형태로 용출되었다.
X. 쿠쥬 이소프렌 합성효소를 더한 상부 MVA 경로를 포함하는 E. coli BL21 로부터 이소프렌의 생산
메발론산 경로 폴리펩타이드 및 쿠쥬 이소프렌 합성효소를 발현하는 대장균의 15-L 규모의 발효가 회분식 배양에서 세포로부터 이소프렌을 생산하는 데 사용되었다. 본 실험은 포도당 제한 조건 하에서 세포를 성장시키는 것이 2.2 g/L의 이소프렌 생산을 가져오는 것을 보여준다.
배지 레시피 (발효 배지 리터 당):
배지는 발효 배지 리터 당 하기 성분을 사용하여 생성되었다: K2HPO4 7.5 g, MgSO4 * 7H2O 2 g, 시트르산 모노하이드레이트 2 g, 철 암모늄 시트르산 0.3 g, 효모추출물 0.5 g, 1000X 변형된 미량 금속 용액1 ml. 모든 성분은 다같이 첨가되었고 diH2O에 녹였다. 본 용액은 고압 멸균되었다. pH는 7.0으로 암모늄 하이드록사이드 (30%)를 사용하여 조정되었고 부피는 q.s. 맞추었다. 포도당 10 g, 티아민 * HCl 0.1 g, 및 항생제가 멸균 및 pH 조정 이후에 첨가되었다.
1000X 변형된 미량 금속 용액:
1000X 변형된 미량 금속 용액은 하기 성분을 사용하여 생성되었다: 시트르산 * H2O 40 g, MnSO4 * H2O 30 g, NaCl 10 g, FeSO4 * 7H2O 1 g, CoCl2 * 6H2O 1 g, ZnSO * 7H2O 1 g, CuSO4 * 5H2O 100 mg, H3BO3 100 mg, NaMoO4 * 2H2O 100 mg. 각 성분은 한 번에 하나씩 DIH2O에 녹이고, pH는 3.0으로 HCl/NaOH를 사용하여 조정한 다음 부피를 q.s. 맞추고 0.22 마이크론 필터로 여과 살균되었다.
발효는 pCL PtrcUpperPathway (도 26) 및 pTrcKKDyIkIS 플라스미드를 포함하는 대장균 BL21(DE3) 세포를 사용하여 15-L 생물반응기에서 수행되었다. 본 실험은 원하는 발효 pH 7.0 및 온도 30℃에서 포도당으로부터 이소프렌 형성을 감시하도록 수행되었다. 냉동 바이알로부터 가져온 대장균 균주의 접종액은 LB 액체배지 아가 플레이트 (항생제 첨가) 상에 뿌려졌고 37℃에서 배양되었다. 단일 콜로니가 소이톤-효모추출물-포도당 배지 내에 접종되었다. 접종액이 550 nm에서 측정되어 OD 1.0까지 된 이후에, 500 mL 이 5-L 생물반응기를 접종하는 데 사용되었다.
포도당은 세포가 안정상에 도달할 때까지 지수적 속도로 첨가되었다. 이 시점 이후 포도당 첨가는 대사적 요구를 만족시키기 위해 감소되었다. 54시간 발효 동안 생물반응기로 운반된 포도당의 전체 양은 3.7 kg이었다. 이 시간에 생물반응기 내 광학 밀도는 도 49A에 나타나있다. 유도는 이소프로필-베타-D-1-티오갈락토피라노사이드 (IPTG)를 첨가하여 달성되었다. IPTG 농도는 광학 밀도가 550 nm (OD550)에서 10이 도달할 때 25 μM가 되었다. IPTG 농도는 OD550이 190에 도달할 때 50 μM로 올라갔다. IPTG 농도는 발효 38시간에서 100 μM로 올라갔다. 시간 경과에 따른 생물반응기의 OD550 프로파일은 도 54에 나타나있다. 생물반응기로부터 나온 배출기체에서 이소프렌의 수준은 본 명세서에서 기술된 바와 같이 결정되었다. 이소프렌의 역가는 발효 과정을 통해 2.2 g/L의 최종 값까지 증가되었다 (도 55). 54시간 발효 동안 생산된 이소프렌의 전체 양은 15.9 g이었고, 생산의 시간 과정은 도 56에 나타나있다.
XI. 메발론산 경로로부터의 유전자를 발현하고 15-L 규모의 회분식 배양에서 자란 대장균으로부터의 이소프렌 발효
메발론산 경로 폴리펩타이드 및 쿠쥬 이소프렌 합성효소를 발현하는 대장균의 15-L 규모의 발효가 회분식 배양에서 세포로부터 이소프렌을 생산하는 데 사용되었다. 본 실험은 포도당 제한 조건 하에서 세포를 성장시키는 것이 3.0 g/L의 이소프렌 생산을 가져오는 것을 보여준다.
배지 레시피 (발효 배지 리터 당):
배지는 발효 배지 리터 당 하기 성분을 사용하여 생성되었다: K2HPO4 7.5 g, MgSO4 * 7H2O 2 g, 시트르산 모노하이드레이트 2 g, 철 암모늄 시트르산 0.3 g, 효모추출물 0.5 g, 1000X 변형된 미량 금속 용액1 ml. 모든 성분은 다같이 첨가되었고 diH2O에 녹였다. 본 용액은 고압 멸균되었다. pH는 7.0으로 암모늄 하이드록사이드 (30%)를 사용하여 조정되었고 부피는 q.s. 맞추었다. 포도당 10 g, 티아민 * HCl 0.1 g, 및 항생제가 멸균 및 pH 조정 이후에 첨가되었다.
1000X 변형된 미량 금속 용액:
1000X 변형된 미량 금속 용액은 하기 성분을 사용하여 생성되었다: 시트르산 * H2O 40 g, MnSO4 * H2O 30 g, NaCl 10 g, FeSO4 * 7H2O 1 g, CoCl2 * 6H2O 1 g, ZnSO * 7H2O 1 g, CuSO4 * 5H2O 100 mg, H3BO3 100 mg, NaMoO4 * 2H2O 100 mg. 각 성분은 한 번에 하나씩 DIH2O에 녹이고, pH는 3.0으로 HCl/NaOH를 사용하여 조정한 다음 부피를 q.s. 맞추고0.22 마이크론 필터로 여과 살균되었다.
발효는 pCL PtrcUpperMVA 및 pTrc KKDyIkIS 플라스미드를 포함하는 대장균 BL21(DE3) 세포를 사용하여 15-L 생물반응기에서 수행되었다. 본 실험은 원하는 발효 pH 7.0 및 온도 30℃에서 포도당으로부터 이소프렌 형성을 감시하도록 수행되었다. 냉동 바이알로부터 가져온 대장균 균주의 접종액은 LB 액체배지 아가 플레이트 (항생제 첨가) 상에 뿌려졌고 37℃에서 배양되었다. 단일 콜로니가 소이톤-효모추출물-포도당 배지 내에 접종되었다. 접종액이 550 nm에서 측정되어 OD 1.0까지 된 이후에, 500 mL 이 5-L 생물반응기를 접종하는 데 사용되었다.
포도당은 세포가 안정상에 도달할 때까지 지수적 속도로 첨가되었다. 이 시점 이후 포도당 첨가는 대사적 요구를 만족시키기 위해 감소되었다. 59시간 발효 동안 생물반응기로 운반된 포도당의 전체 양은 2.2 kg이었다. 유도는 IPTG를 첨가하여 달성되었다. IPTG 농도는 광학 밀도가 550 nm (OD550)에서 10에 도달할 때 25 uM가 되었다. IPTG 농도는 OD550이 190에 도달할 때 50 uM로 올라갔다. 시간 경과에 따른 생물반응기의 OD550 프로파일은 도 93에 나타나있다. 생물반응기로부터 나온 배출기체에서 이소프렌의 수준은 본 명세서에서 기술된 바와 같이 결정되었다. 이소프렌의 역가는 발효 과정을 통해 3.0 g/L의 최종 값까지 증가되었다 (도 94). 59시간 발효 동안 생산된 이소프렌의 전체 양은 22.8 g이었고, 생산의 시간 과정은 도 95에 나타나있다. 발효 동안 이소프렌을 생산하는 데 들어갔던 사용된 탄소의 몰라 수율은 2.2% 이었다. 포도당으로부터 나온 이소프렌의 무게 퍼센트 수율은 1.0%이었다.
XII. 메발론산 경로로부터의 유전자를 발현하고 15-L 규모의 회분식 배양에서 자란 대장균으로부터의 이소프렌 발효
메발론산 경로 폴리펩타이드 및 푸엘라리아 로바타 (Pueraria lobata) 이소프렌 합성효소를 발현하는 대장균의 15-L 규모의 발효가 회분식 배양에서 세포로부터 이소프렌을 생산하는 데 사용되었다. 본 실험은 포도당 제한 조건 하에서 세포를 성장시키는 것이 3.3 g/L의 이소프렌 생산을 가져오는 것을 보여준다.
i) pCLPtrcUpperPathwayHGS2의 제작
푸엘라리아 로바타로부터 이소프렌 합성효소를 인코딩하는 유전자는 프라이머 NsiI-RBS-HGS F (cttgATGCATCCTGCATTCGCCCTTAGGAGG, 서열번호 105) 및 pTrcR (CCAGGCAAATTCTGTTTTATCAG, 서열번호106)를 또한 주형으로 pTrcKKDyIkIS 를 사용하여 PCR-증폭되었다. 따라서 PCR 산물은 NsiI 및 PstI로 소화되어 획득되었고 젤-정제되었다. 플라스미드 pCL PtrcUpperPathway는 제한효소 PstI로 소화되었고 제조사의 지침에 따라 rAPid 알칼라인 포스파타제 (Roche)를 사용하여 탈인산화되었다.
이들 DNA 단편은 다같이 결찰되었고 라이게이션 반응은 화학적으로 능력있는 E. coli Top10 세포 (Invitrogen) 내에 형질전환되었으며, 스펙티노마이신 (50 μg/ml)을 포함하는 L 아가 상에 도말되었고 370℃에서 하룻밤 동안 배양되었다. 플라스미드 DNA는 퀴아젠 스핀 미니-프렙 키트를 사용하여 6개의 클론으로부터 제조되었다. 플라스미드 DNA는 제한효소 EcoRV 및 MluI으로 소화되어 삽입물가 올바른 방향 (예로, pTrc promoter와 동일한 방향으로 배치된 유전자)을 가지는 클론을 확인하였다.
그 결과 나온 정확한 플라스미드는 pCLPtrcUpperPathwayHGS2라고 명명되었다. 본 플라스미드는 본 명세서에서 기술된 상부공간 분석법을 사용하여 분석되었고 E. coli Top10에서 이소프렌을 생산하는 것이 관찰되었으며 따라서 유전자의 기능성을 확인하였다. 플라스미드는 pTrcKKDyIkIS 를 포함하는 대장균 BL21(LDE3) 내에 형질전환되어 대장균 균주 BL21/pCLPtrcUpperPathwayHGS2-pTrcKKDyIkIS가 수득되었다. 본 균주는 대장균 BL21/pCL PtrcUpperMVA 및 pTrc KKDyIkIS 균주 (실시예 8, 제 XI부)와 비교하여 이소프렌 합성효소의 별도의 사본을 가진다. 본 균주는 또한 실시예 8, 제 XI부에서 사용된 대장균 BL21/pCL PtrcUpperMVA 및 pTrc KKDyIkIS 균주와 비교하여 HMGS 의 발현 및 활성을 증가시켰다.
ii) pCLPtrcUpperPathwayHGS2-pTrcKKDyIkIS를 발현하고 15-L 규모의 회분식 배양에서 자란 대장균으로부터의 이소프렌 발효.
배지 레시피 (발효 배지 리터 당):
배지는 발효 배지 리터 당 하기 성분을 사용하여 생성되었다: K2HPO4 7.5 g, MgSO4 * 7H2O 2 g, 시트르산 모노하이드레이트 2 g, 철 암모늄 시트르산 0.3 g, 효모추출물 0.5 g, 1000X 변형된 미량 금속 용액 1 ml. 모든 성분은 다같이 첨가되었고 diH2O에 녹였다. 본 용액은 고압 멸균되었다. pH는 7.0으로 암모늄 하이드록사이드 (30%)를 사용하여 조정되었고 부피는 q.s. 맞추었다. 포도당 10 g, 티아민 * HCl 0.1 g, 및 항생제가 멸균 및 pH 조정 이후에 첨가되었다.
1000X 변형된 미량 금속 용액:
1000X 변형된 미량 금속 용액은 하기 성분을 사용하여 생성되었다: 시트르산 * H2O 40 g, MnSO4 * H2O 30 g, NaCl 10 g, FeSO4 * 7H2O 1 g, CoCl2 * 6H2O 1 g, ZnSO * 7H2O 1 g, CuSO4 * 5H2O 100 mg, H3BO3 100 mg, NaMoO4 * 2H2O 100 mg. 각 성분은 한 번에 하나씩 DI H2O에 녹이고, pH는 3.0으로 HCl/NaOH를 사용하여 조정한 다음 부피를 q.s. 맞추고 0.22 마이크론 필터로 여과 살균되었다.
발효는 pCLPtrcUpperPathwayHGS2 및 pTrc KKDyIkIS 플라스미드를 포함하는 대장균 BL21(DE3) 세포를 사용하여 15-L 생물반응기에서 수행되었다. 본 실험은 원하는 발효 pH 7.0 및 온도 30℃에서 포도당으로부터 이소프렌 형성을 감시하도록 수행되었다. 냉동 바이알로부터 가져온 대장균 균주의 접종액은 LB 액체배지 아가 플레이트 (항생제 첨가) 상에 뿌려졌고 37℃에서 배양되었다. 단일 콜로니가 소이톤-효모추출물-포도당 배지 내에 접종되었다. 접종액이 550 nm에서 측정되어 OD 1.0까지 된 이후에, 500 mL 이 5-L 생물반응기를 접종하는 데 사용되었다.
포도당은 세포가 안정상에 도달할 때까지 지수적 속도로 첨가되었다. 이 시점 이후 포도당 첨가는 대사적 요구를 만족시키기 위해 감소되었다. 59시간 발효 동안 생물반응기로 운반된 포도당의 전체 양은 2.1 kg이었다. 유도는 IPTG를 첨가하여 달성되었다. IPTG 농도는 광학 밀도가 550 nm (OD550)에서 9값에 도달할 때 25 uM가 되었다. IPTG 농도는 OD550이 170에 도달할 때 50 μM로 올라갔다. 시간 경과에 따른 생물반응기의 OD550 프로파일은 도 104에 나타나있다. 생물반응기로부터 나온 배출기체에서 이소프렌의 수준은 본 명세서에서 기술된 바와 같이 결정되었다. 이소프렌의 역가는 발효 과정을 통해 3.3 g/L의 최종 값까지 증가되었다 (도 105). 58시간 발효 동안 생산된 이소프렌의 전체 양은 24.5 g이었고, 생산의 시간 과정은 도 106에 나타나있다. 발효 동안 이소프렌을 생산하는 데 들어갔던 사용된 탄소의 몰라 수율은 2.5% 이었다. 포도당으로부터 나온 이소프렌의 무게 퍼센트 수율은 1.2%이었다. 분석은 이소프렌 합성효소의 활성이 CL PtrcUpperMVA 및 pTrc KKDyIkIS를 발현하는 대장균 BL21과 비교하여 대략 3 - 4배 증가되었던 것을 보여준다 (결과 미도시).
XIII. 대장균에서 하부 메발로네이트 경로의 염색체 도입
메발로네이트 키나제, 메발로네이트 포스페이트 키나제, 메발로네이트 피로포스페이트 탈탄산화효소, 및 IPP 이소머라제를 포함하는 합성 오페론은 대장균 염색체 내로 도입되었다. 원하는 경우, 발현은 오페론의 서로 다른 프로모터를 도입하여 변화될 수 있다.
표 4는 본 실험에 사용되는 프라이머들을 나열하고 있다.
| MCM78 | 삽입 제작물을 위한 attTn7 up rev | gcatgctcgagcggccgcTTTTAATCAAACATCCTGCCAACTC (서열번호 107) |
| MCM79 | 삽입 제작물을 위한 attTn7 down rev | gatcgaagggcgatcgTGTCACAGTCTGGCGAAACCG (서열번호 108) |
| MCM88 | 삽입 제작물을 위한 attTn7 up forw | ctgaattctgcagatatcTGTTTTTCCACTCTTCGTTCACTTT (서열번호 109) |
| MCM89 | 삽입 제작물을 위한 attTn7 down forw | tctagagggcccAAGAAAAATGCCCCGCTTACG (서열번호 110) |
| MCM104 | GI1.2 프로모터 - MVK | Gatcgcggccgcgcccttgacgatgccacatcctgagcaaataattcaaccactaattgtgagcggataacacaaggaggaaacagctatgtcattaccgttcttaacttc (서열번호 111) |
| MCM105 | aspA 종결인자 - yIDI | Gatcgggccccaagaaaaaaggcacgtcatctgacgtgccttttttatttgtagacgcgttgttatagcattcta (서열번호 112) |
| MCM120 | attTn7 전방: attTn7 상동성, GB 마커 상동성 | aaagtagccgaagatgacggtttgtcacatggagttggcaggatgtttgattaaaagcAATTAACCCTCACTAAAGGGCGG (서열번호 113) |
| MCM127 | Rev complement of 1.2 GI: GB 마커 상동성 (초과 길이), 프로모터, RBS, ATG | AGAGTGTTCACCAAAAATAATAACCTTTCCCGGTGCAgaagttaagaacggtaatgacatagctgtttcctccttgtgttatccgctcacaattagtggttgaattatttgctcaggatgtggcatcgtcaagggcTAATACGACTCACTATAGGGCTCG (서열번호 114) |
i) 표적 벡터 제작
attTn7 부위가 통합 (integration)을 위해 선택되었다. 상동성 상류 (attTn7 up) (프라이머 MCM78 및 MCM79) 또한 하류 (attTn7 하류) (프라이머 MCM88 및 MCM89)의 부위들이 MG1655 세포로부터 PCR에 의해 증폭되었다. 1 μL 10 μM 프라이머, 3 μL dd H2O, 45 μL 인비트로겐 플래티넘 PCR 혼합액 (Invitrogen Platinum PCR Supermix High Fidelity), 및 MG1655의 찍힌 콜로니 (scraped colony)가 들어 있는 50 μL 반응은 2:00분 동안 94℃에서 변성되고 25회 사이클 (2:00분 94℃, 0:30분 50℃, 및 1:00분 68℃) 반복되고, 7:00분 72℃ 로 연장되며, 40℃로 식혀졌다. 이로부터 나온 DNA는 제조사의 지침에 따라 pCR2.1 (Invitrogen) 내로 클론되어 플라스미드 MCM278 (attTn7 상류) 및 MCM252 (attTn7 하류)가 만들어졌다. MCM252으로부터 ApaI-PvuI 소화되고 젤 정제된 832bp의 단편은 ApaI-PvuI 소화되고 젤 정제된 플라스미드 pR6K 내로 클론되어 플라스미드 MCM276가 제작되었다. MCM278 으로부터 PstI-NotI 소화되고 젤 정제된 825 bp 단편은 PstI-NotI 소화되고 젤 정제된 MCM276 내로 클론되어 플라스미드 MCM281가 제작되었다.
ii) 하부 경로 및 프로모터의 클로닝
MVK-PMK-MVD-IDI 유전자는 제조사의 지침에 따라 로슈 PCR 시스템 (Roche Expand Long PCR System)을 사용하여 프라이머 MCM104 및 MCM105로 pTrcKKDyIkIS로부터 증폭되었다. 본 산물은 NotI 및 ApaI으로 소화되었고 미리 NotI 및 ApaI으로 소화되었고 젤 정제되었던 MCM281 내에 클론되었다. 프라이머 MCM120 및 MCM127는 스트라타젠 Pfu Ultra II 를 사용하는 진브리지 (GeneBridges) FRT-gb2-Cm-FRT 주형 DNA로부터 CMR카세트를 증폭하는 데 사용되었다. PCR 프로그램은 95℃ 4:00분, 5회 사이클 95℃ 0:20분, 55℃ 0:20분, 72℃ 2:00분, 25회 사이클 95℃ 0:20분, 58℃ 0:20분, 72℃ 2:00분, 72℃ 10:00분, 그 다음 4℃로 식히는 과정이 1 μL ~10 ng/μL 주형, 1 μL 각 프라이머, 1.25 μL 10mM dNTPs, 5 μL 10X 완충용액, 1 μL 효소 및 39.75 μL ddH20을 포함하는 네 개의 50 μL PCR 반응에 사용되었다. 반응은 진행되었고 퀴아젠 PCR 세척 컬럼 (Qiagen PCR cleanup column) 상에서 정제되었으며, 플라스미드 MCM296을 포함하는 물로 세척된 Pir1 세포를 전기천공하는 데 사용되었다. 전기천공은 2 mM 큐벳 (cuvettes)으로 2.5V 및 200 ohms에서 수행되었다. 전기천공 반응은 LB에 넣어 3시간 동안 30℃에서 회복되었다. 형질전환체 MCM330은 CMP5, Kan50을 가지는 LA 상에서 선별되었다 (도 107 및 도 108A 내지 108C; 서열번호 25).
iii) E. coli 염색체 내로 통합
MCM330 로부터 미니프렙된 DNA (Qiaquick Spin kit)는 SnaBI으로 소화되었고 대장균 BL21(DE3) (Novagen) 또는 진브리지 플라스미드 pRedET Carb를 포함하는 MG1655를 전기천공하는 데 사용되었다. 세포는 30℃에서 ~OD1까지 성장시킨 다음 0.4% L-아라비노스로 37℃ 에서 1.5시간 동안 유도되었다. 이들 세포는 4℃ ddH2O에 넣어 2 μL DNA로 전기천공하기 이전에 세 번 세척되었다. 통합물 (integrants)는 클로로암페니콜 (5 μg/ml)을 포함하는 L 아가 상에서 선별되었고 연속적으로 L 아가 + 카나마이신 (50 μg/ml) 상에서 성장하지 못하는 것이 검증되었다. 대장균 BL21 통합물 MCM331 및 MG1655 통합물 MCM333는 냉동되었다.
iv) 쿠쥬 이소프렌 합성효소를 인코딩하는 pET24D-Kudzu의 제작
쿠쥬 이소프렌 합성효소 유전자가 pCR2.1 벡터 (Invitrogen)로부터 pET24d 벡터 (Novagen) 내로 클론되었다. 상세하게, 쿠쥬 이소프렌 합성효소 유전자는 pTrcKudzu 주형 DNA로부터 프라이머MCM50 5'-gatcatgcat tcgcccttag gaggtaaaaa aacatgtgtg cgacctcttc tcaatttact (서열번호 52) 및 MCM53 5'-CGGTCGACGG ATCCCTGCAG TTAGACATAC ATCAGCTG (서열번호 50)를 사용하여 증폭되었다. PCR 반응은 Taq DNA 중합효소 (Invitrogen)를 사용하여 수행되었고, 그 결과 나온 PCR 산물은 pCR2.1-TOPO TA 클로닝 벡터 (Invitrogen) 내로 클론되었고, 화학적으로 능력있는 E. coli Top10 세포 (Invitrogen) 내로 형질전환되었다. 형질전환체는 카베니실린 (50 mg/ml)을 포함하는 L 아가 상에서 도말되었고 37℃에서 하룻밤 동안 배양되었다. 카베니실린 50 mg/ml을 포함하는 5 ml의 루리아 액체배지 배양액은 단일 형질전환체가 접종되고 37℃에서 하룻밤 동안 배양되었다. 5개의 콜로니가 1 ml 액체 배양 (루리아 액체배지)으로부터 분리된 플라스미드 DNA의 서열결정에 의해 정확한 삽입물에 대해 검색되었고 QIA프렙 스핀 미니-프렙 키트 (Qiagen)를 사용하여 정제되었다. 그 결과 나온 MCM93이라고 명명되는 플라스미드는 pCR2.1 골격에 쿠쥬 이소프렌 합성효소 코딩 서열을 포함한다.
쿠쥬 코딩 서열은 PciI 및 BamH1 (Roche)으로 제한효소 소화에 의해 제거되었고 QIA퀵 젤 추출 키트 (Qiagen)를 사용하여 젤 정제되었다. pET24d 벡터 DNA는 NcoI 및 BamHI (Roche)으로 정제되었고 새우 알칼라인 포스파타제 (Roche)로 처리되었으며 QIA프렙 스핀 미니-프렙 키트 (Qiagen)를 사용하여 정제되었다. 쿠쥬 이소프렌 합성효소 단편은 5 : 1의 단편 대 벡터 비율로 전체 20 ml 에서 래피드 DNA 라이게이션 키트 (Roche)를 사용하여 NcoI/BamH1 소화된 pET24d에 결찰되었다. 라이게이션 혼합액의 일정량 (5 ml)이 화학적으로 능력있는 E. coli Top 10 세포에 형질전환되었고 카나마이신 (50 mg/ml)을 포함하는 L 아가 상에 도말되었다. 정확한 형질전환체는 서열결정하여 검증되었고, 화학적으로 능력있는 BL21(lDE3)pLysS cells (Novagen) 내로 형질전환되었다. 단일 콜로니가 카나마이신 (50 mg/ml)을 포함하는 L 아가 상에 37oC로 하룻밤 성장 이후에 선별되었다. 그 결과 나온 pET24D-Kudzu라고 명명되는 플라스미드의 지도는 도 109에 나타나있다. pET24D-Kudzu의 서열 (서열번호 26)는 도 110A 및 도 110B에 나타나있다. 이소프렌 합성효소 활성은 상부공간 분석법을 사용하여 검증되었다.
v) 생산 균주
균주MCM331 및 MCM333는 플라스미드 pCLPtrcupperpathway 및 pTrcKudzu 또는 pETKudzu 둘 중 하나로 공형질전환되었고 표 1에 나타난 균주들을 가져왔다.
표 5는 생산 균주를 나타낸다.
| 기저 | 통합된 하부 | 상부 MVA 플라스미드 |
이소프렌 합성효소 플라스미드 | 생산 균주 |
| BL21(DE3) | MCM331 | pCLPtrcUpper Pathway | pTrcKudzu | MCM343 |
| BL21(DE3) | MCM331 | pCLPtrcUpper Pathway | pET24D-Kudzu | MCM335 |
| MG1655 | MCM333 | pCLPtrcUpper Pathway | pTrcKudzu | MCM345 |
vi) 메발론산 경로부터 나온 유전자를 발현하고 15-L 규모의 회분식 배양에서 자란 대장균으로부터의 이소프렌 발효.
배지 레시피 (발효 배지 리터 당):
배지는 발효 배지 리터 당 하기 성분을 사용하여 생성되었다: K2HPO4 7.5 g, MgSO4 * 7H2O 2 g, 시트르산 모노하이드레이트 2 g, 철 암모늄 시트르산 0.3 g, 효모추출물 0.5 g, 1000X 변형된 미량 금속 용액1 ml. 모든 성분은 다같이 첨가되었고 diH2O에 녹였다. 본 용액은 고압 멸균되었다. pH는 7.0으로 암모늄 하이드록사이드 (30%)를 사용하여 조정되었고 부피는 q.s. 맞추었다. 포도당 10 g, 티아민 * HCl 0.1 g, 및 항생제가 멸균 및 pH 조정 이후에 첨가되었다.
1000X 변형된 미량 금속 용액:
1000X 변형된 미량 금속 용액은 하기 성분을 사용하여 생성되었다: 시트르산 * H2O 40 g, MnSO4 * H2O 30 g, NaCl 10 g, FeSO4 * 7H2O 1 g, CoCl2 * 6H2O 1 g, ZnSO * 7H2O 1 g, CuSO4 * 5H2O 100 mg, H3BO3 100 mg, NaMoO4 * 2H2O 100 mg. 각 성분은 한 번에 하나씩 DIH2O에 녹이고, pH는 3.0으로 HCl/NaOH를 사용하여 조정한 다음 부피를 q.s. 맞추고 0.22 마이크론 필터로 여과 살균되었다.
발효는 상기 기술된gi1.2 도입된 하부 MVA 경로 또한 pCLPtrcUpperMVA 및 pTrc Kudzu 플라스미드를 포함하는 대장균 BL21(DE3) 세포를 사용하여 15-L 생물반응기에서 수행되었다. 본 실험은 원하는 발효 pH 7.0 및 온도 30℃에서 포도당으로부터 이소프렌 형성을 감시하도록 수행되었다. 냉동 바이알로부터 가져온 대장균 균주의 접종액은 LB 액체배지 아가 플레이트 (항생제 첨가) 상에 뿌려졌고 37℃ 에서 배양되었다. 단일 콜로니가 트립톤-효모추출물 배지 내에 접종되었다. 접종액이 550 nm에서 측정되어 OD 1.0까지 성장한 이후에, 500 mL이 5-L 생물반응기를 접종하는 데 사용되었다.
포도당은 세포가 안정상에 도달할 때까지 지수적 속도로 첨가되었다. 이 시점 이후 포도당 첨가는 대사적 요구를 만족시키기 위해 감소되었다. 57시간 발효 동안 생물반응기로 운반된 포도당의 전체 양은 3.9 kg이었다. 유도는 IPTG를 첨가하여 달성되었다. IPTG 농도는 이산화탄소 발생율이 100 mmol/L/시간에 도달할 때 100 uM가 되었다. 시간 경과에 따른 생물반응기 내의 OD550 프로파일은 도 111A에 나타나있다. 생물반응기로부터 나온 배출기체에서 이소프렌의 수준은 본 명세서에서 기술된 바와 같이 결정되었다. 이소프렌의 역가는 발효 과정을 통해 1.6 g/L의 최종 값까지 증가되었다 (도 111B). 발효 과정을 통해 이소프렌의 특이 생산도는 도 11C에 나타나있고 1.2 mg/OD/시간에서 피크에 도달하였다. 57시간 발효 동안 생산된 이소프렌의 전체 양은 16.2 g이었다. 발효 동안 이소프렌을 생산하는 데 들어갔던 사용된 탄소의 몰라 수율은 0.9% 이었다. 포도당으로부터 나온 이소프렌의 무게 퍼센트 수율은 0.4%이었다.
XIV. 탄소원으로서 글리세롤을 사용하는 쿠쥬 이소프렌 합성효소를 포함하는 대장균 BL21로부터의 이소프렌 발효.
쿠쥬 이소프렌 합성효소를 발현하는 대장균의 15-L 규모의 발효가 회분식 배양에서 글리세롤을 준 세포로부터 이소프렌을 생산하는 데 사용되었다. 본 실험은 글리세롤 존재 시 (포도당 없이) 세포를 성장시키는 것이 2.2 mg/L의 이소프렌 생산을 가져오는 것을 보여준다.
배지 레시피 (발효 배지 리터 당):
배지는 발효 배지 리터 당 하기 성분을 사용하여 생성되었다: K2HPO4 7.5 g, MgSO4 * 7H2O 2 g, 시트르산 모노하이드레이트 2 g, 철 암모늄 시트르산 0.3 g, 효모추출물 0.5 g, 1000X 변형된 미량 금속 용액 1 ml. 모든 성분은 다같이 첨가되었고 diH2O에 녹였다. 본 용액은 고압 멸균되었다. pH는 7.0으로 암모늄 하이드록사이드 (30%)를 사용하여 조정되었고 부피는 q.s. 맞추었다. 글리세롤 5.1 g, 티아민 * HCl 0.1 g, 및 항생제가 멸균 및 pH 조정 이후에 첨가되었다.
1000X 변형된 미량 금속 용액:
1000X 변형된 미량 금속 용액은 하기 성분을 사용하여 생성되었다: 시트르산 * H2O 40 g, MnSO4 * H2O 30 g, NaCl 10 g, FeSO4 * 7H2O 1 g, CoCl2 * 6H2O 1 g, ZnSO * 7H2O 1 g, CuSO4 * 5H2O 100 mg, H3BO3 100 mg, NaMoO4 * 2H2O 100 mg. 각 성분은 한 번에 하나씩 DIH2O에 녹이고, pH는 3.0으로 HCl/NaOH를 사용하여 조정한 다음 부피를 q.s. 맞추고0.22 마이크론 필터로 여과 살균되었다.
발효는 pTrcKudzu 플라스미드를 포함하는 대장균 BL21(DE3) 세포를 사용하여 15-L 생물반응기에서 수행되었다. 본 실험은 원하는 발효 pH 7.0 및 온도 30℃에서 포도당으로부터 이소프렌 형성을 감시하도록 수행되었다. 냉동 바이알로부터 가져온 대장균 균주의 접종액은 LB 액체배지 아가 플레이트 (항생제 첨가) 상에 뿌려졌고 37℃에서 배양되었다. 단일 콜로니가 소이톤-효모추출물-포도당 배지 내에 접종되었고 35℃에서 성장시켰다. 접종액이 550 nm에서 측정되어 OD 1.0까지 된 이후에, 600 mL 이 5-L 생물반응기를 접종하는 데 사용되었다.
글리세롤은 세포가 550 nm (OD550)에서 광학 밀도가 153에 도달할 때까지 지수적 속도로 첨가되었다. 36시간 발효 동안 생물반응기로 운반된 포도당의 전체 양은 1.7 kg이었다. 접종액에 넣은 포도당 이외에는 포도당은 생물반응기에 전혀 첨가되지 않았다. 유도는 IPTG를 첨가하여 달성되었다. IPTG 농도는 광학 밀도가 550 nm (OD550)에서 50에 도달할 때 20 μM가 되었다. 시간 경과에 따른 생물반응기의 OD550 프로파일은 도 57에 나타나있다. 생물반응기로부터 나온 배출기체에서 이소프렌의 수준은 본 명세서에서 기술된 바와 같이 결정되었다. 이소프렌의 역가는 발효 과정을 통해 2.2 mg/L의 최종 값까지 증가되었다 (도 58). 54시간 발효 동안 생산된 이소프렌의 전체 양은 20.9 mg이었고, 생산의 시간 과정은 도 59에 나타나있다.
XIV. 메발론산 경로로부터 나온 유전자를 발현하고 탄소원으로 역슈가를 사용하여 회분식 배양에서 15-L 규모로 자란 대장균 BL21로부터의 이소프렌 발효
메발론산 경로 폴리펩타이드 및 쿠쥬 이소프렌 합성효소를 발현하는 대장균의 15-L 규모의 발효가 회분식 배양에서 역슈가를 준 세포로부터 이소프렌을 생산하는 데 사용되었다. 본 실험은 역슈가 존재 시 세포를 성장시키는 것이 2.4 g/L의 이소프렌 생산을 가져오는 것을 보여준다.
배지 레시피 (발효 배지 리터 당):
배지는 발효 배지 리터 당 하기 성분을 사용하여 생성되었다: K2HPO4 7.5 g, MgSO4 * 7H2O 2 g, 시트르산 모노하이드레이트 2 g, 철 암모늄 시트르산 0.3 g, 효모추출물 0.5 g, 1000X 변형된 미량 금속 용액1 ml. 모든 성분은 다같이 첨가되었고 diH2O에 녹였다. 본 용액은 고압 멸균되었다. pH는 7.0으로 암모늄 하이드록사이드 (30%)를 사용하여 조정되었고 부피는 q.s. 맞추었다. 역슈가 10 g, 티아민 * HCl 0.1 g, 및 항생제가 멸균 및 pH 조정 이후에 첨가되었다.
1000X 변형된 미량 금속 용액:
1000X 변형된 미량 금속 용액은 하기 성분을 사용하여 생성되었다: 시트르산 * H2O 40 g, MnSO4 * H2O 30 g, NaCl 10 g, FeSO4 * 7H2O 1 g, CoCl2 * 6H2O 1 g, ZnSO * 7H2O 1 g, CuSO4 * 5H2O 100 mg, H3BO3 100 mg, NaMoO4 * 2H2O 100 mg. 각 성분은 한 번에 하나씩 DI H2O에 녹이고, pH는 3.0으로 HCl/NaOH를 사용하여 조정한 다음 부피를 q.s. 맞추 고0.22 마이크론 필터로 여과 살균되었다.
발효는 pCL PtrcUpperMVA 및 pTrc KKDyIkIS pTrcKudzu 플라스미드를 포함하는 대장균 BL21(DE3) 세포를 사용하여 15-L 생물반응기에서 수행되었다. 본 실험은 원하는 발효 pH 7.0 및 온도 30℃에서 포도당으로부터 이소프렌 형성을 감시하도록 수행되었다. 냉동 바이알로부터 가져온 대장균 균주의 접종액은 LB 액체배지 아가 플레이트 (항생제 첨가) 상에 뿌려졌고 37℃에서 배양되었다. 단일 콜로니가 트립톤-효모추출물 배지 내에 접종되었다. 접종액이 550 nm에서 측정되어 OD 1.0까지 된 이후에, 500 mL 이 5-L 생물반응기를 접종하는 데 사용되었다.
역슈가는 세포가 정지상에 도달할 때까지 지수적 속도로 첨가되었다. 이 시점 이후 첨가된 역슈가는 대사적 요구를 만족시키도록 감소되었다. 44시간 발효 동안 생물반응기로 운반된 포도당의 전체 양은 2.4 kg이었다. 유도는 IPTG를 첨가하여 달성되었다. IPTG 농도는 광학 밀도가 550 nm (OD550)에서 9값에 도달할 때 25 μM가 되었다. IPTG 농도는 OD550가 200에 도달할 때 50 μM이 되었다. 시간 경과에 따른 생물반응기 내의 OD550 프로파일은 도 96에 나타나있다. 생물반응기로부터 나온 배출기체에서 이소프렌의 수준은 본 명세서에서 기술된 바와 같이 결정되었다. 이소프렌의 역가는 발효 과정을 통해 2.4 g/L의 최종 값까지 증가되었다 (도 97). 44시간 발효 동안 생산된 이소프렌의 전체 양은 18.4 g이었고, 생산의 시간 과정은 도 98에 나타나있다. 발효 동안 이소프렌을 생산하는 데 들어갔던 사용된 탄소의 몰라 수율은 1.7% 이었다. 포도당으로부터 나온 이소프렌의 무게 퍼센트 수율은 0.8%이었다.
실시예 9:
바실러스 섭틸리스
내로 통합되기 위한 상부 및 하부 MVA 경로의 제작
I. 바실러스 섭틸리스에서 상부 MVA 경로의 제작
엔테로코커스 페칼리스 (Enterococcus faecalis)로부터 나온 상부 경로는 aprE 프로모터의 조절 하에 B. 바실러스 내로 통합되었다. 상부 경로는 두 개의 유전자로 구성된다; AACT 및 HMGR를 인코딩하는 mvaE, 또한 HMGS를 인코딩하는 mvaS. 두 개 유전자는 둘 사이에 종결 코돈, mvaS 앞에 RBS 부위를 두고 함께 융합되고 aprE 프로모터의 조절 하에 놓인다. 종결인자는 mvaE 유전자 뒤에 위치한다. 클로로암페니콜 저항성 마커는 mvaE 유전자 뒤에 클론되고 제작물은 aprE 좌위에 사이에 낀 상동성 부위를 사용하여 이중 교차 (double cross over)에 의해 도입된다.
네 개의 DNA 단편이 PCR 반응에 의해 다같이 융합되도록 하는 돌출부 (overhangs)를 포함하도록 PCR에 의해 증폭된다. PCR 증폭은 제조사의 지침에 따라 허큘라제 중합효소를 사용하여 수행된다.
1. PaprE
CF 07-134 (+) aprE 프로모터의 시작 PstI
5'-GACATCTGCAGCTCCATTTTCTTCTGC (서열번호 115)
CF 07-94 (-) PaprE 와 mvaE 융합
5'- CAATAATAACTACTGTTTTCACTCTTTACCCTCTCCTTTTAA (서열번호 116)
주형: Bacillus subtilis 염색체DNA
2. mvaE
CF 07-93 (+) aprE 프로모터에 mvaE 융합 (GTG 시작 코돈)
5'- TTAAAAGGAGAGGGTAAAGAGTGAAAACAGTAGTTATTATTG (서열번호 117)
CF 07-62 (-) 둘 사이 RBS로 mvaE 와 mvaS 융합
5'- TTTATCAATCCCAATTGTCATGTTTTTTTACCTCCTTTATTGTTTTCTTAAATC (서열번호 94)
주형: Enterococcus faecalis 염색에 DNA (ATCC로부터 입수)
3. mvaS
CF 07-61 (+) 둘 사이 RBS로 mvaE 와 mvaS 융합
5'- GATTTAAGAAAACAATAAAGGAGGTAAAAAAACATGACAATTGGGATTGATAAA (서열번호 95)
CF 07-124 (-) 종결인자에 mvaS 말단 융합
5'- CGGGGCCAAGGCCGGTTTTTTTTAGTTTCGATAAGAACGAACGGT (서열번호 118)
주형: Enterococcus faecalis 염색체DNA
4. B. amyliquefaciens 알칼라인 세린 프로테아제 종결인자
CF 07-123 (+) 종결인자에 mvaS 말단 융합
5'- ACCGTTCGTTCTTATCGAAACTAAAAAAAACCGGCCTTGGCCCCG (서열번호 119)
CF 07-46 (-) B. amyliquefaciens 종결인자의 말단BamHI
5'- GACATGACGGATCCGATTACGAATGCCGTCTC (서열번호 58)
주형: Bacillus amyliquefaciens 염색체 DNA
PCR 융합 반응
5. mvaE 와 mvaS 융합
CF 07-93 (+) aprE 프로모터에 mvaE 융합 (GTG 시작 코돈)
5'- TTAAAAGGAGAGGGTAAAGAGTGAAAACAGTAGTTATTATTG (서열번호 117)
CF 07-124 (-) 종결인자에 mvaS 말단 융합
5'- CGGGGCCAAGGCCGGTTTTTTTTAGTTTCGATAAGAACGAACGGT (서열번호 118)
주형: 상기로부터 #2 및 #3
6. aprE 프로모터에 mvaE-mvaS 융합
CF 07-134 (+) aprE 프로모터의 시작 PstI
5'- GACATCTGCAGCTCCATTTTCTTCTGC (서열번호 115)
CF 07-124 (-) 종결인자에 mvaS 말단 융합
5'- CGGGGCCAAGGCCGGTTTTTTTTAGTTTCGATAAGAACGAACGGT (서열번호 118)
주형: 상기로부터 #1 및 #4
7. 종결인자에 PaprE-mvaE-mvaS 융합
CF 07-134 (+) aprE 프로모터 시작 PstI
5'- GACATCTGCAGCTCCATTTTCTTCTGC (서열번호 115)
CF 07-46 (-) B. amyliquefaciens 종결인자 말단 BamHI
5'- GACATGACGGATCCGATTACGAATGCCGTCTC (서열번호 58)
주형: #4 및 #6
산물은 제한효소 PstI/BamHI로 소화되고 PstI/BamHI로 소화된 pJM102 (Perego, M. 1993. Integrational vectors for genetic manipulation in Bacillus subtilis, p. 615-624. In A. L. Sonenshein, J. A. Hoch, and R. Losick (ed.), Bacillus subtilis and other gram-positive bacteria: biochemistry, physiology, and molecular genetics. 미국 미생물학회, 워싱턴 DC)와 결찰된다. 라이게이션은 화학적으로 능력있는 E.coli TOP 10 세포에 형질전환되고 형질전환체는 카베니실린 (50 μg/ml)을 포함하는 LA 상에서 선별된다. 정확한 플라스미드는 서열결정에 의해 확인되고 pJMUpperpathway2라고 명명된다 (도 50 및 도 51). 정제된 플라스미드 DNA는 Bacillus subtilis aprEnprE Pxyl-comK 내에 형질전환되고 클로로암페니콜 (5 μg/ml)을 포함하는 L 아가 상에서 선별된다. 정확한 콜로니가 선별되고 상부 경로를 포함하는 카세트의 복제 수를 증폭시키도록 클로로암페니콜 10, 15 및 25 μg/ml을 포함하는 L 아가 상에서 차례대로 도말된다.
그 결과 나온 균주는 1% 포도당을 포함하는 LB에서 성장시켜서 메발론산 생산에 대해 테스트된다. 배양액은 메발론산의 생산에 대해 GC에 의해 분석된다.
본 균주는 하부 메발론산 경로의 통합을 위한 숙주로서 계속 사용된다.
하기 프라이머는 하기 다양한 제작물을 서열결정하는 데 사용된다. 서열결정 프라이머:
CF 07-134 (+) aprE 프로모터 시작 PstI
5'- GACATCTGCAGCTCCATTTTCTTCTGC (서열번호 115)
CF 07-58 (+) mvaE 유전자의 시작
5'- ATGAAAACAGTAGTTATTATTGATGC (서열번호 97)
CF 07-59 (-) mvaE 유전자의 말단
5'- ATGTTATTGTTTTCTTAAATCATTTAAAATAGC (서열번호 98)
CF 07-82 (+) mvaS 유전자의 시작
5'- ATGACAATTGGGATTGATAAAATTAG (서열번호 99)
CF 07-83 (-) mvaS 유전자의 말단
5'- TTAGTTTCGATAAGAACGAACGGT (서열번호 100)
CF 07-86 (+) mvaE 서열
5'- GAAATAGCCCCATTAGAAGTATC (서열번호 101)
CF 07-87 (+) mvaE 서열
5'- TTGCCAATCATATGATTGAAAATC (서열번호 102)
CF 07-88 (+) mvaE 서열
5'- GCTATGCTTCATTAGATCCTTATCG (서열번호 103)
CF 07-89 (+) mvaS 서열
5'- GAAACCTACATCCAATCTTTTGCCC (서열번호 104)
형질전환체는 클로로암페니콜을 5 μg/ml의 농도로 포함하는 LA 상에서 선별된다. 한 개 콜로니가 서열결정에 의해 정확한 도입을 가진 것으로 검증되고 수일 동안 25 μg/ml 의 최종 수준까지 증가하는 클로로암페니콜 농도를 가진 LA 상에서 도말된다. 이것은 관심있는 유전자를 포함하는 카세트의 증폭을 유발한다. 그 결과 나온 균주는 CF 455: pJMupperpathway#1 X Bacillus subtilis aprEnprE Pxyl comK (클로로암페니콜 25 μg/ml을 포함하는 LA 상에서 성장하도록 증폭됨)라고 명명된다.
II. 바실러스 섭틸리스에서 하부 MVA 경로의 제작
유전자 mvk1, pmk, mpd 및 idi로 구성되는 하부 MVA 경로는 B. subtilis 염색체의 nprE 부위로부터 나온 사이에 낀 DNA 부위 (통합 부위), aprE 프로모터, 및 스펙티노마이신 저항성 마커로 구성되는 카세트에 조합된다 (도 28 및 도29를 참조하라; 서열번호13). 본 카세트는 DNA2.0에 의해 합성되고 aprE 좌위에 도입되는 상부 MVA 경로를 포함하는 B. subtilis 염색체 내로 도입된다. 쿠쥬 이소프렌 합성효소 유전자는 실시예 14에 기술된 복제 플라스미드로부터 발현되고 통합된 상부 및 하부 경로 둘 다를 가진 균주 내에 형질전환된다.
실시예 10: 대표적인 이소프렌 조성물 및 이를 제조하는 방법
I. 이소프렌을 포함하는 발효 배출기체의 조성 분석.
14 L 규모의 발효가 이소프레노이드 전구체 생합성에 대한 전체 메발로네이드 경로, 효모로부터 나온 이소프레닐 피로포스페이트 이소머라제, 및 쿠쥬로부터 나온 이소프렌 합성효소를 인코딩하는 두 가지 플라스미드 pCL upperMev; pTrcKKDyIkIS를 포함하는 재조합 E. coli BL21 (DE3) 균주를 사용하여 수행되었다. 14 L 탱크로부터 나온 발효 배출기체는 피크 이소프렌 생산도 주변의 시점 (27.9 시간 경과된 발효시간, "EFT")에 20 mL 상부공간 바이알 내로 수집되었고 휘발성 성분에 대해 상부공간 GC/MS에 의해 분석되었다.
상부공간 분석이 애질런트 HP-5MS GC/MS 컬럼 (30 m x 250 mm; 0.25 mm 필름 두께)에 맞춘 애질런트6890 GC/MS 시스템으로 수행되었다. combiPAL 자동 주입기가 20 mL 상부공간 바이알로부터 500 μL 분량을 수집하는데 사용되었다. GC/MS 방법은 헬륨을 운반기체로서 1 mL/분의 유속에서 사용하였다. 주입기 포트는 250℃에서 50 : 1의 분리비율로 유지되었다. 오븐 온도는 37℃ 에서 초기 2분의 기간 동안 유지되었고 이어서 전체 방법 시간 10분 동안 25℃/분의 속도에서 237℃로 증가되었다. 애질런트 5793N 질량 선별 검출기는 m/z 29로부터m/z 300까지 스캔하였다. 본 시스템의 검출 한계는 대략 0.1 μg/Lgas 또는 대략 0.1 ppm이다. 원하는 경우, 더 낮은 검출 한계를 가진 더 민감한 기기가 사용될 수 있다.
배출기체는 99.925 % (v/v)의 영속적 기체 (N2, CO2 and O2), 대략 0.075%의 이소프렌 (2-메틸-1,3-부타디엔) (~750 ppmv, 2100 mg/L) 및 소량의 에탄올 (< 50 ppmv), 아세톤, 및 두 개 C5 프레닐 알코올로 구성되었다. 물 증기의 양은 결정되지 않았지만, 0℃에서 평형 증기압과 동등한 것으로 평가되었다. 휘발성 유기 분획의 조성은 GC/MS 크로마토그램 (도 86A 및 86B)에서 피크 면적을 통합하여 결정되었고 표 6에 나열되어 있다. 표준 에탄올과 아세톤에 대한 측정 곡선이 표준방법을 사용하여 GC면적이 μg/L 단위의 기체 상 농도로 전환을 가능하게 하였다.
표 6은 발효 배출기체에서 휘발성 유기 성분의 조성을 나타낸다. 발효-기체가 발효 27.9 시간 시점에 이종유래 메발로네이트 경로, 효모로부터 나온 이소프레닌 피로포스페이트 이소머라제, 및 쿠쥬로부터 나온 이소프렌 합성효소를 발현하는 E. coli BL21 (DE3) 균주를 사용하여 분석되었다.
| 화합물 | RT (분) | GC 면적 | 면적 % | 농도 (ug/L) |
| 에탄올 | 1.669 | 239005 | 0.84 | 62 +/- 6 |
| 아세톤 | 1.703 | 288352 | 1.02 | 42 +/- 4 |
| 이소프렌 (2-메틸-1,3-부타디엔) | 1.829 | 27764544 | 97.81 | 2000 +/- 200 |
| 3-메틸-3-부텐-1-올 | 3.493 | 35060 | 0.12 | <10 |
| 3-메틸-2-부텐-1-올 | 4.116 | 58153 | 0.20 | <10 |
II. 재조합 대장군 균주의 발효 동안 공동-생산되는 미량 휘발성 유기화합물 (VOCs)의 측정.
14 L 규모의 발효가 이소프레노이드 전구체 생합성에 대한 전체 메발로네이드 경로, 효모로부터 나온 이소프레닐 피로포스페이트 이소머라제, 및 쿠쥬로부터 나온 이소프렌 합성효소를 인코딩하는 두 가지 플라스미드 (pCL upperMev; pTrcKKDyIkIS)를 포함하는 재조합 E. coli BL21 (DE3) 균주를 사용하여 수행되었다.
발효 배출-기체는 미량 휘발성 유기성분을 농축하여 확인하도록 식힌 상부공간 바이알을 통과시켰다. 본 발효로부터 나온 배출-기체는 수정 모직 (quartz wool, 2g)로 포장된 20 mL 상부공간 바이알을 통하여 1 L/분의 속도로 10분 동안 수집되었고 드라이아이스로 -78℃까지 식혔다. 바이알은 새로운 바이알 뚜껑으로 다시 덮고 실시예 10, 제 I부에 기술된 조건을 사용하여 포집된 VOCs에 대하 상부공간 GC/MS에 의해 분석되었다. 도 87A 내지 87D에서 관찰된 화합물의 비율은 발효 배출-기체의 전체 수준, -78℃에서 상대적 증기압, 및 질량분광기의 검출기 반응의 조합이다. 예를 들어, 산화된 휘발물질 (예로, 아세톤과 에탄올)에 대비한 이소프렌의 낮은 수준은 본 물질의 높은 휘발도의 함수이어서, 이것은 -78℃에서 상부공간 바이알에 축적되지 않는다.
많은 이들 화합물의 존재는 생물학적 출처로부터 유래한 이소프렌 조성물에 독특한 것이다. 결과는 도 87A 내지 87D에 나타나있고 표 7A 및 표 7B에 요약되어 있다.
표 7A는 E. coli BL21 (DE3) (pCL upperMev; pTrcKKDyIkIS)에 의해 생산되고 이어서 -78℃에서 냉동-포집된 배출-기체에 존재하는 미량 휘발물질을 나타내고, 여기에서 1은 GC 면적은 나열된 화합물에 해당하는 피크 아래의 미교정된 면적이고, 2 는 면적 % 는 모든 화합물의 전체 피크 면적에 대비한 %로서 표현되는 피크 면적이고, 3은 비율 %는 2-메틸-1,3-부타디엔의 피크 면적에 대비한 %로서 표현되는 피크 면적이다.
표 7B는 E. coli BL21 (DE3) (pCL upperMev; pTrcKKDyIkIS)에 의해 생산되고 이어서 -196℃에서 냉동-포집된 배출-기체에 존재하는 미량 휘발물질을 나타내고, 1은 GC 면적은 나열된 화합물에 해당하는 피크 아래의 미교정된 면적이고, 2은 면적 % 는 모든 화합물의 전체 피크 면적에 대비한 %로서 표현되는 피크 면적이고, 3은 비율 %는 2-메틸-1,3-부타디엔의 피크 면적에 대비한 %로서 표현되는 피크 면적이다.
| 표 7A: E. coli BL21 (DE3) (pCL upperMev; pTrcKKDyIkIS)에 의해 생산되고 이어서 -78℃에서 냉동-포집된 배출-기체에 존재하는 미량 휘발물질 | ||||
| 화합물 | RT (분 | GC 면적1 | 면적 %2 | 비율%3 |
| 아세트알데하이드 | 1.542 | 4019861 | 4.841 | 40.14 |
| 에탄올 | 1.634 | 10553620 | 12.708 | 105.39 |
| 아세톤 | 1.727 | 7236323 | 8.714 | 72.26 |
| 2-메틸-1,3-부타디엔 | 1.777 | 10013714 | 12.058 | 100.00 |
| 1-프로판올 | 1.987 | 163574 | 0.197 | 1.63 |
| 디아세틸 | 2.156 | 221078 | 0.266 | 2.21 |
| 2-메틸-3부텐-2-올 | 2.316 | 902735 | 1.087 | 9.01 |
| 2-메틸-1-프로판올 | 2.451 | 446387 | 0.538 | 4.46 |
| 3-메틸-1-부탄알 | 2.7 | 165162 | 0.199 | 1.65 |
| 1-부탄올 | 2.791 | 231738 | 0.279 | 2.31 |
| 3-메틸-3-부텐-1-올 | 3.514 | 14851860 | 17.884 | 148.32 |
| 3-메틸-1-부탄올 | 3.557 | 8458483 | 10.185 | 84.47 |
| 3-메틸-2-부텐-1-올 | 4.042 | 18201341 | 21.917 | 181.76 |
| 3-메틸-2-부탄알 | 4.153 | 1837273 | 2.212 | 18.35 |
| 3-메틸부틸 아세테이트 | 5.197 | 196136 | 0.236 | 1.96 |
| 3-메틸-3-부텐-1-일 아세테이트 | 5.284 | 652132 | 0.785 | 6.51 |
| 2-헵탄온 | 5.348 | 67224 | 0.081 | 0.67 |
| 2,5-디메틸피라진 | 5.591 | 58029 | 0.070 | 0.58 |
| 3-메틸-2-부텐-1-일 아세테이트 | 5.676 | 1686507 | 2.031 | 16.84 |
| 6-메틸-5-헵텐-2-온 | 6.307 | 101797 | 0.123 | 1.02 |
| 2,4,5-트리메틸피리딘 | 6.39 | 68477 | 0.082 | 0.68 |
| 2,3,5-트리메틸피라진 | 6.485 | 30420 | 0.037 | 0.30 |
| (E)-3,7-디메틸-1,3,6-옥타트리엔 | 6.766 | 848928 | 1.022 | 8.48 |
| (Z)-3,7-디메틸-1,3,6-옥타트리엔 | 6.864 | 448810 | 0.540 | 4.48 |
| 3-메틸-2-부텐-1-일 부틸레이트 | 7.294 | 105356 | 0.127 | 1.05 |
| 시트로넬랄 | 7.756 | 208092 | 0.251 | 2.08 |
| 2,3-사이클로헵텐올피리딘 | 8.98 | 1119947 | 1.349 |
11.18
|
| 표 7B: E. coli BL21 (DE3) (pCL upperMev; pTrcKKDyIkIS)에 의해 생산되고 이어서 -196℃에서 냉동-포집된 배출-기체에 존재하는 미량 휘발물질 | ||||
| 화합물 | RT(분) | GC 면적1 | 면적%2 | 비율%3 |
| 아세트알데하이드 | 1.54 | 1655710 | 0.276 | 0.33 |
| 메탄티올 | 1.584 | 173620 | 0.029 | 0.03 |
| 에탄올 | 1.631 | 10259680 | 1.707 | 2.03 |
| 아세톤 | 1.722 | 73089100 | 12.164 | 14.43 |
| 2-메틸-1,3-부타디엔 | 1.771 | 506349429 | 84.269 | 100.00 |
| 메틸 아세테이트 | 1.852 | 320112 | 0.053 | 0.06 |
| 1-프로판올 | 1.983 | 156752 | 0.026 | 0.03 |
| 디아세틸 | 2.148 | 67635 | 0.011 | 0.01 |
| 2-메틸-3-부텐-2-올 | 2.216 | 254364 | 0.042 | 0.05 |
| 에틸 아세테이트 | 2.312 | 684708 | 0.114 | 0.14 |
| 2-메틸-1-프로판올 | 2.345 | 2226391 | 0.371 | 0.44 |
| 3-메틸-1-부탄알 | 2.451 | 187719 | 0.031 | 0.04 |
| 3-메틸-2-부탄온 | 2.696 | 115723 | 0.019 | 0.02 |
| 1-부탄올 | 2.792 | 54555 | 0.009 | 0.01 |
| 2-펜탄온 | 3.034 | 66520 | 0.011 | 0.01 |
| 3-메틸-3-부텐-1-올 | 3.516 | 1123520 | 0.187 | 0.22 |
| 3-메틸-1-부탄올 | 3.561 | 572836 | 0.095 | 0.11 |
| 에틸 이소부틸레이트 | 3.861 | 142056 | 0.024 | 0.03 |
| 3-메틸-2-부텐-1-올 | 4.048 | 302558 | 0.050 | 0.06 |
| 3-메틸-2-부텐알 | 4.152 | 585690 | 0.097 | 0.12 |
| 부틸 아세테이트 | 4.502 | 29665 | 0.005 | 0.01 |
| 3-메틸부틸 아세테이트 | 5.194 | 271797 | 0.045 | 0.05 |
| 3-메틸-3-부텐-1-일 아세테이트 | 5.281 | 705366 | 0.117 | 0.14 |
| 3-메틸-2-부텐-1-일 아세테이트 | 5.675 | 815186 | 0.136 | 0.16 |
| (E)-3,7-디메틸-1,3,6-옥타트리엔 | 6.766 | 207061 | 0.034 | 0.04 |
| (Z)-3,7-디메틸-1,3,6-옥타트리엔 | 6.863 | 94294 | 0.016 | 0.02 |
| 2,3-사이클로헵텐올피리딘 | 8.983 | 135104 | 0.022 | 0.03 |
III. 발효로부터 유래한 이소프렌에서 C5 탄화수소 이성질체의 부재.
발효 배출-기체에 존재하는 이소프렌의 냉동-포집은 액체 질소에서 식힌 2 mL 상부공간 바이알을 사용하여 수행된다. 배출-기체 (1 L/분)은 먼저 소듐 하이드록사이드 펠렛을 포함하는 20 mL 바이알을 통과시켜서 2 mL 바이알 (-196℃)에서 얼음 및 고형 CO2의 축적을 최소화하였다. 대략 10L의 배출-기체가 바이알을 통과하였고, 이후에 이는 환기시키면서 -78℃로 데워졌으며, 이어서 새로운 바이알 뚜껑으로 재밀봉하고 GC/MS에 의해 분석되었다.
GC/MS 상부공간 분석은 상부공간 방식에 100 μL 기체를 채운 주사기를 사용하여 애질런트 6890 GC/MS 시스템으로 수행되었다. 제브론 (Zebron) ZB-624 GC/MS 컬럼 (30 m x 250 mm; 1.40 mm 필름 두께)이 분석물의 분리를 위해 사용되었다. GC 자동주입기가 기체-채운 100 uL 주사기에 맞추어졌고, 바늘 높이가 2 mL GC 바이알로부터 50 uL 상부공간 시료의 주입을 허용하도록 조정되었다. GC/MS 방법은 운반 기체로서 헬륨을 1 mL/분의 유속에서 사용하였다. 주입 포트는 200℃에서 20 : 1의 분리율로 유지되었다. 오븐 온도는 37℃에서 분석의 5분 지속기간 동안 유지되었다. 애질런트 5793N 질량 선택 검출기는 단일 이온 감시 (SIM) 방식으로 m/z 55, 66, 67및 70 상에서 작동되었다. 이들 조건 하에서, 이소프렌은 2.966분에서 용출되는 것이 관찰되었다 (도 88B). 석유 유래 이소프렌의 표준 (시그마-알드리치사)도 역시 본 방법을 사용하여 분석되었고 추가적인 C5 탄화수소 이성질체를 포함하는 것이 확인되었으며, 이는 주요 피크 직전 또는 직후에 용출되고 교정된 GC 면적에 근거하여 정량되었다 (도 88A). 표 8A는 석유-유래 이소프렌의 GC/MS 분석표를 나타내고, 표 8B는 발효-유래 이소프렌의 GC/MS 분석 (전체 C5 탄화수소의 면적%)을 나타낸다.
| 표 8A: 석유-유래 이소프렌의 GC/MS 분석 | |||
| 화합물 | RT (분) | GC 면적 | 전체 C5 탄화수소의 면적% |
| 2-메틸-1-부텐 |
2.689 |
18.2 x 103 |
0.017% |
| (Z)-2-펜텐 | 2.835 | 10.6 x 104 | 0.101% |
| 이소프렌 | 2.966 | 10.4 x 107 | 99.869% |
| 1,3-사이클로펜타디엔(CPD) | 3.297 | 12.8 x 103 | 0.012% |
| 표 8B: 발효-유래 이소프렌의 GC/MS 분석 (전체 C5 탄화수소의 면적%) | |||
| 화합물 | RT (분) | 교정된 GC 면적 | 전체 C5 탄화수소의 % |
| 이소프렌 | 966 | 1 x 107 | 0% |
개별적 실험에서, C5 탄화수소의 표준 혼합물은 검출기 반응이 각 화합물에 대해 동일한지 여부를 결정하도록 분석되었다. 화합물은 2-메틸-1-부텐, 2-메틸-1,3-부타디엔, (E)-2-펜텐, (Z)-2-펜텐 및 (E)-1,3-펜타디엔이었다. 본 경우에서, 분석은 50℃에서 유지된 애질런트DB-Petro 컬럼 (100 m x 0.25 mm, 0.50 μm 필름 두께) 상에서 15분 동안 수행되었다. GC/MS 방법은 운반 기체로서 헬륨을 1 mL/분의 유속에서 사용하였다. 주입 포트는 200℃에서 50 : 1의 분리율로 유지되었다. 애질런트 5793N 질량 선택 검출기는 완전 스캔 방식으로 m/z 19로부터 진행되었다. 이들 조건 하에서, 100 μg/L 농도의 각 표준은 실험적 오차 범위 내에서 동일한 검출기 반응을 생성하였다.
IV. 고체 상에 흡착된 이소프렌을 포함하는 조성물
생물학적으로-생산된 이소프렌이 활성화된 탄소에 흡착되어 50 내지 99.9% 탄소, 0.1% 내지 50% 이소프렌, 0.01% 내지 5% 물, 및 소량 (< 0.1%)의 기타 휘발성 유기성분을 포함하는 고체 상이 되었다.
발효 배출-기체는 0℃에 유지된 구리 농축 코일을 통과하였고, 물 증기를 제거하도록 입자화된 실리카 건조제 여과가 이어졌다. 그 다음 습기가 제거된 배출-기체는 사용된 필터에서 이소프렌의 통과가 GC/MS에 의해 검출되었던 시점에 필터를 포함한 탄소 (Koby Jr, Koby Filters, MA)를 통과시켰다. 카트리지에 흡착된 이소프렌량은 배출-기체에서 농도, 전체 유속 및 수집 기간에 따른 통과 퍼센트를 계산하여 간접적으로 결정될 수 있다. 대안으로, 흡착된 이소프렌은 열, 진공, 또는 용매-매개성 탈착에 의해 필터로부터 회수될 수 있다.
V. 농축된 이소프렌의 수집 및 분석
발효 배출-기체는 습기가 제거되었고, CO2 가 적합한 흡착제 (예로, 아스카리트 (ascarite))를 통한 여과에 의해 제거되었다. 그 결과 얻은 배출-기체 유량은 다시 유량으로부터 VOCs를 농축하도록 액체 질소로 식힌 농축기를 통과시켰다. 수집 용기는 그 결과 나온 이소프렌 농축물을 억제하도록 t-부틸 카테콜을 포함하였다. 농축물은 본 명세서에서 기술된 방법과 같은 표준 방법을 사용하여 정제도를 결정하도록 GC/MS 및 NMR에 의해 분석되었다.
VI. 발효에 의한 프레닐 알코올의 생산
쿠쥬 이소프렌 합성효소를 발현하는E. coli BL21 (DE3) 균주로부터 나온 배출-기체의 분석은 이소프렌과 3-메틸-3-부텐-1-올 (이소프레놀) 둘 다의 존재를 보여주었다. 발효 기간 동안 발효 배출-기체에서 두 가지 화합물의 수준은 상부공간 GC/MS에 의해 결정된 바와 같이 도 89에 나타나 있다. 수집된 이소프레놀의 수준 (3-메틸-3-부텐-1-올, 3-MBA)은 본 실험에서 거의 10 μg/Loffgas 가 되었다. 추가적인 실험은 발효 배출-기체에서 대략 20 μg/Loffgas의 수준을 생성하였다.
실시예
11:
메발론산
경로로부터 나온 유전자를 발현하고 사료첨가-
회분식
배양으로 발효되는
대장균에서
성장 및 이소프렌 생산의 분리
실시예 11은 메발론산으로부터 세포 성장 및 이소프렌 생산의 분리를 설명하고 있다.
I. 발효 조건
배지 레시피 (발효 배지 리터 당):
배지는 발효 배지 리터 당 하기 성분을 사용하여 생성되었다: K2HPO4 7.5 g, MgSO4 * 7H2O 2 g, 시트르산 모노하이드레이트 2 g, 철 암모늄 시트르산 0.3 g, 효모추출물 0.5 g, 1000X 변형된 미량 금속 용액 1 ml. 모든 성분은 다같이 첨가되었고 di H2O에 녹였다. 본 용액은 고압 멸균되었다. pH는 7.0으로 암모늄 하이드록사이드 (30%)를 사용하여 조정되었고 부피는 q.s. 맞추었다. 포도당 10 g, 티아민 * HCl 0.1 g, 및 항생제가 멸균 및 pH 조정 이후에 첨가되었다.
1000X 변형된 미량 금속 용액:
1000X 변형된 미량 금속 용액은 하기 성분을 사용하여 생성되었다: 시트르산 * H2O 40 g, MnSO4 * H2O 30 g, NaCl 10 g, FeSO4 * 7H2O 1 g, CoCl2 * 6H2O 1 g, ZnSO * 7H2O 1 g, CuSO4 * 5H2O 100 mg, H3BO3 100 mg, NaMoO4 * 2H2O 100 mg. 각 성분은 한 번에 하나씩 di H2O에 녹이고, pH는 3.0으로 HCl/NaOH를 사용하여 조정한 다음 부피를 q.s. 맞추고 0.22 마이크론 필터로 여과 살균되었다.
발효는 pTrcHis2AUpperPathway (또한 pTrcUpperMVA라고도 명명됨, 도 91 및 도 92A 내지 92C; 서열번호 23) (50 mg/ml 카베니실린) 또는pCL PtrcUpperMVA (또한 pCL PtrcUpperPathway라고도 명명됨, (도 26)) (50 mg/ml 스펙티노마이신) 플라스미드를 포함하는 대장균 세포를 사용하여 수행되었다. 이소프렌을 생산하는 실험을 위해 대장균은 pTrc KKDyIkIS (50 mg/ml 카나마이신)도 역시 포함하였다. 본 실험은 원하는 발효 pH 7.0 및 온도 30℃에서 포도당으로부터 메발론산 또는 이소프렌 형성을 감시하도록 수행되었다. 냉동 바이알로부터 가져온 대장균 균주의 접종액은 LB 액체배지 아가 플레이트 (항생제 첨가) 상에 뿌려졌고 37℃에서 배양되었다. 단일 콜로니가 트립톤-효모추출물 배지 내에 접종되었다. 접종액이 550 nm에서 측정되어 OD 1.0까지 된 이후에, 생물반응기를 접종하는 데 사용되었다.
포도당은 세포가 안정상에 도달할 때까지 지수적 속도로 첨가되었다. 이 시점 이후 포도당 첨가는 대사적 요구를 만족시키기 위해 감소되었다. 유도는 IPTG를 첨가하여 달성되었다. 발효 액체배지에서 메발론산 농도는 과염산 (Sigma-Aldrich # 244252) 처리된 시료 (0.3 M, 4℃에서 5분 동안 배양됨)을 HPLC 컬럼 (BioRad # 125-0140)에 적용하여 결정되었다. 농도는 액체배지 메발론산 피크 크기를 D,L-메발로네이트를 형성하도록 과염산으로 처리된 메발론올아세톤 (mevalonolacetone, Sigma-Aldrich # M4667)으로부터 생성된 측정 곡선과 비교하여 결정되었다. 생물반응기로부터 나온 배출기체에서 이소프렌의 수준은 본 명세서에서 기술된 바와 같이 결정되었다. 이소프렌 역가는 발효액체 배지 리터당 생산되는 이소프렌량으로서 정의된다.
II
.
pTrcUpperMVA
플라스미드를 발현하는
E.
coli
BL21
(
DE3
) 세포로부터 150-L 규모로
메발론산
생산
상기 실시예 11에서 설명된 바와 같이 플레이트 상에서 자란 대장균 BL21 (DE3) 세포는 45 mL의 트립톤-효모추출물 배지를 포함하는 플라스크 내에 접종되었고 30℃에서 170 rpm으로 진탕하면서 5분 동안 배양되었다. 본 용액은 트립톤-효모추출물 배지의 5-L 생물반응기로 전달되었고, 세포를 배양액의 OD550 1.0이 될 때까지 30℃에서 27.5 rpm으로 진탕하면서 성장시켰다. 5 L의 접종액은 45-kg의 배지를 포함하는150-L 생물반응기 내로 접종되었다. IPTG 농도는 OD550가 수치 10에 도달할 때 1.1 mM이 되었다. 시간 경과에 따른 생물반응기 내의 OD550 프로파일은 도 60A에 나타나있다. 메발론산 역가는 발효 과정을 통해 61.3 g/L의 최종 값까지 증가되었다 (도 60B). 발효 과정을 통한 특이 생산도 프로파일은 도 60C에 나타나있고 도 60A와의 대비는 성장과 메발론산 생산의 분리를 설명하고 있다. 52.5 시간의 발효 동안 생산된 메발론산의 전체량은 사용된 포도당 14.1 kg으로부터 4.0 kg이었다. 발효과정 동안 메발론산을 생산하는 데 들어갔던 사용된 탄소의 몰라 수율은 34.2% 이었다.
III. pTrcUpperMVA 플라스미드를 발현하는 E. coli BL21 (DE3) 세포로부터 15-L 규모로 메발론산 생산
상기 실시예 11에서 설명된 바와 같이 플레이트 상에서 자란 대장균 BL21 (DE3) 세포는 500 mL의 트립톤-효모추출물 배지를 포함하는 플라스크 내에 접종되었고 30℃에서 160 rpm으로 진탕하면서 OD550 1.0까지 성장시켰다. 본 물질은 4.5-kg의 배지를 포함하는 15-L 생물반응기 내로 접종되었다. IPTG 농도는 OD550가 10값에 도달할 때 1.0 mM이 되었다. 시간 경과에 따른 생물반응기 내의 OD550 프로파일은 도 61A에 나타나있다. 메발론산 역가는 발효 과정을 통해 53.9 g/L의 최종 값까지 증가되었다 (도 61B). 발효 과정을 통한 특이 생산도 프로파일은 도 61C에 나타나 있고 도 61A와의 대비는 성장과 메발론산 생산의 분리를 설명하고 있다. 46.6 시간의 발효 동안 생산되는 메발론산의 전체량은 사용된 포도당 2.1 kg으로부터 491 g이었다. 발효과정 동안 메발론산을 생산하는 데 들어갔던 사용된 탄소의 몰라 수율은 28.8% 이었다.
IV. pTrcUpperMVA 플라스미드를 발현하는 E. coli FM5 세포로부터 15-L 규모로 메발론산 생산
상기 실시예 11, 제 I부에서 설명된 바와 같이 플레이트 상에서 자란 대장균 FM5 세포는 500 mL의 트립톤-효모추출물 배지를 포함하는 플라스크 내에 접종되었고 30℃에서 160 rpm으로 진탕하면서 OD550 1.0까지 배양되었다. 본 물질은 4.5-kg의 배지를 포함하는15-L 생물반응기 내로 접종되었다. IPTG 농도는 OD550가 수치 10에 도달할 때 1.0 mM이 되었다. 시간 경과에 따른 생물반응기 내의 OD550 프로파일은 도 62A에 나타나있다. 메발론산 역가는 발효 과정을 통해 23.7 g/L의 최종 값까지 증가되었다 (도 62B). 발효 과정을 통한 특이 생산도 프로파일은 도 62C에 나타나있고 또한 도 62A와의 대비는 성장과 메발론산 생산의 분리를 설명하고 있다. 51.2 시간의 발효 동안 생산된 메발론산의 전체량은 사용된 포도당 1.1 kg으로부터 140 g이었다. 발효과정 동안 메발론산을 생산하는 데 들어갔던 사용된 탄소의 몰라 수율은 15.2% 이었다.
V. pCL PtrcUpperMVA 및 pTrc KKDyIkIS 플라스미드를 발현하는 E. coli BL21(DE3) 세포로부터 15-L 규모로 이소프렌 생산
상기 실시예 11, 제 I부에서 설명된 바와 같이 플레이트 상에서 자란 pCL PtrcUpperMVA 및 pTrc KKDyIkIS 플라스미드를 발현하는 대장균 BL21(DE3) 세포는 500 mL의 트립톤-효모추출물 배지를 포함하는 플라스크 내에 접종되었고 30℃에서 160 rpm으로 진탕하면서 OD550 1.0까지 배양되었다. 본 물질은 4.5-kg의 배지를 포함하는 15-L 생물반응기 내로 접종되었다. IPTG 농도는 OD550 가 10값에 도달할 때 25 μM이 되었다. IPTG 농도는 OD550 가 190에 도달할 때 50 μM로 올라갔다. IPTG 농도는 발효 38시간 시점에 100 μM로 올라갔다. 시간 경과에 따른 생물반응기 내의 OD550 프로파일은 도 63A에 나타나있다. 이소프렌 역가는 발효 과정을 통해 2.2 g/L의 최종 값까지 증가되었다 (도 63B). 발효 과정을 통한 특이 생산도 프로파일은 도 63C에 나타나있고 또한 도 63A와의 대비는 성장과 이소프렌 생산의 분리를 설명하고 있다. 54.4 시간의 발효 동안 생산된 이소프렌의 전체량은 사용된 포도당 2.3 kg으로부터 15.9 g이었다. 발효과정 동안 이소프렌을 생산하는 데 들어갔던 사용된 탄소의 몰라 수율은 1.53% 이었다.
VI. pCL PtrcUpperMVA 및 pTrc KKDyIkIS 플라스미드를 발현하는 E. coli BL21(DE3) 튜너 세포로부터 15-L 규모로 이소프렌 생산
상기 실시예 11, 제 I부에서 설명된 바와 같이 플레이트 상에서 자란 pCL PtrcUpperMVA 및 pTrc KKDyIkIS 플라스미드를 발현하는 대장균 BL21(DE3) 세포는 500 mL의 트립톤-효모추출물 배지를 포함하는 플라스크 내에 접종되었고 30℃에서 160 rpm으로 진탕하면서 OD550 1.0까지 배양되었다. 본 물질은 4.5-kg의 배지를 포함하는15-L 생물반응기 내로 접종되었다. IPTG 농도는 OD550 가 10값에 도달할 때 26 μM이 되었다. IPTG 농도는 OD550 가 175에 도달할 때 50 μM로 올라갔다. 시간 경과에 따른 생물반응기 내의 OD550 프로파일은 도 64A에 나타나있다. 이소프렌 역가는 발효 과정을 통해 1.3 g/L의 최종 값까지 증가되었다 (도 64B). 발효 과정을 통한 특이 생산도 프로파일은 도 64C에 나타나있고 또한 도 64A와의 대비는 성장과 이소프렌 생산의 분리를 설명하고 있다. 48.6 시간의 발효 동안 생산된 이소프렌의 전체량은 사용된 포도당 1.6 kg으로부터 9.9 g이었다. 발효과정 동안 이소프렌을 생산하는 데 들어갔던 사용된 탄소의 몰라 수율은 1.34% 이었다.
VII. pCL PtrcUpperMVA 및 pTrc KKDyIkIS 플라스미드를 발현하는 E. coli MG1655 세포로부터 15-L 규모로 이소프렌 생산
상기 실시예 11, 제 I부에서 설명된 바와 같이 플레이트 상에서 자란 pCL PtrcUpperMVA 및 pTrc KKDyIkIS 플라스미드를 발현하는 대장균 MG1655 세포는 500 mL의 트립톤-효모추출물 배지를 포함하는 플라스크 내에 접종되었고 30℃에서 160 rpm으로 진탕하면서 OD550 1.0까지 배양되었다. 본 물질은 4.5-kg의 배지를 포함하는15-L 생물반응기 내로 접종되었다. IPTG 농도는 OD550가 수치 45에 도달할 때 24 μM이 되었다. 시간 경과에 따른 생물반응기 내의 OD550 프로파일은 도 65A에 나타나있다. 이소프렌 역가는 발효 과정을 통해 393 mg/L의 최종 값까지 증가되었다 (도 65B). 발효 과정을 통한 특이 생산도 프로파일은 도 65C에 나타나있고 또한 도 65A와의 대비는 성장과 이소프렌 생산의 분리를 설명하고 있다. 67.4 시간의 발효 동안 생산된 이소프렌의 전체량은 사용된 포도당 520 g으로부터 2.2 g이었다. 발효과정 동안 이소프렌을 생산하는 데 들어갔던 사용된 탄소의 몰라 수율은 0.92% 이었다.
VIII. pCL PtrcUpperMVA 및 pTrc KKDyIkIS 플라스미드를 발현하는 E. coli MG1655ack-pta 세포로부터 15-L 규모로 이소프렌 생산
상기 실시예 11, 제 I부에서 설명된 바와 같이 플레이트 상에서 자란 pCL PtrcUpperMVA 및 pTrc KKDyIkIS 플라스미드를 발현하는 대장균 MG1655ack-pta 세포는 500 mL의 트립톤-효모추출물 배지를 포함하는 플라스크 내에 접종되었고 30℃에서 160 rpm으로 진탕하면서 OD550 1.0까지 배양되었다. 본 물질은 4.5-kg의 배지를 포함하는15-L 생물반응기 내로 접종되었다. IPTG 농도는 OD550 가 10값에 도달할 때 30 μM이 되었다. 시간 경과에 따른 생물반응기 내의 OD550 프로파일은 도 66A에 나타나있다. 이소프렌 역가는 발효 과정을 통해 368 mg/L의 최종 값까지 증가되었다 (도 66B). 발효 과정을 통한 특이 생산도 프로파일은 도 66C에 나타나있고 또한 도 66A와의 대비는 성장과 이소프렌 생산의 분리를 설명하고 있다. 56.7 시간의 발효 동안 생산된 이소프렌의 전체량은 사용된 포도당 531 g으로부터 1.8 g이었다. 발효과정 동안 이소프렌을 생산하는 데 들어갔던 사용된 탄소의 몰라 수율은 0.73% 이었다.
IX. pCL PtrcUpperMVA 및 pTrc KKDyIkIS 플라스미드를 발현하는 E. coli FM5 세포로부터 15-L 규모로 이소프렌 생산
상기 실시예 11, 제 I부에서 설명된 바와 같이 플레이트 상에서 자란 pCL PtrcUpperMVA 및 pTrc KKDyIkIS 플라스미드를 발현하는 대장균 FM5 세포는 500 mL의 트립톤-효모추출물 배지를 포함하는 플라스크 내에 접종되었고 30℃에서 160 rpm으로 진탕하면서 OD550 1.0까지 배양되었다. 본 물질은 4.5-kg의 배지를 포함하는15-L 생물반응기 내로 접종되었다. IPTG 농도는 OD550 가 15값에 도달할 때 27 μM이 되었다. 시간 경과에 따른 생물반응기 내의 OD550 프로파일은 도 67A에 나타나있다. 이소프렌 역가는 발효 과정을 통해 235 mg/L의 최종 값까지 증가되었다 (도 67B). 발효 과정을 통한 특이 생산도 프로파일은 도 67C에 나타나있고 또한 도 67A와의 대비는 성장과 이소프렌 생산의 분리를 설명하고 있다. 52.3 시간의 발효 동안 생산된 이소프렌의 전체량은 사용된 포도당 948 g으로부터 1.4 g이었다. 발효과정 동안 이소프렌을 생산하는 데 들어갔던 사용된 탄소의 몰라 수율은 0.32% 이었다.
실시예
12:
메발론산
경로으로부터
나온 유전자를 발현하고 사료첨가-
회분식
배양으로 발효되는 대장균의
지수적
성장기 동안 이소프렌의 생산
실시예 12는 세포의 지수적 성장기 동안 이소프렌의 생산을 설명하고 있다.
배지 레시피 (발효 배지 리터 당):
배지는 발효 배지 리터 당 하기 성분을 사용하여 생성되었다: K2HPO4 7.5 g, MgSO4 * 7H2O 2 g, 시트르산 모노하이드레이트 2 g, 철 암모늄 시트르산 0.3 g, 효모추출물 0.5 g, 1000X 변형된 미량 금속 용액 1 ml. 모든 성분은 다같이 첨가되었고 di H2O에 녹였다. 본 용액은 고압 멸균되었다. pH는 7.0으로 암모늄 하이드록사이드 (30%)를 사용하여 조정되었고 부피는 q.s. 맞추었다. 포도당 10 g, 티아민 * HCl 0.1 g, 및 항생제가 멸균 및 pH 조정 이후에 첨가되었다.
1000X 변형된 미량 금속 용액:
1000X 변형된 미량 금속 용액은 하기 성분을 사용하여 생성되었다: 시트르산 * H2O 40 g, MnSO4 * H2O 30 g, NaCl 10 g, FeSO4 * 7H2O 1 g, CoCl2 * 6H2O 1 g, ZnSO * 7H2O 1 g, CuSO4 * 5H2O 100 mg, H3BO3 100 mg, NaMoO4 * 2H2O 100 mg. 각 성분은 한 번에 하나씩 di H2O에 녹이고, pH는 3.0으로 HCl/NaOH를 사용하여 조정한 다음 부피를 q.s. 맞추고 0.22 마이크론 필터로 여과 살균되었다.
발효는 pTrcUpperMVA 및 pTrc KKDyIkIS 플라스미드를 포함하는 기탁번호 제ATCC 11303호의 대장균 세포를 가진 15-L 생물반응기 내에서 수행되었다. 본 실험은 원하는 발효 pH 7.0 및 온도 30℃에서 포도당으로부터 이소프렌 형성을 감시하도록 수행되었다. 냉동 바이알로부터 가져온 대장균 균주의 접종액은 LB 액체배지 아가 플레이트 (항생제 첨가) 상에 뿌려졌고 37℃에서 배양되었다. 단일 콜로니가 트립톤-효모추출물 배지 내에 접종되었다. 접종액이 550 nm에서 측정되어 OD 1.0까지 된 이후에, 500 ml이 5-L 생물반응기를 접종하는 데 사용되었다.
포도당은 세포가 안정상에 도달할 때까지 지수적 속도로 첨가되었다. 이 시점 이후 포도당 첨가는 대사적 요구를 만족시키기 위해 감소되었다. 50시간의 발효과정 동안 생물반응기로 첨가된 포도당의 전체량은 2.0 kg이었다. 유도는 IPTG를 첨가하여 달성되었다. IPTG 농도는 550 nm에서 광학 밀도 (OD550)가 10값에 도달할 때 25 μM이 되었다. IPTG 농도는 OD550가 190에 도달할 때 55 μM이 되었다. 시간 경과에 따른 생물반응기 내의 OD550 프로파일은 도 99에 나타나있다. 생물반응기로부터 나온 배출기체에서 이소프렌의 수준은 본 명세서에서 기술된 바와 같이 결정된다. 이소프렌 역가는 발효 과정을 통해 1.4 g/L의 최종 값까지 증가되었다 (도 100). 50시간 발효과정 동안 생산된 이소프렌의 전체량은 10.0 g이었다. 발효 과정을 통한 특이 생산도 프로파일은 도 101에 나타나있다. 발효과정 동안 이소프렌을 생산하는 데 들어갔던 사용된 탄소의 몰라 수율은 1.1% 이었다. 포도당으로부터 이소프렌의 무게 퍼센트 수율은 0.5%이었다.
실시예
13: 발화도
모델링
및 이소프렌 테스트
I. 발화도 모델링 및 이소프렌 테스트의 요약
발화도 모델링 및 실험은 다양한 탄화수소/산소/질소/물/이산화탄소 혼합물에 대해 수행되었다. 본 모델링 및 실험적 테스트는 특정된 유량 하에서 이소프렌과 산소/질소의 발화도 곡선 및 고정된 압력과 온도에서 일산화탄소 농도를 정의하는 데 목적이 있었다. 모델 조건의 매트릭스는 표 9에 나타나있고 수행된 실험의 매트릭스는 표 5에 나타나있다. 표 9는 모델이 된 이소프렌 발화도의 요약을 나타낸다. 표 10은 이소프렌 발화도 테스트의 요약을 나타낸다.
| 시리즈 |
온도
(℃) |
압력
(psig) |
스팀 농도
(wt%) |
이산화탄소 농도
(wt. %) |
이소프렌 농도
(vol. %) |
산소 농도
(vol. %) |
| A | 40 | 0 | 0 | 0 | 다양함 | 다양함 |
| B | 40 | 0 | 4 | 0 | 다양함 | 다양함 |
| C | 40 | 0 | 0 | 5 | 다양함 | 다양함 |
| D | 40 | 0 | 0 | 10 | 다양함 | 다양함 |
| E | 40 | 0 | 0 | 15 | 다양함 | 다양함 |
| F | 40 | 0 | 0 | 20 | 다양함 | 다양함 |
| G | 40 | 0 | 0 | 30 | 다양함 | 다양함 |
| 일련 번호 |
온도
(℃) |
압력
(psig) |
스팀 농도
(vol. %) |
이소프렌 농도
(vol. %) |
산소 농도
(vol. %) |
| 1 | 40 | 0 | 0 | 다양함 | 다양함 |
| 2 | 40 | 0 | 4 | 다양함 | 다양함 |
II. 계산된 단열 발화 온도 (CAFT) 모델의 기재
연소의 전파를 위한 선택된 발화 온도와 함께 계산된 단열발화 온도 (CAFT) 가 이소프렌에 대한 발화도 경계 (envelope)를 결정하는 데 사용되었다. 본 연구에서 발화 온도를 계산하는 데 사용되는 컴퓨터 프로그램은 NASA 글렌 연구소 CEA (Chemical Equilibrium with Applications) 소프트웨어이다.
균일한 연소 기작 (연료와 산화제 둘 다가 기체 상태로 있는 지점)을 위한 단열발화 온도 모델을 사용하여 발화도 경계를 결정하는 데 관여하는 다섯 가지 단계가 있다: 원하는 반응물의 선택, 시험 조건의 선택, 한계 발화온도의 선택, 반응물의 변형, 및 계산으로부터 발화 한계의 작성.
본 첫 번째 단계에서, 원하는 반응물의 선택은 시스템에 존재하게 될 반응물의 종류 및 각각의 정량에 관하여 결정된다. 많은 경우에, 계산에 사용되는 컴퓨터 프로그램은 반응물 및 산물 종류의 리스트를 가진다. 연구될 각 종류에 대한 데이터 모두가 프로그램에서 발견되지 않는 경우라면, 그것들은 JANAF 표와 같은 기타 출처로부터 또는 인터넷으로부터 획득될 수 있다. 본 현재 모델에서, 산소, 질소, 산소 및 이산화탄소에 대한 데이타가 프로그램 데이터베이스에 존재한다. 본 프로그램 데이터베이스는 종류로 이소프렌을 가지지 않았고; 따라서 열역학적 특성은 수동으로 입력되었다.
다음 단계는 연소 공정의 초기 압력 및 온도 조건에서 일어나는 지 여부를 결정하는 것이다. 본 모델에서, 압력은 1 기압 (절대값)이었고, 온도는 이소프렌의 비등점인 40℃이었다.
연소를 위한 한계 발화 온도는 이론적인 원칙에 근거하여 선택되거나 실험적으로 결정될 수 있다. 각 방법은 그 자체 제한점을 가진다.
이전의 연구에 기초하여, 탄화수소의 한계 발화온도는 1000 K 내지 1500 K 범위에 놓여진다. 본 모델의 경우, 1500 K값이 선택되었다. 이것은 일산화탄소의 이산화탄소로의 반응 (높은 발열 반응으로 발화에너지의 유의한 부분이 된다)이 스스로 유지되는 온도이다.
일단 한계 발화온도가 결정되었던 경우라면, 모델 계산이 주어진 반응물 혼합 (종류의 농도) 상에서 수행되고 단열발화 온도가 결정된다. 발화 전파는 온도가 한계 발화온도보다 높은 경우에만 발생되었던 것으로 사료된다. 반응물 혼합 조성이 그 다음 전파 및 비전파 혼합물의 데이타 세트를 만들기 위해 변형되었다.
본 유형의 모델은 실험적으로 결정된 발화도 경계와 좋은 일치를 보여준다. 유래된 경계 외부 지역은 발화가능하지 않고 그의 내부 지역은 발화가능하다. 경계의 모양은 돌출부를 형성한다. 경계의 돌출부는 기체 상 연료에 대해 산소 농도를 제한하는 것과 관련이 있다.
III. 계산된 단열 발화 온도 (CAFT) 모델로부터 나온 결과
시리즈 A 내지 G에 대한 CAFT 모델 결과는 도 68 내지 도 74에서 좌표로 표시되었다. 도면은 계산된 단열발화 온도를 여러가지 산소/질소 비율 (무게 기준)에 대한 연료 농도 (무게 기준)의 함수로서 (NASA CEA 프로그램을 사용함) 좌표 표시된다. 선택된 한계 발화 온도인 1500 K 초과하는 곡선 부분은 발화 전파에 충분한 연료 수준을 포함한다. 결과는 도 68 내지 도 74에 나타난 형태로는 해석하는 것이 어려울 수 있다. 추가적으로, 현재의 형태는 일반적으로 부피 퍼센트로 표현된 실험적 데이터와 비교되지 않는다.
시리즈 A를 예로서 사용하여, 도 68에서의 데이터가 통상적인 발화도 경계의 형태로 좌표 표시될 수 있다. 도 68 및 1500 K온도선을 따른 종좌표 상의 결과 (reading)를 사용하여, 본 한계 발화 온도에 대한 연료 농도를 상호교차하는 각 곡선에 대한 횡좌표의 탄젠트를 대입하여 (산소 대 질소의 비율) 결정할 수 있다. 이들 값은 다시 주어진 산화제의 무게 퍼센트에 대한 연료의 무게 퍼센트로서 도표화될 수 있다 (도 75A). 그 다음 연료의 조성 (100 wt.% 이소프렌) 및 산화제의 조성 (물, 산소 및 질소의 상대적 함유량)을 알아내어 몰라 정량이 확립될 수 있다.
이들 몰라 정량으로부터 부피 백분율 농도가 계산될 수 있다. 그 다음 부피 퍼센트로 표현된 농도는 발화도 경계를 생성하도록 좌표 표시될 수 있다 (도 75B). 경계에 의해 정해진 면적은 폭발가능한 범위이고 배제된 면적은 폭발가능하지 않는 범위이다. 경계의 "노이즈"는 제한 산소 농도이다. 도 76A 및 76B는 표 69에 나타난 데이터로부터 생성된 시리즈 B의 경우에서 발화도 경계에 대한 계산된 부피 농도를 포함한다. 유사한 접근법이 도 70 내지 도 74에 나타난 데이터 상에 사용될 수 있다.
IV. 발화도 테스트 실험적 설비 및 절차
발화도 테스트는 4 리터의 고압 용기에서 시행되었다. 용기는 6" 내부 직경과 8.625"내부 높이를 가진 원통 형태이었다. 용기 (및 내부 기체)의 온도는 PID 조절기에 의해 조절되는 외부 히터를 사용하여 유지되었다. 열 소실을 막기 위하여, 세라믹 모직 및 반사적 절연이 압력 용기 주변을 둘러쌓았다. 타입 K 써모커플 (thermocouples)이 기체 공간의 온도뿐만 아니라 용기 자체의 온도를 측정하는데 사용되었다. 도 77은 테스트 용기를 묘사하고 있다.
테스트가 진행되기 이전에, 용기는 진공화되었고 이전의 테스트로부터 나온 기체 모두가 제거된 것을 보장하도록 질소로 세척되었다. 그 다음 진공이 용기 상에 당겨졌다. 본 과정이 시행된 이후에 압력은 0.06 bar(a) 주변이었다. 질소 살포로 인해, 본 초기 압력을 부여하는 기체는 질소인 것으로 가정되었다. 분압을 사용하여, 물, 이소프렌, 질소, 및 산소가 그 다음 문제가 되는 테스트 조건을 달성하도록 적절한 양으로 첨가되었다. 용기 내에 전가기적으로 작동하는 혼합팬이 기체 내용물의 혼합을 보장해주었다. 기체는 팬이 점화 대략 1분 전에 꺼지면서 약 2분 동안 혼합되도록 하였다.
점화기는 1.5 ohm 니크롬 코일 및 순환 타이머 상에 AC 전압원을 포함한다. 진동측정기 (oscilloscope)를 사용하여, 34.4 VAC이 점화기에 3.2초 동안 전달된 것이 결정되었다. 3.8 amps의 최대 전류가 점화 회로 내로 대략 절반이 발생하였다. 따라서, 최대 전력은 131 W 이었고, 점화 회로 통과 시 제공된 전체 에너지는 대략 210 J이었다.
연소 (deflagration) 데이터는 데이터 획득 시스템에 연결된 다양한 저항Validyne DP215 압력 전달기를 사용하여 획득되었다. 기체 혼합물은 압력 증가가 5% 이상이 되는 경우 급히 연소되는 것으로 생각되었다.
V. 발화도 테스트의 결과
첫 번째 일련의 실험 (시리즈 1)은 증기가 전혀 없이 40℃ 및 0 psig에서 진행되었다. 이소프렌과 산소의 다양한 농도에서 진행되는 테스트는 도 78A에 나타난 발화도 곡선을 생성하였다. 본 곡선에 나타난 데이터 값은 단지 곡선의 경계가 되는 것이다. 본 시리즈를 위해 가져온 모든 데이터 값의 상세한 리스트는 도 80A 및 80B에 나타나 있다.
도 78B는 도 78A에 나타난 폭발도 데이터 값을 정리하고 있다. 도 78C는 실험적 데이터를 CAFT 모델로 예측된 발화도 경계와 비교한 것이다. 모델은 실험적 데이터와 잘 일치하고 있다. 차이점은 테스트 체임버의 비-단열 본성과 모델의 문제점으로 인한 것일 수 있다. 모델은 산화 반응에 대해 무한한 수평적 시간을 바라보지만, 반응 역학적 제한은 전혀 고려하지 않는다.
추가적으로, 모델은 그의 데이터베이스에 있는 평형 화학적 종의 수가 제한되어 있어 열분해 종을 적절히 예측할 수 없다. 도한, 모델에 의해 개발된 발화도 경계는 제한 발화 온도 (1500K)에 대해 하나의 값을 사용한다. 제한 발화 온도는 반응하는 화학적 종에 따라 1,000K 로부터 1,500K까지 값의 범위일 수 있다. 화학량적 연료 (stoichiometric fuel)/산화제 수준 초과의 연료 농도에서 형성되는 열분해 화학적 종의 복잡한 본성은 모델이 본 시스템을 위한 상부 발화가능성 제한을 정확히 예측할 수 없는 하나의 이유가 된다.
두 번째 일련의 실험 (시리즈 2)은 4%의 고정된 증기 농도를 사용하여 40℃와 0 psig에서 진행되었다. 이소프렌과 산소의 다양한 농도에서 진행되는 테스트는 도 79A에 나타난 발화도 곡선을 생성하였다. 본 곡선에 나타난 데이터 값은 단지 곡선의 경계가 되는 것이다. 본 시리즈를 위해 가져온 모든 데이터 값의 상세한 리스트는 도 81에 나타나있다. 시리즈 1에서의 데이터 간 유사성으로 인해, 하부 발화가능성 한계, 제한 산소 농도, 및 상부 발화가능성 한계의 중요한 지점만이 테스트되었다. 테스트 혼합물에 4% 증기의 첨가는 발화도 경계의 중요한 한계 지점을 유의하게 변화시키지 않았다. 증기/물 또는 기타 불활성물의 농도가 더 높으면 발화도 경계에 영향을 줄 수 있는 것이 주목되어야 한다.
도 79B는 도 79A에 나타난 폭발도 데이터 값을 정리하고 있다. 도 79C는 실험적 데이터를 CAFT 모델로 예측된 발화도 경계와 비교한 것이다. 모델은 실험적 데이터와 잘 일치하고 있다. 차이점은 시리즈 1에서 기술된 동일한 인자로 인한 것일 수 있다.
VI. 3 기압 공기에서 이소프렌의 발화도 한계의 계산
실시예 13, 제 I 내지 제 IV부에서 기술된 방법은 또한 3 기압의 절대 시스템 압력 및 40℃에서 이소프렌의 발화도 한계를 계산하는 데 사용되었다. 이들 결과는 1기압의 절대 시스템 압력 및 40℃에서의 실시예 13, 제 I 내지 제 IV부의 것과 대비되었다. 본 더 높은 압력은 발화도 경계가 초기 시스템 압력이 증가되면서 더 크게 확장되거나 성장하기 때문에 테스트되었다. 고부 발화도 한계가 가장 많이 영향을 받고, 이어서 제한 산소 조성에 의해 영향을 받는다. 저부 발화도 한계는 가장 적게 영향을 받는다 (예를 들어, Michael G. Zabetakis 등이 기록한 "Bulletin 627 - Flammability Characteristics of Combustible Gases and Vapors", US Bureau of Mines가 발행함 (1965)을 참조하고, 이는 본 명세서에서 참고문헌으로 전부, 상세하게는 발화도 한계의 계산에 관하여 통합된다).
도 82에서, 계산된 단열 발화 온도는 전체 연료/질소/산소의 무게 퍼센트로 표현되는 이소프렌 (연료) 농도의 함수로서 좌표 표시되고, 여기에서 시스템 압력은 처음에 3기압이었다. 계산된 발화 온도는 1 기압 시스템에서 처음에 결정된 것과 매우 유사하다 (도 83). 그 결과, 발화도 경계가 계산된 발화도 데이터를 사용하여 생성될 때, 곡선은 매우 유사하다 (도 84 및 도 85를 참조하라). 따라서 이들 이론적인 계산을 근거로 하여, 1기압으로부터 3기압까지의 시스템 압력 증가는 발화도 경계의 유의한 증가/확장을 가져오지 않는다. 원하는 경우, 이들 모델 결과는 실험적 테스트를 사용하여 (본 명세서 기술된 1기압의 압력에서 실험적 테스트와 같음) 입증될 수 있다.
VII. 발화도 연구의 요약
계산된 단열 온도 모델은 이소프렌/산소/질소/물/이산화탄소 시스템의 40℃ 와 0 psig에서의 발화도 경계를 위해 개발되었다. 개발된 CAFT 모델은 본 작업에서 시행된 테스트에 의해 생성된 실험적 데이터와 잘 일치하였다. 시리즈 1 및 2로부터 나온 실험적 결과는 시리즈 A 및 B로부터 나온 모델 결과를 입증해주었다.
실시예 14: 발현 제작물 및 균주
I. 메발로네이트 키나제를 인코딩하는 플라스미드의 제작.
Methanosarcina mazei 하부 MVA 경로 (기탁번호 NC_003901.1, NC_003901.1, NC_003901.1, 및 NC_003901.1, 이들은 각각 본 명세서에서 참고문헌으로 전부 통합된다)가 대장균에서 발현을 위한 코돈 최적화를 사용하여 합성되었다. 본 제작물은 M. mazei 고대 하부 경로 오페론 (archeal Lower Pathway operon) (도 112A 내지112C; 서열번호 27)라고 명명되고 M. mazei MVK, 가정적인 탈탄산화효소, IPK, 및 IDI 효소를 인코드한다. MVK (기탁번호 NC_003901.1) 를 인코딩하는 유전자는 프라이머 MCM165 및 MCM177 (표 11)를 사용하고 제조사의 프로토콜에 따라 스트라타젠 허큘라제 II 융합 키트 (Strategene Herculase II Fusion kit)를 사용하여 어닐링 온도 550℃ 및 연장 시간 60초를 30회 반복하여 PCR 증폭되었다. 본 증폭자는 퀴아젠 PCR 컬럼을 사용하여 정제된 다음 10 mL 반응에서 PmeI (NEB 완충용액 4와 BSA 존재 시)으로 37℃에서 소화되었다. 한 시간 이후에, NsiI과 로슈 완충용액 H가 37℃에서 추가 1시간 동안 첨가되었다. 소화된 DNA는 퀴아젠 PCR 컬럼을 통해 정제되었고 유사하게 소화되고 정제된 플라스미드 MCM29 (MCM29는 쿠쥬 이소프렌 합성효소를 인코딩하는 pTrcKudzu로 형질전환된 E. coli TOP10 (Invitrogen)이다) 에 5 μL의 로슈 퀵 라이게이즈 완충용액 1, 1 μL 완충용액 2, 1 μL 플라스미드, 3 μL 증폭자, 및 1 μL 라이게이즈를 포함하는 11 μL 반응에서 결찰되었다 (상온에서 1시간). MCM 29는 pTrcKudzuKan이다. 라이게이션 반응은 인비트로겐 TOP10 세포 내로 도입되었고 형질전환체는 LA/kan50 플레이트 상에서 선별되었으며 37℃에서 하룻밤 동안 배양되었다. 그 결과 나온 플라스미드 MCM382에서 MVK 삽입물는 서열결정되었다 (도 113A 내지 113C; 서열번호 28). 표 11. 올리고뉴클레오타이드들을 나타낸다.
| MCM161 | M.mazei MVK for | CACCATGGTATCCTGTTCTGCG (서열번호 120) |
| MCM162 | M.mazei MVK rev | TTAATCTACTTTCAGACCTTGC (서열번호 121) |
| MCM165 | M.mazei MVK for w/ RBS | gcgaacgATGCATaaaggaggtaaaaaaacATGGTATCCTGTTCTGCGCCGGGTAAGATTTACCTG (서열번호 122) |
| MCM177 | M.mazei MVK rev Pst | gggcccgtttaaactttaactagactTTAATCTACTTTCAGACCTTGC (서열번호 123) |
II. 메발로네이트 키나제 및 이소프렌 합성효소를 과다 발현하는 균주의 제조
플라스미드 MCM382는 LB배지에서 중간로그기까지 자랐고 무균 얼음물에 세 번 세척하였던 MCM331 세포 (S. cerevisiae 메발로네이트 키나제, 메발로네이트 포스페이트 키나제, 메발로네이트 피로포스페이트 탈탄산화효소 및 IPP 이소머라제를 인코딩하는 염색체 제작물 gi1.2KKDyI을 포함함) 내에 형질전환되었다. 1 mL의 DNA가 50 mL의 세포 현탁액에 첨가되었고, 본 혼합물은 2 mm 큐벳에서 2.5 volts, 25 uFd로 천기천공되었고, 이어서 500 mL LB 배지로 1시간 동안 37℃에서 회복되었다. 형질전환체는 LA/kan50 상에서 선별되었고 MCM391라고 명명되었다. 플라스미드 MCM82는 본 균주 내로 동일한 전기천공 프로토콜에 의해 도입되었고 이어서 LA/kan50/spec50 상에서 선별되었다. 그 결과 나온 균주 MCM401는 cmp-표시된 염색체 제작물 gi1.2KKDyI, kan-표시된 플라스미드 MCM382, 및 spec-표시된 플라스미드 MCM82 (이는 E. faecalis mvaE 및 mvaS를 인코딩하는 pCL PtrcUpperPathway 이다)를 포함한다. 표 12는 메발로네이트 키나제 및 이소프렌 합성효소를 과다 발현하는 균주를 나타내고, 이를 참조하라.
| MCM382 | E. coli BL21 (lambdaDE3) pTrcKudzuMVK(M. mazei)GI1.2KKDyI |
| MCM391 | MCM331 pTrcKudzuMVK(M. mazei) |
| MCM401 | MCM331pTrcKudzuMVK(M.mazei)pCLPtrcUpperpathway |
| MCM396 | MCM333pTrcKudzuMVK(M. mazei) |
| MCM406 | MCM333pTrcKudzuMVK(M.mazei)pCLPtrcUpperpathway |
III. pET200D 에서의 M. mazei archeal Lower로부터 나온 플라스미드 MCM376 - MVK의 제작.
M. mazei 고대 하부 경로 오페론 (도 112A 내지 112C; 서열번호 27) 으로부터 나온 MVK ORF는 프라이머 MCM161 및 MCM162 (표 11)을 사용하고 인비트로겐 플래티넘 하이파이 PCR 믹스 (Invitrogen Platinum HiFi PCR mix)을 사용하여 PCR 증폭되었다. 45 μL의 PCR 믹스는 1 μL 주형, 1 μL의 각 10 μM 프라이머, 및 2 μL 물과 조합되었다. 반응은 하기와 같이 순환되었다: 94℃ 2:00분; 94℃ 0:30분, 55℃ 0:30분, 및 68℃ 1:15의 30회 사이클; 그 다음 72℃ 7:00분, 또한 식을 때까지 4℃. 본 PCR 반응액 3 μL이 제조사의 지침에 따라 인비트로겐 pET200D 플라스미드에 결찰되었다. 본 라이게이션의 3 μL이 인비트로겐 TOP10 세포 내로 도입되었고, 형질전환체가 LA/kan50 상에서 선별되었다. 형질전환체로부터 플라스미드는 분리되었고 삽입물는 서열결정되었으며, MCM376가 제작되었다 (도 114A 내지 114C; 서열번호 29).
V. 발현 균주 MCM378의 제조
플라스미드 MCM376는 제조사의 프로토콜에 따라 인비트로겐 BL21(DE3) pLysS 세포 내로 형질전환되었다. 형질전환체 MCM378는 LA/kan50 상에서 선별되었다.
실시예 15: 상부 메발론산 (MVA) 경로, 삽입된 하부 MVA 경로 (gi1.2KKDyI),
M. mazei
로부터 나온 메발로네이트 키나제, 및 쿠쥬로부터 나온 이소프렌 합성효소를 발현하고 20 mL 회분식 규모로 사료첨가-회분식 배양에서 자란 대장균에 의한 이소프렌의 생산
배지 레시피 (발효 배지 리터 당):
발효 배지의 각 리터는 K2HPO4 13.6 g, K2H2PO4 13.6 g, MgSO4 * 7H2O 2 g, 시트르산 모노하이드레이트 2 g, 철 암모늄 시트르산 0.3 g, (NH4)2SO4 3.2g, 효모추출물 1 g, 및 1000X 변형된 미량 금속 용액 1 ml을 포함하였다. 모든 성분은 다같이 첨가되었고 di H2O에 녹였다. pH 6.8로 암모늄 하이드록사이드 (30%)를 사용하여 조정되었고 부피를 맞추었다. 배지는 0.22 마이크론 필터로 여과 살균되었다. 포도당 (2.5 g) 및 항생제가 멸균 및 pH 조정 이후에 첨가되었다.
1000X 미량 금속 용액:
1000X 미량 금속 용액은 시트르산 * H2O 40 g, MnSO4 * H2O 30 g, NaCl 10 g, FeSO4 * 7H2O 1 g, CoCl2 * 6H2O 1 g, ZnSO * 7H2O 1 g, CuSO4 * 5H2O 100 mg, H3BO3 100 mg, NaMoO4 * 2H2O 100 mg을 포함하였다. 각 성분은 DI H2O에 한 번에 하나씩 녹이고, pH는 3.0으로 HCl/NaOH를 사용하여 조정한 다음 부피를 q.s. 맞추고 0.22 마이크론 필터로 여과 살균되었다.
균주:
MCM343 세포는 상부 메발론산 (MVA) 경로 (pCL Upper), 삽입된 하부 MVA 경로 (gi1.2KKDyI), 및 쿠쥬로부터 나온 이소프렌 합성효소 (pTrcKudzu)를 포함하는 대장균 BL21 (DE3) 세포이다.
MCM401 세포는 상부 메발론산 (MVA) 경로 (pCL PtrcUpperPathway), 삽입된 하부 MVA 경로 (gi1.2KKDyI), M. mazei로부터 나온 메발로네이트 키나제의 높은 발현 및 쿠쥬로부터 나온 이소프렌 합성효소 (pTrcKudzuMVK(M.mazei))를 포함하는 대장균 BL21 (DE3) 세포이다.
이소프렌 생산은 균주를 20 mL의 작동 부피를 가지는100 mL 생물반응기로 30℃에서 성장시켜서 분석되었다. 냉동 바이알로부터 가져온E. coli 균주의 접종액은 LB 액체배지 아가 플레이트 (항생제 포함) 상에 뿌려졌고 30℃에서 배양되었다. 단일 콜로니는 배지에 접종되었고 하룻밤 동안 배양되었다. 박테리아는 550 nm에서 측정된 광학밀도가 0.05에 도달하도록 20 mL 배지 내로 희석되었다. 100 mL 생물반응기가 밀봉되었고, 공기가 8 mL/분 속도로 주입되었다. 배지의 적당한 교반이 자기 막대를 사용하여 600 rpm으로 교반하여 시행되었다. 생물반응기로부터 나온 배출-기체가 온라인 Hiden HPR-20 질량 분광측정기를 사용하여 분석되었다. 이소프렌, CO2, 및 공기에서 자연적으로 발생하는 기타 기체에 해당하는 질량이 감시되었다. 축적된 이소프렌과 CO2의 생산이 시간 경과에 따른 각 기체의 농도 (퍼센트)를 합하여 계산되었다. 대기 CO2가 대사적 활성으로 인해 방출되는 CO2를 평가하기 위해 전체로부터 차감되었다.
전체 메발론산 경로 및 쿠쥬 이소프렌 합성효소 (MCM343)를 발현하는 균주로부터 이소프렌 생산이 100 mL 생물반응기에서 추가적으로 M. mazei로부터 나온 MVK및 쿠쥬 이소프렌 합성효소 (MCM401)를 과다 발현하는 균주와 대비되었다. 박테리아는 탄소원으로서 포도당을 가진 정의된 배지에서 동일한 조건 하에서 성장시켰다. 이소프렌 생산의 유도는 이소프로필-베타-D-1-티오갈락토피라노사이드 (IPTG)를 100 μM 또는 200 μM의 최종 농도로 첨가하여 달성되었다. 배출-기체 측정은 MVK 및 이소프렌 합성효소 (MCM401) 둘 다를 과다 발현하는 균주가 도 115A 내지 115D에서 나타난 바와 같이 메발론산과 쿠쥬 이소프렌 합성효소 (MCM343)만을 발현하는 균주에 비해 이소프렌을 유의하게 더 많이 생산하였던 것을 보여주었다. 100 μM 유도에서, MCM401 균주는 MCM343 균주에 비해 3.4배 더 많은 이소프렌을 생산하였다. 대사적 활성의 척도이기도 한 생물반응기로부터 나온 배출-기체에서 CO2 분석은 대사적 활성이 IPTG 유도 및 이소프렌 생산과는 독립적이었던 것을 보여준다.
실시예 16: 상부 메발론산 (MVA) 경로, 삽입된 하부 MVA 경로 (gi1.2KKDyI),
M. mazei
로부터 나온 메발로네이트 키나제, 및 쿠쥬로부터 나온 이소프렌 합성효소를 발현하고 15-L 규모로 사료첨가-회분식 배양에서 자란 대장균에 의한 이소프렌의 생산
배지 레시피 (발효 배지 리터 당):
발효 배지의 각 리터는 K2HPO4 7.5 g, K2H2PO4 7.5 g, MgSO4 * 7H2O 2 g, 시트르산 모노하이드레이트 2 g, 철 암모늄 시트르산 0.3 g, 효모추출물 0.5 g, 1000X 변형된 미량 금속 용액1 ml을 포함하였다. 모든 성분은 다같이 첨가되었고 di H2O에 녹였다. 본 용액은 고압 멸균되었다. pH는 7.0으로 암모늄 하이드록사이드 (30%)를 사용하여 조정되었고 부피는 q.s. 맞추었다. 포도당 10 g, 티아민 * HCl 0.1 g, 및 항생제가 멸균 및 pH 조정 이후에 첨가되었다.
1000X 변형된 미량 금속 용액:
1000X 변형된 미량 금속 용액은 시트르산 * H2O 40 g, MnSO4 * H2O 30 g, NaCl 10 g, FeSO4 * 7H2O 1 g, CoCl2 * 6H2O 1 g, ZnSO * 7H2O 1 g, CuSO4 * 5H2O 100 mg, H3BO3 100 mg, NaMoO4 * 2H2O 100 mg을 포함하였다. 각 성분은 한 번에 하나씩 DIH2O에 녹이고, pH는 3.0으로 HCl/NaOH를 사용하여 조정한 다음 부피를 q.s. 맞추고 0.22 마이크론 필터로 여과 멸균되었다.
발효는 상부 메발론산 (MVA) 경로 (E. faecalis mvaE 및 mvaS를 인코딩하는 pCL PtrcUpperPathway), 삽입된 하부 MVA 경로 (S. cerevisiae 메발로네이트 키나제, 메발로네이트 포스페이트 키나제, 메발로네이트 피로포스페이트 탈탄산화효소, 및 IPP 이소머라제를 인코딩하는gi1.2KKDyI), M. mazei로부터 나온 메발로네이트 키나제의 높은 발현 및 쿠쥬로부터 나온 이소프렌 합성효소 (pTrcKudzuMVK(M.mazei))를 포함하는 대장균 BL21 (DE3) 세포를 사용하여 15-L 생물반응기에서 수행되었다. 본 실험은 원하는 발효 pH 7.0 및 온도 30℃에서 포도당으로부터 이소프렌 형성을 감시하도록 수행되었다. 냉동 바이알로부터 가져온 대장균 균주의 접종액은 LB 액체배지 아가 플레이트 (항생제 첨가) 상에 뿌려졌고 37℃에서 배양되었다. 단일 콜로니가 트립톤-효모추출물 배지 내에 접종되었다. 접종액이 550 nm에서 측정되어 OD 1.0까지 된 이후에, 500 mL 이 15-L 생물반응기에서 5 L의 배지를 접종하는 데 사용되었다.
포도당은 세포가 안정상에 도달할 때까지 지수적 속도로 첨가되었다. 이 시점 이후 포도당 첨가는 대사적 요구를 만족시키기 위해 감소되었다. 68시간 발효 동안 생물반응기로 운반된 포도당의 전체 양은 3.8 kg이었다. 유도는 이소프로필-베타-D-1-티오갈락토피라노사이드 (IPTG)를 첨가하여 달성되었다. IPTG 농도는 광학 밀도가 550 nm (OD550)에서 수치 9에 도달할 때 51 μM가 되었다. IPTG 농도는 OD550이 149에 도달할 때 88 uM로 올라갔다. 추가적인 IPTG 첨가는 농도를 OD550=195에서 119 μM또한 OD550=210에서 210 μM까지 올렸다. 시간 경과에 따른 생물반응기의 OD550 프로파일은 도 116에 나타나있다. 생물반응기로부터 나온 배출기체에서 이소프렌 수준은 하이덴 (Hiden) 질량 분광측정기를 사용하여 결정되었다. 이소프렌의 역가는 발효 과정을 통해 23.8 g/L의 최종 값까지 증가되었다 (도 117). 68시간의 발효과정 동안 생산된 이소프렌의 전체 양은 227.2 g이었고, 생산의 시간 과정은 도 118에 나타나있다. 대사적 활성 프로파일은 TCER에 의해 측정된 바와 같이 도 119에 나타나있다. 전체 생존가능한 수 (전체 콜로니 형성 단위)는 발효 10 및 39시간 사이에서 두 배 정도 감소되었다 (도 120). 발효 동안 이소프렌을 생산하는 데 들어갔던 사용된 탄소의 몰라 수율은 13.0% 이었다. 포도당으로부터 나온 이소프렌의 무게 퍼센트 수율은 6.3%이었다.
실시예 17: 상부 메발론산 (MVA) 경로, 삽입된 하부 MVA 경로 (gi1.2KKDyI),
M. mazei
로부터 나온 메발로네이트 키나제, 및 쿠쥬로부터 나온 이소프렌 합성효소를 발현하고 15-L 규모로 사료첨가-회분식 배양에서 자란 대장균에 의한 이소프렌의 생산 (2x 100μM IPTG 유도)
배지 레시피 (발효 배지 리터 당):
발효 배지의 각 리터는 K2HPO4 7.5 g, MgSO4 * 7H2O 2 g, 시트르산 모노하이드레이트 2 g, 철 암모늄 시트르산 0.3 g, 효모추출물 0.5 g, 1000X 변형된 미량 금속 용액1 ml을 포함하였다. 모든 성분은 다같이 첨가되었고 diH2O에 녹였다. 본 용액은 고압멸균되었다. pH는 7.0으로 암모늄 하이드록사이드 (30%)를 사용하여 조정되었고 부피는 q.s. 맞추었다. 포도당 10 g, 티아민 * HCl 0.1 g, 및 항생제가 멸균 및 pH 조정 이후에 첨가되었다.
1000X 변형된 미량 금속 용액:
1000X 변형된 미량 금속 용액은 시트르산 * H2O 40 g, MnSO4 * H2O 30 g, NaCl 10 g, FeSO4 * 7H2O 1 g, CoCl2 * 6H2O 1 g, ZnSO * 7H2O 1 g, CuSO4 * 5H2O 100 mg, H3BO3 100 mg, NaMoO4 * 2H2O 100 mg을 포함하였다. 각 성분은 한 번에 하나씩 DIH2O에 녹이고, pH는 3.0으로 HCl/NaOH를 사용하여 조정한 다음 부피를 q.s. 맞추고 0.22 마이크론 필터로 여과 멸균되었다.
발효는 상부 메발론산 (MVA) 경로 (E. faecalis mvaE 및 mvaS를 인코딩하는pCL PtrcUpperPathway), 삽입된 하부 MVA 경로 (S. cerevisiae 메발로네이트 키나제, 메발로네이트 포스페이트 키나제, 메발로네이트 피로포스페이트 탈탄산화효소, 및 IPP 이소머라제를 인코딩하는gi1.2KKDyI), M. mazei로부터 나온 메발로네이트 키나제의 높은 발현 및 쿠쥬로부터 나온 이소프렌 합성효소 (pTrcKudzuMVK(M.mazei))를 포함하는 대장균 BL21 (DE3) 세포를 사용하여 15-L 생물반응기에서 수행되었다. 본 실험은 원하는 발효 pH 7.0 및 온도 30℃에서 포도당으로부터 이소프렌 형성을 감시하도록 수행되었다. 냉동 바이알로부터 가져온 대장균 균주의 접종액은 LB 액체배지 아가 플레이트 (항생제 첨가) 상에 뿌려졌고 37℃에서 배양되었다. 단일 콜로니가 트립톤-효모추출물 배지 내에 접종되었다. 접종액이 550 nm에서 측정되어 OD 1.0까지 된 이후에, 500 mL 이 15-L 생물반응기에서 5 L의 배지를 접종하는 데 사용되었다.
포도당은 세포가 안정상에 도달할 때까지 지수적 속도로 첨가되었다. 이 시간 이후 포도당 첨가는 대사적 요구를 만족시키기 위해 감소되었다. 55시간의 발효과정 동안 생물반응기로 운반된 포도당의 전체 양은 1.9 kg이었다. 유도는 이소프로필-베타-D-1-티오갈락토피라노사이드 (IPTG)를 첨가하여 달성되었다. IPTG 농도는 광학 밀도가 550 nm (OD550)에서 수치 9에 도달할 때 111 μM가 되었다. IPTG 농도는 OD550이 155에 도달할 때 193 μM로 올라갔다. 시간 경과에 따른 생물반응기의 OD550 프로파일은 도 121에 나타나있다. 생물반응기로부터 나온 배출기체에서 이소프렌 수준은 하이덴 질량 분광측정기를 사용하여 결정되었다. 이소프렌의 역가는 발효 과정을 통해 19.5 g/L의 최종 값까지 증가되었다 (도 122). 55시간의 발효과정 동안 생산된 이소프렌의 전체 양은 133.8 g이었고, 생산의 시간 과정은 도 123에 나타나있다. 일시적인 부피측정 생산도 수준은 1.5 g/이소프렌/L 액체배지/시간 정도에 도달하였다 (도 124). 일시적인 수율 수준은 17.7% 정도에 도달하였다 (도 125). 대사적 활성 프로파일은 TCER에 의해 측정된 바와 같이 도 126에 나타나있다. 전체 생존가능한 수 (전체 콜로니 형성 단위)는 발효 8 및 36시간 사이에서 두 배 정도 감소되었다 (도 127). 발효 과정 동안 이소프렌을 생산하는 데 들어갔던 사용된 탄소의 몰라 수율은 15.8% 이었다. 전체 발효과정에 따른 포도당으로부터 나온 이소프렌의 무게 퍼센트 수율은 7.4%이었다.
또한 대조군으로서, 발효가 상부 메발론산 (MVA) 경로 (E. faecalis mvaE 및 mvaS를 인코딩하는pCL PtrcUpperPathway), 삽입된 하부 MVA 경로 (S. cerevisiae 메발로네이트 키나제, 메발로네이트 포스페이트 키나제, 메발로네이트 피로포스페이트 탈탄산화효소, 및 IPP 이소머라제를 인코딩하는gi1.2KKDyI), M. mazei로부터 나온 메발로네이트 키나제의 높은 발현 및 쿠쥬로부터 나온 이소프렌 합성효소 (pTrcKudzuMVK(M.mazei))를 포함하는 대장균 BL21 (DE3) 세포를 사용하여 15-L 생물반응기에서 수행되었다. 본 실험은 원하는 발효 pH 7.0 및 온도 30℃에서 포도당으로부터 CER에 의해 측정되는 바와 같이 유도되지 않은 세포 대사 활성을 감시하도록 수행되었다. 냉동 바이알로부터 가져온 대장균 균주 (상기에서 기술된 MCM401)의 접종액은 LB 액체배지 아가 플레이트 (항생제 첨가) 상에 뿌려졌고 37℃에서 배양되었다. 단일 콜로니가 트립톤-효모추출물 배지 내에 접종되었다. 접종액이 550 nm에서 측정되어 OD 1.0까지 된 이후에, 500 mL이 15-L 생물반응기에서 5 L의 배지를 접종하는 데 사용되었다. 포도당은 세포가 안정상에 도달할 때까지 지수적 속도로 첨가되었다. 이 시간 이후에는 포도당 첨가가 대사적 요구를 만족시키기 위해 감소되었다.
도 148은 상기에 기술된 유도되지 않은 세포 및 이소프로필-베타-D-1-티오갈락토피라노사이드 (IPTG)에 의해 유도된 세포에 대한 CER 프로파일을 실시예 16 및 실시예 17에서 비교한 것이다.
실시예 18: 상부 메발론산 (MVA) 경로, 삽입된 하부 MVA 경로 (gi1.2KKDyI),
M. mazei
로부터 나온 메발로네이트 키나제, 및 쿠쥬로부터 나온 이소프렌 합성효소를 발현하고 15-L 규모로 사료첨가-회분식 배양에서 자란 대장균에 의한 이소프렌의 생산 (1x 50μM IPTG + 150μM IPTG 첨가 유도)
배지 레시피 (발효 배지 리터 당):
발효 배지의 각 리터는 K2HPO4 7.5 g, MgSO4 * 7H2O 2 g, 시트르산 모노하이드레이트 2 g, 철 암모늄 시트르산 0.3 g, 효모추출물 0.5 g, 1000X 변형된 미량 금속 용액1 ml을 포함하였다. 모든 성분은 다같이 첨가되었고 diH2O에 녹였다. 본 용액은 고압 멸균되었다. pH는 7.0으로 암모늄 하이드록사이드 (30%)를 사용하여 조정되었고 부피는 q.s. 맞추었다. 포도당 10 g, 티아민 * HCl 0.1 g, 및 항생제가 멸균 및 pH 조정 이후에 첨가되었다.
1000X 변형된 미량 금속 용액:
1000X 변형된 미량 금속 용액은 시트르산 * H2O 40 g, MnSO4 * H2O 30 g, NaCl 10 g, FeSO4 * 7H2O 1 g, CoCl2 * 6H2O 1 g, ZnSO * 7H2O 1 g, CuSO4 * 5H2O 100 mg, H3BO3 100 mg, NaMoO4 * 2H2O 100 mg을 포함하였다. 각 성분은 한 번에 하나씩 DIH2O에 녹이고, pH는 3.0으로 HCl/NaOH를 사용하여 조정한 다음 부피를 q.s. 맞추고 0.22 마이크론 필터로 여과 멸균되었다.
발효는 상부 메발론산 (MVA) 경로 (E. faecalis mvaE 및 mvaS를 인코딩하는pCL PtrcUpperPathway), 삽입된 하부 MVA 경로 (S. cerevisiae 메발로네이트 키나제, 메발로네이트 포스페이트 키나제, 메발로네이트 피로포스페이트 탈탄산화효소, 및 IPP 이소머라제를 인코딩하는gi1.2KKDyI), M. mazei로부터 나온 메발로네이트 키나제의 높은 발현 및 쿠쥬로부터 나온 이소프렌 합성효소 (pTrcKudzuMVK(M.mazei))를 포함하는 대장균 BL21 (DE3) 세포를 사용하여 15-L 생물반응기에서 수행되었다. 본 실험은 원하는 발효 pH 7.0 및 온도 30℃에서 포도당으로부터 이소프렌 형성을 감시하도록 수행되었다. 냉동 바이알로부터 가져온 대장균 균주의 접종액은 LB 액체배지 아가 플레이트 (항생제 첨가) 상에 뿌려졌고 37℃에서 배양되었다. 단일 콜로니가 트립톤-효모추출물 배지 내에 접종되었다. 접종액이 550 nm에서 측정되어 OD 1.0까지 된 이후에, 500 mL이 15-L 생물반응기에서 5 L의 배지를 접종하는 데 사용되었다.
포도당은 세포가 안정상에 도달할 때까지 지수적 속도로 첨가되었다. 이 시간 이후 포도당 첨가는 대사적 요구를 만족시키기 위해 감소되었다. 55시간 발효과정 동안 생물반응기로 운반된 포도당의 전체 양은 1.9 kg이었다. 유도는 이소프로필-베타-D-1-티오갈락토피라노사이드 (IPTG)를 첨가하여 달성되었다. IPTG 농도는 광학 밀도가 550 nm (OD550)에서 수치 10에 도달할 때 51 μM이 되었다. IPTG 스파이크에 덧붙여, OD550 = 10일 때 일정한 첨가가 시작되었고 18시간 경과에 따라 164 mg의 IPTG가 전달되었다. 시간 경과에 따른 생물반응기 내의 OD550 프로파일은 도 128에 나타나있다. 생물반응기로부터 나온 배출기체에서 이소프렌 수준은 하이덴 질량 분광측정기를 사용하여 결정되었다. 이소프렌의 역가는 발효 과정을 통해 22.0 g/L의 최종 값까지 증가되었다 (도 129). 55시간의 발효과정 동안 생산된 이소프렌의 전체 양은 170.5 g이었고, 생산의 시간 과정은 도 130에 나타나있다. 대사적 활성 프로파일은 TCER에 의해 측정된 바와 같이 도 131에 나타나있다. 생물반응기로의 공기유동이 약 1.7시간의 기간 동안 8 slpm으로부터 4 slpm까지 감소되었을 때, 배출기체에서 이소프렌의 농도는 0.51로부터 0.92 w/w%까지 증가하였다 (도 132). 이들 이소프렌의 오른 수준은 전체 이산화탄소 발생율 (TCER)에 의해 측정된 바와 같이 TCER이 37.2 및 39.3 시간 사이에서 단지 7%가 내려갔기 때문에 세포 대사적 활성에 부정적 영향을 주는 것으로 보이지는 않았다 (도 132). 전체 생존가능한 수 (전체 콜로니 형성 단위)는 발효 7 및 36시간 사이에서 두 배 정도 감소되었다 (도 133). 발효 과정 동안 이소프렌을 생산하는 데 들어갔던 사용된 탄소의 몰라 수율은 16.6% 이었다. 전체 발효과정에 따른 포도당으로부터 나온 이소프렌의 무게 퍼센트 수율은 7.7%이었다.
실시예 19: 1-L 규모로 사료첨가-회분식 배양에서 자란 야생형 대장균에 미치는 외부적으로 첨가된 이소프렌의 효과
배지 레시피 (발효 배지 리터 당):
발효 배지의 각 리터는 K2HPO4 7.5 g, MgSO4 * 7H2O 2 g, 시트르산 모노하이드레이트 2 g, 철 암모늄 시트르산 0.3 g, 효모추출물 0.5 g, 1000X 변형된 미량 금속 용액1 ml을 포함하였다. 모든 성분은 다같이 첨가되었고 diH2O에 녹였다. 본 용액은 고압 멸균되었다. pH는 7.0으로 암모늄 하이드록사이드 (30%)를 사용하여 조정되었고 부피는 q.s. 맞추었다. 포도당 10 g, 티아민 * HCl 0.1 g, 및 항생제가 멸균 및 pH 조정 이후에 첨가되었다.
1000X 변형된 미량 금속 용액:
1000X 변형된 미량 금속 용액은 시트르산 * H2O 40 g, MnSO4 * H2O 30 g, NaCl 10 g, FeSO4 * 7H2O 1 g, CoCl2 * 6H2O 1 g, ZnSO * 7H2O 1 g, CuSO4 * 5H2O 100 mg, H3BO3 100 mg, NaMoO4 * 2H2O 100 mg을 포함하였다. 각 성분은 한 번에 하나씩 DIH2O에 녹이고, pH는 3.0으로 HCl/NaOH를 사용하여 조정한 다음 부피를 q.s. 맞추고 0.22 마이크론 필터로 여과 멸균되었다.
발효는 대장균 BL21 (DE3) 세포를 사용하여 1-L 생물반응기에서 수행되었다. 본 실험은 원하는 발효 pH 7.0 및 온도 30℃에서 포도당 첨가-회분식 생물반응기에서 세포 생존도 및 대사적 활성에 미치는 이소프렌의 효과를 감시하도록 수행되었다. 냉동 바이알로부터 가져온 대장균 균주의 접종액은 트립톤-효모추출물 배지 내에 접종되었다. 접종액이 550 nm에서 측정되어 OD 1.0까지 된 이후에, 50 mL 이 1-L 생물반응기에서 0.5 L의 배지를 접종하는 데 사용되었다.
포도당은 세포가 안정상에 도달할 때까지 지수적 속도로 첨가되었다. 이 시간 이후 포도당 첨가는 대사적 요구를 만족시키기 위해 감소되었다. 이소프렌은 질소 기체를 운반체로 사용하여 생물반응기 내로 첨가되었다. 이소프렌 첨가의 속도는 중간-성장기 동안 (OD550 = 31-33) 1g/L/시간이었고 전체 75분 (13.2 내지 14.4 시간) 동안 지속되었다. 시간 경과에 따른 생물반응기 내의 OD550 프로파일은 도 134에 나타나있다. 대사적 활성 프로파일은 TCER에 의해 측정된 바와 같이 도 135에 나타나있다. 전체 생존가능한 수 (전체 콜로니 형성 단위)는 이소프렌이 생물반응기 내로 도입되는 기간 동안 14배 정도 증가되었다 (도 136).
실시예 20:
Saccharomyces cerevisiae
에 의한 이소프렌의 생산 및 이소프렌 합성효소의 발현
쿠쥬 이소프렌 합성효소는 하이브리드 Saccharomyces cerevisiae/Pichia pastoris 코돈 사용 표에 따라 발현을 위해 최적화되었고, 합성되었으며 또한 pDONR221:19430 (DNA 2.0에 의함, 지도는 도 140 또한 서열 (서열번호 38)은 도 141) 내에 클론되었다. 게이트웨이®클로닝 (Invitrogen) 반응이 제조사의 프로토콜에 따라 수행되었다: pDONR221:19430는 "침입 (entry)" 벡터이기 때문에, LR 클로나제 II 효소 (LR 반응)가 코돈-최적화된 이소프렌 합성효소를 "최종 목적 (destination)" 벡터 pYES-DEST52 (Invitrogen) 내로 도입하는 데 사용되었다.
LR 반응은 다시 제조사의 지침에 따라 화학적으로 능력있는 Top10 세포 (Invitrogen) 내로 형질전환되었고, 이소프렌 합성효소 ORF 를 가지는 pYES-DEST52 플라스미드를 보유하는 박테리아는 50 mg/ml의 카베니실린을 포함하는 LA 플레이트 상에서 선별되었다. 개별 양성 형질전환체는 T7 전방 프라이머 및 효모 이소프렌 합성효소-Rev2 프라이머와 함께 (표 13을 참조하라) 일러스트라-PuReTaq 레디-투-고TM PCR (illustra PuReTaq Ready-To-GoTM PCR) 비드 (GE 헬스케어)를 사용한 콜로니 PCR (하기 프라이머 농도 및 열순환 매개변수를 참조하라)에 의해 테스트되었다. 표 13. 이소프렌 합성효소를 증폭하기 위한 프라이머 서열을 나타낸다.
| 프라이머 명칭 | 서열 (5' 내지 3') | 목적 |
| 효모 HGS -For2 |
CACCAAAGACTTCATAGACT
(서열번호 124) |
최적화된 효모 이소프렌 합성효소를 위한 전방 프라이머 |
| 효모HGS -Rev2 |
AGAGATATCTTCCTGCTGCT
(서열번호 125) |
최적화된 효모 이소프렌 합성효소를 위한 역방 프라이머 |
| T7 전방 |
TAATACGACTCACTATAGGG
(서열번호 126) |
PCR 및 서열결정 프라이머 |
정확한 크기 (1354 bp)의 PCR 단편을 수득한 플라스미드는 미니프렙 (Qiagen)에 의해 정제되었고 T7 전방 프라이머 및 효모 이소프렌 합성효소-Rev2 프라이머 (표 13을 참조하라)를 사용한 서열결정 (Quintara Biosciences, Berkeley, CA)을 위해 위탁되었다. 서열결정으로부터 나온 결과는 pDONR221:19430의 기지의 서열과 대비되었고 (벡터 NTI 소프트웨어를 사용함, Invitrogen),단일 플라스미드, pDW14가 심화 연구를 위해 선별되었다 (지도는 도 142A 또한 완전한 서열은 도 142B 및 142C (서열번호 39)). pDW14의 서열은 단일 뉴클레오타이드에 의해 (도 142B에서 굵게 표시됨) pDONR221:19430와는 달라졌다. 단일 뉴클레오타이드 변화 (G에서 A로)는 라이신-인코딩 코돈의 세 번째 위치이기 때문에 ORF에 변화를 가져오지는 못하였다.
정제된 pDW14는 S. c. EasyComp 형질전환 키트 (Invitrogen)를 사용하여 Saccharomyces cerevisiae 균주 INVSc-1에 형질전환되었다. pDW14 또는 pYES-DEST52 (천연 그대로인 URA3 유전자를 포함함)를 보유하는 INVSc-1 균주는 pYES-DEST52 게이트웨이 벡터 매뉴얼 (Invitrogen)에 기술된 바와 같이 2% 포도당을 가진 SC 최소 배지 상에서 우라실 없이 유지되었다. pDW14를 포함하는 INVSc-1의 두 개 독립적인 분리물과 pYES-DEST52를 가진 단일 대조군 균주가 심화 연구를 위해 선택되었다.
이소프렌 합성효소 발현을 유도하기 위하여, 배양은 액체 SC 최소 배지에서 하룻밤 동안 성장되었다. 그 다음 배양은 대략 0.2의 OD600으로 희석되었으며 2-3시간 동안 성장되었다. 배양액은 원심분리되었고 한 번 세척되었으며 우라실 없이 1% 라피노스, 2% 갈락토스를 가진 동일한 부피 (10 ml)의 SC 최소 배지에 재현탁하였다. 균주의 OD600가 결정되었고 (도 144A), 균주가 원심분리에 의해 수확되었으며 2 ml의 용해 완충용액 (50% 글리세롤과 PEB pH 7.4의 1 : 1 혼합액 : 트리스 염기 2.423 g/L, MgCl2 (무수형) 1.904 g/L, KCl 14.910 g/L, DTT 0.154 g/L, 글리세롤 50 mL/L)에 재현탁하였다.
용해 혼합물은 프렌치 프레스기를 세 번 통과시켰고, 용출물은 SDS-PAGE에 의해 분석되었다. 쿠마시 (Coomassie) 젤 분석을 위해 (도 143A), 시료를 환원제를 가진 2X SDS 로딩 완충용액으로 1 : 1로 희석시켰고, 4 - 12% 비스-트리스 젤 상에 로딩하였으며 (20 ml 전체 부피), MES 완충용액에서 진행시켰고, 제조사의 프로토콜에 따라 (Invitrogen Novex 시스템) 심플리블루 세이프스테인 (Simply Blue SafeStain)을 사용하여 염색하였다.
웨스턴브리즈 키트 (WesternBreeze kit, Invitrogen)가 트랜스퍼와 나이트로셀룰로스 막 상에 이소프렌 합성효소의 발색 검출을 위해 사용되었다. 일차 항체는 인비트로겐 항체 희석제에서 1 : 1000으로 10주 희석된 1799A이었다. 일차 항체 결합에 이어서 Alexa Fluor 488 (Invitrogen 카탈로그 번호 A-11008)로 표지된 이차 항체로 정량적 신호 결정을 가능하도록 현상되었다. 웨스턴 블럿 절차는 인비트로겐에 의해 기술된 바와 같이 수행되었다. 형광 신호는 블루필터 설정 (blue filter setting)을 사용하여 분자 다이나믹스 스톰 (Molecular Dynamics Storm) 기기에서 기록되었고 분자 다이나믹스 영상측정 (Molecular Dynamics ImageQuant) 영상 분석 소프트웨어 패키지를 사용하여 정량적으로 분석되었다. 라이브러리 구성원의 특이 활성이 유도 배양액의 A60 또는 웨스턴 블럿에 의해 결정된 이소프렌 합성효소 단백질 농도 둘 중 하나로 나눈 생산된 이소프렌량의 비율로부터 계산되었다. 도 143B는 이소프렌 합성효소가 pYES-DEST52을 보유하는 대조군과 대비하여 (레인 1), pDW14를 보유하는 유도된 INVSc-1 균주에 존재하는 것 (레인 2 및 레인 3)을 보여준다.
이소프렌 합성효소 상부공간에 대한 DMAPP 분석법은 각 균주로부터 나온 25 mL 의 용출물 상에서 수행되었고, 5 mL 1 M MgCl2, 5 mL 100 mM DMAPP, 및 65 mL 50 mM 트리스 pH 8가 첨가되었다. 반응은 30℃에서 15분 동안 기체가 가득찬 1.8 mL GC 튜브에서 수행되었다. 반응은 100 μL의 250 mM EDTA pH 8의 첨가에 의해 정지되었다. 도 144B는 pDW14를 보유하는 유도된 균주의 특이 활성값 (mg HG/L/OD)을 대조군과 대비하여 보여주었다. pDW14를 보유하는 유도된 균주는 이소프렌 합성효소가 없는 대조군보다 대략 20X 더 높은 활성을 나타내었다.
PCR 순환 매개변수
일러스트라 PuReTaq 레디-투-고TM PCR 비드 (GE Healthcare)가 각각 25 ml 전체 부피/반응에서 0.4 mM 농도인 올리고뉴클레오타이드 프라이머쌍과 함께 사용되었다. LR 클로나제 반응 (Invitrogen)으로부터 나온 플라스미드의 분석을 위해, 선별 플레이트 상의 개별적 콜로니로부터 나온 적은 양의 박테리아가 상기 기술된 PCR 믹스를 포함하는 각 튜브에 첨가되었다. 반응 사이클은 다음과 같다: 1) 95℃ 4분; 2) 95℃ 20초; 3) 52℃ 20초; 4) 72℃ 30초; 2) 내지 4) 단계의 5회 사이클 반복; 5) 95℃ 20초; 6) 55℃ 20초; 7) 72℃ 30초; 5) 내지 7) 단계의 25회 사이클 반복; 72℃ 10분, 또한 식을 때까지 4℃ .
실시예 21:
슈도모나스
및 기타 그램 음성 박테리아에서 이소프렌의 생산
pBBR5HGSOpt2_2의 제작,
슈도모나스
에서 접합 및 이소프렌 합성효소 활성의 측정
푸엘라리아 로바타 (Pueraria lobata, Kudzu 식물)로부터 나온 이소프렌 합성효소를 인코딩하는 유전자는 관심있는 서로 다른 미생물 종에 코돈-최적화되었고 (표 14; fluo-opt2v2는 선택된 서열이었음) DNA2.0, Menlo Park, CA에 의해 합성되었다. fluo-opt2v2의 지도와 서열은 도 145A 및 145B (서열번호 40)에서 확인할 수 있다. HindIII및 BamHI 제한효소 부위가 용이한 클로닝을 위해 합성된 서열에 첨가되었고, RBS가 전사를 증진시키도록 ATG 앞에 첨가되었다.
푸엘라리아 로바타로부터 나온 코돈-최적화된 이소프렌 합성효소의 서로 다른 버전에서 희귀 코돈의 수는 미생물 종의 함수이다. 여러 번의 최적화 과정은 관심있는 종 모두에서 희귀 코돈이 전혀 없는 유전자를 유도하였다.
표 14는 희귀 코돈의 수를 나타낸다.
| 생물 | fluo-opt1 (quote) | fluo-opt2 | fluo-opt3 | E. coli opt | fluo-opt2v2 |
| Pseudomonas fluorescens Pf-5 | 19 | X | X | 57 | 0 |
| Phodopseudomonas palustris CGA009 | 37 | 13 | 3 | 74 | 0 |
| Pseudomonas putida F1 | 0 | 0 | 0 | 29 | 0 |
| Corynebacterium glutamicum (ATCC) | 4 (Ser) | 0 | 0 | 0 | 0 |
| Pseudomonas fluorescens PfO-1 | 1 (Val) | 0 | 0 | 57 | 0 |
유전자는 클로닝 벡터에서 DNA2.0에 의해 제공된다. 벡터는 HindIII/BamHI로 소화되었고, 관심있는 삽입물에 해당하는 밴드가 젤-정제되었으며, HindIII/BamHI-소화된 pBBR1MCS5 (Kovach et al, Gene 166:175-176, 1995, 이는 본 명세서에서 참고문헌으로 전부, 상세하게는 pBBR1MCS5에 관하여 통합되어 있다)와 결찰되었다 (지도는 도 146A 및 서열은 도 146B 및 146C (서열번호 41)). 그 결과 이것은 이소프렌 합성효소가 pBBR1MCS5에 표현되는 lac 프로모터로부터 발현되는 플라스미드 pBBR5HGSOpt2_2 (지도는 도147A 및 서열은 도 147B 및 147C (서열번호 42))가 되었다.
벡터는 E. coli S17-1에 형질전환되었고 Pseudomonas putida F1 ATCC700007 및 Pseudomonas fluorescens ATCC 13525와 메이팅되었다. LB 상에서 결합 이후에, 플라스미드를-보유하는 슈도모나스 균주에 대한 선별이 M9 + 16 mM 소듐 사이트레이트 + 젠타마이신 50 ug/ml 상에서 시행되었다. 따라서 생성된 균주에서 플라스미드의 존재는 퀴아젠 키트 (Valencia, CA)를 사용한 플라스미드의 제조에 의해 검토될 수 있다.
재조합 균 주P. putida, pBBR5HGSOpt2_2 및 P. fluorescens, pBBR5HGSOpt2_2의 이소프렌 합성효소 활성은 TM3 배지 (실시예 1, 제 II부에 기술된 바와 같음) + 10 g/L 포도당에서 균주를 성장시키고, 중간-로그기에 바이오매스를 수확하며, 프렌치 프레스기에 의해 세포를 파쇄하고 DMAPP 분석법을 시행하여 분석되었다. 분석법의 결과는 표 15에 나타나있다. DMAPP 분석법에 의해 측정되는 활성의 존재는 이소프렌 합성효소가 Pseudomonas에서 발현된 것을 검증하여 주었다.
이소프렌 합성효소 활성은 pBBR5HGSOpt2_2를 사용하여 lac 프로모터로부터 이소프렌 합성효소를 발현하는 슈도모나스 푸티다 및 슈도모나스 플루오레센스에서 조사되었다.
표 15는 슈도모나스 푸티다 및 슈도모나스 플루오레센스에서 이소프렌 합성효소 활성을 나타낸다.
| 균주 | OD |
이소프렌 합성효소 활성
mg 이소프렌/(L.h.OD) |
| P. fluorescens , pBBR5HGSOpt2_2 | 1.46 | 0.96 |
| P. putida , pBBR5HGSOpt2_2 | 3.44 | 0.65 |
| 대조군 ( P. putida w/o plasmid) | 8.32 | 결정될 예정 |
실시예 22: 대장균 및
슈도모나스
균주의 포도당에 대비한 사탕수수에서의 성장, 및 기질 둘 다를 사용한 이소프렌 합성효소의 발현
I. 액체 사탕수수의 제조.
결정화된 가공하지 않은 사탕수수를 하기 방식으로 물에 녹였다: 750 g H2O 가 250 g 당에 첨가되었다. 용액은 저어주었고 녹을 때까지 가만히 가열하였다. 일부 물질은 녹지 않았다. 용액의 무게는 용해 이후에 증발된 물을 보충하여 1kg으로 조정되었다. 용액의 부피는 940 mL인 것으로 측정되었다. 따라서 용액의 농도는 265 g/L이었다. 산물 표지는 15 g의 가공되지 않은 사탕수수에 대해 14 g의 탄수화물을 표시하였다. 따라서 용액의 탄수화물 농도는 248 g/L이었다. 건조 고체는 24.03% 이고, 예상된 250 g/kg와 근접한 것으로 측정되었다. 용액의 pH는 5.49이었다. 포도당 농도는 포도당 산화제와 함께 효소적/분광측정 분석법을 사용하여 측정되었다. 포도당 농도는 17.4 g/L이었다.
대다수 미생물은 슈크로스를 사용하지 않지만, 포도당과 과당은 사용할 수 있다. 용액은 둘로 나뉘었다. 하나는 한 번 30분 동안 고압 멸균되었다 (사탕수수 그대로). 포도당 함량이 29.75 g/L로 증가되면서 일부 전환이 생겼다 (도 149를 참조하라). 용액의 나머지 반은 포스포릭산을 사용하여 pH 4.0로 조절된 다음, 고압멸균에 의해 전환되었다 (역슈가). 도 149에서 나타난 바와 같이, 3회의 30분 순환이 완전한 전환을 획득하는 데 충분하였다. 용액 둘 다가 하기 기술된 성장 곡선을 위해 사용되었다.
II. 대장균 및 슈도모나스 의 서로 다른 균주의 포도당에 대비한 사탕수수에서의 성장
표 16에서 나타난 각 균주의 콜로니 한 개가 25 ml TM3 + 10 g/L 포도당에 접종되었고, 30℃에서 200 rpm으로 하룻밤 동안 성장되었다. TM3은 실시예 7, 제 II부에 기술되어 있다. 다음날 아침에 각 배양액 1 ml이 25 mL TM3 및 10 g/L 포도당, 10 g/L 그대로인 사탕수수, 또는 10 g/L 전환된 사탕수수 (상기 기술된 사탕수수 용액)을 포함하는 플라스크를 접종하는 데 사용되었다. 플라스크는 30℃에서 200 rpm으로 배양되었고, 시료는 OD600을 측정하도록 규칙적으로 수집되었다. 도 150 및 도 151은 슈도모나스 및 대장균 균주 둘 다의 경우 성장율 및 바이오매스 수율이 포도당 및 전환된 사탕수수에 대해 비교 가능하였던 것을 보여준다. P. fluorescens는 전환되지 않았던 사탕수수도 사용할 수 있는 약간의 증거를 보여주었다.
표 16은 본 연구에서 사용된 균주들을 나타낸다.
| 균주 | |
| Escherichia coli | BL21 |
| MG1655 | |
| ATCC11303 | |
| B REL 606 | |
| Pseudomonas | putida F1 (ATCC700007) |
| Fluorescens (ATCC13525) |
III. 포도당 또는 사탕수수에서 성장할 때 이소프렌을 발현하는 대장균으로부터 이소프렌 생산의 비교.
실시예 14에서 기술된 바와 같이, MVA 경로, M. mazei 로부터 나온 메발로네이트 키나제, 및 푸엘라리아 로바타 (Pueraria lobata)로부터 나온 이소프렌 합성효소를 포함하는 E. coli MCM401 (BL21(DE3))을 TM3 + 10 g/L 포도당 또는 10 g/L 전환된 사탕수수 (시럽의 탄소화물 농도에 근거함) 둘 중 하나에서 성장시켰다. 플라스크는 TM3 + 10 g/L 포도당을 넣어 OD600 = 0.2까지 키운 밤샘 배양액으로부터 접종되었다. 필요한 경우 항생제가 첨가되었다. 두 시간 이후에, 대장균 배양액은 400 μM IPTG로 유도되었다. 성장 6시간 이후에, 실시예 2B에 기술된 바와 같이 DMAPP 분석법을 사용하여 이소프렌 생산 및 이소프렌 합성효소 활성이 측정되었다. 결과는 표 17에 나타나있고 전환된 사탕수수가 세포 기준으로 이소프렌 및 이소프렌 합성효소 생산의 측면에서 포도당과 동등한 것을 분명하게 설명하고 있다.
| 균주 | 탄소원 | OD |
이소프렌 합성효소 활성
mg 이소프렌/(L.h.OD) |
이소프렌 생산
mg 이소프렌/(L.h.OD) |
| MCM401 | 포도당 | 2.20 | 21.06 | 8.98 |
| MCM401 | 전환된 사탕수수 | 2.32 | 20.20 | 9.23 |
실시예
23:
S.
cerevisiae
gi1
.2
KKDyI
오페론
,
P.
alba
이소프렌 합성효소,
M.
mazei
메발로네이트
키나제
,
pCL
Upper
MVA
(
E.
faecalis
mvaE
및
mvaS
) 및 ybhE (
pgl
)을 발현하는 대장균 균주의 제작
(i) EWL201 (BL21, Cm-GI1.2-KKDyI) 균주의 제작
E. coli BL21 (Novagen, EMD Biosciences, Inc.)이 수여 균주로서 MCM331 P1 용출액 (Ausubel, et al., Current Protocols in Molecular Biology. John Wiley and Sons, Inc.에 기술된 방법에 따라 제조된 용출액)으로 형질감염되었다. MCM331 세포는 S. cerevisiae 메발로네이트 키나제, 메발로네이트 포스포페이트 키나제, 메발로네이트피로포스페이트 탈탄산화효소, 및 IPP 이소머라제를 인코딩하는 염색체 제작물 gi1.2KKDyI을 포함한다 (예로, S. cerevisiae로부터 나온 gi1.2-KKDyI 오페론). 형질감염체는 세포를 L 아가 및 20 mg/ml 클로로암페니콜 상에 뿌려서 선별되었다. 플레이트는 30℃에서 하룻밤 동안 배양되었다. 형질감염체의 분석은 대조군 플레이트에서 콜로니를 전혀 보여주지 않았다 (전환에 대해 물 + 세포 대조군 플레이트 또한 용출물 오염에 대해 물과 P1 용출물 대조군 플레이트).
네 개의 형질감염체가 찍혔고 5 mL L 액체배지와 20 mg/ml 클로로암페니콜을 접종하는 데 사용되었다. 배양액은 30℃에서 200 rpm으로 진탕하면서 하룻밤 동안 배양되었다. PCR 분석을 위한 각 형질감염체의 게놈 DNA 프렙을 얻기 위하여, 1.5mL의 밤샘 세포 배양액이 원심분리되었다. 세포 펠렛은 400 ml 재현탁 완충용액 (20 mM 트리스, 1 mM EDTA, 50 mM NaCl, pH 7.5)으로 재현탁되었고 4 ml DNase-없는 RNase, (Roche)가 첨가되었다. 튜브는 37℃에서 30분 동안 배양되었고, 이어서 4 ml의 10% SDS와 4 ml의 10 mg/ml 프로테아제 K 스톡 용액 (Sigma-Aldrich)이 첨가되었다. 튜브는 37℃에서 1분 동안 배양되었다. 세포 용출액은 2 ml 상 잠금 라이트 젤 (Phase Lock Light Gel) 튜브 (Eppendorf) 내로 전달되었고 각 200ml의 포화된 페놀 pH 7.9 (Ambion Inc.)과 클로로포름이 첨가되었다. 튜브는 잘 혼합되었고 5분 동안 마이크로 원심분리 되었다. 두 번째 추출이 400 ml의 클로로포름을 사용하여 시행되었고, 수성 층은 새로운 에펜도르프 튜브에 옮겨졌다. 게놈 DNA는 1 ml의 100% 에탄올의 첨가와 5분 동안 원심분리에 의해 침전되었다. 게놈 DNA 펠렛은 1 ml의 70% 에탄올로 세척되었다. 에탄올은 제거되었고 게놈 DNA 펠렛은 간단하게 공기 건조되도록 하였다. 게놈 DNA 펠렛은 200 ml TE에 재현탁되었다.
Pfu Ultra II DNA 중합효소 (Stratagene) 및 주형으로서 200 ng/ml의 게놈 DNA를 사용하여, 2가지의 서로 다른 세트의 PCR 반응 튜브는 제조사의 프로토콜에 따라 제조되었다. 세트 1의 경우, 프라이머 MCM130 및 GB Cm-Rev (표 18)가 형질감염체가 성공적으로 attTn7 좌위 내에 삽입되었는지 입증하는 데 사용되었다. 세트 1을 위한 PCR 매개변수는 95℃ 2분 (최초 사이클만), 95℃ 25초, 55℃ 25초, 72℃ 25초 (2-4 단계의 28회 반복), 72℃ 1분이었다. 세트 2의 경우, 프라이머 MVD 및 MVDRev (표 18)이 gi1.2-KKDyI 오페론이 적절히 삽입되었는지 입증하는데 사용되었다. 세트 2을 위한 PCR 매개변수는 95℃ 2분 (최초 사이클만), 95℃ 25초, 55℃ 25초, 72℃ 10초 (2-4 단계의 28회 반복), 72℃ 1분이었다. 1.2% E-젤 (Invitrogen Corp.) 상에서 PCR 증폭자의 분석은 4개의 형질감염체 클론 모두가 정확한 것을 보여주었다. 한 개를 뽑아 균주 EWL201라고 명명하였다.
(ii) EWL204 (BL21, loopout-GI1.2-KKDyI) 균주의 제작
클로로암페니콜 마커는 Datsenko 및 Wanner (2000) (Datsenko et al., Proc Natl. Acad. Sci USA 97:6640-6645, 2000)에 기술된 바와 같이 플라스미드 pCP20를 사용하여 EWL201 균주 밖으로 빠져나왔다. 대장균 K-12 에서 염색체 유전자의 일-단계 불활성화는 PCR 산물을 사용한다 (Datsenko et al., PNAS, 97: 6640-6645, 2000). EWL201 세포는 L 액체배지에서 중간로그기로 성장된 다음 얼음에 식힌 무균 물로 세 번 세척되었다. 50 ml 분량의 세포 현탁액이 1 ml의 pCP20와 혼합되었고 세포 현탁 혼합액은 2 mm 큐벳 (Invitrogen Corp.)에 넣어 2.5 Volts 및 25uFd에서 진펄서 전기천공기 (Gene Pulser Electroporator, Bio-Rad Inc.)를 사용하여 전기천공되었다. 1 ml의 LB가 바로 세포에 첨가된 다음 14ml 금속 뚜껑을 가진 폴리프로필렌 튜브 (Sarstedt)로 옮겨졌다. 세포는 30℃에서 1시간 동안 키워서 회복되도록 하였다. 형질전환체는 L 아가 및 20 mg/ml 클로로암페니콜과 50 mg/ml 카베니실린 상에서 선별되었고 30℃에서 하룻밤 동안 배양되었다. 다음 날, 단일 콜론이 10 ml L 액체배지 및 50 mg/ml 카베니실린에서 초기 로그기까지 배양되었다. 자라는 배양액의 온도는 그 다음 2시간 동안 42℃로 올랐다. 일련의 희석이 시행된 다음 세포는 LA 플레이트 (항생제 선별 없음) 상에 뿌려졌으며 30℃에서 하룻밤 동안 배양되었다. 다음 날, 20개의 콜로니가 뽑혔고 L 아가 (항생제 없음) 또한 LA 와 20 mg/ml 클로로암페니콜 플레이트 상에 찍었다. LA 플레이트 상에서 성장할 수 있지만 LA와 20 mg/ml 클로로암페니콜 플레이트 상에서는 그렇지 못한 세포는 클로로암페니콜 마커가 빠져나온 것이 되었다 (한 개를 뽑아 EWL204 균주라고 명명하였다).
(iii) 플라스미드 pEWL230 (pTrc P. alba)의 제작
포풀라 알바 (Populus alba) 이소프렌 합성효소 (P. alba HGS)를 인코딩하는 합성 유전자의 생성은 대장균 발현을 위한 코돈-최적화에 근거하여 외부업체 DNA2.0 Inc. (Menlo Park, CA)에 맡겼다. 합성 유전자는 플라스미드 pET24a (Novagen, EMD Biosciences, Inc.) 내에 주문 클론되었고 냉동건조로 운반되었다 (도 152, 도 153A 내지 153B; 서열번호 43).
P. alba 이소프렌 합성효소 (P. alba HGS) 유전자를 증폭하기 위하여 PCR 반응이 주형으로서 pET24a P. alba HGS, 프라이머 MCM182 및 MCM192, 또한 허큘라제 II 융합 DNA 종합효소 (Stratagene)를 제조사의 지침에 따라 사용하여 수행되었다. PCR 조건은 다음과 같았다: 95℃ 2분 (최초 사이클만), 95℃ 25초, 55℃ 20초, 72℃ 1분, 28회 반복, 또한 72℃ 1분 동안 최종 연장. P. alba 이소프렌 합성효소 PCR 산물은 QIAquick PCR 정제 키트 (Qiagen Inc.)를 사용하여 정제되었다.
P. alba 이소프렌 합성효소 PCR 산물은 다시 2 ml 10X NEB 완충용액 4와 함께 1 ml의 BspHI 제한효소 (New England Biolabs)를 포함하는 20 ml 반응에서 소화되었다. 반응은 37℃에서 2시간 동안 배양되었다. 그 다음 소화된 PCR 단편은 QIAquick PCR 정제 키트를 사용하여 정제되었다. 두 번째 제한효소 소화가 2 ml 10X 완충용액 H와 함께 1 ml PstI 제한효소 (Roche)를 포함하는 20 ml 반응에서 수행되었다. 반응은 37℃에서 2시간 동안 배양되었다. 그 다음 소화된 PCR 단편은 QIAquick PCR 정제 키트를 사용하여 정제되었다. 플라스미드 pTrcHis2B (Invitrogen Corp.)는 1 ml NcoI 제한효소 (Roche), 1 ml PstI 제한효소, 및 2 ml 10X 완충용액 H를 포함하는 20 ml 반응에서 소화되었다. 반응은 37℃에서 2시간 동안 배양되었다. 소화된 pTrcHis2B 벡터는 1.2% E-젤 (Invitrogen Corp.)을 사용하여 젤 정제되었고 QIAquick 젤 추출 키트 (Qiagen) 를 사용하여 추출되었다 (도 154). BspHI 및 NcoI 부위의 양립가능한 점착성 말단을 사용하여, 5 ml P. alba 이소프렌 합성효소 삽입물, 2ml pTrc 벡터, 1 ml T4 DNA 라이게이즈 (New England Biolabs), 2 ml 10X 라이게이즈 완충용액, 및 10 ml ddH2O를 포함하는 20ml라이게이션 반응이 제조되었다. 라이게이션 혼합액은 상온에서 40분 동안 배양되었다. 라이게이션 혼합액은 dd H2O 의 페트리 디쉬에 넣은 0.025 mm 나이트로셀룰로스 막 필터 (Millipore)를 부유시키고 라이게이션 혼합액을 상온에서 30분 동안 나이트로셀룰로스 막 필터 위에 가만히 적용하여 탈염시켰다. MCM446 세포 (섹션 II를 참조하라) 는 LB 에서 중간로그기로 성장시킨 다음 얼음에 식힌 무균 물로 세 번 세척하였다. 50 ml 분량의 세포 현탁액이 5 ml의 탈염된 pTrc P.alba HGS 라이게이션 믹스와 혼합되었다. 세포 현탁 혼합액은 2 mm 큐벳에 넣어 2.5 Volts 및 25 μFd에서 진펄서 전기천공기를 사용하여 전기천공되었다. 1 ml의 LB가 바로 세포에 첨가된 다음 14 ml 금속 뚜껑을 가진 폴리프로필렌 튜브 (Sarstedt)로 옮겨졌다. 세포는 30℃에서 2시간 동안 키워서 회복되도록 하였다. 형질전환체는 L 아가와 50 mg/ml 카베니실린 또한 10 mM 메발론산 상에서 선별되었고 30℃에서 배양되었다. 다음 날, 6개의 형질전환체가 뽑혔고 5 ml L 액체배지 및 50 mg/ml 카베니실린 튜브에서 30℃로 하룻밤 동안 배양되었다. 플라스미드 프렙이 밤샘 배양액으로 QIAquick 스핀 미니프렙 키트 (Qiagen)를 사용하여 수행되었다. 플라스미드를 증식하기 위해 BL21세포를 사용하기 때문에, 스핀 컬럼을 PB 완충용액 5X 및 PE 완충용액 3X로 세척하는 변형이 높은 품질의 플라스미드 DNA를 성취하기 위해 제조사의 표준 프로토콜에 통합되었다. 플라스미드는 20ml 반응에서 PstI으로 소화되어 정확한 크기의 직선상 단편을 입증하였다. 모두 6개의 플라스미드가 정확한 크기를 가졌고 프라이머 MCM65, MCM66, EL1000 (표 18)를 사용한 서열결정을 위해 퀸타라 바이오사이언스사 (Quintara Biosciences, Berkeley, CA)로 보내졌다. DNA 서열결정 결과는 6개 플라스미드 모두가 정확한 것으로 보여주었다. 한 개의 플라스미드가 뽑혔고 플라스미드 EWL230라고 명명하였다 (도 155, 도 156A 및 156B; 서열번호 44).
(iv) 플라스미드pEWL244 (pTrc P. alba-mMVK)의 제작
메타노사르시나 마제이 (Methanosarcina mazei, M. mazei) MVK 유전자를 증폭하기 위하여, PCR 반응이 주형으로 MCM376 (하기 섹션 (v)를 참조하라), 프라이머MCM165 및 MCM177 (표 18을 참조하라), 및 Pfu Ultra II 융합 DNA 중합효소(Stratagene)를 제조사의 프로토콜에 따라 사용하여 수행되었다. PCR 조건은 하기와 같았다: 95℃ 2분 (최초 사이클만), 95℃ 25초, 55℃ 25초, 72℃ 18분, 28회 반복, 또한 72℃ 1분 동안 최종 연장. M. mazei 이소프렌 합성효소 PCR 산물은 QIAquick PCR 정제 키트 (Qiagen Inc.)를 사용하여 정제되었다.
M. mazei MVK PCR 산물은 그 다음 8 ml PCR 산물, 2 ml PmeI 제한효소 (New England Biolabs), 4 ml 10X NEB 완충용액 4, 4 ml 10X NEB BSA, 및 22 ml of ddH2O를 포함하는 40 ml 반응으로 소화되었다. 반응은 37℃에서 3시간 동안 배양되었다. 그 다음 소화된 PCR 단편은 QIAquick PCR 정제 키트를 사용하여 정제되었다. 두 번째 제한효소 소화는 2 ml NsiI 제한효소 (Roche), 4.7 ml 10X 완충용액 H, 및 40 ml의 PmeI 소화된 M. mazei MVK 단편을 포함하는 47 ml 반응으로 수행되었다. 반응은 37℃에서 3시간 동안 배양되었다. 그 다음 소화된 PCR 단편은 1.2% E-젤을 사용하여 젤 정제되었고 QIAquick 젤 추출 키트 (Qiagen)를 사용하여 추출되었다. 플라스미드 EWL230는 10 ml 플라스미드, 2ml PmeI 제한효소, 4 ml 10X NEB 완충용액 4, 4 ml 10X NEB BSA, 및 20 ml of ddH2O를 포함하는 40 ml 반응으로 소화되었다. 반응은 37℃에서 3시간 동안 배양되었다. 그 다음 소화된 PCR 단편은 QIAquick PCR 정제 키트를 사용하여 정제되었다. 두 번째 제한효소 소화는 2ml PstI 제한효소, 4.7 ml 10X 완충용액 H, 및 40 ml의 PmeI 소화된 M. mazei EWL 단편을 포함하는 47 ml 반응으로 수행되었다. 반응은 37℃에서 3시간 동안 배양되었다. 그 다음 소화된 PCR 단편은 1.2% E-젤을 사용하여 젤 정제되었고 QIAquick 젤 추출 키트 (Qiagen)를 사용하여 추출되었다 (도 157). NsiI 및PstI 부위의 양립가능한 점착 발단을 사용하여, 8 ml M. mazei MVK 삽입물, 3 ml EWL230 플라스미드, 1 ml T4 DNA 라이게이즈, 2 ml 10X 라이게이즈 완충용액, 및 6 ml ddH2O을 포함하는 20 ml 라이게이션 반응이 제조되었다. 라이게이션 혼합액은 16˚C에서 하룻밤 동안 배양되었다. 다음 날, 라이게이션 혼합액은 ddH2O의 페트리 디쉬에 넣은 0.025 mm 나이트로셀룰로스 막 필터를 부유시키고 라이게이션 혼합액을 상온에서 30분 동안 나이트로셀룰로스 막 필터 위에 가만히 적용하여 탈염시켰다. MCM446 세포는 LB 에서 중간로그기로 성장시킨 다음 얼음에 식힌 무균 물로 세 번 세척하였다. 50 ml 분량의 세포 현탁액이 5 ml의 탈염된 pTrc P.alba mMVK 라이게이션 믹스와 혼합되었다. 세포 현탁 혼합액은 2 mm 큐벳에 넣어 2.5 Volts 및 25 μFd에서 진펄서 전기천공기를 사용하여 전기천공되었다. 1 ml의 LB가 바로 세포에 첨가된 다음 14 ml 금속 뚜껑을 가진 폴리프로필렌 튜브로 옮겨졌다. 세포는 30℃에서 2시간 동안 키워서 회복되도록 하였다. 형질전환체는 LA와 50 mg/ml 카베니실린 또한 5 mM 메발론산 플레이트 상에서 선별되었고 30℃에서 배양되었다. 다음 날, 6개의 형질전환체가 뽑혔고 5 ml L 액체배지 및 50 mg/ml 카베니실린 튜브에서 30℃ 로 하룻밤 동안 배양되었다. 플라스미드 프렙이 밤샘 배양액으로 QIAquick 스핀 미니프렙 키트 (Qiagen)를 사용하여 수행되었다. 플라스미드를 증식하기 위해 BL21세포를 사용하기 때문에, 스핀 컬럼을 PB 완충용액 5X 및 PE 완충용액 3X로 세척하는 변형이 높은 품질의 플라스미드 DNA를 성취하기 위해 제조사의 표준 프로토콜에 통합되었다. 플라스미드는 20ml 반응에서 PstI으로 소화되어 정확한 크기의 직선상 단편을 입증하였다. 6개 플라스미드 중 세 개가 정확한 크기를 가졌고 프라이머 MCM65, MCM66, EL1000, EL1003, 및 EL1006 (표 18)를 사용한 서열결정을 위해 퀸타라 바이오사이언스사로 보내졌다. DNA 서열결정 결과는 3개 플라스미드 모두가 정확한 것을 보여주었다. 한 개의 플라스미드가 뽑혔고 플라스미드 EWL244라고 명명하였다 (도 158, 도 159A 및 159B; 서열번호 45).
(v) pET200D의 M. mazei archaeal Lower로부터 플라스미드 MCM376 - MVK의 제작
M. mazei archaeal 하부 경로 오페론으로부터 나온 MVK ORF (도 160A 내지 160C; 서열번호 46) 가 인비트로겐 플래티넘 HiFi PCR 믹스를 사용하여 프라이머MCM161 및 MCM162 (표 18)로 PCR 증폭되었다. 45 μL의 PCR 혼합액이 1 μL 주형, 1 μL 의 각 10 μM 프라이머, 및 2 μL 물과 조합되었다. 반응은 하기와 같이 순환되었다: 94℃ 2분; 94℃ 30초, 55℃ 30초, 및 68℃ 1.15분, 30회 반복; 그 다음 72℃ 7분, 및 식을 때까지 4℃. 본 PCR 반응 3 μL은 인비트로겐 pET200D 플라스미드에 제조사의 프로토콜에 따라 결찰되었다. 본 라이게이션 반응 3 μL은 인비트로겐 TOP10 세포 내로 도입되었고, 형질전환체는 LA/kan50 상에서 선별되었다. 형질전환체로부터 나온 플라스미드가 분리되었고 삽입물는 서열결정되어 그 결과 MCM376이 제조되었다 (도 161A 내지 161C).
(vi) EWL251 (BL21(DE3), Cm-GI1.2-KKDyI, pTrc P.alba-mMVK) 균주의 제작
MCM331 세포 (S. cerevisiae 메발로네이트 키나제, 메발로네이트 포스포페이트 키나제, 메발로네이트피로포스페이트 탈탄산화효소, 및 IPP 이소머라제를 인코딩하는 염색체 제작물 gi1.2KKDyI을 포함한다)는 LB 배지에서 중간로그기로 성장시킨 다음 얼음에 차갑게 한 무균 물에 세 번 세척하였다. 50 ml의 세포 현탁액은 1 ml의 플라스미드EWL244와 혼합되었다. 세포 현탁 혼합액은 2 mm 큐벳에 넣어 2.5 Volts 및 25 μFd에서 진펄서 전기천공기를 사용하여 전기천공되었다. 1 ml의 LB가 바로 세포에 첨가된 다음 14 ml 금속 뚜껑을 가진 폴리프로필렌 튜브로 옮겨졌다. 세포는 30℃에서 2시간 동안 키워서 회복되도록 하였다. 형질전환체는 LA와 50 mg/ml 카베니실린 및 5 mM 메발론산 플레이트 상에서 선별되었고 37℃에서 배양되었다. 한 개의 콜로니가 선택되었고 균주 EWL251이라고 명명되었다.
(vii) EWL256 (BL21(DE3), Cm-GI1.2-KKDyI, pTrc P.alba-mMVK, pCL Upper MVA) 균주의 제작
EWL251 세포는 LB에서 중간로그기로 성장시킨 다음 얼음에 차갑게 한 무균 물에 세 번 세척하였다. 50 ml의 세포 현탁액은 1 ml의 플라스미드 MCM82 (E. faecalis mvaE 및 mvaS를 인코딩하는 pCL PtrcUpperPathway ("pCL Upper MVA"라고도 알려려 있음)와 혼합되었다. 플라스미드 pCL Ptrc Upper Pathway는 상기 실시예 8에서 기술된 바와 같이 제작되었다. 세포 현탁 혼합액은 2 mm 큐벳에 넣어 2.5 Volts 및 25 μFd에서 진펄서 전기천공기를 사용하여 전기천공되었다. 1 ml의 LB가 바로 세포에 첨가되었다. 그 다음 세포는 14 ml 금속 뚜껑을 가진 폴리프로필렌 튜브로 옮겨졌다. 세포는 30℃에서 2시간 동안 키워서 회복되도록 하였다. 형질전환체는 LA와 50 mg/ml 카베니실린 및 50 mg/ml 스펙티노마이신 플레이트 상에서 선별되었고 37℃에서 배양되었다. 한 개의 콜로니가 뽑혔고 균주 EWL256이라고 명명되었다.
표 18은 프라이머 서열들을 나타낸다.
| 프라이머 명칭 | 프라이머 서열 |
| MCM130 | ACCAATTGCACCCGGCAGA (서열번호 127) |
| GB Cm Rev | GCTAAAGCGCATGCTCCAGAC (서열번호 128) |
| MVD For | GACTGGCCTCAGATGAAAGC (서열번호 129) |
| MVD Rev | CAAACATGTGGCATGGAAAG (서열번호 130) |
| MCM182 | GGGCCCGTTTAAACTTTAACTAGACTCTGCAGTTAGCGTTCAAACGGCAGAA (서열번호 131) |
| MCM192 |
CGCATGCATGTCATGAGATGTAGCGTGTCCACCGAAAA (서열번호 132)
|
| MCM65 | ACAATTTCACACAGGAAACAGC (서열번호 133) |
| MCM66 | CCAGGCAAATTCTGTTTTATCAG (서열번호 106) |
| EL1000 | GCACTGTCTTTCCGTCTGCTGC (서열번호 134) |
| MCM165 |
GCGAACGATGCATAAAGGAGGTAAAAAAACATGGTATCCTGTTCTGCGCCGGG
TAAGATTTACCTG (서열번호 122) |
| MCM177 | GGGCCCGTTTAAACTTTAACTAGACTTTAATCTACTTTCAGACCTTGC (서열번호 123) |
| EL1003 |
GATAGTAACGGCTGCGCTGCTACC (서열번호 137)
|
| EL1006 |
GACAGCTTATCATCGACTGCACG (서열번호 138)
|
| MCM161 | CACCATGGTATCCTGTTCTGCG (서열번호 120) |
| MCM162 | TTAATCTACTTTCAGACCTTGC (서열번호 121) |
(viii) RM111608-2 (Cm-GI1.2-KKDyI, pTrc P.alba-mMVK, pCL Upper MVA, pBBRCMPGI1.5-pgl) 균주의 제작
이소프렌 합성효소를 생산하는 대장균 BL21 균주 (EWL256)가 복제 플라스미드 pBBR1MCS5(젠타마이신) (Dr. K. Peterson, Louisiana State University로부터 획득함) 상에서 ybhE 유전자의 전신성 발현 (E. coli 6-포스포글루코노락토나제 (phosphogluconolactonase))을 사용하여 제작되었다.
FRT-기초한 재조합 카세트, Red/ET-매개성 삽입을 위한 플라스미드 및 루프아웃 항생제 마커는 진브리지 (Gene Bridges GmbH, Germany)로부터 획득되었다. 이들 재료를 사용하는 절차는 진브리지 프로토콜에 따라 수행되었다. 프라이머 Pgl-F (서열번호 139) 및 PglGI1.5-R (서열번호 140)가 FRT-gb2-Cm-FRT주형으로부터 저항성 카세트를 스트라타젠 허큘라제 II 융합 키트를 제조사의 프로토콜에 따라 사용하여 증폭시키는 데 사용되었다. PCR 반응 (50 μL의 최종 부피)은 다음을 포함한다: 5 μL 완충용액, 1 μL 주형 DNA (진브리지로부터 나온 FRT-gb2-Cm-F), 10 pmols의 각 프라이머, 및 1.5 μL의 25mM dNTP 믹스에 dH2O를 첨가하여 50 μL로 제조됨. 반응은 다음과 같이 순환되었다: 95℃ 1 x 2 분; 그 다음 30회 반복 (95℃ 30초; 63℃ 30초; 72℃ 3분).
그 결과 나온 PCR 산물은 QiaQuick PCR 정제 키트 (Qiagen)를 사용하여 정제되었고 pRed-ET 재조합효소-포함하는 플라스미드를 보유하는 전기적으로 능력있는 MG1655 세포 내로 하기와 같이 전기천공되었다. 세포는 5 mL의 L 배지에서 OD600 ~0.6 로 30℃에서 성장시켜 제조되었다. 세포는 4% 아라비노스의 첨가에 의해 재조합효소의 발현이 유도되었고, 30℃에서 30분 동안 성장시켰으며 이어서 37℃에서 30분 동안 성장되었다. 1.5 mL 분량의 세포가 얼음에 차갑게 한 dH2O로 세척되었다. 최종 세포 펠렛은 40 μL 의 얼음에 차갑게 한 dH2O에 재현탁되었고 2-5 μL 의 PCR 산물이 첨가되었다. 전기천공법은 1-mm 공간 큐벳에 넣어 1.3 kV에서 진펄서 전기천공기 (Bio-Rad Inc.)를 사용하여 수행되었다. 세포는 30℃에서 1-2시간 동안 회복되었고, 클로로암페니콜 (5 mg/ml)을 포함하는 L 아가 상에 도말되었다. 다섯 개의 형질전환체가 PCR에 의해 분석되었고 삽입 부위가 끼워진 프라이머 (2가지 프라이머 세트: pgl 및 49 rev와 3' EcoRV-pglstop; Bottom Pgb2 및 Top GB CMP (946))를 사용하여 서열결정되었다. 정확한 형질전환체가 선별되었고, 본 균주는 MG1655 GI1.5-pgl::CMP라고 명명되었다.
MG1655 GI1.5-pgl::CMP의 염색체 DNA가 FRT-CMP-FRT-GI1.5 - ybhE 제작물을 포함하는 PCR 단편을 생성하는데 주형으로서 사용되었다. 본 제작물은 pBBR1MCS5 (젠타마이신) 내로 하기와 같이 클론되었다. 여기서 CMP-GI1.5-pgl라고 명명되는 단편은 5'프라이머 Pglconfirm-F (서열번호 141) 및 3' 프라이머 EcoRV-pglstop (서열번호 142)를 사용하여 증폭되었다. 그 결과 나온 단편은 인비트로겐 TOPO-Blunt 클로닝 키트를 사용하여 제조사로부터 제시된 바와 같이 플라스미드 벡터 pCR-Blunt II-TOPO 내로 클론되었다. CMP-GI1.5-pgl 단편을 보유하는 NsiI 단편은 pBBR1MCS5(전타마이신)의 PstI 부위 내로 클론되었다. 5ml CMP-GI1.5-pgl 삽입물, 2 ml pBBR1MCS5 (전타마이신) 벡터, 1 ml T4 DNA 라이게이즈 (New England Biolabs), 2 ml 10X 라이게이션 완충용액, 및 10 ml ddH2O 을 포함하는 20 ml의 라이게이션 반응이 제조되었다. 라이게이션 혼합액은 상온에서 40분 동안 배양된 다음 2-4 μL이 전기적으로 능력있는 Top10 세포 (Invitrogen) 내로 상기 기재된 매개변수를 사용하여 전기천공되었다. 형질전환체는 10 μg/ml 클로로암페니콜 및 5 μg/ml 젠타마이신을 포함하는 L 아가 상에서 선별되었다. 선택된 클론의 서열은 상기에 기술된 많은 프라이머 뿐만 아니라 Sequetech, CA 에 의해 제공된 보통의 T3 및 역방 프라이머를 사용하여 결정되었다. 본 플라스미드는 pBBRCMPGI1.5-pgl라고 명명되었다 (도 162, 또한 도 163A 및 163B, 또한 서열번호 48).
본 명세서에서 기술된 바와 같이, 플라스미드 pBBRCMPGI1.5-pgl는 EWL256 내로 전기천공되었고 형질전환체는 클로로암페니콜 (10 μg/mL), 젠타마이신 (5 μg/mL), 스펙티노마이신 (50 μg/mL), 및 카베니실린 (50 μg/mL)을 포함하는 L 아가 상에 도말되었다. 한 개의 형질전환체가 선택되었고 균주 RM111608-2라고 명명되었다.
프라이머:
Pgl-F
5'-accgccaaaagcgactaattttagctgttacagtcagttgaattaaccctcactaaagggcggccgc-3'
(서열번호 139)
PglGI1.5-R
5'- gctggcgatataaactgtttgcttcatgaatgctcctttgggttacctccgggaaacgcggttgatttgtttagtggttgaattatttgctcaggatgtggcatagtcaagggcgtgacggctcgctaatacgactcactatagggctcgag-3'(서열번호 140)
3' EcoRV-pglstop:
5'-CTT GAT ATC TTA GTG TGC GTT AAC CAC CAC (서열번호 142)
pgl +49 rev: CGTGAATTTGCTGGCTCTCAG (서열번호 136)
Bottom Pgb2: GGTTTAGTTCCTCACCTTGTC (서열번호 135)
Top GB' CMP (946): ACTGAAACGTTTTCATCGCTC (서열번호 92)
Pglconfirm-F
5'-accgccaaaagcgactaattttagct-3'(서열번호 141)
실시예 24: 대장균에서
ybhE
(pgl)의 전신성 발현에 의한 이소프렌 합성의 개선
본 실시예는 E. coli ybhE (pgl)를 전신적으로 발현하는 균주에서 이소프렌의 생산을 ybhE 를 야생형 수준으로 발현하는 대조군 균주 (예로, EWL256)과 대비하여 보여주고 있다. 유전자ybhE (pgl)는 이종유래 발현된 단백질의 해독후 글루코닐화를 억제하고 산물 용해도와 수율을 개선시키면서 펜토스 포스페이트 경로를 통한 바이오매스 수율 및 유량도 개선시키는 E. coli 6-포스포글루코노락토나제를 인코드한다 (Aon et al., Applied and Environmental Microbiology, 74(4): 950-958, 2008).
i) 소규모 분석
배지 레시피 (발효 배지 리터 당): K2HPO4 7.5 g, MgSO4 * 7H2O 2 g, 시트르산 모노하이드레이트 2 g, 철 암모늄 시트르산 0.3 g, 효모추출물 0.5 g, 1000X 변형된 미량 금속 용액 1 ml. 모든 성분은 다같이 첨가되었고 diH2O에 녹였다. pH는 7.0으로 암모늄 하이드록사이드 (30%)를 사용하여 조정되었고 부피를 맞추었다. 배지는 0.22 마이크론 필터로 여과-멸균되었다. 포도당 10 g, 티아민 * HCl 0.1 g, 및 항생제가 멸균 및 pH 조정 이후에 첨가되었다.
1000X 미량 금속 용액 (발효 배지 리터 당): 시트르산 * H2O 40 g, MnSO4 * H2O 30 g, NaCl 10 g, FeSO4 * 7H2O 1 g, CoCl2 * 6H2O 1 g, ZnSO * 7H2O 1 g, CuSO4 * 5H2O 100 mg, H3BO3 100 mg, NaMoO4 * 2H2O 100 mg. 각 성분은 한 번에 하나씩 DIH2O에 녹였다. pH는 3.0으로 HCl/NaOH를 사용하여 조정한 다음, 용액으로 부피를 맞추었고 0.22 마이크론 필터로 여과-멸균되었다.
(a) 실험적 절차
이소프렌 합성은 마이크로리액터 테크놀로지사 (MicroReactor Technologies, Inc)로부터 나온 CelleratorTM 에서 균주를 성장시켜서 분석되었다. 24 웰의 각각의 작동 부피는 4.5 mL이었다. 온도는 30℃로 유지되었고, pH 설정점은 7.0이었으며, 산소 유량 설정점은 20 sccm이었고 진탕 속도는 800 rpm이었다. 냉동 바이알로부터 가져온 E. coli 균주의 접종액이 LB 액체배지 아가 플레이트 (항생제 참가) 상에 뿌려졌고 30℃에서 배양되었다. 단일 콜로니가 항생제를 가진 배지에 접종되었고 하룻밤 동안 성장되었다. 박테리아는 항생제를 가진 배지 4.5 mL 내로 550 nm에서 측정된 광학 밀도 0.05 에 도달하도록 희석되었다.
이소프렌의 배출-기체 분석은 기체 크로마토그래프-질량 분광측정기 (GC-MS) (Agilent) 상부공간 분석법을 사용하여 수행되었다. 시료 제조는 다음과 같다: 전체 액체배지 100 mL를 밀봉된 GC 바이알에 넣었고 고정된 30분 시간 동안 30℃에서 배양되었다. 이어서 70℃에서 5분 동안 배양되는 것으로 구성되는 열 사멸 단계가 시행되었고 시료는 GC에 로딩되었다.
550 nm 의 파장에서의 광학 밀도 (OD)가 진행 과정 동안 마이크로플레이트 리더 (Spectramax)를 사용하여 획득되었다. 특이 생산도가 이소프렌 농도 (mg/L)를 OD 해독 및 시간대 (시간)로 나누어 획득되었다.
두 가지 균주 EWL256 및 RM11608-2는 200 및 400 uM IPTG 유도 수준에서 조사되었다. 시료는 유도후 1, 2.5, 4.75, 및 8 시간대에서 이소프렌 생산에 대해 분석되었다. 시료는 이중으로 분석되었다.
(b) 결과
실험은 2가지 서로 다른 IPTG 농도에서, ybhE (pgl) 를 발현하는 균주는 이소프렌의 특이 생산도가 대조군 균주와 대비하여 2-3배 극적으로 증가하는 것을 보여주었다.
Cm-GI1.2-KKDyI, M. mazei 메발로네이트 키나제, P. alba 이소프렌 합성효소, 및 ybhE (pgl) (RM111608-2)을 발현하는 대장균으로부터 15 -L 규모로 사료첨가-회분식 배양에서 배양된 이소프렌 발효.
배지 레시피 (발효 배지 리터 당): K2HPO4 7.5 g, MgSO4 * 7H2O 2 g, 시트르산 모노하이드레이트 2 g, 철 암모늄 시트르산 0.3 g, 효모추출물 0.5 g, 1000X 변형된 미량 금속 용액1 ml. 모든 성분은 다같이 첨가되었고 diH2O에 녹였다. 본 용액은 고압 멸균되었다. pH는 7.0으로 암모늄 하이드록사이드 (30%)를 사용하여 조정되었고 부피를 q.s. 맞추었다. 포도당 10 g, 티아민 * HCl 0.1 g, 및 항생제가 멸균 및 pH 조정 이후에 첨가되었다.
1000X 미량 금속 용액 (발효 배지 리터 당): 시트르산 * H2O 40 g, MnSO4 * H2O 30 g, NaCl 10 g, FeSO4 * 7H2O 1 g, CoCl2 * 6H2O 1 g, ZnSO * 7H2O 1 g, CuSO4 * 5H2O 100 mg, H3BO3 100 mg, NaMoO4 * 2H2O 100 mg. 각 성분은 한 번에 하나씩 DI H2O에 녹였다. pH는 3.0으로 HCl/NaOH를 사용하여 조정한 다음, 부피를 q.s. 맞추었고 0.22 마이크론 필터로 여과-멸균되었다.
발효는 상부 메발론산 (MVA) 경로 (pCL Upper), 삽입된 하부 MVA 경로 (gi1.2KKDyI), M. mazei로부터 나온 메발로네이트 키나제의 높은 발현 및 P. alba (pTrcAlba-mMVK)로부터 나온 이소프렌 합성효소, 및 E. coli pgl (pBBR-pgl)의 높은 발현을 포함하는 대장균 BL21(DE3) 세포를 사용하여 15-L 생물반응기에서 수행되었다. 본 실험은 원하는 발효 pH 7.0 및 온도 34℃에서 포도당으로부터 이소프렌 형성을 감시하도록 수행되었다. 대장균 균주의 냉동 바이알은 해동되었고 트립톤-효모추출물 배지 내에 접종되었다. 접종액이 550 nm에서 측정되어 OD 1.0까지 된 이후에, 500 mL 이 초기 부피가 5-L가 되는15-L 생물반응기를 접종하는 데 사용되었다.
포도당은 세포가 안정상에 도달할 때까지 지수적 속도로 첨가되었다. 이 시점 이후 포도당 첨가는 대사적 요구를 만족시키기 위해 감소되었다. 40시간 (59시간) 발효 동안 생물반응기로 운반된 포도당의 전체 양은 3.1 kg (59시간에서는 4.2 kg)이었다. 유도는 IPTG를 첨가하여 달성되었다. IPTG 농도는 광학 밀도가 550 nm (OD550)에서 4값에 도달할 때 110 μM가 되었다. IPTG 농도는 OD550이 150에 도달할 때 192 μM로 올라갔다. 시간 경과에 따른 생물반응기의 OD550 프로파일은 도 164A에 나타나 있다. 생물반응기로부터 나온 배출기체에서 이소프렌의 수준은 하이덴 질량 분광측정기를 사용하여 결정되었다. 이소프렌의 역가는 발효과정의 경과에 따라 40시간에서 33.2 g/L (59시간에서는 48.6 g/L)의 최대값까지 증가되었다 (도 164B). 발효과정의 경과에 따른 이소프렌 역가는 40시간에서 40.0 g/L (59시간에서는 60.5 g/L)의 최대값까지 증가되었다 (도 164C). 40시간 발효 동안 생산된 이소프렌의 전체 양은 281.3 g (59시간에서는 451.0 g)이었고, 생산의 시간 과정은 도 164D에 나타나있다. 부피측정 생산도의 시간 경과는 도 164E에 나타나있고, 4 및 40 시간 사이에서 1.0g/L/시간의 평균 비율이 유지되었다 (19 및 59시간 사이에서는 1.0g/L/시간). 대사적 프로파일은 CER에 의해 측정된 바와 같이 도 164F에 나타나있다. 발효과정 동안 이소프렌을 생산하는 데 들어갔던 사용된 탄소의 몰라 수율은 40시간에서 19.6% (59시간에서는 23.6%)이었다. 포도당으로부터 나온 이소프렌의 무게 퍼센트 수율은 40시간에서 8.9% (59시간에서는 10.7%)이었다.
실시예 25:
M. mazei
메발로네이트 키나제,
P. alba
이소프렌 합성효소, pCL Upper MVA (
E. faecalis
mvaE와 mvaS) 및
ybhE
(pgl)를 발현하는 대장균 균주에서 이소프렌 및 수소의 공동-생산
발효 배출-기체의 수집 및 수소와 이소프렌 수준에 대한 분석
발효는 균주 RM111608-2 (E. coli BL21 (DE3), pCL Upper MVA, cmR-gi1.2-yKKDyI, pTrcAlba-mMVK, pBBR cmR-gi1.5-pgl) 및 EWL 256 (E. coli BL21 (DE3), pCL Upper MVA, cmR-gi1.2-yKKDyI, pTrcAlba-mMVK)를 사용하여 수행되었다. 박베타리 균주의 제작은 상기 실시예 23에 기술되어 있다.
대장균으로부터 이소프렌의 대량 생산은 M. mazei 메발로네이트 키나제, P. alba 이소프렌 합성효소, pCL Upper MVA (E. faecalis mvaE 와 mvaS)를 발현하고 ybhE (pgl)를 전신적으로 발현 (RM111608-2)하거나 ybhE (pgl) 를 정상적으로 발현 (EWL256)하는 E. coli 균주 EWL256 및 RM111608-2의 사료첨가-회분식 배양으로부터 조사되었다. 본 실험은 성장하는 세포가 포도당 존재 시 이소프렌과 수소를 공동-생산하게 되는 것을 보여준다.
발효 배지 (TM2) 리터 당 발효 배지의 레시피는 다음과 같다: K2HPO4 13.6 g, KH2PO4 13.6 g, MgSO4 * 7H2O 2 g, 시트르산 모노하이드레이트 2 g, 철 암모늄 시트르산 0.3 g, (NH4)2SO4 3.2g, 효모추출물 5 g, 1000X 변형된 미량 금속 용액1 ml. 1000X 변형된 미량 금속 용액: 시트르산 * H2O 40 g, MnSO4 * H2O 30 g, NaCl 10 g, FeSO4 * 7H2O 1 g, CoCl2 * 6H2O 1 g, ZnSO * 7H2O 1 g, CuSO4 * 5H2O 100 mg, H3BO3 100 mg, NaMoO4 * 2H2O 100 mg. 1000X 변형된 미량 금속 용액의 경우, 각 성분은 한 번에 하나씩 DIH2O에 녹이고, pH는 3.0으로 HCl/NaOH를 사용하여 조정한 다음 증류수로 부피를 맞추고 0.22 마이크론 (μm) 필터로 여과 멸균된다 (본 용액은 고압 멸균되지 않는다). TM2 발효 배지의 경우, 모든 성분은 다같이 첨가되었고, diH2O에 녹였으며, pH는 6.8에서 포타슘 하이드록사이드 (KOH)로 조정되어 부피를 q.s. 맞추었고, 배지는 0.22 마이크론 (μm) 필터로 여과 멸균되었다. 포도당은 99DE (덱스트로스와 동등함), 71% DS (건조 고형) 시럽으로서 카길 (Cargill)로부터 공급되었다.
발효는 상부 메발론산 (MVA) 경로 (pCL Upper MVA), 삽입된 상부 MVA 경로 (cmR-gi1.2-yKKDyI), M. mazei 로부터 메발로네이트 키나제 및 P. alba (pTrcAlba-mMVK)로부터 이소프렌 합성효소를 발현하고, ybhE (pgl) 를 전신적으로 발현 (RM111608-2)하거나 ybhE (pgl)를 정상적으로 발현 (EWL256)하는 E. coli 균주 EWL256 또는 RM111608-2를 사용하여 15-L 생물 반응기에서 수행되었다. 본 실험은 원하는 발효 조건 (pH 7.0 및 온도 34℃)에서 포도당으로부터 이소프렌의 형성을 감시하도록 수행되었다.
냉동 바이알로부터 가져온 적절한 E. coli 균주의 접종액이 펩톤-효모 추출물 배지에서 제조되었다. 접종액이 OD550 = 0.6이 된 이후에, 600 mL 이 TM2 배지를 포함하는 15-L 생물반응기를 접종하는 데 사용되었다. 포도당은 세포가 안정상에 도달할 때까지 지수적 속도로 첨가되었다. 이 시점 이후 포도당 첨가는 대사적 요구를 만족시키기 위해 감소되었다. 67시간 발효 동안 생물반응기로 운반된 포도당의 전체 양은 3.9 kg이었다. 유도는 이소프로필-베타-D-1-티오갈락토피라노사이드 (IPTG)를 첨가하여 달성되었다. IPTG 농도는 광학 밀도가 550 nm (OD550)에서 9값에 도달할 때 102 uM이 되었다. IPTG 농도는 OD550이 140에 도달할 때 192 uM로 올라갔다. 접종 이후 다양한 시간대에 시료가 수집되었고 생산된 이소프렌량은 하기에 기술된 바와 같이 결정되었다. 생물반응기로부터 나온 배출기체에서 수소, 질소, 산소, 이산화탄소, 및 이소프렌의 수준은 하기에 논의된 바와 같이 하이덴 HPR-20 질량 분광측정기를 사용하여 결정되었다.
15-L 생물반응기로부터 나온 발효 배출-기체의 시료는 바이알을 1 L배출기체/분 속도로 10초 동안 세척하여 (sparging) 20 mL 유리 상부공간 바이알 내로 수집되었고 테프론-코팅된 격막 (Agilent, CA)에 맞춘 금속 회전 뚜껑으로 밀봉되었다. 바이알은 수집 30분 이내에 분석되었다.
두 가지 시료의 분석은 하이덴 HPR-20 질량 분광측정기 (Hiden Analytics, U.K.) 내에 질량 분광측정기의 유입 튜브를 뚜껑이 없는 상부공간 바이알 내에 1-2분 동안 놓아두고 4 scc/분 (4 mL/분)의 속도로 주입하여 수행되었다. HPR-20 기기는 수소 (m/z 2), 질소 (m/z 28), 산소 (m/z 32), 이산화탄소 (m/z 44) 및 이소프렌 합성효소 (m/z 67)에 해당하는 질량을 스캔하도록 만들어졌다. 파라데이 검출기 (Faraday detector)가 질량28, 32, 44 및 67에 대해 사용되었다. SEM 검출기는 수소 (m/z 2)에 대해 사용되었다. 검출기 반응은 임의적 단위의 압력 (Torr)에서 측정되었다. 절대적 수소 수준은 실제 수소 기체 표준과 비교하여 평가되었다. 결과는 MASsoft V 6.21.0.51 소프트웨어 (Hiden Analytics, 영국)를 사용하여 기록되었다.
결과
배출-기체 시료가 두 가지 발효 진행으로부터 수집되었고 상기에 기술된 바와 같이 분석되었다:
A) 균주 RM111608-2 (E. coli BL21 (DE3), pCL upper, cmR-gi1.2-yKKDyI, pTrcAlba-mMVK, pBBR cmR-gi1.5-pgl). 시료는 발효가 혐기적으로 1 vvm 에서 질소 살포로 진행되고 있는 동안 64.8 시간대에 수집되어 분석되었다.
B) 균주 EWL256 (E. coli BL21 (DE3), pCL upper, cmR-gi1.2-yKKDyI, pTrcAlba-mMVK). 시료는 발효가 혐기적으로 1 vvm 에서 공기 살포로 진행되고 있는 동안 34.5 시간대에 수집되어 분석되었다.
결과는 도165A 및 165B에 나타나있다. 둘 다의 경우에서, 이소프렌, 산소 및 이산화탄소에 덧붙여 낮은 수준의 수소가 검출되었다. 수소에 대한 기저선 리딩은 0.95 x 10-8 Torr이었다. 시료 A 및 B 둘 다는 1.3 x 10-8 Torr 주변의 리딩값을 가졌다. 수소 표준과의 비교에 근거하여, 시료 A 및 B의 경우 배출-기체에 존재하는 수소의 양이 10 ppmv (백만 부피 당 부분) 이하이지만 기저선 초과인 것으로 평가되었다. 도 165A 및 165B에서 나타난 바와 같이, 시료 A 및 B 둘 다는 이소프렌과 이산화탄소의 유의한 양도 역시 포함하였다.
실시예 26:
M. mazei
메발로네이트 키나제,
P. alba
이소프렌 합성효소, pCL Upper MVA (
E. faecalis
mvaE와 mvaS) 및
ybhE
(pgl)를 발현하는 대장균 균주에서 이소프렌 및 수소의 공동-생산
발효 배출-기체의 수집 및 수소와 이소프렌 수준에 대한 분석
본 실험의 목적은 대장균의 조작된 균주에서 수소와 이소프렌을 공동-생산하는 것이다. 본 목적을 위해, 대장균 수소화효소-3를 인코딩하는 hyc 오페론의 일부가 본 명세서에서 기술된 RM111608-2와 같은 박테리아 균주라면 모두가 유사하게 변형될 수 있긴 하지만 본 명세서에서 기술된 바와 같이 제조된 균주 EWL256 [BL21 (DE3), pCL upper, cmR-gi1.2-yKKDyI, pTrcAlba-mMVK]에서 발현될 것이다. hyc 오페론 유전자 hycB (gi|16130631), hycC (gi|16130630), hycD (gi|16130629), hycE (gi|16130628), hycF (gi|16130627), 및 hycG (gi|16130626) 를 포함하는 발현 제작물이 공개적으로 사용가능한 유전자 서열에 의거하여 당해 기술분야에 숙지되어 있는 표준 클로닝 방법에 의해 제조되었고, 새로운 균주 EWL256+Hyd-3를 생산하도록 균주 EWL256 내에 도입되었다.
수소와 이소프렌의 공동-생산에 미치는 추가적인 돌연변이의 영향이 EWL256+Hyd-3에서, 수소화효소-3의 성숙 또는 조절에 관여하는 유전자를 도입에 의해 (예로, hycH (gi|16130625) 및 hycI (gi|16130624)), 수소 흡수 또는 전달에 관여하는 유전자 (예로, E. coli 수소화효소-1 (hya 오페론) 및 수소화효소-2 (hyb 오페론)) 또는 관련 단백질 (예로, 포르메이트 탈수소화효소 (fdhF (gi|16130624)), 포르메이트 용해효소의 억제인자 (hycA (gi|16130632)), 포르메이트 탈수소화제 N, 알파 소단위 (fdnG (gi|16129433)), 포르메이트 탈수소화효소 O, 큰 소단위 (fdoG (gi|16131734)), 나이트레이트 환원효소 (narG (gi|16129187)), 푸마레이트 환원효소 조절인자 (fnr (gi|16129295)), 및 아세틸-공효소 A 합성효소 (acs (gi|16131895)))의 불활성화 또는 결실에 의해, 수소화효소의 상승조절에 관여하는 유전자의 불활성화에 의해 (예로, 수소 포르메이트 용해효소의 활성인자 (fhlA (gi|16130638)), 발효 부산물의 생산에 관여하는 유전자 (예로, 락테이트 탈수소화효소 (ldhA (gi|16129341)), 푸마레이트 환원효소 막 단백질 (frdC (gi|16131977)), 알코올 탈수소화효소 (adhE (gi|16129202)), 피루베이트 산화효소 (poxB (gi|16128839)), 피루베이트 탈수소화효소 E1 능력있는 ackA/pta (aceE (gi|16128107)), 포르메이트 탈수소화효소 조절 단백질 (hycA (gi|16130632 )), 포르메이트 운반체 A와 B (FocA (gi|16128871) 및 FocB (gi|16130417))를 불활성화 또는 결실에 의해, 또는 수소 대사에 관여하는 이종유래 유전자 (예로, Clostridium acetobutylicum로부터 나온 글리세르알데하이드-3-포스페이트 탈수소화효소 (gapC (gi|15893997))의 발현에 의해, 단독 또는 조합하여 평가된다.
발효는 본 명세서에서 기술된 바와 같이 하나 이상의 돌연변이를 단독 또는 조합으로, 필수적으로 상기 실시예 25에서 기술된 바와 같이 포함하도록 변형된, 균주 EWL 256+Hyd-3 (BL21 (DE3), pCL upper, cmR-gi1.2-yKKDyI, pTrcAlba-mMVK and hycB-F)의 조작된 변이체를 사용하여 수행되었다. 수소와 이소프렌의 공동-생산은 필수적으로 상기에서 기술된 바와 같이 배출-기체 시료의 분석에 의해 평가된다. 균주는 이소프렌과 수소 공동-생산률에 근거하는 심화된 분석을 위해 선택된다.
달리 정의되지 않는 경우라면, 본 명세서에서 사용된 모든 기술적 및 과학적 용어의 의미는 본 발명이 속하는 기술분야에서 당업자에 의해 보편적으로 이해되는 것이다. Singleton, et al., Dictionary of Microbiology and Molecular Biology, 2nd ed., John Wiley and Sons, New York (1994), 및 Hale & Marham, The Harper Collins Dictionary of Biology, Harper Perennial, N.Y. (1991)은 본 발명에서 사용되는 많은 용어의 일반적인 사전으로 당업자에게 제공된다. 본 발명은 이들이 다양해질 수 있기 때문에 특정한 방법론, 프로토콜, 및 기술된 반응액에 제한되지 않는 것으로 이해된다. 당업자라면 또한 본 명세서에서 기술된 것과 유사하거나 동등한 방법 및 물질이라면 모두도 역시 본 발명을 시행하거나 테스트하는 데 사용될 수 있는 점을 인정할 것이다.
실시예 27: 쿠쥬 이소프렌 합성효소를 더한 상부 또는 상부 및 하부 메발론산 경로를 포함하는 대장균
fadR atoC
LS5218에서 지방산 또는 팜 오일로부터 나온 이소프렌 또는 메발로네이트의 생산
대장균 fadR atoC 균주 LS5218 (#6966)는 콜라이 유전적스톡 센터로부터 획득되었다. FadR는 지방산 분해효소를 인코딩하는 유전자의 발현을 음성적으로 조절하는 전사 억제인자 (transcription repressor)를 인코드한다 (Campbell et al., J. Bacteriol. 183: 5982-5990, 2001). AtoC는 AtoS가 아세토아세테이트 대사를 조정하는 두 가지-성분 조절 시스템에서 반응 조절인자이다. fadR atoC 균주는 지방산 분해 유전자의 전신 발현을 허용하고 긴 사슬 지방산을 긴-사슬 길이 폴리하이드록시알카노에이트 내로 통합시킨다. 팜 오일이 메발로네이트 또는 이소프렌 생산 둘 중 하나의 탄소원으로서 사용될 때, 팜 오일은 지방산을 더한 글리세롤으로 전환된다. 이를 위한 방법은 당해 기술분야에서 잘 알려져 있고 이것은 리파제 (예를 들어 돼지 췌장 리파제, 칸디다 루고사 (Candida rugosa) 리파제, 또는 기타 유사한 리파제)를 사용한 배양에 의해 효소적으로 또는 소듐 하이드록사이드와 같은 염기와의 비누화 (saponification)에 의해 화학적으로 시행될 수 있다.
i) 상부 메발론산 경로를 발현하는 대장균 fadR atoC 균주
WW4 균주는 표준 방법을 사용하여 pCLPtrcUpperPathway를 LS5218 내로 전기천공하여 만들어졌다 (Sambrooke et al., Molecular Cloning: A Laboratory Manual, 제 2판, 콜드 스프링 하버, 1989). 플라스미드의 도입은 세포가 탄소원으로서 C12 지방산 (FA) 또는 팜 오일 둘 중 하나를 보충한 TM3 배지에서 배양될 때 메발론산 (MVA)의 생산에 의해 전시되었다. 지방산으로부터 WW4에 의한 MVA의 생산을 나타내기 위하여, 밤샘 배양으로부터 얻은 세포는 0.25% C12 FA (시스마사 카탈로그 번호 # L9755)가 보충된 5 mL의 변형된 TM3 배지 (효모 추출물이 없는 TM3) 내에서 1 내지 100으로 희석되었다. MVA 생산의 첫 번째 표시 (24 mg/L)는 IPTG 유도된 세포 배양을 30℃에서 하룻밤 동안 배양한 이후에 드러났다. 생산은 3일 초과 기간 동안 최종 수준이 194 mg/L의 생산된 MVA까지 증가하였다. 오일로부터 WW4에 의한 MVA 생산을 나타내기 위하여, 밤샘 배양으로부터 나온 세포는 5 mL의 TM3 배지 당 200 mg의 소화된 팜 오일이 보충된 변형된 TM3 배지 내에서 1 내지 100으로 희석되었다. MVA 생산의 첫 번째 표시 (50 mg/L)는 IPTG 유도된 세포 배양을 30℃에서 하룻밤 동안 배양한 이후에 드러났다. 생산은 3일 초과 기간 동안 최종 수준이 500 mg/L의 생산된 MVA까지 증가하였다.
ii) 쿠쥬 이소프렌 합성효소를 더한 상부 및 하부 메발론산 경로를 발현하는 대장균 fadR atoC 균주
대장균 균주 WW4 (LS5218 fadR atoC pCLPtrcUpperPathway)가 pMCM118 [pTrcKKDyIkIS]로 형질전환되어 WW10를 획득하였다. 플라스미드의 도입은 균주가 TM3 및 포도당에서 배양되어 IPTG (100, 300, 또는 900 μM)로 유도되었을 때 이소프렌 생산의 입증에 의해 전시되었다. 균주는 IPTG에 상대적으로 민감하였고 심지어 100 μM IPTG에서는 유의한 성장 결함을 보여주었다. 이들 결과는 도 70A에 나타나있다.
도데칸산으로부터 이소프렌 생산을 테스트하기 위하여, WW10가 스펙트로마이신 (50 μg/ml), 및 카나마이신 (50 μg/ml)을 포함하는 LB 배지에서 200 rpm으로 진탕하면서 하룻밤 동안 배양되었다. 세포는 변형된 TM3 배지로 원심분리 및 본 배지를 사용한 그들의 원래 배양 부피에서의 재현탁에 의해 세척되었다. 본 시작 (starter) 배양으로부터 세척되고 재현탁된 세포는 0.125% C12 지방산 (시그마 카탈로그 번호 #L9755)을 포함하는 5 mL의 변형된 TM3 배지 내에서 1 내지 100 및 1 내지 10으로 희석되었다.
팜 오일로부터 메발로네이트 생산을 전시하기 위하여, 오일은 37℃에서 250 rpm으로 수 일 동안 리파제로 전-소화되어 지방산을 방출하였다 (가수분해의 입증은 튜브가 진탕되었을 때 형성되는 거품에 의해 판단되었다).
또한, 배양액은 세척된 세포를 팜 오일과 함께 테스트 튜브에 포함된 변형된 TM3 배지 내에서 1 내지 10으로 희석되는 것으로 설정되었다. 좀 더 나아가 튜브는 추가적 희석 없이 세척된 세포의 나머지 (2.5 mL)에 0.125% C12 FA을 추가하는 것으로 설정되었다 (생물전환). 250 rpm으로 진탕하면서 30℃에서 3.75 시간의 배양 이후에, 모든 배양액은 50 μM IPTG의 첨가에 의해 유도되었다. 배양은 200 μL의 각 배양액이 변형된 상부공간 분석법으로 이소프렌 축적에 대해 분석된 시점 이후에 (500 rpm으로 진탕하면서 30℃에서 1 시간 축적) 4시간 동안 계속되었다. 추가적인 이소프렌 분석법이 GCMS 분석 이전에 분석 유리 블록의 12 시간 배양에 의해 시행되었다. 유도된 배양액의 배양이 하룻밤 동안 계속되었고 200 μL 분량이 다시 이소프렌 생산에 대해 다음날 아침에 분석되었다. 이들 배양액의 분석은 유의한 수준의 이소프렌의 생산을 보여주었다. 가장 높은 수준의 이소프렌이 하룻밤 동안 배양되고 유도되었던 이후에 밤샘 시작 배양액으로부터 나온 1/10 희석으로 접종된 배양액에서 관찰되었다. 본 결과는 본 배양액이 계속 증식하였고 세포 밀도가 증가되었던 것을 제시한다. 이들 결과는 도 70B에 나타나있다. 세포 밀도는 지방산 현탁액이 혼탁한 모습을 가지기 때문에 직접적으로 측정될 수는 없었다. 본 배양액의 세포 밀도는 따라서 배양액의 분량을 도말하여 결정되었으며 8 x 107 콜로니 형성 단위를 보여주었다. 이것은 대략적으로 0.1의 OD600에 해당한다. 그럼에도 불구하고, 본 배양액은 유의한 이소프렌 생산을 제공하였다: 이소프렌은 본 실시예에서 기술된 경로가 없이는 유사한 균주의 경우에도 전혀 관찰되지 않는다.
실시예 28: 스트렙토마이세스 종에서 식물로부터 나온 이소프렌-합성효소의 발현
쿠쥬 이소프렌 합성효소에 대한 유전자가 플라스미드 pJ201:19813로부터 획득되었다. 플라스미드 pJ201:19813는 푸엘라리아 로바타 (Pueraia lobata) (Kudzu 식물)로부터 나온 이소프렌 합성효소를 인코드하고 슈도모나스 플루오레센스 (Pseudomonas fluorescens), 슈도모나스 푸티다 (Pseudomonas putida), 로도슈도모나스 팔루스트리스 (Rhodopseudomonas palustris) 및 코리네박테리움 (Corynebacterium)을 위해 코돈-최적화되었다 (도 79A 내지 79C (서열번호 123)). 플라스미드 pJ201:19813의 제한효소 NdeI 및 BamHI로의 소화는 스트렙토마이세스-대장균 셔틀 벡터 (Streptomyces-E.coli shuttle vector) pUWL201PW (Doumith et al., Mol. Gen. Genet. 264: 477-485, 2000; 도 71) 내로 결찰되었던 유전자 iso 19813을 방출하여 pUWL201_iso를 생성하였다. 성공적인 클로닝이 pUWL201_iso의 제한효소 분석에 의해 확인되었다. 이소프렌 합성효소 iso19813의 발현은 스트렙토마이세스 종에서 전신 발현을 허용하지만 대장균에서 발현은 허용하지 않는 erm-프로모터의 조절 하에 두었다.
PUWL201PW (삽입물 없음) 및 pUWL201_iso는 스트렙토마이세스 알부스 (Streptomyces albus) J1074 (Sanchez et al., Chem. Biol. 9:519-531, 2002)에 Hopwood et al., The John innes foundation, Norwich, 1985에 의해 기술된 바와 같은 원형질체 (protoplasts)의 형질전환에 의해 도입되었다.
200 μl 분량의 원형질체 현탁액이 1.9 μg의 pUWL201PW 또는 2.9 μg의pUWL201_iso로 형질전환되었다. 비-선택적 R5-아가 플레이트 상에서 28℃로 밤샘 배양한 이후에, 양성 형질전환체가 티오스트렙톤 (thiostrepton) (250 μg/ml)을 포함하는 R3-오버레이 아가에서 4일 동안 더 배양하여 선별되었다. 티오스트렙톤 저항성 형질전환체가 플라스미드 미니 키트 (퀴아젠사)를 사용하는 플라스미드 준비에 의해 pUWL-플라스미드의 존재에 대해 조사되었다. 준비된 플라스미드 DNA는 충분한 양의 플라스미드 DNA를 생성하도록 대장균 DH5α 내에 재도입되었고 제한효소 분석에 의해 분석되었다. 양성 형질전환체는 앰피실린-포함 L-아가 플레이트 상에서 선별되었고 삽입물 분석이 제한효소 NdeI 및 BamHI로 플라스미드 DNA의 소화에 의해 시행되었다. 이소프렌 합성효소는 양성 pUWL201 iso 클론에서 1.7 kb 단편으로서 확인되었고 반면 대조군 균주 (pUWL201PW)는 이러한 단편이 전혀 관찰되지 않았다.
S. 알부스의 야생형 균주 및 대조군 플라스미드 pUWL201PW 또는 이소프렌 합성효소를 인코딩하는 pUWL201_iso 를 포함하는 형질전환체가 이소프렌 형성에 대해 분석되었다. 균주는 티오스트렙톤 (200 μg/ml)의 존재 시 또는 부재 시 고체 배지 상에서 두 벌씩 고체 배지 상에서 (트립신 소이 액체배지 아가, TSB; 2.5 ml) 세포 배양되었고 밀봉된 상부-공간 바이알 (전체 부피 20 ml)에서 28℃로 4일 동안 배양되었다. 500 μl의 상부-공간 시료 (종말점 측정)가 SIM 모드에서 GC-MS에 의해 분석되었고, 이소프렌이 기준 보유 시간 및 분자적 질량 (67 m/z)에 따라 확인되었다. 상부-공간 시료에 존재하는 이소프렌은 이전에 생성된 측정 곡선에 의해 정량되었다. 야생형 S. 알부스 및 pUWL201PW를 보유하는 대조군 균주는 검출 한계 (0.04 - 0.07 ppm)보다 약간 높은 농도로 이소프렌을 생산하였던 반면, pUWL201_iso를 보유하는 S. 알부스는 대조군과 대비하여 적어도 10배 초과의 이소프렌을 생산하였다 (0.75 ppm; 도 72). 본 결과는 악티노마이세스 (Actinomycetes) 그룹의 원생생물에서 식물-유래 이소프렌 합성효소의 성공적인 발현을 나타낸다.
실시예 29: 바이오이소프렌
TM
의 회수
바이오이소프렌TM은 활성 탄소의 흡착에 의해 이에 이어지는 오프-라인 스트림의 탈착 및 농축에 의해 발효 배출-기체 스트림으로부터 나온 이소프렌의 비워냄이 연루된 두-단계 작동에 있는 4가지의 14-L 발효의 세트로부터 회수되어 액체 바이오이소프렌TM을 주었다 (도 166A 및 166B). 네 대의 발효기에 의해 생산된 바이오이소프렌TM의 전체량은 1150 g (16.9 mol)이었으며, 이 중에서 953 g (14 mol, 83%) 은 탄소 필터에 흡착되었다. 스트림 탈착/농축 단계 이후에, 회수된 액체 바이오이소프렌TM의 양은 810 g이었으며 전체 회수 수율은 70%에 해당하였다. 회수된 바이오이소프렌TM은 불순물의 존재에 대해 분석되었다.
바이오이소프렌
TM
액체의 분석 및 분순물 프로파일
회수된 바이오이소프렌TM 액체는 불순물의 성질 및 수준을 결정하도록 GC/MS 및 기체 크로마토그래피/발화 이온화 검출 (flame ionization detection) (GC/FID)에 의해 분석되었다. 산물은 > 99.5% 순수한 것으로 결정되었고 많은 소수의 성분에 더하여 여러가지 우세한 불순물을 포함하고 있었다. GC/FID 크로마토그램은 도 167에 나타나 있고, 불순물의 전형적인 수준은 표 19에 보여진다. 불순물 프로파일은 본 규모로 생산된 다른 바이오이소프렌TM 배치와 유사하였다. 표 19는 바이오이소프렌TM의 여러가지 배치에서 나타난 불순물의 성질 및 수준의 요약 정리를 나타낸다.
| 화합물 | 보유 시간 (분) | 농도 범위 | |
| GC/MS | GC/FID | ||
| 에탄올 | 1.59 | 11.89 | <50 ppm |
| 아세톤 | 1.624 | 12.673 | <100 ppm |
| 메타크롤레인 | 1.851 | 15.369 | <200 ppm |
| 메틸 비닐 케톤 | 1.923 | 16.333 | <20 ppm |
| 에틸 아세테이트 | 2.037 | 17.145 | 100 내지 800 ppm |
| 3-메틸-1,3-펜타디엔 | 2.27 | 18.875 | 50 내지 500 ppm |
| 메틸 비닐 옥시란 | 2.548 | 19.931 | <100 ppm |
| 이소프레놀 | 2.962 | 21.583 | <500 ppm |
| 3-메틸-1-부탄올 | 2.99 | 21.783 | <50 ppm |
| 3-헥센-1-올 | 4.019 | 24.819 | <100 ppm |
| 이소펜테닐 아세테이트 | 4.466 | 25.733 | 200 to 1000 ppm |
| 3-헥센-1-일 아세테이트 |
5.339 | 27.223 | <400 ppm |
| 리모넨 | 5.715 | 27.971 | < 500 ppm |
| 기타 고리형 화합물 | 5.50 - 6.50 | 27.5 - 28.0 | <200 ppm |
흡착제로의 처리에 의한 바이오이소프렌
TM
의 정제
흡착제는 탄화수소 공급원료로부터 미량 불순물의 제거를 위한 산업에 의해 널리 사용되고 있다. 적합한 흡착제로는 제올라이트, 알루미나 및 실리카-기초 물질을 포함한다. 바이오이소프렌TM은 실리카겔 위에 통과에 의해, 또한 더 적은 정도로 알루미나를 사용하여 실질적으로 정제될 수 있다. 도 168은 처리 이전 (A) 또한 알루미나 (B) 또는 실리카 (C)로 처리하기 이후에 바이오이소프렌TM의 GC/FID 크로마토그램을 보여준다. BASF로부터 나온 셀렉스소브TM (SelexsorbTM) 흡착제 제품은 바이오이소프렌TM으로부터 나온 극성 불순물의 제거를 위해 선택되는 흡착제의 하나이다. 상세하게는, 설렉스소브 CD 및 CDX 제품은 이소프렌 및 부타디엔 공급원료로부터 극성 불순물의 제거를 위한 그들의 입증된 유용성이 있기 때문에 바람직하다.
실시예 30: 바이오이소프렌
TM
의 화학적 변환
화합물 및 용매는 시그마 알드리치사 (미국 WI)로부터 받아서 사용하였다. 바이오이소프렌TM은 이소프렌 합성효소 및 이종유래 메발론산 (MVA) 이소프렌 전구체 생합성 경로를 발현하는 대장균 BL21 균주의 발효에 의해 생산되었다. 바이오이소프렌은 조, 액체 이소프렌을 획득하도록 활성 탄소에 흡착에 의해, 이어지는 수증기 탈착 및 농축에 의해 발효 배출-기체로부터 회수되었다. 바이오이소프렌은 사용 전 바로 분획 증류법에 의해 정제되었다.
1
H NMR 분석법
양성자 Proton (1H) 핵 자기 공명 (NMR) 스펙트럼이 배리안 VNMRS 500 MHz NMR 시스템 상에서 기록되었다. 모든 NMR 스펙트럼은 테트라메틸실란 (TMS, 0 ppm) 또는 클로로포름 (CHCl3, 7,26 ppm)을 기준으로 하였고 피크 빈도는 달리 특정되지 않는 경우라면 ppm 단위로 기록되었다. 시료는 중수소 클로로포름 (CDCl3) 또는 메탄올 (CD3OD) 둘 중 하나에서 진행되었다.
GC/MS 분석법
분석은 상부공간 모드에서 작동하는 CTC 분석법 (스위스) CombiPAL 자동시료수집기가 내장된 애질런트 6890 GC/MS 시스템을 사용하여 수행되었다. 애질런트 HP-5MS GC/MS 컬럼 (30 m x 0.25 mm; 0.25 μm의 필름 두께)가 분석물의 분리를 위해 사용되었다. 자동시료수집기는 10 μL 액체 주사기로부터 1 μl의 액체 시료를 주입하도록 설정되었다. GC/MS 방법은 운반 기체로서 헬륨을 1 mL/분의 유속으로 사용하였다. 주입 포트는 250℃에서 100 : 1의 간격 비율 (split ratio)로 유지되었다. 오븐 프로그램은 50℃에서 2분 동안 시작되었고, 25℃/분의 속도로 225℃까지 증가하였으며, 10분의 전체 진행 시간 동안 1분의 유지 (hold)가 이어졌다. 애질런트 5793N 질량 선택 검출기 (mass selective detector)는 스캔 모드에서 m/z 29로부터 500까지 진행되었다. 1.5분의 용매 지연이 시행되었다. 이들 조건 하에서 이소프렌 (2-메틸-1,3-부타디엔)은 0.675분에서 용출되는 것이 관찰되었다.
GC/FID 분석법
분석은 액체 모드에서 작동하는 CTC 분석법 (스위스) CombiPAL 자동시료수집기가 내장된 애질런트 6890 GC/FID 시스템을 사용하여 수행되었다. 애질런트 DB-Petro GC 컬럼 (100 m x 0.25 mm; 0.50 μm의 필름 두께)가 분석물의 분리를 위해 사용되었다. 자동시료수집기는 10 μL 액체 주사기로부터 1 μl의 액체 시료를 주입하도록 설정되었다. GC/FID 방법은 운반 기체로서 헬륨을 1 mL/분의 유속으로 사용하였다. 주입 포트는 200℃에서 50 : 1의 간격 비율 (split ratio)로 유지되었다. 오븐 프로그램은 50℃에서 15분 동안 시작되었고, 25℃/분의 속도로 250℃까지 증가하였으며, 33분의 전체 진행 시간 동안 10분의 유지 (hold)가 이어졌다. FID 검출기는 280℃에서 불변 제조 모드 (Constant makeup mode)를 사용하여 35 mL/분의 수소 유속 및 250 mL/분의 공기 유속으로 유지되었다. 이들 조건 하에서 이소프렌 (2-메틸-1,3-부타디엔)은 13.54분에서 용출되는 것이 관찰되었다.
I. 열 디엘-알더 고리부가를 통한 이소프렌의 고리형 이중체의 제조
이소프렌 (1.02 g, 0.015 mole)은 열 이중합의 저해제로서 작용하는 2,6-디-터르-4-메틸페놀 (0.165 g, 0.05 mole)의 존재 시 150℃에서 24시간 동안 가열되었다. 반응은 진공 오븐에서 반응 이전에 24시간 동안 건조되었던 밀봉된 두꺼운-벽을 가진 유리 반응 용기에서 수행되었다. 빈응의 진행은 질량-분광분석 검출기 (GC/MS)를 가진 기체 크로마토그래피에 의해 감시되었다. 반응이 끝난 이후에, 그 결과 얻은 이성질체의 혼합물은 헥산을 용출용매로 가진 실리카겔 크로마토그래피를 사용하여 정제되었다. 회전 진공 증발기 상의 농축에 이어서, 산물은 GC-MS 및 1H-NMR에 의해 특성분석되었다. . GC-MS: 산물 A: 5.17, 5.19분; 산물 B: 5.72, 5.74분; 산물 C: 6.11분. 1H-NMR (CDCl3)δ: 5.8 (m); 5.4 (m); 4.95 (m); 2.4-1.2 (m).
II. Pd-촉매된 올리고중합을 통한 이소프렌 올리고체의 제조
이소프렌 (2.03 g, 0.03 mole)은 밀봉된 두꺼운-벽을 가진 유리 반응 용기에서 이소프로판올 (1.79 g, 0.03 mole)과 혼합되었다. 반응 이전에 유리 체임버는 진공 오븐에서 24시간 동안 건조되었다. 모든 반응액의 트랜스퍼가 불활성 질소 대기 하에서 시행되었다. 팔라듐 아세틸아세토네이트 (0.55 mg, 0.06 mmole) 및 트리페닐포스파인 (1.49 mg, 0.19 mmol)이 반응 혼합물에 첨가되었다. 그 다음 반응 체임버는 자기 교반기를 사용하여 혼합하면서 100℃에서 24시간 동안 가열되었다. 반응의 경과는 GC-MS에 의해 분석되었다. 일단 반응이 끝나면, 산물은 헥산을 용출용매로 가진 실리카겔 크로마토그래피를 사용하여 정제되었다. 최종 산물은 GC-MS 및 1H-NMR에 의해 특성분석되었다. GC-MS: 산물 A: 5.54 분; 산물 B: 6.6분; 산물 C: 6.85분.
III. 불포화된 화합물의 수소화
실시예 2 (1.36 g, 0.01 mole)에서 획득된 이성질체의 혼합물은 자기 교반기를 장착하고 수소화 촉매 (Pd/C, 5 wt%) (0.21 g, 0.1 mmol)를 포함하는 유리 체임버에 놓아둔다. 모든 유리 용기는 실험을 수행하기 이전에 진공 건조되었다. 수소 기체가 시스템 내에 도입되었고 압력은 3 기압으로 유지되었다. 몇 시간 이후에 반응 혼합물 Pd/C는 반응 혼합물로부터 여과되었고 산물은 실리카겔 크로마토그래피를 사용하여 분리되었다. 최종 분석은 GC/MS 및 NMR에 의해 시행되었다.
IV. 이소프렌의 에톡시화된 유도체의 제조
이소프렌 (0.982 g, 0.014 mole)은 자기 교반기를 장착한 두꺼운 유리벽 체임버에서 완전 에탄올 (0.665 g, 0.014 mol)과 혼합되었다. 농축된 황산의 촉매적 양이 반응 혼합물에 첨가되었고, 이어서 85℃에서 하룻밤 동안 교반되었다. 반응의 진행은 GC-MS에 의해 감시되었다. 가열하고 16시간 이후에 GC-MS 추적은 다음의 보유 시간을 가지는 이성질체의 혼합물의 존재를 드러냈다: 산물 A: 2.66분 m/z+ = 99; 산물 B: 3.88 m/z+ = 99, 114; 산물 C: 5.41분, m/z+ = 87, 99, 114.
V. 루테늄 촉매로 이소프렌의 C10 고리형 이중체로의 전환
이소프렌의 C10 고리형 이중체로의 전환은 루테늄 촉매를 사용하여 디메틸-사이클로옥타디엔의 혼합물로 탁월한 수율로 달성되어 왔다 (Itoh, Kenji; Masuda, Katsuyuki; Fukahori, Takahiko; Nakano, Katsumasa; Aoki, Katsuyuki; Nagashima, Hideo, Organometallics (1994), 13(3), 1020-9). 95% 이상의 전환이 매우 적당한 (moderate) 온도에서 (60℃ 정도로 낮음)에서 보고되어 있다. 촉매, 펜타메틸사이클로펜타디에닐-기초 루테늄 오가노금속 화합물은 루테늄 클로라이드 (RuCl3) 및 펜타메틸사이클로펜타디엔 (C5Me5H)을 시작 물질로 사용하는 간단한 두 단계로 제조될 수 있다. 이중합 반응을 위해 촉매는 은 트리플레이트 (silver triflate, AgOTf)로 활성화되어 활성이 있는 종을 생산하지만, 다른 활성인자도 마찬가지로 사용될 수 있다.
VI. 크롬 촉매로 이소프렌의 C15 삼중체로의 전환
이소프렌의 C10 고리형 삼중체로의 전환은 P-N-P 리간드, N,N-비스(디아릴포스피노)아민을 가진 크롬 촉매를 사용하여 수행될 수 있다. 촉매는 그대로 (in situ) 제조되고 이것은 Bowen, L.; Charernsuk, M.; Wass, D.F. Chem. Commun. (2007) 2835-2837에 기술된 바와 같이 MAO를 사용하여 활성화된다. 직선형 및 고리형 산물의 혼합물 (3 : 1)로 구성되는 C15 삼중체로의 이소프렌의 보고된 전환은 적당한 온도 (70℃)에서 95% 정도로 높다. 사중체 (tetramers)는 모든 경우에 주요한 기타 산물로서 확인되었다.
V. 이소프렌의 수소화
이소프렌 (10 mL의 순수 에탄올에 녹인 10% 용액 (v/v))은 H-큐브 수소화 장치 (탈러스나노사 (ThalesNano), 미국 NJ 프린스턴)를 사용하여 연속적 방식으로 2-메틸부탄 (이소펜탄)으로 수소화되었다. 이소프렌 용액은 70℃로 유지된 10% Pd/C 촉매 카트리지를 통하여 0.5 mL/분의 속도로 펌프되었다. 수소 기체는 1 기압에서 "완전 모드 (full mode)"를 사용하여 도입되었다. 산물은 수집되었고 1H NMR 및 GC/FID에 의해 분석되었으며, 이는 부분적으로 수소화된 소량의 모노-올레핀을 추가하여 90% 초과 수율로 2-메틸부탄으로 이소프렌의 전환을 확인해주었다. 1H NMR (500 MHz, CDCl3): δ 0.8 (m, 9H, CH 3 ); 1.12 (m, 2H, CH 2 ); 1.37 (m, 1H, CH). GC/FID: 2-메틸부탄; 보유 시간 = 12.69분.
VIII. 이소프렌의 부분적 수소화
바이오이소프렌TM 산물 (50 mL, 0.5 mol)은 톨루엔 (200 mL)과 혼합되었고 40℃ 및 5 bar 수소압에서 미디-큐브 수소화 장치 (탈레스나노사, 헝가리 부다페스트) 상의 5% Pd/C 촉매 위에서 부분적으로 수소화되었다. 기질 유속은 10 mL/분이었고 수소는 125 mM/분 (5 mmole/분)으로 운반되었다. 산물 스트림은 장치를 통해 2시간의 기간 동안 재순환되었고, 이후에 산물의 분량은 GC/MS 및 GC/FID에 의해 분석되었으며 시작 물질의 대부분이 이소펜탄 및 일정 미반응된 이소프렌에 추가하여 이소아밀렌 (2-메틸-1-부텐, 2-메틸-2-부텐 및 3-메틸-1-부텐)의 혼합물로 전환되었던 것을 보여주었다 (도 170).
IX. 바이오이소프렌
TM
산물의 선택적 수소화
바이오이소프렌TM 산물은 달걀껍질 Pd/δ-Al2O3 촉매를 사용하여 상기 실시예에서 인용된 조건 하에서 선택적으로 수소화되어 이소아밀렌의 혼합물을 주고, 이것은 GC/MS 분석법에 의해 결정된 바와 같이 2-메틸-2-부텐이 전체 이소아밀렌의 > 50%에 해당하는 우세한 산물이 되고, 3-메틸-1-부텐이 전체 이소아밀렌의 < 25%에 해당하는 소수의 산물이 된다. 이소프렌 및 잔존 이소프렌의 양은 전체 산물 스트림의 < 10% 에 해당한다. 유사한 결과가 탄소 촉매 상에 황화된 팔라듐이 반응을 수행하는 데 사용될 때 획득된다.
X. 기체 상에서 바이오이소프렌
TM
산물의 부분적 수소화
바이오이소프렌TM 산물을 포함하는 건조한 기체 스트림이 약간 과다량의 수소 기체 (mol/mol)와 혼합되고 기체성 혼합물은 미국 특허출원 제 20090203520호에서 기술된 바와 같이 높은 공극 부피를 가지는 그룹 IB-촉진된 팔라듐 촉매와 같은 비균질 수소화 촉매 위를 통과하여 이소아밀렌의 혼합물 및 바이오이소프렌TM 산물이 원래 유래한 발효 공정으로부터 유래한 하나 이상의 불순물을 생산한다. 전환은 0.5로부터 200 bar까지 범위의 압력 및 0℃로부터 200℃까지의 온도에서 수행된다.
XI. 고체 산 촉매로 이소아밀렌의 이중합
2-메틸-2-부텐 (1.5 mL) 및 톨루엔 (4 mL)은 앰버리스트 15 산 레진 (186 mg)으로 12시간 동안 상온에서 교반되었다. 분량 (500 μL)이 반응 혼합물로부터 제거되었고 GC 바이알로 이동되었다. 혼합물의 분석은 GC/MS (도 171)에 의해 수행되었고 바이오이소프렌TM 성분으로서 적합한 C10 이중체 (디이소아밀렌)으로 부분적 전환을 드러냈다.
이중합 반응의 산물 (디이소아밀렌, C10 디메이트)은 임의적으로 실시예 30 제 VII부에 기술된 조건 하에서 또는 올레핀의 이소파라핀으로 수소화를 위한 당해 기술분야에 알려져 있는 조건을 통해서 [예를 들어, Marichonna (2001)을 참조하라] 전부 수소화된다.
XII. 고체 산 촉매로 바이오이소프렌
TM
산물의 연속적 올리고중합
바이오이소프렌TM 단일체는 앰버리스트 15 이온 교환 레진 또는 동등한 촉매를 포함하는 이중합 반응기에서 C10 이중체 및 C15 삼중체로 연속적으로 전환된다. 바이오이소프렌TM 공급 스트림은 바이오이소프렌TM 단일체를 포함하고, 임의적으로 바이오이소프렌TM과 보조-용매의 C5 유도체를 포함한다. 공정은 20으로부터 200℃까지 범위의 온도 및 0.5로부터 200 bar까지의 압력에서 시행된다. 이중합 단계의 산물은 첫 번째 분획 컬럼에서 분획되어 미반응된 이소프렌을 고차 (> C5) 올리고머로부터 분리된다. C5 분획은 이중합 반응기로 돌아가서 무거운 > C5 분획은 원하는 C10/C15 분획이 상부 스트림으로부터 수집되는 두 번째 분획법 내로 도입된다. > C15 올리고머로 구성되는 저부 분획은 Grubbs 2세대 촉매와 같은 상호교환 촉매 (metathesis catalyst)를 포함하는 재순환 (heavy recycle) 반응기 내로 공급된다. 상호교환 촉매는 고차 올리고머 분획의 일부분을 도 173에 나타난 바와 같이 분획 컬럼 #1 내로 연속하여 공급되는 올레핀 교차-상호교환 반응에 의해 더 가벼운 성분으로 전환시킨다.
전체적으로, 공정은 실시예 30, 제 VII부에서 기술된 조건 하에서 다음으로 부분적 또는 완전한 수소화에 들어가는 C10 이중체 및 C15 삼중체 바이오이소퓨얼TM 전구체로의 바이오이소프렌 단일체의 전환을 유도한다. 그 결과 얻은 부분적으로 또는 전부 포화된 화합물은 바이오이소퓨얼TM 조성물로서 또한 바이오이소퓨얼TM 혼합원료로서 적합하다.
실시예 31:
13
C/
12
C 동위원소 분석
13C 분석은 코스테크 ECS4010 원소 분석기 (Costech ECS4010 Elemental Analyzer)를 써모피니간 델타 플러스 XP (ThermoFinnigan Delta Plus XP) 동위원소 비율 질량 분광분석기를 위한 인렛으로서 사용하여 탄소 동위원소 분석을 위한 주석 컵 내로 0.5 내지 1.0 mg 시료를 로딩하여 시행될 수 있다. 연소 기체가 헬륨 스트림에서 구리 반응기 (650℃)를 통하여 85 mL/분으로 통과되면서 시료는 1020℃에서 4가 코발트/2가 코발트 옥사이드 연소 반응기 내에 점적되어, NOx를 N2로 전환시키고, N2는 3-m 5Å 분자적 체 컬럼을 사용하여 분리된다. 그 다음 13C/12C 비율이 T. B. Coplen et al, New Guidelines for δ13C Measurements, Anal. Chem., 78, 2439-2441 (2006)의 두 가지 표준 접근법을 사용하는 오프-라인 연소 및 이중-인렛 분석 (dual-inlet analysis)에 의해 VPDB 척도로 조심스럽게 측정되었던 두 가지 실험실 표준 (아세트아닐리드 B, -29.52 ± 0.02‰m 및 옥수수전분 A, -11.01 ± 0.02‰)을 사용하여 VPDB 척도로 측정된다. 코프란 (Coplen)의 지도 (teachings)가 본 명세서에서 δ13C 값을 결정하는 기법을 가르칠 목적을 위해 참고문헌으로 통합되어 있다.
2008년 6월 30일에 제출된 미국 가특허출원 제 61/133,521호 및 국제특허출원 공개 제 WO 2010/05525 A1호는 공급원료 및 다양한 출처로부터 유래한 이소프렌의 중합체들을 위한 δ13C 값을 표 20에 나열된 것들을 포함하여 나열하고 있다.
| 시료 | δ 13 C |
| 팜오일 | -30.00 |
| 효모 추출물 | -25.70 |
| 추출적 증류로부터 얻은 시판되는 폴리이소프렌 | -23.83 |
| 연목질 펄프로부터 얻은 슈가 | -23.00 |
| 이소프렌 시료 B로부터 얻은 폴리이소프렌 (에멀젼 다중합) | -19.67 |
| 역슈가 | -15.37 |
| 이소프렌 시료 A로부터 얻은 폴리이소프렌 (네오디뮴 촉매) | -14.85 |
| 바가스로부터 얻은 포도당 | -13.00 |
| 옥수수 스토버로부터 얻은 포도당 | -11.20 |
| 옥수수 전분 | -11.10 |
| 포도당 | -10.73 |
실시예 32: 대표적인 연료 특성
표 21은 본 명세서에서 기술된 방법을 사용하여 이소프렌으로부터 만들어질 수 있는 소정의 화합물의 연료 특성을 나열하고 있다.
본 명세서에서 제공된 제목은 본 발명의 명세서에 대한 참고문헌으로 전체적으로 설명되는 다양한 관점들 또는 구현예들의 제한은 아니다.
본 명세서에서 인용된 모든 출간물들, 특허 출원들, 및 특허들은 각각의 출간물, 특허 출원, 및 특허가 특정하여 또한 개별적으로 참고문헌으로 통합되는 것을 표시한 것처럼 본 명세서에서 참고문헌으로 통합된다. 상세하게는, 본 명세서에서 인용된 출간물 모두는 본 발명과 연관되어 사용될 수 있는 조성물 및 방법론을 기술하고 기재하는 목적으로 본 명세서에서 참고문헌으로 명백하게 통합되어 있다. 전술한 발명이 명확한 이해의 목적으로 설명과 예시가 어느 정도 상세하게 기술되었을지라도, 이것은 소정의 변화와 변형이 첨부된 청구항의 정신 또는 범위로부터 벗어나지 않고 만들어질 수 있다는 본 발명의 가르침에 비추어 당업자에게 명백한 것이 될 것이다.
부록 1
대표적인 1-데옥시-D-자일루로스-5-포스페이트 합성효소 및 폴리펩타이드
대표적인 아세틸-CoA-아세틸전이효소 핵산 및 폴리펩타이드
대표적인 HMG-CoA 합성효소 핵산 및 폴리펩타이드
대표적인 하이드록시메틸글루타릴-CoA 환원효소 핵산 및 폴리펩타이드
대표적인 메발로네이트 키나제 핵산 및 폴리펩타이드
대표적인 포스포메발로네이트 키나제 핵산 및 폴리펩타이드
대표적인 디포스포메발로네이트 탈탄산효소 핵산 및 폴리펩타이드
대표적인 이소펜테닐 포스페이트 키나제 (IPK) 핵산 및 폴리펩타이드
대표적인 이소펜테닐-디포스페이트 델타-이소머라제 (IDI) 핵산 및 폴리펩타이드
대표적인 이소프렌 합성효소 핵산 및 폴리펩타이드
진뱅크 기탁번호
AY341431
AY316691
AY279379
AJ457070
AY182241
<110> Danisco US Inc.
MCAULIFFE, Joseph C.
PARAMONOV, Sergey E.
SANFORD, Karl J.
<120> FUEL COMPOSITIONS COMPRISING ISOPRENE DERIVATIVES
<130> 643842001440
<140> Not Yet Assigned
<141> 2010-06-17
<150> PCT/US2010/039088
<151> 2010-06-17
<150> 61/187,959
<151> 2009-06-17
<160> 142
<170> FastSEQ for Windows Version 4.0
<210> 1
<211> 1701
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 1
atgtgtgcga cctcttctca atttactcag attaccgagc ataattcccg tcgttccgca 60
aactatcagc caaacctgtg gaatttcgaa ttcctgcaat ccctggagaa cgacctgaaa 120
gtggaaaagc tggaggagaa agcgaccaaa ctggaggaag aagttcgctg catgatcaac 180
cgtgtagaca cccagccgct gtccctgctg gagctgatcg acgatgtgca gcgcctgggt 240
ctgacctaca aatttgaaaa agacatcatt aaagccctgg aaaacatcgt actgctggac 300
gaaaacaaaa agaacaaatc tgacctgcac gcaaccgctc tgtctttccg tctgctgcgt 360
cagcacggtt tcgaggtttc tcaggatgtt tttgagcgtt tcaaggataa agaaggtggt 420
ttcagcggtg aactgaaagg tgacgtccaa ggcctgctga gcctgtatga agcgtcttac 480
ctgggtttcg agggtgagaa cctgctggag gaggcgcgta ccttttccat cacccacctg 540
aagaacaacc tgaaagaagg cattaatacc aaggttgcag aacaagtgag ccacgccctg 600
gaactgccat atcaccagcg tctgcaccgt ctggaggcac gttggttcct ggataaatac 660
gaaccgaaag aaccgcatca ccagctgctg ctggagctgg cgaagctgga ttttaacatg 720
gtacagaccc tgcaccagaa agagctgcaa gatctgtccc gctggtggac cgagatgggc 780
ctggctagca aactggattt tgtacgcgac cgcctgatgg aagtttattt ctgggcactg 840
ggtatggcgc cagacccgca gtttggtgaa tgtcgcaaag ctgttactaa aatgtttggt 900
ctggtgacga tcatcgatga cgtgtatgac gtttatggca ctctggacga actgcaactg 960
ttcaccgatg ctgtagagcg ctgggacgtt aacgctatta acaccctgcc ggactatatg 1020
aaactgtgtt tcctggcact gtacaacacc gttaacgaca cgtcctattc tattctgaaa 1080
gagaaaggtc ataacaacct gtcctatctg acgaaaagct ggcgtgaact gtgcaaagcc 1140
tttctgcaag aggcgaaatg gtccaacaac aaaattatcc cggctttctc caagtacctg 1200
gaaaacgcca gcgtttcctc ctccggtgta gcgctgctgg cgccgtctta cttttccgta 1260
tgccagcagc aggaagacat ctccgaccac gcgctgcgtt ccctgaccga cttccatggt 1320
ctggtgcgtt ctagctgcgt tatcttccgc ctgtgcaacg atctggccac ctctgcggcg 1380
gagctggaac gtggcgagac taccaattct atcattagct acatgcacga aaacgatggt 1440
accagcgagg aacaggcccg cgaagaactg cgtaaactga tcgacgccga atggaaaaag 1500
atgaatcgtg aacgcgttag cgactccacc ctgctgccta aagcgttcat ggaaatcgca 1560
gttaacatgg cacgtgtttc ccactgcacc taccagtatg gcgatggtct gggtcgccca 1620
gactacgcga ctgaaaaccg catcaaactg ctgctgattg accctttccc gattaaccag 1680
ctgatgtatg tctaactgca g 1701
<210> 2
<211> 6080
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 2
gtttgacagc ttatcatcga ctgcacggtg caccaatgct tctggcgtca ggcagccatc 60
ggaagctgtg gtatggctgt gcaggtcgta aatcactgca taattcgtgt cgctcaaggc 120
gcactcccgt tctggataat gttttttgcg ccgacatcat aacggttctg gcaaatattc 180
tgaaatgagc tgttgacaat taatcatccg gctcgtataa tgtgtggaat tgtgagcgga 240
taacaatttc acacaggaaa cagcgccgct gagaaaaagc gaagcggcac tgctctttaa 300
caatttatca gacaatctgt gtgggcactc gaccggaatt atcgattaac tttattatta 360
aaaattaaag aggtatatat taatgtatcg attaaataag gaggaataaa ccatgtgtgc 420
gacctcttct caatttactc agattaccga gcataattcc cgtcgttccg caaactatca 480
gccaaacctg tggaatttcg aattcctgca atccctggag aacgacctga aagtggaaaa 540
gctggaggag aaagcgacca aactggagga agaagttcgc tgcatgatca accgtgtaga 600
cacccagccg ctgtccctgc tggagctgat cgacgatgtg cagcgcctgg gtctgaccta 660
caaatttgaa aaagacatca ttaaagccct ggaaaacatc gtactgctgg acgaaaacaa 720
aaagaacaaa tctgacctgc acgcaaccgc tctgtctttc cgtctgctgc gtcagcacgg 780
tttcgaggtt tctcaggatg tttttgagcg tttcaaggat aaagaaggtg gtttcagcgg 840
tgaactgaaa ggtgacgtcc aaggcctgct gagcctgtat gaagcgtctt acctgggttt 900
cgagggtgag aacctgctgg aggaggcgcg taccttttcc atcacccacc tgaagaacaa 960
cctgaaagaa ggcattaata ccaaggttgc agaacaagtg agccacgccc tggaactgcc 1020
atatcaccag cgtctgcacc gtctggaggc acgttggttc ctggataaat acgaaccgaa 1080
agaaccgcat caccagctgc tgctggagct ggcgaagctg gattttaaca tggtacagac 1140
cctgcaccag aaagagctgc aagatctgtc ccgctggtgg accgagatgg gcctggctag 1200
caaactggat tttgtacgcg accgcctgat ggaagtttat ttctgggcac tgggtatggc 1260
gccagacccg cagtttggtg aatgtcgcaa agctgttact aaaatgtttg gtctggtgac 1320
gatcatcgat gacgtgtatg acgtttatgg cactctggac gaactgcaac tgttcaccga 1380
tgctgtagag cgctgggacg ttaacgctat taacaccctg ccggactata tgaaactgtg 1440
tttcctggca ctgtacaaca ccgttaacga cacgtcctat tctattctga aagagaaagg 1500
tcataacaac ctgtcctatc tgacgaaaag ctggcgtgaa ctgtgcaaag cctttctgca 1560
agaggcgaaa tggtccaaca acaaaattat cccggctttc tccaagtacc tggaaaacgc 1620
cagcgtttcc tcctccggtg tagcgctgct ggcgccgtct tacttttccg tatgccagca 1680
gcaggaagac atctccgacc acgcgctgcg ttccctgacc gacttccatg gtctggtgcg 1740
ttctagctgc gttatcttcc gcctgtgcaa cgatctggcc acctctgcgg cggagctgga 1800
acgtggcgag actaccaatt ctatcattag ctacatgcac gaaaacgatg gtaccagcga 1860
ggaacaggcc cgcgaagaac tgcgtaaact gatcgacgcc gaatggaaaa agatgaatcg 1920
tgaacgcgtt agcgactcca ccctgctgcc taaagcgttc atggaaatcg cagttaacat 1980
ggcacgtgtt tcccactgca cctaccagta tggcgatggt ctgggtcgcc cagactacgc 2040
gactgaaaac cgcatcaaac tgctgctgat tgaccctttc ccgattaacc agctgatgta 2100
tgtctaactg cagctggtac catatgggaa ttcgaagctt tctagaacaa aaactcatct 2160
cagaagagga tctgaatagc gccgtcgacc atcatcatca tcatcattga gtttaaacgg 2220
tctccagctt ggctgttttg gcggatgaga gaagattttc agcctgatac agattaaatc 2280
agaacgcaga agcggtctga taaaacagaa tttgcctggc ggcagtagcg cggtggtccc 2340
acctgacccc atgccgaact cagaagtgaa acgccgtagc gccgatggta gtgtggggtc 2400
tccccatgcg agagtaggga actgccaggc atcaaataaa acgaaaggct cagtcgaaag 2460
actgggcctt tcgttttatc tgttgtttgt cggtgaacgc tctcctgagt aggacaaatc 2520
cgccgggagc ggatttgaac gttgcgaagc aacggcccgg agggtggcgg gcaggacgcc 2580
cgccataaac tgccaggcat caaattaagc agaaggccat cctgacggat ggcctttttg 2640
cgtttctaca aactcttttt gtttattttt ctaaatacat tcaaatatgt atccgctcat 2700
gagacaataa ccctgataaa tgcttcaata atattgaaaa aggaagagta tgagtattca 2760
acatttccgt gtcgccctta ttcccttttt tgcggcattt tgccttcctg tttttgctca 2820
cccagaaacg ctggtgaaag taaaagatgc tgaagatcag ttgggtgcac gagtgggtta 2880
catcgaactg gatctcaaca gcggtaagat ccttgagagt tttcgccccg aagaacgttt 2940
tccaatgatg agcactttta aagttctgct atgtggcgcg gtattatccc gtgttgacgc 3000
cgggcaagag caactcggtc gccgcataca ctattctcag aatgacttgg ttgagtactc 3060
accagtcaca gaaaagcatc ttacggatgg catgacagta agagaattat gcagtgctgc 3120
cataaccatg agtgataaca ctgcggccaa cttacttctg acaacgatcg gaggaccgaa 3180
ggagctaacc gcttttttgc acaacatggg ggatcatgta actcgccttg atcgttggga 3240
accggagctg aatgaagcca taccaaacga cgagcgtgac accacgatgc ctgtagcaat 3300
ggcaacaacg ttgcgcaaac tattaactgg cgaactactt actctagctt cccggcaaca 3360
attaatagac tggatggagg cggataaagt tgcaggacca cttctgcgct cggcccttcc 3420
ggctggctgg tttattgctg ataaatctgg agccggtgag cgtgggtctc gcggtatcat 3480
tgcagcactg gggccagatg gtaagccctc ccgtatcgta gttatctaca cgacggggag 3540
tcaggcaact atggatgaac gaaatagaca gatcgctgag ataggtgcct cactgattaa 3600
gcattggtaa ctgtcagacc aagtttactc atatatactt tagattgatt taaaacttca 3660
tttttaattt aaaaggatct aggtgaagat cctttttgat aatctcatga ccaaaatccc 3720
ttaacgtgag ttttcgttcc actgagcgtc agaccccgta gaaaagatca aaggatcttc 3780
ttgagatcct ttttttctgc gcgtaatctg ctgcttgcaa acaaaaaaac caccgctacc 3840
agcggtggtt tgtttgccgg atcaagagct accaactctt tttccgaagg taactggctt 3900
cagcagagcg cagataccaa atactgtcct tctagtgtag ccgtagttag gccaccactt 3960
caagaactct gtagcaccgc ctacatacct cgctctgcta atcctgttac cagtggctgc 4020
tgccagtggc gataagtcgt gtcttaccgg gttggactca agacgatagt taccggataa 4080
ggcgcagcgg tcgggctgaa cggggggttc gtgcacacag cccagcttgg agcgaacgac 4140
ctacaccgaa ctgagatacc tacagcgtga gctatgagaa agcgccacgc ttcccgaagg 4200
gagaaaggcg gacaggtatc cggtaagcgg cagggtcgga acaggagagc gcacgaggga 4260
gcttccaggg ggaaacgcct ggtatcttta tagtcctgtc gggtttcgcc acctctgact 4320
tgagcgtcga tttttgtgat gctcgtcagg ggggcggagc ctatggaaaa acgccagcaa 4380
cgcggccttt ttacggttcc tggccttttg ctggcctttt gctcacatgt tctttcctgc 4440
gttatcccct gattctgtgg ataaccgtat taccgccttt gagtgagctg ataccgctcg 4500
ccgcagccga acgaccgagc gcagcgagtc agtgagcgag gaagcggaag agcgcctgat 4560
gcggtatttt ctccttacgc atctgtgcgg tatttcacac cgcatatggt gcactctcag 4620
tacaatctgc tctgatgccg catagttaag ccagtataca ctccgctatc gctacgtgac 4680
tgggtcatgg ctgcgccccg acacccgcca acacccgctg acgcgccctg acgggcttgt 4740
ctgctcccgg catccgctta cagacaagct gtgaccgtct ccgggagctg catgtgtcag 4800
aggttttcac cgtcatcacc gaaacgcgcg aggcagcaga tcaattcgcg cgcgaaggcg 4860
aagcggcatg catttacgtt gacaccatcg aatggtgcaa aacctttcgc ggtatggcat 4920
gatagcgccc ggaagagagt caattcaggg tggtgaatgt gaaaccagta acgttatacg 4980
atgtcgcaga gtatgccggt gtctcttatc agaccgtttc ccgcgtggtg aaccaggcca 5040
gccacgtttc tgcgaaaacg cgggaaaaag tggaagcggc gatggcggag ctgaattaca 5100
ttcccaaccg cgtggcacaa caactggcgg gcaaacagtc gttgctgatt ggcgttgcca 5160
cctccagtct ggccctgcac gcgccgtcgc aaattgtcgc ggcgattaaa tctcgcgccg 5220
atcaactggg tgccagcgtg gtggtgtcga tggtagaacg aagcggcgtc gaagcctgta 5280
aagcggcggt gcacaatctt ctcgcgcaac gcgtcagtgg gctgatcatt aactatccgc 5340
tggatgacca ggatgccatt gctgtggaag ctgcctgcac taatgttccg gcgttatttc 5400
ttgatgtctc tgaccagaca cccatcaaca gtattatttt ctcccatgaa gacggtacgc 5460
gactgggcgt ggagcatctg gtcgcattgg gtcaccagca aatcgcgctg ttagcgggcc 5520
cattaagttc tgtctcggcg cgtctgcgtc tggctggctg gcataaatat ctcactcgca 5580
atcaaattca gccgatagcg gaacgggaag gcgactggag tgccatgtcc ggttttcaac 5640
aaaccatgca aatgctgaat gagggcatcg ttcccactgc gatgctggtt gccaacgatc 5700
agatggcgct gggcgcaatg cgcgccatta ccgagtccgg gctgcgcgtt ggtgcggata 5760
tctcggtagt gggatacgac gataccgaag acagctcatg ttatatcccg ccgtcaacca 5820
ccatcaaaca ggattttcgc ctgctggggc aaaccagcgt ggaccgcttg ctgcaactct 5880
ctcagggcca ggcggtgaag ggcaatcagc tgttgcccgt ctcactggtg aaaagaaaaa 5940
ccaccctggc gcccaatacg caaaccgcct ctccccgcgc gttggccgat tcattaatgc 6000
agctggcacg acaggtttcc cgactggaaa gcgggcagtg agcgcaacgc aattaatgtg 6060
agttagcgcg aattgatctg 6080
<210> 3
<211> 7404
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 3
ttctcatgtt tgacagctta tcatcgataa gctttaatgc ggtagtttat cacagttaaa 60
ttgctaacgc agtcaggcac cgtgtatgaa atctaacaat gcgctcatcg tcatcctcgg 120
caccgtcacc ctggatgctg taggcatagg cttggttatg ccggtactgc cgggcctctt 180
gcgggatatc cggatatagt tcctcctttc agcaaaaaac ccctcaagac ccgtttagag 240
gccccaaggg gttatgctag ttattgctca gcggtggcag cagccaactc agcttccttt 300
cgggctttgt tagcagccgg atccctgcag ttagacatac atcagctggt taatcgggaa 360
agggtcaatc agcagcagtt tgatgcggtt ttcagtcgcg tagtctgggc gacccagacc 420
atcgccatac tggtaggtgc agtgggaaac acgtgccatg ttaactgcga tttccatgaa 480
cgctttaggc agcagggtgg agtcgctaac gcgttcacga ttcatctttt tccattcggc 540
gtcgatcagt ttacgcagtt cttcgcgggc ctgttcctcg ctggtaccat cgttttcgtg 600
catgtagcta atgatagaat tggtagtctc gccacgttcc agctccgccg cagaggtggc 660
cagatcgttg cacaggcgga agataacgca gctagaacgc accagaccat ggaagtcggt 720
cagggaacgc agcgcgtggt cggagatgtc ttcctgctgc tggcatacgg aaaagtaaga 780
cggcgccagc agcgctacac cggaggagga aacgctggcg ttttccaggt acttggagaa 840
agccgggata attttgttgt tggaccattt cgcctcttgc agaaaggctt tgcacagttc 900
acgccagctt ttcgtcagat aggacaggtt gttatgacct ttctctttca gaatagaata 960
ggacgtgtcg ttaacggtgt tgtacagtgc caggaaacac agtttcatat agtccggcag 1020
ggtgttaata gcgttaacgt cccagcgctc tacagcatcg gtgaacagtt gcagttcgtc 1080
cagagtgcca taaacgtcat acacgtcatc gatgatcgtc accagaccaa acattttagt 1140
aacagctttg cgacattcac caaactgcgg gtctggcgcc atacccagtg cccagaaata 1200
aacttccatc aggcggtcgc gtacaaaatc cagtttgcta gccaggccca tctcggtcca 1260
ccagcgggac agatcttgca gctctttctg gtgcagggtc tgtaccatgt taaaatccag 1320
cttcgccagc tccagcagca gctggtgatg cggttctttc ggttcgtatt tatccaggaa 1380
ccaacgtgcc tccagacggt gcagacgctg gtgatatggc agttccaggg cgtggctcac 1440
ttgttctgca accttggtat taatgccttc tttcaggttg ttcttcaggt gggtgatgga 1500
aaaggtacgc gcctcctcca gcaggttctc accctcgaaa cccaggtaag acgcttcata 1560
caggctcagc aggccttgga cgtcaccttt cagttcaccg ctgaaaccac cttctttatc 1620
cttgaaacgc tcaaaaacat cctgagaaac ctcgaaaccg tgctgacgca gcagacggaa 1680
agacagagcg gttgcgtgca ggtcagattt gttctttttg ttttcgtcca gcagtacgat 1740
gttttccagg gctttaatga tgtctttttc aaatttgtag gtcagaccca ggcgctgcac 1800
atcgtcgatc agctccagca gggacagcgg ctgggtgtct acacggttga tcatgcagcg 1860
aacttcttcc tccagtttgg tcgctttctc ctccagcttt tccactttca ggtcgttctc 1920
cagggattgc aggaattcga aattccacag gtttggctga tagtttgcgg aacgacggga 1980
attatgctcg gtaatctgag taaattgaga agaggtcgca cacatatgac gaccttcgat 2040
atggccgctg ctgtgatgat gatgatgatg atgatgatga tggcccatgg tatatctcct 2100
tcttaaagtt aaacaaaatt atttctagag gggaattgtt atccgctcac aattccccta 2160
tagtgagtcg tattaatttc gcgggatcga gatctcgatc ctctacgccg gacgcatcgt 2220
ggccggcatc accggcgcca caggtgcggt tgctggcgcc tatatcgccg acatcaccga 2280
tggggaagat cgggctcgcc acttcgggct catgagcgct tgtttcggcg tgggtatggt 2340
ggcaggcccc gtggccgggg gactgttggg cgccatctcc ttgcatgcac cattccttgc 2400
ggcggcggtg ctcaacggcc tcaacctact actgggctgc ttcctaatgc aggagtcgca 2460
taagggagag cgtcgagatc ccggacacca tcgaatggcg caaaaccttt cgcggtatgg 2520
catgatagcg cccggaagag agtcaattca gggtggtgaa tgtgaaacca gtaacgttat 2580
acgatgtcgc agagtatgcc ggtgtctctt atcagaccgt ttcccgcgtg gtgaaccagg 2640
ccagccacgt ttctgcgaaa acgcgggaaa aagtggaagc ggcgatggcg gagctgaatt 2700
acattcccaa ccgcgtggca caacaactgg cgggcaaaca gtcgttgctg attggcgttg 2760
ccacctccag tctggccctg cacgcgccgt cgcaaattgt cgcggcgatt aaatctcgcg 2820
ccgatcaact gggtgccagc gtggtggtgt cgatggtaga acgaagcggc gtcgaagcct 2880
gtaaagcggc ggtgcacaat cttctcgcgc aacgcgtcag tgggctgatc attaactatc 2940
cgctggatga ccaggatgcc attgctgtgg aagctgcctg cactaatgtt ccggcgttat 3000
ttcttgatgt ctctgaccag acacccatca acagtattat tttctcccat gaagacggta 3060
cgcgactggg cgtggagcat ctggtcgcat tgggtcacca gcaaatcgcg ctgttagcgg 3120
gcccattaag ttctgtctcg gcgcgtctgc gtctggctgg ctggcataaa tatctcactc 3180
gcaatcaaat tcagccgata gcggaacggg aaggcgactg gagtgccatg tccggttttc 3240
aacaaaccat gcaaatgctg aatgagggca tcgttcccac tgcgatgctg gttgccaacg 3300
atcagatggc gctgggcgca atgcgcgcca ttaccgagtc cgggctgcgc gttggtgcgg 3360
atatctcggt agtgggatac gacgataccg aagacagctc atgttatatc ccgccgttaa 3420
ccaccatcaa acaggatttt cgcctgctgg ggcaaaccag cgtggaccgc ttgctgcaac 3480
tctctcaggg ccaggcggtg aagggcaatc agctgttgcc cgtctcactg gtgaaaagaa 3540
aaaccaccct ggcgcccaat acgcaaaccg cctctccccg cgcgttggcc gattcattaa 3600
tgcagctggc acgacaggtt tcccgactgg aaagcgggca gtgagcgcaa cgcaattaat 3660
gtaagttagc tcactcatta ggcaccggga tctcgaccga tgcccttgag agccttcaac 3720
ccagtcagct ccttccggtg ggcgcggggc atgactatcg tcgccgcact tatgactgtc 3780
ttctttatca tgcaactcgt aggacaggtg ccggcagcgc tctgggtcat tttcggcgag 3840
gaccgctttc gctggagcgc gacgatgatc ggcctgtcgc ttgcggtatt cggaatcttg 3900
cacgccctcg ctcaagcctt cgtcactggt cccgccacca aacgtttcgg cgagaagcag 3960
gccattatcg ccggcatggc ggccgacgcg ctgggctacg tcttgctggc gttcgcgacg 4020
cgaggctgga tggccttccc cattatgatt cttctcgctt ccggcggcat cgggatgccc 4080
gcgttgcagg ccatgctgtc caggcaggta gatgacgacc atcagggaca gcttcaagga 4140
tcgctcgcgg ctcttaccag cctaacttcg atcactggac cgctgatcgt cacggcgatt 4200
tatgccgcct cggcgagcac atggaacggg ttggcatgga ttgtaggcgc cgccctatac 4260
cttgtctgcc tccccgcgtt gcgtcgcggt gcatggagcc gggccacctc gacctgaatg 4320
gaagccggcg gcacctcgct aacggattca ccactccaag aattggagcc aatcaattct 4380
tgcggagaac tgtgaatgcg caaaccaacc cttggcagaa catatccatc gcgtccgcca 4440
tctccagcag ccgcacgcgg cgcatctcgg gcagcgttgg gtcctggcca cgggtgcgca 4500
tgatcgtgct cctgtcgttg aggacccggc taggctggcg gggttgcctt actggttagc 4560
agaatgaatc accgatacgc gagcgaacgt gaagcgactg ctgctgcaaa acgtctgcga 4620
cctgagcaac aacatgaatg gtcttcggtt tccgtgtttc gtaaagtctg gaaacgcgga 4680
agtcagcgcc ctgcaccatt atgttccgga tctgcatcgc aggatgctgc tggctaccct 4740
gtggaacacc tacatctgta ttaacgaagc gctggcattg accctgagtg atttttctct 4800
ggtcccgccg catccatacc gccagttgtt taccctcaca acgttccagt aaccgggcat 4860
gttcatcatc agtaacccgt atcgtgagca tcctctctcg tttcatcggt atcattaccc 4920
ccatgaacag aaatccccct tacacggagg catcagtgac caaacaggaa aaaaccgccc 4980
ttaacatggc ccgctttatc agaagccaga cattaacgct tctggagaaa ctcaacgagc 5040
tggacgcgga tgaacaggca gacatctgtg aatcgcttca cgaccacgct gatgagcttt 5100
accgcagctg cctcgcgcgt ttcggtgatg acggtgaaaa cctctgacac atgcagctcc 5160
cggagacggt cacagcttgt ctgtaagcgg atgccgggag cagacaagcc cgtcagggcg 5220
cgtcagcggg tgttggcggg tgtcggggcg cagccatgac ccagtcacgt agcgatagcg 5280
gagtgtatac tggcttaact atgcggcatc agagcagatt gtactgagag tgcaccatat 5340
atgcggtgtg aaataccgca cagatgcgta aggagaaaat accgcatcag gcgctcttcc 5400
gcttcctcgc tcactgactc gctgcgctcg gtcgttcggc tgcggcgagc ggtatcagct 5460
cactcaaagg cggtaatacg gttatccaca gaatcagggg ataacgcagg aaagaacatg 5520
tgagcaaaag gccagcaaaa ggccaggaac cgtaaaaagg ccgcgttgct ggcgtttttc 5580
cataggctcc gcccccctga cgagcatcac aaaaatcgac gctcaagtca gaggtggcga 5640
aacccgacag gactataaag ataccaggcg tttccccctg gaagctccct cgtgcgctct 5700
cctgttccga ccctgccgct taccggatac ctgtccgcct ttctcccttc gggaagcgtg 5760
gcgctttctc atagctcacg ctgtaggtat ctcagttcgg tgtaggtcgt tcgctccaag 5820
ctgggctgtg tgcacgaacc ccccgttcag cccgaccgct gcgccttatc cggtaactat 5880
cgtcttgagt ccaacccggt aagacacgac ttatcgccac tggcagcagc cactggtaac 5940
aggattagca gagcgaggta tgtaggcggt gctacagagt tcttgaagtg gtggcctaac 6000
tacggctaca ctagaaggac agtatttggt atctgcgctc tgctgaagcc agttaccttc 6060
ggaaaaagag ttggtagctc ttgatccggc aaacaaacca ccgctggtag cggtggtttt 6120
tttgtttgca agcagcagat tacgcgcaga aaaaaaggat ctcaagaaga tcctttgatc 6180
ttttctacgg ggtctgacgc tcagtggaac gaaaactcac gttaagggat tttggtcatg 6240
agattatcaa aaaggatctt cacctagatc cttttaaatt aaaaatgaag ttttaaatca 6300
atctaaagta tatatgagta aacttggtct gacagttacc aatgcttaat cagtgaggca 6360
cctatctcag cgatctgtct atttcgttca tccatagttg cctgactccc cgtcgtgtag 6420
ataactacga tacgggaggg cttaccatct ggccccagtg ctgcaatgat accgcgagac 6480
ccacgctcac cggctccaga tttatcagca ataaaccagc cagccggaag ggccgagcgc 6540
agaagtggtc ctgcaacttt atccgcctcc atccagtcta ttaattgttg ccgggaagct 6600
agagtaagta gttcgccagt taatagtttg cgcaacgttg ttgccattgc tgcaggcatc 6660
gtggtgtcac gctcgtcgtt tggtatggct tcattcagct ccggttccca acgatcaagg 6720
cgagttacat gatcccccat gttgtgcaaa aaagcggtta gctccttcgg tcctccgatc 6780
gttgtcagaa gtaagttggc cgcagtgtta tcactcatgg ttatggcagc actgcataat 6840
tctcttactg tcatgccatc cgtaagatgc ttttctgtga ctggtgagta ctcaaccaag 6900
tcattctgag aatagtgtat gcggcgaccg agttgctctt gcccggcgtc aacacgggat 6960
aataccgcgc cacatagcag aactttaaaa gtgctcatca ttggaaaacg ttcttcgggg 7020
cgaaaactct caaggatctt accgctgttg agatccagtt cgatgtaacc cactcgtgca 7080
cccaactgat cttcagcatc ttttactttc accagcgttt ctgggtgagc aaaaacagga 7140
aggcaaaatg ccgcaaaaaa gggaataagg gcgacacgga aatgttgaat actcatactc 7200
ttcctttttc aatattattg aagcatttat cagggttatt gtctcatgag cggatacata 7260
tttgaatgta tttagaaaaa taaacaaata ggggttccgc gcacatttcc ccgaaaagtg 7320
ccacctgacg tctaagaaac cattattatc atgacattaa cctataaaaa taggcgtatc 7380
acgaggccct ttcgtcttca agaa 7404
<210> 4
<211> 6266
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 4
cccgtcttac tgtcgggaat tcgcgttggc cgattcatta atgcagctgg cacgacaggt 60
ttcccgactg gaaagcgggc agtgagcgca acgcaattaa tgtgagttag ctcactcatt 120
aggcacccca ggctttacac tttatgcttc cggctcgtat gttgtgtgga attgtgagcg 180
gataacaatt tcacacagga aacagctatg accatgatta cgccaagctt gtatcgatta 240
aataaggagg aataaaccat gtgtgcgacc tcttctcaat ttactcagat taccgagcat 300
aattcccgtc gttccgcaaa ctatcagcca aacctgtgga atttcgaatt cctgcaatcc 360
ctggagaacg acctgaaagt ggaaaagctg gaggagaaag cgaccaaact ggaggaagaa 420
gttcgctgca tgatcaaccg tgtagacacc cagccgctgt ccctgctgga gctgatcgac 480
gatgtgcagc gcctgggtct gacctacaaa tttgaaaaag acatcattaa agccctggaa 540
aacatcgtac tgctggacga aaacaaaaag aacaaatctg acctgcacgc aaccgctctg 600
tctttccgtc tgctgcgtca gcacggtttc gaggtttctc aggatgtttt tgagcgtttc 660
aaggataaag aaggtggttt cagcggtgaa ctgaaaggtg acgtccaagg cctgctgagc 720
ctgtatgaag cgtcttacct gggtttcgag ggtgagaacc tgctggagga ggcgcgtacc 780
ttttccatca cccacctgaa gaacaacctg aaagaaggca ttaataccaa ggttgcagaa 840
caagtgagcc acgccctgga actgccatat caccagcgtc tgcaccgtct ggaggcacgt 900
tggttcctgg ataaatacga accgaaagaa ccgcatcacc agctgctgct ggagctggcg 960
aagctggatt ttaacatggt acagaccctg caccagaaag agctgcaaga tctgtcccgc 1020
tggtggaccg agatgggcct ggctagcaaa ctggattttg tacgcgaccg cctgatggaa 1080
gtttatttct gggcactggg tatggcgcca gacccgcagt ttggtgaatg tcgcaaagct 1140
gttactaaaa tgtttggtct ggtgacgatc atcgatgacg tgtatgacgt ttatggcact 1200
ctggacgaac tgcaactgtt caccgatgct gtagagcgct gggacgttaa cgctattaac 1260
accctgccgg actatatgaa actgtgtttc ctggcactgt acaacaccgt taacgacacg 1320
tcctattcta ttctgaaaga gaaaggtcat aacaacctgt cctatctgac gaaaagctgg 1380
cgtgaactgt gcaaagcctt tctgcaagag gcgaaatggt ccaacaacaa aattatcccg 1440
gctttctcca agtacctgga aaacgccagc gtttcctcct ccggtgtagc gctgctggcg 1500
ccgtcttact tttccgtatg ccagcagcag gaagacatct ccgaccacgc gctgcgttcc 1560
ctgaccgact tccatggtct ggtgcgttct agctgcgtta tcttccgcct gtgcaacgat 1620
ctggccacct ctgcggcgga gctggaacgt ggcgagacta ccaattctat cattagctac 1680
atgcacgaaa acgatggtac cagcgaggaa caggcccgcg aagaactgcg taaactgatc 1740
gacgccgaat ggaaaaagat gaatcgtgaa cgcgttagcg actccaccct gctgcctaaa 1800
gcgttcatgg aaatcgcagt taacatggca cgtgtttccc actgcaccta ccagtatggc 1860
gatggtctgg gtcgcccaga ctacgcgact gaaaaccgca tcaaactgct gctgattgac 1920
cctttcccga ttaaccagct gatgtatgtc taactgcagg tcgactctag aggatccccg 1980
ggtaccgagc tcgaattcac tggccgtcgt tttacaacgt cgtgactggg aaaaccctgg 2040
cgttacccaa cttaatcgcc ttgcagcaca tccccctttc gccagctggc gtaatagcga 2100
agaggcccgc accgatcgcc cttcccaaca gttgcgcagc ctgaatggcg aatggcgcct 2160
gatgcggtat tttctcctta cgcatctgtg cggtatttca caccgcatat ggtgcactct 2220
cagtacaatc tgctctgatg ccgcatagtt aagccagccc cgacacccgc caacacccgc 2280
tgacgagctt agtaaagccc tcgctagatt ttaatgcgga tgttgcgatt acttcgccaa 2340
ctattgcgat aacaagaaaa agccagcctt tcatgatata tctcccaatt tgtgtagggc 2400
ttattatgca cgcttaaaaa taataaaagc agacttgacc tgatagtttg gctgtgagca 2460
attatgtgct tagtgcatct aacgcttgag ttaagccgcg ccgcgaagcg gcgtcggctt 2520
gaacgaattg ttagacatta tttgccgact accttggtga tctcgccttt cacgtagtgg 2580
acaaattctt ccaactgatc tgcgcgcgag gccaagcgat cttcttcttg tccaagataa 2640
gcctgtctag cttcaagtat gacgggctga tactgggccg gcaggcgctc cattgcccag 2700
tcggcagcga catccttcgg cgcgattttg ccggttactg cgctgtacca aatgcgggac 2760
aacgtaagca ctacatttcg ctcatcgcca gcccagtcgg gcggcgagtt ccatagcgtt 2820
aaggtttcat ttagcgcctc aaatagatcc tgttcaggaa ccggatcaaa gagttcctcc 2880
gccgctggac ctaccaaggc aacgctatgt tctcttgctt ttgtcagcaa gatagccaga 2940
tcaatgtcga tcgtggctgg ctcgaagata cctgcaagaa tgtcattgcg ctgccattct 3000
ccaaattgca gttcgcgctt agctggataa cgccacggaa tgatgtcgtc gtgcacaaca 3060
atggtgactt ctacagcgcg gagaatctcg ctctctccag gggaagccga agtttccaaa 3120
aggtcgttga tcaaagctcg ccgcgttgtt tcatcaagcc ttacggtcac cgtaaccagc 3180
aaatcaatat cactgtgtgg cttcaggccg ccatccactg cggagccgta caaatgtacg 3240
gccagcaacg tcggttcgag atggcgctcg atgacgccaa ctacctctga tagttgagtc 3300
gatacttcgg cgatcaccgc ttccctcatg atgtttaact ttgttttagg gcgactgccc 3360
tgctgcgtaa catcgttgct gctccataac atcaaacatc gacccacggc gtaacgcgct 3420
tgctgcttgg atgcccgagg catagactgt accccaaaaa aacagtcata acaagccatg 3480
aaaaccgcca ctgcgccgtt accaccgctg cgttcggtca aggttctgga ccagttgcgt 3540
gagcgcatac gctacttgca ttacagctta cgaaccgaac aggcttatgt ccactgggtt 3600
cgtgccttca tccgtttcca cggtgtgcgt cacccggcaa ccttgggcag cagcgaagtc 3660
gaggcatttc tgtcctggct ggcgaacgag cgcaaggttt cggtctccac gcatcgtcag 3720
gcattggcgg ccttgctgtt cttctacggc aaggtgctgt gcacggatct gccctggctt 3780
caggagatcg gaagacctcg gccgtcgcgg cgcttgccgg tggtgctgac cccggatgaa 3840
gtggttcgca tcctcggttt tctggaaggc gagcatcgtt tgttcgccca gcttctgtat 3900
ggaacgggca tgcggatcag tgagggtttg caactgcggg tcaaggatct ggatttcgat 3960
cacggcacga tcatcgtgcg ggagggcaag ggctccaagg atcgggcctt gatgttaccc 4020
gagagcttgg cacccagcct gcgcgagcag gggaattaat tcccacgggt tttgctgccc 4080
gcaaacgggc tgttctggtg ttgctagttt gttatcagaa tcgcagatcc ggcttcagcc 4140
ggtttgccgg ctgaaagcgc tatttcttcc agaattgcca tgattttttc cccacgggag 4200
gcgtcactgg ctcccgtgtt gtcggcagct ttgattcgat aagcagcatc gcctgtttca 4260
ggctgtctat gtgtgactgt tgagctgtaa caagttgtct caggtgttca atttcatgtt 4320
ctagttgctt tgttttactg gtttcacctg ttctattagg tgttacatgc tgttcatctg 4380
ttacattgtc gatctgttca tggtgaacag ctttgaatgc accaaaaact cgtaaaagct 4440
ctgatgtatc tatctttttt acaccgtttt catctgtgca tatggacagt tttccctttg 4500
atatgtaacg gtgaacagtt gttctacttt tgtttgttag tcttgatgct tcactgatag 4560
atacaagagc cataagaacc tcagatcctt ccgtatttag ccagtatgtt ctctagtgtg 4620
gttcgttgtt tttgcgtgag ccatgagaac gaaccattga gatcatactt actttgcatg 4680
tcactcaaaa attttgcctc aaaactggtg agctgaattt ttgcagttaa agcatcgtgt 4740
agtgtttttc ttagtccgtt atgtaggtag gaatctgatg taatggttgt tggtattttg 4800
tcaccattca tttttatctg gttgttctca agttcggtta cgagatccat ttgtctatct 4860
agttcaactt ggaaaatcaa cgtatcagtc gggcggcctc gcttatcaac caccaatttc 4920
atattgctgt aagtgtttaa atctttactt attggtttca aaacccattg gttaagcctt 4980
ttaaactcat ggtagttatt ttcaagcatt aacatgaact taaattcatc aaggctaatc 5040
tctatatttg ccttgtgagt tttcttttgt gttagttctt ttaataacca ctcataaatc 5100
ctcatagagt atttgttttc aaaagactta acatgttcca gattatattt tatgaatttt 5160
tttaactgga aaagataagg caatatctct tcactaaaaa ctaattctaa tttttcgctt 5220
gagaacttgg catagtttgt ccactggaaa atctcaaagc ctttaaccaa aggattcctg 5280
atttccacag ttctcgtcat cagctctctg gttgctttag ctaatacacc ataagcattt 5340
tccctactga tgttcatcat ctgagcgtat tggttataag tgaacgatac cgtccgttct 5400
ttccttgtag ggttttcaat cgtggggttg agtagtgcca cacagcataa aattagcttg 5460
gtttcatgct ccgttaagtc atagcgacta atcgctagtt catttgcttt gaaaacaact 5520
aattcagaca tacatctcaa ttggtctagg tgattttaat cactatacca attgagatgg 5580
gctagtcaat gataattact agtccttttc ctttgagttg tgggtatctg taaattctgc 5640
tagacctttg ctggaaaact tgtaaattct gctagaccct ctgtaaattc cgctagacct 5700
ttgtgtgttt tttttgttta tattcaagtg gttataattt atagaataaa gaaagaataa 5760
aaaaagataa aaagaataga tcccagccct gtgtataact cactacttta gtcagttccg 5820
cagtattaca aaaggatgtc gcaaacgctg tttgctcctc tacaaaacag accttaaaac 5880
cctaaaggct taagtagcac cctcgcaagc tcgggcaaat cgctgaatat tccttttgtc 5940
tccgaccatc aggcacctga gtcgctgtct ttttcgtgac attcagttcg ctgcgctcac 6000
ggctctggca gtgaatgggg gtaaatggca ctacaggcgc cttttatgga ttcatgcaag 6060
gaaactaccc ataatacaag aaaagcccgt cacgggcttc tcagggcgtt ttatggcggg 6120
tctgctatgt ggtgctatct gactttttgc tgttcagcag ttcctgccct ctgattttcc 6180
agtctgacca cttcggatta tcccgtgaca ggtcattcag actggctaat gcacccagta 6240
aggcagcggt atcatcaaca ggctta 6266
<210> 5
<211> 6592
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 5
gaattgctcc attttcttct gctatcaaaa taacagactc gtgattttcc aaacgagctt 60
tcaaaaaagc ctctgcccct tgcaaatcgg atgcctgtct ataaaattcc cgatattggt 120
taaacagcgg cgcaatggcg gccgcatctg atgtctttgc ttggcgaatg ttcatcttat 180
ttcttcctcc ctctcaataa ttttttcatt ctatcccttt tctgtaaagt ttatttttca 240
gaatactttt atcatcatgc tttgaaaaaa tatcacgata atatccattg ttctcacgga 300
agcacacgca ggtcatttga acgaattttt tcgacaggaa tttgccggga ctcaggagca 360
tttaacctaa aaaagcatga catttcagca taatgaacat ttactcatgt ctattttcgt 420
tcttttctgt atgaaaatag ttatttcgag tctctacgga aatagcgaga gatgatatac 480
ctaaatagag ataaaatcat ctcaaaaaaa tgggtctact aaaatattat tccatctatt 540
acaataaatt cacagaatag tcttttaagt aagtctactc tgaatttttt taaaaggaga 600
gggtaaagag tgtgtgcgac ctcttctcaa tttactcaga ttaccgagca taattcccgt 660
cgttccgcaa actatcagcc aaacctgtgg aatttcgaat tcctgcaatc cctggagaac 720
gacctgaaag tggaaaagct ggaggagaaa gcgaccaaac tggaggaaga agttcgctgc 780
atgatcaacc gtgtagacac ccagccgctg tccctgctgg agctgatcga cgatgtgcag 840
cgcctgggtc tgacctacaa atttgaaaaa gacatcatta aagccctgga aaacatcgta 900
ctgctggacg aaaacaaaaa gaacaaatct gacctgcacg caaccgctct gtctttccgt 960
ctgctgcgtc agcacggttt cgaggtttct caggatgttt ttgagcgttt caaggataaa 1020
gaaggtggtt tcagcggtga actgaaaggt gacgtccaag gcctgctgag cctgtatgaa 1080
gcgtcttacc tgggtttcga gggtgagaac ctgctggagg aggcgcgtac cttttccatc 1140
acccacctga agaacaacct gaaagaaggc attaatacca aggttgcaga acaagtgagc 1200
cacgccctgg aactgccata tcaccagcgt ctgcaccgtc tggaggcacg ttggttcctg 1260
gataaatacg aaccgaaaga accgcatcac cagctgctgc tggagctggc gaagctggat 1320
tttaacatgg tacagaccct gcaccagaaa gagctgcaag atctgtcccg ctggtggacc 1380
gagatgggcc tggctagcaa actggatttt gtacgcgacc gcctgatgga agtttatttc 1440
tgggcactgg gtatggcgcc agacccgcag tttggtgaat gtcgcaaagc tgttactaaa 1500
atgtttggtc tggtgacgat catcgatgac gtgtatgacg tttatggcac tctggacgaa 1560
ctgcaactgt tcaccgatgc tgtagagcgc tgggacgtta acgctattaa caccctgccg 1620
gactatatga aactgtgttt cctggcactg tacaacaccg ttaacgacac gtcctattct 1680
attctgaaag agaaaggtca taacaacctg tcctatctga cgaaaagctg gcgtgaactg 1740
tgcaaagcct ttctgcaaga ggcgaaatgg tccaacaaca aaattatccc ggctttctcc 1800
aagtacctgg aaaacgccag cgtttcctcc tccggtgtag cgctgctggc gccgtcttac 1860
ttttccgtat gccagcagca ggaagacatc tccgaccacg cgctgcgttc cctgaccgac 1920
ttccatggtc tggtgcgttc tagctgcgtt atcttccgcc tgtgcaacga tctggccacc 1980
tctgcggcgg agctggaacg tggcgagact accaattcta tcattagcta catgcacgaa 2040
aacgatggta ccagcgagga acaggcccgc gaagaactgc gtaaactgat cgacgccgaa 2100
tggaaaaaga tgaatcgtga acgcgttagc gactccaccc tgctgcctaa agcgttcatg 2160
gaaatcgcag ttaacatggc acgtgtttcc cactgcacct accagtatgg cgatggtctg 2220
ggtcgcccag actacgcgac tgaaaaccgc atcaaactgc tgctgattga ccctttcccg 2280
attaaccagc tgatgtatgt ctaaaaaaaa ccggccttgg ccccgccggt tttttattat 2340
ttttcttcct ccgcatgttc aatccgctcc ataatcgacg gatggctccc tctgaaaatt 2400
ttaacgagaa acggcgggtt gacccggctc agtcccgtaa cggccaagtc ctgaaacgtc 2460
tcaatcgccg cttcccggtt tccggtcagc tcaatgccgt aacggtcggc ggcgttttcc 2520
tgataccggg agacggcatt cgtaatcgga tcctctagag tcgacctgca ggcatgcaag 2580
ctttgcctcg cgcgtttcgg tgatgacggt gaaaacctct gacacatgca gctcccggag 2640
acggtcacag cttgtctgta agcggatgcc gggagcagac aagcccgtca gggcgcgtca 2700
gcgggtgttg gcgggtgtcg gggcgcagcc atgacccagt cacgtagcga tagcggagtg 2760
tatactggct taactatgcg gcatcagagc agattgtact gagagtgcac catatgcggt 2820
gtgaaatacc gcacagatgc gtaaggagaa aataccgcat caggcgctct tccgcttcct 2880
cgctcactga ctcgctgcgc tcggtcgttc ggctgcggcg agcggtatca gctcactcaa 2940
aggcggtaat acggttatcc acagaatcag gggataacgc aggaaagaac atgtgagcaa 3000
aaggccagca aaaggccagg aaccgtaaaa aggccgcgtt gctggcgttt ttccataggc 3060
tccgcccccc tgacgagcat cacaaaaatc gacgctcaag tcagaggtgg cgaaacccga 3120
caggactata aagataccag gcgtttcccc ctggaagctc cctcgtgcgc tctcctgttc 3180
cgaccctgcc gcttaccgga tacctgtccg cctttctccc ttcgggaagc gtggcgcttt 3240
ctcaatgctc acgctgtagg tatctcagtt cggtgtaggt cgttcgctcc aagctgggct 3300
gtgtgcacga accccccgtt cagcccgacc gctgcgcctt atccggtaac tatcgtcttg 3360
agtccaaccc ggtaagacac gacttatcgc cactggcagc agccactggt aacaggatta 3420
gcagagcgag gtatgtaggc ggtgctacag agttcttgaa gtggtggcct aactacggct 3480
acactagaag gacagtattt ggtatctgcg ctctgctgaa gccagttacc ttcggaaaaa 3540
gagttggtag ctcttgatcc ggcaaacaaa ccaccgctgg tagcggtggt ttttttgttt 3600
gcaagcagca gattacgcgc agaaaaaaag gatctcaaga agatcctttg atcttttcta 3660
cggggtctga cgctcagtgg aacgaaaact cacgttaagg gattttggtc atgagattat 3720
caaaaaggat cgaagtcggt tcagaaaaag aaggatatgg atctggagct gtaatataaa 3780
aaccttcttc aactaacggg gcaggttagt gacattagaa aaccgactgt aaaaagtaca 3840
gtcggcatta tctcatatta taaaagccag tcattaggcc tatctgacaa ttcctgaata 3900
gagttcataa acaatcctgc atgataacca tcacaaacag aatgatgtac ctgtaaagat 3960
agcggtaaat atattgaatt acctttatta atgaattttc ctgctgtaat aatgggtaga 4020
aggtaattac tattattatt gatatttaag ttaaacccag taaatgaagt ccatggaata 4080
atagaaagag aaaaagcatt ttcaggtata ggtgttttgg gaaacaattt aaaagaacca 4140
ttatatttct ctacatcaga aaggtataaa tcataaaact ctttgaagtc attctttaca 4200
ggagtccaaa taccagagaa tgttttagat acaccatcaa aaattgtata aagtggctct 4260
aacttatccc aataacctaa ctctccgtcg ctattgtaac cagttctaaa agctgtattt 4320
gagtttatca cccttgtcac taagaaaata aatgcagggt aaaatttata tccttcttgt 4380
tttatgtttc ggtataaaac actaatatca atttctgtgg ttatactaaa agtcgtttgt 4440
tggttcaaat aatgattaaa tatctctttt ctcttccaat tgtctaaatc aattttatta 4500
aagttcattt gatatgcctc ctaaattttt atctaaagtg aatttaggag gcttacttgt 4560
ctgctttctt cattagaatc aatccttttt taaagtcaat attactgtaa cataaatata 4620
tattttaaaa atatcccact ttatccaatt ttcgtttgtt gaactaatgg gtgctttagt 4680
tgaagaataa agaccacatt aaaaaatgtg gtcttttgtg tttttttaaa ggatttgagc 4740
gtacgcgaaa aatccttttc tttctttctt atcttgataa taagggtaac tattgccggt 4800
tgtccattca tggctgaact ctgcttcctc tgttgacatg acacacatca tctcaatatc 4860
cgaatagggc ccatcagtct gacgaccaag agagccataa acaccaatag ccttaacatc 4920
atccccatat ttatccaata ttcgttcctt aatttcatga acaatcttca ttctttcttc 4980
tctagtcatt attattggtc cattcactat tctcattccc ttttcagata attttagatt 5040
tgcttttcta aataagaata tttggagagc accgttctta ttcagctatt aataactcgt 5100
cttcctaagc atccttcaat ccttttaata acaattatag catctaatct tcaacaaact 5160
ggcccgtttg ttgaactact ctttaataaa ataatttttc cgttcccaat tccacattgc 5220
aataatagaa aatccatctt catcggcttt ttcgtcatca tctgtatgaa tcaaatcgcc 5280
ttcttctgtg tcatcaaggt ttaatttttt atgtatttct tttaacaaac caccatagga 5340
gattaacctt ttacggtgta aaccttcctc caaatcagac aaacgtttca aattcttttc 5400
ttcatcatcg gtcataaaat ccgtatcctt tacaggatat tttgcagttt cgtcaattgc 5460
cgattgtata tccgatttat atttattttt cggtcgaatc atttgaactt ttacatttgg 5520
atcatagtct aatttcattg cctttttcca aaattgaatc cattgttttt gattcacgta 5580
gttttctgtt attctaaaat aagttggttc cacacatacc attacatgca tgtgctgatt 5640
ataagaatta tctttattat ttattgtcac atccgttgca cgcataaaac caacaagatt 5700
tttattaatt tttttatatt gcatcattcg gcgaaatcct tgagccatat ctgtcaaact 5760
cttatttaat tcttcgccat cataaacatt tttaactgtt aatgtgagaa acaaccaacg 5820
aactgttggc ttttgtttaa taacttcagc aacaaccttt tgtgactgaa tgccatgttt 5880
cattgctctc ctccagttgc acattggaca aagcctggat ttgcaaaacc acactcgata 5940
ccactttctt tcgcctgttt cacgattttg tttatactct aatatttcag cacaatcttt 6000
tactctttca gcctttttaa attcaagaat atgcagaagt tcaaagtaat caacattagc 6060
gattttcttt tctctccatg gtctcacttt tccacttttt gtcttgtcca ctaaaaccct 6120
tgatttttca tctgaataaa tgctactatt aggacacata atattaaaag aaacccccat 6180
ctatttagtt atttgtttag tcacttataa ctttaacaga tggggttttt ctgtgcaacc 6240
aattttaagg gttttcaata ctttaaaaca catacatacc aacacttcaa cgcacctttc 6300
agcaactaaa ataaaaatga cgttatttct atatgtatca agataagaaa gaacaagttc 6360
aaaaccatca aaaaaagaca ccttttcagg tgcttttttt attttataaa ctcattccct 6420
gatctcgact tcgttctttt tttacctctc ggttatgagt tagttcaaat tcgttctttt 6480
taggttctaa atcgtgtttt tcttggaatt gtgctgtttt atcctttacc ttgtctacaa 6540
accccttaaa aacgttttta aaggctttta agccgtctgt acgttcctta ag 6592
<210> 6
<211> 1695
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 6
atgtgtgcaa cctcctccca gtttactcag attaccgagc ataattctcg acgatctgct 60
aactaccagc cgaacctttg gaactttgag tttctccagt ctctcgaaaa tgacctgaag 120
gtggaaaagc tcgaggagaa ggcgaccaaa ctcgaggagg aggtgcgatg tatgatcaac 180
agagttgaca cccaacccct gtctttgctg gagctgatcg acgatgtgca gcggttgggt 240
ttgacttata aattcgagaa ggacattatc aaggcactgg agaacattgt gctcctcgac 300
gagaacaaga agaacaagtc tgatcttcac gctaccgctc tctctttccg acttcttcga 360
caacacggct tcgaggtgtc gcaggacgtc ttcgagagat ttaaggacaa ggagggagga 420
tttagcggcg agctgaaggg agacgttcag ggtcttctct ccttgtacga ggcgtcctac 480
ctgggattcg agggagagaa cctcctggag gaagctcgta cattttccat cactcacctt 540
aagaataacc ttaaggaggg aattaacacc aaggtggccg agcaggtttc tcacgccctg 600
gagctcccct accaccaacg gctccataga ctggaggctc gttggttcct ggacaaatat 660
gagccaaagg agcctcatca tcagttgctg ttggagttgg ccaagctgga cttcaatatg 720
gttcagacgc tgcaccaaaa ggagttgcag gacctgtctc gatggtggac cgagatggga 780
ttggcctcga agctggattt tgtccgtgac cgacttatgg aggtctattt ttgggccctt 840
ggaatggcgc ctgaccccca gttcggagag tgccggaagg cggtgacgaa gatgttcggt 900
cttgtgacta tcatcgacga cgtctacgat gtctacggca cactcgacga gttgcagctg 960
ttcactgacg ccgtcgagcg atgggatgtg aacgccatta atactctccc tgactatatg 1020
aagctgtgct tcctggctct gtacaacact gtcaacgata cctcgtactc tatcctcaag 1080
gagaagggac acaacaatct ctcctacttg accaaatcct ggcgagaact gtgcaaggct 1140
tttctgcagg aggctaaatg gtccaataac aagatcattc ctgctttttc taaatacctg 1200
gaaaatgcct cggtgtcgag ctctggcgtc gcccttctgg ccccttccta cttctccgtc 1260
tgccagcagc aggaggatat ttccgatcat gctcttagat cgctgaccga ttttcacggc 1320
ctcgtgcgat cttcctgcgt gatttttcgg ttgtgtaatg accttgcgac ctctgctgct 1380
gagctggaac gaggcgagac tacaaattcc attatttctt acatgcacga aaacgatgga 1440
acatctgaag aacaggctag agaggaactg cgaaagttga tcgacgccga gtggaagaag 1500
atgaacagag agcgggtgtc cgactctacc ctgcttccca aggccttcat ggagatcgcc 1560
gtgaacatgg ctcgagtttc ccattgtact taccagtacg gtgacggcct gggtcgtccg 1620
gactacgcta cagagaaccg aatcaagctg ctgctcatcg accccttccc tatcaaccaa 1680
ttgatgtacg tgtaa 1695
<210> 7
<211> 8191
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 7
tcgaccggtg agaagaacag catcgggaca agggaaggaa gaacaaagac aaagaaaaca 60
aaagaaagca attgaaaaca aaacaaaaca attttcattc cttctcttat cattcctttt 120
cttttctttt ctctcattca acgcactcca tcgtatccgt attcctctta ttttttctct 180
ttctctatat ccatttcttt ctctctaggt gtgtcctctc tctctcttca atttctctac 240
tccgcattcc aacgcatcct tcccccaacc tcccatttcc tccttacggc ccgatagcga 300
tcgtctttcc ctcgctatca ctcgctaccg gcccctcctc tgcaccgtaa cctcctacgt 360
atttaccata tcataaagtt ttttccgacg cttatcgctg accccctgtc gccctcctat 420
tggcttccgg attatcttct tgtccataag gtgatccatg cttcctgaag attcccgaaa 480
tgtgtccact ttggcgggga atcattccat ccacttcttt ctctctcgct ttcctcattc 540
ggcgctcccc ttccgcgtct cattggtctt ccgctccgtt tttgctttgc cgatgttact 600
tggggagagg tgcgataatc ctttcgcaaa aactcggttt gacgcctccc atggtataaa 660
tagtgggtgg tggacaggtg ccttcgcttt tctttaagca agagaatccc attgtcttga 720
ctatcacgaa ttcacataca ttatgaagat caccgctgtc attgcccttt tattctcact 780
tgctgctgcc tcacctattc cagttgccga tcctggtgtg gtttcagtta gcaagtcata 840
tgctgatttc cttcgtgttt accaaagttg gaacactttt gctaatcctg atagacccaa 900
ccttaagaag agaaatgata cacctgcaag tggatatcaa gttgaaaaag tcgtaatttt 960
gtcacgtcac ggtgttaggg cccctacaaa aatgactcaa accatgcgtg atgtcactcc 1020
taatacatgg ccagaatggc ccgttaaatt aggatatatt acaccaagag gtgaacactt 1080
gatatcactt atgggcggtt tttaccgtca aaaattccag caacaaggaa tcctttctca 1140
gggctcctgt cctactccta actccatata tgtctgggct gacgtcgatc agcgtacttt 1200
aaaaactggt gaagcattcc ttgctggttt ggcaccacaa tgtggcttga caattcatca 1260
ccaacaaaat cttgagaaag ctgatcctct ttttcatccc gttaaagctg gaacctgctc 1320
tatggataaa actcaagttc aacaagctgt tgagaaggag gcacaaactc ctatagataa 1380
tttgaatcaa cattacatcc cctttttagc tttaatgaat acaacattaa attttagtac 1440
ttctgcctgg tgccaaaaac actctgctga taaatcctgt gacctaggtt tatccatgcc 1500
ttctaaattg tccataaaag ataatggtaa caaggtcgca ttggatggag ctattggtct 1560
atcctctact ttggccgaga tttttcttct tgaatatgct caaggcatgc ctcaagctgc 1620
ttggggtaac atccactcag agcaagagtg ggcttccttg ctaaagttgc ataatgttca 1680
attcgatttg atggcccgaa caccttatat tgctcgacat aacggtactc ctttattgca 1740
agctatatca aatgccctta atcccaacgc cactgaatca aaacttccag atatttcacc 1800
tgataacaaa atattgttca ttgcaggtca tgacacaaat attgctaata tagccggcat 1860
gttaaatatg cgttggacat taccaggtca accagataat actcctccag gtggtgccct 1920
agtatttgaa cgtcttgctg ataaaagtgg aaaacaatat gtttctgtat ctatggttta 1980
tcaaacacta gaacaacttc gatcacagac tcccctttct ctaaatcagc ctgccggatc 2040
tgttcaactt aaaattccag gttgcaatga tcaaacagcc gagggttact gtcctctttc 2100
cacttttaca agagttgttt cccaatctgt tgaacctgga tgccaacttc aataatgagg 2160
atccaagtaa gggaatgaga atgtgatcca cttttaattc ctaatgaata catgcctata 2220
gttcttttct tttgttcttt atgtcgtttt tcgatggtac ggccgttgtc aatctcagtt 2280
tgtgtgcttg gttgcagctt ggtttcaaat ctgttcatct catgaatctt ttaccatttc 2340
accacacgtt tataccattc tctcatagaa tcttcatcaa accatctcgg ggttagagtg 2400
gaaagaaagt cttgttcttt tatttccttt tttccatctt caaggctttt cttttcttcc 2460
tcctcctcgt tcatcttgag gtttgacgtg tctgtttaga attttgagct gttgcagcat 2520
cttatttttt gttttgcgaa aacgaagcgc tttactctct tcatcagttg gacgattgta 2580
cctttgaaaa ccaactactt ttgcatgttt tgtatagaaa tcaatgatat tagaatccca 2640
tcctttaatt tctttcaaag tagttgagct atagttaagt gtaagggccc tactgcgaaa 2700
gcatttgcca aggatgtttt cattaatcaa gaacgaaagt taggggatcg aagacgatca 2760
gataccgtcg tagtcttaac cataaactat gccgactagg gatcgggcaa tgtttcattt 2820
atcgacttgc tcggcacctt acgagaaatc aaagtctttg ggttccgggg ggagtatggt 2880
cgcaaggctg aaacttaaag gaattgacgg aagggcacca caatggagtg gagcctgcgg 2940
cttaatttga ctcaacacgg ggaaactcac caggtccaga catagtaagg attgacagat 3000
tgagagctct ttcttgattc tatgggtggt ggtgcatggc cgttcttagt tggtggagtg 3060
atttgtctgc ttaattgcga taacgaacga gaccttaacc tgctaaatag ctggatcagc 3120
cattttggct gatcattagc ttcttagagg gactattggc ataaagccaa tggaagtttg 3180
aggcaataac aggtctgtga tgcccttaga tgttctgggc cgcacgcgcg ctacactgac 3240
ggagccaacg agttgaaaaa aatcttttga ttttttatcc ttggccggaa ggtctgggta 3300
atcttgttaa actccgtcgt gctggggata gagcattgca attattgcgg ccgctcctca 3360
attcgatgtt gcagatttta caagttttta aaatgtattt cattattact ttttatatgc 3420
ctaataaaaa agccatagtt taatctatag ataacttttt ttccagtgca ctaacggacg 3480
ttacattccc atacaaaact gcgtagttaa agctaaggaa aagttaatat catgttaatt 3540
aaatacgcta tttacaataa gacattgaac tcatttatat cgttgaatat gaataaccaa 3600
tttcagcgaa tttttaacaa acatcgttca cctcgtttaa ggatatcttg tgtatggggt 3660
gttgacttgc tttatcgaat aattaccgta cctgtaattg gcttgctgga tatagcggta 3720
gtctaatatc tagcaaaaat cttttgggtg aaaaggcttg caatttcacg acaccgaact 3780
atttgtcatt ttttaataag gaagttttcc ataaattcct gtaattctcg gttgatctaa 3840
ttgaaaagag tagttttgca tcacgatgag gagggctttt gtagaaagaa atacgaacga 3900
aacgaaaatc agcgttgcca tcgctttgga caaagctccc ttacctgaag agtcgaattt 3960
tattgatgaa cttataactt ccaagcatgc aaaccaaaag ggagaacaag taatccaagt 4020
agacacggga attggattct tggatcacat gtatcatgca ctggctaaac atgcaggctg 4080
gagcttacga ctttactcaa gaggtgattt aatcatcgat gatcatcaca ctgcagaaga 4140
tactgctatt gcacttggta ttgcattcaa gcaggctatg ggtaactttg ccggcgttaa 4200
aagatttgga catgcttatt gtccacttga cgaagctctt tctagaagcg tagttgactt 4260
gtcgggacgg ccctatgctg ttatcgattt gggattaaag cgtgaaaagg ttggggaatt 4320
gtcctgtgaa atgatccctc acttactata ttccttttcg gtagcagctg gaattacttt 4380
gcatgttacc tgcttatatg gtagtaatga ccatcatcgt gctgaaagcg cttttaaatc 4440
tctggctgtt gccatgcgcg cggctactag tcttactgga agttctgaag tcccaagcac 4500
gaagggagtg ttgtaaagat gaattggatt atgtcaggaa aagaacgaca attttgcatc 4560
caaattgtct aaattttaga gttgcttgaa aacaatagaa ccttacttgc tttataatta 4620
cgttaattag aagcgttatc tcgtgaagga atatagtacg tagccgtata aattgaattg 4680
aatgttcagc ttatagaata gagacacttt gctgttcaat gcgtcgtcac ttaccatact 4740
cactttatta tacgacttta agtataaact ccgcggttat ggtaaaatta atgatgcaca 4800
aacgtccgat tccatatggg tacactacaa ttaaatactt ttaagctgat cccccacaca 4860
ccatagcttc aaaatgtttc tactcctttt ttactcttcc agattttctc ggactccgcg 4920
catcgccgta ccacttcaaa acacccaagc acagcatact aaattttccc tctttcttcc 4980
tctagggtgt cgttaattac ccgtactaaa ggtttggaaa agaaaaaaga gaccgcctcg 5040
tttctttttc ttcgtcgaaa aaggcaataa aaatttttat cacgtttctt tttcttgaaa 5100
tttttttttt tagttttttt ctctttcagt gacctccatt gatatttaag ttaataaacg 5160
gtcttcaatt tctcaagttt cagtttcatt tttcttgttc tattacaact ttttttactt 5220
cttgttcatt agaaagaaag catagcaatc taatctaagg gcggtgttga caattaatca 5280
tcggcatagt atatcggcat agtataatac gacaaggtga ggaactaaac catggccaag 5340
ttgaccagtg ccgttccggt gctcaccgcg cgcgacgtcg ccggagcggt cgagttctgg 5400
accgaccggc tcgggttctc ccgggacttc gtggaggacg acttcgccgg tgtggtccgg 5460
gacgacgtga ccctgttcat cagcgcggtc caggaccagg tggtgccgga caacaccctg 5520
gcctgggtgt gggtgcgcgg cctggacgag ctgtacgccg agtggtcgga ggtcgtgtcc 5580
acgaacttcc gggacgcctc cgggccggcc atgaccgaga tcggcgagca gccgtggggg 5640
cgggagttcg ccctgcgcga cccggccggc aactgcgtgc acttcgtggc cgaggagcag 5700
gactgacacg tccgacggcg gcccacgggt cccaggcctc ggagatccgt cccccttttc 5760
ctttgtcgat atcatgtaat tagttatgtc acgcttacat tcacgccctc cccccacatc 5820
cgctctaacc gaaaaggaag gagttagaca acctgaagtc taggtcccta tttatttttt 5880
tatagttatg ttagtattaa gaacgttatt tatatttcaa atttttcttt tttttctgta 5940
cagacgcgag cttcccagta aatgtgccat ctcgtaggca gaaaacggtt cccccgtagg 6000
gtctctctct tggcctcctt tctaggtcgg gctgattgct cttgaagctc tctagggggg 6060
ctcacaccat aggcagataa cgttccccac cggctcgcct cgtaagcgca caaggactgc 6120
tcccaaagat cctaggcggg attttgccga tttcggccta aaggaaccgg aacacgtaga 6180
aagccagtcc gcagaaacgg tgctgacccc ggatgaatgt cagctactgg gctatctgga 6240
caagggaaaa cgcaagcgca aagagaaagc aggtagcttg cagtgggctt acatggcgat 6300
agctagactg ggcggtttta tggacagcaa gcgaaccgga attgccagct ggggcgccct 6360
ctggtaaggt tgggaagccc tgcaaagtaa actggatggc tttcttgccg ccaaggatct 6420
gatggcgcag gggatcaaga tctgatcaag agacaggatg aggatcgttt cgcatgattg 6480
aacaagatgg attgcacgca ggttctccgg ccgcttgggt ggagaggcta ttcggctatg 6540
actgggcaca acagacaatc ggctgctctg atgccgccgt gttccggctg tcagcgcagg 6600
ggcgcccggt tctttttgtc aagaccgacc tgtccggtgc cctgaatgaa ctgcaggacg 6660
aggcagcgcg gctatcgtgg ctggccacga cgggcgttcc ttgcgcagct gtgctcgacg 6720
ttgtcactga agcgggaagg gactggctgc tattgggcga agtgccgggg caggatctcc 6780
tgtcatctcg ccttgctcct gccgagaaag tatccatcat ggctgatgca atgcggcggc 6840
tgcatacgct tgatccggct acctgcccat tcgaccacca agcgaaacat cgcatcgagc 6900
gagcacgtac tcggatggaa gccggtcttg tcgatcagga tgatctggac gaagagcatc 6960
aggggctcgc gccagccgaa ctgttcgcca ggctcaaggc gcgcatgccc gacggcgagg 7020
atctcgtcgt gatccatggc gatgcctgct tgccgaatat catggtggaa aatggccgct 7080
tttctggatt caacgactgt ggccggctgg gtgtggcgga ccgctatcag gacatagcgt 7140
tggatacccg tgatattgct gaagagcttg gcggcgaatg ggctgaccgc ttcctcgtgc 7200
tttacggtat cgccgctccc gattcgcagc gcatcgcctt ctatcgcctt cttgacgagt 7260
tcttctgaat tgaaaaaggt accaagttta ctcatatata ctttagattg atttaaaact 7320
tcatttttaa tttaaaagga tctaggtgaa gatccttttt gataatctca tgaccaaaat 7380
cccttaacgt gagttttcgt tccactgagc gtcagacccc gtagaaaaga tcaaaggatc 7440
ttcttgagat cctttttttc tgcgcgtaat ctgctgcttg caaacaaaaa aaccaccgct 7500
accagcggtg gtttgtttgc cggatcaaga gctaccaact ctttttccga aggtaactgg 7560
cttcagcaga gcgcagatac caaatactgt ccttctagtg tagccgtagt taggccacca 7620
cttcaagaac tctgtagcac cgcctacata cctcgctctg ctaatcctgt taccagtggc 7680
tgctgccagt ggcgataagt cgtgtcttac cgggttggac tcaagacgat agttaccgga 7740
taaggcgcag cggtcgggct gaacgggggg ttcgtgcaca cagcccagct tggagcgaac 7800
gacctacacc gaactgagat acctacagcg tgagcattga gaaagcgcca cgcttcccga 7860
agggagaaag gcggacaggt atccggtaag cggcagggtc ggaacaggag agcgcacgag 7920
ggagcttcca gggggaaacg cctggtatct ttatagtcct gtcgggtttc gccacctctg 7980
acttgagcgt cgatttttgt gatgctcgtc aggggggcgg agcctatgga aaaacgccag 8040
caacgcggcc tttttacggt tcctggcctt ttgctggcct tttgctcaca tgttctttcc 8100
tgcgttatcc cctgattctg tggataaccg tattaccgcc tttgagtgag ctgataccgc 8160
tcgccgcagc cgaacgaccg agcgcagcga g 8191
<210> 8
<211> 1724
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 8
gaattcaaaa caaaatgtgt gcaacctcct cccagtttac tcagattacc gagcataatt 60
ctcgacgatc tgctaactac cagccgaacc tttggaactt tgagtttctc cagtctctcg 120
aaaatgacct gaaggtggaa aagctcgagg agaaggcgac caaactcgag gaggaggtgc 180
gatgtatgat caacagagtt gacacccaac ccctgtcttt gctggagctg atcgacgatg 240
tgcagcggtt gggtttgact tataaattcg agaaggacat tatcaaggca ctggagaaca 300
ttgtgctcct cgacgagaac aagaagaaca agtctgatct tcacgctacc gctctctctt 360
tccgacttct tcgacaacac ggcttcgagg tgtcgcagga cgtcttcgag agatttaagg 420
acaaggaggg aggatttagc ggcgagctga agggagacgt tcagggtctt ctctccttgt 480
acgaggcgtc ctacctggga ttcgagggag agaacctcct ggaggaagct cgtacatttt 540
ccatcactca ccttaagaat aaccttaagg agggaattaa caccaaggtg gccgagcagg 600
tttctcacgc cctggagctc ccctaccacc aacggctcca tagactggag gctcgttggt 660
tcctggacaa atatgagcca aaggagcctc atcatcagtt gctgttggag ttggccaagc 720
tggacttcaa tatggttcag acgctgcacc aaaaggagtt gcaggacctg tctcgatggt 780
ggaccgagat gggattggcc tcgaagctgg attttgtccg tgaccgactt atggaggtct 840
atttttgggc ccttggaatg gcgcctgacc cccagttcgg agagtgccgg aaggcggtga 900
cgaagatgtt cggtcttgtg actatcatcg acgacgtcta cgatgtctac ggcacactcg 960
acgagttgca gctgttcact gacgccgtcg agcgatggga tgtgaacgcc attaatactc 1020
tccctgacta tatgaagctg tgcttcctgg ctctgtacaa cactgtcaac gatacctcgt 1080
actctatcct caaggagaag ggacacaaca atctctccta cttgaccaaa tcctggcgag 1140
aactgtgcaa ggcttttctg caggaggcta aatggtccaa taacaagatc attcctgctt 1200
tttctaaata cctggaaaat gcctcggtgt cgagctctgg cgtcgccctt ctggcccctt 1260
cctacttctc cgtctgccag cagcaggagg atatttccga tcatgctctt agatcgctga 1320
ccgattttca cggcctcgtg cgatcttcct gcgtgatttt tcggttgtgt aatgaccttg 1380
cgacctctgc tgctgagctg gaacgaggcg agactacaaa ttccattatt tcttacatgc 1440
acgaaaacga tggaacatct gaagaacagg ctagagagga actgcgaaag ttgatcgacg 1500
ccgagtggaa gaagatgaac agagagcggg tgtccgactc taccctgctt cccaaggcct 1560
tcatggagat cgccgtgaac atggctcgag tttcccattg tacttaccag tacggtgacg 1620
gcctgggtcg tccggactac gctacagaga accgaatcaa gctgctgctc atcgacccct 1680
tccctatcaa ccaattgatg tacgtgtaat agtctagagg atcc 1724
<210> 9
<211> 1641
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 9
tgaagcacgt agaagcgcca actacgaacc caactcctgg gattatgact ttctgctgtc 60
ttctgacacc gacgagtcga tcgaggttta taaggataag gccaagaaac ttgaggccga 120
ggtcagacga gagattaaca acgagaaggc cgagttcctg acccttcttg agctgatcga 180
caacgttcaa cgacttggtc ttggttaccg tttcgaatcc gatatccgac gtgcattgga 240
tcgatttgtc tcgtccggag gtttcgatgg tgtgactaag acgtcgctgc acgccacagc 300
tctttccttc agactgttgc ggcagcatgg atttgaggtt tcccaggaag ccttttctgg 360
tttcaaggat cagaacggaa actttttgga gaatctcaag gaggacacca aggccatcct 420
gtcgttgtat gaggcctcgt tcctggctct tgagggcgag aatattctgg atgaggctcg 480
ggttttcgct atttcgcacc tgaaggagtt gtcggaggaa aagatcggaa aggaactggc 540
cgagcaggtc aaccatgcac ttgaacttcc cctgcatcga cgtacccagc gactggaggc 600
cgtgtggagc atcgaggcgt acagaaaaaa ggaggatgct aatcaggttc tgctcgaact 660
cgctatcctc gactataaca tgattcagag cgtgtaccag cgtgacttgc gagagacaag 720
ccggtggtgg cgacgggtgg gactggccac gaagctccac tttgctaaag atcgattgat 780
tgagtcgttc tactgggcag tgggtgtggc ctttgagcct cagtactccg actgccgaaa 840
ctccgttgca aagatgtttt cttttgtcac tatcatcgac gacatctacg atgtttacgg 900
cactctcgat gaactcgaac tcttcacgga cgctgtcgag cgatgggatg tgaatgccat 960
taatgatctg ccagattata tgaagttgtg tttcttggcg ctctacaaca caattaatga 1020
aattgcctac gacaacctca aggacaaggg agagaacatt ctgccctacc ttactaaagc 1080
ctgggccgac ctgtgtaacg cctttttgca ggaagccaag tggctctata acaaatctac 1140
tcctacattt gatgactact tcggcaacgc ttggaagtct tccagcggcc ctctccagtt 1200
gatcttcgct tactttgcag tggtccagaa catcaagaaa gaggagattg agaacctcca 1260
gaagtatcac gacatcatct cccgaccttc gcacatcttt cgactgtgca atgaccttgc 1320
ctccgcatcc gctgagattg cccgaggaga aacagccaat tctgtgtcgt gttacatgcg 1380
tacaaagggc atctccgagg agctggctac cgagtctgtg atgaacctga tcgatgaaac 1440
ctgtaagaag atgaacaaag agaaactggg cggttctctg ttcgccaaac catttgttga 1500
aaccgcgatc aatctggctc gtcagtctca ttgtacttac cataacggtg acgcgcacac 1560
ttcgccggac gaattgaccc gtaagcgtgt gctttcggtg attaccgagc cgatcctgcc 1620
gttcgaaaga taataggatc c 1641
<210> 10
<211> 8804
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 10
gctggtacca tatgggaatt cgaagctttc tagaacaaaa actcatctca gaagaggatc 60
tgaatagcgc cgtcgaccat catcatcatc atcattgagt ttaaacggtc tccagcttgg 120
ctgttttggc ggatgagaga agattttcag cctgatacag attaaatcag aacgcagaag 180
cggtctgata aaacagaatt tgcctggcgg cagtagcgcg gtggtcccac ctgaccccat 240
gccgaactca gaagtgaaac gccgtagcgc cgatggtagt gtggggtctc cccatgcgag 300
agtagggaac tgccaggcat caaataaaac gaaaggctca gtcgaaagac tgggcctttc 360
gttttatctg ttgtttgtcg gtgaacgctc tcctgagtag gacaaatccg ccgggagcgg 420
atttgaacgt tgcgaagcaa cggcccggag ggtggcgggc aggacgcccg ccataaactg 480
ccaggcatca aattaagcag aaggccatcc tgacggatgg cctttttgcg tttctacaaa 540
ctctttttgt ttatttttct aaatacattc aaatatgtat ccgcttaacc ggaattgcca 600
gctggggcgc cctctggtaa ggttgggaag ccctgcaaag taaactggat ggctttctcg 660
ccgccaagga tctgatggcg caggggatca agctctgatc aagagacagg atgaggatcg 720
tttcgcatga ttgaacaaga tggattgcac gcaggttctc cggccgcttg ggtggagagg 780
ctattcggct atgactgggc acaacagaca atcggctgct ctgatgccgc cgtgttccgg 840
ctgtcagcgc aggggcgccc ggttcttttt gtcaagaccg acctgtccgg tgccctgaat 900
gaactgcaag acgaggcagc gcggctatcg tggctggcca cgacgggcgt tccttgcgca 960
gctgtgctcg acgttgtcac tgaagcggga agggactggc tgctattggg cgaagtgccg 1020
gggcaggatc tcctgtcatc tcaccttgct cctgccgaga aagtatccat catggctgat 1080
gcaatgcggc ggctgcatac gcttgatccg gctacctgcc cattcgacca ccaagcgaaa 1140
catcgcatcg agcgagcacg tactcggatg gaagccggtc ttgtcgatca ggatgatctg 1200
gacgaagagc atcaggggct cgcgccagcc gaactgttcg ccaggctcaa ggcgagcatg 1260
cccgacggcg aggatctcgt cgtgacccat ggcgatgcct gcttgccgaa tatcatggtg 1320
gaaaatggcc gcttttctgg attcatcgac tgtggccggc tgggtgtggc ggaccgctat 1380
caggacatag cgttggctac ccgtgatatt gctgaagagc ttggcggcga atgggctgac 1440
cgcttcctcg tgctttacgg tatcgccgct cccgattcgc agcgcatcgc cttctatcgc 1500
cttcttgacg agttcttctg acatgaccaa aatcccttaa cgtgagtttt cgttccactg 1560
agcgtcagac cccgtagaaa agatcaaagg atcttcttga gatccttttt ttctgcgcgt 1620
aatctgctgc ttgcaaacaa aaaaaccacc gctaccagcg gtggtttgtt tgccggatca 1680
agagctacca actctttttc cgaaggtaac tggcttcagc agagcgcaga taccaaatac 1740
tgtccttcta gtgtagccgt agttaggcca ccacttcaag aactctgtag caccgcctac 1800
atacctcgct ctgctaatcc tgttaccagt ggctgctgcc agtggcgata agtcgtgtct 1860
taccgggttg gactcaagac gatagttacc ggataaggcg cagcggtcgg gctgaacggg 1920
gggttcgtgc acacagccca gcttggagcg aacgacctac accgaactga gatacctaca 1980
gcgtgagcta tgagaaagcg ccacgcttcc cgaagggaga aaggcggaca ggtatccggt 2040
aagcggcagg gtcggaacag gagagcgcac gagggagctt ccagggggaa acgcctggta 2100
tctttatagt cctgtcgggt ttcgccacct ctgacttgag cgtcgatttt tgtgatgctc 2160
gtcagggggg cggagcctat ggaaaaacgc cagcaacgcg gcctttttac ggttcctggc 2220
cttttgctgg ccttttgctc acatgttctt tcctgcgtta tcccctgatt ctgtggataa 2280
ccgtattacc gcctttgagt gagctgatac cgctcgccgc agccgaacga ccgagcgcag 2340
cgagtcagtg agcgaggaag cggaagagcg cctgatgcgg tattttctcc ttacgcatct 2400
gtgcggtatt tcacaccgca tatggtgcac tctcagtaca atctgctctg atgccgcata 2460
gttaagccag tatacactcc gctatcgcta cgtgactggg tcatggctgc gccccgacac 2520
ccgccaacac ccgctgacgc gccctgacgg gcttgtctgc tcccggcatc cgcttacaga 2580
caagctgtga ccgtctccgg gagctgcatg tgtcagaggt tttcaccgtc atcaccgaaa 2640
cgcgcgaggc agcagatcaa ttcgcgcgcg aaggcgaagc ggcatgcatt tacgttgaca 2700
ccatcgaatg gtgcaaaacc tttcgcggta tggcatgata gcgcccggaa gagagtcaat 2760
tcagggtggt gaatgtgaaa ccagtaacgt tatacgatgt cgcagagtat gccggtgtct 2820
cttatcagac cgtttcccgc gtggtgaacc aggccagcca cgtttctgcg aaaacgcggg 2880
aaaaagtgga agcggcgatg gcggagctga attacattcc caaccgcgtg gcacaacaac 2940
tggcgggcaa acagtcgttg ctgattggcg ttgccacctc cagtctggcc ctgcacgcgc 3000
cgtcgcaaat tgtcgcggcg attaaatctc gcgccgatca actgggtgcc agcgtggtgg 3060
tgtcgatggt agaacgaagc ggcgtcgaag cctgtaaagc ggcggtgcac aatcttctcg 3120
cgcaacgcgt cagtgggctg atcattaact atccgctgga tgaccaggat gccattgctg 3180
tggaagctgc ctgcactaat gttccggcgt tatttcttga tgtctctgac cagacaccca 3240
tcaacagtat tattttctcc catgaagacg gtacgcgact gggcgtggag catctggtcg 3300
cattgggtca ccagcaaatc gcgctgttag cgggcccatt aagttctgtc tcggcgcgtc 3360
tgcgtctggc tggctggcat aaatatctca ctcgcaatca aattcagccg atagcggaac 3420
gggaaggcga ctggagtgcc atgtccggtt ttcaacaaac catgcaaatg ctgaatgagg 3480
gcatcgttcc cactgcgatg ctggttgcca acgatcagat ggcgctgggc gcaatgcgcg 3540
ccattaccga gtccgggctg cgcgttggtg cggatatctc ggtagtggga tacgacgata 3600
ccgaagacag ctcatgttat atcccgccgt caaccaccat caaacaggat tttcgcctgc 3660
tggggcaaac cagcgtggac cgcttgctgc aactctctca gggccaggcg gtgaagggca 3720
atcagctgtt gcccgtctca ctggtgaaaa gaaaaaccac cctggcgccc aatacgcaaa 3780
ccgcctctcc ccgcgcgttg gccgattcat taatgcagct ggcacgacag gtttcccgac 3840
tggaaagcgg gcagtgagcg caacgcaatt aatgtgagtt agcgcgaatt gatctggttt 3900
gacagcttat catcgactgc acggtgcacc aatgcttctg gcgtcaggca gccatcggaa 3960
gctgtggtat ggctgtgcag gtcgtaaatc actgcataat tcgtgtcgct caaggcgcac 4020
tcccgttctg gataatgttt tttgcgccga catcataacg gttctggcaa atattctgaa 4080
atgagctgtt gacaattaat catccggctc gtataatgtg tggaattgtg agcggataac 4140
aatttcacac aggaaacagc gccgctgaga aaaagcgaag cggcactgct ctttaacaat 4200
ttatcagaca atctgtgtgg gcactcgacc ggaattatcg attaacttta ttattaaaaa 4260
ttaaagaggt atatattaat gtatcgatta aataaggagg aataaaccat gtgtgcgacc 4320
tcttctcaat ttactcagat taccgagcat aattcccgtc gttccgcaaa ctatcagcca 4380
aacctgtgga atttcgaatt cctgcaatcc ctggagaacg acctgaaagt ggaaaagctg 4440
gaggagaaag cgaccaaact ggaggaagaa gttcgctgca tgatcaaccg tgtagacacc 4500
cagccgctgt ccctgctgga gctgatcgac gatgtgcagc gcctgggtct gacctacaaa 4560
tttgaaaaag acatcattaa agccctggaa aacatcgtac tgctggacga aaacaaaaag 4620
aacaaatctg acctgcacgc aaccgctctg tctttccgtc tgctgcgtca gcacggtttc 4680
gaggtttctc aggatgtttt tgagcgtttc aaggataaag aaggtggttt cagcggtgaa 4740
ctgaaaggtg acgtccaagg cctgctgagc ctgtatgaag cgtcttacct gggtttcgag 4800
ggtgagaacc tgctggagga ggcgcgtacc ttttccatca cccacctgaa gaacaacctg 4860
aaagaaggca ttaataccaa ggttgcagaa caagtgagcc acgccctgga actgccatat 4920
caccagcgtc tgcaccgtct ggaggcacgt tggttcctgg ataaatacga accgaaagaa 4980
ccgcatcacc agctgctgct ggagctggcg aagctggatt ttaacatggt acagaccctg 5040
caccagaaag agctgcaaga tctgtcccgc tggtggaccg agatgggcct ggctagcaaa 5100
ctggattttg tacgcgaccg cctgatggaa gtttatttct gggcactggg tatggcgcca 5160
gacccgcagt ttggtgaatg tcgcaaagct gttactaaaa tgtttggtct ggtgacgatc 5220
atcgatgacg tgtatgacgt ttatggcact ctggacgaac tgcaactgtt caccgatgct 5280
gtagagcgct gggacgttaa cgctattaac accctgccgg actatatgaa actgtgtttc 5340
ctggcactgt acaacaccgt taacgacacg tcctattcta ttctgaaaga gaaaggtcat 5400
aacaacctgt cctatctgac gaaaagctgg cgtgaactgt gcaaagcctt tctgcaagag 5460
gcgaaatggt ccaacaacaa aattatcccg gctttctcca agtacctgga aaacgccagc 5520
gtttcctcct ccggtgtagc gctgctggcg ccgtcttact tttccgtatg ccagcagcag 5580
gaagacatct ccgaccacgc gctgcgttcc ctgaccgact tccatggtct ggtgcgttct 5640
agctgcgtta tcttccgcct gtgcaacgat ctggccacct ctgcggcgga gctggaacgt 5700
ggcgagacta ccaattctat cattagctac atgcacgaaa acgatggtac cagcgaggaa 5760
caggcccgcg aagaactgcg taaactgatc gacgccgaat ggaaaaagat gaatcgtgaa 5820
cgcgttagcg actccaccct gctgcctaaa gcgttcatgg aaatcgcagt taacatggca 5880
cgtgtttccc actgcaccta ccagtatggc gatggtctgg gtcgcccaga ctacgcgact 5940
gaaaaccgca tcaaactgct gctgattgac cctttcccga ttaaccagct gatgtatgtc 6000
taactgcatc gcccttagga ggtaaaaaaa aatgactgcc gacaacaata gtatgcccca 6060
tggtgcagta tctagttacg ccaaattagt gcaaaaccaa acacctgaag acattttgga 6120
agagtttcct gaaattattc cattacaaca aagacctaat acccgatcta gtgagacgtc 6180
aaatgacgaa agcggagaaa catgtttttc tggtcatgat gaggagcaaa ttaagttaat 6240
gaatgaaaat tgtattgttt tggattggga cgataatgct attggtgccg gtaccaagaa 6300
agtttgtcat ttaatggaaa atattgaaaa gggtttacta catcgtgcat tctccgtctt 6360
tattttcaat gaacaaggtg aattactttt acaacaaaga gccactgaaa aaataacttt 6420
ccctgatctt tggactaaca catgctgctc tcatccacta tgtattgatg acgaattagg 6480
tttgaagggt aagctagacg ataagattaa gggcgctatt actgcggcgg tgagaaaact 6540
agatcatgaa ttaggtattc cagaagatga aactaagaca aggggtaagt ttcacttttt 6600
aaacagaatc cattacatgg caccaagcaa tgaaccatgg ggtgaacatg aaattgatta 6660
catcctattt tataagatca acgctaaaga aaacttgact gtcaacccaa acgtcaatga 6720
agttagagac ttcaaatggg tttcaccaaa tgatttgaaa actatgtttg ctgacccaag 6780
ttacaagttt acgccttggt ttaagattat ttgcgagaat tacttattca actggtggga 6840
gcaattagat gacctttctg aagtggaaaa tgacaggcaa attcatagaa tgctataaca 6900
acgcgtcctg cattcgccct taggaggtaa aaaaacatga gttttgatat tgccaaatac 6960
ccgaccctgg cactggtcga ctccacccag gagttacgac tgttgccgaa agagagttta 7020
ccgaaactct gcgacgaact gcgccgctat ttactcgaca gcgtgagccg ttccagcggg 7080
cacttcgcct ccgggctggg cacggtcgaa ctgaccgtgg cgctgcacta tgtctacaac 7140
accccgtttg accaattgat ttgggatgtg gggcatcagg cttatccgca taaaattttg 7200
accggacgcc gcgacaaaat cggcaccatc cgtcagaaag gcggtctgca cccgttcccg 7260
tggcgcggcg aaagcgaata tgacgtatta agcgtcgggc attcatcaac ctccatcagt 7320
gccggaattg gtattgcggt tgctgccgaa aaagaaggca aaaatcgccg caccgtctgt 7380
gtcattggcg atggcgcgat taccgcaggc atggcgtttg aagcgatgaa tcacgcgggc 7440
gatatccgtc ctgatatgct ggtgattctc aacgacaatg aaatgtcgat ttccgaaaat 7500
gtcggcgcgc tcaacaacca tctggcacag ctgctttccg gtaagcttta ctcttcactg 7560
cgcgaaggcg ggaaaaaagt tttctctggc gtgccgccaa ttaaagagct gctcaaacgc 7620
accgaagaac atattaaagg catggtagtg cctggcacgt tgtttgaaga gctgggcttt 7680
aactacatcg gcccggtgga cggtcacgat gtgctggggc ttatcaccac gctaaagaac 7740
atgcgcgacc tgaaaggccc gcagttcctg catatcatga ccaaaaaagg tcgtggttat 7800
gaaccggcag aaaaagaccc gatcactttc cacgccgtgc ctaaatttga tccctccagc 7860
ggttgtttgc cgaaaagtag cggcggtttg ccgagctatt caaaaatctt tggcgactgg 7920
ttgtgcgaaa cggcagcgaa agacaacaag ctgatggcga ttactccggc gatgcgtgaa 7980
ggttccggca tggtcgagtt ttcacgtaaa ttcccggatc gctacttcga cgtggcaatt 8040
gccgagcaac acgcggtgac ctttgctgcg ggtctggcga ttggtgggta caaacccatt 8100
gtcgcgattt actccacttt cctgcaacgc gcctatgatc aggtgctgca tgacgtggcg 8160
attcaaaagc ttccggtcct gttcgccatc gaccgcgcgg gcattgttgg tgctgacggt 8220
caaacccatc agggtgcttt tgatctctct tacctgcgct gcataccgga aatggtcatt 8280
atgaccccga gcgatgaaaa cgaatgtcgc cagatgctct ataccggcta tcactataac 8340
gatggcccgt cagcggtgcg ctacccgcgt ggcaacgcgg tcggcgtgga actgacgccg 8400
ctggaaaaac taccaattgg caaaggcatt gtgaagcgtc gtggcgagaa actggcgatc 8460
cttaactttg gtacgctgat gccagaagcg gcgaaagtcg ccgaatcgct gaacgccacg 8520
ctggtcgata tgcgttttgt gaaaccgctt gatgaagcgt taattctgga aatggccgcc 8580
agccatgaag cgctggtcac cgtagaagaa aacgccatta tgggcggcgc aggcagcggc 8640
gtgaacgaag tgctgatggc ccatcgtaaa ccagtacccg tgctgaacat tggcctgccg 8700
gacttcttta ttccgcaagg aactcaggaa gaaatgcgcg ccgaactcgg cctcgatgcc 8760
gctggtatgg aagccaaaat caaggcctgg ctggcataac tgca 8804
<210> 11
<211> 10992
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 11
gtttgacagc ttatcatcga ctgcacggtg caccaatgct tctggcgtca ggcagccatc 60
ggaagctgtg gtatggctgt gcaggtcgta aatcactgca taattcgtgt cgctcaaggc 120
gcactcccgt tctggataat gttttttgcg ccgacatcat aacggttctg gcaaatattc 180
tgaaatgagc tgttgacaat taatcatccg gctcgtataa tgtgtggaat tgtgagcgga 240
taacaatttc acacaggaaa cagcgccgct gagaaaaagc gaagcggcac tgctctttaa 300
caatttatca gacaatctgt gtgggcactc gaccggaatt atcgattaac tttattatta 360
aaaattaaag aggtatatat taatgtatcg attaaataag gaggaataaa ccatggatcc 420
gagctcggat ccactagtaa cggccgccag tgtgctggaa ttcgccctta ggaggtaaaa 480
aaacatgtca ttaccgttct taacttctgc accgggaaag gttattattt ttggtgaaca 540
ctctgctgtg tacaacaagc ctgccgtcgc tgctagtgtg tctgcgttga gaacctacct 600
gctaataagc gagtcatctg caccagatac tattgaattg gacttcccgg acattagctt 660
taatcataag tggtccatca atgatttcaa tgccatcacc gaggatcaag taaactccca 720
aaaattggcc aaggctcaac aagccaccga tggcttgtct caggaactcg ttagtctttt 780
ggatccgttg ttagctcaac tatccgaatc cttccactac catgcagcgt tttgtttcct 840
gtatatgttt gtttgcctat gcccccatgc caagaatatt aagttttctt taaagtctac 900
tttacccatc ggtgctgggt tgggctcaag cgcctctatt tctgtatcac tggccttagc 960
tatggcctac ttgggggggt taataggatc taatgacttg gaaaagctgt cagaaaacga 1020
taagcatata gtgaatcaat gggccttcat aggtgaaaag tgtattcacg gtaccccttc 1080
aggaatagat aacgctgtgg ccacttatgg taatgccctg ctatttgaaa aagactcaca 1140
taatggaaca ataaacacaa acaattttaa gttcttagat gatttcccag ccattccaat 1200
gatcctaacc tatactagaa ttccaaggtc tacaaaagat cttgttgctc gcgttcgtgt 1260
gttggtcacc gagaaatttc ctgaagttat gaagccaatt ctagatgcca tgggtgaatg 1320
tgccctacaa ggcttagaga tcatgactaa gttaagtaaa tgtaaaggca ccgatgacga 1380
ggctgtagaa actaataatg aactgtatga acaactattg gaattgataa gaataaatca 1440
tggactgctt gtctcaatcg gtgtttctca tcctggatta gaacttatta aaaatctgag 1500
cgatgatttg agaattggct ccacaaaact taccggtgct ggtggcggcg gttgctcttt 1560
gactttgtta cgaagagaca ttactcaaga gcaaattgac agcttcaaaa agaaattgca 1620
agatgatttt agttacgaga catttgaaac agacttgggt gggactggct gctgtttgtt 1680
aagcgcaaaa aatttgaata aagatcttaa aatcaaatcc ctagtattcc aattatttga 1740
aaataaaact accacaaagc aacaaattga cgatctatta ttgccaggaa acacgaattt 1800
accatggact tcataagcta atttgcgata ggcctgcacc cttaaggagg aaaaaaacat 1860
gtcagagttg agagccttca gtgccccagg gaaagcgtta ctagctggtg gatatttagt 1920
tttagataca aaatatgaag catttgtagt cggattatcg gcaagaatgc atgctgtagc 1980
ccatccttac ggttcattgc aagggtctga taagtttgaa gtgcgtgtga aaagtaaaca 2040
atttaaagat ggggagtggc tgtaccatat aagtcctaaa agtggcttca ttcctgtttc 2100
gataggcgga tctaagaacc ctttcattga aaaagttatc gctaacgtat ttagctactt 2160
taaacctaac atggacgact actgcaatag aaacttgttc gttattgata ttttctctga 2220
tgatgcctac cattctcagg aggatagcgt taccgaacat cgtggcaaca gaagattgag 2280
ttttcattcg cacagaattg aagaagttcc caaaacaggg ctgggctcct cggcaggttt 2340
agtcacagtt ttaactacag ctttggcctc cttttttgta tcggacctgg aaaataatgt 2400
agacaaatat agagaagtta ttcataattt agcacaagtt gctcattgtc aagctcaggg 2460
taaaattgga agcgggtttg atgtagcggc ggcagcatat ggatctatca gatatagaag 2520
attcccaccc gcattaatct ctaatttgcc agatattgga agtgctactt acggcagtaa 2580
actggcgcat ttggttgatg aagaagactg gaatattacg attaaaagta accatttacc 2640
ttcgggatta actttatgga tgggcgatat taagaatggt tcagaaacag taaaactggt 2700
ccagaaggta aaaaattggt atgattcgca tatgccagaa agcttgaaaa tatatacaga 2760
actcgatcat gcaaattcta gatttatgga tggactatct aaactagatc gcttacacga 2820
gactcatgac gattacagcg atcagatatt tgagtctctt gagaggaatg actgtacctg 2880
tcaaaagtat cctgaaatca cagaagttag agatgcagtt gccacaatta gacgttcctt 2940
tagaaaaata actaaagaat ctggtgccga tatcgaacct cccgtacaaa ctagcttatt 3000
ggatgattgc cagaccttaa aaggagttct tacttgctta atacctggtg ctggtggtta 3060
tgacgccatt gcagtgatta ctaagcaaga tgttgatctt agggctcaaa ccgctaatga 3120
caaaagattt tctaaggttc aatggctgga tgtaactcag gctgactggg gtgttaggaa 3180
agaaaaagat ccggaaactt atcttgataa ataacttaag gtagctgcat gcagaattcg 3240
cccttaagga ggaaaaaaaa atgaccgttt acacagcatc cgttaccgca cccgtcaaca 3300
tcgcaaccct taagtattgg gggaaaaggg acacgaagtt gaatctgccc accaattcgt 3360
ccatatcagt gactttatcg caagatgacc tcagaacgtt gacctctgcg gctactgcac 3420
ctgagtttga acgcgacact ttgtggttaa atggagaacc acacagcatc gacaatgaaa 3480
gaactcaaaa ttgtctgcgc gacctacgcc aattaagaaa ggaaatggaa tcgaaggacg 3540
cctcattgcc cacattatct caatggaaac tccacattgt ctccgaaaat aactttccta 3600
cagcagctgg tttagcttcc tccgctgctg gctttgctgc attggtctct gcaattgcta 3660
agttatacca attaccacag tcaacttcag aaatatctag aatagcaaga aaggggtctg 3720
gttcagcttg tagatcgttg tttggcggat acgtggcctg ggaaatggga aaagctgaag 3780
atggtcatga ttccatggca gtacaaatcg cagacagctc tgactggcct cagatgaaag 3840
cttgtgtcct agttgtcagc gatattaaaa aggatgtgag ttccactcag ggtatgcaat 3900
tgaccgtggc aacctccgaa ctatttaaag aaagaattga acatgtcgta ccaaagagat 3960
ttgaagtcat gcgtaaagcc attgttgaaa aagatttcgc cacctttgca aaggaaacaa 4020
tgatggattc caactctttc catgccacat gtttggactc tttccctcca atattctaca 4080
tgaatgacac ttccaagcgt atcatcagtt ggtgccacac cattaatcag ttttacggag 4140
aaacaatcgt tgcatacacg tttgatgcag gtccaaatgc tgtgttgtac tacttagctg 4200
aaaatgagtc gaaactcttt gcatttatct ataaattgtt tggctctgtt cctggatggg 4260
acaagaaatt tactactgag cagcttgagg ctttcaacca tcaatttgaa tcatctaact 4320
ttactgcacg tgaattggat cttgagttgc aaaaggatgt tgccagagtg attttaactc 4380
aagtcggttc aggcccacaa gaaacaaacg aatctttgat tgacgcaaag actggtctac 4440
caaaggaata agatcaattc gctgcatcgc ccttaggagg taaaaaaaaa tgactgccga 4500
caacaatagt atgccccatg gtgcagtatc tagttacgcc aaattagtgc aaaaccaaac 4560
acctgaagac attttggaag agtttcctga aattattcca ttacaacaaa gacctaatac 4620
ccgatctagt gagacgtcaa atgacgaaag cggagaaaca tgtttttctg gtcatgatga 4680
ggagcaaatt aagttaatga atgaaaattg tattgttttg gattgggacg ataatgctat 4740
tggtgccggt accaagaaag tttgtcattt aatggaaaat attgaaaagg gtttactaca 4800
tcgtgcattc tccgtcttta ttttcaatga acaaggtgaa ttacttttac aacaaagagc 4860
cactgaaaaa ataactttcc ctgatctttg gactaacaca tgctgctctc atccactatg 4920
tattgatgac gaattaggtt tgaagggtaa gctagacgat aagattaagg gcgctattac 4980
tgcggcggtg agaaaactag atcatgaatt aggtattcca gaagatgaaa ctaagacaag 5040
gggtaagttt cactttttaa acagaatcca ttacatggca ccaagcaatg aaccatgggg 5100
tgaacatgaa attgattaca tcctatttta taagatcaac gctaaagaaa acttgactgt 5160
caacccaaac gtcaatgaag ttagagactt caaatgggtt tcaccaaatg atttgaaaac 5220
tatgtttgct gacccaagtt acaagtttac gccttggttt aagattattt gcgagaatta 5280
cttattcaac tggtgggagc aattagatga cctttctgaa gtggaaaatg acaggcaaat 5340
tcatagaatg ctataacaac gcgtcctgca ttcgccctta ggaggtaaaa aaacatgtgt 5400
gcgacctctt ctcaatttac tcagattacc gagcataatt cccgtcgttc cgcaaactat 5460
cagccaaacc tgtggaattt cgaattcctg caatccctgg agaacgacct gaaagtggaa 5520
aagctggagg agaaagcgac caaactggag gaagaagttc gctgcatgat caaccgtgta 5580
gacacccagc cgctgtccct gctggagctg atcgacgatg tgcagcgcct gggtctgacc 5640
tacaaatttg aaaaagacat cattaaagcc ctggaaaaca tcgtactgct ggacgaaaac 5700
aaaaagaaca aatctgacct gcacgcaacc gctctgtctt tccgtctgct gcgtcagcac 5760
ggtttcgagg tttctcagga tgtttttgag cgtttcaagg ataaagaagg tggtttcagc 5820
ggtgaactga aaggtgacgt ccaaggcctg ctgagcctgt atgaagcgtc ttacctgggt 5880
ttcgagggtg agaacctgct ggaggaggcg cgtacctttt ccatcaccca cctgaagaac 5940
aacctgaaag aaggcattaa taccaaggtt gcagaacaag tgagccacgc cctggaactg 6000
ccatatcacc agcgtctgca ccgtctggag gcacgttggt tcctggataa atacgaaccg 6060
aaagaaccgc atcaccagct gctgctggag ctggcgaagc tggattttaa catggtacag 6120
accctgcacc agaaagagct gcaagatctg tcccgctggt ggaccgagat gggcctggct 6180
agcaaactgg attttgtacg cgaccgcctg atggaagttt atttctgggc actgggtatg 6240
gcgccagacc cgcagtttgg tgaatgtcgc aaagctgtta ctaaaatgtt tggtctggtg 6300
acgatcatcg atgacgtgta tgacgtttat ggcactctgg acgaactgca actgttcacc 6360
gatgctgtag agcgctggga cgttaacgct attaacaccc tgccggacta tatgaaactg 6420
tgtttcctgg cactgtacaa caccgttaac gacacgtcct attctattct gaaagagaaa 6480
ggtcataaca acctgtccta tctgacgaaa agctggcgtg aactgtgcaa agcctttctg 6540
caagaggcga aatggtccaa caacaaaatt atcccggctt tctccaagta cctggaaaac 6600
gccagcgttt cctcctccgg tgtagcgctg ctggcgccgt cttacttttc cgtatgccag 6660
cagcaggaag acatctccga ccacgcgctg cgttccctga ccgacttcca tggtctggtg 6720
cgttctagct gcgttatctt ccgcctgtgc aacgatctgg ccacctctgc ggcggagctg 6780
gaacgtggcg agactaccaa ttctatcatt agctacatgc acgaaaacga tggtaccagc 6840
gaggaacagg cccgcgaaga actgcgtaaa ctgatcgacg ccgaatggaa aaagatgaat 6900
cgtgaacgcg ttagcgactc caccctgctg cctaaagcgt tcatggaaat cgcagttaac 6960
atggcacgtg tttcccactg cacctaccag tatggcgatg gtctgggtcg cccagactac 7020
gcgactgaaa accgcatcaa actgctgctg attgaccctt tcccgattaa ccagctgatg 7080
tatgtctaac tgcagctggt accatatggg aattcgaagc tttctagaac aaaaactcat 7140
ctcagaagag gatctgaata gcgccgtcga ccatcatcat catcatcatt gagtttaaac 7200
ggtctccagc ttggctgttt tggcggatga gagaagattt tcagcctgat acagattaaa 7260
tcagaacgca gaagcggtct gataaaacag aatttgcctg gcggcagtag cgcggtggtc 7320
ccacctgacc ccatgccgaa ctcagaagtg aaacgccgta gcgccgatgg tagtgtgggg 7380
tctccccatg cgagagtagg gaactgccag gcatcaaata aaacgaaagg ctcagtcgaa 7440
agactgggcc tttcgtttta tctgttgttt gtcggtgaac gctctcctga gtaggacaaa 7500
tccgccggga gcggatttga acgttgcgaa gcaacggccc ggagggtggc gggcaggacg 7560
cccgccataa actgccaggc atcaaattaa gcagaaggcc atcctgacgg atggcctttt 7620
tgcgtttcta caaactcttt ttgtttattt ttctaaatac attcaaatat gtatccgctt 7680
aaccggaatt gccagctggg gcgccctctg gtaaggttgg gaagccctgc aaagtaaact 7740
ggatggcttt ctcgccgcca aggatctgat ggcgcagggg atcaagctct gatcaagaga 7800
caggatgagg atcgtttcgc atgattgaac aagatggatt gcacgcaggt tctccggccg 7860
cttgggtgga gaggctattc ggctatgact gggcacaaca gacaatcggc tgctctgatg 7920
ccgccgtgtt ccggctgtca gcgcaggggc gcccggttct ttttgtcaag accgacctgt 7980
ccggtgccct gaatgaactg caagacgagg cagcgcggct atcgtggctg gccacgacgg 8040
gcgttccttg cgcagctgtg ctcgacgttg tcactgaagc gggaagggac tggctgctat 8100
tgggcgaagt gccggggcag gatctcctgt catctcacct tgctcctgcc gagaaagtat 8160
ccatcatggc tgatgcaatg cggcggctgc atacgcttga tccggctacc tgcccattcg 8220
accaccaagc gaaacatcgc atcgagcgag cacgtactcg gatggaagcc ggtcttgtcg 8280
atcaggatga tctggacgaa gagcatcagg ggctcgcgcc agccgaactg ttcgccaggc 8340
tcaaggcgag catgcccgac ggcgaggatc tcgtcgtgac ccatggcgat gcctgcttgc 8400
cgaatatcat ggtggaaaat ggccgctttt ctggattcat cgactgtggc cggctgggtg 8460
tggcggaccg ctatcaggac atagcgttgg ctacccgtga tattgctgaa gagcttggcg 8520
gcgaatgggc tgaccgcttc ctcgtgcttt acggtatcgc cgctcccgat tcgcagcgca 8580
tcgccttcta tcgccttctt gacgagttct tctgacgcat gaccaaaatc ccttaacgtg 8640
agttttcgtt ccactgagcg tcagaccccg tagaaaagat caaaggatct tcttgagatc 8700
ctttttttct gcgcgtaatc tgctgcttgc aaacaaaaaa accaccgcta ccagcggtgg 8760
tttgtttgcc ggatcaagag ctaccaactc tttttccgaa ggtaactggc ttcagcagag 8820
cgcagatacc aaatactgtc cttctagtgt agccgtagtt aggccaccac ttcaagaact 8880
ctgtagcacc gcctacatac ctcgctctgc taatcctgtt accagtggct gctgccagtg 8940
gcgataagtc gtgtcttacc gggttggact caagacgata gttaccggat aaggcgcagc 9000
ggtcgggctg aacggggggt tcgtgcacac agcccagctt ggagcgaacg acctacaccg 9060
aactgagata cctacagcgt gagctatgag aaagcgccac gcttcccgaa gggagaaagg 9120
cggacaggta tccggtaagc ggcagggtcg gaacaggaga gcgcacgagg gagcttccag 9180
ggggaaacgc ctggtatctt tatagtcctg tcgggtttcg ccacctctga cttgagcgtc 9240
gatttttgtg atgctcgtca ggggggcgga gcctatggaa aaacgccagc aacgcggcct 9300
ttttacggtt cctggccttt tgctggcctt ttgctcacat gttctttcct gcgttatccc 9360
ctgattctgt ggataaccgt attaccgcct ttgagtgagc tgataccgct cgccgcagcc 9420
gaacgaccga gcgcagcgag tcagtgagcg aggaagcgga agagcgcctg atgcggtatt 9480
ttctccttac gcatctgtgc ggtatttcac accgcatatg gtgcactctc agtacaatct 9540
gctctgatgc cgcatagtta agccagtata cactccgcta tcgctacgtg actgggtcat 9600
ggctgcgccc cgacacccgc caacacccgc tgacgcgccc tgacgggctt gtctgctccc 9660
ggcatccgct tacagacaag ctgtgaccgt ctccgggagc tgcatgtgtc agaggttttc 9720
accgtcatca ccgaaacgcg cgaggcagca gatcaattcg cgcgcgaagg cgaagcggca 9780
tgcatttacg ttgacaccat cgaatggtgc aaaacctttc gcggtatggc atgatagcgc 9840
ccggaagaga gtcaattcag ggtggtgaat gtgaaaccag taacgttata cgatgtcgca 9900
gagtatgccg gtgtctctta tcagaccgtt tcccgcgtgg tgaaccaggc cagccacgtt 9960
tctgcgaaaa cgcgggaaaa agtggaagcg gcgatggcgg agctgaatta cattcccaac 10020
cgcgtggcac aacaactggc gggcaaacag tcgttgctga ttggcgttgc cacctccagt 10080
ctggccctgc acgcgccgtc gcaaattgtc gcggcgatta aatctcgcgc cgatcaactg 10140
ggtgccagcg tggtggtgtc gatggtagaa cgaagcggcg tcgaagcctg taaagcggcg 10200
gtgcacaatc ttctcgcgca acgcgtcagt gggctgatca ttaactatcc gctggatgac 10260
caggatgcca ttgctgtgga agctgcctgc actaatgttc cggcgttatt tcttgatgtc 10320
tctgaccaga cacccatcaa cagtattatt ttctcccatg aagacggtac gcgactgggc 10380
gtggagcatc tggtcgcatt gggtcaccag caaatcgcgc tgttagcggg cccattaagt 10440
tctgtctcgg cgcgtctgcg tctggctggc tggcataaat atctcactcg caatcaaatt 10500
cagccgatag cggaacggga aggcgactgg agtgccatgt ccggttttca acaaaccatg 10560
caaatgctga atgagggcat cgttcccact gcgatgctgg ttgccaacga tcagatggcg 10620
ctgggcgcaa tgcgcgccat taccgagtcc gggctgcgcg ttggtgcgga tatctcggta 10680
gtgggatacg acgataccga agacagctca tgttatatcc cgccgtcaac caccatcaaa 10740
caggattttc gcctgctggg gcaaaccagc gtggaccgct tgctgcaact ctctcagggc 10800
caggcggtga agggcaatca gctgttgccc gtctcactgg tgaaaagaaa aaccaccctg 10860
gcgcccaata cgcaaaccgc ctctccccgc gcgttggccg attcattaat gcagctggca 10920
cgacaggttt cccgactgga aagcgggcag tgagcgcaac gcaattaatg tgagttagcg 10980
cgaattgatc tg 10992
<210> 12
<211> 8703
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 12
cccgtcttac tgtcgggaat tcgcgttggc cgattcatta atgcagattc tgaaatgagc 60
tgttgacaat taatcatccg gctcgtataa tgtgtggaat tgtgagcgga taacaatttc 120
acacaggaaa cagcgccgct gagaaaaagc gaagcggcac tgctctttaa caatttatca 180
gacaatctgt gtgggcactc gaccggaatt atcgattaac tttattatta aaaattaaag 240
aggtatatat taatgtatcg attaaataag gaggaataaa ccatggatcc gagctcagga 300
ggtaaaaaaa catgaaaaca gtagttatta ttgatgcatt acgaacacca attggaaaat 360
ataaaggcag cttaagtcaa gtaagtgccg tagacttagg aacacatgtt acaacacaac 420
ttttaaaaag acattccact atttctgaag aaattgatca agtaatcttt ggaaatgttt 480
tacaagctgg aaatggccaa aatcccgcac gacaaatagc aataaacagc ggtttgtctc 540
atgaaattcc cgcaatgacg gttaatgagg tctgcggatc aggaatgaag gccgttattt 600
tggcgaaaca attgattcaa ttaggagaag cggaagtttt aattgctggc gggattgaga 660
atatgtccca agcacctaaa ttacaacgtt ttaattacga aacagaaagc tacgatgcgc 720
ctttttctag tatgatgtat gatggattaa cggatgcctt tagtggtcag gcaatgggct 780
taactgctga aaatgtggcc gaaaagtatc atgtaactag agaagagcaa gatcaatttt 840
ctgtacattc acaattaaaa gcagctcaag cacaagcaga agggatattc gctgacgaaa 900
tagccccatt agaagtatca ggaacgcttg tggagaaaga tgaagggatt cgccctaatt 960
cgagcgttga gaagctagga acgcttaaaa cagtttttaa agaagacggt actgtaacag 1020
cagggaatgc atcaaccatt aatgatgggg cttctgcttt gattattgct tcacaagaat 1080
atgccgaagc acacggtctt ccttatttag ctattattcg agacagtgtg gaagtcggta 1140
ttgatccagc ctatatggga atttcgccga ttaaagccat tcaaaaactg ttagcgcgca 1200
atcaacttac tacggaagaa attgatctgt atgaaatcaa cgaagcattt gcagcaactt 1260
caatcgtggt ccaaagagaa ctggctttac cagaggaaaa ggtcaacatt tatggtggcg 1320
gtatttcatt aggtcatgcg attggtgcca caggtgctcg tttattaacg agtttaagtt 1380
atcaattaaa tcaaaaagaa aagaaatatg gagtggcttc tttatgtatc ggcggtggct 1440
taggactcgc tatgctacta gagagacctc agcaaaaaaa aaacagccga ttttatcaaa 1500
tgagtcctga ggaacgcctg gcttctcttc ttaatgaagg ccagatttct gctgatacaa 1560
aaaaagaatt tgaaaatacg gctttatctt cgcagattgc caatcatatg attgaaaatc 1620
aaatcagtga aacagaagtg ccgatgggcg ttggcttaca tttaacagtg gacgaaactg 1680
attatttggt accaatggcg acagaagagc cctcagttat tgcggctttg agtaatggtg 1740
caaaaatagc acaaggattt aaaacagtga atcaacaacg cttaatgcgt ggacaaatcg 1800
ttttttacga tgttgcagat cccgagtcat tgattgataa actacaagta agagaagcgg 1860
aagtttttca acaagcagag ttaagttatc catctatcgt taaacggggc ggcggcttaa 1920
gagatttgca atatcgtact tttgatgaat catttgtatc tgtcgacttt ttagtagatg 1980
ttaaggatgc aatgggggca aatatcgtta acgctatgtt ggaaggtgtg gccgagttgt 2040
tccgtgaatg gtttgcggag caaaagattt tattcagtat tttaagtaat tatgccacgg 2100
agtcggttgt tacgatgaaa acggctattc cagtttcacg tttaagtaag gggagcaatg 2160
gccgggaaat tgctgaaaaa attgttttag cttcacgcta tgcttcatta gatccttatc 2220
gggcagtcac gcataacaaa ggaatcatga atggcattga agctgtagtt ttagctacag 2280
gaaatgatac acgcgctgtt agcgcttctt gtcatgcttt tgcggtgaag gaaggtcgct 2340
accaaggctt gactagttgg acgctggatg gcgaacaact aattggtgaa atttcagttc 2400
cgcttgcttt agccacggtt ggcggtgcca caaaagtctt acctaaatct caagcagctg 2460
ctgatttgtt agcagtgacg gatgcaaaag aactaagtcg agtagtagcg gctgttggtt 2520
tggcacaaaa tttagcggcg ttacgggcct tagtctctga aggaattcaa aaaggacaca 2580
tggctctaca agcacgttct ttagcgatga cggtcggagc tactggtaaa gaagttgagg 2640
cagtcgctca acaattaaaa cgtcaaaaaa cgatgaacca agaccgagcc atggctattt 2700
taaatgattt aagaaaacaa taaaggaggt aaaaaaacat gacaattggg attgataaaa 2760
ttagtttttt tgtgccccct tattatattg atatgacggc actggctgaa gccagaaatg 2820
tagaccctgg aaaatttcat attggtattg ggcaagacca aatggcggtg aacccaatca 2880
gccaagatat tgtgacattt gcagccaatg ccgcagaagc gatcttgacc aaagaagata 2940
aagaggccat tgatatggtg attgtcggga ctgagtccag tatcgatgag tcaaaagcgg 3000
ccgcagttgt cttacatcgt ttaatgggga ttcaaccttt cgctcgctct ttcgaaatca 3060
aggaagcttg ttacggagca acagcaggct tacagttagc taagaatcac gtagccttac 3120
atccagataa aaaagtcttg gtcgtagcgg cagatattgc aaaatatggc ttaaattctg 3180
gcggtgagcc tacacaagga gctggggcgg ttgcaatgtt agttgctagt gaaccgcgca 3240
ttttggcttt aaaagaggat aatgtgatgc tgacgcaaga tatctatgac ttttggcgtc 3300
caacaggcca cccgtatcct atggtcgatg gtcctttgtc aaacgaaacc tacatccaat 3360
cttttgccca agtctgggat gaacataaaa aacgaaccgg tcttgatttt gcagattatg 3420
atgctttagc gttccatatt ccttacacaa aaatgggcaa aaaagcctta ttagcaaaaa 3480
tctccgacca aactgaagca gaacaggaac gaattttagc ccgttatgaa gaaagtatcg 3540
tctatagtcg tcgcgtagga aacttgtata cgggttcact ttatctggga ctcatttccc 3600
ttttagaaaa tgcaacgact ttaaccgcag gcaatcaaat tggtttattc agttatggtt 3660
ctggtgctgt cgctgaattt ttcactggtg aattagtagc tggttatcaa aatcatttac 3720
aaaaagaaac tcatttagca ctgctggata atcggacaga actttctatc gctgaatatg 3780
aagccatgtt tgcagaaact ttagacacag acattgatca aacgttagaa gatgaattaa 3840
aatatagtat ttctgctatt aataataccg ttcgttctta tcgaaactaa gagatctgca 3900
gctggtacca tatgggaatt cgaagcttgg gcccgaacaa aaactcatct cagaagagga 3960
tctgaatagc gccgtcgacc atcatcatca tcatcattga gtttaaacgg tctccagctt 4020
ggctgttttg gcggatgaga gaagattttc agcctgatac agattaaatc agaacgcaga 4080
agcggtctga taaaacagaa tttgcctggc ggcagtagcg cggtggtccc acctgacccc 4140
atgccgaact cagaagtgaa acgccgtagc gccgatggta gtgtggggtc tccccatgcg 4200
agagtaggga actgccaggc atcaaataaa acgaaaggct cagtcgaaag actgggcctt 4260
tcgttttatc tgttgtttgt cggtgaacgc tctcctgagt aggacaaatc cgccgggagc 4320
ggatttgaac gttgcgaagc aacggcccgg agggtggcgg gcaggacgcc cgccataaac 4380
tgccaggcat caaattaagc agaaggccat cctgacggat ggcctttttg cgtttctaca 4440
aactcttttt gtttattttt ctaaatacat tcaaatatgt atccgctcat gagacaataa 4500
ccctgataaa tgcttcaata atctggcgta atagcgaaga ggcccgcacc gatcgccctt 4560
cccaacagtt gcgcagcctg aatggcgaat ggcgcctgat gcggtatttt ctccttacgc 4620
atctgtgcgg tatttcacac cgcatatggt gcactctcag tacaatctgc tctgatgccg 4680
catagttaag ccagccccga cacccgccaa cacccgctga cgagcttagt aaagccctcg 4740
ctagatttta atgcggatgt tgcgattact tcgccaacta ttgcgataac aagaaaaagc 4800
cagcctttca tgatatatct cccaatttgt gtagggctta ttatgcacgc ttaaaaataa 4860
taaaagcaga cttgacctga tagtttggct gtgagcaatt atgtgcttag tgcatctaac 4920
gcttgagtta agccgcgccg cgaagcggcg tcggcttgaa cgaattgtta gacattattt 4980
gccgactacc ttggtgatct cgcctttcac gtagtggaca aattcttcca actgatctgc 5040
gcgcgaggcc aagcgatctt cttcttgtcc aagataagcc tgtctagctt caagtatgac 5100
gggctgatac tgggccggca ggcgctccat tgcccagtcg gcagcgacat ccttcggcgc 5160
gattttgccg gttactgcgc tgtaccaaat gcgggacaac gtaagcacta catttcgctc 5220
atcgccagcc cagtcgggcg gcgagttcca tagcgttaag gtttcattta gcgcctcaaa 5280
tagatcctgt tcaggaaccg gatcaaagag ttcctccgcc gctggaccta ccaaggcaac 5340
gctatgttct cttgcttttg tcagcaagat agccagatca atgtcgatcg tggctggctc 5400
gaagatacct gcaagaatgt cattgcgctg ccattctcca aattgcagtt cgcgcttagc 5460
tggataacgc cacggaatga tgtcgtcgtg cacaacaatg gtgacttcta cagcgcggag 5520
aatctcgctc tctccagggg aagccgaagt ttccaaaagg tcgttgatca aagctcgccg 5580
cgttgtttca tcaagcctta cggtcaccgt aaccagcaaa tcaatatcac tgtgtggctt 5640
caggccgcca tccactgcgg agccgtacaa atgtacggcc agcaacgtcg gttcgagatg 5700
gcgctcgatg acgccaacta cctctgatag ttgagtcgat acttcggcga tcaccgcttc 5760
cctcatgatg tttaactttg ttttagggcg actgccctgc tgcgtaacat cgttgctgct 5820
ccataacatc aaacatcgac ccacggcgta acgcgcttgc tgcttggatg cccgaggcat 5880
agactgtacc ccaaaaaaac agtcataaca agccatgaaa accgccactg cgccgttacc 5940
accgctgcgt tcggtcaagg ttctggacca gttgcgtgag cgcatacgct acttgcatta 6000
cagcttacga accgaacagg cttatgtcca ctgggttcgt gccttcatcc gtttccacgg 6060
tgtgcgtcac ccggcaacct tgggcagcag cgaagtcgag gcatttctgt cctggctggc 6120
gaacgagcgc aaggtttcgg tctccacgca tcgtcaggca ttggcggcct tgctgttctt 6180
ctacggcaag gtgctgtgca cggatctgcc ctggcttcag gagatcggaa gacctcggcc 6240
gtcgcggcgc ttgccggtgg tgctgacccc ggatgaagtg gttcgcatcc tcggttttct 6300
ggaaggcgag catcgtttgt tcgcccagct tctgtatgga acgggcatgc ggatcagtga 6360
gggtttgcaa ctgcgggtca aggatctgga tttcgatcac ggcacgatca tcgtgcggga 6420
gggcaagggc tccaaggatc gggccttgat gttacccgag agcttggcac ccagcctgcg 6480
cgagcagggg aattaattcc cacgggtttt gctgcccgca aacgggctgt tctggtgttg 6540
ctagtttgtt atcagaatcg cagatccggc ttcagccggt ttgccggctg aaagcgctat 6600
ttcttccaga attgccatga ttttttcccc acgggaggcg tcactggctc ccgtgttgtc 6660
ggcagctttg attcgataag cagcatcgcc tgtttcaggc tgtctatgtg tgactgttga 6720
gctgtaacaa gttgtctcag gtgttcaatt tcatgttcta gttgctttgt tttactggtt 6780
tcacctgttc tattaggtgt tacatgctgt tcatctgtta cattgtcgat ctgttcatgg 6840
tgaacagctt tgaatgcacc aaaaactcgt aaaagctctg atgtatctat cttttttaca 6900
ccgttttcat ctgtgcatat ggacagtttt ccctttgata tgtaacggtg aacagttgtt 6960
ctacttttgt ttgttagtct tgatgcttca ctgatagata caagagccat aagaacctca 7020
gatccttccg tatttagcca gtatgttctc tagtgtggtt cgttgttttt gcgtgagcca 7080
tgagaacgaa ccattgagat catacttact ttgcatgtca ctcaaaaatt ttgcctcaaa 7140
actggtgagc tgaatttttg cagttaaagc atcgtgtagt gtttttctta gtccgttatg 7200
taggtaggaa tctgatgtaa tggttgttgg tattttgtca ccattcattt ttatctggtt 7260
gttctcaagt tcggttacga gatccatttg tctatctagt tcaacttgga aaatcaacgt 7320
atcagtcggg cggcctcgct tatcaaccac caatttcata ttgctgtaag tgtttaaatc 7380
tttacttatt ggtttcaaaa cccattggtt aagcctttta aactcatggt agttattttc 7440
aagcattaac atgaacttaa attcatcaag gctaatctct atatttgcct tgtgagtttt 7500
cttttgtgtt agttctttta ataaccactc ataaatcctc atagagtatt tgttttcaaa 7560
agacttaaca tgttccagat tatattttat gaattttttt aactggaaaa gataaggcaa 7620
tatctcttca ctaaaaacta attctaattt ttcgcttgag aacttggcat agtttgtcca 7680
ctggaaaatc tcaaagcctt taaccaaagg attcctgatt tccacagttc tcgtcatcag 7740
ctctctggtt gctttagcta atacaccata agcattttcc ctactgatgt tcatcatctg 7800
agcgtattgg ttataagtga acgataccgt ccgttctttc cttgtagggt tttcaatcgt 7860
ggggttgagt agtgccacac agcataaaat tagcttggtt tcatgctccg ttaagtcata 7920
gcgactaatc gctagttcat ttgctttgaa aacaactaat tcagacatac atctcaattg 7980
gtctaggtga ttttaatcac tataccaatt gagatgggct agtcaatgat aattactagt 8040
ccttttcctt tgagttgtgg gtatctgtaa attctgctag acctttgctg gaaaacttgt 8100
aaattctgct agaccctctg taaattccgc tagacctttg tgtgtttttt ttgtttatat 8160
tcaagtggtt ataatttata gaataaagaa agaataaaaa aagataaaaa gaatagatcc 8220
cagccctgtg tataactcac tactttagtc agttccgcag tattacaaaa ggatgtcgca 8280
aacgctgttt gctcctctac aaaacagacc ttaaaaccct aaaggcttaa gtagcaccct 8340
cgcaagctcg ggcaaatcgc tgaatattcc ttttgtctcc gaccatcagg cacctgagtc 8400
gctgtctttt tcgtgacatt cagttcgctg cgctcacggc tctggcagtg aatgggggta 8460
aatggcacta caggcgcctt ttatggattc atgcaaggaa actacccata atacaagaaa 8520
agcccgtcac gggcttctca gggcgtttta tggcgggtct gctatgtggt gctatctgac 8580
tttttgctgt tcagcagttc ctgccctctg attttccagt ctgaccactt cggattatcc 8640
cgtgacaggt cattcagact ggctaatgca cccagtaagg cagcggtatc atcaacaggc 8700
tta 8703
<210> 13
<211> 9371
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 13
tgtaaccttt gctttcaaat gagtagaaat aatgcacatc catgtttgta tcgtgcaaat 60
aaagtgtttc atccgtagga aaaaatgact ttagtatctg ttccgctttt tctgatgaaa 120
tgtgctcccc gacaaaattg aatgaatcat ggacatttgc tggctttgat acagcgaaag 180
cagccgttcc tatgttatat atcggattta acagcaggac aaaaaacacc atgacagcca 240
tcgtcaccca cttattcaca cgcacataaa cctttcctga cttttggaac agatgatagc 300
tcatcaaaaa tcccgccatt gccaaataaa tcgtatatgg cattactgca ccataatctt 360
ttgagatttg attgggatat ggcgcaagca gcaagacaag cagtccgata atcagcgtat 420
aaaataagcc tagtaagatc ttatccgttc tccaatacag cttgaaaaac actacattca 480
acgcaatggg aagagtgatg atgaaaaaca gaaacacgaa tgcaatcggc tccatcccat 540
ccgggtattc cttccaatac gaaaagaaac taaaaatcat ttgtacgatc ggcaaactga 600
caacagcaag gtcgaacgta taaaacttac cctttccgcc atgatcacgc ggcatcagca 660
tatagtgaaa agccgtcagc agcacatatc cgtataacaa aaaatgcagc agcggcagca 720
gttcttttcc gtcctctctt aagtaagcgc tggtgaagtt tgttgattgc acctggtgaa 780
taagttcaac agacactccc gccagcagca caatccgcaa tataacaccc gccaagaaca 840
ttgtgcgctg ccggtttatt ttgggatgat gcaccaaaag atataagccc gccagaacaa 900
caattgacca ttgaatcagc agggtgcttt gtctgcttaa tataaaataa cgttcgaaat 960
gcaatacata atgactgaat aactccaaca cgaacaacaa ctccattttc ttctgctatc 1020
aaaataacag actcgtgatt ttccaaacga gctttcaaaa aagcctctgc cccttgcaaa 1080
tcggatgcct gtctataaaa ttcccgatat tggttaaaca gcggcgcaat ggcggccgca 1140
tctgatgtct ttgcttggcg aatgttcatc ttatttcttc ctccctctca ataatttttt 1200
cattctatcc cttttctgta aagtttattt ttcagaatac ttttatcatc atgctttgaa 1260
aaaatatcac gataatatcc attgttctca cggaagcaca cgcaggtcat ttgaacgaat 1320
tttttcgaca ggaatttgcc gggactcagg agcatttaac ctaaaaaagc atgacatttc 1380
agcataatga acatttactc atgtctattt tcgttctttt ctgtatgaaa atagttattt 1440
cgagtctcta cggaaatagc gagagatgat atacctaaat agagataaaa tcatctcaaa 1500
aaaatgggtc tactaaaata ttattccatc tattacaata aattcacaga atagtctttt 1560
aagtaagtct actctgaatt tttttaaaag gagagggtaa agagtgtcat taccgttctt 1620
aacttctgca ccgggaaagg ttattatttt tggtgaacac tctgctgtgt acaacaagcc 1680
tgccgtcgct gctagtgtgt ctgcgttgag aacctacctg ctaataagcg agtcatctgc 1740
accagatact attgaattgg acttcccgga cattagcttt aatcataagt ggtccatcaa 1800
tgatttcaat gccatcaccg aggatcaagt aaactcccaa aaattggcca aggctcaaca 1860
agccaccgat ggcttgtctc aggaactcgt tagtcttttg gatccgttgt tagctcaact 1920
atccgaatcc ttccactacc atgcagcgtt ttgtttcctg tatatgtttg tttgcctatg 1980
cccccatgcc aagaatatta agttttcttt aaagtctact ttacccatcg gtgctgggtt 2040
gggctcaagc gcctctattt ctgtatcact ggccttagct atggcctact tgggggggtt 2100
aataggatct aatgacttgg aaaagctgtc agaaaacgat aagcatatag tgaatcaatg 2160
ggccttcata ggtgaaaagt gtattcacgg taccccttca ggaatagata acgctgtggc 2220
cacttatggt aatgccctgc tatttgaaaa agactcacat aatggaacaa taaacacaaa 2280
caattttaag ttcttagatg atttcccagc cattccaatg atcctaacct atactagaat 2340
tccaaggtct acaaaagatc ttgttgctcg cgttcgtgtg ttggtcaccg agaaatttcc 2400
tgaagttatg aagccaattc tagatgccat gggtgaatgt gccctacaag gcttagagat 2460
catgactaag ttaagtaaat gtaaaggcac cgatgacgag gctgtagaaa ctaataatga 2520
actgtatgaa caactattgg aattgataag aataaatcat ggactgcttg tctcaatcgg 2580
tgtttctcat cctggattag aacttattaa aaatctgagc gatgatttga gaattggctc 2640
cacaaaactt accggtgctg gtggcggcgg ttgctctttg actttgttac gaagagacat 2700
tactcaagag caaattgaca gcttcaaaaa gaaattgcaa gatgatttta gttacgagac 2760
atttgaaaca gacttgggtg ggactggctg ctgtttgtta agcgcaaaaa atttgaataa 2820
agatcttaaa atcaaatccc tagtattcca attatttgaa aataaaacta ccacaaagca 2880
acaaattgac gatctattat tgccaggaaa cacgaattta ccatggactt cataaaagga 2940
gagggtgtca gagttgagag ccttcagtgc cccagggaaa gcgttactag ctggtggata 3000
tttagtttta gatacaaaat atgaagcatt tgtagtcgga ttatcggcaa gaatgcatgc 3060
tgtagcccat ccttacggtt cattgcaagg gtctgataag tttgaagtgc gtgtgaaaag 3120
taaacaattt aaagatgggg agtggctgta ccatataagt cctaaaagtg gcttcattcc 3180
tgtttcgata ggcggatcta agaacccttt cattgaaaaa gttatcgcta acgtatttag 3240
ctactttaaa cctaacatgg acgactactg caatagaaac ttgttcgtta ttgatatttt 3300
ctctgatgat gcctaccatt ctcaggagga tagcgttacc gaacatcgtg gcaacagaag 3360
attgagtttt cattcgcaca gaattgaaga agttcccaaa acagggctgg gctcctcggc 3420
aggtttagtc acagttttaa ctacagcttt ggcctccttt tttgtatcgg acctggaaaa 3480
taatgtagac aaatatagag aagttattca taatttagca caagttgctc attgtcaagc 3540
tcagggtaaa attggaagcg ggtttgatgt agcggcggca gcatatggat ctatcagata 3600
tagaagattc ccacccgcat taatctctaa tttgccagat attggaagtg ctacttacgg 3660
cagtaaactg gcgcatttgg ttgatgaaga agactggaat attacgatta aaagtaacca 3720
tttaccttcg ggattaactt tatggatggg cgatattaag aatggttcag aaacagtaaa 3780
actggtccag aaggtaaaaa attggtatga ttcgcatatg ccagaaagct tgaaaatata 3840
tacagaactc gatcatgcaa attctagatt tatggatgga ctatctaaac tagatcgctt 3900
acacgagact catgacgatt acagcgatca gatatttgag tctcttgaga ggaatgactg 3960
tacctgtcaa aagtatcctg aaatcacaga agttagagat gcagttgcca caattagacg 4020
ttcctttaga aaaataacta aagaatctgg tgccgatatc gaacctcccg tacaaactag 4080
cttattggat gattgccaga ccttaaaagg agttcttact tgcttaatac ctggtgctgg 4140
tggttatgac gccattgcag tgattactaa gcaagatgtt gatcttaggg ctcaaaccgc 4200
taatgacaaa agattttcta aggttcaatg gctggatgta actcaggctg actggggtgt 4260
taggaaagaa aaagatccgg aaacttatct tgataaataa aaggagaggg tgaccgttta 4320
cacagcatcc gttaccgcac ccgtcaacat cgcaaccctt aagtattggg ggaaaaggga 4380
cacgaagttg aatctgccca ccaattcgtc catatcagtg actttatcgc aagatgacct 4440
cagaacgttg acctctgcgg ctactgcacc tgagtttgaa cgcgacactt tgtggttaaa 4500
tggagaacca cacagcatcg acaatgaaag aactcaaaat tgtctgcgcg acctacgcca 4560
attaagaaag gaaatggaat cgaaggacgc ctcattgccc acattatctc aatggaaact 4620
ccacattgtc tccgaaaata actttcctac agcagctggt ttagcttcct ccgctgctgg 4680
ctttgctgca ttggtctctg caattgctaa gttataccaa ttaccacagt caacttcaga 4740
aatatctaga atagcaagaa aggggtctgg ttcagcttgt agatcgttgt ttggcggata 4800
cgtggcctgg gaaatgggaa aagctgaaga tggtcatgat tccatggcag tacaaatcgc 4860
agacagctct gactggcctc agatgaaagc ttgtgtccta gttgtcagcg atattaaaaa 4920
ggatgtgagt tccactcagg gtatgcaatt gaccgtggca acctccgaac tatttaaaga 4980
aagaattgaa catgtcgtac caaagagatt tgaagtcatg cgtaaagcca ttgttgaaaa 5040
agatttcgcc acctttgcaa aggaaacaat gatggattcc aactctttcc atgccacatg 5100
tttggactct ttccctccaa tattctacat gaatgacact tccaagcgta tcatcagttg 5160
gtgccacacc attaatcagt tttacggaga aacaatcgtt gcatacacgt ttgatgcagg 5220
tccaaatgct gtgttgtact acttagctga aaatgagtcg aaactctttg catttatcta 5280
taaattgttt ggctctgttc ctggatggga caagaaattt actactgagc agcttgaggc 5340
tttcaaccat caatttgaat catctaactt tactgcacgt gaattggatc ttgagttgca 5400
aaaggatgtt gccagagtga ttttaactca agtcggttca ggcccacaag aaacaaacga 5460
atctttgatt gacgcaaaga ctggtctacc aaaggaataa aaggagaggg tgactgccga 5520
caacaatagt atgccccatg gtgcagtatc tagttacgcc aaattagtgc aaaaccaaac 5580
acctgaagac attttggaag agtttcctga aattattcca ttacaacaaa gacctaatac 5640
ccgatctagt gagacgtcaa atgacgaaag cggagaaaca tgtttttctg gtcatgatga 5700
ggagcaaatt aagttaatga atgaaaattg tattgttttg gattgggacg ataatgctat 5760
tggtgccggt accaagaaag tttgtcattt aatggaaaat attgaaaagg gtttactaca 5820
tcgtgcattc tccgtcttta ttttcaatga acaaggtgaa ttacttttac aacaaagagc 5880
cactgaaaaa ataactttcc ctgatctttg gactaacaca tgctgctctc atccactatg 5940
tattgatgac gaattaggtt tgaagggtaa gctagacgat aagattaagg gcgctattac 6000
tgcggcggtg agaaaactag atcatgaatt aggtattcca gaagatgaaa ctaagacaag 6060
gggtaagttt cactttttaa acagaatcca ttacatggca ccaagcaatg aaccatgggg 6120
tgaacatgaa attgattaca tcctatttta taagatcaac gctaaagaaa acttgactgt 6180
caacccaaac gtcaatgaag ttagagactt caaatgggtt tcaccaaatg atttgaaaac 6240
tatgtttgct gacccaagtt acaagtttac gccttggttt aagattattt gcgagaatta 6300
cttattcaac tggtgggagc aattagatga cctttctgaa gtggaaaatg acaggcaaat 6360
tcatagaatg ctataaaaaa aaccggcctt ggccccgccg gttttttatt atttttcttc 6420
ctccgcatgt tcaatccgct ccataatcga cggatggctc cctctgaaaa ttttaacgag 6480
aaacggcggg ttgacccggc tcagtcccgt aacggccaag tcctgaaacg tctcaatcgc 6540
cgcttcccgg tttccggtca gctcaatgcc gtaacggtcg gcggcgtttt cctgataccg 6600
ggagacggca ttcgtaattt gaatacatac gaacaaatta ataaagtgaa aaaaatactt 6660
cggaaacatt taaaaaataa ccttattggt acttacatgt ttggatcagg agttgagagt 6720
ggactaaaac caaatagtga tcttgacttt ttagtcgtcg tatctgaacc attgacagat 6780
caaagtaaag aaatacttat acaaaaaatt agacctattt caaaaaaaat aggagataaa 6840
agcaacttac gatatattga attaacaatt attattcagc aagaaatggt accgtggaat 6900
catcctccca aacaagaatt tatttatgga gaatggttac aagagcttta tgaacaagga 6960
tacattcctc agaaggaatt aaattcagat ttaaccataa tgctttacca agcaaaacga 7020
aaaaataaaa gaatatacgg aaattatgac ttagaggaat tactacctga tattccattt 7080
tctgatgtga gaagagccat tatggattcg tcagaggaat taatagataa ttatcaggat 7140
gatgaaacca actctatatt aactttatgc cgtatgattt taactatgga cacgggtaaa 7200
atcataccaa aagatattgc gggaaatgca gtggctgaat cttctccatt agaacatagg 7260
gagagaattt tgttagcagt tcgtagttat cttggagaga atattgaatg gactaatgaa 7320
aatgtaaatt taactataaa ctatttaaat aacagattaa aaaaattata atgtaacctt 7380
tgctttcaaa tgagtagaaa taatgcacat ccatgtttgt atcgtgcaaa taaagtgttt 7440
catccgtagg aaaaaatgac tttagtatct gttccgcttt ttctgatgaa atgtgctccc 7500
cgacaaaatt gaatgaatca tggacatttg ctggctttga tacagcgaaa gcagccgttc 7560
ctatgttata tatcggattt aacagcagga caaaaaacac catgacagcc atcgtcaccc 7620
acttattcac acgcacataa acctttcctg acttttggaa cagatgatag ctcatcaaaa 7680
atcccgccat tgccaaataa atcgtatatg gcattactgc accataatct tttgagattt 7740
gattgggata tggcgcaagc agcaagacaa gcagtccgat aatcagcgta taaaataagc 7800
ctagtaagat cttatccgtt ctccaataca gcttgaaaaa cactacattc aacgcaatgg 7860
gaagagtgat gatgaaaaac agaaacacga atgcaatcgg ctccatccca tccgggtatt 7920
ccttccaata cgaaaagaaa ctaaaaatca tttgtacgat cggcaaactg acaacagcaa 7980
ggtcgaacgt ataaaactta ccctttccgc catgatcacg cggcatcagc atatagtgaa 8040
aagccgtcag cagcacatat ccgtataaca aaaaatgcag cagcggcagc agttcttttc 8100
cgtcctctct taagtaagcg ctggtgaagt ttgttgattg cacctggtga ataagttcaa 8160
cagacactcc cgccagcagc acaatccgca atataacacc cgccaagaac attgtgcgct 8220
gccggtttat tttgggatga tgcaccaaaa gatataagcc cgccagaaca acaattgacc 8280
attgaatcag cagggtgctt tgtctgctta atataaaata acgttcgaaa tgcaatacat 8340
aatgactgaa taactccaac acgaacaaca aaagtgcgca ttttataaaa gctaatgatt 8400
cagtccacat aattgataga cgaattctgc tacaggtcac gtggctatgt gaaggatcgc 8460
gcgtccagtt aagagcaaaa acattgacaa aaaaatttat ttatgctaaa atttactatt 8520
aatatatttg tatgtataat aagattctcc tggccagggg aatcttattt tttgtggagg 8580
atcatttcat gaggaaaaat gagtccagct taacgtctct aatttcagct tttgcccgtg 8640
catatcacag ccgatatgac acacctctta tttttgatga ttttatcgca aaagatctca 8700
ttaacgaaaa agagtttatc gacatcagta aaaatatgat tcaagaaata tcgtttttca 8760
acaaagagat cgccgaacgt cttcaaaatg atcctgaaaa aatattaaaa tgggttgcac 8820
aaatccagct gtctccaacg cccctagcac gtgcttctta ttgtgaaaaa gtcttgcaca 8880
acgaattaat cctgggggca aaacagtatg tcattcttgg agcgggactg gatactttct 8940
gctttcggca tccagaatta gaaaacagct tacaggtttt cgaggttgat catccggcca 9000
cacagcaatt gaaaaaaaat aagctgaagg atgcaaatct gacaattccg ggtcatcttc 9060
attttgttcc tatggatttc accaaaacgt tttcgtatga tcctctctta gatgaaggat 9120
ttaaaaacac aaaaacattc ttcagccttc tcggagtgtc ttattatgta acacgggaag 9180
aaaatgcaag cttgatcagc aatttatttt ctcatgtccc gcctggaagc tctattgttt 9240
ttgattatgc ggacgaaaca ctttttacag caaaagggac gtcgaatcga gttgaacata 9300
tggtgaagat ggctgccgca agcggggaac cgatgaaatc atgtttcact tatcaagaga 9360
ttgaacatct g 9371
<210> 14
<211> 4339
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 14
tagaaaaact catcgagcat caaatgaaac tgcaatttat tcatatcagg attatcaata 60
ccatattttt gaaaaagccg tttctgtaat gaaggagaaa actcaccgag gcagttccat 120
aggatggcaa gatcctggta tcggtctgcg attccgactc gtccaacatc aatacaacct 180
attaatttcc cctcgtcaaa aataaggtta tcaagtgaga aatcaccatg agtgacgact 240
gaatccggtg agaatggcaa aagtttatgc atttctttcc agacttgttc aacaggccag 300
ccattacgct cgtcatcaaa atcactcgca tcaaccaaac cgttattcat tcgtgattgc 360
gcctgagcga ggcgaaatac gcgatcgctg ttaaaaggac aattacaaac aggaatcgag 420
tgcaaccggc gcaggaacac tgccagcgca tcaacaatat tttcacctga atcaggatat 480
tcttctaata cctggaacgc tgtttttccg gggatcgcag tggtgagtaa ccatgcatca 540
tcaggagtac ggataaaatg cttgatggtc ggaagtggca taaattccgt cagccagttt 600
agtctgacca tctcatctgt aacatcattg gcaacgctac ctttgccatg tttcagaaac 660
aactctggcg catcgggctt cccatacaag cgatagattg tcgcacctga ttgcccgaca 720
ttatcgcgag cccatttata cccatataaa tcagcatcca tgttggaatt taatcgcggc 780
ctcgacgttt cccgttgaat atggctcata ttcttccttt ttcaatatta ttgaagcatt 840
tatcagggtt attgtctcat gagcggatac atatttgaat gtatttagaa aaataaacaa 900
ataggggtca gtgttacaac caattaacca attctgaaca ttatcgcgag cccatttata 960
cctgaatatg gctcataaca ccccttgttt gcctggcggc agtagcgcgg tggtcccacc 1020
tgaccccatg ccgaactcag aagtgaaacg ccgtagcgcc gatggtagtg tggggactcc 1080
ccatgcgaga gtagggaact gccaggcatc aaataaaacg aaaggctcag tcgaaagact 1140
gggcctttcg cccgggctaa ttagggggtg tcgcccttta gtcgctgaac atgtgctctg 1200
tttctaccga gaacgtttcc ttcactgaga cggaaaccga ggcacgtcgt agcgcgaact 1260
acgagccgaa tagctgggac tacgatttcc tgctgtcttc cgatactgac gaatctattg 1320
aggtgtacaa agacaaagca aagaaactgg aggctgaagt gcgccgcgaa attaacaacg 1380
agaaagctga attcctgact ctgctggagc tgatcgataa cgtacagcgc ctgggtctgg 1440
gttaccgctt cgaatctgat atccgtcgcg cactggatcg tttcgtaagc agcggcggtt 1500
tcgatggcgt gaccaaaacg agcctgcacg ctaccgcgct gtccttccgt ctgctgcgtc 1560
agcacggctt cgaagtttct caggaagcat tctccggttt caaagatcaa aacggtaact 1620
tcctggaaaa cctgaaagaa gacactaagg cgatcctgag cctgtatgag gcaagctttc 1680
tggccctgga gggtgagaac atcctggatg aggcgcgcgt attcgccatc tcccatctga 1740
aagagctgtc tgaagagaaa atcggtaagg aactggcaga gcaggttaat cacgcactgg 1800
aactgccgct gcatcgtcgt acccagcgtc tggaggcggt ttggtccatc gaagcgtacc 1860
gcaaaaagga ggatgctaac caggttctgc tggaactggc catcctggac tacaacatga 1920
tccagtccgt ttaccagcgt gatctgcgtg aaacctcccg ttggtggcgc cgtgtgggcc 1980
tggcgaccaa actgcacttc gctaaggacc gcctgattga gtctttttac tgggcagtcg 2040
gcgttgcgtt cgaacctcag tattctgact gccgtaacag cgttgcgaaa atgttcagct 2100
tcgttactat tatcgacgac atctacgacg tttacggtac tctggacgag ctggaactgt 2160
ttaccgacgc tgtcgaacgt tgggatgtta acgccatcaa cgatctgcct gactacatga 2220
aactgtgctt cctggcactg tataacacga tcaacgaaat tgcatacgac aacctgaaag 2280
acaaaggtga aaacatcctg ccgtacctga ctaaagcgtg ggcggatctg tgtaacgctt 2340
ttctgcaaga agcgaaatgg ctgtataaca aatccactcc gacctttgac gattatttcg 2400
gcaatgcctg gaaatccagc tctggcccgc tgcaactgat cttcgcttat tttgcggttg 2460
tccaaaacat caaaaaggag gaaattgaaa acctgcaaaa ataccacgat atcattagcc 2520
gtccttctca tatctttcgc ctgtgcaacg acctggcaag cgcgtccgca gagatcgcac 2580
gtggcgaaac cgctaactct gtttcctgct acatgcgcac caagggcatt tccgaagagc 2640
tggcaaccga gagcgtaatg aatctgatcg acgaaacctg taagaaaatg aacaaagaaa 2700
aactgggtgg ctccctgttc gctaaaccgt tcgtagagac tgctattaac ctggcacgtc 2760
agagccactg cacctaccac aatggtgacg cacatactag cccggatgaa ctgactcgta 2820
aacgtgtact gtctgttatc accgaaccga ttctgccgtt cgaacgttaa ctgcagcgtc 2880
aatcgaaagg gcgacacaaa atttattcta aatgcataat aaatactgat aacatcttat 2940
agtttgtatt atattttgta ttatcgttga catgtataat tttgatatca aaaactgatt 3000
ttccctttat tattttcgag atttattttc ttaattctct ttaacaaact agaaatattg 3060
tatatacaaa aaatcataaa taatagatga atagtttaat tataggtgtt catcaatcga 3120
aaaagcaacg tatcttattt aaagtgcgtt gcttttttct catttataag gttaaataat 3180
tctcatatat caagcaaagt gacaggcgcc cttaaatatt ctgacaaatg ctctttccct 3240
aaactccccc cataaaaaaa cccgccgaag cgggttttta cgttatttgc ggattaacga 3300
ttactcgtta tcagaaccgc ccagggggcc cgagcttaag actggccgtc gttttacaac 3360
acagaaagag tttgtagaaa cgcaaaaagg ccatccgtca ggggccttct gcttagtttg 3420
atgcctggca gttccctact ctcgccttcc gcttcctcgc tcactgactc gctgcgctcg 3480
gtcgttcggc tgcggcgagc ggtatcagct cactcaaagg cggtaatacg gttatccaca 3540
gaatcagggg ataacgcagg aaagaacatg tgagcaaaag gccagcaaaa ggccaggaac 3600
cgtaaaaagg ccgcgttgct ggcgtttttc cataggctcc gcccccctga cgagcatcac 3660
aaaaatcgac gctcaagtca gaggtggcga aacccgacag gactataaag ataccaggcg 3720
tttccccctg gaagctccct cgtgcgctct cctgttccga ccctgccgct taccggatac 3780
ctgtccgcct ttctcccttc gggaagcgtg gcgctttctc atagctcacg ctgtaggtat 3840
ctcagttcgg tgtaggtcgt tcgctccaag ctgggctgtg tgcacgaacc ccccgttcag 3900
cccgaccgct gcgccttatc cggtaactat cgtcttgagt ccaacccggt aagacacgac 3960
ttatcgccac tggcagcagc cactggtaac aggattagca gagcgaggta tgtaggcggt 4020
gctacagagt tcttgaagtg gtgggctaac tacggctaca ctagaagaac agtatttggt 4080
atctgcgctc tgctgaagcc agttaccttc ggaaaaagag ttggtagctc ttgatccggc 4140
aaacaaacca ccgctggtag cggtggtttt tttgtttgca agcagcagat tacgcgcaga 4200
aaaaaaggat ctcaagaaga tcctttgatc ttttctacgg ggtctgacgc tcagtggaac 4260
gacgcgcgcg taactcacgt taagggattt tggtcatgag cttgcgccgt cccgtcaagt 4320
cagcgtaatg ctctgcttt 4339
<210> 15
<211> 6065
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 15
gtttgacagc ttatcatcga ctgcacggtg caccaatgct tctggcgtca ggcagccatc 60
ggaagctgtg gtatggctgt gcaggtcgta aatcactgca taattcgtgt cgctcaaggc 120
gcactcccgt tctggataat gttttttgcg ccgacatcat aacggttctg gcaaatattc 180
tgaaatgagc tgttgacaat taatcatccg gctcgtataa tgtgtggaat tgtgagcgga 240
taacaatttc acacaggaaa cagcgccgct gagaaaaagc gaagcggcac tgctctttaa 300
caatttatca gacaatctgt gtgggcactc gaccggaatt atcgattaac tttattatta 360
aaaattaaag aggtatatat taatgtatcg attaaataag gaggaataaa ccatgtgctc 420
tgtttctacc gagaacgttt ccttcactga gacggaaacc gaggcacgtc gtagcgcgaa 480
ctacgagccg aatagctggg actacgattt cctgctgtct tccgatactg acgaatctat 540
tgaggtgtac aaagacaaag caaagaaact ggaggctgaa gtgcgccgcg aaattaacaa 600
cgagaaagct gaattcctga ctctgctgga gctgatcgat aacgtacagc gcctgggtct 660
gggttaccgc ttcgaatctg atatccgtcg cgcactggat cgtttcgtaa gcagcggcgg 720
tttcgatggc gtgaccaaaa cgagcctgca cgctaccgcg ctgtccttcc gtctgctgcg 780
tcagcacggc ttcgaagttt ctcaggaagc attctccggt ttcaaagatc aaaacggtaa 840
cttcctggaa aacctgaaag aagacactaa ggcgatcctg agcctgtatg aggcaagctt 900
tctggccctg gagggtgaga acatcctgga tgaggcgcgc gtattcgcca tctcccatct 960
gaaagagctg tctgaagaga aaatcggtaa ggaactggca gagcaggtta atcacgcact 1020
ggaactgccg ctgcatcgtc gtacccagcg tctggaggcg gtttggtcca tcgaagcgta 1080
ccgcaaaaag gaggatgcta accaggttct gctggaactg gccatcctgg actacaacat 1140
gatccagtcc gtttaccagc gtgatctgcg tgaaacctcc cgttggtggc gccgtgtggg 1200
cctggcgacc aaactgcact tcgctaagga ccgcctgatt gagtcttttt actgggcagt 1260
cggcgttgcg ttcgaacctc agtattctga ctgccgtaac agcgttgcga aaatgttcag 1320
cttcgttact attatcgacg acatctacga cgtttacggt actctggacg agctggaact 1380
gtttaccgac gctgtcgaac gttgggatgt taacgccatc aacgatctgc ctgactacat 1440
gaaactgtgc ttcctggcac tgtataacac gatcaacgaa attgcatacg acaacctgaa 1500
agacaaaggt gaaaacatcc tgccgtacct gactaaagcg tgggcggatc tgtgtaacgc 1560
ttttctgcaa gaagcgaaat ggctgtataa caaatccact ccgacctttg acgattattt 1620
cggcaatgcc tggaaatcca gctctggccc gctgcaactg atcttcgctt attttgcggt 1680
tgtccaaaac atcaaaaagg aggaaattga aaacctgcaa aaataccacg atatcattag 1740
ccgtccttct catatctttc gcctgtgcaa cgacctggca agcgcgtccg cagagatcgc 1800
acgtggcgaa accgctaact ctgtttcctg ctacatgcgc accaagggca tttccgaaga 1860
gctggcaacc gagagcgtaa tgaatctgat cgacgaaacc tgtaagaaaa tgaacaaaga 1920
aaaactgggt ggctccctgt tcgctaaacc gttcgtagag actgctatta acctggcacg 1980
tcagagccac tgcacctacc acaatggtga cgcacatact agcccggatg aactgactcg 2040
taaacgtgta ctgtctgtta tcaccgaacc gattctgccg ttcgaacgtt aactgcagct 2100
ggtaccatat gggaattcga agctttctag aacaaaaact catctcagaa gaggatctga 2160
atagcgccgt cgaccatcat catcatcatc attgagttta aacggtctcc agcttggctg 2220
ttttggcgga tgagagaaga ttttcagcct gatacagatt aaatcagaac gcagaagcgg 2280
tctgataaaa cagaatttgc ctggcggcag tagcgcggtg gtcccacctg accccatgcc 2340
gaactcagaa gtgaaacgcc gtagcgccga tggtagtgtg gggtctcccc atgcgagagt 2400
agggaactgc caggcatcaa ataaaacgaa aggctcagtc gaaagactgg gcctttcgtt 2460
ttatctgttg tttgtcggtg aacgctctcc tgagtaggac aaatccgccg ggagcggatt 2520
tgaacgttgc gaagcaacgg cccggagggt ggcgggcagg acgcccgcca taaactgcca 2580
ggcatcaaat taagcagaag gccatcctga cggatggcct ttttgcgttt ctacaaactc 2640
tttttgttta tttttctaaa tacattcaaa tatgtatccg ctcatgagac aataaccctg 2700
ataaatgctt caataatatt gaaaaaggaa gagtatgagt attcaacatt tccgtgtcgc 2760
ccttattccc ttttttgcgg cattttgcct tcctgttttt gctcacccag aaacgctggt 2820
gaaagtaaaa gatgctgaag atcagttggg tgcacgagtg ggttacatcg aactggatct 2880
caacagcggt aagatccttg agagttttcg ccccgaagaa cgttttccaa tgatgagcac 2940
ttttaaagtt ctgctatgtg gcgcggtatt atcccgtgtt gacgccgggc aagagcaact 3000
cggtcgccgc atacactatt ctcagaatga cttggttgag tactcaccag tcacagaaaa 3060
gcatcttacg gatggcatga cagtaagaga attatgcagt gctgccataa ccatgagtga 3120
taacactgcg gccaacttac ttctgacaac gatcggagga ccgaaggagc taaccgcttt 3180
tttgcacaac atgggggatc atgtaactcg ccttgatcgt tgggaaccgg agctgaatga 3240
agccatacca aacgacgagc gtgacaccac gatgcctgta gcaatggcaa caacgttgcg 3300
caaactatta actggcgaac tacttactct agcttcccgg caacaattaa tagactggat 3360
ggaggcggat aaagttgcag gaccacttct gcgctcggcc cttccggctg gctggtttat 3420
tgctgataaa tctggagccg gtgagcgtgg gtctcgcggt atcattgcag cactggggcc 3480
agatggtaag ccctcccgta tcgtagttat ctacacgacg gggagtcagg caactatgga 3540
tgaacgaaat agacagatcg ctgagatagg tgcctcactg attaagcatt ggtaactgtc 3600
agaccaagtt tactcatata tactttagat tgatttaaaa cttcattttt aatttaaaag 3660
gatctaggtg aagatccttt ttgataatct catgaccaaa atcccttaac gtgagttttc 3720
gttccactga gcgtcagacc ccgtagaaaa gatcaaagga tcttcttgag atcctttttt 3780
tctgcgcgta atctgctgct tgcaaacaaa aaaaccaccg ctaccagcgg tggtttgttt 3840
gccggatcaa gagctaccaa ctctttttcc gaaggtaact ggcttcagca gagcgcagat 3900
accaaatact gtccttctag tgtagccgta gttaggccac cacttcaaga actctgtagc 3960
accgcctaca tacctcgctc tgctaatcct gttaccagtg gctgctgcca gtggcgataa 4020
gtcgtgtctt accgggttgg actcaagacg atagttaccg gataaggcgc agcggtcggg 4080
ctgaacgggg ggttcgtgca cacagcccag cttggagcga acgacctaca ccgaactgag 4140
atacctacag cgtgagctat gagaaagcgc cacgcttccc gaagggagaa aggcggacag 4200
gtatccggta agcggcaggg tcggaacagg agagcgcacg agggagcttc cagggggaaa 4260
cgcctggtat ctttatagtc ctgtcgggtt tcgccacctc tgacttgagc gtcgattttt 4320
gtgatgctcg tcaggggggc ggagcctatg gaaaaacgcc agcaacgcgg cctttttacg 4380
gttcctggcc ttttgctggc cttttgctca catgttcttt cctgcgttat cccctgattc 4440
tgtggataac cgtattaccg cctttgagtg agctgatacc gctcgccgca gccgaacgac 4500
cgagcgcagc gagtcagtga gcgaggaagc ggaagagcgc ctgatgcggt attttctcct 4560
tacgcatctg tgcggtattt cacaccgcat atggtgcact ctcagtacaa tctgctctga 4620
tgccgcatag ttaagccagt atacactccg ctatcgctac gtgactgggt catggctgcg 4680
ccccgacacc cgccaacacc cgctgacgcg ccctgacggg cttgtctgct cccggcatcc 4740
gcttacagac aagctgtgac cgtctccggg agctgcatgt gtcagaggtt ttcaccgtca 4800
tcaccgaaac gcgcgaggca gcagatcaat tcgcgcgcga aggcgaagcg gcatgcattt 4860
acgttgacac catcgaatgg tgcaaaacct ttcgcggtat ggcatgatag cgcccggaag 4920
agagtcaatt cagggtggtg aatgtgaaac cagtaacgtt atacgatgtc gcagagtatg 4980
ccggtgtctc ttatcagacc gtttcccgcg tggtgaacca ggccagccac gtttctgcga 5040
aaacgcggga aaaagtggaa gcggcgatgg cggagctgaa ttacattccc aaccgcgtgg 5100
cacaacaact ggcgggcaaa cagtcgttgc tgattggcgt tgccacctcc agtctggccc 5160
tgcacgcgcc gtcgcaaatt gtcgcggcga ttaaatctcg cgccgatcaa ctgggtgcca 5220
gcgtggtggt gtcgatggta gaacgaagcg gcgtcgaagc ctgtaaagcg gcggtgcaca 5280
atcttctcgc gcaacgcgtc agtgggctga tcattaacta tccgctggat gaccaggatg 5340
ccattgctgt ggaagctgcc tgcactaatg ttccggcgtt atttcttgat gtctctgacc 5400
agacacccat caacagtatt attttctccc atgaagacgg tacgcgactg ggcgtggagc 5460
atctggtcgc attgggtcac cagcaaatcg cgctgttagc gggcccatta agttctgtct 5520
cggcgcgtct gcgtctggct ggctggcata aatatctcac tcgcaatcaa attcagccga 5580
tagcggaacg ggaaggcgac tggagtgcca tgtccggttt tcaacaaacc atgcaaatgc 5640
tgaatgaggg catcgttccc actgcgatgc tggttgccaa cgatcagatg gcgctgggcg 5700
caatgcgcgc cattaccgag tccgggctgc gcgttggtgc ggatatctcg gtagtgggat 5760
acgacgatac cgaagacagc tcatgttata tcccgccgtc aaccaccatc aaacaggatt 5820
ttcgcctgct ggggcaaacc agcgtggacc gcttgctgca actctctcag ggccaggcgg 5880
tgaagggcaa tcagctgttg cccgtctcac tggtgaaaag aaaaaccacc ctggcgccca 5940
atacgcaaac cgcctctccc cgcgcgttgg ccgattcatt aatgcagctg gcacgacagg 6000
tttcccgact ggaaagcggg cagtgagcgc aacgcaatta atgtgagtta gcgcgaattg 6060
atctg 6065
<210> 16
<211> 6912
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 16
ttgtctgctc ccggcatccg cttacagaca agctgtgacc gtctccggga gctgcatgtg 60
tcagaggttt tcaccgtcat caccgaaacg cgcgaggcag cagatcaatt cgcgcgcgaa 120
ggcgaagcgg catgcattta cgttgacacc atcgaatggt gcaaaacctt tcgcggtatg 180
gcatgatagc gcccggaaga gagtcaattc agggtggtga atgtgaaacc agtaacgtta 240
tacgatgtcg cagagtatgc cggtgtctct tatcagaccg tttcccgcgt ggtgaaccag 300
gccagccacg tttctgcgaa aacgcgggaa aaagtggaag cggcgatggc ggagctgaat 360
tacattccca accgcgtggc acaacaactg gcgggcaaac agtcgttgct gattggcgtt 420
gccacctcca gtctggccct gcacgcgccg tcgcaaattg tcgcggcgat taaatctcgc 480
gccgatcaac tgggtgccag cgtggtggtg tcgatggtag aacgaagcgg cgtcgaagcc 540
tgtaaagcgg cggtgcacaa tcttctcgcg caacgcgtca gtgggctgat cattaactat 600
ccgctggatg accaggatgc cattgctgtg gaagctgcct gcactaatgt tccggcgtta 660
tttcttgatg tctctgacca gacacccatc aacagtatta ttttctccca tgaagacggt 720
acgcgactgg gcgtggagca tctggtcgca ttgggtcacc agcaaatcgc gctgttagcg 780
ggcccattaa gttctgtctc ggcgcgtctg cgtctggctg gctggcataa atatctcact 840
cgcaatcaaa ttcagccgat agcggaacgg gaaggcgact ggagtgccat gtccggtttt 900
caacaaacca tgcaaatgct gaatgagggc atcgttccca ctgcgatgct ggttgccaac 960
gatcagatgg cgctgggcgc aatgcgcgcc attaccgagt ccgggctgcg cgttggtgcg 1020
gatatctcgg tagtgggata cgacgatacc gaagacagct catgttatat cccgccgtca 1080
accaccatca aacaggattt tcgcctgctg gggcaaacca gcgtggaccg cttgctgcaa 1140
ctctctcagg gccaggcggt gaagggcaat cagctgttgc ccgtctcact ggtgaaaaga 1200
aaaaccaccc tggcgcccaa tacgcaaacc gcctctcccc gcgcgttggc cgattcatta 1260
atgcagctgg cacgacaggt ttcccgactg gaaagcgggc agtgagcgca acgcaattaa 1320
tgtgagttag cgcgaattga tctggtttga cagcttatca tcgactgcac ggtgcaccaa 1380
tgcttctggc gtcaggcagc catcggaagc tgtggtatgg ctgtgcaggt cgtaaatcac 1440
tgcataattc gtgtcgctca aggcgcactc ccgttctgga taatgttttt tgcgccgaca 1500
tcataacggt tctggcaaat attctgaaat gagctgttga caattaatca tccggctcgt 1560
ataatgtgtg gaattgtgag cggataacaa tttcacacag gaaacagcgc cgctgagaaa 1620
aagcgaagcg gcactgctct ttaacaattt atcagacaat ctgtgtgggc actcgaccgg 1680
aattatcgat taactttatt attaaaaatt aaagaggtat atattaatgt atcgattaaa 1740
taaggaggaa taaaccatgt gtgcgacctc ttctcaattt actcagatta ccgagcataa 1800
ttcccgtcgt tccgcaaact atcagccaaa cctgtggaat ttcgaattcc tgcaatccct 1860
ggagaacgac ctgaaagtgg aaaagctgga ggagaaagcg accaaactgg aggaagaagt 1920
tcgctgcatg atcaaccgtg tagacaccca gccgctgtcc ctgctggagc tgatcgacga 1980
tgtgcagcgc ctgggtctga cctacaaatt tgaaaaagac atcattaaag ccctggaaaa 2040
catcgtactg ctggacgaaa acaaaaagaa caaatctgac ctgcacgcaa ccgctctgtc 2100
tttccgtctg ctgcgtcagc acggtttcga ggtttctcag gatgtttttg agcgtttcaa 2160
ggataaagaa ggtggtttca gcggtgaact gaaaggtgac gtccaaggcc tgctgagcct 2220
gtatgaagcg tcttacctgg gtttcgaggg tgagaacctg ctggaggagg cgcgtacctt 2280
ttccatcacc cacctgaaga acaacctgaa agaaggcatt aataccaagg ttgcagaaca 2340
agtgagccac gccctggaac tgccatatca ccagcgtctg caccgtctgg aggcacgttg 2400
gttcctggat aaatacgaac cgaaagaacc gcatcaccag ctgctgctgg agctggcgaa 2460
gctggatttt aacatggtac agaccctgca ccagaaagag ctgcaagatc tgtcccgctg 2520
gtggaccgag atgggcctgg ctagcaaact ggattttgta cgcgaccgcc tgatggaagt 2580
ttatttctgg gcactgggta tggcgccaga cccgcagttt ggtgaatgtc gcaaagctgt 2640
tactaaaatg tttggtctgg tgacgatcat cgatgacgtg tatgacgttt atggcactct 2700
ggacgaactg caactgttca ccgatgctgt agagcgctgg gacgttaacg ctattaacac 2760
cctgccggac tatatgaaac tgtgtttcct ggcactgtac aacaccgtta acgacacgtc 2820
ctattctatt ctgaaagaga aaggtcataa caacctgtcc tatctgacga aaagctggcg 2880
tgaactgtgc aaagcctttc tgcaagaggc gaaatggtcc aacaacaaaa ttatcccggc 2940
tttctccaag tacctggaaa acgccagcgt ttcctcctcc ggtgtagcgc tgctggcgcc 3000
gtcttacttt tccgtatgcc agcagcagga agacatctcc gaccacgcgc tgcgttccct 3060
gaccgacttc catggtctgg tgcgttctag ctgcgttatc ttccgcctgt gcaacgatct 3120
ggccacctct gcggcggagc tggaacgtgg cgagactacc aattctatca ttagctacat 3180
gcacgaaaac gatggtacca gcgaggaaca ggcccgcgaa gaactgcgta aactgatcga 3240
cgccgaatgg aaaaagatga atcgtgaacg cgttagcgac tccaccctgc tgcctaaagc 3300
gttcatggaa atcgcagtta acatggcacg tgtttcccac tgcacctacc agtatggcga 3360
tggtctgggt cgcccagact acgcgactga aaaccgcatc aaactgctgc tgattgaccc 3420
tttcccgatt aaccagctga tgtatgtcta actgcatcgc ccttaggagg taaaaaaaaa 3480
tgactgccga caacaatagt atgccccatg gtgcagtatc tagttacgcc aaattagtgc 3540
aaaaccaaac acctgaagac attttggaag agtttcctga aattattcca ttacaacaaa 3600
gacctaatac ccgatctagt gagacgtcaa atgacgaaag cggagaaaca tgtttttctg 3660
gtcatgatga ggagcaaatt aagttaatga atgaaaattg tattgttttg gattgggacg 3720
ataatgctat tggtgccggt accaagaaag tttgtcattt aatggaaaat attgaaaagg 3780
gtttactaca tcgtgcattc tccgtcttta ttttcaatga acaaggtgaa ttacttttac 3840
aacaaagagc cactgaaaaa ataactttcc ctgatctttg gactaacaca tgctgctctc 3900
atccactatg tattgatgac gaattaggtt tgaagggtaa gctagacgat aagattaagg 3960
gcgctattac tgcggcggtg agaaaactag atcatgaatt aggtattcca gaagatgaaa 4020
ctaagacaag gggtaagttt cactttttaa acagaatcca ttacatggca ccaagcaatg 4080
aaccatgggg tgaacatgaa attgattaca tcctatttta taagatcaac gctaaagaaa 4140
acttgactgt caacccaaac gtcaatgaag ttagagactt caaatgggtt tcaccaaatg 4200
atttgaaaac tatgtttgct gacccaagtt acaagtttac gccttggttt aagattattt 4260
gcgagaatta cttattcaac tggtgggagc aattagatga cctttctgaa gtggaaaatg 4320
acaggcaaat tcatagaatg ctataacaac gcgtcctgca gctggtacca tatgggaatt 4380
cgaagctttc tagaacaaaa actcatctca gaagaggatc tgaatagcgc cgtcgaccat 4440
catcatcatc atcattgagt ttaaacggtc tccagcttgg ctgttttggc ggatgagaga 4500
agattttcag cctgatacag attaaatcag aacgcagaag cggtctgata aaacagaatt 4560
tgcctggcgg cagtagcgcg gtggtcccac ctgaccccat gccgaactca gaagtgaaac 4620
gccgtagcgc cgatggtagt gtggggtctc cccatgcgag agtagggaac tgccaggcat 4680
caaataaaac gaaaggctca gtcgaaagac tgggcctttc gttttatctg ttgtttgtcg 4740
gtgaacgctc tcctgagtag gacaaatccg ccgggagcgg atttgaacgt tgcgaagcaa 4800
cggcccggag ggtggcgggc aggacgcccg ccataaactg ccaggcatca aattaagcag 4860
aaggccatcc tgacggatgg cctttttgcg tttctacaaa ctctttttgt ttatttttct 4920
aaatacattc aaatatgtat ccgcttaacc ggaattgcca gctggggcgc cctctggtaa 4980
ggttgggaag ccctgcaaag taaactggat ggctttctcg ccgccaagga tctgatggcg 5040
caggggatca agctctgatc aagagacagg atgaggatcg tttcgcatga ttgaacaaga 5100
tggattgcac gcaggttctc cggccgcttg ggtggagagg ctattcggct atgactgggc 5160
acaacagaca atcggctgct ctgatgccgc cgtgttccgg ctgtcagcgc aggggcgccc 5220
ggttcttttt gtcaagaccg acctgtccgg tgccctgaat gaactgcaag acgaggcagc 5280
gcggctatcg tggctggcca cgacgggcgt tccttgcgca gctgtgctcg acgttgtcac 5340
tgaagcggga agggactggc tgctattggg cgaagtgccg gggcaggatc tcctgtcatc 5400
tcaccttgct cctgccgaga aagtatccat catggctgat gcaatgcggc ggctgcatac 5460
gcttgatccg gctacctgcc cattcgacca ccaagcgaaa catcgcatcg agcgagcacg 5520
tactcggatg gaagccggtc ttgtcgatca ggatgatctg gacgaagagc atcaggggct 5580
cgcgccagcc gaactgttcg ccaggctcaa ggcgagcatg cccgacggcg aggatctcgt 5640
cgtgacccat ggcgatgcct gcttgccgaa tatcatggtg gaaaatggcc gcttttctgg 5700
attcatcgac tgtggccggc tgggtgtggc ggaccgctat caggacatag cgttggctac 5760
ccgtgatatt gctgaagagc ttggcggcga atgggctgac cgcttcctcg tgctttacgg 5820
tatcgccgct cccgattcgc agcgcatcgc cttctatcgc cttcttgacg agttcttctg 5880
acatgaccaa aatcccttaa cgtgagtttt cgttccactg agcgtcagac cccgtagaaa 5940
agatcaaagg atcttcttga gatccttttt ttctgcgcgt aatctgctgc ttgcaaacaa 6000
aaaaaccacc gctaccagcg gtggtttgtt tgccggatca agagctacca actctttttc 6060
cgaaggtaac tggcttcagc agagcgcaga taccaaatac tgtccttcta gtgtagccgt 6120
agttaggcca ccacttcaag aactctgtag caccgcctac atacctcgct ctgctaatcc 6180
tgttaccagt ggctgctgcc agtggcgata agtcgtgtct taccgggttg gactcaagac 6240
gatagttacc ggataaggcg cagcggtcgg gctgaacggg gggttcgtgc acacagccca 6300
gcttggagcg aacgacctac accgaactga gatacctaca gcgtgagcta tgagaaagcg 6360
ccacgcttcc cgaagggaga aaggcggaca ggtatccggt aagcggcagg gtcggaacag 6420
gagagcgcac gagggagctt ccagggggaa acgcctggta tctttatagt cctgtcgggt 6480
ttcgccacct ctgacttgag cgtcgatttt tgtgatgctc gtcagggggg cggagcctat 6540
ggaaaaacgc cagcaacgcg gcctttttac ggttcctggc cttttgctgg ccttttgctc 6600
acatgttctt tcctgcgtta tcccctgatt ctgtggataa ccgtattacc gcctttgagt 6660
gagctgatac cgctcgccgc agccgaacga ccgagcgcag cgagtcagtg agcgaggaag 6720
cggaagagcg cctgatgcgg tattttctcc ttacgcatct gtgcggtatt tcacaccgca 6780
tatggtgcac tctcagtaca atctgctctg atgccgcata gttaagccag tatacactcc 6840
gctatcgcta cgtgactggg tcatggctgc gccccgacac ccgccaacac ccgctgacgc 6900
gccctgacgg gc 6912
<210> 17
<211> 7902
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 17
ttgtctgctc ccggcatccg cttacagaca agctgtgacc gtctccggga gctgcatgtg 60
tcagaggttt tcaccgtcat caccgaaacg cgcgaggcag cagatcaatt cgcgcgcgaa 120
ggcgaagcgg catgcattta cgttgacacc atcgaatggt gcaaaacctt tcgcggtatg 180
gcatgatagc gcccggaaga gagtcaattc agggtggtga atgtgaaacc agtaacgtta 240
tacgatgtcg cagagtatgc cggtgtctct tatcagaccg tttcccgcgt ggtgaaccag 300
gccagccacg tttctgcgaa aacgcgggaa aaagtggaag cggcgatggc ggagctgaat 360
tacattccca accgcgtggc acaacaactg gcgggcaaac agtcgttgct gattggcgtt 420
gccacctcca gtctggccct gcacgcgccg tcgcaaattg tcgcggcgat taaatctcgc 480
gccgatcaac tgggtgccag cgtggtggtg tcgatggtag aacgaagcgg cgtcgaagcc 540
tgtaaagcgg cggtgcacaa tcttctcgcg caacgcgtca gtgggctgat cattaactat 600
ccgctggatg accaggatgc cattgctgtg gaagctgcct gcactaatgt tccggcgtta 660
tttcttgatg tctctgacca gacacccatc aacagtatta ttttctccca tgaagacggt 720
acgcgactgg gcgtggagca tctggtcgca ttgggtcacc agcaaatcgc gctgttagcg 780
ggcccattaa gttctgtctc ggcgcgtctg cgtctggctg gctggcataa atatctcact 840
cgcaatcaaa ttcagccgat agcggaacgg gaaggcgact ggagtgccat gtccggtttt 900
caacaaacca tgcaaatgct gaatgagggc atcgttccca ctgcgatgct ggttgccaac 960
gatcagatgg cgctgggcgc aatgcgcgcc attaccgagt ccgggctgcg cgttggtgcg 1020
gatatctcgg tagtgggata cgacgatacc gaagacagct catgttatat cccgccgtca 1080
accaccatca aacaggattt tcgcctgctg gggcaaacca gcgtggaccg cttgctgcaa 1140
ctctctcagg gccaggcggt gaagggcaat cagctgttgc ccgtctcact ggtgaaaaga 1200
aaaaccaccc tggcgcccaa tacgcaaacc gcctctcccc gcgcgttggc cgattcatta 1260
atgcagctgg cacgacaggt ttcccgactg gaaagcgggc agtgagcgca acgcaattaa 1320
tgtgagttag cgcgaattga tctggtttga cagcttatca tcgactgcac ggtgcaccaa 1380
tgcttctggc gtcaggcagc catcggaagc tgtggtatgg ctgtgcaggt cgtaaatcac 1440
tgcataattc gtgtcgctca aggcgcactc ccgttctgga taatgttttt tgcgccgaca 1500
tcataacggt tctggcaaat attctgaaat gagctgttga caattaatca tccggctcgt 1560
ataatgtgtg gaattgtgag cggataacaa tttcacacag gaaacagcgc cgctgagaaa 1620
aagcgaagcg gcactgctct ttaacaattt atcagacaat ctgtgtgggc actcgaccgg 1680
aattatcgat taactttatt attaaaaatt aaagaggtat atattaatgt atcgattaaa 1740
taaggaggaa taaaccatgt gtgcgacctc ttctcaattt actcagatta ccgagcataa 1800
ttcccgtcgt tccgcaaact atcagccaaa cctgtggaat ttcgaattcc tgcaatccct 1860
ggagaacgac ctgaaagtgg aaaagctgga ggagaaagcg accaaactgg aggaagaagt 1920
tcgctgcatg atcaaccgtg tagacaccca gccgctgtcc ctgctggagc tgatcgacga 1980
tgtgcagcgc ctgggtctga cctacaaatt tgaaaaagac atcattaaag ccctggaaaa 2040
catcgtactg ctggacgaaa acaaaaagaa caaatctgac ctgcacgcaa ccgctctgtc 2100
tttccgtctg ctgcgtcagc acggtttcga ggtttctcag gatgtttttg agcgtttcaa 2160
ggataaagaa ggtggtttca gcggtgaact gaaaggtgac gtccaaggcc tgctgagcct 2220
gtatgaagcg tcttacctgg gtttcgaggg tgagaacctg ctggaggagg cgcgtacctt 2280
ttccatcacc cacctgaaga acaacctgaa agaaggcatt aataccaagg ttgcagaaca 2340
agtgagccac gccctggaac tgccatatca ccagcgtctg caccgtctgg aggcacgttg 2400
gttcctggat aaatacgaac cgaaagaacc gcatcaccag ctgctgctgg agctggcgaa 2460
gctggatttt aacatggtac agaccctgca ccagaaagag ctgcaagatc tgtcccgctg 2520
gtggaccgag atgggcctgg ctagcaaact ggattttgta cgcgaccgcc tgatggaagt 2580
ttatttctgg gcactgggta tggcgccaga cccgcagttt ggtgaatgtc gcaaagctgt 2640
tactaaaatg tttggtctgg tgacgatcat cgatgacgtg tatgacgttt atggcactct 2700
ggacgaactg caactgttca ccgatgctgt agagcgctgg gacgttaacg ctattaacac 2760
cctgccggac tatatgaaac tgtgtttcct ggcactgtac aacaccgtta acgacacgtc 2820
ctattctatt ctgaaagaga aaggtcataa caacctgtcc tatctgacga aaagctggcg 2880
tgaactgtgc aaagcctttc tgcaagaggc gaaatggtcc aacaacaaaa ttatcccggc 2940
tttctccaag tacctggaaa acgccagcgt ttcctcctcc ggtgtagcgc tgctggcgcc 3000
gtcttacttt tccgtatgcc agcagcagga agacatctcc gaccacgcgc tgcgttccct 3060
gaccgacttc catggtctgg tgcgttctag ctgcgttatc ttccgcctgt gcaacgatct 3120
ggccacctct gcggcggagc tggaacgtgg cgagactacc aattctatca ttagctacat 3180
gcacgaaaac gatggtacca gcgaggaaca ggcccgcgaa gaactgcgta aactgatcga 3240
cgccgaatgg aaaaagatga atcgtgaacg cgttagcgac tccaccctgc tgcctaaagc 3300
gttcatggaa atcgcagtta acatggcacg tgtttcccac tgcacctacc agtatggcga 3360
tggtctgggt cgcccagact acgcgactga aaaccgcatc aaactgctgc tgattgaccc 3420
tttcccgatt aaccagctga tgtatgtcta actgcattcg cccttaggag gtaaaaaaac 3480
atgagttttg atattgccaa atacccgacc ctggcactgg tcgactccac ccaggagtta 3540
cgactgttgc cgaaagagag tttaccgaaa ctctgcgacg aactgcgccg ctatttactc 3600
gacagcgtga gccgttccag cgggcacttc gcctccgggc tgggcacggt cgaactgacc 3660
gtggcgctgc actatgtcta caacaccccg tttgaccaat tgatttggga tgtggggcat 3720
caggcttatc cgcataaaat tttgaccgga cgccgcgaca aaatcggcac catccgtcag 3780
aaaggcggtc tgcacccgtt cccgtggcgc ggcgaaagcg aatatgacgt attaagcgtc 3840
gggcattcat caacctccat cagtgccgga attggtattg cggttgctgc cgaaaaagaa 3900
ggcaaaaatc gccgcaccgt ctgtgtcatt ggcgatggcg cgattaccgc aggcatggcg 3960
tttgaagcga tgaatcacgc gggcgatatc cgtcctgata tgctggtgat tctcaacgac 4020
aatgaaatgt cgatttccga aaatgtcggc gcgctcaaca accatctggc acagctgctt 4080
tccggtaagc tttactcttc actgcgcgaa ggcgggaaaa aagttttctc tggcgtgccg 4140
ccaattaaag agctgctcaa acgcaccgaa gaacatatta aaggcatggt agtgcctggc 4200
acgttgtttg aagagctggg ctttaactac atcggcccgg tggacggtca cgatgtgctg 4260
gggcttatca ccacgctaaa gaacatgcgc gacctgaaag gcccgcagtt cctgcatatc 4320
atgaccaaaa aaggtcgtgg ttatgaaccg gcagaaaaag acccgatcac tttccacgcc 4380
gtgcctaaat ttgatccctc cagcggttgt ttgccgaaaa gtagcggcgg tttgccgagc 4440
tattcaaaaa tctttggcga ctggttgtgc gaaacggcag cgaaagacaa caagctgatg 4500
gcgattactc cggcgatgcg tgaaggttcc ggcatggtcg agttttcacg taaattcccg 4560
gatcgctact tcgacgtggc aattgccgag caacacgcgg tgacctttgc tgcgggtctg 4620
gcgattggtg ggtacaaacc cattgtcgcg atttactcca ctttcctgca acgcgcctat 4680
gatcaggtgc tgcatgacgt ggcgattcaa aagcttccgg tcctgttcgc catcgaccgc 4740
gcgggcattg ttggtgctga cggtcaaacc catcagggtg cttttgatct ctcttacctg 4800
cgctgcatac cggaaatggt cattatgacc ccgagcgatg aaaacgaatg tcgccagatg 4860
ctctataccg gctatcacta taacgatggc ccgtcagcgg tgcgctaccc gcgtggcaac 4920
gcggtcggcg tggaactgac gccgctggaa aaactaccaa ttggcaaagg cattgtgaag 4980
cgtcgtggcg agaaactggc gatccttaac tttggtacgc tgatgccaga agcggcgaaa 5040
gtcgccgaat cgctgaacgc cacgctggtc gatatgcgtt ttgtgaaacc gcttgatgaa 5100
gcgttaattc tggaaatggc cgccagccat gaagcgctgg tcaccgtaga agaaaacgcc 5160
attatgggcg gcgcaggcag cggcgtgaac gaagtgctga tggcccatcg taaaccagta 5220
cccgtgctga acattggcct gccggacttc tttattccgc aaggaactca ggaagaaatg 5280
cgcgccgaac tcggcctcga tgccgctggt atggaagcca aaatcaaggc ctggctggca 5340
taactgcagc tggtaccata tgggaattcg aagctttcta gaacaaaaac tcatctcaga 5400
agaggatctg aatagcgccg tcgaccatca tcatcatcat cattgagttt aaacggtctc 5460
cagcttggct gttttggcgg atgagagaag attttcagcc tgatacagat taaatcagaa 5520
cgcagaagcg gtctgataaa acagaatttg cctggcggca gtagcgcggt ggtcccacct 5580
gaccccatgc cgaactcaga agtgaaacgc cgtagcgccg atggtagtgt ggggtctccc 5640
catgcgagag tagggaactg ccaggcatca aataaaacga aaggctcagt cgaaagactg 5700
ggcctttcgt tttatctgtt gtttgtcggt gaacgctctc ctgagtagga caaatccgcc 5760
gggagcggat ttgaacgttg cgaagcaacg gcccggaggg tggcgggcag gacgcccgcc 5820
ataaactgcc aggcatcaaa ttaagcagaa ggccatcctg acggatggcc tttttgcgtt 5880
tctacaaact ctttttgttt atttttctaa atacattcaa atatgtatcc gcttaaccgg 5940
aattgccagc tggggcgccc tctggtaagg ttgggaagcc ctgcaaagta aactggatgg 6000
ctttctcgcc gccaaggatc tgatggcgca ggggatcaag ctctgatcaa gagacaggat 6060
gaggatcgtt tcgcatgatt gaacaagatg gattgcacgc aggttctccg gccgcttggg 6120
tggagaggct attcggctat gactgggcac aacagacaat cggctgctct gatgccgccg 6180
tgttccggct gtcagcgcag gggcgcccgg ttctttttgt caagaccgac ctgtccggtg 6240
ccctgaatga actgcaagac gaggcagcgc ggctatcgtg gctggccacg acgggcgttc 6300
cttgcgcagc tgtgctcgac gttgtcactg aagcgggaag ggactggctg ctattgggcg 6360
aagtgccggg gcaggatctc ctgtcatctc accttgctcc tgccgagaaa gtatccatca 6420
tggctgatgc aatgcggcgg ctgcatacgc ttgatccggc tacctgccca ttcgaccacc 6480
aagcgaaaca tcgcatcgag cgagcacgta ctcggatgga agccggtctt gtcgatcagg 6540
atgatctgga cgaagagcat caggggctcg cgccagccga actgttcgcc aggctcaagg 6600
cgagcatgcc cgacggcgag gatctcgtcg tgacccatgg cgatgcctgc ttgccgaata 6660
tcatggtgga aaatggccgc ttttctggat tcatcgactg tggccggctg ggtgtggcgg 6720
accgctatca ggacatagcg ttggctaccc gtgatattgc tgaagagctt ggcggcgaat 6780
gggctgaccg cttcctcgtg ctttacggta tcgccgctcc cgattcgcag cgcatcgcct 6840
tctatcgcct tcttgacgag ttcttctgac gcatgaccaa aatcccttaa cgtgagtttt 6900
cgttccactg agcgtcagac cccgtagaaa agatcaaagg atcttcttga gatccttttt 6960
ttctgcgcgt aatctgctgc ttgcaaacaa aaaaaccacc gctaccagcg gtggtttgtt 7020
tgccggatca agagctacca actctttttc cgaaggtaac tggcttcagc agagcgcaga 7080
taccaaatac tgtccttcta gtgtagccgt agttaggcca ccacttcaag aactctgtag 7140
caccgcctac atacctcgct ctgctaatcc tgttaccagt ggctgctgcc agtggcgata 7200
agtcgtgtct taccgggttg gactcaagac gatagttacc ggataaggcg cagcggtcgg 7260
gctgaacggg gggttcgtgc acacagccca gcttggagcg aacgacctac accgaactga 7320
gatacctaca gcgtgagcta tgagaaagcg ccacgcttcc cgaagggaga aaggcggaca 7380
ggtatccggt aagcggcagg gtcggaacag gagagcgcac gagggagctt ccagggggaa 7440
acgcctggta tctttatagt cctgtcgggt ttcgccacct ctgacttgag cgtcgatttt 7500
tgtgatgctc gtcagggggg cggagcctat ggaaaaacgc cagcaacgcg gcctttttac 7560
ggttcctggc cttttgctgg ccttttgctc acatgttctt tcctgcgtta tcccctgatt 7620
ctgtggataa ccgtattacc gcctttgagt gagctgatac cgctcgccgc agccgaacga 7680
ccgagcgcag cgagtcagtg agcgaggaag cggaagagcg cctgatgcgg tattttctcc 7740
ttacgcatct gtgcggtatt tcacaccgca tatggtgcac tctcagtaca atctgctctg 7800
atgccgcata gttaagccag tatacactcc gctatcgcta cgtgactggg tcatggctgc 7860
gccccgacac ccgccaacac ccgctgacgc gccctgacgg gc 7902
<210> 18
<211> 6783
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 18
ctggcgtaat agcgaagagg cccgcaccga tcgcccttcc caacagttgc gcagcctgaa 60
tggcgaatgg cgcctgatgc ggtattttct ccttacgcat ctgtgcggta tttcacaccg 120
catatggtgc actctcagta caatctgctc tgatgccgca tagttaagcc agccccgaca 180
cccgccaaca cccgctgacg agcttagtaa agccctcgct agattttaat gcggatgttg 240
cgattacttc gccaactatt gcgataacaa gaaaaagcca gcctttcatg atatatctcc 300
caatttgtgt agggcttatt atgcacgctt aaaaataata aaagcagact tgacctgata 360
gtttggctgt gagcaattat gtgcttagtg catctaacgc ttgagttaag ccgcgccgcg 420
aagcggcgtc ggcttgaacg aattgttaga cattatttgc cgactacctt ggtgatctcg 480
cctttcacgt agtggacaaa ttcttccaac tgatctgcgc gcgaggccaa gcgatcttct 540
tcttgtccaa gataagcctg tctagcttca agtatgacgg gctgatactg ggccggcagg 600
cgctccattg cccagtcggc agcgacatcc ttcggcgcga ttttgccggt tactgcgctg 660
taccaaatgc gggacaacgt aagcactaca tttcgctcat cgccagccca gtcgggcggc 720
gagttccata gcgttaaggt ttcatttagc gcctcaaata gatcctgttc aggaaccgga 780
tcaaagagtt cctccgccgc tggacctacc aaggcaacgc tatgttctct tgcttttgtc 840
agcaagatag ccagatcaat gtcgatcgtg gctggctcga agatacctgc aagaatgtca 900
ttgcgctgcc attctccaaa ttgcagttcg cgcttagctg gataacgcca cggaatgatg 960
tcgtcgtgca caacaatggt gacttctaca gcgcggagaa tctcgctctc tccaggggaa 1020
gccgaagttt ccaaaaggtc gttgatcaaa gctcgccgcg ttgtttcatc aagccttacg 1080
gtcaccgtaa ccagcaaatc aatatcactg tgtggcttca ggccgccatc cactgcggag 1140
ccgtacaaat gtacggccag caacgtcggt tcgagatggc gctcgatgac gccaactacc 1200
tctgatagtt gagtcgatac ttcggcgatc accgcttccc tcatgatgtt taactttgtt 1260
ttagggcgac tgccctgctg cgtaacatcg ttgctgctcc ataacatcaa acatcgaccc 1320
acggcgtaac gcgcttgctg cttggatgcc cgaggcatag actgtacccc aaaaaaacag 1380
tcataacaag ccatgaaaac cgccactgcg ccgttaccac cgctgcgttc ggtcaaggtt 1440
ctggaccagt tgcgtgagcg catacgctac ttgcattaca gcttacgaac cgaacaggct 1500
tatgtccact gggttcgtgc cttcatccgt ttccacggtg tgcgtcaccc ggcaaccttg 1560
ggcagcagcg aagtcgaggc atttctgtcc tggctggcga acgagcgcaa ggtttcggtc 1620
tccacgcatc gtcaggcatt ggcggccttg ctgttcttct acggcaaggt gctgtgcacg 1680
gatctgccct ggcttcagga gatcggaaga cctcggccgt cgcggcgctt gccggtggtg 1740
ctgaccccgg atgaagtggt tcgcatcctc ggttttctgg aaggcgagca tcgtttgttc 1800
gcccagcttc tgtatggaac gggcatgcgg atcagtgagg gtttgcaact gcgggtcaag 1860
gatctggatt tcgatcacgg cacgatcatc gtgcgggagg gcaagggctc caaggatcgg 1920
gccttgatgt tacccgagag cttggcaccc agcctgcgcg agcaggggaa ttaattccca 1980
cgggttttgc tgcccgcaaa cgggctgttc tggtgttgct agtttgttat cagaatcgca 2040
gatccggctt cagccggttt gccggctgaa agcgctattt cttccagaat tgccatgatt 2100
ttttccccac gggaggcgtc actggctccc gtgttgtcgg cagctttgat tcgataagca 2160
gcatcgcctg tttcaggctg tctatgtgtg actgttgagc tgtaacaagt tgtctcaggt 2220
gttcaatttc atgttctagt tgctttgttt tactggtttc acctgttcta ttaggtgtta 2280
catgctgttc atctgttaca ttgtcgatct gttcatggtg aacagctttg aatgcaccaa 2340
aaactcgtaa aagctctgat gtatctatct tttttacacc gttttcatct gtgcatatgg 2400
acagttttcc ctttgatatg taacggtgaa cagttgttct acttttgttt gttagtcttg 2460
atgcttcact gatagataca agagccataa gaacctcaga tccttccgta tttagccagt 2520
atgttctcta gtgtggttcg ttgtttttgc gtgagccatg agaacgaacc attgagatca 2580
tacttacttt gcatgtcact caaaaatttt gcctcaaaac tggtgagctg aatttttgca 2640
gttaaagcat cgtgtagtgt ttttcttagt ccgttatgta ggtaggaatc tgatgtaatg 2700
gttgttggta ttttgtcacc attcattttt atctggttgt tctcaagttc ggttacgaga 2760
tccatttgtc tatctagttc aacttggaaa atcaacgtat cagtcgggcg gcctcgctta 2820
tcaaccacca atttcatatt gctgtaagtg tttaaatctt tacttattgg tttcaaaacc 2880
cattggttaa gccttttaaa ctcatggtag ttattttcaa gcattaacat gaacttaaat 2940
tcatcaaggc taatctctat atttgccttg tgagttttct tttgtgttag ttcttttaat 3000
aaccactcat aaatcctcat agagtatttg ttttcaaaag acttaacatg ttccagatta 3060
tattttatga atttttttaa ctggaaaaga taaggcaata tctcttcact aaaaactaat 3120
tctaattttt cgcttgagaa cttggcatag tttgtccact ggaaaatctc aaagccttta 3180
accaaaggat tcctgatttc cacagttctc gtcatcagct ctctggttgc tttagctaat 3240
acaccataag cattttccct actgatgttc atcatctgag cgtattggtt ataagtgaac 3300
gataccgtcc gttctttcct tgtagggttt tcaatcgtgg ggttgagtag tgccacacag 3360
cataaaatta gcttggtttc atgctccgtt aagtcatagc gactaatcgc tagttcattt 3420
gctttgaaaa caactaattc agacatacat ctcaattggt ctaggtgatt ttaatcacta 3480
taccaattga gatgggctag tcaatgataa ttactagtcc ttttcctttg agttgtgggt 3540
atctgtaaat tctgctagac ctttgctgga aaacttgtaa attctgctag accctctgta 3600
aattccgcta gacctttgtg tgtttttttt gtttatattc aagtggttat aatttataga 3660
ataaagaaag aataaaaaaa gataaaaaga atagatccca gccctgtgta taactcacta 3720
ctttagtcag ttccgcagta ttacaaaagg atgtcgcaaa cgctgtttgc tcctctacaa 3780
aacagacctt aaaaccctaa aggcttaagt agcaccctcg caagctcggg caaatcgctg 3840
aatattcctt ttgtctccga ccatcaggca cctgagtcgc tgtctttttc gtgacattca 3900
gttcgctgcg ctcacggctc tggcagtgaa tgggggtaaa tggcactaca ggcgcctttt 3960
atggattcat gcaaggaaac tacccataat acaagaaaag cccgtcacgg gcttctcagg 4020
gcgttttatg gcgggtctgc tatgtggtgc tatctgactt tttgctgttc agcagttcct 4080
gccctctgat tttccagtct gaccacttcg gattatcccg tgacaggtca ttcagactgg 4140
ctaatgcacc cagtaaggca gcggtatcat caacaggctt acccgtctta ctgtcgggaa 4200
ttcgcgttgg ccgattcatt aatgcagatt ctgaaatgag ctgttgacaa ttaatcatcc 4260
ggctcgtata atgtgtggaa ttgtgagcgg ataacaattt cacacaggaa acagcgccgc 4320
tgagaaaaag cgaagcggca ctgctcttta acaatttatc agacaatctg tgtgggcact 4380
cgaccggaat tatcgattaa ctttattatt aaaaattaaa gaggtatata ttaatgtatc 4440
gattaaataa ggaggaataa accatgtgtg cgacctcttc tcaatttact cagattaccg 4500
agcataattc ccgtcgttcc gcaaactatc agccaaacct gtggaatttc gaattcctgc 4560
aatccctgga gaacgacctg aaagtggaaa agctggagga gaaagcgacc aaactggagg 4620
aagaagttcg ctgcatgatc aaccgtgtag acacccagcc gctgtccctg ctggagctga 4680
tcgacgatgt gcagcgcctg ggtctgacct acaaatttga aaaagacatc attaaagccc 4740
tggaaaacat cgtactgctg gacgaaaaca aaaagaacaa atctgacctg cacgcaaccg 4800
ctctgtcttt ccgtctgctg cgtcagcacg gtttcgaggt ttctcaggat gtttttgagc 4860
gtttcaagga taaagaaggt ggtttcagcg gtgaactgaa aggtgacgtc caaggcctgc 4920
tgagcctgta tgaagcgtct tacctgggtt tcgagggtga gaacctgctg gaggaggcgc 4980
gtaccttttc catcacccac ctgaagaaca acctgaaaga aggcattaat accaaggttg 5040
cagaacaagt gagccacgcc ctggaactgc catatcacca gcgtctgcac cgtctggagg 5100
cacgttggtt cctggataaa tacgaaccga aagaaccgca tcaccagctg ctgctggagc 5160
tggcgaagct ggattttaac atggtacaga ccctgcacca gaaagagctg caagatctgt 5220
cccgctggtg gaccgagatg ggcctggcta gcaaactgga ttttgtacgc gaccgcctga 5280
tggaagttta tttctgggca ctgggtatgg cgccagaccc gcagtttggt gaatgtcgca 5340
aagctgttac taaaatgttt ggtctggtga cgatcatcga tgacgtgtat gacgtttatg 5400
gcactctgga cgaactgcaa ctgttcaccg atgctgtaga gcgctgggac gttaacgcta 5460
ttaacaccct gccggactat atgaaactgt gtttcctggc actgtacaac accgttaacg 5520
acacgtccta ttctattctg aaagagaaag gtcataacaa cctgtcctat ctgacgaaaa 5580
gctggcgtga actgtgcaaa gcctttctgc aagaggcgaa atggtccaac aacaaaatta 5640
tcccggcttt ctccaagtac ctggaaaacg ccagcgtttc ctcctccggt gtagcgctgc 5700
tggcgccgtc ttacttttcc gtatgccagc agcaggaaga catctccgac cacgcgctgc 5760
gttccctgac cgacttccat ggtctggtgc gttctagctg cgttatcttc cgcctgtgca 5820
acgatctggc cacctctgcg gcggagctgg aacgtggcga gactaccaat tctatcatta 5880
gctacatgca cgaaaacgat ggtaccagcg aggaacaggc ccgcgaagaa ctgcgtaaac 5940
tgatcgacgc cgaatggaaa aagatgaatc gtgaacgcgt tagcgactcc accctgctgc 6000
ctaaagcgtt catggaaatc gcagttaaca tggcacgtgt ttcccactgc acctaccagt 6060
atggcgatgg tctgggtcgc ccagactacg cgactgaaaa ccgcatcaaa ctgctgctga 6120
ttgacccttt cccgattaac cagctgatgt atgtctaact gcagctggta ccatatggga 6180
attcgaagct ttctagaaca aaaactcatc tcagaagagg atctgaatag cgccgtcgac 6240
catcatcatc atcatcattg agtttaaacg gtctccagct tggctgtttt ggcggatgag 6300
agaagatttt cagcctgata cagattaaat cagaacgcag aagcggtctg ataaaacaga 6360
atttgcctgg cggcagtagc gcggtggtcc cacctgaccc catgccgaac tcagaagtga 6420
aacgccgtag cgccgatggt agtgtggggt ctccccatgc gagagtaggg aactgccagg 6480
catcaaataa aacgaaaggc tcagtcgaaa gactgggcct ttcgttttat ctgttgtttg 6540
tcggtgaacg ctctcctgag taggacaaat ccgccgggag cggatttgaa cgttgcgaag 6600
caacggcccg gagggtggcg ggcaggacgc ccgccataaa ctgccaggca tcaaattaag 6660
cagaaggcca tcctgacgga tggccttttt gcgtttctac aaactctttt tgtttatttt 6720
tctaaataca ttcaaatatg tatccgctca tgagacaata accctgataa atgcttcaat 6780
aat 6783
<210> 19
<211> 6783
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 19
cccgtcttac tgtcgggaat tcgcgttggc cgattcatta atgcagatta ttgaagcatt 60
tatcagggtt attgtctcat gagcggatac atatttgaat gtatttagaa aaataaacaa 120
aaagagtttg tagaaacgca aaaaggccat ccgtcaggat ggccttctgc ttaatttgat 180
gcctggcagt ttatggcggg cgtcctgccc gccaccctcc gggccgttgc ttcgcaacgt 240
tcaaatccgc tcccggcgga tttgtcctac tcaggagagc gttcaccgac aaacaacaga 300
taaaacgaaa ggcccagtct ttcgactgag cctttcgttt tatttgatgc ctggcagttc 360
cctactctcg catggggaga ccccacacta ccatcggcgc tacggcgttt cacttctgag 420
ttcggcatgg ggtcaggtgg gaccaccgcg ctactgccgc caggcaaatt ctgttttatc 480
agaccgcttc tgcgttctga tttaatctgt atcaggctga aaatcttctc tcatccgcca 540
aaacagccaa gctggagacc gtttaaactc aatgatgatg atgatgatgg tcgacggcgc 600
tattcagatc ctcttctgag atgagttttt gttctagaaa gcttcgaatt cccatatggt 660
accagctgca gttagacata catcagctgg ttaatcggga aagggtcaat cagcagcagt 720
ttgatgcggt tttcagtcgc gtagtctggg cgacccagac catcgccata ctggtaggtg 780
cagtgggaaa cacgtgccat gttaactgcg atttccatga acgctttagg cagcagggtg 840
gagtcgctaa cgcgttcacg attcatcttt ttccattcgg cgtcgatcag tttacgcagt 900
tcttcgcggg cctgttcctc gctggtacca tcgttttcgt gcatgtagct aatgatagaa 960
ttggtagtct cgccacgttc cagctccgcc gcagaggtgg ccagatcgtt gcacaggcgg 1020
aagataacgc agctagaacg caccagacca tggaagtcgg tcagggaacg cagcgcgtgg 1080
tcggagatgt cttcctgctg ctggcatacg gaaaagtaag acggcgccag cagcgctaca 1140
ccggaggagg aaacgctggc gttttccagg tacttggaga aagccgggat aattttgttg 1200
ttggaccatt tcgcctcttg cagaaaggct ttgcacagtt cacgccagct tttcgtcaga 1260
taggacaggt tgttatgacc tttctctttc agaatagaat aggacgtgtc gttaacggtg 1320
ttgtacagtg ccaggaaaca cagtttcata tagtccggca gggtgttaat agcgttaacg 1380
tcccagcgct ctacagcatc ggtgaacagt tgcagttcgt ccagagtgcc ataaacgtca 1440
tacacgtcat cgatgatcgt caccagacca aacattttag taacagcttt gcgacattca 1500
ccaaactgcg ggtctggcgc catacccagt gcccagaaat aaacttccat caggcggtcg 1560
cgtacaaaat ccagtttgct agccaggccc atctcggtcc accagcggga cagatcttgc 1620
agctctttct ggtgcagggt ctgtaccatg ttaaaatcca gcttcgccag ctccagcagc 1680
agctggtgat gcggttcttt cggttcgtat ttatccagga accaacgtgc ctccagacgg 1740
tgcagacgct ggtgatatgg cagttccagg gcgtggctca cttgttctgc aaccttggta 1800
ttaatgcctt ctttcaggtt gttcttcagg tgggtgatgg aaaaggtacg cgcctcctcc 1860
agcaggttct caccctcgaa acccaggtaa gacgcttcat acaggctcag caggccttgg 1920
acgtcacctt tcagttcacc gctgaaacca ccttctttat ccttgaaacg ctcaaaaaca 1980
tcctgagaaa cctcgaaacc gtgctgacgc agcagacgga aagacagagc ggttgcgtgc 2040
aggtcagatt tgttcttttt gttttcgtcc agcagtacga tgttttccag ggctttaatg 2100
atgtcttttt caaatttgta ggtcagaccc aggcgctgca catcgtcgat cagctccagc 2160
agggacagcg gctgggtgtc tacacggttg atcatgcagc gaacttcttc ctccagtttg 2220
gtcgctttct cctccagctt ttccactttc aggtcgttct ccagggattg caggaattcg 2280
aaattccaca ggtttggctg atagtttgcg gaacgacggg aattatgctc ggtaatctga 2340
gtaaattgag aagaggtcgc acacatggtt tattcctcct tatttaatcg atacattaat 2400
atatacctct ttaattttta ataataaagt taatcgataa ttccggtcga gtgcccacac 2460
agattgtctg ataaattgtt aaagagcagt gccgcttcgc tttttctcag cggcgctgtt 2520
tcctgtgtga aattgttatc cgctcacaat tccacacatt atacgagccg gatgattaat 2580
tgtcaacagc tcatttcaga atctggcgta atagcgaaga ggcccgcacc gatcgccctt 2640
cccaacagtt gcgcagcctg aatggcgaat ggcgcctgat gcggtatttt ctccttacgc 2700
atctgtgcgg tatttcacac cgcatatggt gcactctcag tacaatctgc tctgatgccg 2760
catagttaag ccagccccga cacccgccaa cacccgctga cgagcttagt aaagccctcg 2820
ctagatttta atgcggatgt tgcgattact tcgccaacta ttgcgataac aagaaaaagc 2880
cagcctttca tgatatatct cccaatttgt gtagggctta ttatgcacgc ttaaaaataa 2940
taaaagcaga cttgacctga tagtttggct gtgagcaatt atgtgcttag tgcatctaac 3000
gcttgagtta agccgcgccg cgaagcggcg tcggcttgaa cgaattgtta gacattattt 3060
gccgactacc ttggtgatct cgcctttcac gtagtggaca aattcttcca actgatctgc 3120
gcgcgaggcc aagcgatctt cttcttgtcc aagataagcc tgtctagctt caagtatgac 3180
gggctgatac tgggccggca ggcgctccat tgcccagtcg gcagcgacat ccttcggcgc 3240
gattttgccg gttactgcgc tgtaccaaat gcgggacaac gtaagcacta catttcgctc 3300
atcgccagcc cagtcgggcg gcgagttcca tagcgttaag gtttcattta gcgcctcaaa 3360
tagatcctgt tcaggaaccg gatcaaagag ttcctccgcc gctggaccta ccaaggcaac 3420
gctatgttct cttgcttttg tcagcaagat agccagatca atgtcgatcg tggctggctc 3480
gaagatacct gcaagaatgt cattgcgctg ccattctcca aattgcagtt cgcgcttagc 3540
tggataacgc cacggaatga tgtcgtcgtg cacaacaatg gtgacttcta cagcgcggag 3600
aatctcgctc tctccagggg aagccgaagt ttccaaaagg tcgttgatca aagctcgccg 3660
cgttgtttca tcaagcctta cggtcaccgt aaccagcaaa tcaatatcac tgtgtggctt 3720
caggccgcca tccactgcgg agccgtacaa atgtacggcc agcaacgtcg gttcgagatg 3780
gcgctcgatg acgccaacta cctctgatag ttgagtcgat acttcggcga tcaccgcttc 3840
cctcatgatg tttaactttg ttttagggcg actgccctgc tgcgtaacat cgttgctgct 3900
ccataacatc aaacatcgac ccacggcgta acgcgcttgc tgcttggatg cccgaggcat 3960
agactgtacc ccaaaaaaac agtcataaca agccatgaaa accgccactg cgccgttacc 4020
accgctgcgt tcggtcaagg ttctggacca gttgcgtgag cgcatacgct acttgcatta 4080
cagcttacga accgaacagg cttatgtcca ctgggttcgt gccttcatcc gtttccacgg 4140
tgtgcgtcac ccggcaacct tgggcagcag cgaagtcgag gcatttctgt cctggctggc 4200
gaacgagcgc aaggtttcgg tctccacgca tcgtcaggca ttggcggcct tgctgttctt 4260
ctacggcaag gtgctgtgca cggatctgcc ctggcttcag gagatcggaa gacctcggcc 4320
gtcgcggcgc ttgccggtgg tgctgacccc ggatgaagtg gttcgcatcc tcggttttct 4380
ggaaggcgag catcgtttgt tcgcccagct tctgtatgga acgggcatgc ggatcagtga 4440
gggtttgcaa ctgcgggtca aggatctgga tttcgatcac ggcacgatca tcgtgcggga 4500
gggcaagggc tccaaggatc gggccttgat gttacccgag agcttggcac ccagcctgcg 4560
cgagcagggg aattaattcc cacgggtttt gctgcccgca aacgggctgt tctggtgttg 4620
ctagtttgtt atcagaatcg cagatccggc ttcagccggt ttgccggctg aaagcgctat 4680
ttcttccaga attgccatga ttttttcccc acgggaggcg tcactggctc ccgtgttgtc 4740
ggcagctttg attcgataag cagcatcgcc tgtttcaggc tgtctatgtg tgactgttga 4800
gctgtaacaa gttgtctcag gtgttcaatt tcatgttcta gttgctttgt tttactggtt 4860
tcacctgttc tattaggtgt tacatgctgt tcatctgtta cattgtcgat ctgttcatgg 4920
tgaacagctt tgaatgcacc aaaaactcgt aaaagctctg atgtatctat cttttttaca 4980
ccgttttcat ctgtgcatat ggacagtttt ccctttgata tgtaacggtg aacagttgtt 5040
ctacttttgt ttgttagtct tgatgcttca ctgatagata caagagccat aagaacctca 5100
gatccttccg tatttagcca gtatgttctc tagtgtggtt cgttgttttt gcgtgagcca 5160
tgagaacgaa ccattgagat catacttact ttgcatgtca ctcaaaaatt ttgcctcaaa 5220
actggtgagc tgaatttttg cagttaaagc atcgtgtagt gtttttctta gtccgttatg 5280
taggtaggaa tctgatgtaa tggttgttgg tattttgtca ccattcattt ttatctggtt 5340
gttctcaagt tcggttacga gatccatttg tctatctagt tcaacttgga aaatcaacgt 5400
atcagtcggg cggcctcgct tatcaaccac caatttcata ttgctgtaag tgtttaaatc 5460
tttacttatt ggtttcaaaa cccattggtt aagcctttta aactcatggt agttattttc 5520
aagcattaac atgaacttaa attcatcaag gctaatctct atatttgcct tgtgagtttt 5580
cttttgtgtt agttctttta ataaccactc ataaatcctc atagagtatt tgttttcaaa 5640
agacttaaca tgttccagat tatattttat gaattttttt aactggaaaa gataaggcaa 5700
tatctcttca ctaaaaacta attctaattt ttcgcttgag aacttggcat agtttgtcca 5760
ctggaaaatc tcaaagcctt taaccaaagg attcctgatt tccacagttc tcgtcatcag 5820
ctctctggtt gctttagcta atacaccata agcattttcc ctactgatgt tcatcatctg 5880
agcgtattgg ttataagtga acgataccgt ccgttctttc cttgtagggt tttcaatcgt 5940
ggggttgagt agtgccacac agcataaaat tagcttggtt tcatgctccg ttaagtcata 6000
gcgactaatc gctagttcat ttgctttgaa aacaactaat tcagacatac atctcaattg 6060
gtctaggtga ttttaatcac tataccaatt gagatgggct agtcaatgat aattactagt 6120
ccttttcctt tgagttgtgg gtatctgtaa attctgctag acctttgctg gaaaacttgt 6180
aaattctgct agaccctctg taaattccgc tagacctttg tgtgtttttt ttgtttatat 6240
tcaagtggtt ataatttata gaataaagaa agaataaaaa aagataaaaa gaatagatcc 6300
cagccctgtg tataactcac tactttagtc agttccgcag tattacaaaa ggatgtcgca 6360
aacgctgttt gctcctctac aaaacagacc ttaaaaccct aaaggcttaa gtagcaccct 6420
cgcaagctcg ggcaaatcgc tgaatattcc ttttgtctcc gaccatcagg cacctgagtc 6480
gctgtctttt tcgtgacatt cagttcgctg cgctcacggc tctggcagtg aatgggggta 6540
aatggcacta caggcgcctt ttatggattc atgcaaggaa actacccata atacaagaaa 6600
agcccgtcac gggcttctca gggcgtttta tggcgggtct gctatgtggt gctatctgac 6660
tttttgctgt tcagcagttc ctgccctctg attttccagt ctgaccactt cggattatcc 6720
cgtgacaggt cattcagact ggctaatgca cccagtaagg cagcggtatc atcaacaggc 6780
tta 6783
<210> 20
<211> 7687
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 20
ctggcgtaat agcgaagagg cccgcaccga tcgcccttcc caacagttgc gcagcctgaa 60
tggcgaatgg cgcctgatgc ggtattttct ccttacgcat ctgtgcggta tttcacaccg 120
catatggtgc actctcagta caatctgctc tgatgccgca tagttaagcc agccccgaca 180
cccgccaaca cccgctgacg agcttagtaa agccctcgct agattttaat gcggatgttg 240
cgattacttc gccaactatt gcgataacaa gaaaaagcca gcctttcatg atatatctcc 300
caatttgtgt agggcttatt atgcacgctt aaaaataata aaagcagact tgacctgata 360
gtttggctgt gagcaattat gtgcttagtg catctaacgc ttgagttaag ccgcgccgcg 420
aagcggcgtc ggcttgaacg aattgttaga cattatttgc cgactacctt ggtgatctcg 480
cctttcacgt agtggacaaa ttcttccaac tgatctgcgc gcgaggccaa gcgatcttct 540
tcttgtccaa gataagcctg tctagcttca agtatgacgg gctgatactg ggccggcagg 600
cgctccattg cccagtcggc agcgacatcc ttcggcgcga ttttgccggt tactgcgctg 660
taccaaatgc gggacaacgt aagcactaca tttcgctcat cgccagccca gtcgggcggc 720
gagttccata gcgttaaggt ttcatttagc gcctcaaata gatcctgttc aggaaccgga 780
tcaaagagtt cctccgccgc tggacctacc aaggcaacgc tatgttctct tgcttttgtc 840
agcaagatag ccagatcaat gtcgatcgtg gctggctcga agatacctgc aagaatgtca 900
ttgcgctgcc attctccaaa ttgcagttcg cgcttagctg gataacgcca cggaatgatg 960
tcgtcgtgca caacaatggt gacttctaca gcgcggagaa tctcgctctc tccaggggaa 1020
gccgaagttt ccaaaaggtc gttgatcaaa gctcgccgcg ttgtttcatc aagccttacg 1080
gtcaccgtaa ccagcaaatc aatatcactg tgtggcttca ggccgccatc cactgcggag 1140
ccgtacaaat gtacggccag caacgtcggt tcgagatggc gctcgatgac gccaactacc 1200
tctgatagtt gagtcgatac ttcggcgatc accgcttccc tcatgatgtt taactttgtt 1260
ttagggcgac tgccctgctg cgtaacatcg ttgctgctcc ataacatcaa acatcgaccc 1320
acggcgtaac gcgcttgctg cttggatgcc cgaggcatag actgtacccc aaaaaaacag 1380
tcataacaag ccatgaaaac cgccactgcg ccgttaccac cgctgcgttc ggtcaaggtt 1440
ctggaccagt tgcgtgagcg catacgctac ttgcattaca gcttacgaac cgaacaggct 1500
tatgtccact gggttcgtgc cttcatccgt ttccacggtg tgcgtcaccc ggcaaccttg 1560
ggcagcagcg aagtcgaggc atttctgtcc tggctggcga acgagcgcaa ggtttcggtc 1620
tccacgcatc gtcaggcatt ggcggccttg ctgttcttct acggcaaggt gctgtgcacg 1680
gatctgccct ggcttcagga gatcggaaga cctcggccgt cgcggcgctt gccggtggtg 1740
ctgaccccgg atgaagtggt tcgcatcctc ggttttctgg aaggcgagca tcgtttgttc 1800
gcccagcttc tgtatggaac gggcatgcgg atcagtgagg gtttgcaact gcgggtcaag 1860
gatctggatt tcgatcacgg cacgatcatc gtgcgggagg gcaagggctc caaggatcgg 1920
gccttgatgt tacccgagag cttggcaccc agcctgcgcg agcaggggaa ttaattccca 1980
cgggttttgc tgcccgcaaa cgggctgttc tggtgttgct agtttgttat cagaatcgca 2040
gatccggctt cagccggttt gccggctgaa agcgctattt cttccagaat tgccatgatt 2100
ttttccccac gggaggcgtc actggctccc gtgttgtcgg cagctttgat tcgataagca 2160
gcatcgcctg tttcaggctg tctatgtgtg actgttgagc tgtaacaagt tgtctcaggt 2220
gttcaatttc atgttctagt tgctttgttt tactggtttc acctgttcta ttaggtgtta 2280
catgctgttc atctgttaca ttgtcgatct gttcatggtg aacagctttg aatgcaccaa 2340
aaactcgtaa aagctctgat gtatctatct tttttacacc gttttcatct gtgcatatgg 2400
acagttttcc ctttgatatg taacggtgaa cagttgttct acttttgttt gttagtcttg 2460
atgcttcact gatagataca agagccataa gaacctcaga tccttccgta tttagccagt 2520
atgttctcta gtgtggttcg ttgtttttgc gtgagccatg agaacgaacc attgagatca 2580
tacttacttt gcatgtcact caaaaatttt gcctcaaaac tggtgagctg aatttttgca 2640
gttaaagcat cgtgtagtgt ttttcttagt ccgttatgta ggtaggaatc tgatgtaatg 2700
gttgttggta ttttgtcacc attcattttt atctggttgt tctcaagttc ggttacgaga 2760
tccatttgtc tatctagttc aacttggaaa atcaacgtat cagtcgggcg gcctcgctta 2820
tcaaccacca atttcatatt gctgtaagtg tttaaatctt tacttattgg tttcaaaacc 2880
cattggttaa gccttttaaa ctcatggtag ttattttcaa gcattaacat gaacttaaat 2940
tcatcaaggc taatctctat atttgccttg tgagttttct tttgtgttag ttcttttaat 3000
aaccactcat aaatcctcat agagtatttg ttttcaaaag acttaacatg ttccagatta 3060
tattttatga atttttttaa ctggaaaaga taaggcaata tctcttcact aaaaactaat 3120
tctaattttt cgcttgagaa cttggcatag tttgtccact ggaaaatctc aaagccttta 3180
accaaaggat tcctgatttc cacagttctc gtcatcagct ctctggttgc tttagctaat 3240
acaccataag cattttccct actgatgttc atcatctgag cgtattggtt ataagtgaac 3300
gataccgtcc gttctttcct tgtagggttt tcaatcgtgg ggttgagtag tgccacacag 3360
cataaaatta gcttggtttc atgctccgtt aagtcatagc gactaatcgc tagttcattt 3420
gctttgaaaa caactaattc agacatacat ctcaattggt ctaggtgatt ttaatcacta 3480
taccaattga gatgggctag tcaatgataa ttactagtcc ttttcctttg agttgtgggt 3540
atctgtaaat tctgctagac ctttgctgga aaacttgtaa attctgctag accctctgta 3600
aattccgcta gacctttgtg tgtttttttt gtttatattc aagtggttat aatttataga 3660
ataaagaaag aataaaaaaa gataaaaaga atagatccca gccctgtgta taactcacta 3720
ctttagtcag ttccgcagta ttacaaaagg atgtcgcaaa cgctgtttgc tcctctacaa 3780
aacagacctt aaaaccctaa aggcttaagt agcaccctcg caagctcggg caaatcgctg 3840
aatattcctt ttgtctccga ccatcaggca cctgagtcgc tgtctttttc gtgacattca 3900
gttcgctgcg ctcacggctc tggcagtgaa tgggggtaaa tggcactaca ggcgcctttt 3960
atggattcat gcaaggaaac tacccataat acaagaaaag cccgtcacgg gcttctcagg 4020
gcgttttatg gcgggtctgc tatgtggtgc tatctgactt tttgctgttc agcagttcct 4080
gccctctgat tttccagtct gaccacttcg gattatcccg tgacaggtca ttcagactgg 4140
ctaatgcacc cagtaaggca gcggtatcat caacaggctt acccgtctta ctgtcgggaa 4200
ttcgcgttgg ccgattcatt aatgcagatt ctgaaatgag ctgttgacaa ttaatcatcc 4260
ggctcgtata atgtgtggaa ttgtgagcgg ataacaattt cacacaggaa acagcgccgc 4320
tgagaaaaag cgaagcggca ctgctcttta acaatttatc agacaatctg tgtgggcact 4380
cgaccggaat tatcgattaa ctttattatt aaaaattaaa gaggtatata ttaatgtatc 4440
gattaaataa ggaggaataa accatgtgtg cgacctcttc tcaatttact cagattaccg 4500
agcataattc ccgtcgttcc gcaaactatc agccaaacct gtggaatttc gaattcctgc 4560
aatccctgga gaacgacctg aaagtggaaa agctggagga gaaagcgacc aaactggagg 4620
aagaagttcg ctgcatgatc aaccgtgtag acacccagcc gctgtccctg ctggagctga 4680
tcgacgatgt gcagcgcctg ggtctgacct acaaatttga aaaagacatc attaaagccc 4740
tggaaaacat cgtactgctg gacgaaaaca aaaagaacaa atctgacctg cacgcaaccg 4800
ctctgtcttt ccgtctgctg cgtcagcacg gtttcgaggt ttctcaggat gtttttgagc 4860
gtttcaagga taaagaaggt ggtttcagcg gtgaactgaa aggtgacgtc caaggcctgc 4920
tgagcctgta tgaagcgtct tacctgggtt tcgagggtga gaacctgctg gaggaggcgc 4980
gtaccttttc catcacccac ctgaagaaca acctgaaaga aggcattaat accaaggttg 5040
cagaacaagt gagccacgcc ctggaactgc catatcacca gcgtctgcac cgtctggagg 5100
cacgttggtt cctggataaa tacgaaccga aagaaccgca tcaccagctg ctgctggagc 5160
tggcgaagct ggattttaac atggtacaga ccctgcacca gaaagagctg caagatctgt 5220
cccgctggtg gaccgagatg ggcctggcta gcaaactgga ttttgtacgc gaccgcctga 5280
tggaagttta tttctgggca ctgggtatgg cgccagaccc gcagtttggt gaatgtcgca 5340
aagctgttac taaaatgttt ggtctggtga cgatcatcga tgacgtgtat gacgtttatg 5400
gcactctgga cgaactgcaa ctgttcaccg atgctgtaga gcgctgggac gttaacgcta 5460
ttaacaccct gccggactat atgaaactgt gtttcctggc actgtacaac accgttaacg 5520
acacgtccta ttctattctg aaagagaaag gtcataacaa cctgtcctat ctgacgaaaa 5580
gctggcgtga actgtgcaaa gcctttctgc aagaggcgaa atggtccaac aacaaaatta 5640
tcccggcttt ctccaagtac ctggaaaacg ccagcgtttc ctcctccggt gtagcgctgc 5700
tggcgccgtc ttacttttcc gtatgccagc agcaggaaga catctccgac cacgcgctgc 5760
gttccctgac cgacttccat ggtctggtgc gttctagctg cgttatcttc cgcctgtgca 5820
acgatctggc cacctctgcg gcggagctgg aacgtggcga gactaccaat tctatcatta 5880
gctacatgca cgaaaacgat ggtaccagcg aggaacaggc ccgcgaagaa ctgcgtaaac 5940
tgatcgacgc cgaatggaaa aagatgaatc gtgaacgcgt tagcgactcc accctgctgc 6000
ctaaagcgtt catggaaatc gcagttaaca tggcacgtgt ttcccactgc acctaccagt 6060
atggcgatgg tctgggtcgc ccagactacg cgactgaaaa ccgcatcaaa ctgctgctga 6120
ttgacccttt cccgattaac cagctgatgt atgtctaact gcatcgccct taggaggtaa 6180
aaaaaaatga ctgccgacaa caatagtatg ccccatggtg cagtatctag ttacgccaaa 6240
ttagtgcaaa accaaacacc tgaagacatt ttggaagagt ttcctgaaat tattccatta 6300
caacaaagac ctaatacccg atctagtgag acgtcaaatg acgaaagcgg agaaacatgt 6360
ttttctggtc atgatgagga gcaaattaag ttaatgaatg aaaattgtat tgttttggat 6420
tgggacgata atgctattgg tgccggtacc aagaaagttt gtcatttaat ggaaaatatt 6480
gaaaagggtt tactacatcg tgcattctcc gtctttattt tcaatgaaca aggtgaatta 6540
cttttacaac aaagagccac tgaaaaaata actttccctg atctttggac taacacatgc 6600
tgctctcatc cactatgtat tgatgacgaa ttaggtttga agggtaagct agacgataag 6660
attaagggcg ctattactgc ggcggtgaga aaactagatc atgaattagg tattccagaa 6720
gatgaaacta agacaagggg taagtttcac tttttaaaca gaatccatta catggcacca 6780
agcaatgaac catggggtga acatgaaatt gattacatcc tattttataa gatcaacgct 6840
aaagaaaact tgactgtcaa cccaaacgtc aatgaagtta gagacttcaa atgggtttca 6900
ccaaatgatt tgaaaactat gtttgctgac ccaagttaca agtttacgcc ttggtttaag 6960
attatttgcg agaattactt attcaactgg tgggagcaat tagatgacct ttctgaagtg 7020
gaaaatgaca ggcaaattca tagaatgcta taacgacgcg tcctgcagct ggtaccatat 7080
gggaattcga agctttctag aacgaaaact catctcagaa gaggatctga atagcgccgt 7140
cgaccatcat catcatcatc attgagttta aacggtctcc agcttggctg ttttggcgga 7200
tgagagaaga ttttcagcct gatacagatt aaatcagaac gcagaagcgg tctgataaaa 7260
cagaatttgc ctggcggcag tagcgcggtg gtcccacctg accccatgcc gaactcagaa 7320
gtgaaacgcc gtagcgccga tggtagtgtg gggtctcccc atgcgagagt agggaactgc 7380
caggcatcaa ataaaacgaa aggctcagtc gaaagactgg gcctttcgtt ttatctgttg 7440
tttgtcggtg aacgctctcc tgagtaggac aaatccgccg ggagcggatt tgaacgttgc 7500
gaagcaacgg cccggagggt ggcgggcagg acgcccgcca taaactgcca ggcatcaaat 7560
taagcagaag gccatcctga cggatggcct ttttgcgttt ctacaaactc tttttgttta 7620
tttttctaaa tacattcaaa tatgtatccg ctcatgagac aataaccctg ataaatgctt 7680
caataat 7687
<210> 21
<211> 8675
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 21
cccgtcttac tgtcgggaat tcgcgttggc cgattcatta atgcagatta ttgaagcatt 60
tatcagggtt attgtctcat gagcggatac atatttgaat gtatttagaa aaataaacaa 120
aaagagtttg tagaaacgca aaaaggccat ccgtcaggat ggccttctgc ttaatttgat 180
gcctggcagt ttatggcggg cgtcctgccc gccaccctcc gggccgttgc ttcgcaacgt 240
tcaaatccgc tcccggcgga tttgtcctac tcaggagagc gttcaccgac aaacaacaga 300
taaaacgaaa ggcccagtct ttcgactgag cctttcgttt tatttgatgc ctggcagttc 360
cctactctcg catggggaga ccccacacta ccatcggcgc tacggcgttt cacttctgag 420
ttcggcatgg ggtcaggtgg gaccaccgcg ctactgccgc caggcaaatt ctgttttatc 480
agaccgcttc tgcgttctga tttaatctgt atcaggctga aaatcttctc tcatccgcca 540
aaacagccaa gctggagacc gtttaaactc aatgatgatg atgatgatgg tcgacggcgc 600
tattcagatc ctcttctgag atgagttttt gttctagaaa gcttcgaatt cccatatggt 660
accagctgca gttatgccag ccaggccttg attttggctt ccataccagc ggcatcgagg 720
ccgagttcgg cgcgcatttc ttcctgagtt ccttgcggaa taaagaagtc cggcaggcca 780
atgttcagca cgggtactgg tttacgatgg gccatcagca cttcgttcac gccgctgcct 840
gcgccgccca taatggcgtt ttcttctacg gtgaccagcg cttcatggct ggcggccatt 900
tccagaatta acgcttcatc aagcggtttc acaaaacgca tatcgaccag cgtggcgttc 960
agcgattcgg cgactttcgc cgcttctggc atcagcgtac caaagttaag gatcgccagt 1020
ttctcgccac gacgcttcac aatgcctttg ccaattggta gtttttccag cggcgtcagt 1080
tccacgccga ccgcgttgcc acgcgggtag cgcaccgctg acgggccatc gttatagtga 1140
tagccggtat agagcatctg gcgacattcg ttttcatcgc tcggggtcat aatgaccatt 1200
tccggtatgc agcgcaggta agagagatca aaagcaccct gatgggtttg accgtcagca 1260
ccaacaatgc ccgcgcggtc gatggcgaac aggaccggaa gcttttgaat cgccacgtca 1320
tgcagcacct gatcataggc gcgttgcagg aaagtggagt aaatcgcgac aatgggtttg 1380
tacccaccaa tcgccagacc cgcagcaaag gtcaccgcgt gttgctcggc aattgccacg 1440
tcgaagtagc gatccgggaa tttacgtgaa aactcgacca tgccggaacc ttcacgcatc 1500
gccggagtaa tcgccatcag cttgttgtct ttcgctgccg tttcgcacaa ccagtcgcca 1560
aagatttttg aatagctcgg caaaccgccg ctacttttcg gcaaacaacc gctggaggga 1620
tcaaatttag gcacggcgtg gaaagtgatc gggtcttttt ctgccggttc ataaccacga 1680
ccttttttgg tcatgatatg caggaactgc gggcctttca ggtcgcgcat gttctttagc 1740
gtggtgataa gccccagcac atcgtgaccg tccaccgggc cgatgtagtt aaagcccagc 1800
tcttcaaaca acgtgccagg cactaccatg cctttaatat gttcttcggt gcgtttgagc 1860
agctctttaa ttggcggcac gccagagaaa acttttttcc cgccttcgcg cagtgaagag 1920
taaagcttac cggaaagcag ctgtgccaga tggttgttga gcgcgccgac attttcggaa 1980
atcgacattt cattgtcgtt gagaatcacc agcatatcag gacggatatc gcccgcgtga 2040
ttcatcgctt caaacgccat gcctgcggta atcgcgccat cgccaatgac acagacggtg 2100
cggcgatttt tgccttcttt ttcggcagca accgcaatac caattccggc actgatggag 2160
gttgatgaat gcccgacgct taatacgtca tattcgcttt cgccgcgcca cgggaacggg 2220
tgcagaccgc ctttctgacg gatggtgccg attttgtcgc ggcgtccggt caaaatttta 2280
tgcggataag cctgatgccc cacatcccaa atcaattggt caaacggggt gttgtagaca 2340
tagtgcagcg ccacggtcag ttcgaccgtg cccagcccgg aggcgaagtg cccgctggaa 2400
cggctcacgc tgtcgagtaa atagcggcgc agttcgtcgc agagtttcgg taaactctct 2460
ttcggcaaca gtcgtaactc ctgggtggag tcgaccagtg ccagggtcgg gtatttggca 2520
atatcaaaac tcatgttttt ttacctccta agggcgaatg cagttagaca tacatcagct 2580
ggttaatcgg gaaagggtca atcagcagca gtttgatgcg gttttcagtc gcgtagtctg 2640
ggcgacccag accatcgcca tactggtagg tgcagtggga aacacgtgcc atgttaactg 2700
cgatttccat gaacgcttta ggcagcaggg tggagtcgct aacgcgttca cgattcatct 2760
ttttccattc ggcgtcgatc agtttacgca gttcttcgcg ggcctgttcc tcgctggtac 2820
catcgttttc gtgcatgtag ctaatgatag aattggtagt ctcgccacgt tccagctccg 2880
ccgcagaggt ggccagatcg ttgcacaggc ggaagataac gcagctagaa cgcaccagac 2940
catggaagtc ggtcagggaa cgcagcgcgt ggtcggagat gtcttcctgc tgctggcata 3000
cggaaaagta agacggcgcc agcagcgcta caccggagga ggaaacgctg gcgttttcca 3060
ggtacttgga gaaagccggg ataattttgt tgttggacca tttcgcctct tgcagaaagg 3120
ctttgcacag ttcacgccag cttttcgtca gataggacag gttgttatga cctttctctt 3180
tcagaataga ataggacgtg tcgttaacgg tgttgtacag tgccaggaaa cacagtttca 3240
tatagtccgg cagggtgtta atagcgttaa cgtcccagcg ctctacagca tcggtgaaca 3300
gttgcagttc gtccagagtg ccataaacgt catacacgtc atcgatgatc gtcaccagac 3360
caaacatttt agtaacagct ttgcgacatt caccaaactg cgggtctggc gccataccca 3420
gtgcccagaa ataaacttcc atcaggcggt cgcgtacaaa atccagtttg ctagccaggc 3480
ccatctcggt ccaccagcgg gacagatctt gcagctcttt ctggtgcagg gtctgtacca 3540
tgttaaaatc cagcttcgcc agctccagca gcagctggtg atgcggttct ttcggttcgt 3600
atttatccag gaaccaacgt gcctccagac ggtgcagacg ctggtgatat ggcagttcca 3660
gggcgtggct cacttgttct gcaaccttgg tattaatgcc ttctttcagg ttgttcttca 3720
ggtgggtgat ggaaaaggta cgcgcctcct ccagcaggtt ctcaccctcg aaacccaggt 3780
aagacgcttc atacaggctc agcaggcctt ggacgtcacc tttcagttca ccgctgaaac 3840
caccttcttt atccttgaaa cgctcaaaaa catcctgaga aacctcgaaa ccgtgctgac 3900
gcagcagacg gaaagacaga gcggttgcgt gcaggtcaga tttgttcttt ttgttttcgt 3960
ccagcagtac gatgttttcc agggctttaa tgatgtcttt ttcaaatttg taggtcagac 4020
ccaggcgctg cacatcgtcg atcagctcca gcagggacag cggctgggtg tctacacggt 4080
tgatcatgca gcgaacttct tcctccagtt tggtcgcttt ctcctccagc ttttccactt 4140
tcaggtcgtt ctccagggat tgcaggaatt cgaaattcca caggtttggc tgatagtttg 4200
cggaacgacg ggaattatgc tcggtaatct gagtaaattg agaagaggtc gcacacatgg 4260
tttattcctc cttatttaat cgatacatta atatatacct ctttaatttt taataataaa 4320
gttaatcgat aattccggtc gagtgcccac acagattgtc tgataaattg ttaaagagca 4380
gtgccgcttc gctttttctc agcggcgctg tttcctgtgt gaaattgtta tccgctcaca 4440
attccacaca ttatacgagc cggatgatta attgtcaaca gctcatttca gaatctggcg 4500
taatagcgaa gaggcccgca ccgatcgccc ttcccaacag ttgcgcagcc tgaatggcga 4560
atggcgcctg atgcggtatt ttctccttac gcatctgtgc ggtatttcac accgcatatg 4620
gtgcactctc agtacaatct gctctgatgc cgcatagtta agccagcccc gacacccgcc 4680
aacacccgct gacgagctta gtaaagccct cgctagattt taatgcggat gttgcgatta 4740
cttcgccaac tattgcgata acaagaaaaa gccagccttt catgatatat ctcccaattt 4800
gtgtagggct tattatgcac gcttaaaaat aataaaagca gacttgacct gatagtttgg 4860
ctgtgagcaa ttatgtgctt agtgcatcta acgcttgagt taagccgcgc cgcgaagcgg 4920
cgtcggcttg aacgaattgt tagacattat ttgccgacta ccttggtgat ctcgcctttc 4980
acgtagtgga caaattcttc caactgatct gcgcgcgagg ccaagcgatc ttcttcttgt 5040
ccaagataag cctgtctagc ttcaagtatg acgggctgat actgggccgg caggcgctcc 5100
attgcccagt cggcagcgac atccttcggc gcgattttgc cggttactgc gctgtaccaa 5160
atgcgggaca acgtaagcac tacatttcgc tcatcgccag cccagtcggg cggcgagttc 5220
catagcgtta aggtttcatt tagcgcctca aatagatcct gttcaggaac cggatcaaag 5280
agttcctccg ccgctggacc taccaaggca acgctatgtt ctcttgcttt tgtcagcaag 5340
atagccagat caatgtcgat cgtggctggc tcgaagatac ctgcaagaat gtcattgcgc 5400
tgccattctc caaattgcag ttcgcgctta gctggataac gccacggaat gatgtcgtcg 5460
tgcacaacaa tggtgacttc tacagcgcgg agaatctcgc tctctccagg ggaagccgaa 5520
gtttccaaaa ggtcgttgat caaagctcgc cgcgttgttt catcaagcct tacggtcacc 5580
gtaaccagca aatcaatatc actgtgtggc ttcaggccgc catccactgc ggagccgtac 5640
aaatgtacgg ccagcaacgt cggttcgaga tggcgctcga tgacgccaac tacctctgat 5700
agttgagtcg atacttcggc gatcaccgct tccctcatga tgtttaactt tgttttaggg 5760
cgactgccct gctgcgtaac atcgttgctg ctccataaca tcaaacatcg acccacggcg 5820
taacgcgctt gctgcttgga tgcccgaggc atagactgta ccccaaaaaa acagtcataa 5880
caagccatga aaaccgccac tgcgccgtta ccaccgctgc gttcggtcaa ggttctggac 5940
cagttgcgtg agcgcatacg ctacttgcat tacagcttac gaaccgaaca ggcttatgtc 6000
cactgggttc gtgccttcat ccgtttccac ggtgtgcgtc acccggcaac cttgggcagc 6060
agcgaagtcg aggcatttct gtcctggctg gcgaacgagc gcaaggtttc ggtctccacg 6120
catcgtcagg cattggcggc cttgctgttc ttctacggca aggtgctgtg cacggatctg 6180
ccctggcttc aggagatcgg aagacctcgg ccgtcgcggc gcttgccggt ggtgctgacc 6240
ccggatgaag tggttcgcat cctcggtttt ctggaaggcg agcatcgttt gttcgcccag 6300
cttctgtatg gaacgggcat gcggatcagt gagggtttgc aactgcgggt caaggatctg 6360
gatttcgatc acggcacgat catcgtgcgg gagggcaagg gctccaagga tcgggccttg 6420
atgttacccg agagcttggc acccagcctg cgcgagcagg ggaattaatt cccacgggtt 6480
ttgctgcccg caaacgggct gttctggtgt tgctagtttg ttatcagaat cgcagatccg 6540
gcttcagccg gtttgccggc tgaaagcgct atttcttcca gaattgccat gattttttcc 6600
ccacgggagg cgtcactggc tcccgtgttg tcggcagctt tgattcgata agcagcatcg 6660
cctgtttcag gctgtctatg tgtgactgtt gagctgtaac aagttgtctc aggtgttcaa 6720
tttcatgttc tagttgcttt gttttactgg tttcacctgt tctattaggt gttacatgct 6780
gttcatctgt tacattgtcg atctgttcat ggtgaacagc tttgaatgca ccaaaaactc 6840
gtaaaagctc tgatgtatct atctttttta caccgttttc atctgtgcat atggacagtt 6900
ttccctttga tatgtaacgg tgaacagttg ttctactttt gtttgttagt cttgatgctt 6960
cactgataga tacaagagcc ataagaacct cagatccttc cgtatttagc cagtatgttc 7020
tctagtgtgg ttcgttgttt ttgcgtgagc catgagaacg aaccattgag atcatactta 7080
ctttgcatgt cactcaaaaa ttttgcctca aaactggtga gctgaatttt tgcagttaaa 7140
gcatcgtgta gtgtttttct tagtccgtta tgtaggtagg aatctgatgt aatggttgtt 7200
ggtattttgt caccattcat ttttatctgg ttgttctcaa gttcggttac gagatccatt 7260
tgtctatcta gttcaacttg gaaaatcaac gtatcagtcg ggcggcctcg cttatcaacc 7320
accaatttca tattgctgta agtgtttaaa tctttactta ttggtttcaa aacccattgg 7380
ttaagccttt taaactcatg gtagttattt tcaagcatta acatgaactt aaattcatca 7440
aggctaatct ctatatttgc cttgtgagtt ttcttttgtg ttagttcttt taataaccac 7500
tcataaatcc tcatagagta tttgttttca aaagacttaa catgttccag attatatttt 7560
atgaattttt ttaactggaa aagataaggc aatatctctt cactaaaaac taattctaat 7620
ttttcgcttg agaacttggc atagtttgtc cactggaaaa tctcaaagcc tttaaccaaa 7680
ggattcctga tttccacagt tctcgtcatc agctctctgg ttgctttagc taatacacca 7740
taagcatttt ccctactgat gttcatcatc tgagcgtatt ggttataagt gaacgatacc 7800
gtccgttctt tccttgtagg gttttcaatc gtggggttga gtagtgccac acagcataaa 7860
attagcttgg tttcatgctc cgttaagtca tagcgactaa tcgctagttc atttgctttg 7920
aaaacaacta attcagacat acatctcaat tggtctaggt gattttaatc actataccaa 7980
ttgagatggg ctagtcaatg ataattacta gtccttttcc tttgagttgt gggtatctgt 8040
aaattctgct agacctttgc tggaaaactt gtaaattctg ctagaccctc tgtaaattcc 8100
gctagacctt tgtgtgtttt ttttgtttat attcaagtgg ttataattta tagaataaag 8160
aaagaataaa aaaagataaa aagaatagat cccagccctg tgtataactc actactttag 8220
tcagttccgc agtattacaa aaggatgtcg caaacgctgt ttgctcctct acaaaacaga 8280
ccttaaaacc ctaaaggctt aagtagcacc ctcgcaagct cgggcaaatc gctgaatatt 8340
ccttttgtct ccgaccatca ggcacctgag tcgctgtctt tttcgtgaca ttcagttcgc 8400
tgcgctcacg gctctggcag tgaatggggg taaatggcac tacaggcgcc ttttatggat 8460
tcatgcaagg aaactaccca taatacaaga aaagcccgtc acgggcttct cagggcgttt 8520
tatggcgggt ctgctatgtg gtgctatctg actttttgct gttcagcagt tcctgccctc 8580
tgattttcca gtctgaccac ttcggattat cccgtgacag gtcattcaga ctggctaatg 8640
cacccagtaa ggcagcggta tcatcaacag gctta 8675
<210> 22
<211> 8032
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 22
tcgctgcgct cggtcgttcg gctgcggcga gcggtatcag ctcactcaaa ggcggtaata 60
cggttatcca cagaatcagg ggataacgca ggaaagaaca tgtgagcaaa aggccagcaa 120
aaggccagga accgtaaaaa ggccgcgttg ctggcgtttt tccataggct ccgcccccct 180
gacgagcatc acaaaaatcg acgctcaagt cagaggtggc gaaacccgac aggactataa 240
agataccagg cgtttccccc tggaagctcc ctcgtgcgct ctcctgttcc gaccctgccg 300
cttaccggat acctgtccgc ctttctccct tcgggaagcg tggcgctttc tcatagctca 360
cgctgtaggt atctcagttc ggtgtaggtc gttcgctcca agctgggctg tgtgcacgaa 420
ccccccgttc agcccgaccg ctgcgcctta tccggtaact atcgtcttga gtccaacccg 480
gtaagacacg acttatcgcc actggcagca gccactggta acaggattag cagagcgagg 540
tatgtaggcg gtgctacaga gttcttgaag tggtggccta actacggcta cactagaaga 600
acagtatttg gtatctgcgc tctgctgaag ccagttacct tcggaaaaag agttggtagc 660
tcttgatccg gcaaacaaac caccgctggt agcggtggtt tttttgtttg caagcagcag 720
attacgcgca gaaaaaaagg atctcaagaa gatcctttga tcttttctac ggggtctgac 780
gctcagtgga acgaaaactc acgttaaggg attttggtca tgagattatc aaaaaggatc 840
ttcacctaga tccttttaaa ttaaaaatga agttttaaat caatctaaag tatatatgag 900
taaacttggt ctgacagtta ccaatgctta atcagtgagg cacctatctc agcgatctgt 960
ctatttcgtt catccatagt tgcctgactc cccgtcgtgt agataactac gatacgggag 1020
ggcttaccat ctggccccag tgctgcaatg ataccgcgag acccacgctc accggctcca 1080
gatttatcag caataaacca gccagccgga agggccgagc gcagaagtgg tcctgcaact 1140
ttatccgcct ccatccagtc tattaattgt tgccgggaag ctagagtaag tagttcgcca 1200
gttaatagtt tgcgcaacgt tgttgccatt gctacaggca tcgtggtgtc acgctcgtcg 1260
tttggtatgg cttcattcag ctccggttcc caacgatcaa ggcgagttac atgatccccc 1320
atgttgtgca aaaaagcggt tagctccttc ggtcctccga tcgttgtcag aagtaagttg 1380
gccgcagtgt tatcactcat ggttatggca gcactgcata attctcttac tgtcatgcca 1440
tccgtaagat gcttttctgt gactggtgag tactcaacca agtcattctg agaatagtgt 1500
atgcggcgac cgagttgctc ttgcccggcg tcaatacggg ataataccgc gccacatagc 1560
agaactttaa aagtgctcat cattggaaaa cgttcttcgg ggcgaaaact ctcaaggatc 1620
ttaccgctgt tgagatccag ttcgatgtaa cccactcgtg cacccaactg atcttcagca 1680
tcttttactt tcaccagcgt ttctgggtga gcaaaaacag gaaggcaaaa tgccgcaaaa 1740
aagggaataa gggcgacacg gaaatgttga atactcatac tcttcctttt tcaatattat 1800
tgaagcattt atcagggtta ttgtctcatg agcggataca tatttgaatg tatttagaaa 1860
aataaacaaa taggggttcc gcgcacattt ccccgaaaag tgccacctga cgtctaagaa 1920
accattatta tcatgacatt aacctataaa aataggcgta tcacgaggcc ctttcgtctc 1980
gcgcgtttcg gtgatgacgg tgaaaacctc tgacacatgc agctcccgga gacggtcaca 2040
gcttgtctgt aagcggatgc cgggagcaga caagcccgtc agggcgcgtc agcgggtgtt 2100
ggcgggtgtc ggggctggct taactatgcg gcatcagagc agattgtact gagagtgcac 2160
catagatctg gagctgtaat ataaaaacct tcttcaacta acggggcagg ttagtgacat 2220
tagaaaaccg actgtaaaaa gtacagtcgg cattatctca tattataaaa gccagtcatt 2280
aggcctatct gacaattcct gaatagagtt cataaacaat cctgcatgat aaccatcaca 2340
aacagaatga tgtacctgta aagatagcgg taaatatatt gaattacctt tattaatgaa 2400
ttttcctgct gtaataatgg gtagaaggta attactatta ttattgatat ttaagttaaa 2460
cccagtaaat gaagtccatg gaataataga aagagaaaaa gcattttcag gtataggtgt 2520
tttgggaaac aatttccccg aaccattata tttctctaca tcagaaaggt ataaatcata 2580
aaactctttg aagtcattct ttacaggagt ccaaatacca gagaatgttt tagatacacc 2640
atcaaaaatt gtataaagtg gctctaactt atcccaataa cctaactctc cgtcgctatt 2700
gtaaccagtt ctaaaagctg tatttgagtt tatcaccctt gtcactaaga aaataaatgc 2760
agggtaaaat ttatatcctt cttgttttat gtttcggtat aaaacactaa tatcaatttc 2820
tgtggttata ctaaaagtcg tttgttggtt caaataatga ttaaatatct cttttctctt 2880
ccaattgtct aaatcaattt tattaaagtt catttgatat gcctcctaaa tttttatcta 2940
aagtgaattt aggaggctta cttgtctgct ttcttcatta gaatcaatcc ttttttaaaa 3000
gtcaatatta ctgtaacata aatatatatt ttaaaaatat cccactttat ccaattttcg 3060
tttgttgaac taatgggtgc tttagttgaa gaataaaaga cctatgcggt gtgaaatacc 3120
gcacagatgc gtaaggagaa aataccgcat caggcgccat tcgccattca ggctgcgcaa 3180
ctgttgggaa gggcgatcgg tgcgggcctc ttcgctatta cgccagctgg cgaaaggggg 3240
atgtgctgca aggcgattaa gttgggtaac gccagggttt tcccagtcac gacgttgtaa 3300
aacgacggcc agtgccaagc ttgcatgcct gcactccatt ttcttctgct atcaaaataa 3360
cagactcgtg attttccaaa cgagctttca aaaaagcctc tgccccttgc aaatcggatg 3420
cctgtctata aaattcccga tattggttaa acagcggcgc aatggcggcc gcatctgatg 3480
tctttgcttg gcgaatgttc atcttatttc ttcctccctc tcaataattt tttcattcta 3540
tcccttttct gtaaagttta tttttcagaa tacttttatc atcatgcttt gaaaaaatat 3600
cacgataata tccattgttc tcacggaagc acacgcaggt catttgaacg aattttttcg 3660
acaggaattt gccgggactc aggagcattt aacctaaaaa agcatgacat ttcagcataa 3720
tgaacattta ctcatgtcta ttttcgttct tttctgtatg aaaatagtta tttcgagtct 3780
ctacggaaat agcgagagat gatataccta aatagagata aaatcatctc aaaaaaatgg 3840
gtctactaaa atattattcc atctattaca ataaattcac agaatagtct tttaagtaag 3900
tctactctga atttttttaa aaggagaggg taaagagtga aaacagtagt tattattgat 3960
gcattacgaa caccaattgg aaaatataaa ggcagcttaa gtcaagtaag tgccgtagac 4020
ttaggaacac atgttacaac acaactttta aaaagacatt ccactatttc tgaagaaatt 4080
gatcaagtaa tctttggaaa tgttttacaa gctggaaatg gccaaaatcc cgcacgacaa 4140
atagcaataa acagcggttt gtctcatgaa attcccgcaa tgacggttaa tgaggtctgc 4200
ggatcaggaa tgaaggccgt tattttggcg aaacaattga ttcaattagg agaagcggaa 4260
gttttaattg ctggcgggat tgagaatatg tcccaagcac ctaaattaca acgttttaat 4320
tacgaaacag aaagctacga tgcgcctttt tctagtatga tgtatgatgg attaacggat 4380
gcctttagtg gtcaggcaat gggcttaact gctgaaaatg tggccgaaaa gtatcatgta 4440
actagagaag agcaagatca attttctgta cattcacaat taaaagcagc tcaagcacaa 4500
gcagaaggga tattcgctga cgaaatagcc ccattagaag tatcaggaac gcttgtggag 4560
aaagatgaag ggattcgccc taattcgagc gttgagaagc taggaacgct taaaacagtt 4620
tttaaagaag acggtactgt aacagcaggg aatgcatcaa ccattaatga tggggcttct 4680
gctttgatta ttgcttcaca agaatatgcc gaagcacacg gtcttcctta tttagctatt 4740
attcgagaca gtgtggaagt cggtattgat ccagcctata tgggaatttc gccgattaaa 4800
gccattcaaa aactgttagc gcgcaatcaa cttactacgg aagaaattga tctgtatgaa 4860
atcaacgaag catttgcagc aacttcaatc gtggtccaaa gagaactggc tttaccagag 4920
gaaaaggtca acatttatgg tggcggtatt tcattaggtc atgcgattgg tgccacaggt 4980
gctcgtttat taacgagttt aagttatcaa ttaaatcaaa aagaaaagaa atatggagtg 5040
gcttctttat gtatcggcgg tggcttagga ctcgctatgc tactagagag acctcagcaa 5100
aaaaaaaaca gccgatttta tcaaatgagt cctgaggaac gcctggcttc tcttcttaat 5160
gaaggccaga tttctgctga tacaaaaaaa gaatttgaaa atacggcttt atcttcgcag 5220
attgccaatc atatgattga aaatcaaatc agtgaaacag aagtgccgat gggcgttggc 5280
ttacatttaa cagtggacga aactgattat ttggtaccaa tggcgacaga agagccctca 5340
gttattgcgg ctttgagtaa tggtgcaaaa atagcacaag gatttaaaac agtgaatcaa 5400
caacgcttaa tgcgtggaca aatcgttttt tacgatgttg cagatcccga gtcattgatt 5460
gataaactac aagtaagaga agcggaagtt tttcaacaag cagagttaag ttatccatct 5520
atcgttaaac ggggcggcgg cttaagagat ttgcaatatc gtacttttga tgaatcattt 5580
gtatctgtcg actttttagt agatgttaag gatgcaatgg gggcaaatat cgttaacgct 5640
atgttggaag gtgtggccga gttgttccgt gaatggtttg cggagcaaaa gattttattc 5700
agtattttaa gtaattatgc cacggagtcg gttgttacga tgaaaacggc tattccagtt 5760
tcacgtttaa gtaaggggag caatggccgg gaaattgctg aaaaaattgt tttagcttca 5820
cgctatgctt cattagatcc ttatcgggca gtcacgcata acaaaggaat catgaatggc 5880
attgaagctg tagttttagc tacaggaaat gatacacgcg ctgttagcgc ttcttgtcat 5940
gcttttgcgg tgaaggaagg tcgctaccaa ggcttgacta gttggacgct ggatggcgaa 6000
caactaattg gtgaaatttc agttccgctt gctttagcca cggttggcgg tgccacaaaa 6060
gtcttaccta aatctcaagc agctgctgat ttgttagcag tgacggatgc aaaagaacta 6120
agtcgagtag tagcggctgt tggtttggca caaaatttag cggcgttacg ggccttagtc 6180
tctgaaggaa ttcaaaaagg acacatggct ctacaagcac gttctttagc gatgacggtc 6240
ggagctactg gtaaagaagt tgaggcagtc gctcaacaat taaaacgtca aaaaacgatg 6300
aaccaagacc gagccatggc tattttaaat gatttaagaa aacaataaaa ggagagggtg 6360
acaattggga ttgataaaat tagttttttt gtgccccctt attatattga tatgacggca 6420
ctggctgaag ccagaaatgt agaccctgga aaatttcata ttggtattgg gcaagaccaa 6480
atggcggtga acccaatcag ccaagatatt gtgacatttg cagccaatgc cgcagaagcg 6540
atcttgacca aagaagataa agaggccatt gatatggtga ttgtcgggac tgagtccagt 6600
atcgatgagt caaaagcggc cgcagttgtc ttacatcgtt taatggggat tcaacctttc 6660
gctcgctctt tcgaaatcaa ggaagcttgt tacggagcaa cagcaggctt acagttagct 6720
aagaatcacg tagccttaca tccagataaa aaagtcttgg tcgtagcggc agatattgca 6780
aaatatggct taaattctgg cggtgagcct acacaaggag ctggggcggt tgcaatgtta 6840
gttgctagtg aaccgcgcat tttggcttta aaagaggata atgtgatgct gacgcaagat 6900
atctatgact tttggcgtcc aacaggccac ccgtatccta tggtcgatgg tcctttgtca 6960
aacgaaacct acatccaatc ttttgcccaa gtctgggatg aacataaaaa acgaaccggt 7020
cttgattttg cagattatga tgctttagcg ttccatattc cttacacaaa aatgggcaaa 7080
aaagccttat tagcaaaaat ctccgaccaa actgaagcag aacaggaacg aattttagcc 7140
cgttatgaag aaagtatcgt ctatagtcgt cgcgtaggaa acttgtatac gggttcactt 7200
tatctgggac tcatttccct tttagaaaat gcaacgactt taaccgcagg caatcaaatt 7260
ggtttattca gttatggttc tggtgctgtc gctgaatttt tcactggtga attagtagct 7320
ggttatcaaa atcatttaca aaaagaaact catttagcac tgctggataa tcggacagaa 7380
ctttctatcg ctgaatatga agccatgttt gcagaaactt tagacacaga cattgatcaa 7440
acgttagaag atgaattaaa atatagtatt tctgctatta ataataccgt tcgttcttat 7500
cgaaactaaa aaaaaccggc cttggccccg ccggtttttt attatttttc ttcctccgca 7560
tgttcaatcc gctccataat cgacggatgg ctccctctga aaattttaac gagaaacggc 7620
gggttgaccc ggctcagtcc cgtaacggcc aagtcctgaa acgtctcaat cgccgcttcc 7680
cggtttccgg tcagctcaat gccgtaacgg tcggcggcgt tttcctgata ccgggagacg 7740
gcattcgtaa tcgggatccc cgggtaccga gctcgaattc gtaatcatgt catagctgtt 7800
tcctgtgtga aattgttatc cgctcacaat tccacacaac atacgagccg gaagcataaa 7860
gtgtaaagcc tggggtgcct aatgagtgag ctaactcaca ttaattgcgt tgcgctcact 7920
gcccgctttc cagtcgggaa acctgtcgtg ccagctgcat taatgaatcg gccaacgcgc 7980
ggggagaggc ggtttgcgta ttgggcgctc ttccgcttcc tcgctcactg ac 8032
<210> 23
<211> 8000
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 23
gtttgacagc ttatcatcga ctgcacggtg caccaatgct tctggcgtca ggcagccatc 60
ggaagctgtg gtatggctgt gcaggtcgta aatcactgca taattcgtgt cgctcaaggc 120
gcactcccgt tctggataat gttttttgcg ccgacatcat aacggttctg gcaaatattc 180
tgaaatgagc tgttgacaat taatcatccg gctcgtataa tgtgtggaat tgtgagcgga 240
taacaatttc acacaggaaa cagcgccgct gagaaaaagc gaagcggcac tgctctttaa 300
caatttatca gacaatctgt gtgggcactc gaccggaatt atcgattaac tttattatta 360
aaaattaaag aggtatatat taatgtatcg attaaataag gaggaataaa ccatggatcc 420
gagctcagga ggtaaaaaaa catgaaaaca gtagttatta ttgatgcatt acgaacacca 480
attggaaaat ataaaggcag cttaagtcaa gtaagtgccg tagacttagg aacacatgtt 540
acaacacaac ttttaaaaag acattccact atttctgaag aaattgatca agtaatcttt 600
ggaaatgttt tacaagctgg aaatggccaa aatcccgcac gacaaatagc aataaacagc 660
ggtttgtctc atgaaattcc cgcaatgacg gttaatgagg tctgcggatc aggaatgaag 720
gccgttattt tggcgaaaca attgattcaa ttaggagaag cggaagtttt aattgctggc 780
gggattgaga atatgtccca agcacctaaa ttacaacgtt ttaattacga aacagaaagc 840
tacgatgcgc ctttttctag tatgatgtat gatggattaa cggatgcctt tagtggtcag 900
gcaatgggct taactgctga aaatgtggcc gaaaagtatc atgtaactag agaagagcaa 960
gatcaatttt ctgtacattc acaattaaaa gcagctcaag cacaagcaga agggatattc 1020
gctgacgaaa tagccccatt agaagtatca ggaacgcttg tggagaaaga tgaagggatt 1080
cgccctaatt cgagcgttga gaagctagga acgcttaaaa cagtttttaa agaagacggt 1140
actgtaacag cagggaatgc atcaaccatt aatgatgggg cttctgcttt gattattgct 1200
tcacaagaat atgccgaagc acacggtctt ccttatttag ctattattcg agacagtgtg 1260
gaagtcggta ttgatccagc ctatatggga atttcgccga ttaaagccat tcaaaaactg 1320
ttagcgcgca atcaacttac tacggaagaa attgatctgt atgaaatcaa cgaagcattt 1380
gcagcaactt caatcgtggt ccaaagagaa ctggctttac cagaggaaaa ggtcaacatt 1440
tatggtggcg gtatttcatt aggtcatgcg attggtgcca caggtgctcg tttattaacg 1500
agtttaagtt atcaattaaa tcaaaaagaa aagaaatatg gagtggcttc tttatgtatc 1560
ggcggtggct taggactcgc tatgctacta gagagacctc agcaaaaaaa aaacagccga 1620
ttttatcaaa tgagtcctga ggaacgcctg gcttctcttc ttaatgaagg ccagatttct 1680
gctgatacaa aaaaagaatt tgaaaatacg gctttatctt cgcagattgc caatcatatg 1740
attgaaaatc aaatcagtga aacagaagtg ccgatgggcg ttggcttaca tttaacagtg 1800
gacgaaactg attatttggt accaatggcg acagaagagc cctcagttat tgcggctttg 1860
agtaatggtg caaaaatagc acaaggattt aaaacagtga atcaacaacg cttaatgcgt 1920
ggacaaatcg ttttttacga tgttgcagat cccgagtcat tgattgataa actacaagta 1980
agagaagcgg aagtttttca acaagcagag ttaagttatc catctatcgt taaacggggc 2040
ggcggcttaa gagatttgca atatcgtact tttgatgaat catttgtatc tgtcgacttt 2100
ttagtagatg ttaaggatgc aatgggggca aatatcgtta acgctatgtt ggaaggtgtg 2160
gccgagttgt tccgtgaatg gtttgcggag caaaagattt tattcagtat tttaagtaat 2220
tatgccacgg agtcggttgt tacgatgaaa acggctattc cagtttcacg tttaagtaag 2280
gggagcaatg gccgggaaat tgctgaaaaa attgttttag cttcacgcta tgcttcatta 2340
gatccttatc gggcagtcac gcataacaaa ggaatcatga atggcattga agctgtagtt 2400
ttagctacag gaaatgatac acgcgctgtt agcgcttctt gtcatgcttt tgcggtgaag 2460
gaaggtcgct accaaggctt gactagttgg acgctggatg gcgaacaact aattggtgaa 2520
atttcagttc cgcttgcttt agccacggtt ggcggtgcca caaaagtctt acctaaatct 2580
caagcagctg ctgatttgtt agcagtgacg gatgcaaaag aactaagtcg agtagtagcg 2640
gctgttggtt tggcacaaaa tttagcggcg ttacgggcct tagtctctga aggaattcaa 2700
aaaggacaca tggctctaca agcacgttct ttagcgatga cggtcggagc tactggtaaa 2760
gaagttgagg cagtcgctca acaattaaaa cgtcaaaaaa cgatgaacca agaccgagcc 2820
atggctattt taaatgattt aagaaaacaa taaaggaggt aaaaaaacat gacaattggg 2880
attgataaaa ttagtttttt tgtgccccct tattatattg atatgacggc actggctgaa 2940
gccagaaatg tagaccctgg aaaatttcat attggtattg ggcaagacca aatggcggtg 3000
aacccaatca gccaagatat tgtgacattt gcagccaatg ccgcagaagc gatcttgacc 3060
aaagaagata aagaggccat tgatatggtg attgtcggga ctgagtccag tatcgatgag 3120
tcaaaagcgg ccgcagttgt cttacatcgt ttaatgggga ttcaaccttt cgctcgctct 3180
ttcgaaatca aggaagcttg ttacggagca acagcaggct tacagttagc taagaatcac 3240
gtagccttac atccagataa aaaagtcttg gtcgtagcgg cagatattgc aaaatatggc 3300
ttaaattctg gcggtgagcc tacacaagga gctggggcgg ttgcaatgtt agttgctagt 3360
gaaccgcgca ttttggcttt aaaagaggat aatgtgatgc tgacgcaaga tatctatgac 3420
ttttggcgtc caacaggcca cccgtatcct atggtcgatg gtcctttgtc aaacgaaacc 3480
tacatccaat cttttgccca agtctgggat gaacataaaa aacgaaccgg tcttgatttt 3540
gcagattatg atgctttagc gttccatatt ccttacacaa aaatgggcaa aaaagcctta 3600
ttagcaaaaa tctccgacca aactgaagca gaacaggaac gaattttagc ccgttatgaa 3660
gaaagtatcg tctatagtcg tcgcgtagga aacttgtata cgggttcact ttatctggga 3720
ctcatttccc ttttagaaaa tgcaacgact ttaaccgcag gcaatcaaat tggtttattc 3780
agttatggtt ctggtgctgt cgctgaattt ttcactggtg aattagtagc tggttatcaa 3840
aatcatttac aaaaagaaac tcatttagca ctgctggata atcggacaga actttctatc 3900
gctgaatatg aagccatgtt tgcagaaact ttagacacag acattgatca aacgttagaa 3960
gatgaattaa aatatagtat ttctgctatt aataataccg ttcgttctta tcgaaactaa 4020
gagatctgca gctggtacca tatgggaatt cgaagcttgg gcccgaacaa aaactcatct 4080
cagaagagga tctgaatagc gccgtcgacc atcatcatca tcatcattga gtttaaacgg 4140
tctccagctt ggctgttttg gcggatgaga gaagattttc agcctgatac agattaaatc 4200
agaacgcaga agcggtctga taaaacagaa tttgcctggc ggcagtagcg cggtggtccc 4260
acctgacccc atgccgaact cagaagtgaa acgccgtagc gccgatggta gtgtggggtc 4320
tccccatgcg agagtaggga actgccaggc atcaaataaa acgaaaggct cagtcgaaag 4380
actgggcctt tcgttttatc tgttgtttgt cggtgaacgc tctcctgagt aggacaaatc 4440
cgccgggagc ggatttgaac gttgcgaagc aacggcccgg agggtggcgg gcaggacgcc 4500
cgccataaac tgccaggcat caaattaagc agaaggccat cctgacggat ggcctttttg 4560
cgtttctaca aactcttttt gtttattttt ctaaatacat tcaaatatgt atccgctcat 4620
gagacaataa ccctgataaa tgcttcaata atattgaaaa aggaagagta tgagtattca 4680
acatttccgt gtcgccctta ttcccttttt tgcggcattt tgccttcctg tttttgctca 4740
cccagaaacg ctggtgaaag taaaagatgc tgaagatcag ttgggtgcac gagtgggtta 4800
catcgaactg gatctcaaca gcggtaagat ccttgagagt tttcgccccg aagaacgttt 4860
tccaatgatg agcactttta aagttctgct atgtggcgcg gtattatccc gtgttgacgc 4920
cgggcaagag caactcggtc gccgcataca ctattctcag aatgacttgg ttgagtactc 4980
accagtcaca gaaaagcatc ttacggatgg catgacagta agagaattat gcagtgctgc 5040
cataaccatg agtgataaca ctgcggccaa cttacttctg acaacgatcg gaggaccgaa 5100
ggagctaacc gcttttttgc acaacatggg ggatcatgta actcgccttg atcgttggga 5160
accggagctg aatgaagcca taccaaacga cgagcgtgac accacgatgc ctgtagcaat 5220
ggcaacaacg ttgcgcaaac tattaactgg cgaactactt actctagctt cccggcaaca 5280
attaatagac tggatggagg cggataaagt tgcaggacca cttctgcgct cggcccttcc 5340
ggctggctgg tttattgctg ataaatctgg agccggtgag cgtgggtctc gcggtatcat 5400
tgcagcactg gggccagatg gtaagccctc ccgtatcgta gttatctaca cgacggggag 5460
tcaggcaact atggatgaac gaaatagaca gatcgctgag ataggtgcct cactgattaa 5520
gcattggtaa ctgtcagacc aagtttactc atatatactt tagattgatt taaaacttca 5580
tttttaattt aaaaggatct aggtgaagat cctttttgat aatctcatga ccaaaatccc 5640
ttaacgtgag ttttcgttcc actgagcgtc agaccccgta gaaaagatca aaggatcttc 5700
ttgagatcct ttttttctgc gcgtaatctg ctgcttgcaa acaaaaaaac caccgctacc 5760
agcggtggtt tgtttgccgg atcaagagct accaactctt tttccgaagg taactggctt 5820
cagcagagcg cagataccaa atactgtcct tctagtgtag ccgtagttag gccaccactt 5880
caagaactct gtagcaccgc ctacatacct cgctctgcta atcctgttac cagtggctgc 5940
tgccagtggc gataagtcgt gtcttaccgg gttggactca agacgatagt taccggataa 6000
ggcgcagcgg tcgggctgaa cggggggttc gtgcacacag cccagcttgg agcgaacgac 6060
ctacaccgaa ctgagatacc tacagcgtga gctatgagaa agcgccacgc ttcccgaagg 6120
gagaaaggcg gacaggtatc cggtaagcgg cagggtcgga acaggagagc gcacgaggga 6180
gcttccaggg ggaaacgcct ggtatcttta tagtcctgtc gggtttcgcc acctctgact 6240
tgagcgtcga tttttgtgat gctcgtcagg ggggcggagc ctatggaaaa acgccagcaa 6300
cgcggccttt ttacggttcc tggccttttg ctggcctttt gctcacatgt tctttcctgc 6360
gttatcccct gattctgtgg ataaccgtat taccgccttt gagtgagctg ataccgctcg 6420
ccgcagccga acgaccgagc gcagcgagtc agtgagcgag gaagcggaag agcgcctgat 6480
gcggtatttt ctccttacgc atctgtgcgg tatttcacac cgcatatggt gcactctcag 6540
tacaatctgc tctgatgccg catagttaag ccagtataca ctccgctatc gctacgtgac 6600
tgggtcatgg ctgcgccccg acacccgcca acacccgctg acgcgccctg acgggcttgt 6660
ctgctcccgg catccgctta cagacaagct gtgaccgtct ccgggagctg catgtgtcag 6720
aggttttcac cgtcatcacc gaaacgcgcg aggcagcaga tcaattcgcg cgcgaaggcg 6780
aagcggcatg catttacgtt gacaccatcg aatggtgcaa aacctttcgc ggtatggcat 6840
gatagcgccc ggaagagagt caattcaggg tggtgaatgt gaaaccagta acgttatacg 6900
atgtcgcaga gtatgccggt gtctcttatc agaccgtttc ccgcgtggtg aaccaggcca 6960
gccacgtttc tgcgaaaacg cgggaaaaag tggaagcggc gatggcggag ctgaattaca 7020
ttcccaaccg cgtggcacaa caactggcgg gcaaacagtc gttgctgatt ggcgttgcca 7080
cctccagtct ggccctgcac gcgccgtcgc aaattgtcgc ggcgattaaa tctcgcgccg 7140
atcaactggg tgccagcgtg gtggtgtcga tggtagaacg aagcggcgtc gaagcctgta 7200
aagcggcggt gcacaatctt ctcgcgcaac gcgtcagtgg gctgatcatt aactatccgc 7260
tggatgacca ggatgccatt gctgtggaag ctgcctgcac taatgttccg gcgttatttc 7320
ttgatgtctc tgaccagaca cccatcaaca gtattatttt ctcccatgaa gacggtacgc 7380
gactgggcgt ggagcatctg gtcgcattgg gtcaccagca aatcgcgctg ttagcgggcc 7440
cattaagttc tgtctcggcg cgtctgcgtc tggctggctg gcataaatat ctcactcgca 7500
atcaaattca gccgatagcg gaacgggaag gcgactggag tgccatgtcc ggttttcaac 7560
aaaccatgca aatgctgaat gagggcatcg ttcccactgc gatgctggtt gccaacgatc 7620
agatggcgct gggcgcaatg cgcgccatta ccgagtccgg gctgcgcgtt ggtgcggata 7680
tctcggtagt gggatacgac gataccgaag acagctcatg ttatatcccg ccgtcaacca 7740
ccatcaaaca ggattttcgc ctgctggggc aaaccagcgt ggaccgcttg ctgcaactct 7800
ctcagggcca ggcggtgaag ggcaatcagc tgttgcccgt ctcactggtg aaaagaaaaa 7860
ccaccctggc gcccaatacg caaaccgcct ctccccgcgc gttggccgat tcattaatgc 7920
agctggcacg acaggtttcc cgactggaaa gcgggcagtg agcgcaacgc aattaatgtg 7980
agttagcgcg aattgatctg 8000
<210> 24
<211> 10433
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 24
cccgtcttac tgtcgggaat tcgcgttggc cgattcatta atgcagattc tgaaatgagc 60
tgttgacaat taatcatccg gctcgtataa tgtgtggaat tgtgagcgga taacaatttc 120
acacaggaaa cagcgccgct gagaaaaagc gaagcggcac tgctctttaa caatttatca 180
gacaatctgt gtgggcactc gaccggaatt atcgattaac tttattatta aaaattaaag 240
aggtatatat taatgtatcg attaaataag gaggaataaa ccatggatcc gagctcagga 300
ggtaaaaaaa catgaaaaca gtagttatta ttgatgcatt acgaacacca attggaaaat 360
ataaaggcag cttaagtcaa gtaagtgccg tagacttagg aacacatgtt acaacacaac 420
ttttaaaaag acattccact atttctgaag aaattgatca agtaatcttt ggaaatgttt 480
tacaagctgg aaatggccaa aatcccgcac gacaaatagc aataaacagc ggtttgtctc 540
atgaaattcc cgcaatgacg gttaatgagg tctgcggatc aggaatgaag gccgttattt 600
tggcgaaaca attgattcaa ttaggagaag cggaagtttt aattgctggc gggattgaga 660
atatgtccca agcacctaaa ttacaacgtt ttaattacga aacagaaagc tacgatgcgc 720
ctttttctag tatgatgtat gatggattaa cggatgcctt tagtggtcag gcaatgggct 780
taactgctga aaatgtggcc gaaaagtatc atgtaactag agaagagcaa gatcaatttt 840
ctgtacattc acaattaaaa gcagctcaag cacaagcaga agggatattc gctgacgaaa 900
tagccccatt agaagtatca ggaacgcttg tggagaaaga tgaagggatt cgccctaatt 960
cgagcgttga gaagctagga acgcttaaaa cagtttttaa agaagacggt actgtaacag 1020
cagggaatgc atcaaccatt aatgatgggg cttctgcttt gattattgct tcacaagaat 1080
atgccgaagc acacggtctt ccttatttag ctattattcg agacagtgtg gaagtcggta 1140
ttgatccagc ctatatggga atttcgccga ttaaagccat tcaaaaactg ttagcgcgca 1200
atcaacttac tacggaagaa attgatctgt atgaaatcaa cgaagcattt gcagcaactt 1260
caatcgtggt ccaaagagaa ctggctttac cagaggaaaa ggtcaacatt tatggtggcg 1320
gtatttcatt aggtcatgcg attggtgcca caggtgctcg tttattaacg agtttaagtt 1380
atcaattaaa tcaaaaagaa aagaaatatg gagtggcttc tttatgtatc ggcggtggct 1440
taggactcgc tatgctacta gagagacctc agcaaaaaaa aaacagccga ttttatcaaa 1500
tgagtcctga ggaacgcctg gcttctcttc ttaatgaagg ccagatttct gctgatacaa 1560
aaaaagaatt tgaaaatacg gctttatctt cgcagattgc caatcatatg attgaaaatc 1620
aaatcagtga aacagaagtg ccgatgggcg ttggcttaca tttaacagtg gacgaaactg 1680
attatttggt accaatggcg acagaagagc cctcagttat tgcggctttg agtaatggtg 1740
caaaaatagc acaaggattt aaaacagtga atcaacaacg cttaatgcgt ggacaaatcg 1800
ttttttacga tgttgcagat cccgagtcat tgattgataa actacaagta agagaagcgg 1860
aagtttttca acaagcagag ttaagttatc catctatcgt taaacggggc ggcggcttaa 1920
gagatttgca atatcgtact tttgatgaat catttgtatc tgtcgacttt ttagtagatg 1980
ttaaggatgc aatgggggca aatatcgtta acgctatgtt ggaaggtgtg gccgagttgt 2040
tccgtgaatg gtttgcggag caaaagattt tattcagtat tttaagtaat tatgccacgg 2100
agtcggttgt tacgatgaaa acggctattc cagtttcacg tttaagtaag gggagcaatg 2160
gccgggaaat tgctgaaaaa attgttttag cttcacgcta tgcttcatta gatccttatc 2220
gggcagtcac gcataacaaa ggaatcatga atggcattga agctgtagtt ttagctacag 2280
gaaatgatac acgcgctgtt agcgcttctt gtcatgcttt tgcggtgaag gaaggtcgct 2340
accaaggctt gactagttgg acgctggatg gcgaacaact aattggtgaa atttcagttc 2400
cgcttgcttt agccacggtt ggcggtgcca caaaagtctt acctaaatct caagcagctg 2460
ctgatttgtt agcagtgacg gatgcaaaag aactaagtcg agtagtagcg gctgttggtt 2520
tggcacaaaa tttagcggcg ttacgggcct tagtctctga aggaattcaa aaaggacaca 2580
tggctctaca agcacgttct ttagcgatga cggtcggagc tactggtaaa gaagttgagg 2640
cagtcgctca acaattaaaa cgtcaaaaaa cgatgaacca agaccgagcc atggctattt 2700
taaatgattt aagaaaacaa taaaggaggt aaaaaaacat gacaattggg attgataaaa 2760
ttagtttttt tgtgccccct tattatattg atatgacggc actggctgaa gccagaaatg 2820
tagaccctgg aaaatttcat attggtattg ggcaagacca aatggcggtg aacccaatca 2880
gccaagatat tgtgacattt gcagccaatg ccgcagaagc gatcttgacc aaagaagata 2940
aagaggccat tgatatggtg attgtcggga ctgagtccag tatcgatgag tcaaaagcgg 3000
ccgcagttgt cttacatcgt ttaatgggga ttcaaccttt cgctcgctct ttcgaaatca 3060
aggaagcttg ttacggagca acagcaggct tacagttagc taagaatcac gtagccttac 3120
atccagataa aaaagtcttg gtcgtagcgg cagatattgc aaaatatggc ttaaattctg 3180
gcggtgagcc tacacaagga gctggggcgg ttgcaatgtt agttgctagt gaaccgcgca 3240
ttttggcttt aaaagaggat aatgtgatgc tgacgcaaga tatctatgac ttttggcgtc 3300
caacaggcca cccgtatcct atggtcgatg gtcctttgtc aaacgaaacc tacatccaat 3360
cttttgccca agtctgggat gaacataaaa aacgaaccgg tcttgatttt gcagattatg 3420
atgctttagc gttccatatt ccttacacaa aaatgggcaa aaaagcctta ttagcaaaaa 3480
tctccgacca aactgaagca gaacaggaac gaattttagc ccgttatgaa gaaagtatcg 3540
tctatagtcg tcgcgtagga aacttgtata cgggttcact ttatctggga ctcatttccc 3600
ttttagaaaa tgcaacgact ttaaccgcag gcaatcaaat tggtttattc agttatggtt 3660
ctggtgctgt cgctgaattt ttcactggtg aattagtagc tggttatcaa aatcatttac 3720
aaaaagaaac tcatttagca ctgctggata atcggacaga actttctatc gctgaatatg 3780
aagccatgtt tgcagaaact ttagacacag acattgatca aacgttagaa gatgaattaa 3840
aatatagtat ttctgctatt aataataccg ttcgttctta tcgaaactaa agatctgcat 3900
cctgcattcg cccttaggag gtaaaaaaac atgtgtgcga cctcttctca atttactcag 3960
attaccgagc ataattcccg tcgttccgca aactatcagc caaacctgtg gaatttcgaa 4020
ttcctgcaat ccctggagaa cgacctgaaa gtggaaaagc tggaggagaa agcgaccaaa 4080
ctggaggaag aagttcgctg catgatcaac cgtgtagaca cccagccgct gtccctgctg 4140
gagctgatcg acgatgtgca gcgcctgggt ctgacctaca aatttgaaaa agacatcatt 4200
aaagccctgg aaaacatcgt actgctggac gaaaacaaaa agaacaaatc tgacctgcac 4260
gcaaccgctc tgtctttccg tctgctgcgt cagcacggtt tcgaggtttc tcaggatgtt 4320
tttgagcgtt tcaaggataa agaaggtggt ttcagcggtg aactgaaagg tgacgtccaa 4380
ggcctgctga gcctgtatga agcgtcttac ctgggtttcg agggtgagaa cctgctggag 4440
gaggcgcgta ccttttccat cacccacctg aagaacaacc tgaaagaagg cattaatacc 4500
aaggttgcag aacaagtgag ccacgccctg gaactgccat atcaccagcg tctgcaccgt 4560
ctggaggcac gttggttcct ggataaatac gaaccgaaag aaccgcatca ccagctgctg 4620
ctggagctgg cgaagctgga ttttaacatg gtacagaccc tgcaccagaa agagctgcaa 4680
gatctgtccc gctggtggac cgagatgggc ctggctagca aactggattt tgtacgcgac 4740
cgcctgatgg aagtttattt ctgggcactg ggtatggcgc cagacccgca gtttggtgaa 4800
tgtcgcaaag ctgttactaa aatgtttggt ctggtgacga tcatcgatga cgtgtatgac 4860
gtttatggca ctctggacga actgcaactg ttcaccgatg ctgtagagcg ctgggacgtt 4920
aacgctatta acaccctgcc ggactatatg aaactgtgtt tcctggcact gtacaacacc 4980
gttaacgaca cgtcctattc tattctgaaa gagaaaggtc ataacaacct gtcctatctg 5040
acgaaaagct ggcgtgaact gtgcaaagcc tttctgcaag aggcgaaatg gtccaacaac 5100
aaaattatcc cggctttctc caagtacctg gaaaacgcca gcgtttcctc ctccggtgta 5160
gcgctgctgg cgccgtctta cttttccgta tgccagcagc aggaagacat ctccgaccac 5220
gcgctgcgtt ccctgaccga cttccatggt ctggtgcgtt ctagctgcgt tatcttccgc 5280
ctgtgcaacg atctggccac ctctgcggcg gagctggaac gtggcgagac taccaattct 5340
atcattagct acatgcacga aaacgatggt accagcgagg aacaggcccg cgaagaactg 5400
cgtaaactga tcgacgccga atggaaaaag atgaatcgtg aacgcgttag cgactccacc 5460
ctgctgccta aagcgttcat ggaaatcgca gttaacatgg cacgtgtttc ccactgcacc 5520
taccagtatg gcgatggtct gggtcgccca gactacgcga ctgaaaaccg catcaaactg 5580
ctgctgattg accctttccc gattaaccag ctgatgtatg tctaactgca gctggtacca 5640
tatgggaatt cgaagcttgg gcccgaacaa aaactcatct cagaagagga tctgaatagc 5700
gccgtcgacc atcatcatca tcatcattga gtttaaacgg tctccagctt ggctgttttg 5760
gcggatgaga gaagattttc agcctgatac agattaaatc agaacgcaga agcggtctga 5820
taaaacagaa tttgcctggc ggcagtagcg cggtggtccc acctgacccc atgccgaact 5880
cagaagtgaa acgccgtagc gccgatggta gtgtggggtc tccccatgcg agagtaggga 5940
actgccaggc atcaaataaa acgaaaggct cagtcgaaag actgggcctt tcgttttatc 6000
tgttgtttgt cggtgaacgc tctcctgagt aggacaaatc cgccgggagc ggatttgaac 6060
gttgcgaagc aacggcccgg agggtggcgg gcaggacgcc cgccataaac tgccaggcat 6120
caaattaagc agaaggccat cctgacggat ggcctttttg cgtttctaca aactcttttt 6180
gtttattttt ctaaatacat tcaaatatgt atccgctcat gagacaataa ccctgataaa 6240
tgcttcaata atctggcgta atagcgaaga ggcccgcacc gatcgccctt cccaacagtt 6300
gcgcagcctg aatggcgaat ggcgcctgat gcggtatttt ctccttacgc atctgtgcgg 6360
tatttcacac cgcatatggt gcactctcag tacaatctgc tctgatgccg catagttaag 6420
ccagccccga cacccgccaa cacccgctga cgagcttagt aaagccctcg ctagatttta 6480
atgcggatgt tgcgattact tcgccaacta ttgcgataac aagaaaaagc cagcctttca 6540
tgatatatct cccaatttgt gtagggctta ttatgcacgc ttaaaaataa taaaagcaga 6600
cttgacctga tagtttggct gtgagcaatt atgtgcttag tgcatctaac gcttgagtta 6660
agccgcgccg cgaagcggcg tcggcttgaa cgaattgtta gacattattt gccgactacc 6720
ttggtgatct cgcctttcac gtagtggaca aattcttcca actgatctgc gcgcgaggcc 6780
aagcgatctt cttcttgtcc aagataagcc tgtctagctt caagtatgac gggctgatac 6840
tgggccggca ggcgctccat tgcccagtcg gcagcgacat ccttcggcgc gattttgccg 6900
gttactgcgc tgtaccaaat gcgggacaac gtaagcacta catttcgctc atcgccagcc 6960
cagtcgggcg gcgagttcca tagcgttaag gtttcattta gcgcctcaaa tagatcctgt 7020
tcaggaaccg gatcaaagag ttcctccgcc gctggaccta ccaaggcaac gctatgttct 7080
cttgcttttg tcagcaagat agccagatca atgtcgatcg tggctggctc gaagatacct 7140
gcaagaatgt cattgcgctg ccattctcca aattgcagtt cgcgcttagc tggataacgc 7200
cacggaatga tgtcgtcgtg cacaacaatg gtgacttcta cagcgcggag aatctcgctc 7260
tctccagggg aagccgaagt ttccaaaagg tcgttgatca aagctcgccg cgttgtttca 7320
tcaagcctta cggtcaccgt aaccagcaaa tcaatatcac tgtgtggctt caggccgcca 7380
tccactgcgg agccgtacaa atgtacggcc agcaacgtcg gttcgagatg gcgctcgatg 7440
acgccaacta cctctgatag ttgagtcgat acttcggcga tcaccgcttc cctcatgatg 7500
tttaactttg ttttagggcg actgccctgc tgcgtaacat cgttgctgct ccataacatc 7560
aaacatcgac ccacggcgta acgcgcttgc tgcttggatg cccgaggcat agactgtacc 7620
ccaaaaaaac agtcataaca agccatgaaa accgccactg cgccgttacc accgctgcgt 7680
tcggtcaagg ttctggacca gttgcgtgag cgcatacgct acttgcatta cagcttacga 7740
accgaacagg cttatgtcca ctgggttcgt gccttcatcc gtttccacgg tgtgcgtcac 7800
ccggcaacct tgggcagcag cgaagtcgag gcatttctgt cctggctggc gaacgagcgc 7860
aaggtttcgg tctccacgca tcgtcaggca ttggcggcct tgctgttctt ctacggcaag 7920
gtgctgtgca cggatctgcc ctggcttcag gagatcggaa gacctcggcc gtcgcggcgc 7980
ttgccggtgg tgctgacccc ggatgaagtg gttcgcatcc tcggttttct ggaaggcgag 8040
catcgtttgt tcgcccagct tctgtatgga acgggcatgc ggatcagtga gggtttgcaa 8100
ctgcgggtca aggatctgga tttcgatcac ggcacgatca tcgtgcggga gggcaagggc 8160
tccaaggatc gggccttgat gttacccgag agcttggcac ccagcctgcg cgagcagggg 8220
aattaattcc cacgggtttt gctgcccgca aacgggctgt tctggtgttg ctagtttgtt 8280
atcagaatcg cagatccggc ttcagccggt ttgccggctg aaagcgctat ttcttccaga 8340
attgccatga ttttttcccc acgggaggcg tcactggctc ccgtgttgtc ggcagctttg 8400
attcgataag cagcatcgcc tgtttcaggc tgtctatgtg tgactgttga gctgtaacaa 8460
gttgtctcag gtgttcaatt tcatgttcta gttgctttgt tttactggtt tcacctgttc 8520
tattaggtgt tacatgctgt tcatctgtta cattgtcgat ctgttcatgg tgaacagctt 8580
tgaatgcacc aaaaactcgt aaaagctctg atgtatctat cttttttaca ccgttttcat 8640
ctgtgcatat ggacagtttt ccctttgata tgtaacggtg aacagttgtt ctacttttgt 8700
ttgttagtct tgatgcttca ctgatagata caagagccat aagaacctca gatccttccg 8760
tatttagcca gtatgttctc tagtgtggtt cgttgttttt gcgtgagcca tgagaacgaa 8820
ccattgagat catacttact ttgcatgtca ctcaaaaatt ttgcctcaaa actggtgagc 8880
tgaatttttg cagttaaagc atcgtgtagt gtttttctta gtccgttatg taggtaggaa 8940
tctgatgtaa tggttgttgg tattttgtca ccattcattt ttatctggtt gttctcaagt 9000
tcggttacga gatccatttg tctatctagt tcaacttgga aaatcaacgt atcagtcggg 9060
cggcctcgct tatcaaccac caatttcata ttgctgtaag tgtttaaatc tttacttatt 9120
ggtttcaaaa cccattggtt aagcctttta aactcatggt agttattttc aagcattaac 9180
atgaacttaa attcatcaag gctaatctct atatttgcct tgtgagtttt cttttgtgtt 9240
agttctttta ataaccactc ataaatcctc atagagtatt tgttttcaaa agacttaaca 9300
tgttccagat tatattttat gaattttttt aactggaaaa gataaggcaa tatctcttca 9360
ctaaaaacta attctaattt ttcgcttgag aacttggcat agtttgtcca ctggaaaatc 9420
tcaaagcctt taaccaaagg attcctgatt tccacagttc tcgtcatcag ctctctggtt 9480
gctttagcta atacaccata agcattttcc ctactgatgt tcatcatctg agcgtattgg 9540
ttataagtga acgataccgt ccgttctttc cttgtagggt tttcaatcgt ggggttgagt 9600
agtgccacac agcataaaat tagcttggtt tcatgctccg ttaagtcata gcgactaatc 9660
gctagttcat ttgctttgaa aacaactaat tcagacatac atctcaattg gtctaggtga 9720
ttttaatcac tataccaatt gagatgggct agtcaatgat aattactagt ccttttcctt 9780
tgagttgtgg gtatctgtaa attctgctag acctttgctg gaaaacttgt aaattctgct 9840
agaccctctg taaattccgc tagacctttg tgtgtttttt ttgtttatat tcaagtggtt 9900
ataatttata gaataaagaa agaataaaaa aagataaaaa gaatagatcc cagccctgtg 9960
tataactcac tactttagtc agttccgcag tattacaaaa ggatgtcgca aacgctgttt 10020
gctcctctac aaaacagacc ttaaaaccct aaaggcttaa gtagcaccct cgcaagctcg 10080
ggcaaatcgc tgaatattcc ttttgtctcc gaccatcagg cacctgagtc gctgtctttt 10140
tcgtgacatt cagttcgctg cgctcacggc tctggcagtg aatgggggta aatggcacta 10200
caggcgcctt ttatggattc atgcaaggaa actacccata atacaagaaa agcccgtcac 10260
gggcttctca gggcgtttta tggcgggtct gctatgtggt gctatctgac tttttgctgt 10320
tcagcagttc ctgccctctg attttccagt ctgaccactt cggattatcc cgtgacaggt 10380
cattcagact ggctaatgca cccagtaagg cagcggtatc atcaacaggc tta 10433
<210> 25
<211> 10356
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 25
caagaaaaat gccccgctta cgcagggcat ccatttatta ctcaaccgta accgattttg 60
ccaggttacg cggctggtca acgtcggtgc ctttgatcag cgcgacatgg taagccagca 120
gctgcagcgg aacggtgtag aagatcggtg caatcacctc ttccacatgc ggcatctcga 180
tgatgtgcat gttatcgcta cttacaaaac ccgcatcctg atcggcgaag acatacaact 240
gaccgccacg cgcgcgaact tcttcaatgt tggatttcag tttttccagc aattcgttgt 300
tcggtgcaac aacaataacc ggcatatcgg catcaattag cgccagcgga ccgtgtttca 360
gttcgccagc agcgtaggct tcagcgtgaa tgtaagagat ctctttcaac ttcaatgcgc 420
cttccagcgc gattgggtac tgatcgccac ggcccaggaa cagcgcgtga tgtttgtcag 480
agaaatcttc tgccagcgct tcaatgcgtt tgtcctgaga cagcatctgc tcaatacggc 540
tcggcagcgc ctgcagacca tgcacgatgt catgttcaat ggaggcatcc agacctttca 600
ggcgagacag cttcgccacc agcatcaaca gcacagttaa ctgagtggtg aatgctttag 660
tggatgccac gccgatttct gtacccgcgt tggtcattag cgccagatcg gattcgcgca 720
ccagagaaga acccggaacg ttacagattg ccagtgaacc aaggtaaccc agctctttcg 780
acagacgcag gccagccagg gtatccgcgg tttcgccaga ctgtgacacg atcgcccttc 840
ccaacagttg cgcagcctat acgtacggca gtttaaggtt tacacctata aaagagagag 900
ccgttatcgt ctgtttgtgg atgtacagag tgatattatt gacacgccgg ggcgacggat 960
ggtgatcccc ctggccagtg cacgtctgct gtcagataaa gtctcccgtg aactttaccc 1020
ggtggtgcat atcggggatg aaagctggcg catgatgacc accgatatgg ccagtgtgcc 1080
ggtctccgtt atcggggaag aagtggctga tctcagccac cgcgaaaatg acatcaaaaa 1140
cgccattaac ctgatgttct ggggaatata aatgtcaggc atgagattat caaaaaggat 1200
cttcacctag atccttttca cgtagaaagc cagtccgcag aaacggtgct gaccccggat 1260
gaatgtcagc tactgggcta tctggacaag ggaaaacgca agcgcaaaga gaaagcaggt 1320
agcttgcagt gggcttacat ggcgatagct agactgggcg gttttatgga cagcaagcga 1380
accggaattg ccagctgggg cgccctctgg taaggttggg aagccctgca aagtaaactg 1440
gatggctttc tcgccgccaa ggatctgatg gcgcagggga tcaagctctg atcaagagac 1500
aggatgagga tcgtttcgca tgattgaaca agatggattg cacgcaggtt ctccggccgc 1560
ttgggtggag aggctattcg gctatgactg ggcacaacag acaatcggct gctctgatgc 1620
cgccgtgttc cggctgtcag cgcaggggcg cccggttctt tttgtcaaga ccgacctgtc 1680
cggtgccctg aatgaactgc aagacgaggc agcgcggcta tcgtggctgg ccacgacggg 1740
cgttccttgc gcagctgtgc tcgacgttgt cactgaagcg ggaagggact ggctgctatt 1800
gggcgaagtg ccggggcagg atctcctgtc atctcacctt gctcctgccg agaaagtatc 1860
catcatggct gatgcaatgc ggcggctgca tacgcttgat ccggctacct gcccattcga 1920
ccaccaagcg aaacatcgca tcgagcgagc acgtactcgg atggaagccg gtcttgtcga 1980
tcaggatgat ctggacgaag agcatcaggg gctcgcgcca gccgaactgt tcgccaggct 2040
caaggcgagc atgcccgacg gcgaggatct cgtcgtgacc catggcgatg cctgcttgcc 2100
gaatatcatg gtggaaaatg gccgcttttc tggattcatc gactgtggcc ggctgggtgt 2160
ggcggaccgc tatcaggaca tagcgttggc tacccgtgat attgctgaag agcttggcgg 2220
cgaatgggct gaccgcttcc tcgtgcttta cggtatcgcc gctcccgatt cgcagcgcat 2280
cgccttctat cgccttcttg acgagttctt ctgaattatt aacgcttaca atttcctgat 2340
gcggtatttt ctccttacgc atctgtgcgg tatttcacac cgcatacagg tggcactttt 2400
cggggaaatg tgcgcggaac ccctatttgt ttatttttct aaatacattc aaatatgtat 2460
ccgctcatga gacaataacc ctgataaatg cttcaataat agcacgtgag gagggccacc 2520
atggccaagt tgaccagtgc cgttccggtg ctcaccgcgc gcgacgtcgc cggagcggtc 2580
gagttctgga ccgaccggct cgggttctcc cctagtaacg gccgccagtg tgctggaatt 2640
caggcagttc aacctgttga tagtacgtac taagctctca tgtttcacgt actaagctct 2700
catgtttaac gtactaagct ctcatgttta acgaactaaa ccctcatggc taacgtacta 2760
agctctcatg gctaacgtac taagctctca tgtttcacgt actaagctct catgtttgaa 2820
caataaaatt aatataaatc agcaacttaa atagcctcta aggttttaag ttttataaga 2880
aaaaaaagaa tatataaggc ttttaaagct tttaaggttt aacggttgtg gacaacaagc 2940
cagggatgta acgcactgag aagcccttag agcctctcaa agcaattttc agtgacacag 3000
gaacacttaa cggctgacag cctgaattct gcagatatct gtttttccac tcttcgttca 3060
ctttcgccag gtagctggtg aagacgaagg aagtcccgga gccatctgcg cggcgtacta 3120
cagcaatgtt ttgtgaaggc agtttcagac ccggattcag tttggcgatg gcttcatcat 3180
cccacttctt gattttgccc aggtagatgt cgccgagggt tttaccatcc agcaccagtt 3240
cgccagactt cagccctgga atgttaaccg ccagcaccac gccgccaatc acggtcggga 3300
actggaacag accttcctga gccagttttt cgtcagacag cggcgcgtca gaggcaccaa 3360
aatcaacggt attagcgata atctgtttta cgccaccgga agaaccgata ccctggtagt 3420
taactttatt accggtttct ttctggtaag tgtcagccca tttggcatac accggcgcag 3480
ggaaggttgc acctgcacct gtcaggcttg cttctgcaaa cacagagaaa gcactcatcg 3540
ataaggtcgc ggcgacaaca gttgcgacgg tggtacgcat aactttcata atgtctcctg 3600
ggaggattca taaagcattg tttgttggct acgagaagca aaataggaca aacaggtgac 3660
agttatatgt aaggaatatg acagttttat gacagagaga taaagtcttc agtctgattt 3720
aaataagcgt tgatattcag tcaattacaa acattaataa cgaagagatg acagaaaaat 3780
tttcattctg tgacagagaa aaagtagccg aagatgacgg tttgtcacat ggagttggca 3840
ggatgtttga ttaaaagcaa ttaaccctca ctaaagggcg gccgcgaagt tcctattctc 3900
tagaaagtat aggaacttca ttctaccggg taggggaggc gcttttccca aggcagtctg 3960
gagcatgcgc tttagcagcc ccgctgggca cttggcgcta cacaagtggc ctctggcctc 4020
gcacacattc cacatccacc ggtaggcgcc aaccggctcc gttctttggt ggccccttcg 4080
cgccaccttc cactcctccc ctagtcagga agttcccccc cgccccgcag ctcgcgtcgt 4140
gcaggacgtg acaaatggaa gtagcacgtc tcactagtct cgtgcagatg gacagcaccg 4200
ctgagcaatg gaagcgggta ggcctttggg gcagcggcca atagcagctt tgctccttcg 4260
ctttctgggc tcagaggctg ggaaggggtg ggtccggggg cgggctcagg ggcgggctca 4320
ggggcggggc gggcgcccga aggtcctccg gaggcccggc attctgcacg cttcaaaagc 4380
gcacgtctgc cgcgctgttc tcctcttcct catctccggg cctttcgacc tgcagcagca 4440
cgtgttgaca attaatcatc ggcatagtat atcggcatag tataatacga caaggtgagg 4500
aactaaacca tggagaaaaa aatcactgga tataccaccg ttgatatatc ccaatggcat 4560
cgtaaagaac attttgaggc atttcagtca gttgctcaat gtacctataa ccagaccgtt 4620
cagctggata ttacggcctt tttaaagacc gtaaagaaaa ataagcacaa gttttatccg 4680
gcctttattc acattcttgc ccgcctgatg aatgctcatc cggaattccg tatggcaatg 4740
aaagacggtg agctggtgat atgggatagt gttcaccctt gttacaccgt tttccatgag 4800
caaactgaaa cgttttcatc gctctggagt gaataccacg acgatttccg gcagtttcta 4860
cacatatatt cgcaagatgt ggcgtgttac ggtgaaaacc tggcctattt ccctaaaggg 4920
tttattgaga atatgttttt cgtctcagcc aatccctggg tgagtttcac cagttttgat 4980
ttaaacgtgg ccaatatgga caacttcttc gcccccgttt tcaccatggg caaatattat 5040
acgcaaggcg acaaggtgct gatgccgctg gcgattcagg ttcatcatgc cgtttgtgat 5100
ggcttccatg tcggcagaat gcttaatgaa ttacaacagt actgcgatga gtggcagggc 5160
ggggcgtaag cgggactctg gggttcgaat aaagaccgac caagcgacgt ctgagagctc 5220
cctggcgaat tcggtaccaa taaaagagct ttattttcat gatctgtgtg ttggtttttg 5280
tgtgcggcgc ggaagttcct attctctaga aagtatagga acttcctcga gccctatagt 5340
gagtcgtatt agcccttgac gatgccacat cctgagcaaa taattcaacc actaattgtg 5400
agcggataac acaaggagga aacagctatg tcattaccgt tcttaacttc tgcaccggga 5460
aaggttatta tttttggtga acactctgct gtgtacaaca agcctgccgt cgctgctagt 5520
gtgtctgcgt tgagaaccta cctgctaata agcgagtcat ctgcaccaga tactattgaa 5580
ttggacttcc cggacattag ctttaatcat aagtggtcca tcaatgattt caatgccatc 5640
accgaggatc aagtaaactc ccaaaaattg gccaaggctc aacaagccac cgatggcttg 5700
tctcaggaac tcgttagtct tttggatccg ttgttagctc aactatccga atccttccac 5760
taccatgcag cgttttgttt cctgtatatg tttgtttgcc tatgccccca tgccaagaat 5820
attaagtttt ctttaaagtc tactttaccc atcggtgctg ggttgggctc aagcgcctct 5880
atttctgtat cactggcctt agctatggcc tacttggggg ggttaatagg atctaatgac 5940
ttggaaaagc tgtcagaaaa cgataagcat atagtgaatc aatgggcctt cataggtgaa 6000
aagtgtattc acggtacccc ttcaggaata gataacgctg tggccactta tggtaatgcc 6060
ctgctatttg aaaaagactc acataatgga acaataaaca caaacaattt taagttctta 6120
gatgatttcc cagccattcc aatgatccta acctatacta gaattccaag gtctacaaaa 6180
gatcttgttg ctcgcgttcg tgtgttggtc accgagaaat ttcctgaagt tatgaagcca 6240
attctagatg ccatgggtga atgtgcccta caaggcttag agatcatgac taagttaagt 6300
aaatgtaaag gcaccgatga cgaggctgta gaaactaata atgaactgta tgaacaacta 6360
ttggaattga taagaataaa tcatggactg cttgtctcaa tcggtgtttc tcatcctgga 6420
ttagaactta ttaaaaatct gagcgatgat ttgagaattg gctccacaaa acttaccggt 6480
gctggtggcg gcggttgctc tttgactttg ttacgaagag acattactca agagcaaatt 6540
gacagcttca aaaagaaatt gcaagatgat tttagttacg agacatttga aacagacttg 6600
ggtgggactg gctgctgttt gttaagcgca aaaaatttga ataaagatct taaaatcaaa 6660
tccctagtat tccaattatt tgaaaataaa actaccacaa agcaacaaat tgacgatcta 6720
ttattgccag gaaacacgaa tttaccatgg acttcataag ctaatttgcg ataggcctgc 6780
acccttaagg aggaaaaaaa catgtcagag ttgagagcct tcagtgcccc agggaaagcg 6840
ttactagctg gtggatattt agttttagat acaaaatatg aagcatttgt agtcggatta 6900
tcggcaagaa tgcatgctgt agcccatcct tacggttcat tgcaagggtc tgataagttt 6960
gaagtgcgtg tgaaaagtaa acaatttaaa gatggggagt ggctgtacca tataagtcct 7020
aaaagtggct tcattcctgt ttcgataggc ggatctaaga accctttcat tgaaaaagtt 7080
atcgctaacg tatttagcta ctttaaacct aacatggacg actactgcaa tagaaacttg 7140
ttcgttattg atattttctc tgatgatgcc taccattctc aggaggatag cgttaccgaa 7200
catcgtggca acagaagatt gagttttcat tcgcacagaa ttgaagaagt tcccaaaaca 7260
gggctgggct cctcggcagg tttagtcaca gttttaacta cagctttggc ctcctttttt 7320
gtatcggacc tggaaaataa tgtagacaaa tatagagaag ttattcataa tttagcacaa 7380
gttgctcatt gtcaagctca gggtaaaatt ggaagcgggt ttgatgtagc ggcggcagca 7440
tatggatcta tcagatatag aagattccca cccgcattaa tctctaattt gccagatatt 7500
ggaagtgcta cttacggcag taaactggcg catttggttg atgaagaaga ctggaatatt 7560
acgattaaaa gtaaccattt accttcggga ttaactttat ggatgggcga tattaagaat 7620
ggttcagaaa cagtaaaact ggtccagaag gtaaaaaatt ggtatgattc gcatatgcca 7680
gaaagcttga aaatatatac agaactcgat catgcaaatt ctagatttat ggatggacta 7740
tctaaactag atcgcttaca cgagactcat gacgattaca gcgatcagat atttgagtct 7800
cttgagagga atgactgtac ctgtcaaaag tatcctgaaa tcacagaagt tagagatgca 7860
gttgccacaa ttagacgttc ctttagaaaa ataactaaag aatctggtgc cgatatcgaa 7920
cctcccgtac aaactagctt attggatgat tgccagacct taaaaggagt tcttacttgc 7980
ttaatacctg gtgctggtgg ttatgacgcc attgcagtga ttactaagca agatgttgat 8040
cttagggctc aaaccgctaa tgacaaaaga ttttctaagg ttcaatggct ggatgtaact 8100
caggctgact ggggtgttag gaaagaaaaa gatccggaaa cttatcttga taaataactt 8160
aaggtagctg catgcagaat tcgcccttaa ggaggaaaaa aaaatgaccg tttacacagc 8220
atccgttacc gcacccgtca acatcgcaac ccttaagtat tgggggaaaa gggacacgaa 8280
gttgaatctg cccaccaatt cgtccatatc agtgacttta tcgcaagatg acctcagaac 8340
gttgacctct gcggctactg cacctgagtt tgaacgcgac actttgtggt taaatggaga 8400
accacacagc atcgacaatg aaagaactca aaattgtctg cgcgacctac gccaattaag 8460
aaaggaaatg gaatcgaagg acgcctcatt gcccacatta tctcaatgga aactccacat 8520
tgtctccgaa aataactttc ctacagcagc tggtttagct tcctccgctg ctggctttgc 8580
tgcattggtc tctgcaattg ctaagttata ccaattacca cagtcaactt cagaaatatc 8640
tagaatagca agaaaggggt ctggttcagc ttgtagatcg ttgtttggcg gatacgtggc 8700
ctgggaaatg ggaaaagctg aagatggtca tgattccatg gcagtacaaa tcgcagacag 8760
ctctgactgg cctcagatga aagcttgtgt cctagttgtc agcgatatta aaaaggatgt 8820
gagttccact cagggtatgc aattgaccgt ggcaacctcc gaactattta aagaaagaat 8880
tgaacatgtc gtaccaaaga gatttgaagt catgcgtaaa gccattgttg aaaaagattt 8940
cgccaccttt gcaaaggaaa caatgatgga ttccaactct ttccatgcca catgtttgga 9000
ctctttccct ccaatattct acatgaatga cacttccaag cgtatcatca gttggtgcca 9060
caccattaat cagttttacg gagaaacaat cgttgcatac acgtttgatg caggtccaaa 9120
tgctgtgttg tactacttag ctgaaaatga gtcgaaactc tttgcattta tctataaatt 9180
gtttggctct gttcctggat gggacaagaa atttactact gagcagcttg aggctttcaa 9240
ccatcaattt gaatcatcta actttactgc acgtgaattg gatcttgagt tgcaaaagga 9300
tgttgccaga gtgattttaa ctcaagtcgg ttcaggccca caagaaacaa acgaatcttt 9360
gattgacgca aagactggtc taccaaagga ataagatcaa ttcgctgcat cgcccttagg 9420
aggtaaaaaa aaatgactgc cgacaacaat agtatgcccc atggtgcagt atctagttac 9480
gccaaattag tgcaaaacca aacacctgaa gacattttgg aagagtttcc tgaaattatt 9540
ccattacaac aaagacctaa tacccgatct agtgagacgt caaatgacga aagcggagaa 9600
acatgttttt ctggtcatga tgaggagcaa attaagttaa tgaatgaaaa ttgtattgtt 9660
ttggattggg acgataatgc tattggtgcc ggtaccaaga aagtttgtca tttaatggaa 9720
aatattgaaa agggtttact acatcgtgca ttctccgtct ttattttcaa tgaacaaggt 9780
gaattacttt tacaacaaag agccactgaa aaaataactt tccctgatct ttggactaac 9840
acatgctgct ctcatccact atgtattgat gacgaattag gtttgaaggg taagctagac 9900
gataagatta agggcgctat tactgcggcg gtgagaaaac tagatcatga attaggtatt 9960
ccagaagatg aaactaagac aaggggtaag tttcactttt taaacagaat ccattacatg 10020
gcaccaagca atgaaccatg gggtgaacat gaaattgatt acatcctatt ttataagatc 10080
aacgctaaag aaaacttgac tgtcaaccca aacgtcaatg aagttagaga cttcaaatgg 10140
gtttcaccaa atgatttgaa aactatgttt gctgacccaa gttacaagtt tacgccttgg 10200
tttaagatta tttgcgagaa ttacttattc aactggtggg agcaattaga tgacctttct 10260
gaagtggaaa atgacaggca aattcataga atgctataac aacgcgtcta caaataaaaa 10320
aggcacgtca gatgacgtgc cttttttctt ggggcc 10356
<210> 26
<211> 6974
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 26
gtgcggccgc aagcttgtcg acggagctcg aattcggatc cctgcagtta gacatacatc 60
agctggttaa tcgggaaagg gtcaatcagc agcagtttga tgcggttttc agtcgcgtag 120
tctgggcgac ccagaccatc gccatactgg taggtgcagt gggaaacacg tgccatgtta 180
actgcgattt ccatgaacgc tttaggcagc agggtggagt cgctaacgcg ttcacgattc 240
atctttttcc attcggcgtc gatcagttta cgcagttctt cgcgggcctg ttcctcgctg 300
gtaccatcgt tttcgtgcat gtagctaatg atagaattgg tagtctcgcc acgttccagc 360
tccgccgcag aggtggccag atcgttgcac aggcggaaga taacgcagct agaacgcacc 420
agaccatgga agtcggtcag ggaacgcagc gcgtggtcgg agatgtcttc ctgctgctgg 480
catacggaaa agtaagacgg cgccagcagc gctacaccgg aggaggaaac gctggcgttt 540
tccaggtact tggagaaagc cgggataatt ttgttgttgg accatttcgc ctcttgcaga 600
aaggctttgc acagttcacg ccagcttttc gtcagatagg acaggttgtt atgacctttc 660
tctttcagaa tagaatagga cgtgtcgtta acggtgttgt acagtgccag gaaacacagt 720
ttcatatagt ccggcagggt gttaatagcg ttaacgtccc agcgctctac agcatcggtg 780
aacagttgca gttcgtccag agtgccataa acgtcataca cgtcatcgat gatcgtcacc 840
agaccaaaca ttttagtaac agctttgcga cattcaccaa actgcgggtc tggcgccata 900
cccagtgccc agaaataaac ttccatcagg cggtcgcgta caaaatccag tttgctagcc 960
aggcccatct cggtccacca gcgggacaga tcttgcagct ctttctggtg cagggtctgt 1020
accatgttaa aatccagctt cgccagctcc agcagcagct ggtgatgcgg ttctttcggt 1080
tcgtatttat ccaggaacca acgtgcctcc agacggtgca gacgctggtg atatggcagt 1140
tccagggcgt ggctcacttg ttctgcaacc ttggtattaa tgccttcttt caggttgttc 1200
ttcaggtggg tgatggaaaa ggtacgcgcc tcctccagca ggttctcacc ctcgaaaccc 1260
aggtaagacg cttcatacag gctcagcagg ccttggacgt cacctttcag ttcaccgctg 1320
aaaccacctt ctttatcctt gaaacgctca aaaacatcct gagaaacctc gaaaccgtgc 1380
tgacgcagca gacggaaaga cagagcggtt gcgtgcaggt cagatttgtt ctttttgttt 1440
tcgtccagca gtacgatgtt ttccagggct ttaatgatgt ctttttcaaa tttgtaggtc 1500
agacccaggc gctgcacatc gtcgatcagc tccagcaggg acagcggctg ggtgtctaca 1560
cggttgatca tgcagcgaac ttcttcctcc agtttggtcg ctttctcctc cagcttttcc 1620
actttcaggt cgttctccag ggattgcagg aattcgaaat tccacaggtt tggctgatag 1680
tttgcggaac gacgggaatt atgctcggta atctgagtaa attgagaaga ggtcgcacac 1740
atggtatatc tccttcttaa agttaaacaa aattatttct agaggggaat tgttatccgc 1800
tcacaattcc cctatagtga gtcgtattaa tttcgcggga tcgagatctc gatcctctac 1860
gccggacgca tcgtggccgg catcaccggc gccacaggtg cggttgctgg cgcctatatc 1920
gccgacatca ccgatgggga agatcgggct cgccacttcg ggctcatgag cgcttgtttc 1980
ggcgtgggta tggtggcagg ccccgtggcc gggggactgt tgggcgccat ctccttgcat 2040
gcaccattcc ttgcggcggc ggtgctcaac ggcctcaacc tactactggg ctgcttccta 2100
atgcaggagt cgcataaggg agagcgtcga gatcccggac accatcgaat ggcgcaaaac 2160
ctttcgcggt atggcatgat agcgcccgga agagagtcaa ttcagggtgg tgaatgtgaa 2220
accagtaacg ttatacgatg tcgcagagta tgccggtgtc tcttatcaga ccgtttcccg 2280
cgtggtgaac caggccagcc acgtttctgc gaaaacgcgg gaaaaagtgg aagcggcgat 2340
ggcggagctg aattacattc ccaaccgcgt ggcacaacaa ctggcgggca aacagtcgtt 2400
gctgattggc gttgccacct ccagtctggc cctgcacgcg ccgtcgcaaa ttgtcgcggc 2460
gattaaatct cgcgccgatc aactgggtgc cagcgtggtg gtgtcgatgg tagaacgaag 2520
cggcgtcgaa gcctgtaaag cggcggtgca caatcttctc gcgcaacgcg tcagtgggct 2580
gatcattaac tatccgctgg atgaccagga tgccattgct gtggaagctg cctgcactaa 2640
tgttccggcg ttatttcttg atgtctctga ccagacaccc atcaacagta ttattttctc 2700
ccatgaagac ggtacgcgac tgggcgtgga gcatctggtc gcattgggtc accagcaaat 2760
cgcgctgtta gcgggcccat taagttctgt ctcggcgcgt ctgcgtctgg ctggctggca 2820
taaatatctc actcgcaatc aaattcagcc gatagcggaa cgggaaggcg actggagtgc 2880
catgtccggt tttcaacaaa ccatgcaaat gctgaatgag ggcatcgttc ccactgcgat 2940
gctggttgcc aacgatcaga tggcgctggg cgcaatgcgc gccattaccg agtccgggct 3000
gcgcgttggt gcggatatct cggtagtggg atacgacgat accgaagaca gctcatgtta 3060
tatcccgccg ttaaccacca tcaaacagga ttttcgcctg ctggggcaaa ccagcgtgga 3120
ccgcttgctg caactctctc agggccaggc ggtgaagggc aatcagctgt tgcccgtctc 3180
actggtgaaa agaaaaacca ccctggcgcc caatacgcaa accgcctctc cccgcgcgtt 3240
ggccgattca ttaatgcagc tggcacgaca ggtttcccga ctggaaagcg ggcagtgagc 3300
gcaacgcaat taatgtaagt tagctcactc attaggcacc gggatctcga ccgatgccct 3360
tgagagcctt caacccagtc agctccttcc ggtgggcgcg gggcatgact atcgtcgccg 3420
cacttatgac tgtcttcttt atcatgcaac tcgtaggaca ggtgccggca gcgctctggg 3480
tcattttcgg cgaggaccgc tttcgctgga gcgcgacgat gatcggcctg tcgcttgcgg 3540
tattcggaat cttgcacgcc ctcgctcaag ccttcgtcac tggtcccgcc accaaacgtt 3600
tcggcgagaa gcaggccatt atcgccggca tggcggcccc acgggtgcgc atgatcgtgc 3660
tcctgtcgtt gaggacccgg ctaggctggc ggggttgcct tactggttag cagaatgaat 3720
caccgatacg cgagcgaacg tgaagcgact gctgctgcaa aacgtctgcg acctgagcaa 3780
caacatgaat ggtcttcggt ttccgtgttt cgtaaagtct ggaaacgcgg aagtcagcgc 3840
cctgcaccat tatgttccgg atctgcatcg caggatgctg ctggctaccc tgtggaacac 3900
ctacatctgt attaacgaag cgctggcatt gaccctgagt gatttttctc tggtcccgcc 3960
gcatccatac cgccagttgt ttaccctcac aacgttccag taaccgggca tgttcatcat 4020
cagtaacccg tatcgtgagc atcctctctc gtttcatcgg tatcattacc cccatgaaca 4080
gaaatccccc ttacacggag gcatcagtga ccaaacagga aaaaaccgcc cttaacatgg 4140
cccgctttat cagaagccag acattaacgc ttctggagaa actcaacgag ctggacgcgg 4200
atgaacaggc agacatctgt gaatcgcttc acgaccacgc tgatgagctt taccgcagct 4260
gcctcgcgcg tttcggtgat gacggtgaaa acctctgaca catgcagctc ccggagacgg 4320
tcacagcttg tctgtaagcg gatgccggga gcagacaagc ccgtcagggc gcgtcagcgg 4380
gtgttggcgg gtgtcggggc gcagccatga cccagtcacg tagcgatagc ggagtgtata 4440
ctggcttaac tatgcggcat cagagcagat tgtactgaga gtgcaccata tatgcggtgt 4500
gaaataccgc acagatgcgt aaggagaaaa taccgcatca ggcgctcttc cgcttcctcg 4560
ctcactgact cgctgcgctc ggtcgttcgg ctgcggcgag cggtatcagc tcactcaaag 4620
gcggtaatac ggttatccac agaatcaggg gataacgcag gaaagaacat gtgagcaaaa 4680
ggccagcaaa aggccaggaa ccgtaaaaag gccgcgttgc tggcgttttt ccataggctc 4740
cgcccccctg acgagcatca caaaaatcga cgctcaagtc agaggtggcg aaacccgaca 4800
ggactataaa gataccaggc gtttccccct ggaagctccc tcgtgcgctc tcctgttccg 4860
accctgccgc ttaccggata cctgtccgcc tttctccctt cgggaagcgt ggcgctttct 4920
catagctcac gctgtaggta tctcagttcg gtgtaggtcg ttcgctccaa gctgggctgt 4980
gtgcacgaac cccccgttca gcccgaccgc tgcgccttat ccggtaacta tcgtcttgag 5040
tccaacccgg taagacacga cttatcgcca ctggcagcag ccactggtaa caggattagc 5100
agagcgaggt atgtaggcgg tgctacagag ttcttgaagt ggtggcctaa ctacggctac 5160
actagaagga cagtatttgg tatctgcgct ctgctgaagc cagttacctt cggaaaaaga 5220
gttggtagct cttgatccgg caaacaaacc accgctggta gcggtggttt ttttgtttgc 5280
aagcagcaga ttacgcgcag aaaaaaagga tctcaagaag atcctttgat cttttctacg 5340
gggtctgacg ctcagtggaa cgaaaactca cgttaaggga ttttggtcat gaacaataaa 5400
actgtctgct tacataaaca gtaatacaag gggtgttatg agccatattc aacgggaaac 5460
gtcttgctct aggccgcgat taaattccaa catggatgct gatttatatg ggtataaatg 5520
ggctcgcgat aatgtcgggc aatcaggtgc gacaatctat cgattgtatg ggaagcccga 5580
tgcgccagag ttgtttctga aacatggcaa aggtagcgtt gccaatgatg ttacagatga 5640
gatggtcaga ctaaactggc tgacggaatt tatgcctctt ccgaccatca agcattttat 5700
ccgtactcct gatgatgcat ggttactcac cactgcgatc cccgggaaaa cagcattcca 5760
ggtattagaa gaatatcctg attcaggtga aaatattgtt gatgcgctgg cagtgttcct 5820
gcgccggttg cattcgattc ctgtttgtaa ttgtcctttt aacagcgatc gcgtatttcg 5880
tctcgctcag gcgcaatcac gaatgaataa cggtttggtt gatgcgagtg attttgatga 5940
cgagcgtaat ggctggcctg ttgaacaagt ctggaaagaa atgcataaac ttttgccatt 6000
ctcaccggat tcagtcgtca ctcatggtga tttctcactt gataacctta tttttgacga 6060
ggggaaatta ataggttgta ttgatgttgg acgagtcgga atcgcagacc gataccagga 6120
tcttgccatc ctatggaact gcctcggtga gttttctcct tcattacaga aacggctttt 6180
tcaaaaatat ggtattgata atcctgatat gaataaattg cagtttcatt tgatgctcga 6240
tgagtttttc taagaattaa ttcatgagcg gatacatatt tgaatgtatt tagaaaaata 6300
aacaaatagg ggttccgcgc acatttcccc gaaaagtgcc acctgaaatt gtaaacgtta 6360
atattttgtt aaaattcgcg ttaaattttt gttaaatcag ctcatttttt aaccaatagg 6420
ccgaaatcgg caaaatccct tataaatcaa aagaatagac cgagataggg ttgagtgttg 6480
ttccagtttg gaacaagagt ccactattaa agaacgtgga ctccaacgtc aaagggcgaa 6540
aaaccgtcta tcagggcgat ggcccactac gtgaaccatc accctaatca agttttttgg 6600
ggtcgaggtg ccgtaaagca ctaaatcgga accctaaagg gagcccccga tttagagctt 6660
gacggggaaa gccggcgaac gtggcgagaa aggaagggaa gaaagcgaaa ggagcgggcg 6720
ctagggcgct ggcaagtgta gcggtcacgc tgcgcgtaac caccacaccc gccgcgctta 6780
atgcgccgct acagggcgcg tcccattcgc caatccggat atagttcctc ctttcagcaa 6840
aaaacccctc aagacccgtt tagaggcccc aaggggttat gctagttatt gctcagcggt 6900
ggcagcagcc aactcagctt cctttcgggc tttgttagca gccggatctc agtggtggtg 6960
gtggtggtgc tcga 6974
<210> 27
<211> 3913
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 27
gcggccgcgc ccttgacgat gccacatcct gagcaaataa ttcaaccact aattgtgagc 60
ggataacaca aggaggaaac agccatggta tcctgttctg cgccgggtaa gatttacctg 120
ttcggtgaac acgccgtagt ttatggcgaa actgcaattg cgtgtgcggt ggaactgcgt 180
acccgtgttc gcgcggaact caatgactct atcactattc agagccagat cggccgcacc 240
ggtctggatt tcgaaaagca cccttatgtg tctgcggtaa ttgagaaaat gcgcaaatct 300
attcctatta acggtgtttt cttgaccgtc gattccgaca tcccggtggg ctccggtctg 360
ggtagcagcg cagccgttac tatcgcgtct attggtgcgc tgaacgagct gttcggcttt 420
ggcctcagcc tgcaagaaat cgctaaactg ggccacgaaa tcgaaattaa agtacagggt 480
gccgcgtccc caaccgatac gtatgtttct accttcggcg gcgtggttac catcccggaa 540
cgtcgcaaac tgaaaactcc ggactgcggc attgtgattg gcgataccgg cgttttctcc 600
tccaccaaag agttagtagc taacgtacgt cagctgcgcg aaagctaccc ggatttgatc 660
gaaccgctga tgacctctat tggcaaaatc tctcgtatcg gcgaacaact ggttctgtct 720
ggcgactacg catccatcgg ccgcctgatg aacgtcaacc agggtctcct ggacgccctg 780
ggcgttaaca tcttagaact gagccagctg atctattccg ctcgtgcggc aggtgcgttt 840
ggcgctaaaa tcacgggcgc tggcggcggt ggctgtatgg ttgcgctgac cgctccggaa 900
aaatgcaacc aagtggcaga agcggtagca ggcgctggcg gtaaagtgac tatcactaaa 960
ccgaccgagc aaggtctgaa agtagattaa gccttgactt aatagctgct tatttcgccc 1020
ttatggtacc tagtaggagg aaaaaaacat ggaaatgcgt caaccggctg tcgcaggtca 1080
attctaccca ctgcgttgcg agaacctgga aaacgaactg aaacgctgct tcgaaggcct 1140
ggagatccgc gaacaagaag tgctgggcgc agtctgtccg cacgccggtt atatgtactc 1200
tggcaaagtt gcggcgcacg tctatgccac tctgccggaa gctgatacct acgtaatctt 1260
cggcccgaac cacaccggct acggtagccc tgtctctgtg agccgtgaaa cttggaagac 1320
cccgttgggc aatatcgatg ttgacctgga actggcggac ggcttcctgg gttccatcgt 1380
agatgcggat gaactcggtc acaaatacga acactctatc gaagttcagc tgccgtttct 1440
gcaataccgt tttgaacgcg atttcaaaat tctgccaatc tgcatgggta tgcaagacga 1500
agaaaccgcg gtcgaagtag gtaacctgct ggcggatctg atcagcgagt ccggtaaacg 1560
tgctgtgatc atcgcaagct ctgatttcac ccactatgag acggctgaac gtgccaaaga 1620
aatcgattcc gaagttattg attctatcct gaactttgac atctctggca tgtacgatcg 1680
cctgtatcgc cgtaacgcct ctgtttgcgg ttacggcccg atcaccgcta tgctgacggc 1740
aagcaaaaag ctgggcggct ctcgtgcgac tttgctgaaa tacgcaaaca gcggtgacgt 1800
gtccggtgat aaagacgctg tggtgggcta cgccgccatc atcgttgagt aagctgatta 1860
aaggttgaac agataggatt tcgtcatgga tcctacaagg aggaaaaaaa catgaatgct 1920
tctaatgaac cggtgattct gaaactgggt ggctctgcta ttaccgacaa aggtgcctac 1980
gaaggcgtag ttaaggaagc tgatttgctg cgcatcgcac aggaagttag cggtttccgt 2040
ggcaagatga tcgtggttca tggtgctggt agcttcggcc atacgtacgc gaagaaatac 2100
ggcctggacc gtaccttcga cccagagggc gcaattgtta ctcatgaatc tgttaaaaag 2160
ctcgcctcca aagttgtagg tgctctgaat agcttcggcg tgcgtgctat cgcggtgcat 2220
cctatggact gcgcagtatg ccgtaacggt cgtatcgaaa cgatgtatct ggactccatc 2280
aagttaatgc tggaaaaagg tctggtgccg gttctgcacg gcgacgtcgc aatggatatt 2340
gaactgggca cttgtatcct gtccggtgat caaatcgttc cttacctggc caaagaactg 2400
ggtatctccc gcctcggcct gggcagcgca gaggatggtg tgctggatat ggagggcaaa 2460
cctgtaccgg aaatcacccc agaaactttc gaagagttcc gccactgcat cggtggttct 2520
ggttctactg atgtaaccgg tggcatgctg ggcaaagtgc tggaacttct ggaattgagc 2580
aaaaattctt ccattactag ctacattttc aacgctggta aagcagacaa catctaccgc 2640
tttctgaatg gtgagtccat cggcactcgc atcagcccgg acaagcgtgt ttaagctagt 2700
tattaaccta aatgctctaa accagttatg agctctacaa ggaggaaaaa aacatgatta 2760
acactaccag ccgccgcaaa attgaacacc tgaaactctg cgcagaatcc ccggttgaag 2820
cgcgtcaggt atctgccggc tttgaagacg ttactctgat ccaccgcgct ttaccggagc 2880
tgaacatgga tgaactggac ctcagcgttg atttcctggg taaacgcatc aaagcgccgt 2940
tcctgattgc gtctatcacg ggtggtcacc cagataccat cccggttaac gctgcgctgg 3000
cagctgctgc tgaggagctg ggtgttggca tcggcgttgg ctctcagcgc gcggccattg 3060
atgatccgag ccaggaagac agcttccgtg tagtgcgtga tgaagcccca gatgcgtttg 3120
tttatggcaa cgtcggcgca gcacagatcc gtcagtatgg tgttgaaggt gttgaaaaac 3180
tgatcgaaat gattgacgca gatgccttgg caatccacct gaactttctg caagaagcgg 3240
tccaaccgga aggtgaccgc gacgcgaccg gttgcctgga catgattacc gaaatttgct 3300
ctcagattaa aactccggta atcgtgaaag aaaccggtgc aggcattagc cgtgaagatg 3360
cgattctgtt ccagaaagct ggcgtgagcg caatcgacgt tggcggcgcg ggcggcacct 3420
cctgggctgg cgtcgaggtc taccgtgcta aagaaagccg tgactctgtt agcgagcgtt 3480
taggtgagct gttttgggat ttcggcattc cgacggtagc ttctctgatt gaatcccgcg 3540
tttccttgcc gctgatcgca accggcggta tccgtaacgg tctggacatt gctaaaagca 3600
ttgctctcgg cgcaagcgct gccagcgccg ctctgccgtt cgttggtccg tccctggagg 3660
gcaaagaatc cgttgtacgt gtgctgagct gcatgctgga agaatttaaa gcagcaatgt 3720
ttttgtgcgg ttgcggcaac atcaaagacc tgcacaactc tccagtagtg gtaactggtt 3780
ggacccgcga atacctggag cagcgcggtt ttaacgttaa ggacctctcc ctgccgggca 3840
acgctctgta agcttcaacg cgtctacaaa taaaaaaggc acgtcagatg acgtgccttt 3900
tttcttgtct aga 3913
<210> 28
<211> 6848
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 28
gtttgacagc ttatcatcga ctgcacggtg caccaatgct tctggcgtca ggcagccatc 60
ggaagctgtg gtatggctgt gcaggtcgta aatcactgca taattcgtgt cgctcaaggc 120
gcactcccgt tctggataat gttttttgcg ccgacatcat aacggttctg gcaaatattc 180
tgaaatgagc tgttgacaat taatcatccg gctcgtataa tgtgtggaat tgtgagcgga 240
taacaatttc acacaggaaa cagcgccgct gagaaaaagc gaagcggcac tgctctttaa 300
caatttatca gacaatctgt gtgggcactc gaccggaatt atcgattaac tttattatta 360
aaaattaaag aggtatatat taatgtatcg attaaataag gaggaataaa ccatgtgtgc 420
gacctcttct caatttactc agattaccga gcataattcc cgtcgttccg caaactatca 480
gccaaacctg tggaatttcg aattcctgca atccctggag aacgacctga aagtggaaaa 540
gctggaggag aaagcgacca aactggagga agaagttcgc tgcatgatca accgtgtaga 600
cacccagccg ctgtccctgc tggagctgat cgacgatgtg cagcgcctgg gtctgaccta 660
caaatttgaa aaagacatca ttaaagccct ggaaaacatc gtactgctgg acgaaaacaa 720
aaagaacaaa tctgacctgc acgcaaccgc tctgtctttc cgtctgctgc gtcagcacgg 780
tttcgaggtt tctcaggatg tttttgagcg tttcaaggat aaagaaggtg gtttcagcgg 840
tgaactgaaa ggtgacgtcc aaggcctgct gagcctgtat gaagcgtctt acctgggttt 900
cgagggtgag aacctgctgg aggaggcgcg taccttttcc atcacccacc tgaagaacaa 960
cctgaaagaa ggcattaata ccaaggttgc agaacaagtg agccacgccc tggaactgcc 1020
atatcaccag cgtctgcacc gtctggaggc acgttggttc ctggataaat acgaaccgaa 1080
agaaccgcat caccagctgc tgctggagct ggcgaagctg gattttaaca tggtacagac 1140
cctgcaccag aaagagctgc aagatctgtc ccgctggtgg accgagatgg gcctggctag 1200
caaactggat tttgtacgcg accgcctgat ggaagtttat ttctgggcac tgggtatggc 1260
gccagacccg cagtttggtg aatgtcgcaa agctgttact aaaatgtttg gtctggtgac 1320
gatcatcgat gacgtgtatg acgtttatgg cactctggac gaactgcaac tgttcaccga 1380
tgctgtagag cgctgggacg ttaacgctat taacaccctg ccggactata tgaaactgtg 1440
tttcctggca ctgtacaaca ccgttaacga cacgtcctat tctattctga aagagaaagg 1500
tcataacaac ctgtcctatc tgacgaaaag ctggcgtgaa ctgtgcaaag cctttctgca 1560
agaggcgaaa tggtccaaca acaaaattat cccggctttc tccaagtacc tggaaaacgc 1620
cagcgtttcc tcctccggtg tagcgctgct ggcgccgtct tacttttccg tatgccagca 1680
gcaggaagac atctccgacc acgcgctgcg ttccctgacc gacttccatg gtctggtgcg 1740
ttctagctgc gttatcttcc gcctgtgcaa cgatctggcc acctctgcgg cggagctgga 1800
acgtggcgag actaccaatt ctatcattag ctacatgcac gaaaacgatg gtaccagcga 1860
ggaacaggcc cgcgaagaac tgcgtaaact gatcgacgcc gaatggaaaa agatgaatcg 1920
tgaacgcgtt agcgactcca ccctgctgcc taaagcgttc atggaaatcg cagttaacat 1980
ggcacgtgtt tcccactgca cctaccagta tggcgatggt ctgggtcgcc cagactacgc 2040
gactgaaaac cgcatcaaac tgctgctgat tgaccctttc ccgattaacc agctgatgta 2100
tgtctaactg cataaaggag gtaaaaaaac atggtatcct gttctgcgcc gggtaagatt 2160
tacctgttcg gtgaacacgc cgtagtttat ggcgaaactg caattgcgtg tgcggtggaa 2220
ctgcgtaccc gtgttcgcgc ggaactcaat gactctatca ctattcagag ccagatcggc 2280
cgcaccggtc tggatttcga aaagcaccct tatgtgtctg cggtaattga gaaaatgcgc 2340
aaatctattc ctattaacgg tgttttcttg accgtcgatt ccgacatccc ggtgggctcc 2400
ggtctgggta gcagcgcagc cgttactatc gcgtctattg gtgcgctgaa cgagctgttc 2460
ggctttggcc tcagcctgca agaaatcgct aaactgggcc acgaaatcga aattaaagta 2520
cagggtgccg cgtccccaac cgatacgtat gtttctacct tcggcggcgt ggttaccatc 2580
ccggaacgtc gcaaactgaa aactccggac tgcggcattg tgattggcga taccggcgtt 2640
ttctcctcca ccaaagagtt agtagctaac gtacgtcagc tgcgcgaaag ctacccggat 2700
ttgatcgaac cgctgatgac ctctattggc aaaatctctc gtatcggcga acaactggtt 2760
ctgtctggcg actacgcatc catcggccgc ctgatgaacg tcaaccaggg tctcctggac 2820
gccctgggcg ttaacatctt agaactgagc cagctgatct attccgctcg tgcggcaggt 2880
gcgtttggcg ctaaaatcac gggcgctggc ggcggtggct gtatggttgc gctgaccgct 2940
ccggaaaaat gcaaccaagt ggcagaagcg gtagcaggcg ctggcggtaa agtgactatc 3000
actaaaccga ccgagcaagg tctgaaagta gattaaagtc tagttaaagt ttaaacggtc 3060
tccagcttgg ctgttttggc ggatgagaga agattttcag cctgatacag attaaatcag 3120
aacgcagaag cggtctgata aaacagaatt tgcctggcgg cagtagcgcg gtggtcccac 3180
ctgaccccat gccgaactca gaagtgaaac gccgtagcgc cgatggtagt gtggggtctc 3240
cccatgcgag agtagggaac tgccaggcat caaataaaac gaaaggctca gtcgaaagac 3300
tgggcctttc gttttatctg ttgtttgtcg gtgaacgctc tcctgagtag gacaaatccg 3360
ccgggagcgg atttgaacgt tgcgaagcaa cggcccggag ggtggcgggc aggacgcccg 3420
ccataaactg ccaggcatca aattaagcag aaggccatcc tgacggatgg cctttttgcg 3480
tttctacaaa ctctttttgt ttatttttct aaatacattc aaatatgtat ccgcttaacc 3540
ggaattgcca gctggggcgc cctctggtaa ggttgggaag ccctgcaaag taaactggat 3600
ggctttctcg ccgccaagga tctgatggcg caggggatca agctctgatc aagagacagg 3660
atgaggatcg tttcgcatga ttgaacaaga tggattgcac gcaggttctc cggccgcttg 3720
ggtggagagg ctattcggct atgactgggc acaacagaca atcggctgct ctgatgccgc 3780
cgtgttccgg ctgtcagcgc aggggcgccc ggttcttttt gtcaagaccg acctgtccgg 3840
tgccctgaat gaactgcaag acgaggcagc gcggctatcg tggctggcca cgacgggcgt 3900
tccttgcgca gctgtgctcg acgttgtcac tgaagcggga agggactggc tgctattggg 3960
cgaagtgccg gggcaggatc tcctgtcatc tcaccttgct cctgccgaga aagtatccat 4020
catggctgat gcaatgcggc ggctgcatac gcttgatccg gctacctgcc cattcgacca 4080
ccaagcgaaa catcgcatcg agcgagcacg tactcggatg gaagccggtc ttgtcgatca 4140
ggatgatctg gacgaagagc atcaggggct cgcgccagcc gaactgttcg ccaggctcaa 4200
ggcgagcatg cccgacggcg aggatctcgt cgtgacccat ggcgatgcct gcttgccgaa 4260
tatcatggtg gaaaatggcc gcttttctgg attcatcgac tgtggccggc tgggtgtggc 4320
ggaccgctat caggacatag cgttggctac ccgtgatatt gctgaagagc ttggcggcga 4380
atgggctgac cgcttcctcg tgctttacgg tatcgccgct cccgattcgc agcgcatcgc 4440
cttctatcgc cttcttgacg agttcttctg acgcatgacc aaaatccctt aacgtgagtt 4500
ttcgttccac tgagcgtcag accccgtaga aaagatcaaa ggatcttctt gagatccttt 4560
ttttctgcgc gtaatctgct gcttgcaaac aaaaaaacca ccgctaccag cggtggtttg 4620
tttgccggat caagagctac caactctttt tccgaaggta actggcttca gcagagcgca 4680
gataccaaat actgtccttc tagtgtagcc gtagttaggc caccacttca agaactctgt 4740
agcaccgcct acatacctcg ctctgctaat cctgttacca gtggctgctg ccagtggcga 4800
taagtcgtgt cttaccgggt tggactcaag acgatagtta ccggataagg cgcagcggtc 4860
gggctgaacg gggggttcgt gcacacagcc cagcttggag cgaacgacct acaccgaact 4920
gagataccta cagcgtgagc tatgagaaag cgccacgctt cccgaaggga gaaaggcgga 4980
caggtatccg gtaagcggca gggtcggaac aggagagcgc acgagggagc ttccaggggg 5040
aaacgcctgg tatctttata gtcctgtcgg gtttcgccac ctctgacttg agcgtcgatt 5100
tttgtgatgc tcgtcagggg ggcggagcct atggaaaaac gccagcaacg cggccttttt 5160
acggttcctg gccttttgct ggccttttgc tcacatgttc tttcctgcgt tatcccctga 5220
ttctgtggat aaccgtatta ccgcctttga gtgagctgat accgctcgcc gcagccgaac 5280
gaccgagcgc agcgagtcag tgagcgagga agcggaagag cgcctgatgc ggtattttct 5340
ccttacgcat ctgtgcggta tttcacaccg catatggtgc actctcagta caatctgctc 5400
tgatgccgca tagttaagcc agtatacact ccgctatcgc tacgtgactg ggtcatggct 5460
gcgccccgac acccgccaac acccgctgac gcgccctgac gggcttgtct gctcccggca 5520
tccgcttaca gacaagctgt gaccgtctcc gggagctgca tgtgtcagag gttttcaccg 5580
tcatcaccga aacgcgcgag gcagcagatc aattcgcgcg cgaaggcgaa gcggcatgca 5640
tttacgttga caccatcgaa tggtgcaaaa cctttcgcgg tatggcatga tagcgcccgg 5700
aagagagtca attcagggtg gtgaatgtga aaccagtaac gttatacgat gtcgcagagt 5760
atgccggtgt ctcttatcag accgtttccc gcgtggtgaa ccaggccagc cacgtttctg 5820
cgaaaacgcg ggaaaaagtg gaagcggcga tggcggagct gaattacatt cccaaccgcg 5880
tggcacaaca actggcgggc aaacagtcgt tgctgattgg cgttgccacc tccagtctgg 5940
ccctgcacgc gccgtcgcaa attgtcgcgg cgattaaatc tcgcgccgat caactgggtg 6000
ccagcgtggt ggtgtcgatg gtagaacgaa gcggcgtcga agcctgtaaa gcggcggtgc 6060
acaatcttct cgcgcaacgc gtcagtgggc tgatcattaa ctatccgctg gatgaccagg 6120
atgccattgc tgtggaagct gcctgcacta atgttccggc gttatttctt gatgtctctg 6180
accagacacc catcaacagt attattttct cccatgaaga cggtacgcga ctgggcgtgg 6240
agcatctggt cgcattgggt caccagcaaa tcgcgctgtt agcgggccca ttaagttctg 6300
tctcggcgcg tctgcgtctg gctggctggc ataaatatct cactcgcaat caaattcagc 6360
cgatagcgga acgggaaggc gactggagtg ccatgtccgg ttttcaacaa accatgcaaa 6420
tgctgaatga gggcatcgtt cccactgcga tgctggttgc caacgatcag atggcgctgg 6480
gcgcaatgcg cgccattacc gagtccgggc tgcgcgttgg tgcggatatc tcggtagtgg 6540
gatacgacga taccgaagac agctcatgtt atatcccgcc gtcaaccacc atcaaacagg 6600
attttcgcct gctggggcaa accagcgtgg accgcttgct gcaactctct cagggccagg 6660
cggtgaaggg caatcagctg ttgcccgtct cactggtgaa aagaaaaacc accctggcgc 6720
ccaatacgca aaccgcctct ccccgcgcgt tggccgattc attaatgcag ctggcacgac 6780
aggtttcccg actggaaagc gggcagtgag cgcaacgcaa ttaatgtgag ttagcgcgaa 6840
ttgatctg 6848
<210> 29
<211> 6647
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 29
aagggcgagc tcaacgatcc ggctgctaac aaagcccgaa aggaagctga gttggctgct 60
gccaccgctg agcaataact agcataaccc cttggggcct ctaaacgggt cttgaggagt 120
tttttgctga aaggaggaac tatatccgga tatcccgcaa gaggcccggc agtaccggca 180
taaccaagcc tatgcctaca gcatccaggg tgacggtgcc gaggatgacg atgagcgcat 240
tgttagattt catacacggt gcctgactgc gttagcaatt taactgtgat aaactaccgc 300
attaaagctt atcgatgata agctgtcaaa catgagaatt aattcttgaa gacgaaaggg 360
cctcgtgata cgcctatttt tataggttaa tgtcatgata ataatggttt cttagacgtc 420
aggtggcact tttcggggaa atgtgcgcgg aacccctatt tgtttatttt tctaaataca 480
ttcaaatatg tatccgctca tgagacaata accctgataa atgcttcaat aatattgaaa 540
aaggaagagt atgattgaac aagatggatt gcacgcaggt tctccggccg cttgggtgga 600
gaggctattc ggctatgact gggcacaact gacaatcggc tgctctgatg ccgccgtgtt 660
ccggctgtca gcgcaggggc gcccggttct ttttgtcaag accgacctgt ccggtgccct 720
gaatgaactg caggacgagg cagcgcggct atcgtggctg gccacgacgg gcgttccttg 780
cgcagctgtg ctcgacgttg tcactgaagc gggaagggac tggctgctat tgggcgaagt 840
gccggggcag gatctcctgt catctcacct tgctcctgcc gagaaagtat ccatcatggc 900
tgatgcaatg cggcggctgc atacgcttga tccggctacc tgcccattcg accaccaagc 960
gaaacatcgc atcgagcggg cacgtactcg gatggaagcc ggtcttgtcg atcaggatga 1020
tctggacgaa gagcatcagg ggctcgcgcc agccgaactg ttcgccaggc tcaaggcgcg 1080
catgcccgac ggcgaggatc tcgtcgtgac acatggcgat gcctgcttgc cgaatatcat 1140
ggtggaaaat ggccgctttt ctggattcat cgactgtggc cggctgggtg tggcggaccg 1200
ctatcaggac atagcgttgg ctacccgtga tattgctgaa gagcttggcg gcgaatgggc 1260
tgaccgcttc ctcgtgcttt acggtatcgc cgctcccgat tcgcagcgca tcgccttcta 1320
tcgccttctt gacgagttct tctgagcggg actctggggt tcgaaatgac cgaccaagcg 1380
acgcctaact gtcagaccaa gtttactcat atatacttta gattgattta aaacttcatt 1440
tttaatttaa aaggatctag gtgaagatcc tttttgataa tctcatgacc aaaatccctt 1500
aacgtgagtt ttcgttccac tgagcgtcag accccgtaga aaagatcaaa ggatcttctt 1560
gagatccttt ttttctgcgc gtaatctgct gcttgcaaac aaaaaaacca ccgctaccag 1620
cggtggtttg tttgccggat caagagctac caactctttt tccgaaggta actggcttca 1680
gcagagcgca gataccaaat actgtccttc tagtgtagcc gtagttaggc caccacttca 1740
agaactctgt agcaccgcct acatacctcg ctctgctaat cctgttacca gtggctgctg 1800
ccagtggcga taagtcgtgt cttaccgggt tggactcaag acgatagtta ccggataagg 1860
cgcagcggtc gggctgaacg gggggttcgt gcacacagcc cagcttggag cgaacgacct 1920
acaccgaact gagataccta cagcgtgagc tatgagaaag cgccacgctt cccgaaggga 1980
gaaaggcgga caggtatccg gtaagcggca gggtcggaac aggagagcgc acgagggagc 2040
ttccaggggg aaacgcctgg tatctttata gtcctgtcgg gtttcgccac ctctgacttg 2100
agcgtcgatt tttgtgatgc tcgtcagggg ggcggagcct atggaaaaac gccagcaacg 2160
cggccttttt acggttcctg gccttttgct ggccttttgc tcacatgttc tttcctgcgt 2220
tatcccctga ttctgtggat aaccgtatta ccgcctttga gtgagctgat accgctcgcc 2280
gcagccgaac gaccgagcgc agcgagtcag tgagcgagga agcggaagag cgcctgatgc 2340
ggtattttct ccttacgcat ctgtgcggta tttcacaccg caatggtgca ctctcagtac 2400
aatctgctct gatgccgcat agttaagcca gtatacactc cgctatcgct acgtgactgg 2460
gtcatggctg cgccccgaca cccgccaaca cccgctgacg cgccctgacg ggcttgtctg 2520
ctcccggcat ccgcttacag acaagctgtg accgtctccg ggagctgcat gtgtcagagg 2580
ttttcaccgt catcaccgaa acgcgcgagg cagctgcggt aaagctcatc agcgtggtcg 2640
tgaagcgatt cacagatgtc tgcctgttca tccgcgtcca gctcgttgag tttctccaga 2700
agcgttaatg tctggcttct gataaagcgg gccatgttaa gggcggtttt ttcctgtttg 2760
gtcactgatg cctccgtgta agggggattt ctgttcatgg gggtaatgat accgatgaaa 2820
cgagagagga tgctcacgat acgggttact gatgatgaac atgcccggtt actggaacgt 2880
tgtgagggta aacaactggc ggtatggatg cggcgggacc agagaaaaat cactcagggt 2940
caatgccagc gcttcgttaa tacagatgta ggtgttccac agggtagcca gcagcatcct 3000
gcgatgcaga tccggaacat aatggtgcag ggcgctgact tccgcgtttc cagactttac 3060
gaaacacgga aaccgaagac cattcatgtt gttgctcagg tcgcagacgt tttgcagcag 3120
cagtcgcttc acgttcgctc gcgtatcggt gattcattct gctaaccagt aaggcaaccc 3180
cgccagccta gccgggtcct caacgacagg agcacgatca tgcgcacccg tggccaggac 3240
ccaacgctgc ccgagatgcg ccgcgtgcgg ctgctggaga tggcggacgc gatggatatg 3300
ttctgccaag ggttggtttg cgcattcaca gttctccgca agaattgatt ggctccaatt 3360
cttggagtgg tgaatccgtt agcgaggtgc cgccggcttc cattcaggtc gaggtggccc 3420
ggctccatgc accgcgacgc aacgcgggga ggcagacaag gtatagggcg gcgcctacaa 3480
tccatgccaa cccgttccat gtgctcgccg aggcggcata aatcgccgtg acgatcagcg 3540
gtccaatgat cgaagttagg ctggtaagag ccgcgagcga tccttgaagc tgtccctgat 3600
ggtcgtcatc tacctgcctg gacagcatgg cctgcaacgc gggcatcccg atgccgccgg 3660
aagcgagaag aatcataatg gggaaggcca tccagcctcg cgtcgcgaac gccagcaaga 3720
cgtagcccag cgcgtcggcc gccatgccgg cgataatggc ctgcttctcg ccgaaacgtt 3780
tggtggcggg accagtgacg aaggcttgag cgagggcgtg caagattccg aataccgcaa 3840
gcgacaggcc gatcatcgtc gcgctccagc gaaagcggtc ctcgccgaaa atgacccaga 3900
gcgctgccgg cacctgtcct acgagttgca tgataaagaa gacagtcata agtgcggcga 3960
cgatagtcat gccccgcgcc caccggaagg agctgactgg gttgaaggct ctcaagggca 4020
tcggtcgaga tcccggtgcc taatgagtga gctaacttac attaattgcg ttgcgctcac 4080
tgcccgcttt ccagtcggga aacctgtcgt gccagctgca ttaatgaatc ggccaacgcg 4140
cggggagagg cggtttgcgt attgggcgcc agggtggttt ttcttttcac cagtgagacg 4200
ggcaacagct gattgccctt caccgcctgg ccctgagaga gttgcagcaa gcggtccacg 4260
ctggtttgcc ccagcaggcg aaaatcctgt ttgatggtgg ttaacggcgg gatataacat 4320
gagctgtctt cggtatcgtc gtatcccact accgagatat ccgcaccaac gcgcagcccg 4380
gactcggtaa tggcgcgcat tgcgcccagc gccatctgat cgttggcaac cagcatcgca 4440
gtgggaacga tgccctcatt cagcatttgc atggtttgtt gaaaaccgga catggcactc 4500
cagtcgcctt cccgttccgc tatcggctga atttgattgc gagtgagata tttatgccag 4560
ccagccagac gcagacgcgc cgagacagaa cttaatgggc ccgctaacag cgcgatttgc 4620
tggtgaccca atgcgaccag atgctccacg cccagtcgcg taccgtcttc atgggagaaa 4680
ataatactgt tgatgggtgt ctggtcagag acatcaagaa ataacgccgg aacattagtg 4740
caggcagctt ccacagcaat ggcatcctgg tcatccagcg gatagttaat gatcagccca 4800
ctgacgcgtt gcgcgagaag attgtgcacc gccgctttac aggcttcgac gccgcttcgt 4860
tctaccatcg acaccaccac gctggcaccc agttgatcgg cgcgagattt aatcgccgcg 4920
acaatttgcg acggcgcgtg cagggccaga ctggaggtgg caacgccaat cagcaacgac 4980
tgtttgcccg ccagttgttg tgccacgcgg ttgggaatgt aattcagctc cgccatcgcc 5040
gcttccactt tttcccgcgt tttcgcagaa acgtggctgg cctggttcac cacgcgggaa 5100
acggtctgat aagagacacc ggcatactct gcgacatcgt ataacgttac tggtttcaca 5160
ttcaccaccc tgaattgact ctcttccggg cgctatcatg ccataccgcg aaaggttttg 5220
cgccattcga tggtgtccgg gatctcgacg ctctccctta tgcgactcct gcattaggaa 5280
gcagcccagt agtaggttga ggccgttgag caccgccgcc gcaaggaatg gtgcatgcaa 5340
ggagatggcg cccaacagtc ccccggccac ggggcctgcc accataccca cgccgaaaca 5400
agcgctcatg agcccgaagt ggcgagcccg atcttcccca tcggtgatgt cggcgatata 5460
ggcgccagca accgcacctg tggcgccggt gatgccggcc acgatgcgtc cggcgtagag 5520
gatcgagatc tcgatcccgc gaaattaata cgactcacta taggggaatt gtgagcggat 5580
aacaattccc ctctagaaat aattttgttt aactttaaga aggagatata catatgcggg 5640
gttctcatca tcatcatcat catggtatgg ctagcatgac tggtggacag caaatgggtc 5700
gggatctgta cgacgatgac gataaggatc atcccttcac catggtatcc tgttctgcgc 5760
cgggtaagat ttacctgttc ggtgaacacg ccgtagttta tggcgaaact gcaattgcgt 5820
gtgcggtgga actgcgtacc cgtgttcgcg cggaactcaa tgactctatc actattcaga 5880
gccagatcgg ccgcaccggt ctggatttcg aaaagcaccc ttatgtgtct gcggtaattg 5940
agaaaatgcg caaatctatt cctattaacg gtgttttctt gaccgtcgat tccgacatcc 6000
cggtgggctc cggtctgggt agcagcgcag ccgttactat cgcgtctatt ggtgcgctga 6060
acgagctgtt cggctttggc ctcagcctgc aagaaatcgc taaactgggc cacgaaatcg 6120
aaattaaagt acagggtgcc gcgtccccaa ccgatacgta tgtttctacc ttcggcggcg 6180
tggttaccat cccggaacgt cgcaaactga aaactccgga ctgcggcatt gtgattggcg 6240
ataccggcgt tttctcctcc accaaagagt tagtagctaa cgtacgtcag ctgcgcgaaa 6300
gctacccgga tttgatcgaa ccgctgatga cctctattgg caaaatctct cgtatcggcg 6360
aacaactggt tctgtctggc gactacgcat ccatcggccg cctgatgaac gtcaaccagg 6420
gtctcctgga cgccctgggc gttaacatct tagaactgag ccagctgatc tattccgctc 6480
gtgcggcagg tgcgtttggc gctaaaatca cgggcgctgg cggcggtggc tgtatggttg 6540
cgctgaccgc tccggaaaaa tgcaaccaag tggcagaagc ggtagcaggc gctggcggta 6600
aagtgactat cactaaaccg accgagcaag gtctgaaagt agattaa 6647
<210> 30
<211> 6957
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 30
tggcgaatgg gacgcgccct gtagcggcgc attaagcgcg gcgggtgtgg tggttacgcg 60
cagcgtgacc gctacacttg ccagcgccct agcgcccgct cctttcgctt tcttcccttc 120
ctttctcgcc acgttcgccg gctttccccg tcaagctcta aatcgggggc tccctttagg 180
gttccgattt agtgctttac ggcacctcga ccccaaaaaa cttgattagg gtgatggttc 240
acgtagtggg ccatcgccct gatagacggt ttttcgccct ttgacgttgg agtccacgtt 300
ctttaatagt ggactcttgt tccaaactgg aacaacactc aaccctatct cggtctattc 360
ttttgattta taagggattt tgccgatttc ggcctattgg ttaaaaaatg agctgattta 420
acaaaaattt aacgcgaatt ttaacaaaat attaacgttt acaatttcag gtggcacttt 480
tcggggaaat gtgcgcggaa cccctatttg tttatttttc taaatacatt caaatatgta 540
tccgctcatg aattaattct tagaaaaact catcgagcat caaatgaaac tgcaatttat 600
tcatatcagg attatcaata ccatattttt gaaaaagccg tttctgtaat gaaggagaaa 660
actcaccgag gcagttccat aggatggcaa gatcctggta tcggtctgcg attccgactc 720
gtccaacatc aatacaacct attaatttcc cctcgtcaaa aataaggtta tcaagtgaga 780
aatcaccatg agtgacgact gaatccggtg agaatggcaa aagtttatgc atttctttcc 840
agacttgttc aacaggccag ccattacgct cgtcatcaaa atcactcgca tcaaccaaac 900
cgttattcat tcgtgattgc gcctgagcga gacgaaatac gcgatcgctg ttaaaaggac 960
aattacaaac aggaatcgaa tgcaaccggc gcaggaacac tgccagcgca tcaacaatat 1020
tttcacctga atcaggatat tcttctaata cctggaatgc tgttttcccg gggatcgcag 1080
tggtgagtaa ccatgcatca tcaggagtac ggataaaatg cttgatggtc ggaagaggca 1140
taaattccgt cagccagttt agtctgacca tctcatctgt aacatcattg gcaacgctac 1200
ctttgccatg tttcagaaac aactctggcg catcgggctt cccatacaat cgatagattg 1260
tcgcacctga ttgcccgaca ttatcgcgag cccatttata cccatataaa tcagcatcca 1320
tgttggaatt taatcgcggc ctagagcaag acgtttcccg ttgaatatgg ctcataacac 1380
cccttgtatt actgtttatg taagcagaca gttttattgt tcatgaccaa aatcccttaa 1440
cgtgagtttt cgttccactg agcgtcagac cccgtagaaa agatcaaagg atcttcttga 1500
gatccttttt ttctgcgcgt aatctgctgc ttgcaaacaa aaaaaccacc gctaccagcg 1560
gtggtttgtt tgccggatca agagctacca actctttttc cgaaggtaac tggcttcagc 1620
agagcgcaga taccaaatac tgtccttcta gtgtagccgt agttaggcca ccacttcaag 1680
aactctgtag caccgcctac atacctcgct ctgctaatcc tgttaccagt ggctgctgcc 1740
agtggcgata agtcgtgtct taccgggttg gactcaagac gatagttacc ggataaggcg 1800
cagcggtcgg gctgaacggg gggttcgtgc acacagccca gcttggagcg aacgacctac 1860
accgaactga gatacctaca gcgtgagcta tgagaaagcg ccacgcttcc cgaagggaga 1920
aaggcggaca ggtatccggt aagcggcagg gtcggaacag gagagcgcac gagggagctt 1980
ccagggggaa acgcctggta tctttatagt cctgtcgggt ttcgccacct ctgacttgag 2040
cgtcgatttt tgtgatgctc gtcagggggg cggagcctat ggaaaaacgc cagcaacgcg 2100
gcctttttac ggttcctggc cttttgctgg ccttttgctc acatgttctt tcctgcgtta 2160
tcccctgatt ctgtggataa ccgtattacc gcctttgagt gagctgatac cgctcgccgc 2220
agccgaacga ccgagcgcag cgagtcagtg agcgaggaag cggaagagcg cctgatgcgg 2280
tattttctcc ttacgcatct gtgcggtatt tcacaccgca tatatggtgc actctcagta 2340
caatctgctc tgatgccgca tagttaagcc agtatacact ccgctatcgc tacgtgactg 2400
ggtcatggct gcgccccgac acccgccaac acccgctgac gcgccctgac gggcttgtct 2460
gctcccggca tccgcttaca gacaagctgt gaccgtctcc gggagctgca tgtgtcagag 2520
gttttcaccg tcatcaccga aacgcgcgag gcagctgcgg taaagctcat cagcgtggtc 2580
gtgaagcgat tcacagatgt ctgcctgttc atccgcgtcc agctcgttga gtttctccag 2640
aagcgttaat gtctggcttc tgataaagcg ggccatgtta agggcggttt tttcctgttt 2700
ggtcactgat gcctccgtgt aagggggatt tctgttcatg ggggtaatga taccgatgaa 2760
acgagagagg atgctcacga tacgggttac tgatgatgaa catgcccggt tactggaacg 2820
ttgtgagggt aaacaactgg cggtatggat gcggcgggac cagagaaaaa tcactcaggg 2880
tcaatgccag cgcttcgtta atacagatgt aggtgttcca cagggtagcc agcagcatcc 2940
tgcgatgcag atccggaaca taatggtgca gggcgctgac ttccgcgttt ccagacttta 3000
cgaaacacgg aaaccgaaga ccattcatgt tgttgctcag gtcgcagacg ttttgcagca 3060
gcagtcgctt cacgttcgct cgcgtatcgg tgattcattc tgctaaccag taaggcaacc 3120
ccgccagcct agccgggtcc tcaacgacag gagcacgatc atgcgcaccc gtggggccgc 3180
catgccggcg ataatggcct gcttctcgcc gaaacgtttg gtggcgggac cagtgacgaa 3240
ggcttgagcg agggcgtgca agattccgaa taccgcaagc gacaggccga tcatcgtcgc 3300
gctccagcga aagcggtcct cgccgaaaat gacccagagc gctgccggca cctgtcctac 3360
gagttgcatg ataaagaaga cagtcataag tgcggcgacg atagtcatgc cccgcgccca 3420
ccggaaggag ctgactgggt tgaaggctct caagggcatc ggtcgagatc ccggtgccta 3480
atgagtgagc taacttacat taattgcgtt gcgctcactg cccgctttcc agtcgggaaa 3540
cctgtcgtgc cagctgcatt aatgaatcgg ccaacgcgcg gggagaggcg gtttgcgtat 3600
tgggcgccag ggtggttttt cttttcacca gtgagacggg caacagctga ttgcccttca 3660
ccgcctggcc ctgagagagt tgcagcaagc ggtccacgct ggtttgcccc agcaggcgaa 3720
aatcctgttt gatggtggtt aacggcggga tataacatga gctgtcttcg gtatcgtcgt 3780
atcccactac cgagatatcc gcaccaacgc gcagcccgga ctcggtaatg gcgcgcattg 3840
cgcccagcgc catctgatcg ttggcaacca gcatcgcagt gggaacgatg ccctcattca 3900
gcatttgcat ggtttgttga aaaccggaca tggcactcca gtcgccttcc cgttccgcta 3960
tcggctgaat ttgattgcga gtgagatatt tatgccagcc agccagacgc agacgcgccg 4020
agacagaact taatgggccc gctaacagcg cgatttgctg gtgacccaat gcgaccagat 4080
gctccacgcc cagtcgcgta ccgtcttcat gggagaaaat aatactgttg atgggtgtct 4140
ggtcagagac atcaagaaat aacgccggaa cattagtgca ggcagcttcc acagcaatgg 4200
catcctggtc atccagcgga tagttaatga tcagcccact gacgcgttgc gcgagaagat 4260
tgtgcaccgc cgctttacag gcttcgacgc cgcttcgttc taccatcgac accaccacgc 4320
tggcacccag ttgatcggcg cgagatttaa tcgccgcgac aatttgcgac ggcgcgtgca 4380
gggccagact ggaggtggca acgccaatca gcaacgactg tttgcccgcc agttgttgtg 4440
ccacgcggtt gggaatgtaa ttcagctccg ccatcgccgc ttccactttt tcccgcgttt 4500
tcgcagaaac gtggctggcc tggttcacca cgcgggaaac ggtctgataa gagacaccgg 4560
catactctgc gacatcgtat aacgttactg gtttcacatt caccaccctg aattgactct 4620
cttccgggcg ctatcatgcc ataccgcgaa aggttttgcg ccattcgatg gtgtccggga 4680
tctcgacgct ctcccttatg cgactcctgc attaggaagc agcccagtag taggttgagg 4740
ccgttgagca ccgccgccgc aaggaatggt gcatgcaagg agatggcgcc caacagtccc 4800
ccggccacgg ggcctgccac catacccacg ccgaaacaag cgctcatgag cccgaagtgg 4860
cgagcccgat cttccccatc ggtgatgtcg gcgatatagg cgccagcaac cgcacctgtg 4920
gcgccggtga tgccggccac gatgcgtccg gcgtagagga tcgagatctc gatcccgcga 4980
aattaatacg actcactata ggggaattgt gagcggataa caattcccct ctagaaataa 5040
ttttgtttaa ctttaagaag gagatataca tatgcgttgt agcgtgtcca ccgaaaatgt 5100
gtctttcacc gaaactgaaa ccgaagctcg tcgttctgcg aactacgaac ctaacagctg 5160
ggactatgat tacctgctgt cctccgacac ggacgagtcc atcgaagtat acaaagacaa 5220
agcgaaaaag ctggaagccg aagttcgtcg cgagattaat aacgaaaaag cagaatttct 5280
gaccctgctg gaactgattg acaacgtcca gcgcctgggc ctgggttacc gtttcgagtc 5340
tgatatccgt ggtgcgctgg atcgcttcgt ttcctccggc ggcttcgatg cggtaaccaa 5400
gacttccctg cacggtacgg cactgtcttt ccgtctgctg cgtcaacacg gttttgaggt 5460
ttctcaggaa gcgttcagcg gcttcaaaga ccaaaacggc aacttcctgg agaacctgaa 5520
ggaagatatc aaagctatcc tgagcctgta cgaggccagc ttcctggctc tggaaggcga 5580
aaacatcctg gacgaggcga aggttttcgc aatctctcat ctgaaagaac tgtctgaaga 5640
aaagatcggt aaagagctgg cagaacaggt gaaccatgca ctggaactgc cactgcatcg 5700
ccgtactcag cgtctggaag cagtatggtc tatcgaggcc taccgtaaaa aggaggacgc 5760
gaatcaggtt ctgctggagc tggcaattct ggattacaac atgatccagt ctgtatacca 5820
gcgtgatctg cgtgaaacgt cccgttggtg gcgtcgtgtg ggtctggcga ccaaactgca 5880
ctttgctcgt gaccgcctga ttgagagctt ctactgggcc gtgggtgtag cattcgaacc 5940
gcaatactcc gactgccgta actccgtcgc aaaaatgttt tctttcgtaa ccattatcga 6000
cgatatctac gatgtatacg gcaccctgga cgaactggag ctgtttactg atgcagttga 6060
gcgttgggac gtaaacgcca tcaacgacct gccggattac atgaaactgt gctttctggc 6120
tctgtataac actattaacg aaatcgccta cgacaacctg aaagataaag gtgagaacat 6180
cctgccgtat ctgaccaaag cctgggctga cctgtgcaac gctttcctgc aagaagccaa 6240
gtggctgtac aacaaatcta ctccgacctt tgacgactac ttcggcaacg catggaaatc 6300
ctcttctggc ccgctgcaac tggtgttcgc ttacttcgct gtcgtgcaga acattaaaaa 6360
ggaagagatc gaaaacctgc aaaaatacca tgacaccatc tctcgtcctt cccatatctt 6420
ccgtctgtgc aatgacctgg ctagcgcgtc tgcggaaatt gcgcgtggtg aaaccgcaaa 6480
tagcgtttct tgttacatgc gcactaaagg tatctccgaa gaactggcta ccgaaagcgt 6540
gatgaatctg atcgatgaaa cctggaaaaa gatgaacaag gaaaaactgg gtggtagcct 6600
gttcgcgaaa ccgttcgtgg aaaccgcgat caacctggca cgtcaatctc actgcactta 6660
tcataacggc gacgcgcata cctctccgga tgagctgacc cgcaaacgcg ttctgtctgt 6720
aatcactgaa ccgattctgc cgtttgaacg ctaaggatcc gaattcgagc tccgtcgaca 6780
agcttgcggc cgcactcgag caccaccacc accaccactg agatccggct gctaacaaag 6840
cccgaaagga agctgagttg gctgctgcca ccgctgagca ataactagca taaccccttg 6900
gggcctctaa acgggtcttg aggggttttt tgctgaaagg aggaactata tccggat 6957
<210> 31
<211> 6957
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 31
tggcgaatgg gacgcgccct gtagcggcgc attaagcgcg gcgggtgtgg tggttacgcg 60
cagcgtgacc gctacacttg ccagcgccct agcgcccgct cctttcgctt tcttcccttc 120
ctttctcgcc acgttcgccg gctttccccg tcaagctcta aatcgggggc tccctttagg 180
gttccgattt agtgctttac ggcacctcga ccccaaaaaa cttgattagg gtgatggttc 240
acgtagtggg ccatcgccct gatagacggt ttttcgccct ttgacgttgg agtccacgtt 300
ctttaatagt ggactcttgt tccaaactgg aacaacactc aaccctatct cggtctattc 360
ttttgattta taagggattt tgccgatttc ggcctattgg ttaaaaaatg agctgattta 420
acaaaaattt aacgcgaatt ttaacaaaat attaacgttt acaatttcag gtggcacttt 480
tcggggaaat gtgcgcggaa cccctatttg tttatttttc taaatacatt caaatatgta 540
tccgctcatg aattaattct tagaaaaact catcgagcat caaatgaaac tgcaatttat 600
tcatatcagg attatcaata ccatattttt gaaaaagccg tttctgtaat gaaggagaaa 660
actcaccgag gcagttccat aggatggcaa gatcctggta tcggtctgcg attccgactc 720
gtccaacatc aatacaacct attaatttcc cctcgtcaaa aataaggtta tcaagtgaga 780
aatcaccatg agtgacgact gaatccggtg agaatggcaa aagtttatgc atttctttcc 840
agacttgttc aacaggccag ccattacgct cgtcatcaaa atcactcgca tcaaccaaac 900
cgttattcat tcgtgattgc gcctgagcga gacgaaatac gcgatcgctg ttaaaaggac 960
aattacaaac aggaatcgaa tgcaaccggc gcaggaacac tgccagcgca tcaacaatat 1020
tttcacctga atcaggatat tcttctaata cctggaatgc tgttttcccg gggatcgcag 1080
tggtgagtaa ccatgcatca tcaggagtac ggataaaatg cttgatggtc ggaagaggca 1140
taaattccgt cagccagttt agtctgacca tctcatctgt aacatcattg gcaacgctac 1200
ctttgccatg tttcagaaac aactctggcg catcgggctt cccatacaat cgatagattg 1260
tcgcacctga ttgcccgaca ttatcgcgag cccatttata cccatataaa tcagcatcca 1320
tgttggaatt taatcgcggc ctagagcaag acgtttcccg ttgaatatgg ctcataacac 1380
cccttgtatt actgtttatg taagcagaca gttttattgt tcatgaccaa aatcccttaa 1440
cgtgagtttt cgttccactg agcgtcagac cccgtagaaa agatcaaagg atcttcttga 1500
gatccttttt ttctgcgcgt aatctgctgc ttgcaaacaa aaaaaccacc gctaccagcg 1560
gtggtttgtt tgccggatca agagctacca actctttttc cgaaggtaac tggcttcagc 1620
agagcgcaga taccaaatac tgtccttcta gtgtagccgt agttaggcca ccacttcaag 1680
aactctgtag caccgcctac atacctcgct ctgctaatcc tgttaccagt ggctgctgcc 1740
agtggcgata agtcgtgtct taccgggttg gactcaagac gatagttacc ggataaggcg 1800
cagcggtcgg gctgaacggg gggttcgtgc acacagccca gcttggagcg aacgacctac 1860
accgaactga gatacctaca gcgtgagcta tgagaaagcg ccacgcttcc cgaagggaga 1920
aaggcggaca ggtatccggt aagcggcagg gtcggaacag gagagcgcac gagggagctt 1980
ccagggggaa acgcctggta tctttatagt cctgtcgggt ttcgccacct ctgacttgag 2040
cgtcgatttt tgtgatgctc gtcagggggg cggagcctat ggaaaaacgc cagcaacgcg 2100
gcctttttac ggttcctggc cttttgctgg ccttttgctc acatgttctt tcctgcgtta 2160
tcccctgatt ctgtggataa ccgtattacc gcctttgagt gagctgatac cgctcgccgc 2220
agccgaacga ccgagcgcag cgagtcagtg agcgaggaag cggaagagcg cctgatgcgg 2280
tattttctcc ttacgcatct gtgcggtatt tcacaccgca tatatggtgc actctcagta 2340
caatctgctc tgatgccgca tagttaagcc agtatacact ccgctatcgc tacgtgactg 2400
ggtcatggct gcgccccgac acccgccaac acccgctgac gcgccctgac gggcttgtct 2460
gctcccggca tccgcttaca gacaagctgt gaccgtctcc gggagctgca tgtgtcagag 2520
gttttcaccg tcatcaccga aacgcgcgag gcagctgcgg taaagctcat cagcgtggtc 2580
gtgaagcgat tcacagatgt ctgcctgttc atccgcgtcc agctcgttga gtttctccag 2640
aagcgttaat gtctggcttc tgataaagcg ggccatgtta agggcggttt tttcctgttt 2700
ggtcactgat gcctccgtgt aagggggatt tctgttcatg ggggtaatga taccgatgaa 2760
acgagagagg atgctcacga tacgggttac tgatgatgaa catgcccggt tactggaacg 2820
ttgtgagggt aaacaactgg cggtatggat gcggcgggac cagagaaaaa tcactcaggg 2880
tcaatgccag cgcttcgtta atacagatgt aggtgttcca cagggtagcc agcagcatcc 2940
tgcgatgcag atccggaaca taatggtgca gggcgctgac ttccgcgttt ccagacttta 3000
cgaaacacgg aaaccgaaga ccattcatgt tgttgctcag gtcgcagacg ttttgcagca 3060
gcagtcgctt cacgttcgct cgcgtatcgg tgattcattc tgctaaccag taaggcaacc 3120
ccgccagcct agccgggtcc tcaacgacag gagcacgatc atgcgcaccc gtggggccgc 3180
catgccggcg ataatggcct gcttctcgcc gaaacgtttg gtggcgggac cagtgacgaa 3240
ggcttgagcg agggcgtgca agattccgaa taccgcaagc gacaggccga tcatcgtcgc 3300
gctccagcga aagcggtcct cgccgaaaat gacccagagc gctgccggca cctgtcctac 3360
gagttgcatg ataaagaaga cagtcataag tgcggcgacg atagtcatgc cccgcgccca 3420
ccggaaggag ctgactgggt tgaaggctct caagggcatc ggtcgagatc ccggtgccta 3480
atgagtgagc taacttacat taattgcgtt gcgctcactg cccgctttcc agtcgggaaa 3540
cctgtcgtgc cagctgcatt aatgaatcgg ccaacgcgcg gggagaggcg gtttgcgtat 3600
tgggcgccag ggtggttttt cttttcacca gtgagacggg caacagctga ttgcccttca 3660
ccgcctggcc ctgagagagt tgcagcaagc ggtccacgct ggtttgcccc agcaggcgaa 3720
aatcctgttt gatggtggtt aacggcggga tataacatga gctgtcttcg gtatcgtcgt 3780
atcccactac cgagatatcc gcaccaacgc gcagcccgga ctcggtaatg gcgcgcattg 3840
cgcccagcgc catctgatcg ttggcaacca gcatcgcagt gggaacgatg ccctcattca 3900
gcatttgcat ggtttgttga aaaccggaca tggcactcca gtcgccttcc cgttccgcta 3960
tcggctgaat ttgattgcga gtgagatatt tatgccagcc agccagacgc agacgcgccg 4020
agacagaact taatgggccc gctaacagcg cgatttgctg gtgacccaat gcgaccagat 4080
gctccacgcc cagtcgcgta ccgtcttcat gggagaaaat aatactgttg atgggtgtct 4140
ggtcagagac atcaagaaat aacgccggaa cattagtgca ggcagcttcc acagcaatgg 4200
catcctggtc atccagcgga tagttaatga tcagcccact gacgcgttgc gcgagaagat 4260
tgtgcaccgc cgctttacag gcttcgacgc cgcttcgttc taccatcgac accaccacgc 4320
tggcacccag ttgatcggcg cgagatttaa tcgccgcgac aatttgcgac ggcgcgtgca 4380
gggccagact ggaggtggca acgccaatca gcaacgactg tttgcccgcc agttgttgtg 4440
ccacgcggtt gggaatgtaa ttcagctccg ccatcgccgc ttccactttt tcccgcgttt 4500
tcgcagaaac gtggctggcc tggttcacca cgcgggaaac ggtctgataa gagacaccgg 4560
catactctgc gacatcgtat aacgttactg gtttcacatt caccaccctg aattgactct 4620
cttccgggcg ctatcatgcc ataccgcgaa aggttttgcg ccattcgatg gtgtccggga 4680
tctcgacgct ctcccttatg cgactcctgc attaggaagc agcccagtag taggttgagg 4740
ccgttgagca ccgccgccgc aaggaatggt gcatgcaagg agatggcgcc caacagtccc 4800
ccggccacgg ggcctgccac catacccacg ccgaaacaag cgctcatgag cccgaagtgg 4860
cgagcccgat cttccccatc ggtgatgtcg gcgatatagg cgccagcaac cgcacctgtg 4920
gcgccggtga tgccggccac gatgcgtccg gcgtagagga tcgagatctc gatcccgcga 4980
aattaatacg actcactata ggggaattgt gagcggataa caattcccct ctagaaataa 5040
ttttgtttaa ctttaagaag gagatataca tatgcgttgt agcgtgtcca ccgaaaatgt 5100
gtctttcacc gaaactgaaa ccgaaacgcg tcgttctgcg aactacgaac ctaacagctg 5160
ggactatgat tacctgctgt cctccgacac ggacgagtcc atcgaagtat acaaagacaa 5220
agcgaaaaag ctggaagccg aagttcgtcg cgagattaat aacgaaaaag cagaatttct 5280
gaccctgccg gaactgattg acaacgtcca gcgcctgggc ctgggttacc gtttcgagtc 5340
tgatatccgt cgtgcgctgg atcgcttcgt ttcctccggc ggcttcgatg cggtaaccaa 5400
gacttccctg cacgcgacgg cactgtcttt ccgtctgctg cgtcaacacg gttttgaggt 5460
ttctcaggaa gcgttcagcg gcttcaaaga ccaaaacggc aacttcctga aaaacctgaa 5520
ggaagatatc aaagctatcc tgagcctgta cgaggccagc ttcctggctc tggaaggcga 5580
aaacatcctg gacgaggcga aggttttcgc aatctctcat ctgaaagaac tgtctgaaga 5640
aaagatcggt aaagatctgg cagaacaggt gaaccatgca ctggaactgc cactgcatcg 5700
ccgtactcag cgtctggaag cagtatggtc tatcgaggcc taccgtaaaa aggaggacgc 5760
ggatcaggtt ctgctggagc tggcaattct ggattacaac atgatccagt ctgtatacca 5820
gcgtgatctg cgtgaaacgt cccgttggtg gcgtcgtgtg ggtctggcga ccaaactgca 5880
ctttgctcgt gaccgcctga ttgagagctt ctactgggcc gtgggtgtag cattcgaacc 5940
gcaatactcc gactgccgta actccgtcgc aaaaatgttt tctttcgtaa ccattatcga 6000
cgatatctac gatgtatacg gcaccctgga cgaactggag ctgtttactg acgcagttga 6060
gcgttgggac gtaaacgcca tcgacgatct gccggattac atgaaactgt gctttctggc 6120
tctgtataac actattaacg aaatcgccta cgacaacctg aaagataaag gtgagaacat 6180
cctgccgtat ctgaccaaag cctgggctga cctgtgcaac gctttcctgc aagaagccaa 6240
gtggctgtac aacaaatcta ctccgacctt tgacgaatac ttcggcaacg catggaaatc 6300
ctcttctggc ccgctgcaac tggtgttcgc ttacttcgct gtcgtgcaga acattaaaaa 6360
ggaagagatc gataacctgc aaaaatacca tgacatcatc tctcgtcctt cccatatctt 6420
ccgtctgtgc aatgacctgg ctagcgcgtc tgcggaaatt gcgcgtggtg aaaccgcaaa 6480
tagcgtttct tgttacatgc gcactaaagg tatctccgaa gaactggcta ccgaaagcgt 6540
gatgaatctg atcgatgaaa cctggaaaaa gatgaacaag gaaaaactgg gtggtagcct 6600
gttcgcgaaa ccgttcgtgg aaaccgcgat caacctggca cgtcaatctc actgcactta 6660
tcataacggc gacgcgcata cctctccgga tgagctgacc cgcaaacgcg ttctgtctgt 6720
aatcactgaa ccgattctgc cgtttgaacg ctaaggatcc gaattcgagc tccgtcgaca 6780
agcttgcggc cgcactcgag caccaccacc accaccactg agatccggct gctaacaaag 6840
cccgaaagga agctgagttg gctgctgcca ccgctgagca ataactagca taaccccttg 6900
gggcctctaa acgggtcttg aggggttttt tgctgaaagg aggaactata tccggat 6957
<210> 32
<211> 6957
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 32
tggcgaatgg gacgcgccct gtagcggcgc attaagcgcg gcgggtgtgg tggttacgcg 60
cagcgtgacc gctacacttg ccagcgccct agcgcccgct cctttcgctt tcttcccttc 120
ctttctcgcc acgttcgccg gctttccccg tcaagctcta aatcgggggc tccctttagg 180
gttccgattt agtgctttac ggcacctcga ccccaaaaaa cttgattagg gtgatggttc 240
acgtagtggg ccatcgccct gatagacggt ttttcgccct ttgacgttgg agtccacgtt 300
ctttaatagt ggactcttgt tccaaactgg aacaacactc aaccctatct cggtctattc 360
ttttgattta taagggattt tgccgatttc ggcctattgg ttaaaaaatg agctgattta 420
acaaaaattt aacgcgaatt ttaacaaaat attaacgttt acaatttcag gtggcacttt 480
tcggggaaat gtgcgcggaa cccctatttg tttatttttc taaatacatt caaatatgta 540
tccgctcatg aattaattct tagaaaaact catcgagcat caaatgaaac tgcaatttat 600
tcatatcagg attatcaata ccatattttt gaaaaagccg tttctgtaat gaaggagaaa 660
actcaccgag gcagttccat aggatggcaa gatcctggta tcggtctgcg attccgactc 720
gtccaacatc aatacaacct attaatttcc cctcgtcaaa aataaggtta tcaagtgaga 780
aatcaccatg agtgacgact gaatccggtg agaatggcaa aagtttatgc atttctttcc 840
agacttgttc aacaggccag ccattacgct cgtcatcaaa atcactcgca tcaaccaaac 900
cgttattcat tcgtgattgc gcctgagcga gacgaaatac gcgatcgctg ttaaaaggac 960
aattacaaac aggaatcgaa tgcaaccggc gcaggaacac tgccagcgca tcaacaatat 1020
tttcacctga atcaggatat tcttctaata cctggaatgc tgttttcccg gggatcgcag 1080
tggtgagtaa ccatgcatca tcaggagtac ggataaaatg cttgatggtc ggaagaggca 1140
taaattccgt cagccagttt agtctgacca tctcatctgt aacatcattg gcaacgctac 1200
ctttgccatg tttcagaaac aactctggcg catcgggctt cccatacaat cgatagattg 1260
tcgcacctga ttgcccgaca ttatcgcgag cccatttata cccatataaa tcagcatcca 1320
tgttggaatt taatcgcggc ctagagcaag acgtttcccg ttgaatatgg ctcataacac 1380
cccttgtatt actgtttatg taagcagaca gttttattgt tcatgaccaa aatcccttaa 1440
cgtgagtttt cgttccactg agcgtcagac cccgtagaaa agatcaaagg atcttcttga 1500
gatccttttt ttctgcgcgt aatctgctgc ttgcaaacaa aaaaaccacc gctaccagcg 1560
gtggtttgtt tgccggatca agagctacca actctttttc cgaaggtaac tggcttcagc 1620
agagcgcaga taccaaatac tgtccttcta gtgtagccgt agttaggcca ccacttcaag 1680
aactctgtag caccgcctac atacctcgct ctgctaatcc tgttaccagt ggctgctgcc 1740
agtggcgata agtcgtgtct taccgggttg gactcaagac gatagttacc ggataaggcg 1800
cagcggtcgg gctgaacggg gggttcgtgc acacagccca gcttggagcg aacgacctac 1860
accgaactga gatacctaca gcgtgagcta tgagaaagcg ccacgcttcc cgaagggaga 1920
aaggcggaca ggtatccggt aagcggcagg gtcggaacag gagagcgcac gagggagctt 1980
ccagggggaa acgcctggta tctttatagt cctgtcgggt ttcgccacct ctgacttgag 2040
cgtcgatttt tgtgatgctc gtcagggggg cggagcctat ggaaaaacgc cagcaacgcg 2100
gcctttttac ggttcctggc cttttgctgg ccttttgctc acatgttctt tcctgcgtta 2160
tcccctgatt ctgtggataa ccgtattacc gcctttgagt gagctgatac cgctcgccgc 2220
agccgaacga ccgagcgcag cgagtcagtg agcgaggaag cggaagagcg cctgatgcgg 2280
tattttctcc ttacgcatct gtgcggtatt tcacaccgca tatatggtgc actctcagta 2340
caatctgctc tgatgccgca tagttaagcc agtatacact ccgctatcgc tacgtgactg 2400
ggtcatggct gcgccccgac acccgccaac acccgctgac gcgccctgac gggcttgtct 2460
gctcccggca tccgcttaca gacaagctgt gaccgtctcc gggagctgca tgtgtcagag 2520
gttttcaccg tcatcaccga aacgcgcgag gcagctgcgg taaagctcat cagcgtggtc 2580
gtgaagcgat tcacagatgt ctgcctgttc atccgcgtcc agctcgttga gtttctccag 2640
aagcgttaat gtctggcttc tgataaagcg ggccatgtta agggcggttt tttcctgttt 2700
ggtcactgat gcctccgtgt aagggggatt tctgttcatg ggggtaatga taccgatgaa 2760
acgagagagg atgctcacga tacgggttac tgatgatgaa catgcccggt tactggaacg 2820
ttgtgagggt aaacaactgg cggtatggat gcggcgggac cagagaaaaa tcactcaggg 2880
tcaatgccag cgcttcgtta atacagatgt aggtgttcca cagggtagcc agcagcatcc 2940
tgcgatgcag atccggaaca taatggtgca gggcgctgac ttccgcgttt ccagacttta 3000
cgaaacacgg aaaccgaaga ccattcatgt tgttgctcag gtcgcagacg ttttgcagca 3060
gcagtcgctt cacgttcgct cgcgtatcgg tgattcattc tgctaaccag taaggcaacc 3120
ccgccagcct agccgggtcc tcaacgacag gagcacgatc atgcgcaccc gtggggccgc 3180
catgccggcg ataatggcct gcttctcgcc gaaacgtttg gtggcgggac cagtgacgaa 3240
ggcttgagcg agggcgtgca agattccgaa taccgcaagc gacaggccga tcatcgtcgc 3300
gctccagcga aagcggtcct cgccgaaaat gacccagagc gctgccggca cctgtcctac 3360
gagttgcatg ataaagaaga cagtcataag tgcggcgacg atagtcatgc cccgcgccca 3420
ccggaaggag ctgactgggt tgaaggctct caagggcatc ggtcgagatc ccggtgccta 3480
atgagtgagc taacttacat taattgcgtt gcgctcactg cccgctttcc agtcgggaaa 3540
cctgtcgtgc cagctgcatt aatgaatcgg ccaacgcgcg gggagaggcg gtttgcgtat 3600
tgggcgccag ggtggttttt cttttcacca gtgagacggg caacagctga ttgcccttca 3660
ccgcctggcc ctgagagagt tgcagcaagc ggtccacgct ggtttgcccc agcaggcgaa 3720
aatcctgttt gatggtggtt aacggcggga tataacatga gctgtcttcg gtatcgtcgt 3780
atcccactac cgagatatcc gcaccaacgc gcagcccgga ctcggtaatg gcgcgcattg 3840
cgcccagcgc catctgatcg ttggcaacca gcatcgcagt gggaacgatg ccctcattca 3900
gcatttgcat ggtttgttga aaaccggaca tggcactcca gtcgccttcc cgttccgcta 3960
tcggctgaat ttgattgcga gtgagatatt tatgccagcc agccagacgc agacgcgccg 4020
agacagaact taatgggccc gctaacagcg cgatttgctg gtgacccaat gcgaccagat 4080
gctccacgcc cagtcgcgta ccgtcttcat gggagaaaat aatactgttg atgggtgtct 4140
ggtcagagac atcaagaaat aacgccggaa cattagtgca ggcagcttcc acagcaatgg 4200
catcctggtc atccagcgga tagttaatga tcagcccact gacgcgttgc gcgagaagat 4260
tgtgcaccgc cgctttacag gcttcgacgc cgcttcgttc taccatcgac accaccacgc 4320
tggcacccag ttgatcggcg cgagatttaa tcgccgcgac aatttgcgac ggcgcgtgca 4380
gggccagact ggaggtggca acgccaatca gcaacgactg tttgcccgcc agttgttgtg 4440
ccacgcggtt gggaatgtaa ttcagctccg ccatcgccgc ttccactttt tcccgcgttt 4500
tcgcagaaac gtggctggcc tggttcacca cgcgggaaac ggtctgataa gagacaccgg 4560
catactctgc gacatcgtat aacgttactg gtttcacatt caccaccctg aattgactct 4620
cttccgggcg ctatcatgcc ataccgcgaa aggttttgcg ccattcgatg gtgtccggga 4680
tctcgacgct ctcccttatg cgactcctgc attaggaagc agcccagtag taggttgagg 4740
ccgttgagca ccgccgccgc aaggaatggt gcatgcaagg agatggcgcc caacagtccc 4800
ccggccacgg ggcctgccac catacccacg ccgaaacaag cgctcatgag cccgaagtgg 4860
cgagcccgat cttccccatc ggtgatgtcg gcgatatagg cgccagcaac cgcacctgtg 4920
gcgccggtga tgccggccac gatgcgtccg gcgtagagga tcgagatctc gatcccgcga 4980
aattaatacg actcactata ggggaattgt gagcggataa caattcccct ctagaaataa 5040
ttttgtttaa ctttaagaag gagatataca tatgcgttgt agcgtgtcca ccgaaaatgt 5100
gtctttctct gaaactgaaa ccgaaacgcg tcgttctgcg aactacgaac ctaacagctg 5160
ggactatgat tacctgctgt cctccgacac ggacgagtcc atcgaagtac acaaagacaa 5220
agcgaaaaag ctggaagccg aagttcgtcg cgagattaat aacgaaaaag cagaatttct 5280
gaccctgctg gaactgattg acaacgtcca gcgcctgggc ctgggttacc gtttcgagtc 5340
tgatatccgt cgtgcgctgg atcgcttcgt ttcctccggc ggcttcgatg gcgtaaccaa 5400
gacttccctg cacggtacgg cactgtcttt ccgtctgctg cgtcaacacg gttttgaggt 5460
ttctcaggaa gcgttcagcg gcttcaaaga ccaaaacggc aacttcctgg agaacctgaa 5520
ggaagatatc aaagctatcc tgagcctgta cgaggccagc ttcctggctc tggaaggcga 5580
aaacatcctg gacgaggcga aggttttcgc aatctctcat ctgaaagaac tgtctgaaga 5640
aaagatcggt aaagagctgg cagaacaggt gtcccatgca ctggaactgc cactgcatcg 5700
ccgtactcag cgtctggaag cagtatggtc tatcgaggcc taccgtaaaa aggaggacgc 5760
gaaccaggtt ctgctggagc tggcaattct ggattacaac atgatccagt ctgtatacca 5820
gcgtgatctg cgtgaaacgt cccgttggtg gcgtcgtgtg ggtctggcga ccaaactgca 5880
ctttgctcgt gaccgcctga ttgagagctt ctactgggcc gtgggtgtag cattcgaacc 5940
gcaatactcc gactgccgta actccgtcgc aaaaatgttt tctttcgtaa ccattatcga 6000
cgatatctac gatgtatacg gcaccctgga cgaactggag ctgtttactg atgcagttga 6060
gcgttgggac gtaaacgcca tcaacgacct gccggattac atgaaactgt gctttctggc 6120
tctgtataac actattaacg aaatcgccta cgacaacctg aaagataaag gtgagaacat 6180
cctgccgtat ctgaccaaag cctgggctga cctgtgcaac gctttcctgc aagaagccaa 6240
gtggctgtac aacaaatcta ctccgacctt tgacgactac ttcggcaacg catggaaatc 6300
ctcttctggc ccgctgcaac tgatcttcgc ttacttcgct gtcgtgcaga acattaaaaa 6360
ggaagagatc gaaaacctgc aaaaatacca tgacatcatc tctcgtcctt cccatatctt 6420
ccgtctgtgc aatgacctgg ctagcgcgtc tgcggaaatt gcgcgtggtg aaaccgcaaa 6480
tagcgtttct tgttacatgc gcactaaagg tatctccgaa gaactggcta ccgaaagcgt 6540
gatgaatctg atcgatgaaa cctggaaaaa gatgaacaag gaaaaactgg gtggtagcct 6600
gttcgcgaaa ccgttcgtgg aaaccgcgat caacctggca cgtcaatctc actgcactta 6660
tcataacggc gacgcgcata cctctccgga tgagctgacc cgcaaacgcg ttctgtctgt 6720
aatcactgaa ccgattctgc cgtttgaacg ctaaggatcc gaattcgagc tccgtcgaca 6780
agcttgcggc cgcactcgag caccaccacc accaccactg agatccggct gctaacaaag 6840
cccgaaagga agctgagttg gctgctgcca ccgctgagca ataactagca taaccccttg 6900
gggcctctaa acgggtcttg aggggttttt tgctgaaagg aggaactata tccggat 6957
<210> 33
<211> 560
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 33
Met Arg Cys Ser Val Ser Thr Glu Asn Val Ser Phe Ser Glu Thr Glu
1 5 10 15
Thr Glu Thr Arg Arg Ser Ala Asn Tyr Glu Pro Asn Ser Trp Asp Tyr
20 25 30
Asp Tyr Leu Leu Ser Ser Asp Thr Asp Glu Ser Ile Glu Val His Lys
35 40 45
Asp Lys Ala Lys Lys Leu Glu Ala Glu Val Arg Arg Glu Ile Asn Asn
50 55 60
Glu Lys Ala Glu Phe Leu Thr Leu Leu Glu Leu Ile Asp Asn Val Gln
65 70 75 80
Arg Leu Gly Leu Gly Tyr Arg Phe Glu Ser Asp Ile Arg Arg Ala Leu
85 90 95
Asp Arg Phe Val Ser Ser Gly Gly Phe Asp Gly Val Thr Lys Thr Ser
100 105 110
Leu His Gly Thr Ala Leu Ser Phe Arg Leu Leu Arg Gln His Gly Phe
115 120 125
Glu Val Ser Gln Glu Ala Phe Ser Gly Phe Lys Asp Gln Asn Gly Asn
130 135 140
Phe Leu Glu Asn Leu Lys Glu Asp Ile Lys Ala Ile Leu Ser Leu Tyr
145 150 155 160
Glu Ala Ser Phe Leu Ala Leu Glu Gly Glu Asn Ile Leu Asp Glu Ala
165 170 175
Lys Val Phe Ala Ile Ser His Leu Lys Glu Leu Ser Glu Glu Lys Ile
180 185 190
Gly Lys Glu Leu Ala Glu Gln Val Ser His Ala Leu Glu Leu Pro Leu
195 200 205
His Arg Arg Thr Gln Arg Leu Glu Ala Val Trp Ser Ile Glu Ala Tyr
210 215 220
Arg Lys Lys Glu Asp Ala Asn Gln Val Leu Leu Glu Leu Ala Ile Leu
225 230 235 240
Asp Tyr Asn Met Ile Gln Ser Val Tyr Gln Arg Asp Leu Arg Glu Thr
245 250 255
Ser Arg Trp Trp Arg Arg Val Gly Leu Ala Thr Lys Leu His Phe Ala
260 265 270
Arg Asp Arg Leu Ile Glu Ser Phe Tyr Trp Ala Val Gly Val Ala Phe
275 280 285
Glu Pro Gln Tyr Ser Asp Cys Arg Asn Ser Val Ala Lys Met Phe Ser
290 295 300
Phe Val Thr Ile Ile Asp Asp Ile Tyr Asp Val Tyr Gly Thr Leu Asp
305 310 315 320
Glu Leu Glu Leu Phe Thr Asp Ala Val Glu Arg Trp Asp Val Asn Ala
325 330 335
Ile Asn Asp Leu Pro Asp Tyr Met Lys Leu Cys Phe Leu Ala Leu Tyr
340 345 350
Asn Thr Ile Asn Glu Ile Ala Tyr Asp Asn Leu Lys Asp Lys Gly Glu
355 360 365
Asn Ile Leu Pro Tyr Leu Thr Lys Ala Trp Ala Asp Leu Cys Asn Ala
370 375 380
Phe Leu Gln Glu Ala Lys Trp Leu Tyr Asn Lys Ser Thr Pro Thr Phe
385 390 395 400
Asp Asp Tyr Phe Gly Asn Ala Trp Lys Ser Ser Ser Gly Pro Leu Gln
405 410 415
Leu Ile Phe Ala Tyr Phe Ala Val Val Gln Asn Ile Lys Lys Glu Glu
420 425 430
Ile Glu Asn Leu Gln Lys Tyr His Asp Ile Ile Ser Arg Pro Ser His
435 440 445
Ile Phe Arg Leu Cys Asn Asp Leu Ala Ser Ala Ser Ala Glu Ile Ala
450 455 460
Arg Gly Glu Thr Ala Asn Ser Val Ser Cys Tyr Met Arg Thr Lys Gly
465 470 475 480
Ile Ser Glu Glu Leu Ala Thr Glu Ser Val Met Asn Leu Ile Asp Glu
485 490 495
Thr Trp Lys Lys Met Asn Lys Glu Lys Leu Gly Gly Ser Leu Phe Ala
500 505 510
Lys Pro Phe Val Glu Thr Ala Ile Asn Leu Ala Arg Gln Ser His Cys
515 520 525
Thr Tyr His Asn Gly Asp Ala His Thr Ser Pro Asp Glu Leu Thr Arg
530 535 540
Lys Arg Val Leu Ser Val Ile Thr Glu Pro Ile Leu Pro Phe Glu Arg
545 550 555 560
<210> 34
<211> 6963
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 34
tggcgaatgg gacgcgccct gtagcggcgc attaagcgcg gcgggtgtgg tggttacgcg 60
cagcgtgacc gctacacttg ccagcgccct agcgcccgct cctttcgctt tcttcccttc 120
ctttctcgcc acgttcgccg gctttccccg tcaagctcta aatcgggggc tccctttagg 180
gttccgattt agtgctttac ggcacctcga ccccaaaaaa cttgattagg gtgatggttc 240
acgtagtggg ccatcgccct gatagacggt ttttcgccct ttgacgttgg agtccacgtt 300
ctttaatagt ggactcttgt tccaaactgg aacaacactc aaccctatct cggtctattc 360
ttttgattta taagggattt tgccgatttc ggcctattgg ttaaaaaatg agctgattta 420
acaaaaattt aacgcgaatt ttaacaaaat attaacgttt acaatttcag gtggcacttt 480
tcggggaaat gtgcgcggaa cccctatttg tttatttttc taaatacatt caaatatgta 540
tccgctcatg aattaattct tagaaaaact catcgagcat caaatgaaac tgcaatttat 600
tcatatcagg attatcaata ccatattttt gaaaaagccg tttctgtaat gaaggagaaa 660
actcaccgag gcagttccat aggatggcaa gatcctggta tcggtctgcg attccgactc 720
gtccaacatc aatacaacct attaatttcc cctcgtcaaa aataaggtta tcaagtgaga 780
aatcaccatg agtgacgact gaatccggtg agaatggcaa aagtttatgc atttctttcc 840
agacttgttc aacaggccag ccattacgct cgtcatcaaa atcactcgca tcaaccaaac 900
cgttattcat tcgtgattgc gcctgagcga gacgaaatac gcgatcgctg ttaaaaggac 960
aattacaaac aggaatcgaa tgcaaccggc gcaggaacac tgccagcgca tcaacaatat 1020
tttcacctga atcaggatat tcttctaata cctggaatgc tgttttcccg gggatcgcag 1080
tggtgagtaa ccatgcatca tcaggagtac ggataaaatg cttgatggtc ggaagaggca 1140
taaattccgt cagccagttt agtctgacca tctcatctgt aacatcattg gcaacgctac 1200
ctttgccatg tttcagaaac aactctggcg catcgggctt cccatacaat cgatagattg 1260
tcgcacctga ttgcccgaca ttatcgcgag cccatttata cccatataaa tcagcatcca 1320
tgttggaatt taatcgcggc ctagagcaag acgtttcccg ttgaatatgg ctcataacac 1380
cccttgtatt actgtttatg taagcagaca gttttattgt tcatgaccaa aatcccttaa 1440
cgtgagtttt cgttccactg agcgtcagac cccgtagaaa agatcaaagg atcttcttga 1500
gatccttttt ttctgcgcgt aatctgctgc ttgcaaacaa aaaaaccacc gctaccagcg 1560
gtggtttgtt tgccggatca agagctacca actctttttc cgaaggtaac tggcttcagc 1620
agagcgcaga taccaaatac tgtccttcta gtgtagccgt agttaggcca ccacttcaag 1680
aactctgtag caccgcctac atacctcgct ctgctaatcc tgttaccagt ggctgctgcc 1740
agtggcgata agtcgtgtct taccgggttg gactcaagac gatagttacc ggataaggcg 1800
cagcggtcgg gctgaacggg gggttcgtgc acacagccca gcttggagcg aacgacctac 1860
accgaactga gatacctaca gcgtgagcta tgagaaagcg ccacgcttcc cgaagggaga 1920
aaggcggaca ggtatccggt aagcggcagg gtcggaacag gagagcgcac gagggagctt 1980
ccagggggaa acgcctggta tctttatagt cctgtcgggt ttcgccacct ctgacttgag 2040
cgtcgatttt tgtgatgctc gtcagggggg cggagcctat ggaaaaacgc cagcaacgcg 2100
gcctttttac ggttcctggc cttttgctgg ccttttgctc acatgttctt tcctgcgtta 2160
tcccctgatt ctgtggataa ccgtattacc gcctttgagt gagctgatac cgctcgccgc 2220
agccgaacga ccgagcgcag cgagtcagtg agcgaggaag cggaagagcg cctgatgcgg 2280
tattttctcc ttacgcatct gtgcggtatt tcacaccgca tatatggtgc actctcagta 2340
caatctgctc tgatgccgca tagttaagcc agtatacact ccgctatcgc tacgtgactg 2400
ggtcatggct gcgccccgac acccgccaac acccgctgac gcgccctgac gggcttgtct 2460
gctcccggca tccgcttaca gacaagctgt gaccgtctcc gggagctgca tgtgtcagag 2520
gttttcaccg tcatcaccga aacgcgcgag gcagctgcgg taaagctcat cagcgtggtc 2580
gtgaagcgat tcacagatgt ctgcctgttc atccgcgtcc agctcgttga gtttctccag 2640
aagcgttaat gtctggcttc tgataaagcg ggccatgtta agggcggttt tttcctgttt 2700
ggtcactgat gcctccgtgt aagggggatt tctgttcatg ggggtaatga taccgatgaa 2760
acgagagagg atgctcacga tacgggttac tgatgatgaa catgcccggt tactggaacg 2820
ttgtgagggt aaacaactgg cggtatggat gcggcgggac cagagaaaaa tcactcaggg 2880
tcaatgccag cgcttcgtta atacagatgt aggtgttcca cagggtagcc agcagcatcc 2940
tgcgatgcag atccggaaca taatggtgca gggcgctgac ttccgcgttt ccagacttta 3000
cgaaacacgg aaaccgaaga ccattcatgt tgttgctcag gtcgcagacg ttttgcagca 3060
gcagtcgctt cacgttcgct cgcgtatcgg tgattcattc tgctaaccag taaggcaacc 3120
ccgccagcct agccgggtcc tcaacgacag gagcacgatc atgcgcaccc gtggggccgc 3180
catgccggcg ataatggcct gcttctcgcc gaaacgtttg gtggcgggac cagtgacgaa 3240
ggcttgagcg agggcgtgca agattccgaa taccgcaagc gacaggccga tcatcgtcgc 3300
gctccagcga aagcggtcct cgccgaaaat gacccagagc gctgccggca cctgtcctac 3360
gagttgcatg ataaagaaga cagtcataag tgcggcgacg atagtcatgc cccgcgccca 3420
ccggaaggag ctgactgggt tgaaggctct caagggcatc ggtcgagatc ccggtgccta 3480
atgagtgagc taacttacat taattgcgtt gcgctcactg cccgctttcc agtcgggaaa 3540
cctgtcgtgc cagctgcatt aatgaatcgg ccaacgcgcg gggagaggcg gtttgcgtat 3600
tgggcgccag ggtggttttt cttttcacca gtgagacggg caacagctga ttgcccttca 3660
ccgcctggcc ctgagagagt tgcagcaagc ggtccacgct ggtttgcccc agcaggcgaa 3720
aatcctgttt gatggtggtt aacggcggga tataacatga gctgtcttcg gtatcgtcgt 3780
atcccactac cgagatatcc gcaccaacgc gcagcccgga ctcggtaatg gcgcgcattg 3840
cgcccagcgc catctgatcg ttggcaacca gcatcgcagt gggaacgatg ccctcattca 3900
gcatttgcat ggtttgttga aaaccggaca tggcactcca gtcgccttcc cgttccgcta 3960
tcggctgaat ttgattgcga gtgagatatt tatgccagcc agccagacgc agacgcgccg 4020
agacagaact taatgggccc gctaacagcg cgatttgctg gtgacccaat gcgaccagat 4080
gctccacgcc cagtcgcgta ccgtcttcat gggagaaaat aatactgttg atgggtgtct 4140
ggtcagagac atcaagaaat aacgccggaa cattagtgca ggcagcttcc acagcaatgg 4200
catcctggtc atccagcgga tagttaatga tcagcccact gacgcgttgc gcgagaagat 4260
tgtgcaccgc cgctttacag gcttcgacgc cgcttcgttc taccatcgac accaccacgc 4320
tggcacccag ttgatcggcg cgagatttaa tcgccgcgac aatttgcgac ggcgcgtgca 4380
gggccagact ggaggtggca acgccaatca gcaacgactg tttgcccgcc agttgttgtg 4440
ccacgcggtt gggaatgtaa ttcagctccg ccatcgccgc ttccactttt tcccgcgttt 4500
tcgcagaaac gtggctggcc tggttcacca cgcgggaaac ggtctgataa gagacaccgg 4560
catactctgc gacatcgtat aacgttactg gtttcacatt caccaccctg aattgactct 4620
cttccgggcg ctatcatgcc ataccgcgaa aggttttgcg ccattcgatg gtgtccggga 4680
tctcgacgct ctcccttatg cgactcctgc attaggaagc agcccagtag taggttgagg 4740
ccgttgagca ccgccgccgc aaggaatggt gcatgcaagg agatggcgcc caacagtccc 4800
ccggccacgg ggcctgccac catacccacg ccgaaacaag cgctcatgag cccgaagtgg 4860
cgagcccgat cttccccatc ggtgatgtcg gcgatatagg cgccagcaac cgcacctgtg 4920
gcgccggtga tgccggccac gatgcgtccg gcgtagagga tcgagatctc gatcccgcga 4980
aattaatacg actcactata ggggaattgt gagcggataa caattcccct ctagaaataa 5040
ttttgtttaa ctttaagaag gagatataca tatgcatatg cgttgtagcg tgtccaccga 5100
aaatgtgtct ttcaccgaaa ctgaaaccga aacgcgtcgt tctgcgaact acgaacctaa 5160
cagctgggac tatgattacc tgctgtcctc cgacacggac gagtccatcg aagtatacaa 5220
agacaaagcg aaaaagctgg aagccgaagt tcgtcgcgag attaataacg aaaaagcaga 5280
atttctgacc ctgctggaac tgattgacaa cgtccagcgc ctgggcctgg gttaccgttt 5340
cgagtctgat atccgtcgtg cgctggatcg cttcgtttcc tccggcggct tcgatgcggt 5400
aaccaagact tccctgcacg cgacggcact gtctttccgt ctgctgcgtc aacacggttt 5460
tgaggtttct caggaagcgt tcagcggctt caaagaccaa aacggcaact tcctggagaa 5520
cctgaaggaa gatatcaaag ctatcctgag cctgtacgag gccagcttcc tggctctgga 5580
aggcgaaaac atcctggacg aggcgaaggt tttcgcaatc tctcatctga aagaactgtc 5640
tgaagaaaag atcggtaaag atctggcaga acaggtgaac catgcactgg aactgccact 5700
gcatcgccgt actcagcgtc tggaagcagt actgtctatc gaggcctacc gtaaaaagga 5760
ggacgcggat caggttctgc tggagctggc aattctggat tacaacatga tccagtctgt 5820
ataccagcgt gatctgcgtg aaacgtcccg ttggtggcgt cgtgtgggtc tggcgaccaa 5880
actgcacttt gctcgtgacc gcctgattga gagcttctac tgggccgtgg gtgtagcatt 5940
cgaaccgcaa tactccgact gccgtaactc cgtcgcaaaa atgttttctt tcgtaaccat 6000
tatcgacgat atctacgatg tatacggcac cctggacgaa ctggagctgt ttactaacgc 6060
agttgagcgt tgggacgtaa acgccatcga cgatctgccg gattacatga aactgtgctt 6120
tctggctctg tataacacta ttaacgaaat cgcctacgac aacctgaaag aaaaaggtga 6180
gaacatcctg ccgtatctga ccaaagcctg ggctgacctg tgcaacgctt tcctgcaaga 6240
agccaagtgg ctgtacaaca aatctactcc gacctttgac gaatacttcg gcaacgcatg 6300
gaaatcctct tctggcccgc tgcaactggt gttcgcttac ttcgctgtcg tgcagaacat 6360
taaaaaggaa gagatcgaaa acctgcaaaa ataccatgac atcatctctc gtccttccca 6420
tatcttccgt ctgtgcaatg acctggctag cgcgtctgcg gaaattgcgc gtggtgaaac 6480
cgcaaatagc gtttcttgtt acatgcgcac taaaggtatc tccgaagaac tggctaccga 6540
aagcgtgatg aatctgatcg atgaaacctg gaaaaagatg aacaaggaaa aactgggtgg 6600
tagcctgttc gcgaaaccgt tcgtggaaac cgcgatcaac ctggcacgtc aatctcactg 6660
cacttatcat aacggcgacg cgcatacctc tccggatgag ctgacccgca aacgcgttct 6720
gtctgtaatc actgaaccga ttctgccgtt tgaacgctaa ggatccgaat tcgagctccg 6780
tcgacaagct tgcggccgca ctcgagcacc accaccacca ccactgagat ccggctgcta 6840
acaaagcccg aaaggaagct gagttggctg ctgccaccgc tgagcaataa ctagcataac 6900
cccttggggc ctctaaacgg gtcttgaggg gttttttgct gaaaggagga actatatccg 6960
gat 6963
<210> 35
<211> 6966
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 35
tggcgaatgg gacgcgccct gtagcggcgc attaagcgcg gcgggtgtgg tggttacgcg 60
cagcgtgacc gctacacttg ccagcgccct agcgcccgct cctttcgctt tcttcccttc 120
ctttctcgcc acgttcgccg gctttccccg tcaagctcta aatcgggggc tccctttagg 180
gttccgattt agtgctttac ggcacctcga ccccaaaaaa cttgattagg gtgatggttc 240
acgtagtggg ccatcgccct gatagacggt ttttcgccct ttgacgttgg agtccacgtt 300
ctttaatagt ggactcttgt tccaaactgg aacaacactc aaccctatct cggtctattc 360
ttttgattta taagggattt tgccgatttc ggcctattgg ttaaaaaatg agctgattta 420
acaaaaattt aacgcgaatt ttaacaaaat attaacgttt acaatttcag gtggcacttt 480
tcggggaaat gtgcgcggaa cccctatttg tttatttttc taaatacatt caaatatgta 540
tccgctcatg aattaattct tagaaaaact catcgagcat caaatgaaac tgcaatttat 600
tcatatcagg attatcaata ccatattttt gaaaaagccg tttctgtaat gaaggagaaa 660
actcaccgag gcagttccat aggatggcaa gatcctggta tcggtctgcg attccgactc 720
gtccaacatc aatacaacct attaatttcc cctcgtcaaa aataaggtta tcaagtgaga 780
aatcaccatg agtgacgact gaatccggtg agaatggcaa aagtttatgc atttctttcc 840
agacttgttc aacaggccag ccattacgct cgtcatcaaa atcactcgca tcaaccaaac 900
cgttattcat tcgtgattgc gcctgagcga gacgaaatac gcgatcgctg ttaaaaggac 960
aattacaaac aggaatcgaa tgcaaccggc gcaggaacac tgccagcgca tcaacaatat 1020
tttcacctga atcaggatat tcttctaata cctggaatgc tgttttcccg gggatcgcag 1080
tggtgagtaa ccatgcatca tcaggagtac ggataaaatg cttgatggtc ggaagaggca 1140
taaattccgt cagccagttt agtctgacca tctcatctgt aacatcattg gcaacgctac 1200
ctttgccatg tttcagaaac aactctggcg catcgggctt cccatacaat cgatagattg 1260
tcgcacctga ttgcccgaca ttatcgcgag cccatttata cccatataaa tcagcatcca 1320
tgttggaatt taatcgcggc ctagagcaag acgtttcccg ttgaatatgg ctcataacac 1380
cccttgtatt actgtttatg taagcagaca gttttattgt tcatgaccaa aatcccttaa 1440
cgtgagtttt cgttccactg agcgtcagac cccgtagaaa agatcaaagg atcttcttga 1500
gatccttttt ttctgcgcgt aatctgctgc ttgcaaacaa aaaaaccacc gctaccagcg 1560
gtggtttgtt tgccggatca agagctacca actctttttc cgaaggtaac tggcttcagc 1620
agagcgcaga taccaaatac tgtccttcta gtgtagccgt agttaggcca ccacttcaag 1680
aactctgtag caccgcctac atacctcgct ctgctaatcc tgttaccagt ggctgctgcc 1740
agtggcgata agtcgtgtct taccgggttg gactcaagac gatagttacc ggataaggcg 1800
cagcggtcgg gctgaacggg gggttcgtgc acacagccca gcttggagcg aacgacctac 1860
accgaactga gatacctaca gcgtgagcta tgagaaagcg ccacgcttcc cgaagggaga 1920
aaggcggaca ggtatccggt aagcggcagg gtcggaacag gagagcgcac gagggagctt 1980
ccagggggaa acgcctggta tctttatagt cctgtcgggt ttcgccacct ctgacttgag 2040
cgtcgatttt tgtgatgctc gtcagggggg cggagcctat ggaaaaacgc cagcaacgcg 2100
gcctttttac ggttcctggc cttttgctgg ccttttgctc acatgttctt tcctgcgtta 2160
tcccctgatt ctgtggataa ccgtattacc gcctttgagt gagctgatac cgctcgccgc 2220
agccgaacga ccgagcgcag cgagtcagtg agcgaggaag cggaagagcg cctgatgcgg 2280
tattttctcc ttacgcatct gtgcggtatt tcacaccgca tatatggtgc actctcagta 2340
caatctgctc tgatgccgca tagttaagcc agtatacact ccgctatcgc tacgtgactg 2400
ggtcatggct gcgccccgac acccgccaac acccgctgac gcgccctgac gggcttgtct 2460
gctcccggca tccgcttaca gacaagctgt gaccgtctcc gggagctgca tgtgtcagag 2520
gttttcaccg tcatcaccga aacgcgcgag gcagctgcgg taaagctcat cagcgtggtc 2580
gtgaagcgat tcacagatgt ctgcctgttc atccgcgtcc agctcgttga gtttctccag 2640
aagcgttaat gtctggcttc tgataaagcg ggccatgtta agggcggttt tttcctgttt 2700
ggtcactgat gcctccgtgt aagggggatt tctgttcatg ggggtaatga taccgatgaa 2760
acgagagagg atgctcacga tacgggttac tgatgatgaa catgcccggt tactggaacg 2820
ttgtgagggt aaacaactgg cggtatggat gcggcgggac cagagaaaaa tcactcaggg 2880
tcaatgccag cgcttcgtta atacagatgt aggtgttcca cagggtagcc agcagcatcc 2940
tgcgatgcag atccggaaca taatggtgca gggcgctgac ttccgcgttt ccagacttta 3000
cgaaacacgg aaaccgaaga ccattcatgt tgttgctcag gtcgcagacg ttttgcagca 3060
gcagtcgctt cacgttcgct cgcgtatcgg tgattcattc tgctaaccag taaggcaacc 3120
ccgccagcct agccgggtcc tcaacgacag gagcacgatc atgcgcaccc gtggggccgc 3180
catgccggcg ataatggcct gcttctcgcc gaaacgtttg gtggcgggac cagtgacgaa 3240
ggcttgagcg agggcgtgca agattccgaa taccgcaagc gacaggccga tcatcgtcgc 3300
gctccagcga aagcggtcct cgccgaaaat gacccagagc gctgccggca cctgtcctac 3360
gagttgcatg ataaagaaga cagtcataag tgcggcgacg atagtcatgc cccgcgccca 3420
ccggaaggag ctgactgggt tgaaggctct caagggcatc ggtcgagatc ccggtgccta 3480
atgagtgagc taacttacat taattgcgtt gcgctcactg cccgctttcc agtcgggaaa 3540
cctgtcgtgc cagctgcatt aatgaatcgg ccaacgcgcg gggagaggcg gtttgcgtat 3600
tgggcgccag ggtggttttt cttttcacca gtgagacggg caacagctga ttgcccttca 3660
ccgcctggcc ctgagagagt tgcagcaagc ggtccacgct ggtttgcccc agcaggcgaa 3720
aatcctgttt gatggtggtt aacggcggga tataacatga gctgtcttcg gtatcgtcgt 3780
atcccactac cgagatatcc gcaccaacgc gcagcccgga ctcggtaatg gcgcgcattg 3840
cgcccagcgc catctgatcg ttggcaacca gcatcgcagt gggaacgatg ccctcattca 3900
gcatttgcat ggtttgttga aaaccggaca tggcactcca gtcgccttcc cgttccgcta 3960
tcggctgaat ttgattgcga gtgagatatt tatgccagcc agccagacgc agacgcgccg 4020
agacagaact taatgggccc gctaacagcg cgatttgctg gtgacccaat gcgaccagat 4080
gctccacgcc cagtcgcgta ccgtcttcat gggagaaaat aatactgttg atgggtgtct 4140
ggtcagagac atcaagaaat aacgccggaa cattagtgca ggcagcttcc acagcaatgg 4200
catcctggtc atccagcgga tagttaatga tcagcccact gacgcgttgc gcgagaagat 4260
tgtgcaccgc cgctttacag gcttcgacgc cgcttcgttc taccatcgac accaccacgc 4320
tggcacccag ttgatcggcg cgagatttaa tcgccgcgac aatttgcgac ggcgcgtgca 4380
gggccagact ggaggtggca acgccaatca gcaacgactg tttgcccgcc agttgttgtg 4440
ccacgcggtt gggaatgtaa ttcagctccg ccatcgccgc ttccactttt tcccgcgttt 4500
tcgcagaaac gtggctggcc tggttcacca cgcgggaaac ggtctgataa gagacaccgg 4560
catactctgc gacatcgtat aacgttactg gtttcacatt caccaccctg aattgactct 4620
cttccgggcg ctatcatgcc ataccgcgaa aggttttgcg ccattcgatg gtgtccggga 4680
tctcgacgct ctcccttatg cgactcctgc attaggaagc agcccagtag taggttgagg 4740
ccgttgagca ccgccgccgc aaggaatggt gcatgcaagg agatggcgcc caacagtccc 4800
ccggccacgg ggcctgccac catacccacg ccgaaacaag cgctcatgag cccgaagtgg 4860
cgagcccgat cttccccatc ggtgatgtcg gcgatatagg cgccagcaac cgcacctgtg 4920
gcgccggtga tgccggccac gatgcgtccg gcgtagagga tcgagatctc gatcccgcga 4980
aattaatacg actcactata ggggaattgt gagcggataa caattcccct ctagaaataa 5040
ttttgtttaa ctttaagaag gagatataca tatgtgctct gtttctaccg agaacgtttc 5100
cttcactgag acggaaaccg aggcacgtcg tagcgcgaac tacgagccga atagctggga 5160
ctacgatttc ctgctgtctt ccgatactga cgaatctatt gaggtgtaca aagacaaagc 5220
aaagaaactg gaggctgaag tgcgccgcga aattaacaac gagaaagctg aattcctgac 5280
tctgctggag ctgatcgata acgtacagcg cctgggtctg ggttaccgct tcgaatctga 5340
tatccgtcgc gcactggatc gtttcgtaag cagcggcggt ttcgatggcg tgaccaaaac 5400
gagcctgcac gctaccgcgc tgtccttccg tctgctgcgt cagcacggct tcgaagtttc 5460
tcaggaagca ttctccggtt tcaaagatca aaacggtaac ttcctggaaa acctgaaaga 5520
agacactaag gcgatcctga gcctgtatga ggcaagcttt ctggccctgg agggtgagaa 5580
catcctggat gaggcgcgcg tattctccat ctcccatctg aaagagctgt ctgaagagaa 5640
aatcggtaag gaactggcag agcaggttaa tcacgcactg gaactgccgc tgcatcgtcg 5700
tacccagcgt ctggaggcgg tttggtccat cgaagcgtac cgcaaaaagg aggatgctaa 5760
ccaggttctg ctggaactgg ccatcctgga ctacaacatg atccagtccg tttaccagcg 5820
tgatctgcgt gaaacctccc gttggtggcg ccgtgtgggc ctggcgacca aactgcactt 5880
cgctaaggac cgcctgattg agtcttttta ctgggcagtc ggcgttgcgt tcgaacctca 5940
gtattctgac tgccgtaaca gcgttgcgaa aatgttcagc ttcgttacta ttatcgacga 6000
catctacgac gtttacggta ctctggacga gctggaactg tttaccgacg ctgtcgaacg 6060
ttgggatgtt aacgccatca acgatctgcc tgactacatg aaactgtgct tcctggcact 6120
gtataacacg atcaacgaaa ttgcatacga caacctgaaa gacaaaggtg aaaacatcct 6180
gccgtacctg actaaagcgt gggcggatct gtgtaacgct tttctgcaag aagcgaaatg 6240
gctgtataac aaatccactc cgacctttga cgattatttc ggcaatgcct ggaaatccag 6300
ctctggcccg ctgcaactga tcttcgctta ttttgcggtt gtccaaaaca tcaaaaagga 6360
ggaaattgaa aacctgcaaa aataccacga tatcattagc cgtccttctc atatctttcg 6420
cctgtgcaac gacctggcaa gcgcgtccgc agagatcgca cgtggcgaaa ccgctaactc 6480
tgtttcctgc tacatgcgca ccaagggcat ttccgaagag ctggcaaccg agagcgtaat 6540
gaatctgatc gacgaaacct gtaagaaaat gaacaaagaa aaactgggtg gctccctgtt 6600
cgctaaaccg ttcgtagaga ctgctattaa cctggcacgt cagagccact gcacctacca 6660
caatggtgac gcacatacta gcccggatga actgactcgt aaacgtgtac tgtctgttat 6720
caccgaaccg attctgccgt tcgaacgtta actgcagctg gtaggatccg aattcgagct 6780
ccgtcgacaa gcttgcggcc gcactcgagc accaccacca ccaccactga gatccggctg 6840
ctaacaaagc ccgaaaggaa gctgagttgg ctgctgccac cgctgagcaa taactagcat 6900
aaccccttgg ggcctctaaa cgggtcttga ggggtttttt gctgaaagga ggaactatat 6960
ccggat 6966
<210> 36
<211> 5679
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 36
aagggcgaat actgcagata tccatcacac tggcggccgc tcgagcatgc atctagaggg 60
cccaattcgc cctatagtga gtcgtattac aattcactgg ccgtcgtttt acaacgtcgt 120
gactgggaaa accctggcgt tacccaactt aatcgccttg cagcacatcc ccctttcgcc 180
agctggcgta atagcgaaga ggcccgcacc gatcgccctt cccaacagtt gcgcagcctg 240
aatggcgaat ggacgcgccc tgtagcggcg cattaagcgc ggcgggtgtg gtggttacgc 300
gcagcgtgac cgctacactt gccagcgccc tagcgcccgc tcctttcgct ttcttccctt 360
cctttctcgc cacgttcgcc ggctttcccc gtcaagctct aaatcggggg ctccctttag 420
ggttccgatt tagtgcttta cggcacctcg accccaaaaa acttgattag ggtgatggtt 480
cacgtagtgg gccatcgccc tgatagacgg tttttcgccc tttgacgttg gagtccacgt 540
tctttaatag tggactcttg ttccaaactg gaacaacact caaccctatc tcggtctatt 600
cttttgattt ataagggatt ttgccgattt cggcctattg gttaaaaaat gagctgattt 660
aacaaaaatt taacgcgaat tttaacaaaa ttcagggcgc aagggctgct aaaggaagcg 720
gaacacgtag aaagccagtc cgcagaaacg gtgctgaccc cggatgaatg tcagctactg 780
ggctatctgg acaagggaaa acgcaagcgc aaagagaaag caggtagctt gcagtgggct 840
tacatggcga tagctagact gggcggtttt atggacagca agcgaaccgg aattgccagc 900
tggggcgccc tctggtaagg ttgggaagcc ctgcaaagta aactggatgg ctttcttgcc 960
gccaaggatc tgatggcgca ggggatcaag atctgatcaa gagacaggat gaggatcgtt 1020
tcgcatgatt gaacaagatg gattgcacgc aggttctccg gccgcttggg tggagaggct 1080
attcggctat gactgggcac aacagacaat cggctgctct gatgccgccg tgttccggct 1140
gtcagcgcag gggcgcccgg ttctttttgt caagaccgac ctgtccggtg ccctgaatga 1200
actgcaggac gaggcagcgc ggctatcgtg gctggccacg acgggcgttc cttgcgcagc 1260
tgtgctcgac gttgtcactg aagcgggaag ggactggctg ctattgggcg aagtgccggg 1320
gcaggatccc ctgtcatccc accttgctcc tgccgagaaa gtatccatca tggctgatgc 1380
aatgcggcgg ctgcatacgc ttgatccggc tacctgccca ttcgaccacc aagcgaaaca 1440
tcgcatcgag cgagcacgta ctcggatgga agccggtctt gtcgatcagg atgatctgga 1500
cgaagagcat caggggctcg cgccagccga actgttcgcc aggctcaagg cgcgcatgcc 1560
cgacggcgag gatctcgtcg tgacccatgg cgatgcctgc ttgccgaata tcatggtgga 1620
aaatggccgc ttttctggat tcatcgactg tggccggctg ggtgtggcgg accgctatca 1680
ggacatagcg ttggctaccc gtgatattgc tgaagagctt ggcggcgaat gggctgaccg 1740
cttcctcgtg ctttacggta tcgccgctcc cgattcgcag cgcatcgcct tctatcgcct 1800
tcttgacgag ttcttctgaa ttgaaaaagg aagagtatga gtattcaaca tttccgtgtc 1860
gcccttattc ccttttttgc ggcattttgc cttcctgttt ttgctcaccc agaaacgctg 1920
gtgaaagtaa aagatgctga agatcagttg ggtgcacgag tgggttacat cgaactggat 1980
ctcaacagcg gtaagatcct tgagagtttt cgccccgaag aacgttttcc aatgatgagc 2040
acttttaaag ttctgctatg tggcgcggta ttatcccgta ttgacgccgg gcaagagcaa 2100
ctcggtcgcc gcatacacta ttctcagaat gacttggttg agtactcacc agtcacagaa 2160
aagcatctta cggatggcat gacagtaaga gaattatgca gtgctgccat aaccatgagt 2220
gataacactg cggccaactt acttctgaca acgatcggag gaccgaagga gctaaccgct 2280
tttttgcaca acatggggga tcatgtaact cgccttgatc gttgggaacc ggagctgaat 2340
gaagccatac caaacgacga gcgtgacacc acgatgcctg tagcaatggc aacaacgttg 2400
cgcaaactat taactggcga actacttact ctagcttccc ggcaacaatt aatagactgg 2460
atggaggcgg ataaagttgc aggaccactt ctgcgctcgg cccttccggc tggctggttt 2520
attgctgata aatctggagc cggtgagcgt gggtctcgcg gtatcattgc agcactgggg 2580
ccagatggta agccctcccg tatcgtagtt atctacacga cggggagtca ggcaactatg 2640
gatgaacgaa atagacagat cgctgagata ggtgcctcac tgattaagca ttggtaactg 2700
tcagaccaag tttactcata tatactttag attgatttaa aacttcattt ttaatttaaa 2760
aggatctagg tgaagatcct ttttgataat ctcatgacca aaatccctta acgtgagttt 2820
tcgttccact gagcgtcaga ccccgtagaa aagatcaaag gatcttcttg agatcctttt 2880
tttctgcgcg taatctgctg cttgcaaaca aaaaaaccac cgctaccagc ggtggtttgt 2940
ttgccggatc aagagctacc aactcttttt ccgaaggtaa ctggcttcag cagagcgcag 3000
ataccaaata ctgttcttct agtgtagccg tagttaggcc accacttcaa gaactctgta 3060
gcaccgccta catacctcgc tctgctaatc ctgttaccag tggctgctgc cagtggcgat 3120
aagtcgtgtc ttaccgggtt ggactcaaga cgatagttac cggataaggc gcagcggtcg 3180
ggctgaacgg ggggttcgtg cacacagccc agcttggagc gaacgaccta caccgaactg 3240
agatacctac agcgtgagct atgagaaagc gccacgcttc ccgaagggag aaaggcggac 3300
aggtatccgg taagcggcag ggtcggaaca ggagagcgca cgagggagct tccaggggga 3360
aacgcctggt atctttatag tcctgtcggg tttcgccacc tctgacttga gcgtcgattt 3420
ttgtgatgct cgtcaggggg gcggagccta tggaaaaacg ccagcaacgc ggccttttta 3480
cggttcctgg ccttttgctg gccttttgct cacatgttct ttcctgcgtt atcccctgat 3540
tctgtggata accgtattac cgcctttgag tgagctgata ccgctcgccg cagccgaacg 3600
accgagcgca gcgagtcagt gagcgaggaa gcggaagagc gcccaatacg caaaccgcct 3660
ctccccgcgc gttggccgat tcattaatgc agctggcacg acaggtttcc cgactggaaa 3720
gcgggcagtg agcgcaacgc aattaatgtg agttagctca ctcattaggc accccaggct 3780
ttacacttta tgcttccggc tcgtatgttg tgtggaattg tgagcggata acaatttcac 3840
acaggaaaca gctatgacca tgattacgcc aagcttggta ccgagctcgg atccactagt 3900
aacggccgcc agtgtgctgg aattcgccct tgatcatgca ttcgccctta ggaggtaaaa 3960
aaacatgtgt gcgacctctt ctcaatttac tcagattacc gagcataatt cccgtcgttc 4020
cgcaaactat cagccaaacc tgtggaattt cgaattcctg caatccctgg agaacgacct 4080
gaaagtggaa aagctggagg agaaagcgac caaactggag gaagaagttc gctgcatgat 4140
caaccgtgta gacacccagc cgctgtccct gctggagctg atcgacgatg tgcagcgcct 4200
gggtctgacc tacaaatttg aaaaagacat cattaaagcc ctggaaaaca tcgtactgct 4260
ggacgaaaac aaaaagaaca aatctgacct gcacgcaacc gctctgtctt tccgtctgct 4320
gcgtcagcac ggtttcgagg tttctcagga tgtttttgag cgtttcaagg ataaagaagg 4380
tggtttcagc ggtgaactga aaggtgacgt ccaaggcctg ctgagcctgt atgaagcgtc 4440
ttacctgggt ttcgagggtg agaacctgct ggaggaggcg cgtacctttt ccatcaccca 4500
cctgaagaac aacctgaaag aaggcattaa taccaaggtt gcagaacaag tgagccacgc 4560
cctggaactg ccatatcacc agcgtctgca ccgtctggag gcacgttggt tcctggataa 4620
atacgaaccg aaagaaccgc atcaccagct gctgctggag ctggcgaagc tggattttaa 4680
catggtacag accctgcacc agaaagagct gcaagatctg tcccgctggt ggaccgagat 4740
gggcctggct agcaaactgg attttgtacg cgaccgcctg atggaagttt atttctgggc 4800
actgggtatg gcgccagacc cgcagtttgg tgaatgtcgc aaagctgtta ctaaaatgtt 4860
tggtctggtg acgatcatcg atgacgtgta tgacgtttat ggcactctgg acgaactgca 4920
actgttcacc gatgctgtag agcgctggga cgttaacgct attaacaccc tgccggacta 4980
tatgaaactg tgtttcctgg cactgtacaa caccgttaac gacacgtcct attctattct 5040
gaaagagaaa ggtcataaca acctgtccta tctgacgaaa agctggcgtg aactgtgcaa 5100
agcctttctg caagaggcga aatggtccaa caacaaaatt atcccggctt tctccaagta 5160
cctggaaaac gccagcgttt cctcctccgg tgtagcgctg ctggcgccgt cttacttttc 5220
cgtatgccag cagcaggaag acatctccga ccacgcgctg agttccctga ccgacttcca 5280
tggtctggtg cgttctagct gcgttatctt ccgcctgtgc aacgatctgg ccacctctgc 5340
ggcggagctg gaacgtggcg agactaccaa ttctatcatt agctacatgc acgaaaacga 5400
tggtaccagc gaggaacagg cccgcgaaga actgcgtaaa ctgatcgacg ccgaatggaa 5460
aaagatgaat cgtgaacgcg ttagcgactc caccctgctg cctaaagcgt tcatggaaat 5520
cgcagttaac atggcacgtg tttcccactg cacctaccag tatggcgatg gtctgggtcg 5580
cccagactac gcgactgaaa accgcatcaa actgctgctg attgaccctt tcccgattaa 5640
ccagctgatg tatgtctaac tgcagggatc cgtcgaccg 5679
<210> 37
<211> 6974
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 37
gtgcggccgc aagcttgtcg acggagctcg aattcggatc cctgcagtta gacatacatc 60
agctggttaa tcgggaaagg gtcaatcagc agcagtttga tgcggttttc agtcgcgtag 120
tctgggcgac ccagaccatc gccatactgg taggtgcagt gggaaacacg tgccatgtta 180
actgcgattt ccatgaacgc tttaggcagc agggtggagt cgctaacgcg ttcacgattc 240
atctttttcc attcggcgtc gatcagttta cgcagttctt cgcgggcctg ttcctcgctg 300
gtaccatcgt tttcgtgcat gtagctaatg atagaattgg tagtctcgcc acgttccagc 360
tccgccgcag aggtggccag atcgttgcac aggcggaaga taacgcagct agaacgcacc 420
agaccatgga agtcggtcag ggaacgcagc gcgtggtcgg agatgtcttc ctgctgctgg 480
catacggaaa agtaagacgg cgccagcagc gctacaccgg aggaggaaac gctggcgttt 540
tccaggtact tggagaaagc cgggataatt ttgttgttgg accatttcgc ctcttgcaga 600
aaggctttgc acagttcacg ccagcttttc gtcagatagg acaggttgtt atgacctttc 660
tctttcagaa tagaatagga cgtgtcgtta acggtgttgt acagtgccag gaaacacagt 720
ttcatatagt ccggcagggt gttaatagcg ttaacgtccc agcgctctac agcatcggtg 780
aacagttgca gttcgtccag agtgccataa acgtcataca cgtcatcgat gatcgtcacc 840
agaccaaaca ttttagtaac agctttgcga cattcaccaa actgcgggtc tggcgccata 900
cccagtgccc agaaataaac ttccatcagg cggtcgcgta caaaatccag tttgctagcc 960
aggcccatct cggtccacca gcgggacaga tcttgcagct ctttctggtg cagggtctgt 1020
accatgttaa aatccagctt cgccagctcc agcagcagct ggtgatgcgg ttctttcggt 1080
tcgtatttat ccaggaacca acgtgcctcc agacggtgca gacgctggtg atatggcagt 1140
tccagggcgt ggctcacttg ttctgcaacc ttggtattaa tgccttcttt caggttgttc 1200
ttcaggtggg tgatggaaaa ggtacgcgcc tcctccagca ggttctcacc ctcgaaaccc 1260
aggtaagacg cttcatacag gctcagcagg ccttggacgt cacctttcag ttcaccgctg 1320
aaaccacctt ctttatcctt gaaacgctca aaaacatcct gagaaacctc gaaaccgtgc 1380
tgacgcagca gacggaaaga cagagcggtt gcgtgcaggt cagatttgtt ctttttgttt 1440
tcgtccagca gtacgatgtt ttccagggct ttaatgatgt ctttttcaaa tttgtaggtc 1500
agacccaggc gctgcacatc gtcgatcagc tccagcaggg acagcggctg ggtgtctaca 1560
cggttgatca tgcagcgaac ttcttcctcc agtttggtcg ctttctcctc cagcttttcc 1620
actttcaggt cgttctccag ggattgcagg aattcgaaat tccacaggtt tggctgatag 1680
tttgcggaac gacgggaatt atgctcggta atctgagtaa attgagaaga ggtcgcacac 1740
atggtatatc tccttcttaa agttaaacaa aattatttct agaggggaat tgttatccgc 1800
tcacaattcc cctatagtga gtcgtattaa tttcgcggga tcgagatctc gatcctctac 1860
gccggacgca tcgtggccgg catcaccggc gccacaggtg cggttgctgg cgcctatatc 1920
gccgacatca ccgatgggga agatcgggct cgccacttcg ggctcatgag cgcttgtttc 1980
ggcgtgggta tggtggcagg ccccgtggcc gggggactgt tgggcgccat ctccttgcat 2040
gcaccattcc ttgcggcggc ggtgctcaac ggcctcaacc tactactggg ctgcttccta 2100
atgcaggagt cgcataaggg agagcgtcga gatcccggac accatcgaat ggcgcaaaac 2160
ctttcgcggt atggcatgat agcgcccgga agagagtcaa ttcagggtgg tgaatgtgaa 2220
accagtaacg ttatacgatg tcgcagagta tgccggtgtc tcttatcaga ccgtttcccg 2280
cgtggtgaac caggccagcc acgtttctgc gaaaacgcgg gaaaaagtgg aagcggcgat 2340
ggcggagctg aattacattc ccaaccgcgt ggcacaacaa ctggcgggca aacagtcgtt 2400
gctgattggc gttgccacct ccagtctggc cctgcacgcg ccgtcgcaaa ttgtcgcggc 2460
gattaaatct cgcgccgatc aactgggtgc cagcgtggtg gtgtcgatgg tagaacgaag 2520
cggcgtcgaa gcctgtaaag cggcggtgca caatcttctc gcgcaacgcg tcagtgggct 2580
gatcattaac tatccgctgg atgaccagga tgccattgct gtggaagctg cctgcactaa 2640
tgttccggcg ttatttcttg atgtctctga ccagacaccc atcaacagta ttattttctc 2700
ccatgaagac ggtacgcgac tgggcgtgga gcatctggtc gcattgggtc accagcaaat 2760
cgcgctgtta gcgggcccat taagttctgt ctcggcgcgt ctgcgtctgg ctggctggca 2820
taaatatctc actcgcaatc aaattcagcc gatagcggaa cgggaaggcg actggagtgc 2880
catgtccggt tttcaacaaa ccatgcaaat gctgaatgag ggcatcgttc ccactgcgat 2940
gctggttgcc aacgatcaga tggcgctggg cgcaatgcgc gccattaccg agtccgggct 3000
gcgcgttggt gcggatatct cggtagtggg atacgacgat accgaagaca gctcatgtta 3060
tatcccgccg ttaaccacca tcaaacagga ttttcgcctg ctggggcaaa ccagcgtgga 3120
ccgcttgctg caactctctc agggccaggc ggtgaagggc aatcagctgt tgcccgtctc 3180
actggtgaaa agaaaaacca ccctggcgcc caatacgcaa accgcctctc cccgcgcgtt 3240
ggccgattca ttaatgcagc tggcacgaca ggtttcccga ctggaaagcg ggcagtgagc 3300
gcaacgcaat taatgtaagt tagctcactc attaggcacc gggatctcga ccgatgccct 3360
tgagagcctt caacccagtc agctccttcc ggtgggcgcg gggcatgact atcgtcgccg 3420
cacttatgac tgtcttcttt atcatgcaac tcgtaggaca ggtgccggca gcgctctggg 3480
tcattttcgg cgaggaccgc tttcgctgga gcgcgacgat gatcggcctg tcgcttgcgg 3540
tattcggaat cttgcacgcc ctcgctcaag ccttcgtcac tggtcccgcc accaaacgtt 3600
tcggcgagaa gcaggccatt atcgccggca tggcggcccc acgggtgcgc atgatcgtgc 3660
tcctgtcgtt gaggacccgg ctaggctggc ggggttgcct tactggttag cagaatgaat 3720
caccgatacg cgagcgaacg tgaagcgact gctgctgcaa aacgtctgcg acctgagcaa 3780
caacatgaat ggtcttcggt ttccgtgttt cgtaaagtct ggaaacgcgg aagtcagcgc 3840
cctgcaccat tatgttccgg atctgcatcg caggatgctg ctggctaccc tgtggaacac 3900
ctacatctgt attaacgaag cgctggcatt gaccctgagt gatttttctc tggtcccgcc 3960
gcatccatac cgccagttgt ttaccctcac aacgttccag taaccgggca tgttcatcat 4020
cagtaacccg tatcgtgagc atcctctctc gtttcatcgg tatcattacc cccatgaaca 4080
gaaatccccc ttacacggag gcatcagtga ccaaacagga aaaaaccgcc cttaacatgg 4140
cccgctttat cagaagccag acattaacgc ttctggagaa actcaacgag ctggacgcgg 4200
atgaacaggc agacatctgt gaatcgcttc acgaccacgc tgatgagctt taccgcagct 4260
gcctcgcgcg tttcggtgat gacggtgaaa acctctgaca catgcagctc ccggagacgg 4320
tcacagcttg tctgtaagcg gatgccggga gcagacaagc ccgtcagggc gcgtcagcgg 4380
gtgttggcgg gtgtcggggc gcagccatga cccagtcacg tagcgatagc ggagtgtata 4440
ctggcttaac tatgcggcat cagagcagat tgtactgaga gtgcaccata tatgcggtgt 4500
gaaataccgc acagatgcgt aaggagaaaa taccgcatca ggcgctcttc cgcttcctcg 4560
ctcactgact cgctgcgctc ggtcgttcgg ctgcggcgag cggtatcagc tcactcaaag 4620
gcggtaatac ggttatccac agaatcaggg gataacgcag gaaagaacat gtgagcaaaa 4680
ggccagcaaa aggccaggaa ccgtaaaaag gccgcgttgc tggcgttttt ccataggctc 4740
cgcccccctg acgagcatca caaaaatcga cgctcaagtc agaggtggcg aaacccgaca 4800
ggactataaa gataccaggc gtttccccct ggaagctccc tcgtgcgctc tcctgttccg 4860
accctgccgc ttaccggata cctgtccgcc tttctccctt cgggaagcgt ggcgctttct 4920
catagctcac gctgtaggta tctcagttcg gtgtaggtcg ttcgctccaa gctgggctgt 4980
gtgcacgaac cccccgttca gcccgaccgc tgcgccttat ccggtaacta tcgtcttgag 5040
tccaacccgg taagacacga cttatcgcca ctggcagcag ccactggtaa caggattagc 5100
agagcgaggt atgtaggcgg tgctacagag ttcttgaagt ggtggcctaa ctacggctac 5160
actagaagga cagtatttgg tatctgcgct ctgctgaagc cagttacctt cggaaaaaga 5220
gttggtagct cttgatccgg caaacaaacc accgctggta gcggtggttt ttttgtttgc 5280
aagcagcaga ttacgcgcag aaaaaaagga tctcaagaag atcctttgat cttttctacg 5340
gggtctgacg ctcagtggaa cgaaaactca cgttaaggga ttttggtcat gaacaataaa 5400
actgtctgct tacataaaca gtaatacaag gggtgttatg agccatattc aacgggaaac 5460
gtcttgctct aggccgcgat taaattccaa catggatgct gatttatatg ggtataaatg 5520
ggctcgcgat aatgtcgggc aatcaggtgc gacaatctat cgattgtatg ggaagcccga 5580
tgcgccagag ttgtttctga aacatggcaa aggtagcgtt gccaatgatg ttacagatga 5640
gatggtcaga ctaaactggc tgacggaatt tatgcctctt ccgaccatca agcattttat 5700
ccgtactcct gatgatgcat ggttactcac cactgcgatc cccgggaaaa cagcattcca 5760
ggtattagaa gaatatcctg attcaggtga aaatattgtt gatgcgctgg cagtgttcct 5820
gcgccggttg cattcgattc ctgtttgtaa ttgtcctttt aacagcgatc gcgtatttcg 5880
tctcgctcag gcgcaatcac gaatgaataa cggtttggtt gatgcgagtg attttgatga 5940
cgagcgtaat ggctggcctg ttgaacaagt ctggaaagaa atgcataaac ttttgccatt 6000
ctcaccggat tcagtcgtca ctcatggtga tttctcactt gataacctta tttttgacga 6060
ggggaaatta ataggttgta ttgatgttgg acgagtcgga atcgcagacc gataccagga 6120
tcttgccatc ctatggaact gcctcggtga gttttctcct tcattacaga aacggctttt 6180
tcaaaaatat ggtattgata atcctgatat gaataaattg cagtttcatt tgatgctcga 6240
tgagtttttc taagaattaa ttcatgagcg gatacatatt tgaatgtatt tagaaaaata 6300
aacaaatagg ggttccgcgc acatttcccc gaaaagtgcc acctgaaatt gtaaacgtta 6360
atattttgtt aaaattcgcg ttaaattttt gttaaatcag ctcatttttt aaccaatagg 6420
ccgaaatcgg caaaatccct tataaatcaa aagaatagac cgagataggg ttgagtgttg 6480
ttccagtttg gaacaagagt ccactattaa agaacgtgga ctccaacgtc aaagggcgaa 6540
aaaccgtcta tcagggcgat ggcccactac gtgaaccatc accctaatca agttttttgg 6600
ggtcgaggtg ccgtaaagca ctaaatcgga accctaaagg gagcccccga tttagagctt 6660
gacggggaaa gccggcgaac gtggcgagaa aggaagggaa gaaagcgaaa ggagcgggcg 6720
ctagggcgct ggcaagtgta gcggtcacgc tgcgcgtaac caccacaccc gccgcgctta 6780
atgcgccgct acagggcgcg tcccattcgc caatccggat atagttcctc ctttcagcaa 6840
aaaacccctc aagacccgtt tagaggcccc aaggggttat gctagttatt gctcagcggt 6900
ggcagcagcc aactcagctt cctttcgggc tttgttagca gccggatctc agtggtggtg 6960
gtggtggtgc tcga 6974
<210> 38
<211> 1719
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 38
gaattcaaaa tgtgtgcaac ttcatcccaa ttcactcaaa tcacagagca taattctaga 60
cgttcagcta actaccaacc aaatctgtgg aattttgaat ttcttcaatc ccttgaaaat 120
gatttgaaag tggaaaagtt ggaggaaaaa gccacaaaac tagaggaaga agttagatgt 180
atgataaaca gagtagatac acaacctctg tcactactag aattgattga cgatgtccag 240
aggctgggtt taacatataa gttcgaaaag gatataatca aagccttaga aaacatagtc 300
cttctagatg aaaacaagaa gaataagtct gacttgcacg caaccgctct gagttttaga 360
ttgctgagac aacatggttt tgaagtaagt caagatgtgt ttgaaaggtt caaagacaaa 420
gagggaggat tctcaggaga attaaaggga gatgtgcagg gtctgttgtc attgtacgag 480
gccagttatt tggggtttga aggggaaaat ctactagagg aggccagaac cttctctata 540
acccatctga agaataactt gaaagaaggc atcaatacaa aagtggctga acaagtttca 600
catgcattgg aattgcccta ccaccaaaga cttcatagac ttgaagccag atggtttttg 660
gacaagtatg aaccaaagga gcctcaccat caacttttat tggaattagc aaaactggat 720
tttaacatgg ttcagacatt acaccagaaa gaattgcagg acctatcaag atggtggacg 780
gagatgggtt tagccagcaa gttagatttc gttagagata gattgatgga agtttacttt 840
tgggcactgg gaatggcacc agatcctcaa tttggtgaat gtagaaaggc agttacaaag 900
atgtttggtc tagtaacaat cattgatgat gtttatgatg tgtacggaac tttggatgaa 960
ttacaactat tcaccgacgc agttgaacgt tgggatgtaa acgcaataaa cacgttgcct 1020
gattatatga agctgtgttt tctggcattg tacaacacag tcaatgacac ttcttactcc 1080
attttaaagg agaaagggca taacaatcta tcctatttga caaaatcatg gagggagtta 1140
tgcaaagcat tccttcaaga agctaagtgg tctaacaata agataatccc agcattctcc 1200
aagtatcttg aaaacgcttc cgtatcctcc tccggtgtgg ccctactagc accatcatat 1260
ttttccgtct gccagcagca ggaagatatc tctgatcatg ctttgagatc cttaacagat 1320
tttcatggtc tagtcagatc ctcttgcgtg attttcagat tgtgcaatga tttggctact 1380
tcagccgcag agttagagag gggtgaaacc acgaactcaa ttattagtta tatgcacgag 1440
aatgatggaa catccgaaga acaagcccgt gaagaattaa gaaaactgat cgatgctgaa 1500
tggaagaaga tgaatagaga aagagtttcc gacagcactt tgctgcctaa ggcattcatg 1560
gagatagctg ttaacatggc tagggtttca cactgtacat accaatacgg ggacggtctt 1620
ggaaggcccg actacgccac tgaaaataga attaaactgc tactgattga tcctttcccc 1680
attaaccagt taatgtacgt gtaataggga tccgaattc 1719
<210> 39
<211> 7658
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 39
acggattaga agccgccgag cgggtgacag ccctccgaag gaagactctc ctccgtgcgt 60
cctcgtcttc accggtcgcg ttcctgaaac gcagatgtgc ctcgcgccgc actgctccga 120
acaataaaga ttctacaata ctagctttta tggttatgaa gaggaaaaat tggcagtaac 180
ctggccccac aaaccttcaa atgaacgaat caaattaaca accataggat gataatgcga 240
ttagtttttt agccttattt ctggggtaat taatcagcga agcgatgatt tttgatctat 300
taacagatat ataaatgcaa aaactgcata accactttaa ctaatacttt caacattttc 360
ggtttgtatt acttcttatt caaatgtaat aaaagtatca acaaaaaatt gttaatatac 420
ctctatactt taacgtcaag gagaaaaaac cccggatcgg actactagca gctgtaatac 480
gactcactat agggaatatt aagctatcaa acaagtttgt acaaaaaagc aggctgaatt 540
caaaatgtgt gcaacttcat cccaattcac tcaaatcaca gagcataatt ctagacgttc 600
agctaactac caaccaaatc tgtggaattt tgaatttctt caatcccttg aaaatgattt 660
gaaagtggaa aagttggagg aaaaagccac aaaactagag gaagaagtta gatgtatgat 720
aaacagagta gatacacaac ctctgtcact actagaattg attgacgatg tccagaggct 780
gggtttaaca tataagttcg aaaaggatat aatcaaagcc ttagaaaaca tagtccttct 840
agatgaaaac aagaagaata agtctgactt gcacgcaacc gctctgagtt ttagattgct 900
gagacaacat ggttttgaag taagtcaaga tgtgtttgaa aggttcaaag acaaagaggg 960
aggattctca ggagaattaa agggagatgt gcagggtctg ttgtcattgt acgaggccag 1020
ttatttgggg tttgaagggg aaaatctact agaggaggcc agaaccttct ctataaccca 1080
tctgaagaat aacttgaaag aaggcatcaa tacaaaagtg gctgaacaag tttcacatgc 1140
attggaattg ccctaccacc aaagacttca tagacttgaa gccagatggt ttttggacaa 1200
gtatgaacca aaggagcctc accatcaact tttattggaa ttagcaaaac tggattttaa 1260
catggttcag acattacacc agaaagaatt gcaggaccta tcaagatggt ggacggagat 1320
gggtttagcc agcaagttag atttcgttag agatagattg atggaagttt acttttgggc 1380
actgggaatg gcaccagatc ctcaatttgg tgaatgtaga aaggcagtta caaagatgtt 1440
tggtctagta acaatcattg atgatgttta tgatgtgtac ggaactttgg atgaattaca 1500
actattcacc gacgcagttg aacgttggga tgtaaacgca ataaacacgt tgcctgatta 1560
tatgaagctg tgttttctgg cattgtacaa cacagtcaat gacacttctt actccatttt 1620
aaaggagaaa gggcataaca atctatccta tttgacaaaa tcatggaggg agttatgcaa 1680
agcattcctt caagaagcta agtggtctaa caataagata atcccagcat tctccaagta 1740
tcttgaaaac gcttccgtat cctcctccgg tgtggcccta ctagcaccat catatttttc 1800
cgtctgccag cagcaggaag atatctctga tcatgctttg agatccttaa cagattttca 1860
tggtctagtc agatcctctt gcgtgatttt cagattgtgc aatgatttgg ctacttcagc 1920
cgcagagtta gagaggggtg aaaccacgaa ctcaattatt agttatatgc acgagaatga 1980
tggaacatcc gaagaacaag cccgtgaaga attaagaaaa ctgatcgatg ctgaatggaa 2040
gaagatgaat agagaaagag tttccgacag cactttgctg cctaaagcat tcatggagat 2100
agctgttaac atggctaggg tttcacactg tacataccaa tacggggacg gtcttggaag 2160
gcccgactac gccactgaaa atagaattaa actgctactg attgatcctt tccccattaa 2220
ccagttaatg tacgtgtaat agggatccga attcacccag ctttcttgta caaagtggtt 2280
cgatctagag ggcccttcga aggtaagcct atccctaacc ctctcctcgg tctcgattct 2340
acgcgtaccg gtcatcatca ccatcaccat tgagtttaaa cccgctgatc ctagagggcc 2400
gcatcatgta attagttatg tcacgcttac attcacgccc tccccccaca tccgctctaa 2460
ccgaaaagga aggagttaga caacctgaag tctaggtccc tatttatttt tttatagtta 2520
tgttagtatt aagaacgtta tttatatttc aaatttttct tttttttctg tacagacgcg 2580
tgtacgcatg taacattata ctgaaaacct tgcttgagaa ggttttggga cgctcgaagg 2640
ctttaatttg caagctgcgg ccctgcatta atgaatcggc caacgcgcgg ggagaggcgg 2700
tttgcgtatt gggcgctctt ccgcttcctc gctcactgac tcgctgcgct cggtcgttcg 2760
gctgcggcga gcggtatcag ctcactcaaa ggcggtaata cggttatcca cagaatcagg 2820
ggataacgca ggaaagaaca tgtgagcaaa aggccagcaa aagcccagga accgtaaaaa 2880
ggccgcgttg ctggcgtttt tccataggct ccgcccccct gacgagcatc acaaaaatcg 2940
acgctcaagt cagaggtggc gaaacccgac aggactataa agataccagg cgtttccccc 3000
tggaagctcc ctcgtgcgct ctcctgttcc gaccctgccg cttaccggat acctgtccgc 3060
ctttctccct tcgggaagcg tggcgctttc tcatagctca cgctgtaggt atctcagttc 3120
ggtgtaggtc gttcgctcca agctgggctg tgtgcacgaa ccccccgttc agcccgaccg 3180
ctgcgcctta tccggtaact atcgtcttga gtccaacccg gtaagacacg acttatcgcc 3240
actggcagca gccactggta acaggattag cagagcgagg tatgtaggcg gtgctacaga 3300
gttcttgaag tggtggccta actacggcta cactagaagg acagtatttg gtatctgcgc 3360
tctgctgaag ccagttacct tcggaaaaag agttggtagc tcttgatccg gcaaacaaac 3420
caccgctggt agcggtggtt tttttgtttg caagcagcag attacgcgca gaaaaaaagg 3480
atctcaagaa gatcctttga tcttttctac ggggtctgac gctcagtgga acgaaaactc 3540
acgttaaggg attttggtca tgagattatc aaaaaggatc ttcacctaga tccttttaaa 3600
ttaaaaatga agttttaaat caatctaaag tatatatgag taaacttggt ctgacagtta 3660
ccaatgctta atcagtgagg cacctatctc agcgatctgt ctatttcgtt catccatagt 3720
tgcctgactc cccgtcgtgt agataactac gatacgggag cgcttaccat ctggccccag 3780
tgctgcaatg ataccgcgag acccacgctc accggctcca gatttatcag caataaacca 3840
gccagccgga agggccgagc gcagaagtgg tcctgcaact ttatccgcct ccatccagtc 3900
tattaattgt tgccgggaag ctagagtaag tagttcgcca gttaatagtt tgcgcaacgt 3960
tgttggcatt gctacaggca tcgtggtgtc actctcgtcg tttggtatgg cttcattcag 4020
ctccggttcc caacgatcaa ggcgagttac atgatccccc atgttgtgca aaaaagcggt 4080
tagctccttc ggtcctccga tcgttgtcag aagtaagttg gccgcagtgt tatcactcat 4140
ggttatggca gcactgcata attctcttac tgtcatgcca tccgtaagat gcttttctgt 4200
gactggtgag tactcaacca agtcattctg agaatagtgt atgcggcgac cgagttgctc 4260
ttgcccggcg tcaatacggg ataatagtgt atcacatagc agaactttaa aagtgctcat 4320
cattggaaaa cgttcttcgg ggcgaaaact ctcaaggatc ttaccgctgt tgagatccag 4380
ttcgatgtaa cccactcgtg cacccaactg atcttcagca tcttttactt tcaccagcgt 4440
ttctgggtga gcaaaaacag gaaggcaaaa tgccgcaaaa aagggaataa gggcgacacg 4500
gaaatgttga atactcatac tcttcctttt tcaatgggta ataactgata taattaaatt 4560
gaagctctaa tttgtgagtt tagtatacat gcatttactt ataatacagt tttttagttt 4620
tgctggccgc atcttctcaa atatgcttcc cagcctgctt ttctgtaacg ttcaccctct 4680
accttagcat cccttccctt tgcaaatagt cctcttccaa caataataat gtcagatcct 4740
gtagagacca catcatccac ggttctatac tgttgaccca atgcgtctcc cttgtcatct 4800
aaacccacac cgggtgtcat aatcaaccaa tcgtaacctt catctcttcc acccatgtct 4860
ctttgagcaa taaagccgat aacaaaatct ttgtcgctct tcgcaatgtc aacagtaccc 4920
ttagtatatt ctccagtaga tagggagccc ttgcatgaca attctgctaa catcaaaagg 4980
cctctaggtt cctttgttac ttcttctgcc gcctgcttca aaccgctaac aatacctggg 5040
cccaccacac cgtgtgcatt cgtaatgtct gcccattctg ctattctgta tacacccgca 5100
gagtactgca atttgactgt attaccaatg tcagcaaatt ttctgtcttc gaagagtaaa 5160
aaattgtact tggcggataa tgcctttagc ggcttaactg tgccctccat ggaaaaatca 5220
gtcaagatat ccacatgtgt ttttagtaaa caaattttgg gacctaatgc ttcaactaac 5280
tccagtaatt ccttggtggt acgaacatcc aatgaagcac acaagtttgt ttgcttttcg 5340
tgcatgatat taaatagctt ggcagcaaca ggactaggat gagtagcagc acgttcctta 5400
tatgtagctt tcgacatgat ttatcttcgt ttcctgcagg tttttgttct gtgcagttgg 5460
gttaagaata ctgggcaatt tcatgtttct tcaacactac atatgcgtat atataccaat 5520
ctaagtctgt gctccttcct tcgttcttcc ttctgttcgg agattaccga atcaaaaaaa 5580
tttcaaagaa accgaaatca aaaaaaagaa taaaaaaaaa atgatgaatt gaattgaaaa 5640
gctagcttat cgatgataag ctgtcaaaga tgagaattaa ttccacggac tatagactat 5700
actagatact ccgtctactg tacgatacac ttccgctcag gtccttgtcc tttaacgagg 5760
ccttaccact cttttgttac tctattgatc cagctcagca aaggcagtgt gatctaagat 5820
tctatcttcg cgatgtagta aaactagcta gaccgagaaa gagactagaa atgcaaaagg 5880
cacttctaca atggctgcca tcattattat ccgatgtgac gctgcagctt ctcaatgata 5940
ttcgaatacg ctttgaggag atacagccta atatccgaca aactgtttta cagatttacg 6000
atcgtacttg ttacccatca ttgaattttg aacatccgaa cctgggagtt ttccctgaaa 6060
cagatagtat atttgaacct gtataataat atatagtcta gcgctttacg gaagacaatg 6120
tatgtatttc ggttcctgga gaaactattg catctattgc ataggtaatc ttgcacgtcg 6180
catccccggt tcattttctg cgtttccatc ttgcacttca atagcatatc tttgttaacg 6240
aagcatctgt gcttcatttt gtagaacaaa aatgcaacgc gagagcgcta atttttcaaa 6300
caaagaatct gagctgcatt tttacagaac agaaatgcaa cgcgaaagcg ctattttacc 6360
aacgaagaat ctgtgcttca tttttgtaaa acaaaaatgc aacgcgacga gagcgctaat 6420
ttttcaaaca aagaatctga gctgcatttt tacagaacag aaatgcaacg cgagagcgct 6480
attttaccaa caaagaatct atacttcttt tttgttctac aaaaatgcat cccgagagcg 6540
ctatttttct aacaaagcat cttagattac tttttttctc ctttgtgcgc tctataatgc 6600
agtctcttga taactttttg cactgtaggt ccgttaaggt tagaagaagg ctactttggt 6660
gtctattttc tcttccataa aaaaagcctg actccacttc ccgcgtttac tgattactag 6720
cgaagctgcg ggtgcatttt ttcaagataa aggcatcccc gattatattc tataccgatg 6780
tggattgcgc atactttgtg aacagaaagt gatagcgttg atgattcttc attggtcaga 6840
aaattatgaa cggtttcttc tattttgtct ctatatacta cgtataggaa atgtttacat 6900
tttcgtattg ttttcgattc actctatgaa tagttcttac tacaattttt ttgtctaaag 6960
agtaatacta gagataaaca taaaaaatgt agaggtcgag tttagatgca agttcaagga 7020
gcgaaaggtg gatgggtagg ttatataggg atatagcaca gagatatata gcaaagagat 7080
acttttgagc aatgtttgtg gaagcggtat tcgcaatggg aagctccacc ccggttgata 7140
atcagaaaag ccccaaaaac aggaagattg tataagcaaa tatttaaatt gtaaacgtta 7200
atattttgtt aaaattcgcg ttaaattttt gttaaatcag ctcatttttt aacgaatagc 7260
ccgaaatcgg caaaatccct tataaatcaa aagaatagac cgagataggg ttgagtgttg 7320
ttccagtttc caacaagagt ccactattaa agaacgtgga ctccaacgtc aaagggcgaa 7380
aaagggtcta tcagggcgat ggcccactac gtgaaccatc accctaatca agttttttgg 7440
ggtcgaggtg ccgtaaagca gtaaatcgga agggtaaacg gatgccccca tttagagctt 7500
gacggggaaa gccggcgaac gtggcgagaa aggaagggaa gaaagcgaaa ggagcggggg 7560
ctagggcggt gggaagtgta ggggtcacgc tgggcgtaac caccacaccc gccgcgctta 7620
atggggcgct acagggcgcg tggggatgat ccactagt 7658
<210> 40
<211> 1746
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 40
catcttaagc ttgtttaact ttaagaagga gatatacata tgtgcgccac cagcagccag 60
ttcacccaga tcaccgagca taatagccgt cggtccgcga actaccagcc caacctgtgg 120
aacttcgagt tcctgcagag cctggaaaac gacctgaagg tggagaagct cgaagagaag 180
gccaccaagc tggaggagga ggtgcgttgc atgatcaacc gggtggacac ccagcccctg 240
agcctgctgg agctcatcga cgacgtgcag cgcctgggcc tgacctacaa gtttgagaaa 300
gatatcatca aggcgctgga gaacatcgtc ctgctggacg agaataagaa gaacaaaagc 360
gatctgcacg cgaccgccct gagcttccgc ctgctgcggc agcatggctt tgaggtgagc 420
caggacgtgt tcgagcgctt caaggacaaa gaagggggct tctccgggga actgaagggt 480
gacgtgcagg gcctgctgag cctgtacgag gccagctatc tcggtttcga aggcgaaaat 540
ctgctggagg aggcccgtac cttcagcatc acccatctga agaacaacct caaggagggg 600
atcaacacga aggtggccga gcaggtgtcc cacgcgctgg agctgccgta tcatcaacgc 660
ctgcaccgcc tggaggcgcg gtggtttctg gacaagtacg aacccaagga gccgcatcac 720
cagctgctgc tggaactggc caaactcgat ttcaacatgg tccagaccct gcaccaaaaa 780
gagctgcagg acctgagccg gtggtggacc gagatgggcc tcgccagcaa gctggatttc 840
gtgcgggacc gcctgatgga agtgtacttc tgggcgctgg gcatggcgcc ggacccgcag 900
ttcggcgaat gccgcaaggc cgtcaccaag atgttcggtc tggtcaccat tatcgatgac 960
gtctatgacg tgtacggtac cctggacgaa ctgcagctct tcaccgacgc ggtggaacgc 1020
tgggacgtga acgccatcaa cacgctgccc gactatatga agctgtgctt cctggccctg 1080
tacaacaccg tgaacgacac gtcctactcc atcctgaagg agaagggcca caataacctg 1140
agctatctga ccaaaagctg gcgcgaactg tgcaaggcct tcctgcaaga agccaagtgg 1200
agcaataaca agatcatccc cgccttcagc aagtacctgg agaacgccag cgtgtcctcc 1260
agcggggtcg cgctgctggc gccgagctac ttctcggtct gccagcagca ggaagatatc 1320
tcggaccacg ccctccgctc cctgaccgac ttccacggcc tggtgcgctc gtcctgcgtg 1380
atctttcggc tgtgcaacga tctggcgacc tcggcggcgg aactcgaacg cggcgaaacc 1440
accaacagca tcatcagcta catgcacgag aacgacggca cgagcgagga acaggcccgc 1500
gaagagctgc gcaagctgat cgacgccgag tggaagaaaa tgaaccgcga gcgcgtgtcg 1560
gacagcaccc tgctgccgaa ggcgttcatg gagatcgccg tgaacatggc ccgcgtgagc 1620
cactgcacct accaatatgg ggacgggctg ggccgcccgg attacgccac cgagaaccgc 1680
atcaagctgc tgctcatcga cccgttcccc atcaaccagc tgatgtacgt gtgaggatcc 1740
cgtaac 1746
<210> 41
<211> 4768
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 41
ctcgggccgt ctcttgggct tgatcggcct tcttgcgcat ctcacgcgct cctgcggcgg 60
cctgtagggc aggctcatac ccctgccgaa ccgcttttgt cagccggtcg gccacggctt 120
ccggcgtctc aacgcgcttt gagattccca gcttttcggc caatccctgc ggtgcatagg 180
cgcgtggctc gaccgcttgc gggctgatgg tgacgtggcc cactggtggc cgctccaggg 240
cctcgtagaa cgcctgaatg cgcgtgtgac gtgccttgct gccctcgatg ccccgttgca 300
gccctagatc ggccacagcg gccgcaaacg tggtctggtc gcgggtcatc tgcgctttgt 360
tgccgatgaa ctccttggcc gacagcctgc cgtcctgcgt cagcggcacc acgaacgcgg 420
tcatgtgcgg gctggtttcg tcacggtgga tgctggccgt cacgatgcga tccgccccgt 480
acttgtccgc cagccacttg tgcgccttct cgaagaacgc cgcctgctgt tcttggctgg 540
ccgacttcca ccattccggg ctggccgtca tgacgtactc gaccgccaac acagcgtcct 600
tgcgccgctt ctctggcagc aactcgcgca gtcggcccat cgcttcatcg gtgctgctgg 660
ccgcccagtg ctcgttctct ggcgtcctgc tggcgtcagc gttgggcgtc tcgcgctcgc 720
ggtaggcgtg cttgagactg gccgccacgt tgcccatttt cgccagcttc ttgcatcgca 780
tgatcgcgta tgccgccatg cctgcccctc ccttttggtg tccaaccggc tcgacggggg 840
cagcgcaagg cggtgcctcc ggcgggccac tcaatgcttg agtatactca ctagactttg 900
cttcgcaaag tcgtgaccgc ctacggcggc tgcggcgccc tacgggcttg ctctccgggc 960
ttcgccctgc gcggtcgctg cgctcccttg ccagcccgtg gatatgtgga cgatggccgc 1020
gagcggccac cggctggctc gcttcgctcg gcccgtggac aaccctgctg gacaagctga 1080
tggacaggct gcgcctgccc acgagcttga ccacagggat tgcccaccgg ctacccagcc 1140
ttcgaccaca tacccaccgg ctccaactgc gcggcctgcg gccttgcccc atcaattttt 1200
ttaattttct ctggggaaaa gcctccggcc tgcggcctgc gcgcttcgct tgccggttgg 1260
acaccaagtg gaaggcgggt caaggctcgc gcagcgaccg cgcagcggct tggccttgac 1320
gcgcctggaa cgacccaagc ctatgcgagt gggggcagtc gaaggcgaag cccgcccgcc 1380
tgccccccga gcctcacggc ggcgagtgcg ggggttccaa gggggcagcg ccaccttggg 1440
caaggccgaa ggccgcgcag tcgatcaaca agccccggag gggccacttt ttgccggagg 1500
gggagccgcg ccgaaggcgt gggggaaccc cgcaggggtg cccttctttg ggcaccaaag 1560
aactagatat agggcgaaat gcgaaagact taaaaatcaa caacttaaaa aaggggggta 1620
cgcaacagct cattgcggca ccccccgcaa tagctcattg cgtaggttaa agaaaatctg 1680
taattgactg ccacttttac gcaacgcata attgttgtcg cgctgccgaa aagttgcagc 1740
tgattgcgca tggtgccgca accgtgcggc accctaccgc atggagataa gcatggccac 1800
gcagtccaga gaaatcggca ttcaagccaa gaacaagccc ggtcactggg tgcaaacgga 1860
acgcaaagcg catgaggcgt gggccgggct tattgcgagg aaacccacgg cggcaatgct 1920
gctgcatcac ctcgtggcgc agatgggcca ccagaacgcc gtggtggtca gccagaagac 1980
actttccaag ctcatcggac gttctttgcg gacggtccaa tacgcagtca aggacttggt 2040
ggccgagcgc tggatctccg tcgtgaagct caacggcccc ggcaccgtgt cggcctacgt 2100
ggtcaatgac cgcgtggcgt ggggccagcc ccgcgaccag ttgcgcctgt cggtgttcag 2160
tgccgccgtg gtggttgatc acgacgacca ggacgaatcg ctgttggggc atggcgacct 2220
gcgccgcatc ccgaccctgt atccgggcga gcagcaacta ccgaccggcc ccggcgagga 2280
gccgcccagc cagcccggca ttccgggcat ggaaccagac ctgccagcct tgaccgaaac 2340
ggaggaatgg gaacggcgcg ggcagcagcg cctgccgatg cccgatgagc cgtgttttct 2400
ggacgatggc gagccgttgg agccgccgac acgggtcacg ctgccgcgcc ggtagcactt 2460
gggttgcgca gcaacccgta agtgcgctgt tccagactat cggctgtagc cgcctcgccg 2520
ccctatacct tgtctgcctc cccgcgttgc gtcgcggtgc atggagccgg gccacctcga 2580
cctgaatgga agccggcggc acctcgctaa cggattcacc gtttttatca ggctctggga 2640
ggcagaataa atgatcatat cgtcaattat tacctccacg gggagagcct gagcaaactg 2700
gcctcaggca tttgagaagc acacggtcac actgcttccg gtagtcaata aaccggtaaa 2760
ccagcaatag acataagcgg ctatttaacg accctgccct gaaccgacga ccgggtcgaa 2820
tttgctttcg aatttctgcc attcatccgc ttattatcac ttattcaggc gtagcaccag 2880
gcgtttaagg gcaccaataa ctgccttaaa aaaattacgc cccgccctgc cactcatcgc 2940
agtcggccta ttggttaaaa aatgagctga tttaacaaaa atttaacgcg aattttaaca 3000
aaatattaac gcttacaatt tccattcgcc attcaggctg cgcaactgtt gggaagggcg 3060
atcggtgcgg gcctcttcgc tattacgcca gctggcgaaa gggggatgtg ctgcaaggcg 3120
attaagttgg gtaacgccag ggttttccca gtcacgacgt tgtaaaacga cggccagtga 3180
gcgcgcgtaa tacgactcac tatagggcga attggagctc caccgcggtg gcggccgctc 3240
tagaactagt ggatcccccg ggctgcagga attcgatatc aagcttatcg ataccgtcga 3300
cctcgagggg gggcccggta cccagctttt gttcccttta gtgagggtta attgcgcgct 3360
tggcgtaatc atggtcatag ctgtttcctg tgtgaaattg ttatccgctc acaattccac 3420
acaacatacg agccggaagc ataaagtgta aagcctgggg tgcctaatga gtgagctaac 3480
tcacattaat tgcgttgcgc tcactgcccg ctttccagtc gggaaacctg tcgtgccagc 3540
tgcattaatg aatcggccaa cgcgcgggga gaggcggttt gcgtattggg cgcatgcata 3600
aaaactgttg taattcatta agcattctgc cgacatggaa gccatcacaa acggcatgat 3660
gaacctgaat cgccagcggc atcagcacct tgtcgccttg cgtataatat ttgcccatgg 3720
acgcacaccg tggaaacgga tgaaggcacg aacccagttg acataagcct gttcggttcg 3780
taaactgtaa tgcaagtagc gtatgcgctc acgcaactgg tccagaacct tgaccgaacg 3840
cagcggtggt aacggcgcag tggcggtttt catggcttgt tatgactgtt tttttgtaca 3900
gtctatgcct cgggcatcca agcagcaagc gcgttacgcc gtgggtcgat gtttgatgtt 3960
atggagcagc aacgatgtta cgcagcagca acgatgttac gcagcagggc agtcgcccta 4020
aaacaaagtt aggtggctca agtatgggca tcattcgcac atgtaggctc ggccctgacc 4080
aagtcaaatc catgcgggct gctcttgatc ttttcggtcg tgagttcgga gacgtagcca 4140
cctactccca acatcagccg gactccgatt acctcgggaa cttgctccgt agtaagacat 4200
tcatcgcgct tgctgccttc gaccaagaag cggttgttgg cgctctcgcg gcttacgttc 4260
tgcccaggtt tgagcagccg cgtagtgaga tctatatcta tgatctcgca gtctccggcg 4320
agcaccggag gcagggcatt gccaccgcgc tcatcaatct cctcaagcat gaggccaacg 4380
cgcttggtgc ttatgtgatc tacgtgcaag cagattacgg tgacgatccc gcagtggctc 4440
tctatacaaa gttgggcata cgggaagaag tgatgcactt tgatatcgac ccaagtaccg 4500
ccacctaaca attcgttcaa gccgagatcg gcttcccggc cgcggagttg ttcggtaaat 4560
tgtcacaacg ccgccaggtg gcacttttcg gggaaatgtg cgcgcccgcg ttcctgctgg 4620
cgctgggcct gtttctggcg ctggacttcc cgctgttccg tcagcagctt ttcgcccacg 4680
gccttgatga tcgcggcggc cttggcctgc atatcccgat tcaacggccc cagggcgtcc 4740
agaacgggct tcaggcgctc ccgaaggt 4768
<210> 42
<211> 6466
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 42
ctcgggccgt ctcttgggct tgatcggcct tcttgcgcat ctcacgcgct cctgcggcgg 60
cctgtagggc aggctcatac ccctgccgaa ccgcttttgt cagccggtcg gccacggctt 120
ccggcgtctc aacgcgcttt gagattccca gcttttcggc caatccctgc ggtgcatagg 180
cgcgtggctc gaccgcttgc gggctgatgg tgacgtggcc cactggtggc cgctccaggg 240
cctcgtagaa cgcctgaatg cgcgtgtgac gtgccttgct gccctcgatg ccccgttgca 300
gccctagatc ggccacagcg gccgcaaacg tggtctggtc gcgggtcatc tgcgctttgt 360
tgccgatgaa ctccttggcc gacagcctgc cgtcctgcgt cagcggcacc acgaacgcgg 420
tcatgtgcgg gctggtttcg tcacggtgga tgctggccgt cacgatgcga tccgccccgt 480
acttgtccgc cagccacttg tgcgccttct cgaagaacgc cgcctgctgt tcttggctgg 540
ccgacttcca ccattccggg ctggccgtca tgacgtactc gaccgccaac acagcgtcct 600
tgcgccgctt ctctggcagc aactcgcgca gtcggcccat cgcttcatcg gtgctgctgg 660
ccgcccagtg ctcgttctct ggcgtcctgc tggcgtcagc gttgggcgtc tcgcgctcgc 720
ggtaggcgtg cttgagactg gccgccacgt tgcccatttt cgccagcttc ttgcatcgca 780
tgatcgcgta tgccgccatg cctgcccctc ccttttggtg tccaaccggc tcgacggggg 840
cagcgcaagg cggtgcctcc ggcgggccac tcaatgcttg agtatactca ctagactttg 900
cttcgcaaag tcgtgaccgc ctacggcggc tgcggcgccc tacgggcttg ctctccgggc 960
ttcgccctgc gcggtcgctg cgctcccttg ccagcccgtg gatatgtgga cgatggccgc 1020
gagcggccac cggctggctc gcttcgctcg gcccgtggac aaccctgctg gacaagctga 1080
tggacaggct gcgcctgccc acgagcttga ccacagggat tgcccaccgg ctacccagcc 1140
ttcgaccaca tacccaccgg ctccaactgc gcggcctgcg gccttgcccc atcaattttt 1200
ttaattttct ctggggaaaa gcctccggcc tgcggcctgc gcgcttcgct tgccggttgg 1260
acaccaagtg gaaggcgggt caaggctcgc gcagcgaccg cgcagcggct tggccttgac 1320
gcgcctggaa cgacccaagc ctatgcgagt gggggcagtc gaaggcgaag cccgcccgcc 1380
tgccccccga gcctcacggc ggcgagtgcg ggggttccaa gggggcagcg ccaccttggg 1440
caaggccgaa ggccgcgcag tcgatcaaca agccccggag gggccacttt ttgccggagg 1500
gggagccgcg ccgaaggcgt gggggaaccc cgcaggggtg cccttctttg ggcaccaaag 1560
aactagatat agggcgaaat gcgaaagact taaaaatcaa caacttaaaa aaggggggta 1620
cgcaacagct cattgcggca ccccccgcaa tagctcattg cgtaggttaa agaaaatctg 1680
taattgactg ccacttttac gcaacgcata attgttgtcg cgctgccgaa aagttgcagc 1740
tgattgcgca tggtgccgca accgtgcggc accctaccgc atggagataa gcatggccac 1800
gcagtccaga gaaatcggca ttcaagccaa gaacaagccc ggtcactggg tgcaaacgga 1860
acgcaaagcg catgaggcgt gggccgggct tattgcgagg aaacccacgg cggcaatgct 1920
gctgcatcac ctcgtggcgc agatgggcca ccagaacgcc gtggtggtca gccagaagac 1980
actttccaag ctcatcggac gttctttgcg gacggtccaa tacgcagtca aggacttggt 2040
ggccgagcgc tggatctccg tcgtgaagct caacggcccc ggcaccgtgt cggcctacgt 2100
ggtcaatgac cgcgtggcgt ggggccagcc ccgcgaccag ttgcgcctgt cggtgttcag 2160
tgccgccgtg gtggttgatc acgacgacca ggacgaatcg ctgttggggc atggcgacct 2220
gcgccgcatc ccgaccctgt atccgggcga gcagcaacta ccgaccggcc ccggcgagga 2280
gccgcccagc cagcccggca ttccgggcat ggaaccagac ctgccagcct tgaccgaaac 2340
ggaggaatgg gaacggcgcg ggcagcagcg cctgccgatg cccgatgagc cgtgttttct 2400
ggacgatggc gagccgttgg agccgccgac acgggtcacg ctgccgcgcc ggtagcactt 2460
gggttgcgca gcaacccgta agtgcgctgt tccagactat cggctgtagc cgcctcgccg 2520
ccctatacct tgtctgcctc cccgcgttgc gtcgcggtgc atggagccgg gccacctcga 2580
cctgaatgga agccggcggc acctcgctaa cggattcacc gtttttatca ggctctggga 2640
ggcagaataa atgatcatat cgtcaattat tacctccacg gggagagcct gagcaaactg 2700
gcctcaggca tttgagaagc acacggtcac actgcttccg gtagtcaata aaccggtaaa 2760
ccagcaatag acataagcgg ctatttaacg accctgccct gaaccgacga ccgggtcgaa 2820
tttgctttcg aatttctgcc attcatccgc ttattatcac ttattcaggc gtagcaccag 2880
gcgtttaagg gcaccaataa ctgccttaaa aaaattacgc cccgccctgc cactcatcgc 2940
agtcggccta ttggttaaaa aatgagctga tttaacaaaa atttaacgcg aattttaaca 3000
aaatattaac gcttacaatt tccattcgcc attcaggctg cgcaactgtt gggaagggcg 3060
atcggtgcgg gcctcttcgc tattacgcca gctggcgaaa gggggatgtg ctgcaaggcg 3120
attaagttgg gtaacgccag ggttttccca gtcacgacgt tgtaaaacga cggccagtga 3180
gcgcgcgtaa tacgactcac tatagggcga attggagctc caccgcggtg gcggccgctc 3240
tagaactagt ggatcctcac acgtacatca gctggttgat ggggaacggg tcgatgagca 3300
gcagcttgat gcggttctcg gtggcgtaat ccgggcggcc cagcccgtcc ccatattggt 3360
aggtgcagtg gctcacgcgg gccatgttca cggcgatctc catgaacgcc ttcggcagca 3420
gggtgctgtc cgacacgcgc tcgcggttca ttttcttcca ctcggcgtcg atcagcttgc 3480
gcagctcttc gcgggcctgt tcctcgctcg tgccgtcgtt ctcgtgcatg tagctgatga 3540
tgctgttggt ggtttcgccg cgttcgagtt ccgccgccga ggtcgccaga tcgttgcaca 3600
gccgaaagat cacgcaggac gagcgcacca ggccgtggaa gtcggtcagg gagcggaggg 3660
cgtggtccga gatatcttcc tgctgctggc agaccgagaa gtagctcggc gccagcagcg 3720
cgaccccgct ggaggacacg ctggcgttct ccaggtactt gctgaaggcg gggatgatct 3780
tgttattgct ccacttggct tcttgcagga aggccttgca cagttcgcgc cagcttttgg 3840
tcagatagct caggttattg tggcccttct ccttcaggat ggagtaggac gtgtcgttca 3900
cggtgttgta cagggccagg aagcacagct tcatatagtc gggcagcgtg ttgatggcgt 3960
tcacgtccca gcgttccacc gcgtcggtga agagctgcag ttcgtccagg gtaccgtaca 4020
cgtcatagac gtcatcgata atggtgacca gaccgaacat cttggtgacg gccttgcggc 4080
attcgccgaa ctgcgggtcc ggcgccatgc ccagcgccca gaagtacact tccatcaggc 4140
ggtcccgcac gaaatccagc ttgctggcga ggcccatctc ggtccaccac cggctcaggt 4200
cctgcagctc tttttggtgc agggtctgga ccatgttgaa atcgagtttg gccagttcca 4260
gcagcagctg gtgatgcggc tccttgggtt cgtacttgtc cagaaaccac cgcgcctcca 4320
ggcggtgcag gcgttgatga tacggcagct ccagcgcgtg ggacacctgc tcggccacct 4380
tcgtgttgat cccctccttg aggttgttct tcagatgggt gatgctgaag gtacgggcct 4440
cctccagcag attttcgcct tcgaaaccga gatagctggc ctcgtacagg ctcagcaggc 4500
cctgcacgtc acccttcagt tccccggaga agcccccttc tttgtccttg aagcgctcga 4560
acacgtcctg gctcacctca aagccatgct gccgcagcag gcggaagctc agggcggtcg 4620
cgtgcagatc gcttttgttc ttcttattct cgtccagcag gacgatgttc tccagcgcct 4680
tgatgatatc tttctcaaac ttgtaggtca ggcccaggcg ctgcacgtcg tcgatgagct 4740
ccagcaggct caggggctgg gtgtccaccc ggttgatcat gcaacgcacc tcctcctcca 4800
gcttggtggc cttctcttcg agcttctcca ccttcaggtc gttttccagg ctctgcagga 4860
actcgaagtt ccacaggttg ggctggtagt tcgcggaccg acggctatta tgctcggtga 4920
tctgggtgaa ctggctgctg gtggcgcaca tatgtatatc tccttcttaa agttaaacaa 4980
gcttatcgat accgtcgacc tcgagggggg gcccggtacc cagcttttgt tccctttagt 5040
gagggttaat tgcgcgcttg gcgtaatcat ggtcatagct gtttcctgtg tgaaattgtt 5100
atccgctcac aattccacac aacatacgag ccggaagcat aaagtgtaaa gcctggggtg 5160
cctaatgagt gagctaactc acattaattg cgttgcgctc actgcccgct ttccagtcgg 5220
gaaacctgtc gtgccagctg cattaatgaa tcggccaacg cgcggggaga ggcggtttgc 5280
gtattgggcg catgcataaa aactgttgta attcattaag cattctgccg acatggaagc 5340
catcacaaac ggcatgatga acctgaatcg ccagcggcat cagcaccttg tcgccttgcg 5400
tataatattt gcccatggac gcacaccgtg gaaacggatg aaggcacgaa cccagttgac 5460
ataagcctgt tcggttcgta aactgtaatg caagtagcgt atgcgctcac gcaactggtc 5520
cagaaccttg accgaacgca gcggtggtaa cggcgcagtg gcggttttca tggcttgtta 5580
tgactgtttt tttgtacagt ctatgcctcg ggcatccaag cagcaagcgc gttacgccgt 5640
gggtcgatgt ttgatgttat ggagcagcaa cgatgttacg cagcagcaac gatgttacgc 5700
agcagggcag tcgccctaaa acaaagttag gtggctcaag tatgggcatc attcgcacat 5760
gtaggctcgg ccctgaccaa gtcaaatcca tgcgggctgc tcttgatctt ttcggtcgtg 5820
agttcggaga cgtagccacc tactcccaac atcagccgga ctccgattac ctcgggaact 5880
tgctccgtag taagacattc atcgcgcttg ctgccttcga ccaagaagcg gttgttggcg 5940
ctctcgcggc ttacgttctg cccaggtttg agcagccgcg tagtgagatc tatatctatg 6000
atctcgcagt ctccggcgag caccggaggc agggcattgc caccgcgctc atcaatctcc 6060
tcaagcatga ggccaacgcg cttggtgctt atgtgatcta cgtgcaagca gattacggtg 6120
acgatcccgc agtggctctc tatacaaagt tgggcatacg ggaagaagtg atgcactttg 6180
atatcgaccc aagtaccgcc acctaacaat tcgttcaagc cgagatcggc ttcccggccg 6240
cggagttgtt cggtaaattg tcacaacgcc gccaggtggc acttttcggg gaaatgtgcg 6300
cgcccgcgtt cctgctggcg ctgggcctgt ttctggcgct ggacttcccg ctgttccgtc 6360
agcagctttt cgcccacggc cttgatgatc gcggcggcct tggcctgcat atcccgattc 6420
aacggcccca gggcgtccag aacgggcttc aggcgctccc gaaggt 6466
<210> 43
<211> 6957
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 43
tggcgaatgg gacgcgccct gtagcggcgc attaagcgcg gcgggtgtgg tggttacgcg 60
cagcgtgacc gctacacttg ccagcgccct agcgcccgct cctttcgctt tcttcccttc 120
ctttctcgcc acgttcgccg gctttccccg tcaagctcta aatcgggggc tccctttagg 180
gttccgattt agtgctttac ggcacctcga ccccaaaaaa cttgattagg gtgatggttc 240
acgtagtggg ccatcgccct gatagacggt ttttcgccct ttgacgttgg agtccacgtt 300
ctttaatagt ggactcttgt tccaaactgg aacaacactc aaccctatct cggtctattc 360
ttttgattta taagggattt tgccgatttc ggcctattgg ttaaaaaatg agctgattta 420
acaaaaattt aacgcgaatt ttaacaaaat attaacgttt acaatttcag gtggcacttt 480
tcggggaaat gtgcgcggaa cccctatttg tttatttttc taaatacatt caaatatgta 540
tccgctcatg aattaattct tagaaaaact catcgagcat caaatgaaac tgcaatttat 600
tcatatcagg attatcaata ccatattttt gaaaaagccg tttctgtaat gaaggagaaa 660
actcaccgag gcagttccat aggatggcaa gatcctggta tcggtctgcg attccgactc 720
gtccaacatc aatacaacct attaatttcc cctcgtcaaa aataaggtta tcaagtgaga 780
aatcaccatg agtgacgact gaatccggtg agaatggcaa aagtttatgc atttctttcc 840
agacttgttc aacaggccag ccattacgct cgtcatcaaa atcactcgca tcaaccaaac 900
cgttattcat tcgtgattgc gcctgagcga gacgaaatac gcgatcgctg ttaaaaggac 960
aattacaaac aggaatcgaa tgcaaccggc gcaggaacac tgccagcgca tcaacaatat 1020
tttcacctga atcaggatat tcttctaata cctggaatgc tgttttcccg gggatcgcag 1080
tggtgagtaa ccatgcatca tcaggagtac ggataaaatg cttgatggtc ggaagaggca 1140
taaattccgt cagccagttt agtctgacca tctcatctgt aacatcattg gcaacgctac 1200
ctttgccatg tttcagaaac aactctggcg catcgggctt cccatacaat cgatagattg 1260
tcgcacctga ttgcccgaca ttatcgcgag cccatttata cccatataaa tcagcatcca 1320
tgttggaatt taatcgcggc ctagagcaag acgtttcccg ttgaatatgg ctcataacac 1380
cccttgtatt actgtttatg taagcagaca gttttattgt tcatgaccaa aatcccttaa 1440
cgtgagtttt cgttccactg agcgtcagac cccgtagaaa agatcaaagg atcttcttga 1500
gatccttttt ttctgcgcgt aatctgctgc ttgcaaacaa aaaaaccacc gctaccagcg 1560
gtggtttgtt tgccggatca agagctacca actctttttc cgaaggtaac tggcttcagc 1620
agagcgcaga taccaaatac tgtccttcta gtgtagccgt agttaggcca ccacttcaag 1680
aactctgtag caccgcctac atacctcgct ctgctaatcc tgttaccagt ggctgctgcc 1740
agtggcgata agtcgtgtct taccgggttg gactcaagac gatagttacc ggataaggcg 1800
cagcggtcgg gctgaacggg gggttcgtgc acacagccca gcttggagcg aacgacctac 1860
accgaactga gatacctaca gcgtgagcta tgagaaagcg ccacgcttcc cgaagggaga 1920
aaggcggaca ggtatccggt aagcggcagg gtcggaacag gagagcgcac gagggagctt 1980
ccagggggaa acgcctggta tctttatagt cctgtcgggt ttcgccacct ctgacttgag 2040
cgtcgatttt tgtgatgctc gtcagggggg cggagcctat ggaaaaacgc cagcaacgcg 2100
gcctttttac ggttcctggc cttttgctgg ccttttgctc acatgttctt tcctgcgtta 2160
tcccctgatt ctgtggataa ccgtattacc gcctttgagt gagctgatac cgctcgccgc 2220
agccgaacga ccgagcgcag cgagtcagtg agcgaggaag cggaagagcg cctgatgcgg 2280
tattttctcc ttacgcatct gtgcggtatt tcacaccgca tatatggtgc actctcagta 2340
caatctgctc tgatgccgca tagttaagcc agtatacact ccgctatcgc tacgtgactg 2400
ggtcatggct gcgccccgac acccgccaac acccgctgac gcgccctgac gggcttgtct 2460
gctcccggca tccgcttaca gacaagctgt gaccgtctcc gggagctgca tgtgtcagag 2520
gttttcaccg tcatcaccga aacgcgcgag gcagctgcgg taaagctcat cagcgtggtc 2580
gtgaagcgat tcacagatgt ctgcctgttc atccgcgtcc agctcgttga gtttctccag 2640
aagcgttaat gtctggcttc tgataaagcg ggccatgtta agggcggttt tttcctgttt 2700
ggtcactgat gcctccgtgt aagggggatt tctgttcatg ggggtaatga taccgatgaa 2760
acgagagagg atgctcacga tacgggttac tgatgatgaa catgcccggt tactggaacg 2820
ttgtgagggt aaacaactgg cggtatggat gcggcgggac cagagaaaaa tcactcaggg 2880
tcaatgccag cgcttcgtta atacagatgt aggtgttcca cagggtagcc agcagcatcc 2940
tgcgatgcag atccggaaca taatggtgca gggcgctgac ttccgcgttt ccagacttta 3000
cgaaacacgg aaaccgaaga ccattcatgt tgttgctcag gtcgcagacg ttttgcagca 3060
gcagtcgctt cacgttcgct cgcgtatcgg tgattcattc tgctaaccag taaggcaacc 3120
ccgccagcct agccgggtcc tcaacgacag gagcacgatc atgcgcaccc gtggggccgc 3180
catgccggcg ataatggcct gcttctcgcc gaaacgtttg gtggcgggac cagtgacgaa 3240
ggcttgagcg agggcgtgca agattccgaa taccgcaagc gacaggccga tcatcgtcgc 3300
gctccagcga aagcggtcct cgccgaaaat gacccagagc gctgccggca cctgtcctac 3360
gagttgcatg ataaagaaga cagtcataag tgcggcgacg atagtcatgc cccgcgccca 3420
ccggaaggag ctgactgggt tgaaggctct caagggcatc ggtcgagatc ccggtgccta 3480
atgagtgagc taacttacat taattgcgtt gcgctcactg cccgctttcc agtcgggaaa 3540
cctgtcgtgc cagctgcatt aatgaatcgg ccaacgcgcg gggagaggcg gtttgcgtat 3600
tgggcgccag ggtggttttt cttttcacca gtgagacggg caacagctga ttgcccttca 3660
ccgcctggcc ctgagagagt tgcagcaagc ggtccacgct ggtttgcccc agcaggcgaa 3720
aatcctgttt gatggtggtt aacggcggga tataacatga gctgtcttcg gtatcgtcgt 3780
atcccactac cgagatatcc gcaccaacgc gcagcccgga ctcggtaatg gcgcgcattg 3840
cgcccagcgc catctgatcg ttggcaacca gcatcgcagt gggaacgatg ccctcattca 3900
gcatttgcat ggtttgttga aaaccggaca tggcactcca gtcgccttcc cgttccgcta 3960
tcggctgaat ttgattgcga gtgagatatt tatgccagcc agccagacgc agacgcgccg 4020
agacagaact taatgggccc gctaacagcg cgatttgctg gtgacccaat gcgaccagat 4080
gctccacgcc cagtcgcgta ccgtcttcat gggagaaaat aatactgttg atgggtgtct 4140
ggtcagagac atcaagaaat aacgccggaa cattagtgca ggcagcttcc acagcaatgg 4200
catcctggtc atccagcgga tagttaatga tcagcccact gacgcgttgc gcgagaagat 4260
tgtgcaccgc cgctttacag gcttcgacgc cgcttcgttc taccatcgac accaccacgc 4320
tggcacccag ttgatcggcg cgagatttaa tcgccgcgac aatttgcgac ggcgcgtgca 4380
gggccagact ggaggtggca acgccaatca gcaacgactg tttgcccgcc agttgttgtg 4440
ccacgcggtt gggaatgtaa ttcagctccg ccatcgccgc ttccactttt tcccgcgttt 4500
tcgcagaaac gtggctggcc tggttcacca cgcgggaaac ggtctgataa gagacaccgg 4560
catactctgc gacatcgtat aacgttactg gtttcacatt caccaccctg aattgactct 4620
cttccgggcg ctatcatgcc ataccgcgaa aggttttgcg ccattcgatg gtgtccggga 4680
tctcgacgct ctcccttatg cgactcctgc attaggaagc agcccagtag taggttgagg 4740
ccgttgagca ccgccgccgc aaggaatggt gcatgcaagg agatggcgcc caacagtccc 4800
ccggccacgg ggcctgccac catacccacg ccgaaacaag cgctcatgag cccgaagtgg 4860
cgagcccgat cttccccatc ggtgatgtcg gcgatatagg cgccagcaac cgcacctgtg 4920
gcgccggtga tgccggccac gatgcgtccg gcgtagagga tcgagatctc gatcccgcga 4980
aattaatacg actcactata ggggaattgt gagcggataa caattcccct ctagaaataa 5040
ttttgtttaa ctttaagaag gagatataca tatgcgttgt agcgtgtcca ccgaaaatgt 5100
gtctttcacc gaaactgaaa ccgaagctcg tcgttctgcg aactacgaac ctaacagctg 5160
ggactatgat tacctgctgt cctccgacac ggacgagtcc atcgaagtat acaaagacaa 5220
agcgaaaaag ctggaagccg aagttcgtcg cgagattaat aacgaaaaag cagaatttct 5280
gaccctgctg gaactgattg acaacgtcca gcgcctgggc ctgggttacc gtttcgagtc 5340
tgatatccgt ggtgcgctgg atcgcttcgt ttcctccggc ggcttcgatg cggtaaccaa 5400
gacttccctg cacggtacgg cactgtcttt ccgtctgctg cgtcaacacg gttttgaggt 5460
ttctcaggaa gcgttcagcg gcttcaaaga ccaaaacggc aacttcctgg agaacctgaa 5520
ggaagatatc aaagctatcc tgagcctgta cgaggccagc ttcctggctc tggaaggcga 5580
aaacatcctg gacgaggcga aggttttcgc aatctctcat ctgaaagaac tgtctgaaga 5640
aaagatcggt aaagagctgg cagaacaggt gaaccatgca ctggaactgc cactgcatcg 5700
ccgtactcag cgtctggaag cagtatggtc tatcgaggcc taccgtaaaa aggaggacgc 5760
gaatcaggtt ctgctggagc tggcaattct ggattacaac atgatccagt ctgtatacca 5820
gcgtgatctg cgtgaaacgt cccgttggtg gcgtcgtgtg ggtctggcga ccaaactgca 5880
ctttgctcgt gaccgcctga ttgagagctt ctactgggcc gtgggtgtag cattcgaacc 5940
gcaatactcc gactgccgta actccgtcgc aaaaatgttt tctttcgtaa ccattatcga 6000
cgatatctac gatgtatacg gcaccctgga cgaactggag ctgtttactg atgcagttga 6060
gcgttgggac gtaaacgcca tcaacgacct gccggattac atgaaactgt gctttctggc 6120
tctgtataac actattaacg aaatcgccta cgacaacctg aaagataaag gtgagaacat 6180
cctgccgtat ctgaccaaag cctgggctga cctgtgcaac gctttcctgc aagaagccaa 6240
gtggctgtac aacaaatcta ctccgacctt tgacgactac ttcggcaacg catggaaatc 6300
ctcttctggc ccgctgcaac tggtgttcgc ttacttcgct gtcgtgcaga acattaaaaa 6360
ggaagagatc gaaaacctgc aaaaatacca tgacaccatc tctcgtcctt cccatatctt 6420
ccgtctgtgc aatgacctgg ctagcgcgtc tgcggaaatt gcgcgtggtg aaaccgcaaa 6480
tagcgtttct tgttacatgc gcactaaagg tatctccgaa gaactggcta ccgaaagcgt 6540
gatgaatctg atcgatgaaa cctggaaaaa gatgaacaag gaaaaactgg gtggtagcct 6600
gttcgcgaaa ccgttcgtgg aaaccgcgat caacctggca cgtcaatctc actgcactta 6660
tcataacggc gacgcgcata cctctccgga tgagctgacc cgcaaacgcg ttctgtctgt 6720
aatcactgaa ccgattctgc cgtttgaacg ctaaggatcc gaattcgagc tccgtcgaca 6780
agcttgcggc cgcactcgag caccaccacc accaccactg agatccggct gctaacaaag 6840
cccgaaagga agctgagttg gctgctgcca ccgctgagca ataactagca taaccccttg 6900
gggcctctaa acgggtcttg aggggttttt tgctgaaagg aggaactata tccggat 6957
<210> 44
<211> 6068
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 44
gtttgacagc ttatcatcga ctgcacggtg caccaatgct tctggcgtca ggcagccatc 60
ggaagctgtg gtatggctgt gcaggtcgta aatcactgca taattcgtgt cgctcaaggc 120
gcactcccgt tctggataat gttttttgcg ccgacatcat aacggttctg gcaaatattc 180
tgaaatgagc tgttgacaat taatcatccg gctcgtataa tgtgtggaat tgtgagcgga 240
taacaatttc acacaggaaa cagcgccgct gagaaaaagc gaagcggcac tgctctttaa 300
caatttatca gacaatctgt gtgggcactc gaccggaatt atcgattaac tttattatta 360
aaaattaaag aggtatatat taatgtatcg attaaataag gaggaataaa ccatgagatg 420
tagcgtgtcc accgaaaatg tgtctttcac cgaaactgaa accgaagctc gtcgttctgc 480
gaactacgaa cctaacagct gggactatga ttacctgctg tcctccgaca cggacgagtc 540
catcgaagta tacaaagaca aagcgaaaaa gctggaagcc gaagttcgtc gcgagattaa 600
taacgaaaaa gcagaatttc tgaccctgct ggaactgatt gacaacgtcc agcgcctggg 660
cctgggttac cgtttcgagt ctgatatccg tggtgcgctg gatcgcttcg tttcctccgg 720
cggcttcgat gcggtaacca agacttccct gcacggtacg gcactgtctt tccgtctgct 780
gcgtcaacac ggttttgagg tttctcagga agcgttcagc ggcttcaaag accaaaacgg 840
caacttcctg gagaacctga aggaagatat caaagctatc ctgagcctgt acgaggccag 900
cttcctggct ctggaaggcg aaaacatcct ggacgaggcg aaggttttcg caatctctca 960
tctgaaagaa ctgtctgaag aaaagatcgg taaagagctg gcagaacagg tgaaccatgc 1020
actggaactg ccactgcatc gccgtactca gcgtctggaa gcagtatggt ctatcgaggc 1080
ctaccgtaaa aaggaggacg cgaatcaggt tctgctggag ctggcaattc tggattacaa 1140
catgatccag tctgtatacc agcgtgatct gcgtgaaacg tcccgttggt ggcgtcgtgt 1200
gggtctggcg accaaactgc actttgctcg tgaccgcctg attgagagct tctactgggc 1260
cgtgggtgta gcattcgaac cgcaatactc cgactgccgt aactccgtcg caaaaatgtt 1320
ttctttcgta accattatcg acgatatcta cgatgtatac ggcaccctgg acgaactgga 1380
gctgtttact gatgcagttg agcgttggga cgtaaacgcc atcaacgacc tgccggatta 1440
catgaaactg tgctttctgg ctctgtataa cactattaac gaaatcgcct acgacaacct 1500
gaaagataaa ggtgagaaca tcctgccgta tctgaccaaa gcctgggctg acctgtgcaa 1560
cgctttcctg caagaagcca agtggctgta caacaaatct actccgacct ttgacgacta 1620
cttcggcaac gcatggaaat cctcttctgg cccgctgcaa ctggtgttcg cttacttcgc 1680
tgtcgtgcag aacattaaaa aggaagagat cgaaaacctg caaaaatacc atgacaccat 1740
ctctcgtcct tcccatatct tccgtctgtg caatgacctg gctagcgcgt ctgcggaaat 1800
tgcgcgtggt gaaaccgcaa atagcgtttc ttgttacatg cgcactaaag gtatctccga 1860
agaactggct accgaaagcg tgatgaatct gatcgatgaa acctggaaaa agatgaacaa 1920
ggaaaaactg ggtggtagcc tgttcgcgaa accgttcgtg gaaaccgcga tcaacctggc 1980
acgtcaatct cactgcactt atcataacgg cgacgcgcat acctctccgg atgagctgac 2040
ccgcaaacgc gttctgtctg taatcactga accgattctg ccgtttgaac gctaactgca 2100
gctggtacca tatgggaatt cgaagctttc tagaacaaaa actcatctca gaagaggatc 2160
tgaatagcgc cgtcgaccat catcatcatc atcattgagt ttaaacggtc tccagcttgg 2220
ctgttttggc ggatgagaga agattttcag cctgatacag attaaatcag aacgcagaag 2280
cggtctgata aaacagaatt tgcctggcgg cagtagcgcg gtggtcccac ctgaccccat 2340
gccgaactca gaagtgaaac gccgtagcgc cgatggtagt gtggggtctc cccatgcgag 2400
agtagggaac tgccaggcat caaataaaac gaaaggctca gtcgaaagac tgggcctttc 2460
gttttatctg ttgtttgtcg gtgaacgctc tcctgagtag gacaaatccg ccgggagcgg 2520
atttgaacgt tgcgaagcaa cggcccggag ggtggcgggc aggacgcccg ccataaactg 2580
ccaggcatca aattaagcag aaggccatcc tgacggatgg cctttttgcg tttctacaaa 2640
ctctttttgt ttatttttct aaatacattc aaatatgtat ccgctcatga gacaataacc 2700
ctgataaatg cttcaataat attgaaaaag gaagagtatg agtattcaac atttccgtgt 2760
cgcccttatt cccttttttg cggcattttg ccttcctgtt tttgctcacc cagaaacgct 2820
ggtgaaagta aaagatgctg aagatcagtt gggtgcacga gtgggttaca tcgaactgga 2880
tctcaacagc ggtaagatcc ttgagagttt tcgccccgaa gaacgttttc caatgatgag 2940
cacttttaaa gttctgctat gtggcgcggt attatcccgt gttgacgccg ggcaagagca 3000
actcggtcgc cgcatacact attctcagaa tgacttggtt gagtactcac cagtcacaga 3060
aaagcatctt acggatggca tgacagtaag agaattatgc agtgctgcca taaccatgag 3120
tgataacact gcggccaact tacttctgac aacgatcgga ggaccgaagg agctaaccgc 3180
ttttttgcac aacatggggg atcatgtaac tcgccttgat cgttgggaac cggagctgaa 3240
tgaagccata ccaaacgacg agcgtgacac cacgatgcct gtagcaatgg caacaacgtt 3300
gcgcaaacta ttaactggcg aactacttac tctagcttcc cggcaacaat taatagactg 3360
gatggaggcg gataaagttg caggaccact tctgcgctcg gcccttccgg ctggctggtt 3420
tattgctgat aaatctggag ccggtgagcg tgggtctcgc ggtatcattg cagcactggg 3480
gccagatggt aagccctccc gtatcgtagt tatctacacg acggggagtc aggcaactat 3540
ggatgaacga aatagacaga tcgctgagat aggtgcctca ctgattaagc attggtaact 3600
gtcagaccaa gtttactcat atatacttta gattgattta aaacttcatt tttaatttaa 3660
aaggatctag gtgaagatcc tttttgataa tctcatgacc aaaatccctt aacgtgagtt 3720
ttcgttccac tgagcgtcag accccgtaga aaagatcaaa ggatcttctt gagatccttt 3780
ttttctgcgc gtaatctgct gcttgcaaac aaaaaaacca ccgctaccag cggtggtttg 3840
tttgccggat caagagctac caactctttt tccgaaggta actggcttca gcagagcgca 3900
gataccaaat actgtccttc tagtgtagcc gtagttaggc caccacttca agaactctgt 3960
agcaccgcct acatacctcg ctctgctaat cctgttacca gtggctgctg ccagtggcga 4020
taagtcgtgt cttaccgggt tggactcaag acgatagtta ccggataagg cgcagcggtc 4080
gggctgaacg gggggttcgt gcacacagcc cagcttggag cgaacgacct acaccgaact 4140
gagataccta cagcgtgagc tatgagaaag cgccacgctt cccgaaggga gaaaggcgga 4200
caggtatccg gtaagcggca gggtcggaac aggagagcgc acgagggagc ttccaggggg 4260
aaacgcctgg tatctttata gtcctgtcgg gtttcgccac ctctgacttg agcgtcgatt 4320
tttgtgatgc tcgtcagggg ggcggagcct atggaaaaac gccagcaacg cggccttttt 4380
acggttcctg gccttttgct ggccttttgc tcacatgttc tttcctgcgt tatcccctga 4440
ttctgtggat aaccgtatta ccgcctttga gtgagctgat accgctcgcc gcagccgaac 4500
gaccgagcgc agcgagtcag tgagcgagga agcggaagag cgcctgatgc ggtattttct 4560
ccttacgcat ctgtgcggta tttcacaccg catatggtgc actctcagta caatctgctc 4620
tgatgccgca tagttaagcc agtatacact ccgctatcgc tacgtgactg ggtcatggct 4680
gcgccccgac acccgccaac acccgctgac gcgccctgac gggcttgtct gctcccggca 4740
tccgcttaca gacaagctgt gaccgtctcc gggagctgca tgtgtcagag gttttcaccg 4800
tcatcaccga aacgcgcgag gcagcagatc aattcgcgcg cgaaggcgaa gcggcatgca 4860
tttacgttga caccatcgaa tggtgcaaaa cctttcgcgg tatggcatga tagcgcccgg 4920
aagagagtca attcagggtg gtgaatgtga aaccagtaac gttatacgat gtcgcagagt 4980
atgccggtgt ctcttatcag accgtttccc gcgtggtgaa ccaggccagc cacgtttctg 5040
cgaaaacgcg ggaaaaagtg gaagcggcga tggcggagct gaattacatt cccaaccgcg 5100
tggcacaaca actggcgggc aaacagtcgt tgctgattgg cgttgccacc tccagtctgg 5160
ccctgcacgc gccgtcgcaa attgtcgcgg cgattaaatc tcgcgccgat caactgggtg 5220
ccagcgtggt ggtgtcgatg gtagaacgaa gcggcgtcga agcctgtaaa gcggcggtgc 5280
acaatcttct cgcgcaacgc gtcagtgggc tgatcattaa ctatccgctg gatgaccagg 5340
atgccattgc tgtggaagct gcctgcacta atgttccggc gttatttctt gatgtctctg 5400
accagacacc catcaacagt attattttct cccatgaaga cggtacgcga ctgggcgtgg 5460
agcatctggt cgcattgggt caccagcaaa tcgcgctgtt agcgggccca ttaagttctg 5520
tctcggcgcg tctgcgtctg gctggctggc ataaatatct cactcgcaat caaattcagc 5580
cgatagcgga acgggaaggc gactggagtg ccatgtccgg ttttcaacaa accatgcaaa 5640
tgctgaatga gggcatcgtt cccactgcga tgctggttgc caacgatcag atggcgctgg 5700
gcgcaatgcg cgccattacc gagtccgggc tgcgcgttgg tgcggatatc tcggtagtgg 5760
gatacgacga taccgaagac agctcatgtt atatcccgcc gtcaaccacc atcaaacagg 5820
attttcgcct gctggggcaa accagcgtgg accgcttgct gcaactctct cagggccagg 5880
cggtgaaggg caatcagctg ttgcccgtct cactggtgaa aagaaaaacc accctggcgc 5940
ccaatacgca aaccgcctct ccccgcgcgt tggccgattc attaatgcag ctggcacgac 6000
aggtttcccg actggaaagc gggcagtgag cgcaacgcaa ttaatgtgag ttagcgcgaa 6060
ttgatctg 6068
<210> 45
<211> 6906
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 45
gtttgacagc ttatcatcga ctgcacggtg caccaatgct tctggcgtca ggcagccatc 60
ggaagctgtg gtatggctgt gcaggtcgta aatcactgca taattcgtgt cgctcaaggc 120
gcactcccgt tctggataat gttttttgcg ccgacatcat aacggttctg gcaaatattc 180
tgaaatgagc tgttgacaat taatcatccg gctcgtataa tgtgtggaat tgtgagcgga 240
taacaatttc acacaggaaa cagcgccgct gagaaaaagc gaagcggcac tgctctttaa 300
caatttatca gacaatctgt gtgggcactc gaccggaatt atcgattaac tttattatta 360
aaaattaaag aggtatatat taatgtatcg attaaataag gaggaataaa ccatgagatg 420
tagcgtgtcc accgaaaatg tgtctttcac cgaaactgaa accgaagctc gtcgttctgc 480
gaactacgaa cctaacagct gggactatga ttacctgctg tcctccgaca cggacgagtc 540
catcgaagta tacaaagaca aagcgaaaaa gctggaagcc gaagttcgtc gcgagattaa 600
taacgaaaaa gcagaatttc tgaccctgct ggaactgatt gacaacgtcc agcgcctggg 660
cctgggttac cgtttcgagt ctgatatccg tggtgcgctg gatcgcttcg tttcctccgg 720
cggcttcgat gcggtaacca agacttccct gcacggtacg gcactgtctt tccgtctgct 780
gcgtcaacac ggttttgagg tttctcagga agcgttcagc ggcttcaaag accaaaacgg 840
caacttcctg gagaacctga aggaagatat caaagctatc ctgagcctgt acgaggccag 900
cttcctggct ctggaaggcg aaaacatcct ggacgaggcg aaggttttcg caatctctca 960
tctgaaagaa ctgtctgaag aaaagatcgg taaagagctg gcagaacagg tgaaccatgc 1020
actggaactg ccactgcatc gccgtactca gcgtctggaa gcagtatggt ctatcgaggc 1080
ctaccgtaaa aaggaggacg cgaatcaggt tctgctggag ctggcaattc tggattacaa 1140
catgatccag tctgtatacc agcgtgatct gcgtgaaacg tcccgttggt ggcgtcgtgt 1200
gggtctggcg accaaactgc actttgctcg tgaccgcctg attgagagct tctactgggc 1260
cgtgggtgta gcattcgaac cgcaatactc cgactgccgt aactccgtcg caaaaatgtt 1320
ttctttcgta accattatcg acgatatcta cgatgtatac ggcaccctgg acgaactgga 1380
gctgtttact gatgcagttg agcgttggga cgtaaacgcc atcaacgacc tgccggatta 1440
catgaaactg tgctttctgg ctctgtataa cactattaac gaaatcgcct acgacaacct 1500
gaaagataaa ggtgagaaca tcctgccgta tctgaccaaa gcctgggctg acctgtgcaa 1560
cgctttcctg caagaagcca agtggctgta caacaaatct actccgacct ttgacgacta 1620
cttcggcaac gcatggaaat cctcttctgg cccgctgcaa ctggtgttcg cttacttcgc 1680
tgtcgtgcag aacattaaaa aggaagagat cgaaaacctg caaaaatacc atgacaccat 1740
ctctcgtcct tcccatatct tccgtctgtg caatgacctg gctagcgcgt ctgcggaaat 1800
tgcgcgtggt gaaaccgcaa atagcgtttc ttgttacatg cgcactaaag gtatctccga 1860
agaactggct accgaaagcg tgatgaatct gatcgatgaa acctggaaaa agatgaacaa 1920
ggaaaaactg ggtggtagcc tgttcgcgaa accgttcgtg gaaaccgcga tcaacctggc 1980
acgtcaatct cactgcactt atcataacgg cgacgcgcat acctctccgg atgagctgac 2040
ccgcaaacgc gttctgtctg taatcactga accgattctg ccgtttgaac gctaactgca 2100
taaaggaggt aaaaaaacat ggtatcctgt tctgcgccgg gtaagattta cctgttcggt 2160
gaacacgccg tagtttatgg cgaaactgca attgcgtgtg cggtggaact gcgtacccgt 2220
gttcgcgcgg aactcaatga ctctatcact attcagagcc agatcggccg caccggtctg 2280
gatttcgaaa agcaccctta tgtgtctgcg gtaattgaga aaatgcgcaa atctattcct 2340
attaacggtg ttttcttgac cgtcgattcc gacatcccgg tgggctccgg tctgggtagc 2400
agcgcagccg ttactatcgc gtctattggt gcgctgaacg agctgttcgg ctttggcctc 2460
agcctgcaag aaatcgctaa actgggccac gaaatcgaaa ttaaagtaca gggtgccgcg 2520
tccccaaccg atacgtatgt ttctaccttc ggcggcgtgg ttaccatccc ggaacgtcgc 2580
aaactgaaaa ctccggactg cggcattgtg attggcgata ccggcgtttt ctcctccacc 2640
aaagagttag tagctaacgt acgtcagctg cgcgaaagct acccggattt gatcgaaccg 2700
ctgatgacct ctattggcaa aatctctcgt atcggcgaac aactggttct gtctggcgac 2760
tacgcatcca tcggccgcct gatgaacgtc aaccagggtc tcctggacgc cctgggcgtt 2820
aacatcttag aactgagcca gctgatctat tccgctcgtg cggcaggtgc gtttggcgct 2880
aaaatcacgg gcgctggcgg cggtggctgt atggttgcgc tgaccgctcc ggaaaaatgc 2940
aaccaagtgg cagaagcggt agcaggcgct ggcggtaaag tgactatcac taaaccgacc 3000
gagcaaggtc tgaaagtaga ttaaagtcta gttaaagttt aaacggtctc cagcttggct 3060
gttttggcgg atgagagaag attttcagcc tgatacagat taaatcagaa cgcagaagcg 3120
gtctgataaa acagaatttg cctggcggca gtagcgcggt ggtcccacct gaccccatgc 3180
cgaactcaga agtgaaacgc cgtagcgccg atggtagtgt ggggtctccc catgcgagag 3240
tagggaactg ccaggcatca aataaaacga aaggctcagt cgaaagactg ggcctttcgt 3300
tttatctgtt gtttgtcggt gaacgctctc ctgagtagga caaatccgcc gggagcggat 3360
ttgaacgttg cgaagcaacg gcccggaggg tggcgggcag gacgcccgcc ataaactgcc 3420
aggcatcaaa ttaagcagaa ggccatcctg acggatggcc tttttgcgtt tctacaaact 3480
ctttttgttt atttttctaa atacattcaa atatgtatcc gctcatgaga caataaccct 3540
gataaatgct tcaataatat tgaaaaagga agagtatgag tattcaacat ttccgtgtcg 3600
cccttattcc cttttttgcg gcattttgcc ttcctgtttt tgctcaccca gaaacgctgg 3660
tgaaagtaaa agatgctgaa gatcagttgg gtgcacgagt gggttacatc gaactggatc 3720
tcaacagcgg taagatcctt gagagttttc gccccgaaga acgttttcca atgatgagca 3780
cttttaaagt tctgctatgt ggcgcggtat tatcccgtgt tgacgccggg caagagcaac 3840
tcggtcgccg catacactat tctcagaatg acttggttga gtactcacca gtcacagaaa 3900
agcatcttac ggatggcatg acagtaagag aattatgcag tgctgccata accatgagtg 3960
ataacactgc ggccaactta cttctgacaa cgatcggagg accgaaggag ctaaccgctt 4020
ttttgcacaa catgggggat catgtaactc gccttgatcg ttgggaaccg gagctgaatg 4080
aagccatacc aaacgacgag cgtgacacca cgatgcctgt agcaatggca acaacgttgc 4140
gcaaactatt aactggcgaa ctacttactc tagcttcccg gcaacaatta atagactgga 4200
tggaggcgga taaagttgca ggaccacttc tgcgctcggc ccttccggct ggctggttta 4260
ttgctgataa atctggagcc ggtgagcgtg ggtctcgcgg tatcattgca gcactggggc 4320
cagatggtaa gccctcccgt atcgtagtta tctacacgac ggggagtcag gcaactatgg 4380
atgaacgaaa tagacagatc gctgagatag gtgcctcact gattaagcat tggtaactgt 4440
cagaccaagt ttactcatat atactttaga ttgatttaaa acttcatttt taatttaaaa 4500
ggatctaggt gaagatcctt tttgataatc tcatgaccaa aatcccttaa cgtgagtttt 4560
cgttccactg agcgtcagac cccgtagaaa agatcaaagg atcttcttga gatccttttt 4620
ttctgcgcgt aatctgctgc ttgcaaacaa aaaaaccacc gctaccagcg gtggtttgtt 4680
tgccggatca agagctacca actctttttc cgaaggtaac tggcttcagc agagcgcaga 4740
taccaaatac tgtccttcta gtgtagccgt agttaggcca ccacttcaag aactctgtag 4800
caccgcctac atacctcgct ctgctaatcc tgttaccagt ggctgctgcc agtggcgata 4860
agtcgtgtct taccgggttg gactcaagac gatagttacc ggataaggcg cagcggtcgg 4920
gctgaacggg gggttcgtgc acacagccca gcttggagcg aacgacctac accgaactga 4980
gatacctaca gcgtgagcta tgagaaagcg ccacgcttcc cgaagggaga aaggcggaca 5040
ggtatccggt aagcggcagg gtcggaacag gagagcgcac gagggagctt ccagggggaa 5100
acgcctggta tctttatagt cctgtcgggt ttcgccacct ctgacttgag cgtcgatttt 5160
tgtgatgctc gtcagggggg cggagcctat ggaaaaacgc cagcaacgcg gcctttttac 5220
ggttcctggc cttttgctgg ccttttgctc acatgttctt tcctgcgtta tcccctgatt 5280
ctgtggataa ccgtattacc gcctttgagt gagctgatac cgctcgccgc agccgaacga 5340
ccgagcgcag cgagtcagtg agcgaggaag cggaagagcg cctgatgcgg tattttctcc 5400
ttacgcatct gtgcggtatt tcacaccgca tatggtgcac tctcagtaca atctgctctg 5460
atgccgcata gttaagccag tatacactcc gctatcgcta cgtgactggg tcatggctgc 5520
gccccgacac ccgccaacac ccgctgacgc gccctgacgg gcttgtctgc tcccggcatc 5580
cgcttacaga caagctgtga ccgtctccgg gagctgcatg tgtcagaggt tttcaccgtc 5640
atcaccgaaa cgcgcgaggc agcagatcaa ttcgcgcgcg aaggcgaagc ggcatgcatt 5700
tacgttgaca ccatcgaatg gtgcaaaacc tttcgcggta tggcatgata gcgcccggaa 5760
gagagtcaat tcagggtggt gaatgtgaaa ccagtaacgt tatacgatgt cgcagagtat 5820
gccggtgtct cttatcagac cgtttcccgc gtggtgaacc aggccagcca cgtttctgcg 5880
aaaacgcggg aaaaagtgga agcggcgatg gcggagctga attacattcc caaccgcgtg 5940
gcacaacaac tggcgggcaa acagtcgttg ctgattggcg ttgccacctc cagtctggcc 6000
ctgcacgcgc cgtcgcaaat tgtcgcggcg attaaatctc gcgccgatca actgggtgcc 6060
agcgtggtgg tgtcgatggt agaacgaagc ggcgtcgaag cctgtaaagc ggcggtgcac 6120
aatcttctcg cgcaacgcgt cagtgggctg atcattaact atccgctgga tgaccaggat 6180
gccattgctg tggaagctgc ctgcactaat gttccggcgt tatttcttga tgtctctgac 6240
cagacaccca tcaacagtat tattttctcc catgaagacg gtacgcgact gggcgtggag 6300
catctggtcg cattgggtca ccagcaaatc gcgctgttag cgggcccatt aagttctgtc 6360
tcggcgcgtc tgcgtctggc tggctggcat aaatatctca ctcgcaatca aattcagccg 6420
atagcggaac gggaaggcga ctggagtgcc atgtccggtt ttcaacaaac catgcaaatg 6480
ctgaatgagg gcatcgttcc cactgcgatg ctggttgcca acgatcagat ggcgctgggc 6540
gcaatgcgcg ccattaccga gtccgggctg cgcgttggtg cggatatctc ggtagtggga 6600
tacgacgata ccgaagacag ctcatgttat atcccgccgt caaccaccat caaacaggat 6660
tttcgcctgc tggggcaaac cagcgtggac cgcttgctgc aactctctca gggccaggcg 6720
gtgaagggca atcagctgtt gcccgtctca ctggtgaaaa gaaaaaccac cctggcgccc 6780
aatacgcaaa ccgcctctcc ccgcgcgttg gccgattcat taatgcagct ggcacgacag 6840
gtttcccgac tggaaagcgg gcagtgagcg caacgcaatt aatgtgagtt agcgcgaatt 6900
gatctg 6906
<210> 46
<211> 3913
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 46
gcggccgcgc ccttgacgat gccacatcct gagcaaataa ttcaaccact aattgtgagc 60
ggataacaca aggaggaaac agccatggta tcctgttctg cgccgggtaa gatttacctg 120
ttcggtgaac acgccgtagt ttatggcgaa actgcaattg cgtgtgcggt ggaactgcgt 180
acccgtgttc gcgcggaact caatgactct atcactattc agagccagat cggccgcacc 240
ggtctggatt tcgaaaagca cccttatgtg tctgcggtaa ttgagaaaat gcgcaaatct 300
attcctatta acggtgtttt cttgaccgtc gattccgaca tcccggtggg ctccggtctg 360
ggtagcagcg cagccgttac tatcgcgtct attggtgcgc tgaacgagct gttcggcttt 420
ggcctcagcc tgcaagaaat cgctaaactg ggccacgaaa tcgaaattaa agtacagggt 480
gccgcgtccc caaccgatac gtatgtttct accttcggcg gcgtggttac catcccggaa 540
cgtcgcaaac tgaaaactcc ggactgcggc attgtgattg gcgataccgg cgttttctcc 600
tccaccaaag agttagtagc taacgtacgt cagctgcgcg aaagctaccc ggatttgatc 660
gaaccgctga tgacctctat tggcaaaatc tctcgtatcg gcgaacaact ggttctgtct 720
ggcgactacg catccatcgg ccgcctgatg aacgtcaacc agggtctcct ggacgccctg 780
ggcgttaaca tcttagaact gagccagctg atctattccg ctcgtgcggc aggtgcgttt 840
ggcgctaaaa tcacgggcgc tggcggcggt ggctgtatgg ttgcgctgac cgctccggaa 900
aaatgcaacc aagtggcaga agcggtagca ggcgctggcg gtaaagtgac tatcactaaa 960
ccgaccgagc aaggtctgaa agtagattaa gccttgactt aatagctgct tatttcgccc 1020
ttatggtacc tagtaggagg aaaaaaacat ggaaatgcgt caaccggctg tcgcaggtca 1080
attctaccca ctgcgttgcg agaacctgga aaacgaactg aaacgctgct tcgaaggcct 1140
ggagatccgc gaacaagaag tgctgggcgc agtctgtccg cacgccggtt atatgtactc 1200
tggcaaagtt gcggcgcacg tctatgccac tctgccggaa gctgatacct acgtaatctt 1260
cggcccgaac cacaccggct acggtagccc tgtctctgtg agccgtgaaa cttggaagac 1320
cccgttgggc aatatcgatg ttgacctgga actggcggac ggcttcctgg gttccatcgt 1380
agatgcggat gaactcggtc acaaatacga acactctatc gaagttcagc tgccgtttct 1440
gcaataccgt tttgaacgcg atttcaaaat tctgccaatc tgcatgggta tgcaagacga 1500
agaaaccgcg gtcgaagtag gtaacctgct ggcggatctg atcagcgagt ccggtaaacg 1560
tgctgtgatc atcgcaagct ctgatttcac ccactatgag acggctgaac gtgccaaaga 1620
aatcgattcc gaagttattg attctatcct gaactttgac atctctggca tgtacgatcg 1680
cctgtatcgc cgtaacgcct ctgtttgcgg ttacggcccg atcaccgcta tgctgacggc 1740
aagcaaaaag ctgggcggct ctcgtgcgac tttgctgaaa tacgcaaaca gcggtgacgt 1800
gtccggtgat aaagacgctg tggtgggcta cgccgccatc atcgttgagt aagctgatta 1860
aaggttgaac agataggatt tcgtcatgga tcctacaagg aggaaaaaaa catgaatgct 1920
tctaatgaac cggtgattct gaaactgggt ggctctgcta ttaccgacaa aggtgcctac 1980
gaaggcgtag ttaaggaagc tgatttgctg cgcatcgcac aggaagttag cggtttccgt 2040
ggcaagatga tcgtggttca tggtgctggt agcttcggcc atacgtacgc gaagaaatac 2100
ggcctggacc gtaccttcga cccagagggc gcaattgtta ctcatgaatc tgttaaaaag 2160
ctcgcctcca aagttgtagg tgctctgaat agcttcggcg tgcgtgctat cgcggtgcat 2220
cctatggact gcgcagtatg ccgtaacggt cgtatcgaaa cgatgtatct ggactccatc 2280
aagttaatgc tggaaaaagg tctggtgccg gttctgcacg gcgacgtcgc aatggatatt 2340
gaactgggca cttgtatcct gtccggtgat caaatcgttc cttacctggc caaagaactg 2400
ggtatctccc gcctcggcct gggcagcgca gaggatggtg tgctggatat ggagggcaaa 2460
cctgtaccgg aaatcacccc agaaactttc gaagagttcc gccactgcat cggtggttct 2520
ggttctactg atgtaaccgg tggcatgctg ggcaaagtgc tggaacttct ggaattgagc 2580
aaaaattctt ccattactag ctacattttc aacgctggta aagcagacaa catctaccgc 2640
tttctgaatg gtgagtccat cggcactcgc atcagcccgg acaagcgtgt ttaagctagt 2700
tattaaccta aatgctctaa accagttatg agctctacaa ggaggaaaaa aacatgatta 2760
acactaccag ccgccgcaaa attgaacacc tgaaactctg cgcagaatcc ccggttgaag 2820
cgcgtcaggt atctgccggc tttgaagacg ttactctgat ccaccgcgct ttaccggagc 2880
tgaacatgga tgaactggac ctcagcgttg atttcctggg taaacgcatc aaagcgccgt 2940
tcctgattgc gtctatcacg ggtggtcacc cagataccat cccggttaac gctgcgctgg 3000
cagctgctgc tgaggagctg ggtgttggca tcggcgttgg ctctcagcgc gcggccattg 3060
atgatccgag ccaggaagac agcttccgtg tagtgcgtga tgaagcccca gatgcgtttg 3120
tttatggcaa cgtcggcgca gcacagatcc gtcagtatgg tgttgaaggt gttgaaaaac 3180
tgatcgaaat gattgacgca gatgccttgg caatccacct gaactttctg caagaagcgg 3240
tccaaccgga aggtgaccgc gacgcgaccg gttgcctgga catgattacc gaaatttgct 3300
ctcagattaa aactccggta atcgtgaaag aaaccggtgc aggcattagc cgtgaagatg 3360
cgattctgtt ccagaaagct ggcgtgagcg caatcgacgt tggcggcgcg ggcggcacct 3420
cctgggctgg cgtcgaggtc taccgtgcta aagaaagccg tgactctgtt agcgagcgtt 3480
taggtgagct gttttgggat ttcggcattc cgacggtagc ttctctgatt gaatcccgcg 3540
tttccttgcc gctgatcgca accggcggta tccgtaacgg tctggacatt gctaaaagca 3600
ttgctctcgg cgcaagcgct gccagcgccg ctctgccgtt cgttggtccg tccctggagg 3660
gcaaagaatc cgttgtacgt gtgctgagct gcatgctgga agaatttaaa gcagcaatgt 3720
ttttgtgcgg ttgcggcaac atcaaagacc tgcacaactc tccagtagtg gtaactggtt 3780
ggacccgcga atacctggag cagcgcggtt ttaacgttaa ggacctctcc ctgccgggca 3840
acgctctgta agcttcaacg cgtctacaaa taaaaaaggc acgtcagatg acgtgccttt 3900
tttcttgtct aga 3913
<210> 47
<211> 6647
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 47
aagggcgagc tcaacgatcc ggctgctaac aaagcccgaa aggaagctga gttggctgct 60
gccaccgctg agcaataact agcataaccc cttggggcct ctaaacgggt cttgaggagt 120
tttttgctga aaggaggaac tatatccgga tatcccgcaa gaggcccggc agtaccggca 180
taaccaagcc tatgcctaca gcatccaggg tgacggtgcc gaggatgacg atgagcgcat 240
tgttagattt catacacggt gcctgactgc gttagcaatt taactgtgat aaactaccgc 300
attaaagctt atcgatgata agctgtcaaa catgagaatt aattcttgaa gacgaaaggg 360
cctcgtgata cgcctatttt tataggttaa tgtcatgata ataatggttt cttagacgtc 420
aggtggcact tttcggggaa atgtgcgcgg aacccctatt tgtttatttt tctaaataca 480
ttcaaatatg tatccgctca tgagacaata accctgataa atgcttcaat aatattgaaa 540
aaggaagagt atgattgaac aagatggatt gcacgcaggt tctccggccg cttgggtgga 600
gaggctattc ggctatgact gggcacaact gacaatcggc tgctctgatg ccgccgtgtt 660
ccggctgtca gcgcaggggc gcccggttct ttttgtcaag accgacctgt ccggtgccct 720
gaatgaactg caggacgagg cagcgcggct atcgtggctg gccacgacgg gcgttccttg 780
cgcagctgtg ctcgacgttg tcactgaagc gggaagggac tggctgctat tgggcgaagt 840
gccggggcag gatctcctgt catctcacct tgctcctgcc gagaaagtat ccatcatggc 900
tgatgcaatg cggcggctgc atacgcttga tccggctacc tgcccattcg accaccaagc 960
gaaacatcgc atcgagcggg cacgtactcg gatggaagcc ggtcttgtcg atcaggatga 1020
tctggacgaa gagcatcagg ggctcgcgcc agccgaactg ttcgccaggc tcaaggcgcg 1080
catgcccgac ggcgaggatc tcgtcgtgac acatggcgat gcctgcttgc cgaatatcat 1140
ggtggaaaat ggccgctttt ctggattcat cgactgtggc cggctgggtg tggcggaccg 1200
ctatcaggac atagcgttgg ctacccgtga tattgctgaa gagcttggcg gcgaatgggc 1260
tgaccgcttc ctcgtgcttt acggtatcgc cgctcccgat tcgcagcgca tcgccttcta 1320
tcgccttctt gacgagttct tctgagcggg actctggggt tcgaaatgac cgaccaagcg 1380
acgcctaact gtcagaccaa gtttactcat atatacttta gattgattta aaacttcatt 1440
tttaatttaa aaggatctag gtgaagatcc tttttgataa tctcatgacc aaaatccctt 1500
aacgtgagtt ttcgttccac tgagcgtcag accccgtaga aaagatcaaa ggatcttctt 1560
gagatccttt ttttctgcgc gtaatctgct gcttgcaaac aaaaaaacca ccgctaccag 1620
cggtggtttg tttgccggat caagagctac caactctttt tccgaaggta actggcttca 1680
gcagagcgca gataccaaat actgtccttc tagtgtagcc gtagttaggc caccacttca 1740
agaactctgt agcaccgcct acatacctcg ctctgctaat cctgttacca gtggctgctg 1800
ccagtggcga taagtcgtgt cttaccgggt tggactcaag acgatagtta ccggataagg 1860
cgcagcggtc gggctgaacg gggggttcgt gcacacagcc cagcttggag cgaacgacct 1920
acaccgaact gagataccta cagcgtgagc tatgagaaag cgccacgctt cccgaaggga 1980
gaaaggcgga caggtatccg gtaagcggca gggtcggaac aggagagcgc acgagggagc 2040
ttccaggggg aaacgcctgg tatctttata gtcctgtcgg gtttcgccac ctctgacttg 2100
agcgtcgatt tttgtgatgc tcgtcagggg ggcggagcct atggaaaaac gccagcaacg 2160
cggccttttt acggttcctg gccttttgct ggccttttgc tcacatgttc tttcctgcgt 2220
tatcccctga ttctgtggat aaccgtatta ccgcctttga gtgagctgat accgctcgcc 2280
gcagccgaac gaccgagcgc agcgagtcag tgagcgagga agcggaagag cgcctgatgc 2340
ggtattttct ccttacgcat ctgtgcggta tttcacaccg caatggtgca ctctcagtac 2400
aatctgctct gatgccgcat agttaagcca gtatacactc cgctatcgct acgtgactgg 2460
gtcatggctg cgccccgaca cccgccaaca cccgctgacg cgccctgacg ggcttgtctg 2520
ctcccggcat ccgcttacag acaagctgtg accgtctccg ggagctgcat gtgtcagagg 2580
ttttcaccgt catcaccgaa acgcgcgagg cagctgcggt aaagctcatc agcgtggtcg 2640
tgaagcgatt cacagatgtc tgcctgttca tccgcgtcca gctcgttgag tttctccaga 2700
agcgttaatg tctggcttct gataaagcgg gccatgttaa gggcggtttt ttcctgtttg 2760
gtcactgatg cctccgtgta agggggattt ctgttcatgg gggtaatgat accgatgaaa 2820
cgagagagga tgctcacgat acgggttact gatgatgaac atgcccggtt actggaacgt 2880
tgtgagggta aacaactggc ggtatggatg cggcgggacc agagaaaaat cactcagggt 2940
caatgccagc gcttcgttaa tacagatgta ggtgttccac agggtagcca gcagcatcct 3000
gcgatgcaga tccggaacat aatggtgcag ggcgctgact tccgcgtttc cagactttac 3060
gaaacacgga aaccgaagac cattcatgtt gttgctcagg tcgcagacgt tttgcagcag 3120
cagtcgcttc acgttcgctc gcgtatcggt gattcattct gctaaccagt aaggcaaccc 3180
cgccagccta gccgggtcct caacgacagg agcacgatca tgcgcacccg tggccaggac 3240
ccaacgctgc ccgagatgcg ccgcgtgcgg ctgctggaga tggcggacgc gatggatatg 3300
ttctgccaag ggttggtttg cgcattcaca gttctccgca agaattgatt ggctccaatt 3360
cttggagtgg tgaatccgtt agcgaggtgc cgccggcttc cattcaggtc gaggtggccc 3420
ggctccatgc accgcgacgc aacgcgggga ggcagacaag gtatagggcg gcgcctacaa 3480
tccatgccaa cccgttccat gtgctcgccg aggcggcata aatcgccgtg acgatcagcg 3540
gtccaatgat cgaagttagg ctggtaagag ccgcgagcga tccttgaagc tgtccctgat 3600
ggtcgtcatc tacctgcctg gacagcatgg cctgcaacgc gggcatcccg atgccgccgg 3660
aagcgagaag aatcataatg gggaaggcca tccagcctcg cgtcgcgaac gccagcaaga 3720
cgtagcccag cgcgtcggcc gccatgccgg cgataatggc ctgcttctcg ccgaaacgtt 3780
tggtggcggg accagtgacg aaggcttgag cgagggcgtg caagattccg aataccgcaa 3840
gcgacaggcc gatcatcgtc gcgctccagc gaaagcggtc ctcgccgaaa atgacccaga 3900
gcgctgccgg cacctgtcct acgagttgca tgataaagaa gacagtcata agtgcggcga 3960
cgatagtcat gccccgcgcc caccggaagg agctgactgg gttgaaggct ctcaagggca 4020
tcggtcgaga tcccggtgcc taatgagtga gctaacttac attaattgcg ttgcgctcac 4080
tgcccgcttt ccagtcggga aacctgtcgt gccagctgca ttaatgaatc ggccaacgcg 4140
cggggagagg cggtttgcgt attgggcgcc agggtggttt ttcttttcac cagtgagacg 4200
ggcaacagct gattgccctt caccgcctgg ccctgagaga gttgcagcaa gcggtccacg 4260
ctggtttgcc ccagcaggcg aaaatcctgt ttgatggtgg ttaacggcgg gatataacat 4320
gagctgtctt cggtatcgtc gtatcccact accgagatat ccgcaccaac gcgcagcccg 4380
gactcggtaa tggcgcgcat tgcgcccagc gccatctgat cgttggcaac cagcatcgca 4440
gtgggaacga tgccctcatt cagcatttgc atggtttgtt gaaaaccgga catggcactc 4500
cagtcgcctt cccgttccgc tatcggctga atttgattgc gagtgagata tttatgccag 4560
ccagccagac gcagacgcgc cgagacagaa cttaatgggc ccgctaacag cgcgatttgc 4620
tggtgaccca atgcgaccag atgctccacg cccagtcgcg taccgtcttc atgggagaaa 4680
ataatactgt tgatgggtgt ctggtcagag acatcaagaa ataacgccgg aacattagtg 4740
caggcagctt ccacagcaat ggcatcctgg tcatccagcg gatagttaat gatcagccca 4800
ctgacgcgtt gcgcgagaag attgtgcacc gccgctttac aggcttcgac gccgcttcgt 4860
tctaccatcg acaccaccac gctggcaccc agttgatcgg cgcgagattt aatcgccgcg 4920
acaatttgcg acggcgcgtg cagggccaga ctggaggtgg caacgccaat cagcaacgac 4980
tgtttgcccg ccagttgttg tgccacgcgg ttgggaatgt aattcagctc cgccatcgcc 5040
gcttccactt tttcccgcgt tttcgcagaa acgtggctgg cctggttcac cacgcgggaa 5100
acggtctgat aagagacacc ggcatactct gcgacatcgt ataacgttac tggtttcaca 5160
ttcaccaccc tgaattgact ctcttccggg cgctatcatg ccataccgcg aaaggttttg 5220
cgccattcga tggtgtccgg gatctcgacg ctctccctta tgcgactcct gcattaggaa 5280
gcagcccagt agtaggttga ggccgttgag caccgccgcc gcaaggaatg gtgcatgcaa 5340
ggagatggcg cccaacagtc ccccggccac ggggcctgcc accataccca cgccgaaaca 5400
agcgctcatg agcccgaagt ggcgagcccg atcttcccca tcggtgatgt cggcgatata 5460
ggcgccagca accgcacctg tggcgccggt gatgccggcc acgatgcgtc cggcgtagag 5520
gatcgagatc tcgatcccgc gaaattaata cgactcacta taggggaatt gtgagcggat 5580
aacaattccc ctctagaaat aattttgttt aactttaaga aggagatata catatgcggg 5640
gttctcatca tcatcatcat catggtatgg ctagcatgac tggtggacag caaatgggtc 5700
gggatctgta cgacgatgac gataaggatc atcccttcac catggtatcc tgttctgcgc 5760
cgggtaagat ttacctgttc ggtgaacacg ccgtagttta tggcgaaact gcaattgcgt 5820
gtgcggtgga actgcgtacc cgtgttcgcg cggaactcaa tgactctatc actattcaga 5880
gccagatcgg ccgcaccggt ctggatttcg aaaagcaccc ttatgtgtct gcggtaattg 5940
agaaaatgcg caaatctatt cctattaacg gtgttttctt gaccgtcgat tccgacatcc 6000
cggtgggctc cggtctgggt agcagcgcag ccgttactat cgcgtctatt ggtgcgctga 6060
acgagctgtt cggctttggc ctcagcctgc aagaaatcgc taaactgggc cacgaaatcg 6120
aaattaaagt acagggtgcc gcgtccccaa ccgatacgta tgtttctacc ttcggcggcg 6180
tggttaccat cccggaacgt cgcaaactga aaactccgga ctgcggcatt gtgattggcg 6240
ataccggcgt tttctcctcc accaaagagt tagtagctaa cgtacgtcag ctgcgcgaaa 6300
gctacccgga tttgatcgaa ccgctgatga cctctattgg caaaatctct cgtatcggcg 6360
aacaactggt tctgtctggc gactacgcat ccatcggccg cctgatgaac gtcaaccagg 6420
gtctcctgga cgccctgggc gttaacatct tagaactgag ccagctgatc tattccgctc 6480
gtgcggcagg tgcgtttggc gctaaaatca cgggcgctgg cggcggtggc tgtatggttg 6540
cgctgaccgc tccggaaaaa tgcaaccaag tggcagaagc ggtagcaggc gctggcggta 6600
aagtgactat cactaaaccg accgagcaag gtctgaaagt agattaa 6647
<210> 48
<211> 7519
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 48
ctcgggccgt ctcttgggct tgatcggcct tcttgcgcat ctcacgcgct cctgcggcgg 60
cctgtagggc aggctcatac ccctgccgaa ccgcttttgt cagccggtcg gccacggctt 120
ccggcgtctc aacgcgcttt gagattccca gcttttcggc caatccctgc ggtgcatagg 180
cgcgtggctc gaccgcttgc gggctgatgg tgacgtggcc cactggtggc cgctccaggg 240
cctcgtagaa cgcctgaatg cgcgtgtgac gtgccttgct gccctcgatg ccccgttgca 300
gccctagatc ggccacagcg gccgcaaacg tggtctggtc gcgggtcatc tgcgctttgt 360
tgccgatgaa ctccttggcc gacagcctgc cgtcctgcgt cagcggcacc acgaacgcgg 420
tcatgtgcgg gctggtttcg tcacggtgga tgctggccgt cacgatgcga tccgccccgt 480
acttgtccgc cagccacttg tgcgccttct cgaagaacgc cgcctgctgt tcttggctgg 540
ccgacttcca ccattccggg ctggccgtca tgacgtactc gaccgccaac acagcgtcct 600
tgcgccgctt ctctggcagc aactcgcgca gtcggcccat cgcttcatcg gtgctgctgg 660
ccgcccagtg ctcgttctct ggcgtcctgc tggcgtcagc gttgggcgtc tcgcgctcgc 720
ggtaggcgtg cttgagactg gccgccacgt tgcccatttt cgccagcttc ttgcatcgca 780
tgatcgcgta tgccgccatg cctgcccctc ccttttggtg tccaaccggc tcgacggggg 840
cagcgcaagg cggtgcctcc ggcgggccac tcaatgcttg agtatactca ctagactttg 900
cttcgcaaag tcgtgaccgc ctacggcggc tgcggcgccc tacgggcttg ctctccgggc 960
ttcgccctgc gcggtcgctg cgctcccttg ccagcccgtg gatatgtgga cgatggccgc 1020
gagcggccac cggctggctc gcttcgctcg gcccgtggac aaccctgctg gacaagctga 1080
tggacaggct gcgcctgccc acgagcttga ccacagggat tgcccaccgg ctacccagcc 1140
ttcgaccaca tacccaccgg ctccaactgc gcggcctgcg gccttgcccc atcaattttt 1200
ttaattttct ctggggaaaa gcctccggcc tgcggcctgc gcgcttcgct tgccggttgg 1260
acaccaagtg gaaggcgggt caaggctcgc gcagcgaccg cgcagcggct tggccttgac 1320
gcgcctggaa cgacccaagc ctatgcgagt gggggcagtc gaaggcgaag cccgcccgcc 1380
tgccccccga gcctcacggc ggcgagtgcg ggggttccaa gggggcagcg ccaccttggg 1440
caaggccgaa ggccgcgcag tcgatcaaca agccccggag gggccacttt ttgccggagg 1500
gggagccgcg ccgaaggcgt gggggaaccc cgcaggggtg cccttctttg ggcaccaaag 1560
aactagatat agggcgaaat gcgaaagact taaaaatcaa caacttaaaa aaggggggta 1620
cgcaacagct cattgcggca ccccccgcaa tagctcattg cgtaggttaa agaaaatctg 1680
taattgactg ccacttttac gcaacgcata attgttgtcg cgctgccgaa aagttgcagc 1740
tgattgcgca tggtgccgca accgtgcggc accctaccgc atggagataa gcatggccac 1800
gcagtccaga gaaatcggca ttcaagccaa gaacaagccc ggtcactggg tgcaaacgga 1860
acgcaaagcg catgaggcgt gggccgggct tattgcgagg aaacccacgg cggcaatgct 1920
gctgcatcac ctcgtggcgc agatgggcca ccagaacgcc gtggtggtca gccagaagac 1980
actttccaag ctcatcggac gttctttgcg gacggtccaa tacgcagtca aggacttggt 2040
ggccgagcgc tggatctccg tcgtgaagct caacggcccc ggcaccgtgt cggcctacgt 2100
ggtcaatgac cgcgtggcgt ggggccagcc ccgcgaccag ttgcgcctgt cggtgttcag 2160
tgccgccgtg gtggttgatc acgacgacca ggacgaatcg ctgttggggc atggcgacct 2220
gcgccgcatc ccgaccctgt atccgggcga gcagcaacta ccgaccggcc ccggcgagga 2280
gccgcccagc cagcccggca ttccgggcat ggaaccagac ctgccagcct tgaccgaaac 2340
ggaggaatgg gaacggcgcg ggcagcagcg cctgccgatg cccgatgagc cgtgttttct 2400
ggacgatggc gagccgttgg agccgccgac acgggtcacg ctgccgcgcc ggtagcactt 2460
gggttgcgca gcaacccgta agtgcgctgt tccagactat cggctgtagc cgcctcgccg 2520
ccctatacct tgtctgcctc cccgcgttgc gtcgcggtgc atggagccgg gccacctcga 2580
cctgaatgga agccggcggc acctcgctaa cggattcacc gtttttatca ggctctggga 2640
ggcagaataa atgatcatat cgtcaattat tacctccacg gggagagcct gagcaaactg 2700
gcctcaggca tttgagaagc acacggtcac actgcttccg gtagtcaata aaccggtaaa 2760
ccagcaatag acataagcgg ctatttaacg accctgccct gaaccgacga ccgggtcgaa 2820
tttgctttcg aatttctgcc attcatccgc ttattatcac ttattcaggc gtagcaccag 2880
gcgtttaagg gcaccaataa ctgccttaaa aaaattacgc cccgccctgc cactcatcgc 2940
agtcggccta ttggttaaaa aatgagctga tttaacaaaa atttaacgcg aattttaaca 3000
aaatattaac gcttacaatt tccattcgcc attcaggctg cgcaactgtt gggaagggcg 3060
atcggtgcgg gcctcttcgc tattacgcca gctggcgaaa gggggatgtg ctgcaaggcg 3120
attaagttgg gtaacgccag ggttttccca gtcacgacgt tgtaaaacga cggccagtga 3180
gcgcgcgtaa tacgactcac tatagggcga attggagctc caccgcggtg gcggccgctc 3240
tagaactagt ggatcccccg ggctgcatgc tcgagcggcc gccagtgtga tggatatctg 3300
cagaattcgc ccttcttgat atcttagtgt gcgttaacca ccacccacat tggtccctgc 3360
ccgaccgcat agcggccttt ttcatgcagt agcccctgct cgccaacaat ttcgtatacc 3420
gagatgtggt gagatttttg cccggcggca atcagatact tgccgctgtg atcaacattg 3480
aagccgcgcg gctgggtttc cgttggctgg aagccttctt tactcaacac gctgccatct 3540
tccgaaacgc tgaaaacggt aatcaggctg gcggtacggt cgcaggcgta taaatggcga 3600
ccatccgggg tgatatgaat atcagccgcc caacgggtgt cggagaagtt ttccggcatc 3660
atatccagcg tctggacaca ttcgatatta ccgtgcggat ctttcagttc ccagacatcc 3720
actgagctgt ttaactcatt gacgcaatac gcatattgtt cgtttggatg gaataccata 3780
tgacgcgggc cggccccttc aacggtggtc acttccgcag ggtcctgcgc cacgagatga 3840
ccatcatcgc tgaccgtaaa caggcaaatg cgatcctgct ttaatgccgg aacccacagc 3900
gtacggttgt ccggtgagat attggcggaa tggcaaccgt ccagcccctc gaccacatcg 3960
acgacgccca ctggcaggcc atcttccaga cgcgttacgc tcacgttacc cgcattgtaa 4020
gaacctacaa agacaaactg cccctggtga tcggtggaaa tatgcgtcgg actacccggc 4080
agcgcagact ctgcggcaaa ggtcagtgcg ccatcgtccg gggcgatacg atacgccagg 4140
acgcgaaact cagggcgaac accaacatag agataacgtt tgtccgggct gaccaccatc 4200
ggctgcacct gccccggcac atcgacaacc tgtgtcagcg tcagtgcgcc ttcatgattc 4260
agattccaga cgtgaatttg ctggctctca gggctggcga tataaactgt ttgcttcatg 4320
aatgctcctt tgggttacct ccgggaaacg cggttgattt gtttagtggt tgaattattt 4380
gctcaggatg tggcatagtc aagggcgtga cggctcgcta atacaactca ctatagggct 4440
cgaggaagtt cctatacttt ctagagaata ggaacttccg cgccgcacac aaaaaccaac 4500
acacagatca tgaaaataaa gctcttttat tggtaccgaa ttcgccaggg agctctcaga 4560
cgtcgcttgg tcggtcttta ttcgaacccc agagtcccgc ttacgccccg ccctgccact 4620
catcgcagta ctgttgtaat tcattaagca ttctgccgac atggaagcca tcacaaacgg 4680
catgatgaac ctgaatcgcc agcggcatca gcaccttgtc gccttgcgta taatatttgc 4740
ccatggtgaa aacgggggcg aagaagttgt ccatattggc cacgtttaaa tcaaaactgg 4800
tgaaactcac ccagggattg gctgagacga aaaacatatt ctcaataaac cctttaggga 4860
aataggccag gttttcaccg taacacgcca catcttgcga atatatgtgt agaaactgcc 4920
ggaaatcgtc gtggtattca ctccagagcg atgaaaacgt ttcagtttgc tcatggaaaa 4980
cggtgtaaca agggtgaaca ctatcccata tcaccagctc accgtctttc attgccatac 5040
ggaattccgg atgagcattc atcaggcggg caagaatgtg aataaaggcc ggataaaact 5100
tgtgcttatt tttctttacg gtctttaaaa aggccgtaat atccagctga acggtctggt 5160
tataggtaca ttgagcaact gactgaaatg cctcaaaatg ttctttacga tgccattggg 5220
atatatcaac ggtggtatat ccagtgattt ttttctccat ggtttagttc ctcaccttgt 5280
cgtattatac tatgccgata tactatgccg atgattaatt gtcaacacgt gctgctgcag 5340
gtcgaaaggc ccggagatga ggaagaggag aacagcgcgg cagacgtgcg cttttgaagc 5400
gtgcagaatg ccgggcctcc ggaggacctt cgggcgcccg ccccgcccct gagcccgccc 5460
ctgagcccgc ccccggaccc accccttccc agcctctgag cccagaaagc gaaggagcaa 5520
agctgctatt ggccgctgcc ccaaaggcct acccgcttcc attgctcagc ggtgctgtcc 5580
atctgcacga gactagtgag acgtgctact tccatttgtc acgtcctgca cgacgcgagc 5640
tgcggggcgg gggggaactt cctgactagg ggaggagtgg aaggtggcgc gaaggggcca 5700
ccaaagaacg gagccggttg gcgcctaccg gtggatgtgg aatgtgtgcg aggccagagg 5760
ccacttgtgt agcgccaagt gcccagcggg gctgctaaag cgcatgctcc agactgcctt 5820
gggaaaagcg cctcccctac ccggtagaat gaagttccta tactttctag agaataggaa 5880
cttcgcggcc gccctttagt gagggttaat tcaactgact gtaacagcta aaattagtcg 5940
cttttggcgg taagggcgaa ttccagcaca ctggcggccg ttactagtgg atccgagctc 6000
ggtaccaagc ttgatgcagg aattcgatat caagcttatc gataccgtcg acctcgaggg 6060
ggggcccggt acccagcttt tgttcccttt agtgagggtt aattgcgcgc ttggcgtaat 6120
catggtcata gctgtttcct gtgtgaaatt gttatccgct cacaattcca cacaacatac 6180
gagccggaag cataaagtgt aaagcctggg gtgcctaatg agtgagctaa ctcacattaa 6240
ttgcgttgcg ctcactgccc gctttccagt cgggaaacct gtcgtgccag ctgcattaat 6300
gaatcggcca acgcgcgggg agaggcggtt tgcgtattgg gcgcatgcat aaaaactgtt 6360
gtaattcatt aagcattctg ccgacatgga agccatcaca aacggcatga tgaacctgaa 6420
tcgccagcgg catcagcacc ttgtcgcctt gcgtataata tttgcccatg gacgcacacc 6480
gtggaaacgg atgaaggcac gaacccagtt gacataagcc tgttcggttc gtaaactgta 6540
atgcaagtag cgtatgcgct cacgcaactg gtccagaacc ttgaccgaac gcagcggtgg 6600
taacggcgca gtggcggttt tcatggcttg ttatgactgt ttttttgtac agtctatgcc 6660
tcgggcatcc aagcagcaag cgcgttacgc cgtgggtcga tgtttgatgt tatggagcag 6720
caacgatgtt acgcagcagc aacgatgtta cgcagcaggg cagtcgccct aaaacaaagt 6780
taggtggctc aagtatgggc atcattcgca catgtaggct cggccctgac caagtcaaat 6840
ccatgcgggc tgctcttgat cttttcggtc gtgagttcgg agacgtagcc acctactccc 6900
aacatcagcc ggactccgat tacctcggga acttgctccg tagtaagaca ttcatcgcgc 6960
ttgctgcctt cgaccaagaa gcggttgttg gcgctctcgc ggcttacgtt ctgcccaggt 7020
ttgagcagcc gcgtagtgag atctatatct atgatctcgc agtctccggc gagcaccgga 7080
ggcagggcat tgccaccgcg ctcatcaatc tcctcaagca tgaggccaac gcgcttggtg 7140
cttatgtgat ctacgtgcaa gcagattacg gtgacgatcc cgcagtggct ctctatacaa 7200
agttgggcat acgggaagaa gtgatgcact ttgatatcga cccaagtacc gccacctaac 7260
aattcgttca agccgagatc ggcttcccgg ccgcggagtt gttcggtaaa ttgtcacaac 7320
gccgccaggt ggcacttttc ggggaaatgt gcgcgcccgc gttcctgctg gcgctgggcc 7380
tgtttctggc gctggacttc ccgctgttcc gtcagcagct tttcgcccac ggccttgatg 7440
atcgcggcgg ccttggcctg catatcccga ttcaacggcc ccagggcgtc cagaacgggc 7500
ttcaggcgct cccgaaggt 7519
<210> 49
<211> 37
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 49
cgtgagatca tatgtgtgcg acctcttctc aatttac 37
<210> 50
<211> 38
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 50
cggtcgacgg atccctgcag ttagacatac atcagctg 38
<210> 51
<211> 41
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 51
catatgaaag cttgtatcga ttaaataagg aggaataaac c 41
<210> 52
<211> 60
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 52
gatcatgcat tcgcccttag gaggtaaaaa aacatgtgtg cgacctcttc tcaatttact 60
60
<210> 53
<211> 31
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 53
gacatcaatt gctccatttt cttctgctat c 31
<210> 54
<211> 41
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 54
attgagaaga ggtcgcacac actctttacc ctctcctttt a 41
<210> 55
<211> 41
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 55
taaaaggaga gggtaaagag tgtgtgcgac ctcttctcaa t 41
<210> 56
<211> 41
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 56
ccaaggccgg ttttttttag acatacatca gctggttaat c 41
<210> 57
<211> 41
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 57
gattaaccag ctgatgtatg tctaaaaaaa accggccttg g 41
<210> 58
<211> 32
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 58
gacatgacgg atccgattac gaatgccgtc tc 32
<210> 59
<211> 27
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 59
gacatgaatt cctccatttt cttctgc 27
<210> 60
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 60
aggagagggt aaagagtgag 20
<210> 61
<211> 22
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 61
cttttccatc acccacctga ag 22
<210> 62
<211> 28
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 62
ggcgaaatgg tccaacaaca aaattatc 28
<210> 63
<211> 40
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 63
gcttatggat cctctagact attacacgta catcaattgg 40
<210> 64
<211> 30
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 64
caccatgtgt gcaacctcct cccagtttac 30
<210> 65
<211> 51
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 65
ggtgaattca gtctactggg gattcccaaa tctatatata ctgcaggtga c 51
<210> 66
<211> 23
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 66
gcaggtggga aactatgcac tcc 23
<210> 67
<211> 36
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 67
cctgaattct gttggattgg aggattggat agtggg 36
<210> 68
<211> 30
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 68
ggtgtcgacg tacggtcgag cttattgacc 30
<210> 69
<211> 32
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 69
ggtgggcccg cattttgcca cctacaagcc ag 32
<210> 70
<211> 40
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 70
ggtgaattct agaggatccc aacgctgttg cctacaacgg 40
<210> 71
<211> 36
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 71
ggtgcggccg ctgtctggac ctggtgagtt tccccg 36
<210> 72
<211> 37
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 72
ggtgggccca ttaaatcagt tatcgtttat ttgatag 37
<210> 73
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 73
ggtgaccagc aagtccatgg gtggtttgat catgg 35
<210> 74
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 74
ggtgcggccg cctttggagt acgactccaa ctatg 35
<210> 75
<211> 31
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 75
gcggccgcag actaaattta tttcagtctc c 31
<210> 76
<211> 28
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 76
gatcaagctt aaccggaatt gccagctg 28
<210> 77
<211> 33
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 77
gatccgatcg tcagaagaac tcgtcaagaa ggc 33
<210> 78
<211> 38
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 78
catcaatgca tcgcccttag gaggtaaaaa aaaatgac 38
<210> 79
<211> 26
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 79
ccttctgcag gacgcgttgt tatagc 26
<210> 80
<211> 60
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 80
gatcatgcat tcgcccttag gaggtaaaaa aacatgagtt ttgatattgc caaatacccg 60
60
<210> 81
<211> 31
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 81
catgctgcag ttatgccagc caggccttga t 31
<210> 82
<211> 7
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 82
aggaggt 7
<210> 83
<211> 7
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 83
aaggagg 7
<210> 84
<211> 41
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 84
aggaggtaaa aaaacatgtc attaccgttc ttaacttctg c 41
<210> 85
<211> 52
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 85
atggctgcag gcctatcgca aattagctta tgaagtccat ggtaaattcg tg 52
<210> 86
<211> 23
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 86
gaattcgccc ttctgcagct acc 23
<210> 87
<211> 38
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 87
cgactggtgc acccttaagg aggaaaaaaa catgtcag 38
<210> 88
<211> 25
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 88
gtgctggaat tcgcccttct gcagc 25
<210> 89
<211> 32
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 89
gtagatgcat gcagaattcg cccttaagga gg 32
<210> 90
<211> 25
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 90
gtgtgatgga tatctgcaga attcg 25
<210> 91
<211> 36
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 91
catcaatgca tcgcccttag gaggtaaaaa aacatg 36
<210> 92
<211> 21
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 92
actgaaacgt tttcatcgct c 21
<210> 93
<211> 50
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 93
gagacatgag ctcaggaggt aaaaaaacat gaaaacagta gttattattg 50
<210> 94
<211> 54
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 94
tttatcaatc ccaattgtca tgttttttta cctcctttat tgttttctta aatc 54
<210> 95
<211> 54
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 95
gatttaagaa aacaataaag gaggtaaaaa aacatgacaa ttgggattga taaa 54
<210> 96
<211> 40
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 96
gacatgacat agatctttag tttcgataag aacgaacggt 40
<210> 97
<211> 26
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 97
atgaaaacag tagttattat tgatgc 26
<210> 98
<211> 33
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 98
atgttattgt tttcttaaat catttaaaat agc 33
<210> 99
<211> 26
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 99
atgacaattg ggattgataa aattag 26
<210> 100
<211> 24
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 100
ttagtttcga taagaacgaa cggt 24
<210> 101
<211> 23
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 101
gaaatagccc cattagaagt atc 23
<210> 102
<211> 24
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 102
ttgccaatca tatgattgaa aatc 24
<210> 103
<211> 25
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 103
gctatgcttc attagatcct tatcg 25
<210> 104
<211> 25
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 104
gaaacctaca tccaatcttt tgccc 25
<210> 105
<211> 31
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 105
cttgatgcat cctgcattcg cccttaggag g 31
<210> 106
<211> 23
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 106
ccaggcaaat tctgttttat cag 23
<210> 107
<211> 43
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 107
gcatgctcga gcggccgctt ttaatcaaac atcctgccaa ctc 43
<210> 108
<211> 37
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 108
gatcgaaggg cgatcgtgtc acagtctggc gaaaccg 37
<210> 109
<211> 43
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 109
ctgaattctg cagatatctg tttttccact cttcgttcac ttt 43
<210> 110
<211> 33
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 110
tctagagggc ccaagaaaaa tgccccgctt acg 33
<210> 111
<211> 111
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 111
gatcgcggcc gcgcccttga cgatgccaca tcctgagcaa ataattcaac cactaattgt 60
gagcggataa cacaaggagg aaacagctat gtcattaccg ttcttaactt c 111
<210> 112
<211> 75
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 112
gatcgggccc caagaaaaaa ggcacgtcat ctgacgtgcc ttttttattt gtagacgcgt 60
tgttatagca ttcta 75
<210> 113
<211> 81
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 113
aaagtagccg aagatgacgg tttgtcacat ggagttggca ggatgtttga ttaaaagcaa 60
ttaaccctca ctaaagggcg g 81
<210> 114
<211> 160
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 114
agagtgttca ccaaaaataa taacctttcc cggtgcagaa gttaagaacg gtaatgacat 60
agctgtttcc tccttgtgtt atccgctcac aattagtggt tgaattattt gctcaggatg 120
tggcatcgtc aagggctaat acgactcact atagggctcg 160
<210> 115
<211> 27
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 115
gacatctgca gctccatttt cttctgc 27
<210> 116
<211> 42
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 116
caataataac tactgttttc actctttacc ctctcctttt aa 42
<210> 117
<211> 42
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 117
ttaaaaggag agggtaaaga gtgaaaacag tagttattat tg 42
<210> 118
<211> 45
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 118
cggggccaag gccggttttt tttagtttcg ataagaacga acggt 45
<210> 119
<211> 45
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 119
accgttcgtt cttatcgaaa ctaaaaaaaa ccggccttgg ccccg 45
<210> 120
<211> 22
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 120
caccatggta tcctgttctg cg 22
<210> 121
<211> 22
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 121
ttaatctact ttcagacctt gc 22
<210> 122
<211> 66
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 122
gcgaacgatg cataaaggag gtaaaaaaac atggtatcct gttctgcgcc gggtaagatt 60
tacctg 66
<210> 123
<211> 48
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 123
gggcccgttt aaactttaac tagactttaa tctactttca gaccttgc 48
<210> 124
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 124
caccaaagac ttcatagact 20
<210> 125
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 125
agagatatct tcctgctgct 20
<210> 126
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 126
taatacgact cactataggg 20
<210> 127
<211> 19
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 127
accaattgca cccggcaga 19
<210> 128
<211> 21
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 128
gctaaagcgc atgctccaga c 21
<210> 129
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 129
gactggcctc agatgaaagc 20
<210> 130
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 130
caaacatgtg gcatggaaag 20
<210> 131
<211> 52
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 131
gggcccgttt aaactttaac tagactctgc agttagcgtt caaacggcag aa 52
<210> 132
<211> 38
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 132
cgcatgcatg tcatgagatg tagcgtgtcc accgaaaa 38
<210> 133
<211> 22
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 133
acaatttcac acaggaaaca gc 22
<210> 134
<211> 22
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 134
gcactgtctt tccgtctgct gc 22
<210> 135
<211> 21
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 135
ggtttagttc ctcaccttgt c 21
<210> 136
<211> 21
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 136
cgtgaatttg ctggctctca g 21
<210> 137
<211> 24
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 137
gatagtaacg gctgcgctgc tacc 24
<210> 138
<211> 23
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 138
gacagcttat catcgactgc acg 23
<210> 139
<211> 67
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 139
accgccaaaa gcgactaatt ttagctgtta cagtcagttg aattaaccct cactaaaggg 60
cggccgc 67
<210> 140
<211> 152
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 140
gctggcgata taaactgttt gcttcatgaa tgctcctttg ggttacctcc gggaaacgcg 60
gttgatttgt ttagtggttg aattatttgc tcaggatgtg gcatagtcaa gggcgtgacg 120
gctcgctaat acgactcact atagggctcg ag 152
<210> 141
<211> 26
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 141
accgccaaaa gcgactaatt ttagct 26
<210> 142
<211> 30
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 142
cttgatatct tagtgtgcgt taaccaccac 30
Claims (19)
- (1) 바이오이소프렌 조성물을 이소프렌 이중합 (dimerization)에 적합한 가열 (heat) 또는 촉매적 조건에 맡겨두어 이소프렌 이중체 (isoprene dimer)를 생산한 다음, 이소프렌 이중체를 촉매적으로 수소화하여 포화된 C10 연료 성분을 형성하는 것; 또는
(2) (i) 상기 바이오이소프렌 조성물을 부분적으로 수소화하여 이소아밀렌을 생산하고, (ii) 상기 이소아밀렌을 이소아밀렌, 프로필렌 및 이소부텐으로 이루어진 그룹으로부터 선택되는 모노-올레핀과 이중합하여 디메이트 (dimate)를 형성하고, 또한 (iii) 상기 디메이트를 완전하게 수소화하여 연료 성분을 생산하는 것:
에 의해 상기 바이오이소프렌 조성물에서 이소프렌의 실질적인 부분을 비-이소프렌 화합물들로 화학적으로 변환시키는 것을 포함하는 상기 바이오이소프렌 조성물로부터 연료 성분을 생산하는 방법. - 제 1항에 있어서,
상기 바이오이소프렌 조성물에서 적어도 95%의 이소프렌은 비-이소프렌 화합물들로 전환되는, 방법 - 제 1항에 있어서,
상기 바이오이소프렌 조성물은 약 150℃ 내지 약 250℃로 가열되어 불포화된 고리형 이소프렌 이중체를 생산하고, 상기 불포화된 고리형 이소프렌 이중체는 촉매적으로 수소화되어 포화된 고리형 이소프렌 이중체 연료 성분을 생산하는, 방법. - 제 1항에 있어서,
상기 방법은 (i) 바이오이소프렌 조성물을 이소프렌의 고리-이중합 (cyclo-dimerization)을 촉매 작용하는 촉매와 접촉시켜서 불포화된 고리형 이소프렌 이중체를 생산하고, 상기 불포화된 고리형 이소프렌 이중체는 촉매적으로 수소화되어 포화된 고리형 이소프렌 이중체 연료 성분을 생산하는, 방법. - 제 4항에 있어서,
상기 이소프렌의 고리-이중합을 촉매 작용하는 촉매는 니켈 촉매, 철 촉매 및 크롬 촉매로 이루어진 그룹으로부터 선택되는 촉매를 포함하는, 방법. - 제 1항에 있어서,
상기 바이오이소프렌 조성물을 부분적으로 수소화하는 단계는 바이오이소프렌 조성물을 수소 기체 및 이소프렌의 부분적 수소화를 촉매 작용하는 촉매와 접촉시키는 것을 포함하는, 방법. - 제 6항에 있어서,
상기 이소프렌의 부분적 수소화를 촉매 작용하는 촉매는 팔라듐 촉매를 포함하는, 방법. - 제 1항에 있어서,
상기 이소아밀렌을 모노-올레핀으로 이중합하는 단계는 모노-올레핀의 이중합을 촉매 작용하는 촉매의 존재 시 상기 이소아밀렌을 상기 모노-올레핀과 접촉시키는 것을 포함하는, 방법. - 제 8항에 있어서,
상기 모노-올레핀의 이중합을 촉매 작용하는 촉매는 산 촉매를 포함하는, 방법 - 제 1항에 있어서,
상기에 더하여 상기 바이오이소프렌 조성물을 연료 성분으로 화학적으로 변환시키기 이전에 상기 바이오이소프렌 조성물로부터 이소프렌을 정제하는 것을 포함하는, 방법 - 바이오이소프렌 조성물에서 이소프렌의 실질적인 부분을 비-이소프렌 화합물들로 화학적으로 전환시키고, 시스템은 상기 바이오이소프렌 조성물 또한
(a)(i) 상기 바이오이소프렌 조성물에서 이소프렌을 이중합할 수 있는 하나 이상의 화합물 또는 상기 바이오이소프렌 조성물에서 이소프렌을 이중합할 수 있는 가열원 (source of heat); 및 (ii) 상기 이소프렌 이중체를 수소화하여 포화된 C10 연료 성분을 형성할 수 있는 촉매; 또는
(b)(i) 상기 바이오이소프렌 조성물에서 이소프렌을 부분적으로 수소화하여 이소아밀렌을 생산할 수 있는 화합물, (ii) 상기 이소아밀렌을 이소아밀렌, 프로필렌 및 이소부텐으로 이루어진 그룹으로부터 선택되는 모노-올레핀과 이중합하여 디메이트를 형성할 수 있는 화합물, 및 (iii) 상기 디메이트를 완전하게 수소화하여 연료 성분을 생산할 수 있는 화합물:
을 포함하는, 상기 바이오이소프렌 조성물로부터 연료 성분을 생산하는 시스템. - 제 11항에 있어서,
상기 바이오이소프렌 조성물은 약 2 mg 이상의 이소프렌을 포함하고, 상기 조성물에서의 모든 C5 탄화수소의 전체 무게에 대비하여 무게로 약 99.94% 이상의 이소프렌을 포함하는, 시스템. - 제 11항에 있어서,
상기 이소프렌을 이중합할 수 있는 하나 이상의 화합물은 루테늄 촉매, 니켈 촉매, 철 촉매 및 크롬 촉매로 이루어진 그룹으로부터 선택되는 촉매를 포함하는 이소프렌의 고리-이중합 (cyclo-dimerization)을 촉매 작용하는 촉매를 포함하는, 시스템. - 제 11항에 있어서,
상기 불포화된 이소프렌 이중체를 수소화하는 촉매는 팔라듐 촉매, 니켈 촉매, 루테늄 촉매 및 로듐 촉매로 이루어진 그룹으로부터 선택되는 촉매를 포함하는, 시스템. - 제 11항에 있어서,
상기 이소프렌을 부분적으로 수소화할 수 있는 화합물은 팔라듐 촉매를 포함하는, 시스템. - 제 11항에 있어서,
상기 이소아밀렌을 모노-올레핀과 이중합할 수 있는 화합물은 산 촉매를 포함하는, 시스템. - 제 1항의 방법에 의해 생산되는 연료 성분을 포함하는 연료 조성물.
- 제 17항에 있어서,
상기 연료 조성물은 실질적으로 이소프렌이 없는, 연료 조성물. - 제 17항에 있어서,
상기 연료 조성물은 -22‰ 이상 또는 -32‰내지 -24‰의 범위 이내인 δ13C 값을 가지는, 연료 조성물.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US18795909P | 2009-06-17 | 2009-06-17 | |
| US61/187,959 | 2009-06-17 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20120047908A true KR20120047908A (ko) | 2012-05-14 |
Family
ID=43356762
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020127001228A KR20120047908A (ko) | 2009-06-17 | 2010-06-17 | 이소프렌 유도체들을 포함하는 연료 조성물들 |
Country Status (16)
| Country | Link |
|---|---|
| US (2) | US8450549B2 (ko) |
| EP (1) | EP2448891A4 (ko) |
| JP (1) | JP5448220B2 (ko) |
| KR (1) | KR20120047908A (ko) |
| CN (1) | CN102803185B (ko) |
| AR (1) | AR077114A1 (ko) |
| AU (1) | AU2010262774B2 (ko) |
| BR (1) | BRPI1011952A2 (ko) |
| CA (1) | CA2765916A1 (ko) |
| MX (1) | MX2011013805A (ko) |
| MY (1) | MY155508A (ko) |
| RU (1) | RU2531623C2 (ko) |
| SG (2) | SG176875A1 (ko) |
| TW (1) | TWI434921B (ko) |
| WO (1) | WO2010148256A1 (ko) |
| ZA (1) | ZA201109375B (ko) |
Families Citing this family (47)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CA2748887A1 (en) | 2008-12-30 | 2010-07-08 | Danisco Us Inc. | Methods of producing isoprene and a co-product |
| TW201412988A (zh) | 2009-06-17 | 2014-04-01 | Danisco Us Inc | 使用dxp及mva途徑之改良之異戊二烯製造 |
| US9266792B2 (en) * | 2009-07-29 | 2016-02-23 | The United States Of America As Represented By The Secretary Of The Navy | Process and apparatus for the selective dimerization of terpenes and alpha-olefin oligomers with a single-stage reactor and a single-stage fractionation system |
| JP5643838B2 (ja) * | 2009-12-18 | 2014-12-17 | ダニスコ・ユーエス・インク | 再生可能資源からのイソプレンの精製 |
| BR112012015117A2 (pt) * | 2009-12-22 | 2019-09-24 | Danisco Us Inc | "biorreator de membrana para produção aumentada de gás isopreno" |
| US8933282B2 (en) * | 2010-06-17 | 2015-01-13 | Danisco Us Inc. | Fuel compositions comprising isoprene derivatives |
| US20120045812A1 (en) | 2010-08-06 | 2012-02-23 | Danisco Us Inc. | PRODUCTION OF ISOPRENE UNDER NEUTRAL pH CONDITIONS |
| CN103443271A (zh) | 2010-10-27 | 2013-12-11 | 丹尼斯科美国公司 | 用于增加异戊二烯产量的异戊二烯合酶变体 |
| US8691541B2 (en) | 2010-12-22 | 2014-04-08 | Danisco Us Inc. | Biological production of pentose sugars using recombinant cells |
| WO2012088462A1 (en) | 2010-12-22 | 2012-06-28 | Danisco Us Inc. | Compositions and methods for improved isoprene production using two types of ispg enzymes |
| ES2699747T3 (es) * | 2011-04-29 | 2019-02-12 | Danisco Us Inc | Microorganismos recombinantes para la producción potenciada de mevalonato, isopreno e isoprenoides |
| JP2014519811A (ja) | 2011-04-29 | 2014-08-21 | ダニスコ・ユーエス・インク | チオラーゼ、HMG−CoA合成酵素及びHMG−CoA還元酵素活性を有するポリペプチドをコードしている遺伝子を使用するメバロン酸、イソプレン、及びイソプレノイドの生産 |
| WO2013016690A1 (en) * | 2011-07-28 | 2013-01-31 | Glycos Biotechnologies, Inc. | Compositions and methods for biofermentation of oil-containing feedstocks |
| AU2012289886A1 (en) | 2011-08-04 | 2014-02-20 | Danisco Us Inc. | Production of isoprene, isoprenoid precursors, and isoprenoids using acetoacetyl-CoA synthase |
| US8951764B2 (en) | 2011-08-05 | 2015-02-10 | Danisco Us Inc. | Production of isoprenoids under neutral pH conditions |
| WO2013040210A2 (en) * | 2011-09-14 | 2013-03-21 | The Regents Of The University Of California | Methods for increasing production of 3-methyl-2-butenol using fusion proteins |
| DK2764084T4 (da) | 2011-10-07 | 2021-12-06 | Danisco Us Inc | Anvendelse af phosphoketolase i fremstillingen af mevalonat, isoprenoid-udgangsstoffer, og isopren |
| EP2794876A1 (en) | 2011-12-23 | 2014-10-29 | Danisco US Inc. | Production of isoprene under reduced oxygen inlet levels |
| EP2794863A1 (en) | 2011-12-23 | 2014-10-29 | Danisco US Inc. | Enhanced production of isoprene using host cells having decreased ispa activity |
| US9315831B2 (en) | 2012-03-30 | 2016-04-19 | Danisco Us Inc. | Direct starch to fermentable sugar as feedstock for the production of isoprene, isoprenoid precursor molecules, and/or isoprenoids |
| US8895277B2 (en) | 2012-05-02 | 2014-11-25 | Danisco Us Inc. | Legume isoprene synthase for production of isoprene |
| US9163263B2 (en) | 2012-05-02 | 2015-10-20 | The Goodyear Tire & Rubber Company | Identification of isoprene synthase variants with improved properties for the production of isoprene |
| WO2013181647A2 (en) * | 2012-06-01 | 2013-12-05 | Danisco Us Inc. | Compositions and methods of producing isoprene and/or industrrial bio-products using anaerobic microorganisms |
| WO2014047520A1 (en) | 2012-09-20 | 2014-03-27 | Danisco Us Inc. | Microtiter plates for controlled release of culture components to cell cultures |
| EP2935364A2 (en) | 2012-12-21 | 2015-10-28 | Danisco US Inc. | Production of isoprene, isoprenoid, and isoprenoid precursors using an alternative lower mevalonate pathway |
| US9914071B2 (en) * | 2013-02-07 | 2018-03-13 | Braskem S.A. | Systems and methods for separating and purifying butadiene |
| US9850512B2 (en) | 2013-03-15 | 2017-12-26 | The Research Foundation For The State University Of New York | Hydrolysis of cellulosic fines in primary clarified sludge of paper mills and the addition of a surfactant to increase the yield |
| WO2014156997A1 (ja) * | 2013-03-29 | 2014-10-02 | 味の素株式会社 | 発酵ガス中のイソプレンの回収方法および精製イソプレンの製造方法 |
| ES2735331T3 (es) | 2013-04-10 | 2019-12-18 | Goodyear Tire & Rubber | Fosfocetolasas para mejorar la producción de metabolitos derivados de acetil-coenzima A, isopreno, precursores de isoprenoides e isoprenoides |
| CN105518130A (zh) | 2013-06-21 | 2016-04-20 | 丹尼斯科美国公司 | 用于梭菌转化的组合物和方法 |
| US9371258B1 (en) * | 2013-06-27 | 2016-06-21 | The United States Of America As Represented By The Secretary Of The Navy | High density fuels from isoprene |
| US9926245B2 (en) * | 2013-09-30 | 2018-03-27 | Pioneer Energy | Fuels and chemicals from lower alkanes |
| WO2015081406A1 (en) * | 2013-12-02 | 2015-06-11 | Braskem S.A. | Fermentation hydrocarbon gas products separation via membrane |
| US10648004B2 (en) | 2014-02-20 | 2020-05-12 | Danisco Us Inc. | Recombinant microorganisms for the enhanced production of mevalonate, isoprene, isoprenoid precursors, isoprenoids, and acetyl-CoA-derived products |
| US9951363B2 (en) | 2014-03-14 | 2018-04-24 | The Research Foundation for the State University of New York College of Environmental Science and Forestry | Enzymatic hydrolysis of old corrugated cardboard (OCC) fines from recycled linerboard mill waste rejects |
| WO2016015021A1 (en) | 2014-07-24 | 2016-01-28 | The Regents Of The University Of California | Oxidative starch degradation by a new family of pmos |
| MY184132A (en) * | 2014-11-26 | 2021-03-20 | Visolis Inc | Processes for conversion of biologically derived mevalonic acid |
| DE102015000626A1 (de) * | 2015-01-22 | 2016-07-28 | Kibion Gmbh | Verfahren zum Nachweis von Helicobacter Pylori |
| BR112018016320B1 (pt) * | 2016-02-11 | 2022-07-12 | Dow Technology Investments Llc | Processo para converter olefinas em álcoois, éteres ou combinações dos mesmos |
| FR3062132B1 (fr) | 2017-01-23 | 2020-12-04 | Eitl | Produit retardateur de flamme, procede de fabrication d'un tel produit et dispositif d'extinction comportant un tel produit |
| CN108998106B (zh) * | 2018-08-27 | 2022-01-28 | 太原理工大学 | 一种焦化厂脱硫脱氨方法 |
| CN113573798A (zh) * | 2019-03-18 | 2021-10-29 | 诺沃梅尔公司 | 膜分离系统和其用途 |
| CN111909727B (zh) * | 2020-09-22 | 2022-02-01 | 中国海洋大学 | 一种异戊二烯制备饱和烃类燃料的绿色合成方法 |
| CN112588279B (zh) * | 2020-12-15 | 2022-08-02 | 华东理工大学 | 一种用于甲醇蒸汽重整制氢的催化剂的制备方法及其产品和应用 |
| US20230193148A1 (en) * | 2021-12-16 | 2023-06-22 | Battelle Memorial Institute | Method embodiments for partial hydrogenation of carbocyclic compounds to produce jet fuel blendstock |
| CN115557826B (zh) * | 2022-10-09 | 2024-09-06 | 天津大学 | 异戊二烯二聚体的制备方法、燃料及其制备方法 |
| CN115845899B (zh) * | 2022-12-02 | 2024-03-01 | 平顶山学院 | 一种催化1,3-丁二烯双羰基化合成己二酸甲酯的催化剂的制备方法 |
Family Cites Families (99)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US1338607A (en) | 1919-10-18 | 1920-04-27 | William E Bell | Electric switch |
| US3185739A (en) * | 1960-05-19 | 1965-05-25 | Phillips Petroleum Co | Conversion of cyclotriene compounds |
| US3418386A (en) | 1966-07-05 | 1968-12-24 | Columbian Carbon | Hydrogenation of cyclooctadienes to cyclooctenes |
| JPS507565B1 (ko) * | 1969-12-24 | 1975-03-27 | ||
| JPS5233110B2 (ko) | 1971-12-13 | 1977-08-26 | ||
| FR2202062B1 (ko) * | 1972-10-10 | 1975-03-14 | Elf Aquitaine Union Chimique | |
| FR2225401B1 (ko) | 1973-04-12 | 1976-05-21 | Aquitaine Petrole | |
| SU493455A1 (ru) | 1973-07-03 | 1975-11-28 | Институт Химии Башкирского Филиала Ан Ссср | Способ получени 1,5-диметилциклооктадиена 1,5 |
| JPS535642B2 (ko) * | 1973-09-08 | 1978-03-01 | ||
| SU615056A1 (ru) | 1976-08-01 | 1978-07-15 | Институт Химии Башкирского Филиала Ан Ссср | Способ получени 1,5-диметилциклооктадиена-1,5 |
| GB1575235A (en) * | 1977-01-19 | 1980-09-17 | Shell Int Research | Catalysts used for preparing 1,5-dimethyl-1,5-cyclooctadiene and 1,4-dimethyl-4-vinyl-1-cyclohexene |
| US4189403A (en) | 1977-01-19 | 1980-02-19 | Shell Oil Company | Catalyst for cyclodimerization of isoprene |
| US4181707A (en) | 1977-07-20 | 1980-01-01 | Phillips Petroleum Company | Diolefin dimerization catalyst and method for producing nitrosyl halides of iron triad metals |
| US4144278A (en) | 1977-07-20 | 1979-03-13 | Phillips Petroleum Company | Diolefin dimerization using nitrosyl halides of iron triad metals |
| FR2443877A1 (fr) * | 1978-12-11 | 1980-07-11 | Inst Francais Du Petrole | Nouvelle composition catalytique et sa mise en oeuvre pour l'oligomerisation des olefines |
| DD153820A1 (de) * | 1980-08-29 | 1982-02-03 | Ernst Alder | Verfahren zur herstellung acylischer dihydrodimerer von 1.3-dienen |
| JPS5855434A (ja) | 1981-09-28 | 1983-04-01 | Mitsubishi Petrochem Co Ltd | ジメチルシクロオクタジエンの製造方法 |
| US4740222A (en) | 1982-05-03 | 1988-04-26 | Advanced Extraction Technologies, Inc. | Recovery and purification of hydrogen from refinery and petrochemical off-gas streams |
| JPS5965026A (ja) | 1982-10-05 | 1984-04-13 | Mitsubishi Petrochem Co Ltd | 1,6−ジメチル−1,5−シクロオクタジエンの製造方法 |
| JPS59170192A (ja) * | 1983-03-18 | 1984-09-26 | Nippon Petrochem Co Ltd | 燃料組成物 |
| CA1338400C (en) | 1983-08-31 | 1996-06-18 | David H. Gelfand | Recombinant fungal cellulases |
| GB8407828D0 (en) | 1984-03-27 | 1984-05-02 | Ontario Research Foundation | In situ preparation |
| DE3560049D1 (en) * | 1984-05-10 | 1987-02-19 | Charbonnages Ste Chimique | Process for dimerizung a conjugated diene |
| FR2564089B1 (fr) * | 1984-05-10 | 1986-09-12 | Charbonnages Ste Chimique | Procede de dimerisation du butadiene-1,3 |
| US4652527A (en) | 1984-10-09 | 1987-03-24 | Celanese Corporation | Process for culturing methylophilus methylotrophus |
| US4570029A (en) | 1985-03-04 | 1986-02-11 | Uop Inc. | Process for separating isoprene |
| US4683202A (en) | 1985-03-28 | 1987-07-28 | Cetus Corporation | Process for amplifying nucleic acid sequences |
| AU607398B2 (en) | 1985-08-29 | 1991-03-07 | Genencor Inc. | Heterologous polypeptides expressed in filamentous fungi, processes for making same, and vectors for making same |
| DK122686D0 (da) | 1986-03-17 | 1986-03-17 | Novo Industri As | Fremstilling af proteiner |
| GB8610600D0 (en) | 1986-04-30 | 1986-06-04 | Novo Industri As | Transformation of trichoderma |
| US4818250A (en) | 1987-10-21 | 1989-04-04 | Lemco Energy, Inc. | Process for producing fuel from plant sources and fuel blends containing same |
| US4973568A (en) | 1989-05-08 | 1990-11-27 | The Dow Chemical Company | Preparation of a catalyst useful in the dimerization of butadiene |
| US4973787A (en) * | 1989-09-05 | 1990-11-27 | The Goodyear Tire & Rubber Company | Process for the thermal dimerization of isoprene |
| EP0562003B2 (en) | 1990-12-10 | 2015-04-01 | Danisco US Inc. | Improved saccharification of cellulose by cloning and amplification of the beta-glucosidase gene of trichoderma reesei |
| US5329057A (en) | 1991-04-19 | 1994-07-12 | The Dow Chemical Company | Process for the cyclodimerization of 1,3-butadienes to 4-vinylcyclohexenes |
| NL9201931A (nl) * | 1992-11-05 | 1994-06-01 | Dsm Nv | Werkwijze voor de dimerisatie van een geconjungeerd diëen. |
| JP3299585B2 (ja) * | 1993-03-29 | 2002-07-08 | 株式会社東芝 | 給紙装置 |
| FR2704222B1 (fr) * | 1993-04-23 | 1995-06-30 | Inst Francais Du Petrole | Procédé de codimérisation de diènes et d'oléfines. |
| WO1995004134A1 (en) | 1993-08-02 | 1995-02-09 | Genencor International, Inc. | Method of reducing complex carbohydrates in fermentation products |
| US5861271A (en) | 1993-12-17 | 1999-01-19 | Fowler; Timothy | Cellulase enzymes and systems for their expressions |
| US5575822A (en) | 1994-05-04 | 1996-11-19 | Wilkins, Jr.; Joe S. | Engine fuels |
| US5446102A (en) | 1994-08-10 | 1995-08-29 | Bridgeston, Corporation | Olefin metathesis catalysts for degelling polymerization reactors |
| US5686276A (en) | 1995-05-12 | 1997-11-11 | E. I. Du Pont De Nemours And Company | Bioconversion of a fermentable carbon source to 1,3-propanediol by a single microorganism |
| US6428767B1 (en) | 1995-05-12 | 2002-08-06 | E. I. Du Pont De Nemours And Company | Method for identifying the source of carbon in 1,3-propanediol |
| US5849970A (en) | 1995-06-23 | 1998-12-15 | The Regents Of The University Of Colorado | Materials and methods for the bacterial production of isoprene |
| DE19629568C1 (de) | 1996-07-15 | 1998-01-08 | Fraunhofer Ges Forschung | Verfahren zur Herstellung von Isopren |
| AR007876A1 (es) | 1996-07-16 | 1999-11-24 | Shell Int Research | Un metodo para modificar un combustible liquido de hidrocarburo |
| US6429349B1 (en) | 1996-08-12 | 2002-08-06 | Bp Corporation North America Inc. | Co-alkylation for gasoline RVP reduction |
| DE19637574A1 (de) | 1996-09-14 | 1998-03-26 | Braun Ag | Verfahren und Anordnung zur Abschaltung von Verbrauchern |
| US6176176B1 (en) | 1998-04-30 | 2001-01-23 | Board Of Trustees Operating Michigan State University | Apparatus for treating cellulosic materials |
| US6268328B1 (en) | 1998-12-18 | 2001-07-31 | Genencor International, Inc. | Variant EGIII-like cellulase compositions |
| US6235954B1 (en) | 1999-09-29 | 2001-05-22 | Phillips Petroleum Company | Hydrocarbon hydrogenation catalyst and process |
| MXPA02007946A (es) | 2000-02-14 | 2002-11-29 | Procter & Gamble | Composiciones y procedimientos sinteticos de combustible para motor de reaccion y para motor diesel. |
| EP1245591B1 (en) * | 2000-06-30 | 2006-11-22 | Asahi Kasei Kabushiki Kaisha | Method for hydrogenation of diene polymers and copolymers |
| FR2814173B1 (fr) | 2000-09-15 | 2005-09-16 | Inst Francais Du Petrole | Compositions de carburants diesel contenant des composes oxygenes derives du tetrahydrofurfuryle |
| US6660898B1 (en) | 2000-11-03 | 2003-12-09 | Fortum Oil & Gas Oy | Process for dimerizing light olefins to produce a fuel component |
| US7241587B2 (en) | 2001-04-04 | 2007-07-10 | Genencor International, Inc. | Method of uncoupling the catabolic pathway of glycolysis from the oxidative membrane bound pathway of glucose conversion |
| RU2184720C1 (ru) * | 2001-08-24 | 2002-07-10 | Попов Валерий Георгиевич | Способ получения димеров и олигомеров олефинов |
| US7338541B2 (en) | 2001-11-20 | 2008-03-04 | The Procter & Gamble Company | Synthetic jet fuel and diesel fuel compositions and processes |
| MXPA04010366A (es) | 2002-04-22 | 2005-02-17 | Du Pont | Sistema promotor y plasmido para ingenieria genetica. |
| US6949686B2 (en) | 2002-05-30 | 2005-09-27 | Equistar Chemicals, Lp | Pyrolysis gasoline stabilization |
| US20040004031A1 (en) | 2002-06-26 | 2004-01-08 | Boger Thorsten R. | System and process for pyrolysis gasoline hydrotreatment |
| KR101148255B1 (ko) | 2002-10-04 | 2012-08-08 | 다니스코 유에스 인크. | 고수율을 갖는 1,3-프로판디올의 생물학적 제조 방법 |
| WO2005001036A2 (en) | 2003-05-29 | 2005-01-06 | Genencor International, Inc. | Novel trichoderma genes |
| US8329603B2 (en) | 2003-09-16 | 2012-12-11 | Uop Llc | Isoparaffin-olefin alkylation |
| CN1875099B (zh) | 2003-11-21 | 2011-05-04 | 金克克国际有限公司 | 颗粒淀粉水解酶在木霉菌中的表达和从颗粒淀粉底物产生葡萄糖的方法 |
| US7521393B2 (en) | 2004-07-27 | 2009-04-21 | Süd-Chemie Inc | Selective hydrogenation catalyst designed for raw gas feed streams |
| DE102004054477A1 (de) | 2004-11-11 | 2006-05-24 | Degussa Ag | Verfahren zur Herstellung von Trimethylcyclododecatrien |
| JP5102943B2 (ja) | 2005-05-25 | 2012-12-19 | Jx日鉱日石エネルギー株式会社 | 固体リン酸触媒およびそれを用いたオレフィンの二量化反応方法 |
| US8299312B2 (en) * | 2005-10-28 | 2012-10-30 | Neste Oil Oyj | Process for dimerizing olefins |
| WO2007089901A2 (en) | 2006-02-01 | 2007-08-09 | University Of Hawaii | Metabolically engineered organisms for the production of hydrogen and hydrogenase |
| AU2007267914C1 (en) | 2006-05-26 | 2012-06-07 | Amyris, Inc. | Fuel components, fuel compositions and methods of making and using same |
| US20080009656A1 (en) | 2006-06-16 | 2008-01-10 | D Amore Michael B | Process for making isooctenes from dry isobutanol |
| US20090099401A1 (en) | 2006-06-16 | 2009-04-16 | D Amore Michael B | Process for making isooctenes from aqueous isobutanol |
| US7947478B2 (en) | 2006-06-29 | 2011-05-24 | The Regents Of The University Of California | Short chain volatile hydrocarbon production using genetically engineered microalgae, cyanobacteria or bacteria |
| DE102007023515A1 (de) * | 2006-07-05 | 2008-01-10 | Evonik Degussa Gmbh | Verfahren zur Herstellung von Dienen durch Hydrodimerisierung |
| US8049048B2 (en) | 2006-07-27 | 2011-11-01 | Swift Enterprises, Ltd. | Renewable engine fuel |
| US7846222B2 (en) | 2006-10-10 | 2010-12-07 | Amyris Biotechnologies, Inc. | Fuel compositions comprising farnesane and farnesane derivatives and method of making and using same |
| US20080236029A1 (en) | 2007-03-27 | 2008-10-02 | Wilkins Joe S | Engine fuel compositions |
| EP2152854A2 (en) | 2007-05-01 | 2010-02-17 | Acidophil LLC | Methods for the direct conversion of carbon dioxide into a hydrocarbon using a metabolically engineered photosynthetic microorganism |
| EP2173837A2 (en) | 2007-07-20 | 2010-04-14 | Amyris Biotechnologies, Inc. | Fuel compositions comprising tetramethylcyclohexane |
| US8523959B2 (en) | 2007-07-26 | 2013-09-03 | Chevron U.S.A. Inc. | Paraffinic biologically-derived distillate fuels with bio-oxygenates for improved lubricity and methods of making same |
| NZ583620A (en) | 2007-09-11 | 2012-08-31 | Sapphire Energy Inc | Methods of producing organic fuel products with photosynthetic organisms |
| US8309323B2 (en) * | 2007-11-13 | 2012-11-13 | Synthetic Genomics, Inc. | Dimethyloctane as an advanced biofuel |
| US8211189B2 (en) | 2007-12-10 | 2012-07-03 | Wisys Technology Foundation, Inc. | Lignin-solvent fuel and method and apparatus for making same |
| SG162265A1 (en) | 2007-12-13 | 2010-07-29 | Danisco Us Inc | Compositions and methods for producing isoprene |
| US8173410B2 (en) | 2008-04-23 | 2012-05-08 | Danisco Us Inc. | Isoprene synthase variants for improved microbial production of isoprene |
| RU2505605C2 (ru) | 2008-06-30 | 2014-01-27 | Дзе Гудйеар Тайр Энд Раббер Компани | Полимеры изопрена из возобновляемых источников |
| MY156256A (en) | 2008-07-02 | 2016-01-29 | Danisco Us Inc | Compositions and methods for producing isoprene free of c5 hydrocarbons under decoupling conditions and/or safe operating ranges |
| BRPI0918453A2 (pt) | 2008-09-15 | 2019-12-17 | Danisco Us Inc | sistemas usando cultura de células para a produção de isopreno |
| SG169640A1 (en) | 2008-09-15 | 2011-04-29 | Danisco Us Inc | Increased isoprene production using mevalonate kinase and isoprene synthase |
| CA2737195A1 (en) | 2008-09-15 | 2010-03-18 | The Goodyear Tire & Rubber Company | Conversion of prenyl derivatives to isoprene |
| WO2010031062A1 (en) | 2008-09-15 | 2010-03-18 | Danisco Us Inc. | Increased isoprene production using the archaeal lower mevalonate pathway |
| WO2010031068A1 (en) | 2008-09-15 | 2010-03-18 | Danisco Us Inc. | Reduction of carbon dioxide emission during isoprene production by fermentation |
| US20100099932A1 (en) | 2008-10-21 | 2010-04-22 | Ecoprene Llc | Isoprene Compositions and Methods of Use |
| CA2748887A1 (en) | 2008-12-30 | 2010-07-08 | Danisco Us Inc. | Methods of producing isoprene and a co-product |
| TW201120213A (en) | 2009-06-17 | 2011-06-16 | Danisco Us Inc | Polymerization of isoprene from renewable resources |
| JP5643838B2 (ja) | 2009-12-18 | 2014-12-17 | ダニスコ・ユーエス・インク | 再生可能資源からのイソプレンの精製 |
| US8933282B2 (en) * | 2010-06-17 | 2015-01-13 | Danisco Us Inc. | Fuel compositions comprising isoprene derivatives |
-
2010
- 2010-06-15 TW TW099119620A patent/TWI434921B/zh active
- 2010-06-16 AR ARP100102131A patent/AR077114A1/es unknown
- 2010-06-17 BR BRPI1011952A patent/BRPI1011952A2/pt not_active IP Right Cessation
- 2010-06-17 SG SG2011093077A patent/SG176875A1/en unknown
- 2010-06-17 AU AU2010262774A patent/AU2010262774B2/en not_active Ceased
- 2010-06-17 SG SG10201507749UA patent/SG10201507749UA/en unknown
- 2010-06-17 KR KR1020127001228A patent/KR20120047908A/ko not_active Application Discontinuation
- 2010-06-17 US US12/818,090 patent/US8450549B2/en not_active Expired - Fee Related
- 2010-06-17 CN CN201080036083.XA patent/CN102803185B/zh not_active Expired - Fee Related
- 2010-06-17 MX MX2011013805A patent/MX2011013805A/es active IP Right Grant
- 2010-06-17 EP EP10790225.6A patent/EP2448891A4/en not_active Withdrawn
- 2010-06-17 RU RU2012101453/04A patent/RU2531623C2/ru not_active IP Right Cessation
- 2010-06-17 CA CA2765916A patent/CA2765916A1/en not_active Abandoned
- 2010-06-17 JP JP2012516318A patent/JP5448220B2/ja not_active Expired - Fee Related
- 2010-06-17 MY MYPI2011006129A patent/MY155508A/en unknown
- 2010-06-17 WO PCT/US2010/039088 patent/WO2010148256A1/en active Application Filing
-
2011
- 2011-12-20 ZA ZA2011/09375A patent/ZA201109375B/en unknown
-
2013
- 2013-04-26 US US13/872,006 patent/US20140148623A1/en not_active Abandoned
Also Published As
| Publication number | Publication date |
|---|---|
| AU2010262774A1 (en) | 2012-01-19 |
| RU2012101453A (ru) | 2013-07-27 |
| EP2448891A4 (en) | 2013-07-24 |
| MY155508A (en) | 2015-10-30 |
| US20110046422A1 (en) | 2011-02-24 |
| JP2012530716A (ja) | 2012-12-06 |
| JP5448220B2 (ja) | 2014-03-19 |
| SG176875A1 (en) | 2012-02-28 |
| TW201120204A (en) | 2011-06-16 |
| TWI434921B (zh) | 2014-04-21 |
| CN102803185A (zh) | 2012-11-28 |
| ZA201109375B (en) | 2014-03-26 |
| AR077114A1 (es) | 2011-08-03 |
| EP2448891A1 (en) | 2012-05-09 |
| US8450549B2 (en) | 2013-05-28 |
| AU2010262774B2 (en) | 2015-12-03 |
| WO2010148256A1 (en) | 2010-12-23 |
| CA2765916A1 (en) | 2010-12-23 |
| RU2531623C2 (ru) | 2014-10-27 |
| BRPI1011952A2 (pt) | 2016-04-26 |
| SG10201507749UA (en) | 2015-10-29 |
| CN102803185B (zh) | 2016-01-06 |
| US20140148623A1 (en) | 2014-05-29 |
| MX2011013805A (es) | 2012-07-20 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR20120047908A (ko) | 이소프렌 유도체들을 포함하는 연료 조성물들 | |
| DK2443163T3 (en) | POLYMERIZATION OF ISOPREN FROM RENEWABLE RESOURCES | |
| KR20110122672A (ko) | 이소프렌 및 공-산물을 제조하는 방법 | |
| AU2021203008B2 (en) | Genetically engineered bacterium comprising energy-generating fermentation pathway | |
| KR20100118973A (ko) | 이소프렌을 생성하기 위한 조성물 및 방법 | |
| KR20110076868A (ko) | 분리 조건 및/또는 안전한 작업 범위 하에서의 c5 탄화수소가 없는 이소프렌의 제조 방법 및 조성물 | |
| KR20110038087A (ko) | 재생가능 자원으로부터의 이소프렌 중합체 | |
| AU2016203445B2 (en) | Integration of a polynucleotide encoding a polypeptide that catalyzes pyruvate to acetolactate conversion | |
| CN101365788B (zh) | Δ-9延伸酶及其在制备多不饱和脂肪酸中的用途 | |
| KR102700050B1 (ko) | 조작된 내수송/외수송을 가진 미생물 숙주에서 모유 올리고당류의 생산 | |
| CN101939434B (zh) | 用于在大豆中提高种子贮藏油脂的生成和改变脂肪酸谱的来自解脂耶氏酵母的dgat基因 | |
| KR20210149060A (ko) | Tn7-유사 트랜스포존을 사용한 rna-유도된 dna 통합 | |
| DK2087105T3 (da) | Delta 17-desaturase og anvendelse heraf ved fremstilling af flerumættede fedtsyrer | |
| KR20140092759A (ko) | 숙주 세포 및 아이소부탄올의 제조 방법 | |
| DK2663645T3 (da) | Gærstammer, der er modificeret til produktion af ethanol fra glycerol | |
| TW201111512A (en) | Improved isoprene production using the DXP and MVA pathway | |
| KR20130032897A (ko) | 알코올 발효 시의 알코올 에스테르의 생성 및 원위치에서의 생성물 제거 | |
| KR20120099509A (ko) | 재조합 숙주 세포에서 육탄당 키나아제의 발현 | |
| KR20140015136A (ko) | 3-히드록시프로피온산 및 다른 생성물의 제조 방법 | |
| KR20140113997A (ko) | 부탄올 생성을 위한 유전자 스위치 | |
| KR20120136349A (ko) | 고가의 화학적 생성물의 미생물 생산, 및 관련 조성물, 방법 및 시스템 | |
| DK2576605T3 (en) | PREPARATION OF METABOLITES | |
| KR20140099224A (ko) | 케토-아이소발레레이트 데카르복실라제 효소 및 이의 이용 방법 | |
| KR20130087013A (ko) | 추출 발효에서의 알코올 제거를 위한 오일로부터 유래되는 추출 용매 | |
| KR20220012327A (ko) | 피토칸나비노이드 및 피토칸나비노이드 전구체의 생산을 위한 방법 및 세포 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| WITN | Application deemed withdrawn, e.g. because no request for examination was filed or no examination fee was paid |