本発明は、とりわけ、イソプレン由来の燃料構成要素の組成物および産出方法を提供する。本明細書では、燃料構成要素もしくは添加物、例えば、環状イソプレン二量体および三量体、線状イソプレンオリゴマー、芳香族および脂環式イソプレン誘導体、ならびに酸化イソプレン誘導体を提供する。燃料構成要素は、商業的に有益な量の高純度イソプレンを含む出発材料の化学的変換により産出できる。一態様では、商業的に有益な量の高純度イソプレンは、Bioisopreneを含む。別の態様では、商業的に有益な量の高純度イソプレンは、Bioisopreneであることができる。別の態様では、商業的に有益な量の高純度イソプレンは、異種イソプレンシンターゼ酵素を発現する培養細胞により産出された高純度イソプレン組成物であることができる。他の態様では、高純度イソプレンは、オリゴマー化を経て、不飽和イソプレンオリゴマー、例えば、環状二量体もしくは三量体ならびに線状オリゴマーを形成する。不飽和オリゴマーを水素化して、飽和炭化水素燃料構成要素を産出し得る。いくつかの実施形態では、酸触媒の存在下における高純度イソプレンのアルコールとの反応は、燃料酸素化物を産出する。別の態様では、高純度イソプレンは、部分的に水素化してイソアミレンを産出する。いくつかの実施形態では、高純度イソプレンから得られるイソアミレン産物は、二量体化を経てイソデセンを形成する。いくつかの実施形態では、高純度イソプレンから得られるイソアミレン産物は、酸触媒の存在下でアルコールと反応し、燃料酸素化物を産出する。
再生可能な炭素から得られるBioisopreneは、化学触媒作用により種々の炭化水素燃料に変換できる。本明細書では、発酵からのイソプレンの回収方法、および続く化学触媒作用による炭化水素燃料のより高い分子量の化合物への変換方法を提供する。これらの方法は、限定するものではないが、発酵オフガスからのイソプレンの回収および精製、ならびに続く気相もしくは液相触媒作用により燃料価の化合物を提供することを含む。連続およびバッチモードの両プロセスを、本発明の範囲内に意図する。
本明細書にさらに記載しているように、Bioisoprene組成物が、限定するものではないが、1,3−シクロペンタジエン、trans−1,3−ペンタジエン、cis−1,3−ペンタジエン、1,4−ペンタジエン、1−ペンチン、2−ペンチン、3−メチル−1−ブチン、ペント−4−エン−1−イン、trans−ペント−3−エン−1−イン、およびcis−ペント−3−エン−1−インなどの通常石油−イソプレン組成物中に存在する任意の汚染不飽和C5炭化水素を実質的に含まないという点でBioisoprene組成物は石油−イソプレン組成物と区別される。本明細書に記載のBioisoprene出発材料に任意の汚染不飽和C5炭化水素が存在する場合、それらは、石油−イソプレン組成物中のものより低レベルで存在する。したがって、本明細書に記載のBioisoprene組成物から得られる任意の燃料産物は、任意の汚染不飽和C5炭化水素またはこのような汚染不飽和C5炭化水素から得られる産物を本質的に含まないか、または石油−イソプレンから得られる燃料産物より低レベルで含む。加えて、Bioisoprene組成物中の硫黄レベルは、石油−イソプレン組成物中の硫黄レベルより低い。Bioisoprene組成物から得られる燃料産物は、石油−イソプレンから得られる燃料産物中のものより低レベルの硫黄を含む。
Bioisopreneは、石油−イソプレン組成物中に存在しないかさらにより低レベルで存在するもの、例えば、アルコール、アルデヒド、ケトンなどの他の生体副産物(Bioisopreneと共に得られる、生物学的源由来のおよび/または生物学的プロセスと関連する化合物)と産出されるという点でBioisopreneは石油−イソプレンと区別される。生体副産物は、限定するものではないが、エタノール、アセトン、メタノール、アセトアルデヒド、メタクロレイン、メチルビニルケトン、2−メチル−2−ビニルオキシラン、cis−3−メチル−1,3−ペンタジエンおよびtrans−3−メチル−1,3−ペンタジエン、C5プレニルアルコール(例えば、3−メチル−3−ブテン−1−オールもしくは3−メチル−2−ブテン−1−オール)、2−ヘプタノン、6−メチル−5−ヘプタン−2−オン、2,4,5−トリメチルピリジン、2,3,5−トリメチルピラジン、シトロネラル、メタンチオール、メチルアセタート、1−プロパノール、ジアセチル、2−ブタノン、2−メチル−3−ブテン−2−オール、エチルアセタート、2−メチル−1−プロパノール、3−メチル−1ブタナール、3−メチル−2−ブタノン、1−ブタノール、2−ペンタノン、3−メチル−1−ブタノール、エチルイソブチレート、3−メチル−2−ブテナール、ブチルアセタート、3−メチルブチルアセタート、3−メチル−3−ブテン−1−イルアセタート、3−メチル−2−ブテン−1−イルアセタート、3−ヘキセン−1−オール、3−ヘキセン−1−イルアセタート、リモネン、ゲラニオール(trans−3,7−ジメチル−2,6−オクタジエン−1−オール)、シトロネロール(3,7−ジメチル−6−オクテン−1−オール)、(E)−3,7−ジメチル−1,3,6−オクタトリエン、(Z)−3,7−ジメチル−1,3,6−オクタトリエン、2,3−シクロヘプテノルピリジン、または線状イソプレンポリマー(例えば、複数のイソプレン単位の重合から得られる線状イソプレン二量体もしくは線状イソプレン三量体)を含み得る。Bioisopreneから得られる燃料産物は、任意の生体副産物から得られる1以上の生体副産物または化合物を含む。加えて、Bioisopreneから得られる燃料産物は、続く化学変換中にこれらの生体副産物から形成された化合物を含み得る。このような化合物の例としては、求ジエン体からイソプレンまたはその燃料誘導体へのディールス・アルダー環付加、イソプレンまたは燃料誘導体の酸化から得られるものが挙げられる。
さらに、Bioisopreneは、炭素フィンガープリント法により石油−イソプレンから区別される。一態様では、Bioisopreneは、石油−イソプレンより高い放射活性炭素14(14C)含量またはより高い14C/12C比を有する。Bioisopreneは再生可能な炭素源から産出するため、Bioisoprene中の14C含量または14C/12C比は、大気中に存在するものと同じである。一方、石油−イソプレンは、数千〜数百万年前に沈殿した化石燃料に由来するため、14C含量または14C/12C比は放射活性崩壊のために減少している。本明細書においてさらに論じるように、Bioisopreneから得られる燃料産物は、石油−イソプレンから得られる燃料産物より高い14C含量または14C/12C比を有する。一実施形態では、本明細書に記載のBioisopreneから得られる燃料産物は、大気中のものに類似している14C含量または14C/12C比を有する。別の態様では、Bioisopreneは、記号d13Cにより表す「デルタ値」として報告できる安定した炭素同位体比(13C/12C)により石油−イソプレンと分析的に区別できる。例えば、石油精製のC5ストリームの抽出蒸留から得られるイソプレンにおいて、δ13Cは約−22‰〜約−24‰である。この範囲は石油から得られた軽不飽和炭化水素において典型的であり、石油ベースのイソプレンから得られる産物は、典型的には同じδ13Cのイソプレン単位を含む。トウモロコシ由来グルコースの発酵(δ13C−10.73‰)により最少量の他の炭素含有栄養剤(例えば、酵母抽出物)と産出されたBioisopreneは、δ13C−14.66‰〜14.85‰でポリイソプレンにポリマー化できるイソプレンを産出する。このようなBioisopreneから産出される産物は、石油ベースのイソプレンから得られるものより負の値が小さいδ13C値を有することが予期される。
これらの方法により作製された化合物としては、環状イソプレン二量体および三量体、線状オリゴマー、芳香族および脂環式誘導体が挙げられる。ジイソアミレンは、Bioisoprene組成物の一部水素化を含む方法により作製する。これらイソプレンの化学誘導体は、液体輸送燃料(Isofuels(商標))として、および燃料添加物として有用である。
本明細書において、アルコール、ケトン、エステルおよびエーテルを含むイソプレンの酸化誘導体の産出方法も提供する。イソプレンの酸化誘導体の合成方法は、同種および異種触媒を用いて液相または気相で実施することもできる。この化学クラスの化合物は、液体輸送燃料としても有用であり、放射還元のための燃料酸素化物として、および燃料改良剤として、例えばディーゼルのセタン価向上剤として燃料混合物中で使用できる。
イソプレンは石油を分別することによって得ることができるが、この物質の精製は高価で、時間がかかる。炭化水素のC5ストリームの石油分解からは、わずか約15%のイソプレンしか産出されない。イソプレンは、種々の微生物、植物、および動物種によって天然にも産出される。イソプレンの生合成については、特に、2つの経路、すなわち、メバロン酸(MVA)経路と非メバロン酸(DXP)経路が同定されている。バイオリアクター中で遺伝子加工された細胞培養物は、例えば米国仮特許出願第61/013,386号および第61/013,574号(2007年12月13日出願)、WO2009/076676号、米国仮特許出願第61/134,094号、第61/134,947号、第61/134,011号および第61/134,103号(2008年7月2日出願)、WO2010/003007号、米国仮特許出願第61/097,163号(2008年9月15日出願)、WO2010/031079号、米国仮特許出願第61/097,186号(2008年9月15日出願)、WO2010/031062号、米国仮特許出願第61/097,189号(2008年9月15日出願)、WO2010/031077号、米国仮特許出願第61/097,200号(2008年9月15日出願)、WO2010/031068号、米国仮特許出願第61/097,204号(2008年9月15日出願)、WO2010/031076号、米国仮特許出願第61/141,652号(2008年12月30日出願)、PCT刊行物/米国特許第09/069862号、米国特許第12/335,071号(2008年12月15日出願)(米国特許第2009/0203102A1号)および米国特許第12/429,143号(2009年4月23日出願)(米国特許第2010/0003716A1号)に記載されているように(その全体が参照により本明細書に組み込まれる)、より効果的に、より大量に、より高純度および/もしくは独特な不純物プロファイルでイソプレンを産出している。
定義
特に定義しない限り、本明細書で使用される全ての技術的および科学的用語の意味は、本発明が属する技術分野の当業者によって共通に理解されるものである。本発明を実施するために本明細書に記載された方法および材料と同様または同等の任意の方法および材料を用いることができるが、好ましい方法および材料は、本明細書に記載されている。したがって、直下に定義する用語は、本明細書を全体として参照することによってさらに完全に記載される。引用した文書は全て、関連部分において、参照により本明細書に組み込まれる。しかしながら、いずれの文書の引用も、本発明に関する先行技術であると承認することを意図するものではない。
本明細書で使用する場合、特に明確に断りがない限り、「1つの(a)」、「1つの(an)」および「その(the)」という単数形の用語は、複数形の対象物を含む。
本明細書を通して与えられた数値上限は全て、より低い数値限界を、あたかもこのようなより低い数値限界が本明細書において明示的に記載されているかのように全て含むことを意図する。本明細書を通して与えられた数値下限は全て、より高い数値限界を、あたかもこのようなより高い数値限界が本明細書において明示的に記載されているかのように全て含む。本明細書を通して与えられた数値範囲は全て、このような広い数値範囲内に収まる狭い数値範囲を、あたかもこのような狭い数値範囲が全て本明細書において明示的に記載されているかのように全て含む。
「イソプレン」という用語は、3,3−ジメチルアリル二リン酸(DMAPP)からのピロリン酸塩の排除からの直接および最終揮発性C5炭化水素産物であり、IPP分子(1以上)のDMAPP分子(1以上)への連結またはポリマー化には関与しない、2−メチル−1,3−ブタジエン(CAS番号78−79−5)を指す。「イソプレン」という用語は、本明細書において特に断りのない限り、一般にその産出方法を制限することを意図しない。
本明細書で使用する「生物学的に産出されたイソプレン」または「Bioisoprene」とは、任意の生物学的手段により産出された、例えば、遺伝子加工された細胞培養物、天然微生物、植物または動物により産出されたイソプレンである。
「Bioisoprene組成物」とは、任意の生物学的手段、例えば、イソプレンを産出するように加工された系(例えば、細胞)を産出できる組成物を指す。イソプレンならびにイソプレンと共に共産出された(不純物を含む)および/もしくは単離された他の化合物を含む。Bioisoprene組成物は、通常は、石油化学源から産出されるイソプレンよりも少ない炭化水素不純物を含み、しばしばポリマー化グレードのための最小限の処理を必要とする。本明細書に記載のように、Bioisoprene組成物はまた、石油化学的に産出されたイソプレン組成物と異なる不純物プロファイルを有する。
本明細書で使用する「イソプレン出発組成物の少なくとも一部」とは、化学的変換を経たイソプレン出発組成物の少なくとも約1%、5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、99.5%、99.6%、99.7%、99.8%、99.9%、または100%を指すことができる。
本明細書で使用する場合、Isofuels(商標)とは、イソプレンから得られる液体輸送燃料を含む燃料を指す。BioIsoFuel(商標)とは、Bioisopreneから得られる液体輸送燃料を含む燃料を指す。
本明細書で使用する場合、「オリゴマー化」という用語は、2以上の単量体単位を結合させるための化学プロセスを指す。イソプレンの「オリゴマー化」は、2以上のイソプレン分子、例えば、線状イソプレン二量体、環状イソプレン二量体、線状イソプレン三量体、環状イソプレン三量体などから得られるイソプレンの誘導体を産出する。
「完全な水素化(Complete hydrogenation)」、「完全に水素化する(Completely hydrogenate)」または「完全に水素化する(Fully hydrogenate)」とは、完全飽和生成化合物を得るための、典型的には水素化触媒の存在下で、前駆体化合物内の全ての不飽和官能基、例えば、炭素−炭素二重結合への水素(H2)の付加と定義される。例えば、イソプレンの完全な水素化は、イソプレン1モル当たり2モルのH2が消費されたイソペンタンを形成する。
「一部水素化」または「部分的に水素化する」とは、典型的には水素化触媒の存在下で、前駆体化合物内の少なくとも1つだが全てではない不飽和官能基、例えば、炭素−炭素二重結合への水素(H2)の付加と定義される。一部水素化の産物(1以上)は、さらに完全に水素化して、完全飽和生成化合物を得ることができる。ジエンの一部水素化は1以上のモノ−オレフィンを形成する。例えば、イソプレンの一部水素化により、イソプレン1モル当たり1モルのH2が消費された3つの異性体のイソペンタン(2−メチルブタ−1−エン、2−メチルブタ−2−エンおよび3−メチルブタ−1−エン)を得ることができる。
「選択的水素化」または「選択的に水素化する」とは、典型的には水素化触媒の存在下で、前駆体化合物内の少なくとも1つだが全てではない不飽和官能基、例えば、炭素−炭素二重結合への水素(H2)の付加と定義され、ある不飽和官能基は、選択条件下で他の不飽和基より選択的に水素化される。例えば、イソプレンの選択的水素化は、選択的に2−メチル−2−ブテン、2−メチル−1−ブテン、3−メチル−1−ブテンまたはその混合物を形成し得る。
本明細書で使用される場合、「ポリペプチド」という用語は、ポリペプチド、タンパク質、ペプチド、ポリペプチドの断片、および融合ポリペプチドを含む。
本明細書で使用される場合、「単離されたポリペプチド」は、ポリペプチドのライブラリー、例えば、2、5、10、20、50個またはそれより多くの異なるポリペプチドのライブラリーの一部ではなく、それが天然に生じる少なくとも1つの構成要素から分離されている。単離されたポリペプチドは、例えば、そのポリペプチドをコードする組換え核酸の発現によって得ることができる。
「異種ポリペプチド」とは、そのアミノ酸配列が同じ宿主細胞で天然に発現される別のポリペプチドのアミノ酸配列とは同一でないポリペプチドを意味する。特に、異種ポリペプチドは、天然で同じ宿主細胞中に見出される野生型ポリペプチドとは同一でない。
「コドン縮重」とは、コードされたポリペプチドのアミノ酸配列に影響を及ぼすことなくヌクレオチド配列の変異を許容する遺伝暗号の相違を指す。当業者は、所与のアミノ酸を特定するヌクレオチドコドンの使用において特定の宿主細胞によって示される「コドンバイアス」について十分に知っている。そのため、宿主細胞での発現を改善する核酸を合成する場合、いくつかの実施形態では、そのコドン使用の頻度が宿主細胞の好ましいコドン使用の頻度に近づくように核酸を設計することが望ましい。
本明細書で使用される場合、「核酸」とは、一本鎖または二本鎖のいずれかの形態で共有結合した2以上のデオキシリボヌクレオチドおよび/またはリボヌクレオチドを指す。
「組換え核酸」とは、目的の核酸が得られる生物のゲノムに存在し、目的とする核酸をはさむ1以上の核酸(例えば、遺伝子)を含まない目的の核酸を意味する。したがって、この用語は、例えば、ベクターに、自律複製するプラスミドもしくはウイルスに、または原核生物もしくは真核生物のゲノムDNAに組み込まれる組換えDNA、あるいは他の配列から独立した別個の分子(例えば、PCRまたは制限エンドヌクレアーゼ消化によって生成されるcDNA、ゲノムDNA断片、またはcDNA断片)として存在する組換えDNAを含む。
「異種核酸」とは、その核酸配列が同じ宿主細胞で天然に見出される別の核酸の核酸配列とは同一でない核酸を意味する。特に、異種核酸は、天然で同じ宿主細胞中に見出される野生型核酸とは同一でない。
本明細書で使用される場合、「ベクター」は、1以上の目的の核酸を送達し、望ましくは宿主細胞内でこれを発現することができるコンストラクトを意味する。ベクターの例としては、限定するものではないが、プラスミド、ウイルスベクター、DNAまたはRNA発現ベクター、コスミド、およびファージベクターが挙げられる。
本明細書で使用される場合、「発現制御配列」は、目的の核酸の転写を導く核酸配列を意味する。発現制御配列は、プロモーター(例えば、構成的もしくは誘導性プロモーター)、またはエンハンサーであることができる。「誘導性プロモーター」は、環境的または発生的調節の下で活性のあるプロモーターである。発現制御配列は、転写される核酸断片に機能的に連結されている。
「選択マーカー」または「選択可能マーカー」という用語は、導入された核酸またはベクターを含有する宿主細胞の選択を容易にする宿主細胞で発現可能な核酸を指す。選択可能マーカーの例としては、限定するものではないが、抗生物質耐性核酸(例えば、カナマイシン、アンピシリン、カルベニシリン、ゲンタマイシン、ハイグロマイシン、フレオマイシン、ブレオマイシン、ネオマイシン、またはクロラムフェニコール)および/または代謝的利益(例えば、宿主細胞に対する栄養的利益)を付与する核酸が挙げられる。例示的な栄養選択マーカーとしては、amdS、argB、およびpyr4のような当該技術分野で公知のマーカーが挙げられる。
組成物および系
石油化学源から得られたイソプレンは、通常は、物質がポリマー化または他の化学的変換に適する前に大規模の精製を必要とする不純C5炭化水素画分である。いくつかの不純物は、イソプレンとの構造的類似性、およびポリマー化触媒毒として作用し得るという事実を考慮すると、特に問題である。このような化合物としては、限定するものではないが、1,3−シクロペンタジエン、cis−1,3−ペンタジエンおよびtrans−1,3−ペンタジエン、1,4−ペンタジエン、1−ペンチン、2−ペンチン、3−メチル−1−ブチン、ペント−4−エン−1−イン、trans−ペント−3−エン−1−イン、およびcis−ペント−3−エン−1−インが挙げられる。下記のとおり、生物学的に産出されたイソプレンは、大規模の精製を行なわずに任意の汚染不飽和C5炭化水素を実質的に含まないことができる。一部の生物学的に産出されたイソプレン組成物は、エタノール、アセトン、およびC5プレニルアルコールを含む。これらの成分は、石油化学源由来のイソプレン組成物中に存在する異性体C5炭化水素画分より容易にイソプレンストリームから取り出される。さらに、これらの不純物は、バイオプロセスにおいて、例えば産出菌株の遺伝子的修飾、炭素供給溶液、代替的発酵条件、回収プロセス修飾ならびに追加的もしくは代替的精製方法により処理できる。
一態様では、本発明は、(a)商業的に有益な量の高純度イソプレン出発組成物;ならびに(b)高純度イソプレン出発材料の少なくとも一部から産出される燃料構成要素を含むイソプレンから燃料構成要素を産出するための組成物および系を特徴とし、ここで商業的に有益な量の高純度イソプレン出発組成物の少なくとも一部は、化学的変換を経る。高純度イソプレン出発材料は、燃料作製のために有用な商業的に有益な量の産物を産出する化学反応に供する。一態様では、商業的に有益な量の高純度イソプレンは、Bioisopreneを含む。一態様では、商業的に有益な量の高純度イソプレンは、Bioisopreneであることができる。
例示的な出発イソプレン組成物
いくつかの実施形態では、商業的に有益な量の高純度イソプレン出発組成物は、約2、5、10、20、30、40、50、60、70、80、90、100、200、300、400、500、600、700、800、900、もしくは1000mgまたはそれらより多いイソプレンを含む。いくつかの実施形態では、出発イソプレン組成物は、約2、5、10、20、30、40、50、60、70、80、90、100gまたはそれらより多いイソプレンを含む。いくつかの実施形態では、出発イソプレン組成物は、約0.2、0.5、1、2、5、10、20、50、100、200、500、1000kgまたはそれより多いイソプレンを含む。いくつかの実施形態では、出発組成物中のイソプレンの量は、約2〜約5,000mg、例えば、約2〜約100mg、約100〜約500mg、約500〜約1,000mg、約1,000〜約2,000mg、または約2,000〜約5,000mgである。いくつかの実施形態では、出発組成物中のイソプレンの量は、約20〜約5,000mg、約100〜約5,000mg、約200〜約2,000mg、約200〜約1,000mg、約300〜約1,000mg、または約400〜約1,000mgである。いくつかの実施形態では、出発組成物中のイソプレンの量は、約2〜約5,000g、例えば、約2〜約100g、約100〜約500g、約500〜約1,000g、約1,000〜約2,000g、または約2,000〜約5,000gである。いくつかの実施形態では、出発組成物中のイソプレンの量は、約2〜約5,000kg、約10〜約2,000kg、約20〜約1,000kg、約20〜約500kg、約30〜約200kg、または約40〜約100kgである。いくつかの実施形態では、出発組成物の揮発性有機画分の約20、25、30、40、50、60、70、80、90、もしくは95%(w/w)またはそれらより多くがイソプレンである。
いくつかの実施形態では、高純度イソプレン出発組成物は、出発組成物中の全てのC5炭化水素の総重量と比べて、約98.0、98.5、99.0、99.5、もしくは100重量%またはそれより多いイソプレンを含む。いくつかの実施形態では、高純度イソプレン出発組成物は、出発組成物中の全てのC5炭化水素の総重量と比べて、約99.90、99.92、99.94、99.96、99.98、もしくは100重量%またはそれらより多くのイソプレンとを含む。いくつかの実施形態では、出発組成物は、出発組成物中の全てのC5炭化水素の検出器応答と比べて、約98.0、98.5、99.0、99.5、もしくは100%またはそれより多いイソプレンの相対検出器応答を有する。いくつかの実施形態では、出発組成物は、出発組成物中の全てのC5炭化水素の検出器応答と比べて、約99.90、99.91、99.92、99.93、99.94、99.95、99.96、99.97、99.98、99.99、もしくは100%またはそれより多いイソプレンの相対検出器応答を有する。いくつかの実施形態では、出発イソプレン組成物は、出発組成物中の全てのC5炭化水素の総重量と比べて、約98.0〜約98.5、約98.5〜約99.0、約99.0〜約99.5、約99.5〜約99.8、約99.8〜100重量%のイソプレンを含む。いくつかの実施形態では、出発イソプレン組成物は、出発組成物中の全てのC5炭化水素の総重量と比べて、約99.90〜約99.92、約99.92〜約99.94、約99.94〜約99.96、約99.96〜約99.98、約99.98〜100重量%のイソプレンを含む。
いくつかの実施形態では、高純度イソプレン出発組成物は、出発組成物中の全てのC5炭化水素の総重量と比べて、約2.0、1.5、1.0、0.5、0.2、0.12、0.10、0.08、0.06、0.04、0.02、0.01、0.005、0.001、0.0005、0.0001、0.00005、もしくは0.00001重量%またはそれらより少ない量のイソプレン以外のC5炭化水素(例えば、1,3−シクロペンタジエン、cis−1,3−ペンタジエン、trans−1,3−ペンタジエン、1,4−ペンタジエン、1−ペンチン、2−ペンチン、1−ペンテン、2−メチル−1−ブテン、3−メチル−1−ブチン、ペント−4−エン−1−イン、trans−ペント−3−エン−1−イン、またはcis−ペント−3−エン−1−イン)を含む。いくつかの実施形態では、出発組成物は、出発組成物中の全てのC5炭化水素の検出器応答と比べて、約2.0、1.5、1.0、0.5、0.2、0.12、0.10、0.08、0.06、0.04、0.02、0.01、0.005、0.001、0.0005、0.0001、0.00005、もしくは0.00001%またはそれらより少ない量のイソプレン以外のC5炭化水素の相対検出器応答を有する。いくつかの実施形態では、出発組成物は、出発組成物中の全てのC5炭化水素の検出器応答と比べて、約2.0、1.5、1.0、0.5、0.2、0.12、0.10、0.08、0.06、0.04、0.02、0.01、0.005、0.001、0.0005、0.0001、0.00005、もしくは0.00001%またはそれらより少ない量の1,3−シクロペンタジエン、cis−1,3−ペンタジエン、trans−1,3−ペンタジエン、1,4−ペンタジエン、1−ペンチン、2−ペンチン、1−ペンテン、2−メチル−1−ブテン、3−メチル−1−ブチン、ペント−4−エン−1−イン、trans−ペント−3−エン−1−イン、またはcis−ペント−3−エン−1−インの相対検出器応答を有する。いくつかの実施形態では、高純度イソプレン出発組成物は、出発組成物中の全てのC5炭化水素の総重量と比べて、約0.02〜約0.04%、約0.04〜約0.06%、約0.06〜0.08%、約0.08〜0.10%、または約0.10〜約0.12重量%のイソプレン以外のC5炭化水素(例えば、1,3−シクロペンタジエン、cis−1,3−ペンタジエン、trans−1,3−ペンタジエン、1,4−ペンタジエン、1−ペンチン、2−ペンチン、1−ペンテン、2−メチル−1−ブテン、3−メチル−1−ブチン、ペント−4−エン−1−イン、trans−ペント−3−エン−1−イン、またはcis−ペント−3−エン−1−イン)を含む。
いくつかの実施形態では、高純度イソプレン出発組成物は、イソプレンの重合を阻害する出発組成物中の任意の化合物について、イソプレンの重合を阻害する約50、40、30、20、10、5、1、0.5、0.1、0.05、0.01、もしくは0.005μg/Lまたはそれらより少ない量を含む。いくつかの実施形態では、出発イソプレン組成物は、イソプレンの重合を阻害する出発組成物中の任意の化合物について、イソプレンの重合を阻害する約0.005〜約50、例えば、約0.01〜約10、約0.01〜約5、約0.01〜約1、約0.01〜約0.5、または約0.01〜約0.005μg/Lの化合物を含む。いくつかの実施形態では、出発イソプレン組成物は、約50、40、30、20、10、5、1、0.5、0.1、0.05、0.01、もしくは0.005μg/Lまたはそれらより少ない量のイソプレン以外の炭化水素(1,3−シクロペンタジエン、cis−1,3−ペンタジエン、trans−1,3−ペンタジエン、1,4−ペンタジエン、1−ペンチン、2−ペンチン、1−ペンテン、2−メチル−1−ブテン、3−メチル−1−ブチン、ペント−4−エン−1−イン、trans−ペント−3−エン−1−イン、またはcis−ペント−3−エン−1−インなど)を含む。いくつかの実施形態では、出発イソプレン組成物は、約0.005〜約50、例えば、約0.01〜約10、約0.01〜約5、約0.01〜約1、約0.01〜約0.5、または約0.01〜約0.005μg/Lのイソプレン以外の炭化水素を含む。いくつかの実施形態では、出発イソプレン組成物は、約50、40、30、20、10、5、1、0.5、0.1、0.05、0.01、もしくは0.005μg/Lまたはそれらより少ない量のタンパク質または脂肪酸(例えば、天然ゴムと天然に組み合わされているタンパク質または脂肪酸)を含む。
いくつかの実施形態では、高純度イソプレン出発組成物は、約10、5、1、0.8、0.5、0.1、0.05、0.01、もしくは0.005ppmまたはそれら未満のアルファアセチレン、ピペリレン、アセトニトリル、または1,3−シクロペンタジエンを含む。いくつかの実施形態では、出発イソプレン組成物は、約5、1、0.5、0.1、0.05、0.01、もしくは0.005ppmまたはそれら未満の硫黄またはアレンを含む。いくつかの実施形態では、出発イソプレン組成物は、約30、20、15、10、5、1、0.5、0.1、0.05、0.01、もしくは0.005ppmまたはそれら未満の全てのアセチレン(例えば、1−ペンチン、2−ペンチン、3−メチル−1−ブチン、ペント−4−エン−1−イン、trans−ペント−3−エン−1−イン、およびcis−ペント−3−エン−1−イン)を含む。いくつかの実施形態では、出発イソプレン組成物は、約2000、1000、500、200、100、50、40、30、20、10、5、1、0.5、0.1、0.05、0.01、もしくは0.005ppmまたはそれら未満のイソプレン二量体、例えば、環状イソプレン二量体(例えば、2つのイソプレン単位の二量体化から得られる環状C10化合物)を含む。
いくつかの実施形態では、高純度イソプレン出発組成物は、エタノール、アセトン、メタノール、アセトアルデヒド、メタクロレイン、メチルビニルケトン、2−メチル−2−ビニルオキシラン、cis−3−メチル−1,3−ペンタジエンおよびtrans−3−メチル−1,3−ペンタジエン、C5プレニルアルコール(例えば、3−メチル−3−ブテン−1−オールもしくは3−メチル−2−ブテン−1−オール)、または前述のもののいずれか2つ以上を含む。特定の実施形態では、出発イソプレン組成物は、約0.005、0.01、0.05、0.1、0.5、1、5、10、20、30、40、60、80、100、もしくは120μg/Lまたはそれより多いエタノール、アセトン、メタノール、アセトアルデヒド、メタクロレイン、メチルビニルケトン、2−メチル−2−ビニルオキシラン、cis−3−メチル−1,3−ペンタジエンおよびtrans−3−メチル−1,3−ペンタジエン、C5プレニルアルコール(例えば、3−メチル−3−ブテン−1−オールもしくは3−メチル−2−ブテン−1−オール)、または前述のもののいずれか2つ以上を含む。いくつかの実施形態では、イソプレン組成物は、約0.005〜約120、例えば、約0.01〜約80、約0.01〜約60、約0.01〜約40、約0.01〜約30、約0.01〜約20、約0.01〜約10、約0.1〜約80、約0.1〜約60、約0.1〜約40、約5〜約80、約5〜約60、または約5〜約40μg/Lのエタノール、アセトン、メタノール、アセトアルデヒド、メタクロレイン、メチルビニルケトン、2−メチル−2−ビニルオキシラン、cis−3−メチル−1,3−ペンタジエンおよびtrans−3−メチル−1,3−ペンタジエン、C5プレニルアルコール、または前述のもののいずれか2つ以上を含む。
いくつかの実施形態では、高純度イソプレン出発組成物は、以下の成分:2−ヘプタノン、6−メチル−5−ヘプタン−2−オン、2,4,5−トリメチルピリジン、2,3,5−トリメチルピラジン、シトロネラル、アセトアルデヒド、メタンチオール、メチルアセタート、1−プロパノール、ジアセチル、2−ブタノン、2−メチル−3−ブテン−2−オール、エチルアセタート、2−メチル−1−プロパノール、3−メチル−1ブタナール、3−メチル−2−ブタノン、1−ブタノール、2−ペンタノン、3−メチル−1−ブタノール、エチルイソブチレート、3−メチル−2−ブテナール、ブチルアセタート、3−メチルブチルアセタート、3−メチル−3−ブテン−1−イルアセタート、3−メチル−2−ブテン−1−イルアセタート、3−ヘキセン−1−オール、3−ヘキセン−1−イルアセタート、リモネン、ゲラニオール(trans−3,7−ジメチル−2,6−オクタジエン−1−オール)、シトロネロール(3,7−ジメチル−6−オクテン−1−オール)、(E)−3,7−ジメチル−1,3,6−オクタトリエン、(Z)−3,7−ジメチル−1,3,6−オクタトリエン、2,3−シクロヘプテノルピリジン、または線状イソプレンポリマー(例えば、複数のイソプレン単位の重合から得られる線状イソプレン二量体もしくは線状イソプレン三量体)のうちの1以上を含む。様々な実施形態では、重量パーセント(すなわち、成分の重量をイソプレンの重量で割って100を掛けたもの)の単位で表されるイソプレンの量と比べたこれらの成分の1つの量は、約0.01、0.02、0.05、0.1、0.5、1、5、10、20、30、40、50、60、70、80、90、100、もしくは110%(w/w)またはそれらより多い量である。いくつかの実施形態では、第2の化合物の相対検出器応答はイソプレンの検出器応答と比べて、約0.01、0.02、0.05、0.1、0.5、1、5、10、20、30、40、50、60、70、80、90、100、もしくは110%またはそれより多い。様々な実施形態では、重量パーセント(すなわち、成分の重量をイソプレンの重量で割って100を掛けたもの)の単位で表されるイソプレンの量と比べたこれらの成分の1つの量は、約0.01〜約105%(w/w)、例えば、約0.01〜約90、約0.01〜約80、約0.01〜約50、約0.01〜約20、約0.01〜約10、約0.02〜約50、約0.05〜約50、約0.1〜約50、もしくは0.1〜約20%(w/w)である。
いくつかの実施形態では、高純度イソプレン出発組成物の少なくとも一部は気相中にある。いくつかの実施形態では、高純度イソプレン出発組成物の少なくとも一部は、液相(例えば、凝結物)中にある。いくつかの実施形態では、高純度イソプレン出発組成物の少なくとも一部は固相中にある。いくつかの実施形態では、高純度イソプレン出発組成物の少なくとも一部は、シリカおよび/または活性炭を含む支持体などの固体支持体に吸着する。いくつかの実施形態では、出発イソプレン組成物は、1以上の溶媒と混合する。いくつかの実施形態では、出発イソプレン組成物は、1以上のガスと混合する。
他の実施形態では、商業的に有益な量の高純度イソプレン出発組成物は、生物学的プロセスにより産出される。いくつかの好ましい実施形態では、高純度イソプレン出発組成物は、約400nmoleのイソプレン/細胞の湿重量に対する細胞のグラム/時間(nmole/gwcm/時間)を上回るイソプレンを産出する細胞の培養により産出されたBioisoprene組成物である。一実施形態では、Bioisoprene組成物は、細胞培養培地中の約0.002%超の炭素をイソプレンに変換する細胞培養により産出される。他の実施形態では、細胞は、(i)イソプレンシンターゼポリペプチド、例えば天然に生じる植物由来ポリペプチド、例えば、Puerariaをコードする、ならびに(ii)プロモーター、例えばT7プロモーターに機能的に連結されている異種核酸を有する。他のイソプレンシンターゼポリペプチド(例えば、ポプラ由来)、および天然に生じる変異体ならびに親イソプレンシンターゼは、Bioisopreneを産出するために使用できる。使用できるイソプレンシンターゼおよびその変異体の例は、米国特許第12/429,143号に記載されており、これは、その全体が参照により本明細書に組み込まれる。
いくつかの実施形態では、細胞を、限定するものではないが、炭水化物、グリセロール、グリセリン、ジヒドロキシアセトン、1炭素源、油、動物性脂肪、動物性油、脂肪酸、脂質、リン脂質、グリセロ脂質、モノグリセリド、ジグリセリド、トリグリセリド、再生可能な炭素源、ポリペプチド(例えば、微生物もしくは植物のタンパク質もしくはペプチド)、酵母抽出物、または酵母抽出物由来の成分などの1炭素源、または前述のもののいずれか2つ以上の組み合わせを含む培養培地中で培養する。いくつかの実施形態では、細胞を制限グルコース条件下で培養する。いくつかの実施形態では、細胞はさらに、IDIポリペプチドをコードする異種核酸を含む。いくつかの実施形態では、細胞はさらに、MDV経路ポリペプチドをコードする異種核酸を含む。いくつかの実施形態では、出発イソプレン組成物は、米国仮特許出願第61/134,094号(2008年7月2日出願)、WO2010/003007号、および米国特許第12/335,071号(2008年12月15日出願)(米国特許第2009/0203102A1号)(その全体が参照により本明細書に組み込まれる)に記載のイソプレン組成物または記載の任意の細胞培養により産出される。
いくつかの実施形態では、高純度イソプレン出発組成物は、イソプレンを産出する細胞培養により産出される気相(オフガス)を含む。いくつかの実施形態では、気相は、非引火イソプレン濃度を有する。いくつかの実施形態では、気相は、約9.5%(体積)未満の酸素を含む。いくつかの実施形態では、気相は、9.5%超または約9.5%(体積)の酸素を含み、気相中のイソプレンの濃度は、引火下限未満であるかまたは引火上限を上回る。いくつかの実施形態では、イソプレン以外の気相の部分は、約0%〜約100%(体積)の酸素、例えば、約10%〜約100%(体積)の酸素を含む。いくつかの実施形態では、イソプレン以外の気相の部分は、約0%〜約99%(体積)の窒素を含む。いくつかの実施形態では、イソプレン以外の気相の部分は、約1%〜約50%(体積)のCO2を含む。
いくつかの実施形態では、高純度イソプレン出発組成物は、以下のうちの1以上を含む:アルコール、アルデヒド、ケトン、またはエステル(例えば、本明細書に記載の任意のアルコール、アルデヒド、ケトンまたはエステル)。いくつかの実施形態では、イソプレン組成物は、(i)アルコールとアルデヒド、(ii)アルコールとケトン、(iii)アルデヒドとケトン、または(iv)アルコールとアルデヒドとケトンを含む。いくつかの実施形態では、任意のイソプレン組成物はさらに、エステルを含む。
いくつかの実施形態では、高純度イソプレン出発組成物は、以下のうちの1以上を含む生物学的源(例えば、細胞培養)から得られる:メタノール、アセトアルデヒド、エタノール、メタンチオール、1−ブタノール、3−メチル−1−プロパノール、アセトン、酢酸、2−ブタノン、2−メチル−1−ブタノール、またはインドール。いくつかの実施形態では、出発イソプレン組成物は、以下のうちの1以上を1ppm以上含有する:メタノール、アセトアルデヒド、エタノール、メタンチオール、1−ブタノール、3−メチル−1−プロパノール、アセトン、酢酸、2−ブタノン、2−メチル−1−ブタノール、またはインドール。いくつかの実施形態では、以下のもの:メタノール、アセトアルデヒド、エタノール、メタンチオール、1−ブタノール、3−メチル−1−プロパノール、アセトン、酢酸、2−ブタノン、2−メチル−1−ブタノール、またはインドールのうちの1以上の濃度は、出発イソプレン組成物中(例えば、精製される前のオフガス)約1〜約10,000ppmである。いくつかの実施形態では、出発イソプレン組成物(例えば、1以上の精製工程を経た後のオフガス)は、以下のもの:メタノール、アセトアルデヒド、エタノール、メタンチオール、1−ブタノール、3−メチル−1−プロパノール、アセトン、酢酸、2−ブタノン、2−メチル−1−ブタノール、またはインドールのうちの1以上を、約1〜約100ppm、例えば、約1〜約10ppm、約10〜約20ppm、約20〜約30ppm、約30〜約40ppm、約40〜約50ppm、約50〜約60ppm、約60〜約70ppm、約70〜約80ppm、約80〜約90ppm、または約90〜約100ppmの濃度で含む。いくつかの実施形態では、出発イソプレン組成物は、1ppm未満のメタンチオール(最終燃料産物中の強力な触媒毒および硫黄源)を含む。細胞培養物由来の揮発性有機化合物(例えば、細胞培養物のヘッドスペース中の揮発性有機化合物)を、本明細書に記載した方法などの標準的な方法またはプロトン転移反応−マススペクトロメトリーなどの他の標準的な方法を用いて分析することができる(例えば、Bunge et al.,Applied and Environmental Microbiology,74(7):2179−2186,2008を参照されたく、これは、特に、揮発性有機化合物の分析に関して、その全体が参照により本明細書に組み込まれる)。
本発明は、イソプレンと水素を共産出する生物学的源(例えば、細胞培養)から得られる高純度イソプレン出発組成物の使用も意図する。いくつかの実施形態では、出発Bioisoprene組成物は、水素3モルパーセントごとに少なくとも1モルパーセントのイソプレンから水素4モルパーセントごとに少なくとも1モルパーセントのイソプレンの比率でイソプレンと水素を含む。いくつかの実施形態では、出発Bioisoprene組成物は、約1対9、2対8、3対7、4対6、5対5、6対4、7対3、8対2、もしくは9対1のモル比でイソプレンと水素を含む。いくつかの実施形態では、組成物はさらに、1〜11モルパーセントのイソプレンおよび4〜44モルパーセントの水素を含む。いくつかの実施形態では、組成物はさらに、酸素、二酸化炭素、または窒素を含む。いくつかの実施形態では、組成物はさらに、0〜21モルパーセントの酸素、18〜44モルパーセントの二酸化炭素、および0〜78モルパーセントの窒素を含む。いくつかの実施形態では、組成物はさらに、1.0×10−4モルパーセント以下のメタン以外の揮発性不純物を含む。いくつかの実施形態では、メタン以外の揮発性不純物は、以下のうちの1以上を含む:2−ヘプタノン、6−メチル−5−ヘプタン−2−オン、2,4,5−トリメチルピリジン、2,3,5−トリメチルピラジン、シトロネラル、アセトアルデヒド、メタンチオール、メチルアセタート、1−プロパノール、ジアセチル、2−ブタノン、2−メチル−3−ブテン−2−オール、エチルアセタート、2−メチル−1−プロパノール、3−メチル−1ブタナール、3−メチル−2−ブタノン、1−ブタノール、2−ペンタノン、3−メチル−1−ブタノール、エチルイソブチレート、3−メチル−2−ブテナール、ブチルアセタート、3−メチルブチルアセタート、3−メチル−3−ブテン−1−イルアセタート、3−メチル−2−ブテン−1−イルアセタート、3−ヘキセン−1−オール、3−ヘキセン−1−イルアセタート、リモネン、ゲラニオール(trans−3,7−ジメチル−2,6−オクタジエン−1−オール)、シトロネロール(3,7−ジメチル−6−オクテン−1−オール)、(E)−3,7−ジメチル−1,3,6−オクタトリエン、(Z)−3,7−ジメチル−1,3,6−オクタトリエン、2,3−シクロヘプテノルピリジン、または線状イソプレンポリマー(例えば、複数のイソプレン単位の重合から得られる線状イソプレン二量体もしくは線状イソプレン三量体)。いくつかの実施形態では、メタン以外の揮発性不純物は、以下のうちの1以上を含む:イソプレン組成物は、以下のうちの1以上を含む:アルコール、アルデヒド、またはケトン(例えば、本明細書に記載の任意のアルコール、アルデヒド、またはケトン)。いくつかの実施形態では、イソプレン組成物は、(i)アルコールとアルデヒド、(ii)アルコールとケトン、(iii)アルデヒドとケトン、または(iv)アルコールとアルデヒドとケトンを含む。いくつかの実施形態では、メタン以外の揮発性不純物は、以下のうちの1以上を含む:メタノール、アセトアルデヒド、エタノール、メタンチオール、1−ブタノール、3−メチル−1−プロパノール、アセトン、酢酸、2−ブタノン、2−メチル−1−ブタノール、またはインドール。
培養細胞中のイソプレン産出技術は、米国仮特許出願第61/013,386号および第61/013,574号(2007年12月13日出願)、WO2009/076676号、米国仮特許出願第61/134,094号、第61/134,947号、第61/134,011号および第61/134,103号(2008年7月2日出願)、WO2010/003007号、米国仮特許出願第61/097,163号(2008年9月15日出願)、WO2010/031079号、米国仮特許出願第61/097,186号(2008年9月15日出願)、WO2010/031062号、米国仮特許出願第61/097,189号(2008年9月15日出願)、WO2010/031077号、米国仮特許出願第61/097,200号(2008年9月15日出願)、WO2010/031068号、米国仮特許出願第61/097,204号(2008年9月15日出願)、WO2010/031076号、米国仮特許出願第61/141,652号(2008年12月30日出願)、PCT刊行物/米国特許第09/069862号、米国特許第12/335,071号(2008年12月15日出願)(米国特許第2009/0203102A1号)および米国特許第12/429,143号(2009年4月23日出願)(米国特許第2010/0003716A1号)に記載されており、これらの教示は、このようなプロセスによるイソプレンの産出および回収技術を教示する目的のため、参照により本明細書に組み込まれる。いずれの場合も、米国仮特許出願第61/013,386号および第61/013,574号(2007年12月13日出願)、WO2009/076676号、米国仮特許出願第61/134,094号、第61/134,947号、第61/134,011号および第61/134,103号(2008年7月2日出願)、WO2010/003007号、米国仮特許出願第61/097,163号(2008年9月15日出願)、WO2010/031079号、米国仮特許出願第61/097,186号(2008年9月15日出願)、WO2010/031062号、米国仮特許出願第61/097,189号(2008年9月15日出願)、WO2010/031077号、米国仮特許出願第61/097,200号(2008年9月15日出願)、WO2010/031068号、米国仮特許出願第61/097,204号(2008年9月15日出願)、WO2010/031076号、米国仮特許出願第61/141,652号(2008年12月30日出願)、PCT刊行物/米国特許第09/069862号、米国特許第12/335,071号(2008年12月15日出願)(米国特許第2009/0203102A1号)および米国特許第12/429,143号(2009年4月23日出願)(米国特許第2010/0003716A1号)は細胞培養物中の増量イソプレン産出のための組成物および方法を教示する。米国特許第12/335,071号(2008年12月15日出願)および米国特許第2009/0203102A1号はさらに培養細胞からのイソプレンと水素の共産出のための組成物および方法を教示する。特に、これらの組成物および方法は、イソプレンの産出速度を増加させ、産出されるイソプレン総量を増加させる。例えば、4.8×104nmole/gwcm/時間のイソプレンを生成する細胞培養系が作製されている(表1)。これらの系の効率は、細胞が細胞培養培地から消費する炭素の約2.2%がイソプレンに変換されることによって示される。実施例および表2に示すように、ブロス1リットル当たり約3gのイソプレンが生成された。所望により、他の条件(例えば、本明細書に記載の他の条件)を用いて、一層より多くの量のイソプレンを得ることができる。いくつかの実施形態では、再生可能な炭素源をイソプレンの産出に使用する。いくつかの実施形態では、イソプレンの産出は、細胞の増殖とは切り離されている。いくつかの実施形態では、イソプレンと任意の酸化体の濃度は、イソプレンの産出または回収時に火災が発生し得る危険性を低下させるかまたは排除するために非引火範囲内とする。組成物および方法は、細胞当たりの高いイソプレン収率、高い炭素収率、高いイソプレン純度、高い生産性、低いエネルギー使用、低い生産コストと生産投資、および最小限の副反応を可能にするので望ましい。この効率的で、大規模なイソプレン産出のための生合成プロセスは、合成イソプレン系産物、例えば、ゴムのためのイソプレン源を提供し、天然ゴムの使用に代わる望ましい低コスト代替物を提供する。
以下でさらに論じるように、細胞によって産出されるイソプレンの量を、イソプレンシンターゼポリペプチド(例えば、植物イソプレンシンターゼポリペプチド)をコードする異種核酸を細胞に導入することによって大いに増加させることができる。イソプレンシンターゼポリペプチドは、ジメチルアリル二リン酸(DMAPP)をイソプレンに変換する。実施例に示すように、異種タイワンクズ(クズ)イソプレンシンターゼポリペプチドを、大腸菌、パントエア・シトレア、枯草菌、ヤロウイア・リポリティカ(Yarrowia lipolytica)、およびトリコデルマ・リーゼイ(Trichoderma reesei)などの、種々の宿主細胞で発現させた。これらの細胞は全て、異種イソプレンシンターゼポリペプチドを有さない対応する細胞よりも多くのイソプレンを産出した。表1および2に示すように、本明細書に記載の方法を用いて、大量のイソプレンが産出される。例えば、異種イソプレンシンターゼ核酸を有する枯草菌細胞は、14リットル発酵槽において、異種核酸を有さない対応する対照枯草菌細胞よりも約10倍多いイソプレンを産出した(表2)。発酵槽における大腸菌による300mgのイソプレン/ブロス1リットル(mg/L、ここで、ブロスの容積は、細胞培地の容量と細胞の容積の両方を含む)および枯草菌による30mg/Lは、相当な量のイソプレンを生成させることができることを示している(表2)。所望により、イソプレンを一層より大きい規模で産出させることができ、または本明細書に記載の他の条件を用いて、イソプレンの量をさらに増加させることができる。表1および2ならびに実験条件に記載のベクターは、以下および実施例の節でさらに詳細に記載されている。
本明細書に記載の細胞培養物と方法を用いた振盪フラスコからのイソプレンの例示的な収率。イソプレン産出を測定するためのアッセイは実施例I、第II部に記載されている。このアッセイのために、試料を1以上の時点で振盪フラスコから取り出し、30分間培養した。次に、この試料中で産出されたイソプレンの量を測定した。イソプレン産出のヘッドスペース濃度および比速度を表1に掲載し、さらに本明細書に記載する。
*液体とヘッドスペースの容積比が1:19の密封ヘッドスペースバイアル中で1時間培養した、1mLの1OD
600に対して標準化した
本明細書に記載の細胞培養物と方法を用いた発酵槽におけるイソプレンの例示的な収率。イソプレン産出を測定するためのアッセイは実施例I、第II部に記載されている。このアッセイのために、発酵槽のオフガスの試料を採取し、イソプレンの量について解析した。ピークヘッドスペース濃度(これは、発酵時の最大ヘッドスペース濃度である)、力価(これは、ブロス1リットル当たりに産出される累積イソプレン総量である)、およびイソプレン産出のピーク比速度(これは、発酵時の最大比速度である)を表2に掲載し、さらに本明細書に記載する。
**1vvm(1容積オフガス/1L
ブロス/分)のオフガス流速に対して標準化した
さらに、異種イソプレンシンターゼ核酸を含有する細胞によるイソプレン産出を、細胞によって発現される1−デオキシ−D−キシルロース−5−リン酸シンターゼ(DXS)ポリペプチドおよび/またはイソペンテニル二リン酸イソメラーゼ(IDI)ポリペプチドの量を増加させることによって増強することができる。例えば、DXS核酸および/またはIDI核酸を細胞に導入することができる。DXS核酸は、異種核酸または重複コピーの内在性核酸であり得る。同様に、IDI核酸は、異種核酸または重複コピーの内在性核酸であり得る。いくつかの実施形態では、DXSおよび/またはIDIポリペプチドの量を、内在性DXSおよび/またはIDIのプロモーターまたは調節領域をDXSおよび/またはIDI核酸のより多くの転写をもたらす他のプロモーターおよび/または調節領域と置き換えることによって増加させる。いくつかの実施形態では、細胞は、イソプレンシンターゼポリペプチド(例えば、植物イソプレンシンターゼ核酸)をコードする異種核酸とイソプレンシンターゼポリペプチドをコードする重複コピーの内在性核酸の両方を含有する。
コードされたDXSおよびIDIポリペプチドは、イソプレンの生合成のためのDXP経路の一部である(図19A)。DXSポリペプチドは、ピルビン酸とD−グリセルアルデヒド−3−リンを1−デオキシ−D−キシルロース−5−リン酸に変換する。任意の特定の理論に束縛されるつもりはないが、DXSポリペプチドの量を増加させると、DXP経路を通る炭素の流れが増加して、より多くのイソプレン産出が生じると考えられている。IDIポリペプチドは、イソペンテニル二リン酸(IPP)とジメチルアリル二リン酸(DMAPP)の相互変換を触媒する。任意の特定の理論に束縛されるつもりはないが、細胞内のIDIポリペプチドの量を増加させると、DMAPP(これはイソプレンに変換される)に変換されるIPPの量(および変換速度)が増加すると考えられている。
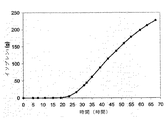
例えば、クズイソプレンシンターゼ、出芽酵母IDI、および大腸菌DXS核酸を有する大腸菌細胞の発酵を用いて、イソプレンを産出させた。イソプレンのレベルは、15時間の間に50から300μg/Lの間で変動した(実施例7、第VII部)。
いくつかの実施形態では、異種のまたは余分な内在性イソプレンシンターゼ、IDI、およびDXS核酸の存在のために、これらの異種のまたは余分な内在性核酸のうちの1つだけまたは2つを有する対応する細胞と比べて、細胞がより繁殖して増殖するかまたはより長く生存し続ける。例えば、異種イソプレンシンターゼ、IDI、およびDXS核酸を含有する細胞は、異種イソプレンシンターゼとDXS核酸のみを有するかまたは異種イソプレンシンターゼ核酸のみを有する細胞よりも良好に増殖した。また、異種イソプレンシンターゼ、IDI、およびDXS核酸を、大腸菌細胞により維持される高コピープラスミド上の強力なプロモーターに機能的に連結することができたが、これは、細胞に対して過剰量の毒性を引き起こすことなく、大量のこれらのポリペプチドを細胞内で発現し得ることを示唆する。特定の理論に束縛されるつもりはないが、異種のまたは余分な内在性イソプレンシンターゼおよびIDI核酸の存在によって、それがなければ、異種のまたは余分な内在性DXS核酸のみが細胞内に存在する場合に蓄積するであろう1以上の潜在的な毒性中間体の量を減らし得ると考えられている。
いくつかの実施形態では、異種イソプレンシンターゼ核酸を含有する細胞によるイソプレンの産出を、細胞によって発現されるMVAポリペプチドの量を増加させることによって強化する(図19Aおよび19B)。例示的なMVA経路ポリペプチドとしては、以下のポリペプチドのいずれかが挙げられる:アセチル−CoAアセチルトランスフェラーゼ(AA−CoAチオラーゼ)ポリペプチド、3−ヒドロキシ−3−メチルグルタリル−CoAシンターゼ(HMG−CoAシンターゼ)ポリペプチド、3−ヒドロキシ−3−メチルグルタリル−CoAレダクターゼ(HMG−CoAレダクターゼ)ポリペプチド、メバロン酸キナーゼ(MVK)ポリペプチド、ホスホメバロン酸キナーゼ(PMK)ポリペプチド、ジホスホメバロン酸デカルボキシラーゼ(MVD)ポリペプチド、ホスホメバロン酸デカルボキシラーゼ(PMDC)ポリペプチド、イソペンテニルリン酸キナーゼ(IPK)ポリペプチド、IDIポリペプチド、および2以上のMVA経路ポリペプチドの活性を有するポリペプチド(例えば、融合ポリペプチド)。例えば、1以上のMVA経路核酸を細胞に導入することができる。いくつかの実施形態では、細胞は、AA−CoAチオラーゼ、HMG−CoAシンターゼ、およびHMG−CoAレダクターゼ核酸を含む上流MVA経路を含有する。いくつかの実施形態では、細胞は、MVK、PMK、MVD、およびIDI核酸を含む下流MVA経路を含有する。いくつかの実施形態では、細胞は、AA−CoAチオラーゼ、HMG−CoAシンターゼ、HMG−CoAレダクターゼ、MVK、PMK、MVD、およびIDI核酸を含む全MVA経路を含有する。いくつかの実施形態では、細胞は、AA−CoAチオラーゼ、HMG−CoAシンターゼ、HMG−CoAレダクターゼ、MVK、PMDC、IPK、およびIDI核酸を含む全MVA経路を含有する。MVA経路核酸は、異種核酸または重複コピーの内在性核酸であり得る。いくつかの実施形態では、1以上のMVA経路ポリペプチドの量を、MVA経路核酸の内在性プロモーターまたは調節領域をMVA経路核酸のより多くの転写をもたらす他のプロモーターおよび/または調節領域と置き換えることによって増加させる。いくつかの実施形態では、細胞は、イソプレンシンターゼポリペプチド(例えば、植物イソプレンシンターゼ核酸)をコードする異種核酸とイソプレンシンターゼポリペプチドをコードする重複コピーの内在性核酸の両方を含有する。
例えば、クズイソプレンシンターゼポリペプチドをコードする核酸と、出芽酵母のMVK、PMK、MVD、およびIDIポリペプチドをコードする核酸とを含有する大腸菌細胞は、6.67×10−4mol/Lブロス/OD600/時間の速度でイソプレンを生成させた(実施例8参照)。さらに、エンテロコックス・フェカーリスのAA−CoAチオラーゼ、HMG−CoAシンターゼ、およびHMG−CoAレダクターゼポリペプチドをコードする核酸を有する大腸菌細胞の14リットル発酵は、22グラムのメバロン酸(MVA経路の中間物)を産出した。これらの細胞の振盪フラスコは、1リットル当たり2〜4グラムのメバロン酸を産出した。これらの結果は、異種MVA経路核酸が大腸菌において活性があることを示している。上流MVA経路と下流MVA経路の両方およびクズイソプレンシンターゼの核酸を含有する大腸菌細胞は、下流MVA経路のみとクズイソプレンシンターゼの核酸を有する大腸菌細胞(MCM131株)と比べて有意により多いイソプレン(874μg/L)を産出した(表3および実施例8、第VIII部を参照されたい)。
いくつかの実施形態では、細胞の少なくとも一部は、連続培養(例えば、希釈しない連続培養)において少なくとも約5、10、20、50、75、100、200、300回、またはそれより多くの細胞分裂の間、異種イソプレンシンターゼ、DXS、IDI、および/またはMVA経路核酸を維持する。本明細書に記載の態様のいずれかのいくつかの実施形態では、異種または重複コピーの内在性イソプレンシンターゼ、DXS、IDI、および/またはMVA経路核酸を含む核酸はまた、カナマイシン、アンピシリン、カルベニシリン、ゲンタマイシン、ハイグロマイシン、フレオマイシン、ブレオマイシン、ネオマイシン、またはクロラムフェニコール抗生物質耐性核酸などの選択マーカーを含む。
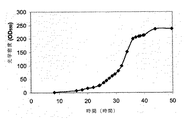
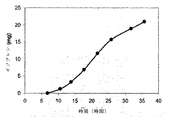
実施例7、第VI部に示すように、産出されるイソプレンの量を、酵母抽出物を細胞培養培地に添加することによってさらに増加させることができる。この実施例では、産出されたイソプレンの量は、試験された濃度について細胞培地中の酵母抽出物の量に直線的に比例した(図48C)。さらに、ブロス1リットル当たり約0.11グラムのイソプレンが、酵母抽出物とグルコースを含む細胞培地から産出された(実施例7、第VIII部)。これらの実験は両方とも、イソプレンをさせるために、クズイソプレンシンターゼ、出芽酵母IDI、および大腸菌DXS核酸を有する大腸菌細胞を用いた。グルコースの存在下で酵母抽出物の量を増加させると、酵母抽出物の存在下でグルコースの量を増加させるよりもより多くのイソプレンが産出された。また、酵母抽出物の量を増加させることで、細胞により長い間にわたって高レベルのイソプレンを産出させることが可能になり、細胞の健康が改善された。
イソプレン産出はまた、3種類の加水分解されたバイオマス(バガス、コーンストーバー、および針葉樹パルプ)を炭素源として用いて示された(図46A〜C)。クズイソプレンシンターゼ、出芽酵母IDI、および大腸菌DXS核酸を有する大腸菌細胞は、等量のグルコース(例えば、1%グルコース、w/v)からと同じだけのこれらの加水分解されたバイオマス炭素源からのイソプレンを産出した。所望により、任意の他のバイオマス炭素源を本発明の組成物および方法で用いることができる。多くの従来の細胞培地よりも安価であり、それによりイソプレンの経済的な生産が促進されるので、バイオマス炭素源が望ましい。
さらに、転化糖は、イソプレンを生成させるための炭素源として機能することが示された(図47Cおよび96〜98)。例えば、2.4g/Lのイソプレンが、MVA経路ポリペプチドとクズイソプレンシンターゼを発現する細胞から産出された(実施例8、第XV部)。グリセロールも、クズイソプレンシンターゼを発現する細胞から2.2mg/Lのイソプレンの生成させるための炭素源として用いられた(実施例8、第XIV部)。イソプレンシンターゼ核酸に加えて、DXS核酸、IDI核酸、および/または1以上のMVA経路核酸(例えば、全MVA経路をコードする核酸)を発現させると、グリセロールからのイソプレンの産出が増加し得る。
いくつかの実施形態では、油を細胞培地に含める。例えば、クズイソプレンシンターゼ核酸を含有する枯草菌細胞は、油とグルコース源とを含有する細胞培地で培養した場合、イソプレンを産出した(実施例4、第III部)。いくつかの実施形態では、2種以上の油(例えば、2、3、4、5種またはそれより多くの油)を細胞培地に含める。任意の特定の理論に束縛されるつもりはないが、(i)油がイソプレンへの変換に利用可能な細胞内の炭素量を増加させ得る、(ii)油が細胞内のアセチル−CoAの量を増加させ、それによりMVA経路を通る炭素の流れを増加させ得る、および/または(ii)油が細胞に余分な栄養を提供し得る(これは、細胞内の炭素の多くが他の産物ではなくイソプレンに変換されるので望ましい)と考えられている。いくつかの実施形態では、油を含有する細胞培地中で培養される細胞は、自然にMVA経路を用いてイソプレンを産出するかまたは全MVA経路の核酸を含有するように遺伝子改変されている。いくつかの実施形態では、油は部分的または完全に加水分解された後、宿主細胞による油の使用を促進するために細胞培養培地に添加される。
細胞(例えば、細菌)内でイソプレンなどの小分子を商業的に産出させる上での大きな障害の1つは、分子の産出と細胞の増殖とを脱共役させることである。商業的に実現可能なイソプレン産出のためのいくつかの実施形態では、原料由来炭素の相当な量が、細胞の増殖や維持にではなく、イソプレンに変換される(「炭素効率」)。様々な実施形態では、細胞は、細胞培養培地中の炭素の約0.0015、0.002、0.005、0.01、0.02、0.05、0.1、0.12、0.14、0.16、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0、1.2、1.4、1.6、1.8、2.0、2.5、3.0、3.5、4.0、5.0、6.0、7.0、もしくは8.0%またはそれらより多くをイソプレンに変換する。特定の実施形態では、下流産物に変換される原料由来炭素の相当な部分が、イソプレンに変換される。実施例11でさらに記載するように、MVA経路とクズイソプレンシンターゼ核酸を発現する大腸菌細胞は、イソプレンまたは中間体メバロン酸の産出と増殖とを脱共役させ、高い炭素効率を得ていることが示された。特に、メバロン酸は、エンテロコックス・フェカーリス由来の上流MVA経路を発現する細胞から形成された。イソプレンは、エンテロコックス・フェカーリス由来の上流MVA経路、出芽酵母由来の下流MVA経路、およびタイワンクズ(クズ)由来のイソプレンシンターゼを発現する細胞から形成された。このイソプレンまたはメバロン酸産出と増殖の脱共役は、4つの異なる大腸菌株:BL21(LDE3)、BL21(LDE3)Tuner、FM5、およびMG1655で示された。最初の2つの大腸菌株はB株であり、後者2つは、K12株である。産出と増殖の脱共役は、ack遺伝子とpta遺伝子が欠失している変異体MG1655でも示された。この変異体は、より少ない酢酸の産出も示した。
例示的なポリペプチドおよび核酸
様々なイソプレンシンターゼ、DXS、IDI、MVA経路、ヒドロゲナーゼ、ヒドロゲナーゼ成熟因子またはヒドロゲナーゼ転写因子のポリペプチドおよび核酸を本発明に記載の組成物および方法で用いることができる。
いくつかの実施形態では、融合ポリペプチドは、第1のポリペプチド(例えば、イソプレンシンターゼ、DXS、IDI、MVA経路、ヒドロゲナーゼ、ヒドロゲナーゼ成熟因子もしくはヒドロゲナーゼ転写因子のポリペプチドまたはそれらの触媒活性断片)の一部または全てを含み、第2のポリペプチド(例えば、融合ポリペプチドの精製または検出を容易にするペプチド、例えば、Hisタグ)の一部または全てを任意で含み得る。いくつかの実施形態では、融合ポリペプチドは、2以上のMVA経路ポリペプチド(例えば、AA−CoAチオラーゼおよびHMG−CoAレダクターゼポリペプチド)の活性を有する。いくつかの実施形態では、ポリペプチドは、2以上のMVA経路ポリペプチドの活性を有する天然のポリペプチド(例えば、エンテロコックス・フェカーリスmvaE核酸によってコードされるポリペプチド)である。
様々な実施形態では、ポリペプチドは、少なくともまたは約50、100、150、175、200、250、300、350、400個、またはそれより多くのアミノ酸を有する。いくつかの実施形態では、ポリペプチド断片は、全長ポリペプチド由来の少なくともまたは約25、50、75、100、150、200、300個、またはそれより多くの連続するアミノ酸を含有し、かつ対応する全長ポリペプチドの活性の少なくともまたは約5%、10%、20%、30%、40%、50%、60%、70%、80%、90%、95%、または100%を有する。特定の実施形態では、ポリペプチドは、任意の天然のイソプレンシンターゼ、DXS、IDI、MVA経路、ヒドロゲナーゼ、ヒドロゲナーゼ成熟因子またはヒドロゲナーゼ転写因子のポリペプチドのアミノ酸配列の部分またはアミノ酸配列全体を含む。いくつかの実施形態では、ポリペプチドは、野生型(すなわち、天然に生じる配列)のイソプレンシンターゼ、DXS、IDI、MVA経路、ヒドロゲナーゼ、ヒドロゲナーゼ成熟因子またはヒドロゲナーゼ転写因子のポリペプチドの配列と比べて、1以上の突然変異を有する。
いくつかの実施形態では、ポリペプチドは単離されたポリペプチドである。いくつかの実施形態では、ポリペプチドは異種ポリペプチドである。
いくつかの実施形態では、核酸は組換え核酸である。いくつかの実施形態では、イソプレンシンターゼ、DXS、IDI、MVA経路、ヒドロゲナーゼ、ヒドロゲナーゼ成熟因子またはヒドロゲナーゼ転写因子の核酸は、組換え核酸が、イソプレンシンターゼ、DXS、IDI、MVA経路、ヒドロゲナーゼ、ヒドロゲナーゼ成熟因子またはヒドロゲナーゼ転写因子のポリペプチドを含む融合ポリペプチドおよび別のポリペプチド(例えば、融合ポリペプチドの精製または検出を容易にするペプチド、例えば、Hisタグ)の全てまたは一部をコードするように、別のポリペプチドの全てまたは一部をコードする別の核酸に機能的に連結されている。いくつかの実施形態では、組換え核酸の一部または全てを化学合成する。
いくつかの実施形態では、核酸は異種核酸である。特定の実施形態では、核酸は、任意の天然のイソプレンシンターゼ、DXS、IDI、MVA経路、ヒドロゲナーゼ、ヒドロゲナーゼ成熟因子またはヒドロゲナーゼ転写因子の核酸の核酸配列の部分または核酸配列全体を含む。いくつかの実施形態では、核酸は、天然のイソプレンシンターゼ核酸DXS、IDI、MVA経路、ヒドロゲナーゼ、ヒドロゲナーゼ成熟因子またはヒドロゲナーゼ転写因子の核酸由来の少なくともまたは約50、100、150、200、300、400、500、600、700、800個、またはそれより多くの連続するヌクレオチドを含む。いくつかの実施形態では、核酸は、野生型(すなわち、天然に生じる配列)イソプレンシンターゼ、DXS、IDI、MVA経路、ヒドロゲナーゼ、ヒドロゲナーゼ成熟因子またはヒドロゲナーゼ転写因子の核酸の配列と比べて、1以上の突然変異を有する。いくつかの実施形態では、核酸は、イソプレンシンターゼ、DXS、IDI、MVA経路、ヒドロゲナーゼ、または転写因子核酸の転写または翻訳を増加させる1以上の突然変異(例えば、サイレント突然変異)を有する。いくつかの実施形態では、核酸は、イソプレンシンターゼ、DXS、IDI、MVA経路、ヒドロゲナーゼ、ヒドロゲナーゼ成熟因子またはヒドロゲナーゼ転写因子のポリペプチドをコードする任意の核酸の縮重変異体である。
例示的なイソプレンシンターゼ、DXS、IDI、および/またはMVA経路のポリペプチドと核酸のアクセッション番号を別表1に掲載する(別表1のアクセッション番号およびその対応する配列は、特に、イソプレンシンターゼ、DXS、IDI、および/またはMVA経路ポリペプチドと核酸のアミノ酸配列と核酸配列に関して、その全体が参照により本明細書に組み込まれる)。Keggデータベースもまた、多数の例示的なイソプレンシンターゼ、DXS、IDI、および/またはMVA経路のポリペプチドと核酸のアミノ酸配列と核酸配列を含有する(例えば、“genome.jp/kegg/pathway/map/map00100.html”のワールド・ワイド・ウェブ、およびその中の配列を参照されたく、これらは各々、特に、イソプレンシンターゼ、DXS、IDI、および/またはMVA経路のポリペプチドと核酸のアミノ酸配列と核酸配列に関して、その全体が参照により本明細書に組み込まれる)。いくつかの実施形態では、イソプレンシンターゼ、DXS、IDI、および/またはMVA経路ポリペプチドおよび/または核酸の1以上は、2007年12月12日または2008年9月14日に公的に入手可能になった配列と同一の配列(例えば、別表1のアクセッション番号のいずれかに対応する配列のいずれかまたはKeggデータベース中に存在する配列のいずれか)を有する。さらなる例示的なイソプレンシンターゼ、DXS、IDI、および/またはMVA経路のポリペプチドと核酸が以下でさらに記載されている。
例示的なイソプレンシンターゼポリペプチドおよび核酸
上述のように、イソプレンシンターゼポリペプチド、ジメチルアリル二リン酸(DMAPP)をイソプレンに変換する。例示的なイソプレンシンターゼポリペプチドには、イソプレンシンターゼポリペプチドの少なくとも1つの活性を有するポリペプチド、ポリペプチドの断片、ペプチド、および融合ポリペプチドが含まれる。標準的な方法を用いて、インビトロで、細胞抽出物中で、またはインビボでDMAPPをイソプレンに変換するポリペプチドの能力を測定することにより、ポリペプチドがイソプレンシンターゼポリペプチド活性を有するかどうかを決定することができる。例示的なアッセイでは、細胞抽出物を、実施例1に記載されるような振盪フラスコ法で株(例えば、本明細書に記載の大腸菌/pTrcKudzu株)を増殖させることにより調製する。誘導が終わった後、約10mLの細胞を7000×gで10分間の遠心分離でペレット化し、グリセロールを含まない5mlのPEBに再懸濁する。標準的な手順を用いて、フレンチプレス細胞破砕機(French Pressure cell)を用いて、細胞を溶解する。あるいは、−80℃で凍結/融解した後、細胞をリゾチーム(Ready−Lyseリゾチーム溶液;EpiCentre)で処理する。
細胞抽出物中のイソプレンシンターゼポリペプチド活性を、例えば、Silver et al.,J.Biol.Chem.270:13010−13016,1995およびその中の参考文献(これらは各々、特に、イソプレンシンターゼポリペプチド活性のアッセイに関して、その全体が参照により本明細書に組み込まれる)に記載されているように測定することができる。DMAPP(Sigma)を窒素流下で蒸発乾固させ、100mMリン酸カリウム緩衝液pH8.2中100mMの濃度になるように再水和させ、−20℃で保存する。アッセイを実施するために、5μLの1M MgCl2、1mM(250μg/ml)のDMAPP、65μLの植物抽出物緩衝液(PEB)(50mM Tris−HCl、pH8.0、20mM MgCl2、5%グリセロール、および2mM DTT)の溶液を、金属スクリューキャップとテフロンコーティングされたシリコンセプタムが付いた20mlヘッドスペースバイアル(Agilent Technologies)中の25μLの細胞抽出物に添加し、振盪させながら37℃で15分間培養する。200μLの250mM EDTAを添加して反応をクエンチし、実施例1、第II部に記載されるようにGC/MSで定量する。
例示的なイソプレンシンターゼ核酸としては、イソプレンシンターゼポリペプチド核酸の少なくとも1つの活性を有するポリペプチド、ポリペプチドの断片、ペプチド、または融合ポリペプチドをコードする核酸が挙げられる。例示的なイソプレンシンターゼポリペプチドおよび核酸としては、本明細書に記載の供給源細胞のいずれかに由来する天然のポリペプチドおよび核酸ならびに本明細書に記載の供給源細胞のいずれかから得られる突然変異体ポリペプチドおよび核酸が挙げられる。
いくつかの実施形態では、イソプレンシンターゼポリペプチドまたは核酸は、マメ科(例えば、マメ亜科)に由来するものである。いくつかの実施形態では、イソプレンシンターゼポリペプチドまたは核酸は、タイワンクズ(クズ)(Sharkey et al.,Plant Physiology 137:700−712,2005)、クズ(Pueraria lobata)、ポプラ(例えば、ウラジロハコヤナギ、クロヤマナラシ、ブラックコットンウッド、もしくはウラジロハコヤナギ×ヨーロッパヤマナラシ(CAC35696) Miller et al.,Planta213:483−487,2001)、アスペン(例えば、アメリカヤマナラシ) Silver et al.,JBC 270(22):13010−1316,1995)、またはヨーロッパナラ(ヨーロッパナラ(Quercus robur))(Zimmer et al.,WO98/02550号)(これらは各々、特に、イソプレンシンターゼ核酸と、イソプレンシンターゼポリペプチドの発現とに関して、その全体が参照により本明細書に組み込まれる)に由来するポリペプチドまたは核酸である。好適なイソプレンシンターゼとしては、限定するものではないが、Genbankアクセッション番号AY341431、AY316691、AY279379、AJ457070、およびAY182241(これらは各々、特に、イソプレンシンターゼ核酸およびポリペプチドの配列に関して、その全体が参照により本明細書に組み込まれる)により特定されるものが挙げられる。いくつかの実施形態では、イソプレンシンターゼポリペプチドまたは核酸は、ヨーロッパナラ由来の天然のポリペプチドまたは核酸ではない(すなわち、イソプレンシンターゼポリペプチドまたは核酸は、ヨーロッパナラ由来の天然のポリペプチドまたは核酸以外のイソプレンシンターゼポリペプチドまたは核酸である)。いくつかの実施形態では、イソプレンシンターゼ核酸またはポリペプチドは、ポプラ由来の天然のポリペプチドまたは核酸である。いくつかの実施形態では、イソプレンシンターゼ核酸またはポリペプチドは、ポプラ由来の天然のポリペプチドまたは核酸ではない。
例示的なDXSポリペプチドおよび核酸
上述のように、1−デオキシ−D−キシルロース−5−リン酸シンターゼ(DXS)ポリペプチドは、ピルビン酸とD−グリセルアルデヒド−3−リン酸を1−デオキシ−D−キシルロース−5−リン酸に変換する。例示的なDXSポリペプチドとしては、DXSポリペプチドの少なくとも1つの活性を有するポリペプチド、ポリペプチドの断片、ペプチド、および融合ポリペプチドが挙げられる。標準的な方法(例えば、本明細書に記載の方法)を用いて、インビトロで、細胞抽出物中で、またはインビボで、ピルビン酸とD−グリセルアルデヒド−3−リン酸を1−デオキシ−D−キシルロース−5−リン酸に変換するポリペプチドの能力を測定することにより、ポリペプチドがDXSポリペプチド活性を有するかどうかを決定することができる。例示的なDXS核酸としては、DXSポリペプチドの少なくとも1つの活性を有するポリペプチド、ポリペプチドの断片、ペプチド、または融合ポリペプチドをコードする核酸が挙げられる。例示的なDXSポリペプチドおよび核酸としては、本明細書に記載の供給源細胞のいずれかに由来する天然のポリペプチドおよび核酸ならびに本明細書に記載の供給源細胞のいずれかから得られる突然変異体ポリペプチドおよび核酸が挙げられる。
例示的なIDIポリペプチドおよび核酸
イソペンテニル二リン酸イソメラーゼポリペプチド(イソペンテニル二リン酸デルタイソメラーゼまたはIDI)は、イソペンテニル二リン酸(IPP)とジメチルアリル二リン酸(DMAPP)の相互変換を触媒する(例えば、IPPをDMAPPに変換するおよび/またはDMAPPをIPPに変換する)。例示的なIDIポリペプチドとしては、IDIポリペプチドの少なくとも1つの活性を有するポリペプチド、ポリペプチドの断片、ペプチド、および融合ポリペプチドが挙げられる。標準的な方法(例えば、本明細書に記載の方法)を用いて、インビトロで、細胞抽出物中で、またはインビボで、IPPとDMAPPを相互変換するポリペプチドの能力を測定することにより、ポリペプチドがIDIポリペプチド活性を有するかどうかを決定することができる。例示的なIDI核酸としては、IDIポリペプチドの少なくとも1つの活性を有するポリペプチド、ポリペプチドの断片、ペプチド、または融合ポリペプチドをコードする核酸が挙げられる。例示的なIDIポリペプチドおよび核酸としては、本明細書に記載の供給源細胞のいずれかに由来する天然のポリペプチドおよび核酸ならびに本明細書に記載の供給源細胞のいずれかから得られる突然変異体ポリペプチドおよび核酸が挙げられる。
例示的なMVA経路ポリペプチドおよび核酸
例示的なMVA経路ポリペプチドとしては、アセチル−CoAアセチルトランスフェラーゼ(AA−CoAチオラーゼ)ポリペプチド、3−ヒドロキシ−3−メチルグルタリル−CoAシンターゼ(HMG−CoAシンターゼ)ポリペプチド、3−ヒドロキシ−3−メチルグルタリル−CoAレダクターゼ(HMG−CoAレダクターゼ)ポリペプチド、メバロン酸キナーゼ(MVK)ポリペプチド、ホスホメバロン酸キナーゼ(PMK)ポリペプチド、ジホスホメバロン酸デカルボキシラーゼ(MVD)ポリペプチド、ホスホメバロン酸デカルボキシラーゼ(PMDC)ポリペプチド、イソペンテニルリン酸キナーゼ(IPK)ポリペプチド、IDIポリペプチドおよび2以上のMVA経路ポリペプチドの活性を有するポリペプチド(例えば、融合ポリペプチド)が挙げられる。特に、MVA経路ポリペプチドとしては、MVA経路ポリペプチドの少なくとも1つの活性を有するポリペプチド、ポリペプチドの断片、ペプチド、および融合ポリペプチドが挙げられる。例示的なMVA経路核酸としては、MVA経路ポリペプチドの少なくとも1つの活性を有するポリペプチド、ポリペプチドの断片、ペプチド、または融合ポリペプチドをコードする核酸が挙げられる。例示的なMVA経路ポリペプチドおよび核酸としては、本明細書に記載の供給源細胞のいずれかに由来する天然のポリペプチドおよび核酸ならびに本明細書に記載の供給源細胞のいずれかから得られる突然変異体ポリペプチドおよび核酸が挙げられる。
特に、アセチル−CoAアセチルトランスフェラーゼポリペプチド(AA−CoAチオラーゼまたはAACT)は、2分子のアセチル−CoAをアセトアセチル−CoAに変換する。標準的な方法(例えば、本明細書に記載の方法)を用いて、インビトロで、細胞抽出物中で、またはインビボで、2分子のアセチル−CoAをアセトアセチル−CoAに変換するポリペプチドの能力を測定することにより、ポリペプチドがAA−CoAチオラーゼポリペプチド活性を有するかどうかを決定することができる。
3−ヒドロキシ−3−メチルグルタリル−CoAシンターゼ(HMG−CoAシンターゼまたはHMGS)ポリペプチドは、アセトアセチル−CoAを3−ヒドロキシ−3−メチルグルタリル−CoAに変換する。標準的な方法(例えば、本明細書に記載の方法)を用いて、インビトロで、細胞抽出物中で、またはインビボで、アセトアセチル−CoAを3−ヒドロキシ−3−メチルグルタリル−CoAに変換するポリペプチドの能力を測定することにより、ポリペプチドがHMG−CoAシンターゼポリペプチド活性を有するかどうかを決定することができる。
3−ヒドロキシ−3−メチルグルタリル−CoAレダクターゼ(HMG−CoAレダクターゼまたはHMGR)ポリペプチドは、3−ヒドロキシ−3−メチルグルタリル−CoAをメバロン酸に変換する。標準的な方法(例えば、本明細書に記載の方法)を用いて、インビトロで、細胞抽出物中で、またはインビボで、3−ヒドロキシ−3−メチルグルタリル−CoAをメバロン酸に変換するポリペプチドの能力を測定することにより、ポリペプチドがHMG−CoAレダクターゼポリペプチド活性を有するかどうかを決定することができる。
メバロン酸キナーゼ(MVK)ポリペプチドはメバロン酸をリン酸化して、メバロン酸−5−リン酸を形成させる。標準的な方法(例えば、本明細書に記載の方法)を用いて、インビトロで、細胞抽出物中で、またはインビボで、メバロン酸をメバロン酸−5−リン酸に変換するポリペプチドの能力を測定することにより、ポリペプチドがMVKポリペプチド活性を有するかどうかを決定することができる。
ホスホメバロン酸キナーゼ(PMK)ポリペプチドはメバロン酸−5−リン酸をリン酸化して、メバロン酸−5−二リン酸を形成させる。標準的な方法(例えば、本明細書に記載の方法)を用いて、インビトロで、細胞抽出物中で、またはインビボで、メバロン酸−5−リン酸をメバロン酸−5−二リン酸に変換するポリペプチドの能力を測定することにより、ポリペプチドがPMKポリペプチド活性を有するかどうかを決定することができる。
ジホスホメバロン酸デカルボキシラーゼ(MVDまたはDPMDC)ポリペプチドは、メバロン酸−5−二リン酸をイソペンテニル二リン酸(IPP)に変換する。標準的な方法(例えば、本明細書に記載の方法)を用いて、インビトロで、細胞抽出物中で、またはインビボで、メバロン酸−5−二リン酸をIPPに変換するポリペプチドの能力を測定することにより、ポリペプチドがMVDポリペプチド活性を有するかどうかを決定することができる。
ホスホメバロン酸デカルボキシラーゼ(PMDC)ポリペプチドは、メバロン酸−5−リン酸をイソペンテニルリン酸(IP)に変換する。標準的な方法(例えば、本明細書に記載の方法)を用いて、インビトロで、細胞抽出物中で、またはインビボで、メバロン酸−5−リン酸をIPに変換するポリペプチドの能力を測定することにより、ポリペプチドがPMDCポリペプチド活性を有するかどうかを決定することができる。
イソペンテニルリン酸キナーゼ(IPK)ポリペプチドはイソペンテニルリン酸(IP)をリン酸化して、イソペンテニル二リン酸(IPP)を形成させる。標準的な方法(例えば、本明細書に記載の方法)を用いて、インビトロで、細胞抽出物中で、またはインビボで、IPをIPPに変換するポリペプチドの能力を測定することにより、ポリペプチドがIPKポリペプチド活性を有するかどうかを決定することができる。
例示的なIDIポリペプチドおよび核酸は上に記載されている。
例示的なヒドロゲナーゼポリペプチドおよび核酸
ヒドロゲナーゼポリペプチドは、次の反応を触媒する:2H++2e−⇔H2。インビトロでは、その反応は可逆的であるが、ある種のヒドロゲナーゼは、インビボでは、H2を酸化するかまたはH+を還元するかのいずれかの、一方向でしか働かない場合がある。ヒドロゲナーゼポリペプチドは酸素感受性で、その触媒中心の一部として錯体金属補因子を含有することがあり、時には複数のサブユニットからなることもあり、ヒドロゲナーゼ遺伝子の発現には、「成熟」因子または転写調節因子(すなわち、活性化因子または抑制因子)などのさらなるアクセサリーポリペプチドが必要になることもある。ヒドロゲナーゼは、その触媒中心の金属補因子の種類に基づいて大きく少なくとも3つのグループに分類される。すなわち、(1)ニッケル−鉄(「NiFe」)ヒドロゲナーゼは、ニッケル/鉄補因子を有し、(2)鉄−鉄ヒドロゲナーゼ(「FeFe」)は、鉄/鉄補因子を有し、(3)鉄/非硫黄含有(「Fe」)ヒドロゲナーゼ(これは、グループ(1)と(2)に見られる4Fe4Sクラスターを欠く)は、鉄補因子とメテニル−テトラヒドロメタノプテリン電子担体とを有する。例えば、Chung−Jung Chou et al.,“Hydrogenesis in hyperthermophilic microorganisms:implications for biofuels,” Metabol.Eng.10:394−404(2008)、およびGoenuel Vardar−Schara et al.,“Metabolically engineered bacteria for producing hydrogen via fermentation,” Microbial Biotechnol.1(2):107−125(2008)を参照されたく、これらは両方とも、特に、様々な種類およびクラスのヒドロゲナーゼに関して、その全体が参照により本明細書に組み込まれる。多くの生物は複数のヒドロゲナーゼを含有しているが、NiFeヒドロゲナーゼとFeFeヒドロゲナーゼの両方の遺伝子を含有するものはわずかである。
NiFeヒドロゲナーゼの触媒中心はニッケル原子と鉄原子からなり、各々、2つの一酸化炭素(CO)配位子と2つのシアン化物(CN−)配位子を有する。NiFeヒドロゲナーゼは全て、触媒中心の内外に電子を伝達するための複数の鉄−硫黄(Fe−S)中心を含有する少なくとも第2のサブユニットを含む。NiFeヒドロゲナーゼは、4つの主なクラスにさらに分けることができる:(1)呼吸酵素。これは、H2の酸化を、嫌気性条件下での最終電子受容体(例えば、SO4 2−もしくはNO3 −)の還元、または好気性微生物でのO2と共役させる多酵素系の一部である;(2)H2センサー。これは、代謝活性のあるNiFeヒドロゲナーゼの発現を活性化させる;(3)NADP+を利用することができる多サブユニットを含有する細胞質ヒドロゲナーゼ。これは、インビトロでは容易に可逆性となるが、インビボではH2の酸化しかしない場合がある;および(4)細菌や古細菌でも見出されている膜結合型のエネルギー変換多酵素複合体。Chung−Jung Chou et al.,“Hydrogenesis in hyperthermophilic microorganisms:implications for biofuels,” Metabol.Eng.10:394−404(2008)。
FeFeヒドロゲナーゼの触媒中心は、単一のタンパク質(システイン)配位子によって[4Fe−4S]中心に架橋した二核(FeFe)部位を配位する触媒「Hクラスター」を含有する。二核中心の2つの鉄原子は各々、2つの一酸化炭素(CO)配位子と2つのシアン化物(CN−)配位子を有し、小有機分子の一部となる2つの硫黄原子によっても架橋される。大部分のFeFeヒドロゲナーゼは、約50キロダルトン(kDa)の単量体酵素であり、インビボでは主に、プロトンを水素ガスに還元することによって余剰の還元性等価物を廃棄するように働くように思われる。Chung−Jung Chou et al.,“Hydrogenesis in hyperthermophilic microorganisms:implications for biofuels,” Metabol.Eng.10:394−404(2008)。
Feヒドロゲナーゼの触媒中心は、当初、有機補因子を基礎にした活性部位を有し、金属は含まないと考えられたが、後に単核Fe原子を含有することが示された。3種類のヒドロゲナーゼには系統発生上の違いがあるものの、少なくとも1つの鉄原子の他に、3種類のヒドロゲナーゼは全て、その活性部位に鉄原子に対する少なくとも1つの一酸化炭素(CO)配位子を含有し、この配位子によって、H2の触媒による酸化やプロトンの還元が促進される。Chung−Jung Chou et al.,“Hydrogenesis in hyperthermophilic microorganisms:implications for biofuels,” Metabol.Eng.10:394−404(2008)。
例示的なヒドロゲナーゼポリペプチドとしては、限定するものではないが、大腸菌ヒドロゲナーゼ−1(Hyd−1)ポリペプチド、大腸菌ヒドロゲナーゼ−2(Hyd−2)ポリペプチド、大腸菌ヒドロゲナーゼ−3(Hyd−3)ポリペプチド、大腸菌ヒドロゲナーゼ−4(Hyd−4)ポリペプチド、大腸菌ギ酸水素リアーゼ(FHL)複合体(これは、酸性pH、嫌気性条件下で、ギ酸とCO2から水素ガスを産出させる(例えば、Akihito Yoshida et al.,“Efficient induction of formate hydrogen lyase of aerobically grown Escherichia coli in a three−step biohydrogen production process,” Appl.Microbiol.Biotechnol.74:754−760(2007)を参照されたく、これは、特に、大腸菌におけるギ酸水素リアーゼの発現の誘導に関して、その全体が参照により本明細書に組み込まれる))、ラルストニア・ユートロファ(Ralstonia eutropha)H16ヒドロゲナーゼ(R.ユートロファHoxH)、ロドコックス・オパクス(Rhodococcus opacus)MR11ヒドロゲナーゼ(R.オパクスHoxH)ポリペプチド、シネコシスティス(Synechosystis)種PCC 6803ヒドロゲナーゼ(Syn.PCC 6803 HoxH)ポリペプチド、デスルフォビブリオ・ギガス(Desulfovibrio gigas)ヒドロゲナーゼ(D.ギガス)ポリペプチド、およびデスルホビブリオ・デスルフリカンス(Desulfovibrio desulfuricans)ATCC 7757ヒドロゲナーゼ(D.デスルフリカンス)ポリペプチド(例えば、Goenuel Vardar−Schara et al.,“Metabolically engineered bacteria for producing hydrogen via fermentation,” Microbial Biotechnol.1(2):107−125(2008)を参照されたく、これは、特に、様々な種類およびクラスのヒドロゲナーゼに関して、その全体が参照により本明細書に組み込まれる)ならびに2以上のヒドロゲナーゼポリペプチドの活性を有するポリペプチド(例えば、融合ポリペプチド)が挙げられる。特に、ヒドロゲナーゼポリペプチドとしては、ヒドロゲナーゼポリペプチドの少なくとも1つの活性を有するポリペプチド、ポリペプチドの断片、ペプチド、および融合ポリペプチドが挙げられる。例示的なヒドロゲナーゼ核酸としては、ヒドロゲナーゼポリペプチドの少なくとも1つの活性、またはヒドロゲナーゼポリペプチドの発現、プロセッシング、もしくは成熟に必要な少なくとも1つの活性を有するポリペプチド、ポリペプチドの断片、ペプチド、または融合ポリペプチドをコードする核酸が挙げられる。例示的なヒドロゲナーゼポリペプチドおよび核酸としては、本明細書に記載の供給源細胞のいずれかに由来する天然のポリペプチドおよび核酸ならびに本明細書に記載の供給源細胞のいずれかから得られる突然変異体ポリペプチドおよび核酸が挙げられる。
嫌気性ギ酸水素リアーゼ(FHL)複合体の一部である、大腸菌Hyd−3は、(hycA、hycB、hycC、hycD、hycE、hycF、hycG、hycH、およびhycI遺伝子を含む)hycオペロンによってコードされている。大腸菌Hyd−4は、(hyfA、hyfB、hyfC、hyfD、hyfE、hyfF、hyfG、hyfH、hyfI、hyfJ、およびhyfR遺伝子を含む)hyfオペロンによってコードされている。大腸菌FHLは、hycオペロン由来の6つの遺伝子(hycB、hycC、hycD、hycE、hycFおよびhycG)と、(ギ酸デヒドロゲナーゼH(Fdh−H)をコードする)fdhF遺伝子とによってコードされている。FHL複合体の発現はさらに、fdhFおよびhycオペロンの転写を活性化する転写因子であるピルビン酸ギ酸リアーゼ(pfl)のFhlAの発現、またはFHLの転写を負に調節するhycA遺伝子によってコードされる転写因子であるHycAの欠失/不活化を必要とすることがある。イソプレンと水素の共産出は、ヒドロゲナーゼおよび例えば、鉄−硫黄錯体転写調節因子(iscR)(Kalim−Akhtar et al.,“Deletion of iscR stimulates recombinant Clostridial Fe/Fe hydrogenase activity and H2−accumulation in Escherichia coli BL21(DE3),” Appl.Microbiol.Biotechnol.78:853−862(2008)、これは、特に、iscR遺伝子を欠失させることによるクロストリジウムのFe/Feヒドロゲナーゼ活性の刺激および大腸菌における水素蓄積に関して、その全体が参照により本明細書に組み込まれる)などの他の酵素の遺伝子発現の調節に関与するさらなるタンパク質の発現または不活化/欠失によって改善することができる。
例示的なフェレドキシン依存的ヒドロゲナーゼポリペプチドとしては、限定するものではないが、クロストリジウム・アセトブツリクムヒドロゲナーゼA(HydA)(例えば、P.W.King et al.,“Functional studies of [FeFe] hydrogenase maturation in an Escherichia coli biosynthetic system,” J.Bacteriol.188(6):163−172(2006)を参照されたく、これは、特に、HydAと3つのHydA関連成熟酵素(HydE、HydGおよびHydF)(これらは、単独でまたは以下のうちの1以上とともに発現させてもよい:(1)枯草菌NADPHフェレドキシンオキシドレダクターゼ(NFOR)(例えば、Viet et al.,(2008))を参照されたく、これは、特に、NFORによる水素の産出に関して、その全体が参照により本明細書に組み込まれる;また、PCT刊行物WO/2007/089901号を参照されたく、これは、特に、水素を産出するための大腸菌株の最適化に関して、その全体が参照により本明細書に組み込まれる)、クロストリジウム・クルイベリNADHフェレドキシンオキシドレダクターゼ(RnfCDGEAB)(Henning Seedorf et al.,“The genome of Clostridium kluyveri, a strict anaerobe with unique metabolic features,” Proc.Nat’l Acad.Sci.U.S.A.105(6):2128−2133(2008)、これは、特に、NADHフェレドキシンオキシドレダクターゼに関して、および嫌気的エタノール−酢酸発酵経路の構成要素に関して、その全体が参照により本明細書に組み込まれる)、もしくはクロストリジウム・パスツラニヌム(Clostridium pasteuranium)フェレドキシンオキシドレダクターゼ(Fdx);(2)グリセルアルデヒド−6−リン酸フェレドキシンオキシドレダクターゼ(「GAPOR」);または(3)ピルビン酸フェレドキシンオキシドレダクターゼ(「POR」))による水素の産出に関して、その全体が参照により本明細書に組み込まれる)、および2以上のヒドロゲナーゼポリペプチドの活性を有するかまたは1以上のヒドロゲナーゼポリペプチドの活性と1以上のフェレドキシン依存的オキシドレダクターゼの活性とを有するポリペプチド(例えば、融合ポリペプチド)が挙げられる。特に、フェレドキシン依存的ヒドロゲナーゼポリペプチドとしては、フェレドキシン依存的ヒドロゲナーゼポリペプチドの少なくとも1つの活性を有するポリペプチド、ポリペプチドの断片、ペプチド、および融合ポリペプチドが挙げられる。
例示的なNADPH依存的ヒドロゲナーゼポリペプチドとしては、限定するものではないが、ピロコックス・フリオススヒドロゲナーゼ(例えば、J.Woodward et al.,“Enzymatic production of biohydrogen,” Nature 405(6790):1014−1015(2000)を参照されたい)などの好熱性ヒドロゲナーゼポリペプチド、および2以上のNADPH依存的ヒドロゲナーゼポリペプチドの活性を有するポリペプチド(例えば、融合ポリペプチド)が挙げられる。特に、NADPH依存的ヒドロゲナーゼポリペプチドとしては、NADPH依存的ヒドロゲナーゼポリペプチドの少なくとも1つの活性を有するポリペプチド、ポリペプチドの断片、ペプチド、および融合ポリペプチドが挙げられる。
例示的な酸素耐性または酸素非感受性ヒドロゲナーゼとしては、限定するものではないが、ルブリビバクス・ゲラチノーススヒドロゲナーゼ(例えば、P.C.Maness et al.,“Characterization of the oxygen tolerance of a hydrogenase linked to a carbon monoxide oxidation pathway in Rubrivivax gelatinosus,” Appl.Environ.Microbiol.68(6):2633−2636(2002)を参照されたく、これは、特に、R.ゲラチノーススヒドロゲナーゼに関して、その全体が参照により本明細書に組み込まれる)、およびラルストニア・ユートロファヒドロゲナーゼポリペプチド(例えば、T.Burgdorf et al.,“[NiFe]−hydrogenases of Ralstonia eutropha H16:modular enzymes for oxygen−tolerant biological hydrogen oxidation,” J.Mol.Microbiol.Biotechnol.10(2−4):181−196(2005)を参照されたく、これは、特に、R.ユートロファヒドロゲナーゼポリペプチドに関して、その全体が参照により本明細書に組み込まれる)が挙げられる。あるいは、ヒドロゲナーゼポリペプチドをコードする異種核酸を、標準的な方法およびアッセイを用いて突然変異させ、O2耐性またはO2非感受性についてスクリーニングすることができる(例えば、L.E.Nagy et al.,“Application of gene−shuffling for the rapid generation of novel [FeFe]−hydrogenase libraries,” Biotechnol.Letts.29(3)421−430(2007)を参照されたく、これは、特に、酸素耐性ヒドロゲナーゼポリペプチドの突然変異導入およびスクリーニングに関して、参照により本明細書に組み込まれる)。
標準的な方法(例えば、本明細書に記載の方法)を用いて、インビトロで、細胞抽出物中で、またはインビボで、水素ガスを産出するポリペプチドの能力を測定することにより、ポリペプチドがヒドロゲナーゼ活性を有するかどうかを決定することができる。
発酵副産物の産出に関する遺伝子の例示的なポリペプチドおよび核酸
大腸菌における異種またはネイティブなヒドロゲナーゼの発現または過剰発現の他に、イソプレンと水素の共産出を、嫌気性生合成経路を不活化し、それにより、限定するものではないが、乳酸、酢酸、ピルビン酸、エタノール、コハク酸、およびグリセロールをはじめとする、酸素制限条件または嫌気性条件の下で産出される種々の代謝産物(すなわち、発酵副産物)への炭素の流れを遮断することによって改善することができる。発酵副産物の産出に関与する例示的なポリペプチドとしては、ギ酸デヒドロゲナーゼN、αサブユニット(fdnG)、ギ酸デヒドロゲナーゼO、大サブユニット(fdoG)、硝酸レダクターゼ(narG)、ギ酸輸送体A(focA)、ギ酸輸送体B(focB)、ピルビン酸オキシダーゼ(poxB)、ピルビン酸デヒドロゲナーゼE1成分ackA/pta(aceE)、アルコールデヒドロゲナーゼ(adhE)、フマル酸レダクターゼ膜タンパク質(frdC)、および乳酸デヒドロゲナーゼ(ldhA)が挙げられる。例えば、Toshinori Maeda et al.,“Enhanced hydrogen production from glucose by metabolically engineered Escherichia coli,” Appl.Microbiol.Biotechnol.77(4):879−890(2007)を参照されたく、これは、特に、グルコース代謝が改変された大腸菌株の産出に関して、その全体が参照により本明細書に組み込まれる。イソプレンと水素の共産出を改善するために不活化することも可能な発酵副産物の産出に関与する遺伝子の調節または発現に関与する例示的なポリペプチドとしては、限定するものではないが、ギ酸水素リアーゼ(hycA)の抑制因子、フマル酸レダクターゼ調節因子(fnr)、アセチル−補酵素Aシンセターゼ(acs)、およびギ酸デヒドロゲナーゼ調節タンパク質(hycA)(これは、転写調節因子fhlA(ギ酸水素リアーゼ転写活性化因子)の発現を調節する)が挙げられる。
水素再取込みに関連する遺伝子の例示的なポリペプチドおよび核酸
イソプレンと水素の共産出を改善するために不活化することが同じく可能な水素再取込みに関与する例示的なポリペプチドとしては、限定するものではないが、大腸菌ヒドロゲナーゼ−1(Hyd−1)(hyaオペロン)および大腸菌ヒドロゲナーゼ−2(Hyd−2)(hybオペロン)が挙げられる。大腸菌Hyd−1は、(hyaA、hyaB、hyaC、hyaD、hyaE、およびhyaF遺伝子を含む)hyaオペロンによってコードされている。大腸菌Hyd−2は、(hybA、hybB、hybC、hybD、hybE、hybF、hybG、およびhybO遺伝子を含む)hybオペロンによってコードされている。
核酸を単離するための例示的な方法
イソプレンシンターゼ、DXS、IDI、MVA経路、ヒドロゲナーゼ、ヒドロゲナーゼ成熟因子および/またはヒドロゲナーゼ転写因子の核酸を標準的な方法を用いて単離することができる。目的の供給源生物由来の所望の核酸(例えば、細菌ゲノム)を得る方法は、分子生物学の技術分野において一般的かつ周知である(例えば、WO2004/033646号およびその中に引用された参考文献を参照されたく、これらは各々、特に、目的の核酸の単離に関して、その全体が参照により本明細書に組み込まれる)。例えば、核酸の配列が既知(例えば、本明細書に記載の既知の核酸のいずれか)である場合、好適なゲノムライブラリーを、制限エンドヌクレアーゼ消化によって作製し得、所望の核酸配列に相補的なプローブでスクリーニングし得る。配列が単離されれば、ポリメラーゼ連鎖反応(PCR)(米国特許第4,683,202号、これは、特に、PCR法に関して、その全体が参照により本明細書に組み込まれる)などの標準的なプライマー特異的増幅法を用いてDNAを増幅し、適当なベクターを用いた形質転換に好適な大量のDNAを入手し得る。
あるいは、イソプレンシンターゼ、DXS、IDI、MVA経路、ヒドロゲナーゼ、ヒドロゲナーゼ成熟因子および/またはヒドロゲナーゼ転写因子の核酸(例えば、既知の核酸配列を有する任意のイソプレンシンターゼ、DXS、IDI、MVA経路、ヒドロゲナーゼ、ヒドロゲナーゼ成熟因子および/またはヒドロゲナーゼ転写因子の核酸)を、標準的な方法を用いて化学合成することができる。
本明細書に記載の組成物および方法で用いるのに好適であり得るさらなるイソプレンシンターゼ、DXS、IDI、MVA経路、ヒドロゲナーゼ、ヒドロゲナーゼ成熟因子および/またはヒドロゲナーゼ転写因子のポリペプチドおよび核酸を、標準的な方法を用いて同定することができる。例えば、天然にイソプレンを産出することが知られている生物の染色体DNAのコスミドライブラリーを、大腸菌などの生物において構築し、その後、イソプレン産出についてスクリーニングすることができる。特に、巨大なゲノムDNA断片(35〜45kb)がベクターにパッケージングされていて、適当な宿主を形質転換するのに用いられるコスミドライブラリーを作製し得る。コスミドベクターは、大量のDNAを収容することができる点が独特である。通常、コスミドベクターは、異種DNAのパッケージングとその後の環状化に必要な少なくとも1コピーのcos DNA配列を有する。cos配列の他に、これらのベクターは、複製起点(例えば、ColEI)や薬剤耐性マーカー(例えば、アンピシリンまたはネオマイシンに耐性のある核酸)も含有する。好適な細菌宿主の形質転換にコスミドベクターを用いる方法については、Sambrook et al.,Molecular Cloning:A Laboratory Manual,第2版,Cold Spring Harbor,1989(これは、特に、形質転換法に関して、その全体が参照により本明細書に組み込まれる)に十分に記載されている。
通常、コスミドをクローニングするためには、適当な制限エンドヌクレアーゼを用いて異種DNAを単離し、適当なリガーゼを用いてコスミドベクターのcos領域の隣りに連結する。その後、線状化した異種DNAを含有するコスミドベクターを、バクテリオファージなどのDNAパッケージングビヒクルと反応させる。パッケージングプロセスの間に、cos部位が切断され、異種DNAが細菌ウイルス粒子の頭部にパッケージングされる。その後、これらの粒子を用いて、大腸菌などの好適な宿主細胞をトランスフェクトする。細胞に注入されれば、異種DNAは、cos付着末端の影響を受けて環状化する。このようにして、巨大な異種DNA断片を導入し、宿主細胞で発現させることができる。
イソプレンシンターゼ、DXS、IDI、MVA経路、ヒドロゲナーゼ、ヒドロゲナーゼ成熟因子および/またはヒドロゲナーゼ転写因子の核酸を入手するさらなる方法としては、アッセイ(例えば、本明細書に記載のヘッドスペースアッセイ)によるかまたはある長さの保存されたアミノ酸(例えば、少なくとも3つの保存されたアミノ酸)をコードするヌクレオチドに対するプライマーを用いるPCRによるメタゲノムライブラリーのスクリーニングが挙げられる。保存されたアミノ酸は、既知のイソプレンシンターゼ、DXS、IDI、MVA経路、ヒドロゲナーゼ、ヒドロゲナーゼ成熟因子および/またはヒドロゲナーゼ転写因子のポリペプチドのアミノ酸配列をアラインすることによって同定することができる。イソプレンシンターゼポリペプチドの保存されたアミノ酸は、アラインした既知のイソプレンシンターゼポリペプチドの配列に基づいて同定することができる。天然にイソプレンを産出することが分かった生物を(当該技術分野で周知の)標準的なタンパク質精製法に供することができ、得られた精製ポリペプチドを、標準的な方法を用いてシークエンシングすることができる。他の方法が文献中に見出される(例えば、Julsing et al.,Applied.Microbiol.Biotechnol.75:1377−84,2007;Withers et al.,Appl Environ Microbiol.73(19):6277−83,2007を参照されたく、これらは各々、特に、イソプレンの合成に関与する核酸の同定に関して、その全体が参照により本明細書に組み込まれる)。
さらに、標準的な配列アラインメントおよび/または構造予測プログラムを用いて、その一次構造および/または予測されるポリペプチド二次構造と、既知のDXS、IDI、MVA経路、ヒドロゲナーゼ、ヒドロゲナーゼ成熟因子および/またはヒドロゲナーゼ転写因子のポリペプチドおよび核酸の一次構造および/または予測されるポリペプチド二次構造との類似性に基づいて、さらなるDXS、IDI、MVA経路、ヒドロゲナーゼ、ヒドロゲナーゼ成熟因子および/またはヒドロゲナーゼ転写因子のポリペプチドおよび核酸を同定することができる。swissprot−tremblデータベース(“expasy.org”のワールド・ワイド・ウェブ,Swiss Institute of Bioinformatics Swiss−Prot group CMU − 1 rue Michel Servet CH−1211 Geneva 4,Switzerland)などの標準的なデータベースを用いて、イソプレンシンターゼ、DXS、IDI、MVA経路、ヒドロゲナーゼ、ヒドロゲナーゼ成熟および/または転写調節のポリペプチドおよび核酸を同定することもできる。イソプレンシンターゼ、DXS、IDI、MVA経路、ヒドロゲナーゼ、ヒドロゲナーゼ成熟因子および/またはヒドロゲナーゼ転写因子のポリペプチドの二次および/または三次構造を、PredictProtein(630 West,168 Street,BB217,New York,N.Y.10032,USA)などの、標準的な構造予測プログラムのデフォルト設定を用いて予測することができる。あるいは、イソプレンシンターゼ、DXS、IDI、MVA経路、ヒドロゲナーゼ、ヒドロゲナーゼ成熟因子および/またはヒドロゲナーゼ転写因子のポリペプチドの実際の二次および/または三次構造を、標準的な方法を用いて決定することができる。さらなるイソプレンシンターゼ、DXS、IDI、MVA経路、ヒドロゲナーゼ、ヒドロゲナーゼ成熟因子および/またはヒドロゲナーゼ転写因子の核酸を、既知のイソプレンシンターゼ、DXS、IDI、MVA経路、ヒドロゲナーゼ、ヒドロゲナーゼ成熟因子および/またはヒドロゲナーゼ転写因子の核酸から作製したプローブに対するハイブリダイゼーションによって同定することもできる。
例示的なプロモーターおよびベクター
本明細書に記載のイソプレンシンターゼ、DXS、IDI、MVA経路、ヒドロゲナーゼ、ヒドロゲナーゼ成熟因子および/またはヒドロゲナーゼ転写因子の核酸のいずれかを1以上のベクターに含めることができる。したがって、本明細書に記載のイソプレンシンターゼ、DXS、IDI、MVA経路、ヒドロゲナーゼ、ヒドロゲナーゼ成熟因子および/またはヒドロゲナーゼ転写因子のポリペプチドのいずれかをコードする1以上の核酸を含むベクターも本明細書に記載されている。いくつかの実施形態では、ベクターは、発現制御配列の制御下にある核酸を含有する。
いくつかの実施形態では、ベクターは、選択マーカーまたは選択可能マーカーを含有する。トリコデルマの形質転換用のベクター系で有用なマーカーが当該技術分野で知られている(例えば、Finkelstein,Biotechnology of Filamentous Fungi 第6章,Finkelstein et al.,編.Butterworth−Heinemann,Boston,MA,第6章,1992;およびKinghorn et al.,Applied Molecular Genetics of Filamentous Fungi,Blackie Academic and Professional,Chapman and Hall,London,1992を参照されたく、これらは各々、特に、選択マーカーに関して、その全体が参照により本明細書に組み込まれる)。いくつかの実施形態では、選択マーカーは、amdS核酸であり、これは、酵素アセトアミダーゼをコードし、形質転換細胞が窒素源としてのアセトアミドで増殖するをの可能にする。選択マーカーとしてのA.ニヅランスamdS核酸の使用がKelley et al.,EMBO J.4:475−479,1985およびPenttila et al.,Gene 61:155−164,1987に記載されている(これらは各々、特に、選択マーカーに関して、その全体が参照により本明細書に組み込まれる)。いくつかの実施形態では、イソプレンシンターゼ、DXS、IDI、MVA経路、ヒドロゲナーゼ、ヒドロゲナーゼ成熟、または転写調節の核酸は、選択マーカーを伴わずに細胞の染色体に組み込まれる。
好適なベクターは、使用される宿主細胞と適合するベクターである。好適なベクターを、例えば、細菌、ウイルス(例えば、バクテリオファージT7またはM−13由来のファージ)、コスミド、酵母、または植物から得ることができる。このようなベクターを入手および使用するためのプロトコルは、当業者に公知である(例えば、Sambrook et al.,Molecular Cloning:A Laboratory Manual,第2版,Cold Spring Harbor,1989を参照されたく、これは、特に、ベクターの使用に関して、その全体が参照により本明細書に組み込まれる)。
プロモーターは当該技術分野で周知である。宿主細胞において機能するプロモーターはいずれも、宿主細胞におけるイソプレンシンターゼ、DXS、IDI、MVA経路、ヒドロゲナーゼ、ヒドロゲナーゼ成熟因子および/またはヒドロゲナーゼ転写因子の核酸の発現に用いることができる。様々な宿主細胞においてイソプレンシンターゼ、DXS、IDI、MVA経路、ヒドロゲナーゼ、ヒドロゲナーゼ成熟因子および/またはヒドロゲナーゼ転写因子の核酸の発現を促進するために有用な開始制御領域またはプロモーターは数多くあり、当業者によく知られている(例えば、WO2004/033646号およびその中に引用された参考文献を参照されたく、これらは各々、特に、目的の核酸を発現させるためのベクターに関して、その全体が参照により本明細書に組み込まれる)。これらの核酸を促進することができるほとんど全てのプロモーターを使用することができ、これらには、限定するものではないが、(サッカロミセスでの発現に有用な)CYC1、HIS3、GAL1、GAL10、ADH1、PGK、PHO5、GAPDH、ADCI、TRP1、URA3、LEU2、ENO、およびTPI;(ピキアでの発現に有用な)AOX1;ならびに(大腸菌での発現に有用な)lac、trp、λPL、λPR、T7、tac、およびtrcが含まれる。
いくつかの実施形態では、グルコースイソメラーゼプロモーターを使用する(例えば、米国特許第7,132,527号およびその中に引用された参考文献を参照されたく、これらは各々、特に、目的のポリペプチドを発現させるためのプロモーターおよびプラスミド系に関して、その全体が参照により本明細書に組み込まれる)。報告されているグルコースイソメラーゼプロモーター突然変異体を用いて、グルコースイソメラーゼプロモーターに機能的に連結された核酸によってコードされるポリペプチドの発現のレベルを変化させることができる(米国特許第7,132,527号)。様々な実施形態では、グルコースイソメラーゼプロモーターは、低、中、または高コピーのプラスミドの含まれている(米国特許第7,132,527号)。
様々な実施形態では、イソプレンシンターゼ、DXS、IDI、MVA経路、ヒドロゲナーゼ、ヒドロゲナーゼ成熟因子および/またはヒドロゲナーゼ転写因子の核酸は、低コピープラスミド(例えば、細胞当たり約1〜約4コピーで維持されるプラスミド)、中コピープラスミド(例えば、細胞当たり約10〜約15コピーで維持されるプラスミド)、または高コピープラスミド(例えば、細胞当たり約50コピー以上で維持されるプラスミド)に含まれている。いくつかの実施形態では、異種のまたは余分な内在性イソプレンシンターゼ、DXS、IDI、MVA経路、ヒドロゲナーゼ、ヒドロゲナーゼ成熟因子および/またはヒドロゲナーゼ転写因子の核酸は、T7プロモーターに機能的に連結されている。いくつかの実施形態では、T7プロモーターに機能的に連結された異種のまたは余分な内在性イソプレンシンターゼ、DXS、IDI、MVA経路、ヒドロゲナーゼ、ヒドロゲナーゼ成熟因子および/またはヒドロゲナーゼ転写因子の核酸は、中または高コピープラスミドに含まれている、いくつかの実施形態では、異種のまたは余分な内在性イソプレンシンターゼ、DXS、IDI、MVA経路、ヒドロゲナーゼ、ヒドロゲナーゼ成熟因子および/またはヒドロゲナーゼ転写因子の核酸は、Trcプロモーターに機能的に連結されている。いくつかの実施形態では、Trcプロモーターに機能的に連結された異種のまたは余分な内在性イソプレンシンターゼ、DXS、IDI、MVA経路、ヒドロゲナーゼ、ヒドロゲナーゼ成熟因子および/またはヒドロゲナーゼ転写因子の核酸は、中または高コピープラスミドに含まれている。いくつかの実施形態では、異種のまたは余分な内在性イソプレンシンターゼ、DXS、IDI、MVA経路、ヒドロゲナーゼ、ヒドロゲナーゼ成熟因子および/またはヒドロゲナーゼ転写因子の核酸は、Lacプロモーターに機能的に連結されている。いくつかの実施形態では、Lacプロモーターに機能的に連結された異種のまたは余分な内在性イソプレンシンターゼ、DXS、IDI、MVA経路、ヒドロゲナーゼ、ヒドロゲナーゼ成熟因子および/またはヒドロゲナーゼ転写因子の核酸は、低コピープラスミドに含まれている。いくつかの実施形態では、異種のまたは余分な内在性イソプレンシンターゼ、DXS、IDI、MVA経路、ヒドロゲナーゼ、ヒドロゲナーゼ成熟因子および/またはヒドロゲナーゼ転写因子の核酸は、内在性エシェリキア、パントエア、バシルス、ヤロウイア、ストレプトミセス、またはトリコデルマプロモーターまたは内在性アルカリ性セリンプロテアーゼ、イソプレンシンターゼ、DXS、IDI、MVA経路、ヒドロゲナーゼ、ヒドロゲナーゼ成熟因子および/またはヒドロゲナーゼ転写因子のプロモーターなどの、内在性プロモーターに機能的に連結されている。いくつかの実施形態では、内在性プロモーターに機能的に連結された異種のまたは余分な内在性イソプレンシンターゼ、DXS、IDI、MVA経路、ヒドロゲナーゼ、ヒドロゲナーゼ成熟因子および/またはヒドロゲナーゼ転写因子の核酸は、高コピープラスミドに含まれている。いくつかの実施形態では、ベクターは、細胞内で染色体に組み込まれない複製プラスミドである。いくつかの実施形態では、ベクターの一部または全てが細胞内で染色体に組み込まれる。
いくつかの実施形態では、ベクターは、真菌宿主細胞に導入されたときに、宿主細胞ゲノムに組み込まれて、複製する任意のベクターである。ベクターのリストについては、Fungal Genetics Stock Center Catalogue of Strains(FGSC、“fgsc.net”のワールド・ワイド・ウェブおよびその中に引用された参考文献、これらは各々、特に、ベクターに関して、その全体が参照により本明細書に組み込まれる)を参照されたい。好適な発現ベクターおよび/または組込みベクターのさらなる例は、Sambrook et al.,Molecular Cloning:A Laboratory Manual,第2版,Cold Spring Harbor,1989、Current Protocols in Molecular Biology(F.M.Ausubel et al.(編) 1987,補遺30巻,第7.7.18節);Bennett and Lasure(編) More Gene Manipulations in Fungi,Academic Press pp.396−428,1991のvan den Hondel et al.;および米国特許第5,874,276号(これらは各々、特に、ベクターに関して、その全体が参照により本明細書に組み込まれる)に提供されている。特に有用なベクターとしては、pFB6、pBR322、PUC18、pUC100、およびpENTR/Dが挙げられる。
いくつかの実施形態では、イソプレンシンターゼ、DXS、IDI、MVA経路、ヒドロゲナーゼ、ヒドロゲナーゼ成熟因子および/またはヒドロゲナーゼ転写因子の核酸は、真菌宿主細胞で転写活性を示す好適なプロモーターに機能的に連結されている。プロモーターは、宿主細胞にとって内在性または異種のいずれかのポリペプチドをコードする1以上の核酸に由来するものであってもよい。いくつかの実施形態では、プロモーターは、トリコデルマ宿主において有用である。プロモーターの好適な非限定例としては、cbh1、cbh2、egl1、egl2、pepA、hfb1、hfb2、xyn1、およびamyが挙げられる。いくつかの実施形態では、プロモーターは、宿主細胞にとってネイティブなプロモーターである。例えば、T.リーゼイが宿主であるいくつかの実施形態では、プロモーターは、ネイティブのT.リーゼイプロモーターである。いくつかの実施形態では、プロモーターは、T.リーゼイのcbh1であるが、これは、誘導性プロモーターであり、アクセッション番号D86235(これは、特に、プロモーターに関して、その全体が参照により本明細書に組み込まれる)の下でGenBankに寄託されている。いくつかの実施形態では、プロモーターは、真菌宿主細胞にとって異種のプロモーターである。有用なプロモーターの他の例としては、A.アワモリおよびA.ニゲルのグルコアミラーゼ(glaA)(Nunberg et al.,Mol.Cell Biol.4:2306−2315,1984およびBoel et al.,EMBO J.3:1581−1585,1984(これらは各々、特に、プロモーターに関して、その全体が参照により本明細書に組み込まれる);アスペルギルス・ニゲル(Aspergillus niger)のαアミラーゼ、アスペルギルス・オリザエ(Aspergillus oryzae)のTAKAアミラーゼ、T.リーゼイのxln1、およびT.リーゼイのセロビオヒドラーゼ1(欧州特許第137280号(これは、特に、プロモーターに関して、その全体が参照により本明細書に組み込まれる)の遺伝子由来のプロモーターが挙げられる。
いくつかの実施形態では、発現ベクターには終結配列も含まれる。終結制御領域はまた、宿主細胞にネイティブな様々な遺伝子に由来するものであってもよい。いくつかの実施形態では、終結配列およびプロモーター配列は同じ源に由来するものである。別の実施形態では、終結配列は宿主細胞にとって内在性である。特に好適なターミネーター配列は、トリコデルマ株(例えば、T.リーゼイ)に由来するcbh1である。他の有用な真菌ターミネーターとしては、。A.ニゲルまたはA.アワモリのグルコアミラーゼ核酸(Nunberg et al.,Mol.Cell Biol.4:2306−2315,1984およびBoel et al.,EMBO J.3:1581−1585,1984;これらは各々、特に、真菌ターミネーターに関して、その全体が参照により本明細書に組み込まれる)に由来するターミネーターが挙げられる。場合により、終結部位を含めてもよい。ポリペプチドの効率的な発現のために、ポリペプチドをコードするDNAは、発現によって適切なメッセンジャーRNAが形成されるように、開始コドンを介して選択された発現制御領域に機能的に連結されている。
いくつかの実施形態では、プロモーター、コード領域およびターミネーターが全て、発現されるイソプレンシンターゼ、DXS、IDI、MVA経路、ヒドロゲナーゼ、ヒドロゲナーゼ成熟因子および/またはヒドロゲナーゼ転写因子の核酸に由来する。いくつかの実施形態では、イソプレンシンターゼ、DXS、IDI、MVA経路、ヒドロゲナーゼ、ヒドロゲナーゼ成熟因子および/またはヒドロゲナーゼ転写因子の核酸のコード領域は、発現コンストラクトのプロモーター配列とターミネーター配列の転写制御下にあるように、汎用発現ベクターに挿入される。いくつかの実施形態では、遺伝子またはその部分は、強力なcbh1プロモーターの下流に挿入される。
イソプレンシンターゼ、DXS、IDI、MVA経路、ヒドロゲナーゼ、ヒドロゲナーゼ成熟因子および/またはヒドロゲナーゼ転写因子の核酸を、標準的な技術を用いて、発現ベクターなどのベクターに組み込むことができる(Sambrook et al.,Molecular Cloning:A Laboratory Manual,Cold Spring Harbor,1982、これは、特に、適当なDNA配列のスクリーニングおよびベクターの構築に関して、その全体が参照により本明細書に組み込まれる)。目的の核酸(例えば、イソプレンシンターゼ、DXS、IDI、MVA経路、ヒドロゲナーゼ、ヒドロゲナーゼ成熟因子および/またはヒドロゲナーゼ転写因子の核酸)、プロモーター、ターミネーターならびに他の配列を含むDNAコンストラクトを連結するために、およびそれらを好適なベクターに挿入するために用いられる方法は、当該技術分野で周知である。例えば、制限酵素を用いて、イソプレンシンターゼ、DXS、IDI、MVA経路、ヒドロゲナーゼ、ヒドロゲナーゼ成熟因子および/またはヒドロゲナーゼ転写因子の核酸とベクターとを切断することができる。その後、切断されたイソプレンシンターゼ、DXS、IDI、MVA経路、ヒドロゲナーゼ、ヒドロゲナーゼ成熟因子および/またはヒドロゲナーゼ転写因子の核酸と切断されたベクターの互換性のある末端を連結することができる。連結は、通常、好都合な制限部位でのライゲーションによって達成される。このような部位が存在しない場合は、従来の慣行に従って合成オリゴヌクレオチドリンカーを用いる(Sambrook et al.,Molecular Cloning:A Laboratory Manual,第2版,Cold Spring Harbor,1989、およびBennett and Lasure,More Gene Manipulations in Fungi,Academic Press,San Diego,pp70−76,1991を参照されたく、これらは各々、特に、オリゴヌクレオチドリンカーに関して、その全体が参照により本明細書に組み込まれる)。さらに、ベクターを、既知の組換え技術を用いて構築することができる(例えば、Invitrogen Life Technologies,Gateway Technology)。
いくつかの実施形態では、イソプレンシンターゼ、DXS、IDI、MVA経路、ヒドロゲナーゼ、ヒドロゲナーゼ成熟因子および/またはヒドロゲナーゼ転写因子の核酸を、天然の細胞で現在見られるよりもずっと高いレベルで過剰発現させることが望ましい場合がある。この結果は、それらのポリペプチドをコードする核酸を多コピープラスミドに選択的にクローニングするかまたはそれらの核酸を強力な誘導性もしくは構成的プロモーターの下に置くことによって達成され得る。所望のポリペプチドを過剰発現させる方法は、分子生物学の分野では一般的かつ周知であり、Sambrook et al.,Molecular Cloning:A Laboratory Manual,第2版,Cold Spring Harbor,1989(これは、特に、クローニング技術に関して、その全体が参照により本明細書に組み込まれる)に例を見出し得る。
いくつかの実施形態では、イソプレンシンターゼ、DXS、IDI、MVA経路、ヒドロゲナーゼ、ヒドロゲナーゼ成熟、または転写因子ポリペプチドをコードする核酸を、天然の細胞で現在見られるよりもずっと低いレベルで過小発現する(例えば、突然変異させる、不活化する、または欠失させる)ことが望ましい場合がある。この結果は、イソプレンシンターゼ、DXS、IDI、MVA経路、ヒドロゲナーゼ、ヒドロゲナーゼ成熟因子および/またはヒドロゲナーゼ転写因子の核酸の発現に必要な転写調節タンパク質の突然変異または不活化によるか、イソプレンシンターゼ、DXS、IDI、MVA経路、ヒドロゲナーゼ、ヒドロゲナーゼ成熟因子および/またはヒドロゲナーゼ転写因子の核酸の欠失によるか、あるいはそれらの核酸を強力な抑制性プロモーターの制御下に置くことによって達成され得る。所望のポリペプチドを突然変異させるか、不活化するか、または欠失させる方法は、分子生物学の分野では一般的かつ周知であり、Sambrook et al.,Molecular Cloning:A Laboratory Manual,第2版,Cold Spring Harbor,1989(これは、特に、クローニング技術および突然変異導入技術に関して、その全体が参照により本明細書に組み込まれる)に例を見出し得る。
以下のリソースは、本明細書に記載の組成物および方法に従って有用なさらなる一般的方法論に関する記載を含む:Kreigler,Gene Transfer and Expression;A Laboratory Manual,1990およびAusubel et al.,編.Current Protocols in Molecular Biology,1994(これらは各々、特に、分子生物学およびクローニング技術に関して、その全体が参照により本明細書に組み込まれる)。
例示的な供給源生物
イソプレンシンターゼ、DXS、IDI、MVA経路、ヒドロゲナーゼ、ヒドロゲナーゼ成熟因子および/またはヒドロゲナーゼ転写因子の核酸(ならびにそれらのコードされたポリペプチド)を、イソプレンシンターゼ、DXS、IDI、MVA経路、ヒドロゲナーゼ、ヒドロゲナーゼ成熟因子および/またはヒドロゲナーゼ転写因子の核酸を天然に含有する任意の生物から入手することができる。上述のように、イソプレンは、種々の生物(例えば、細菌、酵母、植物、および動物)によって天然に形成される。生物は、イソプレンを産出するためのMVA経路、DXP経路、またはMVA経路とDXP経路の両方を含有している(図19Aおよび19B)。したがって、DXS核酸を、例えば、DXP経路を含有するかまたはMVA経路とDXP経路の両方を含有する任意の生物から入手することができる。IDIおよびイソプレンシンターゼの核酸を、例えば、MVA経路、DXP経路、またはMVA経路とDXP経路の両方を含有する任意の生物から入手することができる。MVA経路核酸を、例えば、MVA経路を含有するかまたはMVA経路とDXP経路の両方を含有する任意の生物から入手することができる。ヒドロゲナーゼ核酸を、例えば、水素を酸化するかまたは水素イオンを還元する任意の生物から入手することができる。発酵副産物遺伝子を、例えば、酸素制限呼吸または嫌気性呼吸(例えば、解糖)をする任意の生物から入手または同定することができる。
いくつかの実施形態では、イソプレンシンターゼ、DXS、IDI、MVA経路、ヒドロゲナーゼ、ヒドロゲナーゼ成熟因子および/またはヒドロゲナーゼ転写因子の核酸の核酸配列は、以下の天然生物のいずれかによって産出される核酸の配列と同一である。いくつかの実施形態では、イソプレンシンターゼ、DXS、IDI、MVA経路、ヒドロゲナーゼ、ヒドロゲナーゼ成熟因子および/またはヒドロゲナーゼ転写因子ポリペプチドのアミノ酸配列は、以下の天然生物のいずれかによって産出されるポリペプチドの配列と同一である。いくつかの実施形態では、イソプレンシンターゼ、DXS、IDI、MVA経路、ヒドロゲナーゼ、ヒドロゲナーゼ成熟因子および/またはヒドロゲナーゼ転写因子の核酸またはポリペプチドは、本明細書に記載の生物のいずれかに由来する突然変異体核酸またはポリペプチドである。本明細書で使用される場合、「に由来する」とは、1以上の突然変異が導入される核酸またはポリペプチドの供給源を指す。例えば、「植物ポリペプチド」に由来するポリペプチドは、1以上の突然変異を野生型(すなわち、天然に生じる配列)の植物ポリペプチドの配列に導入することによって得られる目的のポリペプチドを指す。
いくつかの実施形態では、供給源生物は真菌であり、その例は、A.オリザエやA.ニゲルなどのアスペルギルスの種、出芽酵母などのサッカロミセスの種、分裂酵母などのスキゾサッカロミセスの種、およびT.リーゼイなどのトリコデルマの種である。いくつかの実施形態では、供給源生物は糸状真菌細胞である。「糸状真菌」という用語は、ユーミコチナ亜分類の全ての糸状形態を指す(Alexopoulos,C.J.(1962),Introductory Mycology,Wiley,New Yorkを参照されたい)。これらの真菌は、キチン、セルロース、および他の複合多糖類から構成された細胞壁を有する栄養菌糸を特徴とする。糸状真菌は、形態学的に、生理学的に、および遺伝学的に酵母とは異なる。糸状真菌による栄養増殖は菌糸伸長によるものであり、炭素代謝は絶対好気性である。糸状真菌親細胞は、限定するものではないが、トリコデルマ(例えば、以前はT.ロンギブラキアツムと分類されていた、ヒポクレア・ジェコリナの無性モルフであるトリコデルマ・リーゼイ、トリコデルマ・ビリデ、トリコデルマ・コニンギイ、トリコデルマ・ハルジアヌム)(Sheir−Neirs et al.,Appl.Microbiol.Biotechnol 20:46−53,1984;ATCC番号56765およびATCC番号26921);ペニシリウム種、フミコラ種(例えば、H.イソレンス、H.ラヌギノス、またはH.グリセア);クリソスポリウム種(例えば、C.ルクノウェンス)、グリオクラジウム種、アスペルギルス種(例えば、A.オリザエ、A.ニゲル、A.ソーエ、A.ジャポニクス、A.ニヅランス、またはA.アワモリ)(Ward et al.,Appl.Microbiol.Biotechnol.39:7380743,1993およびGoedegebuur et al.,Genet 41:89−98,2002)、フサリウム種(例えば、F.ロセウム、F.グラミヌム、F.セレアリス、F.オキシスポリウム、またはF.ベネナツム)、ネウロスポラ種(例えば、N.クラッサ)、ヒポクレア種、ムコール種(例えば、M.ミエエイ)、リゾプス種、およびエメリセラ種(Innis et al.,Sci.228:21−26,1985も参照されたい)の種の細胞であってもよい。「トリコデルマ」または「トリコデルマ種(Trichoderma sp.)」または「トリコデルマ種(Trichoderma spp.)」という用語は、以前にトリコデルマと分類されていたかまたは現在トリコデルマと分類されている任意の真菌属を指す。
いくつかの実施形態では、真菌は、A.ニヅランス、A.アワモリ、A.オリザエ、A.アクレータス、A.ニゲル、A.ジャポニクス、T.リーゼイ、T.ビリデ、F.オキシスポルム、またはF.ソラニである。アスペルギルス株は、Ward et al.,Appl.Microbiol.Biotechnol.39:738−743,1993およびGoedegebuur et al.,Curr Gene 41:89−98,2002(これらは各々、特に、真菌に関して、その全体が参照により本明細書に組み込まれる)に開示されている。特定の実施形態では、真菌は、トリコデルマの株、例えば、T.リーゼイの株である。T.リーゼイの株は既知であり、非限定例としては、ATCC番号13631、ATCC番号26921、ATCC番号56764、ATCC番号56765、ATCC番号56767、およびNRRL 15709(これらは各々、特に、T.リーゼイの株に関して、その全体が参照により本明細書に組み込まれる)が挙げられる。いくつかの実施形態では、宿主株は、RL−P37の派生物である。RL−P37は、Sheir−Neiss et al.,Appl.Microbiol.Biotechnology 20:46−53,1984、これは、特に、T.リーゼイの株に関して、その全体が参照により本明細書に組み込まれる)に開示されている。
いくつかの実施形態では、供給源生物は、サッカロミセス種、スキゾサッカロミセス種、ピキア種、またはカンジダ種などの酵母である。いくつかの実施形態では、サッカロミセス種は出芽酵母である。
いくつかの実施形態では、供給源生物は、バシルスの株(例えば、B.リケニフォルミスまたは枯草菌)、パントエアの株(例えば、P.シトレア)、シュードモナスの株(例えば、P.アルカリゲンス、P.プチダ、もしくはP.フルオレセンス)、ストレプトミセスの株(例えば、S.リビダンスもしくはS.ルビギノスス)、コリネバクテリウム種の株(例えば、コリネバクテリウム・グルタミクム)、ロドシュードモナス種の株(例えば、ロドシュードモナス・パルストリス(Rhodopseudomonas palustris))、またはエシェリキアの株(例えば、大腸菌)などの細菌である。
本明細書で使用される場合、「バシルス属」は、当業者に知られているような「バシルス」属内の全ての種を含み、これには、限定するものではないが、枯草菌、B.リケニフォルミス、B.レンツス、B.ブレビス、B.ステアロテルモフィルス、B.アルカロフィルス、B.アミロリケファシエンス、B.クラウジイ、B.ハロヅランス、B.メガテリウム、B.コアグランス、B.シルクランス、B.ラウツス、およびB.ツリンギエンシスが含まれる。バシルス属は、分類上の再編成が引き続き行なわれていることが認められる。したがって、この属には、限定するものではないが、現在「ゲオバシルス・ステアロテルモフィルス」と名付けられているB.ステアロテルモフィルスなどの生物をはじめとする、再分類された種が含まれることが意図される。酸素の存在下での耐性内性胞子の産出は、バシルス属の特徴を規定するものと考えられているが、この特徴は、最近名付けられたアリシクロバシルス、アムフィバシルス、アネウリニバシルス、アノキシバシルス、ブレビバシルス、フィロバシルス、グラシリバシルス、ハロバシルス、パエニバシルス、サリバシルス、テルモバシルス、ウレイバシルス、およびビルギバシルスにも当てはまる。
いくつかの実施形態では、供給源生物はグラム陽性細菌である。非限定的な例としては、ストレプトミセスの株(例えば、S.リビダンス、S.コエリコロール、またはS.グリセウス)およびバシルスが挙げられる。いくつかの実施形態では、供給源生物は、大腸菌、ロドシュードモナス種(例えば、ロドシュードモナス・パルストリス)、またはシュードモナス種(例えば、P.アルカリゲネス、P.プチダ、もしくはP.フルオレセンス)などの、グラム陰性細菌である。
いくつかの実施形態では、供給源生物は、マメ科(例えば、マメ亜科)由来の植物などの植物である。いくつかの実施形態では、供給源生物は、クズ、ポプラ(例えば、ウラジロハコヤナギ×ヨーロッパヤマナラシCAC35696)、アスペン(例えば、アメリカヤマナラシ)、またはヨーロッパナラである。
いくつかの実施形態では、供給源生物は、緑藻、紅藻、灰色藻、クロララクニオン藻、ユーグレナ藻、クロミスタ、または渦鞭毛藻などの藻類である。
いくつかの実施形態では、供給源生物は、形態に基づいて以下のグループ:クロオコックス目、プレウロカプサ目、ユレモ目、ネンジュモ目、またはスティゴネマ目のいずれかに分類されるシアノバクテリアなどのシアノバクテリアである。
いくつかの実施形態では、生物源は嫌気性生物である。嫌気性生物としては、偏性好気性菌、条件的好気性菌、および酸素耐性好気性菌が挙げられるが、これらに限定されない。このような生物は、バクテリア、酵母菌など、上に掲載の任意の生物であることができる。一実施形態では、偏性好気性菌は、Clostridium ljungdahlii、Clostridium autoethanogenum、Eurobacterium limosum、Clostridium carboxydivorans、Peptostreptococcus productus、およびButyribacterium methylotrophicumからなる群から選択される任意の1つまたは組み合わせであることができる。本明細書に記載の任意の生物源の任意の組み合わせを本発明の他の実施形態のために使用できることが理解されるべきである。
例示的な宿主細胞
種々の宿主細胞を用いて、イソプレンシンターゼ、DXS、IDI、MVA経路、ヒドロゲナーゼ、ヒドロゲナーゼ成熟因子および/またはヒドロゲナーゼ転写因子のポリペプチドを発現させ、本明細書に記載の方法においてイソプレンと水素を共産出させることができる。例示的な宿主細胞としては、先の「例示的な供給源生物」という見出しの節で記載された生物のいずれかに由来する生物が挙げられる。宿主細胞は、天然にイソプレンを産出する細胞であっても、天然にはイソプレンを産出しない細胞であってもよい。いくつかの実施形態では、宿主細胞は、DXP経路を用いて天然にイソプレンを産出しており、この経路を用いたイソプレンの産出を増強するためにイソプレンシンターゼ、DXS、および/またはIDI核酸が付加される。いくつかの実施形態では、宿主細胞は、イソプレンを用いて天然にイソプレンを産出しており、この経路を用いたイソプレンの産出を増強するためにイソプレンシンターゼおよび/または1以上のMVA経路核酸が付加される。いくつかの実施形態では、宿主細胞は、DXP経路を用いて天然にイソプレンを産出しており、MVA経路およびDXP経路の一部または全てを用いてイソプレンを産出するために1以上のMVA経路核酸が付加される。いくつかの実施形態では、宿主細胞は、DXP経路とMVA経路の両方を用いて天然にイソプレンを産出しており、これらの経路のうちの一方または両方によるイソプレンの産出を増強するために1以上のイソプレンシンターゼ、DXS、IDI、またはMVA経路核酸が付加される。
いくつかの実施形態では、宿主細胞は、DXP経路とMVA経路の両方を用いて天然にイソプレンを産出しており、これらの経路のうちの一方または両方によるイソプレンの産出を増強するために1以上のイソプレンシンターゼ、DXS、IDI、またはMVA経路核酸が付加され、水素産出を増強するために1以上のヒドロゲナーゼ核酸が付加され、発酵副産物の産出を制限するために、発酵副産物を産出する1以上の遺伝子が不活化されるかまたは欠失させられる。いくつかの実施形態では、宿主細胞は、DXP経路とMVA経路の両方を用いて天然にイソプレンと水素を産出しており、これらの経路のうちの一方または両方によるイソプレンの産出を増強するために1以上のイソプレンシンターゼ、DXS、IDI、またはMVA経路核酸が付加され、水素産出を増強するために1以上のヒドロゲナーゼ核酸が付加され、発酵副産物の産出を制限するために、発酵副産物を産出する1以上の遺伝子が不活化されるかまたは欠失させられ、水素産出を増加させるために1以上の水素再取込み遺伝子が不活化されるかまたは欠失させられる。いくつかの実施形態では、宿主細胞は、DXP経路とMVA経路の両方およびヒドロゲナーゼを用いて天然にイソプレンと水素を産出しており、これらの経路のうちの一方または両方によるイソプレンの産出を増強するために1以上のイソプレンシンターゼ、DXS、IDI、またはMVA経路核酸が付加され、水素産出を増強するために1以上のヒドロゲナーゼ核酸が付加され、水素産出を増強するために1以上のヒドロゲナーゼ成熟核酸が付加され、発酵副産物の産出を制限するために、発酵副産物を産出する1以上の遺伝子が不活化されるかまたは欠失させられ、水素産出を増加させるために1以上の水素再取込み遺伝子が不活化されるかまたは欠失させられる。いくつかの実施形態では、宿主細胞は、DXP経路とMVA経路の両方を用いて天然にイソプレンと水素を産出しており、これらの経路のうちの一方または両方によるイソプレンの産出を増強するために1以上のイソプレンシンターゼ、DXS、IDI、またはMVA経路核酸が付加され、水素産出を増強するために1以上のヒドロゲナーゼ核酸が付加され、水素産出を増強するために1以上のヒドロゲナーゼ成熟核酸が付加され、ヒドロゲナーゼ産出を増強するために1以上の転写因子核酸が付加されるかまたは不活化されるもしくは欠失させられ、発酵副産物の産出を制限するために、発酵副産物を産出する1以上の遺伝子が不活化されるかまたは欠失させられ、水素産出を増加させるために1以上の水素再取込み遺伝子が不活化されるかまたは欠失させられる。
例示的な形質転換方法
イソプレンシンターゼ、DXS、IDI、MVA経路、ヒドロゲナーゼ、ヒドロゲナーゼ成熟因子および/またはヒドロゲナーゼ転写因子の核酸あるいはそれらを含有するベクターを、コードされたイソプレンシンターゼ、DXS、IDI、MVA経路、ヒドロゲナーゼ、ヒドロゲナーゼ成熟因子および/またはヒドロゲナーゼ転写因子のポリペプチドの発現させるための標準的な技術を用いて宿主細胞(例えば、本明細書に記載の植物細胞、真菌細胞、酵母細胞、細菌細胞)に挿入することができる。形質転換、エレクトロポレーション、核マイクロインジェクション、形質導入、トランスフェクション(例えば、リポフェクションを介するまたはDEAE−デキストランを介するトランスフェクションまたは組換えファージウイルスを用いるトランスフェクション)、リン酸カルシウムDNA沈殿を用いるインキュベーション、DNAをコーティングした微粒子銃を用いる高速衝突、およびプトロプラスト融合などの技術を用いて、DNAコンストラクトまたはベクターの宿主細胞への導入を行なうことができる。一般的な形質転換技術は当該技術分野で公知である(例えば、Current Protocols in Molecular Biology(F.M.Ausubel et al.(編) 第9章,1987;Sambrook et al.,Molecular Cloning:A Laboratory Manual,第2版,Cold Spring Harbor,1989;およびCampbell et al.,Curr.Genet.16:53−56,1989を参照されたく、これらは各々、特に、形質転換方法に関して、その全体が参照により本明細書に組み込まれる)。トリコデルマにおける異種ポリペプチドの発現は、米国特許第6,022,725号;米国特許第6,268,328号;米国特許第7,262,041号;WO2005/001036号;Harkki et al.,Enzyme Microb.Technol.13:227−233,1991;Harkki et al.,Bio Technol.7:596−603,1989;欧州特許第244,234号;欧州特許第215,594号;およびMolecular Industrial Mycology,Leong and Berka編,Marcel Dekker Inc.,NY pp.129−148,1992中のNevalainen et al.,“The Molecular Biology of Trichoderma and its Application to the Expression of Both Homologous and Heterologous Genes”(これらは各々、特に、形質転換方法および発現方法に関して、その全体が参照により本明細書に組み込まれる)に記載されている。アスペルギルス株の形質転換については、Cao et al.,(Sci.9:991−1001,2000;欧州特許第238023号;およびYelton et al.,Proceedings.Natl.Acad.Sci.USA 81:1470−1474,1984(これらは各々、特に、形質転換方法に関して、その全体が参照により本明細書に組み込まれる)も参照されたい。導入された核酸は、染色体DNAに組み込まれ得るかまたは染色体外の複製配列として維持され得る。
当該技術分野で公知の任意の方法を用いて形質転換体を選択し得る。1つの非限定的な例では、amdSマーカーを含む安定な形質転換体を、そのより速い増殖速度や、アセトアミドを含有する固形培養培地上でのギザギザではなく、滑らかな輪郭を有する円形コロニーの形成によって、不安定な形質転換体から区別する。さらに、場合によっては、形質転換体を固形非選択培地(例えば、アセトアミドを欠く培地)上で増殖させ、この培養培地から胞子を採取し、アセトアミドを含有する選択培地上で後に発芽および増殖するこれらの胞子のパーセンテージを決定することによって、さらなる安定性の試験を実施する。
いくつかの実施形態では、真菌細胞を、プロトプラスト形成およびプロトプラストの形質転換、それに続く既知の方法での細胞壁の再生を伴うプロセスによって形質転換する。特定の一実施形態では、形質転換用のトリコデルマ種の調製は、真菌菌糸からのプロトプラストの調製を必要とする(Campbell et al.,Curr.Genet.16:53−56,1989を参照されたく、これは、特に、形質転換方法に関して、その全体が参照により本明細書に組み込まれる)。いくつかの実施形態では、菌糸を、発芽した栄養胞子から得る。菌糸を、細胞壁を消化する酵素で処理して、プロトプラストを生じさせる。次に、プロトプラストを、懸濁媒体中に浸透圧安定化剤を存在させることによって保護する。これらの安定化剤としては、ソルビトール、マンニトール、塩化カリウム、硫酸マグネシウムなどが挙げられる。通常、これらの安定化剤の濃度は、0.8Mから1.2Mの間で変動する。懸濁媒体中約1.2Mのソルビトール溶液を用いることが望ましい。
宿主トリコデルマ種株へのDNAの取込みは、カルシウムイオン濃度に依存する。通常、約10mM CaCl2から50mM CaCl2を取込み溶液中で使用する。取込み溶液中のカルシウムイオンの他に、通常含まれる他の化合物は、TE緩衝液(10mM Tris、pH7.4;1mM EDTA)または10mM MOPS、pH6.0緩衝液(モルホリンプロパンスルホン酸)およびポリエチレングリコール(PEG)などの緩衝系である。任意の特定の理論に束縛されるつもりはないが、ポリエチレングリコールは細胞膜を融合させるように働き、それにより、媒体の内容物をトリコデルマ種株の細胞質に送達し、プラスミドDNAを核に移すことを可能にすると考えられている。この融合によって、複数コピーのプラスミドDNAが宿主染色体に組み込まれたままになることが多い。
通常、105〜107/mL(例えば、2×106/mL)の密度で透過処理を受けさせたトリコデルマ種のプロトプラストまたは細胞を含有する懸濁液を形質転換で用いる。適当な溶液(例えば、1.2Mのソルビトールおよび50mMのCaCl2)中の100μLの容量のこれらのプロトプラストまたは細胞を、所望のDNAと混合する。通常、高濃度のPEGを取込み溶液に添加する。0.1〜1容量の25%PEG 4000をプロトプラスト懸濁液に添加することができる。いくつかの実施形態では、約0.25容量をプロトプラスト懸濁液に添加する。また、ジメチルスルホキシド、ヘパリン、スペルミジン、塩化カリウムなどのような添加剤を取込み溶液に添加して、形質転換を助けてもよい。同様の手順が他の真菌宿主細胞に利用可能である(例えば、米国特許第6,022,725号および第6,268,328号を参照されたく、これらは各々、特に、形質転換に関して、その全体が参照により本明細書に組み込まれる)。
通常は、その後、混合物を約0℃で10〜30分間培養する。その後、この混合物にPEGをさらに添加して、所望の核酸配列の取込みをさらに増強する。通常、25%のPEG 4000を、形質転換混合物の容量の5〜15倍の容量で添加するが、より多いまたはより少ない容量が好適である場合もある。25%のPEG 4000は、望ましくは形質転換混合物の容量の約10倍である。PEGを添加した後、形質転換混合物を室温または氷上のいずれかで培養し、その後、ソルビトール/CaCl2溶液を添加する。その後、プロトプラスト懸濁液を、培養培地の溶解アリコートにさらに添加する。増殖培地に増殖を選択するもの(例えば、アセトアミドまたは抗生物質)が含まれる場合、それによって、形質転換体の増殖のみが許容される。
細菌細胞の形質転換を、例えば、Sambrook et al.,Molecular Cloning:A Laboratory Manual,Cold Spring Harbor,1982(これは、特に、形質転換方法に関して、その全体が参照により本明細書に組み込まれる)に記載されているような従来の方法に従って行なってもよい。
例示的な細胞培養培地
イソプレンと水素を共産出する培養細胞かまたは培養細胞の集団も本明細書に記載する。「培養細胞」とは、細胞が1回以上の細胞分裂を経るのを可能にする溶液(例えば、細胞増殖培地)中の2以上の細胞を意味する。「培養細胞」には、植物組織に分化した細胞を含有する生きた多細胞植物の部分である植物細胞は含まれない。様々な実施形態では、細胞培養物には、少なくともまたは約10、20、50、100、200、500、1,000、5,000、10,000個またはそれより多くの細胞が含まれる。
「酸素制限培養された細胞」とは、細胞が1回以上の細胞分裂を経るのを可能にする溶液(例えば、細胞増殖培地)中の2以上の細胞を意味し、その場合、この溶液は制限量の酸素を含有する。「酸素制限培養」という用語は、培養が無酸素性であるかまたは還元性等価物の酸素への生物学的移動を介した呼吸を支えるための所要量に満たない酸素を含有するかのいずれかであることを意味し、嫌気性培養も包含する。酸素制限培養条件下では、酸素濃度が低すぎるために、炭素代謝から得られるいくつかの電子を受容することができず、細胞が電子を受容するための適当な代謝経路を含まない場合、細胞を水素産出に切り替えさせる。酸素制限培養条件は、培養培地中のゼロに近い溶存酸素濃度で示される、酸素移動速度(「OTR」)が酸素取込み速度(「OUR」)よりも低い場合に発生する。
任意の炭素源を用いて、宿主細胞を培養することができる。「炭素源」という用語は、宿主細胞または生物によって代謝されることができる1以上の炭素含有化合物を指す。例えば、宿主細胞を培養するために用いられる細胞培地は、宿主細胞の生存または増殖を維持するのに好適な任意の炭素源を含んでいてもよい。
いくつかの実施形態では、炭素源は、炭水化物(例えば、単糖、二糖、オリゴ糖、もしくは多糖類)、転化糖(例えば、酵素処理したスクロースシロップ)、グリセロール、グリセリン(例えば、バイオディーゼルもしくは石鹸製造プロセスのグリセリン副生成物)、ジヒドロキシアセトン、1炭素源、油(例えば、植物油もしくは植物性油、例えば、トウモロコシ油、ヤシ油、もしくは大豆油)、動物性脂肪、動物性油、脂肪酸(例えば、飽和脂肪酸、不飽和脂肪酸、もしくは多価不飽和脂肪酸)、脂質、リン脂質、グリセロ脂質、モノグリセリド、ジグリセリド、トリグリセリド、ポリペプチド(例えば、微生物もしくは植物のタンパク質もしくはペプチド)、再生可能な炭素源(例えば、バイオマス炭素源、例えば、加水分解されたバイオマス炭素源)、酵母抽出物、酵母抽出物由来の成分、ポリマー、酸、アルコール、アルデヒド、ケトン、アミノ酸、コハク酸、乳酸、酢酸、エタノール、または上述のもののうちの2つ以上の任意の組合せである。いくつかの実施形態では、炭素源は、限定するものではないが、グルコースをはじめとする光合成産物である。
例示的な単糖としては、グルコースおよびフルクトースが挙げられ、例示的なオリゴ糖としては、ラクトースおよびスクロースが挙げられ、例示的な多糖類としては、デンプンおよびセルロースが挙げられる。例示的な炭水化物としては、C6糖(例えば、フルクトース、マンノース、ガラクトース、またはグルコース)およびC5糖(例えば、キシロースまたはアラビノース)が挙げられる。いくつかの実施形態では、細胞培地は、炭水化物および炭水化物(例えば、グリセロール、グリセリン、ジヒドロキシアセトン、1炭素源、油、動物性脂肪、動物性油、脂肪酸、脂質、リン脂質、グリセロ脂質、モノグリセリド、ジグリセリド、トリグリセリド、再生可能な炭素源、または酵母抽出物由来の成分)以外の1以上の炭素源を含む。いくつかの実施形態では、細胞培地は、炭水化物およびポリペプチド(例えば、微生物または植物のタンパク質またはペプチド)を含む。いくつかの実施形態では、微生物ポリペプチドは、酵母または細菌由来のポリペプチドである。いくつかの実施形態では、植物ポリペプチドは、大豆、トウモロコシ、キャノーラ、ジャトロファ、ヤシ、落花生、ヒマワリ、ココナッツ、カラシ、菜種、綿の実、パーム核、オリーブ、サフラワー、ゴマ、またはアマニ由来のポリペプチドである。
いくつかの実施形態では、炭水化物の濃度は、少なくともまたは約5グラム/ブロス1リットル(g/L、ここで、ブロスの容積は、細胞培地の容量と細胞の容積の両方を含む)、例えば、少なくともまたは約10、15、20、30、40、50、60、80、100、150、200、300、400g/L、またはそれよりも多い。いくつかの実施形態では、炭水化物の濃度は、約50〜約400g/L、例えば、約100〜約360g/L、約120〜約360g/L、または約200〜約300g/Lである。いくつかの実施形態では、炭水化物のこの濃度は、宿主細胞の培養前および/または培養中に添加される炭水化物の総量を含む。
いくつかの実施形態では、細胞を制限グルコース条件下で培養する。「制限グルコース条件」とは、添加されるグルコースの量が、細胞によって消費されるグルコースの量の105%未満または約105%(例えば、約100%)であることを意味する。特定の実施形態では、培養培地に添加されるグルコースの量は、一定期間内に細胞によって消費されるグルコースの量とほぼ同じである。いくつかの実施形態では、細胞培地中のグルコースの量で支えることができる速度で細胞が増殖するように、細胞増殖の速度を、添加されるグルコースの量を制限することで制御する。いくつかの実施形態では、グルコースは細胞培養中に蓄積しない。様々な実施形態では、約1、2、3、5、10、15、20、25、30、35、40、50、60、もしくは70時間またはそれらより長い時間、細胞を制限グルコース条件下で培養する。様々な実施形態では、細胞が培養される総時間の約5、10、15、20、25、30、35、40、50、60、70、80、90、95、もしくは100%またはそれらより長い時間、細胞を制限グルコース条件下で培養する。任意の特定の理論に束縛されるつもりはないが、制限グルコース条件が細胞のより有利な調節を可能にし得ると考えられている。
いくつかの実施形態では、細胞を過剰なグルコースの存在下で培養する。特定の実施形態では、添加されるグルコースの量は、一定期間内に細胞によって消費されるグルコースの量の約105%超(例えば、約110、120、150、175、200、250、300、400、もしくは500%またはそれらを上回る)あるいはそれを上回る。いくつかの実施形態では、グルコースは細胞培養中に蓄積する。
例示的な脂質は、飽和しているか、不飽和であるか、または分岐しているC4およびそれを上回る脂肪酸である1以上の脂肪酸を含有する任意の物質である。
例示的な油は、室温で液体である脂質である。いくつかの実施形態では、脂質は、1以上のC4またはそれを上回る脂肪酸を含有する(例えば、4以上の炭素を有する1以上の飽和、不飽和、または分岐脂肪酸を含有する)。いくつかの実施形態では、油は、大豆、トウモロコシ、キャノーラ、ジャトロファ、ヤシ、落花生、ヒマワリ、ココナッツ、カラシ、菜種、綿の実、パーム核、オリーブ、サフラワー、ゴマ、アマニ、油脂性微生物細胞、ナンキンハゼ、または上述のもののうちの2つ以上の任意の組合せから得られる。
例示的な脂肪酸としては、式RCOOHの化合物(式中、「R」は炭化水素である)が挙げられる。例示的な不飽和脂肪酸としては、「R」が少なくとも1つの炭素−炭素二重結合を含む化合物が挙げられる。例示的な不飽和脂肪酸としては、限定するものではないが、オレイン酸、バクセン酸、リノレイン酸、パルミトレイン酸酸、およびアラキドン酸が挙げられる。例示的な多価不飽和脂肪酸としては、「R」が複数の炭素−炭素二重結合を含む化合物が挙げられる。例示的な飽和脂肪酸としては、「R」が飽和脂肪族基である化合物が挙げられる。いくつかの実施形態では、炭素源は、1以上のC12−C22脂肪酸、例えば、C12飽和脂肪酸、C14飽和脂肪酸、C16飽和脂肪酸、C18飽和脂肪酸、C20飽和脂肪酸、またはC22飽和脂肪酸を含む。例示的な実施形態では、脂肪酸はパルミチン酸である。いくつかの実施形態では、炭素源は、脂肪酸(例えば、不飽和脂肪酸)の塩、脂肪酸(例えば、不飽和脂肪酸)の誘導体、または脂肪酸(例えば、不飽和脂肪酸)の誘導体の塩である。好適な塩としては、限定するものではないが、リチウム塩、カリウム塩、ナトリウム塩などが挙げられる。ジグリセリドおよびトリグリセリドは、グリセロールの脂肪酸エステルである。
いくつかの実施形態では、脂質、油、脂肪、脂肪酸、モノグリセリド、ジグリセリド、またはトリグリセリドの濃度は、少なくともまたは約1グラム/ブロス1リットル(g/L、ここで、ブロスの容積は、細胞培地の容量と細胞の容積の両方を含む)、例えば、少なくともまたは約5、10、15、20、30、40、50、60、80、100、150、200、300、400g/L、またはそれよりも多い。いくつかの実施形態では、脂質、油、脂肪、脂肪酸、モノグリセリド、ジグリセリド、またはトリグリセリドの濃度は、約10〜約400g/L、例えば、約25〜約300g/L、約60〜約180g/L、または約75〜約150g/Lである。いくつかの実施形態では、この濃度は、宿主細胞の培養前および/または培養中に添加される脂質、油、脂肪、脂肪酸、モノグリセリド、ジグリセリド、またはトリグリセリドの総量を含む。いくつかの実施形態では、炭素源は、(i)脂質、油、脂肪、脂肪酸、モノグリセリド、ジグリセリド、またはトリグリセリドおよび(ii)炭水化物(例えば、グルコース)を含む。いくつかの実施形態では、脂質、油、脂肪、脂肪酸、モノグリセリド、ジグリセリド、またはトリグリセリドと炭水化物の比率は、炭素ベースで約1:1(すなわち、炭水化物の炭素1個当たりに脂質、油、脂肪、脂肪酸、モノグリセリド、ジグリセリド、またはトリグリセリド中の炭素が1個)である。特定の実施形態では、脂質、油、脂肪、脂肪酸、モノグリセリド、ジグリセリド、またはトリグリセリドの量は約60〜180g/Lであり、炭水化物の量は約120〜360g/Lである。
例示的な微生物ポリペプチド炭素源としては、酵母または細菌由来の1以上のポリペプチドが挙げられる。例示的な植物ポリペプチド炭素源としては、大豆、トウモロコシ、キャノーラ、ジャトロファ、ヤシ、落花生、ヒマワリ、ココナッツ、カラシ、菜種、綿の実、パーム核、オリーブ、サフラワー、ゴマ、またはアマニ由来の1以上のポリペプチドが挙げられる。
例示的な再生可能な炭素源としては、チーズホエー浸透液、コーンスティープリカー、甜菜糖液、大麦麦芽、および上述のもののいずれかに由来する成分が挙げられる。例示的な再生可能な炭素源としては、バイオマス(例えば、トウモロコシ、スイッチグラス、サトウキビ、発酵プロセスの細胞廃棄物、および大豆、トウモロコシ、または小麦の製粉からのタンパク質副産物)中に存在するグルコース、ヘキソース、ペントース、およびキシロースも挙げられる。いくつかの実施形態では、バイオマス炭素源は、限定するものではないが、草、小麦、麦わら、バガス、サトウキビバガス、針葉樹パルプ、トウモロコシ、トウモロコシの軸または皮、トウモロコシの実、トウモロコシの実からの繊維、コーンストーバー、スイッチグラス、籾殻産物、または穀物(例えば、トウモロコシ、ソルガム、ライ麦、トリティケート、大麦、小麦、および/またはディスティラーズグレイン)の湿式もしくは乾式製粉からの副産物などの、リグノセルロース系材料、ヘミセルロース系材料、またはセルロース系材料である。例示的なセルロース系材料としては、木材、紙およびパルプ廃棄物、草本植物、および果肉が挙げられる。いくつかの実施形態では、炭素源としては、茎、穀粒、根、または塊根などの任意の植物部分が挙げられる。いくつかの実施形態では、以下の植物のいずれかの全てまたは一部を炭素源として用いる:トウモロコシ、小麦、ライ麦、ソルガム、トリティケート、米、キビ、大麦、キャッサバ、マメ(例えば、豆およびエンドウ豆)、ジャガイモ、サツマイモ、バナナ、サトウキビ、および/またはタピオカ。いくつかの実施形態では、炭素源は、バイオマス加水分解物(例えば、キシロースとグルコースの両方を含むかまたはスクロースとグルコースの両方を含むバイオマス加水分解物)である。
いくつかの実施形態では、再生可能な炭素源(例えば、バイオマス)を、細胞培養培地に添加する前に前処理する。いくつかの実施形態では、前処理は、酵素的前処理、化学的前処理または酵素的前処理と化学的前処理の両方の組合せを含む(例えば、Farzaneh et al.,Bioresource Technology 96(18):2014−2018,2005;米国特許第6,176,176号;米国特許第6,106,888号を参照されたく、これらは各々、特に、再生可能な炭素源の前処理に関して、その全体が参照により本明細書に組み込まれる)。いくつかの実施形態では、再生可能な炭素源を、細胞培養培地に添加する前に、部分的にまたは完全に加水分解する。
いくつかの実施形態では、再生可能な炭素源(例えば、コーンストーバー)を細胞培養培地に添加する前にアンモニア繊維膨潤(AFEX)前処理する(例えば、Farzaneh et al.,Bioresource Technology 96(18):2014−2018,2005を参照されたい)。AFEX前処理の間、再生可能な炭素源を、液体無水アンモニアにより、穏やかな温度(例えば、約60〜約100℃)において高圧(例えば、約250〜約300psi)で約5分間処理する。その後、圧力を速やかに解放する。このプロセスでは、リグニン可溶化、ヘミセルロース加水分解、セルロース脱結晶化、および表面積の増加の化学的効果と物理的効果の組合せにより、セルロースとヘミセルロースを酵素的に変換して、ほぼ完全に発酵性糖にすることができる。AFEX前処理には、アンモニアのほぼ全量を回収して再使用することができるとともに、残量が下流プロセス中の微生物の窒素源として役立てられるという利点がある。また、AFEX前処理には洗浄ストリームが必要ない。したがって、AFEX処理後の乾燥物質の回収率は、本質的に100%である。AFEXは、基本的には、乾燥状態から乾燥状態へのプロセスである。処理された再生可能な炭素源は長期間安定であり、極めて高い固体含有量で酵素的加水分解または発酵プロセスに供給することができる。セルロースおよびヘミセルロースは、ほとんどまたは全く分解せず、AFEXプロセスで十分に保存される。AFEX前処理した再生可能な炭素源の酵素的加水分解の前に中和する必要はない。AFEX処理した炭素源の酵素的加水分解により、次の発酵で使用するための清浄な糖ストリームが産出される。
いくつかの実施形態では、炭素源(例えば、再生可能な炭素源)の濃度は、少なくともまたは約0.1、0.5、1、1.5、2、3、4、5、10、15、20、30、40、または50%グルコース(w/v)に等しい。グルコースの当量は、グルコースを参照として標準的なHPLC法を用いて、炭素源から生成されるグルコースの量を測定することにより決定することができる。いくつかの実施形態では、炭素源(例えば、再生可能な炭素源)の濃度は、約0.1〜約20%グルコース、例えば、約0.1〜約10%グルコース、約0.5〜約10%グルコース、約1〜約10%グルコース、約1〜約5%グルコース、または約1〜約2%グルコースに等しい。
いくつかの実施形態では、炭素源には、酵母抽出物または酵母抽出物の1以上の成分が含まれる。いくつかの実施形態では、酵母抽出物の濃度は、少なくとも1グラムの酵母抽出物/ブロス1リットル(g/L、ここで、ブロスの容積は、細胞培地の容量と細胞の容積の両方を含む)、例えば、少なくともまたは約5、10、15、20、30、40、50、60、80、100、150、200、300g/L、またはそれより多い。いくつかの実施形態では、酵母抽出物の濃度は、約1〜約300g/L、例えば、約1〜約200g/L、約5〜約200g/L、約5〜約100g/L、または約5〜約60g/Lである。いくつかの実施形態では、濃度は、宿主細胞の培養前および/または培養中に添加される酵母抽出物の総量を含む。いくつかの実施形態では、炭素源は、酵母抽出物(または1以上のその成分)と別の炭素源(例えば、グルコース)の両方を含む。いくつかの実施形態では、酵母抽出物と他の炭素源の比率は、約1:5、約1:10、または約1:20(w/w)である。
さらに、炭素源はまた、二酸化炭素またはメタノールなどの1炭素基質であってもよい。メチルトローフ酵母(Yamada et al.,Agric.Biol.Chem.,53(2) 541−543,1989、これは、特に、炭素源に関して、その全体が参照により本明細書に組み込まれる)や細菌(Hunter et.al.,Biochemistry,24,4148−4155,1985、これは、特に、炭素源に関して、その全体が参照により本明細書に組み込まれる)において、1炭素源(例えば、メタノール、ホルムアルデヒド、またはギ酸)からグリセロールが産出されることが報告されている。これらの生物は、メタンからギ酸の範囲の酸化状態にある1炭素化合物を同化して、グリセロールを産出することができる。炭素同化の経路は、リブロース一リン酸経由、セリン経由、またはキシルロース−一リン酸経由であることができる(Gottschalk,Bacterial Metabolism,第2版,Springer−Verlag:New York,1986、これは、特に、炭素源に関して、その全体が参照により本明細書に組み込まれる)。リブロース一リン酸経路では、ギ酸とリブロース−5−リン酸の縮合によって、フルクトースとなる6単糖が形成され、最終的に炭素数3の産物であるグリセルアルデヒド−3−リン酸になる。同様に、セリン経路では、1炭素化合物がメチレンテトラヒドロ葉酸を経由して解糖経路に取り込まれる。
1炭素基質および2炭素基質の他に、メチルトローフ生物は、メチルアミン、グルコサミン、および代謝活性のための種々のアミノ酸などの、いくつかの他の炭素含有化合物を利用することも知られている。例えば、メチルトローフ酵母は、メチルアミンの炭素を利用して、トレハロースまたはグリセロールを形成することが知られている(Bellion et al.,Microb.Growth Cl Compd.,[Int.Symp.],第7版.,415−32.編者:Murrell et al.,Publisher:Intercept,Andover,UK,1993、これは、特に、炭素源に関して、その全体が参照により本明細書に組み込まれる)。同様に、カンジダの様々な種は、アラニンまたはオレイン酸を代謝する(Sulter et al.,Arch.Microbiol.153(5),485−9,1990、これは、特に、炭素源に関して、その全体が参照により本明細書に組み込まれる)。
いくつかの実施形態では、細胞を生理的塩と栄養素を含有する標準的な培地中で培養する(例えば、Pourquie,J.et al.,Biochemistry and Genetics of Cellulose Degradation,編.Aubert et al.,Academic Press,pp.71−86,1988およびIlmen et al.,Appl.Environ.Microbiol.63:1298−1306,1997を参照されたく、これらは各々、特に、細胞培地に関して、その全体が参照により本明細書に組み込まれる)。例示的な増殖培地は、ルリア・ベルターニ(LB)ブロス、サブロー・デキストロース(SD)ブロス、または酵母培地(YM)ブロスなどの、一般的な市販調製培地である。また、他の規定増殖培地または合成増殖培地を用いてもよく、特定の宿主細胞の増殖に適した培地は、微生物学または発酵科学の分野の当業者に知られている。
適当な炭素源の他に、細胞培地は、好適なミネラル、塩、補因子、緩衝剤、および培養物の増殖またはイソプレン産出の増強に好適であることが当業者に知られている他の成分を含有することが望ましい(例えば、WO2004/033646号およびその中に引用された参考文献ならびにWO96/35796号およびその中に引用された参考文献を参照されたく、これらは各々、特に、細胞培地および細胞培養条件に関して、その全体が参照により本明細書に組み込まれる)。イソプレンシンターゼ、DXS、IDI、および/またはMVA経路核酸が誘導性プロモーターの制御下にあるいくつかの実施形態では、誘導剤(例えば、糖、金属塩または抗微生物薬)を、イソプレンシンターゼ、DXS、IDI、および/またはMVA経路ポリペプチドの発現を誘導するために有効な濃度で培地に添加することが望ましい。いくつかの実施形態では、細胞培地は、1以上のDXS、IDI、またはMVA経路核酸を有するベクター上の抗生物質耐性核酸(例えば、カナマイシン耐性核酸)に対応する抗生物質(例えば、カナマイシン)を有する。
例示的な細胞培養条件
細菌培養物の維持および増殖に好適な材料および方法は、当該技術分野で周知である。例示的な技術を、Manual of Methods for General Bacteriology Gerhardt et al.,編),American Society for Microbiology,Washington,D.C.(1994)またはBiotechnology:A Textbook of Industrial Microbiology,第2版(1989) Sinauer Associates,Inc.,Sunderland,MA中のBrock(これらは各々、特に、細胞培養技術に関して、その全体が参照により本明細書に組み込まれる)に見出し得る。いくつかの実施形態では、細胞を、宿主細胞に挿入された核酸によってコードされる1以上のイソプレンシンターゼ、DXS、IDI、またはMVA経路ポリペプチドの発現を許容する条件下、培養培地中で培養する。
標準的な細胞培養条件を用いて細胞を培養することができる(例えば、WO2004/033646号およびその中に引用された参考文献を参照されたく、これらは各々、特に、細胞培養条件および発酵条件に関して、その全体が参照により本明細書に組み込まれる)。細胞を、適当な温度、ガス混合、およびpHで(例えば、約20℃〜約37℃、約6%〜約84%CO2、およびpH約5〜約9で)増殖させ、維持する。いくつかの実施形態では、細胞を適当な細胞培地中、35℃で増殖させる。いくつかの実施形態では、例えば、培養物を、所望量のイソプレンと水素の共産出が達成されるまで、振盪培養液または発酵槽中の適当な培地中、約28℃で培養する。いくつかの実施形態では、発酵のためのpH範囲は、約pH5.0〜約pH9.0(例えば、約pH6.0〜約pH8.0または約6.5〜約7.0)である。反応は、宿主細胞の要件に基づいて、好気性、無酸素性、または嫌気性条件下で行なわれてもよい。いくつかの実施形態では、細胞を酸素制限条件下で培養する。いくつかの実施形態では、細胞を、産出されるイソプレン1モル当たり0.5モルの酸素が取り込まれる条件下、酸素の存在下で培養する。いくつかの実施形態では、細胞を嫌気性条件下で培養する。所与の糸状真菌のための例示的な培養条件は当該技術分野で公知であり、科学文献でおよび/またはAmerican Type Culture Collection and Fungal Genetics Stock Centerなどの真菌の供給源から見出し得る。
様々な実施形態では、バッチプロセス、フェドバッチプロセス、または連続プロセスなどの任意の既知の発酵様式を用いて増殖させる。いくつかの実施形態では、バッチ発酵法を用いる。古典的なバッチ発酵は、培地の組成物を発酵の開始時に仕込み、発酵中に人為的な変更は行なわない閉鎖系である。したがって、発酵の開始時に、細胞培地に所望の宿主細胞を植菌し、この系に何も添加せずに発酵させる。しかしながら、通常、「バッチ」発酵は、炭素源の添加に関してバッチであり、pHや酸素濃度などの因子を制御する試みはよく行なわれる。バッチ系では、系の代謝産物とバイオマスの組成が発酵が停止するまで絶えず変化する。バッチ培養では、細胞は、穏やかに静的遅滞期から高増殖対数増殖期を経て、最終的に増殖速度が減弱または停止する定常期に至る。いくつかの実施形態では、対数増殖期の細胞が、大部分のイソプレン産出に関与する。いくつかの実施形態では、定常期の細胞がイソプレンを産出する。
いくつかの実施形態では、フェドバッチ系などの標準的なバッチ系に対する変更を用いる。フェドバッチ発酵プロセスは、発酵が進行するにしたがって炭素源を徐々に添加する点を除き、通常のバッチ系を含む。フェドバッチ系は、異化代謝産物抑制によって細胞の代謝が抑制される傾向があって、細胞培地中の炭素源の量を制限することが望ましいときに有用である。フェドバッチ発酵を、制限された量または過剰な量の炭素源(例えば、グルコース)を用いて行なってもよい。フェドバッチ系において実際の炭素源濃度を測定することは難しいので、pH、溶存酸素、およびCO2等の排気ガスの分圧などの、測定可能な因子の変化に基づいて推定する。バッチ発酵およびフェドバッチ発酵は当該技術分野で一般的かつ公知であり、Brock,Biotechnology:A Textbook of Industrial Microbiology,第2版(1989) Sinauer Associates,Inc.(これは、特に、細胞培養条件および発酵条件に関して、その全体が参照により本明細書に組み込まれる)に例を見出し得る。
いくつかの実施形態では、連続発酵法を用いる。連続発酵は、所定の発酵培地がバイオリアクターに連続的に添加され、同時に処理のために等量の馴化培地が取り除かれる開放系である。連続発酵では、通常、培養物が一定の高密度に維持され、細胞は主に対数期増殖にある。
連続発酵では、細胞増殖またはイソプレン産出に影響を及ぼす1つの因子または任意の数の因子を調節することができる。例えば、ある方法では、炭素源または窒素レベルなどの制限栄養素を一定の割合に維持し、他の全てのパラメータを調節することができる。他の系では、細胞濃度(例えば、培地の濁度によって測定される濃度)を一定に保ちながら、増殖に影響を及ぼすいくつかの因子を連続的に変化させることができる。連続系は、安定な増殖条件を維持しようとする。したがって、培地を取り出すことによる細胞の損失を、発酵における細胞増殖速度で釣り合わせる。連続発酵プロセスの栄養素および増殖因子を調節する方法ならびに産物形成の速度を最大化する技術は、工業微生物学の分野で周知であり、種々の方法がBrock,Biotechnology:A Textbook of Industrial Microbiology,第2版(1989) Sinauer Associates,Inc.(これは、特に、細胞培養条件および発酵条件に関して、その全体が参照により本明細書に組み込まれる)に詳述されている。
いくつかの実施形態では、細胞を全細胞触媒として基板上に固定し、イソプレンを産出するための発酵条件下に置く。
いくつかの実施形態では、酸素を液体に導入し、かつ培養物の均一性を維持するために培養液のボトルを振盪器の中に置く。いくつかの実施形態では、インキュベーターを用いて、温度、湿度、振盪速度、および/または培養物を増殖させる他の条件を制御する。最も簡単なインキュベーターは、通常約65℃まで上昇する、調整可能なヒーターの付いた断熱箱である。より洗練されたインキュベーターは、(冷却により)温度を下げる能力、または湿度もしくはCO2レベルを制御する能力も含むことができる。ほとんどのインキュベーターはタイマーを含み、異なる温度、湿度レベルなどを周期的に繰り返すようにプログラムできるものもある。インキュベーターのサイズは、卓上型から小さな部屋程度のものまで様々であり得る。
所望により、細胞培地の一部または全てを取り換えて、栄養素を補給しかつ/または潜在的に有害な代謝副生成物と死んだ細胞の蓄積を防ぐことができる。懸濁培養物の場合、懸濁培養物を遠心分離または濾過し、次に、新鮮な培地に再懸濁することにより、細胞を培地から分離することができる。付着培養物の場合、培地をアスピレーションにより直接除去して、入れ換えることができる。いくつかの実施形態では、細胞培地は、細胞の少なくとも一部を、連続培養(例えば、希釈しない連続培養)において少なくともまたは約5、10、20、40、50、60、65回、またはそれより多くの細胞分裂の間、分裂させることができる。
いくつかの実施形態では、構成的または漏出型プロモーター(例えば、Trcプロモーター)を用い、プロモーターに機能的に連結されたイソプレンシンターゼ、DXS、IDI、またはMVA経路核酸の発現を誘導するために化合物(例えば、IPTG)を添加することはない。いくつかの実施形態では、プロモーターに機能的に連結されたイソプレンシンターゼ、DXS、IDI、またはMVA経路核酸の発現を誘導するために化合物(例えば、IPTG)を添加する。
イソプレン産出を細胞増殖から脱共役する例示的な方法
望ましくは、原料由来の炭素を、細胞の増殖や維持にではなく、イソプレンに変換する。いくつかの実施形態では、細胞を低から中程度のOD600まで増殖させ、その後、イソプレンの産出を開始または増加させる。この戦略により、炭素の大部分をイソプレンに変換することができる。
いくつかの実施形態では、細胞は、もはや分裂しないかまたは極端にゆっくりと分裂するが、数時間(例えば、約2、4、6、8、10、15、20、25、30時間、またはそれより長い時間)の間、イソプレンを作り続けるような光学密度に達する。例えば、図60A〜67Cは、細胞がもはや分裂しないかまたは極端にゆっくりと分裂する光学密度に達した後に、細胞が相当な量のメバロン酸またはイソプレンを産出し続け得ることを示している。場合によっては、550nmにおける光学密度が時間の経過とともに減少し(例えば、細胞溶解によって細胞がもはや指数関数的増殖期にはいなくなった後の光学密度の減少)、細胞は相当な量のメバロン酸またはイソプレンを産出し続ける。いくつかの実施形態では、550nmにおける細胞の光学密度は、一定の期間(例えば、約5、10、15、20、25、30、40、50、もしくは60時間またはそれらより長い時間)、50%未満または約50%(例えば、約40、30、20、10、5、もしくは0%またはそれら未満)増加し、細胞は、この期間中に、約1、10、25、50、100、150、200、250、300、400、500、600、700、800、900、1,000、1,250、1,500、1,750、2,000、2,500、3,000、4,000、5,000nmole、もしくはそれより多くのイソプレン/細胞の湿重量に対する細胞のグラム/時間(nmole/gwcm/時間)のイソプレンを産出する。いくつかの実施形態では、イソプレンの量は、約2〜約5,000nmole/gwcm/時間、例えば、約2〜約100nmole/gwcm/時間、約100〜約500nmole/gwcm/時間、約150〜約500nmole/gwcm/時間、約500〜約1,000nmole/gwcm/時間、約1,000〜約2,000nmole/gwcm/時間、または約2,000〜約5,000nmole/gwcm/時間である。いくつかの実施形態では、イソプレンの量は、約20〜約5,000nmole/gwcm/時間、約100〜約5,000nmole/gwcm/時間、約200〜約2,000nmole/gwcm/時間、約200〜約1,000nmole/gwcm/時間、約300〜約1,000nmole/gwcm/時間、または約400〜約1,000nmole/gwcm/時間である。
いくつかの実施形態では、550nmにおける細胞の光学密度は、一定の期間(例えば、約5、10、15、20、25、30、40、50、もしくは60時間またはそれらより長い時間)、50%未満または約50%(例えば、約40、30、20、10、5、もしくは0%またはそれら未満)増加し、細胞は、この期間中に、約1、10、25、50、100、150、200、250、300、400、500、600、700、800、900、1,000、1,250、1,500、1,750、2,000、2,500、3,000、4,000、5,000、10,000、50,000、100,000mg、もしくはそれより多くのイソプレン/ブロスのL(mg/Lブロス、ここで、ブロスの容積は、細胞と細胞培地の容積を含む)の累積力価(総量)のイソプレンを産出する。いくつかの実施形態では、イソプレンの量は、約2〜約5,000mg/Lブロス、例えば、約2〜約100mg/Lブロス、約100〜約500mg/Lブロス、約500〜約1,000mg/Lブロス、約1,000〜約2,000mg/Lブロス、または約2,000〜約5,000mg/Lブロスである。いくつかの実施形態では、イソプレンの量は、約20〜約5,000mg/Lブロス、約100〜約5,000mg/Lブロス、約200〜約2,000mg/Lブロス、約200〜約1,000mg/Lブロス、約300〜約1,000mg/Lブロス、または約400〜約1,000mg/Lブロスである。
いくつかの実施形態では、550nmにおける細胞の光学密度は、一定の期間(例えば、約5、10、15、20、25、30、40、50、もしくは60時間またはそれらより長い時間)、50%未満または約50%(例えば、約40、30、20、10、5、もしくは0%またはそれら未満)増加し、細胞は、この期間中に、細胞培養培地中の炭素の約0.0015、0.002、0.005、0.01、0.02、0.05、0.1、0.12、0.14、0.16、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0、1.2、1.4、1.6、1.8、2.0、2.5、3.0、3.5、4.0、5.0、6.0、7.0、もしくは8.0%またはそれらより多くをイソプレンに変換する。いくつかの実施形態では、炭素のイソプレンへの変換率は、例えば、約0.002〜約4.0%、約0.002〜約3.0%、約0.002〜約2.0%、約0.002〜約1.6%、約0.002〜約0.005%、約0.005〜約0.01%、約0.01〜約0.05%、約0.05〜約0.15%、0.15〜約0.2%、約0.2〜約0.3%、約0.3〜約0.5%、約0.5〜約0.8%、約0.8〜約1.0%、または約1.0〜約1.6%である。いくつかの実施形態では、炭素のイソプレンへの変換率は、約0.002〜約0.4%、0.002〜約0.16%、0.04〜約0.16%、約0.005〜約0.3%、約0.01〜約0.3%、または約0.05〜約0.3%である。
いくつかの実施形態では、イソプレンは定常期にのみ産出される。いくつかの実施形態では、イソプレンは増殖期と定常期の両方に産出される。様々な実施形態では、定常期に産出されるイソプレンの量(例えば、産出されるイソプレンの総量またはOD600で1時間当たりブロス1リットルから産出されるイソプレンの量)は、同じ時間の長さで増殖期に産出されるイソプレンの量の約2、3、4、5、10、20、30、40、50倍、もしくはそれより多い。様々な実施形態では、細胞が定常期にいる間に、産出されるイソプレンの総量(例えば、一定の時間、例えば、20時間の発酵におけるイソプレンの産出)約5、10、20、30、40、50、60、70、80、90、95、99%もしくはそれより多くが産出される。様々な実施形態では、550nmにおける細胞の光学密度が、50%未満または約50%(例えば、約40、30、20、10、5、もしくは0%またはそれら未満)増加するように細胞がゆっくりと分裂するかまたは全く分裂しない間に、産出されるイソプレンの総量(例えば、一定の時間、例えば、20時間の発酵におけるイソプレンの産出)の約5、10、20、30、40、50、60、70、80、90、95、99%もしくはそれより多くが産出される。いくつかの実施形態では、イソプレンは増殖期にのみ産出される。
いくつかの実施形態では、1以上のMVA経路、IDI、DXP、またはイソプレンシンターゼ核酸は、増殖期よりも定常期に活性の高いプロモーターまたは因子の制御下に置かれている。例えば、1以上のMVA経路、IDI、DXP、またはイソプレンシンターゼ核酸は、定常期σ因子(例えば、RpoS)の制御下に置かれていてもよい。いくつかの実施形態では、1以上のMVA経路、IDI、DXP、またはイソプレンシンターゼ核酸は、定常期に誘導可能なプロモーター(例えば、定常期に活性のある応答調節因子によって誘導可能なプロモーター)の制御下に置かれている。
安全操作範囲内のイソプレンの産出
その引火特性に従う安全操作レベル内のイソプレンの産出によって、商業施設の設計と構築が単純化され、安全に操作する能力が大いに改善され、火災が発生する可能性が制限される。特に、イソプレン産出の最適な範囲は、安全圏、すなわち、イソプレン濃度の非引火範囲内である。そのような一態様では、イソプレン濃度の非引火範囲内(イソプレンの引火限度外)でのイソプレン産出方法を本明細書に記載する。
したがって、プロセスの安全性を確保するために、コンピュータモデリング試験と実験的試験を用いて、イソプレン(例えば、O2、N2、CO2または前述のガスのうちの2つ以上の任意の組合せの存在下のイソプレン)の引火限界を決定した。引火限度は、引火下限(LFL)、引火上限(UFL)、制限酸素濃度(LOC)、および制限温度によって特徴付けられる。系が引火性である場合、最少量の酸化体(通常、酸素)の存在下で、最少量の燃料(例えば、イソプレン)でなければならない。LFLは、燃焼を持続させるために存在しなければならないイソプレンの最少量であり、一方、UFLは、存在することができるイソプレンの最大量である。この限度を超えると、混合物は燃料過多となり、酸素の割合が低くなりすぎて、引火性混合物でなくなる。LOCは、引火性混合物を得るために存在しなければならない酸素の最低限の割合を示す。制限温度は、イソプレンの引火点に基づくものであり、イソプレンの燃焼を伝播させることができる最低の温度である。これらの限度は、イソプレンの濃度、酸化体の種類や濃度、系に存在する不活性ガス、温度、および系の圧力に特異的である。引火限度の限度内に収まる組成物は、燃焼を伝播させ、プロセス装置の設計と操作の両方におけるさらなる安全対策を必要とする。
コンピュータシミュレーションと数理解析と実験的試験を用いて、以下の条件を試験した。所望により、本明細書に記載の方法を用いて、他の条件(例えば、他の温度、圧力、および永久ガス組成)を試験し、LFL、UFL、およびLOC濃度を決定してもよい。
(1)コンピュータシミュレーションおよび数理解析
試験項目1:
イソプレン:0重量%〜14重量%
O2:6重量%〜21重量%
N2:79重量%〜94重量%
試験項目2:
イソプレン:0重量%〜14重量%
O2:6重量%〜21重量%
N2:79重量%〜94重量%
H2Oで飽和する
試験項目3:
イソプレン:0重量%〜14重量%
O2:6重量%〜21重量%
N2:79重量%〜94重量%
CO2:5重量%〜30重量%
(2)引火限界の最終決定のための実験的試験
試験項目1:
イソプレン:0重量%〜14重量%
O2:6重量%〜21重量%
N2:79重量%〜94重量%
試験項目2:
イソプレン:0重量%〜14重量%
O2:6重量%〜21重量%
N2:79重量%〜94重量%
H2Oで飽和する
シミュレーションソフトウェアを用いて、いくつかの異なる検討条件について系の引火特性を推定した。CO2は、系の引火限界にそれほど影響を示さなかった。試験項目1と2は、実験的試験で確認した。モデリングの結果は、実験的試験結果と一致した。水を添加した場合に、ほんのわずかな変動が見られた。
LOCは、イソプレンとO2とN2とCO2の混合物について、40℃、1気圧で9.5体積%であると決定された。最大30%までのCO2を添加しても、イソプレンとO2とN2の混合物の引火特性にそれほど影響がなかった。乾燥したイソプレンとO2とN2の系と、水飽和したイソプレンとO2とN2の系の間で、ほんのわずかな引火特性の変動が示された。制限温度は約−54℃である。約−54℃未満の温度では低すぎて、イソプレンの燃焼を伝播させることができない。
いくつかの実施形態では、系中の酸素の量に応じて、イソプレンのLFLは約1.5体積%〜約2.0体積%であり、イソプレンのUFLは約2.0体積%〜約12.0体積%である。いくつかの実施形態では、LOCは約9.5体積%酸素である。いくつかの実施形態では、温度が約25℃〜約55℃(例えば、約40℃)であり、圧力が約1気圧〜3気圧であるとき、イソプレンのLFLは約1.5体積%〜約2.0体積%であり、イソプレンのUFLは約2.0体積%〜約12.0体積%であり、LOCは約9.5体積%酸素である。
いくつかの実施形態では、イソプレンは、約9.5体積%未満の酸素(すなわち、イソプレンの引火性混合物を得るために必要なLOC未満)の存在下で産出される。イソプレンが9.5体積%超または約9.5体積%の酸素の存在下で産出されるいくつかの実施形態では、イソプレン濃度は、LFL未満(例えば、約1.5体積%未満)である。例えば、不活性ガスでイソプレン組成物を希釈することによって(例えば、イソプレン組成物をLFL未満に保つために窒素などの不活性ガスを連続的にまたは定期的に添加することによって)イソプレンの量をLFL未満に保つことができる。イソプレンが9.5体積%超または約9.5体積%の酸素の存在下で産出されるいくつかの実施形態では、イソプレン濃度はUFLを上回る(例えば、約12体積%を上回る)。例えば、イソプレンの量を、UFLを上回る濃度のイソプレンを産出する系(例えば、本明細書に記載の細胞培養系のいずれか)を用いることによって、UFLよりも大きく保つことができる。所望により、UFLも比較的低くなるように、比較的低レベルの酸素を用いることができる。この場合、UFLを上回り続けるためには、より低いイソプレン濃度が必要である。
イソプレンが9.5体積%超または約9.5体積%の酸素の存在下で産出されるいくつかの実施形態では、イソプレン濃度は引火限度内(例えば、LFLとUFLの間)である。イソプレン濃度が引火限度内に収まり得るいくつかの実施形態では、火災または爆発の可能性を低下させるために1以上の工程を行なう。例えば、1以上の発火源(例えば、火花を発生させるおそれのある任意の物質)を避けることができる。いくつかの実施形態では、イソプレンの濃度が引火限度内にあり続ける時間の量を減らすために1以上の工程を行なう。いくつかの実施形態では、センサーを用いて、イソプレンの濃度が引火限度に近いかまたは引火限度内にあるときに検出する。所望により、イソプレンの濃度を、細胞培養期間中の1以上の時点で測定することができ、イソプレンの濃度が引火限度に近いかまたは引火限度内にある場合、標準的な方法を用いて、細胞培養条件および/または不活性ガスの量を調整することができる。特定の実施形態では、細胞培養条件(例えば、発酵条件)を調整して、イソプレンの濃度をLFL未満に減らすかまたはイソプレンの濃度をUFLよりも大きく増加させる。いくつかの実施形態では、不活性ガスでイソプレン組成物を希釈することによって(例えば、イソプレン組成物をLFL未満に保つために不活性ガスを連続的にまたは定期的に添加することによって)イソプレンの量をLFL未満に保つ。
いくつかの実施形態では、イソプレン以外の引火性揮発性物質(例えば、1以上の糖類)の量は、産出されるイソプレンの量よりも少なくとも約2、5、10、50、75、または100倍少ない。いくつかの実施形態では、イソプレンガス以外の気相の部分は、約0%〜約100%(体積)の酸素、例えば、約0%〜約10%、約10%〜約20%、約20%〜約30%、約30%〜約40%、約40%〜約50%、約50%〜約60%、約60%〜約70%、約70%〜約80%、約90%〜約90%、または約90%〜約100%(体積)の酸素を含む。いくつかの実施形態では、イソプレンガス以外の気相の部分は、約0%〜約99%(体積)の窒素、例えば、約0%〜約10%、約10%〜約20%、約20%〜約30%、約30%〜約40%、約40%〜約50%、約50%〜約60%、約60%〜約70%、約70%〜約80%、約90%〜約90%、または約90%〜約99%(体積)の窒素を含む。
いくつかの実施形態では、イソプレンガス以外の気相の部分は、約1%〜約50%(体積)のCO2、例えば、約1%〜約10%、約10%〜約20%、約20%〜約30%、約30%〜約40%、または約40%〜約50%(体積)のCO2を含む。
いくつかの実施形態では、イソプレン組成物はまた、エタノールを含む。例えば、エタノールをイソプレンの抽出蒸留に用いて、エタノールとイソプレンの両方を含む組成物(例えば、中間産物ストリーム)を生じさせてもよい。望ましくは、エタノールの量は、エタノールの引火限度外にある。エタノールのLOCは約8.7体積%であり、エタノールのLFLは、標準的な条件(例えば、約1気圧、約60°F)で約3.3体積%である(NFPA 69 Standard on Explosion Prevention Systems,2008年版、これは、特に、LOC値、LFL値、およびUFL値に関して、その全体が参照により本明細書に組み込まれる)。いくつかの実施形態では、イソプレンとエタノールを含む組成物は、エタノールの引火性混合物を得るために必要なLOC未満(例えば、約8.7%体積%未満)の存在下で産出される。イソプレンとエタノールを含む組成物が、エタノールの引火性混合物を得るために必要なLOCよりも多くまたはエタノールの引火性混合物を得るために必要なおよそのLOCの存在下で産出されるいくつかの実施形態では、エタノール濃度はLFL未満(例えば、約3.3体積%未満)である。
様々な実施形態では、酸化体(例えば、酸素)の量は、系中の任意の燃料(例えば、イソプレンまたはエタノール)のLOC未満である。様々な実施形態では、酸化体(例えば、酸素)の量は、イソプレンまたはエタノールのLOCの約60、40、30、20、10、または5%未満である。様々な実施形態では、酸化体(例えば、酸素)の量は、少なくとも2、4、5、またはそれを上回る完全百分率点(体積%)だけ、イソプレンまたはエタノールのLOCよりも少ない。特定の実施形態では、酸素の量は、イソプレンまたはエタノールのLOCよりも少なくとも2完全百分率点(体積%)少ない(例えば、イソプレンのLOCが9.5体積%であるとき、酸素濃度は7.5体積%未満である)。様々な実施形態では、燃料(例えば、イソプレンまたはエタノール)の量は、燃料のLFLの25、20、15、10、もしくは5%未満または約25、20、15、10、もしくは5%である。
揮発性炭化水素であるイソプレンの発酵による高効率産出および回収
イソプレンを産出する方法であって、a)イソプレンの産出に好適な条件下で細胞を培養することと、b)イソプレンを産出することとを含む方法が提供されており、ここで、イソプレンの液相濃度は約200mg/L未満である。いくつかの実施形態では、培養物中のイソプレンの液相濃度は、175mg/mL、150mg/mL、125mg/mL、100mg/mL、75mg/mL、50mg/mL、25mg/mL、20mg/mL、15mg/mL、10mg/mL、5mg/mL、または2.5mg/Lの約いずれか未満である。いくつかの実施形態では、培養物中のイソプレンの液相濃度は、0.1mg/L〜200mg/L、1mg/L〜200mg/L、1mg/L〜150mg/L、1mg/L〜100mg/L、1mg/L〜50mg/L、1mg/L〜25mg/L、1mg/L〜20mg/L、または10mg/L〜20mg/Lの約いずれかである。いくつかの実施形態では、産出されるイソプレンは、「イソプレンの例示的な産出」と題された節に開示された任意の濃度または量である。いくつかの実施形態では、液相濃度は、イソプレンの溶解限界未満である。
本方法のいくつかの実施形態では、細胞は、約400nmole/gwcm/時間を上回るイソプレンを産出する。いくつかの実施形態では、イソプレンの量は、400nmole/gwcm/時間〜1mole/gwcm/時間、400nmole/gwcm/時間〜1mmole/gwcm/時間、400nmole/gwcm/時間〜40mmole/gwcm/時間、400nmole/gwcm/時間〜4mmole/gwcm/時間、1mmole/gwcm/時間〜1.5mmole/gwcm/時間、1.5mmole/gwcm/時間〜3mmole/gwcm/時間、3mmole/gwcm/時間〜5mmole/gwcm/時間、5mmole/gwcm/時間〜25mmole/gwcm/時間、25mmole/gwcm/時間〜100mmole/gwcm/時間、100mmole/gwcm/時間〜500mmole/gwcm/時間、または500mmole/gwcm/時間〜1000mmole/gwcm/時間の約いずれかである。いくつかの実施形態では、イソプレンの量は、1mmole/gwcm/時間、1.5mmole/gwcm/時間、2mmole/gwcm/時間、3mmole/gwcm/時間、4mmole/gwcm/時間、または5mmole/gwcm/時間のいずれか程度である。
ヘンリー係数の値(Matm−1単位)が低いことは、イソプレンを低い放出速度(例えば、0.01vvm〜2vvm)でのガスストリッピングにより発酵ブロスから回収することができることを意味する。いくつかの実施形態では、ガス放出速度は、0.1vvm〜1vvm、0.01vvm〜0.5vvm、0.2vvm〜1vvm、または0.5vvm〜1vvmのいずれか程度である。いくつかの実施形態では、ガス放出速度は、0.1vvm、0.25vvm、0.5vvm、0.75vvm、1vvm、1.25vvm、1.5vvm、1.75vvm、または2vvmのいずれか程度である。いくつかの実施形態では、低い放出速度を、発酵操作の全期間、増殖期の間、または定常期の間、維持する。いくつかの実施形態では、低い放出速度を、1時間〜5時間、5時間〜10時間、10時間〜20時間、20時間〜30時間、30時間〜40時間、40時間〜50時間、または50時間〜60時間の約いずれかの間、維持する。より低い望ましいガス放出限度は、水相がイソプレンで飽和するようになり、液体有機相が形成される時点によって規定される。これは、イソプレンの沸点(1気圧で34.1℃)未満でしか起こり得ず、これより上で、液体イソプレン相が形成されることは決してない。イソプレンの沸点未満の温度では、液相の形成はイソプレンの水溶解度によって決定され、これは、25℃で約650mg/Lである。液体イソプレン相の形成を避けることが極めて望ましいが、細胞が毒性効果を伴わずに液体イソプレンの存在に耐えることができるならば、これが絶対的に必要であるというわけではない。
いくつかの実施形態では、酸素、CO2、およびイソプレンは、「安全操作範囲のイソプレンの産出」という題の節に論じられている量または濃度のいずれかである。いくつかの実施形態では、完全に好気的な代謝を維持しながら、全ての酸素が細胞によって消費される。いくつかの実施形態では、細胞の酸素必要量を満たすために、過剰の酸素が用いられる。オフガス中の望ましい酸素範囲は、20%未満または15%未満または10%未満(v/v)である。イソプレンの燃焼に必要な制限酸素濃度未満の酸素レベル(1気圧で9.5%v/v)が特に望ましい。いくつかの実施形態では、細胞の酸素必要量を満たしながら、最低限のガススイープ率を可能にする目的で、酸素濃縮空気を利用する。いくつかの実施形態では、ガススイープの気相の部分は、約0.1%〜約10%、約10%〜約20%、または約20%〜約30%(体積)の酸素を含む。いくつかの実施形態では、液相中の所要の溶存酸素レベルを維持するために必要とされる余分な酸素量を最小限に抑えるために、イソプレン発酵を高圧下で行なう。
いくつかの実施形態では、発酵槽全体のガススイープ率の低下は、そのような条件によって、細胞の生理機能に悪影響を及ぼすことなく、オフガスイソプレンレベルが最大約30,000μg/L(約1%v/v)まで濃縮されるという点でイソプレン産出プロセスの統合に有利である。
いくつかの実施形態では、ガス放出速度の低下は、細胞の生理機能にそれほど悪影響を及ぼさない。いくつかの実施形態では、ガス放出速度を低下させた場合の培養細胞の二酸化炭素発生速度は、1×10-18mmol/L/時間〜約1mol/L/時間、1mmol/L/時間〜1mol/L/時間、25mmol/L/時間〜750mmol/L/時間、25mmol/L/時間〜75mmol/L/時間、250mmol/L/時間〜750mmol/L/時間、または450mmol/L/時間〜550mmol/L/時間の約いずれかである。いくつかの実施形態では、二酸化炭素発生速度は、50mmol/L/時間、100mmol/L/時間、150mmol/L/時間、200mmol/L/時間、250mmol/L/時間、300mmol/L/時間、350mmol/L/時間、400mmol/L/時間、450mmol/L/時間、または500mmol/L/時間の約いずれかである。いくつかの実施形態では、ガス放出速度を低下させた場合の細胞生存性は、1.75倍、1.5倍、1.25倍、1倍、0.75倍、0.5倍、または0.25倍の約いずれか未満だけ低下する。いくつかの実施形態では、ガス放出速度を低下させた場合の細胞生存性は、約2倍だけ低下する。いくつかの実施形態では、ガス放出速度を低下させた場合の異種および/または重複コピーのMVA経路および/またはDXP経路の核酸の1以上からMVA経路および/またはDXP経路のRNAおよび/またはタンパク質を発現する細胞の細胞生存性を、ガス放出速度を低下させた場合の異種および/または重複コピーのMVA経路および/またはDXP経路核酸の1以上を欠く対照細胞と比較する。いくつかの実施形態では、ガス放出速度を低下させた場合の、誘導性プロモーターの制御下にある異種および/または重複コピーのMVA経路および/またはDXP経路の核酸の1以上からMVA経路および/またはDXP経路のRNAおよび/またはタンパク質を発現する細胞(この場合、プロモーターは誘導されている)の細胞生存性を、ガス放出速度を低下させた場合の、誘導性プロモーターの制御下にある異種および/または重複コピーのMVA経路および/またはDXP経路の核酸の1以上を含有する対照細胞(この場合、プロモーターは誘導されていない(未誘導である))と比較する。いくつかの実施形態では、誘導性プロモーターは、β−ガラクトシダーゼプロモーターである。
いくつかの実施形態では、生物によって消費される総炭素の少なくとも5%を揮発性の不飽和炭化水素に変換する遺伝子改変された宿主生物の発酵。いくつかの実施形態では、100μg/L、500μg/L、1000μg/L、2,500μg/L、5,000μg/L、7,500μg/L、または10,000μg/Lの少なくともいずれか程度のレベルの発酵オフガス中に存在するような割合での不飽和炭化水素の産出。
いくつかの実施形態では、100μg/L、500μg/L、1000μg/L、2,500μg/L、5,000μg/L、7,500μg/L、または10,000μg/Lの少なくともいずれか程度のオフガス中の濃度に相当する、高率産出に相応しいやり方で、不飽和炭化水素をオフガス流から回収する。いくつかの実施形態では、得られるオフガスが目的の揮発性成分中に濃縮されるように、特に低いガススイープ率での発酵オフガスからの不飽和炭化水素の連続的な抽出および回収。いくつかの実施形態では、揮発性物質の濃度の上昇に依存する方法による揮発性炭化水素の回収。例えば、圧縮/凝結技術または抽出蒸留技術の使用による発酵オフガス中のイソプレン効率的な捕獲。シリカゲル吸着剤に加えた活性炭カートリッジの使用、炭素カートリッジからのイソプレンの解離および濃縮、および/またはグルコース基質の約5%またはそれより多くをイソプレンに変換し、約15,000μg/Lイソプレンを上回るオフガス濃度を生じさせることができる宿主生物(例えば、大腸菌株)の構築および発酵も企図される。回収方法は、本明細書に記載の方法のいずれかを含む。
また、化合物の産出方法が本明細書で提供され、ここで、この化合物は、(a)約250M/atm未満のヘンリー則係数と(b)約100g/L未満の水溶解度からなる群から選択される1以上の特徴を有する。いくつかの実施形態では、本方法は、a)化合物の産出に好適な条件下で細胞を培養すること、ここで、ガスは約0.01vvm〜約2vvmのガス放出速度で添加される(例えば、発酵系などの系へのガスの添加)と、b)化合物を産出することとを含む。
いくつかの実施形態では、細胞質量に区分される化合物の量は、液相溶解度値には含まれない。いくつかの実施形態では、液相濃度は化合物の溶解限界未満である。
いくつかの実施形態では、化合物、特に、250M/atm、200M/atm、150M/atm、100M/atm、75M/atm、50M/atm、25M/atm、10M/atm、5M/atm、または1M/atm未満の約いずれかのヘンリー則係数を有する化合物を、中から低ガス放出速度でのガスストリッピングによって発酵ブロスから連続的に回収することができる。例としては、アセトアルデヒド(15M/atm)などのアルデヒド、アセトン(30M/atm)もしくは2−ブタノン(20M/atm)などのケトン、またはメタノール(220M/atm)、エタノール(200M/atm)、1−ブタノール(120M/atm)もしくはC5アルコール(3−メチル−3−ブテン−1−オール、および3−メチル−2−ブテン−1−オールを含む)(50〜100M/atm)をはじめとするアルコールが挙げられる。アルコールのエステルは、通常、それぞれのアルコールよりも低いヘンリー定数を有する(例えば、酢酸エチル(6〜9M/atm)またはC5アルコールのアセチルエステル(<5M/atm))。1M/atm未満のヘンリー則係数を有する化合物が特に望ましい。例としては、C1〜C5炭化水素(例えば、メタン、エタン、エチレン、またはプロピレン)などの他の炭化水素の他に、ヘミテルペン、モノテルペン、またはセスキテルペンが挙げられる。いくつかの実施形態では、炭化水素(例えば、C1〜C5炭化水素)は、飽和したもの、不飽和のもの、または分岐したものである。
一般に、係数の極めて低い化合物が水に溶けにくい(実質的に水に溶けない)という点でヘンリー則係数と水溶解度の間には相関関係がある。水に無限に溶ける揮発性物質(例えば、アセトンまたはエタノール)をガスストリッピングによって除去することができるが、望ましい溶解限界は、100g/L、75g/L、50g/L、25g/L、10g/L、5g/L、または1g/Lの約いずれか未満である。
上記の化合物のいずれかを産出する方法のいずれかのいくつかの実施形態では、ガス放出速度は、およそ0.1vvm〜1vvm、0.2vvm〜1vvm、または0.5vvm〜1vvmのいずれかである。いくつかの実施形態では、ガス放出速度は、0.1vvm、0.25vvm、0.5vvm、0.75vvm、1vvm、1.25vvm、1.5vvm、1.75vvm、または2vvmの約いずれかである。いくつかの実施形態では、低放出速度を、発酵操作の全期間、増殖期の間、または定常期の間、維持する。いくつかの実施形態では、低放出速度を、1時間〜5時間、5時間〜10時間、10時間〜20時間、20時間〜30時間、30時間〜40時間、40時間〜50時間、または50時間〜60時間の約いずれかの間、維持する。
本明細書に記載の系はいずれも、上記の化合物を産出する方法において使用することができる。「例示的な精製方法」と題された節に記載されているような標準的な方法を用いて、精製することができる。例えば、蒸留または選択的吸着技術によって、回収後に分離を行なうことができる。
Bioisopreneの例示的な産出
いくつかの実施形態では、細胞を、細胞によるイソプレンの産出を可能にする条件下で培養培地中で培養する。
「ピーク絶対生産性」とは、特定の時間、細胞を培養したときの(例えば、特定の発酵操作時間、細胞を培養したときの)オフガス中のイソプレンの最大絶対量を意味する。「ピーク絶対生産性時点」とは、オフガス中のイソプレンの絶対量が、特定の時間、細胞を培養したときに(例えば、特定の発酵操作時間、細胞を培養したときに)最大となる発酵操作中の時点を意味する。いくつかの実施形態では、イソプレン量をピーク絶対生産性時点で測定する。いくつかの実施形態では、細胞のピーク絶対生産性は、本明細書に開示されたイソプレン量の約いずれかである。
「ピーク比生産性」とは、特定の時間、細胞を培養したときの(例えば、特定の発酵操作時間、細胞を培養したときの)細胞当たりに産出されるイソプレンの最大量を意味する。「ピーク比生産性時点」とは、細胞当たりに産出されるイソプレンの量が最大になる特定の時間、細胞を培養したときの(例えば、特定の発酵操作時間、細胞を培養したときの)時点を意味する。ピーク比生産性は、総生産性を600nmにおける光学密度(OD600)により求められる細胞の量で割ることにより求められる。いくつかの実施形態では、イソプレン量をピーク比生産性時点で測定する。いくつかの実施形態では、細胞のピーク比生産性は、本明細書に開示された細胞当たりのイソプレン量の約いずれかである。
「ピーク容積生産性」とは、特定の時間、細胞を培養したときの(例えば、特定の発酵操作時間、細胞を培養したときの)ブロス(細胞と細胞培地の容積を含む)の容積当たりに産出されるイソプレンの最大量を意味する。「ピーク比容積生産性時点」とは、ブロスの容積当たりに産出されるイソプレンの量が最大になる特定の時間、細胞を培養したときの(例えば、特定の発酵操作時間、細胞を培養したときの)時点を意味する。ピーク比容積生産性は、総生産性をブロスの容積と時間とで割ることにより求められる。いくつかの実施形態では、イソプレン量をピーク比容積生産性時点で測定する。いくつかの実施形態では、細胞のピーク比容積生産性は、本明細書に開示された時間当たり容積当たりのイソプレン量の約いずれかである。
「ピーク濃度」とは、特定の時間、細胞を培養したときの(例えば、特定の発酵操作時間、細胞を培養したときの)産出されるイソプレンの最大量を意味する。「ピーク濃度時点」とは、細胞当たりに産出されるイソプレンの量が最大になる特定の時間、細胞を培養したときの(例えば、特定の発酵操作時間、細胞を培養したときの)時点を意味する。いくつかの実施形態では、イソプレン量をピーク濃度時点で測定する。いくつかの実施形態では、細胞のピーク濃度は、本明細書に開示されたイソプレン量の約いずれかである。
「平均容積生産性」とは、特定の時間、細胞を培養したときの(例えば、特定の発酵操作時間、細胞を培養したときの)ブロス(細胞と細胞培地の容積を含む)の容積当たりに産出されるイソプレンの平均量を意味する。平均容積生産性は、総生産性をブロスの容積と時間とで割ることにより求められる。いくつかの実施形態では、細胞の平均比容積生産性は、本明細書に開示された時間当たり容積当たりのイソプレン量の約いずれかである。
「累計生産性」とは、特定の時間、細胞を培養したときの(例えば、特定の発酵操作時間、細胞を培養したときの)産出されるイソプレンの累積総量を意味する。いくつかの実施形態では、イソプレンの累積総量を測定する。いくつかの実施形態では、細胞の累計生産性は、本明細書に開示されたイソプレン量の約いずれかである。
本明細書に使用する「相対検出器応答」とは、ある化合物(例えば、イソプレン)の検出器応答(例えば、GC/MS面積)と1以上の化合物(例えば、全てのC5炭化水素)の検出器応答(例えば、GC/MS面積)の比を指す。検出器応答を、本明細書に記載の通りに、例えば、Agilent HP−5MS GC/MSカラム(30m×250μm;0.25μm膜厚)を備えたAgilent 6890 GC/MSシステムで実施されるGC/MS分析により、測定してもよい。所望により、相対検出器応答を、各々の化合物の応答係数を用いて重量パーセントに換算することができる。この応答係数は、シグナルが所与の量の特定の化合物についてどの程度発生するか(すなわち、検出器が特定の化合物に対してどの程度の感度を有するか)という尺度である。検出器が比較されている化合物に対して様々な感度を有する場合は、この応答係数を、相対検出器応答を重量パーセントに換算するための相関係数として用いることができる。あるいは、比較されている化合物について応答係数が同じであると仮定して、重量パーセントを概算することができる。したがって、重量パーセントを相対検出器応答とほぼ同じものであると仮定することができる。
いくつかの実施形態では、培養細胞は、約1、10、25、50、100、150、200、250、300、400、500、600、700、800、900、1,000、1,250、1,500、1,750、2,000、2,500、3,000、4,000、5,000、10,000、12,500、20,000、30,000、40,000、50,000、75,000、100,000、125,000、150,000、188,000nmole、もしくはそれより多くのイソプレン/細胞の湿重量に対する細胞のグラム/時間(nmole/gwcm/時間)またはそれを上回るイソプレンを産出する。いくつかの実施形態では、イソプレンの量は、約2〜約200,000nmole/gwcm/時間、例えば、約2〜約100nmole/gwcm/時間、約100〜約500nmole/gwcm/時間、約150〜約500nmole/gwcm/時間、約500〜約1,000nmole/gwcm/時間、約1,000〜約2,000nmole/gwcm/時間、または約2,000〜約5,000nmole/gwcm/時間、約5,000〜約10,000nmole/gwcm/時間、約10,000〜約50,000nmole/gwcm/時間、約50,000〜約100,000nmole/gwcm/時間、約100,000〜約150,000nmole/gwcm/時間、または約150,000〜約200,000nmole/gwcm/時間である。いくつかの実施形態では、イソプレンの量は、約20〜約5,000nmole/gwcm/時間、約100〜約5,000nmole/gwcm/時間、約200〜約2,000nmole/gwcm/時間、約200〜約1,000nmole/gwcm/時間、約300〜約1,000nmole/gwcm/時間、または約400〜約1,000nmole/gwcm/時間、約1,000〜約5,000nmole/gwcm/時間、約2,000〜約20,000nmole/gwcm/時間、約5,000〜約50,000nmole/gwcm/時間、約10,000〜約100,000nmole/gwcm/時間、約20,000〜約150,000nmole/gwcm/時間、または約20,000〜約200,000nmole/gwcm/時間である。
nmole/gwcm/時間という単位で表されるイソプレンの量を、米国特許第5,849,970号(これは、特に、イソプレン産出の測定に関して、その全体が参照により本明細書に組み込まれる)に開示されているように測定することができる。例えば、2mLのヘッドスペース(例えば、200rpmで約3時間振盪しながら、密封バイアル中、32℃で培養された2mLの培養物などの培養物のヘッドスペース)を、標準的なガスクロマトグラフィーシステム、例えば、等温(85℃)で操作され、n−オクタン/porasil Cカラム(Alltech Associates,Inc.,Deerfield,Ill.)を備え、RGD2酸化水銀還元ガス検出器に接続されているシステムを用いて、イソプレンについて分析する(Trace Analytical,Menlo Park,CA)(例えば、Greenberg et al,Atmos.Environ.27A:2689−2692,1993;Silver et al.,Plant Physiol.97:1588−1591,1991を参照されたく、これらは各々、特に、イソプレン産出の測定に関して、その全体が参照により本明細書に組み込まれる)。ガスクロマトグラフィーの面積単位を、標準イソプレン濃度検量線を用いてnmolイソプレンに換算する。いくつかの実施形態では、細胞の湿重量を表す細胞のグラム数は、細胞培養物の試料についてのA600値を取得し、次に、このA600値を、既知のA600値を有する細胞培養物についての湿重量の検量線に基づいて細胞のグラムに換算することにより算出される。いくつかの実施形態では、細胞のグラムは、A600値が1の1リットルブロス(細胞培地と細胞を含む)に1グラムの湿細胞重量が含まれると仮定することにより推定される。また、この値を、培養物をインキュベートした時間(例えば、3時間)で割り算する。
いくつかの実施形態では、培養細胞は、1、10、25、50、100、150、200、250、300、400、500、600、700、800、900、1,000、1,250、1,500、1,750、2,000、2,500、3,000、4,000、5,000、10,000、100,000ng、もしくはそれより多くのイソプレン/細胞の湿重量に対する細胞のグラム/時間(ng/gwcm/h)のイソプレンを産出する。いくつかの実施形態では、イソプレンの量は、約2〜約5,000ng/gwcm/h、例えば、約2〜約100ng/gwcm/h、約100〜約500ng/gwcm/h、約500〜約1,000ng/gwcm/h、約1,000〜約2,000ng/gwcm/h、または約2,000〜約5,000ng/gwcm/hである。いくつかの実施形態では、イソプレンの量は、約20〜約5,000ng/gwcm/h、約100〜約5,000ng/gwcm/h、約200〜約2,000ng/gwcm/h、約200〜約1,000ng/gwcm/h、約300〜約1,000ng/gwcm/h、または約400〜約1,000ng/gwcm/hである。ng/gwcm/hで示されるイソプレンの量を、上で論じたnmole/gwcm/時間という単位で表されるイソプレン産出値に(下記の方程式5に記載したように)68.1を掛けることで算出することができる。
いくつかの実施形態では、培養細胞は、1、10、25、50、100、150、200、250、300、400、500、600、700、800、900、1,000、1,250、1,500、1,750、2,000、2,500、3,000、4,000、5,000、10,000、50,000、100,000mg、もしくはそれより多くのイソプレン/ブロスのL(mg/Lブロス、ここで、ブロスの容積は、細胞と細胞培地の容積を含む)累積力価(総量)のイソプレンを産出する。いくつかの実施形態では、イソプレンの量は、約2〜約5,000mg/Lブロス、例えば、約2〜約100mg/Lブロス、約100〜約500mg/Lブロス、約500〜約1,000mg/Lブロス、約1,000〜約2,000mg/Lブロス、または約2,000〜約5,000mg/Lブロスである。いくつかの実施形態では、イソプレンの量は、約20〜約5,000mg/Lブロス、約100〜約5,000mg/Lブロス、約200〜約2,000mg/Lブロス、約200〜約1,000mg/Lブロス、約300〜約1,000mg/Lブロス、または約400〜約1,000mg/Lブロスである。
イソプレンのmg/振盪フラスコ培養または同様の培養のヘッドスペースのLで表されるイソプレンの比生産性は、(例えば、実施例I、第II部に記載されているように)OD600の値が約1.0の細胞培養物から1ml試料を採取し、それを20mLバイアルに入れ、30分間インキュベートした後、ヘッドスペース中のイソプレンの量を測定することによって測定することができる。OD600の値が1.0でない場合は、OD600の値で割ることにより、測定値を1.0のOD600の値に標準化することができる。mgイソプレン/Lヘッドスペースの値は、38という係数を掛けることにより、mg/Lブロス/時間/培養ブロスのOD600に換算することができる。mg/Lブロス/時間/OD600という単位で表される値に時間数とOD600の値を掛けることにより、イソプレンのmg/ブロスのLという単位で表される累積力価を得ることができる。
いくつかの実施形態では、培養細胞は、0.1、1.0、10、25、50、100、150、200、250、300、400、500、600、700、800、900、1,000、1100、1200、1300、1,400、1,500、1,600、1,700、1,800、1,900、2,000、2,100、2,200、2,300、2,400、2,500、2,600、2,700、2,800、2,900、3,000、3,100、3,200、3,300、3,400、3,500mg、もしくはそれより多くのイソプレン/ブロスのL/時間(mg/Lブロス/時間、ここで、ブロスの容積は、細胞と細胞培地の容積を含む)イソプレンの平均容積生産性を有する。いくつかの実施形態では、イソプレンの平均容積生産性は、約0.1〜約3,500mg/Lブロス/時間、例えば、約0.1〜約100mg/Lブロス/時間、約100〜約500mg/Lブロス/時間、約500〜約1,000mg/Lブロス/時間、約1,000〜約1,500mg/Lブロス/時間、約1,500〜約2,000mg/Lブロス/時間、約2,000〜約2,500mg/Lブロス/時間、約2,500〜約3,000mg/Lブロス/時間、または約3,000〜約3,500mg/Lブロス/時間である。いくつかの実施形態では、イソプレンの平均容積生産性は、約10〜約3,500mg/Lブロス/時間、約100〜約3,500mg/Lブロス/時間、約200〜約1,000mg/Lブロス/時間、約200〜約1,500mg/Lブロス/時間、約1,000〜約3,000mg/Lブロス/時間、または約1,500〜約3,000mg/Lブロス/時間である。
いくつかの実施形態では、培養細胞は、0.5、1.0、10、25、50、100、150、200、250、300、400、500、600、700、800、900、1,000、1100、1200、1300、1,400、1,500、1,600、1,700、1,800、1,900、2,000、2,100、2,200、2,300、2,400、2,500、2,600、2,700、2,800、2,900、3,000、3,100、3,200、3,300、3,400、3,500、3,750、4,000、4,250、4,500、4,750、5,000、5,250、5,500、5,750、6,000、6,250、6,500、6,750、7,000、7,250、7,500、7,750、8,000、8,250、8,500、8,750、9,000、9,250、9,500、9,750、10,000、12,500、15,000mg、もしくはそれより多くのイソプレン/ブロスのL/時間(mg/Lブロス/時間、ここで、ブロスの容積は、細胞と細胞培地の容積を含む)のイソプレンのピーク容積生産性を有する。いくつかの実施形態では、イソプレンのピーク容積生産性は、約0.5〜約15,000mg/Lブロス/時間、例えば、約0.5〜約10mg/Lブロス/時間、約1.0〜約100mg/Lブロス/時間、約100〜約500mg/Lブロス/時間、約500〜約1,000mg/Lブロス/時間、約1,000〜約1,500mg/Lブロス/時間、約1,500〜約2,000mg/Lブロス/時間、約2,000〜約2,500mg/Lブロス/時間、約2,500〜約3,000mg/Lブロス/時間、約3,000〜約3,500mg/Lブロス/時間、約3,500〜約5,000mg/Lブロス/時間、約5,000〜約7,500mg/Lブロス/時間、約7,500〜約10,000mg/Lブロス/時間、約10,000〜約12,500mg/Lブロス/時間、または約12,500〜約15,000mg/Lブロス/時間である。いくつかの実施形態では、イソプレンのピーク容積生産性は、約10〜約15,000mg/Lブロス/時間、約100〜約2,500mg/Lブロス/時間、約1,000〜約5,000mg/Lブロス/時間、約2,500〜約7,500mg/Lブロス/時間、約5,000〜約10,000mg/Lブロス/時間、約7,500〜約12,500mg/Lブロス/時間、または約10,000〜約15,000mg/Lブロス/時間である。
mg/Lブロス/時間で表される発酵槽における瞬間イソプレン産出速度は、発酵槽オフガスの試料を採取し、それを、例えば、実施例1、第II部に記載されているように、イソプレンの量(イソプレンのmg/Lガスなどの単位で表される)について分析し、この値に、ブロス1リットルごとにオフガスが通過する速度(例えば、1vvm(空気の容積/ブロスの容積/分)、これは、60Lガス/時間である)を掛けることにより測定することができる。したがって、1mg/Lガスのオフガスレベルは、1vvmの空気流量における60mg/Lブロス/時間の瞬間産出速度に相当する。所望により、mg/Lブロス/時間という単位で表される値をOD600の値で割って、mg/Lブロス/時間/ODという単位で表される比速度を得ることができる。mgイソプレン/Lガスの平均値は、この平均オフガスイソプレン濃度に発酵中に発酵ブロス1リットルから放出されたオフガスの総量を掛けることにより、総産物生産性(発酵ブロス1リットル当たりのイソプレンのグラム、mg/Lブロス)に換算することができる。したがって、1vvmで10時間の0.5mg/Lブロス/時間の平均オフガスイソプレン濃度は、300mgイソプレン/Lブロスの総産物濃度に相当する。
いくつかの実施形態では、培養細胞は、細胞培養培地中の炭素の約0.0015、0.002、0.005、0.01、0.02、0.05、0.1、0.12、0.14、0.16、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0、1.2、1.4、1.6、1.8、2.0、2.2、2.4、2.6、3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0、12.0、13.0、14.0、15.0、16.0、17.0、18.0、19.0、20.0、21.0、22.0、23.0、23.2、23.4、23.6、23.8、24.0、25.0、30.0、31.0、32.0、33.0、35.0、37.5、40.0、45.0、47.5、50.0、55.0、60.0、65.0、70.0、75.0、80.0、85.0、もしくは90.0モルパーセントまたはそれより多くをイソプレンに変換する。いくつかの実施形態では、炭素のイソプレンへの変換率は、約0.002〜約90.0モルパーセント、例えば、約0.002〜約0.005%、約0.005〜約0.01%、約0.01〜約0.05%、約0.05〜約0.15%、0.15〜約0.2%、約0.2〜約0.3%、約0.3〜約0.5%、約0.5〜約0.8%、約0.8〜約1.0%、約1.0〜約1.6%、約1.6〜約3.0%、約3.0〜約5.0%、約5.0〜約8.0%、約8.0〜約10.0%、約10.0〜約15.0%、約15.0〜約20.0%、約20.0〜約25.0%、約25.0%〜30.0%、約30.0%〜35.0%、約35.0%〜40.0%、約45.0%〜50.0%、約50.0%〜55.0%、約55.0%〜60.0%、約60.0%〜65.0%、約65.0%〜70.0%、約75.0%〜80.0%、約80.0%〜85.0%、もしくは約85.0%〜90.0%である。いくつかの実施形態では、炭素のイソプレンへの変換率は、約0.002〜約0.4モルパーセント、0.002〜約0.16モルパーセント、0.04〜約0.16モルパーセント、約0.005〜約0.3モルパーセント、約0.01〜約0.3モルパーセント、約0.05〜約0.3モルパーセント、約0.1〜0.3モルパーセント、約0.3〜約1.0モルパーセント、約1.0〜約5.0モルパーセント、約2〜約5.0モルパーセント、約5.0〜約10.0モルパーセント、約7〜約10.0モルパーセント、約10.0〜約20.0モルパーセント、約12〜約20.0モルパーセント、約16〜約20.0モルパーセント、約18〜約20.0モルパーセント、約18〜23.2モルパーセント、約18〜23.6モルパーセント、約18〜約23.8モルパーセント、約18〜約24.0モルパーセント、約18〜約25.0モルパーセント、約20〜約30.0モルパーセント、約30〜約40.0モルパーセント、約30〜約50.0モルパーセント、約30〜約60.0モルパーセント、約30〜約70.0モルパーセント、約30〜約80.0モルパーセント、もしくは約30〜約90.0モルパーセントである。
炭素のイソプレンへの変換パーセント(「炭素収率%」とも呼ぶ)は、産出されたイソプレン中の炭素モル数を炭素源中の炭素モル数(例えば、バッチで供給されたグルコースおよび酵母抽出物中の炭素モル数)で割ることにより測定することができる。(方程式1に示すように)この数字に100%を掛けると、パーセントの値が得られる。
方程式1
[数1]
炭素収率%=(産出されたイソプレン中の炭素モル数)/(炭素源中の炭素モル数)*100
この計算では、酵母抽出物は、50%w/w炭素を含有すると仮定することができる。一例として、実施例7、第VIII部に記載されている500リットルの場合、炭素のイソプレンへの変換パーセントは、方程式2に示すように計算される。
方程式2
[数2]
%炭素収率=(39.1gイソプレン*1/68.1mol/g*5C/mol)/[(181221gグルコース*1/180mol/g*6C/mol)+(17780g酵母抽出物*0.5*1/12mol/g)]*100=0.042%
本明細書に記載の2例の500リットル発酵(実施例7、第VII部および第VIII部)では、炭素のイソプレンへの変換パーセントは、0.04〜0.06%であった。本明細書に記載の14リットルの系を用いて0.11〜0.16%の炭素収率が達成されている。実施例11、第V部には、本明細書に記載の方法を用いて、炭素の1.53%がイソプレンに変換されたことが記載されている。
当業者であれば、イソプレンの産出速度または産出されたイソプレンの量を任意の他の単位に容易に変換することができる。以下に、単位間で相互変換するための例示的な方程式を記載する。
イソプレン産出速度の単位(全体および比)
方程式3
[数3]
1gイソプレン/Lブロス/時間=14.7mmolイソプレン/Lブロス/時間(総容積速度)
方程式4
[数4]
1nmolイソプレン/gwcm/時間=1nmolイソプレン/Lブロス/時間/OD600(この変換は、OD600の値が1の1リットルのブロスに1グラムの湿細胞重量が含まれると仮定している。)
方程式5
[数5]
1nmol/gwcm/時間イソプレン=68.1ngイソプレン/gwcm/時間(イソプレンの分子量を所与とする)
方程式6
[数6]
1nmolイソプレン/LガスO2/時間=90nmolイソプレン/Lブロス/時間(培養ブロス1リットル当たりのO2流速が90L/時間のとき)
方程式7
[数7]
1μgイソプレン/オフガス中のLガスイソプレン=60μgイソプレン/Lブロス/時間 Lブロス当たりの流速が60Lガスのとき(1vvm)
力価の単位(全体および比)
方程式8
[数8]
1nmolイソプレン/mg細胞タンパク質=150nmolイソプレン/Lブロス/OD600(この変換は、OD600の値が1の1リットルのブロスに約150mgの総細胞タンパク質が含まれると仮定している)(比生産性)
方程式9
[数9]
1gイソプレン/Lブロス=14.7mmolイソプレン/Lブロス(総力価)
所望により、方程式10を用いて、細胞の湿重量を含む単位のいずれかを細胞の乾燥重量を含む対応する単位に変換することができる。
方程式10
[数10]
細胞の乾燥重量=(細胞の湿重量)/3.3
所望により、方程式11を用いて、単位ppmとμg/Lを変換することができる。特に、「ppm」は、μg/g(w/w)で定義される百万分率を意味する。ガスの濃度は、μL/L(vol/vol)で定義される「ppmv」(容積による百万分率)を用いて容積ベースで表すこともできる。オフガス1L当たりの質量(すなわち、ガスの密度)を測定することにより、μg/Lのppmへの変換(例えば、ガス1g当たりの分析物のμg)を行なうことができる。例えば、標準的な温度および圧力(STP;101.3kPa(1bar)および273.15K)の空気の1リットルは、約1.29g/Lの密度を有する。したがって、1ppm(μg/g)の濃度は、STPにおいて1.29μg/Lに等しい(方程式11)。ppm(μg/g)のμg/Lへの変換は、圧力と温度とオフガスの全組成の関数である。
方程式11
[数11]
1ppm(μg/g)=1.29μg/L(標準的な温度および圧力(STP;101.3kPa(1バール)および273.15K)において)
一般ガス法則(方程式12)を用いて、μg/Lのppmv(例えば、ガス1g当たりの分析物のμL)への変換を行なうことができる。例えば、1000μg/Lガスのオフガス濃度は、14.7μmol/Lガスに相当する。一般ガス定数は、0.082057L.atm K−1mol−1であるので、方程式12を用いると、STPにおいて14.7μmolのHGが占める容積は0.329mLに等しい。したがって、1000μg/LのHGの濃度は、STPにおいて329ppmvまたは0.0329%(v/v)に等しい。
方程式12
[数12]
PV=nRT、式中、「P」は圧力、「V」は容積、「n」はガスのモル数、「R」は一般ガス定数、「T」はケルビンで表される温度である。
イソプレン組成物中の不純物の量は、本明細書では通常、μg/Lなどの単位で表される重量/容積(w/v)ベースで測定される。所望により、μg/Lという単位の測定値を方程式13を用いてmg/m3という単位に変換することができる。
方程式13
[数13]
1μg/L=1mg/m3
本明細書に記載のいくつかの実施形態では、イソプレンシンターゼポリペプチドをコードする異種核酸を含む細胞は、イソプレンシンターゼポリペプチドをコードする異種核酸を含まない本質的に同じ条件下で増殖した対応する細胞から産出されるイソプレンの量よりも少なくともまたは約2倍、3倍、5倍、10倍、25倍、50倍、100倍、150倍、200倍、400倍、またはそれを上回る量のイソプレンを産出する。
本明細書に記載のいくつかの実施形態では、イソプレンシンターゼポリペプチドをコードする異種核酸とDXS、IDI、および/またはMVA経路ポリペプチドをコードする1以上の異種核酸とを含む細胞は、異種核酸を含まない本質的に同じ条件下で増殖した対応する細胞から産出されるイソプレンの量よりも少なくともまたは約2倍、3倍、5倍、10倍、25倍、50倍、100倍、150倍、200倍、400倍、またはそれを上回る量のイソプレンを産出する。
いくつかの実施形態では、イソプレン組成物は、組成物中の全てのC5炭化水素の総重量と比べて、99.90、99.92、99.94、99.96、99.98、もしくは100重量%またはそれらより多くのイソプレンを含む。いくつかの実施形態では、組成物は、組成物中の全てのC5炭化水素の検出器応答と比べて、99.90、99.91、99.92、99.93、99.94、99.95、99.96、99.97、99.98、99.99、もしくは100%またはそれらより多くのイソプレンの相対検出器応答を有する。いくつかの実施形態では、イソプレン組成物は、組成物中の全てのC5炭化水素の総重量と比べて、約99.90〜約99.92、約99.92〜約99.94、約99.94〜約99.96、約99.96〜約99.98、約99.98〜100重量%のイソプレンを含む。
いくつかの実施形態では、イソプレン組成物は、組成物中の全てのC5炭化水素の総重量と比べて、約0.12、0.10、0.08、0.06、0.04、0.02、0.01、0.005、0.001、0.0005、0.0001、0.00005、もしくは0.00001重量%またはそれら未満のイソプレン以外のC5炭化水素(例えば、1,3−シクロペンタジエン、cis−1,3−ペンタジエン、trans−1,3−ペンタジエン、1,4−ペンタジエン、1−ペンチン、2−ペンチン、1−ペンテン、2−メチル−1−ブテン、3−メチル−1−ブチン、ペント−4−エン−1−イン、trans−ペント−3−エン−1−イン、またはcis−ペント−3−エン−1−イン)を含む。いくつかの実施形態では、組成物は、組成物中の全てのC5炭化水素の検出器応答と比べて、0.12、0.10、0.08、0.06、0.04、0.02、0.01、0.005、0.001、0.0005、0.0001、0.00005、もしくは0.00001%またはそれら未満のイソプレン以外のC5炭化水素の相対検出器応答を有する。いくつかの実施形態では、組成物は、組成物中の全てのC5炭化水素の検出器応答と比べて、約0.12、0.10、0.08、0.06、0.04、0.02、0.01、0.005、0.001、0.0005、0.0001、0.00005、もしくは0.00001%またはそれら未満の1,3−シクロペンタジエン、cis−1,3−ペンタジエン、trans−1,3−ペンタジエン、1,4−ペンタジエン、1−ペンチン、2−ペンチン、1−ペンテン、2−メチル−1−ブテン、3−メチル−1−ブチン、ペント−4−エン−1−イン、trans−ペント−3−エン−1−イン、またはcis−ペント−3−エン−1−インの相対検出器応答を有する。いくつかの実施形態では、イソプレン組成物は、組成物中の全てのC5炭化水素の総重量と比べて、約0.02〜約0.04%、約0.04〜約0.06%、約0.06〜0.08%、約0.08〜0.10%、または約0.10〜約0.12重量%のイソプレン以外のC5炭化水素(例えば、1,3−シクロペンタジエン、cis−1,3−ペンタジエン、trans−1,3−ペンタジエン、1,4−ペンタジエン、1−ペンチン、2−ペンチン、1−ペンテン、2−メチル−1−ブテン、3−メチル−1−ブチン、ペント−4−エン−1−イン、trans−ペント−3−エン−1−イン、またはcis−ペント−3−エン−1−イン)を含む。
いくつかの実施形態では、イソプレン組成物は、イソプレンの重合を阻害する、組成物中の任意の化合物について、イソプレンの重合を阻害する約50、40、30、20、10、5、1、0.5、0.1、0.05、0.01、もしくは0.005μg/Lの化合物を含む。いくつかの実施形態では、イソプレン組成物は、イソプレンの重合を阻害する、組成物中の任意の化合物について、イソプレンの重合を阻害する約0.005〜約50、例えば、約0.01〜約10、約0.01〜約5、約0.01〜約1、約0.01〜約0.5、または約0.01〜約0.005μg/Lの化合物を含む。いくつかの実施形態では、イソプレン組成物は、約50、40、30、20、10、5、1、0.5、0.1、0.05、0.01、もしくは0.005μg/Lまたはそれら未満のイソプレン以外の炭化水素(例えば、1,3−シクロペンタジエン、cis−1,3−ペンタジエン、trans−1,3−ペンタジエン、1,4−ペンタジエン、1−ペンチン、2−ペンチン、1−ペンテン、2−メチル−1−ブテン、3−メチル−1−ブチン、ペント−4−エン−1−イン、trans−ペント−3−エン−1−イン、またはcis−ペント−3−エン−1−イン)を含む。いくつかの実施形態では、イソプレン組成物は、約0.005〜約50、例えば、約0.01〜約10、約0.01〜約5、約0.01〜約1、約0.01〜約0.5、または約0.01〜約0.005μg/Lのイソプレン以外の炭化水素を含む。いくつかの実施形態では、イソプレン組成物は、50、40、30、20、10、5、1、0.5、0.1、0.05、0.01、もしくは0.005μg/L未満または約50、40、30、20、10、5、1、0.5、0.1、0.05、0.01、もしくは0.005μg/Lのタンパク質または脂肪酸(例えば、天然ゴムと天然に合わされているタンパク質または脂肪酸)を含む。
いくつかの実施形態では、イソプレン組成物は、10、5、1、0.8、0.5、0.1、0.05、0.01、もしくは0.005ppm未満または約10、5、1、0.8、0.5、0.1、0.05、0.01、もしくは0.005ppmのα−アセチレン、ピペリレン、アセトニトリル、または1,3−シクロペンタジエンを含む。いくつかの実施形態では、イソプレン組成物は、約5、1、0.5、0.1、0.05、0.01、もしくは0.005ppmのまたはそれら未満の硫黄またはアレンを含む。いくつかの実施形態では、イソプレン組成物は、約30、20、15、10、5、1、0.5、0.1、0.05、0.01、もしくは0.005ppmまたはそれら未満の全アセチレン(例えば、1−ペンチン、2−ペンチン、3−メチル−1−ブチン、ペント−4−エン−1−イン、trans−ペント−3−エン−1−イン、およびcis−ペント−3−エン−1−イン)を含む。いくつかの実施形態では、イソプレン組成物は、約2000、1000、500、200、100、50、40、30、20、10、5、1、0.5、0.1、0.05、0.01、もしくは0.005ppmまたはそれら未満のイソプレン二量体、例えば、環状イソプレン二量体(例えば、2つのイソプレン単位の二量体化から得られる環状C10化合物)を含む。
いくつかの実施形態では、イソプレン組成物は、エタノール、アセトンC5プレニルアルコール(例えば、3−メチル−3−ブテン−1−オールもしくは3−メチル−2−ブテン−1−オール)、または前述のもののいずれか2つ以上を含む。特定の実施形態では、イソプレン組成物は、約0.005、0.01、0.05、0.1、0.5、1、5、10、20、30、40、60、80、100、もしくは120μg/Lまたはそれらより多くのエタノール、アセトン、C5プレニルアルコール(例えば、3−メチル−3−ブテン−1−オールもしくは3−メチル−2−ブテン−1−オール)、または前述のもののいずれか2つ以上を含む。いくつかの実施形態では、イソプレン組成物は、約0.005〜約120、例えば、約0.01〜約80、約0.01〜約60、約0.01〜約40、約0.01〜約30、約0.01〜約20、約0.01〜約10、約0.1〜約80、約0.1〜約60、約0.1〜約40、約5〜約80、約5〜約60、または約5〜約40μg/Lのエタノール、アセトン、C5プレニルアルコール、または前述のもののいずれか2つ以上を含む。
いくつかの実施形態では、イソプレン組成物は、以下の成分:2−ヘプタノン、6−メチル−5−ヘプテン−2−オン、2,4,5−トリメチルピリジン、2,3,5−トリメチルピラジン、シトロネラル、アセトアルデヒド、メタンチオール、メチルアセタート、1−プロパノール、ジアセチル、2−ブタノン、2−メチル−3−ブテン−2−オール、エチルアセタート、2−メチル−1−プロパノール、3−メチル−1ブタナール、3−メチル−2−ブタノン、1−ブタノール、2−ペンタノン、3−メチル−1−ブタノール、エチルイソブチレート、3−メチル−2−ブテナール、ブチルアセタート、3−メチルブチルアセタート、3−メチル−3−ブテン−1−イルアセタート、3−メチル−2−ブテン−1−イルアセタート、3−ヘキセン−1−オール、3−ヘキセン−1−イルアセタート、リモネン、ゲラニオール(trans−3,7−ジメチル−2,6−オクタジエン−1−オール)、シトロネロール(3,7−ジメチル−6−オクテン−1−オール)、(E)−3,7−ジメチル−1,3,6−オクタトリエン、(Z)−3,7−ジメチル−1,3,6−オクタトリエン、2,3−シクロヘプテノルピリジン、または線状イソプレンポリマー(例えば、複数のイソプレン単位の重合から得られる線状イソプレン二量体もしくは線状イソプレン三量体)のうちの1以上を含む。
いくつかの実施形態では、イソプレン組成物は、以下のもの:アルコール、アルデヒド、またはケトン(例えば、本明細書に記載のアルコール、アルデヒド、またはケトンのいずれか)のうちの1以上を含む。いくつかの実施形態では、イソプレン組成物は、(i)アルコールとアルデヒド、(ii)アルコールとケトン、(iii)アルデヒドとケトン、または(iv)アルコールとアルデヒドとケトンを含む。
いくつかの実施形態では、イソプレン組成物は、以下のもの:メタノール、アセトアルデヒド、エタノール、メタンチオール、1−ブタノール、3−メチル−1−プロパノール、アセトン、酢酸、2−ブタノン、2−メチル−1−ブタノール、またはインドールのうちの1以上を含有する。いくつかの実施形態では、イソプレン組成物は、1ppmまたはそれより多くの以下のうちの1以上を含有する:メタノール、アセトアルデヒド、エタノール、メタンチオール、1−ブタノール、3−メチル−1−プロパノール、アセトン、酢酸、2−ブタノン、2−メチル−1−ブタノール、またはインドール。いくつかの実施形態では、以下のもの:メタノール、アセトアルデヒド、エタノール、メタンチオール、1−ブタノール、3−メチル−1−プロパノール、アセトン、酢酸、2−ブタノン、2−メチル−1−ブタノール、またはインドールのうちの1以上よりも多くの濃度は、イソプレン組成物中(例えば、精製される前のオフガス)約1〜約10,000ppmである。いくつかの実施形態では、イソプレン組成物(例えば、1以上の精製工程を経た後のオフガス)は、以下のもの:メタノール、アセトアルデヒド、エタノール、メタンチオール、1−ブタノール、3−メチル−1−プロパノール、アセトン、酢酸、2−ブタノン、2−メチル−1−ブタノール、またはインドールのうちの1以上を、約1〜約100ppm、例えば、約1〜約10ppm、約10〜約20ppm、約20〜約30ppm、約30〜約40ppm、約40〜約50ppm、約50〜約60ppm、約60〜約70ppm、約70〜約80ppm、約80〜約90ppm、または約90〜約100ppmの濃度で含む。細胞培養物由来の揮発性有機化合物(例えば、細胞培養物のヘッドスペース中の揮発性有機化合物)を、本明細書に記載した方法などの標準的な方法またはプロトン転移反応−マススペクトロメトリーなどの他の標準的な方法を用いて分析することができる(例えば、Bunge et al.,Applied and Environmental Microbiology,74(7):2179−2186,2008を参照されたく、これは、特に、揮発性有機化合物の分析に関して、その全体が参照により本明細書に組み込まれる)。
いくつかの実施形態では、組成物は、約2mg超のイソプレン、例えば、約5、10、20、30、40、50、60、70、80、90、100、200、300、400、500、600、700、800、900、もしくは1000mgまたはそれらより多くのイソプレンを含む。いくつかの実施形態では、組成物は、約2、5、10、20、30、40、50、60、70、80、90、100gまたはそれらより多くのイソプレンを含む。いくつかの実施形態では、組成物中のイソプレンの量は、約2〜約5,000mg、例えば、約2〜約100mg、約100〜約500mg、約500〜約1,000mg、約1,000〜約2,000mg、または約2,000〜約5,000mgである。いくつかの実施形態では、組成物中のイソプレンの量は、約20〜約5,000mg、約100〜約5,000mg、約200〜約2,000mg、約200〜約1,000mg、約300〜約1,000mg、または約400〜約1,000mgである。いくつかの実施形態では、組成物の揮発性有機画分の約20、25、30、40、50、60、70、80、90、もしくは95重量%またはそれらより多くがイソプレンである。
いくつかの実施形態では、組成物はエタノールを含む。いくつかの実施形態では、組成物は、約75〜約90重量%のエタノール、例えば、約75〜約80%、約80〜約85%、または約85〜約90重量%のエタノールを含む。組成物がエタノールを含むいくつかの実施形態では、組成物は、約4〜約15重量%のイソプレン、例えば、約4〜約8%、約8〜約12%、または約12〜約15重量%のイソプレンも含む。
本明細書に記載のいくつかの実施形態では、イソプレンシンターゼポリペプチド、DXSポリペプチド、IDIポリペプチド、および/またはMVA経路ポリペプチドをコードする1以上の異種核酸を含む細胞は、1以上の異種核酸を含まない本質的に同じ条件下で増殖した対応する細胞から産出されるイソプレノイド化合物の量よりも約2倍、3倍、5倍、10倍、25倍、50倍、100倍、150倍、200倍、400倍、もしくはそれより多くの量のイソプレノイド化合物(例えば、1以上のIPP分子と1以上のDMAPP分子との反応から形成される10個またはそれより多くの炭素原子を含む化合物)を産出する。本明細書に記載のいくつかの実施形態では、イソプレンシンターゼポリペプチド、DXSポリペプチド、IDIポリペプチド、および/またはMVA経路ポリペプチドをコードする1以上の異種核酸を含む細胞は、1以上の異種核酸を含まない本質的に同じ条件下で増殖した対応する細胞から産出されるC5プレニルアルコールの量よりも約2倍、3倍、5倍、10倍、25倍、50倍、100倍、150倍、200倍、400倍、もしくはそれより多くの量のC5プレニルアルコール(例えば、3−メチル−3−ブテン−1−オールまたは3−メチル−2−ブテン−1−オール)を産出する。
Bioisopreneと水素の例示的な共産出
いくつかの実施形態では、プロモーターに機能的に連結された、イソプレンシンターゼポリペプチド、DXSポリペプチド、IDIポリペプチド、および/またはMVA経路ポリペプチドをコードする1以上の異種核酸を含む本明細書に記載のイソプレン産出細胞はいずれも、1以上のヒドロゲナーゼポリペプチドまたはヒドロゲナーゼポリペプチドの調節または発現に関与する1以上のポリペプチド(例えば、ヒドロゲナーゼ成熟タンパク質または転写因子)をコードし、プロモーターに機能的に連結された異種核酸をさらに含む。いくつかの実施形態では、プロモーターに機能的に連結された、イソプレンシンターゼポリペプチド、DXSポリペプチド、IDIポリペプチド、MVA経路ポリペプチド、1以上のヒドロゲナーゼポリペプチドまたはヒドロゲナーゼポリペプチドの調節または発現に関与する1以上のポリペプチドをコードする1以上の異種核酸を含む本明細書に記載のイソプレン産出細胞はいずれも、発酵副産物の産出に関与する1以上のポリペプチド、発酵副産物の産出に関する遺伝子の調節または発現に関与する1以上のポリペプチド、または水素再取込みに関与する1以上のポリペプチドを不活化する突然変異または欠失をさらに含む。このような細胞は、イソプレンと水素を共産出することができる。
本明細書に記載の態様のいずれかのいくつかの実施形態では、細胞は、グラム陽性細菌細胞(例えば、枯草菌細胞などのバシルス細胞またはストレプトミセス・リビダンス(Streptomyces lividans)、ストレプトミセス・コエリコロル(Streptomyces coelicolor)、もしくはストレプトミセス・グリセウス(Streptomyces griseus)細胞などのストレプトミセス細胞)などの細菌細胞である。本明細書に記載の態様のいずれかのいくつかの実施形態では、細胞は、グラム陰性細菌細胞(例えば、大腸菌細胞などのエシェリキア細胞、ロドシュードモナス・パルストリス細胞などのロドシュードモナス種、シュードモナス・フルオレセンス細胞またはシュードモナス・プチダ細胞などのシュードモナス種、またはパントエア・シトレア細胞などのパントエア細胞)である。本明細書に記載の態様のいずれかのいくつかの実施形態では、細胞は、糸状真菌細胞(例えば、トリコデルマ・リーゼイ細胞などのトリコデルマ細胞もしくはアスペルギルス・オリザエおよびアスペルギルス・ニゲルなどのアスペルギルス細胞)または酵母細胞(例えば、ヤロウイア・リポリティカ細胞などのヤロウイア細胞または出芽酵母などのサッカロミセス細胞)などの真菌細胞である。
本明細書に記載の態様のいずれかのいくつかの実施形態では、イソプレンシンターゼポリペプチドは、クズ属(例えば、タイワンクズもしくはクズ)またはポプラ属(例えば、アメリカヤマナラシ、ウラジロハコヤナギ、クロヤマナラシ、ブラックコットンウッド、もしくは交配種であるウラジロハコヤナギ×ヨーロッパヤマナラシ)植物由来のポリペプチドである。
本明細書に記載の態様のいずれかのいくつかの実施形態では、細胞はさらに、IDIポリペプチドをコードする異種核酸を含む。本明細書に記載の態様のいずれかのいくつかの実施形態では、細胞はさらに、IDIポリペプチドをコードする1コピーの内在性核酸の挿入を含む。本明細書に記載の態様のいずれかのいくつかの実施形態では、細胞はさらに、DXSポリペプチドをコードする異種核酸を含む。本明細書に記載の態様のいずれかのいくつかの実施形態では、細胞はさらに、DXSポリペプチドをコードする1コピーの内在性核酸の挿入を含む。本明細書に記載の態様のいずれかのいくつかの実施形態では、細胞はさらに、IDIポリペプチドとDXSポリペプチドをコードする1以上の核酸を含む。本明細書に記載の態様のいずれかのいくつかの実施形態では、1つの核酸が、イソプレンシンターゼポリペプチドとIDIポリペプチドとDXSポリペプチドをコードする。本明細書に記載の態様のいずれかのいくつかの実施形態では、1つのベクターが、イソプレンシンターゼポリペプチドとIDIポリペプチドとDXSポリペプチドをコードする。いくつかの実施形態では、ベクターは、選択マーカーまたは選択可能マーカー(例えば、抗生物質耐性核酸)を含む。
本明細書に記載の態様のいずれかのいくつかの実施形態では、細胞はさらに、MVA経路ポリペプチド(例えば、出芽酵母またはエンテロコックス・フェカーリス由来のMVA経路ポリペプチド)をコードする異種核酸を含む。本明細書に記載の態様のいずれかのいくつかの実施形態では、細胞はさらに、MVA経路ポリペプチド(例えば、出芽酵母またはエンテロコックス・フェカーリス由来のMVA経路ポリペプチド)をコードする1コピーの内在性核酸の挿入を含む。本明細書に記載の態様のいずれかのいくつかの実施形態では、細胞は、イソプレンシンターゼ、DXS、およびMVA経路核酸を含む。本明細書に記載の態様のいずれかのいくつかの実施形態では、細胞は、イソプレンシンターゼ核酸、DXS核酸、IDI核酸、およびMVA経路核酸を含む。
いくつかの実施形態では、本明細書に記載のイソプレン産出細胞はさらに、プロモーターに機能的に連結された、ヒドロゲナーゼポリペプチドをコードする異種核酸を含む。いくつかの実施形態では、ヒドロゲナーゼポリペプチドは、大腸菌ヒドロゲナーゼ−1(Hyd−1)、大腸菌ヒドロゲナーゼ−2(Hyd−2)、大腸菌ヒドロゲナーゼ−3(Hyd−3)、大腸菌ヒドロゲナーゼ−4(Hyd−4)、大腸菌ギ酸水素リアーゼ(FHL)複合体(これは、酸性pH、嫌気性条件下で、ギ酸とCO2から水素ガスを産出させる)、ロドコックス・オパクスMR11ヒドロゲナーゼ(R.オパクス HoxH)、シネコシスティス属PCC 6803ヒドロゲナーゼ(Syn.PCC 6803 HoxH)、デスルフォビブリオ・ギガスヒドロゲナーゼ(D.ギガス)、およびデスルホビブリオ・デスルフリカンスATCC 7757ヒドロゲナーゼ(D.デスルフリカンス)を含む。いくつかの実施形態では、プロモーターに機能的に連結されたヒドロゲナーゼポリペプチドをコードする異種核酸をさらに含むイソプレン産出細胞はさらに、大腸菌ヒドロゲナーゼ−3(Hyd−3)、大腸菌ピルビン酸ギ酸リアーゼ(pfl)、および大腸菌ギ酸水素リアーゼ(FHL)複合体を含む。
いくつかの実施形態では、ヒドロゲナーゼポリペプチドは、フェレドキシン依存的ヒドロゲナーゼポリペプチドをコードする。いくつかの実施形態では、フェレドキシン依存的ヒドロゲナーゼポリペプチドは、クロストリジウム・アセトブツリクムヒドロゲナーゼA(HydA)を含み、これは、以下のもの:(1)枯草菌NADPHフェレドキシンオキシドレダクターゼ(NFOR)もしくはクロストリジウム・クルイベリNADHフェレドキシンオキシドレダクターゼ(RnfCDGEAB)、クロストリジウム・パスツラニヌムフェレドキシンオキシドレダクターゼ(Fdx);(2)グリセルアルデヒド−6−リン酸フェレドキシンオキシドレダクターゼ(GAPOR);または(3)ピルビン酸フェレドキシンオキシドレダクターゼ(POR)のうちの1以上とともに発現させることができる。いくつかの実施形態では、フェレドキシン依存的ヒドロゲナーゼポリペプチドクロストリジウム・アセトブツリクムヒドロゲナーゼA(HydA)を3つのHydA関連成熟酵素(HydE、HydGおよびHydF)とともに、またさらに以下のもの:(1)枯草菌NADPHフェレドキシンオキシドレダクターゼ(NFOR)もしくはクロストリジウム・クルイベリNADHフェレドキシンオキシドレダクターゼ(RnfCDGEAB)、クロストリジウム・パスツラニヌムフェレドキシンオキシドレダクターゼ(Fdx);(2)グリセルアルデヒド−6−リン酸フェレドキシンオキシドレダクターゼ(GAPOR);または(3)ピルビン酸フェレドキシンオキシドレダクターゼ(POR)のうちの1以上とともに発現させる。
いくつかの実施形態では、ヒドロゲナーゼポリペプチドは、NADPH依存的ヒドロゲナーゼポリペプチドをコードする。いくつかの実施形態では、NADPH依存的ヒドロゲナーゼポリペプチドは、ピロコックス・フリオススヒドロゲナーゼを含む。いくつかの実施形態では、ヒドロゲナーゼポリペプチドは、酸素耐性ヒドロゲナーゼをコードする。いくつかの実施形態では、酸素耐性ヒドロゲナーゼは、ルブリビバクス・ゲラチノーススヒドロゲナーゼ、およびラルストニア・ユートロファヒドロゲナーゼを含む。
いくつかの実施形態では、本明細書に記載のイソプレン産出細胞はさらに、鉄−硫黄錯体転写調節因子(iscR)などの、ヒドロゲナーゼ活性の調節に関与する遺伝子を不活化する突然変異または欠失を含む(Kalim−Akhtar et al.,“Deletion of iscR stimulates recombinant Clostridial Fe/Fe hydrogenase activity and H2−accumulation in Escherichia coli BL21(DE3),” Appl.Microbiol.Biotechnol.78:853−862(2008)、これは、特に、iscR遺伝子を欠失させることによるクロストリジウムFe/Feヒドロゲナーゼ活性の刺激および大腸菌における水素蓄積に関して、その全体が参照により本明細書に組み込まれる)。
いくつかの実施形態では、本明細書に記載のイソプレン産出細胞はさらに、乳酸、酢酸、ピルビン酸、エタノール、コハク酸、およびグリセロールなどの発酵副産物の産出に関与する1以上の細胞ポリペプチドをコードする遺伝子を不活化する突然変異または欠失を含む。いくつかの実施形態では、発酵副産物の産出に関与する不活化ポリペプチドは、ギ酸デヒドロゲナーゼN、αサブユニット(fdnG)、ギ酸デヒドロゲナーゼO、大サブユニット(fdoG)、硝酸レダクターゼ(narG)、ギ酸輸送体A(focA)、ギ酸輸送体B(focB)、ピルビン酸オキシダーゼ(poxB)、ピルビン酸デヒドロゲナーゼE1成分ackA/pta(aceE)、アルコールデヒドロゲナーゼ(adhE)、フマル酸レダクターゼ膜タンパク質(frdC)、または乳酸デヒドロゲナーゼ(ldhA)をコードする1以上のポリペプチドを含む。
いくつかの実施形態では、本明細書に記載のイソプレン産出細胞はさらに、発酵副産物の産出に関与する遺伝子の調節または発現に関与する1以上の細胞ポリペプチドをコードする遺伝子を不活化する突然変異または欠失を含む。いくつかの実施形態では、発酵副産物の産出に関与する遺伝子の調節または発現に関与する不活化ポリペプチドは、ギ酸水素リアーゼ(hycA)、フマル酸レダクターゼ調節因子(fnr)、アセチル−補酵素Aシンセターゼ(acs)、およびギ酸デヒドロゲナーゼ調節タンパク質(hycA)の抑制因子を含む。
いくつかの実施形態では、本明細書に記載のイソプレン産出細胞はさらに、水素再取込みに関与する1以上の細胞ポリペプチドをコードする遺伝子を不活化する突然変異または欠失を含む。いくつかの実施形態では、水素再取込みに関与する不活化ポリペプチドは、大腸菌ヒドロゲナーゼ−1(Hyd−1)(hyaオペロン)および大腸菌ヒドロゲナーゼ−2(Hyd−2)(hybオペロン)を含む。
本明細書に記載の態様のいずれかのいくつかの実施形態では、異種イソプレンシンターゼ、DXSポリペプチド、IDIポリペプチド、MVA経路、ヒドロゲナーゼ、ヒドロゲナーゼ成熟因子またはヒドロゲナーゼ転写因子のポリペプチドまたは核酸は、T7プロモーター(例えば、中または高コピープラスミドに含まれるT7プロモーター)に機能的に連結されている。本明細書に記載の態様のいずれかのいくつかの実施形態では、異種イソプレンシンターゼ、DXSポリペプチド、IDIポリペプチド、MVA経路、ヒドロゲナーゼ、ヒドロゲナーゼ成熟因子またはヒドロゲナーゼ転写因子の核酸は、Trcプロモーター(例えば、中または高コピープラスミドに含まれるTrcプロモーター)に機能的に連結されている。本明細書に記載の態様のいずれかのいくつかの実施形態では、異種イソプレンシンターゼ、DXSポリペプチド、IDIポリペプチド、MVA経路、ヒドロゲナーゼ、ヒドロゲナーゼ成熟因子またはヒドロゲナーゼ転写因子の核酸は、Lacプロモーター(例えば、低コピープラスミドに含まれるLacプロモーター)に機能的に連結されている。本明細書に記載の態様のいずれかのいくつかの実施形態では、異種イソプレンシンターゼ、DXSポリペプチド、IDIポリペプチド、MVA経路、ヒドロゲナーゼ、ヒドロゲナーゼ成熟因子またはヒドロゲナーゼ転写因子の核酸は、内在性プロモーター(例えば、内在性アルカリ性セリンプロテアーゼプロモーター)に機能的に連結されている。いくつかの実施形態では、異種イソプレンシンターゼ、DXSポリペプチド、IDIポリペプチド、MVA経路、ヒドロゲナーゼ、ヒドロゲナーゼ成熟因子またはヒドロゲナーゼ転写因子の核酸は、選択マーカーを伴わずにまたは選択可能マーカーを伴わずに、細胞のゲノムに組み込まれる。
いくつかの実施形態では、1以上のMVA経路、IDI、DXS、イソプレンシンターゼ、ヒドロゲナーゼ、ヒドロゲナーゼ成熟因子またはヒドロゲナーゼ転写因子の核酸は、増殖期よりも定常期に活性の高いプロモーターまたは因子の制御下に置かれている。例えば、1以上のMVA経路、IDI、DXS、イソプレンシンターゼ、ヒドロゲナーゼ、ヒドロゲナーゼ成熟因子またはヒドロゲナーゼ転写因子の核酸は、定常期σ因子(例えば、RpoS)の制御下に置かれていてもよい。いくつかの実施形態では、1以上のMVA経路、IDI、DXS、イソプレンシンターゼ、ヒドロゲナーゼ、ヒドロゲナーゼ成熟因子またはヒドロゲナーゼ転写因子の核酸は、定常期に誘導可能なプロモーター(例えば、定常期に活性のある応答調節因子によって誘導可能なプロモーター)の制御下に置かれている。
本明細書に記載の態様のいずれかのいくつかの実施形態では、細胞の少なくとも一部は、連続培養(例えば、希釈しない連続培養)において少なくともまたは約5、10、20、40、50、60、65回、またはそれより多くの細胞分裂の間、異種イソプレンシンターゼ、DXSポリペプチド、IDIポリペプチド、MVA経路、ヒドロゲナーゼ、ヒドロゲナーゼ成熟因子またはヒドロゲナーゼ転写因子の核酸を維持する。本明細書に記載の態様のいずれかのいくつかの実施形態では、イソプレンシンターゼ、DXSポリペプチド、IDIポリペプチド、MVA経路、ヒドロゲナーゼ、ヒドロゲナーゼ成熟因子またはヒドロゲナーゼ転写因子の核酸異種イソプレンシンターゼ、DXSポリペプチド、IDIポリペプチド、MVA経路、エタノール発酵関連および/または転写因子核酸を含む核酸はまた、選択マーカーまたは選択可能マーカー(例えば、抗生物質耐性核酸)を含む。
本明細書に記載の態様のいずれかのいくつかの実施形態では、イソプレンと水素を共産出する細胞を、細胞によるイソプレンと水素の共産出を促進する酸素制限条件下で、本明細書に記載の培養培地のいずれかにおいて培養する。いくつかの実施形態では、細胞を酸素制限培養で増殖させる。いくつかの実施形態では、細胞を、イソプレン1モル当たり0.5モルの酸素の存在下で増殖させる。いくつかの実施形態では、細胞を、酸素の不在下で、嫌気的に増殖させる。
いくつかの実施形態では、本明細書に記載の細胞はいずれも酸素制限培養で増殖し、イソプレンと水素を共産出する。いくつかの実施形態では、酸素制限培養された細胞は、約400nmole/gwcm/時間を上回る速度でイソプレンを産出し、約125nmole/gwcm/時間を上回る速度で水素を産出する。いくつかの実施形態では、酸素制限培養された細胞は、約400nmole/gwcm/時間〜約2.0×105nmole/gwcm/時間の速度でイソプレンを産出し、約125nmole/gwcm/時間〜約1.25×104nmole/gwcm/時間の速度で水素を産出する。いくつかの実施形態では、酸素制限培養された細胞は、約400nmole/gwcm/時間〜約2.0×105nmole/gwcm/時間、約500nmole/gwcm/時間〜約1.5×105nmole/gwcm/時間、約750nmole/gwcm/時間〜約1×105nmole/gwcm/時間、約1000nmole/gwcm/時間〜約1×105nmole/gwcm/時間、約2500nmole/gwcm/時間〜約1×105nmole/gwcm/時間、約5000nmole/gwcm/時間〜約1×105nmole/gwcm/時間、約7500nmole/gwcm/時間〜約1×105nmole/gwcm/時間、および約1×104nmole/gwcm/時間〜約1×105nmole/gwcm/時間の速度でイソプレンを産出する。いくつかの実施形態では、酸素制限培養された細胞は、約400、500、600、700、800、900、1,000、1,250、1,500、1,750、2,000、2,500、3,000、4,000、5,000nmole/gwcm/時間、またはそれより多くを超えるイソプレンを産出する。いくつかの実施形態では、酸素制限培養された細胞は、約125nmole/gwcm/時間〜約1.25×104nmole/gwcm/時間、約250nmole/gwcm/時間〜約1.25×104nmole/gwcm/時間、約500nmole/gwcm/時間〜約1.25×104nmole/gwcm/時間、約750nmole/gwcm/時間〜約1.25×104nmole/gwcm/時間、約1000nmole/gwcm/時間〜約1.25×104nmole/gwcm/時間、約1250nmole/gwcm/時間〜約1.25×104nmole/gwcm/時間、約2500nmole/gwcm/時間〜約1.25×104nmole/gwcm/時間、約5000nmole/gwcm/時間〜約1.25×104nmole/gwcm/時間、約7500nmole/gwcm/時間〜約1.25×104nmole/gwcm/時間、および約1.00×104nmole/gwcm/時間〜約1.25×104nmole/gwcm/時間の速度で水素を産出する。いくつかの実施形態では、酸素制限培養された細胞は、約125、250、500、750、1000、1,250、1,500、1,750、2,000、2,500、3,000、4,000、5,000、7,500、10,000nmole/gwcm/時間、またはそれより多くを超える水素を産出する。
いくつかの実施形態では、本明細書に記載の細胞はいずれも酸素制限培養で増殖し、イソプレンと水素を共産出する。いくつかの実施形態では、酸素制限培養された細胞は、約0.1mg/Lブロス/時間を上回るイソプレンの平均容積生産性と、約0.005mg/Lブロス/時間を上回る水素の平均容積生産性とを有する。いくつかの実施形態では、酸素制限培養された細胞は、約1000mg/Lブロス/時間を上回るイソプレンのピーク容積生産性と、約5mg/Lブロス/時間を上回る水素のピーク容積生産性とを有する。いくつかの実施形態では、酸素制限培養された細胞は、約3000mg/Lブロス/時間を上回るイソプレンのピーク容積生産性と、約5mg/Lブロス/時間を上回る水素のピーク容積生産性とを有する。いくつかの実施形態では、酸素制限培養された細胞は、約5000mg/Lブロス/時間を上回るイソプレンのピーク容積生産性と、約5mg/Lブロス/時間を上回る水素のピーク容積生産性とを有する。いくつかの実施形態では、酸素制限培養された細胞は、約0.1mg/Lブロス/時間〜約5000mg/Lブロス/時間のイソプレンの平均容積生産性と、約0.005mg/Lブロス/時間〜約5mg/Lブロス/時間の水素の平均容積生産性とを有する。いくつかの実施形態では、酸素制限培養された細胞は、約1mg/Lブロス/時間〜約5000mg/Lブロス/時間、約5mg/Lブロス/時間〜約5000mg/Lブロス/時間、約10mg/Lブロス/時間〜約5000mg/Lブロス/時間、約25mg/Lブロス/時間〜約5000mg/Lブロス/時間、約50mg/Lブロス/時間〜約5000mg/Lブロス/時間、約100mg/Lブロス/時間〜約5000mg/Lブロス/時間、約250mg/Lブロス/時間〜約5000mg/Lブロス/時間、約500mg/Lブロス/時間〜約5000mg/Lブロス/時間、約1000mg/Lブロス/時間〜約5000mg/Lブロス/時間、および約2500mg/Lブロス/時間〜約5000mg/Lブロス/時間のイソプレンの平均容積生産性と、約0.01mg/Lブロス/時間〜約5mg/Lブロス/時間、約0.025mg/Lブロス/時間〜約5mg/Lブロス/時間、約0.05mg/Lブロス/時間〜約5mg/Lブロス/時間、約0.1mg/Lブロス/時間〜約5mg/Lブロス/時間、約0.25mg/Lブロス/時間〜約5mg/Lブロス/時間、約0.5mg/Lブロス/時間〜約5mg/Lブロス/時間、約1mg/Lブロス/時間〜約5mg/Lブロス/時間、および約2.5mg/Lブロス/時間〜約5mg/Lブロス/時間の水素の平均容積生産性とを有する。
いくつかの実施形態では、本明細書に記載の細胞はいずれも酸素制限培養で増殖し、イソプレンと水素を共産出する。いくつかの実施形態では、酸素制限培養された細胞は、細胞が細胞培養培地から消費する炭素の約0.002モルパーセント超をイソプレンに変換し、細胞が細胞培養培地から消費する炭素の約0.024モルパーセント超に等しい水素を産出する。いくつかの実施形態では、酸素制限培養された細胞は、細胞が細胞培養培地から消費する炭素の約0.002モルパーセント超をイソプレンに変換し、細胞が細胞培養培地から消費する炭素の約400モルパーセント超に等しい水素を産出する。
いくつかの実施形態では、イソプレンと水素を共産出する本明細書に記載の細胞をいずれかを酸素制限培養で増殖させる。いくつかの実施形態では、酸素制限培養された細胞は、水素3モルパーセントごとに少なくとも1モルパーセントのイソプレンから水素4モルパーセントごとに少なくとも1モルパーセントのイソプレンの比率でイソプレンと水素を共産出する。いくつかの実施形態では、酸素制限培養された細胞は、1〜11モルパーセントのイソプレンと、3〜33モルパーセントの水素とを産出する。いくつかの実施形態では、細胞は、1〜11モルパーセントのイソプレンと、4〜44モルパーセントの水素とを産出する。いくつかの実施形態では、酸素制限培養された細胞は、酸素、二酸化炭素、または窒素も産出する。いくつかの実施形態では、酸素制限培養された細胞は、0〜21モルパーセントの酸素と、18〜44モルパーセントの二酸化炭素と、0〜78モルパーセントの窒素とを産出する。
別の態様では、イソプレンと水素を共産出する酸素制限培養された細胞であって、イソプレンシンターゼポリペプチドをコードする異種核酸を含む細胞を本明細書で提供し、ここで、細胞は、(i)約400nmole/gwcm/時間を上回る速度でイソプレンを産出し、約125nmole/gwcm/時間を上回る速度で水素を産出するか、(ii)約0.1mg/Lブロス/時間を上回るイソプレンの平均容積生産性と、約0.005mg/Lブロス/時間を上回る水素の平均容積生産性とを有するか、または(iii)細胞が細胞培養培地から消費する炭素の約0.002モルパーセント超をイソプレンに変換し、細胞が細胞培養培地から消費する炭素の約0.024モルパーセント超に等しい水素を産出する。いくつかの実施形態では、細胞は、酸素制限条件下でイソプレンと水素を共産出することができる。
いくつかの実施形態では、酸素制限培養された細胞は、イソプレンシンターゼポリペプチドをコードする異種核酸を含み、ここで、この異種核酸はプロモーターに機能的に連結されており、この細胞は、約400nmole/gwcm/時間を上回るイソプレンと、約125nmole/gwcm/時間を上回る水素とを産出する。いくつかの実施形態では、酸素制限培養された細胞は、イソプレンシンターゼポリペプチドをコードする異種核酸を含み、ここで、この異種核酸はプロモーターに機能的に連結されており、この細胞は、約0.1mg/Lブロス/時間を上回るイソプレンの平均容積生産性と、約0.005mg/Lブロス/時間を上回る水素の平均容積生産性とを有する。いくつかの実施形態では、酸素制限培養された細胞は、イソプレンシンターゼポリペプチドをコードする異種核酸を含み、ここで、この異種核酸はプロモーターに機能的に連結されており、この細胞は、細胞が細胞培養培地から消費する炭素の約0.002モルパーセント超をイソプレンに、細胞が細胞培養培地から消費する炭素の約0.024モルパーセント超を水素に変換する。いくつかの実施形態では、イソプレンシンターゼポリペプチドは、植物イソプレンシンターゼポリペプチドである。
いくつかの実施形態では、イソプレンシンターゼポリペプチドをコードする異種核酸を含む酸素制限培養された細胞は、約400nmole/gwcm/時間〜約2.0×105nmole/gwcm/時間、約500nmole/gwcm/時間〜約1.5×105nmole/gwcm/時間、約750nmole/gwcm/時間〜約1×105nmole/gwcm/時間、約1000nmole/gwcm/時間〜約1×105nmole/gwcm/時間、約2500nmole/gwcm/時間〜約1×105nmole/gwcm/時間、約5000nmole/gwcm/時間〜約1×105nmole/gwcm/時間、約7500nmole/gwcm/時間〜約1×105nmole/gwcm/時間、および 約1×104nmole/gwcm/時間〜約1×105nmole/gwcm/時間の速度でイソプレンを産出し、約125nmole/gwcm/時間〜約1.25×104nmole/gwcm/時間、約250nmole/gwcm/時間〜約1.25×104nmole/gwcm/時間、約500nmole/gwcm/時間〜約1.25×104nmole/gwcm/時間、約750nmole/gwcm/時間〜約1.25×104nmole/gwcm/時間、約1000nmole/gwcm/時間〜約1.25×104nmole/gwcm/時間、約1250nmole/gwcm/時間〜約1.25×104nmole/gwcm/時間、約2500nmole/gwcm/時間〜約1.25×104nmole/gwcm/時間、約5000nmole/gwcm/時間〜約1.25×104nmole/gwcm/時間、約7500nmole/gwcm/時間〜約1.25×104nmole/gwcm/時間、および 約1.00×104nmole/gwcm/時間〜約1.25×104nmole/gwcm/時間の速度で水素を産出する。
いくつかの実施形態では、イソプレンと水素を共産出する方法であって、(a)イソプレンと水素の共産出に好適な条件下で細胞を培養することと、(b)イソプレンと水素を共産出することとを含む、方法が本明細書で提供され、ここで、この細胞は、約400nmole/gwcm/時間を上回るイソプレンを産出し、細胞は、約125nmole/gwcm/時間を上回る水素を産出する。いくつかの実施形態では、細胞を酸素制限培養で増殖させる。
いくつかの実施形態では、イソプレンシンターゼポリペプチドをコードする異種核酸を含む酸素制限培養された細胞は、約400nmole/gwcm/時間〜約2.0×105nmole/gwcm/時間、約500nmole/gwcm/時間〜約1.5×105nmole/gwcm/時間、約750nmole/gwcm/時間〜約1×105nmole/gwcm/時間、約1000nmole/gwcm/時間〜約1×105nmole/gwcm/時間、約2500nmole/gwcm/時間〜約1×105nmole/gwcm/時間、約5000nmole/gwcm/時間〜約1×105nmole/gwcm/時間、約7500nmole/gwcm/時間〜約1×105nmole/gwcm/時間、および約1×104nmole/gwcm/時間〜約1×105nmole/gwcm/時間の速度でイソプレンを産出し、約125nmole/gwcm/時間〜約1.25×104nmole/gwcm/時間、約250nmole/gwcm/時間〜約1.25×104nmole/gwcm/時間、約500nmole/gwcm/時間〜約1.25×104nmole/gwcm/時間、約750nmole/gwcm/時間〜約1.25×104nmole/gwcm/時間、約1000nmole/gwcm/時間〜約1.25×104nmole/gwcm/時間、約1250nmole/gwcm/時間〜約1.25×104nmole/gwcm/時間、約2500nmole/gwcm/時間〜約1.25×104nmole/gwcm/時間、約5000nmole/gwcm/時間〜約1.25×104nmole/gwcm/時間、約7500nmole/gwcm/時間〜約1.25×104nmole/gwcm/時間、および約1.00×104nmole/gwcm/時間〜約1.25×104nmole/gwcm/時間の速度で水素を産出する。
Bioisopreneと水素の例示的な共産出
いくつかの実施形態では、イソプレンと水素を共産出する方法であって、(a)イソプレンと水素の共産出に好適な条件下で細胞を培養することと、(b)イソプレンと水素を共産出することとを含む、方法が本明細書で提供され、ここで、この細胞は、約0.1mg/Lブロス/時間を上回るイソプレンの平均容積生産性と、約0.005mg/Lブロス/時間を上回る水素の平均容積生産性とを有する。
いくつかの実施形態では、イソプレンと水素を共産出する方法であって、(a)イソプレンと水素の共産出に好適な条件下で細胞を培養することと、(b)イソプレンと水素を共産出することとを含む、方法が本明細書で提供され、ここで、この細胞は、細胞が細胞培養培地から消費する炭素の約0.002モルパーセント超をイソプレンに変換し、細胞が細胞培養培地から消費する炭素の約0.024モルパーセント超に等しい水素を産出する。
いくつかの実施形態では、水素3モルパーセントごとに少なくとも1モルパーセントのイソプレンから水素4モルパーセントごとに少なくとも1モルパーセントのイソプレンの比率のイソプレンおよび水素と、0.1モルパーセントまたはそれ未満の揮発性不純物とを含む組成物が本明細書で提供される。いくつかの実施形態では、組成物はさらに、1〜11モルパーセントのイソプレンと、4〜44モルパーセントの水素を含む。いくつかの実施形態では、組成物はさらに、酸素、二酸化炭素、または窒素を含む。いくつかの実施形態では、組成物はさらに、0〜21モルパーセントの酸素、18〜44モルパーセントの二酸化炭素、および0〜78モルパーセントの窒素を含む。いくつかの実施形態では、組成物はさらに、1.0×10−4モルパーセント以下のメタン以外の揮発性不純物を含む。いくつかの実施形態では、メタン以外の揮発性不純物は、以下のうちの1以上を含む:2−ヘプタノン、6−メチル−5−ヘプタン−2−オン、2,4,5−トリメチルピリジン、2,3,5−トリメチルピラジン、シトロネラル、アセトアルデヒド、メタンチオール、メチルアセタート、1−プロパノール、ジアセチル、2−ブタノン、2−メチル−3−ブテン−2−オール、エチルアセタート、2−メチル−1−プロパノール、3−メチル−1ブタナール、3−メチル−2−ブタノン、1−ブタノール、2−ペンタノン、3−メチル−1−ブタノール、エチルイソブチレート、3−メチル−2−ブテナール、ブチルアセタート、3−メチルブチルアセタート、3−メチル−3−ブテン−1−イルアセタート、3−メチル−2−ブテン−1−イルアセタート、(E)−3,7−ジメチル−1,3,6−オクタトリエン、(Z)−3,7−ジメチル−1,3,6−オクタトリエン、2,3−シクロヘプテノルピリジン、3−ヘキセン−1−オール、3−ヘキセン−1−イルアセタート、リモネン、ゲラニオール(trans−3,7−ジメチル−2,6−オクタジエン−1−オール)およびシトロネロール(3,7−ジメチル−6−オクテン−1−オール)、(E)−3,7−ジメチル−1,3,6−オクタトリエン、(Z)−3,7−ジメチル−1,3,6−オクタトリエン、2,3−シクロヘプテノルピリジン、または線状イソプレンポリマー(例えば、複数のイソプレン単位の重合から得られる線状イソプレン二量体もしくは線状イソプレン三量体)。いくつかの実施形態では、メタン以外の揮発性不純物は、以下のうちの1以上を含む:イソプレン組成物は、以下のうちの1以上を含む:アルコール、アルデヒド、またはケトン(例えば、本明細書に記載のアルコール、アルデヒドまたはケトンのいずれか)。いくつかの実施形態では、イソプレン組成物は、(i)アルコールとアルデヒド、(ii)アルコールとケトン、(iii)アルデヒドとケトン、または(iv)アルコールとアルデヒドとケトンを含む。いくつかの実施形態では、メタン以外の揮発性不純物は、以下のうちの1以上を含む:メタノール、アセトアルデヒド、エタノール、メタンチオール、1−ブタノール、3−メチル−1−プロパノール、アセトン、酢酸、2−ブタノン、2−メチル−1−ブタノール、またはインドール。
また、イソプレンと水素を共産出する方法であって、(a)イソプレンと水素の共産出に好適な条件下で細胞を培養することと、(b)イソプレンと水素を共産出することとを含む、方法が本明細書で提供され、ここで、酸素制限培養された細胞によって産出されるイソプレンのピーク濃度は、約10ng/Lブロスを上回り、細胞の水素発生速度は、約0.0025mmol/Lブロス/時間を上回る。いくつかの実施形態では、細胞を酸素制限条件下で増殖させる。これらの方法のいずれかのいくつかの実施形態では、水素発生速度は、0.0025mmol/Lブロス/時間〜約10mmol/Lブロス/時間、約0.0025mmol/Lブロス/時間〜約5mmol/Lブロス/時間、約0.0025mmol/Lブロス/時間〜約2.5mmol/Lブロス/時間、約0.0025mmol/Lブロス/時間〜約1mmol/Lブロス/時間、約0.0025mmol/Lブロス/時間〜約0.5mmol/Lブロス/時間、約0.0025mmol/Lブロス/時間〜約0.25mmol/Lブロス/時間、約0.0025mmol/Lブロス/時間〜約0.025mmol/Lブロス/時間、約0.025mmol/Lブロス/時間〜約0.5mmol/Lブロス/時間、約0.025mmol/Lブロス/時間〜約1mmol/Lブロス/時間、約0.025mmol/Lブロス/時間〜約2.5mmol/Lブロス/時間、約0.025mmol/Lブロス/時間〜約5mmol/Lブロス/時間、約0.025mmol/Lブロス/時間〜約10mmol/Lブロス/時間、約0.25mmol/Lブロス/時間〜1mmol/Lブロス/時間、約0.25mmol/Lブロス/時間〜2.5mmol/Lブロス/時間、約0.25mmol/Lブロス/時間〜2.5mmol/Lブロス/時間、約0.25mmol/Lブロス/時間〜10mmol/Lブロス/時間、約0.01mmol/Lブロス/時間〜10mmol/Lブロス/時間、約0.01mmol/Lブロス/時間〜50mmol/Lブロス/時間、約0.01mmol/Lブロス/時間〜100mmol/Lブロス/時間、および約0.01mmol/Lブロス/時間〜200mmol/Lブロス/時間の約いずれかである。
また、イソプレンと水素を共産出する方法であって、(a)イソプレンと水素の共産出に好適な条件下で細胞を培養することと、(b)イソプレンと水素を共産出することとを含む、方法が本明細書で提供され、ここで、イソプレンの液相濃度は、約200mg/mL未満であり、細胞は、約400nmole/gwcm/時間を上回るイソプレンを産出し、細胞の水素発生速度は、約0.0025mmol/L/時間を上回る。いくつかの実施形態では、細胞を酸素制限条件下で増殖させる。いくつかの実施形態では、培養物中のイソプレンの液相濃度は、175mg/mL、150mg/mL、125mg/mL、100mg/mL、75mg/mL、50mg/mL、25mg/mL、20mg/mL、15mg/mL、10mg/mL、5mg/mL、または2.5mg/Lの約いずれか未満である。いくつかの実施形態では、培養物中のイソプレンの液相濃度は、0.1mg/L〜200mg/L、1mg/L〜200mg/L、1mg/L〜150mg/L、1mg/L〜100mg/L、1mg/L〜50mg/L、1mg/L〜25mg/L、1mg/L〜20mg/L、または10mg/L〜20mg/Lのいずれか程度である。これらの方法のいずれかのいくつかの実施形態では、水素発生速度は、0.0025mmol/Lブロス/時間〜約10mmol/Lブロス/時間、約0.0025mmol/Lブロス/時間〜約5mmol/Lブロス/時間、約0.0025mmol/Lブロス/時間〜約2.5mmol/Lブロス/時間、約0.0025mmol/Lブロス/時間〜約1mmol/Lブロス/時間、約0.0025mmol/Lブロス/時間〜約0.5mmol/Lブロス/時間、約0.0025mmol/Lブロス/時間〜約0.25mmol/Lブロス/時間、約0.0025mmol/Lブロス/時間〜約0.025mmol/Lブロス/時間、約0.025mmol/Lブロス/時間〜約0.5mmol/Lブロス/時間、約0.025mmol/Lブロス/時間〜約1mmol/Lブロス/時間、約0.025mmol/Lブロス/時間〜約2.5mmol/Lブロス/時間、約0.025mmol/Lブロス/時間〜約5mmol/Lブロス/時間、約0.025mmol/Lブロス/時間〜約10mmol/Lブロス/時間、約0.25mmol/Lブロス/時間〜1mmol/Lブロス/時間、約0.25mmol/Lブロス/時間〜2.5mmol/Lブロス/時間、約0.25mmol/Lブロス/時間〜2.5mmol/Lブロス/時間、および約0.25mmol/Lブロス/時間〜10mmol/Lブロス/時間の約いずれかである。
一態様では、イソプレンと水素を共産出する酸素制限培養された細胞が本明細書で提供される。いくつかの実施形態では、酸素制限培養は嫌気的である。いくつかの実施形態では、本発明は、約400nmole/gwcm/時間を上回るイソプレンと、約125nmole/gwcm/時間を上回る水素を産出する酸素制限培養された細胞を提供する。いくつかの実施形態では、細胞は、(i)イソプレンシンターゼポリペプチドをコードし、(ii)プロモーターに機能的に連結されている異種核酸を有する。いくつかの実施形態では、細胞を、限定するものではないが、炭水化物、グリセロール、グリセリン、ジヒドロキシアセトン、1炭素源、油、動物性脂肪、動物性油、脂肪酸、脂質、リン脂質、グリセロ脂質、モノグリセリド、ジグリセリド、トリグリセリド、再生可能な炭素源、ポリペプチド(例えば、微生物もしくは植物のタンパク質もしくはペプチド)、酵母抽出物、または酵母抽出物由来の成分などの1炭素源、または前述のもののいずれか2つ以上を含む。いくつかの実施形態では、細胞を制限グルコース条件下で培養する。
いくつかの実施形態では、細胞培養培地中の炭素の約0.002%超をイソプレンに変換し、細胞培養培地中の炭素の約0.024モルパーセント超に等しい水素を産出する酸素制限培養された細胞が本明細書で提供される。いくつかの実施形態では、酸素制限培養は嫌気的である。いくつかの実施形態では、(i)イソプレンシンターゼポリペプチドをコードし、(ii)プロモーターに機能的に連結されている異種核酸を有する。いくつかの実施形態では、細胞を、限定するものではないが、炭水化物、グリセロール、グリセリン、ジヒドロキシアセトン、1炭素源、油、動物性脂肪、動物性油、脂肪酸、脂質、リン脂質、グリセロ脂質、モノグリセリド、ジグリセリド、トリグリセリド、再生可能な炭素源、ポリペプチド(例えば、微生物もしくは植物のタンパク質もしくはペプチド)、酵母抽出物、または酵母抽出物由来の成分などの1炭素源、または前述のもののいずれか2つ以上を含む。いくつかの実施形態では、細胞を制限グルコース条件下で培養する。
いくつかの実施形態では、イソプレンシンターゼポリペプチドをコードする異種核酸を含む酸素制限培養された細胞が本明細書で提供される。いくつかの実施形態では、酸素制限培養は嫌気的である。いくつかの実施形態では、(i)イソプレンシンターゼポリペプチドをコードし、(ii)プロモーターに機能的に連結されている異種核酸を有する。いくつかの実施形態では、細胞を、限定するものではないが、炭水化物、グリセロール、グリセリン、ジヒドロキシアセトン、1炭素源、油、動物性脂肪、動物性油、脂肪酸、脂質、リン脂質、グリセロ脂質、モノグリセリド、ジグリセリド、トリグリセリド、再生可能な炭素源、ポリペプチド(例えば、微生物もしくは植物のタンパク質もしくはペプチド)、酵母抽出物、または酵母抽出物由来の成分などの1炭素源、または前述のもののいずれか2つ以上を含む。いくつかの実施形態では、細胞を制限グルコース条件下で培養する。
一態様では、イソプレンを別の化合物とともに共産出する方法、例えば、本明細書に記載の細胞のいずれかを用いてイソプレンと水素を共産出する方法が本明細書で提供される。いくつかの実施形態では、本方法は、約400nmole/gwcm/時間を上回るイソプレンと約125nmole/gwcm/時間を上回る水素を産出するのに十分な酸素制限条件下で細胞を培養することを含む。いくつかの実施形態では、酸素制限培養は嫌気的である。いくつかの実施形態では、本方法はまた、細胞によって産出されたイソプレンと水素を回収することを含む。いくつかの実施形態では、本方法はさらに、細胞によって産出されたイソプレンと水素を精製することを含む。いくつかの実施形態では、本方法は、イソプレンを重合させることを含む。いくつかの実施形態では、(i)イソプレンシンターゼポリペプチドをコードし、(ii)プロモーターに機能的に連結されている異種核酸を有する。いくつかの実施形態では、細胞を、限定するものではないが、炭水化物、グリセロール、グリセリン、ジヒドロキシアセトン、1炭素源、油、動物性脂肪、動物性油、脂肪酸、脂質、リン脂質、グリセロ脂質、モノグリセリド、ジグリセリド、トリグリセリド、再生可能な炭素源、ポリペプチド(例えば、微生物もしくは植物のタンパク質もしくはペプチド)、酵母抽出物、または酵母抽出物由来の成分などの1炭素源、または前述のもののいずれか2つ以上を含む。いくつかの実施形態では、細胞を制限グルコース条件下で培養する。様々な実施形態では、定常期に産出されるイソプレンの量(例えば、産出されるイソプレンの総量またはOD600で1時間当たりブロス1リットルから産出されるイソプレンの量)は、同じ時間の長さで増殖期に産出されるイソプレンの量の2倍以上よりも多いかまたは約2倍以上である。
いくつかの実施形態では、本方法は、細胞培養培地の炭素(mol/mol)の約0.002%超をイソプレンに変換し、細胞培養培地中の炭素の約0.024モルパーセント超に等しい水素を産出するのに十分な酸素制限条件下で細胞を培養することを含む。いくつかの実施形態では、酸素制限培養は嫌気的である。いくつかの実施形態では、本方法はまた、細胞によって産出されたイソプレンと水素を回収することを含む。いくつかの実施形態では、本方法はさらに、細胞によって産出されたイソプレンと水素を精製することを含む。いくつかの実施形態では、本方法は、イソプレンを重合させることを含む。いくつかの実施形態では、(i)イソプレンシンターゼポリペプチドをコードし、(ii)プロモーターに機能的に連結されている異種核酸を有する。いくつかの実施形態では、細胞を、限定するものではないが、炭水化物、グリセロール、グリセリン、ジヒドロキシアセトン、1炭素源、油、動物性脂肪、動物性油、脂肪酸、脂質、リン脂質、グリセロ脂質、モノグリセリド、ジグリセリド、トリグリセリド、再生可能な炭素源、ポリペプチド(例えば、微生物もしくは植物のタンパク質もしくはペプチド)、酵母抽出物、または酵母抽出物由来の成分などの1炭素源、または前述のもののいずれか2つ以上を含む。
本明細書に記載の態様のいずれかのいくつかの実施形態では、微生物ポリペプチド炭素源は、酵母または細菌由来の1以上のポリペプチドを含む。本明細書に記載の態様のいずれかのいくつかの実施形態では、植物ポリペプチド炭素源は、大豆、トウモロコシ、キャノーラ、ジャトロファ、ヤシ、落花生、ヒマワリ、ココナッツ、カラシ、菜種、綿の実、パーム核、オリーブ、サフラワー、ゴマ、またはアマニ由来の1以上のポリペプチドを含む。
いくつかの実施形態では、イソプレンと水素は、定常期にのみ共産出される。いくつかの実施形態では、イソプレンと水素は、増殖期と定常期の両方に共産出される。様々な実施形態では、定常期に産出されるイソプレンの量(例えば、産出されるイソプレンの総量またはOD600で1時間当たりブロス1リットルから産出されるイソプレンの量)は、同じ時間の長さで増殖期に産出されるイソプレンの量の約2、3、4、5、10、20、30、40、50倍もしくはそれより多い。様々な実施形態では、定常期に産出される水素の量(例えば、産出される水素の総量またはOD600で1時間当たりブロス1リットルから産出される水素の量)は、同じ時間の長さで増殖期に産出される水素の量の約2、3、4、5、10、20、30、40、50倍もしくはそれより多い。
いくつかの実施形態では、本明細書で提供される組成物は、水素と、組成物中の全てのC5炭化水素の総重量と比べて、99.90、99.92、99.94、99.96、99.98、もしくは100重量%超または約99.90、99.92、99.94、99.96、99.98、もしくは100重量%のイソプレンを含む。いくつかの実施形態では、組成物は、組成物中の全てのC5炭化水素の総重量と比べて、0.12、0.10、0.08、0.06、0.04、0.02、0.01、0.005、0.001、0.0005、0.0001、0.00005、もしくは0.00001重量%未満または約0.12、0.10、0.08、0.06、0.04、0.02、0.01、0.005、0.001、0.0005、0.0001、0.00005、もしくは0.00001重量%のイソプレン以外のC5炭化水素(例えば、1,3−シクロペンタジエン、cis−1,3−ペンタジエン、trans−1,3−ペンタジエン、1,4−ペンタジエン、1−ペンチン、2−ペンチン、1−ペンテン、2−メチル−1−ブテン、3−メチル−1−ブチン、ペント−4−エン−1−イン、trans−ペント−3−エン−1−イン、またはcis−ペント−3−エン−1−イン)を含む。いくつかの実施形態では、組成物は、1,3−シクロペンタジエン、cis−1,3−ペンタジエン、trans−1,3−ペンタジエン、1,4−ペンタジエン、1−ペンチン、2−ペンチン、1−ペンテン、2−メチル−1−ブテン、3−メチル−1−ブチン、ペント−4−エン−1−イン、trans−ペント−3−エン−1−イン、またはcis−ペント−3−エン−1−インについて、組成物中の全てのC5炭化水素の総重量と比べて、0.12、0.10、0.08、0.06、0.04、0.02、0.01、0.005、0.001、0.0005、0.0001、0.00005、もしくは0.00001重量%未満または約0.12、0.10、0.08、0.06、0.04、0.02、0.01、0.005、0.001、0.0005、0.0001、0.00005、もしくは0.00001重量%を有する。特定の実施形態では、組成物は、約2mg超のイソプレンを有し、かつ組成物中の全てのC5炭化水素の総重量と比べて、99.90、99.92、99.94、99.96、99.98、もしくは100重量%超または約99.90、99.92、99.94、99.96、99.98、もしくは100重量%のイソプレンを有する。いくつかの実施形態では、組成物は、イソプレンの重合を阻害する、組成物中の任意の化合物について、イソプレンの重合を阻害する約50、40、30、20、10、5、1、0.5、0.1、0.05、0.01、もしくは0.005μg/Lまたはそれ未満の化合物を有する。特定の実施形態では、組成物はまた、約2mg超のイソプレンと、約0.48mg超の水素とを含む。
いくつかの実施形態では、気相の揮発性有機画分は、イソプレンの重合を阻害する、気相の揮発性有機画分中の任意の化合物について、イソプレンの重合を阻害する50、40、30、20、10、5、1、0.5、0.1、0.05、0.01、もしくは0.005μg/L未満または約50、40、30、20、10、5、1、0.5、0.1、0.05、0.01、もしくは0.005μg/Lの化合物を有する。特定の実施形態では、気相の揮発性有機画分はまた、約2mg超のイソプレンと、約0.48mg超の水素とを含む。
いくつかの実施形態では、この系は、本明細書に記載の細胞および/または組成物のいずれかを含む。いくつかの実施形態では、この系は、チャンバーが、約400、500、600、700、800、900、1,000、1,250、1,500、1,750、2,000、2,500、3,000、4,000、5,000nmole/gwcm/時間、またはそれより多いイソプレンと、約125、250、500、750、1000、1,250、1,500、1,750、2,000、2,500、3,000、4,000、5,000、7,500、10,000nmole/gwcm/時間、またはそれより多い水素とを産出する酸素制限培養された細胞を含む反応器を含む。いくつかの実施形態では、この系は、閉鎖系ではない。いくつかの実施形態では、イソプレンの少なくとも一部をこの系から取り出す。いくつかの実施形態では、この系は、イソプレンと水素とを含む気相を含む。様々な実施形態では、この気相は、本明細書に記載の組成物のいずれかを含む。
一態様では、本明細書において、本明細書に記載の任意の組成物または方法により産出される産物を特徴とする。
高イソプレン力価での細胞生存性
イソプレンは、多くの植物、動物、および微生物によって分泌される疎水性分子である。バシルスなどの細菌は、かなり低いレベルでイソプレンを産出する。植物がイソプレンを分泌して熱保護を助けるという証拠もあるが、イソプレンは、シアノバクテリアもしくは真菌に対してアンタゴニストとして作用し得る、または抗微生物剤として作用し得るという仮説が立てられている。例えば、Ladygina et al.,Process Biochemistry 41:1001−1014(2006)を参照されたく、これは、特に、アンタゴニストとして作用するイソプレンに関して、その全体が参照により本明細書に組み込まれる。抗微生物性であるには、自然で発生する極めて低い産出レベルで十分なので、イソプレンの商業化に必要なイソプレンの力価および産出レベルでは宿主微生物が死滅するということが大きな懸念であった。
本発明者らは、二酸化炭素発生速度または総二酸化炭素発生速度によって示されるような細胞生存性および/または代謝活性を維持すると同時に、イソプレンの商業化のためのイソプレンの力価および産出レベルを産出する方法を見出した。
イソプレンを産出する方法であって、(a)イソプレンの産出に好適な条件下で細胞を培養することと、(b)イソプレンを産出することとを含む、方法が本明細書で提供され、ここで、この細胞は、約400nmole/gwcm/時間を上回るイソプレンを産出し、細胞の二酸化炭素発生速度は、約1×10−18mmol/L/時間を上回る。いくつかの実施形態では、産出されるイソプレンは、「イソプレンの例示的な産出」と題された節に開示された任意の濃度または量である。いくつかの実施形態では、イソプレンの量は、400nmole/gwcm/時間〜1mole/gwcm/時間、400nmole/gwcm/時間〜1mmole/gwcm/時間、400nmole/gwcm/時間〜40mmole/gwcm/時間、400nmole/gwcm/時間〜4mmole/gwcm/時間、1mmole/gwcm/時間〜1.5mmole/gwcm/時間、1.5mmole/gwcm/時間〜3mmole/gwcm/時間、3mmole/gwcm/時間〜5mmole/gwcm/時間、5mmole/gwcm/時間〜25mmole/gwcm/時間、25mmole/gwcm/時間〜100mmole/gwcm/時間、100mmole/gwcm/時間〜500mmole/gwcm/時間、または500mmole/gwcm/時間〜1000mmole/gwcm/時間の約いずれかである。いくつかの実施形態では、イソプレンの量は、1mmole/gwcm/時間、1.5mmole/gwcm/時間、2mmole/gwcm/時間、3mmole/gwcm/時間、4mmole/gwcm/時間、または5mmole/gwcm/時間の約いずれかである。いくつかの実施形態では、二酸化炭素発生速度は、1×10−18mmol/L/時間〜約1mol/L/時間、1mmol/L/時間〜1mol/L/時間、25mmol/L/時間〜750mmol/L/時間、25mmol/L/時間〜75mmol/L/時間、250mmol/L/時間〜750mmol/L/時間、または450mmol/L/時間〜550mmol/L/時間の約いずれか程度である。いくつかの実施形態では、二酸化炭素発生速度は、50mmol/L/時間、100mmol/L/時間、150mmol/L/時間、200mmol/L/時間、250mmol/L/時間、300mmol/L/時間、350mmol/L/時間、400mmol/L/時間、450mmol/L/時間、または500mmol/L/時間の約いずれかである。
また、イソプレンを産出する方法であって、(a)イソプレンの産出に好適な条件下で細胞を培養することと、(b)イソプレンを産出することとを含む、方法が本明細書で提供され、ここで、この細胞は、約400nmole/gwcm/時間を上回るイソプレンを産出し、細胞生存性は、約2倍未満低下する。いくつかの実施形態では、産出されるイソプレンは、「イソプレンの例示的な産出」と題された節に開示された任意の濃度または量である。いくつかの実施形態では、イソプレンの量は、400nmole/gwcm/時間〜1mole/gwcm/時間、400nmole/gwcm/時間〜1mmole/gwcm/時間、400nmole/gwcm/時間〜40mmole/gwcm/時間、400nmole/gwcm/時間〜4mmole/gwcm/時間、1mmole/gwcm/時間〜1.5mmole/gwcm/時間、1.5mmole/gwcm/時間〜3mmole/gwcm/時間、3mmole/gwcm/時間〜5mmole/gwcm/時間、5mmole/gwcm/時間〜25mmole/gwcm/時間、25mmole/gwcm/時間〜100mmole/gwcm/時間、100mmole/gwcm/時間〜500mmole/gwcm/時間、または500mmole/gwcm/時間〜1000mmole/gwcm/時間の約いずれかである。いくつかの実施形態では、イソプレンの量は、1mmole/gwcm/時間、1.5mmole/gwcm/時間、2mmole/gwcm/時間、3mmole/gwcm/時間、4mmole/gwcm/時間、または5mmole/gwcm/時間の約いずれかである。いくつかの実施形態では、細胞生存性は、1.75倍、1.5倍、1.25倍、1倍、0.75倍、0.5倍、または0.25倍のいずれか程度未満低下する。いくつかの実施形態では、細胞生存性は、約2倍低下する。
さらに、イソプレンを産出する方法であって、(a)イソプレンの産出に好適な条件下で細胞を培養することと、(b)イソプレンを産出することとを含む、方法が本明細書で提供され、ここで、培養細胞によって産出されるイソプレンの累計生産性は、約0.2mg/Lブロス/時間を上回り、細胞の二酸化炭素発生速度は、約1×10−18mmol/L/時間を上回る。いくつかの実施形態では、イソプレンの累計生産性は、「イソプレンの例示的な産出」と題された節に開示された任意の濃度または量である。いくつかの実施形態では、イソプレンの累計生産性は、0.2mg/Lブロス/時間〜5g/Lブロス/時間、0.2mg/Lブロス/時間〜1g/Lブロス/時間、1g/Lブロス/時間〜2.5g/Lブロス/時間、2.5g/Lブロス/時間〜5g/Lブロス/時間のいずれか程度である。いくつかの実施形態では、二酸化炭素発生速度は、1×10−18mmol/L/時間〜約1mol/L/時間、1mmol/L/時間〜1mol/L/時間、25mmol/L/時間〜750mmol/L/時間、25mmol/L/時間〜75mmol/L/時間、250mmol/L/時間〜750mmol/L/時間、または450mmol/L/時間〜550mmol/L/時間の約いずれかである。いくつかの実施形態では、二酸化炭素発生速度は、50mmol/L/時間、100mmol/L/時間、150mmol/L/時間、200mmol/L/時間、250mmol/L/時間、300mmol/L/時間、350mmol/L/時間、400mmol/L/時間、450mmol/L/時間、または500mmol/L/時間の約いずれかである。
イソプレンを産出する方法であって、(a)イソプレンの産出に好適な条件下で細胞を培養することと、(b)イソプレンを産出することとを含む、方法が本明細書で提供され、ここで、培養細胞によって産出されるイソプレンの累計生産性は、約0.2mg/Lブロス/時間を上回り、細胞生存性は約2倍未満低下する。いくつかの実施形態では、イソプレンの累計生産性は、「イソプレンの例示的な産出」と題された節に開示された任意の濃度または量である。いくつかの実施形態では、イソプレンの累計生産性は、0.2mg/Lブロス/時間〜5g/Lブロス/時間、0.2mg/Lブロス/時間〜1g/Lブロス/時間、1g/Lブロス/時間〜2.5g/Lブロス/時間、2.5g/Lブロス/時間〜5g/Lブロス/時間の約いずれかである。いくつかの実施形態では、細胞生存性は、1.75倍、1.5倍、1.25倍、1倍、0.75倍、0.5倍、または0.25倍のいずれか程度未満低下する。
また、イソプレンを産出する方法であって、(a)イソプレンの産出に好適な条件下で細胞を培養することと、(b)イソプレンを産出することとを含む、方法が本明細書で提供され、ここで、培養細胞によって産出されるイソプレンのピーク濃度は、約10ng/Lブロスを上回り、細胞の二酸化炭素発生速度は、約1×10−18mmol/L/時間を上回る。いくつかの実施形態では、イソプレンのピーク濃度は、「イソプレンの例示的な産出」と題された節に開示された任意の濃度または量である。いくつかの実施形態では、イソプレンのピーク濃度は、10ng/Lブロス〜500ng/Lブロス、500ng/Lブロス〜1μg/Lブロス、1μg/Lブロス〜5μg/Lブロス、5μg/Lブロス〜50μg/Lブロス、5μg/Lブロス〜100μg/Lブロス、5μg/Lブロス〜250μg/Lブロス、250μg/Lブロス〜500μg/Lブロス、500μg/Lブロス〜1mg/Lブロス、1mg/Lブロス〜50mg/Lブロス、1mg/Lブロス〜100mg/Lブロス、1mg/Lブロス〜200mg/Lブロス、10ng/Lブロス〜200mg/Lブロス、5μg/Lブロス〜100mg/Lブロス、または5μg/Lブロス〜200mg/Lブロスの約いずれかである。いくつかの実施形態では、ピーク濃度は、約10ng/Lブロス、100ng/Lブロス、1μg/Lブロス、5μg/Lブロス、1mg/Lブロス、30mg/Lブロス、100mg/Lブロス、または200mg/Lブロスのいずれかである。いくつかの実施形態では、二酸化炭素発生速度は、1×10−18mmol/L/時間〜約1mol/L/時間、1mmol/L/時間〜1mol/L/時間、25mmol/L/時間〜750mmol/L/時間、25mmol/L/時間〜75mmol/L/時間、250mmol/L/時間〜750mmol/L/時間、または450mmol/L/時間〜550mmol/L/時間の約いずれかである。いくつかの実施形態では、二酸化炭素発生速度は、50mmol/L/時間、100mmol/L/時間、150mmol/L/時間、200mmol/L/時間、250mmol/L/時間、300mmol/L/時間、350mmol/L/時間、400mmol/L/時間、450mmol/L/時間、または500mmol/L/時間の約いずれかである。
さらに、イソプレンを産出する方法であって、(a)イソプレンの産出に好適な条件下で細胞を培養することと、(b)イソプレンを産出することとを含む、方法が本明細書で提供され、ここで、培養細胞によって産出されるイソプレンのピーク濃度は、約10ng/Lブロスを上回り、細胞生存性は約2倍未満低下する。いくつかの実施形態では、イソプレンのピーク濃度は、「イソプレンの例示的な産出」と題された節に開示された任意の濃度または量である。いくつかの実施形態では、イソプレンのピーク濃度は、10ng/Lブロス〜500ng/Lブロス、500ng/Lブロス〜1μg/Lブロス、1μg/Lブロス〜5μg/Lブロス、5μg/Lブロス〜50μg/Lブロス、5μg/Lブロス〜100μg/Lブロス、5μg/Lブロス〜250μg/Lブロス、250μg/Lブロス〜500μg/Lブロス、500μg/Lブロス〜1mg/Lブロス、1mg/Lブロス〜50mg/Lブロス、1mg/Lブロス〜100mg/Lブロス、1mg/Lブロス〜200mg/Lブロス、10ng/Lブロス〜200mg/Lブロス、5μg/Lブロス〜100mg/Lブロス、または5μg/Lブロス〜200mg/Lブロスのいずれか程度である。いくつかの実施形態では、ピーク濃度は、約10ng/Lブロス、100ng/Lブロス、1μg/Lブロス、5μg/Lブロス、1mg/Lブロス、30mg/Lブロス、100mg/Lブロス、または200mg/Lブロスのいずれかである。いくつかの実施形態では、細胞生存性は、1.75倍、1.5倍、1.25倍、1倍、0.75倍、0.5倍、または0.25倍のいずれか程度未満低下する。いくつかの実施形態では、細胞生存性は、約2倍低下する。
また、イソプレンシンターゼポリペプチドをコードする核酸を含む培養細胞が本明細書で提供され、ここで、この細胞は、約400nmole/gwcm/時間を上回るイソプレンを産出し、細胞の二酸化炭素発生速度は、約1×10−18mmol/L/時間を上回る。いくつかの実施形態では、産出されるイソプレンは、「イソプレンの例示的な産出」と題された節に開示された任意の濃度または量である。いくつかの実施形態では、イソプレンの量は、400nmole/gwcm/時間〜1mole/gwcm/時間、400nmole/gwcm/時間〜1mmole/gwcm/時間、400nmole/gwcm/時間〜40mmole/gwcm/時間、400nmole/gwcm/時間〜4mmole/gwcm/時間、1mmole/gwcm/時間〜1.5mmole/gwcm/時間、1.5mmole/gwcm/時間〜3mmole/gwcm/時間、3mmole/gwcm/時間〜5mmole/gwcm/時間、5mmole/gwcm/時間〜25mmole/gwcm/時間、25mmole/gwcm/時間〜100mmole/gwcm/時間、100mmole/gwcm/時間〜500mmole/gwcm/時間、または500mmole/gwcm/時間〜1000mmole/gwcm/時間のいずれか程度である。いくつかの実施形態では、イソプレンの量は、1mmole/gwcm/時間、1.5mmole/gwcm/時間、2mmole/gwcm/時間、3mmole/gwcm/時間、4mmole/gwcm/時間、または5mmole/gwcm/時間のいずれか程度である。いくつかの実施形態では、二酸化炭素発生速度は、1×10−18mmol/L/時間〜約1mol/L/時間、1mmol/L/時間〜1mol/L/時間、25mmol/L/時間〜750mmol/L/時間、25mmol/L/時間〜75mmol/L/時間、250mmol/L/時間〜750mmol/L/時間、または450mmol/L/時間〜550mmol/L/時間のいずれか程度である。いくつかの実施形態では、二酸化炭素発生速度は、50mmol/L/時間、100mmol/L/時間、150mmol/L/時間、200mmol/L/時間、250mmol/L/時間、300mmol/L/時間、350mmol/L/時間、400mmol/L/時間、450mmol/L/時間、または500mmol/L/時間のいずれか程度である。
また、イソプレンシンターゼポリペプチドをコードする核酸を含む培養細胞が本明細書で提供され、ここで、この培養細胞によって産出されるイソプレンの累計生産性は、約0.2mg/Lブロス/時間を上回り、細胞の二酸化炭素発生速度は、約1×10−18mmol/L/時間を上回る。いくつかの実施形態では、イソプレンの累計生産性は、「イソプレンの例示的な産出」と題された節に開示された任意の濃度または量である。いくつかの実施形態では、イソプレンの累計生産性は、0.2mg/Lブロス/時間〜5g/Lブロス/時間、0.2mg/Lブロス/時間〜1g/Lブロス/時間、1g/Lブロス/時間〜2.5g/Lブロス/時間、2.5g/Lブロス/時間〜5g/Lブロス/時間のいずれか程度である。いくつかの実施形態では、二酸化炭素発生速度は、1×10−18mmol/L/時間〜約1mol/L/時間、1mmol/L/時間〜1mol/L/時間、25mmol/L/時間〜750mmol/L/時間、25mmol/L/時間〜75mmol/L/時間、250mmol/L/時間〜750mmol/L/時間、または450mmol/L/時間〜550mmol/L/時間のいずれか程度である。いくつかの実施形態では、二酸化炭素発生速度は、50mmol/L/時間、100mmol/L/時間、150mmol/L/時間、200mmol/L/時間、250mmol/L/時間、300mmol/L/時間、350mmol/L/時間、400mmol/L/時間、450mmol/L/時間、または500mmol/L/時間の約いずれかである。
さらに、イソプレンシンターゼポリペプチドをコードする核酸を含む培養細胞が本明細書で提供され、ここで、この培養細胞によって産出されるイソプレンのピーク濃度は、約10ng/Lブロスを上回り、細胞の二酸化炭素発生速度は、約1×10−18mmol/L/時間を上回る。いくつかの実施形態では、イソプレンのピーク濃度は、「イソプレンの例示的な産出」と題された節に開示された任意の濃度または量である。いくつかの実施形態では、イソプレンのピーク濃度は、10ng/Lブロス〜500ng/Lブロス、500ng/Lブロス〜1μg/Lブロス、1μg/Lブロス〜5μg/Lブロス、5μg/Lブロス〜50μg/Lブロス、5μg/Lブロス〜100μg/Lブロス、5μg/Lブロス〜250μg/Lブロス、250μg/Lブロス〜500μg/Lブロス、500μg/Lブロス〜1mg/Lブロス、1mg/Lブロス〜50mg/Lブロス、1mg/Lブロス〜100mg/Lブロス、1mg/Lブロス〜200mg/Lブロス、10ng/Lブロス〜200mg/Lブロス、5μg/Lブロス〜100mg/Lブロス、または5μg/Lブロス〜200mg/Lブロス。いくつかの実施形態では、ピーク濃度は、約10ng/Lブロス、100ng/Lブロス、1μg/Lブロス、5μg/Lブロス、1mg/Lブロス、30mg/Lブロス、100mg/Lブロス、または200mg/Lブロスのいずれかである。いくつかの実施形態では、二酸化炭素発生速度は、1×10−18mmol/L/時間〜約1mol/L/時間、1mmol/L/時間〜1mol/L/時間、25mmol/L/時間〜750mmol/L/時間、25mmol/L/時間〜75mmol/L/時間、250mmol/L/時間〜750mmol/L/時間、または450mmol/L/時間〜550mmol/L/時間の約いずれかである。いくつかの実施形態では、二酸化炭素発生速度は、50mmol/L/時間、100mmol/L/時間、150mmol/L/時間、200mmol/L/時間、250mmol/L/時間、300mmol/L/時間、350mmol/L/時間、400mmol/L/時間、450mmol/L/時間、または500mmol/L/時間の約いずれかである。
本明細書に記載の方法および細胞のいずれかのいくつかの実施形態では、異種および/または重複コピーのMVA経路および/またはDXP経路の核酸の1以上からMVA経路および/またはDXP経路のRNAおよび/またはタンパク質を発現する細胞の二酸化炭素発生速度および/または細胞生存性を、異種および/または重複コピーのMVA経路および/またはDXP経路核酸の1以上を欠く対照細胞と比較する。いくつかの実施形態では、誘導性プロモーターの制御下にある異種および/または重複コピーのMVA経路および/またはDXP経路の核酸の1以上からMVA経路および/またはDXP経路のRNAおよび/またはタンパク質を発現する細胞の二酸化炭素発生速度および/または細胞生存性(この場合、プロモーターは誘導されている)を、誘導性プロモーターの制御下にある異種および/または重複コピーのMVA経路および/またはDXP経路核酸の1以上を含有する対照細胞(この場合、プロモーターは誘導されていない(未誘導である))と比較する。いくつかの実施形態では、誘導性プロモーターは、β−ガラクトシダーゼプロモーターである。
本発明は、イソプレンを産出する方法であって、(a)イソプレンの産出に好適な条件下で細胞を培養することと、(b)イソプレンを産出することとを含む、方法を提供し、ここで、細胞は、約400nmole/gwcm/時間を上回るイソプレンを産出し、細胞の二酸化炭素発生速度は、約1×10−18mmol/L/時間を上回る。さらに、イソプレンを産出する方法であって、(a)イソプレンの産出に好適な条件下で細胞を培養することと、(b)イソプレンを産出することとを含む、方法が本明細書で提供され、ここで、この培養細胞によって産出されるイソプレンの累計生産性は、約0.2mg/Lブロス/時間を上回り、細胞の二酸化炭素発生速度は、約1×10−18mmol/L/時間を上回る。また、イソプレンを産出する方法であって、(a)イソプレンの産出に好適な条件下で細胞を培養することと、(b)イソプレンを産出することとを含む、方法が本明細書で提供され、ここで、この培養細胞によって産出されるイソプレンのピーク濃度は、約10ng/Lブロスを上回り、細胞の二酸化炭素発生速度は、約1×10−18mmol/L/時間を上回る。これらの方法のいずれかのいくつかの実施形態では、二酸化炭素発生速度は、1×10−18mmol/L/時間〜約1mol/L/時間、1mmol/L/時間〜1mol/L/時間、25mmol/L/時間〜750mmol/L/時間、25mmol/L/時間〜75mmol/L/時間、250mmol/L/時間〜750mmol/L/時間、または450mmol/L/時間〜550mmol/L/時間の約いずれかである。いくつかの実施形態では、二酸化炭素発生速度は、約50mmol/L/時間または約500mmol/L/時間である。
さらに、イソプレンシンターゼポリペプチドをコードする核酸を含む培養細胞が本明細書で提供され、ここで、この細胞は、約400nmole/gwcm/時間を上回るイソプレンを産出し、細胞の二酸化炭素発生速度は、約1×10−18mmol/L/時間を上回る。また、イソプレンシンターゼポリペプチドをコードする核酸を含む培養細胞が本明細書で提供され、ここで、培養細胞によって産出されるイソプレンの累計生産性は、約0.2mg/Lブロス/時間を上回り、細胞の二酸化炭素発生速度は、約1×10−18mmol/L/時間を上回る。さらに、イソプレンシンターゼポリペプチドをコードする核酸を含む培養細胞が本明細書で提供され、ここで、培養細胞によって産出されるイソプレンのピーク濃度は、約10ng/Lブロスを上回り、細胞の二酸化炭素発生速度は、約1×10−18mmol/L/時間を上回る。これらの培養細胞のいずれかのいくつかの実施形態では、二酸化炭素発生速度は、1×10−18mmol/L/時間〜約1mol/L/時間、1mmol/L/時間〜1mol/L/時間、25mmol/L/時間〜750mmol/L/時間、25mmol/L/時間〜75mmol/L/時間、250mmol/L/時間〜750mmol/L/時間、または450mmol/L/時間〜550mmol/L/時間の約いずれかである。いくつかの実施形態では、二酸化炭素発生速度は、約50mmol/L/時間または約500mmol/L/時間である。
また、イソプレンを産出する方法であって、(a)イソプレンの産出に好適な条件下で細胞を培養することと、(b)イソプレンを産出することとを含む、方法が本明細書で提供され、ここで、イソプレンの液相濃度は、約200mg/L未満であり、細胞は、約400nmole/gwcm/時間を上回るイソプレンを産出する。いくつかの実施形態では、培養物中のイソプレンの液相濃度は、175mg/mL、150mg/mL、125mg/mL、100mg/mL、75mg/mL、50mg/mL、25mg/mL、20mg/mL、15mg/mL、10mg/mL、5mg/mL、または2.5mg/Lの約いずれか未満である。いくつかの実施形態では、培養物中のイソプレンの液相濃度は、0.1mg/L〜200mg/L、1mg/L〜200mg/L、1mg/L〜150mg/L、1mg/L〜100mg/L、1mg/L〜50mg/L、1mg/L〜25mg/L、1mg/L〜20mg/L、または10mg/L〜20mg/Lの約いずれかである。
また、化合物を産出する方法が本明細書で提供され、ここで、この化合物は、(a)約250M/atm未満のヘンリー則係数および(b)約100g/L未満の水溶解度からなる群から選択される1以上の特徴を有する。いくつかの実施形態では、本方法は、a)化合物の産出に好適な条件下で細胞を培養すること、その場合、約0.01vvm〜約2vvmのガス放出速度でガスを添加する(例えば、ガスを発酵系などの系に添加する)と、b)化合物を産出することとを含む。いくつかの実施形態では、化合物のヘンリー則係数は、200M/atm、150M/atm、100M/atm、75M/atm、50M/atm、25M/atm、10M/atm、5M/atm、または1M/atmの約いずれか未満である。いくつかの実施形態では、化合物の水溶解度は、75g/L、50g/L、25g/L、10g/L、5g/L、または1g/Lの約いずれか未満である。いくつかの実施形態では、化合物は、イソプレン、アルデヒド(例えば、アセトアルデヒド)、ケトン(例えば、アセトンまたは2−ブタノン)、アルコール(例えば、メタノール、エタノール、1−ブタノール、またはC5アルコール(例えば、3−メチル−3−ブテン−1−オールまたは3−メチル−2−ブテン−1−オール)、アルコールのエステル(例えば、酢酸エチルまたはC5アルコールのアセチルエステル)、ヘミテルペン、モノテルペン、セスキテルペン、およびC1〜C5炭化水素(例えば、メタン、エタン、エチレン、またはプロピレン)からなる群から選択される。いくつかの実施形態では、C1〜C5炭化水素は、飽和したもの、不飽和のもの、または分岐したものである。特定の実施形態では、化合物はイソプレンである。上記の化合物のいずれかを産出する方法のいくつかの実施形態では、ガス放出速度は、0.1vvm〜1vvm、0.2vvm〜1vvm、または0.5vvm〜1vvmの約いずれかである。
一態様では、培養細胞を用いて、イソプレンを産出する。いくつかの実施形態では、培養細胞は、約400nmoleのイソプレン/細胞の湿重量に対する細胞のグラム/時間(nmole/gwcm/時間)を上回るイソプレンを産出する。いくつかの実施形態では、細胞は、細胞は、(i)イソプレンシンターゼポリペプチドをコードし、かつ(ii)プロモーターに機能的に連結されている異種核酸を有する。いくつかの実施形態では、細胞を、限定するものではないが、炭水化物、グリセロール、グリセリン、ジヒドロキシアセトン、1炭素源、油、動物性脂肪、動物性油、脂肪酸、脂質、リン脂質、グリセロ脂質、モノグリセリド、ジグリセリド、トリグリセリド、再生可能な炭素源、ポリペプチド(例えば、微生物もしくは植物のタンパク質もしくはペプチド)、酵母抽出物、または酵母抽出物由来の成分などの1炭素源、または前述のもののいずれか2つ以上の組み合わせを含む培養培地中で培養する。いくつかの実施形態では、細胞を制限グルコース条件下で培養する。
いくつかの実施形態では、本発明は、細胞培養培地中の炭素の約0.002%超をイソプレンに変換する培養細胞を提供する。いくつかの実施形態では、(i)イソプレンシンターゼポリペプチドをコードし、(ii)プロモーターに機能的に連結されている異種核酸を有する。いくつかの実施形態では、細胞を、限定するものではないが、炭水化物、グリセロール、グリセリン、ジヒドロキシアセトン、1炭素源、油、動物性脂肪、動物性油、脂肪酸、脂質、リン脂質、グリセロ脂質、モノグリセリド、ジグリセリド、トリグリセリド、再生可能な炭素源、ポリペプチド(例えば、微生物もしくは植物のタンパク質もしくはペプチド)、酵母抽出物、または酵母抽出物由来の成分などの1炭素源、または前述のもののいずれか2つ以上を含む。いくつかの実施形態では、細胞を制限グルコース条件下で培養する。
いくつかの実施形態では、本発明は、イソプレンシンターゼポリペプチドをコードする異種核酸を含む培養細胞を提供する。いくつかの実施形態では、(i)イソプレンシンターゼポリペプチドをコードし、(ii)プロモーターに機能的に連結されている異種核酸を有する。いくつかの実施形態では、細胞を、限定するものではないが、炭水化物、グリセロール、グリセリン、ジヒドロキシアセトン、1炭素源、油、動物性脂肪、動物性油、脂肪酸、脂質、リン脂質、グリセロ脂質、モノグリセリド、ジグリセリド、トリグリセリド、再生可能な炭素源、ポリペプチド(例えば、微生物もしくは植物のタンパク質もしくはペプチド)、酵母抽出物、または酵母抽出物由来の成分などの1炭素源、または前述のもののいずれか2つ以上を含む。いくつかの実施形態では、細胞を制限グルコース条件下で培養する。
一態様では、本発明は、本明細書に記載の細胞のいずれかを用いてイソプレンを産出する方法などの、イソプレンを産出する方法を特徴とする。いくつかの実施形態では、本方法は、約400nmole/gwcm/時間を上回るイソプレンを産出するのに十分な条件下で細胞を培養することを含む。いくつかの実施形態では、本方法はまた、細胞により産出されたイソプレンを回収することを含む。いくつかの実施形態では、本方法は、細胞により産出されたイソプレンを精製することを含む。いくつかの実施形態では、本方法は、イソプレンを重合させることを含む。いくつかの実施形態では、細胞は(i)イソプレンシンターゼポリペプチドをコードし、(ii)プロモーターに機能的に連結されている異種核酸を有する。いくつかの実施形態では、細胞を、限定するものではないが、炭水化物、グリセロール、グリセリン、ジヒドロキシアセトン、1炭素源、油、動物性脂肪、動物性油、脂肪酸、脂質、リン脂質、グリセロ脂質、モノグリセリド、ジグリセリド、トリグリセリド、再生可能な炭素源、ポリペプチド(例えば、微生物もしくは植物のタンパク質もしくはペプチド)、酵母抽出物、または酵母抽出物由来の成分などの1炭素源、または前述のもののいずれか2つ以上を含む。いくつかの実施形態では、細胞を制限グルコース条件下で培養する。様々な実施形態では、定常期に産出されるイソプレンの量(例えば、産出されるイソプレンの総量またはOD600で1時間当たりブロス1リットルから産出されるイソプレンの量)は、同じ時間の長さで増殖期に産出されるイソプレンの量の2倍以上よりも多いかまたは約2倍以上である。いくつかの実施形態では、気相は、9.5%超または約9.5%(体積)の酸素を含み、気相中のイソプレンの濃度は、引火下限未満であるかまたは引火上限を上回る。特定の実施形態では、(i)気相中のイソプレンの濃度は、引火下限未満であるかまたは引火上限を上回り、(ii)細胞は、約400nmole/gwcm/時間を上回るイソプレンを産出する。
いくつかの実施形態では、本方法は、細胞培養培地中の炭素(mol/mol)の約0.002%超をイソプレンに変換するのに十分な条件下で細胞を培養することを含む。いくつかの実施形態では、本方法はまた、細胞により産出されたイソプレンを回収することを含む。いくつかの実施形態では、本方法は、細胞により産出されたイソプレンを精製することを含む。いくつかの実施形態では、本方法は、イソプレンを重合させることを含む。いくつかの実施形態では、(i)イソプレンシンターゼポリペプチドをコードし、(ii)プロモーターに機能的に連結されている異種核酸を有する。いくつかの実施形態では、細胞を、限定するものではないが、炭水化物、グリセロール、グリセリン、ジヒドロキシアセトン、1炭素源、油、動物性脂肪、動物性油、脂肪酸、脂質、リン脂質、グリセロ脂質、モノグリセリド、ジグリセリド、トリグリセリド、再生可能な炭素源、ポリペプチド(例えば、微生物もしくは植物のタンパク質もしくはペプチド)、酵母抽出物、または酵母抽出物由来の成分などの1炭素源、または前述のもののいずれか2つ以上を含む。いくつかの実施形態では、細胞を制限グルコース条件下で培養する。
いくつかの実施形態では、イソプレンは定常期にのみ産出される。いくつかの実施形態では、イソプレンは増殖期と定常期の両方に産出される。様々な実施形態では、定常期に産出されるイソプレンの量(例えば、産出されるイソプレンの総量またはOD600で1時間当たりブロス1リットルから産出されるイソプレンの量)は、同じ時間の長さで増殖期に産出されるイソプレンの量の約2、3、4、5、10、20、30、40、50倍もしくはそれより多い
一態様では、イソプレンを含む組成物および系を本明細書に記載する。いくつかの実施形態では、組成物は、約2、5、10、20、30、40、50、60、70、80、90、100、200、300、400、500、600、700、800、900、もしくは1000mgまたはそれらより多くのイソプレンを含む。いくつかの実施形態では、組成物は、約2、5、10、20、30、40、50、60、70、80、90、100gmまたはそれらより多くのイソプレン(w/w)を含み、組成物の揮発性有機画分はイソプレンである。
いくつかの実施形態では、組成物は、組成物中の全てのC5炭化水素の総重量と比べて、約99.90、99.92、99.94、99.96、99.98、もしくは100重量%またはそれらをこえる量のイソプレンを含む。いくつかの実施形態では、組成物は、組成物中の全てのC5炭化水素の総重量と比べて、約0.12、0.10、0.08、0.06、0.04、0.02、0.01、0.005、0.001、0.0005、0.0001、0.00005、もしくは0.00001重量%またはそれら未満のイソプレン以外のC5炭化水素(例えば、1,3−シクロペンタジエン、cis−1,3−ペンタジエン、trans−1,3−ペンタジエン、1,4−ペンタジエン、1−ペンチン、2−ペンチン、1−ペンテン、2−メチル−1−ブテン、3−メチル−1−ブチン、ペント−4−エン−1−イン、trans−ペント−3−エン−1−イン、またはcis−ペント−3−エン−1−イン)を含む。いくつかの実施形態では、組成物は1,3−シクロペンタジエン、cis−1,3−ペンタジエン、trans−1,3−ペンタジエン、1,4−ペンタジエン、1−ペンチン、2−ペンチン、1−ペンテン、2−メチル−1−ブテン、3−メチル−1−ブチン、ペント−4−エン−1−イン、trans−ペント−3−エン−1−イン、またはcis−ペント−3−エン−1−インについて、組成物中の全てのC5炭化水素の総重量と比べて、約0.12、0.10、0.08、0.06、0.04、0.02、0.01、0.005、0.001、0.0005、0.0001、0.00005、もしくは0.00001重量%またはそれら未満を有する。特定の実施形態では、組成物は、約2mg超のイソプレンを有し、組成物中の全てのC5炭化水素の総重量と比べて、約99.90、99.92、99.94、99.96、99.98、もしくは100重量%またはそれらより多いイソプレンを有する。
いくつかの実施形態では、組成物は、イソプレンの重合を阻害する、組成物中の任意の化合物について、イソプレンの重合を阻害する約50、40、30、20、10、5、1、0.5、0.1、0.05、0.01、もしくは0.005μg/Lまたはそれ未満の化合物を有する。特定の実施形態では、組成物はまた、約2mg超のイソプレンを有する。
いくつかの実施形態では、組成物は、エタノール、アセトン、C5プレニルアルコール、および10以上の炭素原子を有するイソプレノイド化合物からなる群から選択される1以上の化合物を有する。いくつかの実施形態では、組成物は、約0.005、0.01、0.05、0.1、0.5、1、5、10、20、30、40、60、80、100、もしくは120μg/Lまたはそれらより多くのエタノール、アセトン、C5プレニルアルコール(例えば、3−メチル−3−ブテン−1−オールもしくは3−メチル−2−ブテン−1−オール)、または前述のもののいずれか2つ以上を有する。特定の実施形態では、組成物は、約2mg超のイソプレンを有し、エタノール、アセトン、C5プレニルアルコール、および10以上の炭素原子を有するイソプレノイド化合物からなる群から選択される1以上の化合物を有する。
いくつかの実施形態では、組成物は、イソプレンと、2−ヘプタノン、6−メチル−5−ヘプタン−2−オン、2,4,5−トリメチルピリジン、2,3,5−トリメチルピラジン、シトロネラル、アセトアルデヒド、メタンチオール、メチルアセタート、1−プロパノール、ジアセチル、2−ブタノン、2−メチル−3−ブテン−2−オール、エチルアセタート、2−メチル−1−プロパノール、3−メチル−1ブタナール、3−メチル−2−ブタノン、1−ブタノール、2−ペンタノン、3−メチル−1−ブタノール、エチルイソブチレート、3−メチル−2−ブテナール、ブチルアセタート、3−メチルブチルアセタート、3−メチル−3−ブテン−1−イルアセタート、3−メチル−2−ブテン−1−イルアセタート、3−ヘキセン−1−オール、3−ヘキセン−1−イルアセタート、リモネン、ゲラニオール(trans−3,7−ジメチル−2,6−オクタジエン−1−オール)、シトロネロール(3,7−ジメチル−6−オクテン−1−オール)、(E)−3,7−ジメチル−1,3,6−オクタトリエン、(Z)−3,7−ジメチル−1,3,6−オクタトリエン、および2,3−シクロヘプテノルピリジンからなる群から選択される1以上の第2の化合物とを含む。様々な実施形態では、重量パーセント(すなわち、成分の重量をイソプレンの重量で割って100を掛けたもの)の単位で表されるイソプレンの量と比べたこれらの第2の成分の1つの量は、約0.01、0.02、0.05、0.1、0.5、1、5、10、20、30、40、50、60、70、80、90、100、もしくは110%(w/w)またはそれらより多い。
いくつかの実施形態では、組成物は、(i)イソプレンを含む気相と、(ii)約400nmole/gwcm/時間またはそれらを上回るイソプレンを産出する培養細胞とを含む。いくつかの実施形態では、組成物は閉鎖系を含み、気相は、1時間培養した1mLの1OD600に対して標準化したとき、約5、10、20、30、40、50、60、70、80、90、100μg/Lまたはそれらを超えるイソプレンを含む。いくつかの実施形態では、組成物は、開放系を含み、気相は、1vvmの速度で放出されるとき、約5、10、20、30、40、50、60、70、80、90、100μg/Lまたはそれらを超えるイソプレンを含む。いくつかの実施形態では、気相の揮発性有機画分は、揮発性有機画分中の全てのC5炭化水素の総量と比べて、約99.90、99.92、99.94、99.96、99.98、もしくは100重量%またはそれらを超えるイソプレンを含む。いくつかの実施形態では、気相の揮発性有機画分は、揮発性有機画分中の全てのC5炭化水素の総量と比べて、約0.12、0.10、0.08、0.06、0.04、0.02、0.01、0.005、0.001、0.0005、0.0001、0.00005、もしくは0.00001重量%またはそれら未満の1,3−シクロペンタジエン、cis−1,3−ペンタジエン、trans−1,3−ペンタジエン、1,4−ペンタジエン、1−ペンチン、2−ペンチン、1−ペンテン、2−メチル−1−ブテン、3−メチル−1−ブチン、ペント−4−エン−1−イン、trans−ペント−3−エン−1−イン、またはcis−ペント−3−エン−1−インを含む。特定の実施形態では、気相の揮発性有機画分は、約2mg超のイソプレンを有し、揮発性有機画分中の全てのC5炭化水素の総量と比べて、約99.90、99.92、99.94、99.96、99.98、もしくは100重量%またはそれより多いイソプレンを有する。
いくつかの実施形態では、気相の揮発性有機画分は、イソプレンの重合を阻害する、気相の揮発性有機画分中の任意の化合物について、イソプレンの重合を阻害する約50、40、30、20、10、5、1、0.5、0.1、0.05、0.01、もしくは0.005μg/Lまたはそれ未満の化合物を有する。特定の実施形態では、気相の揮発性有機画分はまた、約2mg超のイソプレンを有する。
いくつかの実施形態では、気相の揮発性有機画分は、エタノール、アセトン、C5プレニルアルコール、および10以上の炭素原子を有するイソプレノイド化合物からなる群から選択される1以上の化合物を有する。いくつかの実施形態では、気相の揮発性有機画分は、約0.005、0.01、0.05、0.1、0.5、1、5、10、20、30、40、60、80、100、もしくは120μg/Lまたはそれらより多くのエタノール、アセトン、C5プレニルアルコール(例えば、3−メチル−3−ブテン−1−オールまたは3−メチル−2−ブテン−1−オール)、または前述のもののいずれか2つ以上を有する。特定の実施形態では、気相の揮発性有機画分は、約2mg超のイソプレンを有し、エタノール、アセトン、C5プレニルアルコール、および10以上の炭素原子を有するイソプレノイド化合物からなる群から選択される1以上の化合物を有する。
いくつかの実施形態では、気相の揮発性有機画分は、イソプレンと、2−ヘプタノン、6−メチル−5−ヘプタン−2−オン、2,4,5−トリメチルピリジン、2,3,5−トリメチルピラジン、シトロネラル、アセトアルデヒド、メタンチオール、メチルアセタート、1−プロパノール、ジアセチル、2−ブタノン、2−メチル−3−ブテン−2−オール、エチルアセタート、2−メチル−1−プロパノール、3−メチル−1ブタナール、3−メチル−2−ブタノン、1−ブタノール、2−ペンタノン、3−メチル−1−ブタノール、エチルイソブチレート、3−メチル−2−ブテナール、ブチルアセタート、3−メチルブチルアセタート、3−メチル−3−ブテン−1−イルアセタート、3−メチル−2−ブテン−1−イルアセタート、3−ヘキセン−1−イルアセタート、リモネン、ゲラニオール(trans−3,7−ジメチル−2,6−オクタジエン−1−オール)、シトロネロール(3,7−ジメチル−6−オクテン−1−オール)、(E)−3,7−ジメチル−1,3,6−オクタトリエン、(Z)−3,7−ジメチル−1,3,6−オクタトリエン、および2,3−シクロヘプテノルピリジンからなる群から選択される1以上の第2の化合物とを含む。様々な実施形態では、重量パーセント(すなわち、成分の重量をイソプレンの重量で割って100を掛けたもの)の単位で表されるイソプレンの量と比べたこれらの第2の成分の1つの量は、気相の揮発性有機画分中、約0.01、0.02、0.05、0.1、0.5、1、5、10、20、30、40、50、60、70、80、90、100、もしくは110%(w/w)またはそれらより多い量である。
本発明の組成物のいずれかのいくつかの実施形態では、イソプレンの少なくとも一部は気相中にある。いくつかの実施形態では、イソプレンの少なくとも一部は、液相(例えば、凝結物)中にある。いくつかの実施形態では、イソプレンの少なくとも一部は固相中にある。いくつかの実施形態では、イソプレンの少なくとも一部は、シリカおよび/または活性炭を含む支持体などの固体支持体に吸着する。いくつかの実施形態では、組成物は、エタノールを含む。いくつかの実施形態では、組成物は、約75〜約90重量%のエタノール、例えば、約75〜約80重量%、約80〜約85重量%、または約85〜約90重量%のエタノールを含む。いくつかの実施形態では、組成物は、約4〜約15重量%のイソプレン、例えば、約4〜約8重量%、約8〜約12重量%、または約12〜約15重量%のイソプレンを含む。
いくつかの実施形態では、本方法はまた、本明細書に記載の細胞および/または組成物のいずれかを含む系を特徴とする。いくつかの実施形態では、この系は、チャンバーが、約400、500、600、700、800、900、1,000、1,250、1,500、1,750、2,000、2,500、3,000、4,000、5,000nmole/gwcm/時間、またはそれより多くをイソプレンを産出する培養細胞を含む反応器を含む。いくつかの実施形態では、この系は、閉鎖系ではない。いくつかの実施形態では、イソプレンの少なくとも一部をこの系から取り出す。いくつかの実施形態では、この系は、イソプレンを含む気相を含む。様々な実施形態では、この気相は、本明細書に記載の組成物のいずれかを含む。
本明細書に記載の組成物、系および方法のいずれかのいくつかの実施形態では、気相中の引火しない濃度のイソプレンが産出される。いくつかの実施形態では、気相は、約9.5%(体積)未満の酸素を含む。いくつかの実施形態では、気相は、9.5%(体積)超または約9.5%(体積)の酸素を含み、気相中のイソプレンの濃度は、引火下限未満であるかまたは引火上限を上回る。いくつかの実施形態では、イソプレン以外の気相の部分は、約0%〜約100%(体積)の酸素、例えば、約10%〜約100%(体積)の酸素を含む。いくつかの実施形態では、イソプレン以外の気相の部分は、約0%〜約99%(体積)の窒素を含む。いくつかの実施形態では、イソプレン以外の気相の部分は、約1%〜約50%(体積)のCO2を含む。
本明細書に記載の態様のいずれかのいくつかの実施形態では、培養細胞は、約400、500、600、700、800、900、1,000、1,250、1,500、1,750、2,000、2,500、3,000、4,000、5,000nmole/gwcm/時間、またはそれより多くのイソプレンを産出する。本明細書に記載の態様のいずれかのいくつかの実施形態では、培養細胞は、細胞培養培地中の炭素の約0.002、0.005、0.01、0.02、0.05、0.1、0.12、0.14、0.16、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0、1.2、1.4、1.6%、もしくはそれより多くをイソプレンに変換する。本明細書に記載の態様のいずれかのいくつかの実施形態では、培養細胞は、約1、10、25、50、100、150、200、250、300、400、500、600、700、800、900、1,000、1,250、1,500、1,750、2,000、2,500、3,000、4,000、5,000、10,000、100,000ng、もしくはそれより多いイソプレン/細胞の湿重量に対する細胞のグラム/時間(ng/gwcm/h)でイソプレンを産出する。本明細書に記載の態様のいずれかのいくつかの実施形態では、培養細胞は、約1、10、25、50、100、150、200、250、300、400、500、600、700、800、900、1,000、1,250、1,500、1,750、2,000、2,500、3,000、4,000、5,000、10,000、50,000、100,000mg、もしくはそれより多いイソプレン/ブロスのL(mg/Lブロスブロスの容量は細胞の容量と培地の容量を含む)で累積力価(総量)のイソプレンを産出する。他の例示的なイソプレン産出の速度とイソプレン産出の総量が本明細書に開示されている。
本明細書に記載の態様のいずれかのいくつかの実施形態では、細胞はさらに、IDIポリペプチドをコードする異種核酸を含む。本明細書に記載の態様のいずれかのいくつかの実施形態では、細胞はさらに、IDIポリペプチドをコードする1コピーの内在性核酸の挿入を含む。本明細書に記載の態様のいずれかのいくつかの実施形態では、細胞はさらに、DXSポリペプチドをコードする異種核酸を含む。本明細書に記載の態様のいずれかのいくつかの実施形態では、細胞はさらに、DXSポリペプチドをコードする1コピーの内在性核酸の挿入を含む。本明細書に記載の態様のいずれかのいくつかの実施形態では、細胞はさらに、IDIポリペプチドとDXSポリペプチドをコードする1以上の核酸を含む。本明細書に記載の態様のいずれかのいくつかの実施形態では、1つの核酸が、イソプレンシンターゼポリペプチドとIDIポリペプチドとDXSポリペプチドをコードする。本明細書に記載の態様のいずれかのいくつかの実施形態では、1つのベクターが、イソプレンシンターゼポリペプチドとIDIポリペプチドとDXSポリペプチドをコードする。いくつかの実施形態では、ベクターは、抗生物質耐性核酸などの選択マーカーを含む。
本明細書に記載の態様のいずれかのいくつかの実施形態では、異種イソプレンシンターゼ核酸は、T7プロモーター(例えば、中または高コピープラスミドに含まれるT7プロモーター)に機能的に連結されている。本明細書に記載の態様のいずれかのいくつかの実施形態では、異種イソプレンシンターゼ核酸は、Trcプロモーター(例えば、中または高コピープラスミドに含まれるTrcプロモーター)に機能的に連結されている。本明細書に記載の態様のいずれかのいくつかの実施形態では、異種イソプレンシンターゼ核酸は、Lacプロモーター(例えば、低コピープラスミドに含まれるLacプロモーター)に機能的に連結されている。本明細書に記載の態様のいずれかのいくつかの実施形態では、異種イソプレンシンターゼ核酸は、内在性プロモーター(例えば、内在性アルカリ性セリンプロテアーゼプロモーター)に機能的に連結されている。いくつかの実施形態では、異種イソプレンシンターゼ核酸は、選択マーカーを伴わずに細胞の染色体に組み込まれる。
いくつかの実施形態では、1以上のMVA経路、IDI、DXP、またはイソプレンシンターゼ核酸は、増殖期よりも定常期に活性の高いプロモーターまたは因子の制御下に置かれている。例えば、1以上のMVA経路、IDI、DXP、またはイソプレンシンターゼ核酸は、定常期σ因子(例えば、RpoS)の制御下に置かれていてもよい。いくつかの実施形態では、1以上のMVA経路、IDI、DXP、またはイソプレンシンターゼ核酸は、定常期に誘導可能なプロモーター(例えば、定常期に活性のある応答調節因子によって誘導可能なプロモーター)の制御下に置かれている。
本明細書に記載の態様のいずれかのいくつかの実施形態では、細胞の少なくとも一部は、連続培養(例えば、希釈しない連続培養)において少なくともまたは約5、10、20、40、50、60、65回、またはそれより多くの細胞分裂の間、異種イソプレンシンターゼ核酸を維持する。本明細書に記載の態様のいずれかのいくつかの実施形態では、イソプレンシンターゼ、IDI、またはDXS核酸を含む核酸はまた、抗生物質耐性核酸などの選択マーカーを含む。
本明細書に記載の態様のいずれかのいくつかの実施形態では、細胞はさらに、MVA経路ポリペプチド(例えば、出芽酵母またはエンテロコックス・フェカーリス由来のMVA経路ポリペプチド)をコードする異種核酸を含む。本明細書に記載の態様のいずれかのいくつかの実施形態では、細胞はさらに、MVA経路ポリペプチド(例えば、出芽酵母またはエンテロコックス・フェカーリス由来のMVA経路ポリペプチド)をコードする1コピーの内在性核酸の挿入を含む。本明細書に記載の態様のいずれかのいくつかの実施形態では、細胞は、イソプレンシンターゼ、DXS、およびMVA経路核酸を含む。本明細書に記載の態様のいずれかのいくつかの実施形態では、細胞は、イソプレンシンターゼ核酸、DXS核酸、IDI核酸、および(IDI核酸に加えて)MVA経路核酸を含む。
本明細書に記載の態様のいずれかのいくつかの実施形態では、イソプレンシンターゼポリペプチドは、クズ属(例えば、タイワンクズもしくはクズ)またはポプラ属(例えば、アメリカヤマナラシ、ウラジロハコヤナギ、クロヤマナラシ、ブラックコットンウッド、もしくは交配種であるウラジロハコヤナギ×ヨーロッパヤマナラシ)などの植物由来のポリペプチドである。
本明細書に記載の態様のいずれかのいくつかの実施形態では、細胞は、グラム陽性細菌細胞(例えば、枯草菌細胞などのバシルス細胞またはストレプトミセス・リビダンス、ストレプトミセス・コエリコロル、もしくはストレプトミセス・グリセウス細胞などのストレプトミセス細胞)などの細菌細胞である。本明細書に記載の態様のいずれかのいくつかの実施形態では、細胞は、グラム陰性細菌細胞(例えば、大腸菌細胞などのエシェリキア細胞、ロドシュードモナス・パルストリス細胞などのロドシュードモナス種、シュードモナス・フルオレセンス細胞もしくはシュードモナス・プチダ細胞などのシュードモナス種、またはパントエア・シトレア細胞などのパントエア細胞)である。本明細書に記載の態様のいずれかのいくつかの実施形態では、細胞は、糸状真菌細胞(例えば、トリコデルマ・リーゼイ細胞などのトリコデルマ細胞もしくはアスペルギルス・オリザエおよびアスペルギルス・ニゲルなどのアスペルギルス細胞)または酵母細胞(例えば、ヤロウイア・リポリティカ細胞などのヤロウイア細胞または出芽酵母などのサッカロミセス細胞)などの真菌細胞である。
本明細書に記載の態様のいずれかのいくつかの実施形態では、微生物ポリペプチド炭素源は、酵母または細菌由来の1以上のポリペプチドを含む。本明細書に記載の態様のいずれかのいくつかの実施形態では、植物ポリペプチド炭素源は、大豆、トウモロコシ、キャノーラ、ジャトロファ、ヤシ、落花生、ヒマワリ、ココナッツ、カラシ、菜種、綿の実、パーム核、オリーブ、サフラワー、ゴマ、またはアマニ由来の1以上のポリペプチドを含む。
エネルギー源として合成ガスを用いる嫌気性細菌におけるイソプレンの産出
いくつかの実施形態では、Bioisoprene組成物は、米国仮特許出願第61/289,347号および第61/289,355号(2009年12月22日出願)(この開示は、その全体が参照により本明細書に組み込まれる)に記載されているように、エネルギー源として合成ガスを用いる嫌気性細菌において産出される。
嫌気性生物による合成ガスからのイソプレンの産出は、好気性生物による糖からのイソプレンの産出に対していくつかの利点を提供し得る。第1に、イソプレンの質量収率の最大理論値は、以下にさらに論じるように、好気性生物においてより高値であり得る。第2に、嫌気性生物は、細胞増殖、副産物(例えば、グリセロール、乳酸、またはエタノール)の形成または分子酸素を用いた酸化を介してターンオーバーしなければならないNAD(P)H状の過剰な還元粉を有さない。このNAD(P)Hターンオーバーを必要とせずに、嫌気性生物のエネルギー収率はより高く、酸素の需要量はより低く、発酵熱はより低いことができ、プロセス実行の使用コストを下げる。第3に、系における酸素欠如のため、嫌気性生物は、オフガス中でより高いイソプレン濃度、引火イソプレン−酸素混合物生成のより低い可能性、より容易な回収、およびより高いイソプレン質を有することができる。第4に、嫌気性生物は、既存の基盤、例えば、バイオエタノールの産出のために設計した既存の植物を用いることにより、より容易に増殖できる。
イソプレン産出のために有用な嫌気性生物としては、偏性好気性菌、条件的好気性菌、および酸素耐性好気性菌を挙げることができる。偏性好気性菌は、Clostridium ljungdahlii、Clostridium autoethanogenum、Eurobacterium limosum、Clostridium carboxydivorans、Peptostreptococcus productus、およびButyribacterium methylotrophicumからなる群から選択される任意の1つまたは組み合わせであることができる。イソプレンの産出のためのエネルギー源として有用な合成ガスは、メタン改良、石炭液化、共燃焼、発酵反応、酵素反応、およびバイオマスガス化を含む種々のプロセスにより供給溶液から得ることができる。
例示的な精製方法
いくつかの実施形態では、本明細書に記載の方法はいずれも、共産出された化合物を回収することをさらに含む。いくつかの実施形態では、本明細書に記載の方法はいずれも、イソプレンを回収することをさらに含む。いくつかの実施形態では、本明細書に記載の方法はいずれも、極低温膜吸着マトリックスに基づく分離方法によって水素を回収することをさらに含む。
本明細書に記載の組成物および方法を用いて産出されるイソプレンと水素を、固相からのイソプレンのガスストリッピング、膜増強分離、分別、吸着/脱離、パーベーパレーション、熱脱離もしくは真空脱離、または溶媒による固相に固定化もしくは吸収されたイソプレンの抽出などの標準的な技術を用いて回収することができる(例えば、米国特許第4,703,007号、第4,570,029号、および第4,740,222号(「Recovery and Purification of Hydrogen from Refinery and Petrochemical Off−gas Streams」)を参照されたく、特に、イソプレンの回収および精製方法(’007号および’029号特許)に関して、および水素の回収および精製方法(’222号特許)に関して、その全体が参照により本明細書に組み込まれる。)。特定の実施形態では、アルコール(例えば、エタノール、メタノール、プロパノール、またはそれらの組合せ)による抽出蒸留を用いて、イソプレンを回収する。いくつかの実施形態では、イソプレンの回収は、液体形態のイソプレン(例えば、イソプレンのニート溶液または溶媒中のイソプレン溶液)の単離を含む。ガスストリッピングは、連続的に発酵オフガス流からイソプレン蒸気を除去することを含む。このような除去を、限定するものではないが、固相への吸着、液相への分離、または直接的な凝結(例えば、凝結コイルへの曝露もしくは圧力の増加による凝結)をはじめとするいくつかの異なる方法で達成することができる。いくつかの実施形態では、蒸気の露点を超えた希薄なイソプレン蒸気流の膜濃縮により、液体イソプレンの凝結が生じる。いくつかの実施形態では、イソプレンを圧縮および凝結させる。
イソプレンの回収は、1工程または複数工程を含み得る。いくつかの実施形態では、発酵オフガスからのイソプレン蒸気の除去とイソプレンの液相への変換を同時に行なう。例えば、イソプレンをオフガス流から直接凝結させて、液体を形成させることができる。いくつかの実施形態では、発酵オフガスからのイソプレン蒸気の除去とイソプレンの液相への変換を順次行なう。例えば、イソプレンを固相に吸着させ、その後、溶媒を用いて固相から抽出し得る。
水素の回収は、1工程または複数工程を含み得る。いくつかの実施形態では、発酵オフガスからの水素ガスの除去と水素の液相への変換を同時に行なう。いくつかの実施形態では、発酵オフガスからの水素ガスの除去と水素の液相への変換を順次行なう。例えば、水素を固相に吸着させ、その後、圧力スイングによって固相から脱離させ得る。
いくつかの実施形態では、本明細書に記載の方法はいずれも、イソプレンを精製することをさらに含む。例えば、本明細書に記載の組成物および方法を用いて産出されたイソプレンを、標準的な技術を用いて精製することができる。精製とは、イソプレンが産出されるときに存在する1以上の成分からイソプレンを分離するプロセスを指す。いくつかの実施形態では、イソプレンを実質的に純粋な液体として得る。精製方法の例としては、(i)液体抽出剤中の溶液からの蒸留および(ii)クロマトグラフィーが挙げられる。本明細書で使用される場合、「精製イソプレン」は、イソプレンが産出されるときに存在する1以上の成分から分離されたイソプレンを意味する。いくつかの実施形態では、イソプレンは、少なくとも約20重量%であり、イソプレンが産出されるときに存在する他の成分を含まない。様々な実施形態では、イソプレンは、少なくともまたは約25重量%、30重量%、40重量%、50重量%、60重量%、70重量%、75重量%、80重量%、90重量%、95重量%、または99重量%で、純粋である。純度は、任意の適切な方法により、例えば、カラムクロマトグラフィー、HPLC分析、またはGC−MS分析により、アッセイすることができる。
いくつかの実施形態では、本明細書に記載の方法はいずれも、水素を精製することをさらに含む。例えば、本明細書に記載の組成物および方法を用いて産出された水素を、標準的な技術を用いて精製することができる。精製とは、水素が産出されるときに存在する1以上の成分から水素を分離するプロセスを指す。いくつかの実施形態では、水素を実質的に純粋なガスとして得る。いくつかの実施形態では、水素を実質的に純粋な液体として得る。精製方法の例としては、(i)極低温凝結および(ii)固体マトリックス吸着が挙げられる。本明細書で使用される場合、「精製水素」は、水素が産出されるときに存在する1以上の成分から分離された水素を意味する。いくつかの実施形態では、水素は、少なくとも約20重量%であり、水素が産出されるときに存在する他の成分を含まない。様々な実施形態では、水素は、少なくともまたは約25重量%、30重量%、40重量%、50重量%、60重量%、70重量%、75重量%、80重量%、90重量%、95重量%、または99重量%で、純粋である。純度は、任意の適切な方法により、例えば、カラムクロマトグラフィーまたはGC−MS分析により、アッセイすることができる。
いくつかの実施形態では、イソプレンを除去するための1以上の回収工程の後に残存する気相の少なくとも一部が、この気相をイソプレン産出用の細胞培養系(例えば、発酵槽)に導入することにより再利用される。
発酵オフガスからのBioisoprene組成物の精製の方法および装置は、米国仮特許出願第61/88,142号(2009年12月18日出願)に記載され、その全体が参照により本明細書に組み込まれる。
発酵オフガスからのBioisoprene組成物は、揮発性不純物および生体副産物不純物とBioisopreneを含み得る。いくつかの実施形態では、発酵オフガスからのBioisoprene組成物は、以下を含む方法を用いて精製する:(a)発酵オフガスを第1のカラム内の溶媒と接触させて、溶媒、大部分のイソプレンおよび大部分の生体副産物不純物を含むイソプレンの豊富な溶液;ならびに大部分の揮発性不純物を含む蒸気を形成すること;(b)イソプレンの豊富な溶液を第1のカラムから第2のカラムへ移すこと;ならびに(c)第2のカラムのイソプレンの豊富な溶液からイソプレンをストリッピングして大部分の生体副産物不純物;ならびに精製されたイソプレン組成物を含むイソプレン希薄液を形成することである。
図169にイソプレンの例示的な精製方法および例示的な装置を例証する。イソプレンを含む発酵オフガスは、例えば、米国仮特許出願第61/187,944号に記載されている(この内容は、特に、イソプレンを含む発酵オフガスを産出する方法に関して、参照により本明細書に組み込まれる)当該技術分野の任意の方法により、再生可能な資源(例えば、炭素源)から生成し得る。1以上の個々の発酵槽12(連続しておよび/または並行して接続した、例えば、1、2、3、4、5、6、7、8、またはそれより多い発酵槽)から生成された発酵オフガスは第1のカラム14を通過するように方向付け得る。下記のとおり、発酵オフガスは単離単位16を通過するように方向付け得るおよび/または圧力手段、例えば、圧力系18により圧縮し得る。追加的に、発酵オフガス温度は任意選択的に溶媒との接触前の任意の時点で低下させて、例えば、凝結物または部分的な凝結物を形成させ得る(これは1以上のオフガス成分、例えば、イソプレンの可溶化を促進し得る)。発酵オフガスは、カラム14で溶媒(例えば、本明細書に記載の任意の溶媒、例えば、非極性の高沸点溶媒)と接触(例えば、吸着)し得る。溶媒中の吸着傾向の低い揮発性不純物(特に非極性の高沸点溶媒)は残りの溶媒/発酵オフガス混合物から分離し、(例えば、ポート20に存在する)大部分の揮発性不純物を含む蒸気、ならびに大部分のイソプレンおよび大部分の生体副産物不純物(例えば、ポート22)を有するイソプレンの豊富な溶液を生じる。溶媒は、発酵オフガスと接触の前、接触と同時、および/または接触後に任意の適切な手段により(例えば、蒸気により)任意選択的に加熱し得、これは残りの溶液からの揮発性不純物の分離を促進し得る。蒸気は、カラム(任意の適切な位置、例えば、図169に示すとおりオフガス入り口付近および/または揮発性不純物が出る反対端)を通過するように方向付け得、揮発性不純物の除去を促進し得る湿潤性蒸気相を提供する。
大部分のイソプレンおよび大部分の生体副産物不純物を(例えば、ポート22で)有するイソプレンの豊富な溶液は、第2のカラム24を通過するように方向付け得る。第2のカラムは、(図169に示すように)第1のカラム14から単離されてもよく、または第1のカラムと第2のカラムの両方を含む単一カラム(例えば、溶媒が第1のカラムの片端またはその付近に入り、反対端またはその付近の第2のカラムから出る直列カラム)の一部であってもよい。イソプレンは、第2のカラム内のイソプレンの豊富な溶液からストリップして、(例えば、ポート26で)精製されたイソプレン組成物を、および(例えば、ポート28で)大部分の生体副産物不純物を含むイソプレン希薄液を生成し得る。イソプレンの豊富な溶液は、任意の適切な手段により(例えば、蒸気により)加熱し得、これは残りの溶液からのイソプレンのストリッピングを促進し得る。蒸気は、カラム(任意の適切な位置、例えば、図169に示すようにイソプレンの豊富な溶液の入り口と反対端および/またはイソプレン希薄液の出口付近)を通過するように方向付け得る。
本明細書に記載のように、カラムは、従来のおよび任意の適切なサイズであり得る。例示的なタイプのカラムは、Koch Modularプロセスシステム(Paramus, NJ)、Fluor Corporation (Irving, TX), Kuhni USA (Mount Holly, NC)を含む製造元から市販されている。通常、カラムは、所望の有効性を得るために蒸気/液体との接触を最大化するように設計されている。これは、カラムに、カラムに沿って一定間隔でパッキング物質、またはトレーのいずれかを装填することによって達成される。適切なパッキング物質としては、金属、ガラス、ポリマーおよびセラミック物質に基づく無作為タイプと構造タイプの両方が挙げられる。例示的な無作為パッキングタイプとしては、Raschig rings, Pall rings, A−PAK rings, Saddle rings, Pro−Pak, Heli−Pak, Ceramic saddles and FLEXIRINGS(登録商標)が挙げられる。構築パッキングとしては、ワイヤーメッシュおよび穿孔性金属プレートタイプ物質が挙げられる。カラムパッキング専門製造元としては、ACS Separations & Mass−Transfer Products (Houston, TX), Johnson Bros. Metal Forming Co. (Berkeley, IL) and Koch Glitsch, Inc. Knight Div. (East Canton, OH)が挙げられる。ガスストリッピングカラムの有効性は、カラム内のプレートの理論的なプレートの高さおよび総数に関して表される。通常、理論的なプレート数値が高いほど、カラムの有効性は高い。実験室規模のカラムは、Ace Glass (Vineland, NJ), Sigma−Aldrich (St. Louis, MO)およびChemglass (Vineland, NJ)から購入できる。適切なタイプのガラス製カラムとしては、Vigreux、Snyder、HempleおよびPerforatedプレートタイプカラムが挙げられる。カラムは、パッキング材料を含むこともでき、蒸気/液体接触を最大化するように設計された特徴を含むこともできる。実験室規模のガス洗浄器単位(パーツ番号CG−1830−10)は、Chemglassから入手可能であり、パックしたガラス製カラム、溶媒容器および溶媒再利用ポンプからなる。
第2のカラム24(例えば、ポート26に存在する)から精製されたイソプレン組成物は、任意の適切な手段により(例えば、還流コンデンサー34および/または吸着系36、例えば、シリカ吸着系を用いて)、さらに精製し得る。還流は、イソプレン産物中の溶媒組成物を還元する。イソプレン希薄液は、(例えば、図169ポート30に示すように)再利用のために第1のカラムに戻して再循環させ得る。イソプレン希薄液は、第1のカラム14への再利用前に任意の適切な手段により(例えば、液体−液体抽出および/または吸着系32、例えば、シリカ吸着系により)精製して、生体副産物の量を減らし得る。追加的に、イソプレン希薄液の温度は、第1のカラム14への再利用前(例えば、任意選択的にイソプレン溶液の精製前、精製と同時、および/または精製後)に任意の適切な手段により低下させ得る。図169に、イソプレン希薄液の精製前のポート40におけるイソプレン希薄液の温度低下の例(この場合、温度を低下させるための冷却液を使用)を示す。
大部分の揮発性不純物を含む蒸気(例えば、図169のポート20から出る蒸気)は、少量のイソプレン(例えば、イソプレンの豊富な溶液中に残らない残存イソプレン)を含み得る。残存イソプレンは、使用のため、大部分の揮発性不純物を含む蒸気から任意の適切な手段(例えば、吸着系38、例えば、活性炭吸着系)により再回収し得、場合により、図169に示すように、精製されたイソプレン組成物と組み合わせ得る(例えば、追加の精製、例えば、系36に類似している吸着系の前、間、または後)。図169には、蒸気から大気(例えば、CO2)中に放出された望ましくない成分量を減らすことができる任意選択的な捕獲機器42(例えば、熱酸化剤および/またはCO2捕獲系)も示す。
イソプレンの例示的な化学的変換
現在のイソプレンの産業的使用の大部分は合成ゴムの産出であるが、イソプレンは反応性の抱合体化ジエンであり、種々の化学的変換を経て、酸素化物およびより高い分子量の炭化水素を形成する。例えば、パラジウム(0)錯体(Pd(acac)2−Ph3PおよびPd(OAc)2−Ph3P)はアルコール溶媒中のイソプレンの二量体化および短鎖重合化を触媒して、線状イソプレン二量体(例えば2,7−ジメチル−1,3,7−オクタトリエン)およびメトキシジメチルオクタジエンを得る(Zakharkin, L. I. and Babich, S. A. Russ. Chem. Bull. (1976), pp 1967−1968)。Adams, J. M. and Clapp, T. V. (Clay and Clay Minerals (1986), 34(3), 287−294)は、イソプレン二量体およびメタノールとの付加物を得るための、2価および3価転移金属交換モンモリロナイト(例えばCr3+−モンモリロナイト)上のイソプレン反応について報告している。Ni(0)−アミノ亜ホスフィン酸系により触媒化されたイソプレンの線状二量体化はtail−to−tail型の位置選択的線状二量体に至り、競合的シクロ二量体化反応によって達成される(Denis, Philippe; Croizy, Jean Francois; Mortreux, Andre; Petit, Francis, Journal of Molecular Catalysis (1991), 68(2), 159−75. Denis, Philippe; Jean, Andre; Croizy, Jean Francois; Mortreux, Andre; Petit, Francis, Journal of the American Chemical Society (1990), 112(3), 1292−4)。新規キラルアミノ亜ホスフィン酸リガンド、例えば、(+)−MeCH2CHMeCH(NH2)CH2OPPh2がイソプレンの線状二量体化における同種の触媒として調査され、50%以上の変換率に至った(Masotti, Henriette; Peiffer, Gilbert; Siv, Chhan; Courbis, Pierre; Sergent, Michelle; Phan Tan Luu, Roger, Bulletin des Societes Chimiques Belges (1991), 100(1), 63−77)。
ポリマー化阻害剤としてのジニトロクレゾールの存在下、110〜250℃でイソプレンの熱二量体化により高収率の二量体およびわずかなポリマーを得た(米国特許第4,973,787号)。イソプレンのNi触媒化二量体化により、80%の1,5−ジメチル−1,5−シクロオクタジエンおよび20%の1,6−ジメチル−1,5−シクロオクタジエンからなるジメチル−1,5−シクロオクタジエン混合物を得る(Doppelt, Pascal; Baum, Thomas H.; Ricard, Louis, Inorganic Chemistry (1996), 35(5), 1286−91)。
イソプレンは、触媒量のCp*Ru(η4−イソプレン)ClおよびAgOTfでジメチルシクロオクタジエンに変換される(Itoh, Kenji; Masuda, Katsuyuki; Fukahori, Takahiko; Nakano, Katsumasa; Aoki, Katsuyuki; Nagashima, Hideo, Organometallics (1994), 13(3), 1020−9)。
日本国特許第59065026A号(1984年)は、Feカルボキシレートもしくはβ−ジケトン化合物、有機−AlもしくはMg化合物、ならびに電子供与基を有する2,2’−ジピリジル誘導体を含む触媒存在下のイソプレンの環状二量体化による1,6−ジメチル−1,5−シクロオクタジエンの調製について報告している。Niカルボキシレートもしくはβ−ケトン、有機アルミニウムもしくは有機マグネシウム化合物ならびに置換したトリフェニル亜リン酸を含む3成分触媒上でのイソプレンのシクロ二量体化によりジメチルシクロオクタジエンを調製した(日本国特許第58055434A号、1983年)。Fe(3)塩、有機アルミニウム化合物および活性化因子を含む同種の触媒の存在下(ソ連特許第615056A1号、1978年)、Niアセチルアセトネート、亜リン酸トリアリールおよびペルヒドロアルモフェノレンを含む同種の触媒の存在下(ソ連特許第493455A1号、1975年)、NiカルボキシレートまたはNiと1−ヒドロキシ−3−カルボニル化合物のカルボキシレートもしくはキレート化合物の混合物、トリアルキルアルミニウム、ジアルキルマグネシウムまたは抱合体化ジエンおよびMg、亜リン酸トリアリールおよび三次アミンから得られる活性有機−Mg化合物を含む触媒の存在下(日本国特許第48064049A号、1973年)、またはNiナフテン酸、Et3Al、およびトリ−o−クレシルホスファートからなる触媒の存在下において100〜300℃で不活性有機溶媒中のイソプレンをシクロ二量体化させて、1,5−ジメチル−1,5−シクロオクタジエンを調製した(Suga, K.; Watanabe, S.; Fujita, T.; Shimada, T., Israel Journal of Chemistry (1972), 10(1), 15−18)。米国特許第3,954,665号には、Fe、Co、またはNiカルボニルと[(η3−C6H5)NiBr]2または[M(NO)2X]2(M=Fe、Co;X=Cl、I、Br)反応産物の存在下でのイソプレンの二量体化について開示されている。欧州特許第2411(1981)には、1−メチル−4−イソプロペニル−1−シクロヘキセンおよび2−メチル−4−イソプロペニル−1−シクロヘキセンならびに1,4−ジメチル−4−ビニル−1−シクロヘキセンおよび2,4−ジメチル−4−ビニル−1−シクロヘキセンを得るための、Fe(NO)2Cl−ビス(1,5−シクロオクタジエン)ニッケル触媒上、−5℃〜+20℃でのイソプレンのシクロ二量体化について開示されている。米国特許第4,189,403号には、トリス(置換したヒドロカルビル)亜リン酸、亜ヒ酸、もしくはアンチモナイトならびにVIII群金属(0)化合物(例えばNiアセチルアセトネート)の混合した触媒とイソプレンを接触させることによる1,5−ジメチル−1,5−シクロオクタジエンおよび1,4−ジメチル−4−ビニル−1−シクロヘキセンの調製について開示されている。Jackstell, R.; Grotevendt, A.; Michalik, D.; El Firdoussi, L.; Beller, M. J. Organometallic Chem. (2007) 692(21), 4737−4744には、イソプレン二量体化のためのパラジウム/カルベン触媒の使用について引用されている。Bowen, L.; Charernsuk, M.; Wass, D.F. Chem. Commun. (2007) 2835−2837は線状および環状イソプレン三量体の産出のためのクロムN,N−ビス(ジアリールホスフィノ)アミン触媒の使用について記載している。
イソプレンはNi触媒の存在下で二量体化して、cis−2−イソプロペニル−1−メチルビニルシクロブタンを生じることが報告されている(Billups, W. E.; Cross, J. H.; Smith, C. V., Journal of the American Chemical Society (1973), 95(10), 3438−9)。電子供与体として様々な亜リン酸の存在下、ニッケルナフテン酸およびイソプレンマグネシウムにより触媒されたイソプレン[78−79−5]のオリゴマー化により、ジメチルシクロオクタジエン[39881−79−3]を含む環状二量体を得た;特に1,1,1−トリス(ヒドロキシメチル)プロパン亜リン酸[39865−19−5]によりトリメチルシクロドデカトリエン[39881−80−6]を選択的に得た(Suga, Kyoichi; Watanabe, Shoji; Fujita, Tsutomu; Shimada, Takashi, Journal of Applied Chemistry & Biotechnology (1973), 23(2), 131−8)。WO2006/051011号は、Niおよび/もしくはTi、1以上の有機金属化合物、ならびにVA群化合物を含む触媒系の存在下のイソプレンの三量体化による(この反応は、水酸基含有溶媒で行なわれる)、香料および芳香剤に有用なトリメチルシクロドデカトリエンの調製について開示している。Ligabue, R. A.; Dupont, J.; de Souza, R. F., Alegre, R.S. J. Mol. Cat. A: Chem. (2001), 169(1−2), 11−17は、イオン性液体中で鉄ニトロシル触媒を用いたイソプレンの6員環二量体への選択的二量体化について記載している。Huchette, D.; Nicole, J.; Petit, F., Tetrahedron Letters (1979), (12), 1035−8は、鉄ニトロシル触媒の電気化学生成および続くイソプレンのシクロヘキセン二量体への二量体化のための使用について記載している。Zakharkin, L. I.; Zhigareva, G. G.; Pryanishnikov, A. P. Zhurnal Obshchei Khimii (1987), 57(11), 2551−6は、錯体ニッケルおよび鉄触媒上のイソプレンのシクロオリゴマー化について記載している。
本明細書に記載の高純度イソプレン出発組成物は、引用された参考文献に開示の各触媒系および反応条件を用いて化学的変換される。当該技術分野で公知である他の触媒および反応条件、例えば、1,3−ブタジエンの化学的変換に適用される触媒および反応条件は、当業者によってイソプレン出発組成物に適用できる。
二量体化および三量体化
いくつかの実施形態では、商業的に有益な量の高純度イソプレン出発材料は、触媒的化学的変換を経て、二量体および三量体を生じる。触媒系は、当該技術分野で公知である方法を用いて同定される。好ましい触媒としては、イソプレンを高い効率で二量体および三量体に変換する上で公知のものが挙げられる。例としては、パラジウム、ニッケル、コバルト、鉄およびクロムベースのものが挙げられる。
いくつかの実施形態では、商業的に有益な量の高純度イソプレン出発材料は、熱もしくは触媒的二量体化を経る。出発組成物を圧力下で加熱することにより、イソプレン出発組成物を不飽和6および8員環を含む二量体の混合物に変換する。いくつかの実施形態では、出発イソプレン組成物を圧力下で約100、125、150、175、200、225もしくは250℃またはそれより高温に加熱する。いくつかの実施形態では、出発イソプレン組成物は、抗酸化剤(例えば2,6−ジ−tert−ブチル−4−メチルフェノール)の存在下で加熱してラジカル媒介性ポリマー化を予防する。いくつかの実施形態では、反応は、イソプレンの環状二量体化を触媒するための当該技術分野で公知である触媒(例えば、米国特許第4,144,278号、第4,181,707号、第5,545,789号および欧州特許第0397266A2号に記載の鉄ニトロシルハロゲン化触媒)から選択される1以上の触媒により加速する。イオン性液体中の鉄ニトロシル触媒の使用については、Ligabue et al. (2001) J. Mol. Catalysis A: Chemical, 169 (2), 11−17により記載されている。触媒の例としては、限定するものではないが、Fe(NO)2Cl2およびCr3+−モンモリロナイトが挙げられる。別の例では、イソプレン出発組成物は、ルテニウム触媒を用いてC10環状二量体(例えばジメチル−シクロオクタジエンの混合物)に変換する(Itoh, Kenji; Masuda, Katsuyuki; Fukahori, Takahiko; Nakano, Katsumasa; Aoki, Katsuyuki; Nagashima, Hideo, Organometallics (1994), 13(3), 1020−9)。
特定の実施形態では、液体状態のイソプレン出発組成物は、圧力下、抗酸化剤の存在下で100℃超に加熱して、6および8員環、例えば、リモネン(1−メチル−4−(プロプ−1−エン−2−イル)シクロヘキサ−−1−エン)、1−メチル−5−(プロプ−1−エン−2−イル)シクロヘキサ−−1−エン、1,4−ジメチル−4−ビニルシクロヘキセン、2,4−ジメチル−4−ビニルシクロヘキセン、1,5−ジメチルシクロオクタ−1,5−ジエン、1,6−ジメチルシクロオクタ−1,5−ジエン、2,6−ジメチル−1,3−シクロオクタジエン、2,6−ジメチル−1,4−シクロオクタジエン、3,7−ジメチル−1,5−シクロオクタジエン、3,7−ジメチル−1,3−シクロオクタジエン、3,6−ジメチル−1,3−シクロオクタジエン、ならびにOrganometallics (1994), 13(3), 1020−9に記載されている他の8員環イソプレン二量体を含む二量体の混合物を産出する。これらの化合物の立体異性体を全て意図する。イソプレンの二量体への変換を、望ましくない反応産物の産出を避けるように酸素の不在下で最良に実施する。
いくつかの実施形態では、商業的に有益な量の高純度イソプレン出発材料は、光二量体化を経て、4員環二量体を生じる。イソプレン出発組成物は、1以上の1,2−ジ(プロプ−1−エン−2−イル)シクロブタン、1,3−ジ(プロプ−1−エン−2−イル)シクロブタン、1−メチル−1−ビニル−3−(プロプ−1−エン−2−イル)シクロブタン、1−メチル−1−ビニル−2−(プロプ−1−エン−2−イル)シクロブタン、1,3−ジメチル−1,3−ジビニルシクロブタン、1,2−ジメチル−1,2−ジビニルシクロブタンおよびその立体異性体を含む混合物への光照射により変換される。いくつかの実施形態では、高純度イソプレン出発材料は、触媒(例えばニッケル触媒)または光増感剤(例えばベンゾフェノン)の存在下で二量体化され、6および8員環に加えて4員環二量体、例えばcis−2−イソプロペニル−1−メチルビニルシクロブタン、を生じる[Hammond, J.S. ;Turro, N.J. ; Liu, R.S.H. (1963) “Mechanisms of Photochemical Reactions in Solution. XVI. Photosensitized Dimerization of Conjugated Dienes.” J. Org. Chem., 28, 3297−3303を参照されたい]。
いくつかの実施形態では、商業的に有益な量の高純度イソプレン出発材料は、触媒系の存在下、環状三量体に変換する。いくつかの実施形態では、環状三量体は、トリメチルシクロドデカトリエンである。いくつかの実施形態では、触媒系は、ニッケル触媒を含む。いくつかの実施形態では、触媒系は、チタン化合物を含む。いくつかの実施形態では、触媒系は、ニッケル触媒およびチタン化合物を含む。いくつかの実施形態では、触媒系は、1以上の有機金属化合物、ならびにVA群化合物を含む。いくつかの実施形態では、触媒的変換は、水酸基含有溶媒で行なわれる。特定の実施形態では、出発イソプレン組成物を、Niおよび/もしくはTi、1以上の有機金属化合物、ならびにVA群化合物を含む触媒系の存在下(この反応は、水酸基含有溶媒で行なわれる)、トリメチルシクロドデカトリエンに変換する。
いくつかの実施形態では、商業的に有益な量の高純度イソプレン出発材料は、C2〜C5不飽和炭化水素処理によるC7〜C14範囲内の炭化水素への熱もしくは触媒的変換を経る。C2〜C5炭化水素は、アルケン、ジエンまたはアルキンであることができる。例えば、いくつかの実施形態では、イソプレンは、エチレンおよび適切な触媒と接触させてC7化合物を産出する。別の実施形態では、イソプレンを1,3−ブタジエンと接触させて環状C9炭化水素を形成する。これらのC7〜C14炭化水素の水素化は、ジェット燃料および他の航空燃料としての使用に適した組成物に至る。さらに別の実施形態では、イソプレンに由来する不飽和C7〜C14炭化水素ならびに1以上の不飽和炭化水素は水素化を経て、ジェット燃料および他の航空燃料として、またはこのような燃料のための混合ストックとしての使用に適した芳香族誘導体を形成する。
いくつかの実施形態では、商業的に有益な量の高純度イソプレン出発材料を、アルコール溶媒中で触媒系を用いて線状二量体と三量体の混合物に変換する。この反応もまた、メタノールまたはエタノール中で実施時にアルコキシ誘導体を産出する。いくつかの実施形態では、触媒系は、パラジウムベースの触媒系、例えば、パラジウムアセチルアセトネート−トリフェニルホスフィン系またはパラジウムアセタート−トリフェニルホスフィン系である。いくつかの実施形態では、アルコール溶媒は、メタノール、エタノールまたはイソプロピルアルコールである。産物の性質は、使用した触媒および溶媒による。例えば、パラジウムベースの触媒系、例えば、Pd(acac)2−Ph3PまたはPd(OAc)2−Ph3Pをイソプロピルアルコール溶媒に使用時、線状イソプレン二量体、例えば2,7−ジメチル−1,3,7−オクタトリエンおよび2,7−ジメチル−2,4,6−オクタトリエンが形成される。この反応をメタノール中で実施時、線状イソプレン二量体、例えば、ジメチルオクタトリエンに加えて、メトキシジメチルオクタジエン(例えば、1−メトキシ−2,7−ジメチル−2,7−オクタジエンおよび3−メトキシ−2,7−ジメチル−1,7−オクタジエン)が形成される。一部の反応は、線状イソプレン三量体、例えば、α−ファルネセン(3,7,11−トリメチル−1,3,6,10−ドデカテトラエン)、β−ファルネセン(7,11−ジメチル−3−メチレン−1,6,10−ドデカトリエン)および他の位置異性体(例えばtail−to−tail型およびhead−to−head型のイソプレン単位の添加)を産出する。別の例では、イソプレンは、クロムN,N−ビス(ジアリールホスフィノ)アミン触媒を用いて線状および環状C15三量体に変換する(Bowen, L.; Charernsuk, M.; Wass, D.F. Chem. Commun. (2007) 2835−2837)。
酸素化物への変換
いくつかの実施形態では、商業的に有益な量の高純度イソプレン出発材料は、酸触媒の存在下、エタノールおよび他のアルコールとの反応により燃料酸素化物に変換する。一実施形態では、酸触媒は硫酸である。別の実施形態では、酸触媒は固相硫酸(例えば、Dowex Marathon(登録商標))である。他の触媒としては、液相と固相の両方のフルオロスルホン酸、例えば、トリフルオロメタンスルホン酸およびナフィオン−H(DuPont)が挙げられる。リモネンおよび関連モノテルペンのメトキシル化のため、ゼオライト触媒、例えばベータ−ゼオライトも、Hensel et al. [Hensen, K.; Mahaim, C.; Holderich, W.F., Applied Catalysis A: General (1997) 140(2), 311−329.]により記載されているものに類似している条件下で使用できる。いくつかの実施形態では、高純度イソプレン出発材料は、水酸化/エステル化プロセスもしくは当該技術分野で公知である他のアルケン反応、例えば過酸、例えば、過酢酸および3−クロロ過安息香酸とのエポキシ化への過酸化;ならびに水和によりアルコールおよびエステルに変換して、i)水および酸触媒ならびにii)ヒドロホウ素化反応方法でアルコールおよびジオールを得る。このような反応については、例えば、Michael B. Smith and Jerry March, Advanced Organic Chemistry: Reactions, Mechanisms, and Structure, Sixth Edition, John Wiley & Sons, 2007に記載されている。図3および4に出発イソプレン組成物から産出できるアルコールおよび酸素化物の例を示す。
一部水素化
いくつかの実施形態では、商業的に有益な量の高純度イソプレン出発材料は、モノ−オレフィン(例えば2−メチルブタ−1−エン、3−メチル−ブタ−1−エンおよび2−メチルブタ−2−エン)に部分的に水素化する。いくつかの実施形態では、モノ−オレフィンは、例えば、イソブチレンをイソオクタンに変換する上で使用される従来の炭化水素カチオン触媒作用を用いて二量体化または他のオレフィンとの反応を経る。例えば、H.M. Lybarger. Isoprene in Kirk−Othmer Encyclopedia of Chemical Technology, 4th ed., Wiley, New York (1995), 14, 934−952を参照されたい。いくつかの好ましい実施形態では、高純度イソプレン出発材料はBioisoprene組成物である。
いくつかの実施形態では、商業的に有益な量の高純度イソプレン出発材料は、一部水素化を経て、モノ−オレフィン(例えば2−メチルブタ−1−エン、3−メチル−ブタ−1−エンおよび2−メチルブタ−2−エン)を形成する。いくつかの好ましい実施形態では、高純度イソプレン出発材料はBioisoprene組成物である。いくつかの実施形態では、イソプレン出発材料の一部水素化は、イソペンタンへの変換を最小限に抑えて低い残存イソプレンレベルで高収率のモノ−オレフィンを産出する。いくつかの実施形態では、低い残存イソプレンレベルでモノ−オレフィンとイソペンタンの混合物を産出する。いくつかの実施形態では、一部水素化は、特定のモノ−オレフィン、例えば、2−メチルブタ−2−エン、2−メチルブタ−1−エン、または3−メチルブタ−1−エンが選択的に産出される選択的水素化である。好ましい水素化触媒は高い触媒活性をもたらし、経時的な触媒活性を維持し、イソプレンのモノ−オレフィンへの変換に対する選択性が高い。
イソプレン出発組成物の一部水素化に適した触媒は、白金群金属、例えば、白金、パラジウム、ロジウム、もしくはルテニウム、または遷移金属、例えば、ニッケル、コバルト、銅、鉄、モリブデン、または貴金属、例えば、元素形態の銀もしくは金、または有機リガンドと無機リガンドの塩もしくは錯体を含み得る。これらの金属の合金も、一部の状況において使用することができる。これらの金属およびそれらの誘導体は、純粋であることもでき、他の活性および不活性物質と混合していることもできる。触媒は、効果的な表面領域を最大化するために支持体物質(例えば、活性炭、アルミナ、またはシリカ)に吸着させ得る。水素化触媒の物理的形態学は、それらの実施に対してかなりの影響を有することが知られている。好ましい水素化触媒としては、支持体物質に対して0.1%Pd〜20%Pd(w/w)の範囲のグレードの異種パラジウム触媒、例えば、炭素上のパラジウム(Pd/C)、アルミナ上のパラジウム(Pd/Al2O3)、またはシリカ上のパラジウム(Pd/SiO2)が挙げられる。適切な選択的水素化触媒の例は、アルミナ上の硫黄耐性促進PdであるLD 2773である(Axens, Rueil−Malmaison Cedex, France)。イソプレンのイソアミレンへの変換を、イソペンタンへの変換を最小限に抑えて行なうことができる一部水素化触媒としては、リンドラー触媒(キノリンで処理したPd/BaSO4)、第15族元素(N、P、As)のトリフェニル誘導体で処理したPd/C、硫黄含有化合物で処理したPd/C、モリブデン硫化物、およびPd/Fe合金が挙げられる。1つの好ましい触媒は、卵殻アルミナ(δ−Al2O3)に吸着したパラジウムを含む。熱分解ガソリンからのジオレフィンおよびアルキンの除去のために製油業界において使用される触媒、例えばNi/Al2O3およびPd/Al2O3ベースの触媒が特に好ましい。イソプレンのイソアミレンへの変換に適した別の触媒クラスは、産業において熱分解ガソリンの水素処理に使用されるものである。例えば米国特許第7,014,750号および第6,9949,686号、ならびに引用された参考文献を参照されたい。通常、熱分解ガス水素処理に使用される触媒は、アセチレンおよびジオレフィン(例えばイソプレンおよびピペリレン)のモノオレフィンへの選択的変換を可能とする。
水素源は、水素ガス(H2)、ギ酸、ヒドラジン、またはイソプロパノールが挙げられるが、これらに限定されない水素ガスまたは水素源であることができる。水素源は、化学的に引き出すこともでき、生物学的に引き出すこともできる。いくつかの実施形態では、水素化のために使用される水素は、発酵中にイソプレンと共産出される。水素化は、0.5atm〜200atmの範囲、またはより高い水素圧で実施できる。温度は0℃〜200℃の範囲であることができる。
Bioisoprene組成物の一部水素化からの産物は、出発イソプレン組成物に元々存在するある不純物(例えば、アセトン、エタノール、アミルアルコール、エチルアセタート、イソアミルアセタート、メチルエチルケトンおよび他の飽和極性不純物および/または不純物の水素化した誘導体、)を含むことが予期される。
いくつかの実施形態では、イソプレン出発組成物は、パラジウム触媒の存在下、一部水素化または選択的水素化を経る。例えば、パラジウム触媒、例えば、Pd/CaCO3、Pd/BaSO4、Pd/C、Pdブラック、Pd/SiO3、Pd/Al2O3、またはPd/SiO2は完全に還元されたC5アルカンに対し95%超の選択性でイソプレンをモノ−オレフィンに変換したことが示された。これらのパラジウム触媒の使用は、3−メチルブタ−1−エンに対する最大選択性を有する5%Pd/CaCO3および2−メチルブタ−2−エンに対する最大選択性を有する5%のPd/SiO2とモノ−オレフィン産物の混合物を生じる。(G.C. Bond and A.F. Rawle. J. Mol. Catalysis A: Chemical 109 (1996) 261−271を参照されたい)。BondおよびRawleは、パラジウム−金およびパラジウム−銀触媒(例えば、Pd−Au/SiO2およびPd−Ag/SiO2)が完全に還元されたC5アルカンによりも高い選択性でイソプレンをモノ−オレフィンへ還元することも示している。いくつかの実施形態では、シリカ支持ポリアミドアミン(PAMAM)デンドリマー−パラジウム錯体が環状および非環状ジエンのモノ−オレフィン異性体の混合物への還元を選択的に触媒するために使用されている。様々なモノ−オレフィン異性体に対する選択性は、触媒に使用される正確なPAMAMリガンドに応じた(P.P. Zweni and H. Alper. Adv. Synth. Catal. 348 (2006) 725−731を参照されたい)。いくつかの実施形態では、イソプレンのモノ−オレフィンへの還元は、触媒として無機支持体(例えば、金属ゼオライト)上でVIB群金属を用いて実行できる。例えば、Mo/Al2O3触媒を用いて1,3−ブタジエンをそれぞれのモノ−オレフィンに選択的に還元する(米国特許第6,235,954B1号を参照されたい)。いくつかの実施形態では、イソプレンは、IB、VIB、VIIB、または亜鉛群からの金属により促進されたVIII群金属触媒を用いてモノ−オレフィンに還元し、触媒毒を減らすことができる(米国特許第6,949,686B2号を参照されたい)。いくつかの実施形態では、イソプレンは、ハニカム配置であり得る一体化した触媒床を用いてモノ−オレフィンに還元できる。一体化した触媒床のための触媒支持体物質としては、金属、例えば、ニッケル、白金、パラジウム、ロジウム、ルテニウム、銀、鉄、銅、コバルト、クロム、イリジウム、スズ、ならびにその合金もしくは混合物を挙げ得る。(米国特許第7,014,750B2号を参照されたい)。いくつかの実施形態では、イソプレンは、特に反応に水を含まない場合、卵殻Pd/δ−Al2O3触媒を用いてモノ−オレフィンに還元できる。卵殻Pd/δ−Al2O3触媒は、完全に還元されたアルカンよりも、モノ−オレフィンに対して選択的であり、2−メチルブタ−2−エンは、熱力学的に良好な異性体である。(J.−R. Chang and C.−H. Cheng. Ind. Eng. Chem. Res. 36 (1997) 4094−4099を参照されたい)。
軽オレフィン(C3〜C6)は、酸触媒を用いて容易に二量体化して、ダイメートとしても知られているより高級なオレフィン(C6〜C12)を得ることができる。例えば、イソブチレン(2−メチルプロペン)のイソオクテンへの変換は、硫酸、リン酸および他の鉱酸、スルホン酸、フルオロスルホン酸、ゼオライトおよび酸性粘土を含む種々の酸触媒を用いて、当該技術分野で十分に記載されている。
いくつかの実施形態では、イソプレン出発組成物は、一部水素化または選択的水素化を経て、モノ−オレフィンを形成し、このモノ−オレフィンは、例えば、イソブチレンをイソオクタンに変換するために使用される従来の炭化水素カチオン触媒、例えば硫酸、リン酸および他の鉱酸、スルホン酸、フルオロスルホン酸、ゼオライトおよび酸性粘土を用いて、他のオレフィンとの二量体化または反応を経る。例えば、H.M. Lybarger. Isoprene in Kirk−Othmer Encyclopedia of Chemical Technology, 4th ed., Wiley, New York (1995), 14, 934−952を参照されたい。いくつかの好ましい実施形態では、高純度イソプレン出発材料はBioisoprene組成物である。液体と固体の両形態の酸触媒を使用できる。酸樹脂が好ましく、これには、Amberlyst15、35、XE586、XN1010(Rohm and Haas)および類似の酸性イオン交換樹脂が挙げられる。培地間隙酸分子シーブ、例えば、ZSM−5、フェリエライト、ZSM−22およびZSM−23を含む中径細孔モレキュラーシーブも好ましい触媒である。
いくつかの実施形態では、イソプレン出発組成物は、一部水素化または選択的水素化を経て、イソアミレンを形成する。いくつかの実施形態では、イソアミレンを二量体化して、C10ダイメート、例えば、イソデセンを得る。いくつかの実施形態では、イソアミレンをオレフィン、例えば、プロピレン、ブタンまたはイソブテンと二量体化して、C8〜C10ダイメートを得る。いくつかの実施形態では、モノ−オレフィンは、樹脂触媒(例えば、Amberlyst、Amberlyst35、Amberlyst15、Amberlyst XN1010、Amberlyst XE586)を用いて二量体化を経て、ジイソアミレンを産出する。このような樹脂触媒の使用は、クラッキングおよびさらなるオリゴマー化反応を最小限に抑え、最適条件下で樹脂触媒は、8%未満の三量体形成を伴う92%超の二量体に対する選択性を提供することが示されている。例えば、M. Marchionna et al. Catalysis Today 65 (2001) 397−403を参照されたい。いくつかの実施形態では、モノ−オレフィンは、酸性メソポーラスモレキュラーシーブ、例えば、ゼオライト構造に組み込まれているメソポーラスシーブ、ZSM−5、フェリエライト、ZSM−22、またはZSM−23を含む触媒物質を用いて二量体化を経る。特定の実施形態では、触媒物質は、高温(例えば、少なくとも900℃)で熱的に安定している。別の特定の実施形態では、モノ−オレフィンは、多不飽和炭化水素、例えば、イソプレンを実質的に含まない。二量体化のための酸性メソポーラス分子シーブを含む触媒物質の使用は、80%超の二量体に対する選択性をもたらすことができる。例えば、米国特許第2007/0191662A1号を参照されたい。いくつかの実施形態では、モノ−オレフィンは、固体酸性触媒(例えば、固体リン酸触媒、酸性イオン交換樹脂)を用いて二量体化を経る。固体リン酸触媒を用いた二量体に対する選択性は、少なくとも75%、少なくとも85%もしくは少なくとも90%であることができる。例えば、米国特許第2009/0099400A1号および米国特許第6,660,898B1号を参照されたい。
効率的な二量体化は、しばしば極性成分(1以上)、例えば、供給ストリーム内の水および酸化化合物の存在を必要とし得る。例としては、アルコール、例えば、メタノール、エタノールおよびt−ブタノール、エーテル、例えば、メチルt−ブチルエーテル(MTBE)およびメチルt−アミルエーテル(TAME)またはエステル、例えば、C1〜C5アセタートが挙げられる。いくつかの実施形態では、イソアミレンは、酸触媒の存在下でアルコール処理によりエーテル、例えば、TAMEに変換できる。
いくつかの実施形態では、本明細書に記載のいずれかの方法により産出されたモノ−オレフィンのC10二量体は、(例えば、水素化により)完全飽和C10アルキル化に還元できる。特定の実施形態では、イソプレンまたはモノ−オレフィンは、酸成分を含む触媒、例えば、硫酸、フルオロスルホン酸、過ハロアルキルスルホン酸、イオン性液体、またはポリマー成分、例えば、ポリアクリル酸と混合したブレーンステッド酸とルイス酸の混合物を用いてアルキレートに還元できる。(米国特許第2010/0094072A1号を参照されたい)。
いくつかの実施形態では、商業的に有益な量の高純度イソプレン出発材料は、酸触媒の存在下でオリゴマー化を経て、二量体、三量体、より高いオリゴマー、芳香族産物、および/またはポリマー性産物を産出する。ゴム形成およびコーキングは触媒の脱活性化に至ることが既知の課題であるが、反応物の動力学的制御は、ある産物、例えばより低いオリゴマーに有利であることができる。
例示的な不飽和イソプレン誘導体
いくつかの実施形態では、イソプレンから燃料構成要素を産出するための組成物および系はさらに、イソプレン出発組成物の燃料構成要素への化学的変換のための不飽和炭化水素または酸素化中間体を含む。いくつかの実施形態では、不飽和炭化水素中間体は、1,2−ジ(プロプ−1−エン−2−イル)シクロブタン、1,3−ジ(プロプ−1−エン−2−イル)シクロブタン、1−メチル−1−ビニル−3−(プロプ−1−エン−2−イル)シクロブタン、1−メチル−1−ビニル−2−(プロプ−1−エン−2−イル)シクロブタン、1,3−ジメチル−1,3−ジビニルシクロブタン、1,2−ジメチル−1,2−ジビニルシクロブタン、1−メチル−4−(プロプ−1−エン−2−イル)シクロヘキサ−1−エン)、1−メチル−5−(プロプ−1−エン−2−イル)シクロヘキサ−1−エン、1,4−ジメチル−4−ビニルシクロヘキセン、2,4−ジメチル−4−ビニルシクロヘキセン、1,5−ジメチルシクロオクタ−1,5−ジエン、1,6−ジメチルシクロオクタ−1,5−ジエン、1,4−ジメチル−4−ビニル−1−シクロヘキセン、2,4−ジメチル−4−ビニル−1−シクロヘキセン、2,7−ジメチル−1,3,7−オクタトリエン、2,7−ジメチル−2,4,6−オクタトリエン、2,6−ジメチル−1,3−シクロオクタジエン、2,6−ジメチル−1,4−シクロオクタジエン、3,7−ジメチル−1,5−シクロオクタジエン、3,7−ジメチル−1,3−シクロオクタジエンおよび3,6−ジメチル−1,3−シクロオクタジエンからなる群から選択される1以上の不飽和イソプレン二量体を含む。いくつかの実施形態では、不飽和炭化水素中間体は、1以上の不飽和三量体、例えば、α−ファルネセン、β−ファルネセン、トリメチルシクロドデカトリエン(例えば1,5,9−トリメチル−(1E,5E,9E)−シクロドデカトリエンならびにその位置および幾何学的異性体)およびトリメチルドデカテトラエンなどを含む。いくつかの実施形態では、不飽和酸素化中間体は、1以上の不飽和メチルエーテル、例えば、1−メトキシ−2,7−ジメチル−2,7−オクタジエンおよび3−メトキシ−2,7−ジメチル−1,7−オクタジエンなどを含む。いくつかの実施形態では、不飽和酸素化中間体は、1以上の不飽和エチルエーテル、例えば、エチル3−メチル−3−ブテニルエーテル、エチル1,1−ジメチル−2−プロペニルエーテル、エチル1,2−ジメチル−2−プロペニルエーテル、エチル2−メチル−3−ブテニルエーテルなどを含む。いくつかの実施形態では、不飽和酸素化中間体は、1以上の不飽和アルコール、例えば、3−メチル−3−ブテン−1−オール、2−メチル−3−ブテン−2−オール、3−メチル−3−ブテン−2−オール、2−メチル−3−ブテン−1−オールなどを含む。いくつかの実施形態では、不飽和酸素化中間体は、1以上の不飽和エステル、例えば、3−メチル−3−ブテン−1−イルアセタート、2−メチル−3−ブテン−2−イルアセタート、3−メチル−3−ブテン−2−イルアセタート、2−メチル−3−ブテン−1−イルアセタートおよび他のC
3〜C
18脂肪族カルボン酸のエステルを含む。いくつかの実施形態では、不飽和炭化水素中間体は、1以上のイソアミレン、例えば2−メチルブタ−1−エン、3−メチル−ブタ−1−エンおよび2−メチルブタ−2−エンを含む。いくつかの実施形態では、不飽和炭化水素中間体は、イソアミレンの二量体化から得られる1以上のジイソアミレンを含む。
スキームI.不飽和6および8員環中間体の例
スキームII.不飽和4員環中間体の例
スキームIII.不飽和イソプレン短鎖重合体および酸素化中間体の例
スキームIV.不飽和エチルエーテル中間体の例
スキームV.不飽和アルコール中間体の例
スキームVI.不飽和エステル中間体の例
例示的な不飽和中間体の水素化
不飽和イソプレン誘導体は、水素化触媒の存在下で水素化に供して飽和化合物を産出する。飽和化合物は特性化して、それらの燃料としての値を評価する。いくつかの実施形態では、水素化のための水素源は水素ガスである。いくつかの実施形態では、水素ガスは、米国仮特許出願第61/141,652号(2008年12月30日出願)および米国特許第2009/0203102A1号に記載されているBioisopreneと共産出する。いくつかの実施形態では、水素化触媒は、パラジウムベースの触媒、例えば、Pd/C(例えば5%(重量)Pd/C)である。いくつかの実施形態では、水素化触媒は、ラネーニッケル触媒である。いくつかの実施形態では、水素化触媒は、同種触媒、例えば、ルテニウムまたはロジウムベースの同種水素化触媒である。いくつかの実施形態では、不飽和イソプレン二量体および三量体を水素化して、燃料作製に適した飽和C10およびC15炭化水素を産出する。いくつかの実施形態では、不飽和環状二量体を水素化して、飽和環状C10炭化水素、例えば、1,2−ビス(イソプロピル)シクロブタン、1,2−ビス(イソプロピル)シクロブタン、1−メチル−4−イソプロピルシクロヘキサン、1−メチル−3−イソプロピルシクロヘキサン、1−エチル−1,4−ジメチルシクロヘキサン、1−エチル−1,3−ジメチルシクロヘキサン、1,5−ジメチルシクロオクタンおよび1,4−ジメチルシクロオクタンを産出する。いくつかの実施形態では、不飽和環状三量体を水素化して、飽和環状C15炭化水素、例えば、1,5,9−トリメチルシクロドデカンおよび1,5,10−トリメチルシクロドデカンを産出する(スキームVIIを参照)。いくつかの実施形態では、不飽和線状二量体を水素化して、飽和脂肪族C10炭化水素、例えば、2,6−ジメチルオクタン、2,7−ジメチルオクタンおよび3,6−ジメチルオクタンを産出する。いくつかの実施形態では、不飽和線状三量体を水素化して、飽和脂肪族C15炭化水素、例えば、2,6,10−トリメチルドデカン、2,7,10−トリメチルドデカンおよび3,7,10−トリメチルドデカンを産出する(スキームVIIIを参照)。いくつかの実施形態では、イソアミレン二量体化産物(ジアミレンまたはC10ダイメート)は、イソパラフィン(例えば2,3,4,4−テトラメチルヘキサン、2,2,3,4−テトラメチルヘキサン、2,3,3,4−テトラメチルヘキサンおよび3,3,5−トリメチルヘプタン)に完全に水素化する(スキームVIIIaを参照)。いくつかの実施形態では、商業的に有益な量の高純度イソプレン出発組成物を水素化して、2−メチルブタンを含む産物を産出する。いくつかの実施形態では、不飽和イソプレンヒドロキシレートを水素化して、飽和ヒドロキシレート、例えば、C5アルコールおよびジオール(例えば3−メチル−ブタン−1−オール、2−メチル−ブタン−1−オールおよび2−メチル−ブタン−2−オール、3−メチル−ブタン−1,3−ジオールおよび2−メチル−ブタン−2,3−ジオール)、C10アルコールおよびジオール(例えば3,7−ジメチルオクタン−1−オール、2,7−ジメチルオクタン−1−オール、2,7−ジメチルオクタン−2−オールおよび2,7−ジメチルオクタン−2,7−ジオール)および環状C10アルコール(例えば2−(4−メチルシクロヘキシル)プロパン−2−オール、2−(4−メチルシクロヘキシル)プロパン−1−オール、2−(1,4−ジメチルシクロヘキシル)エタノールおよび4−エチル−1,4−ジメチルシクロヘキサノール)を産出する(スキームIXを参照)。いくつかの実施形態では、不飽和イソプレン酸素化物を水素化して、飽和エーテル、例えば、1,3−ジエトキシ−3−メチルブタン、1−エトキシ−3−メチルブタン、1−メトキシ−2,7−ジメチルオクタンおよび3−メトキシ−2,7−ジメチルオクタンを産出する(スキームXを参照)。アルケン部分が水素化する場合、1以上の立体異性体が産出されることが理解される。立体異性体間の相対比率は、使用する反応条件および触媒による。適切な場合、立体異性体は各々および全て、本明細書に記載の飽和炭化水素および酸素化物を意図する。
スキームVII.イソプレンから得られる環状炭化水素の例
スキームVIII.イソプレンから得られる脂肪族炭化水素の例
スキームVIIIa.イソアミレンから得られるイソデカンの例
スキームIX.イソプレンから得られるBioIsoFuel(商標)アルコールの例
スキームX.イソプレンから得られるBioIsoFuel(商標)酸素化物の例
いくつかの実施形態では、商業的に有益な量の高純度イソプレン出発組成物の化学的変換により産出された燃料構成要素は、飽和イソプレン誘導体を含む。いくつかの実施形態では、燃料構成要素は、イソプレンから得られる飽和C10およびC15炭化水素を含む。いくつかの実施形態では、燃料構成要素は、1,2−ビス(イソプロピル)シクロブタン、1,2−ビス(イソプロピル)シクロブタン、1−メチル−4−イソプロピルシクロヘキサン、1−メチル−3−イソプロピルシクロヘキサン、1−エチル−1,4−ジメチルシクロヘキサン、1−エチル−1,3−ジメチルシクロヘキサン、1,5−ジメチルシクロオクタンおよび1,4−ジメチルシクロオクタンからなる群から選択される1以上の飽和環状C10炭化水素を含む。いくつかの実施形態では、燃料構成要素は、1,5,9−トリメチルシクロドデカンおよび1,5,10−トリメチルシクロドデカンからなる群から選択される1以上の飽和環状C15炭化水素を含む。いくつかの実施形態では、燃料構成要素は、2,6−ジメチルオクタン、2,7−ジメチルオクタンおよび3,6−ジメチルオクタンからなる群から選択される1以上の飽和脂肪族C10炭化水素を含む。いくつかの実施形態では、燃料構成要素は、2,6,10−トリメチルドデカン、2,7,10−トリメチルドデカンおよび3,7,10−トリメチルドデカンからなる群から選択される1以上の飽和脂肪族C15炭化水素を含む。いくつかの実施形態では、燃料構成要素は、2−メチルブタンを含む。いくつかの実施形態では、燃料構成要素は、2,3,4,4−テトラメチルヘキサン、2,2,3,4−テトラメチルヘキサン、2,3,3,4−テトラメチルヘキサンおよび3,3,5−トリメチルヘプタンからなる群から選択される1以上のイソパラフィンを含む。いくつかの実施形態では、燃料構成要素は、3−メチル−ブタン−1−オール、2−メチル−ブタン−1−オールおよび2−メチル−ブタン−2−オール、3−メチル−ブタン−1,3−ジオール、2−メチル−ブタン−2,3−ジオール、3,7−ジメチルオクタン−1−オール、2,7−ジメチルオクタン−1−オール、2,7−ジメチルオクタン−2−オール、2,7−ジメチルオクタン−2,7−ジオール、2−(4−メチルシクロヘキシル)プロパン−2−オール、2−(4−メチルシクロヘキシル)プロパン−1−オール、2−(1,4−ジメチルシクロヘキシル)エタノールおよび4−エチル−1,4−ジメチルシクロヘキサノールからなる群から選択される1以上の飽和ヒドロキシレートを含む。いくつかの実施形態では、燃料構成要素は、1,3−ジエトキシ−3−メチルブタン、1−エトキシ−3−メチルブタン、1−メトキシ−2,7−ジメチルオクタンおよび3−メトキシ−2,7−ジメチルオクタンからなる群から選択される1以上の飽和エーテルを含む。いくつかの実施形態では、燃料構成要素は、3−メチルテトラヒドロフラン、3−メチル−2−ブタノンおよびイソペンチルアセタートからなる群から選択される1以上のイソプレンの酸素化物を含む。
いくつかの実施形態では、イソプレンから燃料構成要素を産出するための組成物および系はさらに、イソプレン出発組成物の、燃料構成要素または燃料構成要素作製のための中間体への化学的変換を触媒するための触媒を含む。いくつかの実施形態では、イソプレンから燃料構成要素を産出するための組成物および系はさらに、飽和燃料構成要素を産出するために不飽和中間体の水素化を触媒するための触媒を含む。いくつかの実施形態では、触媒は、記載した任意の触媒、または1以上の本明細書に記載の触媒の組み合わせである。
燃料を産出する方法および/またはプロセス
本発明は、(a)商業的に有益な量の高純度イソプレンを得ること;ならびに(b)商業的に有益な量の高純度イソプレンの少なくとも一部を燃料構成要素へ化学的変換することを含むイソプレンから燃料構成要素を産出する方法および/またはプロセスを提供する。一実施形態では、高純度イソプレン組成物は、連続化学プロセスにおいて燃料成分へ変換する。別の実施形態では、高純度イソプレンを燃料組成物へ化学的変換前にさらに精製する。さらに別の実施形態では、高純度イソプレンは、中間体組成物への化学的変換;中間体組成物は、さらに化学的変換を経て、燃料または燃料成分を産出する。さらなる1つの実施形態では、産出された燃料成分は、石油留出物および他の任意の添加物と混合して燃料を産出する。いくつかの好ましい実施形態では、高純度イソプレンは、Bioisoprene組成物である。
いくつかの実施形態では、イソプレンから燃料構成要素を産出する方法は、商業的に有益な量の高純度イソプレン組成物を得ることを含む。いくつかの実施形態では、本発明において有用な高純度イソプレン組成物は、約2、5、10、20、30、40、50、60、70、80、90、100、200、300、400、500、600、700、800、900、もしくは1000mgまたはそれより多い量のイソプレンを含む。いくつかの実施形態では、高純度イソプレン組成物は、約2、5、10、20、30、40、50、60、70、80、90、100gまたはそれより多い量のイソプレンを含む。いくつかの実施形態では、出発イソプレン組成物は、約0.2、0.5、1、2、5、10、20、50、100、200、500、1000kgまたはそれより多いイソプレンを含む。
いくつかの実施形態では、イソプレンから燃料構成要素を産出する方法は、商業的に有益な量の高純度イソプレン組成物を得ることを含む。いくつかの実施形態では、高純度イソプレン出発組成物は、出発組成物中の全てのC5炭化水素の総重量と比べて、約98.0、98.5、99.0、99.5、もしくは100重量%またはそれより多いイソプレンを含む。いくつかの実施形態では、本発明において有用な高純度イソプレン組成物は、組成物中の全てのC5炭化水素の総重量と比べて、約99.90、99.92、99.94、99.96、99.98、もしくは100重量%またはそれより多い量のイソプレンとを含む。いくつかの実施形態では、高純度イソプレン組成物は、組成物中の全てのC5炭化水素の総重量と比べて、約2.0、1.5、1.0、0.5、0.2、0.12、0.10、0.08、0.06、0.04、0.02、0.01、0.005、0.001、0.0005、0.0001、0.00005、もしくは0.00001重量%またはそれ未満のイソプレン以外のC5炭化水素(例えば、1,3−シクロペンタジエン、cis−1,3−ペンタジエン、trans−1,3−ペンタジエン、1,4−ペンタジエン、1−ペンチン、2−ペンチン、1−ペンテン、2−メチル−1−ブテン、3−メチル−1−ブチン、ペント−4−エン−1−イン、trans−ペント−3−エン−1−イン、またはcis−ペント−3−エン−1−イン)を含む。いくつかの実施形態では、高純度イソプレン組成物は、1,3−シクロペンタジエン、cis−1,3−ペンタジエン、trans−1,3−ペンタジエン、1,4−ペンタジエン、1−ペンチン、2−ペンチン、1−ペンテン、2−メチル−1−ブテン、3−メチル−1−ブチン、ペント−4−エン−1−イン、trans−ペント−3−エン−1−イン、またはcis−ペント−3−エン−1−インについて、組成物中の全てのC5炭化水素の総重量と比べて、約2.0、1.5、1.0、0.5、0.2、0.12、0.10、0.08、0.06、0.04、0.02、0.01、0.005、0.001、0.0005、0.0001、0.00005、もしくは0.00001重量パーセントを有する。特定の実施形態では、高純度イソプレン組成物は、約2mg超のイソプレンを有し、組成物中のC5炭化水素の総重量に対し約98.0、98.5、99.0、99.5、99.90、99.92、99.94、99.96、99.98、もしくは100重量%またはそれより多いイソプレンを有する。
いくつかの実施形態では、イソプレンから燃料構成要素を産出する方法は、商業的に有益な量の高純度イソプレン組成物を得ることを含む。いくつかの実施形態では、本発明において有用な高純度イソプレン組成物は、イソプレンの重合を阻害する、組成物中の任意の化合物について、イソプレンの重合を阻害する約50、40、30、20、10、5、1、0.5、0.1、0.05、0.01、もしくは0.005μg/L又はそれら未満の化合物を有する。特定の実施形態では、組成物は、約2mg超のイソプレンも有する。
いくつかの実施形態では、イソプレンから燃料構成要素を産出する方法は、商業的に有益な量の高純度イソプレン組成物を得ることを含む。いくつかの実施形態では、本発明において有用な高純度イソプレン組成物は、エタノール、アセトン、C5プレニルアルコール、および10以上の炭素原子を有するイソプレノイド化合物からなる群から選択される1以上の化合物を有する。いくつかの実施形態では、高純度イソプレン組成物は、約0.005、0.01、0.05、0.1、0.5、1、5、10、20、30、40、60、80、100、もしくは120μg/Lまたはそれより多いエタノール、アセトン、C5プレニルアルコール(例えば、3−メチル−3−ブテン−1−オールもしくは3−メチル−2−ブテン−1−オール)、または前述のもののいずれか2つ以上を有する。特定の実施形態では、高純度イソプレン組成物は、約2mg超のイソプレンを有し、エタノール、アセトン、C5プレニルアルコール、および10以上の炭素原子を有するイソプレノイド化合物からなる群から選択される1以上の化合物を有する。
いくつかの実施形態では、イソプレンから燃料構成要素を産出する方法は、商業的に有益な量の高純度イソプレン組成物を得ることを含む。いくつかの実施形態では、本発明において有用な高純度イソプレン組成物は、イソプレンと、2−ヘプタノン、6−メチル−5−ヘプタン−2−オン、2,4,5−トリメチルピリジン、2,3,5−トリメチルピラジン、シトロネラル、アセトアルデヒド、メタンチオール、メチルアセタート、1−プロパノール、ジアセチル、2−ブタノン、2−メチル−3−ブテン−2−オール、エチルアセタート、2−メチル−1−プロパノール、3−メチル−1ブタナール、3−メチル−2−ブタノン、1−ブタノール、2−ペンタノン、3−メチル−1−ブタノール、エチルイソブチレート、3−メチル−2−ブテナール、ブチルアセタート、3−メチルブチルアセタート、3−メチル−3−ブテン−1−イルアセタート、3−メチル−2−ブテン−1−イルアセタート、3−ヘキセン−1−オール、3−ヘキセン−1−イルアセタート、リモネン、ゲラニオール(trans−3,7−ジメチル−2,6−オクタジエン−1−オール)、シトロネロール(3,7−ジメチル−6−オクテン−1−オール)、(E)−3,7−ジメチル−1,3,6−オクタトリエン、(Z)−3,7−ジメチル−1,3,6−オクタトリエン、および2,3−シクロヘプテノルピリジンからなる群から選択される1以上の第2の化合物とを含む。様々な実施形態では、重量パーセント(すなわち、成分の重量をイソプレンの重量で割って100を掛けたもの)の単位で表されるイソプレンの量と比べたこれらの第2の成分の1つの量は、約0.01、0.02、0.05、0.1、0.5、1、5、10、20、30、40、50、60、70、80、90、100、もしくは110%(w/w)またはそれより多い量である。いくつかの実施形態では、イソプレン量と比べてメタンチオール量は重量パーセント単位で0.01%(w/w)未満である。
いくつかの実施形態では、イソプレンから燃料構成要素を産出する方法は、商業的に有益な量の高純度イソプレン組成物を得ることを含む。いくつかの実施形態では、本方法は、生物学的プロセスから商業的に有益な量の高純度イソプレン組成物を得ることを含み、(a)イソプレンの産出に好適な培養条件下でイソプレンシンターゼポリペプチドをコードする異種核酸を含む細胞を培養すること、ここで細胞は(i)約400nmole/gwcm/時間を上回るイソプレンを産出し、(ii)細胞が細胞培養培地から消費する炭素の約0.002モルパーセント超をイソプレンに変換し、または(iii)約0.1mg/Lブロス/時間を上回るイソプレンの平均容積生産性を有し、ならびに(b)イソプレンを産出することを含む。いくつかの実施形態では、細胞は、(i)イソプレンシンターゼポリペプチド、例えば植物、例えば、Pueraria由来の天然に生じるポリペプチドをコードし、(ii)プロモーター、例えばT7プロモーターに機能的に連結されている異種核酸を有する。いくつかの実施形態では、細胞を、限定するものではないが、炭水化物、グリセロール、グリセリン、ジヒドロキシアセトン、1炭素源、油、動物性脂肪、動物性油、脂肪酸、脂質、リン脂質、グリセロ脂質、モノグリセリド、ジグリセリド、トリグリセリド、再生可能な炭素源、ポリペプチド(例えば、微生物もしくは植物のタンパク質もしくはペプチド)、酵母抽出物、または酵母抽出物由来の成分などの1炭素源、または前述のもののいずれか2つ以上の組み合わせを含む培養培地中で培養する。いくつかの実施形態では、細胞を制限グルコース条件下で培養する。いくつかの実施形態では、細胞はさらに、IDIポリペプチドをコードする異種核酸を含む。いくつかの実施形態では、細胞はさらに、MDV経路ポリペプチドをコードする異種核酸を含む。いくつかの実施形態では、本方法は、米国仮特許出願第61/134,094号(2008年7月2日出願)、WO2010/003007号、および米国特許第12/335,071号(2008年12月15日出願)(米国特許第2009/0203102A1号)(その全体が参照により本明細書に組み込まれる)に記載の方法を用いてイソプレンを産出することを含む。
いくつかの実施形態では、本方法は、イソプレンを産出する細胞の培養により産出された気相(オフガス)を得ることを含む。いくつかの実施形態では、培養細胞は、約400nmole/gwcm/時間を上回るイソプレンを産出する。いくつかの実施形態では、気相は、1vvmの速度で発生時、約5、10、20、30、40、50、60、70、80、90、100μg/Lまたはそれより多い量のイソプレンを含む。いくつかの実施形態では、気相の揮発性有機画分は、揮発性有機画分中の全てのC5炭化水素の総量と比べて、約99.90、99.92、99.94、99.96、99.98、もしくは100重量%またはそれより多い量のイソプレンとを含む。いくつかの実施形態では、気相の揮発性有機画分は、揮発性有機画分中の全てのC5炭化水素の総量と比べて、約2.0、1.5、1.0、0.5、0.2、0.12、0.10、0.08、0.06、0.04、0.02、0.01、0.005、0.001、0.0005、0.0001、0.00005、もしくは0.00001重量%またはそれらより少ない量のイソプレン以外のC5炭化水素(例えば、1,3−シクロペンタジエン、cis−1,3−ペンタジエン、trans−1,3−ペンタジエン、1,4−ペンタジエン、1−ペンチン、2−ペンチン、1−ペンテン、2−メチル−1−ブテン、3−メチル−1−ブチン、ペント−4−エン−1−イン、trans−ペント−3−エン−1−イン、またはcis−ペント−3−エン−1−イン)を含む。いくつかの実施形態では、気相の揮発性有機画分は、1,3−シクロペンタジエン、cis−1,3−ペンタジエン、trans−1,3−ペンタジエン、1,4−ペンタジエン、1−ペンチン、2−ペンチン、1−ペンテン、2−メチル−1−ブテン、3−メチル−1−ブチン、ペント−4−エン−1−イン、trans−ペント−3−エン−1−イン、またはcis−ペント−3−エン−1−インについて、揮発性有機画分中の全てのC5炭化水素の総量と比べて、約2.0、1.5、1.0、0.5、0.2、0.12、0.10、0.08、0.06、0.04、0.02、0.01、0.005、0.001、0.0005、0.0001、0.00005、もしくは0.00001重量パーセントまたはそれより少ない量を有する。特定の実施形態では、気相の揮発性有機画分は、約2mg超のイソプレンを有し、揮発性有機画分中の全てのC5炭化水素の総量と比べて、約99.90、99.92、99.94、99.96、99.98、もしくは100重量%またはそれより多いイソプレンを有する。
いくつかの実施形態では、本方法は、イソプレンを産出する細胞の培養により産出された気相(オフガス)を得ることを含む。いくつかの実施形態では、気相の揮発性有機画分は、イソプレンの重合を阻害する気相の揮発性有機画分中の任意の化合物について、イソプレンの重合を阻害するは約50、40、30、20、10、5、1、0.5、0.1、0.05、0.01、もしくは0.005μg/Lまたはそれらより少ない量の化合物を有する。特定の実施形態では、気相の揮発性有機画分は、約2mg超のイソプレンも有する。いくつかの実施形態では、気相の揮発性有機画分は、エタノール、アセトン、C5プレニルアルコール、および10以上の炭素原子を有するイソプレノイド化合物からなる群から選択される1以上の化合物を有する。いくつかの実施形態では、気相の揮発性有機画分は、約0.005、0.01、0.05、0.1、0.5、1、5、10、20、30、40、60、80、100、もしくは120μg/Lまたはそれより多いエタノール、アセトン、C5プレニルアルコール(例えば、3−メチル−3−ブテン−1−オールもしくは3−メチル−2−ブテン−1−オール)、または前述のもののいずれか2つ以上を有する。特定の実施形態では、気相の揮発性有機画分は、約2mg超のイソプレンを有し、エタノール、アセトン、C5プレニルアルコール、および10以上の炭素原子を有するイソプレノイド化合物からなる群から選択される1以上の化合物を有する。いくつかの実施形態では、気相の揮発性有機画分は、イソプレンと、2−ヘプタノン、6−メチル−5−ヘプタン−2−オン、2,4,5−トリメチルピリジン、2,3,5−トリメチルピラジン、シトロネラル、アセトアルデヒド、メタンチオール、メチルアセタート、1−プロパノール、ジアセチル、2−ブタノン、2−メチル−3−ブテン−2−オール、エチルアセタート、2−メチル−1−プロパノール、3−メチル−1ブタナール、3−メチル−2−ブタノン、1−ブタノール、2−ペンタノン、3−メチル−1−ブタノール、エチルイソブチレート、3−メチル−2−ブテナール、ブチルアセタート、3−メチルブチルアセタート、3−メチル−3−ブテン−1−イルアセタート、3−メチル−2−ブテン−1−イルアセタート、3−ヘキセン−1−オール、3−ヘキセン−1−イルアセタート、リモネン、ゲラニオール(trans−3,7−ジメチル−2,6−オクタジエン−1−オール)、シトロネロール(3,7−ジメチル−6−オクテン−1−オール)、(E)−3,7−ジメチル−1,3,6−オクタトリエン、(Z)−3,7−ジメチル−1,3,6−オクタトリエン、および2,3−シクロヘプテノルピリジンからなる群から選択される1以上の第2の化合物とを含む。様々な実施形態では、重量パーセント(すなわち、成分の重量をイソプレンの重量で割って100を掛けたもの)の単位で表されるイソプレンの量と比べたこれらの第2の成分の1つの量は、気相の揮発性有機画分中、約0.01、0.02、0.05、0.1、0.5、1、5、10、20、30、40、50、60、70、80、90、100、もしくは110%(w/w)またはそれらより多い。いくつかの実施形態では、本方法はさらに、気相からイソプレンを回収することを含む。例えば、イソプレンを含む気相中のイソプレンは、ガスストリッピング、膜増強分離、分別、吸着/脱離、パーベーパレーション、熱脱離もしくは真空脱離、または溶媒による固相に固定化もしくは吸収されたイソプレンの抽出などの標準的な技術を用いて回収することができる(例えば、米国特許第4,703,007号および第4,570,029号を参照されたく、これらは各々、特に、イソプレンの回収および精製方法に関して、その全体が参照により本明細書に組み込まれる)。いくつかの特定の実施形態では、アルコール(例えば、エタノール、メタノール、プロパノール、またはそれらの組合せ)による抽出蒸留を用いて、イソプレンを回収する。いくつかの実施形態では、イソプレンの回収は、液体形態のイソプレン(例えば、イソプレンのニート溶液または溶媒中のイソプレン溶液)の単離を含む。ガスストリッピングは、連続的に発酵オフガス流からイソプレン蒸気を除去することを含む。このような除去を、限定するものではないが、固相への吸着、液相への分離、または直接的な凝結(例えば、凝結コイルへの曝露もしくは圧力の増加による凝結)をはじめとするいくつかの異なる方法で達成することができる。いくつかの実施形態では、蒸気の露点を超えた希薄なイソプレン蒸気流の膜濃縮により、液体イソプレンの凝結が生じる。いくつかの実施形態では、回収したイソプレンを圧縮および凝結させる。
イソプレンの回収は1つの工程または複数の工程を含み得る。いくつかの実施形態では、発酵オフガスからのイソプレン蒸気の除去とイソプレンの液相への変換を同時に実施する。例えば、イソプレンは、オフガスストリームから直接濃縮して液体を形成することができる。いくつかの実施形態では、発酵オフガスからのイソプレン蒸気の除去とイソプレンの液相への変換は、連続して実施する。例えば、イソプレンは、固相に吸着させてから溶媒で固相から抽出する。
いくつかの実施形態では、ニートBioisopreneの加熱を含む環状イソプレン二量体の産出方法を提供する。産出された環状イソプレン二量体は、6員環二量体(例えば[2+4]電子的環化産物、例えば、リモネン)もしくは8員環二量体またはその混合物であり得る。6員環二量体の例としては、限定するものではないが、1−メチル−4−(プロプ−1−エン−2−イル)シクロヘキサ−−1−エン、1−メチル−5−(プロプ−1−エン−2−イル)シクロヘキサ−−1−エン、1,4−ジメチル−4−ビニルシクロヘキセン、2,4−ジメチル−4−ビニルシクロヘキセンなどが挙げられる。8員環二量体の例としては、限定するものではないが、1,5−ジメチルシクロオクタ−1,5−ジエン、1,6−ジメチルシクロオクタ−1,5−ジエンなどが挙げられる。一実施形態では、ニートの生物学的に産出されたイソプレンは、約100℃〜約300℃の温度、好ましくは約150℃〜約250℃に加熱することにより二量体化する。圧力は約2〜3atmで維持する。別の実施形態では、抱合体化ジエンの触媒的二量体化に適した触媒を使用し得る。産物混合物中の様々な二量体の割合は、触媒および他の反応条件により制御し得る。例えば、ニッケル触媒は、8員環二量体の形成を促進できる。
いくつかの実施形態では、Bioisopreneの光二量体化を含む環状イソプレン二量体を産出する方法を提供する。産出された環状イソプレン二量体は、1以上の4員環二量体またはその混合物であり得る。4員環二量体の例としては、限定するものではないが、1,2−ジ(プロプ−1−エン−2−イル)シクロブタン、1,3−ジ(プロプ−1−エン−2−イル)シクロブタン、1−メチル−1−ビニル−3−(プロプ−1−エン−2−イル)シクロブタン、1−メチル−1−ビニル−2−(プロプ−1−エン−2−イル)シクロブタン、1,3−ジメチル−1,3−ジビニルシクロブタン、1,2−ジメチル−1,2−ジビニルシクロブタンなどが挙げられる。一実施形態では、ニートの生物学的に産出されたイソプレンは、好ましくは光増感剤、例えば、ベンゾフェノンの存在下で、UV光照射により二量体化する。
イソプレン二量体は、水素化して、燃料として役立ち得る飽和C10炭化水素を形成することもでき、燃料に混合することもできる。一実施形態では、不飽和イソプレン二量体を触媒的水素化に供して、一部水素化したおよび/または完全に水素化した産物を産出する。完全に水素化した産物の例としては、限定するものではないが、1−メチル−4−イソプロピルシクロヘキサンおよび1−メチル−5−イソプロピルシクロヘキサン、1,4−ジメチル−4−エチルシクロヘキサン、2,4−ジメチル−4−エチルシクロヘキサン、1,2−ジイソプロピルシクロブタンおよび1,3−ジイソプロピルシクロブタン、1−メチル−1−ビニル−3−(プロプ−1−エン−2−イル)シクロブタン、1−メチル−1−エチル−2−(プロプ−2−イル)シクロブタン、1,3−ジメチル−1,3−エチルシクロブタン、1,2−ジメチル−1,2−ジエチルシクロブタン、1,5−ジメチルシクロオクタン、1,6−ジメチルシクロオクタンなどが挙げられる。
いくつかの実施形態では、イソプレンから燃料構成要素を産出する方法は、(a)商業的に有益な量の本明細書に記載の任意の高純度イソプレン出発組成物を得ること;(b)(i)高純度イソプレン組成物を圧力下で100℃超または約100℃に加熱すること;(ii)出発イソプレン組成物の少なくとも一部を不飽和環状イソプレン二量体へ変換すること;ならびに(iii)不飽和環状イソプレン二量体を水素化して飽和環状イソプレン二量体を産出することとを含む高純度イソプレン出発組成物の少なくとも一部を燃料構成要素へ化学的変換することとを含む。いくつかの実施形態では、出発イソプレン組成物を圧力下で約100、125、150、175、200、225もしくは250℃またはそれより高温に加熱する。いくつかの実施形態では、出発イソプレン組成物は、抗酸化剤(例えば2,6−ジ−tert−ブチル−4−メチルフェノール)の存在下で加熱してラジカル媒介性ポリマー化を予防する。一実施形態では、イソプレンの熱二量体化は、ポリマー化阻害剤としてのジニトロクレゾールの存在下で実施する。適切な抗酸化剤をポリマー化阻害剤として使用してよい。いくつかの実施形態では、出発イソプレン組成物の少なくとも一部を6および8員環、例えば、リモネン(1−メチル−4−(プロプ−1−エン−2−イル)シクロヘキサ−−1−エン)、1−メチル−5−(プロプ−1−エン−2−イル)シクロヘキサ−1−エン、1,4−ジメチル−4−ビニルシクロヘキセン、2,4−ジメチル−4−ビニルシクロヘキセン、1,5−ジメチルシクロオクタ−1,5−ジエン、1,6−ジメチルシクロオクタ−1,5−ジエン、2,6−ジメチル−1,3−シクロオクタジエン、2,6−ジメチル−1,4−シクロオクタジエン、3,7−ジメチル−1,5−シクロオクタジエン、3,7−ジメチル−1,3−シクロオクタジエンおよび3,6−ジメチル−1,3−シクロオクタジエンを含む不飽和二量体の混合物とする。いくつかの実施形態では、出発イソプレン組成物中の約20、30、40、50、60、70、75、80、85、90、95、98、99もしくは100%またはそれより多いイソプレンが不飽和環状イソプレン二量体に変換する。いくつかの実施形態では、不飽和環状イソプレン二量体の水素化は、水素化触媒、例えば、パラジウムベースの触媒(例えばPd/C、例えば5%(重量)Pd/C)により触媒される。いくつかの実施形態では、飽和環状イソプレン二量体は、1−メチル−4−イソプロピルシクロヘキサン、1−メチル−3−イソプロピルシクロヘキサン、1,5−ジメチルシクロオクタンおよび1,4−ジメチルシクロオクタンからなる群から選択される1以上のC10炭化水素を含む。いくつかの好ましい実施形態では、出発イソプレン組成物はBioisoprene組成物である。
いくつかの実施形態では、イソプレンから燃料構成要素を産出する方法は、(a)商業的に有益な量の本明細書に記載の任意の高純度イソプレン出発組成物を得ること;(b)(i)高純度イソプレン組成物を触媒系と接触させること;(ii)出発イソプレン組成物の少なくとも一部を不飽和イソプレン二量体および/もしくは三量体へ変換すること;ならびに(iii)不飽和二量体および/または三量体を水素化して飽和C10および/もしくはC15炭化水素を産出することとを含む高純度イソプレン出発組成物の少なくとも一部を燃料構成要素へ化学的変換することとを含む。いくつかの実施形態では、出発イソプレン組成物中の約20、30、40、50、60、70、75、80、85、90、95、98、99もしくは100%またはそれより多いイソプレンが不飽和二量体および/または三量体イソプレンに変換する。いくつかの実施形態では、出発イソプレン組成物は、当該技術分野で公知である適切な触媒系と接触させて、1,2−ジ(プロプ−1−エン−2−イル)シクロブタン、1,3−ジ(プロプ−1−エン−2−イル)シクロブタン、1−メチル−1−ビニル−3−(プロプ−1−エン−2−イル)シクロブタン、1−メチル−1−ビニル−2−(プロプ−1−エン−2−イル)シクロブタン、1,3−ジメチル−1,3−ジビニルシクロブタン、1,2−ジメチル−1,2−ジビニルシクロブタン、1−メチル−4−(プロプ−1−エン−2−イル)シクロヘキサ−−1−エン)、1−メチル−5−(プロプ−1−エン−2−イル)シクロヘキサ−−1−エン、1,4−ジメチル−4−ビニルシクロヘキセン、2,4−ジメチル−4−ビニルシクロヘキセン、1,5−ジメチルシクロオクタ−1,5−ジエン、1,6−ジメチルシクロオクタ−1,5−ジエン、1,4−ジメチル−4−ビニル−1−シクロヘキセン、2,4−ジメチル−4−ビニル−1−シクロヘキセン、2,7−ジメチル−1,3,7−オクタトリエン、2,7−ジメチル−2,4,6−オクタトリエン、2,6−ジメチル−1,3−シクロオクタジエン、2,6−ジメチル−1,4−シクロオクタジエン、3,7−ジメチル−1,5−シクロオクタジエン、3,7−ジメチル−1,3−シクロオクタジエンおよび3,6−ジメチル−1,3−シクロオクタジエンからなる群から選択される1以上の不飽和環状イソプレン二量体を得る。いくつかの実施形態では、出発イソプレン組成物は、当該技術分野で公知である適切な触媒系と接触させて、1以上の不飽和環状イソプレン三量体、例えば、トリメチルシクロドデカトリエンおよびトリメチルドデカテトラエンなどを得る。いくつかの実施形態では、出発イソプレン組成物は、当該技術分野で公知である適切な触媒系と接触させて1以上の不飽和線状二量体および/または三量体イソプレン、例えば、ジメチルオクタトリエン(例えば2,7−ジメチル−1,3,7−オクタトリエンおよび2,7−ジメチル−2,4,6−オクタトリエン)およびトリメチルドデカテトラエン(例えば2,6,10−トリメチル−1,5,9,11−ドデカテトラエン、α−ファルネセンおよびβ−ファルネセン)などを得る。いくつかの好ましい実施形態では、出発イソプレン組成物はBioisoprene組成物である。
いくつかの実施形態では、イソプレンから燃料構成要素を産出する方法は、高純度イソプレン組成物を触媒系と接触させて、出発イソプレン組成物の少なくとも一部を不飽和イソプレン二量体および/または三量体に変換することを含む。いくつかの実施形態では、触媒系は、Ni、FeまたはCo触媒を含み、出発組成物中イソプレンは、ジメチルシクロオクタジエン、例えば、1,5−ジメチルシクロオクタ−1,5−ジエンおよび1,6−ジメチルシクロオクタ−1,5−ジエンを含む8員環イソプレン二量体に変換する。いくつかの実施形態では、触媒系はニッケル化合物を含む。イソプレンのNi触媒化二量体化により、約90:10、80:20、70:30、60:40、50:50、40:60、30:70、20:80および10:90比率の1,5−ジメチル−1,5−シクロオクタジエン対1,6−ジメチル−1,5−シクロオクタジエンからなるジメチル−1,5−シクロオクタジエン混合物を得る。一実施形態では、触媒系は、Niカルボキシレートもしくはβ−ケトン、有機アルミニウムもしくは有機マグネシウム化合物ならびに置換したトリフェニル亜リン酸を含む3成分触媒を含む。例えば、無水トルエン中の高純度イソプレン出発組成物の脱気溶液は、Ni(acac)2、Et3Al、およびトリス(3,4−ビス(ジメチルアミノ)フェニル)亜リン酸と窒素大気下で混合し、混合物を95℃で加熱してジメチルシクロオクタジエンを得る。別の実施形態では、触媒系は、Feカルボキシレートもしくはβ−ジケトン化合物、有機−AlもしくはMg化合物、ならびに電子供与基を有する2,2’−ジピリジル誘導体を含む。例えば、出発イソプレン組成物は、Feアセチルアセトネート、4,4’−ジメチル−2,2’−ジピリジル、およびEt3Alのトルエン溶液の混合物で加熱して、1,6−ジメチル−1,5−シクロオクタジエンを良好な収率で得る。いくつかの好ましい実施形態では、出発イソプレン組成物はBioisoprene組成物である。
いくつかの実施形態では、イソプレンから燃料構成要素を産出する方法は、高純度イソプレン組成物を触媒系と接触させて、出発イソプレン組成物の少なくとも一部を不飽和イソプレン二量体および/または三量体に変換することを含む。いくつかの実施形態では、触媒系は、Ru、Fe、NiもしくはPd触媒またはその組み合わせを含み、出発組成物中イソプレンを6員環イソプレン二量体を含む混合物に変換する。一実施形態では、触媒系は、Fe(NO)2Cl−ビス(1,5−シクロオクタジエン)ニッケル触媒系であり、出発組成物中イソプレンは、低温(例えば−5〜+20℃)でシクロ二量体化して、1−メチル−4−イソプロペニル−1−シクロヘキセンおよび2−メチル−4−イソプロペニル−1−シクロヘキセンならびに1,4−ジメチル−4−ビニル−1−シクロヘキセンおよび2,4−ジメチル−4−ビニル−1−シクロヘキセンを得る。別の実施形態では、トリス(置換したヒドロカルビル)亜リン酸、亜ヒ酸、もしくはアンチモナイトならびにVIII群金属(0)化合物(例えばNiアセチルアセトネート)の混合触媒と接触させることにより、出発組成物中イソプレンを1,4−ジメチル−4−ビニル−1−シクロヘキセンおよび1,5−ジメチル−1,5−シクロオクタジエンに変換する。別の実施形態では、イソプレン出発組成物をルテニウム触媒と接触させること(例えばItoh, Kenji; Masuda, Katsuyuki; Fukahori, Takahiko; Nakano, Katsumasa; Aoki, Katsuyuki; Nagashima, Hideo, Organometallics (1994), 13(3), 1020−9を参照されたい)により、イソプレンをC10環状二量体(例えばジメチル−シクロオクタジエンの混合物)に変換する。ルテニウム触媒は、RuCl3およびペンタメチルシクロペンタジエン(C5Me5H)から2つの工程において合成できる。本プロセスは、バッチモードで実施し得、触媒は回収して再利用する。いくつかの好ましい実施形態では、出発イソプレン組成物はBioisoprene組成物である。この方法の一実施形態をスキームXIに例証する。
いくつかの実施形態では、イソプレンから燃料構成要素を産出する方法は、高純度イソプレン組成物を触媒系と接触させて、出発イソプレン組成物の少なくとも一部を不飽和イソプレン二量体および/または三量体に変換することを含む。いくつかの実施形態では、触媒系は、Ni、Ti、Al、もしくはMg触媒またはその混合物を含み、出発組成物中イソプレンを環状イソプレン三量体、例えば、トリメチルシクロドデカトリエンを含む混合物に変換する。一実施形態では、イソプレンの三量体化のための触媒系は、Niおよび/もしくはTi、1以上の有機金属化合物、ならびにVA群化合物を含む。反応は、水酸基含有溶媒で行ない得る。別の実施形態では、電子供与体としての様々な亜リン酸の存在下、ニッケルナフテン酸およびイソプレンマグネシウムにより触媒されたイソプレンのオリゴマー化により、ジメチルシクロオクタジエンを含む環状二量体が得られ、特に1,1,1−トリス(ヒドロキシメチル)プロパン亜リン酸によりトリメチルシクロドデカトリエンが選択的に得られる。
スキームXI
いくつかの実施形態では、イソプレンから燃料構成要素を産出する方法は、高純度イソプレン組成物を触媒系と接触させて、出発イソプレン組成物の少なくとも一部を不飽和イソプレン二量体および/または三量体に変換することを含む。いくつかの実施形態では、触媒系は、Ni、PdもしくはCr触媒またはその混合物を含み、出発組成物中イソプレンは、短鎖重合体または線状二量体および/もしくは三量体に変換される。一実施形態では、Pd(0)錯体を含む触媒系(例えばPd(acac)2−Ph3PおよびPd(OAc)2−Ph3P)は、イソプレンの二量体化および短鎖重合化を触媒して、線状イソプレン二量体(例えば2,7−ジメチル−1,3,7−オクタトリエン)を得る。1つの代表例を挙げると、反応は、メタノールを溶媒として実施され、メチルエーテル、例えば、メトキシジメチルオクタジエン(例えば1−メトキシ−2,7−ジメチル−2,7−オクタジエンおよび3−メトキシ−2,7−ジメチル−1,7−オクタジエン)が産出される。別の実施形態では、触媒系は、2価および3価遷移金属交換モンモリロナイト(例えばCr3+−モンモリロナイト)を含む。別の実施形態では、触媒系は、Ni(0)−アミノ亜ホスフィン酸触媒を含み、出発組成物中イソプレンは線状二量体にhead−to−head型で位置選択的に変換する。いくつかの代表例を挙げると、線状二量体形態は、競合的シクロ二量体化反応により達成される。別の実施形態では、触媒系は、クロムN,N−ビス(ジアリールホスフィノ)アミン触媒(例えばBowen, L.; Charernsuk, M.; Wass, D.F. Chem. Commun. (2007) 2835−2837を参照されたい)を含み、イソプレンは、線状および環状C15三量体に変換する。1つの代表例を挙げると、クロム触媒は、CrCl3(THF)3およびPNPホスフィンリガンドからin situ作製される。
いくつかの実施形態では、Bioisoprene組成物から燃料構成要素を産出する方法は、(i)イソプレンの三量体化を触媒するための触媒とBioisoprene組成物を接触させて不飽和イソプレン三量体を産出すること、および(ii)イソプレン三量体を水素化して燃料構成要素を産出することにより、Bioisoprene組成物中イソプレンの実質的な一部を化学的変換させることを含む。いくつかの実施形態では、化学的変換中、Bioisoprene組成物中少なくとも約95%のイソプレンが非イソプレン化合物に変換される。
いくつかの実施形態では、イソプレンから燃料構成要素を産出する方法は、(a)商業的に有益な量の本明細書に記載の任意の高純度イソプレン出発組成物を得ること;(b)出発イソプレン組成物の少なくとも一部を不飽和イソプレン誘導体へ変換すること;ならびに(c)不飽和イソプレン誘導体を水素化して飽和化合物を産出することとを含む。いくつかの実施形態では、不飽和イソプレン誘導体の飽和化合物への水素化は、バッチモードで実施する。いくつかの実施形態では、不飽和イソプレン誘導体の飽和化合物への水素化は、連続モードで実施する。この方法の一実施形態をスキームXIIに例証する。
スキームXII
いくつかの実施形態では、イソプレンから燃料構成要素を産出する方法は、(a)商業的に有益な量の本明細書に記載の任意の高純度イソプレン出発組成物を得ること;(b)出発イソプレン組成物の少なくとも一部を酸化イソプレン誘導体へ変換すること;ならびに任意選択的に(c)任意の不飽和酸化イソプレン誘導体を水素化して飽和酸素化物を産出することを含む。いくつかの実施形態では、イソプレン出発組成物は、アルコール(例えばメタノールもしくはエタノールまたはその混合物)の存在下で触媒と接触させて、1以上の不飽和または飽和エーテル(例えばメチルエーテルもしくはエチルエーテルまたはその混合物)を含む酸化イソプレン誘導体を形成する。いくつかの実施形態では、触媒は、酸触媒、例えば、硫酸、固相硫酸(例えば、Dowex Marathon(登録商標))、液相および固相フルオロスルホン酸(例えばトリフルオロメタンスルホン酸およびナフィオン−H(DuPont))である。ゼオライト触媒、例えばベータ−ゼオライトも、リモネンおよび関連モノテルペンのメトキシル化のために、Hensel et al. [Hensen, K.; Mahaim, C.; Holderich, W.F., Applied Catalysis A: General (1997) 140(2), 311−329.]により記載されているものに類似した条件下で使用できる。いくつかの実施形態では、イソプレン出発組成物または不飽和イソプレン二量体もしくは三量体は、酸化/水素化を経て、1以上のアルコール、例えば、C5、C10およびC15アルコールならびにジオールを含むヒドロキシル化イソプレン誘導体を形成する。いくつかの実施形態では、イソプレン出発組成物は、水酸化/エステル化を経て、アルコールおよびエステルを形成する。例えば、Bioisopreneまたは不飽和中間体は、過酸、例えば、過酢酸および3−クロロ過安息香酸でのエポキシドへの過酸化;ならびに水和を経て、i)水と酸触媒およびii)ヒドロホウ素化反応方法でアルコールとジオールを得る。このような反応については、例えば、Michael B. Smith and Jerry March, Advanced Organic Chemistry: Reactions, Mechanisms, and Structure, Sixth Edition, John Wiley & Sons, 2007に記載されている。いくつかの好ましい実施形態では、出発イソプレン組成物はBioisoprene組成物である。
いくつかの実施形態では、イソプレンから燃料構成要素を産出する方法は、(a)商業的に有益な量の本明細書に記載の任意の高純度イソプレン出発組成物を得ること;(b)出発イソプレン組成物をモノ−オレフィン(例えば2−メチルブタ−1−エン、3−メチル−ブタ−1−エンおよび2−メチルブタ−2−エン)に一部水素化すること;ならびに(c)燃料構成要素をモノ−オレフィンから産出することを含む。一実施形態では、モノ−オレフィンは、二量体化を経る。別の実施形態では、例えば、イソブチレンをイソオクタンへ変換するために使用されるように従来の炭化水素カチオン触媒作用を用いてモノ−オレフィンを他のオレフィンと反応させる。次いで、二量体化または他のオレフィンとの反応産物は水素化を経て、飽和燃料構成要素を生じる。いくつかの好ましい実施形態では、高純度イソプレンはBioisoprene組成物である。いくつかの実施形態では、パラジウム触媒、例えば、Pd/CaCO3、Pd/BaSO4、Pd/C、Pdブラック、Pd/SiO3、Pd/Al2O3、またはPd/SiO2を用いて出発イソプレン組成物を一部水素化する。いくつかの実施形態では、シリカ支持ポリアミドアミン(PAMAM)デンドリマー−パラジウム錯体を用いて出発イソプレン組成物を一部水素化する。いくつかの実施形態では、パラジウム−金およびパラジウム−銀触媒(例えば、Pd−Au/SiO2およびPd−Ag/SiO2)を用いて一部水素化した出発イソプレン組成物は、完全に還元されたC5アルカンよりも、イソプレンをモノ−オレフィンへ還元する高い選択性を有する。いくつかの実施形態では、無機支持体(例えば、金属ゼオライト)上のVIB群金属を触媒、例えばMo/Al2O3触媒として用いて出発イソプレン組成物を一部水素化する。いくつかの実施形態では、ハニカム配置であり得る一体化した触媒床を用いて出発イソプレン組成物を一部水素化する。一体化した触媒床のための触媒支持体物質としては、金属、例えば、ニッケル、白金、パラジウム、ロジウム、ルテニウム、銀、鉄、銅、コバルト、クロム、イリジウム、スズ、および合金またはその混合物を挙げ得る。いくつかの実施形態では、特に反応に水を含まない場合、卵殻Pd/δ−Al2O3触媒を用いて出発イソプレン組成物を一部水素化する。いくつかの実施形態では、IB、VIB、VIIB群からの金属、または亜鉛により促進されたVIII群金属触媒を用いて出発イソプレン組成物を一部水素化し、触媒毒を減らす。イソプレンからイソアミレン(モノ−オレフィン)への変換方法は、同種触媒または異種触媒の両方を用いて、連続モードで実施することもでき、バッチモードで実施することもできる。この方法の一実施形態をスキームXIIIに例証する。
いくつかの実施形態では、イソプレンの部分的な水素化から産出するイソアミレンは、イオン交換樹脂およびゼオライト上で液相中の三量体化を経る。GranGranollers, Ind. Eng. Chem. Res., 49 (8), pp 3561−3570 (2001)を参照されたい。
スキームXIII
いくつかの実施形態では、イソプレンから燃料構成要素を産出する方法は、(a)商業的に有益な量の本明細書に記載の任意の高純度イソプレン出発組成物を得ること;(b)出発イソプレン組成物をモノ−オレフィン(例えば2−メチルブタ−1−エン、3−メチル−ブタ−1−エンおよび2−メチルブタ−2−エン)に一部水素化すること;(c)モノ−オレフィンの二量体化のための触媒とモノ−オレフィンを接触させて、モノ−オレフィンと別のダイメートを形成すること;ならびに(d)二量体化の産物(ダイメート)を水素化して飽和炭化水素燃料構成要素を産出することとを含む。いくつかの好ましい実施形態では、高純度イソプレンは、Bioisoprene組成物である。いくつかの実施形態では、他のモノ−オレフィンは、高純度イソプレン出発組成物から得られるイソアミレンである。いくつかの実施形態では、他のモノ−オレフィンは、別の源、例えば、プロピレン、ブタンまたはイソブテン由来のオレフィンである。いくつかの実施形態では、二量体化のための触媒は、樹脂触媒(例えば、Amberlyst、Amberlyst35、Amberlyst15、Amberlyst XN1010、Amberlyst XE586)である。いくつかの実施形態では、二量体化のための触媒は、酸性メソポーラスモレキュラーシーブ、例えば、ゼオライト構造、ZSM−5、フェリエライト、ZSM−22、またはZSM−23に組み込まれているメソポーラスシーブを含む触媒物質である。いくつかの実施形態では、二量体化のための触媒は、高温(例えば、少なくとも900℃)で熱的に安定している触媒物質である。いくつかの実施形態では、二量体化のための触媒は、酸性メソポーラスモレキュラーシーブを含む触媒物質である。いくつかの実施形態では、二量体化のための触媒は、固体酸性触媒(例えば、固体リン酸触媒、酸性イオン交換樹脂)である。この方法の一実施形態をスキームXIVに例証する。
スキームXIV
いくつかの実施形態では、イソプレンから燃料構成要素を産出する方法は、(a)商業的に有益な量の本明細書に記載の任意の高純度イソプレン出発組成物を得ること;(b)出発イソプレン組成物をイソアミレン(例えば2−メチルブタ−1−エン、3−メチル−ブタ−1−エンおよび2−メチルブタ−2−エン)に一部水素化すること;(c)イソアミレンをアルコールおよび触媒と接触させて酸素化物を形成すること;ならびに(c)イソアミレン酸素化から燃料構成要素を産出することとを含む。いくつかの好ましい実施形態では、高純度イソプレンは、Bioisoprene組成物である。いくつかの実施形態では、イソアミレンはエタノールと接触させて、形成される燃料酸素化物は、エーテル、例えば、TAMEである。
いくつかの実施形態では、本明細書に記載の方法はいずれも、化学的変換前に出発イソプレン組成物を精製することをさらに含む。例えば、本発明の組成物および方法を用いて産出されたイソプレンを、標準的な技術を用いて精製することができる。精製とは、イソプレンが産出されるときに存在する1以上の成分からイソプレンを分離するプロセスを指す。いくつかの実施形態では、イソプレンを実質的に純粋な液体として得る。精製方法の例としては、(i)液体抽出剤中の溶液からの蒸留および(ii)クロマトグラフィーが挙げられる。本明細書で使用される場合、「精製イソプレン」は、イソプレンが産出されるときに存在する1以上の成分から分離されたイソプレンを意味する。いくつかの実施形態では、イソプレンは、少なくとも約20重量%であり、イソプレンが産出されるときに存在する他の成分を含まない。様々な実施形態では、イソプレンは、少なくともまたは約25重量%、30重量%、40重量%、50重量%、60重量%、70重量%、75重量%、80重量%、90重量%、95重量%、または99重量%で、純粋である。純度は、任意の適切な方法により、例えば、カラムクロマトグラフィー、HPLC分析、またはGC−MS分析により、アッセイすることができる。いくつかの実施形態では、Bioisopreneは、活性炭への初回吸着、その後の脱離および凝結により発酵オフガスから回収して、燃料構成要素への化学的変換のための液体イソプレン組成物を得る。
燃料を産出するための連続プロセス
本発明は、イソプレンから燃料構成要素を産出するための連続プロセスも提供し、この連続プロセスは、(a)商業的に有益な量の高純度イソプレンを連続的に産出すること;ならびに(b)商業的に有益な量の高純度イソプレンの少なくとも一部を燃料構成要素へ連続的に化学的変換することとを含む。本発明による連続プロセスにおいて、高純度イソプレンストリームを、例えば、(例えばイソプレンを産出する細胞を培養する)生物学的プロセスにより連続的に産出して、化学的変換リアクターに通過させる。いくつかの実施形態では、発酵オフガスからのイソプレンは、抽出蒸留、凝結、吸着または連続精製単位の膜を用いて水および他の恒久的ガス(例えば、O2、N2およびCO2)から分離し、ここで酸素レベルはppm範囲に低下し、他の関心の不純物は除去される;イソプレン蒸気は、異種触媒を用いて二量体(C10)および三量体(C15)に触媒的に変換する;所望の産物を分離し、未反応イソプレンはさらに変換するためリアクターに戻す。いくつかの実施形態では、気相中の所望されるC10炭化水素レベルを測定することにより触媒の二量体化をモニタリングする。
いくつかの実施形態では、生物学的に産出されたイソプレンストリームは、温度を約100℃〜約300℃で維持した化学リアクター(例えば、反応管)を通過させ、ここで生物学的に産出されたイソプレンは二量体化反応を経る。1つの代表例を挙げると、イソプレン二量体は産物ストリームから分離され、未反応イソプレンの少なくとも一部は化学リアクターに戻されて再利用される。一実施形態では、産出された不飽和イソプレン二量体は、第2の化学リアクター内で水素化触媒および水素源と接触させて、一部水素化したおよび/または完全に水素化した産物を産出する。本プロセスは、イソプレンを産出するバイオリアクターのオフガスからのイソプレン回収工程をさらに含むことができる。
いくつかの実施形態では、共産出された水素を含むBioisopreneストリームは、最初に水素ガスから分離され、Bioisopreneストリームは化学リアクター(例えば、反応管)に通過させて約100℃〜約300℃の温度で維持し、ここで生物学的に産出されたイソプレンは二量体化反応を経る。1つの代表例を挙げると、イソプレン二量体は産物ストリームから分離され、未反応イソプレンの少なくとも一部は化学リアクターに戻されて再利用される。一実施形態では、産出された不飽和イソプレン二量体は、第2の化学リアクター内で水素化触媒および水素源と接触させて、一部水素化したおよび/または完全に水素化した産物を産出する。1つの代表例を挙げると、イソプレン−水素の共産出から単離された水素ストリームは、水素化工程に使用される。本プロセスは、イソプレンを産出するバイオリアクターのオフガスからのイソプレン回収工程をさらに含むことができる。本プロセスは、当該技術分野で公知である精製方法、例えば、極低温凝結および固体マトリックス吸着を用いた、イソプレン−水素の共産出から単離された水素ストリームの精製工程をさらに含むことができる。
燃料産物からのジエンおよびポリマーの除去
燃料組成物は、ゴム、樹脂、ポリマーおよび他の望ましくない副産物を経時的に形成し得る不飽和化合物(オレフィン、ジオレフィンおよびポリオールフィン)をしばしば含む(例えば、Pereira and Pasa (2006) Fuel, 85, 1860−1865およびその参考文献を参照されたい)。通常、所定の化合物の不飽和増加度につれて、化合物がこのような副産物を形成する可能性が高くなる。イソプレンは、燃料組成物中に存在するとき望ましくないポリマー性副産物を形成しやすい1,3−ジエンである。副産物の形成程度を減らすことができる燃料添加物(抗酸化剤、ラジカル消光剤など)が存在する一方、このような副産物は依然として経時的に形成され得る。オレフィンも、燃料から蒸発して大気中に放出されるとき、またはオレフィン含有燃料の不完全燃焼の結果として、地表濃度オゾンの形成に寄与し得る。
したがって、イソプレンに完全にまたは部分的に由来する燃料組成物は、イソプレンをほとんど含まないか全く含まないべきである。この一連の方法は、燃料組成物からイソプレンを例えば、蒸留精製、アルコールとの反応により取り出してエーテルを形成するか、または水素化してイソプレンを飽和誘導体に変換するかのいずれかのために使用できる。あるいは、イソプレンは、求ジエン体、例えば、無水リンゴ酸で処理して望ましくない副産物の形成に寄与しない不活性付加物を産出できる。
イソプレンを実質的に含まないイソプレン誘導体を含む燃料組成物を提供する。いくつかの実施形態では、燃料組成物は、0.01%、0.1%、1%、2%、3%、4%、5%、10%または15%未満のイソプレンを含む。イソプレンを実質的に含まないイソプレン誘導体を含む燃料組成物へBioisoprene組成物を化学的変換するための方法も提供する。いくつかの実施形態では、Bioisoprene組成物由来のイソプレンの実質的な一部を燃料構成要素に変換する。いくつかの実施形態では、Bioisoprene組成物由来のイソプレンの実質的な一部を、燃料構成要素を産出するためにさらに変換できる中間体に変換する。いくつかの実施形態では、Bioisoprene組成物由来のイソプレンの実質的な一部をイソプレン以外の化合物に変換する。「実質的な一部」とは、99.99%、99.9%、99%、98%、97%、96%、95%、90%、85%または80%である。
いくつかの例では、イソプレンおよび他の共役ジエンは、所望の産物の収率の低下および/または触媒を失活させることができるゴム様の粘りのあるポリマー性産物を形成できる。(例えば、R.C.C. Pereira and V.M.D. Pasa. Fuel 85 (2006) 1860−1865を参照されたい)。いくつかの実施形態では、生成物混合物中に存在する共役ジエン量の決定方法を提供する。D.F. Andrade et al.は、共役ジエン存在量の以下を含む様々な決定方法について記載している(Fuel (2010), doi:10.106/j.fuel/2010.01.003):1)UOP−326方法(マレイン酸無水物方法)、ジエンでディールス・アルダー反応を介して消費したマレイン酸無水物量を測定する半定量方法;2)ポーラログラフィー;3)ガスクロマトグラフィー、ジエンは誘導体化剤、例えば、4−メチル−1,2,4−トリアゾリン−3,5−ジオン(MTAD)または4−フェニル−1,2,4−トリアゾリン−3,5−ジオン(PTAD)と反応し得る;4)HPLC;5)超臨界流体クロマトグラフィー;6)NMR;7)UVおよび近赤外分析;ならびに8)p−ニトロベンゼンジアゾニウムテトラフルオロボラートによるジエンの最初の誘導化を含み得る他の分光方法。
本明細書では、ゴム形成の最小化および/またはゴム産出量の低減方法を提供する。いくつかの実施形態では、抗酸化剤を使用してゴム形成を最小限に抑える。他の実施形態では、ポリマー性副産物は、プロセスストリームに戻して再利用する。いくつかの実施形態では、ポリマー性副産物の脱ポリマー化は、オレフィンメタセシスを介して実行する。オレフィンメタセシスは、モリブデンまたはタングステン触媒、例えば、2,6−ジイソプロピルフェニルイミドネオフィリデンモリブデンビス(2−tertブチルフェノキシド)を用いて実行できる。(米国特許第5,446,102号を参照されたい)。
いくつかの実施形態では、本明細書に記載の方法はいずれも、これらの反応の産物を特性の分析をし、潜在的な燃料価値を評価することをさらに含む。例えば、産物は、当該技術分野で公知である標準的な方法、例えばGC/MS、NMR、UV−VisおよびIR分光学、沸騰温度、密度ならびに他の物理的特性により特徴付けられる。産物は、二重炭素−同位体のフィンガープリント法によりさらに特性化することができる(米国特許第7,169,588号を参照されたい)。産物の潜在的燃料価値は、燃料特性、例えば、エネルギー密度、加熱値、水可溶性、オクタン/セタン価、密度、粘度、表面張力、蒸気化のエンタルピー、蒸気拡散度、引火点、自己発火点、可燃限界、曇点および化学安定性ののような燃料の性質の尺度となるパラメーターにより評価する。
市販の石油燃料と同様に、BioIsoFuel(商標)産物は、酸性度、密度、微量無機物含量、ベンゼン、総芳香族含量、含水量、および腐食性について試験できる。BioIsoFuel(商標)産物中の少量不純物がそれらの物質特性に有害な影響を与えないことを確実にするため、試料の腐食性および燃料系との適合性について、水のためのKarl Fischer、腐食性についての銅のストリップのような標準的ASTM試験により試験することもできる。
燃料組成物
本発明は、本明細書に記載の任意の方法およびプロセスにより産出された燃料構成要素を含む燃料組成物を提供する。いくつかの実施形態では、燃料構成要素は、イソプレンおよびイソプレンの酸化誘導体から得られる飽和C10およびC15炭化水素からなる群から選択される1以上の炭化水素を含む。炭化水素BioIsoFuel(商標)産物は、石油ガソリンおよびディーゼルと完全に適合性のあることが期待される。BioIsoFuel(商標)と市販の石油燃料の混合物は酸、硫黄、芳香族、または他の望ましくない不純物を含まないため、より所望される特性を有することが期待される。
いくつかの好ましい実施形態では、燃料構成要素は、Bioisopreneの誘導体を含む。再生可能な非石油化学ベースの資源から作製されるBioisopreneから得られる燃料に対して強い需要があるであろうことが予期される。産業的顧客および消費者は、石油化学プロセスから得られたイソプレンで作製されるこのような環境に優しい源から得られる燃料成分を購入する方を好むと考えられる。さらに、顧客は、再生可能な資源で作製されるこのような環境に優しい産物を割増価格で喜んで支払うものと考えられる。本明細書に記載のBioisoprene組成物から得られる燃料成分は、非石油化学ベースの資源から得られることが証明できる便益を提供する。
いくつかの実施形態では、燃料構成要素は、1以上の飽和環状C10炭化水素、例えば、1,2−ビス(イソプロピル)シクロブタン、1,2−ビス(イソプロピル)シクロブタン、1−メチル−4−イソプロピルシクロヘキサン、1−メチル−3−イソプロピルシクロヘキサン、1−エチル−1,4−ジメチルシクロヘキサン、1−エチル−1,3−ジメチルシクロヘキサン、1,5−ジメチルシクロオクタンおよび1,4−ジメチルシクロオクタンを含む。いくつかの実施形態では、燃料構成要素は、1以上の飽和環状C15炭化水素、例えば、1,5,9−トリメチルシクロドデカンおよび1,5,10−トリメチルシクロドデカンを含む。いくつかの実施形態では、燃料構成要素は、1以上の飽和脂肪族C10炭化水素、例えば、2,6−ジメチルオクタン、2,7−ジメチルオクタンおよび3,6−ジメチルオクタンを含む。いくつかの実施形態では、燃料構成要素は、1以上の飽和脂肪族C15炭化水素、例えば、2,6,10−トリメチルドデカン、2,7,10−トリメチルドデカンおよび3,7,10−トリメチルドデカンを含む。いくつかの実施形態では、燃料構成要素は、2−メチルブタンを含む。いくつかの実施形態では、燃料構成要素は、1,2−ビス(イソプロピル)シクロブタン、1,2−ビス(イソプロピル)シクロブタン、1−メチル−4−イソプロピルシクロヘキサン、1−メチル−3−イソプロピルシクロヘキサン、1−エチル−1,4−ジメチルシクロヘキサン、1−エチル−1,3−ジメチルシクロヘキサン、1,5−ジメチルシクロオクタン、1,4−ジメチルシクロオクタン、1,5,9−トリメチルシクロドデカン、1,5,10−トリメチルシクロドデカン、2,6−ジメチルオクタン、2,7−ジメチルオクタン、3,6−ジメチルオクタン、2,6,10−トリメチルドデカン、2,7,10−トリメチルドデカン、3,7,10−トリメチルドデカンおよび2−メチルブタンからなる群から選択される1以上の炭化水素を含む。
いくつかの実施形態では、燃料構成要素は、1以上の飽和ヒドロキシレート、例えば、C5アルコールおよびジオール(例えば3−メチル−ブタン−1−オール、2−メチル−ブタン−1−オールおよび2−メチル−ブタン−2−オール、3−メチル−ブタン−1,3−ジオールおよび2−メチル−ブタン−2,3−ジオール)、C10アルコールおよびジオール(例えば3,7−ジメチルオクタン−1−オール、2,7−ジメチルオクタン−1−オール、2,7−ジメチルオクタン−2−オールおよび2,7−ジメチルオクタン−2,7−ジオール)および環状C10アルコール(例えば2−(4−メチルシクロヘキシル)プロパン−2−オール、2−(4−メチルシクロヘキシル)プロパン−1−オール、2−(1,4−ジメチルシクロヘキシル)エタノールおよび4−エチル−1,4−ジメチルシクロヘキサノール)を含む。いくつかの実施形態では、燃料構成要素は、1以上の飽和エーテル、例えば、1,3−ジエトキシ−3−メチルブタン、1−エトキシ−3−メチルブタン、1−メトキシ−2,7−ジメチルオクタンおよび3−メトキシ−2,7−ジメチルオクタンを含む。いくつかの実施形態では、燃料構成要素は、3−メチル−ブタン−1−オール、2−メチル−ブタン−1−オール、2−メチル−ブタン−2−オール、3−メチル−ブタン−1,3−ジオール、2−メチル−ブタン−2,3−ジオール、3,7−ジメチルオクタン−1−オール、2,7−ジメチルオクタン−1−オール、2,7−ジメチルオクタン−2−オール、2,7−ジメチルオクタン−2,7−ジオール、2−(4−メチルシクロヘキシル)プロパン−2−オール、2−(4−メチルシクロヘキシル)プロパン−1−オール、2−(1,4−ジメチルシクロヘキシル)エタノール、4−エチル−1,4−ジメチルシクロヘキサノール、1,3−ジエトキシ−3−メチルブタン、1−エトキシ−3−メチルブタン、1−メトキシ−2,7−ジメチルオクタンおよび3−メトキシ−2,7−ジメチルオクタンからなる群から選択される1以上のイソプレン誘導酸素化物を含む。
いくつかの実施形態では、燃料構成要素は、本明細書に記載の任意の方法およびプロセスによる工程を経た後、0.5μg/L未満または約0.5μg/Lのイソプレン以外のC5炭化水素由来の産物を含む。一実施形態では、燃料構成要素は、本明細書に記載の任意の方法およびプロセスによる工程を経た後、イソプレン以外のC5炭化水素由来の産物を実質的に含まない。いくつかの実施形態では、燃料構成要素は、出発組成物中の全てのC5炭化水素の総重量と比べて、約0.2、0.12、0.10、0.08、0.06、0.04、0.02、0.01、0.005、0.001、0.0005、0.0001、0.00005、もしくは0.00001重量%またはそれ未満のイソプレン以外のC5炭化水素(例えば、1,3−シクロペンタジエン、cis−1,3−ペンタジエン、trans−1,3−ペンタジエン、1,4−ペンタジエン、1−ペンチン、2−ペンチン、1−ペンテン、2−メチル−1−ブテン、3−メチル−1−ブチン、ペント−4−エン−1−イン、trans−ペント−3−エン−1−イン、またはcis−ペント−3−エン−1−イン)を含む。いくつかの実施形態では、燃料構成要素は、イソプレン以外のC5炭化水素(1,3−シクロペンタジエン、trans−1,3−ペンタジエン、cis−1,3−ペンタジエン、1,4−ペンタジエン、1−ペンチン、2−ペンチン、1−ペンテン、2−メチル−1−ブテン、3−メチル−1−ブチン、ペント−4−エン−1−イン、trans−ペント−3−エン−1−イン、またはcis−ペント−3−エン−1−インなど)を、100、10、1、0.1もしくは0.01ppm未満の濃度で含む。
本明細書に記載のBioisoprene組成物中のイソプレン以外の成分は、本明細書に記載の様々なプロセスを経た後、異なる産物に変換されるであろうことが理解される。イソプレン以外の成分への方法/プロセスに用いる金属ベースの触媒の感受性は、これらの成分の性質およびレベルに応じて異なる。熱二量体化プロセスにおいて、非常に広範囲の化合物が許容されるであろう。場合により、イソプレン以外の成分はイソプレンと反応して付加物を産出する。例えば、メタクロレインとメチルビニルケトンのイソプレンとのディールス・アルダー反応により、6員環産物が生じる。不飽和付加物は、燃料構成要素および組成物に含まれる飽和誘導体、例えば1,4−ジメチル−1−(ヒドロキシメチル)シクロヘキサンおよび1−(1−ヒドロキシエチル)−4−メチルシクロヘキサンにさらに水素化できる(スキームXVを参照)。
スキームXV.Bioisoprene(商標)から得られる微量不純物の例
いくつかの実施形態では、燃料構成要素は、本明細書に記載の任意の方法およびプロセスによる工程を経た後、エタノール、アセトン、C5プレニルアルコール、および10以上の炭素原子を有するイソプレノイド化合物からなる群から選択される化合物由来の産物を含む。いくつかの実施形態では、燃料構成要素は、本明細書に記載の任意の方法およびプロセスによる工程を経た後、エタノール、アセトン、メタノール、アセトアルデヒド、メタクロレイン、メチルビニルケトン、2−メチル−2−ビニルオキシラン、cis−3−メチル−1,3−ペンタジエンおよびtrans−3−メチル−1,3−ペンタジエン、C5プレニルアルコール(例えば、3−メチル−3−ブテン−1−オールもしくは3−メチル−2−ブテン−1−オール)、2−ヘプタノン、6−メチル−5−ヘプタン−2−オン、2,4,5−トリメチルピリジン、2,3,5−トリメチルピラジン、シトロネラル、メタンチオール、メチルアセタート、1−プロパノール、ジアセチル、2−ブタノン、2−メチル−3−ブテン−2−オール、エチルアセタート、2−メチル−1−プロパノール、3−メチル−1ブタナール、3−メチル−2−ブタノン、1−ブタノール、2−ペンタノン、3−メチル−1−ブタノール、エチルイソブチレート、3−メチル−2−ブテナール、ブチルアセタート、3−メチルブチルアセタート、3−メチル−3−ブテン−1−イルアセタート、3−メチル−2−ブテン−1−イルアセタート、3−ヘキセン−1−オール、3−ヘキセン−1−イルアセタート、リモネン、ゲラニオール(trans−3,7−ジメチル−2,6−オクタジエン−1−オール)、シトロネロール(3,7−ジメチル−6−オクテン−1−オール)、(E)−3,7−ジメチル−1,3,6−オクタトリエン、(Z)−3,7−ジメチル−1,3,6−オクタトリエン、および2,3−シクロヘプテノルピリジンからなる群から選択される1以上の化合物からの1以上の産物を含む。いくつかの実施形態では、燃料構成要素は、1,4−ジメチル−1−(ヒドロキシメチル)シクロヘキサン、1−(1−ヒドロキシエチル)−4−メチルシクロヘキサン、2−メチルブタン、3−メチルペンタン、2−プロパノール、2−メチル−1−プロパノール、2−ブタノール、3−メチル−1−ブタノール、エチルアセタートおよび3−メチル−1−ブチルアセタートからなる群から選択される1以上の化合物を含む。いくつかの実施形態では、燃料構成要素は、1,4−ジメチル−1−(ヒドロキシメチル)シクロヘキサン、1−(1−ヒドロキシエチル)−4−メチルシクロヘキサン、2−メチルブタン、3−メチルペンタン、2−プロパノール、2−メチル−1−プロパノール、2−ブタノール、3−メチル−1−ブタノール、エチルアセタートおよび3−メチル−1−ブチルアセタートからなる群から選択される1以上の化合物を約10ppm、1ppm、100ppb、10ppbもしくは1ppbまたはそれより多いレベルで含む。
いくつかの実施形態では、燃料構成要素は、エタノール、アセトン、メタノール、アセトアルデヒド、メタクロレイン、メチルビニルケトン、2−メチル−2−ビニルオキシラン、cis−3−メチル−1,3−ペンタジエンおよびtrans−3−メチル−1,3−ペンタジエン、C5プレニルアルコール(例えば、3−メチル−3−ブテン−1−オールもしくは3−メチル−2−ブテン−1−オール)、2−ヘプタノン、6−メチル−5−ヘプタン−2−オン、2,4,5−トリメチルピリジン、2,3,5−トリメチルピラジン、シトロネラル、メタンチオール、メチルアセタート、1−プロパノール、ジアセチル、2−ブタノン、2−メチル−3−ブテン−2−オール、エチルアセタート、2−メチル−1−プロパノール、3−メチル−1ブタナール、3−メチル−2−ブタノン、1−ブタノール、2−ペンタノン、3−メチル−1−ブタノール、エチルイソブチレート、3−メチル−2−ブテナール、ブチルアセタート、3−メチルブチルアセタート、3−メチル−3−ブテン−1−イルアセタート、3−メチル−2−ブテン−1−イルアセタート、3−ヘキセン−1−オール、3−ヘキセン−1−イルアセタート、リモネン、ゲラニオール(trans−3,7−ジメチル−2,6−オクタジエン−1−オール)、シトロネロール(3,7−ジメチル−6−オクテン−1−オール)、(E)−3,7−ジメチル−1,3,6−オクタトリエン、(Z)−3,7−ジメチル−1,3,6−オクタトリエン、および2,3−シクロヘプテノルピリジンからなる群から選択される1以上の化合物を約10ppm、1ppm、100ppb、10ppbもしくは1ppbまたはそれより多いレベルで含む。
炭素フィンガープリント法
Bioisopreneから得られるBioIsoFuelは、二重炭素−同位体のフィンガープリント法に基づき、石油化学炭素由来の燃料と区別できる。加えて、生物源炭素の具体的な源(例えばグルコース対グリセロール)は二重炭素−同位体のフィンガープリント法により決定できる(米国特許第7,169,588号を参照されたく、これは参照により本明細書に組み込まれる)。
本方法は、化学的に等価な材料を区別したり、生物圏(植物)構成要素の成長源(および、おそらくは成長年代)により炭素材料を分類するのに有用である。同位体14Cと13Cがこの問題に相補的な情報をもたらす。放射性炭素年代測定で使用する同位体(14C)は、5730年の核半減期を有しており、試料炭素を化石(「死んでいる」)原料と生物圏(「生きている」)原料に明確に分けることができる[Currie, L. A. “Source Apportionment of Atmospheric Particles,” Characterization of Environmental Particles, J. Buffle and H. P. van Leeuwen, Eds., 1 of Vol. I of the IUPAC Environmental Analytical Chemistry Series (Lewis Publishers, Inc) (1992) 3 74]。放射性炭素年代測定の基本的な前提は、大気圏に存在する14C濃度が一定であることから、生きている有機体内の14Cも一定であるとすることである。単離した試料を扱うとき、試料の年代は、t=(−5730/0.693)ln(A/AO)(式14)(式中、t=年代、5730年は放射性炭素の半減期であり、AおよびAOはそれぞれ試料およびモデム炭素標準物質の14C比放射能である)の関係により近似的に推定することができる[Hsieh, Y., Soil Sci. Soc. Am J., 56, 460, (1992)]。しかしながら、1950年以降の大気圏核実験および1850年以降の化石燃料の燃焼により、14Cは第2の地球化学的時間特性を有するようになった。大気圏における、したがって生物圏におけるCO2中の14Cの濃度は、1960年代半ばの核実験ピーク時には約2倍に達した。以降、緩和「半減期」が約7〜10年で、定常状態のコスモジェニックな(大気圏の)同位体比(14C/12C)のベースラインが約1.2×10−12に徐々に戻りつつある。この後者の半減期は文字通りに取ってはならず、むしろ、詳細な大気圏の核生成/崩壊関数を使って核時代の幕開け以来の大気圏および生物圏の14Cの変動を追跡しなければならない。近年の生物圏炭素の年代測定を保証するのは、この後者の生物圏14Cの時間特性である。14Cは加速器質量分析法(AMS)によって測定することができ、結果は「モデム炭素分率」(fM)の単位で与えられる。fMは、米国標準技術局(NIST)の標準基準物質(SRM)4990Bおよび4990C、(それぞれシュウ酸標準物質HOxIおよびHOxIIとして知られる)より定義されている。基本の定義はHOxIの14C/12C同位体比を0.95倍することに関係している(AD1950を基準として)。これは大体、崩壊を補正した産業革命以前の樹木と等価である。現在の生物圏(植物材料)はfM約1.1である。
安定な炭素同位体比(13C/12C)は成長源の分別と分類を行なうための相補的な手段となる。与えられた生物由来材料の13C/12C比は、二酸化炭素が固定された時点における大気圏の二酸化炭素中の13C/12C比の結果であり、また正確な代謝経路を反映する。地域的な変動もある。石油、C3植物(広葉樹)、C4植物(草類)および海洋の炭酸塩は全て、13C/12Cおよび対応するδ13C値に有意差を示す。さらに、C3植物とC4植物の脂質を分析すると、同じ植物の炭水化物成分から誘導された物質とは代謝経路を反映して異なる結果が得られる。13Cは、同位体分別効果によって測定精度の範囲内で大きく変動するが、その中で本発明にとって最も重大なものは光合成のメカニズムである。植物中の炭素同位体比が異なる主な原因は、植物の光合成による炭素の代謝経路の違い、特に、最初のカルボキシル化、すなわち大気圏CO2の初期の固定化段階で起こる反応の違いに密接に関係している。植物の生育を2つに大別すると、「C3」(またはCalvin−Benson)光合成回路を組み込んだものと、「C4」(またはHatch−Slack)光合成回路を組み込んだものに分類される。C3植物、例えば、広葉樹および針葉樹は温帯気候の地域で優勢な植物である。C3植物では、最初のCO2固定化またはカルボキシル化反応に、酵素リブロース−1,5−ジホスフェートカルボキシラーゼ酵素を使用し、最初の安定な生成物は炭素数が3の化合物である。他方、C4植物としては、熱帯の草類、トウモロコシおよびサトウキビなどの植物が挙げられる。C4植物では、別の酵素のホスフェノール−ピルビン酸カルボキシラーゼが関与するさらなるカルボキシル化反応が、最初のカルボキシル化反応である。最初の安定な炭素化合物は炭素数4の酸であって、これはその後脱カルボキシル化される。こうして放出されたCO2はC3回路で再固定化される。
C
4植物とC
3植物は共に、ある範囲の
13C/
12C同位体比を示すが、典型的な値は約−10〜−14パーミル(C
4)および−21〜−26パーミル(C
3)である[Weber et al., J. Agric. Food Chem., 45, 2942 (1997)]。石炭と石油は、一般に、この後者の範囲内に収まる。
13C測定の尺度は、当初ピー・ディー・ベレムナイト(PDB)石灰石によりゼロ点が定義され、数値はこの物質からの千分率の偏差で与えられる。「δ
13C」値は、‰と略される千分率(パーミル)で表され、次のように計算される(式15):
(式15)
PDB基準物質(RM)が使い尽されてしまったので、一連の代替RMがIAEA、USGS、NIST、および他の選ばれた国際同位体研究所の協力の下に開発されている。PDBからの千分率偏差の表記はδ
13Cである。測定はCO
2を試料として高精度安定比質量分析法(IRMS)により質量数44、45および46の分子イオンについて行なう。
石油精製からのC5ストリーム抽出蒸留から得られるイソプレンにおいて、δ13Cは約−22‰〜約−24‰である。この範囲は石油から得られる軽不飽和炭化水素において典型的であり、石油ベースのイソプレンから得られる産物は典型的には同じδ13Cでイソプレン単位を含む。最少量の他の炭素含有栄養剤(例えば、酵母抽出物)とトウモロコシ派生グルコース(δ13C−10.73‰)発酵により産出されたBioisopreneは、ポリイソプレンにポリマー化できるイソプレンをδ13C−14.66〜−14.85‰産出する。このようなBioisopreneから産出される産物は、石油ベースのイソプレンから得られるものより負の値が小さいδ13C値を有することが予期される。イソブチレンとホルムアルデヒドの反応から得られるイソプレンにおいて、δ13C値は約−34.4‰であることができる。なぜならホルムアルデヒドは、しばしば、さらにより負のδ13C値をもつ供給原料由来であるためである。
生物再生可能な炭素源を用いて細胞培養からイソプレンで生成される本発明の燃料および燃料構成要素は、それらのδ13C値および他の燃料特徴に基づいてそのようなものとして同定できる。いくつかの実施形態では、Bioisoprene由来の燃料構成要素は、−22‰より高い(負の値が小さい)δ13C値を有する。いくつかの実施形態では、Bioisoprene由来の燃料構成要素は、−20、−18、−16、−14、−12、または−10‰を上回るδ13C値を有する。いくつかの実施形態では、Bioisoprene由来の燃料構成要素は、−22〜−10、−21〜−12、または−20〜−14‰の範囲内であるδ13C値を有する。いくつかの実施形態では、Bioisoprene由来の燃料構成要素は、−34〜−24、−34〜−25、−33〜−25、−32〜−24、−32〜−25、−31〜−25、−30〜−29、−30.0〜−29.5、−29.5〜−28.5、または−29.0〜−28.5‰の範囲内であるδ13C値を有する。
いくつかの実施形態では、Bioisoprene由来の燃料構成要素は、放射性炭素14を含む。いくつかの実施形態では、14C/12C比は、約1.0×10−12、1.05×10−12、1.1×10−12、1.15×10−12、もしくは1.2×10−12またはそれより多い。いくつかの実施形態では、Bioisoprene由来の燃料構成要素は、約0.9、0.95、1.0、1.05もしくは1.1またはそれより多いfM値を有する。いくつかの実施形態では、Bioisoprene由来の燃料構成要素は、約0.9、0.95、1.0、1.05もしくは1.1またはそれより多いfM値と−22‰より高い(負の値が小さい)δ13C値を有する。いくつかの実施形態では、Bioisoprene由来の燃料構成要素は、約0.9、0.95、1.0、1.05もしくは1.1またはそれより多いfM値と−22〜−10、−21〜−12、または−20〜−14‰の範囲内のδ13C値を有する。いくつかの実施形態では、Bioisoprene由来の燃料構成要素は、約0.9、0.95、1.0、1.05もしくは1.1またはそれより多いfM値と−34〜−24、−34〜−25、−33〜−25、−32〜−24、−32〜−25、−31〜−25、−30〜−29、−30.0〜−29.5、−29.5〜−28.5、または−29.0〜−28.5‰の範囲内のδ13C値を有する。
Bioisoprene誘導体および関連したBioIsoFuel、中間体、および混合物は、14C(fM)および二重炭素−同位体のフィンガープリント法に基づき石油化学派生対応物と完全に区別し得、新規の組成合成物であることを示す。
いくつかの実施形態では、本発明の燃料構成要素は、エタノールの燃料構成要素より高いエネルギー密度を有する。いくつかの実施形態では、燃料構成要素は、燃料のセタン数、例えば、石油ベースの燃料をブーストする。いくつかの実施形態では、燃料構成要素は、石油ベースの燃料放出を減らす。いくつかの実施形態では、燃料組成物は、約80〜約120の範囲のオクタン数を有する。いくつかの実施形態では、燃料組成物は、約30〜約130の範囲のセタン数を有する。
いくつかの実施形態では、本発明の燃料組成物は、1以上のジメチルシクロオクタン化合物を含む。いくつかの実施形態では、本発明の燃料組成物は、1以上のC10炭化水素、例えば、置換シクロヘキサンを含む。いくつかの実施形態では、本発明の燃料組成物は、本明細書に記載の1以上のイソプレン派生酸素化物を含む。いくつかの実施形態では、本明細書に記載の任意の燃料組成物はさらに、総燃料組成物の総重量または総体積に基づき約1%〜約95重量%または体積%の量で石油ベースの燃料を含む。
本発明はさらには、石油留出物を得ることおよび本発明の燃料構成要素を添加することを含む燃料組成物の作製方法を提供する。
本発明は、さらに以下の実施例を参照することにより理解でき、この実施例は例証として提供し、制限することを意味しない。
実施例
実施例1:組換えクズイソプレンシンターゼを発現する大腸菌におけるイソプレンの産出
I.大腸菌でクズイソプレンシンターゼを発現させるためのベクターの構築
クズ(タイワンクズ)イソプレンシンターゼ遺伝子(IspS)のタンパク質配列をGenBank(AAQ84170)から得た。大腸菌コドン使用に最適化されたクズイソプレンシンターゼ遺伝子を、DNA2.0から購入した(配列番号1)。イソプレンシンターゼ遺伝子を、供給されたプラスミドからBspLU11I/PstIによる制限エンドヌクレアーゼ消化で取り出し、ゲル精製し、NcoI/PstIで消化しておいたpTrcHis2B(Invitrogen)に連結した。コンストラクトを、イソプレンシンターゼ遺伝子の終止コドンがPstI部位の5’になるように設計した。結果として、このコンストラクトが発現されたときに、Hisタグはイソプレンシンターゼタンパク質に付加されない。得られたプラスミド、pTrcKudzuをシークエンシングで確認した(図2および3;配列番号2)。
イソプレンシンターゼ遺伝子をpET16b(Novagen)にもクローニングした。この場合は、組換えイソプレンシンターゼタンパク質がN末端Hisタグを含有するように、イソプレンシンターゼ遺伝子をpET16bに挿入した。イソプレンシンターゼ遺伝子を、プライマーセットのpET−His−Kudzu−2F:5’−CGTGAGATCATATGTGTGCGACCTCTTCTCAATTTAC(配列番号49)およびpET−His−Kudzu−R:5’−CGGTCGACGGATCCCTGCAGTTAGACATACATCAGCTG(配列番号50)を用いたPCRにより、pTrcKudzuから増幅した。これらのプライマーにより、遺伝子の5’末端と3’末端に、それぞれ、NdeI部位とBamH1部位が付加された。上記のプラスミド、pTrcKudzuを鋳型DNAとして用い、Herculaseポリメラーゼ(Stratagene)を製造元の取扱説明書に従って用い、プライマーを10pMolの濃度で添加した。PCRを総量25μlで行なった。PCR産物をNdeI/BamH1で消化し、同じ酵素で消化したpET16bにクローニングした。ライゲーション混合物を大腸菌Top10(Invitrogen)に形質転換し、正しいクローンをシークエンシングで選択した。得られたプラスミドは、クズイソプレンシンターゼ遺伝子がT7プロモーターから発現されるが、これを、pETNHisKudzuと命名した(図4および5;配列番号51)。
クズイソプレンシンターゼ遺伝子を低コピー数プラスミドpCL1920にもクローニングした。プライマーを用いて、上記のpTrcKudzuからクズイソプレンシンターゼ遺伝子を増幅した。フォワードプライマーには、5’末端にHindIII部位と大腸菌コンセンサスRBSを付加した。PstIクローニング部位は、終止コドンのすぐ3’でpTrcKudzuに既に存在していたので、リバースプライマーは、最終的なPCR産物がPstI部位を含むように構築された。プライマーの配列は、HindIII−rbs−Kudzu F:5’−CATATGAAAGCTTGTATCGATTAAATAAGGAGGAATAAACC(配列番号51)およびBamH1−Kudzu R:
5’−CGGTCGACGGATCCCTGCAGTTAGACATACATCAGCTG(配列番号50)であった。10pmolの濃度のプライマーと1ngの鋳型DNA(pTrcKudzu)とともにHerculaseポリメラーゼを用いてPCR産物を増幅した。増幅プロトコルは30サイクルの(95℃1分、60℃1分、72℃2分)が含まれた。この産物をHindIIIとPstIで消化し、同じくHindIIIとPstIで消化しておいたpCL1920に連結した。ライゲーション混合物を大腸菌Top10に形質転換した。いくつかの形質転換体をシークエンシングで調べた。得られたプラスミドをpCL−lac−Kudzuと命名した(図6および7;配列番号4)。
II.イソプレン産出の測定
振盪フラスコ培養のために、1mlの培養物を振盪フラスコから20mlCTCヘッドスペースバイアル(Agilentバイアルカタログ番号5188 2753;キャップカタログ番号5188 2759)に移した。キャップを回して堅く締め、250rpmで振盪させながらバイアルを等価温度でインキュベートした。30分後、バイアルをインキュベーターから取り出し、以下に記載するように分析した(このアッセイから得られるいくつかの実験的値については、表1を参照されたい)。
発酵槽中のイソプレン産出を測定する場合、試料を発酵槽のオフガスから採取し、以下に記載するように直接分析した(このアッセイから得られるいくつかの実験的値については、表2を参照されたい)。
ヘッドスペースモードで操作するCTC Analystics(Switzerland) CombiPALオートサンプラーを接続したAgilent 6890 GC/MSシステムを用いて分析を行なった。分析物の分離にはAgilent HP−5MS GC/MSカラム(30m×0.25mm;0.25μm膜厚)を用いた。500μLのヘッドスペースガスを注入するようにサンプラーを設定した。GC/MS法では、キャリアガスとして1ml/分の流量でヘリウムを用いた。注入口を250℃に保ち、分割比を50:1とした。2分間の分析の間、オーブン温度を37℃に保った。m/z 67での単一イオンモニタリング(SIM)モードでAgilent 5793N質量選択検出器を操作した。1.4分から1.7分まで検出器を切り、永久ガスを溶出させた。これらの条件下で、イソプレン(2−メチル−1,3−ブタジエン)は、1.78分で溶出することが観察された。較正表を用いて、イソプレンの絶対量を定量し、1μg/L〜70,000μg/Lまで線形であることが分かった。この方法を用いて、検出限界は50〜100ng/Lと推定された。
III.組換えイソプレンシンターゼを発現する大腸菌細胞を含有する振盪フラスコにおけるイソプレンの産出
上記のベクターを大腸菌株BL21(Novagen)に導入して、BL21/ptrcKudzu株、BL21/pCL−lac−Kudzu株およびBL21/pETHisKudzu株を作製した。単離するために、これらの株をLA(ルリア寒天)+カルベニシリン(50μg/ml)上に播き、37℃で一晩インキュベートした。単一のコロニーを、20mlルリア・ベルターニブロス(LB)とカルベニシリン(100μg/ml)を含有する250mlバッフル付き振盪フラスコに植菌した。培養物を、200rpmで振盪させながら20℃で一晩増殖させた。終夜培養物のOD600を測定し、培養物を、30ml MagicMedia(Invitrogen)+カルベニシリン(100μg/ml)を含有する250mlバッフル付き振盪フラスコに入れてOD600が約0.05になるまで希釈した。培養物を200rpmで振盪させながら30℃でインキュベートした。OD600が約0.5〜0.8になったとき、400μMのIPTGを添加し、200rpmで振盪させながら、細胞をさらに30℃で6時間インキュベートした。IPTGによる誘導の0、2、4および6時間後、培養物の1mlアリコートを回収し、OD600を測定し、産出されたイソプレンの量を上記のように測定した。結果を図8に示す。
IV.14リットル発酵におけるBL21/ptrcKudzuからのイソプレンの産出
組換えクズイソプレンシンターゼ遺伝子を含有する大腸菌からのイソプレンの大規模産出をフェドバッチ培養物から測定した。発酵培地1リットル当たりの発酵培地(TM2)のレシピは次の通りであった:K2HPO4 13.6g、KH2PO4 13.6g、MgSO4 *7H2O 2g、クエン酸一水和物2g、クエン酸第二鉄アンモニウム0.3g、(NH4)2SO4 3.2g、酵母抽出物5g、1000×改変微量金属溶液1ml。全ての成分を一緒に添加し、diH2Oに溶解させた。水酸化カリウム(KOH)でpHを6.8に調整し、適量を加えて全量とした。最終産物を0.22μフィルターで濾過滅菌した(濾過滅菌のみで、オートクレーブなしない)。1000×改変微量金属溶液のレシピは次の通りであった:クエン酸*H2O 40g、MnSO4 *H2O 30g、NaCl 10g、FeSO4 *7H2O 1g、CoCl2 *6H2O 1g、ZnSO*7H2O 1g、CuSO4 *5H2O 100mg、H3BO3 100mg、NaMoO4 *2H2O 100mg。各成分を一度にdiH2Oに溶解させ、HCl/NaOHでpHを3.0にした後、適量を加えて全量とし、0.22μフィルターで濾過滅菌した。
所望の発酵(pH6.7および温度34℃)におけるグルコースからのイソプレン形成をモニタリングするために、この実験を14Lバイオリアクターで行なった。凍結バイアルから採取した大腸菌株BL21/ptrcKudzuの種菌をソイトン−酵母抽出物−グルコース培地中に調製した。種菌が増殖してOD550=0.6になったときに、2つの600mlフラスコを遠心分離し、その中身を70ml上清に再懸濁して、細胞ペレット(OD3.1の材料70ml)をバイオリアクターに移した。植菌後の様々な時点で、サンプルを取り出し、産出されたイソプレンの量を上記のように測定した。結果を図9に示す。
実施例2:組換えポプライソプレンシンターゼを発現する大腸菌におけるイソプレンの産出
ポプラ(ウラジロハコヤナギ×ヨーロッパヤマナラシ)イソプレンシンターゼのタンパク質配列(Schnitzler,J−P,et al.(2005) Planta 222:777−786)をGenBank(CAC35696)から得た。大腸菌用にコドンが最適化された遺伝子をDNA2.0から購入した(p9796−poplar、図30および31;配列番号14)。このイソプレンシンターゼ遺伝子を、供給されたプラスミドからBspLU11I/PstIを用いた制限エンドヌクレアーゼ消化によって取り出し、ゲル精製し、NcoI/PstIで消化しておいたpTrcHis2Bに連結した。このコンストラクトは、挿入物中の終止コドンがPstI部位の前にあるようにクローニングされ、Hisタグがイソプレンシンターゼタンパク質に付加されないコンストラクトを生じさせる。得られたプラスミドpTrcPoplar(図32および33;配列番号15)をシークエンシングで確認した。
実施例2B:いくつかのポプラ属イソプレンシンターゼのイソプレンシンターゼ活性の証明
以下のイソプレンシンターゼ;ウラジロハコヤナギ(アクセッション番号BAD98243;図137AおよびB;配列番号30)、クロヤマナラシ(アクセッション番号CAL69918;図137CおよびD;配列番号31)、アメリカヤマナラシ(アクセッション番号AAQ16588;図137E、F、およびG;配列番号32〜33)、ブラックコットンウッド(アクセッション番号ACD70404;図137HおよびI;配列番号34)、ウラジロハコヤナギ×ヨーロッパヤマナラシ(アクセッション番号CAJ29303;図137JおよびK;配列番号35)、ならびにMCM112−Kudzuを調べた。
pET24Kudzu(MCM112とも呼ぶ)を以下のように構築した。クズイソプレンシンターゼ遺伝子をpCR2.1ベクター(Invitrogen)からpET24dベクター(Novagen)にサブクローニングした。クズIspS遺伝子を、プライマーのMCM50 5’−gatcatgcat tcgcccttag gaggtaaaaaaacatgtgtgcgacctcttc tcaatttact(配列番号52);およびMCM53 5’−CGGTCGACGGATCCCTGCAG TTAGACATAC ATCAGCTG(配列番号50)を用いて、pTrcKudzu鋳型DNAから増幅した。Taq DNAポリメラーゼ(Invitrogen)を用いてPCR反応を行ない、得られたPCR産物をpCR2.1−TOPO TAクローニングベクター(Invitrogen)にクローニングし、大腸菌Top10化学的コンピテントセル(Invitrogen)に形質転換した。形質転換体をカルベニシリン(50μg/ml)を含有するL−寒天にプレーティングし、37℃で一晩インキュベートした。カルベニシリン50μg/mlを含有する5mlのルリアブロス培養液に単一の形質転換体を植菌し、37℃で一晩増殖させた。1mlの培養液(ルリアブロス)から単離されたプラスミドDNAのシークエンシングにより、5つのコロニーを正しい挿入についてスクリーニングし、QIAprepスピンミニプレップキット(Qiagen)を用いて精製した。MCM93と命名された、得られたプラスミドは、pCR2.1骨格中にクズIspSコード配列を含有する(図137L)。MCM93の配列(配列番号36)を図137MおよびNに示す。
クズコード配列をPciIとBamH1(Roche)を用いた制限エンドヌクレアーゼ消化により取り出し、QIAquickゲル抽出キット(Qiagen)を用いてゲル精製した。pET24dベクターDNAをNcoIとBamHI(Roche)で消化し、エビアルカリホスファターゼ(Roche)で処理し、QIAprepスピンミニプレップキット(Qiagen)を用いて精製した。クズIspS断片を、20μlの全容量中、5:1の断片対ベクター比で迅速DNAライゲーションキット(Roche)を用いて、NcoI/BamH1消化したpET24dに連結した。このライゲーション混合物(5μl)の一部を大腸菌Top10化学的コンピテントセルに形質転換し、カナマイシン(50μg/ml)を含有するL寒天上にプレーティングした。正しい形質転換体をシークエンシングで確認し、化学的コンピテントBL21(λDE3)pLysS細胞(Novagen)に形質転換した。カナマイシン(50μg/ml)を含有するL寒天上で、37℃で一晩増殖させた後、単一コロニーを選択した。pET24D−Kudzuと命名された得られたプラスミドのマップを図137Oに示す。pET24D−Kudzuの配列(配列番号37)を図137PおよびQに示す。
アメリカヤマナラシ、ウラジロハコヤナギ、クロヤマナラシおよびブラックコットンウッドについては、pET24a発現ベクター(Novagen)にクローニングされた大腸菌に最適化されたイソプレンシンターゼ遺伝子をDNA2.0(Menlo Park,CA)から購入した。葉緑体輸送ペプチド配列を除去して遺伝子を合成し、成熟タンパク質を発現させた。
クズイソプレンシンターゼのコンストラクトをこの実施例の対照として用いた。このプラスミドを大腸菌発現宿主BL21(DE3)plysSに形質転換し、形質転換体を0.6mlのTM3培地中で増殖させた。TM3培地のレシピは次の通りである:K2HPO4(13.6g/l) KH2PO4(13.6g/l)、MgSO4 *7H2O(2g/L) クエン酸一水和物(2g/L) クエン酸第二鉄アンモニウム(0.3g/L)(NH4)2SO4(3.2g/L) 酵母抽出物(0.2g/L) 1000×微量元素溶液1ml(これらを水酸化アンモニウムでpHを6.8に調整し、滅菌DIH2Oを適量を加えて全量とし、0.22ミクロンフィルターで濾過滅菌した)。1000×微量元素溶液のレシピは次の通りである:クエン酸*H2O(40g/L)、MnSO4 *H2O(30g/L)、NaCl(10g/L)、FeSO4 *7H2O(1g/L)、CoCl2 *6H2O(1g/L)、ZnSO4 *7H2O(1g/L)、CuSO4 *5H2O(100mg/L)、H3BO3(100mg/L)、NaMoO4 *2H2O(100mg/L)。各成分を一度にDIH2Oに溶解させ、HCl/NaOHでpHを3.0に調整し、適量を加えて全量とし、0.22ミクロンフィルターで濾過滅菌した。
培養物を400μMのIPTGで誘導し、OD600が約5になるまで増殖させ続けた。培養物のアリコートを深ウェルガラスプレートに移し、ウェルをアルミニウムプレートシーラーで密封した。プレートを、450rpmで振盪させながら、25℃で30分間インキュベートした。この反応液を、5分間、温度を70℃に上昇させることにより、熱不活化した。全細胞ヘッドスペースを、実施例1、第II部に記載したようなGCMS法により測定した。
同様の方法で増殖させたが、細胞を回収して、凍結/融解リゾチームプロトコルで溶解させた培養物からKm値を得た。容量400μLの培養物を新しい96ウェルプレート(Perkin Elmer,カタログ番号6008290)に移し、細胞を、2500×gで、Beckman Coulter Allegra 6R遠心分離器で遠心分離することにより回収した。ペレットを200mLの低張緩衝液(5mM MgCL2、5mM Tris HCl、5mM DTT pH8.0)に再懸濁し、プレートを−80℃で最低60分間、凍結させた。プレートを融解し、32mLのイソプレンシンターゼDMAPPアッセイ緩衝液(57mM Tris HCl、19mM MgCl2、74mg/mL DNアーゼI(Sigmaカタログ番号DN−25)、2.63×105U/mLのReadyLyseリゾチーム溶液(Epicentreカタログ番号R1802M)、および5mg/mLの分子生物学等級BSAを添加することにより、細胞ライセートを調製した。プレートを振盪させながら25℃で30分間インキュベートした後、氷上に置いた。上記の全細胞ヘッドスペースアッセイのために、DMAPPおよびライセートを、密封した深ウェルガラスブロック中に所望の濃度で添加した。この反応を1時間進行させておいた後、上記の加熱工程で終了させ、同じく上記のようにヘッドスペース活性を測定した。
代わりのアプローチでは、25mL容量で培養し、上記のように誘導した細胞から酵素の活性を測定した。細胞を遠心分離により回収し、50%グリセロールと20mM Tris/HCl pH7.4、20mM MgCl2、200mM KCl、1mM DTTを1:1で混合したものからなる緩衝液中でフレンチプレスで破壊することによりペレットを溶解させた。容量25μLのライセートを、75μLのアッセイ緩衝液(66.6 mM Tris/HCl pH8、6.66mM DMAPP、43mM MgCl2)を含有する2mLスクリューキャップバイアル中でイソプレンシンターゼ活性についてアッセイした。反応液を30℃で15分間インキュベートし、バイアルのセプタムを通して100μLの250mM EDTAを添加することによりクエンチした。イソプレンを実施例1、第II部で記載したようなGC/MSで測定した。
全ての活性測定方法により、純系のポプラに由来するポプラ酵素は、ポプラ[ウラジロハコヤナギ×ヨーロッパヤマナラシ]よりも数倍高いことが示された。図138および139は、それぞれ、これらの全細胞ヘッドスペースアッセイおよびDMAPPアッセイの結果を示し、驚くべきことに、クロヤマナラシ、アメリカヤマナラシ、ブラックコットンウッド、およびウラジロハコヤナギ由来の酵素が全て、交配種の[ウラジロハコヤナギ×ヨーロッパヤマナラシ]よりも有意に高い活性を有していたことを示している。
DMAPPアッセイを次のように行なった。容量400μLの培養物を新しい96ウェルプレート(Perkin Elmer,カタログ番号6008290)に移し、細胞を、2500×gで、Beckman Coulter Allegra 6R遠心分離器で遠心分離することにより回収した。ペレットを200mLの低張緩衝液(5mM MgCL2、5mM Tris HCl、5mM DTT pH8.0)に再懸濁し、プレートを−80℃で最低60分間、凍結させた。プレートを融解し、32mLのイソプレンシンターゼDMAPPアッセイ緩衝液(57mM Tris HCl、19mM MgCl2、74mg/mL DNアーゼI(Sigmaカタログ番号DN−25)、2.63×105U/mLのReadyLyseリゾチーム溶液(Epicentreカタログ番号R1802M)、および5mg/mLの分子生物学等級BSAを添加することにより、細胞ライセートを調製した。プレートを振盪させながら25℃で30分間インキュベートした後、氷上に置いた。イソプレン産出のために、ライセートのアリコート80mLを96深ウェルガラスプレート(Zinsserカタログ番号3600600)に移し、100mM K2HPO4、pH8.2(Cayman Chemicalカタログ番号63180)中の20mLの10mM DMAPP溶液を添加した。このプレートをアルミニウムプレートシール(Beckman Coultorカタログ番号538619)で密封し、浸透させながら30℃で60分間インキュベートした。ガラスブロックを加熱することにより(70℃、5分間)、酵素反応を終了させた。実施例1、第II部に記載したように、各ウェルの細胞ヘッドスペースを定量的に分析した。
注目すべきことに、ウラジロハコヤナギ、P.トレムロイデス、P.トリコカルパは、クズ由来のイソプレンシンターゼよりも高い活性を有していた。ウラジロハコヤナギ由来の酵素は、試験した全ての酵素のうち最も大きい活性を有して発現した。全細胞ヘッドスペースアッセイと比べてより高い活性が細胞ライセートで観察されたのは、細胞の内在性デオキシキシルロース5−リン酸(DXP)経路によって送達される、これらの酵素基質のDMAPPが制限されていたためである可能性が高い。
速度論的パラメータKmは、値が測定された全ての酵素について約2〜3mMと測定された。
実施例3:組換えクズイソプレンシンターゼを発現するパントエア・シトレアにおけるイソプレンの産出
実施例1に記載のpTrcKudzuプラスミドおよびpCL−lac KudzuプラスミドをP.シトレア(米国特許第7,241,587号)にエレクトロポレートした。形質転換体をそれぞれ、カルベニシリン(200μg/ml)またはスペクチノマイシン(50μg/ml)を含有するLA上で選択した。振盪フラスコからのイソプレンの産出と産出されたイソプレンの量の測定を、組換えクズイソプレンシンターゼを発現する大腸菌株について実施例1に記載したように行なった。結果を図10に示す。
実施例4:組換えクズイソプレンシンターゼを発現する枯草菌におけるイソプレンの産出
I.クズイソプレンシンターゼを発現させるための枯草菌複製プラスミドの構築
クズイソプレンシンターゼ遺伝子を、aprEプロモーターの制御下にある複製プラスミド(クロラムフェニコール耐性カセットを有するpBS19)を用いて枯草菌aprEnprE Pxyl−comK株(BG3594comK)で発現させた。イソプレンシンターゼ遺伝子、aprEプロモーターおよび転写ターミネーターを別々に増幅し、PCRを用いて融合させた。その後、コンストラクトをpBS19にクローニングし、枯草菌に形質転換した。
a)aprEプロモーターの増幅
aprEプロモーターを、以下のプライマーを用いて枯草菌由来の染色体DNAから増幅した。
CF 797(+) 開始点 aprEプロモーター MfeI
[化17]
5’−GACATCAATTGCTCCATTTTCTTCTGCTATC(配列番号53)
CF 07−43(−) aprEプロモーターをクズispSに融合する
[化18]
5’−ATTGAGAAGAGGTCGCACACACTCTTTACCCTCTCCTTTTA(配列番号54)
[0481]
b)イソプレンシンターゼ遺伝子の増幅
クズイソプレンシンターゼ遺伝子をプラスミドpTrcKudzu(配列番号2)から増幅した。この遺伝子は大腸菌用にコドンが最適化されており、DNA2.0により合成されていた。以下のプライマーを用いた。
CF 07−42(+) aprEプロモーターをクズイソプレンシンターゼ遺伝子(GTG開始コドン)に融合する
[化19]
5’−TAAAAGGAGAGGGTAAAGAGTGTGTGCGACCTCTTCTCAAT(配列番号55)
CF 07−45(−) クズイソプレンシンターゼ遺伝子3’末端をターミネーターに融合する
[化20]
5’−CCAAGGCCGGTTTTTTTTAGACATACATCAGCTGGTTAATC(配列番号56)
c)転写ターミネーターの増幅
バシルス・アミリケファシエンスのアルカリ性セリンプロテアーゼ由来のターミネーターを、以前に配列が決定されたプラスミドpJHPms382から、以下のプライマーを用いて増幅した。
CF 07−44(+) クズイソプレンシンターゼの3’末端をターミネーターに融合する
[化21]
5’−GATTAACCAGCTGATGTATGTCTAAAAAAAACCGGCCTTGG(配列番号57)
CF 07−46(−) B.アミロリケファシエンスターミネーター(BamHI)の末端
[化22]
5’−GACATGACGGATCCGATTACGAATGCCGTCTC(配列番号58)
このクズ断片を、以下のプライマーを用いたPCRを用いてターミネーター断片に融合した。
CF 07−42(+) aprEプロモーターをクズイソプレンシンターゼ遺伝子(GTG開始コドン)に融合する
[化23]
5’−TAAAAGGAGAGGGTAAAGAGTGTGTGCGACCTCTTCTCAAT(配列番号55)
CF 07−46(−) B.アミロリケファシエンスターミネーター(BamHI)の末端
[化24]
5’−GACATGACGGATCCGATTACGAATGCCGTCTC(配列番号58)
このクズターミネーター断片を、以下のプライマーを用いたPCRを用いてプロモーター断片に融合した。
CF 797(+) 開始点 aprEプロモーター MfeI
[化25]
5’−GACATCAATTGCTCCATTTTCTTCTGCTATC(配列番号53)
CF 07−46(−) B.アミロリケファシエンスターミネーター(BamHI)の末端
[化26]
5’−GACATGACGGATCCGATTACGAATGCCGTCTC(配列番号58)
この融合PCR断片をQiagenキットを用いて精製し、制限酵素のMfeIとBamHIで消化した。この消化したDNA断片をQiagenキットを用いてゲル精製した。これを、EcoRIとBamHIで消化し、ゲル精製しておいたpBS19として知られるベクターに連結した。
このライゲーション混合物を大腸菌Top10細胞に形質転換し、コロニーをLA+50カルベニシリンプレート上で選択した。合計6つのコロニーを選び、LB+50カルベニシリン中で一晩増殖させた後、Qiagenキットを用いてプラスミドを単離した。このプラスミドをEcoRIとBamHIで消化して、挿入物を調べ、正しいプラスミドのうちの3つを、以下のプライマーを用いるシークエンシングに回した。
CF 149(+) EcoRI aprEプロモーターの開始点
[化27]
5’−GACATGAATTCCTCCATTTTCTTCTGC(配列番号59)
CF 847(+) pXX 049中の配列(aprEプロモーターの終点)
[化28]
5’−AGGAGAGGGTAAAGAGTGAG(配列番号60)
CF 07−45(−) クズイソプレンシンターゼの3’末端をターミネーターに融合する
[化29]
5’−CCAAGGCCGGTTTTTTTTAGACATACATCAGCTGGTTAATC(配列番号56)
CF 07−48(+) クズイソプレンシンターゼのシークエンシングプライマー
[化30]
5’−CTTTTCCATCACCCACCTGAAG(配列番号61)
CF 07−49(+) クズイソプレンシンターゼ中の配列
[化31]
5’−GGCGAAATGGTCCAACAACAAAATTATC(配列番号62)
pBS Kudzu #2(図52および12;配列番号5)と命名されたプラスミドは、シークエンシングにより正しいものであった。これを、枯草菌宿主株のBG 3594 comKに形質転換した。LA+5クロラムフェニコールプレート上で選択を行なった。形質転換体を選び、LA+5クロラムフェニコール上で単一コロニーを突いた後、OD600が1.5に達するまで、LB+5クロラムフェニコール中で増殖させた。これを、グリセロールの存在下、−80℃でバイアル中に凍結保存した。得られた株をCF 443と命名した。
II.組換えイソプレンシンターゼを発現する枯草菌細胞を含有する振盪フラスコにおけるイソプレンの産出
終夜培養液に、LA+クロラムフェニコール(Cm、25μg/ml)からのCF 443の単一コロニーを植菌した。培養物を200rpmで振盪させながらLB+Cm中、37℃で増殖させた。これらの終夜培養物(1ml)を用いて、25mlのGrants II培地と最終濃度25μg/mlのクロラムフェニコールとを含有する250mlバッフル付き振盪フラスコに植菌した。Grants II培地のレシピは、10gソイトン、3ml 1M K2HPO4、75gグルコース、3.6g尿素、100ml 10×MOPSを、H2O(pH7.2)を適量加えて1Lにしたものであり;10×MOPSのレシピは、83.72g MOPS、7.17gトリシン、12g KOHペレット、10ml 0.276M K2SO4溶液、10ml 0.528M MgCl2溶液、29.22g NaCl、100ml 100×微量栄養素を、H2Oを適量加えて1Lにしたものであり;100×微量栄養素のレシピは、1.47g CaCl2 *2H2O、0.4g FeSO4 *7H20、0.1g MnSO4 *H20、0.1g ZnSO4 *H2O、0.05g CuCl2 *2H2O、0.1g CoCl2 *6H2O、0.1g Na2MoO4 *2H2Oを、H2Oを適量加えて1Lにしたものであった。振盪フラスコを37℃でインキュベートし、サンプルを18、24、および44時間で採取した。18時間で、CF443および対照株のヘッドスペースをサンプリングした。これは、イソプレンが18時間蓄積したものに相当した。イソプレンの量を、実施例1に記載したようにガスクロマトグラフィーで測定した。イソプレンの産出は、組換えイソプレンシンターゼを発現させることにより有意に増強された(図11)。
III.14L発酵におけるCF443によるイソプレンの産出
複製プラスミド上に組換えクズイソプレンシンターゼ遺伝子を含有する枯草菌からのイソプレンの大規模産出を、フェドバッチ培養から測定した。クズイソプレンシンターゼ遺伝子を発現するバシルス株CF 443、またはクズイソプレンシンターゼ遺伝子を発現しない対照株を、大豆ミール(Cargill)、リン酸ナトリウムおよびリン酸カリウム、硫酸マグネシウムならびにクエン酸、塩化第二鉄および塩化マンガンの溶液を含有する栄養培地中で従来のフェドバッチ発酵により培養した。発酵前に、セルラーゼ、ヘミセルラーゼおよびペクチナーゼを含む酵素の混合物を用いて、培地を90分間軟化させる(macerate)(WO95/04134号を参照されたい)。14Lバッチ発酵に、60%wt/wtグルコース(Cargill DE99デキストロース、ADM Versadex greensまたはDanisco転化糖)と99%wt/wt油(Western Family大豆油、ここで、99%wt/wtとは、細胞培養培地に添加されてしまう前の油の濃度である)とを供給する。バッチ中のグルコースが検出されなくなったときに供給を開始した。供給速度を数時間かけて上昇させ、炭素量が等しくなるように油が添加されるように調整した。28%w/v水酸化アンモニウムを用いてpHを6.8〜7.4に調節した。泡が立つ場合、消泡剤を培地に添加した。発酵温度を37℃に調節し、発酵培養物を750rpmで撹拌した。pH、DO%、空気流量、および圧力などの様々な他のパラメータを、プロセス全体を通じてモニタリングした。DO%は20より高く維持される。サンプルを36時間にわたってずっと採取し、細胞増殖(OD550)およびイソプレン産出について分析した。これらの実験の結果を図53Aおよび53Bに示す。
IV.クズイソプレンシンターゼ(ispS)の枯草菌への組込み
クズイソプレンシンターゼ遺伝子を、aprEプロモーターの制御下にある組込みプラスミド(pJH101−cmpR)にクローニングした。試験した条件下では、イソプレンが検出されなかった。
実施例5:トリコデルマにおけるイソプレンの産出
I.トリコデルマ・リーゼイにおいてクズイソプレンシンターゼを発現させるためのベクターの構築
ヤロウイア・リポリティカのコドンに最適化されたクズIS遺伝子はDNA2.0によって合成された(配列番号6)(図13)。このプラスミドは、以下のPCR増幅反応(全反応容量50μl中、1μlのプラスミド鋳型(20ng/ul)、1μlのプライマーEL−945(10μM)5’−GCTTATGGATCCTCTAGACTATTACACGTACATCAATTGG(配列番号63)、1μlのプライマーEL−965(10μM)5’−CACCATGTGTGCAACCTCCTCCCAGTTTAC(配列番号64)、1μlのdNTP(10mM)、5μlの10×PfuUltra II Fusion HS DNAポリメラーゼ緩衝液、1μlのPfuUltra II Fusion HS DNAポリメラーゼ、40μlの水)の鋳型としての役割を果たした。フォワードプライマーは、Y.リポリティカのコドンに最適化されたクズイソプレンシンターゼ遺伝子に対応するものではないが、pENTR/D−TOPOベクターへのクローニングに必要な5’末端の追加の4ヌクレオチドを含んでいた。リバースプライマーは、Y.リポリティカのコドンに最適化されたクズイソプレンシンターゼ遺伝子に対応するものではないが、他のベクター骨格にクローニングするために挿入される5’末端の追加の21ヌクレオチドを含んでいた。MJ Research PTC−200 Thermocyclerを用いて、以下のようにPCR反応を行なった。95℃で2分間(最初のサイクルのみ)、95℃で30秒間、55℃で30秒間、72℃で30秒間(27サイクル繰り返す)、最後のサイクルの後に72℃で1分間。PCR産物を1.2%E−ゲル上で解析して、Y.リポリティカのコドンに最適化されたクズイソプレンシンターゼ遺伝子が増幅できたことを確認した。
次に、このPCR産物を、製造元のプロトコル(全反応容量6μl中、1μlのPCR反応液、1μlの塩溶液、1μlのTOPO pENTR/D−TOPOベクターおよび3μlの水)に従って、TOPO pENTR/D−TOPOクローニングキットを用いてクローニングした。反応液を室温で5分間インキュベートした。1μlのTOPO反応液をTOP10化学的コンピテント大腸菌細胞に形質転換した。形質転換体をLA+50μg/mlカナマイシンプレート上で選択した。いくつかのコロニーを取り、各々をLB+50μg/mlカナマイシンを含有する5mlチューブに植菌し、培養物を、200rpmで振盪させながら、37℃で一晩増殖させた。製造元のプロトコルに従って、QIAprepスピンミニプレップキットを用いて終夜培養チューブからプラスミドを単離した。いくつかのプラスミドをシークエンシングし、DNA配列が正しいことを確認した。
Y.リポリティカのコドンに最適化されたクズイソプレンシンターゼ遺伝子をコードする単一のpENTR/D−TOPOプラスミドを、オーダーメイドのpTrex3gベクターへのGatewayクローニングに用いた。pTrex3gの構築については、WO2005/001036 A2号に記載されている。Gateway LRクロナーゼII酵素ミックスキット(Invitrogen)用の製造元のプロトコル(全反応容量8μl中、1μlのY.リポリティカのコドンに最適化されたクズイソプレンシンターゼ遺伝子pENTR/D−TOPOドナーベクター、1μlのpTrex3gデスティネーションベクター、6μlのTE緩衝液(pH8.0))に従って、反応を行なった。反応液を室温で1時間インキュベートした後、1μlのプロテイナーゼK溶液を添加し、37℃で10分間インキュベーションを続けた。その後、反応液1μlをTOP10化学的コンピテント大腸菌細胞に形質転換した。形質転換体をLA+50μg/mlカルベニシリンプレート上で選択した。いくつかのコロニーを取り、各々をLB+50μg/mlカナマイシンを含有する5mlチューブに植菌し、培養物を、200rpmで振盪させながら、37℃で一晩増殖させた。製造元のプロトコルに従って、QIAprepスピンミニプレップキットを用いて終夜培養チューブからプラスミドを単離した。いくつかのプラスミドをシークエンシングし、DNA配列が正しいことを確認した。
Y.リポリティカのコドンに最適化されたクズイソプレンシンターゼpTrex3gプラスミド(図14)の四重欠失トリコデルマ・リーゼイ株への微粒子銃による形質転換を、微粒子銃PDS−1000/HE粒子送達系を用いて行なった(WO2005/001036 A2号参照)。安定な形質転換体の単離と振盪フラスコの評価は、特許刊行物WO2005/001036 A2号の実施例11に記載のプロトコルを用いて行なった。
II.組換えT.リーゼイの株におけるイソプレンの産出
上記のイソプレンシンターゼ形質転換体の15時間および36時間培養物1mlをヘッドスペースバイアルに移した。このバイアルを密封し、30℃で5時間インキュベートした。ヘッドスペースガスを測定し、実施例1に記載の方法によりイソプレンを同定した。これらの形質転換体のうちの2つは、微量のイソプレンを示した。14時間インキュベートすることにより、イソプレンの量を増加させることができた。この2つの陽性サンプルは、14時間のインキュベーンで約0.5μg/Lのレベルのイソプレンを示した。形質転換していない対照は、検出可能なレベルのイソプレンを示さなかった。この実験により、T.リーゼイが、外因性イソプレンシンターゼを供給したときに内在性前駆体からイソプレンを産出することができることが示される。
実施例6:ヤロウイアにおけるイソプレンの産出
I.ヤロウイア・リポリティカにおいてクズイソプレンシンターゼを発現させるためのベクターの構築
ヤロウイア・リポリティカにおいてクズイソプレンシンターゼを発現させるためのベクターの構築するための出発点は、ベクターpSPZ1(MAP29Spb)であった。このベクターの全配列(配列番号7)を図15に示す。
Y.リポリティカ株GICC 120285の染色体DNAを鋳型として用いたPCRにより、以下の断片を増幅した:プロモーターレス形態のURA3遺伝子、18SリボソームRNA遺伝子の断片、Y.リポリティカXPR2遺伝子の転写ターミネーターならびにXPR2遺伝子およびICL1遺伝子のプロモーターを含有する2つのDNA断片。以下のPCRプライマーを用いた。
ICL1 3
[化32]
5’−GGTGAATTCAGTCTACTGGGGATTCCCAAATCTATATATACTGCAGGTGAC(配列番号65)
ICL1 5
[化33]
5’−GCAGGTGGGAAACTATGCACTCC(配列番号66)
XPR 3
[化34]
5’−CCTGAATTCTGTTGGATTGGAGGATTGGATAGTGGG(配列番号67)
XPR 5
[化35]
5’−GGTGTCGACGTACGGTCGAGCTTATTGACC(配列番号68)
XPRT3
[化36]
5’−GGTGGGCCCGCATTTTGCCACCTACAAGCCAG(配列番号69)
XPRT 5
[化37]
5’−GGTGAATTCTAGAGGATCCCAACGCTGTTGCCTACAACGG(配列番号70)
Y18S3
[化38]
5’−GGTGCGGCCGCTGTCTGGACCTGGTGAGTTTCCCCG(配列番号71)
Y18S 5
[化39]
5’−GGTGGGCCCATTAAATCAGTTATCGTTTATTTGATAG(配列番号72)
YURA3
[化40]
5’−GGTGACCAGCAAGTCCATGGGTGGTTTGATCATGG(配列番号73)
YURA 50
[化41]
5’−GGTGCGGCCGCCTTTGGAGTACGACTCCAACTATG(配列番号74)
YURA 51
[化42]
5’−GCGGCCGCAGACTAAATTTATTTCAGTCTCC(配列番号75)
PCR増幅のために、PfuUltraIIポリメラーゼ(Stratagene)、供給元により提供された緩衝液およびdNTP、2.5μMプライマーならびに示された鋳型DNAを製造元の取扱説明書の通りに用いた。以下のサイクル:95℃で1分間;34回(95℃、30秒;55℃、30秒;72℃、3分)および72℃、10分を用いて増殖を行ない、次いで、4℃でインキュベーションした。
ヤロウイアにおける発現のためにコドンが最適化されたクズイソプレンシンターゼ遺伝子をコードする合成DNA分子を、DNA2.0から得た(図16;配列番号8)。それぞれ、XPR2プロモーターおよびICL1プロモーターの制御下にある合成クズイソプレンシンターゼ遺伝子を担持するプラスミドであるpYLA(KZ1)およびpYLI(KZ1)の構築スキームの完全な詳細を図18に示す。接合因子遺伝子(MAP29)がイソプレンシンターゼ遺伝子の代わりに挿入されている対照プラスミドも構築した(図18Eおよび18F)。
同様のクローニング手順を用いて、ポプラ(ウラジロハコヤナギ×ヨーロッパヤマナラシ)イソプレンシンターゼ遺伝子を発現させることができる。ポプライソプレンの配列は、Miller B.et al.(2001) Planta 213,483−487に記載されており、これを図17に示す(配列番号9)。それぞれ、XPR2プロモーターおよびICL1プロモーターの制御下にある合成ポプライソプレンシンターゼ遺伝子を担持するプラスミドであるpYLA(POP1)およびpYLI(POP1)を作製するための構築スキームを図18AおよびBに示す。
II.Y.リポリティカの組換え株によるイソプレンの産出
ベクターpYLA(KZ1)、pYLI(KZ1)、pYLA(MAP29)およびpYLI(MAP29)をSacIIで消化し、これらを用いて、標準的な酢酸リチウム/ポリエチレングリコール手順によってY.リポリティカ株CLIB 122をウリジン原栄養性に形質転換した。簡潔に述べると、YEPD(1%酵母抽出物、2%ペプトン、2%グルコース)中で一晩増殖させた酵母細胞を遠心分離(4000rpm、10分)で回収し、滅菌水で1回洗浄し、0.1M酢酸リチウム、pH6.0に懸濁した。細胞懸濁液のアリコート200μlを線状化プラスミドDNA溶液(10〜20μg)と混合し、室温で10分間インキュベートし、同じ緩衝剤中で1mlの50%PEG 4000と混合した。この懸濁液を室温でさらに1時間インキュベートした後、42℃で2分間熱ショックを与えた。次に、細胞をSC his leuプレート(0.67%酵母窒素塩基、2%グルコース、各々100mg/Lのロイシンおよびヒスチジン)上にプレーティングした。30℃で3〜4日間インキュベートした後に形質転換体が現われた。
pYLA(KZ1)形質転換からの3つの単離株、pYLI(KZ1)形質転換からの3つの単離株、pYLA(MAP29)形質転換からの2つの単離株およびpYLI(MAP29)形質転換からの2つの単離株を、振盪させながらYEP7培地(1%酵母抽出物、2%ペプトン、pH7.0)中、30℃で24時間増殖させた。培養物10mlから遠心分離により細胞を回収し、3mlの新鮮なYEP7に再懸濁し、15mlスクリューキャップバイアルに入れた。このバイアルを穏やかに(60rpm)振盪させながら室温で一晩インキュベートした。これらのバイアルのヘッドスペース中のイソプレン含有量を、実施例1に記載したようにマススペクトロメトリー検出器を用いてガスクロマトグラフィーで分析した。pYLA(KZ1)およびpYLI(KZ1)で得られた形質転換体は全て、すぐに検出可能な量のイソプレン(0.5μg/L〜1μg/L、図20)を産出した。イソプレンシンターゼ遺伝子の代わりにフィターゼ遺伝子を担持する対照株のヘッドスペースにはイソプレンが検出されなかった。
実施例7:クズイソプレンシンターゼとidi、またはdxs、またはidiとdxsを発現する大腸菌におけるイソプレンの産出
I.大腸菌においてイソプレンを産出させるためのクズイソプレンシンターゼとidi、またはdxs、またはidiとdxsをコードするベクターの構築
i)pTrcKudzuKanの構築
pTrcKudzu(実施例1に記載)のbla遺伝子を、カナマイシン耐性を付与する遺伝子と置き換えた。bla遺伝子を取り除くために、pTrcKudzuをBspHIで消化し、エビアルカリホスファターゼ(SAP)で処理し、65℃で熱不活化した後、クレノー断片とdNTPで末端を充填した。5kbpの大きな断片をアガロースゲルから精製し、kanr遺伝子に連結した。このkanr遺伝子は、プライマーのMCM22 5’−GATCAAGCTTAACCGGAATTGCCAGCTG(配列番号76)およびMCM23 5’−GATCCGATCGTCAGAAGAACTCGTCAAGAAGGC(配列番号77)を用いてpCR−Blunt−II−TOPOからPCR増幅し、HindIIIとPvuIで消化し、末端を充填しておいたものである。カナマイシン耐性を付与するプラスミドを担持する形質転換体(pTrcKudzu Kan)をカナマイシン50μg/mlを含有するLA上で選択した。
ii)pTrcKudzu yIDI Kanの構築
pTrcKudzuKanをPstIで消化し、SAPで処理し、熱不活化し、ゲル精製した。これを、合成RBSとともに出芽酵母由来のidiをコードするPCR産物に連結した。PCR用のプライマーは、NsiI−YIDI 1F 5’−CATCAATGCATCGCCCTTAGGAGGTAAAAAAAAATGAC(配列番号78)およびPstI−YIDI 1R 5’−CCTTCTGCAGGACGCGTTGTTATAGC(配列番号79)であり、鋳型は出芽酵母ゲノムDNAであった。PCR産物をNsiIとPstIで消化し、ライゲーションの前にゲル精製した。このライゲーション混合物を化学的コンピテントTOP10細胞に形質転換し、50μg/mlカナマイシンを含有するLA上で選択した。いくつかの形質転換体を単離し、配列を決定し、得られたプラスミドをpTrcKudzu−yIDI(kan)と名付けた(図34および35;配列番号16)。
iii)pTrcKudzu DXS Kanの構築
プラスミドpTrcKudzu KanをPstIで消化し、SAPで処理し、熱不活化し、ゲル精製した。これを、合成RBSとともに大腸菌由来のdxsをコードするPCR産物に連結した。PCR用のプライマーは、MCM13 5’−GATCATGCATTCGCCCTTAGGAGGTAAAAAAACATGAGTTTTGATATTGCCAAATACCCG(配列番号80)およびMCM14 5’−CATGCTGCAGTTATGCCAGCCAGGCCTTGAT(配列番号81)であり、鋳型は大腸菌ゲノムDNAであった。PCR産物をNsiIとPstIで消化し、ライゲーションの前にゲル精製した。得られた形質転換反応液をTOP10細胞に形質転換し、カナマイシン50μg/mlを含有するLA上で選択した。いくつかの形質転換体を単離し、配列を決定し、得られたプラスミドをpTrcKudzu−DXS(kan)と名付けた(図36および37;配列番号17)。
iv)pTrcKudzu−yIDI−dxs(kan)の構築
pTrcKudzu−yIDI(kan)をPstIで消化し、SAPで処理し、熱不活化し、ゲル精製した。これを、合成RBSとともに大腸菌dxsをコードするPCR産物に連結した(プライマーはMCM13 5’−GATCATGCATTCGCCCTTAGGAGGTAAAAAAACATGAGTTTTGATATTGCCAAATACCCG(配列番号80)およびMCM14 5’−CATGCTGCAGTTATGCCAGCCAGGCCTTGAT(配列番号81);鋳型はTOP10細胞)。このPCR産物は、NsiIおよびPstIで消化し、ゲル精製しておいたものである。最終的なプラスミドをpTrcKudzu−yIDI−dxs(kan)と名付けた(図21および22;配列番号10)。
v)pCL PtrcKudzuの構築
上記の実施例1由来のプロモーター、構造遺伝子およびターミネーターを含有するDNAの断片をSspIを用いてpTrcKudzuから消化し、ゲル精製した。これを、PvuIIで消化し、SAPで処理し、熱不活化しておいたpCL1920に連結した。得られたライゲーション混合物をTOP10細胞に形質転換し、スペクチノマイシン50μg/mlを含有するLA中で選択した。いくつかのクローンを単離し、配列を決定し、2つを選択した。pCL PtrcKudzuおよびpCL PtrcKudzu(A3)は、反対の向きで挿入物を有している(図38〜41;配列番号18〜19)。
vi)pCL PtrcKudzu yIDIの構築
NsiI−PstI消化し、ゲル精製した上記(ii)由来のIDIのPCRアンプリコンを、PstIで消化し、SAPで処理し、熱不活化しておいたpCL PtrcKudzuに連結した。このライゲーション混合物をTOP10細胞に形質転換し、スペクチノマイシン50μg/mlを含有するLA中で選択した。いくつかのクローンを単離し、配列を決定し、得られたプラスミドをpCL PtrcKudzu yIDIと名付けた(図42および43;配列番号20)。
vii)pCL PtrcKudzu DXSの構築
NsiI−PstI消化し、ゲル精製した上記(iii)由来のDXS PCRアンプリコンを、PstIで消化し、SAPで処理し、熱不活化しておいたpCL PtrcKudzu(A3)に連結した。このライゲーション混合物をTOP10細胞に形質転換し、スペクチノマイシン50μg/mlを含有するLA中で選択した。いくつかのクローンを単離し、配列を決定し、得られたプラスミドをpCL PtrcKudzu DXSと名付けた(図44および45;配列番号21)。
II.様々なコピー数でクズイソプレンシンターゼ、idi、および/またはdxsを発現する培養物からのヘッドスペース中のイソプレンの測定
プラスミドのpTrcKudzu(kan)(A)、pTrcKudzu−yIDI kan(B)、pTrcKudzu−DXS kan(C)、pTrcKudzu−yIDI−DXS kan(D)で以前に形質転換した大腸菌BL21(λDE3)の培養物をLBカナマイシン50μg/mL中で増殖させた。pCL PtrcKudzu(E)、pCL PtrcKudzu、pCL PtrcKudzu−yIDI(F)およびpCL PtrcKudzu−DXS(G)の培養物をLBスペクチノマイシン50μg/mL中で増殖させた。培養物を、時間0(OD600 約0.5)において400μMのIPTGで誘導し、イソプレンヘッドスペース測定用にサンプルを採取した(実施例1参照)。結果を図23A〜23Gに示す。
プラスミドpTrcKudzu−yIDI−dxs(kan)を形質転換により大腸菌株BL21に導入した。得られた株BL21/pTrc Kudzu IDI DXSをカナマイシン(50μg/ml)を含有するLB中、20℃で一晩増殖させ、これを用いて、1%グルコースを含有するTM3(13.6g K2PO4、13.6g KH2PO4、2.0g MgSO4 *7H2O、2.0gクエン酸一水和物、0.3gクエン酸第二鉄アンモニウム、3.2g(NH4)2SO4、0.2g酵母抽出物、1.0ml 1000×改変微量金属溶液をpH6.8に調整し、適量のH2Oを加えて全量とし、濾過滅菌したもの)の振盪フラスコに植菌した。OD600が0.8に達するまでフラスコを30℃でインキュベートした後、400μMのIPTGで誘導した。サンプルを誘導後の様々な時点で採取し、ヘッドスペース中のイソプレンの量を実施例1に記載したように測定した。結果を図23Hに示す。
III.E.coli/pTrcKudzu yIDIDXSにおけるバイオマスからのイソプレンの産出
BL21 pTrcKudzu IDI DXS株を、グルコースを対照として、3種類のバイオマス;バガス、コーンストーバーおよび針葉樹パルプからイソプレンを生成する能力について試験した。バイオマスの加水分解物を酵素的加水分解(Brown,L and Torget,R.,1996,NREL standard assay method Lap−009 “Enzymatic Saccharification of Lignocellulosic Biomass”)により調製し、グルコース当量に基づく希釈で用いた。この実施例では、グルコース当量は1%グルコースに等しかった。新たに形質転換したBL21(DE3)pTrcKudzu yIDI DXS(kan)細胞のプレート由来の単一コロニーを用いて、5mlのLB+カナマイシン(50μg/ml)に植菌した。この培養物を振盪させながら25℃で一晩インキュベートした。翌日、終夜培養物を、OD600が0.05になるまで25mlのTM3+0.2%YE+1%原料中で希釈した。原料は、コーンストーバー、バガス、または針葉樹パルプであった。グルコースを陽性対照として用い、グルコースなしを陰性対照として用いた。培養物を180rpmで振盪させながら30℃でインキュベートした。培養物をOD600についてモニタリングし、OD600が約0.8に達したとき、培養物を、実施例1に記載したようにイソプレン産出について、1時間および3時間で分析した。培養物は誘導されていない。追加した原料を含有する培養物は全て、グルコース陽性対照のイソプレンと同等のイソプレンを産出する。実験は2つ1組で行なわれた。これを図46に示す。
IV.E.coli/pTrcKudzuIDIDXSにおける転化糖からのイソプレンの産出
新たに形質転換したBL21(λDE3)/pTrcKudzu yIDI DXS(kan)細胞のプレート由来の単一コロニーを用いて、5mlのLB+カナマイシン(50μg/ml)に植菌した。この培養物を振盪させながら25℃で一晩インキュベートした。翌日、終夜培養物を、OD600が0.05になるまで25mlのTM3+0.2%YE+1%原料中で希釈した。原料はグルコース、転化グルコースまたはコーンストーバーであった。転化糖原料(Danisco転化糖)は、スクロースシロップを酵素処理することにより調製した。AFEXコーンストーバーは、以下(第V部)に記載するように調製した。細胞を30℃で増殖させ、培養物のOD600が約0.8〜1.0に達したとき(0時間)、最初のサンプルを測定した。この培養物を、OD600によって測定される増殖と、実施例1に記載の0、1および3時間でのイソプレン産出について分析した。結果を図47に示す。
V.AFEX前処理コーンストーバーからの加水分解物の調製
AFEX前処理コーンストーバーをMichigan Biotechnology Instituteから得た。前処理条件は、湿度60%、アンモニア負荷1:1、および90℃、30分間とし、その後、風乾した。AFEX前処理コーンストーバーの含水率は21.27%であった。AFEX前処理コーンストーバーにおけるグルカンとキシランの含有率は、それぞれ31.7%と19.1%(乾燥ベース)であった。糖化プロセスは次の通りであった。20gのAFEX前処理コーンストーバーを、5mlの1Mクエン酸ナトリウム緩衝液pH4.8、2.25mlのアセレラーゼ1000、0.1mlのグリンダミルH121(製パン業界用のアスペルギルス・ニゲル由来のDaniscoキシラナーゼ製品)、および72.65mlのDI水とともに500mlフラスコに添加した。フラスコをオービタルシェーカー内に置き、50℃で96時間インキュベートした。シェーカーからサンプルを1つ採取し、HPLCを用いて分析した。この加水分解物は、38.5g/lのグルコース、21.8g/lのキシロース、および10.3g/lのグルコースおよび/またはキシロースのオリゴマーを含有していた。
VI.フェドバッチ培養で増殖した大腸菌におけるイソプレン産出に対する酵母抽出物の影響
上記のpTrcKudzu yIDI DXSプラスミドを含有する大腸菌細胞に関して記載したように、14Lスケールで発酵を行なった。酵母抽出物(Bio Springer,Montreal,Quebec,CaNADa)を指数関数的割合で供給した。発酵槽に送達した酵母抽出物の総量は、40時間の発酵の間に70から830gの間で変動した。発酵ブロスの光学密度を550nmの波長で測定した。発酵槽内の最終的な光学密度は、添加された酵母抽出物の量に比例した(図48A)。発酵槽からのオフガス中のイソプレンレベルを先に記載したように測定した。イソプレン力価は発酵の間に増加した(図48B)。産出されたイソプレンの量は、供給された酵母抽出物の量に直線的に比例した(図48C)。
VII.pTrcKudzu DXS yIDIの500L発酵におけるイソプレンの産出
クズイソプレンシンターゼ、出芽酵母IDI、および大腸菌DXS核酸(大腸菌BL21(λDE3) pTrc Kudzu dxs yidi)を有する大腸菌細胞の500リットル発酵を用いて、イソプレンを産出した。イソプレンのレベルは、15時間の間に50から300μg/Lの間で変動した。平均イソプレン濃度、装置を通る平均流量およびイソプレン分解の程度に基づくと、回収されたイソプレンの量は約17gと計算された。
VIII.フェドバッチ培養で増殖した大腸菌の500L発酵におけるイソプレンの産出
培地レシピ(発酵培地1リットル当たり):
K2HPO4 7.5g、MgSO4 *7H2O 2g、クエン酸一水和物2g、クエン酸第二鉄アンモニウム0.3g、酵母抽出物0.5g、1000×改変微量金属溶液1ml。全ての成分を一緒に添加し、diH2Oに溶解させた。この溶液をオートクレーブした。アンモニアガス(NH3)でpHを7.0に調整し、適量を加えて全量とした。グルコース10g、チアミン*HCl 0.1g、および抗生物質を、滅菌およびpH調整の後に添加した。
1000×改変微量金属溶液:
クエン酸*H2O 40g、MnSO4 *H2O 30g、NaCl 10g、FeSO4 *7H2O 1g、CoCl2 *6H2O 1g、ZnSO*7H2O 1g、CuSO4 *5H2O 100mg、H3BO3 100mg、NaMoO4 *2H2O 100mg。各成分を一度にDIH2Oに溶解させ、HCl/NaOHでpHを3.0にし、次に、適量を加えて全量とし、0.22ミクロンフィルターで濾過滅菌した。
pTrcKudzu yIDI DXSプラスミドを含有する大腸菌細胞を含む500Lバイオリアクター中で発酵を行なった。この実験は、所望の発酵(pH7.0および温度30℃)でグルコースと酵母抽出物からのイソプレン形成をモニタリングするために行なわれた。凍結バイアルから採取した大腸菌株の種菌をソイトン−酵母抽出物−グルコース培地中に調製した。種菌をODが0.15になるまで増殖させ、550nmで測定し、20mlを用いて、2.5Lのソイトン−酵母抽出物−グルコース培地を含有するバイオリアクターに植菌した。2.5LのバイオリアクターをODが1.0になるまで30℃で増殖させ、2.0Lを500Lバイオリアクターに移した。
酵母抽出物(Bio Springer,Montreal,Quebec,CaNADa)とグルコースを指数関数的割合で供給した。50時間の発酵の間にバイオリアクターに送達されたグルコースと酵母抽出物の総量は、ぞれぞれ、181.2kgと17.6kgであった。バイオリアクター内の経時的な光学密度を図49Aに示す。バイオリアクターからのオフガス中のイソプレンレベルを先に記載したように測定した。イソプレン力価は発酵の間に増加した(図49B)。50時間の発酵の間に産出されたイソプレンの総量は55.1gであった。産出の時間経過を図49Cに示す。
実施例8:クズイソプレンシンターゼと組換えメバロン酸経路遺伝子を発現する大腸菌におけるイソプレンの産出
I.下流MVA経路のクローニング
下流メバロン酸経路のクローニング戦略は以下の通りであった。メバロン酸生合成経路の4つの遺伝子;メバロン酸キナーゼ(MVK)、ホスホメバロン酸キナーゼ(PMK)、ジホスホメバロン酸デカルボキシラーゼ(MVD)およびイソペンテニルジホスホイソメラーゼ遺伝子を出芽酵母染色体DNAからPCRで増幅し、個々にpCR BluntII TOPOプラスミド(Invitrogen)にクローニングした。場合によっては、idi遺伝子を大腸菌染色体DNAから増幅した。大腸菌コンセンサスRBS(AGGAGGT(配列番号82)またはAAGGAGG(配列番号83))が、5’末端で、開始コドンの8bp上流に挿入され、PstI部位が3’末端で付加されるように、プライマーを設計した。次に、これらの遺伝子を経路全体がアセンブルされるまで1つずつpTrcHis2Bベクターにクローニングした。
出芽酵母S288C由来の染色体DNAを、ATCC(ATCC 204508D)から得た。製造元の取扱説明書の通りにPfuTurboを用いて、プライマー、MVKF(5’−AGGAGGTAAAAAAACATGTCATTACCGTTCTTAACTTCTGC、配列番号84)およびMVK−Pst1−R(5’−ATGGCTGCAGGCCTATCGCAAATTAGCTTATGAAGTCCATGGTAAATTCGTG、配列番号85)を用いて、MVK遺伝子を出芽酵母の染色体から増幅した。サイズの正しいPCR産物(1370bp)を、1.2%E−ゲル(Invitrogen)を通した電気泳動で同定し、pZeroBLUNT TOPOにクローニングした。得られたプラスミドをpMVK1と命名した。このプラスミドpMVK1を制限エンドヌクレアーゼのSacIとTaq1で消化し、その断片をゲル精製して、SacIとBstBIで消化したpTrcHis2Bに連結した。得られたプラスミドをpTrcMVK1と名付けた。
メバロン酸生合成経路中の2番目の遺伝子であるPMKを、プライマー:PstI−PMK1 R(5’−GAATTCGCCCTTCTGCAGCTACC、配列番号86)およびBsiHKA I−PMK1 F(5’−CGACTGGTGCACCCTTAAGGAGGAAAAAAACATGTCAG、配列番号87)を用いたPCRで増幅させた。製造元の取扱説明書の通りにPfu Turboポリメラーゼ(Stratagene)を用いてPCR反応を行なった。サイズの正しい産物(1387bp)をPstIとBsiHKIで消化し、PstIで消化したpTrcMVK1に連結した。得られたプラスミドをpTrcKKと名付けた。MVD遺伝子とidi遺伝子を同じようにクローニングした。MVD遺伝子を増幅するために、プライマー対のPstI−MVD 1 R(5’−GTGCTGGAATTCGCCCTTCTGCAGC、配列番号88)およびNsiI−MVD 1 F(5’−GTAGATGCATGCAGAATTCGCCCTTAAGGAGG、配列番号89)を用いて、yIDI遺伝子を増幅するために、プライマー対のPstI−YIDI 1 R(5’−CCTTCTGCAGGACGCGTTGTTATAGC、配列番号79)およびNsiI−YIDI 1 F(5’−CATCAATGCATCGCCCTTAGGAGGTAAAAAAAAATGAC、配列番号78)を用いて、PCRを行なった。場合によって、大腸菌由来のIPPイソメラーゼ遺伝子であるidiを用いた。大腸菌染色体DNAからidiを増幅するために、以下のプライマーセットを用いた:PstI−CIDI 1 R(5’−GTGTGATGGATATCTGCAGAATTCG、配列番号90)およびNsiI−CIDI 1 F(5’−CATCAATGCATCGCCCTTAGGAGGTAAAAAAACATG、配列番号91)。鋳型DNAは、標準的な方法で大腸菌FM5から単離された染色体DNAであった(WO96/35796号およびWO2004/033646号、これらは各々、特に、核酸の単離に関して、その全体が参照により本明細書に組み込まれる)。最終的なプラスミドを、酵母idi遺伝子コードするコンストラクトを表すpKKDIyまたは大腸菌idi遺伝子をコードするコンストラクトを表すpKKDIcと名付けた。後に解析するために、これらのプラスミドを大腸菌宿主BL21に形質転換した。場合によって、クズ由来のイソプレンシンターゼをpKKDIyにクローニングして、プラスミドpKKDIyISを得た。
下流MVA経路を、カナマイシン抗生物質耐性マーカーを含有するpTrcにもクローニングした。プラスミドpTrcKKDIyを制限エンドヌクレアーゼのApaIとPstIで消化し、5930bp断片を1.2%アガロースE−ゲル上で分離し、製造元の取扱説明書に従ってQiagenゲル精製キットを用いて精製した。実施例7に記載のプラスミドpTrcKudzu Kanを制限エンドヌクレアーゼのApaIとPstIで消化し、このベクターを含有する3338bp断片を、Qiagenゲル精製キットを用いて1.2%E−ゲルから精製した。この3338bpのベクター断片と5930bpの下流MVA経路断片を、Rocheクイックライゲーションキットを用いて連結した。このライゲーション混合物を大腸菌TOP10細胞に形質転換し、形質転換体を、カナマイシン(50μg/ml)を含有するLA上で選択しながら、37℃で一晩増殖させた。形質転換体を制限酵素消化で確認し、1つをストックとして凍結させた。このプラスミドをpTrcKanKKDIyと命名した。
II.pTrcKanKKDIyへのクズイソプレンシンターゼ遺伝子のクローニング
クズイソプレンシンターゼ遺伝子を、プライマーのMCM50 5’−GATCATGCATTCGCCCTTAGGAGGTAAAAAAACATGTGTGCGACCTCTTCTCAATTTACT(配列番号52)およびMCM53 5’−CGGTCGACGGATCCCTGCAGTTAGACATACATCAGCTG(配列番号50)を用いて、実施例1に記載のpTrcKudzuからPCRで増幅させた。得られたPCR断片をpCR2.1にクローニングし、大腸菌TOP10に形質転換した。この断片は、クズイソプレンシンターゼのコード配列と、大腸菌由来のRBSを含有する上流領域とを含有する。形質転換体を、カルベニシリン(50μg/ml)を含有するLA上で選択しながら、37℃で一晩インキュベートした。断片の正しい挿入をシークエンシングで確認し、この株をMCM93と命名した。
MCM93株由来のプラスミドを制限エンドヌクレアーゼのNsiIとPstIで消化して、RBSとクズイソプレンシンターゼとを含有する1724bp挿入物を遊離させた。この1724bp断片を1.2%アガロースE−ゲル上で分離し、製造元の取扱説明書に従ってQiagenゲル精製キットを用いて精製した。プラスミドpTrcKanKKDIyを制限エンドヌクレアーゼPstIで消化し、SAPを用いて37℃で30分間処理し、Qiagen PCRクリーンアップキットを用いて精製した。このプラスミドとクズイソプレンシンターゼをコードするDNA断片を、Rocheクイックライゲーションキットを用いて連結した。このライゲーション混合物を大腸菌TOP10細胞に形質転換し、50μg/mlでカナマイシンを含有するLA上で選択しながら、形質転換体を37℃で一晩増殖させた。正しい形質転換体を制限消化で確認し、このプラスミドをpTrcKKDyIkISKanと命名した(図24および25;配列番号11)。このプラスミドをBL21(λDE3)細胞(Invitrogen)に形質転換した。
III.クズ由来の組換え下流メバロン酸経路とイソプレンシンターゼを発現する大腸菌におけるメバロン酸からのイソプレン産出
BL21/pTrcKKDyIkISKan株を、pHを7.1に調整し、0.5%グルコースおよび0.5%メバロン酸を補充したMOPS培地(Neidhardt et al.,(1974) J.Bacteriology 119:736−747)中で培養した。同一条件を用いるが、0.5%メバロン酸を添加しないで、対照培養物も用意した。培養を1%の種菌を含む終夜種培養物から始め、培養物が0.3〜0.5のOD600に達したときに500μMのIPTGで誘導した。この培養物を250rpmで振盪させながら30℃で増殖させた。誘導して3時間後、実施例1に記載のヘッドスペースアッセイを用いてイソプレンの産出を分析した。イソプレンの最大産出は、6.67×10−4mol/Lブロス/OD600/時間(ここで、Lブロスはブロスの容積であり、細胞培地の容積と細胞の容積の両方を含む)であった。メバロン酸を添加していない対照培養物は、測定可能なイソプレンを産出しなかった。
IV.上流MVA経路のクローニング
3つの酵素活性をコードする2つの遺伝子を含む、上流メバロン酸生合成経路を、エンテロコックス・フェカーリスからクローニングした。mvaE遺伝子は、この経路の最初のタンパク質と3番目のタンパク質である、アセチル−CoAアセチルトランスフェラーゼと3−ヒドロキシ−3−メチルグルタリル−CoA(HMG−CoA)レダクターゼの両方の酵素活性を持つタンパク質をコードしており、mvaS遺伝子は、この経路中の2番目の酵素である、HMG−CoAシンターゼをコードしている。mvaE遺伝子を、以下のプライマーを用いて、大腸菌リボソーム結合部位とスペーサーとを前に付けて、E.フェカーリスのゲノムDNA(ATCC 700802D−5)から増幅させた。
CF 07−60(+) mvaEの開始点(RBSを含む)+ATG開始コドン SacI
[化43]
5’−GAGACATGAGCTCAGGAGGTAAAAAAACATGAAAACAGTAGTTATTATTG(配列番号93)
CF 07−62(−) mvaEをその間にあるRBSとともにmvaSと融合する
[化44]
5’−TTTATCAATCCCAATTGTCATGTTTTTTTACCTCCTTTATTGTTTTCTTAAATC(配列番号94)
mvaS遺伝子を、以下のプライマーを用いて、大腸菌由来のRBSとスペーサーを前に付けて、E.フェカーリスのゲノムDNA(ATCC 700802D−5)から増幅させた。
CF 07−61(+) mvaEをその間にあるRBSとともにmvaSと融合する
[化45]
5’−GATTTAAGAAAACAATAAAGGAGGTAAAAAAACATGACAATTGGGATTGATAAA(配列番号95)
CF 07−102(−) mvaS遺伝子の終点 BglII
[化46]
5’−GACATGACATAGATCTTTAGTTTCGATAAGAACGAACGGT(配列番号96)
PCR断片を、以下のプライマーを用いるPCRで1つに融合した。
CF 07−60(+) mvaEの開始点(RBSを含む)+ATG開始コドン SacI
[化47]
5’−GAGACATGAGCTCAGGAGGTAAAAAAACATGAAAACAGTAGTTATTATTG(配列番号93)
CF 07−102(−) mvaS遺伝子の終点 BglII
[化48]
5’−GACATGACATAGATCTTTAGTTTCGATAAGAACGAACGGT(配列番号96)
融合PCR断片を、Qiagenキットを用いて精製し、制限酵素のSacIとBglIIで消化した。この消化したDNA断片を、Qiagenキットを用いてゲル精製し、SacIとBglIIで消化し、ゲル精製しておいた市販のベクターpTrcHis2Aに連結した。
ライゲーション混合物を大腸菌Top10細胞に形質転換し、コロニーをLA+50μg/mlカルベニシリンプレート上で選択した。合計6つのコロニーを選び、LB+50μg/mlカルベニシリン中で一晩増殖させ、Qiagenキットを用いてプラスミドを単離した。このプラスミドをSacIとBglIIで消化して、挿入物について調べ、1つの正しいプラスミドを、以下のプライマーを用いてシークエンシングした。
CF 07−58(+) mvaE遺伝子の開始点
[化49]
5’−ATGAAAACAGTAGTTATTATTGATGC(配列番号97)
CF 07−59(−) mvaE遺伝子の終点
[化50]
5’−ATGTTATTGTTTTCTTAAATCATTTAAAATAGC(配列番号98)
CF 07−82(+) mvaS遺伝子の開始点
[化51]
5’−ATGACAATTGGGATTGATAAAATTAG(配列番号99)
CF 07−83(−) mvaS遺伝子の終点
[化52]
5’−TTAGTTTCGATAAGAACGAACGGT(配列番号100)
CF 07−86(+) mvaE中の配列
[化53]
5’−GAAATAGCCCCATTAGAAGTATC(配列番号101)
CF 07−87(+) mvaE中の配列
[化54]
5’−TTGCCAATCATATGATTGAAAATC(配列番号102)
CF 07−88(+) mvaE中の配列
[化55]
5’−GCTATGCTTCATTAGATCCTTATCG(配列番号103)
CF 07−89(+) 配列mvaS
[化56]
5’−GAAACCTACATCCAATCTTTTGCCC(配列番号104)
pTrcHis2AUpperPathway#1と呼ばれるプラスミドは、シークエンシングにより正しかった。これを市販の大腸菌株BL21に形質転換した。LA+50μg/mlカルベニシリン上で選択を行なった。2つの形質転換体を選び、OD600が1.5に達するまでLB+50μg/mlカルベニシリン中で増殖させた。両方の株を、グリセロールの存在下、バイアル中、−80℃で凍結させた。株を、BL21中のpTrcHis2AUpperPathway#1(単離株#1)についてはCF 449、およびBL21中のpTrcHis2AUpperPathway#1(単離株#2)についてはCF 450と命名した。解析したとき、両方のクローンは同一の挙動を示すことが分かった。
V.上流MVA経路のpCL1920へのクローニング
プラスミドpTrcHis2AUpperPathwayを制限エンドヌクレアーゼSspIで消化して、pTrc−mvaE−mvaS−(Hisタグ)−ターミネーターを含有する断片を放出させた。この断片では、hisタグは翻訳されなかった。この平滑末端の4.5kbp断片をQiagenゲル精製キットを用いて1.2%E−ゲルから精製した。ベクターを制限エンドヌクレアーゼPvuIIで消化し、SAPで処理し、Qiagenゲル精製キットを用いて1.2%E−ゲルから精製することにより、pCL1920由来のリン酸化された平滑末端の4.2kbp断片を調製した。2つの断片をRoche迅速ライゲーションキットを用いて連結し、TOP10化学的コンピテントセルに形質転換した。形質転換体をスペクチノマイシン(50μg/ml)を含有するLA上で選択した。PCRで挿入物の存在をスクリーニングすることにより、正しいコロニーを同定した。このプラスミドをpCL PtrcUpperPathwayと命名した(図26および27A〜27D;配列番号12)。
VI.組み合わせた上流メバロン酸経路と下流メバロン酸経路を発現する株
完全なメバロン酸経路とクズイソプレンシンターゼとを有する株を得るために、プラスミドpTrcKKDyIkISkanおよびpCLpTrcUpperPathwayを両方ともBL21(λDE3)コンピテント細胞(Invitrogen)に形質転換し、形質転換体をカナマイシン(50μg/ml)およびスペクチノマイシン(50μg/ml)を含有するLA上で選択した。形質転換体をプラスミドプレップで調べて、両方のプラスミドが宿主内に保持されていることを保証した。この株をMCM127と命名した。
VII.大腸菌/pUpperpathwayにおけるグルコースからのメバロン酸の産出
BL21/pTrcHis2A−mvaE/mvaSまたはFM5/p pTrcHis2A−mvaE/mvaSの単一コロニーをLB+カルベニシリン(100μg/ml)に植菌し、200rpmで振盪させながら37℃で一晩増殖させる。これらの培養物を、OD600が0.1になるまで250mlバッフル付きフラスコ中の50ml培地中に希釈する。この培地は、TM3+1または2%グルコース+カルベニシリン(100μg/ml)またはTM3+1%グルコース+加水分解した大豆油+カルベニシリン(100μg/ml)またはTM3+バイオマス(調製済みのバガス、コーンストーバーまたはスイッチグラス)であった。培養物を、200rpmで振盪させながら、OD600が0.4に達するまで30℃で約2〜3時間増殖させた。この時点で、IPTG(400μM)を添加することにより、mvaE mvaSコンストラクトからの発現を誘導した。培養物をさらに20または40時間インキュベートし、2時間間隔で誘導6時間後まで、また、その後、必要に応じて24、36および48時間でサンプルを採取した。サンプリングは、1mlの培養物を取り出し、そのOD600を測定し、微量遠心管中で細胞をペレット化し、上清を除去し、それをメバロン酸について分析することにより行なった。
エンテロコックス・フェカーリスAA−CoAチオラーゼ、HMG−CoAシンターゼ、およびHMG−CoAレダクターゼポリペプチドをコードする核酸を有する大腸菌細胞の14リットル発酵は、TM3培地と2%グルコースを細胞培地として用いた場合、22グラムのメバロン酸を産出した。これらの細胞の振盪フラスコは、LB培地と1%グルコースを細胞培養培地として用いた場合、1リットル当たり2〜4グラムのメバロン酸を産出した。これらの株におけるメバロン酸の産出は、MVA経路が大腸菌内で機能的であることを示した。
VIII.上流MVA経路および下流MVA経路+クズイソプレンシンターゼを含有する大腸菌BL21からのイソプレンの産出
上記の上流MVA経路遺伝子および下流MVA経路遺伝子およびクズイソプレンシンターゼ遺伝子を含有するプラスミドと、実施例7に記載のidi遺伝子、dxs遺伝子、およびdxr遺伝子ならびにイソプレンシンターゼ遺伝子を含有するプラスミドの様々な組合せで形質転換することにより以下の株を作製した。使用した宿主細胞は化学的コンピテントBL21(λDE3)であり、形質転換は標準的な方法により行なった。形質転換体をカナマイシン(50μg/ml)またはカナマイシン+スペクチノマイシン(両方とも50μg/mlの濃度)を含有するL寒天上で選択した。プレートを37℃で増殖させた。得られた株を次のように命名した。
カナマイシン+スペクチノマイシン(各50μg/ml)上で増殖したもの
MCM127−pCL Upper MVA+pTrcKKDyIkIS(kan)を含むBL21(λDE3)
MCM131−pCL1920+pTrcKKDyIkIS(kan)を含むBL21(λDE3)
MCM125−pCL Upper MVA+pTrcHis2B(kan)を含むBL21(λDE3)
カナマイシン(50μg/ml)上で増殖したもの
MCM64−pTrcKudzu yIDIDXS(kan)を含むBL21(λDE3)
MCM50−pTrcKudzu(kan)を含むBL21(λDE3)
MCM123−pTrcKudzu yIDIDXS DXR(kan)を含むBL21(λDE3)
上記の株を凍結ストックからLA+適当な抗生物質にストリークし、37℃で一晩増殖させた。各プレート由来の単一コロニーを用いて振盪フラスコ(25mlのLB+適当な抗生物質)に植菌した。このフラスコを200rpmで振盪させながら22℃で一晩インキュベートした。翌朝、フラスコを37℃インキュベーターに移し、200rpmで振盪させながらさらに4.5時間増殖させた。25ml培養物を遠心分離して細胞をペレット化し、この細胞を5mlのLB+適当な抗生物質に再懸濁した。次に、この培養物を、OD
600が0.1になるまで25mlのLB+1%グルコース+適当な抗生物質中に希釈した。各株に2つのフラスコを用意し、1つの組はIPTG(800μM)で誘導し、2つ目の組は誘導しなかった。培養物を250rpmで振盪させながら37℃でインキュベートした。これらの培養物のうちの1つの組を1.50時間後(サンプリング時点1の直後)に誘導した。各サンプリング時点で、OD
600を測定し、実施例1に記載したようにイソプレンの量を決定した。結果を表3に示す。生成されたイソプレンの量は、特定の株についてのピーク産出時の量として示されている。
IX.メバロン酸の分析
メバロノラクトン(1.0g、7.7mmol)(CAS#503−48−0)は、メバロン酸のカリウム塩を生成するために水(7.7mL)に溶解され、水酸化カリウム(7.7mmol)で処理されたシロップとしてSigma−Aldrich(WI,USA)から供給された。メバロン酸への変換は1H NMR分析により確認した。HPLC分析用のサンプルは、14,000rpmで5分間の遠心分離によって細胞を除去し、次いで上清のアリコート300μlを900μlのH2Oに添加して調製した。次に、過塩素酸(36μlの70%溶液)を添加し、その後、混合して、氷上で5分間冷却させた。次に、サンプルを再度遠心分離し(14,000rpm、5分間)、上清をHPLCにかけた。メバロン酸標準(20、10、5、1および0.5g/L)を同じように調製した。メバロン酸(20μL注入容量)の分析は、屈折率(RI)を検出しながら、5mM硫酸を0.6mL/分で用いて溶出させるBioRad Aminex 87−H+カラム(300mm×7.0mm)を用いるHPLCで行なった。これらの条件下では、メバロン酸は、18.5分でラクトン形態として溶出した。
X.上流MVA経路+クズイソプレンシンターゼを含有する大腸菌BL21からのイソプレンの産出
メバロン酸経路ポリペプチドとクズイソプレンシンターゼを発現する大腸菌の15Lスケール発酵を用いて、フェドバッチ培養された細胞からイソプレンを産出させた。この実験は、グルコース制限条件下で細胞を増殖させることにより、2.2g/Lのイソプレンが産出されたことを示している。
培地レシピ(発酵培地1リットル当たり):
発酵培地1リットル当たり以下の成分を用いて培地を作製した:K2HPO4 7.5g、MgSO4 *7H2O 2g、クエン酸一水和物2g、クエン酸第二鉄アンモニウム0.3g、酵母抽出物0.5g、および1000×改変微量金属溶液1ml。全ての成分を一緒に添加し、diH2Oに溶解させた。この溶液をオートクレーブした水酸化アンモニウム(30%)でpHを7.0に調整し、適量を加えて全量とした。グルコース10g、チアミン*HCl 0.1g、および抗生物質を、滅菌およびpH調整の後に添加した。
1000×改変微量金属溶液:
以下の成分を用いて1000×改変微量金属溶液を作製した:クエン酸*H2O 40g、MnSO4 *H2O 30g、NaCl 10g、FeSO4 *7H2O 1g、CoCl2 *6H2O 1g、ZnSO*7H2O 1g、CuSO4 *5H2O 100mg、H3BO3 100mg、およびNaMoO4 *2H2O 100mg。各成分を一度にdiH2Oに溶解させ、HCl/NaOHでpHを3.0にした後、適量を加えて全量とし、0.22ミクロンフィルターで濾過滅菌した。
pCL PtrcUpperPathwayプラスミド(図26)およびpTrcKKDyIkISプラスミドを含有するBL21(DE3)大腸菌細胞を含む15Lバイオリアクター中で発酵を行なった。この実験は、所望の発酵(pH7.0および温度30℃)におけるグルコースからのイソプレン形成をモニタリングするために行なわれた。凍結バイアルから採取した大腸菌株の種菌をLBブロス寒天プレート(抗生物質を含む)上にストリークし、37℃でインキュベートした。単一コロニーをソイトン−酵母抽出物−グルコース培地中に植菌した。550nmで測定したときに種菌がOD1.0にまで増殖した後、500mLを用いて5Lバイオリアクターに植菌した。
細胞が定常期に達するまで、グルコースを指数関数的割合で供給した。定常期以降、代謝要求量を満足させるようにグルコース供給を減らした。54時間の発酵の間にバイオリアクターに送達されたグルコースの総量は、3.7kgであった。イソプロピル−β−D−1−チオガラクトピラノシド(IPTG)を添加して、誘導を達成した。550nmでの光学密度(OD550)が10という値に達したとき、IPTG濃度を25μMにした。OD550が190に達したとき、IPTG濃度を50μMに上昇させた。発酵して38時間でIPTG濃度を100μMに上昇させた。バイオリアクター内の経時的なOD550プロファイルを図54に示す。バイオリアクターからのオフガス中のイソプレンレベルを本明細書に記載したように測定した。イソプレン力価は発酵の間に最終値2.2g/Lまで増加した(図55)。54時間の発酵の間に産出されるイソプレンの総量は15.9gであった。産出の時間経過を図56に示す。
XI.メバロン酸経路の遺伝子を発現し、15Lスケールのフェドバッチ培養で増殖した大腸菌からのイソプレン発酵
メバロン酸経路ポリペプチドとクズイソプレンシンターゼとを発現する大腸菌の15Lスケール発酵を用いて、フェドバッチ培養された細胞からイソプレンを産出させた。この実験は、グルコース制限条件下で細胞を増殖させることにより、3.0g/Lのイソプレンが産出されたことを示している。
培地レシピ(発酵培地1リットル当たり):
発酵培地1リットル当たり以下の成分を用いて培地を作製した:K2HPO4 7.5g、MgSO4 *7H2O 2g、クエン酸一水和物2g、クエン酸第二鉄アンモニウム0.3g、酵母抽出物0.5g、および1000×改変微量金属溶液1ml。全ての成分を一緒に添加し、diH2Oに溶解させた。この溶液をオートクレーブした水酸化アンモニウム(30%)でpHを7.0に調整し、適量を加えて全量とした。グルコース10g、チアミン*HCl 0.1g、および抗生物質を、滅菌およびpH調整の後に添加した。
1000×改変微量金属溶液:
以下の成分を用いて1000×改変微量金属溶液を作製した:クエン酸*H2O 40g、MnSO4 *H2O 30g、NaCl 10g、FeSO4 *7H2O 1g、CoCl2 *6H2O 1g、ZnSO*7H2O 1g、CuSO4 *5H2O 100mg, H3BO3 100mg、およびNaMoO4 *2H2O 100mg。各成分を一度にdiH2Oに溶解させ、HCl/NaOHでpHを3.0にした後、適量を加えて全量とし、0.22ミクロンフィルターで濾過滅菌した。
pCL PtrcUpperMVAプラスミドとpTrc KKDyIkISプラスミドを含有するBL21(DE3)大腸菌細胞を含む15Lバイオリアクター中で発酵を行なった。この実験は、所望の発酵(pH7.0および温度30℃)におけるグルコースからのイソプレン形成をモニタリングするために行なわれた。凍結バイアルから採取した大腸菌株の種菌をLBブロス寒天プレート(抗生物質を含む)上にストリークし、37℃でインキュベートした。単一コロニーをトリプトン−酵母抽出物培地中に植菌した。550nmで測定して、種菌がOD1.0にまで増殖した後、500mLを用いて5Lバイオリアクターに植菌した。
細胞が定常期に達するまで、グルコースを指数関数的割合で供給した。定常期以降、代謝要求量を満足させるようにグルコース供給を減らした。59時間の発酵の間にバイオリアクターに送達されたグルコースの総量は、2.2kgであった。IPTGを添加して誘導を達成した。550nmでの光学密度(OD550)が10という値に達したとき、IPTG濃度を25μMにした。OD550が190に達したとき、IPTG濃度を50μMに上昇させた。バイオリアクター内の経時的なOD550プロファイルを図93に示す。バイオリアクターからのオフガス中のイソプレンレベルを本明細書に記載したように測定した。イソプレン力価は発酵の間に最終値3.0g/Lまで増加した(図94)。59時間の発酵の間に産出されるイソプレンの総量は22.8gであった。産出の時間経過を図95に示す。発酵の時にイソプレン産出に回った利用炭素のモル収率は2.2%であった。グルコースからのイソプレンの重量パーセント収率は1.0%であった。
XII.メバロン酸経路の遺伝子を発現し、15Lスケールのフェドバッチ培養で増殖した大腸菌からのイソプレン発酵
メバロン酸経路ポリペプチド、クズイソプレンシンターゼ、およびクズイソプレンシンターゼを発現する大腸菌の15Lスケール発酵を用いて、フェドバッチ培養された細胞からイソプレンを産出させた。この実験は、グルコース制限条件下で細胞を増殖させることにより、3.3g/Lのイソプレンが産出されたことを示している。
i)pCLPtrcUpperPathwayHGS2の構築
クズ由来のイソプレンシンターゼをコードする遺伝子を、プライマーのNsiI−RBS−HGS F(cttgATGCATCCTGCATTCGCCCTTAGGAGG、配列番号105)およびpTrc R(CCAGGCAAATTCTGTTTTATCAG、配列番号106)と、鋳型としてのpTrcKKDyIkISとを用いてPCR増幅した。このようにして得られたPCR産物をNsiIとPstIで制限消化し、ゲル精製した。プラスミドpCL PtrcUpperPathwayをPstIで制限消化し、製造元の取扱説明書に従ってrAPidアルカリホスファターゼ(Roche)を用いて脱リン酸化した。
これらのDNA断片を1つに連結し、ライゲーション反応液を大腸菌Top10化学的コンピテント細胞(Invitrogen)に形質転換し、スペクチノマイシン(50μg/ml)を含有するL寒天上にプレーティングし、37℃で一晩インキュベートした。プラスミドDNAをQiaquickスピンミニプレップキットを用いて6つのコロニーから調製した。このプラスミドDNAを制限酵素のEcoRVとMluIで消化し、挿入物が正しい向きを有するクローン(すなわち、pTrcプロモーターと同じ方向に向いた遺伝子)を同定した。
得られた正しいプラスミドをpCLPtrcUpperPathwayHGS2と命名した。このプラスミドを本明細書に記載のヘッドスペースアッセイを用いてアッセイし、大腸菌Top10においてイソプレンを産出することが分かった。したがって、この遺伝子の機能性を確認した。プラスミドをpTrcKKDyIkISを含有するBL21(LDE3)に形質転換して、BL21/pCLPtrcUpperPathwayHGS2−pTrcKKDyIkIS株を得た。この株は、BL21/pCL PtrcUpperMVA+pTrc KKDyIkIS株(実施例8、第XI部)と比べて、余分なコピーのイソプレンシンターゼを有する。この株はまた、実施例8、第XI部で使用されたBL21/pCL PtrcUpperMVA+pTrc KKDyIkIS株と比べて、HMGSの発現と活性が増加していた。
ii)pCLPtrcUpperPathwayHGS2−pTrcKKDyIkISを発現し、15Lスケールのフェドバッチ培養で増殖した大腸菌からのイソプレン発酵
培地レシピ(発酵培地1リットル当たり):
発酵培地1リットル当たり以下の成分を用いて培地を作製した:K2HPO4 7.5g、MgSO4 *7H2O 2g、クエン酸一水和物2g、クエン酸第二鉄アンモニウム0.3g、酵母抽出物0.5g、および1000×改変微量金属溶液1ml。全ての成分を一緒に添加し、diH2Oに溶解させた。この溶液をオートクレーブした水酸化アンモニウム(30%)でpHを7.0に調整し、適量を加えて全量とした。グルコース10g、チアミン*HCl 0.1g、および抗生物質を、滅菌およびpH調整の後に添加した。
1000×改変微量金属溶液:
以下の成分を用いて1000×改変微量金属溶液を作製した:クエン酸*H2O 40g、MnSO4 *H2O 30g、NaCl 10g、FeSO4 *7H2O 1g、CoCl2 *6H2O 1g、ZnSO*7H2O 1g、CuSO4 *5H2O 100mg, H3BO3 100mg、およびNaMoO4 *2H2O 100mg。各成分を一度にDiH2Oに溶解させ、HCl/NaOHでpHを3.0にし、次に、適量を加えて全量とし、0.22ミクロンフィルターで滅菌濾過した。
pCLPtrcUpperPathwayHGS2プラスミドとpTrc KKDyIkISプラスミドを含有するBL21(DE3)大腸菌細胞を含む15Lバイオリアクター中で発酵を行なった。この実験は、所望の発酵(pH7.0および温度30℃)におけるグルコースからのイソプレン形成をモニタリングするために行なわれた。凍結バイアルから採取した大腸菌株の種菌をLBブロス寒天プレート(抗生物質を含む)上にストリークし、37℃でインキュベートした。単一コロニーをトリプトン−酵母抽出物培地中に植菌した。550nmで測定して、種菌がOD1.0にまで増殖した後、500mLを用いて5Lバイオリアクターに植菌した。
細胞が定常期に達するまで、グルコースを指数関数的割合で供給した。定常期以降、代謝要求量を満足させるようにグルコース供給を減らした。58時間の発酵の間にバイオリアクターに送達されたグルコースの総量は、2.1kgであった。IPTGを添加して誘導を達成した。550nmでの光学密度(OD550)が9という値に達したとき、IPTG濃度を25μMにした。OD550が170に達したとき、IPTG濃度を50μMに上昇させた。バイオリアクター内の経時的なOD550プロファイルを図104に示す。バイオリアクターからのオフガス中のイソプレンレベルを本明細書に記載したように測定した。イソプレン力価は発酵の間に最終値3.3g/Lまで増加した(図105)。58時間の発酵の間に産出されるイソプレンの総量は24.5gであった。産出の時間経過を図106に示す。発酵の時にイソプレン産出に回った利用炭素のモル収率は2.5%であった。グルコースからのイソプレンの重量パーセント収率は1.2%であった。分析により、イソプレンシンターゼの活性が、CL PtrcUpperMVAプラスミドとpTrc KKDyIkISプラスミドを発現するBL21と比較して約3〜4倍増加したことが示された(データは示さない)。
XIII.大腸菌における下流メバロン酸経路の染色体組込み
メバロン酸キナーゼ、メバロン酸リン酸キナーゼ、メバロン酸ピロリン酸デカルボキシラーゼ、およびIPPイソメラーゼを含有する合成オペロンを大腸菌の染色体に組み込んだ。所望により、様々なプロモーターをオペロンの5’に組み込むことにより、発現を変化させてもよい。
表4に、この実験に用いられるプライマーを掲載する。
i)標的ベクター構築
attTn7部位を組込み用に選択した。上流(attTn7 up)(プライマー、MCM78およびMCM79)と下流(attTn7 down)(プライマー、MCM88およびMCM89)の相同領域をMG1655細胞からPCRで増幅した。1μLの10μMプライマー、3μLのddH2O、45μLのInvitrogen Platinum PCR Supermix High Fidelityを含む50μLの反応液と、擦り取ったMG1655のコロニーとを94℃で2分間変性させ、25サイクル繰り返し(94℃で2分、50℃で30秒、および68℃で1分)、72℃で7分伸長させ、4℃に冷却した。この得られたDNAを製造元の取扱説明書に従ってpCR2.1(Invitrogen)にクローニングし、プラスミドのMCM278(attTn7 up)とMCM252(attTn7 down)を得た。MCM252から消化してゲル精製した832bpのApaI−PvuI断片を、ApaI−PvuI消化し、ゲル精製したプラスミドpR6Kにクローニングし、プラスミドMCM276を作製した。MCM278から消化し、ゲル精製した825bpのPstI−NotI断片を、PstI−NotI消化し、ゲル精製したMCM276にクローニングし、プラスミドMCM281を作製した。
ii)下流経路およびプロモーターのクローニング
MVK−PMK−MVD−IDI遺伝子を製造元の取扱説明書に従ってRoche Expand Long PCRシステムを用い、プライマーのMCM104とMCM105を用いてpTrcKKDyIkISから増幅した。この産物をNotIとApaIで消化し、NotIとApaIで消化し、ゲル精製しておいたMCM281にクローニングした。プライマーのMCM120とMCM127を用いて、Stratagene Pfu Ultra IIを用いてGeneBridges FRT−gb2−Cm−FRT鋳型DNAからCMRカセットを増幅した。1μLの約10ng/μLの鋳型、1μLの各プライマー、1.25μLの10mM dNTP、5μLの10×緩衝液、1μLの酵素、および39.75μLのddH20を含有する4つの50μLのPCR反応液で、95℃で4分間の変性、5サイクルの95℃で20秒、55℃で20秒、72℃で2分、25サイクルの95℃で20秒、58℃で20秒、72℃で2分、72℃で10分、その後4℃に冷却というPCRプログラムを用いた。反応液をプールし、Qiagen PCRクリーンアップカラム上で精製し、これを用いて、プラスミドMCM296を含有する水で洗浄したPir1細胞にエレクトロポレートした。エレクトロポレーションは、2mMキュベット中、2.5Vおよび200ohmで行なった。エレクトロポレーション反応液をLB中、30℃で3時間、回復させた。形質転換体MCM330をCMP5、Kan50を含むLA上で選択した(図107および108A〜108C;配列番号25)。
iii)大腸菌染色体への組込み
MCM330由来のミニプレップDNA(Qiaquickスピンキット)をSnaBIで消化し、これを用いてBL21(DE3)(Novagen)またはGeneBridgesプラスミドpRedET Carbを含有するMG1655にエレクトロポレートした。細胞を30℃で約OD1まで増殖させた後、0.4%のL−アラビノースを用いて、37℃で1.5時間誘導した。これらの細胞を4℃のddH2O中で3回洗浄した後、細胞に2μLのDNAをエレクトロポレートした。組込み体をクロラムフェニコール(5μg/ml)を含有するL寒天上で選択し、その後、L寒天+カナマイシン(50μg/ml)上で増殖しないことを確認した。BL21組込み体MCM331およびMG1655組込み体MCM333を凍結させた。
iv)クズイソプレンシンターゼをコードするpET24D−Kudzuの構築
クズイソプレンシンターゼ遺伝子をpCR2.1ベクター(Invitrogen)由来のpET24dベクター(Novagen)にサブクローニングした。特に、クズイソプレンシンターゼ遺伝子を、プライマーのMCM50 5’−GATCATGCAT TCGCCCTTAG GAGGTAAAAA AACATGTGTG CGACCTCTTC TCAATTTACT(配列番号52)およびMCM53 5’−CGGTCGACGG ATCCCTGCAG TTAGACATAC ATCAGCTG(配列番号50)を用いてpTrcKudzu鋳型DNAから増幅した。Taq DNAポリメラーゼ(Invitrogen)を用いてPCR反応を行ない、得られたPCR産物をpCR2.1−TOPO TAクローニングベクター(Invitrogen)にクローニングし、大腸菌Top10化学的コンピテントセル(Invitrogen)に形質転換した。形質転換体をカルベニシリン(50μg/ml)を含有するL寒天上にプレーティングし、37℃で一晩インキュベートした。カルベニシリン50μg/mlを含有する5mlのルリアブロス培養液に単一の形質転換体を植菌し、37℃で一晩増殖させた。1mlの培養液(ルリアブロス)から単離したプラスミドDNAをシークエンシングすることにより、5つのコロニーを正しい挿入についてスクリーニングし、QIAprepスピンミニプレップキット(Qiagen)を用いて精製した。MCM93と命名された得られたプラスミドは、pCR2.1骨格中にクズイソプレンシンターゼコード配列を含有している。
クズコード配列をPciIとBamH1(Roche)を用いた制限エンドヌクレアーゼ消化により取り出し、QIAquickゲル抽出キット(Qiagen)を用いてゲル精製した。pET24dベクターDNAをNcoIとBamHI(Roche)で消化し、エビアルカリホスファターゼ(Roche)で処理し、QIAprepスピンミニプレップキット(Qiagen)を用いて精製した。クズイソプレンシンターゼ断片を、迅速DNAライゲーションキット(Roche)を用いてNcoI/BamH1消化したpET24dに総容量20μl中5:1の断片対ベクター比で連結した。ライゲーション混合物(5μl)の一部を大腸菌Top10化学的コンピテントセルに形質転換し、カナマイシン(50μg/ml)を含有するL寒天上にプレーティングした。正しい形質転換体をシークエンシングで確認し、化学的コンピテントBL21(λDE3)pLysS細胞(Novagen)に形質転換した。カナマイシン(50μg/ml)を含有するL寒天上で、37℃で一晩増殖させた後、単一コロニーを選択した。pET24D−Kudzuと命名された得られたプラスミドのマップを図109に示す。pET24D−Kudzuの配列(配列番号26)を図110Aおよび110Bに示す。イソプレンシンターゼ活性は、ヘッドスペースアッセイを用いて確認した。
v)産出株
MCM331株とMCM333株にプラスミドpCLPtrcupperpathwayとpTrcKudzuまたはpETKudzuのいずれかを共形質転換し、表5に示す株を得た。
vi)メバロン酸経路の遺伝子を発現し、15Lスケールのフェドバッチ培養で増殖した大腸菌からのイソプレン発酵
培地レシピ(発酵培地1リットル当たり):
発酵培地1リットル当たり以下の成分を用いて培地を作製した:K2HPO4 7.5g、MgSO4 *7H2O 2g、クエン酸一水和物2g、クエン酸第二鉄アンモニウム0.3g、酵母抽出物0.5g、および1000×改変微量金属溶液1ml。全ての成分を一緒に添加し、diH2Oに溶解させた。この溶液をオートクレーブした水酸化アンモニウム(30%)でpHを7.0に調整し、適量を加えて全量とした。グルコース10g、チアミン*HCl 0.1g、および抗生物質を、滅菌およびpH調整の後に添加した。
1000×改変微量金属溶液:
以下の成分を用いて1000×改変微量金属溶液を作製した:クエン酸*H2O 40g、MnSO4 *H2O 30g、NaCl 10g、FeSO4 *7H2O 1g、CoCl2 *6H2O 1g、ZnSO*7H2O 1g、CuSO4 *5H2O 100mg、H3BO3 100mg、およびNaMoO4 *2H2O 100mg。各成分を一度にDiH2Oに溶解させ、HCl/NaOHでpHを3.0にし、次に、適量を加えて全量とし、0.22ミクロンフィルターで濾過滅菌した。
上記のgi1.2組込み下流MVA経路とpCL PtrcUpperMVAプラスミドおよびpTrcKudzuプラスミドを含有するBL21(DE3)大腸菌細胞を含む15Lバイオリアクター中で発酵を行なった。この実験は、所望の発酵(pH7.0および温度30℃)におけるグルコースからのイソプレン形成をモニタリングするために行なわれた。凍結バイアルから採取した大腸菌株の種菌をLBブロス寒天プレート(抗生物質を含む)上にストリークし、37℃でインキュベートした。単一コロニーをトリプトン−酵母抽出物培地中に植菌した。550nmで測定して、種菌がOD1.0にまで増殖した後、500mLを用いて5Lバイオリアクターに植菌した。
細胞が定常期に達するまで、グルコースを指数関数的割合で供給した。定常期以降、代謝要求量を満足させるようにグルコース供給を減らした。57時間の発酵の間にバイオリアクターに送達されたグルコースの総量は、3.9kgであった。IPTGを添加して誘導を達成した。二酸化炭素発生速度が100mmol/L/時間に達したときIPTG濃度を100μMにした。バイオリアクター内の経時的なOD550プロファイルを図111Aに示す。バイオリアクターからのオフガス中のイソプレンレベルを本明細書に記載したように測定した。イソプレン力価は発酵の間に最終値1.6g/Lまで増加した(図111B)。イソプレン発酵の間の比生産性が図111Cに示されており、1.2mg/OD/時間でピークであった。57時間の発酵の間に産出されるイソプレンの総量は16.2gであった。発酵の時にイソプレン産出に回った利用炭素のモル収率は0.9%であった。グルコースからのイソプレンの重量パーセント収率は0.4%であった。
XIV.グリセロールを炭素源として用いたクズイソプレンシンターゼを含有する大腸菌BL21からのイソプレンの産出
クズイソプレンシンターゼを発現する大腸菌の15Lスケール発酵を用いて、フェドバッチ培養でグリセロールを供給した細胞からイソプレンを産出させた。この実験は、グリセロール(グルコースなし)の存在下で細胞を増殖させることにより、2.2mg/Lのイソプレンが産出されたことを示している。
培地レシピ(発酵培地1リットル当たり):
発酵培地1リットル当たり以下の成分を用いて培地を作製した:K2HPO4 7.5g、MgSO4 *7H2O 2g、クエン酸一水和物2g、クエン酸第二鉄アンモニウム0.3g、および1000×改変微量金属溶液1ml。全ての成分を一緒に添加し、diH2Oに溶解させた。この溶液をオートクレーブした水酸化アンモニウム(30%)でpHを7.0に調整し、適量を加えて全量とした。グリセロール5.1g、チアミン*HCl 0.1g、および抗生物質を、滅菌およびpH調整の後に添加した。
1000×改変微量金属溶液:
発酵培地1リットル当たり以下の成分を用いて培地を作製した:クエン酸*H2O 40g、MnSO4 *H2O 30g、NaCl 10g、FeSO4 *7H2O 1g、CoCl2 *6H2O 1g、ZnSO*7H2O 1g、CuSO4 *5H2O 100mg、H3BO3 100mg、およびNaMoO4 *2H2O 100mg。各成分を一度にdiH2Oに溶解させ、HCl/NaOHでpHを3.0にし、次に、適量を加えて全量とし、0.22ミクロンフィルターで濾過滅菌した。
pTrcKudzuプラスミドを含有するBL21(DE3)大腸菌細胞を含む15Lバイオリアクター中で発酵を行なった。所望の発酵(pH7.0および温度35℃)におけるグリセロールからのイソプレン形成をモニタリングするために行なわれた。凍結バイアルから採取した大腸菌株の種菌をLAブロス寒天プレート(抗生物質を含む)上にストリークし、37℃でインキュベートした。単一コロニーをソイトン−酵母抽出物−グルコース培地中に植菌し、35℃で増殖させた。550nmで測定して、種菌がOD1.0にまで増殖した後、600mLを用いて、7.5Lバイオリアクターに植菌した。
細胞が153という550nmでの光学密度(OD550)に達するまでグリセロールを指数関数的割合で供給した。36時間の発酵の間にバイオリアクターに送達されるグリセロールの総量は1.7kgであった。種菌中のグルコース以外に、グルコースはバイオリアクターに添加されなかった。IPTGを添加して誘導を達成した。OD550が50という値に達したとき、IPTG濃度を20μMにした。バイオリアクター内の経時的なOD550プロファイルを図57に示す。バイオリアクターからのオフガス中のイソプレンレベルを本明細書に記載したように測定した。イソプレン力価は発酵の間に最終値2.2mg/Lまで増加した(図58)。54時間の発酵の間に産出されるイソプレンの総量は20.9mgであった。産出の時間経過を図59に示す。
XV.メバロン酸経路の遺伝子を発現し、転化糖を炭素源として用いた15Lスケールのフェドバッチ培養で増殖した大腸菌からのイソプレン発酵
メバロン酸経路ポリペプチドとクズイソプレンシンターゼを発現する大腸菌の15Lスケール発酵を用いて、フェドバッチ培養で転化糖を供給した細胞からイソプレンを産出させた。この実験は、転化糖の存在下で細胞を培養することにより、2.4g/Lのイソプレンが産出されたことを示している。
培地レシピ(発酵培地1リットル当たり):
発酵培地1リットル当たり以下の成分を用いて培地を作製した:K2HPO4 7.5g、MgSO4 *7H2O 2g、クエン酸一水和物2g、クエン酸第二鉄アンモニウム0.3g、酵母抽出物0.5g、および1000×改変微量金属溶液1ml。全ての成分を一緒に添加し、diH2Oに溶解させた。この溶液をオートクレーブした水酸化アンモニウム(30%)でpHを7.0に調整し、適量を加えて全量とした。転化糖10g、チアミン*HCl 0.1g、および抗生物質を、滅菌およびpH調整の後に添加した。
1000×改変微量金属溶液:
以下の成分を用いて1000×改変微量金属溶液を作製した:クエン酸*H2O 40g、MnSO4 *H2O 30g、NaCl 10g、FeSO4 *7H2O 1g、CoCl2 *6H2O 1g、ZnSO*7H2O 1g、CuSO4 *5H2O 100mg、H3BO3 100mg、およびNaMoO4 *2H2O 100mg。各成分を一度にDiH2Oに溶解させ、HCl/NaOHでpHを3.0にし、次に、適量を加えて全量とし、0.22ミクロンフィルターで滅菌濾過した。
pCL PtrcUpperMVAプラスミドとpTrc KKDyIkISプラスミドを含有するBL21(DE3)大腸菌細胞を含む15Lバイオリアクター中で発酵を行なった。この実験は、所望の発酵(pH7.0および温度30℃)における転化糖からのイソプレン形成をモニタリングするために行なわれた。凍結バイアルから採取した大腸菌株の種菌をLBブロス寒天プレート(抗生物質を含む)上にストリークし、37℃でインキュベートした。単一コロニーをトリプトン−酵母抽出物培地中に植菌した。550nmで測定して、種菌がOD1.0にまで増殖した後、500mLを用いて5Lバイオリアクターに植菌した。
細胞が定常期に達するまで転化糖を指数関数的割合で供給した。定常期以降、代謝要求量を満足させるように転化糖供給を減らした。44時間の発酵の間にバイオリアクターに送達される転化糖の総量は2.4kgであった。IPTGを添加して誘導を達成した。550nmでの光学密度(OD550)が9という値に達したとき、IPTG濃度を25μMにした。OD550が200に達したとき、IPTG濃度を50μMに上昇させた。バイオリアクター内の経時的なOD550プロファイルを図96に示す。バイオリアクターからのオフガス中のイソプレンレベルを本明細書に記載したように測定した。イソプレン力価は発酵の間に最終値2.4g/Lまで増加した(図97)。44時間の発酵の間に産出されるイソプレンの総量は18.4gであった。産出の時間経過を図98に示す。発酵の時にイソプレン産出に回った利用炭素のモル収率は1.7%であった。グルコースからのイソプレンの重量パーセント収率は0.8%であった。
実施例9.枯草菌に組み込むための上流MVA経路および下流MVA経路の構築
I.枯草菌における上流MVA経路の構築
エンテロコックス・フェカーリス由来の上流経路をaprEプロモーターの制御下に枯草菌に組み込む。この上流経路は、2つの遺伝子;mvaE(これはAACTおよびHMGRをコードする)とmvaS(これはHMGSをコードする)からなる。この2つの遺伝子は、間に終止コドンを挟み、RBS部位をmvaSの前にして1つに融合され、aprEプロモーターの制御下に置かれる。ターミネーターはmvaE遺伝子の後に置かれる。クロラムフェニコール耐性マーカーをmvaE遺伝子の後ろにクローニングし、このコンストラクトを相同な隣接領域を用いた二重乗換えによってaprE遺伝子座に組み込む。
4つのDNA断片を、PCR反応で1つに融合されることができる突出を含有するように、PCRで増幅する。製造元の説明書に従ってHerculaseポリメラーゼを用いてPCR増幅を行なう。
1.PaprE
CF 07−134(+) aprEプロモーターの開始点 PstI
[化57]
5’−GACATCTGCAGCTCCATTTTCTTCTGC(配列番号115)
CF 07−94(−) PaprEをmvaEに融合する
[化58]
5’−CAATAATAACTACTGTTTTCACTCTTTACCCTCTCCTTTTAA(配列番号116)
鋳型:枯草菌染色体DNA
2.mvaE
CF 07−93(+) mvaEをaprEプロモーター(GTG開始コドン)に融合する
[化59]
5’−TTAAAAGGAGAGGGTAAAGAGTGAAAACAGTAGTTATTATTG(配列番号117)
CF 07−62(−) mvaEを間にあるRBSとともにmvaSに融合する
[化60]
5’−TTTATCAATCCCAATTGTCATGTTTTTTTACCTCCTTTATTGTTTTCTTAAATC(配列番号94)
鋳型:エンテロコックス・フェカーリス染色体DNA(ATCCから得た)
3.mvaS
CF 07−61(+) mvaEを間にあるRBSとともにmvaSに融合する
[化61]
5’−GATTTAAGAAAACAATAAAGGAGGTAAAAAAACATGACAATTGGGATTGATAAA(配列番号95)
CF 07−124(−) mvaSの末端をターミネーターに融合する
[化62]
5’−CGGGGCCAAGGCCGGTTTTTTTTAGTTTCGATAAGAACGAACGGT(配列番号118)
鋳型:エンテロコックス・フェカーリス染色体DNA
4.B.アミロリケファシエンスアルカリ性セリンプロテアーゼターミネーター
CF 07−123(+) mvaSの終点をターミネーターに融合する
[化63]
5’−ACCGTTCGTTCTTATCGAAACTAAAAAAAACCGGCCTTGGCCCCG(配列番号119)
CF 07−46(−) B.アミロリケファシエンスの終点 ターミネーター BamHI
[化64]
5’−GACATGACGGATCCGATTACGAATGCCGTCTC(配列番号58)
鋳型:バシルス・アミリケファシエンス染色体DNA
PCR融合反応
5.mvaEをmvaSに融合する
CF 07−93(+) mvaEをaprEプロモーター(GTG開始コドン)に融合する
[化65]
5’−TTAAAAGGAGAGGGTAAAGAGTGAAAACAGTAGTTATTATTG(配列番号117)
CF 07−124(−) mvaSの末端をターミネーターに融合する
[化66]
5’−CGGGGCCAAGGCCGGTTTTTTTTAGTTTCGATAAGAACGAACGGT(配列番号118)
鋳型:上記の#2および#3
6.mvaE−mvaSをaprEプロモーターに融合する
CF 07−134(+) aprEプロモーターの開始点 PstI
[化67]
5’−GACATCTGCAGCTCCATTTTCTTCTGC(配列番号115)
CF 07−124(−) mvaSの末端をターミネーターに融合する
[化68]
5’−CGGGGCCAAGGCCGGTTTTTTTTAGTTTCGATAAGAACGAACGGT(配列番号118)
上記の鋳型#1および#4
7.PaprE−mvaE−mvaSをターミネーターに融合する
CF 07−134(+) aprEプロモーターの開始点 PstI
[化69]
5’−GACATCTGCAGCTCCATTTTCTTCTGC(配列番号115)
CF 07−46(−) B.アミロリケファシエンスの終点 ターミネーター BamHI
[化70]
5’−GACATGACGGATCCGATTACGAATGCCGTCTC(配列番号58)
鋳型:#4および#6
産物を制限エンドヌクレアーゼのPstI/BamHIで消化し、PstI/BamHIで消化されているpJM102に連結する(A.L.Sonenshein,J.A.Hoch,and R.Losick(編),Bacillus subtilis and other gram−positive bacteria:biochemistry,physiology,and molecular genetics.American Society for Microbiology,Washington,D.C.中のPerego,M.1993.Integrational vectors for genetic manipulation in Bacillus subtilis,p.615−624)。このライゲーション液を大腸菌TOP 10化学的コンピテントセルに形質転換し、形質転換体をカルベニシリン(50μg/ml)を含有するLA上で選択する。正しいプラスミドをシークエンシングで同定し、pJMUpperpathway2と命名する(図50および51)。精製したプラスミドDNAを枯草菌aprEnprE Pxyl−comKに形質転換し、形質転換体をクロラムフェニコール(5μg/ml)を含有するL寒天上で選択する。正しいクローンを選択し、10、15および25μg/mlのクロラムフェニコールを含有するL寒天上に順次プレーティングして、上流経路を含有するカセットのコピー数を増幅する。
1%グルコースと1%を含有するLB中で増殖させることにより、得られた株をメバロン酸産出について試験する。培養物をメバロン酸の産出についてGCで分析する。
この株は、後に、下流メバロン酸経路を組み込むための宿主として用いる。
以下のプライマーを用いて、上記の様々なコンストラクトをシークエンシングする。
シークエンシングプライマー:
CF 07−134(+) aprEプロモーターの開始点 PstI
[化71]
5’−GACATCTGCAGCTCCATTTTCTTCTGC(配列番号115)
CF 07−58(+) mvaE遺伝子の開始点
[化72]
5’−ATGAAAACAGTAGTTATTATTGATGC(配列番号97)
CF 07−59(−) mvaE遺伝子の開始点
[化73]
5’−ATGTTATTGTTTTCTTAAATCATTTAAAATAGC(配列番号98)
CF 07−82(+) mvaS遺伝子の開始点
[化74]
5’−ATGACAATTGGGATTGATAAAATTAG(配列番号99)
CF 07−83(−) mvaS遺伝子の終点
[化75]
5’−TTAGTTTCGATAAGAACGAACGGT(配列番号100)
CF 07−86(+) mvaE中の終点
[化76]
5’−GAAATAGCCCCATTAGAAGTATC(配列番号101)
CF 07−87(+) mvaE中の配列
[化77]
5’−TTGCCAATCATATGATTGAAAATC(配列番号102)
CF 07−88(+) mvaE中の配列
[化78
5’−GCTATGCTTCATTAGATCCTTATCG(配列番号103)
CF 07−89(+) 配列mvaS
[化79]
5’−GAAACCTACATCCAATCTTTTGCCC(配列番号104)
形質転換体を5μg/mlの濃度のクロラムフェニコールを含有するLA上で選択する。あるコロニーが正しい組込みを有することをシークエンシングで確認し、最終レベル25μg/mlまで数日かけて増加する濃度のクロラムフェニコールを含有するLA上にプレーティングする。これにより、目的の遺伝子を含有するカセットが増幅される。得られた株をCF 455:pJMupperpathway#1×Bacillus subtillis aprEnprE Pxyl comKと命名する(増幅して、クロラムフェニコール25μg/mlを含有するLA上で増殖させる)。
II.枯草菌における下流MVA経路の構築
遺伝子mvk1、pmk、mpdおよびidiからなる下流MVA経路を、枯草菌染色体(組込み部位)のnprE領域由来の隣接DNA領域、aprEプロモーター、およびスペクチノマイシン耐性マーカーからなるカセット中で組み合わせる(図28および29;配列番号13参照)。このカセットをDNA2.0により合成し、aprE遺伝子座に組み込まれた上流MVA経路を含有する枯草菌の染色体に組み込む。このクズイソプレンシンターゼ遺伝子を実施例4に記載の複製プラスミドから発現させ、上流経路と下流経路の両方が組み込まれた株に形質転換する。
実施例10:例示的なイソプレン組成物とその作製方法
I.イソプレンを含有する発酵オフガスの組成分析
イソプレノイド前駆体生合成のための完全なメバロン酸経路をコードする2つのプラスミド(pCL upperMev;pTrcKKDyIkIS)、酵母由来のイソプレニルピロリン酸イソメラーゼ、およびクズ由来のイソプレンシンターゼを含有する組換え大腸菌BL21(DE3)株を用いて、14Lスケール発酵を行なった。14Lタンクからの発酵オフガスをピークイソプレン生産性(27.9時間の経過発酵時間、「EFT」)の時点の前後で20mLヘッドスペースバイアルに回収し、揮発性物質成分についてヘッドスペースGC/MSで分析した。
Agilent HP−5MS GC/MSカラム(30m×250μm;0.25μm膜厚)に取り付けたAgilent 6890 GC/MSシステムを用いて、ヘッドスペース分析を行なった。20mLヘッドスペースバイアルからの500μLアリコートのサンプリングにはcombiPALオートインジェクターを用いた。GC/MS法では、ヘリウムがキャリアガスとして1mL/分の流量で利用された。注入口を250℃に保ち、分割比を50:1とした。オーブン温度は、最初の2分間は37℃に保ち、次いで10分間の全方法時間の間、25℃/分の速度で237℃にまで上昇させた。Agilent 5793N質量選択検出器をm/z 29からm/z 300までスキャンした。このシステムの検出限界は、約0.1μg/Lガスまたは約0.1ppmである。所望により、検出限界がより低い、より感度の高い装置を用いてもよい。
オフガスは、99.925%(v/v)の永久ガス(N
2、CO
2およびO
2)、約0.075%のイソプレン(2−メチル−1,3−ブタジエン)(約750ppmv、2100μg/L)および微量(<50ppmv)のエタノール、アセトン、および2種のC5プレニルアルコールからなっていた。水蒸気の量は測定されなかったが、0℃における平衡蒸気圧に等しいと推定された。揮発性有機画分の組成は、GC/MSクロマトグラムのピーク下面積を積分して決定された(図86Aおよび86B)。これを表6に記載する。エタノール標準およびアセトン標準の検量線から、標準的な方法を用いてGC面積をμg/Lという単位で表される気相濃度に変換することができた。
発酵オフガス中の揮発性有機成分の組成。異種メバロン酸経路、酵母由来のイソプレニルピロリン酸イソメラーゼ、およびクズ由来のイソプレンシンターゼを発現する大腸菌BL21(DE3)株を用いた発酵の27.9時間の時点でオフガスを分析した。
II.組換え大腸菌株の発酵の間にイソプレンとともに共産出される微量の揮発性有機化合物(VOC)の測定
イソプレノイド前駆体生合成のための完全なメバロン酸経路をコードする2つのプラスミド(pCL upperMev;pTrcKKDyIkIS)、酵母由来のイソプレニルピロリン酸イソメラーゼ、およびクズ由来のイソプレンシンターゼを含有する組換え大腸菌BL21(DE3)株を用いて、14Lスケール発酵を行なった。
微量の揮発性有機成分を濃縮し同定するために、発酵オフガスを、冷却したヘッドスペースバイアルに通した。この発酵からのオフガスを、石英ウール(2g)を詰めた20mLヘッドスペースバイアルを通して、1L/分の速度で10分間サンプリングし、ドライアイスで−78℃に冷却した。このバイアルに新しいバイアルキャップで再度蓋をし、実施例10、第I部に記載の条件を用いて、トラップしたVOCについてヘッドスペースGC/MSで分析した。図87A〜87Dに見られる化合物の比率は、発酵オフガス中の全体的なレベルと−78℃での相対蒸発圧と質量分析計の検出器応答を組み合わせたものである。例えば、酸素化した揮発性物質(例えば、アセトンおよびエタノール)と比べた低レベルのイソプレンは、−78℃でヘッドスペースバイアルに蓄積しない程度のこの物質の高揮発性の関数である。
これらの化合物の多くの存在は、生物学的源に由来するイソプレン組成物に特有である。これらの結果を図87A〜87Dに示し、表7および8にまとめる。
−78℃でクライオトラッピングした、大腸菌BL21(DE3)(pCL upperMev;pTrcKKDyIkIS)によって産出されたオフガス中に存在する微量揮発性物質
1、GC面積は、記載された化合物に対応する未補正のピーク下面積である。
2、面積%は、%として表された、全化合物の総ピーク面積に対するピーク面積である。
3、比率%は、%として表された、2−メチル−1,3−ブタジエンのピーク面積に対するピーク面積である。
−196℃でクライオトラッピングした、大腸菌BL21(DE3)(pCL upperMev;pTrcKKDyIkIS)によって産出されたオフガス中に存在する微量揮発性物質
1 GC面積は、記載された化合物に対応する未補正のピーク下面積である。
2 面積%は、%として表された、全化合物の総ピーク面積に対するピーク面積である。
3 比率%は、%として表された、2−メチル−1,3−ブタジエンのピーク面積に対するピーク面積である。
III.発酵から得られるイソプレンにおけるC5炭化水素異性体の不在
液体窒素中で冷却した2mLヘッドスペースバイアルを用いて、発酵オフガス中に存在するイソプレンのクライオトラッピングを行なった。2mLバイアル(−196℃)中での氷と固体CO2の蓄積を最小限に抑えるために、オフガス(1L/分)を水酸化ナトリウムペレットを含有する20mLバイアルにまず通した。約10Lのオフガスをバイアルに通した後、通気して−78℃まで温めておき、次に、新しいバイアルキャップで再度密封して、GC/MSで分析した。
ヘッドスペースモードで100μLガスタイトシリンジを用いるAgilent 6890 GC/MSシステムでGC/MSヘッドスペース分析を行なった。分析物の分離には、Zebron ZB−624 GC/MSカラム(30m×250μm;1.40μm膜厚)を用いた。GCオートインジェクターをガスタイト100μLシリンジに取り付け、2mLのGCバイアルから50μLのヘッドスペースサンプルを注入することができるように針の高さを調整した。GC/MS法では、ヘリウムがキャリアガスとして1mL/分の流量で利用された。注入口は、分割比を20:1にして200℃に保った。オーブン温度は、5分間の分析の間、37℃に保った。Agilent 5793N質量選択検出器を、m/z 55、66、67および70で単一イオンモニタリング(SIM)モードで操作した。これらの条件下では、イソプレンが2.966分で溶出することが観察された(図88B)。この方法を用いて、石油から得られたイソプレン標準(Sigma−Aldrich)も分析し、さらなるC5炭化水素異性体を含有することが分かった。この異性体は、主ピークのすぐ前またはすぐ後に溶出し、補正したGC面積に基づいて定量された(図88A)。
別々の実験で、検出器応答が各々の化合物について同じであるかどうかを決定するために、C5炭化水素の標準混合物を分析した。化合物は、2−メチル−1−ブテン、2−メチル−1,3−ブタジエン、(E)−2−ペンテン、(Z)−2−ペンテンおよび(E)−1,3−ペンタジエンであった。この例では、50℃で15分間保持されたAgilent DB−Petroカラム(100m×0.25mm、0.50μm膜厚)で分析を行なった。GC/MS法では、ヘリウムがキャリアガスとして1mL/分の流量で利用された。注入口は、分割比を50:1にして200℃に保った。Agilent 5793N質量選択検出器をフルスキャンモードでm/z 19からm/z 250まで操作した。これらの条件下では、100μg/Lの濃度の各標準は、実験誤差の範囲内の同じ検出器応答を生じさせた。
IV.固相に吸着したイソプレンを含む組成物
生物学的に産出されるイソプレンを活性炭に吸着させて、50〜99.9%炭素、0.1%〜50%イソプレン、0.01%〜5%水、および微量(<0.1%)の他の揮発性有機成分を含有する固相を生じさせた。
水蒸気を除去するために、発酵オフガスを0℃に保持された銅凝結コイル、次いで粒状シリカ乾燥フィルターに通して流した。その後、除湿したオフガスを、炭素含有フィルター(Koby Jr,Koby Filters,MA)から、GC/MSでイソプレンの分解がフィルター排ガス中に検出される位置まで流した。カートリッジに吸着したイソプレンの量は、オフガス中の濃度、全体的な流速および回収期間中の分解パーセントを計算することにより間接的に決定することができる。あるいは、吸着したイソプレンを熱、真空、または溶媒による脱離によってフィルターから回収することができる。
V.濃縮イソプレンの回収および分析
発酵オフガスを除湿し、好適な吸着剤(例えば、アスカライト)に通して濾過することにより、CO2を除去する。次に、ストリーム中のVOCを凝結するために、得られるオフガス流を、液体窒素で冷却した凝結器に通して流す。回収容器には、得られるイソプレン凝結物を阻害するためのt−ブチルカテコールが含まれる。本明細書に記載した方法などの標準的な方法を用いて純度を測定するために、この凝結物をGC/MSおよびNMRで分析する。
VI.発酵によるプレニルアルコールの産出
クズイソプレンシンターゼを発現する大腸菌BL21(DE3)株からのオフガスの分析から、イソプレンと3−メチル−3−ブテン−1−オール(イソプレノール)の両方が存在することが明らかになった。ヘッドスペースGC/MSで測定した場合の発酵全体での発酵オフガス中の2つの化合物のレベルを図89に示す。得られたイソプレノール(3−メチル−3−ブテン−1−オール、3−MBA)のレベルは、この実験ではほぼ10μg/Lオフガスであった。さらなる実験により、発酵オフガス中に約20μg/Lオフガスのレベルが産出された。
実施例11:メバロン酸経路由来の遺伝子を発現し、フェドバッチ培養で発酵させた大腸菌における増殖とイソプレン産出の脱共役
実施例11は、メバロン酸およびイソプレン産出からの細胞増殖の脱共役を示す。
I.発酵条件
培地レシピ(発酵培地1リットル当たり):
発酵培地1リットル当たり以下の成分を用いて培地を作製した:K2HPO4 7.5g、MgSO4 *7H2O 2g、クエン酸一水和物2g、クエン酸第二鉄アンモニウム0.3g、酵母抽出物0.5g、および1000×改変微量金属溶液1ml。全ての成分を一緒に添加し、diH2Oに溶解させた。この溶液をオートクレーブした水酸化アンモニウム(30%)でpHを7.0に調整し、適量を加えて全量とした。グルコース10g、チアミン*HCl 0.1g、および抗生物質を、滅菌およびpH調整の後に添加した。
1000×改変微量金属溶液:
以下の成分を用いて1000×改変微量金属溶液を作製した:クエン酸*H2O 40g、MnSO4 *H2O 30g、NaCl 10g、FeSO4 *7H2O 1g、CoCl2*6H2O 1g、ZnSO*7H2O 1g、CuSO4 *5H2O 100mg、H3BO3 100mg、およびNaMoO4 *2H2O 100mg。各成分を一度にDiH2Oに溶解させ、HCl/NaOHでpHを3.0にした後、適量を加えて全量とし、0.22ミクロンフィルターで濾過滅菌した。
pTrcHis2AUpperPathway(pTrcUpperMVAとも呼ぶ、図91および92A〜92C;配列番号23)(50μg/mlカルベニシリン)またはpCL PtrcUpperMVA(pCL PtrcUpperPathwayとも呼ぶ(図26))(50μg/mlスペクチノマイシン)プラスミドを含有する大腸菌細胞を用いて発酵を行なった。イソプレンを産出する実験の場合、大腸菌細胞は、pTrc KKDyIkIS(50μg/mlカナマイシン)プラスミドも含有していた。これらの実験は、所望の発酵(pH7.0および温度30℃)におけるグルコースからのメバロン酸またはイソプレン形成をモニタリングするために行なわれた。凍結バイアルから採取した大腸菌株の種菌をLAブロス寒天プレート(抗生物質を含む)上にストリークし、37℃でインキュベートした。単一コロニーをトリプトン−酵母抽出物培地中に植菌した。550nmで測定したときに種菌が光学密度1.0まで増殖した後、それをバイオリアクターに植菌するために用いた。
細胞が定常期に達するまで、グルコースを指数関数的割合で供給した。定常期以降、代謝要求量を満足させるようにグルコース供給を減らした。IPTGを添加して誘導を達成した。過塩素酸(Sigma−Aldrich #244252)処理したサンプル(0.3M、4℃で5分間インキュベートしたもの)を有機酸HPLCカラム(BioRad #125−0140)に適用して、発酵ブロス中のメバロン酸濃度を測定した。ブロスメバロン酸ピークサイズを、メバロノールアセトン(Sigma−Aldrich # M4667)を過塩素酸で処理して、D,L−メバロン酸を形成したものから作成した検量線と比較することにより、濃度を決定した。バイオリアクターからのオフガス中のイソプレンレベルを本明細書に記載したように測定した。イソプレン力価は、発酵ブロス1リットル当たりに産出されるイソプレンの量と定義される。
II.150LスケールでのpTrcUpperMVAプラスミドを発現する大腸菌BL21(DE3)細胞からのメバロン酸産出
上記の実施例11、第I部で説明したようにプレート上で増殖させたBL21(DE3)細胞を、45mLのトリプトン−酵母抽出物培地を含有するフラスコに植菌し、170rpmで振盪させながら、30℃で5時間インキュベートした。この溶液をトリプトン−酵母抽出物培地の5Lバイオリアクターに移し、培養物のOD550が1.0に達するまで、細胞を30℃、27.5rpmで増殖させた。5Lの種菌を45kgの培地を含有する150Lバイオリアクターに播種した。OD550が10という値に達したとき、IPTG濃度を1.1mMにした。バイオリアクター内の経時的なOD550プロファイルを図60Aに示す。メバロン酸力価は、発酵の間に最終値61.3g/Lまで増加した(図60B)。発酵の全期間を通じた比生産性プロファイルを図60Cに示す。図60Aとの比較から、増殖とメバロン酸産出の脱共役が示されている。52.5時間の発酵の間に産出されるメバロン酸の総量は、利用されたグルコース14.1kgから4.0kgであった。発酵の時にメバロン酸産出に回った利用炭素のモル収率は34.2%であった。
III.15LスケールでのpTrcUpperMVAプラスミドを発現する大腸菌BL21(DE3)細胞からのメバロン酸産出
上記の実施例11、第I部で説明したようにプレート上で増殖させたBL21(DE3)細胞を、500mLのトリプトン−酵母抽出物培地を含有するフラスコに植菌し、培養物のOD550が1.0になるまで、30℃、160rpmで増殖させた。この材料を4.5kgの培地を含有する15Lバイオリアクターに播種した。OD550が10という値に達したとき、IPTG濃度を1.0mMにした。バイオリアクター内の経時的なOD550プロファイルを図61Aに示す。メバロン酸力価は、発酵の間に最終値53.9g/Lまで増加した(図61B)。発酵の全期間を通じた比生産性プロファイルを図61Cに示す。図61Aとの比較から、増殖とメバロン酸産出の脱共役が示されている。46.6時間の発酵の間に産出されるメバロン酸の総量は、利用されたグルコース2.1kgから491gであった。発酵の時にメバロン酸産出に回った利用炭素のモル収率は28.8%であった。
IV.15LスケールでのpTrcUpperMVAプラスミドを発現する大腸菌FM5細胞からのメバロン酸産出
上記の実施例11、第I部で説明したようにプレート上で増殖させたFM5細胞を、500mLのトリプトン−酵母抽出物培地を含有するフラスコに植菌し、培養物のOD550が1.0になるまで、30℃、160rpmで増殖させた。この材料を4.5kgの培地を含有する15Lバイオリアクターに播種した。OD550が30という値に達したとき、IPTG濃度を1.0mMにした。バイオリアクター内の経時的なOD550プロファイルを図62Aに示す。メバロン酸力価は、発酵の間に最終値23.7g/Lまで増加した(図62B)。発酵の全期間を通じた比生産性プロファイルを図62Cに示す。図62Aとの比較から、増殖とメバロン酸産出の脱共役が示されている。51.2時間の発酵の間に産出されるメバロン酸の総量は、利用されたグルコース1.1kgから140gであった。発酵の時にメバロン酸産出に回った利用炭素のモル収率は15.2%であった。
V.15LスケールでのpTrcUpperMVAプラスミドを発現する大腸菌BL21(DE3)細胞からのイソプレン産出
上記の実施例11、第I部で説明したようにプレート上で増殖させたpCL PtrcUpperMVAプラスミドおよびpTrc KKDyIkISプラスミドを発現するBL21(DE3)細胞を、500mLのトリプトン−酵母抽出物培地を含有するフラスコに植菌し、培養物のOD550が1.0になるまで、30℃、160rpmで増殖させた。この材料を4.5kgの培地を含有する15Lバイオリアクターに播種した。OD550が10という値に達したとき、IPTG濃度を25μMにした。OD550が190に達したとき、IPTG濃度を50μMに上昇させた。発酵して38時間でIPTG濃度を100μMに上昇させた。バイオリアクター内の経時的なOD550プロファイルを図63Aに示す。イソプレン力価は発酵の間に最終値2.2g/Lブロスまで増加した(図63B)。発酵の全期間を通じた比生産性プロファイルを図63Cに示す。図63Aとの比較から、増殖とイソプレン産出の脱共役が示されている。54.4時間の発酵の間に産出されるイソプレンの総量は、利用されたグルコース2.3kgから15.9gであった。発酵の時にイソプレン産出に回った利用炭素のモル収率は1.53%であった。
VI.15LスケールでのpCL PtrcUpperMVAプラスミドおよびpTrc KKDyIkISプラスミドを発現する大腸菌BL21(DE3)チューナー細胞からのイソプレン産出
上記の実施例11、第I部で説明したようにプレート上で増殖させたpCL PtrcUpperMVAプラスミドおよびpTrc KKDyIkISプラスミドを発現するBL21(DE3)細胞を、500mLのトリプトン−酵母抽出物培地を含有するフラスコに植菌し、培養物のOD550が1.0になるまで、30℃、160rpmで増殖させた。この材料を4.5kgの培地を含有する15Lバイオリアクターに播種した。OD550が10という値に達したとき、IPTG濃度を26μMにした。OD550が175に達したとき、IPTG濃度を50μMに上昇させた。バイオリアクター内の経時的なOD550プロファイルを図64Aに示す。イソプレン力価は発酵の間に最終値1.3g/Lブロスまで増加した(図64B)。発酵の全期間を通じた比生産性プロファイルを図64Cに示す。図64Aとの比較から、増殖とイソプレン産出の脱共役が示されている。48.6時間の発酵の間に産出されるイソプレンの総量は、利用されたグルコース1.6kgから9.9gであった。発酵の時にイソプレン産出に回った利用炭素のモル収率は1.34%であった。
VII.15LスケールでのpCL PtrcUpperMVAプラスミドおよびpTrc KKDyIkISプラスミドを発現する大腸菌MG1655細胞からのイソプレン産出
上記の実施例11、第I部で説明したようにプレート上で増殖させたpCL PtrcUpperMVAプラスミドおよびpTrc KKDyIkISプラスミドを発現するMG1655細胞を、500mLのトリプトン−酵母抽出物培地を含有するフラスコに植菌し、培養物のOD550が1.0になるまで、30℃、160rpmで増殖させた。この材料を4.5kgの培地を含有する15Lバイオリアクターに播種した。OD550が45という値に達したとき、IPTG濃度を24μMにした。バイオリアクター内の経時的なOD550プロファイルを図65Aに示す。イソプレン力価は発酵の間に最終値393mg/Lブロスまで増加した(図65B)。発酵の全期間を通じた比生産性プロファイルを図65Cに示す。図65Aとの比較から、増殖とイソプレン産出の脱共役が示されている。67.4時間の発酵の間に産出されるイソプレンの総量は、利用されたグルコース520gから2.2gであった。発酵の時にイソプレン産出に回った利用炭素のモル収率は0.92%であった。
VIII.15LスケールでのpCL PtrcUpperMVAプラスミドおよびpTrc KKDyIkISプラスミドを発現するMG1655ack−pta細胞からのイソプレン産出
上記の実施例11、第I部で説明したようにプレート上で増殖させたpCL PtrcUpperMVAプラスミドおよびpTrc KKDyIkISプラスミドを発現するMG1655ack−pta細胞を、500mLのトリプトン−酵母抽出物培地を含有するフラスコに植菌し、培養物のOD550が1.0になるまで、30℃、160rpmで増殖させた。この材料を4.5kgの培地を含有する15Lバイオリアクターに播種した。OD550が10という値に達したとき、IPTG濃度を30μMにした。バイオリアクター内の経時的なOD550プロファイルを図66Aに示す。イソプレン力価は発酵の間に最終値368mg/Lブロスまで増加した(図66B)。発酵の全期間を通じた比生産性プロファイルを図66Cに示す。図66Aとの比較から、増殖とイソプレン産出の脱共役が示されている。56.7時間の発酵の間に産出されるイソプレンの総量は、利用されたグルコース531gから1.8gであった。発酵の時にイソプレン産出に回った利用炭素のモル収率は0.73%であった。
IX.15LスケールでのpCL PtrcUpperMVAプラスミドおよびpTrc KKDyIkISプラスミドを発現する大腸菌FM5細胞からのイソプレン産出
上記の実施例11、第I部で説明したようにプレート上で増殖させたpCL PtrcUpperMVAプラスミドおよびpTrc KKDyIkISプラスミドを発現するFM5細胞を、500mLのトリプトン−酵母抽出物培地を含有するフラスコに植菌し、培養物のOD550が1.0になるまで、30℃、160rpmで増殖させた。この材料を4.5kgの培地を含有する15Lバイオリアクターに播種した。OD550が15という値に達したとき、IPTG濃度を27μMにした。バイオリアクター内の経時的なOD550プロファイルを図67Aに示す。イソプレン力価は発酵の間に最終値235mg/Lブロスまで増加した(図67B)。発酵の全期間を通じた比生産性プロファイルを図67Cに示す。図67Aとの比較から、増殖とイソプレン産出の脱共役が示されている。52.3時間の発酵の間に産出されるイソプレンの総量は、利用されたグルコース948gから1.4gであった。発酵の時にイソプレン産出に回った利用炭素のモル収率は0.32%であった。
実施例12:メバロン酸経路由来の遺伝子を発現し、フェドバッチ培養で発酵させた大腸菌の指数関数的増殖期におけるイソプレンの産出
実施例12は、細胞の指数関数的増殖期におけるイソプレンの産出を示す。
培地レシピ(発酵培地1リットル当たり):
発酵培地1リットル当たり以下の成分を用いて培地を作製した:K2HPO4 7.5g、MgSO4 *7H2O 2g、クエン酸一水和物2g、クエン酸第二鉄アンモニウム0.3g、酵母抽出物0.5g、および1000×改変微量金属溶液1ml。全ての成分を一緒に添加し、diH2Oに溶解させた。この溶液をオートクレーブした水酸化アンモニウム(30%)でpHを7.0に調整し、適量を加えて全量とした。グルコース10g、チアミン*HCl 0.1g、および抗生物質を、滅菌およびpH調整の後に添加した。
1000×改変微量金属溶液:
以下の成分を用いて1000×改変微量金属溶液を作製した:クエン酸*H2O 40g、MnSO4 *H2O 30g、NaCl 10g、FeSO4 *7H2O 1g、CoCl2*6H2O 1g、ZnSO*7H2O 1g、CuSO4 *5H2O 100mg、H3BO3 100mg、およびNaMoO4 *2H2O 100mg。各成分を一度にDiH2Oに溶解させ、HCl/NaOHでpHを3.0にし、次に、適量を加えて全量とし、0.22ミクロンフィルターで滅菌濾過した。
pCL PtrcUpperMVAプラスミドおよびpTrc KKDyIkISプラスミドを含有するATCC11303大腸菌細胞を含む15Lバイオリアクター中で発酵を行なった。この実験は、所望の発酵(pH7.0および温度30℃)におけるグルコースからのイソプレン形成をモニタリングするために行なわれた。凍結バイアルから採取した大腸菌株の種菌をLBブロス寒天プレート(抗生物質を含む)上にストリークし、37℃でインキュベートした。単一コロニーをトリプトン−酵母抽出物培地中に植菌した。550nmで測定して、種菌がOD1.0にまで増殖した後、500mLを用いて5Lバイオリアクターに植菌した。
細胞が定常期に達するまで、グルコースを指数関数的割合で供給した。定常期以降、代謝要求量を満足させるようにグルコース供給を減らした。50時間の発酵の間にバイオリアクターに送達されたグルコースの総量は、2.0kgであった。IPTGを添加して誘導を達成した。550nmでの光学密度(OD550)が10という値に達したとき、IPTG濃度を25μMにした。OD550が190に達したとき、IPTG濃度を50μMに上昇させた。バイオリアクター内の経時的なOD550プロファイルを図99に示す。バイオリアクターからのオフガス中のイソプレンレベルを本明細書に記載したように測定した。イソプレン力価は発酵の間に最終値1.4g/Lまで増加した(図100)。50時間の発酵の間に産出されたイソプレンの総量は10.0gであった。バイオリアクター内の経時的なイソプレン比生産性のプロファイルを図101に示す。発酵の時にイソプレン産出に寄与した利用炭素のモル収率は1.1%であった。グルコースからのイソプレンの重量パーセント収率は0.5%であった。
実施例13:イソプレンの引火性のモデリングと試験
I.イソプレンの引火性のモデリングと試験の概要
引火性のモデリングと実験を様々な炭化水素/酸素/窒素/水/二酸化炭素混合物について行なった。試験されたこのモデリングと実験は、一定の圧力および温度における特定の蒸気および一酸化炭素濃度下のイソプレンおよび酸素/窒素引火性曲線を規定することが目的であった。モデル条件のマトリックスを表11に示し、実施された実験のマトリックスを表5に示す。
モデリングされたイソプレン引火性のまとめ
II.計算断熱火炎温度(CAFT)モデルの説明
計算断熱火炎温度(CAFT)を燃焼伝播のための選択限界火炎温度とともに用いて、イソプレンの引火限度を決定した。この研究で火炎温度を計算するために用いられたコンピュータプログラムは、NASA Glenn Research Center CEA(Chemical Equilibrium with Applications)ソフトウェアである。
均質な燃焼機構(この場合、燃料と酸化体の両方がガス状態にある)に関する断熱火炎温度モデルを用いた引火限度の決定には、5つの工程、すなわち、所望の反応剤の選択、試験条件の選択、限界火炎温度の選択、反応剤の修飾、および計算値からの引火限度の構築が関与している。
この最初の工程である、所望の反応剤の選択では、この系に存在する反応剤種と各々の量に関して決定がなされなければならない。多くの場合、計算に用いられるコンピュータプログラムは、反応剤および産物種のリストを有している。調査すべき種に関するデータがプログラム中に見つからない場合は、JANAF表などの他の情報源またはインターネットから取得してもよい。この現在のモデルでは、水、窒素、酸素および二酸化炭素に関するデータが、プログラムデータベース中に存在していた。このプログラムデータベースは、イソプレンを種として含んでいなかった。そのため、熱力学特性を手動で組み入れた。
次の工程は、燃焼プロセスが生じる初期の圧力および温度条件を決定することである。このモデルでは、圧力は1気圧(絶対気圧)、温度は、イソプレンの沸点である40℃である。
燃焼の限界火炎温度は、理論的原理に基づいて選択されるかまたは実験的に決定されるかのいずれかであることができる。各々の方法にそれ独自の限界がある。
先行研究に基づくと、炭化水素の限界火炎温度は、1000K〜1500Kの範囲に収まる。このモデルでは、1500Kという値を選択した。これは、一酸化炭素から二酸化炭素への反応(高発熱反応であり、火炎エネルギーのかなりの割合を占める)が自律的になる温度である。
ひとたび限界火炎温度が決定されれば、所与の反応剤混合物に対してモデル計算を行ない(種濃度)、断熱火炎温度を決定する。温度が限界火炎温度を超えた場合にのみ、火炎伝播が起こったと考えられる。次に、反応剤混合物の組成を変更して、伝播混合物と非伝播混合物のデータセットを作成する。
この種のモデルは、実験的に決定される引火限界と十分一致する。得られた限度外の領域が非引火性であり、得られた限度の範囲内の領域が引火性である。限度の形状は先端を形成する。限度の先端は、ガス燃料の制限酸素濃度(LOC)に関連する。
III.計算断熱火炎温度(CAFT)モデルからの結果
シリーズAからGまでのCAFTモデル結果が、それぞれ、図68から図74にかけてプロットされている。これらの図では、計算断熱火炎温度が、(NASA CEAプログラムを用いて)いくつかの酸素/窒素比(重量による)に対する燃料濃度(重量による)の関数としてプロットされている。1500Kを超える曲線の部分である、選択限界火炎温度は、火炎伝播に十分な燃料レベルを含有している。これらの結果は、図68から図74にかけて提示された形で解釈するのは困難な場合がある。さらに、現在の形は、通常は容積パーセントの単位で提示される実験データと比較することができない。
シリーズAを例として用いて、図68のデータを従来的な引火限度の形でプロットすることができる。図68および縦座標上の1500Kの温度線と交差する読取り値を用いて、それが交わる各曲線(酸素対窒素比)の横座標に向かって接線を引くことにより、この限界火炎温度の燃料濃度を決定することができる。次に、これらの値を、所与の酸化体の重量パーセントに対する燃料の重量パーセントとして一覧にすることができる(図75A)。次に、燃料の組成(100重量%イソプレン)と酸化体の組成(水、酸素および窒素の相対含有量)が分かれば、モル量を確定することができる。
これらのモル量から、容積濃度パーセントを計算することができる。次に、容積パーセント単位の濃度をプロットして、引火限度を生成することができる(図75B)。この限度によって囲まれる部分が爆発範囲であり、除外される部分が非爆発範囲である。この限度の「先端」が制限酸素濃度である。図76Aおよび76Bは、図69に提示されたデータから生成されたシリーズBの引火限度の計算容積濃度を含有している。図70〜74に提示されたデータに対して同様の手法を用いることができる。
IV.引火性試験実験装置および手順
引火性試験は、4リットル高圧容器内で行なわれた。容器は円筒状で、内径が6インチ、内のり高さが8.625インチであった。容器(および内部のガス)の温度は、PIDコントローラーで制御される外部加熱器を用いて維持された。熱損失を防ぐために、セラミックウールと反射断熱材とを圧力容器の周囲に巻き付けた。Kタイプの熱電温度計を用いて、ガススペースの温度および容器それ自体の温度を測定した。図77に試験容器を示す。
試験を実施する前に、容器を空にし、窒素でパージして、それまでの試験で発生したガスを全て確実に除去した。次に、容器に真空を引いた。これが行なわれた後の圧力は、通常、約0.06barであった(a)。窒素パージングしたため、この初期の圧力の原因となるガスは、窒素であると仮定された。分圧を用いて、次に、水、イソプレン、窒素、および酸素を適当な量で添加して、問題とする試験条件を達成した。容器内の磁気駆動型ミキシングファンで、ガス内容物を確実に混合した。点火の約1分前に切れるファンを用いて、ガスを約2分間混合させておいた。
点火装置は、タイマー回路上の1.5ohmのニクロムコイルとAC電源から構成されていた。オシロスコープを用いて、34.4のVACがこの点火装置に3.2秒間送達されると決定された。点火サイクルのほぼ中間で3.8ampの最大電流が発生した。したがって、最大出力は131Wであり、点火サイクルの間に提供される総エネルギーは、約210Jであった。
データ獲得システムに接続された可変リラクタンスValidyne DP215圧力変換器を用いて爆燃データを獲得した。ガス混合物は、圧力が5%以上上昇した場合に爆燃すると考えられた。
V.引火性試験の結果
最初の実験シリーズ(シリーズ1)は、40℃、0psig、蒸気なしで実施された。様々な濃度のイソプレンと酸素で試験を実施すると、図78Aに示す引火性曲線が生成された。この曲線で示すデータ点は、曲線に接するもののみである。このシリーズで取得された全データ点の詳細なリストを図80Aおよび80Bに示す。
図78Aで示した爆発データ点を図78Bにまとめる。図78Cは、実験データをCAFTモデルで予測された引火限度と比較したものである。このモデルは、実験データと非常によく一致している。不一致は、試験チャンバーの非断熱性とモデルの限界とによるものであり得る。このモデルは、酸化反応に対して無限時間軸を考えており、反応の動力学的な限界を全く考慮していない。
さらに、このモデルは、そのデータベースに含まれる平衡化学種の数によって制限され、したがって、熱分解種を適切に予測し得ない。また、このモデルで生じる引火限度では、限界火炎温度(1500K)に対して1つの値が用いられる。限界火炎温度は、反応する化学種によって、1,000K〜1,500Kの範囲の値であることができる。化学量論的燃料/酸化体レベルを上回る燃料濃度で形成される熱分解化学種の複雑な性質は、このモデルでこの系の引火上限を正確に予測し得ない1つの理由である。
第2の実験シリーズ(シリーズ2)は、40℃、0psig、4%という一定の蒸気濃度で実施された。様々な濃度のイソプレンと酸素で試験を実施すると、図79Aに示す引火性曲線が生成された。この曲線で示すデータ点は、曲線に接するもののみである。このシリーズで取得された全データ点の詳細なリストを図81に示す。シリーズ1のデータと類似しているので、引火下限、制限酸素濃度、および引火上限といった重要な点だけを試験した。試験混合物に4%の蒸気を添加しても、引火限度の主要な限界はそれほど変化しなかった。より高濃度の蒸気/水および/または他の不活性ガスが引火限度に影響を与えた可能性があることに留意すべきである。
図79Aで示した爆発データ点を図79Bにまとめる。図79Cは、実験データをCAFTモデルで予測された引火限度と比較したものである。このモデルは、実験データと非常によく一致している。不一致は、シリーズ1に記載したものと同じ要因によるものであり得る。
V.3気圧の空気中のイソプレンの引火限界の計算
3気圧の絶対系圧および40℃におけるイソプレンの引火限界を計算するために、実施例13の第I部から第IV部に記載された方法も用いた。これらの結果を、1気圧の絶対系圧および40℃における実施例13の第I部から第IV部の結果と比較した。初期の系圧が増加するにつれて引火限度が拡大するかまたは大きくなるので、このより高い圧力を試験した。引火上限が最も影響を受け、制限酸素組成物がそれに続く。引火下限は最も影響を受けなかった(例えば、“Bulletin 627−Flammability Characteristics of Combustible Gases and Vapors” written by Michael G.Zabetakis and published by the former US Bureau of Mines(1965)を参照されたく、これは、特に、引火限界の計算に関して、その全体が参照により本明細書に組み込まれる)。
図82では、計算断熱火炎温度が、総燃料/窒素/酸素の重量パーセントで表されるイソプレン(燃料)濃度の関数としてプロットされており、ここで、系圧は最初は3気圧であった。計算火炎温度は、1気圧の系で最初に決定されたものと非常によく似ている(図83)。結果として、計算断熱引火性データを用いて引火限度が生成される場合は、曲線が非常によく似ている(図84および85を参照)。それゆえ、これらの理論的計算に基づくと、1気圧から3気圧への系圧増加は、引火限度の著しい増加/拡大をもたらさない。所望により、これらのモデル結果の妥当性を、実験的試験(例えば、1気圧の圧力における本明細書に記載の実験的試験)を用いて確認してもよい。
VII.引火性研究のまとめ
計算断熱温度モデルを、40℃および0psigにおけるイソプレン/酸素/窒素/水/二酸化炭素の系の引火限度のために開発した。開発されたCAFTモデルは、この研究で実施された試験によって生成された実験データとよく一致した。シリーズ1および2の実験結果により、シリーズAおよびBのモデル結果の妥当性が確認された。
実施例14:発現コンストラクトおよび株
I.メバロン酸キナーゼをコードするプラスミドの構築
メタノサルキナ・マゼイの下流MVA経路(アクセッション番号NC_003901.1、NC_003901.1、NC_003901.1、およびNC_003901.1、これらは各々、その全体が参照により本明細書に組み込まれる)をコードするコンストラクトを、大腸菌での発現のためにコドンを最適化して合成した。このコンストラクトは、M.マゼイ古細菌下流経路オペロンと名付けられ(図112A〜112C;配列番号27)、M.マゼイのMVK酵素(デカルボキシラーゼと推定される)、IPK酵素、およびIDI酵素をコードしている。MVK(アクセッション番号NC_003901.1)をコードする遺伝子を、アニーリング温度55℃および伸長時間60秒の30サイクルを用いて、製造元のプロトコルに従ってStrategene Herculase II Fusionキットを用いて、プライマーのMCM165およびMCM177(表13)を用いてPCR増幅した。このアンプリコンをQiagen PCRカラムを用いて精製した後、PmeIを含む10μLの反応液(NEB緩衝液4とBSAの存在下)中37℃で消化した。1時間後、NsiIとRocheの緩衝液Hとを37℃でさらに1時間添加した。消化されたDNAをQiagen PCRカラムで精製し、同じように消化され、精製されたプラスミドMCM29(MCM29は、クズイソプレンシンターゼをコードするpTrcKudzuで形質転換した大腸菌TOP10(Invitrogen)である)に、11μLの反応液(5μLのRoche Quickリガーゼ緩衝液1、1μLの緩衝液2、1μLのプラスミド、3μLのアンプリコン、および1μLのリガーゼ)中で連結した(室温で1時間)。MCM29はpTrcKudzu Kanである。ライゲーション反応液をInvitrogen TOP10細胞に導入し、形質転換体を37℃で一晩インキュベートしたLA/kan50プレート上で選択した。得られたプラスミドMCM382中のMVK挿入物をシークエンシングした(図113A〜113C;配列番号28)。
オリゴヌクレオチド
II.メバロン酸キナーゼとイソプレンシンターゼを過剰発現する株の作製
プラスミドMCM382を、LB培地中で対数増殖期中期(midlog)まで増殖させ、氷冷滅菌水で3回洗浄しておいたMCM331細胞(出芽酵母メバロン酸キナーゼ、メバロン酸リン酸キナーゼ、メバロン酸ピロリン酸デカルボキシラーゼ、およびIPPイソメラーゼをコードする染色体コンストラクトgi1.2KKDyIを含有する)に形質転換した。1μLのDNAを50μLの細胞懸濁液に添加し、この混合物を2mmキュベット中、2.5volt、25μFdでエレクトロポレートし、その後すぐに、500μLのLB培地中、37℃で1時間回復させた。形質転換体をLA/kan50上で選択し、MCM391と名付けた。プラスミドMCM82を同じエレクトロポレーションプロトコルでこの株に導入し、その後、LA/kan50/spec50上で選択した。得られた株MCM401は、cmpをマーカーとする染色体コンストラクトgi1.2KKDyIと、kanをマーカーとするプラスミドMCM382と、specをマーカーとするプラスミドMCM82(これは、E.フェカーリスのmvaEおよびmvaSをコードするpCL PtrcUpperPathwayである)とを含有している。表14を参照されたい。
メバロン酸キナーゼとイソプレンシンターゼを過剰発現する株
III.プラスミドMCM376の構築−M.マゼイ古細菌下流由来のMVKを含むpET200D
M.マゼイ古細菌下流経路オペロン由来のMVK ORF(図112A〜112C;配列番号27)を、Invitrogen Platinum HiFi PCRミックスを用いて、プライマーのMCM161およびMCM162(表13)を用いてPCR増幅した。45μLのPCRミックスを、1μLの鋳型、1μLの10μMの各プライマー、および2μLの水と合わせた。反応を以下のようなサイクルで繰り返した:94℃、2分;94℃、30秒、55℃、30秒、および68℃、1分15秒を30サイクル;その後、72℃、7分、冷えるまで4℃。3μLのこのPCR反応液を、製造元のプロトコルに従ってInvitrogen pET200Dプラスミドに連結した。3μLのこのライゲーション液をInvitrogen TOP10細胞に導入し、形質転換体をLA/kan50上で選択した。形質転換体からのプラスミドを単離し、挿入物をシークエンシングし、MCM376が得られた(図114A〜114C;配列番号29)。
V.発現株MCM378の作製
プラスミドMCM376を、製造元のプロトコルに従ってInvitrogen BL21(DE3)pLysS細胞に形質転換した。形質転換体MCM378をLA/kan50上で選択した。
実施例15:上流メバロン酸(MVA)経路と、組み込まれた下流MVA経路(gi1.2KKDyI)と、M.マゼイ由来のメバロン酸キナーゼと、クズ由来のイソプレンシンターゼとを発現し、20mLバッチスケールでフェドバッチ培養された大腸菌によるイソプレンの産出
培地レシピ(発酵培地1リットル当たり):
各々1リットルの発酵培地には、K2HPO4 13.6g、KH2PO4 13.6g、MgSO4 *7H2O 2g、クエン酸一水和物2g、クエン酸第二鉄アンモニウム0.3g、(NH4)2SO4 3.2g、酵母抽出物1g、および1000×微量金属溶液1mlが含まれていた。全ての成分を一緒に添加し、diH2Oに溶解させた。水酸化アンモニウム(30%)を用いてpHを6.8に調整し、全量とした。培地を0.22ミクロンフィルターで濾過滅菌した。グルコース(2.5g)と抗生物質を、滅菌およびpH調整の後に添加した。
1000×微量金属溶液:
1000×微量金属溶液には、クエン酸*H2O 40g、MnSO4 *H2O 30g、NaCl 10g、FeSO4 *7H2O 1g、CoCl2 *6H2O 1g、ZnSO4 *7H2O 1g、CuSO4 *5H2O 100mg、H3BO3 100mg、およびNaMoO4 *2H2O 100mgが含まれていた。各成分を一度にdiH2Oに溶解させ、HCl/NaOHでpHを3.0にした後、全量とし、0.22ミクロンフィルターで濾過滅菌した。
株:
MCM343細胞は、上流メバロン酸(MVA)経路(pCL Upper)と、組み込まれた下流MVA経路(gi1.2KKDyI)と、クズ由来のイソプレンシンターゼ(pTrcKudzu)とを含有するBL21(DE3)大腸菌細胞である。
MCM401細胞は、上流メバロン酸(MVA)経路(pCL PtrcUpperPathway)と、組み込まれた下流MVA経路(gi1.2KKDyI)と、高発現のM.マゼイ由来のメバロン酸キナーゼおよびクズ由来のイソプレンシンターゼ(pTrcKudzuMVK(M.mazei))とを含有するBL21(DE3)大腸菌細胞である。
20mLワーキング容量を含む100mLバイオリアクター中、30℃で、これらの株を増殖させることにより、イソプレン産出を分析した。凍結バイアルから採取した大腸菌株の種菌をLBブロス寒天プレート(抗生物質を含む)上にストリークし、30℃でインキュベートした。単一コロニーを培地に植菌し、一晩増殖させた。細菌を20mLの培地中に希釈し、550nmで測定して0.05の光学密度に達した。100mLバイオリアクターを密封し、8mL/分の速度で空気をポンプで送り出した。磁気撹拌子を用いて600rpmで撹拌することにより、培地を十分に撹拌した。オンライン式のHiden HPR−20質量分析計を用いて、バイオリアクターからのオフガスを分析した。イソプレン、CO2、および空気中に天然に存在する他のガスに対応する質量をモニタリングした。それぞれのガスの経時的な濃度(パーセント単位)を合計することにより、蓄積したイソプレンおよびCO2産出を計算した。代謝活性により放出されたCO2を推定するために、大気のCO2を全体から差し引いた。
完全なメバロン酸経路とクズイソプレンシンターゼとを発現する株(MCM343)からのイソプレン産出を、M.マゼイ由来のMVKとクズイソプレンシンターゼとをさらに過剰発現する株(MCM401)と、100mLバイオリアクターにおいて比較した。グルコースを炭素源として用いる規定培地中、同一条件下で、細菌を増殖させた。イソプロピル−β−D−1−チオガラクトピラノシド(IPTG)を100μMまたは200μMのいずれかの最終濃度で添加することにより、イソプレン産出の誘導を達成した。図115A〜115Dに示すように、オフガス測定から、MVKとイソプレンシンターゼの両方をを過剰発現する株(MCM401)は、メバロン酸経路とクズイソプレンシンターゼのみを発現する株(MCM343)と比べて有意に多いイソプレンを産出することが明らかになった。100μMによる誘導では、MCM401株は、MCM343株と比べて2倍多いイソプレンを産出した。200μMのIPTGによる誘導では、MCM401株は、MCM343株と比べて3.4倍多いイソプレンを産出した。代謝活性の尺度となる、バイオリアクターからのオフガス中のCO2の分析により、代謝活性がIPTG誘導やイソプレン産出とは無関係であったことが示される。
実施例16:上流メバロン酸(MVA)経路と、組み込まれた下流MVA経路(gi1.2KKDyI)と、M.マゼイ由来のメバロン酸キナーゼと、クズ由来のイソプレンシンターゼとを発現し、15Lスケールのフェドバッチ培養で増殖させた大腸菌によるイソプレンの産出
培地レシピ(発酵培地1リットル当たり):
各々1リットルの発酵培地には、K2HPO4 7.5g、MgSO4 *7H2O 2g、クエン酸一水和物2g、クエン酸第二鉄アンモニウム0.3g、酵母抽出物0.5g、および1000×改変微量金属溶液1mlが含まれていた。全ての成分を一緒に添加し、DIH2Oに溶解させた。この溶液をオートクレーブした水酸化アンモニウム(30%)でpHを7.0に調整し、適量を加えて全量とした。グルコース10g、チアミン*HCl 0.1g、および抗生物質を、滅菌およびpH調整の後に添加した。
1000×改変微量金属溶液:
1000×改変微量金属溶液には、クエン酸*H2O 40g、MnSO4 *H2O 30g、NaCl 10g、FeSO4 *7H2O 1g、CoCl2 *6H2O 1g、ZnSO4 *7H2O 1g、CuSO4 *5H2O 100mg、H3BO3 100mg、およびNaMoO4 *2H2O 100mgが含まれていた。各成分を一度にDIH2Oに溶解させ、HCl/NaOHでpHを3.0にし、次に、適量を加えて全量とし、0.22ミクロンフィルターで濾過滅菌した。
上流メバロン酸(MVA)経路(E.フェカーリスのmvaEおよびmvaSをコードするpCL PtrcUpperPathway)と、組み込まれた下流MVA経路(出芽酵母メバロン酸キナーゼ、メバロン酸リン酸キナーゼ、メバロン酸ピロリン酸デカルボキシラーゼ、およびIPPイソメラーゼをコードするgi1.2KKDyI)と、高発現のM.マゼイ由来のメバロン酸キナーゼおよびクズ由来のイソプレンシンターゼ(pTrcKudzuMVK(M.mazei))とを含有するBL21(DE3)大腸菌細胞を含む15Lバイオリアクター中で発酵を行なった。この実験は、所望の発酵(pH7.0および温度30℃)におけるグルコースからのイソプレン形成をモニタリングするために行なわれた。凍結バイアルから採取した大腸菌株の種菌をLBブロス寒天プレート(抗生物質を含む)上にストリークし、37℃でインキュベートした。単一コロニーをトリプトン−酵母抽出物培地中に植菌した。550nmで測定して、種菌がOD1.0にまで増殖した後、500mLを用いて、15Lバイオリアクター中の5Lの培地に植菌した。
細胞が定常期に達するまで、グルコースを指数関数的割合で供給した。定常期以降、代謝要求量を満足させるようにグルコース供給を減らした。68時間の発酵の間にバイオリアクターに送達されたグルコースの総量は、3.8kgであった。イソプロピル−β−D−1−チオガラクトピラノシド(IPTG)を添加して、誘導を達成した。550nmでの光学密度が(OD550)が9という値に達したとき、IPTG濃度を51μMにした。OD550が149に達したとき、IPTG濃度を88μMに上昇させた。OD550=195で119μMまで、OD550=210で152μMまで、IPTGをさらに添加して濃度を上昇させた。バイオリアクター内の経時的なOD550プロファイルを図116に示す。バイオリアクターからのオフガス中のイソプレンレベルをHiden質量分析計を用いて測定した。イソプレン力価は発酵の間に最終値23.8g/Lまで増加した(図117)。68時間の発酵の間に産出されるイソプレンの総量は227.2gであった。産出の時間経過を図118に示す。TCERで測定したときの代謝活性プロファイルを図119に示す。総生菌数(総コロニー形成単位)は、発酵10時間から39時間で2桁減少した(図120)。発酵の時にイソプレン産出に回った利用炭素のモル収率は13.0%であった。グルコースからのイソプレンの重量パーセント収率は6.3%であった。
実施例17:上流メバロン酸(MVA)経路と、組み込まれた下流MVA経路(gi1.2KKDyI)と、M.マゼイ由来のメバロン酸キナーゼと、クズ由来のイソプレンシンターゼとを発現し、15Lスケールのフェドバッチ培養で増殖させた大腸菌によるイソプレンの産出(2×100μMのIPTGによる誘導)
培地レシピ(発酵培地1リットル当たり):
各々1リットルの発酵培地には、K2HPO4 7.5g、MgSO4 *7H2O 2g、クエン酸一水和物2g、クエン酸第二鉄アンモニウム0.3g、酵母抽出物0.5g、および1000×改変微量金属溶液1mlが含まれていた。全ての成分を一緒に添加し、DIH2Oに溶解させた。この溶液をオートクレーブした水酸化アンモニウム(30%)でpHを7.0に調整し、適量を加えて全量とした。グルコース10g、チアミン*HCl 0.1g、および抗生物質を、滅菌およびpH調整の後に添加した。
1000×改変微量金属溶液:
1000×改変微量金属溶液には、クエン酸*H2O 40g、MnSO4 *H2O 30g、NaCl 10g、FeSO4 *7H2O 1g、CoCl2 *6H2O 1g、ZnSO4 *7H2O 1g、CuSO4 *5H2O 100mg, H3BO3 100mg、およびNaMoO4 *2H2O 100mgが含まれていた。各成分を一度にDIH2Oに溶解させ、HCl/NaOHでpHを3.0にし、次に、適量を加えて全量とし、0.22ミクロンフィルターで濾過滅菌した。
上流メバロン酸(MVA)経路(E.フェカーリスのmvaEおよびmvaSをコードするpCL PtrcUpperPathway)と、組み込まれた下流MVA経路(出芽酵母メバロン酸キナーゼ、メバロン酸リン酸キナーゼ、メバロン酸ピロリン酸デカルボキシラーゼ、およびIPPイソメラーゼをコードするgi1.2KKDyI)と、高発現のM.マゼイ由来のメバロン酸キナーゼおよびクズ由来のイソプレンシンターゼ(pTrcKudzuMVK(M.mazei))とを含有するBL21(DE3)大腸菌細胞を含む15Lバイオリアクター中で発酵を行なった。この実験は、所望の発酵(pH7.0および温度30℃)におけるグルコースからのイソプレン形成をモニタリングするために行なわれた。凍結バイアルから採取した大腸菌株の種菌をLBブロス寒天プレート(抗生物質を含む)上にストリークし、37℃でインキュベートした。単一コロニーをトリプトン−酵母抽出物培地中に植菌した。550nmで測定して、種菌がOD1.0にまで増殖した後、500mLを用いて、15Lバイオリアクター中の5Lの培地に植菌した。
細胞が定常期に達するまで、グルコースを指数関数的割合で供給した。定常期以降、代謝要求量を満足させるようにグルコース供給を減らした。55時間の発酵の間にバイオリアクターに送達されたグルコースの総量は、1.9kgであった。イソプロピル−β−D−1−チオガラクトピラノシド(IPTG)を添加して、誘導を達成した。550nmでの光学密度が(OD550)が9という値に達したとき、IPTG濃度を111μMにした。OD550が155に達したとき、IPTG濃度を193μMに上昇させた。バイオリアクター内の経時的なOD550プロファイルを図121に示す。バイオリアクターからのオフガス中のイソプレンレベルをHiden質量分析計を用いて測定した。イソプレン力価は発酵の間に最終値19.5g/Lまで増加した(図122)。55時間の発酵の間に産出されるイソプレンの総量は133.8gであった。産出の時間経過を図123に示す。瞬間的容積生産性レベルは、1.5gイソプレン/Lブロス/時間と同じくらい高い値に達した(図124)。瞬間的収率レベルは、17.7%w/wにも達した(図125)。TCERで測定したときの代謝活性プロファイルを図126に示す。総生菌数(総コロニー形成単位)は、発酵8時間から36時間で2桁減少した(図127)。発酵の時にイソプレン産出に回った利用炭素のモル収率は15.8%であった。発酵全体を通じたグルコースからのイソプレンの重量パーセント収率は7.4%であった。
さらに、対照として、上流メバロン酸(MVA)経路(E.フェカーリスのmvaEおよびmvaSをコードするpCL PtrcUpperPathway)と、組み込まれた下流MVA経路(出芽酵母メバロン酸キナーゼ、メバロン酸リン酸キナーゼ、メバロン酸ピロリン酸デカルボキシラーゼ、およびIPPイソメラーゼをコードするgi1.2KKDyI)と、高発現のM.マゼイ由来のメバロン酸キナーゼおよびクズ由来のイソプレンシンターゼ(pTrcKudzuMVK(M.mazei))とを含有するBL21(DE3)大腸菌細胞を含む15Lバイオリアクター中で発酵を行なった。この実験は、所望の発酵(pH7.0および温度30℃)におけるグルコースからのCERフォーマットで測定した場合の誘導されていない細胞代謝活性をモニタリングするために行なわれた。凍結バイアルから採取した大腸菌株(上記のMCM401)の種菌をLBブロス寒天プレート(抗生物質を含む)上にストリークし、37℃でインキュベートした。単一コロニーをトリプトン−酵母抽出物培地中に植菌した。550nmで測定して、種菌がOD1.0にまで増殖した後、500mLを用いて、15Lバイオリアクター中の5Lの培地に植菌した。細胞が定常期に達するまで、グルコースを指数関数的割合で供給した。定常期以降、代謝要求量を満足させるようにグルコース供給を減らした。
図148は、上記の誘導されていない細胞と実施例16および17に見られるイソプロピル−β−D−1−チオガラクトピラノシド(IPTG)を添加して誘導された細胞のCERプロファイルを比較したものである。
実施例18:上流メバロン酸(MVA)経路と、組み込まれた下流MVA経路(gi1.2KKDyI)と、M.マゼイ由来のメバロン酸キナーゼと、クズ由来のイソプレンシンターゼとを発現し、15Lスケールのフェドバッチ培養で増殖させた大腸菌によるイソプレンの産出(1×50μMのIPTG+150μMの供給IPTGによる誘導)
培地レシピ(発酵培地1リットル当たり):
各々1リットルの発酵培地には、以下が含まれていた。K2HPO4 7.5g、MgSO4 *7H2O 2g、クエン酸一水和物2g、クエン酸第二鉄アンモニウム0.3g、酵母抽出物0.5g、および1000×改変微量金属溶液1ml。全ての成分を一緒に添加し、diH2Oに溶解させた。この溶液をオートクレーブした水酸化アンモニウム(30%)でpHを7.0に調整し、適量を加えて全量とした。グルコース10g、チアミン*HCl 0.1g、および抗生物質を、滅菌およびpH調整の後に添加した。
1000×改変微量金属溶液:
1000×改変微量金属溶液には、クエン酸*H2O 40g、MnSO4 *H2O 30g、NaCl 10g、FeSO4 *7H2O 1g、CoCl2 *6H2O 1g、ZnSO4 *7H2O 1g、CuSO4 *5H2O 100mg、H3BO3 100mg、およびNaMoO4 *2H2O 100mgが含まれていた。各成分を一度にDIH2Oに溶解させ、HCl/NaOHでpHを3.0にし、次に、適量を加えて全量とし、0.22ミクロンフィルターで濾過滅菌した。
上流メバロン酸(MVA)経路(E.フェカーリスのmvaEおよびmvaSをコードするpCL PtrcUpperPathway)と、組み込まれた下流MVA経路(出芽酵母メバロン酸キナーゼ、メバロン酸リン酸キナーゼ、メバロン酸ピロリン酸デカルボキシラーゼ、およびIPPイソメラーゼをコードするgi1.2KKDyI)と、高発現のM.マゼイ由来のメバロン酸キナーゼおよびクズ由来のイソプレンシンターゼ(pTrcKudzuMVK(M.mazei))とを含有するBL21(DE3)大腸菌細胞を含む15Lバイオリアクター中で発酵を行なった。この実験は、所望の発酵(pH7.0および温度30℃)におけるグルコースからのイソプレン形成をモニタリングするために行なわれた。凍結バイアルから採取した大腸菌株の種菌をLBブロス寒天プレート(抗生物質を含む)上にストリークし、37℃でインキュベートした。単一コロニーをトリプトン−酵母抽出物培地中に植菌した。550nmで測定して、種菌がOD1.0にまで増殖した後、500mLを用いて、15Lバイオリアクター中の5Lの培地に植菌した。
細胞が定常期に達するまで、グルコースを指数関数的割合で供給した。定常期以降、代謝要求量を満足させるようにグルコース供給を減らした。55時間の発酵の間にバイオリアクターに送達されたグルコースの総量は、2.2kgであった。イソプロピル−β−D−1−チオガラクトピラノシド(IPTG)を添加して、誘導を達成した。550nmでの光学密度が(OD550)が10という値に達したとき、IPTG濃度を51μMにした。OD550=10でIPTGを添加したのに加えて、定期的な供給を開始し、18時間かけて164mgのIPTGを供給した。バイオリアクター内の経時的なOD550プロファイルを図128に示す。バイオリアクターからのオフガス中のイソプレンレベルをHiden質量分析計を用いて測定した。イソプレン力価は発酵の間に最終値22.0g/Lまで増加した(図129)。55時間の発酵の間に産出されるイソプレンの総量は170.5gであった。産出の時間経過を図130に示す。TCERで測定したときの代謝活性プロファイルを図131に示す。バイオリアクターへの空気流量が約1.7時間の間に8slpmから4slpmへと減少したとき、オフガス中のイソプレンの濃度は、0.51w/w%から0.92w/w%へと増加した(図132)。これらのイソプレンレベルの上昇は、総二酸化炭素発生速度(TCER)で測定したとき、37.2時間から39.3時間の間にわずか7%しか低下しなかったので、細胞代謝活性に負の影響を及ぼすようには見えなかった(図132)。総生菌数(総コロニー形成単位)は、発酵7時間から36時間で2桁減少した(図133)。発酵の時にイソプレン産出に回った利用炭素のモル収率は16.6%であった。発酵全体を通じたグルコースからのイソプレンの重量パーセント収率は7.7%であった。
実施例19:1Lスケールの野生型フェドバッチ培養で増殖した大腸菌に対する外部適用したイソプレンの影響
培地レシピ(発酵培地1リットル当たり):
各々1リットルの発酵培地には、以下のものが含まれていた。K2HPO4 7.5g、MgSO4 *7H2O 2g、クエン酸一水和物2g、クエン酸第二鉄アンモニウム0.3g、酵母抽出物0.5g、および1000×改変微量金属溶液1ml。全ての成分を一緒に添加し、diH2Oに溶解させた。この溶液をオートクレーブした水酸化アンモニウム(30%)でpHを7.0に調整し、適量を加えて全量とした。グルコース10g、チアミン*HCl 0.1g、および抗生物質を、滅菌およびpH調整の後に添加した。
1000×改変微量金属溶液:
1000×改変微量金属溶液には、クエン酸*H2O 40g、MnSO4 *H2O 30g、NaCl 10g、FeSO4 *7H2O 1g、CoCl2 *6H2O 1g、ZnSO4 *7H2O 1g、CuSO4 *5H2O 100mg、H3BO3 100mg、およびNaMoO4 *2H2O 100mgが含まれていた。各成分を一度にDIH2Oに溶解させ、HCl/NaOHでpHを3.0にし、次に、適量を加えて全量とし、0.22ミクロンフィルターで濾過滅菌した。
BL21(DE3)大腸菌細胞を含む1Lバイオリアクター中で発酵を行なった。この実験は、所望の発酵(pH7.0および温度30℃)におけるグルコースフェドバッチバイオリアクター内の細胞生存性および代謝活性に対するイソプレンの影響をモニタリングするために行なわれた。凍結バイアルからの大腸菌株の種菌をトリプトン−酵母抽出物培地に植菌した。550nmで測定して、種菌がOD1.0にまで増殖した後、50mを用いて、1Lバイオリアクター中の0.5Lの培地に植菌した。
細胞が定常期に達するまで、グルコースを指数関数的割合で供給した。定常期以降、代謝要求量を満足させるようにグルコース供給を供給した。窒素をキャリアとして用いて、イソプレンをバイオリアクターに供給した。イソプレン供給速度は、中間の増殖期(OD550=31〜44)は1g/L/時間であり、計75分(13.2〜14.4時間)持続した。バイオリアクター内の経時的なOD550プロファイルを図134に示す。TCERで測定したときの代謝活性プロファイルを図135に示す。総生菌数(総コロニー形成単位)は、イソプレンがバイオリアクターに導入されている間に14倍増加した(図136)。
実施例20:出芽酵母によるイソプレンの産出とイソプレンシンターゼの発現
クズイソプレンシンターゼ酵素を、交配種の出芽酵母/ピキア・パストリスのコドン使用表に従って発現のため最適し、合成し、pDONR221:19430(DNA2.0製、マップについては図140、配列については図141(配列番号38))にクローニングした。製造元のプロトコルに従って、Gateway(登録商標)クローニング(Invitrogen)反応を行なった。pDONR221:19430は「エントリー」ベクターであるので、LRクロナーゼII酵素(LR反応)を用いて、コドン最適化イソプレンシンターゼを「デスティネーション」ベクターpYES−DEST52(Invitrogen)に導入した。
次に、LR反応液を製造元のプロトコルに従ってTop10化学的コンピテントセル(Invitrogen)に形質転換し、イソプレンシンターゼORFを含むpYES−DEST52プラスミドを有する細菌を50μg/mlカルベニシリンを含有するLAプレート上で選択した。個々の陽性形質転換体を、illustra PuReTaq Ready−To−Go(商標)PCRビーズ(GE Healthcare)をT7フォワードプライマーおよび酵母イソプレンシンターゼ−Rev2プライマー(表15参照)とともに用いるコロニーPCRで試験した(プライマー濃度およびサーモサイクリングパラメータについては下記参照)。
イソプレンシンターゼを増幅するためのプライマー配列
正しいサイズ(1354bp)のPCR断片を生じさせたプラスミドをミニプレップ(Qiagen)で精製し、T7フォワードプライマーおよび酵母イソプレンシンターゼ−For2プライマー(表15参照)を用いるシークエンシング(Quintara Biosciences,Berkeley,CA)に回した。シークエンシング実施から得た結果を、(Vector NTIソフトウェア、Invitrogenを使用して)既知のpDONR221:19430配列と比較し、単一のプラスミド、pDW14をさらなる研究用に選択した(マップについては図142A、完全な配列については図142BおよびC(配列番号39))。pDW14の配列は、1ヌクレオチド(図142B中、太字で目印が付けられている)だけ、pDONR221:19430の配列と違っていた。リジンをコードするコドンの3番目の位置にあったので、1ヌクレオチドの変化(GからA)によりORFに変化は生じなかった。この塩基変化がLRクローニング反応で導入されたのか、またはDNA2.0により合成されたもとの配列中のエラーであったのかは不明である。シークエンシングされたプラスミドは全て、この塩基変化を含有していた。
精製したpDW14をS.c.EasyComp形質転換キット(Invitrogen)に記載されたプロトコルに従って、出芽酵母株INVSc−1に形質転換した。pDW14または(インタクトのURA3遺伝子を含有する)pYES−DEST52を有するINVSc−1株を、pYES−DEST52 Gatewayベクターマニュアル(Invitrogen)に記載されているように選択し、SC最小培地(2%グルコース含有、ウラシル非含有)上で維持した。pDW14を含有するINVSc−12つの独立した単離株とpYES−DEST52を含む1つの対照株をさらなる解析用に選んだ。
イソプレンシンターゼ発現を誘導するために、培養物を液体SC最小培地中で一晩増殖させた。次に、この培養物をOD600が約0.2になるまで希釈し、2〜3時間増殖させた。培養物を遠心分離でスピンし、1回洗浄し、等量(10ml)のSC最小培地(1%ラフィノース含有、2%ガラクトース含有、ウラシル非含有)に再懸濁し、一晩増殖させて、イソプレンシンターゼの発現を誘導した。この株のOD600を測定し(図144A)、株を遠心分離で回収し、2mlの溶解緩衝液(50%グリセロールとPEB pH7.4:Trisベース2.423g/L、MgCl2(無水物) 1.904g/L、KCl 14.910g/L、DTT 0.154g/L、グリセロール50mL/Lの1:1混合液)に再懸濁した。
溶解混合物をフレンチプレスに3回通し、ライセートをSDS−PAGEで解析した。クマシーゲル解析(図143A)のために、サンプルを、還元剤を含む2×SDSローディング緩衝液で1:1に希釈し、4−12%ビス−trisゲルに充填し(20μl総容量)、MES緩衝液中で泳動し、製造元のプロトコルに従って、SimplyBlue SafeStain(Invitrogen Novex system)を用いて染色した。
ニトロセルロース膜へのイソプレンシンターゼの転写およびニトロセルロース膜上での発色による検出には、WesternBreezeキット(Invitrogen)を用いた。1次抗体は、Invitrogen抗体希釈液中で1:1000倍に薄く希釈した1799A 10であった。1次抗体の結合後、Alexa Fluor 488標識2次抗体(Invitrogenカタログ番号A−11008)を用いて発色させて、定量的なシグナル測定を可能にした。ウェスタンブロット手順は、Invitrogenに記載の通りに行なった。蛍光シグナルを青のフィルターセッティングを用いてMolecular Dynamics Storm装置で記録し、Molecular Dynamics ImageQuant画像解析ソフトウェアパッケージで定量的に解析した。誘導培養物のA600か、またはウェスタンブロットで測定されたイソプレンシンターゼタンパク質濃度のいずれかで割った産出されたイソプレンの量の比からライブラリーメンバーの比活性を算出した。図143Bは、イソプレンシンターゼが、pYES−DEST52(レーン1)を有する対照と比較してpDW14を有する誘導されたINVSc−1株(レーン2および3)中に存在したことを示す。
各々の株から得た25μLのライセート(5μLの1M MgCl2、5μLの100mM DMAPP、および65μLの50mM Tris(pH8)を添加した)に対して、イソプレンシンターゼヘッドスペースのDMAPPアッセイを行なった。ガスタイト1.8mL GCチューブ中、30℃で15分間、反応を行なった。100μLの250mM EDTA(pH8)を添加して、反応を停止させた。図144Bには、対照と比較してpDW14を有する誘導された株の比活性値(μg HG/L/OD単位)を示した。pDW14を有する誘導された株は、イソプレンシンターゼを欠く対照よりも約20倍高い活性を示した。
PCRサイクリングパラメータ
Illustra PuReTaq Ready−To−Go(商標)PCRビーズ(GE Healthcare)を、各々25μlの総容量/反応で、濃度0.4μMのオリゴヌクレオチドプライマー対とともに用いた。LRクロナーゼ反応(Invitrogen)から得られるプラスミドを解析するために、選択プレート上の個々のコロニー由来の少量の細菌を、上記のPCRミックスを含有する各チューブに添加した。反応サイクルは、次の通りであった。1)95℃、4分;2)95℃、20秒;3)52℃、20秒;4)72℃、30秒;ステップ2から4までを5サイクル;5)95℃、20秒;6)55℃、20秒;7)72℃、30秒;ステップ5から7までを25サイクル、72℃、10分、および冷えるまで4℃。
実施例21:シュードモナスおよび他のグラム陰性細菌におけるイソプレンの産出
pBBR5HGSOpt2_2の構築、シュードモナスにおける接合およびイソプレンシンターゼ活性の測定
クズ(クズ植物)由来のイソプレンシンターゼをコードする遺伝子を目的の様々な微生物種用にコドン最適化され(表16;fluo−opt2v2は選ばれた配列であった)、DNA2.0,Menlo Park,CAにより合成されたものであった。fluo−opt2v2のマップと配列を、図145Aと145B(配列番号40)に見出すことができる。クローニングしやすくするために、HindIII制限部位とBamHI制限部位を合成された配列に付加し、転写を増強するためにRBSをATGの前に付加した。
様々なバージョンのコドン最適化されたクズ由来イソプレンシンターゼにおける、微生物種の関数としての、レアコドンの数。数回の最適化によって、目的の全ての種においてレアコドンのない遺伝子が生じた。
レアコドンの数
遺伝子は、DNA2.0によりクローニングベクター中に提供された。ベクターをHindIII/BamHIで消化し、目的の挿入物に対応するバンドをゲル精製し、HindIII/BamHIで消化されたpBBR1MCS5(Kovach et al,Gene 166:175−176,1995、これは、特に、pBBR1MCS5に関して、その全体が参照により本明細書に組み込まれる。マップについては図146A、配列については図146BおよびC(配列番号41))に再び連結した。これにより、プラスミドpBBR5HGSOpt2_2が得られ(マップについては図147A、配列については図147BおよびC(配列番号42))、このプラスミドにおいて、イソプレンシンターゼは、pBBR1MCS5に提供されているlacプロモーターから発現された。
ベクターを大腸菌S17−1に形質転換し、シュードモナス・プチダF1 ATCC700007およびシュードモナス・フルオレセンスATCC 13525と接合させた。LB上で接合させた後、プラスミドを保有するシュードモナス株の選択をM9+16mMクエン酸ナトリウム+ゲンタマイシン50μg/ml上で行なった。Qiagenキット(Valencia,CA)を用いてプラスミドを調製することにより、このように生成された株にプラスミドが存在することを調べた。
組換え株であるP.プチダ、pBBR5HGSOpt2_2およびP.フルオレセンス、pBBR5HGSOpt2_2のイソプレンシンターゼ活性をこれらの株を、TM3培地(実施例1、第II部に記載されたもの)+10g/Lグルコース中で増殖させ、対数増殖期中期のバイオマスを回収し、細胞をフレンチプレスで破壊し、DMAPPアッセイに進めることにより、アッセイした。アッセイの結果を表17に示した。DMAPPアッセイで測定された活性の存在から、イソプレンシンターゼがシュードモナスで発現されることを確認された。
イソプレンシンターゼ活性を、プラスミドpBBR5HGSOpt2_2を用いて、lacプロモーターからイソプレンシンターゼを発現するシュードモナス・プチダおよびシュードモナス・フルオレセンスで調べた。
シュードモナス・プチダおよびシュードモナス・フルオレセンスにおけるイソプレンシンターゼ活性
実施例22:グルコースと比べたサトウキビでの大腸菌株およびシュードモナス株の増殖、ならびに両方の基質を用いたイソプレンシンターゼの発現
I.液体サトウキビの調製
結晶化した原料サトウキビ糖を次のように水に溶解させた。750gのH2Oを250gの糖に添加した。この溶液を撹拌し、溶解するまで穏やかに加熱した。溶けない物質もあった。溶解した後に溶液の重量を1kgに調整して、蒸発した水を補った。溶液の容量を測定すると、940mLであった。したがって、溶液の濃度は265g/Lであった。製品ラベルには、原料サトウキビ15gで炭水化物14gと書かれていた。したがって、溶液の炭水化物濃度は248g/Lであった。乾燥固体を測定すると、24.03%であり、予想された250g/kgと大差なかった。溶液のpHは5.49であった。グルコース濃度は、グルコースオキシダーゼを用いる酵素/分光学アッセイを用いて測定した。グルコース濃度は17.4g/Lであった。
大部分の微生物はスクロースを利用しないが、グルコースとフルクトースを利用することができるので、この溶液を2つに分けた。一方の半分は、(未処理のサトウキビを)1回、30分間オートクレーブした。グルコース含有量が29.75g/Lにまで増加したとき、ある程度の転化が生じた(図149参照)。溶液のもう一方の半分は、リン酸を用いてpH4.0に調整し、次に、この溶液をオートクレーブして転化させた(転化サトウキビ)。図149に示すように、完全な転化を達成するのに30分間3サイクルで十分であった。両方の溶液を下記の増殖曲線に用いた。
II.グルコースと比べたサトウキビでの様々な大腸菌株およびシュードモナス株の増殖曲線
表18に示す各々の株の1つのコロニーを25ml TM3+10g/Lグルコースに植菌し、200rpm、30℃で一晩増殖させた。TM3は実施例7、第II節に記載されている。翌朝、各々の培養物1mlを用いて、25mLのTM3と10g/Lのグルコース、10g/Lの未処理のサトウキビ、または10g/L転化サトウキビ(上記のサトウキビ溶液)とを含有するフラスコに植菌した。このフラスコを30℃、200rpmでインキュベートし、サンプルを定期的に採取して、OD
600を測定した。図150および151は、増殖速度とバイオマス収率が、シュードモナス株と大腸菌株の両方について、グルコースと転化サトウキビで同程度であったことを示している。P.フルオレセンスは、あまり転化されていないサトウキビを利用することができるいくつかの兆候を示した。
本研究で用いた株
III.グルコースまたはサトウキビで増殖させた場合のイソプレンシンターゼを発現する大腸菌からのイソプレン産出の比較
実施例14、第II節に記載したような、完全なMVA経路と、M.マゼイ由来のメバロン酸キナーゼと、クズ由来のイソプレンシンターゼとを含有する大腸菌MCM401(BL21(DE3))をTM3+10g/Lグルコースまたは10g/L転化サトウキビ(シロップの炭水化物濃度に基づく)中で増殖させた。OD
600=0.2でTM3+10g/Lグルコースに終夜培養物からフラスコに植菌した。必要な場合、抗生物質を添加した。2時間後、大腸菌培養物を400μMのIPTGで誘導した。増殖して6時間後、実施例2Bに記載のDMAPPアッセイを用いて、イソプレン産出およびイソプレンシンターゼ活性を測定した。結果を表19に示す。これにより、転化サトウキビが1細胞ベースのイソプレンおよびイソプレンシンターゼ産出に関してグルコースと等価であることが明白に示されている。
実施例23:出芽酵母gi1.2KKDyIオペロンと、ウラジロハコヤナギイソプレンシンターゼと、M.マゼイメバロン酸キナーゼと、pCL Upper MVA(E.フェカーリスのmvaEおよびmvaS)と、ybhE(pgl)とを発現する大腸菌株の構築
(i)EWL201(BL21、Cm−GI1.2−KKDyI)株の構築
大腸菌BL21(Novagenブランド,EMD Biosciences,Inc.)は、MCM331 P1ライセート(Ausubel,et al.,Current Protocols in Molecular Biology.John Wiley and Sons,Inc.に記載の方法によって調製されたライセート)を形質導入された、レシピエント株であった。MCM331細胞は、出芽酵母メバロン酸キナーゼ、メバロン酸リン酸キナーゼ、メバロン酸ピロリン酸デカルボキシラーゼ、およびIPPイソメラーゼ(すなわち、出芽酵母由来のgi1.2−KKDyIオペロン)をコードする染色体コンストラクトgi1.2KKDyIを含有している。細胞をL寒天+20μg/μlクロラムフェニコール上に広げることにより、形質導入体を選択した。このプレートを30℃で一晩インキュベートした。形質導入体の解析から対照プレート上にはコロニーがないことが示された(復帰については、水+細胞対照プレート、ライセート汚染については水+P1ライセート対照プレート)。
4つの形質導入体を選び、これらを用いて5mL Lブロス+20μg/μlクロラムフェニコールに植菌した。これらの培養物を200rpmで振盪させながら30℃で一晩増殖させた。PCR解析用の各形質導入体のゲノムDNAプレップを作製するために、1.5mLの終夜細胞培養物を遠心分離した。細胞ペレットを400μlの再懸濁緩衝液(20mM Tris、1mM EDTA、50mM NaCl、pH7.5)で再懸濁し、DNアーゼを含まないRNアーゼ(Roche)を4μl添加した。チューブを37℃で30分間インキュベートした後、4μlの10%SDSおよび4μlの10mg/mlプロテイナーゼKストック溶液(Sigma−Aldrich)を添加した。チューブを37℃で1時間インキュベートした。細胞ライセートを2ml Phase Lock Light Gelチューブ(Eppendorf)に移し、各々200μlの飽和フェノールpH7.9(Ambion Inc.)とクロロフォルムを添加した。チューブをよく混合し、5分間微量遠心分離した。400μlクロロフォルムで2回目の抽出を行ない、水相を新しいエッペンドルフチューブに移した。1mlの100%エタノールを添加し、5分間遠心分離して、ゲノムDNAを沈殿させた。ゲノムDNAペレットを1mlの70%エタノールで洗浄した。エタノールを除去し、ゲノムDNAペレットを短時間風乾させておいた。ゲノムDNAペレットを200μlのTEに再懸濁した。
Pfu Ultra II DNAポリメラーゼ(Stratagene)と、鋳型としての200ng/μlのゲノムDNAとを用いて、製造元のプロトコルに従って、2つの異なるPCR反応チューブのセットを準備した。セット1の場合、プライマーのMCM130およびGB Cm−Rev(表20)を用いて、形質導入体がattTn7遺伝子座にうまく組み込まれることを保証した。セット1のPCRパラメータは、95℃で2分(最初のサイクルのみ)、95℃で25秒、55℃で25秒、72℃で25秒(ステップ2〜4を28サイクル繰り返す)、72℃で1分であった。セット2の場合、プライマーのMVD ForおよびMVD Rev(表20)を用いて、gi1.2−KKDyIオペロンが適切に組み込まれることを保証した。セット2のPCRパラメータは、95℃で2分(最初のサイクルのみ)、95℃で25秒、55℃で25秒、72℃で10秒(ステップ2〜4を28サイクル繰り返す)、72℃で1分であった。1.2%E−ゲル(Invitrogen Corp.)でのPCRアンプリコンの解析から、4つの形質導入体クローンの全てが正しいことが示された。1つを選んで、EWL201株と命名した。
(ii)EWL204(BL21、loopout−GI1.2−KKDyI)株の構築
Datsenko and Wanner(2000)(Datsenko et al.,Proc Natl.Acad.Sci USA 97:6640−6645,2000)に記載されているように、プラスミドpCP20を用いて、クロラムフェニコールマーカーをEWL201株からループアウトさせた。One−step inactivation of chromosomal genes in E.coli K−12 using PCR products.(Datsenko et al.,PNAS,97:6640−6645,2000)。EWL201細胞を対数増殖期中期までLブロス中で増殖させた後、氷冷滅菌水で3回洗浄した。細胞懸濁液のアリコート50μlを、1μlのpCP20と混合し、細胞懸濁混合物を、Gene Pulser Electroporator(Bio−Rad Inc.)を用いて、2mmキュベット(Invitrogen Corp.)中、2.5Volt、25μFdでエレクトロポレートした。1mlのLBをすぐに細胞に添加し、その後、金属のキャップの付いた14mlポリプロピレンチューブ(Sarstedt)に移した。30℃で1時間増殖させて、細胞を回復させておいた。形質転換体をL寒天+20μg/μlクロラムフェニコール+50μg/μlカルベニシリン上で選択し、30℃で一晩インキュベートした。翌日、対数増殖期初期まで単一クローンを10mlLブロス+50μg/μlカルベニシリン中、30℃で増殖させた。その後、増殖中の培養物の温度を2時間42℃に変えた。連続希釈物を作製した後、細胞をLAプレート(抗生物質選択なし)上に広げ、30℃で一晩インキュベートした。翌日、20個のコロニーを選び、L寒天(抗生物質なし)プレートおよびLA+20μg/μlクロラムフェニコールプレート上に当てた。その後、プレートを30℃で一晩インキュベートした。細胞はLAプレート上では増殖することができたが、LA+20μg/μlクロラムフェニコール上では増殖することができず、クロラムフェニコールマーカーがループアウトしたとみなされた(1つ選んで、EWL204株と命名した)。
(iii)プラスミドpEWL230(pTrc P.alba)の構築
大腸菌発現用のコドン最適化方法に基づくウラジロハコヤナギイソプレンシンターゼ(ウラジロハコヤナギHGS)をコードする合成遺伝子の作製を、DNA2.0 Inc.(Menlo Park,CA)に外注した。合成遺伝子は、プラスミドpET24a(Novagenブランド,EMD Biosciences,Inc.)にカスタムクローニングされ、凍結乾燥品として配送された(図152、153A〜B;配列番号43)。
鋳型としてのpET24 P.alba HGSと、プライマーのMCM182およびMCM192と、Herculase II Fusion DNAポリメラーゼ(Stratagene)を製造元のプロトコルに従って用いて、PCR反応を行なって、ウラジロハコヤナギイソプレンシンターゼ(ウラジロハコヤナギHGS)遺伝子を増幅した。PCR条件は次の通りであった。95℃で2分(最初のサイクルのみ)、25サイクルの95℃で25秒、55℃で20秒、72℃で1分の繰返し、72℃で3分の最後の伸長。ウラジロハコヤナギイソプレンシンターゼのPCR産物をQIAquick PCR精製キット(Qiagen Inc.)を用いて精製した。
次に、ウラジロハコヤナギイソプレンシンターゼのPCR産物を、1μlのBspHIエンドヌクレアーゼ(New England Biolabs)と2μlの10×NEB緩衝液4を含有する20μl反応液中で消化した。反応液を37℃で2時間インキュベートした。次に、消化したPCR断片をQIAquick PCR精製キットを用いて精製した。1μlのPstIエンドヌクレアーゼ(Roche)と2μlの10×緩衝液Hを含有する20μl反応液中で2回目の制限消化を行なった。反応液を37℃で2時間インキュベートした。次に、消化したPCR断片をQIAquick PCR精製キットを用いて精製した。プラスミドpTrcHis2B(Invitrogen Corp.)を、1μlのNcoIエンドヌクレアーゼ(Roche)と、1μlのPstIエンドヌクレアーゼと、2μlの10×緩衝液Hを含有する20μl反応液中で消化した。反応液を37℃で2時間インキュベートした。消化したpTrcHis2Bベクターを1.2%E−ゲル(Invitrogen Corp.)を用いてゲル精製し、QIAquickゲル抽出キット(Qiagen)を用いて抽出した(図154)。BspHI部位とNcoI部位という互換的な付着末端を用いて、5μlのウラジロハコヤナギイソプレンシンターゼ挿入物、2μlのpTrcベクター、1μlのT4 DNAリガーゼ(New England Biolabs)、2μlの10×リガーゼ緩衝液、および10μlのddH2Oを含有する20μlライゲーション反応液を調製した。このライゲーション混合物を室温で40分間インキュベートした。ペトリ皿のddH2Oに0.025μmニトロセルロース膜フィルター(Millipore)を浮かべ、このニトロセルロース膜フィルターの上にライゲーション混合物を室温で30分間軽く適用することにより、ライゲーション混合物を脱塩した。MCM446細胞(第II節参照)を対数増殖期中期までLB中で増殖させた後、氷冷滅菌水で3回洗浄した。細胞懸濁液のアリコート50μlを、5μlの脱塩pTrc P.alba HGSライゲーションミックスと混合した。この細胞懸濁混合物を、Gene Pulser Electroporatorを用いて、2mmキュベット中、2.5Volt、25μFdでエレクトロポレートした。1mlのLBをすぐに細胞に添加し、その後、金属のキャップの付いた14mlポリプロピレンチューブ(Sarstedt)に移した。30℃で2時間増殖させて、細胞を回復させておいた。形質転換体をL寒天+50μg/μlカルベニシリン+10mM メバロン酸上で選択し、30℃でインキュベートした。翌日、6個の形質転換体を選び、5mlのLブロス+50μg/μlカルベニシリンチューブ中、30℃で一晩増殖させた。QIAquickスピンミニプレップキット(Qiagen)を用いて、終夜培養物に対してプラスミドプレップを行なった。プラスミド増殖にBL21細胞を用いたため、高品質のプラスミドDNAを得るための標準的な製造元のプロトコルに、スピンカラムをPB緩衝液で5回、PE緩衝液で3回洗浄するという変更を組み入れた。プラスミドを、20μl反応液中のPstIで消化して、正しいサイズの線状断片を保証した。6つのプラスミドは全てサイズが正しく、プライマーのMCM65、MCM66、EL1000(表20)を用いるシークエンシングのためにQuintara Biosciences(Berkeley,CA)に送った。DNAシークエンシングの結果から、6つのプラスミド全てが正しいことが示された。1つのプラスミドを選び、プラスミドEWL230と命名した(図155、156A〜B;配列番号44)。
(iv)プラスミドpEWL244(pTrc P.alba−mMVK)の構築
鋳型としてのMCM376(下記第(v)節参照)と、プライマーのMCM165およびMCM177(表20参照)と、Pfu Ultra IIフュージョンDNAポリメラーゼ(Stratagene)とを製造元のプロトコルに従って用いて、PCR反応を行ない、メタノサルキナ・マゼイ(M.マゼイ)MVK遺伝子を増幅した。PCR条件は次の通りであった。95℃で2分(最初のサイクルのみ)、28サイクルの95℃で25秒、55℃で25秒、72℃で18秒の繰返し、72℃で1分の最後の伸長。M.マゼイMVKのPCR産物をQIAquick PCR精製キット(Qiagen Inc.)を用いて精製した。
次に、M.マゼイMVKのPCR産物を、8μlのPCR産物、2μlのPmeIエンドヌクレアーゼ(New England Biolabs)、4μlの10×NEB緩衝液4、4μlの10×NEB BSA、および22μlのddH2Oを含有する40μl反応液中で消化した。反応液を37℃で3時間インキュベートした。次に、消化したPCR断片をQIAquick PCR精製キットを用いて精製した。2μlのNsiIエンドヌクレアーゼ(Roche)、4.7μlの10×緩衝液H、および40μlのPmeI 消化したM.マゼイMVK断片を含有する47μl反応液中で2回目の消化を行なった。反応液を37℃で3時間インキュベートした。次に、消化したPCR断片を1.2%E−ゲルを用いてゲル精製し、QIAquickゲル抽出キットを用いて抽出した。プラスミドEWL230を、10μlのプラスミド、2μlのPmeIエンドヌクレアーゼ、4μlの10×NEB緩衝液4、4μlの10×NEB BSA、および20μlのddH2Oを含有する40μl反応液中で消化した。反応液を37℃で3時間インキュベートした。次に、消化したPCR断片をQIAquick PCR精製キットを用いて精製した。2μlのPstIエンドヌクレアーゼ、4.7μlの10×緩衝液H、および40μlのPmeI消化したEWL230線状断片を含有する47μl反応液中で2回目の消化を行なった。反応液を37℃で3時間インキュベートした。次に、消化したPCR断片を1.2%E−ゲルを用いてゲル精製し、QIAquickゲル抽出キットを用いて精製した(図157)。NsiI部位とPstI部位の互換性のある付着末端を用いて、8μlのM.マゼイMVK挿入物、3μlのEWL230プラスミド、1μlのT4 DNAリガーゼ、2μlの10×リガーゼ緩衝液、および6μlのddH2Oを含有する20μlのライゲーション反応液を調製した。このライゲーション混合物を16℃で一晩インキュベートした。翌日、ペトリ皿のddH2Oに0.025μmニトロセルロース膜フィルターを浮かべ、このニトロセルロース膜フィルターの上にライゲーション混合物を室温で30分間軽く適用することにより、ライゲーション混合物を脱塩した。MCM446細胞を対数増殖期中期までLB中で増殖させた後、氷冷滅菌水で3回洗浄した。細胞懸濁液のアリコート50μlを、5μlの脱塩pTrc P.alba mMVKライゲーションミックスと混合した。細胞懸濁混合物を、Gene Pulser Electroporatorを用いて、2mmキュベット中、2.5Volt、25μFdでエレクトロポレートした。1mlのLBをすぐに細胞に添加し、その後、金属のキャップの付いた14mlポリプロピレンチューブに移した。30℃で2時間増殖させて、細胞を回復させておいた。形質転換体をLA+50μg/μlカルベニシリン+5mM メバロン酸プレート上で選択し、30℃でインキュベートした。翌日、6個の形質転換体を選び、5mlのLB+50μg/μlカルベニシリンチューブ中、30℃で一晩増殖させた。QIAquickスピンミニプレップキット(Qiagen)を用いて、終夜培養物に対してプラスミドプレップを行なった。プラスミド増殖にBL21細胞を用いたため、高品質のプラスミドDNAを得るための標準的な製造元のプロトコルに、スピンカラムをPB緩衝液で5回、PE緩衝液で3回洗浄するという変更を組み入れた。プラスミドを、20μl反応液中のPstIで消化して、正しいサイズの線状断片を保証した。6つのプラスミドのうち3つはサイズが正しく、プライマーのMCM65、MCM66、EL1000、EL1003、およびEL1006(表20)を用いるシークエンシングのためにQuintara Biosciencesに送った。DNAシークエンシングの結果から、3つのプラスミド全てが正しいことが示された。1つのプラスミドを選び、プラスミドEWL244と命名した(図158、159A〜B;配列番号45)。
(v)MCM376−M.マゼイ古細菌下流由来のMVKを含むpET200Dの構築プラスミド
M.マゼイ古細菌下流経路オペロン由来のMVK ORF(図160A〜C;配列番号46)をInvitrogen Platinum HiFi PCRミックスを用い、プライマーのMCM161およびMCM162(表)を用いてPCR増幅した。45μLのPCRミックスを1μLの鋳型、1μLの各プライマー(10μM)、および2μLの水と合わせた。反応を次のようなサイクルで行なった。94℃で2分;30サイクルの94℃で30秒、55℃で30秒、および68℃で1分15秒;次に、72℃で7分、そして、冷えるまで4℃。3μLのこのPCR反応液を製造元のプロトコルに従ってInvitrogen pET200Dプラスミドに連結した。3μLのこのライゲーション液をInvitrogen TOP10細胞に導入し、形質転換体をLA/kan50上で選択した。形質転換体から得たプラスミドを単離し、挿入物をシークエンシングし、MCM376を得た(図161A〜C;配列番号47)。
(vi)EWL251株(BL21(DE3)、Cm−GI1.2−KKDyI、pTrc P.alba−mMVK)の構築
MCM331細胞(これは、出芽酵母メバロン酸キナーゼ、メバロン酸リン酸キナーゼ、メバロン酸ピロリン酸デカルボキシラーゼ、およびIPPイソメラーゼをコードする染色体コンストラクトgi1.2KKDyIを含有する)を対数増殖期中期までLB中で増殖させた後、氷冷滅菌水で3回洗浄した。50μlの細胞懸濁液を1μlのプラスミドEWL244混合した。細胞懸濁混合物を、Gene Pulser Electroporatorを用いて、2mmキュベット中、2.5Volt、25μFdでエレクトロポレートした。1mlのLBをすぐに細胞に添加し、その後、金属のキャップの付いた14mlポリプロピレンチューブに移した。30℃で2時間増殖させて、細胞を回復させておいた。形質転換体をLA+50μg/μlカルベニシリン+5mM メバロン酸プレート上で選択し、37℃でインキュベートした。1つのコロニーを選択し、EWL251株と命名した。
(vii)EWL256株(BL21(DE3)、Cm−GI1.2−KKDyI、pTrc P.alba−mMVK, pCL Upper MVA)の構築
EWL251細胞を対数増殖期中期までLB中で増殖させた後、氷冷滅菌水で3回洗浄した。50μlの細胞懸濁液を1μlのプラスミドMCM82(E.フェカーリスのmvaEおよびmvaSをコードする、pCL PtrcUpperPathway(別名「pCL Upper MVA」)を含む)と混合した。プラスミドpCL Ptrc Upper Pathwayは上記の実施例8に記載したように構築した。この細胞懸濁混合物を、Gene Pulser Electroporatorを用いて、2mmキュベット中、2.5Volt、25μFdでエレクトロポレートした。1mlのLBをすぐに細胞に添加した。その後、細胞を金属のキャップの付いた14mlポリプロピレンチューブに移した。30℃で2時間増殖させて、細胞を回復させておいた。形質転換体をLA+50μg/μlカルベニシリン+50μg/μlスペクチノマイシンプレート上で選択し、37℃でインキュベートした。1つのコロニーを選び、EWL256株と命名した。
プライマー配列
(viii)RM111608−2株(Cm−GI1.2−KKDyI、pTrc P.alba−mMVK、pCL Upper MVA、pBBRCMPGI1.5−pgl)の構築
複製プラスミドpBBR1MCS5(ゲンタマイシン)(K.Peterson博士,Louisiana State Universityから入手)上のybhE遺伝子(大腸菌6−ホスホグルコノラクトナーゼをコードする)を構成的に発現する、イソプレンを産出するBL21株の大腸菌(EWL256)を構築した。
FRTに基づく組換えカセットと、Red/ETによる組込みおよび抗生物質のマーカーループアウト用のプラスミドをGene Bridges GmbH(Germany)から得た。これらの材料を用いた処理を、Gene Bridgesのプロトコルに従って行なった。プライマーのPgl−F(配列番号139)およびPglGI1.5−R(配列番号140)を用い、製造元のプロトコルに従ってStratagene Herculase II Fusionキットを用いて、FRT−gb2−Cm−FRT鋳型の耐性カセットを増幅した。PCR反応液(最終容量50μL)は、5μLの緩衝液、1μLの鋳型DNA(Gene BridgesからのFRT−gb2−Cm−F)、10pmolの各プライマー、および1.5μLの25mM dNTPミックスを含んでおり、これをdH2Oで50μLにした。反応を次のようなサイクルで行なった。1×2分、95℃、次に、30サイクルの(95℃、30秒;63℃、30秒;72℃、3分)。
得られたPCR産物をQiaQick PCR精製キット(Qiagen)を用いて精製し、以下のように、pRed−ETリコンビナーゼ含有プラスミドを有するエレクトロコンピテントMG1655細胞にエレクトロポレートした。OD600が約0.6になるまで5mLのLブロス中、30℃で増殖させることにより、細胞を調製した。リコンビナーゼを発現させるために4%アラビノースを添加して細胞を誘導し、30℃で30分間増殖させておき、その後、37℃で30分間増殖させた。細胞のアリコート1.5mLを、氷冷dH2Oで3〜4回洗浄した。最終的な細胞ペレットを40μLの氷冷dH2Oに再懸濁し、2〜5μLのPCR産物を添加した。Gene Pulser Electroporator(Bio−Rad Inc.)で、1mmのギャップのキュベット中、1.3kVでエレクトロポレーションを行なった。細胞を30℃で1〜2時間回復させ、クロラムフェニコール(5μg/mL)を含有するL寒天上にプレーティングした。5つの形質転換体をPCRで解析し、組込み部位に隣接するプライマー(2つのプライマーセット:pgl+49 revおよび3’EcoRV−pglstop;Bottom Pgb2およびTop GB’s CMP(946))を用いてシークエンシングした。正しい形質転換体を選択し、この株をMG1655 GI1.5−pgl::CMPと命名した。
MG1655 GI1.5−pgl::CMPの染色体DNAを鋳型として用いて、FRT−CMP−FRT−GI1.5−ybhEコンストラクトを含有するPCR断片を生成させた。このコンストラクトを以下のようにpBBR1MCS5(ゲンタマイシン)にクローニングした。この断片(ここでは、CMP−GI1.5−pglと呼ぶ)を、5’プライマーのPglconfirm−F(配列番号141)および3’プライマーの3’EcoRV−pglstop(配列番号142)を用いて増幅した。得られた断片を、製造元が提案するようにInvitrogen TOPO−Bluntクローニングキットを用いてプラスミドベクターpCR−Blunt II−TOPOにクローニングした。CMP−GI1.5−pgl断片を有するNsiI断片をpBBR1MCS5(ゲンタマイシン)のPstI部位にクローニングした。5μlのCMP−GI1.5−pgl挿入物、2μlのpBBR1MCS5(ゲンタマイシン)ベクター、1μlのT4DNAリガーゼ(New England Biolabs)、2μlの10×リガーゼ緩衝液、および10μlのddH2Oを含有する20μlのライゲーション液を調製した。このライゲーション混合物を室温で40分間インキュベートした後、2〜4μLを、上で開示したパラメータを用いてエレクトロコンピテントTop10細胞(Invitrogen)にエレクトロポレートした。形質転換体を10μg/mlクロラムフェニコールおよび5μg/mlゲンタマイシンを含有するL寒天上で選択した。上記のいくつかのプライマーならびにSequetech,CAによって提供された自社製のT3プライマーおよびリバースプライマーを用いて、選択されたクローンの配列を決定した。このプラスミドをpBBRCMPGI1.5−pgl(図162、163A〜Bおよび配列番号48)と命名した。
プラスミドpBBRCMPGI1.5−pglを上記のようにEWL256にエレクトロポレートし、形質転換体をクロラムフェニコール(10μg/mL)、ゲンタマイシン(5μg/mL)、スペクチノマイシン(50μg/mL)、およびカルベニシリン(50μg/mL)を含有するL寒天上にプレーティングした。1つの形質転換体を選択し、RM111608−2株と命名した。
プライマー:
Pgl−F
[化80]
5’−accgccaaaagcgactaattttagctgttacagtcagttgaattaaccctcactaaagggcggccgc−3’(配列番号139)
[化81]
PglGI1.5−R
5’−gctggcgatataaactgtttgcttcatgaatgctcctttgggttacctccgggaaacgcggttgatttgtttagtggttgaattatttgctcaggatgtggcatagtcaagggcgtgacggctcgctaatacgactcactatagggctcgag−3’(配列番号140)
3’EcoRV−pglstop:
[化82]
5’−CTT GAT ATC TTA GTG TGC GTT AAC CAC CAC(配列番号142)
[化83]
pgl+49 rev:CGTGAATTTGCTGGCTCTCAG(配列番号136)
[化84]
Bottom Pgb2:GGTTTAGTTCCTCACCTTGTC(配列番号135)
[化85]
Top GB’s CMP(946):ACTGAAACGTTTTCATCGCTC(配列番号92)
Pglconfirm−F
[化86]
5’−accgccaaaagcgactaattttagct−3’(配列番号141)
実施例24:大腸菌におけるybhE(pgl)の構成的発現によるイソプレン産出の改善
この実施例は、野生型レベルでybhEを発現する対照株(すなわち、EWL256)と比べた、大腸菌ybhE(pgl)を構成的に発現する株におけるイソプレンの産出を示す。遺伝子ybhE(pgl)は、異種発現されたタンパク質の翻訳後グルコニル化を抑制し、産物の溶解度と収率を改善すると同時に、バイオマスの収率とペントースリン酸経路への流量を改善する大腸菌6−ホスホグルコノラクトナーゼをコードする。(Aon et al.,Applied and Environmental Microbiology,74(4):950−958,2008)。
i)小規模解析
培地レシピ(発酵培地1リットル当たり):K2HPO4 13.6g、KH2PO4 13.6g、MgSO4 *7H2O 2g、クエン酸一水和物2g、クエン酸第二鉄アンモニウム0.3g、(NH4)2SO4 3.2g、酵母抽出物1g、1000×微量金属溶液1ml。全ての成分を一緒に添加し、diH2Oに溶解させた。水酸化アンモニウム(30%)を用いてpHを6.8に調整し、全量に合わせた。培地を0.22ミクロンフィルターで濾過滅菌した。グルコース5.0gおよび抗生物質を、滅菌およびpH調整の後に添加した。
1000×微量金属溶液(発酵培地1リットル当たり):クエン酸*H2O 40g、MnSO4 *H2O 30g、NaCl 10g、FeSO4 *7H2O 1g、CoCl2 *6H2O 1g、ZnSO4 *7H2O 1g、CuSO4 *5H2O 100mg、H3BO3 100mg、NaMoO4 *2H2O 100mg。各成分を一度にdiH2Oに溶解させる。pHをHCl/NaOHで3.0に調整した後、溶液を全量に合わせ、0.22ミクロンフィルターで濾過滅菌する。
(a)実験手順
MicroReactor Technologies,Inc製のCellerator(商標)で株を増殖させることにより、イソプレン産出を分析した。各々24ウェル中のワーキング容量は4.5mLであった。温度は30℃で維持され、pH定値は7.0であり、酸素流量定値は20sccmであり、撹拌速度は800rpmであった。凍結バイアルから採取した大腸菌株の種菌をLBブロス寒天プレート(抗生物質を含む)上にストリークし、30℃でインキュベートした。単一コロニーを抗生物質を含む培地に植菌し、一晩増殖させた。550nmで測定して光学密度が0.05に達するように、細菌を抗生物質を含む4.5mLの培地に希釈した。
ガスクロマトグラフ−質量分析計(GC−MS)(Agilent)によるヘッドスペースアッセイを用いて、イソプレンのオフガス分析を行なった。サンプル調製は次のようにした。100μLの全ブロスを密封GCバイアルに入れ、30℃で30分という一定時間インキュベートした。70℃で5分間のインキュベーションからなる熱不活化工程の後、サンプルをGCに投入した。
実行中にマイクロプレートリーダー(Spectramax)を用いて波長550nmでの光学密度(OD)を得た。イソプレン濃度(μg/L)をこのOD測定値と時間(時間)で割って比生産性を得た。
200および400μMのIPTG誘導レベルで、2つの株、EWL256およびRM11608−2を評価した。誘導後1、2.5、4.75、および8時間でのイソプレン産出および細胞増殖(OD550)について、サンプルを分析した。サンプルは2つ1組で作製した。
(b)結果
2つの異なるIPTG濃度で、ybhE(pgl)を発現する株は、対照株と比べて劇的に2〜3倍イソプレン比生産性を増加させることが実験により示された。
Cm−GI1.2−KKDyI、M.マゼイメバロン酸キナーゼ、ウラジロハコヤナギイソプレンシンターゼ、およびybhE(pgl)(RM111608−2)を発現し、15Lスケールのフェドバッチ培養で増殖させた大腸菌からのイソプレン発酵
培地レシピ(発酵培地1リットル当たり):K2HPO4 7.5g、MgSO4 *7H2O 2g、クエン酸一水和物2g、クエン酸第二鉄アンモニウム0.3g、酵母抽出物0.5g、1000×改変微量金属溶液1ml。これらの成分を全て一緒に添加し、diH2Oに溶解させた。この溶液をオートクレーブした。pHを水酸化アンモニウム(30%)で7.0に調整し、適量を加えて全量とした。グルコース10g、チアミン*HCl 0.1g、および抗生物質を、滅菌およびpH調整の後に添加した。
1000×改変微量金属溶液:クエン酸*H2O 40g、MnSO4 *H2O 30g、NaCl 10g、FeSO4 *7H2O 1g、CoCl2 *6H2O 1g、ZnSO4 *7H2O 1g、CuSO4 *5H2O 100mg、H3BO3 100mg、NaMoO4 *2H2O 100mg。各成分を一度にDiH2Oに溶解させ、HCl/NaOHでpHを3.0にし、次に、適量を加えて全量とし、0.22ミクロンフィルターで濾過滅菌した。
上流メバロン酸(MVA)経路(pCL Upper)と、組み込まれた下流MVA経路(gi1.2KKDyI)と、高発現のM.マゼイ由来のメバロン酸キナーゼおよびウラジロハコヤナギ由来のイソプレンシンターゼ(pTrcAlba−mMVK)と、高発現の大腸菌pgl(pBBR−pgl)とを含有するBL21(DE3)大腸菌細胞を含む15Lバイオリアクター中で発酵を行なった。この実験は、所望の発酵(pH7.0および温度34℃)におけるグルコースからのイソプレン形成をモニタリングするために行なわれた。大腸菌株の凍結バイアルを解凍し、トリプトン−酵母抽出物培地に植菌した。550nmで測定して、種菌がOD1.0にまで増殖した後、500mLを用いて15Lバイオリアクターに植菌し、初期容量を5Lにした。
細胞が定常期に達するまで、グルコースを指数関数的割合で供給した。定常期以降、代謝要求量を満足させるようにグルコース供給を減らした。40時間(59時間)の発酵の間にバイオリアクターに送達されたグルコースの総量は3.1kg(59時間で4.2kg)であった。IPTGを添加して誘導を達成した。550nmでの光学密度(OD550)が4という値に達したとき、IPTG濃度を110μMにした。OD550が150に達したとき、IPTG濃度を192μMに上昇させた。バイオリアクター内の経時的なOD550プロファイルを図164Aに示す。バイオリアクターからのオフガス中のイソプレンレベルをHiden質量分析計を用いて測定した。イソプレン力価は、発酵の間に、40時間で最大値33.2g/L(59時間で最大値48.6g/L)まで増加した(図164B)。イソプレン力価は、発酵の間に、40時間で最大値40.0g/L(59時間で最大値60.5g/L)まで増加した(図164C)。40時間(59時間)の発酵の間に産出されたイソプレンの総量は、281.3g(59時間で451.0g)であった。産出の時間経過を図164Dに示す。容積生産性の時間経過を図164Eに示す。これは、1.0g/L/時間という平均速度が0〜40時間の間(19〜59時間では1.4g/L/時間)に維持されたことを示す。CERで測定された場合の代謝活性プロファイルを図164Fに示す。発酵の時にイソプレン産出に回った利用炭素のモル収率は、40時間で19.6%であった(59時間で(23.6%)。グルコースからのイソプレンの重量パーセント収率は、40時間で8.9%(59時間で10.7%)であった。
実施例25:M.マゼイメバロン酸キナーゼと、ウラジロハコヤナギイソプレンシンターゼと、pCL Upper MVA(E.フェカーリスのmvaEおよびmvaS)とybhE(pgl)とを発現する大腸菌株におけるイソプレンと水素の共産出
発酵オフガスの回収ならびに発酵オフガスの水素レベルおよびイソプレンレベルの分析
RM111608−2株(大腸菌BL21(DE3)、pCL Upper MVA、cmR−gi1.2−yKKDyI、pTrcAlba−mMVK、pBBR cmR−gi1.5−pgl)およびEWL 256株(大腸菌BL21(DE3)、pCL Upper MVA、cmR−gi1.2−yKKDyI、pTrcAlba−mMVK)を用いて発酵を行なった。細菌株の構築は上の実施例23に記載されている。
大腸菌からのイソプレンの大量産出を、M.マゼイメバロン酸キナーゼと、ウラジロハコヤナギイソプレンシンターゼと、pCL Upper MVA(E.フェカーリスのmvaEおよびmvaS)と、構成的に発現するybhE(pgl)(RM111608−2)または正常に発現するybhE(pgl)(EWL256)のいずれかとを発現する大腸菌株のEWL256およびRM111608−2のフェドバッチ培養から決定した。この実験により、グルコースの存在下で細胞を増殖させると、イソプレンと水素の共産出が生じたことが示されている。
TM2発酵培地1リットル当たりの発酵培地(TM2)のレシピは次の通りであった。K2HPO4 13.6g、KH2PO4 13.6g、MgSO4 *7H2O 2g、クエン酸一水和物2g、クエン酸第二鉄アンモニウム0.3g、(NH4)2SO4 3.2g、酵母抽出物5g、1000×改変微量金属溶液1ml。1000×改変微量金属溶液:クエン酸*H2O 40g、MnSO4 *H2O 30g、NaCl 10g、FeSO4 *7H2O 1g、CoCl2 *6H2O 1g、ZnSO4 *7H2O 1g、CuSO4 *5H2O 100mg、H3BO3 100mg、NaMoO4 *2H2O 100mg。1000×改変微量金属溶液の場合、各成分を一度にDiH2Oに溶解させ、HCl/NaOHでpHを3.0にした後、蒸留水中で最終容量に合わせ、0.22ミクロン(μm)フィルターで滅菌濾過する(この溶液はオートクレーブしない)。TM2発酵培地の場合、全ての成分を一緒に添加し、diH2Oに溶解させ、水酸化カリウム(KOH)でpHを6.8に調整し、適量を加えて全量とし、培地を0.22ミクロン(μm)フィルターで濾過滅菌した。グルコースは、99DE(デキストロース当量)の71%DS(乾燥固体)シロップとしてCargillから供給された。
上流メバロン酸(MVA)経路(pCL Upper MVA)と、組み込まれた下流MVA経路(cmR−gi1.2−yKKDyI)と、M.マゼイ由来のメバロン酸キナーゼと、ウラジロハコヤナギ由来のイソプレンシンターゼ(pTrcAlba−mMVK)と、構成的に発現するybhE(pgl)(RM111608−2)または正常に発現するybhE(pgl)(EWL256)とを含有する大腸菌株のEWL256またはRM111608−2を含む15Lバイオリアクター中で発酵を行なった。この実験は、所望の発酵条件(pH7.0および温度34℃)におけるグルコースからのイソプレン形成をモニタリングするために行なわれた。
凍結バイアルから採取された適当な大腸菌株の種菌をペプトン−酵母抽出物培地中に調製した。種菌がOD550=0.6まで増殖した後、600mLを用いて、TM2培地を含有する15Lバイオリアクターに植菌した。細胞が定常期に達するまで、グルコースを指数関数的割合で供給した。定常期以降、代謝要求量を満足させるようにグルコース供給を減らした。67時間の発酵の間にバイオリアクターに送達されたグルコースの総量は、3.9kgであった。イソプロピル−β−D−1−チオガラクトピラノシド(IPTG)を添加して、誘導を達成した。550nmでの光学密度(OD550)が9という値に達したとき、IPTG濃度を102μMにした。OD550が140に達したとき、IPTG濃度を192μMに上昇させた。植菌後の様々な時点で、サンプルを取り出し、産出されたイソプレンの量を以下のように測定した。バイオリアクターからのオフガス中の水素、窒素、酸素、二酸化炭素、およびイソプレンのレベルを、以下に論じるように、Hiden HPR−20質量分析計を用いて測定した。
15Lバイオリアクターからの発酵オフガスのサンプルを、1Lオフガス/分で10秒間、バイアルに放出することにより、20mLガラスヘッドスペースバイアル中に回収し、テフロンコートしたセプタム(Agilent,CA)が付いた金属スクリューキャップで密封した。このバイアルを回収から30分以内に分析した。
質量分析計の注入チューブをキャップしていないヘッドスペースバイアルに1〜2分間入れることによって4scc/分(4mL/分)の速度でHiden HPR−20質量分析計(Hiden Analystic,U.K.)に注入することにより、2つのサンプルの分析を行なった。HPR−20装置は、水素(m/z 2)、窒素(m/z 28)、酸素(m/z 32)、二酸化炭素(m/z 44)およびイソプレン(m/z 67)に対応する質量をスキャンするように構成された。質量28、32、44および67にはFaraday検出器を用いた。水素(m/z 2)にはSEM検出器を用いた。検出器応答を任意単位の圧力(Torr)として測定した。絶対水素レベルを信頼のおける水素ガス標準との比較により推定した。MASsoft V 6.21.0.51ソフトウェア(Hiden Analystic,United Kingdom)を用いて結果を記録した。
結果
オフガスサンプルを2つの発酵操作から採取し、上記のように分析した。
A)RM111608−2株(大腸菌BL21(DE3)、pCL upper、cmR−gi1.2−yKKDyI、pTrcAlba−mMVK、pBBR cmR−gi1.5−pgl)。サンプルは64.8時間でrunに取り込まれたが、その間、発酵は、窒素放出1vvmで嫌気的に行なわれていた。
B)EWL256株(大腸菌BL21(DE3)、pCL upper、cmR−gi1.2−yKKDyI、pTrcAlba−mMVK)。サンプルは、34.5時間でに取り込まれたが、その間、発酵は、空気放出1vvmで好気的行なわれていた。
結果を図165A〜Bに示す。両方の場合において、イソプレン、酸素および二酸化炭素の他に、低レベルの水素を検出した。水素のベースライン測定値は0.95×10−8トールであった。サンプルAとBは両方とも、約1.3×10−8トールという測定値を与えた。水素標準との比較を基にすると、サンプルAとBのオフガス中に存在する水素の量は、10ppmv(容積百万分率)未満であると推定されたが、ベースラインを上回っていた。図165A〜Bに示すように、サンプルAとBは両方とも、かなりの量のイソプレンと二酸化炭素も含んでいた。
実施例26:M.マゼイメバロン酸キナーゼと、ウラジロハコヤナギイソプレンシンターゼと、pCL Upper MVA(E.フェカーリスのmvaEおよびmvaS)とybhE(pgl)とを発現する大腸菌株におけるイソプレンと水素の共産出
発酵オフガスの回収ならびに発酵オフガスの水素レベルおよびイソプレンレベルの分析
この実験の目的は、人為操作した大腸菌株において水素とイソプレンを共産出させることである。この目的のために、上記のように調製される大腸菌ヒドロゲナーゼ−3を発現するhycオペロンの一部をEWL256株[BL21(DE3)、pCL upper、cmR−gi1.2−yKKDyI、pTrcAlba−mMVK]で発現させるが、RM111608−2などの、上記の細菌株のどれかを同じように改変することができる。hycオペロン遺伝子のhycB(gi|16130631)、hycC(gi|16130630)、hycD(gi|16130629)、hycE(gi|16130628)、hycF(gi|16130627)、およびhycG(gi|16130626)を含む発現コンストラクトを、公けに利用可能な遺伝子配列に基づいて当該技術分野で公知の標準的なクローニング方法で調製し、EWL256株に導入して、新しいEWL256+Hyd−3株を作製する。
さらなる突然変異が水素とイソプレンの共産出に与える影響を単独でまたはヒドロゲナーゼ−3の成熟もしくは調節に関与する遺伝子(例えば、hycH(gi|16130625)およびhycI(gi|16130624))を導入することによって、水素取込みもしくは輸送に関与する遺伝子(例えば、大腸菌ヒドロゲナーゼ−1(hyaオペロン)およびヒドロゲナーゼ−2(hybオペロン))もしくは関連タンパク質(例えば、ギ酸デヒドロゲナーゼ(fdhF(gi|16130624))、ギ酸リアーゼのリプレッサー(hycA(gi|16130632))、ギ酸デヒドロゲナーゼN、αサブユニット(fdnG(gi|16129433))、ギ酸デヒドロゲナーゼO、大サブユニット(fdoG(gi|16131734))、硝酸レダクターゼ(narG(gi|16129187))、フマル酸レダクターゼ調節因子(fnr(gi|16129295))、およびアセチル−補酵素Aシンセターゼ(acs(gi|16131895)))を不活化もしくは欠失させることによって、ヒドロゲナーゼの上方調節に関与する遺伝子(例えば、ギ酸水素リアーゼの活性化因子(fhlA(gi|16130638))を活性化することによって、発酵副産物の産出に関与する遺伝子(例えば、乳酸デヒドロゲナーゼ(ldhA(gi|16129341))、フマル酸レダクターゼ膜タンパク質(frdC(gi|16131977))、アルコールデヒドロゲナーゼ(adhE(gi|16129202))、ピルビン酸オキシダーゼ(poxB(gi|16128839))、ピルビン酸デヒドロゲナーゼE1成分ackA/pta(aceE(gi|16128107))、ギ酸デヒドロゲナーゼ調節タンパク質(hycA(gi|16130632 ))、およびギ酸輸送体AおよびB(FocA(gi|16128871)ならびにFocB(gi|16130417))を不活化もしくは欠失させることによって、または水素代謝に関与する異種遺伝子(例えば、グリセルアルデヒド−3−リン酸デヒドロゲナーゼfrom クロストリジウム・アセトブツリクム(gapC(gi|15893997))を発現させることによって、EWL256+Hyd−3と組み合わせて評価した。
本質的に上記の実施例25に記載したように、単独でまたは組み合わせて、上記のような1以上の追加の突然変異を含むように改変された、EWL256+Hyd−3株(BL21(DE3)、pCL upper、cmR−gi1.2−yKKDyI、pTrcAlba−mMVKおよびhycB−F)という人為操作した変異体を用いて発酵を行なう。水素とイソプレンの共産出を、本質的に上に記載したように、オフガスサンプルの分析によって評価する。株をイソプレンと水素の共産出の速度に基づくさらなる分析用に選択する。
特に定義しない限り、本明細書で使用される全ての技術的および科学的用語の意味は、本発明が属する技術分野の当業者によって共通に理解されるものである。Singleton,et al.,Dictionary of Microbiology and Molecular Biology,第2版,John Wiley and Sons,New York(1994)、およびHale & Marham,The Harper Collins Dictionary of Biology,Harper Perennial,N.Y.(1991)は、本発明で使用される用語の多くの一般的な辞書を当業者に提供する。記載された特定の方法、プロトコル、および試薬は様々に異なり得るので、本発明は、これらに限定されるものではないことが理解されるべきである。また、当業者であれば、本発明を実施または試験するために、本明細書に記載された方法および材料と同様または同等の任意の方法および材料を用いることができることも理解するであろう。
実施例27:上流または上流および下流メバロン酸経路+クズイソプレンシンターゼを含む大腸菌fadR atoCLS5218内の脂肪酸またはパーム油由来のイソプレンまたはメバロナートの産出。
大腸菌fadR atoC菌株LS5218(番号6966)をColi Genetic Stockセンターから得た。FadRは脂肪酸分解酵素をコードする遺伝子発現を負制御する転写リプレッサーをコードする(Campbell et al., J. Bacteriol. 183: 5982−5990, 2001)。AtoCは、AtoSがアセト乳酸代謝を調節する2成分調節系における反応調節因子である。fadR atoC菌株は脂肪酸分解遺伝子を構造的に発現させ、長鎖脂肪酸を長鎖ポリヒドロキシアルカノエートに組み込む。パーム油をメバロナートまたはイソプレン産出のいずれかのための炭素源として使用する場合、パーム油をグリセロール+脂肪酸に変換する。この方法は当該技術分野で周知であり、それは、リパーゼ(例えばブタ膵リパーゼ、Candida rugosaリパーゼ、または他の類似しているリパーゼ)とのインキュベーションにより酵素的に、または塩基、例えば、水酸化ナトリウムとの鹸化により化学的に行なうことができる。
i)上流メバロン酸経路を発現する大腸菌fadR atoC菌株
標準的な方法を用いてpCLPtrc UpperPathwayをLS5218中に電気穿孔して菌株WW4を作製した(Sambrooke et al., Molecular Cloning: A Laboratory Manual,第2版編集, Cold Spring Harbor, 1989)。炭素源としてC12脂肪酸(FA)またはパーム油のいずれかで補充したTM3培地内で細胞培養時、メバロン酸(MVA)の産出によりプラスミド挿入が示された。脂肪酸からのWW4によるMVA産出を示すため、0.25%のC12 FA(Sigmaカタログ番号L9755)で補充した5mLの修飾TM3培地(酵母抽出物を含まないTM3)内で一晩培養した細胞を1〜100希釈した。MVA産出の最初の兆候(24mg/L)は、IPTG誘発培養で30℃で一晩インキュベーション後に明らかであった。産出は3日間にわたり増加し、最終レベル194mg/LのMVAを産出した。油からのWW4によるMVA産出を示すため、一晩培養した細胞を、200mgの消化したパーム油/5mLのTM3培地で補充した修飾TM3培地内で1〜100希釈した。MVA産出の最初の兆候(50mg/L)は、IPTG誘発培養で30℃で一晩インキュベーション後に明らかであった。産出は3日間にわたり増加し、最終レベル500mg/LのMVAを産出した。
ii)上流および下流MVA経路+クズイソプレンシンターゼを発現する大腸菌fadR atoC菌株
大腸菌菌株WW4(LS5218 fadR atoC pCLPtrc UpperPathway)をpMCM118[pTrcKKDyIkIS]と変換してWW10を得た。TM3およびグルコース内で菌株を培養してIPTG(100、300、または900μM)で誘発時のイソプレン産出の証拠によりプラスミド挿入が示された。菌株はIPTGに比較的感受性であり、100μMのIPTGでさえ有意な増殖欠損を示した。これらの結果を図70Aに示す。
ドデカン酸からのイソプレン産出を試験するため、スペクチノマイシン(50μg/ml)、およびカナマイシン(50μg/ml)を含むLブロス内でWW10を200rpmで撹拌しながら37℃で一晩培養した。この培地とそれらの元々の培養容積内で遠心分離および再懸濁することにより、細胞を修飾TM3培地で洗浄した。この出発培養から洗浄および再懸濁した細胞を、0.125%のC12脂肪酸(Sigmaカタログ番号L9755)を含む5mLの修飾TM3培地内で1〜100および1〜10希釈した。
パーム油からのメバロナートの産出を示すため、油をリパーゼで37℃、250rpmで数日間前消化して脂肪酸を放出させた(加水分解の証拠は管を撹拌時に形成される発泡体により判断した)。
加えて、培養を、パーム油と試験管内に含まれる修飾TM3培地内で洗浄した細胞により1〜10希釈して調整した。残り(2.5mL)の洗浄した細胞に0.125%のC12FAをそれ以上希釈(生物変換)せずに添加してさらなる管を調整した。250rpmで撹拌しながら30℃で3.75時間増殖後、50μMのIPTGを添加して全ての培養物を誘発した。インキュベーションを4時間継続後、各培養物200μLのイソプレン蓄積について、修飾ヘッドスペースアッセイでアッセイした(500rpmで撹拌しながら30℃で1時間蓄積)。追加のイソプレンアッセイを、GCMS分析の前にアッセイガラスブロックの12時間のインキュベーションにより実施した。誘発した培養物のインキュベーションを一晩継続して、翌朝、アリコート200μLのイソプレン産出について再びアッセイした(1時間、30deg、500rpm Shel−Lab振盪機)。これらの培養の分析は、有意なレベルのイソプレン産出を示した。最高レベルのイソプレンは、一晩インキュベートおよび誘発後に一晩の出発培養物から1/10希釈で播種した培養に観察された。この結果は、この培養が増殖し続けて細胞密度が増加したことを示唆する。これらの結果を図70Bに示す。脂肪酸懸濁液は混濁していたため、細胞密度を直接測定することはできなかった。そのためこの培養の細胞密度は培養のアリコートをプレートすることにより測定し、8×107コロニー形成単位が示された。これは約OD600 0.1に相当する。それにも関わらず、この培養物は有意なイソプレン産出を提供した;この実施例に記載の経路のない類似している菌株において、イソプレンは観察されない。
実施例28:Streptomyces sp植物からのイソプレンシンターゼ発現。
イソプレンシンターゼクズ遺伝子をプラスミドpJ201:19813から得た。プラスミドpJ201:19813はPueraia lobata(クズ植物)からイソプレンシンターゼをコードし、Pseudomonas fluorescens、Pseudomonas putida、Rhodopseudomonas palustrisおよびCorynebacteriumのためにコドン最適化した(図79A〜79C(配列番号123))。
制限酵素NdeIおよびBamHIのプラスミドpJ201:19813を消化し、遺伝子iso19813を分離し、Streptomyces−E.coliシャトルベクターpUWL201PW内にライゲーションした。(Doumith et al., Mol. Gen. Genet. 264: 477−485, 2000;図71)、pUWL201_isoを産出した。pUWL201_isoの制限分析により成功的なクローニングを確認した。イソプレンシンターゼiso19813発現は、Streptomycetes種において構成的に発現させるが大腸菌において発現させないermプロモーターの制限下にあった。
Hopwood et al., The John innes foundation, Norwich, 1985に記載の原形質体の形質転換によりPUWL201PW(挿入なし)およびpUWL201_isoをStreptomyces albus J1074(Sanchez et al., Chem. Biol. 9:519−531, 2002)に導入した。
原形質体懸濁液のアリコート200μlを1.9μgのpUWL201PWまたは2.9μgのpUWL201_isoで形質転換させた。非選択的R5−寒天プレート上で28℃で一晩インキュベーション後、陽性形質転換体をチオストレプトン(250μg/ml)を含むR3−オーバーレイ寒天内でさらに4日間インキュベーションして選択した。プラスミドMiniキット(Qiagen)を用いたプラスミド調製により、チオストレプトン耐性形質転換体のpUWL−プラスミドの存在を評価した。調製したプラスミドDNAを大腸菌DH5α内で再導入して制限分析により分析するための十分な量のプラスミドDNAを生成した。陽性形質転換体をアンピシリン含有L寒天プレート上で選択して、NdeIおよびBamHIエンドヌクレアーゼでのプラスミドDNAの消化により挿入分析を行なった。イソプレンシンターゼを陽性pUWL201イソクローン中で1.7kb断片として同定した一方、対照菌株(pUWL201PW)内ではこのような断片は観察されなかった。
対照プラスミドpUWL201PWまたはpUWL201_isoをコードするイソプレンシンターゼを含むS.albusの野生型菌株および形質転換体のイソプレン形成について分析した。菌株を固体培地(トリプシン大豆ブロス寒天、TSB;2.5ml)上、チオストレプトン(200μg/ml)の存在または不在下で反復培養し、密閉ヘッドスペースバイアル(総容積20ml)内で28℃で4日間インキュベートした。500μlのヘッドスペース試料(評価項目測定)をSIMモード内でGC−MSにより分析し、基準保持時間および分子質量(67m/z)に応じてイソプレンを同定した。先に作成した較正曲線によってヘッドスペース試料中に存在するイソプレンを定量化した。野生型S.albusおよびpUWL201PWを内部に持つ対照菌株はイソプレンを検出限界よりわずかに高い濃度(0.04〜0.07ppm)で産出した一方、pUWL201_isoを内部に持つS.albusはイソプレンを対照と比べて少なくとも10倍多く(0.75ppm;図72)産出した。この結果は、Actinomycetes群の原核生物内の植物由来イソプレンシンターゼの成功的な発現を示す。
実施例29:Bioisoprene(商標)の回収
Bioisoprene(商標)を、活性炭へ吸着させてからオフライン蒸気の脱離および凝結により液体Bioisoprene(商標)を得る、発酵オフガス流からイソプレンをストリッピングすることに関与する2つの工程操作における一連の4つの14−Lスケールの発酵から回収した(図166Aおよび166B)。4つの発酵槽に産出されたBioisoprene(商標)の総量は1150g(16.9mol)であり、このうち953g(14mol、83%)を炭素フィルターにより吸着した。蒸気の脱離/凝結工程後、回収した液体Bioisoprene(商標)量は810gであり、これは全回収率の70%相当である。回収したBioisoprene(商標)中の不純物の存在について分析した。
Bioisoprene(商標)液体の分析および不純物プロファイル
回収したBioisoprene(商標)液体をGC/MSおよびガスクロマトグラフィー/水素炎イオン化検出(GC/FID)により分析して、不純物の性質およびレベルを決定した。産物は純度99.5%超であり、多くの少量成分に加えていくつかの優勢な不純物を含んでいることが測定された。GC/FIDクロマトグラムを図167に示し、典型的レベルの不純物を表21に示す。不純物プロファイルは、このスケールで産出した他のBioisoprene(商標)バッチに類似していた。
Bioisoprene(商標)のいくつかのバッチに見られる不純物の性質およびレベルの概要。
吸着材処理によるBioisoprene(商標)の精製
吸着材は、炭化水素供給原料からの微量不純物の除去のための産業により広範囲に使用されている。適切な吸着材としては、ゼオライト、アルミナおよびシリカベース材料が挙げられる。Bioisoprene(商標)は、シリカゲルに通過させることにより、少ない範囲のアルミナで実質的に精製できる。図168に、処理前(A)ならびにアルミナ処理後(B)もしくはシリカ処理後(C)のBioisoprene(商標)試料のGC/FIDクロマトグラムを示す。BASFからのSelexsorb(商標)吸着産物は、Bioisoprene(商標)からの極性不純物の除去のための選択の吸着材の1つである。具体的には、イソプレンおよびブタジエン供給原料からの極性不純物の除去において実績のある用途を考慮すると、Selexsorb CDおよびCDX産物が好ましい。
実施例30:Bioisoprene(商標)の化学的変換
Sigma Aldrich Corp (WI, USA)から受けとった化学物質および溶媒を使用した。Bioisoprene(商標)は、イソプレンシンターゼおよび異種メバロン酸(MVA)イソプレン前駆体生合成経路を発現する大腸菌BL21菌株の発酵により産出された。Bioisopreneを活性炭へ吸着させて発酵オフガスから回収してから、蒸気を脱離および凝結させて粗液体Bioisopreneを得た。Bioisopreneは使用直前に分別蒸留により精製した。
1H NMR分析
プロトン(1H)核磁気共鳴(NMR)スペクトルをVarian VNMRS 500MHz NMRシステム上で記録した。特に断りのない限り、テトラメチルシラン(TMS、0ppm)またはクロロホルム(CHCl3、7,26ppm)を全てのNMRスペクトルの基準とし、ピーク周波数はppmで記録する。試料は重水素化クロロホルム(CDCl3)またはメタノール(CD3OD)のいずれかで測定した。
GC/MS分析
ヘッドスペースモードで操作するCTC alystics(Switzerland) CombiPALオートサンプラーを接続したAgilent 6890 GC/MSシステムを用いて分析を行なった。分析物の分離にはAgilent HP−5MS GC/MSカラム(30m×0.25mm;0.25μm膜厚)を用いた。10μL液体シリンジから1μLの液体試料を注入するようにオートサンプラーを設定する。GC/MS法では、キャリアガスとして1ml/分の流量でヘリウムを用いた。注入口を250℃に保ち、分割比を100:1とする。オーブンプログラムを50℃2分間から開始し、25℃/分の速度で225℃に上昇させてから1分間保ち、総実行時間10分とした。m/z 29〜500でのスキャンモードでAgilent 5793N質量選択検出器を操作した。1.5分の溶媒遅延化を用いた。これらの条件下で、イソプレン(2−メチル−1,3−ブタジエン)は、0.675分で溶出することが観察された。
GC/FID分析
液体モードで操作するCTC alystics(Switzerland) CombiPALオートサンプラーを接続したAgilent 6890 GC/FIDシステムを用いて分析を行なった。分析物の分離にはアジレントDB−石油GCカラム(100m×0.25mm;0.50μm膜厚)を用いた。10μL液体シリンジから1μLの液体試料を注入するようにオートサンプラーを設定する。GC/FID方法には、ヘリウムを担体ガスとして流速1mL/分で用いた。注射ポートを分割比50:1で200℃に保った。オーブンプログラムを50℃15分間から開始し、25℃/分の速度で250℃に上昇させてから10分間保ち、総実行時間33分とした。FID検出器を定常補給モードで、水素流35mL/分および空気流250mL/分で280℃で保った。これらの条件下で、イソプレン(2−メチル−1,3−ブタジエン)は、13.54分で溶出することが観察された。
I.熱ディールス・アルダー環付加を介した環状イソプレン二量体の調製
イソプレン(1.02g、0.015モル)を熱ポリマー化の阻害剤として、2,6−ジ−tert−ブチル−4−メチルフェノール(0.165g、0.05モル)作用の存在下、150℃で24時間加熱した。反応前に真空オーブン内で24時間乾燥させた密閉ガラス製厚壁反応容器内で反応を実施した。磁気撹拌子を用いて反応混合物を撹拌した。マススペクトルメータ検出器(GC−MS)でガスクロマトグラフィーにより反応進行をモニタリングした。反応完了後、ヘキサンを溶出剤としたシリカゲルクロマトグラフィーを用いて、生成した異性体混合物を精製した。回転真空蒸発器上で濃縮した後、生成物をGC−MSおよび1H−NMRにより分析した。GC−MS:生成物A:5.17、5.19分;生成物B:5.72、5.74分;生成物C:6.11分。1H−NMR(CDCl3)δ:5.8(m);5.4(m);4.95(m);2.4−1.2(m)。
II.Pd触媒オリゴマー化を介したイソプレンオリゴマーの調製
密閉ガラス製厚壁反応容器内でイソプレン(2.03g、0.03モル)をイソプロパノール(1.79g、0.03モル)と混合した。反応前にガラス製チャンバーを真空オーブン内で24時間乾燥させた。試薬は全て不活性窒素大気下で移した。パラジウムアセチルアセトネート(0.55mg、0.06mmol)およびトリフェニルホスフィン(1.49mg、0.19mmol)を反応混合物に添加した。次いで磁気撹拌子を介して混合しながら反応チャンバーを100℃に24時間加熱した。反応過程をGC−MSにより分析した。反応完了後、ヘキサンを溶出剤として用いたシリカゲルカラムクロマトグラフィーにより生成物を単離した。最終生成物をGC−MSおよび1H−NMR分光学により分析した。GC−MS:生成物A:5.54分;生成物B:6.6分;生成物C:6.85分。
III.不飽和化合物の水素化
磁気撹拌子を備えて、水素化触媒(Pd/C、5重量%)(0.21g、0.1mmol)を含むガラス製チャンバーに実施例2において得られた異性体の混合物(1.36g、0.01mole)を入れる。ガラス器具は全て、実験操作前に真空乾燥する。水素ガスを系に導入して、圧力を3atmで保つ。数時間後、反応混合物Pd/Cを反応混合物から濾過し、シリカゲルクロマトグラフィーを用いて生成物を分離する。最終分析は、GC−MSおよびNMRを用いて行なう。
IV.イソプレンのエトキシル化誘導体の調製
磁気撹拌子を備えたガラス製厚壁チャンバー内でイソプレン(0.982g、0.014モル)を無水エタノール(0.665g、0.014mol)と混合した。触媒量の濃硫酸を反応混合物に添加してから、85℃で一晩撹拌した。反応進行をGC−MSによりモニタリングした。16時間加熱後、GC−MSトレースにより以下の保持時間の異性体の混合物の存在を明らかにした:生成物A:2.66分m/z
+=99;生成物B:3.88m/z
+=99,114;生成物C:5.41分、m/z
+=87,99,114。
V.ルテニウム触媒を用いたイソプレンのC10環状二量体への変換
イソプレンのC10環状二量体への変換はジメチル−シクロオクタジエン混合物へのルテニウム触媒を用いて優れた収率で達成されている(Itoh, Kenji; Masuda, Katsuyuki; Fukahori, Takahiko; Nakano, Katsumasa; Aoki, Katsuyuki; Nagashima, Hideo, Organometallics (1994), 13(3), 1020−9)。非常に温和な温度(60℃ほどの低さ)で95%超の変換が報告されている。この触媒、ペンタメチルシクロペンタジエニルに基づくルテニウム有機金属化合物は、ルテニウムクロライド(RuCl
3)およびペンタメチルシクロペンタジエン(C
5Me
5H)を出発材料として用いて2つの容易な工程において調製できる。二量体化反応において、触媒は銀トリフレート(AgOTf)で活性化されて活性種を産出するが、他の活性化因子も同様に使用できる。
VI.クロム触媒を用いたイソプレンのC15三量体への変換
イソプレンのC15三量体への変換は、P−N−Pリガンド、N,N−ビス(ジアリールホスフィノ)アミンとクロム触媒を用いて実行できる。触媒は、in situ調製し、Bowen, L.; Charernsuk, M.; Wass, D.F. Chem. Commun. (2007) 2835−2837に記載されているようにMAOを用いて活性化する。線状産物と環状産物の混合物(3:1)からなるイソプレンのC15三量体への変換が中温(70℃)で高い(95%ほど)ことが報告されている。どの場合においても、4量体は大部分の他の産物として同定される。
VII.イソプレンの水素化
H−cube水素化機器(ThalesNano, Princeton, NJ, U.S.A.)を用いて、イソプレン(10%無水エタノール(v/v)溶液10mL)を連続式に2−メチルブタン(イソペンタン)に水素化した。イソプレン溶液は70℃で保った10%Pd/C触媒カートリッジを介して0.5mL/分でポンプした。1atm気圧で「完全モード」を用いて水素ガスを誘発した。産物を回収して、1H NMRおよびGC/FIDにより分析し、これによりイソプレンが2−メチルブタンへ変換し(収率90%超)、少量がモノ−オレフィンに一部水素化したことを確認した。1H NMR(500MHz、CDCl3):δ0.8(m、9H、CH3);1.12(m、2H、CH2);1.37(m、1H、CH)。GC/FID:2−メチルブタン;保持時間=12.69分。
VIII.イソプレンの一部水素化
Bioisoprene(商標)産物(50mL、0.5mol)をトルエン(200mL)と混合し、Midi−Cube水素化機器(ThalesNano, Budapest, Hungary)上、40℃および5bar水素圧で5%のPd/C触媒上で一部水素化した。基質流速は10mL/分であり、水素は125mL/分(5mmol/分)で送達された。機器を介して産物ストリームを2時間再利用後、産物のアリコートをGC/MSおよびGC/FIDにより分析したところ、イソペンタンおよび一部の未反応イソプレンに加えて、出発材料の大部分はイソアミレン(2−メチル−1−ブテン、2−メチル−2−ブテンおよび3−メチル−1−ブテン)の混合物に変換されたことが示された(図170)。
IX.Bioisoprene(商標)産物の選択的水素化
Bioisoprene(商標)産物は、卵殻Pd/δ−Al2O3触媒を用いて上の例に引用された条件下で選択的に水素化し、2−メチル−2−ブテンが総イソアミレンの50%超の割合を占める優勢な産物であり、3−メチル−1−ブテンが総イソアミレン産物の25%未満の割合を占める少量の産物であることがGC/MS分析により測定されたイソアミレンの混合物を得る。イソペンタンと残存イソプレンの量は総産物ストリームの10%未満の割合を占める。炭素触媒上で硫化パラジウムを用いて反応を実施した場合、類似した結果が得られる。
X.気相中のBioisoprene(商標)産物の部分的な水素化
Bioisoprene(商標)産物を含む乾燥ガスストリームをわずかに過剰の水素ガス(mol/mol)と混合し、ガス状混合物を不均一な水素化触媒、例えば、米国特許第20090203520号に記載されている高間隙容積でIB族促進パラジウム触媒に通し、Bioisoprene(商標)産物を得た発酵プロセスから得られた1以上の不純物とイソアミレンの混合物を産出する。変換は、0.5〜200bar範囲の圧力、および0℃〜200℃の温度で実行する。
XI.固体酸触媒でのイソアミレンの二量体化
2−メチル−2−ブテン(1.5mL)およびトルエン(4mL)をAmberlyst15酸樹脂(186mg)と室温で12時間撹拌した。アリコート(500μl)を反応混合物から取り出し、GCバイアルに移した。混合物の分析をGC/MSにより実施し(図171)、BioIsoFuel(商標)成分として適切なC10二量体(ジイソアミレン)への部分的な変換を明らかにした。
二量体化反応の産物(ジイソアミレン、C10ダイメート)は実施例30、第VII部に記載の条件下で、または当該技術分野で公知であるオレフィンのイソパラフィンへの水素化条件[例えば、Marichonna (2001)を参照されたい]を介して任意選択的に完全に水素化する。
XII.固体酸触媒でのBioisoprene(商標)産物のオリゴマー化
Bioisoprene(商標)単量体、2−メチル−2−ブテン(1.5mL)とトルエン(4mL)の混合物をAmberlyst15酸樹脂(186mg)と室温で12時間撹拌した。アリコート(500μl)を反応混合物から取り出し、GCバイアルに移した。混合物の分析をGC/MSにより実施し(図172)、イソプレン、線状、環状および芳香族C10、C15およびより高いオリゴマーからなる産物の複合混合物を明らかにした。
XIII.固体酸触媒でのBioisoprene(商標)産物の連続オリゴマー化
Bioisoprene(商標)単量体は、Amberlyst15イオン交換樹脂または等価触媒を含む二量体化リアクター内でC10二量体とC15三量体に連続的に変換する。Bioisoprene(商標)供給ストリームは、Bioisoprene(商標)単量体ならびに任意選択的にBioisoprene(商標)および共溶媒のC5誘導体を含む。本プロセスは、20〜200℃の温度範囲および0.5〜200bar圧で行なう。二量体化工程の産物は、第1の分別カラム中で画分化して、未反応イソプレンをより高い(C5超)オリゴマーから分離する。C5画分は、二量体化リアクターに戻し、C5より重い画分を第2の分別カラムに導入し、ここで所望のC10/C15画分を頭上ストリームから回収する。C15超のオリゴマーからなる底画分を、転換触媒、例えば、第2世代グラブスメタセシス触媒を含む重再利用リアクター内に供給する。図173に示すとおり、メタセシス触媒は、より高いオリゴマー画分部分をオレフィン交差メタセシスによってより軽い成分に変換してから反応物を分別カラム番号1に供給した。
全体として、本プロセスは、Bioisoprene単量体のC10二量体およびC15三量体BioIsoFuel(商標)前駆体への変換に至り、これは次いで実施例30、第VII部に記載の部分的または完全な水素化条件下に供する。生成した部分的または完全飽和化合物は、BioIsoFuel(商標)組成物としておよびBioIsoFuel(商標)混合ストックとして適切である。
実施例31 13 C/ 12 C同位体分析
13C分析は、ThermoFinnigan Delta Plus XP同位体比マススペクトロメータのための入り口としてCostech ECS4010 Elemental分析器を用いて、0.5〜1.0mg試料を炭素同位体の分析用の錫のカップに入れることにより行なうことができる。試料は1020℃で酸化第一コバルト/酸化第二コバルト燃焼反応器へ落ち、燃焼ガスは85mL/分のヘリウム流の中で銅反応器(650℃)を通り、NOxはN2となる。CO2とN2は、3−m 5Åモレキュラーシーブカラムを用いて分離する。次いで、T. B. Coplen et al, New Guidelines for δ13C Measurements, Anal. Chem., 78, 2439−2441 (2006)の2つの標準的なアプローチを用いてオフライン燃焼および二重吸気分析によりVPDB尺度に慎重に較正されている2つの実験室標準(Acetanilide B、−29.52±0.02‰mおよびトウモロコシデンプンA、−11.01±0.02‰)を用いて13C/12C比をVPDB尺度に較正する。Coplenの教示は、δ13C値測定技術を教示する目的のために、参照により本明細書に組み込まれる。
米国仮特許出願第61/133,521号(2008年6月30日出願)およびWO2010/05525A1号は、供給溶液のδ
13C値および様々な源(表22に掲載したものを含む)から得られるイソプレンのポリマーについて掲載している。
実施例32−例示的な燃料特性
表23は、本明細書に記載の方法を用いてイソプレンから作製できるある化合物の燃料特性を掲載する。
本明細書で提供する見出しは、本発明の様々な態様または実施形態を限定するものではない。本発明の様々な態様または実施形態は、本明細書を全体として参照することによって捉えることができる。
本明細書に引用されている刊行物、特許出願、および特許は全て、あたかも各々の個々の刊行物、特許出願、または特許が具体的かつ個別的に参照により組み込まれることが示されるように、参照により本明細書に組み込まれる。特に、本明細書に引用されている刊行物は全て、本発明に関連して使用し得る組成物および方法を説明および開示する目的で、参照により本明細書に明示的に組み込まれる。上述の発明は、理解を明確にするために説明や例によってある程度詳細に記載されているが、本発明の教示に照らして、添付の特許請求の範囲の精神または範囲を逸脱することなく、本発明を種々変更および修正し得ることが当業者には明白となるであろう。
別表1
例示的な1−デオキシ−D−キシロース−5−リン酸シンターゼ核酸およびポリペプチド