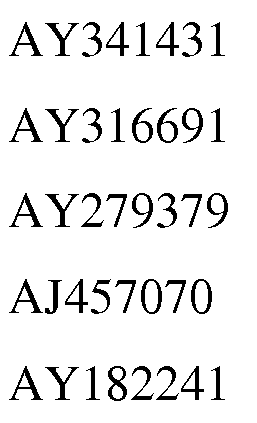하나의 양상에서, 본 발명은 증가된 양 및/또는 순도로의 이소프렌의 제조 방법 및 조성물을 특징으로 한다. 본원에 사용되는 바와 같이, 용어 "이소프렌" 또는 "2-메틸-1,3-부타디엔" (CAS# 78-79-5) 은 3,3-디메틸알릴 피로포스페이트 (DMAPP) 로부터의 피로포스페이트의 제거로부터 생성된 직접적 및 최종 휘발성 C5 탄화수소 생성물을 말하고, 하나 이상의 DMAPP 분자에 대한 하나 이상의 이소펜테닐 디포스페이트 (IPP) 분자의 연결 또는 중합을 포함하지 않는다.
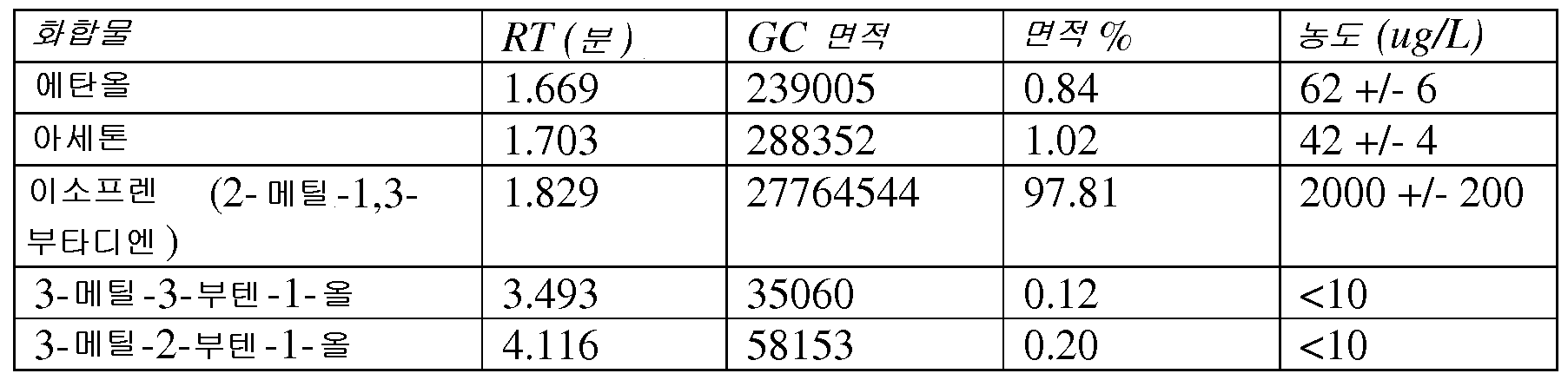
대부분의 이소프렌은 물질이 중합에 적합하기 전 집중적인 정제를 필요로 하는 불순한 C5 탄화수소 분획으로서 석유화학 공급원으로부터 유도된다. 여러 불순물은 이소프렌과의 구조적 유사성 및 중합 촉매 독성으로서 작용할 수 있다는 사실로 인해 특히 문제가 있다. 이러한 화합물에는 1,3-시클로펜타디엔, 시스- 및 트랜스-1,3-펜타디엔, 1-펜틴, 2-펜틴, 3-메틸-1-부틴, 트랜스-피페릴렌, 시스-피페릴렌, 펜트-4-엔-1-인, 트랜스-펜트-3-엔-1-인, 및 시스-펜트-3-엔-1-인 (도 90) 이 포함된다. 일부 구현예에서, 본 발명의 이소프렌 조성물은 임의의 오염 불포화 C5 탄화수소가 실질적으로 없다. 실시예 10 에 추가로 기재되는 바와 같이, 이소프렌 이외의 불포화 C5 탄화수소 (예컨대 1,3-시클로펜타디엔, 시스-1,3-펜타디엔, 트랜 스-1,3-펜타디엔, 1-펜틴, 2-펜틴, 1-펜텐, 2-메틸-1-부텐, 3-메틸-1-부틴, 트랜스-피페릴렌, 시스-피페릴렌, 펜트-4-엔-1-인, 트랜스-펜트-3-엔-1-인, 또는 시스-펜트-3-엔-1-인) 의 검출가능한 양이 본원에 기재된 방법을 사용하여 제조된 이소프렌 조성물에서 발견되지 않았다. 본원에 기재된 방법을 사용하여 제조된 일부 이소프렌 조성물은 GC/MS 분석에 의해 측정되는 바와 같이 에탄올, 아세톤, 및 C5 프레닐 알코올을 함유한다. 모든 이들 성분은 석유화학 공급원으로부터 유도된 이소프렌 조성물에 존재하는 이성질체 C5 탄화수소 분획보다 이소프렌 스트림으로부터 더욱 쉽게 제거된다. 따라서, 일부 구현예에서, 본 발명의 이소프렌 조성물은 중합 등급을 위해 최소의 처리를 필요로 한다.
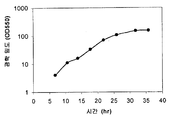
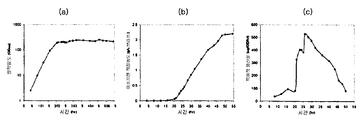
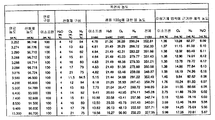
하나의 양상에서, 본 발명의 조성물 및 방법은 이소프렌 제조 속도를 증가시키고 제조되는 이소프렌의 총 양을 증가시킨다. 예를 들어, 4.8 × 104 nmole/gwcm/hr 의 이소프렌을 생성하는 세포 배양 시스템이 제조되었다 (표 1). 상기 시스템의 효율은 세포가 세포 배양 배지로부터 소모하는 탄소의 약 2.2% 를 이소프렌으로 전환킴으로써 입증된다. 실시예 및 표 2 에서 제시되는 바와 같이, 브로쓰 1 리터 당 대략 3 g 의 이소프렌이 생성되었다. 바람직한 경우, 예컨대 본원에 기재된 바와 같은 다른 조건을 사용하여 더욱 많은 양의 이소프렌이 수득될 수 있다. 일부 구현예에서, 재생가능 탄소원이 이소프렌의 제조에 사용된다. 일부 구현예에서, 이소프렌의 제조는 세포의 성장과 분리된다. 일부 구현예에서, 이소프렌의 농도 및 임의의 산화제는 이소프렌의 제조 또는 회수 동안 화재가 일어날 수 있는 위험을 감소 또는 제거시키기 위해 불연성 범위 내에 있다. 본 발명의 조성물 및 방법은 세포 당 고 이소프렌 수율, 고 탄소 수율, 고 이소프렌 순도, 고 생산성, 저 에너지 사용, 저 제조 비용 및 투자, 및 최소 부작용을 허용케 하므로 바람직하다. 이소프렌 제조를 위한 상기 효율적인, 대규모, 생합성 방법은 합성 이소프렌-기재 고무를 위한 이소프렌 공급원을 제공하고, 천연 고무 사용에 대한 바람직한, 저비용 대안을 제공한다.
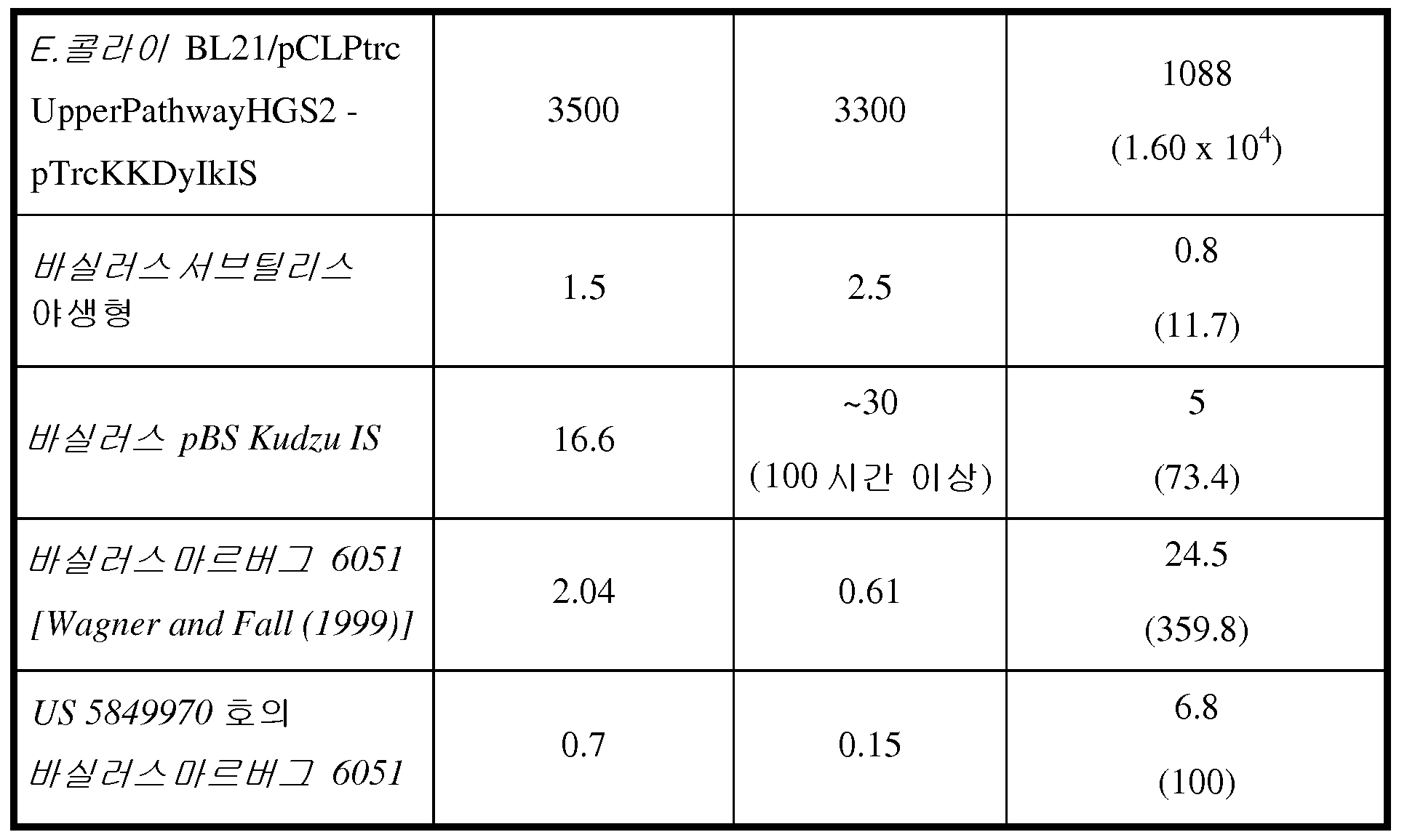
하기 추가 논의되는 바와 같이, 세포에 의해 제조된 이소프렌의 양은 이소프렌 합성효소 폴리펩티드 (예를 들어, 식물 이소프렌 합성효소 폴리펩티드) 를 코딩하는 이종 핵산을 세포 내에 도입함으로써 크게 증가될 수 있다. 이소프렌 합성효소 폴리펩티드는 디메틸알릴 디포스페이트 (DMAPP) 를 이소프렌으로 전환시킨다. 실시예에서 제시되는 바와 같이, 이종 푸에라리아 몬타나 (Pueraria Montana) (kudzu) 이소프렌 합성효소 폴리펩티드는 다양한 숙주 세포, 예컨대 에스케리챠 콜라이 (Escherichia coli), 판테오아 시트레아 (Panteoa citrea), 바실러스 서브틸리스 (Bacillus subtilis), 야로이야 리폴라이티카 (Yarrowia lipolytica), 및 트리코데르마 레에세이 (Trichoderma reesei) 에서 발현되었다. 모든 상기 세포는 이종 이소프렌 합성효소 폴리펩티드가 없는 상응하는 세포보다 더욱 많은 이소프렌을 제조한다. 표 1 및 2 에서 예증되는 바와 같이, 본원에 기재된 방법을 사용하여 다량의 이소프렌이 제조된다. 예를 들어, 이종 이소프렌 합성효소 핵산이 있는 B. 서브틸리스 세포는 이종 핵산이 없는 상응하는 대조군 B. 서브틸리스 세포보다 14 리터 발효기에서 대략 10 배 더 많은 이소프렌을 제조한다 (표 2). 발효기 내, E. 콜라이에 의한 브로쓰 1 리터 당 300 mg 의 이소프렌 (mg/L, 브로쓰의 부피에는 세포의 부피 및 세포 배지의 부피가 포함된다) 및 B. 서브틸리스에 의한 30 mg/L 의 제조는 현저한 양의 이소프렌이 제조될 수 있음을 나타낸다 (표 2). 바람직한 경우, 이소프렌은 더욱 큰 큐모로 제조될 수 있거나, 본원에 기재된 다른 조건이 이소프렌의 양을 추가로 증가시키기 위해 사용될 수 있다. 표 1 및 2 에 열거된 벡터 및 실험 조건은 하기 추가 상세한 사항 및 실시예 섹션에 기재되어 있다.
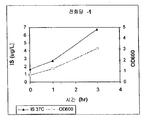
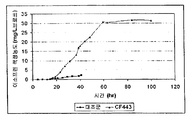
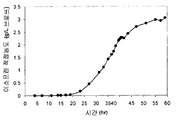
표 1: 본 발명의 세포 배양물 및 방법을 사용하는 진탕 플라스크로부터의 이소프렌의 예시적 수율. 이소프렌 제조 측정을 위한 어세이는 실시예 I, 파트 II 에 기재되어 있다. 본 어세이를 위해, 진탕 플라스크로부터 샘플을 1 회 이상의 시점에서 제거하고, 30 분 동안 배양하였다. 그 다음 본 샘플에서 제조된 이소프렌의 양을 측정하였다. 이소프렌 제조의 상부공간 농도 및 특이적 속도는 표 1 에 나열되어 있고 본원에서 추가로 기재된다.
* 액체 대 상부공간 부피비가 1:19 인 밀봉된 상부공간 바이알에서 1 시간 동안 배양된, 1 OD600 1 mL 로 표준화됨.
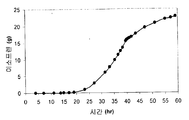
표 2: 본 발명의 세포 배양물 및 방법을 사용하는 발효기 내 이소프렌의 예시적 수율. 이소프렌 제조 측정을 위한 어세이는 실시예 I, 파트 II 에 기재되어 있다. 본 어세이를 위해, 발효기의 방출-기체의 샘플을 취하고, 이소프렌의 양에 대해 분석하였다. 피크 상부공간 농도 (발효 동안 최고 상부공간 농도임), 적정농도 (브로쓰 1 리터 당 제조되는 이소프렌의, 누적 총 양임), 및 이소프렌 제조의 피크 특이적 속도 (발효 동안 최고 특이적 속도임) 가 표 2 에 나열되고 본원에 추가로 기재되어 있다.
** 1 vvm (방출-기체 1 부피/1 L브로쓰/분) 의 방출-기체 흐름 속도에 표준화됨.
부가적으로는, 이종 이소프렌 합성효소 핵산을 함유하는 세포에 의한 이소프렌 제조는 세포에 의해 발현되는 1-데옥시-D-자일룰로오스-5-포스페이트 합성효소 (DXS) 폴리펩티드 및/또는 이소펜테닐 디포스페이트 이소머라아제 (IDI) 폴리펩티드의 양을 증가시킴으로써 향상될 수 있다. 예를 들어, DXS 핵산 및/또는 IDI 핵산은 세포 내에 도입될 수 있다. DXS 핵산은 이종 핵산 또는 내생 핵산의 이중 카피일 수 있다. 유사하게는, IDI 핵산은 이종 핵산 또는 내생 핵산의 이중 카피일 수 있다. 일부 구현예에서, DXS 및/또는 IDI 폴리펩티드의 양은 내생 DXS 및/또는 IDI 프로모터 또는 조절 영역을 DXS 및/또는 IDI 핵산의 더 큰 전사를 야기하는 기타 프로모터 및/또는 조절 영역으로 대체함으로써 증가된다. 일부 구현예에서, 세포는 이소프렌 합성효소 폴리펩티드를 코딩하는 이종 핵산 (예를 들어, 식물 이소프렌 합성효소 핵산) 및 이소프렌 합성효소 폴리펩티드를 코딩하는 내생 핵산의 이중 카피 모두를 함유한다.
코딩된 DXS 및 IDI 폴리펩티드는 이소프렌의 생합성을 위한 DXP 경로의 일부이다 (도 19). DXS 폴리펩티드는 피루베이트 및 D-글리세르알데하이드-3-포스페이트를 1-데옥시-D-자일룰로오스-5-포스페이트로 전환시킨다. 임의의 특정 이론에 얽매이는 것으로 의도되지 않으면서, DXS 폴리펩티드의 양의 증가가 DXP 경로를 통해 탄소의 흐름을 증가시켜, 더 큰 이소프렌 제조를 야기하는 것으로 여겨진다. IDI 폴리펩티드는 이소펜테닐 디포스페이트 (IPP) 와 디메틸알릴 디포스페이트 (DMAPP) 의 상호전환을 촉매화한다. 임의의 특정 이론에 얽매이는 것으로 의도되지 않으면서, 세포 내 IDI 폴리펩티드의 양의 증가가 DMAPP 로 전환되고, 그 후 이소프렌으로 전환되는 IPP 의 양 (및 전환 속도) 을 증가시키는 것으로 여겨진다.
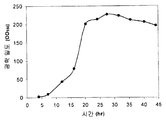
예를 들어, kudzu 이소프렌 합성효소, S. 세레비지아 IDI, 및 E. 콜라이 DXS 핵산을 가진 E. 콜라이 세포의 발효를 이소프렌 제조에 사용하였다. 이소프렌 수준은 15 시간의 시간 동안 50 내지 300 ㎍/L 로 변하였다 (실시예 7, 파트 VII).
일부 구현예에서, 이종 또는 추가의 내생 이소프렌 합성효소, IDI, 및 DXS 핵산의 존재는 이들 이종 또는 추가의 내생 핵산 중 오직 1 개 또는 2 개를 갖는 상응하는 세포와 비교하여, 세포를 더욱 재생가능하게 성장시키고 더욱 장기간 생존가능하게 남아있게 한다. 예를 들어, 이종 이소프렌 합성효소, IDI, 및 DXS 핵산을 함유하는 세포는 이종 이소프렌 합성효소 및 DXS 핵산 만을 갖는 세포 또는 이종 이소프렌 합성효소 핵산 만을 갖는 세포보다 잘 성장하였다. 또한, 이종 이소프렌 합성효소, IDI, 및 DXS 핵산은 E. 콜라이 세포에 의해 유지되었던 고 카피 플라스미드 상의 강한 프로모터에 성공적으로 작동가능하게 연결되어 있고, 이것은 다량의 상기 폴리펩티드가 세포에게 과량의 독성을 유발하지 않으면서 세포에서 발현될 수 있음을 암시한다. 임의의 특정 이론에 얽매이는 것으로 의도되지 않으면서, 이종 또는 추가의 내생 이소프렌 합성효소 및 IDI 핵산의 존재가, 세포에 오직 이종 또는 추가의 내생 DXS 핵산 만이 존재했을 경우 축적될 것인 하나 이상의 잠재적으로 독성인 중간체의 양을 감소시킬 수 있을 것으로 여겨진다.
일부 구현예에서, 이종 이소프렌 합성효소 핵산을 함유하는 세포에 의한 이소프렌의 제조는 세포에 의해 발현된 MVA 폴리펩티드의 양을 증가시킴으로써 증가된다 (도 19). 예시적 MVA 경로 폴리펩티드에는 하기 폴리펩티드 중 임의의 것이 포함된다: 아세틸-CoA 아세틸트랜스페라아제 (AA-CoA 티올라아제) 폴리펩티드, 3-히드록시-3-메틸글루타릴-CoA 합성효소 (HMG-CoA 합성효소) 폴리펩티드, 3-히드록시-3-메틸글루타릴-CoA 리덕타아제 (HMG-CoA 리덕타아제) 폴리펩티드, 메발로네이트 키나아제 (MVK) 폴리펩티드, 포스포메발로네이트 키나아제 (PMK) 폴리펩티드, 디포스포메발로네이트 데카르복실라아제 (MVD) 폴리펩티드, IDI 폴리펩티드, 및 2 개 이상의 MVA 경로 폴리펩티드의 활성을 갖는 폴리펩티드 (예를 들어, 융합 폴리펩티드). 예를 들어, 하나 이상의 MVA 경로 핵산이 세포 내에 도입될 수 있다. 일부 구현예에서, 세포는 AA-CoA 티올라아제, HMG-CoA 합성효소, 및 HMG-CoA 리덕타아제 핵산을 포함하는 상위 MVA 경로를 함유한다. 일부 구현예에서, 세포는 MVK, PMK, MVD, 및 IDI 핵산을 포함하는 하위 MVA 경로를 함유한다. 일부 구현예에서, 세포는 AA-CoA 티올라아제, HMG-CoA 합성효소, HMG-CoA 리덕타아제, MVK, PMK, MVD, 및 IDI 핵산을 포함하는 전체 MVA 경로를 함유한다. MVA 경로 핵산은 이종 핵산 또는 내생 핵산의 이중 카피일 수 있다. 일부 구현예에서, 하나 이상의 MVA 경로 폴리펩티드의 양은 MVA 경로 핵산에 대한 내생 프로모터 또는 조절 영역을 MVA 경로 핵산의 더 큰 전사를 유발하는 기타 프로모터 및/또는 조절 영역으로 대체함으로써 증가된다. 일부 구현예에서, 세포는 이소프렌 합성효소 폴리펩티드를 코딩하는 이종 핵산 (예를 들어, 식물 이소프렌 합성효소 핵산) 및 이소프렌 합성효소 폴리펩티드를 코딩하는 내생 핵산의 이중 카피 모두를 함유한다.
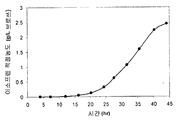
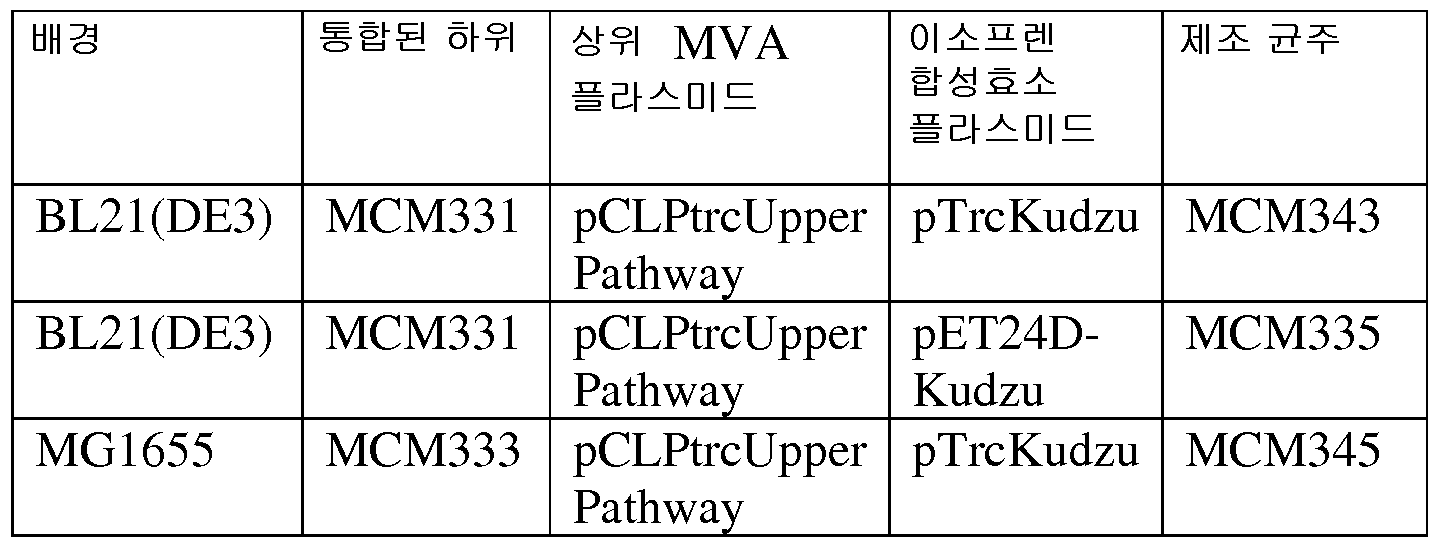
예를 들어, kudzu 이소프렌 합성효소 폴리펩티드를 코딩하는 핵산 및 사카로마이세스 세레비지아 (Saccharomyces cerevisia) MVK, PMK, MVD, 및 IDI 폴리펩티드를 코딩하는 핵산을 함유하는 E. 콜라이 세포는 이소프렌을 6.67 × 10-4 mol/L브로쓰/OD600/hr 의 속도로 제조하였다 (실시예 8 참조). 부가적으로는, 엔테로코쿠스 파에칼리스 (Enterococcus faecalis) AA-CoA 티올라아제, HMG-CoA 합성효소, 및 HMG-CoA 리덕타아제 폴리펩티드를 코딩하는 핵산을 갖는 E. 콜라이 세포의 14 리터 발효는 22 그램의 메발론산 (MVA 경로의 중간체) 을 제조하였다. 상기 세포의 진탕 플라스크는 리터 당 2-4 그램의 메발론산을 제조하였다. 이 결과는 이종 MVA 경로 핵산이 E. 콜라이에서 활성임을 나타낸다. 상위 MVA 경로 및 하위 MVA 경로 모두, 뿐 아니라 kudzu 이소프렌 합성효소에 대한 핵산을 함유하는 E. 콜라이 세포 (균주 MCM 127) 는 오직 하위 MVA 경로 및 kudzu 이소프렌 합성효소에 대한 핵산을 갖는 E. 콜라이 세포와 비교하여 (균주 MCM 131) 유의하게 많은 이소프렌 (874 ug/L) 을 제조하였다 (표 3 및 실시예 8, 파트 VIII 참조).
일부 구현예에서, 세포의 일부 이상은 연속 배양물 (예컨대 희석 없는 연속 배양물) 에서 약 5, 10, 20, 50, 75, 100, 200, 300, 이상의 세포 분열에 대해 이종 이소프렌 합성효소, DXS, IDI, 및/또는 MVA 경로 핵산을 유지한다. 본 발명의 임의의 양상의 일부 구현예에서, 내생 이소프렌 합성효소, DXS, IDI, 및/또는 MVA 경로 핵산의 이종 또는 이중 카피를 포함하는 핵산은 또한 선별 마커, 예컨대 카나마이신, 암피실린, 카르베니실린, 젠타마이신, 하이그로마이신, 플레오마이신, 블레오마이신, 네오마이신, 또는 클로르암페니콜 항생제 내성 핵산을 포함한다.
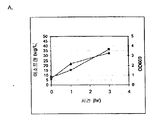
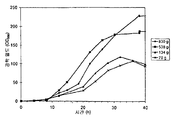
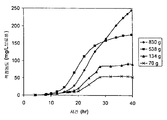
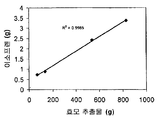
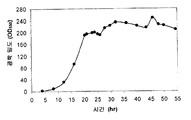
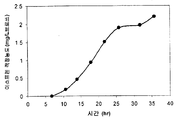
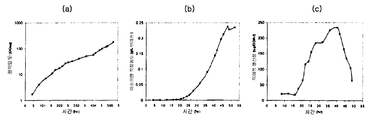
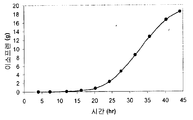
실시예 7, 파트 VI 에서 나타내는 바와 같이, 제조되는 이소프렌의 양은 효모 추출물을 세포 배양 배지에 첨가함으로써 추가로 증가될 수 있다. 본 실시예에서, 제조되는 이소프렌의 양은 시험된 농도에 대해 세포 배지 내 효모 추출물의 양에 선형 비례하였다 (도 48C). 부가적으로는, 브로쓰 1 리터 당 대략 0.11 그램의 이소프렌을 효모 추출물 및 글루코오스가 있는 세포 배지로부터 제조하였다 (실시예 7, 파트 VIII). 상기 실험 모두는 이소프렌을 제조하기 위해 kudzu 이소프렌 합성효소, S. 세레비지아 IDI, 및 E. 콜라이 DXS 핵산을 갖는 E. 콜라이 세포를 사용하였다. 글루코오스의 존재하에서의 효모 추출물의 양의 증가는 효모 추출물의 존재하에서의 글루코오스의 양의 증가보다 더 많은 이소프렌이 제조되도록 하였다. 또한, 효모 추출물 양의 증가는 세포에게 더 긴 시간 동안 높은 수준의 이소프렌을 제조하게 하였고, 세포의 건강을 향상시켰다.
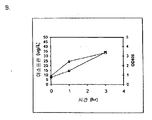
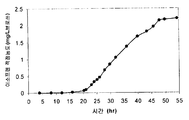
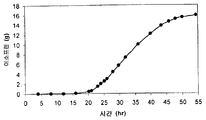
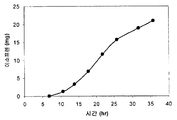
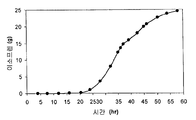
또한 탄소원으로서 3 가지 유형의 가수분해된 바이오매스 (버개스, 옥수수 대, 및 침엽수 펄프) 를 사용하여 이소프렌 제조를 입증하였다 (도 46A-C). kudzu 이소프렌 합성효소, S. 세레비지아 IDI, 및 E. 콜라이 DXS 핵산을 갖는 E. 콜라이 세포는 동등량의 글루코오스로부터 생성된 것만큼의 이소프렌을 상기 가수분해된 바이오매스 탄소원으로부터 제조하였다 (예를 들어, 1% 글루코오스, w/v). 바람직한 경우, 임의의 기타 바이오매스 탄소원이 본 발명의 조성물 및 방법에 사용될 수 있다. 바이오매스 탄소원은 많은 통상적인 세포 배지보다 값싸기 때문에 바이오매스 탄소원이 바람직하고, 이로 인해 이소프렌의 경제적인 제조를 용이하게 한다.
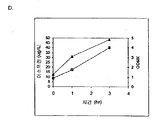
부가적으로는, 전화당은 이소프렌 발생을 위한 탄소원으로서 기능하는 것으로 제시되었다 (도 47C 및 96-98). 예를 들어, 2.4 g/L 의 이소프렌을 MVA 경로 폴리펩티드 및 Kudzu 이소프렌 합성효소를 발현하는 세포로부터 제조하였다 (실시예 8, 파트 XV). 글리세롤은 또한 Kudzu 이소프렌 합성효소를 발현하는 세포로부터 2.2 mg/L 의 이소프렌 발생을 위한 탄소원으로서 사용되었다 (실시예 8, 파트 XIV). 이소프렌 합성효소 핵산 외에 DXS 핵산, IDI 핵산, 및/또는 하나 이상의 MVA 경로 핵산 (예컨대, 전체 MVA 경로를 코딩하는 핵산) 을 발현하는 것은 글리세롤로부터 이소프렌의 제조를 증가시킬 수 있다.
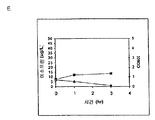
일부 구현예에서, 오일이 세포 배지에 포함된다. 예를 들어, 오일 및 글루코오스 공급원을 함유하는 세포 배지에서 배양되는 경우 kudzu 이소프렌 합성효소 핵산을 함유하는 B. 서브틸리스 세포는 이소프렌을 제조하였다 (실시예 4, 파트 III). 일부 구현예에서, 1 개 초과의 오일 (예컨대 2, 3, 4, 5 개 이상의 오일) 이 세포 배지에 포함된다. 임의의 특정 이론에 얽매이는 것으로 의도되지 않으면서, (i) 오일은 이소프렌으로의 전환에 이용가능한 세포 내 탄소의 양을 증가시킬 수 있고, (ii) 오일은 세포 내 아세틸-CoA 의 양을 증가시켜, MVA 경로를 통한 탄소 흐름을 증가시킬 수 있고, 및/또는 (ii) 오일은 세포에 추가 영양분을 제공할 수 있으며, 이것은 세포 내의 많은 탄소가 다른 생성물보다 이소프렌으로 전환되므로 바람직한 것으로 여겨진다. 일부 구현예에서, 오일을 함유하는 세포 배지에서 배양된 세포는 이소프렌을 제조하기 위해 자연적으로 MVA 경로를 사용하고, 전체 MVA 경로에 대한 핵산을 함유하도록 유전적으로 개질된다. 일부 구현예에서, 오일은 숙주 세포에 의해 오일의 사용을 용이하게 하기 위해 세포 배양 배지에 첨가되기 전에 부분적으로 또는 완전히 가수분해된다.
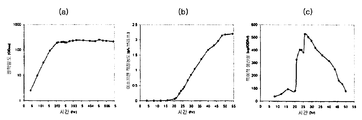
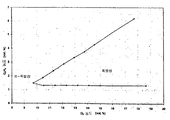
세포 (예를 들어, 박테리아) 내 이소프렌과 같은 소형 분자의 상업적 제조에 대한 주요 장애 중 하나는 분자 제조를 세포의 성장과 분리시키는 것이다. 이소프렌의 상업적으로 실행가능한 제조를 위한 일부 구현예에서, 공급원료로부터의 상당한 양의 탄소가 세포의 성장 및 유지 ("탄소 효율") 보다, 이소프렌으로 전환된다. 다양한 구현예에서, 세포는 세포 배양 배지 내 탄소의 약 0.0015, 0.002, 0.005, 0.01, 0.02, 0.05, 0.1, 0.12, 0.14, 0.16, 0.2, 0.3, 0.4, 0.5, 0.6, 0.7, 0.8, 0.9, 1.0, 1.2, 1.4, 1.6, 1.8, 2.0, 2.5, 3.0, 3.5, 4.0, 5.0, 6.0, 7.0, 또는 8.0% 이상을 이소프렌으로 전환시킨다. 특정 구현예에서, 하류방향 생성물로 전환된 공급원료로부터의 탄소의 상당한 부분이 이소프렌으로 전환된다. 실시예 11 에 추가로 기재되는 바와 같이, MVA 경로 및 kudzu 이소프렌 합성효소 핵산을 발현하는 E. 콜라이 세포는 이소프렌 또는 중간체 메발론산 제조와 성장과의 분리를 보여, 높은 탄소 효율을 야기한다. 특히, 메발론산은 엔테로코쿠스 파에칼리스 (Enterococcus faecalis) 로부터의 상위 MVA 경로를 발현하는 세포로부터 형성되었다. 이소프렌은 엔테로코쿠스 파에칼리스 (Enterococcus faecalis) 로부터의 상위 MVA 경로, 사카로마이세스 세레비지아에 (Saccharomyces cerevisiae) 로부터의 하위 MVA 경로, 및 푸에라리아 몬타나 (Pueraria montana) (Kudzu) 로부터의 이소프렌 합성효소를 발현하는 세포로부터 형성되었다. 이러한 이소프렌 또는 메발론산 제조와 성장과의 분리는 E. 콜라이의 4 가지 상이한 균주: BL21(LDE3), BL21(LDE3) 튜너 (Tuner), FM5, 및 MG1655 에서 입증되었다. 첫번째 2 개의 E. 콜라이 균주는 B 균주이고, 나머지 2 개는 K12 균주이다. 제조와 성장과의 분리는 또한 ack 및 pta 유전자가 결실된 MG1655 의 변이체에서 입증되었다. 상기 변이체는 또한 아세테이트의 제조가 적은 것이 입증되었다.
예시적 폴리펩티드 및 핵산
다양한 이소프렌 합성효소, DXS, IDI, 및/또는 MVA 경로 폴리펩티드 및 핵산이 본 발명의 조성물 및 방법에 사용될 수 있다.
본원에 사용되는 바와 같이, "폴리펩티드" 에는 폴리펩티드, 단백질, 펩티드, 폴리펩티드의 분절, 및 융합 폴리펩티드가 포함된다. 일부 구현예에서, 융합 폴리펩티드에는 첫번째 폴리펩티드의 일부 또는 전부 (예를 들어, 이소프렌 합성효소, DXS, IDI, 또는 MVA 경로 폴리펩티드 또는 이의 촉매적으로 활성인 분절) 가 포함되고, 임의로 제 2 폴리펩티드의 일부 또는 전부 (예를 들어, 융합 폴리펩티드의 정제 또는 결실을 용이하게 하는 펩티드, 예컨대 His-태그) 가 포함될 수 있다. 일부 구현예에서, 융합 폴리펩티드는 2 개 이상의 MVA 경로 폴리펩티드 (예컨대, AA-CoA 티올라아제 및 HMG-CoA 리덕타아제 폴리펩티드) 의 활성을 갖는다. 일부 구현예에서, 폴리펩티드는 2 개 이상의 MVA 경로 폴리펩티드의 활성을 갖는 자연 발생적 폴리펩티드 (예컨대, 엔테로코쿠스 파에칼리스 (Enterococcus faecalis) mvaE 핵산에 의해 코딩된 폴리펩티드) 이다.
다양한 구현예에서, 폴리펩티드는 약 50, 100, 150, 175, 200, 250, 300, 350, 400 개 이상의 아미노산을 갖는다. 일부 구현예에서, 폴리펩티드 분절은 전장 폴리펩티드로부터 약 25, 50, 75, 100, 150, 200, 300 개 이상의 인접 아미노산을 함유하고, 상응하는 전장 폴리펩티드의 활성의 약 5%, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95%, 또는 100% 이상을 갖는다. 특정 구현예에서, 폴리펩티드에는 임의의 자연 발생적 이소프렌 합성효소, DXS, IDI, 또는 MVA 경로 폴리펩티드의 전체 아미노산 서열 또는 절편이 포함된다. 일부 구현예에서, 폴리펩티드는 야생형 (즉, 자연 발생적 서열) 이소프렌 합성효소, DXS, IDI, 또는 MVA 경로 폴리펩티드의 서열과 비교하여 하나 이상의 돌연변이를 갖는다.
일부 구현예에서, 폴리펩티드는 단리된 폴리펩티드이다. 본원에 사용되는 바와 같이, "단리된 폴리펩티드" 는 폴리펩티드의 라이브러리, 예컨대 2, 5, 10, 20, 50 이상의 상이한 폴리펩티드의 라이브러리의 일부가 아니고, 자연적으로 발생하는 하나 이상의 성분과 분리된다. 단리된 폴리펩티드는 예를 들어, 폴리펩티드를 코딩하는 재조합 핵산의 발현에 의해 수득될 수 있다.
일부 구현예에서, 폴리펩티드는 이종 폴리펩티드이다. "이종 폴리펩티드" 는 그의 아미노산 서열이 동일한 숙주 세포에서 자연적으로 발현되는 또다른 폴리펩티드의 서열과 일치하지 않는 폴리펩티드를 의미한다. 특히, 이종 폴리펩티드는 자연에서 동일한 숙주 세포에서 발견되는 야생형 핵산과 일치하지 않는다.
본원에 사용되는 바와 같이, "핵산" 은 단일 또는 이중 가닥 형태의 2 개 이상의 데옥시리보뉴클레오티드 및/또는 리보뉴클레오티드를 말한다. 일부 구현예에서, 핵산은 재조합 핵산이다. "재조합 핵산" 은 관심의 핵산이 유래한 유기체의 자연에서 발생되는 게놈 내에, 관심의 핵산 측면에 있는 하나 이상의 핵산 (예를 들어, 유전자) 이 없는 관심의 핵산을 의미한다. 그러므로 용어에는 예를 들어, 벡터 내에, 자가 복제성 플라스미드 또는 바이러스 내에, 또는 원핵생물 또는 진핵생물의 게놈 DNA 내에 도입된, 또는 다른 서열과 독립적인 개별 분자 (예를 들어, cDNA, 게놈 DNA 분절, 또는 PCR 또는 제한 엔도뉴클레아제 소화에 의해 제조된 cDNA 분절) 로서 존재하는 재조합 DNA 가 포함된다. 다양한 구현예에서, 핵산은 재조합 핵산이다. 일부 구현예에서, 이소프렌 합성효소, DXS, IDI, 또는 MVA 경로 핵산은, 재조합 핵산이 이소프렌 합성효소, DXS, IDI, 또는 MVA 경로 폴리펩티드 및 또다른 폴리펩티드의 전부 또는 일부 (예를 들어, 융합 폴리펩티드의 정제 또는 결실을 용이하게 하는 펩티드, 예컨대 His-태그) 를 포함하는 융합 폴리펩티드를 코딩하도록 또다른 폴리펩티드의 전부 또는 일부를 코딩하는 또다른 핵산에 작동가능하게 연결된다. 일부 구현예에서, 재조합 핵산의 일부 또는 전부는 화학적으로 합성된다.
일부 구현예에서, 핵산은 이종 핵산이다. "이종 핵산" 은 그의 핵산 서열이 동일한 숙주 세포에서 자연적으로 발견되는 또다른 핵산의 서열과 일치하지 않는 핵산을 의미한다.
특정 구현예에서, 핵산에는 임의의 자연 발생적 이소프렌 합성효소, DXS, IDI, 또는 MVA 경로 핵산의 전체 핵산 서열 또는 절편이 포함된다. 일부 구현예에서, 핵산에는 자연 발생적 이소프렌 합성효소 핵산 DXS, IDI, 또는 MVA 경로 핵산으로부터 약 50, 100, 150, 200, 300, 400, 500, 600, 700, 800 개 이상의 인접 뉴클레오티드가 포함된다. 일부 구현예에서, 핵산은 야생형 (즉, 자연에서 발생하는 서열) 이소프렌 합성효소, DXS, IDI, 또는 MVA 경로 핵산의 서열과 비교하여 하나 이상의 돌연변이를 갖는다. 일부 구현예에서, 핵산은 이소프렌 합성효소, DXS, IDI, 또는 MVA 경로 핵산의 전사 또는 번역을 증가시키는 하나 이상의 돌연변이 (예를 들어, 묵음 돌연변이) 를 갖는다. 일부 구현예에서, 핵산은 이소프렌 합성효소, DXS, IDI, 또는 MVA 경로 폴리펩티드를 코딩하는 임의의 핵산의 축퇴 변이체이다.
"코돈 축퇴성" 은 코딩된 폴리펩티드의 아미노산 서열에 영향을 주지 않으면서 뉴클레오티드 서열의 변화를 가능하게 하는 유전적 코드의 다양성을 말한다. 당업자는 제공된 아미노산을 구체화하기 위한 뉴클레오티드 코돈의 사용에서 특이적 숙주 세포에 의해 나타내진 "코돈-편향" 을 잘 알고 있다. 그러므로, 숙주 세포에서 향상된 발현을 위해 핵산을 합성하는 경우, 일부 구현예에서, 코돈 사용 빈도가 숙주 세포의 바람직한 코돈 사용 빈도에 근접하도록 핵산을 디자인하는 것이 바람직하다.
예시적 이소프렌 합성효소, DXS, IDI, 및/또는 MVA 경로 폴리펩티드 및 핵산의 접근 번호는 부록 1 에 나열되어 있다 (부록 1 의 접근 번호 및 상응하는 서열은, 특히 이소프렌 합성효소, DXS, IDI, 및/또는 MVA 경로 폴리펩티드 및 핵산의 아미노산 및 핵산 서열에 대해, 본원에 그 전체가 참조로서 인용되어 있다). Kegg 데이터베이스는 또한 수 많은 예시적 이소프렌 합성효소, DXS, IDI, 및/또는 MVA 경로 폴리펩티드 및 핵산의 아미노산 및 핵산 서열 (예를 들어, 특히 이소프렌 합성효소, DXS, IDI, 및/또는 MVA 경로 폴리펩티드 및 핵산의 아미노산 및 핵산 서열과 관련하여, 전체가 본원에 각각 참조로서 인용된 "genome.jp/kegg/pathway/map/map00100.html" 웹사이트 및 그곳의 서열 참조) 을 함유한다. 일부 구현예에서, 이소프렌 합성효소, DXS, IDI, 및/또는 MVA 경로 폴리펩티드 및/또는 핵산 중 하나 이상은 부록 1 중의 임의의 접근 번호 또는 Kegg 데이터베이스에 존재하는 임의의 서열에 상응하는 임의의 서열과 같은 2007 년 12 월 12 일에 공개적으로 이용가능한 서열과 일치하는 서열을 갖는다. 부가적인 예시적 이소프렌 합성효소, DXS, IDI, 및/또는 MVA 경로 폴리펩티드 및 핵산은 하기에 추가로 기재되어 있다.
예시적 이소프렌 합성효소 폴리펩티드 및 핵산
상기 주지된 바와 같이, 이소프렌 합성효소 폴리펩티드는 디메틸알릴 디포스페이트 (DMAPP) 를 이소프렌으로 전환시킨다. 예시적 이소프렌 합성효소 폴리펩티드에는 폴리펩티드, 폴리펩티드의 분절, 펩티드, 및 이소프렌 합성효소 폴리펩티드의 하나 이상의 활성을 갖는 융합 폴리펩티드가 포함된다. 표준 방법은 시험관 내에서, 세포 추출물 내에서, 또는 생체 내에서 DMAPP 를 이소프렌으로 전환시키는 폴리펩티드의 능력을 측정함으로써 폴리펩티드가 이소프렌 합성효소 폴리펩티드 활성을 갖는지의 여부를 측정하는데 사용될 수 있다. 예시적 어세이에서, 세포 추출물은 실시예 1 에 기재된 바와 같은 진탕 플라스크 방법에서 균주 (예를 들어, 본원에 기재된 E. 콜라이/pTrcKudzu 균주) 를 성장시켜 조제된다. 유도 완료 후, 대략 10 mL 의 세포를 7000 × g 에서 10 분 동안의 원심분리에 의해 펠렛화하고, 글리세롤 없이 5 ml 의 PEB 에 재현탁시켰다. 표준 절차를 사용하여 프렌치 압력 셀 (French Pressure cell) 을 사용하여 세포를 용해시켰다. 대안적으로는, -80℃ 에서 동결/해동 후 세포에 라이소자임 (Ready-Lyse 라이소자임 용액; EpiCentre) 을 처리한다.
세포 추출물 내의 이소프렌 합성효소 폴리펩티드 활성은 예를 들어, 특히, 이소프렌 합성효소 폴리펩티드 활성에 대한 어세이에 대해, 전체가 각각 본원에 참조로서 인용된 문헌 [Silver et al., J. Biol. Chem. 270:13010-13016, 1995] 및 그곳의 참조에 기재된 바와 같이 측정될 수 있다. DMAPP (Sigma) 를 질소 스트림 하에서 건조 상태로 증발시키고, 100 mM 인산칼륨 완충액 (pH 8.2) 중 100 mM 의 농도로 재수화시켜, -20℃ 에 저장하였다. 어세이를 수행하기 위해, 5 ㎕ 의 1 M MgCl2, 1 mM (250 ㎍/ml) DMAPP, 65 ㎕ 의 식물 추출물 완충액 (PEB) (50 mM Tris-HCl, pH 8.0, 20 mM MgCl2, 5% 글리세롤, 및 2 mM DTT) 의 용액을 금속 스크류 캡 및 테플론 코팅 실리콘 격막을 가진 20 ml Headspace 바이알 (Agilent Technologies) 에 25 ㎕ 의 세포 추출물에 첨가하고, 37℃ 에서 15 분 동안 진탕하면서 배양하였다. 200 ㎕ 의 250 mM EDTA 를 첨가하여 반응을 켄칭하고, 실시예 1, 파트 II 에 기재된 바와 같이 GC/MS 에 의해 정량하였다.
예시적 이소프렌 합성효소 핵산에는 폴리펩티드, 폴리펩티드의 분절, 펩티드, 또는 이소프렌 합성효소 폴리펩티드의 하나 이상의 활성을 갖는 융합 폴리펩티드를 코딩하는 핵산이 포함된다. 예시적 이소프렌 합성효소 폴리펩티드 및 핵산에는 본원에 기재된 임의의 공급원 유기체로부터의 자연 발생적 폴리펩티드 및 핵산 뿐 아니라 본원에 기재된 임의의 공급원 유기체로부터 유래된 돌연변이체 폴리펩티드 및 핵산이 포함된다.
일부 구현예에서, 이소프렌 합성효소 폴리펩티드 또는 핵산은 파바세아에 (Fabaceae) 과, 예컨대 파보이데아에 (Faboideae) 아과로부터의 것이다. 일부 구현예에서, 이소프렌 합성효소 폴리펩티드 또는 핵산은, 특히, 이소프렌 합성효소 핵산 및 이소프렌 합성효소 폴리펩티드의 발현에 대해 각각 전체가 참조로서 인용된, 푸에라리아 몬타나 (Pueraria montana) (kudzu) (Sharkey et al., Plant Physiology 137: 700-712, 2005), 푸에라리아 로바타 (Pueraria lobata), 포플러 (예컨대, 포풀러스 알바 x 트레물라 (Populus alba x tremula) CAC35696) Miller et al., Planta 213: 483-487, 2001) 사시나무 (예컨대, 포풀러스 트레물로이데스 (Populus tremuloides) Silver et al, JBC 270(22): 13010-1316, 1995), 또는 영국산 오크 (English Oak) 퀘르쿠스 로부르 (Quercus robur) (Zimmer et al., WO 98/02550) 로부터의 자연 발생적 폴리펩티드 또는 핵산이다. 적합한 이소프렌 합성효소에는 특히 이소프렌 합성효소 핵산 및 폴리펩티드의 서열에 대해, 전체가 참조로서 각각 인용된 Genbank 접근 번호 AY341431, AY316691, AY279379, AJ457070, 및 AY182241 이 포함되나 이에 제한되는 것은 아니다. 일부 구현예에서, 이소프렌 합성효소 폴리펩티드 또는 핵산은 퀘르쿠스 로부르 (Quercus robur) 로부터의 자연 발생적 폴리펩티드 또는 핵산이 아니다 (즉, 이소프렌 합성효소 폴리펩티드 또는 핵산은 퀘르쿠스 로부르 (Quercus robur) 로부터의 자연 발생적 폴리펩티드 또는 핵산 이외의 이소프렌 합성효소 폴리펩티드 또는 핵산이다). 일부 구현예에서, 이소프렌 합성효소 핵산 또는 폴리펩티드는 포플러 (예컨대, 포풀러스 알바 x 트레물라 (Populus alba x tremula) CAC35696) 로부터의 자연 발생적 폴리펩티드 또는 핵산이 아니다.
예시적
DXS
폴리펩티드 및 핵산
상기 주지된 바와 같이, 1-데옥시-D-자일룰로오스-5-포스페이트 합성효소 (DXS) 폴리펩티드는 피루베이트 및 D-글리세르알데하이드-3-포스페이트를 1-데옥시-D-자일룰로오스-5-포스페이트로 전환시킨다. 예시적 DXS 폴리펩티드에는 폴리펩티드, 폴리펩티드의 분절, 펩티드, 및 DXS 폴리펩티드의 하나 이상의 활성을 가진 융합 폴리펩티드가 포함된다. 표준 방법 (예컨대 본원에 기재된 방법) 은 시험관 내에서, 세포 추출물 내에서, 또는 생체 내에서 피루베이트 및 D-글리세르알데하이드-3-포스페이트를 1-데옥시-D-자일룰로오스-5-포스페이트로 전환시키는 폴리펩티드의 능력을 측정함으로써 폴리펩티드가 DXS 폴리펩티드 활성을 갖는지를 측정하기 위해 사용될 수 있다. 예시적 DXS 핵산에는 폴리펩티드, 폴리펩티드의 분절, 펩티드, 또는 DXS 폴리펩티드의 하나 이상의 활성을 가진 융합 폴리펩티드를 코딩하는 핵산이 포함된다. 예시적 DXS 폴리펩티드 및 핵산에는 본원에 기재된 임의의 공급원 유기체로부터의 자연 발생적 폴리펩티드 및 핵산 뿐 아니라 본원에 기재된 임의의 공급원 유기체로부터 유래된 돌연변이체 폴리펩티드 및 핵산이 포함된다.
예시적
IDI
폴리펩티드 및 핵산
이소펜테닐 디포스페이트 이소머라아제 폴리펩티드 (이소펜테닐-디포스페이트 델타-이소머라아제 또는 IDI) 는 이소펜테닐 디포스페이트 (IPP) 및 디메틸알릴 디포스페이트 (DMAPP) 의 상호전환 (예를 들어, IPP 를 DMAPP 로 전환시킴 및/또는 DMAPP 를 IPP 로 전환시킴) 을 촉매화한다. 예시적 IDI 폴리펩티드에는 폴리펩티드, 폴리펩티드의 분절, 펩티드, 및 IDI 폴리펩티드의 하나 이상의 활성을 갖는 융합 폴리펩티드가 포함된다. 표준 방법 (예컨대 본원에 기재된 방법) 은 시험관 내에서, 세포 추출물 내에서, 또는 생체 내에서 IPP 및 DMAPP 를 상호전환시키는 폴리펩티드의 능력을 측정함으로써 폴리펩티드가 IDI 폴리펩티드 활성을 갖는지를 측정하기 위해 사용될 수 있다. 예시적 IDI 핵산에는 폴리펩티드, 폴리펩티드의 분절, 펩티드, 또는 IDI 폴리펩티드의 하나 이상의 활성을 갖는 융합 폴리펩티드를 코딩하는 핵산이 포함된다. 예시적 IDI 폴리펩티드 및 핵산에는 본원에 기재된 임의의 공급원 유기체로부터의 자연 발생적 폴리펩티드 및 핵산 뿐 아니라 본원에 기재된 임의의 공급원 유기체로부터 유래된 돌연변이체 폴리펩티드 및 핵산이 포함된다.
예시적
MVA
경로 폴리펩티드 및 핵산
예시적 MVA 경로 폴리펩티드에는 아세틸-CoA 아세틸트랜스페라아제 (AA-CoA 티올라아제) 폴리펩티드, 3-히드록시-3-메틸글루타릴-CoA 합성효소 (HMG-CoA 합성효소) 폴리펩티드, 3-히드록시-3-메틸글루타릴-CoA 리덕타아제 (HMG-CoA 리덕타아제) 폴리펩티드, 메발로네이트 키나아제 (MVK) 폴리펩티드, 포스포메발로네이트 키나아제 (PMK) 폴리펩티드, 디포스포메발로네이트 데카르복실라아제 (MVD) 폴리펩티드, IDI 폴리펩티드, 및 2 개 이상의 MVA 경로 폴리펩티드의 활성을 갖는 폴리펩티드 (예를 들어, 융합 폴리펩티드) 가 포함된다. 특히, MVA 경로 폴리펩티드에는 폴리펩티드, 폴리펩티드의 분절, 펩티드, 및 MVA 경로 폴리펩티드의 하나 이상의 활성을 갖는 융합 폴리펩티드가 포함된다. 예시적 MVA 경로 핵산에는 폴리펩티드, 폴리펩티드의 분절, 펩티드, 또는 MVA 경로 폴리펩티드의 하나 이상의 활성을 갖는 융합 폴리펩티드를 코딩하는 핵산이 포함된다. 예시적 MVA 경로 폴리펩티드 및 핵산에는 본원에 기재된 임의의 공급원 유기체로부터의 자연 발생적 폴리펩티드 및 핵산 뿐 아니라 본원에 기재된 임의의 공급원 유기체로부터 유래된 돌연변이체 폴리펩티드 및 핵산이 포함된다.
특히, 아세틸-CoA 아세틸트랜스페라아제 폴리펩티드 (AA-CoA 티올라아제 또는 AACT) 는 아세틸-CoA 의 2 개의 분자를 아세토아세틸-CoA 로 전환시킨다. 표준 방법 (예컨대 본원에 기재된 방법) 은 시험관 내에서, 세포 추출물 내에서, 또는 생체 내에서 아세틸-CoA 의 2 개의 분자를 아세토아세틸-CoA 로 전환시키는 폴리펩티드의 능력을 측정함으로써 폴리펩티드가 AA-CoA 티올라아제 폴리펩티드 활성을 갖는지를 측정하기 위해 사용될 수 있다.
3-히드록시-3-메틸글루타릴-CoA 합성효소 (HMG-CoA 합성효소 또는 HMGS) 폴리펩티드는 아세토아세틸-CoA 를 3-히드록시-3-메틸글루타릴-CoA 로 전환시킨다. 표준 방법 (예컨대 본원에 기재된 방법) 은 시험관 내에서, 세포 추출물 내에서, 또는 생체 내에서 아세토아세틸-CoA 를 3-히드록시-3-메틸글루타릴-CoA 로 전환시키는 폴리펩티드의 능력을 측정함으로써 폴리펩티드가 HMG-CoA 합성효소 폴리펩티드 활성을 갖는지를 측정하기 위해 사용될 수 있다.
3-히드록시-3-메틸글루타릴-CoA 리덕타아제 (HMG-CoA 리덕타아제 또는 HMGR) 폴리펩티드는 3-히드록시-3-메틸글루타릴-CoA 를 메발로네이트로 전환시킨다. 표준 방법 (예컨대 본원에 기재된 방법) 은 시험관 내에서, 세포 추출물 내에서, 또는 생체 내에서 3-히드록시-3-메틸글루타릴-CoA 를 메발로네이트로 전환시키는 폴리펩티드의 능력을 측정함으로써 폴리펩티드가 HMG-CoA 리덕타아제 폴리펩티드 활성을 갖는지를 측정하기 위해 사용될 수 있다.
메발로네이트 키나아제 (MVK) 폴리펩티드는 메발로네이트가 메발로네이트-5-포스페이트를 형성하도록 인산화시킨다. 표준 방법 (예컨대 본원에 기재된 방법) 은 시험관 내에서, 세포 추출물 내에서, 또는 생체 내에서 메발로네이트를 메발로네이트-5-포스페이트로 전환시키는 폴리펩티드의 능력을 측정함으로써 폴리펩티드가 MVK 폴리펩티드 활성을 갖는지를 측정하기 위해 사용될 수 있다.
포스포메발로네이트 키나아제 (PMK) 폴리펩티드는 메발로네이트-5-포스페이트가 메발로네이트-5-디포스페이트를 형성하도록 인산화시킨다. 표준 방법 (예컨대 본원에 기재된 방법) 은 시험관 내에서, 세포 추출물 내에서, 또는 생체 내에서 메발로네이트-5-포스페이트를 메발로네이트-5-디포스페이트로 전환시키는 폴리펩티드의 능력을 측정함으로써 폴리펩티드가 PMK 폴리펩티드 활성을 갖는지를 측정하기 위해 사용될 수 있다.
디포스포메발로네이트 데카르복실라아제 (MVD 또는 DPMDC) 폴리펩티드는 메발로네이트-5-디포스페이트를 이소펜테닐 디포스페이트 폴리펩티드 (IPP) 로 전환시킨다. 표준 방법 (예컨대 본원에 기재된 방법) 은 시험관 내에서, 세포 추출물 내에서, 또는 생체 내에서 메발로네이트-5-디포스페이트를 IPP 로 전환시키는 폴리펩티드의 능력을 측정함으로써 폴리펩티드가 MVD 폴리펩티드 활성을 갖는지를 측정하기 위해 사용될 수 있다.
예시적 IDI 폴리펩티드 및 핵산은 상기 기재되어 있다.
핵산 단리를 위한 예시적 방법
이소프렌 합성효소, DXS, IDI, 및/또는 MVA 경로 핵산은 표준 방법을 사용하여 단리될 수 있다. 관심의 공급원 유기체 (예컨대, 박테리아 게놈) 로부터의 바람직한 핵산 수득 방법은 공통적이고, 분자 생물학 업계에 잘 알려져 있다 (예를 들어, 특히, 관심의 핵산의 단리에 대해, 각각 전체가 본원에 참조로서 인용된, WO 2004/033646 호 및 그곳에 언급된 참고문헌 참조). 예를 들어, 핵산의 서열이 공지된 경우 (예컨대 본원에 기재된 임의의 공지된 핵산), 적합한 게놈 라이브러리는 제한 엔도뉴클레아제 소화에 의해 생성될 수 있고, 바람직한 핵산 서열에 상보적인 탐침으로 스크리닝할 수 있다. 일단 서열이 단리되면, DNA 는 표준 프라이머 지정 증폭 방법, 예컨대 적합한 벡터를 사용하는 형질전환에 적합한 DNA 의 양을 수득하기 위한 폴리머라아제 연쇄 반응 (PCR) (특히, PCR 방법에 대해, 본원에 전체가 참조로서 인용된 미국 특허 제 4,683,202 호) 을 사용하여 증폭될 수 있다.
대안적으로는, 이소프렌 합성효소, DXS, IDI, 및/또는 MVA 경로 핵산 (예컨대, 공지된 핵산 서열을 가진 임의의 이소프렌 합성효소, DXS, IDI, 및/또는 MVA 경로 핵산) 은 표준 방법을 사용하여 화학적으로 합성될 수 있다.
본원에 기재된 조성물 및 방법에 사용하기에 적합할 수 있는 부가적인 이소프렌 합성효소, DXS, IDI, 또는 MVA 경로 폴리펩티드 및 핵산은 표준 방법을 사용하여 확인될 수 있다. 예를 들어, 자연적으로 이소프렌을 제조하는 것으로 알려진 유기체의 염색체 DNA 의 코스미드 라이브러리는 E. 콜라이와 같은 유기체에서 구축될 수 있고, 그 다음 이소프렌 제조에 대해 스크리닝된다. 특히, 코스미드 라이브러리는 게놈 DNA 의 큰 절편 (35-45 kb) 이 벡터 내로 패키지되는 곳에서 작성될 수 있고, 적합한 숙주를 형질전환시키는데 사용될 수 있다. 코스미드 벡터는 다량의 DNA 를 수용할 수 있다는데 있어 독특하다. 일반적으로, 코스미드 벡터는 이종 DNA 의 패키지 및 후속 환형화에 필요한 cos DNA 서열의 하나 이상의 카피를 갖는다. cos 서열 외에, 상기 벡터는 또한 ColEI 및 암피실린 또는 네오마이신에 내성인 핵산과 같은 약물 내성 마커와 같은 복제 기원을 함유한다. 적합한 박테리아 숙주의 형질전환을 위해 코스미드 벡터를 사용하는 방법은, 특히, 형질전환 방법과 관련하여, 전체가 참조로서 본원에 인용된 문헌 [Sambrook et al, Molecular Cloning: A Laboratory Manual, 2nd ed., Cold Spring Harbor, 1989] 에 잘 기재되어 있다.
전형적으로는 코스미드를 클로닝하기 위해, 적합한 제한 엔도뉴클레아제를 사용하여 이종 DNA 를 단리하고, 적합한 리가아제를 사용하여 코스미드 벡터의 cos 영역에 인접하게 라이게이션하였다. 그 다음 선형화 이종 DNA 를 함유하는 코스미드 벡터를 박테리오파지와 같은 DNA 패키지 비히클과 반응시켰다. 패키지 과정 동안, cos 부위는 분할되고, 이종 DNA 가 박테리아 바이러스 입자의 머리 부분 내에 패키지되었다. 그 다음 상기 입자는 E. 콜라이와 같은 적합한 숙주 세포를 트랜스펙션시키기 위해 사용된다. 일단 세포 내에 주입되면, 이종 DNA 는 cos 점착성 말단의 영향 하에서 환형화된다. 이 방식으로, 이종 DNA 의 큰 절편이 숙주 세포에 도입되고 발현된다.
이소프렌 합성효소, DXS, IDI, 및/또는 MVA 경로 핵산을 수득하기 위한 부가적인 방법에는 어세이 (예컨대 본원에 기재된 상부공간 어세이) 에 의해 또는 보존된 아미노산 길이 (예를 들어, 3 개 이상의 보존된 아미노산) 를 코딩하는 뉴클레오티드에 대해 지정된 프라이머를 사용하는 PCR 에 의해 메타게놈 라이브러리를 스크리닝하는 것이 포함된다. 보존된 아미노산은 공지된 이소프렌 합성효소, DXS, IDI, 및/또는 MVA 경로 폴리펩티드의 아미노산 서열을 정렬시켜 확인될 수 있다. 이소프렌 합성효소 폴리펩티드에 대해 보존된 아미노산은 공지된 이소프렌 합성효소 폴리펩티드의 정렬된 서열에 근거하여 확인될 수 있다. 자연적으로 이소프렌을 제조하는 것으로 발견된 유기체는 표준 단백질 정제 방법 (당업계에 잘 알려짐) 에 적용될 수 있고, 수득된 정제된 폴리펩티드는 표준 방법을 사용하여 서열분석될 수 있다. 다른 방법은 문헌 (예를 들어, 특히 이소프렌의 합성에 관여하는 핵산의 확인에 대해, 전체가 참조로서 본원에 인용된 문헌 [Julsing et al ., Applied . Microbiol. Biotechnol . 75: 1377-84, 2007; Withers et al ., Appl Environ Microbiol. 73(19):6277-83, 2007] 참조) 에서 발견된다.
부가적으로는, 표준 서열 정렬 및/또는 구조 예측 프로그램은 일차 및/또는 예측된 폴리펩티드 이차 구조와, 공지된 DXS, IDI, 또는 MVA 경로 폴리펩티드 및 핵산의 구조와의 유사성에 근거한 부가적인 DXS, IDI, 또는 MVA 경로 폴리펩티드 및 핵산을 확인하기 위해 사용될 수 있다. 스위스포트-트렘블 데이터베이스 (웹사이트 "expasy.org", Swiss Institute of Bioinformatics Swiss-Prot group CMU - 1 rue Michel Servet CH-1211 Geneva 4, Switzerland) 와 같은 표준 데이터베이스가 또한 이소프렌 합성효소, DXS, IDI, 또는 MVA 경로 폴리펩티드 및 핵산을 확인하기 위해 사용될 수 있다. 이소프렌 합성효소, DXS, IDI, 또는 MVA 경로 폴리펩티드의 이차 및/또는 삼차 구조는 표준 구조 예측 프로그램, 예컨대 PredictProtein (630 West, 168 Street, BB217, New York, N.Y. 10032, USA) 의 디폴트 설정을 사용하여 예측될 수 있다. 대안적으로는, 이소프렌 합성효소, DXS, IDI, 또는 MVA 경로 폴리펩티드의 실제 이차 및/또는 삼차 구조는 표준 방법을 사용하여 측정될 수 있다. 부가적인 이소프렌 합성효소, DXS, IDI, 또는 MVA 경로 핵산은 또한 공지된 이소프렌 합성효소, DXS, IDI, 또는 MVA 경로 핵산으로부터 생성된 탐침에 대한 혼성화에 의해 확인될 수 있다.
예시적 프로모터 및 벡터
본원에 기재된 임의의 이소프렌 합성효소, DXS, IDI, 또는 MVA 경로 핵산은 하나 이상의 벡터에 포함될 수 있다. 따라서, 본 발명은 또한 본원에 기재된 이소프렌 합성효소, DXS, IDI, 또는 MVA 경로 폴리펩티드 중 임의의 것을 코딩하는 하나 이상의 핵산을 가진 벡터를 특징으로 한다. 본원에 사용되는 바와 같이, "벡터" 는 숙주 세포에서 하나 이상의 관심의 핵산을 전달할 수 있는, 바람직하게는 발현할 수 있는 구축물을 의미한다. 벡터의 예에는 플라스미드, 바이러스 벡터, DNA 또는 RNA 발현 벡터, 코스미드, 및 파지 벡터가 포함되나 이에 제한되지 않는다. 일부 구현예에서, 벡터는 발현 조절 서열의 조절 하에서 핵산을 함유한다.
본원에 사용되는 바와 같이, "발현 조절 서열" 은 관심의 핵산의 전사를 지정하는 핵산 서열을 의미한다. 발현 조절 서열은 프로모터, 예컨대 구성적 또는 유도성 프로모터, 또는 인핸서일 수 있다. "유도성 프로모터" 는 환경적 또는 발달적 규제 하에서 활성인 프로모터이다. 발현 조절 서열은 전사되는 핵산 절편에 작동가능하게 연결된다.
일부 구현예에서, 벡터는 선별 마커를 포함한다. "선별 마커" 라는 용어는 도입된 핵산 또는 벡터를 함유하는 숙주 세포의 선별을 용이하게 하는, 숙주 세포에서 발현을 가능하게 하는 핵산을 말한다. 선별가능한 마커의 예에는 항생제 내성 핵산 (예를 들어, 카나마이신, 암피실린, 카르베니실린, 젠타마이신, 하이그로마이신, 플레오마이신, 블레오마이신, 네오마이신, 또는 클로르암페니콜) 및/또는 대사적 장점, 예컨대 숙주 세포에 대한 영양적 장점을 부여하는 핵산이 포함되나 이에 제한되는 것은 아니다. 예시적인 영양 선별 마커에는 amdS, argB, 및 pyr4 로서 당업계에 공지된 마커가 포함된다. 트리코데르마 (Trichoderma) 의 형질전환을 위한 벡터 시스템에 유용한 마커는 당업계에 알려져 있다 (예를 들어, 특히 선별 마커에 관해, 본원에 전체가 참조로서 인용된 문헌 [Finkelstein, Chapter 6 in Biotechnology of Filamentous Fungi, Finkelstein et al., Eds. Butterworth-Heinemann, Boston, MA, Chap. 6., 1992; 및 Kinghorn et al., Applied Molecular Genetics of Filamentous Fungi, Blackie Academic and Professional, Chapman and Hall, London, 1992] 참조). 일부 구현예에서, 선별 마커는 amdS 핵산이며, 이것은 효소 아세타미다아제를 코딩하고, 형질변환된 세포를 질소원으로서 아세타미드 상에서 성장하도록 한다. 선별 마커로서 A. 니둘란스 (A. nidulans) amdS 핵산의 사용이 [Kelley et al, EMBO J. 4:475 - 479, 1985 및 Penttila et al., Gene 61:155-164, 1987 (특히 선별 마커에 관해, 본원에 각각 전체가 참조로서 인용됨)] 에 기재되어 있다. 일부 구현예에서, 이소프렌 합성효소, DXS, IDI, 또는 MVA 경로 핵산은 선별 마커 없이 세포의 염색체 내에 통합된다.
적합한 벡터는 사용되는 숙주 세포와 상용성인 것이다. 적합한 벡터는 예를 들어, 박테리아, 바이러스 (예컨대, 박테리오파지 T7 또는 M-13 유래 파지), 코스미드, 효모, 또는 식물로부터 유래될 수 있다. 이러한 벡터를 수득하기 위한 프로토콜 그리고 사용하는 프로토콜은 당업자에게 공지되어 있다 (예를 들어, 특히 벡터의 사용에 관해, 본원에 전체가 참조로서 인용된 Sambrook et al, Molecular Cloning: A Laboratory Manual, 2nd ed., Cold Spring Harbor, 1989 참조).
프로모터는 당업계에 잘 알려져 있다. 숙주 세포에서 기능하는 임의의 프로모터는 숙주 세포 내 이소프렌 합성효소, DXS, IDI, 또는 MVA 경로 핵산의 발현에 사용될 수 있다. 다양한 숙주 세포에서 이소프렌 합성효소, DXS, IDI, 또는 MVA 경로 핵산의 발현을 유도하는데 유용한 개시 조절 영역 또는 프로모터는 수 많으며, 당업자에게 익숙하다 (예를 들어, 특히, 관심의 핵산의 발현용 벡터에 관해, 본원에 각각 전체가 참조로서 인용된 WO 2004/033646 및 그곳에 언급된 참조문헌 참조). 상기 핵산을 유도할 수 있는 사실상 임의의 프로모터가 본 발명에 적합하다 (CYC1, HIS3, GAL1, GAL10, ADH1, PGK, PHO5, GAPDH, ADCI, TRP1, URA3, LEU2, ENO, 및 TPI (사카로마이세스 (Saccharomyces) 에서의 발현에 유용함); AOX1 (피치아 (Pichia) 에서의 발현에 유용함); 및 lac, trp, □PL, □PR, T7, tac, 및 trc (E. 콜라이에서의 발현에 유용함) 를 포함하나 이에 제한되지 않음).
일부 구현예에서, 글루코오스 이소머라아제 프로모터가 사용된다 (예를 들어, 관심의 폴리펩티드의 발현을 위한 각각의 프로모터 및 플라스미드 시스템에 관해, 본원에 각각 전체가 참조로서 인용된 미국 특허 번호 7,132,527 및 그곳에 언급된 참조문헌 참조). 보고된 글루코오스 이소머라아제 프로모터 돌연변이체는 글루코오스 이소머라아제 프로모터에 작동가능하게 연결된 핵산에 의해 코딩된 폴리펩티드의 발현 수준을 변화시키기 위해 사용될 수 있다 (미국 특허 번호 7,132,527). 다양한 구현예에서, 글루코오스 이소머라아제 프로모터는 저, 중간 또는 고 카피 플라스미드에 함유된다 (미국 특허 번호 7,132,527).
다양한 구현예에서, 이소프렌 합성효소, DXS, IDI, 및/또는 MVA 경로 핵산은 저 카피 플라스미드 (예를 들어, 세포 당 약 1 내지 약 4 카피로 유지되는 플라스미드), 중 카피 플라스미드 (예를 들어, 세포 당 약 10 내지 약 15 카피로 유지되는 플라스미드), 또는 고 카피 플라스미드 (예를 들어, 세포 당 약 50 개 이상의 카피로 유지되는 플라스미드) 에 함유된다. 일부 구현예에서, 이종 또는 추가의 내생 이소프렌 합성효소, DXS, IDI, 또는 MVA 경로 핵산은 T7 프로모터에 작동가능하게 연결된다. 일부 구현예에서, T7 프로모터에 작동가능하게 연결된 이종 또는 추가의 내생 이소프렌 합성효소, DXS, IDI, 또는 MVA 경로 핵산은 중 또는 고 카피 플라스미드에 함유된다. 일부 구현예에서, 이종 또는 추가의 내생 이소프렌 합성효소, DXS, IDI, 또는 MVA 경로 핵산은 Trc 프로모터에 작동가능하게 연결된다. 일부 구현예에서, Trc 프로모터에 작동가능하게 연결된 이종 또는 추가의 내생 이소프렌 합성효소, DXS, IDI, 또는 MVA 경로 핵산은 중 또는 고 카피 플라스미드에 함유된다. 일부 구현예에서, 이종 또는 추가의 내생 이소프렌 합성효소, DXS, IDI, 또는 MVA 경로 핵산은 Lac 프로모터에 작동가능하게 연결된다. 일부 구현예에서, Lac 프로모터에 작동가능하게 연결된 이종 또는 추가의 내생 이소프렌 합성효소, DXS, IDI, 또는 MVA 경로 핵산은 저 카피 플라스미드에 함유된다. 일부 구현예에서, 이종 또는 추가의 내생 이소프렌 합성효소, DXS, IDI, 또는 MVA 경로 핵산은 내생 프로모터, 예컨대 내생 에스케리챠 (Escherichia), 판테오아 (Panteoa), 바실러스 (Bacillus), 야로이와 (Yarrowia), 스트렙토마이세스 (Streptomyces), 또는 트리코데르마 (Trichoderma) 프로모터 또는 내생 알칼리 세린 프로테아제, 이소프렌 합성효소, DXS, IDI, 또는 MVA 경로 프로모터에 작동가능하게 연결된다. 일부 구현예에서, 내생 프로모터에 작동가능하게 연결된 이종 또는 추가의 내생 이소프렌 합성효소, DXS, IDI, 또는 MVA 경로 핵산은 고 카피 플라스미드에 함유된다. 일부 구현예에서, 벡터는 세포 내 세포 내 염색체 내에 통합되지 않는 복제 플라스미드이다. 일부 구현예에서, 벡터의 일부 또는 모두는 세포 내 염색체 내에 통합된다.
일부 구현예에서, 벡터는 진균 숙주 세포 내로 도입되는 경우 숙주 세포 게놈 내로 통합되고 복제되는 임의의 벡터이다. 벡터 목록에 대해 Fungal Genetics Stock Center Catalogue of Strains (FGSC, 특히 벡터에 관해, 본원에 각각 전체가 참조로서 인용된 웹사이트 "fgsc.net" 및 그곳에 언급된 참조문헌) 을 참조한다. 적합한 발현 및/또는 통합 벡터의 부가적인 예는 (특히 벡터에 관해, 본원에 각각 전체가 참조로서 인용된 문헌 [Sambrook et al., Molecular Cloning: A Laboratory Manual, 2nd ed., Cold Spring Harbor, 1989, Current Protocols in Molecular Biology (F. M. Ausubel et al., (eds) 1987, Supplement 30, section 7.7.18); van den Hondel et al. in Bennett and Lasure (Eds.) More Gene Manipulations in Fungi, Academic Press pp. 396-428, 1991]; 및 미국 특허 번호 5,874,276) 에 제공된다. 특히 유용한 벡터에는 pFB6, pBR322, PUC18, pUC100, 및 pENTR/D 가 포함된다.
일부 구현예에서, 이소프렌 합성효소, DXS, IDI, 또는 MVA 경로 핵산은 진균 숙주 세포에서 전사 활성을 나타내는 적합한 프로모터에 작동가능하게 연결된다. 프로모터는 숙주 세포에 대해 내생 또는 이종인 폴리펩티드를 코딩하는 하나 이상의 핵산으로부터 유래될 수 있다. 일부 구현예에서, 프로모터는 트리코데르마 (Trichoderma) 숙주에서 유용하다. 프로모터의 적합한 비-제한적 예에는 cbh1, cbh2, egl1, egl2, pepA, hfb1, hfb2, xyn1, 및 amy 가 포함된다. 일부 구현예에서, 프로모터는 숙주 세포에 대해 본래의 것이다. 예를 들어, 일부 구현예에서, T. 레에세이가 숙주인 경우, 프로모터는 본래의 T. 레에세이 프로모터이다. 일부 구현예에서, 프로모터는 T. 레에세이 cbh1 이고, 이것은 유도성 프로모터이고, 특히 프로모터에 대해, 전체가 참조로서 인용된 접근 번호 D86235 로 GenBank 에 기탁되어 있다. 일부 구현예에서, 프로모터는 진균 숙주 세포에 대해 이종인 것이다. 유용한 프로모터의 다른 예에는 A. 아와모리 및 A 니게르 글루코아밀라아제 (glaA) (특히 프로모터에 관해, 각각 전체가 참조로서 본원에 인용된 Nunberg et al., Mol. Cell Biol. 4:2306-2315, 1984 및 Boel et al., EMBO J. 3:1581-1585, 1984); 아스페르길루스 니게르 (Aspergillus niger) 알파 아밀라아제, 아스페르길루스 오리자에 (Aspergillus oryzae) TAKA 아밀라아제, T. 레에세이 xln1, 및 T. 레에세이 셀로바이오히드롤라아제 1 (특히 프로모터에 관해, 전체가 참조로서 인용된 EP 137280) 의 유전자로부터의 프로모터가 포함된다.
일부 구현예에서, 발현 벡터에는 또한 종결 서열이 포함된다. 종결 조절 영역은 또한 숙주 세포에 대해 본래의 것인 다양한 유전자로부터 유래될 수 있다. 일부 구현예에서, 종결 서열 및 프로모터 서열은 동일한 공급원으로부터 유래된다. 또다른 구현예에서, 종결 서열은 숙주 세포에 대해 내생이다. 특히 적합한 터미네이터 서열은 트리코데르마 균주 (예컨대, T. 레에세이) 로부터 유래된 cbh1 이다. 기타 유용한 진균 터미네이터에는 A. 니게르 또는 A. 아와모리 글루코아밀라아제 핵산으로부터의 터미네이터 (특히 진균 터미네이터에 관해, 본원에 전체가 각각 참조로서 인용된 Nunberg et al ., Mol . Cell Biol . 4:2306-2315, 1984 및 Boel et al ., EMBO J. 3:1581-1585, 1984) 가 포함된다. 임의로, 종결 부위가 포함될 수 있다. 폴리펩티드의 효과적인 발현을 위해, 폴리펩티드를 코딩하는 DNA 는 발현이 적합한 메신저 RNA 의 형성을 야기하도록 선택된 발현 조절 영역에 개시 코돈을 통해 작동가능하게 연결된다.
일부 구현예에서, 프로모터, 코딩 영역 및 터미네이터 모두는 발현될 이소프렌 합성효소, DXS, IDI, 또는 MVA 경로 핵산으로부터 기원한다. 일부 구현예에서, 이소프렌 합성효소, DXS, IDI, 또는 MVA 경로 핵산에 대한 코딩 영역은, 이것이 발현 구축물 프로모터 및 터미네이터 서열의 전사 통제 하에 있도록 일반적인-목적 발현 벡터 내로 삽입된다. 일부 구현예에서, 유전자 또는 이의 일부는 강한 cbh1 프로모터의 하류방향에 삽입된다.
이소프렌 합성효소, DXS, IDI, 또는 MVA 경로 핵산은 표준 기술 (특히 적합한 DNA 서열의 스크리닝 및 벡터의 구축에 관해, 본원에 전체가 참조로서 인용된 문헌 [Sambrook et al., Molecular Cloning: A Laboratory Manual, Cold Spring Harbor, 1982]) 을 사용하여 발현 벡터와 같은 벡터 내로 도입될 수 있다. 관심의 핵산 (예컨대, 이소프렌 합성효소, DXS, IDI, 또는 MVA 경로 핵산), 프로모터, 터미네이터, 및 기타 서열을 포함하는 DNA 구축물을 라이게이션하기 위해 사용되는 방법 및 이들을 적합한 벡터 내에 삽입하기 위한 방법은 당업계에 잘 알려져 있다. 예를 들어, 제한 효소는 이소프렌 합성효소, DXS, IDI, 또는 MVA 경로 핵산 및 벡터를 분할하기 위해 사용될 수 있다. 그 다음, 분할된 이소프렌 합성효소, DXS, IDI, 또는 MVA 경로 핵산의 상용성 말단 및 분할된 벡터는 라이게이션될 수 있다. 연결은 일반적으로 편리한 제한 부위에서의 라이게이션에 의해 달성된다. 이러한 부위가 존재하지 않는 경우, 합성 올리고뉴클레오티드 링커는 통상의 실시에 따라 사용된다 (특히, 올리고뉴클레오티드 링커에 관해, 전체가 참조로서 본원에 각각 인용된 문헌 [Sambrook et al., Molecular Cloning: A Laboratory Manual, 2nd ed., Cold Spring Harbor, 1989, 및 Bennett and Lasure, More Gene Manipulations in Fungi, Academic Press, San Diego, pp 70-76, 1991] 참조). 부가적으로는, 벡터는 공지된 재조합 기술을 사용하여 구축될 수 있다 (예를 들어, Invitrogen Life Technologies, Gateway Technology).
일부 구현예에서, 자연 발생적 세포에서 현재 발견되는 것보다 훨씬 더 높은 수준으로 이소프렌 합성효소, DXS, IDI, 또는 MVA 경로 핵산을 과발현시키는 것이 바람직할 것이다. 이 결과는 상기 폴리펩티드를 다중카피 플라스미드로 코딩하는 핵산의 선택성 클로닝 및 강한 유도성 또는 구성적 프로모터 하에 상기 핵산을 놓음으로써 달성될 수 있다. 원하는 폴리펩티드의 과발현 방법은 분자 생물학 업계에 공통적이고 잘 알려져 있으며, 예는 특히, 클로닝 기술에 관해, 본원에 전체가 참조로서 인용된 문헌 [Sambrook et al., Molecular Cloning: A Laboratory Manual, 2nd ed., Cold Spring Harbor, 1989] 에서 찾을 수 있다.
하기 자원에는 본 발명에 따라 유용한 부가적인 일반적 방법론의 설명이 포함된다: 특히, 분자 생물학 및 클로닝 기술에 관해, 본원에 각각 전체가 참조로서 인용된 문헌 [Kreigler, Gene Transfer and Expression; A Laboratory Manual, 1990 및 Ausubel et al., Eds. Current Protocols in Molecular Biology, 1994].
예시적 공급원 유기체
이소프렌 합성효소, DXS, IDI, 또는 MVA 경로 핵산 (및 그들의 코딩된 폴리펩티드) 은 자연적으로 이소프렌 합성효소, DXS, IDI, 및/또는 MVA 경로 핵산을 함유하는 임의의 유기체로부터 수득될 수 있다. 상기 주지된 바와 같이, 이소프렌은 다양한 유기체, 예컨대 박테리아, 효모, 식물 및 동물에 의해 자연적으로 형성된다. 유기체는 이소프렌을 제조하기 위해 MVA 경로, DXP 경로, 또는 MVA 및 DXP 경로 모두를 함유한다 (도 19). 그러므로, DXS 핵산은 예를 들어, DXP 경로를 함유하는 또는 MVA 및 DXP 경로 모두를 함유하는 임의의 유기체로부터 선택될 수 있다. IDI 및 이소프렌 합성효소 핵산은 예를 들어, MVA 경로, DXP 경로, 또는 MVA 및 DXP 경로 모두를 함유하는 임의의 유기체로부터 수득될 수 있다. MVA 경로 핵산은 MVA 경로를 함유하는 또는 MVA 및 DXP 경로 모두를 함유하는 임의의 유기체로부터 수득될 수 있다.
일부 구현예에서, 이소프렌 합성효소, DXS, IDI, 또는 MVA 경로 핵산의 핵산 서열은 자연에서 하기 유기체 중 임의의 것에 의해 제조되는 핵산의 서열과 일치한다. 일부 구현예에서, 이소프렌 합성효소, DXS, IDI, 또는 MVA 경로 폴리펩티드의 아미노산 서열은 자연에서 하기 유기체 중 임의의 것에 의해 제조되는 폴리펩티드의 서열과 일치한다. 일부 구현예에서, 이소프렌 합성효소, DXS, IDI, 또는 MVA 경로 핵산 또는 폴리펩티드는 본원에 기재된 임의의 유기체로부터 유래된 돌연변이체 핵산 또는 폴리펩티드이다. 본원에서 사용되는 바와 같은, "~ 로부터 유래된" 은 하나 이상의 돌연변이가 도입된 핵산 또는 폴리펩티드의 공급원을 말한다. 예를 들어, "식물 폴리펩티드로부터 유래된" 폴리펩티드는 하나 이상의 돌연변이를 야생형 (즉, 자연에서 발생하는 서열) 식물 폴리펩티드의 서열 내에 도입함으로부터 산출되는 관심의 폴리펩티드를 말한다.
일부 구현예에서, 공급원 유기체는 진균이고, 이의 예는 아스페르길루스 (Aspergillus) 종, 예컨대 A 오리자에 및 A 니게르, 사카로마이세스 (Saccharomyces) 종, 예컨대 S. 세레비지아에, 스퀴조사카로마이세스 (Schizosaccharomyces) 종, 예컨대 S. 폼베, 및 트리코데르마 (Trichoderma) 종, 예컨대 T. 레에세이이다. 일부 구현예에서, 공급원 유기체는 사상 진균 세포이다. "사상 진균" 이라는 용어는 아문 에우마이코티나 (Eumycotina) 의 모든 사상 형태 (Alexopoulos, C. J. (1962), Introductory Mycology, Wiley, New York 참조) 를 말한다. 상기 진균은 키틴, 셀룰로오스, 및 기타 복합 다당류로 구성된 세포벽을 갖는 영양 균사체를 특징으로 한다. 사상 진균은 효모와 형태적으로, 물리적으로 그리고 유전적으로 구별된다. 사상 진균에 의한 영양적 성장은 군사 신장에 의해 이루어지고, 탄소 이화작용은 의무적 호기성이다. 사상 진균 모 세포는 트리코데르마 (Trichoderma), (예를 들어, 트리코데르마 레에세이 (Trichoderma reesei), 하이포크레아 제코리나 (Hypocrea jecorina) 의 무성 형태, 이전에는 T. 롱기브라키아툼 (T. longibrachiatum), 트리코데르마 비리데 (Trichoderma viride), 트리코데르마 코닌기이 (Trichoderma koningii), 트리코데르마 하르지아눔 (Trichoderma harzianum) 으로서 분류되었음) (Sheir-Neirs et al., Appl. Microbiol. Biotechnol 20: 46-53, 1984; ATCC No. 56765 및 ATCC No. 26921); 페니실리움 (Penicillium) 종, 휴미콜라 (Humicola) 종 (예를 들어, H. 인솔렌스 (H. insolens), H. 라누기노스 (H. lanuginose), 또는 H. 그리세아 (H. grisea)); 크리소스포리움 (Chrysosporium) 종 (예를 들어, C. 루크노웬스 (C. lucknowense)), 글리오클라디움 (Gliocladium) 종, 아스페르길루스 (Aspergillus) 종 (예를 들어, A. 오리자에 (A. oryzae), A. 니게르 (A. niger), A. 소자에 (A. sojae), A. 자포니쿠스 (A. japonicus), A. 니둘란스 (A. nidulans), 또는 A. 아와모리 (A. awamori)) (Ward et al., Appl. Microbiol. Biotechnol. 39: 7380743, 1993 및 Goedegebuur et al, Genet 41: 89-98, 2002), 푸사리움 종 (Fusarium sp.), (예를 들어, F. 로세움 (F. roseum), F. 그라미눔 (F. graminum), F. 세레알리스 (F. cerealis), F. 옥시스포룸 (F. oxysporuim), 또는 F. 베네나툼 (F. venenatum)), 뉴로스포라 (Neurospora) 종 (예를 들어, N. 크라싸 (N. crassa)), 하이포크레아 (Hypocrea) 종, 무코르 (Mucor) 종 (예를 들어, M. 미에헤이 (M. miehei)), 리조푸스 (Rhizopus) 종 및 에메리셀라 (Emericella) 종 (또한, Innis et al., Sci. 228: 21-26, 1985 참조) 의 세포일 수 있으나 이에 제한되는 것은 아니다. "트리코데르마" 또는 "트리코데르마 종 (Trichoderma sp. 또는 Trichoderma spp.)" 이라는 용어는 트리코데르마로서 이전에 또는 현재 분류되는 임의의 진균 속을 말한다.
일부 구현예에서, 진균은 A. 니둘란스, A. 아와모리, A. 오리자에, A. 아쿨레아투스 (A. aculeatus), A. 니게르, A. 자포니쿠스, T. 레에세이, T. 비리데, F. 옥시스포룸, 또는 F. 솔라니이다. 아스페르길루스 (Aspergillus) 균주는 특히, 진균에 관해, 전체가 본원에 각각 참조로서 인용된 문헌 [Ward et al., Appl. Microbiol. Biotechnol. 39:738-743, 1993 및 Goedegebuur et al., Curr Gene 41:89-98, 2002] 에 기재되어 있다. 특정 구현예에서, 진균은 트리코데르마의 균주, 예컨대 T. 레에세이의 균주이다. T. 레에세이의 균주는 알려져 있고, 비제한적인 예에는 특히, T. 레에세이의 균주에 관해, 전체가 본원에 각각 참조로서 인용된 ATCC No. 13631, ATCC No. 26921, ATCC No. 56764, ATCC No. 56765, ATCC No. 56767, 및 NRRL 15709 가 포함된다. 일부 구현예에서, 숙주 균주는 RL-P37 의 유도체이다. RL-P37 은 특히, T. 레에세이의 균주에 관해, 전체가 본원에 참조로서 인용된 문헌 [Sheir-Neiss et al., Appl. Microbiol. Biotechnology 20:46-53, 1984] 에 기재되어 있다.
일부 구현예에서, 공급원 유기체는 효모, 예컨대 사카로마이세스 종, 스퀴조사카로마이세스 종, 피치아 종, 또는 칸디다 (Candida) 종이다.
일부 구현예에서, 공급원 유기체는 박테리아, 예컨대 바실러스의 균주, 예컨대 B. 리케니포르미스 또는 B. 서브틸리스, 판토에아 (Pantoea) 균주, 예컨대 P. 시트레아 (P. citrea), 슈도모나스 (Pseudomonas) 균주, 예컨대 P. 알칼리제네스 (P. alcaligenes), 스트렙토마이세스 균주, 예컨대 S. 리비단스 또는 S. 루비지노수스 (S. rubiginosus), 또는 에스케리챠 균주, 예컨대 E. 콜라이이다.
본원에서 사용되는 바와 같이, "바실러스 속" 에는 당업자에게 알려진 바와 같은 "바실러스" 속 내의 모든 종이 포함되며, B. 서브틸리스, B. 리케니포르미스, B. 렌투스, B. 브레비스, B. 스테아로테르모필루스 (B. stearothermophilus), B. 알칼로필루스 (B. alkalophilus), B. 아밀로리퀘파시엔스 (B. amyloliquefaciens), B. 클라우시 (B. clausii), B. 할로두란스 (B. halodurans), B. 메가테리움 (B. megaterium), B. 코아굴란스 (B. coagulans), B. 써큘란스 (B. circulans), B. 라우투스 (B. lautus), 및 B. 투린지엔시스 (B. thuringiensis) 가 포함되나 이에 제한되지 않는다. 바실러스 속에 대한 분류학 재편성이 지속적으로 이루어짐을 인지한다. 그러므로, 속에는 이제는 "제오바실러스 스테아로테르모필러스 (Geobacillus stearothermophilus)" 라고 칭하는 B. 스테아로테르모필러스 (B. stearothermophilus) 와 같은 유기체가 포함되나 이에 제한되지 않는, 재분류된 종이 포함되는 것으로 의도된다. 산소의 존재하에서 저항성 내생포자의 생성은 바실러스 속의 정의된 특징으로 간주되나, 이러한 특성은 또한 최근의 명칭 알리시클로바실러스 (Alicyclobacillus), 암피바실러스 (Amphibacillus), 아뉴리니바실러스 (Aneurinibacillus), 아녹시바실러스 (Anoxybacillus), 브레비바실러스 (Brevibacillus), 필로바실러스 (Filobacillus), 그라실리바실러스 (Gracilibacillus), 할로바실러스 (Halobacillus), 파에니바실러스 (Paenibacillus), 살리바실러스 (Salibacillus), 테르모바실러스 (Thermobacillus), 우레이바실러스 (Ureibacillus), 및 버지바실러스 (Virgibacillus) 에도 적용된다.
일부 구현예에서, 공급원 유기체는 그람-양성 박테리아이다. 비-제한적인 예에는 스트렙토마이세스 (Streptomyces) (예를 들어, S. 리비단스, S. 코엘리콜로르, 또는 S. 그리세우스) 및 바실러스의 균주가 포함된다. 일부 구현예에서, 공급원 유기체는 그람-음성 박테리아, 예컨대 E. 콜라이 또는 슈도모나스 종이다.
일부 구현예에서, 공급원 유기체는 식물, 예컨대 파바세아에 (Fabaceae) 족, 예컨대 파보이데아에 (Faboideae) 아족으로부터의 식물이다. 일부 구현예에서, 공급원 유기체는 칡, 포플러 (예컨대, 포풀러스 알바 x 트레물라 (Populus alba x tremula) CAC35696), 사시나무 (예컨대, 포풀러스 트레물로이데스 (Populus tremuloides)), 또는 퀘르쿠스 로부르 (Quercus robur) 이다.
일부 구현예에서, 공급원 유기체는 조류, 예컨대 녹색 조류, 적색 조류, 회조류, 클로라라크니오조류, 유글레나, 크로미스타, 또는 와편모충이다.
일부 구현예에서, 공급원 유기체는 시아노박테리아, 예컨대 형태학 상으로 하기 그룹 중 임의의 것으로 분류되는 시아노박테리아이다: 크로오코칼스 (Chroococcales), 플뤠로캅살스 (Pleurocapsales), 오실라토리알레스 (Oscillatoriales), 노스토칼레스 (Nostocales), 또는 스티고네마탈레스 (Stigonematales).
예시적 숙주 세포
다양한 숙주 세포는 이소프렌 합성효소, DXS, IDI, 및/또는 MVA 경로 폴리펩티드를 발현하고, 청구된 본 발명의 방법에서 이소프렌을 제조하기 위해 사용될 수 있다. 예시적 숙주 세포에는 "예시적 공급원 유기체" 라는 표제하에서 이전 섹션에서 열거된 임의의 유기체로부터의 세포가 포함된다. 숙주 세포는 이소프렌을 자연적으로 제조하는 세포 또는 이소프렌을 자연적으로 제조하지 않는 세포일 수 있다. 일부 구현예에서, 숙주 세포는 DXP 경로를 사용하여 이소프렌을 자연적으로 제조하고, 이소프렌 합성효소, DXS, 및/또는 IDI 핵산은 상기 경로를 사용하여 이소프렌의 제조를 향상시키기 위해 첨가된다. 일부 구현예에서, 숙주 세포는 MVA 경로를 사용하여 이소프렌을 자연적으로 제조하고, 이소프렌 합성효소 및/또는 하나 이상의 MVA 경로 핵산은 상기 경로를 사용하여 이소프렌의 제조를 향상시키기 위해 첨가된다. 일부 구현예에서, 숙주 세포는 DXP 경로를 사용하여 이소프렌을 자연적으로 제조하고, 하나 이상의 MVA 경로 핵산은 MVA 경로의 일부 또는 전부 뿐 아니라 DXP 경로를 사용하여 이소프렌을 제조하기 위해 첨가된다. 일부 구현예에서, 숙주 세포는 DXP 및 MVA 경로 모두를 사용하여 이소프렌을 자연적으로 제조하고, 하나 이상의 이소프렌 합성효소, DXS, IDI, 또는 MVA 경로 핵산은 상기 경로 중 하나 또는 모두에 의한 이소프렌의 제조를 향상시키기 위해 첨가된다.
예시적 형질전환 방법
이소프렌 합성효소, DXS, IDI, 및/또는 MVA 경로 핵산 또는 이들을 함유하는 벡터는 코딩된 이소프렌 합성효소, DXS, IDI, 및/또는 MVA 경로 폴리펩티드의 발현을 위해 표준 기술을 사용하여 숙주 세포 (예를 들어, 식물 세포, 진균 세포, 효모 세포, 또는 본원에 기재된 박테리아 세포) 내로 삽입될 수 있다. 숙주 세포 내로의 DNA 구축물 또는 벡터의 도입은 형질전환, 전기천공법, 핵 마이크로주입, 형질도입, 트랜스펙션 (예를 들어, 리포펙틴 매개 또는 DEAE-덱스트린 매개 트랜스펙션 또는 재조합 파지 바이러스를 사용하는 트랜스펙션), 인산칼슘 DNA 침전물로의 인큐베이션, DNA-코팅 마이크로발사체로의 고속 포격, 및 원생동물 융합과 같은 기술을 사용하여 수행될 수 있다. 일반적인 형질전환 기술은 당업계에 알려져 있다 (예를 들어, 특히, 형질전환 방법에 관해, 전체가 참조로서 본원에 각각 인용된 문헌 [Current Protocols in Molecular Biology (F. M. Ausubel et al. (eds) Chapter 9, 1987; Sambrook et al., Molecular Cloning: A Laboratory Manual, 2nd ed., Cold Spring Harbor, 1989; 및 Campbell et al., Curr . Genet. 16:53-56, 1989] 참조). 트리코데르마 내 이종 폴리펩티드의 발현은 특히, 형질전환 및 발현 방법에 관해, 전체가 참조로서 본원에 각각 인용된 미국 특허 번호 6,022,725; 미국 특허 번호 6,268,328; 미국 특허 번호 7,262,041; WO 2005/001036; Harkki et al .; Enzyme Microb . Technol. 13:227-233, 1991; Harkki et al ., Bio Technol. 7:596-603, 1989; EP 244,234; EP 215,594; 및 Nevalainen et al ., " The Molecular Biology of Trichoderma and its Application to the Expression of Both Homologous and Heterologous Genes," in Molecular Industrial Mycology, Eds. Leong and Berka, Marcel Dekker Inc., NY pp. 129 - 148, 1992] 에 기재되어 있다. 또한, 아스페르길루스 균주의 형질전환에 대해 Cao et al., (Sci. 9:991-1001, 2000; EP 238023; 및 Yelton et al ., Proceedings . Natl . Acad . Sci. USA 81:1470-1474, 1984 (특히, 형질전환 방법에 관해, 전체가 참조로서 본원에 각각 인용됨) 를 참조할 수 있다. 도입된 핵산은 염색체 DNA 내로 통합될 수 있거나, 외부염색체 복제 서열로서 유지될 수 있다.
당업계에 공지된 임의의 방법은 형질전환체를 선택하는데 사용될 수 있다. 하나의 비제한적 예에서, amdS 마커를 포함하는 안정한 형질전환체는, 빠른 성장 속도와 아세타미드를 함유하는 고체 배양 배지 상에서의 우둘투둘하다기 보다는 매끈한 가장자리를 갖는 원형 콜로니의 형성에 의해 불안정한 형질전환체와 구별된다. 부가적으로는, 일부 경우에서, 추가의 안정성 시험은, 고체 비-선별 배지 (예를 들어, 아세타미드가 결핍된 배지) 상에서 형질전환체를 성장시키고, 상기 배양 배지로부터 포자를 수확하고, 아세타미드를 함유하는 선별 배지 상에서 후속적으로 발아하고 성장하는 포자의 % 를 측정하여 수행된다.
일부 구현예에서, 진균 세포는 원생동물 형성 및 원생동물의 형질전환 후 공지된 방식으로 세포 벽의 재생을 포함하는 방법에 의해 형질전환된다. 하나의 특이적 구현예에서, 형질전환을 위한 트리코데르마 종의 조제는 진균 균사로부터의 원생동물의 조제를 포함한다 (특히, 형질전환 방법에 관해, 본원에 전체가 참조로서 인용된 문헌 [Campbell et al ., Curr . Genet . 16:53-56, 1989] 참조). 일부 구현예에서, 균사는 발아된 영양 포자로부터 수득된다. 균사는 원생동물을 야기하는 세포벽을 소화하는 효소로 처리된다. 그 다음 원생동물은 현탁 배지 내 삼투압 안정화제의 존재에 의해 보호된다. 상기 안정화제에는 소르비톨, 만니톨, 염화칼륨, 황산마그네슘 등이 포함된다. 통상, 상기 안정화제의 농도는 0.8 M 내지 1.2 M 이다. 현탁 배지 내 소르비톨의 약 1.2 M 용액을 사용하는 것이 바람직하다.
숙주 트리코데르마 종 균주 내로의 DNA 의 섭취는 칼슘 이온 농도에 따라 다르다. 일반적으로, 약 10 mM CaCl2 내지 50 mM CaCl2 가 섭취 용액에 사용된다. 섭취 용액 내 칼슘 이온 외에, 일반적으로 포함되는 다른 화합물은 TE 완충액 (10 Mm Tris, pH 7.4; 1 mM EDTA) 또는 10 mM MOPS, pH 6.0 완충액 (모르폴린프로판술폰산) 및 폴리에틸렌 글리콜 (PEG) 과 같은 완충 시스템이다. 임의의 특정 이론에 구애되는 것으로 의도되지 않으면서, 폴리에틸렌 글리콜은 세포막을 융합시키도록 작용하여, 배지의 내용물이 트리코데르마 종 균주의 세포질 내로 전달되도록 하고, 플라스미드 DNA 가 핵으로 이동되도록 하는 것으로 여겨진다. 상기 융합은 종종 숙주 염색체 내에 통합된 플라스미드 DNA 의 다중 카피를 남긴다.
통상적으로, 105 내지 107/mL (예컨대 2 × 106/mL) 의 밀도로 투과성 처리에 적용된 트리코데르마 종 원생동물 또는 세포를 함유하는 현탁액이 형질전환에 사용된다. 적합한 용액 (예를 들어, 1.2 M 소르비톨 및 50 mM CaCl2) 내 부피 100 ㎕ 의 상기 원생동물 또는 세포를 바람직한 DNA 와 혼합한다. 일반적으로, 고 농도의 PEG 를 섭취 용액에 첨가한다. 0.1 내지 1 부피의 25% PEG 4000 을 원생동물 현탁액에 첨가할 수 있다. 일부 구현예에서, 약 0.25 부피를 원생동물 현탁액에 첨가한다. 디메틸 술폭시드, 헤파린, 스페르미딘, 염화칼륨 등과 같은 첨가제를 또한 섭취 용액에 첨가하고 형질전환을 도울 수 있다. 유사한 절차가 다른 진균 숙주 세포 (예를 들어, 특히, 형질전환 방법에 관해, 각각 본원에 전체가 참조로서 인용된 미국 특허 번호 6,022,725 및 6,268,328 참조) 에 대해 이용가능하다.
일반적으로, 그 다음 혼합물은 10 내지 30 분의 기간 동안 대략 0℃ 에서 배양된다. 그 다음 부가적인 PEG 를 혼합물에 첨가하여 바람직한 핵산 서열의 섭취를 추가로 향상시킨다. 25% PEG 4000 은 일반적으로 형질전환 혼합물의 부피의 5 내지 15 배 부피로 첨가된다; 그러나, 다소 적거나 많은 부피가 적합할 수 있다. 25% PEG 4000 은 바람직하게는 형질전환 혼합물의 약 10 배 부피이다. PEG 를 첨가한 후, 그 다음 형질전환 혼합물은 소르비톨 및 CaCl2 용액의 첨가 전 실온 또는 빙상에서 배양된다. 그 다음 원생동물 현탁액을 성장 배지의 용융 분취액에 추가로 첨가한다. 성장 배지가 성장 선별 (예를 들어, 아세타미드 또는 항생제) 에 포함되는 경우, 이것은 형질전환체의 성장만을 허용한다.
박테리아 세포의 형질전환은 예를 들어, 특히, 형질전환 방법에 관해, 본원에 전체가 참조로서 인용된 문헌 [Sambrook et al., Molecular Cloning: A Laboratory Manual, Cold Spring Harbor, 1982] 에 기재된 바와 같은 통상의 방법에 따라 수행될 수 있다.
예시적 세포 배양 배지
본 발명에는 또한 이소프렌을 제조하는 세포 또는 배양물 내 세포의 집단이 포함된다. "배양물 내 세포" 란, 세포가 1 회 이상의 세포 분열을 겪도록 하는 용액 (예를 들어, 세포 배지) 내 2 개 이상의 세포를 의미한다. "배양물 내 세포" 에는 식물 조직으로 분화된 세포를 함유하는 살아있는, 다세포 식물의 일부인 식물 세포는 포함되지 않는다. 다양한 구현예에서, 세포 배양물에는 약 10, 20, 50, 100, 200, 500, 1,000, 5,000, 10,000 개 이상의 세포가 포함된다.
임의의 탄소원은 숙주 세포를 배양하기 위해 사용될 수 있다. "탄소원" 이라는 용어는 숙주 세포 또는 유기체에 의해 대사될 수 있는 하나 이상의 탄소-함유 화합물을 말한다. 예를 들어, 숙주 세포를 배양하는데 사용되는 세포 배지에는 생존력을 유지하거나 숙주 세포를 성장시키는데 적합한 임의의 탄소원이 포함될 수 있다.
일부 구현예에서, 탄소원은 탄수화물 (예컨대, 단당류, 이당류, 올리고당류, 또는 다당류), 전화당 (예를 들어, 효소적으로 처리된 수크로오스 시럽), 글리세롤, 글리세린 (예를 들어, 바이오디젤 또는 비누 제조 공정의 글리세린 부산물), 디히드록시아세톤, 일-탄소원, 오일 (예를 들어, 식물 또는 식물성 오일, 예컨대 옥수수, 야자, 또는 대두유), 동물 지방, 동물 오일, 지방산 (예를 들어, 포화 지방산, 불포화 지방산, 또는 다중불포화 지방산), 지질, 인지질, 글리세롤지질, 모노글리세라이드, 디글리세라이드, 트리글리세라이드, 폴리펩티드 (예를 들어, 미생물 또는 식물 단백질 또는 펩티드), 재생가능 탄소원 (예를 들어, 바이오매스 탄소원, 예컨대 가수분해된 바이오매스 탄소원), 효모 추출물, 효모 추출물로부터의 성분, 중합체, 산, 알코올, 알데하이드, 케톤, 아미노산, 숙시네이트, 락테이트, 아세테이트, 에탄올, 또는 상기 중 2 개 이상의 임의의 조합이다. 일부 구현예에서, 탄소원은 글루코오스를 포함하나 이에 제한되지 않는 광합성 생성물이다.
예시적 단당류에는 글루코오스 및 프룩토오스가 포함되고; 예시적 올리고당류에는 락토오스 및 수크로오스가 포함되고, 예시적 다당류에는 전분 및 셀룰로오스가 포함된다. 예시적 탄수화물에는 C6 당 (예를 들어, 프룩토오스, 만노오스, 갈락토오스, 또는 글루코오스) 및 C5 당 (예를 들어, 자일로오스 또는 아라비노오스) 이 포함된다. 일부 구현예에서, 세포 배지에는 탄수화물 뿐 아니라 탄수화물 이외의 탄소원 (예를 들어, 글리세롤, 글리세린, 디히드록시아세톤, 일-탄소원, 오일, 동물 지방, 동물 오일, 지방산, 지질, 인지질, 글리세롤지질, 모노글리세라이드, 디글리세라이드, 트리글리세라이드, 재생가능 탄소원, 또는 효모 추출물로부터의 성분) 이 포함된다. 일부 구현예에서, 세포 배지에는 탄수화물 뿐 아니라 폴리펩티드 (예를 들어, 미생물 또는 식물 단백질 또는 펩티드) 가 포함된다. 일부 구현예에서, 미생물 폴리펩티드는 효모 또는 박테리아로부터의 폴리펩티드이다. 일부 구현예에서, 식물 폴리펩티드는 대두, 옥수수, 카놀라, 야트로파, 야자, 땅콩, 해바라기, 코코넛, 머스타드, 평지씨, 면화씨, 야자핵, 올리브, 잇꽃, 참깨, 또는 아마씨로부터의 폴리펩티드이다.
일부 구현예에서, 탄수화물의 농도는 브로쓰 1 리터 당 약 5 그램 이상 (g/L, 브로쓰의 부피에는 세포의 부피 및 세포 배지의 부피가 모두 포함된다), 예컨대 약 10, 15, 20, 30, 40, 50, 60, 80, 100, 150, 200, 300, 400, 이상 g/L 이다. 일부 구현예에서, 탄수화물의 농도는 약 50 내지 약 400 g/L, 예컨대 약 100 내지 약 360 g/L, 약 120 내지 약 360 g/L, 또는 약 200 내지 약 300 g/L 이다. 일부 구현예에서, 상기 탄수화물의 농도에는 숙주 세포의 배양 전 및/또는 그 동안 첨가되는 탄수화물의 총 양이 포함된다.
일부 구현예에서, 세포는 제한된 글루코오스 조건 하에서 배양된다. "제한된 글루코오스 조건" 이란, 첨가되는 글루코오스의 양이 세포에 의해 소모되는 글루코오스의 양의 약 105% 이하 (예컨대, 약 100%) 인 것을 의미한다. 특정 구현예에서, 배양 배지에 첨가되는 글루코오스의 양은 특정 시간 동안 세포에 의해 소모되는 글루코오스의 양과 대략 동일하다. 일부 구현예에서, 세포 성장 속도는 세포가 세포 배지 내 글루코오스의 양에 의해 지지될 수 있는 속도로 성장하는 식으로 첨가된 글루코오스의 양을 제한하여 조절된다. 일부 구현예에서, 글루코오스는 세포가 배양된 시간 동안 축적되지 않는다. 다양한 구현예에서, 세포는 약 1, 2, 3, 5, 10, 15, 20, 25, 30, 35, 40, 50, 60, 또는 70 시간 이상 동안 제한된 글루코오스 조건 하에서 배양된다. 다양한 구현예에서, 세포는 세포가 배양되는 총 시간 길이의 약 5, 10, 15, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 95, 또는 100% 이상 동안 제한된 글루코오스 조건 하에서 배양된다. 임의의 특정 이론에 구애되는 것으로 의도되지 않으면서, 제한된 글루코오스 조건이 더욱 바람직한 세포의 조절을 가능하게 할 수 있을 것으로 여겨진다.
일부 구현예에서, 세포는 과량의 글루코오스의 존재하에서 배양된다. 특정 구현예에서, 첨가되는 글루코오스의 양은 특정 시간 기간 동안 세포에 의해 소모되는 글루코오스의 양의 약 105% (예컨대, 약 110, 120, 150, 175, 200, 250, 300, 400, 또는 500% 초과) 이상이다. 일부 구현예에서, 글루코오스는 세포가 배양되는 시간 동안 축적된다.
예시적 지질은 포화, 불포화 또는 분지된 C4 이상의 지방산인 하나 이상의 지방산을 함유하는 임의의 성분이다.
예시적 오일은 실온에서 액체인 지질이다. 일부 구현예에서, 지질은 하나 이상의 C4 이상의 지방산 (예를 들어, 4 개 이상의 탄소를 갖는 하나 이상의 포화, 불포화 또는 분지형 지방산을 함유함) 을 함유한다. 일부 구현예에서, 오일은 대두, 옥수수, 카놀라, 야트로파, 야자, 땅콩, 해바라기, 코코넛, 머스타드, 평지씨, 면화씨, 야자핵, 올리브, 잇꽃, 참깨, 아마씨, 유질 미생물 세포, 오구나무, 또는 상기 중 2 이상의 임의의 조합으로부터 수득된다.
예시적 지방산에는 화학식 RCOOH (식 중, "R" 은 탄화수소임) 의 화합물이 포함된다. 예시적 불포화 지방산에는 "R" 에 하나 이상의 탄소-탄소 이중 결합이 포함되는 화합물이 포함된다. 예시적 불포화 지방산에는 올레산, 박센산, 리놀레산, 팔미텔라이드산, 및 아라키돈산이 포함되나 이에 제한되는 것은 아니다. 예시적 다중불포화 지방산에는 "R" 에 다수의 탄소-탄소 이중 결합이 포함되는 화합물이 포함된다. 예시적 포화 지방산에는 "R" 이 포화 지방족 기인 화합물이 포함된다. 일부 구현예에서, 탄소원에는 하나 이상의 C12-C22 지방산, 예컨대 C12 포화 지방산, C14 포화 지방산, C16 포화 지방산, C18 포화 지방산, C20 포화 지방산, 또는 C22 포화 지방산이 포함된다. 예시적 구현예에서, 지방산은 팔미트산이다. 일부 구현예에서, 탄소원은 지방산의 염 (예를 들어, 불포화 지방산), 지방산의 유도체 (예를 들어, 불포화 지방산), 또는 지방산의 염 또는 유도체 (예를 들어, 불포화 지방산) 이다. 적합한 염에는 리튬 염, 칼륨 염, 나트륨 염 등이 포함되나 이에 제한되지 않는다. 디- 및 트리글리세롤은 글리세롤의 지방산 에스테르이다.
일부 구현예에서, 지질, 오일, 지방, 지방산, 모노글리세라이드, 디글리세라이드, 또는 트리글리세라이드의 농도는 브로쓰 1 리터 당 약 1 그램 이상 (g/L, 브로쓰의 부피에는 세포의 부피 및 세포 배지의 부피가 모두 포함된다), 예컨대 약 5, 10, 15, 20, 30, 40, 50, 60, 80, 100, 150, 200, 300, 400 g/L 이상이다. 일부 구현예에서, 지질, 오일, 지방, 지방산, 모노글리세라이드, 디글리세라이드, 또는 트리글리세라이드의 농도는 약 10 내지 약 400 g/L, 예컨대 약 25 내지 약 300 g/L, 약 60 내지 약 180 g/L, 또는 약 75 내지 약 150 g/L 이다. 일부 구현예에서, 농도에는 숙주 세포의 배양 전 및/또는 그 동안 첨가되는 지질, 오일, 지방, 지방산, 모노글리세라이드, 디글리세라이드, 또는 트리글리세라이드의 총 양이 포함된다. 일부 구현예에서, 탄소원에는 (i) 지질, 오일, 지방, 지방산, 모노글리세라이드, 디글리세라이드, 또는 트리글리세라이드 및 (ii) 탄수화물, 예컨대 글루코오스가 모두 포함된다. 일부 구현예에서, 지질, 오일, 지방, 지방산, 모노글리세라이드, 디글리세라이드, 또는 트리글리세라이드 대 탄수화물의 비는 탄소 기준으로 (즉, 탄수화물 탄소 당 지질, 오일, 지방, 지방산, 모노글리세라이드, 디글리세라이드, 또는 트리글리세라이드 내 1 개 탄소) 약 1:1 이다. 특정 구현예에서, 지질, 오일, 지방, 지방산, 모노글리세라이드, 디글리세라이드, 또는 트리글리세라이드의 양은 약 60 내지 180 g/L 이고, 탄수화물의 양은 약 120 내지 360 g/L 이다.
예시적 미생물 폴리펩티드 탄소원에는 효모 또는 박테리아로부터의 하나 이상의 폴리펩티드가 포함된다. 예시적 식물 폴리펩티드 탄소원에는 대두, 옥수수, 카놀라, 야트로파, 야자, 땅콩, 해바라기, 코코넛, 머스타드, 평지씨, 면화씨, 야자핵, 올리브, 잇꽃, 참깨, 또는 아마씨로부터의 하나 이상의 폴리펩티드가 포함된다.
예시적 재생가능 탄소원에는 치즈 유청 침투물, 옥수수 침지액, 사탕무우 당밀, 보리 누룩, 및 상기 중 임의의 것으로부터의 성분이 포함된다. 예시적 재생가능 탄소원에는 또한 바이오매스에 존재하는 글루코오스, 헥소오스, 펜토오스 및 자일로오스, 예컨대 옥수수, 지팽이풀 (switchgrass), 사탕수수, 발효 공정의 세포 폐기물, 및 대두, 옥수수, 또는 밀의 제분으로부터의 단백질 부산물이 포함된다. 일부 구현예에서, 바이오매스 탄소원은 리그노셀룰로오스, 헤미셀룰로오스 또는 세룰로오스 물질, 예컨대, 잔디, 밀, 밀짚, 버개스, 사탕수수 버개스, 침엽수 펄프, 옥수수, 옥수수 속 또는 겉껍질, 옥수수 핵, 옥수수 핵으로부터의 섬유, 옥수수 대, 지팽이풀, 왕겨 생성물, 또는 곡물의 습윤 또는 건조 제분으로부터의 부산물 (예를 들어, 옥수수, 수수, 호밀, 라이밀 (triticate), 보리, 밀, 및/또는 주정박) 이나 이에 제한되지 않는다. 예시적 세룰로오스 물질에는 목재, 종이 및 펄프 폐기물, 초본 식물, 및 과일 과육이 포함된다. 일부 구현예에서, 탄소원에는 임의의 식물 부분, 예컨대 줄기, 곡물, 뿌리 또는 덩이줄기가 포함된다. 일부 구현예에서, 하기 식물 중 임의의 것의 전부 또는 일부는 탄소원으로서 사용된다: 옥수수, 밀, 호밀, 수수, 라이밀, 쌀, 기장, 보리, 카사바, 콩과, 예컨대 콩 및 완두콩, 감자, 고구마, 바나나, 사탕수수, 및/또는 타피오카. 일부 구현예에서, 탄소원은 바이오매스 가수분해물, 예컨대 자일로오스 및 글루코오스를 모두 포함하는 또는 수크로오스 및 글루코오스를 모두 포함하는 바이오매스 가수분해물이다.
일부 구현예에서, 재생가능 탄소원 (예컨대, 바이오매스) 은 세포 배양 배지에 첨가되기 전에 전처리된다. 일부 구현예에서, 전처리에는 효소적 전처리, 화학적 전처리, 또는 효소적 및 화학적 전처리 모두의 조합 (예를 들어, 특히, 재생가능 탄소원의 전처리에 관해, 각각 본원에 전체가 참조로서 인용된 문헌 [Farzaneh et al ., Bioresource Technology 96 (18): 2014-2018, 2005]; 미국 특허 번호 6,176,176; 미국 특허 번호 6,106,888 참조) 이 포함된다. 일부 구현예에서, 재생가능 탄소원은 세포 배양 배지에 첨가되기 전에 부분적으로 또는 완전히 가수분해된다.
일부 구현예에서, 재생가능 탄소원 (예컨대, 옥수수 대) 은 세포 배양 배지에 첨가하기 전에 암모니아 섬유 팽창 (AFEX) 전처리에 적용된다 (예를 들어, 문헌 [Farzaneh et al ., Bioresource Technology 96 (18): 2014-2018, 2005] 참조). AFEX 전처리 동안, 재생가능 탄소원을 중간 온도 (예컨대, 약 60 내지 약 100℃) 및 고압 (예컨대, 약 250 내지 약 300 psi) 에서 약 5 분 동안 액체 무수 암모니아로 처리한다. 그 다음, 압력은 빠르게 방출된다. 이 과정에서, 리그닌 가용화, 헤미셀룰로오스 가수분해, 셀룰로오스 탈결정화 (decrystallization) 의 조합된 화학적 및 물리적 효과, 및 증가된 표면적은 셀룰로오스 및 헤미셀룰로오스의 발효성 당으로의 거의 완전한 효소적 전환을 가능하게 한다. AFEX 전처리는, 거의 모든 암모니아가 회수 및 재사용될 수 있는 반면, 나머지는 하류방향 과정 내 미생물에 대한 질소원으로서 담당한다는 장점을 갖는다. 또한, 세정 스트림이 AFEX 전처리에 필요하지 않다. 그러므로, AFEX 처리 후 건조 물질 회수는 본질적으로 100% 이다. AFEX 는 기본적으로 건조 내지 건조 공정이다. 처리된 재생가능 탄소원은 장기간 동안 안정하고, 효소적 가수분해 또는 발효 공정에 매우 높은 고체 적재량으로 공급될 수 있다. 셀룰로오스 및 헤미셀룰로오스는 분해되지 않거나 거의 분해되지 않으면서, AFEX 공정에서 매우 잘 보존된다. AFEX 전처리를 거친 재생가능 탄소원의 효소적 가수분해 전에 중화할 필요가 없다. AFEX-처리된 탄소원의 효소적 가수분해는 후속 발효 용도를 위해 깨끗한 당 스트림을 생성한다.
일부 구현예에서, 탄소원 (예를 들어, 재생가능 탄소원) 의 농도는 약 0.1, 0.5, 1, 1.5, 2, 3, 4, 5, 10, 15, 20, 30, 40, 또는 50% 이상 글루코오스 (w/v) 에 동등하다. 동등량의 글루코오스는 탄소원으로부터 발생된 글루코오스의 양을 측정하기 위한 참조로서 글루코오스로의 표준 HPLC 방법을 사용하여 측정할 수 있다. 일부 구현예에서, 탄소원 (예를 들어, 재생가능 탄소원) 의 농도는 약 0.1 내지 약 20% 글루코오스, 예컨대 약 0.1 내지 약 10% 글루코오스, 약 0.5 내지 약 10% 글루코오스, 약 1 내지 약 10% 글루코오스, 약 1 내지 약 5% 글루코오스, 또는 약 1 내지 약 2% 글루코오스에 동등하다.
일부 구현예에서, 탄소원에는 효모 추출물 또는 효모 추출물의 하나 이상의 성분이 포함된다. 일부 구현예에서, 효모 추출물의 농도는 브로쓰 1 리터 당 1 그램 이상의 효모 추출물 (g/L, 브로쓰의 부피에는 세포의 부피 및 세포 배지의 부피가 모두 포함된다), 예컨대 약 5, 10, 15, 20, 30, 40, 50, 60, 80, 100, 150, 200, 300 g/L 이상이다. 일부 구현예에서, 효모 추출물의 농도는 약 1 내지 약 300 g/L, 예컨대 약 1 내지 약 200 g/L, 약 5 내지 약 200 g/L, 약 5 내지 약 100 g/L, 또는 약 5 내지 약 60 g/L 이다. 일부 구현예에서, 농도에는 숙주 세포의 배양 전 및/또는 그 동안 첨가되는 효모 추출물의 총 양이 포함된다. 일부 구현예에서, 탄소원에는 효모 추출물 (또는 그의 하나 이상의 성분) 및 또다른 탄소원, 예컨대 글루코오스 모두가 포함된다. 일부 구현예에서, 효모 추출물 대 다른 탄소원의 비는 약 1:5, 약 1:10, 또는 약 1:20 (w/w) 이다.
부가적으로는, 탄소원은 또한 이산화탄소, 또는 메탄올과 같은 1-탄소 기질일 것이다. 단일 탄소원 (예를 들어, 메탄올, 포름알데하이드, 또는 포르메이트) 로부터의 글리세롤 제조는 메틸요구성 효모 (특히, 탄소원에 관해, 본원에 전체가 참조로서 인용된 문헌 [Yamada et al ., Agric . Biol . Chem ., 53(2) 541-543, 1989]) 및 박테리아 (특히, 탄소원에 관해, 본원에 전체가 참조로서 인용된 문헌 [Hunter et . al ., Biochemistry, 24, 4148-4155, 1985]) 에서 보고되어 있다. 상기 유기체는 메탄에서 포르메이트로의 산화 상태 범위의 단일 탄소 화합물을 동화시키고, 글리세롤을 제조할 수 있다. 탄소 동화 경로는 리불로오스 모노포스페이트를 통해, 세린을 통해, 또는 자일룰로오스-모노포스페이트를 통해 (특히, 탄소원에 관해, 본원에 전체가 참조로서 인용된 문헌 [Gottschalk, Bacterial Metabolism, Second Edition, Springer-Verlag: New York, 1986]) 이루어질 수 있다. 리불로오스 모노포스페이트 경로에는 프룩토오스 및 결국에는 3 탄소 생성물 글리세르알데하이드-3-포스페이트가 되는 6 탄당을 형성하는, 포르메이트의 리불로오스-5-포스페이트와의 축합이 포함된다. 마찬가지로, 세린 경로는 메틸렌테트라히드로폴레이트를 통한 당분해 경로로 1-탄소 화합물을 동화시킨다.
1 내지 2 탄소 기질 외에, 메틸요구성 유기체는 또한 대사 활성을 위해 메틸아민, 글루코사민과 같은 화합물 및 다양한 아미노산을 함유하는 수 많은 다른 탄소를 이용하는 것으로 알려져 있다. 예를 들어, 메틸요구성 효모는 트레할로오스 또는 글리세롤을 형성하기 위해 메틸아민으로부터 탄소를 이용하는 것으로 알려져 있다 (특히, 탄소원에 관해, 본원에 전체가 참조로서 인용된 문헌 [Bellion et al, Microb . Growth Cl Compd ., [Int. Symp.], 7th ed., 415-32. Editors: Murrell et al ., Publisher: Intercept, Andover, UK, 1993]). 유사하게는, 칸디다의 다양한 종은 알라닌 또는 올레산을 대사한다 (특히, 탄소원에 관해, 본원에 전체가 참조로서 인용된 문헌 [Suiter et al ., Arch . Microbiol. 153(5), 485-9, 1990]).
일부 구현예에서, 세포를 생리학적 염 및 영양분을 함유하는 표준 배지에서 배양한다 (예를 들어, 특히, 세포 배지에 관해, 본원에 전체가 각각 참조로서 인용된 문헌 [Pourquie, J. et al ., Biochemistry and Genetics of Cellulose Degradation, eds. Aubert et al., Academic Press, pp. 71-86, 1988 및 Ilmen et al., Appl . Environ . Microbiol . 63:1298-1306, 1997] 참조). 예시적 성장 배지는 보통의 시판 제조 배지, 예컨대 루리아 베르타니 (Luria Bertani: LB) 브로쓰, 사보우라우드 덱스트로오스 (Sabouraud Dextrose: SD) 브로쓰, 또는 효모 배지 (Yeast medium: YM) 브로쓰이다. 기타 정의된 또는 합성 성장 배지가 또한 사용될 수 있고, 특정 숙주 세포의 성장에 적합한 배지가 미생물학 또는 발효 과학 당업자에게 알려져 있다.
적합한 탄소원 외에, 세포 배지는 바람직하게는 적합한 미네랄, 염, 보조인자, 완충액, 및 배양물 성장 또는 이소프렌 제조의 향상에 적합한 당업자에게 알려져 있는 다른 성분을 함유한다 (예를 들어, 특히, 세포 배지 및 세포 배양 조건에 관해, 본원에 전체가 각각 참조로서 인용된 WO 2004/033646 및 그곳에 언급된 참조문헌 및 WO 96/35796 및 그곳에 언급된 참조문헌 참조). 이소프렌 합성효소, DXS, IDI, 및/또는 MVA 경로 핵산이 유도성 프로모터의 조절 하에 있는 일부 구현예에서, 유도제 (예를 들어, 당, 금속 염 또는 항생제) 가 바람직하게는, 이소프렌 합성효소, DXS, IDI, 및/또는 MVA 경로 폴리펩티드의 발현을 유도하는데 효과적인 농도로 배지에 첨가된다. 일부 구현예에서, 세포 배지는 하나 이상의 DXS, IDI, 또는 MVA 경로 핵산을 갖는 벡터 상의 항생제 내성 핵산 (예컨대, 카나마이신 내성 핵산) 에 상응하는 항생제 (예컨대, 카나마이신) 를 갖는다.
예시적 세포 배양 조건
박테리아 배양물의 유지 및 성장에 적합한 물질 및 방법은 당업계에 잘 알려져 있다. 예시적 기술은 특히, 세포 배양 기술에 관해, 본원에 전체가 각각 참조로서 인용된 문헌 [Manual of Methods for General Bacteriology Gerhardt et al., eds), American Society for Microbiology, Washington, D.C. (1994) 또는 Brock in Biotechnology : A Textbook of Industrial Microbiology, Second Edition (1989) Sinauer Associates, Inc., Sunderland, MA] 에서 찾을 수 있다. 일부 구현예에서, 세포는 숙주 세포 내에 삽입된 핵산에 의해 코딩되는 하나 이상의 이소프렌 합성효소, DXS, IDI, 또는 MVA 경로 폴리펩티드의 발현을 가능하게 하는 조건 하에서 배양 배지에서 배양된다.
표준 세포 배양 조건은 세포를 배양하는데 사용될 수 있다 (예를 들어, 특히, 세포 배양 및 발효 조건에 관해, 본원에 전체가 참조로서 인용된 WO 2004/033646 및 그곳에 언급된 참조문헌 참조). 적합한 온도, 기체 혼합물, 및 pH (예컨대 약 20 내지 약 37℃, 약 6% 내지 약 84% CO2, 및 pH 약 5 내지 약 9) 에서 세포를 성장 및 유지시킨다. 일부 구현예에서, 적합한 세포 배지에서 세포를 35℃ 에서 성장시킨다. 일부 구현예에서, 예를 들어, 원하는 양의 이소프렌 제조가 달성될 때까지 배양물을 진탕 배양물 또는 발효기 내의 적합한 배지에서 대략 28℃ 에서 배양한다. 일부 구현예에서, 발효를 위한 pH 범위는 약 pH 5.0 내지 약 pH 9.0 (예컨대, 약 pH 6.0 내지 약 pH 8.0 또는 약 6.5 내지 약 7.0) 이다. 숙주 세포의 요구에 근거해, 호기성, 무산소성 또는 혐기성 조건 하에서 반응을 수행할 수 있다. 제시된 사상 진균을 위한 예시적 배양 조건은 당업계에 알려져 있고, 과학 문헌 및/또는 미국 미생물 보존센터 및 진균 유전학 저장 센터 [American Type Culture Collection and Fungal Genetics Stock Center] 와 같은 진균 공급원으로부터 찾을 수 있다.
다양한 구현예에서, 임의의 공지된 발효 방식, 예컨대 배치, 공급-배치, 또는 연속 과정을 사용하여 세포를 성장시킨다. 일부 구현예에서, 배치 발효 방법이 사용된다. 고전적인 배치 발효는 배지 조성이 발효 시작시에 고정되고, 발효 동안 인위적인 변경을 적용하지 않는 폐쇄계이다. 그러므로, 발효 시작 시, 세포 배지를 바람직한 숙주 세포로 접종하고, 발효는 시스템에 아무것도 첨가하지 않고 일어나게 한다. 그러나, 전형적으로는 "배치" 발효는 탄소원의 첨가에 관한 배치이고, pH 및 산소 농도와 같은 인자에 대한 조절 시도가 종종 이루어진다. 배치 시스템에서, 시스템의 대사물질 및 바이오매스 조성물은 발효가 중지되는 시간까지 계속 변한다. 배치 배양물 내에서, 세포는 정적 지체상에서 고속 성장 로그 상으로, 그리고 최종적으로 성장 속도가 감소하거나 중단되는 정지상으로 조정된다. 일부 구현예에서, 로그상 내 세포는 대부분의 이소프렌 제조를 담당한다. 일부 구현예에서, 정지상 내 세포는 이소프렌을 제조한다.
일부 구현예에서, 표준 배치 시스템에 대한 변형, 예컨대 공급-배치식 시스템이 사용된다. 공급-배치식 발효 공정은 발효가 진행되면 탄소원을 증분으로 첨가하는 제외가 있는 전형적인 배치 시스템을 포함한다. 공급-배치식 시스템은 대사물질 억제가 세포의 대사를 억제하기 쉬울 때, 및 세포 배지 내 제한된 양의 탄소원을 갖는 것이 바람직한 경우 유용하다. 공급-배치식 발효는 제한된 양 또는 과량의 탄소원 (예를 들어, 글루코오스) 으로 수행될 수 있다. 공급-배치식 시스템 내 실제 탄소원 농도의 측정은 어렵고, 그러므로 측정가능한 인자, 예컨대 pH, 용존 산소, 및 CO2 와 같은 폐 기체의 부분압의 변화에 근거하여 추정된다. 배치 및 공급-배치식 발효는 통상적이고 당업계에 잘 알려져 있으며, 예는 특히, 세포 배양물 및 발효 조건에 관해, 본원에 전체가 각각 참조로서 인용된 문헌 [Brock, Biotechnology: A Textbook of Industrial Microbiology, Second Edition (1989) Sinauer Associates, Inc.] 에서 찾을 수 있다.
일부 구현예에서, 연속 발효 방법이 사용된다. 연속 발효는 정의된 발효 배지를 생물반응기에 연속해서 첨가하고, 동등 량의 조건화 배지를 처리를 위해 동시에 제거하는 개방계이다. 연속 발효는 일반적으로, 세포가 주로 로그 상 성장에 있을 때 일정한 고 밀도로 배양물을 유지한다.
연속 발효는 세포 성장 또는 이소프렌 제조에 영향을 주는 하나의 인자 또는 임의의 수의 인자의 조절을 가능하게 한다. 예를 들어, 하나의 방법은 제한 영양분, 예컨대 탄소원 또는 질소 수준을 고정된 속도로 유지하고, 모든 다른 변수를 적정하게 한다. 다른 시스템에서, 성장에 영향을 주는 다수의 인자는 계속 변할 수 있지만, 세포 농도 (예를 들어, 배지 탁도에 의해 측정된 농도) 가 일정하게 유지된다. 연속 시스템은 안정한 상태 성장 조건을 유지하기 위해 노력한다. 그러므로, 배출되는 배지로 인한 세포 손실은 발효 내 세포 성장 속도에 대해 균형을 이룬다. 연속 발효 공정을 위한 영양분 및 성장 인자 조절 방법 뿐 아니라, 생성물 형성 속도 최대화 기술은 산업 미생물 분야에 잘 알려져 있고, 다양한 방법이 특히, 세포 배양물 및 발효 조건에 관해, 본원에 전체가 참조로서 인용된 문헌 [Brock, Biotechnology: A Textbook of Industrial Microbiology, Second Edition (1989) Sinauer Associates, Inc.] 에 상세히 기재되어 있다.
일부 구현예에서, 세포는 전체 세포 촉매로서 기질 상에 고정되고, 이소프렌 제조를 위해 발효 조건에 적용된다.
일부 구현예에서, 산소를 액체에 도입하고 배양물의 균일성을 유지하기 위해 액체 배양 병을 진탕기 내에 둔다. 일부 구현예에서, 배양물이 성장하는 온도, 습도, 진탕 속도, 및/또는 다른 조건을 조절하기 위해 인큐베이터를 사용한다. 가장 간단한 인큐베이터는 전형적으로 약 65℃ 이하인, 조절가능한 히터가 있는 절연 박스이다. 더욱 정교한 인큐베이터에는 또한 온도 (냉장고를 통해) 저하 능력, 또는 습도 또는 CO2 수준 조절 능력이 포함될 수 있다. 대부분의 인큐베이터에는 타이머가 포함되고; 일부는 또한 상이한 온도, 습도 수준, 등을 통해 사이클을 프로그래밍할 수 있다. 인큐베이터는 크기가 테이블탑에서 유닛까지 작은 공간의 크기가 다양할 수 있다.
원한다면, 세포 배지의 일부 또는 전부는 영양분 보충 및/또는 잠재적으로 유해한 대사 부산물 및 사멸 세포의 축적을 피하기 위해 교체될 수 있다. 현탁 배양의 경우, 세포는 현탁 배양물을 원심분리 또는 여과한 다음, 신선한 배지에 세포를 재현탁함으로써 배지로부터 분리될 수 있다. 부착 배양의 경우, 배지는 흡입에 의해 직접적으로 제거되고 대체될 수 있다. 일부 구현예에서, 세포 배지는 세포의 일부 이상이 연속 배양물 (예컨대, 희석 없는 연속 배양물) 에서 약 5, 10, 20, 40, 50, 60, 65 이상의 세포 분열에 대해 분열하도록 한다.
일부 구현예에서, 구성적 또는 누출 프로모터 (예컨대, Trc 프로모터) 가 사용되고, 화합물 (예컨대, IPTG) 은 프로모터에 작동가능하게 연결된 이소프렌 합성효소, DXS, IDI, 또는 MVA 경로 핵산(들) 의 발현을 유도하기 위해 첨가되지 않는다. 일부 구현예에서, 화합물 (예컨대, IPTG) 은 프로모터에 작동가능하게 연결된 이소프렌 합성효소, DXS, IDI, 또는 MVA 경로 핵산(들) 의 발현을 유도하기 위해 첨가된다.
세포 성장과 이소프렌 제조를 분리하기 위한 예시적 방법
바람직하게는, 공급원료로부터의 탄소는 세포의 성장 및 유지보다는 이소프렌으로 전환된다. 일부 구현예에서, 세포를 저 내지 중간 OD600 으로 성장시킨 다음, 이소프렌 제조를 시작 또는 증가시킨다. 상기 전략은 많은 부분의 탄소가 이소프렌으로 전환되도록 한다.
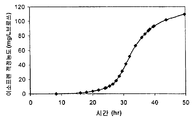
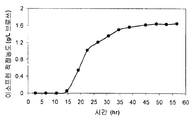
일부 구현예에서, 세포는 이들이 더이상 분열하지 않거나 매우 천천히 분열하면서, 여러 시간 (예컨대, 약 2, 4, 6, 8, 10, 15, 20, 25, 30 시간 이상) 동안 이소프렌을 계속 제조하는 정도의 광학 밀도에 도달한다. 예를 들어, 도 60A-67C 는 세포가 이들이 더이상 분열하지 않거나 매우 천천히 분열하는 정도의 광학 밀도에 도달한 후 세포가 상당량의 메발론산 또는 이소프렌을 계속 제조할 수 있음을 나타낸다. 이 경우, 550 nm 에서의 광학 밀도는 시간에 걸쳐 감소하고 (예컨대 세포가 세포 용해, 성장 중단, 영양분 결핍 또는 세포 성장 결핍을 초래하는 다른 인자로 인해 더이상 기하급수적 성장상에 있지 않은 후 광학 밀도의 감소), 세포는 상당량의 메발론산 또는 이소프렌을 계속 제조한다. 일부 구현예에서, 세포의 550 nm 에서의 광학 밀도는 특정 시간 동안 (예컨대 약 5, 10, 15, 20, 25, 30, 40, 50 또는 60 시간 이상) 에 걸쳐 약 50% 이하 (예컨대 약 40, 30, 20, 10, 5, 또는 0% 이하) 로 증가하고, 상기 시간 동안 세포는 이소프렌을 약 1, 10, 25, 50, 100, 150, 200, 250, 300, 400, 500, 600, 700, 800, 900, 1,000; 1,250; 1,500; 1,750; 2,000; 2,500; 3,000; 4,000; 5,000; 10,000; 20,000; 30,000; 40,000; 50,000; 100,000; 200,000; 300,000; 400,000; 500,000; 600,000; 700,000; 800,000; 900,000; 1,000,000 이상 몰의 이소프렌/세포의 습윤 중량에 대한 세포 g/시간 (nmole/gwcm/hr) 로 제조한다. 일부 구현예에서, 이소프렌의 양은 약 2 내지 약 5,000 nmole/gwcm/hr, 예컨대 약 2 내지 약 100 nmole/gwcm/hr, 약 100 내지 약 500 nmole/gwcm/hr, 약 150 내지 약 500 nmole/gwcm/hr, 약 500 내지 약 1,000 nmole/gwcm/hr, 약 1,000 내지 약 2,000 nmole/gwcm/hr, 또는 약 2,000 내지 약 5,000 nmole/gwcm/hr 이다. 일부 구현예에서, 이소프렌의 양은 약 20 내지 약 5,000 nmole/gwcm/hr, 약 100 내지 약 5,000 nmole/gwcm/hr, 약 200 내지 약 2,000 nmole/gwcm/hr, 약 200 내지 약 1,000 nmole/gwcm/hr, 약 300 내지 약 1,000 nmole/gwcm/hr, 또는 약 400 내지 약 1,000 nmole/gwcm/hr 이다.
일부 구현예에서, 세포의 550 nm 에서의 광학 밀도는 특정 시간 (예컨대 약 5, 10, 15, 20, 25, 30, 40, 50 또는 60 시간 이상) 에 걸쳐 약 50% 이하 (예컨대 약 40, 30, 20, 10, 5, 또는 0% 이하) 로 감소하고, 세포는 상기 시간 동안 약 1, 10, 25, 50, 100, 150, 200, 250, 300, 400, 500, 600, 700, 800, 900, 1,000, 1,250, 1,500, 1,750, 2,000, 2,500, 3,000, 4,000, 5,000, 10,000, 50,000, 100,000, mg 이상의 이소프렌/브로쓰 L (mg/L브로쓰, 브로쓰의 부피에는 세포의 부피 및 세포 배지의 부피가 포함된다) 의 이소프렌의 누적 적정농도 (총 양) 를 제조한다. 일부 구현예에서, 이소프렌의 양은 약 2 내지 약 5,000 mg/L브로쓰, 예컨대 약 2 내지 약 100 mg/L브로쓰, 약 100 내지 약 500 mg/L브로쓰, 약 500 내지 약 1,000 mg/L브 로쓰, 약 1,000 내지 약 2,000 mg/L브로쓰, 또는 약 2,000 내지 약 5,000 mg/L브로쓰 이다. 일부 구현예에서, 이소프렌의 양은 약 20 내지 약 5,000 mg/L브로쓰, 약 100 내지 약 5,000 mg/L브로쓰, 약 200 내지 약 2,000 mg/L브로쓰, 약 200 내지 약 1,000 mg/L브로 쓰, 약 300 내지 약 1,000 mg/L브로쓰, 또는 약 400 내지 약 1,000 mg/L브로쓰 이다.
일부 구현예에서, 세포의 550 nm 에서의 광학 밀도는 특정 시간 (예컨대 약 5, 10, 15, 20, 25, 30, 40, 50 또는 60 시간 이상) 에 걸쳐 약 50% 이하 (예컨대 약 40, 30, 20, 10, 5, 또는 0% 이하) 로 증가하고, 그 시간 동안 세포는 약 0.0015, 0.002, 0.005, 0.01, 0.02, 0.05, 0.1, 0.12, 0.14, 0.16, 0.2, 0.3, 0.4, 0.5, 0.6, 0.7, 0.8, 0.9, 1.0, 1.2, 1.4, 1.6, 1.8, 2.0, 2.5, 3.0, 3.5, 4.0, 5.0, 6.0, 7.0, 또는 8.0% 이상의 세포 배양 배지 내 탄소를 이소프렌으로 전환시킨다. 일부 구현예에서, 탄소의 이소프렌으로의 % 전환율은 예컨대 약 0.002 내지 약 4.0%, 약 0.002 내지 약 3.0%, 약 0.002 내지 약 2.0%, 약 0.002 내지 약 1.6%, 약 0.002 내지 약 0.005%, 약 0.005 내지 약 0.01%, 약 0.01 내지 약 0.05%, 약 0.05 내지 약 0.15%, 0.15 내지 약 0.2%, 약 0.2 내지 약 0.3%, 약 0.3 내지 약 0.5%, 약 0.5 내지 약 0.8%, 약 0.8 내지 약 1.0%, 또는 약 1.0 내지 약 1.6% 이다. 일부 구현예에서, 탄소의 이소프렌으로의 % 전환율은 약 0.002 내지 약 0.4%, 0.002 내지 약 0.16%, 0.04 내지 약 0.16%, 약 0.005 내지 약 0.3%, 약 0.01 내지 약 0.3%, 또는 약 0.05 내지 약 0.3% 이다.
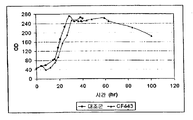
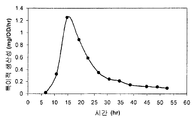
일부 구현예에서, 이소프렌은 오직 정지상에서 제조된다. 일부 구현예에서, 이소프렌은 성장상 및 정지상 모두에서 제조된다. 다양한 구현예에서, 정지상 동안 제조된 이소프렌의 양 (예컨대 제조된 이소프렌의 총 양 또는 OD600 당 1 시간 당 브로쓰 1 리터 당 제조된 이소프렌의 양) 은 동일한 시간 동안의 성장상 동안 제조된 이소프렌의 양의 약 2, 3, 4, 5, 10, 20, 30, 40, 50 배 이상이다. 다양한 구현예에서, 세포가 정지상에 있는 동안, 제조되는 이소프렌의 총 양 (예컨대, 특정 시간, 예컨대 20 시간 동안의 발효 동안 이소프렌의 제조) 의 약 5, 10, 20, 30, 40, 50, 60, 70, 80, 90, 95, 99% 이상이 제조된다. 다양한 구현예에서, 세포의 550 nm 에서의 광학 밀도가 약 50% 이하 (예컨대, 약 40, 30, 20, 10, 5, 또는 0% 이하) 로 증가하는 정도로 세포가 천천히 분열하거나 전혀 분열하지 않는 동안, 제조되는 이소프렌의 총 양 (예컨대, 특정 시간, 예컨대 20 시간 동안의 발효 동안 이소프렌의 제조) 의 약 5, 10, 20, 30, 40, 50, 60, 70, 80, 90, 95, 99% 이상이 제조된다. 일부 구현예에서, 이소프렌은 오직 성장상에서 제조된다.
일부 구현예에서, 하나 이상의 MVA 경로, IDI, DXP, 또는 이소프렌 합성효소 핵산은 성장상에서보다 정지상에서 더욱 활성인 프로모터 또는 인자의 조절 하에 있다. 예를 들어, 하나 이상의 MVA 경로, IDI, DXP, 또는 이소프렌 합성효소 핵산은 정지상 시그마 인자, 예컨대 RpoS 의 조절 하에 있을 수 있다. 일부 구현예에서, 하나 이상의 MVA 경로, IDI, DXP, 또는 이소프렌 합성효소 핵산은 정지상에서 활성인 반응 조절자에 의해 유도가능한 프로모터와 같은, 정지상에서 유도가능한 프로모터의 조절 하에 있다.
안전한 조작 범위 내에서의 이소프렌의 제조
가연성 특성에 따라 안전한 조작 수준 내에서의 이소프렌의 제조는 상업적 설비의 디자인 및 구축을 단순히하고, 안전하게 작업하기 위한 능력을 크게 향상시키고, 화재 발생 잠재성을 제한한다. 특히, 이소프렌 제조를 위한 최적 범위는 안전한 구역, 즉, 불연성 범위의 이소프렌 농도 내이다. 하나의 이러한 양상에서, 본 발명은 불연성 범위의 이소프렌 농도 내 (이소프렌의 가연성 엔벨로프 외부) 이소프렌의 제조 방법을 특징으로 한다.
그러므로, 공정 안전성을 확실히 하기 위해, 이소프렌의 연소 한계 (예컨대 O2, N2, CO2, 또는 상기 기체 중 2 개 이상의 임의의 조합의 존재하에서의 이소프렌) 를 측정하는데 컴퓨터 모델링 및 실험적 시험을 사용하였다. 가연성 엔벨로프는 연소 하한계 (LFL), 연소 상한계 (UFL), 제한 산소 농도 (LOC), 및 제한 온도를 특징으로 한다. 연소되는 시스템에 대해, 최소량의 연료 (예컨대, 이소프렌) 가 최소량의 산화제, 전형적으로 산소의 존재하에 있어야만 한다. LFL 은 연소를 유지하기 위해 존재해야만 하는 최소량의 이소프렌인 반면, UFL 은 존재할 수 있는 최대 량의 이소프렌이다. 상기 제한 초과에서, 혼합물은 풍부한 연료이고, 산소 분획은 가연성 혼합물을 갖기엔 너무 낮다. LOC 는 가연성 혼합물을 갖기 위해 또한 존재해야만 하는 최소 분획의 산소를 나타낸다. 제한 온도는 이소프렌 발화점을 기준으로 하며, 이소프렌의 연소를 발할 수 있는 최하 온도이다. 상기 한계는 이소프렌의 농도, 산화제의 유형 및 농도, 시스템 내 존재하는 비활성 물질, 온도, 및 시스템의 압력에 특이적이다. 가연성 엔벨로프의 제한 내에 놓인 조성물은 연소를 발하고 공정 설비의 디자인 및 조작 모두에서 부가적인 안전성 예방책을 필요로 한다.
하기 조건은 컴퓨터 시뮬레이션 및 수학적 분석 및 실험적 시험을 사용하여 시험되었다. 원한다면, 다른 조건 (예컨대 다른 온도, 압력, 및 영구 기체 조성) 은 LFL, UFL, 및 LOC 농도를 측정하기 위해 본원에 기재된 방법을 사용하여 시험될 수 있다.
(1) 컴퓨터 시뮬레이션 및 수학적 분석
시험 스위트 1:
이소프렌: 0 wt% - 14 wt%
O2: 6 wt% - 21 wt%
N2: 79 wt% - 94 wt%
시험 스위트 2:
이소프렌: 0 wt% - 14 wt%
O2: 6 wt% - 21 wt%
N2: 79 wt% - 94 wt%
H2O 로 포화됨
시험 스위트 3:
이소프렌: 0 wt% - 14 wt%
O2: 6 wt% - 21 wt%
N2: 79 wt% - 94 wt%
CO2: 5 wt% - 30 wt%
(2) 연소 한계의 최종 측정을 위한 실험적 시험
시험 스위트 1:
이소프렌: 0 wt% - 14 wt%
O2: 6 wt% - 21 wt%
N2: 79 wt% - 94 wt%
시험 스위트 2:
이소프렌: 0 wt% - 14 wt%
O2: 6 wt% - 21 wt%
N2: 79 wt% - 94 wt%
H2O 로 포화됨
시뮬레이션 소프트웨어를 사용하여 여러 상이한 시험 조건에 대해 시스템의 가연성 특성의 추정치를 제공하였다. CO2 는 시스템의 연소 한계에 대해 유의한 영향을 보이지 않았다. 시험 스위트 1 및 2 는 실험적 시험에 의해 확인되었다. 모델링 결과는 실험적 시험 결과와 연관이 있었다. 물을 첨가하면 약간의 변화만이 발견되었다.
LOC 는 40℃, 1 대기압에서 이소프렌, O2, N2, 및 CO2 혼합물에 대해 9.5 부피% 인 것으로 측정되었다. 30% 이하의 CO2 의 첨가는 이소프렌, O2, 및 N2 혼합물의 가연성 특성에 유의하게 영향을 미치지 않았다. 가연성 특성에서의 오직 약간의 변화가 건조 및 물 포화 이소프렌, O2, 및 N2 시스템 사이에서 보였다. 제한 온도는 약 -54℃ 이다. 약 -54℃ 미만의 온도는 이소프렌의 연소를 발하기에는 너무 낮다.
일부 구현예에서, 시스템 내의 산소의 양에 따라 이소프렌의 LFL 은 약 1.5 부피% 내지 약 2.0 부피% 의 범위이고, 이소프렌의 UFL 은 약 2.0 부피% 내지 약 12.0 부피% 의 범위이다. 일부 구현예에서, LOC 는 약 9.5 부피% 산소이다. 일부 구현예에서, 이소프렌의 LFL 은 약 1.5 부피% 내지 약 2.0 부피% 이고, 이소프렌의 UFL 은 약 2.0 부피% 내지 약 12.0 부피% 이고, 온도가 약 25℃ 내지 약 55℃ (예컨대, 약 40℃) 인 경우 LOC 는 약 9.5 부피% 산소이고, 압력은 약 1 대기압 내지 3 대기압이다.
일부 구현예에서, 이소프렌은 약 9.5 부피% 산소 미만 (즉, 이소프렌의 가연성 혼합물을 갖기 위해 필요한 LOC 미만) 의 존재하에서 제조된다. 이소프렌이 약 9.5 부피% 산소 이상의 존재하에서 제조되는 일부 구현예에서, 이소프렌 농도는 LFL 미만 (예컨대 약 1.5 부피% 미만) 이다. 예를 들어, 이소프렌의 양은 이소프렌 조성물을 비활성 기체로 희석함으로써 (예를 들어, 이소프렌 조성물을 LFL 미만으로 유지하기 위해 질소와 같은 비활성 기체를 연속적으로 또는 주기적으로 첨가함으로써) LFL 미만으로 유지될 수 있다. 이소프렌이 약 9.5 부피% 산소 이상의 존재하에서 제조되는 일부 구현예에서, 이소프렌 농도는 UFL 초과 (예컨대 약 12 부피% 초과) 이다. 예를 들어, 이소프렌의 양은 이소프렌을 UFL 초과의 농도로 제조하는 시스템 (예컨대 본원에 기재된 세포 배양 시스템 중 임의의 것) 을 사용하여 UFL 초과의 농도로 유지될 수 있다. 바람직한 경우, 비교적 낮은 수준의 산소가 사용되어 UFL 이 또한 비교적 낮도록 할 수 있다. 이 경우, UFL 초과로 남아있기 위해 보다 낮은 이소프렌 농도가 필요하다.
이소프렌이 약 9.5 부피% 산소 이상의 존재하에서 제조되는 일부 구현예에서, 이소프렌 농도는 가연성 엔벨로프 내 (예컨대 LFL 내지 UFL) 이다. 이소프렌 농도가 가연성 엔벨로프 내에 있을 수 있는 일부 구현예에서, 화재 또는 폭발 가능성을 감소시키기 위해 하나 이상의 단계가 수행된다. 예를 들어, 하나 이상의 점화원 (예컨대, 스파크를 일으킬 수 있는 임의의 물질) 이 회피될 수 있다. 일부 구현예에서, 이소프렌의 농도가 가연성 엔벨로프 내에 남아있는 시간을 감소시키기 위해 하나 이상의 단계가 수행된다. 일부 구현예에서, 이소프렌의 농도가 가연성 엔벨로프 근처이거나 그 내에 있는 때를 검출하기 위해 센서가 사용된다. 바람직한 경우, 이소프렌의 농도는 세포 배양 동안 1 이상의 시점에서 측정할 수 있고, 세포 배양 조건 및/또는 비활성 기체의 양은 이소프렌의 농도가 가연성 엔벨로프 근처이거나 그 내에 있는 경우 표준 방법을 사용하여 조정될 수 있다. 특정 구현예에서, 세포 배양 조건 (예컨대, 발효 조건) 은 이소프렌의 농도를 LFL 미만으로 감소시키거나, 이소프렌의 농도를 UFL 초과로 증가시키기 위해 조정된다. 일부 구현예에서, 이소프렌의 양은 이소프렌 조성물을 비활성 기체로 희석함으로써 (예컨대, 이소프렌 조성물을 LFL 미만으로 유지하기 위해 비활성 기체를 연속적으로 또는 주기적으로 첨가함으로써) LFL 미만으로 유지된다.
일부 구현예에서, 이소프렌 이외의 가연성 휘발물질 (예컨대 하나 이상의 당) 의 양은 제조되는 이소프렌의 양의 적어도 약 2, 5, 10, 50, 75, 또는 100 배 미만이다. 일부 구현예에서, 이소프렌 기체 이외의 기상 부분은 약 0% 내지 약 100% (부피) 산소, 예컨대 약 0% 내지 약 10%, 약 10% 내지 약 20%, 약 20% 내지 약 30%, 약 30% 내지 약 40%, 약 40% 내지 약 50%, 약 50% 내지 약 60%, 약 60% 내지 약 70%, 약 70% 내지 약 80%, 약 90% 내지 약 90%, 또는 약 90% 내지 약 100% (부피) 산소를 포함한다. 일부 구현예에서, 이소프렌 기체 이외의 기상 부분은 약 0% 내지 약 99% (부피) 질소, 예컨대 약 0% 내지 약 10%, 약 10% 내지 약 20%, 약 20% 내지 약 30%, 약 30% 내지 약 40%, 약 40% 내지 약 50%, 약 50% 내지 약 60%, 약 60% 내지 약 70%, 약 70% 내지 약 80%, 약 90% 내지 약 90%, 또는 약 90% 내지 약 99% (부피) 질소를 포함한다.
일부 구현예에서, 이소프렌 기체 이외의 기상 부분은 약 1% 내지 약 50% (부피) CO2, 예컨대 약 1% 내지 약 10%, 약 10% 내지 약 20%, 약 20% 내지 약 30%, 약 30% 내지 약 40%, 또는 약 40% 내지 약 50% (부피) CO2 를 포함한다.
일부 구현예에서, 이소프렌 조성물은 또한 에탄올을 함유한다. 예를 들어, 에탄올은 이소프렌의 추출 증류에 사용되어, 에탄올 및 이소프렌 모두를 포함하는 조성물 (예컨대 중간체 생성물 스트림) 을 산출할 수 있다. 바람직하게는, 에탄올의 양은 에탄올에 대해 가연성 엔벨로프 외부에 있다. 에탄올의 LOC 는 약 8.7 부피% 이고, 에탄올에 대한 LFL 은 표준 조건, 예컨대 약 1 대기압 및 약 60℉ 에서 약 3.3 부피% 이다 (특히, LOC, LFL, 및 UFL 값에 관해, 본원에 전체가 참조로서 인용된 문헌 [NFPA 69 Standard on Explosion Prevention Systems, 2008 edition] 참조). 일부 구현예에서, 이소프렌 및 에탄올을 포함하는 조성물은 에탄올의 가연성 혼합물을 갖는데 필요한 LOC 미만 (예컨대 약 8.7% 부피% 미만) 의 존재하에서 제조된다. 이소프렌 및 에탄올을 포함하는 조성물이 에탄올의 가연성 혼합물을 갖는데 필요한 약 LOC 이상의 존재하에서 제조되는 일부 구현예에서, 에탄올 농도는 LFL 미만 (예컨대 약 3.3 부피% 미만) 이다.
다양한 구현예에서, 산화제 (예컨대 산소) 의 양은 시스템 내 임의의 연료 (예컨대 이소프렌 또는 에탄올) 의 LOC 미만이다. 다양한 구현예에서, 산화제 (예컨대 산소) 의 양은 이소프렌 또는 에탄올의 LOC 의 약 60, 40, 30, 20, 10, 또는 5% 미만이다. 다양한 구현예에서, 산화제 (예컨대 산소) 의 양은 2, 4, 5, 이상의 절대 % 지점 (부피%) 으로 이소프렌 또는 에탄올의 LOC 미만이다. 특정 구현예에서, 산소의 양은 이소프렌 또는 에탄올의 LOC 미만으로 2 절대 % 지점 (부피%) 이상이다 (예컨대, 이소프렌의 LOC 가 9.5 부피% 인 경우 7.5 부피% 미만의 산소 농도). 다양한 구현예에서, 연료의 양 (예컨대 이소프렌 또는 에탄올) 은 연료에 대한 LFL 의 약 25, 20, 15, 10, 또는 5% 이하이다.
이소프렌의 예시적 제조
일부 구현예에서, 세포는 세포에 의해 이소프렌의 제조를 허용하는 조건 하에서 배양 배지에서 배양된다. "피크 절대 생산성" 이란, 특정 시간 동안의 세포 배양 (예를 들어, 특정 발효 실행 동안 세포의 배양) 동안 방출-기체 내의 이소프렌의 최대 절대량을 의미한다. "피크 절대 생산성 시점" 이란, 방출-기체 내 이소프렌의 절대 량이 특정 시간 동안의 세포 배양 (예를 들어, 특정 발효 실행 동안 세포의 배양) 동안 최대인 때의 발효 실행 동안의 시점을 의미한다. 일부 구현예에서, 이소프렌 양은 피크 절대 생산성 시점에서 측정된다. 일부 구현예에서, 세포에 대한 피크 절대 생산성은 대략 본원에 기재된 이소프렌 양 중 임의의 양이다.
"피크 특이적 생산성" 이란, 특정 시간 동안의 세포 배양 (예를 들어, 특정 발효 실행 동안 세포의 배양) 동안 세포 당 제조되는 이소프렌의 최대 량을 의미한다. "피크 특이적 생산성 시점" 이란, 세포 당 제조되는 이소프렌의 양이 최대인 때의 특정 시간 동안의 세포 배양 (예를 들어, 특정 발효 실행 동안 세포의 배양) 동안의 시점을 의미한다. 특이적 생산성은 총 생산성을, 600 nm 에서의 광학 밀도 (OD600) 에 의해 측정된 바와 같은 세포의 양으로 나누에 결정된다. 일부 구현예에서, 이소프렌 양은 피크 특이적 생산성 시점에서 측정된다. 일부 구현예에서, 세포에 대한 피크 특이적 생산성은 대략 본원에 기재된 세포 당 이소프렌의 양 중 임의의 양이다.
"누적 총 생산성" 이란, 특정 시간 동안의 세포 배양 (예를 들어, 특정 발효 실행 동안 세포의 배양) 동안 제조되는 이소프렌의 누적, 총 양을 의미한다. 일부 구현예에서, 이소프렌의 누적, 총 양을 측정한다. 일부 구현예에서, 세포에 대한 누적 총 생산성은 대략 본원에 기재된 이소프렌의 양 중 임의의 양이다.
"상대적 검출기 반응" 이란, 하나의 화합물 (예컨대, 이소프렌) 에 대한 검출기 반응 (예컨대, GC/MS 영역) 대 하나 이상의 화합물 (예컨대, 모든 C5 탄화수소) 의 검출기 반응 (예컨대, GC/MS 영역) 사이의 비를 말한다. 검출기 반응은 본원에 기재된 바와 같이 측정될 수 있다 (예컨대 Agilent HP-5MS GC/MS 컬럼 (30 m × 250 ㎛; 0.25 ㎛ 필름 두께) 이 구비된 Agilent 6890 GC/MS 시스템으로 수행되는 GC/MS 분석). 바람직한 경우, 상대적 검출기 반응은 각각의 화합물에 대한 반응 인자를 사용하여 중량% 로 전환될 수 있다. 상기 반응 인자는 제공된 양의 특정 화합물에 대해 얼마나 많은 신호가 발생하는지 (즉, 검출기가 특정 화합물에 대해 얼마나 민감한지) 에 대한 측정값이다. 상기 반응 인자는 검출기가 비교되는 화합물에 대해 상이한 민감성을 가지고 있는 경우 상대적 검출기 반응을 중량% 로 전환시키기 위한 교정 인자로서 사용될 수 있다. 대안적으로는, 중량% 는 반응 인자가 비교되는 화합물에 대해 동일하다는 것을 추정함으로써 근사치를 계산할 수 있다. 그러므로, 중량% 는 상대적 검출기 반응과 대략 동일한 것으로 추정될 수 있다.
일부 구현예에서, 배양물 내 세포는 이소프렌을 약 1, 10, 25, 50, 100, 150, 200, 250, 300, 400, 500, 600, 700, 800, 900, 1,000, 1,250, 1,500, 1,750, 2,000, 2,500, 3,000, 4,000, 5,000, 이상 몰의 이소프렌/세포의 습윤 중량에 대한 세포 g/시간 (nmole/gwcm/hr) 으로 제조한다. 일부 구현예에서, 이소프렌의 양은 약 2 내지 약 5,000 nmole/gwcm/hr, 예컨대 약 2 내지 약 100 nmole/gwcm/hr, 약 100 내지 약 500 nmole/gwcm/hr, 약 150 내지 약 500 nmole/gwcm/hr, 약 500 내지 약 1,000 nmole/gwcm/hr, 약 1,000 내지 약 2,000 nmole/gwcm/hr, 또는 약 2,000 내지 약 5,000 nmole/gwcm/hr 이다. 일부 구현예에서, 이소프렌의 양은 약 20 내지 약 5,000 nmole/gwcm/hr, 약 100 내지 약 5,000 nmole/gwcm/hr, 약 200 내지 약 2,000 nmole/gwcm/hr, 약 200 내지 약 1,000 nmole/gwcm/hr, 약 300 내지 약 1,000 nmole/gwcm/hr, 또는 약 400 내지 약 1,000 nmole/gwcm/hr 이다.
단위 nmole/gwcm/hr 의 이소프렌의 양은 특히, 이소프렌 제조의 측정에 관해, 본원에 전체가 참조로서 인용된 미국 특허 번호 5,849,970 에 기재된 바와 같이 측정할 수 있다. 예를 들어, 2 mL 의 상부공간 (예를 들어, 200 rpm 에서 대략 3 시간 동안 진탕하며 32℃ 의 밀폐 바이알에서 배양된 2 mL 의 배양물과 같은 배양물로부터의 상부공간) 은 표준 기체 크로마토그래피 시스템, 예컨대 n-옥탄/porasil C 컬럼 (Alltech Associates, Inc., Deerfield, 111.) 이 구비되고, RGD2 산화제2수은 환원 기체 검출기 (Trace Analytical, Menlo Park, CA) 가 연결된 등온선적으로 (85℃) 작동되는 시스템을 사용하여 이소프렌에 대해 분석한다 (예를 들어, 특히, 이소프렌 제조의 측정에 관해, 본원에 전체가 각각 참조로서 인용된 문헌 [Greenberg et al, Atmos . Environ. 27A: 2689-2692, 1993; Silver et al ., Plant Physiol. 97:1588-1591, 1991] 참조). 기체 크로마토그래피 영역 단위는 표준 이소프렌 농도 검정 곡선을 통해 nmol 이소프렌으로 전환된다. 일부 구현예에서, 세포의 습윤 중량에 대한 세포의 그램에 대한 값은 세포 배양물의 샘플에 대한 A600 값을 수득한 다음, A600 값을 공지된 A600 값을 갖는 세포 배양물에 대한 습윤 중량의 검정 곡선에 대해 세포의 그램으로 전환시킴으로써 계산된다. 일부 구현예에서, 세포의 그램은, A600 값이 1 인 1 리터의 브로쓰 (세포 배지 및 세포 포함) 가 1 그램의 습윤 세포 중량을 갖는 것으로 가정함으로써 추정한다. 값은 또한 배양물을 인큐베이션하는 시간의 수, 예컨대 3 시간으로 나눈다.
일부 구현예에서, 배양물 내 세포는 이소프렌을 약 1, 10, 25, 50, 100, 150, 200, 250, 300, 400, 500, 600, 700, 800, 900, 1,000, 1,250, 1,500, 1,750, 2,000, 2,500, 3,000, 4,000, 5,000, 10,000, 100,000, 이상의 ng 의 이소프렌/세포의 습윤 중량에 대한 세포 g/hr (ng/gwcm/h) 로 제조한다. 일부 구현예에서, 이소프렌의 양은 약 2 내지 약 5,000 ng/gwcm/h, 예컨대 약 2 내지 약 100 ng/gwcm/h, 약 100 내지 약 500 ng/gwcm/h, 약 500 내지 약 1,000 ng/gwcm/h, 약 1,000 내지 약 2,000 ng/gwcm/h, 또는 약 2,000 내지 약 5,000 ng/gwcm/h 이다. 일부 구현예에서, 이소프렌의 양은 약 20 내지 약 5,000 ng/gwcm/h, 약 100 내지 약 5,000 ng/gwcm/h, 약 200 내지 약 2,000 ng/gwcm/h, 약 200 내지 약 1,000 ng/gwcm/h, 약 300 내지 약 1,000 ng/gwcm/h, 또는 약 400 내지 약 1,000 ng/gwcm/h 이다. 이소프렌의 양 (ng/gwcm/h) 은 상기 논의된 nmole/gwcm/hr 의 단위의 이소프렌 제조에 대한 값에 68.1 을 곱하여 (하기 방정식 5 에 기재된 바와 같음) 계산될 수 있다.
일부 구현예에서, 배양물 내 세포는 이소프렌의 누적 적정농도 (총 양) 를 약 1, 10, 25, 50, 100, 150, 200, 250, 300, 400, 500, 600, 700, 800, 900, 1,000, 1,250, 1,500, 1,750, 2,000, 2,500, 3,000, 4,000, 5,000, 10,000, 50,000, 100,000, 이상 mg 의 이소프렌/브로쓰 L (mg/L브로쓰, 브로쓰의 부피에는 세포 및 세포 배지의 부피가 포함된다) 로 제조한다. 일부 구현예에서, 이소프렌의 양은 약 2 내지 약 5,000 mg/L브로쓰, 예컨대 약 2 내지 약 100 mg/L브로쓰, 약 100 내지 약 500 mg/L브로쓰, 약 500 내지 약 1,000 mg/L브로쓰, 약 1,000 내지 약 2,000 mg/L브로쓰, 또는 약 2,000 내지 약 5,000 mg/L브로쓰 이다. 일부 구현예에서, 이소프렌의 양은 약 20 내지 약 5,000 mg/L브로쓰, 약 100 내지 약 5,000 mg/L브로쓰, 약 200 내지 약 2,000 mg/L브로쓰, 약 200 내지 약 1,000 mg/L브로쓰, 약 300 내지 약 1,000 mg/L브로쓰, 또는 약 400 내지 약 1,000 mg/L브로쓰 이다.
이소프렌의 특이적 생산성 (이소프렌 mg/진탕 플라스크 또는 유사한 배양물로부터의 상부공간 L) 은, 대략 1.0 의 OD600 값에서 세포 배양물로부터 1 ml 샘플을 취하고, 이것을 20 mL 바이알에 넣고, 30 분 동안 인큐베이션한 다음, 상부공간 내 이소프렌의 양을 측정함으로써 (예를 들어, 실시예 I, 파트 II 에 기재된 바와 같음) 측정할 수 있다. OD600 값이 1.0 이 아닌 경우, 측정은 OD600 값으로 나눔으로써 1.0 의 OD600 값에 표준화될 수 있다. 이소프렌 mg/상부공간 L 의 값은 38 의 인자를 곱하여 mg/L브로쓰/hr/OD600 배양 브로쓰로 전환될 수 있다. mg/L브로쓰/hr/OD600 단위의 값은 시간의 수 및 OD600 값을 곱하여 이소프렌 mg/브로쓰 L 단위의 누적 적정농도를 수득할 수 있다.
발효기 내의 즉각적인 이소프렌 제조 속도 (mg/L브로쓰/hr) 는 발효기 방출-기체의 샘플을 취하고, 이것을 예를 들어, 실시예 I, 파트 II 에 기재된 바와 같이 이소프렌의 양에 대해 분석하고 (단위, 예컨대 L기체 당 이소프렌 mg), 이 값을 방출-기체가 브로쓰 1 리터를 통과하는 속도로 곱함으로써 (예를 들어, 1 vvm (공기의 부피/브로쓰의 부피/분) 에서 이것은 시간 당 60 L기체 이다) 측정할 수 있다. 그러므로, 1 mg/L기체 의 방출-기체 수준은 1 vvm 의 공기 흐름에서 60 mg/L브로쓰/hr 의 즉각적인 제조 속도에 상응한다. 바람직하게는, mg/L브로쓰/hr 단위의 값은 OD600 값으로 나누어 mg/L브로쓰/hr/OD 단위의 특이적 속도를 수득할 수 있다. 이소프렌 mg/L기체 의 평균 값은 상기 평균 방출-기체 이소프렌 농도에 발효 동안 발효 브로쓰 1 리터당 살포되는 방출-기체의 총 양을 곱함으로써 총 생성물 생산성 (발효 브로쓰 1 리터 당 이소프렌 그램, mg/L브로쓰) 으로 전환될 수 있다. 그러므로, 1 vvm 에서 10 시간에 걸친 0.5 mg/L브로쓰/hr 의 평균 방출-기체 이소프렌 농도는 300 mg 이소프렌/L브로쓰 의 총 생성물 농도에 상응한다.
일부 구현예에서, 배양물 내 세포는 세포 배양 배지 내 탄소의 약 0.0015, 0.002, 0.005, 0.01, 0.02, 0.05, 0.1, 0.12, 0.14, 0.16, 0.2, 0.3, 0.4, 0.5, 0.6, 0.7, 0.8, 0.9, 1.0, 1.2, 1.4, 1.6, 1.8, 2.0, 2.5, 3.0, 3.5, 4.0, 5.0, 6.0, 7.0, 또는 8.0% 이상을 이소프렌으로 전환시킨다. 일부 구현예에서, 탄소의 이소프렌으로의 % 전환율은 약 0.002 내지 약 4.0%, 약 0.002 내지 약 3.0%, 약 0.002 내지 약 2.0%, 약 0.002 내지 약 1.6%, 약 0.002 내지 약 0.005%, 약 0.005 내지 약 0.01%, 약 0.01 내지 약 0.05%, 약 0.05 내지 약 0.15%, 0.15 내지 약 0.2%, 약 0.2 내지 약 0.3%, 약 0.3 내지 약 0.5%, 약 0.5 내지 약 0.8%, 약 0.8 내지 약 1.0%, 또는 약 1.0 내지 약 1.6% 이다. 일부 구현예에서, 탄소의 이소프렌으로의 % 전환율은 약 0.002 내지 약 0.4%, 0.002 내지 약 0.16%, 0.04 내지 약 0.16%, 약 0.005 내지 약 0.3%, 약 0.01 내지 약 0.3%, 또는 약 0.05 내지 약 0.3% 이다.
탄소의 이소프렌으로의 % 전환율 (또한 "% 탄소 수율" 로서 언급됨) 은 제조되는 이소프렌 내 탄소 몰을 탄소원 내 탄소 몰 (예컨대, 배치 및 공급 글루코오스 및 효모 추출물 내 탄소 몰) 로 나누어 측정할 수 있다. 상기 수에 100% 를 곱하여 % 값을 산출한다 (방정식 1 에 표시된 바와 같음).
방정식 1
% 탄소 수율 = (제조되는 이소프렌 내 탄소 몰)/(탄소원 내 탄소 몰) * 100
상기 계산을 위해, 효모 추출물은 50% w/w 탄소를 함유하는 것으로 추정될 수 있다. 예로서, 실시예 7, 파트 VIII 에 기재된 500 리터에 대해, 탄소의 이소프렌으로의 % 전환율은 방정식 2 에 제시된 바와 같이 계산할 수 있다.
방정식 2
% 탄소 수율 = (39.1 g 이소프렌 * 1/68.1 mol/g * 5 C/mol)/[(181221 g 글루코오스 * 1/180 mol/g * 6 C/mol) + (17780 g 효모 추출물 * 0.5 * 1/12 mol/g)] * 100 = 0.042%
본원에 기재된 2 개의 500 리터 발효 (실시예 7, 파트 VII 및 VIII) 의 경우, 탄소의 이소프렌으로의 % 전환율은 0.04 내지 0.06% 였다. 0.11 내지 0.16% 탄소 수율은 본원에 기재된 바와 같은 14 리터 시스템을 사용하여 달성하였다. 실시예 11, 파트 V 에는 본원에 기재된 방법을 사용하여 탄소의 이소프렌으로의 1.53% 전환율이 기재되어 있다.
당업자는 이소프렌 제조 속도 또는 제조된 이소프렌의 양을 임의의 기타 단위로 쉽게 전환시킬 수 있다. 예시적 방정식은 단위 사이에 상호전환을 위해 하기에 열거되어 있다.
이소프렌 제조 속도에 대한 단위 (총 및 특이적)
방정식 3
1 g 이소프렌/L브로쓰/hr = 14.7 mmol 이소프렌/L브로쓰/hr (총 체적 속도)
방정식 4
1 nmol 이소프렌/gwcm/hr = 1 nmol 이소프렌/L브로쓰/hr/OD600 (이 전환율은 1 의 OD600 값을 갖는 브로쓰 1 리터가 1 그램의 습윤 세포 중량을 갖는다는 것으로 추정한다)
방정식 5
1 nmol 이소프렌/gwcm/hr = 68.1 ng 이소프렌/gwcm/hr (제공된 이소프렌의 분자량)
방정식 6
1 nmol 이소프렌/L기체 O2/hr = 90 nmol 이소프렌/L브로쓰/hr (배양 브로쓰 L 당 90 L/hr 의 O2 흐름 속도로)
방정식 7
1 ug 이소프렌/L기체 방출-기체 내 이소프렌 = 60 ug 이소프렌/L브로쓰/hr, L브로쓰 당 60 L기체 의 흐름 속도로 (1 vvm)
적정농도에 대한 단위 (총 및 특이적)
방정식 8
1 nmol 이소프렌/세포 단백질 mg = 150 nmol 이소프렌/L브로쓰/OD600 (이 전환율은 1 의 OD600 값을 갖는 브로쓰 1 리터가 대략 150 mg 의 총 세포 단백질을 갖는다는 것으로 추정한다) (특이적 생산성)
방정식 9
1 g 이소프렌/L브로쓰 = 14.7 mmol 이소프렌/L브로쓰 (총 적정농도)
바람직한 경우, 방정식 10 은 세포의 습윤 중량을 포함하는 임의의 단위를 세포의 건조 중량을 포함하는 상응하는 단위로 전환하기 위해 사용될 수 있다.
방정식 10
세포의 건조 중량 = (세포의 습윤 중량)/3.3
바람직한 경우, 방정식 11 은 ppm 내지 ug/L 단위 사이를 전환하기 위해 사용될 수 있다. 특히, "ppm" 은 ug/g (w/w) 또는 uL/L (vol/vol) 로 정의된 백만 당 부를 의미한다. ug/L 에서 ppm 로의 전환 (예를 들어, 기체 g 당 분석물 ug) 은 방출-기체 L 당 질량 (즉, 기체의 밀도) 을 측정하여 수행될 수 있다. 예를 들어, STP 에서의 공기 1 리터는 대략 1.2 g/L 의 밀도를 갖는다. 그러므로, 1 ppm (ug/g) 의 농도는 STP 에서의 0.83 ug/L (방정식 11) 과 동일하다. ppm (ug/g) 에서 ug/L 로의 전환은 압력, 온도, 및 방출-기체의 전체적인 조성 모두의 함수이다.
방정식 11
1 ppm (ug/g) 은 표준 온도 및 압력 (STP; 101.3 kPa (1 bar) 및 273.15K) 에서의 0.83 ug/L 와 동일하다.
ug/L 에서 ppmv 으로의 전환 (예를 들어, 기체 L 당 분석물 uL) 은 이상 기체 법칙 (방정식 12) 을 사용하여 수행될 수 있다. 예를 들어, 1000 ug/L기체 의 방출-기체 농도는 14.7 umol/L기체 에 상응한다. 이상 기체 상수는 0.082057 L.atm K-1mol-1 이고, 방정식 12 를 사용하여, STP 에서 HG 의 14.7 umol 에 의해 점유된 부피는 0.329 mL 이다. 그러므로, 1000 ug/L HG 의 농도는 STP 에서 329 ppmv 또는 0.0329% (v/v) 이다.
방정식 12
PV = nRT, 식 중, "P" 는 압력이고, "V" 는 부피이고, "n" 은 기체의 몰이고, "R" 은 이상 기체 상수이고, "T" 는 온도 (Kelvin) 이다.
이소프렌 조성물 내 불순물의 양은 전형적으로 본원에서 부피 당 중량 (w/v) 기반, 단위 예컨대 ug/L 로 측정된다. 바람직한 경우, 단위 ug/L 의 측정치는 방정식 13 을 사용하는 mg/m3 으로 전환될 수 있다.
방정식 13
1 ug/L = 1 mg/m3
본 발명에 포함되는 일부 구현예에서, 이소프렌 합성효소 폴리펩티드를 코딩하는 이종 핵산을 포함하는 세포는 이소프렌 합성효소 폴리펩티드를 코딩하는 이종 핵산 없이 본질적으로 동일한 조건하에서 성장하는 상응하는 세포로부터 제조되는 이소프렌의 양보다 약 2 배, 3 배, 5 배, 10 배, 25 배, 50 배, 100 배, 150 배, 200 배, 400 배 이상의 이소프렌의 양을 제조한다.
본 발명에 포함되는 일부 구현예에서, 이소프렌 합성효소 폴리펩티드를 코딩하는 이종 핵산 및 DXS, IDI, 및/또는 MVA 경로 폴리펩티드를 코딩하는 하나 이상의 이종 핵산을 포함하는 세포는 이종 핵산 없이 본질적으로 동일한 조건하에서 성장하는 상응하는 세포로부터 제조되는 이소프렌의 양보다 약 2 배, 3 배, 5 배, 10 배, 25 배, 50 배, 100 배, 150 배, 200 배, 400 배 이상의 이소프렌의 양을 제조한다.
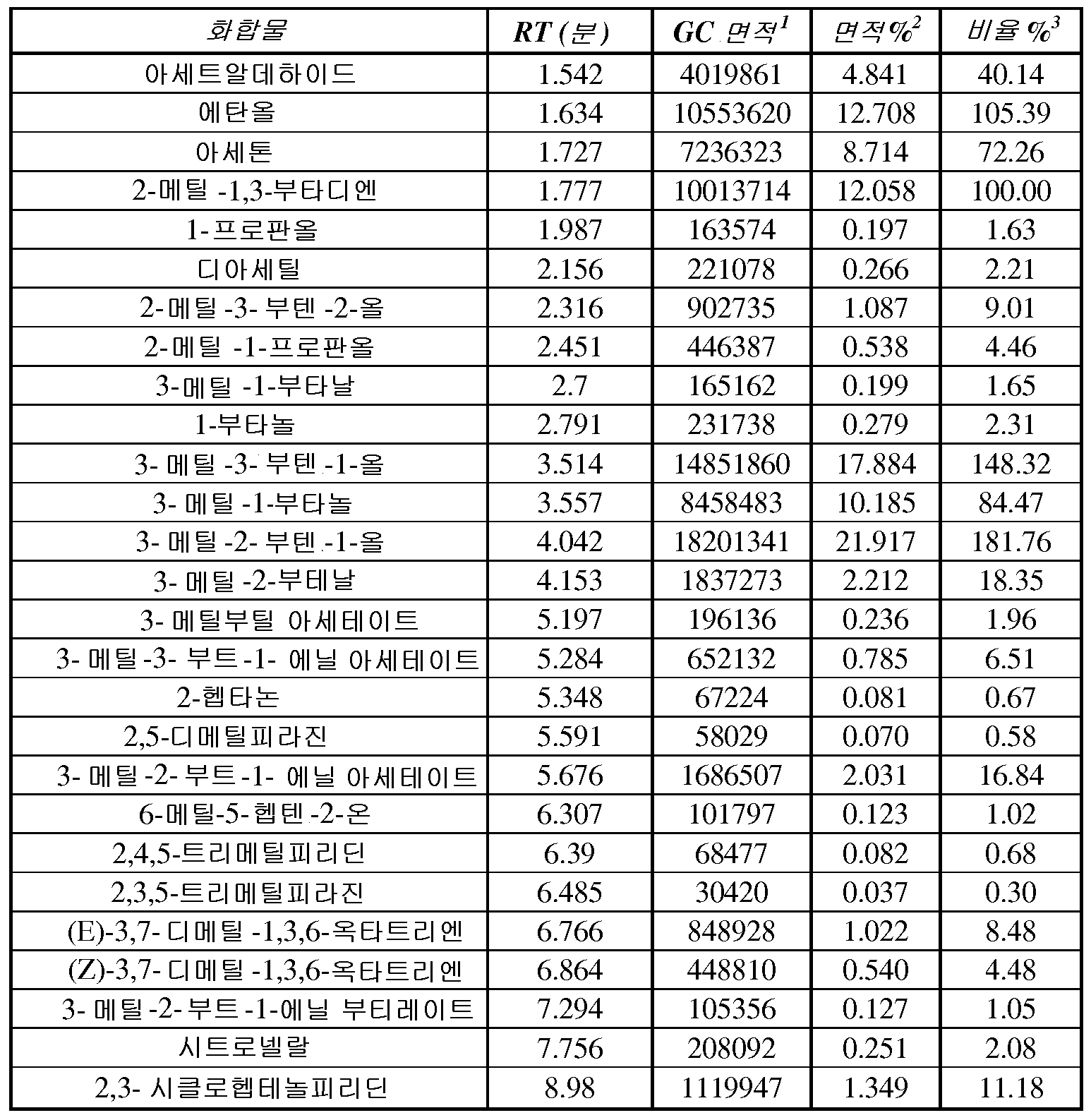
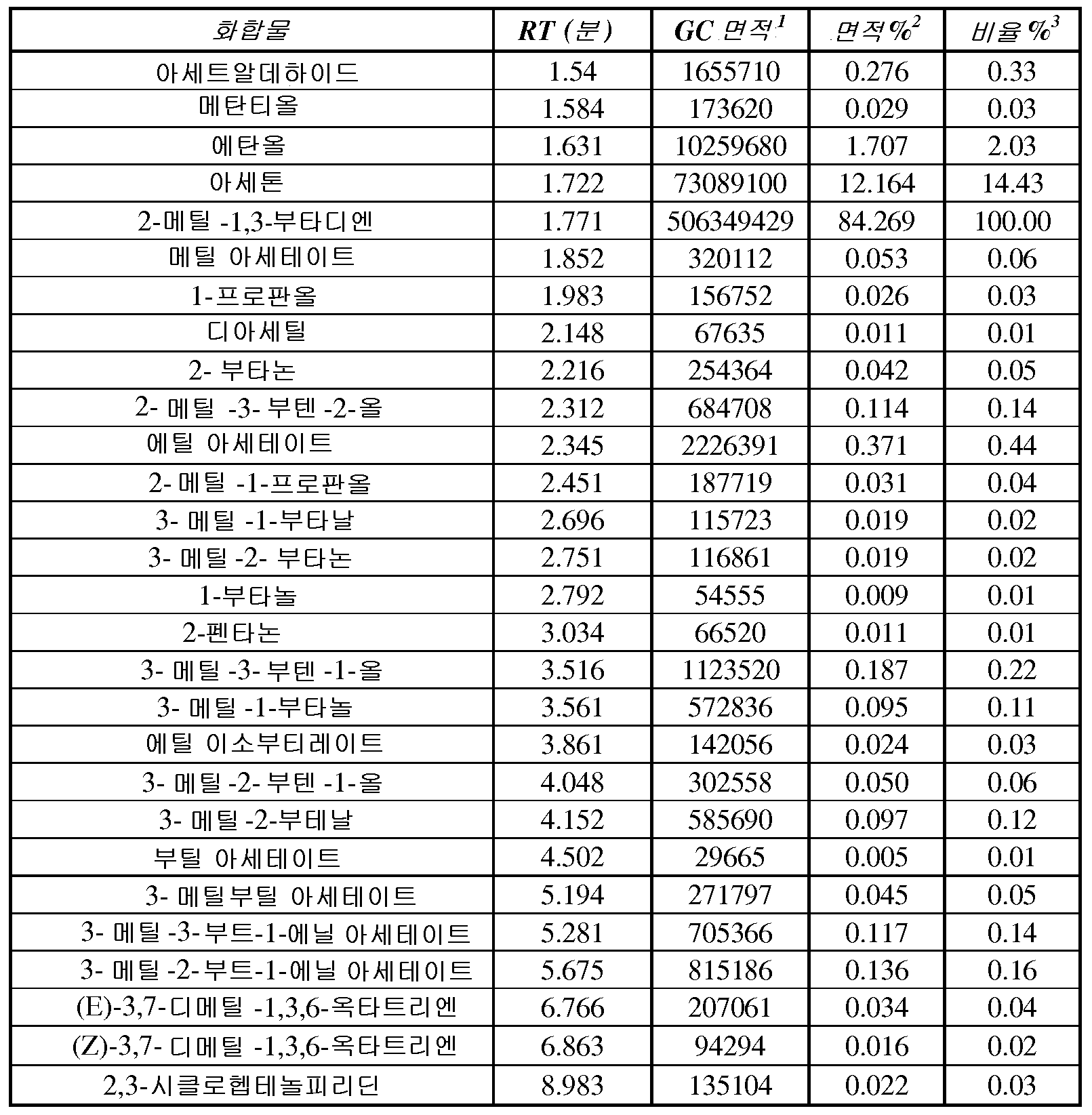
일부 구현예에서, 이소프렌 조성물은 조성물 내 모든 C5 탄화수소의 총 중량에 대해 약 99.90, 99.92, 99.94, 99.96, 99.98, 또는 100 중량% 이상의 이소프렌을 포함한다. 일부 구현예에서, 조성물은 조성물 내 모든 C5 탄화수소에 대한 검출기 반응과 비교하여 이소프렌에 대해, 약 99.90, 99.91, 99.92, 99.93, 99.94, 99.95, 99.96, 99.97, 99.98, 99.99, 또는 100% 이상의 상대적 검출기 반응을 갖는다. 일부 구현예에서, 이소프렌 조성물은 조성물 내 모든 C5 탄화수소의 총 중량에 대해 약 99.90 내지 약 99.92, 약 99.92 내지 약 99.94, 약 99.94 내지 약 99.96, 약 99.96 내지 약 99.98, 약 99.98 내지 100 중량% 이상의 이소프렌을 포함한다.
일부 구현예에서, 이소프렌 조성물은 조성물 내 모든 C5 탄화수소의 총 중량에 대해 약 0.12, 0.10, 0.08, 0.06, 0.04, 0.02, 0.01, 0.005, 0.001, 0.0005, 0.0001, 0.00005, 또는 0.00001 중량% 이하의 이소프렌 이외의 C5 탄화수소 (예컨대, 1,3-시클로펜타디엔, 시스-1,3-펜타디엔, 트랜스-1,3-펜타디엔, 1-펜틴, 2-펜틴, 1-펜텐, 2-메틸-1-부텐, 3-메틸-1-부틴, 트랜스-피페릴렌, 시스-피페릴렌, 펜트-4-엔-1-인, 트랜스-펜트-3-엔-1-인, 또는 시스-펜트-3-엔-1-인) 를 포함한다. 일부 구현예에서, 조성물은 조성물 내 모든 C5 탄화수소에 대한 검출기 반응에 대해, 이소프렌 이외의 C5 탄화수소에 대해 약 0.12, 0.10, 0.08, 0.06, 0.04, 0.02, 0.01, 0.005, 0.001, 0.0005, 0.0001, 0.00005, 또는 0.00001% 이하의 상대적 검출기 반응을 갖는다. 일부 구현예에서, 조성물은 조성물 내 모든 C5 탄화수소에 대한 검출기 반응에 대해, 1,3-시클로펜타디엔, 시스-1,3-펜타디엔, 트랜스-1,3-펜타디엔, 1-펜틴, 2-펜틴, 1-펜텐, 2-메틸-1-부텐, 3-메틸-1-부틴, 트랜스-피페릴렌, 시 스-피페릴렌, 펜트-4-엔-1-인, 트랜스-펜트-3-엔-1-인, 또는 시스-펜트-3-엔-1-인에 대해 약 0.12, 0.10, 0.08, 0.06, 0.04, 0.02, 0.01, 0.005, 0.001, 0.0005, 0.0001, 0.00005, 또는 0.00001% 이하의 상대적 검출기 반응을 갖는다. 일부 구현예에서, 이소프렌 조성물은 조성물 내 모든 C5 탄화수소의 총 중량에 대해, 약 0.02 내지 약 0.04%, 약 0.04 내지 약 0.06%, 약 0.06 내지 0.08%, 약 0.08 내지 0.10%, 또는 약 0.10 내지 약 0.12 중량% 의 이소프렌 이외의 C5 탄화수소 (예컨대, 1,3-시클로펜타디엔, 시스-1,3-펜타디엔, 트랜스-1,3-펜타디엔, 1-펜틴, 2-펜틴, 1-펜텐, 2-메틸-1-부텐, 3-메틸-1-부틴, 트랜스-피페릴렌, 시스-피페릴렌, 펜트-4-엔-1-인, 트랜스-펜트-3-엔-1-인, 또는 시스-펜트-3-엔-1-인) 를 포함한다.
일부 구현예에서, 이소프렌 조성물은 이소프렌의 중합을 억제하는 조성물 내 임의의 화합물에 대한 이소프렌의 중합을 억제하는 화합물을 약 50, 40, 30, 20, 10, 5, 1, 0.5, 0.1, 0.05, 0.01, 또는 0.005 ug/L 이하 포함한다. 일부 구현예에서, 이소프렌 조성물은 이소프렌의 중합을 억제하는 조성물 내 임의의 화합물에 대한 이소프렌의 중합을 억제하는 화합물을 약 0.005 내지 약 50, 예컨대 약 0.01 내지 약 10, 약 0.01 내지 약 5, 약 0.01 내지 약 1, 약 0.01 내지 약 0.5, 또는 약 0.01 내지 약 0.005 ug/L 포함한다. 일부 구현예에서, 이소프렌 조성물은 약 50, 40, 30, 20, 10, 5, 1, 0.5, 0.1, 0.05, 0.01, 또는 0.005 ug/L 이하의 이소프렌 이외의 탄화수소 (예컨대, 1,3-시클로펜타디엔, 시스-1,3-펜타디엔, 트랜스-1,3-펜타디엔, 1-펜틴, 2-펜틴, 1-펜텐, 2-메틸-1-부텐, 3-메틸-1-부틴, 트랜스-피페릴렌, 시스-피페릴렌, 펜트-4-엔-1-인, 트랜스-펜트-3-엔-1-인, 또는 시스-펜트-3-엔-1-인) 을 포함한다. 일부 구현예에서, 이소프렌 조성물은 약 0.005 내지 약 50, 예컨대 약 0.01 내지 약 10, 약 0.01 내지 약 5, 약 0.01 내지 약 1, 약 0.01 내지 약 0.5, 또는 약 0.01 내지 약 0.005 ug/L 의 이소프렌 이외의 탄화수소를 포함한다. 일부 구현예에서, 이소프렌 조성물은 약 50, 40, 30, 20, 10, 5, 1, 0.5, 0.1, 0.05, 0.01, 또는 0.005 ug/L 이하의 단백질 또는 지방산 (예컨대, 천연 고무와 자연적으로 관련된 단백질 또는 지방산) 을 포함한다.
일부 구현예에서, 이소프렌 조성물은 약 10, 5, 1, 0.8, 0.5, 0.1, 0.05, 0.01, 또는 0.005 ppm 이하의 알파 아세틸렌, 피페릴렌, 아세토니트릴, 또는 1,3-시클로펜타디엔을 포함한다. 일부 구현예에서, 이소프렌 조성물은 약 5, 1, 0.5, 0.1, 0.05, 0.01, 또는 0.005 ppm 이하의 황 또는 알렌을 포함한다. 일부 구현예에서, 이소프렌 조성물은 약 30, 20, 15, 10, 5, 1, 0.5, 0.1, 0.05, 0.01, 또는 0.005 ppm 이하의 모든 아세틸렌 (예컨대, 펜틴-1, 부틴-2, 2MB1-3-인, 및 1-펜틴-4-인) 을 포함한다. 일부 구현예에서, 이소프렌 조성물은 약 2000, 1000, 500, 200, 100, 50, 40, 30, 20, 10, 5, 1, 0.5, 0.1, 0.05, 0.01, 또는 0.005 ppm 이하의 이소프렌 이량체, 예컨대 시클릭 이소프렌 이량체 (예를 들어, 2 개의 이소프렌 단위의 이량체화로부터 유도된 시클릭 C10 화합물) 를 포함한다.
일부 구현예에서, 이소프렌 조성물에는 에탄올, 아세톤, C5 프레닐 알코올 (예컨대, 3-메틸-3-부텐-1-올 또는 3-메틸-2-부텐-1-올), 또는 상기 중 임의의 2 개 이상이 포함된다. 특정 구현예에서, 이소프렌 조성물은 약 0.005, 0.01, 0.05, 0.1, 0.5, 1, 5, 10, 20, 30, 40, 60, 80, 100, 또는 120 ug/L 이상의 에탄올, 아세톤, C5 프레닐 알코올 (예컨대, 3-메틸-3-부텐-1-올 또는 3-메틸-2-부텐-1-올), 또는 상기 중 임의의 2 개 이상을 포함한다. 일부 구현예에서, 이소프렌 조성물은 약 0.005 내지 약 120, 예컨대 약 0.01 내지 약 80, 약 0.01 내지 약 60, 약 0.01 내지 약 40, 약 0.01 내지 약 30, 약 0.01 내지 약 20, 약 0.01 내지 약 10, 약 0.1 내지 약 80, 약 0.1 내지 약 60, 약 0.1 내지 약 40, 약 5 내지 약 80, 약 5 내지 약 60, 또는 약 5 내지 약 40 ug/L 의 에탄올, 아세톤, C5 프레닐 알코올, 또는 상기 중 임의의 2 개 이상을 포함한다.
일부 구현예에서, 이소프렌 조성물에는 하나 이상의 하기 성분이 포함된다: 2-헵타논, 6-메틸-5-헵텐-2-온, 2,4,5-트리메틸피리딘, 2,3,5-트리메틸피라진, 시트로넬랄, 아세트알데하이드, 메탄티올, 메틸 아세테이트, 1-프로판올, 디아세틸, 2-부타논, 2-메틸-3-부텐-2-올, 에틸 아세테이트, 2-메틸-1-프로판올, 3-메틸-1- 부타날, 3-메틸-2-부타논, 1-부탄올, 2-펜타논, 3-메틸-1-부탄올, 에틸 이소부티레이트, 3-메틸-2-부테날, 부틸 아세테이트, 3-메틸부틸 아세테이트, 3-메틸-3-부트-1-에닐 아세테이트, 3-메틸-2-부트-1-에닐 아세테이트, (E)-3,7-디메틸-1,3,6-옥타트리엔, (Z)-3,7-디메틸-1,3,6-옥타트리엔, 2,3-시클로헵텐올피리딘, 또는 선형 이소프렌 중합체 (예컨대, 다중 이소프렌 단위의 중합으로부터 유도된 선형 이소프렌 이량체 또는 선형 이소프렌 삼량체). 다양한 구현예에서, 중량% 의 단위 내 이소프렌의 양에 대한 상기 성분 중 하나의 양 (즉, 성분의 중량 ÷ 이소프렌의 중량 × 100) 은 약 0.01, 0.02, 0.05, 0.1, 0.5, 1, 5, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 또는 110% (w/w) 이상이다. 일부 구현예에서, 이소프렌에 대한 검출기 반응에 대한 제 2 화합물에 대한 상대적 검출기 반응은 약 0.01, 0.02, 0.05, 0.1, 0.5, 1, 5, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 또는 110% 이상이다. 다양한 구현예에서, 중량% 의 단위 내 이소프렌의 양에 대한 상기 성분 중 하나의 양 (즉, 성분의 중량 ÷ 이소프렌의 중량 × 100) 은 약 0.01 내지 약 105% (w/w), 예컨대 약 0.01 내지 약 90, 약 0.01 내지 약 80, 약 0.01 내지 약 50, 약 0.01 내지 약 20, 약 0.01 내지 약 10, 약 0.02 내지 약 50, 약 0.05 내지 약 50, 약 0.1 내지 약 50, 또는 0.1 내지 약 20% (w/w) 이다.
일부 구현예에서, 이소프렌 조성물에는 하기 중 하나 이상이 포함된다: 알코올, 알데하이드, 또는 케톤 (예컨대, 본원에 기재된 알코올, 알데하이드, 또는 케톤 중 임의의 것). 일부 구현예에서, 이소프렌 조성물에는 (i) 알코올 및 알데하이드, (ii) 알코올 및 케톤, (iii) 알데하이드 및 케톤, 또는 (iv) 알코올, 알데하이드, 및 케톤이 포함된다.
일부 구현예에서, 이소프렌 조성물은 메탄올, 아세트알데하이드, 에탄올, 메탄티올, 1-부탄올, 3-메틸-1-프로판올, 아세톤, 아세트산, 2-부타논, 2-메틸-1-부탄올, 또는 인돌 중 하나 이상을 함유한다. 일부 구현예에서, 이소프렌 조성물은 메탄올, 아세트알데하이드, 에탄올, 메탄티올, 1-부탄올, 3-메틸-1-프로판올, 아세톤, 아세트산, 2-부타논, 2-메틸- 1-부탄올, 또는 인돌 중 하나 이상을 1 ppm 이상 함유한다. 일부 구현예에서, 메탄올, 아세트알데하이드, 에탄올, 메탄티올, 1-부탄올, 3-메틸-1-프로판올, 아세톤, 아세트산, 2-부타논, 2-메틸-1-부탄올, 또는 인돌 중 하나 이상의 농도는, 이소프렌 조성물 (예컨대 정제 전 방출-기체) 내에서 약 1 내지 약 10,000 ppm 이다. 일부 구현예에서, 이소프렌 조성물 (예컨대 하나 이상의 정제 단계를 거친 후의 방출-기체) 에는 메탄올, 아세트알데하이드, 에탄올, 메탄티올, 1-부탄올, 3-메틸-1-프로판올, 아세톤, 아세트산, 2-부타논, 2-메틸-1-부탄올, 또는 인돌 중 하나 이상이 약 1 내지 약 100 ppm, 예컨대 약 1 내지 약 10 ppm, 약 10 내지 약 20 ppm, 약 20 내지 약 30 ppm, 약 30 내지 약 40 ppm, 약 40 내지 약 50 ppm, 약 50 내지 약 60 ppm, 약 60 내지 약 70 ppm, 약 70 내지 약 80 ppm, 약 80 내지 약 90 ppm, 또는 약 90 내지 약 100 ppm 의 농도로 포함된다. 세포 배양물 (예컨대, 세포 배양물의 상부공간 내 휘발성 유기 화합물) 로부터의 휘발성 유기 화합물은 표준 방법, 예컨대 본원에 기재된 방법 또는 다른 표준 방법, 예컨대 양자 이동 반응-질량 분석 (예를 들어, 특히, 휘발성 유기 화합물의 분석에 관해, 본원에 전체가 참조로서 인용된 문헌 [Bunge et al ., Applied and Environmental Microbiology, 74(7):2179-2186, 2008] 참조) 을 사용하여 분석될 수 있다.
일부 구현예에서, 조성물은 약 2 mg 초과의 이소프렌, 예컨대 약 5, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 200, 300, 400, 500, 600, 700, 800, 900, 또는 1000 mg 이상의 이소프렌을 포함한다. 일부 구현예에서, 조성물은 약 2, 5, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100 g 이상의 이소프렌을 포함한다. 일부 구현예에서, 조성물 내 이소프렌의 양은 약 2 내지 약 5,000 mg, 예컨대 약 2 내지 약 100 mg, 약 100 내지 약 500 mg, 약 500 내지 약 1,000 mg, 약 1,000 내지 약 2,000 mg, 또는 약 2,000 내지 약 5,000 mg 이다. 일부 구현예에서, 조성물 내 이소프렌의 양은 약 20 내지 약 5,000 mg, 약 100 내지 약 5,000 mg, 약 200 내지 약 2,000 mg, 약 200 내지 약 1,000 mg, 약 300 내지 약 1,000 mg, 또는 약 400 내지 약 1,000 mg 이다. 일부 구현예에서, 조성물의 휘발성 유기 분획의 약 20, 25, 30, 40, 50, 60, 70, 80, 90, 또는 95 중량% 이상은 이소프렌이다.
일부 구현예에서, 조성물에는 에탄올이 포함된다. 일부 구현예에서, 조성물에는 약 75 내지 약 90 중량% 의 에탄올, 예컨대 약 75 내지 약 80 중량%, 약 80 내지 약 85 중량%, 또는 약 85 내지 약 90 중량% 의 에탄올이 포함된다. 조성물에 에탄올이 포함되는 일부 구현예에서, 조성물에는 또한 약 4 내지 약 15 중량% 의 이소프렌, 예컨대 약 4 내지 약 8 중량%, 약 8 내지 약 12 중량%, 또는 약 12 내지 약 15 중량% 의 이소프렌이 포함된다.
본 발명에 포함되는 일부 구현예에서, 이소프렌 합성효소 폴리펩티드, DXS 폴리펩티드, IDI 폴리펩티드, 및/또는 MVA 경로 폴리펩티드를 코딩하는 하나 이상의 이종 핵산을 포함하는 세포는, 하나 이상의 이종 핵산이 없는 본질적으로 동일한 조건 하에서 성장된 상응하는 세포로부터 제조된 이소프레노이드 화합물보다 약 2 배, 3 배, 5 배, 10 배, 25 배, 50 배, 100 배, 150 배, 200 배, 400 배 초과하는 양의 이소프레노이드 화합물 (예컨대, 하나 이상의 IPP 분자와 하나 이상의 DMAPP 분자의 반응으로부터 형성된 10 개 이상의 탄소 원자를 갖는 화합물) 을 제조한다. 본 발명에 포함되는 일부 구현예에서, 이소프렌 합성효소 폴리펩티드, DXS 폴리펩티드, IDI 폴리펩티드, 및/또는 MVA 경로 폴리펩티드를 코딩하는 하나 이상의 이종 핵산을 포함하는 세포는, 하나 이상의 이종 핵산이 없는 본질적으로 동일한 조건 하에서 성장된 상응하는 세포로부터 제조된 C5 프레닐 알코올의 양보다 약 2 배, 3 배, 5 배, 10 배, 25 배, 50 배, 100 배, 150 배, 200 배, 400 배 초과하는 양의 C5 프레닐 알코올 (예컨대 3-메틸-3-부텐-1-올 또는 3-메틸-2-부텐-1-올) 을 제조한다.
예시적 이소프렌 정제 방법
일부 구현예에서, 본원에 기재된 임의의 방법은 이소프렌을 회수하는 것을 추가로 포함한다. 예를 들어, 본 발명의 조성물 및 방법을 사용하여 제조된 이소프렌은 표준 기술, 예컨대 기체 스트리핑, 막 향상 분리, 분획화, 흡착/탈착, 투석증발, 고상으로부터 이소프렌의 열 또는 진공 탈착, 또는 고상에 고정 또는 흡착된 이소프렌의 용매로의 추출을 사용하여 회수될 수 있다 (예를 들어, 특히, 이소프렌 회수 및 정제 방법에 관해, 본원에 전체가 각각 참조로서 인용된 미국 특허 번호 4,703,007 및 4,570,029 참조). 특정 구현예에서, 알코올 (예컨대 에탄올, 메탄올, 프로판올, 또는 이의 조합) 로의 추출 증류는 이소프렌을 회수하기 위해 사용된다. 일부 구현예에서, 이소프렌의 회수에는 액체 형태의 이소프렌의 단리 (예컨대, 이소프렌의 순 용액 또는 용매 중의 이소프렌의 용액) 가 포함된다. 기체 스트리핑에는 연속 방식으로의 발효 방출-기체 스트림으로부터의 이소프렌 증기의 제거가 포함된다. 이러한 제거는 고상에 대한 흡착, 액상 내로의 분할, 또는 직접 응축 (예컨대 응축 코일에 대한 노출로 인한 또는 압력 증가로 인한 응축) 을 포함하나 이에 제한되지 않는 여러 상이한 방식으로 달성될 수 있다. 일부 구현예에서, 증기의 이슬점 초과의 희석 이소프렌 증기 스트림의 막 풍부는 액체 이소프렌의 응축을 야기한다. 일부 구현예에서, 이소프렌은 압착되고 응축된다.
이소프렌의 회수에는 1 단계 또는 다단계가 포함될 수 있다. 일부 구현예에서, 발효 방출-기체로부터의 이소프렌 증기의 제거 및 이소프렌의 액상으로의 전환은 연속으로 수행된다. 예를 들어, 이소프렌은 방출-기체 스트림으로부터 직접 응축되어 액체를 형성할 수 있다. 일부 구현예에서, 발효 방출-기체로부터의 이소프렌 증기의 제거 및 이소프렌의 액상으로의 전환은 연속으로 수행된다. 예를 들어, 이소프렌은 고상에 흡착된 다음, 고상으로부터 용매로 추출될 수 있다.
일부 구현예에서, 본원에 기재된 임의의 방법에는 이소프렌을 정제하는 것이 추가로 포함된다. 예를 들어, 본 발명의 조성물 및 방법을 사용하여 제조된 이소프렌은 표준 기술을 사용하여 정제될 수 있다. 정제는 이소프렌이 제조될 때, 존재하는 하나 이상의 성분으로부터 이소프렌을 분리하는 방법을 말한다. 일부 구현예에서, 이소프렌은 실질적으로 순수한 액체로서 수득된다. 정제 방법의 예에는 (i) 액체 추출제 내 용액으로부터의 증류 및 (ii) 크로마토그래피가 포함된다. 본원에 사용된 바와 같은, "정제된 이소프렌" 은 이소프렌이 제조될 때, 존재하는 하나 이상의 성분으로부터 분리된 이소프렌을 의미한다. 일부 구현예에서, 이소프렌은 이소프렌이 제조될 때, 존재하는 다른 성분이 없이 약 20 중량% 이상이다. 다양한 구현예에서, 이소프렌은 약 25 중량%, 30 중량%, 40 중량%, 50 중량%, 60 중량%, 70 중량%, 75 중량%, 80 중량%, 90 중량%, 95 중량%, 또는 99 중량% 이상 순수하다. 순도는 임의의 적합한 방법에 의해, 예를 들어, 컬럼 크로마토그래피, HPLC 분석, 또는 GC-MS 분석에 의해 어세이할 수 있다.
일부 구현예에서, 이소프렌의 제거를 위한 하나 이상의 회수 단계 후 남은 기상의 일부 이상은 이소프렌의 제조를 위해 기상을 세포 배양 시스템 (예컨대 발효기) 내로 도입함으로써 재생된다.
일부 구현예에서, 본원에 기재된 임의의 방법에는 이소프렌을 중합하는 것이 추가로 포함된다. 예를 들어, 표준 방법은 정제된 이소프렌을 중합하여 시스-폴리이소프렌 또는 표준 방법을 사용하는 기타 하위 스트림 생성물을 형성하기 위해 사용될 수 있다. 따라서, 본 발명은 또한 본원에 기재된 임의의 이소프렌 조성물로 만들어진 폴리이소프렌, 예컨대 시스-1,4-폴리이소프렌 및/또는 트랜스-1,4-폴리이소프렌을 포함하는 타이어를 특징으로 한다.
실시예
본 발명의 순수한 예로 의도되고, 그러므로 본 발명을 어떠한 방식으로도 제한하는 것으로 고려되지 않아야 하는 실시예, 및 상기 논의된 본 발명의 상세한 양상 및 구현예를 또한 설명한다. 다르게 언급되지 않는 경우, 온도는 섭씨 온도이고, 기압은 대기압 또는 그 근처의 압력이다. 하기 실시예 및 상세한 설명은 제한이 아닌 예로서 제공되는 것이다. 본 명세서에 언급된 모든 공개, 특허 출원 및 특허는, 각각의 개별 공개, 특허 출원, 또는 특허가 참조로서 인용되는 것으로 구체적으로 개별적으로 나타내지는 경우와 같이 참조로서 본원에 인용된다. 특히, 본원에 언급된 모든 공개는 본 발명과 연관하여 사용될 수 있는 조성물 및 방법론을 설명 및 기재하려는 목적으로 참조로서 본원에 표현적으로 인용된다. 상기 발명이 설명으로서, 이해의 명확성을 목적으로 실시예로서 일부 상세히 기재되어 있지만, 당업자에게는 본 발명의 교시의 견지에서 특허청구범위의 취지 또는 범주로부터 벗어남 없이 특정 변화 및 개질이 이루어질 수 있다는 것이 쉽게 명백할 것이다.
실시예
1: 재조합
kudzu
이소프렌 합성효소를 발현하는 E.
콜라이
내 이소프렌의 제조
I. E. 콜라이 내 kudzu 이소프렌 합성효소의 발현용 벡터의 구축
kudzu (푸에라리아 몬타나 (Pueraria montana)) 이소프렌 합성효소 유전자 (IspS) 에 대한 단백질 서열을 GenBank (AAQ84170) 로부터 수득하였다. E. 콜라이 코돈 용법에 대해 최적화된 kudzu 이소프렌 합성효소 유전자를 DNA2.0 (SEQ ID NO: 1) 에서 구입하였다. BspLU11I/PstI 로의 제한 엔도뉴클레아제 소화에 의해 공급된 플라스미드로부터 이소프렌 합성효소 유전자를 제거하고, 젤-정제하고, NcoI/PstI 으로 소화된 pTrcHis2B (Invitrogen) 내에 라이게이션하였다. PstI 부위에 대해 이소프렌 합성효소 유전자 5' 에 정지 코돈이 있도록 구축물을 디자인하였다. 그 결과, 구축물이 발현될 때, His-태그는 이소프렌 합성효소 단백질에 부착되지 않는다. 수득 플라스미드인 pTrcKudzu 를 서열분석에 의해 입증하였다 (도 2 및 3).
또한 이소프렌 합성효소 유전자를 pET16b (Novagen) 내에 클로닝하였다. 이 경우, 이소프렌 합성효소 유전자를 재조합 이소프렌 합성효소 단백질이 N-말단 His 태그에 함유되도록 pET16b 내에 삽입하였다. 이소프렌 합성효소 유전자를 프라이머 세트 pET-His-Kudzu-2F: 5'-CGTGAGATCATATGTGTGCGACCTCTTCTCAATTTAC (SEQ ID NO:3) 및 pET-His-Kudzu-R: 5'-CGGTCGACGGATCCCTGCAGTTAGACATACATCAGCTG (SEQ ID NO:4) 를 사용하여 PCR 에 의해 pTrcKudzu 로부터 증폭시켰다. 상기 프라이머에 유전자의 5'-말단에 NdeI 부위 및 3' 말단에 BamH1 부위를 각각 첨가하였다. 상기 기재된 플라스미드 pTrcKudzu 를 주형 DNA 로서 사용하였고, 헤르쿨라아제 (Herculase) 폴리머라아제 (Stratagene) 를 제조자의 지침에 따라 사용하였고, 프라이머를 10 pMol 의 농도로 첨가하였다. PCR 을 총 부피 25 ㎕ 에서 수행하였다. PCR 생성물을 NdeI/BamH1 으로 소화하고, 동일한 효소로 소화된 pET16b 내로 클로닝하였다. 라이게이션 믹스를 E. 콜라이 Top10 (Invitrogen) 내로 형질전환시키고, 서열분석에 의해 올바른 클론을 선택하였다. kudzu 이소프렌 합성효소 유전자가 T7 프로모터로부터 발현된 수득된 플라스미드를 pETNHisKudzu (도 4 및 5) 로 지정하였다.
kudzu 이소프렌 합성효소 유전자를 또한 저 카피 수 플라스미드 pCL1920 내로 클로닝하였다. 프라이머를 상기 기재된 pTrcKudzu 로부터 kudzu 이소프렌 합성효소 유전자를 증폭시키는데 사용하였다. 정방향 프라이머에 HindIII 부위 및 E. 콜라이 일치 RBS 를 5' 말단에 첨가하였다. PstI 클로닝 부위는 pTrcKudzu 내 정지 코돈의 바로 3' 에 이미 존재하여, 최종 PCR 생성물에 PstI 부위가 포함되도록 역방향 프라이머를 구축하였다. 프라이머의 서열은 다음과 같았다: HindIII-rbs-Kudzu F: 5'-CATATGAAAGCTTGTATCGATTAAATAAGGAGGAATAAACC (SEQ ID NO:6) 및 BamH1-Kudzu R:
5'-CGGTCGACGGATCCCTGCAGTTAGACATACATCAGCTG (SEQ ID NO:4). PCR 생성물을 10 pmol 의 농도의 프라이머 및 1 ng 의 주형 DNA (pTrcKudzu) 로, 헤르쿨라아제 폴리머라아제를 사용하여 증폭시켰다. 증폭 프로토콜에는 (1 분 동안 95℃, 1 분 동안 60℃, 2 분 동안 72℃) 의 30 사이클이 포함되었다. 생성물을 HindIII 및 PstI 으로 소화시키고, HindIII 및 PstI 로 소화되었던 pCL1920 내로 라이게이션하였다. 라이게이션 믹스를 E. 콜라이 Top 10 내로 형질전환시켰다. 여러 개의 형질전환체를 서열분석에 의해 확인하였다. 수득된 플라스미드를 pCL-lac-Kudzu (도 6 및 7) 로 지정하였다.
II. 이소프렌 제조의 측정
진탕 플라스크 배양을 위해, 1 ml 의 배양물을 진탕 플라스크에서 20 ml CTC 상부공간 바이알 (Agilent 바이알 cat# 5188 2753; 캡 cat# 5188 2759) 로 옮겼다. 캡을 단단히 돌려 잠그고, 바이알을 250 rpm 에서 진탕하면서 동일한 온도에서 인큐베이션하였다. 30 분 후, 바이알을 인큐베이터에서 제거하고, 하기 기재된 바와 같이 분석하였다 (상기 어세이로부터의 일부 실험 값에 대해 표 1 참조).
발효기 내 이소프렌 제조가 측정되었던 경우, 샘플을 발효기의 방출-기체로부터 취하고, 하기 기재된 바와 같이 직접적으로 분석하였다 (상기 어세이로부터의 일부 실험 값에 대해 표 2 참조).
상부공간 방식으로 작동하는 CTC Analytics (Switzerland) CombiPAL 오토샘플러가 접속된 Agilent 6890 GC/MS 시스템을 사용하여 분석하였다. Agilent HP-5MS GC/MS 컬럼 (30 m × 0.25 mm; 0.25 ㎛ 필름 두께) 를 분석물 분리를 위해 사용하였다. 샘플러를 500 ㎕ 의 상부공간 기체를 주입하는 것으로 설정하였다. GC/MS 방법은 운반 기체로서 헬륨을 1 ml/분의 속도로 이용하였다. 주입 포트를 50:1 의 분열비로 250℃ 에서 유지하였다. 오븐 온도를 분석 2 분 기간 동안 37℃ 로 유지하였다. Agilent 5793N 질량 선택적 검출기를 m/z 67 상의 단일 이온 모니터링 (SIM) 방식으로 실행시켰다. 검출기를 1.4 에서 1.7 분으로 전환시켜 영구 기체 용리를 시켰다. 상기 조건 하에서, 이소프렌 (2-메틸-1,3-부타디엔) 은 1.78 분에 용리되는 것을 관찰하였다. 검정 표를 사용하여 이소프렌 절대량을 정량하였고, 1 ㎍/L 에서 2000 ㎍/L 까지 선형인 것으로 발견되었다. 검출 한계는 상기 방법을 사용하여 50 내지 100 ng/L 인 것으로 추정되었다.
III. 재조합 이소프렌 합성효소를 발현하는 E. 콜라이 세포를 함유하는 진탕 플라스크 내 이소프렌의 제조
상기 기재된 벡터를 E. 콜라이 균주 BL21 (Novagen) 내에 도입하여 균주 BL21/ptrcKudzu, BL21/pCL-lac-Kudzu 및 BL21/pETHisKudzu 를 제조하였다. 균주를 LA (루리아 아가 (Luria agar)) + 카르베니실린 (50 ㎍/ml) 상의 단리를 위해 얇게 퍼뜨리고, 37℃ 에서 밤새 인큐베이션하였다. 단일 콜로니를 20 ml 루리아 베르타니 (Luria Bertani) 브로쓰 (LB) 및 카르베니실린 (100 ㎍/ml) 을 함유하는 250 ml 배플 (baffled) 진탕 플라스크 내에 인큐베이션하였다. 배양물을 200 rpm 으로 진탕하면서 20℃ 에서 밤새 성장시켰다. 밤샘 배양물의 OD600 을 측정하고, 배양물을 30 ml MagicMedia (Invitrogen) + 카르베니실린 (100 ㎍/ml) 을 함유하는 250 ml 배플 진탕 플라스크에 OD600 ~ 0.05 으로 희석하였다. 배양물을 200 rpm 으로 진탕하면서 30℃ 에서 인큐베이션하였다. OD600 가 약 0.5 - 0.8 일 때, 400 μM IPTG 를 첨가하고, 세포를 200 rpm 으로 진탕하면서 30℃ 에서 추가 6 시간 동안 인큐베이션하였다. IPTG 로의 인큐베이션 0, 2, 4 및 6 시간 후에, 배양물 1 ml 분취액을 수집하고, OD600 을 측정하고, 제조된 이소프렌의 양을 상기 기재된 바와 같이 측정하였다. 결과를 도 8 에 제시한다.
IV. 14 리터 발효 내 BL21/ptrcKudzu 로부터의 이소프렌의 제조
재조합 kudzu 이소프렌 합성효소 유전자를 함유하는 E. 콜라이로부터의 이소프렌의 대규모 제조를 공급-배치식 배양물로부터 측정하였다. 발효 배지 1 리터 당 발효 배지 (TM2) 에 대한 구성은 다음과 같았다: K2HPO4 13.6 g, KH2PO4 13.6 g, MgSO4 * 7H2O 2 g, 구연산 1 수화물 2 g, 철 암모늄 시트레이트 0.3 g, (NH4)2SO4 3.2 g, 효모 추출물 5 g, 1000× 개질 미량 금속 용액 (Modified Trace Metal Solution) 1 ml. 모든 성분을 함께 첨가하고, diH2O 에 용해하였다. 수산화칼륨 (KOH) 으로 pH 를 6.8 으로 조정하고, 부피를 충분히 하였다. 최종 생성물을 0.22 μ 필터 (이것으로만, 오토클레이브하지 않음) 로 필터 멸균하였다. 1000× 개질 미량 금속 용액 (Modified Trace Metal Solution) 에 대한 구성은 다음과 같았다: 구연산 * H2O 40 g, MnSO4 * H2O 30 g, NaCl 10 g, FeSO4 * 7H2O 1 g, CoCl2 * 6H2O 1 g, ZnSO * 7H2O 1 g, CuSO4 * 5H2O 100 mg, H3BO3 100 mg, NaMoO4 * 2H2O 100 mg. 각 성분을 diH2O 에 한번에 용해하고, HCl/NaOH 로 pH 를 3.0 으로 조정한 다음, 부피를 충분히 하고, 0.22 μ 필터로 필터 멸균하였다.
바람직한 발효, pH 6.7 및 온도 34℃ 에서 글루코오스로부터 이소프렌 형성을 모니터링하기 위해 14 L 생물반응기에서 상기 실험을 수행하였다. 동결 바이알로부터 취해진 E. 콜라이 균주 BL21/ptrcKudzu 의 접종물을 소이톤-효모 추출물-글루코오스 배지에서 제조하였다. 접종물을 OD550 = 0.6 까지 성장시킨 후, 2 개의 600 ml 플라스크를 원심분리하고, 세포 펠렛 (70 ml 의 OD 3.1 물질) 을 생물반응기에 옮기기 위해 내용물을 70 ml 상청액에 재현탁하였다. 접종 후 다양한 시간에서, 샘플을 제거하고, 제조된 이소프렌의 양을 상기 기재된 바와 같이 측정하였다. 결과는 도 9 에 제시된다.
실시예
2: 재조합
poplar
이소프렌 합성효소를 발현하는 E.
콜라이
내 이소프렌의 제조
poplar (포풀러스 알바 x 포풀러스 트레물라 (Populus alba x Populus tremula)) 이소프렌 합성효소에 대한 단백질 서열 (Schnitzler, J-P, et al. (2005) Planta 222:777-786) 을 GenBank (CAC35696) 로부터 입수하였다. E. 콜라이에 대해 최적화된 코돈인 유전자를 DNA2.0 로부터 구입하였다 (p9796-poplar, 도 30 및 31). BspLU11I/PstI 로의 제한 엔도뉴클레아제 소화에 의해 공급된 플라스미드로부터 이소프렌 합성효소 유전자를 제거하고, 젤-정제하고, NcoI/PstI 으로 소화된 pTrcHis2B 내로 라이게이션하였다. 삽입물 내 정지 코돈이 PstI 부위 전에 있도록 구축물을 클로닝하여, His-태그가 이소프렌 합성효소 단백질에 부착되지 않은 구축물을 산출한다. 수득된 플라스미드 pTrcPoplar (도 32 및 33) 를 서열분석에 의해 입증하였다.
실시예
3: 재조합
kudzu
이소프렌 합성효소를 발현하는
판테오아
시트레아
(Panteoa
citrea
) 내 이소프렌의 제조
실시예 1 에 기재된 pTrcKudzu 및 pCL-lac Kudzu 플라스미드를 P. 시트레아 내로 전기천공시켰다 (미국 특허 번호 7,241,587). 형질전환체를 카르베니실린 (200 ㎍/ml) 또는 스펙티노마이신 (50 ㎍/ml) 을 각각 함유하는 LA 상에서 선별하였다. 진탕 플라스크로부터의 이소프렌의 제조 및 제조되는 이소프렌의 양의 측정을 재조합 kudzu 이소프렌 합성효소를 발현하는 E. 콜라이 균주에 대해 실시예 1 에 기재된 바와 같이 수행하였다. 결과를 도 10 에 제시한다.
실시예
4: 재조합
kudzu
이소프렌 합성효소를 발현하는
바실러스
서브틸리스
내 이소프렌의 제조
I. kudzu 이소프렌 합성효소의 발현을 위한 B. 서브틸리스 복제 플라스미드의 구축
kudzu 이소프렌 합성효소 유전자를, aprE 프로모터의 통제 하에서 복제 플라스미드 (클로르암페니콜 내성 카세트가 있는 pBS19) 를 사용하여 바실러스 서브틸리스 aprEnprE Pxyl-comK 균주 (BG3594comK) 에서 발현하였다. 이소프렌 합성효소 유전자, aprE 프로모터 및 전사 터미네이터를 각각 증폭시키고, PCR 를 사용하여 융합시켰다. 구축물을 pBS19 내로 클로닝하고, B. 서브틸리스 내로 형질전환시켰다.
a) aprE 프로모터의 증폭
aprE 프로모터를 하기 프라이머를 사용하여 바실러스 서브틸리스로부터의 염색체 DNA 로부터 증폭시켰다:
CF 797 (+) aprE 프로모터 MfeI 를 출발함
5'- GACATCAATTGCTCCATTTTCTTCTGCTATC (SEQ ID NO:58)
CF 07-43 (-) Kudzu ispS 에 대해 aprE 프로모터를 융합함
5'- ATTGAGAAGAGGTCGCACACACTCTTTACCCTCTCCTTTTA (SEQ ID NO:59)
b) 이소프렌 합성효소 유전자의 증폭
kudzu 이소프렌 합성효소 유전자를 플라스미드 pTrcKudzu (SEQ ID NO:2) 로부터 증폭시켰다. 유전자는 E. 콜라이에 대해 최적화된 코돈을 가지고 있고, DNA 2.0 에 의해 합성되었다. 하기 프라이머를 사용하였다:
CF 07-42 (+) kudzu 이소프렌 합성효소 유전자에 대해 aprE 프로모터를 융합함 (GTG 출발 코돈)
5'- TAAAAGGAGAGGGTAAAGAGTGTGTGCGACCTCTTCTCAAT (SEQ ID NO:60)
CF 07-45 (-) 터미네이터에 대해 kudzu 이소프렌 합성효소 유전자의 3' 말단을 융합함
5'- CCAAGGCCGGTTTTTTTTAGACATACATCAGCTGGTTAATC (SEQ ID NO:61)
c) 전사 터미네이터의 증폭
바실러스 아밀리퀘파시엔스의 알칼리 세린 프로테아제로부터의 터미네이터를 하기 프라이머를 사용하여 미리 서열분석된 플라스미드 pJHPms382 로부터 증폭시켰다:
CF 07-44 (+) 터미네이터에 대해 kudzu 이소프렌 합성효소의 3' 말단을 융합함
5'- GATTAACCAGCTGATGTATGTCTAAAAAAAACCGGCCTTGG (SEQ ID NO:62)
CF 07-46 (-) B. 아밀리퀘파시엔스 터미네이터의 말단 (BamH1)
5'- GACATGACGGATCCGATTACGAATGCCGTCTC (SEQ ID NO:63)
kudzu 분절을 하기 프라이머로의 PCR 을 사용하여 터미네이터 분절에 융합시켰다:
CF 07-42 (+) kudzu 이소프렌 합성효소 유전자에 대해 aprE 프로모터를 융합함 (GTG 출발 코돈)
5'- TAAAAGGAGAGGGTAAAGAGTGTGTGCGACCTCTTCTCAAT (SEQ ID NO:61)
CF 07-46 (-) B. 아밀리퀘파시엔스 터미네이터의 말단 (BamH1)
5'- GACATGACGGATCCGATTACGAATGCCGTCTC (SEQ ID NO:63)
kudzu-터미네이터 분절을 하기 프라이머로의 PCR 을 사용하여 프로모터 분절에 융합시켰다:
CF 797 (+) aprE 프로모터 MfeI 를 출발함
5'- GACATCAATTGCTCCATTTTCTTCTGCTATC (SEQ ID NO:64)
CF 07-46 (-) B. 아밀리퀘파시엔스 터미네이터 (BamH1) 의 말단
5'- GACATGACGGATCCGATTACGAATGCCGTCTC (SEQ ID NO:63)
융합 PCR 분절을 Qiagen 키트를 사용하여 정제하고, 제한 효소 MfeI 및 BamH1 으로 소화하였다. 상기 소화된 DNA 분절을 Qiagen 키트를 사용하여 젤 정제하고, EcoRI 및 BamH1 으로 소화하여 젤 정제한 pBS19 로서 알려진 벡터와 라이게이션하였다.
라이게이션 믹스를 E. 콜라이 Top 10 세포 내로 형질전환시키고, 콜로니를 LA+50 카르베니실린 플레이트 상에서 선별하였다. 총 6 개의 콜로니를 선택하고 LB+50 카르베니실린에서 밤새 성장시킨 다음, 플라스미드를 Qiagen 키트를 사용하여 단리하였다. 삽입물을 확인하기 위해 플라스미드를 EcoRI 및 BamH1 으로 소화시키고, 올바른 플라스미드 중 3 개를 하기 프라이머로의 서열분석을 위해 보냈다:
CF 149 (+) aprE 프로모터의 EcoRI 출발
5'- GACATGAATTCCTCCATTTTCTTCTGC (SEQ ID NO:65)
CF 847 (+) pXX 049 내 서열 (aprE 프로모터의 말단)
5'- AGGAGAGGGTAAAGAGTGAG (SEQ ID NO:66)
CF 07-45 (-) 터미네이터에 대해 kudzu 이소프렌 합성효소의 3' 말단을 융합함
5'- CCAAGGCCGGTTTTTTTTAGACATACATCAGCTGGTTAATC (SEQ ID NO:61)
CF 07-48 (+) kudzu 이소프렌 합성효소에 대한 서열분석 프라이머
5'- CTTTTCCATCACCCACCTGAAG (SEQ ID NO:67)
CF 07-49 (+) kudzu 이소프렌 합성효소 내 서열분석
5'- GGCGAAATGGTCCAACAACAAAATTATC (SEQ ID NO:68)
pBS Kudzu #2 (도 52 및 12) 로 지정된 플라스미드를 서열분석에 의해 정정하고, 바실러스 서브틸리스 숙주 균주인 BG 3594 comK 내로 형질전환시켰다. LA + 5 클로르암페니콜 플레이트 상에서 선별을 수행하였다. 형질전환체를 선택하고, LA + 5 클로르암페니콜 상의 단일 콜로니를 딴 다음, OD600 이 1.5 에 도달할 때까지 LB+5 클로르암페니콜에서 성장시켰다. 이것을 글리세롤의 존재하에, -80℃ 에서 바이알 내에 동결건조하였다. 수득된 균주를 CF 443 으로 지정하였다.
II. 재조합 이소프렌 합성효소를 발현하는 B. 서브틸리스 세포를 함유하는 진탕 플라스크 내 이소프렌의 제조
밤샘 배양물을 LA + 클로르암페니콜 (Cm, 25 ㎍/ml) 로부터 CF 443 의 단일 콜로니로 접종시켰다. 200 rpm 으로 진탕하면서 37℃ 에서 배양물을 LB + Cm 에서 성장시켰다. 상기 밤샘 배양물 (1 ml) 을 사용하여, 25 ㎍/ml 의 최종 농도로 25 ml Grants II 배지 및 클로르암페니콜을 함유하는 250 ml 배플 진탕 플라스크를 접종하였다. Grants II 배지 구성은 10 g 소이톤, 3 ml 1 M K2HPO4, 75 g 글루코오스, 3.6 g 우레아, 100 ml 10× MOPS, 1 L 까지 H2O 충분량, pH 7.2 이었고; 10× MOPS 구성은 83.72 g MOPS, 7.17 g 트리신, 12 g KOH 펠렛, 10 ml 0.276M K2SO4 용액, 10 ml 0.528M MgCl2 용액, 29.22 g NaCl, 100 ml 100× 미량영양소, 1 L 까지 H2O 충분량이었고; 100× 미량영양소 구성은 1.47 g CaCl2*2H2O, 0.4 g FeSO4*7H20, 0.1 g MnSO4*H20, 0.1 g ZnSO4*H2O, 0.05 g CuCl2*2H2O, 0.1 g CoCl2*6H2O, 0.1 g Na2MoO4*2H2O, 1 L 까지 H2O 충분량이었다. 진탕 플라스크를 37℃ 에서 인큐베이션하고, 샘플을 18, 24, 및 44 시간에 취하였다. 18 시간에 CF443 의 상부공간 및 대조군 균주를 샘플링하였다. 이것은 이소프렌의 18 시간 축적을 나타내었다. 이소프렌의 양을 실시예 1 에 기재된 바와 같은 기체 크로마토그래피에 의해 측정하였다. 이소프렌의 제조는 재조합 이소프렌 합성효소를 발현시킴으로써 유의하게 향상되었다 (도 11).
III. 14 L 발효 내 CF443 에 의한 이소프렌의 제조
복제 플라스미드 상에 재조합 kudzu 이소프렌 합성효소 유전자를 함유하는 B. 서브틸리스로부터의 이소프렌의 대규모 제조를 공급-배치식 배양물로부터 측정하였다. kudzu 이소프렌 합성효소 유전자를 발현하는 바실러스 균주 CF 443, 또는 kudzu 이소프렌 합성효소 유전자를 발현하지 않는 대조군 균주를 대두 가루 (Cargill), 인산나트륨 및 인산칼륨, 황산마그네슘 및, 구연산, 염화제2철 및 염화망간의 용액을 함유하는 영양 배지에서 통상의 공급-배치식 발효에 의해 배양하였다. 발효 전 배지를 셀룰라아제, 헤미셀룰라아제 및 펙티나아제를 포함하는 효소의 혼합물을 사용하여 90 분 동안 불린다 (참조, WO95/04134). 14 L 배치 발효에 60% wt/wt 글루코오스 (Cargill DE99 덱스트로오스, ADM Versadex greens 또는 Danisco 전화당) 및 99% wt/wt 오일 (Western Family 대두 오일, 99% wt/wt 는 세포 배양 배지에 첨가하기 전의 오일의 농도이다) 을 공급한다. 배치 중의 글루코오스가 검출되지 않을 때 공급을 시작하였다. 공급 속도를 여러 시간에 걸쳐 높이고, 동일한 탄소 기재의 오일을 첨가하여 조절하였다. 28% w/v 수산화암모늄을 사용하여 pH 를 6.8 - 7.4 로 조절하였다. 거품이 발생하는 경우, 소포제를 배지에 첨가하였다. 발효 온도를 37℃ 에서 조절하고, 발효 배양물을 750 rpm 으로 진탕하였다. pH, DO%, 기류, 및 압력과 같은 다양한 기타 파라미터를 전체 공정 동안 모니터링하였다. DO% 를 20 초과로 유지한다. 샘플을 36 시간의 시간 과정에 걸쳐 채취하고, 세포 성장 (OD550) 및 이소프렌 제조에 대해 분석하였다. 상기 실험 결과를 도 53A 및 53B 에 제시한다.
IV. B. 서브틸리스 내 kudzu 이소프렌 합성효소 (ispS) 의 통합
kudzu 이소프렌 합성효소 유전자를 aprE 프로모터의 통제 하에서 통합 플라스미드 (pJH101-cmpR) 내에 클로닝하였다. 시험된 조건 하에서, 이소프렌이 검출되지 않았다.
실시예
5: 트리코데르마 내 이소프렌의 제조
I. 트리코데르마 레에세이 내 kudzu 이소프렌 합성효소의 발현용 벡터의 구축
야로이야 리폴라이티카 (Yarrowia lipolytica) 코돈-최적화 kudzu IS 유전자를 DNA 2.0 (SEQ ID NO:8) 에 의해 합성하였다 (도 13). 상기 플라스미드는 하기 PCR 증폭 반응에 대한 주형으로서 담당하였다: 총 반응 부피 50 ㎕ 중에, 1 ㎕ 플라스미드 주형 (20 ng/ul), 1 ㎕ 프라이머 EL-945 (10 uM) 5'- GCTTATGGATCCTCTAGACTATTACACGTACATCAATTGG (SEQ ID NO:9), 1 ㎕ 프라이머 EL-965 (10 uM) 5'-CACCATGTGTGCAACCTCCTCCCAGTTTAC (SEQ ID NO:10), 1 ㎕ dNTP (10 mM), 5 ㎕ 10× PfuUltra II 융합 HS DNA 폴리머라아제 완충액, 1 ㎕ PfuUltra II 융합 HS DNA 폴리머라아제, 40 ㎕ 물. 정방향 프라이머에는 Y. 리폴라이티카 코돈-최적화 kudzu 이소프렌 합성효소 유전자에 상응하지 않으나, pENTR/D-TOPO 벡터 내의 클로닝에 필요한 5'-말단에 부가적인 4 개의 뉴클레오티드가 함유되어 있다. 역방향 프라이머에는 Y. 리폴라이티카 코돈-최적화 kudzu 이소프렌 합성효소 유전자에 상응하지 않으나, 다른 벡터 백본 내로의 클로닝을 위해 삽입된 5'-말단에 부가적인 21 개의 뉴클레오티드가 함유되어 있다. MJ Research PTC-200 Thermocycler 를 사용하여, PCR 반응을 하기와 같이 수행하였다: 2 분 동안 95℃ (첫번째 사이클만), 30 초 동안 95℃, 30 초 동안 55℃, 30 초 동안 72℃ (27 사이클 동안 반복), 마지막 사이클 후 1 분 동안 72℃. PCR 생성물을 1.2% E-젤 상에서 분석하여, Y. 리폴라이티카 코돈-최적화 kudzu 이소프렌 합성효소 유전자의 성공적인 증폭을 확인하였다.
그 다음 PCR 생성물을 하기 제조자의 프로토콜에 따라 TOPO pENTR/D-TOPO Cloning Kit 를 사용하여 클로닝하였다: 총 반응 용액 6 ㎕ 중에, 1 ㎕ PCR 반응물, 1 ㎕ 염 용액, 1 ㎕ TOPO pENTR/D-TOPO 벡터 및 3 ㎕ 물. 반응을 실온에서 5 분 동안 인큐베이션하였다. 1 ㎕ 의 TOPO 반응물을 TOP10 화학적으로 수용능이 된 E. 콜라이 세포 내로 형질전환시켰다. 형질전환체를 LA + 50 ㎍/ml 카나마이신 플레이트 상에서 선별하였다. 여러 개의 콜로니를 집어내고, 각각을 LB + 50 ㎍/ml 카나마이신을 함유하는 5 ml 튜브 내에 접종하고, 배양물을 200 rpm 으로 진탕하면서 37℃ 에서 밤새 성장시켰다. 제조자의 프로토콜에 따라 QIAprep Spin Miniprep Kit 를 사용하여 밤샘 배양 튜브로부터 플라스미드를 단리하였다. 여러 개의 플라스미드을 서열분석하여 DNA 서열이 올바른지를 입증하였다.
Y. 리폴라이티카 코돈-최적화 kudzu 이소프렌 합성효소 유전자를 코딩하는 단일 pENTR/D-TOPO 플라스미드를, 주문 제작된 pTrex3g 벡터 내로의 Gateway 클로닝을 위해 사용하였다. pTrex3g 의 구축은 WO 2005/001036 A2 에 기재되어 있다. Gateway LR Clonase II Enzyme Mix Kit (Invitrogen) 에 대한 제조자의 프로토콜에 따라 반응을 수행하였다: 1 ㎕ Y. 리폴라이티카 코돈-최적화 kudzu 이소프렌 합성효소 유전자 pENTR/D-TOPO 공여체 벡터, 1 ㎕ pTrex3g 목적지 벡터, 6 ㎕ TE 완충액, pH 8.0 (총 반응 부피 8 ㎕). 반응을 실온에서 1 시간 동안 인큐베이션시킨 다음 1 ㎕ 트로테이나아제 K 용액을 첨가하고, 인큐베이션을 37℃ 에서 10 분 동안 계속하였다. 그 다음, 1 ㎕ 의 반응물을 TOP10 화학적으로 수용능이 된 E. 콜라이 세포 내로 형질전환시켰다. 형질전환체를 LA + 50 ㎍/ml 카르베니실린 플레이트 상에서 선별하였다. 여러 개의 콜로니를 집어내고, 각각을 LB + 50 ㎍/ml 카르베니실린을 함유하는 5 ml 튜브 내에 접종하고, 배양물을 200 rpm 으로 진탕하면서 37℃ 에서 밤새 성장시켰다. 제조자의 프로토콜에 따라 QIAprep Spin Miniprep Kit (Qiagen, Inc.) 를 사용하여 밤샘 배양 튜브로부터 플라스미드를 단리하였다. 여러 개의 플라스미드을 서열분석하여 DNA 서열이 올바른지를 입증하였다.
4 개의 (quad) 결실 트리코데르마 레에세이 균주 내로의 Y. 리폴라이티카 코돈-최적화 kudzu 이소프렌 합성효소 pTrex3g 플라스미드의 유전자주입 형질전환 (도 14) 을 Biolistic PDS-1000/HE Particle Delivery System (참조, WO 2005/001036 A2) 을 사용하여 수행하였다. 안정한 형질전환체의 단리 및 진탕 플라스크 평가를 특허 공개 WO 2005/001036 A2 의 실시예 11 에 열거된 프로토콜을 사용하여 수행하였다.
II. T. 레에세이의 재조합 균주 내 이소프렌의 제조
상기 기재된 이소프렌 합성효소 형질전환체의 1 ml 의 15 및 36 시간 동안의 배양물을 상부공간 바이알로 옮겼다. 바이알을 밀봉하고, 5 시간 동안 30℃ 에서 인큐베이션하였다. 상부공간 기체를 측정하고, 실시예 1 에 기재된 방법에 의해 이소프렌을 확인하였다. 형질전환체 중 2 개가 미량의 이소프렌을 보였다. 이소프렌의 양은 14 시간 인큐베이션에 의해 증가될 수 있었다. 2 개의 양성 샘플은 14 시간 인큐베이션 동안 약 0.5 ㎍/L 의 수준에서 이소프렌을 보였다. 비-형질전환된 대조군은 검출할 수 없는 이소프렌 수준을 보였다. 상기 실험은 외생 이소프렌 합성효소를 보충하였을 때 T. 레에세이가 내생 전구체로부터 이소프렌을 제조할 수 있음을 보인다.
실시예
6:
야로이야
내 이소프렌의 제조
I. 야로이야 리폴라이티카 내 kudzu 이소프렌 합성효소의 발현용 벡터의 구축.
야로이야 리폴라이티카 내 kudzu 이소프렌 합성효소 유전자의 발현용 벡터의 구축을 위한 시작점은 벡터 pSPZl(MAP29Spb) 였다. 상기 벡터 (SEQ ID No: 11) 의 완전한 서열은 도 15 에 제시되어 있다.
하기 분절을 주형으로서 Y. 리폴라이티카 균주 GICC 120285 의 염색체 DNA: URA3 유전자의 프로모터가 없는 형태, 18S 리보솜 RNA 유전자의 분절, Y. 리폴라이티카 XPR2 유전자의 전사 터미네이터 및 XPR2 및 ICL1 유전자의 프로모터를 함유하는 2 개의 DNA 분절을 사용하여 PCR 에 의해 증폭하였다. 하기 PCR 프라이머를 사용하였다
ICL1 3
5 ' - GGTGAATTCAGTCTACTGGGGATTCCCAAATCTATATATACTGCAGGTGAC
(SEQ ID NO:69)
ICL1 5
5'- GCAGGTGGGAAACTATGCACTCC (SEQ ID NO:70)
XPR 3
5'- CCTGAATTCTGTTGGATTGGAGGATTGGATAGTGGG (SEQ ID NO:71)
XPR 5
5'- GGTGTCGACGTACGGTCGAGCTTATTGACC (SEQ ID NO:72)
XPRT3
5'- GGTGGGCCCGCATTTTGCCACCTACAAGCCAG (SEQ ID NO:73)
XPRT 5
5'- GGTGAATTCTAGAGGATCCCAACGCTGTTGCCTACAACGG (SEQ ID NO:74)
Y18S3
5'- GGTGCGGCCGCTGTCTGGACCTGGTGAGTTTCCCCG (SEQ ID NO:75)
Y18S 5
5'- GGTGGGCCCATTAAATCAGTTATCGTTTATTTGATAG (SEQ ID NO:76)
YURA3
5'- GGTGACCAGCAAGTCCATGGGTGGTTTGATCATGG (SEQ ID NO:77)
YURA 50
5'- GGTGCGGCCGCCTTTGGAGTACGACTCCAACTATG (SEQ ID NO:78)
YURA 51
5'- GCGGCCGCAGACTAAATTTATTTCAGTCTCC (SEQ ID NO:79)
PCR 증폭을 위해, PfuUltraII 폴리머라아제 (Stratagene), 공급처에서 제공된 완충액 및 dNTPs, 2.5 μM 프라이머 및 표시된 주형 DNA 를 제조자의 지침대로 사용하였다. 하기 사이클을 사용하여 증폭을 수행하였다: 1 분 동안 95℃; 34× (30 초 동안 95℃; 30 초 동안 55℃; 3 분 동안 72℃) 및 72℃ 에서 10 분 후, 4℃ 인큐베이션.
야로이야 내의 발현을 위해 코돈-최적화된, kudzu 이소프렌 합성효소 유전자를 코딩하는 합성 DNA 분자를 DNA 2.0 로부터 입수하였다 (도 16; SEQ ID NO: 12). 각각 XPR2 및 ICL1 프로모터의 통제하에서 합성 kudzu 이소프렌 합성효소 유전자를 가지고 있는 플라스미드 pYLA(KZ1) 및 pYLI(KZ1) 의 구축물 도식에 대한 상세한 설명을 도 18 에 제시한다. 교배 인자 유전자 (MAP29) 가 이소프렌 합성효소 유전자 대신에 삽입된 대조군 플라스미드를 또한 구축하였다 (도 18E 및 18F).
유사한 클로닝 절차가 poplar (포풀러스 알바 x 포풀러스 트레물라 (Populus alba x Populus tremula)) 이소프렌 합성효소 유전자를 발현하기 위해 사용될 수 있다. poplar 이소프렌의 서열이 문헌 [Miller B. et al. (2001) Planta 213, 483-487] 에 기재되어 있고 도 17 에 제시되어 있다 (SEQ ID NO: 13). 각각 XPR2 및 ICL1 프로모터의 통제하에서 합성 poplar 이소프렌 합성효소 유전자를 가지고 있는 플라스미드 pYLA(POP1) 및 pYLI(POP1) 의 생성을 위한 구축물 도식을 도 18A 및 B 에 제시한다.
II. Y. 리폴라이티카의 재조합 균주에 의한 이소프렌의 제조.
벡터 pYLA(KZ1), pYLI(KZ1), pYLA(MAP29) 및 pYLI(MAP29) 를 SacII 로 소화시키고, 우리딘 영양요구성을 위해 표준 리튬 아세테이트/폴리에틸렌 글리콜 절차에 의해 균주 Y. 리폴라이티카 CLIB 122 를 형질전환시키는데 사용하였다. 간략하게는, 밤새 YEPD (1% 효모 추출물, 2% 펩톤, 2% 글루코오스) 에서 성장된 효모 세포를 원심분리 (4000 rpm, 10 분) 에 의해 수집하고, 멸균수로 1 회 세정하고, 0.1 M 리튬 아세테이트, pH 6.0 에 현탁시켰다. 세포 현탁액의 200 ㎕ 분취액을 선형화된 플라스미드 DNA 용액 (10-20 ㎍) 과 혼합하고, 10 분 동안 실온에서 인큐베이션하고, 샘플 완충액 내 1 ml 의 50% PEG 4000 과 혼합하였다. 현탁액을 1 시간 동안 실온에서 추가로 인큐베이션한 후, 42℃ 에서 2 분 열 쇼크를 주었다. 그 다음 세포를 SC his leu 플레이트 (0.67% 효모 질소 베이스, 2% 글루코오스, 류신 및 히스티딘 각각 100 mg/L) 상에 플레이팅하였다. 형질전환체는 30℃ 에서 3-4 일의 인큐베이션 후 나타났다.
pYLA(KZ1) 형질전환으로부터의 3 개의 단리물, pYLI(KZ1) 형질전환으로부터의 3 개의 단리물, pYLA(MAP29) 형질전환으로부터의 2 개의 단리물 및 pYLI(MAP29) 형질전환으로부터의 2 개의 단리물을 YEP7 배지 (1% 효모 추출물, 2% 펩톤, pH 7.0) 에서, 30℃ 에서 진탕하면서 24 시간 동안 성장시켰다. 10 ml 의 배양액으로부터의 세포를 원심분리에 의해 수집하고, 3 ml 의 신선한 YEP7 에 재현탁시키고, 15 ml 마개 뚜껑 바이알에 넣었다. 바이알을 천천히 (60 rpm) 진탕하면서 실온에서 밤새 인큐베이션시켰다. 상기 바이알의 상부공간 내 이소프렌 함량을 실시예 1 에 기재된 바와 같은 질량-분석 검출기를 사용하여 기체 크로마토그래피에 의해 분석하였다. pYLA(KZ1) 및 pYLI(KZ1) 로 수득된 모든 형질전환체는 쉽게 검출가능한 양의 이소프렌 (0.5 ㎍/L 내지 1 ㎍/L, 도 20) 을 제조하였다. 이소프렌 합성효소 유전자 대신 피타아제 유전자를 가지고 있는 대조군 균주의 상부공간에서는 이소프렌이 검출되지 않았다.
실시예
7:
kudzu
이소프렌 합성효소 및
idi
, 또는
dxs
, 또는
idi
및
dxs 를
발현하는 E.
콜라이
내 이소프렌의 제조
I. E. 콜라이 내 이소프렌의 제조를 위해 kudzu 이소프렌 합성효소 및 idi, 또는 dxs, 또는 idi 및 dxs 를 코딩하는 벡터의 구축
i) pTrcKudzuKan 의 구축
pTrcKudzu 의 bla 유전자 (실시예 1 에 기재됨) 를 카나마이신 내성을 부여하는 유전자로 대체하였다. bla 유전자를 제거하기 위해, pTrcKudzu 를 BspHI 로 소화시키고, Shrimp Alkaline Phosphatase (SAP) 로 처리하고, 65℃ 에서 가열 치사시킨 다음, Klenow 분절 및 dNTP 로 말단을 채웠다. 5 kbp 큰 분절을 아가로오스 젤로부터 정제하고, 프라이머 MCM22 5'- GATCAAGCTTAACCGGAATTGCCAGCTG (SEQ ID NO: 14) 및 MCM23 5'- GATCCGATCGTCAGAAGAACTCGTCAAGAAGGC (SEQ ID NO: 15) 를 사용하여 pCR-Blunt-II-TOPO 로부터 PCR 증폭된 kanr 유전자에 라이게이션시키고, HindIII 및 PvuI 으로 소화시키고, 말단을 채웠다. 카나마이신 내성을 부여하는 플라스미드 (pTrcKudzuKan) 를 가지고 있는 형질전환체를 카나마이신 50 ㎍/ml 을 함유하는 LA 상에서 선별하였다.
ii) pTrcKudzu yIDI Kan 의 구축
pTrcKudzuKan 을 PstI 으로 소화시키고, SAP 로 처리하고, 가열 치사시키고, 젤 정제하였다. 이것을 합성 RBS 를 가진 S. 세레비지아에로부터 idi 를 코딩하는 PCR 생성물에 라이게이션하였다. PCR 에 대한 프라이머는 NsiI-YIDI 1 F 5'- CATCAATGCATCGCCCTTAGGAGGTAAAAAAAAATGAC (SEQ ID NO: 16) 및 PstI-YIDI 1 R 5'- CCTTCTGCAGGACGCGTTGTTATAGC (SEQ ID NO: 17) 이었고; 주형은 S. 세레비지아에 게놈 DNA 였다. PCR 생성물을 NsiI 및 PstI 로 소화시키고, 라이게이션 전에 젤 정제하였다. 라이게이션 혼합물을 화학적으로 수용능이 된 TOP10 세포 내로 형질전환시키고, 50 ㎍/ml 카나마이신을 함유하는 LA 상에서 선별하였다. 여러 개의 형질전환체를 단리하고, 서열분석하고, 수득된 플라스미드를 pTrcKudzu-yΙDI(kan) 으로 불렀다 (도 34 및 35).
iii) pTrcKudzu DXS Kan 의 구축
플라스미드 pTrcKudzuKan 을 PstI 으로 소화시키고, SAP 로 처리하고, 가열 치사시키고, 젤 정제하였다. 이것을 합성 RBS 를 가진 E. 콜라이로부터 dxs 를 코딩하는 PCR 생성물에 라이게이션하였다. PCR 에 대한 프라이머는 MCM 13 5'- GATCATGCATTCGCCCTTAGGAGGTAAAAAAACATGAGTTTTGATATTGCCAAAT ACCCG (SEQ ID NO: 18) 및 MCM14 5'- CATGCTGCAGTTATGCCAGCCAGGCCTTGAT (SEQ ID NO: 19) 이었고; 주형은 E. 콜라이 게놈 DNA 였다. PCR 생성물을 NsiI 및 PstI 로 소화시키고, 라이게이션 전에 젤 정제하였다. 수득된 형질전환 반응물을 TOP10 세포 내로 형질전환시키고, 카나마이신 50 ㎍/ml 을 함유하는 LA 상에서 선별하였다. 여러 개의 형질전환체를 단리하고, 서열분석하고, 수득된 플라스미드를 pTrcKudzu-DXS(kan) 으로 불렀다 (도 36 및 37).
iv) pTrcKudzu-yIDI-dxs (kan) 의 구축
pTrcKudzu-yIDI(kan) 을 PstI 으로 소화시키고, SAP 로 처리하고, 가열 치사시키고, 젤 정제하였다. 이것을 NsiI 및 PstI 로 소화시킨 합성 RBS (프라이머 MCM13 5'-GATCATGCATTCGCCCTTAGGAGGTAAAAAAACATGAGTTTTGATATTGCCAAAT ACCCG (SEQ ID NO: 18) 및 MCM14 5'-CATGCTGCAGTTATGCCAGCCAGGCCTTGAT (SEQ ID NO: 19); 주형 TOP10 세포) 를 가진 E. 콜라이 dxs 를 코딩하는 PCR 생성물에 라이게이션하고, 젤 정제하였다. 최종 플라스미드를 pTrcKudzu-yIDI-dxs (kan) 으로 불렀다 (도 21 및 22).
v) pCL PtrcKudzu 의 구축
상기 실시예 1 로부터의 프로모터, 구조적 유전자 및 터미네이터를 함유하는 DNA 의 분절을 SspI 를 사용하여 pTrcKudzu 로부터 소화시키고, 젤 정제하였다. 이것을 PvuII 로 소화시킨 pCL1920 에 라이게이션하고, SAP 로 처리하고, 가열 치사시켰다. 수득되는 라이게이션 혼합물을 TOP10 세포 내로 형질전환시키고, 스펙티노마이신 50 ㎍/ml 을 함유하는 LA 에서 선별하였다. 여러 개의 클론을 단리하고, 서열분석하고, 2 개를 선별하였다. pCL PtrcKudzu 및 pCL PtrcKudzu (A3) 은 반대 방향의 삽입물을 갖는다 (도 38-41).
vi) pCL PtrcKudzu yIDI 의 구축
NsiI-PstI 소화되고, 젤 정제된, 상기 IDI PCR 엠플리콘 형태 (ii) 를 PstI 로 소화된 pCL PtrcKudzu 내로 라이게이션하고, SAP 로 처리하고, 가열 치사시켰다. 라이게이션 혼합물을 TOP10 세포 내로 형질전환시키고, 스펙티노마이신 50 ㎍/ml 을 함유하는 LA 에서 선별하였다. 여러 개의 클론을 단리하고, 서열분석하고, 수득된 플라스미드를 pCL PtrcKudzu yIDI 로 불렀다 (도 42 및 43).
vii) pCL PtrcKudzu DXS 의 구축
NsiI-PstI 소화되고, 젤 정제된, 상기 DXS PCR 엠플리콘 형태 (iii) 를 PstI 로 소화된 pCL PtrcKudzu (A3) 내로 라이게이션하고, SAP 로 처리하고, 가열 치사시켰다. 라이게이션 혼합물을 TOP10 세포 내로 형질전환시키고, 스펙티노마이신 50 ㎍/ml 을 함유하는 LA 에서 선별하였다. 여러 개의 클론을 단리하고, 서열분석하고, 수득된 플라스미드를 pCL PtrcKudzu DXS 로 불렀다 (도 44 및 45).
II. 상이한 카피 수의 kudzu 이소프렌 합성효소, idi, 및/또는 dxs 를 발현하는 배양물로부터의 상부공간 내 이소프렌의 측정
플라스미드 pTrcKudzu(kan) (A), pTrcKudzu-yIDI kan (B), pTrcKudzu-DXS kan (C), pTrcKudzu-ylDI-DXS kan (D) 로 이전에 형질전환된 E. 콜라이 BL21(λDE3) 의 배양물을 LB 카나마이신 50 ㎍/mL 에서 성장시켰다. pCL PtrcKudzu (E), pCL PtrcKudzu, pCL PtrcKudzu-yIDI (F) 및 pCL PtrcKudzu-DXS (G) 의 배양물을 LB 스펙티노마이신 50 ㎍/mL 에서 성장시켰다. 배양물을 시간 0 (OD600 대략 0.5) 에서 400 μM IPTG 로 유도하고, 이소프렌 상부공간 측정을 위해 샘플을 채취하였다 (실시예 1 참조). 결과를 도 23A-23G 에 제시한다.
플라스미드 pTrcKudzu-yIDI-dxs (kan) 를 형질전환에 의해 E. 콜라이 균주 BL21 내로 도입하였다. 수득된 균주 BL21/pTrc Kudzu IDI DXS 를 20℃ 에서 카나마이신 (50 ㎍/ml) 을 함유하는 LB 에서 밤새 성장시키고, 1% 글루코오스를 함유하는 TM3 (13.6 g K2PO4, 13.6 g KH2PO4, 2.0 g MgSO4*7H2O), 2.0 g 구연산 1 수화물, 0.3 g 철 암모늄 시트레이트, 3.2 g (NH4)2SO4, 0.2 g 효모 추출물, 1.0 ml 100O× Modified Trace Metal Solution, pH 6.8 로 조정됨 및 H2O 충분량, 및 필터 살균됨) 의 진탕 플라스크에 접종하는데 사용하였다. OD600 이 0.8 에 도달할 때까지, 플라스크를 30℃ 에서 인큐베이션시킨 다음, 400 μM IPTG 로 유도하였다. 유도 후 다양한 시간에 샘플을 채취하고, 상부공간 내 이소프렌의 양을 실시예 1 에 기재된 바와 같이 측정하였다. 결과를 도 23H 에 제시한다.
III. E. 콜라이/pTrcKudzu yIDI DXS 내 바이오매스로부터의 이소프렌의 제조
균주 BL21 pTrcKudzuIDIDXS 를 대조군으로서 글루코오스와 3 가지 유형의 바이오매스; 버개스, 옥수수 대 및 침엽수 펄프로부터 이소프렌을 생성하는 능력에 대해 시험하였다. 바이오매스의 가수분해산물을 효소적 가수분해에 의해 제조하고 (Brown, L and Torget, R., 1996, NREL 표준 어세이 방법 Lap-009 "Enzymatic Saccharification of Lignocellulosic Biomass"), 글루코오스 등가물에 대해 희석물로서 사용하였다. 상기 예에서, 글루코오스 등가물은 1% 글루코오스와 동일하였다. BL21 (DE3) pTrcKudzu yIDI DXS (kan) 의 새롭게 형질전환된 세포 플레이트로부터의 단일 콜로니를 5 ml 의 LB + 카나마이신 (50 ㎍/ml) 접종에 사용하였다. 배양물을 25℃ 에서 밤새 진탕하면서 인큐베이션하였다. 다음날, 밤샘 배양물을 25 ml 의 TM3 + 0.2% YE + 1% 공급원료에 OD600 이 0.05 가 되도록 희석하였다. 공급원료는 옥수수 대, 버개스, 또는 침엽수 펄프였다. 글루코오스를 양성 대조군으로서 사용하였고, 음성 대조군으로서 글루코오스가 사용되지 않았다. 배양물을 180 rpm 으로 진탕하면서 30℃ 에서 인큐베이션하였다. OD600 가 ~0.8 에 도달할 때까지 배양물을 OD600 에 대해 모니터링하고, 배양물을 실시예 1 에 기재된 바와 같이 이소프렌 제조에 대해 1 및 3 시간에 분석하였다. 배양물을 유도하지 않았다. 첨가된 공급원료를 함유하는 모든 배양물은 글루코오스 양성 대조군과 동등한 이소프렌을 제조한다. 실험을 2 중으로 수행하였고, 도 46 에 제시한다.
IV. E. 콜라이/pTrcKudzuIDIDXS 내 전화당으로부터의 이소프렌의 제조
BL21 (λDE3)/pTrcKudzu yIDI DXS (kan) 의 새롭게 형질전환된 세포 플레이트로부터의 단일 콜로니를 5 mL 의 LB + 카나마이신 (50 ㎍/ml) 접종에 사용하였다. 배양물을 25℃ 에서 밤새 진탕하면서 인큐베이션하였다. 다음날, 밤샘 배양물을 25 ml 의 TM3 + 0.2% YE + 1% 공급원료에 OD600 이 0.05 가 되도록 희석하였다. 공급원료는 글루코오스, 전환 글루코오스 또는 옥수수 대였다. 전화당 공급원료 (Danisco Invert Sugar) 를 효소적으로 처리한 수크로오스 시럽에 의해 제조하였다. AFEX 옥수수 대를 하기 기재된 바와 같이 제조하였다 (파트 V). 세포를 30℃ 에서 성장시키고, 첫번째 샘플을 배양물의 OD600 가 ~0.8-1.0 에 도달할 때 측정하였다 (0 시간). 배양물을 0, 1 및 3 시간에 실시예 1 과 같이 이소프렌 제조에 대해, OD600 에 의해 측정된 바와 같은 성장에 대해 분석하였다. 결과를 도 47 에 제시한다.
V. AFEX 전처리된 옥수수 대로부터의 가수분해물의 제조
AFEX 전처리된 옥수수 대를 Michigan Biotechnology Institute 로부터 입수하였다. 전처리 조건은 60% 습도, 1:1 암모니아 적재, 및 90℃ 에서 30 분 동안이었고, 그 다음 공기 건조시켰다. AFEX 전처리된 옥수수 대 내의 습도 함량은 21.27% 였다. AFEX 전처리된 옥수수 대 내 글루칸 및 자일란의 함량은 각각 31.7% 및 19.1% (건조 기준) 였다. 당화 과정은 다음과 같았다; 20 g 의 AFEX 전처리된 옥수수 대를 5 ml 의 1 M 나트륨 시트레이트 완충액 pH 4.8, 2.25 ml 의 Accellerase 1000, 0.1 ml 의 Grindamyl H121 (제빵 산업에 대한 아스페르길루스 니게르 (Aspergillus niger) 로부터의 Danisco 자일라나아제 제품), 및 72.65 ml 의 DI 물이 있는 500 ml 플라스크에 첨가하였다. 플라스크를 오비탈 쉐이커에 넣고, 50℃ 에서 96 시간 동안 인큐베이션하였다. 쉐이커로부터 1 개의 샘플을 취하고, HPLC 를 사용하여 분석하였다. 가수분해물에는 38.5 g/l 의 글루코오스, 21.8 g/l 의 자일로오스, 및 10.3 g/l 의 글루코오스 및/또는 자일로오스의 올리고머가 함유되어 있다.
VI. 공급-배치식 배양물에서 성장한 E. 콜라이 내 이소프렌 제조에 대한 효모 추출물의 효과
발효를, 상기 기재된 pTrcKudzu yIDI DXS 플라스미드를 함유하는 E. 콜라이 세포로 이전에 기재된 바와 같이 14 L 규모로 수행하였다. 효모 추출물 (Bio Springer, Montreal, Quebec, Canada) 을 기하급수적 속도로 공급하였다. 발효기에 전달된 효모 추출물의 총 양은 40 시간 발효 동안 70 내지 830 g 이었다. 발효 브로쓰의 광학 밀도를 550 nm 의 파장에서 측정하였다. 발효기 내의 최종 광학 밀도는 첨가된 효모 추출물의 양에 비례하였다 (도 48A). 발효기로부터의 방출-기체 내 이소프렌 수준을 이전에 기재된 바와 같이 측정하였다. 이소프렌 적정농도는 발효 과정에 걸쳐 증가하였다 (도 48B). 제조되는 이소프렌의 양은 공급된 효모 추출물의 양에 선형으로 비례하였다 (도 48C).
VII. pTrcKudzu DXS yIDI 의 500 L 발효 내 이소프렌의 제조
kudzu 이소프렌 합성효소, S. 세레비지아에 IDI, 및 E. 콜라이 DXS 핵산 (E. 콜라이 BL21 (λDE3) pTrc Kudzu dxs yidi) 을 갖는 E. 콜라이 세포의 500 리터 발효를 이소프렌을 제조하기 위해 사용하였다. 이소프렌의 수준은 15 시간의 기간에 걸쳐 50 내지 300 ㎍/L 였다. 평균 이소프렌 농도, 장치를 통한 평균 흐름 및 이소프렌 초기흡착포화선 (breakthrough) 의 범위를 기반으로 하여, 수집된 이소프렌의 양은 대략 17 g 인 것으로 계산되었다.
VIII. 공급-배치식 배양물에서 성장한 E. 콜라이의 500 L 발효 내 이소프렌의 제조
배지 구성 (발효 배지 1 리터 당):
K2HPO4 7.5 g, MgSO4 * 7H2O 2 g, 구연산 1 수화물 2 g, 철 암모늄 시트레이트 0.3 g, 효모 추출물 0.5 g, 1000× 개질 미량 금속 용액 (Modified Trace Metal Solution) 1 ml. 모든 성분을 함께 첨가하고, diH2O 에 용해하였다. 상기 용액을 오토클레이브하였다. 암모니아 기체 (NH3) 로 pH 를 7.0 로 조정하고, 부피를 충분량으로 하였다. 멸균 및 pH 조정 후에 글루코오스 10 g, 티아민 * HCl 0.1 g, 및 항생제를 첨가하였다.
1000× 개질 미량 금속 용액 (Modified Trace Metal Solution):
구연산 * H2O 40 g, MnSO4 * H2O 30 g, NaCl 10 g, FeSO4 * 7H2O 1 g, CoCl2 * 6H2O 1 g, ZnSO * 7H2O 1 g, CuSO4 * 5H2O 100 mg, H3BO3 100 mg, NaMoO4 * 2H2O 100 mg. 각 성분을 diH2O 에 한번에 용해하고, HCl/NaOH 로 pH 를 3.0 으로 조정한 다음, 부피를 충분히 하고, 0.22 μ 필터로 필터 멸균하였다.
발효를, pTrcKudzu yIDI DXS 플라스미드를 함유하는 E. 콜라이 세포로 500 L 생물반응기에서 수행하였다. 상기 실험을 바람직한 발효 pH 7.0 및 온도 30℃ 에서 글루코오스 및 효모 추출물로부터 이소프렌 형성을 모니터링하기 위해 수행하였다. 동결 바이알로부터 채취한 E. 콜라이 균주 접종물을 소이톤-효모 추출물-글루코오스 배지에 조제하였다. 접종물을 550 nm 에서 측정된 OD 0.15 까지 성장시킨 후, 20 ml 을 2.5 L 소이톤-효모 추출물-글루코오스 배지를 함유하는 생물반응기 접종에 사용하였다. 2.5 L 생물반응기를 30℃ 에서 OD 1.0 까지 성장시키고, 2.0 L 를 500 L 생물반응기로 옮겼다.
효모 추출물 (Bio Springer, Montreal, Quebec, Canada) 및 글루코오스를 기하급수적 속도로 공급하였다. 50 시간 발효 동안 생물반응기에 전달된 글루코오스 및 효모 추출물의 총 양은 각각 181.2 kg 및 17.6 kg 이었다. 시간에 걸친 생물반응기 내의 광학 밀도를 도 49A 에 제시한다. 생물반응기로부터의 방출-기체 내 이소프렌 수준을 이전에 기재된 바와 같이 측정하였다. 이소프렌 적정농도는 발효 과정에 걸쳐 증가하였다 (도 49B). 50 시간 발효 동안 제조되는 이소프렌의 총 양은 55.1 g 이었고, 제조 시간 과정은 도 49C 에 제시된다.
실시예
8:
kudzu
이소프렌 합성효소 및 재조합
메발론산
경로 유전자를 발현하는 E.
콜라이
내 이소프렌의 제조
I. 하위 MVA 경로 클로닝
하위 메발론산 경로를 클로닝하기 위한 전략은 다음과 같았다. 메발론산 생합성 경로 중 4 개의 유전자; 메발로네이트 키나아제 (MVK), 포스포메발로네이트 키나아제 (PMK), 디포스포메발로네이트 데카르복실라아제 (MVD) 및 이소펜테닐 디포스페이트 이소머라아제 유전자를 S. 세레비지아에 염색체 DNA 로부터 PCR 에 의해 증폭시키고, pCR BluntII TOPO 플라스미드 (Invitrogen) 내에 개별적으로 클로닝하였다. 일부 경우에서, idi 유전자를 E. 콜라이 염색체 DNA 로부터 증폭시켰다. E. 콜라이 일치 RBS (AGGAGGT (SEQ ID NO:80) 또는 AAGGAGG (SEQ ID NO:81)) 를 5' 말단에 삽입하고, 출발 코돈 및 PstI 부위의 8 bp 상류방향을 3' 말단에 첨가하는 식으로 프라이머를 디자인하였다. 그 다음 유전자를 전체 경로가 조립될 때까지 pTrcHis2B 벡터 내로 하나씩 클로닝하였다.
S. 세레비지아에 S288C 로부터의 염색체 DNA 를 ATCC (ATCC 204508D) 로부터 입수하였다. 제조자의 지침대로 PfuTurbo 를 사용하고 프라이머 MVKF (5'-AGGAGGTAAAAAAACATGTCATTACCGTTCTTAACTTCTGC, SEQ ID NO:21) 및 MVK-Pst1-R (5'- ATGGCTGCAGGCCTATCGCAAATTAGCTTATGAAGTCCATGGTAAATTCGTG, SEQ ID NO:22) 을 사용하여 S. 세레비지아에의 염색체로부터 MVK 유전자를 증폭시켰다. 올바른 크기의 PCR 생성물 (1370 bp) 을 1.2% E-젤 (Invitrogen) 을 통해 전기영동에 의해 확인하고, pZeroBLUNT TOPO 내로 클로닝하였다. 수득된 플라스미드를 pMVK1 로 지정하였다. 플라스미드 pMVK1 을 SacI 및 Taq 1 제한 엔도뉴클라아제로 소화시키고, 분절을 젤 정제하고, SacI 및 BstBI 로 소화된 pTrcHis2B 내로 라이게이션하였다. 수득된 플라스미드를 pTrcMVK1 이라고 불렀다.
메발론산 생합성 경로 내의 제 2 유전자 PMK 를 프라이머: PstI-PMK1 R (5'-GAATTCGCCCTTCTGCAGCTACC, SEQ ID NO:23) 및 BsiHKA I-PMK1 F (5'-CGACTGGTGCACCCTTAAGGAGGAAAAAAACATGTCAG, SEQ ID NO:24) 를 사용하는 PCR 에 의해 증폭시켰다. PCR 반응을 제조자의 지침대로 Pfu Turbo 폴리머라아제 (Stratagene) 를 사용하여 수행하였다. 올바른 크기의 생성물 (1387 bp) 을 PstI 및 BsiHKI 로 소화시키고, PstI 로 소화된 pTrcMVK1 내로 라이게이션시켰다. 수득된 플라스미드를 pTrcKK 라고 불렀다. MVD 및 idi 유전자를 동일한 방식으로 클로닝하였다. 프라이머 쌍 PstI-MVD 1 R (5'-GTGCTGGAATTCGCCCTTCTGCAGC, SEQ ID NO:25) 및 NsiI-MVD 1 F (5'-GTAGATGCATGCAGAATTCGCCCTTAAGGAGG, SEQ ID NO:26) 을 사용하여 PCR 을 수행하여 MVD 유전자를 증폭시키고, PstI-YIDI 1 R (5'-CCTTCTGCAGGACGCGTTGTTATAGC, SEQ ID NO:27) 및 NsiI-YIDI 1 F (5'- CATCAATGCATCGCCCTTAGGAGGTAAAAAAAAATGAC, SEQ ID NO:28) 로 yIDI 유전자를 증폭시켰다. 일부 경우에서, E. 콜라이로부터의 IPP 이소머라아제 유전자, idi 를 사용하였다. E. 콜라이 염색체 DNA 로부터 idi 를 증폭시키기 위해, 하기 프라이머 세트를 사용하였다: PstI-CIDI 1 R (5'- GTGTGATGGATATCTGCAGAATTCG, SEQ ID NO:29) 및 NsiI-CIDI 1 F (5'- CATCAATGCATCGCCCTTAGGAGGTAAAAAAACATG, SEQ ID NO:30). 주형 DNA 는 E. 콜라이 FM5 로부터 표준 방법에 의해 단리된 염색체 DNA 였다 (특히, 핵산의 단리에 관해, 본원에 각각 전체가 참조로서 인용된 WO 96/35796 및 WO 2004/033646). 최종 플라스미드를, 효모 idi 유전자를 코딩하는 구축물에 대해 pKKDIy 로 또는 E. 콜라이 idi 유전자를 코딩하는 구축물에 대해 pKKDIc 라고 불렀다. 플라스미드를 후속 분석을 위해 E. 콜라이 숙주 BL21 내로 형질전환하였다. 일부 경우에서 kudzu 로부터의 이소프렌 합성효소를 pKKDIy 내로 클로닝하여, 플라스미드 pKKDIyIS 를 산출하였다.
하위 MVA 경로를 또한 카나마이신 항생제 내성 마커를 함유하는 pTrc 내로 클로닝하였다. 플라스미드 pTrcKKDIy 를 제한 엔도뉴클레아제 ApaI 및 PstI 로 소화시키고, 5930 bp 분절을 1.2% 아가로오스 E-젤 상에서 분리하고, 제조자의 지침에 따라 Qiagen Gel Purification 키트를 사용하여 정제하였다. 실시예 7 에 기재된 플라스미드 pTrcKudzuKan 을 제한 엔도뉴클레아제 ApaI 및 PstI 로 소화시키고, Qiagen Gel Purification 키트를 사용하여 1.2% E-젤로부터 벡터를 함유하는 3338 bp 분절을 정제하였다. 3338 bp 벡터 분절 및 5930 bp 하위 MVA 경로 분절을 Roche Quick Ligation 키트를 사용하여 라이게이션하였다. 라이게이션 믹스를 E. 콜라이 TOP10 세포 내로 형질전환시키고, 형질전환체를 카나마이신 (50 ㎍/ml) 을 함유하는 LA 상에서 선별하여 밤새 37℃ 에서 성장시켰다. 형질전환체를 제한 효소 소화에 의해 입증하고, 하나를 저장물로서 동결시켰다. 플라스미드를 pTrcKanKKDIy 로 지정하였다.
II. pTrcKanKKDIy 내로의 kudzu 이소프렌 합성효소 유전자의 클로닝
kudzu 이소프렌 합성효소 유전자를, 프라이머 MCM50 5'-GATCATGCATTCGCCCTTAGGAGGTAAAAAAACATGTGTGCGACCTCTTCTCAATTTACT (SEQ ID NO:31) 및 MCM53 5'-CGGTCGACGGATCCCTGCAGTTAGACATACATCAGCTG (SEQ ID NO:32) 를 사용하여 실시예 1 에 기재된 pTrcKudzu 로부터 PCR 에 의해 증폭시켰다. 수득된 PCR 분절을 pCR2.1 내에 클로닝하고, E. 콜라이 TOP10 내로 형질전환시켰다. 상기 분절은 kudzu 이소프렌 합성효소에 대한 코딩 서열 및 E. 콜라이로부터의 RBS 을 함유하는 상류방향 영역을 함유한다. 형질전환체를 카르베니실린 (50 ㎍/ml) 을 함유하는 LA 상에서 선별하여 밤새 37℃ 에서 인큐베이션하였다. 분절의 올바른 삽입을 서열분석에 의해 입증하였고, 상기 균주를 MCM93 으로 지정하였다.
균주 MCM93 으로부터의 플라스미드를 제한 엔도뉴클레아제 NsiI 및 PstI 로 소화시켜, RBS 및 kudzu 이소프렌 합성효소를 함유하는 1724 bp 삽입체를 방출시켰다. 1724 bp 분절을 1.2% 아가로오스 E-젤 상에서 분리하고, 제조자의 지침에 따라 Qiagen Gel Purification 키트를 사용하여 정제하였다. 플라스미드 pTrcKanKKDIy 를 제한 엔도뉴클레아제 PstI 로 소화시키고, SAP 로 30 분 동안 37℃ 에서 처리하고, Qiagen PCR 클린업 (cleanup) 키트를 사용하여 정제하였다. DNA 분절을 코딩하는 플라스미드 및 kudzu 이소프렌 합성효소를 Roche Quick Ligation 키트를 사용하여 라이게이션하였다. 라이게이션 믹스를 E. 콜라이 TOP10 세포 내로 형질전환시키고, 형질전환체를 50 ㎍/ml 으로 카나마이신을 함유하는 LA 상에서 선별하여 37℃ 에서 밤새 성장시켰다. 올바른 형질전환체를 제한 소화에 의해 입증하고, 플라스미드를 pTrcKKDyIkISKan 이라고 지정하였다 (도 24 및 25). 상기 플라스미드를 BL21(λDE3) 세포 (Invitrogen) 내로 형질전환시켰다.
III. kudzu 로부터 재조합 하위 메발로네이트 경로 및 이소프렌 합성효소를 발현하는 E. 콜라이 내 메발로네이트로부터의 이소프렌 제조.
균주 BL21/pTrcKKDyIkISKan 을 pH 7.1 로 조정하고 0.5% 글루코오스 및 0.5% 메발론산을 보충한 MOPS 배지 (Neidhardt et al., (1974) J. Bacteriology 119:736-747) 내에서 배양하였다. 또한, 동일한 조건을 사용하나, 0.5% 메발론산을 첨가하지 않은 대조군 배양물을 설정하였다. 1% 접종물이 있는 밤샘 종자 배양물로부터 배양을 시작하고, 배양물의 OD600 이 0.3 내지 0.5 에 도달할 때 500 μM IPTG 로 유도하였다. 배양물을 250 rpm 으로 진탕하면서 30℃ 에서 성장시켰다. 이소프렌 제조를 실시예 1 에 기재된 상부공간 어세이를 사용함으로써 유도 3 시간 후에 분석하였다. 이소프렌의 최대 제조는 6.67 × 10-4 mol/L브로쓰/OD600/hr (식 중, L브로쓰 는 브로쓰의 부피이고, 여기에는 세포의 부피 및 세포 배지의 부피가 모두 포함된다) 였다. 메발론산을 보충하지 않은 대조군 배양물은 측정가능한 이소프렌을 제조하지 않았다.
IV. 상위 MVA 경로 클로닝
3 개의 효소 활성을 코딩하는 2 개의 유전자를 포함하는 상위 메발로네이트 생합성 경로를 엔테로코쿠스 파에칼리스 (Enterococcus faecalis) 로부터 클로닝하였다. mvaE 유전자는 경로 내의 첫번째 및 세번째 단백질인 아세틸-CoA 아세틸트랜스페라아제 및 3-히드록시-3-메틸글루타릴-CoA (HMG-CoA) 리덕타아제 모두의 효소 활성을 갖는 단백질을 코딩하고, mvaS 유전자는 경로 내 제 2 효소인 HMG-CoA 합성효소를 코딩한다. mvaE 유전자를 하기 프라이머를 사용하여 앞쪽에 스페이서 및 E. 콜라이 리보솜 결합 부위를 갖는 E. 파에칼리스 게놈 DNA (ATCC 700802D-5) 로부터 증폭시켰다:
CF 07-60 (+) mvaE w/RBS + ATG 출발 코돈 SacI 의 출발
5' -GAGACATGAGCTCAGGAGGTAAAAAAACATGAAAACAGTAGTTATTATTG (SEQ ID NO:34)
CF 07-62 (-) 사이에 RBS 를 갖는 mvaS 에 대해 mvaE 를 융합함
5' -TTTATCAATCCCAATTGTCATGTTTTTTTACCTCCTTTATTGTTTTCTTAAATC (SEQ ID NO:35)
mvaS 유전자를 하기 프라이머를 사용하여 앞쪽에 E. 콜라이로부터 스페이서 및 RBS 를 갖는 E. 파에칼리스 게놈 DNA (ATCC 700802D-5) 로부터 증폭시켰다:
CF 07-61 (+) 사이에 RBS 를 갖는 mvaS 에 대해 mvaE 를 융합함
5' -GATTTAAGAAAACAATAAAGGAGGTAAAAAAACATGACAATTGGGATTGATAAA (SEQ ID NO:36)
CF 07-102 (-) mvaS 유전자 BglII 의 말단
5' -GACATGACATAGATCTTTAGTTTCGATAAGAACGAACGGT (SEQ ID NO:37)
PCR 분절을 하기 프라이머를 사용하는 PCR 로 함께 융합하였다:
CF 07-60 (+) mvaE w/RBS + ATG 출발 코돈 SacI 의 출발
5 ' -GAGACATGAGCTCAGGAGGTAAAAAAACATGAAAACAGTAGTTATTATTG (SEQ ID NO:34)
CF 07-102 (-) mvaS 유전자 BglII 의 말단
5'-GACATGACATAGATCTTTAGTTTCGATAAGAACGAACGGT (SEQ ID NO:37)
융합 PCR 분절을 Qiagen 키트를 사용하여 정제하고, 제한 효소 SacI 및 BglII 로 소화시켰다. 상기 소화된 DNA 분절을 Qiagen 키트를 사용하여 젤 정제하고, SacI 및 BglII 로 소화된 시판 벡터 pTrcHis2A 내로 라이게이션하고, 젤 정제하였다.
라이게이션 믹스를 E. 콜라이 Top 10 세포 내에 형질전환하고, 콜로니를 LA+50 ㎍/ml 카르베니실린 플레이트 상에서 선별하였다. 총 6 개의 콜로니를 선택하고, LB+50 ㎍/ml 카르베니실린에서 밤새 성장시키고, Qiagen 키트를 사용하여 플라스미드를 단리하였다. 플라스미드를 SacI 및 BglII 로 소화시켜 삽입물을 확인하고, 하나의 올바른 플라스미드를 하기 프라이머로 서열분석하였다:
CF 07-58 (+) mvaE 유전자의 출발
5' - ATGAAAACAGTAGTTATTATTGATGC (SEQ ID NO:38)
CF 07-59 (-) mvaE 유전자의 말단
5' - ATGTTATTGTTTTCTTAAATCATTTAAAATAGC (SEQ ID NO:39)
CF 07-82 (+) mvaS 유전자의 출발
5' - ATGACAATTGGGATTGATAAAATTAG (SEQ ID NO:40)
CF 07-83 (-) mvaS 유전자의 말단
5' - TTAGTTTCGATAAGAACGAACGGT (SEQ ID NO:41)
CF 07-86 (+) mvaE 내 서열
5' - GAAATAGCCCCATTAGAAGTATC (SEQ ID NO:42)
CF 07-87 (+) mvaE 내 서열
5' - TTGCCAATCATATGATTGAAAATC (SEQ ID NO:43)
CF 07-88 (+) mvaE 내 서열
5' - GCTATGCTTCATTAGATCCTTATCG (SEQ ID NO:44)
CF 07-89 (+) 서열 mvaS
5' - GAAACCTACATCCAATCTTTTGCCC (SEQ ID NO:45)
pTrcHis2AUpperPathway#1 이라고 불리는 플라스미드를 서열분석에 의해 정정하고, 시판 E. 콜라이 균주 BL21 내로 형질전환시켰다. LA+ 50 ㎍/ml 카르베니실린 상에서 선별하였다. 2 개의 형질전환체를 선택하고, 이들의 OD600 이 1.5 에 도달할 때까지 LB+ 50 ㎍/ml 카르베니실린에서 성장시켰다. 글리세롤의 존재하에 -80℃ 의 바이알에서 모든 균주를 동결시켰다. 균주를 BL21 내 pTrcHis2AUpperPathway#1 에 대해서는 CF 449, 단리물 #1 및 BL21 내 pTrcHis2AUpperPathway#1 에 대해서는 CF 450, 단리물 #2 로 지정하였다. 분석 시 모든 클론은 동일하게 행동하는 것으로 발견되었다.
V. pCL1920 내로의 UpperMVA Pathway 의 클로닝
플라스미드 pTrcHis2AUpperPathway 를 제한 엔도뉴클레아제 SspI 으로 소화시켜, pTrc-mvaE-mvaS-(His 태그)-터미네이터를 함유하는 분절을 방출시켰다. 상기 분절에서, his-태그는 번역되지 않았다. 상기 뭉툭한 말단 4.5 kbp 분절을 Qiagen Gel Purification 키트를 사용하여 1.2% E-젤로부터 정제하였다. pCL1920 으로부터의 탈인산화된, 뭉툭한 말단 4.2 kbp 분절을, 벡터를 제한 엔도뉴클레아제 PvuII 로 소화시키고, SAP 로 처리하고, Qiagen Gel Purification 키트를 사용하여 1.2% E-젤로부터 젤 정제함으로써 제조하였다. Roche Quick Ligation Kit 를 사용하여 2 개의 분절을 라이게이션하고, TOP10 화학적으로 수용능이 된 세포 내에 형질전환시켰다. 형질전환체를 스펙티노마이신 (50 ㎍/ml) 을 함유하는 LA 상에서 선별하였다. PCR 에 의한 삽입물의 존재에 대해 스크리닝함으로써 올바른 콜로니를 확인하였다. 플라스미드를 pCL PtrcUpperPathway (도 26 및 27A-27D) 로 지정하였다.
VI. 조합된 상위 및 하위 메발론산 경로를 발현하는 균주
완전한 메발론산 경로와 kudzu 이소프렌 합성효소를 갖는 균주를 수득하기 위해, 플라스미드 pTrcKKDyIkISkan 및 pCLpTrcUpperPathway 를 모두 BL21(λDE3) 수용능 세포 (Invitrogen) 내에 형질전환시키고, 형질전환체를 카나마이신 (50 ㎍/ml) 및 스펙티노마이신 (50 ㎍/ml) 을 함유하는 LA 상에서 선별하였다. 모든 플라스미드가 숙주 내에 유지되었는지를 확인하기 위해 형질전환체를 플라스미드 프렙에 의해 체크하였다. 균주를 MCM 127 로 지정하였다.
VII. E. 콜라이/pUpperpathway 내 글루코오스로부터 메발론산의 제조
BL21/pTrcHis2A-mvaE/mvaS 또는 FM5/p pTrcHis2A-mvaE/mvaS 의 단일 콜로니를 LB + 카르베니실린 (100 ㎍/ml) 내에 접종하고, 200 rpm 으로 진탕하면서 37℃ 에서 밤새 성장시켰다. 상기 배양물을 250 ml 배플 플라스크 내의 50 ml 배지 내에 OD600 이 0.1 이 되도록 희석하였다. 배지는 TM3 + 1 또는 2% 글루코오스 + 카르베니실린 (100 ug/ml) 또는 TM3 + 1% 글루코오스 + 가수분해된 대두 오일 + 카르베니실린 (100 ug/ml) 또는 TM3 + 바이오매스 (조제된 버개스, 옥수수 대 또는 지팽이풀) 이었다. 배양물을 OD600 0.4 에 도달할 때까지 대략 2-3 시간 동안 200 rpm 으로 진탕하면서 30℃ 에서 성장시켰다. 이 시점에, mvaE mvaS 구축물로부터의 발현을 IPTG (400 μM) 의 첨가에 의해 유도하였다. 2 시간 간격에서 유도 후 6 시간 (그 다음 필요하면 24, 36 및 48 시간) 에 채취된 샘플로 추가 20 또는 40 시간 동안 배양물을 인큐베이션하였다. 1 ml 의 배양물을 제거하고, OD600 을 측정하고, 마이크로퓨즈 내 세포를 펠렛화하고, 상청액을 제거하고, 이것을 메발론산에 대해 분석함으로써 샘플링을 수행하였다.
엔테로코쿠스 파에칼리스 AA-CoA 티올라아제, HMG-CoA 합성효소, 및 HMG-CoA 리덕타아제 폴리펩티드를 코딩하는 핵산을 갖는 E. 콜라이 세포의 14 리터 발효로 세포 배지로서 TM3 배지 및 2% 글루코오스와 함께 22 그램의 메발론산이 제조되었다. 상기 세포의 진탕 플라스크는 세포 배양 배지로서 LB 배지 및 1% 글루코오스와 함께 1 리터 당 2-4 그램의 메발론산을 제조하였다. 상기 균주에서의 메발론산의 제조는 MVA 경로가 E. 콜라이에서 기능을 하였음을 나타내었다.
VIII. 상위 및 하위 MVA 경로와 kudzu 이소프렌 합성효소를 함유하는 E. 콜라이 BL21 로부터의 이소프렌의 제조.
하기 균주를 상위 및 하위 MVA 경로를 함유하는 플라스미드 및 상기 기재된 바와 같은 kudzu 이소프렌 합성효소 유전자 및 idi, dxs, 및 dxr 을 함유하는 플라스미드 및 실시예 7 에 기재된 이소프렌 합성효소 유전자의 다양한 조합으로의 형질전환에 의해 제작하였다. 사용된 숙주 세포는 화학적으로 수용능이 된 BL21(λDE3) 이었고, 형질전환을 표준 방법에 의해 수행하였다. 형질전환체를 카나마이신 (50 ㎍/ml) 또는 카나마이신 + 스펙티노마이신 (모두 농도는 50 ㎍/ml 임) 을 함유하는 L 아가 상에서 선별하였다. 플레이트를 37℃ 에서 성장시켰다. 수득된 균주를 하기와 같이 지정하였다:
카나마이신 + 스펙티노마이신 (각각 50 ㎍/ml) 상에서 성장함
MCM127 - BL21(λDE3) 내 pCL Upper MVA + pTrcKKDyIkIS (kan)
MCM131 - BL21(λDE3) 내 pCL1920 + pTrcKKDyIkIS (kan)
MCM125 - BL21(λDE3) 내 pCL Upper MVA + pTrcHis2B (kan)
카나마이신 (50 ㎍/ml) 상에서 성장함
MCM64 - BL21(λDE3) 내 pTrcKudzu yIDI DXS (kan)
MCM50 - BL21(λDE3) 내 pTrcKudzu (kan)
MCM123 - BL21(λDE3) 내 pTrcKudzu yIDI DXS DXR (kan)
상기 균주를 동결 저장액으로부터 LA + 적합한 항생제에 스트리킹하고, 37℃ 에서 밤새 성장시켰다. 각 플레이트로부터 단일 콜로니를 진탕 플라스크 (25 ml LB + 적합한 항생제) 에 접종하는데 사용하였다. 플라스크를 200 rpm 으로 진탕하면서 밤새 22℃ 에서 인큐베이션시켰다. 다음날 아침, 플라스크를 37℃ 인큐베이터로 옮기고, 200 rpm 으로 진탕하면서 추가 4.5 시간 동안 성장시켰다. 세포를 펠렛화하기 위해 25 ml 배양물을 원심분리하고, 세포를 5 ml LB + 적합한 항생제에 재현탁시켰다. 그 다음 배양물을 OD600 가 0.1 이 되도록 25 ml LB+ 1% 글루코오스 + 적합한 항생제 내에 희석하였다. 각 균주에 대해 2 개의 플라스크를 배정하고, 하나의 세트는 IPTG (800 μM) 로 유도하고, 제 2 세트는 유도하지 않았다. 배양물을 250 rpm 으로 진탕하면서 37℃ 에서 인큐베이션하였다. 1 세트의 배양물을 1.50 시간 (샘플링 시점 1 후 즉시) 후에 유도하였다. 각 샘플링 시점에, OD600 을 측정하고, 이소프렌의 양을 실시예 1 에 기재된 바와 같이 측정하였다. 결과를 표 3 에 제시한다. 제조된 이소프렌의 양을 특정 균주에 대해 피크 제조시 양으로 나타낸다.
표 3. E.
콜라이
균주 내 이소프렌의 제조
메발로노락톤 (1.0 g, 7.7 mmol) (CAS# 503-48-0) 을 물 (7.7 mL) 에 용해된 시럽으로서 Sigma-Aldrich (WI, USA) 로부터 공급받고, 메발론산의 칼륨 염을 생성하기 위해 수산화칼륨 (7.7 mmol) 으로 처리하였다. 메발론산으로의 전환을 1H NMR 분석에 의해 확인하였다. HPLC 분석용 샘플을 14,000 rpm 으로 5 분 동안 원심분리에 의해 제조하여 세포를 제거한 후, 300 ㎕ 상청액 분취액을 900 ㎕ 의 H2O 에 첨가하였다. 그 다음 과염소산 (70% 용액 36 ㎕) 을 첨가한 후 혼합하고 빙상에서 5 분 동안 냉각시켰다. 그 다음 샘플을 다시 원심분리하고 (14,000 rpm, 5 분 동안), 상청액을 HPLC 로 옮겼다. 메발론산 표준 (20, 10, 5, 1 및 0.5 g/L) 을 동일한 방식으로 제조하였다. 메발론산 (20 uL 주사 부피) 분석을, 굴절률 (RI) 검출로 0.6 mL/분에서 5 mM 황산으로 용리되는 BioRad Aminex 87-H+ 컬럼 (7.0 mm 에 의해 300 mm) 을 사용하여 HPLC 에 의해 수행하였다. 상기 조건 하에서 메발론산은 18.5 분에 락톤 형태로서 용리되었다.
X. 상위 MVA 경로 + kudzu 이소프렌 합성효소를 함유하는 E. 콜라이 BL21 로부터의 이소프렌의 제조
메발론산 경로 폴리펩티드 + Kudzu 이소프렌 합성효소를 발현하는 E. 콜라이의 15 L 규모 발효를 사용하여, 공급-배치식 배양액 내 세포로부터 이소프렌을 제조하였다. 상기 실험은 글루코오스 제한 조건 하에서 성장하는 세포가 2.2 g/L 의 이소프렌을 제조한다는 것을 증명한다.
배지 구성 (발효 배지 1 리터 당):
발효 배지 1 리터 당 하기 성분을 사용하여 배지를 제조하였다: K2HPO4 7.5 g, MgSO4 * 7H2O 2 g, 구연산 1 수화물 2 g, 철 암모늄 시트레이트 0.3 g, 효모 추출물 0.5 g, 및 1000× 개질 미량 금속 용액 (Modified Trace Metal Solution) 1 ml. 모든 성분을 함께 첨가하고, diH2O 에 용해하였다. 상기 용액을 오토클레이브하였다. 수산화암모늄 (30%) 으로 pH 를 7.0 로 조정하고, 부피를 충분량으로 하였다. 멸균 및 pH 조정 후에 글루코오스 10 g, 티아민 * HCl 0.1 g, 및 항생제를 첨가하였다.
1000× 개질 미량 금속 용액 (Modified Trace Metal Solution):
1000× 개질 미량 금속 용액을 하기 성분을 사용하여 제조하였다: 구연산 * H2O 40 g, MnSO4 * H2O 30 g, NaCl 10 g, FeSO4 * 7H2O 1 g, CoCl2 * 6H2O 1 g, ZnSO * 7H2O 1 g, CuSO4 * 5H2O 100 mg, H3BO3 100 mg, 및 NaMoO4 * 2H2O 100 mg. 각 성분을 diH2O 에 한번에 용해하고, HCl/NaOH 로 pH 를 3.0 으로 조정한 다음, 부피를 충분히 하고, 0.22 μ 필터로 필터 멸균하였다.
발효를, pCL PtrcUpperPathway (도 26) 및 pTrcKKDyIkIS 플라스미드를 함유하는 BL21 (DE3) E. 콜라이 세포로 15 L 생물반응기에서 수행하였다. 상기 실험을 바람직한 발효 pH 7.0 및 온도 30℃ 에서 글루코오스로부터 이소프렌 형성을 모니터링 하기 위해 실시하였다. 동결 바이알로부터 채취한 E. 콜라이 균주의 접종물을 LB 브로쓰 아가 플레이트 (항생제 있음) 상에 스트리킹하고 37℃ 에서 인큐베이션하였다. 단일 콜로니를 소이톤-효모 추출물-글루코오스 배지 내로 접종하였다. 550 nm 에서 측정하였을 때 접종물이 OD 1.0 까지 성장한 후, 500 mL 을 5 L 생물반응기에 접종하는데 사용하였다.
세포가 정지상에 도달할 때까지 글루코오스를 기하급수적 속도로 공급하였다. 이 후 글루코오스 공급량을 감소시켜 대사 요구를 충족시켰다. 54 시간 발효 동안 생물반응기에 전달되는 글루코오스의 총 양은 3.7 kg 이었다. 이소프로필-베타-D-1-티오갈락토피라노시드 (IPTG) 를 첨가하여 유도를 달성하였다. 550 nm 에서의 광학 밀도 (OD550) 가 10 의 값에 도달하였을 때 IPTG 농도를 25 uM 로 하였다. OD550 이 190 에 도달하였을 때 IPTG 농도를 50 uM 으로 상승시켰다. IPTG 농도를 38 시간 발효 시 100 uM 로 증가시켰다. 시간에 따른 생물반응기 내 OD550 프로파일을 도 54 에 제시한다. 생물반응기로부터의 배출 기체 내 이소프렌 수준을 본원에 기재된 바와 같이 측정하였다. 이소프렌 적정농도는 발효 과정 동안 최종 값 2.2 g/L 로 증가되었다 (도 55). 54 시간 발효 동안 제조되는 이소프렌의 총 양은 15.9 g 이었고, 제조 시간 과정은 도 56 에 제시된다.
XI. 15 L 규모의 공급-배치식 배양물에서 성장하고 메발론산 경로로부터의 유전자를 발현하는 E. 콜라이로부터의 이소프렌 발효
메발론산 경로 폴리펩티드 및 Kudzu 이소프렌 합성효소를 발현하는 E. 콜라이의 15 L 규모 발효를 공급-배치식 배양물 내 세포로부터 이소프렌을 제조하는데 사용하였다. 상기 실험은 글루코오스 제한 조건 하에서 성장하는 세포가 3.0 g/L 의 이소프렌을 제조한다는 것을 증명한다.
배지 구성 (발효 배지 1 리터 당):
발효 배지 1 리터 당 하기 성분을 사용하여 배지를 제조하였다: K2HPO4 7.5 g, MgSO4 * 7H2O 2 g, 구연산 1 수화물 2 g, 철 암모늄 시트레이트 0.3 g, 효모 추출물 0.5 g, 및 1000× 개질 미량 금속 용액 (Modified Trace Metal Solution) 1 ml. 모든 성분을 함께 첨가하고, diH2O 에 용해하였다. 상기 용액을 오토클레이브하였다. 수산화암모늄 (30%) 으로 pH 를 7.0 로 조정하고, 부피를 충분량으로 하였다. 멸균 및 pH 조정 후에 글루코오스 10 g, 티아민 * HCl 0.1 g, 및 항생제를 첨가하였다.
1000× 개질 미량 금속 용액 (Modified Trace Metal Solution):
1000× 개질 미량 금속 용액을 하기 성분을 사용하여 제조하였다: 구연산 * H2O 40 g, MnSO4 * H2O 30 g, NaCl 10 g, FeSO4 * 7H2O 1 g, CoCl2 * 6H2O 1 g, ZnSO * 7H2O 1 g, CuSO4 * 5H2O 100 mg, H3BO3 100 mg, 및 NaMoO4 * 2H2O 100 mg. 각 성분을 diH2O 에 한번에 용해하고, HCl/NaOH 로 pH 를 3.0 으로 조정한 다음, 부피를 충분히 하고, 0.22 μ 필터로 필터 멸균하였다.
pCL PtrcUpperMVA 및 pTrc KKDyIkIS 플라스미드를 함유하는 BL21 (DE3) E. 콜라이 세포로 15 L 생물반응기에서 발효를 수행하였다. 상기 실험을 바람직한 발효 pH 7.0 및 온도 30℃ 에서 글루코오스로부터 이소프렌 형성을 모니터링 하기 위해 실시하였다. 동결 바이알로부터 채취한 E. 콜라이 균주의 접종물을 LB 브로쓰 아가 플레이트 (항생제 있음) 상에 스트리킹하고 37℃ 에서 인큐베이션하였다. 단일 콜로니를 트립톤-효모 추출물 배지 내로 접종하였다. 550 nm 에서 측정하였을 때 접종물이 OD 1.0 까지 성장한 후, 500 mL 을 5 L 생물반응기에 접종하는데 사용하였다.
세포가 정지상에 도달할 때까지 글루코오스를 기하급수적 속도로 공급하였다. 이 후 글루코오스 공급량을 감소시켜 대사 요구를 충족시켰다. 59 시간 발효 동안 생물반응기에 전달되는 글루코오스의 총 양은 2.2 kg 이었다. IPTG 를 첨가하여 유도를 달성하였다. 550 nm 에서의 광학 밀도 (OD550) 가 10 의 값에 도달하였을 때 IPTG 농도를 25 uM 로 하였다. OD550 이 190 에 도달하였을 때 IPTG 농도를 50 uM 으로 상승시켰다. 시간에 따른 생물반응기 내 OD550 프로파일을 도 93 에 제시한다. 생물반응기로부터의 배출 기체 내 이소프렌 수준을 본원에 기재된 바와 같이 측정하였다. 이소프렌 적정농도는 발효 과정 동안 최종 값 3.0 g/L 로 증가되었다 (도 94). 59 시간 발효 동안 제조되는 이소프렌의 총 양은 22.8 g 이었고, 제조 시간 과정은 도 95 에 제시된다. 발효 동안 이소프렌 제조에 투입된 이용된 탄소의 몰 수율은 2.2% 였다. 글루코오스로부터의 이소프렌의 중량% 수율은 1.0% 였다.
XII. 15 L 규모의 공급-배치식 배양물에서 성장하고 메발론산 경로로부터의 유전자를 발현하는 E. 콜라이로부터의 이소프렌 발효
메발론산 경로 폴리펩티드, 푸에라리아 로바타 (Pueraria lobata) 이소프렌 합성효소, 및 Kudzu 이소프렌 합성효소를 발현하는 E. 콜라이의 15 L 규모 발효를 공급-배치식 배양물 내 세포로부터 이소프렌을 제조하는데 사용하였다. 상기 실험은 글루코오스 제한 조건 하에서 성장하는 세포가 3.3 g/L 의 이소프렌을 제조한다는 것을 증명한다.
i) pCLPtrcUpperPathwayHGS2 의 구축
푸에라리아 로바타 (Pueraria lobata) 로부터 이소프렌 합성효소를 코딩하는 유전자를 프라이머 NsiI-RBS-HGS F (CTTGATGCATCCTGCATTCGCCCTTAGGAGG, SEQ ID NO:88) 및 pTrcR (CCAGGCAAATTCTGTTTTATCAG, SEQ ID NO:89), 및 pTrcKKDyIkIS 를 주형으로서 사용하여 PCR 증폭시켰다. 그렇게 수득된 PCR 생성물을 NsiI 및 PstI 로 제한 소화시키고, 젤 정제하였다. 플라스미드 pCL PtrcUpperPathway 를 PstI 로 제한 소화시키고, 제조자의 지침에 따라 rAPid 알칼리 포스파타아제 (Roche) 를 사용하여 탈인산화시켰다.
상기 DNA 분절을 함께 라이게이션하고, 라이게이션 반응물을 E. 콜라이 Top 10 화학적으로 수용능이 된 세포 (Invitrogen) 내로 형질전환시키고, 스펙티노마이신 (50 ug/ml) 을 함유하는 L 아가 상에 플레이팅하고, 37℃ 에서 밤새 인큐베이션하였다. 플라스미드 DNA 를 Qiaquick Spin Mini-prep 키트를 사용하여 6 개의 클론으로부터 제조하였다. 플라스미드 DNA 를 제한 효소 EcoRV 및 MluI 으로 소화시켜 삽입물이 오른쪽 방향을 갖는 클론을 확인하였다 (즉, pTrc 프로모터와 동일한 방향의 유전자).
수득된 올바른 플라스미드를 pCLPtrcUpperPathwayHGS2 로 지정하였다. 상기 플라스미드를 본원에 기재된 상부공간 어세이를 사용하여 어세이하고, E. 콜라이 Top 10 내 이소프렌을 제조하였음을 발견하여, 유전자의 기능성을 입증하였다. 플라스미드를 pTrcKKDyIkIS 를 함유하는 BL21(LDE3) 내로 형질전환시켜, 균주 BL21/pCLPtrcUpperPathwayHGS2-pTrcKKDyIkIS 를 산출하였다. 상기 균주는 BL21/pCL PtrcUpperMVA 및 pTrc KKDyIkIS 균주와 비교하여 이소프렌 합성효소의 추가 카피를 갖는다 (실시예 8, 파트 XI). 상기 균주는 또한 실시예 8, 파트 XI 에서 사용된 BL21/pCL PtrcUpperMVA 및 pTrc KKDyIkIS 균주와 비교해 HMGS 의 발현 및 활성이 증가하였다.
ii) 15 L 규모의 공급-배치식 배양물에서 성장하고 pCLPtrcUpperPathwayHGS2-pTrcKKDyIkIS 를 발현하는 E. 콜라이로부터의 이소프렌 발효
배지 구성 (발효 배지 1 리터 당):
발효 배지 1 리터 당 하기 성분을 사용하여 배지를 제조하였다: K2HPO4 7.5 g, MgSO4 * 7H2O 2 g, 구연산 1 수화물 2 g, 철 암모늄 시트레이트 0.3 g, 효모 추출물 0.5 g, 및 1000× 개질 미량 금속 용액 (Modified Trace Metal Solution) 1 ml. 모든 성분을 함께 첨가하고, diH2O 에 용해하였다. 상기 용액을 오토클레이브하였다. 수산화암모늄 (30%) 으로 pH 를 7.0 로 조정하고, 부피를 충분량으로 하였다. 멸균 및 pH 조정 후에 글루코오스 10 g, 티아민 * HCl 0.1 g, 및 항생제를 첨가하였다.
1000× 개질 미량 금속 용액 (Modified Trace Metal Solution):
1000× 개질 미량 금속 용액을 하기 성분을 사용하여 제조하였다: 구연산 * H2O 40 g, MnSO4 * H2O 30 g, NaCl 10 g, FeSO4 * 7H2O 1 g, CoCl2 * 6H2O 1 g, ZnSO * 7H2O 1 g, CuSO4 * 5H2O 100 mg, H3BO3 100 mg, 및 NaMoO4 * 2H2O 100 mg. 각 성분을 diH2O 에 한번에 용해하고, HCl/NaOH 로 pH 를 3.0 으로 조정한 다음, 부피를 충분히 하고, 0.22 μ 필터로 필터 멸균하였다.
pCLPtrcUpperPathwayHGS2 및 pTrc KKDyIkIS 플라스미드를 함유하는 BL21 (DE3) E. 콜라이 세포로 15 L 생물반응기에서 발효를 수행하였다. 상기 실험을 바람직한 발효 pH 7.0 및 온도 30℃ 에서 글루코오스로부터 이소프렌 형성을 모니터링 하기 위해 실시하였다. 동결 바이알로부터 채취한 E. 콜라이 균주의 접종물을 LB 브로쓰 아가 플레이트 (항생제 있음) 상에 스트리킹하고 37℃ 에서 인큐베이션하였다. 단일 콜로니를 트립톤-효모 추출물 배지 내로 접종하였다. 550 nm 에서 측정하였을 때 접종물이 OD 1.0 까지 성장한 후, 500 mL 을 5 L 생물반응기에 접종하는데 사용하였다.
세포가 정지상에 도달할 때까지 글루코오스를 기하급수적 속도로 공급하였다. 이 후 글루코오스 공급량을 감소시켜 대사 요구를 충족시켰다. 58 시간 발효 동안 생물반응기에 전달되는 글루코오스의 총 양은 2.1 kg 이었다. IPTG 를 첨가하여 유도를 달성하였다. 550 nm 에서의 광학 밀도 (OD550) 가 9 의 값에 도달하였을 때 IPTG 농도를 25 uM 로 하였다. OD550 이 170 에 도달하였을 때 IPTG 농도를 50 uM 으로 상승시켰다. 시간에 따른 생물반응기 내 OD550 프로파일을 도 104 에 제시한다. 생물반응기로부터의 배출 기체 내 이소프렌 수준을 본원에 기재된 바와 같이 측정하였다. 이소프렌 적정농도는 발효 과정 동안 최종 값 3.3 g/L 로 증가되었다 (도 105). 58 시간 발효 동안 제조되는 이소프렌의 총 양은 24.5 g 이었고, 제조 시간 과정은 도 106 에 제시된다. 발효 동안 이소프렌 제조에 투입된 이용된 탄소의 몰 수율은 2.5% 였다. 글루코오스로부터의 이소프렌의 중량% 수율은 1.2% 였다. 분석으로 이소프렌 합성효소의 활성이 CL PtrcUpperMVA 및 pTrc KKDyIkIS 플라스미드를 발현하는 BL21 (데이터는 제시되지 않음) 과 비교하여 대략 3-4 배 증가하였음을 보여주었다.
XIII. E. 콜라이 내 하위 메발로네이트 경로의 염색체 통합.
메발로네이트 키나아제, 메발로네이트 포스페이트 키나아제, 메발로네이트 피로포스페이트 데카르복실라아제, 및 IPP 이소머라아제를 함유하는 합성 오페론을 E. 콜라이의 염색체 내에 통합시켰다. 바람직한 경우, 오페론의 상이한 프로모터 5' 를 통합시켜 발현이 변경될 수 있다.
표 9 에는 본 실험에 사용된 프라이머를 나열한다.
표 9.
프라이머
i) 표적 벡터 구축
통합을 위해 attTn7 부위를 선택하였다. 상동성 상류방향 (attTn7 업) (프라이머 MCM78 및 MCM79) 및 하류방향 (attTn7 다운) (프라이머 MCM88 및 MCM89) 영역을 MG1655 세포로부터 PCR 에 의해 증폭시켰다. 1uL 10uM 프라이머, 3uL ddH2O, 45uL Invitrogen Platinum PCR Supermix High Fidelity, 및 MG1655 의 스크랩한 콜로니를 함유하는 50 uL 반응물을 94℃ 에서 2:00 동안 변성시키고, 25 회 (94℃ 에서 2:00, 50℃ 에서 0:30, 및 68℃ 에서 1:00) 사이클에 적용하고, 72℃ 에서 7:00 동안 확장시키고, 4℃ 로 냉각시켰다. 제조자의 지침에 따라 상기 수득된 DNA 를 pCR2.1 (Invitrogen) 내로 클로닝하여, 플라스미드 MCM278 (attTn7 업) 및 MCM252 (attTn7 다운) 를 산출하였다. MCM252 로부터 소화되고 젤 정제된 832bp ApaI-PvuI 분절을 ApaI-PvuI 소화되고 젤 정제된 플라스미드 pR6K 내로 클로닝하여, 플라스미드 MCM276 을 제작하였다. MCM278 로부터 소화되고 젤 정제된 825bp PstI-NotI 분절을 PstI-NotI 소화되고 젤 정제된 MCM276 내로 클로닝하여, 플라스미드 MCM281 을 제작하였다.
ii) 하위 경로 및 프로모터의 클로닝
제조자의 지침에 따라 Roche Expand Long PCR System 을 사용하여 프라이머 MCM104 및 MCM105 로 pTrcKKDyIkIS 로부터 MVK-PMK-MVD-IDI 유전자를 증폭시켰다. 상기 생성물을 NotI 및 ApaI 로 소화시키고, NotI 및 ApaI 로 소화된 MCM281 내로 클로닝시키고 젤 정제하였다. 프라이머 MCM120 및 MCM127 을, Stratagene Pfu Ultra II 를 사용하여 GeneBridges FRT-gb2-Cm-FRT 주형 DNA 로부터 CMR 카세트를 증폭하기 위해 사용하였다. 4:00 동안의 95℃ 에서의 변성, 0:20 동안 95℃, 0:20 동안 55℃, 2:00 동안 72℃ 의 5 회 사이클, 0:20 동안 95℃, 0:20 동안 58℃, 2:00 동안 72℃, 10:00 동안 72℃ 의 25 회 사이클 후, 4℃ 로의 냉각의 PCR 프로그램을 1uL ~10 ng/uL 주형, 1 uL 각 프라이머, 1.25 uL 10 mM dNTPs, 5 uL 10x 완충액, 1 uL 효소, 및 39.75 uL ddH20 를 함유하는 4 개의 5O uL PCR 반응에 사용하였다. 반응물을 수집하고, Qiagen PCR 클린업 컬럼으로 정제하고, 플라스미드 MCM296 을 함유하는 물 세정된 Pirl 세포를 전기천공하기 위해 사용하였다. 2.5V 및 200 ohms 에서 2 mM 큐벳 내에서 전기천공을 수행하였다. 30℃ 에서 3 hr 동안 LB 에서 전기천공 반응을 회복시켰다. 형질전환체 MCM330 을 CMP5, Kan50 이 있는 LA 상에서 선별하였다 (도 107 및 108A-108C).
iii) E. 콜라이 염색체 내로의 통합
MCM330 으로부터 미니프렙된 DNA (Qiaquick Spin 키트) 를 SnaBI 으로 소화시키고, GeneBridges 플라스미드 pRedET Carb 을 함유하는 BL21(DE3) (Novagen) 또는 MG1655 를 전기천공하는데 사용하였다. 세포를 30℃ 에서 ~OD1 까지 성장시킨 다음, 0.4% L-아라비노오스로 37℃ 에서 1.5 시간 동안 유도하였다. 상기 세포를 4℃ ddH2O 로 3 회 세정한 후, 2 uL 의 DNA 를 전기천공시켰다. 클로르암페니콜 (5 ug/ml) 을 함유하는 L 아가 상에서 통합체를 선별하고, 이어서 L 아가 + 카나마이신 (50 ug/ml) 상에서 성장하지 않는다는 것을 확인하였다. BL21 통합체 MCM331 및 MG1655 통합체 MCM333 을 동결시켰다.
iv) Kudzu 이소프렌 합성효소를 코딩하는 pET24D-Kudzu 의 구축
kudzu 이소프렌 합성효소 유전자를 pCR2.1 벡터 (Invitrogen) 로부터의 pET24d 벡터 (Novagen) 내로 서브클로닝하였다. 특히, kudzu 이소프렌 합성효소 유전자를 프라이머 MCM50 5'- GATCATGCAT TCGCCCTTAG GAGGTAAAAA AACATGTGTG CGACCTCTTC TCAATTTACT (SEQ ID NO:99) 및 MCM53 5'-CGGTCGACGG ATCCCTGCAG TTAGACATAC ATCAGCTG (SEQ ID NO: 100) 을 사용하여 pTrcKudzu 주형 DNA 로부터 증폭시켰다. Taq DNA Polymerase (Invitrogen) 를 사용하여 PCR 반응을 수행하였고, 수득된 PCR 반응물을 pCR2.1-TOPO TA 클로닝 벡터 (Invitrogen) 내로 클로닝하고, E. 콜라이 Top 10 화학적으로 수용능이 된 세포 (Invitrogen) 내로 형질전환시켰다. 카르베니실린 (50 ㎍/ml) 을 함유하는 L 아가 상에 형질전환체를 플레이팅하고, 37℃ 에서 밤새 인큐베이션하였다. 카르베니실린 50 ㎍/ml 을 함유하는 5 ml Luria Broth 배양물을 단일 형질전환체로 접종하고, 밤새 37℃ 에서 성장시켰다. 5 개의 콜로니를 1 ml 의 액체 배양물 (Luria Broth) 로부터 단리된 플라스미드 DNA 의 서열분석에 의해 올바른 삽입물에 대해 스크리닝하고, QIAprep Spin Mini-prep Kit (Qiagen) 를 사용하여 정제하였다. MCM93 으로 지칭된 수득된 플라스미드는 pCR2.1 백본 내에 kudzu 이소프렌 합성효소 코딩 서열을 함유한다.
kudzu 코딩 서열을 PciI 및 BamH1 (Roche) 로 제한 엔도뉴클레아제 소화에 의해 제거하고, QIAquick Gel Extraction 키트 (Qiagen) 를 사용하여 젤 정제하였다. pET24d 벡터 DNA 를 NcoI 및 BamH1 (Roche) 로 소화시키고, 새우 알칼리 포스파타아제 (Roche) 로 처리하고, QIAprep Spin Mini-prep Kit (Qiagen) 를 사용하여 정제하였다. kudzu 이소프렌 합성효소 분절을 Rapid DNA Ligation Kit (Roche) 를 사용하여 NcoI/BamH1 소화된 pET24d 로 5:1 분절 대 벡터 비로 총 부피 20 ㎕ 에서 라이게이션시켰다. 라이게이션 혼합물 일부 (5 ㎕) 를 E. 콜라이 Top 10 화학적으로 수용능이 된 세포 내로 형질전환시키고, 카나마이신 (50 ㎍/ml) 을 함유하는 L 아가 상에 플레이팅시켰다. 올바른 형질전환체를 서열분석에 의해 확인하고, 화학적으로 수용능이 된 BL21(λDE3)pLysS 세포 (Novagen) 내로 형질전환시켰다. 카나마이신 (50 ㎍/ml) 을 함유하는 L 아가 상에 37℃ 에서 밤새 성장시킨 후 단일 콜로니를 선별하였다. pET24D-Kudzu 로서 지정된 수득된 플라스미드의 맵을 도 109 에 제시한다. pET24D-Kudzu 의 서열 (SEQ ID NO: 101) 을 도 110A 및 110B 에 제시한다. 이소프렌 합성효소 활성을 상부공간 어세이를 사용하여 확인하였다.
v) 제조 균주
균주 MCM331 및 MCM333 을 플라스미드 pCLPtrcupperpathway 및 pTrcKudzu 또는 pETKudzu 으로 공동형질전환시켜, 표 10 에 제시된 균주를 산출하였다.
표 10. 제조 균주
vi) 15 L 규모의 공급-배치식 배양물에서 성장하고 메발론산 경로로부터의 유전자를 발현하는 E. 콜라이로부터의 이소프렌 발효
배지 구성 (발효 배지 1 리터 당):
발효 배지 1 리터 당 하기 성분을 사용하여 배지를 제조하였다: K2HPO4 7.5 g, MgSO4 * 7H2O 2 g, 구연산 1 수화물 2 g, 철 암모늄 시트레이트 0.3 g, 효모 추출물 0.5 g, 및 1000× 개질 미량 금속 용액 (Modified Trace Metal Solution) 1 ml. 모든 성분을 함께 첨가하고, diH2O 에 용해하였다. 상기 용액을 오토클레이브하였다. 수산화암모늄 (30%) 으로 pH 를 7.0 로 조정하고, 부피를 충분량으로 하였다. 멸균 및 pH 조정 후에 글루코오스 10 g, 티아민 * HCl 0.1 g, 및 항생제를 첨가하였다.
1000× 개질 미량 금속 용액 (Modified Trace Metal Solution):
1000× 개질 미량 금속 용액을 하기 성분을 사용하여 제조하였다: 구연산 * H2O 40 g, MnSO4 * H2O 30 g, NaCl 10 g, FeSO4 * 7H2O 1 g, CoCl2 * 6H2O 1 g, ZnSO * 7H2O 1 g, CuSO4 * 5H2O 100 mg, H3BO3 100 mg, 및 NaMoO4 * 2H2O 100 mg. 각 성분을 diH2O 에 한번에 용해하고, HCl/NaOH 로 pH 를 3.0 으로 조정한 다음, 부피를 충분히 하고, 0.22 μ 필터로 필터 멸균하였다.
pCL PtrcUpperMVA 및 pTrcKudzu 플라스미드 및 상기 기재된 gil.2 통합된 하위 MVA 경로를 함유하는 BL21 (DE3) E. 콜라이 세포로 15 L 생물반응기에서 발효를 수행하였다. 상기 실험을 바람직한 발효 pH 7.0 및 온도 30℃ 에서 글루코오스로부터 이소프렌 형성을 모니터링 하기 위해 실시하였다. 동결 바이알로부터 채취한 E. 콜라이 균주의 접종물을 LB 브로쓰 아가 플레이트 (항생제 있음) 상에 스트리킹하고 37℃ 에서 인큐베이션하였다. 단일 콜로니를 트립톤-효모 추출물 배지 내로 접종하였다. 550 nm 에서 측정하였을 때 접종물이 OD 1.0 까지 성장한 후, 500 mL 을 5 L 생물반응기에 접종하는데 사용하였다.
세포가 정지상에 도달할 때까지 글루코오스를 기하급수적 속도로 공급하였다. 이 후 글루코오스 공급량을 감소시켜 대사 요구를 충족시켰다. 57 시간 발효 동안 생물반응기에 전달되는 글루코오스의 총 양은 3.9 kg 이었다. IPTG 를 첨가하여 유도를 달성하였다. 이산화탄소 증발 속도가 100 mmol/L/hr 에 도달하였을 때 IPTG 농도를 100 uM 로 하였다. 시간에 따른 생물반응기 내 OD550 프로파일을 도 111A 에 제시한다. 생물반응기로부터의 배출 기체 내 이소프렌 수준을 본원에 기재된 바와 같이 측정하였다.
이소프렌 적정농도는 발효 과정 동안 최종 값 1.6 g/L 로 증가되었다 (도 111B). 발효 과정 동안 이소프렌의 특이적 생산성은 도 111C 에 제시되고, 1.2 mg/OD/hr 에서 피크를 이루었다. 57 시간 발효 동안 제조되는 이소프렌의 총 양은 16.2 g 이었다. 발효 동안 이소프렌 제조에 투입된 이용된 탄소의 몰 수율은 0.9% 였다. 글루코오스로부터의 이소프렌의 중량% 수율은 0.4% 였다.
XIV. 탄소원으로서 글리세롤을 사용하는 kudzu 이소프렌 합성효소를 함유하는 E. 콜라이 BL21 로부터의 이소프렌의 제조
Kudzu 이소프렌 합성효소를 발현하는 E. 콜라이의 15 L 규모 발효를 공급-배치식 배양물 내 글리세롤 공급된 세포로부터 이소프렌을 제조하기 위해 사용하였다. 상기 실험은 글리세롤 (글루코오스 없음) 의 존재하에서 성장하는 세포가 2.2 mg/L 의 이소프렌을 제조하였음을 증명한다.
배지 구성 (발효 배지 1 리터 당):
발효 배지 1 리터 당 하기 성분을 사용하여 배지를 제조하였다: K2HPO4 7.5 g, MgSO4 * 7H2O 2 g, 구연산 1 수화물 2 g, 철 암모늄 시트레이트 0.3 g, 및 1000× 개질 미량 금속 용액 (Modified Trace Metal Solution) 1 ml. 모든 성분을 함께 첨가하고, diH2O 에 용해하였다. 상기 용액을 오토클레이브하였다. 수산화암모늄 (30%) 으로 pH 를 7.0 로 조정하고, 부피를 충분량으로 하였다. 멸균 및 pH 조정 후에 글리세롤 5.1 g, 티아민 * HCl 0.1 g, 및 항생제를 첨가하였다.
1000× 개질 미량 금속 용액 (Modified Trace Metal Solution):
발효 배지 1 리터 당 하기 성분을 사용하여 배지를 제조하였다: 구연산 * H2O 40 g, MnSO4 * H2O 30 g, NaCl 10 g, FeSO4 * 7H2O 1 g, CoCl2 * 6H2O 1 g, ZnSO * 7H2O 1 g, CuSO4 * 5H2O 100 mg, H3BO3 100 mg, 및 NaMoO4 * 2H2O 100 mg. 각 성분을 diH2O 에 한번에 용해하고, HCl/NaOH 로 pH 를 3.0 으로 조정한 다음, 부피를 충분히 하고, 0.22 μ 필터로 필터 멸균하였다.
pTrcKudzu 플라스미드를 함유하는 BL21 (DE3) E. 콜라이 세포로 15 L 생물반응기에서 발효를 수행하였다. 상기 실험을 바람직한 발효 pH 7.0 및 온도 35℃ 에서 글리세롤로부터 이소프렌 형성을 모니터링 하기 위해 실시하였다. 동결 바이알로부터 채취한 E. 콜라이 균주의 접종물을 LB 브로쓰 아가 플레이트 (항생제 있음) 상에 스트리킹하고 37℃ 에서 인큐베이션하였다. 단일 콜로니를 소이톤-효모 추출물-글루코오스 배지 내로 접종하고, 35℃ 에서 성장시켰다. 550 nm 에서 측정하였을 때 접종물이 OD 1.0 까지 성장한 후, 600 mL 을 7.5 L 생물반응기에 접종하는데 사용하였다.
세포가 550 nm 에서의 광학 밀도 (OD550) 가 153 에 도달할 때까지 글리세롤을 기하급수적 속도로 공급하였다. 36 시간 발효 동안 생물반응기에 전달되는 글리세롤의 총 양은 1.7 kg 이었다. 접종 물 내의 글루코오스 외에는, 생물반응기에 글루코오스를 추가하지 않았다. IPTG 를 첨가하여 유도를 달성하였다. OD550 이 50 의 값에 도달하였을 때 IPTG 농도를 20 uM 로 하였다. 시간에 따른 생물반응기 내 OD550 프로파일을 도 57 에 제시한다. 생물반응기로부터의 배출 기체 내 이소프렌 수준을 본원에 기재된 바와 같이 측정하였다. 이소프렌 적정농도는 발효 과정 동안 최종 값 2.2 g/L 로 증가되었다 (도 58). 54 시간 발효 동안 제조되는 이소프렌의 총 양은 20.9 mg 이었고, 제조 시간 과정은 도 59 에 제시된다.
XV. 탄소원으로서 전화당을 사용하는 15 L 규모에서의 공급-배치식 배양물 내에서 성장하고, 메발론산 경로로부터의 유전자를 발현하는 E. 콜라이로부터의 이소프렌 발효
메발론산 경로 폴리펩티드 및 Kudzu 이소프렌 합성효소를 발현하는 E. 콜라이의 15 L 규모 발효를 공급-배치식 배양물 내 전화당 공급된 세포로부터 이소프렌을 제조하기 위해 사용하였다. 상기 실험은 전화당의 존재하에서 성장하는 세포가 2.4 g/L 의 이소프렌을 제조하였음을 증명한다.
배지 구성 (발효 배지 1 리터 당):
발효 배지 1 리터 당 하기 성분을 사용하여 배지를 제조하였다: K2HPO4 7.5 g, MgSO4 * 7H2O 2 g, 구연산 1 수화물 2 g, 철 암모늄 시트레이트 0.3 g, 효모 추출물 0.5 g, 및 1000× 개질 미량 금속 용액 (Modified Trace Metal Solution) 1 ml. 모든 성분을 함께 첨가하고, diH2O 에 용해하였다. 상기 용액을 오토클레이브하였다. 수산화암모늄 (30%) 으로 pH 를 7.0 로 조정하고, 부피를 충분량으로 하였다. 멸균 및 pH 조정 후에 전화당 10 g, 티아민 * HCl 0.1 g, 및 항생제를 첨가하였다.
1000× 개질 미량 금속 용액 (Modified Trace Metal Solution):
1000× 개질 미량 금속 용액을 하기 성분을 사용하여 제조하였다: 구연산 * H2O 40 g, MnSO4 * H2O 30 g, NaCl 10 g, FeSO4 * 7H2O 1 g, CoCl2 * 6H2O 1 g, ZnSO * 7H2O 1 g, CuSO4 * 5H2O 100 mg, H3BO3 100 mg, 및 NaMoO4 * 2H2O 100 mg. 각 성분을 diH2O 에 한번에 용해하고, HCl/NaOH 로 pH 를 3.0 으로 조정한 다음, 부피를 충분히 하고, 0.22 μ 필터로 필터 멸균하였다.
pCL PtrcUpperMVA 및 pTrc KKDyIkIS 플라스미드를 함유하는 BL21 (DE3) E. 콜라이 세포로 15 L 생물반응기에서 발효를 수행하였다. 상기 실험을 바람직한 발효 pH 7.0 및 온도 30℃ 에서 전화당으로부터 이소프렌 형성을 모니터링 하기 위해 실시하였다. 동결 바이알로부터 채취한 E. 콜라이 균주의 접종물을 LB 브로쓰 아가 플레이트 (항생제 있음) 상에 스트리킹하고 37℃ 에서 인큐베이션하였다. 단일 콜로니를 트립톤-효모 추출물 배지 내로 접종하였다. 550 nm 에서 측정하였을 때 접종물이 OD 1.0 까지 성장한 후, 500 mL 을 5 L 생물반응기에 접종하는데 사용하였다.
세포가 정지상에 도달할 때까지 전화당을 기하급수적 속도로 공급하였다. 이 후 전화당 공급량을 감소시켜 대사 요구를 충족시켰다. 44 시간 발효 동안 생물반응기에 전달되는 전화당의 총 양은 2.4 kg 이었다. IPTG 를 첨가하여 유도를 달성하였다. 550 nm 에서의 광학 밀도 (OD550) 가 9 의 값에 도달하였을 때 IPTG 농도를 25 uM 로 하였다. OD550 이 200 에 도달하였을 때 IPTG 농도를 50 uM 로 증가시켰다. 시간에 따른 생물반응기 내 OD550 프로파일을 도 96 에 제시한다. 생물반응기로부터의 배출 기체 내 이소프렌 수준을 본원에 기재된 바와 같이 측정하였다. 이소프렌 적정농도는 발효 과정 동안 최종 값 2.4 g/L 로 증가되었다 (도 97). 44 시간 발효 동안 제조되는 이소프렌의 총 양은 18.4 g 이었고, 제조 시간 과정은 도 98 에 제시된다. 발효 동안 이소프렌 제조에 투입된 이용된 탄소의 몰 수율은 1.7% 였다. 글루코오스로부터의 이소프렌의 중량% 수율은 0.8% 였다.
실시예
9.
바실러스
서브틸리스
내로의 통합을 위한 상위 및 하위
MVA
경로의 구축
I. 바실러스 서브틸리스 내 상위 MVA 경로의 구축
엔테로코쿠스 파에칼리스 (Enterococcus faecalis) 로부터의 상위 경로를 aprE 프로모터의 통제 하에서 B. 서브틸리스 내로 통합한다. 상위 경로는 2 개의 유전자; AACT 및 HMGR 을 코딩하는 mvaE, 및 HMGS 를 코딩하는 mvaS 로 이루어진다. 2 개의 유전자를 mvaS 앞의 RBS 부위 사이에 정지 코돈과 함께 융합하고, aprE 프로모터의 통제 하에 두었다. 터미네이터를 mvaE 유전자 뒤에 위치시켰다. 클로르암페니콜 내성 마커를 mvaE 유전자 후에 클로닝하고, 구축물을 상동성 측면 영역을 사용하여 이중 체크에 의해 aprE 유전자좌에 통합시킨다.
4 개의 DNA 분절을 PCR 반응에 의해 서로 융합되도록 하게 할 돌출부를 함유하도록 PCR 에 의해 증폭시킨다. PCR 증폭을 제조자의 지침에 따라 헤르큘라아제 폴리머라아제를 사용하여 실시한다.
1. PaprE
CF 07-134 (+) aprE 프로모터 PstI 의 출발
5'- GACATCTGCAGCTCCATTTTCTTCTGC (SEQ ID NO: 82)
CF 07-94 (-) mvaE 에 PaprE 를 융합시킴
5'- CAATAATAACTACTGTTTTCACTCTTTACCCTCTCCTTTTAA (SEQ ID NO: 83)
주형: 바실러스 서브틸리스 염색체 DNA
2. mvaE
CF 07-93 (+) aprE 프로모터에 mvaE 를 융합시킴 (GTG 출발 코돈)
5'- TTAAAAGGAGAGGGTAAAGAGTGAAAACAGTAGTTATTATTG (SEQ ID NO: 84)
CF 07-62 (-) 사이에 RBS 를 두고 mvaS 에 mvaE 를 융합시킴
5'- TTTATCAATCCCAATTGTCATGTTTTTTTACCTCCTTTATTGTTTTCTTAAATC
(SEQ ID NO:35)
주형: 엔테로코쿠스 파에칼리스 염색체 DNA (ATCC 로부터)
3. mvaS
CF 07-61 (+) 사이에 RBS 를 두고 mvaS 에 mvaE 를 융합시킴
5'-GATTTAAGAAAACAATAAAGGAGGTAAAAAAACATGACAATTGGGATTGATAAA (SEQ ID NO:36)
CF 07-124 (-) 터미네이터에 mvaS 의 말단을 융합시킴
5'- CGGGGCCAAGGCCGGTTTTTTTTAGTTTCGATAAGAACGAACGGT (SEQ ID NO:85)
주형: 엔테로코쿠스 파에칼리스 염색체 DNA
4. B. 아밀리퀘파시엔스 알칼리 세린 프로테아제 터미네이터
CF 07-123 (+) 터미네이터에 mvaS 의 말단을 융합시킴
5'- ACCGTTCGTTCTTATCGAAACTAAAAAAAACCGGCCTTGGCCCCG (SEQ ID NO:86)
CF 07-46 (-) B. 아밀리퀘파시엔스 터미네이터 BamH1 의 말단
5'- GACATGACGGATCCGATTACGAATGCCGTCTC (SEQ ID NO:63)
주형: 바실러스 아밀리퀘파시엔스 염색체 DNA
PCR 융합 반응
5. mvaS 에 mvaE 를 융합시킴
CF 07-93 (+) aprE 프로모터에 mvaE 를 융합시킴 (GTG 출발 코돈)
5'- TTAAAAGGAGAGGGTAAAGAGTGAAAACAGTAGTTATTATTG (SEQ ID NO: 84)
CF 07-124 (-) 터미네이터에 mvaS 의 말단을 융합시킴
5'- CGGGGCCAAGGCCGGTTTTTTTTAGTTTCGATAAGAACGAACGGT (SEQ ID NO:85)
주형: 상기로부터의 #2 및 3
6. aprE 프로모터에 mvaE-mvaS 를 융합시킴
CF 07-134 (+) aprE 프로모터 PstI 의 출발
5'- GACATCTGCAGCTCCATTTTCTTCTGC (SEQ ID NO: 82)
CF 07-124 (-) 터미네이터에 mvaS 의 말단을 융합시킴
5'- CGGGGCCAAGGCCGGTTTTTTTTAGTTTCGATAAGAACGAACGGT (SEQ ID NO:85)
주형: 상기로부터의 #1 및 #4
7. 터미네이터에 PaprE-mvaE-mvaS 를 융합시킴
CF 07-134 (+) aprE 프로모터 PstI 의 출발
5'- GACATCTGCAGCTCCATTTTCTTCTGC (SEQ ID NO: 82)
CF 07-46 (-) B. 아밀리퀘파시엔스 터미네이터 BamH1 의 말단
5'- GACATGACGGATCCGATTACGAATGCCGTCTC (SEQ ID NO:63)
주형: #4 및 #6
생성물을 제한 엔도뉴클레아제 PstI/BamH1 로 소화시키고, PstI/BamH1 로 소화된 pJM102 에 라이게이션시켰다 (Perego, M. 1993. Integrational vectors for genetic manipulation in Bacillus subtilis, p. 615-624. In A. L. Sonenshein, J. A. Hoch, and R. Losick (ed.), Bacillus subtilis and other gram-positive bacteria: biochemistry, physiology, and molecular genetics. American Society for Microbiology, Washington,D.C.). 라이게이션을 E. 콜라이 TOP 10 화학적으로 수용능이 된 세포 내로 형질전환시키고, 형질전환체를 카르베니실린 (50 ㎍/ml) 을 함유하는 LA 상에서 선별한다. 서열분석에 의해 올바른 플라스미드를 확인하고, pJMUpperpathway2 (도 50 및 51) 로 지정한다. 정제된 플라스미드 DNA 를 바실러스 서브틸리스 aprEnprE Pxy1-comK 내로 형질전환시키고, 형질전환체를 클로르암페니콜 (5 ㎍/ml) 을 함유하는 L 아가 상에서 선별한다. 올바른 콜로니를 선별하고, 이어서 클로르암페니콜 10, 15 및 25 ㎍/ml 을 함유하는 L 아가 상에 플레이팅하여, 상위 경로를 함유하는 카세트의 카피 수를 증폭시킨다.
수득된 균주를 1% 글루코오스 및 1% 를 함유하는 LB 에서 성장시킴으로써 메발론산 제조에 대해 시험한다. 배양물을 메발론산의 제조에 대해 GC 에 의해 분석한다.
이어서 상기 균주를 하위 메발론산 경로의 통합을 위한 숙주로서 사용한다.
하기 프라이머를 상기 다양한 구축물을 서열분석하는데 사용하였다.
서열분석 프라이머:
CF 07-134 (+) aprE 프로모터 PstI 의 출발
5'- GACATCTGCAGCTCCATTTTCTTCTGC (SEQ ID NO: 82)
CF 07-58 (+) mvaE 유전자의 출발
5'- ATGAAAACAGTAGTTATTATTGATGC (SEQ ID NO:38)
CF 07-59 (-) mvaE 유전자의 말단
5'- ATGTTATTGTTTTCTTAAATCATTTAAAATAGC (SEQ ID NO:39)
CF 07-82 (+) mvaS 유전자의 출발
5'- ATGACAATTGGGATTGATAAAATTAG (SEQ ID NO:40)
CF 07-83 (-) mvaS 유전자의 말단
5'- TTAGTTTCGATAAGAACGAACGGT (SEQ ID NO:41)
CF 07-86 (+) mvaE 내 서열
5'- GAAATAGCCCCATTAGAAGTATC (SEQ ID NO:42)
CF 07-87 (+) mvaE 내 서열
5'- TTGCCAATCATATGATTGAAAATC (SEQ ID NO:43)
CF 07-88 (+) mvaE 내 서열
5'- GCTATGCTTCATTAGATCCTTATCG (SEQ ID NO:44)
CF 07-89 (+) 서열 mvaS
5'- GAAACCTACATCCAATCTTTTGCCC (SEQ ID NO:45)
형질전환체를 5 ㎍/ml 의 농도로 클로르암페니콜을 함유하는 LA 상에서 선별한다. 하나의 콜로니를 서열분석에 의해 올바른 통합을 갖는지를 확인하고, 수 일에 걸쳐 클로르암페니콜의 농도를 25 ㎍/ml 의 최종 수준으로 증가시켜 함유하는 LA 상에 플레이팅한다. 이것은 관심의 유전자를 함유하는 카세트를 증폭시킨다. 수득된 균주를 CF 455: pJMupperpathway#1 X Bacillus subtilis aprEnprE Pxyl comK 로 지정한다 (클로르암페니콜 25 ㎍/ml 을 함유하는 LA 상에서 성장시키기 위해 증폭됨).
II. 바실러스 서브틸리스 내 하위 MVA 경로의 구축
유전자 mvk1, pmk, mpd 및 idi 로 이루어진 하위 MVA 경로를 B. 서브틸리스 염색체 (통합 부위) 의 nprE 영역으로부터의 측면 DNA 영역, aprE 프로모터, 및 스펙티노마이신 내성 마커 (도 28 및 29 참조) 로 이루어진 카세트에 조합한다. 상기 카세트를 DNA2.0 에 의해 합성하고, aprE 유전자좌에 통합된 상위 MVA 경로를 함유하는 B. 서브틸리스의 염색체 내에 통합한다. kudzu 이소프렌 합성효소 유전자를 실시예 4 에 기재된 복제 플라스미드로부터 발현시키고, 통합된 상위 및 하위 경로 모두를 갖는 균주 내로 형질전환시킨다.
실시예
10: 예시적 이소프렌 조성물 및 이의 제조 방법
I. 이소프렌 함유 발효 방출-기체의 조성 분석
14 L 규모 발효를 이소프레노이드 전구체 생합성에 대한 전체 메발로네이트 경로, 효모로부터의 이소프레닐 피로포스페이트 이소머라아제, 및 Kudzu 로부터의 이소프렌 합성효소를 코딩하는 2 개의 플라스미드 (pCL upperMev; pTrcKKDyIkIS) 를 함유하는 재조합 E. 콜라이 BL21 (DE3) 균주로 수행하였다. 14 L 탱크로부터의 발효 방출-기체를 피크 이소프렌 생산성 시간 (27.9 시간 경과 발효 시간, "EFT") 근처에 20 mL 상부공간 바이알 내에 수집하고, 휘발성 성분에 대해 상부공간 GC/MS 에 의해 분석한다.
상부공간 분석을 Agilent HP-5MS GC/MS 컬럼 (30 m × 250 ㎛; 0.25 ㎛ 필름 두께) 이 장착된 Agilent 6890 GC/MS 시스템으로 수행하였다. 20 mL 상부공간 바이알로부터 500 uL 분취액을 샘플링하기 위해 combiPAL 자동주입기를 사용하였다. GC/MS 방법은 헬륨을 운반 기체로서 1 mL/분의 흐름으로 이용하였다. 주입 포트를 250℃ 에서 50:1 의 분할 비로 유지하였다. 오븐 온도를 37℃ 에서 초기 2 분 기간에서 유지한 후, 10 분의 총 방법 시간 동안 25℃/분의 속도로 237℃ 로 증가시켰다. Agilent 5793N 질량 선택 검출기는 m/z 29 에서 m/z 300 으로 스캐닝하였다. 상기 시스템의 검출 한계는 대략 0.1 ug/L기체 또는 대략 0.1 ppm 이다. 바람직한 경우, 낮은 검출 한계를 갖는 더욱 민감한 장비를 사용할 수 있다.
방출-기체는 99.925 % (v/v) 영구 기체 (N2, CO2 및 O2), 대략 0.075% 이소프렌 (2-메틸-1,3-부타디엔) (~750 ppmv, 2100 ㎍/L) 및 소량 (<50 ppmv) 의 에탄올, 아세톤, 및 2 개의 C5 프레닐 알코올로 이루어졌다. 수증기의 양은 측정하지는 않았으나, 0℃ 에서의 평형 증기압과 동일한 것으로 추정되었다. 휘발성 유기 분획의 조성을 GC/MS 크로마토그램 내 피크 하 면적의 적분 (도 86A 및 86B) 에 의해 측정하고, 표 6 에 나열한다. 에탄올 및 아세톤 표준에 대한 검정 곡선은 표준 방법을 사용하여 GC 면적의 기상 농도로의 전환 (단위 ug/L) 을 가능하게 하였다.
표 6. 발효 방출-기체 내 휘발성 유기 성분의 조성. 방출-기체를 이종 메발로네이트 경로, 효모로부터의 이소프레닐 피로포스페이트 이소머라아제, 및 Kudzu 로부터의 이소프렌 합성효소를 발현하는 E. 콜라이 BL21 (DE3) 균주를 사용하는 발효의 27.9 시간 시점에 분석하였다.
II. 재조합 E. 콜라이 균주의 발효 동안 이소프렌과 동시 제조되는 미량 휘발성 유기 화합물 (VOC) 의 측정
14 L 규모 발효를 이소프레노이드 전구체 생합성에 대한 전체 메발로네이트 경로, 효모로부터의 이소프레℃닐 피로포스페이트 이소머라아제, 및 Kudzu 로부터의 이소프렌 합성효소를 코딩하는 2 개의 플라스미드 (pCL upperMev; pTrcKKDyIkIS) 를 함유하는 재조합 E. 콜라이 BL21 (DE3) 균주로 수행하였다.
발효 방출-기체를 농축을 위해 냉각 상부공간 바이알을 통해 통과시키고, 미량의 휘발성 유기 성분을 확인하였다. 상기 발효로부터의 방출-기체를 석영솜 (2 g) 으로 패킹한 20 mL 상부공간 바이알을 통해 10 분 동안 1 L/분의 속도로 샘플링하고, 드라이 아이스로 -78℃ 로 냉각시켰다. 바이알을 새로운 비닐 캡으로 다시 캡을 씌우고, 실시예 10, 파트 I 에 기재된 조건을 사용하여 트랩된 VOC 에 대해 상부공간 GC/MS 에 의해 분석하였다. 도 87A-87D 에 관찰된 화합물의 비는 발효 방출-기체, -78℃ 에서의 상대적 증기압, 및 질량분석기의 검출기 반응의 전체적 수준의 조합이다. 예를 들어, 산화된 휘발물질 (예를 들어, 아세톤 및 에탄올) 에 대한 이소프렌의 낮은 수준은 -78℃ 에서 상부공간 바이알에 축적되지 않는 정도의 상기 물질의 높은 휘발성의 작용이다.
많은 상기 화합물의 존재는 생물학적 공급원으로부터 유도된 이소프렌 조성물에 독특한 것이다. 결과는 도 87A-87D 에 묘사되어 있고, 표 7A 및 7B 에 요약된다.
표 7A: -
78℃ 에서
저온-
트랩핑
후 E.
콜라이
BL21
(
DE3
) (
pCL
upperMev
; pTrcKKDyIkIS) 에 의해 제조된 방출-기체 내 존재하는 미량 휘발물질.
1GC 면적은 열거된 화합물에 상응하는 피크 하의 비-교정된 면적이다.
2면적 % 는 모든 화합물의 총 피크 면적에 상대적인 % 로서 표현되는 피크 면적이다.
3비율 % 는 2-메틸-1,3-부타디엔의 피크 면적에 상대적인 % 로서 표현되는 피크 면적이다.
표 7B. -
196℃ 에서
저온-
트랩핑
후 E.
콜라이
BL21
(
DE3
) (
pCL
upperMev
; pTrcKKDyIkIS) 에 의해 제조된 방출-기체 내 존재하는 미량 휘발물질.
1GC 면적은 열거된 화합물에 상응하는 피크 하의 비-교정된 면적이다.
2면적 % 는 모든 화합물의 총 피크 면적에 상대적인 % 로서 표현되는 피크 면적이다.
3비율 % 는 2-메틸-1,3-부타디엔의 피크 면적에 상대적인 % 로서 표현되는 피크 면적이다.
III. 발효로부터 유도된 이소프렌 내 C5 탄화수소 이성질체의 부재.
발효 방출-기체에 존재하는 이소프렌의 저온-트랩핑을 액체 질소에 냉각된 2 mL 상부공간 바이알을 사용하여 수행하였다. 방출-기체 (1 L/분) 를 먼저, 2 mL 바이알 (-196℃) 내 얼음 및 고체 CO2 의 축적을 최소화하기 위해 수산화나트륨 펠렛을 함유하는 20 mL 바이알을 통해 통과시켰다. 대략 10 L 의 방출-기체를 바이알을 통해 통과시키고, 그 후 이것을 배출로 -78℃ 로 가온시킨 후, 새로운 바이알 캡으로 다시 밀폐하고 GC/MS 에 의해 분석하였다.
GC/MS 상부공간 분석을 상부공간 방식으로 100 uL 기체 타이트 주사기를 사용하는 Agilent 6890 GC/MS 시스템으로 수행하였다. Zebron ZB-624 GC/MS 컬럼 (30 m × 250 ㎛; 1.40 ㎛ 필름 두께) 을 분석물 분리를 위해 사용하였다. GC 자동주입기에 기체-타이트 100 uL 주사기를 장착시키고, 바늘 높이를 조절하여 2 mL GC 바이알로부터 50 uL 상부공간 샘플을 주사하였다. GC/MS 방법은 헬륨을 운반 기체로서 1 mL/분의 흐름으로 이용하였다. 주입 포트를 200℃ 에서 20:1 의 분할 비로 유지하였다. 오븐 온도를 37℃ 에서 5 분 분석 기간 동안 유지하였다. Agilent 5793N 질량 선택 검출기는 m/z 55, 66, 67 및 70 에서 단일 이온 모니터링 (SIM) 방식으로 실행하였다. 상기 조건 하에서, 이소프렌은 2.966 분에 용리되는 것으로 관찰되었다 (도 88B). 석유 유도 이소프렌의 표준 (Sigma-Aldrich) 을 또한 상기 방법을 사용하여 분석하였고, 주 피크 바로 전 또는 후에 용리되고 교정된 GC 면적에 근거하여 정량화된 부가적인 C5 탄화수소 이성질체를 함유하는 것으로 발견되었다 (도 88A).
표 8A: 석유-유도 이소프렌의
GC
/
MS
분석
표 8B: 발효-유도 이소프렌 (% 총
C5
탄화수소) 의
GC
/
MS
분석
별도의 실험에서, 검출기 반응이 각 화합물에 대해 동일하였는지를 측정하기 위해 C5 탄화수소의 표준 혼합물을 분석하였다. 화합물은 2-메틸-1-부텐, 2-메틸- 1,3-부타디엔, (E)-2-펜텐, (Z)-2-펜텐 및 (E)-1,3-펜타디엔이었다. 이 경우, 분석을 50℃ 에서 15 분 동안 유지된 Agilent DB-Petro 컬럼 (100 m × 0.25 mm, 0.50 um 필름 두께) 상에서 수행하였다. GC/MS 방법은 헬륨을 운반 기체로서 1 mL/분의 흐름으로 이용하였다. 주입 포트를 200℃ 에서 50:1 의 분할 비로 유지하였다. Agilent 5793N 질량 선택 검출기는 m/z 19 에서 m/z 250 까지의 전체 스캔 방식으로 실행하였다. 상기 조건하에서, 각각의 표준의 100 ug/L 농도는 실험 오차 내에서 동일한 검출기 반응을 산출하였다.
IV. 고상에 흡착된 이소프렌을 포함하는 조성물.
생물학적으로 제조된 이소프렌을 활성탄에 흡착시켜 50 내지 99.9% 탄소, 0.1% 내지 50% 이소프렌, 0.01% 내지 5% 물, 및 미량 (<0.1%) 의 기타 휘발성 유기 성분을 함유하는 고상을 산출하였다.
발효 방출-기체를 0℃ 로 유지된 구리 응축 코일을 통과시킨 후, 수증기를 제거하기 위해 과립화된 실리카 건조제 필터에 적용하였다. 탈습된 방출-기체를 이소프렌의 초기흡착포화선이 GC/MS 에 의해 필터 배기관에서 검출되는 지점까지 탄소 함유 필터 (Koby Jr, Koby Filters, MA) 를 통과시켰다. 카트리지에 흡착된 이소프렌의 양은 수집 기간에 걸친 방출-기체 내 농도, 전체 흐름 속도 및 % 초기흡착포화를 계산함으로써 간접적으로 측정될 수 있다. 대안적으로는 흡착된 이소프렌은 열, 진공 또는 용매-매개 탈착에 의해 필터로부터 회수할 수 있다.
V. 응축 이소프렌의 수집 및 분석.
발효 방출-기체를 탈습시키고, 적합한 흡착제 (예를 들어, 아스카라이트) 를 통해 여과에 의해 CO2 를 제거하였다. 그 다음 수득된 방출-기체 스트림을 스트림 내 VOC 를 축합시키기 위해 액체 질소-냉각 콘덴서를 통과시켰다. 수집 용기는 수득된 이소프렌 축합물을 억제시키기 위해 t-부틸 카테콜을 함유한다. 표준 방법, 예컨대 본원에 기재된 방법을 사용하여 순도를 측정하기 위해 축합물을 GC/MS 및 NMR 에 의해 분석하였다.
VI. 발효에 의한 프레닐 알코올의 제조
Kudzu 이소프렌 합성효소를 발현하는 E. 콜라이 BL21 (DE3) 균주로부터의 방출-기체의 분석은 이소프렌 및 3-메틸-3-부텐-1-올 (이소프레놀) 모두의 존재하에서 밝혀졌다. 발효에 걸친 발효 방출-기체 내 2 개 화합물의 수준은 상부공간 GC/MS 에 의해 측정되는 바와 같이 도 89 에 제시된다. 획득된 이소프레놀 (3-메틸-3-부텐-1-올, 3-MBA) 의 수준은 이 실험에서 거의 10 ug/L방출기체 였다. 부가적인 실험으로 발효 방출-기체 내 대략 20 ug/L방출기체 의 수준을 제조하였다.
실시예
11: 공급-배치식 배양물에서 발효되고
메발론산
경로로부터의 유전자를 발현하는 E.
콜라이
내 이소프렌의 성장 및 제조의 분리
실시예 11 은 이소프렌 제조 및 메발론산으로부터의 세포 성장 분리를 나타낸다.
I. 발효 조건
배지 구성 (발효 배지 1 리터 당):
발효 배지 1 리터 당 하기 성분을 사용하여 배지를 제조하였다: K2HPO4 7.5 g, MgSO4 * 7H2O 2 g, 구연산 1 수화물 2 g, 철 암모늄 시트레이트 0.3 g, 효모 추출물 0.5 g, 및 1000× 개질 미량 금속 용액 (Modified Trace Metal Solution) 1 ml. 모든 성분을 함께 첨가하고, diH2O 에 용해하였다. 상기 용액을 오토클레이브하였다. 수산화암모늄 (30%) 으로 pH 를 7.0 로 조정하고, 부피를 충분량으로 하였다. 멸균 및 pH 조정 후에 글루코오스 10 g, 티아민 * HCl 0.1 g, 및 항생제를 첨가하였다.
1000× 개질 미량 금속 용액 (Modified Trace Metal Solution):
1000× 개질 미량 금속 용액을 하기 성분을 사용하여 제조하였다: 구연산 * H2O 40 g, MnSO4 * H2O 30 g, NaCl 10 g, FeSO4 * 7H2O 1 g, CoCl2 * 6H2O 1 g, ZnSO * 7H2O 1 g, CuSO4 * 5H2O 100 mg, H3BO3 100 mg, 및 NaMoO4 * 2H2O 100 mg. 각 성분을 diH2O 에 한번에 용해하고, HCl/NaOH 로 pH 를 3.0 으로 조정한 다음, 부피를 충분히 하고, 0.22 μ 필터로 필터 멸균하였다.
pTrcHis2AUpperPathway (또는 pTrcUpperMVA 로 불림, 도 91 및 92A-92C) (50 ㎍/ml 카르베니실린) 또는 pCL PtrcUpperMVA (또한 pCL PtrcUpperPathway 로 불림 (도 26)) (50 ㎍/ml 스펙티노마이신) 플라스미드를 함유하는 E. 콜라이 세포로 발효를 수행하였다. 이소프렌이 제조되는 실험을 위해, E. 콜라이 세포에는 또한 pTrc KKDyIkIS (50 ㎍/ml 카나마이신) 플라스미드가 함유된다. 상기 실험을 바람직한 발효 pH 7.0 및 온도 30℃ 에서 글루코오스로부터 메발론산 또는 이소프렌 형성을 모니터링 하기 위해 실시하였다. 동결 바이알로부터 채취한 E. 콜라이 균주의 접종물을 LB 브로쓰 아가 플레이트 (항생제 있음) 상에 스트리킹하고 37℃ 에서 인큐베이션하였다. 단일 콜로니를 트립톤-효모 추출물 배지 내로 접종하였다. 550 nm 에서 측정하였을 때 접종물이 광학 밀도 1.0 까지 성장한 후, 이것을 생물반응기에 접종하는데 사용하였다.
세포가 정지상에 도달할 때까지 글루코오스를 기하급수적 속도로 공급하였다. 이 후 글루코오스 공급량을 감소시켜 대사 요구를 충족시켰다. IPTG 를 첨가하여 유도를 달성하였다. 과염소산 (Sigma-Aldrich # 244252) 처리된 샘플 (0.3 M, 4℃ 에서 5 분 동안 인큐베이션됨) 을 유기산 HPLC 컬럼 (BioRad # 125-0140) 에 적용하여 발효 브로쓰 내 메발론산 농도를 측정하였다. 브로쓰 메발론산 피크 크기를 D,L-메발로네이트를 형성하기 위해 과염소산이 처리된 메발로놀아세톤 (Sigma-Aldrich # M4667) 으로부터 발생되는 검정 곡선과 비교하여 농도를 측정하였다. 생물반응기로부터의 방출-기체 내 이소프렌 수준을 본원에 기재된 바와 같이 측정하였다. 이소프렌 적정농도를 발효 브로쓰 1 리터 당 제조되는 이소프렌의 양으로서 정의한다.
II. 150 L 규모에서 pTrcUpperMVA 플라스미드를 발현하는 E. 콜라이 BL21 (DE3) 세포로부터의 메발론산 제조
실시예 11, 파트 I 에서 상기 설명된 바와 같이 플레이트 상에서 성장한 BL21 (DE3) 세포를 45 mL 의 트립톤-효모 추출물 배지를 함유하는 플라스크 내에 접종하고, 170 rpm 으로 진탕하면서 30℃ 에서 5 시간 동안 인큐베이션하였다. 상기 용액을 트립톤-효모 추출물 배지의 5 L 생물반응기로 옮기고, 배양물의 OD550 이 1.0 에 도달할 때까지 세포를 27.5 rpm 으로 30℃ 에서 성장시켰다. 5 L 의 접종물을 45 kg 의 배지를 함유하는 150 L 생물반응기 내에 시딩하였다. OD550 이 10 의 값에 도달하였을 때 IPTG 농도를 1.1 mM 로 하였다. 시간에 따른 생물반응기 내 OD550 프로파일을 도 60A 에 제시한다. 메발론산 적정농도를 발효 과정에 따라 최종 값 61.3 g/L (도 60B) 으로 증가시켰다. 발효 동안의 특이적 생산성 프로파일은 도 60C 에 제시되어 있고, 도 60A 와의 비교는 성장과 메발론산 제조의 분리를 증명한다. 52.5 시간 발효 동안 제조된 메발론산의 총 양은 이용된 글루코오스 14.1 kg 으로부터 4.0 kg 이었다. 발효 동안 메발론산 제조에 투입된 이용된 탄소의 몰 수율은 34.2% 였다.
III. 15 L 규모에서 pTrcUpperMVA 플라스미드를 발현하는 E. 콜라이 BL21 (DE3) 세포로부터의 메발론산 제조
실시예 11, 파트 I 에서 상기 설명된 바와 같이 플레이트 상에서 성장한 BL21 (DE3) 세포를 500 mL 의 트립톤-효모 추출물 배지를 함유하는 플라스크 내에 접종하고, 160 rpm 으로 30℃ 에서 OD550 이 1.0 이 될 때까지 성장시켰다. 상기 물질을 4.5 kg 의 배지를 함유하는 15 L 생물반응기 내에 시딩하였다. OD550 이 10 의 값에 도달하였을 때 IPTG 농도를 1.0 mM 로 하였다. 시간에 따른 생물반응기 내 OD550 프로파일을 도 61A 에 제시한다. 메발론산 적정농도를 발효 과정에 따라 최종 값 53.9 g/L (도 61B) 으로 증가시켰다. 발효 동안의 특이적 생산성 프로파일은 도 61C 에 제시되어 있고, 도 61A 와의 비교는 성장과 메발론산 제조의 분리를 증명한다. 46.6 시간 발효 동안 제조된 메발론산의 총 양은 이용된 글루코오스 2.1 kg 으로부터 491 g 이었다. 발효 동안 메발론산 제조에 투입된 이용된 탄소의 몰 수율은 28.8% 였다.
IV. 15 L 규모에서 pTrcUpperMVA 플라스미드를 발현하는 E. 콜라이 FM5 세포로부터의 메발론산 제조
실시예 11, 파트 I 에서 상기 설명된 바와 같이 플레이트 상에서 성장한 FM5 세포를 500 mL 의 트립톤-효모 추출물 배지를 함유하는 플라스크 내에 접종하고, 160 rpm 으로 30℃ 에서 OD550 이 1.0 이 될 때까지 성장시켰다. 상기 물질을 4.5 kg 의 배지를 함유하는 15 L 생물반응기 내에 시딩하였다. OD550 이 30 의 값에 도달하였을 때 IPTG 농도를 1.0 mM 로 하였다. 시간에 따른 생물반응기 내 OD550 프로파일을 도 62A 에 제시한다. 메발론산 적정농도를 발효 과정에 따라 최종 값 23.7 g/L (도 62B) 으로 증가시켰다. 발효 동안의 특이적 생산성 프로파일은 도 62C 에 제시되어 있고, 도 62A 와의 비교는 성장과 메발론산 제조의 분리를 증명한다. 51.2 시간 발효 동안 제조된 메발론산의 총 양은 이용된 글루코오스 1.1 kg 으로부터 140 g 이었다. 발효 동안 메발론산 제조에 투입된 이용된 탄소의 몰 수율은 15.2% 였다.
V. 15 L 규모에서 pCL PtrcUpperMVA 및 pTrc KKDyIkIS 플라스미드를 발현하는 E. 콜라이 BL21 (DE3) 세포로부터의 이소프렌 제조
실시예 11, 파트 I 에서 상기 설명된 바와 같이 플레이트 상에서 성장한 pCL PtrcUpperMVA 및 pTrc KKDyIkIS 플라스미드를 발현하는 BL21 (DE3) 세포를 500 mL 의 트립톤-효모 추출물 배지를 함유하는 플라스크 내에 접종하고, 160 rpm 으로 30℃ 에서 OD550 이 1.0 이 될 때까지 성장시켰다. 상기 물질을 4.5 kg 의 배지를 함유하는 15 L 생물반응기 내에 시딩하였다. OD550 이 10 의 값에 도달하였을 때 IPTG 농도를 25 μM 로 하였다. OD550 이 190 에 도달하였을 때 IPTG 농도를 50 uM 로 증가시켰다. 발효 38 시간에 IPTG 농도를 100 uM 로 상승시켰다. 시간에 따른 생물반응기 내 OD550 프로파일을 도 63A 에 제시한다. 이소프렌 적정농도를 발효 과정에 따라 최종 값 2.2 g/L 브로쓰 (도 63B) 로 증가시켰다. 발효 동안의 특이적 생산성 프로파일은 도 63C 에 제시되어 있고, 도 63A 와의 비교는 성장과 이소프렌 제조의 분리를 증명한다. 54.4 시간 발효 동안 제조된 이소프렌의 총 양은 이용된 글루코오스 2.3 kg 으로부터 15.9 g 이었다. 발효 동안 이소프렌 제조에 투입된 이용된 탄소의 몰 수율은 1.53% 였다.
VI. 15 L 규모에서 pCL PtrcUpperMVA 및 pTrc KKDyIkIS 플라스미드를 발현하는 E. 콜라이 BL21 (DE3) 튜너 세포로부터의 이소프렌 제조
실시예 11, 파트 I 에서 상기 설명된 바와 같이 플레이트 상에서 성장한 pCL PtrcUpperMVA 및 pTrc KKDyIkIS 플라스미드를 발현하는 BL21 (DE3) 튜너 세포를 500 mL 의 트립톤-효모 추출물 배지를 함유하는 플라스크 내에 접종하고, 160 rpm 으로 30℃ 에서 OD550 이 1.0 이 될 때까지 성장시켰다. 상기 물질을 4.5 kg 의 배지를 함유하는 15 L 생물반응기 내에 시딩하였다. OD550 이 10 의 값에 도달하였을 때 IPTG 농도를 26 μM 로 하였다. OD550 이 175 에 도달하였을 때 IPTG 농도를 50 uM 로 증가시켰다. 시간에 따른 생물반응기 내 OD550 프로파일을 도 64A 에 제시한다. 이소프렌 적정농도를 발효 과정에 따라 최종 값 1.3 g/L 브로쓰 (도 64B) 로 증가시켰다. 발효 동안의 특이적 생산성 프로파일은 도 64C 에 제시되어 있고, 도 64A 와의 비교는 성장과 이소프렌 제조의 분리를 증명한다. 48.6 시간 발효 동안 제조된 이소프렌의 총 양은 이용된 글루코오스 1.6 kg 으로부터 9.9 g 이었다. 발효 동안 이소프렌 제조에 투입된 이용된 탄소의 몰 수율은 1.34% 였다.
VII. 15 L 규모에서 pCL PtrcUpperMVA 및 pTrc KKDyIkIS 플라스미드를 발현하는 E. 콜라이 MG1655 세포로부터의 이소프렌 제조
실시예 11, 파트 I 에서 상기 설명된 바와 같이 플레이트 상에서 성장한 pCL PtrcUpperMVA 및 pTrc KKDyIkIS 플라스미드를 발현하는 MG1655 세포를 500 mL 의 트립톤-효모 추출물 배지를 함유하는 플라스크 내에 접종하고, 160 rpm 으로 30℃ 에서 OD550 이 1.0 이 될 때까지 성장시켰다. 상기 물질을 4.5 kg 의 배지를 함유하는 15 L 생물반응기 내에 시딩하였다. OD550 이 45 의 값에 도달하였을 때 IPTG 농도를 24 μM 로 하였다. 시간에 따른 생물반응기 내 OD550 프로파일을 도 65A 에 제시한다. 이소프렌 적정농도를 발효 과정에 따라 최종 값 393 mg/L 브로쓰로 증가시켰다 (도 65B). 발효 동안의 특이적 생산성 프로파일은 도 65C 에 제시되어 있고, 도 65A 와의 비교는 성장과 이소프렌 제조의 분리를 증명한다. 67.4 시간 발효 동안 제조된 이소프렌의 총 양은 이용된 글루코오스 520 g 으로부터 2.2 g 이었다. 발효 동안 이소프렌 제조에 투입된 이용된 탄소의 몰 수율은 0.92% 였다.
VIII. 15 L 규모에서 pCL PtrcUpperMVA 및 pTrc KKDyIkIS 플라스미드를 발현하는 E. 콜라이 MG1655ack-pta 세포로부터의 이소프렌 제조
실시예 11, 파트 I 에서 상기 설명된 바와 같이 플레이트 상에서 성장한 pCL PtrcUpperMVA 및 pTrc KKDyIkIS 플라스미드를 발현하는 MG1655ack-pta 세포를 500 mL 의 트립톤-효모 추출물 배지를 함유하는 플라스크 내에 접종하고, 160 rpm 으로 30℃ 에서 OD550 이 1.0 이 될 때까지 성장시켰다. 상기 물질을 4.5 kg 의 배지를 함유하는 15 L 생물반응기 내에 시딩하였다. OD550 이 10 의 값에 도달하였을 때 IPTG 농도를 30 μM 로 하였다. 시간에 따른 생물반응기 내 OD550 프로파일을 도 66A 에 제시한다. 이소프렌 적정농도를 발효 과정에 따라 최종 값 368 mg/L 브로쓰로 증가시켰다 (도 66B). 발효 동안의 특이적 생산성 프로파일은 도 66C 에 제시되어 있고, 도 66A 와의 비교는 성장과 이소프렌 제조의 분리를 증명한다. 56.7 시간 발효 동안 제조된 이소프렌의 총 양은 이용된 글루코오스 531 g 으로부터 1.8 g 이었다. 발효 동안 이소프렌 제조에 투입된 이용된 탄소의 몰 수율은 0.73% 였다.
IX. 15 L 규모에서 pCL PtrcUpperMVA 및 pTrc KKDyIkIS 플라스미드를 발현하는 E. 콜라이 FM5 세포로부터의 이소프렌 제조
실시예 11, 파트 I 에서 상기 설명된 바와 같이 플레이트 상에서 성장한 pCL PtrcUpperMVA 및 pTrc KKDyIkIS 플라스미드를 발현하는 FM5 세포를 500 mL 의 트립톤-효모 추출물 배지를 함유하는 플라스크 내에 접종하고, 160 rpm 으로 30℃ 에서 OD550 이 1.0 이 될 때까지 성장시켰다. 상기 물질을 4.5 kg 의 배지를 함유하는 15 L 생물반응기 내에 시딩하였다. OD550 이 15 의 값에 도달하였을 때 IPTG 농도를 27 μM 로 하였다. 시간에 따른 생물반응기 내 OD550 프로파일을 도 67A 에 제시한다. 이소프렌 적정농도를 발효 과정에 따라 최종 값 235 mg/L 브로쓰로 증가시켰다 (도 67B). 발효 동안의 특이적 생산성 프로파일은 도 67C 에 제시되어 있고, 도 67A 와의 비교는 성장과 이소프렌 제조의 분리를 증명한다. 52.3 시간 발효 동안 제조된 이소프렌의 총 양은 이용된 글루코오스 948 g 으로부터 1.4 g 이었다. 발효 동안 이소프렌 제조에 투입된 이용된 탄소의 몰 수율은 0.32% 였다.
실시예
12: 공급-배치식 배양물에서 발효되고
메발론산
경로로부터의 유전자를 발현하는 E.
콜라이의
기하급수적 성장상 동안의 이소프렌의 제조
실시예 12 는 세포의 기하급수적 성장상 동안의 이소프렌의 제조를 예증한다.
배지 구성 (발효 배지 1 리터 당):
발효 배지 1 리터 당 하기 성분을 사용하여 배지를 제조하였다: K2HPO4 7.5 g, MgSO4 * 7H2O 2 g, 구연산 1 수화물 2 g, 철 암모늄 시트레이트 0.3 g, 효모 추출물 0.5 g, 및 1000× 개질 미량 금속 용액 (Modified Trace Metal Solution) 1 ml. 모든 성분을 함께 첨가하고, diH2O 에 용해하였다. 상기 용액을 오토클레이브하였다. 수산화암모늄 (30%) 으로 pH 를 7.0 로 조정하고, 부피를 충분량으로 하였다. 멸균 및 pH 조정 후에 글루코오스 10 g, 티아민 * HCl 0.1 g, 및 항생제를 첨가하였다.
1000× 개질 미량 금속 용액 (Modified Trace Metal Solution):
1000× 개질 미량 금속 용액을 하기 성분을 사용하여 제조하였다: 구연산 * H2O 40 g, MnSO4 * H2O 30 g, NaCl 10 g, FeSO4 * 7H2O 1 g, CoCl2 * 6H2O 1 g, ZnSO * 7H2O 1 g, CuSO4 * 5H2O 100 mg, H3BO3 100 mg, 및 NaMoO4 * 2H2O 100 mg. 각 성분을 diH2O 에 한번에 용해하고, HCl/NaOH 로 pH 를 3.0 으로 조정한 다음, 부피를 충분히 하고, 0.22 μ 필터로 필터 멸균하였다.
pCL PtrcUpperMVA 및 pTrc KKDyIkIS 플라스미드를 함유하는 ATCC11303 E. 콜라이 세포로 15 L 생물반응기에서 발효를 수행하였다. 상기 실험을 바람직한 발효 pH 7.0 및 온도 30℃ 에서 글루코오스로부터 이소프렌 형성을 모니터링 하기 위해 실시하였다. 동결 바이알로부터 채취한 E. 콜라이 균주의 접종물을 LB 브로쓰 아가 플레이트 (항생제 있음) 상에 스트리킹하고 37℃ 에서 인큐베이션하였다. 단일 콜로니를 트립톤-효모 추출물 배지 내로 접종하였다. 550 nm 에서 측정하였을 때 접종물이 OD 1.0 까지 성장한 후, 500 mL 을 5 L 생물반응기에 접종하는데 사용하였다.
세포가 정지상에 도달할 때까지 글루코오스를 기하급수적 속도로 공급하였다. 이 후 글루코오스 공급량을 감소시켜 대사 요구를 충족시켰다. 50 시간 발효 동안 생물반응기에 전달되는 글루코오스의 총 양은 2.0 kg 이었다. IPTG 를 첨가하여 유도를 달성하였다. 550 nm 에서의 광학 밀도 (OD550) 가 10 의 값에 도달하였을 때 IPTG 농도를 25 uM 로 하였다. OD550 이 190 에 도달하였을 때 IPTG 농도를 50 uM 로 증가시켰다. 시간에 따른 생물반응기 내 OD550 프로파일을 도 99 에 제시한다. 생물반응기로부터의 배출 기체 내 이소프렌 수준을 본원에 기재된 바와 같이 측정하였다. 이소프렌 적정농도를 발효 과정에 따라 최종 값 1.4 g/L (도 100) 로 증가시켰다. 50 시간 발효 동안 제조된 이소프렌의 총 양은 10.0 g 이었다. 생물반응기 내에서 시간에 걸친 이소프렌 특이적 생산성의 프로파일은 도 101 에 제시된다. 발효 동안 이소프렌 제조에 투입된 이용된 탄소의 몰 수율은 1.1% 였다. 글루코오스로부터의 이소프렌의 중량% 수율은 0.5% 였다.
실시예
13: 이소프렌의 가연성
모델링
및 시험
I. 이소프렌의 가연성 모델링 및 시험 요약
가연성 모델링 및 실험을 다양한 탄화수소/산소/질소/물/이산화탄소 혼합물에 대해 수행하였다. 상기 모델링 및 시험된 실험은 고정된 압력 및 온도에서 구체적인 스팀 및 일산화탄소 농도 하에서의 이소프렌 및 산소/질소 가연성 곡선을 규정하기 위한 것이었다. 모델 조건의 매트릭스를 표 4 에 제시하고, 수행된 실험 매트릭스를 표 5 에 제시한다.
표 4.
모델링된
이소프렌 가연성의 요약
표 5. 이소프렌 가연성 시험의 요약
II. 계산된 단열 불꽃 온도 (CAFT) 모델의 설명
연소 발생에 대해 선택된 제한 불꽃 온도에 따른 계산된 단열 불꽃 온도 (CAFT) 를 이소프렌에 대한 가연성 엔벨로프를 측정하기 위해 사용하였다. 불꽃 온도를 계산하기 위해 본 연구에 사용된 컴퓨터 프로그램은 NASA Glenn Research Center CEA (Chemical Equilibrium with Applications) 소프트웨어이다.
균질 연소 메카니즘 (연소 및 산화제 모두가 기체 상태인) 에 대한 단열 불꽃 온도 모델을 사용하는 가연성 엔벨로프를 측정하는데 5 단계가 포함된다: 바람직한 반응물의 선택, 시험 조건의 선택, 제한 불꽃 온도의 선택, 반응물의 개질, 및 계산으로부터 가연성 엔벨로프의 구축.
상기 첫번째 단계인 바람직한 반응물의 선택에서는, 시스템에 존재할 반응물 종류 및 각각의 양으로서 결정해야만 한다. 많은 경우, 계산에 사용되는 컴퓨터 프로그램은 반응물 목록 및 제품 종류를 가지고 있다. 연구되는 종류에 대한 데이터 중 임의의 것이 프로그램에서 발견되지 않는 경우, 이들을 JANAF 표와 같은 다른 공급원 또는 인터넷으로부터 입수할 수 있다. 상기 현행 모델에서 물, 질소, 산소 및 이산화탄소에 대한 데이터는 프로그램 데이터베이스에 존재하였다. 프로그램 데이터베이스는 종류로서 이소프렌을 가지지 않았다; 그러므로 열역학적 특성은 수동으로 입력하였다.
다음 단계는 연소 과정이 일어나는 초기 압력 및 온도 조건을 결정하는 단계이다. 이 모델에서 압력은 1 대기압 (절대) 이었고, 온도는 이소프렌의 비등점인 40℃ 였다.
연소에 대한 제한 불꽃 온도는 이론적 원리에 근거해 선택되거나 실험적으로 측정될 수 있다. 각 방법은 스스로의 제한을 갖는다.
이전 연구에 근거해, 탄화수소의 제한 불꽃 온도는 1000 K 내지 1500 K 범위에 놓였다. 이 모델을 위해, 1500 K 의 값을 선택하였다. 이것은 일산화탄소의 이산화탄소로의 반응 (고도의 발열 반응, 및 대부분의 비율의 불꽃 에너지를 구성함) 이 자가 유지되게 되는 온도이다.
일단 제한 불꽃 온도가 결정되면, 제공된 반응 혼합물 (종류 농도) 에 대해 모델 계산을 수행하고, 단열 불꽃 온도를 결정한다. 불꽃 발생은 온도가 제한 불꽃 온도보다 높은 경우에만 발생한 것으로 간주된다. 그 다음 반응 혼합물 조성을 변경시켜 발생 및 비-발생 혼합물에 대한 데이터 세트를 작성하였다.
상기 유형의 모델은 실험적으로 측정된 연소 한계와 양호한 일치성을 보인다. 유도된 엔벨로프 외부의 영역은 불연성이고 내부 영역은 가연성이다. 엔벨로프의 형태는 코를 형성한다. 엔벨로프의 코는 기체 연료에 대한 제한 산소 농도 (LOC) 와 관련된다.
III. 계산된 단열 불꽃 온도 (CAFT) 모델로부터의 결과
도 68 내지 74 에 작성된 것은 시리즈 A 내지 G 각각에 대한 CAFT 모델 결과이다. 도면은 계산된 단열 불꽃 온도 (NASA CEA 프로그램 사용) 를 여러 산소/질소 비율 (중량) 에 대한 연료 농도 (중량) 의 함수로서 작성한다. 선택된 제한 불꽃 온도인 1500 K 초과인 곡선의 일부는, 불꽃 발생에 충분한 연료 수준을 함유한다. 결과는 도 68 내지 74 에 제시된 형태로 해석되기는 어려울 수 있다. 부가적으로는, 현행 형태는 일반적으로 부피% 로 제시된 실험 데이터와 비교하기 위해 수행되기에는 좋지 않다.
실시예로서 시리즈 A 를 사용하여 도 68 에서의 데이터를 전통적 가연성 엔벨로프의 형태로 플롯팅할 수 있다. 도 68 및 세로좌표 상의 1500 K 온도선을 가로지르는 판독을 사용하여, 교차하는 각 곡선에 대해 접선 대 가로좌표 (산소 대 질소 비) 를 떨어뜨림으로서 상기 제한 불꽃 온도에 대한 연료 농도를 측정할 수 있다. 상기 값은 제시된 중량% 의 산화제 (도 75A) 에 대한 연료의 중량% 로서 표에 나타낼 수 있다. 그 다음 연료의 조성 (100 중량% 이소프렌) 및 산화제의 조성 (물, 산소 및 질소의 상대적 함량) 을 알면 몰 량을 달성할 수 있다.
상기 몰 량으로부터 % 부피 농도를 계산할 수 있다. 그 다음 부피% 로의 농도는 가연성 엔벨로프를 작성하기 위해 플롯팅될 수 있다 (도 75B). 엔벨로프에 의해 둘러싸인 면적은 폭발성 범위이고, 배제된 면적은 비-폭발성 범위이다. 엔벨로프의 "코" 는 제한 산소 농도이다. 도 76A 및 76B 는 도 69 에 제시된 데이터로부터 발생된 시리즈 B 에 대한 가연성 엔벨로프에 대해 계산된 부피 농도가 제시되어 있다. 도 70-74 에 제시된 데이터에 대해 유사한 접근법이 사용될 수 있다.
IV. 가연성 시험 실험 장비 및 절차
가연성 시험 4 리터 고압 용기에서 수행하였다. 용기는 내부 직경 6" 및 내부 높이 8.625" 의, 실린더 형태였다. 용기의 온도 (및 내부 기체) 를 PID 통제기에 의해 통제되는 외부 가열기를 사용하여 유지하였다. 열 손실을 막기 위해, 압력 용기 주변에 세라믹 울과 반사 단열제를 둘러쌌다. 유형 K 열전대를 기체 공간의 온도 뿐 아니라 용기 자체의 온도를 측정하기 위해 사용하였다. 도 77 은 시험 용기를 나타낸다.
시험을 실시하기 전, 용기를 비우고, 질소로 퍼지하여, 이전 시험으로부터의 임의의 기체가 제거되었음을 확실히 하였다. 그 다음 용기에 진공을 적용했다. 이후 수행된 압력은 전형적으로 대략 0.06 bar(a) 였다. 질소 퍼지로 인해, 상기 초기압을 담당하는 기체가 질소인 것으로 가정하였다. 부분압을 사용하고, 물, 이소프렌, 질소, 및 산소를 적합한 양으로 첨가하여 문제의 시험 조건을 달성하였다. 용기 내의 자석으로 움직이는 혼합 팬은 기체 내용물의 혼합을 확실히 하였다. 점화 대략 1 분 전에 팬을 꺼서, 약 2 분 동안 기체가 혼합되게 하였다.
점화기는 타이머 회로 상의 1.5 ohm 니크롬 코일 및 AC 볼트 공급원으로 구성되었다. 오실로스코프를 사용하여, 34.4 VAC 가 3.2 초 동안 점화기에 전달된 것으로 측정되었다. 3.8 amps 의 최대 전류가 점화 사이클 내에서는 대략 절반으로 발생하였다. 그러므로, 최대 파워는 131 W 이었고, 점화 사이클에 걸쳐 제공된 총 에너지는 대략 210 J 이었다.
데이터 습득 시스템에 연결된 가변적 자기저항 Validyne DP215 압력 전송기를 사용하여 폭연 데이터를 습득하였다. 압력 상승이 5% 이상이었을 경우 기체 혼합물이 폭연된 것으로 간주하였다.
V. 가연성 시험 결과
첫번째 실험 시리즈 (시리즈 1) 를 스팀 없이 40℃ 및 0 psig 에서 실행하였다. 다양한 농도의 이소프렌 및 산소에서의 실험 실행으로 도 78A 에 제시된 가연성 곡선을 산출하였다. 상기 곡선에서 제시된 데이터 지점은 오직 곡선 경계에 있는 것이다. 상기 시리즈로부터 취득된 모든 데이터 지점의 상세한 목록은 도 8OA 및 80B 에 제시된다.
도 78B 는 도 78A 에서 제시된 폭발성 데이터 지점을 요약한다. 도 78C 는 CAFT 모델 예측 가연성 엔벨로프로의 실험 데이터의 비교이다. 모델은 실험 데이터에 매우 잘 들어맞는다. 불일치는 시험 챔버의 비-단열 특성 및 모델의 제한으로 인한 것일 수 있다. 모델은 산화 반응에 대한 무한한 시간 수평선을 보고, 임의의 반응 동역학 제한하는 것은 고려하지 않는다.
부가적으로는, 모델은 데이터베이스에 있는 평형 화학 종류의 수가 제한되어 있으므로, 열분해 종류를 적합하게 예측할 수 없을 것이다. 또한, 모델에 의해 개발되는 가연성 엔벨로프는 제한 불꽃 온도 (1500K) 에 대해 하나의 값을 사용한다. 제한 불꽃 온도는 반응하는 화학적 종류에 따라 1,000K 내지 1,500K 의 값의 범위일 수 있다. 화학량론적 연료/산화제 수준 초과의 연료 농도에서 형성되는 열분해 화학 종류의 착물 특성이, 이 모델이 상기 시스템에 대한 상위 가연성 제한을 정확하게 예측할 수 없는지에 대한 하나의 이유이다.
제 2 실험 시리즈 (시리즈 2) 를 4% 의 고정된 스팀 농도로 40℃ 및 0 psig 에서 실행하였다. 다양한 농도의 이소프렌 및 산소에서의 실험 실행으로 도 79A 에 제시된 가연성 곡선을 산출하였다. 상기 곡선에서 제시된 데이터 지점은 오직 곡선 경계에 있는 것이다. 상기 시리즈로부터 취득된 모든 데이터 지점의 상세한 목록은 도 81 에 제시된다.
시리즈 1 의 데이터와의 유사성으로 인해, 하위 가연성 제한, 제한 산소 농도, 및 상위 가연성 제한의 오직 핵심 지점을 시험하였다. 시험 혼합물에 대한 4% 스팀의 첨가는 가연성 엔벨로프의 핵심 제한을 유의하게 변경하지 않았다. 스팀/물 및 또는 기타 비활성물질의 더 높은 농도가 가연성 엔벨로프에 영향을 줄 수 있는 것을 유념해야만 한다.
도 79B 는 도 79A 에 제시된 폭발성 데이터 지점을 요약한다. 도 79C 는 CAFT 모델 예상된 가연성 엔벨로프와 실험 데이터의 비교이다. 모델은 실험 데이터와 매우 잘 들어맞는다. 불일치는 시리즈 1 에 기재된 동일한 인자로 인한 것일 수 있다.
V. 3 대기압에서 공기 내 이소프렌의 가연성 제한 계산
실시예 13, 파트 I 내지 IV 에 기재된 방법은 또한 3 대기압 및 40℃ 의 절대 시스템 압력에서 이소프렌의 연소 한계를 계산하기 위해 사용하였다. 상기 결과를 대기압 및 40℃ 의 절대 시스템 압력에서 실시예 13, 파트 I 내지 IV 의 것과 비교하였다. 초기 시스템 압력을 증가시켜 가연성 엔벨로프를 더 크게 확장 또는 성장시키기 때문에 더 높은 압력을 시험하였다. 연소 상한계가 가장 영향을 받았고, 그 다음 산소 조성 제한이었다. 연소 하한계는 가장 적게 영향을 받았다 (예를 들어, 특히, 연소 한계의 계산에 관해, 본원에 전체가 참조로서 인용된 문헌 "Bulletin 627 - Flammability Characteristics of Combustible Gases and Vapors" Michael G. Zabetakis 저, 이전의 US Bureau of Mines 출판 (1965) 참조).
도 82 에서, 계산된 단열 불꽃 온도는 총 연료/질소/산소의 중량% (시스템 압력은 초기에는 3 대기압이었음) 로 표현된 이소프렌 (연료) 농도의 함수로서 작성된다. 계산된 불꽃 온도는 1 대기압 시스템에서 초기에 측정된 것과 매우 유사하다 (도 83). 그 결과, 가연성 엔벨로프가 계산된 단열 가연성 데이터를 사용하여 작성되는 경우, 곡선은 매우 유사하였다 (도 84 및 85 참조). 그러므로, 상기 이론적 계산에 근거하여, 1 대기압에서 3 대기압으로의 시스템 압력 증가는 가연성 엔벨로프의 유의한 증가/확장을 낳지는 않는다. 바람직한 경우, 상기 모델 결과는 실험 시험 (예컨대, 1 대기압에서 본원에 기재된 실험 시험) 을 사용하여 입증될 수 있다.
VII. 가연성 연구 요약
계산된 단열 온도 모델을 40℃ 및 0 psig 에서 이소프렌/산소/질소/물/이산화탄소 시스템의 가연성 엔벨로프에 대해 개발하였다. 개발된 CAFT 모델은 상기 작업에서 수행된 시험에 의해 발생되는 실험 데이터와 잘 들어맞는다. 시리즈 1 및 2 로부터의 실험 결과는 시리즈 A 및 B 로부터의 모델 결과를 입증하였다.
다르게 정의하지 않는 한, 본원에서 사용된 모든 기술적 및 과학적 용어는 본 발명이 속한 당업자에 의해 통상적으로 이해되는 것들이다. 문헌 [Singleton, et al., Dictionary of Microbiology and Molecular Biology, 2nd ed., John Wiley and Sons, New York (1994), 및 Hale & Marham, The Harper Collins Dictionary of Biology, Harper Perennial, N.Y. (1991)] 은 본 발명에서 사용되는 많은 용어에 대한 일반적 정의를 제공한다.
본 발명은 기재된 특정 방법론, 프로토콜 및 시약이 변화될 수 있으므로 이에 제한되는 것이 아닌 것으로 이해된다. 당업자는 또한 본원에 기재된 것과 유사한 또는 동등한 임의의 방법 및 물질이 본 발명을 실시 또는 시험하기 위해 사용될 수 있다는 것을 인지할 것이다.
본원에 제공된 표제는 전체로서 본 명세서에 참고로 포함될 수 있는 발명의 다양한 양상 또는 구현예의 제한이 아니다. 본원에서 사용하기 위해 다르게 명확하게 표시되지 않는 한, 단수형 표현은 복수형 표현을 나타낸다.
본원의 값 또는 매개변수에 대한 표현 "약" 은 자체적 값 또는 매개변수를 지시하는 구현예를 포함 (및 설명) 한다. 예를 들어, "약 X" 를 나타내는 설명은 "X" 의 설명을 포함한다. 수치적 범위는 범위를 한정하는 수치를 포함한다.
본원에 기재된 본 발명의 양상 및 구현예에는 양상 및 구현예 "를 포함하는," "로 이루어지는," 및 "로 본질적으로 이루어지는 것이 포함되는 것으로 이해된다.
부록 1
예시적-
데옥시
-D-
자일룰로오스
-5-
포스페이트
합성효소 핵산 및 폴리펩티드
예시적 아세틸-
CoA
-
아세틸트랜스페라아제
핵산 및 폴리펩티드
예시적
HMG
-
CoA
합성효소 핵산 및 폴리펩티드
예시적
히드록시에틸글루타릴
-
CoA
리덕타아제
핵산 및 폴리펩티드
예시적
메발로네이트
키나아제
핵산 및 폴리펩티드
예시적
포스포메발로네이트
키나아제
핵산 및 폴리펩티드
예시적
디포스포메발로네이트
데카르복실라아제
핵산 및 폴리펩티드
예시적
이소펜테닐
-
디포스페이트
델타-
이소머라아제
(
IDI
) 핵산 및 폴리펩티드
예시적 이소프렌 합성효소 핵산 및 폴리펩티드
Genbank 접근 번호