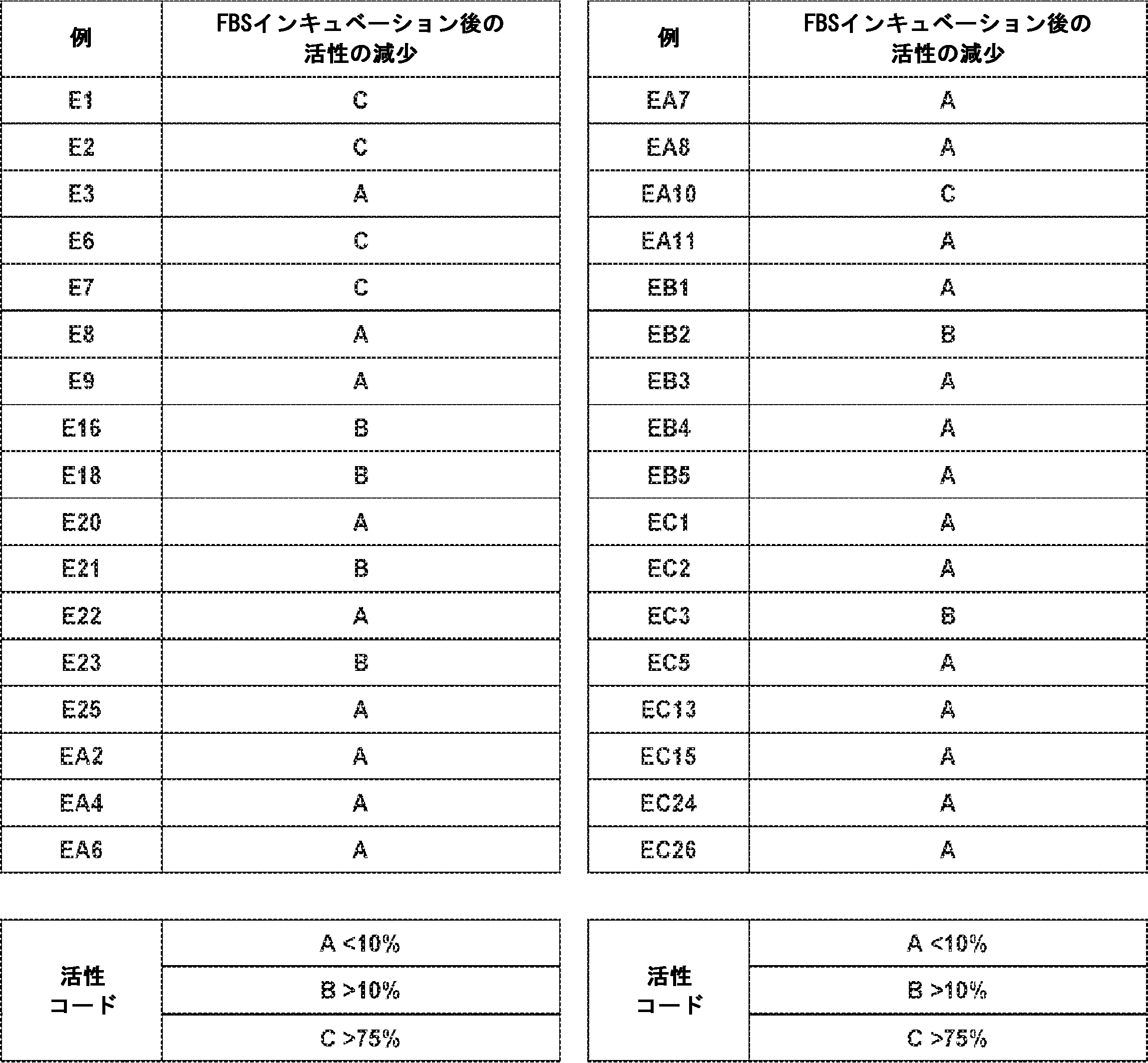
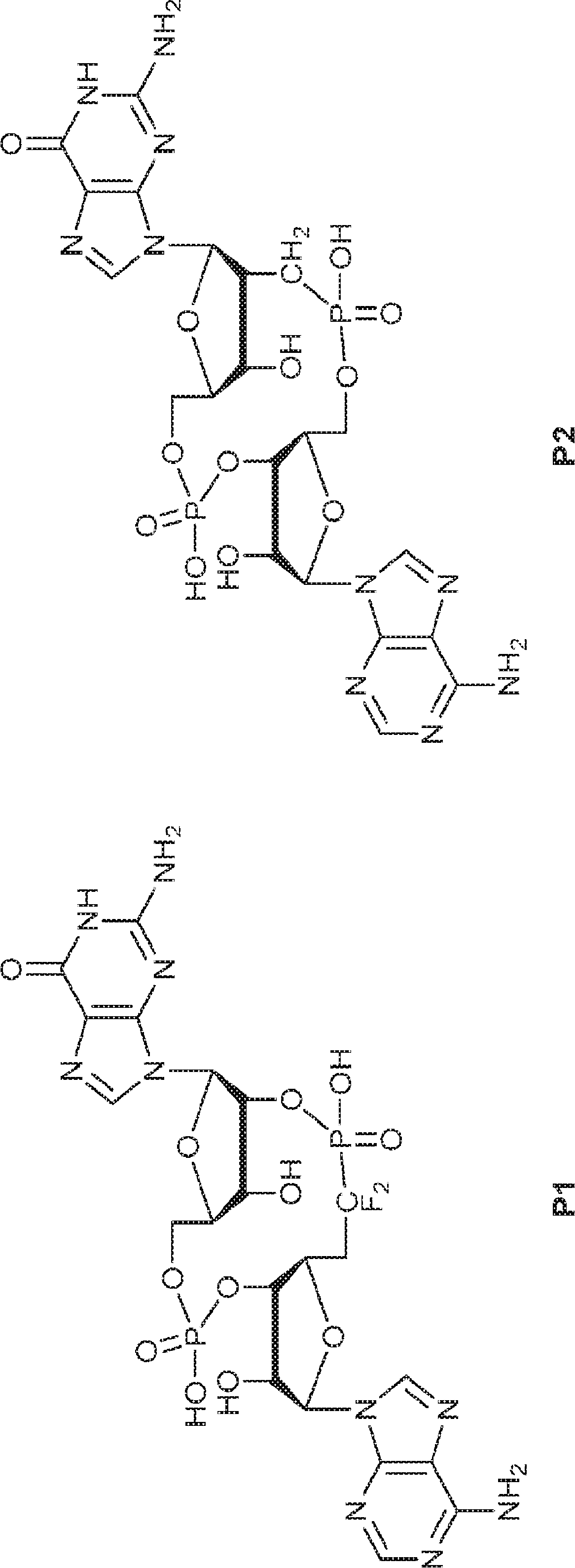
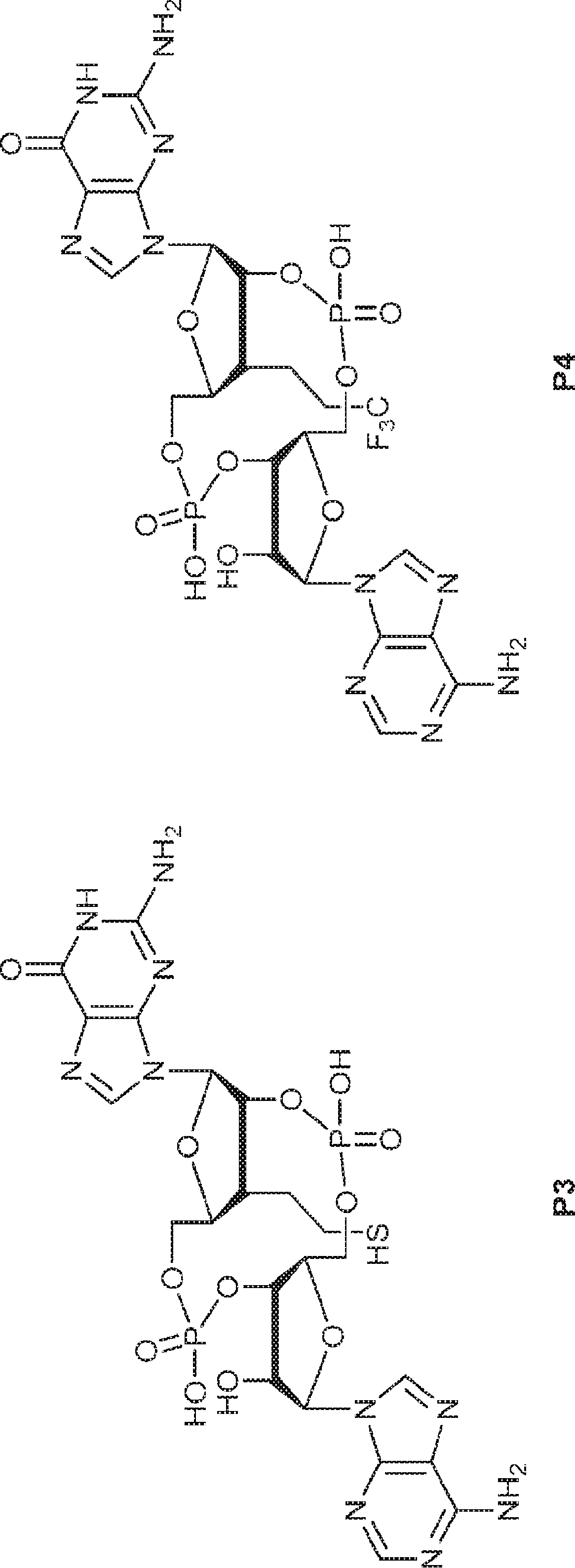
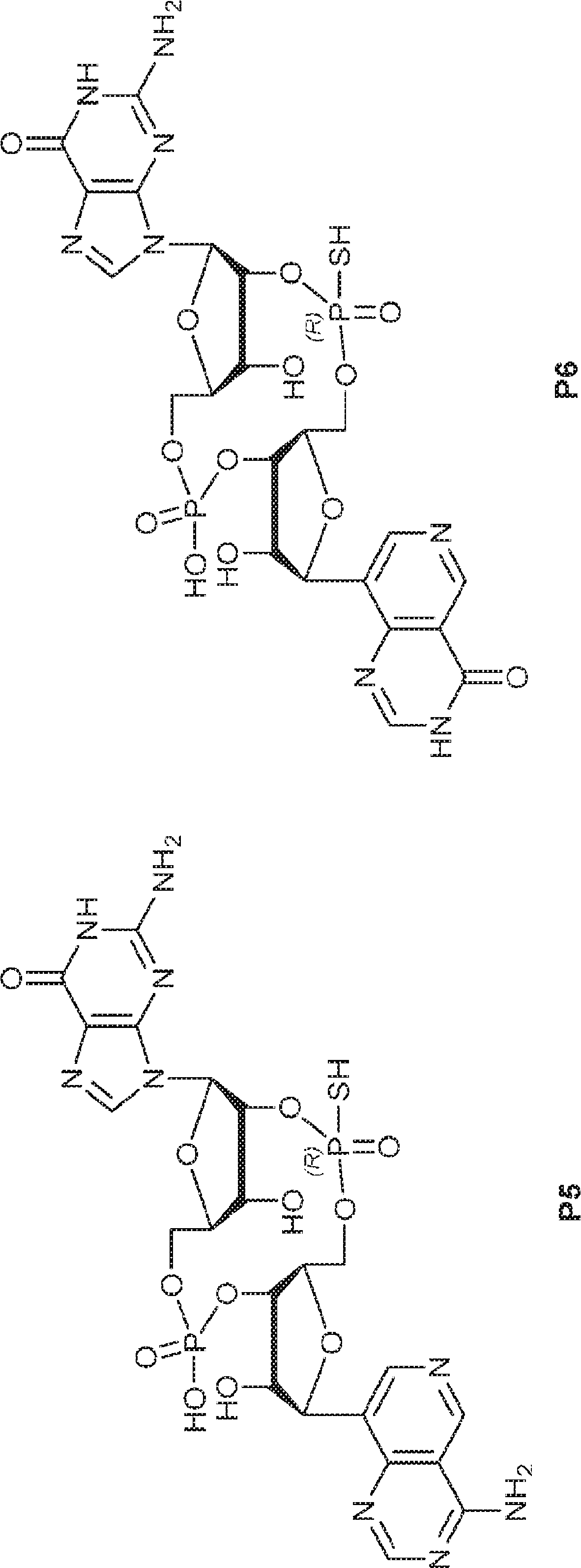
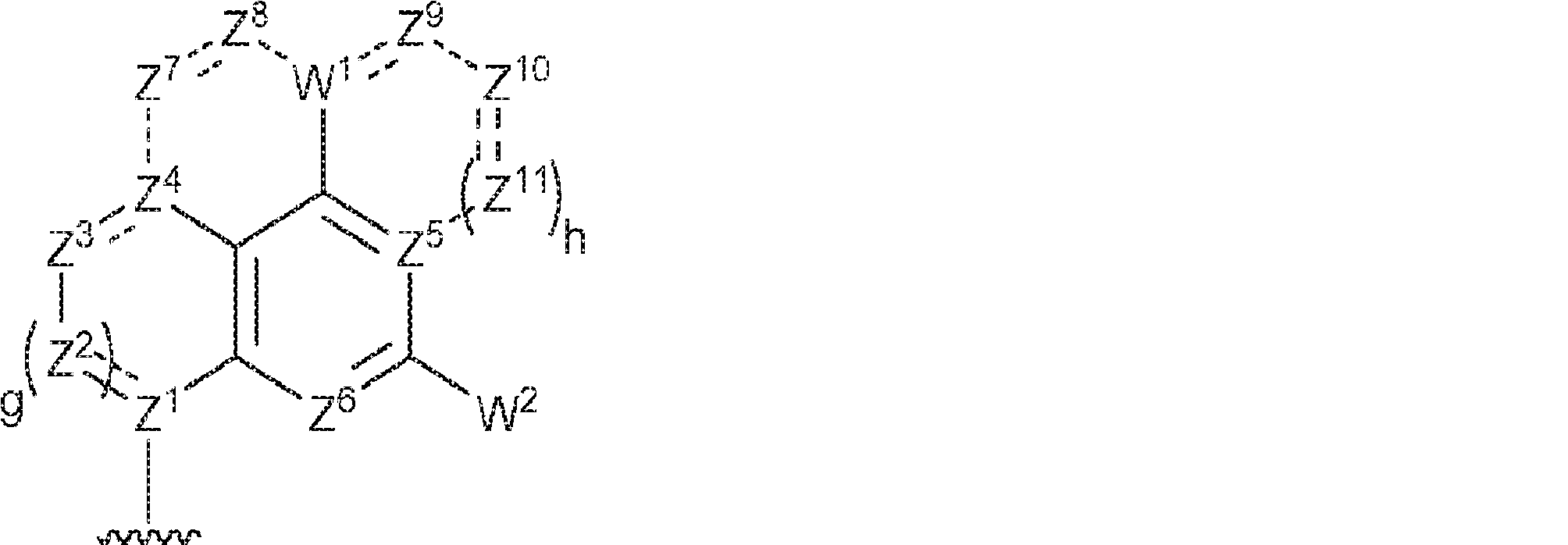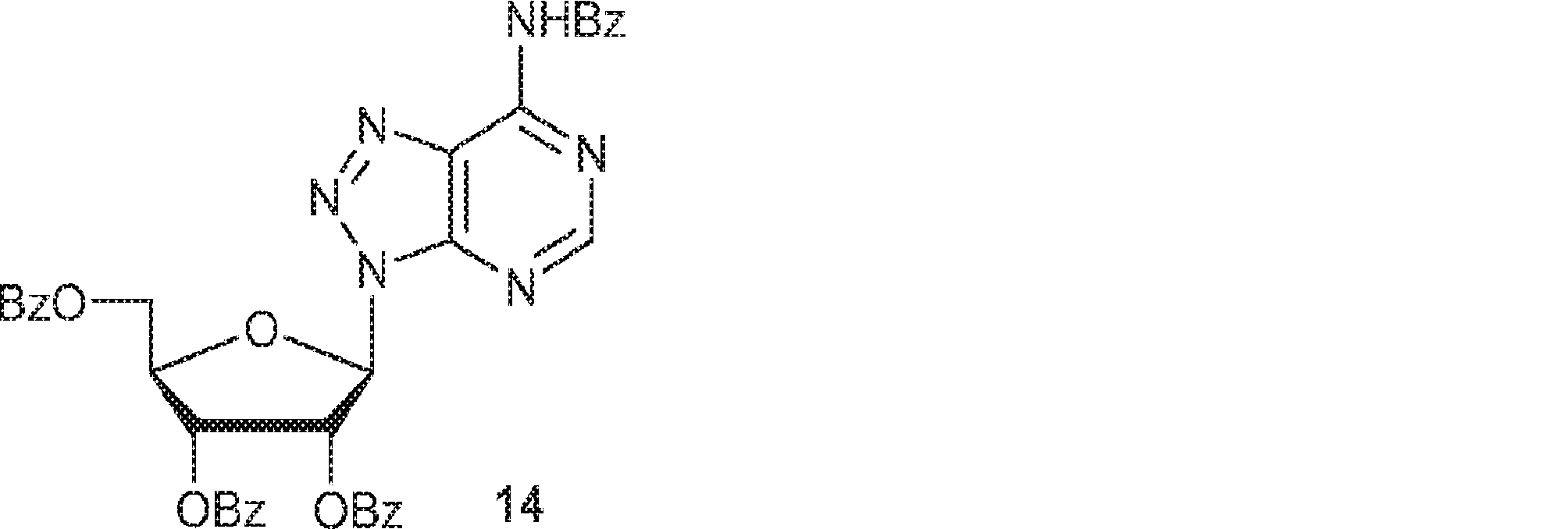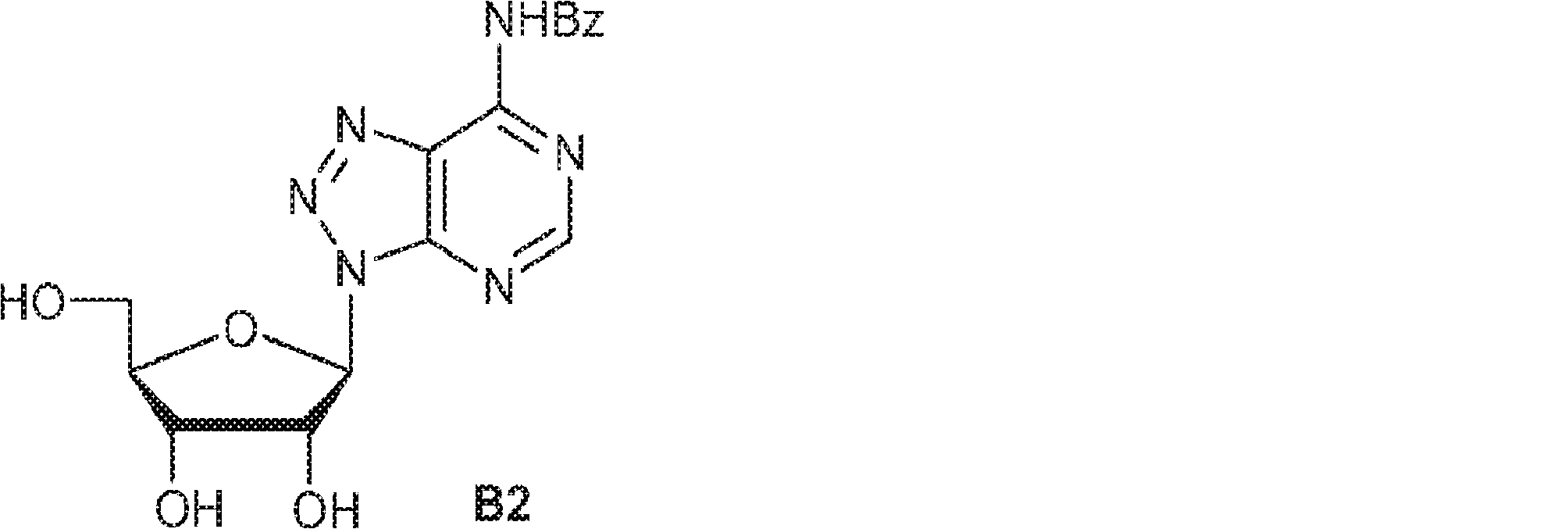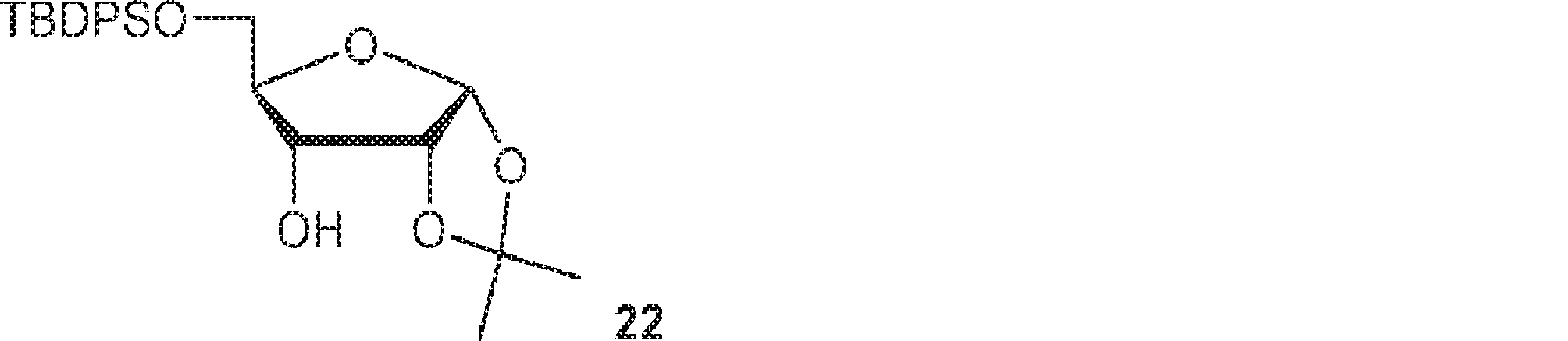JP2022017500A - 環状ジヌクレオチド化合物および使用方法 - Google Patents
環状ジヌクレオチド化合物および使用方法 Download PDFInfo
- Publication number
- JP2022017500A JP2022017500A JP2021180838A JP2021180838A JP2022017500A JP 2022017500 A JP2022017500 A JP 2022017500A JP 2021180838 A JP2021180838 A JP 2021180838A JP 2021180838 A JP2021180838 A JP 2021180838A JP 2022017500 A JP2022017500 A JP 2022017500A
- Authority
- JP
- Japan
- Prior art keywords
- groups
- group
- alkyl
- amino
- amino group
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- 0 CC*(C)(CC)C1(C)C(CC2)CC2C1 Chemical compound CC*(C)(CC)C1(C)C(CC2)CC2C1 0.000 description 43
- JVCYMIYPGWGCGT-AATRIKPKSA-N CC/C(/N)=C(/C)\NS(NC)(=O)=O Chemical compound CC/C(/N)=C(/C)\NS(NC)(=O)=O JVCYMIYPGWGCGT-AATRIKPKSA-N 0.000 description 2
- LTQXSWOHMBWBJW-FFFRKSDCSA-N NC(NC1=O)=Nc2c1nc[n]2[C@@H](C1OP(OC[C@H](C(C2)OP(O)(OC3)=O)O[C@H]2c2ccc(cc4)c5c2ccc2c5c4ccc2)(S)=O)O[C@H]3C1O Chemical compound NC(NC1=O)=Nc2c1nc[n]2[C@@H](C1OP(OC[C@H](C(C2)OP(O)(OC3)=O)O[C@H]2c2ccc(cc4)c5c2ccc2c5c4ccc2)(S)=O)O[C@H]3C1O LTQXSWOHMBWBJW-FFFRKSDCSA-N 0.000 description 2
- GDOPTJXRTPNYNR-UHFFFAOYSA-N CC1CCCC1 Chemical compound CC1CCCC1 GDOPTJXRTPNYNR-UHFFFAOYSA-N 0.000 description 1
- IFTRQJLVEBNKJK-UHFFFAOYSA-N CCC1CCCC1 Chemical compound CCC1CCCC1 IFTRQJLVEBNKJK-UHFFFAOYSA-N 0.000 description 1
- PXCSPAWQUHASJQ-NVJFOEDDSA-N CCCC(C1OP(O)(OC[C@H](C(C2O)OP(O)(OC3)=O)O[C@H]2[n]2c(ncnc4N)c4nc2)=O)=C3O[C@H]1[n]1c(N=C(N)NC2=O)c2nc1 Chemical compound CCCC(C1OP(O)(OC[C@H](C(C2O)OP(O)(OC3)=O)O[C@H]2[n]2c(ncnc4N)c4nc2)=O)=C3O[C@H]1[n]1c(N=C(N)NC2=O)c2nc1 PXCSPAWQUHASJQ-NVJFOEDDSA-N 0.000 description 1
- QGELLSNOXWILNK-UHFFFAOYSA-N CCC[U]/C(/CNC)=C(/C)\N(C(C1)P)C(N=C(C)C)=C1C(C)=O Chemical compound CCC[U]/C(/CNC)=C(/C)\N(C(C1)P)C(N=C(C)C)=C1C(C)=O QGELLSNOXWILNK-UHFFFAOYSA-N 0.000 description 1
- UQABWPSYPMMXBY-XYBHJXGASA-N CN(C)P(OC[C@H](C(C1O)OP(O)(OC2)=O)O[C@H]1[n]1c(ncnc3N)c3nc1)(OC1[C@H]([n]3c(N=C(N)NC4=O)c4nc3)O[C@H]2C1O)=O Chemical compound CN(C)P(OC[C@H](C(C1O)OP(O)(OC2)=O)O[C@H]1[n]1c(ncnc3N)c3nc1)(OC1[C@H]([n]3c(N=C(N)NC4=O)c4nc3)O[C@H]2C1O)=O UQABWPSYPMMXBY-XYBHJXGASA-N 0.000 description 1
- XEUGXEPDOATBOT-SASVASPOSA-N C[C@@](COP(OC1[C@H]([n](cc2)c(N=C(N)N3)c2C3=O)OC(COP(O)(OC23)=O)C1O)(S)=O)(C2O)O[C@H]3[n]1c(ncnc2N)c2nc1 Chemical compound C[C@@](COP(OC1[C@H]([n](cc2)c(N=C(N)N3)c2C3=O)OC(COP(O)(OC23)=O)C1O)(S)=O)(C2O)O[C@H]3[n]1c(ncnc2N)c2nc1 XEUGXEPDOATBOT-SASVASPOSA-N 0.000 description 1
- GZWGNHWTLOUWIE-YJRKASINSA-N NC(NC1=O)=Nc2c1nc[n]2[C@@H](C1OP(O)(OC[C@H](C(C2O)OP(O)(OC3)=O)O[C@H]2[n]2c(nc[n]4c5ncc4)c5nc2)=O)O[C@H]3C1O Chemical compound NC(NC1=O)=Nc2c1nc[n]2[C@@H](C1OP(O)(OC[C@H](C(C2O)OP(O)(OC3)=O)O[C@H]2[n]2c(nc[n]4c5ncc4)c5nc2)=O)O[C@H]3C1O GZWGNHWTLOUWIE-YJRKASINSA-N 0.000 description 1
- ODQHUXLWUFBILB-FOHKRMRBSA-N NC(NC1=O)=Nc2c1nc[n]2[C@@H](C1OP(O)(OC[C@H](C2OP(O)(OC3)=O)OC([n]4c(nc[n]5c6ncc5)c6nc4)=C2O)=O)O[C@H]3C1O[IH]C(F)(F)F Chemical compound NC(NC1=O)=Nc2c1nc[n]2[C@@H](C1OP(O)(OC[C@H](C2OP(O)(OC3)=O)OC([n]4c(nc[n]5c6ncc5)c6nc4)=C2O)=O)O[C@H]3C1O[IH]C(F)(F)F ODQHUXLWUFBILB-FOHKRMRBSA-N 0.000 description 1
- KXXQEYIDFCANIV-QFNAKULQSA-N Nc1ncnc2c1nc[n]2[C@@H](C1O)O[C@H](CNC(C(C2=O)=O)=C2NC2[C@H]([n]3c(N=C(N)NC4=O)c4nc3)O[C@H](CO3)C2O)C1OP3(O)=O Chemical compound Nc1ncnc2c1nc[n]2[C@@H](C1O)O[C@H](CNC(C(C2=O)=O)=C2NC2[C@H]([n]3c(N=C(N)NC4=O)c4nc3)O[C@H](CO3)C2O)C1OP3(O)=O KXXQEYIDFCANIV-QFNAKULQSA-N 0.000 description 1
- UCTYAYGKEVAKRJ-SVKVBJPBSA-N Nc1ncnc2c1nc[n]2[C@@H](C1O)O[C@H](CNS(NC2[C@H]([n]3c(N=C(N)NC4=O)c4nc3)O[C@H](CO3)C2O)(=O)=O)C1OP3(O)=O Chemical compound Nc1ncnc2c1nc[n]2[C@@H](C1O)O[C@H](CNS(NC2[C@H]([n]3c(N=C(N)NC4=O)c4nc3)O[C@H](CO3)C2O)(=O)=O)C1OP3(O)=O UCTYAYGKEVAKRJ-SVKVBJPBSA-N 0.000 description 1
- HFMFYPFXASFSSE-LSEYUMQNSA-N Nc1ncnc2c1nc[n]2[C@@H](C1O)O[C@H](C[n]2nnc(COC3[C@H]([n]4c(N=C(N)NC5=O)c5nc4)O[C@H](CO4)C3O)c2)C1OP4(O)=O Chemical compound Nc1ncnc2c1nc[n]2[C@@H](C1O)O[C@H](C[n]2nnc(COC3[C@H]([n]4c(N=C(N)NC5=O)c5nc4)O[C@H](CO4)C3O)c2)C1OP4(O)=O HFMFYPFXASFSSE-LSEYUMQNSA-N 0.000 description 1
- DRRQHPNOHPDWCN-FOHKRMRBSA-N Nc1ncnc2c1nc[n]2[C@@H](C1O)O[C@H](Cc2c[n](C3=C([n]4c(N=C(N)NC5=O)c5nc4)O[C@H](CO4)C3O)nn2)C1OP4(O)=O Chemical compound Nc1ncnc2c1nc[n]2[C@@H](C1O)O[C@H](Cc2c[n](C3=C([n]4c(N=C(N)NC5=O)c5nc4)O[C@H](CO4)C3O)nn2)C1OP4(O)=O DRRQHPNOHPDWCN-FOHKRMRBSA-N 0.000 description 1
- NHLJYMFVQJCUBU-INMZTKTKSA-N Nc1ncnc2c1nc[n]2[C@@H](C1OP(O)(OCC(O[C@H](C2OP(O)(OC3)=O)[n]4c(N=C(N)NC5=O)c5nc4)=C2OCC(F)(F)F)=O)O[C@H]3C1O Chemical compound Nc1ncnc2c1nc[n]2[C@@H](C1OP(O)(OCC(O[C@H](C2OP(O)(OC3)=O)[n]4c(N=C(N)NC5=O)c5nc4)=C2OCC(F)(F)F)=O)O[C@H]3C1O NHLJYMFVQJCUBU-INMZTKTKSA-N 0.000 description 1
- PPRDYPVGZIHATQ-CGCQPWTRSA-N Nc1ncnc2c1nc[n]2[C@@H](C1OP(O)(OC[C@H](C(C2OP(OC3)(S)=O)O)O[C@H]2[n](cc2)c(N=C(N)N4)c2C4=O)=O)O[C@H]3C1O Chemical compound Nc1ncnc2c1nc[n]2[C@@H](C1OP(O)(OC[C@H](C(C2OP(OC3)(S)=O)O)O[C@H]2[n](cc2)c(N=C(N)N4)c2C4=O)=O)O[C@H]3C1O PPRDYPVGZIHATQ-CGCQPWTRSA-N 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07H—SUGARS; DERIVATIVES THEREOF; NUCLEOSIDES; NUCLEOTIDES; NUCLEIC ACIDS
- C07H21/00—Compounds containing two or more mononucleotide units having separate phosphate or polyphosphate groups linked by saccharide radicals of nucleoside groups, e.g. nucleic acids
- C07H21/02—Compounds containing two or more mononucleotide units having separate phosphate or polyphosphate groups linked by saccharide radicals of nucleoside groups, e.g. nucleic acids with ribosyl as saccharide radical
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07H—SUGARS; DERIVATIVES THEREOF; NUCLEOSIDES; NUCLEOTIDES; NUCLEIC ACIDS
- C07H19/00—Compounds containing a hetero ring sharing one ring hetero atom with a saccharide radical; Nucleosides; Mononucleotides; Anhydro-derivatives thereof
- C07H19/02—Compounds containing a hetero ring sharing one ring hetero atom with a saccharide radical; Nucleosides; Mononucleotides; Anhydro-derivatives thereof sharing nitrogen
- C07H19/04—Heterocyclic radicals containing only nitrogen atoms as ring hetero atom
- C07H19/16—Purine radicals
- C07H19/20—Purine radicals with the saccharide radical esterified by phosphoric or polyphosphoric acids
- C07H19/213—Purine radicals with the saccharide radical esterified by phosphoric or polyphosphoric acids containing cyclic phosphate
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7084—Compounds having two nucleosides or nucleotides, e.g. nicotinamide-adenine dinucleotide, flavine-adenine dinucleotide
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/48—Preparations in capsules, e.g. of gelatin, of chocolate
- A61K9/50—Microcapsules having a gas, liquid or semi-solid filling; Solid microparticles or pellets surrounded by a distinct coating layer, e.g. coated microspheres, coated drug crystals
- A61K9/51—Nanocapsules; Nanoparticles
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/04—Immunostimulants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07H—SUGARS; DERIVATIVES THEREOF; NUCLEOSIDES; NUCLEOTIDES; NUCLEIC ACIDS
- C07H21/00—Compounds containing two or more mononucleotide units having separate phosphate or polyphosphate groups linked by saccharide radicals of nucleoside groups, e.g. nucleic acids
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07H—SUGARS; DERIVATIVES THEREOF; NUCLEOSIDES; NUCLEOTIDES; NUCLEIC ACIDS
- C07H21/00—Compounds containing two or more mononucleotide units having separate phosphate or polyphosphate groups linked by saccharide radicals of nucleoside groups, e.g. nucleic acids
- C07H21/04—Compounds containing two or more mononucleotide units having separate phosphate or polyphosphate groups linked by saccharide radicals of nucleoside groups, e.g. nucleic acids with deoxyribosyl as saccharide radical
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Organic Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Molecular Biology (AREA)
- Biochemistry (AREA)
- Engineering & Computer Science (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Genetics & Genomics (AREA)
- Biotechnology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Immunology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Epidemiology (AREA)
- Communicable Diseases (AREA)
- Oncology (AREA)
- Optics & Photonics (AREA)
- Nanotechnology (AREA)
- Biomedical Technology (AREA)
- Physics & Mathematics (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Saccharide Compounds (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Medicinal Preparation (AREA)
- Cephalosporin Compounds (AREA)
Abstract
Description
本出願は、2016年3月18日出願の米国特許仮出願第62/310,364号、2016年6月28日出願の米国特許仮出願第62/355,382号、および2016年9月17日出願の米国特許仮出願第62/396,140号の恩典を主張するものであり、各特許仮出願の内容全体が参照により本明細書に組み入れられる。
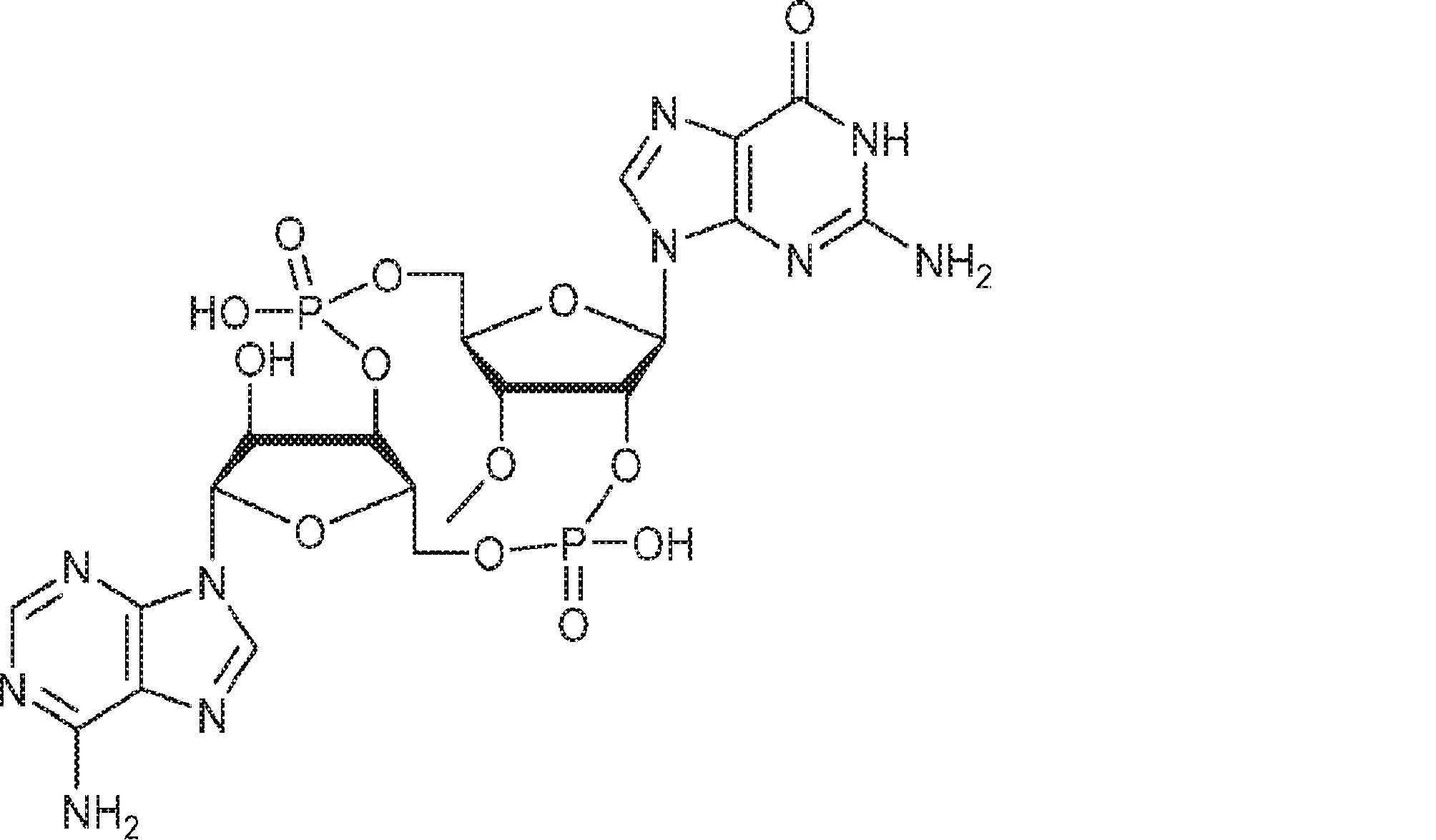
本発明は、新規環状ジヌクレオチドcGAMP類似体、その薬学的組成物、その合成方法、および医学的治療におけるその使用を提供する。特に、本発明の化合物は、STING(インターフェロン遺伝子刺激因子)を活性化することで身体の免疫応答を増強するものであり、がん、感染性疾患、および免疫障害の免疫療法に有用である。本化合物は、がんおよび感染性疾患に対するワクチンを開発するためのアジュバントとしても有用である。
サイトゾルDNAは、微生物感染および悪性細胞に対する免疫防御に重要なI型インターフェロンおよび他のサイトカインを誘導するが、自己免疫を生じさせることもある。このDNAシグナル伝達経路はアダプタータンパク質STING(インターフェロン遺伝子刺激因子)および転写因子IRF3を必要とするが、DNAセンシング機構は最近まで不明であった。テキサス大学の国際公開公報第2014099824号(特許文献1)では、哺乳動物サイトゾル抽出物がインビトロでATPおよびGTPから、RNAの存在下ではなくDNAの存在下で環状GMP-AMP(cGAMP)を合成したことが開示された。哺乳動物細胞のDNA遺伝子導入またはDNAウイルス感染もcGAMP産生を誘発した。cGAMPがSTINGに結合することで、IRF3が活性化され、インターフェロンβ(IFN-β)を含むI型インターフェロンが誘導された。したがって、cGAMPは、後生動物において第1の環状ジヌクレオチドとなり、また、サイトゾルDNAに応答してインターフェロン産生を誘発する内在性のセカンドメッセンジャーとして機能する。
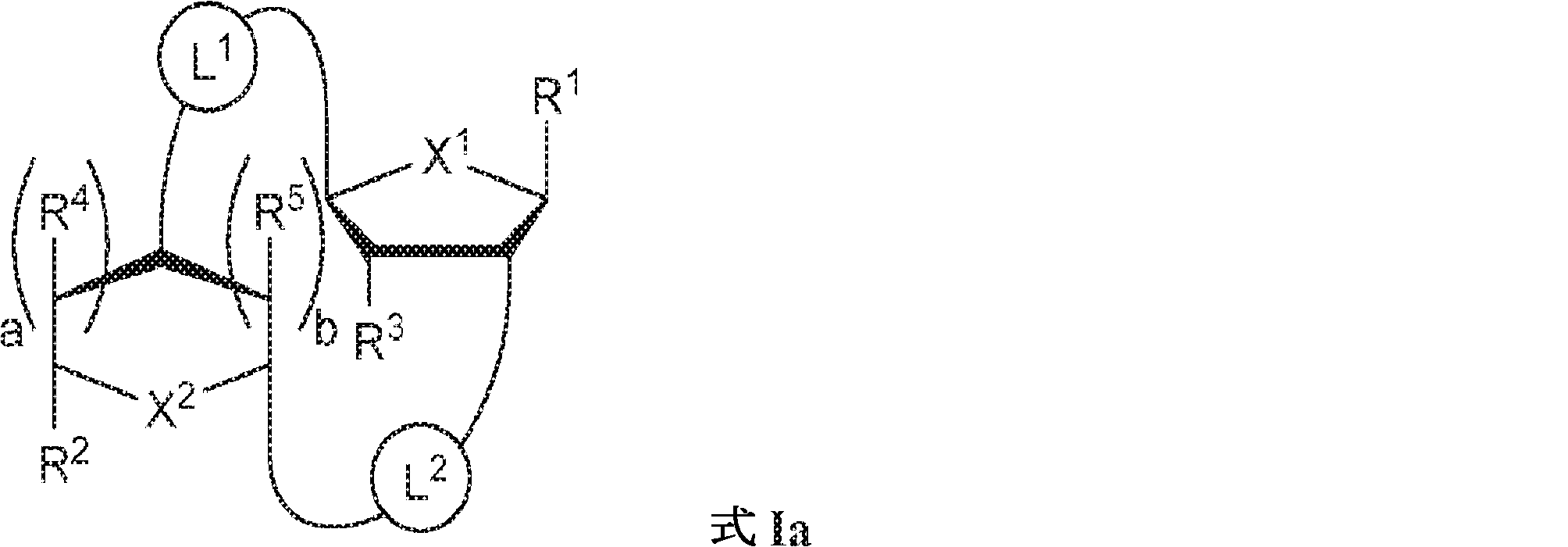
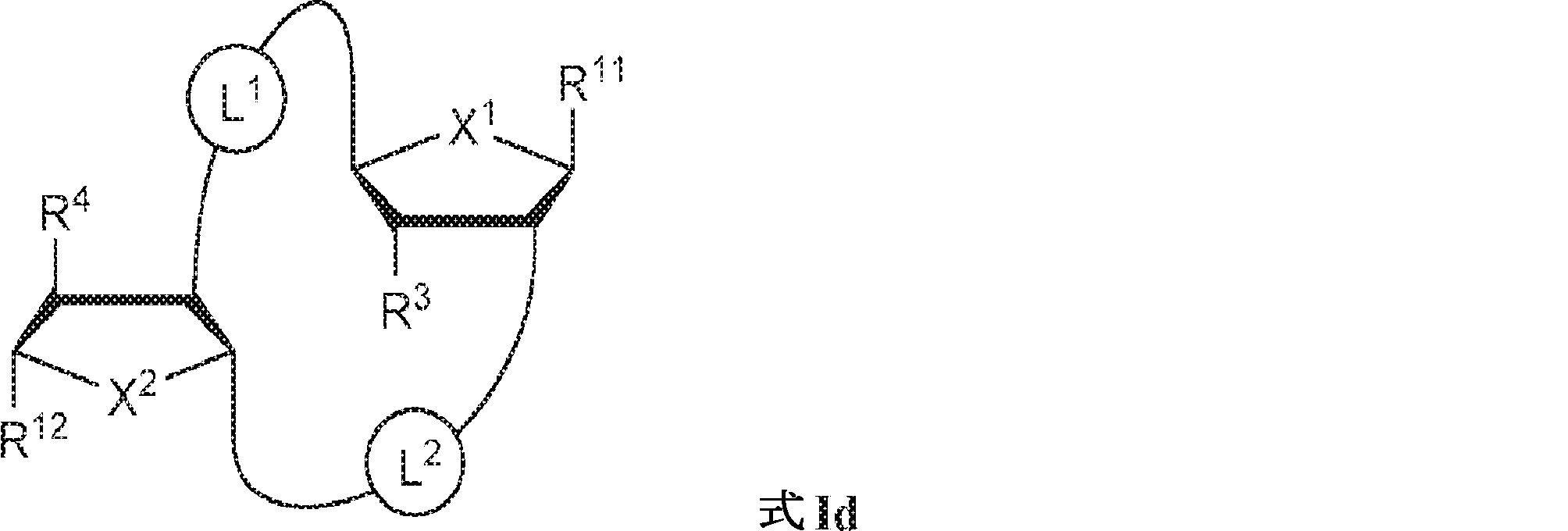
の化合物またはその薬学的に許容される塩を提供し、
式中、
aおよびbは独立して0または1であり、かつ、aが1でありbが0でありかつR5が存在しない場合; およびaが0でありbが1でありかつR4が存在しない場合にa + b = 1であり;
X1およびX2は独立して5員環中のO、S、またはSeであり;
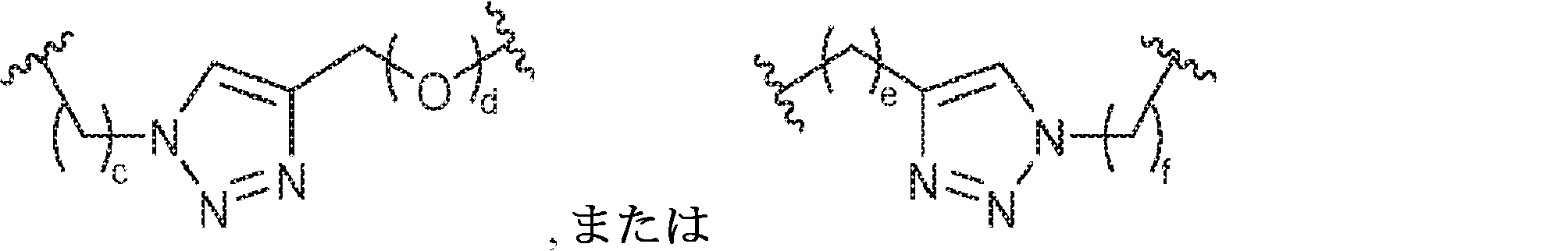
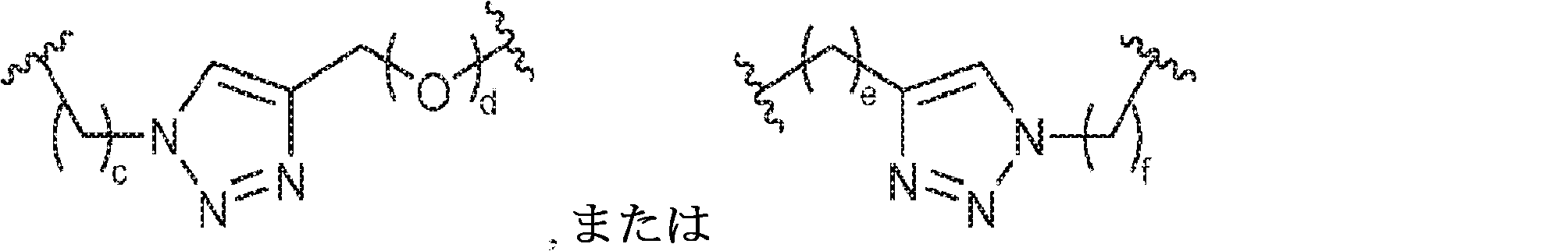
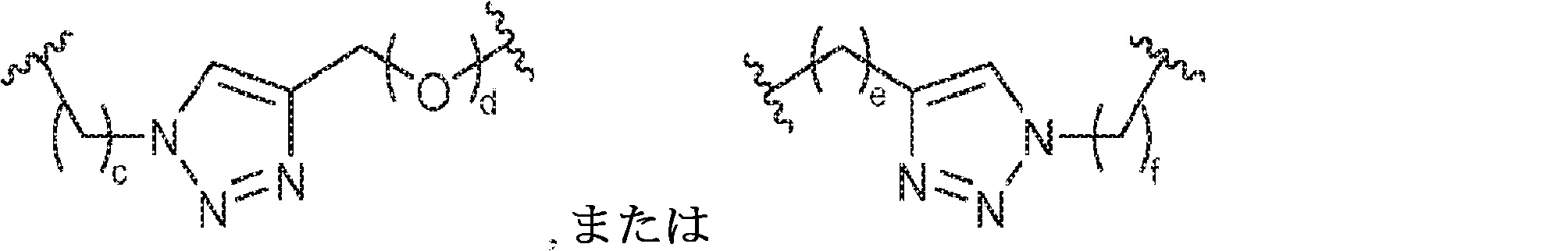
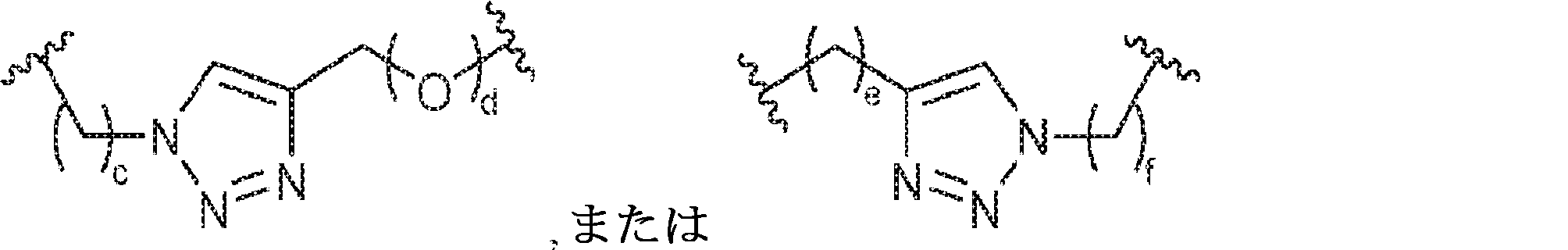
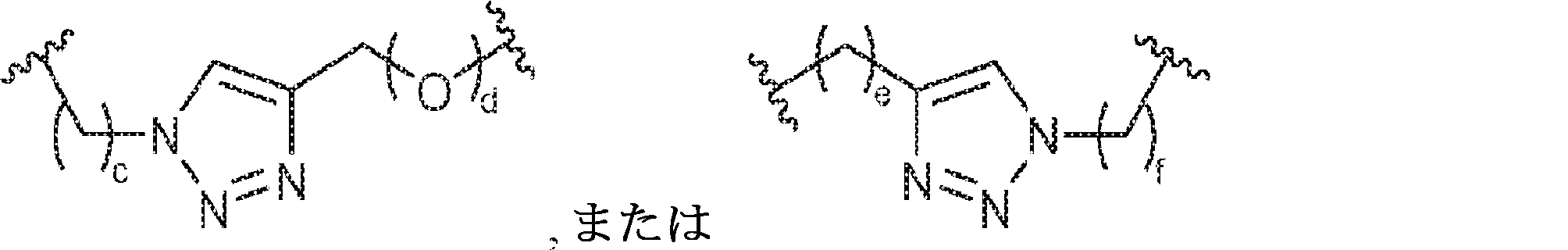
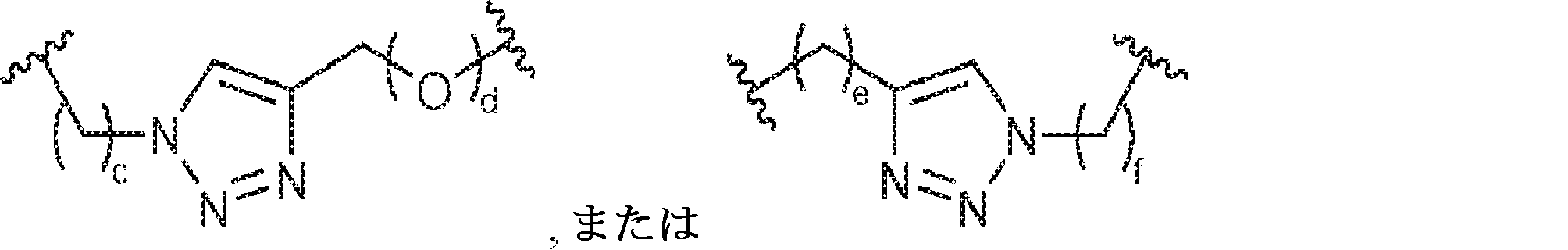
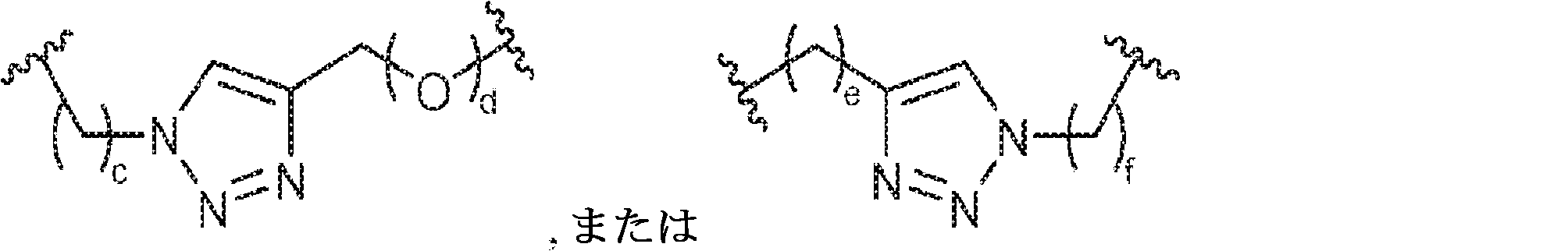
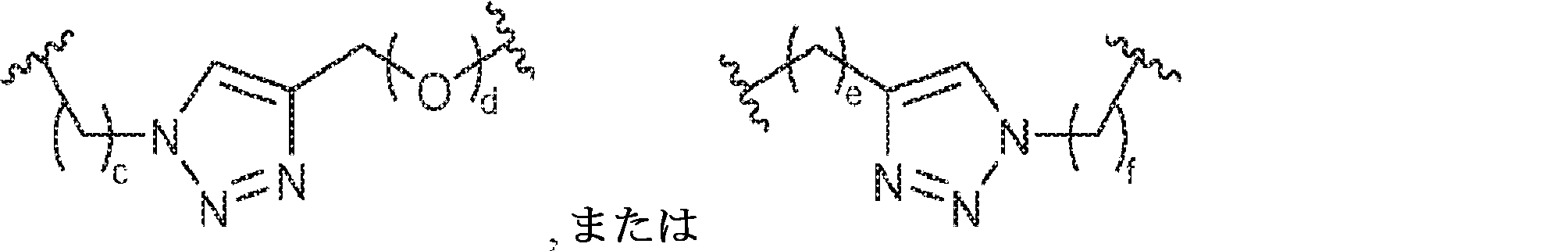
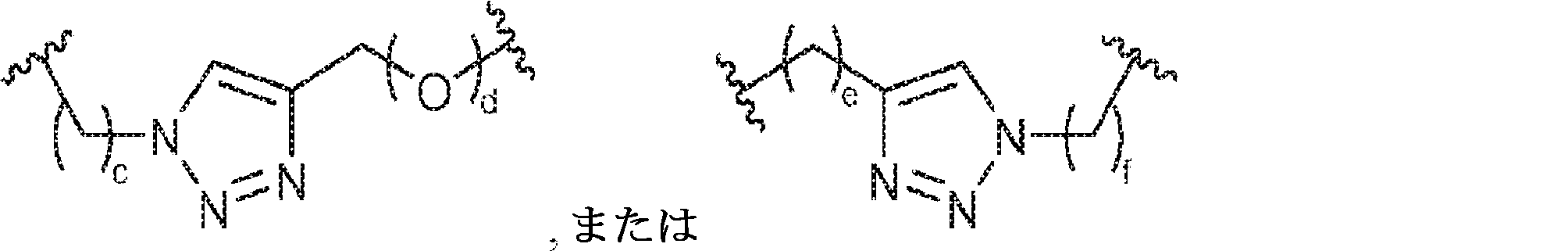
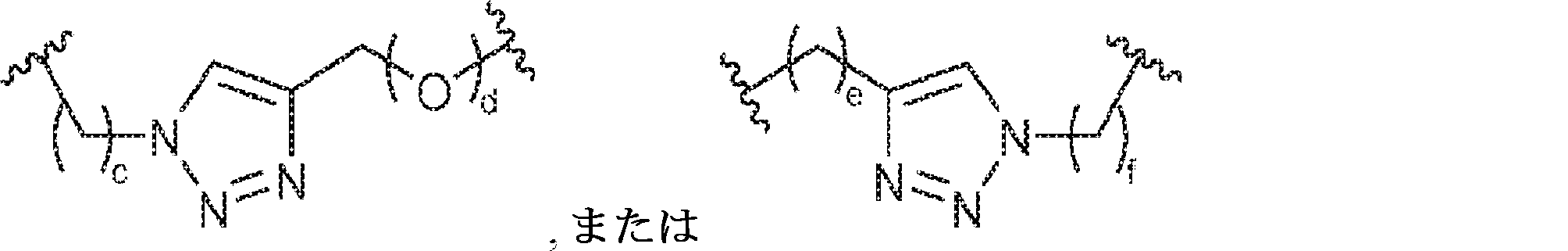
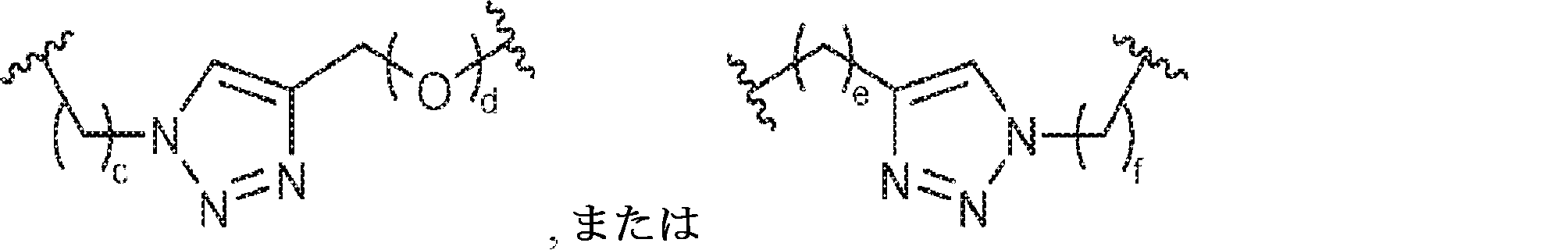
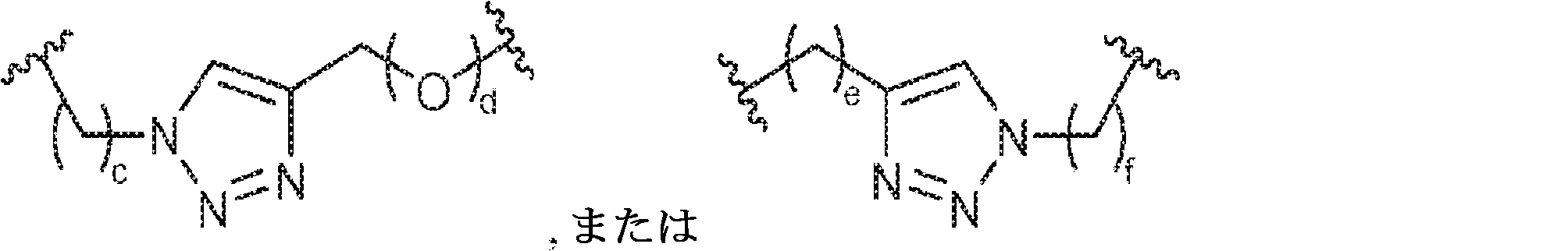
X1に対してα位の炭素から出発するL1、およびX2に対してα位の炭素から出発するL2は独立して、-CH2O-P(O)R6-O-、-CH2O-P(S)R6-O-、-C(Y1)(Y2)O-P(O)R6-C(Y3)(Y4)-、-CH2NHSO2NH-、-CH2NHC(O)NH-、-CH2NHC(S)NH-、-CH2NHC(NH)NH-、-CH2NHC(O)CH2-、-CH2NHSO2CH2-、-CH2CH2C(O)NH-、-CH2CH2SO2NH-、-CH2NH(3,4-ジオキソシクロブテン-1,2-ジイル)NH-、
であり;
cは0、1、または2であり;
d、e、およびfは独立して0または1であり;
Y1、Y2、Y3、およびY4は独立してHまたはFであり;
R6は、ヒドロキシル、チオール、C1~6アルキル、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルキル、C1~6アルコキシ、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルコキシ、C3~5アルケニル-O-、C3~5アルキニル-O-、オリゴ(エチレングリコール)、ポリ(エチレングリコール)、ボラノ(-BH3 -)、または-NR7R8であり;
R7およびR8は独立して、水素、C1~6アルキル、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルキル、環状-(C1~6アルキル)-、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、もしくはジ(C1~6アルキル)アミノ基を用いて選択的に官能基を付与された環状-(C1~6アルキル)-、環状-(C1~6オキサアルキル)-、または1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、もしくはジ(C1~6アルキル)アミノ基を用いて選択的に官能基を付与された環状-(C1~6オキサアルキル)-であり;
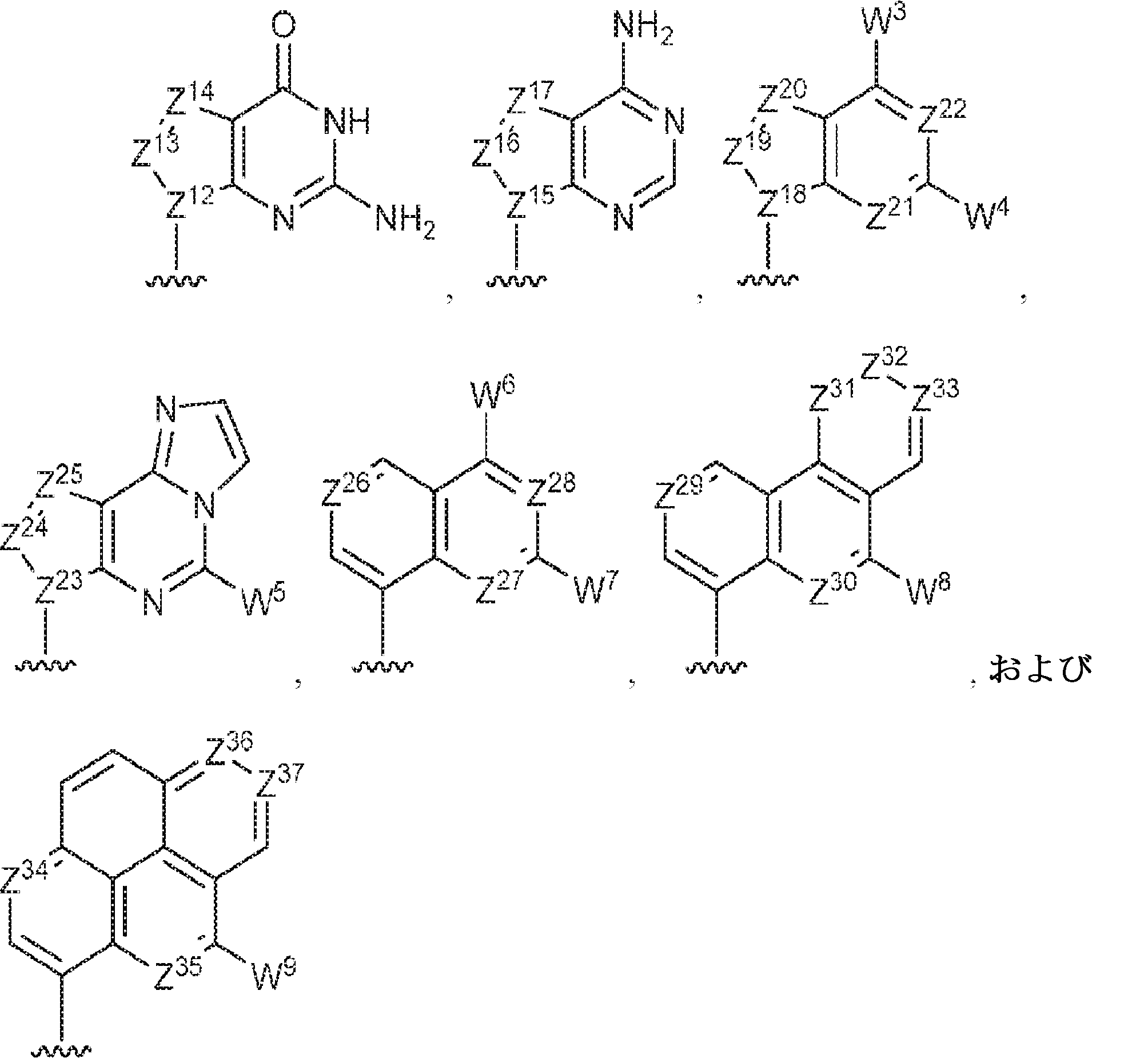
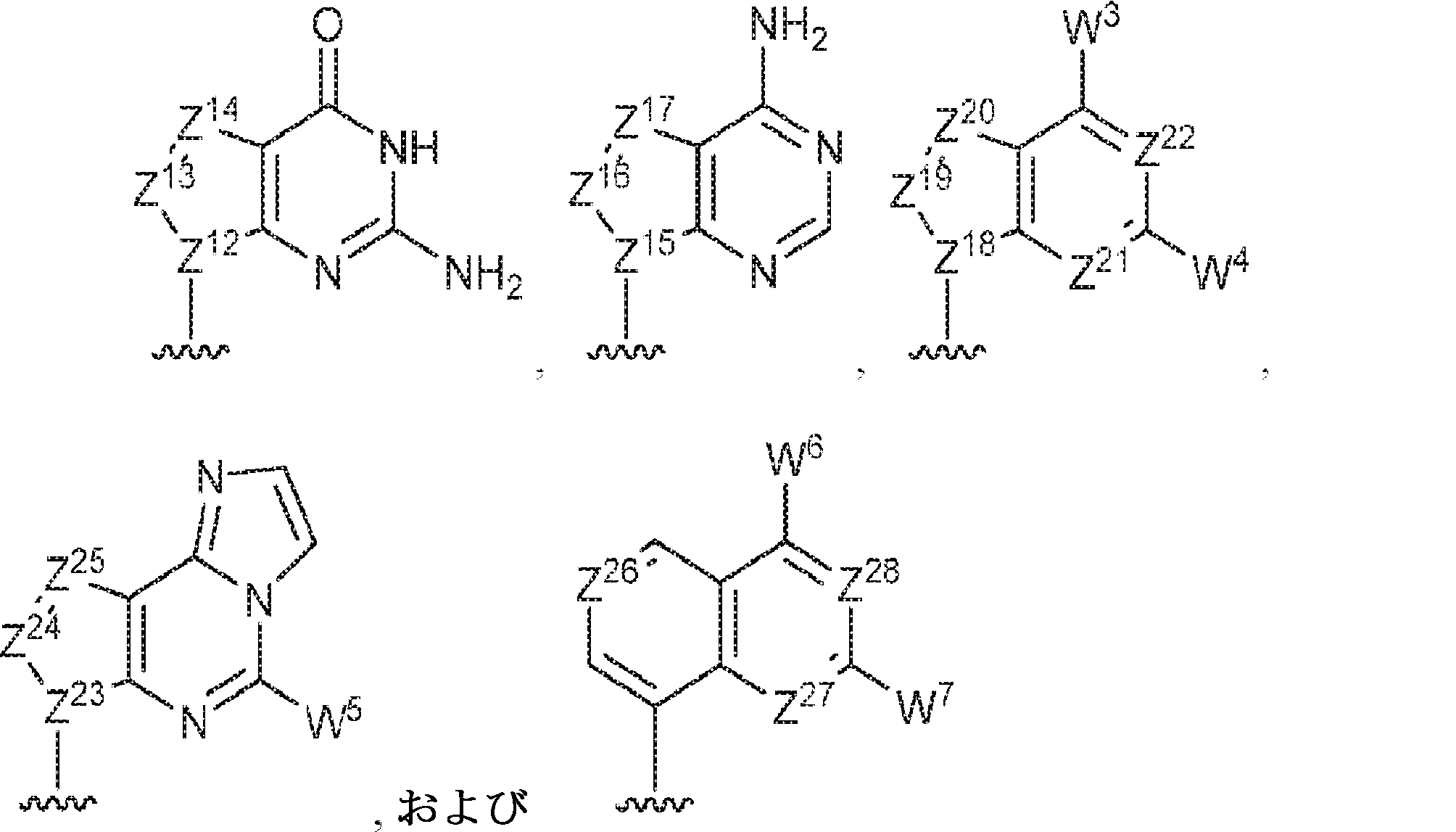
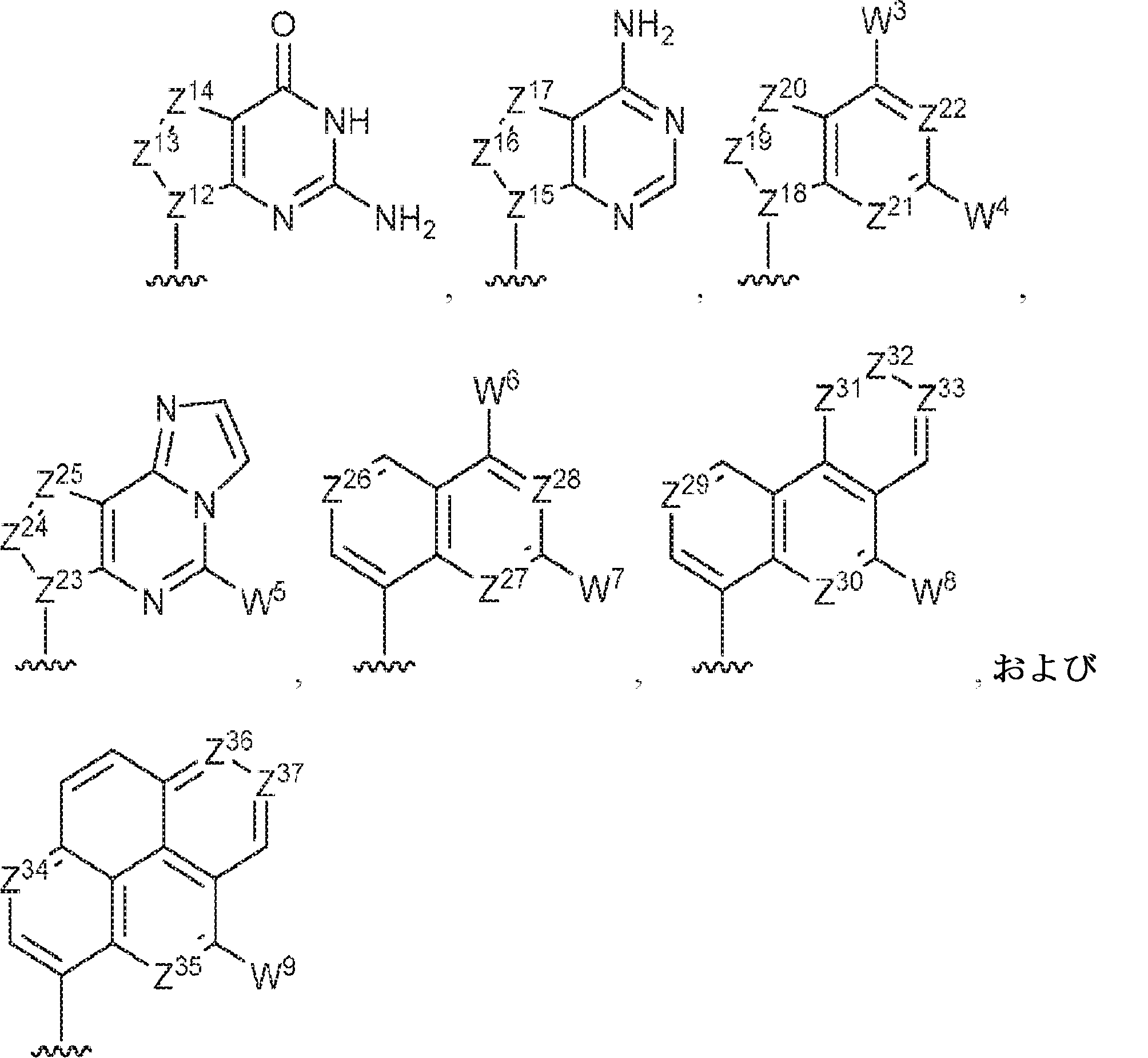
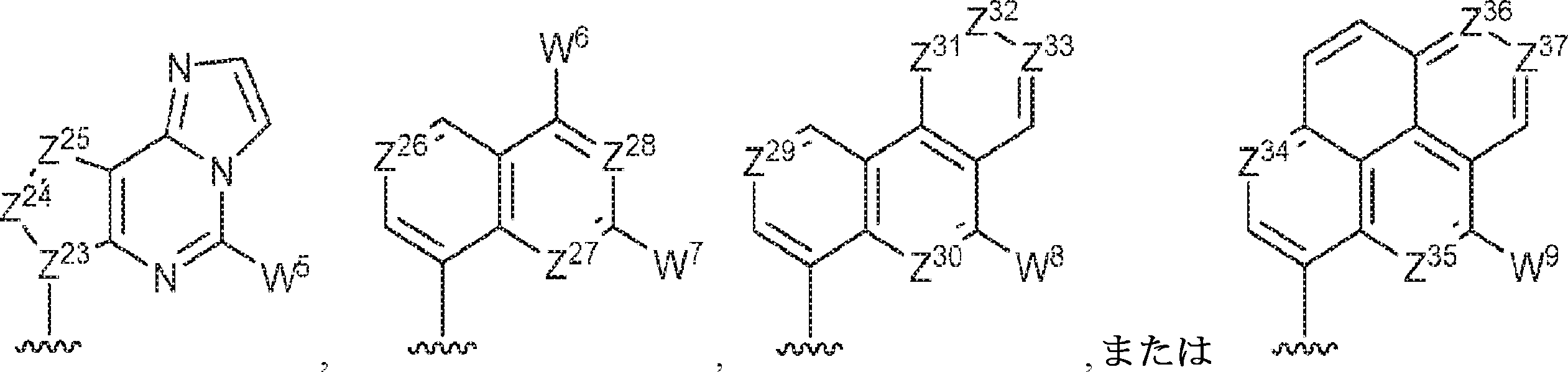
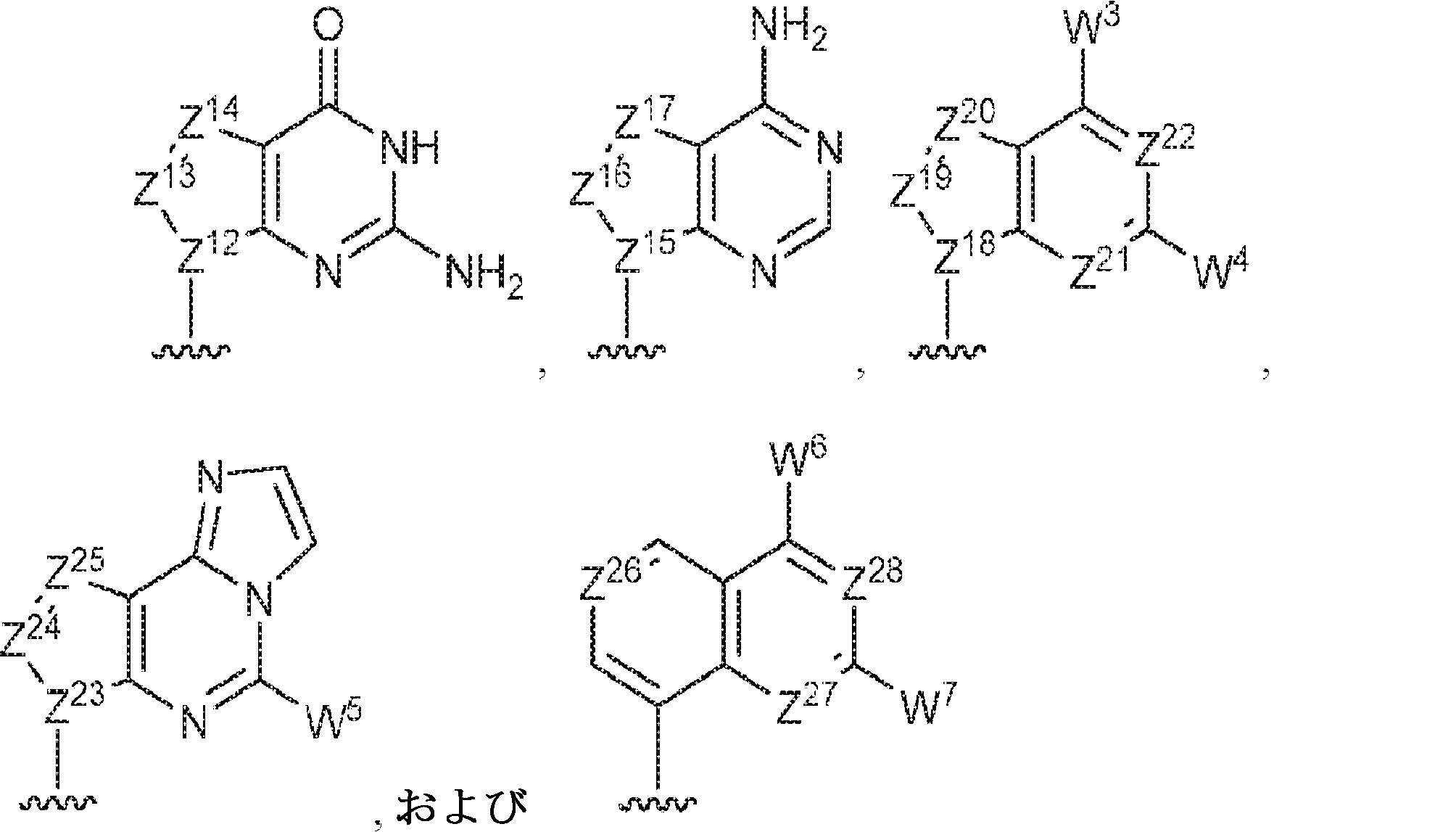
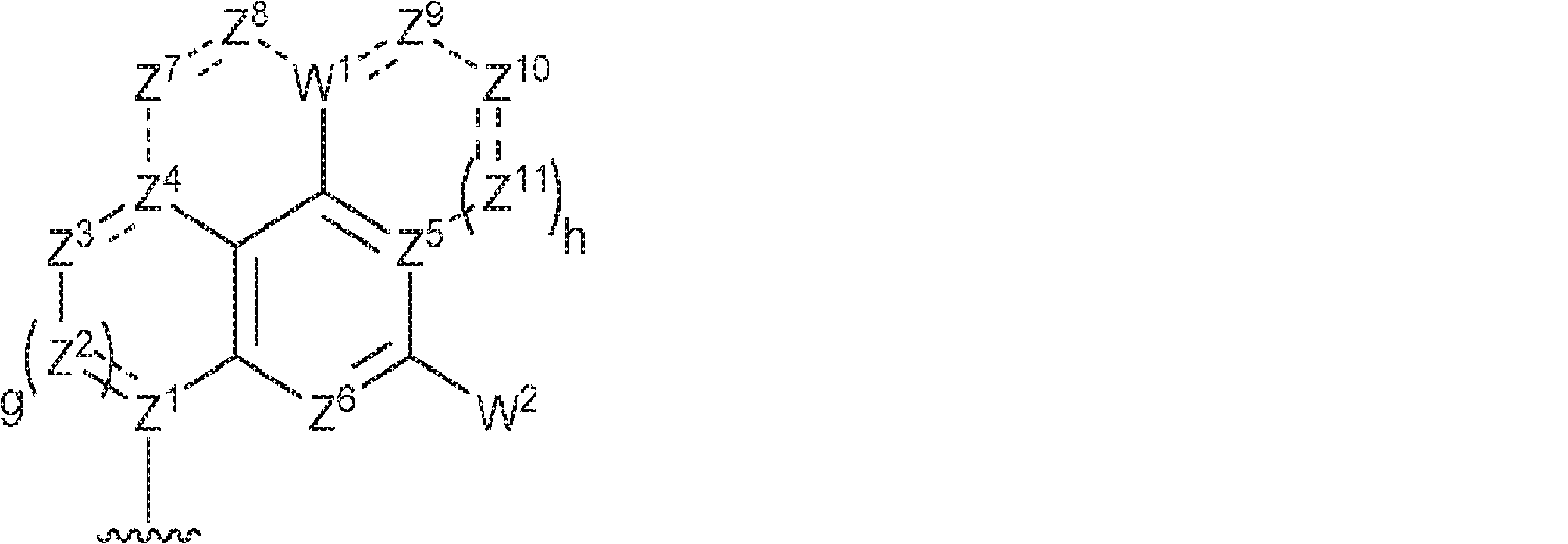
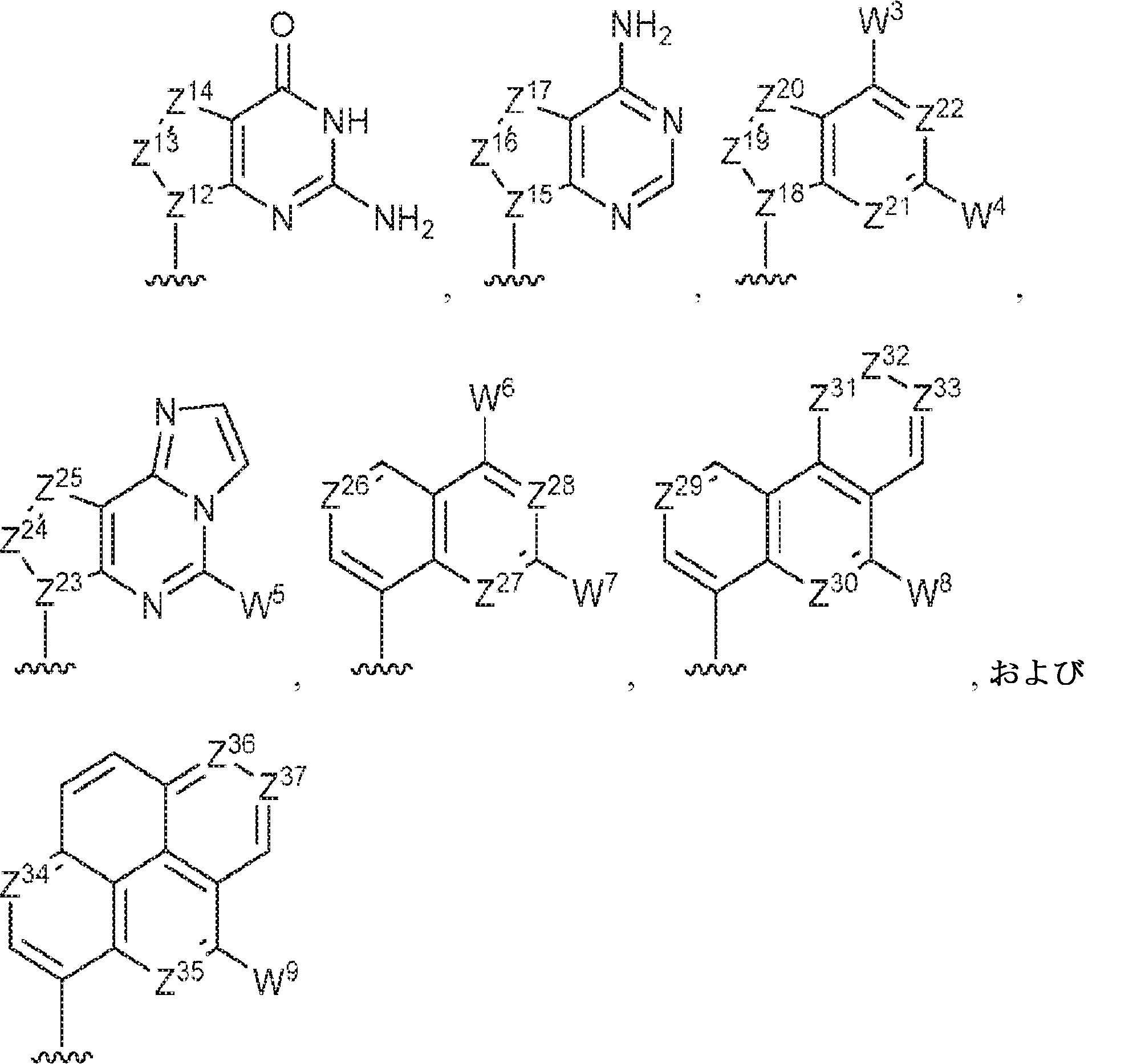
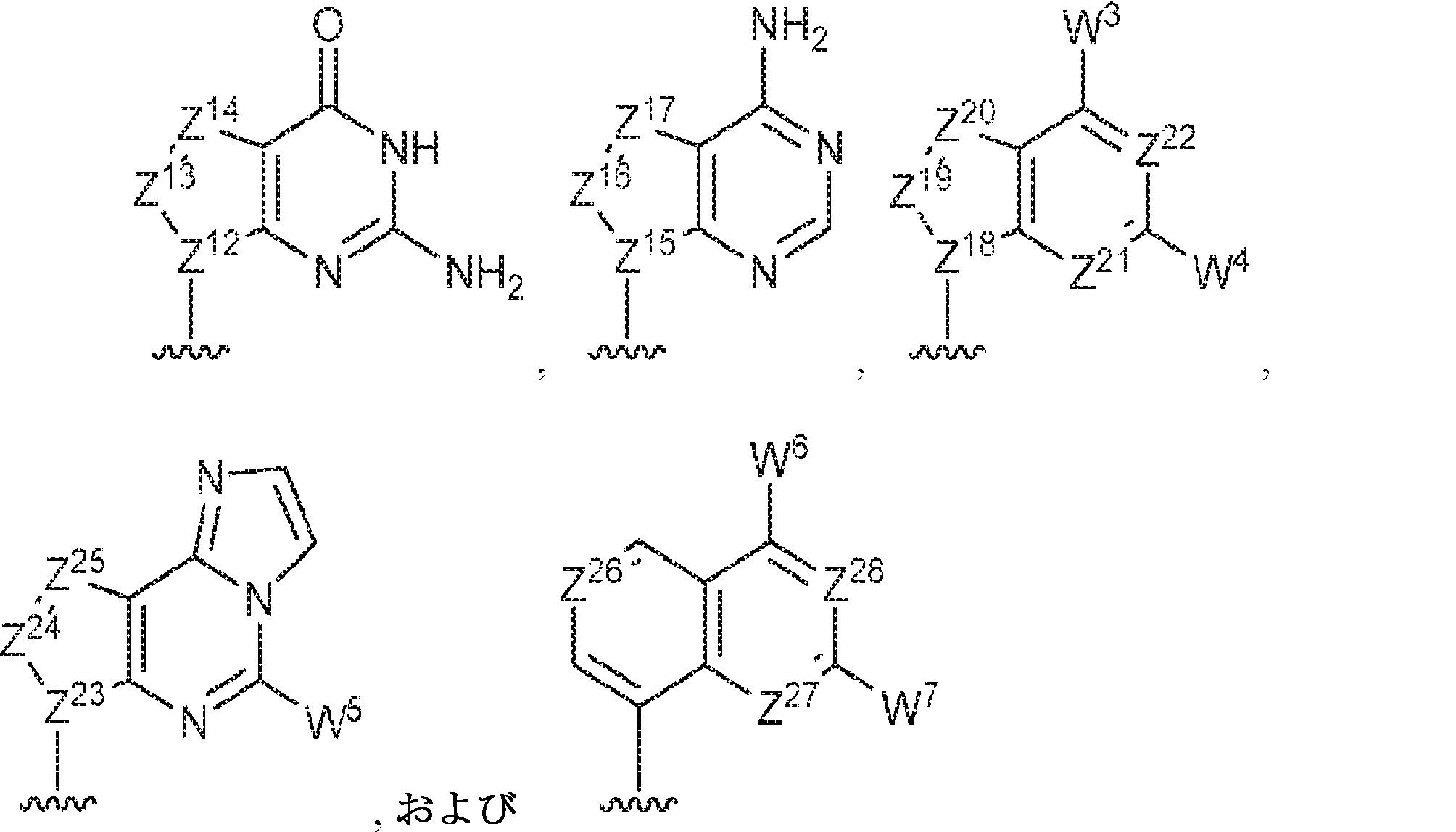
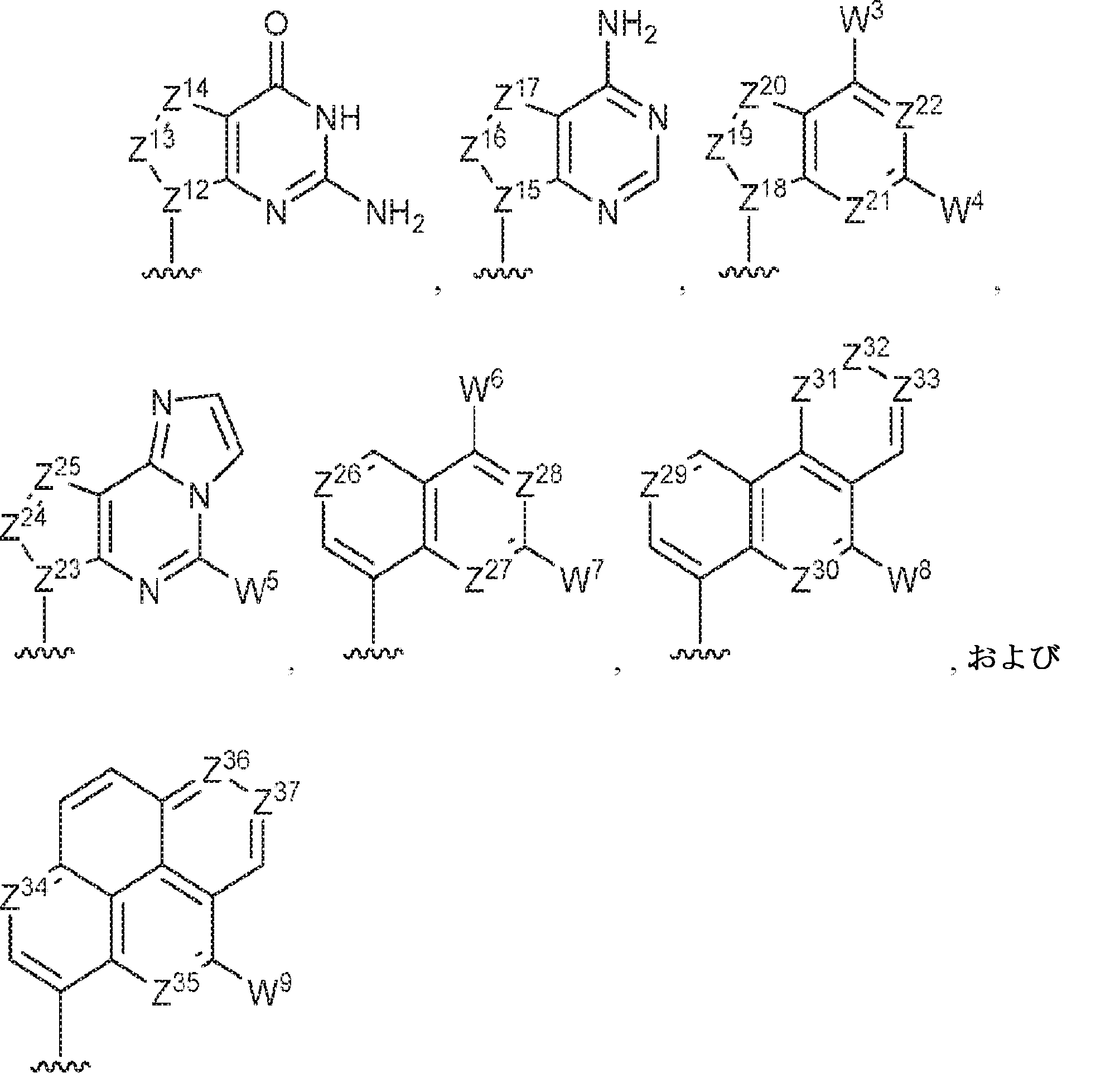
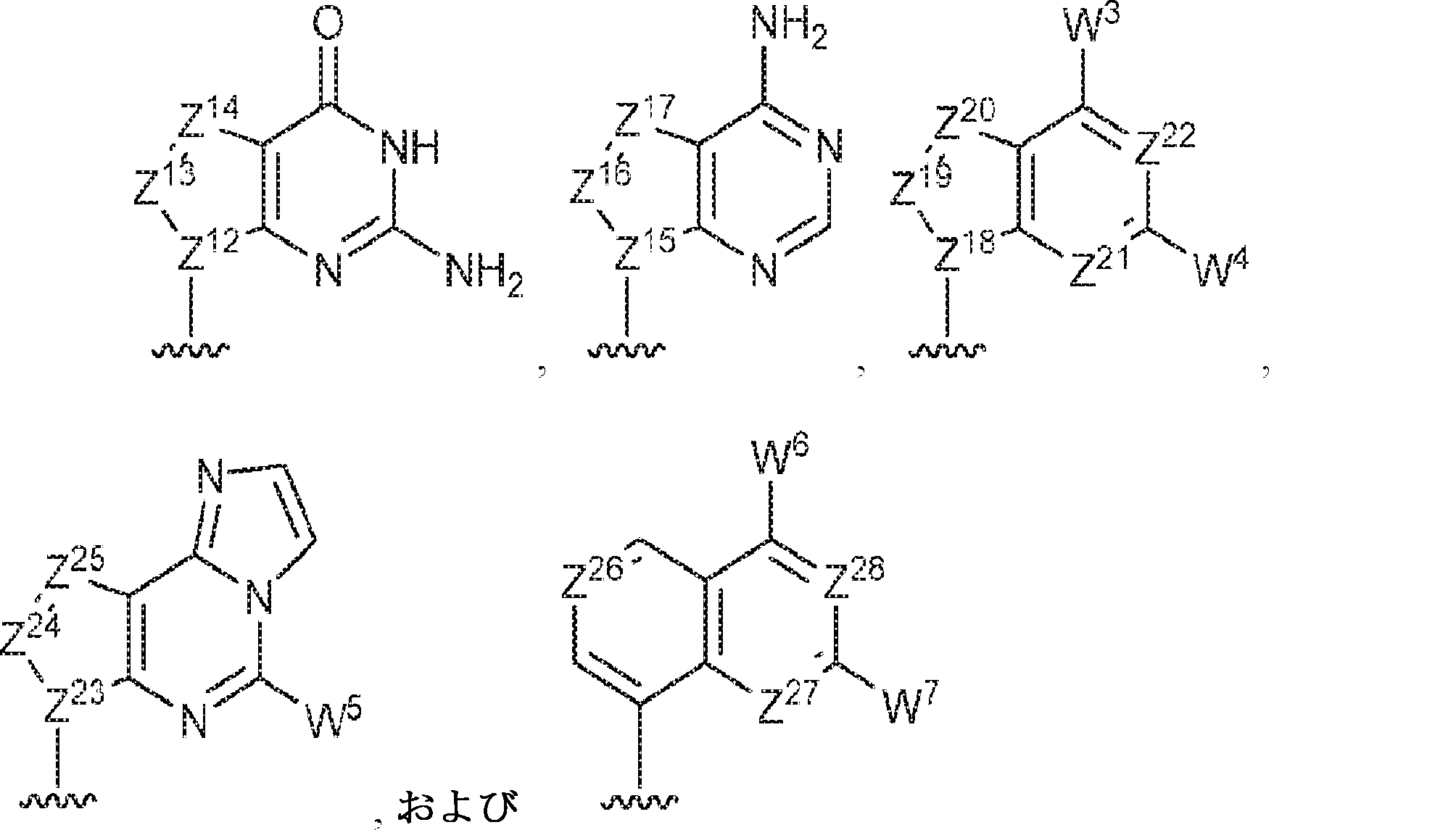
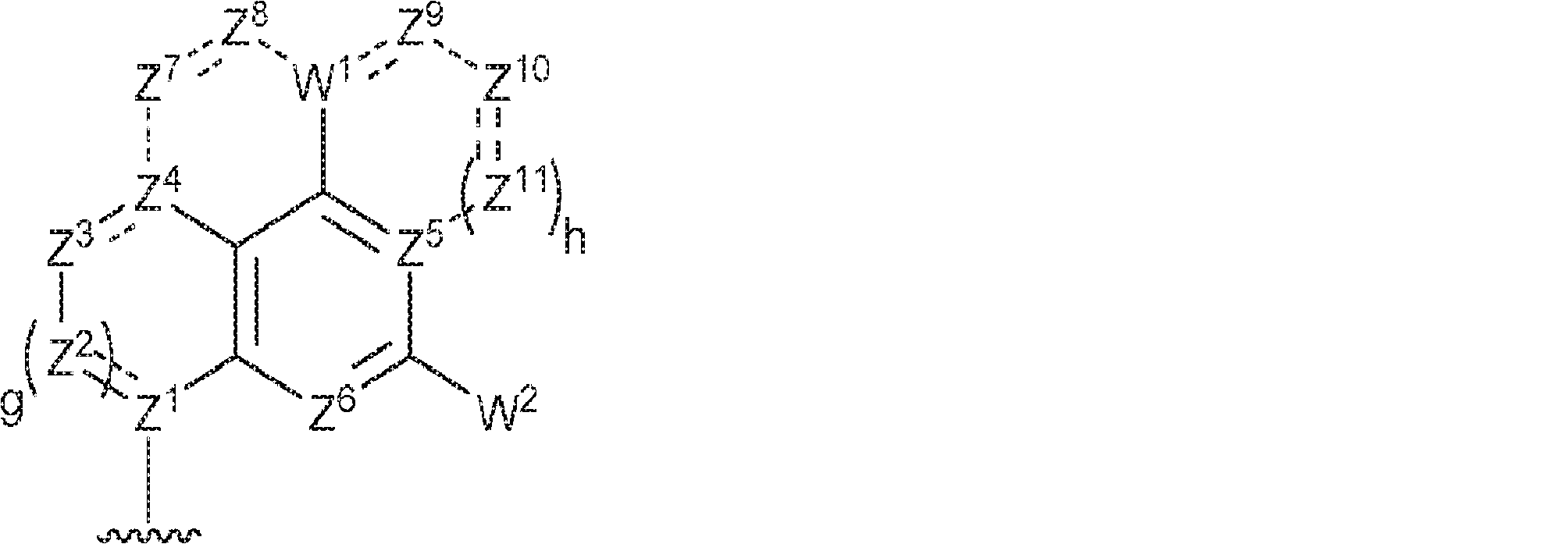
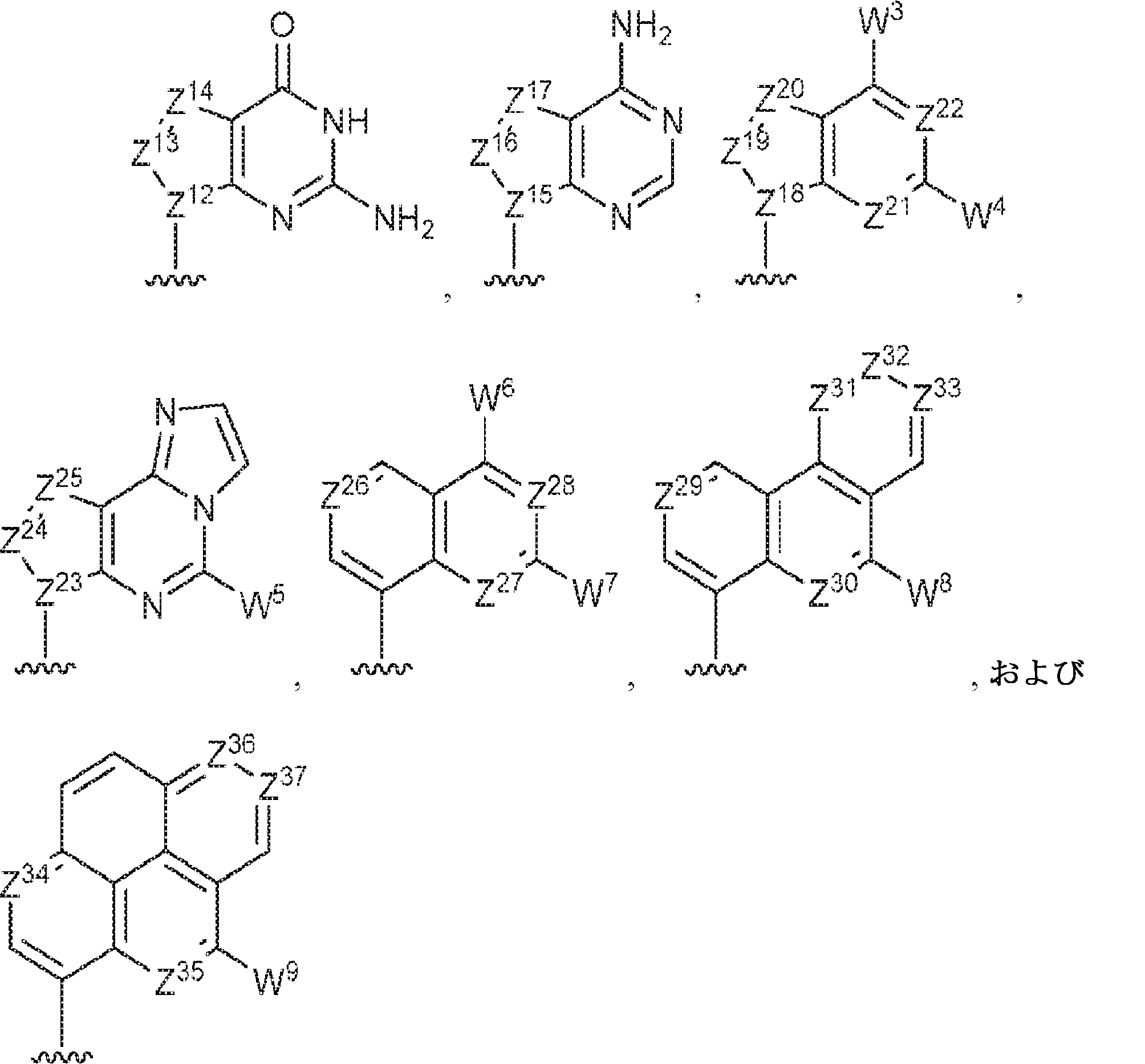
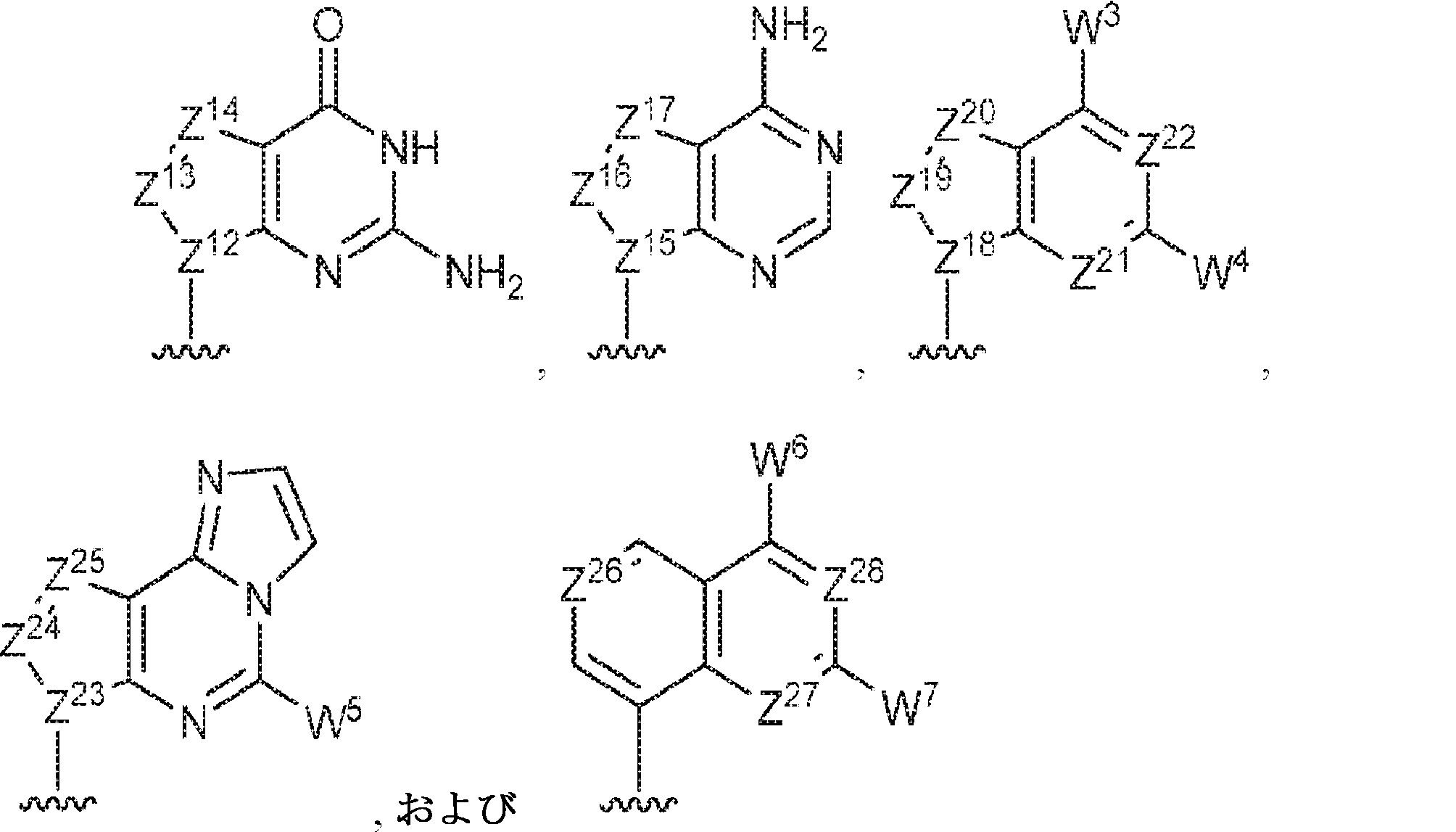
R1およびR2は独立して、互変異性形態を含む以下の一般構造:
を有する芳香環または芳香族複素環であり;
gおよびhは独立して0または1であり;
W1およびW2は独立して、水素、ハロゲン、ヒドロキシル、C1~6アルキル、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルキル、C1~6アルコキシ、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルコキシ、C3~5アルケニル-O-、C3~5アルキニル-O-、オリゴ(エチレングリコール)、ポリ(エチレングリコール)、アジド、または-NR7R8であり;
Z1、Z2、Z3、Z4、Z5、およびZ6は独立してCHまたはNであり;
存在する場合に、Z7、Z8、Z9、Z10、およびZ11は独立してCHまたはNであり、さらにW1はCHまたはNであり;かつ
R3、R4、およびR5は独立して、水素、ハロゲン、ヒドロキシル、アミノ、C1~6アルキル、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルキル、C1~6アルコキシ、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルコキシ、C3~5アルケニル-O-、C3~5アルキニル-O-、オリゴ(エチレングリコール)、ポリ(エチレングリコール)、アジド、または-NR7R8である。
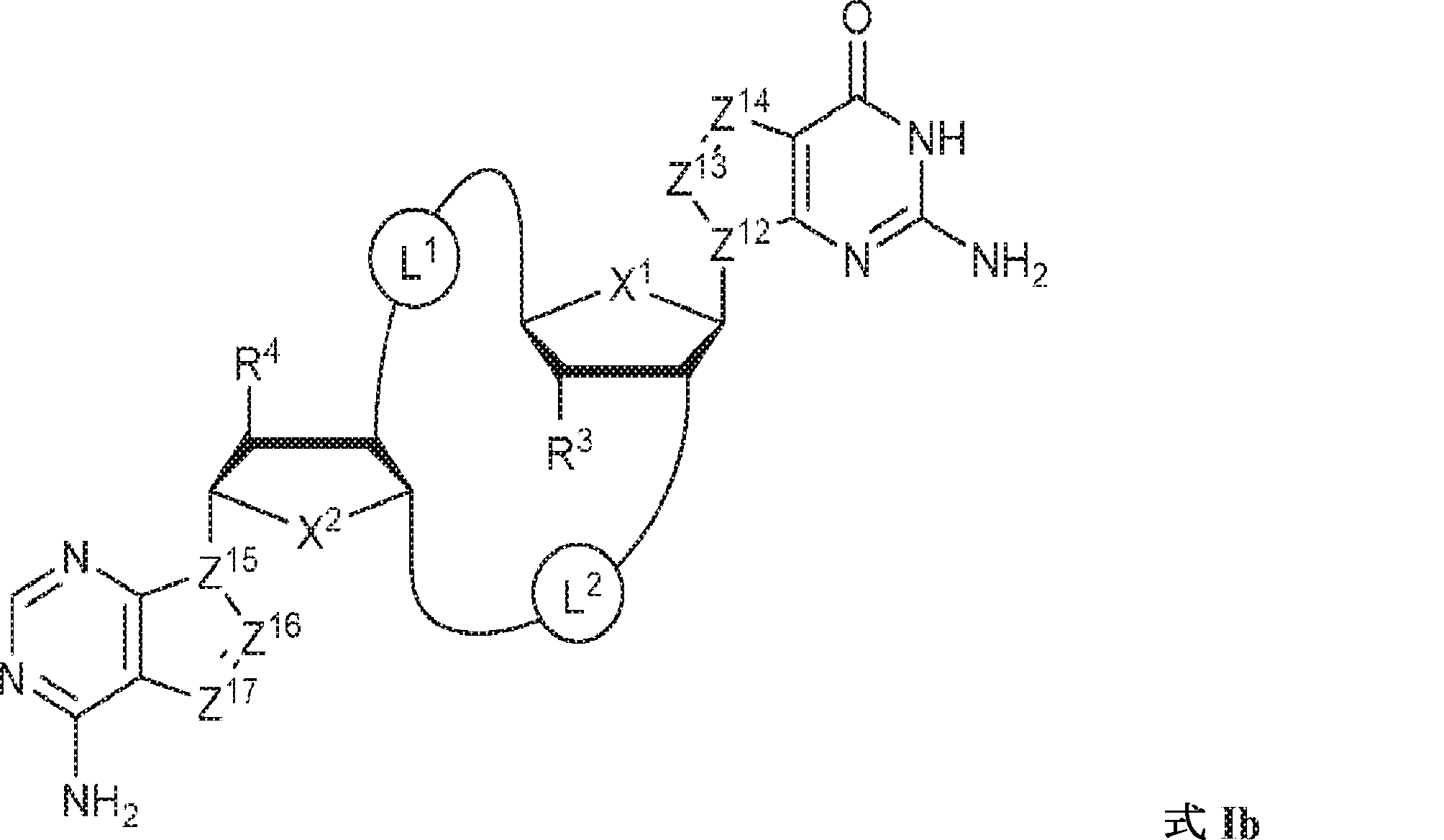
の化合物またはその薬学的に許容される塩を提供し、
式中、
X1およびX2は独立してO、S、またはSeであり;
Z12、Z13、Z14、Z15、Z16、およびZ17は独立してCHまたはNであり;
X1に対してα位の炭素から出発するL1、およびX2に対してα位の炭素から出発するL2は独立して、-CH2O-P(O)R6-O-、-CH2O-P(S)R6-O-、-C(Y1)(Y2)O-P(O)R6-C(Y3)(Y4)-、-CH2NHSO2NH-、-CH2NHC(O)NH-、-CH2NHC(S)NH-、-CH2NHC(NH)NH-、-CH2NHC(O)CH2-、-CH2NHSO2CH2-、-CH2CH2C(O)NH-、-CH2CH2SO2NH-、-CH2NH(3,4-ジオキソシクロブテン-1,2-ジイル)NH-、
であり;
cは0、1、または2であり;
d、e、およびfは独立して0または1であり;
Y1、Y2、Y3、およびY4は独立してHまたはFであり;
R6は、ヒドロキシル、チオール、C1~6アルキル、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルキル、C1~6アルコキシ、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルコキシ、C3~5アルケニル-O-、C3~5アルキニル-O-、オリゴ(エチレングリコール)、ポリ(エチレングリコール)、ボラノ(-BH3 -)、または-NR7R8であり;
R7およびR8は独立して、水素、C1~6アルキル、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルキル、環状-(C1~6アルキル)-、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、もしくはジ(C1~6アルキル)アミノ基を用いて選択的に官能基を付与された環状-(C1~6アルキル)-、環状-(C1~6オキサアルキル)-、または1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、もしくはジ(C1~6アルキル)アミノ基を用いて選択的に官能基を付与された環状-(C1~6オキサアルキル)-であり;かつ
R3およびR4は独立して、水素、ハロゲン、ヒドロキシル、アミノ、C1~6アルキル、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルキル、C1~6アルコキシ、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルコキシ、C3~5アルケニル-O-、C3~5アルキニル-O-、オリゴ(エチレングリコール)、ポリ(エチレングリコール)、アジド、または-NR7R8である。
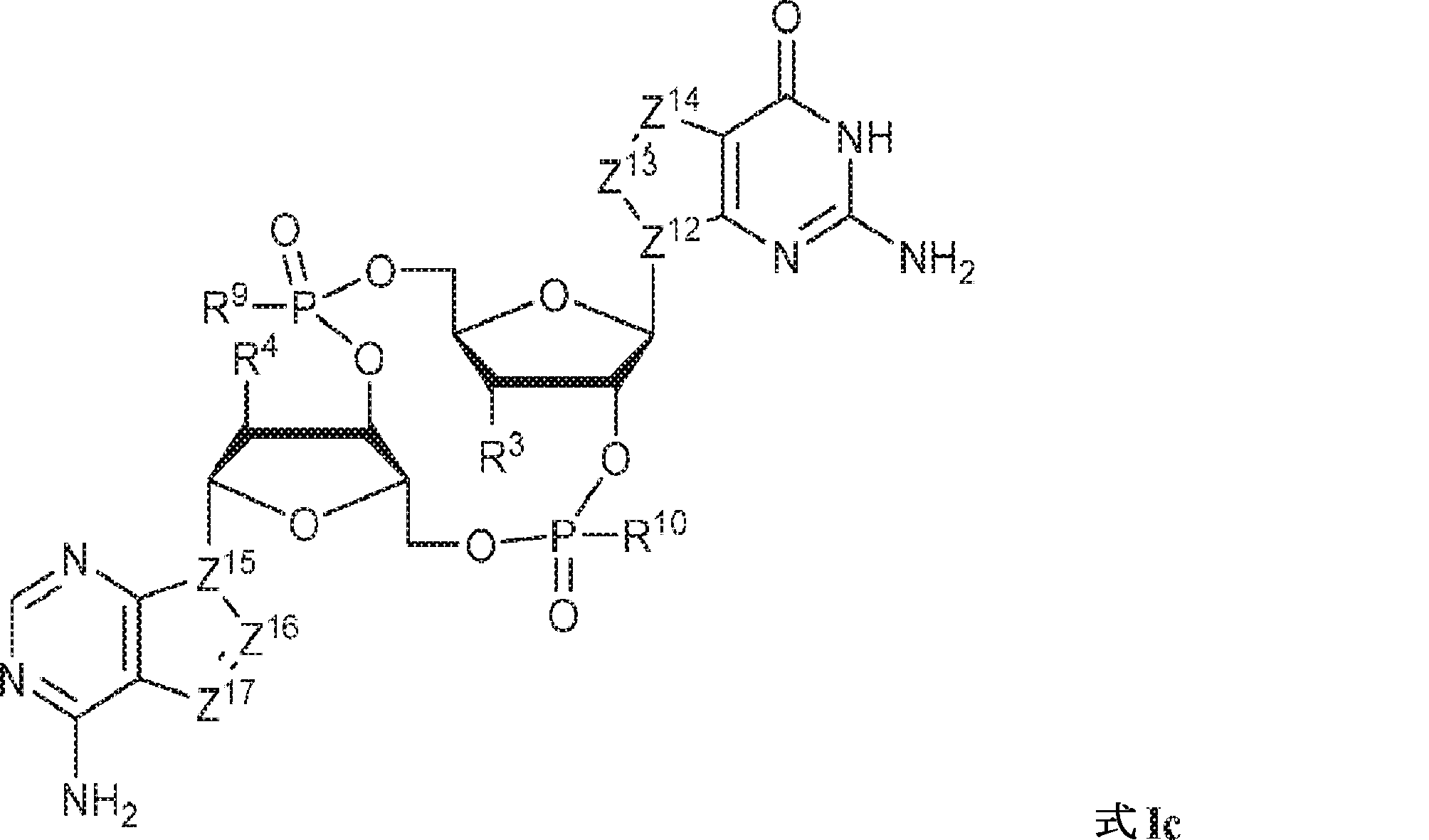
の化合物またはその薬学的に許容される塩を提供し、
式中、
Z12、Z13、Z14、Z15、Z16、およびZ17は独立してCHまたはNであり;
R3およびR4は独立して、水素、ハロゲン、ヒドロキシル、アミノ、C1~6アルキル、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルキル、C1~6アルコキシ、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルコキシ、C3~5アルケニル-O-、C3~5アルキニル-O-、オリゴ(エチレングリコール)、ポリ(エチレングリコール)、アジド、または-NR7R8であり;
R7およびR8は独立して、水素、C1~6アルキル、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルキル、環状-(C1~6アルキル)-、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、もしくはジ(C1~6アルキル)アミノ基を用いて選択的に官能基を付与された環状-(C1~6アルキル)-、環状-(C1~6オキサアルキル)-、または1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、もしくはジ(C1~6アルキル)アミノ基を用いて選択的に官能基を付与された環状-(C1~6オキサアルキル)-であり;かつ
R9およびR10は独立して、ヒドロキシル、チオール、C1~6アルキル、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルキル、C1~6アルコキシ、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルコキシ、C3~5アルケニル-O-、C3~5アルキニル-O-、オリゴ(エチレングリコール)、ポリ(エチレングリコール)、ボラノ(-BH3 -)、または-NR7R8である。
の化合物またはその薬学的に許容される塩を提供し、
式中、
X1およびX2は独立してO、S、またはSeであり;
X1に対してα位の炭素から出発するL1、およびX2に対してα位の炭素から出発するL2は独立して、-CH2O-P(O)R6-O-、-CH2O-P(S)R6-O-、-C(Y1)(Y2)O-P(O)R6-C(Y3)(Y4)-、-CH2NHSO2NH-、-CH2NHC(O)NH-、-CH2NHC(S)NH-、-CH2NHC(NH)NH-、-CH2NHC(O)CH2-、-CH2NHSO2CH2-、-CH2CH2C(O)NH-、-CH2CH2SO2NH-、-CH2NH(3,4-ジオキソシクロブテン-1,2-ジイル)NH-、
であり;
cは0、1、または2であり;
d、e、およびfは独立して0または1であり;
Y1、Y2、Y3、およびY4は独立してHまたはFであり;
R6は、ヒドロキシル、チオール、C1~6アルキル、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルキル、C1~6アルコキシ、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルコキシ、C3~5アルケニル-O-、C3~5アルキニル-O-、オリゴ(エチレングリコール)、ポリ(エチレングリコール)、ボラノ(-BH3 -)、または-NR7R8であり;
R7およびR8は独立して、水素、C1~6アルキル、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルキル、環状-(C1~6アルキル)-、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、もしくはジ(C1~6アルキル)アミノ基を用いて選択的に官能基を付与された環状-(C1~6アルキル)-、環状-(C1~6オキサアルキル)-、または1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、もしくはジ(C1~6アルキル)アミノ基を用いて選択的に官能基を付与された環状-(C1~6オキサアルキル)-であり;
R3およびR4は独立して、水素、ハロゲン、ヒドロキシル、アミノ、C1~6アルキル、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルキル、C1~6アルコキシ、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルコキシ、C3~5アルケニル-O-、C3~5アルキニル-O-、オリゴ(エチレングリコール)、ポリ(エチレングリコール)、アジド、または-NR7R8であり;
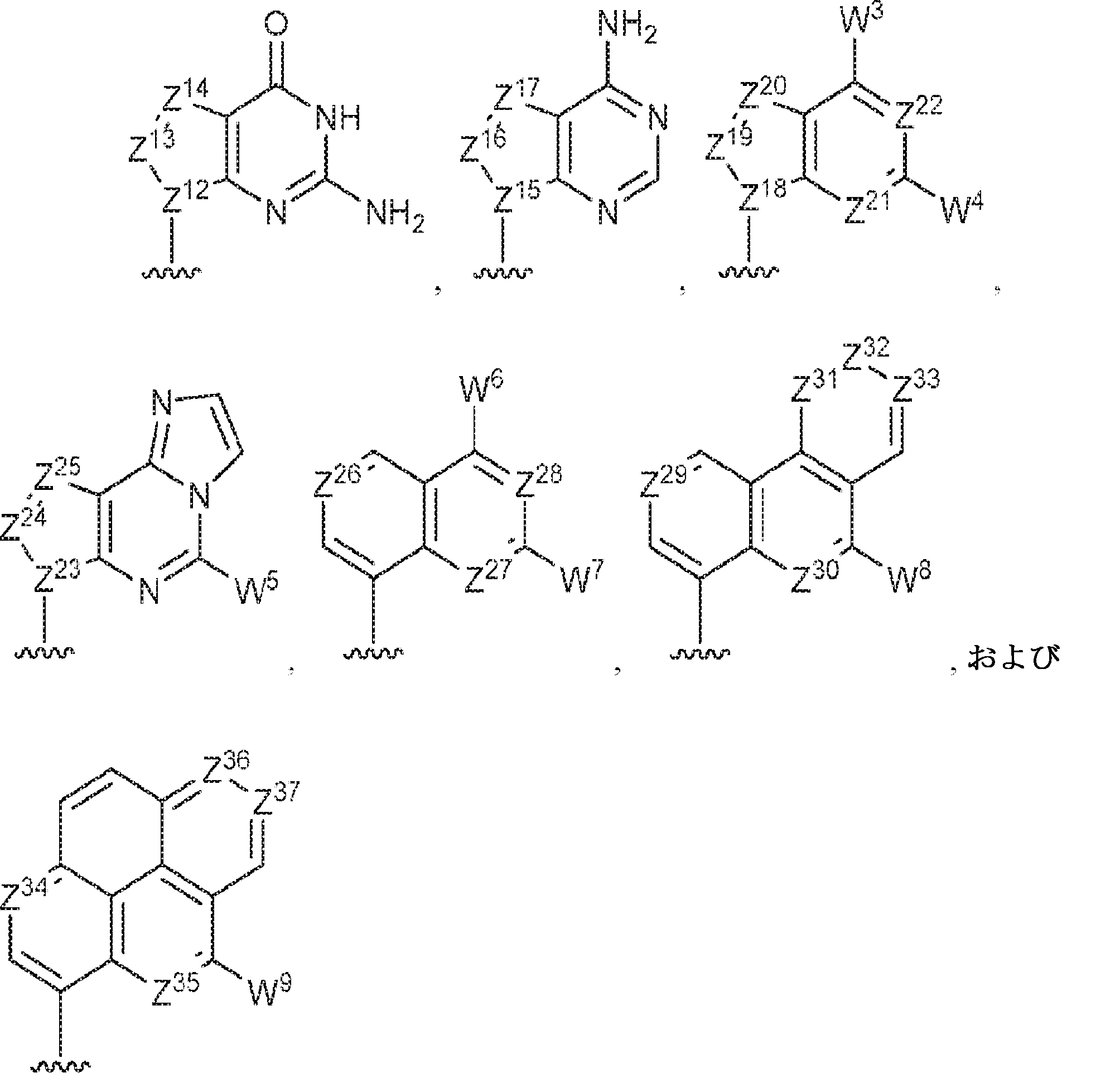
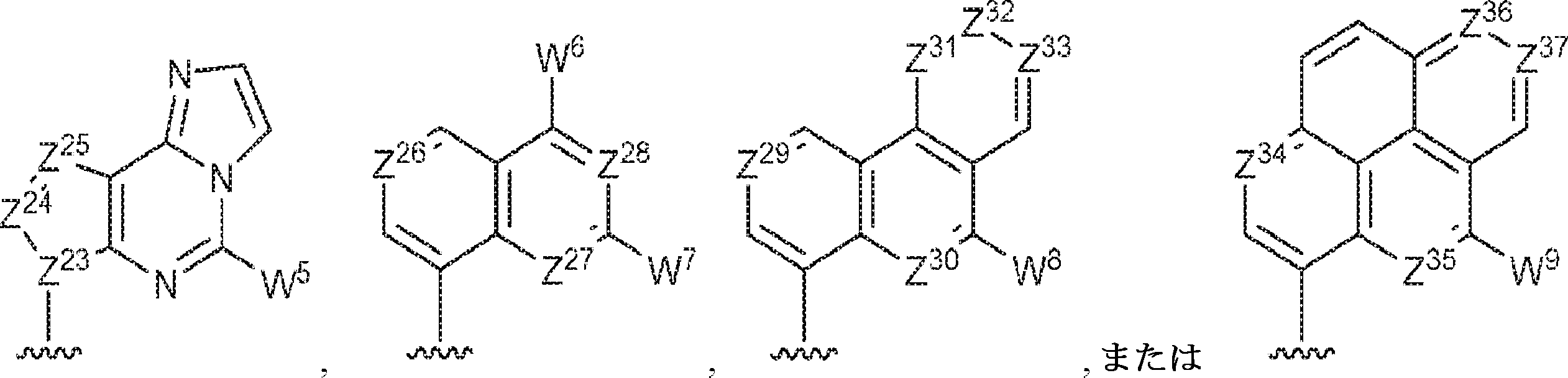
R11およびR12は独立して、
からなる群より選択され、R11およびR12のうち少なくとも一方は
であり;
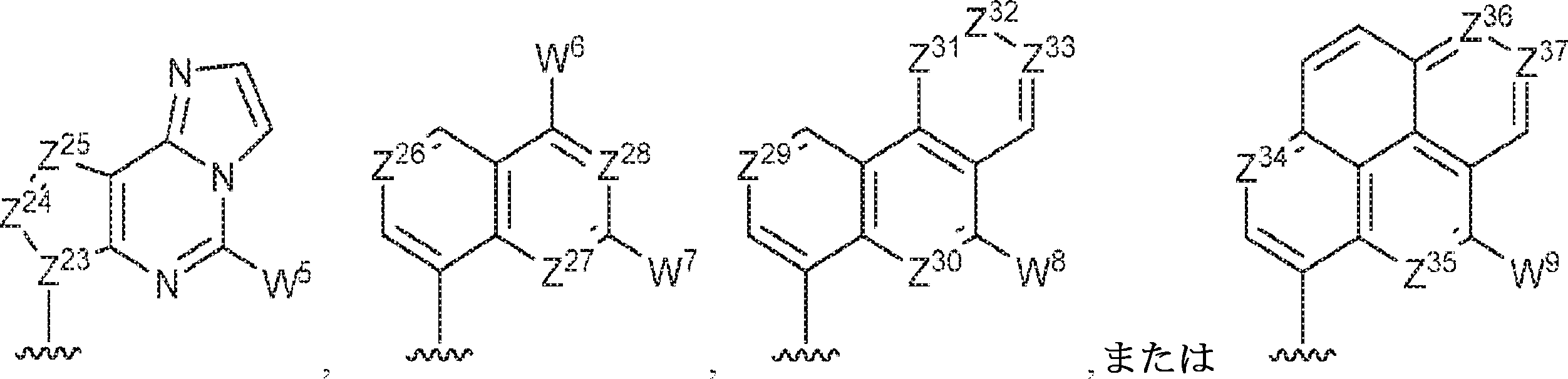
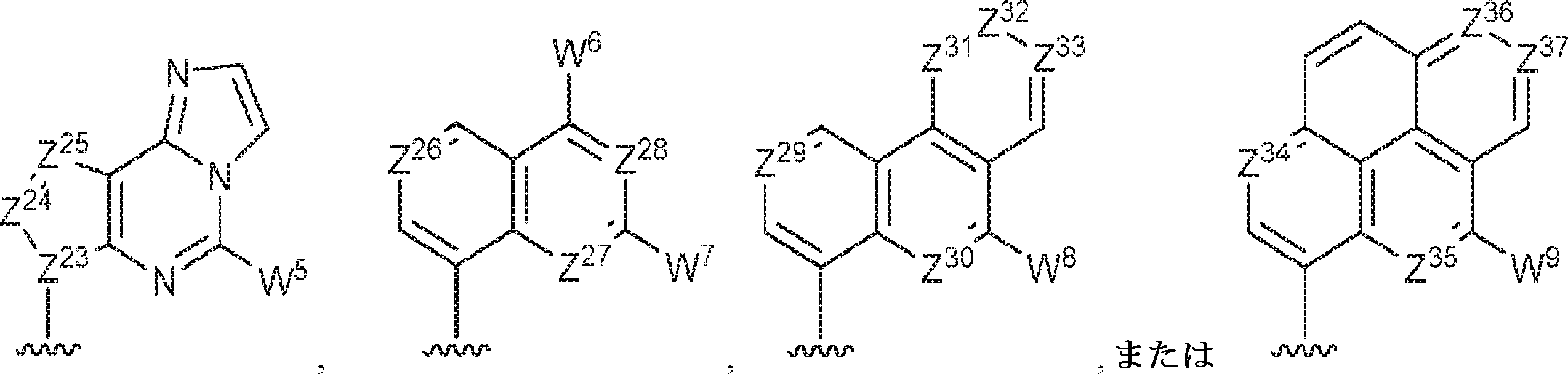
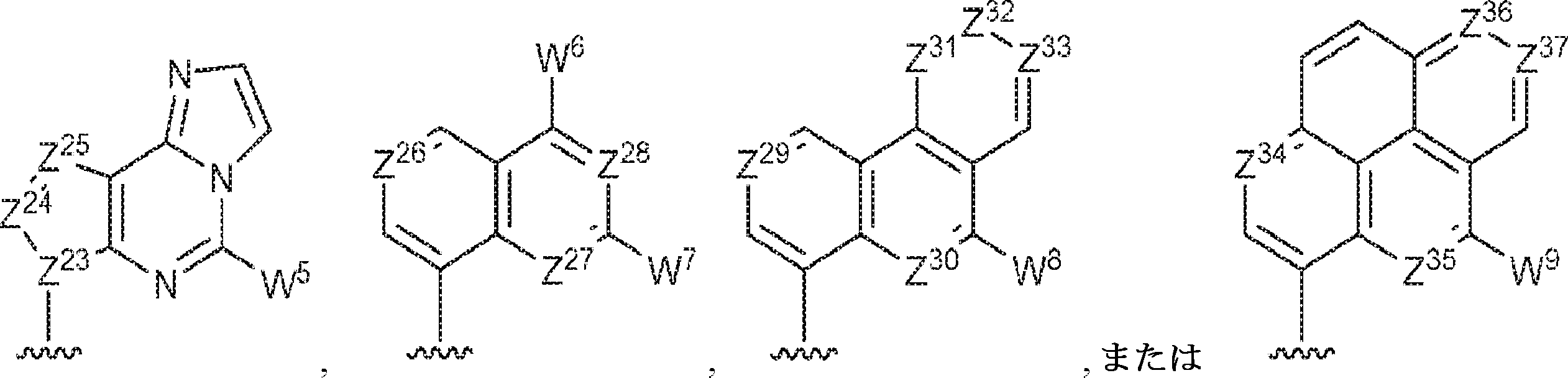
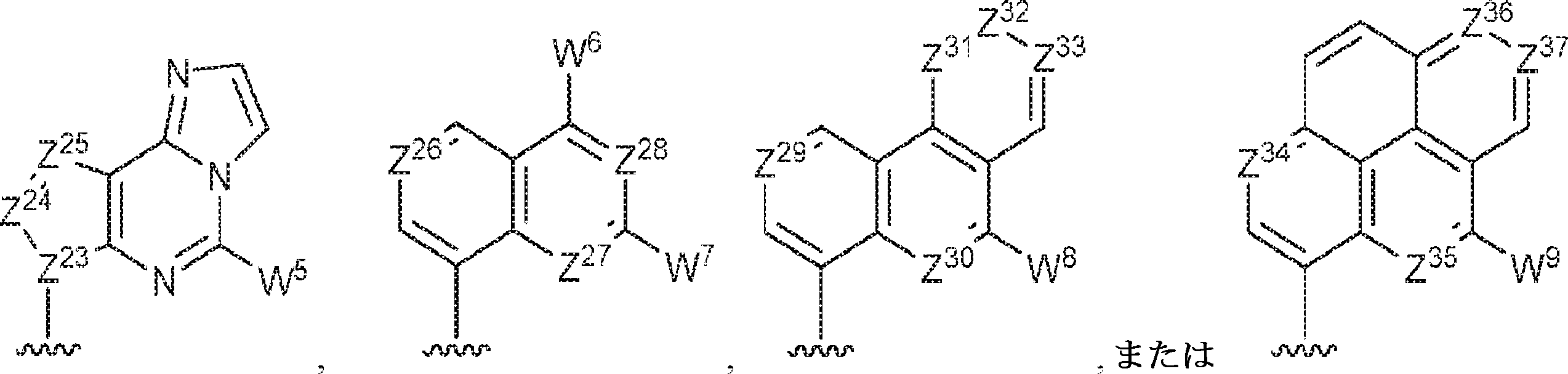
Z12、Z13、Z14、Z15、Z16、Z17、Z18、Z19、Z20、Z21、Z22、Z23、Z24、Z25、Z26、Z27、Z28、Z29、Z30、Z31、Z32、Z33、Z34、Z35、Z36、およびZ37はそれぞれ独立してCHまたはNであり;かつ
W3、W4、W5、W6、W7、W8、およびW9は独立して、水素、ハロゲン、ヒドロキシル、C1~6アルキル、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルキル、C1~6アルコキシ、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルコキシ、C3~5アルケニル-O-、C3~5アルキニル-O-、オリゴ(エチレングリコール)、ポリ(エチレングリコール)、アジド、または-NR7R8である。
の化合物またはその薬学的に許容される塩を提供し、
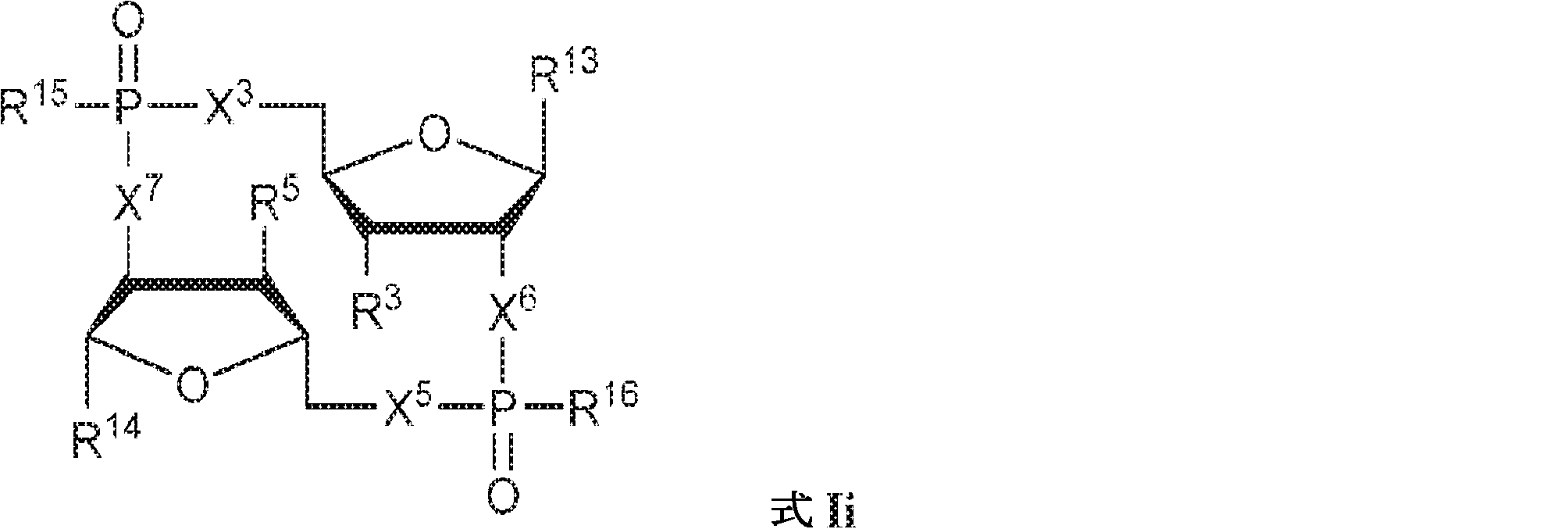
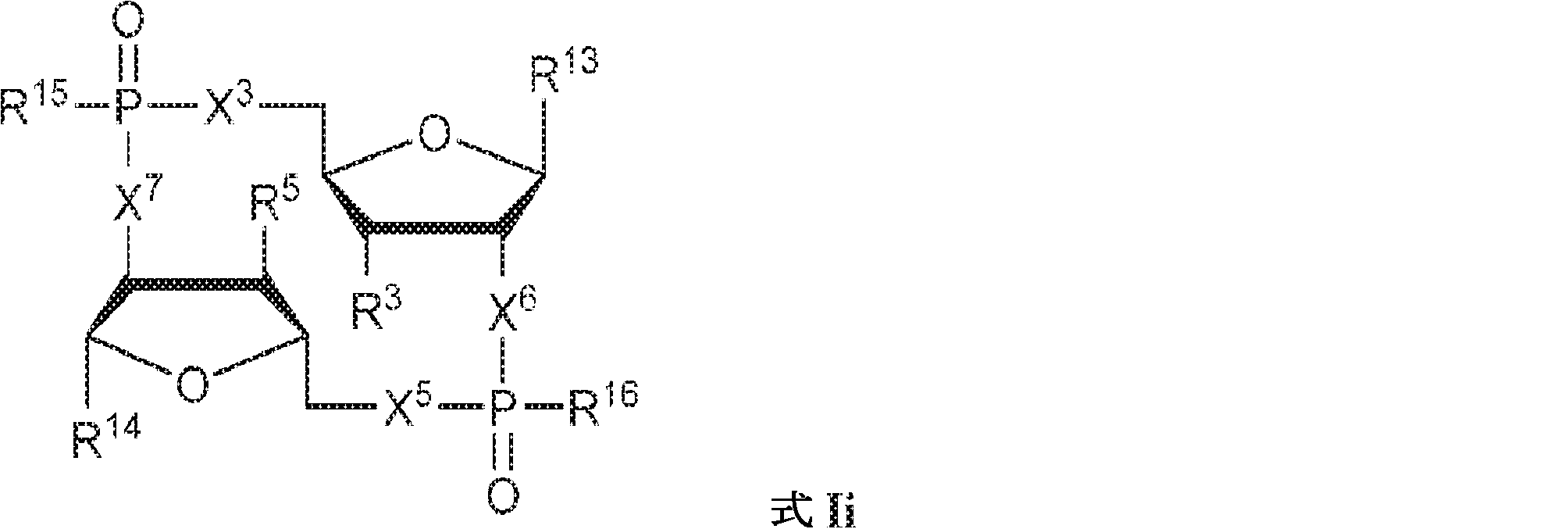
式中、
X3、X4、X5、およびX6は独立してO、NH、CH2、CHF、またはCF2であり;
R13およびR14は独立して、
からなる群より選択され;
Z12、Z13、Z14、Z15、Z16、Z17、Z18、Z19、Z20、Z21、Z22、Z23、Z24、Z25、Z26、Z27、およびZ28はそれぞれ独立してCHまたはNであり;かつ
W3、W4、W5、W6、およびW7は独立して、水素、ハロゲン、ヒドロキシル、C1~6アルキル、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルキル、C1~6アルコキシ、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルコキシ、C3~5アルケニル-O-、C3~5アルキニル-O-、オリゴ(エチレングリコール)、ポリ(エチレングリコール)、アジド、または-NR7R8であり;
R7およびR8は独立して、水素、C1~6アルキル、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルキル、環状-(C1~6アルキル)-、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、もしくはジ(C1~6アルキル)アミノ基を用いて選択的に官能基を付与された環状-(C1~6アルキル)-、環状-(C1~6オキサアルキル)-、または1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、もしくはジ(C1~6アルキル)アミノ基を用いて選択的に官能基を付与された環状-(C1~6オキサアルキル)-であり;
R3およびR4は独立して、水素、ハロゲン、ヒドロキシル、アミノ、C1~6アルキル、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルキル、C1~6アルコキシ、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルコキシ、C3~5アルケニル-O-、C3~5アルキニル-O-、オリゴ(エチレングリコール)、ポリ(エチレングリコール)、アジド、または-NR7R8であり;かつ
R15およびR16は独立して、ヒドロキシル、チオール、メトキシ、エトキシ、アミノ、N-メチルアミノ、N,N-ジメチルアミノ、N-エチルアミノ、N,N-ジエチルアミノ、N-モルホリノ、またはボラノ(-BH3 -)である。
の化合物またはその薬学的に許容される塩を提供し、
式中、
X1およびX2は独立してO、S、またはSeであり;
Z12、Z13、Z14、Z15、Z16、およびZ17は独立してCHまたはNであり;
X1に対してα位の炭素から出発するL1、およびX2に対してα位の炭素から出発するL2は独立して、-CH2O-P(O)R6-O-、-CH2O-P(S)R6-O-、-C(Y1)(Y2)O-P(O)R6-C(Y3)(Y4)-、-CH2NHSO2NH-、-CH2NHC(O)NH-、-CH2NHC(S)NH-、-CH2NHC(NH)NH-、-CH2NHC(O)CH2-、-CH2NHSO2CH2-、-CH2CH2C(O)NH-、-CH2CH2SO2NH-、-CH2NH(3,4-ジオキソシクロブテン-1,2-ジイル)NH-、
であり;
cは0、1、または2であり;
d、e、およびfは独立して0または1であり;
Y1、Y2、Y3、およびY4は独立してHまたはFであり;
R6は、ヒドロキシル、チオール、C1~6アルキル、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルキル、C1~6アルコキシ、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルコキシ、C3~5アルケニル-O-、C3~5アルキニル-O-、オリゴ(エチレングリコール)、ポリ(エチレングリコール)、ボラノ(-BH3 -)、または-NR7R8であり;
R7およびR8は独立して、水素、C1~6アルキル、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルキル、環状-(C1~6アルキル)-、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、もしくはジ(C1~6アルキル)アミノ基を用いて選択的に官能基を付与された環状-(C1~6アルキル)-、環状-(C1~6オキサアルキル)-、または1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、もしくはジ(C1~6アルキル)アミノ基を用いて選択的に官能基を付与された環状-(C1~6オキサアルキル)-であり;かつ
R3およびR5は独立して、水素、ハロゲン、ヒドロキシル、アミノ、C1~6アルキル、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルキル、C1~6アルコキシ、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルコキシ、C3~5アルケニル-O-、C3~5アルキニル-O-、オリゴ(エチレングリコール)、ポリ(エチレングリコール)、アジド、または-NR7R8である。
の化合物またはその薬学的に許容される塩を提供し、
式中、
Z12、Z13、Z14、Z15、Z16、およびZ17は独立してCHまたはNであり;
R3およびR5は独立して、水素、ハロゲン、ヒドロキシル、アミノ、C1~6アルキル、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルキル、C1~6アルコキシ、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルコキシ、C3~5アルケニル-O-、C3~5アルキニル-O-、オリゴ(エチレングリコール)、ポリ(エチレングリコール)、アジド、または-NR7R8であり;
R7およびR8は独立して、水素、C1~6アルキル、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルキル、環状-(C1~6アルキル)-、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、もしくはジ(C1~6アルキル)アミノ基を用いて選択的に官能基を付与された環状-(C1~6アルキル)-、環状-(C1~6オキサアルキル)-、または1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、もしくはジ(C1~6アルキル)アミノ基を用いて選択的に官能基を付与された環状-(C1~6オキサアルキル)-であり;かつ
R9およびR10は独立して、ヒドロキシル、チオール、C1~6アルキル、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルキル、C1~6アルコキシ、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルコキシ、C3~5アルケニル-O-、C3~5アルキニル-O-、オリゴ(エチレングリコール)、ポリ(エチレングリコール)、ボラノ(-BH3 -)、または-NR7R8である。
の化合物またはその薬学的に許容される塩を提供し、
式中、
X1およびX2は独立してO、S、またはSeであり;
X1に対してα位の炭素から出発するL1、およびX2に対してα位の炭素から出発するL2は独立して、-CH2O-P(O)R6-O-、-CH2O-P(S)R6-O-、-C(Y1)(Y2)O-P(O)R6-C(Y3)(Y4)-、-CH2NHSO2NH-、-CH2NHC(O)NH-、-CH2NHC(S)NH-、-CH2NHC(NH)NH-、-CH2NHC(O)CH2-、-CH2NHSO2CH2-、-CH2CH2C(O)NH-、-CH2CH2SO2NH-、-CH2NH(3,4-ジオキソシクロブテン-1,2-ジイル)NH-、
であり;
cは0、1、または2であり;
d、e、およびfは独立して0または1であり;
Y1、Y2、Y3、およびY4は独立してHまたはFであり;
R6は、ヒドロキシル、チオール、C1~6アルキル、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルキル、C1~6アルコキシ、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルコキシ、C3~5アルケニル-O-、C3~5アルキニル-O-、オリゴ(エチレングリコール)、ポリ(エチレングリコール)、ボラノ(-BH3 -)、または-NR7R8であり;
R7およびR8は独立して、水素、C1~6アルキル、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルキル、環状-(C1~6アルキル)-、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、もしくはジ(C1~6アルキル)アミノ基を用いて選択的に官能基を付与された環状-(C1~6アルキル)-、環状-(C1~6オキサアルキル)-、または1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、もしくはジ(C1~6アルキル)アミノ基を用いて選択的に官能基を付与された環状-(C1~6オキサアルキル)-であり;
R3およびR5は独立して、水素、ハロゲン、ヒドロキシル、アミノ、C1~6アルキル、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルキル、C1~6アルコキシ、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルコキシ、C3~5アルケニル-O-、C3~5アルキニル-O-、オリゴ(エチレングリコール)、ポリ(エチレングリコール)、アジド、または-NR7R8であり;
R11およびR12は独立して、
からなる群より選択され、R11およびR12のうち少なくとも一方は
であり;
Z12、Z13、Z14、Z15、Z16、Z17、Z18、Z19、Z20、Z21、Z22、Z23、Z24、Z25、Z26、Z27、Z28、Z29、Z30、Z31、Z32、Z33、Z34、Z35、Z36、およびZ37はそれぞれ独立してCHまたはNであり;かつ
W3、W4、W5、W6、W7、W8、およびW9は独立して、水素、ハロゲン、ヒドロキシル、C1~6アルキル、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルキル、C1~6アルコキシ、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルコキシ、C3~5アルケニル-O-、C3~5アルキニル-O-、オリゴ(エチレングリコール)、ポリ(エチレングリコール)、アジド、または-NR7R8である。
の化合物またはその薬学的に許容される塩を提供し、
式中、
X3、X5、X6、およびX7は独立してO、NH、CH2、CHF、またはCF2であり;
R13およびR14は独立して、
からなる群より選択され;
Z12、Z13、Z14、Z15、Z16、Z17、Z18、Z19、Z20、Z21、Z22、Z23、Z24、Z25、Z26、Z27、およびZ28はそれぞれ独立してCHまたはNであり;かつ
W3、W4、W5、W6、およびW7は独立して、水素、ハロゲン、ヒドロキシル、C1~6アルキル、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルキル、C1~6アルコキシ、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルコキシ、C3~5アルケニル-O-、C3~5アルキニル-O-、オリゴ(エチレングリコール)、ポリ(エチレングリコール)、アジド、または-NR7R8であり;
R7およびR8は独立して、水素、C1~6アルキル、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルキル、環状-(C1~6アルキル)-、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、もしくはジ(C1~6アルキル)アミノ基を用いて選択的に官能基を付与された環状-(C1~6アルキル)-、環状-(C1~6オキサアルキル)-、または1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、もしくはジ(C1~6アルキル)アミノ基を用いて選択的に官能基を付与された環状-(C1~6オキサアルキル)-であり;
R3およびR5は独立して、水素、ハロゲン、ヒドロキシル、アミノ、C1~6アルキル、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルキル、C1~6アルコキシ、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルコキシ、C3~5アルケニル-O-、C3~5アルキニル-O-、オリゴ(エチレングリコール)、ポリ(エチレングリコール)、アジド、または-NR7R8であり;かつ
R15およびR16は独立して、ヒドロキシル、チオール、メトキシ、エトキシ、アミノ、N-メチルアミノ、N,N-ジメチルアミノ、N-エチルアミノ、N,N-ジエチルアミノ、N-モルホリノ、またはボラノ(-BH3 -)である。
[本発明1001]
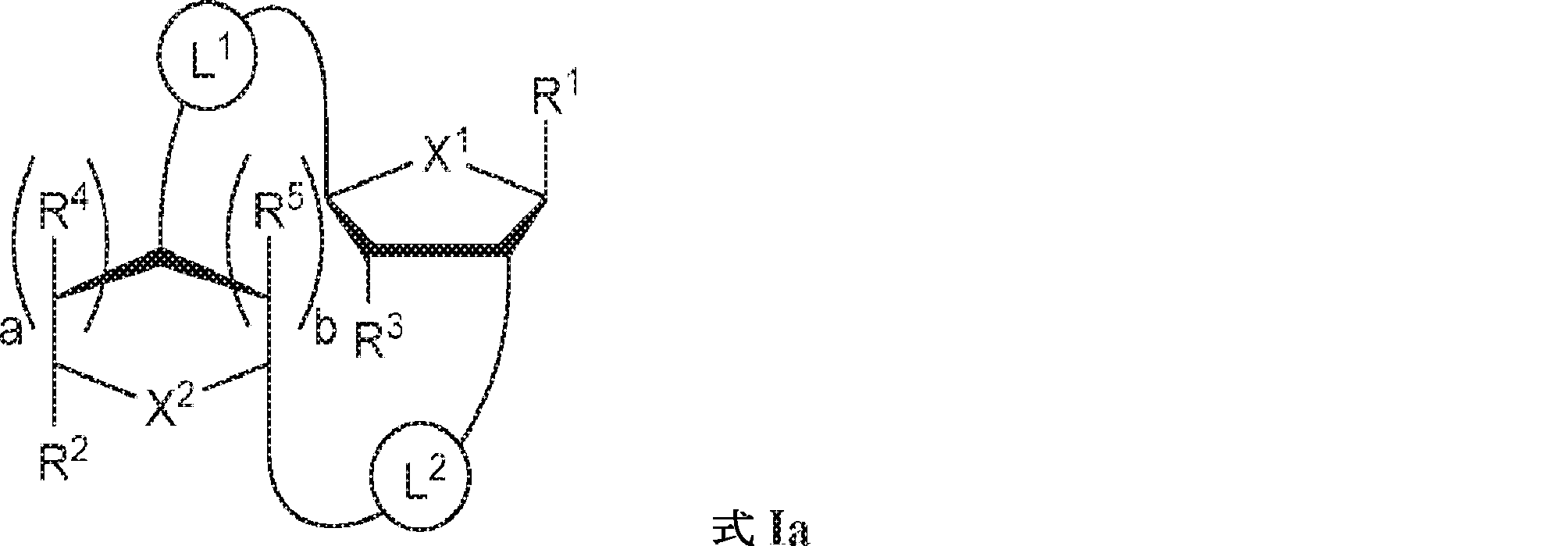
式Ia:
の化合物またはその薬学的に許容される塩:
式中、
aおよびbは独立して0または1であり、かつ、aが1でありbが0でありかつR5が存在しない場合; およびaが0でありbが1でありかつR4が存在しない場合にa + b = 1であり;
X1およびX2は独立して5員環中のO、S、またはSeであり;
X1に対してα位の炭素から出発するL1、およびX2に対してα位の炭素から出発するL2は独立して、-CH2O-P(O)R6-O-、-CH2O-P(S)R6-O-、-C(Y1)(Y2)O-P(O)R6-C(Y3)(Y4)-、-CH2NHSO2NH-、-CH2NHC(O)NH-、-CH2NHC(S)NH-、-CH2NHC(NH)NH-、-CH2NHC(O)CH2-、-CH2NHSO2CH2-、-CH2CH2C(O)NH-、-CH2CH2SO2NH-、-CH2NH(3,4-ジオキソシクロブテン-1,2-ジイル)NH-、
であり;
cは0、1、または2であり;
d、e、およびfは独立して0または1であり;
Y1、Y2、Y3、およびY4は独立してHまたはFであり;
R6は、ヒドロキシル、チオール、C1~6アルキル、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルキル、C1~6アルコキシ、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルコキシ、C3~5アルケニル-O-、C3~5アルキニル-O-、オリゴ(エチレングリコール)、ポリ(エチレングリコール)、ボラノ(-BH3 -)、または-NR7R8であり;
R7およびR8は独立して、水素、C1~6アルキル、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルキル、環状-(C1~6アルキル)-、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、もしくはジ(C1~6アルキル)アミノ基を用いて選択的に官能基を付与された環状-(C1~6アルキル)-、環状-(C1~6オキサアルキル)-、または1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、もしくはジ(C1~6アルキル)アミノ基を用いて選択的に官能基を付与された環状-(C1~6オキサアルキル)-であり;
R1およびR2は独立して、互変異性形態を含む以下の一般構造:
を有する芳香環または芳香族複素環であり;
gおよびhは独立して0または1であり;
W1およびW2は独立して、水素、ハロゲン、ヒドロキシル、C1~6アルキル、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルキル、C1~6アルコキシ、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルコキシ、C3~5アルケニル-O-、C3~5アルキニル-O-、オリゴ(エチレングリコール)、ポリ(エチレングリコール)、アジド、または-NR7R8であり;
Z1、Z2、Z3、Z4、Z5、およびZ6は独立してCHまたはNであり;
存在する場合に、Z7、Z8、Z9、Z10、およびZ11は独立してCHまたはNであり、さらにW1はCHまたはNであり;
R3、R4、およびR5は独立して、水素、ハロゲン、ヒドロキシル、アミノ、C1~6アルキル、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルキル、C1~6アルコキシ、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルコキシ、C3~5アルケニル-O-、C3~5アルキニル-O-、オリゴ(エチレングリコール)、ポリ(エチレングリコール)、アジド、または-NR7R8であり;かつ
該化合物は2'3'-cGAMPではない。
[本発明1002]
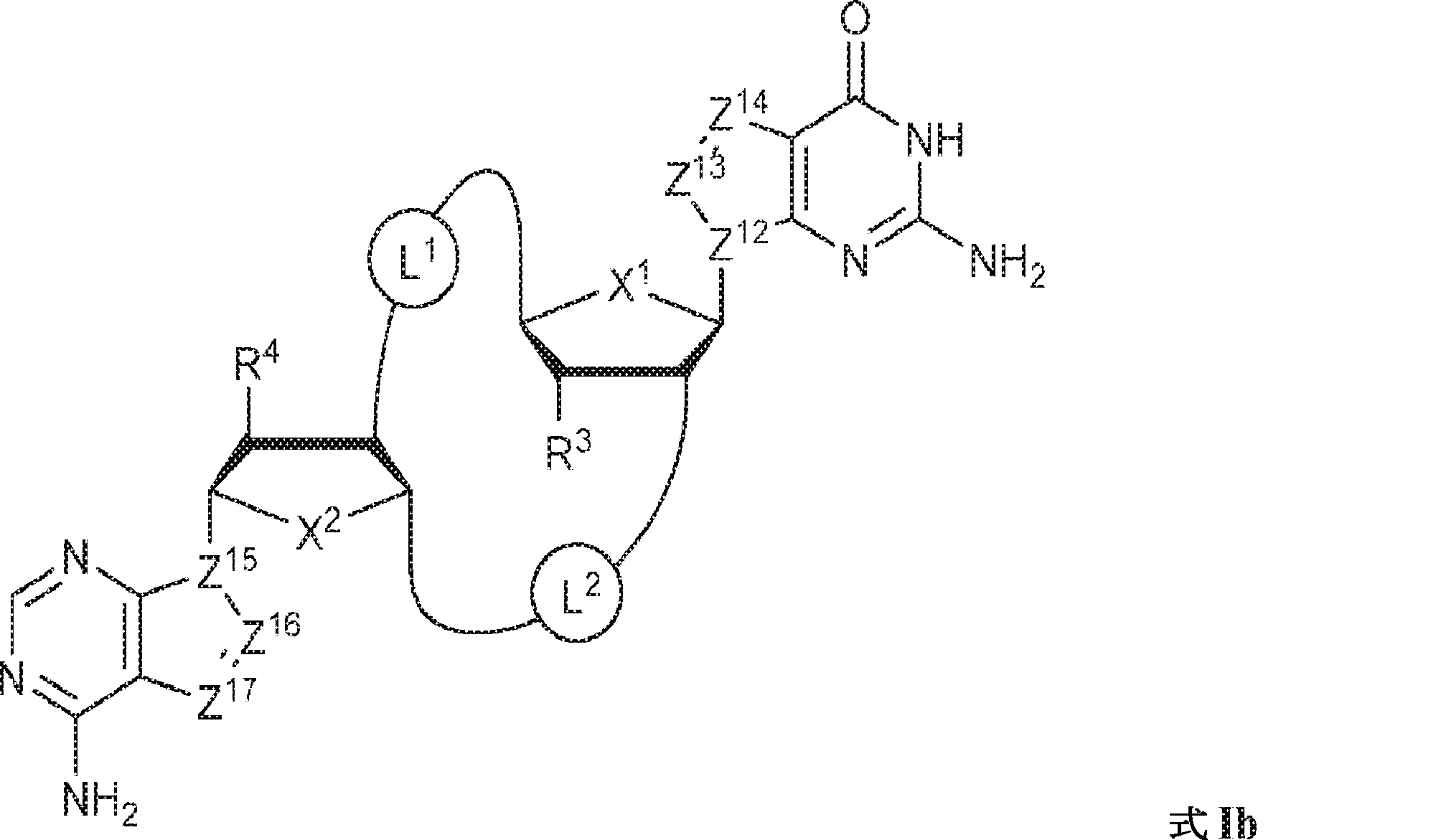
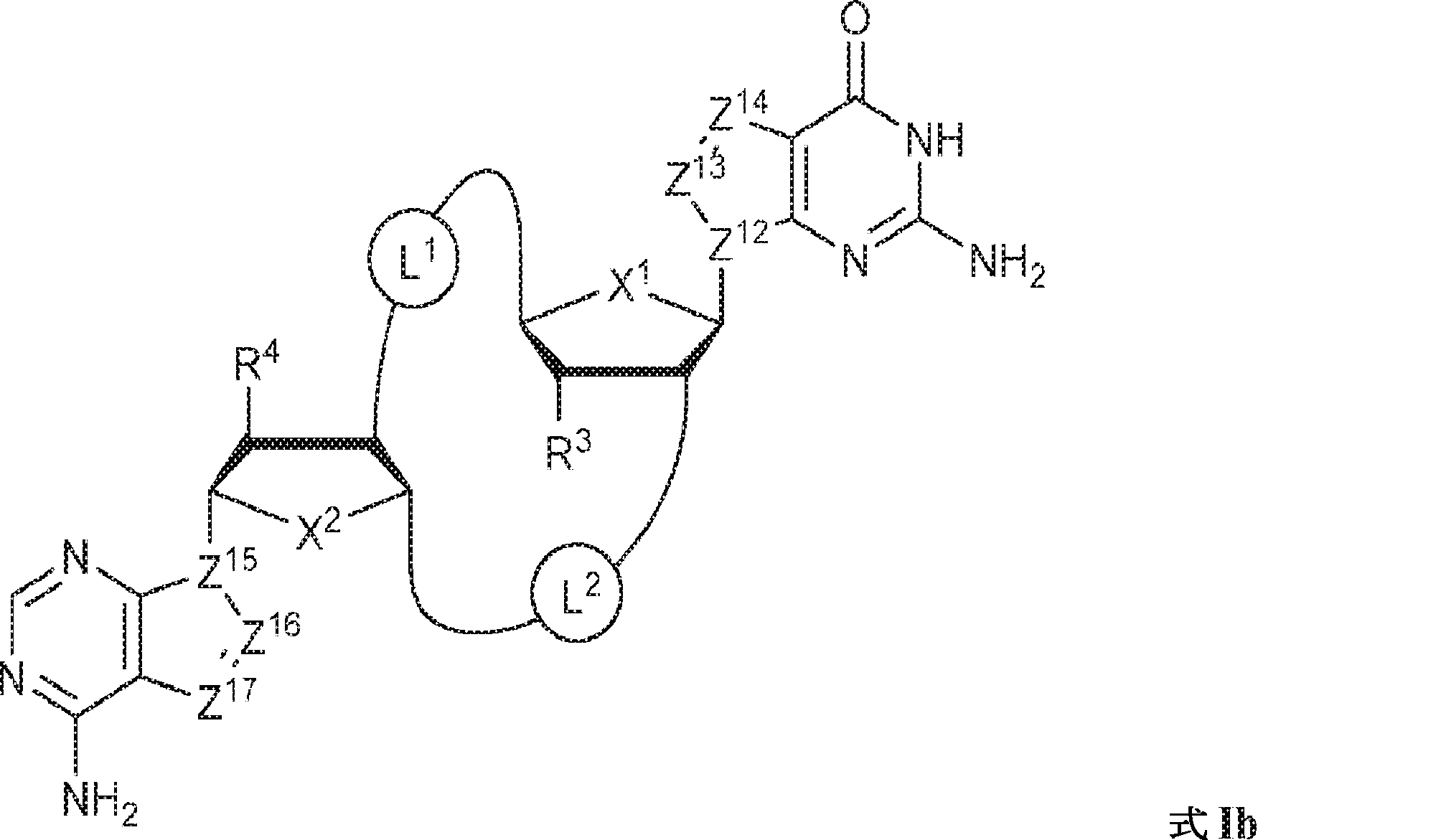
式Ib:
の化合物またはその薬学的に許容される塩である、本発明1001の化合物:
式中、
X1およびX2は独立してO、S、またはSeであり;
Z12、Z13、Z14、Z15、Z16、およびZ17は独立してCHまたはNであり;
X1に対してα位の炭素から出発するL1、およびX2に対してα位の炭素から出発するL2は独立して、-CH2O-P(O)R6-O-、-CH2O-P(S)R6-O-、-C(Y1)(Y2)O-P(O)R6-C(Y3)(Y4)-、-CH2NHSO2NH-、-CH2NHC(O)NH-、-CH2NHC(S)NH-、-CH2NHC(NH)NH-、-CH2NHC(O)CH2-、-CH2NHSO2CH2-、-CH2CH2C(O)NH-、-CH2CH2SO2NH-、-CH2NH(3,4-ジオキソシクロブテン-1,2-ジイル)NH-、
であり;
cは0、1、または2であり;
d、e、およびfは独立して0または1であり;
Y1、Y2、Y3、およびY4は独立してHまたはFであり;
R6は、ヒドロキシル、チオール、C1~6アルキル、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルキル、C1~6アルコキシ、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルコキシ、C3~5アルケニル-O-、C3~5アルキニル-O-、オリゴ(エチレングリコール)、ポリ(エチレングリコール)、ボラノ(-BH3 -)、または-NR7R8であり;
R7およびR8は独立して、水素、C1~6アルキル、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルキル、環状-(C1~6アルキル)-、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、もしくはジ(C1~6アルキル)アミノ基を用いて選択的に官能基を付与された環状-(C1~6アルキル)-、環状-(C1~6オキサアルキル)-、または1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、もしくはジ(C1~6アルキル)アミノ基を用いて選択的に官能基を付与された環状-(C1~6オキサアルキル)-であり;
R3およびR4は独立して、水素、ハロゲン、ヒドロキシル、アミノ、C1~6アルキル、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルキル、C1~6アルコキシ、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルコキシ、C3~5アルケニル-O-、C3~5アルキニル-O-、オリゴ(エチレングリコール)、ポリ(エチレングリコール)、アジド、または-NR7R8であり;かつ
該化合物は、2'3'-cGAMPを含む既に開示された化合物ではない。
[本発明1003]
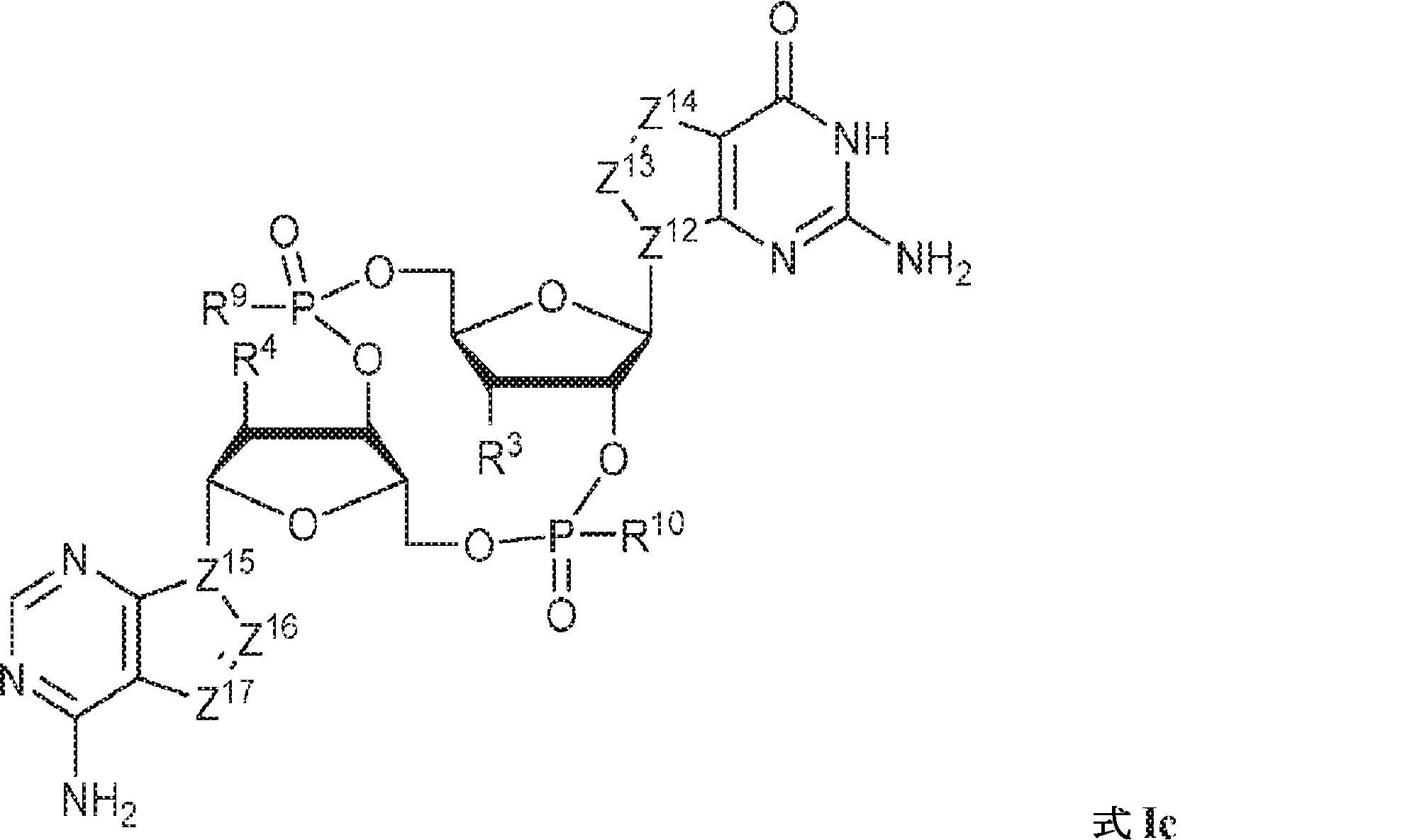
式Ic:
の化合物またはその薬学的に許容される塩である、本発明1001の化合物:
式中、
Z12、Z13、Z14、Z15、Z16、およびZ17は独立してCHまたはNであり;
R3およびR4は独立して、水素、ハロゲン、ヒドロキシル、アミノ、C1~6アルキル、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルキル、C1~6アルコキシ、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルコキシ、C3~5アルケニル-O-、C3~5アルキニル-O-、オリゴ(エチレングリコール)、ポリ(エチレングリコール)、アジド、または-NR7R8であり;
R7およびR8は独立して、水素、C1~6アルキル、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルキル、環状-(C1~6アルキル)-、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、もしくはジ(C1~6アルキル)アミノ基を用いて選択的に官能基を付与された環状-(C1~6アルキル)-、環状-(C1~6オキサアルキル)-、または1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、もしくはジ(C1~6アルキル)アミノ基を用いて選択的に官能基を付与された環状-(C1~6オキサアルキル)-であり;
R9およびR10は独立して、ヒドロキシル、チオール、C1~6アルキル、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルキル、C1~6アルコキシ、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルコキシ、C3~5アルケニル-O-、C3~5アルキニル-O-、オリゴ(エチレングリコール)、ポリ(エチレングリコール)、ボラノ(-BH3 -)、または-NR7R8であり;
式Icの一方または両方のテトラヒドロフラニル環中の酸素原子は硫黄原子またはセレン原子で置き換えられていてもよく;かつ
該化合物は2'3'-cGAMPではない。
[本発明1004]
式Id:
の化合物またはその薬学的に許容される塩である、本発明1001の化合物:
式中、
X1およびX2は独立してO、S、またはSeであり;
X1に対してα位の炭素から出発するL1、およびX2に対してα位の炭素から出発するL2は独立して、-CH2O-P(O)R6-O-、-CH2O-P(S)R6-O-、-C(Y1)(Y2)O-P(O)R6-C(Y3)(Y4)-、-CH2NHSO2NH-、-CH2NHC(O)NH-、-CH2NHC(S)NH-、-CH2NHC(NH)NH-、-CH2NHC(O)CH2-、-CH2NHSO2CH2-、-CH2CH2C(O)NH-、-CH2CH2SO2NH-、-CH2NH(3,4-ジオキソシクロブテン-1,2-ジイル)NH-、
であり;
cは0、1、または2であり;
d、e、およびfは独立して0または1であり;
Y1、Y2、Y3、およびY4は独立してHまたはFであり;
R6は、ヒドロキシル、チオール、C1~6アルキル、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルキル、C1~6アルコキシ、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルコキシ、C3~5アルケニル-O-、C3~5アルキニル-O-、オリゴ(エチレングリコール)、ポリ(エチレングリコール)、ボラノ(-BH3 -)、または-NR7R8であり;
R7およびR8は独立して、水素、C1~6アルキル、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルキル、環状-(C1~6アルキル)-、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、もしくはジ(C1~6アルキル)アミノ基を用いて選択的に官能基を付与された環状-(C1~6アルキル)-、環状-(C1~6オキサアルキル)-、または1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、もしくはジ(C1~6アルキル)アミノ基を用いて選択的に官能基を付与された環状-(C1~6オキサアルキル)-であり;
R3およびR4は独立して、水素、ハロゲン、ヒドロキシル、アミノ、C1~6アルキル、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルキル、C1~6アルコキシ、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルコキシ、C3~5アルケニル-O-、C3~5アルキニル-O-、オリゴ(エチレングリコール)、ポリ(エチレングリコール)、アジド、または-NR7R8であり;
R11およびR12は独立して、
からなる群より選択され、R11およびR12のうち少なくとも一方は
であり;
Z12、Z13、Z14、Z15、Z16、Z17、Z18、Z19、Z20、Z21、Z22、Z23、Z24、Z25、Z26、Z27、Z28、Z29、Z30、Z31、Z32、Z33、Z34、Z35、Z36、およびZ37はそれぞれ独立してCHまたはNであり;かつ
W3、W4、W5、W6、W7、W8、およびW9は独立して、水素、ハロゲン、ヒドロキシル、C1~6アルキル、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルキル、C1~6アルコキシ、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルコキシ、C3~5アルケニル-O-、C3~5アルキニル-O-、オリゴ(エチレングリコール)、ポリ(エチレングリコール)、アジド、または-NR7R8である。
[本発明1005]
式Ie:
の化合物またはその薬学的に許容される塩である、本発明1001の化合物:
式中、
X3、X4、X5、およびX6は独立してO、NH、CH2、CHF、またはCF2であり;
R13およびR14は独立して、
からなる群より選択され;
Z12、Z13、Z14、Z15、Z16、Z17、Z18、Z19、Z20、Z21、Z22、Z23、Z24、Z25、Z26、Z27、およびZ28はそれぞれ独立してCHまたはNであり;かつ
W3、W4、W5、W6、およびW7は独立して、水素、ハロゲン、ヒドロキシル、C1~6アルキル、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルキル、C1~6アルコキシ、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルコキシ、C3~5アルケニル-O-、C3~5アルキニル-O-、オリゴ(エチレングリコール)、ポリ(エチレングリコール)、アジド、または-NR7R8であり;
R7およびR8は独立して、水素、C1~6アルキル、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルキル、環状-(C1~6アルキル)-、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、もしくはジ(C1~6アルキル)アミノ基を用いて選択的に官能基を付与された環状-(C1~6アルキル)-、環状-(C1~6オキサアルキル)-、または1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、もしくはジ(C1~6アルキル)アミノ基を用いて選択的に官能基を付与された環状-(C1~6オキサアルキル)-であり;
R3およびR4は独立して、水素、ハロゲン、ヒドロキシル、アミノ、C1~6アルキル、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルキル、C1~6アルコキシ、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルコキシ、C3~5アルケニル-O-、C3~5アルキニル-O-、オリゴ(エチレングリコール)、ポリ(エチレングリコール)、アジド、または-NR7R8であり;
R15およびR16は独立して、ヒドロキシル、チオール、メトキシ、エトキシ、アミノ、N-メチルアミノ、N,N-ジメチルアミノ、N-エチルアミノ、N,N-ジエチルアミノ、N-モルホリノ、またはボラノ(-BH3 -)であり;
式Ieの一方または両方のテトラヒドロフラニル環中の酸素原子は硫黄原子またはセレン原子で置き換えられていてもよく;かつ
該化合物は2'3'-cGAMPではない。
[本発明1006]
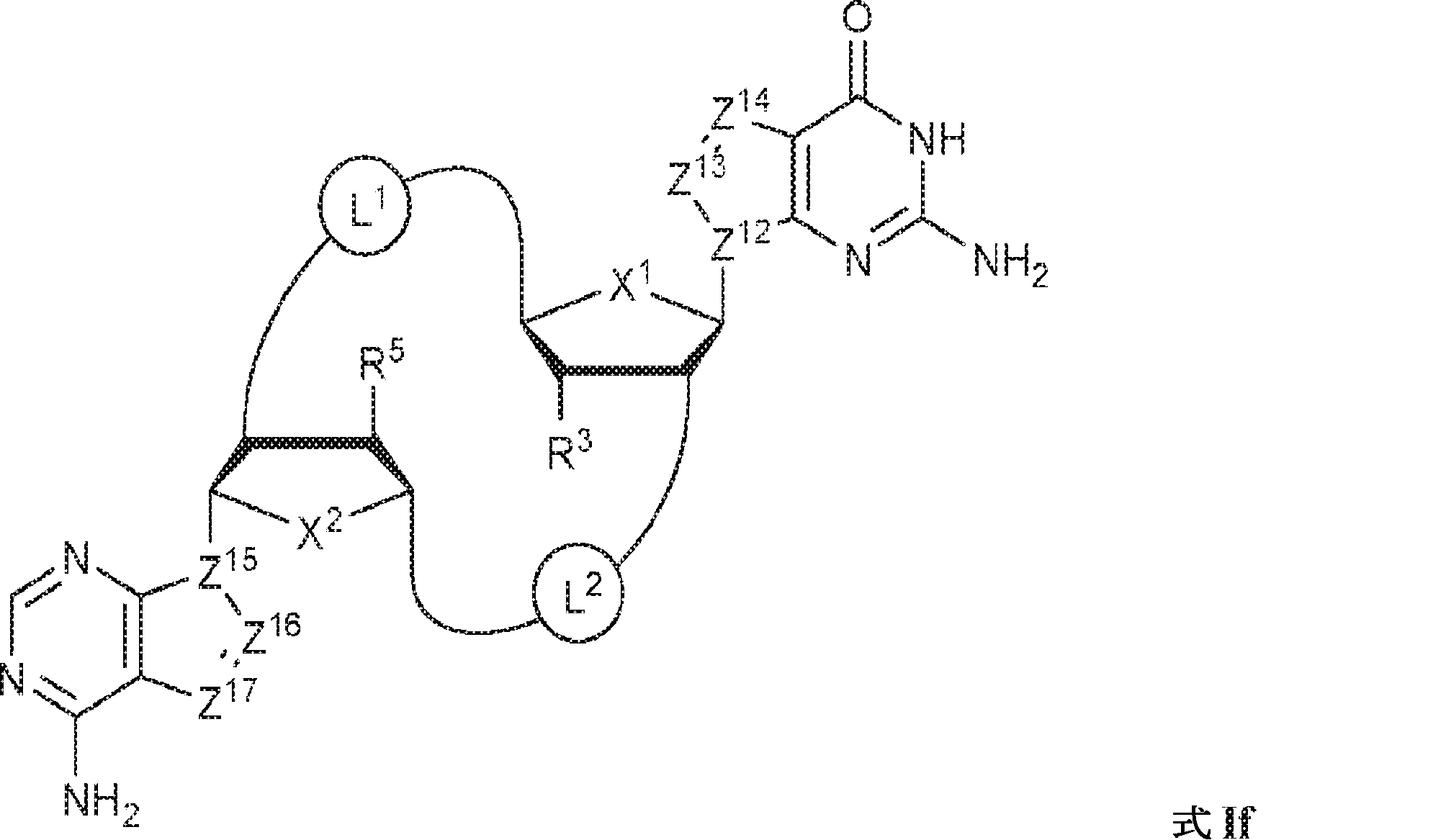
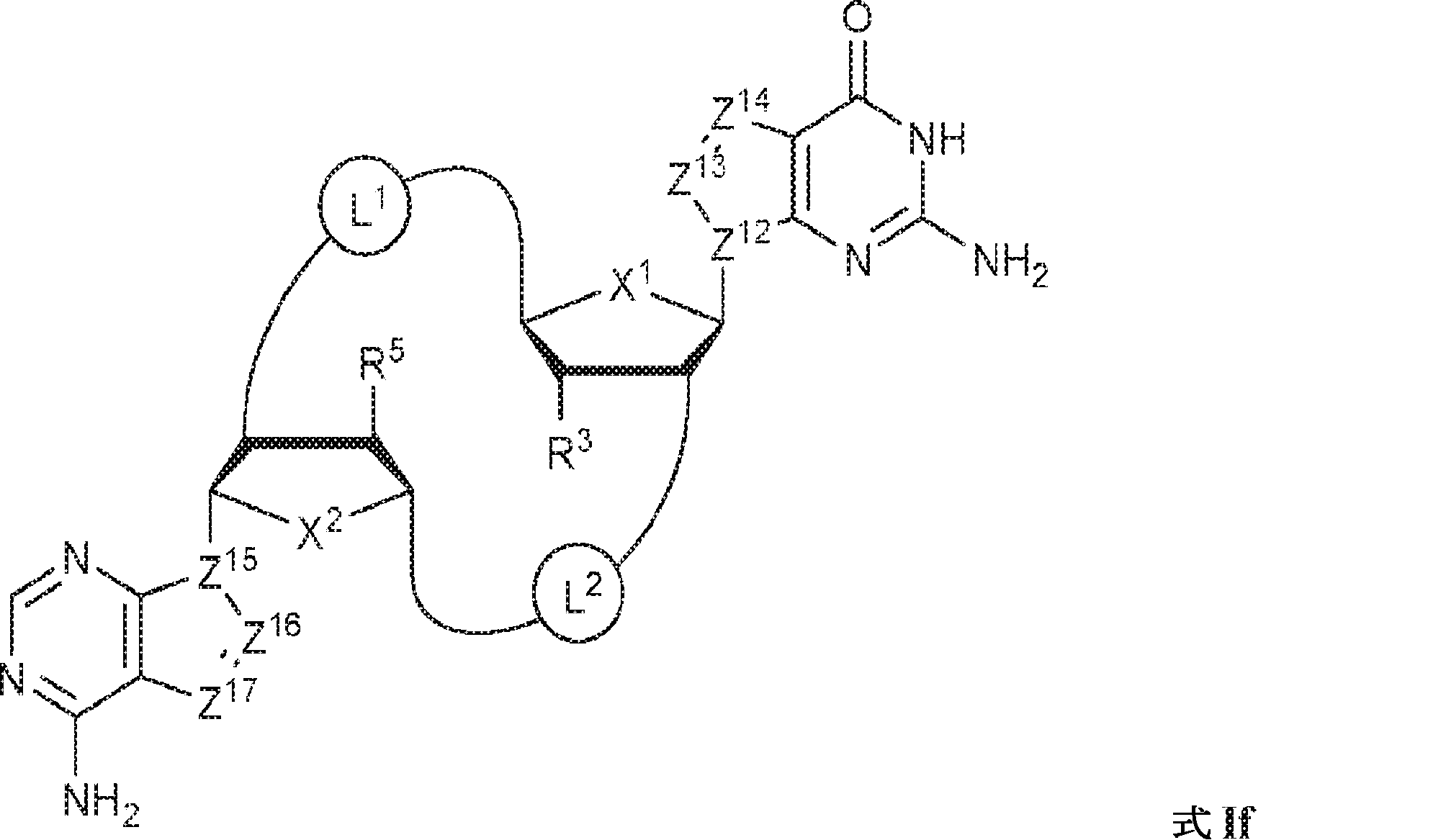
式If:
の化合物またはその薬学的に許容される塩である、本発明1001の化合物:
式中、
X1およびX2は独立してO、S、またはSeであり;
Z12、Z13、Z14、Z15、Z16、およびZ17は独立してCHまたはNであり;
X1に対してα位の炭素から出発するL1、およびX2に対してα位の炭素から出発するL2は独立して、-CH2O-P(O)R6-O-、-CH2O-P(S)R6-O-、-C(Y1)(Y2)O-P(O)R6-C(Y3)(Y4)-、-CH2NHSO2NH-、-CH2NHC(O)NH-、-CH2NHC(S)NH-、-CH2NHC(NH)NH-、-CH2NHC(O)CH2-、-CH2NHSO2CH2-、-CH2CH2C(O)NH-、-CH2CH2SO2NH-、-CH2NH(3,4-ジオキソシクロブテン-1,2-ジイル)NH-、
であり;
cは0、1、または2であり;
d、e、およびfは独立して0または1であり;
Y1、Y2、Y3、およびY4は独立してHまたはFであり;
R6は、ヒドロキシル、チオール、C1~6アルキル、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルキル、C1~6アルコキシ、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルコキシ、C3~5アルケニル-O-、C3~5アルキニル-O-、オリゴ(エチレングリコール)、ポリ(エチレングリコール)、ボラノ(-BH3 -)、または-NR7R8であり;
R7およびR8は独立して、水素、C1~6アルキル、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルキル、環状-(C1~6アルキル)-、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、もしくはジ(C1~6アルキル)アミノ基を用いて選択的に官能基を付与された環状-(C1~6アルキル)-、環状-(C1~6オキサアルキル)-、または1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、もしくはジ(C1~6アルキル)アミノ基を用いて選択的に官能基を付与された環状-(C1~6オキサアルキル)-であり;
R3およびR5は独立して、水素、ハロゲン、ヒドロキシル、アミノ、C1~6アルキル、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルキル、C1~6アルコキシ、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルコキシ、C3~5アルケニル-O-、C3~5アルキニル-O-、オリゴ(エチレングリコール)、ポリ(エチレングリコール)、アジド、または-NR7R8であり;かつ
該化合物は2'2'-cGAMPではない。
[本発明1007]
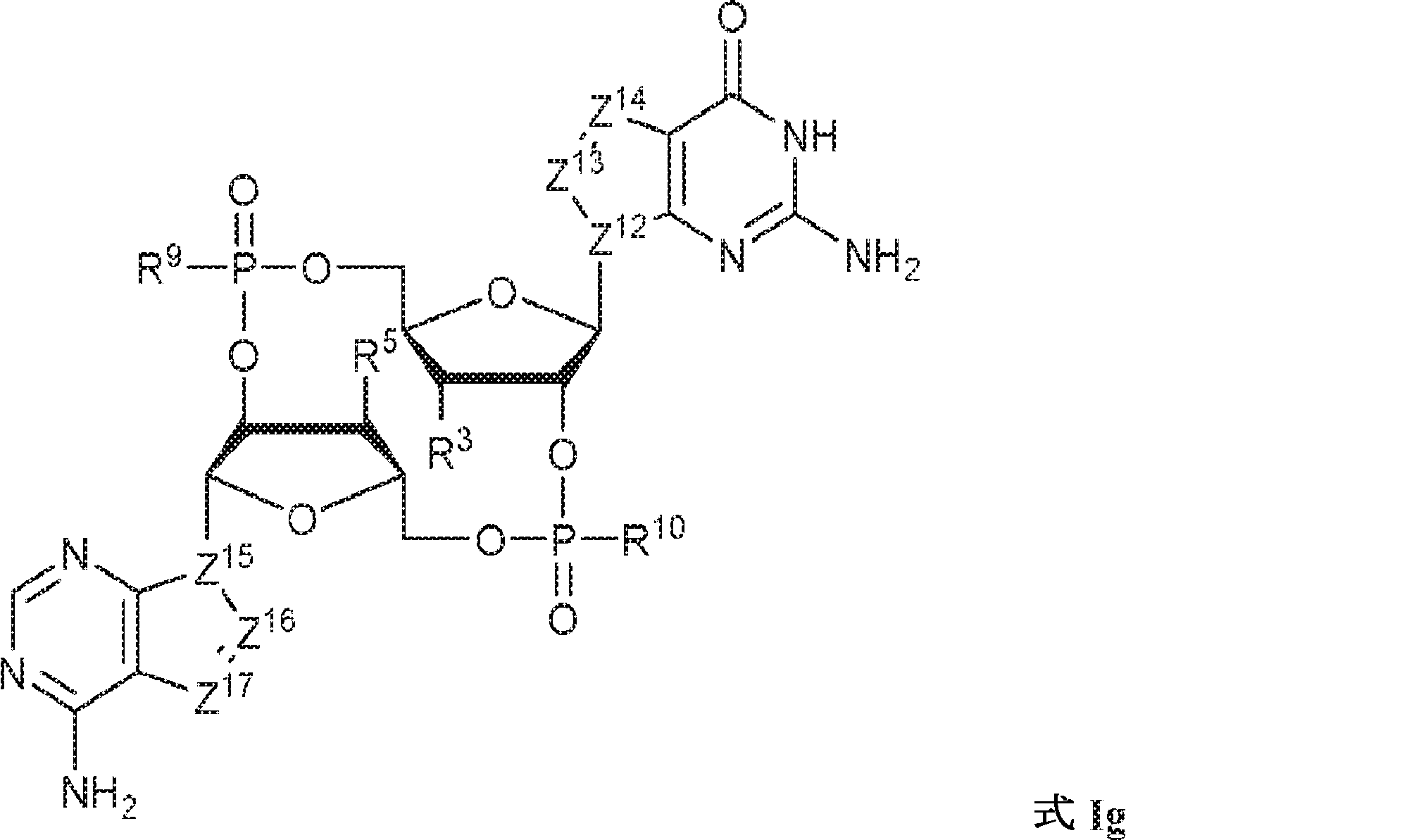
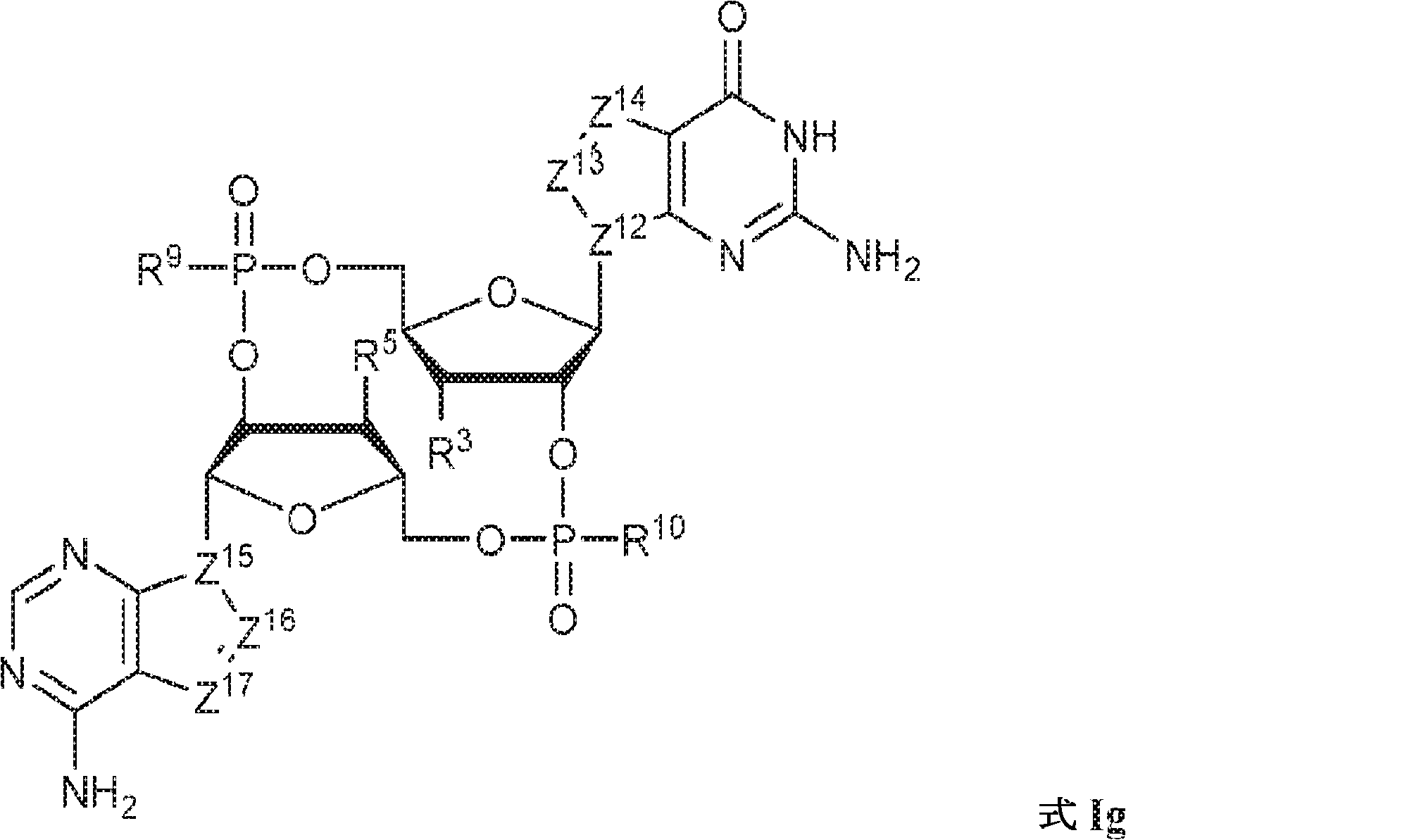
式Ig:
の化合物またはその薬学的に許容される塩である、本発明1001の化合物:
式中、
Z12、Z13、Z14、Z15、Z16、およびZ17は独立してCHまたはNであり;
R3およびR5は独立して、水素、ハロゲン、ヒドロキシル、アミノ、C1~6アルキル、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルキル、C1~6アルコキシ、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルコキシ、C3~5アルケニル-O-、C3~5アルキニル-O-、オリゴ(エチレングリコール)、ポリ(エチレングリコール)、アジド、または-NR7R8であり;
R7およびR8は独立して、水素、C1~6アルキル、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルキル、環状-(C1~6アルキル)-、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、もしくはジ(C1~6アルキル)アミノ基を用いて選択的に官能基を付与された環状-(C1~6アルキル)-、環状-(C1~6オキサアルキル)-、または1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、もしくはジ(C1~6アルキル)アミノ基を用いて選択的に官能基を付与された環状-(C1~6オキサアルキル)-であり;
R9およびR10は独立して、ヒドロキシル、チオール、C1~6アルキル、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルキル、C1~6アルコキシ、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルコキシ、C3~5アルケニル-O-、C3~5アルキニル-O-、オリゴ(エチレングリコール)、ポリ(エチレングリコール)、ボラノ(-BH3 -)、または-NR7R8であり;
式Igの一方または両方のテトラヒドロフラニル環中の酸素原子は硫黄原子またはセレン原子で置き換えられていてもよく;かつ
該化合物は2'2'-cGAMPではない。
[本発明1008]
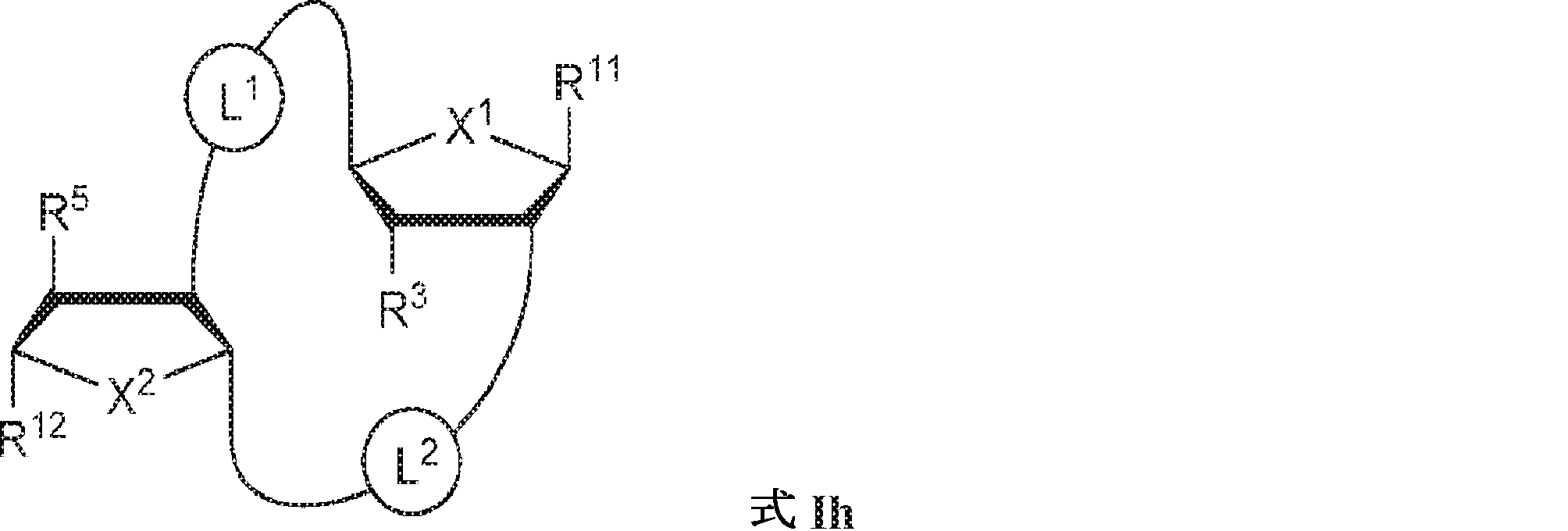
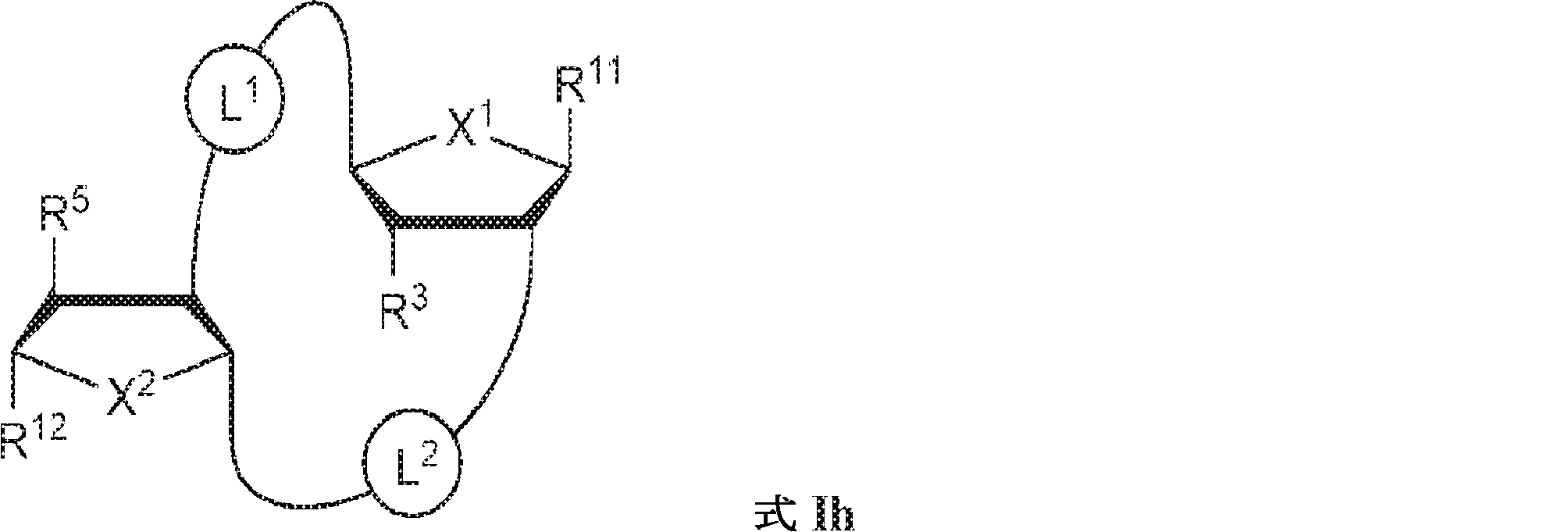
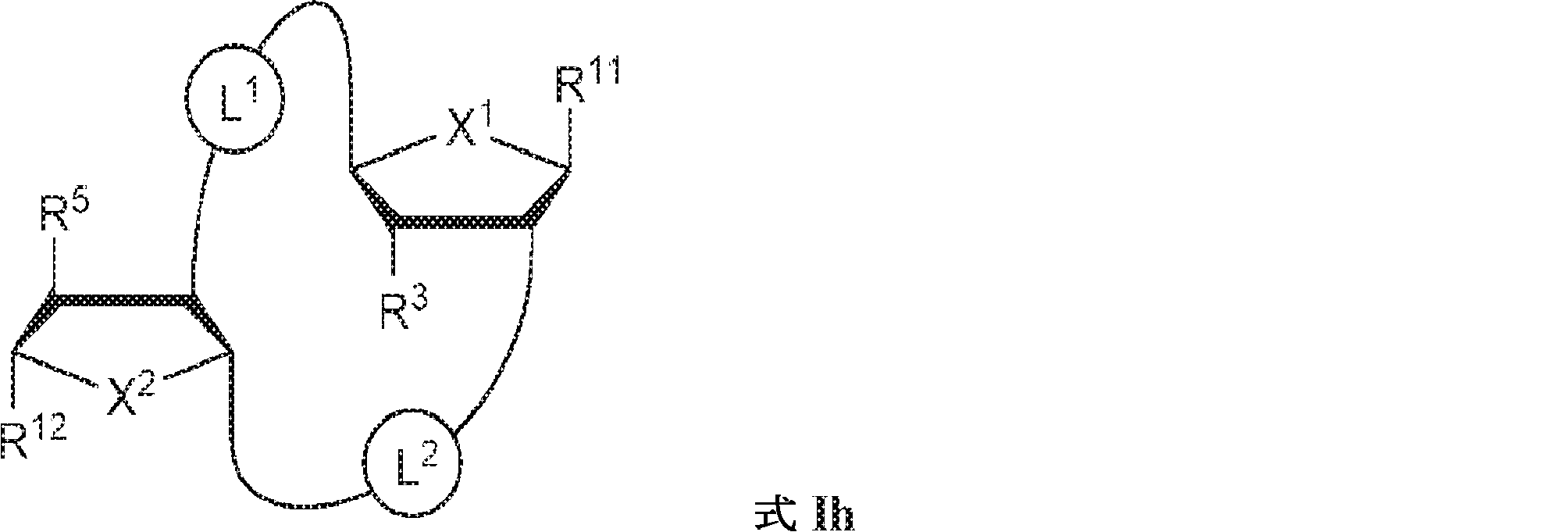
式Ih:
の化合物またはその薬学的に許容される塩である、本発明1001の化合物:
式中、
X1およびX2は独立してO、S、またはSeであり;
X1に対してα位の炭素から出発するL1、およびX2に対してα位の炭素から出発するL2は独立して、-CH2O-P(O)R6-O-、-CH2O-P(S)R6-O-、-C(Y1)(Y2)O-P(O)R6-C(Y3)(Y4)-、-CH2NHSO2NH-、-CH2NHC(O)NH-、-CH2NHC(S)NH-、-CH2NHC(NH)NH-、-CH2NHC(O)CH2-、-CH2NHSO2CH2-、-CH2CH2C(O)NH-、-CH2CH2SO2NH-、-CH2NH(3,4-ジオキソシクロブテン-1,2-ジイル)NH-、
であり;
cは0、1、または2であり;
d、e、およびfは独立して0または1であり;
Y1、Y2、Y3、およびY4は独立してHまたはFであり;
R6は、ヒドロキシル、チオール、C1~6アルキル、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルキル、C1~6アルコキシ、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルコキシ、C3~5アルケニル-O-、C3~5アルキニル-O-、オリゴ(エチレングリコール)、ポリ(エチレングリコール)、ボラノ(-BH3 -)、または-NR7R8であり;
R7およびR8は独立して、水素、C1~6アルキル、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルキル、環状-(C1~6アルキル)-、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、もしくはジ(C1~6アルキル)アミノ基を用いて選択的に官能基を付与された環状-(C1~6アルキル)-、環状-(C1~6オキサアルキル)-、または1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、もしくはジ(C1~6アルキル)アミノ基を用いて選択的に官能基を付与された環状-(C1~6オキサアルキル)-であり;
R3およびR5は独立して、水素、ハロゲン、ヒドロキシル、アミノ、C1~6アルキル、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルキル、C1~6アルコキシ、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルコキシ、C3~5アルケニル-O-、C3~5アルキニル-O-、オリゴ(エチレングリコール)、ポリ(エチレングリコール)、アジド、または-NR7R8であり;
R11およびR12は独立して、
からなる群より選択され、R11およびR12のうち少なくとも一方は
であり;
Z12、Z13、Z14、Z15、Z16、Z17、Z18、Z19、Z20、Z21、Z22、Z23、Z24、Z25、Z26、Z27、Z28、Z29、Z30、Z31、Z32、Z33、Z34、Z35、Z36、およびZ37はそれぞれ独立してCHまたはNであり;かつ
W3、W4、W5、W6、W7、W8、およびW9は独立して、水素、ハロゲン、ヒドロキシル、C1~6アルキル、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルキル、C1~6アルコキシ、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルコキシ、C3~5アルケニル-O-、C3~5アルキニル-O-、オリゴ(エチレングリコール)、ポリ(エチレングリコール)、アジド、または-NR7R8である。
[本発明1009]
式Ii:
の化合物またはその薬学的に許容される塩である、本発明1001の化合物:
式中、
X3、X5、X6、およびX7は独立してO、NH、CH2、CHF、またはCF2であり;
R13およびR14は独立して、
からなる群より選択され;
Z12、Z13、Z14、Z15、Z16、Z17、Z18、Z19、Z20、Z21、Z22、Z23、Z24、Z25、Z26、Z27、およびZ28はそれぞれ独立してCHまたはNであり;かつ
W3、W4、W5、W6、およびW7は独立して、水素、ハロゲン、ヒドロキシル、C1~6アルキル、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルキル、C1~6アルコキシ、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルコキシ、C3~5アルケニル-O-、C3~5アルキニル-O-、オリゴ(エチレングリコール)、ポリ(エチレングリコール)、アジド、または-NR7R8であり;
R7およびR8は独立して、水素、C1~6アルキル、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルキル、環状-(C1~6アルキル)-、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、もしくはジ(C1~6アルキル)アミノ基を用いて選択的に官能基を付与された環状-(C1~6アルキル)-、環状-(C1~6オキサアルキル)-、または1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、もしくはジ(C1~6アルキル)アミノ基を用いて選択的に官能基を付与された環状-(C1~6オキサアルキル)-であり;
R3およびR5は独立して、水素、ハロゲン、ヒドロキシル、アミノ、C1~6アルキル、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルキル、C1~6アルコキシ、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルコキシ、C3~5アルケニル-O-、C3~5アルキニル-O-、オリゴ(エチレングリコール)、ポリ(エチレングリコール)、アジド、または-NR7R8であり;
R15およびR16は独立して、ヒドロキシル、チオール、メトキシ、エトキシ、アミノ、N-メチルアミノ、N,N-ジメチルアミノ、N-エチルアミノ、N,N-ジエチルアミノ、N-モルホリノ、またはボラノ(-BH3 -)であり;
式Iiの一方または両方のテトラヒドロフラニル環中の酸素原子は硫黄原子またはセレン原子で置き換えられていてもよく;かつ
該化合物は2'2'-cGAMPではない。
[本発明1010]
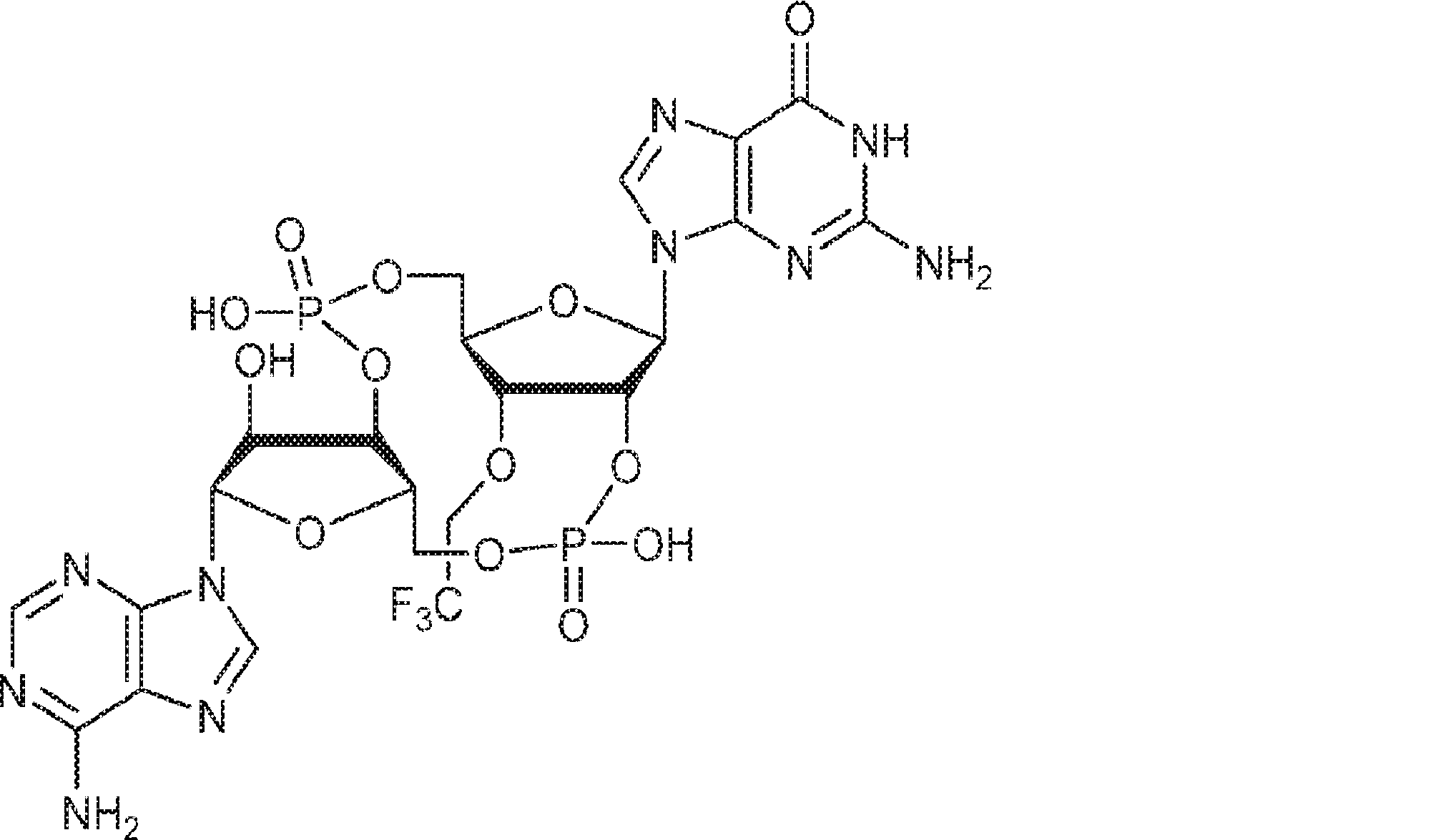
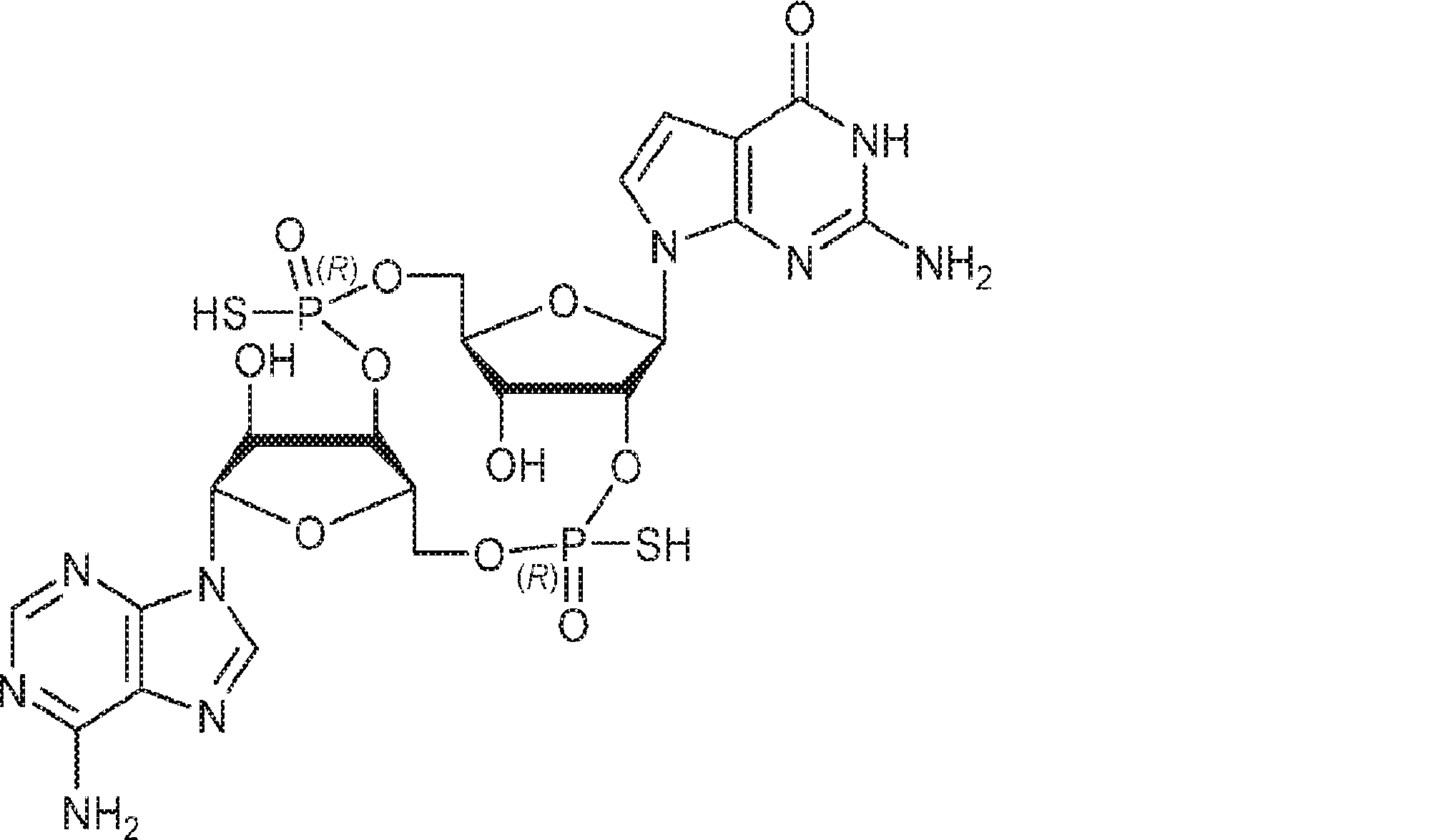
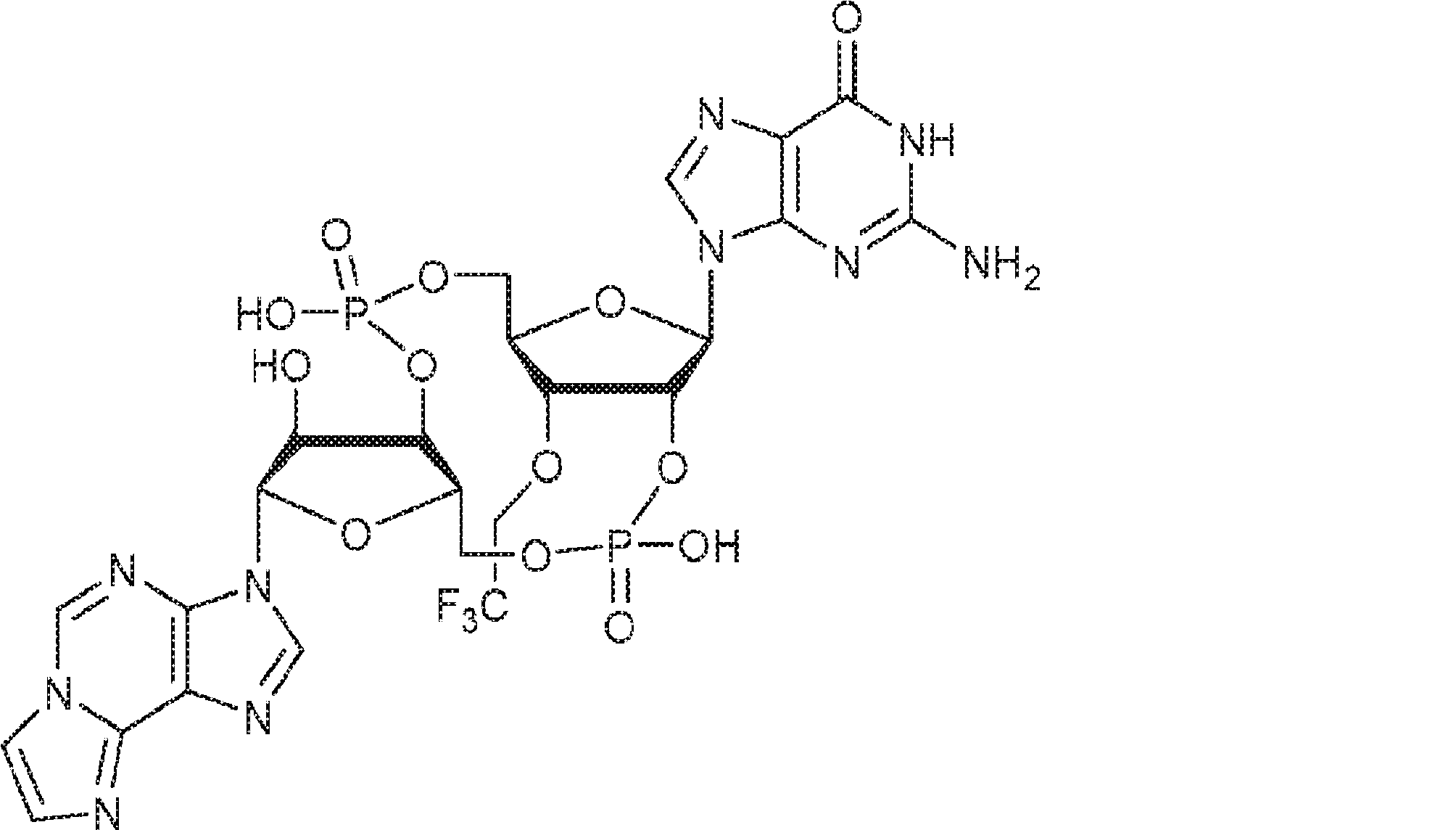
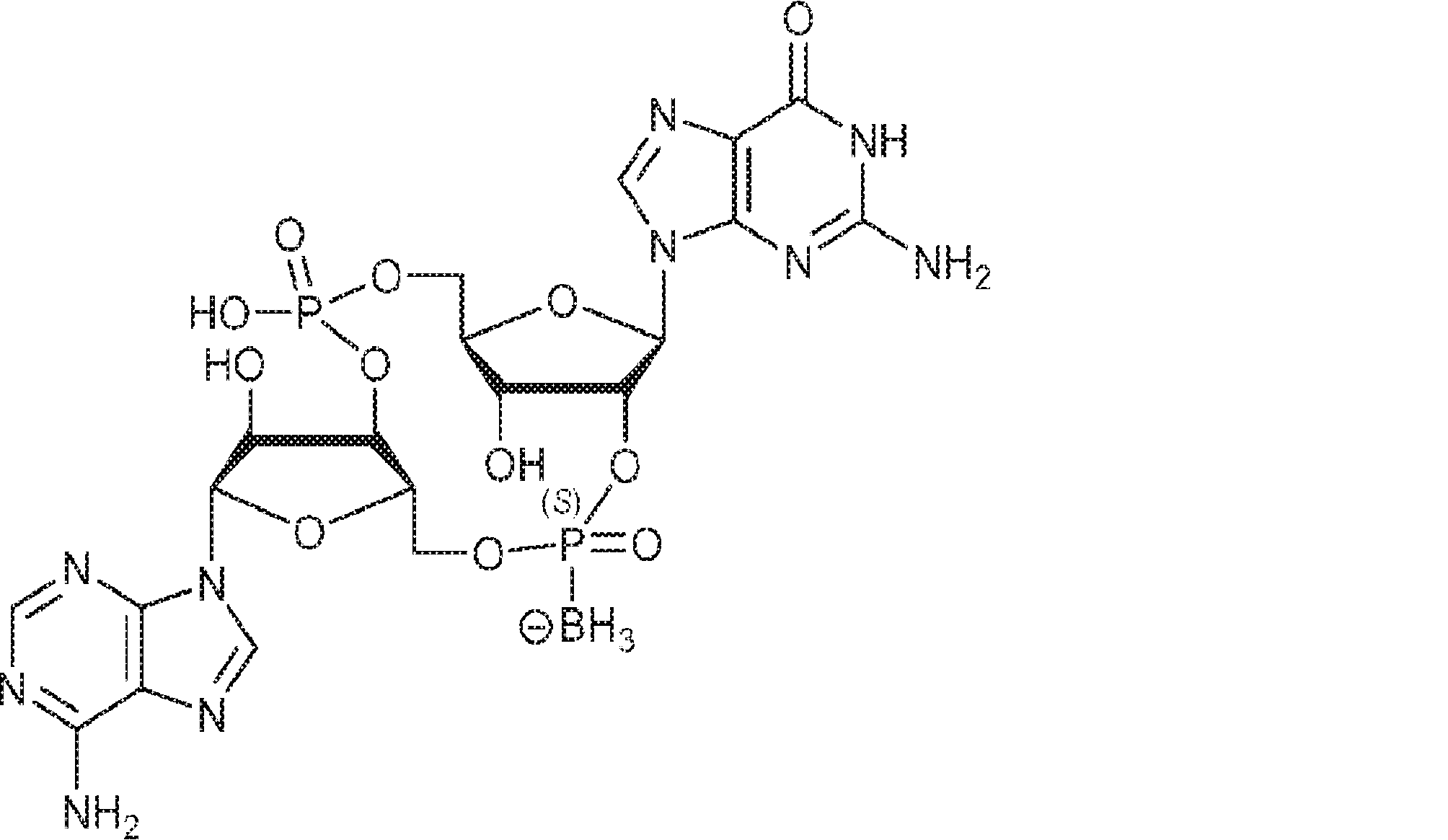
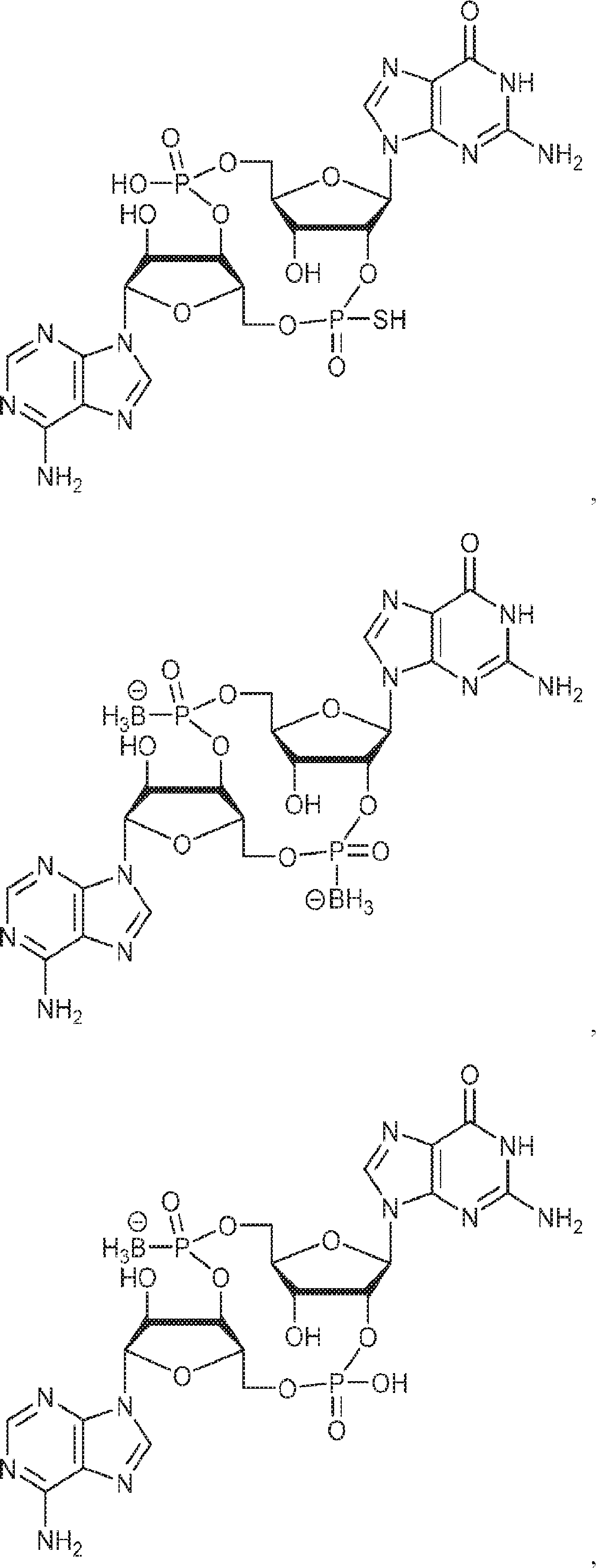
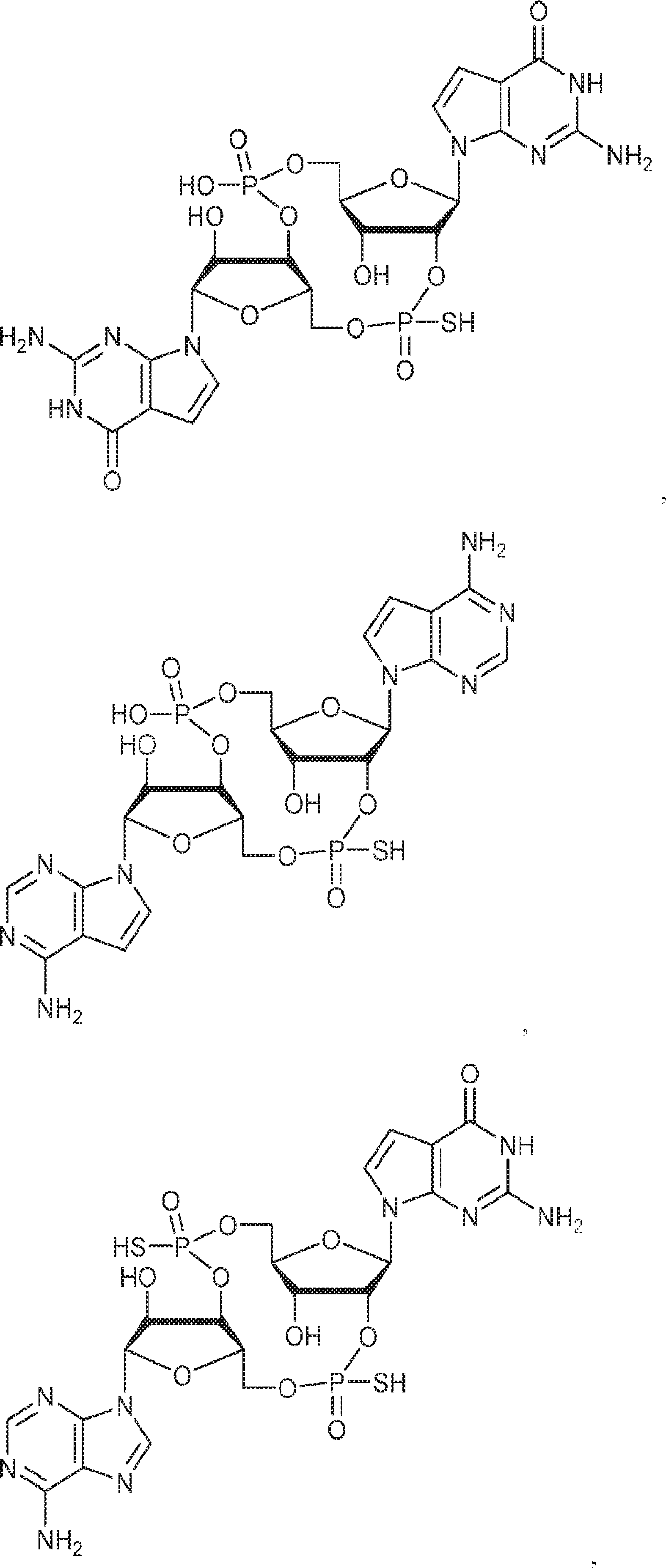
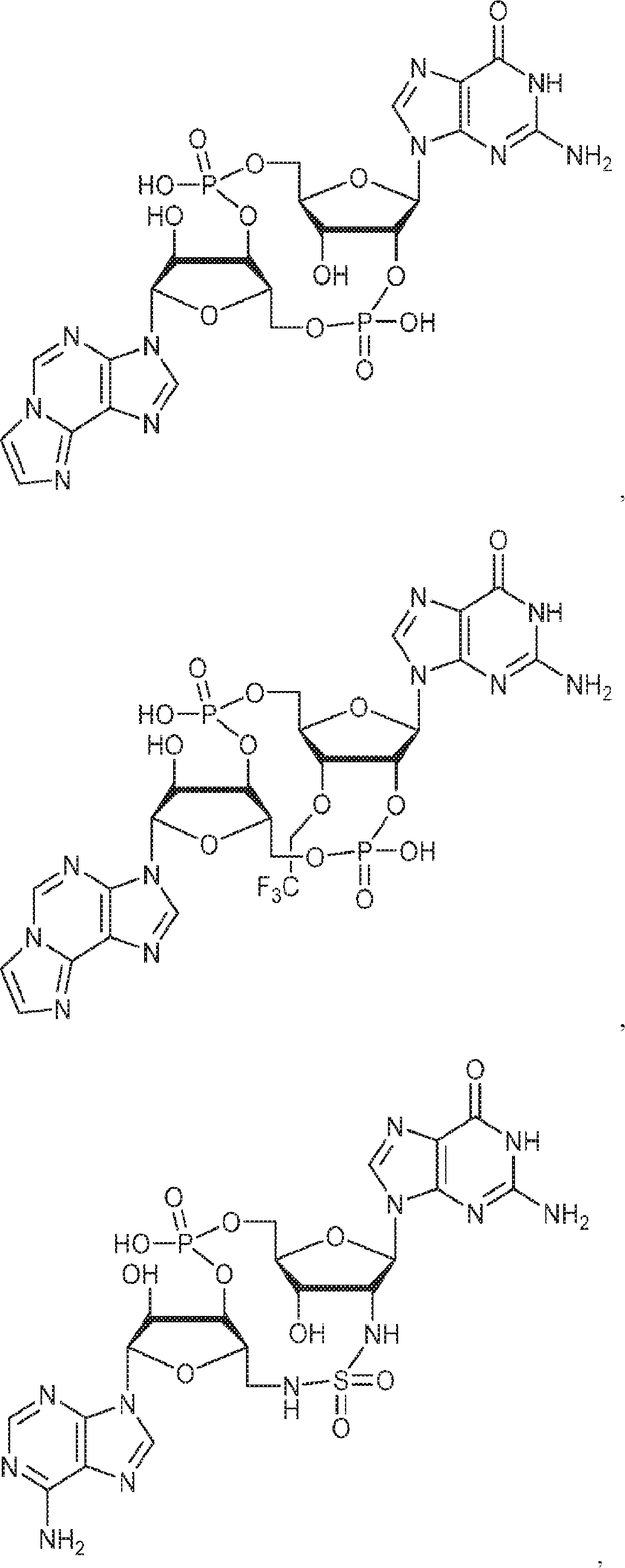
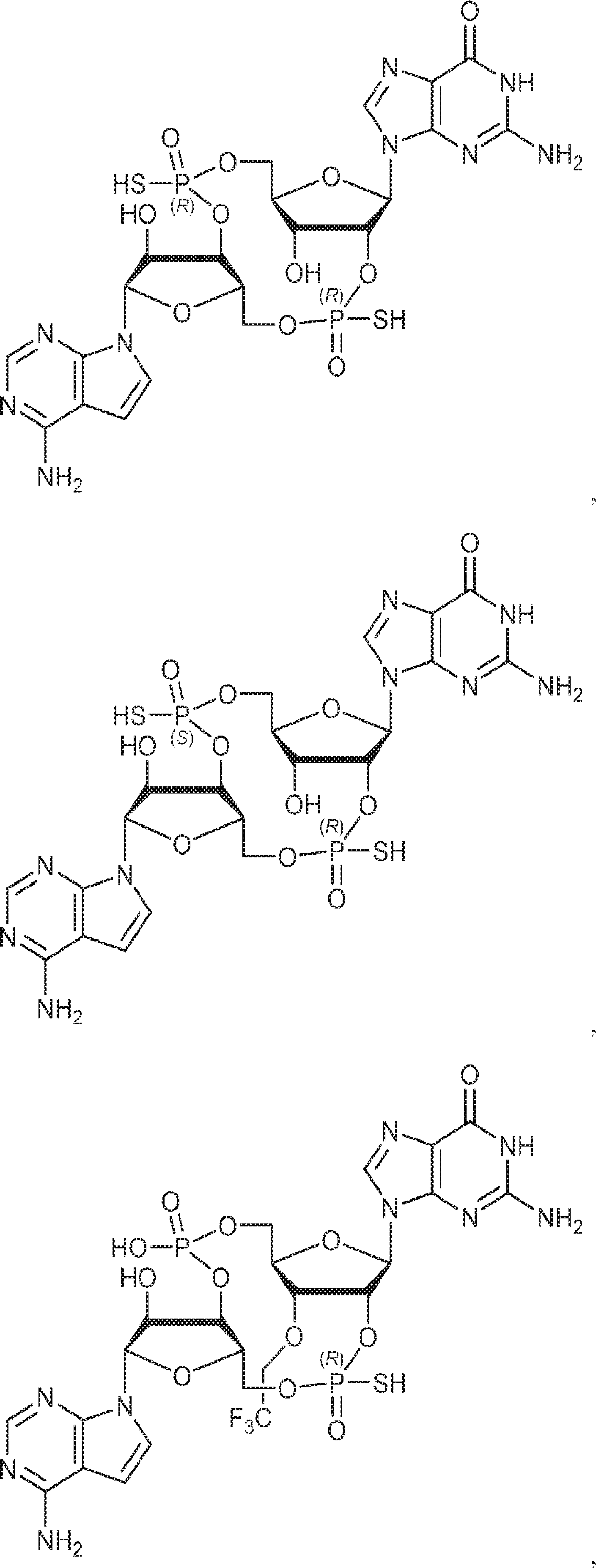
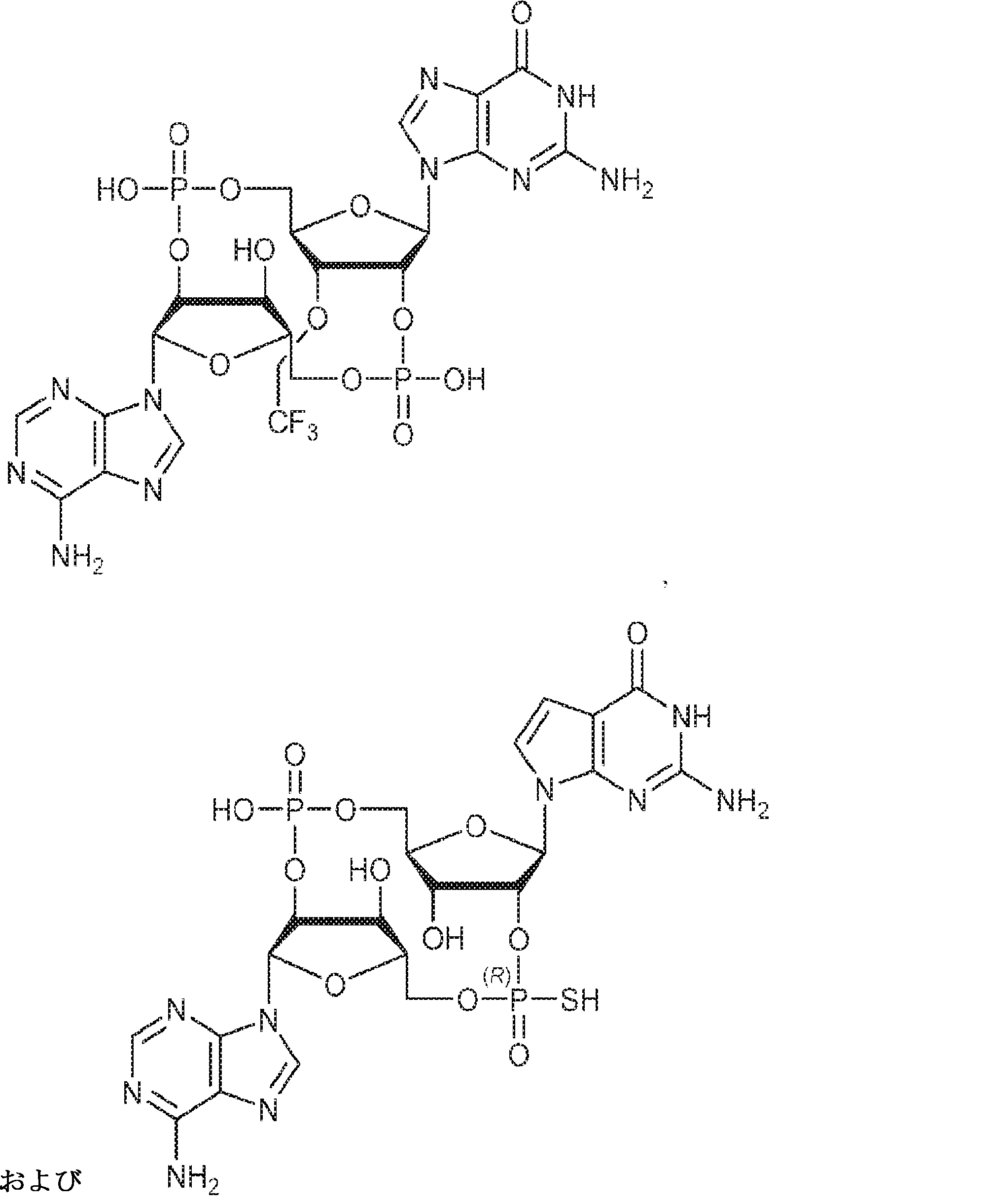
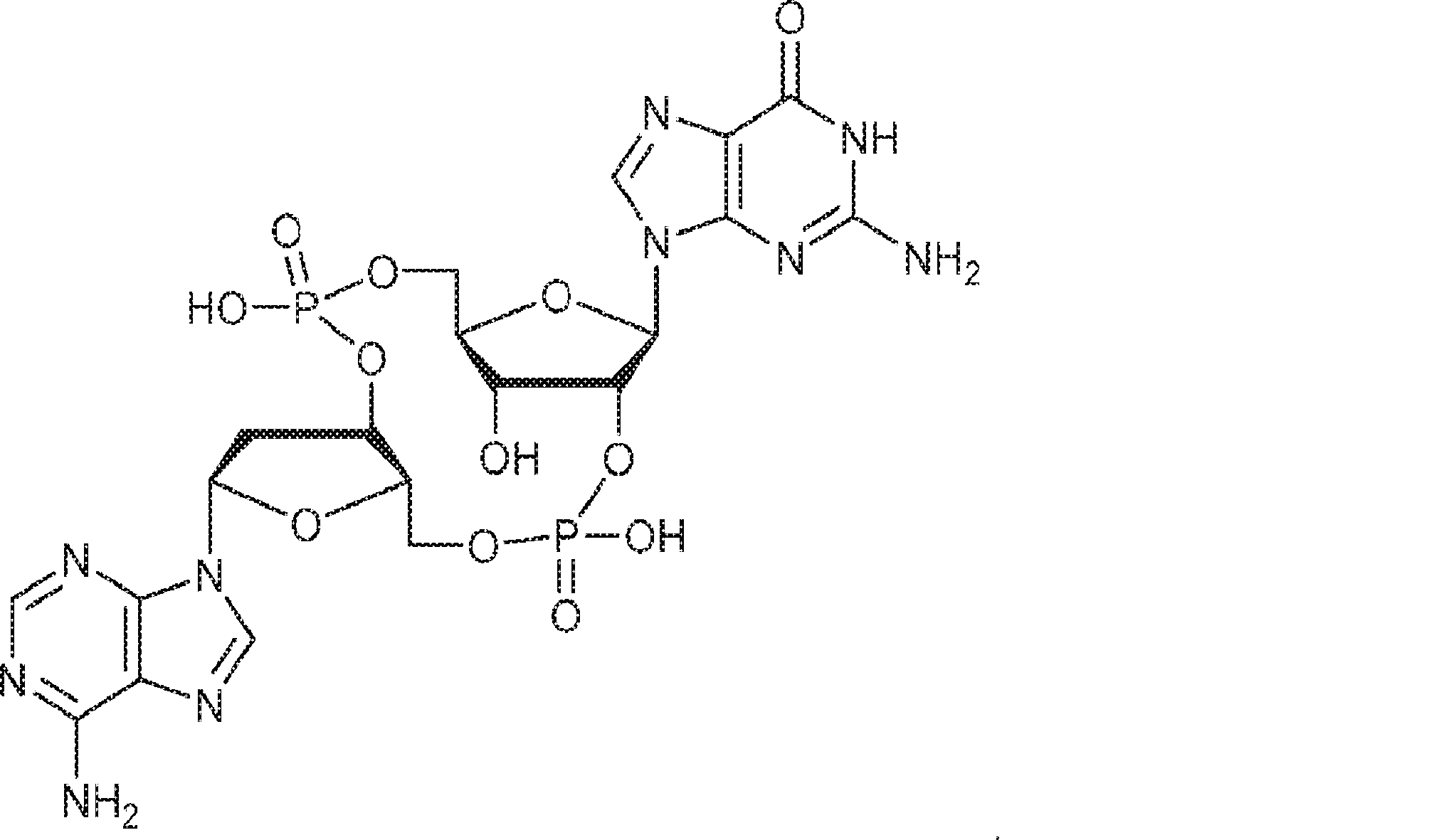
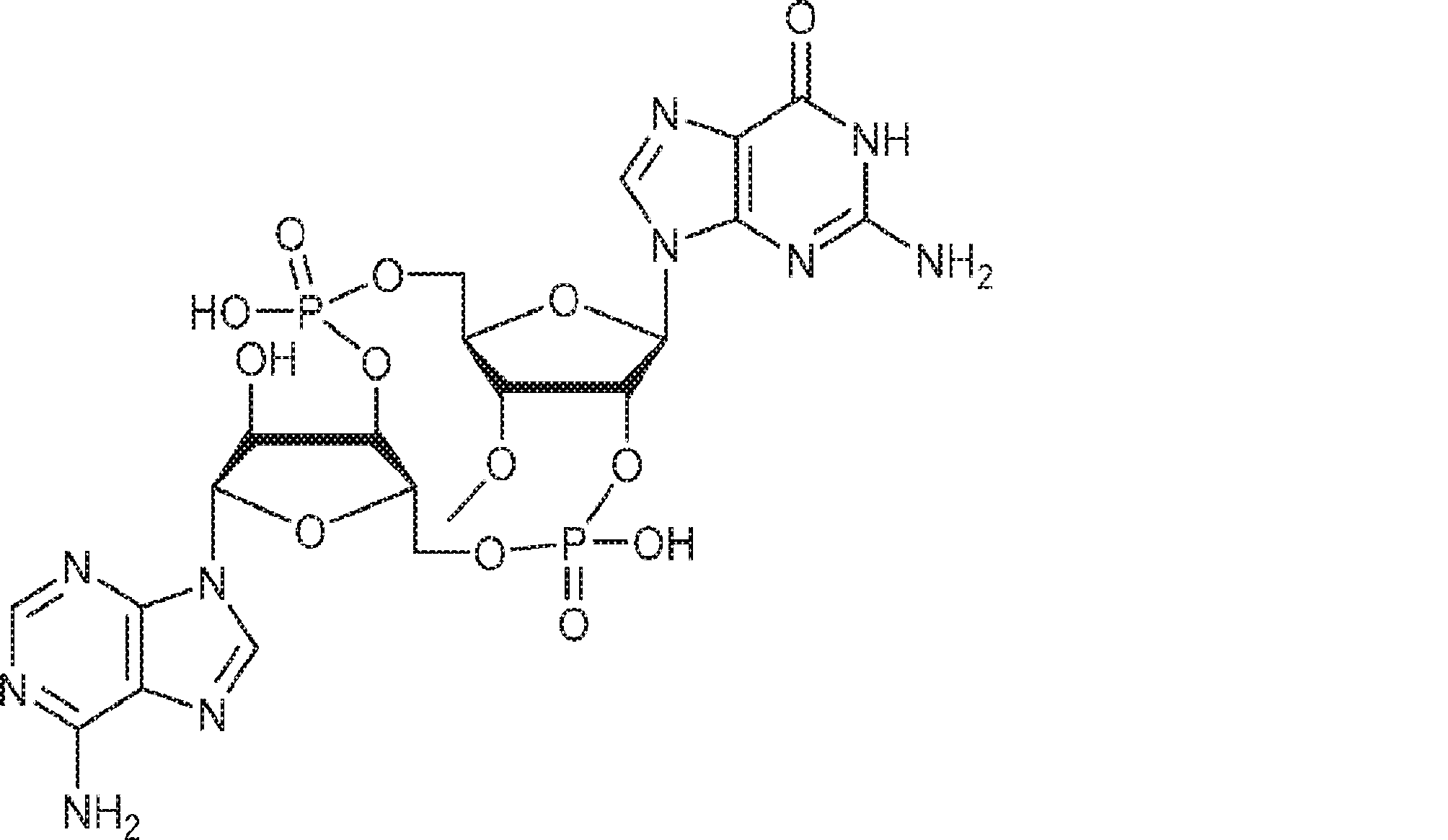
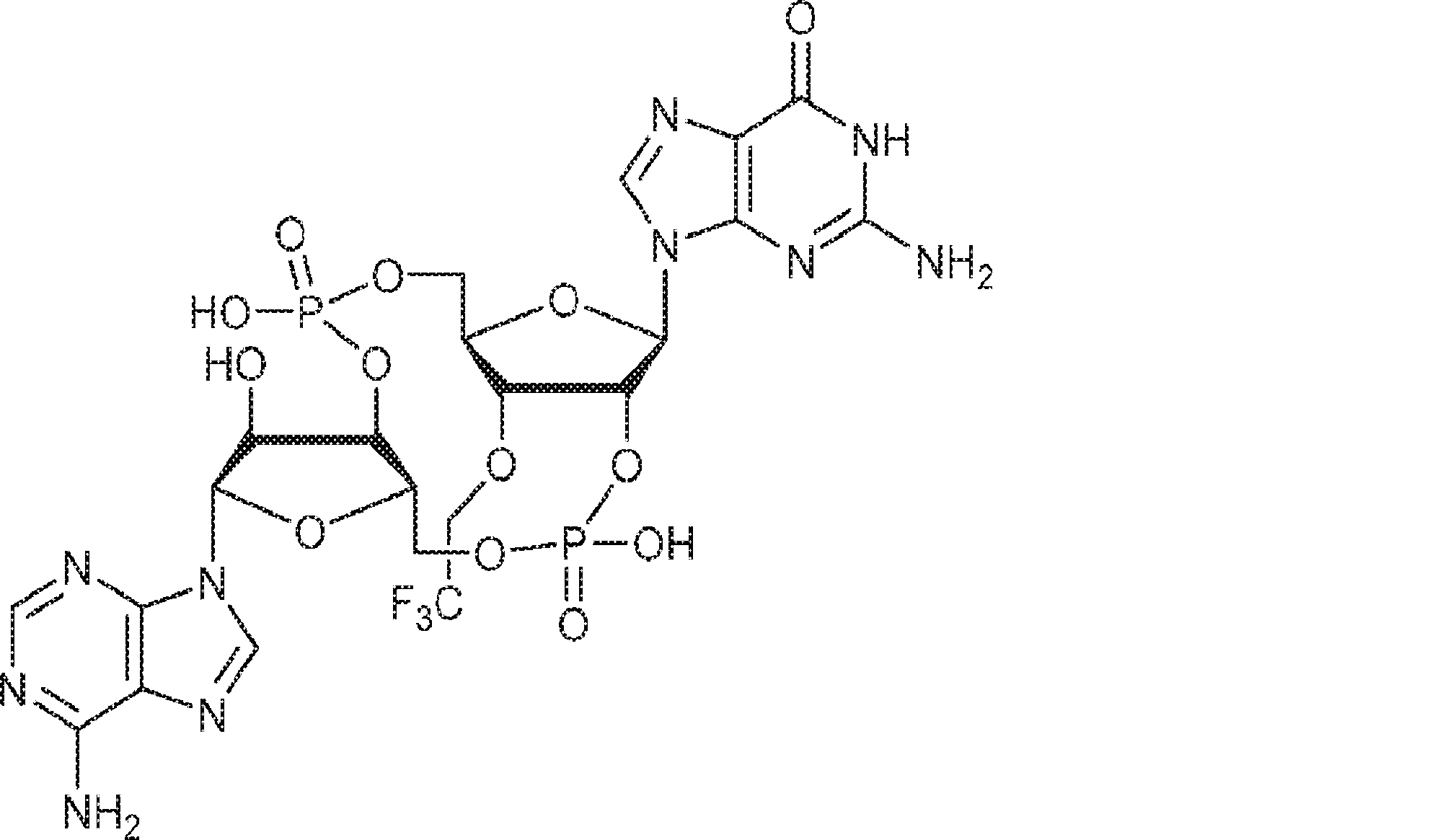
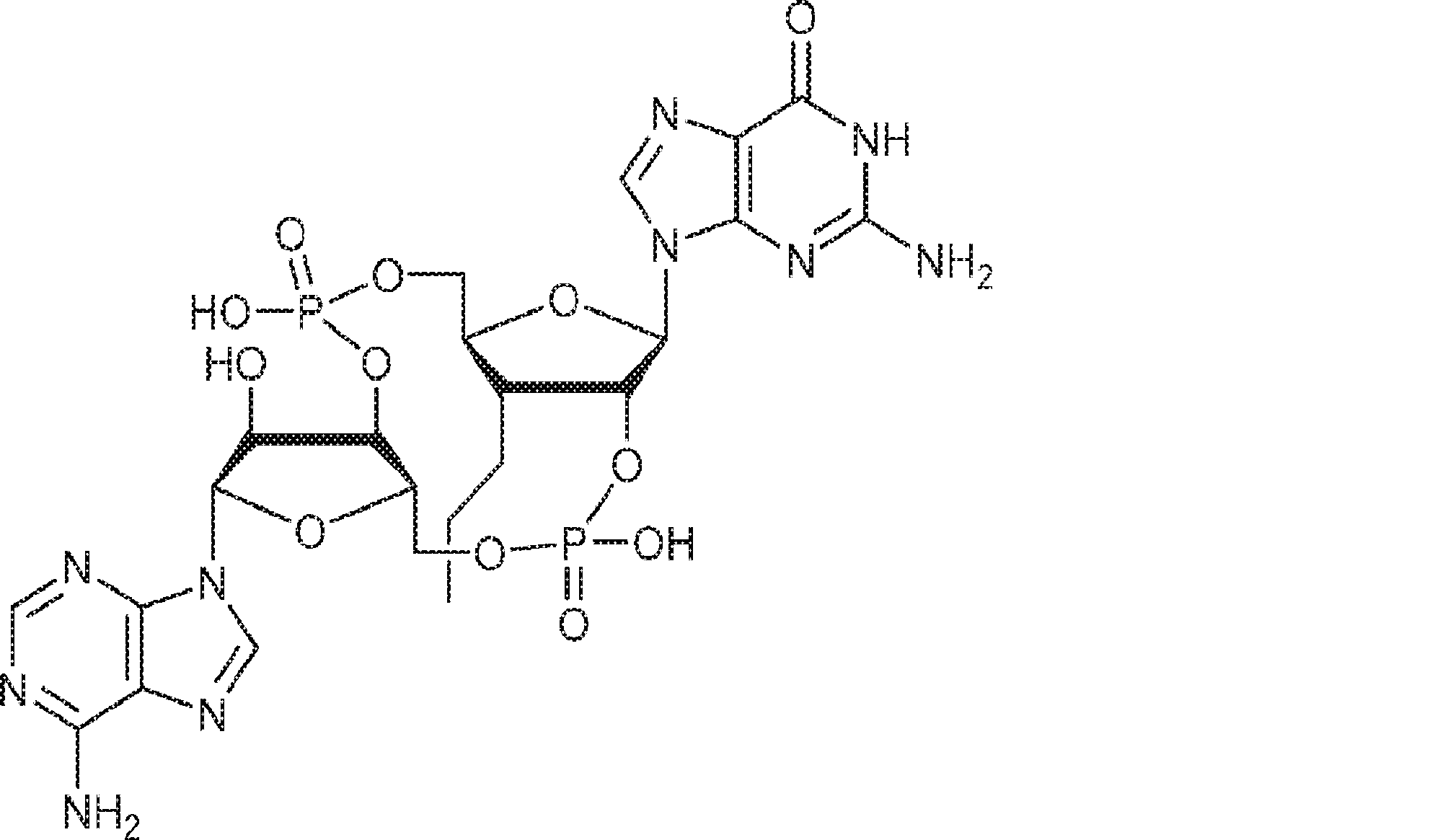
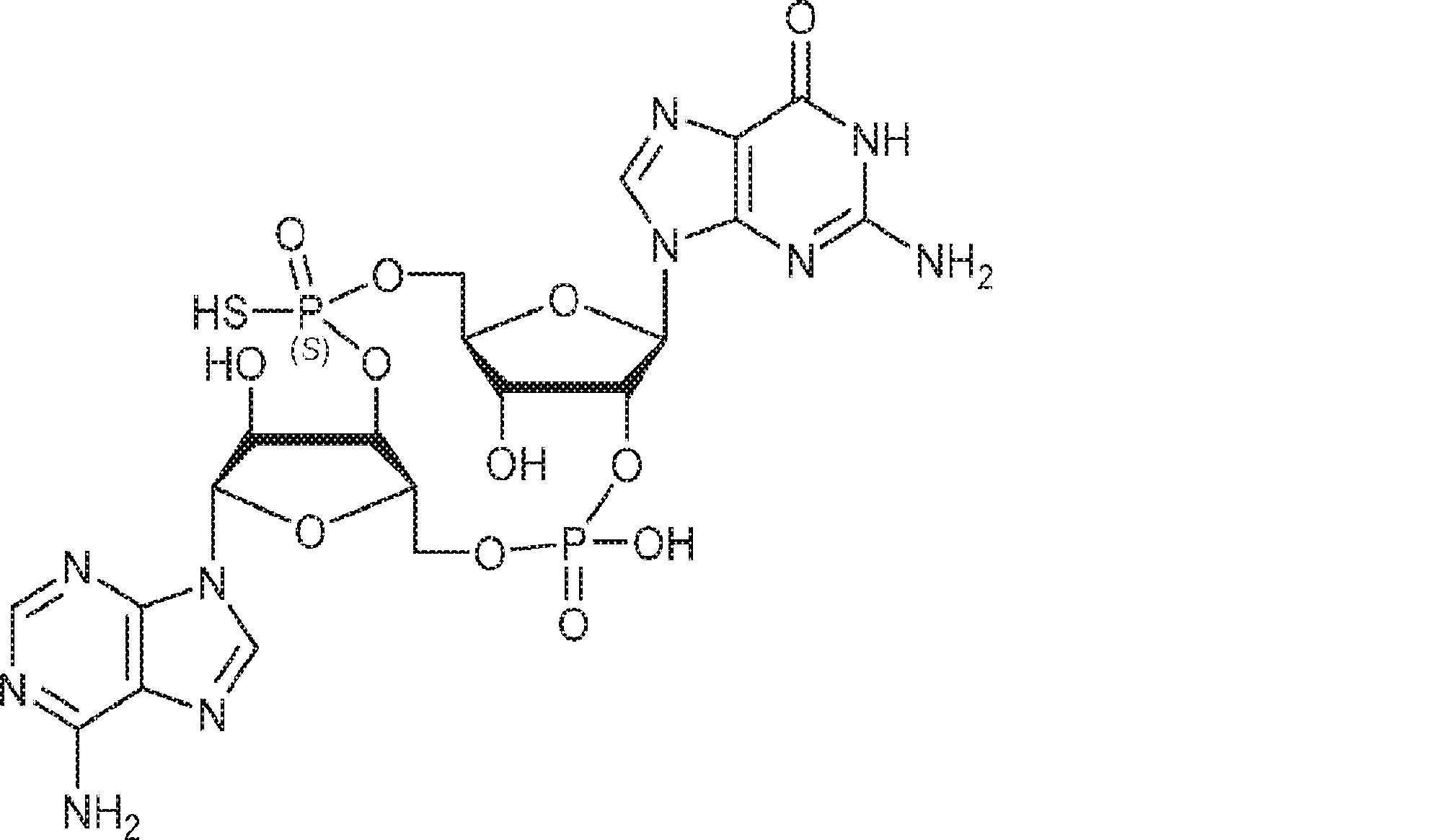
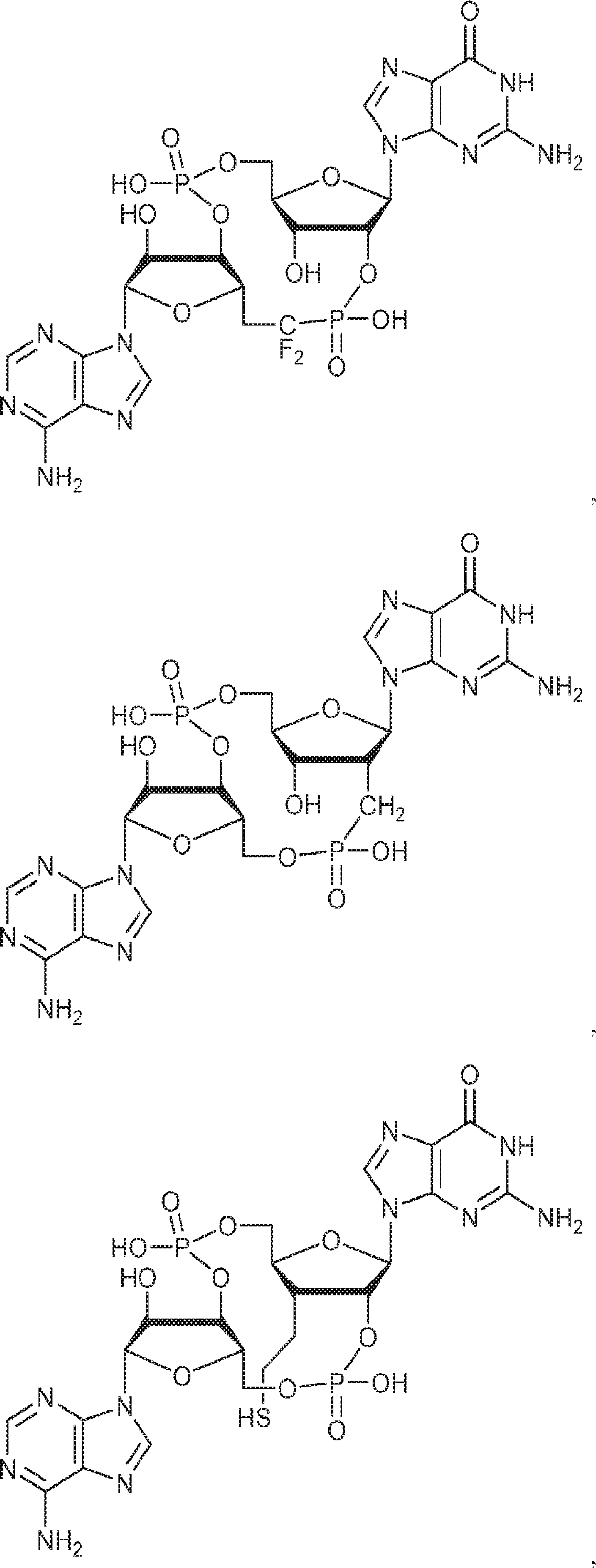
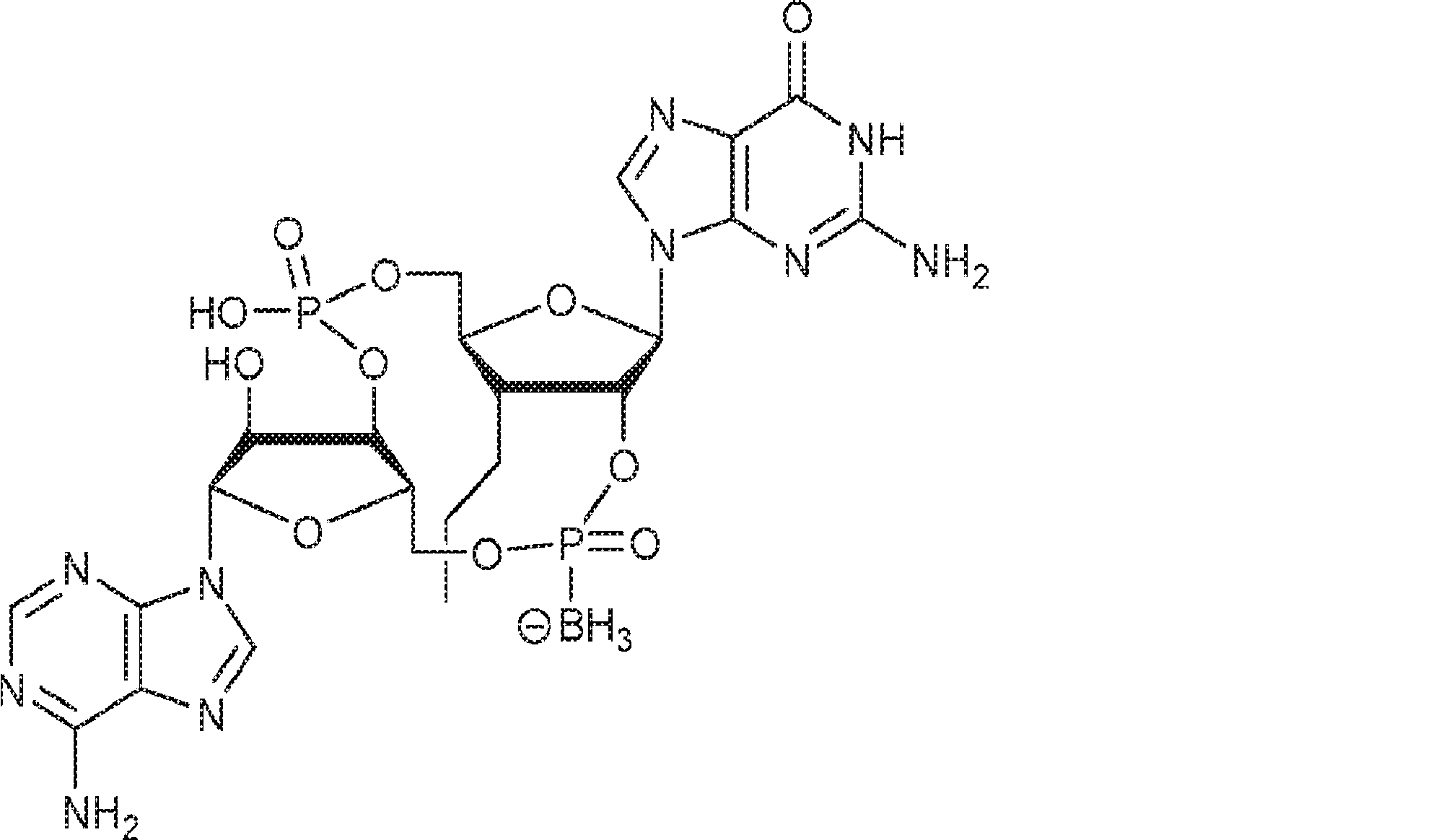
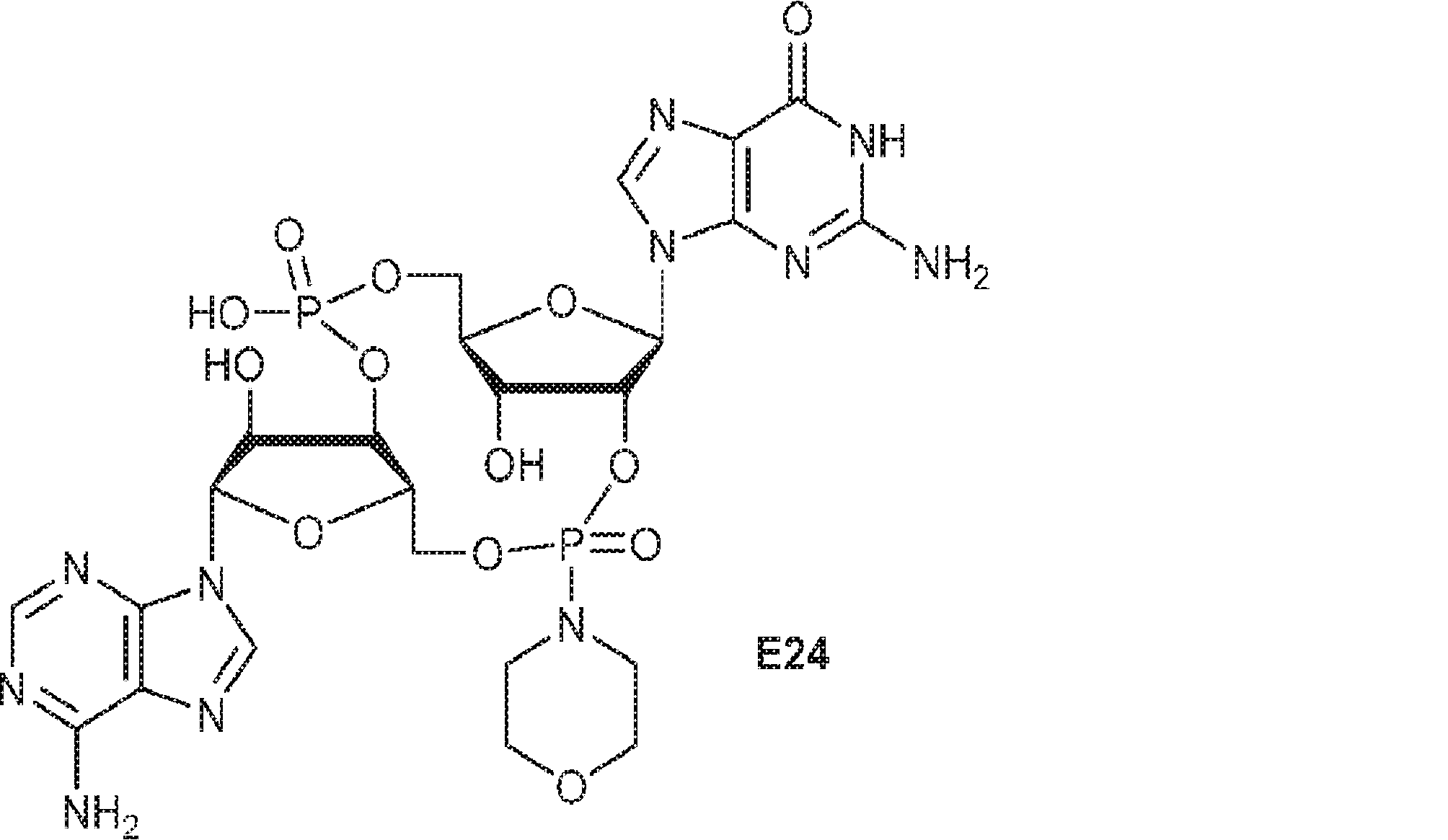
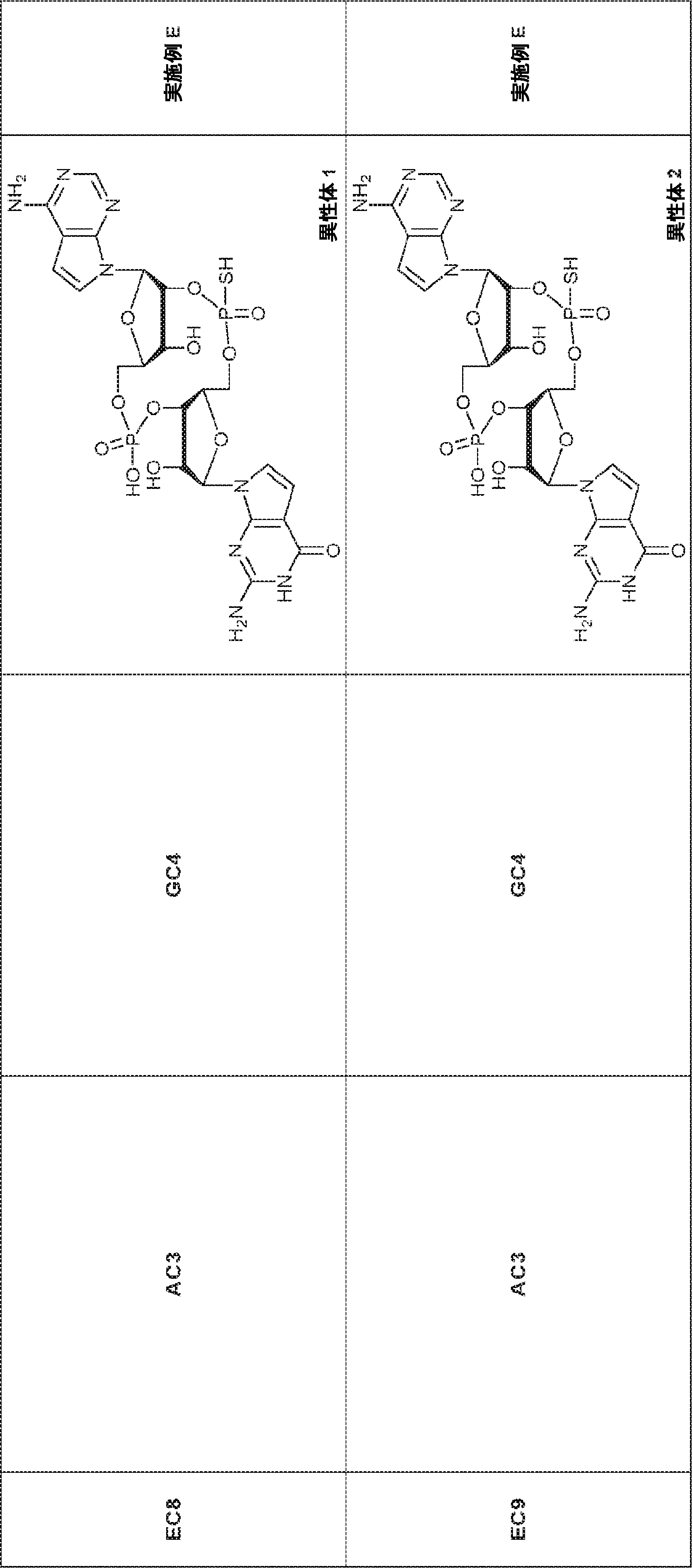
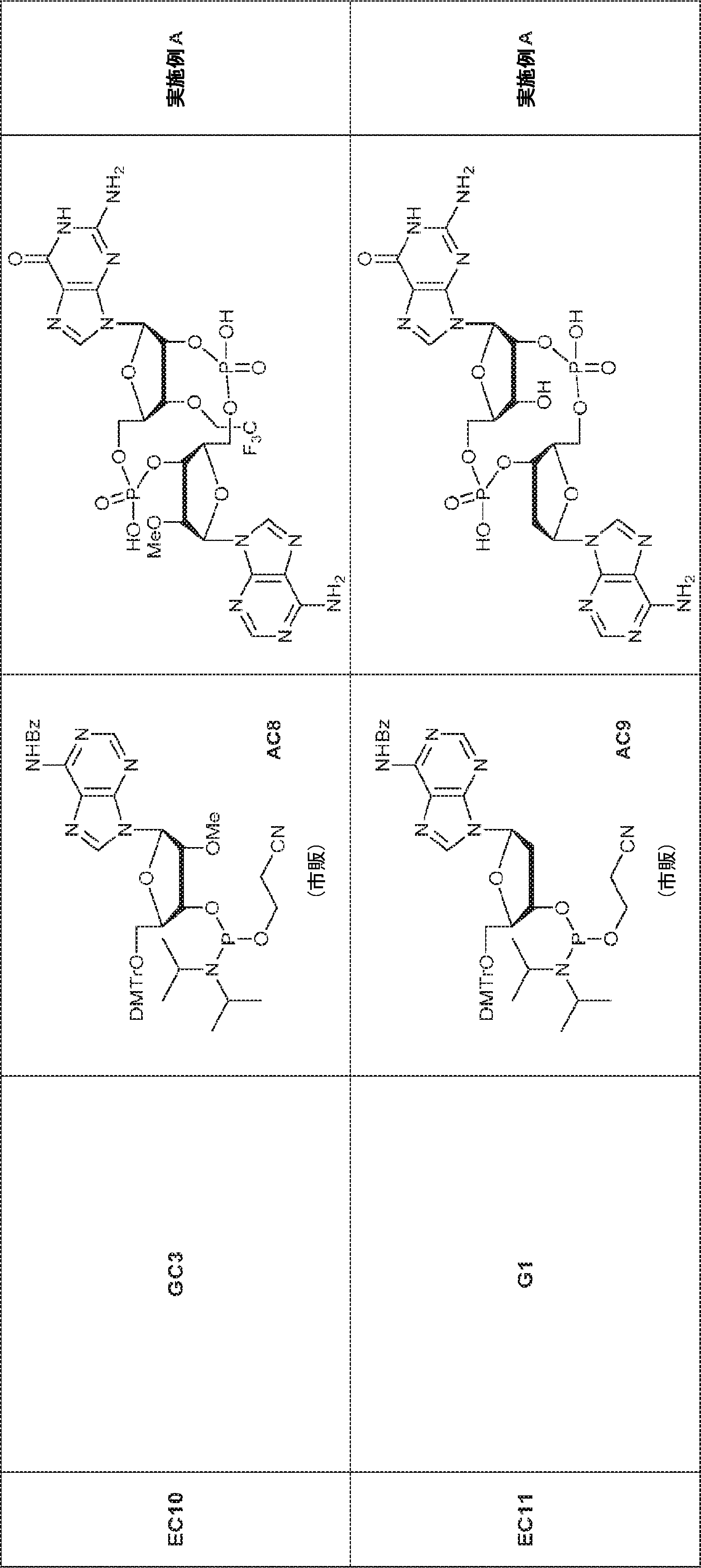
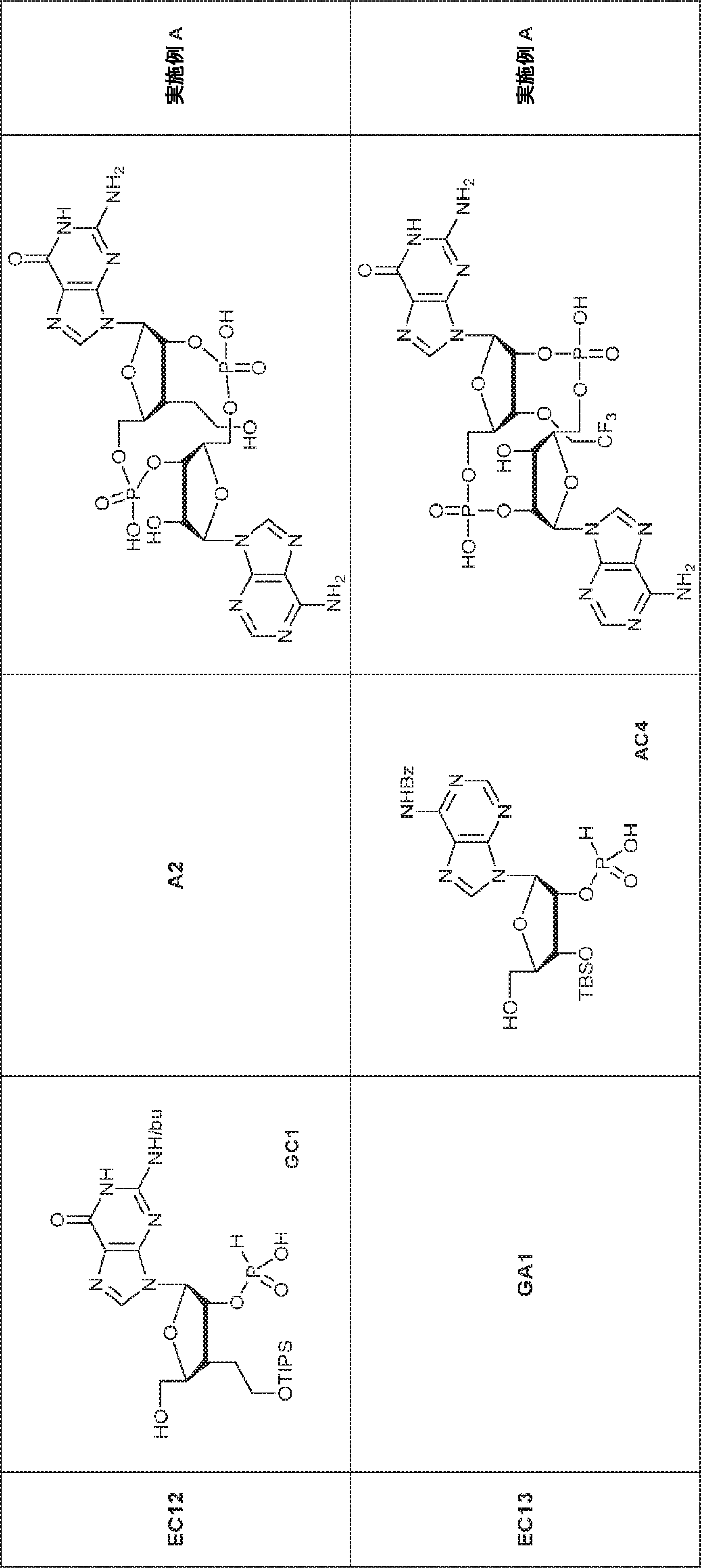
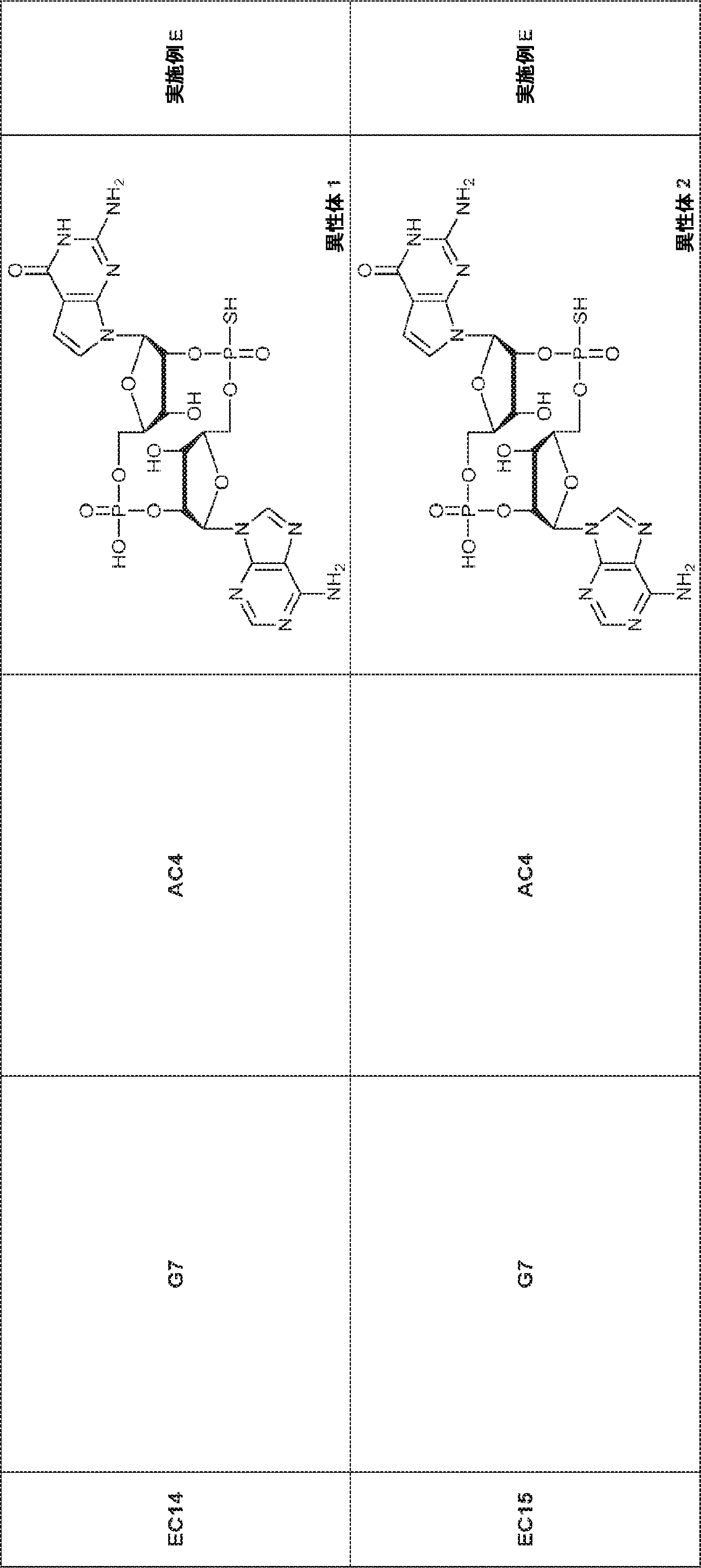
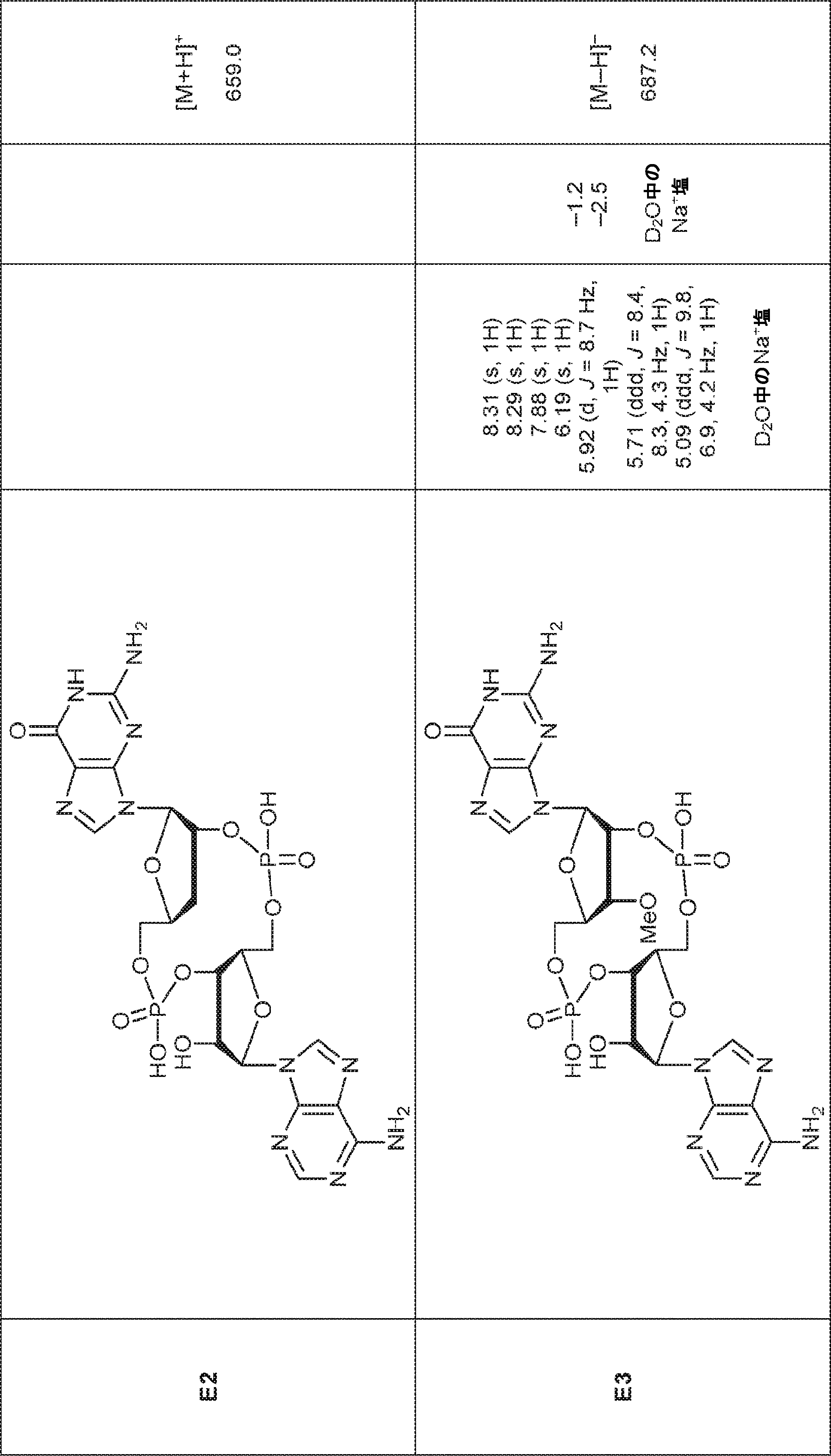
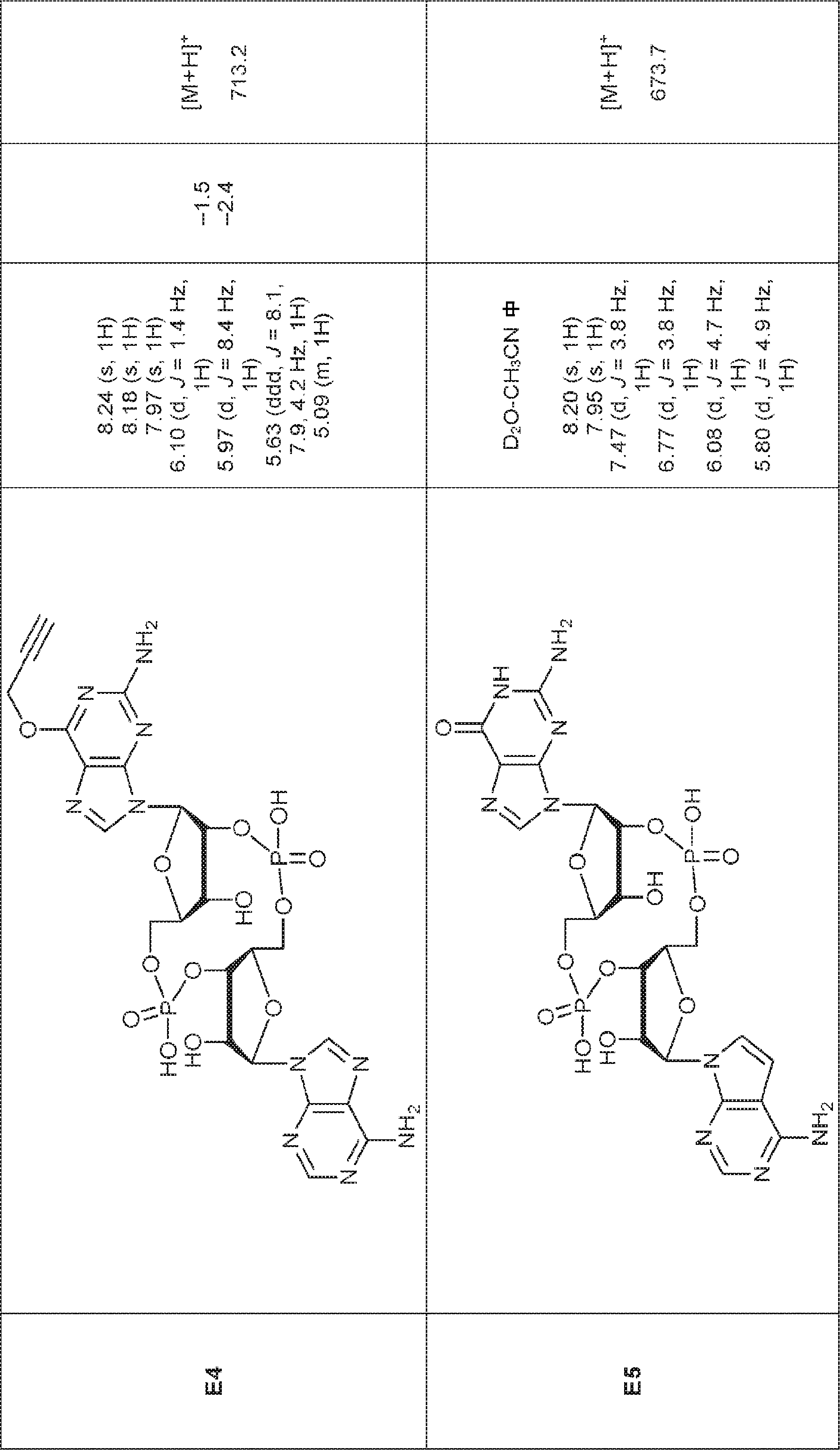
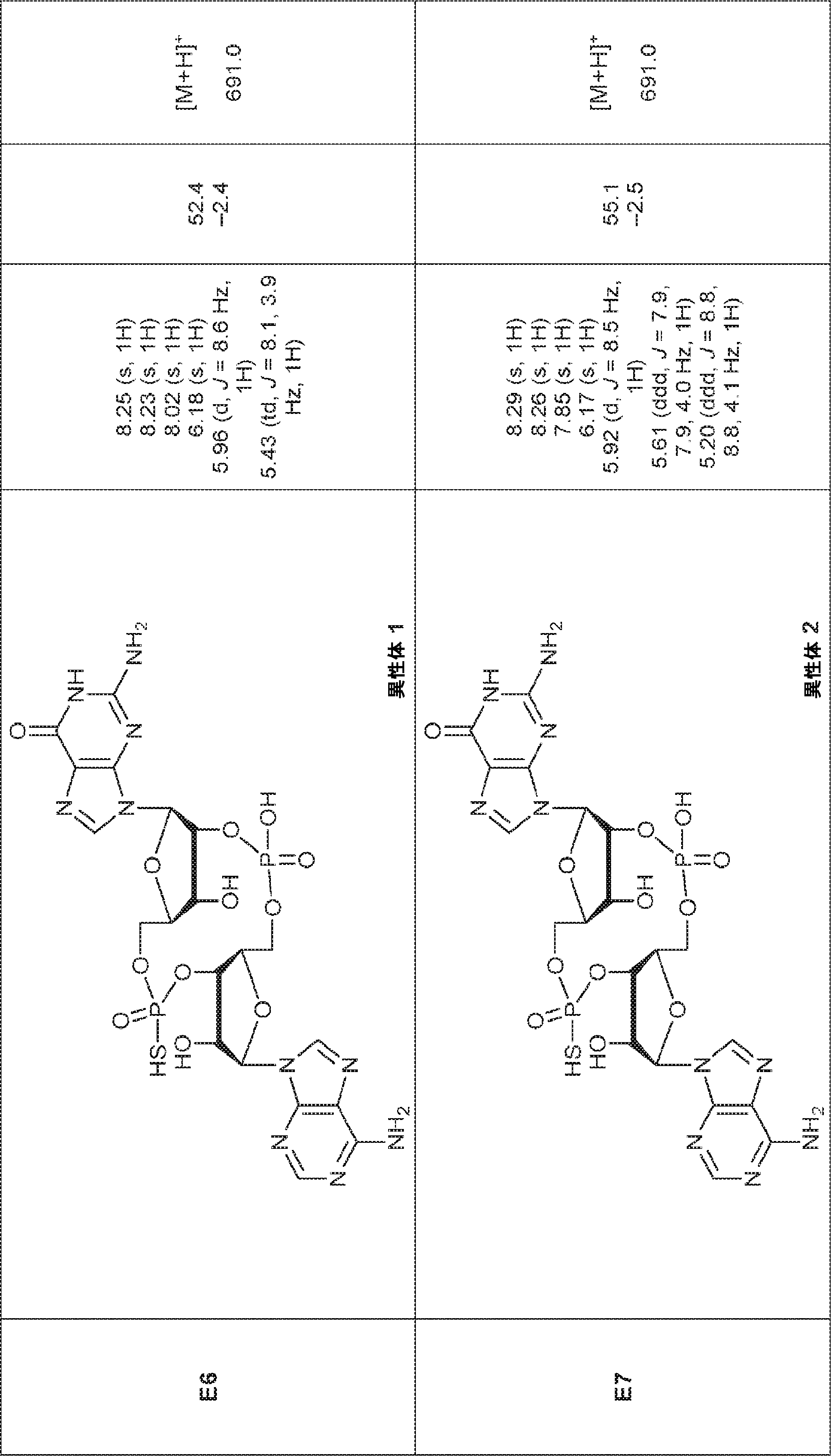
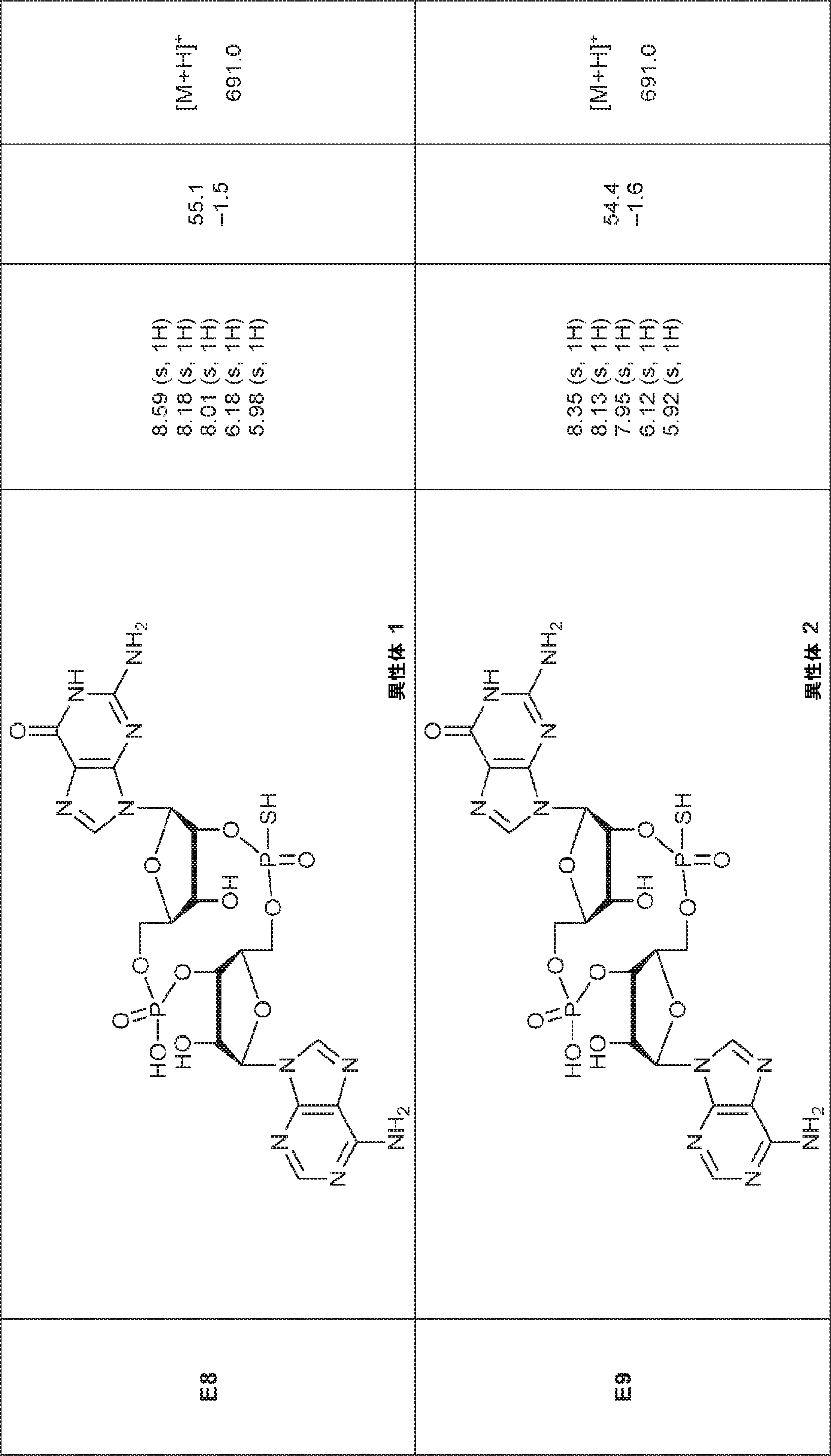
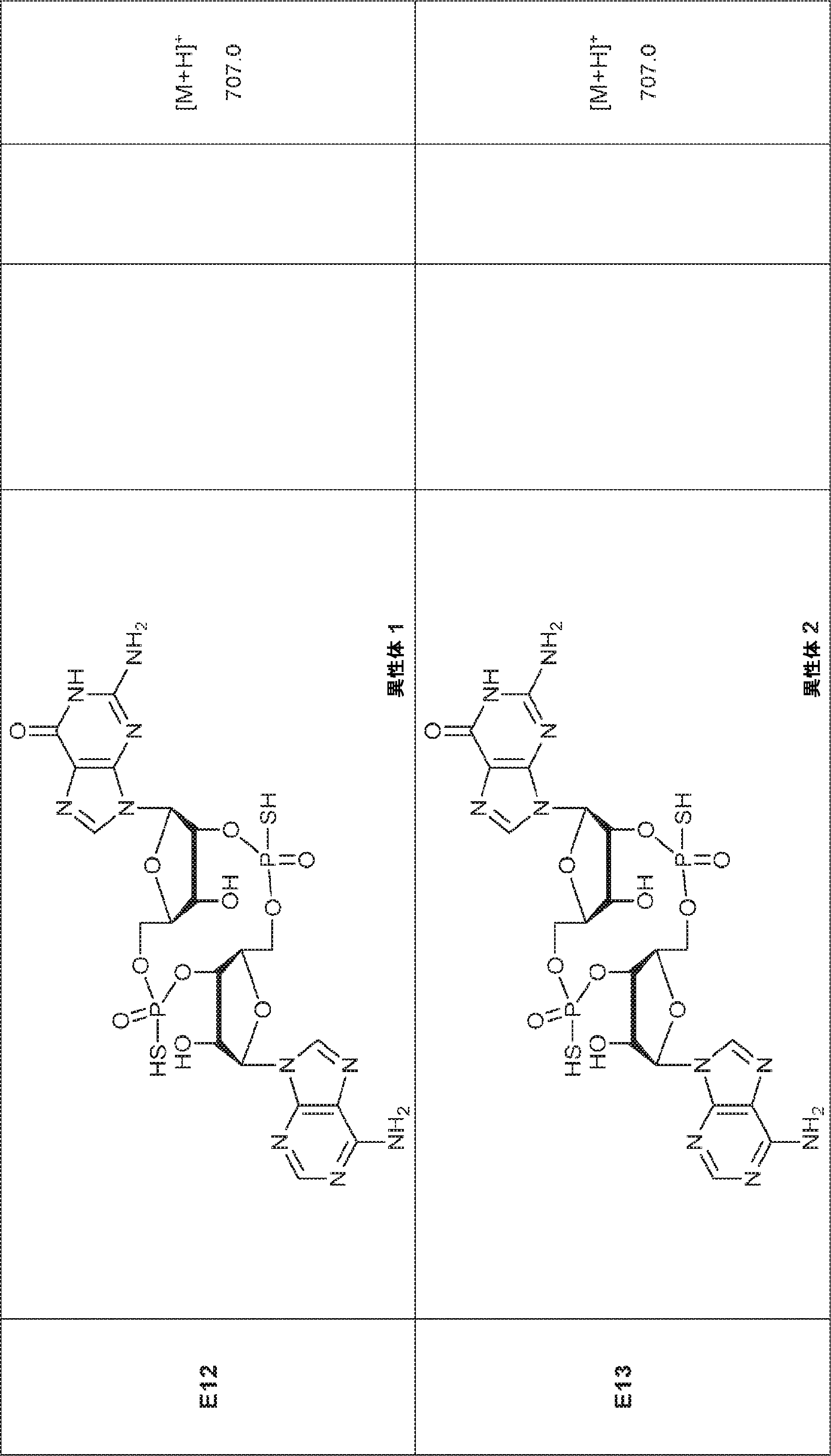
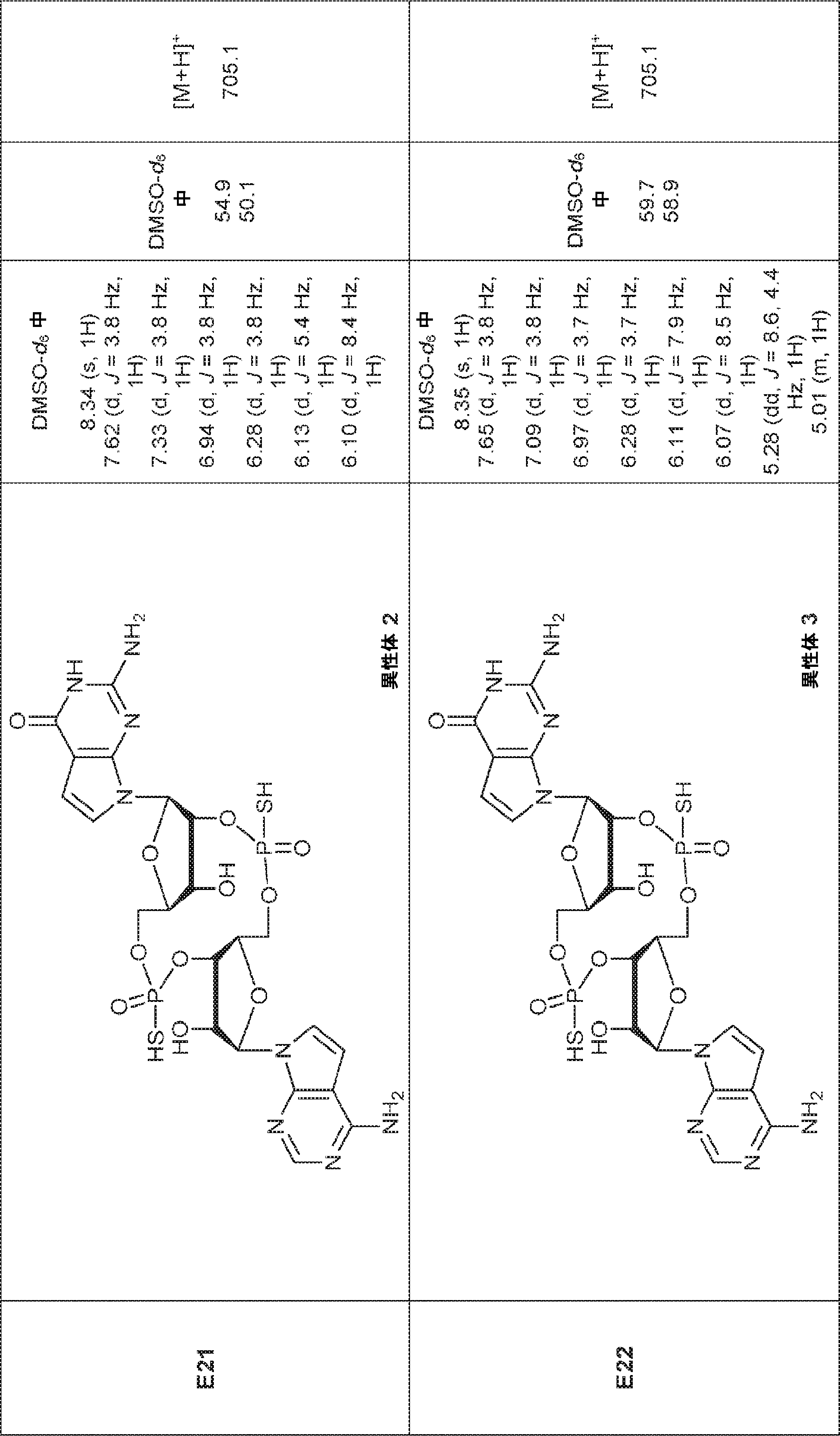
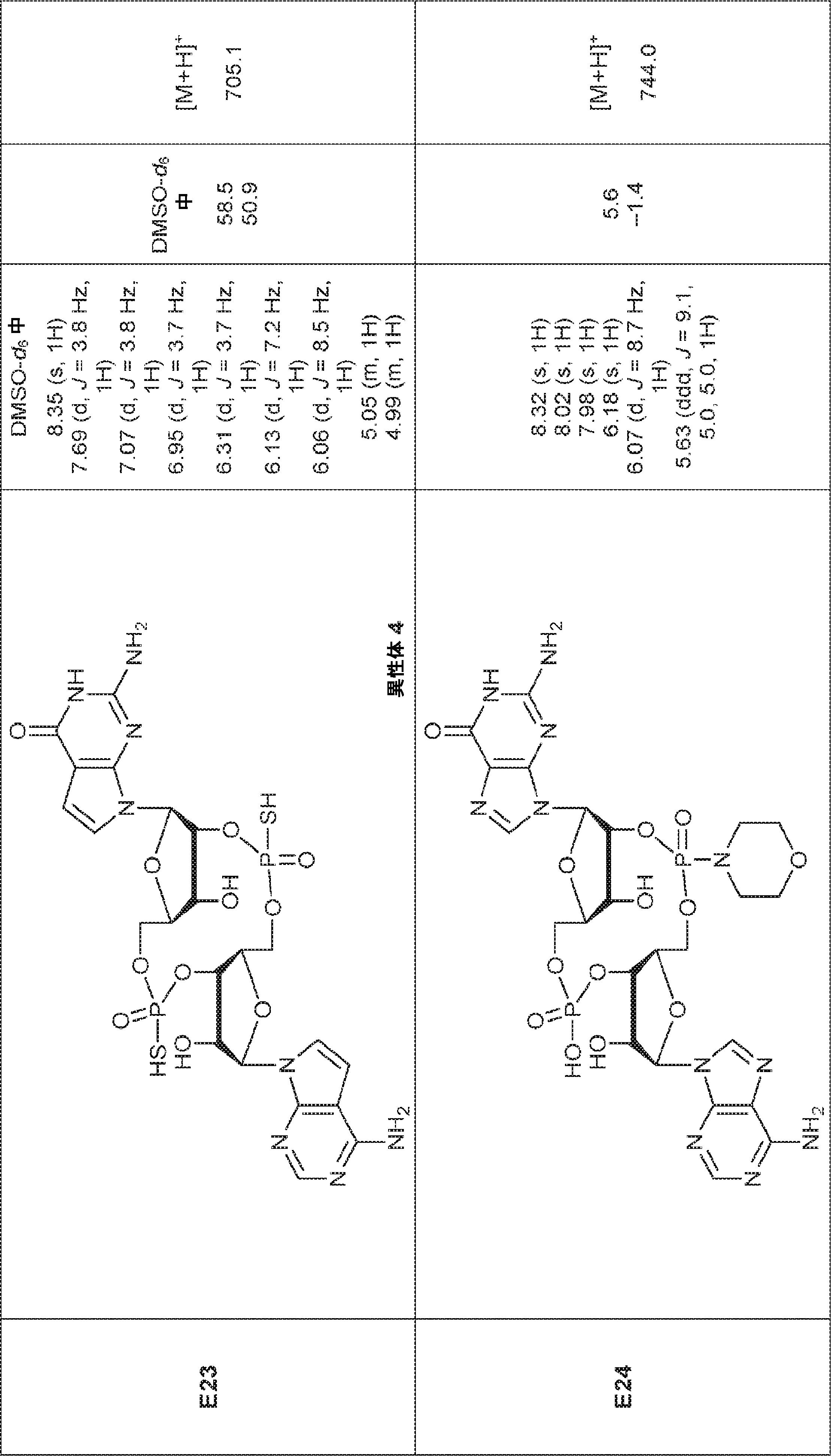
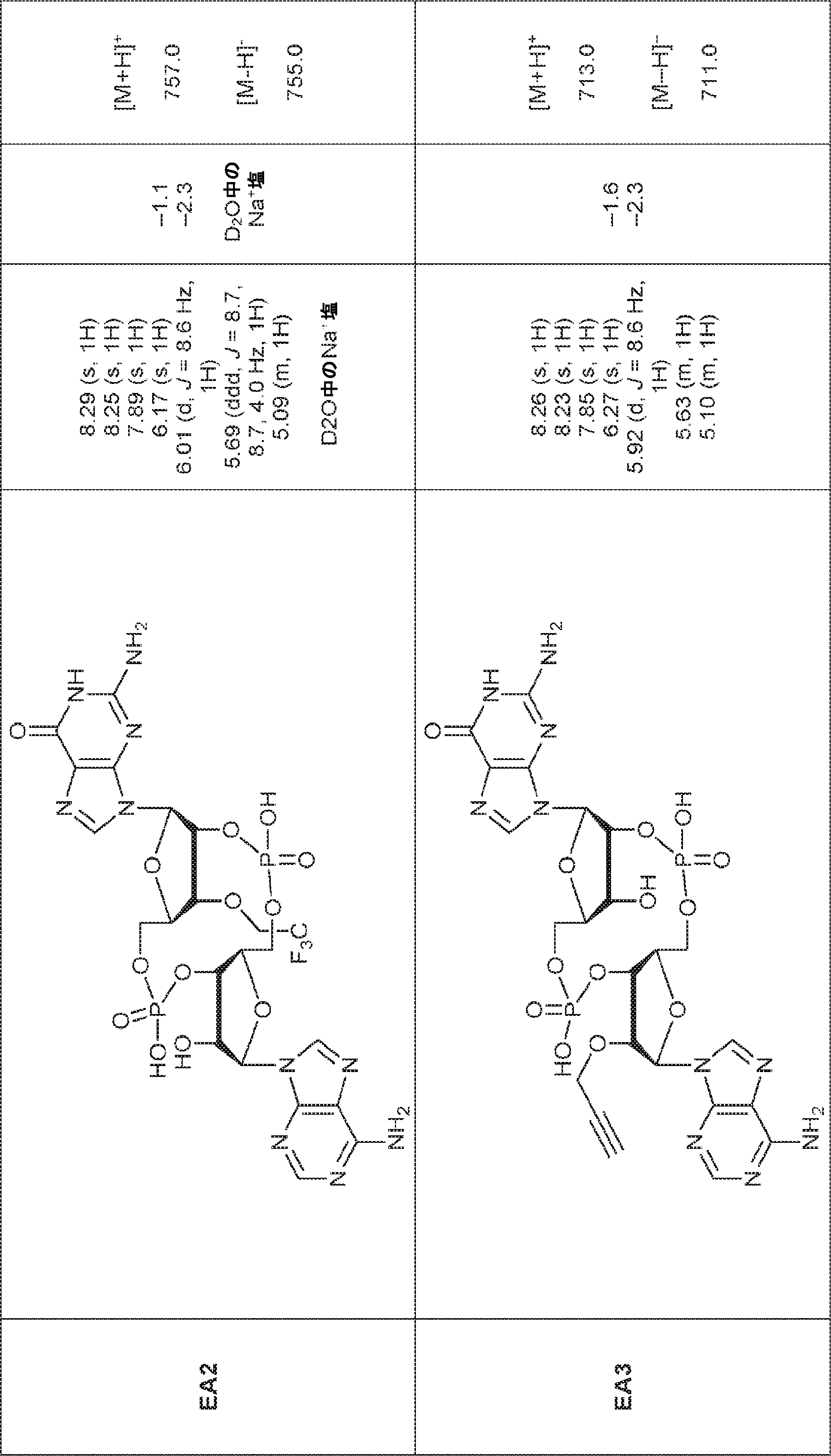
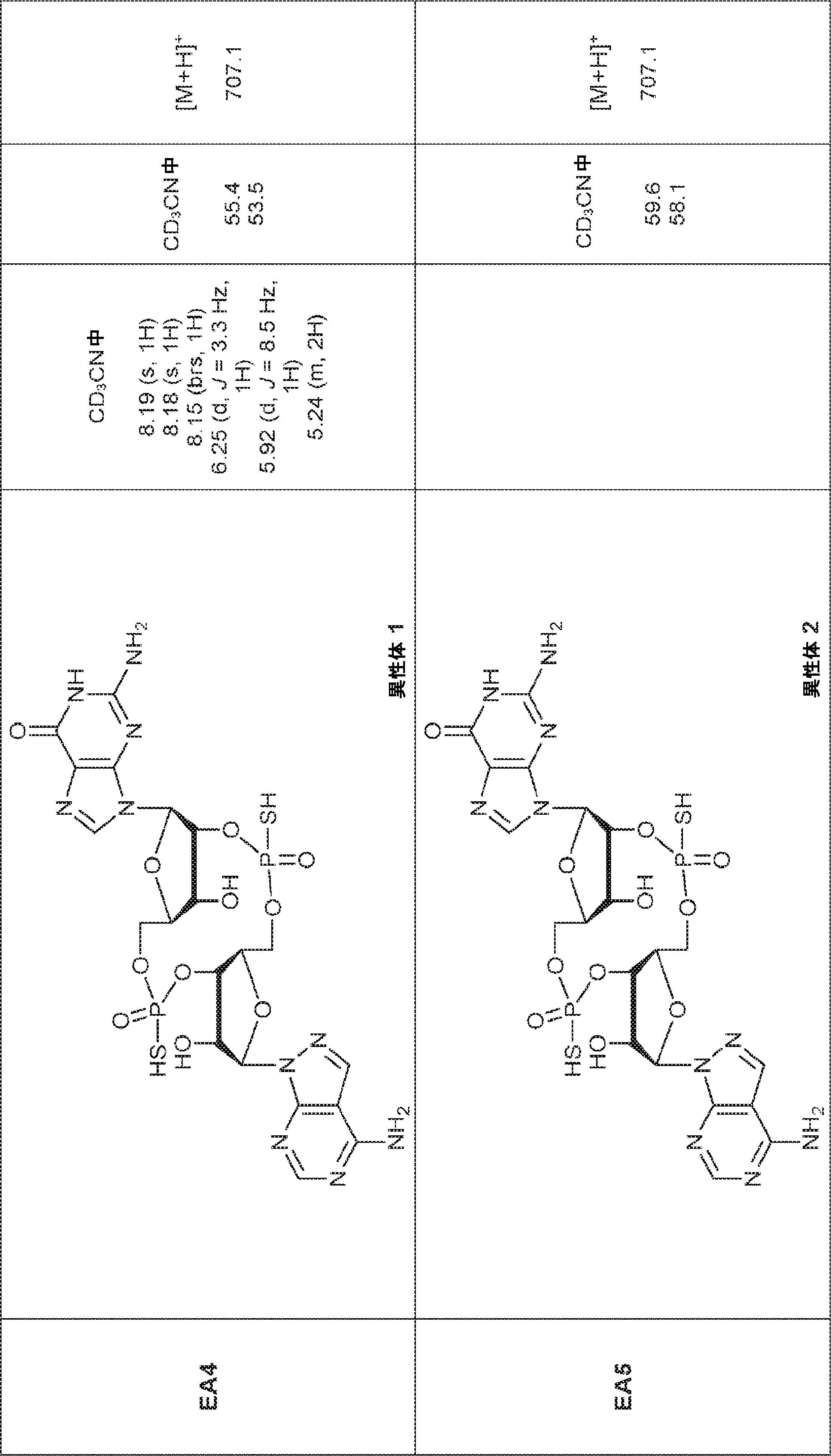
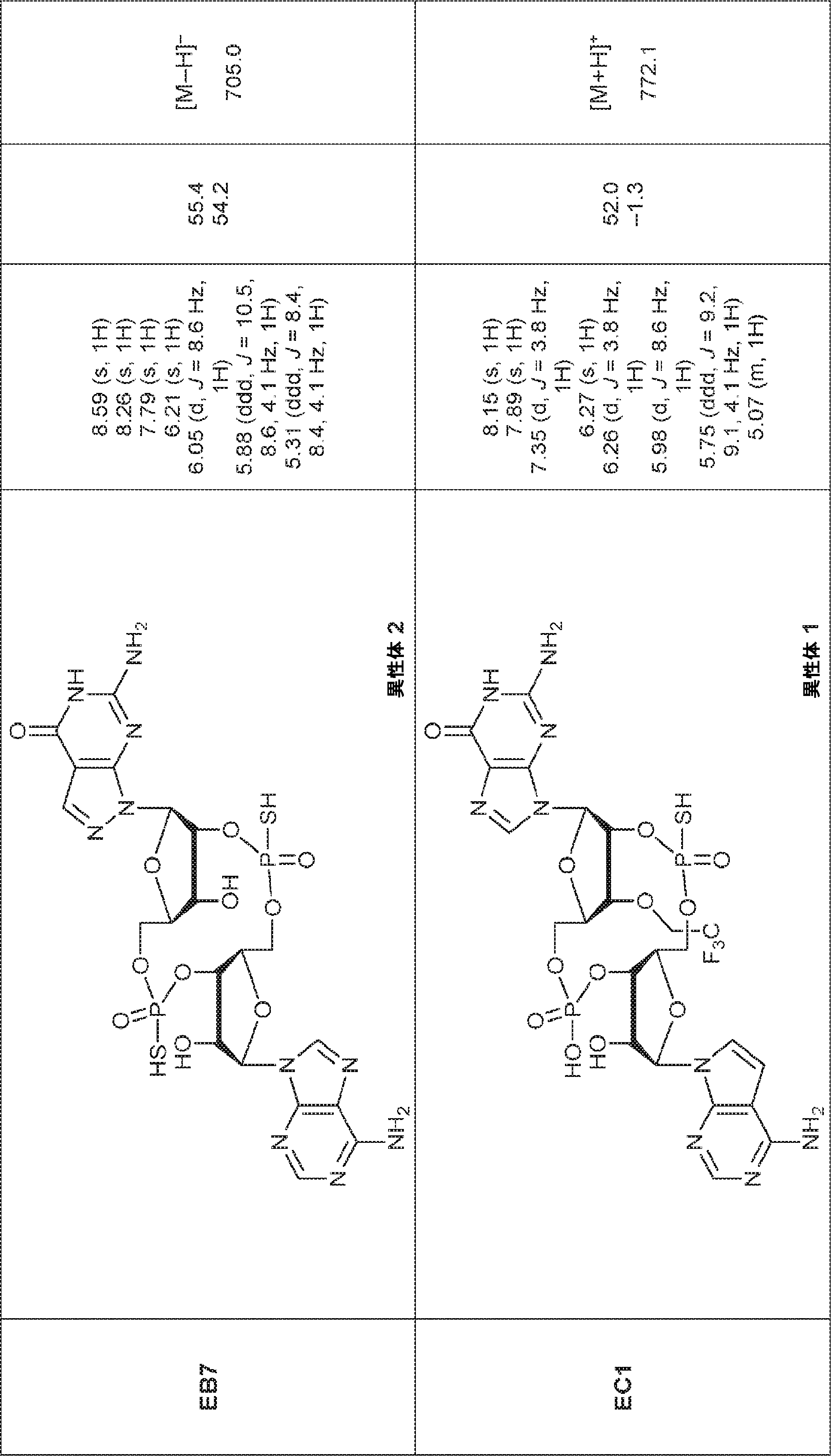
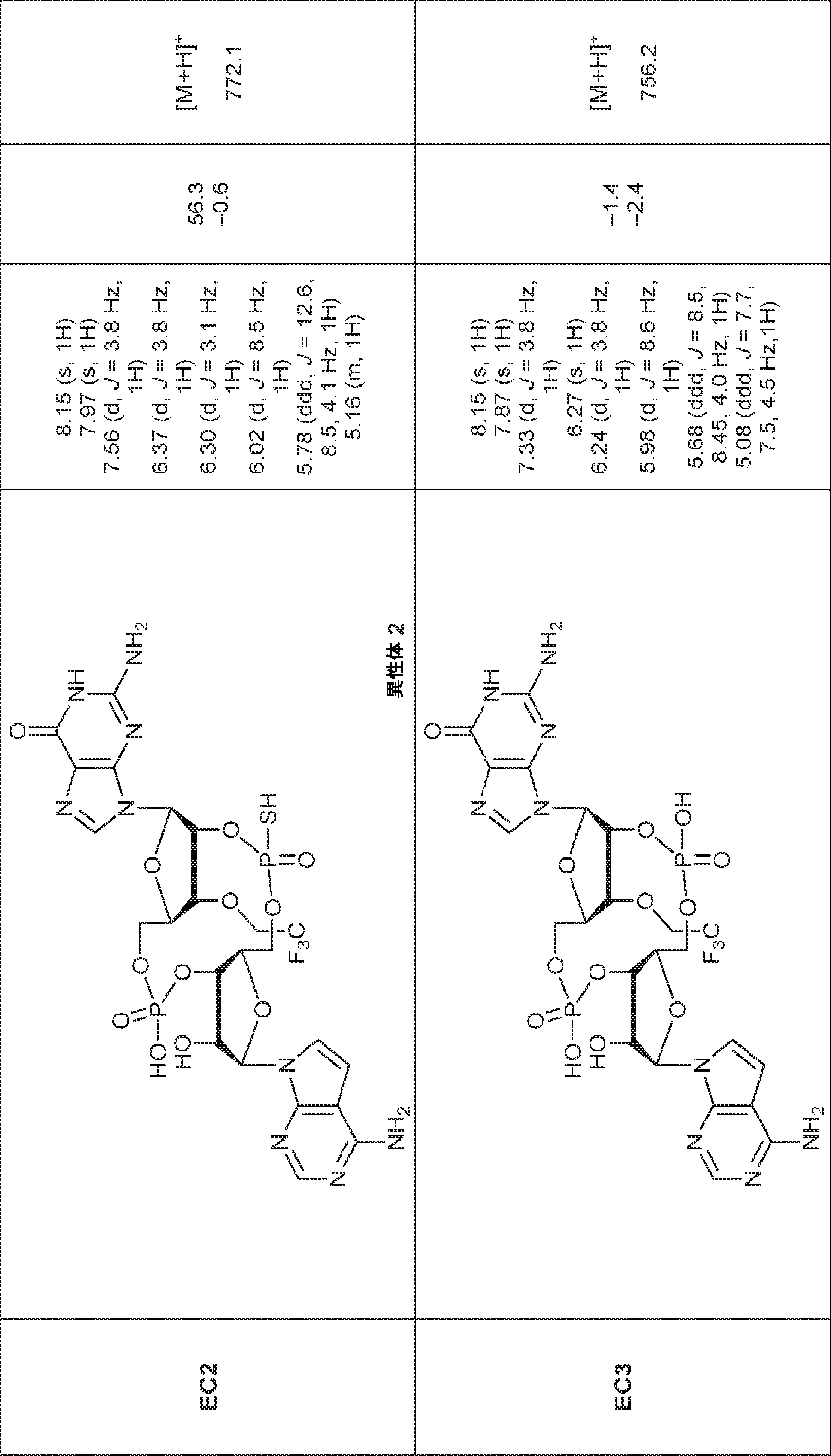
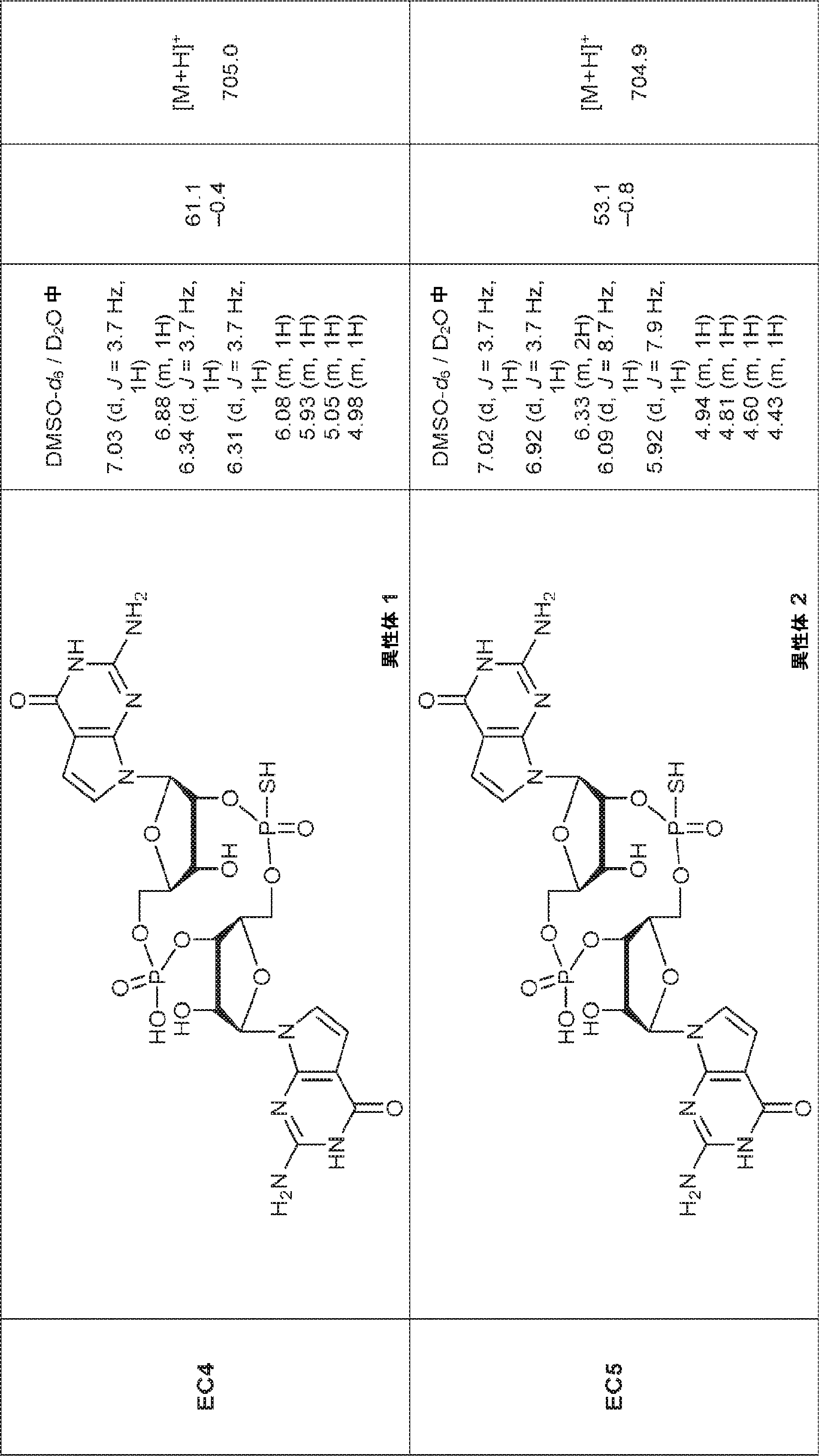
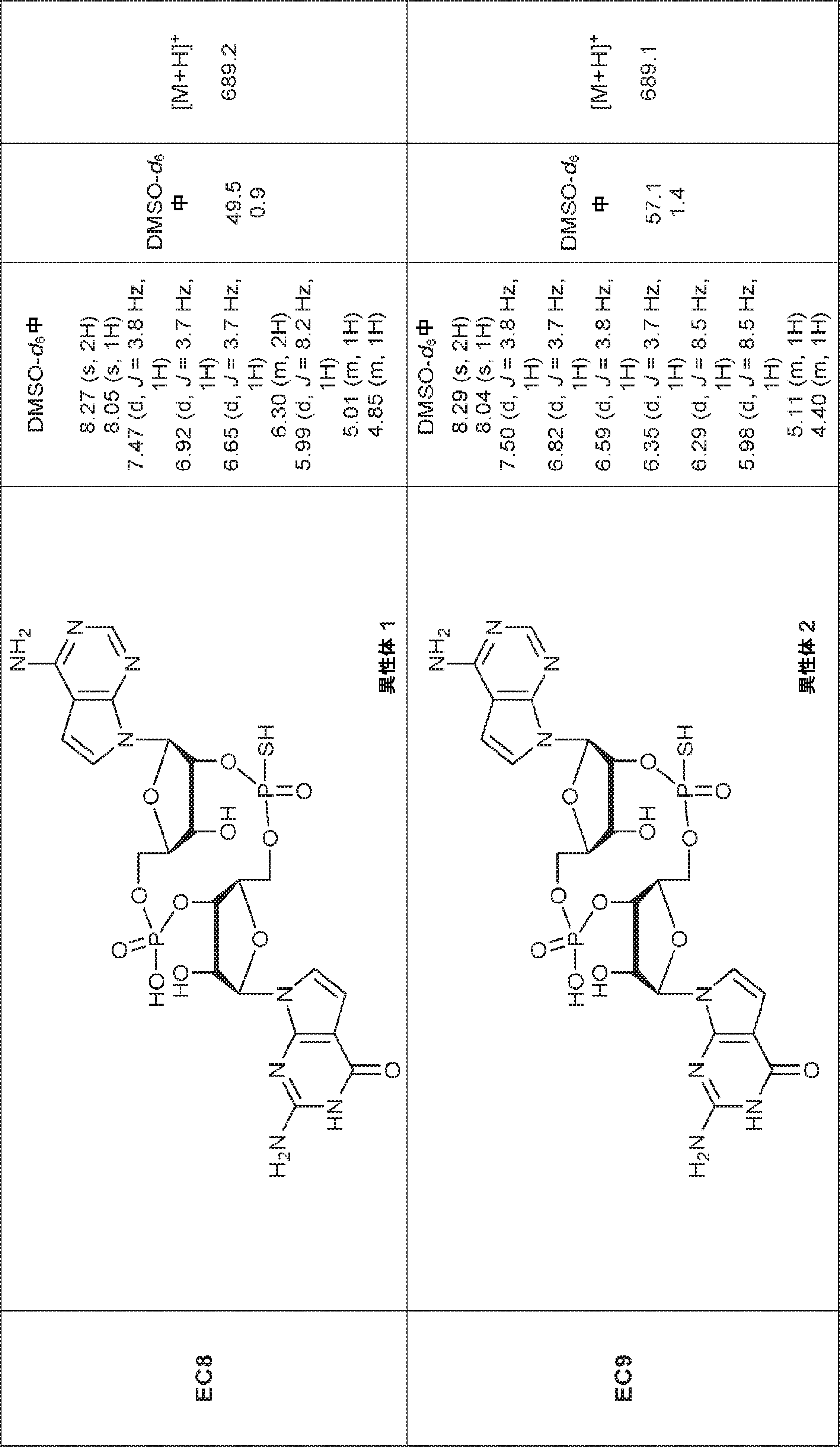
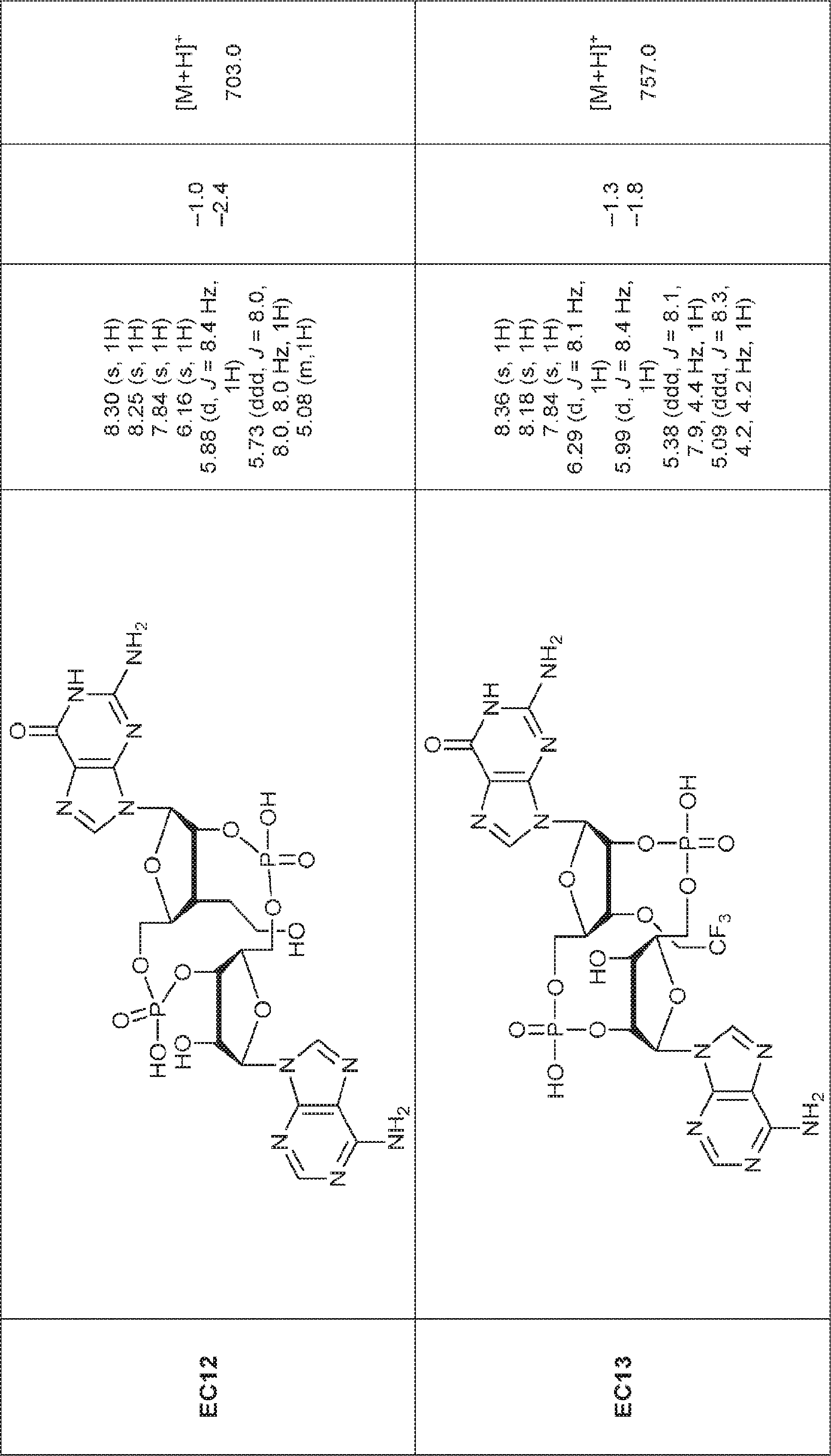
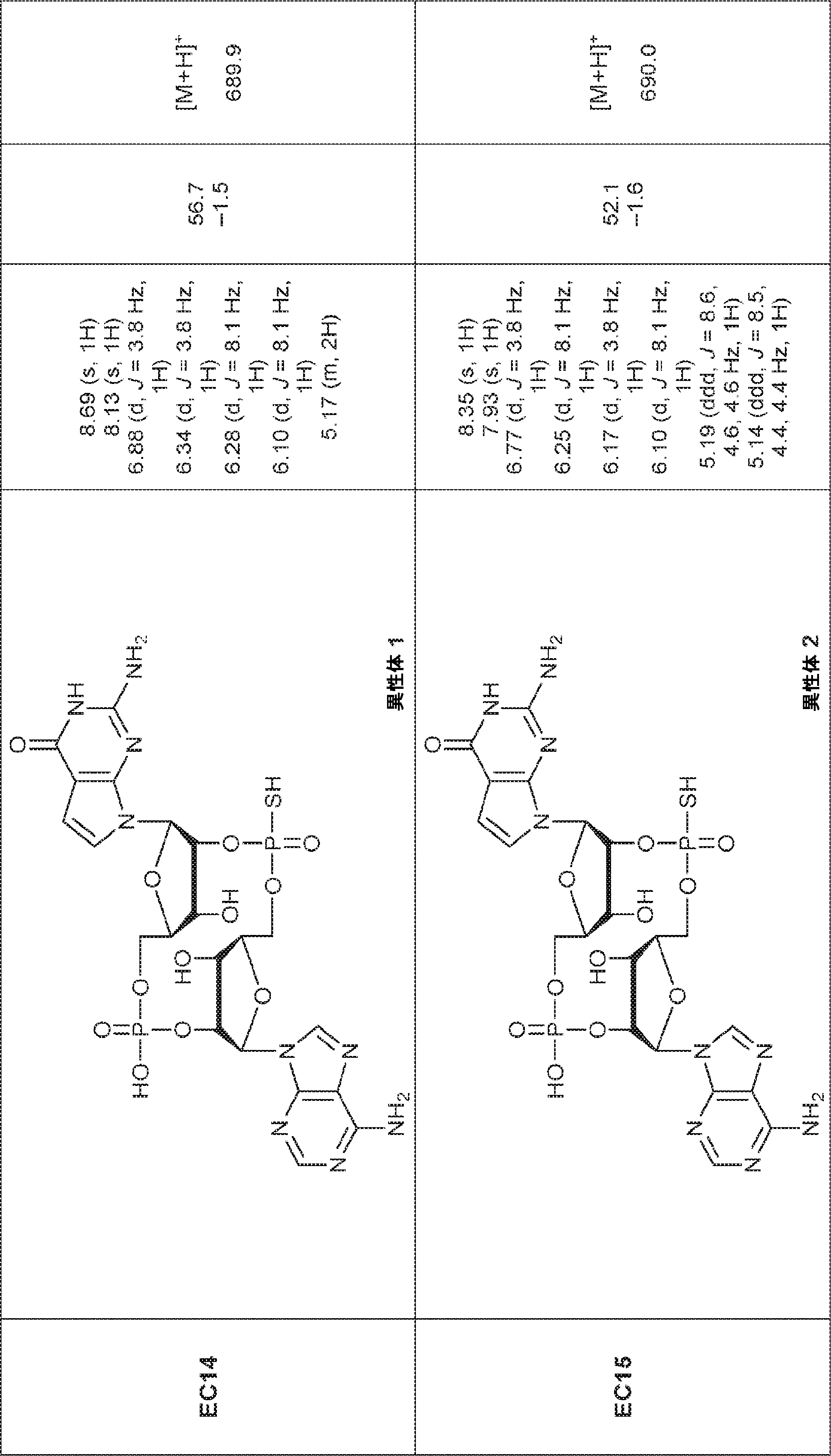
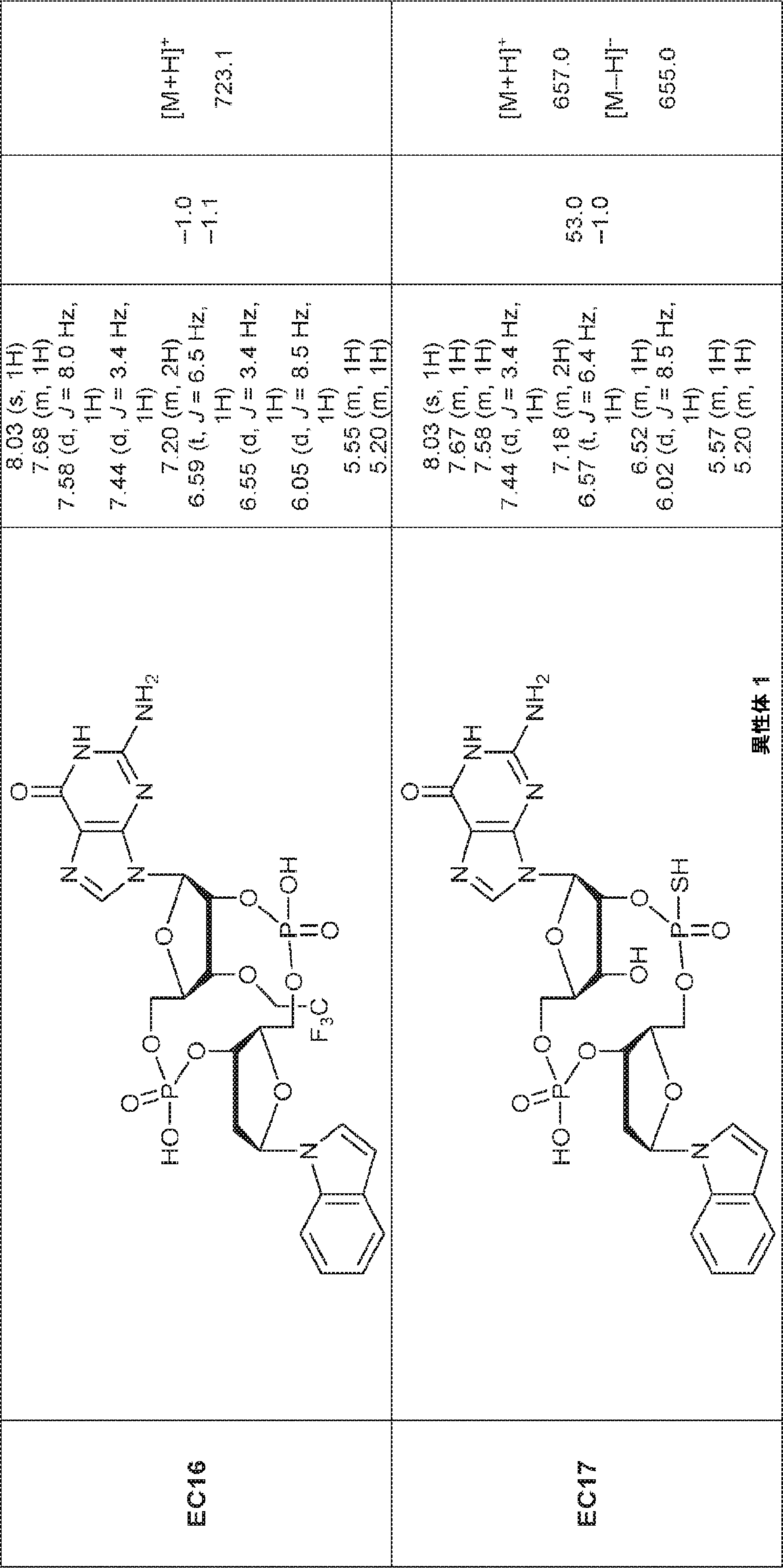
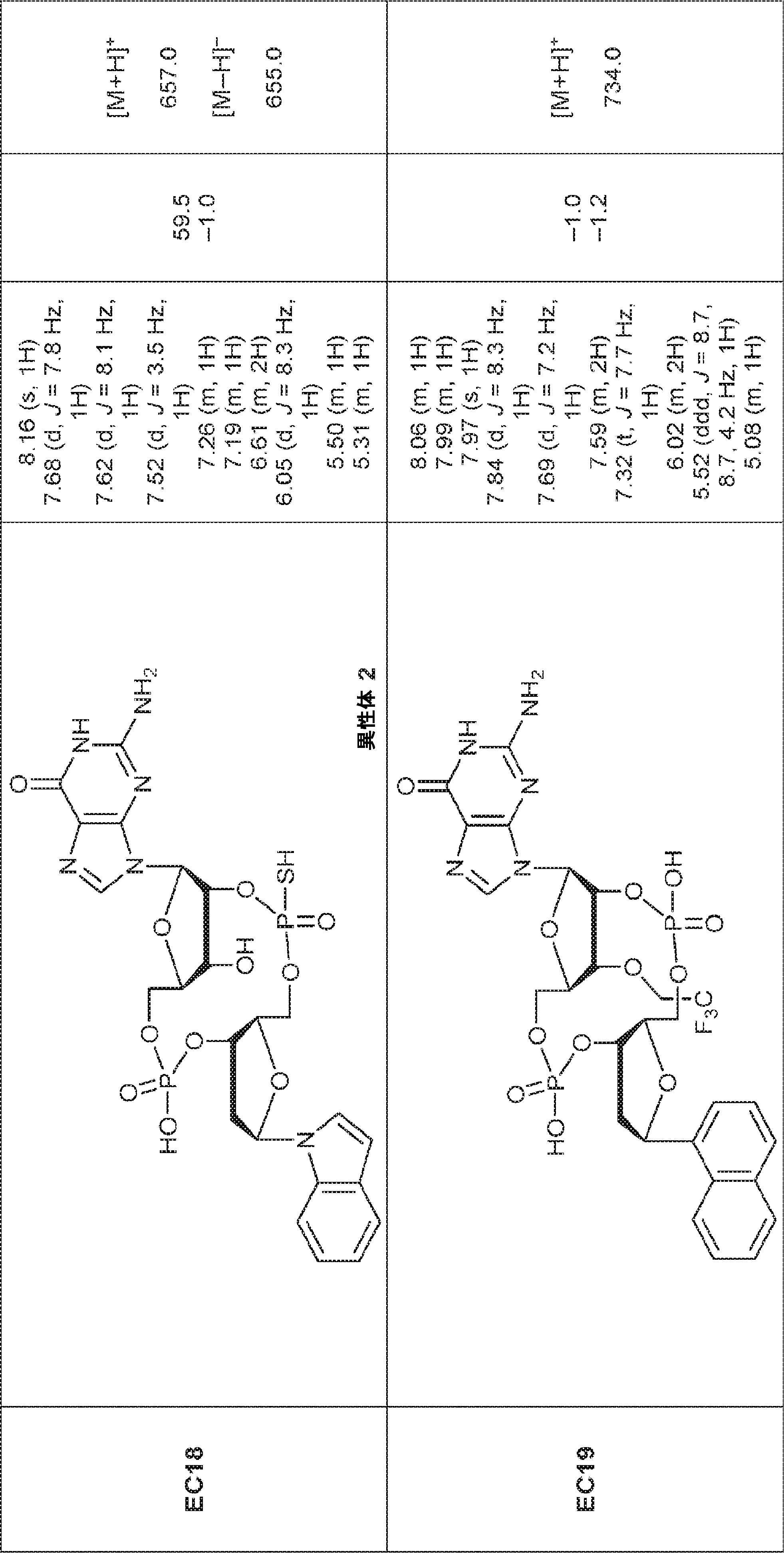
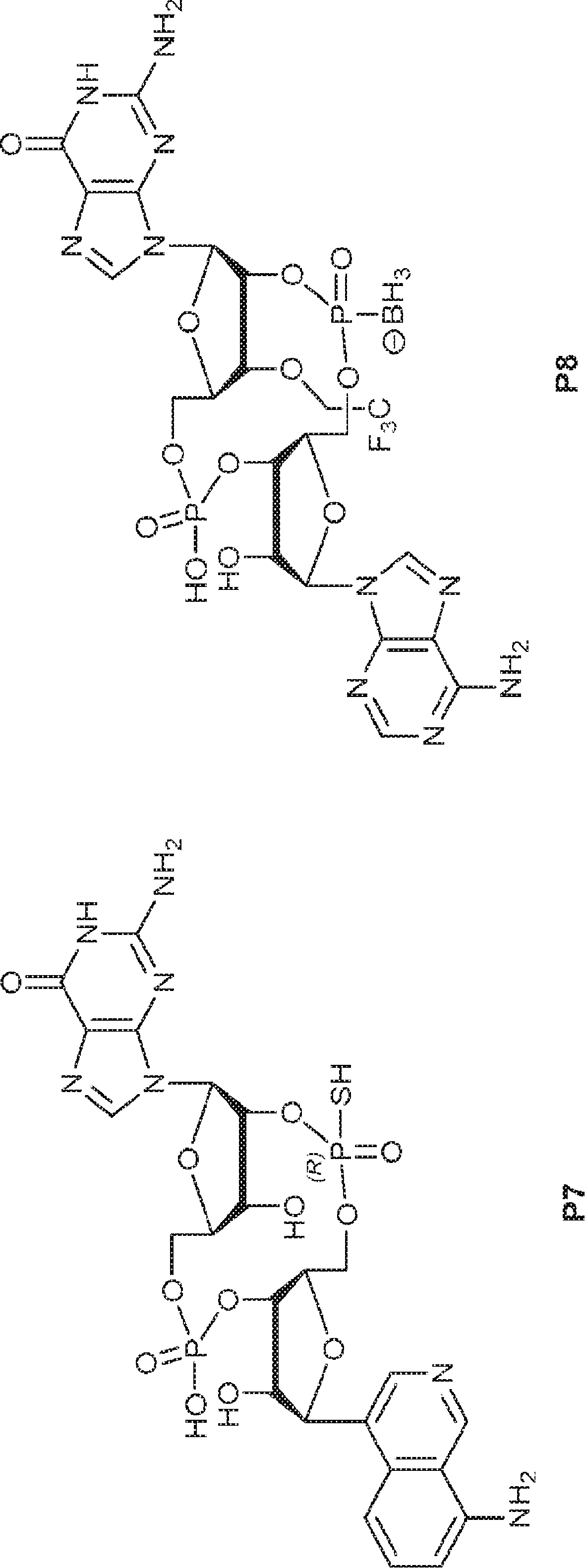
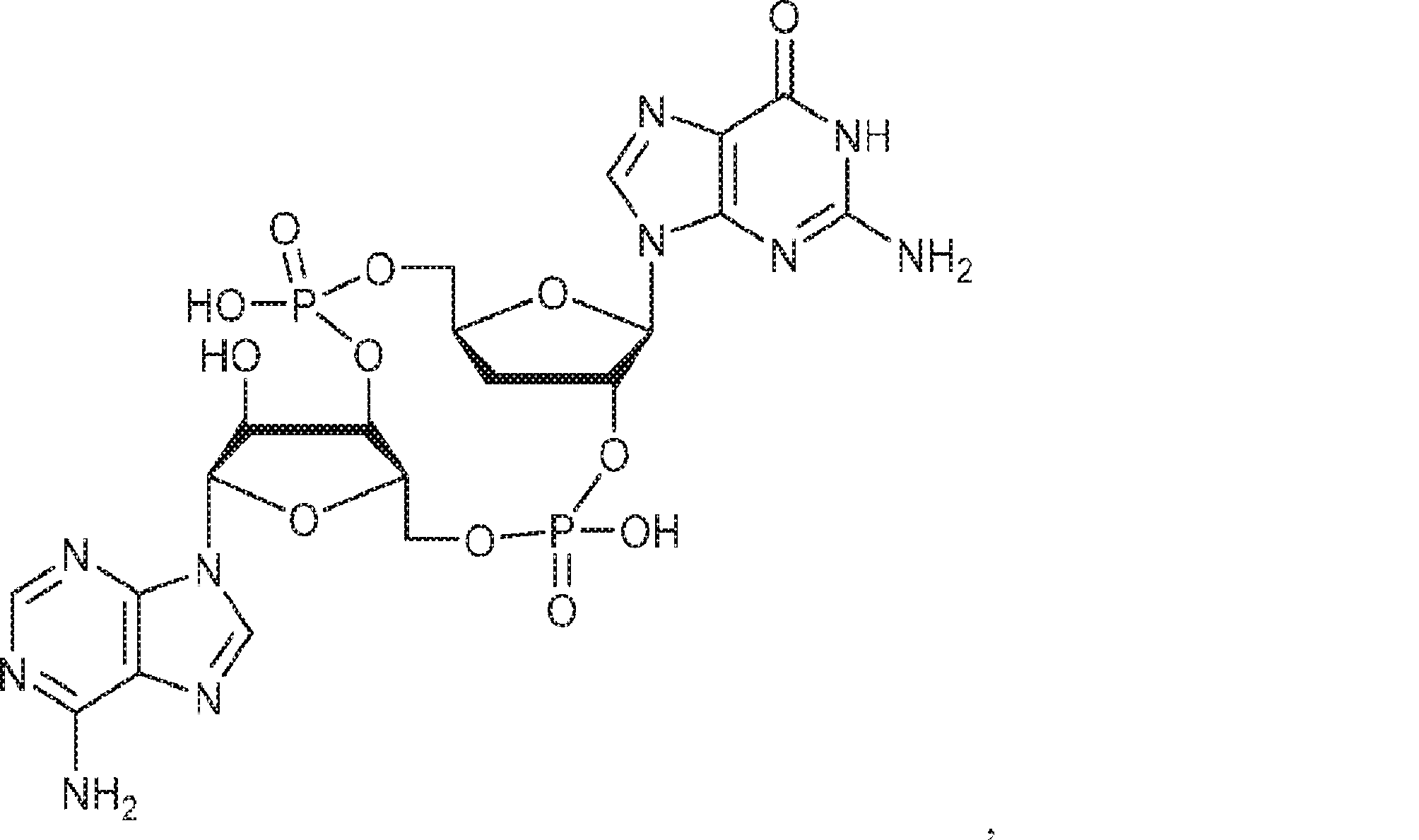
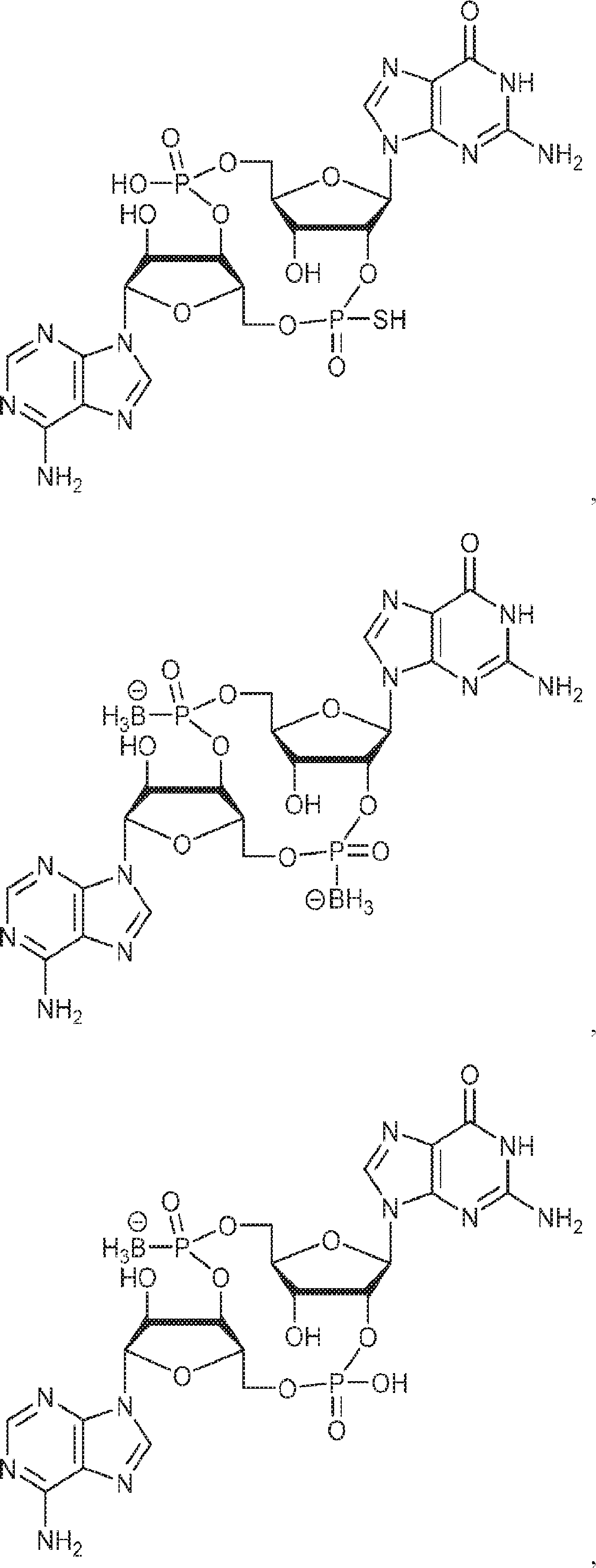
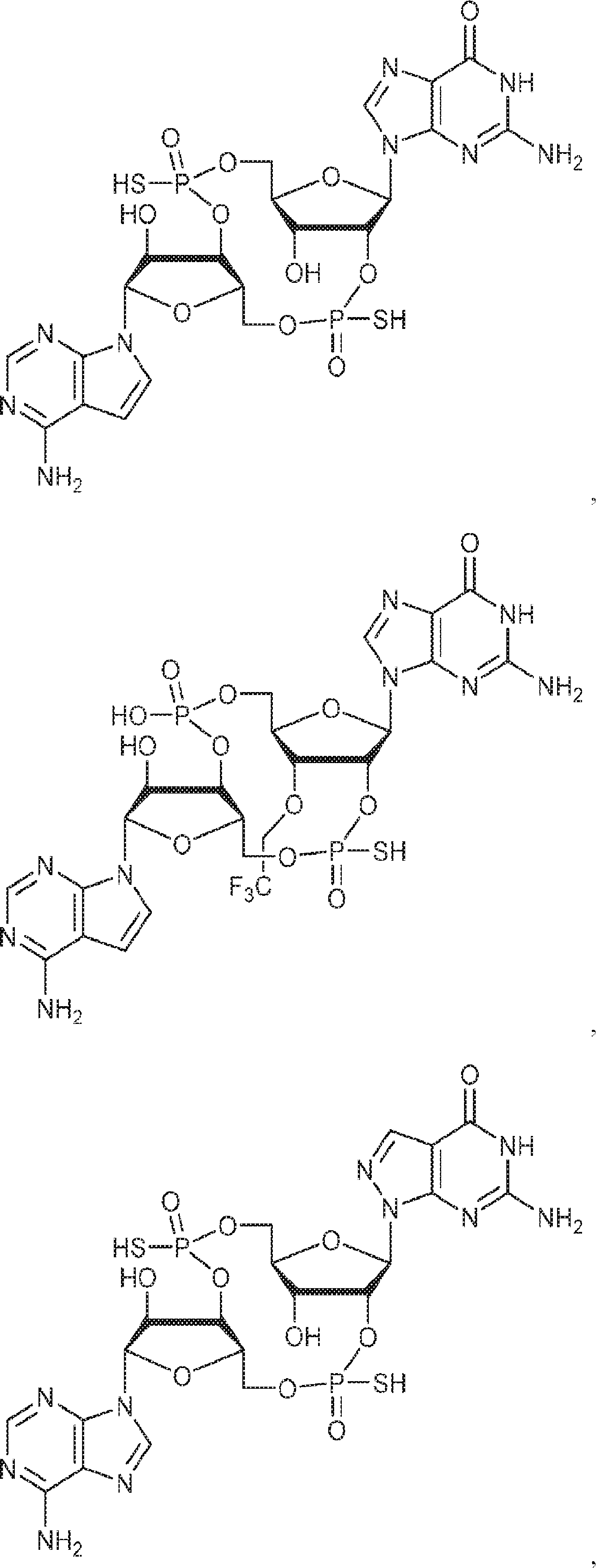
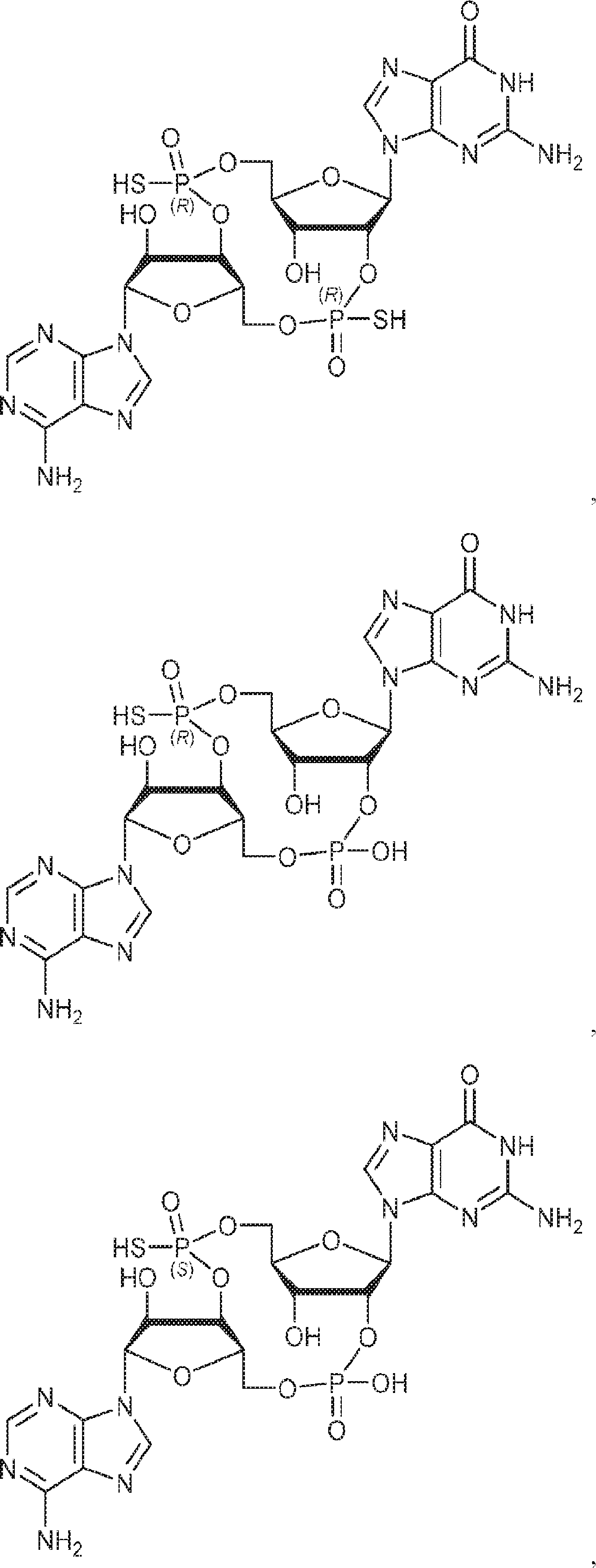
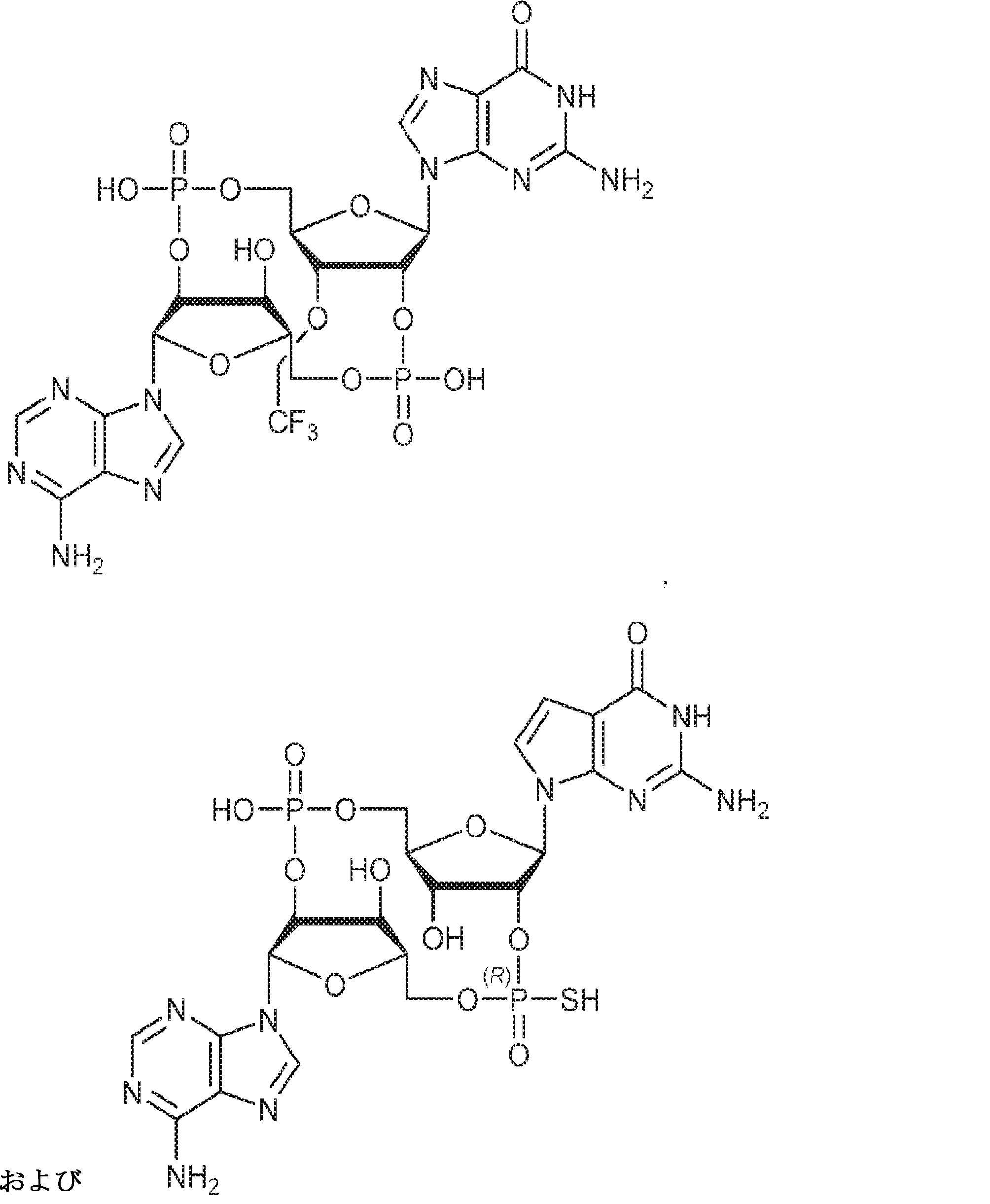
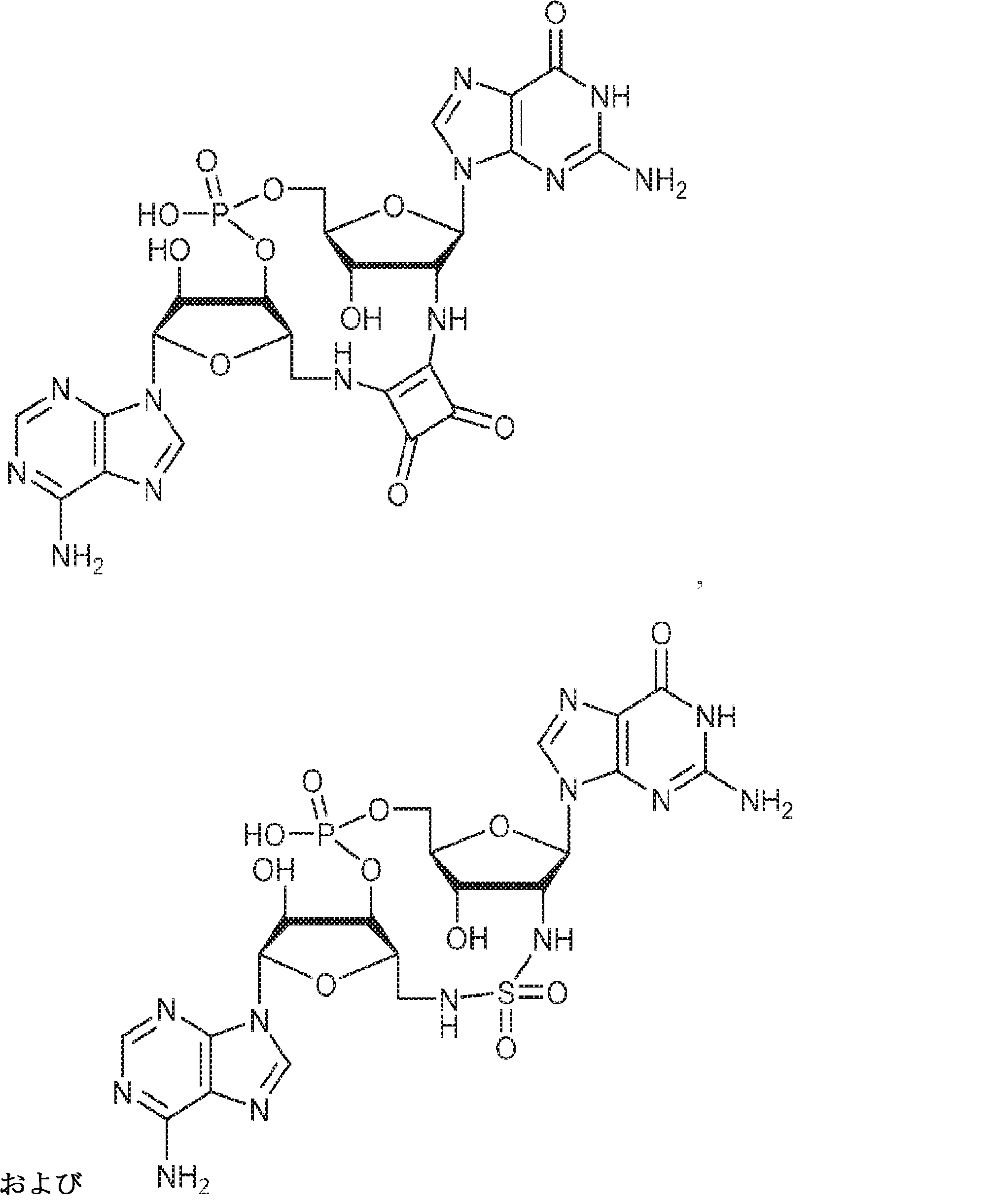
からなる群より選択される、化合物。
[本発明1011]
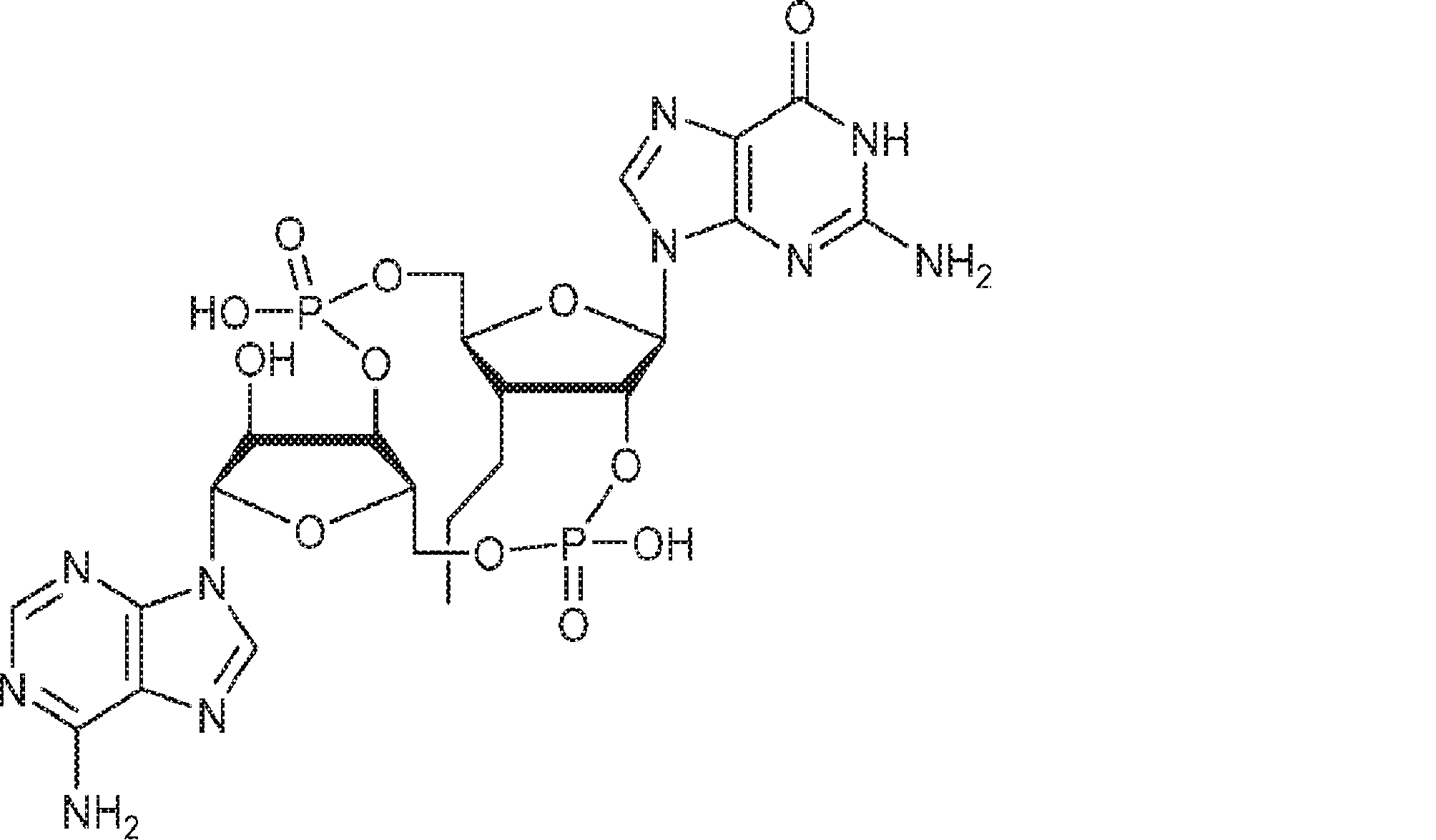
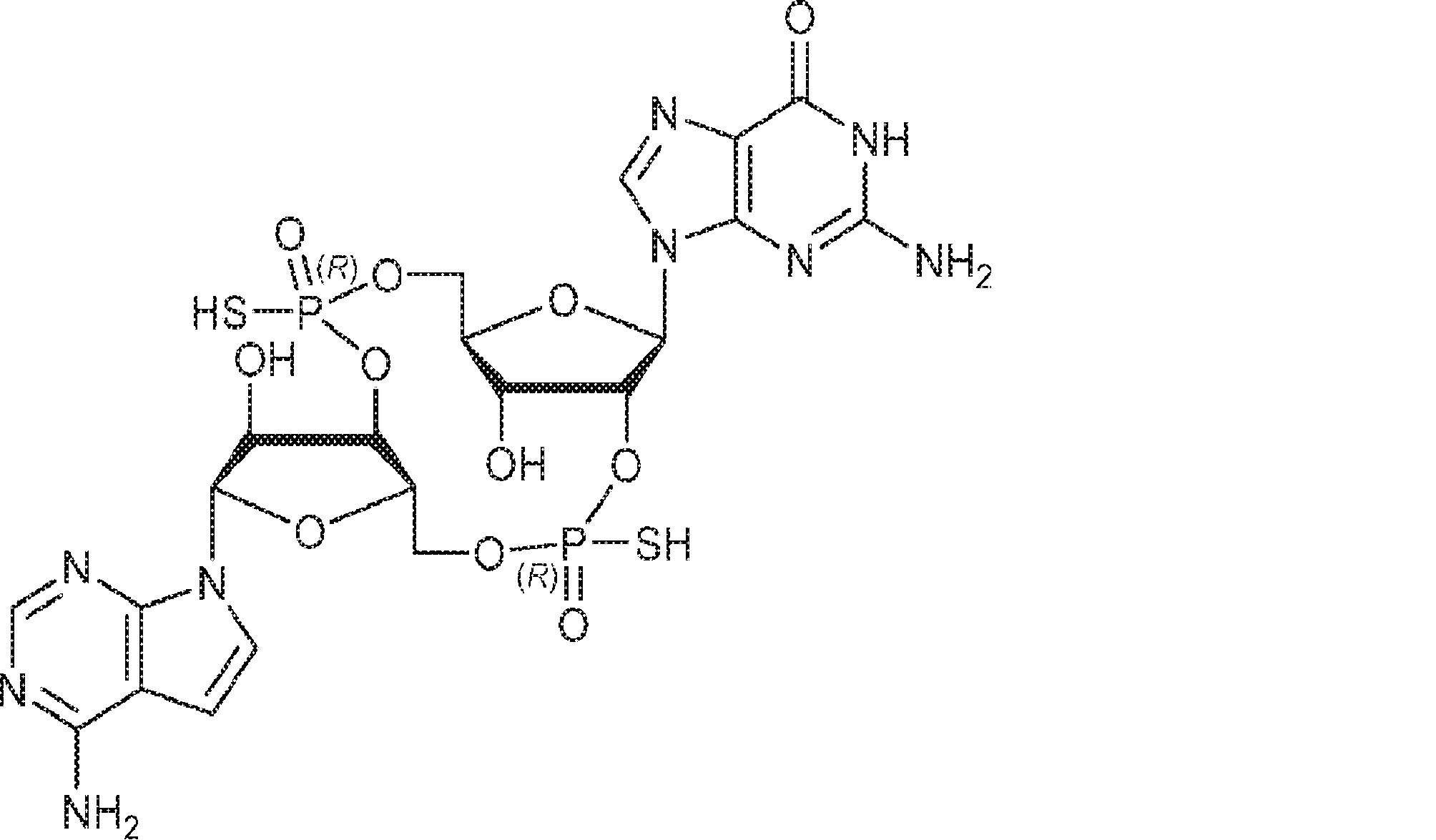
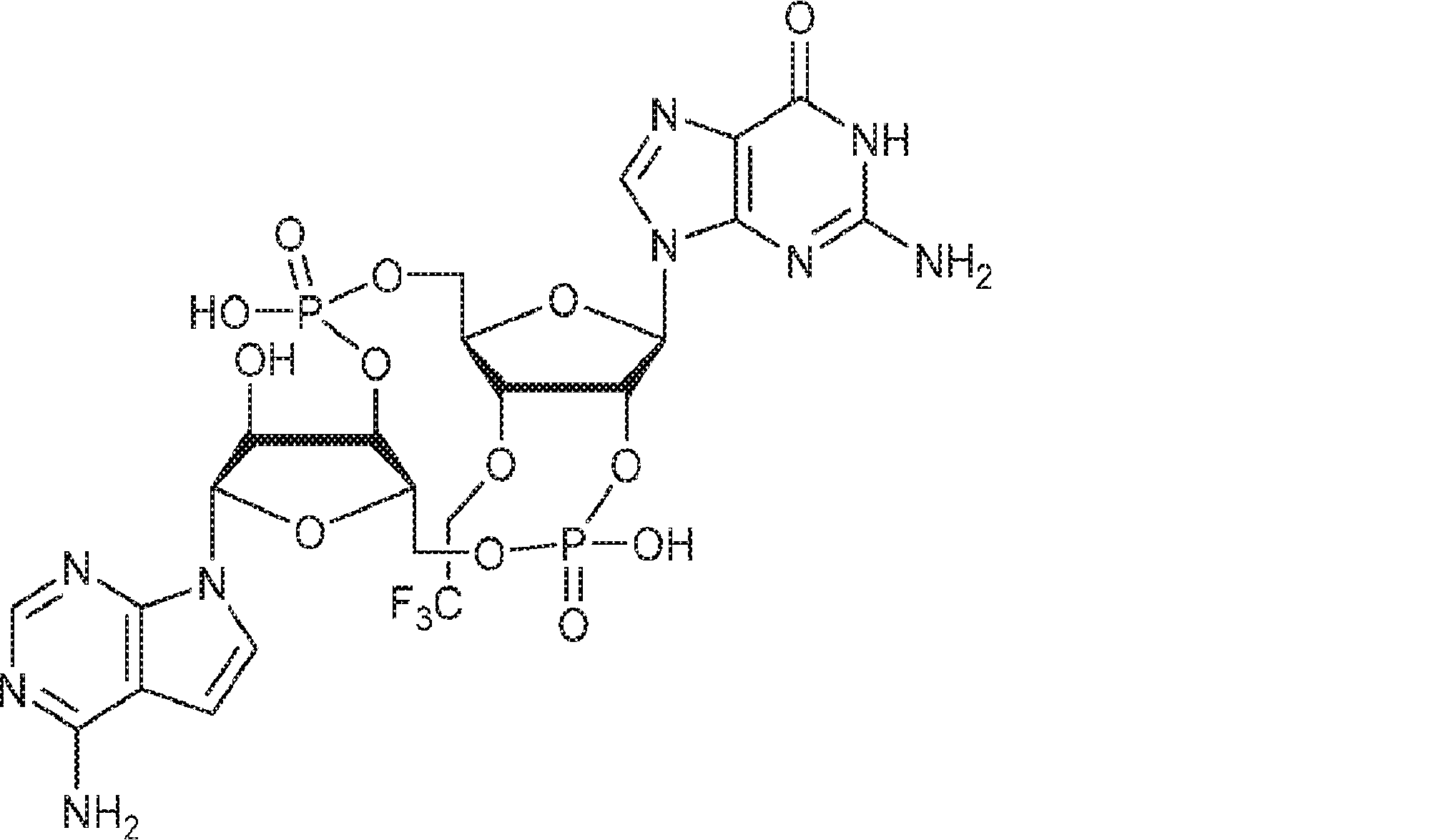
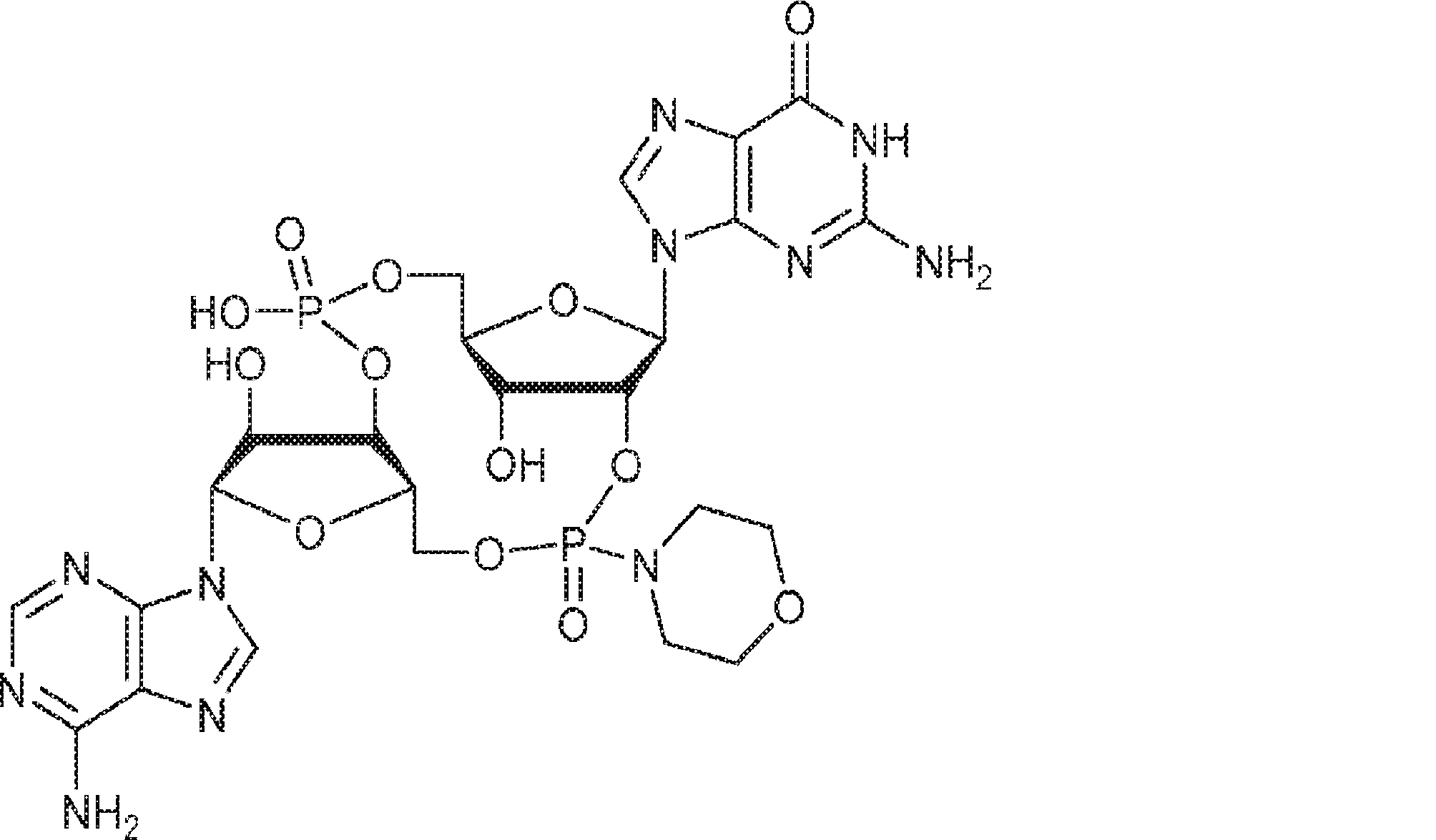
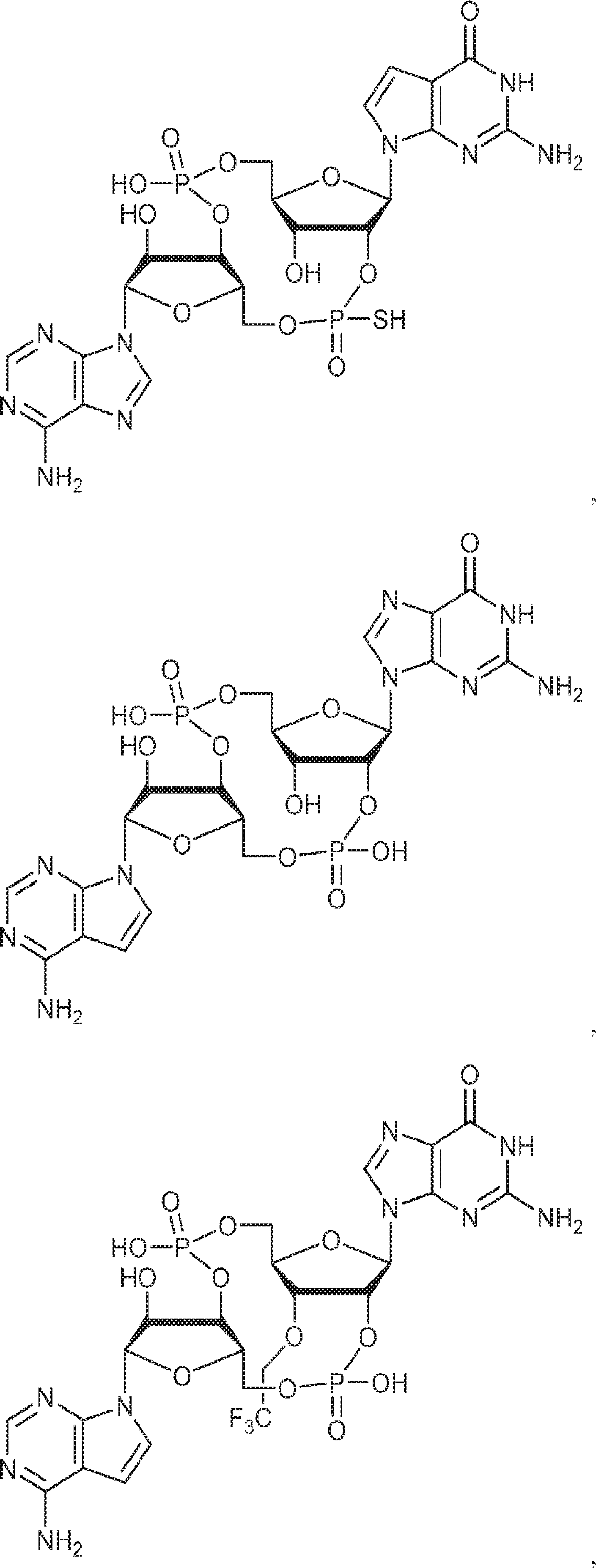
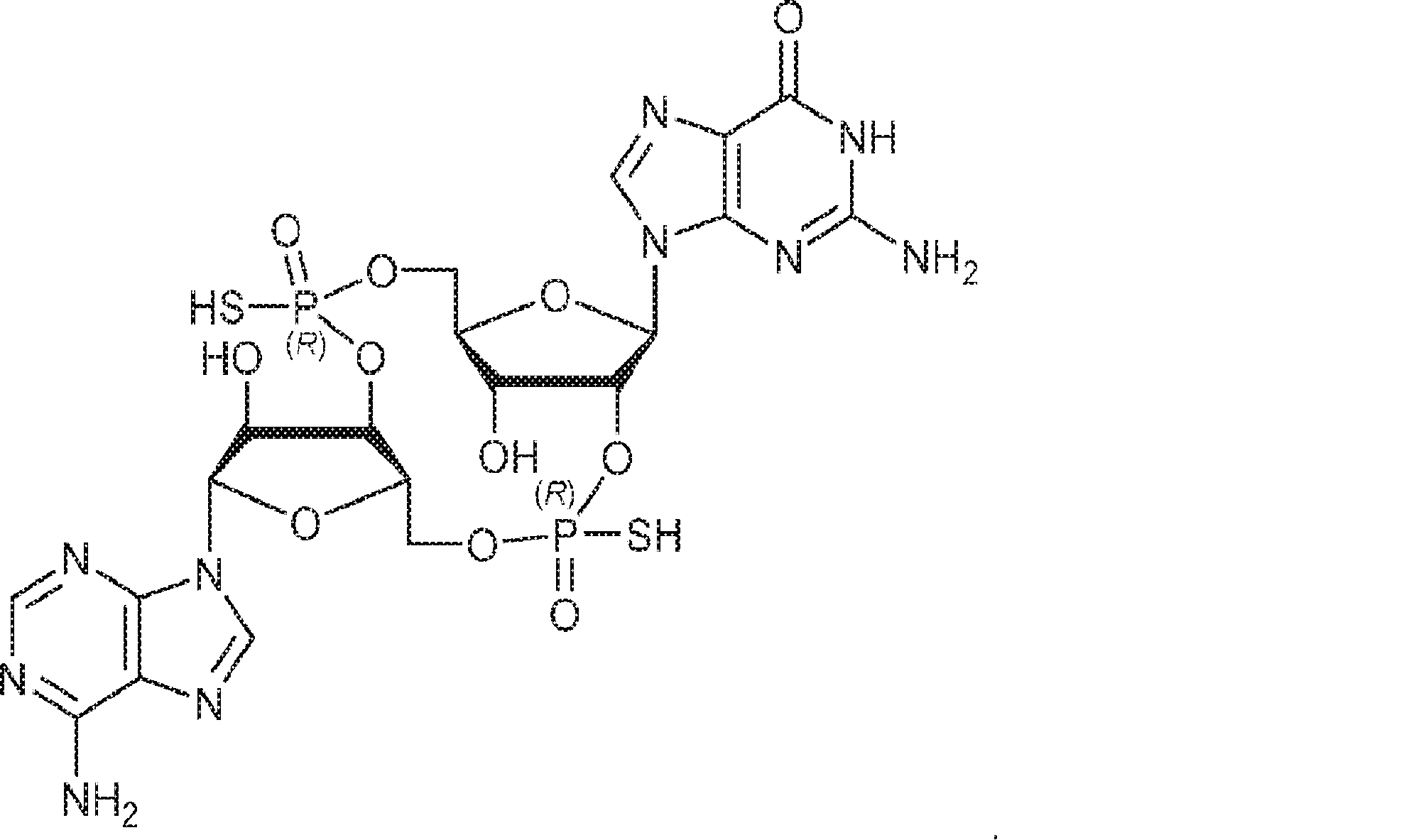
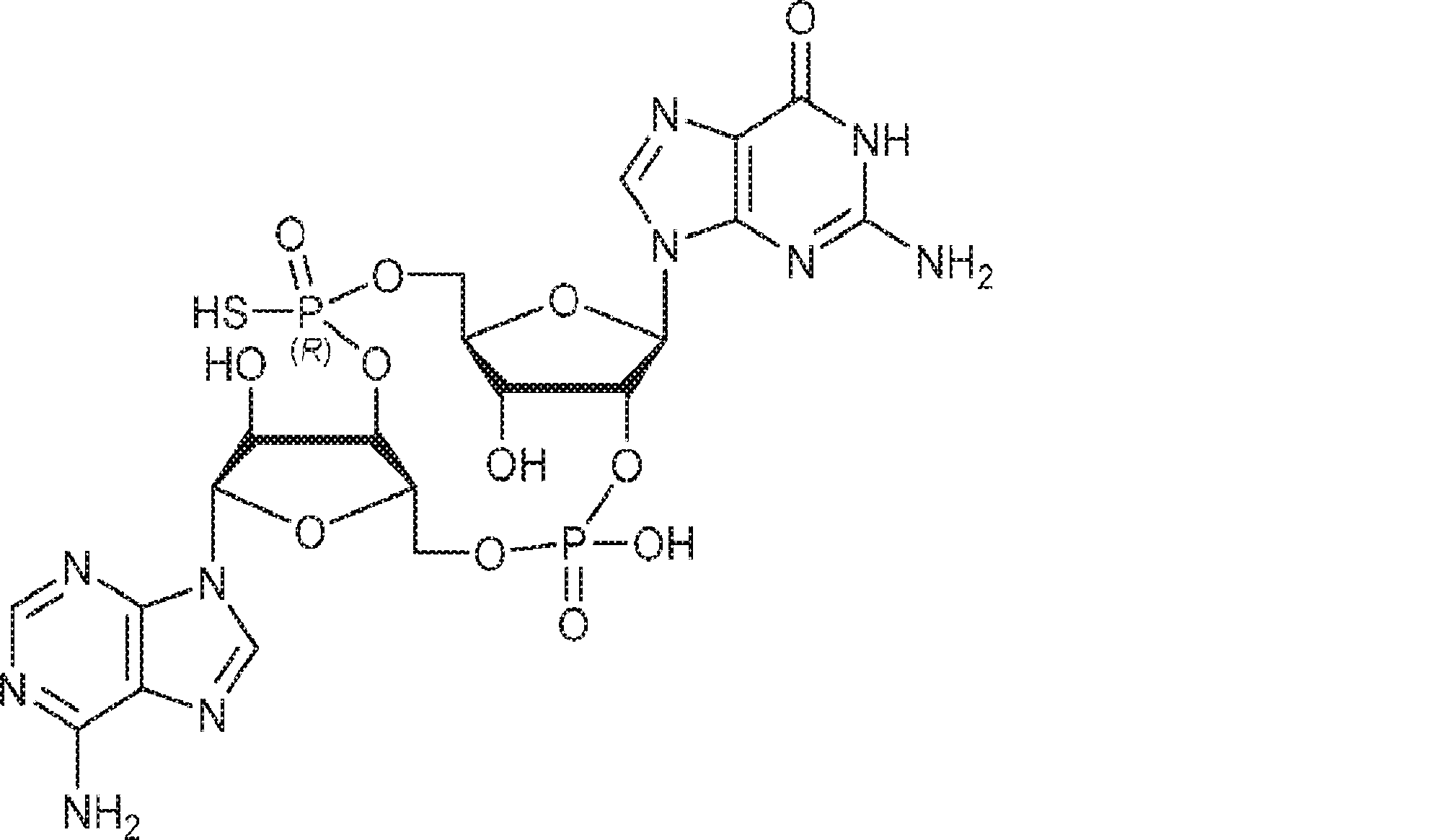
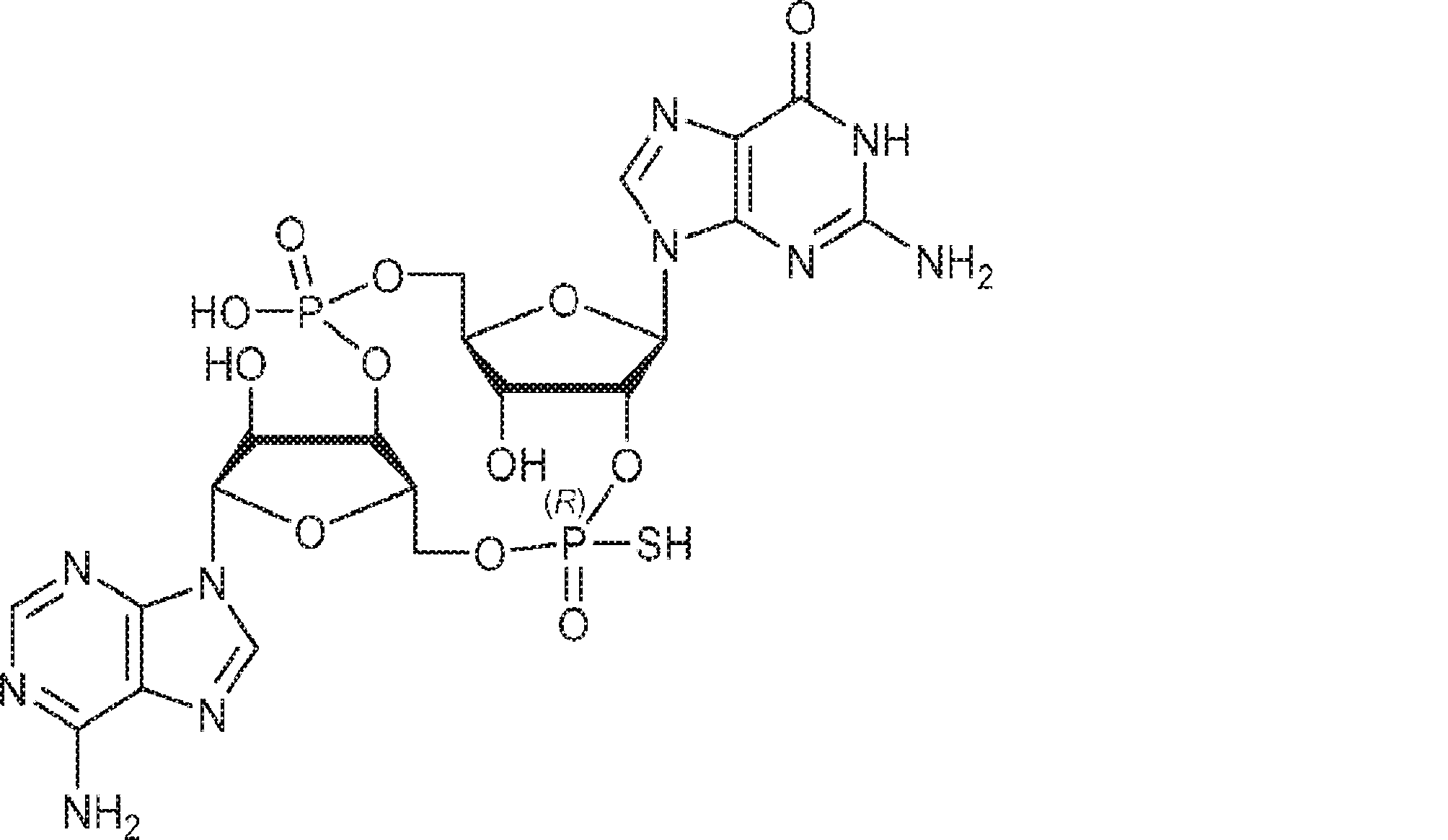
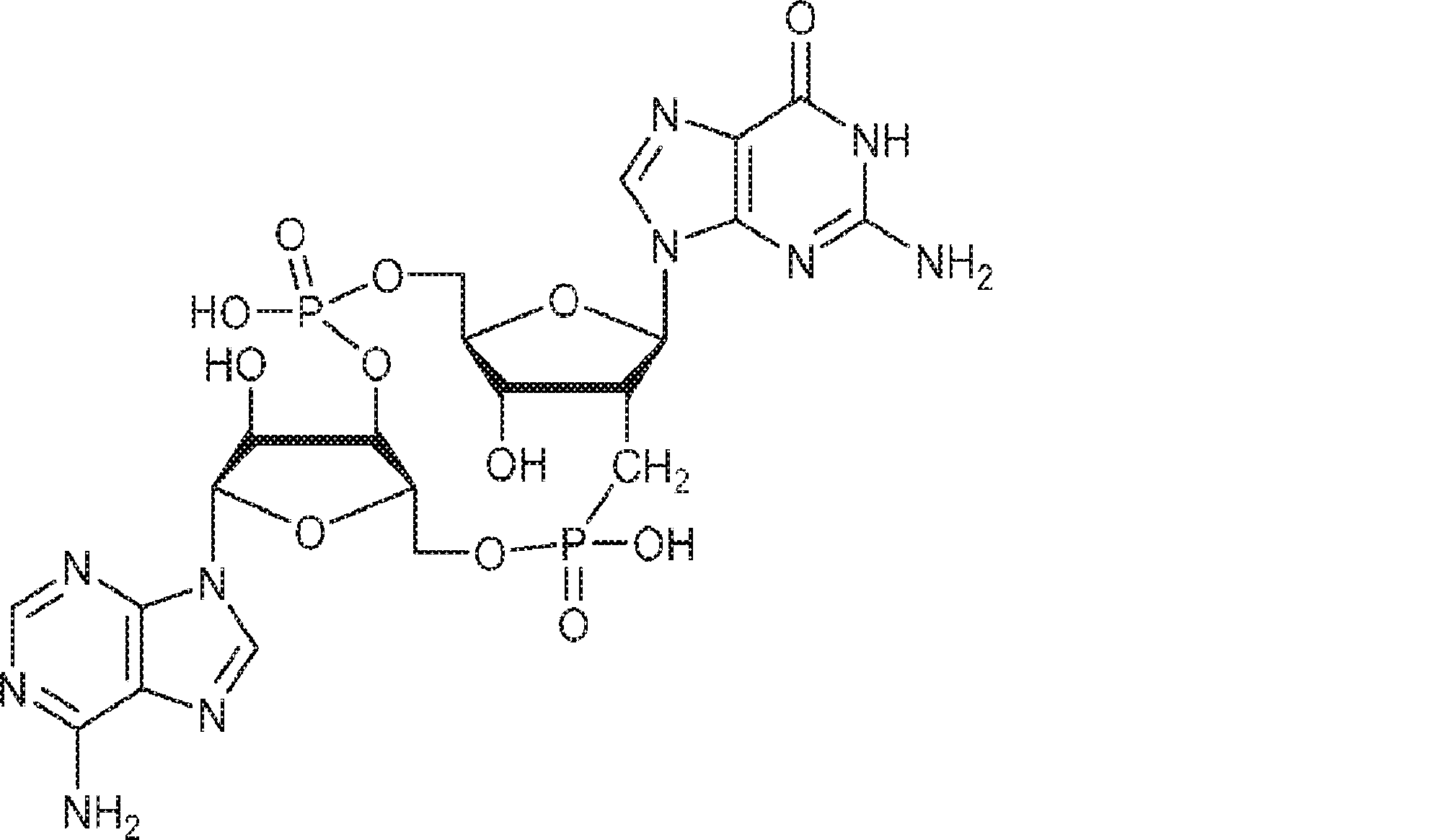
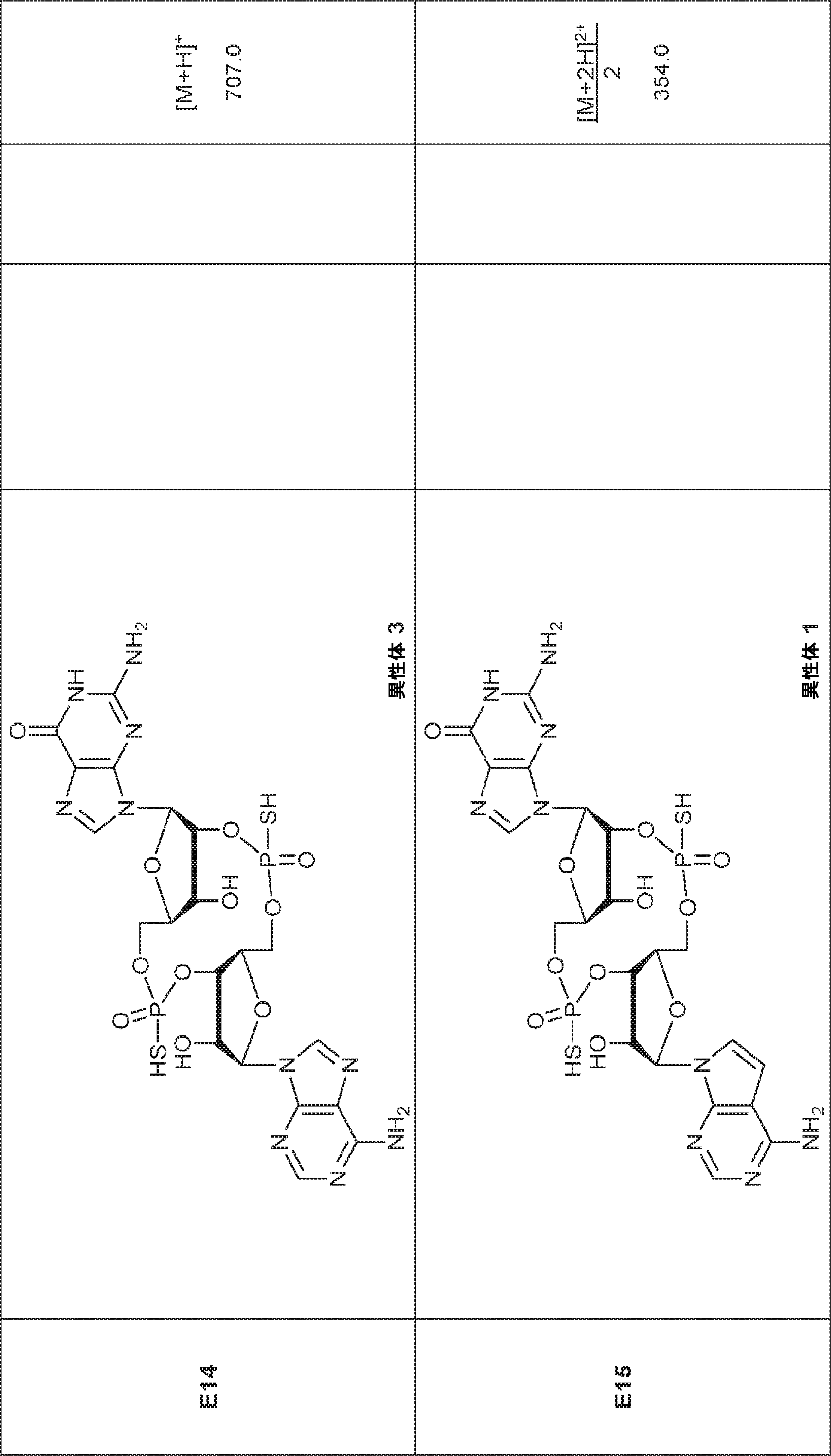
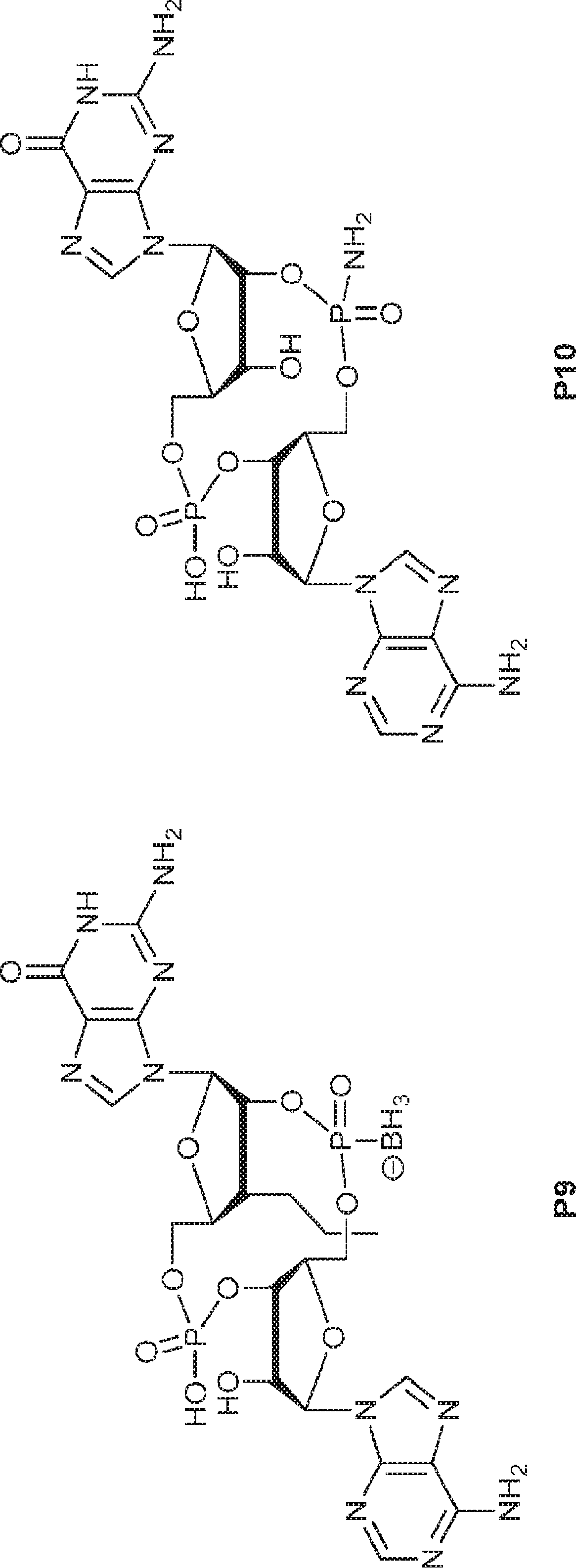
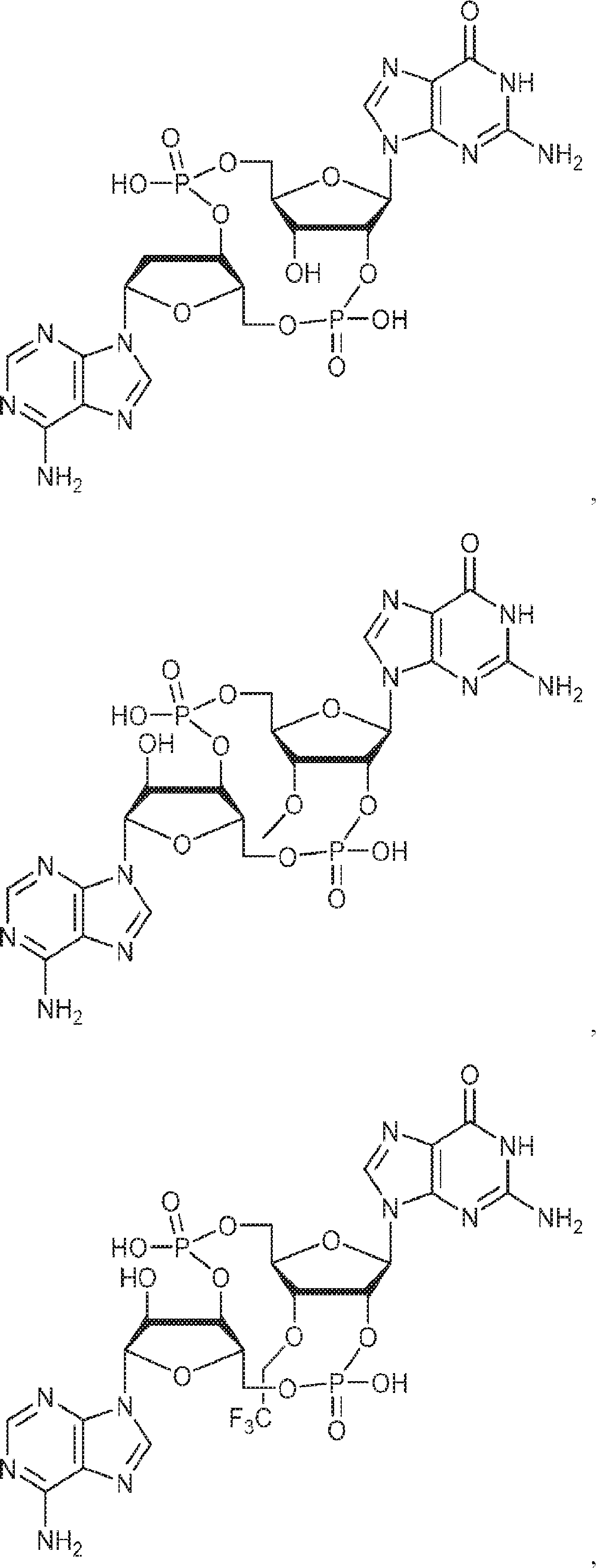
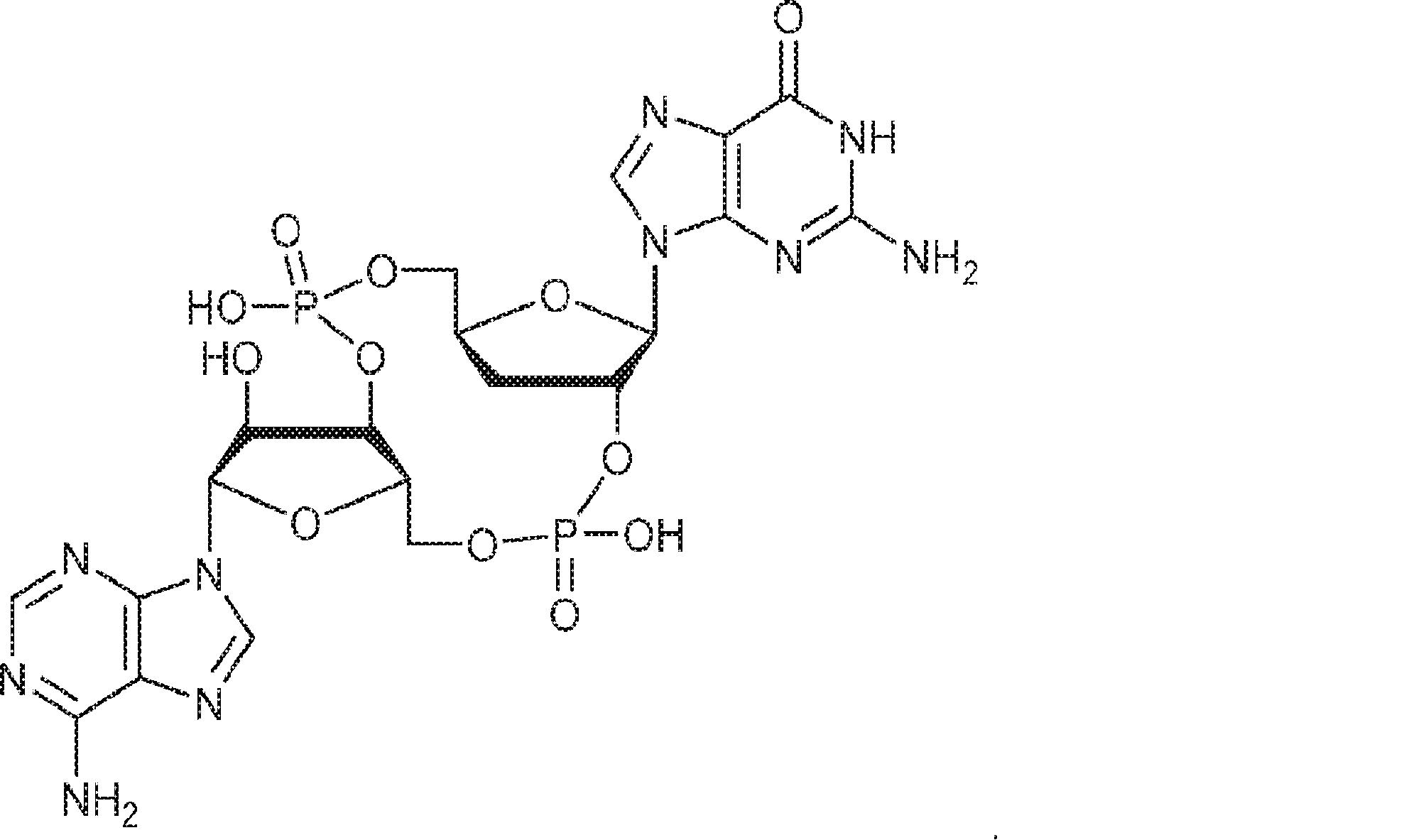
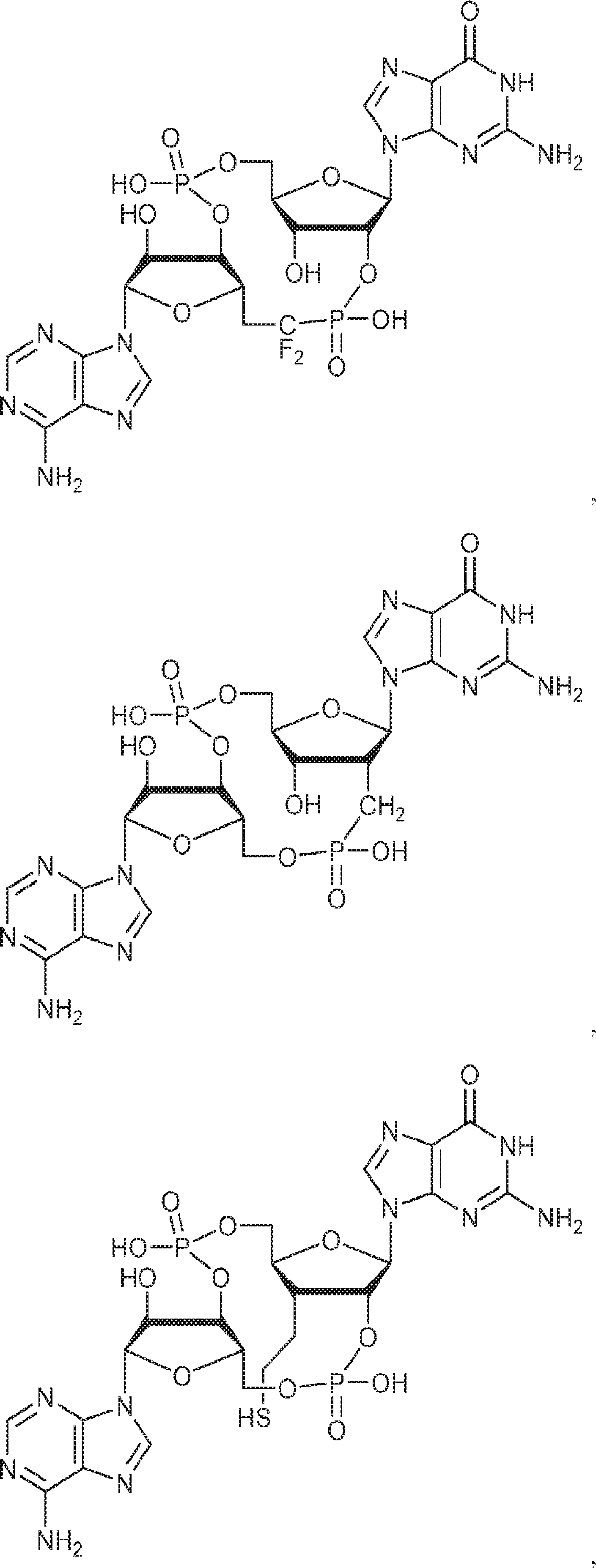
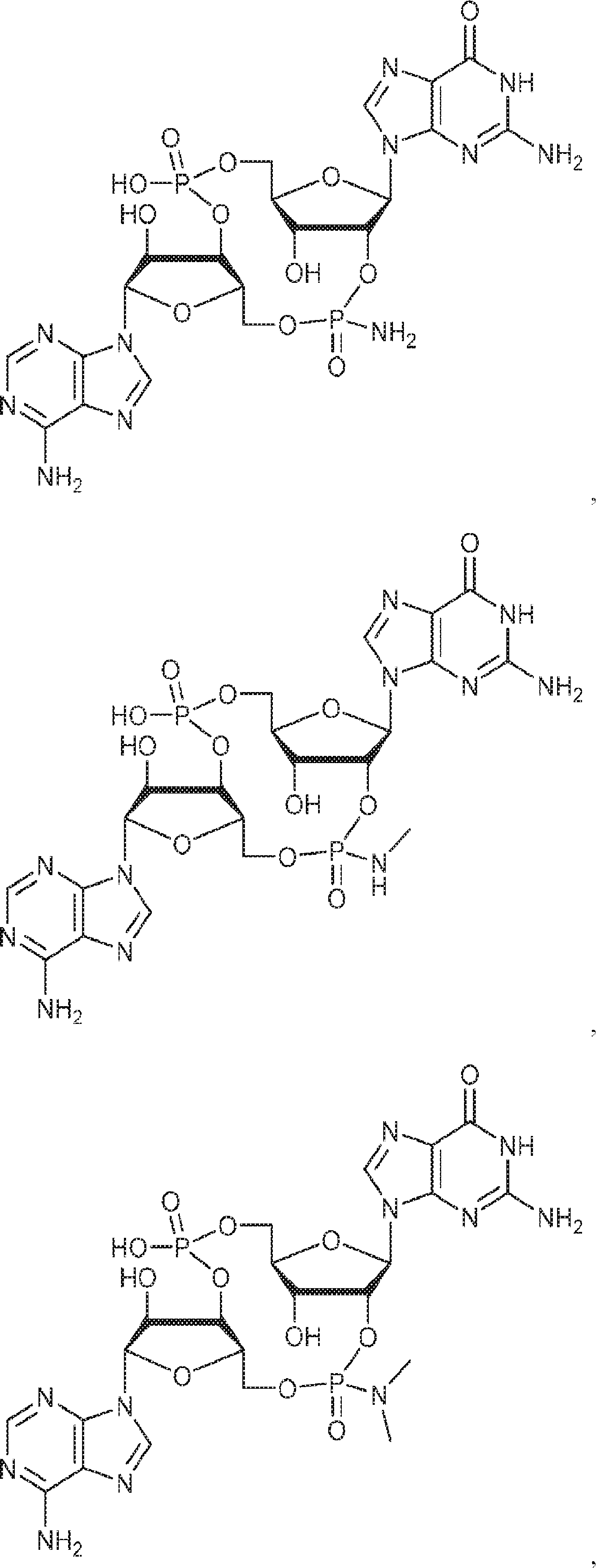
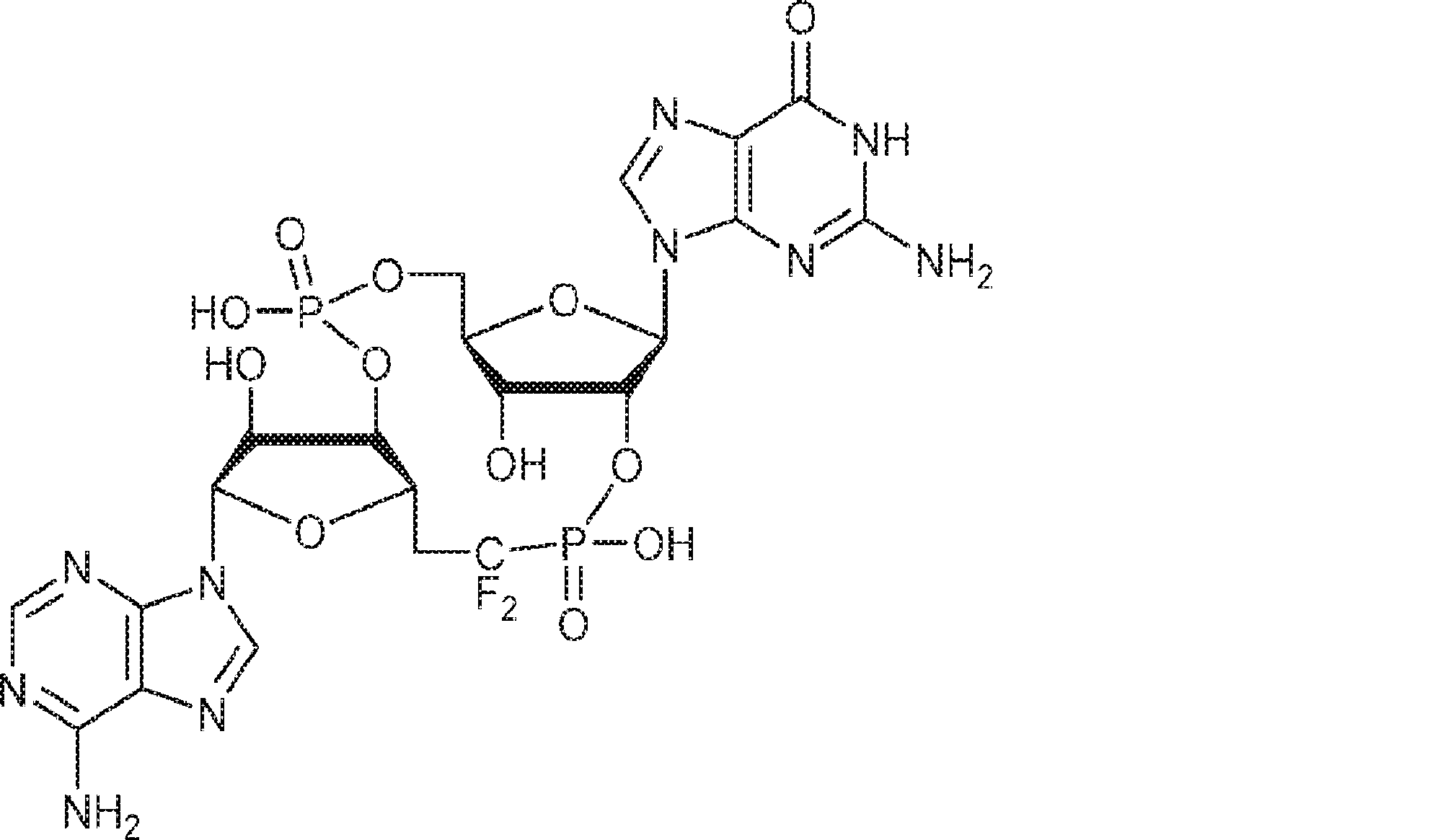
からなる群より選択される、化合物。
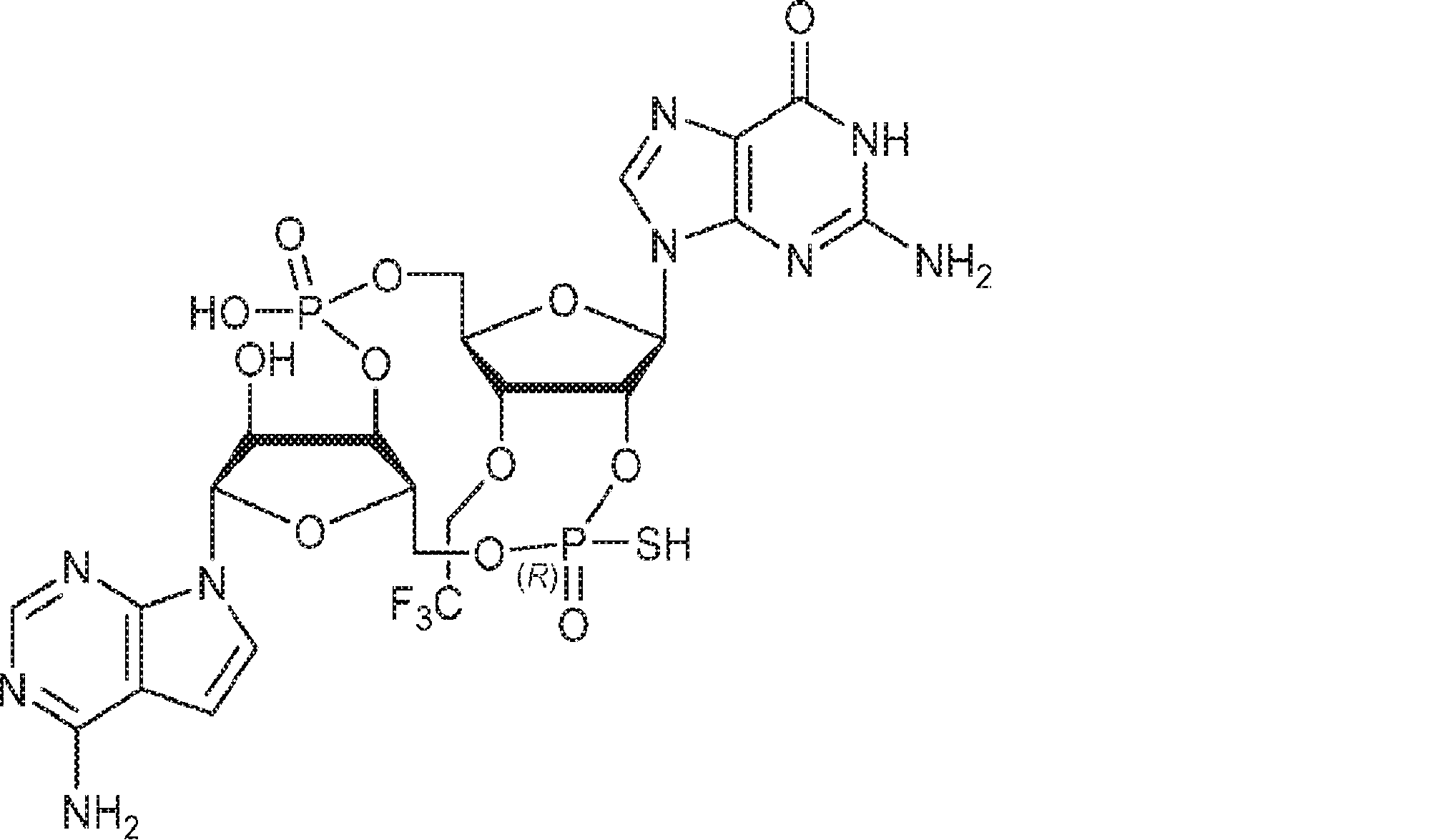
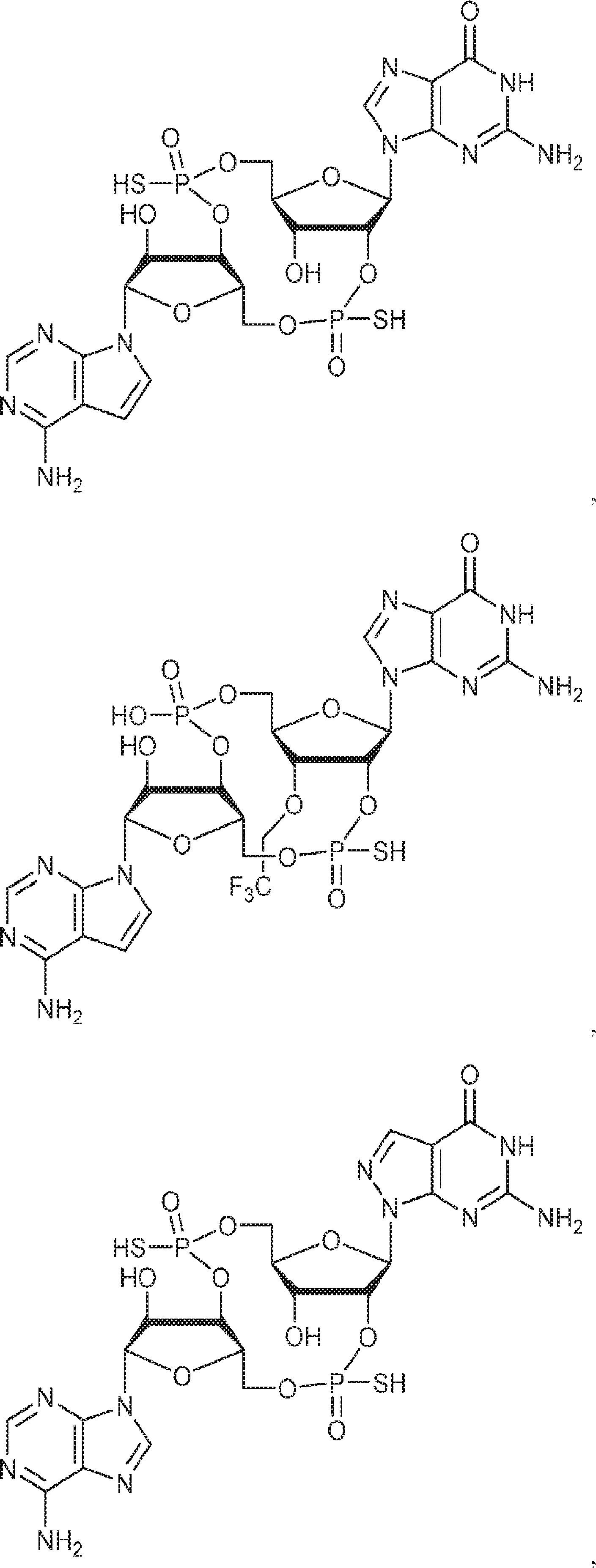
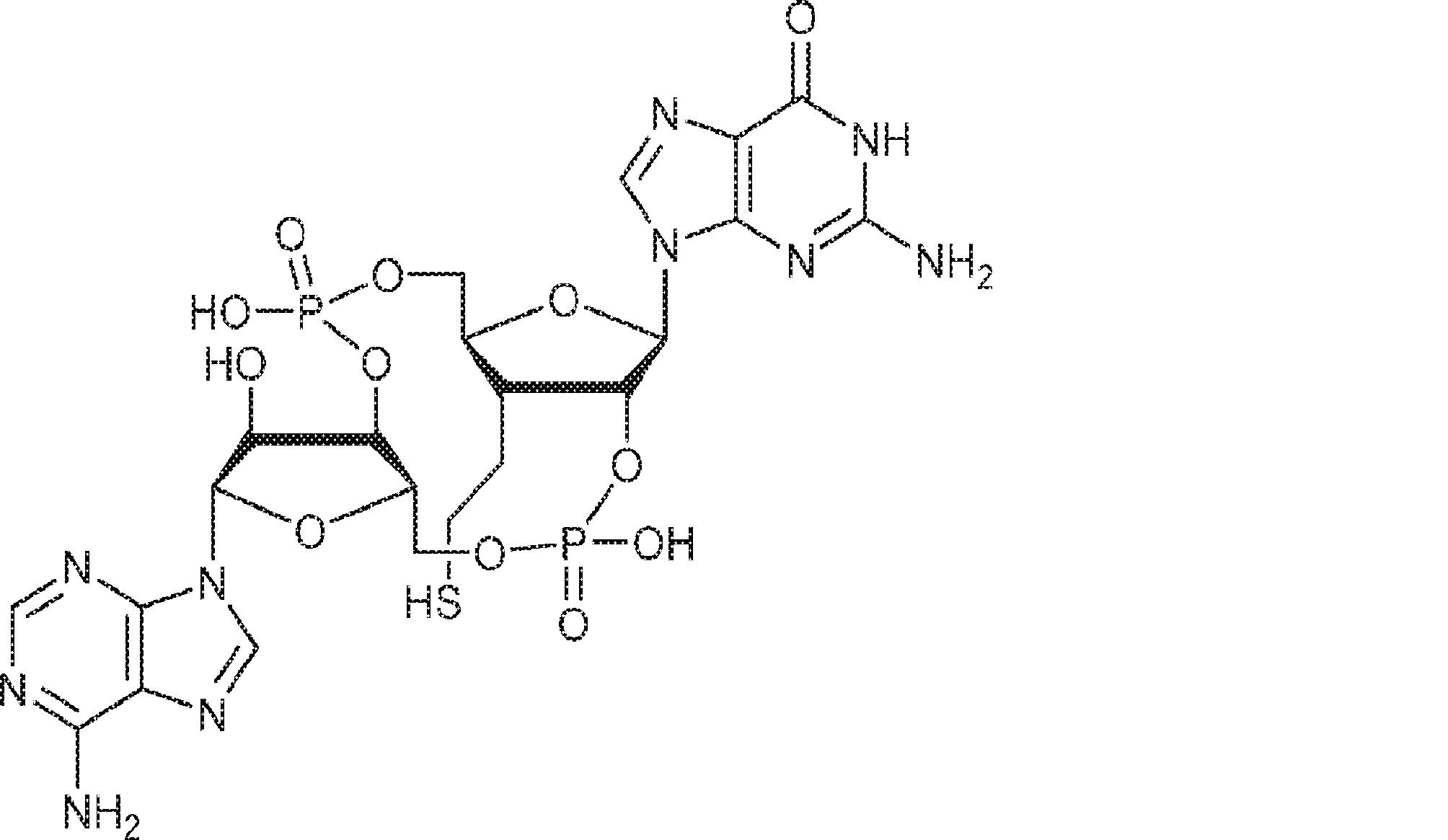
[本発明1012]
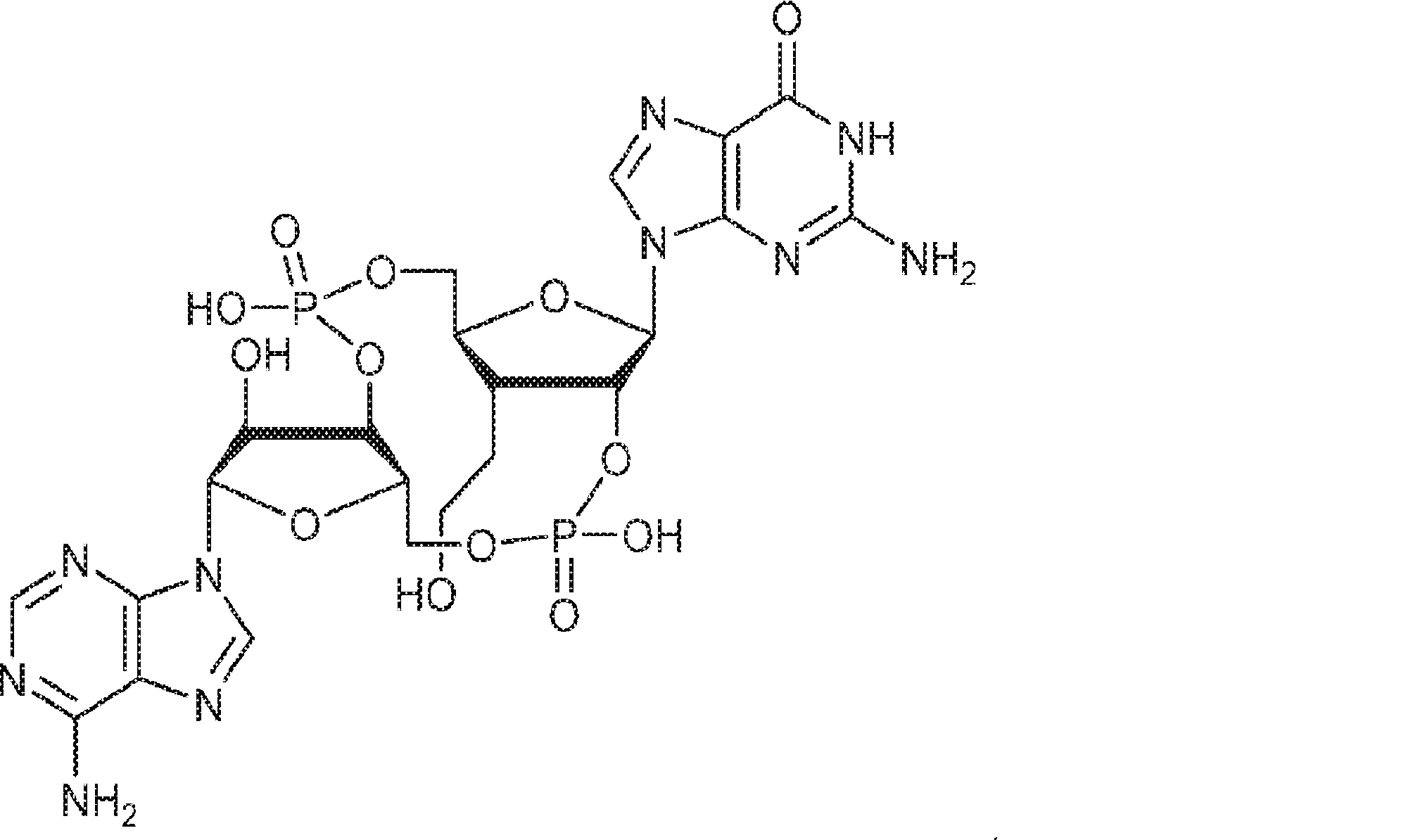
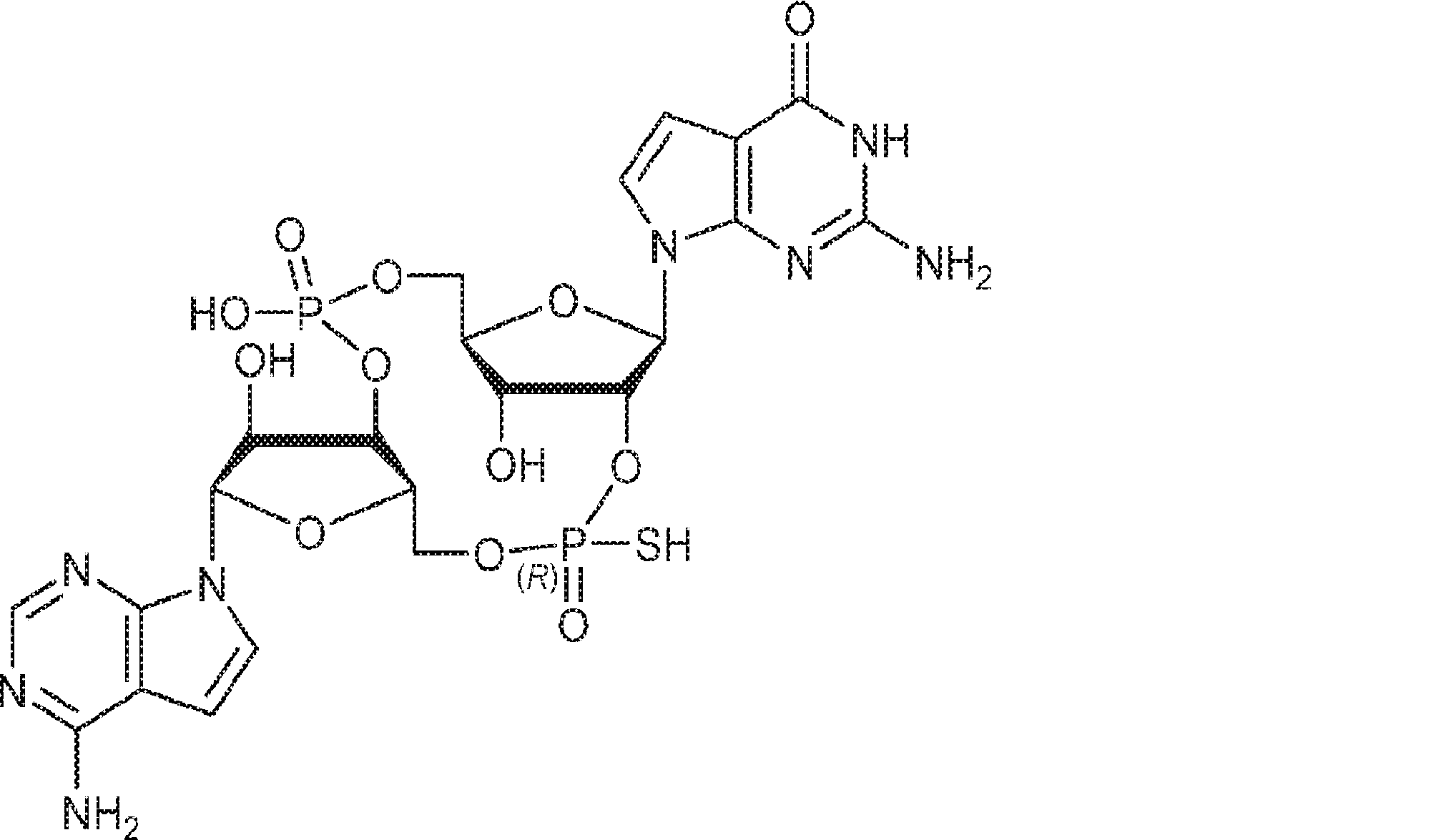
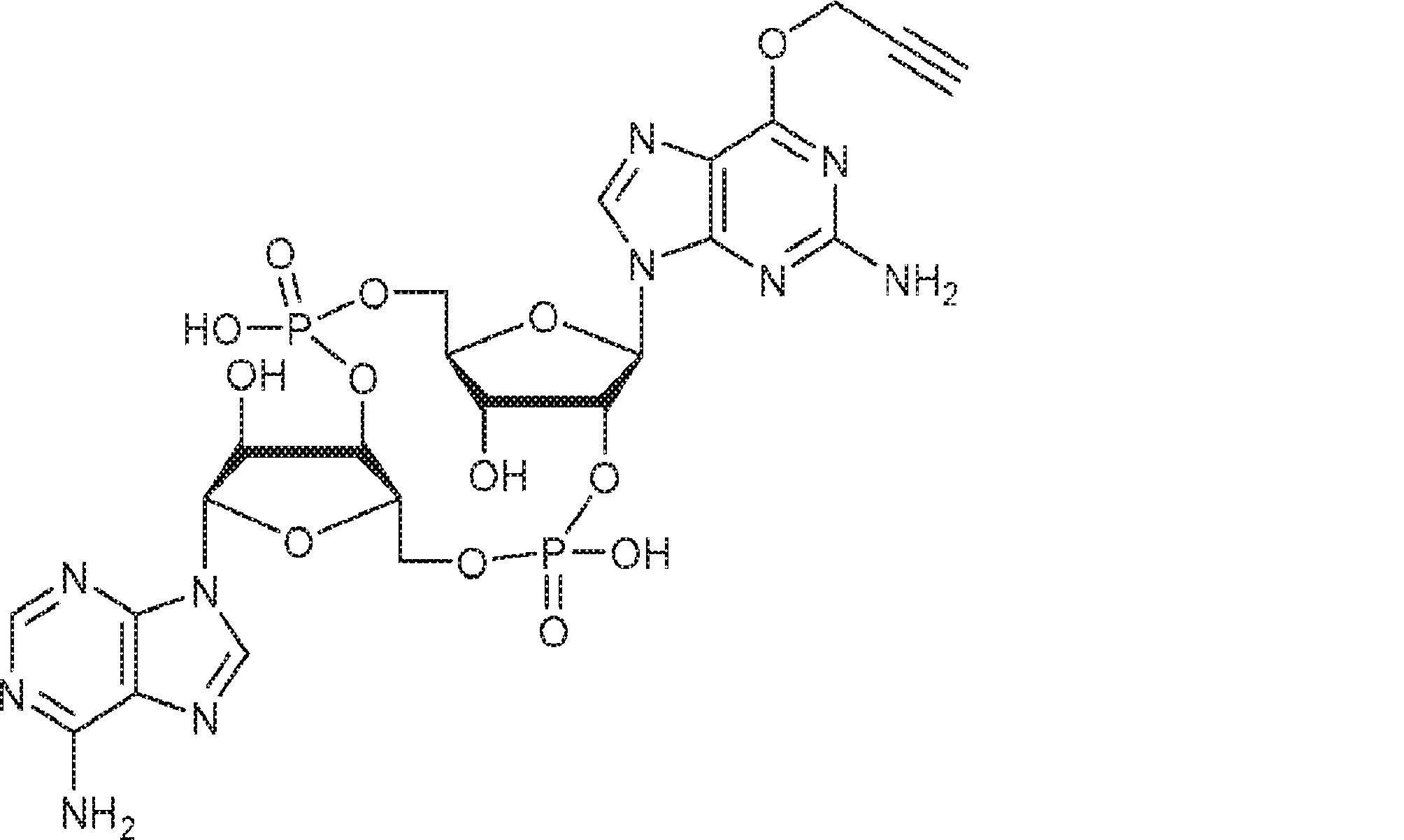
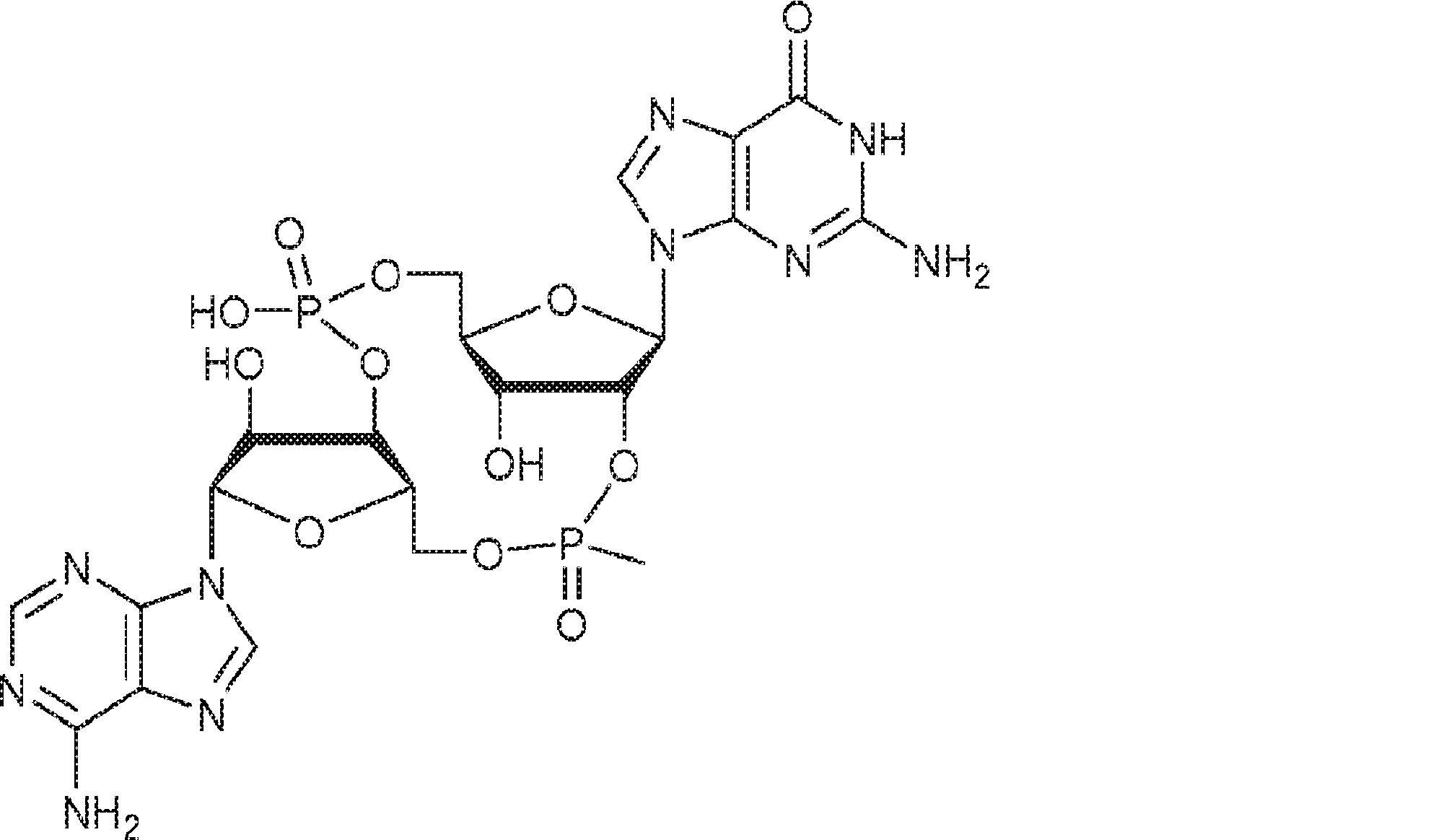
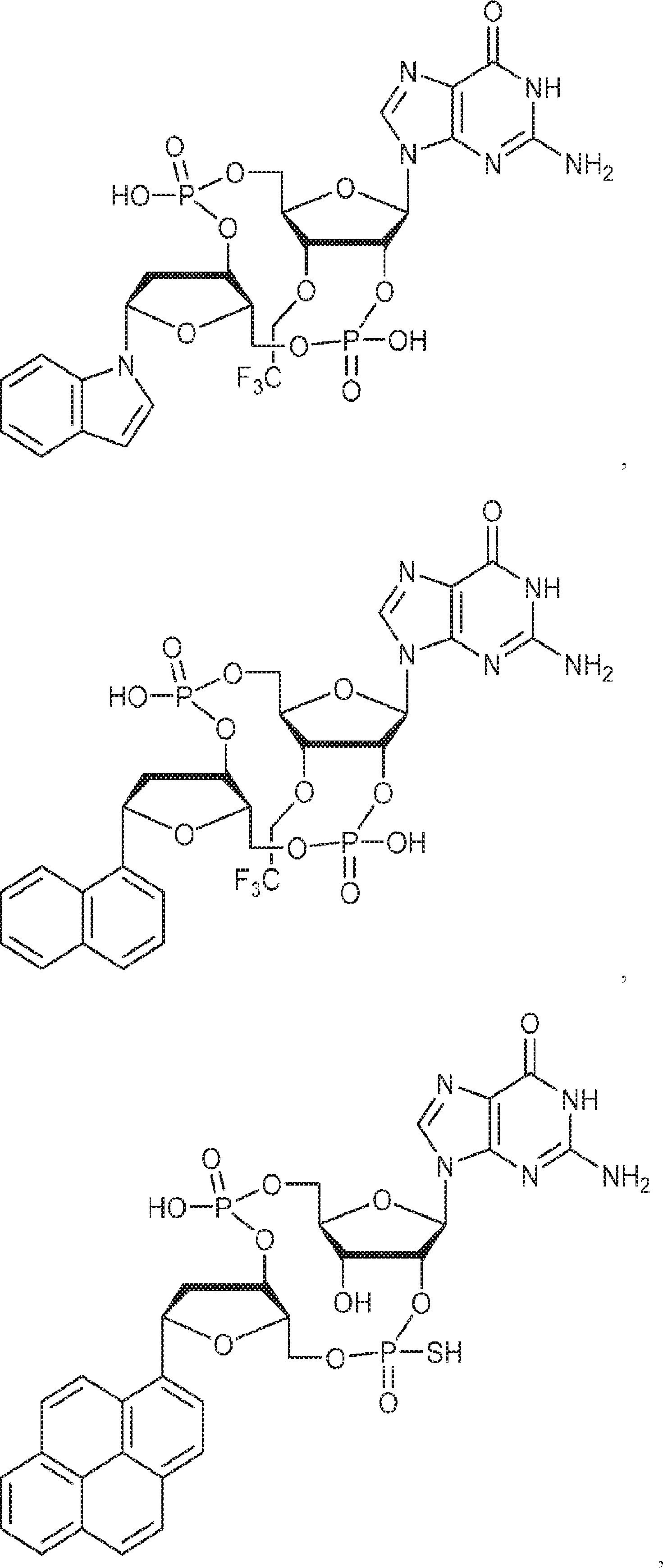
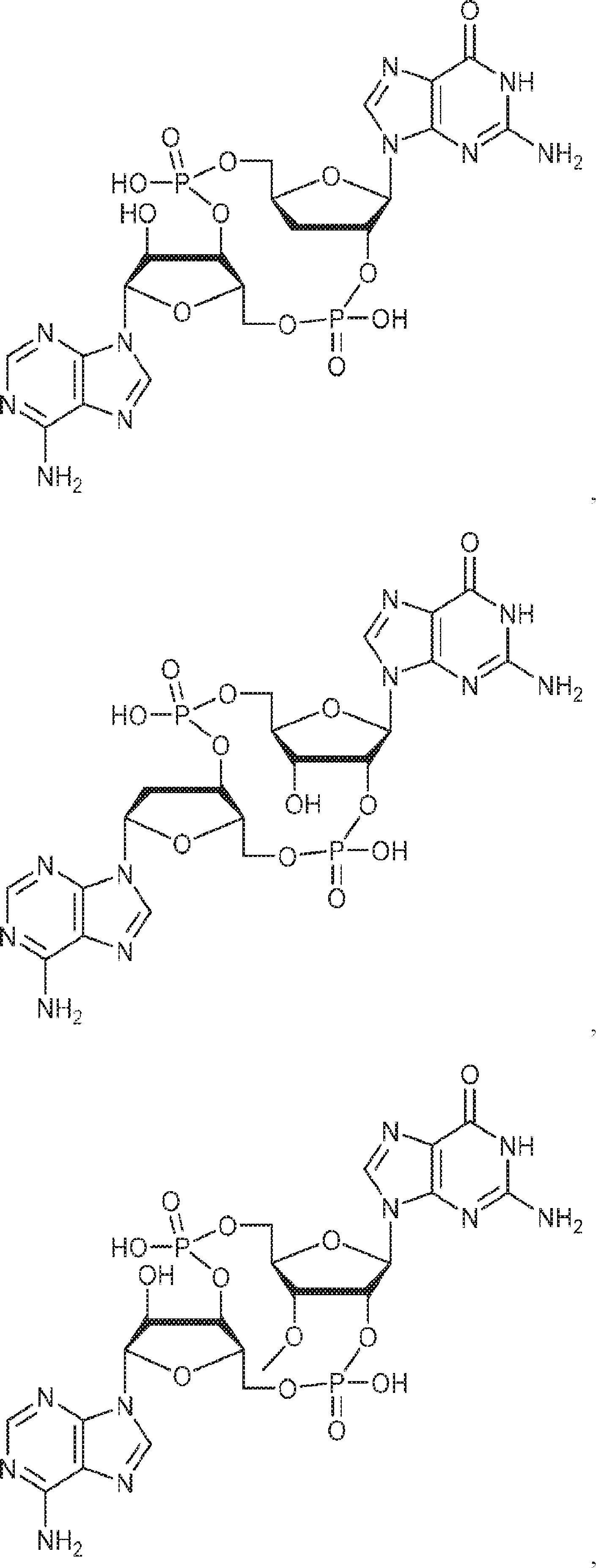
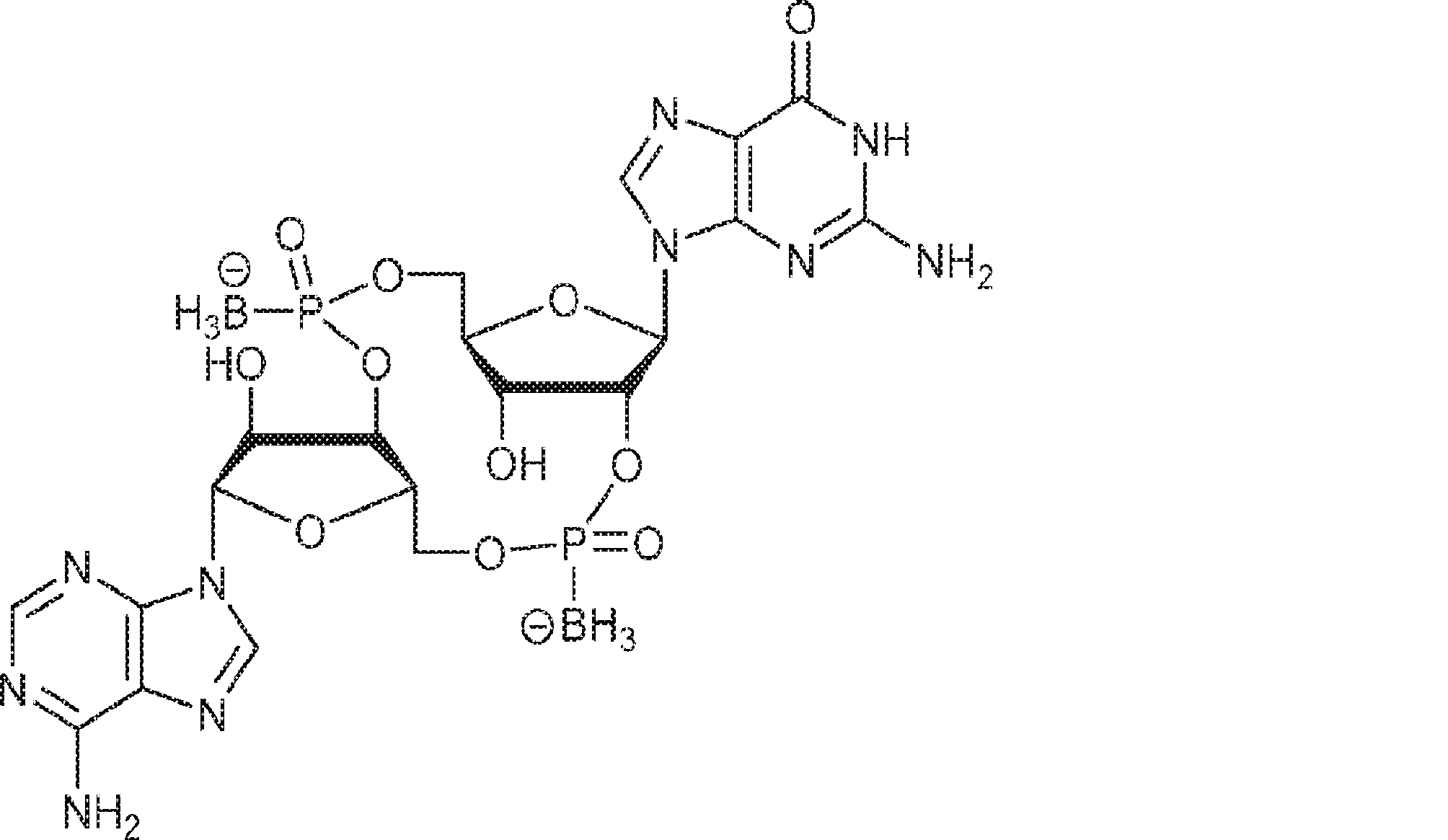
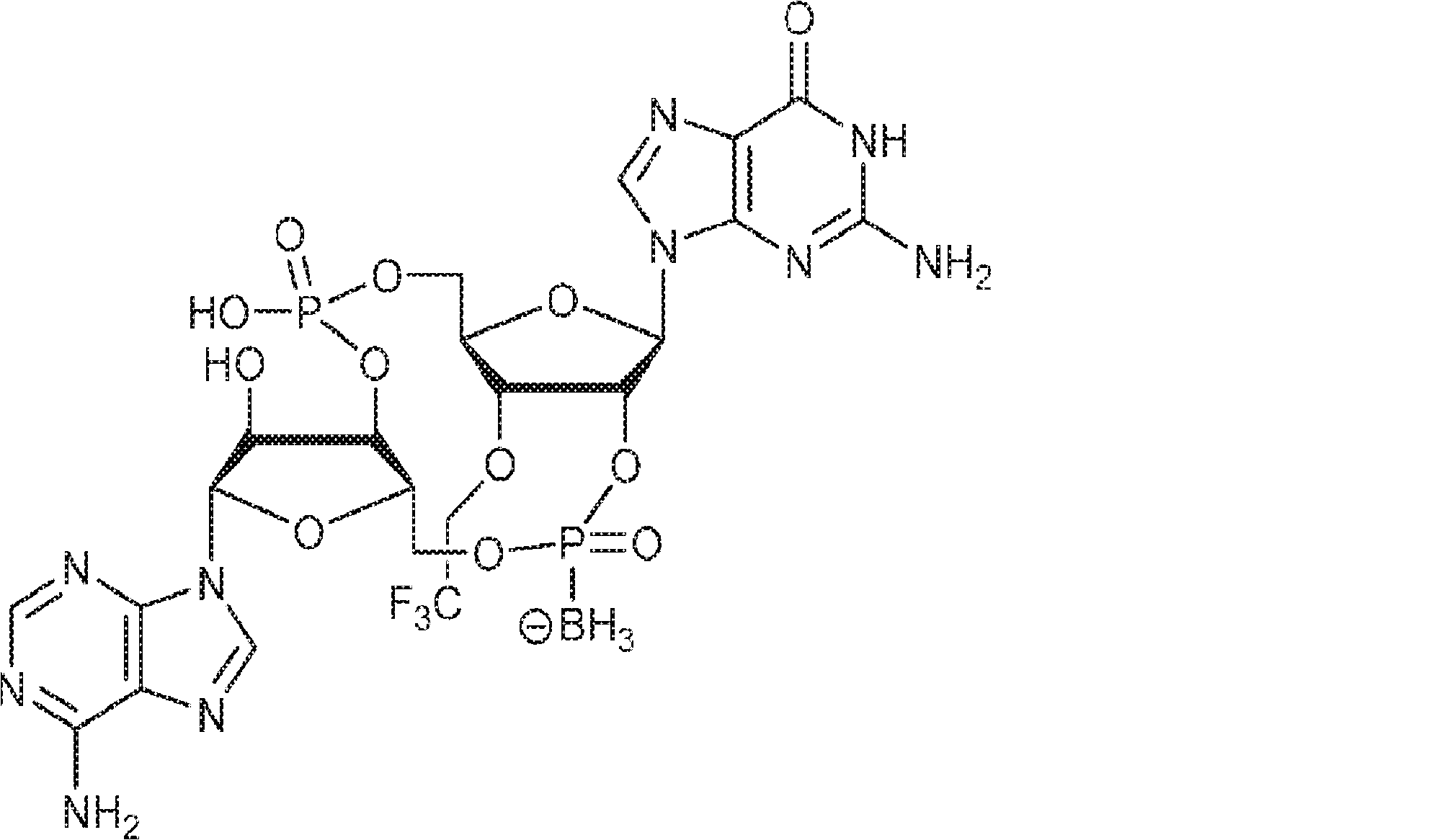
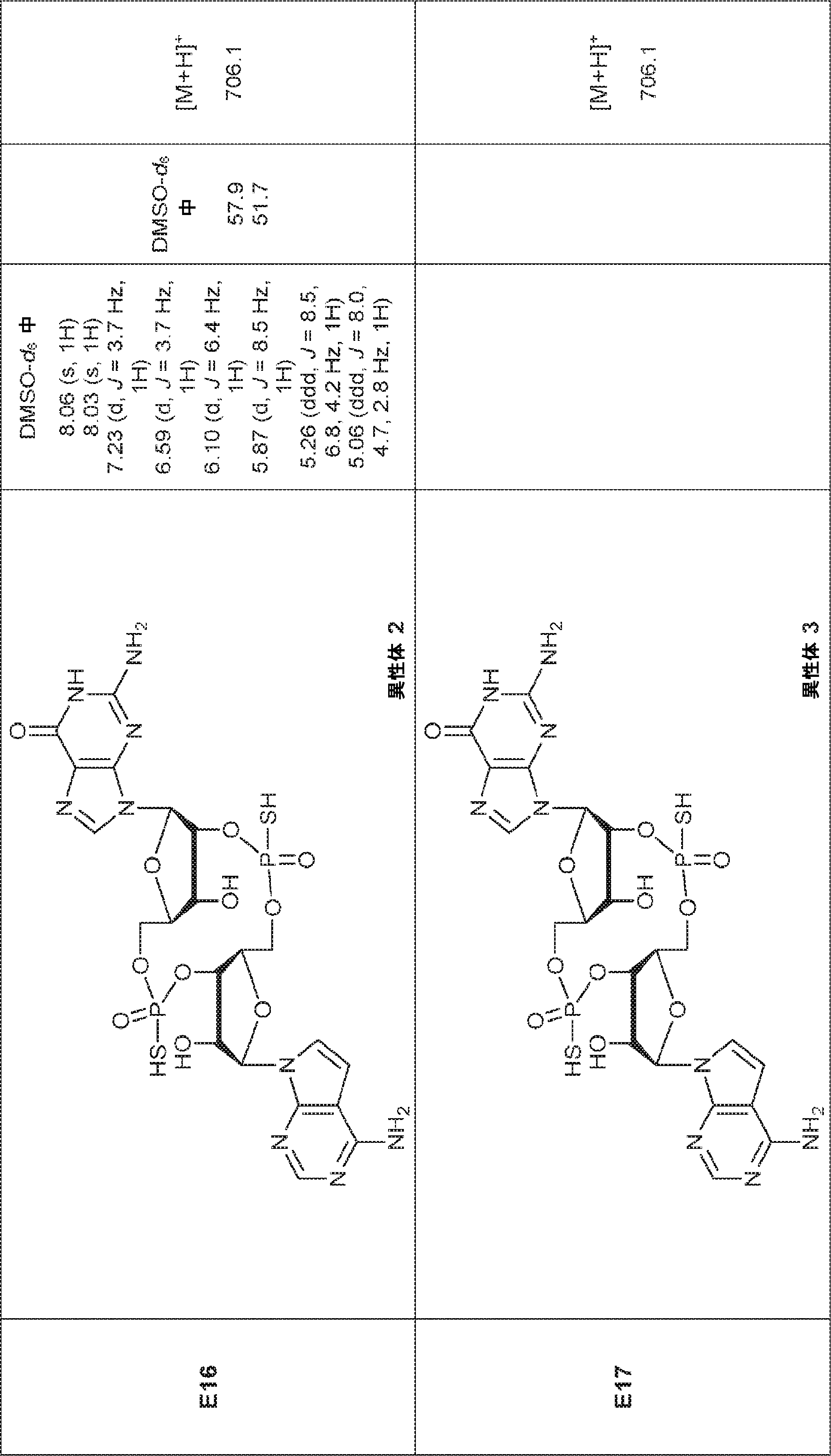
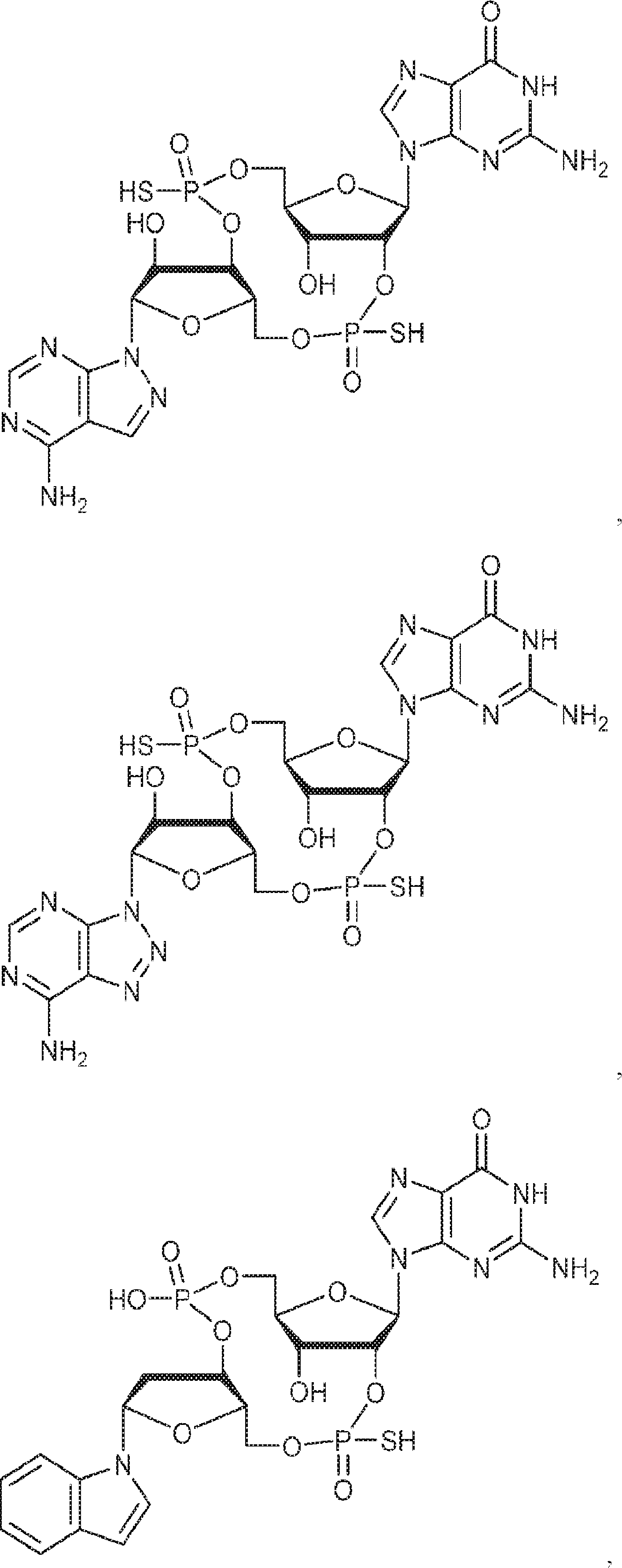
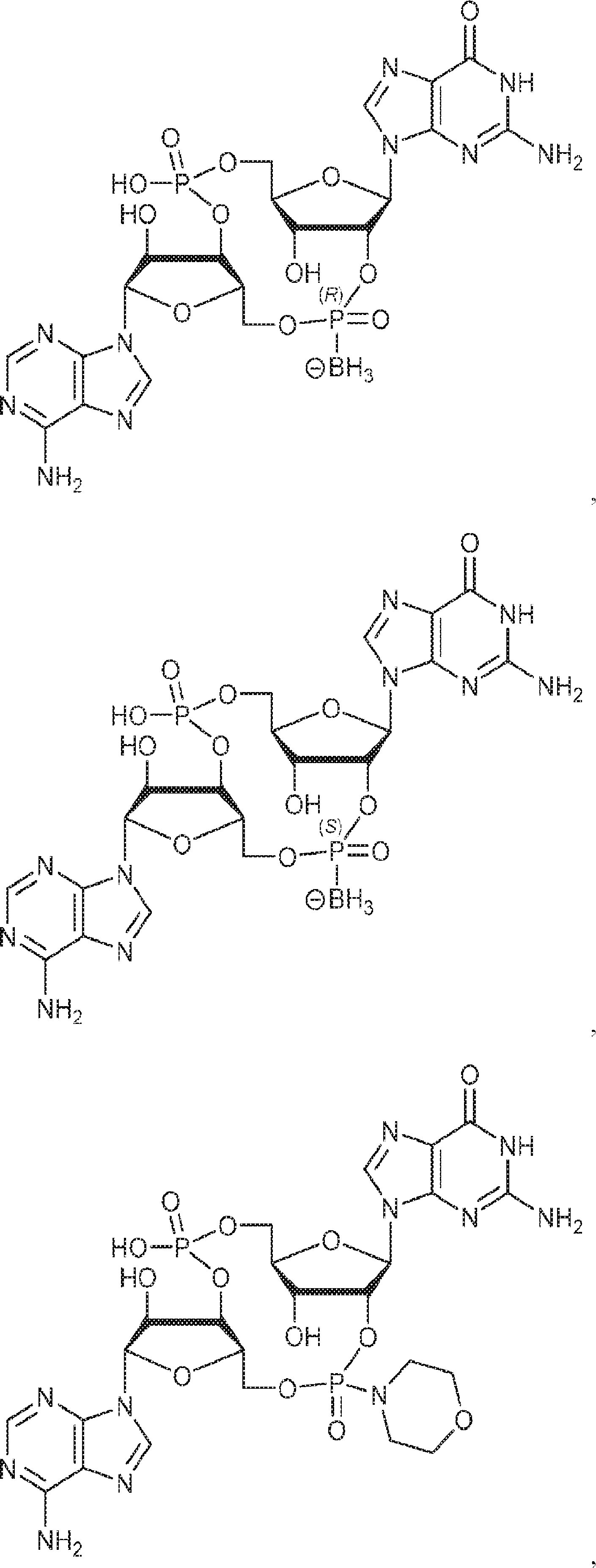
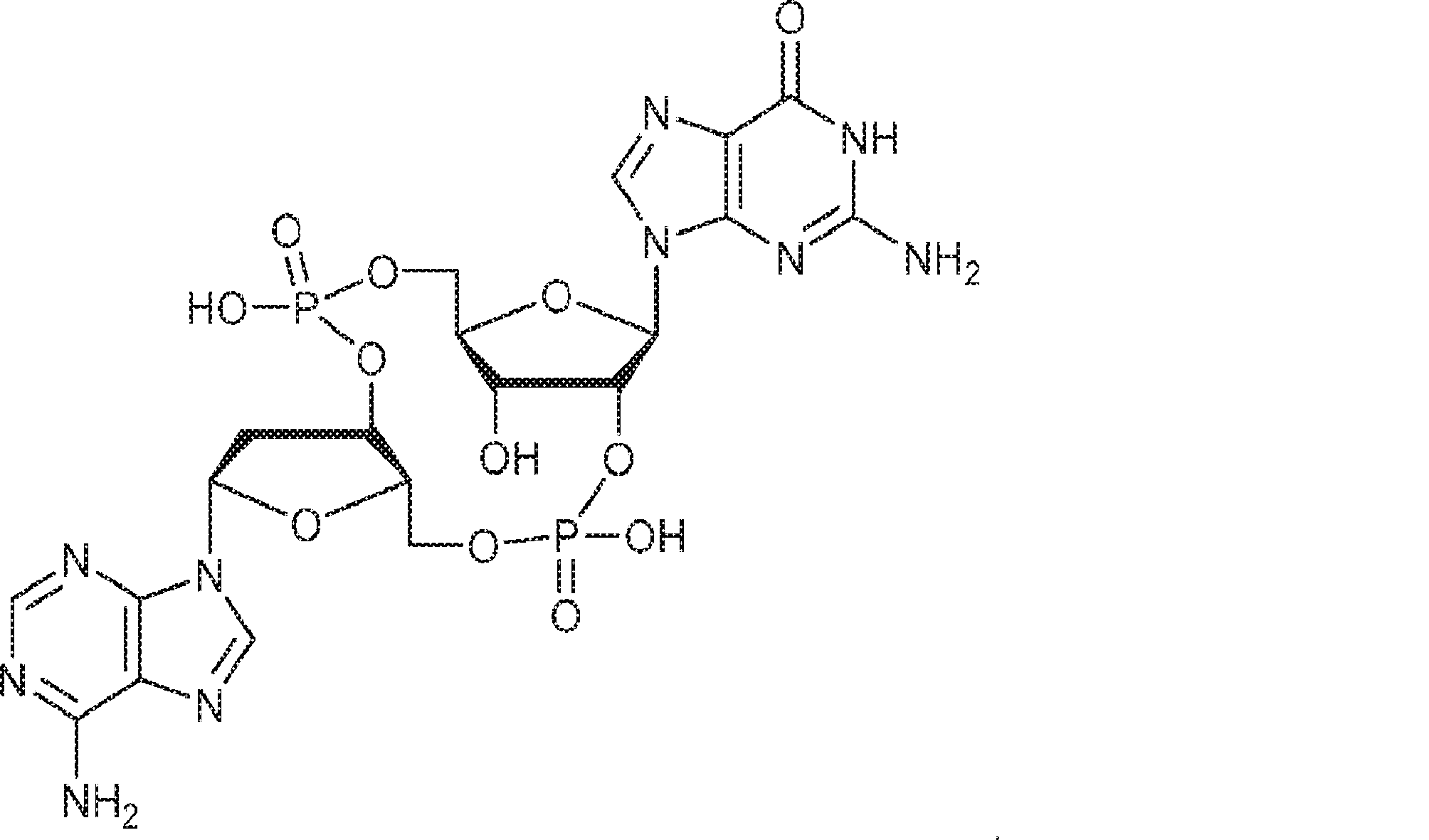
式:
の化合物。
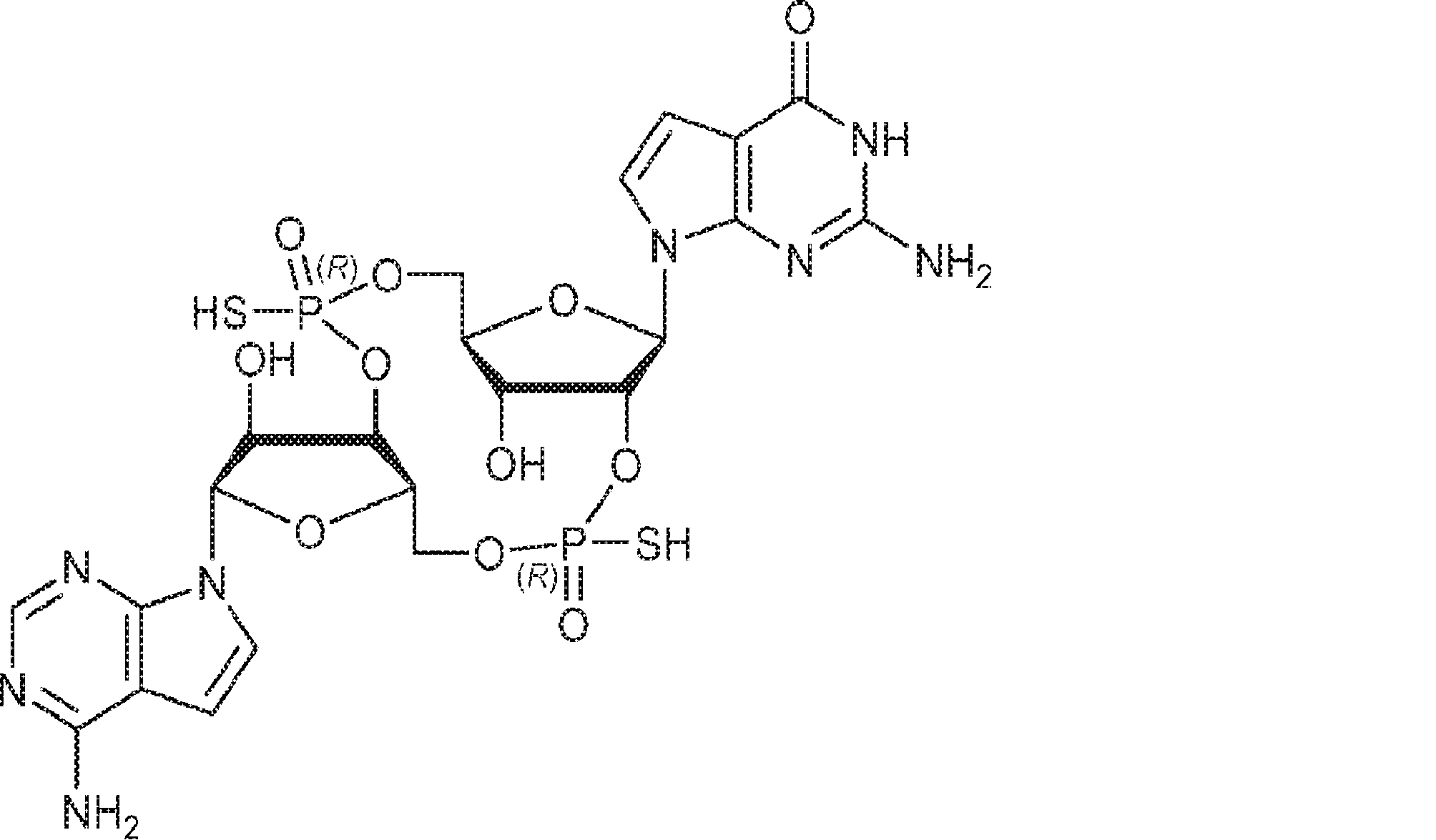
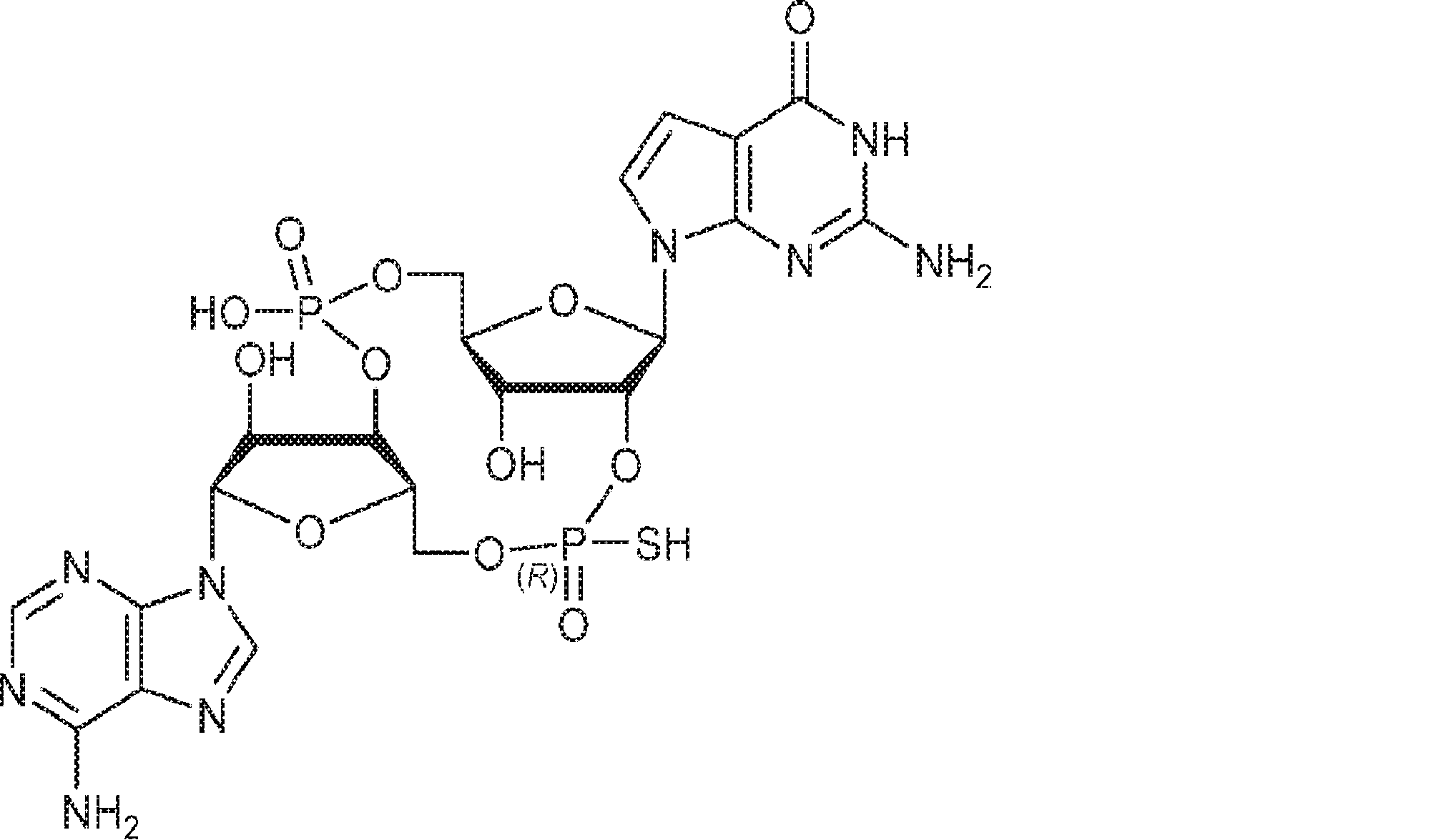
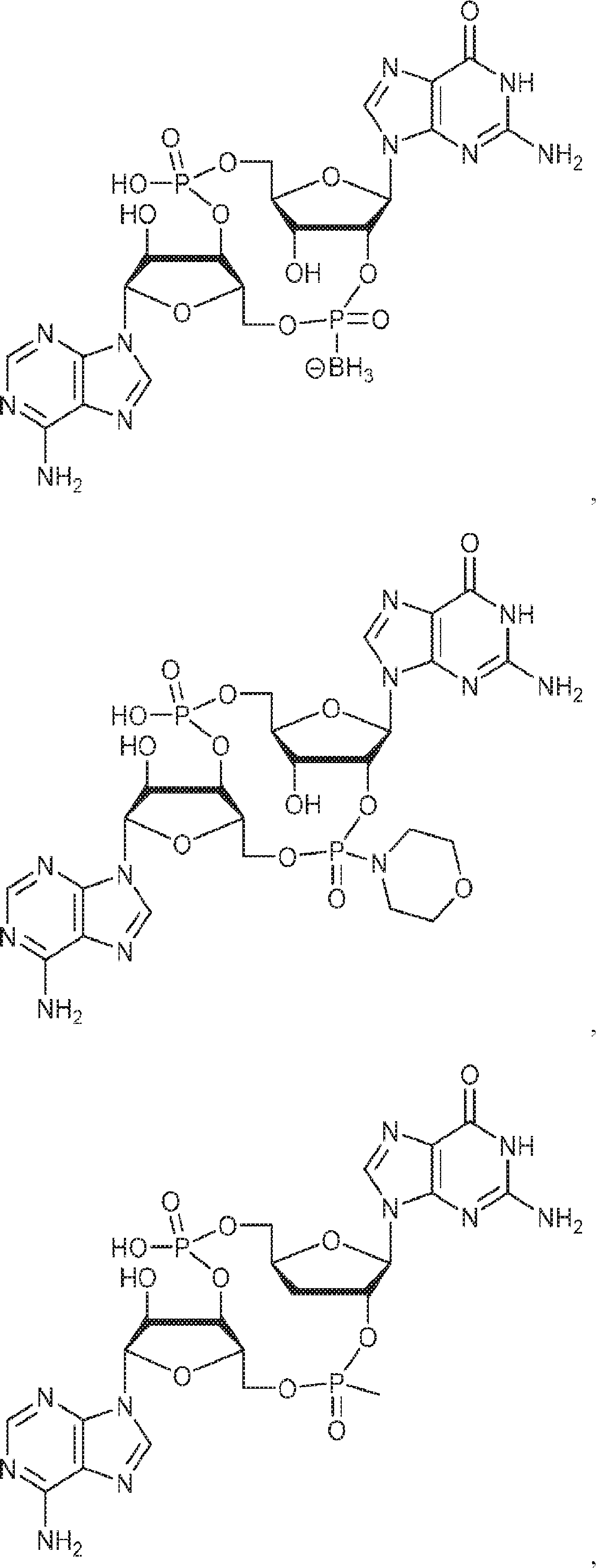
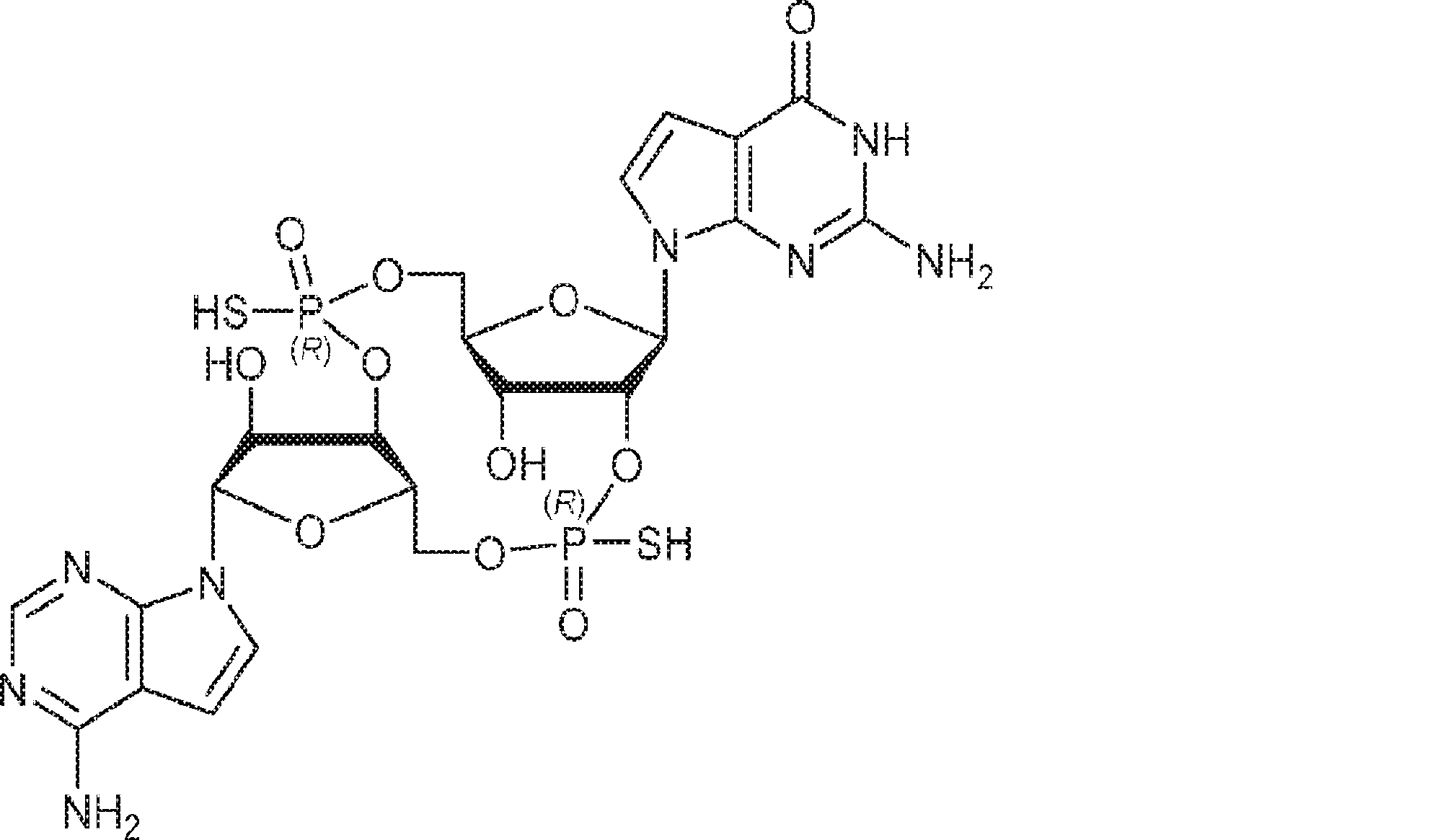
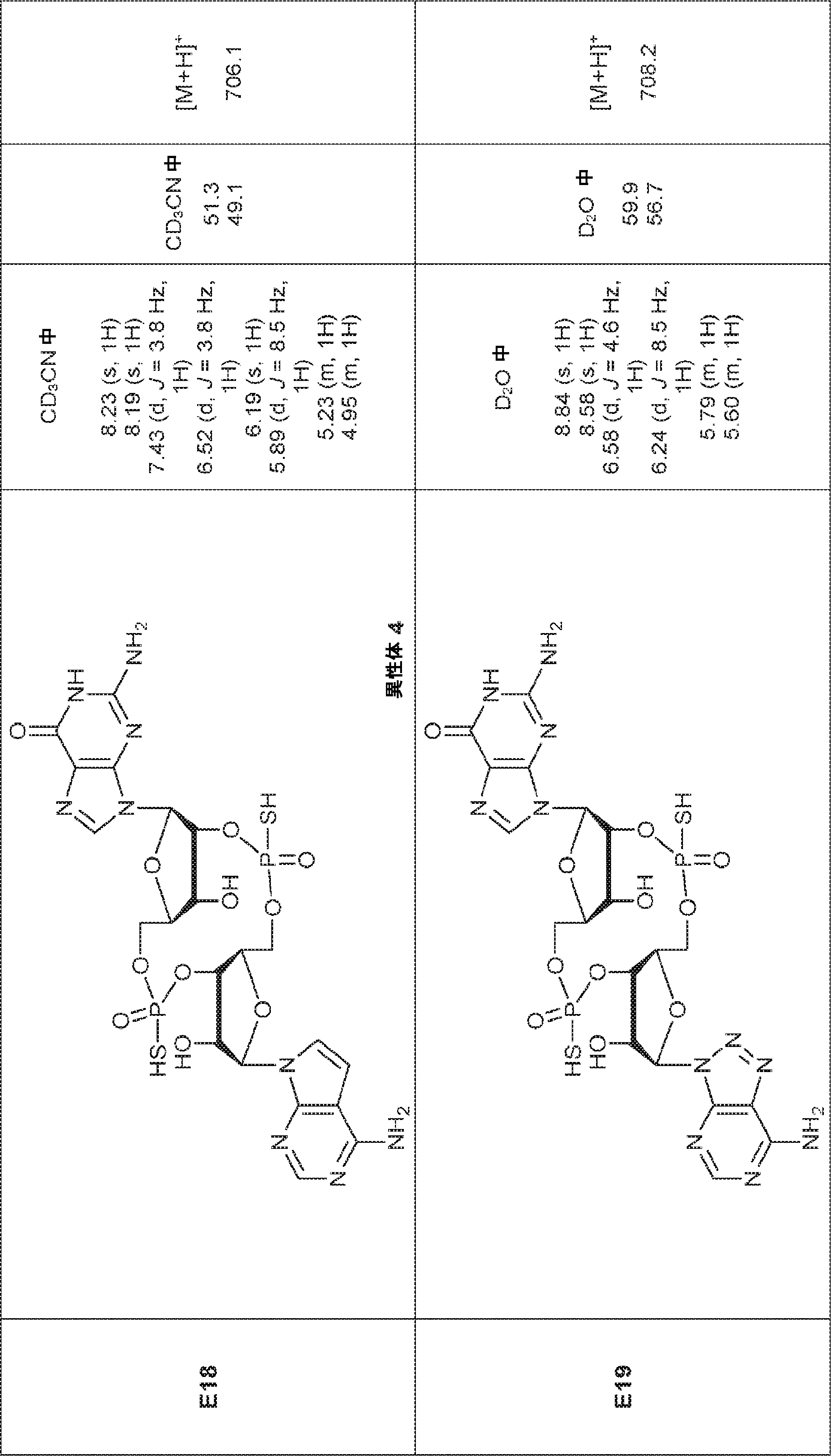
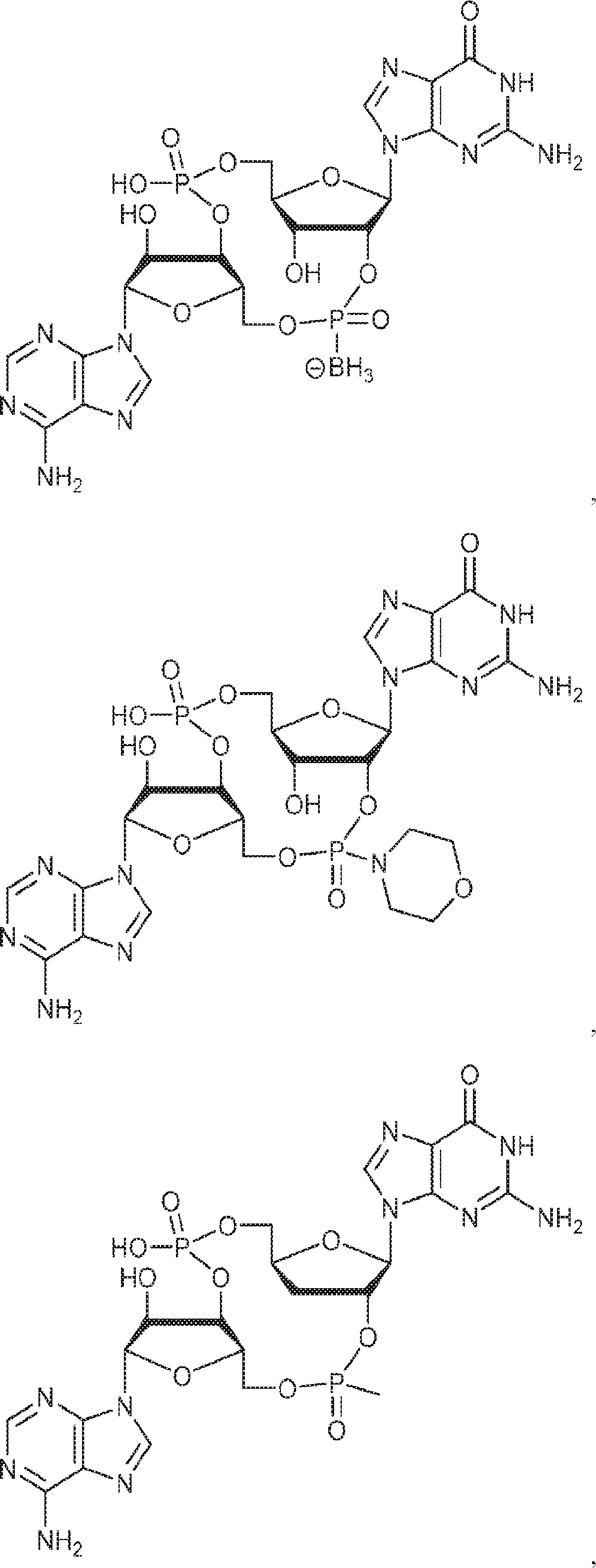
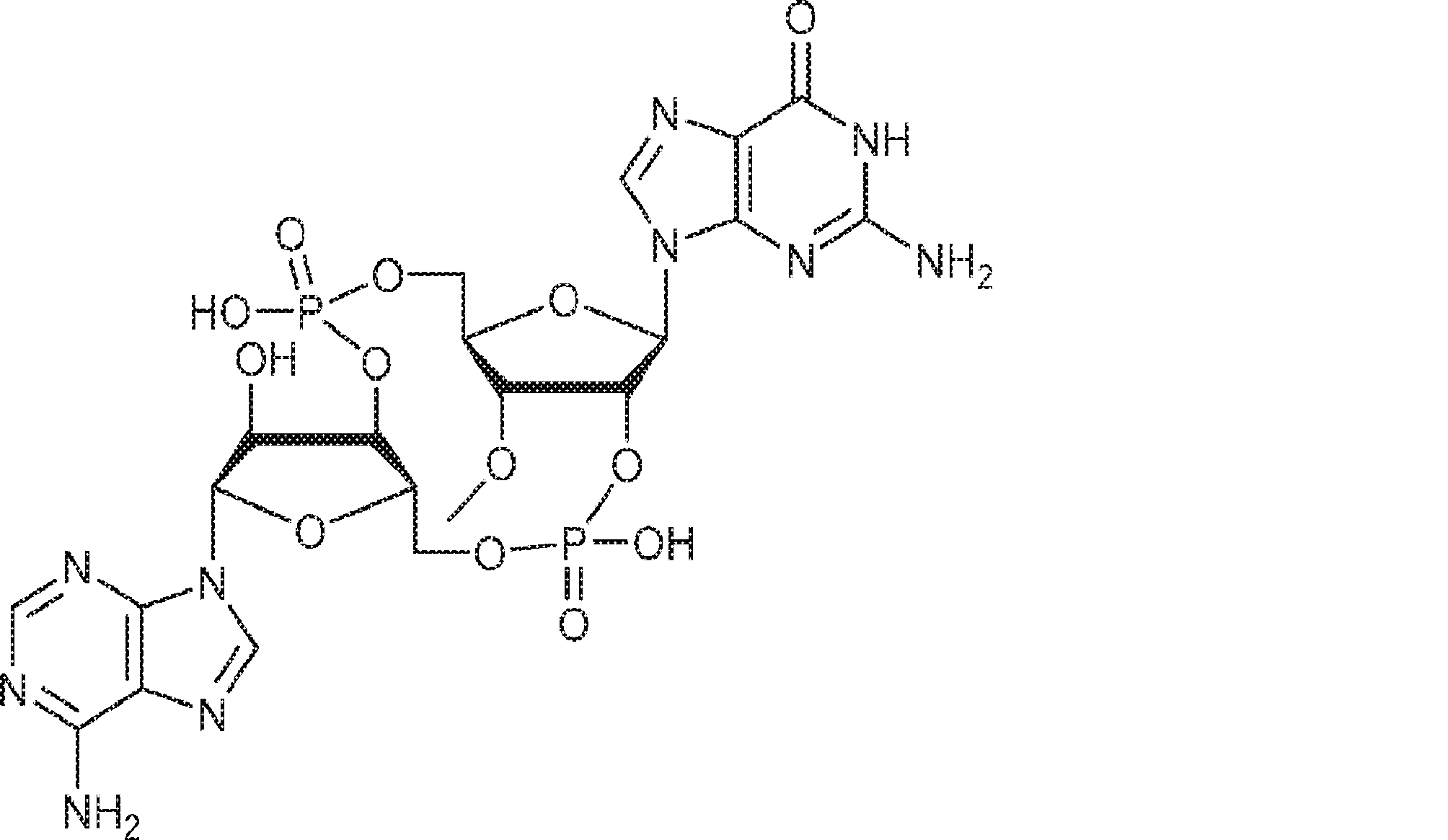
[本発明1013]
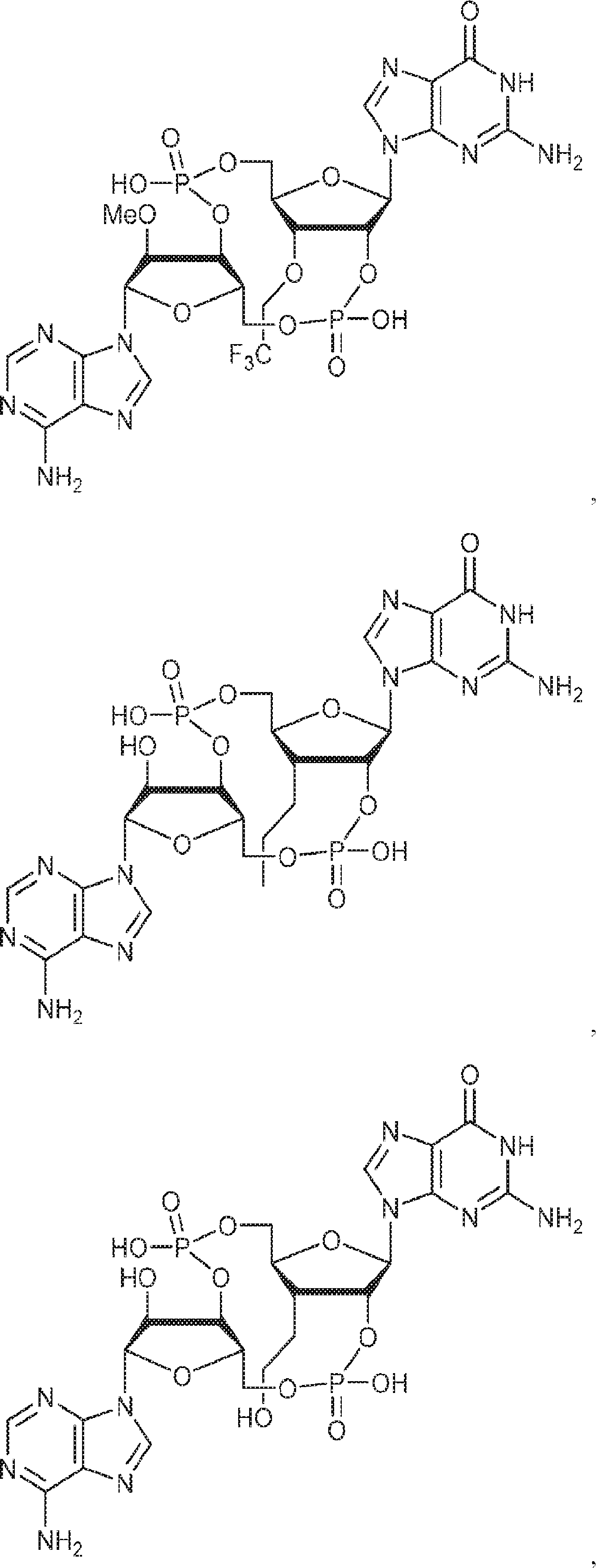
式:
の化合物。
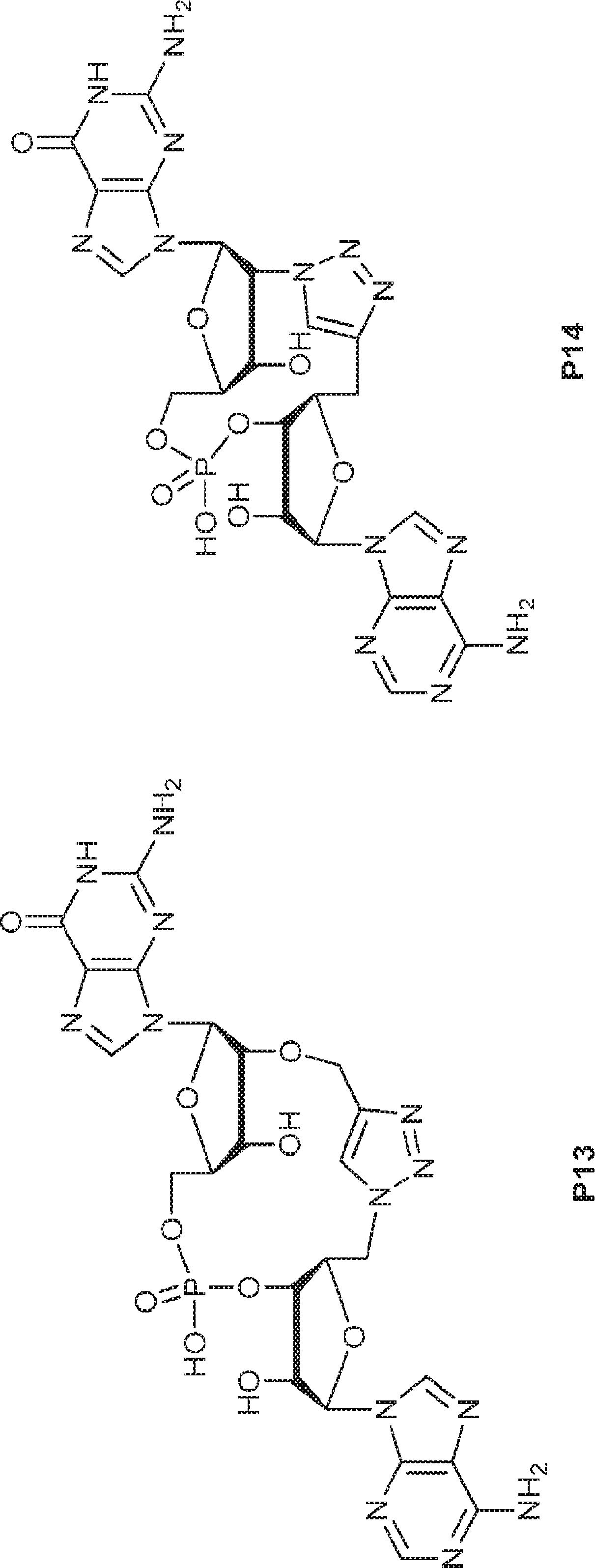
[本発明1014]
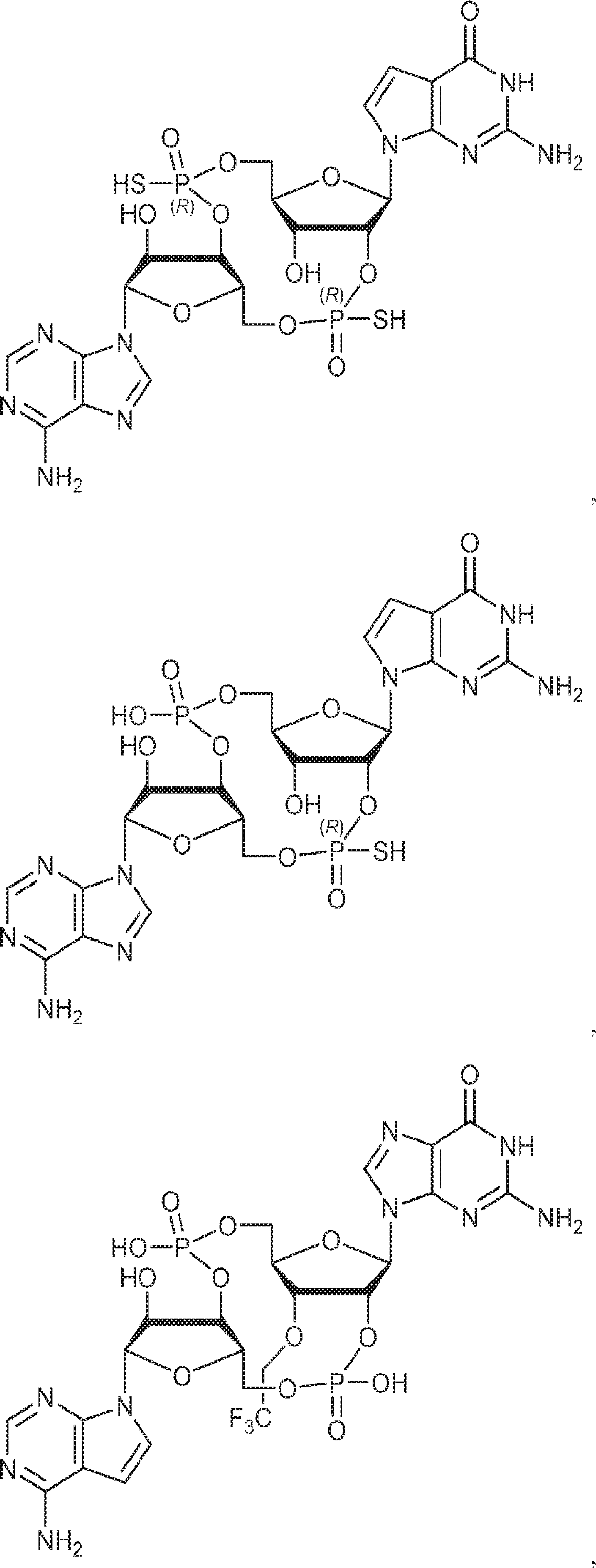
式:
の化合物。
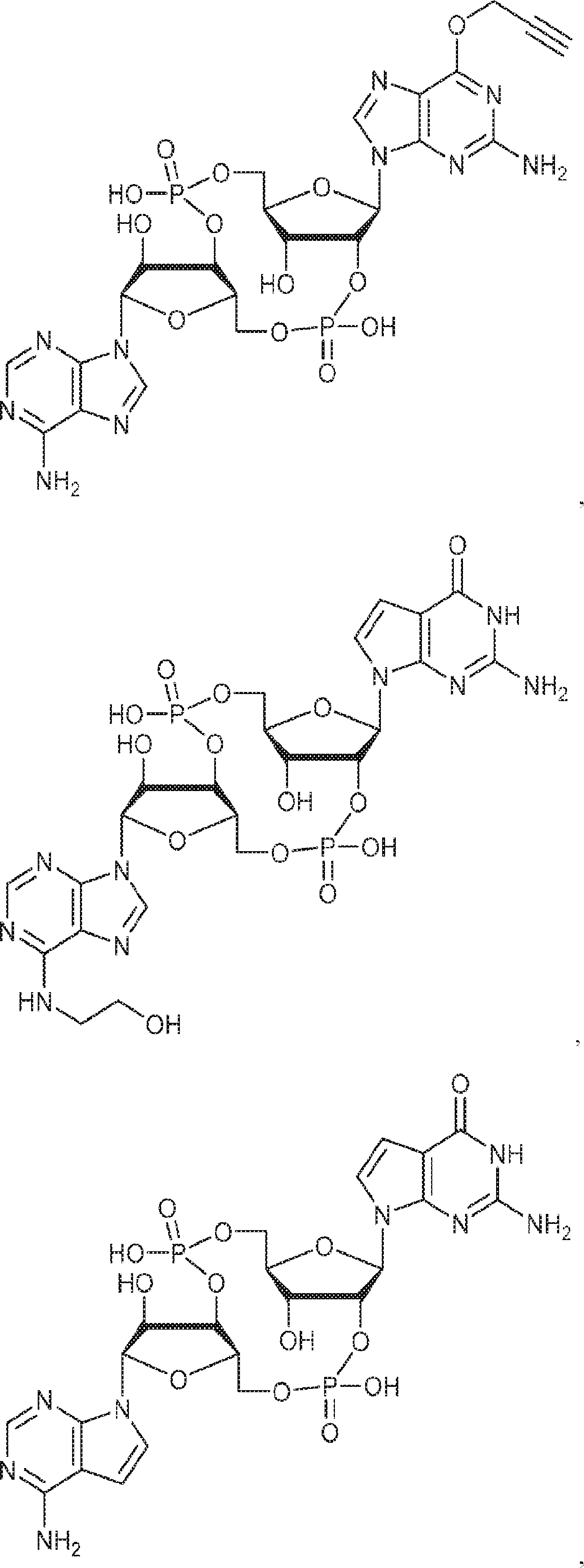
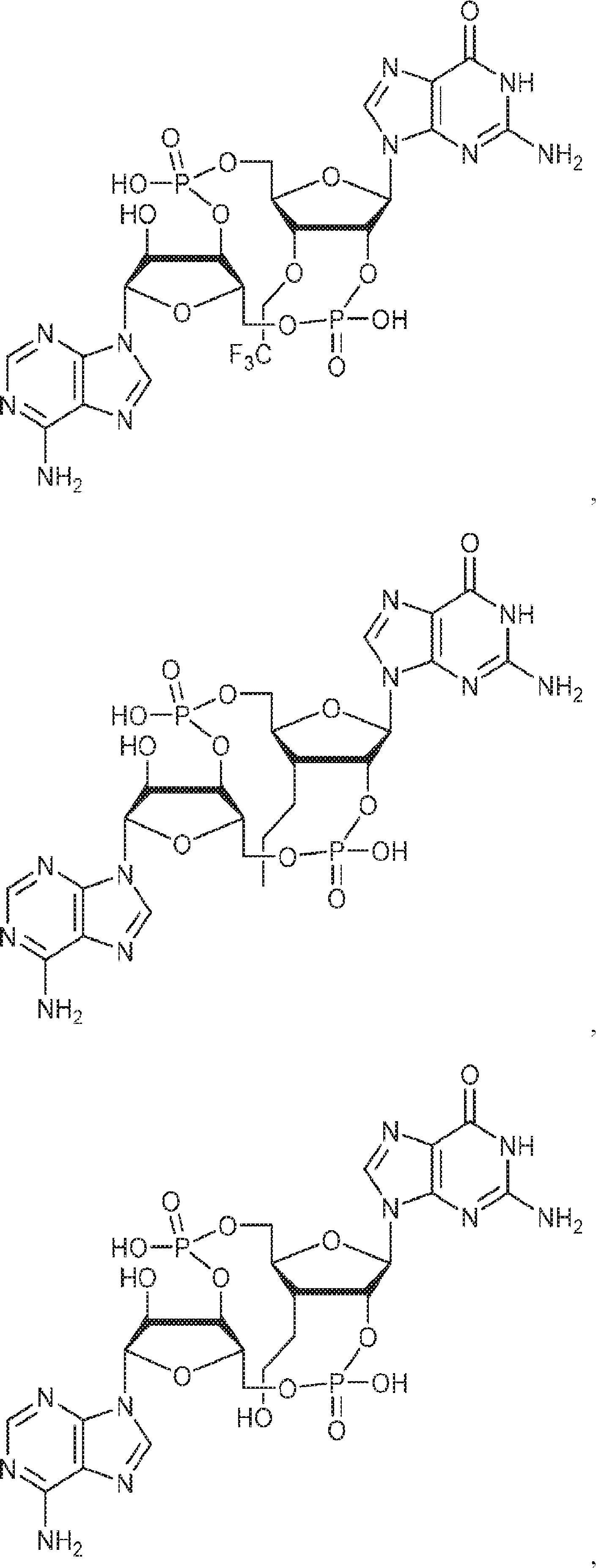
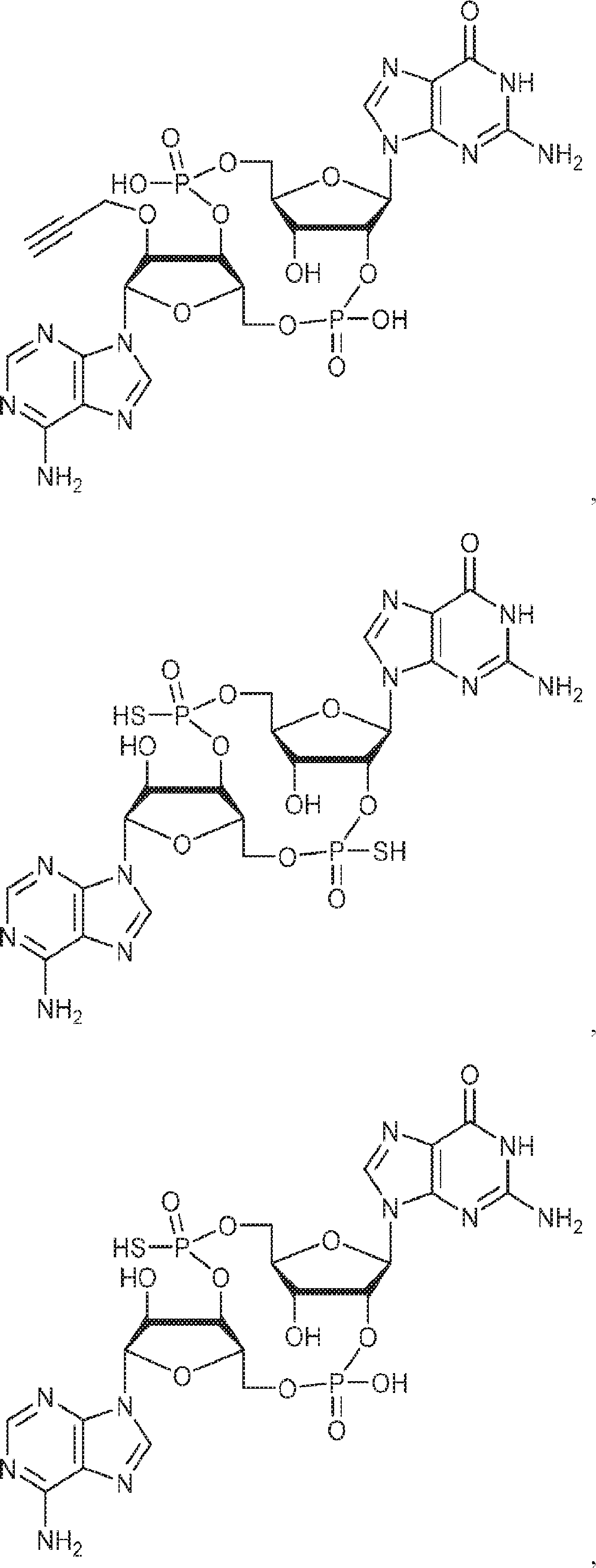
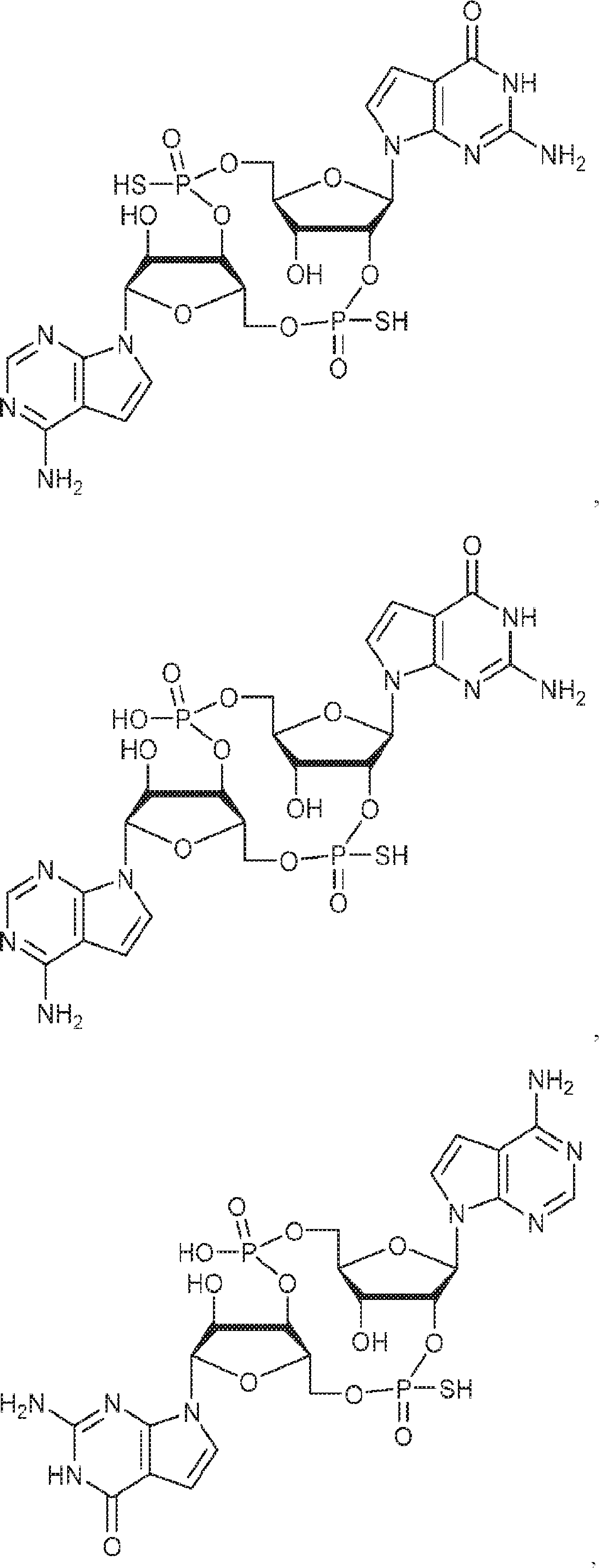
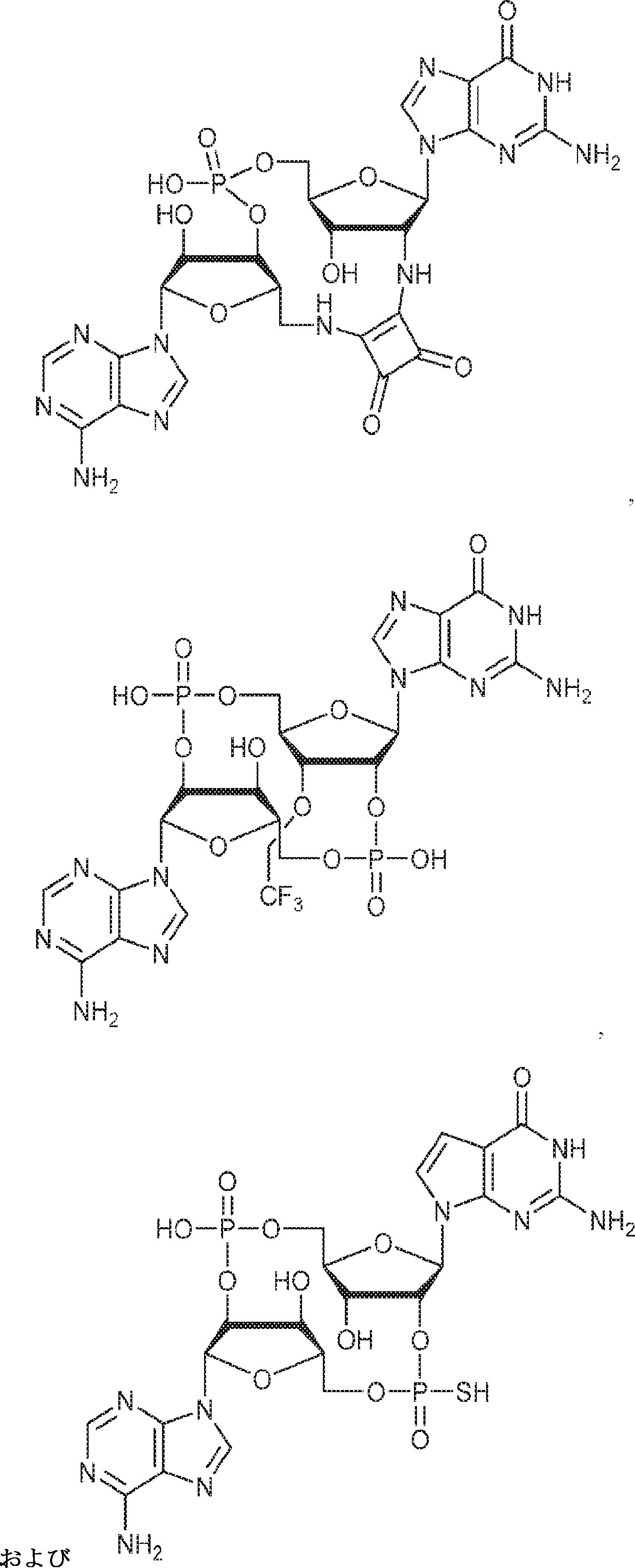
[本発明1015]
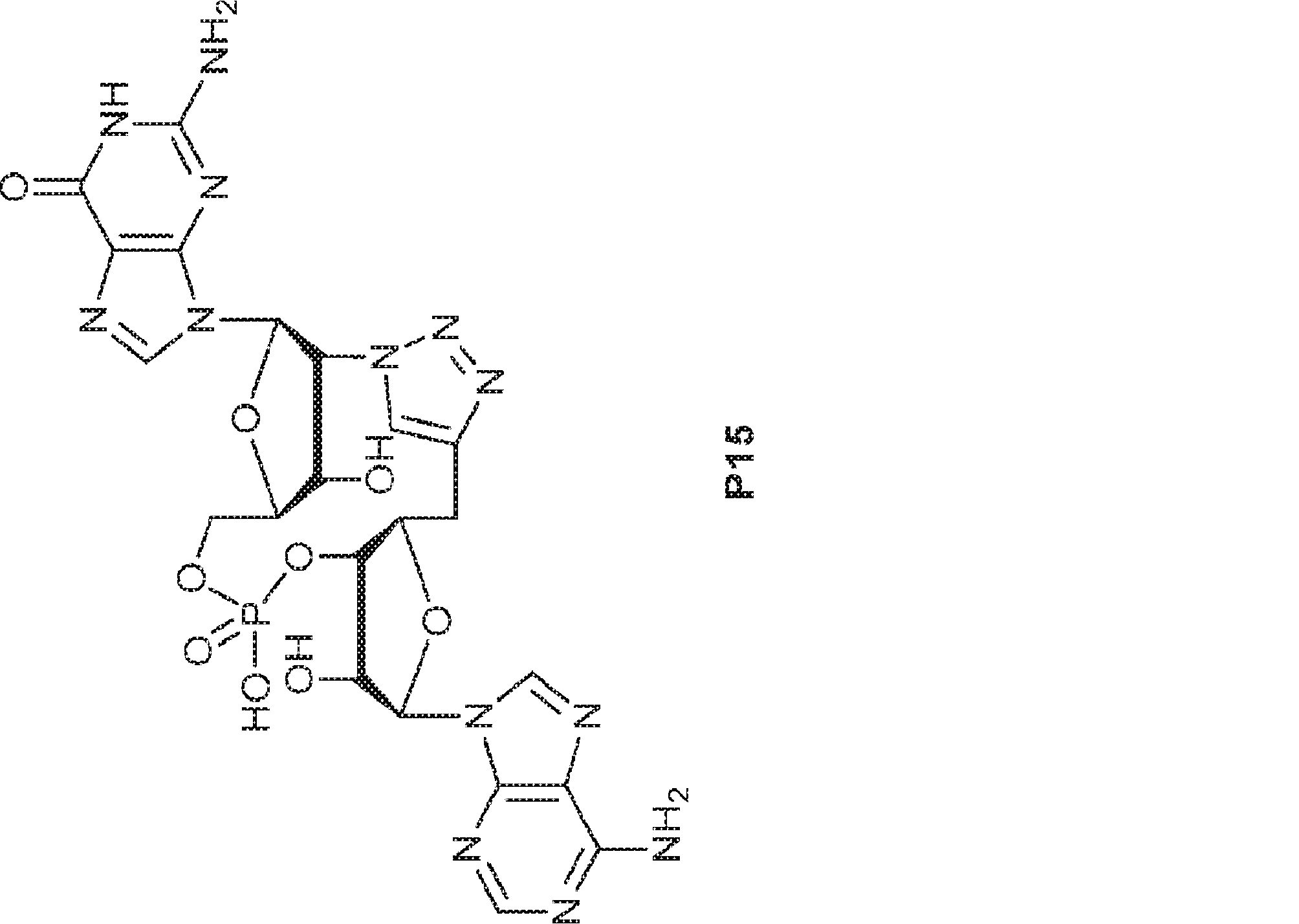
式:
の化合物。
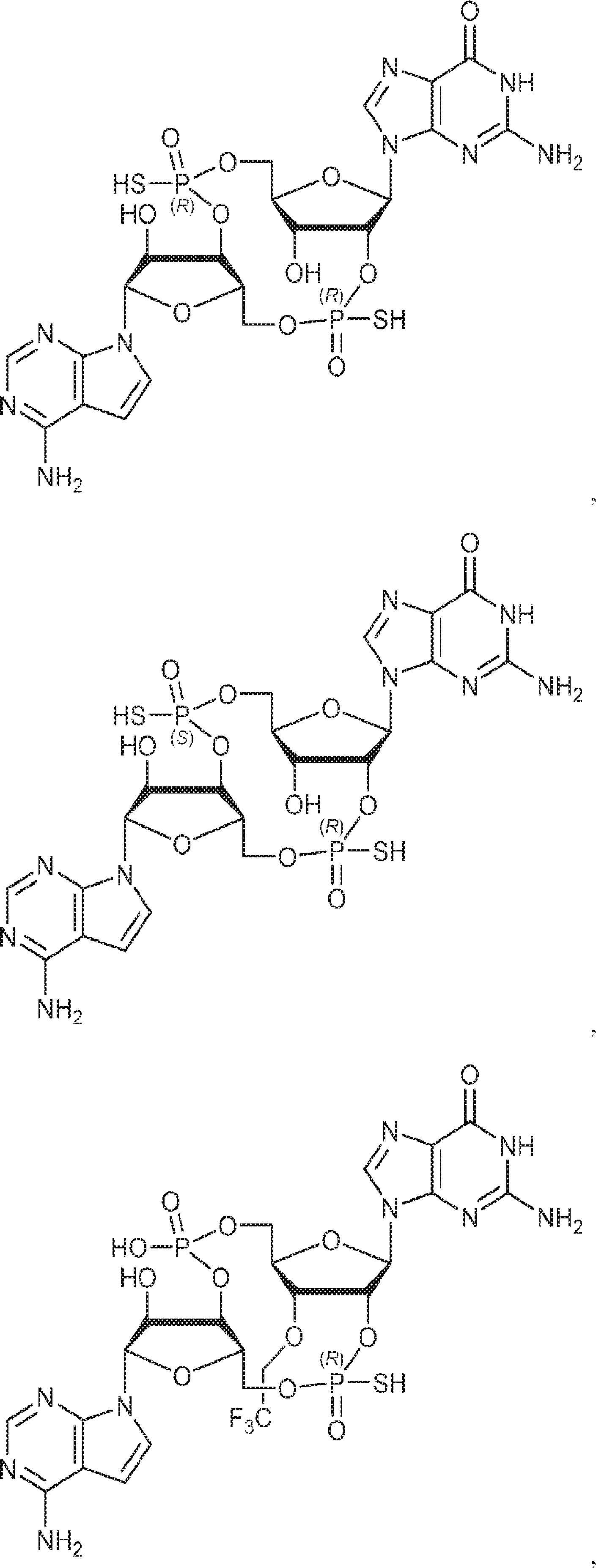
[本発明1016]
式:
の化合物。
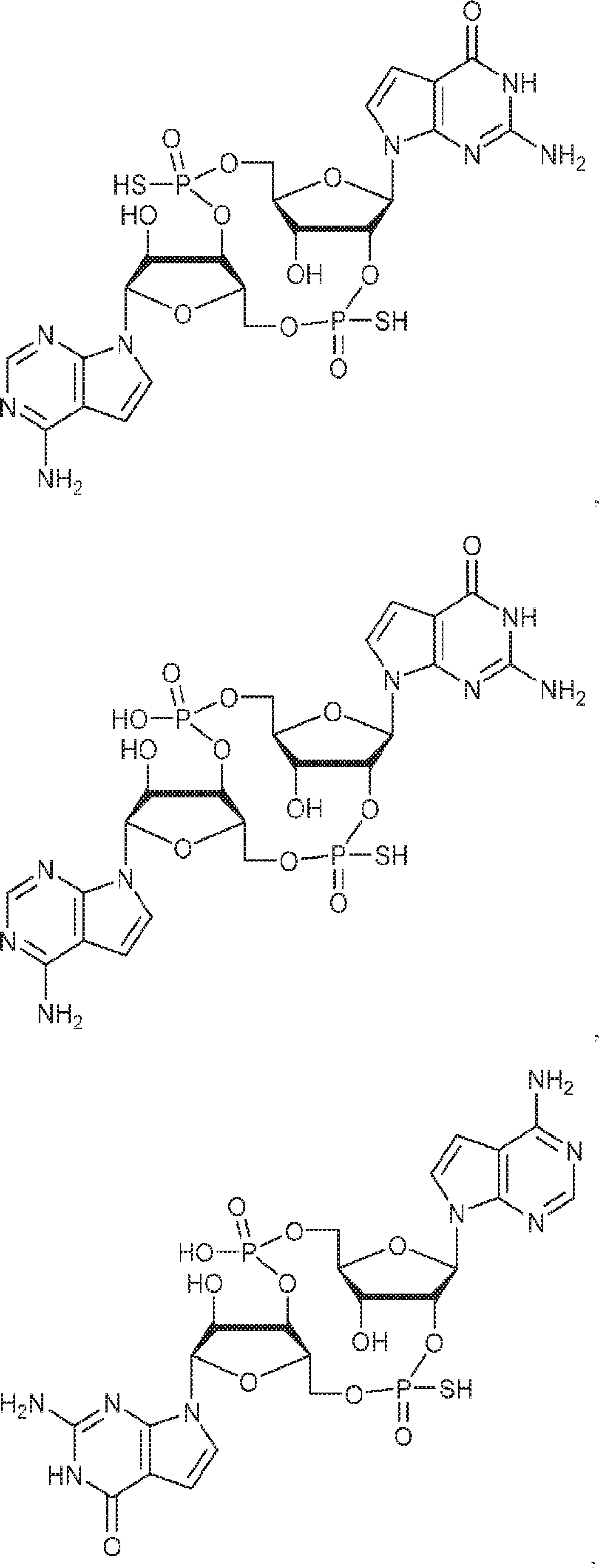
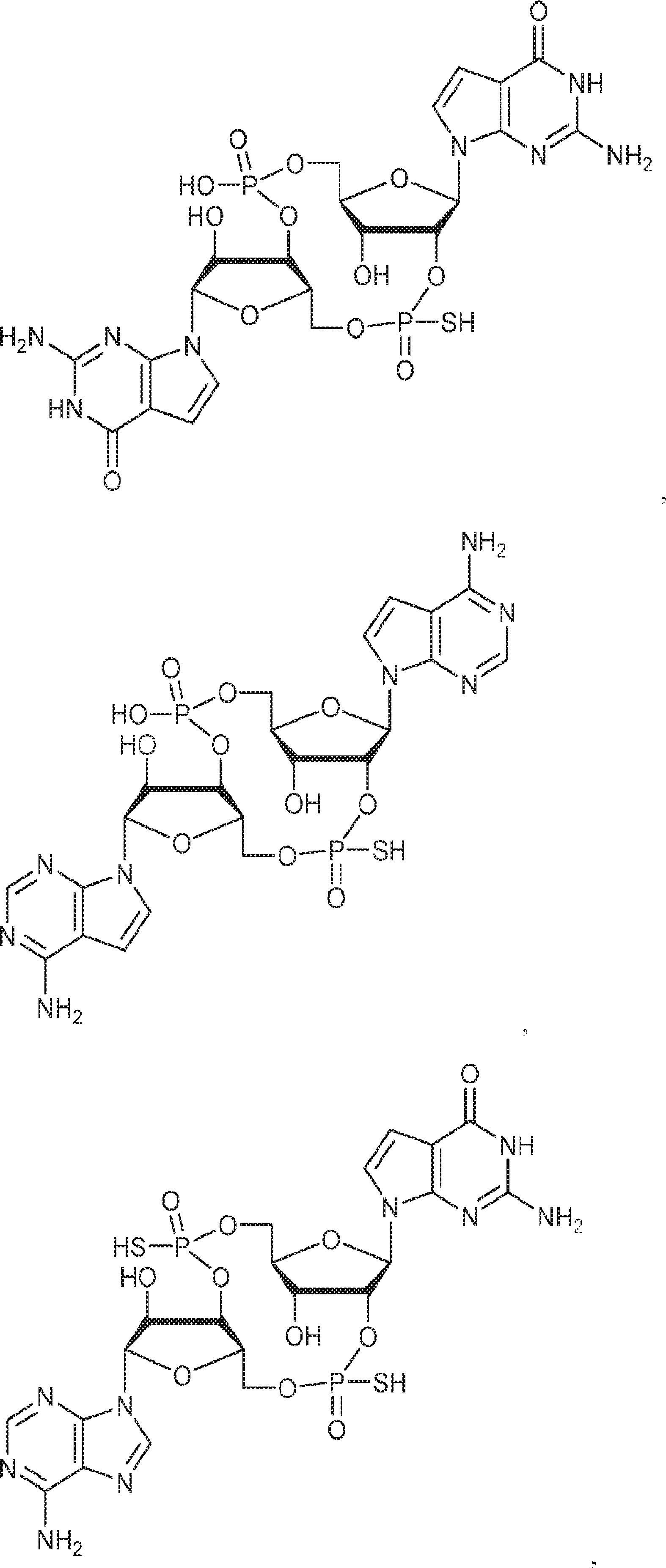
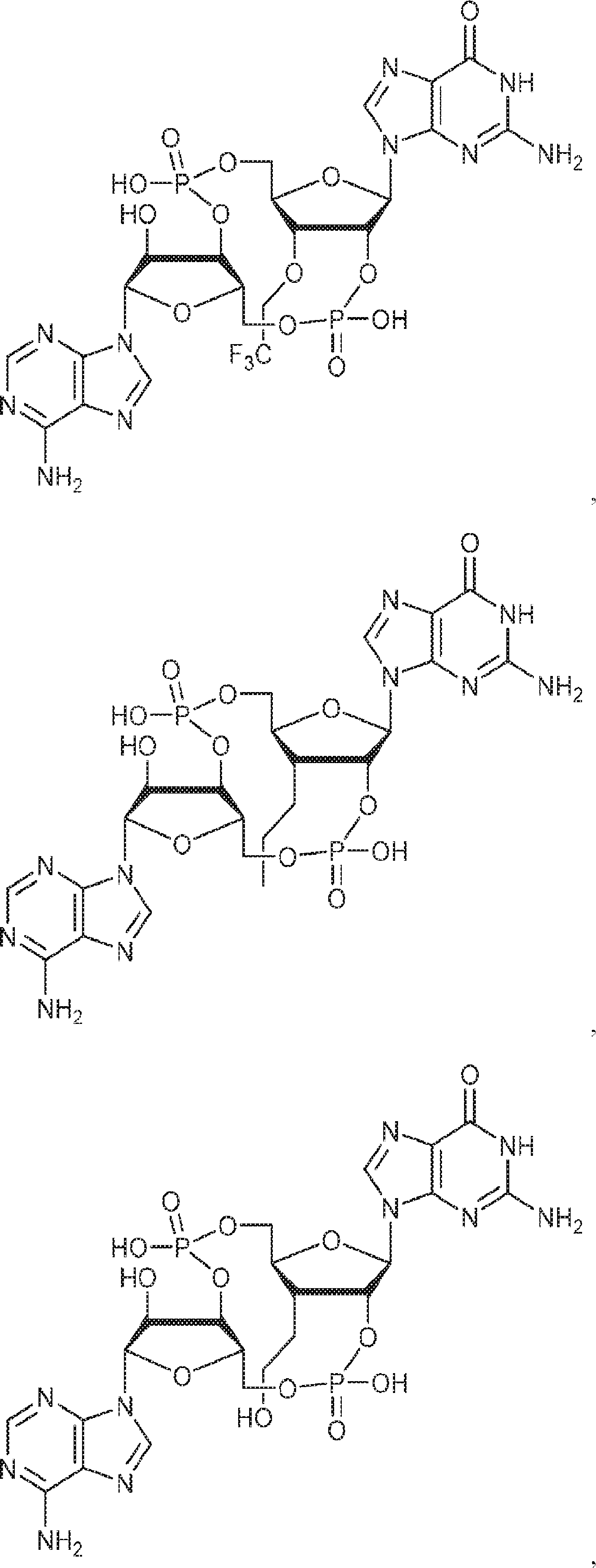
[本発明1017]
式:
の化合物。
[本発明1018]
式:
の化合物。
[本発明1019]
式:
の化合物。
[本発明1020]
式:
の化合物。
[本発明1021]
式:
の化合物。
[本発明1022]
式:
の化合物。
[本発明1023]
式:
の化合物。
[本発明1024]
式:
の化合物。
[本発明1025]
式:
の化合物。
[本発明1026]
式:
の化合物。
[本発明1027]
式:
の化合物。
[本発明1028]
式:
の化合物。
[本発明1029]
式:
の化合物。
[本発明1030]
式:
の化合物。
[本発明1031]
式:
の化合物。
[本発明1032]
式:
の化合物。
[本発明1033]
式:
の化合物。
[本発明1034]
式:
の化合物。
[本発明1035]
式:
の化合物。
[本発明1036]
式:
の化合物。
[本発明1037]
式:
の化合物。
[本発明1038]
からなる群より選択される、化合物。
[本発明1039]
からなる群より選択される、化合物。
[本発明1040]
式:
の化合物。
[本発明1041]
式:
の化合物。
[本発明1042]
式:
の化合物。
[本発明1043]
式:
の化合物。
[本発明1044]
式:
の化合物。
[本発明1045]
式:
の化合物。
[本発明1046]
式:
の化合物。
[本発明1047]
式:
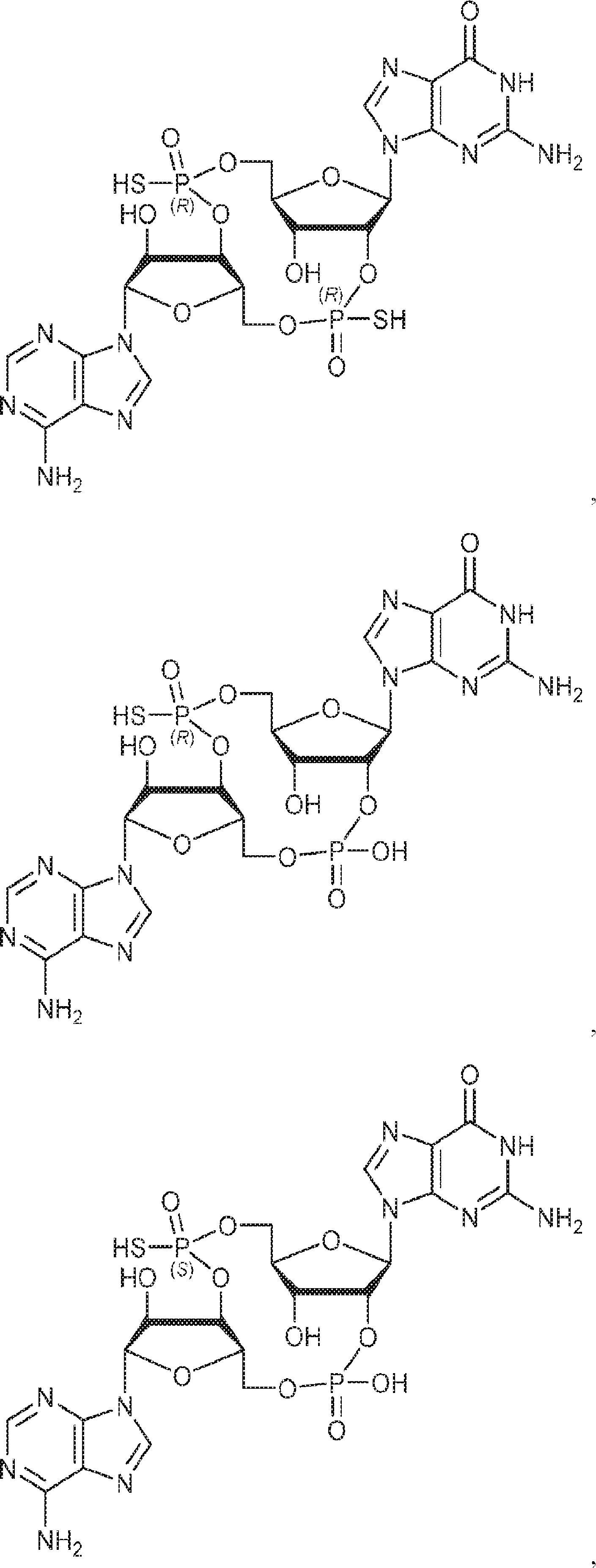
の(RP)-および(SP)-ボラノリン酸からなる群より選択される、化合物。
[本発明1048]
式:
の(RP)-および(SP)-ボラノリン酸からなる群より選択される、化合物。
[本発明1049]
式:
の化合物。
[本発明1050]
式:
の化合物。
[本発明1051]
式:
の化合物。
[本発明1052]
式:
の化合物。
[本発明1053]
式:
の化合物。
[本発明1054]
式:
の化合物。
[本発明1055]
式Iの化合物またはその薬学的に許容される塩を含む、薬学的組成物。
[本発明1056]
ナノ粒子または別の送達ビヒクルを含む薬学的製剤中の式Iの化合物である、薬学的組成物。
[本発明1057]
式Iの化合物と少なくとも1つのさらなる治療用物質との組み合わせである、薬学的組成物。
[本発明1058]
前記さらなる治療用物質が、PD-1に対する、PD-L1に対する、またはCTLA-4に対する抗体を含むがそれらに限定されない免疫チェックポイント阻害物質である、本発明1057の薬学的組成物。
[本発明1059]
前記さらなる治療用物質が、体幹部定位放射線治療(SBRT)を含む放射線である、本発明1057の薬学的組成物。
[本発明1060]
前記さらなる治療用物質が、化学療法剤と治療用抗体とを含む抗悪性腫瘍剤である、本発明1057の薬学的組成物。
[本発明1061]
がん細胞の免疫原(腫瘍抗原)または感染性病原体の免疫原を有する薬学的製剤中の式Iの化合物である、薬学的組成物。
[本発明1062]
1つまたは複数の薬学的に許容される担体、希釈剤、および賦形剤をさらに含む、本発明1057の薬学的組成物。
[本発明1063]
それを必要とする患者に、式Iの化合物またはその薬学的に許容される塩の有効量を投与する段階を含む、免疫応答を誘導または促進する方法。
[本発明1064]
それを必要とする患者に、本発明1063の薬学的組成物の有効量を投与する段階を含む、免疫応答を誘導または促進する方法。
[本発明1065]
それを必要とする患者に、式Iの化合物またはその薬学的に許容される塩の有効量を投与する段階を含む、STING依存性免疫応答を誘導または促進する方法。
[本発明1066]
それを必要とする患者に、本発明1063の薬学的組成物の有効量を投与する段階を含む、STING依存性免疫応答を誘導または促進する方法。
[本発明1067]
それを必要とする患者に、式Iの化合物またはその薬学的に許容される塩の治療有効量を投与する段階を含む、がんを処置する方法。
[本発明1068]
それを必要とする患者に、本発明1067の薬学的組成物の治療有効量を投与する段階を含む、がんを処置する方法。
[本発明1069]
それを必要とする患者に、PD-1に対する、PD-L1に対する、またはCTLA-4に対する抗体を含むがそれらに限定されない免疫チェックポイント抗体と組み合わせて式Iの化合物またはその薬学的に許容される塩を含む薬学的組成物の治療有効量を投与する段階を含む、がんを処置する方法。
[本発明1070]
それを必要とする患者に、体幹部定位放射線治療(SBRT)を含む放射線と組み合わせて式Iの化合物またはその薬学的に許容される塩を含む薬学的組成物の治療有効量を投与する段階を含む、がんを処置する方法。
[本発明1071]
それを必要とする患者に、化学療法剤と治療用抗体とを含む抗悪性腫瘍剤と組み合わせて式Iの化合物またはその薬学的に許容される塩を含む薬学的組成物の治療有効量を投与する段階を含む、がんを処置する方法。
[本発明1072]
それを必要とする患者に、式Iの化合物またはその薬学的に許容される塩の治療有効量を投与する段階を含む、感染性疾患を処置する方法。
[本発明1073]
それを必要とする患者に、本発明1072の薬学的組成物の治療有効量を投与する段階を含む、感染性疾患を処置する方法。
[本発明1074]
それを必要とする患者に、式Iの化合物またはその薬学的に許容される塩の治療有効量を投与する段階を含む、免疫障害を処置する方法。
[本発明1075]
それを必要とする患者に、本発明1074の薬学的組成物の治療有効量を投与する段階を含む、免疫障害を処置する方法。
[本発明1076]
疾患の処置または予防における使用のための、抗原または抗原組成物と式Iの化合物またはその薬学的に許容される塩とを含むワクチン組成物。
[本発明1077]
疾患の処置用または予防用の抗原または抗原組成物を含むワクチン組成物の製造のための、式Iの化合物またはその薬学的に許容される塩の使用。
[本発明1078]
疾患に罹患しているかまたは罹患しやすい患者に、抗原または抗原組成物と式Iの化合物またはその薬学的に許容される塩とを含むワクチン組成物を投与する段階を含む、該疾患を処置または予防する方法。
[本発明1079]
それを必要とする患者に、式Iの化合物またはその薬学的に許容される塩の治療有効量を投与する段階を含み、該患者が哺乳動物である、疾患を処置または予防する方法。
[本発明1080]
それを必要とする患者に、式Iの化合物またはその薬学的に許容される塩の治療有効量を投与する段階を含み、該患者がヒトである、疾患を処置または予防する方法。
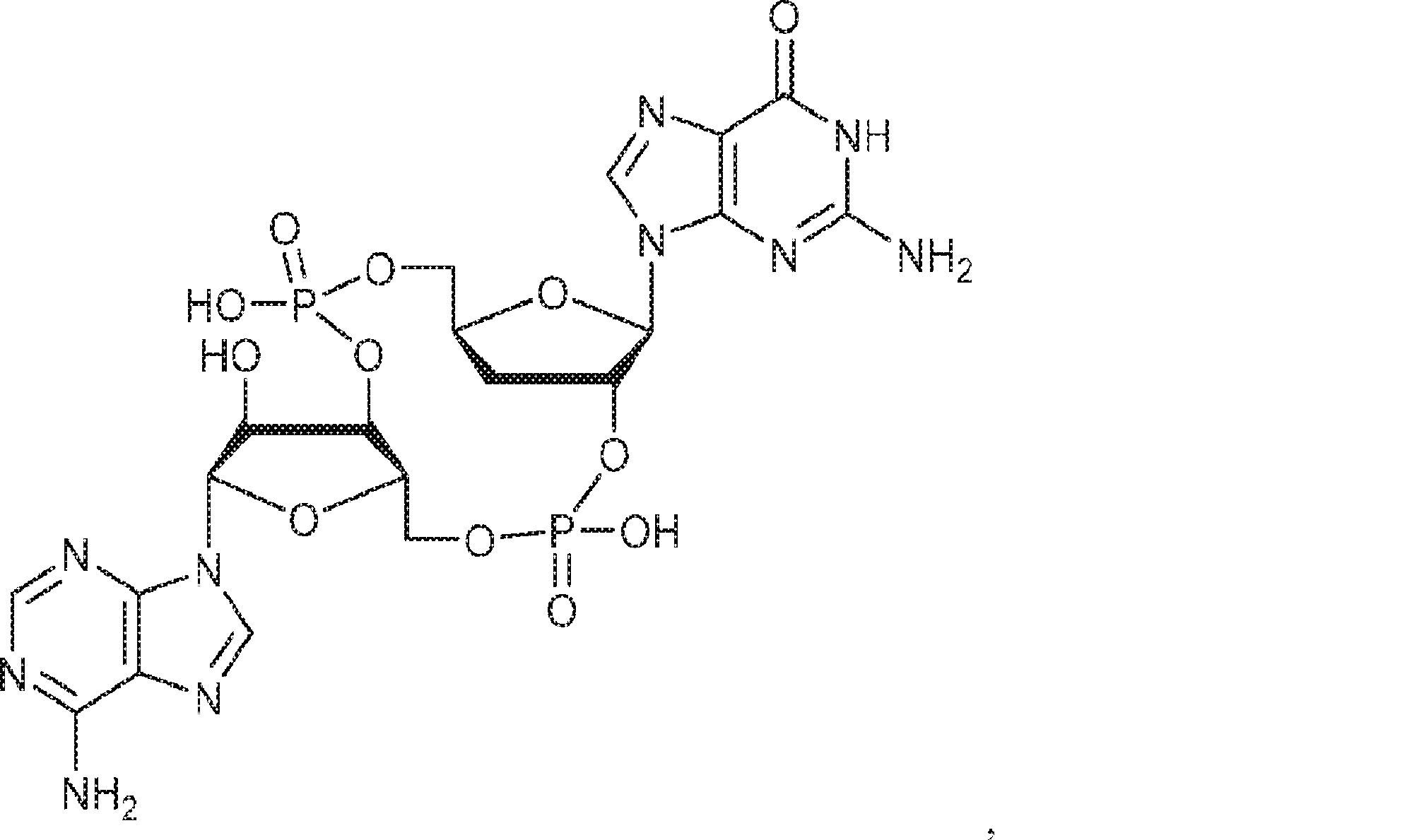
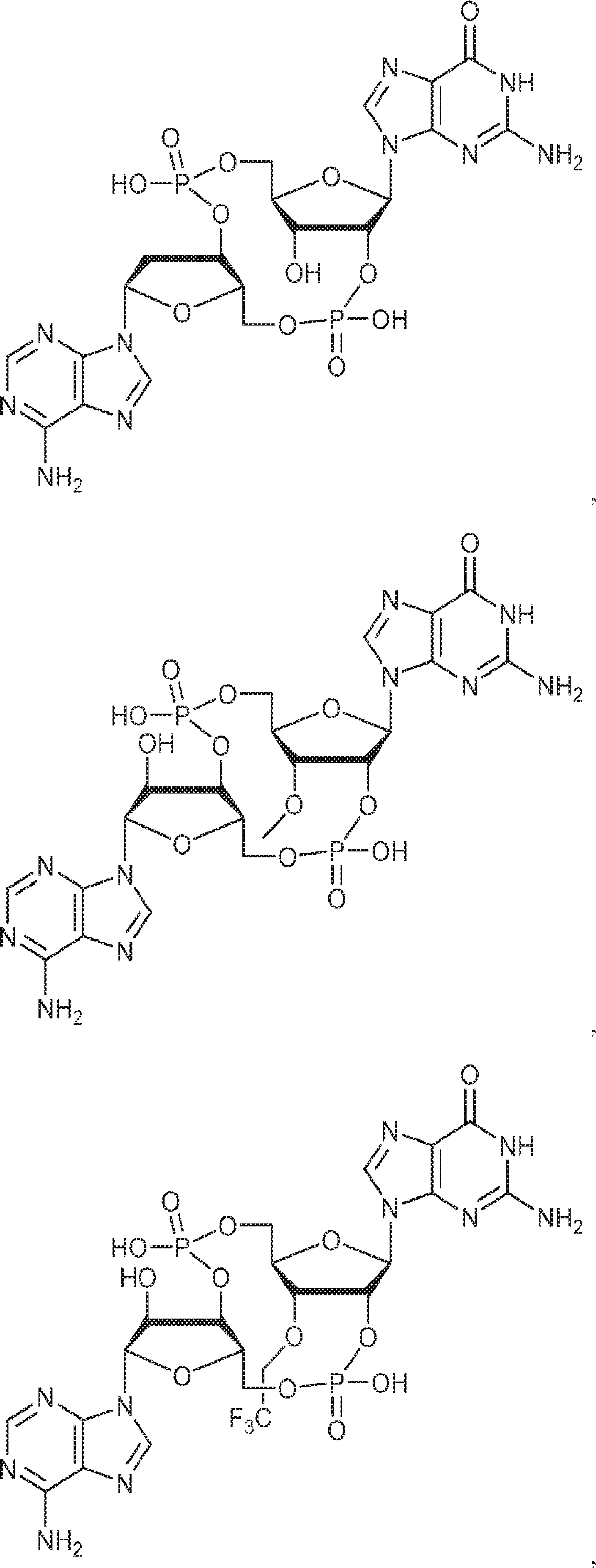
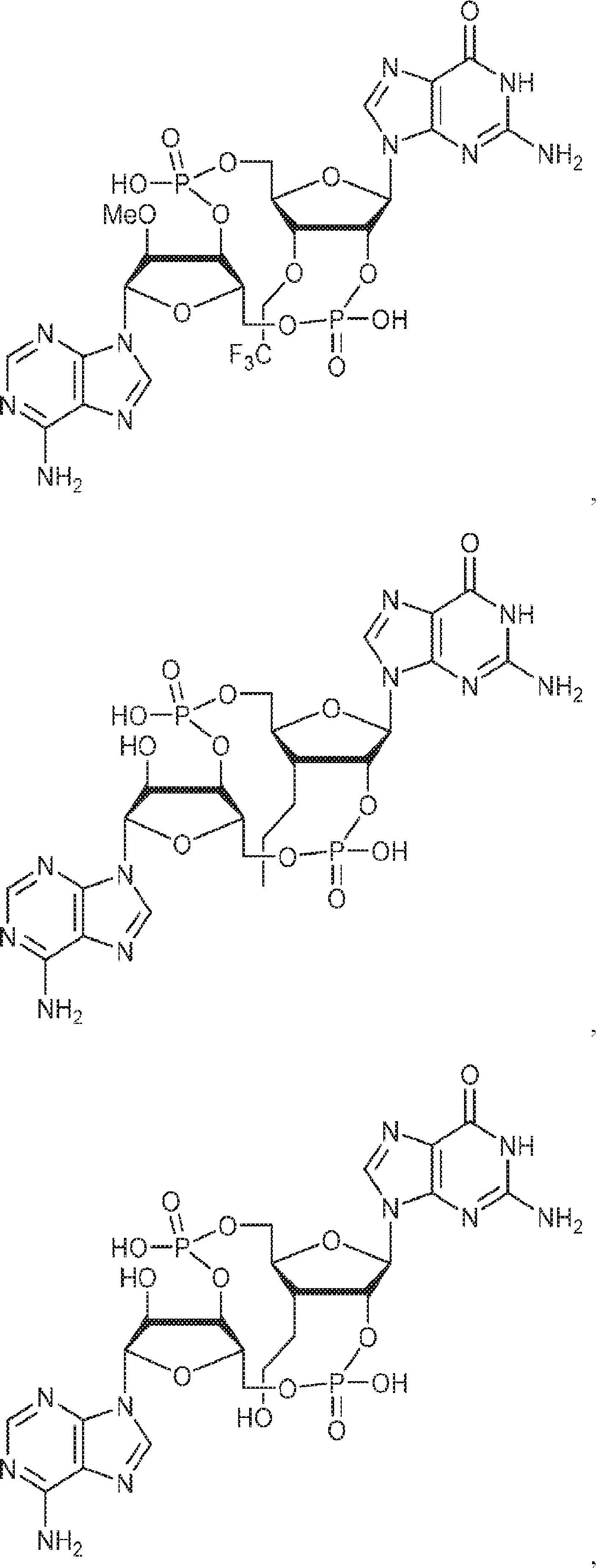
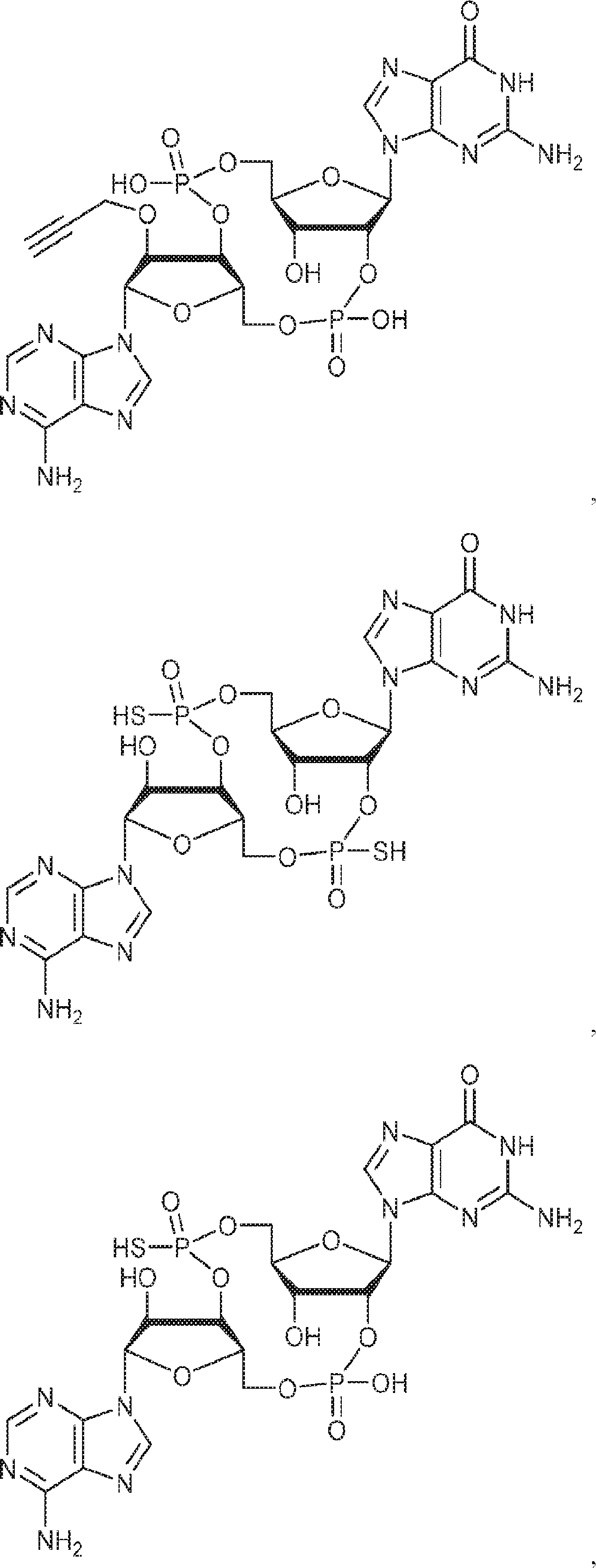
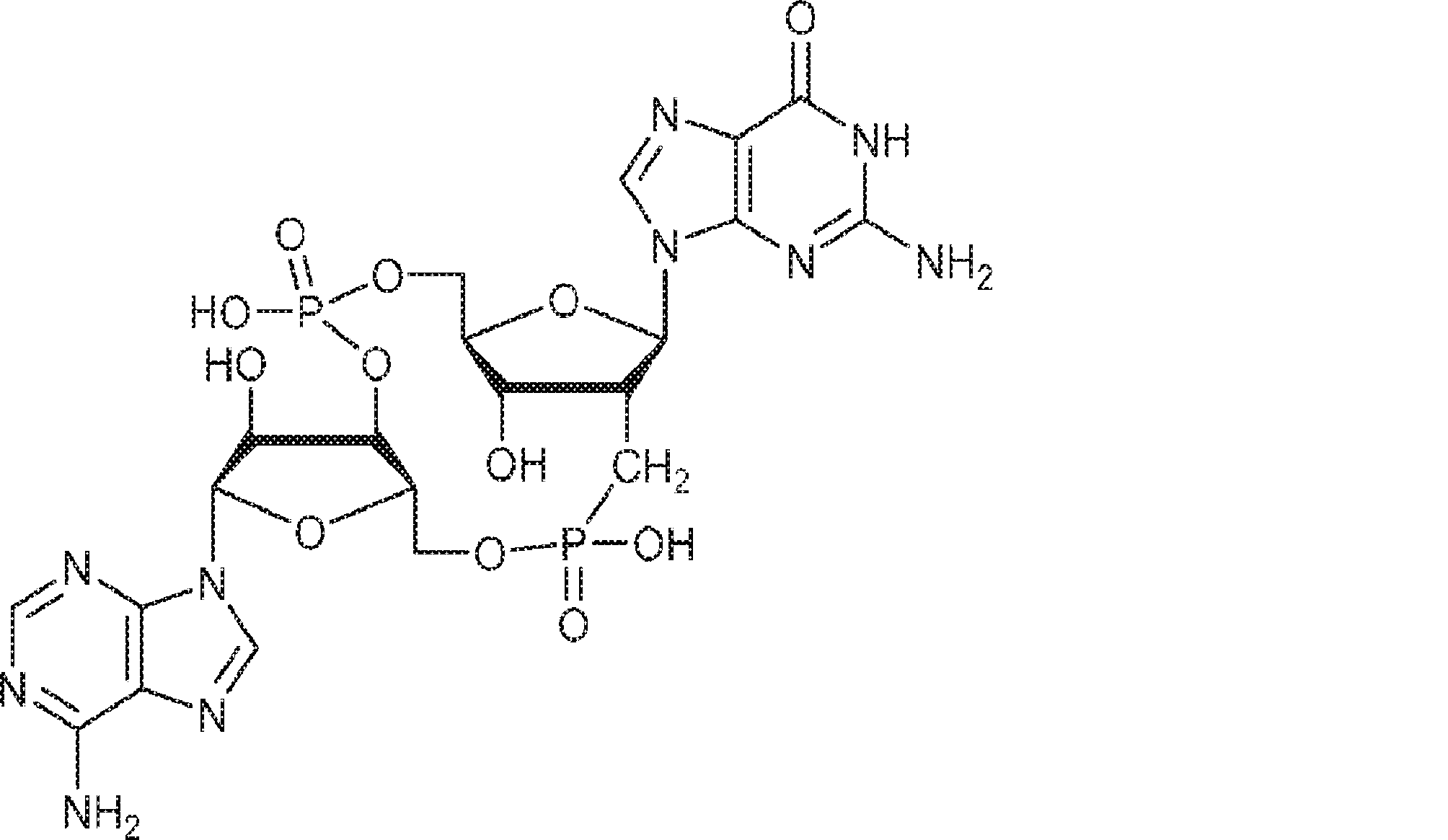
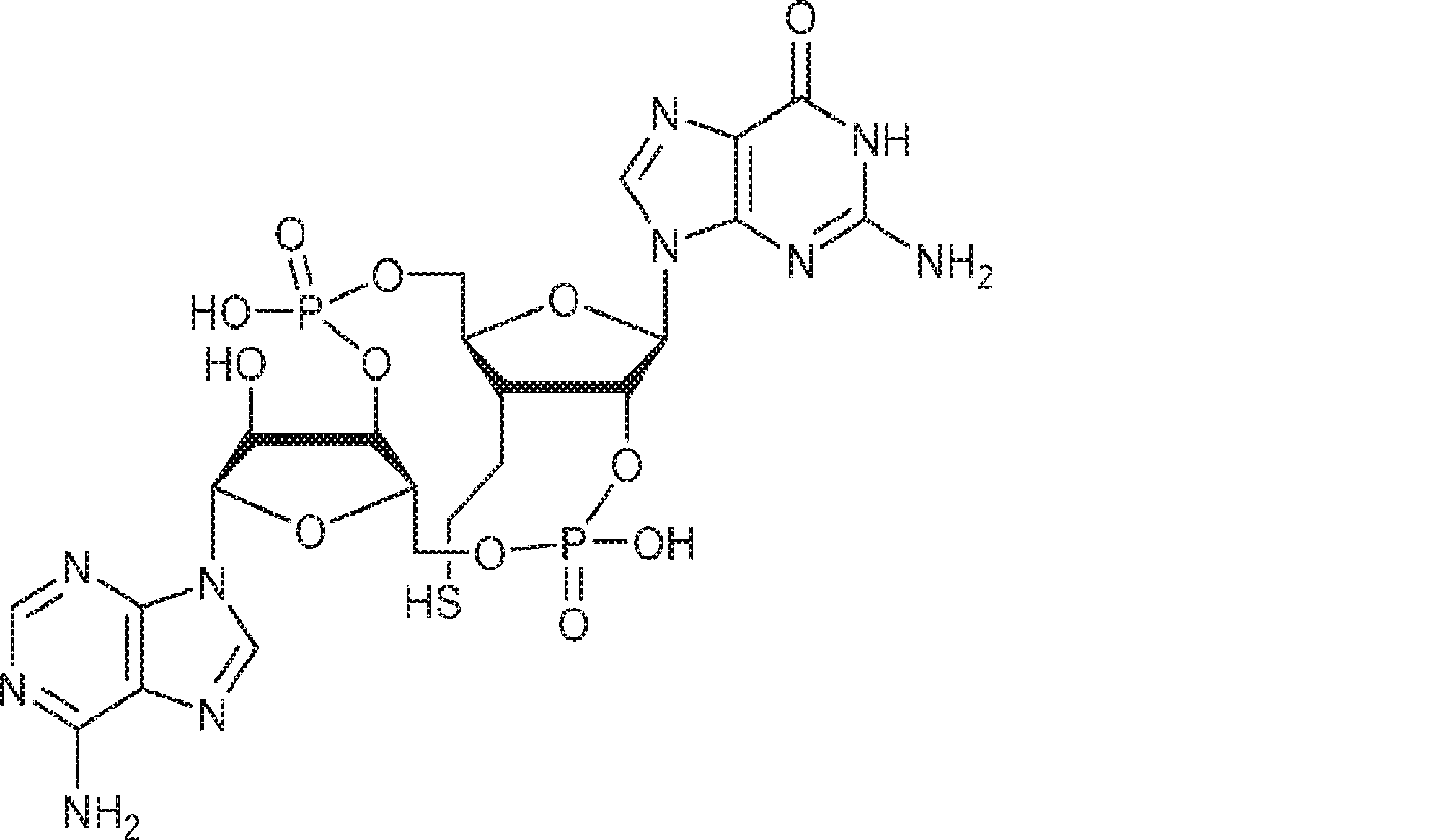
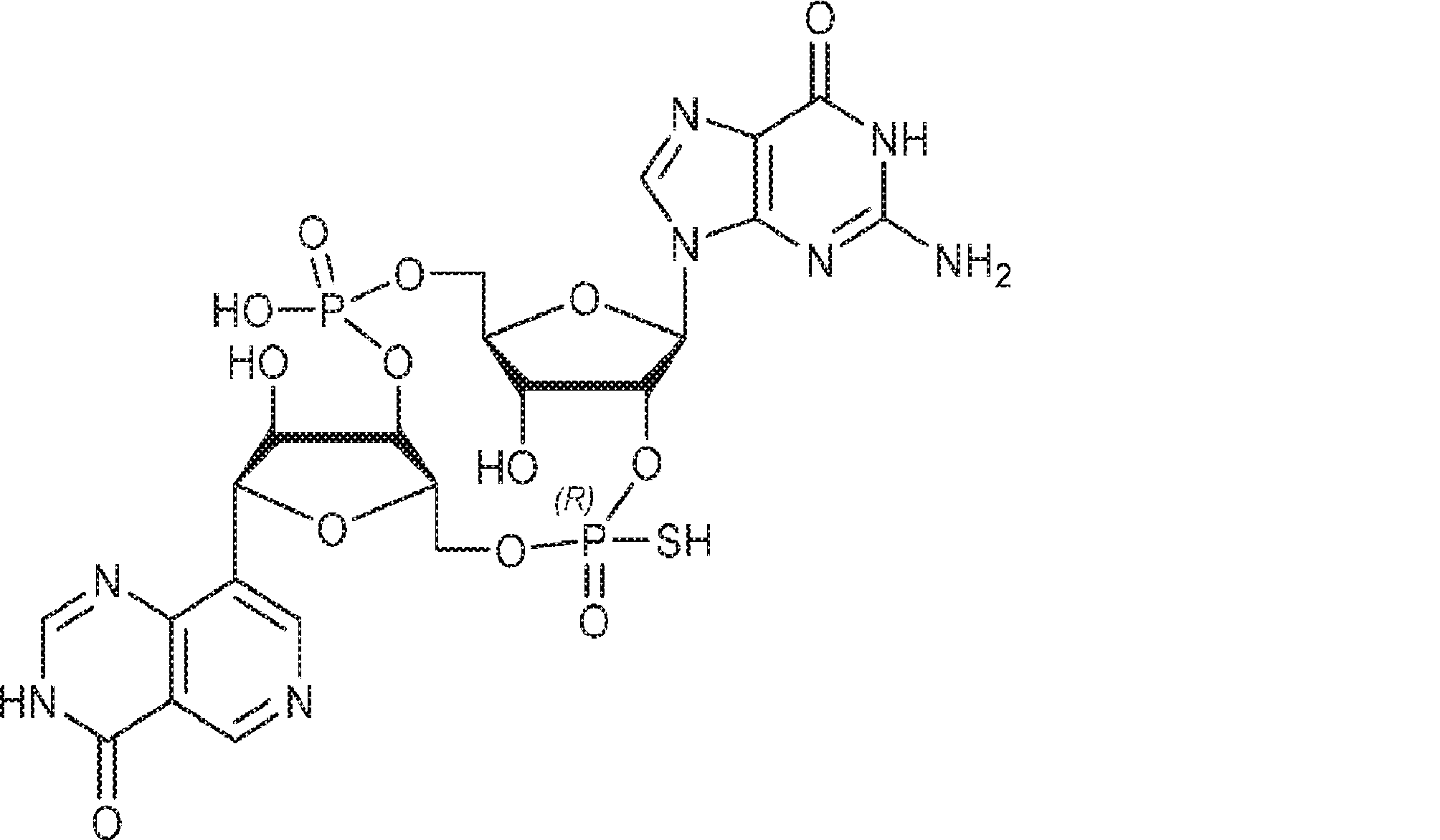
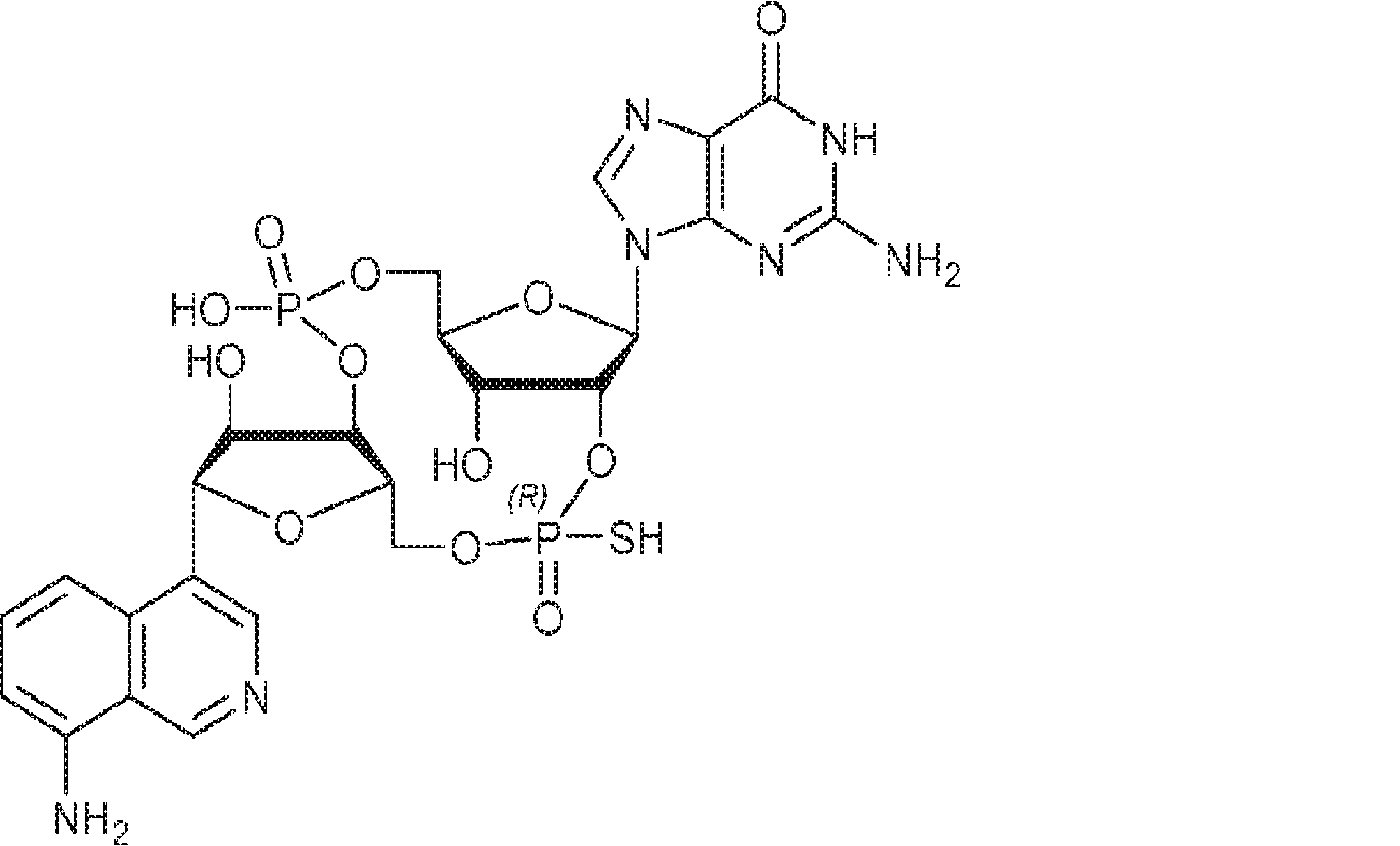
本発明は、新規cGAMP類似体、その薬学的組成物、および治療におけるその使用を提供する。2'3'-cGAMPは、哺乳動物細胞により産生される内在性のセカンドメッセンジャーである。それは、STINGの立体構造変化を誘導するSTINGの高親和性リガンドであり、I型インターフェロンの強力な誘導因子である。cGASおよびcGAS-cGAMP経路は、自己DNAおよび外来DNAに対する炎症応答を誘発するために重要である。したがって、cGASは、DNAを含みかつライフサイクルにDNAを必要とする微生物病原体に対する免疫防御のために重要である。これらの病原体としてはDNAウイルス、HIVを含むレトロウイルス、結核菌を含む細菌、真菌、および寄生虫が挙げられる。また、cGASは、腫瘍DNAを検出することができ、悪性細胞に対する身体の内因性免疫のために重要である。cGAS-cGAMP-STING経路の活性化は、がん免疫療法のために重要である。
「ハロ」および「ハロゲン」という用語は単独でまたは他の基と組み合わせて、フルオロ-、クロロ-、ブロモ-、およびヨード-を意味する。
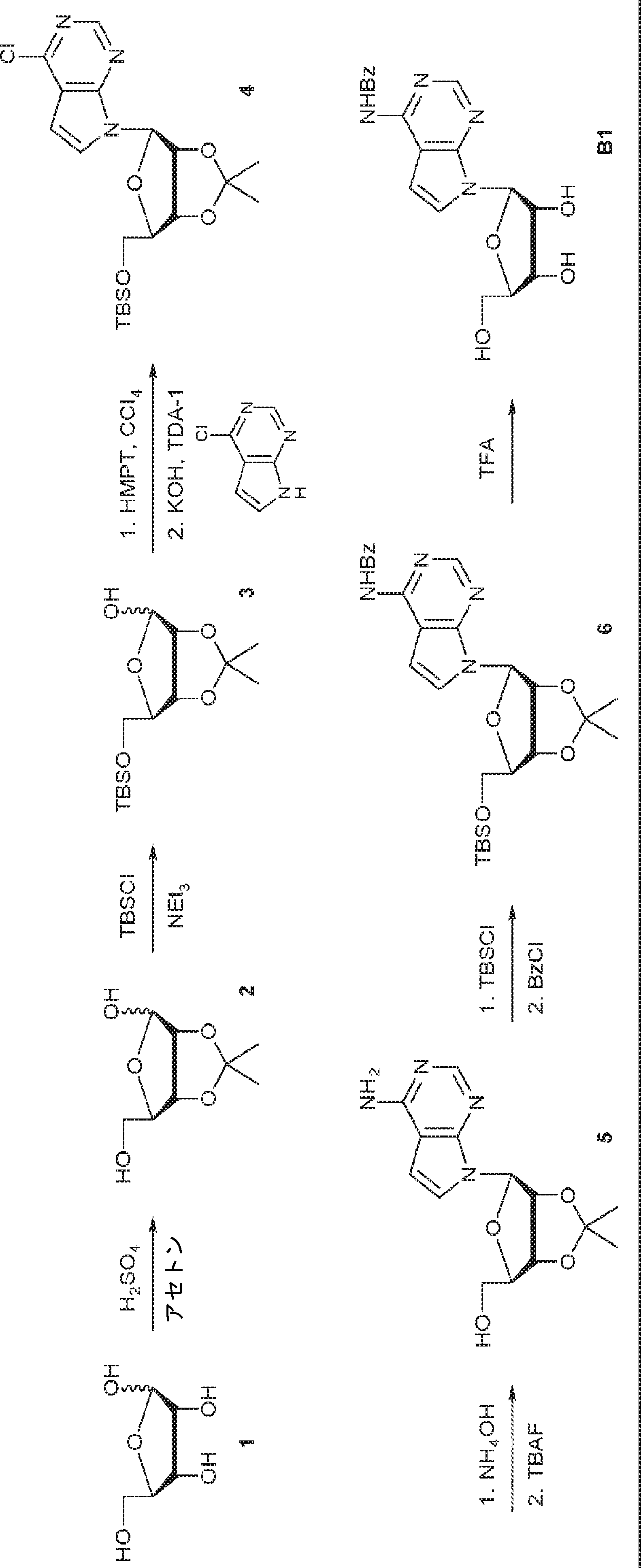
D-リボース(1)(160g、1.07mol)のアセトン(2.0L)懸濁液に濃硫酸(10.7g、107mmol、5.8mL)を27℃で滴下する。12時間攪拌後、固体炭酸水素ナトリウム(100g)を加える。次に混合物を濾過し、濾液を濃縮して粗生成物2(215.0g)を得る。
粗生成物2(215g、1.13mol)のDCM(1.5L)溶液にTBSCl(170g、1.13mol)およびTEA(172g、1.69mol)を0℃で加える。27℃で12時間攪拌後、混合物を濾過し、濃縮し、シリカゲルカラムクロマトグラフィー(EA/PE = 1/100→1/50)で精製して3を無色油状物(285g、収率83%)として得る。
3(60.0g、197.08mmol)および四塩化炭素(67.3g、438mmol、42mL)のTHF(1.2L)溶液にHMPT(63.0g、386mmol、70mL)を-78℃で滴下し、27℃で2時間攪拌する。別の6-クロロ-7-デアザプリン(24.2g、158mmol)およびKOH(16.6g、296mmol)のMeCN(1.2L)溶液に27℃でTDA-1(6.37g、19.7mmol)、続いて上記で得たTHF溶液を加える。27℃で12時間攪拌後、反応混合物を濾過し、濃縮し、シリカゲルカラムクロマトグラフィー(EA/PE = 1/50→1/10)で精製して4を黄色油状物(15.3g、収率18%)として得る。
4(28.6g、64.9mmol)のジオキサン(150mL)および水酸化アンモニウム水溶液(500mL)中溶液を密封オートクレーブ中、120℃で30時間攪拌する。次に揮発物を除去し、水溶液をEA(300mL×3)で抽出する。一緒にした有機層をブライン(100mL)で洗浄し、無水硫酸ナトリウムで乾燥させ、濾過し、濃縮し、シリカゲルカラムクロマトグラフィー(EA/DCM = 1/1)で部分精製して黄色泡状物(9.65g)を得る。次に、この残渣をTHF(50mL)に溶解させ、TBAF三水和物(10.9g、34.4mmol)によって27℃で処理する。2時間攪拌後、混合物を濃縮し、シリカゲルカラムクロマトグラフィー(EA/DCM = 1/1→7/1)で精製して5(5.56g、収率79%)を黄色固体として得る。
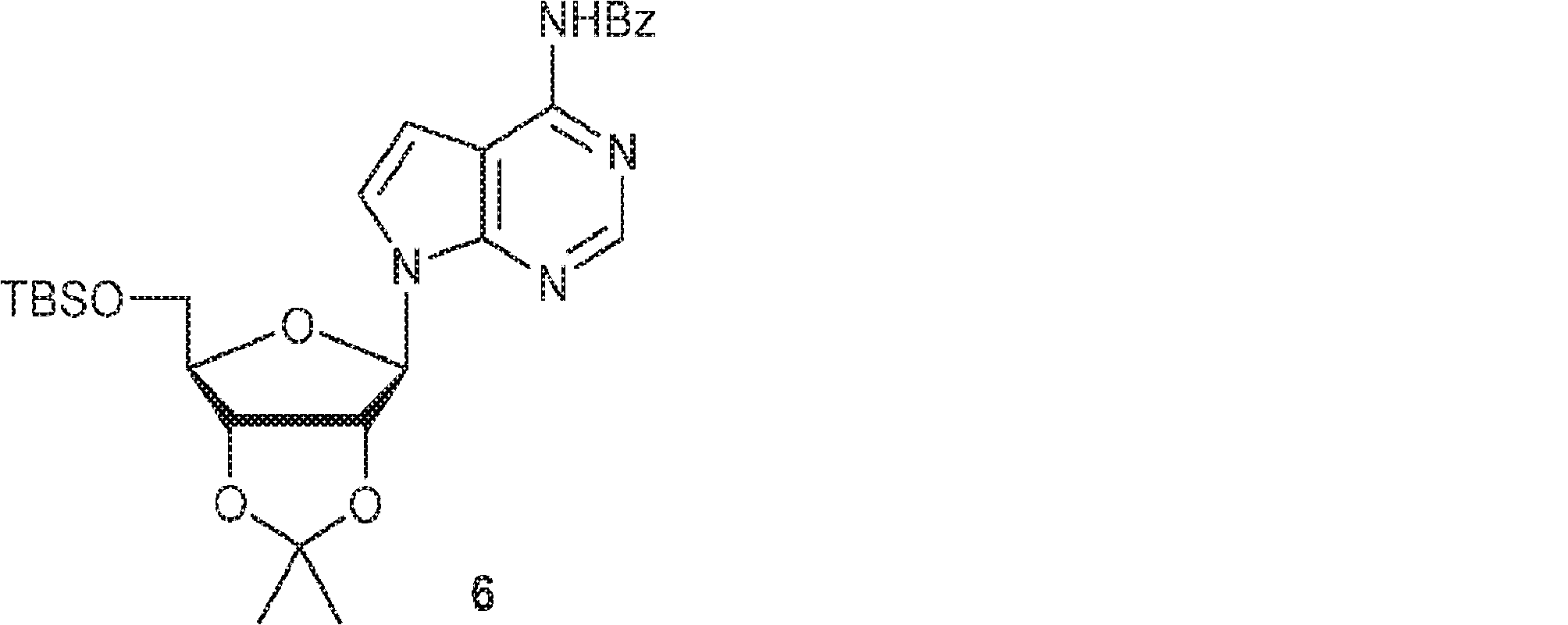
5(7.26g、23.7mmol)のDCM(60mL)溶液にImid(4.84g、71.1mmol)およびTBSCl(5.36g、35.6mmol)を27℃で加える。27℃で1.5時間攪拌後、水(100mL)を加え、混合物をDCM(200mL)で抽出する。有機層をブライン(100mL)で洗浄し、無水硫酸ナトリウムで乾燥させ、濾過し、濃縮して粗生成物TBS-5を得る。上記で得た粗生成物TBS-5のDCM(100mL)溶液に塩化ベンゾイル(5.14g、36.6mmol)を27℃で加える。12時間攪拌後、水(200mL)を加え、混合物をDCM(500mL)で抽出する。有機層を無水硫酸ナトリウムで乾燥させ、濾過し、濃縮し、シリカゲルカラムクロマトグラフィー(EA/PE = 1/50→1/10)で精製して6を黄色泡状物(8.12g、収率64%)として得る。
6(15.2g、28.9mmol)のTFA(90mL)およびDCM(20mL)溶液を27℃で12時間攪拌する。次に揮発物を除去し、残渣をシリカゲルカラムクロマトグラフィー(MeOH/DCM = 1/100→1/10)で精製してB1を黄色固体(10.16g、収率95%)として得る。
5-アミノ-4,6-ジクロロピリミジン(63.0g、384mmol)のn-BuOH(300.0mL)溶液にp-メトキシベンジルアミン(58.0g、423mmol、55mL)およびDIPEA(99.3g、768mmol、134mL)を加える。100~110℃で15時間攪拌後、揮発物を除去し、次にMTBE(100mL)を加える。固体を濾取し、EAで洗浄して8を帯黄白色固体(55.0g、収率54%)として得る。(MS: [M+H]+ 265.0)
DCM(200mL)、AcOH(100mL)、および水(100mL)の混合物中の8(10.0g、37.8mmol)の溶液に亜硝酸ナトリウム(2.87g、41.6mmol、2.3mL)を0℃で加える。0~25℃で1時間攪拌後、DCM(30mL)および飽和炭酸水素ナトリウム水溶液(30mL)を加える。次に層を分離し、水相をDCM(150mL×3)で抽出する。一緒にした有機相を無水硫酸ナトリウムで乾燥させ、濾過し、濃縮し、シリカゲルカラムクロマトグラフィー(EA/PE = 1/3)で精製して9を明黄色固体(6.0g、収率88%)として得る。(MS: [M+H]+ 276.0)
9(6.0g、21.8mmol)の1,4-ジオキサン(30mL)溶液に水酸化アンモニウム水溶液(30mL)を加える。30~40℃で5時間攪拌後、固体を濾取して10を白色固体(4.0g、収率70%)として得る。(MS: [M+H]+ 257.1)
10(17.0g、66.3mmol)のPy(100mL)溶液にDMAP(8.92g、73.0mmol)、Imid(13.6g、199mmol)、および塩化ベンゾイル(14.0g、99.5mmol、11.6mL)を加える。110~120℃で18時間攪拌後、揮発物を除去し、DCM(300mL)および水(300mL)を加える。層を分離し、有機相を無水硫酸ナトリウムで乾燥させ、濾過し、濃縮し、シリカゲルカラムクロマトグラフィー(EA/PE = 1:1)で精製して11を帯黄白色固体(17.0g、収率68%)として得る。(MS: [M+H]+ 361.2)
11(6.40g、17.8mmol)のMeCN(60mL)懸濁液にCAN(29.2g、53.3mmol)および炭酸水素ナトリウム(1.49g、17.76mmol)の水(60mL)溶液を0℃で加える。0~25℃で12時間攪拌後、混合物を炭酸水素ナトリウムで約pH 7に中和する。固体を濾取して12(2.6g、収率57%)を得る。(MS: [M+H]+ 241.1)
12(9.30g、38.7mmol)および13(20.5g、40.7mmol)のMeCN(350mL)溶液に塩化スズ(IV)(30.3g、116mmol、13.6mL)を0℃で加える。0~25℃で24時間攪拌後、反応混合物を飽和炭酸水素ナトリウム水溶液(300mL)に注ぐ。固体を濾去し、水(100mL)で洗浄する。濾液をDCM(150mL×4)で抽出し、一緒にした有機層を無水硫酸ナトリウムで乾燥させ、濾過し、濃縮し、シリカゲルカラムクロマトグラフィー(EA/DCM = 1/10)で精製して14を帯黄白色ゴム状物(6.10g、収率21%)として得る。(MS: [M+H]+ 684.9)
THF(35mL)およびMeOH(28mL)の混合物中の14(6.1g、8.9mmol)の溶液に水酸化リチウム水溶液(1M、16.0mL)を0℃で加える。0~25℃で3時間攪拌後、混合物をクエン酸水溶液(1M)で約pH 7に中和し、次に濃縮し、シリカゲルカラムクロマトグラフィー(MeOH/DCM = 1/20)で精製してB2を帯黄白色固体(2.9g、収率87%)として得る。(MS: [M+H]+ 373.1)
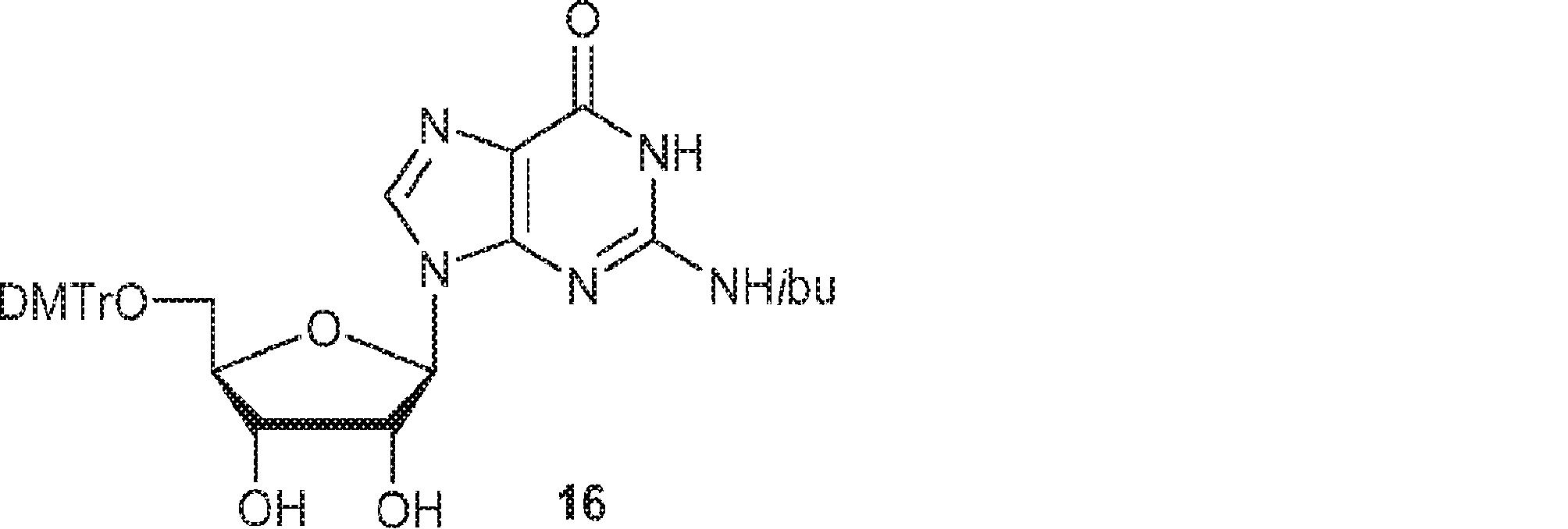
15(880mg、2.5mmol)のPy(10mL)溶液にDMTrCl(940mg、2.6mmol)のPy(5mL)溶液を加える。3時間攪拌後、混合物を濃縮し、シリカゲルカラムクロマトグラフィー(MeOH/DCM = 1/20→1/10)で精製して16を白色泡状物(1.23g、収率75%)として得る。(MS: [M+H]+ 656.2)
16(900mg、1.4mmol)およびImid(280mg、4.15mmol)のPy(15mL)溶液にTBSCl(310mg、2.05mmol)を加える。4時間攪拌後、揮発物を除去し、残渣はDCM(50mL)に溶解させ、飽和炭酸水素ナトリウム水溶液およびブラインで洗浄し、無水硫酸ナトリウムで乾燥させ、濃縮し、シリカゲルカラムクロマトグラフィー(EA/トルエン = 1/3→2/3)で精製して17を白色固体(480mg、収率45%)として得る。(MS: [M+H]+ 770.2)
17(500mg、0.65mmol)のDMF(6mL)溶液にTCDI(350mg、1.94mmol)を加える。2日間攪拌後、EA(40mL)および水(25mL)を加え、層を分離する。水層を酢酸エチル(25mL×3)で抽出する。一緒にした有機層を水(20mL)、ブライン(20mL×2)で洗浄し、無水硫酸ナトリウムで乾燥させ、濃縮して粗生成物18を得る。(MS: [M+H]+ 880.2)
粗生成物18のトルエン(10mL)中脱気溶液にAIBN(57mg、0.34mmol)、水素化トリブチルスズ(0.51mL、1.94mmol)のトルエン(3mL)中脱気溶液を110℃で30分かけて加える。110℃で6時間攪拌後、混合物を室温に冷却し、濃縮し、シリカゲルカラムクロマトグラフィー(EA/ヘキサン = 1/5→2/1)で精製して19を黄色の油状物(195mg、2工程で収率40%)として得る。(MS: [M+H]+ 754.2)
19(190mg、0.252mmol)のTHF(5mL)溶液にTBAF(THF中1M、0.50mL)を加える。室温で2時間攪拌後、水(5mL)を加え、混合物をEA(8mL×3)で抽出し、無水硫酸ナトリウムで乾燥させ、濃縮し、シリカゲルカラムクロマトグラフィー(MeOH/DCM = 1/20)で精製してDMTr-B3を白色固体(132mg、収率82%)として得る。(MS: [M+H]+ 640.2)
20(12.8g、67.0mmol)のPy(300mL)溶液にTBDPSCl(21.0mL、80.4mmol)を加える。3時間攪拌後、MeOH(25mL)を加え、混合物を濃縮する。残渣をジエチルエーテル(200mL)に溶解させ、炭酸水素ナトリウム水溶液(10%、100mL)および水(100mL)で洗浄し、無水硫酸ナトリウムで乾燥させ、濾過し、濃縮し、シリカゲルカラムクロマトグラフィー(ジエチルエーテル/PE = 1/2)で精製して21を白色固体(27.2g、収率95%)として得る。(MS: [M+Na]+ 451.2)
21(27.2g、63.7mmol)のDMSO(200mL)およびAc2O(50mL)溶液を16時間攪拌した後、氷水(200mL)に注ぐ。混合物をジエチルエーテル(100mL×3)で抽出し、一緒にした有機層を炭酸水素ナトリウム水溶液(10%、100mL)および水(100mL)で洗浄し、濃縮する。次に残渣をMeOH(250mL)およびDCM(250mL)に0℃で溶解させ、続いて水素化ホウ素ナトリウム(12.0g)を10回に分けて加える。5分間攪拌後、水(100mL)を加え、層を分離する。次に有機層を濃縮し、シリカゲルカラムクロマトグラフィー(ジエチルエーテル/PE = 1/2)で精製して22を白色固体(20.4g、2工程で収率75%)として得る。(MS: [M+Na]+ 451.2)
22(4.0g、9.33mmol)のDMF(45mL)溶液に水素化ナトリウム(484mg、12.1mmol)を0℃で加え、30分間攪拌した後、ヨウ化メチル(0.64mL、10.3mmol)をゆっくりと加える。3時間攪拌後、水(3mL)を加え、揮発物を除去し、シリカゲルカラムクロマトグラフィー(EA/PE = 1/10)で精製して23を白色固体(3.8g、収率92%)として得る。(MS: [M+Na]+ 465.2)
23(3.1g、7.0mmol)のTHF(50mL)溶液にTBAF(8.4mL、8.4mmol)を0℃で加える。室温で4時間攪拌後、水(5mL)およびEAを加える。層を分離し、有機層を水およびブラインで洗浄し、濃縮し、得られた残渣をDCMに溶解させ、続いてTEA(4.9mL、35mmol)および塩化ベンゾイル(0.98mL、8.4mmol)を加える。1時間攪拌後、水(3mL)を加え、揮発物を除去する。残渣をシリカゲルカラムクロマトグラフィー(EA/PE = 1/5)で精製して24を白色固体(1.9g、収率88%)として得る。(MS: [M+ Na]+ 331.0)
24(0.71g、2.3mmol)のHOAc(14mL)および水(6mL)溶液を還流下で30分間加熱する。室温に冷却後、混合物をトルエン(10mL×4)と共蒸発させ、得られた残渣をPy/Ac2O(10/1 v/v、10mL)に溶解させ、続いてDMAP(50mg、0.46mmol)を加える。4時間攪拌後、混合物を濃縮し、シリカゲルカラムクロマトグラフィー(EA/PE = 1/3)で精製して25を白色固体(0.75g、収率92%)として得る。(MS: [M+Na]+ 375.0)
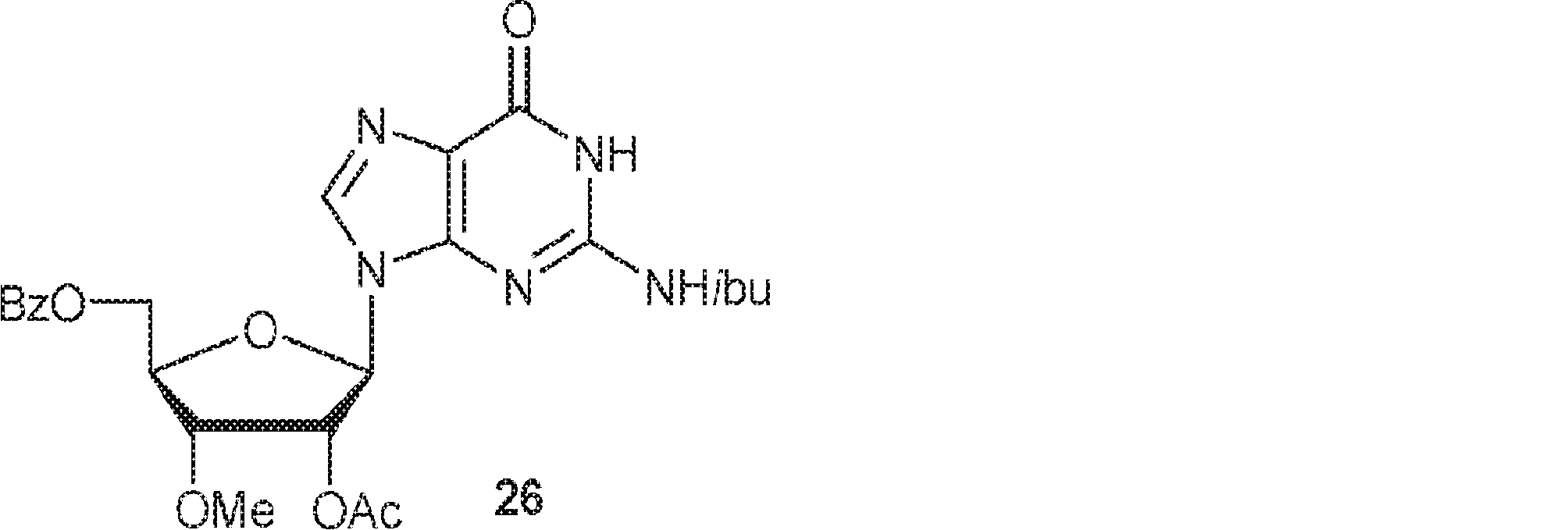
25(500mg、1.42mmol)およびN2-イソブチリルグアニン(500mg、2.13mmol)のDCM(20mL)懸濁液に80℃でBSA(1.8mL、7.4mmol)を加え、1時間攪拌した後、TMSOTf(0.77mL、4.26mmol)を加える。80℃で3時間攪拌後、混合物を室温に冷却し、次に炭酸水素ナトリウム水溶液(50mL)を加える。次に混合物をDCM(50mL×3)で抽出する。一緒にした有機層を無水硫酸ナトリウムで乾燥させ、濃縮し、シリカゲルカラムクロマトグラフィー(MeOH/DCM = 1/20→1/10)で精製して26を白色粉末(624mg、収率85%)として得る。(MS: [M+H]+ 514.2)
27(0.49g、0.96mmol)のMeOH/THF/水(4/5/1 v/v/v、20mL)溶液に水酸化ナトリウム水溶液(10M、0.25mL、2.5mmol)を0℃で加える。30分間攪拌後、HOAcを加え、混合物を濃縮し、シリカゲルカラムクロマトグラフィー(MeOH/DCM = 1/10→1/5)で精製してB4を油状物(322mg、収率92%)として得る。(MS: [M+H]+ 368.2)
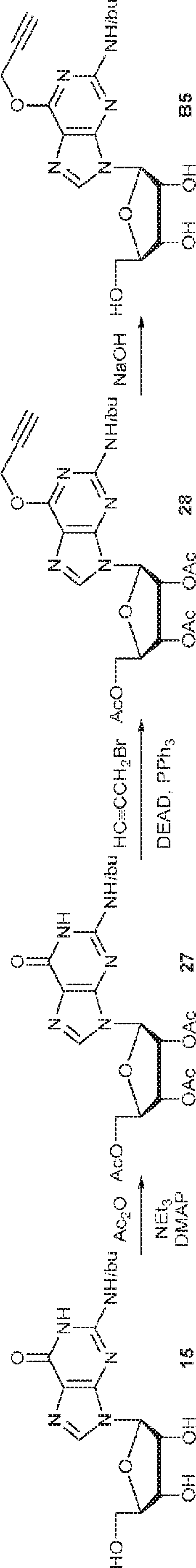
15(7.0g、20mmol)のMeCN(100mL)溶液にDMAP(1.2g、10mmol)およびAc2O(7.5mL、80mmol)を0℃で加える。室温で終夜攪拌後、混合物を濃縮し、シリカゲルフラッシュクロマトグラフィー(MeOH/DCM = 1/20→1/10)で精製して27を白色固体(8.77g、収率92%)として得る。(MS: [M+H]+ 480.0)
27(480mg、1.0mmol)の1,4-ジオキサン(1mL)溶液にPPh3(656mg、2.5mmol)と、臭化プロパルギル(0.15mL、2mmol)と、DEAD(0.49mL、2.5mmol)のジオキサン(1mL)溶液とを0℃で加える。2時間攪拌後、混合物を濃縮し、シリカゲルカラムクロマトグラフィー(MeOH/DCM = 1/50→1/20)で精製して28を白色固体(440mg、収率47%)として得る。(MS: [M+H]+ 518.2)
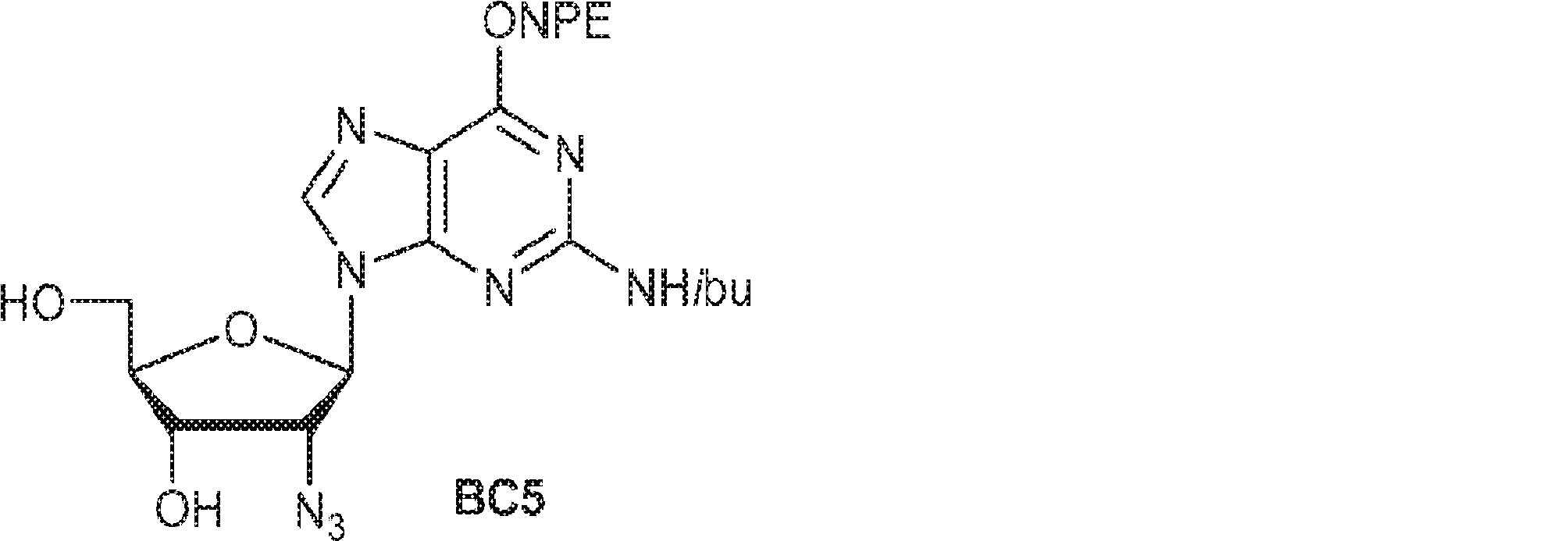
28(150mg、0.17mmol)のTHF(4.5mL)およびMeOH(0.5mL)溶液に水酸化ナトリウム水溶液(1M、0.5mL)を0℃で加える。1時間攪拌後、HOAc(0.1mL)を加え、混合物を濃縮し、シリカゲルカラムクロマトグラフィー(MeOH/DCM = 1/20→1/10)で精製してB5を白色固体(40mg、収率64%)として得る。(MS: [M+H]+ 392.0)
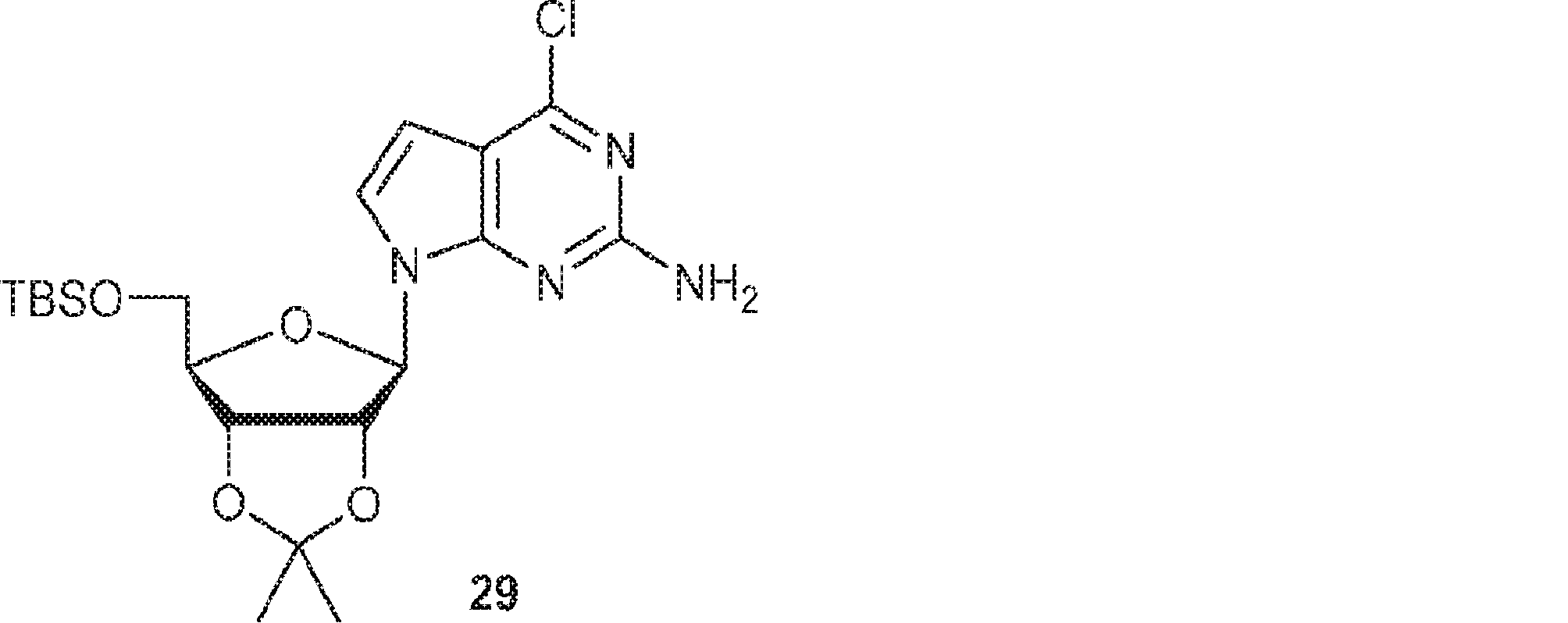
3(40.0g、131mmol)および四塩化炭素(33.6g、218mmol、21mL)のTHF(500mL)溶液にHMPT(22.5g、138mmol、25mL)を-78℃で15分かけて加える。ゲル形成を防ぐために短期間わずかに昇温させながら2時間攪拌した後、混合物を約70mLに濃縮する。KOH(25.8g、460mmol)のMeCN(600mL)懸濁液にTDA-1(4.25g、13.14mmol、4.2mL)を加える。25℃で10分間攪拌後、2-アミノ-6-クロロ-7-デアザプリン(22.2g、131mmol)を加える。混合物をさらに10分間攪拌した後、上記で得たTHF溶液を加える。2時間攪拌後、混合物を濾過し、濃縮し、シリカゲルカラムクロマトグラフィー(EA/PE = 3/17)で精製して29(9.20g、収率15%)を得る。(MS: [M+H]+ 455.3)
29(13.7g、30.1mmol)のジオキサン(10mL)中混合物に水酸化ナトリウム(11.7g、291mmol)の水(100 mL)溶液を25℃で加える。80℃で64時間攪拌後、混合物を0℃に冷却し、AcOHで約pH 7に中和し、EtOAc(100mL×3)で抽出する。一緒にした有機層を無水硫酸ナトリウムで乾燥させ、濾過し、濃縮して粗生成物30を得る。(MS: [M+1]+ 323.1)
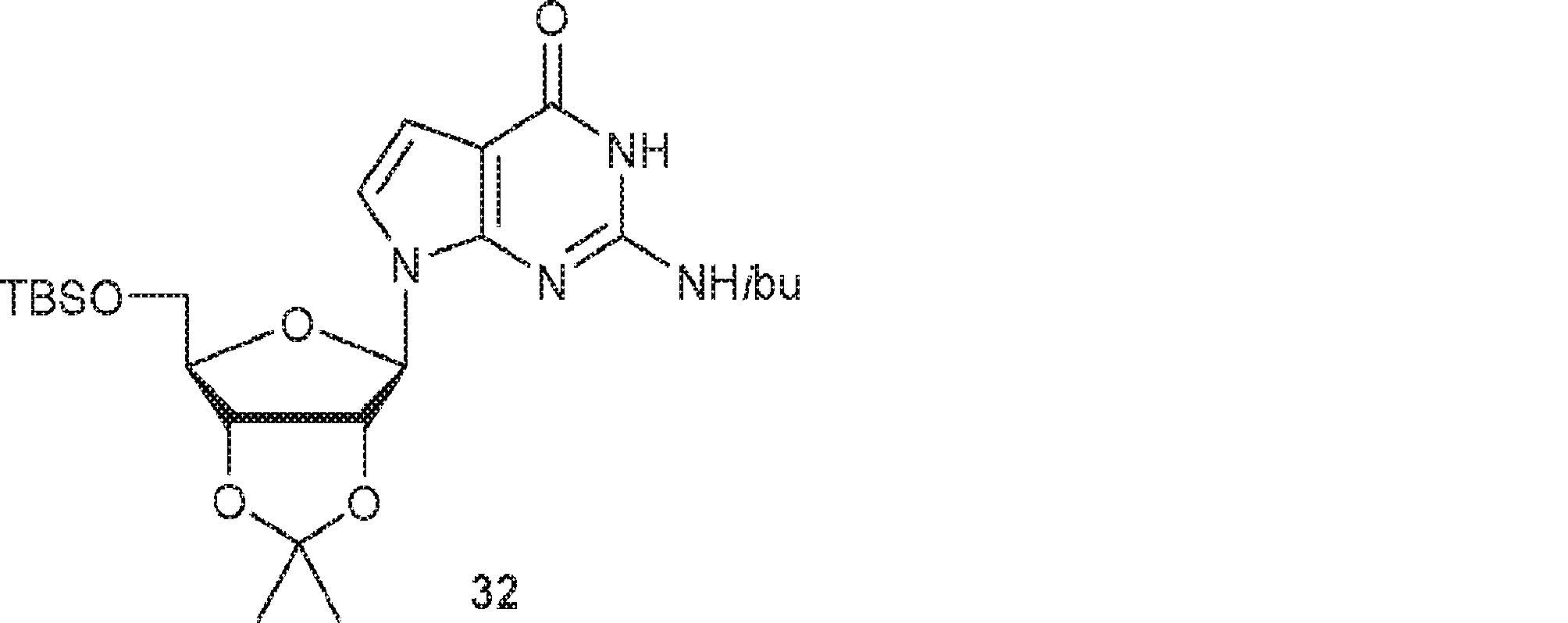
粗生成物30(9.7g、30.1mmol)およびImid(4.1g、60.3mmol)のDCM(10mL)溶液にTBSCl(9.08g、60.3mmol)を25℃で加える。16時間攪拌後、混合物をDCM(100mL)で希釈し、ブライン(80mL)で洗浄し、無水硫酸ナトリウムで乾燥させ、濾過し、濃縮し、シリカゲルカラムクロマトグラフィー(EA/PE = 1/4→1/1、次にMeOH/DCM = 1/50)で精製して31(9.0g、収率68%)を固体として得る。(MS: [M+H]+ 437.2)
31(9.0g、20.6mmol)およびTEA(4.2g、41.2mmol)のDCM(80mL)溶液に塩化イソブチリル(3.29g、30.9mmol)を0℃で加える。25℃で16時間攪拌後、混合物をDCM(100mL)で希釈し、飽和炭酸水素ナトリウム水溶液(50mL×2)およびブライン(50mL)で洗浄し、無水硫酸ナトリウムで乾燥させ、濾過し、濃縮し、シリカゲルカラムクロマトグラフィー(EA/PE = 1/5→1/2)で精製して32を白色固体(4.2g、収率40%)として得る。(MS: [M+H]+ 507.2)
32(4.2g、8.29mmol)のDCM(6mL)およびTFA(24mL)溶液を25℃で1時間攪拌した後、濃縮する。次に残渣を塩化水素(MeOH中4M、10mL)によって0℃で処理する。25℃で10分間攪拌後、混合物を濃縮して粗生成物B6を白色固体(2.92g、収率99%)として得る。(MS: [M+H]+ 353.0)
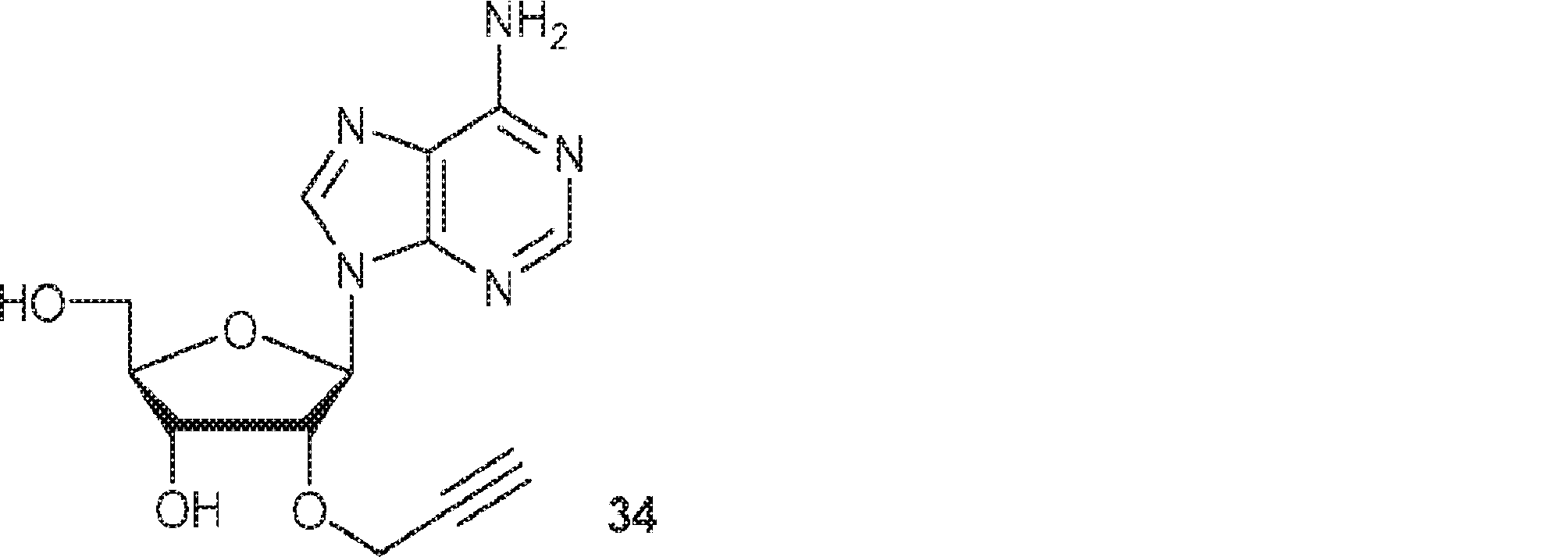
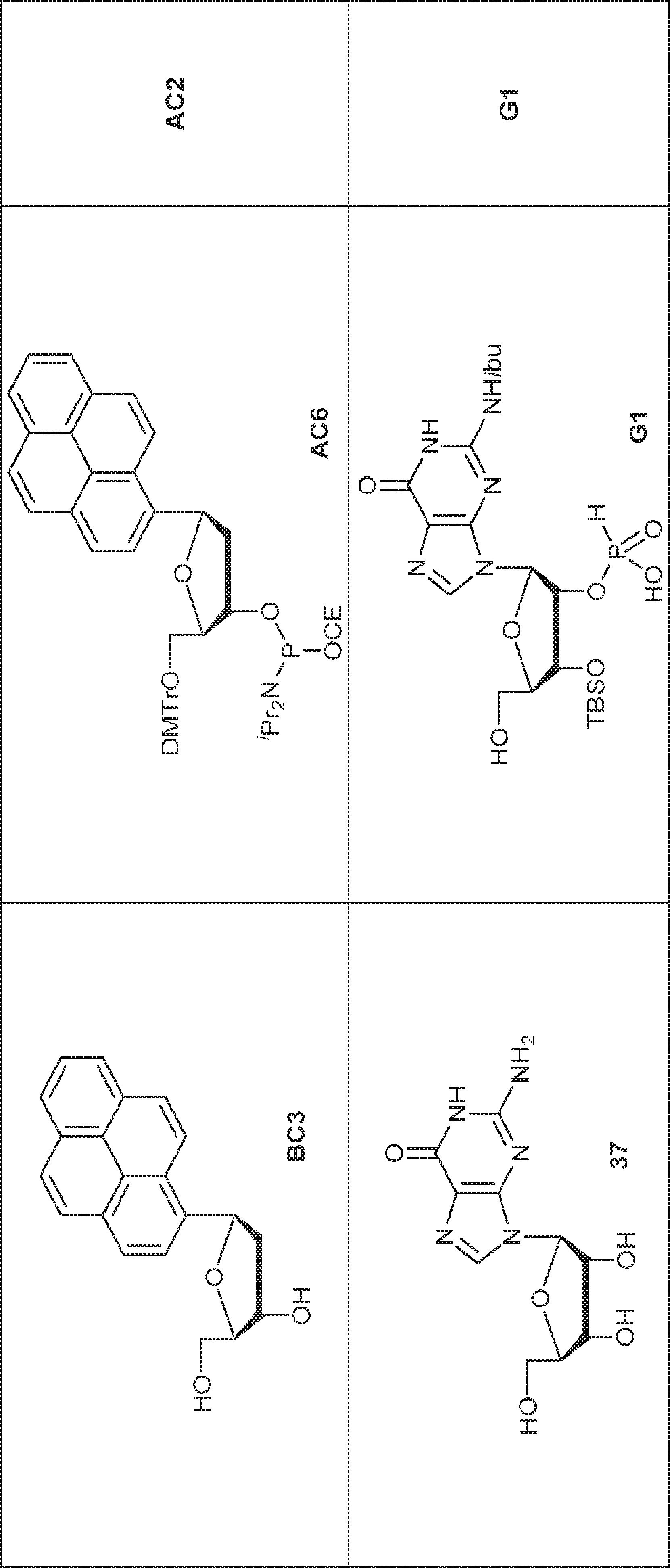
アデノシン(33)(5.0g、18.7mmol)のDMF(200mL)溶液に0℃で水素化ナトリウム(ミネラルオイル中60%分散液、1.0g、25mmol)、続いてTBAI(1.5g、4.06mmol)および臭化プロパルギル(2.12mL、20.9mmol)を加える。55℃で2日間攪拌後、混合物をシリカゲルカラムクロマトグラフィー(MeOH/DCM = 7/93)、続いてエタノールからの再結晶で精製して34を淡黄色固体(2.56g、45%)として得る。
34(1.4g、4.59mmol、Pyと2回共蒸発)のPy(20mL)溶液にTMSCl(2.4mL、18.9mmol)を加える。30分間攪拌後、塩化ベンゾイル(0.7mL、6.0mmol)を加え、混合物を3時間攪拌した後、水(10mL)および水酸化アンモニウム水溶液(15mL)を0℃で加える。室温で20分間攪拌後、混合物をDCM(25mL×3)で抽出する。一緒にした有機層を無水硫酸ナトリウムで乾燥させ、濃縮し、シリカゲルカラムクロマトグラフィー(MeOH/DCM = 5:95)で精製してBA1を白色泡状物(1.73g、92%)として得る。(MS: [M+H]+ 410.2)
35(10.0g、56.5mmol)のTHF(80mL)溶液にDIPEA(7.3g、56.5mmol、9.9mL)を加える。0℃で10分間攪拌後、ヒドラジン(1.81g、56.5mmol、2.0mL)のTHF(20mL)溶液を加える。次に混合物を20℃で2時間攪拌した後、濃縮する。DCM(100mL)およびH2O(100mL)を残渣に加えた後、層を分離し、水層をDCM(100mL×3)で抽出する。一緒にした有機層をブライン(100mL)で洗浄し、無水硫酸ナトリウムで乾燥させ、濾過し、濃縮し、シリカゲルカラムクロマトグラフィー(EA/PE = 1/15→1/8)で精製して36を黄色固体(3.10g、収率35%)として得る。(MS: [M+H]+ 155.1)
36(200mg、1.29mmol)のTHF(2.0mL)溶液に水酸化アンモニウム(2.0mL)を加える。20~30℃で2時間攪拌後、混合物を濃縮し、MeCN(0.5mL)でトリチュレートし、濾取して37を赤色固体(100mg、収率57%)として得る。
37(20.0g、148mmol)および13(101g、200mmol)のMeCN(1.2L)中懸濁液に三フッ化ホウ素ジエチルエーテラート(30.5g、215mmol、26.5mL)を加える。75~85℃で2時間攪拌後、混合物を濃縮し、シリカゲルカラムクロマトグラフィー(EA/PE = 1/5→2/1)で精製して38を黄色固体(35.0g、収率40%)として得る。(MS: [M+H]+ 580.3)
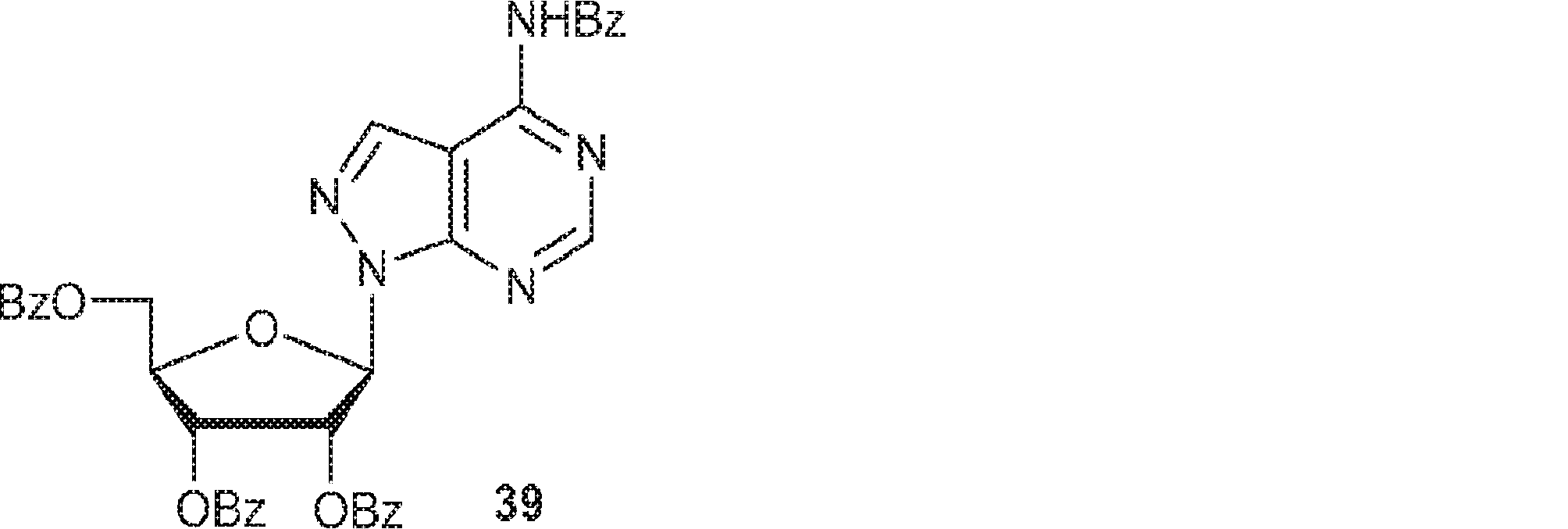
38(10.0g、17.3mmol)のDCM(100mL)溶液にDMAP(421mg、3.45mmol)およびTEA(5.24g、51.8mmol、7.2mL)、続いて塩化ベンゾイル(2.91g、20.7mmol、2.4mL)を滴下する。20~25℃で8時間攪拌後、混合物を濃縮し、シリカゲルカラムクロマトグラフィー(EA/PE = 1/5→11/)で精製して39を白色固体(9.0g、収率76%)として得る。(MS: [M+H]+ 684.1)
39(1.0g、1.46mmol)のTHF(1.5mL)、MeOH(1.2mL)、およびH2O(0.3mL)溶液に水酸化リチウム水溶液(5M、0.53mL)を加える。0~25℃で2時間攪拌後、混合物をクエン酸(1M)で約pH 7に中和し、次に揮発物を除去する。次に水溶液中の固体を濾取してBA2を帯黄白色固体(300mg、収率54%)として得る。(MS: [M+H]+ 372.2)
22(0.4g、0.93mmol)のDMF(8mL)溶液に水素化ナトリウム(48mg、1.12mmol)を0℃で加え、混合物を30分間攪拌した後、2,2,2-トリフルオロエチル トリフルオロメタンスルホネート(0.165mL、1.12mmol)をゆっくりと加える。0℃で3時間攪拌後、水(3mL)を加え、混合物を濃縮し、シリカゲルカラムクロマトグラフィー(EA/ヘキサン = 1/10)で精製して40を白色固体(218mg、収率46%)として得る。
40(1.4g、2.74mmol)のTHF(25mL)溶液にTBAF(3.3mL、3.3mmol)を0℃で加える。室温で4時間攪拌後、水(2mL)を加え、混合物をEAで抽出する。有機層を水およびブラインで洗浄し、濃縮する。次に残渣をDCMに溶解させ、続いてTEA(1.92mL、13.8mmol)および塩化ベンゾイル(0.42mL、3.6mmol)を加える。1時間攪拌後、水(1mL)を加え、混合物を濃縮し、シリカゲルカラムクロマトグラフィー(EA/PE = 1/5)で精製して41を白色固体(0.795g、収率77%)として得る。
41(0.79g、2.1mmol)のHOAc(17.5mL)および水(7.5mL)溶液を還流温度で30分間攪拌した後、室温に冷却し、トルエン(10mL×4)と共蒸発させる。次に残渣をPy(12mL)に溶解させ、続いてAc2O(0.8mL、8.4mmol)を加える。6時間攪拌後、混合物を濃縮し、シリカゲルカラムクロマトグラフィー(EA/PE = 1/4)で精製して42を白色固体(0.82g、収率91%)として得る。
42(800mg、1.9mmol)およびN2-イソブチリルグアニン(633mg、2.86mmol)のジクロロエタン(25mL)懸濁液に80℃でBSA(2.74mL、10.1mmol)を加え、1時間攪拌した後、TMSOTf(1.03mL、5.7mmol)を加える。100℃で3時間攪拌後、混合物を炭酸水素ナトリウム水溶液(60mL)に注ぎ、DCM(60mL×3)で抽出する。一緒にした有機層を無水硫酸ナトリウムで乾燥させ、濃縮し、シリカゲルカラムクロマトグラフィー(MeOH/DCM = 1/20→1/10)で精製して43を白色固体(938mg、収率85%)として得る。
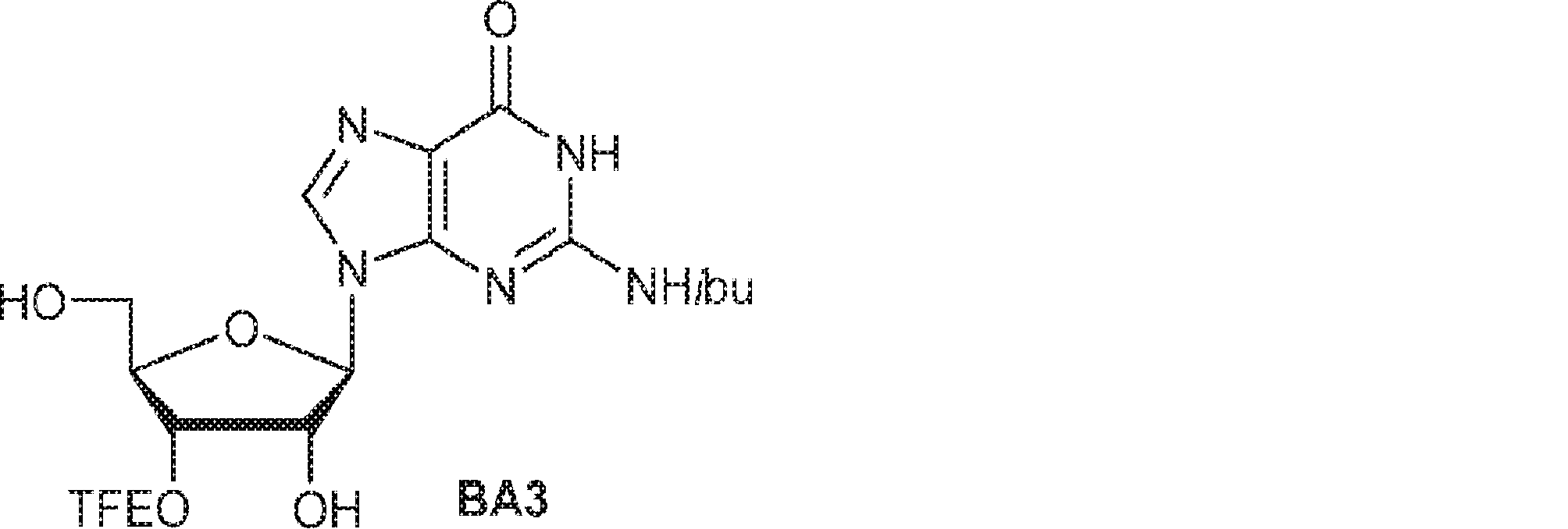
43(0.5g、0.86mmol)のMeOH(8mL)、THF(10mL)、および水(2mL)溶液に水酸化ナトリウム水溶液(10M、0.34mL)を0℃で加える。30分間攪拌後、HOAcを加え、混合物を濃縮し、シリカゲルカラムクロマトグラフィー(MeOH/DCM = 1/10→1/5)で精製してBA3を油状物(348mg、収率93%)として得る。
2(75g、395mmol)のMeOH(600mL)溶液にヒドラジン水和物(120mL)を25℃で加える。2時間攪拌後、混合物を濃縮し、残渣をEtOH(600mL)に溶解させ、次に(エトキシメチレン)マロノニトリル(110g、901mmol)を加える。78℃で30分間攪拌後、混合物を濃縮し、シリカゲルカラムクロマトグラフィー(EA/PE = 1/20→1/15)で精製して44を淡黄色固体(42g、収率38%)として得る。
44(16.0g、57mmol)のMeOH(75mL)および水(25mL)溶液に水酸化アンモニウム(280mL)および過酸化水素(150mL)を加える。25℃で16時間攪拌後、混合物を亜硫酸ナトリウム水溶液(2L)に注ぎ、次にEA(700mL×3)で抽出する。一緒にした有機層を無水硫酸ナトリウムで乾燥させ、濾過し、濃縮する。次に残渣をアセトン(90mL)に溶解させた後、イソチオシアン酸ベンゾイル(6.96g、42.7mmol、5.75mL)を25℃で加える。60℃で4時間攪拌後、混合物を濃縮して粗生成物45を黄色固体として得る。
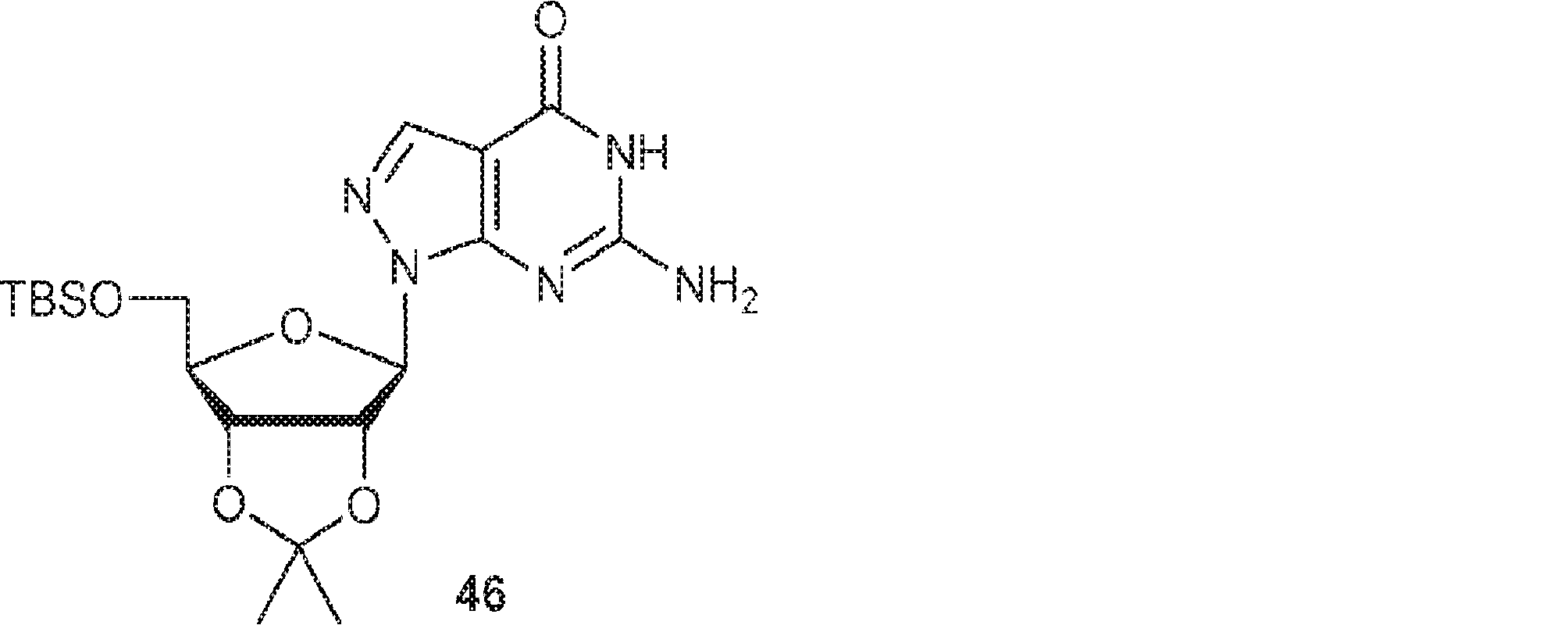
上記で得た粗生成物45のMeOH(150mL)溶液に水酸化ナトリウム水溶液(0.7M、80mL)、続いてヨウ化メチル(6.8g、47.9mmol、3.0mL)を加える。20℃で2時間攪拌後、混合物をHOAcで約pH 6に中和し、続いて水(80mL)を加え、EA(100mL×3)で抽出する。一緒にした有機層を無水硫酸ナトリウムで乾燥させ、濾過し、濃縮する。次に残渣をMeOH(30mL)に溶解させ、水酸化ナトリウム水溶液(1.4M、250mL)を加える。100℃で2時間攪拌後、混合物を濃縮し、残渣をトルエン(200mL×3)と共蒸発させ、DCM(500mL)に溶解させる。次にImid(18.5g、271mmol)、DMAP(1.66g、13.6mmol)、およびTBSCl(40.9g、271mmol)を加える。25℃で18時間攪拌後、飽和炭酸水素ナトリウム水溶液(1L)を加え、混合物をEA(500mL×3)で抽出する。一緒にした有機層を無水硫酸ナトリウムで乾燥させ、濾過し、濃縮し、シリカゲルカラムクロマトグラフィー(MeOH/DCM = 1/60→1/30)で精製して46を白色固体(8.50g、5工程で収率34%)として得る。
46(23.4g、53.5mmol)のPy(120mL)溶液に塩化イソブチリル(11.4g、107mmol、11.2mL)を25℃で加える。25℃で16時間攪拌後、水酸化アンモニウム(0.5mL)を加え、混合物を30分間攪拌し、次に濃縮する。次に残渣をEtOAc(1.5L)に溶解させ、飽和水酸化アンモニウム水溶液(500mL×3)およびブライン(500mL)で洗浄し、無水硫酸ナトリウムで乾燥させ、濾過し、濃縮し、シリカゲルカラムクロマトグラフィー(EA/PE = 1/10→1/3)で精製して47を明黄色固体(24.0g、収率88%)として得る。(MS: [M+Na]+ 530.1)
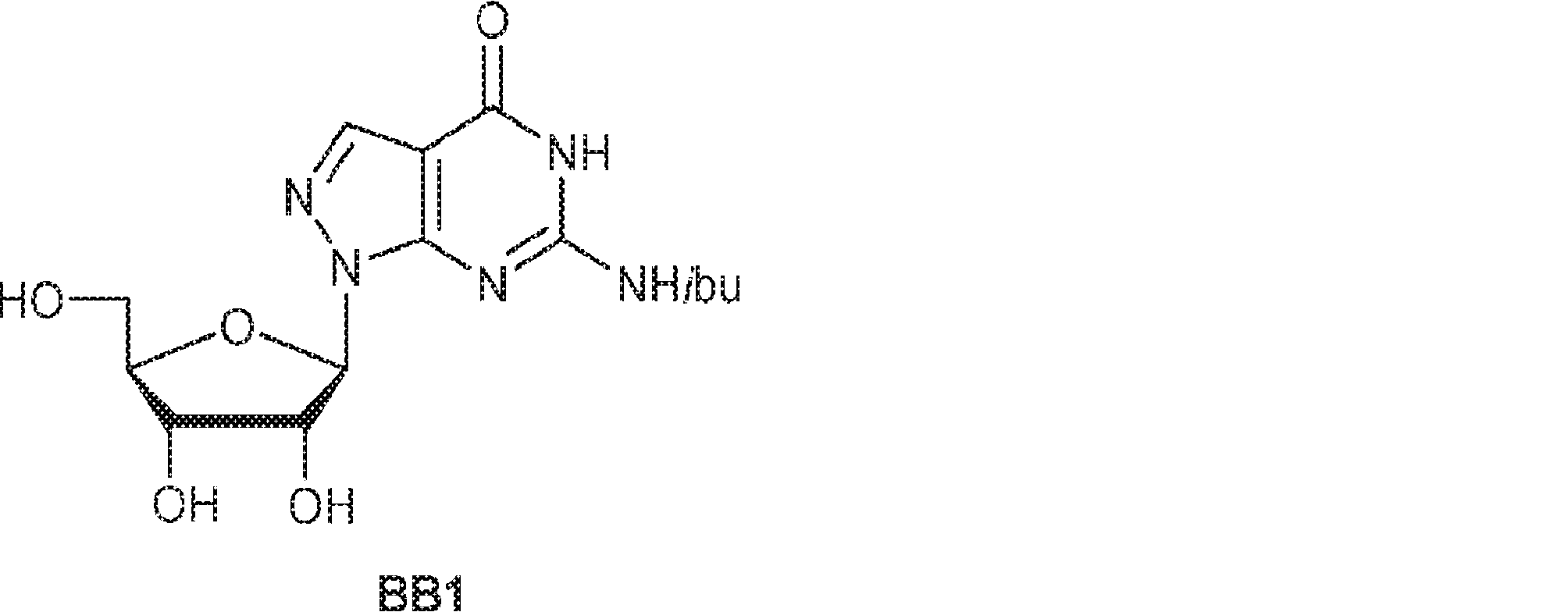
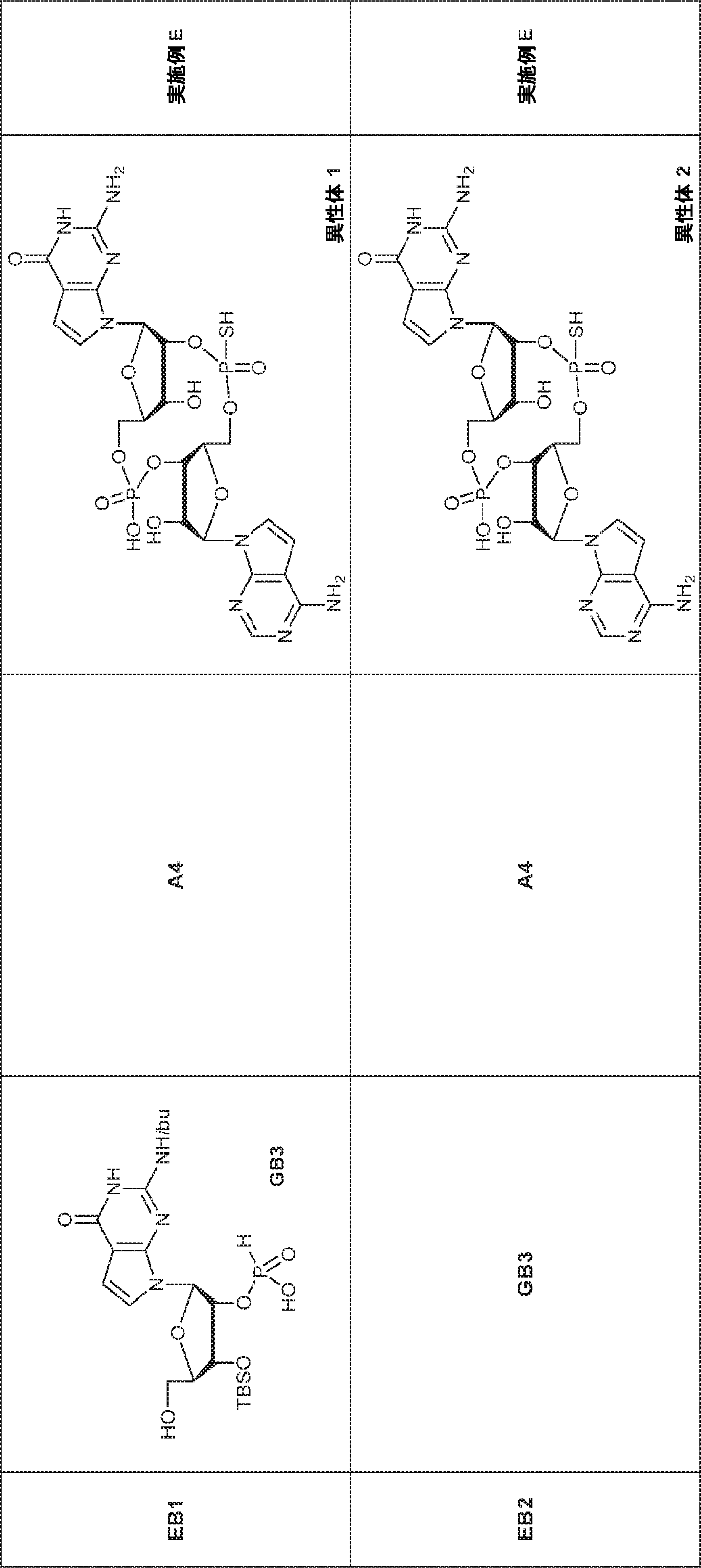
47(10.0g、19.7mmol)のHOAc(6mL)および水(3mL)溶液を65℃で5時間攪拌する。次に反応混合物を濃縮し、DCM(15mL)でトリチュレートする。固体を濾取して粗生成物BB1を白色固体(4.0g)として得る。(MS: [M+H]+ 354.0)
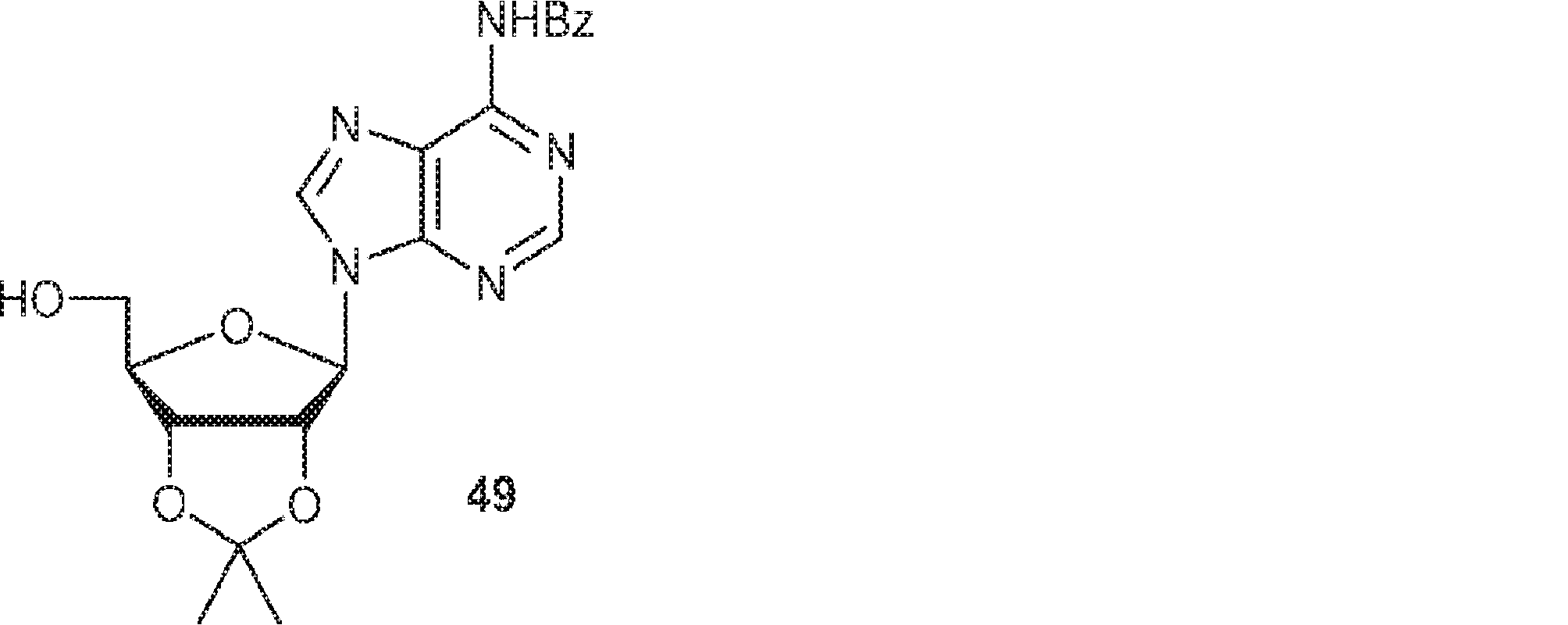
48(50g、135mmol)のアセトン(500mL)溶液に2,2-ジメトキシプロパン(85g、816mmol、100mL)および濃硫酸(1.32g、13.5mmol、0.72mL)を加える。25℃で30分間攪拌後、飽和炭酸水素ナトリウム水溶液(30mL)を加える。溶液を濾過し、濃縮し、シリカゲルカラムクロマトグラフィー(MeOH/DCM = 1/200→1/50)で精製して49を白色固体(35g、収率63%)として得る。(MS: [M+H]+ 412.1)
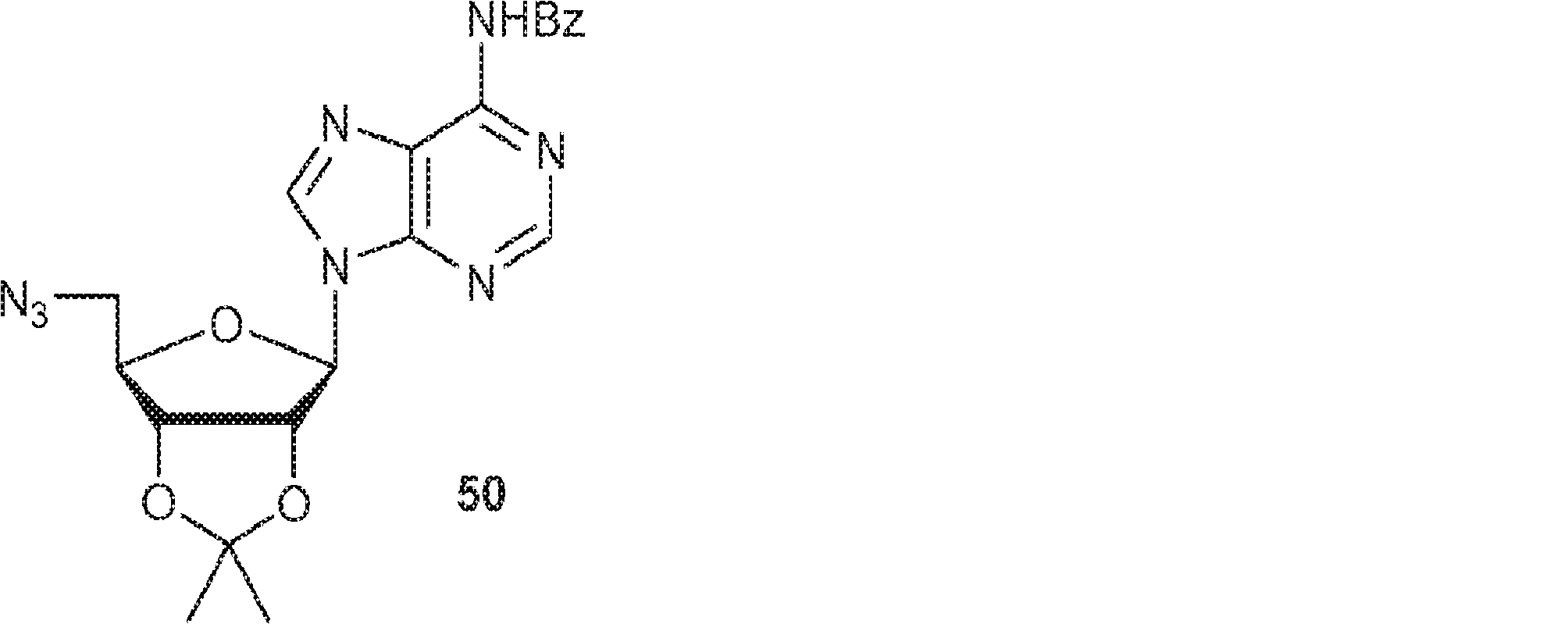
49(5.0g、12.2mmol)のPy(50mL)溶液に塩化メタンスルホニル(2.1g、18mmol、1.4mL)を0℃で加える。25℃で1時間攪拌後、DCM(200mL)を加え、溶液を飽和炭酸水素ナトリウム水溶液、続いてブラインで洗浄し、無水硫酸ナトリウムで乾燥させ、濃縮する。次に残渣をDMF(50mL)に溶解させ、続いてアジ化ナトリウム(3.4g、52.3mmol)を加える。50℃で16時間攪拌後、DCM(400mL)を加える。混合物を水(300mL)、ブラインで洗浄し、硫酸ナトリウムで乾燥させ、濃縮し、シリカゲルカラムクロマトグラフィー(EA/PE = 1/1)で精製して50を明黄色固体(4.0g)として得る。(MS: [M+H]+ 437.1)
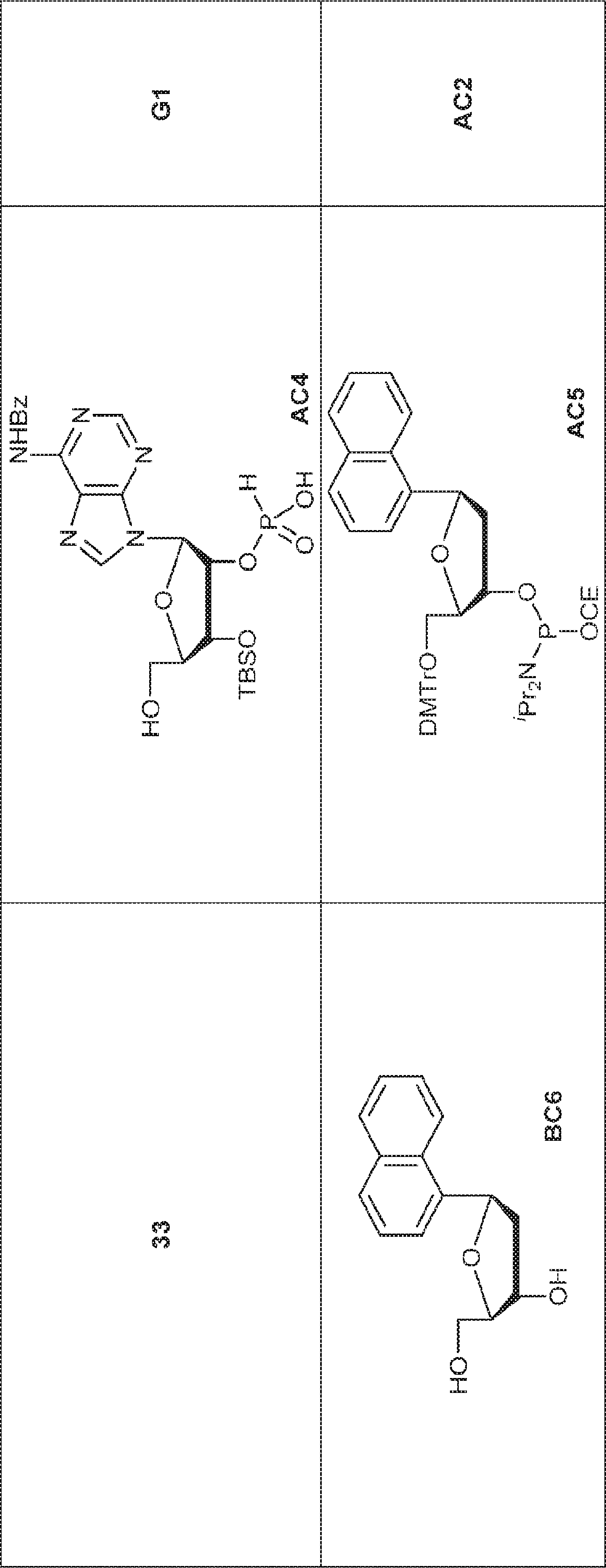
50(50g、115mmol)のTFA(125mL)および水(125mL)溶液を25℃で5時間攪拌した後、濃縮し、トルエンと2回共蒸発させ、MeOH(50mL)に溶解させる。次に混合物を炭酸水素ナトリウム水溶液(1%)で中和し、MTBEでトリチュレートする。固体を収集し、MTBEで洗浄し、乾燥させ、DMF(400mL)に溶解させる。次にPd/C(10% w/w、10g)を加え、混合物を水素雰囲気(15psi)下、25℃で6時間攪拌した後、濾過し、濃縮して粗生成物BC1を黄色油状物(39g)として得る。(MS: [M+H]+ 371.1)
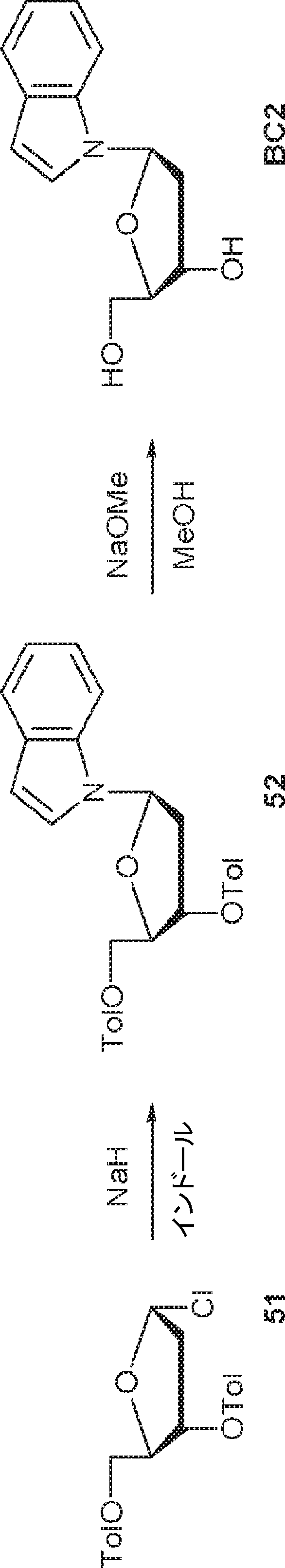
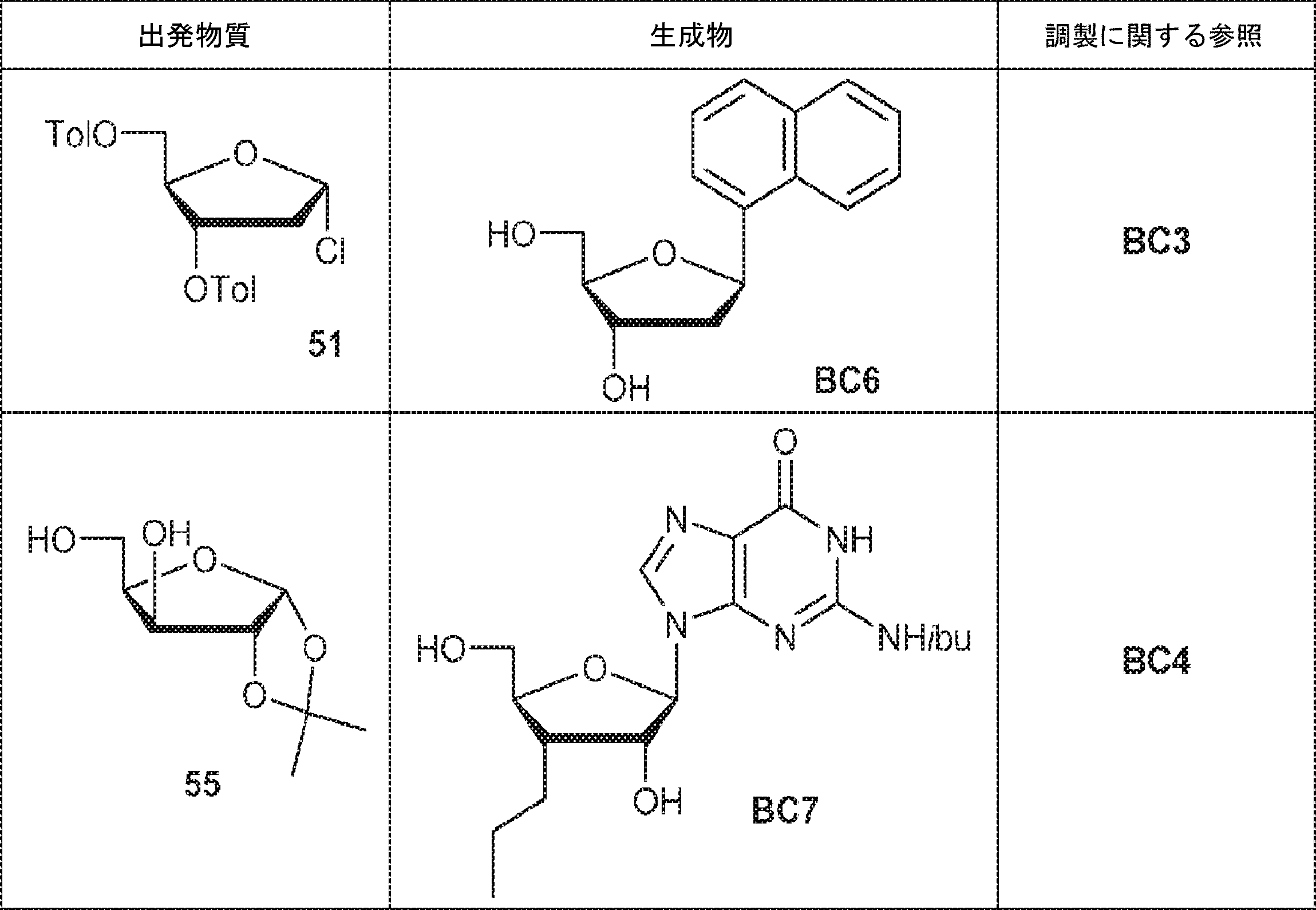
インドール(305mg、2.6mmol)のMeCN(10mL)溶液に水素化ナトリウム(160mg、4.0mmol)を0℃で加え、30分間攪拌した後、51(1.0g、2.6mmol)を加える。1時間攪拌後、飽和炭酸水素ナトリウム水溶液(5mL)を加え、混合物をEA(20mL×3)で抽出する。一緒にした有機層を飽和炭酸水素ナトリウム水溶液およびブラインで洗浄し、濃縮し、シリカゲルカラムクロマトグラフィー(EA/ヘキサン = 1/4)で精製して52を黄色油状物(886mg、収率71%)として得る。(MS: [M+H]+ 470.2)
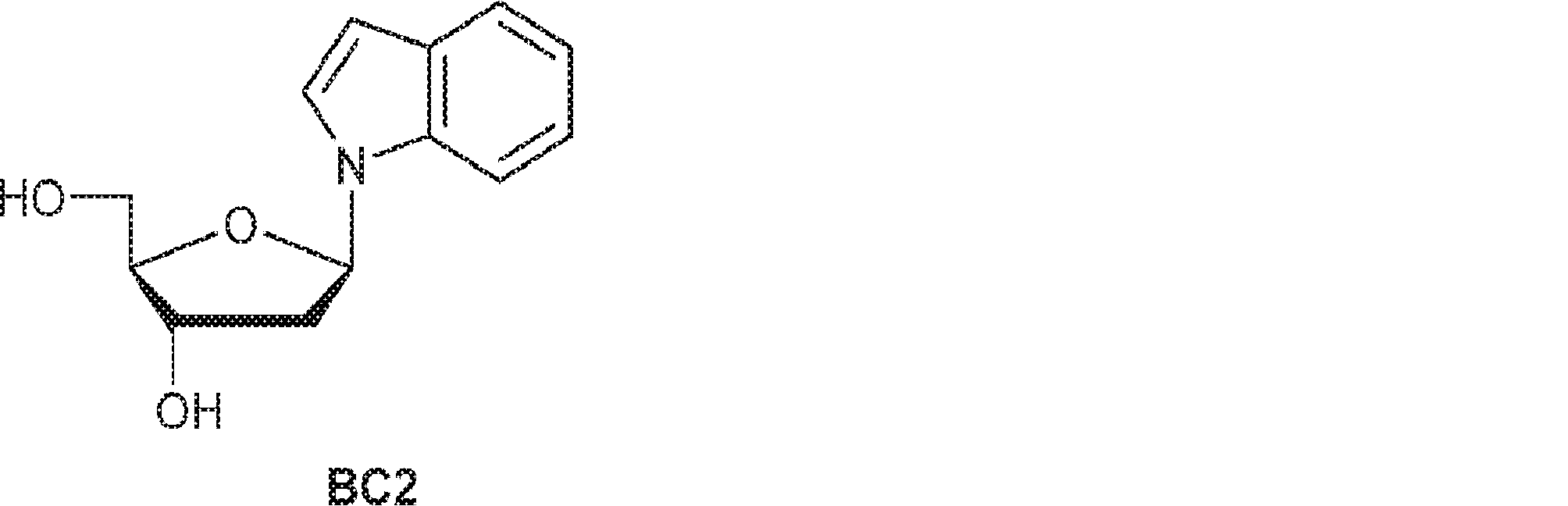
52(610mg、1.3mmol)のMeOH(9mL)溶液にナトリウムメトキシド(メタノール中5.4M、0.54mL)を加える。1時間攪拌後、塩酸(5M、0.5mL)を0℃で加え、溶液を10分間攪拌した後、濃縮し、シリカゲルカラムクロマトグラフィー(MeOH/DCM = 1/9)で精製して所望の生成物を白色固体(197mg、収率92%)として得る。(MS: [M+H]+ 234.1)
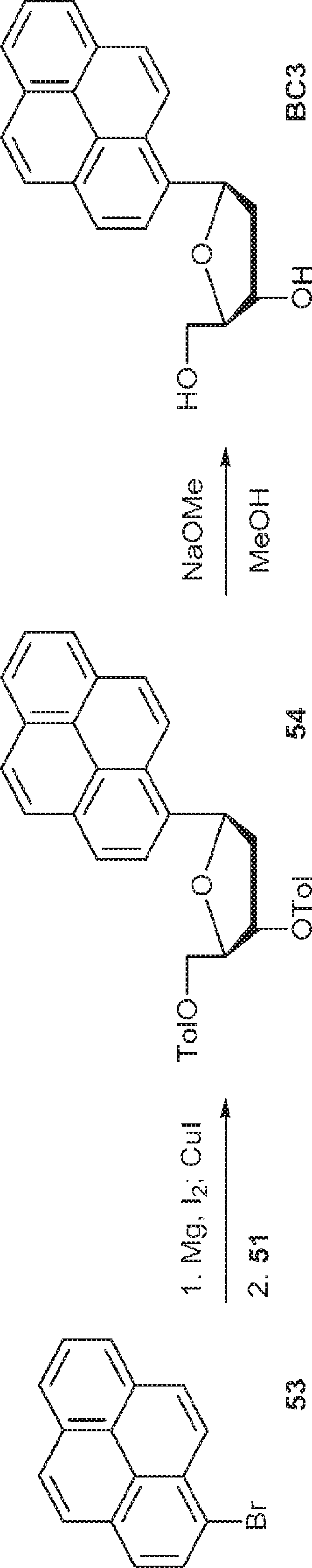
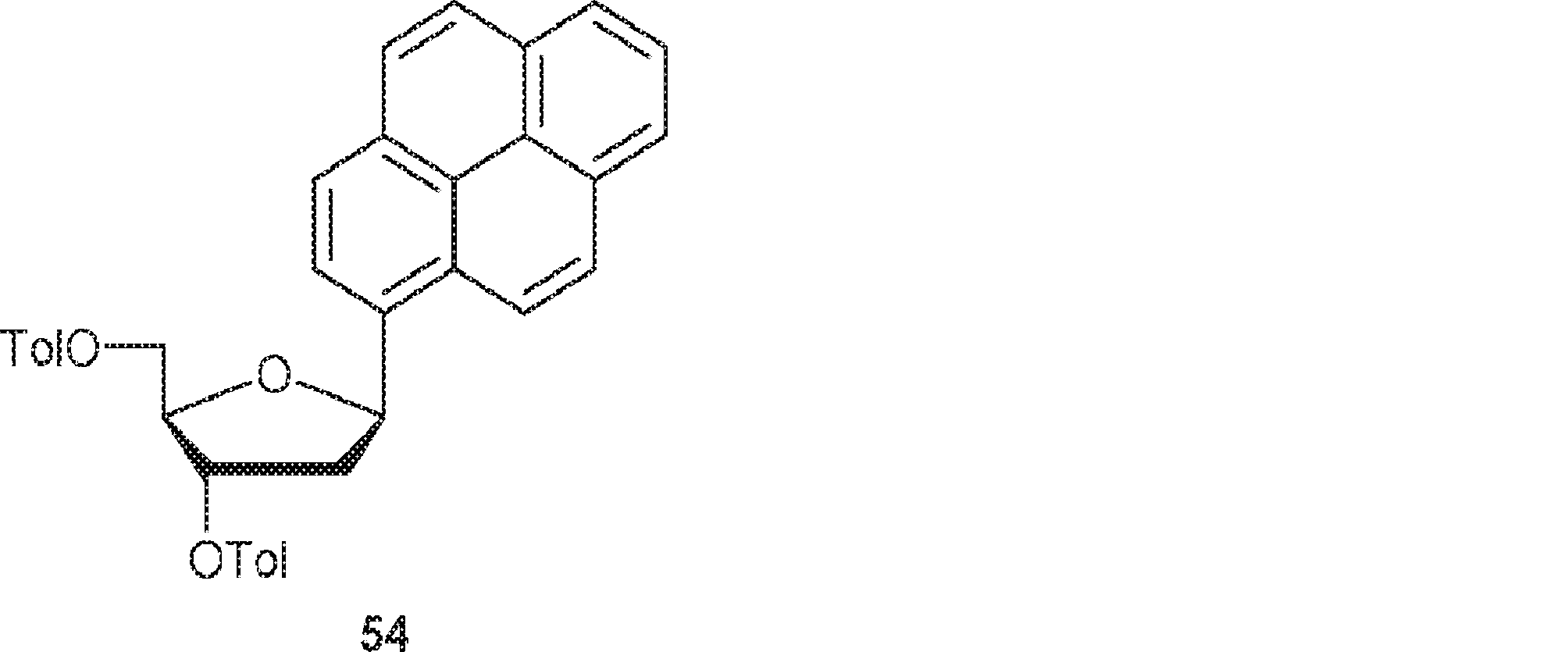
53(560mg、2mmol)のTHF溶液にマグネシウム(54mg、2.3mmol)、続いて少量のヨウ素を加える。55℃で3時間攪拌後、ヨウ化銅(I)(213mg、1.1mmol)を0℃で加える。混合物を45分間室温で攪拌した後、51(367mg、0.98mmol)を40℃で加える。2時間攪拌後、飽和塩化アンモニウム水溶液(2mL)およびDCM(20mL)を加える。層を分離し、有機層を飽和炭酸水素ナトリウム水溶液およびブラインで洗浄し、無水硫酸ナトリウムで乾燥させ、濃縮し、シリカゲルカラムクロマトグラフィー(EA/ヘキサン = 1/10→1/5)で精製して54を白色固体(52mg、10%)として得る。
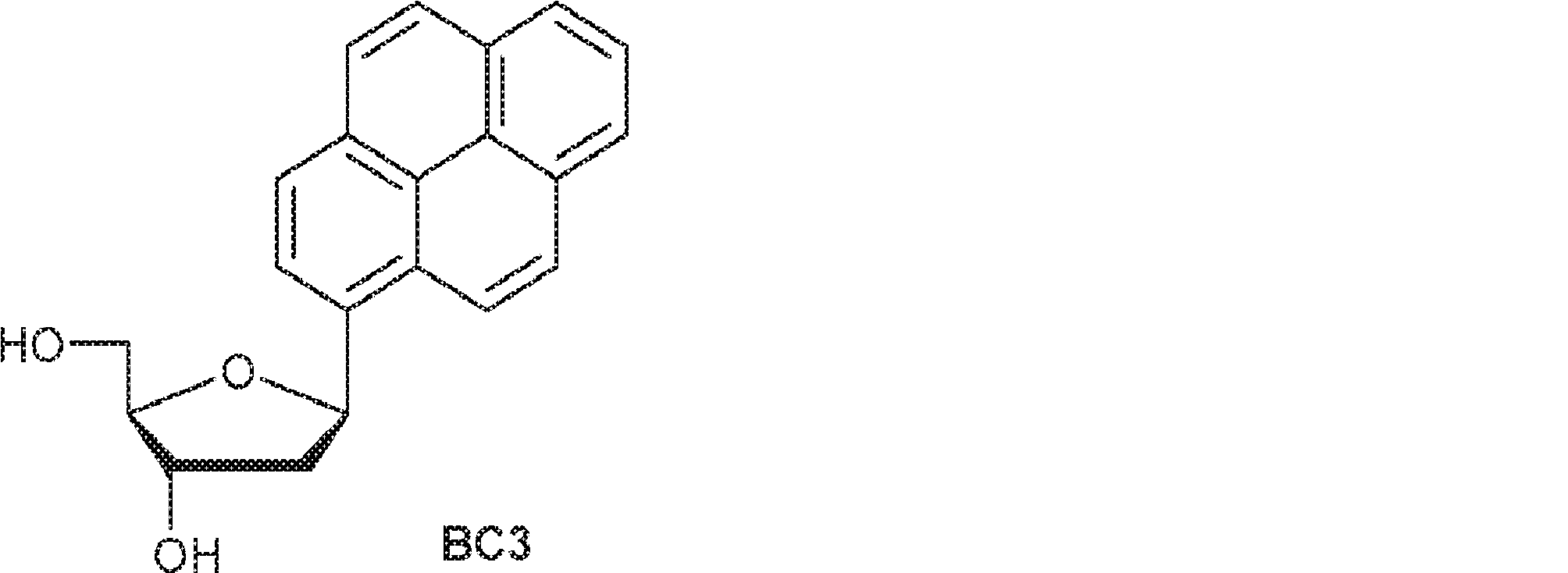
54(230mg、0.4mmol)のMeOH(5mL)溶液にナトリウムメトキシド(MeOH中30%、0.23mL、1.2mmol)を室温で加える。1時間攪拌後、飽和塩化アンモニウム(5mL)を加え、混合物をEA(10mL×3)で抽出する。有機層をブラインで洗浄し、無水硫酸ナトリウムで乾燥させ、濃縮して粗生成物BC3を白色固体(150mg)として得る。
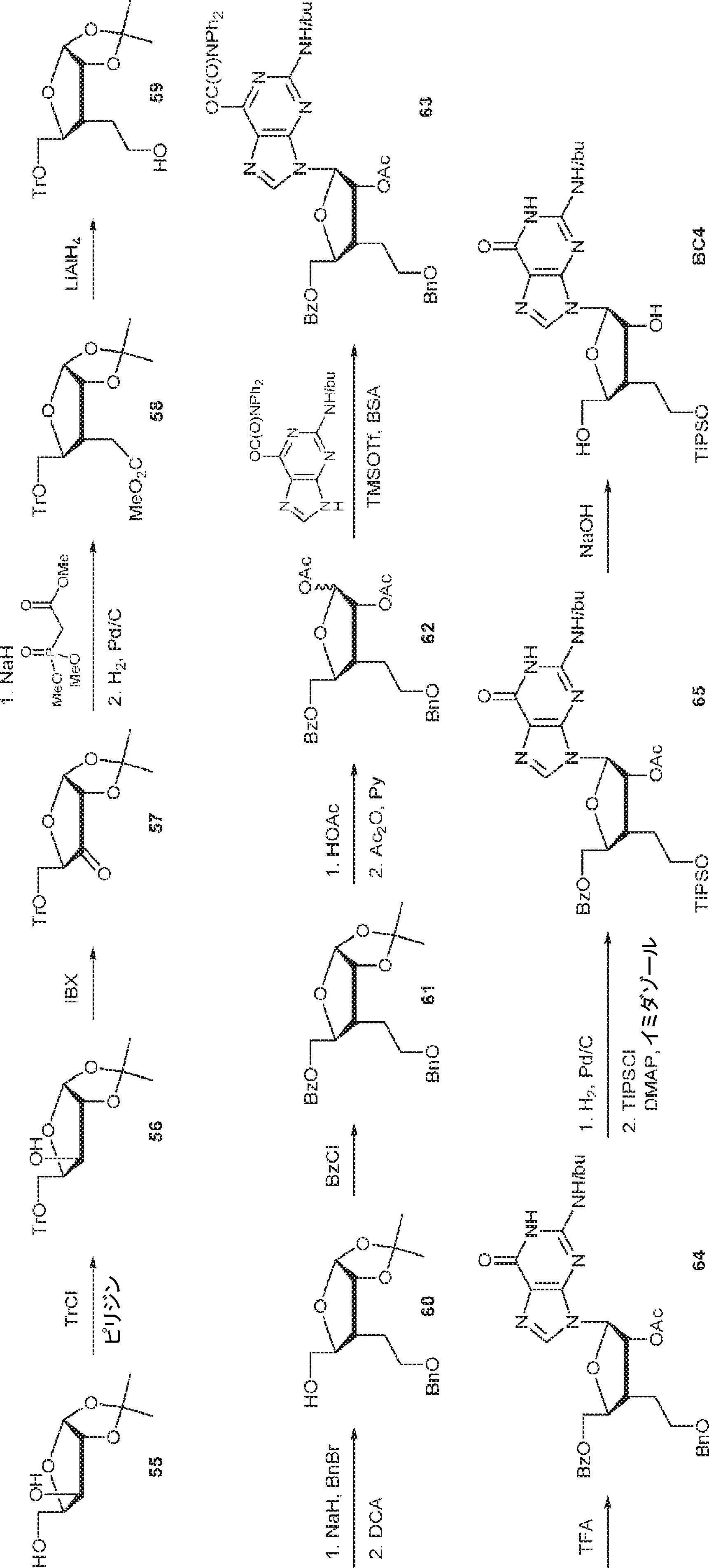
55(91.4g、481mmol)のPy(600mL)溶液に塩化トリチル(160.7g、577mmol)を加える。60℃で16時間攪拌後、混合物を濃縮し、トルエンと3回共蒸発させる。混合物をDCM(400mL)で希釈し、飽和炭酸水素ナトリウム(2×750mL)で洗浄する。層を分離し、水相をDCM(400mL×2)で抽出する。一緒にした有機層を無水硫酸ナトリウムで乾燥させ、濾過し、濃縮し、シリカゲルカラムクロマトグラフィー(EA/PE = 1/10→1/5)で精製して56を白色固体(180.5g、収率87%)として得る。(MS: [M+Na]+ 455.0)
56(176g、407mmol)のMeCN(1.0L)溶液にIBX(228g、814mmol)を加える。90℃で6時間攪拌後、混合物を濾過し、濃縮して粗生成物57を明黄色油状物(175g)として得る。(MS: [M+Na]+ 453.0)
水素化ナトリウム(20.1g、502mmol)のTHF(1.0L)溶液に2-ジメトキシホスホリル酢酸メチル(96.3g、529mmol、76.5mL)を0℃で15分かけて滴下する。60分間攪拌後、THF(500mL)中の上記で得た粗生成物57(175g)を0℃で滴下する。25℃で16時間攪拌後、水(50mL)を0℃で加え、揮発物を除去し、ブライン(500mL)を加える。次に混合物をDCM(500mL×3)で抽出する。一緒にした有機層を無水硫酸ナトリウムで乾燥させ、濾過し、濃縮する。次に残渣(上記で得た216g中198g)をEA(500mL)に溶解させ、Pd/C(10% w/w、10g)を加える。水素雰囲気(20psi)下、25℃で16時間攪拌後、混合物を濾過し、濾液を濃縮し、シリカゲルカラムクロマトグラフィー(EA/PE = 1/15→1/10)で精製して58を白色固体(120g、収率66%)として得る。(MS: [M+Na]+ 511.1)
水素化アルミニウムリチウム(6.21g、164mmol)のTHF(200mL)溶液にTHF(50mL)中58(20.0g、40.9mmol)を0℃でゆっくりと加える。25℃で16時間攪拌後、反応液を水(6.2mL)、水酸化ナトリウム水溶液(15%、6.2mL)、および水(18.6mL)の連続的な添加により反応停止させる。次に混合物を無水硫酸ナトリウムで乾燥させ、濾過し、濃縮し、シリカゲルカラムクロマトグラフィー(EA/PE = 1/10→1/4)で精製して59を白色固体として得る。(MS: [M+Na]+ 483.2)
水素化ナトリウム(60% w/w、6.95g、174mmol)のTHF(200mL)溶液にTHF(80mL)中59(20.0g、43.4mmol)を-20℃で5分かけて滴下する。25℃で2時間攪拌後、臭化ベンジル(22.3g、130mmol、15.5mL)を滴下し、混合物を80℃で16時間攪拌し、次に水(2mL)を0℃で加える。混合物を水(200mL)で希釈し、DCM(200mL×3)で抽出する。一緒にした有機層を無水硫酸ナトリウムで乾燥させ、濾過し、濃縮する。次に残渣をDCM(200mL)に溶解させ、DCA(5.48g、42.5mmol、12.0mL)を加える。25℃で3時間攪拌後、飽和炭酸水素ナトリウム水溶液を0℃で加える。次に混合物をDCM(150mL×3)で抽出する。一緒にした有機溶媒を無水硫酸ナトリウムで乾燥させ、濾過し、濃縮し、シリカゲルカラムクロマトグラフィー(EA/PE = 1/5→1/2)で精製して60を黄色油状物(12.1g、収率90%)として得る。
60(24.0g、78mmol)のDCM(500mL)溶液に塩化ベンゾイル(16.4g、116.7mmol、13.6mL)およびTEA(23.6g、233.5mmol、32.4mL)を加える。25℃で16時間攪拌後、混合物を濃縮し、シリカゲルカラムクロマトグラフィー(EA/PE = 1/15→1/10)で精製して61を明黄色油状物(30.0g、収率93%)として得る。(MS: [M+Na]+ 435.1)
61(29.0g、70.3mmol)および水(3.0mL)のHOAc(220mL)中混合物を70℃で16時間攪拌した後、飽和炭酸水素ナトリウム水溶液を加える。次に混合物をDCM(400mL×3)で抽出する。一緒にした有機層を濃縮し、残渣をPy(30mL)に溶解させ、続いてAc2O(28.5g、280mmol、26mL)を加える。20℃で16時間攪拌後、飽和炭酸水素ナトリウム水溶液を加え、次に混合物をDCM(500mL×3)で抽出する。一緒にした有機層を濃縮し、シリカゲルカラムクロマトグラフィー(EA/PE = 1/10→1/5)で精製して62を白色固体(31.1g、収率97%)として得る。(MS: [M+Na]+ 479.1)
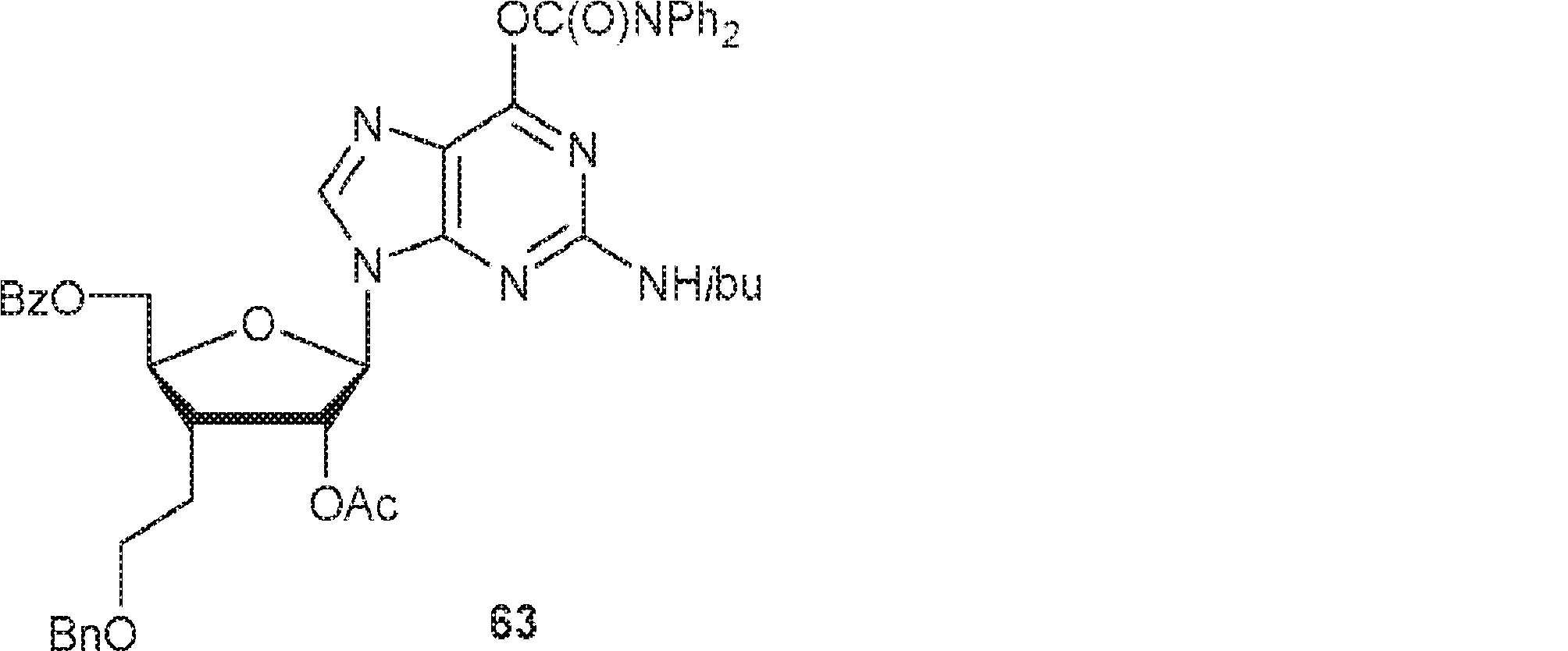
O6-ジフェニルカルバモイル-N2-イソブチリルグアニン(5.47g、13.1mmol)のMeCN(150mL)懸濁液にBSA(11.6g、57.0mmol、14.1mL)を20℃で加える。63℃で30分間攪拌後、揮発物を除去し、残渣をMeCN(200mL)に溶解させ、次にMeCN(50mL)中62(5.00g、11.0mmol)、およびTMSOTf(3.65g、16.4mmol、3.0mL)を-15℃で加える。63℃で50分間攪拌後、混合物を0℃に冷却し、飽和炭酸水素ナトリウム水溶液に注ぎ、EA(150mL×3)で抽出する。一緒にした有機層を無水硫酸ナトリウムで乾燥させ、濃縮し、シリカゲルフラッシュクロマトグラフィー(EA/PE = 1/3→1/1)で精製して63を白色固体として得る。(MS: [M+H]+ 813.1)
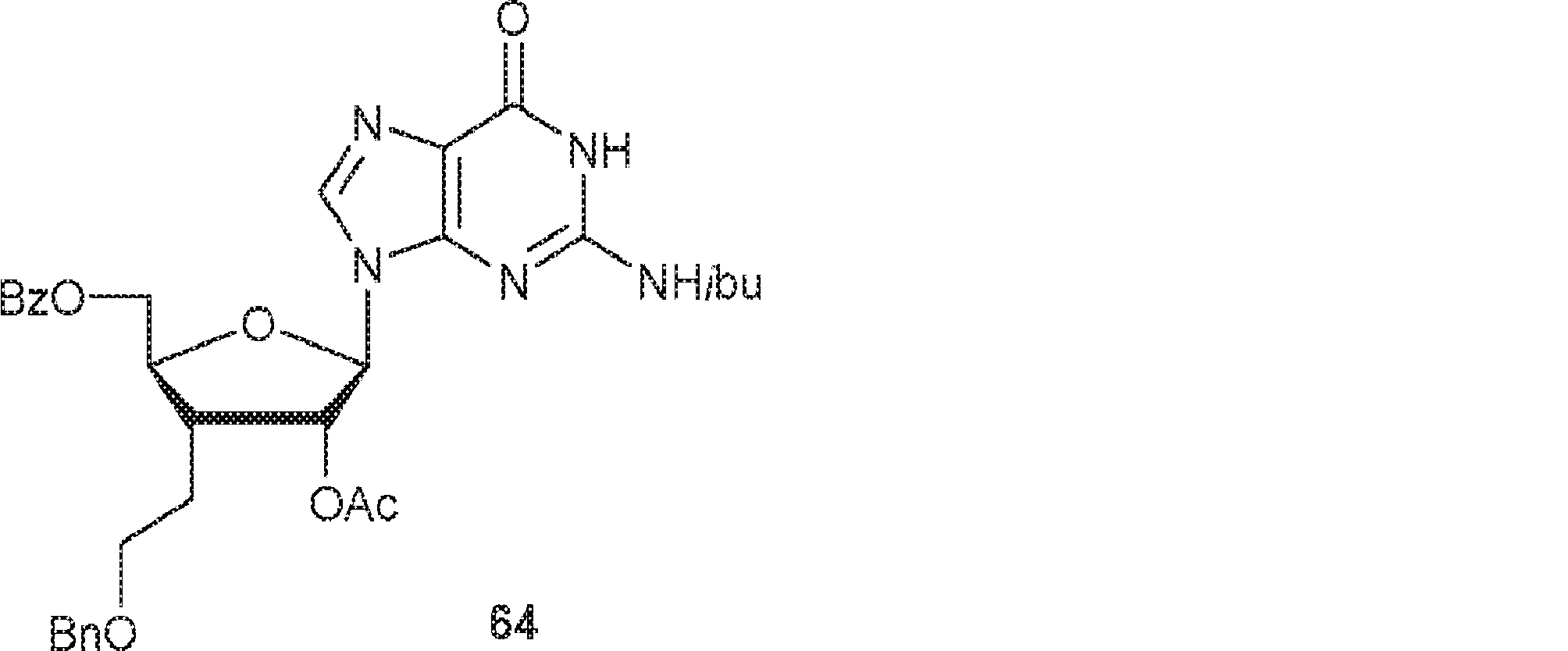
63(16.2g、19.9mmol)の90% TFA水溶液(60mL)中溶液を20℃で30分間攪拌した後、飽和炭酸水素ナトリウム水溶液に0℃で注ぎ、EA(100mL×4)で抽出する。一緒にした有機層を無水硫酸ナトリウムで乾燥させ、濃縮し、シリカゲルフラッシュクロマトグラフィー(EA/PE = 1/1→1/0)で精製して64を白色固体(11.4g、収率93%)として得る。(MS: [M+H]+ 618.1)
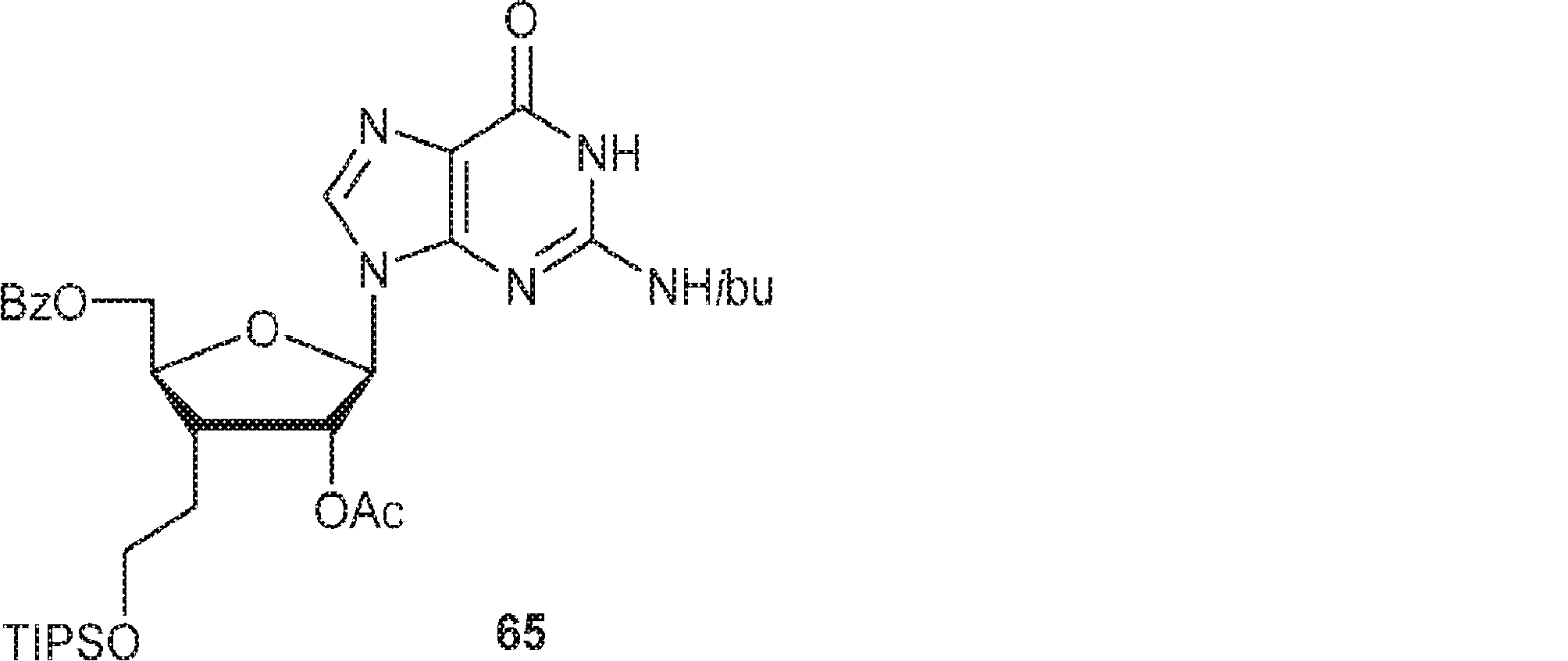
64(15.0g、24.3mmol)のEtOH(500mL)溶液にPd/C(10% w/w、2.0g)および濃塩酸(10滴)を加える。水素雰囲気(45psi)下、50℃で15時間攪拌後、混合物を濾過し、固体をEtOH(100mL×3)で洗浄する。濾液を濃縮し、残渣の3分の1をDMF(60mL)に溶解させ、続いてImid(1.57g、23.0mmol)、DMAP(46.9mg、0.38mmol)、およびトリイソプロピルシリルクロリド(2.22g、11.5mmol、2.5mL)を加える。20℃で16時間攪拌後、飽和炭酸水素ナトリウム水溶液(20mL)および水(100mL)を加える。次に混合物をEA(100mL×2)で抽出する。一緒にした有機層を無水硫酸ナトリウムで乾燥させ、濾過し、濃縮し、シリカゲルカラムクロマトグラフィー(EA/PE = 1/5→2/1)で精製して65を白色固体(4.52g、収率86%)として得る。(MS: [M+H]+ 684.4)
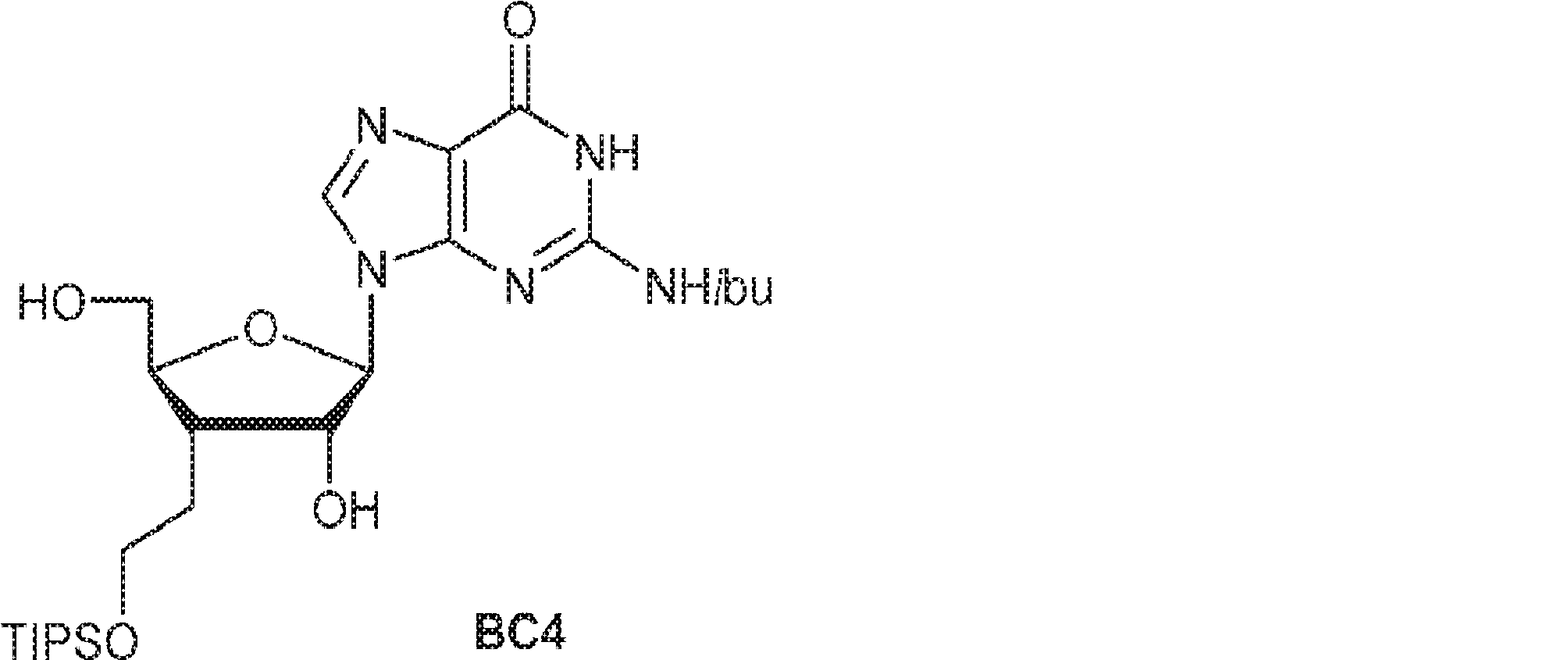
65(3.0g、4.4mmol)のEtOH(30mL)溶液に水酸化ナトリウム水溶液(2M、31mL)を0℃で加える。0℃で30分間攪拌後、混合物を0℃での塩酸溶液(1N)およびHOAcの添加により中和する。次にトルエン(30mL)を加え、混合物を濃縮して粗生成物BC4を白色固体(3.0g)として得る。(MS: [M+H]+ 538.2)
15(2.0g、5.66mmol)のPy(56mL)溶液に1,3-ジクロロ-1,1,3,3-テトライソプロピルジシロキサン(1.79g、5.66mmol、1.8mL)を0℃でゆっくりと加える。0℃で30分間、25℃で12時間攪拌後、溶液を濃縮し、シリカゲルカラムクロマトグラフィー(MeOH/DCM = 1/20)で精製して66(1.6g、収率47%)を得る。(MS: [M+H]+ 596.3)
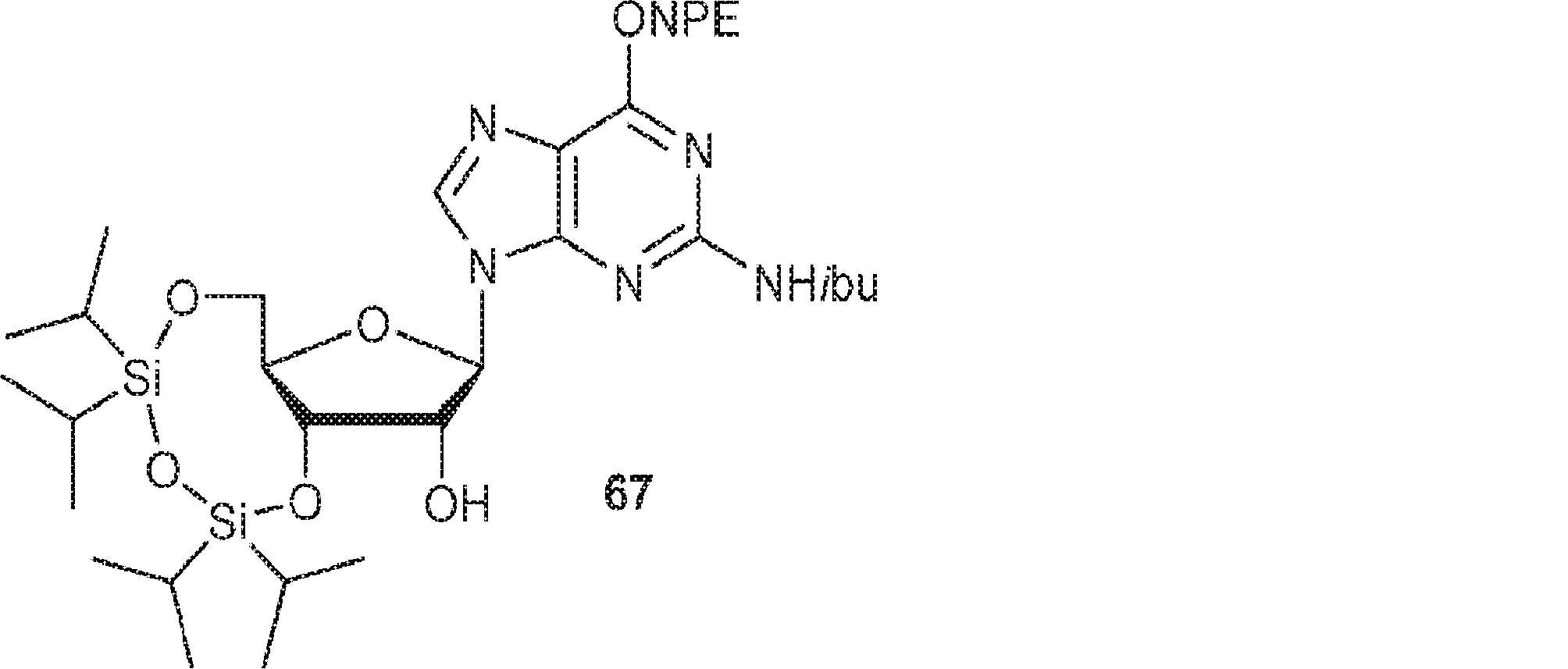
66(8.0g、13.5mmol)および2-(4-ニトロフェニル)エタノール(3.37g、20.2mmol)のTHF(100mL)溶液にDIAD(6.81g、33.7mmol、6.6mL)およびPPh3(8.83g、33.7mmol)を25℃でゆっくりと加える。25℃で12時間攪拌後、水(5mL)を加え、混合物を濃縮し、シリカゲルカラムクロマトグラフィー(MeOH/DCM = 1/20)で精製して67を淡黄色固体(4.5g、収率44%)として得る。(MS: [M+H]+ 745.3)
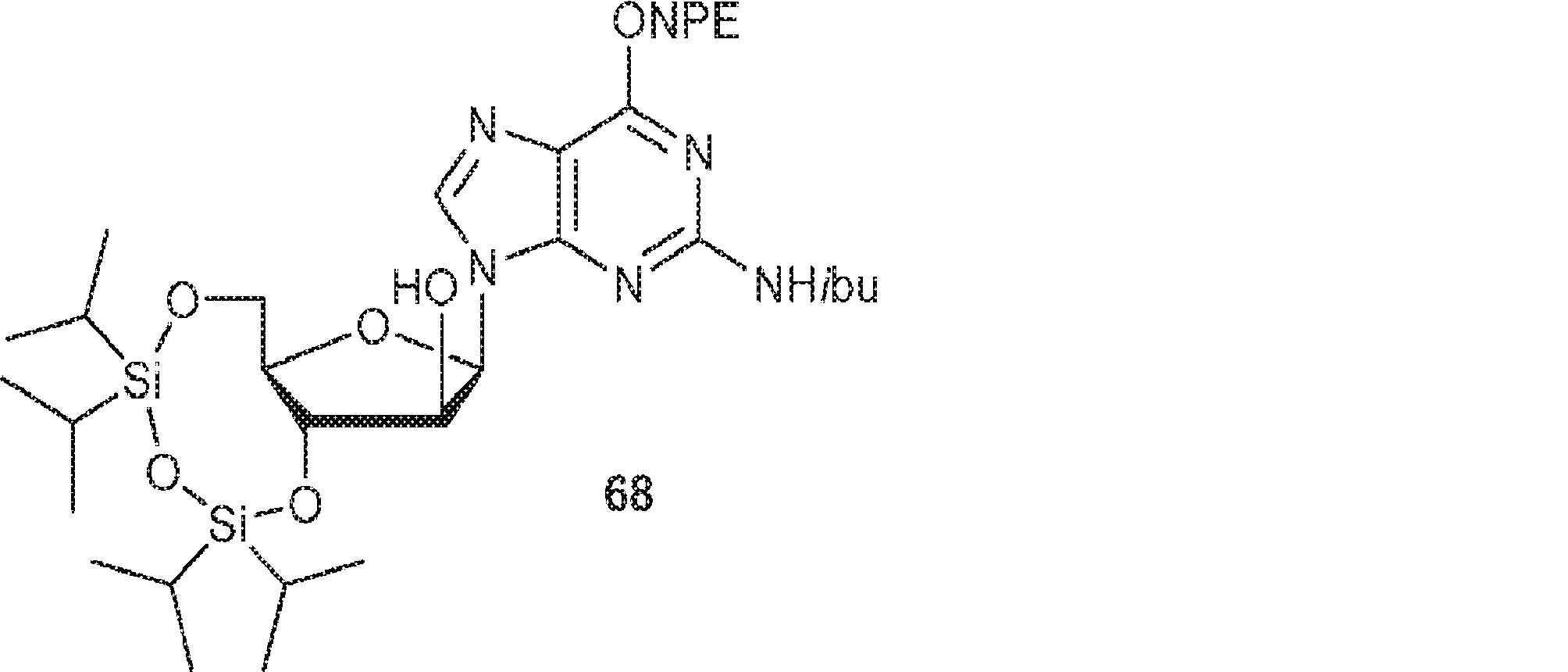
67(4.20g、5.64mmol)のMeCN(40mL)溶液にIBX(3.16g、11.3mmol)を25℃で加える。80℃で12時間攪拌後、混合物を濾過し、濃縮し、THF(50mL)に溶解させる。次にトリアセトキシ水素化ホウ素ナトリウム(5.7g、27.0mmol)を0℃でゆっくりと加える。25℃で6時間攪拌後、水(5mL)を加え、混合物を濃縮し、シリカゲルカラムクロマトグラフィー(MeOH/DCM = 1/20)で精製して68を淡黄色油状物(1.0g、収率33%)として得る。(MS: [M+H]+ 745.3)
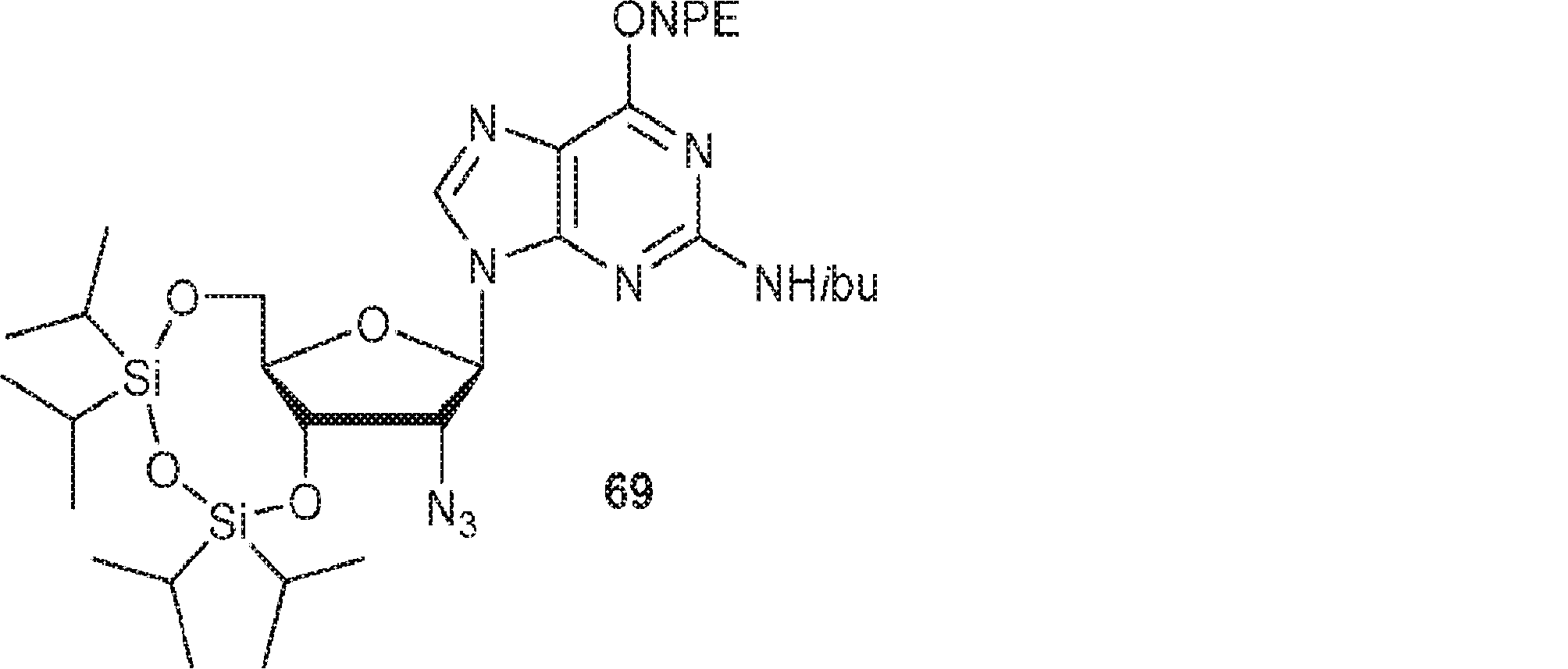
68(2.2g、2.95mmol)およびDMAP(1.44g、11.8mmol)のDCM(140mL)およびPy(10mL)溶液に無水トリフルオロメタンスルホン酸(1.33g、4.72mmol、0.78mL)を0℃でゆっくりと加える。0℃で1.5時間攪拌後、混合物を濃縮する。次に残渣をDMF(10mL)に溶解させ、アジ化ナトリウム(0.49g、7.53mmol)を加える。60℃で6時間攪拌後、溶液を濃縮し、分取HPLC(MeOH/0.1% HCOOH入りの水: 40→100%)で精製して69を淡黄色固体(1.50g、収率79%)として得る。(MS: [M+H]+ 770.4)
69(2.50g、3.25mmol)のTHF(12mL)溶液にTBAF(13.1g、50.1mmol)およびHOAc(1.50g、25.0mmol、1.43mL)を15℃でゆっくりと加える。15℃で12時間攪拌後、混合物を濃縮する。次に残渣をDCM(20mL)に溶解させ、水(5mL×2)で洗浄し、無水硫酸ナトリウムで乾燥させ、濾過し、シリカゲルカラムクロマトグラフィー(MeOH/DCM = 1/20)で精製してBC5を淡黄色固体(900mg、収率53%)として得る。(MS: [M+H]+ 528.2)
33(120g、449mmol)のPy(1.0L)溶液にTMSCl(390g、3.59mol、454mL)を加える。0℃で2時間攪拌後、塩化ベンゾイル(316g、2.25mol、261mL)を滴下し、混合物を25℃で14時間攪拌した後、0℃に冷却する。次に水(240mL)を加え、混合物を25℃で30分間攪拌した後、水酸化アンモニウム(460mL)を0℃で加熱する。2時間攪拌後、混合物を濃縮して70を白色固体(150g、収率90%)として得る。
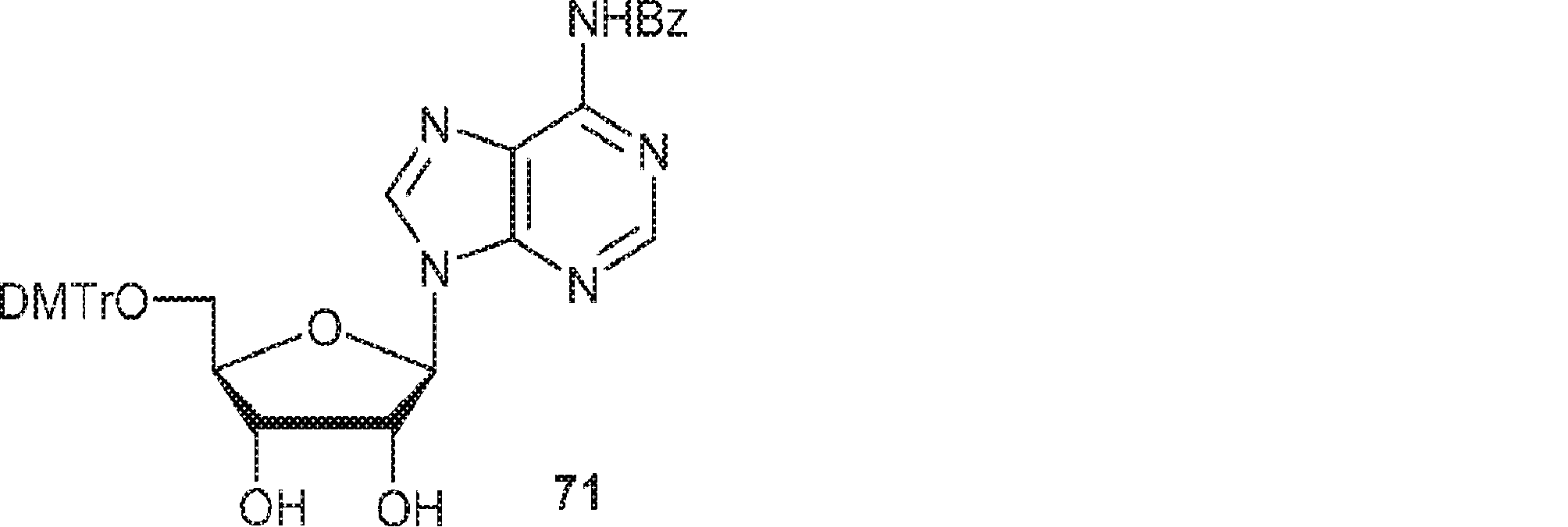
70(150g、404mmol)のPy(500mL)溶液にDMTrCl(274g、808mmol)、TEA(81.8g、808mmol、112mL)、およびDMAP(4.93g、40.4mmol)を0℃で加える。25℃で16時間攪拌後、飽和炭酸水素ナトリウム水溶液(1L)を加え、混合物をEtOAc(600mL×3)で抽出する。一緒にした有機層を無水硫酸ナトリウムで乾燥させ、濾過し、濃縮し、シリカゲルカラムクロマトグラフィー(EA/PE 1/4→1/2、次にMeOH/DCM 1/100→1/20)で精製して71を白色固体(65.0g、収率24%)として得る。
71(65.0g、96.5mmol)のPy(500mL)溶液に硝酸銀(32.8g、193mmol)およびTBSCl(29.1g、193mmol)を25℃で加える。25℃で1時間攪拌後、飽和炭酸水素ナトリウム水溶液(1L)を加え、混合物をEtOAc(600mL×3)で抽出する。一緒にした有機層を無水硫酸ナトリウムで乾燥させ、濾過し、濃縮し、シリカゲルカラムクロマトグラフィー(EA/PE = 1/4→1/1)で精製して72を白色固体(20.0g、収率26%)として得る。
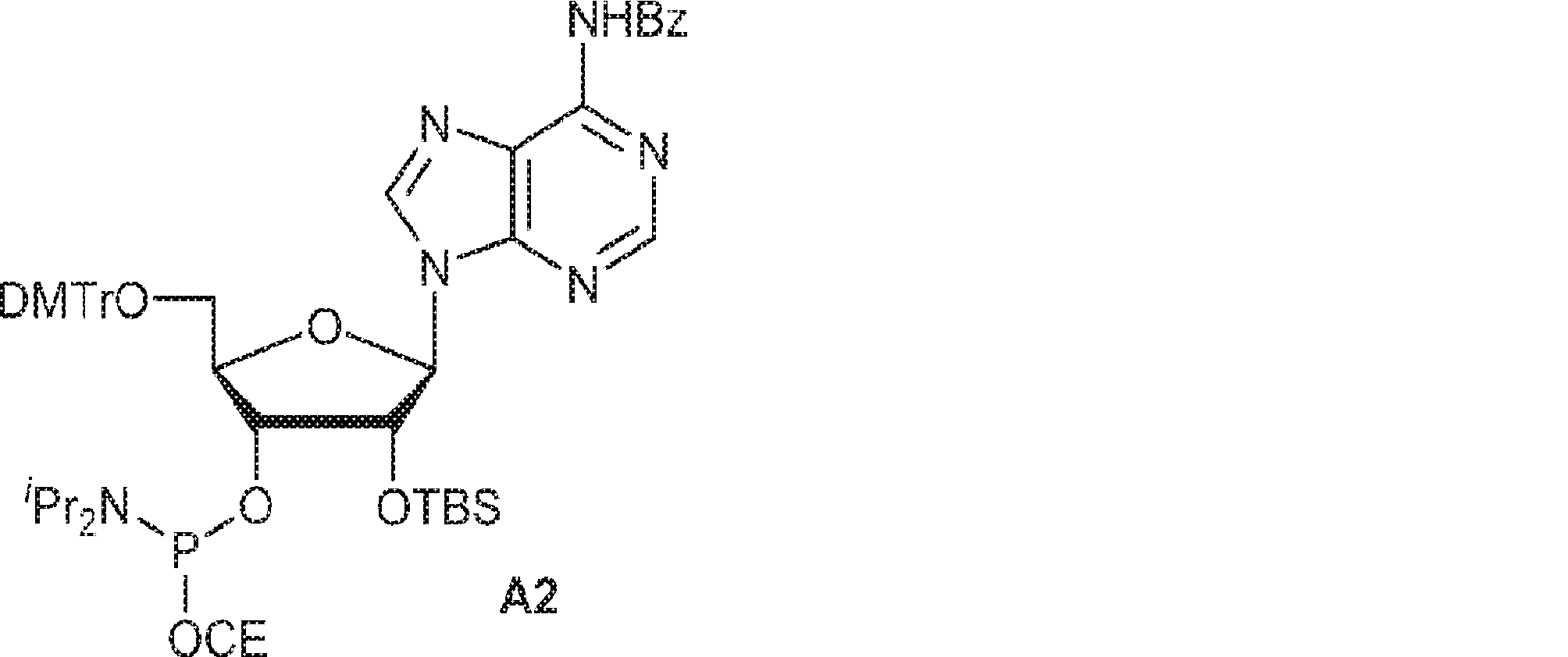
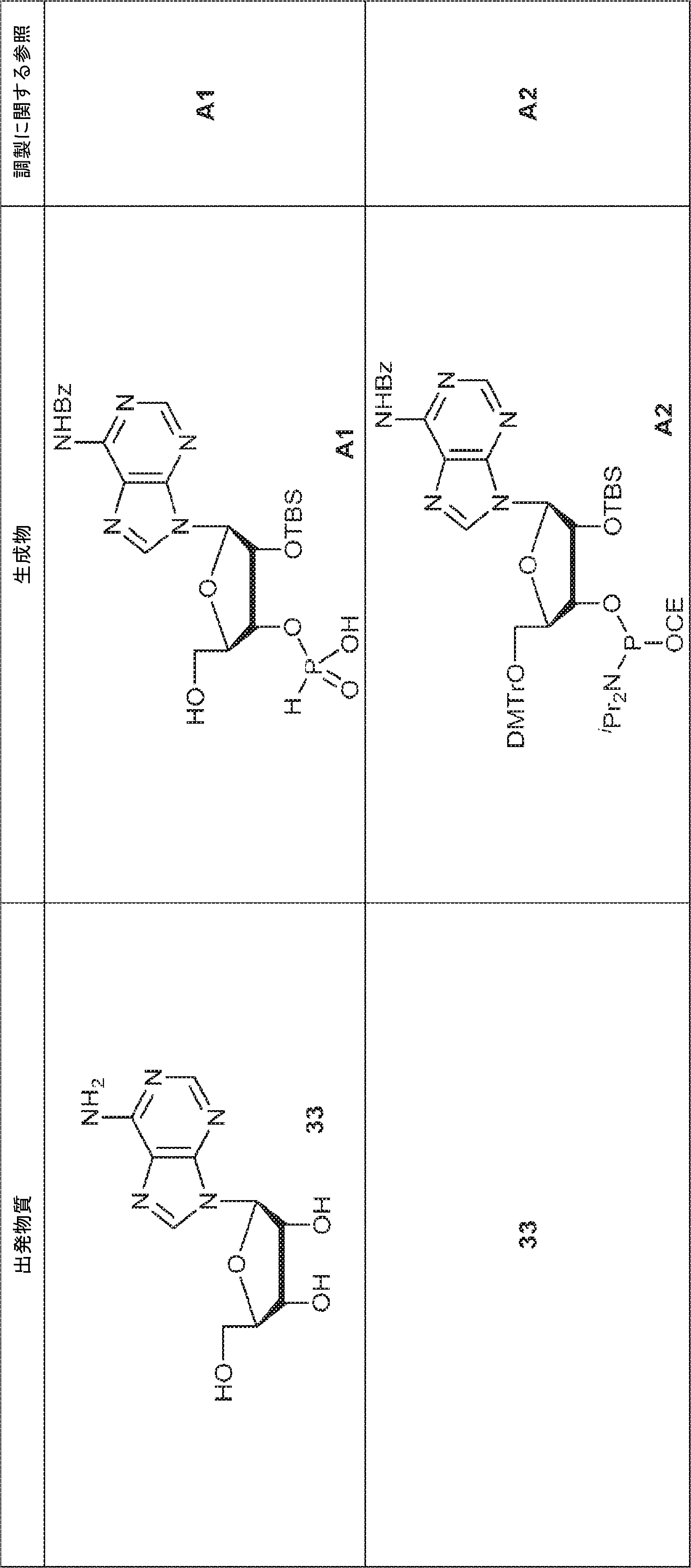
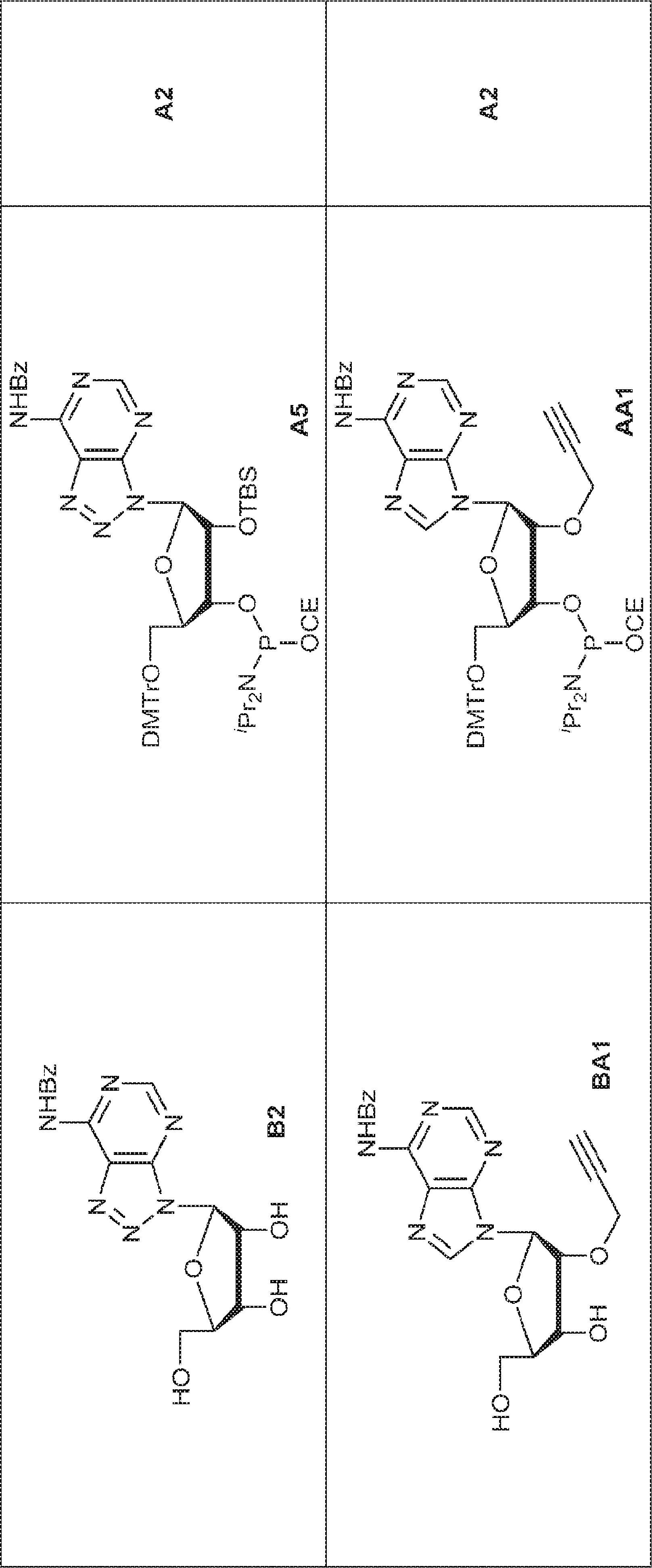
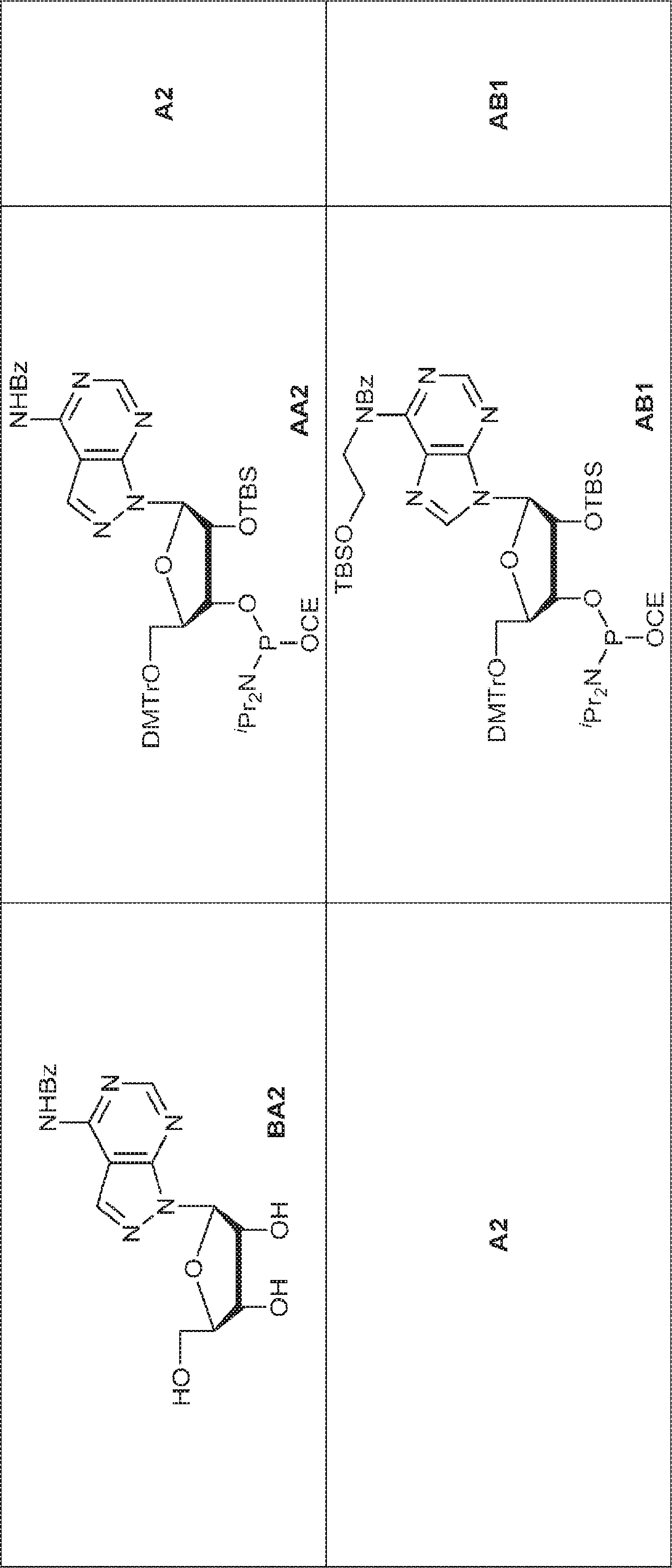
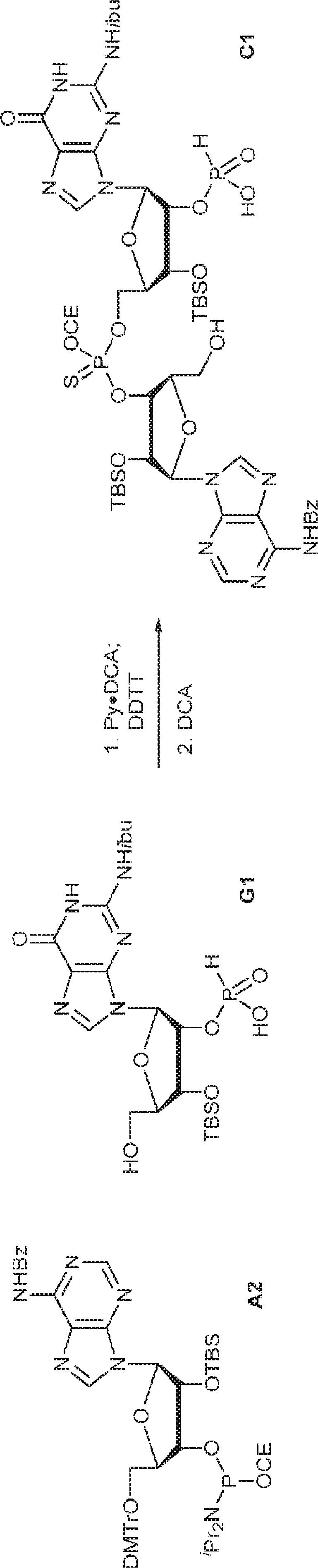
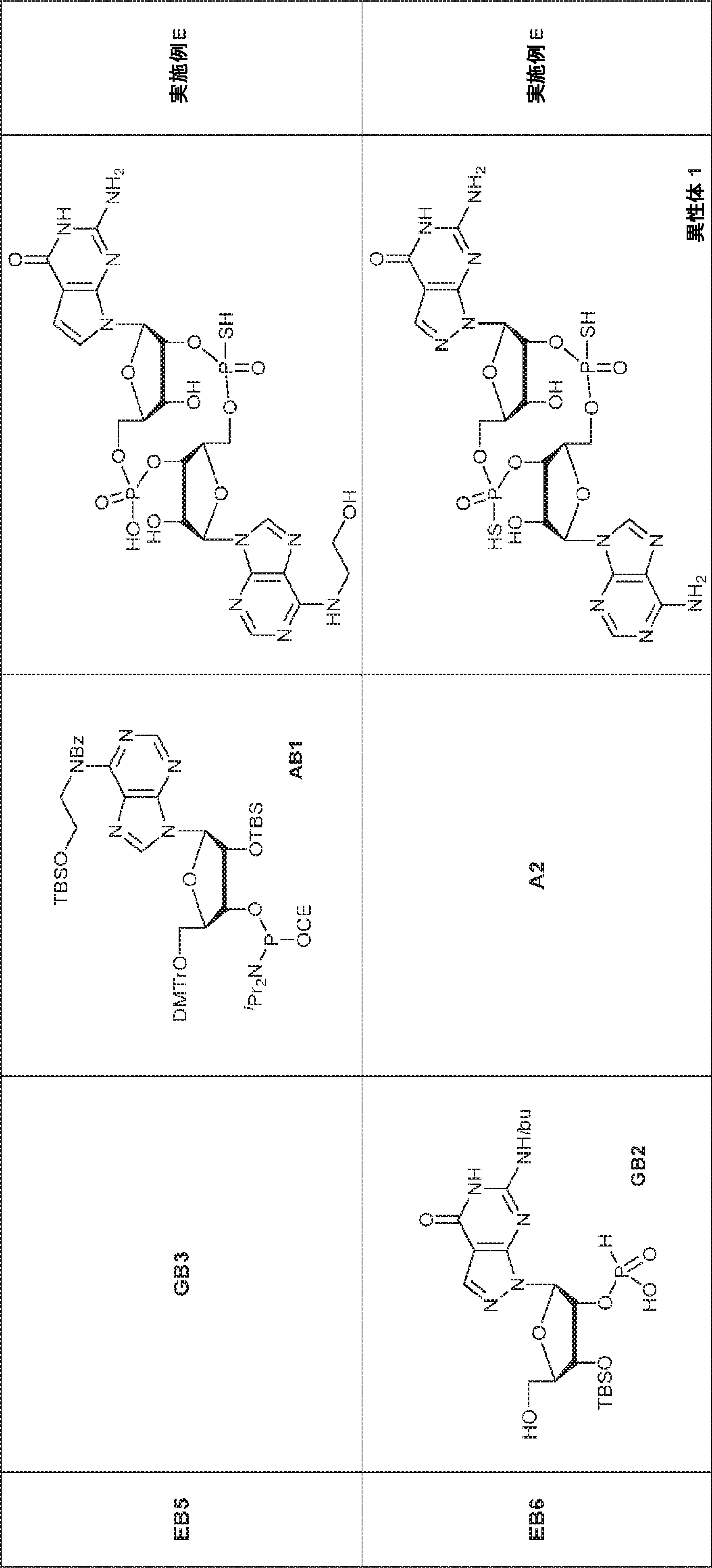
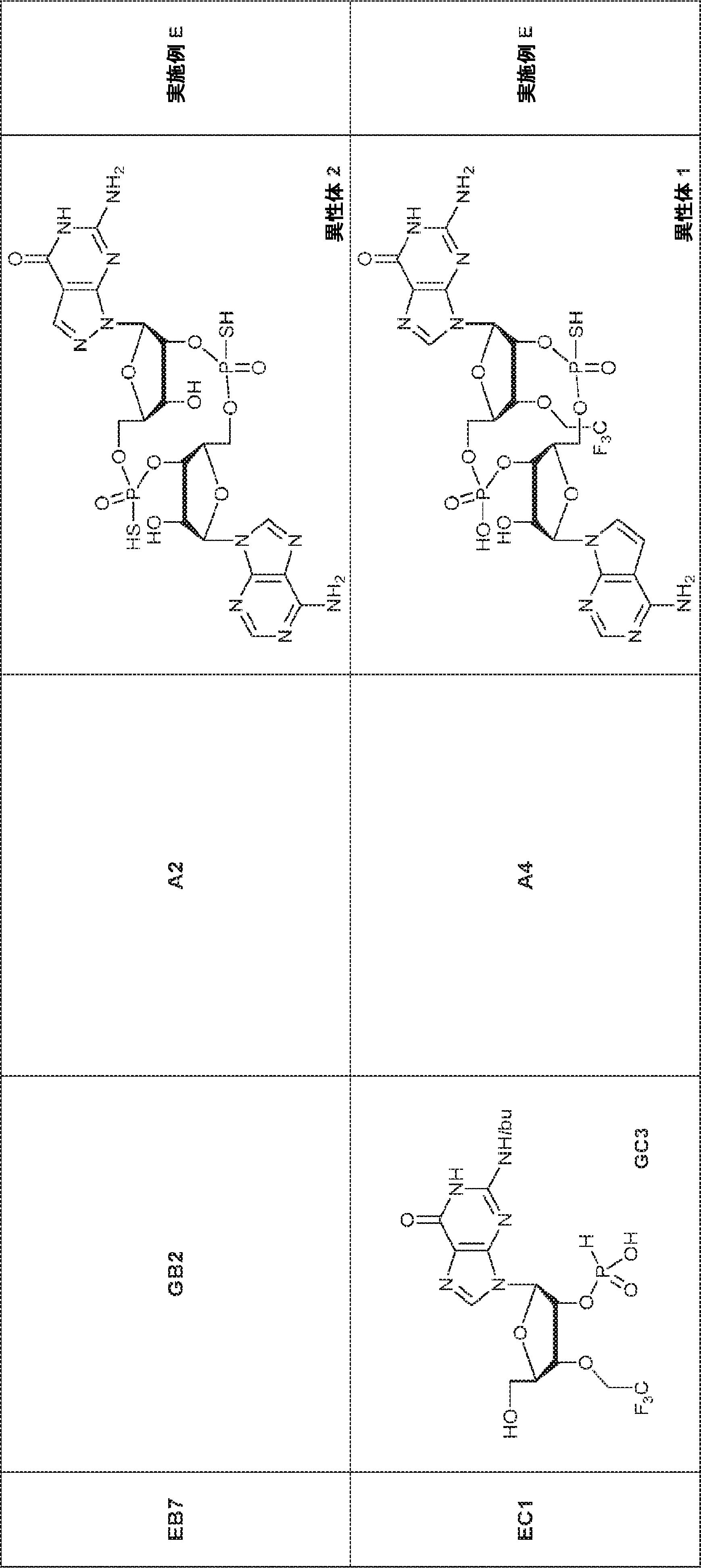
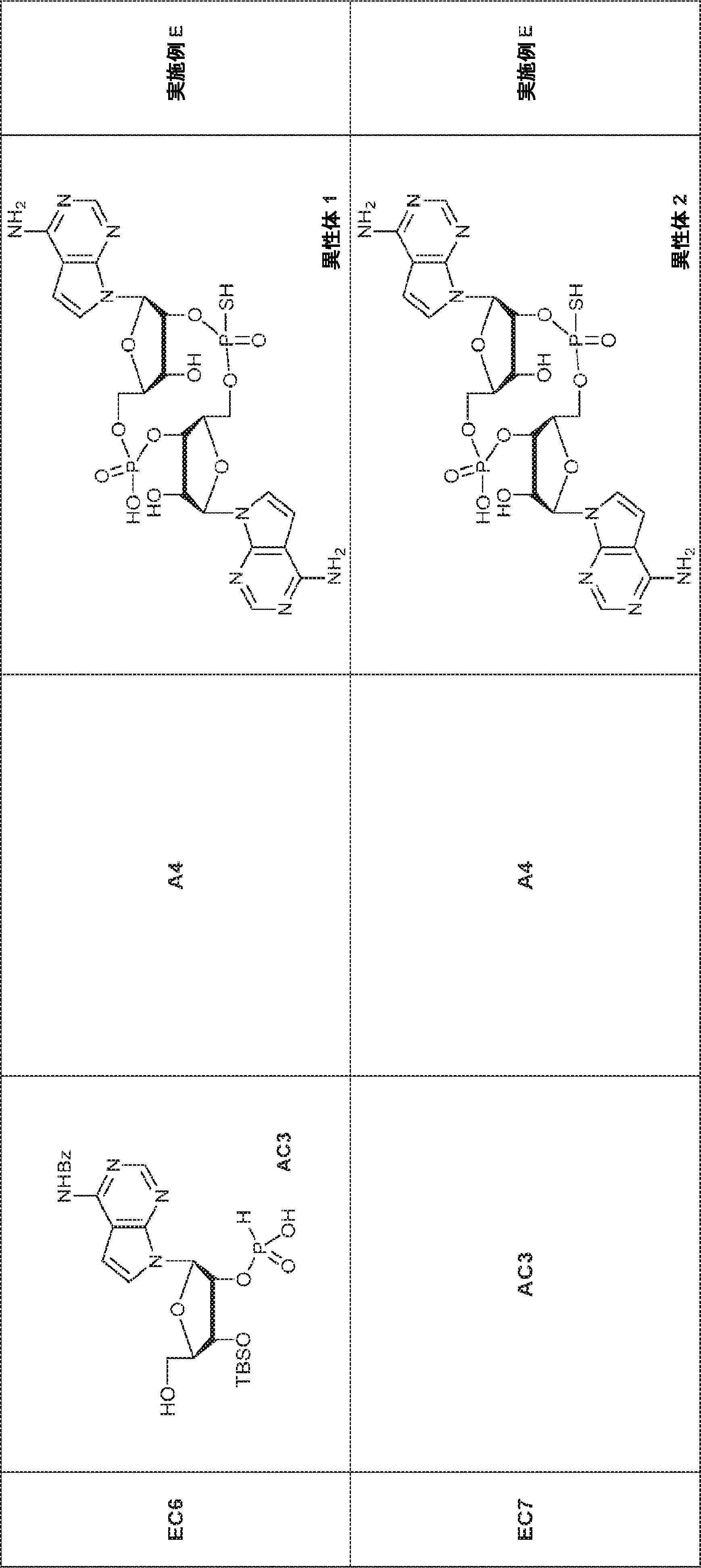
72(12.0g、15.2mmol)のDIPEA(15mL)およびDCM(30mL)溶液にDMAP(744mg、6.09mmol)および2-シアノエチル N,N-ジイソプロピルクロロホスホロアミダイト(5.41g、22.9mmol)を25℃で加える。2時間攪拌後、混合物を塩基性シリカゲルカラムクロマトグラフィー(EA/PE = 1/4→1/1)で直接精製してA2を白色固体(13.0g、収率86%)として得る。
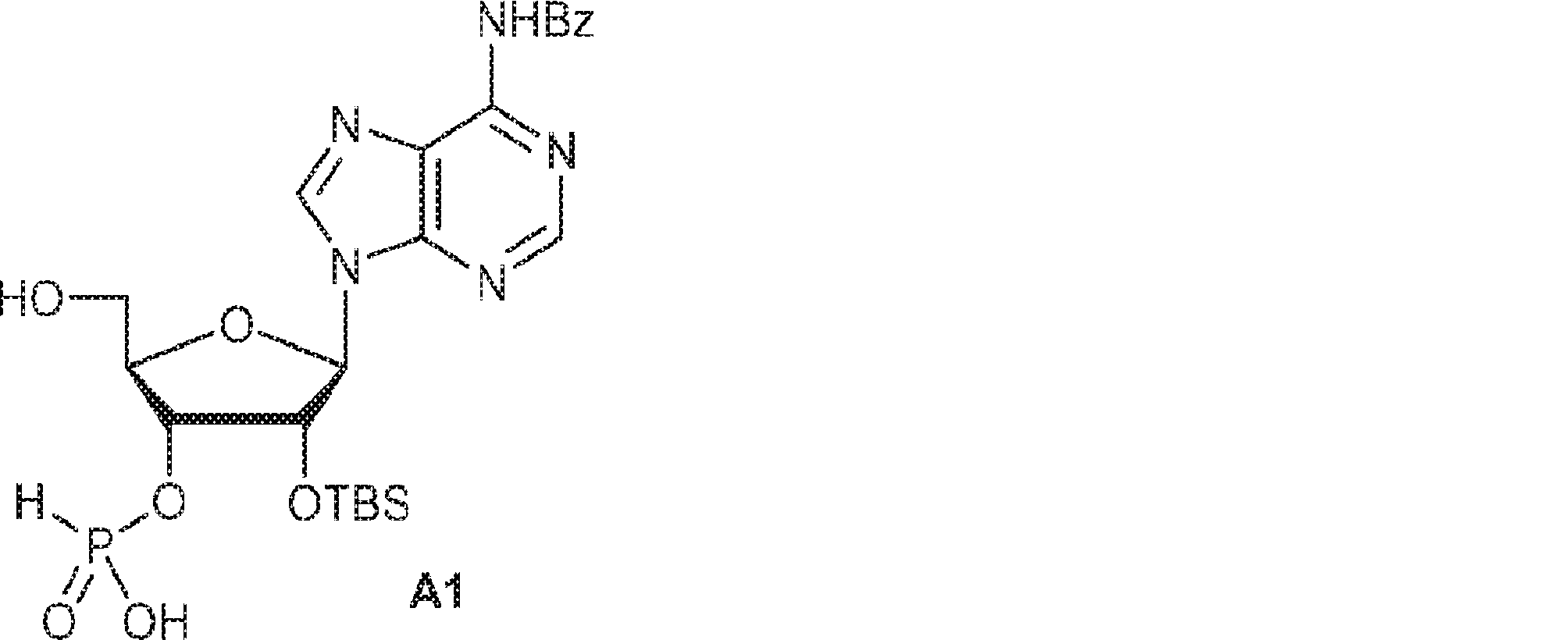
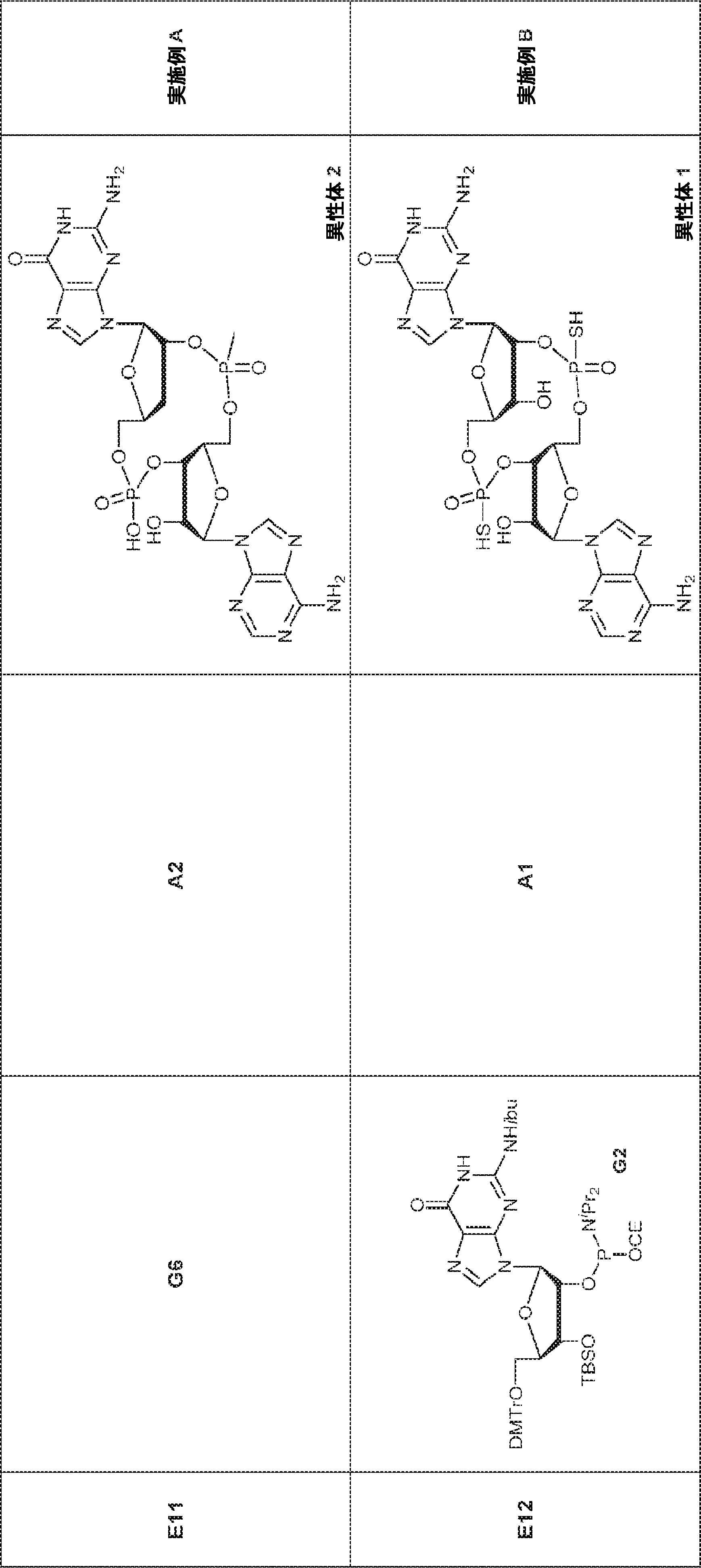
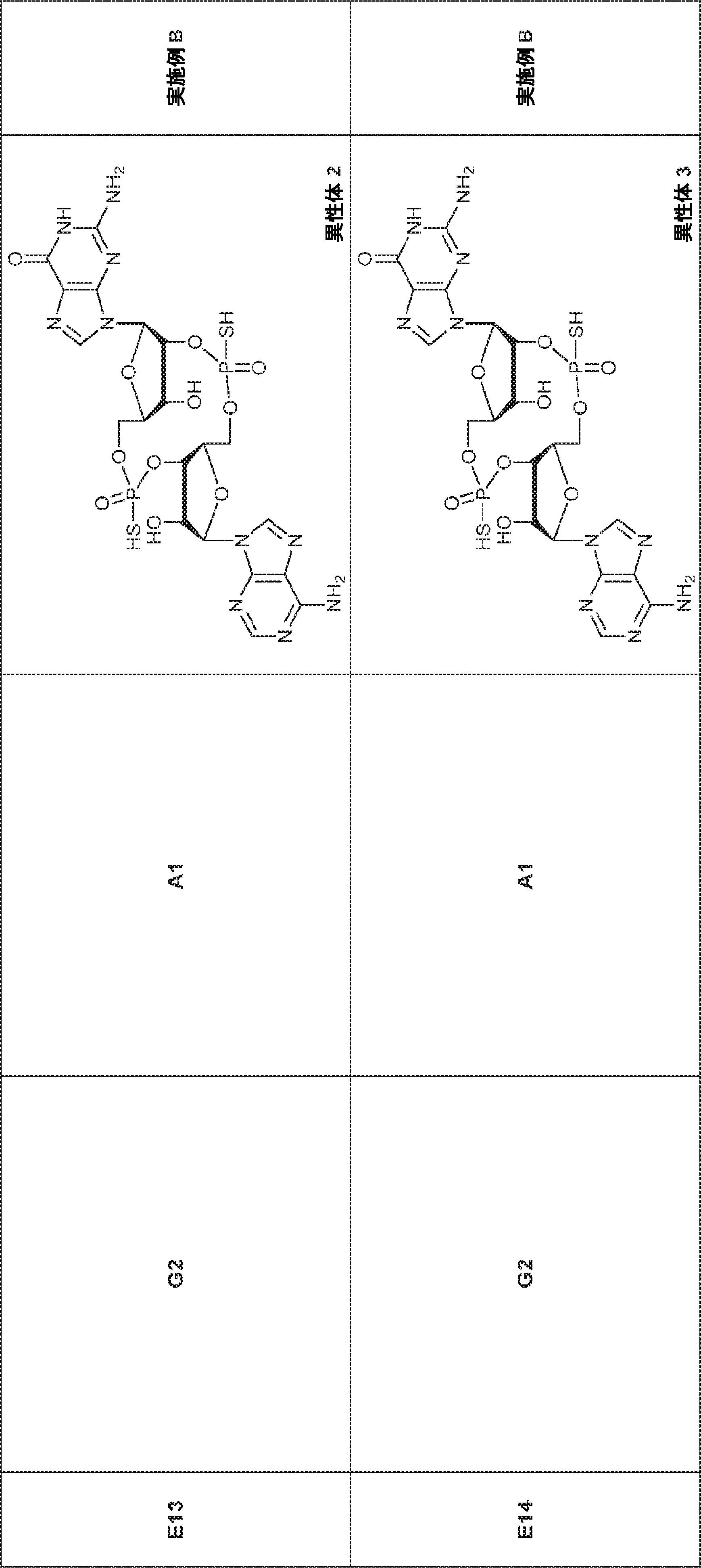
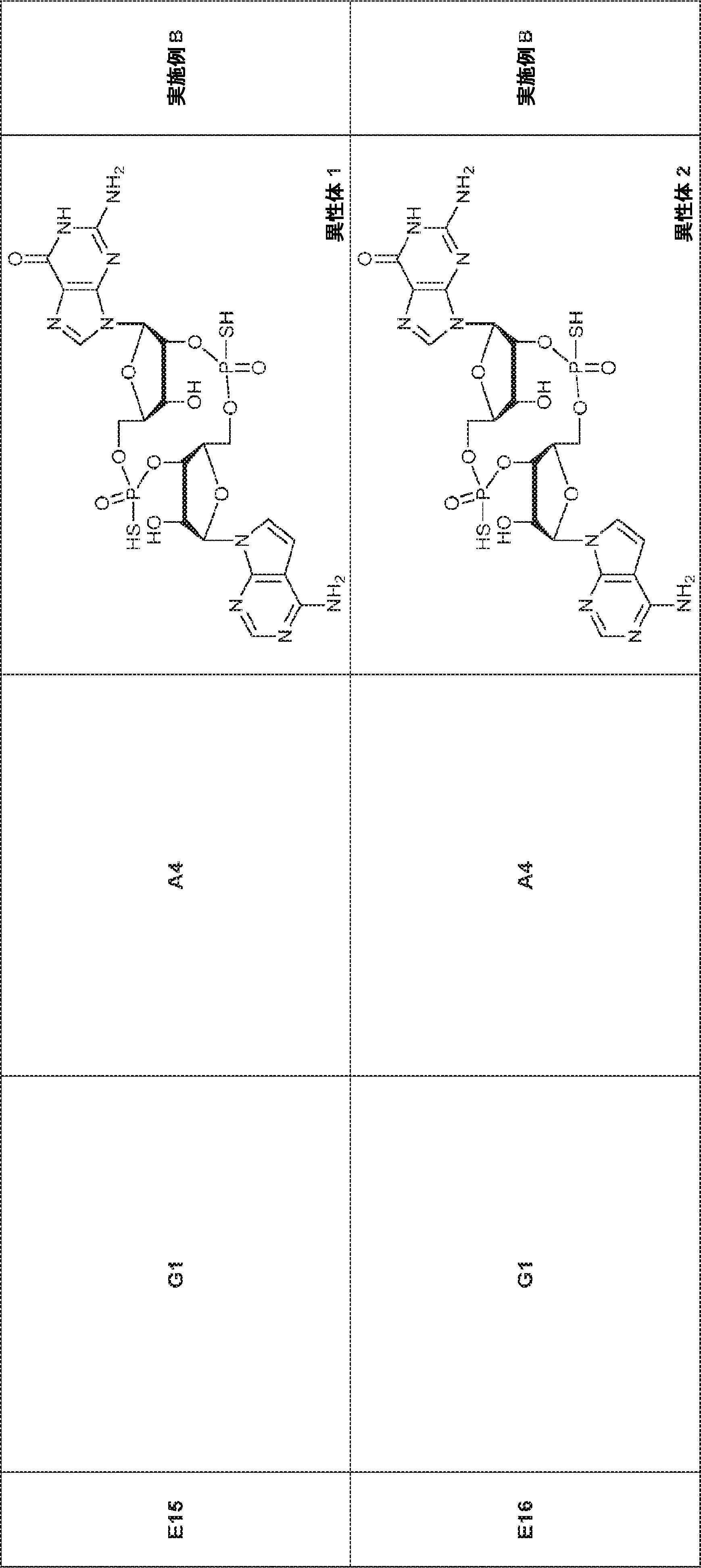
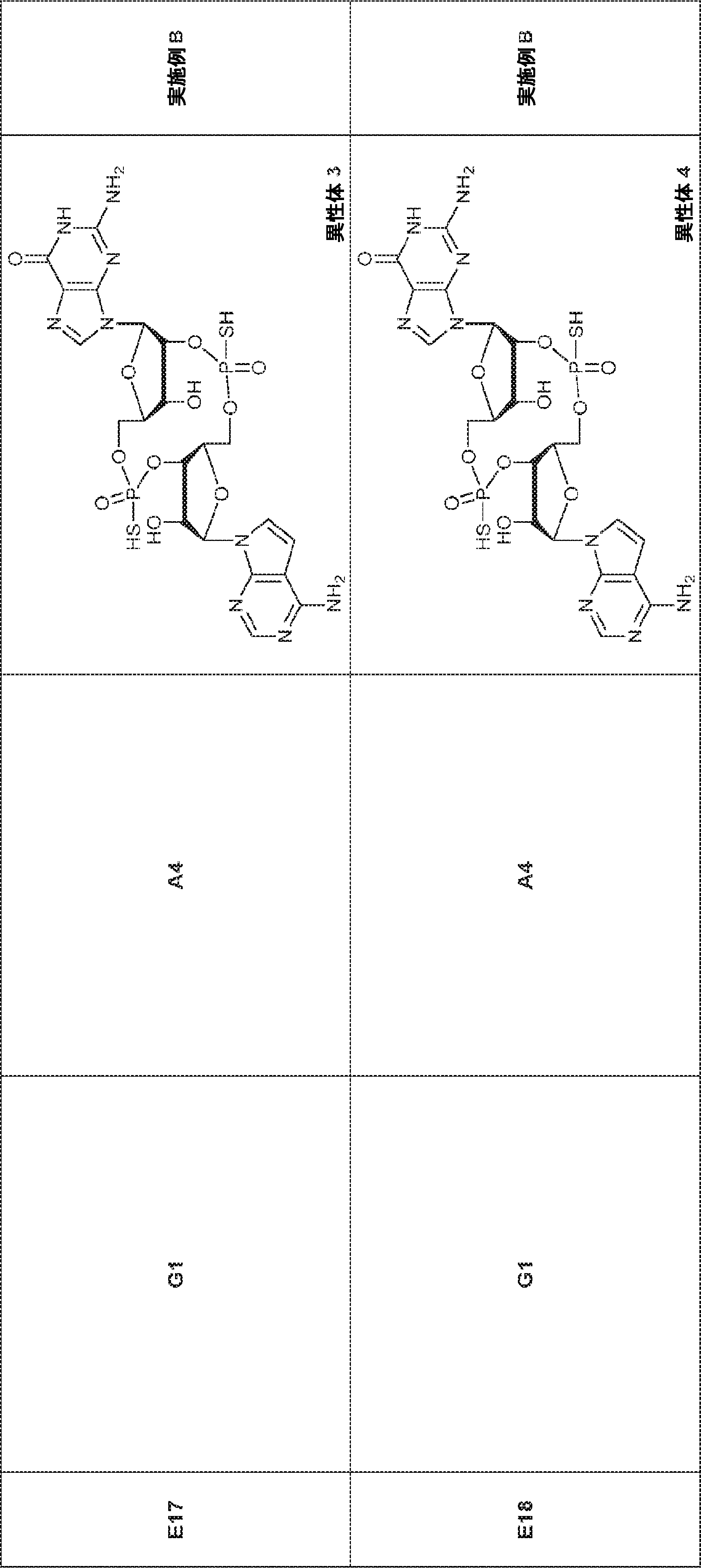
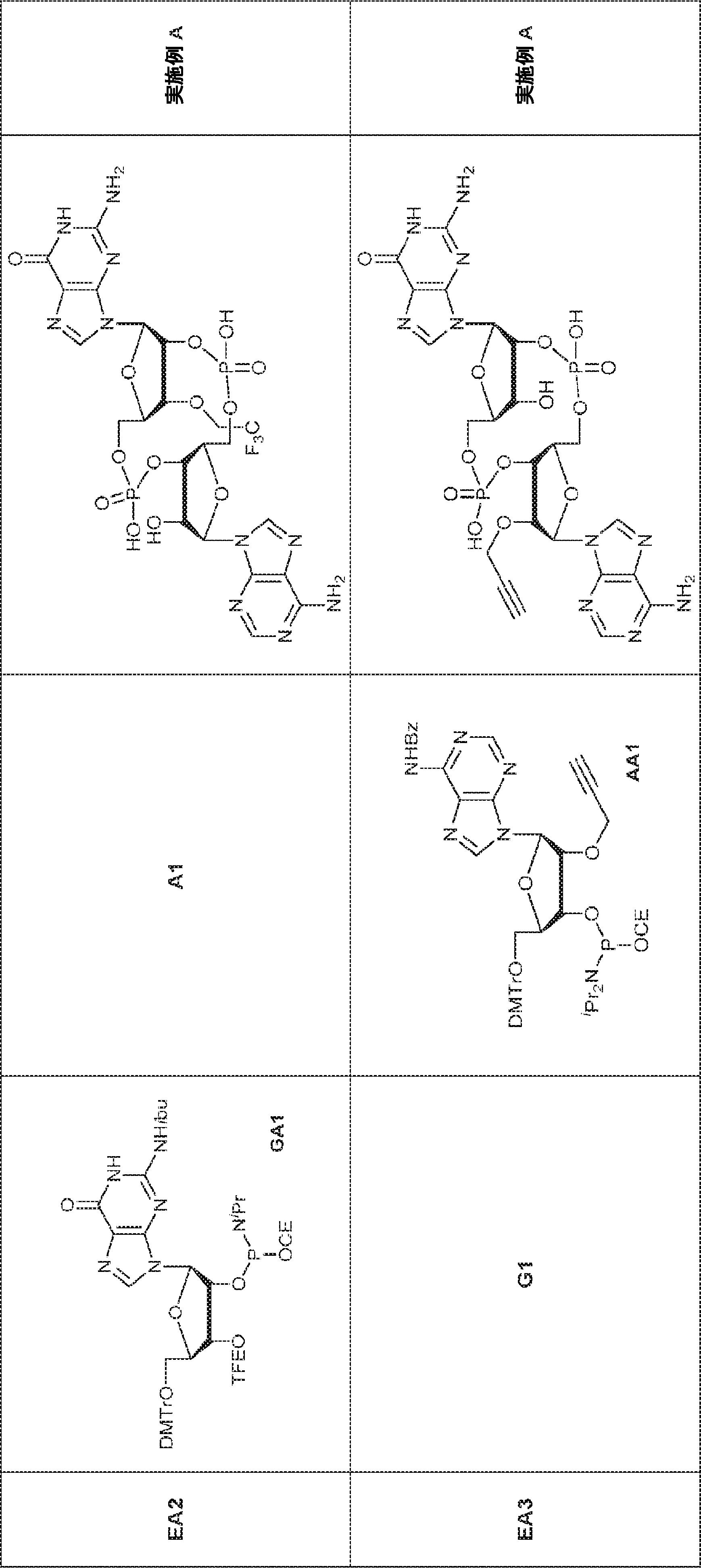
A2(3.8g、3.9mmol)のMeCN(20mL)溶液に水(0.1mL)およびトリフルオロ酢酸ピリジニウム(1.1g、5.8mmol)を25℃で加え、5分間攪拌した後、tert-ブチルアミン(14.0g、0.19mmol)を加える。15分間攪拌後、揮発物を除去し、残渣をDCM(20mL)に溶解させる。次にDCA(1.9g、14.6mmol)のDCM(20mL)溶液を加える。30分間攪拌後、TEA(3mL)を加え、混合物を濃縮し、逆相シリカゲルカラムクロマトグラフィー(0.1% TEA入りMeCN/水 = 0%→100%)で精製してA1・TEA塩を白色固体(1.5g、収率71%)として得る。(MS: [M+H]+ 549.2)
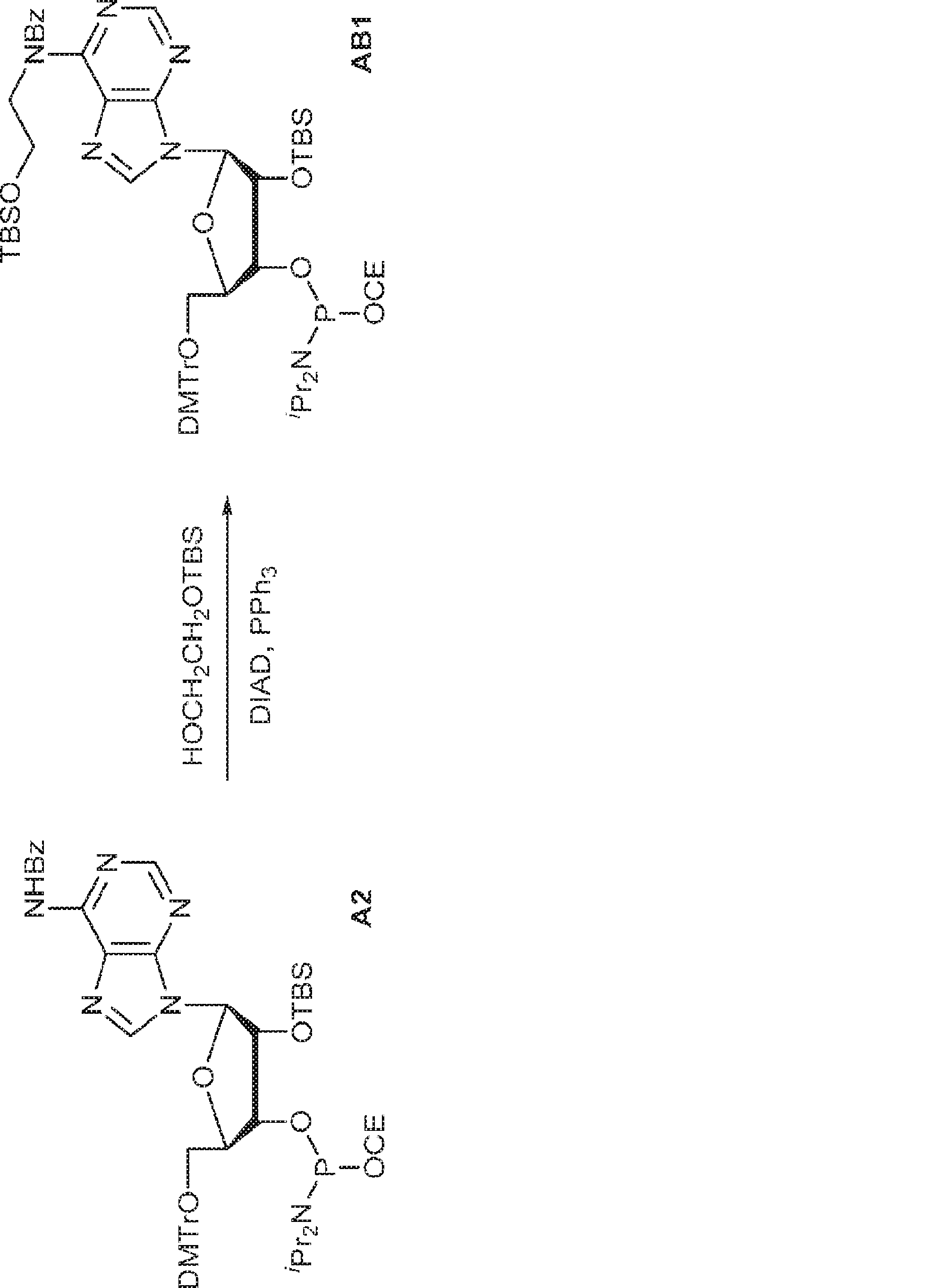
A2(494mg、0.5mmol)、トリフェニルホスフィン(197mg、0.75mmol)、および2-(tert-ブチルジメチルシリルオキシ)エタノール(132mg、0.75mmol)のTHF(5mL)溶液にDIAD(0.15mL、0.75mmol)を加える。室温で5時間攪拌後、混合物を濃縮し、シリカゲルカラムクロマトグラフィー(EA/ヘキサン = 1/9→1/4)で精製してAB1を白色固体(230mg、収率40%)として得る。
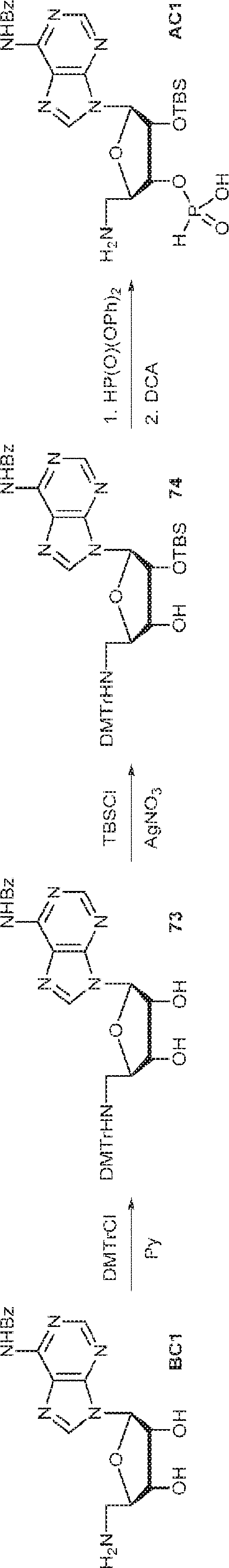
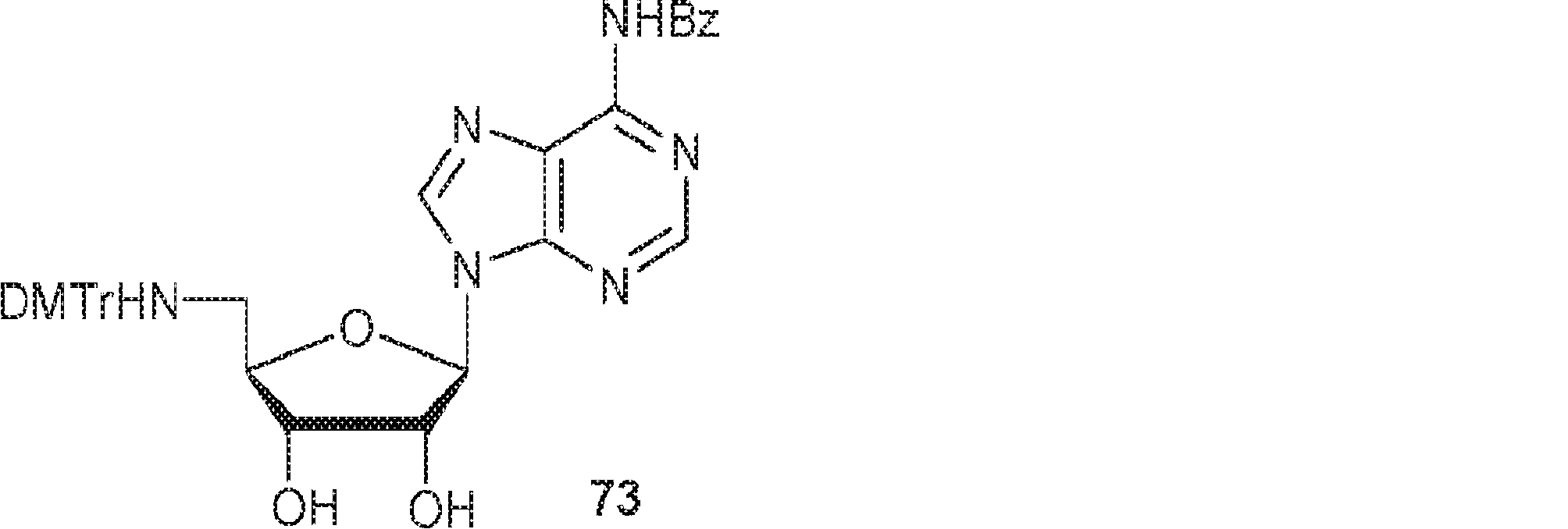
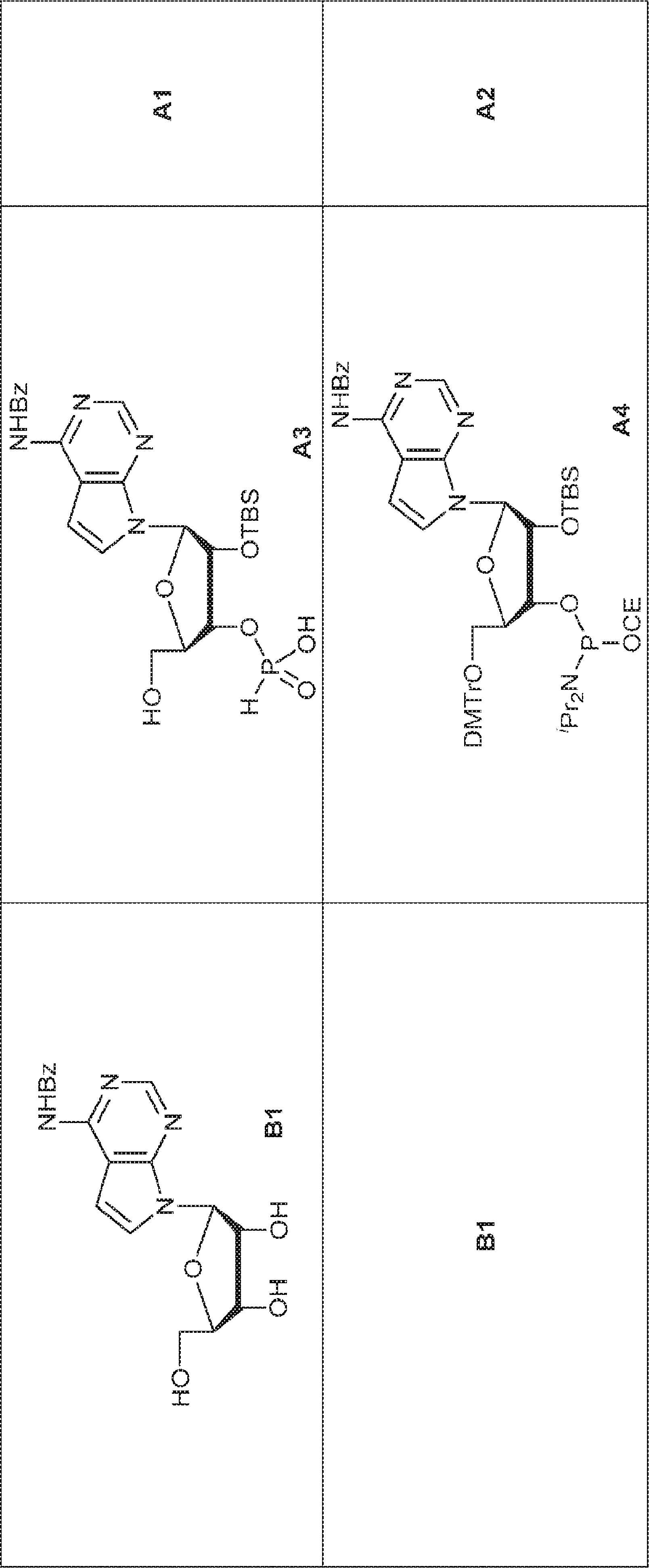
粗生成物BC1(39g)のPy(40mL)溶液にDMTrCl(35.9g、106mmol)を0℃で加える。25℃で16時間攪拌後、MeOH(50mL)を加え、混合物を濃縮する。次に残渣をDCM(600mL)に溶解させ、飽和炭酸水素ナトリウム水溶液およびブラインで洗浄し、濃縮し、シリカゲルカラムクロマトグラフィー(MeOH/DCM = 1/100→1/50)で精製して73を淡黄色固体(34.0g、2工程で収率48%)として得る。(MS: [M+H]+ 673.2)
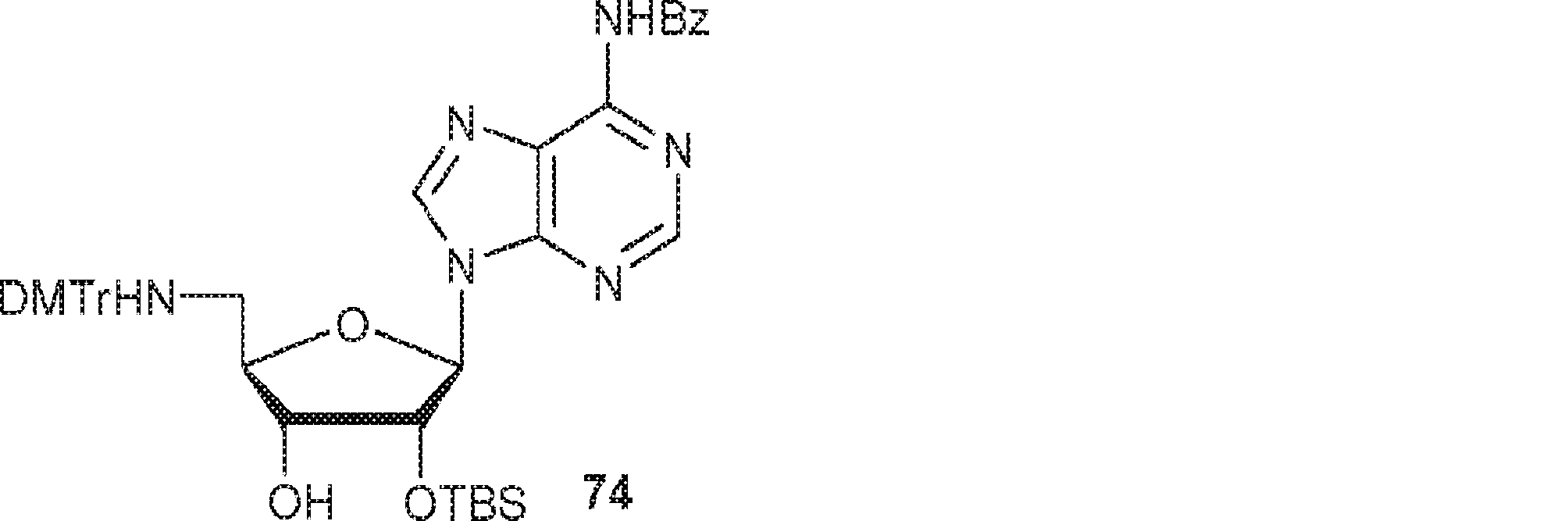
73(1.0g、1.49mmol)のPy(10mL)溶液に硝酸銀(380mg、2.24mmol、0.38mL)を0℃で加える。15分間攪拌後、TBSCl(270mg、1.79mmol)を加え、混合物を25℃で2時間攪拌した後、飽和炭酸水素ナトリウム水溶液を加える。次に混合物をEA(10mL)で抽出し、有機層をブラインで洗浄し、濃縮し、シリカゲルカラムクロマトグラフィー(EA/PE = 1/5)で精製して74を淡黄色固体(400mg、収率34%)として得る。(MS: [M+H]+ 787.3)
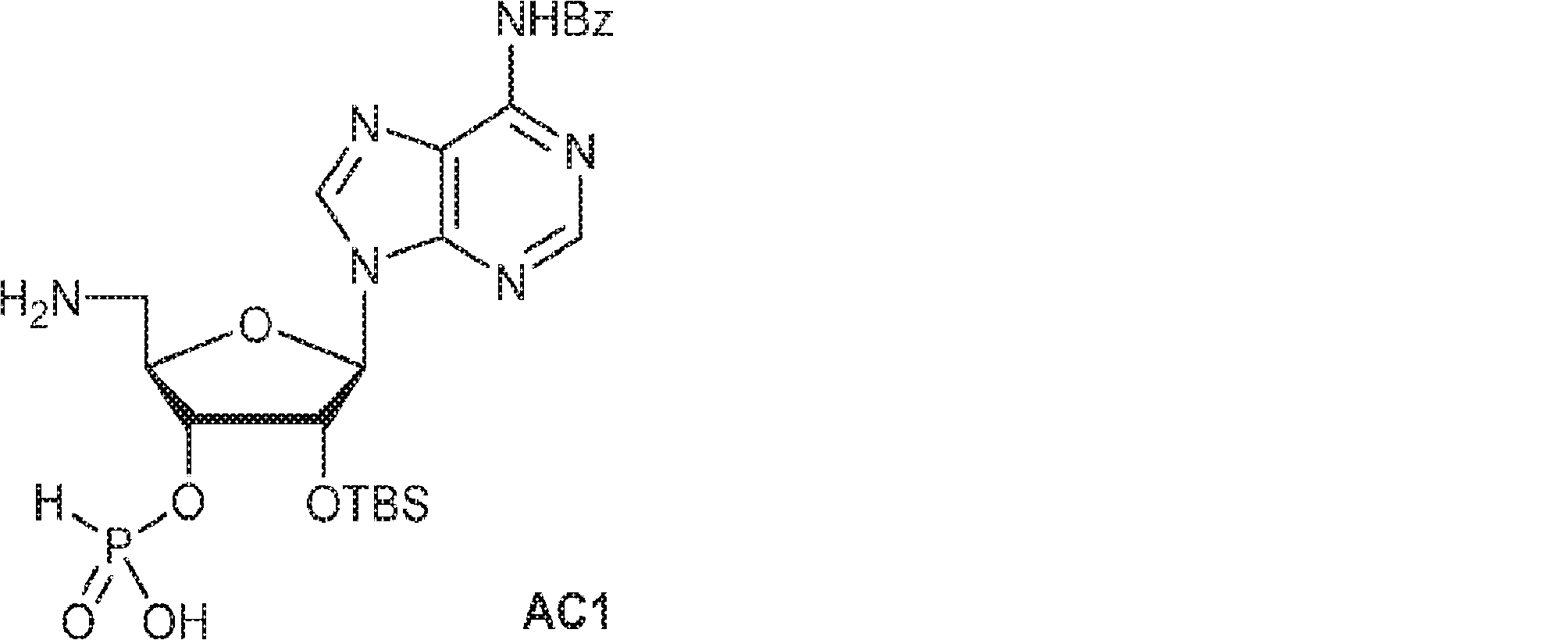
74(1.0g、1.27mmol)のPy(10mL)溶液に亜リン酸ジフェニル(80%、744mg、2.54mmol、0.61mL)を加える。20℃で1時間攪拌後、EA(2mL)および飽和炭酸水素ナトリウム水溶液(2mL)を加え、混合物を1時間攪拌する。層を分離し、有機層を濃縮する。次に残渣をDCM(1.0mL)に溶解させ、DCA(164mg、1.27mmol、0.1mL)を加える。25℃で30分間攪拌後、TEA(1mL)を加え、溶液を濃縮し、逆相シリカゲルカラムクロマトグラフィー(0.1% TEA入りMeCN/水 = 0%→100%)で精製してAC1を白色固体(500mg、収率72%)として得る。(MS: [M+H]+ 549.2)
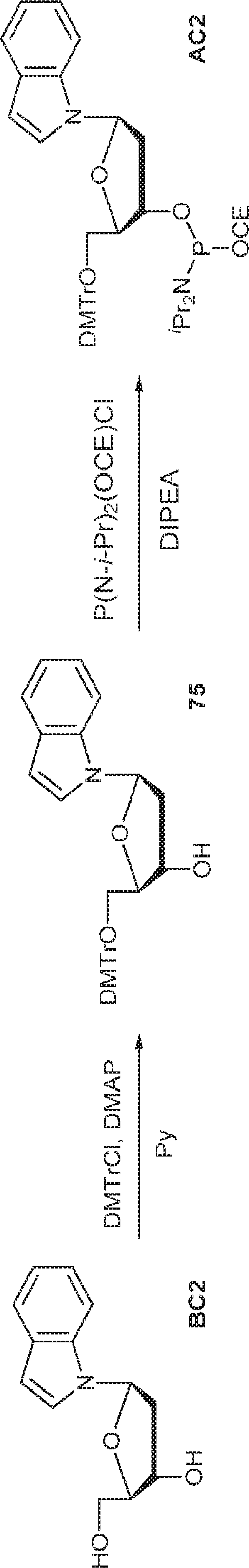
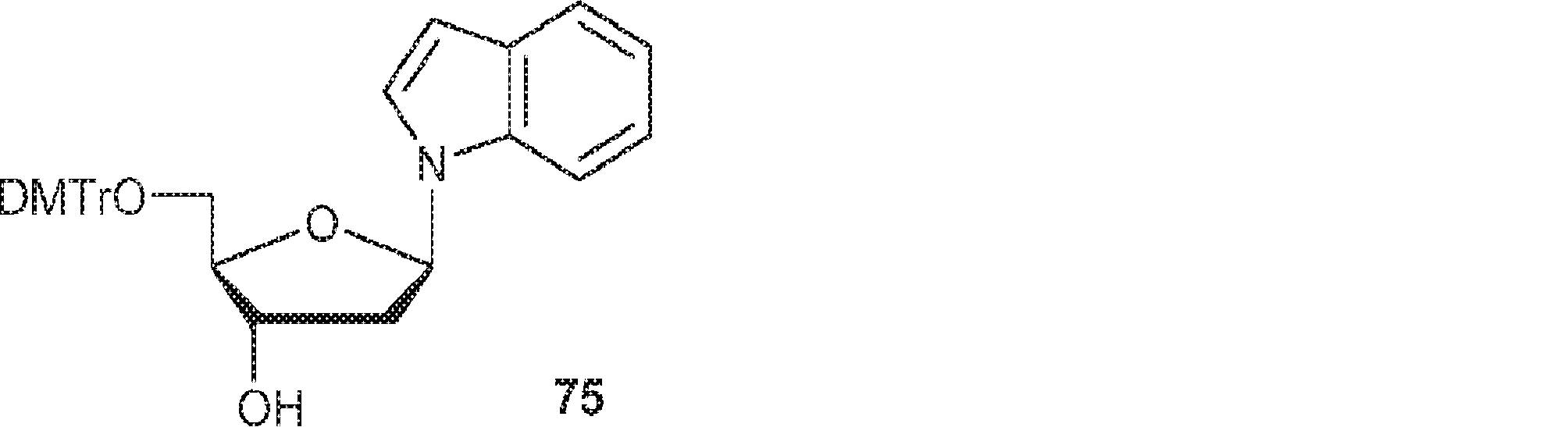
BC2(348mg、1.49mmol)のPy(15mL)溶液にDMAP(18mg、0.15mmol)およびDMTrCl(0.66g、1.94mmol)を加える。終夜攪拌後、MeOH(3mL)を加え、混合物を濃縮し、シリカゲルカラムクロマトグラフィー(EA/ヘキサン = 1/4)で精製して75(662mg、収率83%)を得る。(MS: [M+H]+ 536.2)
75(0.2g、0.37mmol)のDCM(4mL)溶液にDIEPA(0.15g、1.2mmol、0.2mL)および2-シアノエチル N,N-ジイソプロピルクロロホスホロアミダイト(0.14g、0.56mmol、0.13mL)を加える。4時間攪拌後、混合物を濃縮し、シリカゲルカラムクロマトグラフィー(EA/1% TEA入りのヘキサン = 1/4)で精製してAC2(232mg、収率85%)を得る。(MS: [M-NiPr2+H2O]+ 653.2)
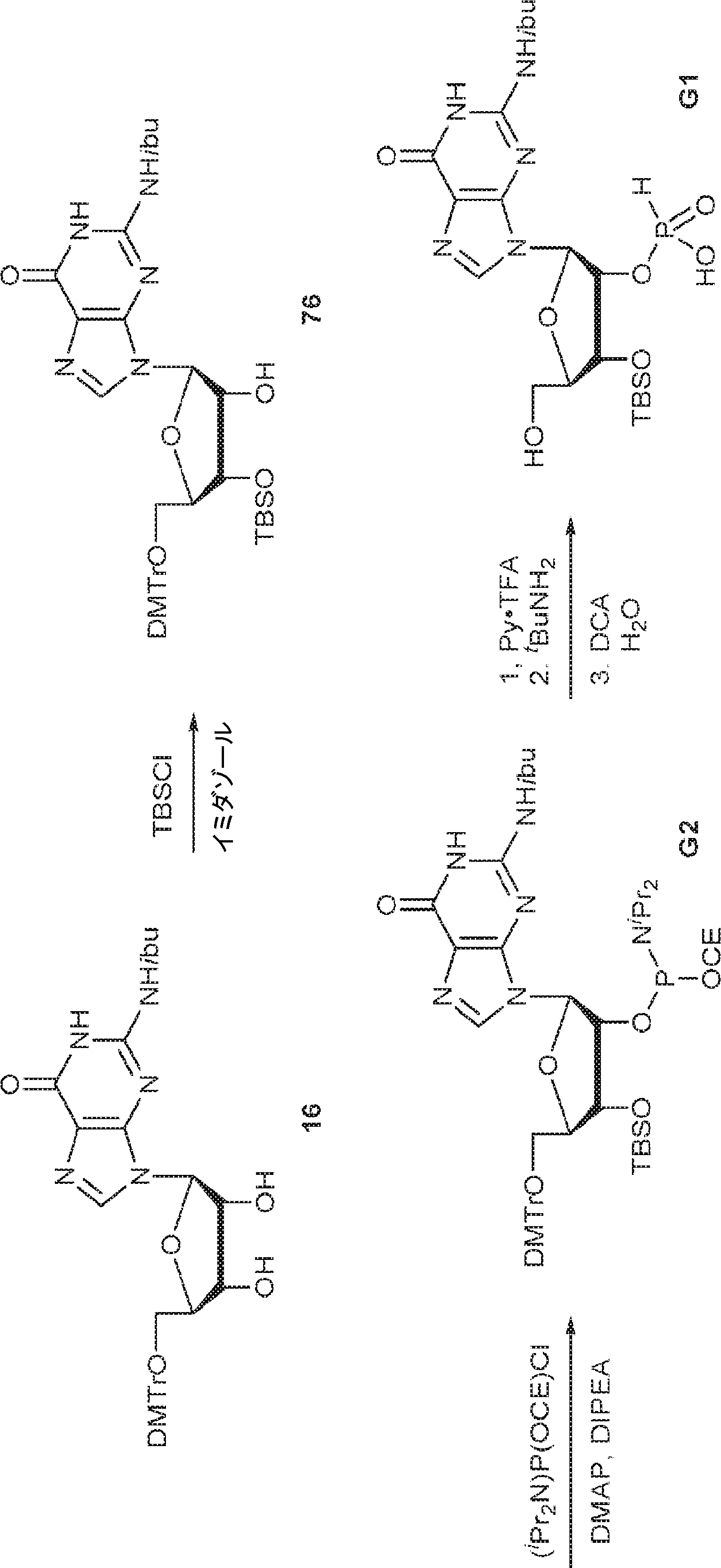
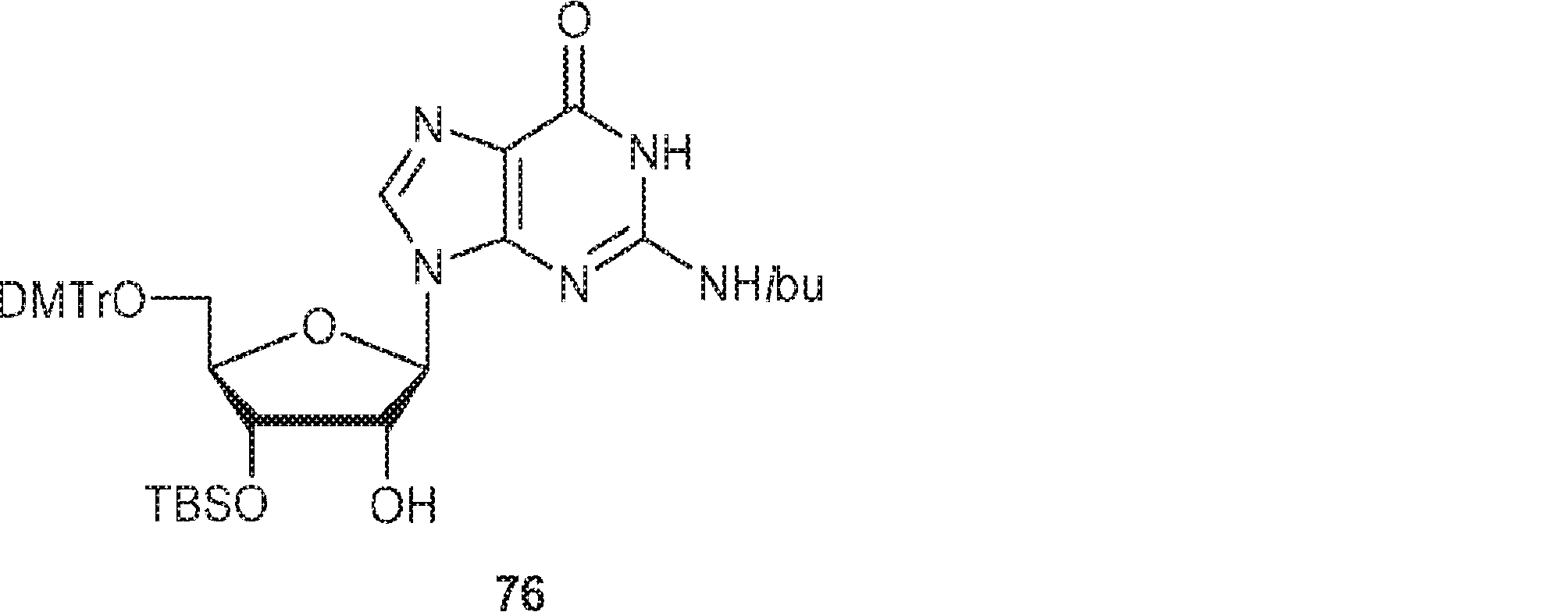
16(11.0g、16.8mmol)のDCM(80mL)溶液にTBSCl(7.59g、50.3mmol)およびImid(3.43g、50.3mmol)を加える。25℃で16時間攪拌後、炭酸水素ナトリウム水溶液(5%、30mL)を加え、混合物をDCM(60mL×3)で抽出する。一緒にした有機層をブライン(100mL)で洗浄し、無水硫酸ナトリウムで乾燥させ、濾過し、濃縮し、塩基性シリカゲルカラムクロマトグラフィー(EA/PE = 1/5→1/1)で精製して76を白色固体(2.1g、収率16%)として得る。
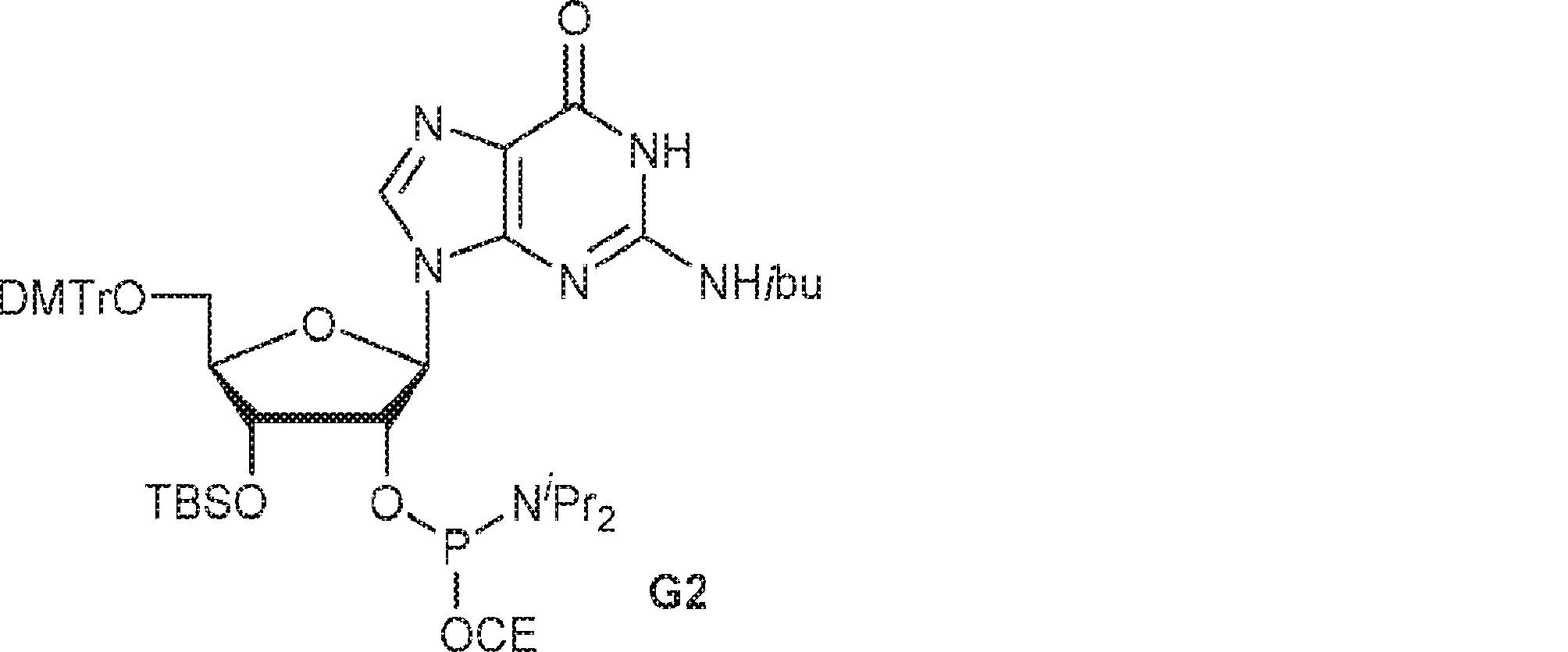
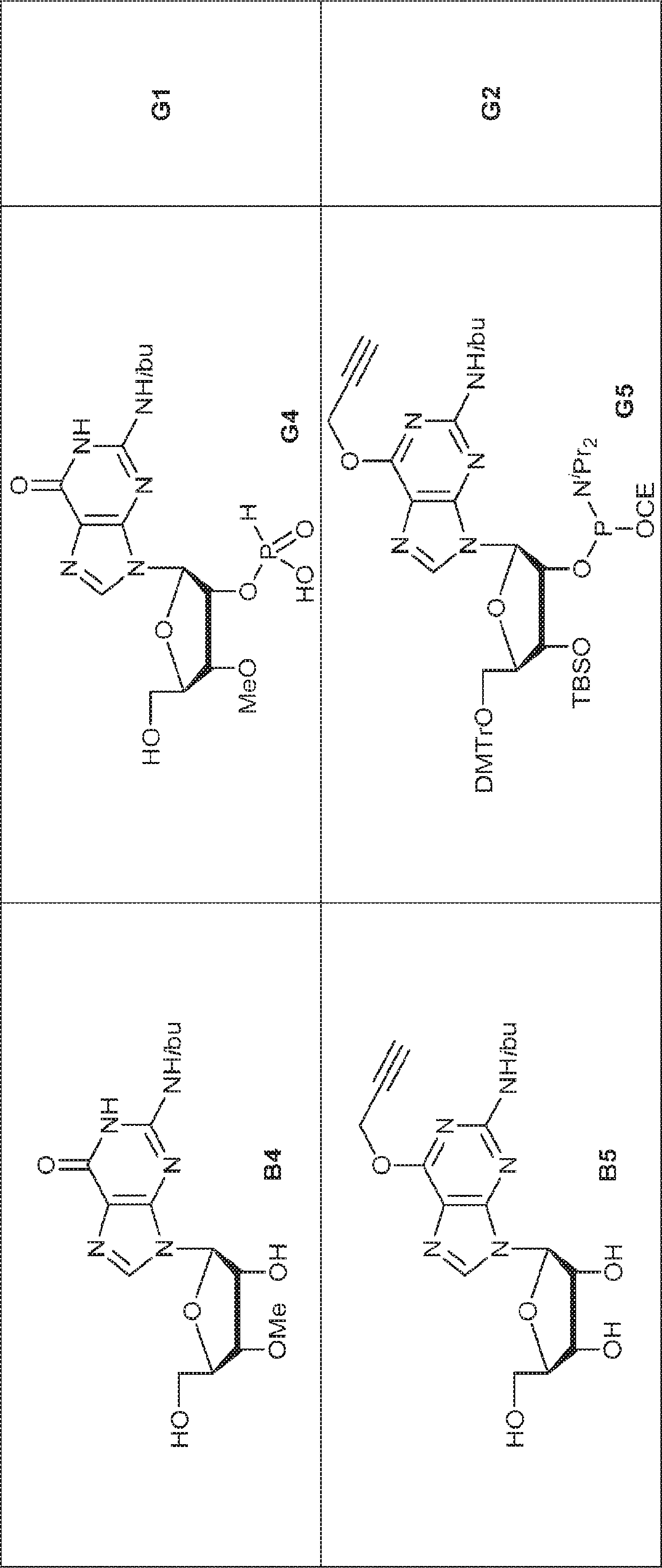
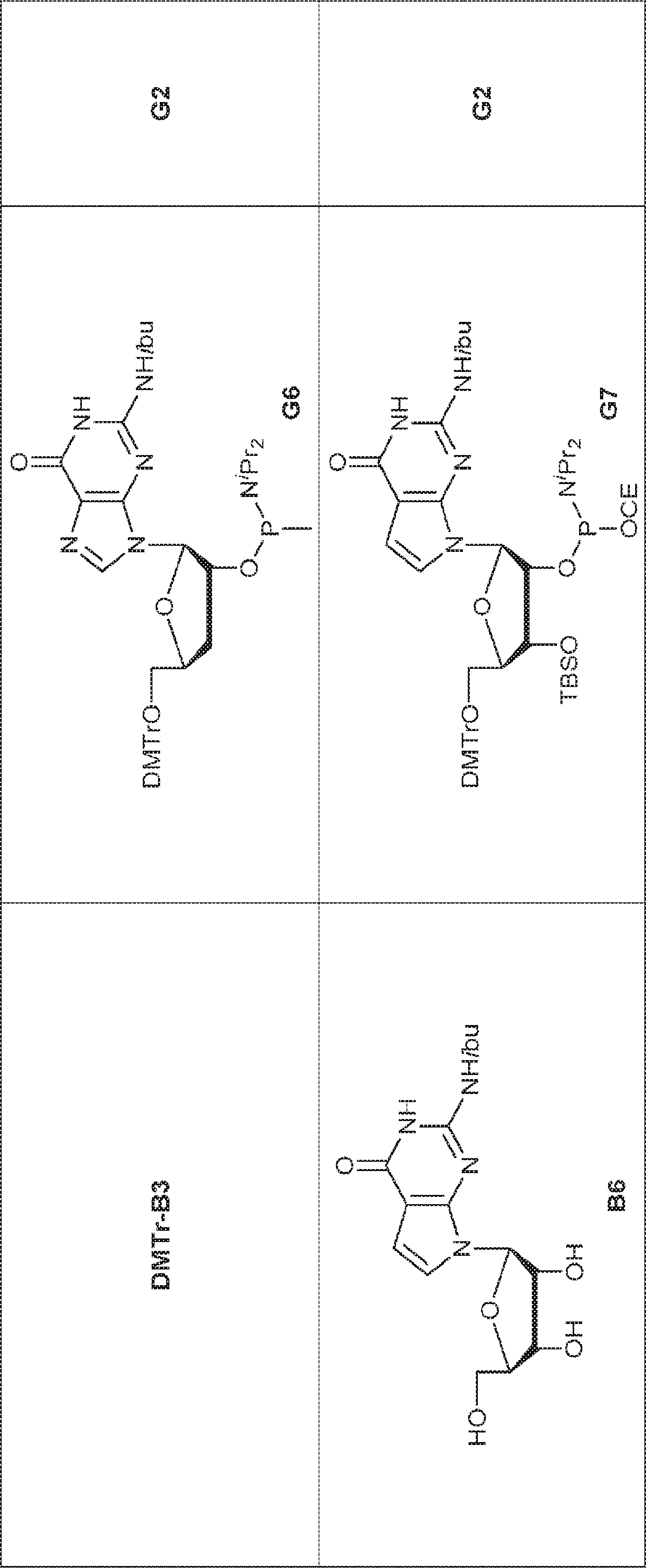
76(900mg、1.17mmol)のTHF(4.0mL)およびDIEPA(4.0mL)溶液にDMAP(14.3mg、0.12mmol)、続いて2-シアノエチル N,N-ジイソプロピルクロロホスホロアミダイト(415mg、1.76mmol)を0℃で滴下する。20~25℃で2時間攪拌後、炭酸水素ナトリウム水溶液(5%、15mL)を0℃で加える。次に混合物を水(15mL)で希釈し、EA(15mL×3)で抽出する。一緒にした有機層をブライン(10mL)で洗浄し、無水硫酸ナトリウムで乾燥させ、濾過し、濃縮し、シリカゲルカラムクロマトグラフィー(アセトン/PE = 1/10→1/3)で精製してG2を白色固体(600mg、収率53%)として得る。
G1(7.0g、7.22mmol)のMeCN(30mL)溶液に水(0.11mL)およびトリフルオロ酢酸ピリジニウム(4.18g、21.7mmol)を25℃で加える。25℃で15分間攪拌後、tert-ブチルアミン(37mL)を加え、混合物を25℃で45分間攪拌し、次に濃縮する。次に残渣をDCM(30mL)に溶解させ、DCAのDCM溶液(6% v/v、30mL)を滴下する。20~25℃で30分間攪拌後、DCM(30mL)およびTEA(4mL)を加える。次に混合物を濃縮し、MeCN(5mL)および水(5mL)の混合物に溶解させ、C18逆相中圧液体クロマトグラフィー(0.1% TEA入りのMeCN/水 = 0%→60%)で精製してG1・TEA塩を黄色固体(2.30g、収率56%)として得る。(MS: [M+H]+ 532.3)
上記で得た2つのバッチの粗生成物BB1(8.0g)のPy(50mL)溶液にDMTrCl(9.2g、27.2mmol)を加える。20~30℃で1時間攪拌した後、MeOH(10mL)を加え、混合物を濃縮し、シリカゲルカラムクロマトグラフィー(EA/PE = 1/5→MeOH/DCM = 1/20)で精製して77を黄色固体(11.0g、2工程で収率30%)として得る。(MS: [M+Na]+ 678.2)
77(9.0g、14.0mmol)のPy(50mL)溶液にTBSCl(2.48g、16.5mmol)および硝酸銀(5.83g、34.3mmol)を加える。25~30℃で30分間攪拌後、飽和炭酸水素ナトリウム水溶液を加える。次に混合物をDCM(200mL×2)で抽出し、一緒にした有機層を水(50mL)、ブライン(50mL)で洗浄し、無水硫酸ナトリウムで乾燥させ、濾過し、濃縮し、シリカゲルカラムクロマトグラフィー(EA/PE = 1/10→1/5→1/3)で精製して78を白色泡状物(1.50g、収率14%)として得る。(MS: [M+Na]+ 792.2)
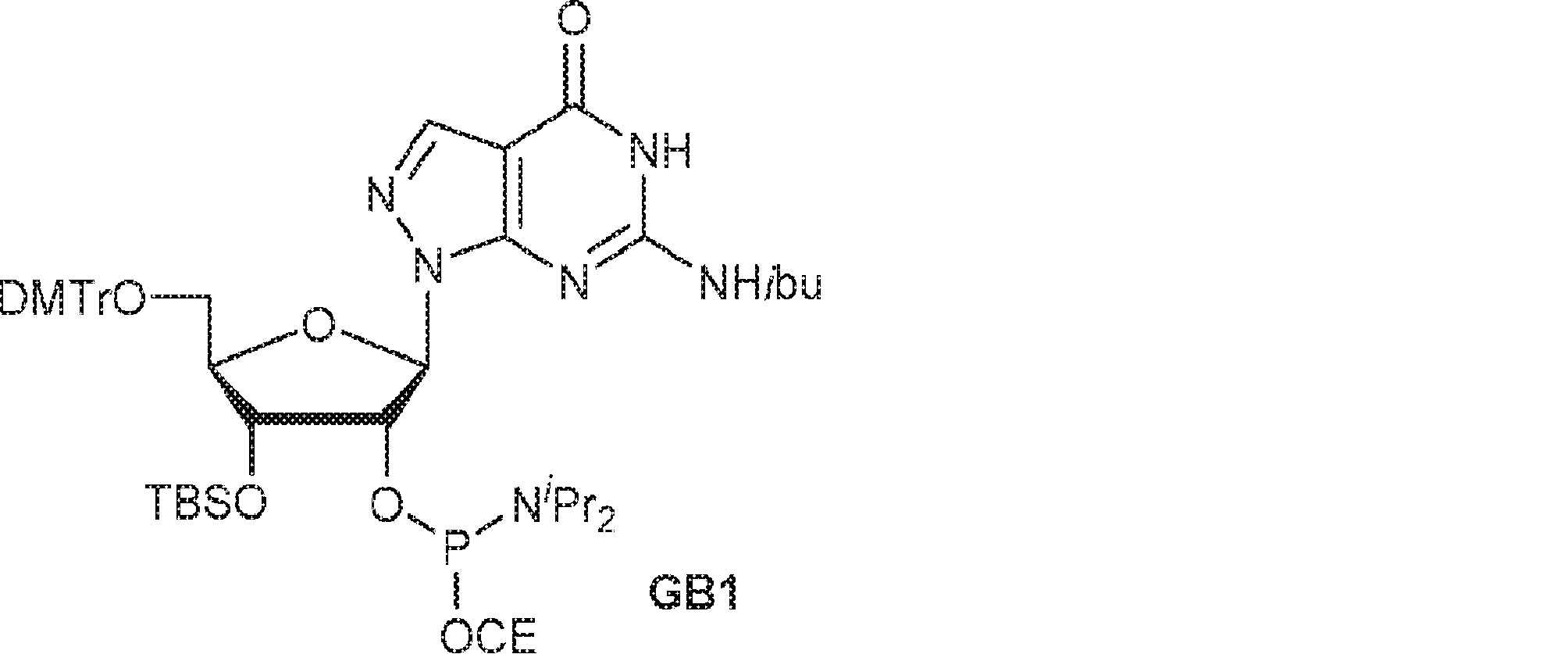
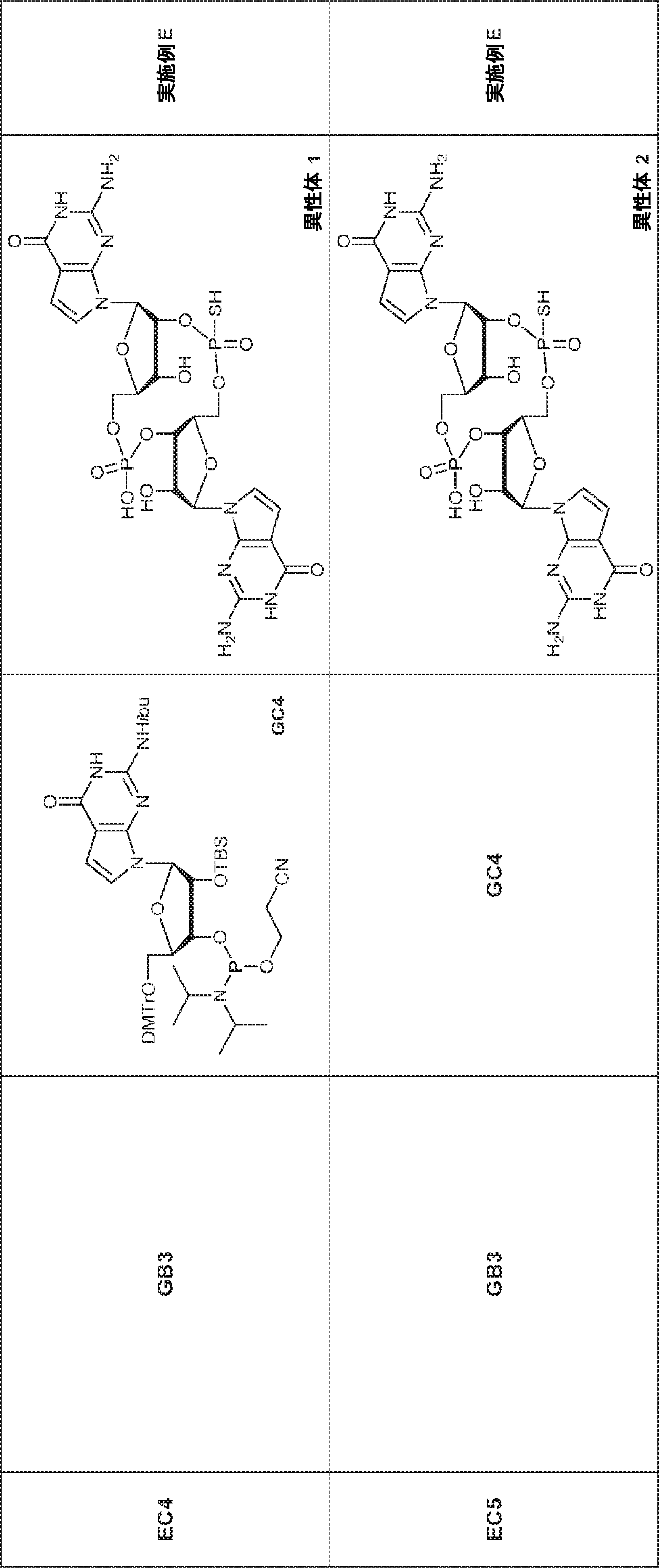
78(2.50g、3.3mmol)のDIEPA(5mL)およびDCM(5mL)溶液にDMAP(200mg、1.62mmol)および2-シアノエチル N,N-ジイソプロピルクロロホスホロアミダイト(1.0g、4.22mmol)を加える。20~25℃で2時間攪拌後、混合物を濃縮し、シリカゲルカラムクロマトグラフィー(EA/PE = 1/10→1/4)で精製してGB1を白色泡状物(2.30g、収率73%)として得る。
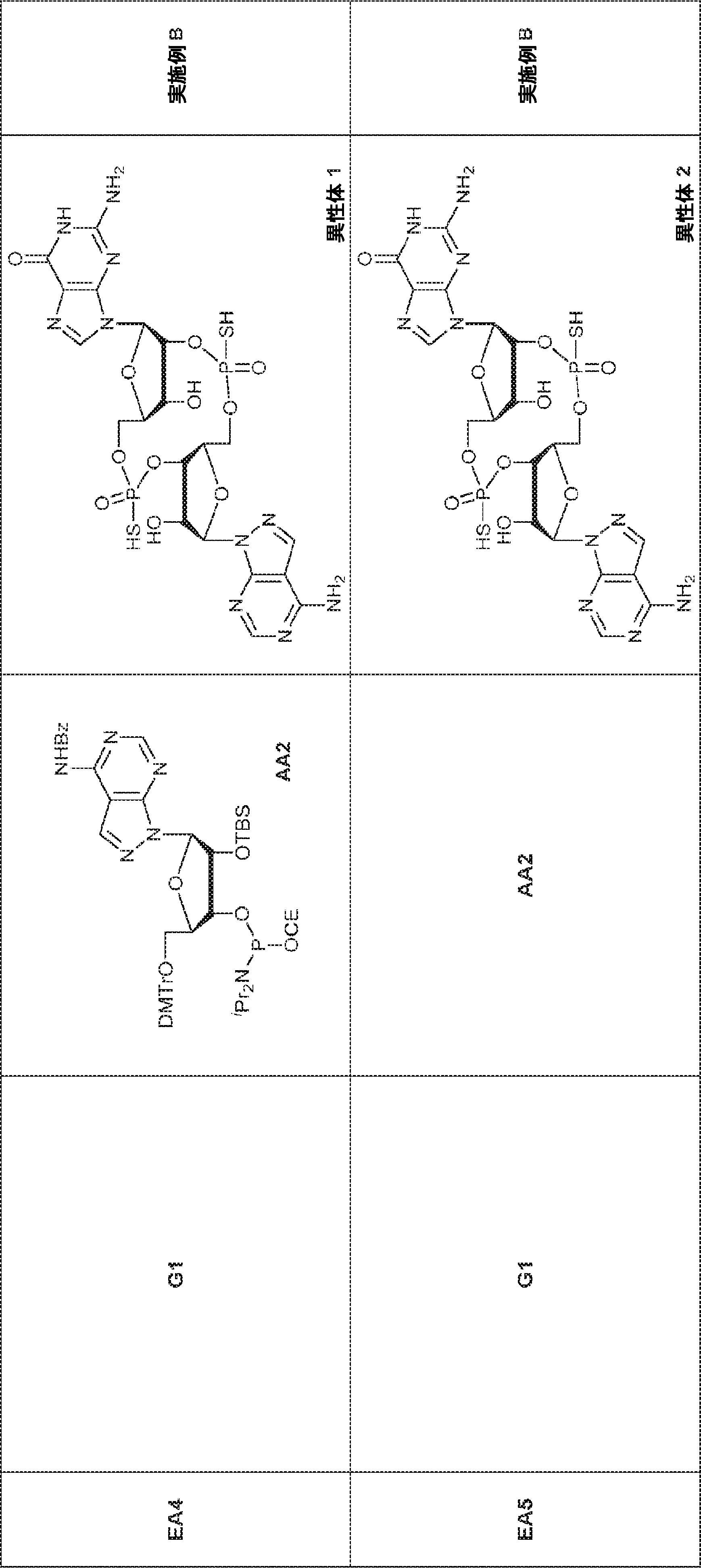
GB1(2.30g、2.4mmol)のMeCN(2.0mL)溶液に水(0.11mL、6.1mmol)およびトリフルオロ酢酸ピリジニウム(687mg、3.56mmol)を25℃で加える。25~30℃で30分間攪拌後、混合物を濃縮し、残渣をMeCN(20mL)に溶解させ、次にtert-ブチルアミン(10.5g、144mmol、15.0mL)を加える。25~30℃で30分間攪拌後、混合物を濃縮し、DCM(20mL)、続いてDCAのDCM溶液(6% v/v、18.2mL)を加える。混合物を25~30℃で30分間攪拌した後、TEAで約pH 7に中和し、濃縮し、C18逆相シリカゲルカラムクロマトグラフィー(0.1% TEA入りのMeCN/水 = 0%→40%)で精製してGB2を白色固体(800mg、収率63%)として得る。(MS: [M+H]+ 532.0)
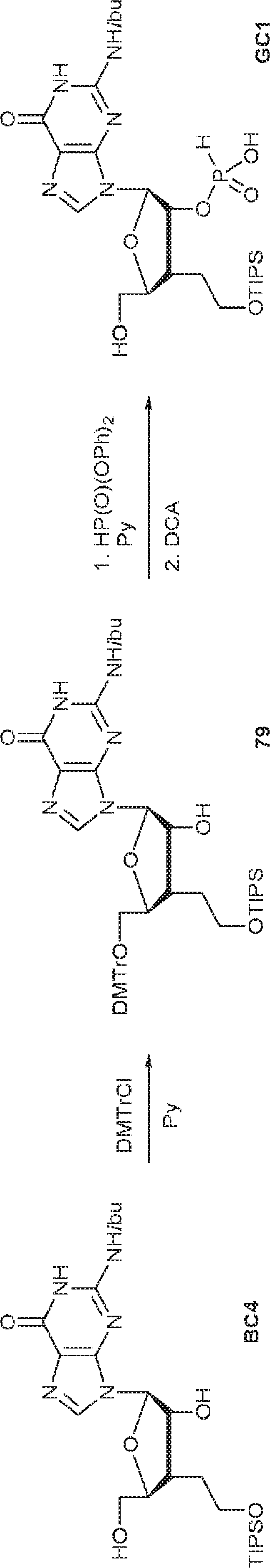
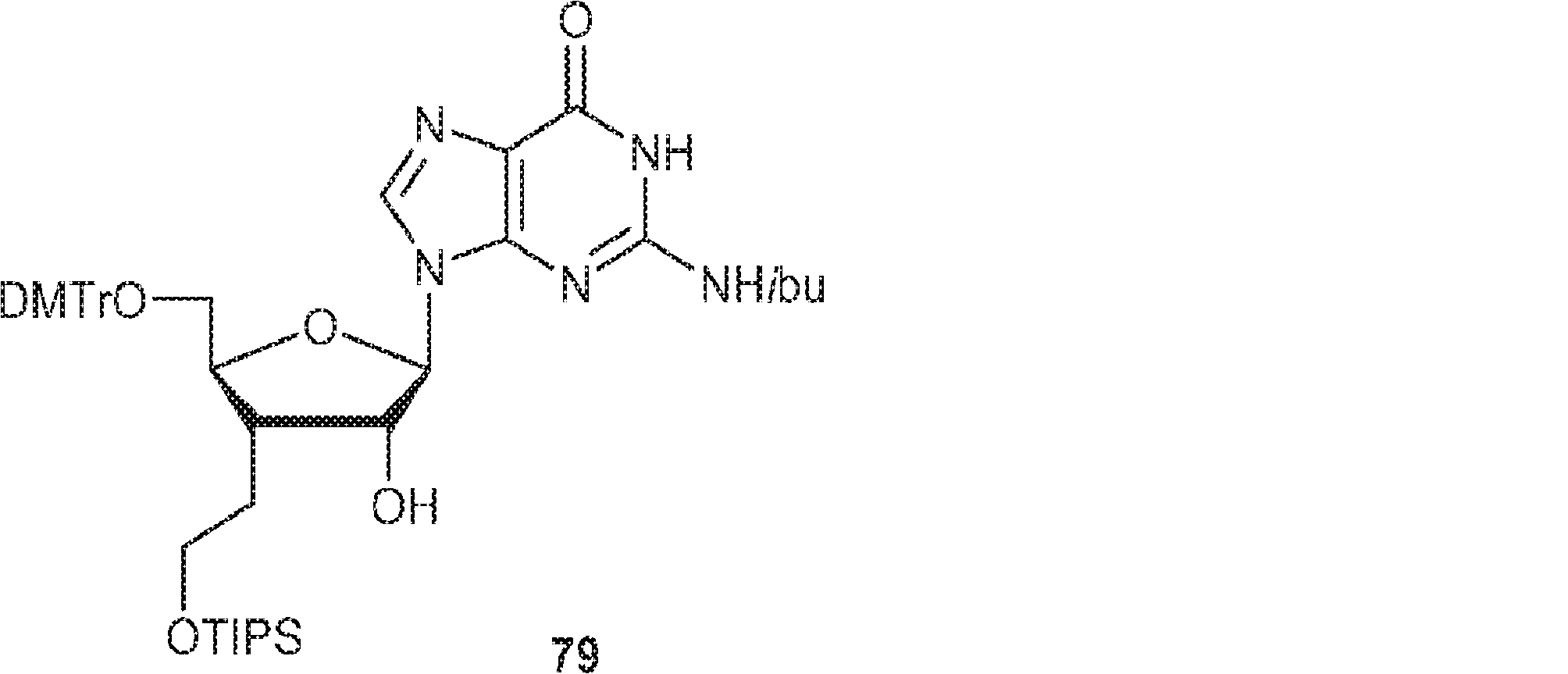
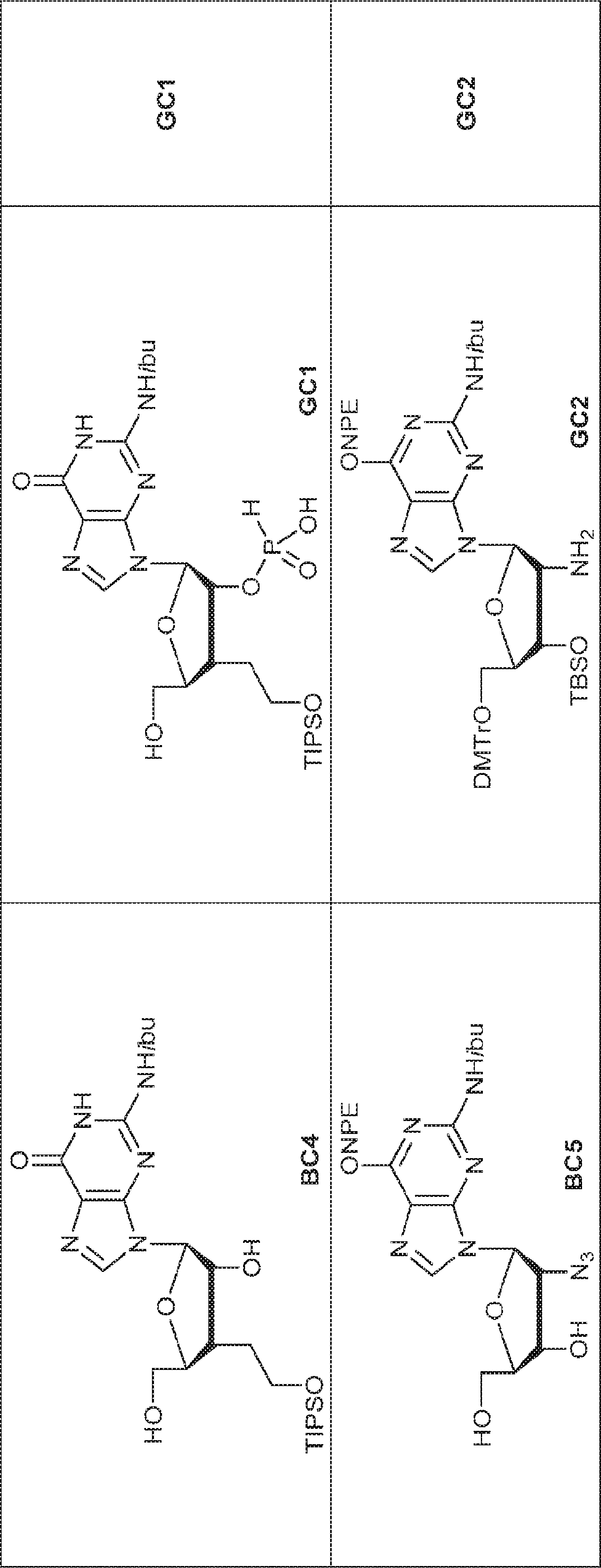
BC4(1.97g、2.4mmol)のPy(20mL)溶液にDMTrCl(984mg、2.90mmol)を25℃で加える。3時間攪拌後、MeOH(30mL)を加え、混合物を濃縮し、塩基性シリカゲルフラッシュクロマトグラフィー(EA/PE = 1/5→4/1)で精製して79を明黄色粉末(1.65g、収率82%)として得る。(MS: [M+H]+ 840.2)
79(2.0g、2.38mmol)のPy(15mL)溶液に亜リン酸ジフェニル(1.7g、7.1mmol、1.4mL)を加える。20℃で30分間攪拌後、飽和炭酸水素ナトリウム水溶液(30mL)を加え、混合物を1時間攪拌する。次に混合物をEA(30mL×3)で抽出する。一緒にした有機層を飽和炭酸水素ナトリウム水溶液(20mL)およびブライン(20mL)で洗浄し、無水硫酸ナトリウムで乾燥させ、濃縮する。次に残渣をDCM(40mL)に溶解させ、続いて水(0.4mL)およびDCA(DCM中6% v/v、40mL)を加える。20℃で15分間攪拌後、混合物をTEAで約pH 7に中和し、濃縮し、逆相シリカゲルカラムクロマトグラフィー(MeCN/水 = 25%→90%)で精製してGC1を白色固体(1.3g、収率90%)として得る。(MS: [M+H]+ 602.1)
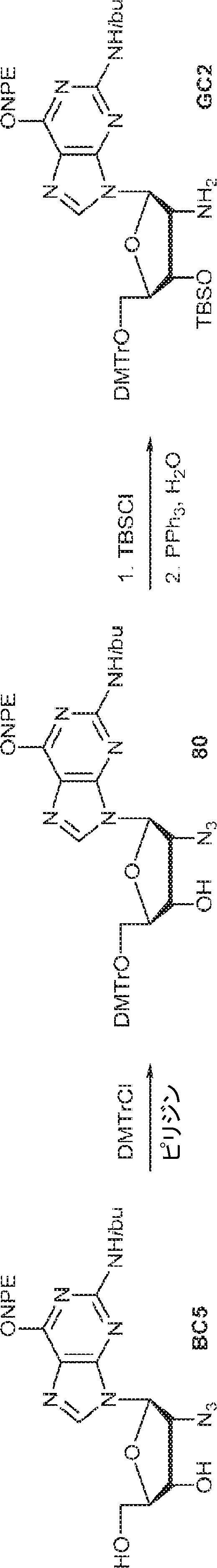
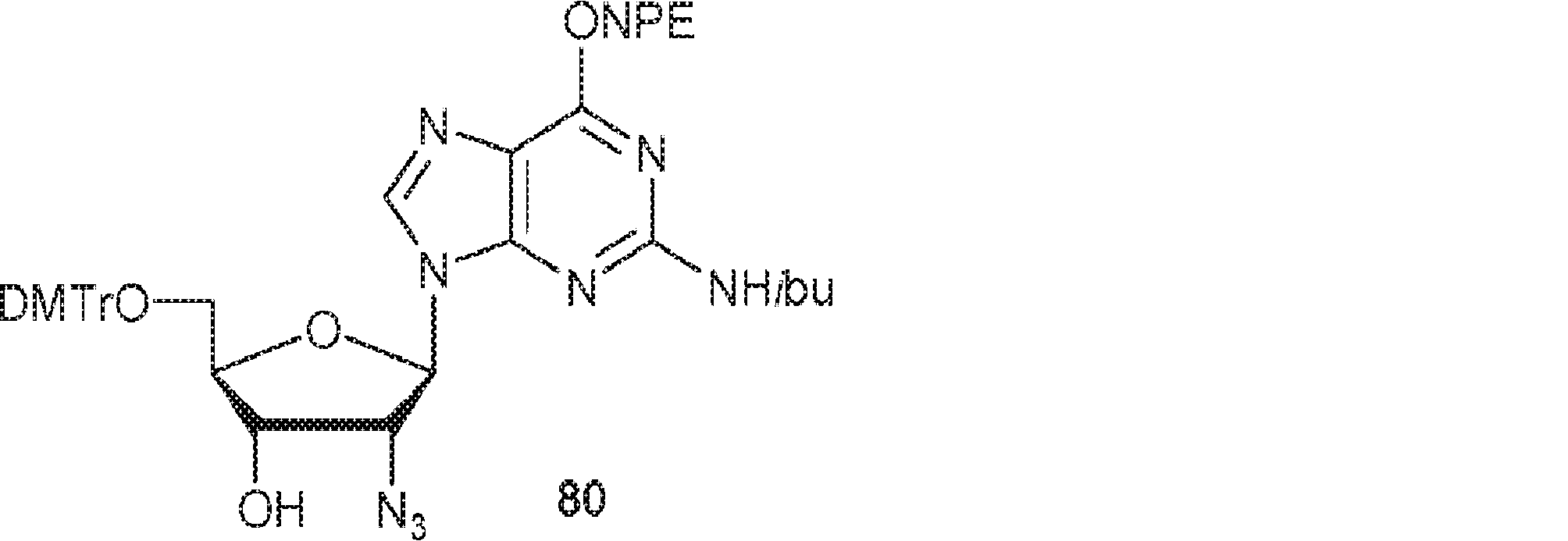
BC5(900mg、1.71mmol)のPy(10mL)溶液にDMTrCl(809mg、2.39mmol)を15℃で加える。15℃で12時間攪拌後、MeOH(0.5mL)を加え、混合物を濃縮し、シリカゲルカラムクロマトグラフィー(MeOH/DCM = 1/50)で精製して80を黄色油状物(1.0g、収率71%)として得る。(MS: [M+H]+ 528.2)
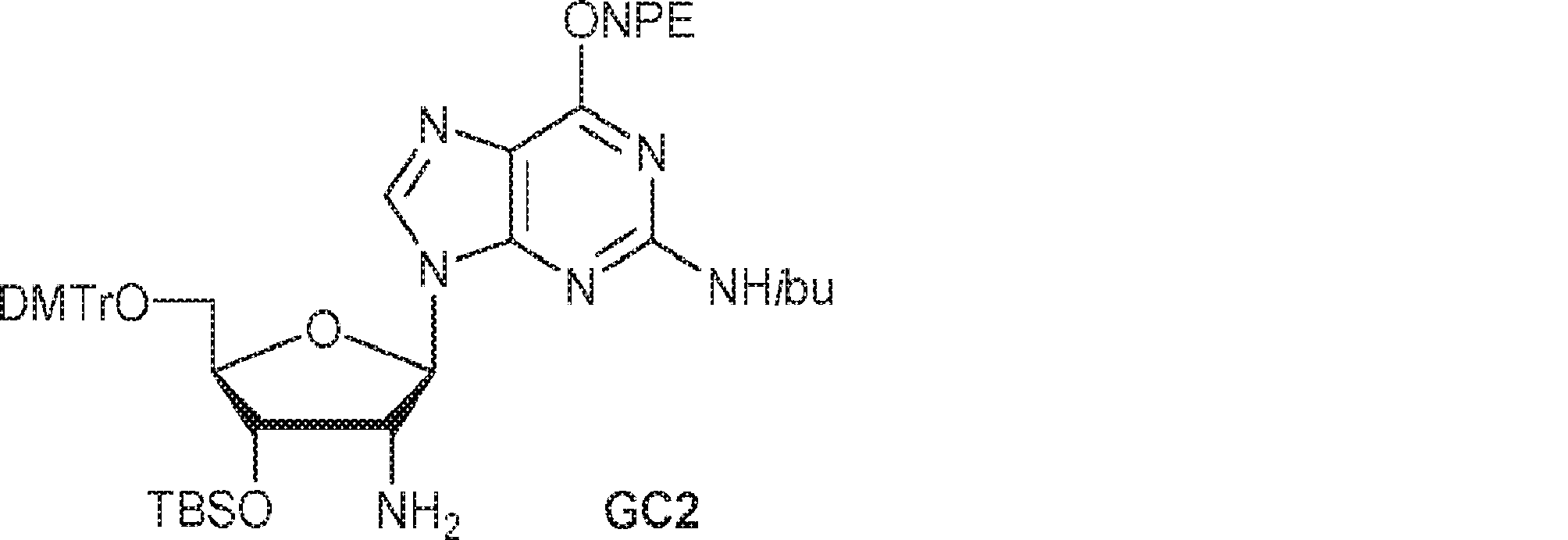
80(2.05g、2.47mmol)のDMF(5.0mL)溶液にImid(673mg、9.88mmol)およびTBSCl(745mg、4.94mmol、0.61mL)を15℃で加える。15℃で12時間攪拌後、混合物を濃縮し、残渣を水(10mL)でトリチュレートする。次に固体を収集し、水(10mL×2)、PE(10mL×2)で洗浄し、乾燥させ、THF(18mL)に溶解させた後、PPh3(1.11g、4.24mmol)を15℃で加える。15℃で2.5時間攪拌後、水(0.16mL)を加え、混合物を50℃で12時間攪拌する。次に溶液を濃縮し、逆相分取HPLC(0.1% TEA入りのMeOH/水 = 20%→80%)で精製してGC2を白色固体(900mg、収率58%)として得る。(MS: [M+H]+ 918.1)
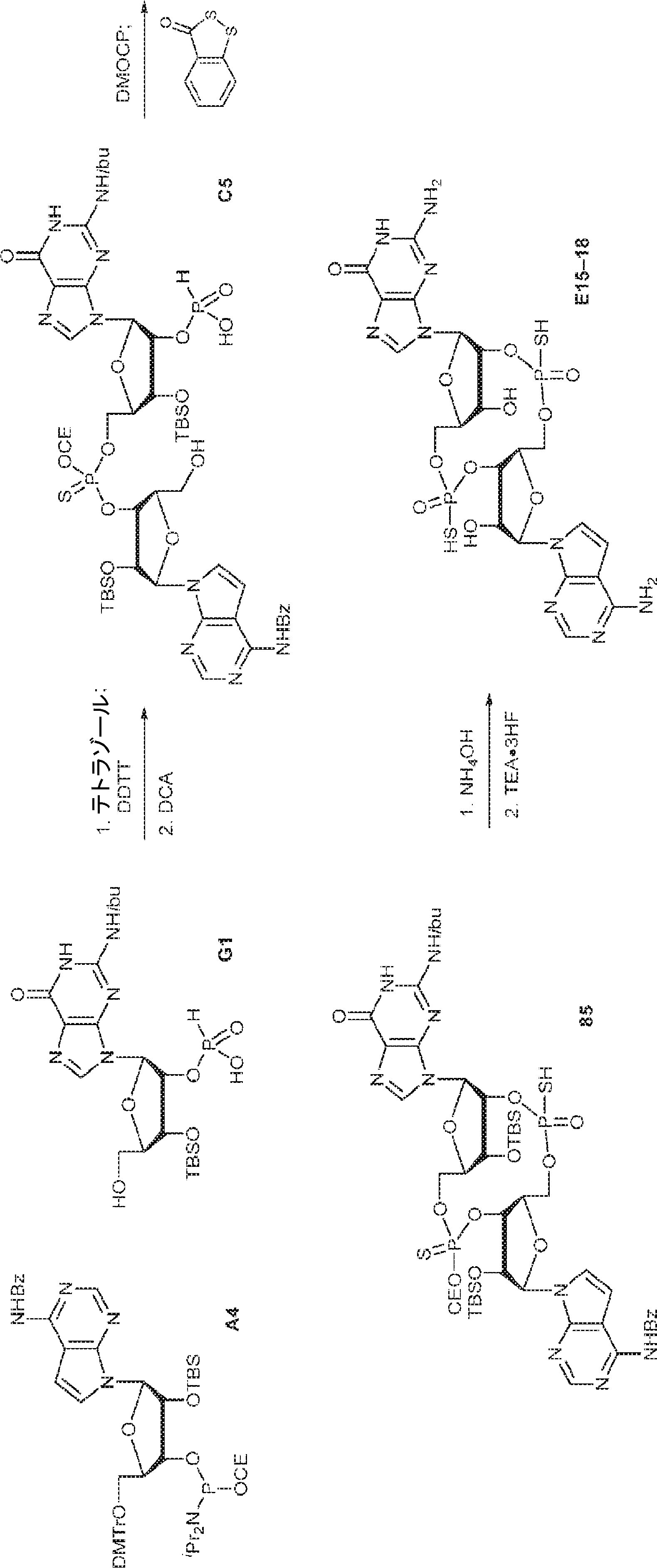
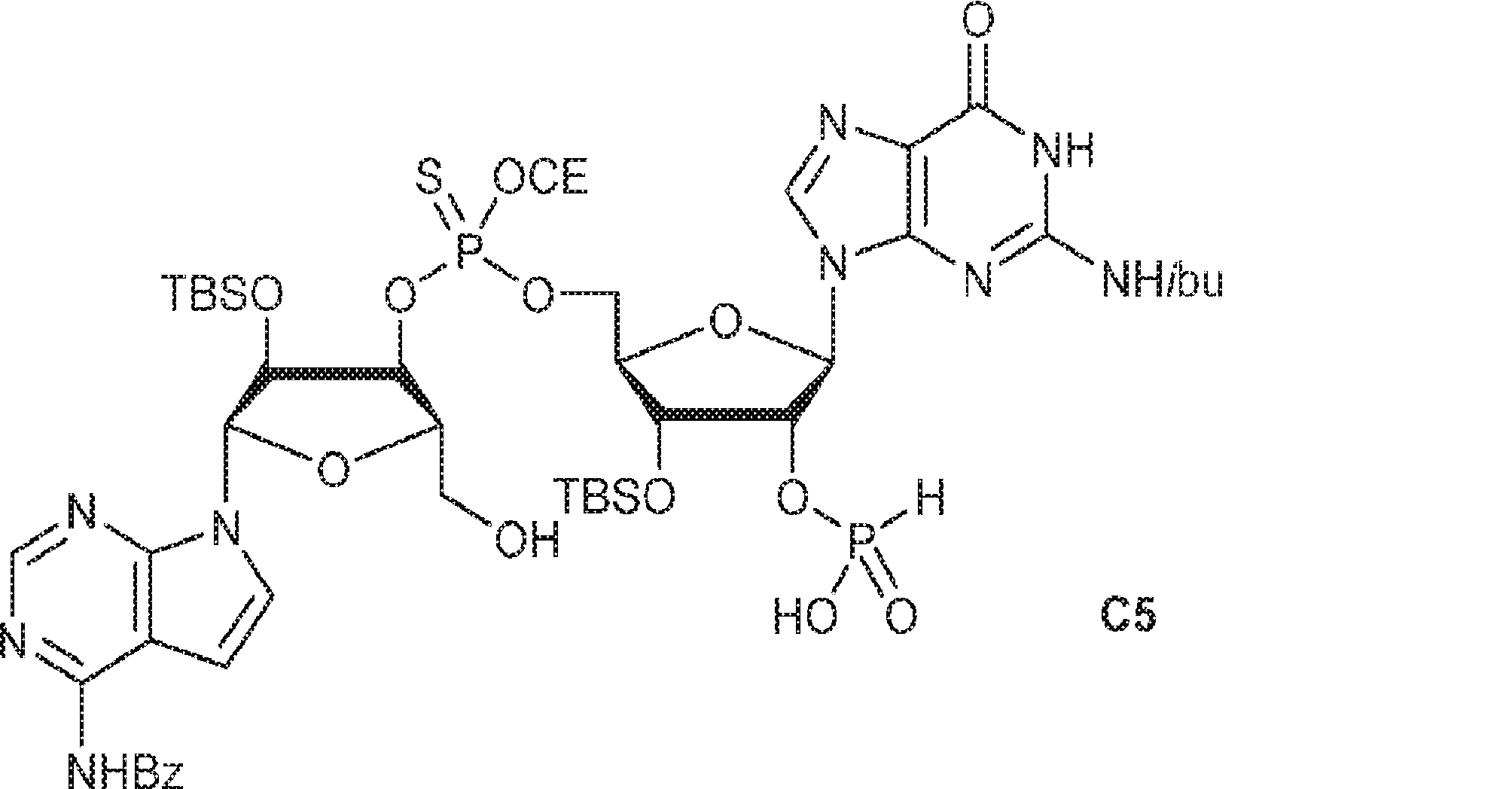
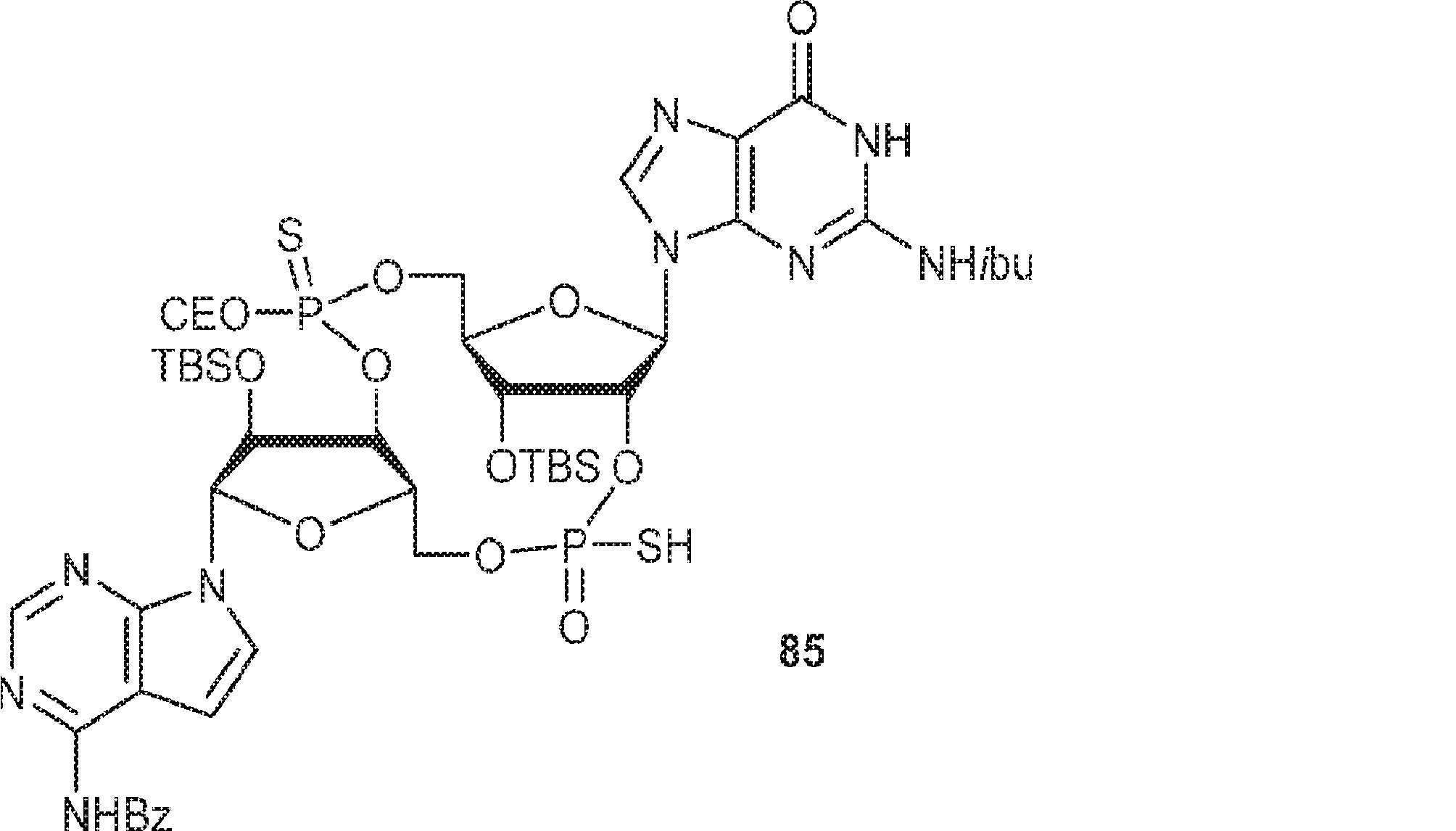
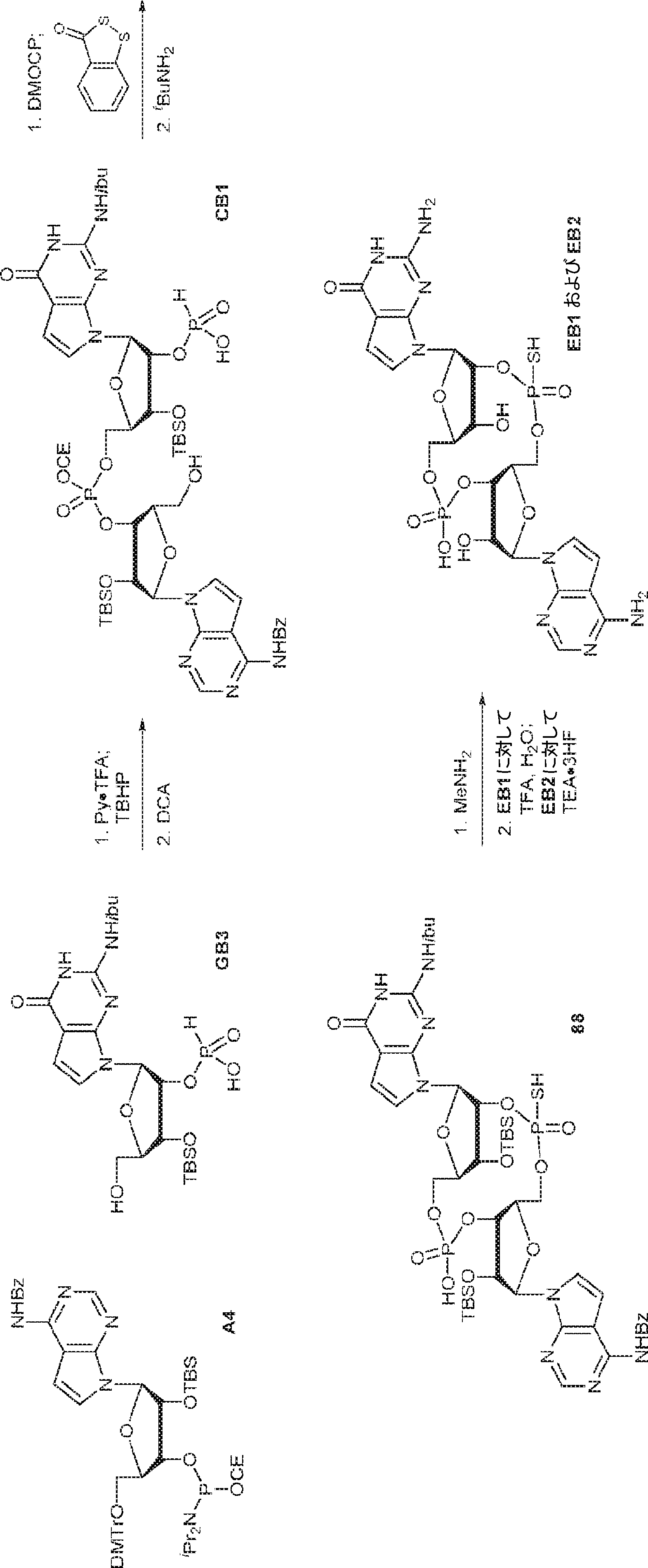
粗生成物G1(Py・DCA塩を含むG2・TEA塩(0.2mmol)187mgから得た)のMeCN(0.5mL)溶液にA2(0.26g、0.26mmol)のMeCN(0.2mL)溶液を加える。30分間攪拌後、DDTT(46mg、0.22mmol)を加え、混合物を1時間攪拌し、次に濃縮する。残渣をDCM(4.8mL)に溶解させ、水(0.036mL)およびDCA(DCM中6%、4.8mL)を加える。10分間攪拌後、Py(1mL)を加え、混合物を濃縮し、シリカゲルカラムクロマトグラフィー(MeOH/DCM = 1/10→1/5)で精製してC1・Py塩を白色固体(86mg、収率35%)として得る。(MS: [M+H]+ 1148.0)
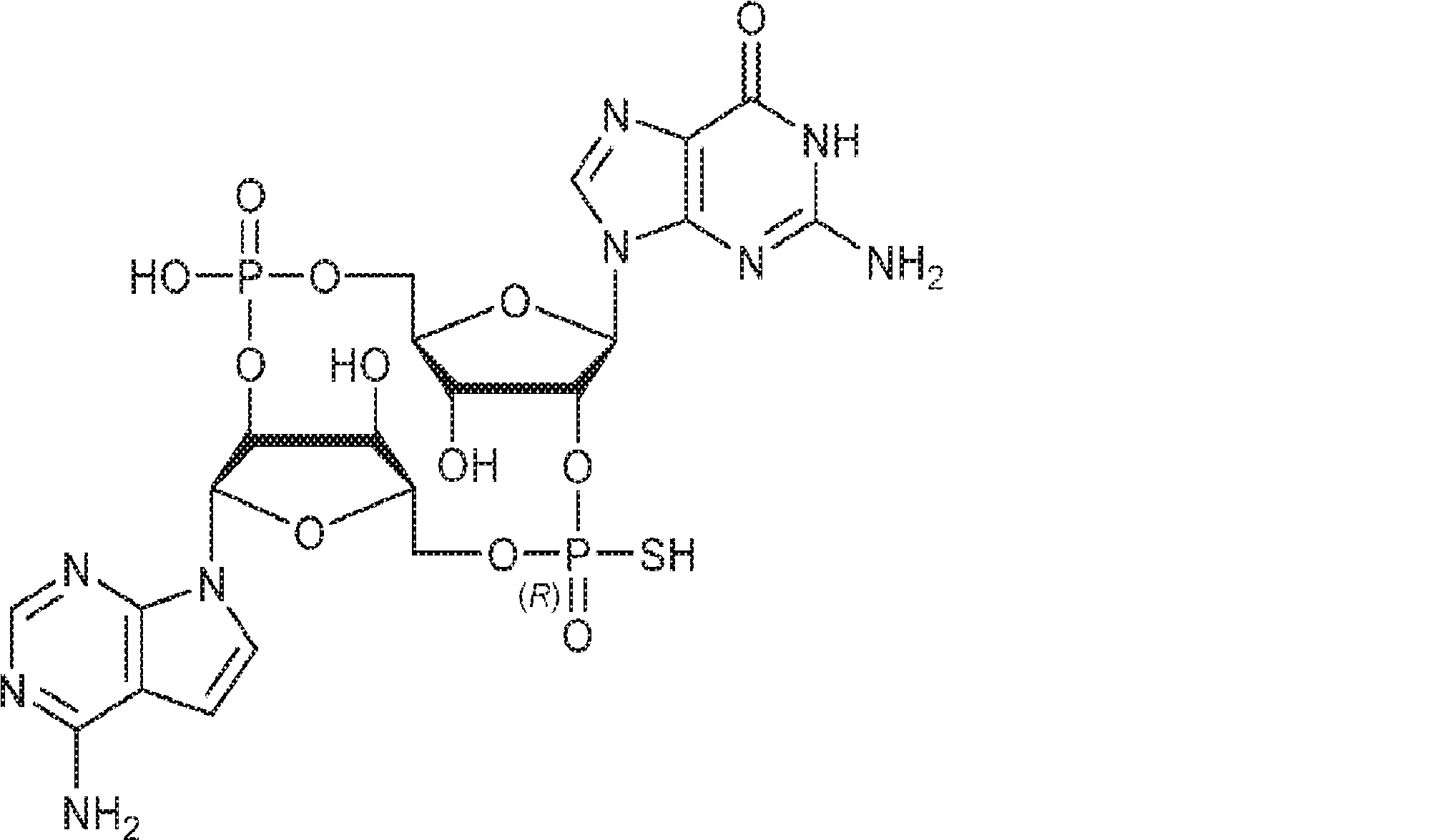
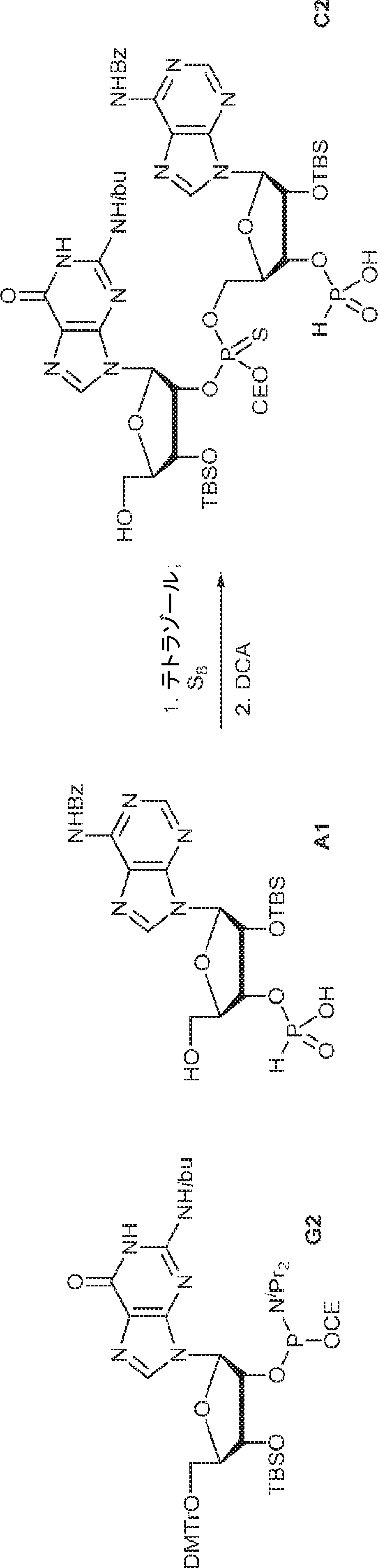
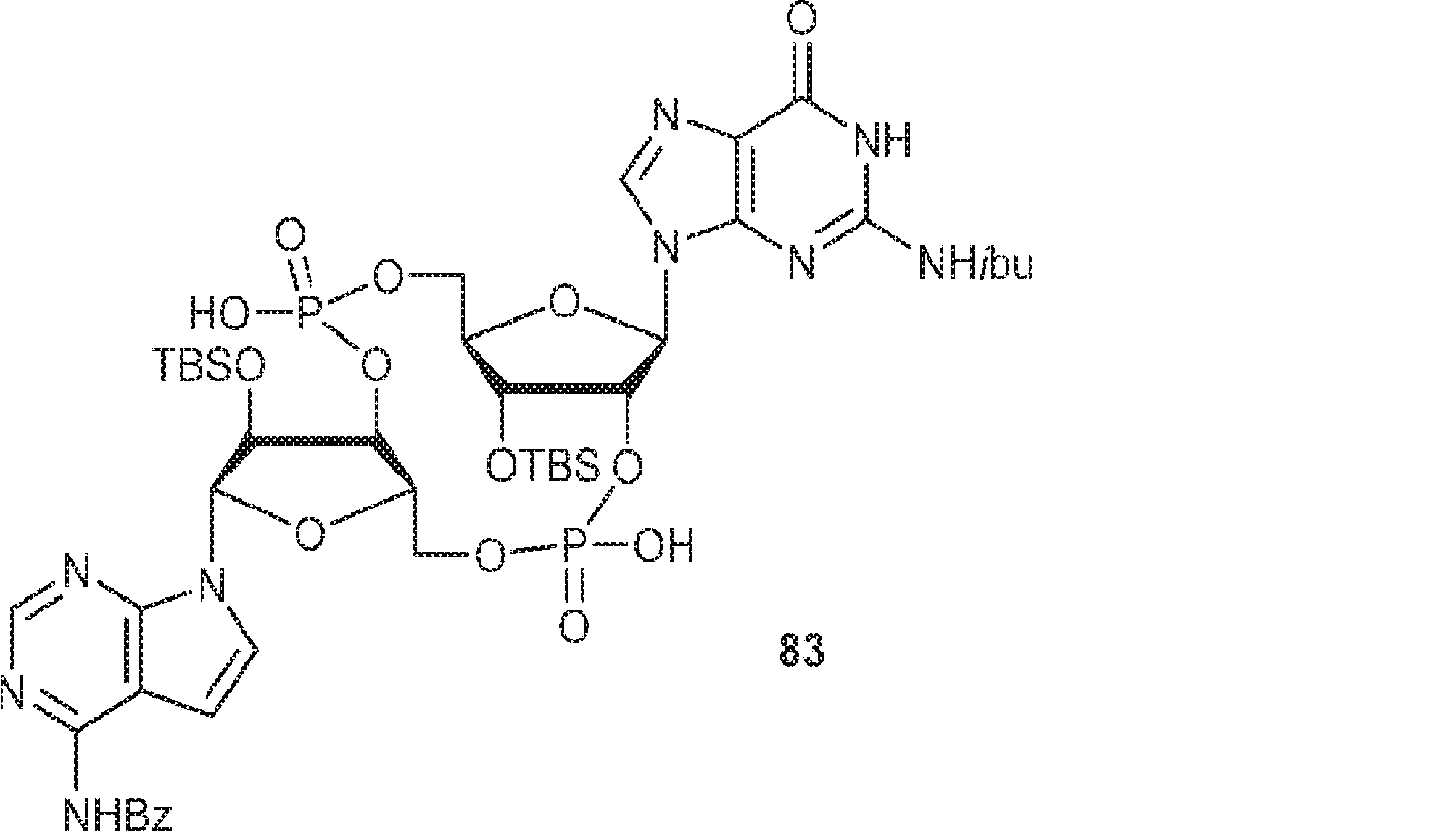
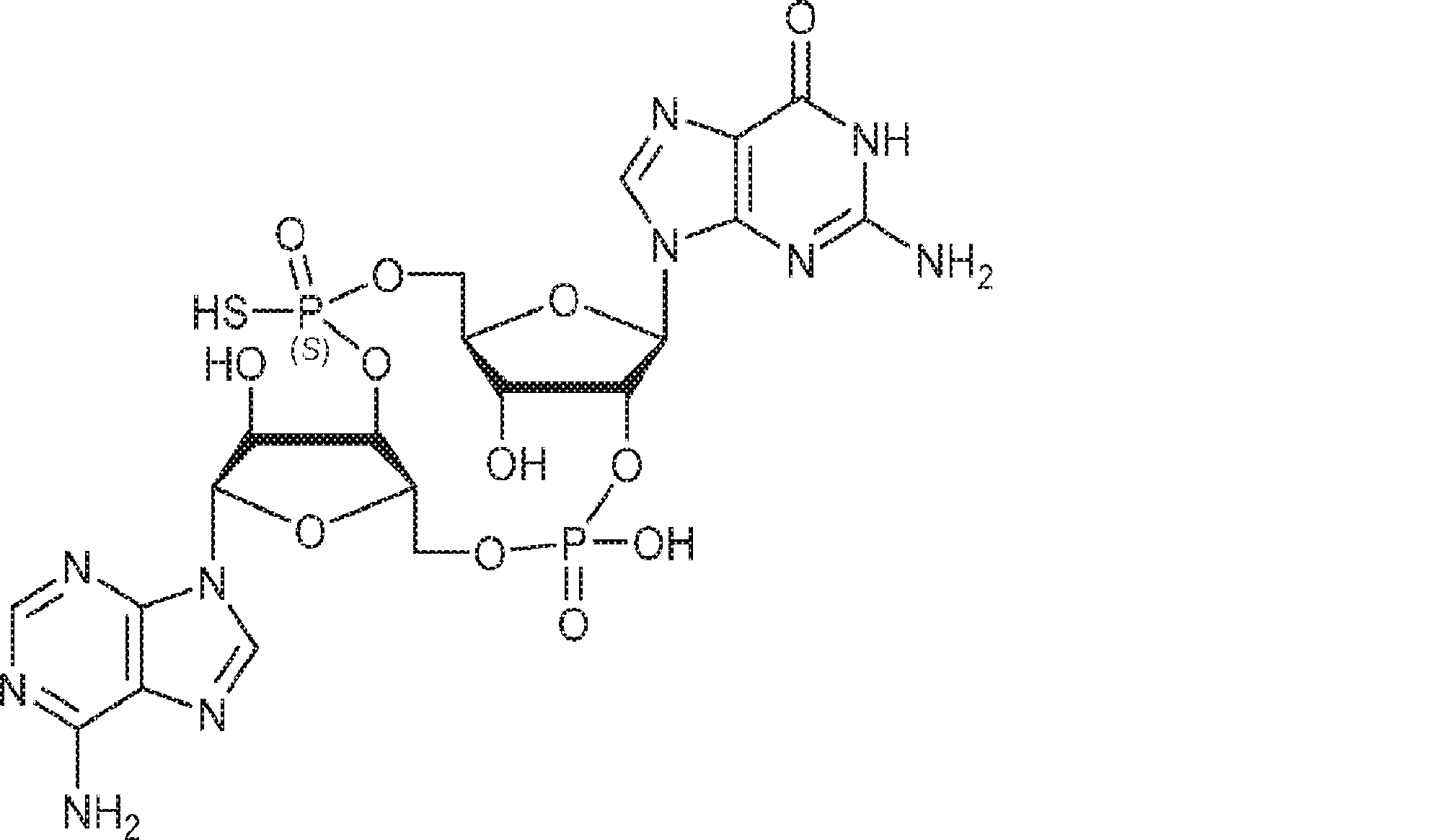
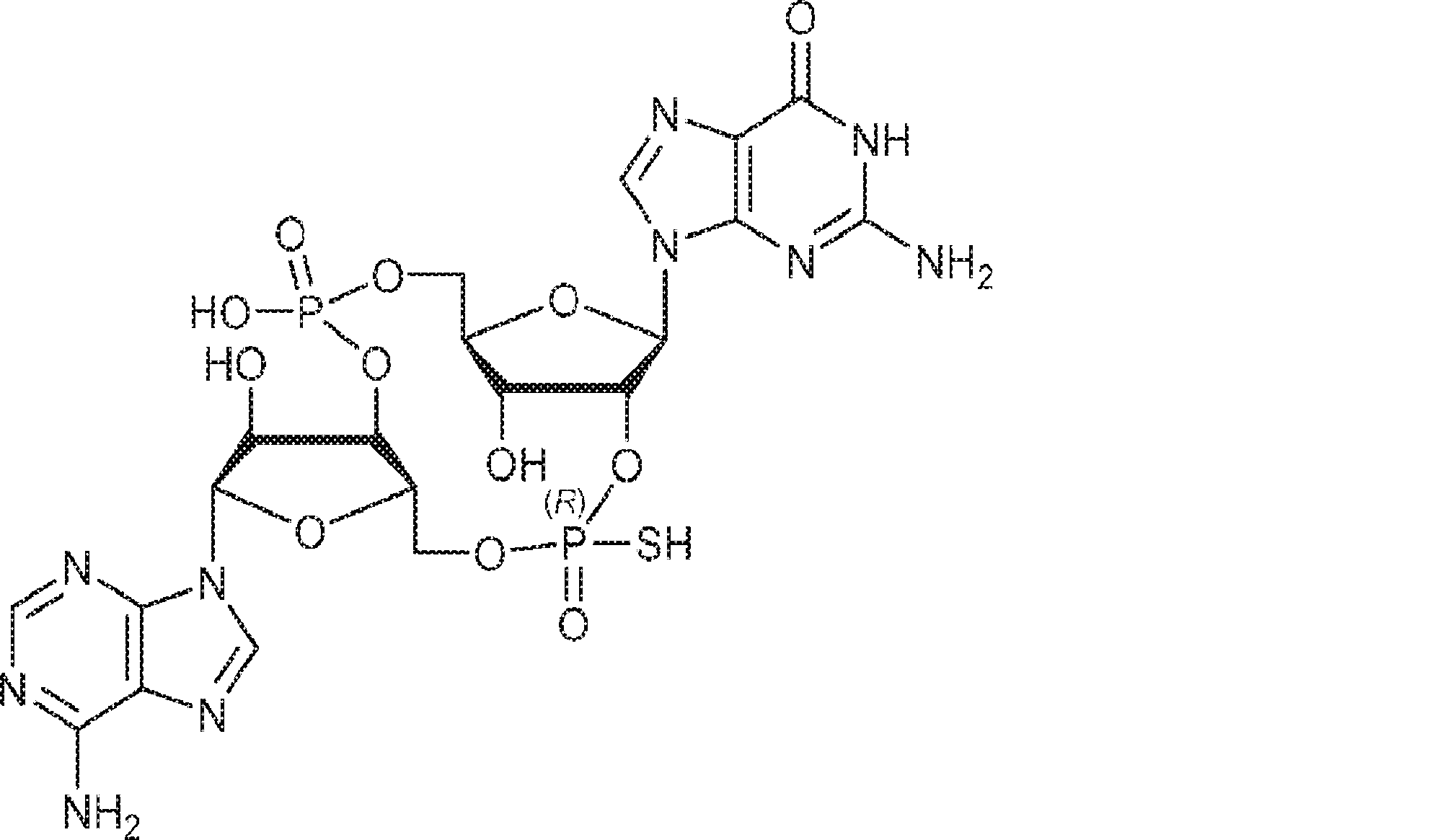
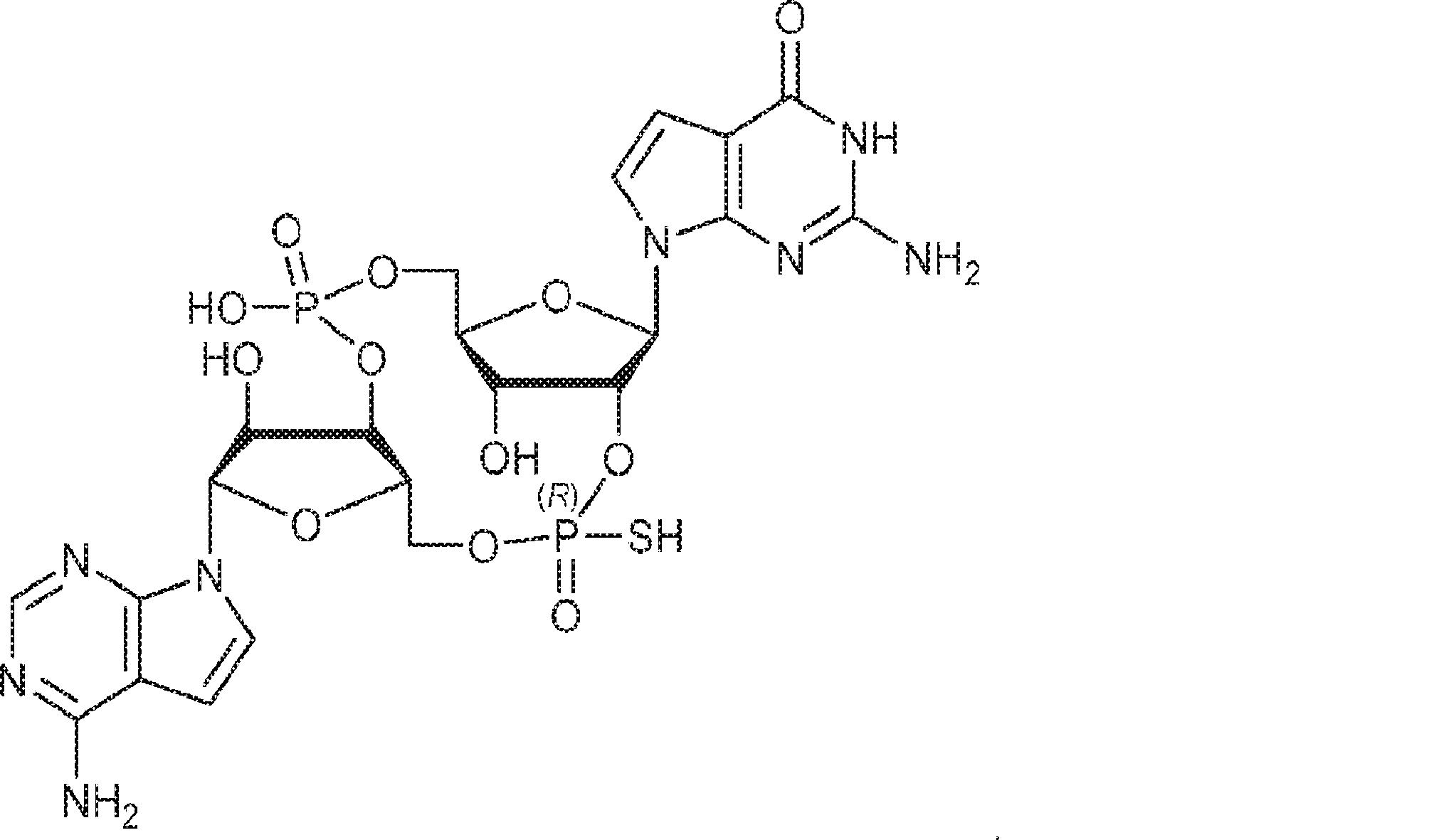
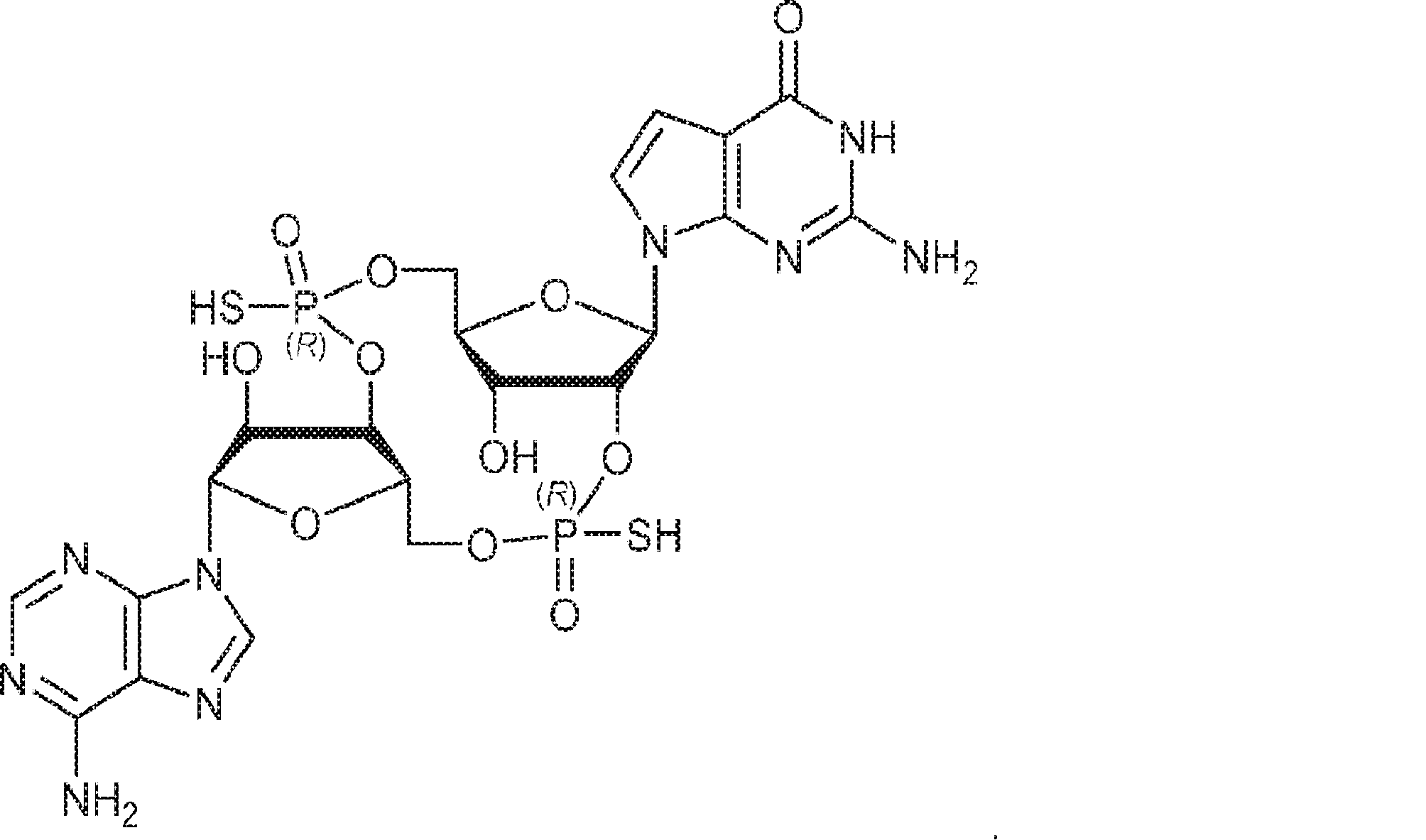
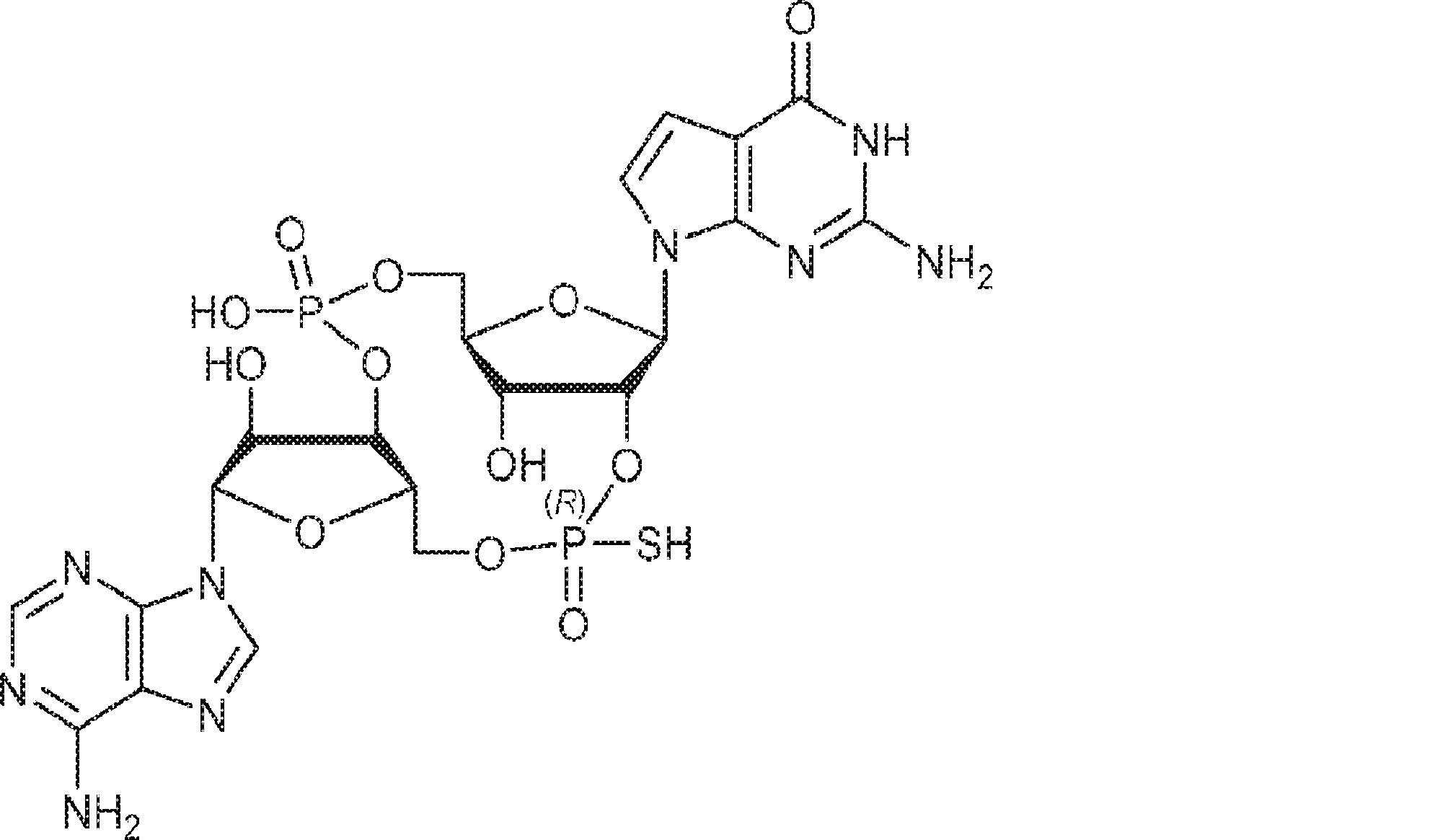
A1(1.0g、1.82mmol、MeCN 20mL×3と共蒸発)およびG2(2.3g、2.37mmol、MeCN 20mL×3と共蒸発)の混合物にテトラゾール(MeCN中0.45M、10mL)を25℃で加え、1時間攪拌した後、元素硫黄(1.75g、6.84mmol)を加える。1時間攪拌後、MeCN(20mL)を加え、混合物を濾過し、濃縮する。残渣をDCM(100mL)に溶解させ、DCA(1.96g、15.2mmol、1.25mL)を加える。25℃で2時間攪拌後、飽和炭酸水素ナトリウム水溶液(100mL)を加える。層を分離し、水層をEA(100mL×3)で抽出する。一緒にした有機層を無水硫酸ナトリウムで乾燥させ、濾過し、濃縮し、逆相シリカゲルカラムクロマトグラフィー(0.1% TEA入りのMeCN/水 = 0%→100%)で精製してC2・TEA塩を白色固体(100mg、収率5%)として得る。(MS: {[M+2H]2+}/2 574.6)
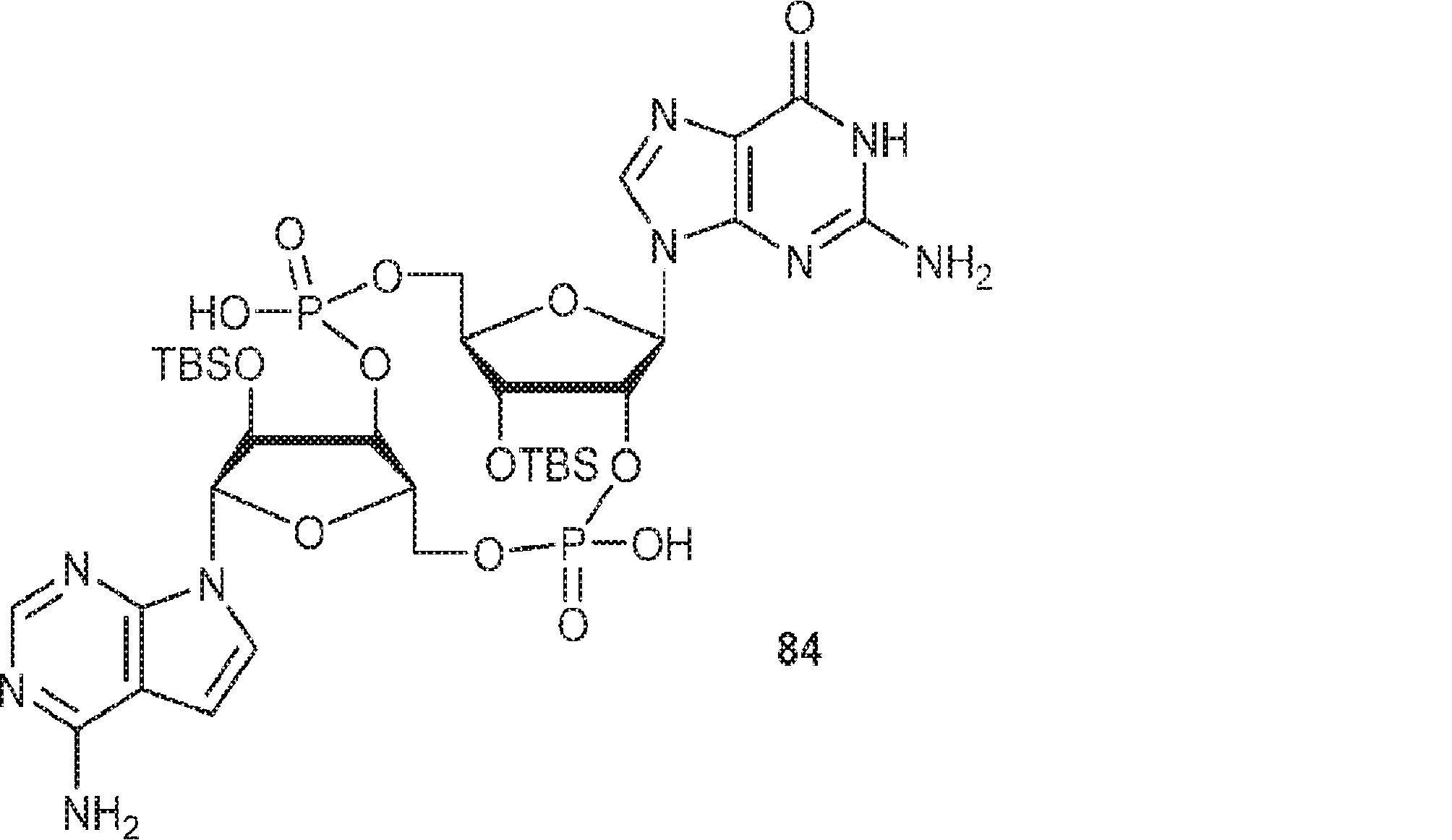
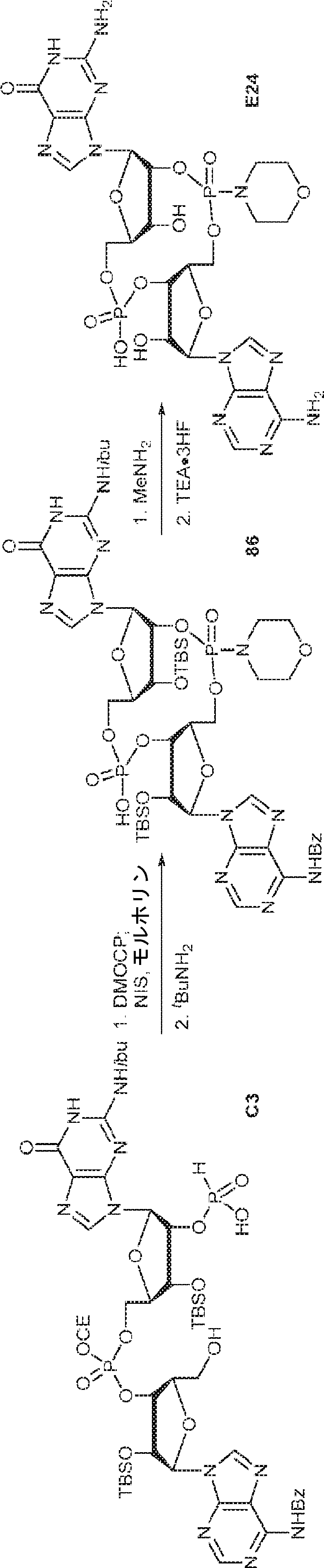
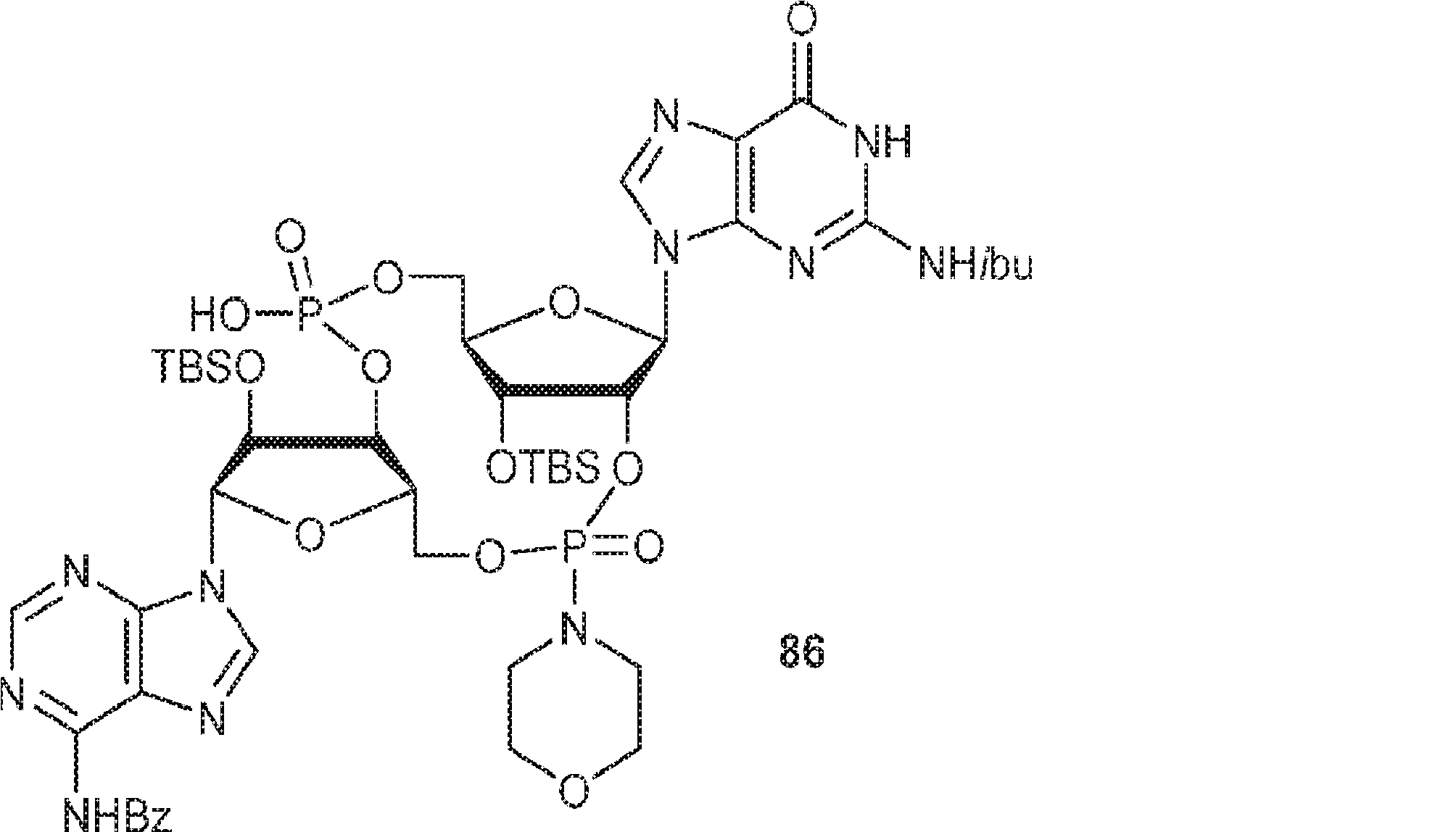
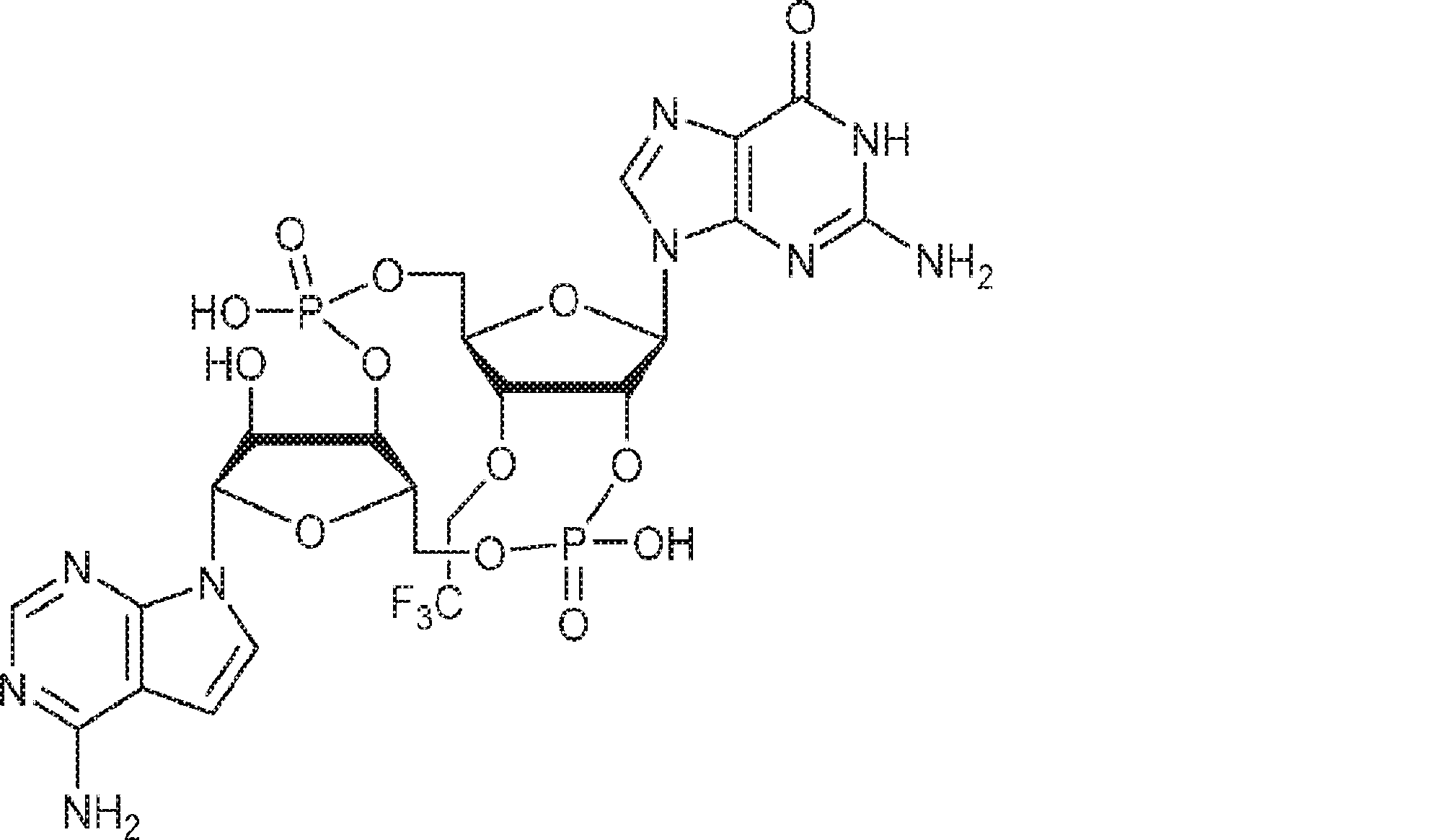
3Å MS(100mg)で30分間処理された、A2(510mg、0.52mmol、MeCN 5mL×3と共蒸発)のMeCN(1mL)溶液に、3Å MS(50mg)で30分間処理された、G1(250mg、0.47mmol、MeCN 5mL×3と共蒸発)およびトリフルオロ酢酸ピリジニウム(109mg、0.56mmol、MeCN 5mL×3と共蒸発)のMeCN(1.5mL)中混合物を加える。4時間攪拌後、TBHP(デカン中5.5M、0.26mL)を加え、混合物を30分間攪拌し、次に亜硫酸水素ナトリウム水溶液(33%、0.24mL)を0℃で加える。次に混合物を室温で10分間攪拌した後、濾過し、濃縮する。残渣をDCM(6.2mL)に溶解させ、続いて水(0.09mL)、およびDCM(6.2mL)中DCA(0.37mL)を加える。室温で10分間攪拌後、Py(0.73mL、9.05mmol)およびDCM(35mL)を加える。混合物を水(10mL×2)で洗浄し、一緒にした水層をジクロロメタン(10mL×2)で抽出する。一緒にした有機層を無水硫酸ナトリウムで乾燥させ、濃縮し、シリカゲルカラムクロマトグラフィー(MeOH/CH2Cl2/Py = 10:89.5:0.5→25:74.5:0.5)で精製してC3を白色固体(250mg、47%)として得る。(MS: [M+H]+ 1132.2)
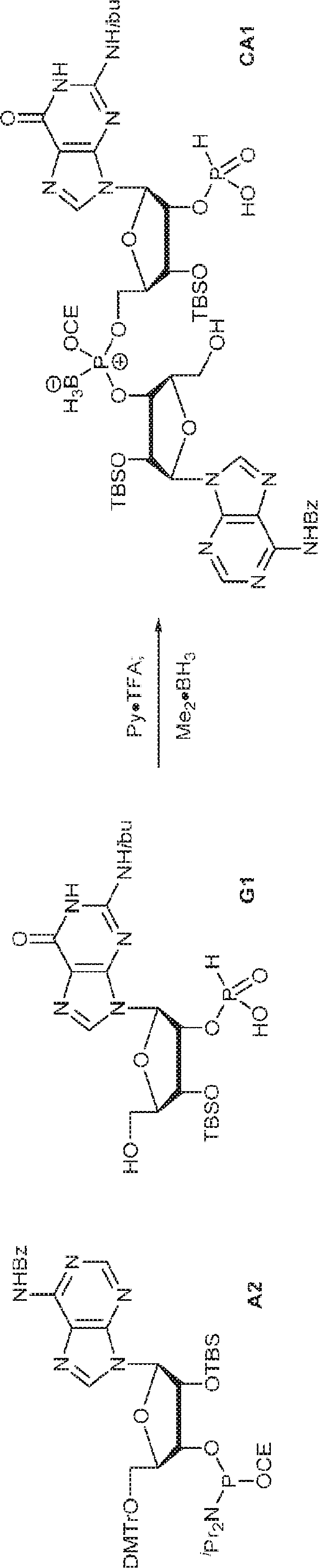
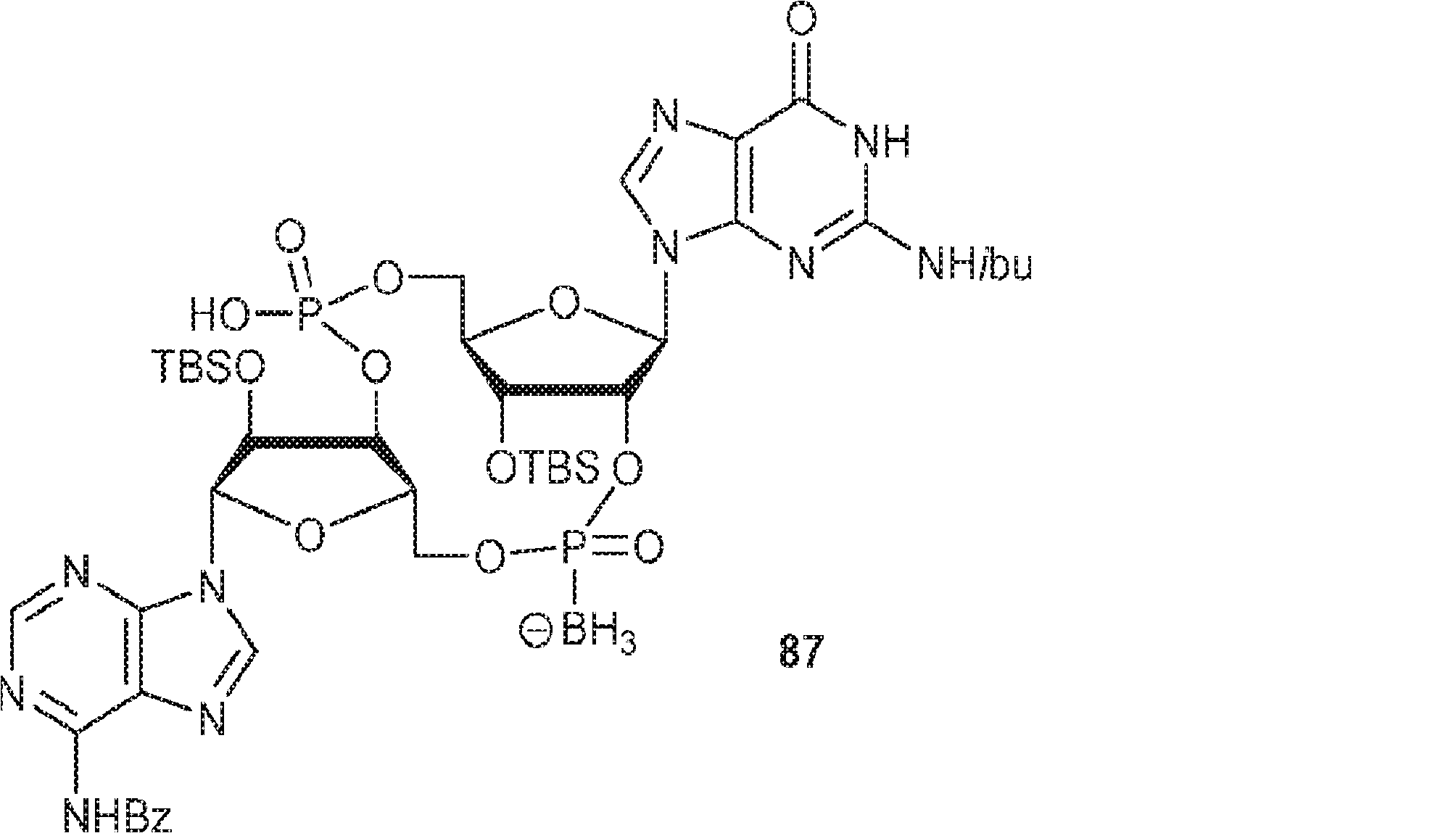
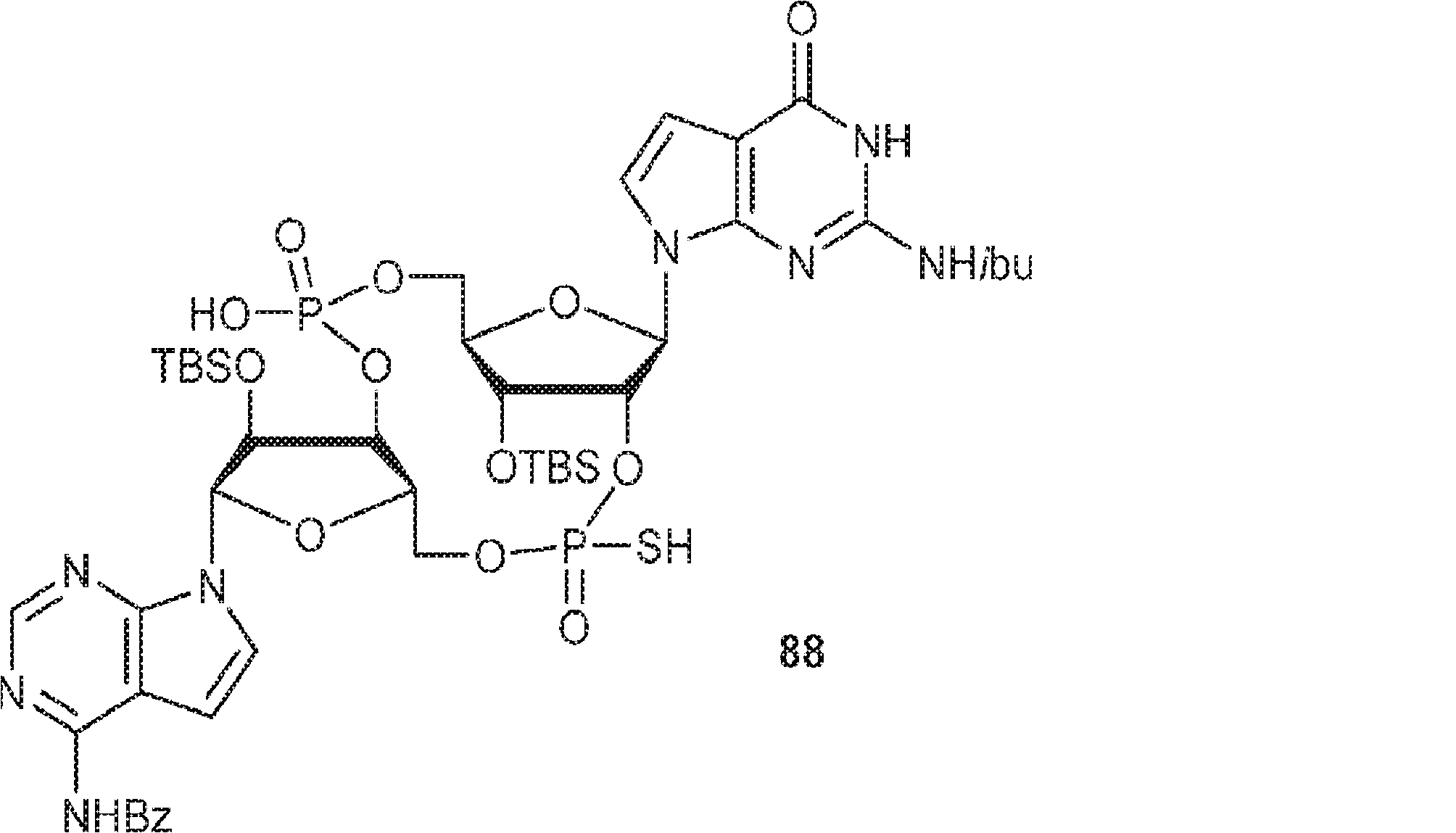
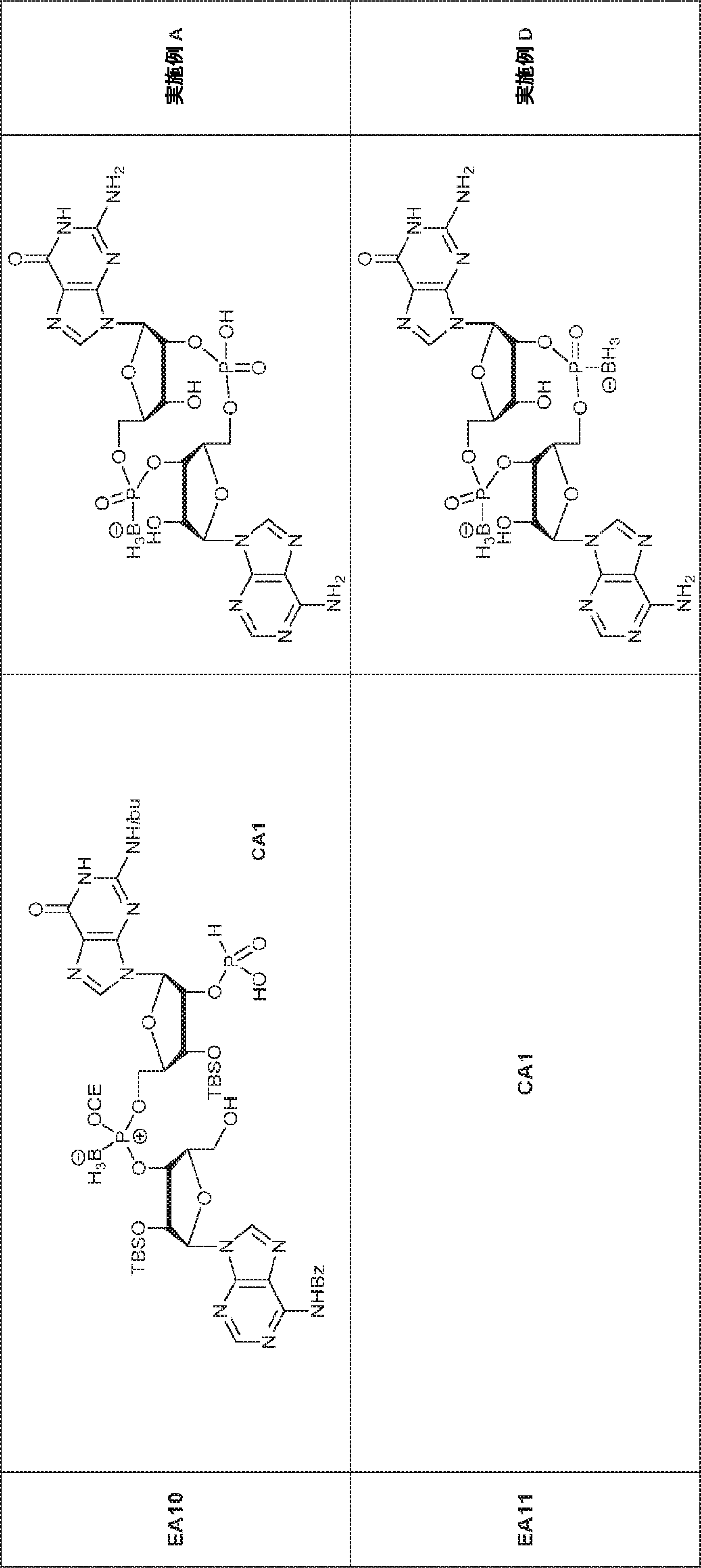
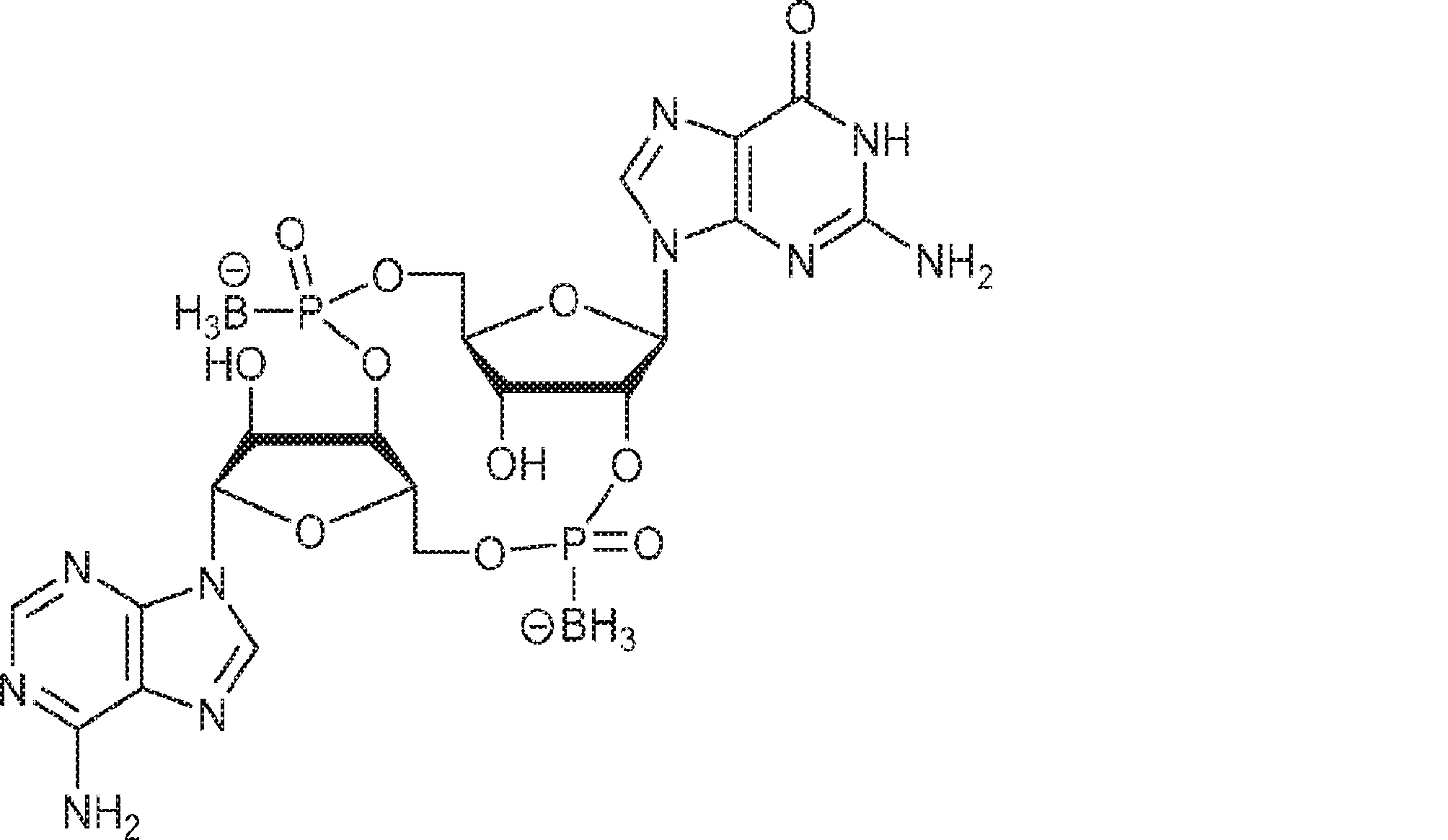
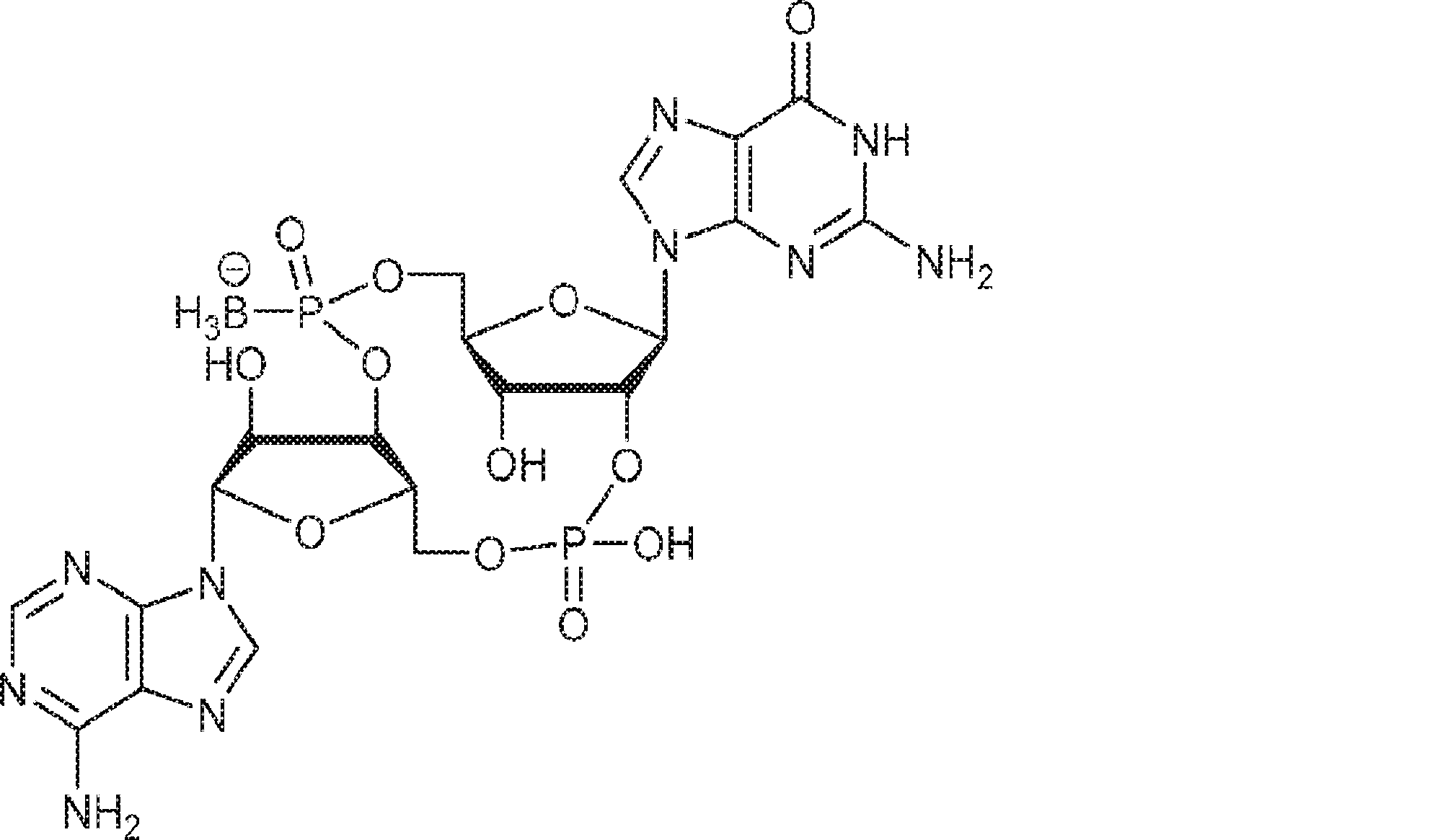
3Å MS(100mg)で30分間処理された、G1(500mg、0.94mmol、MeCN 10mL×3と共蒸発)およびトリフルオロ酢酸ピリジニウム(218mg、1.13mmol、MeCN 10mL×3と共蒸発)のMeCN(3mL)溶液に、3Å MS(200mg)で30分間処理された、A2(976mg、0.99mmol、MeCN 10mL×3と共蒸発)のMeCN(2mL)溶液を加える。室温で2.5時間攪拌後、混合物を濃縮し、MeCN(10mL×2)と共蒸発させる。次に残渣をDCM(20mL)に溶解させ、続いてボランジメチルスルフィド錯体(THF中2M、0.94mL、1.88mmol)を滴下する。室温で1時間攪拌後、MeOH(0.17mL)を0℃で加え、20分間攪拌した後、濃縮して粗生成物CA1を得る。
GC2(802mg、0.87mmol)のDMF(5mL)溶液に3,4-ジメトキシ-3-シクロブテン-1,2-ジオン(186mg、1.31mmol)を15℃でゆっくりと加える。15℃で2時間攪拌後、混合物を濃縮し、逆相分取HPLC(0.1% TEA入りのMeCN/水 = 0%→100%)で精製して所望の生成物と未同定の副生成物との混合物(0.7g、純度約84%)を得る。(MS: [M+H]+ 1028.4)
上記で得た81(純度約84%、0.6g)およびAC1(0.64g、1.17mmol)のDMF(5.0mL)溶液にTEA(177mg、1.75mmol、0.24mL)を15℃で加える。15℃で12時間攪拌後、混合物を濃縮し、残渣をDCM(5.0mL)に溶解させた後、DCA(470mg、3.65mmol、0.3mL)を加える。次に混合物を15℃で15分間攪拌した後、濃縮する。残渣を逆相分取HPLC(0.1% TEA入りのMeCN/水 = 0%→100%)で精製してCC1を白色固体(0.54g、2工程で収率40%)として得る。(MS: [M+H]+ 1242.3)
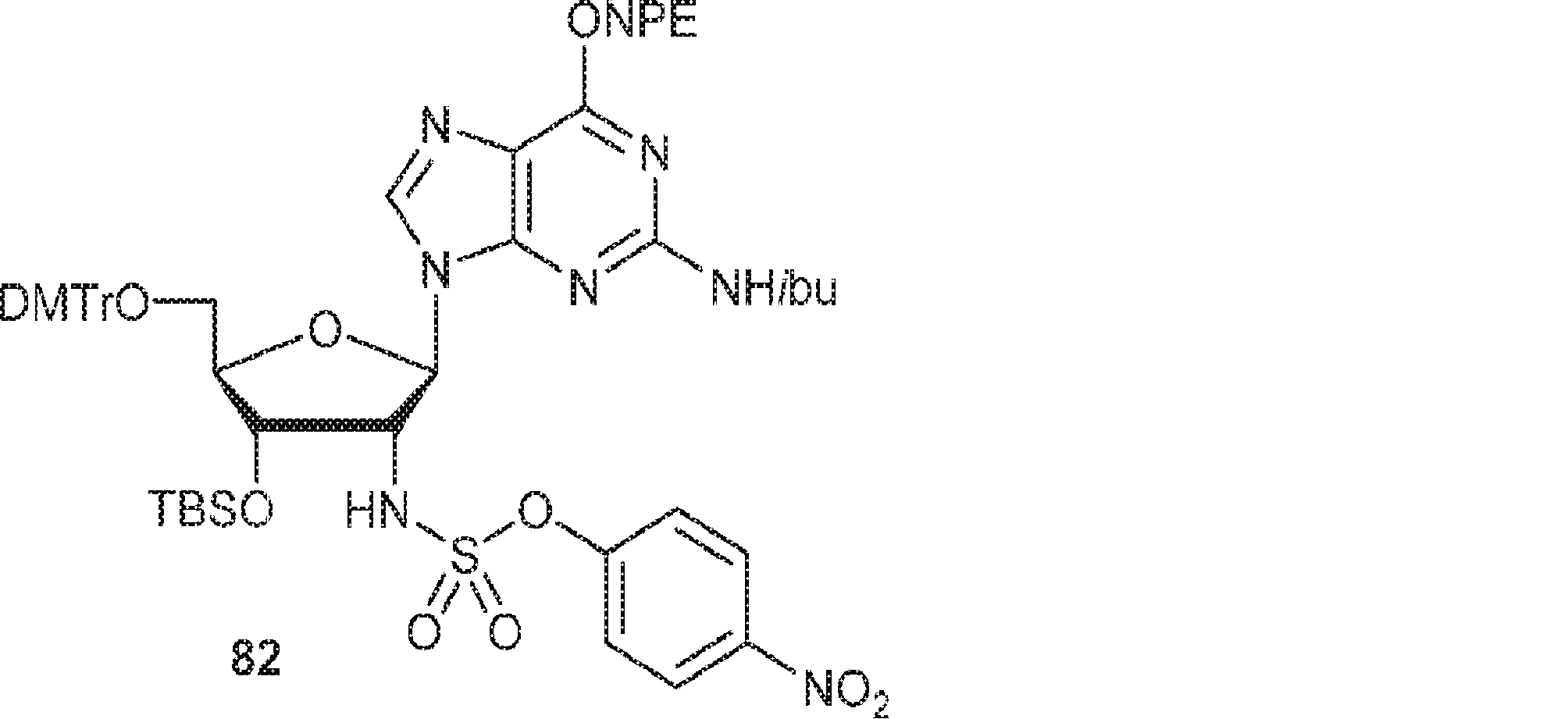
クロロ硫酸4-ニトロフェニル(0.31g、1.31mmol)のDCM(1.0mL)溶液にGC2(0.40g、0.44mmol)、4-ニトロフェノール(0.61g、4.4mmol)、およびTEA(0.73mL、5.23mmol)のDCM(5mL)溶液を-78℃で加える。30分間攪拌後、混合物を室温に昇温させ、DCM(20mL)で希釈し、水(20mL×3)で洗浄する。一緒にした水層をDCM(20mL×2)で抽出し、一緒にした有機層を無水硫酸マグネシウムで乾燥させ、濾過し、濃縮し、シリカゲルカラムクロマトグラフィー(EA/1% TEA入りのPE = 1/5→1/2)で精製して82(0.30g、収率59%)を白色固体として得る。(MS: [M+H]+ 1118.9)
82(0.2g、0.18mmol)のTHF(1.0mL)、4Å MS(0.05g)、およびTEA(0.12mL、0.89mmol)溶液にAC1(0.12g、0.21mmol)を加える。12時間攪拌後で、混合物をTHF(2mL)で希釈し、濾過し、濃縮する。次に残渣をDCM(5.0mL)に溶解させた後、水(0.1mL)、およびDCA(0.46mL)のDCM(5.0mL)溶液を加える。15分間攪拌後、混合物をTEAで約pH 7に中和し、次に濃縮し、逆相C18シリカゲルカラムクロマトグラフィー(0.5% TEA入りのMeCN/水 = 0%→40%)で精製してCC2(0.11g、収率44%)を白色固体として得る。(MS: [M+H]+ 1226.0)
A4(1.0g、1.01mmol)およびG1(1.07g、2.02mmol)のMeCN(10mL)溶液にPy・DCA(420mg、2.02mmol)を加える。20℃で2時間攪拌後、TBHP(水中70%、0.65mL、5.05mmol)を加え、混合物を1時間攪拌した後、炭酸水素ナトリウム水溶液(50mL)を加える。混合物を酢酸エチル(100mL)で抽出し、有機層をブライン(30mL)で洗浄し、無水硫酸ナトリウムで乾燥させ、濾過し、濃縮する。次に残渣をDCM(20mL)、TFA(1.0mL)、およびトリエチルシラン(5.0mL)の混合物に溶解させる。2時間攪拌後、混合物を固体炭酸水素ナトリウムで約pH 7に中和する。次に混合物を濾過し、固体をEA(50mL×3)で洗浄する。濾液を濃縮し、分取HPLC(0.1% TEA入りのMeCN/水 = 0%→30%)で精製してC4・TEAを白色固体(620mg、収率49%)として得る。(MS: [M+H]+ 1131.1)
C4(583mg、0.515mmol)のPy(10mL)溶液にDMOCP(583mg、3.16mmol)を20℃で加える。2時間攪拌後、ヨウ素(654mg、2.58mmol)を加え、混合物を1時間攪拌し、次に飽和硫酸ナトリウム水溶液(30mL)および飽和炭酸水素ナトリウム水溶液(30mL)を加える。次に混合物をEA(100mL)で抽出し、ブライン(60mL)で洗浄し、無水硫酸ナトリウムで乾燥させ、濾過し、濃縮し、逆相シリカゲルカラムクロマトグラフィー(0.1% TEA入りのMeCN/水 = 20%→40%)で精製して83・TEAを白色固体(172.0mg、収率31%)として得る。(MS: [M+H]+ 1076.1)
83(100mg、0.093mmol)のMeOH(1.0mL)および水酸化アンモニウム(1.0mL)溶液を50℃で12時間攪拌する。次に混合物を濃縮し、逆相シリカゲルカラムクロマトグラフィー(0.1% TEA入りのMeCN/水 = 20%→40%)で精製して84を黄色固体(27.0mg、収率32%)として得る。(MS: [M+H]+ 902.5)
84(27mg、0.030mmol)のTEA・3HF(10mL)溶液を50℃で3時間攪拌する。次に混合物を冷炭酸水素トリエチルアンモニウムで約pH 7に中和し、濃縮し、C18逆相シリカゲルカラムクロマトグラフィー(0.1% TEA入りのMeCN/水 = 0%→20%)で精製してE5・TEAを白色固体(5.2mg、収率26%)として得る。(MS: [M+H]+ 673.7)
A4(500mg、0.50mmol、MeCN 5mL×1およびトルエン10mL×2と共蒸発)ならびにG1(322mg、0.61mmol、MeCN 5mL×1およびトルエン10mL×2と共蒸発)の混合物にテトラゾール(MeCN中0.45M、4.0mL)を加える。25℃で2時間攪拌後、DDTT(240mg、1.2mmol)を加え、混合物を16時間攪拌し、次に濾過し、濃縮する。次に残渣をDCM(10mL)に溶解させ、続いて水(0.1mL)およびDCA(0.21mL)を加える。10分間攪拌後、TEA(1mL)を加え、混合物を濃縮し、逆相シリカゲルカラムクロマトグラフィー(0.1% TEA入りMeCN/水 = 0%→100%)で精製してC5・TEAを白色固体(250mg、収率35%)として得る。(MS: {[M+2H]2+)/2 574.6)
C5(600mg、0.423mmol、Py 3mL×2と共蒸発)のPy(5.0mL)溶液にDMOCP(313mg、1.69mmol)を25℃で加える。2時間攪拌後、3H-1,2-ベンゾジチオール-3-オン(142mg、0.85mmol)を加え、混合物を2時間攪拌し、次に炭酸水素ナトリウム水溶液(5%、10mL)を加える。次に混合物をEA(10mL×3)で抽出する。一緒にした有機層を無水硫酸ナトリウムで乾燥させ、濾過し、濃縮し、逆相HPLC(0.1% TEA入りのMeCN/水 = 0→100%)で精製して85・TEAの4つのジアステレオマーを白色固体として得る。異性体1(28mg) (MS: [M+H]+ 1160.9); 異性体2(25mg) (MS: [M+H]+ 1160.9); 異性体3(50mg) (MS: [M+H]+ 1160.9); 異性体4(52mg) (MS: [M+1]+ 1160.9)
水酸化アンモニウム(5.6mL)およびMeOH(4.0mL)中の85・TEAの各異性体(25mg、0.022mmol)を50℃で16時間攪拌する。次に混合物を窒素によって室温で5分間掃流した後、濃縮する。残渣をTEA(0.5mL)およびPy(0.2mL)に溶解させ、TEA・3HF(0.7mL)を加える。50℃で24時間攪拌後、炭酸水素トリエチルアンモニウム水溶液(1M、5mL)を加え、混合物を逆相シリカゲルカラムクロマトグラフィー(0.1% TEA入りのMeCN/水 = 0%→30%)で精製してE15~E18を白色固体として得る。
C3(16mg、0.014mmol、Py 1mL×3と共蒸発)のPy(0.5mL)溶液にDMOCP(10.4mg、0.056mmol)を加える。15分間攪拌後、NIS(4.1mg、0.0183mmol)およびモルホリン(0.012mL、0.141mmol)を加え、混合物を1時間攪拌し、次に亜硫酸水素ナトリウム水溶液(0.14%、1mL)および炭酸水素ナトリウム(80mg)を加える。次に混合物をDCM(5mL×3)で抽出し、無水硫酸ナトリウムで乾燥させ、濃縮する。次に残渣をMeCN(0.5mL)およびt-ブチルアミン(0.5mL)中にて室温で15分間攪拌した後、濃縮する。次に得られた残渣をMeCN(1mL×3)と共蒸発させ、HPLCで精製して86を白色固体(2.4mg、15%)として得る。(MS: [M+H]+ 1146.2)
86(2.4mg、0.0021mmol)にメチルアミン(EtOH中33%、0.3mL)を加える。室温で16時間攪拌後、混合物を濃縮し、残渣をTEAおよびTEA・3HFのTHF中混合物(0.036mL/0.018mL/0.3mL)中にて35℃で18時間攪拌する。次にMeCN(1.0mL)を加え、固体を遠心分離により収集し、MeCN(1mL×2)で洗浄してE24を白色固体(0.6mg、収率38%)として得る。(MS: [M+H]+ 744.0)
C3(100mg、0.088mmol、Py 4mL×3と共蒸発)のPy(3mL)溶液にDMOCP(57mg、0.337mmol)を加える。15分間攪拌後、BSTFA(0.10mL、0.371mmol)を滴下し、混合物を20分間攪拌し、次にボランN,N-ジイソプロピルエチルアミン錯体(0.092mL、0.530mmol)を加える。次に混合物を3時間攪拌した後、濃縮し、シリカゲルカラムクロマトグラフィー(MeOH/DCM = 1/19→1/9)で精製して半純粋CE保護87を黄色固体として得る。上記で得た半純粋CE保護87をMeCN(1mL)およびt-ブチルアミン(0.5mL)の混合物中で10分間攪拌した後、濃縮する。次に残渣をMeCN(4mL×3)と共蒸発させ、逆相HPLC(0.1% TEA入りのMeCN/水 = 40%→90%)で精製して87を白色固体(11mg、2工程で12%)として得る。(MS: [M]- 1073.2)
87(5.7mg、0.0053mmol)にメチルアミン(EtOH中33%、1mL)を加える。室温で18時間攪拌後、混合物を濃縮し、残渣をTEA(0.08mL)およびTEA・3HF(0.04mL)のTHF(0.5mL)中混合物中にて35℃で18時間攪拌する。次にMeCN(1.2mL)を加え、固体を遠心分離により収集し、逆相HPLC(0.1% TFA入りのMeCN/水 = 0%→20%)で精製してE25を白色固体(2.5mg、収率61%)として得る。(MS: [M]- 671.2)
3Å MS(500mg)で30分間処理された、GB3(160mg、0.25mmol、MeCN 1mL×3と共蒸発)およびトリフルオロ酢酸ピリジニウム(35mg、0.39mmol、MeCN 1mL×3と共蒸発)のMeCN(1mL)溶液に、3Å MS(700mg)で30分間処理された、A4(355mg、0.36mmol、MeCN 1mL×3と共蒸発)のMeCN(1mL)溶液を加える。室温で2時間攪拌後、TBHP(デカン中5.5M、0.164mL、0.9mmol)を加え、混合物を30分間攪拌し、次に亜硫酸水素ナトリウム水溶液(33%、0.15mL)を0℃で加える。次に混合物を濃縮し、残渣をDCM(4.8mL)に溶解させ、続いて水(0.054mL)およびジクロロ酢酸(塩化メチレン中6%、4.8mL)を加える。10分間攪拌後、Py(1.5mL)を加え、混合物を濃縮し、シリカゲルカラムクロマトグラフィー(MeOH/DCM = 1/10→1/4、1% Py入り)で精製してCB1・Pyを白色固体(213mg、収率66%)として得る。
CB1(60mg、53μmol)のPy(1mL)溶液にDMOCP(30mg、162.5μmol)を加える。10分間攪拌後、水(0.027mL)および3H-1,2-ベンゾジチオール-3-オン(13mg、0.077mmol)を加える。混合物を5分間攪拌した後、炭酸水素ナトリウム(210mg)の水(7.5mL)溶液に注ぐ。5分間攪拌後、混合物をEA/ジエチルエーテル(1:1、10mL×3)で抽出する。一緒にした有機層を濃縮して黄色固体(100mg)を得る。上記で得た黄色固体のMeCN(0.5mL)溶液にtert-ブチルアミン(0.5mL)を加える。10分間攪拌後、混合物を濃縮し、HPLC(MeCN/0.1% TFA入りの水: 50%→100%)で精製して88の2つのジアステレオマーを得る。異性体1(7mg) ([M+H]+ 977.0); 異性体2(16mg) (MS: [M+H]+ 977.0)
88の異性体1(7mg)にメチルアミン(エタノール中33%、1mL)を加える。室温で12時間攪拌後、混合物を濃縮し、残渣をTFA水溶液(3% v/v、1mL)に溶解させる。2時間攪拌後、混合物を濃縮し、HPLC(MeCN/0.1% TFA入りの水、0%→45%)で精製してEB1を白色固体(2.5mg、収率57%)として得る。(MS: [M+H]+ 689.0)
E1・TEA塩(10mg、0.0114mmol)の水(0.3mL)溶液に2-クロロアセトアルデヒド(0.015mL、0.118mmol)および水酸化ナトリウム水溶液(1M、0.012mL、0.012mmol)を加える。37℃で18時間攪拌後、混合物を濃縮し、逆相HPLC(MeCN/0.1% TFA入りの水 = 0%→30%)で精製してEC26を白色固体として得る。(MS: [M]- 697.1)
96ウェルプレート中で、cGAMP類似体化合物のリン酸緩衝食塩水(PBS)中段階希釈液と、0.2×106個/ウェルのTHP1ルシフェラーゼレポーター細胞とを、細胞膜上に開口チャネルを形成することで化合物取り込みを促進しうるパーフリンゴリジンO(PFO)1nMの存在下または非存在下で混合する。16時間後、各ウェルから培地15μLを新たなプレートに移し、発光を測定する。PBS刺激細胞に対する発光の増大倍率を各化合物の濃度の対数に対してプロットし、EC50をGraphpadを使用して算出する。
Claims (80)
- 式Ia:
の化合物またはその薬学的に許容される塩:
式中、
aおよびbは独立して0または1であり、かつ、aが1でありbが0でありかつR5が存在しない場合; およびaが0でありbが1でありかつR4が存在しない場合にa + b = 1であり;
X1およびX2は独立して5員環中のO、S、またはSeであり;
X1に対してα位の炭素から出発するL1、およびX2に対してα位の炭素から出発するL2は独立して、-CH2O-P(O)R6-O-、-CH2O-P(S)R6-O-、-C(Y1)(Y2)O-P(O)R6-C(Y3)(Y4)-、-CH2NHSO2NH-、-CH2NHC(O)NH-、-CH2NHC(S)NH-、-CH2NHC(NH)NH-、-CH2NHC(O)CH2-、-CH2NHSO2CH2-、-CH2CH2C(O)NH-、-CH2CH2SO2NH-、-CH2NH(3,4-ジオキソシクロブテン-1,2-ジイル)NH-、
であり;
cは0、1、または2であり;
d、e、およびfは独立して0または1であり;
Y1、Y2、Y3、およびY4は独立してHまたはFであり;
R6は、ヒドロキシル、チオール、C1~6アルキル、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルキル、C1~6アルコキシ、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルコキシ、C3~5アルケニル-O-、C3~5アルキニル-O-、オリゴ(エチレングリコール)、ポリ(エチレングリコール)、ボラノ(-BH3 -)、または-NR7R8であり;
R7およびR8は独立して、水素、C1~6アルキル、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルキル、環状-(C1~6アルキル)-、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、もしくはジ(C1~6アルキル)アミノ基を用いて選択的に官能基を付与された環状-(C1~6アルキル)-、環状-(C1~6オキサアルキル)-、または1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、もしくはジ(C1~6アルキル)アミノ基を用いて選択的に官能基を付与された環状-(C1~6オキサアルキル)-であり;
R1およびR2は独立して、互変異性形態を含む以下の一般構造:
を有する芳香環または芳香族複素環であり;
gおよびhは独立して0または1であり;
W1およびW2は独立して、水素、ハロゲン、ヒドロキシル、C1~6アルキル、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルキル、C1~6アルコキシ、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルコキシ、C3~5アルケニル-O-、C3~5アルキニル-O-、オリゴ(エチレングリコール)、ポリ(エチレングリコール)、アジド、または-NR7R8であり;
Z1、Z2、Z3、Z4、Z5、およびZ6は独立してCHまたはNであり;
存在する場合に、Z7、Z8、Z9、Z10、およびZ11は独立してCHまたはNであり、さらにW1はCHまたはNであり;
R3、R4、およびR5は独立して、水素、ハロゲン、ヒドロキシル、アミノ、C1~6アルキル、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルキル、C1~6アルコキシ、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルコキシ、C3~5アルケニル-O-、C3~5アルキニル-O-、オリゴ(エチレングリコール)、ポリ(エチレングリコール)、アジド、または-NR7R8であり;かつ
該化合物は2'3'-cGAMPではない。 - 式Ib:
の化合物またはその薬学的に許容される塩である、請求項1に記載の化合物:
式中、
X1およびX2は独立してO、S、またはSeであり;
Z12、Z13、Z14、Z15、Z16、およびZ17は独立してCHまたはNであり;
X1に対してα位の炭素から出発するL1、およびX2に対してα位の炭素から出発するL2は独立して、-CH2O-P(O)R6-O-、-CH2O-P(S)R6-O-、-C(Y1)(Y2)O-P(O)R6-C(Y3)(Y4)-、-CH2NHSO2NH-、-CH2NHC(O)NH-、-CH2NHC(S)NH-、-CH2NHC(NH)NH-、-CH2NHC(O)CH2-、-CH2NHSO2CH2-、-CH2CH2C(O)NH-、-CH2CH2SO2NH-、-CH2NH(3,4-ジオキソシクロブテン-1,2-ジイル)NH-、
であり;
cは0、1、または2であり;
d、e、およびfは独立して0または1であり;
Y1、Y2、Y3、およびY4は独立してHまたはFであり;
R6は、ヒドロキシル、チオール、C1~6アルキル、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルキル、C1~6アルコキシ、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルコキシ、C3~5アルケニル-O-、C3~5アルキニル-O-、オリゴ(エチレングリコール)、ポリ(エチレングリコール)、ボラノ(-BH3 -)、または-NR7R8であり;
R7およびR8は独立して、水素、C1~6アルキル、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルキル、環状-(C1~6アルキル)-、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、もしくはジ(C1~6アルキル)アミノ基を用いて選択的に官能基を付与された環状-(C1~6アルキル)-、環状-(C1~6オキサアルキル)-、または1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、もしくはジ(C1~6アルキル)アミノ基を用いて選択的に官能基を付与された環状-(C1~6オキサアルキル)-であり;
R3およびR4は独立して、水素、ハロゲン、ヒドロキシル、アミノ、C1~6アルキル、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルキル、C1~6アルコキシ、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルコキシ、C3~5アルケニル-O-、C3~5アルキニル-O-、オリゴ(エチレングリコール)、ポリ(エチレングリコール)、アジド、または-NR7R8であり;かつ
該化合物は、2'3'-cGAMPを含む既に開示された化合物ではない。 - 式Ic:
の化合物またはその薬学的に許容される塩である、請求項1に記載の化合物:
式中、
Z12、Z13、Z14、Z15、Z16、およびZ17は独立してCHまたはNであり;
R3およびR4は独立して、水素、ハロゲン、ヒドロキシル、アミノ、C1~6アルキル、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルキル、C1~6アルコキシ、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルコキシ、C3~5アルケニル-O-、C3~5アルキニル-O-、オリゴ(エチレングリコール)、ポリ(エチレングリコール)、アジド、または-NR7R8であり;
R7およびR8は独立して、水素、C1~6アルキル、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルキル、環状-(C1~6アルキル)-、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、もしくはジ(C1~6アルキル)アミノ基を用いて選択的に官能基を付与された環状-(C1~6アルキル)-、環状-(C1~6オキサアルキル)-、または1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、もしくはジ(C1~6アルキル)アミノ基を用いて選択的に官能基を付与された環状-(C1~6オキサアルキル)-であり;
R9およびR10は独立して、ヒドロキシル、チオール、C1~6アルキル、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルキル、C1~6アルコキシ、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルコキシ、C3~5アルケニル-O-、C3~5アルキニル-O-、オリゴ(エチレングリコール)、ポリ(エチレングリコール)、ボラノ(-BH3 -)、または-NR7R8であり;
式Icの一方または両方のテトラヒドロフラニル環中の酸素原子は硫黄原子またはセレン原子で置き換えられていてもよく;かつ
該化合物は2'3'-cGAMPではない。 - 式Id:
の化合物またはその薬学的に許容される塩である、請求項1に記載の化合物:
式中、
X1およびX2は独立してO、S、またはSeであり;
X1に対してα位の炭素から出発するL1、およびX2に対してα位の炭素から出発するL2は独立して、-CH2O-P(O)R6-O-、-CH2O-P(S)R6-O-、-C(Y1)(Y2)O-P(O)R6-C(Y3)(Y4)-、-CH2NHSO2NH-、-CH2NHC(O)NH-、-CH2NHC(S)NH-、-CH2NHC(NH)NH-、-CH2NHC(O)CH2-、-CH2NHSO2CH2-、-CH2CH2C(O)NH-、-CH2CH2SO2NH-、-CH2NH(3,4-ジオキソシクロブテン-1,2-ジイル)NH-、
であり;
cは0、1、または2であり;
d、e、およびfは独立して0または1であり;
Y1、Y2、Y3、およびY4は独立してHまたはFであり;
R6は、ヒドロキシル、チオール、C1~6アルキル、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルキル、C1~6アルコキシ、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルコキシ、C3~5アルケニル-O-、C3~5アルキニル-O-、オリゴ(エチレングリコール)、ポリ(エチレングリコール)、ボラノ(-BH3 -)、または-NR7R8であり;
R7およびR8は独立して、水素、C1~6アルキル、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルキル、環状-(C1~6アルキル)-、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、もしくはジ(C1~6アルキル)アミノ基を用いて選択的に官能基を付与された環状-(C1~6アルキル)-、環状-(C1~6オキサアルキル)-、または1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、もしくはジ(C1~6アルキル)アミノ基を用いて選択的に官能基を付与された環状-(C1~6オキサアルキル)-であり;
R3およびR4は独立して、水素、ハロゲン、ヒドロキシル、アミノ、C1~6アルキル、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルキル、C1~6アルコキシ、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルコキシ、C3~5アルケニル-O-、C3~5アルキニル-O-、オリゴ(エチレングリコール)、ポリ(エチレングリコール)、アジド、または-NR7R8であり;
R11およびR12は独立して、
からなる群より選択され、R11およびR12のうち少なくとも一方は
であり;
Z12、Z13、Z14、Z15、Z16、Z17、Z18、Z19、Z20、Z21、Z22、Z23、Z24、Z25、Z26、Z27、Z28、Z29、Z30、Z31、Z32、Z33、Z34、Z35、Z36、およびZ37はそれぞれ独立してCHまたはNであり;かつ
W3、W4、W5、W6、W7、W8、およびW9は独立して、水素、ハロゲン、ヒドロキシル、C1~6アルキル、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルキル、C1~6アルコキシ、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルコキシ、C3~5アルケニル-O-、C3~5アルキニル-O-、オリゴ(エチレングリコール)、ポリ(エチレングリコール)、アジド、または-NR7R8である。 - 式Ie:
の化合物またはその薬学的に許容される塩である、請求項1に記載の化合物:
式中、
X3、X4、X5、およびX6は独立してO、NH、CH2、CHF、またはCF2であり;
R13およびR14は独立して、
からなる群より選択され;
Z12、Z13、Z14、Z15、Z16、Z17、Z18、Z19、Z20、Z21、Z22、Z23、Z24、Z25、Z26、Z27、およびZ28はそれぞれ独立してCHまたはNであり;かつ
W3、W4、W5、W6、およびW7は独立して、水素、ハロゲン、ヒドロキシル、C1~6アルキル、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルキル、C1~6アルコキシ、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルコキシ、C3~5アルケニル-O-、C3~5アルキニル-O-、オリゴ(エチレングリコール)、ポリ(エチレングリコール)、アジド、または-NR7R8であり;
R7およびR8は独立して、水素、C1~6アルキル、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルキル、環状-(C1~6アルキル)-、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、もしくはジ(C1~6アルキル)アミノ基を用いて選択的に官能基を付与された環状-(C1~6アルキル)-、環状-(C1~6オキサアルキル)-、または1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、もしくはジ(C1~6アルキル)アミノ基を用いて選択的に官能基を付与された環状-(C1~6オキサアルキル)-であり;
R3およびR4は独立して、水素、ハロゲン、ヒドロキシル、アミノ、C1~6アルキル、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルキル、C1~6アルコキシ、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルコキシ、C3~5アルケニル-O-、C3~5アルキニル-O-、オリゴ(エチレングリコール)、ポリ(エチレングリコール)、アジド、または-NR7R8であり;
R15およびR16は独立して、ヒドロキシル、チオール、メトキシ、エトキシ、アミノ、N-メチルアミノ、N,N-ジメチルアミノ、N-エチルアミノ、N,N-ジエチルアミノ、N-モルホリノ、またはボラノ(-BH3 -)であり;
式Ieの一方または両方のテトラヒドロフラニル環中の酸素原子は硫黄原子またはセレン原子で置き換えられていてもよく;かつ
該化合物は2'3'-cGAMPではない。 - 式If:
の化合物またはその薬学的に許容される塩である、請求項1に記載の化合物:
式中、
X1およびX2は独立してO、S、またはSeであり;
Z12、Z13、Z14、Z15、Z16、およびZ17は独立してCHまたはNであり;
X1に対してα位の炭素から出発するL1、およびX2に対してα位の炭素から出発するL2は独立して、-CH2O-P(O)R6-O-、-CH2O-P(S)R6-O-、-C(Y1)(Y2)O-P(O)R6-C(Y3)(Y4)-、-CH2NHSO2NH-、-CH2NHC(O)NH-、-CH2NHC(S)NH-、-CH2NHC(NH)NH-、-CH2NHC(O)CH2-、-CH2NHSO2CH2-、-CH2CH2C(O)NH-、-CH2CH2SO2NH-、-CH2NH(3,4-ジオキソシクロブテン-1,2-ジイル)NH-、
であり;
cは0、1、または2であり;
d、e、およびfは独立して0または1であり;
Y1、Y2、Y3、およびY4は独立してHまたはFであり;
R6は、ヒドロキシル、チオール、C1~6アルキル、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルキル、C1~6アルコキシ、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルコキシ、C3~5アルケニル-O-、C3~5アルキニル-O-、オリゴ(エチレングリコール)、ポリ(エチレングリコール)、ボラノ(-BH3 -)、または-NR7R8であり;
R7およびR8は独立して、水素、C1~6アルキル、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルキル、環状-(C1~6アルキル)-、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、もしくはジ(C1~6アルキル)アミノ基を用いて選択的に官能基を付与された環状-(C1~6アルキル)-、環状-(C1~6オキサアルキル)-、または1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、もしくはジ(C1~6アルキル)アミノ基を用いて選択的に官能基を付与された環状-(C1~6オキサアルキル)-であり;
R3およびR5は独立して、水素、ハロゲン、ヒドロキシル、アミノ、C1~6アルキル、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルキル、C1~6アルコキシ、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルコキシ、C3~5アルケニル-O-、C3~5アルキニル-O-、オリゴ(エチレングリコール)、ポリ(エチレングリコール)、アジド、または-NR7R8であり;かつ
該化合物は2'2'-cGAMPではない。 - 式Ig:
の化合物またはその薬学的に許容される塩である、請求項1に記載の化合物:
式中、
Z12、Z13、Z14、Z15、Z16、およびZ17は独立してCHまたはNであり;
R3およびR5は独立して、水素、ハロゲン、ヒドロキシル、アミノ、C1~6アルキル、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルキル、C1~6アルコキシ、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルコキシ、C3~5アルケニル-O-、C3~5アルキニル-O-、オリゴ(エチレングリコール)、ポリ(エチレングリコール)、アジド、または-NR7R8であり;
R7およびR8は独立して、水素、C1~6アルキル、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルキル、環状-(C1~6アルキル)-、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、もしくはジ(C1~6アルキル)アミノ基を用いて選択的に官能基を付与された環状-(C1~6アルキル)-、環状-(C1~6オキサアルキル)-、または1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、もしくはジ(C1~6アルキル)アミノ基を用いて選択的に官能基を付与された環状-(C1~6オキサアルキル)-であり;
R9およびR10は独立して、ヒドロキシル、チオール、C1~6アルキル、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルキル、C1~6アルコキシ、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルコキシ、C3~5アルケニル-O-、C3~5アルキニル-O-、オリゴ(エチレングリコール)、ポリ(エチレングリコール)、ボラノ(-BH3 -)、または-NR7R8であり;
式Igの一方または両方のテトラヒドロフラニル環中の酸素原子は硫黄原子またはセレン原子で置き換えられていてもよく;かつ
該化合物は2'2'-cGAMPではない。 - 式Ih:
の化合物またはその薬学的に許容される塩である、請求項1に記載の化合物:
式中、
X1およびX2は独立してO、S、またはSeであり;
X1に対してα位の炭素から出発するL1、およびX2に対してα位の炭素から出発するL2は独立して、-CH2O-P(O)R6-O-、-CH2O-P(S)R6-O-、-C(Y1)(Y2)O-P(O)R6-C(Y3)(Y4)-、-CH2NHSO2NH-、-CH2NHC(O)NH-、-CH2NHC(S)NH-、-CH2NHC(NH)NH-、-CH2NHC(O)CH2-、-CH2NHSO2CH2-、-CH2CH2C(O)NH-、-CH2CH2SO2NH-、-CH2NH(3,4-ジオキソシクロブテン-1,2-ジイル)NH-、
であり;
cは0、1、または2であり;
d、e、およびfは独立して0または1であり;
Y1、Y2、Y3、およびY4は独立してHまたはFであり;
R6は、ヒドロキシル、チオール、C1~6アルキル、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルキル、C1~6アルコキシ、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルコキシ、C3~5アルケニル-O-、C3~5アルキニル-O-、オリゴ(エチレングリコール)、ポリ(エチレングリコール)、ボラノ(-BH3 -)、または-NR7R8であり;
R7およびR8は独立して、水素、C1~6アルキル、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルキル、環状-(C1~6アルキル)-、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、もしくはジ(C1~6アルキル)アミノ基を用いて選択的に官能基を付与された環状-(C1~6アルキル)-、環状-(C1~6オキサアルキル)-、または1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、もしくはジ(C1~6アルキル)アミノ基を用いて選択的に官能基を付与された環状-(C1~6オキサアルキル)-であり;
R3およびR5は独立して、水素、ハロゲン、ヒドロキシル、アミノ、C1~6アルキル、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルキル、C1~6アルコキシ、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルコキシ、C3~5アルケニル-O-、C3~5アルキニル-O-、オリゴ(エチレングリコール)、ポリ(エチレングリコール)、アジド、または-NR7R8であり;
R11およびR12は独立して、
からなる群より選択され、R11およびR12のうち少なくとも一方は
であり;
Z12、Z13、Z14、Z15、Z16、Z17、Z18、Z19、Z20、Z21、Z22、Z23、Z24、Z25、Z26、Z27、Z28、Z29、Z30、Z31、Z32、Z33、Z34、Z35、Z36、およびZ37はそれぞれ独立してCHまたはNであり;かつ
W3、W4、W5、W6、W7、W8、およびW9は独立して、水素、ハロゲン、ヒドロキシル、C1~6アルキル、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルキル、C1~6アルコキシ、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルコキシ、C3~5アルケニル-O-、C3~5アルキニル-O-、オリゴ(エチレングリコール)、ポリ(エチレングリコール)、アジド、または-NR7R8である。 - 式Ii:
の化合物またはその薬学的に許容される塩である、請求項1に記載の化合物:
式中、
X3、X5、X6、およびX7は独立してO、NH、CH2、CHF、またはCF2であり;
R13およびR14は独立して、
からなる群より選択され;
Z12、Z13、Z14、Z15、Z16、Z17、Z18、Z19、Z20、Z21、Z22、Z23、Z24、Z25、Z26、Z27、およびZ28はそれぞれ独立してCHまたはNであり;かつ
W3、W4、W5、W6、およびW7は独立して、水素、ハロゲン、ヒドロキシル、C1~6アルキル、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルキル、C1~6アルコキシ、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルコキシ、C3~5アルケニル-O-、C3~5アルキニル-O-、オリゴ(エチレングリコール)、ポリ(エチレングリコール)、アジド、または-NR7R8であり;
R7およびR8は独立して、水素、C1~6アルキル、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルキル、環状-(C1~6アルキル)-、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、もしくはジ(C1~6アルキル)アミノ基を用いて選択的に官能基を付与された環状-(C1~6アルキル)-、環状-(C1~6オキサアルキル)-、または1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、もしくはジ(C1~6アルキル)アミノ基を用いて選択的に官能基を付与された環状-(C1~6オキサアルキル)-であり;
R3およびR5は独立して、水素、ハロゲン、ヒドロキシル、アミノ、C1~6アルキル、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6アルコキシ基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルキル、C1~6アルコキシ、1個もしくは複数のハロゲン基、チオール基、ヒドロキシル基、カルボニル基、カルボキシル基、カルボニルオキシル基、C1~6ヒドロキシアルコキシ基、アミノ基、C1~6アルキルアミノ基、ジ(C1~6アルキル)アミノ基、もしくはアジド基を用いて選択的に官能基を付与されたC1~6アルコキシ、C3~5アルケニル-O-、C3~5アルキニル-O-、オリゴ(エチレングリコール)、ポリ(エチレングリコール)、アジド、または-NR7R8であり;
R15およびR16は独立して、ヒドロキシル、チオール、メトキシ、エトキシ、アミノ、N-メチルアミノ、N,N-ジメチルアミノ、N-エチルアミノ、N,N-ジエチルアミノ、N-モルホリノ、またはボラノ(-BH3 -)であり;
式Iiの一方または両方のテトラヒドロフラニル環中の酸素原子は硫黄原子またはセレン原子で置き換えられていてもよく;かつ
該化合物は2'2'-cGAMPではない。 - 式Iの化合物またはその薬学的に許容される塩を含む、薬学的組成物。
- ナノ粒子または別の送達ビヒクルを含む薬学的製剤中の式Iの化合物である、薬学的組成物。
- 式Iの化合物と少なくとも1つのさらなる治療用物質との組み合わせである、薬学的組成物。
- 前記さらなる治療用物質が、PD-1に対する、PD-L1に対する、またはCTLA-4に対する抗体を含むがそれらに限定されない免疫チェックポイント阻害物質である、請求項57に記載の薬学的組成物。
- 前記さらなる治療用物質が、体幹部定位放射線治療(SBRT)を含む放射線である、請求項57に記載の薬学的組成物。
- 前記さらなる治療用物質が、化学療法剤と治療用抗体とを含む抗悪性腫瘍剤である、請求項57に記載の薬学的組成物。
- がん細胞の免疫原(腫瘍抗原)または感染性病原体の免疫原を有する薬学的製剤中の式Iの化合物である、薬学的組成物。
- 1つまたは複数の薬学的に許容される担体、希釈剤、および賦形剤をさらに含む、請求項57に記載の薬学的組成物。
- それを必要とする患者に、式Iの化合物またはその薬学的に許容される塩の有効量を投与する段階を含む、免疫応答を誘導または促進する方法。
- それを必要とする患者に、請求項63に記載の薬学的組成物の有効量を投与する段階を含む、免疫応答を誘導または促進する方法。
- それを必要とする患者に、式Iの化合物またはその薬学的に許容される塩の有効量を投与する段階を含む、STING依存性免疫応答を誘導または促進する方法。
- それを必要とする患者に、請求項63に記載の薬学的組成物の有効量を投与する段階を含む、STING依存性免疫応答を誘導または促進する方法。
- それを必要とする患者に、式Iの化合物またはその薬学的に許容される塩の治療有効量を投与する段階を含む、がんを処置する方法。
- それを必要とする患者に、請求項67に記載の薬学的組成物の治療有効量を投与する段階を含む、がんを処置する方法。
- それを必要とする患者に、PD-1に対する、PD-L1に対する、またはCTLA-4に対する抗体を含むがそれらに限定されない免疫チェックポイント抗体と組み合わせて式Iの化合物またはその薬学的に許容される塩を含む薬学的組成物の治療有効量を投与する段階を含む、がんを処置する方法。
- それを必要とする患者に、体幹部定位放射線治療(SBRT)を含む放射線と組み合わせて式Iの化合物またはその薬学的に許容される塩を含む薬学的組成物の治療有効量を投与する段階を含む、がんを処置する方法。
- それを必要とする患者に、化学療法剤と治療用抗体とを含む抗悪性腫瘍剤と組み合わせて式Iの化合物またはその薬学的に許容される塩を含む薬学的組成物の治療有効量を投与する段階を含む、がんを処置する方法。
- それを必要とする患者に、式Iの化合物またはその薬学的に許容される塩の治療有効量を投与する段階を含む、感染性疾患を処置する方法。
- それを必要とする患者に、請求項72に記載の薬学的組成物の治療有効量を投与する段階を含む、感染性疾患を処置する方法。
- それを必要とする患者に、式Iの化合物またはその薬学的に許容される塩の治療有効量を投与する段階を含む、免疫障害を処置する方法。
- それを必要とする患者に、請求項74に記載の薬学的組成物の治療有効量を投与する段階を含む、免疫障害を処置する方法。
- 疾患の処置または予防における使用のための、抗原または抗原組成物と式Iの化合物またはその薬学的に許容される塩とを含むワクチン組成物。
- 疾患の処置用または予防用の抗原または抗原組成物を含むワクチン組成物の製造のための、式Iの化合物またはその薬学的に許容される塩の使用。
- 疾患に罹患しているかまたは罹患しやすい患者に、抗原または抗原組成物と式Iの化合物またはその薬学的に許容される塩とを含むワクチン組成物を投与する段階を含む、該疾患を処置または予防する方法。
- それを必要とする患者に、式Iの化合物またはその薬学的に許容される塩の治療有効量を投与する段階を含み、該患者が哺乳動物である、疾患を処置または予防する方法。
- それを必要とする患者に、式Iの化合物またはその薬学的に許容される塩の治療有効量を投与する段階を含み、該患者がヒトである、疾患を処置または予防する方法。
Applications Claiming Priority (7)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201662310364P | 2016-03-18 | 2016-03-18 | |
| US62/310,364 | 2016-03-18 | ||
| US201662355382P | 2016-06-28 | 2016-06-28 | |
| US62/355,382 | 2016-06-28 | ||
| US201662396140P | 2016-09-17 | 2016-09-17 | |
| US62/396,140 | 2016-09-17 | ||
| JP2018568181A JP6980198B2 (ja) | 2016-03-18 | 2017-03-17 | 環状ジヌクレオチド化合物および使用方法 |
Related Parent Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2018568181A Division JP6980198B2 (ja) | 2016-03-18 | 2017-03-17 | 環状ジヌクレオチド化合物および使用方法 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| JP2022017500A true JP2022017500A (ja) | 2022-01-25 |
Family
ID=59851227
Family Applications (3)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2018568181A Active JP6980198B2 (ja) | 2016-03-18 | 2017-03-17 | 環状ジヌクレオチド化合物および使用方法 |
| JP2020031617A Active JP6980200B2 (ja) | 2016-03-18 | 2020-02-27 | 環状ジヌクレオチド化合物および使用方法 |
| JP2021180838A Pending JP2022017500A (ja) | 2016-03-18 | 2021-11-05 | 環状ジヌクレオチド化合物および使用方法 |
Family Applications Before (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2018568181A Active JP6980198B2 (ja) | 2016-03-18 | 2017-03-17 | 環状ジヌクレオチド化合物および使用方法 |
| JP2020031617A Active JP6980200B2 (ja) | 2016-03-18 | 2020-02-27 | 環状ジヌクレオチド化合物および使用方法 |
Country Status (22)
| Country | Link |
|---|---|
| US (3) | US10519188B2 (ja) |
| EP (2) | EP3429596B1 (ja) |
| JP (3) | JP6980198B2 (ja) |
| KR (1) | KR102530488B1 (ja) |
| CN (3) | CN114751950B (ja) |
| AU (1) | AU2017233068C1 (ja) |
| BR (1) | BR112018068748B1 (ja) |
| CA (1) | CA3017524A1 (ja) |
| DK (1) | DK3429596T3 (ja) |
| ES (1) | ES2929628T3 (ja) |
| HR (1) | HRP20221263T1 (ja) |
| HU (1) | HUE060396T2 (ja) |
| IL (2) | IL280430B2 (ja) |
| LT (1) | LT3429596T (ja) |
| MA (1) | MA43827A (ja) |
| MX (2) | MX390014B (ja) |
| NZ (1) | NZ746112A (ja) |
| PL (1) | PL3429596T3 (ja) |
| PT (1) | PT3429596T (ja) |
| SG (2) | SG10201912074PA (ja) |
| WO (1) | WO2017161349A1 (ja) |
| ZA (1) | ZA201806074B (ja) |
Families Citing this family (118)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GEP20207182B (en) | 2015-08-13 | 2020-11-25 | Merck Sharp & Dohme | Cyclic di-nucleotide compounds as sting agonists |
| US11453697B1 (en) | 2015-08-13 | 2022-09-27 | Merck Sharp & Dohme Llc | Cyclic di-nucleotide compounds as sting agonists |
| MX363780B (es) | 2015-12-03 | 2019-04-03 | Glaxosmithkline Ip Dev Ltd | Dinucleótidos de purina cíclica como moduladores del estimulador de los genes de interferón. |
| SMT202500412T1 (it) | 2016-01-11 | 2025-11-10 | Innate Tumor Immunity Inc | Dinucleotidi ciclici per il trattamento di condizioni associate all’attività di sting quali il cancro |
| CN114751950B (zh) * | 2016-03-18 | 2025-04-18 | 免疫传感器公司 | 环二核苷酸化合物及使用方法 |
| TN2020000158A1 (en) | 2016-10-04 | 2022-04-04 | Merck Sharp & Dohme | BENZO[b]THIOPHENE COMPOUNDS AS STING AGONISTS |
| IL308894A (en) | 2016-10-14 | 2024-01-01 | Prec Biosciences Inc | Engineered meganucleases specific for recognition sequences in the hepatitis b virus genome |
| JOP20170188A1 (ar) * | 2016-11-25 | 2019-01-30 | Janssen Biotech Inc | ثنائي النوكليوتيدات الحلقية كمنبهات ستينغ (sting) |
| JOP20170192A1 (ar) * | 2016-12-01 | 2019-01-30 | Takeda Pharmaceuticals Co | داي نوكليوتيد حلقي |
| JP2018090562A (ja) * | 2016-12-01 | 2018-06-14 | 武田薬品工業株式会社 | 環状ジヌクレオチド |
| AU2017378783A1 (en) * | 2016-12-20 | 2019-07-04 | Merck Sharp & Dohme Corp. | Cyclic dinucleotide sting agonists for cancer treatment |
| AU2018212787B2 (en) | 2017-01-27 | 2023-10-26 | Janssen Biotech, Inc. | Cyclic dinucleotides as sting agonists |
| ES2924186T3 (es) | 2017-01-27 | 2022-10-05 | Janssen Biotech Inc | Dinucleótidos cíclicos como agonistas de STING |
| US20200055883A1 (en) | 2017-02-17 | 2020-02-20 | Eisai R&D Management Co., Ltd. | Cyclic di-nucleotides derivative for the treatment of cancer |
| US10933078B2 (en) | 2017-02-21 | 2021-03-02 | Board Of Regents, The University Of Texas System | Cyclic dinucleotides as agonists of stimulator of interferon gene dependent signalling |
| WO2018198084A1 (en) * | 2017-04-27 | 2018-11-01 | Lupin Limited | Cyclic di-nucleotide compounds with tricyclic nucleobases |
| WO2018208667A1 (en) | 2017-05-12 | 2018-11-15 | Merck Sharp & Dohme Corp. | Cyclic di-nucleotide compounds as sting agonists |
| CA3071538A1 (en) | 2017-08-04 | 2019-02-07 | Merck Sharp & Dohme Corp. | Benzo[b]thiophene sting agonists for cancer treatment |
| JP2020529421A (ja) | 2017-08-04 | 2020-10-08 | メルク・シャープ・アンド・ドーム・コーポレーションMerck Sharp & Dohme Corp. | がんの処置のためのPD−1アンタゴニストおよびベンゾ[b]チオフェンSTINGアゴニストの組み合わせ |
| MX2020002303A (es) | 2017-08-30 | 2020-09-10 | Beijing Xuanyi Pharmasciences Co Ltd | Dinucleotidos ciclicos como moduladores del estimulador de genes de interferon. |
| WO2019046511A1 (en) * | 2017-08-31 | 2019-03-07 | Sperovie Biosciences, Inc. | COMPOUNDS, COMPOSITIONS AND METHODS FOR THE TREATMENT OF DISEASE |
| US11660311B2 (en) | 2017-10-10 | 2023-05-30 | Bristol-Myers Squibb Company | Cyclic dinucleotides as anticancer agents |
| JP7254821B2 (ja) * | 2017-10-16 | 2023-04-10 | ブリストル-マイヤーズ スクイブ カンパニー | 抗がん剤としての環状ジヌクレオチド |
| WO2019084060A1 (en) | 2017-10-24 | 2019-05-02 | Silverback Therapeutics, Inc. | CONJUGATES AND METHODS OF USE FOR THE SELECTIVE DELIVERY OF IMMUNOMODULATORY AGENTS |
| PE20210156A1 (es) | 2017-11-10 | 2021-01-26 | Takeda Pharmaceuticals Co | Compuestos moduladores de sting y metodos de elaboracion y uso |
| EA038805B1 (ru) * | 2017-11-21 | 2021-10-21 | Такеда Фармасьютикал Компани Лимитед | Циклические динуклеотиды в качестве агонистов sting (стимулятор генов интерферона) |
| CA3085337A1 (en) * | 2017-12-15 | 2019-06-20 | Janssen Biotech, Inc. | Cyclic dinucleotides as sting agonists |
| WO2019123339A1 (en) * | 2017-12-20 | 2019-06-27 | Institute Of Organic Chemistry And Biochemistry Ascr, V.V.I. | 2'3' cyclic dinucleotides with phosphonate bond activating the sting adaptor protein |
| WO2019123340A1 (en) * | 2017-12-20 | 2019-06-27 | Institute Of Organic Chemistry And Biochemistry Ascr, V.V.I. | 3'3' cyclic dinucleotides with phosphonate bond activating the sting adaptor protein |
| US11685761B2 (en) | 2017-12-20 | 2023-06-27 | Merck Sharp & Dohme Llc | Cyclic di-nucleotide compounds as sting agonists |
| WO2019123338A1 (en) * | 2017-12-20 | 2019-06-27 | Institute Of Organic Chemistry And Biochemistry Ascr, V.V.I. | 2'2' cyclic dinucleotides with phosphonate bond activating the sting adaptor protein |
| KR102526964B1 (ko) | 2018-02-26 | 2023-04-28 | 길리애드 사이언시즈, 인코포레이티드 | Hbv 복제 억제제로서의 치환된 피롤리진 화합물 |
| ES2980374T3 (es) | 2018-03-08 | 2024-10-01 | Bristol Myers Squibb Co | Dinucleótidos cíclicos como agentes anticancerosos |
| JP7337086B2 (ja) * | 2018-03-23 | 2023-09-01 | 武田薬品工業株式会社 | スルファメート結合を有するstingモジュレーター化合物、及び製造及び使用の方法 |
| US10793557B2 (en) | 2018-04-03 | 2020-10-06 | Merck Sharp & Dohme Corp. | Sting agonist compounds |
| US11702430B2 (en) | 2018-04-03 | 2023-07-18 | Merck Sharp & Dohme Llc | Aza-benzothiophene compounds as STING agonists |
| WO2019195658A1 (en) | 2018-04-05 | 2019-10-10 | Dana-Farber Cancer Institute, Inc. | Sting levels as a biomarker for cancer immunotherapy |
| EP3774883A1 (en) | 2018-04-05 | 2021-02-17 | Gilead Sciences, Inc. | Antibodies and fragments thereof that bind hepatitis b virus protein x |
| TWI818007B (zh) * | 2018-04-06 | 2023-10-11 | 捷克科學院有機化學與生物化學研究所 | 2'3'-環二核苷酸 |
| TWI833744B (zh) * | 2018-04-06 | 2024-03-01 | 捷克科學院有機化學與生物化學研究所 | 3'3'-環二核苷酸 |
| TW202005654A (zh) | 2018-04-06 | 2020-02-01 | 捷克科學院有機化學與生物化學研究所 | 2,2,─環二核苷酸 |
| TW201945388A (zh) | 2018-04-12 | 2019-12-01 | 美商精密生物科學公司 | 對b型肝炎病毒基因體中之識別序列具有特異性之最佳化之經工程化巨核酸酶 |
| CN110407879A (zh) * | 2018-04-28 | 2019-11-05 | 杭州星鳌生物科技有限公司 | Txs-wx类化合物的化学组成、制备方法及其在抗肿瘤中的应用 |
| TW202014193A (zh) | 2018-05-03 | 2020-04-16 | 捷克科學院有機化學與生物化學研究所 | 包含碳環核苷酸之2’3’-環二核苷酸 |
| MA52754A (fr) | 2018-05-25 | 2021-04-14 | Incyte Corp | Composés hétérocycliques tricycliques en tant qu'activateurs de sting |
| EP3820477A4 (en) | 2018-07-10 | 2022-07-13 | Sperovie Biosciences, Inc. | COMPOUNDS, COMPOSITIONS AND METHODS FOR TREATMENT OF DISEASES |
| TW202030199A (zh) | 2018-07-17 | 2020-08-16 | 美商健生生物科技公司 | 作為sting促效劑之環狀二核苷酸 |
| US10875872B2 (en) | 2018-07-31 | 2020-12-29 | Incyte Corporation | Heteroaryl amide compounds as sting activators |
| WO2020028565A1 (en) | 2018-07-31 | 2020-02-06 | Incyte Corporation | Tricyclic heteraryl compounds as sting activators |
| WO2020028097A1 (en) | 2018-08-01 | 2020-02-06 | Gilead Sciences, Inc. | Solid forms of (r)-11-(methoxymethyl)-12-(3-methoxypropoxy)-3,3-dimethyl-8-0x0-2,3,8,13b-tetrahydro-1h-pyrido[2,1-a]pyrrolo[1,2-c] phthalazine-7-c arboxylic acid |
| KR102783784B1 (ko) | 2018-08-16 | 2025-03-21 | 에자이 알앤드디 매니지먼트 가부시키가이샤 | 화합물의 염 및 이의 결정 |
| MA53438A (fr) | 2018-08-24 | 2021-09-15 | Codiak Biosciences Inc | Vésicules extracellulaires ciblant des cellules dendritiques et utilisations associées |
| SMT202500141T1 (it) * | 2018-09-06 | 2025-05-12 | Daiichi Sankyo Co Ltd | Coniugati farmaco-anticorpo di derivati dinucleotidici ciclici |
| US20200113912A1 (en) | 2018-09-12 | 2020-04-16 | Silverback Therapeutics, Inc. | Methods and Compositions for the Treatment of Disease with Immune Stimulatory Conjugates |
| MX2021003207A (es) * | 2018-09-21 | 2021-06-23 | Shanghai De Novo Pharmatech Co Ltd | Analogo de dinucleotido ciclico. composicion farmaceutica del mismo y su aplicacion. |
| JP7492523B2 (ja) * | 2018-10-12 | 2024-05-29 | シャンハイ ジェミンケア ファーマシューティカル カンパニー,リミティド | 環状ジヌクレオチド化合物及びその使用 |
| US11110106B2 (en) | 2018-10-29 | 2021-09-07 | Venenum Biodesign, LLC | Sting agonists for treating bladder cancer and solid tumors |
| AU2019371206A1 (en) | 2018-10-29 | 2021-05-27 | Venenum Biodesign, LLC | Novel sting agonists |
| PL3873903T3 (pl) | 2018-10-31 | 2024-05-20 | Gilead Sciences, Inc. | Podstawione związki 6-azabenzimidazolu jako inhibitory hpk1 |
| US11071730B2 (en) | 2018-10-31 | 2021-07-27 | Gilead Sciences, Inc. | Substituted 6-azabenzimidazole compounds |
| TWI827720B (zh) * | 2018-11-02 | 2024-01-01 | 大陸商上海濟煜醫藥科技有限公司 | 環二核苷酸化合物及其應用 |
| US11596692B1 (en) | 2018-11-21 | 2023-03-07 | Incyte Corporation | PD-L1/STING conjugates and methods of use |
| CN111349132B (zh) * | 2018-12-21 | 2021-06-04 | 上海济煜医药科技有限公司 | 肿瘤免疫类化合物及其应用 |
| US12129267B2 (en) | 2019-01-07 | 2024-10-29 | Incyte Corporation | Heteroaryl amide compounds as sting activators |
| CN113543851B (zh) * | 2019-03-07 | 2025-03-18 | 捷克共和国有机化学与生物化学研究所 | 2’3’-环二核苷酸及其前药 |
| WO2020178768A1 (en) | 2019-03-07 | 2020-09-10 | Institute Of Organic Chemistry And Biochemistry Ascr, V.V.I. | 3'3'-cyclic dinucleotide analogue comprising a cyclopentanyl modified nucleotide as sting modulator |
| US20220143061A1 (en) | 2019-03-07 | 2022-05-12 | Institute Of Organic Chemistry And Biochemistry Ascr, V.V.I. | 3'3'-cyclic dinucleotides and prodrugs thereof |
| SG11202109702QA (en) | 2019-03-21 | 2021-10-28 | Codiak Biosciences Inc | Extracellular vesicles for vaccine delivery |
| US12233356B2 (en) | 2019-03-21 | 2025-02-25 | Lonza Sales Ag | Process for preparing extracellular vesicles |
| WO2020210938A1 (en) * | 2019-04-15 | 2020-10-22 | Bioardis Llc | Quinazoline derivatives as cd73 inhibitors |
| CN109929894B (zh) * | 2019-04-17 | 2021-06-01 | 中国农业科学院兰州兽医研究所 | 一种猪源第二信使分子2′3′-cGAMP的制备及活性鉴定方法 |
| TWI751516B (zh) | 2019-04-17 | 2022-01-01 | 美商基利科學股份有限公司 | 類鐸受體調節劑之固體形式 |
| TWI751517B (zh) | 2019-04-17 | 2022-01-01 | 美商基利科學股份有限公司 | 類鐸受體調節劑之固體形式 |
| WO2020227421A1 (en) * | 2019-05-09 | 2020-11-12 | Aligos Therapeutics, Inc. | Modified cyclic dinucleoside compounds as sting modulators |
| EP3972695A1 (en) | 2019-05-23 | 2022-03-30 | Gilead Sciences, Inc. | Substituted exo-methylene-oxindoles which are hpk1/map4k1 inhibitors |
| US20210009718A1 (en) | 2019-06-25 | 2021-01-14 | Gilead Sciences, Inc. | FLT3L-Fc FUSION PROTEINS AND METHODS OF USE |
| US20220251200A1 (en) | 2019-07-03 | 2022-08-11 | Codiak Biosciences, Inc. | Extracellular vesicles targeting t cells and uses thereof |
| WO2021007160A1 (en) * | 2019-07-05 | 2021-01-14 | Tambo, Inc. | Trans-cyclooctene bioorthogonal agents and uses in cancer and immunotherapy |
| WO2021016204A1 (en) | 2019-07-19 | 2021-01-28 | Immunesensor Therapeutics, Inc. | Antibody-sting agonist conjugates and their use in immunotherapy |
| EP4017476A1 (en) | 2019-08-19 | 2022-06-29 | Gilead Sciences, Inc. | Pharmaceutical formulations of tenofovir alafenamide |
| WO2021041532A1 (en) | 2019-08-26 | 2021-03-04 | Dana-Farber Cancer Institute, Inc. | Use of heparin to promote type 1 interferon signaling |
| EP4034276A1 (en) * | 2019-09-25 | 2022-08-03 | Codiak BioSciences, Inc. | Methods of producing extracellular vesicles |
| US20240099973A1 (en) | 2019-09-25 | 2024-03-28 | Lonza Sales Ag | Extracellular vesicle compositions |
| US11497808B2 (en) | 2019-09-30 | 2022-11-15 | Gilead Sciences, Inc. | HBV vaccines and methods treating HBV |
| WO2021067644A1 (en) | 2019-10-01 | 2021-04-08 | Silverback Therapeutics, Inc. | Combination therapy with immune stimulatory conjugates |
| EP4045059A1 (en) * | 2019-10-14 | 2022-08-24 | Immunesensor Therapeutics, Inc. | Methods of treating cancer with a sting agonist |
| EP4567109A3 (en) | 2019-12-06 | 2025-09-17 | Precision Biosciences, Inc. | Optimized engineered meganucleases having specificity for a recognition sequence in the hepatitis b virus genome |
| EP4106819A1 (en) | 2020-02-21 | 2022-12-28 | Silverback Therapeutics, Inc. | Nectin-4 antibody conjugates and uses thereof |
| EP4115909A4 (en) | 2020-03-06 | 2024-10-30 | Daiichi Sankyo Company, Limited | ANTIBODY-DRUG CONJUGATE WITH NOVEL CYCLIC DINUCLEOTIDE DERIVATIVE |
| WO2021184017A1 (en) | 2020-03-13 | 2021-09-16 | Codiak Biosciences, Inc. | Extracellular vesicles for treating neurological disorders |
| TW202421168A (zh) | 2020-03-20 | 2024-06-01 | 美商基利科學股份有限公司 | 4’-c-經取代-2-鹵基-2’-去氧腺苷核苷之前藥及其製造與使用方法 |
| AU2021236763A1 (en) | 2020-03-20 | 2022-10-06 | Lonza Sales Ag | Extracellular vesicles for therapy |
| EP4134098A4 (en) | 2020-04-10 | 2024-05-15 | ONO Pharmaceutical Co., Ltd. | Method of cancer therapy |
| EP4149457A1 (en) * | 2020-05-15 | 2023-03-22 | Immunesensor Therapeutics, Inc. | Sting agonist combination treatments with immune checkpoint inhibitors |
| KR20230047361A (ko) | 2020-07-01 | 2023-04-07 | 아르스 파마슈티컬스 인크. | 항-asgr1 항체 접합체 및 이의 용도 |
| WO2022031894A1 (en) | 2020-08-07 | 2022-02-10 | Gilead Sciences, Inc. | Prodrugs of phosphonamide nucleotide analogues and their pharmaceutical use |
| TW202227479A (zh) | 2020-09-02 | 2022-07-16 | 日商第一三共股份有限公司 | 新穎內-β-N-乙醯葡萄糖胺苷酶 |
| WO2022066883A1 (en) | 2020-09-23 | 2022-03-31 | Codiak Biosciences, Inc. | Extracellular vesicles comprising kras antigens and uses thereof |
| US20240241020A1 (en) | 2020-09-23 | 2024-07-18 | Lonza Sales Ag | Process for preparing extracellular vesicles |
| CA3192470A1 (en) | 2020-09-23 | 2022-03-31 | Tim SOOS | Methods of producing extracellular vesicles |
| EP4217087A2 (en) | 2020-09-23 | 2023-08-02 | Codiak BioSciences, Inc. | Process for preparing extracellular vesicles |
| EP4240488A1 (en) | 2020-11-09 | 2023-09-13 | Takeda Pharmaceutical Company Limited | Antibody drug conjugates |
| EP4337223A1 (en) | 2021-05-13 | 2024-03-20 | Gilead Sciences, Inc. | Combination of a tlr8 modulating compound and anti-hbv sirna therapeutics |
| TW202313094A (zh) | 2021-05-18 | 2023-04-01 | 美商基利科學股份有限公司 | 使用FLT3L—Fc融合蛋白之方法 |
| MX2023014762A (es) | 2021-06-23 | 2024-01-15 | Gilead Sciences Inc | Compuestos moduladores de diacilglicerol quinasa. |
| US11976072B2 (en) | 2021-06-23 | 2024-05-07 | Gilead Sciences, Inc. | Diacylglycerol kinase modulating compounds |
| EP4359411A1 (en) | 2021-06-23 | 2024-05-01 | Gilead Sciences, Inc. | Diacylglyercol kinase modulating compounds |
| EP4359413A1 (en) | 2021-06-23 | 2024-05-01 | Gilead Sciences, Inc. | Diacylglyercol kinase modulating compounds |
| US20230121320A1 (en) * | 2021-07-23 | 2023-04-20 | Immunesensor Therapeutics, Inc. | Sting agonist combination treatments with cytokines |
| EP4137499A1 (en) | 2021-08-17 | 2023-02-22 | Ustav organicke chemie a biochemie AV CR, v.v.i. | 7-substituted 7-deazaadenine-containing 2,3 -cyclic dinucleotides |
| KR20240155298A (ko) | 2022-03-02 | 2024-10-28 | 다이이찌 산쿄 가부시키가이샤 | Fc 함유 분자의 제조 방법 |
| WO2024048490A1 (ja) | 2022-08-29 | 2024-03-07 | 第一三共株式会社 | 変異Fc領域を含む抗体薬物コンジュゲート |
| CN115417906B (zh) * | 2022-09-14 | 2024-02-27 | 杭州星鳌生物科技有限公司 | 环二核苷酸金属化合物及其制备方法、应用 |
| GB202304385D0 (en) | 2023-03-24 | 2023-05-10 | Prostate Cancer Res | Combinatorial IL-15 therapy |
| US20250345389A1 (en) | 2024-05-13 | 2025-11-13 | Gilead Sciences, Inc. | Combination therapies |
| WO2025240242A1 (en) | 2024-05-13 | 2025-11-20 | Gilead Sciences, Inc. | Combination therapies with ribavirin |
| WO2025240244A1 (en) | 2024-05-13 | 2025-11-20 | Gilead Sciences, Inc. | Combination therapies comprising bulevirtide and lonafarnib for use in the treatment of hepatitis d virus infection |
| WO2025240246A1 (en) | 2024-05-13 | 2025-11-20 | Gilead Sciences, Inc. | Combination therapies with ribavirin |
Citations (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2014189805A1 (en) * | 2013-05-18 | 2014-11-27 | Auro Biotech, Inc. | Compositions and methods for activating "stimulator of interferon gene"-dependent signalling |
| JP2015518901A (ja) * | 2012-06-08 | 2015-07-06 | アデュロ バイオテック | 癌免疫療法のための組成物および方法 |
| CN104962561A (zh) * | 2015-06-25 | 2015-10-07 | 河南农业大学 | 酶促cGAMP生成量检测所用RNA适配体及检测方法 |
| WO2017027646A1 (en) * | 2015-08-13 | 2017-02-16 | Merck Sharp & Dohme Corp. | Cyclic di-nucleotide compounds as sting agonists |
| JP6980198B2 (ja) * | 2016-03-18 | 2021-12-15 | イミューン センサー リミテッド ライアビリティ カンパニー | 環状ジヌクレオチド化合物および使用方法 |
Family Cites Families (91)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB9716557D0 (en) | 1997-08-06 | 1997-10-08 | Glaxo Group Ltd | Benzylidene-1,3-dihydro-indol-2-one derivatives having anti-cancer activity |
| US8367716B2 (en) | 2003-07-28 | 2013-02-05 | Karaolis David K R | Method for attentuating virulence of microbial pathogens and for inhibiting microbial biofilm formation |
| EP1740192B1 (en) | 2004-03-15 | 2012-06-13 | David K. R. Karaolis | Cyclic dinucleotide for stimulating the immune of inflammatory response |
| EP1782826A1 (en) | 2005-11-08 | 2007-05-09 | GBF Gesellschaft für Biotechnologische Forschung mbH | PQS and c-diGMP and its conjugates as adjuvants and their uses in pharmaceutical compositions |
| JP2011529708A (ja) | 2008-08-04 | 2011-12-15 | ユニバーシティ オブ マイアミ | 自然免疫応答の調節因子sting(インターフェロン遺伝子の刺激因子) |
| EP2448954A1 (en) | 2009-07-01 | 2012-05-09 | Rutgers, The State University of New Jersey | Synthesis of cyclic diguanosine monophosphate and thiophosphate analogs thereof |
| US9061048B2 (en) | 2010-12-15 | 2015-06-23 | The Regents Of The University Of California | Cyclic di-AMP induction of type I interferon |
| JP5650780B2 (ja) | 2012-04-04 | 2015-01-07 | 日東電工株式会社 | ワクチン組成物 |
| KR20150004416A (ko) | 2012-04-30 | 2015-01-12 | 글렌 엔. 바버 | 면역 반응의 조절 |
| EA201590396A1 (ru) | 2012-12-13 | 2015-12-30 | Адуро Биотек, Инк. | Композиция, содержащая циклические пуриновые динуклеотиды с определенной стереохимией, и способ ее получения и применения |
| MX365661B (es) | 2012-12-19 | 2019-06-10 | Univ Texas | Activacion farmaceutica de una senda de señalizacion de di-nucleotido ciclico de mamifero. |
| JP2016503655A (ja) * | 2012-12-27 | 2016-02-08 | アデュロ バイオテック,インコーポレイテッド | リステリアの抗原配列の発現を容易にするシグナルペプチド融合パートナー、ならびにその調製方法およびその使用 |
| JP6153116B2 (ja) | 2013-01-09 | 2017-06-28 | 国立大学法人東北大学 | トリアゾール連結型環状ジヌクレオチド類縁体 |
| ES2935257T3 (es) * | 2013-03-15 | 2023-03-03 | Univ Chicago | Métodos y composiciones relacionadas con la actividad de las células T |
| CA2908154C (en) | 2013-04-29 | 2023-11-28 | Memorial Sloan Kettering Cancer Center | Compositions and methods for altering second messenger signaling |
| WO2014179760A1 (en) | 2013-05-03 | 2014-11-06 | The Regents Of The University Of California | Cyclic di-nucleotide induction of type i interferon |
| US9549944B2 (en) | 2013-05-18 | 2017-01-24 | Aduro Biotech, Inc. | Compositions and methods for inhibiting “stimulator of interferon gene”—dependent signalling |
| JP6400082B2 (ja) * | 2013-05-18 | 2018-10-03 | アデュロ バイオテック,インコーポレイテッド | 「インターフェロン遺伝子の刺激因子」依存性シグナル伝達を抑制するための組成物および方法 |
| WO2015017652A1 (en) | 2013-07-31 | 2015-02-05 | Memorial Sloan-Kettering Cancer Center | Sting crystals and modulators |
| CN109394752A (zh) | 2013-10-21 | 2019-03-01 | 德雷克塞尔大学 | 治疗慢性乙型肝炎病毒感染的sting激动剂的用途 |
| JP2016538344A (ja) | 2013-11-19 | 2016-12-08 | ザ・ユニバーシティ・オブ・シカゴThe University Of Chicago | 癌処置としてのstingアゴニストの使用 |
| EP3094342A4 (en) * | 2014-01-15 | 2017-12-27 | Nikolai Khodarev | Anti-tumor therapy |
| CN103908468B (zh) | 2014-04-21 | 2017-02-08 | 上海捌加壹医药科技有限公司 | 环二核苷酸cGAMP在制备抗肿瘤药物中的应用 |
| ES2692226T3 (es) * | 2014-06-04 | 2018-11-30 | Glaxosmithkline Intellectual Property Development Limited | Dinucleótidos cíclicos como moduladores de STING |
| US11058758B2 (en) | 2014-11-20 | 2021-07-13 | National Institutes Of Biomedical Innovation, Health And Nutrition | TH1-inducing adjuvant comprising combination of different nucleic acid adjuvants, and use of same |
| US20170340658A1 (en) | 2014-12-16 | 2017-11-30 | Invivogen | Combined use of a chemotherapeutic agent and a cyclic dinucleotide for cancer treatment |
| ES2764178T3 (es) | 2014-12-16 | 2020-06-02 | Kayla Therapeutics | Dinucleótidos cíclicos fluorados para inducción de citocinas |
| CN112626153A (zh) | 2014-12-17 | 2021-04-09 | 立博美华基因科技有限责任公司 | 用cGAMP或cGAsMP治疗癌症的方法 |
| GB201501462D0 (en) | 2015-01-29 | 2015-03-18 | Glaxosmithkline Ip Dev Ltd | Novel compounds |
| HK1247089A1 (zh) | 2015-03-10 | 2018-09-21 | Aduro Biotech, Inc. | 用於活化“干扰素基因刺激物”依赖性信号传导的组合物和方法 |
| WO2016176222A1 (en) | 2015-04-30 | 2016-11-03 | University Of Washington | Cgas in systemic lupus erythematosus (sle) |
| BR112017026709A2 (pt) | 2015-06-11 | 2018-08-28 | Univ Miami | tratamento e diagnóstico de câncer |
| CN106318997A (zh) | 2015-07-03 | 2017-01-11 | 聊城市奥润生物医药科技有限公司 | 硫(硒)代磷酸环二核苷酸cGAMP的高效制备、纯化方法 |
| WO2017011444A1 (en) | 2015-07-13 | 2017-01-19 | The Wistar Institute Of Anatomy And Biology | Methods and compositions for treating b cell cancers |
| TW201717968A (zh) | 2015-07-14 | 2017-06-01 | 春季銀行製藥公司 | 誘導rig-i和其他模式辨識受體之化合物及組成物 |
| UY36969A (es) | 2015-10-28 | 2017-05-31 | Novartis Ag | Composiciones y métodos para activar la señalización dependiente del estimulador del gen de interferon |
| US20170146519A1 (en) | 2015-11-20 | 2017-05-25 | Oregon Health & Science University | Sting agonists and methods of selecting sting agonists |
| MX363780B (es) | 2015-12-03 | 2019-04-03 | Glaxosmithkline Ip Dev Ltd | Dinucleótidos de purina cíclica como moduladores del estimulador de los genes de interferón. |
| US20170158772A1 (en) | 2015-12-07 | 2017-06-08 | Opi Vi - Ip Holdco Llc | Compositions of antibody construct - agonist conjugates and methods of use thereof |
| DE212016000029U1 (de) | 2015-12-07 | 2017-07-30 | Opi Vi - Ip Holdco Llc | Zusammensetzungen von Antikörperkonstrukt-Agonist-Konjugaten |
| CN106554416B (zh) | 2015-12-09 | 2019-03-15 | 聊城市奥润生物医药科技有限公司 | 一种抗pd-l1人源化单克隆抗体联合干扰素基因刺激蛋白(sting)激动剂在抗肿瘤中的应用 |
| CN106540260A (zh) | 2015-12-09 | 2017-03-29 | 聊城市奥润生物医药科技有限公司 | 干扰素基因刺激蛋白(sting)激动剂在抗阿尔兹海默症中的应用 |
| WO2017106740A1 (en) | 2015-12-16 | 2017-06-22 | Aduro Biotech, Inc. | Methods for identifying inhibitors of "stimulator of interferon gene"-dependent interferon production |
| WO2017123657A1 (en) | 2016-01-11 | 2017-07-20 | Gary Glick | Cyclic dinucleotides for treating conditions associated with sting activity such as cancer |
| SMT202500412T1 (it) | 2016-01-11 | 2025-11-10 | Innate Tumor Immunity Inc | Dinucleotidi ciclici per il trattamento di condizioni associate all’attività di sting quali il cancro |
| US20170239283A1 (en) | 2016-02-23 | 2017-08-24 | Providence Health & Services - Oregon | Use of sting agonists to treat virally-induced and pre-malignant growths |
| JP2019511483A (ja) | 2016-03-02 | 2019-04-25 | ザ ボード オブ リージェンツ オブ ザ ユニバーシティー オブ テキサス システム | 免疫療法のためのsting活性化ナノワクチン |
| WO2017156391A1 (en) | 2016-03-11 | 2017-09-14 | Spring Bank Pharmaceuticals, Inc. | Compounds and compositions for the treatment of infections |
| CN108779473A (zh) | 2016-03-16 | 2018-11-09 | 法国居里学院 | 用于制备具有环二核苷酸的病毒颗粒的方法和所述颗粒用于治疗癌症的用途 |
| CN106539757A (zh) | 2016-03-20 | 2017-03-29 | 聊城市奥润生物医药科技有限公司 | 环二核苷酸cGAMP-脂质体在抗肿瘤中的应用 |
| WO2017175156A1 (en) | 2016-04-07 | 2017-10-12 | Glaxosmithkline Intellectual Property Development Limited | Heterocyclic amides useful as protein modulators |
| JOP20170083B1 (ar) | 2016-04-07 | 2022-03-14 | Glaxosmithkline Ip Dev Ltd | أميدات هتيروسيكلية مفيدة كمعدلات بروتين |
| WO2017186711A1 (en) | 2016-04-25 | 2017-11-02 | Invivogen | Novel complexes of immunostimulatory compounds, and uses thereof |
| CN107412260B (zh) | 2016-05-23 | 2022-07-19 | 北京大学 | cGAS-STING通路激活剂及其用途 |
| WO2017218358A1 (en) | 2016-06-13 | 2017-12-21 | The Regents Of The University Of California | FLUORESCENT BIOSENSOR FOR 2', 3'-cGAMP |
| CN106552265A (zh) | 2016-06-21 | 2017-04-05 | 聊城市奥润生物医药科技有限公司 | Sting激动剂与ido1抑制剂联合用药在抗肿瘤中的应用 |
| IL263680B2 (en) | 2016-06-24 | 2025-10-01 | Infinity Pharmaceuticals Inc | PI3K inhibitors for use in combination with a second therapeutic agent for the treatment, management or prevention of cancer |
| US11098077B2 (en) | 2016-07-05 | 2021-08-24 | Chinook Therapeutics, Inc. | Locked nucleic acid cyclic dinucleotide compounds and uses thereof |
| EP3481402A4 (en) | 2016-07-06 | 2020-01-22 | Sperovie Biosciences, Inc. | CONNECTIONS, COMPOSITIONS AND METHODS FOR TREATING A DISEASE |
| WO2018009652A1 (en) | 2016-07-06 | 2018-01-11 | Sperovie Biosciences, Inc. | Compounds, compositions, and methods for the treatment of disease |
| WO2018013887A1 (en) | 2016-07-15 | 2018-01-18 | Sperovie Biosciences, Inc. | Compounds, compositions, and methods for the treatment of disease |
| US11725035B2 (en) | 2016-08-09 | 2023-08-15 | Stipe Therapeutics Aps | Methods of treating a disorder associated with with insufficient stimulator of interferon genes (STING) activity |
| BR112019004042A2 (pt) | 2016-08-30 | 2019-05-28 | Dana-Farber Cancer Institute, Inc. | composições de liberação de fármaco e usos das mesmas |
| US20190345191A1 (en) | 2016-08-31 | 2019-11-14 | Innate Tumor Immunity, Inc. | Cyclic dinucleotide analogs for treating conditions associated with sting (stimulator of interferon genes) activity |
| US11052149B2 (en) | 2016-09-19 | 2021-07-06 | The University Of North Carolina At Chapel Hill | Methods and compositions for inducing an immune response |
| US10537590B2 (en) | 2016-09-30 | 2020-01-21 | Boehringer Ingelheim International Gmbh | Cyclic dinucleotide compounds |
| TN2020000158A1 (en) | 2016-10-04 | 2022-04-04 | Merck Sharp & Dohme | BENZO[b]THIOPHENE COMPOUNDS AS STING AGONISTS |
| WO2018065360A1 (de) | 2016-10-07 | 2018-04-12 | Biolog Life Science Institute Forschungslabor Und Biochemica-Vertrieb Gmbh | Benzimidazolhaltige cyclische dinukleotide, verfahren zu deren herstellung und ihre verwendung zur aktivierung von stimulator von interferongenen (sting)-abhängigen signalwegen |
| EP3525817A4 (en) | 2016-10-11 | 2020-09-16 | The Governors of the University of Alberta | HEPATITIS C VIRUS-BASED IMMUNOGENIC COMPOSITIONS INCLUDING AS ADJUSTING A CYCLIC DINULEOTIDE OR ARCHAEOSOME AND THEIR METHODS OF USE |
| JOP20170188A1 (ar) | 2016-11-25 | 2019-01-30 | Janssen Biotech Inc | ثنائي النوكليوتيدات الحلقية كمنبهات ستينغ (sting) |
| JOP20170192A1 (ar) | 2016-12-01 | 2019-01-30 | Takeda Pharmaceuticals Co | داي نوكليوتيد حلقي |
| AU2017378782A1 (en) | 2016-12-20 | 2019-07-04 | Merck Sharp & Dohme Corp. | Combinations of PD-1 antagonists and cyclic dinucleotide sting agonists for cancer treatment |
| AU2017378783A1 (en) | 2016-12-20 | 2019-07-04 | Merck Sharp & Dohme Corp. | Cyclic dinucleotide sting agonists for cancer treatment |
| WO2018119117A1 (en) | 2016-12-22 | 2018-06-28 | The Regents Of The University Of California | Methods of producing cyclic dinucleotides |
| CA3047579A1 (en) | 2016-12-22 | 2018-06-28 | Mavupharma, Inc. | Compositions and methods of enhancing or augmenting type i ifn production |
| EA201991556A1 (ru) | 2016-12-22 | 2020-01-23 | Мавуфарма, Инк. | Ингибиторы фосфодиэстеразы и способы лечения микробной инфекции |
| AU2018212787B2 (en) | 2017-01-27 | 2023-10-26 | Janssen Biotech, Inc. | Cyclic dinucleotides as sting agonists |
| ES2924186T3 (es) | 2017-01-27 | 2022-10-05 | Janssen Biotech Inc | Dinucleótidos cíclicos como agonistas de STING |
| US20190336615A1 (en) | 2017-01-27 | 2019-11-07 | Silverback Therapeutics, Inc. | Tumor targeting conjugates and methods of use thereof |
| JP7731656B2 (ja) | 2017-02-01 | 2025-09-01 | モデルナティエックス インコーポレイテッド | Rna癌ワクチン |
| JP2018131427A (ja) | 2017-02-17 | 2018-08-23 | 国立研究開発法人理化学研究所 | 免疫細胞の制御技術 |
| US10933078B2 (en) | 2017-02-21 | 2021-03-02 | Board Of Regents, The University Of Texas System | Cyclic dinucleotides as agonists of stimulator of interferon gene dependent signalling |
| JOP20190218A1 (ar) | 2017-03-22 | 2019-09-22 | Boehringer Ingelheim Int | مركبات ثنائية النيوكليوتيدات حلقية معدلة |
| WO2018198084A1 (en) | 2017-04-27 | 2018-11-01 | Lupin Limited | Cyclic di-nucleotide compounds with tricyclic nucleobases |
| WO2018208667A1 (en) | 2017-05-12 | 2018-11-15 | Merck Sharp & Dohme Corp. | Cyclic di-nucleotide compounds as sting agonists |
| EP3431484A1 (en) | 2017-07-21 | 2019-01-23 | Ludwig-Maximilians-Universität München | A fluorescent cyclic dinucleotide and its use in methods of identifying substances having an ability to modulate the cgas/sting pathway |
| CN107335049B (zh) | 2017-08-18 | 2019-10-18 | 中国药科大学 | 菊科类型环肽化合物作为cGAS-STING信号通路抑制剂的应用 |
| MX2020002303A (es) | 2017-08-30 | 2020-09-10 | Beijing Xuanyi Pharmasciences Co Ltd | Dinucleotidos ciclicos como moduladores del estimulador de genes de interferon. |
| WO2019046511A1 (en) | 2017-08-31 | 2019-03-07 | Sperovie Biosciences, Inc. | COMPOUNDS, COMPOSITIONS AND METHODS FOR THE TREATMENT OF DISEASE |
| JP7337086B2 (ja) | 2018-03-23 | 2023-09-01 | 武田薬品工業株式会社 | スルファメート結合を有するstingモジュレーター化合物、及び製造及び使用の方法 |
| CN108498529A (zh) | 2018-06-20 | 2018-09-07 | 福建师范大学 | 用于肿瘤预防治疗的DNA甲基转移酶抑制剂与cGAMP药物组合物 |
-
2017
- 2017-03-17 CN CN202210558244.6A patent/CN114751950B/zh active Active
- 2017-03-17 PL PL17767683.0T patent/PL3429596T3/pl unknown
- 2017-03-17 MX MX2018011224A patent/MX390014B/es unknown
- 2017-03-17 BR BR112018068748-0A patent/BR112018068748B1/pt active IP Right Grant
- 2017-03-17 CA CA3017524A patent/CA3017524A1/en active Pending
- 2017-03-17 HR HRP20221263TT patent/HRP20221263T1/hr unknown
- 2017-03-17 CN CN202111504995.1A patent/CN114230625A/zh active Pending
- 2017-03-17 MA MA043827A patent/MA43827A/fr unknown
- 2017-03-17 WO PCT/US2017/023093 patent/WO2017161349A1/en not_active Ceased
- 2017-03-17 EP EP17767683.0A patent/EP3429596B1/en active Active
- 2017-03-17 LT LTEPPCT/US2017/023093T patent/LT3429596T/lt unknown
- 2017-03-17 DK DK17767683.0T patent/DK3429596T3/da active
- 2017-03-17 SG SG10201912074PA patent/SG10201912074PA/en unknown
- 2017-03-17 AU AU2017233068A patent/AU2017233068C1/en active Active
- 2017-03-17 IL IL280430A patent/IL280430B2/en unknown
- 2017-03-17 PT PT177676830T patent/PT3429596T/pt unknown
- 2017-03-17 NZ NZ746112A patent/NZ746112A/en unknown
- 2017-03-17 ES ES17767683T patent/ES2929628T3/es active Active
- 2017-03-17 HU HUE17767683A patent/HUE060396T2/hu unknown
- 2017-03-17 JP JP2018568181A patent/JP6980198B2/ja active Active
- 2017-03-17 SG SG11201807660QA patent/SG11201807660QA/en unknown
- 2017-03-17 CN CN201780030376.9A patent/CN109475570B/zh active Active
- 2017-03-17 KR KR1020187029283A patent/KR102530488B1/ko active Active
- 2017-03-17 EP EP19218894.4A patent/EP3692996A1/en active Pending
-
2018
- 2018-04-15 US US15/953,492 patent/US10519188B2/en active Active
- 2018-09-11 ZA ZA2018/06074A patent/ZA201806074B/en unknown
- 2018-09-14 MX MX2022001755A patent/MX2022001755A/es unknown
- 2018-09-17 IL IL261827A patent/IL261827B/en active IP Right Grant
-
2019
- 2019-06-11 US US16/438,153 patent/US11299512B2/en active Active
-
2020
- 2020-02-27 JP JP2020031617A patent/JP6980200B2/ja active Active
-
2021
- 2021-11-05 JP JP2021180838A patent/JP2022017500A/ja active Pending
-
2022
- 2022-03-17 US US17/697,247 patent/US20220340613A1/en not_active Abandoned
Patent Citations (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2015518901A (ja) * | 2012-06-08 | 2015-07-06 | アデュロ バイオテック | 癌免疫療法のための組成物および方法 |
| WO2014189805A1 (en) * | 2013-05-18 | 2014-11-27 | Auro Biotech, Inc. | Compositions and methods for activating "stimulator of interferon gene"-dependent signalling |
| CN104962561A (zh) * | 2015-06-25 | 2015-10-07 | 河南农业大学 | 酶促cGAMP生成量检测所用RNA适配体及检测方法 |
| WO2017027646A1 (en) * | 2015-08-13 | 2017-02-16 | Merck Sharp & Dohme Corp. | Cyclic di-nucleotide compounds as sting agonists |
| JP6980198B2 (ja) * | 2016-03-18 | 2021-12-15 | イミューン センサー リミテッド ライアビリティ カンパニー | 環状ジヌクレオチド化合物および使用方法 |
| JP6980200B2 (ja) * | 2016-03-18 | 2021-12-15 | イミューン センサー リミテッド ライアビリティ カンパニー | 環状ジヌクレオチド化合物および使用方法 |
Non-Patent Citations (2)
| Title |
|---|
| LI,L. ET AL.: "Hydrolysis of 2'3'-cGAMP by ENPP1 and design of nonhydrolyzable analogs", NATURE CHEMICAL BIOLOGY, vol. 10, no. 12, JPN6022048439, 2014, pages 1043 - 1048, ISSN: 0005136648 * |
| ZHANG,X. ET AL.: "Cyclic GMP-AMP Containing Mixed Phosphodiester Linkages Is An Endogenous High-Affinity Ligand for ST", MOLECULAR CELL, vol. 51, no. 2, JPN6022048440, 2013, pages 226 - 235, ISSN: 0004922543 * |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6980200B2 (ja) | 環状ジヌクレオチド化合物および使用方法 | |
| CN106459131B (zh) | 作为sting调节剂的环状二核苷酸 | |
| JP6722682B2 (ja) | 特に癌の治療に有用な環状ヌクレオチド | |
| EA020488B1 (ru) | Производные пурина или деазапурина для применения при лечении вирусных инфекций и других заболеваний | |
| RU2361589C2 (ru) | Способ лечения рака | |
| HK40073085A (en) | Cyclic di-nucleotide compounds and methods of use | |
| HK40003440B (zh) | 环二核苷酸化合物及使用方法 | |
| HK40003440A (en) | Cyclic di-nucleotide compounds and methods of use | |
| HK40035878A (en) | Cyclic di-nucleotide compounds and methods of use | |
| TW202539640A (zh) | 三環化合物之尿素衍生物及其組成物與方法 | |
| EA037513B1 (ru) | Циклические динуклеотидные соединения и способы их применения |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20211206 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20211206 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20221116 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20230214 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20230512 |
|
| RD04 | Notification of resignation of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7424 Effective date: 20230720 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20230828 |