JP2017532042A - 標的化核酸配列決定のための方法及び組成物 - Google Patents
標的化核酸配列決定のための方法及び組成物 Download PDFInfo
- Publication number
- JP2017532042A JP2017532042A JP2017519628A JP2017519628A JP2017532042A JP 2017532042 A JP2017532042 A JP 2017532042A JP 2017519628 A JP2017519628 A JP 2017519628A JP 2017519628 A JP2017519628 A JP 2017519628A JP 2017532042 A JP2017532042 A JP 2017532042A
- Authority
- JP
- Japan
- Prior art keywords
- probes
- nucleic acid
- library
- fragment
- fragments
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/68—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving nucleic acids
- C12Q1/6806—Preparing nucleic acids for analysis, e.g. for polymerase chain reaction [PCR] assay
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/68—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving nucleic acids
- C12Q1/6813—Hybridisation assays
- C12Q1/6834—Enzymatic or biochemical coupling of nucleic acids to a solid phase
- C12Q1/6837—Enzymatic or biochemical coupling of nucleic acids to a solid phase using probe arrays or probe chips
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/68—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving nucleic acids
- C12Q1/6869—Methods for sequencing
- C12Q1/6874—Methods for sequencing involving nucleic acid arrays, e.g. sequencing by hybridisation
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q2535/00—Reactions characterised by the assay type for determining the identity of a nucleotide base or a sequence of oligonucleotides
- C12Q2535/122—Massive parallel sequencing
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q2537/00—Reactions characterised by the reaction format or use of a specific feature
- C12Q2537/10—Reactions characterised by the reaction format or use of a specific feature the purpose or use of
- C12Q2537/159—Reduction of complexity, e.g. amplification of subsets, removing duplicated genomic regions
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q2563/00—Nucleic acid detection characterized by the use of physical, structural and functional properties
- C12Q2563/179—Nucleic acid detection characterized by the use of physical, structural and functional properties the label being a nucleic acid
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q2565/00—Nucleic acid analysis characterised by mode or means of detection
- C12Q2565/50—Detection characterised by immobilisation to a surface
- C12Q2565/514—Detection characterised by immobilisation to a surface characterised by the use of the arrayed oligonucleotides as identifier tags, e.g. universal addressable array, anti-tag or tag complement array
Abstract
Description
本出願は、米国特許仮出願第62/072,164号、2014年10月29日出願の利益を主張し、これは、全ての目的においてその全体が参照として本明細書に明確に組み込まれる。
本開示は、遺伝子材料の特徴決定に有用な方法、組成物及び系を提供する。特に、本明細書に記載されている方法、組成物及び系は、特定の染色体、染色体の領域、全てのエクソン(エクソーム)、エクソームの一部、特定の遺伝子、遺伝子のパネル(例えば、カイノームもしくは他の標的化遺伝子パネル)、イントロン領域、ゲノムのタイル状部分、またはゲノムの任意の他の選択部分が限定されることなく含まれる、ゲノムの標的化領域の遺伝子特徴決定を提供する。
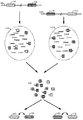
1つの例示的な態様において、本開示に記載されている方法及び系は、個別の試料(例えば、核酸)を分離区分に沈着または区分化することを提供し、それぞれの区分は、それ自体の内容物を他の区分の内容物から離した状態に維持している。本明細書において使用されるとき、区分とは、様々な異なる形態、例えば、ウエル、管、マイクロまたはナノウエル、中空などの容器または器を指す。しかし好ましい態様では、区分は流体流の中で流動可能である。これらの器は、例えば、内側流体中心またはコアを囲む外側隔壁を有するマイクロカプセルまたは微小胞から構成されていてもよく、あるいは、マトリックス内に材料を進入させる及び/または保持することができる多孔質マトリックスであってもよい。しかし好ましい態様では、これらの区分は、非水性連続相、例えば油相内の水性流体の液滴を構成しうる。様々な異なる器は、例えば、米国特許出願第13/966,150号、2013年8月13日出願に記載されている。同様に、非水性または油連続相中に安定した液滴を作り出すエマルション系は、例えば米国特許出願公開第2010−0105112号に詳細に記載されている。特定の場合において、マイクロ流体チャンネル網状組織は、本明細書に記載されている区分の生成に特に適している。そのようなマイクロ流体デバイスには、米国特許出願第14/682,952号、2015年4月9日出願において詳細に記載されたものが含まれ、この全開示は、全ての目的においてその全体が参照として本明細書に組み込まれる。細胞の水性混合物がその中を通って非水性流体中に抽出される多孔質膜を含む、代替的な機構を個別の細胞の区分化に用いることもできる。そのような系は、例えば、Nanomi,Incから一般に入手可能である。
1つの態様において、本明細書に記載されている系及び方法は、ゲノムの標的化領域から配列情報を得るために使用される。
理解されるように、本明細書において考察される方法及び系を使用して、任意の種類のゲノム材料から標的化配列情報を得ることができる。そのようなゲノム材料は、患者から採取した試料によって得てもよい。本明細書において考察される方法及び系に使用されるゲノム材料の例示的な試料及び種類には、ポリヌクレオチド、核酸、オリゴヌクレオチド、循環無細胞核酸、循環腫瘍細胞(CTC)、核酸断片、ヌクレオチド、DNA、RNA、ペプチドポリヌクレオチド、相補的DNA(cDNA)、二本鎖DNA(dsDNA)、一本鎖DNA(ssDNA)、プラスミドDNA、コスミドDNA、染色体DNA、ゲノムDNA(gDNA)、ウイルスDNA、細菌DNA、mtDNA(ミトコンドリアDNA)、リボソームRNA、無細胞DNA、無細胞胎児DNA(cffDNA)、mRNA、rRNA、tRNA、nRNA、siRNA、snRNA、snoRNA、scaRNA、マイクロRNA、dsRNA、ウイルスRNAなどが限定されることなく含まれる。まとめると、使用される試料は、特定の処理に必要性に応じて変わりうる。
NA12878ヒト細胞系のゲノムDNAを、Blue−PippinDNAサイズ分類系の使用によりサイズに基づいた断片の分離に付して、およそ10kb以上の長さの断片を回収した。次に、サイズに基づいて選択された試料核酸を、マイクロ流体区分化系の使用により、フッ素化油連続相内において水性液滴中でバーコードビーズと共に同時区分化し(例えば、2015年4月9日に出願され、全ての目的においてその全体が参照として本明細書に組み込まれる、米国特許出願第14/682,952号を参照すること)、ここで水性液滴は、dNTP、熱安定性DNAポリメラーゼ及び液滴内で増幅を実施する他の試薬、ならびにビーズからバーコードオリゴヌクレオチドを遊離するDTTも含んだ。これを、1ngの総投入DNA及び2ngの総投入DNAの両方で繰り返した。バーコードビーズを、700,000個を超える異なるバーコード配列のバーコード密度を表す貯蔵ライブラリーのサブセットとして得た。バーコード含有オリゴヌクレオチドは、追加の配列構成成分を含み、一般構造:
ビーズ−P5−BC−R1−Nmer
を有した。
NA19701及びNA19661細胞系のゲノムDNAは、上記の実施例1に記載された方法に従って調製した。これらの2つの細胞系の、位相データを含むデータを、下記の表に提示する。
Claims (95)
- ゲノムの1つ以上の選択部分を配列決定する方法であって、
(a)出発ゲノム材料を準備することと、
(b)前記出発ゲノム材料の個別の核酸分子を、分離区分がそれぞれ第1の個別核酸分子を含有するように、分離区分の中に分配することと、
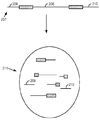
(c)前記分離区分中にある前記個別の核酸分子を断片化して、複数の断片を形成し、断片のそれぞれがバーコードを更に含み、所定の分離区分内の断片が、それぞれ共通のバーコードを含み、それによって、それぞれの断片を、それが誘導された前記個別の核酸分子と関連づけることと、
(d)前記ゲノムの前記1つ以上の選択部分の少なくとも一部を含む断片が豊富化された個体群を提供することと、
(e)前記個体群から配列情報を取得し、それによってゲノムの1つ以上の選択部分を配列決定することと
を含む、前記方法。 - 前記提供工程(d)が、
(i)前記ゲノムの前記1つ以上の選択部分の中の、または近くの領域に相補的なプローブを、前記断片とハイブリッド形成させて、プローブ断片複合体を形成するステップと、
(ii)プローブ断片複合体を固体支持体の表面に捕捉し、
それによって、前記ゲノムの前記1つ以上の選択部分の少なくとも一部を含む断片を、前記個体群において豊富化するステップと
を含む、請求項1に記載の方法。 - 前記固体支持体がビーズを含む、請求項2に記載の方法。
- 前記プローブが結合部分を含み、前記表面が捕捉部分を含み、前記プローブ断片複合体が、前記結合部分と前記捕捉部分との反応によって前記表面に捕捉される、請求項2〜3に記載の方法。
- 前記捕捉部分がストレプトアビジンを含み、前記結合部分がビオチンを含む、請求項4に記載の方法。
- 前記捕捉部分がストレプトアビジン磁気ビーズを含み、前記結合部分がビオチン化RNAライブラリーベイトを含む、請求項4に記載の方法。
- 前記捕捉部分が、全体的もしくは部分的なエクソームの捕捉、パネルの捕捉、標的化エクソンの捕捉、アンカード(anchored)エクソームの捕捉及びタイル状(tiled)ゲノム領域の捕捉からなる群から選択されるメンバーに向けられている、請求項4に記載の方法。
- 前記取得ステップ(e)の前に、前記断片を増幅して、増幅産物を形成する、請求項1〜7に記載の方法。
- 前記増幅産物が、部分的または完全なヘアピン構造を形成する能力がある、請求項8に記載の方法。
- 前記取得ステップ(e)が、短い読み込み長さ(read−length)配列決定反応及び長い読み込み長さ配列決定反応からなる群から選択される配列決定反応を含む、請求項1〜9に記載の方法。
- 前記配列決定反応が、短い読み込みで高い精度の配列決定反応である、請求項10に記載の方法。
- 前記取得ステップ(e)が、前記出発ゲノム材料の90%未満についての配列情報を提供する、請求項1〜11に記載の方法。
- 前記取得ステップ(e)が、前記出発ゲノム材料の75%未満についての配列情報を提供する、請求項1〜11に記載の方法。
- 前記取得ステップ(e)が、前記出発ゲノム材料の50%未満についての配列情報を提供する、請求項1〜11に記載の方法。
- 前記方法が、単離された前記断片の重複配列に基づいて、推定コンティグ中において2つ以上の前記個別の核酸分子を連結することを更に含み、前記推定コンティグが、少なくとも10kbのN50長さを含む、請求項1〜14に記載の方法。
- 前記推定コンティグが、少なくとも20kbのN50長さを含む、請求項15に記載の方法。
- 前記推定コンティグが、少なくとも40kbのN50長さを含む、請求項15に記載の方法。
- 前記推定コンティグが、少なくとも50kbのN50長さを含む、請求項15に記載の方法。
- 前記推定コンティグが、少なくとも100kbのN50長さを含む、請求項15に記載の方法。
- 前記推定コンティグが、少なくとも200kbのN50長さを含む、請求項15に記載の方法。
- 前記方法が、単離された前記断片の配列内の重複位相変異体に基づいて、位相ブロック中において2つ以上の前記個別の核酸分子を連結することを更に含み、前記位相ブロックが、少なくとも10kbのN50長さを含む、請求項1〜14に記載の方法。
- 前記位相ブロックが、少なくとも20kbのN50長さを含む、請求項21に記載の方法。
- 前記位相ブロックが、少なくとも40kbのN50長さを含む、請求項21に記載の方法。
- 前記位相ブロックが、少なくとも50kbのN50長さを含む、請求項18に記載の方法。
- 前記位相ブロックが、少なくとも100kbのN50長さを含む、請求項21に記載の方法。
- 前記位相ブロックが、少なくとも200kbのN50長さを含む、請求項21に記載の方法。
- 前記ゲノムの前記選択部分が、エクソームを含む、請求項1〜26に記載の方法。
- それぞれの分離区分中の前記個別の核酸分子が、単一細胞のゲノムDNAを含む、請求項1〜26に記載の方法。
- それぞれの分離区分が、異なる染色体のゲノムDNAを含む、請求項1〜28に記載の方法。
- 前記分離区分が、エマルションの液滴を含む、請求項1〜29に記載の方法。
- 前記断片に結合した前記バーコードが、少なくとも700,000個のバーコードのライブラリーからのものである、請求項1〜30に記載の方法。
- 前記バーコードが、追加の配列セグメントを更に含む、請求項1〜31に記載の方法。
- 前記追加の配列セグメントが、プライマー、結合配列、ランダムn−merオリゴヌクレオチド、ウラシル核酸塩基を含むオリゴヌクレオチドからなる群から選択される1つ以上のメンバーを含む、請求項32に記載の方法。
- ゲノム試料の1つ以上の標的化部分から配列情報を取得する方法であって、
(a)前記ゲノム試料の個別の第1の核酸断片分子を分離区分の中に提供することと、
(b)前記分離区分内の前記個別の第1核酸断片分子を断片化して、前記個別の第1の核酸断片分子のそれぞれから複数の第2の断片を作り出すことと、
(c)共通のバーコード配列を、前記複数の第2の断片のそれぞれが、それらが含有されている前記分離区分に起因するように、前記分離区分内の前記複数の第2の断片に結合することと、
(d)前記ゲノム試料の前記1つ以上の標的化部分に向けられているプローブのライブラリーを、前記第2の断片に適用することと、
(e)配列決定反応を実施して、前記プローブのライブラリーとハイブリッド形成する前記複数の第2の断片の配列を特定し、それによって前記ゲノム試料の前記1つ以上の標的化部分から配列情報を取得することと
を含む、前記方法。 - 前記プローブのライブラリーを結合部分に結合し、前記実施ステップ(e)の前に、前記第2の断片を、捕捉部分を含んだ表面に、前記結合部分と前記捕捉部分の反応を介して捕捉する、請求項34に記載の方法。
- 前記実施ステップ(e)の前に、前記第2の断片を、前記第2の断片が前記表面に捕捉される前後に増幅する、請求項35に記載の方法。
- 前記結合部分がビオチンを含み、前記捕捉部分がストレプトアビジンを含む、請求項35〜36に記載の方法。
- 前記配列決定反応が、短い読み込み長さ配列決定反応及び長い読み込み長さ配列決定反応からなる群から選択されるメンバーである、請求項34〜37に記載の方法。
- 前記配列決定反応が、短い読み込みで高い精度の配列決定反応である、請求項34〜38に記載の方法。
- 前記方法が、前記複数の第の2断片の重複配列に基づいて、推定コンティグ中において2つ以上の前記個別の核酸分子を連結することを更に含み、前記推定コンティグが、少なくとも10kbのN50長さを含む、請求項34〜39に記載の方法。
- 前記推定コンティグが、少なくとも20kbのN50長さを含む、請求項40に記載の方法。
- 前記推定コンティグが、少なくとも40kbのN50長さを含む、請求項40に記載の方法。
- 前記推定コンティグが、少なくとも50kbのN50長さを含む、請求項40に記載の方法。
- 前記推定コンティグが、少なくとも100kbのN50長さを含む、請求項40に記載の方法。
- 前記推定コンティグが、少なくとも200kbのN50長さを含む、請求項40に記載の方法。
- 前記方法が、前記複数の第2の断片の配列内の重複位相変異体に基づいて、位相ブロック中において2つ以上の複数の前記個別の核酸分子を連結することを更に含み、前記位相ブロックが、少なくとも10kbのN50長さを含む、請求項34〜39に記載の方法。
- 前記位相ブロックが、少なくとも20kbのN50長さを含む、請求項46に記載の方法。
- 前記位相ブロックが、少なくとも40kbのN50長さを含む、請求項46に記載の方法。
- 前記位相ブロックが、少なくとも50kbのN50長さを含む、請求項46に記載の方法。
- 前記位相ブロックが、少なくとも100kbのN50長さを含む、請求項46に記載の方法。
- 前記位相ブロックが、少なくとも200kbのN50長さを含む、請求項46に記載の方法。
- 前記ゲノムの前記標的化部分が、エクソームを含む、請求項34〜51に記載の方法。
- それぞれの分離区分中の前記ゲノム試料が、単一細胞のゲノムDNAを含む、請求項34〜51に記載の方法。
- それぞれの分離区分が、異なる染色体のゲノムDNAを含む、請求項34〜51に記載の方法。
- 前記分離区分が、エマルションの液滴を含む、請求項34〜54に記載の方法。
- 前記第2の断片に結合した前記バーコード配列が、少なくとも700,000個のバーコードのライブラリーからのものである、請求項34〜55に記載の方法。
- 前記バーコードが、追加の配列セグメントを更に含む、請求項34〜56に記載の方法。
- 前記追加の配列セグメントが、プライマー、結合配列、ランダムn−merオリゴヌクレオチド、ウラシル核酸塩基を含むオリゴヌクレオチドからなる群から選択される1つ以上のメンバーを含む、請求項57に記載の方法。
- 前記第2の断片が、得られた増幅産物が部分的または完全なヘアピン構造を形成する能力があるように増幅される、請求項36〜58に記載の方法。
- 分子構成を保持しながら、ゲノム試料の1つ以上の標的化部分から配列情報を取得する方法であって、
(a)出発ゲノム材料を準備することと、
(b)前記出発ゲノム材料の個別の核酸分子を、分離区分がそれぞれ第1の個別核酸分子を含有するように、分離区分の中に分配することと、
(c)前記分離区分中における前記第1の個別核酸分子を断片化して、複数の断片を形成することと、
(d)前記ゲノムの1つ以上の選択部分の少なくとも一部を含む断片が豊富化された個体群を提供することと、
(e)前記個体群から配列情報を取得し、それによって、分子構成を保持しながら、前記ゲノム試料の1つ以上の標的化部分を配列決定することと
を含む、前記方法。 - 前記取得ステップ(e)の前に、前記複数の断片にバーコードをタグ付けして、それぞれの断片を、それらが形成された前記分離区分と関連づける、請求項60に記載の方法。
- ステップ(b)の前記個別の核酸分子が、第1の個別の核酸分子のそれぞれの分子構成が維持されるように分配される、請求項60に記載の方法。
- ゲノム試料の1つ以上の標的化部分から配列情報を取得する方法であって、
(a)前記ゲノム試料の個別の核酸断分子を分離区分の中に提供することと、
(b)前記分離区分中にある前記個別の核酸分子を断片化して、複数の断片を形成し、断片のそれぞれがバーコードを更に含み、所定の分離区分内の断片が、それぞれ共通のバーコードを含み、それによって、それぞれの断片を、それが誘導された前記個別の核酸分子と関連づけることと、
(c)前記ゲノム試料の前記1つ以上の標的化部分に向けられているプローブのライブラリーを、前記複数の断片に適用し、前記プローブのライブラリーにおける少なくとも大部分のプローブが、有益な一塩基多形(SNP)とハイブリッド形成するように設計されていることと、
(d)配列決定反応を実施して、前記プローブのライブラリーとハイブリッド形成する前記複数の断片の配列を特定し、それによって前記ゲノム試料の前記1つ以上の標的化部分から配列情報を取得することと
を含む、前記方法。 - 前記プローブのライブラリーにおける約80%〜99%のプローブが、有益なSNPとハイブリッド形成するように設計されている、請求項63に記載の方法。
- 前記プローブのライブラリーにおける約65%〜85%のプローブが、有益なSNPとハイブリッド形成するように設計されている、請求項63に記載の方法。
- 前記プローブのライブラリーにおける約70%〜80%のプローブが、有益なSNPとハイブリッド形成するように設計されている、請求項63に記載の方法。
- 前記プローブのライブラリーにおける少なくとも65%のプローブが、有益なSNPとハイブリッド形成するように設計されている、請求項63に記載の方法。
- 前記プローブのライブラリーにおける少なくとも75%のプローブが、有益なSNPとハイブリッド形成するように設計されている、請求項63に記載の方法。
- 前記プローブのライブラリーにおける少なくとも85%のプローブが、有益なSNPとハイブリッド形成するように設計されている、請求項63に記載の方法。
- 前記プローブのライブラリーにおける少なくとも90%のプローブが、有益なSNPとハイブリッド形成するように設計されている、請求項63に記載の方法。
- 前記有益なSNPが、前記ゲノム試料の前記標的化部分のエクソンとイントロンの両方に位置する、請求項63〜70に記載の方法。
- 前記プローブのライブラリーにおける前記大部分のプローブが、約1キロベースから約15キロベース(kb)の間隔を置いた有益なSNPとハイブリッド形成するように更に設計されている、請求項63〜70に記載の方法。
- 前記プローブのライブラリーにおける前記大部分のプローブが、約5kb〜約10kbの間隔を置いた有益なSNPとハイブリッド形成するように更に設計されている、請求項63〜70に記載の方法。
- 前記プローブのライブラリーにおける前記大部分のプローブが、約3kb〜約6kbの間隔を置いた有益なSNPとハイブリッド形成するように更に設計されている、請求項63〜70に記載の方法。
- 前記プローブのライブラリーにおける前記大部分のプローブが、約1kbの間隔を置いた有益なSNPとハイブリッド形成するように更に設計されている、請求項63〜70に記載の方法。
- 前記プローブのライブラリーにおける前記大部分のプローブが、約3kbの間隔を置いた有益なSNPとハイブリッド形成するように更に設計されている、請求項63〜70に記載の方法。
- 前記プローブのライブラリーにおける前記大部分のプローブが、約10kbの間隔を置いた有益なSNPとハイブリッド形成するように更に設計されている、請求項63〜70に記載の方法。
- 前記プローブのライブラリー内の複数のプローブが、以下の条件の1つ以上の任意の組み合わせを満たすように設計され、
(i)エクソンとイントロンの境界の10〜50kbの範囲内に有益なSNPがない前記ゲノム試料の標的化部分では、前記複数のプローブが、その境界からのイントロン内の有益なSNPとハイブリッド形成するように設計され、
(ii)エクソン内に第1の有益なSNPが存在し、その第1の有益なSNPが隣接イントロンとの境界から10〜50kbに位置し、前記隣接イントロン内に第2の有益なSNPが存在し、その第2の有益なSNPが前記境界から10〜50kbに位置する前記ゲノム試料の標的化部分では、前記複数のプローブが、前記第1及び第2の有益なSNPの間の前記ゲノム試料の領域とハイブリッド形成するように設計され、
(iii)少なくとも10〜50kbに有益なSNPを含まない前記ゲノム試料の標的化部分では、前記複数のプローブが、前記ゲノム試料のこれらの標的化部分と0.5、1、3、または5kb毎にハイブリッド形成するように設計され、
(iv)エクソンとイントロンの境界の10〜50kbの範囲内に有益なSNPがない前記ゲノム試料の標的化部分では、前記複数のプローブが、前記エクソンとイントロンの境界に二番目に近い有益なSNPとハイブリッド形成するように設計される
請求項63〜77に記載の方法。 - 前記プローブのライブラリーが、バーコードに連結情報を提供する密度でエクソンに隣接する、前記ゲノム試料の領域と、ハイブリッド形成するように設計されたプローブを含む、請求項63〜78に記載の方法。
- 前記プローブのライブラリーにより表される適用範囲が、長い個別の核酸断片分子を高い割合で含有する方法が小さい適用範囲のプローブのライブラリーを使用するように、前記分離区分内の前記ゲノム試料の前記個別の核酸断片分子の長さの分配に反比例する、請求項63〜79に記載の方法。
- 前記プローブのライブラリーが、前記ゲノム試料の前記標的化部分の適用範囲を最適化し、前記ゲノム試料の前記標的化部分が、高品質のマップ範囲を含む、請求項63〜80に記載の方法。
- 前記プローブのライブラリーが、ゲノム試料の前記1つ以上の標的化部分の特徴により情報提供される特徴を有し、
(i)高品質マップの標的化部分では、前記プローブのライブラリーが、エクソンとイントロンの境界の1kb〜1メガメース(Mb)の範囲内の有益なSNPとハイブリッド形成するプローブを含み、
(ii)バーコード付き前記断片の長さの前記分配が、高い割合で約250kbより長い断片を有する標的化部分では、前記プローブのライブラリーが、少なくとも50kb離れている有益なSNPとハイブリッド形成するプローブを含み、
(iii)低品質マップの標的化部分では、前記プローブのライブラリーが、エクソンとイントロンの境界の1kb内の有益なSNPとハイブリッド形成するプローブを含み、かつエクソン内及びイントロン内の有益なSNPとハイブリッド形成するプローブを含み、
(iv)遺伝子間領域を含む標的化部分では、前記プローブのライブラリーが、少なくとも2kbの距離の間隔を置いた有益なSNPとハイブリッド形成するプローブを含む
請求項63〜80に記載の方法。 - ステップ(d)で取得した前記配列情報が、遺伝子融合、コピー数変動、挿入及び欠失からなる群の1つ以上のメンバーについての情報を含む、請求項63〜84に記載の方法。
- ゲノム試料の1つ以上の標的化部分から配列情報を取得する方法であって、
(a)前記ゲノム試料の個別の核酸断分子を準備することと、
(b)前記個別の核酸分子を断片化して、複数の断片を形成し、前記断片のそれぞれがバーコードを更に含み、同じ前記個別の核酸分子の断片が共通のバーコードを含み、それによって、それぞれの断片を、それが誘導された前記個別の核酸分子と関連づけることと、
(c)前記複数の断片を、前記ゲノム試料の前記1つ以上の標的化部分を含有する断片で豊富化することと、
(d)配列決定反応を実施して、豊富化された前記複数の断片の配列を特定し、それによって前記ゲノム試料の前記1つ以上の標的化部分から配列情報を取得することと
を含む、前記方法。 - バーコードが、前記断片化ステップ(b)の前に、前記個別の核酸分子に付加される、請求項86に記載の方法。
- 前記バーコードが、トランスポゾンの使用により、前記個別の核酸分子に付加される、請求項87に記載の方法。
- バーコードが、前記断片化と同時に付加される、請求項86に記載の方法。
- 前記断片化が増幅ステップを含む、請求項89に記載の方法。
- 前記豊富化ステップ(c)が、前記ゲノム試料の前記1つ以上の標的化部分に向けられたプローブのライブラリーを適用することを含む、請求項86〜90に記載の方法。
- 前記プローブのライブラリーを結合部分に結合し、前記実施ステップ(d)の前に、前記断片を、前記結合部分と前記捕捉部分の反応を介して捕捉する、請求項91に記載の方法。
- 前記結合部分と前記捕捉部分との前記反応が、前記断片を表面に固定化する、請求項92に記載の方法。
- 前記結合部分がビオチンを含み、前記捕捉部分がストレプトアビジンを含む、請求項92〜93に記載の方法。
- 前記配列決定反応が、短い読み込み長さ配列決定反応及び長い読み込み長さ配列決定反応からなる群から選択されるメンバーである、請求項86〜94に記載の方法。
- 前記配列決定反応が、短い読み込みで高い精度の配列決定反応である、請求項86〜94に記載の方法。
- 前記断片が、得られた増幅産物が部分的または完全なヘアピン構造を形成する能力があるように増幅される、請求項86〜96に記載の方法。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201462072164P | 2014-10-29 | 2014-10-29 | |
| US62/072,164 | 2014-10-29 | ||
| PCT/US2015/058142 WO2016069939A1 (en) | 2014-10-29 | 2015-10-29 | Methods and compositions for targeted nucleic acid sequencing |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2017532042A true JP2017532042A (ja) | 2017-11-02 |
| JP2017532042A5 JP2017532042A5 (ja) | 2018-12-06 |
Family
ID=54540216
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2017519628A Pending JP2017532042A (ja) | 2014-10-29 | 2015-10-29 | 標的化核酸配列決定のための方法及び組成物 |
Country Status (10)
| Country | Link |
|---|---|
| US (7) | US20160122817A1 (ja) |
| EP (1) | EP3212807B1 (ja) |
| JP (1) | JP2017532042A (ja) |
| KR (1) | KR20170073667A (ja) |
| CN (2) | CN114807307A (ja) |
| AU (1) | AU2015339148B2 (ja) |
| BR (1) | BR112017008877A2 (ja) |
| CA (1) | CA2964472A1 (ja) |
| MX (1) | MX2017005267A (ja) |
| WO (1) | WO2016069939A1 (ja) |
Families Citing this family (98)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20190300945A1 (en) | 2010-04-05 | 2019-10-03 | Prognosys Biosciences, Inc. | Spatially Encoded Biological Assays |
| US10221442B2 (en) | 2012-08-14 | 2019-03-05 | 10X Genomics, Inc. | Compositions and methods for sample processing |
| US9701998B2 (en) | 2012-12-14 | 2017-07-11 | 10X Genomics, Inc. | Methods and systems for processing polynucleotides |
| US10752949B2 (en) | 2012-08-14 | 2020-08-25 | 10X Genomics, Inc. | Methods and systems for processing polynucleotides |
| US11591637B2 (en) | 2012-08-14 | 2023-02-28 | 10X Genomics, Inc. | Compositions and methods for sample processing |
| US9951386B2 (en) | 2014-06-26 | 2018-04-24 | 10X Genomics, Inc. | Methods and systems for processing polynucleotides |
| US9567631B2 (en) | 2012-12-14 | 2017-02-14 | 10X Genomics, Inc. | Methods and systems for processing polynucleotides |
| US10400280B2 (en) | 2012-08-14 | 2019-09-03 | 10X Genomics, Inc. | Methods and systems for processing polynucleotides |
| CN111748607B (zh) | 2012-08-14 | 2024-04-30 | 10X基因组学有限公司 | 微胶囊组合物及方法 |
| US10273541B2 (en) | 2012-08-14 | 2019-04-30 | 10X Genomics, Inc. | Methods and systems for processing polynucleotides |
| US10323279B2 (en) | 2012-08-14 | 2019-06-18 | 10X Genomics, Inc. | Methods and systems for processing polynucleotides |
| US10533221B2 (en) | 2012-12-14 | 2020-01-14 | 10X Genomics, Inc. | Methods and systems for processing polynucleotides |
| CN108753766A (zh) | 2013-02-08 | 2018-11-06 | 10X基因组学有限公司 | 多核苷酸条形码生成 |
| US9868979B2 (en) | 2013-06-25 | 2018-01-16 | Prognosys Biosciences, Inc. | Spatially encoded biological assays using a microfluidic device |
| US9824068B2 (en) | 2013-12-16 | 2017-11-21 | 10X Genomics, Inc. | Methods and apparatus for sorting data |
| KR102596508B1 (ko) | 2014-04-10 | 2023-10-30 | 10엑스 제노믹스, 인크. | 시약을 캡슐화 및 구획화하기 위한 유체 디바이스, 시스템, 및 방법, 및 이의 응용 |
| EP3161157B1 (en) | 2014-06-24 | 2024-03-27 | Bio-Rad Laboratories, Inc. | Digital pcr barcoding |
| CN106795553B (zh) | 2014-06-26 | 2021-06-04 | 10X基因组学有限公司 | 分析来自单个细胞或细胞群体的核酸的方法 |
| JP2017532042A (ja) | 2014-10-29 | 2017-11-02 | 10エックス ゲノミクス,インコーポレイテッド | 標的化核酸配列決定のための方法及び組成物 |
| US9975122B2 (en) | 2014-11-05 | 2018-05-22 | 10X Genomics, Inc. | Instrument systems for integrated sample processing |
| KR102321863B1 (ko) | 2015-01-12 | 2021-11-08 | 10엑스 제노믹스, 인크. | 핵산 시퀀싱 라이브러리의 제조 방법 및 시스템 및 이를 이용하여 제조한 라이브러리 |
| US10697000B2 (en) | 2015-02-24 | 2020-06-30 | 10X Genomics, Inc. | Partition processing methods and systems |
| BR112017018054A2 (pt) | 2015-02-24 | 2018-07-24 | 10X Genomics Inc | métodos para a cobertura de sequências de ácidos nucleicos direcionadas |
| ES2955916T3 (es) | 2015-04-10 | 2023-12-11 | Spatial Transcriptomics Ab | Análisis múltiplex de especímenes biológicos de ácidos nucleicos espacialmente distinguidos |
| US11371094B2 (en) | 2015-11-19 | 2022-06-28 | 10X Genomics, Inc. | Systems and methods for nucleic acid processing using degenerate nucleotides |
| SG11201804086VA (en) | 2015-12-04 | 2018-06-28 | 10X Genomics Inc | Methods and compositions for nucleic acid analysis |
| WO2017138984A1 (en) | 2016-02-11 | 2017-08-17 | 10X Genomics, Inc. | Systems, methods, and media for de novo assembly of whole genome sequence data |
| WO2017197338A1 (en) | 2016-05-13 | 2017-11-16 | 10X Genomics, Inc. | Microfluidic systems and methods of use |
| WO2017218864A1 (en) * | 2016-06-17 | 2017-12-21 | Mayo Foundation For Medical Education And Research | Methods and materials for the effective use of combined targeted enrichment of genomic regions and low coverage whole genome sequencing |
| US20200013482A1 (en) * | 2016-09-30 | 2020-01-09 | Guardant Health, Inc. | Methods for multi-resolution analysis of cell-free nucleic acids |
| ES2870639T3 (es) | 2016-10-24 | 2021-10-27 | Geneinfosec Inc | Ocultación de información presente en los ácidos nucleicos |
| US10011872B1 (en) | 2016-12-22 | 2018-07-03 | 10X Genomics, Inc. | Methods and systems for processing polynucleotides |
| US10815525B2 (en) | 2016-12-22 | 2020-10-27 | 10X Genomics, Inc. | Methods and systems for processing polynucleotides |
| US10550429B2 (en) | 2016-12-22 | 2020-02-04 | 10X Genomics, Inc. | Methods and systems for processing polynucleotides |
| CN117512066A (zh) | 2017-01-30 | 2024-02-06 | 10X基因组学有限公司 | 用于基于微滴的单细胞条形编码的方法和系统 |
| US10995333B2 (en) | 2017-02-06 | 2021-05-04 | 10X Genomics, Inc. | Systems and methods for nucleic acid preparation |
| EP4215616A1 (en) | 2017-05-18 | 2023-07-26 | 10X Genomics, Inc. | Methods and systems for sorting droplets and beads |
| US10544413B2 (en) | 2017-05-18 | 2020-01-28 | 10X Genomics, Inc. | Methods and systems for sorting droplets and beads |
| US10844372B2 (en) | 2017-05-26 | 2020-11-24 | 10X Genomics, Inc. | Single cell analysis of transposase accessible chromatin |
| SG11201901822QA (en) | 2017-05-26 | 2019-03-28 | 10X Genomics Inc | Single cell analysis of transposase accessible chromatin |
| US20190064173A1 (en) | 2017-08-22 | 2019-02-28 | 10X Genomics, Inc. | Methods of producing droplets including a particle and an analyte |
| US10837047B2 (en) | 2017-10-04 | 2020-11-17 | 10X Genomics, Inc. | Compositions, methods, and systems for bead formation using improved polymers |
| US10590244B2 (en) | 2017-10-04 | 2020-03-17 | 10X Genomics, Inc. | Compositions, methods, and systems for bead formation using improved polymers |
| WO2019083852A1 (en) | 2017-10-26 | 2019-05-02 | 10X Genomics, Inc. | MICROFLUIDIC CHANNEL NETWORKS FOR PARTITIONING |
| WO2019084043A1 (en) | 2017-10-26 | 2019-05-02 | 10X Genomics, Inc. | METHODS AND SYSTEMS FOR NUCLEIC ACID PREPARATION AND CHROMATIN ANALYSIS |
| WO2019084165A1 (en) | 2017-10-27 | 2019-05-02 | 10X Genomics, Inc. | METHODS AND SYSTEMS FOR SAMPLE PREPARATION AND ANALYSIS |
| SG11201913654QA (en) | 2017-11-15 | 2020-01-30 | 10X Genomics Inc | Functionalized gel beads |
| US10829815B2 (en) | 2017-11-17 | 2020-11-10 | 10X Genomics, Inc. | Methods and systems for associating physical and genetic properties of biological particles |
| WO2019108851A1 (en) | 2017-11-30 | 2019-06-06 | 10X Genomics, Inc. | Systems and methods for nucleic acid preparation and analysis |
| CN108165646A (zh) * | 2017-12-26 | 2018-06-15 | 河北省农林科学院谷子研究所 | 一种适用于谷子的简化基因组建库方法 |
| EP3752832A1 (en) | 2018-02-12 | 2020-12-23 | 10X Genomics, Inc. | Methods characterizing multiple analytes from individual cells or cell populations |
| US11639928B2 (en) | 2018-02-22 | 2023-05-02 | 10X Genomics, Inc. | Methods and systems for characterizing analytes from individual cells or cell populations |
| US20190284625A1 (en) * | 2018-03-16 | 2019-09-19 | Gencove Inc. | Methods for joint low-pass and targeted sequencing |
| CN112262218A (zh) | 2018-04-06 | 2021-01-22 | 10X基因组学有限公司 | 用于单细胞处理中的质量控制的系统和方法 |
| WO2019217486A1 (en) * | 2018-05-08 | 2019-11-14 | Memorial Sloan Kettering Cancer Center | Methods and compositions for detecting myeloma |
| US11932899B2 (en) | 2018-06-07 | 2024-03-19 | 10X Genomics, Inc. | Methods and systems for characterizing nucleic acid molecules |
| CN112567081A (zh) * | 2018-06-11 | 2021-03-26 | 基础医疗股份有限公司 | 评价基因组改变的组合物和方法 |
| US11703427B2 (en) | 2018-06-25 | 2023-07-18 | 10X Genomics, Inc. | Methods and systems for cell and bead processing |
| US20200032335A1 (en) | 2018-07-27 | 2020-01-30 | 10X Genomics, Inc. | Systems and methods for metabolome analysis |
| SG11202101371TA (en) | 2018-08-13 | 2021-03-30 | Rootpath Genomics Inc | High throughput cloning of paired bipartite immunoreceptor polynucleotides and applications thereof |
| US11519033B2 (en) | 2018-08-28 | 2022-12-06 | 10X Genomics, Inc. | Method for transposase-mediated spatial tagging and analyzing genomic DNA in a biological sample |
| US11459607B1 (en) | 2018-12-10 | 2022-10-04 | 10X Genomics, Inc. | Systems and methods for processing-nucleic acid molecules from a single cell using sequential co-partitioning and composite barcodes |
| WO2020123301A2 (en) | 2018-12-10 | 2020-06-18 | 10X Genomics, Inc. | Generating spatial arrays with gradients |
| US11649485B2 (en) | 2019-01-06 | 2023-05-16 | 10X Genomics, Inc. | Generating capture probes for spatial analysis |
| US11926867B2 (en) | 2019-01-06 | 2024-03-12 | 10X Genomics, Inc. | Generating capture probes for spatial analysis |
| US11845983B1 (en) | 2019-01-09 | 2023-12-19 | 10X Genomics, Inc. | Methods and systems for multiplexing of droplet based assays |
| US11851683B1 (en) | 2019-02-12 | 2023-12-26 | 10X Genomics, Inc. | Methods and systems for selective analysis of cellular samples |
| WO2020168013A1 (en) | 2019-02-12 | 2020-08-20 | 10X Genomics, Inc. | Methods for processing nucleic acid molecules |
| US11467153B2 (en) | 2019-02-12 | 2022-10-11 | 10X Genomics, Inc. | Methods for processing nucleic acid molecules |
| US11655499B1 (en) | 2019-02-25 | 2023-05-23 | 10X Genomics, Inc. | Detection of sequence elements in nucleic acid molecules |
| EP3938537A1 (en) | 2019-03-11 | 2022-01-19 | 10X Genomics, Inc. | Systems and methods for processing optically tagged beads |
| WO2020206238A2 (en) | 2019-04-05 | 2020-10-08 | Rootpath Genomics, Inc. | Compositions and methods for t-cell receptor gene assembly |
| WO2020243579A1 (en) | 2019-05-30 | 2020-12-03 | 10X Genomics, Inc. | Methods of detecting spatial heterogeneity of a biological sample |
| JP2022544662A (ja) * | 2019-08-19 | 2022-10-20 | ユニバーサル シーケンシング テクノロジー コーポレイション | 核酸シーケンシングの核酸フラグメント起源を追跡するための方法および組成物 |
| GB2604481A (en) | 2019-10-10 | 2022-09-07 | 1859 Inc | Methods and systems for microfluidic screening |
| EP4025711A2 (en) | 2019-11-08 | 2022-07-13 | 10X Genomics, Inc. | Enhancing specificity of analyte binding |
| SG11202106899SA (en) | 2019-12-23 | 2021-09-29 | 10X Genomics Inc | Methods for spatial analysis using rna-templated ligation |
| US11702693B2 (en) | 2020-01-21 | 2023-07-18 | 10X Genomics, Inc. | Methods for printing cells and generating arrays of barcoded cells |
| US11732299B2 (en) | 2020-01-21 | 2023-08-22 | 10X Genomics, Inc. | Spatial assays with perturbed cells |
| US11898205B2 (en) | 2020-02-03 | 2024-02-13 | 10X Genomics, Inc. | Increasing capture efficiency of spatial assays |
| US11732300B2 (en) | 2020-02-05 | 2023-08-22 | 10X Genomics, Inc. | Increasing efficiency of spatial analysis in a biological sample |
| EP4107282A1 (en) * | 2020-02-21 | 2022-12-28 | 10X Genomics, Inc. | Capturing genetic targets using a hybridization approach |
| US11891654B2 (en) | 2020-02-24 | 2024-02-06 | 10X Genomics, Inc. | Methods of making gene expression libraries |
| ES2965354T3 (es) | 2020-04-22 | 2024-04-12 | 10X Genomics Inc | Métodos para análisis espacial que usan eliminación de ARN elegido como diana |
| US11851700B1 (en) | 2020-05-13 | 2023-12-26 | 10X Genomics, Inc. | Methods, kits, and compositions for processing extracellular molecules |
| EP4153775A1 (en) | 2020-05-22 | 2023-03-29 | 10X Genomics, Inc. | Simultaneous spatio-temporal measurement of gene expression and cellular activity |
| EP4153776A1 (en) | 2020-05-22 | 2023-03-29 | 10X Genomics, Inc. | Spatial analysis to detect sequence variants |
| WO2021242834A1 (en) | 2020-05-26 | 2021-12-02 | 10X Genomics, Inc. | Method for resetting an array |
| WO2021252499A1 (en) | 2020-06-08 | 2021-12-16 | 10X Genomics, Inc. | Methods of determining a surgical margin and methods of use thereof |
| WO2021252591A1 (en) | 2020-06-10 | 2021-12-16 | 10X Genomics, Inc. | Methods for determining a location of an analyte in a biological sample |
| CN116034166A (zh) | 2020-06-25 | 2023-04-28 | 10X基因组学有限公司 | Dna甲基化的空间分析 |
| US11761038B1 (en) | 2020-07-06 | 2023-09-19 | 10X Genomics, Inc. | Methods for identifying a location of an RNA in a biological sample |
| US11926822B1 (en) | 2020-09-23 | 2024-03-12 | 10X Genomics, Inc. | Three-dimensional spatial analysis |
| US11827935B1 (en) | 2020-11-19 | 2023-11-28 | 10X Genomics, Inc. | Methods for spatial analysis using rolling circle amplification and detection probes |
| WO2022140028A1 (en) | 2020-12-21 | 2022-06-30 | 10X Genomics, Inc. | Methods, compositions, and systems for capturing probes and/or barcodes |
| AU2022227563A1 (en) | 2021-02-23 | 2023-08-24 | 10X Genomics, Inc. | Probe-based analysis of nucleic acids and proteins |
| GB2621782A (en) * | 2021-05-05 | 2024-02-21 | Univ Leland Stanford Junior | Methods and systems for analyzing nucleic acid molecules |
| EP4196605A1 (en) | 2021-09-01 | 2023-06-21 | 10X Genomics, Inc. | Methods, compositions, and kits for blocking a capture probe on a spatial array |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2013036929A1 (en) * | 2011-09-09 | 2013-03-14 | The Board Of Trustees Of The Leland Stanford Junior | Methods for obtaining a sequence |
| US20130130919A1 (en) * | 2011-10-18 | 2013-05-23 | The Regents Of The University Of California | Long-Range Barcode Labeling-Sequencing |
| JP2014506788A (ja) * | 2011-02-02 | 2014-03-20 | ユニヴァーシティ・オブ・ワシントン・スルー・イッツ・センター・フォー・コマーシャリゼーション | 大量並列連続性マッピング |
Family Cites Families (523)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US1124638A (en) | 1914-06-11 | 1915-01-12 | James G Coffin | Method of producing planographic printing-forms. |
| US2797149A (en) | 1953-01-08 | 1957-06-25 | Technicon International Ltd | Methods of and apparatus for analyzing liquids containing crystalloid and non-crystalloid constituents |
| US3047367A (en) | 1959-12-01 | 1962-07-31 | Technicon Instr | Automatic analysis with fluid segmentation |
| US3479141A (en) | 1967-05-17 | 1969-11-18 | Technicon Corp | Method and apparatus for analysis |
| US4124638A (en) | 1977-09-12 | 1978-11-07 | Hansen John N | Solubilizable polyacrylamide gels containing disulfide cross-linkages |
| US4253846A (en) | 1979-11-21 | 1981-03-03 | Technicon Instruments Corporation | Method and apparatus for automated analysis of fluid samples |
| GB2097692B (en) | 1981-01-10 | 1985-05-22 | Shaw Stewart P D | Combining chemical reagents |
| DE3230289A1 (de) | 1982-08-14 | 1984-02-16 | Bayer Ag, 5090 Leverkusen | Herstellung von pharmazeutischen oder kosmetischen dispersionen |
| US4582802A (en) | 1983-09-30 | 1986-04-15 | The United States Of America As Represented By The Department Of Health And Human Services | Stimulation of enzymatic ligation of DNA by high concentrations of nonspecific polymers |
| JPS60227826A (ja) | 1984-04-27 | 1985-11-13 | Sogo Yatsukou Kk | pHに応答するグラフトカプセル |
| WO1988002057A1 (en) | 1986-09-22 | 1988-03-24 | Bergwerksverband Gmbh | Combined rigid profiled and expanding anchor |
| US4916070A (en) | 1986-04-14 | 1990-04-10 | The General Hospital Corporation | Fibrin-specific antibodies and method of screening for the antibodies |
| DE3619763A1 (de) | 1986-06-12 | 1987-12-17 | Binz Gmbh & Co | Krankentransport- bzw. rettungsfahrzeug |
| US5618711A (en) | 1986-08-22 | 1997-04-08 | Hoffmann-La Roche Inc. | Recombinant expression vectors and purification methods for Thermus thermophilus DNA polymerase |
| US4872895A (en) | 1986-12-11 | 1989-10-10 | American Telephone And Telegraph Company, At&T Bell Laboratories | Method for fabricating articles which include high silica glass bodies |
| US5525464A (en) | 1987-04-01 | 1996-06-11 | Hyseq, Inc. | Method of sequencing by hybridization of oligonucleotide probes |
| US5202231A (en) | 1987-04-01 | 1993-04-13 | Drmanac Radoje T | Method of sequencing of genomes by hybridization of oligonucleotide probes |
| US5149625A (en) | 1987-08-11 | 1992-09-22 | President And Fellows Of Harvard College | Multiplex analysis of DNA |
| US5137829A (en) | 1987-10-05 | 1992-08-11 | Washington University | DNA transposon TN5SEQ1 |
| US5185099A (en) | 1988-04-20 | 1993-02-09 | Institut National De Recherche Chimique Appliquee | Visco-elastic, isotropic materials based on water, fluorinate sufactants and fluorinated oils, process for their preparation, and their use in various fields, such as optics, pharmacology and electrodynamics |
| US5237016A (en) | 1989-01-05 | 1993-08-17 | Siska Diagnostics, Inc. | End-attachment of oligonucleotides to polyacrylamide solid supports for capture and detection of nucleic acids |
| US5756334A (en) | 1990-04-26 | 1998-05-26 | New England Biolabs, Inc. | Thermostable DNA polymerase from 9°N-7 and methods for producing the same |
| DE69130800T2 (de) | 1990-07-24 | 1999-09-16 | Hoffmann La Roche | Verringerung von nicht spezifischer amplifikation während einer (in vitro) nukleinsäure amplifikation unter verwendung von modifizierten nukleinsäure basen |
| US5489523A (en) | 1990-12-03 | 1996-02-06 | Stratagene | Exonuclease-deficient thermostable Pyrococcus furiosus DNA polymerase I |
| US5270183A (en) | 1991-02-08 | 1993-12-14 | Beckman Research Institute Of The City Of Hope | Device and method for the automated cycling of solutions between two or more temperatures |
| US5994056A (en) | 1991-05-02 | 1999-11-30 | Roche Molecular Systems, Inc. | Homogeneous methods for nucleic acid amplification and detection |
| CA2118806A1 (en) | 1991-09-18 | 1993-04-01 | William J. Dower | Method of synthesizing diverse collections of oligomers |
| US5413924A (en) | 1992-02-13 | 1995-05-09 | Kosak; Kenneth M. | Preparation of wax beads containing a reagent for release by heating |
| WO1993019205A1 (en) | 1992-03-19 | 1993-09-30 | The Regents Of The University Of California | Multiple tag labeling method for dna sequencing |
| CA2134474C (en) | 1992-05-01 | 1999-07-06 | The Trustees Of The University Of Pennsylvania | Microfabricated sperm handling devices |
| US5587128A (en) | 1992-05-01 | 1996-12-24 | The Trustees Of The University Of Pennsylvania | Mesoscale polynucleotide amplification devices |
| US5840865A (en) | 1992-09-14 | 1998-11-24 | Institute Of Molecular Biology And Biotechnology/Forth | Eukaryotic transposable element |
| US5569364A (en) | 1992-11-05 | 1996-10-29 | Soane Biosciences, Inc. | Separation media for electrophoresis |
| IL108497A0 (en) | 1993-02-01 | 1994-05-30 | Seq Ltd | Methods and apparatus for dna sequencing |
| WO1994019101A1 (en) | 1993-02-16 | 1994-09-01 | Alliance Pharmaceutical Corp. | Method of microemulsifying fluorinated oils |
| WO1994023699A1 (en) | 1993-04-19 | 1994-10-27 | Medisorb Technologies International L.P. | Long-acting treatment by slow-release delivery of antisense oligodeoxyribonucleotides from biodegradable microparticles |
| ATE208658T1 (de) | 1993-07-28 | 2001-11-15 | Pe Corp Ny | Vorrichtung und verfahren zur nukleinsäurevervielfältigung |
| AU7516694A (en) | 1993-07-30 | 1995-02-28 | Affymax Technologies N.V. | Biotinylation of proteins |
| US5512131A (en) | 1993-10-04 | 1996-04-30 | President And Fellows Of Harvard College | Formation of microstamped patterns on surfaces and derivative articles |
| US20030044777A1 (en) | 1993-10-28 | 2003-03-06 | Kenneth L. Beattie | Flowthrough devices for multiple discrete binding reactions |
| US5605793A (en) | 1994-02-17 | 1997-02-25 | Affymax Technologies N.V. | Methods for in vitro recombination |
| US5558071A (en) | 1994-03-07 | 1996-09-24 | Combustion Electromagnetics, Inc. | Ignition system power converter and controller |
| US5648211A (en) | 1994-04-18 | 1997-07-15 | Becton, Dickinson And Company | Strand displacement amplification using thermophilic enzymes |
| US5834197A (en) | 1994-05-11 | 1998-11-10 | Genera Technologies Limited | Methods of capturing species from liquids and assay procedures |
| US5705628A (en) | 1994-09-20 | 1998-01-06 | Whitehead Institute For Biomedical Research | DNA purification and isolation using magnetic particles |
| US5846719A (en) | 1994-10-13 | 1998-12-08 | Lynx Therapeutics, Inc. | Oligonucleotide tags for sorting and identification |
| US5585069A (en) | 1994-11-10 | 1996-12-17 | David Sarnoff Research Center, Inc. | Partitioned microelectronic and fluidic device array for clinical diagnostics and chemical synthesis |
| WO1996029629A2 (en) | 1995-03-01 | 1996-09-26 | President And Fellows Of Harvard College | Microcontact printing on surfaces and derivative articles |
| US5700642A (en) | 1995-05-22 | 1997-12-23 | Sri International | Oligonucleotide sizing using immobilized cleavable primers |
| EP0832287B1 (en) | 1995-06-07 | 2007-10-10 | Solexa, Inc | Oligonucleotide tags for sorting and identification |
| CA2332731A1 (en) | 1995-06-07 | 1996-12-19 | Sydney Brenner | Oligonucleotide tags for sorting and identification |
| US5856174A (en) | 1995-06-29 | 1999-01-05 | Affymetrix, Inc. | Integrated nucleic acid diagnostic device |
| US6866760B2 (en) | 1998-08-27 | 2005-03-15 | E Ink Corporation | Electrophoretic medium and process for the production thereof |
| US5872010A (en) | 1995-07-21 | 1999-02-16 | Northeastern University | Microscale fluid handling system |
| US6057149A (en) | 1995-09-15 | 2000-05-02 | The University Of Michigan | Microscale devices and reactions in microscale devices |
| US5851769A (en) | 1995-09-27 | 1998-12-22 | The Regents Of The University Of California | Quantitative DNA fiber mapping |
| US5736330A (en) | 1995-10-11 | 1998-04-07 | Luminex Corporation | Method and compositions for flow cytometric determination of DNA sequences |
| US5736332A (en) | 1995-11-30 | 1998-04-07 | Mandecki; Wlodek | Method of determining the sequence of nucleic acids employing solid-phase particles carrying transponders |
| US6001571A (en) | 1995-11-30 | 1999-12-14 | Mandecki; Wlodek | Multiplex assay for nucleic acids employing transponders |
| US6051377A (en) | 1995-11-30 | 2000-04-18 | Pharmaseq, Inc. | Multiplex assay for nucleic acids employing transponders |
| US6355198B1 (en) | 1996-03-15 | 2002-03-12 | President And Fellows Of Harvard College | Method of forming articles including waveguides via capillary micromolding and microtransfer molding |
| EP0832436A1 (en) | 1996-04-15 | 1998-04-01 | Dade Behring Inc. | Apparatus and method for analysis |
| US5846727A (en) | 1996-06-06 | 1998-12-08 | Board Of Supervisors Of Louisiana State University And Agricultural & Mechanical College | Microsystem for rapid DNA sequencing |
| WO1998002237A1 (en) | 1996-07-15 | 1998-01-22 | Kemgas Limited | Production of powders |
| US5965443A (en) | 1996-09-09 | 1999-10-12 | Wisconsin Alumni Research Foundation | System for in vitro transposition |
| US6133436A (en) | 1996-11-06 | 2000-10-17 | Sequenom, Inc. | Beads bound to a solid support and to nucleic acids |
| US5900481A (en) | 1996-11-06 | 1999-05-04 | Sequenom, Inc. | Bead linkers for immobilizing nucleic acids to solid supports |
| CA2276251A1 (en) | 1996-11-20 | 1998-05-28 | The Regents Of The University Of Michigan | Microfabricated isothermal nucleic acid amplification devices and methods |
| US5958703A (en) | 1996-12-03 | 1999-09-28 | Glaxo Group Limited | Use of modified tethers in screening compound libraries |
| US20050042625A1 (en) | 1997-01-15 | 2005-02-24 | Xzillion Gmbh & Co. | Mass label linked hybridisation probes |
| US20020034737A1 (en) | 1997-03-04 | 2002-03-21 | Hyseq, Inc. | Methods and compositions for detection or quantification of nucleic acid species |
| US6297006B1 (en) | 1997-01-16 | 2001-10-02 | Hyseq, Inc. | Methods for sequencing repetitive sequences and for determining the order of sequence subfragments |
| US7622294B2 (en) | 1997-03-14 | 2009-11-24 | Trustees Of Tufts College | Methods for detecting target analytes and enzymatic reactions |
| US6327410B1 (en) | 1997-03-14 | 2001-12-04 | The Trustees Of Tufts College | Target analyte sensors utilizing Microspheres |
| US6391622B1 (en) | 1997-04-04 | 2002-05-21 | Caliper Technologies Corp. | Closed-loop biochemical analyzers |
| US6143496A (en) | 1997-04-17 | 2000-11-07 | Cytonix Corporation | Method of sampling, amplifying and quantifying segment of nucleic acid, polymerase chain reaction assembly having nanoliter-sized sample chambers, and method of filling assembly |
| WO1998052691A1 (en) | 1997-05-16 | 1998-11-26 | Alberta Research Council | Microfluidic system and methods of use |
| CA2291180A1 (en) | 1997-05-23 | 1998-11-26 | Lynx Therapeutics, Inc. | System and apparatus for sequential processing of analytes |
| US6969488B2 (en) | 1998-05-22 | 2005-11-29 | Solexa, Inc. | System and apparatus for sequential processing of analytes |
| US20040241759A1 (en) | 1997-06-16 | 2004-12-02 | Eileen Tozer | High throughput screening of libraries |
| ATE358177T1 (de) | 1997-07-07 | 2007-04-15 | Medical Res Council | Ein in vitro sortierverfahren |
| GB9714716D0 (en) | 1997-07-11 | 1997-09-17 | Brax Genomics Ltd | Characterising nucleic acids |
| FI103809B1 (fi) | 1997-07-14 | 1999-09-30 | Finnzymes Oy | In vitro -menetelmä templaattien tuottamiseksi DNA-sekventointia varten |
| US6974669B2 (en) | 2000-03-28 | 2005-12-13 | Nanosphere, Inc. | Bio-barcodes based on oligonucleotide-modified nanoparticles |
| US6368871B1 (en) | 1997-08-13 | 2002-04-09 | Cepheid | Non-planar microstructures for manipulation of fluid samples |
| EP1012335A4 (en) | 1997-08-15 | 2004-06-09 | Hyseq Inc | METHODS AND COMPOSITIONS FOR DETECTION OR QUANTIFICATION OF NUCLEIC ACID SPECIES |
| US6207031B1 (en) | 1997-09-15 | 2001-03-27 | Whitehead Institute For Biomedical Research | Methods and apparatus for processing a sample of biomolecular analyte using a microfabricated device |
| US20020092767A1 (en) | 1997-09-19 | 2002-07-18 | Aclara Biosciences, Inc. | Multiple array microfluidic device units |
| US7214298B2 (en) | 1997-09-23 | 2007-05-08 | California Institute Of Technology | Microfabricated cell sorter |
| WO1999018438A1 (en) | 1997-10-02 | 1999-04-15 | Aclara Biosciences, Inc. | Capillary assays involving separation of free and bound species |
| US5842787A (en) | 1997-10-09 | 1998-12-01 | Caliper Technologies Corporation | Microfluidic systems incorporating varied channel dimensions |
| EP1028970A1 (en) | 1997-10-10 | 2000-08-23 | President And Fellows Of Harvard College | Replica amplification of nucleic acid arrays |
| US6485944B1 (en) | 1997-10-10 | 2002-11-26 | President And Fellows Of Harvard College | Replica amplification of nucleic acid arrays |
| US6511803B1 (en) | 1997-10-10 | 2003-01-28 | President And Fellows Of Harvard College | Replica amplification of nucleic acid arrays |
| KR20010031140A (ko) | 1997-10-14 | 2001-04-16 | 루미넥스 코포레이션 | 정밀 형광염료 입자 및 그의 제조방법 그리고 그의 사용 |
| EP1036332B1 (en) | 1997-12-04 | 2005-07-13 | Amersham Biosciences UK Limited | Multiple assay method |
| WO1999033963A1 (en) | 1997-12-31 | 1999-07-08 | Chiron Corporation | Metastatic cancer regulated gene |
| AU3196099A (en) | 1998-03-27 | 1999-10-18 | President And Fellows Of Harvard College | Systematic identification of essential genes by (in vitro) transposon mutagenesis |
| US6022716A (en) | 1998-04-10 | 2000-02-08 | Genset Sa | High throughput DNA sequencing vector |
| WO1999052708A1 (en) | 1998-04-13 | 1999-10-21 | Luminex Corporation | Liquid labeling with fluorescent microparticles |
| US6780591B2 (en) | 1998-05-01 | 2004-08-24 | Arizona Board Of Regents | Method of determining the nucleotide sequence of oligonucleotides and DNA molecules |
| US5997636A (en) | 1998-05-01 | 1999-12-07 | Instrumentation Technology Associates, Inc. | Method and apparatus for growing crystals |
| US6306590B1 (en) | 1998-06-08 | 2001-10-23 | Caliper Technologies Corp. | Microfluidic matrix localization apparatus and methods |
| AU764633B2 (en) | 1998-08-07 | 2003-08-28 | Cellay, Llc | Gel microdrops in genetic analysis |
| US6159736A (en) | 1998-09-23 | 2000-12-12 | Wisconsin Alumni Research Foundation | Method for making insertional mutations using a Tn5 synaptic complex |
| AR021833A1 (es) | 1998-09-30 | 2002-08-07 | Applied Research Systems | Metodos de amplificacion y secuenciacion de acido nucleico |
| CA2347182C (en) | 1998-10-13 | 2004-06-15 | Biomicro Systems, Inc. | Fluid circuit components based upon passive fluid dynamics |
| US6489096B1 (en) | 1998-10-15 | 2002-12-03 | Princeton University | Quantitative analysis of hybridization patterns and intensities in oligonucleotide arrays |
| SE9803614L (sv) | 1998-10-19 | 2000-04-20 | Muhammed Mamoun | Förfarande och anordning för framställning av nanopartiklar |
| WO2000026412A1 (en) | 1998-11-02 | 2000-05-11 | Kenneth Loren Beattie | Nucleic acid analysis using sequence-targeted tandem hybridization |
| US6569631B1 (en) | 1998-11-12 | 2003-05-27 | 3-Dimensional Pharmaceuticals, Inc. | Microplate thermal shift assay for ligand development using 5-(4″dimethylaminophenyl)-2-(4′-phenyl)oxazole derivative fluorescent dyes |
| NO986133D0 (no) | 1998-12-23 | 1998-12-23 | Preben Lexow | FremgangsmÕte for DNA-sekvensering |
| GB9900298D0 (en) | 1999-01-07 | 1999-02-24 | Medical Res Council | Optical sorting method |
| US6416642B1 (en) | 1999-01-21 | 2002-07-09 | Caliper Technologies Corp. | Method and apparatus for continuous liquid flow in microscale channels using pressure injection, wicking, and electrokinetic injection |
| US6635419B1 (en) | 1999-02-16 | 2003-10-21 | Applera Corporation | Polynucleotide sequencing method |
| US20030027214A1 (en) | 1999-02-17 | 2003-02-06 | Kamb Carl Alexander | Methods for substrate-ligand interaction screening |
| US6613513B1 (en) | 1999-02-23 | 2003-09-02 | Caliper Technologies Corp. | Sequencing by incorporation |
| US6171850B1 (en) | 1999-03-08 | 2001-01-09 | Caliper Technologies Corp. | Integrated devices and systems for performing temperature controlled reactions and analyses |
| US6303343B1 (en) | 1999-04-06 | 2001-10-16 | Caliper Technologies Corp. | Inefficient fast PCR |
| US6908737B2 (en) | 1999-04-15 | 2005-06-21 | Vitra Bioscience, Inc. | Systems and methods of conducting multiplexed experiments |
| US20060275782A1 (en) | 1999-04-20 | 2006-12-07 | Illumina, Inc. | Detection of nucleic acid reactions on bead arrays |
| AU4806100A (en) | 1999-04-28 | 2000-11-10 | Board Of Trustees Of The Leland Stanford Junior University | P element derived vector and methods for its use |
| JP3815969B2 (ja) | 1999-05-12 | 2006-08-30 | アクララ バイオサイエンシーズ, インコーポレイテッド | 微量流体デバイスにおける多重方式蛍光検出 |
| WO2000070095A2 (en) | 1999-05-17 | 2000-11-23 | Dade Behring Inc. | Homogeneous isothermal amplification and detection of nucleic acids using a template switch oligonucleotide |
| US20020051971A1 (en) | 1999-05-21 | 2002-05-02 | John R. Stuelpnagel | Use of microfluidic systems in the detection of target analytes using microsphere arrays |
| US6846622B1 (en) | 1999-05-26 | 2005-01-25 | Oregon Health & Science University | Tagged epitope protein transposable element |
| US20030124509A1 (en) | 1999-06-03 | 2003-07-03 | Kenis Paul J.A. | Laminar flow patterning and articles made thereby |
| US6372813B1 (en) | 1999-06-25 | 2002-04-16 | Motorola | Methods and compositions for attachment of biomolecules to solid supports, hydrogels, and hydrogel arrays |
| AU6068300A (en) | 1999-07-06 | 2001-01-22 | Caliper Technologies Corporation | Microfluidic systems and methods for determining modulator kinetics |
| US6977145B2 (en) | 1999-07-28 | 2005-12-20 | Serono Genetics Institute S.A. | Method for carrying out a biochemical protocol in continuous flow in a microreactor |
| US6524456B1 (en) | 1999-08-12 | 2003-02-25 | Ut-Battelle, Llc | Microfluidic devices for the controlled manipulation of small volumes |
| WO2001013086A2 (en) | 1999-08-13 | 2001-02-22 | Brandeis University | Detection of nucleic acids |
| AU6788100A (en) | 1999-08-20 | 2001-03-19 | Luminex Corporation | Liquid array technology |
| WO2001016372A1 (en) | 1999-08-27 | 2001-03-08 | Matrix Technologies Corporation | Methods of immobilizing ligands on solid supports and apparatus and methods of use therefor |
| US6982146B1 (en) | 1999-08-30 | 2006-01-03 | The United States Of America As Represented By The Department Of Health And Human Services | High speed parallel molecular nucleic acid sequencing |
| CA2386193A1 (en) | 1999-10-13 | 2001-04-19 | Signature Bioscience, Inc. | System and method for detecting and identifying molecular events in a test sample |
| AU7444300A (en) | 1999-10-21 | 2001-05-08 | Isamu Aotani | Vertical pump |
| US6958225B2 (en) | 1999-10-27 | 2005-10-25 | Affymetrix, Inc. | Complexity management of genomic DNA |
| AU1100201A (en) | 1999-10-28 | 2001-05-08 | Board Of Trustees Of The Leland Stanford Junior University | Methods of in vivo gene transfer using a sleeping beauty transposon system |
| JP4721603B2 (ja) | 1999-11-08 | 2011-07-13 | 栄研化学株式会社 | 変異および/または多型の検出方法 |
| US6432290B1 (en) | 1999-11-26 | 2002-08-13 | The Governors Of The University Of Alberta | Apparatus and method for trapping bead based reagents within microfluidic analysis systems |
| US20020051882A1 (en) | 2000-02-18 | 2002-05-02 | Lawton Ernest L. | Forming size compositions, glass fibers coated with the same and fabrics woven from such coated fibers |
| AU3986501A (en) | 2000-02-23 | 2001-09-03 | Zyomyx Inc | Chips having elevated sample surfaces |
| IL134830A0 (en) | 2000-03-01 | 2001-05-20 | Chay 13 Medical Res Group N V | Peptides and immunostimulatory and anti-bacterial pharmaceutical compositions containing them |
| US6579851B2 (en) | 2000-03-14 | 2003-06-17 | Amylin Pharmaceuticals, Inc. | Effects of glucagon-like peptide-1 (7-36) on antro-pyloro-duodenal motility |
| CA2404008A1 (en) | 2000-03-31 | 2001-10-11 | Jurgen Sygusch | Protein crystallization in microfluidic structures |
| US20020001856A1 (en) | 2000-04-06 | 2002-01-03 | Chow Andrea W. | Methods and devices for achieving long incubation times in high-throughput systems |
| US6481453B1 (en) | 2000-04-14 | 2002-11-19 | Nanostream, Inc. | Microfluidic branch metering systems and methods |
| US6800298B1 (en) | 2000-05-11 | 2004-10-05 | Clemson University | Biological lubricant composition and method of applying lubricant composition |
| US20060008799A1 (en) | 2000-05-22 | 2006-01-12 | Hong Cai | Rapid haplotyping by single molecule detection |
| JP2004502926A (ja) | 2000-05-24 | 2004-01-29 | マイクロニックス、インコーポレーテッド | 濃度勾配をもたらすマイクロ流体用装置 |
| US6645432B1 (en) | 2000-05-25 | 2003-11-11 | President & Fellows Of Harvard College | Microfluidic systems including three-dimensionally arrayed channel networks |
| US20060263888A1 (en) | 2000-06-02 | 2006-11-23 | Honeywell International Inc. | Differential white blood count on a disposable card |
| US6632606B1 (en) | 2000-06-12 | 2003-10-14 | Aclara Biosciences, Inc. | Methods for single nucleotide polymorphism detection |
| WO2001098765A1 (en) | 2000-06-21 | 2001-12-27 | Bioarray Solutions, Ltd. | Multianalyte molecular analysis |
| AU2001281076A1 (en) | 2000-08-07 | 2002-02-18 | Nanostream, Inc. | Fluidic mixer in microfluidic system |
| US6610499B1 (en) | 2000-08-31 | 2003-08-26 | The Regents Of The University Of California | Capillary array and related methods |
| US6773566B2 (en) | 2000-08-31 | 2004-08-10 | Nanolytics, Inc. | Electrostatic actuators for microfluidics and methods for using same |
| WO2002022878A1 (en) | 2000-09-14 | 2002-03-21 | Caliper Technologies Corp. | Microfluidic devices and methods for performing temperature mediated reactions |
| AU2001290879A1 (en) | 2000-09-15 | 2002-03-26 | California Institute Of Technology | Microfabricated crossflow devices and methods |
| AU2001294775A1 (en) | 2000-09-29 | 2002-04-08 | Hnc Software, Inc. | Score based decisioning |
| MXPA02005717A (es) | 2000-10-10 | 2003-10-14 | Diversa Corp | Analisis de alto rendimiento o a base de capilares para bioactividad o biomoleuclas. |
| JP2002155305A (ja) | 2000-11-14 | 2002-05-31 | Akira Kawasaki | 単分散粒子の製造装置及び単分散粒子の製造方法及びその製造方法で製造された単分散粒子 |
| CA2332186A1 (en) | 2001-02-08 | 2002-08-08 | Her Majesty In Right Of Canada As Represented By The Minister Of Agricul Ture And Agri-Food Canada | Replicative in vivo gene targeting |
| US7670559B2 (en) | 2001-02-15 | 2010-03-02 | Caliper Life Sciences, Inc. | Microfluidic systems with enhanced detection systems |
| ATE312076T1 (de) | 2001-02-22 | 2005-12-15 | Anika Therapeutics Inc | Thiol-modifizierte hyaluronan-derivate |
| EP1362634B1 (en) | 2001-02-23 | 2006-05-31 | Japan Science and Technology Agency | Process for producing emulsion and apparatus therefor |
| US7211654B2 (en) | 2001-03-14 | 2007-05-01 | Regents Of The University Of Michigan | Linkers and co-coupling agents for optimization of oligonucleotide synthesis and purification on solid supports |
| US20020172622A1 (en) | 2001-04-03 | 2002-11-21 | Weigl Bernhard H. | Microfluidic device for concentrating particles in a concentrating solution |
| US7138267B1 (en) | 2001-04-04 | 2006-11-21 | Epicentre Technologies Corporation | Methods and compositions for amplifying DNA clone copy number |
| US20030027221A1 (en) | 2001-04-06 | 2003-02-06 | Scott Melissa E. | High-throughput screening assays by encapsulation |
| US7572642B2 (en) | 2001-04-18 | 2009-08-11 | Ambrigen, Llc | Assay based on particles, which specifically bind with targets in spatially distributed characteristic patterns |
| WO2004040406A2 (en) | 2001-04-27 | 2004-05-13 | The Directv Group, Inc. | Estimating the operating point on a nonlinear traveling wave tube amplifier |
| AU2002314820B2 (en) | 2001-05-26 | 2008-01-24 | One Cell Systems, Inc. | Secretion of Molecules by Encapsulated Cells |
| US6880576B2 (en) | 2001-06-07 | 2005-04-19 | Nanostream, Inc. | Microfluidic devices for methods development |
| US7179423B2 (en) | 2001-06-20 | 2007-02-20 | Cytonome, Inc. | Microfluidic system including a virtual wall fluid interface port for interfacing fluids with the microfluidic system |
| US6613523B2 (en) | 2001-06-29 | 2003-09-02 | Agilent Technologies, Inc. | Method of DNA sequencing using cleavable tags |
| US7682353B2 (en) | 2001-06-29 | 2010-03-23 | Coloplast A/S | Catheter device |
| US7077152B2 (en) | 2001-07-07 | 2006-07-18 | Nanostream, Inc. | Microfluidic metering systems and methods |
| US6767731B2 (en) | 2001-08-27 | 2004-07-27 | Intel Corporation | Electron induced fluorescent method for nucleic acid sequencing |
| KR100415894B1 (ko) | 2001-08-31 | 2004-01-24 | 주식회사 테크노모아 | 오버헤드 도어의 와이어 이탈방지장치 |
| US7297485B2 (en) | 2001-10-15 | 2007-11-20 | Qiagen Gmbh | Method for nucleic acid amplification that results in low amplification bias |
| CA2464350A1 (en) | 2001-10-19 | 2003-05-30 | West Virginia University Research Corporation | Microfluidic system for proteome analysis |
| US6783647B2 (en) | 2001-10-19 | 2004-08-31 | Ut-Battelle, Llc | Microfluidic systems and methods of transport and lysis of cells and analysis of cell lysate |
| US20030149307A1 (en) | 2001-10-24 | 2003-08-07 | Baxter International Inc. | Process for the preparation of polyethylene glycol bis amine |
| US20030182068A1 (en) | 2001-10-30 | 2003-09-25 | Battersby Bronwyn J. | Device and methods for directed synthesis of chemical libraries |
| GB0127564D0 (en) | 2001-11-16 | 2002-01-09 | Medical Res Council | Emulsion compositions |
| US7335153B2 (en) | 2001-12-28 | 2008-02-26 | Bio Array Solutions Ltd. | Arrays of microparticles and methods of preparation thereof |
| US20030170698A1 (en) | 2002-01-04 | 2003-09-11 | Peter Gascoyne | Droplet-based microfluidic oligonucleotide synthesis engine |
| CA2473376A1 (en) | 2002-01-16 | 2003-07-31 | Dynal Biotech Asa | Method for isolating nucleic acids and protein from a single sample |
| KR100459870B1 (ko) | 2002-02-22 | 2004-12-04 | 한국과학기술원 | 트랜스포존과 Cre/loxP 부위 특이적 재조합 방법을 이용하는 염색체의 특정부위가 제거된 미생물 변이주 제조방법 |
| DE60321325D1 (de) | 2002-03-20 | 2008-07-10 | Innovativebio Biz Kowloon | Mikrokapseln mit kontrollierter durchlässigkeit die ein nukleinsäureamplifizierungsreaktionsgemisch enthalten und deren benutzung als reaktionsgefäss für parallele reaktionen |
| US7901939B2 (en) | 2002-05-09 | 2011-03-08 | University Of Chicago | Method for performing crystallization and reactions in pressure-driven fluid plugs |
| EP2282214B1 (en) | 2002-05-09 | 2022-10-05 | The University of Chicago | Device and method for pressure-driven plug transport and reaction |
| US7527966B2 (en) | 2002-06-26 | 2009-05-05 | Transgenrx, Inc. | Gene regulation in transgenic animals using a transposon-based vector |
| JP2006507921A (ja) | 2002-06-28 | 2006-03-09 | プレジデント・アンド・フェロウズ・オブ・ハーバード・カレッジ | 流体分散のための方法および装置 |
| WO2004010106A2 (en) | 2002-07-24 | 2004-01-29 | Ptc Therapeutics, Inc. | METHODS FOR IDENTIFYING SMALL MOLEDULES THAT MODULATE PREMATURE TRANSLATION TERMINATION AND NONSENSE MEDIATED mRNA DECAY |
| WO2004021151A2 (en) | 2002-08-30 | 2004-03-11 | Orasee Corp. | Multi-dimensional image system for digital image input and output |
| IL151660A0 (en) | 2002-09-09 | 2003-04-10 | Univ Ben Gurion | Method for isolating and culturing unculturable microorganisms |
| US20040081962A1 (en) | 2002-10-23 | 2004-04-29 | Caifu Chen | Methods for synthesizing complementary DNA |
| US20040248299A1 (en) | 2002-12-27 | 2004-12-09 | Sumedha Jayasena | RNA interference |
| US20040224331A1 (en) | 2003-01-17 | 2004-11-11 | The Trustees Of Boston University | Haplotype analysis |
| WO2004070007A2 (en) | 2003-01-29 | 2004-08-19 | 454 Corporation | Method for preparing single-stranded dna libraries |
| JP2006518204A (ja) | 2003-02-10 | 2006-08-10 | マックス−デルブルック−セントラム フユール モレクラーレ メディツィン(エムディーシー) | トランスポゾンに基づく標的化システム |
| EP1604609A4 (en) | 2003-02-17 | 2008-09-03 | Toyo Prec Parts Mfg Co Ltd | LINEAR DEVICE |
| US7041481B2 (en) | 2003-03-14 | 2006-05-09 | The Regents Of The University Of California | Chemical amplification based on fluid partitioning |
| US7316903B2 (en) | 2003-03-28 | 2008-01-08 | United States Of America As Represented By The Department Of Health And Human Services | Detection of nucleic acid sequence variations using phase Mu transposase |
| GB0307428D0 (en) | 2003-03-31 | 2003-05-07 | Medical Res Council | Compartmentalised combinatorial chemistry |
| US20060078893A1 (en) | 2004-10-12 | 2006-04-13 | Medical Research Council | Compartmentalised combinatorial chemistry by microfluidic control |
| GB0307403D0 (en) | 2003-03-31 | 2003-05-07 | Medical Res Council | Selection by compartmentalised screening |
| RU2005130646A (ru) | 2003-04-04 | 2006-01-27 | Пфайзер Продактс Инк. (Us) | Микрофлюидизированные эмульсии масло в воде и композиции вакцины |
| US20100035254A1 (en) | 2003-04-08 | 2010-02-11 | Pacific Biosciences Of California, Inc. | Composition and method for nucleic acid sequencing |
| EP2266687A3 (en) | 2003-04-10 | 2011-06-29 | The President and Fellows of Harvard College | Formation and control of fluidic species |
| WO2004102204A1 (en) | 2003-05-16 | 2004-11-25 | Global Technologies (Nz) Ltd | Method and apparatus for mixing sample and reagent in a suspension fluid |
| WO2004103565A2 (de) | 2003-05-19 | 2004-12-02 | Hans-Knöll-Institut für Naturstoff-Forschung e.V. | Vorrichtung und verfahren zur strukturierung von flüssigkeiten und zum zudosieren von reaktionsflüssigkeiten zu in separationsmedium eingebetteten flüssigkeitskompartimenten |
| WO2004105734A1 (en) | 2003-05-28 | 2004-12-09 | Valorisation Recherche, Societe En Commandite | Method of preparing microcapsules |
| WO2004113877A1 (en) | 2003-06-13 | 2004-12-29 | The General Hospital Corporation | Microfluidic systems for size based removal of red blood cells and platelets from blood |
| GB2403475B (en) | 2003-07-01 | 2008-02-06 | Oxitec Ltd | Stable integrands |
| GB0315438D0 (en) | 2003-07-02 | 2003-08-06 | Univ Manchester | Analysis of mixed cell populations |
| US8048627B2 (en) | 2003-07-05 | 2011-11-01 | The Johns Hopkins University | Method and compositions for detection and enumeration of genetic variations |
| BRPI0414004A (pt) | 2003-08-27 | 2006-10-24 | Harvard College | controle eletrÈnico de espécies fluìdicas |
| JP4988345B2 (ja) | 2003-09-04 | 2012-08-01 | ザ・ユナイテッド・ステイツ・オブ・アメリカ・アズ・リプレゼンティッド・バイ・ザ・デパートメント・オブ・ヴェテランズ・アフェアーズ | 眼用ハイドロゲルナノコンポジット |
| EP1672064A4 (en) | 2003-09-22 | 2006-12-20 | Riken | EFFICIENT METHOD FOR GENERATING AN INVERTED REPEAT DNA STRUCTURE |
| US20080014631A1 (en) | 2003-09-25 | 2008-01-17 | Sachiko Kondo | Microwell Array Chip and Its Manufacturing Method |
| EP1691792A4 (en) | 2003-11-24 | 2008-05-28 | Yeda Res & Dev | COMPOSITIONS AND METHODS FOR IN VITRO / I SORTING OF MOLECULAR AND CELLULAR BANKS |
| US8071364B2 (en) | 2003-12-24 | 2011-12-06 | Transgenrx, Inc. | Gene therapy using transposon-based vectors |
| US20050181379A1 (en) | 2004-02-18 | 2005-08-18 | Intel Corporation | Method and device for isolating and positioning single nucleic acid molecules |
| CN1950519A (zh) | 2004-02-27 | 2007-04-18 | 哈佛大学的校长及成员们 | 聚合酶群落荧光原位测序珠子 |
| KR100552706B1 (ko) | 2004-03-12 | 2006-02-20 | 삼성전자주식회사 | 핵산 증폭 방법 및 장치 |
| US20050221339A1 (en) | 2004-03-31 | 2005-10-06 | Medical Research Council Harvard University | Compartmentalised screening by microfluidic control |
| US20060020371A1 (en) | 2004-04-13 | 2006-01-26 | President And Fellows Of Harvard College | Methods and apparatus for manipulation and/or detection of biological samples and other objects |
| US7799553B2 (en) | 2004-06-01 | 2010-09-21 | The Regents Of The University Of California | Microfabricated integrated DNA analysis system |
| US7700281B2 (en) | 2004-06-30 | 2010-04-20 | Usb Corporation | Hot start nucleic acid amplification |
| US7968085B2 (en) | 2004-07-05 | 2011-06-28 | Ascendis Pharma A/S | Hydrogel formulations |
| CN100481111C (zh) | 2004-07-21 | 2009-04-22 | 索尼株式会社 | 内容再现装置、内容处理装置、内容分发服务器、内容分发方法和内容处理方法 |
| CN1648671B (zh) | 2005-02-06 | 2012-09-26 | 成都夸常医学工业有限公司 | 多反应器分析芯片检测方法和分析芯片及检测装置 |
| US7608434B2 (en) | 2004-08-04 | 2009-10-27 | Wisconsin Alumni Research Foundation | Mutated Tn5 transposase proteins and the use thereof |
| WO2006030993A1 (en) | 2004-09-14 | 2006-03-23 | Jin-Ho Choy | Information code system using dna sequences |
| US7892731B2 (en) | 2004-10-01 | 2011-02-22 | Radix Biosolutions, Ltd. | System and method for inhibiting the decryption of a nucleic acid probe sequence used for the detection of a specific nucleic acid |
| US7968287B2 (en) | 2004-10-08 | 2011-06-28 | Medical Research Council Harvard University | In vitro evolution in microfluidic systems |
| WO2007001448A2 (en) | 2004-11-04 | 2007-01-04 | Massachusetts Institute Of Technology | Coated controlled release polymer particles as efficient oral delivery vehicles for biopharmaceuticals |
| WO2006051552A2 (en) | 2004-11-15 | 2006-05-18 | Yeda Research And Development Co. Ltd. At The Weizmann Institute Of Science | Directed evolution and selection using in vitro compartmentalization |
| US7329493B2 (en) | 2004-12-22 | 2008-02-12 | Asiagen Corporation | One-tube nested PCR for detecting Mycobacterium tuberculosis |
| WO2006078841A1 (en) | 2005-01-21 | 2006-07-27 | President And Fellows Of Harvard College | Systems and methods for forming fluidic droplets encapsulated in particles such as colloidal particles |
| WO2006081222A2 (en) | 2005-01-25 | 2006-08-03 | Compass Genetics, Llc. | Isothermal dna amplification |
| US7393665B2 (en) | 2005-02-10 | 2008-07-01 | Population Genetics Technologies Ltd | Methods and compositions for tagging and identifying polynucleotides |
| US7407757B2 (en) | 2005-02-10 | 2008-08-05 | Population Genetics Technologies | Genetic analysis by sequence-specific sorting |
| CA2598520A1 (en) | 2005-02-18 | 2006-08-24 | Canon U.S. Life Sciences, Inc. | Devices and methods for identifying genomic dna of organisms |
| US8062391B2 (en) | 2005-02-21 | 2011-11-22 | Kagoshima University | Method for purifying biodiesel fuel |
| US20070054119A1 (en) | 2005-03-04 | 2007-03-08 | Piotr Garstecki | Systems and methods of forming particles |
| JP2008535644A (ja) | 2005-03-04 | 2008-09-04 | プレジデント・アンド・フエローズ・オブ・ハーバード・カレツジ | 多重エマルジョンの形成のための方法および装置 |
| US9040237B2 (en) | 2005-03-04 | 2015-05-26 | Intel Corporation | Sensor arrays and nucleic acid sequencing applications |
| JP2006289250A (ja) | 2005-04-08 | 2006-10-26 | Kao Corp | マイクロミキサー及びそれを用いた流体混合方法 |
| WO2006138257A2 (en) | 2005-06-15 | 2006-12-28 | Callida Genomics, Inc. | Single molecule arrays for genetic and chemical analysis |
| JP2006349060A (ja) | 2005-06-16 | 2006-12-28 | Ntn Corp | ボールねじ |
| US8828209B2 (en) | 2005-06-22 | 2014-09-09 | The Research Foundation For The State University Of New York | Massively parallel 2-dimensional capillary electrophoresis |
| WO2007002567A2 (en) | 2005-06-23 | 2007-01-04 | Nanosphere, Inc. | Selective isolation and concentration of nucleic acids from complex samples |
| EP2392657B1 (en) | 2005-07-05 | 2013-09-25 | The Chemo-Sero-Therapeutic Research Institute | Modified transposon vector and its use |
| JP5051490B2 (ja) | 2005-07-08 | 2012-10-17 | 独立行政法人産業技術総合研究所 | マクロ生体材料を内包する無機マイクロカプセルおよびその製造方法 |
| US20070020640A1 (en) | 2005-07-21 | 2007-01-25 | Mccloskey Megan L | Molecular encoding of nucleic acid templates for PCR and other forms of sequence analysis |
| FR2888912B1 (fr) | 2005-07-25 | 2007-08-24 | Commissariat Energie Atomique | Procede de commande d'une communication entre deux zones par electromouillage, dispositif comportant des zones isolables les unes des autres et procede de realisation d'un tel dispositif |
| WO2007015990A2 (en) | 2005-08-01 | 2007-02-08 | Technorati, Inc. | Techniques for analyzing and presenting information in an event-based data aggregation system |
| US20070031857A1 (en) | 2005-08-02 | 2007-02-08 | Rubicon Genomics, Inc. | Compositions and methods for processing and amplification of DNA, including using multiple enzymes in a single reaction |
| KR20050094360A (ko) | 2005-08-16 | 2005-09-27 | 김태완 | 관정용 지하수오염방지장치 케이싱과 발전기가장착된지구중력이용 무동력 양수장치기 및 그장치방법 |
| WO2007024840A2 (en) | 2005-08-22 | 2007-03-01 | Critical Therapeutics, Inc. | Method of quantitating nucleic acids by flow cytometry microparticle-based array |
| JP2007074967A (ja) | 2005-09-13 | 2007-03-29 | Canon Inc | 識別子プローブ及びそれを用いた核酸増幅方法 |
| EP1931943A2 (en) | 2005-09-16 | 2008-06-18 | The Regents of the University of California | A colorimetric bio-barcode amplification assay for analyte detection |
| AU2007249635B2 (en) | 2005-10-07 | 2012-05-31 | Complete Genomics, Inc. | High throughput genome sequencing on DNA arrays |
| US7960104B2 (en) | 2005-10-07 | 2011-06-14 | Callida Genomics, Inc. | Self-assembled single molecule arrays and uses thereof |
| US20070190543A1 (en) | 2005-11-14 | 2007-08-16 | Applera Corporation | Coded Molecules for Detecting Target Analytes |
| US7932037B2 (en) | 2007-12-05 | 2011-04-26 | Perkinelmer Health Sciences, Inc. | DNA assays using amplicon probes on encoded particles |
| WO2007081386A2 (en) | 2006-01-11 | 2007-07-19 | Raindance Technologies, Inc. | Microfluidic devices and methods of use |
| US7544473B2 (en) | 2006-01-23 | 2009-06-09 | Population Genetics Technologies Ltd. | Nucleic acid analysis using sequence tokens |
| US7537897B2 (en) | 2006-01-23 | 2009-05-26 | Population Genetics Technologies, Ltd. | Molecular counting |
| US20070195127A1 (en) | 2006-01-27 | 2007-08-23 | President And Fellows Of Harvard College | Fluidic droplet coalescence |
| PL1981995T5 (pl) | 2006-02-02 | 2019-10-31 | Univ Leland Stanford Junior | Nieinwazyjne genetyczne badania przesiewowe płodu metodą analizy cyfrowej |
| WO2007092538A2 (en) | 2006-02-07 | 2007-08-16 | President And Fellows Of Harvard College | Methods for making nucleotide probes for sequencing and synthesis |
| GB0603251D0 (en) | 2006-02-17 | 2006-03-29 | Isis Innovation | DNA conformation |
| SG170028A1 (en) | 2006-02-24 | 2011-04-29 | Callida Genomics Inc | High throughput genome sequencing on dna arrays |
| US20070231823A1 (en) | 2006-03-23 | 2007-10-04 | Mckernan Kevin J | Directed enrichment of genomic DNA for high-throughput sequencing |
| JP4921829B2 (ja) | 2006-03-30 | 2012-04-25 | 株式会社東芝 | 微粒子の製造装置、乳化剤保持部、微粒子の製造方法および分子膜の製造方法 |
| US20090181864A1 (en) | 2006-03-31 | 2009-07-16 | Nam Trung Nguyen | Active control for droplet-based microfluidics |
| ITTO20060259A1 (it) | 2006-04-07 | 2007-10-08 | Elbi Int Spa | Dispositivo per l'erogazione di un agente di lavaggio in una macchina lavatrice, in particolare una macchina lavastoviglie. |
| US7656144B2 (en) | 2006-04-07 | 2010-02-02 | Qualcomm, Incorporated | Bias generator with reduced current consumption |
| EP2007907A2 (en) | 2006-04-19 | 2008-12-31 | Applera Corporation | Reagents, methods, and libraries for gel-free bead-based sequencing |
| US7811603B2 (en) | 2006-05-09 | 2010-10-12 | The Regents Of The University Of California | Microfluidic device for forming monodisperse lipoplexes |
| EP2481815B1 (en) | 2006-05-11 | 2016-01-27 | Raindance Technologies, Inc. | Microfluidic devices |
| AU2007268027B2 (en) | 2006-05-22 | 2012-08-09 | Nanostring Technologies, Inc. | Systems and methods for analyzing nanoreporters |
| WO2007140015A2 (en) | 2006-05-26 | 2007-12-06 | Althea Technologies, Inc | Biochemical analysis of partitioned cells |
| FR2901717A1 (fr) | 2006-05-30 | 2007-12-07 | Centre Nat Rech Scient | Procede de traitement de gouttes dans un circuit microfluidique. |
| EP3424598B1 (en) | 2006-06-14 | 2022-06-08 | Verinata Health, Inc. | Rare cell analysis using sample splitting and dna tags |
| CN101506378A (zh) | 2006-06-19 | 2009-08-12 | 约翰·霍普金斯大学 | 在油包水乳液中的微粒上的单分子pcr |
| US20080076909A1 (en) | 2006-06-30 | 2008-03-27 | Applera Corporation | Emulsion pcr and amplicon capture |
| EP1878501A1 (en) | 2006-07-14 | 2008-01-16 | Roche Diagnostics GmbH | Instrument for heating and cooling |
| WO2008021123A1 (en) | 2006-08-07 | 2008-02-21 | President And Fellows Of Harvard College | Fluorocarbon emulsion stabilizing surfactants |
| ITLO20060004A1 (it) | 2006-08-08 | 2008-02-09 | River Pharma Srl | "lapille" e una nuova invenzione avente per oggetto una nuova combinazione chimica stabile per uso cosmetico e farmaceutico contenente come ingredienti attivi l'acido alfa-lipoico ed il dimetilsulfossido, in grado di migliorare l'assorbimento, la bio |
| CN104774275A (zh) | 2006-09-25 | 2015-07-15 | 阿彻-丹尼尔斯-米德兰德公司 | 超吸收性的经表面处理的羧烷基化多糖及其制备方法 |
| US7935518B2 (en) | 2006-09-27 | 2011-05-03 | Alessandra Luchini | Smart hydrogel particles for biomarker harvesting |
| WO2008052138A2 (en) | 2006-10-25 | 2008-05-02 | The Regents Of The University Of California | Inline-injection microdevice and microfabricated integrated dna analysis system using same |
| US7910354B2 (en) | 2006-10-27 | 2011-03-22 | Complete Genomics, Inc. | Efficient arrays of amplified polynucleotides |
| WO2008061193A2 (en) | 2006-11-15 | 2008-05-22 | Biospherex Llc | Multitag sequencing and ecogenomics analysis |
| US20080242560A1 (en) | 2006-11-21 | 2008-10-02 | Gunderson Kevin L | Methods for generating amplified nucleic acid arrays |
| WO2008072540A1 (ja) | 2006-12-13 | 2008-06-19 | National University Corporation Nagoya University | Tol1因子のトランスポザーゼ及びそれを用いたDNA導入システム |
| US7844658B2 (en) | 2007-01-22 | 2010-11-30 | Comcast Cable Holdings, Llc | System and method for providing an application to a device |
| US20080176768A1 (en) | 2007-01-23 | 2008-07-24 | Honeywell Honeywell International | Hydrogel microarray with embedded metal nanoparticles |
| EP2121983A2 (en) | 2007-02-02 | 2009-11-25 | Illumina Cambridge Limited | Methods for indexing samples and sequencing multiple nucleotide templates |
| US8003312B2 (en) | 2007-02-16 | 2011-08-23 | The Board Of Trustees Of The Leland Stanford Junior University | Multiplex cellular assays using detectable cell barcodes |
| FI20075124A0 (fi) | 2007-02-21 | 2007-02-21 | Valtion Teknillinen | Menetelmä ja testikitti nukleotidivariaatioiden toteamiseksi |
| WO2008109178A1 (en) | 2007-03-07 | 2008-09-12 | Alantos Pharmaceuticals Holding, Inc. | Metalloprotease inhibitors containing a squaramide moiety |
| US9029085B2 (en) | 2007-03-07 | 2015-05-12 | President And Fellows Of Harvard College | Assays and other reactions involving droplets |
| US20080228288A1 (en) | 2007-03-13 | 2008-09-18 | Ronald Harry Nelson | Composite Prosthetic Foot |
| US20080228268A1 (en) | 2007-03-15 | 2008-09-18 | Uluru, Inc. | Method of Formation of Viscous, Shape Conforming Gels and Their Uses as Medical Prosthesis |
| WO2008121342A2 (en) | 2007-03-28 | 2008-10-09 | President And Fellows Of Harvard College | Emulsions and techniques for formation |
| US20100130369A1 (en) | 2007-04-23 | 2010-05-27 | Advanced Liquid Logic, Inc. | Bead-Based Multiplexed Analytical Methods and Instrumentation |
| CN101293191B (zh) | 2007-04-25 | 2011-11-09 | 中国科学院过程工程研究所 | 一种琼脂糖凝胶微球的制备方法 |
| EP2164985A4 (en) | 2007-06-01 | 2014-05-14 | 454 Life Sciences Corp | SYSTEM AND METHOD FOR IDENTIFYING INDIVIDUAL SAMPLES FROM A MULTIPLEX MIXTURE |
| WO2009005680A1 (en) | 2007-06-29 | 2009-01-08 | President And Fellows Of Harvard College | Methods and apparatus for manipulation of fluidic species |
| US20090068170A1 (en) | 2007-07-13 | 2009-03-12 | President And Fellows Of Harvard College | Droplet-based selection |
| US8454906B2 (en) | 2007-07-24 | 2013-06-04 | The Regents Of The University Of California | Microfabricated droplet generator for single molecule/cell genetic analysis in engineered monodispersed emulsions |
| US20130084243A1 (en) | 2010-01-27 | 2013-04-04 | Liliane Goetsch | Igf-1r specific antibodies useful in the detection and diagnosis of cellular proliferative disorders |
| US8563527B2 (en) | 2007-08-20 | 2013-10-22 | Pharmain Corporation | Oligonucleotide core carrier compositions for delivery of nucleic acid-containing therapeutic agents, methods of making and using the same |
| US8268564B2 (en) | 2007-09-26 | 2012-09-18 | President And Fellows Of Harvard College | Methods and applications for stitched DNA barcodes |
| WO2009048532A2 (en) | 2007-10-05 | 2009-04-16 | President And Fellows Of Harvard College | Formation of particles for ultrasound application, drug release, and other uses, and microfluidic methods of preparation |
| US20090099040A1 (en) | 2007-10-15 | 2009-04-16 | Sigma Aldrich Company | Degenerate oligonucleotides and their uses |
| US20100086914A1 (en) | 2008-10-03 | 2010-04-08 | Roche Molecular Systems, Inc. | High resolution, high throughput hla genotyping by clonal sequencing |
| EP2053132A1 (en) * | 2007-10-23 | 2009-04-29 | Roche Diagnostics GmbH | Enrichment and sequence analysis of geomic regions |
| WO2009061372A1 (en) | 2007-11-02 | 2009-05-14 | President And Fellows Of Harvard College | Systems and methods for creating multi-phase entities, including particles and/or fluids |
| US8592150B2 (en) | 2007-12-05 | 2013-11-26 | Complete Genomics, Inc. | Methods and compositions for long fragment read sequencing |
| US20110008775A1 (en) | 2007-12-10 | 2011-01-13 | Xiaolian Gao | Sequencing of nucleic acids |
| US7771944B2 (en) | 2007-12-14 | 2010-08-10 | The Board Of Trustees Of The University Of Illinois | Methods for determining genetic haplotypes and DNA mapping |
| WO2009085215A1 (en) | 2007-12-21 | 2009-07-09 | President And Fellows Of Harvard College | Systems and methods for nucleic acid sequencing |
| EP2620511B1 (en) | 2008-01-17 | 2018-02-28 | Sequenom, Inc. | Single molecule nucleic acid sequence analysis processes |
| US9262594B2 (en) | 2008-01-18 | 2016-02-16 | Microsoft Technology Licensing, Llc | Tamper evidence per device protected identity |
| JP5468271B2 (ja) | 2008-02-08 | 2014-04-09 | 花王株式会社 | 微粒子分散液の製造方法 |
| US8034568B2 (en) | 2008-02-12 | 2011-10-11 | Nugen Technologies, Inc. | Isothermal nucleic acid amplification methods and compositions |
| JP5663723B2 (ja) | 2008-05-14 | 2015-02-04 | アンセルム(アンスチチュ ナショナル ドゥ ラ サンテ エ ドゥ ラ ルシェルシュ メディカル) | 関節リウマチの診断のための方法およびキット |
| US9068181B2 (en) | 2008-05-23 | 2015-06-30 | The General Hospital Corporation | Microfluidic droplet encapsulation |
| GB0810051D0 (en) | 2008-06-02 | 2008-07-09 | Oxford Biodynamics Ltd | Method of diagnosis |
| WO2009148598A1 (en) | 2008-06-05 | 2009-12-10 | President And Fellows Of Harvard College | Polymersomes, colloidosomes, liposomes, and other species associated with fluidic droplets |
| EP2291533B2 (en) | 2008-07-02 | 2020-09-30 | Illumina Cambridge Limited | Using populations of beads for the fabrication of arrays on surfaces |
| EP2303245B1 (en) | 2008-07-11 | 2016-12-28 | ETH Zurich | Degradable microcapsules |
| EP4047367A1 (en) | 2008-07-18 | 2022-08-24 | Bio-Rad Laboratories, Inc. | Method for detecting target analytes with droplet libraries |
| US20100062494A1 (en) | 2008-08-08 | 2010-03-11 | President And Fellows Of Harvard College | Enzymatic oligonucleotide pre-adenylation |
| US8383345B2 (en) | 2008-09-12 | 2013-02-26 | University Of Washington | Sequence tag directed subassembly of short sequencing reads into long sequencing reads |
| US20110218123A1 (en) | 2008-09-19 | 2011-09-08 | President And Fellows Of Harvard College | Creation of libraries of droplets and related species |
| US8709762B2 (en) | 2010-03-02 | 2014-04-29 | Bio-Rad Laboratories, Inc. | System for hot-start amplification via a multiple emulsion |
| US9156010B2 (en) | 2008-09-23 | 2015-10-13 | Bio-Rad Laboratories, Inc. | Droplet-based assay system |
| US20120252015A1 (en) | 2011-02-18 | 2012-10-04 | Bio-Rad Laboratories | Methods and compositions for detecting genetic material |
| WO2013016459A1 (en) | 2011-07-25 | 2013-01-31 | Bio-Rad Laboratories, Inc. | Breakage of an emulsion containing nucleic acid |
| AU2009296734B2 (en) | 2008-09-25 | 2016-02-18 | Cephalon Llc | Liquid formulations of bendamustine |
| US8361299B2 (en) | 2008-10-08 | 2013-01-29 | Sage Science, Inc. | Multichannel preparative electrophoresis system |
| US9080211B2 (en) | 2008-10-24 | 2015-07-14 | Epicentre Technologies Corporation | Transposon end compositions and methods for modifying nucleic acids |
| ES2403756T3 (es) | 2008-10-24 | 2013-05-21 | Epicentre Technologies Corporation | Composiciones de extremo del transposón y métodos para modificar ácidos nucleicos |
| US20100113296A1 (en) | 2008-11-05 | 2010-05-06 | Joel Myerson | Methods And Kits For Nucleic Acid Analysis |
| US8748103B2 (en) | 2008-11-07 | 2014-06-10 | Sequenta, Inc. | Monitoring health and disease status using clonotype profiles |
| EP2373812B1 (en) | 2008-12-19 | 2016-11-09 | President and Fellows of Harvard College | Particle-assisted nucleic acid sequencing |
| KR101065807B1 (ko) | 2009-01-23 | 2011-09-19 | 충남대학교산학협력단 | 액적 기반의 미세유체 칩을 이용한 마이크로 캡슐 제조방법 |
| US9347092B2 (en) | 2009-02-25 | 2016-05-24 | Roche Molecular System, Inc. | Solid support for high-throughput nucleic acid analysis |
| JP5457222B2 (ja) | 2009-02-25 | 2014-04-02 | エフ.ホフマン−ラ ロシュ アーゲー | 小型化ハイスループット核酸分析 |
| US9056299B2 (en) | 2009-03-13 | 2015-06-16 | President And Fellows Of Harvard College | Scale-up of flow-focusing microfluidic devices |
| WO2010104604A1 (en) | 2009-03-13 | 2010-09-16 | President And Fellows Of Harvard College | Method for the controlled creation of emulsions, including multiple emulsions |
| WO2010111231A1 (en) | 2009-03-23 | 2010-09-30 | Raindance Technologies, Inc. | Manipulation of microfluidic droplets |
| EP3998346A1 (en) | 2009-03-30 | 2022-05-18 | Illumina, Inc. | Gene expression analysis in single cells |
| EA023190B9 (ru) | 2009-04-02 | 2018-03-30 | Флуидигм Корпорейшн | Способ мультипраймерной амплификации для штрихового кодирования целевых нуклеиновых кислот |
| FR2945819B1 (fr) | 2009-05-19 | 2011-06-17 | Commissariat Energie Atomique | Dispositif et procede d'isolement de cibles biologiques ou chimiques |
| US8574835B2 (en) | 2009-05-29 | 2013-11-05 | Life Technologies Corporation | Scaffolded nucleic acid polymer particles and methods of making and using |
| DK2977455T3 (da) | 2009-06-15 | 2020-07-13 | Complete Genomics Inc | Fremgangsmåde til langfragmentaflæsnings-sekventering |
| US9524369B2 (en) * | 2009-06-15 | 2016-12-20 | Complete Genomics, Inc. | Processing and analysis of complex nucleic acid sequence data |
| EP4019977A1 (en) | 2009-06-26 | 2022-06-29 | President and Fellows of Harvard College | Fluid injection |
| US20110028412A1 (en) | 2009-08-03 | 2011-02-03 | Cappellos, Inc. | Herbal enhanced analgesic formulations |
| US20110033548A1 (en) | 2009-08-05 | 2011-02-10 | E.I. Du Pont De Nemours And Company | Degradable crosslinked aminated dextran microspheres and methods of use |
| CN102482668A (zh) | 2009-08-20 | 2012-05-30 | 群体遗传学科技有限公司 | 分子内核酸重排的组合物和方法 |
| JP6155418B2 (ja) | 2009-09-02 | 2017-07-05 | バイオ−ラッド・ラボラトリーズ・インコーポレーテッド | 多重エマルジョンの合体による、流体を混合するためのシステム |
| US20120211084A1 (en) | 2009-09-02 | 2012-08-23 | President And Fellows Of Harvard College | Multiple emulsions created using jetting and other techniques |
| US9625454B2 (en) | 2009-09-04 | 2017-04-18 | The Research Foundation For The State University Of New York | Rapid and continuous analyte processing in droplet microfluidic devices |
| GB0918564D0 (en) | 2009-10-22 | 2009-12-09 | Plasticell Ltd | Nested cell encapsulation |
| AU2010315580B2 (en) | 2009-10-27 | 2014-11-06 | President And Fellows Of Harvard College | Droplet creation techniques |
| WO2011056872A2 (en) | 2009-11-03 | 2011-05-12 | Gen9, Inc. | Methods and microfluidic devices for the manipulation of droplets in high fidelity polynucleotide assembly |
| CN102712935B (zh) | 2009-11-04 | 2017-04-26 | 不列颠哥伦比亚大学 | 含有核酸的脂质粒子及相关的方法 |
| EP2504448B1 (en) | 2009-11-25 | 2016-10-19 | Bio-Rad Laboratories, Inc. | Methods and compositions for detecting genetic material |
| CN102985552B (zh) | 2009-11-25 | 2016-02-17 | 伯乐生命医学产品有限公司 | 用于检测遗传物质的方法和组合物 |
| US9023769B2 (en) | 2009-11-30 | 2015-05-05 | Complete Genomics, Inc. | cDNA library for nucleic acid sequencing |
| US8835358B2 (en) | 2009-12-15 | 2014-09-16 | Cellular Research, Inc. | Digital counting of individual molecules by stochastic attachment of diverse labels |
| WO2011074960A1 (en) | 2009-12-17 | 2011-06-23 | Keygene N.V. | Restriction enzyme based whole genome sequencing |
| EP2517025B1 (en) | 2009-12-23 | 2019-11-27 | Bio-Rad Laboratories, Inc. | Methods for reducing the exchange of molecules between droplets |
| US8716467B2 (en) | 2010-03-03 | 2014-05-06 | Gen9, Inc. | Methods and devices for nucleic acid synthesis |
| US8342338B2 (en) | 2010-03-22 | 2013-01-01 | Hydro International Plc | Separator for separating solids from an influent |
| CA2767182C (en) | 2010-03-25 | 2020-03-24 | Bio-Rad Laboratories, Inc. | Droplet generation for droplet-based assays |
| US20120000777A1 (en) | 2010-06-04 | 2012-01-05 | The Regents Of The University Of California | Devices and methods for forming double emulsion droplet compositions and polymer particles |
| US8703493B2 (en) | 2010-06-15 | 2014-04-22 | Src, Inc. | Location analysis using fire retardant-protected nucleic acid-labeled tags |
| US20120003657A1 (en) | 2010-07-02 | 2012-01-05 | Samuel Myllykangas | Targeted sequencing library preparation by genomic dna circularization |
| WO2012012037A1 (en) | 2010-07-19 | 2012-01-26 | New England Biolabs, Inc. | Oligonucleotide adaptors: compositions and methods of use |
| US20130203675A1 (en) | 2010-09-16 | 2013-08-08 | Joseph M. DeSimone | Asymmetric biofunctional silyl monomers and particles thereof as prodrugs and delivery vehicles for pharmaceutical, chemical and biological agents |
| ES2523140T3 (es) | 2010-09-21 | 2014-11-21 | Population Genetics Technologies Ltd. | Aumento de la confianza en las identificaciones de alelos con el recuento molecular |
| EP2625526B1 (en) | 2010-10-04 | 2017-03-15 | Genapsys Inc. | Systems and methods for automated reusable parallel biological reactions |
| US9999886B2 (en) | 2010-10-07 | 2018-06-19 | The Regents Of The University Of California | Methods and systems for on demand droplet generation and impedance based detection |
| EP3561159B1 (en) * | 2010-10-08 | 2023-09-20 | President and Fellows of Harvard College | High-throughput single cell barcoding |
| US8829171B2 (en) | 2011-02-10 | 2014-09-09 | Illumina, Inc. | Linking sequence reads using paired code tags |
| AU2011323107B2 (en) | 2010-11-05 | 2015-09-10 | Illumina, Inc. | Linking sequence reads using paired code tags |
| US9074251B2 (en) | 2011-02-10 | 2015-07-07 | Illumina, Inc. | Linking sequence reads using paired code tags |
| US9009487B2 (en) | 2010-11-19 | 2015-04-14 | International Business Machines Corporation | Device archiving of past cluster binding information on a broadcast encryption-based network |
| EP2652155B1 (en) | 2010-12-16 | 2016-11-16 | Gigagen, Inc. | Methods for massively parallel analysis of nucleic acids in single cells |
| US8765455B2 (en) | 2011-01-27 | 2014-07-01 | Lawrence Livermore National Security, Llc | Chip-based droplet sorting |
| CA2821559C (en) | 2011-01-28 | 2017-01-31 | Illumina, Inc. | Oligonucleotide replacement for di-tagged and directional libraries |
| US8785380B2 (en) | 2011-02-01 | 2014-07-22 | M/S Akay Flavours & Aromatics Pvt Ltd. | Formulation containing curcuminoids exhibiting enhanced bioavailability |
| EP3736281A1 (en) * | 2011-02-18 | 2020-11-11 | Bio-Rad Laboratories, Inc. | Compositions and methods for molecular labeling |
| GB2489714B (en) | 2011-04-05 | 2013-11-06 | Tracesa Ltd | Fluid Identification Method |
| EP2694489B1 (en) | 2011-04-07 | 2017-09-06 | Merck Sharp & Dohme Corp. | C5-c6 oxacyclic-fused thiadiazine dioxide compounds as bace inhibitors, compositions, and their use |
| AU2012249759A1 (en) | 2011-04-25 | 2013-11-07 | Bio-Rad Laboratories, Inc. | Methods and compositions for nucleic acid analysis |
| EP3495497B1 (en) | 2011-04-28 | 2021-03-24 | Life Technologies Corporation | Methods and compositions for multiplex pcr |
| SI3418380T1 (sl) | 2011-04-28 | 2022-10-28 | The Board Of Trustees Of The Leland Stanford Junior University | Identifikacija polinukleotidov, povezanih z vzorcem |
| JP6100685B2 (ja) | 2011-05-16 | 2017-03-22 | 地方独立行政法人 大阪府立病院機構 | 血中dnaの定量的検出による悪性新生物の病勢の進行を評価する方法 |
| CN103547362B (zh) | 2011-05-23 | 2016-05-25 | 哈佛学院院长等 | 乳液、包括多重乳液的控制 |
| US9005935B2 (en) | 2011-05-23 | 2015-04-14 | Agilent Technologies, Inc. | Methods and compositions for DNA fragmentation and tagging by transposases |
| WO2012166425A2 (en) | 2011-05-27 | 2012-12-06 | President And Fellows Of Harvard College | Methods of amplifying whole genome of a single cell |
| US8841071B2 (en) | 2011-06-02 | 2014-09-23 | Raindance Technologies, Inc. | Sample multiplexing |
| US9150916B2 (en) | 2011-06-24 | 2015-10-06 | Beat Christen | Compositions and methods for identifying the essential genome of an organism |
| US8927218B2 (en) | 2011-06-27 | 2015-01-06 | Flir Systems, Inc. | Methods and compositions for segregating target nucleic acid from mixed nucleic acid samples |
| US20130017978A1 (en) | 2011-07-11 | 2013-01-17 | Finnzymes Oy | Methods and transposon nucleic acids for generating a dna library |
| US9605304B2 (en) | 2011-07-20 | 2017-03-28 | The Hong Kong Polytechnic University | Ultra-stable oligonucleotide-gold and-silver nanoparticle conjugates and method of their preparation |
| WO2013019751A1 (en) | 2011-07-29 | 2013-02-07 | Bio-Rad Laboratories, Inc., | Library characterization by digital assay |
| WO2013055955A1 (en) | 2011-10-12 | 2013-04-18 | Complete Genomics, Inc. | Identification of dna fragments and structural variations |
| US20130109576A1 (en) | 2011-10-28 | 2013-05-02 | Anthony P. Shuber | Methods for detecting mutations |
| AU2012332703B2 (en) | 2011-10-31 | 2017-05-25 | University Of Utah Research Foundation | Evaluation of cardiac structure |
| EP2774277A4 (en) | 2011-11-04 | 2015-07-22 | Intel Corp | SIGNALING FOR THE CONFIGURATION OF COORDINATED DOWNLINK MULTIPORT COMMUNICATIONS |
| JP6083713B2 (ja) | 2011-11-16 | 2017-02-22 | インターナショナル・ビジネス・マシーンズ・コーポレーションInternational Business Machines Corporation | 変形可能バルブを備えたマイクロ流体デバイス |
| US9938524B2 (en) | 2011-11-22 | 2018-04-10 | Active Motif, Inc. | Multiplex isolation of protein-associated nucleic acids |
| US10689643B2 (en) | 2011-11-22 | 2020-06-23 | Active Motif, Inc. | Targeted transposition for use in epigenetic studies |
| US10227639B2 (en) | 2011-12-22 | 2019-03-12 | President And Fellows Of Harvard College | Compositions and methods for analyte detection |
| KR20130076978A (ko) | 2011-12-29 | 2013-07-09 | 삼성전자주식회사 | 표시 장치 및 그 색상 보정 방법 |
| US9243085B2 (en) | 2012-02-09 | 2016-01-26 | Life Technologies Corporation | Hydrophilic polymeric particles and methods for making and using same |
| US9637781B2 (en) | 2012-02-14 | 2017-05-02 | The Johns Hopkins University | MiRNA analysis methods |
| CA2864287C (en) | 2012-02-15 | 2021-01-12 | Wisconsin Alumni Research Foundation | Dithioamine reducing agents |
| WO2013123125A1 (en) | 2012-02-17 | 2013-08-22 | President And Fellows Of Harvard College | Assembly of nucleic acid sequences in emulsions |
| EP2817418B1 (en) | 2012-02-24 | 2017-10-11 | Raindance Technologies, Inc. | Labeling and sample preparation for sequencing |
| EP3495503A1 (en) | 2012-03-05 | 2019-06-12 | President and Fellows of Harvard College | Systems and methods for epigenetic sequencing |
| NO2694769T3 (ja) | 2012-03-06 | 2018-03-03 | ||
| EP2647426A1 (en) | 2012-04-03 | 2013-10-09 | Max-Planck-Gesellschaft zur Förderung der Wissenschaften e.V. | Replication of distributed nucleic acid molecules with preservation of their relative distribution through hybridization-based binding |
| US20130296173A1 (en) | 2012-04-23 | 2013-11-07 | Complete Genomics, Inc. | Pre-anchor wash |
| EP2852687A4 (en) | 2012-05-21 | 2016-10-05 | Scripps Research Inst | METHODS FOR PREPARING A SAMPLE |
| US9708654B2 (en) | 2012-06-15 | 2017-07-18 | Board Of Regents, The University Of Texas System | High throughput sequencing of multiple transcripts |
| US9567631B2 (en) | 2012-12-14 | 2017-02-14 | 10X Genomics, Inc. | Methods and systems for processing polynucleotides |
| US9951386B2 (en) | 2014-06-26 | 2018-04-24 | 10X Genomics, Inc. | Methods and systems for processing polynucleotides |
| US20140378349A1 (en) | 2012-08-14 | 2014-12-25 | 10X Technologies, Inc. | Compositions and methods for sample processing |
| US9701998B2 (en) | 2012-12-14 | 2017-07-11 | 10X Genomics, Inc. | Methods and systems for processing polynucleotides |
| CN111748607B (zh) | 2012-08-14 | 2024-04-30 | 10X基因组学有限公司 | 微胶囊组合物及方法 |
| US10221442B2 (en) | 2012-08-14 | 2019-03-05 | 10X Genomics, Inc. | Compositions and methods for sample processing |
| US20140378345A1 (en) | 2012-08-14 | 2014-12-25 | 10X Technologies, Inc. | Compositions and methods for sample processing |
| US20150005200A1 (en) | 2012-08-14 | 2015-01-01 | 10X Technologies, Inc. | Compositions and methods for sample processing |
| US20150005199A1 (en) | 2012-08-14 | 2015-01-01 | 10X Technologies, Inc. | Compositions and methods for sample processing |
| US20140378322A1 (en) | 2012-08-14 | 2014-12-25 | 10X Technologies, Inc. | Compositions and methods for sample processing |
| EP2898096B1 (en) | 2012-09-21 | 2024-02-14 | The Broad Institute, Inc. | Methods for labeling of rnas |
| JP2014067204A (ja) | 2012-09-26 | 2014-04-17 | Brother Ind Ltd | パネル制御装置、パネル制御方法、及びパネル制御プログラム |
| US9644199B2 (en) | 2012-10-01 | 2017-05-09 | Agilent Technologies, Inc. | Immobilized transposase complexes for DNA fragmentation and tagging |
| GB201217772D0 (en) | 2012-10-04 | 2012-11-14 | Base4 Innovation Ltd | Sequencing method |
| EP2906715B1 (en) | 2012-10-15 | 2017-07-26 | Life Technologies Corporation | Compositions, methods, systems and kits for target nucleic acid enrichment |
| CN104903466B (zh) | 2012-11-05 | 2016-11-23 | 鲁比康基因组学公司 | 条形编码核酸 |
| US20140127688A1 (en) | 2012-11-07 | 2014-05-08 | Good Start Genetics, Inc. | Methods and systems for identifying contamination in samples |
| CN105026576A (zh) | 2012-12-03 | 2015-11-04 | 以琳生物药物有限公司 | 单链多核苷酸扩增方法 |
| EP2752664A1 (en) | 2013-01-07 | 2014-07-09 | Max-Planck-Gesellschaft zur Förderung der Wissenschaften e.V. | Label-free method for the detection of analytes |
| US9683230B2 (en) | 2013-01-09 | 2017-06-20 | Illumina Cambridge Limited | Sample preparation on a solid support |
| CN108753766A (zh) | 2013-02-08 | 2018-11-06 | 10X基因组学有限公司 | 多核苷酸条形码生成 |
| EP3418398B1 (en) | 2013-03-08 | 2020-05-13 | Bio-Rad Laboratories, Inc. | Compositions for polymerase chain reaction assays |
| AU2013382098B2 (en) | 2013-03-13 | 2019-02-07 | Illumina, Inc. | Methods and compositions for nucleic acid sequencing |
| US9328382B2 (en) | 2013-03-15 | 2016-05-03 | Complete Genomics, Inc. | Multiple tagging of individual long DNA fragments |
| US11299718B2 (en) | 2013-03-15 | 2022-04-12 | 4basebio Sl | Methods for amplification and sequencing using thermostable TthPrimPol |
| US20140274729A1 (en) | 2013-03-15 | 2014-09-18 | Nugen Technologies, Inc. | Methods, compositions and kits for generation of stranded rna or dna libraries |
| EP4345463A2 (en) | 2013-03-15 | 2024-04-03 | Bruker Nano, Inc. | Chemical nano-identification of a sample using normalized near-field spectroscopy |
| GB2584364A (en) | 2013-03-15 | 2020-12-02 | Abvitro Llc | Single cell bar-coding for antibody discovery |
| EP2994559B1 (en) | 2013-05-09 | 2020-07-08 | Bio-rad Laboratories, Inc. | Magnetic immuno digital pcr assay |
| US10059989B2 (en) | 2013-05-23 | 2018-08-28 | The Board Of Trustees Of The Leland Stanford Junior University | Transposition of native chromatin for personal epigenomics |
| US20160122753A1 (en) | 2013-06-12 | 2016-05-05 | Tarjei Mikkelsen | High-throughput rna-seq |
| CN113425857A (zh) | 2013-06-17 | 2021-09-24 | 布罗德研究所有限公司 | 用于肝靶向和治疗的crispr-cas系统、载体和组合物的递送与用途 |
| US20160208323A1 (en) | 2013-06-21 | 2016-07-21 | The Broad Institute, Inc. | Methods for Shearing and Tagging DNA for Chromatin Immunoprecipitation and Sequencing |
| CN110592182B (zh) | 2013-06-27 | 2023-11-28 | 10X基因组学有限公司 | 用于样品处理的组合物和方法 |
| CA2919503C (en) | 2013-07-12 | 2019-06-25 | University Of South Alabama | Minimal piggybac vectors for genome integration |
| EP3842542A1 (en) | 2013-08-28 | 2021-06-30 | Becton, Dickinson and Company | Massively parallel single cell analysis |
| CN105764490B (zh) | 2013-09-24 | 2020-10-09 | 加利福尼亚大学董事会 | 用于生物测定和诊断的胶囊封装的传感器和感测系统及其制造和使用方法 |
| GB201317301D0 (en) | 2013-09-30 | 2013-11-13 | Linnarsson Sten | Method for capturing and encoding nucleic acid from a plurality of single cells |
| US9937495B2 (en) | 2013-10-28 | 2018-04-10 | Massachusetts Institute Of Technology | Hydrogel microstructures with immiscible fluid isolation for small reaction volumes |
| EP4094834A1 (en) | 2013-12-30 | 2022-11-30 | Atreca, Inc. | Analysis of nucleic acids associated with single cells using nucleic acid barcodes |
| CN106103713B (zh) | 2014-02-03 | 2021-05-28 | 赛默飞世尔科技波罗的海封闭股份公司 | 用于经控制dna片段化的方法 |
| CA3214905A1 (en) | 2014-02-27 | 2015-09-03 | Jumpcode Genomics, Inc. | Methods for analysis of somatic mobile elements, and uses thereof |
| KR102596508B1 (ko) | 2014-04-10 | 2023-10-30 | 10엑스 제노믹스, 인크. | 시약을 캡슐화 및 구획화하기 위한 유체 디바이스, 시스템, 및 방법, 및 이의 응용 |
| EP3132029A2 (en) | 2014-04-15 | 2017-02-22 | Illumina, Inc. | Modified transposases for improved insertion sequence bias and increased dna input tolerance |
| EP3456846B1 (en) | 2014-04-21 | 2022-06-22 | President and Fellows of Harvard College | Systems and methods for barcoding nucleic acid |
| US20150298091A1 (en) | 2014-04-21 | 2015-10-22 | President And Fellows Of Harvard College | Systems and methods for barcoding nucleic acids |
| US10975371B2 (en) | 2014-04-29 | 2021-04-13 | Illumina, Inc. | Nucleic acid sequence analysis from single cells |
| EP3146046B1 (en) | 2014-05-23 | 2020-03-11 | Digenomix Corporation | Haploidome determination by digitized transposons |
| US9534215B2 (en) | 2014-06-11 | 2017-01-03 | Life Technologies Corporation | Systems and methods for substrate enrichment |
| US9657404B2 (en) | 2014-06-27 | 2017-05-23 | Wistron Neweb Corp. | Method of forming metallic pattern on polymer substrate |
| EP3161157B1 (en) | 2014-06-24 | 2024-03-27 | Bio-Rad Laboratories, Inc. | Digital pcr barcoding |
| JP2017523774A (ja) | 2014-06-26 | 2017-08-24 | 10エックス ジェノミクス, インコーポレイテッド | サンプル分析のための方法及び組成物 |
| US10017759B2 (en) | 2014-06-26 | 2018-07-10 | Illumina, Inc. | Library preparation of tagged nucleic acid |
| MX2016016904A (es) | 2014-06-26 | 2017-03-27 | 10X Genomics Inc | Analisis de secuencias de acidos nucleicos. |
| AU2015279546B2 (en) | 2014-06-26 | 2021-04-08 | 10X Genomics, Inc. | Processes and systems for nucleic acid sequence assembly |
| CN106795553B (zh) | 2014-06-26 | 2021-06-04 | 10X基因组学有限公司 | 分析来自单个细胞或细胞群体的核酸的方法 |
| US20160024558A1 (en) | 2014-07-23 | 2016-01-28 | 10X Genomics, Inc. | Nucleic acid binding proteins and uses thereof |
| JP2017532024A (ja) | 2014-09-09 | 2017-11-02 | ザ・ブロード・インスティテュート・インコーポレイテッド | コンポジット単一細胞核酸分析のための液滴ベースの方法および機器 |
| EP3194593B1 (en) | 2014-09-15 | 2019-02-06 | AbVitro LLC | High-throughput nucleotide library sequencing |
| CA2964799A1 (en) | 2014-10-17 | 2016-04-21 | Illumina Cambridge Limited | Contiguity preserving transposition |
| JP2017532042A (ja) | 2014-10-29 | 2017-11-02 | 10エックス ゲノミクス,インコーポレイテッド | 標的化核酸配列決定のための方法及び組成物 |
| KR102321863B1 (ko) | 2015-01-12 | 2021-11-08 | 10엑스 제노믹스, 인크. | 핵산 시퀀싱 라이브러리의 제조 방법 및 시스템 및 이를 이용하여 제조한 라이브러리 |
| EP4112744A1 (en) | 2015-02-04 | 2023-01-04 | The Regents of the University of California | Sequencing of nucleic acids via barcoding in discrete entities |
| US10697000B2 (en) | 2015-02-24 | 2020-06-30 | 10X Genomics, Inc. | Partition processing methods and systems |
| BR112017018054A2 (pt) | 2015-02-24 | 2018-07-24 | 10X Genomics Inc | métodos para a cobertura de sequências de ácidos nucleicos direcionadas |
| EP3298168A4 (en) | 2015-05-18 | 2019-02-20 | 10X Genomics, Inc. | STABILIZED REDUCING AGENTS AND METHODS OF USE |
| JP2018518950A (ja) | 2015-05-18 | 2018-07-19 | 10エックス ジェノミクス, インコーポレイテッド | 生物医学的な反応及び分析で使用するための移動固相組成物 |
| WO2016187717A1 (en) | 2015-05-26 | 2016-12-01 | Exerkine Corporation | Exosomes useful for genome editing |
| WO2016191618A1 (en) | 2015-05-27 | 2016-12-01 | Jianbiao Zheng | Methods of inserting molecular barcodes |
| WO2016207647A1 (en) | 2015-06-24 | 2016-12-29 | Oxford Biodynamics Limited | Epigenetic chromosome interactions |
| JP2018527947A (ja) | 2015-07-17 | 2018-09-27 | プレジデント アンド フェローズ オブ ハーバード カレッジ | 核酸配列増幅方法 |
| HUE047175T2 (hu) | 2015-08-12 | 2020-04-28 | Cemm Forschungszentrum Fuer Molekulare Medizin Gmbh | Eljárások nukleinsavak tanulmányozására |
| KR20180085717A (ko) | 2015-09-24 | 2018-07-27 | 에이비비트로, 엘엘씨 | 친화성-올리고뉴클레오타이드 콘쥬게이트 및 그것의 사용 |
| US11092607B2 (en) | 2015-10-28 | 2021-08-17 | The Board Institute, Inc. | Multiplex analysis of single cell constituents |
| CN108350499B (zh) | 2015-11-19 | 2022-05-13 | 10X基因组学有限公司 | 可转化标记组合物、方法及结合其的过程 |
| US20170260584A1 (en) | 2016-02-11 | 2017-09-14 | 10X Genomics, Inc. | Cell population analysis using single nucleotide polymorphisms from single cell transcriptomes |
| US11680253B2 (en) | 2016-03-10 | 2023-06-20 | The Board Of Trustees Of The Leland Stanford Junior University | Transposase-mediated imaging of the accessible genome |
| EP3507385A4 (en) | 2016-08-31 | 2020-04-29 | President and Fellows of Harvard College | METHODS OF COMBINING THE DETECTION OF BIOMOLECULES IN A SINGLE ASSAY USING IN SITU FLUORESCENT SEQUENCING |
| DK3529357T3 (da) | 2016-10-19 | 2022-04-25 | 10X Genomics Inc | Fremgangsmåder til stregkodning af nukleinsyremolekyler fra individuelle celler |
| WO2018118971A1 (en) | 2016-12-19 | 2018-06-28 | Bio-Rad Laboratories, Inc. | Droplet tagging contiguity preserved tagmented dna |
| US10011872B1 (en) | 2016-12-22 | 2018-07-03 | 10X Genomics, Inc. | Methods and systems for processing polynucleotides |
| CN117512066A (zh) | 2017-01-30 | 2024-02-06 | 10X基因组学有限公司 | 用于基于微滴的单细胞条形编码的方法和系统 |
-
2015
- 2015-10-29 JP JP2017519628A patent/JP2017532042A/ja active Pending
- 2015-10-29 AU AU2015339148A patent/AU2015339148B2/en active Active
- 2015-10-29 KR KR1020177013904A patent/KR20170073667A/ko not_active Application Discontinuation
- 2015-10-29 WO PCT/US2015/058142 patent/WO2016069939A1/en active Application Filing
- 2015-10-29 CN CN202210420031.7A patent/CN114807307A/zh active Pending
- 2015-10-29 MX MX2017005267A patent/MX2017005267A/es unknown
- 2015-10-29 CN CN201580059008.8A patent/CN107002128A/zh active Pending
- 2015-10-29 EP EP15793990.1A patent/EP3212807B1/en active Active
- 2015-10-29 CA CA2964472A patent/CA2964472A1/en not_active Abandoned
- 2015-10-29 BR BR112017008877A patent/BR112017008877A2/pt not_active Application Discontinuation
- 2015-10-29 US US14/927,297 patent/US20160122817A1/en not_active Abandoned
-
2016
- 2016-06-06 US US15/174,923 patent/US20160281137A1/en not_active Abandoned
- 2016-06-06 US US15/174,919 patent/US20160281136A1/en not_active Abandoned
- 2016-06-06 US US15/174,922 patent/US20160281161A1/en not_active Abandoned
- 2016-06-06 US US15/174,928 patent/US10287623B2/en active Active
-
2020
- 2020-10-06 US US17/064,508 patent/US11739368B2/en active Active
-
2023
- 2023-06-30 US US18/346,011 patent/US20240035066A1/en active Pending
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2014506788A (ja) * | 2011-02-02 | 2014-03-20 | ユニヴァーシティ・オブ・ワシントン・スルー・イッツ・センター・フォー・コマーシャリゼーション | 大量並列連続性マッピング |
| WO2013036929A1 (en) * | 2011-09-09 | 2013-03-14 | The Board Of Trustees Of The Leland Stanford Junior | Methods for obtaining a sequence |
| US20130130919A1 (en) * | 2011-10-18 | 2013-05-23 | The Regents Of The University Of California | Long-Range Barcode Labeling-Sequencing |
Also Published As
| Publication number | Publication date |
|---|---|
| US20160122817A1 (en) | 2016-05-05 |
| EP3212807A1 (en) | 2017-09-06 |
| AU2015339148A1 (en) | 2017-05-18 |
| MX2017005267A (es) | 2017-07-26 |
| US10287623B2 (en) | 2019-05-14 |
| US11739368B2 (en) | 2023-08-29 |
| US20160281137A1 (en) | 2016-09-29 |
| KR20170073667A (ko) | 2017-06-28 |
| US20210269852A1 (en) | 2021-09-02 |
| CA2964472A1 (en) | 2016-05-06 |
| US20160281138A1 (en) | 2016-09-29 |
| US20160281136A1 (en) | 2016-09-29 |
| CN107002128A (zh) | 2017-08-01 |
| US20160281161A1 (en) | 2016-09-29 |
| CN114807307A (zh) | 2022-07-29 |
| US20240035066A1 (en) | 2024-02-01 |
| EP3212807B1 (en) | 2020-09-02 |
| BR112017008877A2 (pt) | 2018-07-03 |
| WO2016069939A1 (en) | 2016-05-06 |
| AU2015339148B2 (en) | 2022-03-10 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US11739368B2 (en) | Methods and compositions for targeted nucleic acid sequencing | |
| US20220403464A1 (en) | Methods and Compositions for Targeted Nucleic Acid Sequence Coverage | |
| US11873528B2 (en) | Methods and compositions for nucleic acid analysis |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20181026 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20181026 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20190821 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20191121 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20200121 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20200220 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20200617 |