JP2004509970A - 位置的化学変化による免疫刺激オリゴヌクレオチドアナログの免疫刺激活性の調節 - Google Patents
位置的化学変化による免疫刺激オリゴヌクレオチドアナログの免疫刺激活性の調節 Download PDFInfo
- Publication number
- JP2004509970A JP2004509970A JP2002531140A JP2002531140A JP2004509970A JP 2004509970 A JP2004509970 A JP 2004509970A JP 2002531140 A JP2002531140 A JP 2002531140A JP 2002531140 A JP2002531140 A JP 2002531140A JP 2004509970 A JP2004509970 A JP 2004509970A
- Authority
- JP
- Japan
- Prior art keywords
- immunostimulatory
- nucleoside
- group
- naturally occurring
- oligonucleotide compound
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- 230000003308 immunostimulating effect Effects 0.000 title claims abstract description 245
- 108091034117 Oligonucleotide Proteins 0.000 title claims abstract description 237
- 239000000126 substance Substances 0.000 title description 5
- 150000001875 compounds Chemical class 0.000 claims abstract description 79
- 238000000034 method Methods 0.000 claims description 57
- 239000002777 nucleoside Substances 0.000 claims description 47
- 150000003833 nucleoside derivatives Chemical class 0.000 claims description 31
- 229910052739 hydrogen Inorganic materials 0.000 claims description 24
- 239000001257 hydrogen Substances 0.000 claims description 24
- 235000000346 sugar Nutrition 0.000 claims description 20
- -1 nucleoside methylphosphonate Chemical class 0.000 claims description 18
- 239000002718 pyrimidine nucleoside Substances 0.000 claims description 17
- 125000006850 spacer group Chemical group 0.000 claims description 15
- TVICROIWXBFQEL-UHFFFAOYSA-N 6-(ethylamino)-1h-pyrimidin-2-one Chemical compound CCNC1=CC=NC(=O)N1 TVICROIWXBFQEL-UHFFFAOYSA-N 0.000 claims description 14
- CZPWVGJYEJSRLH-UHFFFAOYSA-N Pyrimidine Chemical compound C1=CN=CN=C1 CZPWVGJYEJSRLH-UHFFFAOYSA-N 0.000 claims description 14
- NLLCDONDZDHLCI-UHFFFAOYSA-N 6-amino-5-hydroxy-1h-pyrimidin-2-one Chemical compound NC=1NC(=O)N=CC=1O NLLCDONDZDHLCI-UHFFFAOYSA-N 0.000 claims description 12
- NYHBQMYGNKIUIF-UUOKFMHZSA-N Guanosine Chemical compound C1=NC=2C(=O)NC(N)=NC=2N1[C@@H]1O[C@H](CO)[C@@H](O)[C@H]1O NYHBQMYGNKIUIF-UUOKFMHZSA-N 0.000 claims description 12
- 239000002342 ribonucleoside Substances 0.000 claims description 12
- RYYWUUFWQRZTIU-UHFFFAOYSA-K thiophosphate Chemical compound [O-]P([O-])([O-])=S RYYWUUFWQRZTIU-UHFFFAOYSA-K 0.000 claims description 11
- UHDGCWIWMRVCDJ-ZAKLUEHWSA-N cytidine Chemical class O=C1N=C(N)C=CN1[C@H]1[C@H](O)[C@@H](O)[C@H](CO)O1 UHDGCWIWMRVCDJ-ZAKLUEHWSA-N 0.000 claims description 10
- 229960005486 vaccine Drugs 0.000 claims description 10
- CKTSBUTUHBMZGZ-SHYZEUOFSA-N 2'‐deoxycytidine Chemical compound O=C1N=C(N)C=CN1[C@@H]1O[C@H](CO)[C@@H](O)C1 CKTSBUTUHBMZGZ-SHYZEUOFSA-N 0.000 claims description 9
- CKTSBUTUHBMZGZ-UHFFFAOYSA-N Deoxycytidine Natural products O=C1N=C(N)C=CN1C1OC(CO)C(O)C1 CKTSBUTUHBMZGZ-UHFFFAOYSA-N 0.000 claims description 9
- 239000002671 adjuvant Substances 0.000 claims description 9
- 150000004713 phosphodiesters Chemical class 0.000 claims description 9
- 238000011144 upstream manufacturing Methods 0.000 claims description 9
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical group N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 claims description 8
- 230000028993 immune response Effects 0.000 claims description 8
- YACKEPLHDIMKIO-UHFFFAOYSA-N methylphosphonic acid Chemical compound CP(O)(O)=O YACKEPLHDIMKIO-UHFFFAOYSA-N 0.000 claims description 8
- 125000003835 nucleoside group Chemical group 0.000 claims description 8
- UHDGCWIWMRVCDJ-UHFFFAOYSA-N 1-beta-D-Xylofuranosyl-NH-Cytosine Natural products O=C1N=C(N)C=CN1C1C(O)C(O)C(CO)O1 UHDGCWIWMRVCDJ-UHFFFAOYSA-N 0.000 claims description 7
- UHDGCWIWMRVCDJ-PSQAKQOGSA-N Cytidine Natural products O=C1N=C(N)C=CN1[C@@H]1[C@@H](O)[C@@H](O)[C@H](CO)O1 UHDGCWIWMRVCDJ-PSQAKQOGSA-N 0.000 claims description 7
- PYMYPHUHKUWMLA-UHFFFAOYSA-N arabinose Natural products OCC(O)C(O)C(O)C=O PYMYPHUHKUWMLA-UHFFFAOYSA-N 0.000 claims description 7
- SRBFZHDQGSBBOR-UHFFFAOYSA-N beta-D-Pyranose-Lyxose Natural products OC1COC(O)C(O)C1O SRBFZHDQGSBBOR-UHFFFAOYSA-N 0.000 claims description 7
- 239000002212 purine nucleoside Substances 0.000 claims description 7
- KDCGOANMDULRCW-UHFFFAOYSA-N 7H-purine Chemical compound N1=CNC2=NC=NC2=C1 KDCGOANMDULRCW-UHFFFAOYSA-N 0.000 claims description 6
- 239000000427 antigen Substances 0.000 claims description 6
- 102000036639 antigens Human genes 0.000 claims description 6
- 108091007433 antigens Proteins 0.000 claims description 6
- 201000010099 disease Diseases 0.000 claims description 6
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 claims description 6
- MRWXACSTFXYYMV-FDDDBJFASA-N nebularine Chemical compound O[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1N1C2=NC=NC=C2N=C1 MRWXACSTFXYYMV-FDDDBJFASA-N 0.000 claims description 6
- 244000052769 pathogen Species 0.000 claims description 6
- 230000001717 pathogenic effect Effects 0.000 claims description 6
- YKBGVTZYEHREMT-KVQBGUIXSA-N 2'-deoxyguanosine Chemical compound C1=NC=2C(=O)NC(N)=NC=2N1[C@H]1C[C@H](O)[C@@H](CO)O1 YKBGVTZYEHREMT-KVQBGUIXSA-N 0.000 claims description 5
- 230000002708 enhancing effect Effects 0.000 claims description 5
- 125000001165 hydrophobic group Chemical group 0.000 claims description 5
- OVONXEQGWXGFJD-UHFFFAOYSA-N 4-sulfanylidene-1h-pyrimidin-2-one Chemical compound SC=1C=CNC(=O)N=1 OVONXEQGWXGFJD-UHFFFAOYSA-N 0.000 claims description 4
- RYVNIFSIEDRLSJ-UHFFFAOYSA-N 5-(hydroxymethyl)cytosine Chemical compound NC=1NC(=O)N=CC=1CO RYVNIFSIEDRLSJ-UHFFFAOYSA-N 0.000 claims description 4
- 208000023275 Autoimmune disease Diseases 0.000 claims description 4
- MIKUYHXYGGJMLM-GIMIYPNGSA-N Crotonoside Natural products C1=NC2=C(N)NC(=O)N=C2N1[C@H]1O[C@@H](CO)[C@H](O)[C@@H]1O MIKUYHXYGGJMLM-GIMIYPNGSA-N 0.000 claims description 4
- NYHBQMYGNKIUIF-UHFFFAOYSA-N D-guanosine Natural products C1=2NC(N)=NC(=O)C=2N=CN1C1OC(CO)C(O)C1O NYHBQMYGNKIUIF-UHFFFAOYSA-N 0.000 claims description 4
- 206010028980 Neoplasm Diseases 0.000 claims description 4
- 201000011510 cancer Diseases 0.000 claims description 4
- 229940029575 guanosine Drugs 0.000 claims description 4
- 150000002402 hexoses Chemical class 0.000 claims description 4
- 229910052757 nitrogen Chemical group 0.000 claims description 4
- 150000002972 pentoses Chemical class 0.000 claims description 4
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical group [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 claims description 3
- 208000037883 airway inflammation Diseases 0.000 claims description 3
- 208000028004 allergic respiratory disease Diseases 0.000 claims description 3
- 230000007815 allergy Effects 0.000 claims description 3
- 239000003242 anti bacterial agent Substances 0.000 claims description 3
- 208000006673 asthma Diseases 0.000 claims description 3
- 230000001363 autoimmune Effects 0.000 claims description 3
- 229910052799 carbon Inorganic materials 0.000 claims description 3
- 125000006575 electron-withdrawing group Chemical group 0.000 claims description 3
- 201000004335 respiratory allergy Diseases 0.000 claims description 3
- 230000004936 stimulating effect Effects 0.000 claims description 3
- 108010041986 DNA Vaccines Proteins 0.000 claims description 2
- 229940021995 DNA vaccine Drugs 0.000 claims description 2
- 239000013566 allergen Substances 0.000 claims description 2
- 239000000074 antisense oligonucleotide Substances 0.000 claims description 2
- 238000012230 antisense oligonucleotides Methods 0.000 claims description 2
- 230000003115 biocidal effect Effects 0.000 claims description 2
- 230000000295 complement effect Effects 0.000 claims description 2
- 239000002254 cytotoxic agent Substances 0.000 claims description 2
- 229940127089 cytotoxic agent Drugs 0.000 claims description 2
- 231100000599 cytotoxic agent Toxicity 0.000 claims description 2
- 238000001415 gene therapy Methods 0.000 claims description 2
- 230000036039 immunity Effects 0.000 claims description 2
- YKBGVTZYEHREMT-UHFFFAOYSA-N 2'-deoxyguanosine Natural products C1=2NC(N)=NC(=O)C=2N=CN1C1CC(O)C(CO)O1 YKBGVTZYEHREMT-UHFFFAOYSA-N 0.000 claims 3
- VGONTNSXDCQUGY-UHFFFAOYSA-N desoxyinosine Natural products C1C(O)C(CO)OC1N1C(NC=NC2=O)=C2N=C1 VGONTNSXDCQUGY-UHFFFAOYSA-N 0.000 claims 3
- 150000002431 hydrogen Chemical group 0.000 claims 3
- 241000894006 Bacteria Species 0.000 claims 1
- 241000713772 Human immunodeficiency virus 1 Species 0.000 claims 1
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 claims 1
- 241000700605 Viruses Species 0.000 claims 1
- 125000000089 arabinosyl group Chemical group C1([C@@H](O)[C@H](O)[C@H](O)CO1)* 0.000 claims 1
- 230000000973 chemotherapeutic effect Effects 0.000 claims 1
- 108700004026 gag Genes Proteins 0.000 claims 1
- 101150098622 gag gene Proteins 0.000 claims 1
- 244000045947 parasite Species 0.000 claims 1
- 108700004027 tat Genes Proteins 0.000 claims 1
- 101150098170 tat gene Proteins 0.000 claims 1
- 238000009169 immunotherapy Methods 0.000 abstract description 6
- JLCPHMBAVCMARE-UHFFFAOYSA-N [3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-hydroxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methyl [5-(6-aminopurin-9-yl)-2-(hydroxymethyl)oxolan-3-yl] hydrogen phosphate Polymers Cc1cn(C2CC(OP(O)(=O)OCC3OC(CC3OP(O)(=O)OCC3OC(CC3O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c3nc(N)[nH]c4=O)C(COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3CO)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cc(C)c(=O)[nH]c3=O)n3cc(C)c(=O)[nH]c3=O)n3ccc(N)nc3=O)n3cc(C)c(=O)[nH]c3=O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)O2)c(=O)[nH]c1=O JLCPHMBAVCMARE-UHFFFAOYSA-N 0.000 description 67
- 238000006467 substitution reaction Methods 0.000 description 67
- OPTASPLRGRRNAP-UHFFFAOYSA-N cytosine Chemical compound NC=1C=CNC(=O)N=1 OPTASPLRGRRNAP-UHFFFAOYSA-N 0.000 description 63
- 210000000952 spleen Anatomy 0.000 description 53
- 238000003556 assay Methods 0.000 description 32
- 238000001516 cell proliferation assay Methods 0.000 description 27
- 229940104302 cytosine Drugs 0.000 description 27
- 230000015572 biosynthetic process Effects 0.000 description 21
- 241000699670 Mus sp. Species 0.000 description 20
- 238000003786 synthesis reaction Methods 0.000 description 20
- 230000000694 effects Effects 0.000 description 15
- 150000008300 phosphoramidites Chemical class 0.000 description 15
- CTMZLDSMFCVUNX-VMIOUTBZSA-N cytidylyl-(3'->5')-guanosine Chemical compound O=C1N=C(N)C=CN1[C@H]1[C@H](O)[C@H](OP(O)(=O)OC[C@@H]2[C@H]([C@@H](O)[C@@H](O2)N2C3=C(C(N=C(N)N3)=O)N=C2)O)[C@@H](CO)O1 CTMZLDSMFCVUNX-VMIOUTBZSA-N 0.000 description 14
- 210000004698 lymphocyte Anatomy 0.000 description 13
- 230000012010 growth Effects 0.000 description 10
- 241000699666 Mus <mouse, genus> Species 0.000 description 9
- 210000004027 cell Anatomy 0.000 description 8
- 230000004048 modification Effects 0.000 description 7
- 238000012986 modification Methods 0.000 description 7
- 230000001225 therapeutic effect Effects 0.000 description 7
- NHBKXEKEPDILRR-UHFFFAOYSA-N 2,3-bis(butanoylsulfanyl)propyl butanoate Chemical compound CCCC(=O)OCC(SC(=O)CCC)CSC(=O)CCC NHBKXEKEPDILRR-UHFFFAOYSA-N 0.000 description 6
- 108091093037 Peptide nucleic acid Proteins 0.000 description 6
- 102000005962 receptors Human genes 0.000 description 6
- 108020003175 receptors Proteins 0.000 description 6
- MXHRCPNRJAMMIM-SHYZEUOFSA-N 2'-deoxyuridine Chemical compound C1[C@H](O)[C@@H](CO)O[C@H]1N1C(=O)NC(=O)C=C1 MXHRCPNRJAMMIM-SHYZEUOFSA-N 0.000 description 5
- 125000003277 amino group Chemical group 0.000 description 5
- 230000004663 cell proliferation Effects 0.000 description 5
- 230000001965 increasing effect Effects 0.000 description 5
- 238000001840 matrix-assisted laser desorption--ionisation time-of-flight mass spectrometry Methods 0.000 description 5
- 239000000203 mixture Substances 0.000 description 5
- 108090000623 proteins and genes Proteins 0.000 description 5
- 102000004169 proteins and genes Human genes 0.000 description 5
- VHUUQVKOLVNVRT-UHFFFAOYSA-N Ammonium hydroxide Chemical compound [NH4+].[OH-] VHUUQVKOLVNVRT-UHFFFAOYSA-N 0.000 description 4
- UHDGCWIWMRVCDJ-CCXZUQQUSA-N Cytarabine Chemical compound O=C1N=C(N)C=CN1[C@H]1[C@@H](O)[C@H](O)[C@@H](CO)O1 UHDGCWIWMRVCDJ-CCXZUQQUSA-N 0.000 description 4
- ISAKRJDGNUQOIC-UHFFFAOYSA-N Uracil Chemical compound O=C1C=CNC(=O)N1 ISAKRJDGNUQOIC-UHFFFAOYSA-N 0.000 description 4
- 235000011114 ammonium hydroxide Nutrition 0.000 description 4
- 230000000692 anti-sense effect Effects 0.000 description 4
- 125000004432 carbon atom Chemical group C* 0.000 description 4
- 231100000673 dose–response relationship Toxicity 0.000 description 4
- 125000000524 functional group Chemical group 0.000 description 4
- UYTPUPDQBNUYGX-UHFFFAOYSA-N guanine Chemical compound O=C1NC(N)=NC2=C1N=CN2 UYTPUPDQBNUYGX-UHFFFAOYSA-N 0.000 description 4
- 230000002209 hydrophobic effect Effects 0.000 description 4
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 4
- 108020004707 nucleic acids Proteins 0.000 description 4
- 102000039446 nucleic acids Human genes 0.000 description 4
- 125000002467 phosphate group Chemical group [H]OP(=O)(O[H])O[*] 0.000 description 4
- 230000035755 proliferation Effects 0.000 description 4
- 239000007787 solid Substances 0.000 description 4
- WYWHKKSPHMUBEB-UHFFFAOYSA-N tioguanine Chemical group N1C(N)=NC(=S)C2=C1N=CN2 WYWHKKSPHMUBEB-UHFFFAOYSA-N 0.000 description 4
- YKUFMYSNUQLIQS-UHFFFAOYSA-N 2-amino-5-methyl-1h-pyrimidin-6-one Chemical compound CC1=CNC(N)=NC1=O YKUFMYSNUQLIQS-UHFFFAOYSA-N 0.000 description 3
- 108020005029 5' Flanking Region Proteins 0.000 description 3
- LOSIULRWFAEMFL-UHFFFAOYSA-N 7-deazaguanine Chemical group O=C1NC(N)=NC2=C1CC=N2 LOSIULRWFAEMFL-UHFFFAOYSA-N 0.000 description 3
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 3
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 3
- 108020004414 DNA Proteins 0.000 description 3
- 241001465754 Metazoa Species 0.000 description 3
- PYMYPHUHKUWMLA-LMVFSUKVSA-N Ribose Natural products OC[C@@H](O)[C@@H](O)[C@@H](O)C=O PYMYPHUHKUWMLA-LMVFSUKVSA-N 0.000 description 3
- RYYWUUFWQRZTIU-UHFFFAOYSA-N Thiophosphoric acid Chemical class OP(O)(S)=O RYYWUUFWQRZTIU-UHFFFAOYSA-N 0.000 description 3
- HMFHBZSHGGEWLO-UHFFFAOYSA-N alpha-D-Furanose-Ribose Natural products OCC1OC(O)C(O)C1O HMFHBZSHGGEWLO-UHFFFAOYSA-N 0.000 description 3
- 239000000908 ammonium hydroxide Substances 0.000 description 3
- 230000015556 catabolic process Effects 0.000 description 3
- 230000010261 cell growth Effects 0.000 description 3
- 230000008859 change Effects 0.000 description 3
- 238000006731 degradation reaction Methods 0.000 description 3
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 3
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 3
- 229960001438 immunostimulant agent Drugs 0.000 description 3
- 239000003022 immunostimulating agent Substances 0.000 description 3
- 230000001024 immunotherapeutic effect Effects 0.000 description 3
- 238000001727 in vivo Methods 0.000 description 3
- 238000010348 incorporation Methods 0.000 description 3
- 239000002609 medium Substances 0.000 description 3
- 239000000178 monomer Substances 0.000 description 3
- 150000008298 phosphoramidates Chemical class 0.000 description 3
- 229920000642 polymer Polymers 0.000 description 3
- 230000002062 proliferating effect Effects 0.000 description 3
- 230000002194 synthesizing effect Effects 0.000 description 3
- 238000011282 treatment Methods 0.000 description 3
- 0 *=C(*(C=C1O)N)*=C1O Chemical compound *=C(*(C=C1O)N)*=C1O 0.000 description 2
- 125000003903 2-propenyl group Chemical group [H]C([*])([H])C([H])=C([H])[H] 0.000 description 2
- RNLZVUVMQXRIHF-QXFUBDJGSA-N 4-(ethylamino)-1-[(2r,4s,5r)-4-hydroxy-5-(hydroxymethyl)oxolan-2-yl]pyrimidin-2-one Chemical compound O=C1N=C(NCC)C=CN1[C@@H]1O[C@H](CO)[C@@H](O)C1 RNLZVUVMQXRIHF-QXFUBDJGSA-N 0.000 description 2
- CKZJTNZSBMVFSU-UBKIQSJTSA-N 4-amino-5-hydroxy-1-[(2r,4s,5r)-4-hydroxy-5-(hydroxymethyl)oxolan-2-yl]pyrimidin-2-one Chemical compound C1=C(O)C(N)=NC(=O)N1[C@@H]1O[C@H](CO)[C@@H](O)C1 CKZJTNZSBMVFSU-UBKIQSJTSA-N 0.000 description 2
- CKZJTNZSBMVFSU-UHFFFAOYSA-N 5-hydroxydeoxycytidine Natural products C1=C(O)C(N)=NC(=O)N1C1OC(CO)C(O)C1 CKZJTNZSBMVFSU-UHFFFAOYSA-N 0.000 description 2
- USFZMSVCRYTOJT-UHFFFAOYSA-N Ammonium acetate Chemical compound N.CC(O)=O USFZMSVCRYTOJT-UHFFFAOYSA-N 0.000 description 2
- 239000005695 Ammonium acetate Substances 0.000 description 2
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 2
- 108090000695 Cytokines Proteins 0.000 description 2
- 102000004127 Cytokines Human genes 0.000 description 2
- HMFHBZSHGGEWLO-SOOFDHNKSA-N D-ribofuranose Chemical compound OC[C@H]1OC(O)[C@H](O)[C@@H]1O HMFHBZSHGGEWLO-SOOFDHNKSA-N 0.000 description 2
- MYMOFIZGZYHOMD-UHFFFAOYSA-N Dioxygen Chemical compound O=O MYMOFIZGZYHOMD-UHFFFAOYSA-N 0.000 description 2
- 108060002716 Exonuclease Proteins 0.000 description 2
- 239000012979 RPMI medium Substances 0.000 description 2
- 230000004913 activation Effects 0.000 description 2
- ORILYTVJVMAKLC-UHFFFAOYSA-N adamantane Chemical compound C1C(C2)CC3CC1CC2C3 ORILYTVJVMAKLC-UHFFFAOYSA-N 0.000 description 2
- 125000000217 alkyl group Chemical group 0.000 description 2
- 229940043376 ammonium acetate Drugs 0.000 description 2
- 235000019257 ammonium acetate Nutrition 0.000 description 2
- 238000004458 analytical method Methods 0.000 description 2
- 238000013459 approach Methods 0.000 description 2
- PYMYPHUHKUWMLA-WDCZJNDASA-N arabinose Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)C=O PYMYPHUHKUWMLA-WDCZJNDASA-N 0.000 description 2
- 150000001479 arabinose derivatives Chemical class 0.000 description 2
- 238000007385 chemical modification Methods 0.000 description 2
- 230000008878 coupling Effects 0.000 description 2
- 238000010168 coupling process Methods 0.000 description 2
- 238000005859 coupling reaction Methods 0.000 description 2
- 239000005549 deoxyribonucleoside Substances 0.000 description 2
- MXHRCPNRJAMMIM-UHFFFAOYSA-N desoxyuridine Natural products C1C(O)C(CO)OC1N1C(=O)NC(=O)C=C1 MXHRCPNRJAMMIM-UHFFFAOYSA-N 0.000 description 2
- NAGJZTKCGNOGPW-UHFFFAOYSA-K dioxido-sulfanylidene-sulfido-$l^{5}-phosphane Chemical compound [O-]P([O-])([S-])=S NAGJZTKCGNOGPW-UHFFFAOYSA-K 0.000 description 2
- 239000012154 double-distilled water Substances 0.000 description 2
- 239000002158 endotoxin Substances 0.000 description 2
- 238000005516 engineering process Methods 0.000 description 2
- 102000013165 exonuclease Human genes 0.000 description 2
- 238000002474 experimental method Methods 0.000 description 2
- 239000012091 fetal bovine serum Substances 0.000 description 2
- 230000002163 immunogen Effects 0.000 description 2
- 238000000338 in vitro Methods 0.000 description 2
- 230000003993 interaction Effects 0.000 description 2
- 125000005647 linker group Chemical group 0.000 description 2
- 229920006008 lipopolysaccharide Polymers 0.000 description 2
- 238000002844 melting Methods 0.000 description 2
- 230000008018 melting Effects 0.000 description 2
- 229940035032 monophosphoryl lipid a Drugs 0.000 description 2
- 150000007523 nucleic acids Chemical class 0.000 description 2
- 238000002515 oligonucleotide synthesis Methods 0.000 description 2
- 230000037361 pathway Effects 0.000 description 2
- 108091033319 polynucleotide Proteins 0.000 description 2
- 102000040430 polynucleotide Human genes 0.000 description 2
- 239000002157 polynucleotide Substances 0.000 description 2
- 238000011160 research Methods 0.000 description 2
- 238000004007 reversed phase HPLC Methods 0.000 description 2
- UCSJYZPVAKXKNQ-HZYVHMACSA-N streptomycin Chemical compound CN[C@H]1[C@H](O)[C@@H](O)[C@H](CO)O[C@H]1O[C@@H]1[C@](C=O)(O)[C@H](C)O[C@H]1O[C@@H]1[C@@H](NC(N)=N)[C@H](O)[C@@H](NC(N)=N)[C@H](O)[C@H]1O UCSJYZPVAKXKNQ-HZYVHMACSA-N 0.000 description 2
- 238000005556 structure-activity relationship Methods 0.000 description 2
- 125000001424 substituent group Chemical group 0.000 description 2
- 238000010189 synthetic method Methods 0.000 description 2
- RWQNBRDOKXIBIV-UHFFFAOYSA-N thymine Chemical compound CC1=CNC(=O)NC1=O RWQNBRDOKXIBIV-UHFFFAOYSA-N 0.000 description 2
- 229960003087 tioguanine Drugs 0.000 description 2
- 229940035893 uracil Drugs 0.000 description 2
- 229940045145 uridine Drugs 0.000 description 2
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Chemical compound O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 2
- DGVVWUTYPXICAM-UHFFFAOYSA-N β‐Mercaptoethanol Chemical compound OCCS DGVVWUTYPXICAM-UHFFFAOYSA-N 0.000 description 2
- STGXGJRRAJKJRG-JDJSBBGDSA-N (3r,4r,5r)-5-(hydroxymethyl)-3-methoxyoxolane-2,4-diol Chemical compound CO[C@H]1C(O)O[C@H](CO)[C@H]1O STGXGJRRAJKJRG-JDJSBBGDSA-N 0.000 description 1
- MZOFCQQQCNRIBI-VMXHOPILSA-N (3s)-4-[[(2s)-1-[[(2s)-1-[[(1s)-1-carboxy-2-hydroxyethyl]amino]-4-methyl-1-oxopentan-2-yl]amino]-5-(diaminomethylideneamino)-1-oxopentan-2-yl]amino]-3-[[2-[[(2s)-2,6-diaminohexanoyl]amino]acetyl]amino]-4-oxobutanoic acid Chemical compound OC[C@@H](C(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CCCN=C(N)N)NC(=O)[C@H](CC(O)=O)NC(=O)CNC(=O)[C@@H](N)CCCCN MZOFCQQQCNRIBI-VMXHOPILSA-N 0.000 description 1
- JUDOLRSMWHVKGX-UHFFFAOYSA-N 1,1-dioxo-1$l^{6},2-benzodithiol-3-one Chemical compound C1=CC=C2C(=O)SS(=O)(=O)C2=C1 JUDOLRSMWHVKGX-UHFFFAOYSA-N 0.000 description 1
- JRYMOPZHXMVHTA-DAGMQNCNSA-N 2-amino-7-[(2r,3r,4s,5r)-3,4-dihydroxy-5-(hydroxymethyl)oxolan-2-yl]-1h-pyrrolo[2,3-d]pyrimidin-4-one Chemical compound C1=CC=2C(=O)NC(N)=NC=2N1[C@@H]1O[C@H](CO)[C@@H](O)[C@H]1O JRYMOPZHXMVHTA-DAGMQNCNSA-N 0.000 description 1
- SCVJRXQHFJXZFZ-KVQBGUIXSA-N 2-amino-9-[(2r,4s,5r)-4-hydroxy-5-(hydroxymethyl)oxolan-2-yl]-3h-purine-6-thione Chemical compound C1=2NC(N)=NC(=S)C=2N=CN1[C@H]1C[C@H](O)[C@@H](CO)O1 SCVJRXQHFJXZFZ-KVQBGUIXSA-N 0.000 description 1
- KMEMIMRPZGDOMG-UHFFFAOYSA-N 2-cyanoethoxyphosphonamidous acid Chemical compound NP(O)OCCC#N KMEMIMRPZGDOMG-UHFFFAOYSA-N 0.000 description 1
- FTBBGQKRYUTLMP-UHFFFAOYSA-N 2-nitro-1h-pyrrole Chemical compound [O-][N+](=O)C1=CC=CN1 FTBBGQKRYUTLMP-UHFFFAOYSA-N 0.000 description 1
- 125000002103 4,4'-dimethoxytriphenylmethyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C(*)(C1=C([H])C([H])=C(OC([H])([H])[H])C([H])=C1[H])C1=C([H])C([H])=C(OC([H])([H])[H])C([H])=C1[H] 0.000 description 1
- ZLOIGESWDJYCTF-UHFFFAOYSA-N 4-Thiouridine Natural products OC1C(O)C(CO)OC1N1C(=O)NC(=S)C=C1 ZLOIGESWDJYCTF-UHFFFAOYSA-N 0.000 description 1
- HMUOMFLFUUHUPE-XLPZGREQSA-N 4-amino-1-[(2r,4s,5r)-4-hydroxy-5-(hydroxymethyl)oxolan-2-yl]-5-(hydroxymethyl)pyrimidin-2-one Chemical compound C1=C(CO)C(N)=NC(=O)N1[C@@H]1O[C@H](CO)[C@@H](O)C1 HMUOMFLFUUHUPE-XLPZGREQSA-N 0.000 description 1
- ZLOIGESWDJYCTF-XVFCMESISA-N 4-thiouridine Chemical compound O[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1N1C(=O)NC(=S)C=C1 ZLOIGESWDJYCTF-XVFCMESISA-N 0.000 description 1
- LRSASMSXMSNRBT-UHFFFAOYSA-N 5-methylcytosine Chemical compound CC1=CNC(=O)N=C1N LRSASMSXMSNRBT-UHFFFAOYSA-N 0.000 description 1
- LMEHJKJEPRYEEB-UHFFFAOYSA-N 5-prop-1-ynylpyrimidine Chemical compound CC#CC1=CN=CN=C1 LMEHJKJEPRYEEB-UHFFFAOYSA-N 0.000 description 1
- VKKXEIQIGGPMHT-UHFFFAOYSA-N 7h-purine-2,8-diamine Chemical class NC1=NC=C2NC(N)=NC2=N1 VKKXEIQIGGPMHT-UHFFFAOYSA-N 0.000 description 1
- MSSXOMSJDRHRMC-UHFFFAOYSA-N 9H-purine-2,6-diamine Chemical compound NC1=NC(N)=C2NC=NC2=N1 MSSXOMSJDRHRMC-UHFFFAOYSA-N 0.000 description 1
- 208000035657 Abasia Diseases 0.000 description 1
- 229930024421 Adenine Natural products 0.000 description 1
- GFFGJBXGBJISGV-UHFFFAOYSA-N Adenine Chemical compound NC1=NC=NC2=C1N=CN2 GFFGJBXGBJISGV-UHFFFAOYSA-N 0.000 description 1
- NLXLAEXVIDQMFP-UHFFFAOYSA-N Ammonium chloride Substances [NH4+].[Cl-] NLXLAEXVIDQMFP-UHFFFAOYSA-N 0.000 description 1
- 208000031295 Animal disease Diseases 0.000 description 1
- 102000014914 Carrier Proteins Human genes 0.000 description 1
- 108010078791 Carrier Proteins Proteins 0.000 description 1
- 102000009016 Cholera Toxin Human genes 0.000 description 1
- 108010049048 Cholera Toxin Proteins 0.000 description 1
- 108091029430 CpG site Proteins 0.000 description 1
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 1
- 108090000790 Enzymes Proteins 0.000 description 1
- 102000004190 Enzymes Human genes 0.000 description 1
- HEFNNWSXXWATRW-UHFFFAOYSA-N Ibuprofen Chemical compound CC(C)CC1=CC=C(C(C)C(O)=O)C=C1 HEFNNWSXXWATRW-UHFFFAOYSA-N 0.000 description 1
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical group C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 1
- 102000006992 Interferon-alpha Human genes 0.000 description 1
- 108010047761 Interferon-alpha Proteins 0.000 description 1
- 102000008070 Interferon-gamma Human genes 0.000 description 1
- 108010074328 Interferon-gamma Proteins 0.000 description 1
- 108090001005 Interleukin-6 Proteins 0.000 description 1
- ZDXPYRJPNDTMRX-VKHMYHEASA-N L-glutamine Chemical compound OC(=O)[C@@H](N)CCC(N)=O ZDXPYRJPNDTMRX-VKHMYHEASA-N 0.000 description 1
- 229930182816 L-glutamine Natural products 0.000 description 1
- WXJXBKBJAKPJRN-UHFFFAOYSA-N Methanephosphonothioic acid Chemical group CP(O)(O)=S WXJXBKBJAKPJRN-UHFFFAOYSA-N 0.000 description 1
- 108010057466 NF-kappa B Proteins 0.000 description 1
- 102000003945 NF-kappa B Human genes 0.000 description 1
- 101710163270 Nuclease Proteins 0.000 description 1
- 229930182555 Penicillin Natural products 0.000 description 1
- JGSARLDLIJGVTE-MBNYWOFBSA-N Penicillin G Chemical compound N([C@H]1[C@H]2SC([C@@H](N2C1=O)C(O)=O)(C)C)C(=O)CC1=CC=CC=C1 JGSARLDLIJGVTE-MBNYWOFBSA-N 0.000 description 1
- 108091000080 Phosphotransferase Proteins 0.000 description 1
- 239000002202 Polyethylene glycol Substances 0.000 description 1
- 102000001708 Protein Isoforms Human genes 0.000 description 1
- 108010029485 Protein Isoforms Proteins 0.000 description 1
- 239000006146 Roswell Park Memorial Institute medium Substances 0.000 description 1
- 206010041660 Splenomegaly Diseases 0.000 description 1
- 108090000190 Thrombin Proteins 0.000 description 1
- 239000007984 Tris EDTA buffer Substances 0.000 description 1
- 108060008682 Tumor Necrosis Factor Proteins 0.000 description 1
- 102000000852 Tumor Necrosis Factor-alpha Human genes 0.000 description 1
- DRTQHJPVMGBUCF-XVFCMESISA-N Uridine Chemical compound O[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1N1C(=O)NC(=O)C=C1 DRTQHJPVMGBUCF-XVFCMESISA-N 0.000 description 1
- FOHAAKXDYWAXGS-HKNIKODTSA-N [(2R,3S,5R)-5-(6-amino-2-oxo-1H-purin-9-yl)-3-hydroxyoxolan-2-yl]methoxyphosphonamidous acid Chemical compound P(O)(N)OC[C@@H]1[C@H](C[C@@H](O1)N1C=NC2=C(N)NC(=O)N=C12)O FOHAAKXDYWAXGS-HKNIKODTSA-N 0.000 description 1
- AIENOCLWTGSMTQ-RTUIIADLSA-N [(2r,3s,5r)-3-hydroxy-5-(2-oxo-4-sulfanylidenepyrimidin-1-yl)oxolan-2-yl]methoxyphosphonamidous acid Chemical compound C1[C@H](O)[C@@H](COP(O)N)O[C@H]1N1C(=O)NC(=S)C=C1 AIENOCLWTGSMTQ-RTUIIADLSA-N 0.000 description 1
- PLUSNNPKNYLQDZ-QWEIFEMGSA-N [(2r,3s,5r)-3-hydroxy-5-(6-oxo-3h-purin-9-yl)oxolan-2-yl]methoxyphosphonamidous acid Chemical compound C1[C@H](O)[C@@H](COP(O)N)O[C@H]1N1C2=NC=NC(O)=C2N=C1 PLUSNNPKNYLQDZ-QWEIFEMGSA-N 0.000 description 1
- HYMVYGVWJICQNH-XRAHYEKOSA-N [(2r,3s,5r)-5-(2,4-dioxopyrimidin-1-yl)-3-hydroxyoxolan-2-yl]methoxyphosphonamidous acid Chemical compound C1[C@H](O)[C@@H](COP(O)N)O[C@H]1N1C(=O)NC(=O)C=C1 HYMVYGVWJICQNH-XRAHYEKOSA-N 0.000 description 1
- VXJDHHZGZJLVAB-HKNIKODTSA-N [(2r,3s,5r)-5-(2,6-diaminopurin-9-yl)-3-hydroxyoxolan-2-yl]methoxyphosphonamidous acid Chemical compound C1[C@H](O)[C@@H](COP(O)N)O[C@H]1N1C2=NC(N)=NC(N)=C2N=C1 VXJDHHZGZJLVAB-HKNIKODTSA-N 0.000 description 1
- WXUUESDYKZCZKY-IRZJFOJRSA-N [(2r,3s,5r)-5-(2-amino-6,8-dioxopurin-9-yl)-3-hydroxyoxolan-2-yl]methoxyphosphonamidous acid Chemical compound C1[C@H](O)[C@@H](COP(O)N)O[C@H]1N1C2=NC(N)=NC(=O)C2=NC1=O WXUUESDYKZCZKY-IRZJFOJRSA-N 0.000 description 1
- UFAODRIECMTEDI-WPMIDDKHSA-N [(2r,3s,5r)-5-(2-amino-6-sulfanylidene-3h-purin-9-yl)-3-hydroxyoxolan-2-yl]methoxyphosphonamidous acid Chemical compound C1[C@H](O)[C@@H](COP(O)N)O[C@H]1N1C(N=C(N)NC2=S)=C2N=C1 UFAODRIECMTEDI-WPMIDDKHSA-N 0.000 description 1
- ABLMKHHPRKGFBJ-IRZJFOJRSA-N [(2r,3s,5r)-5-(2-amino-8-bromo-6-oxo-3h-purin-9-yl)-3-hydroxyoxolan-2-yl]methoxyphosphonamidous acid Chemical compound C1[C@H](O)[C@@H](COP(O)N)O[C@H]1N1C(N=C(N)NC2=O)=C2N=C1Br ABLMKHHPRKGFBJ-IRZJFOJRSA-N 0.000 description 1
- 230000003213 activating effect Effects 0.000 description 1
- 125000002252 acyl group Chemical group 0.000 description 1
- 125000004423 acyloxy group Chemical group 0.000 description 1
- 229960000643 adenine Drugs 0.000 description 1
- 125000003545 alkoxy group Chemical group 0.000 description 1
- 125000005600 alkyl phosphonate group Chemical group 0.000 description 1
- 229940037003 alum Drugs 0.000 description 1
- 150000001413 amino acids Chemical class 0.000 description 1
- 230000000844 anti-bacterial effect Effects 0.000 description 1
- 239000002260 anti-inflammatory agent Substances 0.000 description 1
- 229940121363 anti-inflammatory agent Drugs 0.000 description 1
- 230000000118 anti-neoplastic effect Effects 0.000 description 1
- 230000000840 anti-viral effect Effects 0.000 description 1
- 239000002246 antineoplastic agent Substances 0.000 description 1
- 239000003443 antiviral agent Substances 0.000 description 1
- 125000003118 aryl group Chemical group 0.000 description 1
- 210000003719 b-lymphocyte Anatomy 0.000 description 1
- 230000004071 biological effect Effects 0.000 description 1
- 230000036765 blood level Effects 0.000 description 1
- 230000037396 body weight Effects 0.000 description 1
- 238000006664 bond formation reaction Methods 0.000 description 1
- 229910052794 bromium Inorganic materials 0.000 description 1
- 150000004657 carbamic acid derivatives Chemical class 0.000 description 1
- 150000001720 carbohydrates Chemical group 0.000 description 1
- 150000004649 carbonic acid derivatives Chemical class 0.000 description 1
- 125000002915 carbonyl group Chemical group [*:2]C([*:1])=O 0.000 description 1
- 238000004113 cell culture Methods 0.000 description 1
- 239000006285 cell suspension Substances 0.000 description 1
- 238000012512 characterization method Methods 0.000 description 1
- 229910052801 chlorine Inorganic materials 0.000 description 1
- 230000035602 clotting Effects 0.000 description 1
- 238000011284 combination treatment Methods 0.000 description 1
- 239000005289 controlled pore glass Substances 0.000 description 1
- 238000004132 cross linking Methods 0.000 description 1
- 125000004093 cyano group Chemical group *C#N 0.000 description 1
- 125000004122 cyclic group Chemical group 0.000 description 1
- 229960000684 cytarabine Drugs 0.000 description 1
- 230000001419 dependent effect Effects 0.000 description 1
- 238000010586 diagram Methods 0.000 description 1
- 238000000502 dialysis Methods 0.000 description 1
- 150000004985 diamines Chemical class 0.000 description 1
- 239000012153 distilled water Substances 0.000 description 1
- 238000001035 drying Methods 0.000 description 1
- 239000003623 enhancer Substances 0.000 description 1
- 229940088598 enzyme Drugs 0.000 description 1
- 229910052731 fluorine Inorganic materials 0.000 description 1
- 235000013305 food Nutrition 0.000 description 1
- 230000006870 function Effects 0.000 description 1
- 230000014509 gene expression Effects 0.000 description 1
- 239000011521 glass Substances 0.000 description 1
- 229910052736 halogen Inorganic materials 0.000 description 1
- 125000001475 halogen functional group Chemical group 0.000 description 1
- 150000002367 halogens Chemical class 0.000 description 1
- 208000002672 hepatitis B Diseases 0.000 description 1
- 125000000623 heterocyclic group Chemical group 0.000 description 1
- 238000004128 high performance liquid chromatography Methods 0.000 description 1
- IVVMYMCCLPZNRL-UHFFFAOYSA-N hydrazinylphosphonic acid Chemical class NNP(O)(O)=O IVVMYMCCLPZNRL-UHFFFAOYSA-N 0.000 description 1
- 125000004435 hydrogen atom Chemical class [H]* 0.000 description 1
- 230000002519 immonomodulatory effect Effects 0.000 description 1
- 210000000987 immune system Anatomy 0.000 description 1
- 230000006698 induction Effects 0.000 description 1
- 230000001939 inductive effect Effects 0.000 description 1
- 230000002401 inhibitory effect Effects 0.000 description 1
- 230000005764 inhibitory process Effects 0.000 description 1
- 239000000138 intercalating agent Substances 0.000 description 1
- 102000027411 intracellular receptors Human genes 0.000 description 1
- 108091008582 intracellular receptors Proteins 0.000 description 1
- 125000000468 ketone group Chemical group 0.000 description 1
- 108010045069 keyhole-limpet hemocyanin Proteins 0.000 description 1
- 239000011159 matrix material Substances 0.000 description 1
- 238000005259 measurement Methods 0.000 description 1
- 230000007246 mechanism Effects 0.000 description 1
- 230000011278 mitosis Effects 0.000 description 1
- CPQCSJYYDADLCZ-UHFFFAOYSA-N n-methylhydroxylamine Chemical compound CNO CPQCSJYYDADLCZ-UHFFFAOYSA-N 0.000 description 1
- 230000031942 natural killer cell mediated cytotoxicity Effects 0.000 description 1
- 125000000449 nitro group Chemical group [O-][N+](*)=O 0.000 description 1
- QJGQUHMNIGDVPM-UHFFFAOYSA-N nitrogen group Chemical group [N] QJGQUHMNIGDVPM-UHFFFAOYSA-N 0.000 description 1
- 239000002773 nucleotide Substances 0.000 description 1
- 125000003729 nucleotide group Chemical group 0.000 description 1
- 239000007800 oxidant agent Substances 0.000 description 1
- 230000001590 oxidative effect Effects 0.000 description 1
- 229910052760 oxygen Inorganic materials 0.000 description 1
- 239000001301 oxygen Substances 0.000 description 1
- 229940049954 penicillin Drugs 0.000 description 1
- PTMHPRAIXMAOOB-UHFFFAOYSA-L phosphoramidate Chemical compound NP([O-])([O-])=O PTMHPRAIXMAOOB-UHFFFAOYSA-L 0.000 description 1
- 102000020233 phosphotransferase Human genes 0.000 description 1
- 229920001223 polyethylene glycol Polymers 0.000 description 1
- 230000003389 potentiating effect Effects 0.000 description 1
- 108090000765 processed proteins & peptides Proteins 0.000 description 1
- 229940002612 prodrug Drugs 0.000 description 1
- 239000000651 prodrug Substances 0.000 description 1
- 150000003834 purine nucleoside derivatives Chemical class 0.000 description 1
- 150000003222 pyridines Chemical class 0.000 description 1
- 230000002441 reversible effect Effects 0.000 description 1
- 125000000548 ribosyl group Chemical group C1([C@H](O)[C@H](O)[C@H](O1)CO)* 0.000 description 1
- 239000000523 sample Substances 0.000 description 1
- 229930182490 saponin Natural products 0.000 description 1
- 150000007949 saponins Chemical class 0.000 description 1
- 235000017709 saponins Nutrition 0.000 description 1
- 229920006395 saturated elastomer Polymers 0.000 description 1
- 239000000243 solution Substances 0.000 description 1
- 239000002904 solvent Substances 0.000 description 1
- 241000894007 species Species 0.000 description 1
- 238000010183 spectrum analysis Methods 0.000 description 1
- 210000004989 spleen cell Anatomy 0.000 description 1
- 108010068698 spleen exonuclease Proteins 0.000 description 1
- 230000000707 stereoselective effect Effects 0.000 description 1
- 230000000638 stimulation Effects 0.000 description 1
- 229960005322 streptomycin Drugs 0.000 description 1
- 150000008163 sugars Chemical class 0.000 description 1
- IIACRCGMVDHOTQ-UHFFFAOYSA-M sulfamate Chemical compound NS([O-])(=O)=O IIACRCGMVDHOTQ-UHFFFAOYSA-M 0.000 description 1
- 229940124530 sulfonamide Drugs 0.000 description 1
- 150000003456 sulfonamides Chemical class 0.000 description 1
- 150000003457 sulfones Chemical class 0.000 description 1
- 239000006228 supernatant Substances 0.000 description 1
- 230000001629 suppression Effects 0.000 description 1
- 230000002459 sustained effect Effects 0.000 description 1
- 208000024891 symptom Diseases 0.000 description 1
- 230000008685 targeting Effects 0.000 description 1
- 229960004072 thrombin Drugs 0.000 description 1
- 229940113082 thymine Drugs 0.000 description 1
- 238000011200 topical administration Methods 0.000 description 1
- 230000000699 topical effect Effects 0.000 description 1
- 150000005691 triesters Chemical class 0.000 description 1
- 125000002023 trifluoromethyl group Chemical group FC(F)(F)* 0.000 description 1
- 241000712461 unidentified influenza virus Species 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/11—DNA or RNA fragments; Modified forms thereof; Non-coding nucleic acids having a biological activity
- C12N15/117—Nucleic acids having immunomodulatory properties, e.g. containing CpG-motifs
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7088—Compounds having three or more nucleosides or nucleotides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7088—Compounds having three or more nucleosides or nucleotides
- A61K31/7115—Nucleic acids or oligonucleotides having modified bases, i.e. other than adenine, guanine, cytosine, uracil or thymine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/04—Antibacterial agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P33/00—Antiparasitic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/04—Immunostimulants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/08—Antiallergic agents
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07H—SUGARS; DERIVATIVES THEREOF; NUCLEOSIDES; NUCLEOTIDES; NUCLEIC ACIDS
- C07H21/00—Compounds containing two or more mononucleotide units having separate phosphate or polyphosphate groups linked by saccharide radicals of nucleoside groups, e.g. nucleic acids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/555—Medicinal preparations containing antigens or antibodies characterised by a specific combination antigen/adjuvant
- A61K2039/55511—Organic adjuvants
- A61K2039/55561—CpG containing adjuvants; Oligonucleotide containing adjuvants
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/10—Type of nucleic acid
- C12N2310/18—Type of nucleic acid acting by a non-sequence specific mechanism
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/30—Chemical structure
- C12N2310/31—Chemical structure of the backbone
- C12N2310/312—Phosphonates
- C12N2310/3125—Methylphosphonates
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/30—Chemical structure
- C12N2310/31—Chemical structure of the backbone
- C12N2310/317—Chemical structure of the backbone with an inverted bond, e.g. a cap structure
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/30—Chemical structure
- C12N2310/31—Chemical structure of the backbone
- C12N2310/318—Chemical structure of the backbone where the PO2 is completely replaced, e.g. MMI or formacetal
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/30—Chemical structure
- C12N2310/32—Chemical structure of the sugar
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/30—Chemical structure
- C12N2310/32—Chemical structure of the sugar
- C12N2310/321—2'-O-R Modification
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/30—Chemical structure
- C12N2310/33—Chemical structure of the base
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/30—Chemical structure
- C12N2310/33—Chemical structure of the base
- C12N2310/334—Modified C
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/30—Chemical structure
- C12N2310/33—Chemical structure of the base
- C12N2310/336—Modified G
Abstract
Description
発明の背景
発明の分野
本発明は、免疫治療用途における、免疫刺激剤としてのオリゴヌクレオチドまたはオリゴヌクレオチドアナログの治療的な使用に関する。
【0002】
関連技術の概要
オリゴヌクレオチドは、現代の分子生物学において、不可欠のツールとなっており、PCRの診断プローブ法から遺伝子発現のアンチセンス阻害および免疫治療用途に至るまで、多種多様の技術に使用されている。
オリゴヌクレオチドのこの広範囲に及ぶ使用は、オリゴヌクレオチドを合成するための迅速、安価かつ効率的な方法に対する増大する需要をもたらした。
【0003】
アンチセンスおよび診断用途のためのオリゴヌクレオチドの合成は、現在では、日常的に達成できる。例えば、Methods in Molecular Biology, Vol 20: Protocols for Oligonucleotides and Analogs pp. 165−189 (S. Agrawal, Ed., Humana Press, 1993); Oligonucleotides and Analogues: A Practical Approach, pp. 87−108 (F. Eckstein, Ed., 1991); and Uhlmann and Peyman, supra. Agrawal and Iyer, Curr. Op. in Biotech. 6: 12 (1995); およびAntisense Research and Applications (Crooke and Lebleu, Eds., CRC Press, Boca Raton, 1993)を参照。初期の合成方法は、ホスホジエステルおよびホスホトリエステル化学を含んでいた。
【0004】
Khorana et al., J. Molec. Biol. 72: 209 (1972)には、オリゴヌクレオチド合成のためのホスホジエステル化学が開示されている。Reese, Tetrahedron Lett. 34: 3143−3179 (1978)には、オリゴヌクレオチドおよびポリヌクレオチドの合成のためのホスホトリエステル化学が開示されている。これらの初期の方法は、大幅に、合成において一層効率的なホスホラミダイトおよびH−ホスホネート方法に移行した。Beaucage and Caruthers, Tetrahedron Lett. 22: 1859−1862 (1981)には、ポリヌクレオチド合成におけるデオキシヌクレオシドホスホラミダイトの使用が開示されている。Agrawal and Zamecnik, 米国特許第5,149,798号(1992)には、H−ホスホネート方法による最適化されたオリゴヌクレオチド合成が開示されている。
【0005】
これらの現代的な方法の両方は、種々の修飾されたヌクレオチド間結合を有するオリゴヌクレオチドの合成に使用されている。Agrawal and Goodchild, Tetrahedron Lett. 28: 3539−3542 (1987)には、ホスホラミダイト化学を用いるオリゴヌクレオチドメチルホスホネートの合成が教示されている。Connolly et al., Biochemistry 23: 3443 (1984)には、ホスホラミダイト化学を用いるオリゴヌクレオチドホスホロチオエートの合成が開示されている。Jager et al., Biochemistry 27: 7237 (1988)には、ホスホラミダイト化学を用いるオリゴヌクレオチドホスホラミデートの合成が開示されている。Agrawal et al., Proc. Natl. Acad. Sci. USA 85: 7079−7083 (1988)には、H−ホスホネート化学を用いるオリゴヌクレオチドホスホラミデートおよびホスホロチオエートの合成が開示されている。
【0006】
さらに最近、数人の研究者が、免疫治療用途における免疫刺激剤としてのオリゴヌクレオチドの使用の有効性を例証した。ホスホジエステルおよびホスホロチオエートオリゴヌクレオチドが免疫刺激を誘導することができるという観察は、治療のツールとして、この副作用を開発する興味を引き起こした。これらの取り組みは、ジヌクレオチドCpGを含有するホスホロチオエートオリゴヌクレオチドを対象とした。
【0007】
Kuramoto et al., Jpn. J. Cancer Res. 83: 1128−1131 (1992)には、CpGジヌクレオチドを含むパリンドロームを含有するホスホジエステルが、インターフェロン−αおよびγ合成を誘導し、並びにナチュラルキラー活性を増強することができることが教示されている。Krieg et al., Nature 371: 546−549 (1995)には、ホスホロチオエートCpG含有オリゴヌクレオチドが、免疫刺激性であることが開示されている。Liang et al., J. Clin. Invest. 98: 1119−1129 (1996)には、このようなオリゴヌクレオチドが、ヒトB細胞を活性化させることが開示されている。
【0008】
Pisetsky, D. S.; Rich C. F., Life Sci. 54: 101 (1994)には、CpG−オリゴの免疫刺激活性が、さらに、これらのオリゴ上のホスホロチオエート(PS)バックボーンの存在により増強されることが教示されている。Tokunaga, T.; Yamamoto, T.; Yamamoto, S. Jap. J. Infect. Dis. 52: 1 (1999)には、CpG−オリゴの免疫刺激活性が、CpG−モチーフの位置およびCpG−モチーフの近傍に位置する配列に依存することが教示されている。CpG−オリゴによる免疫刺激の活性化機構は十分に理解されていなかった。しかし、Yamamoto, T.; Yamamoto, S.; Kataoka, T.; Tokunaga, T., Microbiol. Immunol. 38: 831 (1994)には、CpG−オリゴが、まだ特徴づけされていない細胞内レセプター/タンパク質に結合することにより、免疫カスケードを誘導することが示唆されている。
【0009】
数人の研究者は、これが、最終的に、ストレスキナーゼ経路、NF−κBの活性化およびIL−6、IL−12、γ−IFNおよびTNF−αなど種々のサイトカインの誘導を引き起こすことを見出した(例えば、Klinman, D. M.; Yi, A. K.; Beaucage, S. L.; Conover, J.; Krieg, A. M., Proc. Natl. Acad. Sci. U. S. A. 93: 2879 (1996); Sparwasser, T.; Miethke, T.; Lipford, G. B.; Erdmann, A.; Haecker, H.; Heeg, K.; Wagner, H., Eur. J. Immunol. 27: 1671 (1997); Lipford, G. B.; Sparwasser, T.; Bauer, M.; Zimmermann, S.; Koch, E. S.; Heeg, K.; Wagner, H. Eur. J., Immunol. 27: 3420 (1997); Sparwasser, T.; Koch, E. S.; Vabulas, R. M.; Lipford, G. B.; Heeg, K.; Ellart, J. W.; Wagner, H., Eur. J. Immunol. 28: 2045 (1998); およびZhao, Q.; Temsamani, J.; Zhou, R. Z.; Agrawal, S. Antisense Nucleic Acid Drug Dev. 7: 495 (1997)を参照)。
【0010】
抗腫瘍剤、抗ウイルス剤、抗菌剤および抗炎症剤、ならびに免疫治療におけるアジュバントとしてのCpG−PS−オリゴの使用が、報告されている (例えば、Dunford, P. J.; Mulqueen, M. J.; Agrawal, S. Antisense 97: Targeting the Molecular Basis of Disease, (Nature Biotechnology) Conference abstract, 1997, pp 40; Agrawal, S.; Kandimalla E. R. Mol. Med. Today 6: 72 (2000); Chu. R. S.; Targoni, O. S.; Krieg, A. M.; Lehmann, P. V.; Harding, C. V. J. Exp. Med. 186: 1623 (1997); Zimmermann, S.; Egeter, O.; Hausmann, S.; Lipford, G. B.; Rocken, M.; Wagner, H.; Heeg, K. J. Immunol. 160: 3627 (1998)を参照)。
【0011】
Moldoveanu et al., Vaccine 16: 1216−124 (1998)には、CpG含有ホスホロチオエートオリゴヌクレオチドが、インフルエンザウイルスに対する免疫応答を増強するということが教示されている。McCluskie and Davis, J. Immunol. 161: 4463−4466 (1998)には、CpG含有オリゴヌクレオチドが、B型肝炎表面抗原に対する免疫応答を増強する強力なアジュバントとして作用することが教示されている。
【0012】
Zhao, Q.; Temsamani, J.; Idarola, P.; Jiang, Z.; Agrawal, S. Biochem. Pharmacol. 51: 173 (1996)には、CpG−モチーフにおけるデオキシヌクレオシドを2’−O−メチルリボヌクレオシドに置換することは、免疫刺激活性を抑制することが教示されており、2’−O−メチル修飾より誘導された強固なC3’−エンド(endo)型コンホメーションにより、免疫刺激経路に関与するタンパク質とCpG−モチーフの適切な認識および/または相互作用がなされないことが示唆されている。さらに、この文献には、CpG−モチーフのCとG間におけるリン酸基の非架橋性酸素に対するメチル基の置換が、免疫刺激活性を抑制することが教示されており、リン酸基の負電荷がタンパク質認識および相互作用のために不可欠であるということが示唆されている。
【0013】
Zhao, Q.; Yu, D.; Agrawal, S. Bioorg. Med. Chem. Lett. 9: 3453 (1999)には、5’−側で、CpG−モチーフに隣接する1つまたは2つの2’−デオキシヌクレオシドを2’−または3’−O−メチルリボヌクレオシドに置換することは、免疫刺激活性の減衰を引き起こすが、同じ置換がCpG−モチーフの3’−側でなされる場合は、それは微々たる影響しか有さないことが教示されている。しかし、Zhao, Q.; Yu, D.; Agrawal, S. Bioorg. Med. Chem. Lett. 10: 1051 (2000)には、5’−側のCpG−モチーフから2または3ヌクレオシド離れているデオキシヌクレオシドを1つまたは2つの2’−O−メトキシエチルまたは2’−若しくは3’−O−メチルリボヌクレオシドに置換することが、免疫刺激活性の著しい増強をもたらすことが教示されている。
【0014】
免疫刺激の原因となる、タンパク質/レセプター因子の認識に必要なCpG−モチーフの正確な構造条件および特有の官能基は、未だ詳細には研究されていない。したがって、効果的な免疫刺激活性を与える新規な免疫刺激モチーフが必要である。
【0015】
発明の概要
本発明は、免疫刺激オリゴヌクレオチド化合物による免疫応答を増強するための方法を提供する。本発明による方法は、免疫治療用途における免疫刺激効果を増大させること可能にする。したがって、本発明は、さらに、このようなオリゴヌクレオチド化合物を製造し、使用するための方法を提供する。
本発明者らは、驚くべきことに、免疫刺激オリゴヌクレオチドの位置的修飾が、これらの免疫刺激能力に劇的に影響することを見出した。特に、免疫刺激ドメインおよび/または増強ドメインにおける修飾は、免疫刺激効果を、再現可能かつ予測可能な方法で増強する。
【0016】
第1の側面において、本発明は、免疫刺激ドメインおよび随意的に、1つまたは2つ以上の増強ドメインを含む免疫刺激オリゴヌクレオチド化合物を提供する。いくつかの態様において、免疫刺激ドメインは、非天然に生ずるピリミジン塩基を含んでいるジヌクレオチドアナログを含む。いくつかの態様において、免疫刺激ドメインおよび/または増強ドメインは、以下に記載されるように、特定の位置に免疫刺激部分を含む。いくつかの態様において、免疫刺激オリゴヌクレオチドは、3’−3’結合を含む。一態様において、そのような3’−3’結合のオリゴヌクレオチドは、2つのアクセス可能な(accessible)5’−末端を有する。
【0017】
第2の側面において、本発明は、免疫刺激オリゴヌクレオチド化合物の免疫刺激効果を調節するための方法を提供する。いくつかの態様において、本方法は、免疫刺激ドメインに非天然に生ずるピリミジン塩基を含むジヌクレオチドアナログを導入することを含む。いくつかの態様において、本方法は、以下に記載されるように特定の位置で、免疫刺激部分を免疫刺激ドメインおよび/または増強ドメインに導入することを含む。いくつかの態様において、本方法は、3’−3’結合をオリゴヌクレオチドに導入することを含む。
【0018】
第3の側面において、本発明は、患者に免疫応答を引き起こすための方法であって、本発明による免疫刺激オリゴヌクレオチド化合物を患者に投与することを含む方法を提供する。
【0019】
第4の側面において、本発明は、病原体による疾患を有する患者を治療的に処置するための方法であって、本発明による免疫刺激オリゴヌクレオチド化合物を患者に投与することを含む方法を提供する。
【0020】
第5の側面において、本発明は、癌患者を処置するための方法であって、本発明による免疫刺激オリゴヌクレオチド化合物を患者に投与することを含む方法を提供する。
【0021】
第6の側面において、本発明は、自己免疫性の喘息などの自己免疫疾患を処置するための方法であって、本発明によるオリゴヌクレオチドアナログ免疫刺激化合物を患者に投与することを含む方法を提供する。投与は、本発明の第3の側面で記載したように実施する。
【0022】
第7の側面において、本発明は、気道炎症またはアレルギーを処置するための方法であって、本発明によるオリゴヌクレオチドアナログ免疫刺激化合物を患者に投与することを含む方法を提供する。投与は、本発明の第3の側面で記載したように実施する。
【0023】
詳細な説明
本発明は、免疫治療用途における免疫刺激剤としてのオリゴヌクレオチドまたはオリゴヌクレオチドアナログの治療的な使用に関する。本明細書中で引用した特許および刊行物は、当該分野における知識のレベルを反映し、これらの全体が、参照により本出願中に組み込まれる。本明細書中に引用した任意の参考文献の任意の教示と本明細書との間に矛盾がある場合には、本発明に関しては、後者が優勢でなければならない。
【0024】
本発明は、免疫治療用途における免疫刺激オリゴヌクレオチド化合物による免疫応答を増強するための方法を提供する。したがって、本発明は、さらに、免疫治療のための最適レベルの免疫刺激効果を有する化合物、並びにそのようなオリゴヌクレオチド化合物を製造し、使用するための方法を提供する。
【0025】
本発明者らは、驚くべきことに、免疫刺激オリゴヌクレオチドに導入された位置的化学修飾が、これらの免疫刺激能力に劇的に影響することを見出した。特に、免疫刺激ドメインおよび/または増強ドメインにおける修飾は、免疫刺激効果を、所望の用途に対して再現可能な様式で増強することができる。
【0026】
第1の側面において、本発明は、免疫刺激ドメインおよび随意的に、1つまたは2つ以上の増強ドメインを含む免疫刺激オリゴヌクレオチド化合物を提供する。ある好ましい態様において、免疫刺激ドメインは、非天然ピリミジンヌクレオシドを含んでいるジヌクレオチドアナログを含む。
【0027】
本発明の全ての側面に関して、用語「オリゴヌクレオチド」は、2または3以上のデオキシリボヌクレオシドのポリマー、または2’−若しくは3’−置換ヌクレオシド、2’−若しくは3’−O−置換リボヌクレオシド、デアザヌクレオシドまたはこれらの任意の組み合わせを含む、任意の修飾されたヌクレオシドのポリマーを含む。このようなモノマーは、互いに、既知の種々のヌクレオシド間結合のいずれかにより結合させることができる。ある好ましい態様において、これらのヌクレオシド間結合は、ホスホジエステル、ホスホトリエステル、ホスホロチオエート、ホスホロジチオエートまたはホスホラミデート結合であってもよく、前記の任意の3’−5’、2’−5’、3’−3’および5’−5’結合またはこれらの組み合わせを含む。
【0028】
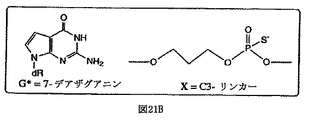
用語オリゴヌクレオチドはまた、化学的に修飾された塩基または糖を有し、および/または、限定せずに親油性基、挿入剤、ジアミンおよびアダマンタンを含む、追加の置換基を有するようなポリマーを包含する。用語オリゴヌクレオチドはまた、以下でさらに記載されるように、ペプチド核酸(PNA)、リン酸基を有するペプチド核酸(PHONA)、ロック(locked)核酸(LNA)、モルホリノ核酸並びに非ペントース糖(例えばヘキソース)またはアベーシック(abasic)糖のバックボーン若しくはバックボーン部分を含むオリゴヌクレオチドおよびノンシュガーリンカー若しくはスペーサー基を有するバックボーン部分を含むオリゴヌクレオチドを包含する。
【0029】
本発明に関して、用語「2’−置換」および「3’−置換」は、(それぞれ)ペントース部分の2’(または3’)位置のハロゲン(好ましくはCl、BrまたはF)、または1〜6個の飽和若しくは不飽和炭素原子を含有する−O−低級アルキル基での、あるいは2〜6個の炭素原子を有する−O−アリールまたはアリル基での置換を意味し、ここで、このようなアルキル、アリールまたはアリル基は、非置換であってもよく、または、例えば、ハロ、ヒドロキシ、トリフルオロメチル、シアノ、ニトロ、アシル、アシルオキシ、アルコキシ、カルボニル、カルバルコキシまたはアミノ基で置換されてもよく;または、このような2’置換は、水酸基(リボヌクレオシドを生成するため)またはアミノ基によるものでもよいが、2’(または3’)H基によるものではない。
【0030】
本発明に関して、用語「免疫刺激オリゴヌクレオチド化合物」は、それがなければ該化合物が免疫刺激効果を有さないであろう、免疫刺激ジヌクレオチドを含む化合物を意味する。「免疫刺激ジヌクレオチド」は、式5’−ピリミジン−プリン−3’、式中、「ピリミジン」は、天然または非天然ピリミジンヌクレオシドであり、および「プリン」は、天然または非天然プリンヌクレオシドである、を有するジヌクレオチドである。このような免疫刺激ジヌクレオチドの1種は、CpGである。
【0031】
用語「CpG」または「CpGジヌクレオチド」は、ジヌクレオチド5’−デオキシシチジン−デオキシグアノシン−3’を意味し、ここで、pは、ヌクレオチド間結合であり、好ましくは、ホスホジエステル、ホスホロチオエートおよびホスホロジチオエートから選択される。
【0032】
本発明に関して、用語「ジヌクレオチドアナログ」は、上記の免疫刺激ジヌクレオチドであり、ここで、ピリミジンおよびプリンヌクレオシドの一方または両方は、非天然ヌクレオシドである。「非天然」ヌクレオシドは、非天然に生ずる塩基および/または非天然に生ずる糖部分を含有するものである。
【0033】
本発明に関して、塩基は、それがチミン、グアニン、シトシン、アデニンおよびウラシルからなる群から選択されない場合、非天然とみなされる。用語「C*pG」および「CpG*」は、各々、シチジンアナログ(非天然ピリミジンヌクレオシド)またはグアノシンアナログ(非天然プリンヌクレオシド)を含む免疫刺激ジヌクレオチドアナログを示す。
【0034】
図27は、CpG−モチーフの化学構造を示しており、シトシンの水素結合受容基および水素結合供与基として作用する官能基を示している。シトシンは、2つの水素結合受容基を位置2(ケト−酸素)および位置3(窒素)に、および水素結合供与基を位置4(アミノ基)に有する。これらの基は、免疫刺激を担うレセプターとの、潜在的な認識および相互作用基として働くことができる。
【0035】
図28は、天然シトシンと同型構造であり、5−メチル−デオキシシトシン(2)、5−メチル−デオキシイソシトシン(3)、5−ヒドロキシ−デオキシシトシン(4)、デオキシウリジン(5)、N4−エチル−デオキシシトシン(6)およびデオキシ−P−塩基(7)を含むシトシンアナログを示す。
【0036】
したがって、一態様において、免疫刺激ジヌクレオチドは、構造(I):
【化3】
【0037】
(I)において、Dは、水素結合供与体であり、D’は、水素、水素結合供与体、水素結合受容体、親水基、疎水基、電子吸引基および電子供与基からなる群から選択され、Aは、水素結合受容体であり、Xは、炭素または窒素であり、およびSは、ピリミジン塩基に連結されたペントースまたはヘキソース糖環である、で表されるピリミジンヌクレオシドを含むいくつかの態様において、ピリミジンヌクレオシドは、非天然ピリミジンヌクレオシドであり、すなわち、構造(I)で表される化合物は、シチジンまたはデオキシシチジンではない。
【0038】
いくつかの態様において、(I)の塩基部分は、非天然に生ずるピリミジン塩基である。好ましい非天然に生ずるピリミジン塩基の例は、限定されることなく、5−ヒドロキシシトシン、5−ヒドロキシメチルシトシン、N4−アルキルシトシン、好ましくは、N4−エチルシトシンおよび4−チオウラシルを含む。
【0039】
いくつかの態様において、(I)の糖部分Sは、非天然に生ずる糖部分である。本発明に関して、「天然に生ずる糖部分」は、リボースまたは2’−デオキシリボースであり、そして「非天然に生ずる糖部分」は、ヌクレオチドにおけるバックボーンに用いることができる、リボースまたは2’−デオキシリボース以外のいずれかの糖である。アラビノースおよびアラビノース誘導体は、好ましい非天然に生ずる糖部分の例である。
【0040】
本発明による免疫刺激ドメインは、免疫刺激天然ジヌクレオチドまたは非天然ジヌクレオチドアナログの片側あるいは両側の免疫刺激部分を含んでもよい。例えば、免疫刺激ドメインは、以下のように描写されてもよく、
5’――――――X1−X2−Y−Z−X3−X4――――――3’
ここで、Yは、シチジンまたは非天然ピリミジンヌクレオシドアナログを示し、Zは、グアノシンまたは非天然プリンヌクレオシドアナログを示し、および各Xは、独立して、本発明によるヌクレオシドまたは免疫刺激部分を示す。
【0041】
「免疫刺激部分」は、免疫刺激部分を欠くものより高免疫刺激性の免疫刺激オリゴヌクレオチドをもたらす、免疫刺激ドメインまたは増強ドメイン中の特定の位置における化学構造である。
【0042】
好ましい免疫刺激部分は、限定されることなく、メチルホスホネート、メチルホスホノチオエート、ホスホトリエステル、ホスホチオトリエステル、ホスホロチオエート、ホスホロジチオエート、トリエステルプロドラッグ、スルホン、スルホンアミド、スルファメート、ホルムアセタール、N−メチルヒドロキシルアミン、カルボネート、カルバメート、ボラノホスホネート、ホスホラミデート、特に、一級アミノホスホラミデート、N3−ホスホラミデートおよびN5−ホスホラミデート、並びに立体特異的な結合(例えば、(R)−または(S)−ホスホロチオエート、アルキルホスホネートまたはホスホトリエステル結合)を含む、リン酸バックボーンにおける修飾を含む。
【0043】
本発明による好ましい免疫刺激部分は、さらに、限定されることなく、2’−O−メチルリボース、2’−O−メトキシエチルリボース、2’−O−プロパルギルリボースおよび2’−デオキシ−2’−フルオロリボースを含む2’−置換ペントース糖;限定されることなく、3’−O−メチルリボースを含む3’−置換ペントース糖;1’,2’−ジデオキシリボース;限定されることなく、アラビノース、1’−メチルアラビノース、3’−ヒドロキシメチルアラビノース、4’−ヒドロキシメチルアラビノースおよび2’−置換アラビノースを含むヘキソース糖;並びにα−アノマーを、限定されることなく含む糖修飾を有するヌクレオシドを含む。
【0044】
本発明による好ましい免疫刺激部分は、他の炭水化物バックボーン修飾および置換を有し、ペプチド核酸(PNA)、リン酸基を有するペプチド核酸(PHONA)、ロック核酸(LNA)、モルホリノ核酸を含むオリゴヌクレオチド、およびアルキルリンカーまたはアミノリンカーを有するバックボーン部分を有するオリゴヌクレオチドをさらに含む。
【0045】
アルキルリンカーは、分枝状または非分枝状であってもよく、置換されていてもまたは非置換であってもよく、および光学的に純粋であってもまたはラセミ混合物でもよい。最も好ましくは、約2〜約18個の炭素原子を有するこのようなアルキルリンカーである。
【0046】
いくつかの好ましい態様において、このようなアルキルリンカーは、約3〜約9個の炭素原子を有する。このようなアルキルリンカーは、ポリエチレングリコールリンカー[−O−CH2−CH2−]n(n=2〜9)を含む。いくつかの好ましい態様において、このようなアルキルリンカーは、ペプチドまたはアミノ酸を含んでもよい。
【0047】
本発明による好ましい免疫刺激部分は、さらに、限定されることなく、β−L−デオキシヌクレオシドおよびα−デオキシヌクレオシドを含むDNAアイソフォームを含む。本発明による好ましい免疫刺激部分は、さらに、限定されることなく、2’−5’、2’−2’、3’−3’および5’−5’結合を含む、非天然なヌクレオシド間結合位置を有するヌクレオシドを含む。
【0048】
本発明による好ましい免疫刺激部分は、さらに、限定されることなく、5−ヒドロキシデオキシシチジン、5−ヒドロキシメチルデオキシシチジン、N4−アルキルデオキシシチジン、好ましくは、N4−エチルデオキシシチジン、4−チオウリジン、6−チオデオキシグアノシン、7−デアザグアノシンおよびニトロピロールのデオキシリボヌクレオシド、C5−プロピニルピリミジン、および限定されることなく、2,6−ジアミノプリンを含むジアミノプリンを含む、修飾された複素環式の塩基を有するヌクレオシドを含む。
【0049】
具体的な説明のために、そして限定することを目的とせずに、例えば、前記の免疫刺激ドメインにおいて、
5’――――――X1−X2−Y−Z−X3−X4――――――3’
位置X3またはX4のヌクレオシドメチルホスホネートは免疫刺激部分であり、位置X1の置換または非置換アルキルリンカーは、免疫刺激部分であり、そして位置X1のβ−L−デオキシヌクレオシドは、免疫刺激部分である。免疫刺激ドメイン中の免疫刺激部分の代表的な位置および構造については、以下の表1を参照。
【0050】
【表1】
【0051】
いくつかの態様において、免疫刺激オリゴヌクレオチドは、さらに、増強ドメインを含む。
「増強ドメイン」は、増強ドメインを含有する場合に、増強ドメインを欠くオリゴヌクレオチドより高免疫刺激性のオリゴヌクレオチドをもたらす、免疫刺激ドメイン以外の免疫刺激オリゴヌクレオチドアナログの領域である。
【0052】
増強ドメインは、免疫刺激ドメインに対して上流または下流であることができる。用語「上流」は、免疫刺激ジヌクレオチドまたはジヌクレオチドアナログ(Y−Z)の5’側の位置を示すために用いられる。用語「下流」は、Y−Zの3’側の位置を示すために用いられる。
【0053】
例えば、免疫刺激オリゴヌクレオチドアナログは、構造
5’−U9−U8−U7−U6−U5−U4−U3−U2−U1−X1−X2−Y−Z−X3−X4−N−N−N−3’
を有してもよく、ここで、U9〜U1は、上流増強ドメインを示し、ここで、各Uは、独立して、同一または異なるヌクレオシド免疫刺激部分を示し、Nは、任意のヌクレオシドを示し、およびX1〜X4、YおよびZは、前記と同様である。
【0054】
代替的に、免疫刺激オリゴヌクレオチドアナログは、構造
5’−N−N−X1−X2−Y−Z−X3−X4−D1−D2−D3−D4−D5−D6−D7−D8−3’
を有してもよく、ここで、D1〜D8は、下流増強ドメインを示し、ここで、各Dは、独立して、同一または異なるヌクレオシドまたは免疫刺激部分を示し、および他の記号の全ては、上記と同様である。
【0055】
これらの構成において、U6の免疫刺激部分は、免疫刺激ジヌクレオチドまたはジヌクレオチドアナログから6位置上流であり、およびD4の免疫刺激部分は、免疫刺激ジヌクレオチドまたはジヌクレオチドアナログから4位置下流であろう。
【0056】
任意のUまたはD位置は、ヌクレオシドまたはヌクレオシドアナログであるか、またはそうでなくてもよい免疫刺激部分を示すことができるため、ヌクレオシドよりむしろ用語「位置」が用いられる。当然ながら、上流および下流増強ドメインの両方を有するオリゴヌクレオチドアナログは構築可能である。
【0057】
表2は、上流増強ドメインを有する免疫刺激オリゴヌクレオチド中の免疫刺激部分の代表的な位置と構造を示す。表2および3に記載のスペーサー9およびスペーサー18の定義については、図7を参照。
【表2】
【0058】
表3は、下流増強ドメインを有する免疫刺激オリゴヌクレオチド中の免疫刺激部分の代表的な位置と構造を示す。
【表3】
【0059】
本発明の別の態様において、本発明によるオリゴヌクレオチドは、1つまたは2つのアクセス可能な5’末端を有する。本発明者らは、免疫刺激ジヌクレオチドに対し5’領域での免疫刺激部分は、免疫刺激ジヌクレオチドに対し3’領域での同様の置換よりも免疫刺激活性に対する影響が増大であることを見出した。
【0060】
この観察は、CpG−PS−オリゴの5’−フランキング領域は、免疫刺激活性において、重要な役割を果たすことを示唆する。さらに、本発明者らは、3’−5’または3’−3’結合を介して連結した2つのオリゴヌクレオチドユニットを有する化合物は、5’−5’結合を介して連結した2つのオリゴヌクレオチドユニットの化合物より高い免疫刺激活性を有することを見出した。
【0061】
したがって、いくつかの好ましい態様において、本発明による免疫刺激オリゴヌクレオチドは、3’−3’結合を含む。いくつかのそのような態様において、オリゴヌクレオチドは、1つまたは2つのアクセス可能な5’末端を有する。
【0062】
第2の側面において、本発明は、免疫刺激オリゴヌクレオチドの免疫刺激効果を調節するための方法を提供する。いくつかの態様において、本方法は、本発明の第一の側面で記載したように、免疫刺激ドメインに非天然に生ずるピリミジン塩基を含むジヌクレオチドアナログを導入することを含む。
【0063】
いくつかの態様において、本方法は、上記のように、特定の位置で免疫刺激部分を免疫刺激ドメインおよび/または増強ドメインに導入することを含む。いくつかの態様において、本方法は、3’−3’結合をオリゴヌクレオチドに導入することを含む。
【0064】
本発明に関して、特定の位置で、「免疫刺激部分を導入すること」は、単に、特定された位置で免疫刺激部分を有するオリゴヌクレオチドを合成することを意味する。例えば、「位置U6に免疫刺激部分を導入すること」は、単に、例えば以下の構造
5’−U9−U8−U7−U6−U5−U4−U3−U2−U1−X1−X2−Y−Z−X3−X4−D1−D2−D3−3’
を参照し、そのような位置で免疫刺激部分を有するオリゴヌクレオチドを合成することを意味する。
【0065】
好ましくは、本発明のこの側面による方法は、表1〜3に記載した好ましい置換パターンによる免疫刺激ドメインまたは上流若しくは下流増強ドメインの位置で、免疫刺激部分を導入することを含む。
【0066】
本発明のこの側面による方法は、単に、所望の位置を得るための適切なサイクル中における合成方法において、適切な免疫刺激部分のモノマーシントンを用いることにより、よく知られた合成手法のいずれかを用いて、好都合に実施することができる。
【0067】
好ましいモノマーは、ホスホラミダイト、ホスホトリエステルおよびH−ホスホネートを含む。PS−オリゴは、簡易に、例えば、適切なホスホラミダイトを用いるCPG−固体担体で、β−シアノエチルホスホラミダイト化学を用いて合成し、必要に応じて、脱保護し、C18逆相HPLCにより精製し、蒸留水に対して透析し、および凍結乾燥する。各PS−オリゴの純度は、簡易に、CGEにより測定され、そして分子量は、MALDI−TOFマススペクトル分析により確認できる。
【0068】
第3の側面において、本発明は、患者の免疫応答を引き起こすための方法であって、本発明によるオリゴヌクレオチドアナログ免疫刺激化合物を患者に投与することを含む方法を提供する。
【0069】
本発明のこの側面による方法において、好ましくは、化合物の投与は、非経口、経口、舌下、経皮的、局所的、鼻腔内、気管内、膣内または直腸内である。治療組成物の投与は、既知の手順を用いて、疾患の症状または代用のマーカーを減少させるのに有効な投与量および期間で実施することができる。全身的に投与する場合、治療組成物を、好ましくは、約0.001マイクロモル〜約10マイクロモルのオリゴヌクレオチドの血中レベルを達成するのに十分な投与量で投与する。
【0070】
局所的投与において、これよりもはるかに低い濃度が有効であり得、およびはるかに高い濃度が耐容され得る。好ましくは、オリゴヌクレオチドの合計投与量は、患者あたり1日約0.1mgのオリゴヌクレオチド〜体重1kgあたり1日約40mgのオリゴヌクレオチドの範囲内であろう。治療に有効な量の1種または2種以上の本発明の治療組成物を、同時にまたは逐次的に、個体に、単一の処置エピソードとして投与することが望ましいだろう。
【0071】
いくつかの例において、上記定義より低い投与量でも効果を与え得る。好ましい態様において、対象となる組成物を投与した後に、補体の活性化、有糸分裂の誘導およびトロンビン血餅形成の阻害からなる群から選択された生物学的効果の1または2以上の測定を行う。
【0072】
ある好ましい態様において、本発明による化合物を、抗生物質、抗原、アレルゲン、ワクチン、抗体、細胞毒性剤、アンチセンスオリゴヌクレオチド、遺伝子療法ベクター、DNAワクチンおよび/またはアジュバントと組み合わせて投与して、免疫応答の特異性または規模を増大する。化合物若しくはワクチンのいずれか、または両方を、随意に、キーホールリンペットヘモシアニン、コレラ毒素Bサブユニットなどの免疫原性タンパク質または任意の他の免疫原性担体タンパク質に結合させることができる。限定されることなく、完全フロイントアジュバント、モノホスホリル脂質A(MPL)、QS−21を含むサポニン、ミョウバンおよびこれらの組み合わせを含む、多くの任意のアジュバントを用いてもよい。
【0073】
本発明による方法の、ある好ましい態様は、免疫刺激オリゴヌクレオチド化合物の投与により、サイトカインを誘導する。ある好ましい態様において、免疫刺激オリゴヌクレオチド化合物を、抗原、ハプテンまたはワクチンに結合させる。上記のように、本発明者らは、アクセス可能な5’−末端が、ある免疫刺激オリゴヌクレオチド化合物の活性に非常に重要であることを見出した。したがって、最適の免疫刺激活性のために、オリゴヌクレオチドを、好ましくは、オリゴヌクレオチド化合物の3’−末端によって、抗原またはワクチンに結合させる。
【0074】
この側面に関して、「組み合わせて」は、同一の患者において、同一の疾患を処置する経過において、を意味し、オリゴヌクレオチドおよび/またはワクチンおよび/またはアジュバントを、同時投与および数日間隔までの時間的に離間した順序を含む任意の順序で投与することを含む。
【0075】
このような組み合わせ処置はまた、オリゴヌクレオチドおよび/または独立してワクチンおよび/または独立してアジュバントの一回より多い投与を含んでもよい。オリゴヌクレオチドおよび/またはワクチンおよび/またはアジュバントの投与は、同一または異なる経路からであってもよい。
本発明のこの側面による方法は、免疫系のモデル研究のために有用であり、さらにヒトまたは動物疾患の治療的処置に有用である。
【0076】
第4の側面において、本発明は、病原体による疾患を有する患者を治療的に処置するための方法であって、患者に本発明によるオリゴヌクレオチドアナログ免疫刺激化合物を投与することを含む方法を提供する。投与は、本発明の第3の側面における記載のように実施する。
【0077】
第5の側面において、本発明は、癌患者を処置するための方法であって、患者に本発明によるオリゴヌクレオチドアナログ免疫刺激化合物を投与することを含む方法を提供する。投与は、本発明の第3の側面における記載のように実施する。
【0078】
第6の側面において、本発明は、自己免疫性の喘息などの自己免疫疾患を処置するための方法であって、患者に本発明によるオリゴヌクレオチドアナログ免疫刺激化合物を投与することを含む方法を提供する。投与は、本発明の第3の側面における記載のように実施する。
【0079】
第7の側面において、本発明は、気道炎症またはアレルギーを処置するための方法であって、患者に本発明によるオリゴヌクレオチドアナログ免疫刺激化合物を投与することを含む方法を提供する。投与は、本発明の第3の側面における記載のように実施する。
【0080】
以下の例は、本発明のある好ましい態様をさらに説明することを意図するものであって、本発明の範囲を限定することを意図するものではない。
【0081】
例
例1:免疫調節部分を含むオリゴヌクレオチドの合成
オリゴヌクレオチドを、自動DNA合成装置(Expedite 8909, PerSeptive Biosystems, Foster City, CA)を用いて、1マイクロモル規模で合成した。標準的なデオキシヌクレオシドホスホラミダイトは、PerSeptive Biosystemsから得た。1’,2’−ジデオキシリボースホスホラミダイト、プロピル−1−ホスホラミダイト、2’−デオキシ−5−ニトロインドール−リボフラノシルホスホラミダイト、2’−デオキシ−ウリジン−ホスホラミダイト、2’−デオキシ−Pホスホラミダイト、2’−デオキシ−2−アミノプリンホスホラミダイト、2’−デオキシ−ネブラリンホスホラミダイト、
【0082】
2’−デオキシ−7−デアザグアノシンホスホラミダイト、2’−デオキシ−4−チオウリジンホスホラミダイト、2’−デオキシ−イソグアノシンホスホラミダイト、2’−デオキシ−5−メチルイソシトシンホスホラミダイト、2’−デオキシ−4−チオチミジンホスホラミダイト、2’−デオキシ−Kホスホラミダイト、2’−デオキシ−2−アミノアデノシンホスホラミダイト、2’−デオキシ−N4−エチル−シトシンホスホラミダイト、2’−デオキシ−6−チオグアノシンホスホラミダイト、2’−デオキシ−7−デアザ−キサントシンホスホラミダイト、
【0083】
2’−デオキシ−8−ブロモグアノシンホスホラミダイト、2’−デオキシ−8−オキソグアノシンホスホラミダイト、2’−デオキシ−5−ヒドロキシシトシンホスホラミダイト、アラビノ−シトシンホスホラミダイトおよび2’−デオキシ−5−プロピンシトシンホスホラミダイトは、Glen Research (Sterling, VA)から得た。2’−デオキシ−イノシンホスホラミダイトは、ChemGenes (Ashland, MA)から得た。
【0084】
通常のカップリングサイクルまたはホスホラミダイト製造業者により推奨されるカップリングサイクルを、全てのホスホラミダイトに用いた。ホスホロチオエート修飾を得るために、ビューケージ(Beaucage)試薬をオキシダントとして用いた。合成後、オリゴヌクレオチドを、CPG−結合オリゴヌクレオチドを濃縮水酸化アンモニウムとともに、室温で1.5〜2時間インキュベートし、次いで、水酸化アンモニウム上清を55℃で12時間インキュベートし、またはホスホラミダイト製造業者により推奨されるようにして、脱保護した。
【0085】
水酸化アンモニウム溶液を、speed−vacにおいて蒸発乾固し、5’−DMTr−オリゴヌクレオチドをC18逆相マトリックスにおけるHPLCにより、0.1M酢酸アンモニウムおよび1:5比率のアセトニトリル中の0.1M酢酸アンモニウムの溶媒系を用いて精製した。次いで、オリゴヌクレオチドを、80%酢酸で処理して、DMTr基を除去し、ナトリウム形態に転化し、2回蒸留水に対して透析することにより脱塩した。オリゴヌクレオチドを、0.4μ フィルターに通してろ過し、凍結乾燥し、および2回蒸留水に再溶解した。特性評価は、変性PAGEおよびMALDI−TOF質量分析法により達成した。
【0086】
例2:シトシンアナログを含有するCpG−PS−オリゴの合成
例1で概説された手順に従って、以下のオリゴヌクレオチドが合成された。
【表4】
aCpG−モチーフは、下線で示されている。C*は、5−ヒドロキシシトシン(オリゴ2および3)またはN4−エチルシトシン(オリゴ4および5)を示す。
【0087】
オリゴヌクレオチドは、CGEおよびMALDI−TOF質量分析法(Brucker Proflex III MALDI−TOF 質量分析計の337nm N2レーザー)により特性評価した。各オリゴヌクレオチドにおける観察分子量および計算分子量(括弧で示される)は、以下のとおりである:オリゴ1、5704(5704.8);オリゴ2、5720(5720.8);オリゴ3、5681(5680.7);オリゴ4、5733、(5733);オリゴ5、5694(5693)。
【0088】
例3:処置マウスにおける脾臓重量の分析
メスBALB/cマウス(4〜5週齢、19〜21g、Charles River, Wilmington, MA)を、本研究に用いた。その動物に商用の食餌および水を制限せずに与えた。その動物に、滅菌PBSに溶解した免疫刺激オリゴヌクレオチド化合物の5または10mg/kg用量を注入した。マウスの一群に、コントロール(PBS)として、PBSのみを与えた。各免疫刺激オリゴヌクレオチド化合物に対し、4匹の動物を用いた。マウスを72時間後に屠殺し、脾臓を摘出し、重量を測定した。
【0089】
例4:マウスリンパ球増殖アッセイにおける免疫刺激オリゴヌクレオチド化合物の分析
CD−1、BALB/c、C57BL/6マウス(4〜8週齢)からの脾臓を、リンパ球源として用いた。ガラススライドのフロストされた末端で、穏やかに細分し、単細胞浮遊液を調製した。次いで、細胞を、RPMI完全培地[10%ウシ胎児血清(FBS)(56℃で30分間、熱不活化)、50μM 2−メルカプトエタノール、100U/mL ペニシリン、100μg/mL ストレプトマイシン、2mM L−グルタミン加RPMI培地]で培養した。次いで、細胞を、最終容積100μLの106細胞/mLの密度で、96ウェルディッシュに播いた。
【0090】
免疫刺激オリゴヌクレオチド化合物またはLPS(リポ多糖類)を10μLのTE緩衝液(10mM トリス−HCl、pH 7.5、1mM EDTA)中で、細胞培養物に加えた。次いで、細胞を37℃で培養に付した。44時間後、1μCi3H−ウリジン(Amersham, Arlington Heights, IL)を、20μLのRPMI培地の培養に加え、細胞を、さらに4時間、パルスラベルした。細胞を自動細胞採取装置(Skatron, Sterling, VA)により採取し、フィルターをシンチレーションカウンターで計測した。実験は、3回実施した。
【0091】
例5:シトシンアナログを含有するCpG−PS−オリゴのリンパ球増殖活性
CpG−PS−オリゴ1〜5(例4)の免疫刺激活性を、BALB/cマウスリンパ球増殖アッセイを用いて研究した。すなわち、マウス脾臓細胞を培養し、0.1、0.3、1.0および3.0μg/mLの濃度のCpG−PS−オリゴとともに48時間インキュベートし、そして細胞増殖を3H−ウリジンの取り込みにより測定した。
【0092】
図23は、マウスリンパ球培養におけるオリゴ1〜5の用量依存的細胞増殖活性を示す。用量3.0μg/mLで、天然シチジンを有するオリゴ1は、増殖率29.5±2.1を示した。CpG−モチーフのデオキシシチジンのシトシン塩基が5−ヒドロキシシトシンで置換されているオリゴ2もまた、用量依存的リンパ球増殖を示した。オリゴ2においては、用量3.0μg/mLで、増殖率23.7±2.9が観察された。
【0093】
CpG−モチーフにおいて、シトシン塩基の代わりにN4−エチル−シトシンを含有するPS−オリゴ4もまた、用量依存的細胞増殖活性を示した。オリゴ4において、用量3.0μg/mLで観察された増殖率18.7±1.6は、CpG−モチーフにおけるシトシンの4−アミノ基に対するかさ高い疎水性置換の存在が、免疫刺激活性を若干妨げることを示唆する。
【0094】
CpG−モチーフのデオキシシチジン位置の代わりにデオキシグアノシン位置で5−ヒドロキシ−デオキシシチジンが置換されているオリゴ3は、培地コントロールにおいて観察されたのと同様の増殖率を示した(図23)。同様に、CpG−モチーフのデオキシグアノシンがN4−エチルデオキシシチジンで置換されているコントロールオリゴ5は、培地コントロールと同様の細胞増殖を示した。
【0095】
CpG−モチーフのシトシン塩基が、5−メチル−デオキシシトシン(2;図28参照)、5−メチル−デオキシイソシトシン(3)、デオキシウリジン(5)またはデオキシ−P−塩基(7)で置換されている他のオリゴは、同様のアッセイシステムにおいて、細胞増殖活性がないか、またはわずかな細胞増殖活性しか示さなかった。
【0096】
これらの結果は、(i)CpG−モチーフのシトシン塩基が5−ヒドロキシシトシンまたはN4−エチルシトシンで置換されている場合(それぞれオリゴ2および4)には、細胞増殖活性は維持されるが、(ii)グアニン塩基をこれらのシトシンアナログに置換することは、細胞増殖活性の損失をもたらすことを示唆するものである。
【0097】
例6:シトシンアナログを含有するCpG−PS−オリゴにより誘導されたマウスの脾種
CpG−PS−オリゴのインビトロでの効果を確認するために、オリゴ1、2および4(例4から)を、用量10mg/kgで、BALB/cマウスに腹腔内(ip)注入し、各PS−オリゴの免疫刺激活性のレベルの指標として脾臓重量の変化を測定した。CpG−PS−オリゴで処置した結果としての脾臓重量の変化を、図24に示す。
【0098】
メスBALB/cマウス(4〜6週齢、19〜21g)を、各グループ4匹のマウスの異なるグループに分割した。オリゴヌクレオチドを滅菌PBSに溶解し、用量10mg/kgで、マウスに腹腔内投与した。72時間後、マウスを屠殺して、脾臓を取り出し、重量を測定した。各円は、個々のマウスの脾臓重量を表し、+は、各グループにおける平均脾臓重量を表す。
【0099】
CpG−モチーフに天然デオキシシチジンを有するオリゴ1は、PBSを受けたマウスのコントロールグループと比較し、用量10mg/kgで、脾臓重量の約45%の増加を示した。CpG−モチーフのシトシン塩基の代わりに5−ヒドロキシシトシンを有するオリゴ2は、同じ用量で、脾臓重量の約35%の増加を示した。
【0100】
CpG−モチーフのシトシン塩基の代わりにN4−エチルシトシンを有するオリゴ4は、コントロールグループと比較して、同じ用量で、脾臓重量の約34%の増加を示した。これらのデータは、CpG−モチーフにおいて、デオキシシチジンの代わりに、修飾されたシチジンアナログを含有するこれらのオリゴに対するリンパ球増殖アッセイで観察された結果を確認するものである。
【0101】
例7:C*pG−PS−オリゴの構造活性相関
CpG−モチーフにおいて、シトシンの5−位置でのメチル基の存在(5−メチル−デオキシシトシン、2(図28))は、CpG−PS−オリゴのCpGに関する免疫刺激効果を完全になくす。インビトロおよびインビボ実験において観察された結果に基づき、我々は、シトシンアナログを含有するPS−オリゴにおける構造活性相関を構築した。
【0102】
CpG−モチーフにおいて、シトシン塩基(1)の5−メチルイソシトシン(3)での置換は、5−メチルシトシン(2)でのものと同様に免疫刺激活性の完全な喪失をもたらすが、これは、それぞれ2および4−位置のケトおよびアミノ基の入れ替えおよび/またはシトシンの5−位置への、疎水性メチル基の設置の結果であり得る。
【0103】
CpG−モチーフにおいて、シトシンの5−位置での親水性水酸基置換を含有するオリゴ2は、天然シトシン塩基を含有するオリゴ1と同様の免疫刺激活性を示した。この観察は、CpG−PS−オリゴの免疫刺激活性に関して、かさ高い親水基は、シトシンの5−位置の疎水基より一層耐容されることを示唆する。おそらく、レセプター上のCpG−オリゴに対する結合ポケットは事実上親水性であり、シトシンの5−位置の疎水基に適合できない。
【0104】
CpG−モチーフにおいて、シトシン塩基を、ケト基が2および4−位置の両方に存在するウラシルと置換する場合(5(図28参照))、免疫刺激活性は観察されず、これは、シトシンの4−位置の水素結合供与性アミノ基が、免疫刺激活性に重要であることを示唆している。
【0105】
CpG−モチーフにおいて、シトシンの4−アミノ基に大型疎水性エチル基を置換する場合、マウスのリンパ球増殖の減少および脾臓重量増加の若干の減少が観察され、これは、この位置でのかさ高いエチル基は、免疫刺激活性を引き起こすレセプター因子へのCpG−PS−オリゴの結合を妨害しないことを示唆するものである。
【0106】
エチル置換にもかかわらず、N4−エチルシトシン(6)の4−アミノ基は、受容体との水素結合形成に関与できる。4−位置に位置する窒素基が5−位置との環状構造形成に関与し、水素結合供与性アミノ基を4−位置に有さない、修飾ピリジン塩基dPは、培養中で、マウスリンパ球増殖活性を有さなかったが、これは、CpG−モチーフにおいて、シトシンの4−アミノ基が免疫刺激活性に重要であることを示唆するものである。
【0107】
結論として、ここで示した結果は、シトシンの2、3および4位置の官能基が、CpG−関連免疫刺激活性に重要であることを示している。シトシンの5−位置での疎水性置換は、完全にCpG−オリゴの免疫刺激活性を抑制するが、この位置の親水基は、十分に耐容される。
【0108】
さらに、CpG−モチーフにおいて、シトシンの代わりに、5−ヒドロキシシトシンまたはN4−エチルシトシンを含有するCpG−PS−オリゴの免疫刺激活性は、5’−フランキング配列における適切な化学修飾の組込みにより有意に調節でき、これは、CpG−モチーフにおいて、これらのシトシンアナログは免疫刺激モチーフの一部として認識されることを示唆している。
【0109】
例8:末端−ブロックCpG−PS−オリゴヌクレオチドの合成
図17で示されるCpG−PS−オリゴは、自動化合成装置およびホスホラミダイト方法を用いて合成した。オリゴ1(16マー(16−mer))は、ヌクレオシド−5’−β−シアノエチルホスホラミダイトを用いて合成した。オリゴ2(32マー)を、ヌクレオシド−3’−β−シアノエチルホスホラミダイトおよびオリゴ1の16マー配列が二度繰り返された3’−結合ヌクレオシドを有するコントロールドポアガラス担体(CPG−固体担体)を用いて合成した;したがって、オリゴ2は、通常の3’−5’結合により連結した2つの16マー(オリゴ1)を有した。
【0110】
オリゴ3(32マー)は、5’−5’結合により連結した2つの16マー(オリゴ1)により合成したため、オリゴ3は、2つの3’−末端を有し、5’−末端は有さない。オリゴ3の合成は、2段階で実施した:第一の16マーを、ヌクレオシド−3’−β−シアノエチルホスホラミダイトおよび3’−結合ヌクレオシドを有する固体担体を用いて合成し、次いで、第二の16マーセグメントの合成を、ヌクレオシド−5’−β−シアノエチルホスホラミダイト用いて継続した。
【0111】
オリゴ4(32マー)は、3’−3’結合により連結した2つの16マー(オリゴ1)を含むため、オリゴ4は、2つの5’−末端を有し、3’−末端は有さない。オリゴ4の合成は、2段階で実施した:第一の16マーを、ヌクレオシド−5’−β−シアノエチルホスホラミダイトおよび5’−結合ヌクレオシドを有する固体担体を用いて合成し、第二の16マーセグメントの合成を、ヌクレオシド−3’−β−シアノエチルホスホラミダイトを用いて継続した。
【0112】
オリゴ5〜8の合成は、それぞれ、オリゴ1〜4に関するのと、同一のヌクレオシド−β−シアノエチルホスホラミダイトを用いることにより実施した。合成の最後で、オリゴ1〜8を、濃縮アンモニア溶液で脱保護し、逆相HPLCにより精製し、脱トリチル化し、脱塩しおよび透析した。各PS−オリゴの純度を、CGEによりチェックし、および分子量をMALDI−TOF質量分析法により確認した(表1)。
【0113】
オリゴ1〜8において、5’−CpGモチーフの配列完全性および方向性を、これらのそれぞれのDNA相補鎖(オリゴ1〜4については5’−AAGGTCGAGCGTTCTC−3’、オリゴ5〜8については5’−ATGGCGCACGCTGGGAGA−3’)との二重鎖の融解温度(Tms)を記録することにより確認した。これらの二重鎖の融解温度は、53.9±0.9℃(オリゴ1〜4)、61.8℃(オリゴ5)および58.8±0.6℃(オリゴ6〜8)であった(注:オリゴ5は18マーであり、およびオリゴ6〜8は、32マーであり、36マーではない)。
【0114】
例9:末端ブロックCpG−PS−オリゴヌクレオチドのマウス脾臓リンパ球増殖活性
リンパ球増殖アッセイにおいて、例8の末端−ブロックCpG−PS−オリゴの免疫刺激活性を、最初に研究した。典型的には、マウス(Balb−C)脾臓リンパ球を、CpG−PS−オリゴとともに濃度0.1、1.0および10.0μg/mlで48時間培養し、細胞増殖を、例3で記載したように、3H−ウリジンの取り込みにより決定した。結果は図17に示す。
【0115】
オリゴ1は、細胞増殖の用量依存的効果を誘導した;濃度10μg/ml(〜2.0μM)で、増殖率は5.0±0.32であった。3’−5’結合により連結されたオリゴ1の2つのユニットからなるオリゴ2は、同用量(〜1.0μM)で、5.8±0.28の増殖率を有した。
【0116】
5’−5’結合により連結されたオリゴ1の2つのユニットからなるオリゴ3は、2.0±0.26の増殖率を有し、これは、オリゴ1および2での観察よりも極めて低い免疫刺激活性であるということを示す。3’−3’結合により連結されたオリゴ1の2つのユニットからなるオリゴ4は、7.2±0.5の増殖率を有し、これは、オリゴ1および2での観察よりも高い免疫刺激活性であるということを示す。
【0117】
オリゴ5〜8でも同様の結果が得られた。オリゴ5は、3.9±0.12の増殖率を有した。2ユニットのオリゴ5が、3’−5’結合(オリゴ6)、5’−5’結合(オリゴ7)および3’−3’結合(オリゴ8)により連結したオリゴ6〜8は、それぞれ、4.9±0.2、1.74±0.21および7.7±0.82の増殖率を有した。
【0118】
オリゴ6〜8で得られた結果の比較は、2つのオリゴ5配列が3’−5’結合または3’−3’結合により連結したオリゴ6および8は、オリゴ5よりも高い免疫刺激活性を有するが、2つのオリゴ5が5’−5’結合により連結したオリゴ7は、オリゴ5よりも極めて低い免疫刺激活性を有することを示す。
オリゴ1〜8のリンパ球増殖の結果から、オリゴが5’−末端を介して連結する場合、免疫刺激活性の大きな損失となるが、それらが3’−末端を介して連結する場合、免疫刺激活性の増大になることは明白である。
【0119】
3’−3’結合のオリゴは、同様に増大した免疫刺激活性をもたらすフリーな3’−末端を含有するオリゴよりも、実質的に、エキソヌクレアーゼによる分解に対し十分な安定性を示したことに注目することは重要である。オリゴの5’−末端がブロックされたオリゴ3および7の低い免疫刺激活性は、オリゴの5’−末端へのアクセス性がCpG−PS−オリゴの免疫刺激活性に不可欠であることを示唆している。
【0120】
例10:末端−ブロックCpG−PS−オリゴヌクレオチドにより誘導されたマウスの脾腫
オリゴ1〜8(例8)のインビボでの免疫刺激活性を確認するために、用量5mg/kgのオリゴヌクレオチドを、BALB/cマウスに腹腔内注入した。投与72時間後にマウスを屠殺し、脾臓を取り除き、乾燥のためにブロットし、重量を測定した。処置されたマウスと処置されてないマウスの脾臓重量変化を免疫刺激活性のパラメータとして使用した。
【0121】
5mg/kgの用量のオリゴ1の投与は、PBSを与えられたコントロールマウスと比較して、脾臓重量の約40%の増加を引き起こした。オリゴ2および4の投与もまた、脾臓重量の約50%の増加を引き起こした。オリゴ3の投与は、コントロールマウスと比較し、脾臓重量の変化を引き起こさなかった。
【0122】
これらの結果は、さらに、5’−末端がブロックされたオリゴ3は、アクセス可能な5’−末端を有するオリゴと比較し、非常に低い免疫刺激活性を有するという観察を裏付けるものである。これらの結果はまた、オリゴ5〜8の投与によっても確認された。オリゴ5、6および8の投与は、脾臓重量の約40〜50%の増加を引き起こしたが、オリゴ7の投与の後には脾臓重量の変化は観察されなかった。
【0123】
上記の結果は、オリゴの5’−末端がアクセス可能でない場合に、CpGモチーフを含有するPS−オリゴの免疫刺激活性が、著しく最小化されることを示唆している。オリゴ3および7の免疫刺激活性のこの損失は、ヌクレアーゼ安定性に基づいて説明できない。なぜなら、両方のオリゴが、2つの3’−末端を有し、1つの3’−末端を有するオリゴ1、2、5および6よりも3’−エキソヌクレアーゼ分解に敏感でないためである。
【0124】
ブロックされた3’−末端を有し、エキソヌクレアーゼによる分解に非常に安定であるPS−オリゴ4および8は、同様の免疫刺激活性を示した。オリゴ4および8は、投与後わずか72時間でマウスを屠殺したため、本研究においては確かではないが、インビボで増大した安定性のため、持続的免疫刺激活性を示し得る。投与後72時間より長い時間でマウスを屠殺する場合の研究が進行中である。
【0125】
ここで記載した結果は、興味深く、そしてCpG−PS−オリゴの5’−末端が、免疫刺激活性に重要であることを示唆している。ここで論じたように、我々は、5’−フランキング領域において、修飾2’−または3’−置換リボヌクレオシドによるデオキシヌクレオシドの置換は、免疫刺激活性の増大を引き起こすことを示した。
【0126】
さらに、CpGモチーフに対し直上流(5’−末端)のデオキシヌクレオシドの置換は、著しい抑制を引き起こし、およびCpGモチーフに対し直下流(3’−末端)のデオキシヌクレオシドの置換は、免疫刺激活性には影響しなかった。総合すれば、これらの結果は、免疫刺激に関与する酵素/レセプターが、5’−末端からオリゴのCpGモチーフを認識し、5’−末端へのアクセス性を要求することを示唆している。
【0127】
上記発明を、明瞭性および理解のために、幾分詳細に記載したが、本発明の範囲および付加請求の正確な範囲からはずれることなく、当業者は、この開示を読解することにより、形態および細部における種々の変更が可能であることを理解するであろう。
【図面の簡単な説明】
【図1A】
種々の位置において、1’,2’−ジデオキシリボース置換を有するオリゴヌクレオチドを用いた増殖アッセイの結果を示した図である。
【図1B】
種々の位置において、1’,2’−ジデオキシリボース置換を有するオリゴヌクレオチドを用いた増殖アッセイの結果を示した図である。
【図2A】
種々の位置において、1’,2’−ジデオキシリボース置換を有するオリゴヌクレオチドを用いた脾臓重量アッセイの結果を示した図である。
【図2B】
種々の位置において、1’,2’−ジデオキシリボース置換を有するオリゴヌクレオチドを用いた脾臓重量アッセイの結果を示した図である。
【図3A】
種々の位置において、1’,2’−ジデオキシリボース置換を有する異なったオリゴヌクレオチドを用いた増殖アッセイの結果を示した図である。
【図3B】
種々の位置において、1’,2’−ジデオキシリボース置換を有する異なったオリゴヌクレオチドを用いた増殖アッセイの結果を示した図である。
【図4A】
種々の位置において、1’,2’−ジデオキシリボース置換を有する異なったオリゴヌクレオチドを用いた脾臓重量アッセイの結果を示した図である。
【図4B】
種々の位置において、1’,2’−ジデオキシリボース置換を有する異なったオリゴヌクレオチドを用いた脾臓重量アッセイの結果を示した図である。
【図5A】
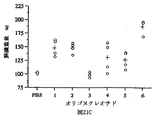
種々の位置において、C3−リンカー置換を有するオリゴヌクレオチドを用いた増殖アッセイの結果を示した図である。
【図5B】
種々の位置において、C3−リンカー置換を有するオリゴヌクレオチドを用いた増殖アッセイの結果を示した図である。
【図6A】
種々の位置において、C3−リンカー置換を有するオリゴヌクレオチドを用いた脾臓重量アッセイの結果を示した図である。
【図6B】
種々の位置において、C3−リンカー置換を有するオリゴヌクレオチドを用いた脾臓重量アッセイの結果を示した図である。
【図7A】
種々の位置において、スペーサー9またはスペーサー18置換を有するオリゴヌクレオチドを用いた増殖アッセイの結果を示した図である。
【図7B】
種々の位置において、スペーサー9またはスペーサー18置換を有するオリゴヌクレオチドを用いた増殖アッセイの結果を示した図である。
【図8A】
種々の位置において、スペーサー9またはスペーサー18置換を有するオリゴヌクレオチドを用いた脾臓重量アッセイの結果を示した図である。
【図8B】
種々の位置において、スペーサー9またはスペーサー18置換を有するオリゴヌクレオチドを用いた脾臓重量アッセイの結果を示した図である。
【図9A】
種々の位置において、アミノ−リンカー置換を有するオリゴヌクレオチドを用いた増殖アッセイの結果を示した図である。
【図9B】
種々の位置において、アミノ−リンカー置換を有するオリゴヌクレオチドを用いた増殖アッセイの結果を示した図である。
【図10A】
種々の位置において、アミノ−リンカー置換を有するオリゴヌクレオチドを用いた脾臓重量アッセイの結果を示した図である。
【図10B】
種々の位置において、アミノ−リンカー置換を有するオリゴヌクレオチドを用いた脾臓重量アッセイの結果を示した図である。
【図11A】
種々の位置において、3’−デオキシヌクレオシド置換を有するオリゴヌクレオチドを用いた増殖アッセイの結果を示した図である。
【図11B】
種々の位置において、3’−デオキシヌクレオシド置換を有するオリゴヌクレオチドを用いた増殖アッセイの結果を示した図である。
【図12A】
種々の位置において、3’−デオキシヌクレオシド置換を有するオリゴヌクレオチドを用いた脾臓重量アッセイの結果を示した図である。
【図12B】
種々の位置において、3’−デオキシヌクレオシド置換を有するオリゴヌクレオチドを用いた脾臓重量アッセイの結果を示した図である。
【図13A】
種々の位置において、メチルホスホネート置換を有するオリゴヌクレオチドを用いた増殖アッセイの結果を示した図である。
【図13B】
種々の位置において、メチルホスホネート置換を有するオリゴヌクレオチドを用いた増殖アッセイの結果を示した図である。
【図14A】
種々の位置において、メチルホスホネート置換を有するオリゴヌクレオチドを用いた脾臓重量アッセイの結果を示した図である。
【図14B】
種々の位置において、メチルホスホネート置換を有するオリゴヌクレオチドを用いた脾臓重量アッセイの結果を示した図である。
【図15A】
種々の位置において、2’−O−メチルリボヌクレオシドまたは2’−O−メトキシエチル置換を有するオリゴヌクレオチドを用いた増殖アッセイの結果を示した図である。
【図15B】
種々の位置において、2’−O−メチルリボヌクレオシドまたは2’−O−メトキシエチル置換を有するオリゴヌクレオチドを用いた増殖アッセイの結果を示した図である。
【図16A】
種々の位置において、2’−O−メチルリボヌクレオシドまたは2’−O−メトキシエチル置換を有するオリゴヌクレオチドを用いた脾臓重量アッセイの結果を示した図である。
【図16B】
種々の位置において、2’−O−メチルリボヌクレオシドまたは2’−O−メトキシエチル置換を有するオリゴヌクレオチドを用いた脾臓重量アッセイの結果を示した図である。
【図17A】
種々の位置において、5’−3’、5’−5’または3’−3’結合置換を有するオリゴヌクレオチドを用いた増殖アッセイの結果を示した図である。
【図17B】
種々の位置において、5’−3’、5’−5’または3’−3’結合置換を有するオリゴヌクレオチドを用いた増殖アッセイの結果を示した図である。
【図17C】
種々の位置において、5’−3’、5’−5’または3’−3’結合置換を有するオリゴヌクレオチドを用いた増殖アッセイの結果を示した図である。
【図18A】
種々の位置において、β−L−デオキシヌクレオシド置換を有するオリゴヌクレオチドを用いた脾臓重量アッセイの結果を示した図である。
【図18B】
種々の位置において、β−L−デオキシヌクレオシド置換を有するオリゴヌクレオチドを用いた脾臓重量アッセイの結果を示した図である。
【図19A】
種々の位置において、2’−O−プロパルギル置換を有するオリゴヌクレオチドを用いた脾臓重量アッセイの結果を示した図である。
【図19B】
種々の位置において、2’−O−プロパルギル置換を有するオリゴヌクレオチドを用いた脾臓重量アッセイの結果を示した図である。
【図20A】
種々の位置において、種々の置換を有するオリゴヌクレオチドを用いた脾臓重量アッセイの結果を示した図である。
【図20B】
種々の位置において、種々の置換を有するオリゴヌクレオチドを用いた脾臓重量アッセイの結果を示した図である。
【図21A】
免疫刺激ジヌクレオチドに、7−デアザグアニン置換を有するオリゴヌクレオチドを用いた脾臓重量アッセイの結果を示した図である。
【図21B】
免疫刺激ジヌクレオチドに、7−デアザグアニン置換を有するオリゴヌクレオチドを用いた脾臓重量アッセイの結果を示した図である。
【図21C】
免疫刺激ジヌクレオチドに、7−デアザグアニン置換を有するオリゴヌクレオチドを用いた脾臓重量アッセイの結果を示した図である。
【図22A】
免疫刺激ジヌクレオチドに、6−チオグアニン置換を有するオリゴヌクレオチドを用いた増殖アッセイの結果を示した図である。
【図22B】
免疫刺激ジヌクレオチドに、6−チオグアニン置換を有するオリゴヌクレオチドを用いた増殖アッセイの結果を示した図である。
【図23A】
免疫刺激ジヌクレオチドに、5−ヒドロキシシトシンまたはN4−エチルシトシン置換を有するオリゴヌクレオチドを用いた脾臓重量アッセイの結果を示した図である。
【図23B】
免疫刺激ジヌクレオチドに、5−ヒドロキシシトシンまたはN4−エチルシトシン置換を有するオリゴヌクレオチドを用いた脾臓重量アッセイの結果を示した図である。
【図24A】
免疫刺激ジヌクレオチドに、5−ヒドロキシシトシンまたはN4−エチルシトシン置換を有するオリゴヌクレオチドを用いた脾臓重量アッセイの結果を示した図である。
【図24B】
免疫刺激ジヌクレオチドに、5−ヒドロキシシトシンまたはN4−エチルシトシン置換を有するオリゴヌクレオチドを用いた脾臓重量アッセイの結果を示した図である。
【図25A】
免疫刺激ジヌクレオチドに、アラビノフラノシルシトシン(アラシチジン;Ara−C)置換を有するオリゴヌクレオチドを用いた増殖アッセイの結果を示した図である。
【図25B】
免疫刺激ジヌクレオチドに、アラビノフラノシルシトシン(アラシチジン;Ara−C)置換を有するオリゴヌクレオチドを用いた増殖アッセイの結果を示した図である。
【図26A】
免疫刺激ジヌクレオチドに、4−チオウラシル置換を有するオリゴヌクレオチドを用いた脾臓重量アッセイの結果を示した図である。
【図26B】
免疫刺激ジヌクレオチドに、4−チオウラシル置換を有するオリゴヌクレオチドを用いた脾臓重量アッセイの結果を示した図である。
【図27】
水素結合受容基および水素結合供与基として機能するシトシンの官能基を示している、CpG−モチーフの化学構造を示した図である。
【図28】
シトシン(1)およびシトシンアナログ(2〜7)の化学構造を示した図である。ヌクレオシドシチジン、デオキシシチジンおよび関連するアナログにおいて、置換基Rは、リボースまたは2’−デオキシリボースである。
Claims (38)
- 免疫刺激オリゴヌクレオチド化合物であって、式5’−ピリミジン−プリン−3’、式中、ピリミジンは非天然ピリミジンヌクレオシドであり、およびプリンは天然または非天然プリンヌクレオシドである、で表される免疫刺激ジヌクレオチドを含む、前記免疫刺激オリゴヌクレオチド化合物。
- 免疫刺激オリゴヌクレオチド化合物であって、式C*pG、式中、C*はシチジンアナログであり、Gはグアノシン、2’−デオキシグアノシンまたはグアノシンアナログであり、およびpは、ホスホジエステル、ホスホロチオエートおよびホスホロジチオエートからなる群から選択されるヌクレオチド間結合である、で表される免疫刺激ジヌクレオチドを含む、前記免疫刺激オリゴヌクレオチド化合物。
- 非天然ピリミジンヌクレオシドが、非天然に生ずるピリミジン塩基を含む、請求項3に記載の免疫刺激オリゴヌクレオチド化合物。
- 非天然に生ずるピリミジン塩基が、5−ヒドロキシシトシン、5−ヒドロキシメチルシトシン、N4−アルキルシトシンおよび4−チオウラシルからなる群から選択される、請求項4に記載の免疫刺激オリゴヌクレオチド化合物。
- 非天然に生ずるピリミジン塩基が、5−ヒドロキシシトシンおよびN4−エチルシトシンからなる群から選択される、請求項4に記載の免疫刺激オリゴヌクレオチド化合物。
- 式(I)で表される非天然ピリミジンヌクレオシドが、非天然に生ずる糖部分を含む、請求項4に記載の免疫刺激オリゴヌクレオチド化合物。
- 非天然に生ずる糖部分がアラビノースである、請求項7に記載の免疫刺激オリゴヌクレオチド化合物。
- 免疫刺激オリゴヌクレオチド化合物であって、式(II):
5’――――X1−X2−Y−Z−X3−X4――――3’ (II)
式中、
Yは、シチジン、2’−デオキシシチジンまたは非天然ピリミジンヌクレオシドであり;
Zは、グアノシン、2’−デオキシグアノシンまたは非天然プリンヌクレオシドであり;
X1は、天然に生ずるヌクレオシドまたはC3−アルキルリンカー、2−アミノブチル−1,3−プロパンジオールリンカーおよびβ−L−デオキシヌクレオシドからなる群から選択される免疫刺激部分であり;
X2は、天然に生ずるヌクレオシドまたはアミノリンカーである免疫刺激部分であり;
X3は、天然に生ずるヌクレオシドまたはヌクレオシドメチルホスホネートである免疫刺激部分であり;
X4は、天然に生ずるヌクレオシドまたはヌクレオシドメチルホスホネートおよび2’−O−メチルリボヌクレオシドからなる群から選択される免疫刺激部分であり;
但し、X1、X2、X3およびX4の少なくとも1つが免疫刺激部分である、
で表される免疫刺激ドメインを含む、前記免疫刺激オリゴヌクレオチド化合物。 - Yが、非天然ピリミジンヌクレオシドである、請求項9に記載の免疫刺激オリゴヌクレオチド化合物。
- 免疫刺激オリゴヌクレオチド化合物であって、式(III):
5’−Um.......U1−X1−X2−Y−Z−X3−X4−D1........Dm−3’ (III)
式中:
Yは、非天然ピリミジンヌクレオシドであり;
Zは、グアノシン、2’−デオキシグアノシンまたは非天然プリンヌクレオシドであり;
各Xは、独立して、天然に生ずるヌクレオシドまたは免疫刺激部分であり;
式中、Um−U1は、上流増強ドメインを示し、ここで、各Uは、独立して、天然に生ずるヌクレオシドまたは免疫刺激部分であり;
式中、D1−Dmは、下流増強ドメインを示し、ここで、各Dは、独立して、天然に生ずるヌクレオシドまたは免疫刺激部分であり;および
mは、各場合において、0〜30の数を示す、
で表される配列を含む、前記免疫刺激オリゴヌクレオチド化合物。 - 少なくとも1つのX、UまたはDが、免疫刺激部分である、請求項12に記載の免疫刺激オリゴヌクレオチド化合物。
- X1が、天然に生ずるヌクレオシドまたはC3−アルキルリンカー、2−アミノブチル−1,3−プロパンジオールリンカーおよびβ−L−デオキシヌクレオシドからなる群から選択される免疫刺激部分であり;
X2が、天然に生ずるヌクレオシドまたはアミノリンカーである免疫刺激部分であり;
X3が、天然に生ずるヌクレオシドまたはヌクレオシドメチルホスホネートである免疫刺激部分であり;
X4が、天然に生ずるヌクレオシドまたはヌクレオシドメチルホスホネートおよび2’−O−メチルリボヌクレオシドからなる群から選択される免疫刺激部分であり;
U1が、天然に生ずるヌクレオシドまたは1’,2’−ジデオキシリボース、C3−リンカーおよび2’−O−メチルリボヌクレオシドからなる群から選択される免疫刺激部分であり;
U2が、天然に生ずるヌクレオシドまたは1’,2’−ジデオキシリボース、C3−リンカー、スペーサー18、3’−デオキシヌクレオシド、ヌクレオシドメチルホスホネート、β−L−デオキシヌクレオシドおよび2’−O−プロパルギルリボヌクレオシドからなる群から選択される免疫刺激部分であり;
U3が、天然に生ずるヌクレオシドまたは1’,2’−ジデオキシリボース、C3−リンカー、スペーサー9、スペーサー18、ヌクレオシドメチルホスホネートおよび2’−5’結合からなる群から選択される免疫刺激部分であり;
D1が、天然に生ずるヌクレオシドまたは1’,2’−ジデオキシリボースおよびヌクレオシドメチルホスホネートからなる群から選択される免疫刺激部分であり;
D2が、天然に生ずるヌクレオシドまたは1’,2’−ジデオキシリボース、C3−リンカー、スペーサー9、スペーサー18、2−アミノブチル−1,3−プロパンジオールリンカー、ヌクレオシドメチルホスホネートおよびβ−L−デオキシヌクレオシドからなる群から選択される免疫刺激部分であり;および
D3が、天然に生ずるヌクレオシドまたは3’−デオキシヌクレオシド、2’−O−プロパルギルリボヌクレオシドおよび2’−5’結合からなる群から選択される免疫刺激部分である;
請求項13に記載の免疫刺激オリゴヌクレオチド化合物。 - U2およびU3が、両方ともに、1’,2’−ジデオキシリボース、C3−リンカーおよびβ−L−デオキシヌクレオシドからなる群から選択される同一の免疫刺激部分である、請求項13に記載の免疫刺激オリゴヌクレオチド化合物。
- U3およびU4が、両方ともに、ヌクレオシドメチルホスホネートおよび2’−O−メトキシエチルリボヌクレオシドからなる群から選択される同一の免疫刺激部分である、請求項13に記載の免疫刺激オリゴヌクレオチド化合物。
- U5およびU6が、両方ともに、1’,2’−ジデオキシリボースおよびC3−リンカーからなる群から選択される同一の免疫刺激部分である、請求項13に記載の免疫刺激オリゴヌクレオチド化合物。
- X1およびU3が、両方ともに、1’,2’−ジデオキシリボースである、請求項13に記載の免疫刺激オリゴヌクレオチド化合物。
- D2およびD3が、両方ともに、1’,2’−ジデオキシリボースおよびβ−L−デオキシヌクレオシドからなる群から選択される同一の免疫刺激部分である、請求項13に記載の免疫刺激オリゴヌクレオチド化合物。
- 免疫刺激オリゴヌクレオチド化合物であって:
式5’−ピリミジン−プリン−3’、式中、ピリミジンは天然または非天然ピリミジンヌクレオシドであり、およびプリンは天然または非天然プリンヌクレオシドである、で表される免疫刺激ジヌクレオチド;
3’−3’結合;および
1つまたは2つのアクセス可能な5’−末端;
を含み、但し、オリゴヌクレオチドは、HIV−1のgagまたはtat遺伝子に相補的ではない、前記免疫刺激オリゴヌクレオチド化合物。 - オリゴヌクレオチドが、2つのアクセス可能な5’−末端を含む、請求項20に記載の免疫刺激オリゴヌクレオチド化合物。
- 免疫刺激ジヌクレオチドが、非天然ピリミジンヌクレオシドを含む、請求項20に記載の免疫刺激オリゴヌクレオチド化合物。
- 非天然に生ずるピリミジン塩基を含むジヌクレオチドアナログを免疫刺激ドメインに導入することを含む、免疫刺激オリゴヌクレオチド化合物の免疫刺激効果を調節するための方法。
- 免疫刺激部分を免疫刺激ドメインおよび/または増強ドメインに導入することを含む、免疫刺激オリゴヌクレオチド化合物の免疫刺激効果を調節するための方法。
- 3’−3’結合をオリゴヌクレオチドに導入することを含む、免疫刺激オリゴヌクレオチド化合物の免疫刺激効果を調節するための方法。
- 患者に免疫応答を引き起こすための方法であって、請求項1〜22のいずれかに記載のオリゴヌクレオチドアナログ免疫刺激化合物を患者に投与することを含む、前記方法。
- オリゴヌクレオチドアナログ免疫刺激化合物が、抗生物質、抗原、アレルゲン、ワクチン、抗体、細胞毒性剤、アンチセンスオリゴヌクレオチド、遺伝子療法ベクター、DNAワクチン、アジュバントまたはこれらの組み合わせと組み合わせて投与される、請求項26に記載の方法。
- 免疫刺激オリゴヌクレオチド化合物が、抗原またはワクチンと結合している、請求項26に記載の方法。
- 結合がオリゴヌクレオチド化合物の3’−末端へのものである、請求項28に記載の方法。
- 病原体による疾患を有する患者を治療的に処置するための方法であって、請求項1〜22のいずれかに記載の免疫刺激オリゴヌクレオチド化合物を患者に投与することを含む、前記方法。
- 病原体がウイルスである、請求項30に記載の方法。
- 病原体が寄生虫である、請求項30に記載の方法。
- 病原体がバクテリアである、請求項30に記載の方法。
- 癌患者を処置するための方法であって、請求項1〜22のいずれかに記載の免疫刺激オリゴヌクレオチド化合物を患者に投与することを含む、前記方法。
- 免疫刺激オリゴヌクレオチド化合物が、化学療法化合物と組み合わせて投与される、請求項34に記載の方法。
- 自己免疫疾患を処置するための方法であって、請求項1〜22のいずれかに記載のオリゴヌクレオチドアナログ免疫刺激化合物を患者に投与することを含む、前記方法。
- 自己免疫疾患が自己免疫性の喘息である、請求項36に記載の方法。
- 気道炎症またはアレルギーを処置するための方法であって、請求項1〜22のいずれかに記載のオリゴヌクレオチドアナログ免疫刺激化合物を患者に投与することを含む、前記方法。
Applications Claiming Priority (4)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US23545200P | 2000-09-26 | 2000-09-26 | |
| US23545300P | 2000-09-26 | 2000-09-26 | |
| US71289800A | 2000-11-15 | 2000-11-15 | |
| PCT/US2001/030137 WO2002026757A2 (en) | 2000-09-26 | 2001-09-26 | Modulation of immunostimulatory activity of immunostimulatory oligonucleotide analogs by positional chemical changes |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2004509970A true JP2004509970A (ja) | 2004-04-02 |
| JP2004509970A5 JP2004509970A5 (ja) | 2008-11-20 |
Family
ID=27398718
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2002531140A Pending JP2004509970A (ja) | 2000-09-26 | 2001-09-26 | 位置的化学変化による免疫刺激オリゴヌクレオチドアナログの免疫刺激活性の調節 |
Country Status (10)
| Country | Link |
|---|---|
| US (8) | US7262286B2 (ja) |
| EP (2) | EP1322656B1 (ja) |
| JP (1) | JP2004509970A (ja) |
| KR (2) | KR100865706B1 (ja) |
| AT (1) | ATE384072T1 (ja) |
| AU (2) | AU2001294750C1 (ja) |
| CA (1) | CA2423487C (ja) |
| DE (1) | DE60132471T2 (ja) |
| ES (1) | ES2298269T3 (ja) |
| WO (1) | WO2002026757A2 (ja) |
Cited By (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2004537535A (ja) * | 2001-06-21 | 2004-12-16 | ダイナバックス テクノロジーズ コーポレイション | キメラ免疫調節化合物とその使用方法 |
| JP2008502688A (ja) * | 2004-06-15 | 2008-01-31 | イデラ ファーマシューティカルズ インコーポレイテッド | 免疫賦活オリゴヌクレオチドマルチマー |
| JP2009520502A (ja) * | 2005-12-20 | 2009-05-28 | イデラ ファーマシューティカルズ インコーポレイテッド | Cgジヌクレオチド修飾物を含有するトール様受容体の新規な合成アゴニスト |
| US7785610B2 (en) | 2001-06-21 | 2010-08-31 | Dynavax Technologies Corporation | Chimeric immunomodulatory compounds and methods of using the same—III |
Families Citing this family (174)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6207646B1 (en) | 1994-07-15 | 2001-03-27 | University Of Iowa Research Foundation | Immunostimulatory nucleic acid molecules |
| US20030022854A1 (en) | 1998-06-25 | 2003-01-30 | Dow Steven W. | Vaccines using nucleic acid-lipid complexes |
| US6977245B2 (en) | 1999-04-12 | 2005-12-20 | The United States Of America As Represented By The Department Of Health And Human Services | Oligodeoxynucleotide and its use to induce an immune response |
| ATE378348T1 (de) | 2000-01-14 | 2007-11-15 | Us Health | Oligodeoxynukleotide und ihre verwendung zur induktion einer immunreaktion |
| WO2002026757A2 (en) * | 2000-09-26 | 2002-04-04 | Hybridon, Inc. | Modulation of immunostimulatory activity of immunostimulatory oligonucleotide analogs by positional chemical changes |
| EP1364010B1 (en) * | 2000-12-27 | 2010-06-16 | Dynavax Technologies Corporation | Immunomodulatory polynucleotides and methods of using the same |
| GB0114719D0 (en) * | 2001-06-15 | 2001-08-08 | Glaxo Group Ltd | Compound |
| US7666674B2 (en) | 2001-07-27 | 2010-02-23 | The United States Of America As Represented By The Secretary Of The Department Of Health And Human Services | Use of sterically stabilized cationic liposomes to efficiently deliver CPG oligonucleotides in vivo |
| AU2002361468A1 (en) | 2001-08-14 | 2003-03-18 | The Government Of The United States Of America As Represented By The Secretary Of Health And Human S | Method for rapid generation of mature dendritic cells |
| WO2003035836A2 (en) * | 2001-10-24 | 2003-05-01 | Hybridon Inc. | Modulation of immunostimulatory properties of oligonucleotide-based compounds by optimal presentation of 5' ends |
| US7276489B2 (en) | 2002-10-24 | 2007-10-02 | Idera Pharmaceuticals, Inc. | Modulation of immunostimulatory properties of oligonucleotide-based compounds by optimal presentation of 5′ ends |
| US8466116B2 (en) | 2001-12-20 | 2013-06-18 | The Unites States Of America As Represented By The Secretary Of The Department Of Health And Human Services | Use of CpG oligodeoxynucleotides to induce epithelial cell growth |
| AU2002366710A1 (en) | 2001-12-20 | 2003-07-09 | The Government Of The United States Of America As Represented By The Secretary Of The Department Of | USE OF CpG OLIGODEOXYNUCLEOTIDES TO INDUCE ANGIOGENESIS |
| CA2388049A1 (en) | 2002-05-30 | 2003-11-30 | Immunotech S.A. | Immunostimulatory oligonucleotides and uses thereof |
| EP1393745A1 (en) * | 2002-07-29 | 2004-03-03 | Hybridon, Inc. | Modulation of immunostimulatory properties of oligonucleotide-based compounds by optimal presentation of 5'ends |
| AR040996A1 (es) | 2002-08-19 | 2005-04-27 | Coley Pharm Group Inc | Acidos nucleicos inmunoestimuladores |
| US8263091B2 (en) | 2002-09-18 | 2012-09-11 | The United States Of America As Represented By The Secretary Of The Department Of Health And Human Services | Method of treating and preventing infections in immunocompromised subjects with immunostimulatory CpG oligonucleotides |
| ATE492288T1 (de) | 2002-10-11 | 2011-01-15 | Novartis Vaccines & Diagnostic | Polypeptidimpstoffe zum breiten schutz gegen hypervirulente meningokokken-linien |
| US7956043B2 (en) | 2002-12-11 | 2011-06-07 | Coley Pharmaceutical Group, Inc. | 5′ CpG nucleic acids and methods of use |
| US8158768B2 (en) * | 2002-12-23 | 2012-04-17 | Dynavax Technologies Corporation | Immunostimulatory sequence oligonucleotides and methods of using the same |
| EP1575977B1 (en) | 2002-12-23 | 2009-09-09 | Dynavax Technologies Corporation | Immunostimulatory sequence oligonucleotides and methods of using the same |
| WO2004064782A2 (en) | 2003-01-16 | 2004-08-05 | Hybridon, Inc. | Modulation of immunostimulatory properties of oligonucleotide-based compounds by utilizing modified immunostimulatory dinucleotides |
| JP4827726B2 (ja) | 2003-01-30 | 2011-11-30 | ノバルティス ヴァクシンズ アンド ダイアグノスティクス エスアールエル | 複数の髄膜炎菌血清群に対する注射可能ワクチン |
| US7354907B2 (en) | 2003-02-07 | 2008-04-08 | Idera Pharmaceuticals, Inc. | Short immunomodulatory oligonucleotides |
| EP1601756B1 (en) | 2003-02-20 | 2010-12-15 | University of Connecticut Health Center | Methods for the preparation of alpha (2) macroglobulin-antigenic molecule complexes |
| KR100681470B1 (ko) | 2003-03-03 | 2007-02-12 | 연세대학교 산학협력단 | 면역반응 증진용 올리고뉴크레오타이드 |
| CA2522379C (en) | 2003-04-10 | 2012-10-23 | Chiron Corporation | The severe acute respiratory syndrome coronavirus |
| MXPA05012421A (es) * | 2003-05-16 | 2006-02-22 | Hybridon Inc | Tratamiento sinergistico de cancer usando inmunomeros junto con agentes quimioterapeuticos. |
| KR101137572B1 (ko) * | 2003-06-11 | 2012-05-30 | 이데라 파마슈티칼즈, 인코포레이티드 | 안정화된 면역조절 올리고뉴클레오티드 |
| EP1648913A4 (en) | 2003-07-15 | 2008-09-10 | Idera Pharmaceuticals Inc | SYNERGISTIC STIMULATION OF THE IMMUNE SYSTEM WITH IMMUNOSTIMULATING OLIGONUCLEOTIDES AND / OR IMMUNOMER COMPOUNDS RELATED TO CYTOKINES AND / OR CHEMOTHERAPEAN MEDICAMENTS OR RADIATION THERAPY |
| AU2004275876B2 (en) * | 2003-09-25 | 2011-03-31 | Coley Pharmaceutical Gmbh | Nucleic acid-lipophilic conjugates |
| GB0323103D0 (en) | 2003-10-02 | 2003-11-05 | Chiron Srl | De-acetylated saccharides |
| CN103357002A (zh) | 2003-10-02 | 2013-10-23 | 诺华疫苗和诊断有限公司 | 多种脑膜炎球菌血清群的液体疫苗 |
| CN101454451A (zh) | 2003-10-30 | 2009-06-10 | 科勒制药有限公司 | 具有增强免疫刺激能力的c类寡核苷酸类似物 |
| KR101138131B1 (ko) | 2003-12-08 | 2012-04-23 | 이데라 파마슈티칼즈, 인코포레이티드 | 작은 올리고뉴클레오티드-기초 화합물에 의한 면역자극특성의 조절 |
| JP4817599B2 (ja) * | 2003-12-25 | 2011-11-16 | 独立行政法人科学技術振興機構 | 免疫活性増強剤とこれを用いた免疫活性の増強方法 |
| US20050222072A1 (en) * | 2004-02-20 | 2005-10-06 | Hybridon, Inc. | Potent mucosal immune response induced by modified immunomodulatory oligonucleotides |
| EP1722815A1 (en) | 2004-03-09 | 2006-11-22 | Chiron Corporation | Influenza virus vaccines |
| GB0409745D0 (en) | 2004-04-30 | 2004-06-09 | Chiron Srl | Compositions including unconjugated carrier proteins |
| RU2379052C2 (ru) | 2004-04-30 | 2010-01-20 | Чирон С.Р.Л. | Вакцинация менингококковыми конъюгатами |
| GB0500787D0 (en) | 2005-01-14 | 2005-02-23 | Chiron Srl | Integration of meningococcal conjugate vaccination |
| GB0410866D0 (en) | 2004-05-14 | 2004-06-16 | Chiron Srl | Haemophilius influenzae |
| WO2006078294A2 (en) | 2004-05-21 | 2006-07-27 | Novartis Vaccines And Diagnostics Inc. | Alphavirus vectors for respiratory pathogen vaccines |
| CA2567789A1 (en) * | 2004-06-08 | 2006-08-03 | Coley Pharmaceutical Gmbh | Abasic oligonucleotide as carrier platform for antigen and immunostimulatory agonist and antagonist |
| US7427405B2 (en) * | 2004-06-15 | 2008-09-23 | Idera Pharmaceuticals, Inc. | Immunostimulatory oligonucleotide multimers |
| JP2008508320A (ja) | 2004-07-29 | 2008-03-21 | カイロン コーポレイション | Streptococcusagalactiaeのようなグラム陽性細菌に対する免疫原性組成物 |
| MY159370A (en) | 2004-10-20 | 2016-12-30 | Coley Pharm Group Inc | Semi-soft-class immunostimulatory oligonucleotides |
| DE102004051804A1 (de) * | 2004-10-21 | 2006-04-27 | Max-Delbrück-Centrum Für Molekulare Medizin (Mdc) | Beta-L-N4-Hydroxycytosin-Desoxynucleoside und ihre Verwendung als pharmazeutische Mittel zur Prophylaxe oder Therapie von viralen Erkrankungen |
| GB0424092D0 (en) | 2004-10-29 | 2004-12-01 | Chiron Srl | Immunogenic bacterial vesicles with outer membrane proteins |
| GB0502095D0 (en) | 2005-02-01 | 2005-03-09 | Chiron Srl | Conjugation of streptococcal capsular saccharides |
| SG164344A1 (en) | 2005-02-18 | 2010-09-29 | Novartis Vaccines & Diagnostics Srl | Immunogens from uropathogenic escherichia coli |
| EP1858920B1 (en) | 2005-02-18 | 2016-02-03 | GlaxoSmithKline Biologicals SA | Proteins and nucleic acids from meningitis/sepsis-associated escherichia coli |
| WO2006113528A2 (en) | 2005-04-18 | 2006-10-26 | Novartis Vaccines And Diagnostics Inc. | Expressing hepatitis b virus surface antigen for vaccine preparation |
| EP2614709A1 (en) | 2005-07-18 | 2013-07-17 | Novartis AG | Small animal model for HCV replication |
| WO2007047749A1 (en) | 2005-10-18 | 2007-04-26 | Novartis Vaccines And Diagnostics Inc. | Mucosal and systemic immunizations with alphavirus replicon particles |
| PT1951299E (pt) | 2005-11-04 | 2012-02-28 | Novartis Vaccines & Diagnostic | Vacinas contra a gripe que incluem combinações de adjuvantes particulados e imuno-potenciadores |
| CA2628206A1 (en) | 2005-11-04 | 2007-05-10 | Novartis Vaccines And Diagnostics S.R.L. | Influenza vaccine with reduced amount of oil-in-water emulsion as adjuvant |
| EP1945252B1 (en) | 2005-11-04 | 2013-05-29 | Novartis Vaccines and Diagnostics S.r.l. | Vaccines comprising purified surface antigens prepared from influenza viruses grown in cell culture, adjuvanted with squalene |
| JP2009514839A (ja) | 2005-11-04 | 2009-04-09 | ノバルティス ヴァクシンズ アンド ダイアグノスティクス エスアールエル | サイトカイン誘導剤を含むアジュバントインフルエンザワクチン |
| US7470674B2 (en) * | 2005-11-07 | 2008-12-30 | Idera Pharmaceuticals, Inc. | Immunostimulatory properties of oligonucleotide-based compounds comprising modified immunostimulatory dinucleotides |
| US7776834B2 (en) * | 2005-11-07 | 2010-08-17 | Idera Pharmaceuticals, Inc. | Immunostimulatory properties of oligonucleotide-based compounds comprising modified immunostimulatory dinucleotides |
| WO2007081447A2 (en) | 2005-11-22 | 2007-07-19 | Novartis Vaccines And Diagnostics, Inc. | Norovirus and sapovirus antigens |
| GB0524066D0 (en) | 2005-11-25 | 2006-01-04 | Chiron Srl | 741 ii |
| JO2813B1 (en) | 2005-12-22 | 2014-09-15 | جلاكسو سميث كلاين بايولوجيكالز اس.ايه | A vaccine with multiple pneumococcal saccharides |
| GB0607088D0 (en) | 2006-04-07 | 2006-05-17 | Glaxosmithkline Biolog Sa | Vaccine |
| JP6087041B2 (ja) | 2006-01-27 | 2017-03-08 | ノバルティス アーゲー | 血球凝集素およびマトリックスタンパク質を含むインフルエンザウイルスワクチン |
| CA2646539A1 (en) | 2006-03-23 | 2007-09-27 | Novartis Ag | Imidazoquinoxaline compounds as immunomodulators |
| WO2007110776A1 (en) | 2006-03-24 | 2007-10-04 | Novartis Vaccines And Diagnostics Gmbh & Co Kg | Storage of influenza vaccines without refrigeration |
| MX337528B (es) | 2006-03-30 | 2016-03-09 | Glaxosmithkline Biolog Sa | Composición inmunogénica que comprende un sacárido capsular estafilocócico o-acetilado y una proteína estafilocócica. |
| EP2382988A1 (en) | 2006-03-31 | 2011-11-02 | Novartis AG | Combined mucosal and parenteral immunization against HIV |
| ATE522541T1 (de) | 2006-06-09 | 2011-09-15 | Novartis Ag | Bakterielle adhäsine konformere |
| GB0614460D0 (en) | 2006-07-20 | 2006-08-30 | Novartis Ag | Vaccines |
| EP2586790A3 (en) | 2006-08-16 | 2013-08-14 | Novartis AG | Immunogens from uropathogenic Escherichia coli |
| ES2536401T3 (es) | 2006-09-11 | 2015-05-25 | Novartis Ag | Fabricación de vacunas contra virus de la gripe sin usar huevos |
| MX2009003398A (es) | 2006-09-27 | 2009-08-12 | Coley Pharm Gmbh | Analogos de oligonucleotidos cpg que contienen analogos t hidrofobos con actividad inmunoestimuladora mejorada. |
| DE102006050655A1 (de) * | 2006-10-24 | 2008-04-30 | Halmon Beheer B.V. | Pharmazeutische Zusammensetzung zur Behandlung allergischer Erkrankungen |
| ES2480491T3 (es) | 2006-12-06 | 2014-07-28 | Novartis Ag | Vacunas incluyendo antígeno de cuatro cepas de virus de la gripe |
| GB0700562D0 (en) | 2007-01-11 | 2007-02-21 | Novartis Vaccines & Diagnostic | Modified Saccharides |
| CA2687632C (en) | 2007-05-24 | 2013-01-15 | Glaxosmithkline Biologicals S.A. | Lyophilised antigen composition |
| PT2167121E (pt) | 2007-06-26 | 2015-12-02 | Glaxosmithkline Biolog Sa | Vacina compreendendo conjugados de polissacáridos capsulares de streptococcus pneumoniae |
| BRPI0813866A2 (pt) | 2007-06-27 | 2015-01-06 | Novartis Ag | Vacinas contra influenza com baixo teor de aditivos |
| GB0713880D0 (en) | 2007-07-17 | 2007-08-29 | Novartis Ag | Conjugate purification |
| CA2695385A1 (en) * | 2007-07-31 | 2009-02-05 | Atul Bedi | Polypeptide-nucleic acid conjugate for immunoprophylaxis or immunotherapy for neoplastic or infectious disorders |
| GB0714963D0 (en) | 2007-08-01 | 2007-09-12 | Novartis Ag | Compositions comprising antigens |
| ES2561483T3 (es) | 2007-09-12 | 2016-02-26 | Glaxosmithkline Biologicals Sa | Antígenos mutantes de GAS57 y anticuerpos de GAS57 |
| GB0810305D0 (en) | 2008-06-05 | 2008-07-09 | Novartis Ag | Influenza vaccination |
| GB0818453D0 (en) | 2008-10-08 | 2008-11-12 | Novartis Ag | Fermentation processes for cultivating streptococci and purification processes for obtaining cps therefrom |
| KR101773114B1 (ko) | 2007-12-21 | 2017-08-30 | 노파르티스 아게 | 스트렙토라이신 o의 돌연변이 형태 |
| ES2532946T3 (es) | 2008-02-21 | 2015-04-06 | Novartis Ag | Polipéptidos PUfH meningocócicos |
| JP5518041B2 (ja) | 2008-03-18 | 2014-06-11 | ノバルティス アーゲー | インフルエンザウイルスワクチン抗原の調製における改良 |
| CA2746508A1 (en) * | 2008-12-17 | 2010-07-15 | Avi Biopharma, Inc. | Antisense compositions and methods for modulating contact hypersensitivity or contact dermatitis |
| US8465751B2 (en) | 2009-01-12 | 2013-06-18 | Novartis Ag | Cna—B domain antigens in vaccines against gram positive bacteria |
| EP3549602A1 (en) | 2009-03-06 | 2019-10-09 | GlaxoSmithKline Biologicals S.A. | Chlamydia antigens |
| SI2510947T1 (sl) | 2009-04-14 | 2016-05-31 | Glaxosmithkline Biologicals S.A. | Sestavki za imunizacijo proti Staphylococcus aureus |
| CA2765364C (en) | 2009-06-15 | 2015-05-26 | National University Of Singapore | Influenza vaccine, composition, and methods of use |
| CA2767536A1 (en) | 2009-07-07 | 2011-01-13 | Novartis Ag | Conserved escherichia coli immunogens |
| BR112012001666A2 (pt) | 2009-07-15 | 2019-09-24 | Novartis Ag | composições de proteína rsv f e métodos para fazer as mesmas |
| JP2012532626A (ja) | 2009-07-16 | 2012-12-20 | ノバルティス アーゲー | 無毒化されたEscherichiacoli免疫原 |
| GB0913681D0 (en) | 2009-08-05 | 2009-09-16 | Glaxosmithkline Biolog Sa | Immunogenic composition |
| GB0913680D0 (en) | 2009-08-05 | 2009-09-16 | Glaxosmithkline Biolog Sa | Immunogenic composition |
| CN102596240B (zh) | 2009-08-27 | 2015-02-04 | 诺华股份有限公司 | 包括脑膜炎球菌fHBP序列的杂交多肽 |
| US20120237536A1 (en) | 2009-09-10 | 2012-09-20 | Novartis | Combination vaccines against respiratory tract diseases |
| GB0917003D0 (en) | 2009-09-28 | 2009-11-11 | Novartis Vaccines Inst For Global Health Srl | Purification of bacterial vesicles |
| GB0917002D0 (en) | 2009-09-28 | 2009-11-11 | Novartis Vaccines Inst For Global Health Srl | Improved shigella blebs |
| CN102724988B (zh) | 2009-09-30 | 2014-09-10 | 诺华股份有限公司 | 脑膜炎球菌fHBP多肽的表达 |
| CA2779798C (en) | 2009-09-30 | 2019-03-19 | Novartis Ag | Conjugation of staphylococcus aureus type 5 and type 8 capsular polysaccharides |
| GB0918392D0 (en) | 2009-10-20 | 2009-12-02 | Novartis Ag | Diagnostic and therapeutic methods |
| MX2012004850A (es) | 2009-10-27 | 2012-05-22 | Novartis Ag | Polipeptidos fhbp meningococicos modificados. |
| GB0919690D0 (en) | 2009-11-10 | 2009-12-23 | Guy S And St Thomas S Nhs Foun | compositions for immunising against staphylococcus aureus |
| ES2707778T3 (es) | 2009-12-30 | 2019-04-05 | Glaxosmithkline Biologicals Sa | Inmunógenos polisacáridos conjugados con proteínas portadoras de E. coli |
| GB201003333D0 (en) | 2010-02-26 | 2010-04-14 | Novartis Ag | Immunogenic proteins and compositions |
| GB201003920D0 (en) | 2010-03-09 | 2010-04-21 | Glaxosmithkline Biolog Sa | Method of treatment |
| GB201003924D0 (en) | 2010-03-09 | 2010-04-21 | Glaxosmithkline Biolog Sa | Immunogenic composition |
| GB201005625D0 (en) | 2010-04-01 | 2010-05-19 | Novartis Ag | Immunogenic proteins and compositions |
| JP2013529894A (ja) | 2010-04-07 | 2013-07-25 | ノバルティス アーゲー | パルボウイルスb19のウイルス様粒子を生成するための方法 |
| EP2558069A1 (en) | 2010-04-13 | 2013-02-20 | Novartis AG | Benzonapthyridine compositions and uses thereof |
| AU2011258156B2 (en) | 2010-05-26 | 2016-11-24 | Selecta Biosciences, Inc. | Multivalent synthetic nanocarrier vaccines |
| KR20130121699A (ko) | 2010-05-28 | 2013-11-06 | 테트리스 온라인, 인코포레이티드 | 상호작용 혼성 비동기 컴퓨터 게임 기반구조 |
| GB201009861D0 (en) | 2010-06-11 | 2010-07-21 | Novartis Ag | OMV vaccines |
| US9192661B2 (en) | 2010-07-06 | 2015-11-24 | Novartis Ag | Delivery of self-replicating RNA using biodegradable polymer particles |
| WO2012006293A1 (en) | 2010-07-06 | 2012-01-12 | Novartis Ag | Norovirus derived immunogenic compositions and methods |
| GB201101665D0 (en) | 2011-01-31 | 2011-03-16 | Novartis Ag | Immunogenic compositions |
| GB201017519D0 (en) | 2010-10-15 | 2010-12-01 | Novartis Vaccines Inst For Global Health S R L | Vaccines |
| US9994443B2 (en) | 2010-11-05 | 2018-06-12 | Selecta Biosciences, Inc. | Modified nicotinic compounds and related methods |
| WO2012072769A1 (en) | 2010-12-01 | 2012-06-07 | Novartis Ag | Pneumococcal rrgb epitopes and clade combinations |
| GB201021867D0 (en) | 2010-12-23 | 2011-02-02 | Mologen Ag | Non-coding immunomodulatory DNA construct |
| WO2012085668A2 (en) | 2010-12-24 | 2012-06-28 | Novartis Ag | Compounds |
| SI2667892T1 (sl) | 2011-01-26 | 2019-05-31 | Glaxosmithkline Biologicals Sa | Imunizacijski režim proti RSV |
| TW201302779A (zh) | 2011-04-13 | 2013-01-16 | Glaxosmithkline Biolog Sa | 融合蛋白質及組合疫苗 |
| ES2651143T3 (es) | 2011-05-13 | 2018-01-24 | Glaxosmithkline Biologicals Sa | Antígenos de F de prefusión del VRS |
| FR2975600B1 (fr) | 2011-05-24 | 2013-07-05 | Assist Publ Hopitaux De Paris | Agents pour le traitement de tumeurs |
| EP2729168A2 (en) | 2011-07-06 | 2014-05-14 | Novartis AG | Immunogenic compositions and uses thereof |
| WO2013006838A1 (en) | 2011-07-06 | 2013-01-10 | Novartis Ag | Immunogenic combination compositions and uses thereof |
| US9149541B2 (en) | 2011-07-08 | 2015-10-06 | Novartis Ag | Tyrosine ligation process |
| WO2013016460A1 (en) | 2011-07-25 | 2013-01-31 | Novartis Ag | Compositions and methods for assessing functional immunogenicity of parvovirus vaccines |
| AU2012290306B2 (en) | 2011-07-29 | 2017-08-17 | Selecta Biosciences, Inc. | Synthetic nanocarriers that generate humoral and cytotoxic T lymphocyte (CTL) immune responses |
| CN103917245B (zh) | 2011-09-14 | 2017-06-06 | 葛兰素史密丝克莱恩生物有限公司 | 用于制备糖‑蛋白质糖缀合物的方法 |
| CN104080479B (zh) | 2011-11-07 | 2019-11-05 | 葛兰素史密丝克莱恩生物有限公司 | 包括spr0096和spr2021抗原的运载体分子 |
| JP6073916B2 (ja) | 2011-12-05 | 2017-02-01 | ファクター バイオサイエンス インコーポレイテッド | 細胞に形質移入するための方法および製品 |
| WO2013108272A2 (en) | 2012-01-20 | 2013-07-25 | International Centre For Genetic Engineering And Biotechnology | Blood stage malaria vaccine |
| MX2014014067A (es) | 2012-05-22 | 2015-02-04 | Novartis Ag | Conjugado de serogrupo x de meningococo. |
| WO2014005958A1 (en) | 2012-07-06 | 2014-01-09 | Novartis Ag | Immunogenic compositions and uses thereof |
| EP3400960A1 (en) | 2012-09-18 | 2018-11-14 | GlaxoSmithKline Biologicals S.A. | Outer membrane vesicles |
| WO2014053521A2 (en) | 2012-10-02 | 2014-04-10 | Novartis Ag | Nonlinear saccharide conjugates |
| CN104717977A (zh) | 2012-10-03 | 2015-06-17 | 诺华股份有限公司 | 免疫原性组合物 |
| KR20230154283A (ko) | 2012-11-01 | 2023-11-07 | 팩터 바이오사이언스 인크. | 세포에서 단백질을 발현시키는 방법들과 생성물들 |
| CN111249455A (zh) | 2012-11-30 | 2020-06-09 | 葛兰素史密丝克莱恩生物有限公司 | 假单胞菌抗原和抗原组合 |
| WO2014110081A1 (en) * | 2013-01-08 | 2014-07-17 | Idera Pharmaceuticals, Inc. | Immune regulatory oligonucleotide (iro) compounds to modulate toll-like receptor based immune response |
| WO2014124228A1 (en) | 2013-02-07 | 2014-08-14 | Children's Medical Center Corporation | Protein antigens that provide protection against pneumococcal colonization and/or disease |
| GB201310008D0 (en) | 2013-06-05 | 2013-07-17 | Glaxosmithkline Biolog Sa | Immunogenic composition for use in therapy |
| MX2016009771A (es) | 2014-01-31 | 2016-11-14 | Factor Bioscience Inc | Metodos y productos para la produccion y administracion de acido nucleico. |
| TW201620927A (zh) | 2014-02-24 | 2016-06-16 | 葛蘭素史密斯克藍生物品公司 | Uspa2蛋白質構築體及其用途 |
| ES2769647T3 (es) | 2014-03-26 | 2020-06-26 | Glaxosmithkline Biologicals Sa | Antígenos estafilocócicos mutantes |
| CN106535876B (zh) | 2014-06-04 | 2020-09-11 | 埃克西奎雷股份有限公司 | 免疫调节剂通过脂质体球形核酸的多价递送以用于预防或治疗应用 |
| JP2017537619A (ja) | 2014-11-21 | 2017-12-21 | ノースウェスタン ユニバーシティ | 球状核酸ナノ粒子複合体の配列特異的細胞内取込 |
| BE1023004A1 (fr) | 2014-12-10 | 2016-10-31 | Glaxosmithkline Biologicals Sa | Procede de traitement |
| JP7199809B2 (ja) | 2015-02-13 | 2023-01-06 | ファクター バイオサイエンス インコーポレイテッド | 核酸製品及びその投与方法 |
| EP3313439A2 (en) | 2015-06-26 | 2018-05-02 | Seqirus UK Limited | Antigenically matched influenza vaccines |
| LU92821B1 (en) | 2015-09-09 | 2017-03-20 | Mologen Ag | Combination comprising immunostimulatory oligonucleotides |
| GB2542425A (en) | 2015-09-21 | 2017-03-22 | Mologen Ag | Means for the treatment of HIV |
| CN109311265A (zh) | 2016-03-30 | 2019-02-05 | 3M创新有限公司 | 以随机分布的微球的预定图案为特征的制品及其制备方法 |
| WO2018035377A1 (en) | 2016-08-17 | 2018-02-22 | Factor Bioscience Inc. | Nucleic acid products and methods of administration thereof |
| US11364304B2 (en) | 2016-08-25 | 2022-06-21 | Northwestern University | Crosslinked micellar spherical nucleic acids |
| WO2018178265A1 (en) | 2017-03-31 | 2018-10-04 | Glaxosmithkline Intellectual Property Development Limited | Immunogenic composition, use and method of treatment |
| WO2018178264A1 (en) | 2017-03-31 | 2018-10-04 | Glaxosmithkline Intellectual Property Development Limited | Immunogenic composition, use and method of treatment |
| WO2018209270A1 (en) | 2017-05-11 | 2018-11-15 | Northwestern University | Adoptive cell therapy using spherical nucleic acids (snas) |
| CN110996994A (zh) | 2017-08-14 | 2020-04-10 | 葛兰素史密丝克莱恩生物有限公司 | 加强免疫应答的方法 |
| WO2020115171A1 (en) | 2018-12-06 | 2020-06-11 | Glaxosmithkline Biologicals Sa | Immunogenic compositions |
| EP3956666A1 (en) | 2019-04-18 | 2022-02-23 | GlaxoSmithKline Biologicals S.A. | Antigen binding proteins and assays |
| US10501404B1 (en) | 2019-07-30 | 2019-12-10 | Factor Bioscience Inc. | Cationic lipids and transfection methods |
| CA3148924A1 (en) | 2019-08-05 | 2021-02-11 | Glaxosmithkline Biologicals Sa | Immunogenic composition |
| EP3799884A1 (en) | 2019-10-01 | 2021-04-07 | GlaxoSmithKline Biologicals S.A. | Immunogenic compositions |
| EP4294433A1 (en) | 2021-02-22 | 2023-12-27 | GlaxoSmithKline Biologicals SA | Immunogenic composition, use and methods |
| WO2023201109A1 (en) | 2022-04-15 | 2023-10-19 | Yale University | Exatecan formulation |
Family Cites Families (37)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3687808A (en) * | 1969-08-14 | 1972-08-29 | Univ Leland Stanford Junior | Synthetic polynucleotides |
| US5149798A (en) | 1989-04-06 | 1992-09-22 | Worcester Foundation For Experimental Biology | Process for synthesizing oligonucleotides and their analogs adaptable to large scale syntheses |
| KR920701230A (ko) * | 1989-06-05 | 1992-08-11 | 원본미기재 | 엑소뉴클레아제-내성 올리고뉴클레오티드 및 그 제조방법 |
| US6365730B1 (en) * | 1990-06-19 | 2002-04-02 | Gene Shears Pty. Limited | DNA-Armed ribozymes and minizymes |
| DK0464638T3 (da) * | 1990-07-02 | 1997-10-13 | Hoechst Ag | Oligonukleotidanaloge med terminale 3-3- eller 5-5-internukleotidbindinger. |
| US5599797A (en) * | 1991-10-15 | 1997-02-04 | Isis Pharmaceuticals, Inc. | Oligonucleotides having phosphorothioate linkages of high chiral purity |
| ATE154029T1 (de) * | 1993-03-30 | 1997-06-15 | Sanofi Sa | 7-deazapurin modifizierte oligonukleotide |
| AU1436995A (en) * | 1993-12-30 | 1995-07-17 | Chemgenes Corporation | Synthesis of propargyl modified nucleosides and phosphoramidites and their incorporation into defined sequence oligonucleotides |
| US6207646B1 (en) * | 1994-07-15 | 2001-03-27 | University Of Iowa Research Foundation | Immunostimulatory nucleic acid molecules |
| US5693773A (en) * | 1995-06-07 | 1997-12-02 | Hybridon Incorporated | Triplex-forming antisense oligonucleotides having abasic linkers targeting nucleic acids comprising mixed sequences of purines and pyrimidines |
| CA2181421C (en) * | 1995-07-18 | 2007-02-13 | Tsutomu Takahashi | Para-oriented aromatic polyamide porous film |
| US5856462A (en) * | 1996-09-10 | 1999-01-05 | Hybridon Incorporated | Oligonucleotides having modified CpG dinucleosides |
| US6444650B1 (en) * | 1996-10-01 | 2002-09-03 | Geron Corporation | Antisense compositions for detecting and inhibiting telomerase reverse transcriptase |
| US6077833A (en) * | 1996-12-31 | 2000-06-20 | Isis Pharmaceuticals, Inc. | Oligonucleotide compositions and methods for the modulation of the expression of B7 protein |
| US6028183A (en) * | 1997-11-07 | 2000-02-22 | Gilead Sciences, Inc. | Pyrimidine derivatives and oligonucleotides containing same |
| FR2771189B1 (fr) * | 1997-11-14 | 2000-01-07 | Eastman Kodak Co | Procede pour minimiser l'oxydation aerienne des revelateurs photographiques |
| JPH11209289A (ja) * | 1998-01-22 | 1999-08-03 | Taisho Pharmaceut Co Ltd | 粘膜免疫誘起剤 |
| US6562798B1 (en) * | 1998-06-05 | 2003-05-13 | Dynavax Technologies Corp. | Immunostimulatory oligonucleotides with modified bases and methods of use thereof |
| WO2000006588A1 (en) * | 1998-07-27 | 2000-02-10 | University Of Iowa Research Foundation | STEREOISOMERS OF CpG OLIGONUCLEOTIDES AND RELATED METHODS |
| US6172216B1 (en) * | 1998-10-07 | 2001-01-09 | Isis Pharmaceuticals Inc. | Antisense modulation of BCL-X expression |
| WO2000032823A1 (en) * | 1998-12-02 | 2000-06-08 | Phylos, Inc. | Dna-protein fusions and uses thereof |
| CN102586228A (zh) * | 1999-09-13 | 2012-07-18 | 纽亘技术公司 | 用于多核苷酸序列线性等温扩增的方法及组合物 |
| CA2398432C (en) * | 2000-01-26 | 2012-06-19 | Hybridon, Inc. | Modulation of oligonucleotide cpg-mediated immune stimulation by positional modification of nucleosides |
| CA2407942A1 (en) * | 2000-05-01 | 2001-11-08 | Hybridon, Inc. | Modulation of oligonucleotide cpg-mediated immune stimulation by positional modification of nucleosides |
| WO2002026757A2 (en) * | 2000-09-26 | 2002-04-04 | Hybridon, Inc. | Modulation of immunostimulatory activity of immunostimulatory oligonucleotide analogs by positional chemical changes |
| US7176296B2 (en) * | 2001-04-30 | 2007-02-13 | Idera Pharmaceuticals, Inc. | Modulation of oligonucleotide CpG-mediated immune stimulation by positional modification of nucleosides |
| US7105495B2 (en) * | 2001-04-30 | 2006-09-12 | Idera Pharmaceuticals, Inc. | Modulation of oligonucleotide CpG-mediated immune stimulation by positional modification of nucleosides |
| US7276489B2 (en) * | 2002-10-24 | 2007-10-02 | Idera Pharmaceuticals, Inc. | Modulation of immunostimulatory properties of oligonucleotide-based compounds by optimal presentation of 5′ ends |
| WO2004064782A2 (en) * | 2003-01-16 | 2004-08-05 | Hybridon, Inc. | Modulation of immunostimulatory properties of oligonucleotide-based compounds by utilizing modified immunostimulatory dinucleotides |
| MXPA05012421A (es) * | 2003-05-16 | 2006-02-22 | Hybridon Inc | Tratamiento sinergistico de cancer usando inmunomeros junto con agentes quimioterapeuticos. |
| US7323319B2 (en) * | 2003-05-29 | 2008-01-29 | The University Of Southern Mississippi | RNA containing coenzymes, biotin, or fluorophores, and methods for their preparation and use |
| KR101137572B1 (ko) * | 2003-06-11 | 2012-05-30 | 이데라 파마슈티칼즈, 인코포레이티드 | 안정화된 면역조절 올리고뉴클레오티드 |
| EP1648913A4 (en) * | 2003-07-15 | 2008-09-10 | Idera Pharmaceuticals Inc | SYNERGISTIC STIMULATION OF THE IMMUNE SYSTEM WITH IMMUNOSTIMULATING OLIGONUCLEOTIDES AND / OR IMMUNOMER COMPOUNDS RELATED TO CYTOKINES AND / OR CHEMOTHERAPEAN MEDICAMENTS OR RADIATION THERAPY |
| US7427405B2 (en) * | 2004-06-15 | 2008-09-23 | Idera Pharmaceuticals, Inc. | Immunostimulatory oligonucleotide multimers |
| AU2005257938B2 (en) * | 2004-06-15 | 2010-11-11 | Idera Pharmaceuticals, Inc. | Immunostimulatory oligonucleotide multimers |
| US20070093439A1 (en) * | 2005-10-25 | 2007-04-26 | Idera Pharmaceuticals, Inc. | Short immunomodulatory oligonucleotides |
| US7470674B2 (en) * | 2005-11-07 | 2008-12-30 | Idera Pharmaceuticals, Inc. | Immunostimulatory properties of oligonucleotide-based compounds comprising modified immunostimulatory dinucleotides |
-
2001
- 2001-09-26 WO PCT/US2001/030137 patent/WO2002026757A2/en active IP Right Grant
- 2001-09-26 JP JP2002531140A patent/JP2004509970A/ja active Pending
- 2001-09-26 EP EP01975423A patent/EP1322656B1/en not_active Expired - Lifetime
- 2001-09-26 KR KR1020037004314A patent/KR100865706B1/ko not_active IP Right Cessation
- 2001-09-26 KR KR1020087002314A patent/KR100894767B1/ko not_active IP Right Cessation
- 2001-09-26 CA CA2423487A patent/CA2423487C/en not_active Expired - Lifetime
- 2001-09-26 EP EP10183871A patent/EP2292632A3/en not_active Withdrawn
- 2001-09-26 ES ES01975423T patent/ES2298269T3/es not_active Expired - Lifetime
- 2001-09-26 AT AT01975423T patent/ATE384072T1/de not_active IP Right Cessation
- 2001-09-26 DE DE60132471T patent/DE60132471T2/de not_active Expired - Lifetime
- 2001-09-26 US US09/965,116 patent/US7262286B2/en not_active Expired - Fee Related
- 2001-09-26 AU AU2001294750A patent/AU2001294750C1/en not_active Ceased
- 2001-09-26 AU AU9475001A patent/AU9475001A/xx active Pending
-
2003
- 2003-10-27 US US10/694,207 patent/US7790168B2/en not_active Expired - Fee Related
- 2003-10-27 US US10/694,075 patent/US8716253B2/en active Active
- 2003-10-27 US US10/694,586 patent/US7932367B2/en not_active Expired - Fee Related
- 2003-10-27 US US10/694,418 patent/US7824696B2/en not_active Expired - Fee Related
- 2003-10-27 US US10/694,383 patent/US8030462B2/en not_active Expired - Fee Related
-
2005
- 2005-11-09 US US11/270,805 patent/US7833538B2/en not_active Expired - Lifetime
-
2006
- 2006-12-12 US US11/637,184 patent/US8476416B2/en not_active Expired - Lifetime
Cited By (11)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2004537535A (ja) * | 2001-06-21 | 2004-12-16 | ダイナバックス テクノロジーズ コーポレイション | キメラ免疫調節化合物とその使用方法 |
| US7785610B2 (en) | 2001-06-21 | 2010-08-31 | Dynavax Technologies Corporation | Chimeric immunomodulatory compounds and methods of using the same—III |
| JP2010189400A (ja) * | 2001-06-21 | 2010-09-02 | Dynavax Technologies Corp | キメラ免疫調節化合物とその使用方法 |
| US8003115B2 (en) | 2001-06-21 | 2011-08-23 | Dynavax Technologies Corporation | Chimeric immunomodulatory compounds and methods of using the same |
| US8114418B2 (en) | 2001-06-21 | 2012-02-14 | Dynavax Technologies Corporation | Chimeric immunomodulatory compounds and methods of using the same—IV |
| US8222398B2 (en) | 2001-06-21 | 2012-07-17 | Dynavax Technologies Corporation | Chimeric immunomodulatory compounds and methods of using the same-II |
| US8597665B2 (en) | 2001-06-21 | 2013-12-03 | Dynavax Technologies Corporation | Chimeric immunomodulatory compounds and methods of using the same-IV |
| US9028845B2 (en) | 2001-06-21 | 2015-05-12 | Dynavax Technologies Corporation | Chimeric immunomodulatory compounds and methods of using the same-IV |
| JP2008502688A (ja) * | 2004-06-15 | 2008-01-31 | イデラ ファーマシューティカルズ インコーポレイテッド | 免疫賦活オリゴヌクレオチドマルチマー |
| JP4942646B2 (ja) * | 2004-06-15 | 2012-05-30 | イデラ ファーマシューティカルズ インコーポレイテッド | 免疫賦活オリゴヌクレオチドマルチマー |
| JP2009520502A (ja) * | 2005-12-20 | 2009-05-28 | イデラ ファーマシューティカルズ インコーポレイテッド | Cgジヌクレオチド修飾物を含有するトール様受容体の新規な合成アゴニスト |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR100894767B1 (ko) | 화학적인 위치 변화에 의해 면역자극 올리고누클레오티드유사체의 면역자극 활성을 조절하는 방법 | |
| AU2001294750A1 (en) | Modulation of immunostimulatory activity of immunostimulatory oligonucleotide analogs by positional chemical changes | |
| EP1252307B1 (en) | MODULATION OF OLIGONUCLEOTIDE CpG-MEDIATED IMMUNE STIMULATION BY POSITIONAL MODIFICATION OF NUCLEOSIDES | |
| EP1278761B1 (en) | MODULATION OF OLIGONUCLEOTIDE CpG-MEDIATED IMMUNE STIMULATION BY POSITIONAL MODIFICATION OF NUCLEOSIDES | |
| US20030212029A1 (en) | Modulation of oligonucleotides CpG-mediated immune stimulation by positional modification of nucleosides | |
| CA2381993A1 (en) | Modulation of oligonucleotide cpg-mediated immune stimulation by positional modification of nucleosides | |
| US20030236211A1 (en) | Modulation of oligonucleotide CpG-mediated immune stimulation by positional modification of nucleosides | |
| AU2006203435B2 (en) | Modulation of immunostimulatory activity of immunostimulatory oligonucleotide analogs by positional chemical changes | |
| EP1840132A2 (en) | Modulation of immunostimulatory activity of immunostimulatory oligonucleotide analogs by positional chemical changes |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20080925 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20080925 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20111115 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20120213 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20120220 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20120314 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20120322 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20120416 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20120423 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20120515 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20120612 |