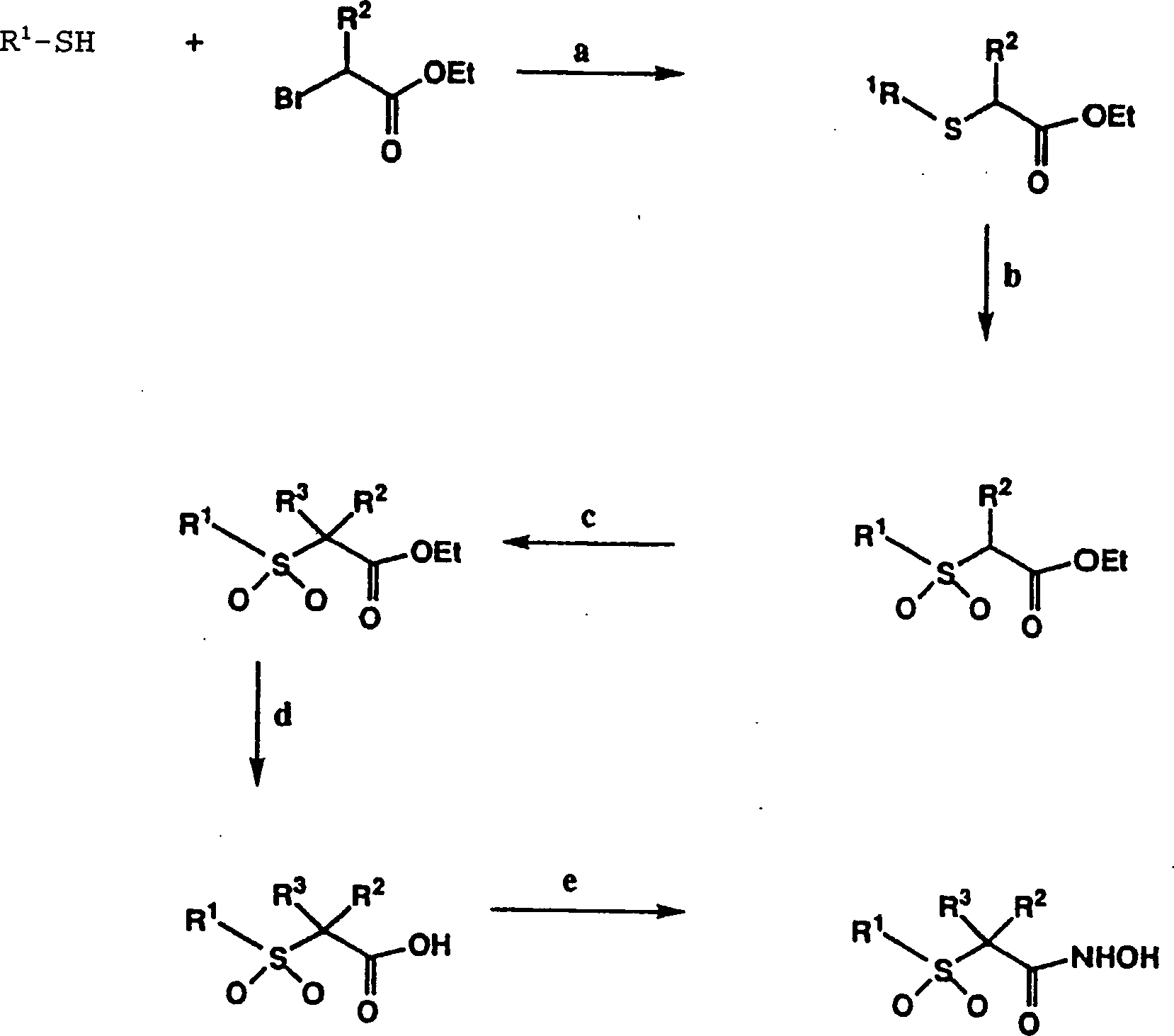
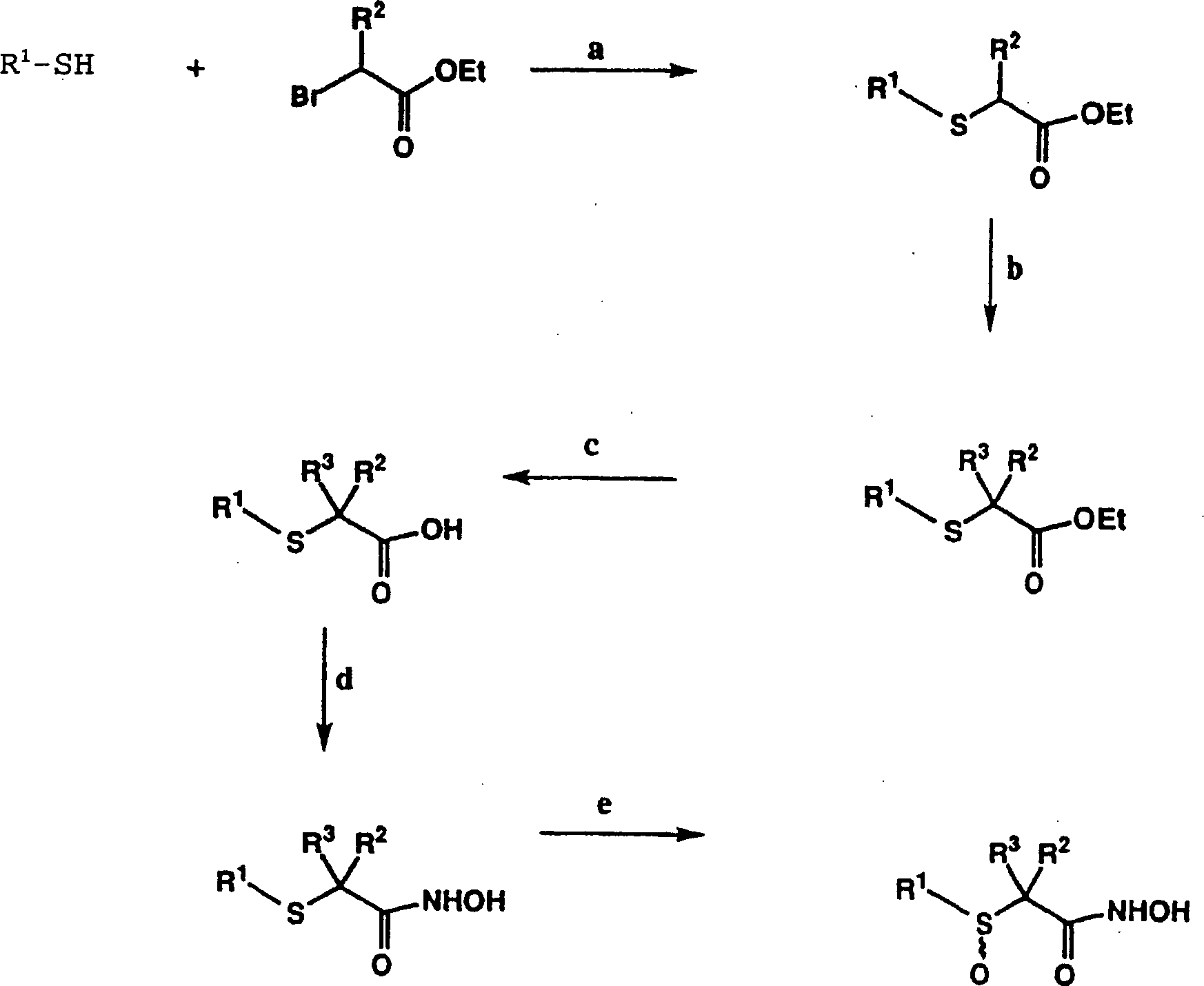
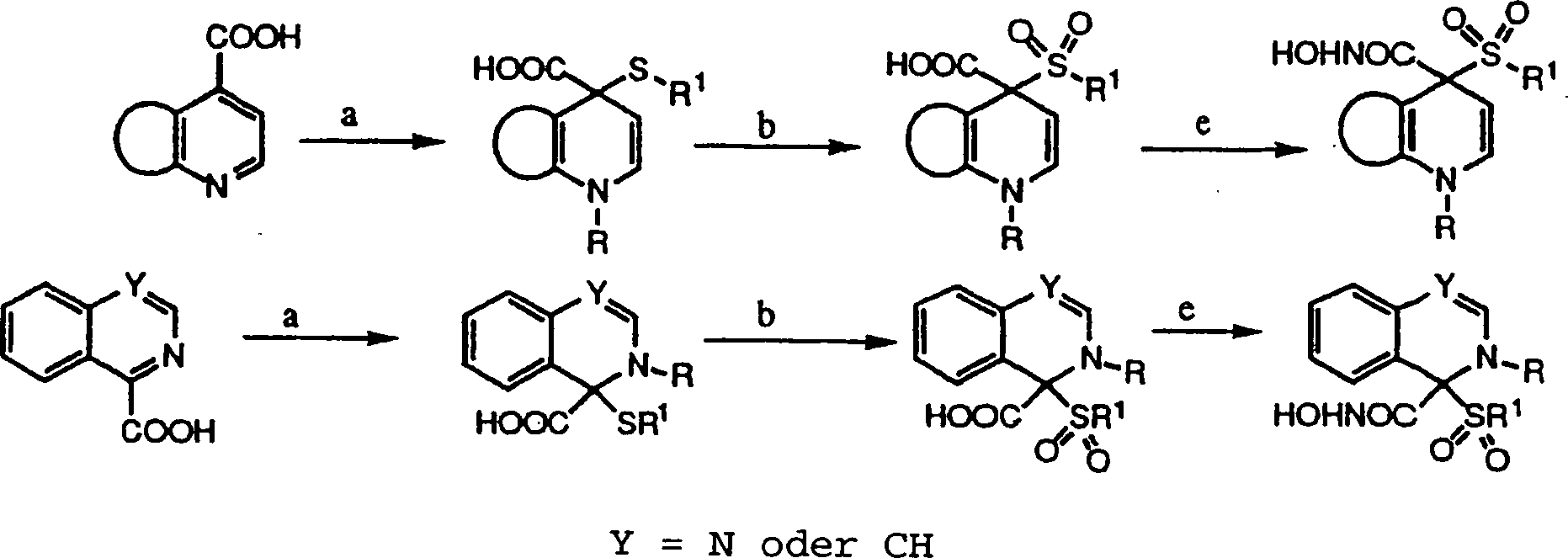
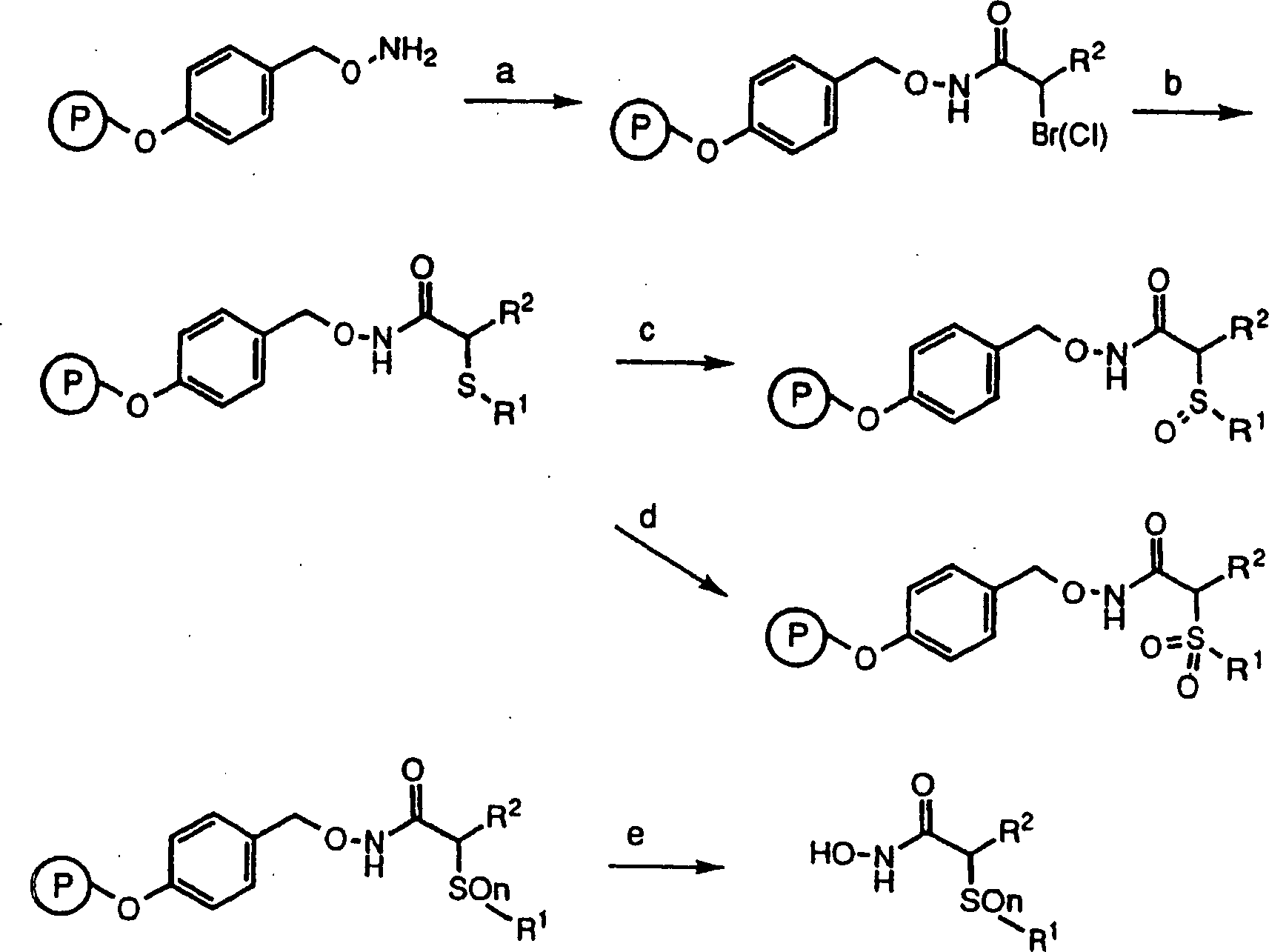
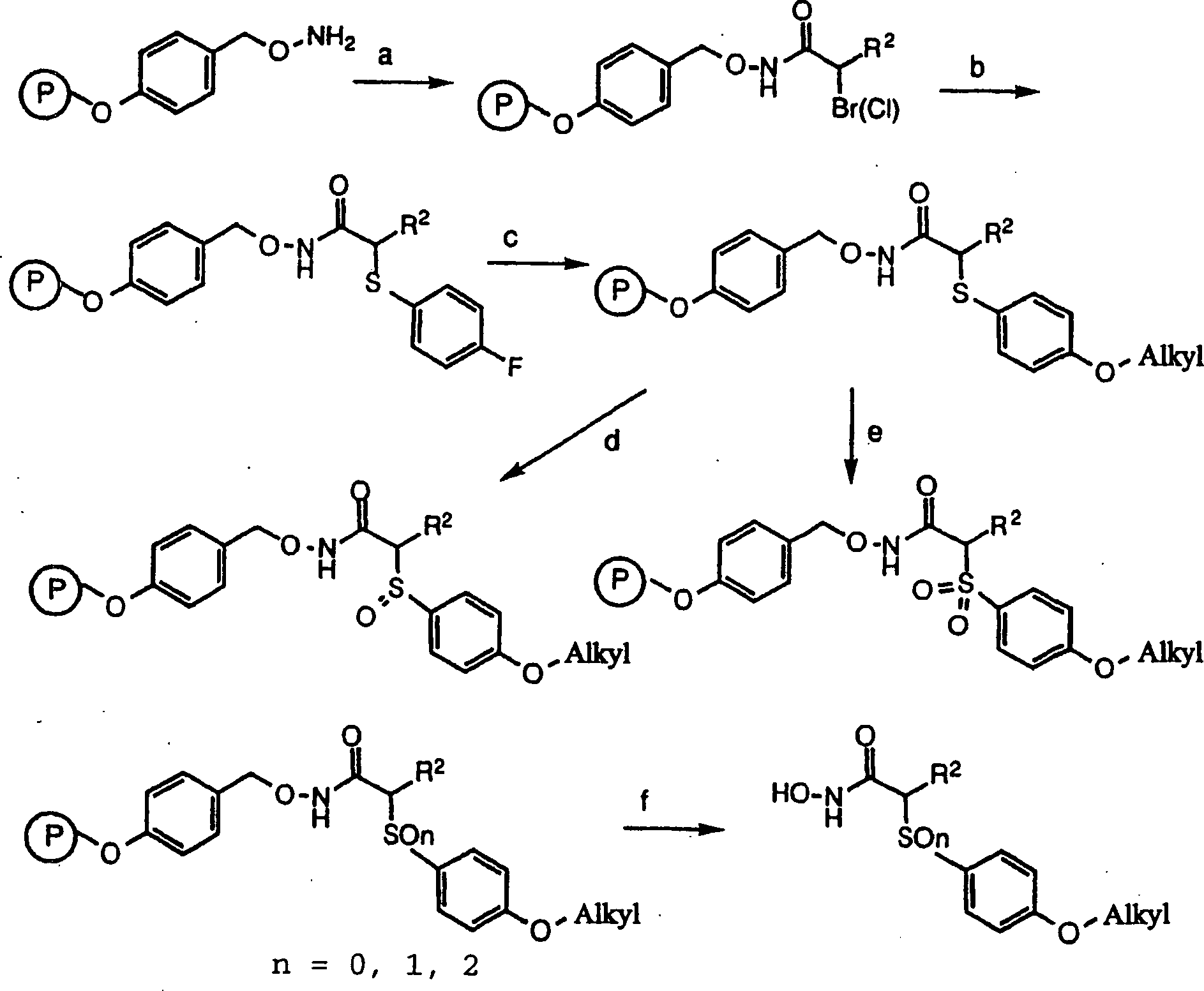
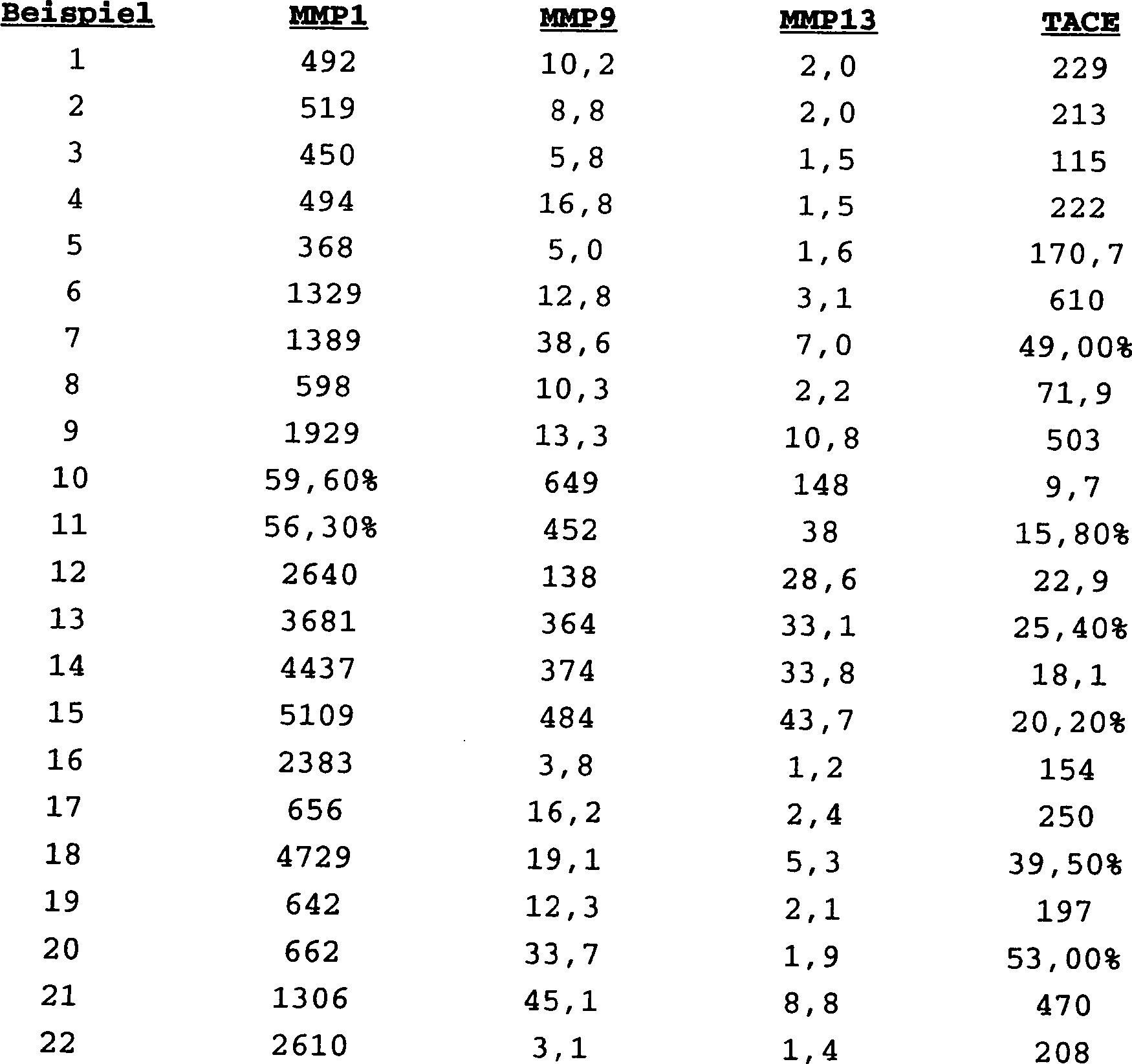
DE69823019T2 - N-hydroxy-2-(alkyl, aryl oder heteroaryl sulfanyl, sulfinyl oder sulfonyl)-3-substituierte alkyl-, aryl- oder heteroarylamide als matrixmetalloproteinaseinhibitoren - Google Patents
N-hydroxy-2-(alkyl, aryl oder heteroaryl sulfanyl, sulfinyl oder sulfonyl)-3-substituierte alkyl-, aryl- oder heteroarylamide als matrixmetalloproteinaseinhibitoren Download PDFInfo
- Publication number
- DE69823019T2 DE69823019T2 DE69823019T DE69823019T DE69823019T2 DE 69823019 T2 DE69823019 T2 DE 69823019T2 DE 69823019 T DE69823019 T DE 69823019T DE 69823019 T DE69823019 T DE 69823019T DE 69823019 T2 DE69823019 T2 DE 69823019T2
- Authority
- DE
- Germany
- Prior art keywords
- alkyl
- independently selected
- aryl
- optionally substituted
- benzenesulfonyl
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
- 239000003771 matrix metalloproteinase inhibitor Substances 0.000 title description 3
- 229940121386 matrix metalloproteinase inhibitor Drugs 0.000 title description 3
- RAHZWNYVWXNFOC-UHFFFAOYSA-N Sulphur dioxide Chemical class O=S=O RAHZWNYVWXNFOC-UHFFFAOYSA-N 0.000 title 1
- PXQLVRUNWNTZOS-UHFFFAOYSA-N sulfanyl Chemical class [SH] PXQLVRUNWNTZOS-UHFFFAOYSA-N 0.000 title 1
- XTQHKBHJIVJGKJ-UHFFFAOYSA-N sulfur monoxide Chemical class S=O XTQHKBHJIVJGKJ-UHFFFAOYSA-N 0.000 title 1
- 125000004432 carbon atom Chemical group C* 0.000 claims description 89
- 125000003118 aryl group Chemical group 0.000 claims description 59
- 125000001072 heteroaryl group Chemical group 0.000 claims description 54
- 229910052760 oxygen Inorganic materials 0.000 claims description 46
- 229910052717 sulfur Inorganic materials 0.000 claims description 46
- -1 cyano, amino Chemical group 0.000 claims description 43
- 125000005842 heteroatom Chemical group 0.000 claims description 40
- 150000001875 compounds Chemical class 0.000 claims description 36
- 125000001624 naphthyl group Chemical group 0.000 claims description 33
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 claims description 33
- 125000000217 alkyl group Chemical group 0.000 claims description 23
- 229910052736 halogen Inorganic materials 0.000 claims description 20
- 150000002367 halogens Chemical class 0.000 claims description 20
- 125000002887 hydroxy group Chemical group [H]O* 0.000 claims description 19
- 229920006395 saturated elastomer Polymers 0.000 claims description 19
- 125000002619 bicyclic group Chemical group 0.000 claims description 18
- 125000002618 bicyclic heterocycle group Chemical group 0.000 claims description 18
- 229910052739 hydrogen Inorganic materials 0.000 claims description 18
- 125000002911 monocyclic heterocycle group Chemical group 0.000 claims description 18
- 125000000449 nitro group Chemical group [O-][N+](*)=O 0.000 claims description 18
- 125000002950 monocyclic group Chemical group 0.000 claims description 17
- 125000003342 alkenyl group Chemical group 0.000 claims description 16
- 125000000304 alkynyl group Chemical group 0.000 claims description 16
- 229910052799 carbon Inorganic materials 0.000 claims description 16
- 102000002274 Matrix Metalloproteinases Human genes 0.000 claims description 14
- 108010000684 Matrix Metalloproteinases Proteins 0.000 claims description 14
- 125000000753 cycloalkyl group Chemical group 0.000 claims description 14
- SNOOUWRIMMFWNE-UHFFFAOYSA-M sodium;6-[(3,4,5-trimethoxybenzoyl)amino]hexanoate Chemical compound [Na+].COC1=CC(C(=O)NCCCCCC([O-])=O)=CC(OC)=C1OC SNOOUWRIMMFWNE-UHFFFAOYSA-M 0.000 claims description 14
- 102100031111 Disintegrin and metalloproteinase domain-containing protein 17 Human genes 0.000 claims description 13
- 229910052757 nitrogen Inorganic materials 0.000 claims description 12
- 239000003814 drug Substances 0.000 claims description 11
- 150000001602 bicycloalkyls Chemical group 0.000 claims description 10
- BFPSDSIWYFKGBC-UHFFFAOYSA-N chlorotrianisene Chemical compound C1=CC(OC)=CC=C1C(Cl)=C(C=1C=CC(OC)=CC=1)C1=CC=C(OC)C=C1 BFPSDSIWYFKGBC-UHFFFAOYSA-N 0.000 claims description 10
- 229940079593 drug Drugs 0.000 claims description 10
- 229910052801 chlorine Inorganic materials 0.000 claims description 9
- 150000003839 salts Chemical class 0.000 claims description 9
- 125000004104 aryloxy group Chemical group 0.000 claims description 8
- ZUOUZKKEUPVFJK-UHFFFAOYSA-N diphenyl Chemical compound C1=CC=CC=C1C1=CC=CC=C1 ZUOUZKKEUPVFJK-UHFFFAOYSA-N 0.000 claims description 8
- 125000005553 heteroaryloxy group Chemical group 0.000 claims description 8
- 125000000623 heterocyclic group Chemical group 0.000 claims description 7
- 125000006663 (C1-C6) perfluoroalkyl group Chemical group 0.000 claims description 6
- 125000006711 (C2-C12) alkynyl group Chemical group 0.000 claims description 6
- JSWNZVXGNOTJIM-UHFFFAOYSA-N 1-[(3,4-dichlorophenyl)methyl]-4-(4-methoxyphenyl)sulfonylpiperidine-4-carboxylic acid Chemical compound C1=CC(OC)=CC=C1S(=O)(=O)C1(C(O)=O)CCN(CC=2C=C(Cl)C(Cl)=CC=2)CC1 JSWNZVXGNOTJIM-UHFFFAOYSA-N 0.000 claims description 6
- JBQHDBBLSWCKPO-UHFFFAOYSA-N 4-(4-methoxyphenyl)sulfonyl-1-(3-methylbut-2-enyl)piperidine-4-carboxylic acid Chemical compound C1=CC(OC)=CC=C1S(=O)(=O)C1(C(O)=O)CCN(CC=C(C)C)CC1 JBQHDBBLSWCKPO-UHFFFAOYSA-N 0.000 claims description 6
- HKMTZJUWMOYMCB-UHFFFAOYSA-N 4-(4-methoxyphenyl)sulfonyl-1-[(4-methylphenyl)methyl]piperidine-4-carboxylic acid Chemical compound C1=CC(OC)=CC=C1S(=O)(=O)C1(C(O)=O)CCN(CC=2C=CC(C)=CC=2)CC1 HKMTZJUWMOYMCB-UHFFFAOYSA-N 0.000 claims description 6
- JXNPCFNODXHENK-UHFFFAOYSA-N 4-(4-methoxyphenyl)sulfonyl-1-[(4-phenylphenyl)methyl]piperidine-4-carboxylic acid Chemical compound C1=CC(OC)=CC=C1S(=O)(=O)C1(C(O)=O)CCN(CC=2C=CC(=CC=2)C=2C=CC=CC=2)CC1 JXNPCFNODXHENK-UHFFFAOYSA-N 0.000 claims description 6
- 125000003341 7 membered heterocyclic group Chemical group 0.000 claims description 6
- 125000005018 aryl alkenyl group Chemical group 0.000 claims description 6
- 125000003710 aryl alkyl group Chemical group 0.000 claims description 6
- 229910052794 bromium Inorganic materials 0.000 claims description 6
- 125000001316 cycloalkyl alkyl group Chemical group 0.000 claims description 6
- 229910052731 fluorine Inorganic materials 0.000 claims description 6
- 239000001257 hydrogen Substances 0.000 claims description 6
- 125000004435 hydrogen atom Chemical class [H]* 0.000 claims description 6
- 229910052740 iodine Inorganic materials 0.000 claims description 6
- 125000000896 monocarboxylic acid group Chemical group 0.000 claims description 6
- 125000004430 oxygen atom Chemical group O* 0.000 claims description 6
- 239000008194 pharmaceutical composition Substances 0.000 claims description 6
- WBTLASDHZWDFMT-UHFFFAOYSA-N 4-(4-methoxyphenyl)sulfonyl-2-methyl-1-naphthalen-2-ylpiperidine-4-carboxylic acid Chemical compound C1=CC(OC)=CC=C1S(=O)(=O)C1(C(O)=O)CC(C)N(C=2C=C3C=CC=CC3=CC=2)CC1 WBTLASDHZWDFMT-UHFFFAOYSA-N 0.000 claims description 5
- 239000003937 drug carrier Substances 0.000 claims description 5
- YMQWZRPLMNNHEU-UHFFFAOYSA-N 1-[(4-bromophenyl)methyl]-n-hydroxy-4-(4-methoxyphenyl)sulfonylpiperidine-4-carboxamide Chemical compound C1=CC(OC)=CC=C1S(=O)(=O)C1(C(=O)NO)CCN(CC=2C=CC(Br)=CC=2)CC1 YMQWZRPLMNNHEU-UHFFFAOYSA-N 0.000 claims description 4
- HYZDHISHDZBYBQ-UHFFFAOYSA-N 1-[(4-fluorophenyl)methyl]-n-hydroxy-4-(4-methoxyphenyl)sulfonylpiperidine-4-carboxamide Chemical compound C1=CC(OC)=CC=C1S(=O)(=O)C1(C(=O)NO)CCN(CC=2C=CC(F)=CC=2)CC1 HYZDHISHDZBYBQ-UHFFFAOYSA-N 0.000 claims description 4
- SRPXVKQVZQEPFT-UHFFFAOYSA-N 1-benzyl-4-(4-butoxyphenyl)sulfonyl-n-hydroxypiperidine-4-carboxamide Chemical compound C1=CC(OCCCC)=CC=C1S(=O)(=O)C1(C(=O)NO)CCN(CC=2C=CC=CC=2)CC1 SRPXVKQVZQEPFT-UHFFFAOYSA-N 0.000 claims description 4
- NZSGHPOSLLMCJS-UHFFFAOYSA-N 1-benzyl-n-hydroxy-4-(4-methoxyphenyl)sulfonylpiperidine-4-carboxamide Chemical compound C1=CC(OC)=CC=C1S(=O)(=O)C1(C(=O)NO)CCN(CC=2C=CC=CC=2)CC1 NZSGHPOSLLMCJS-UHFFFAOYSA-N 0.000 claims description 4
- UZVVYDVVOHQVFV-UHFFFAOYSA-N 1-butyl-n-hydroxy-4-(4-methoxyphenyl)sulfonylpiperidine-4-carboxamide Chemical compound C1CN(CCCC)CCC1(C(=O)NO)S(=O)(=O)C1=CC=C(OC)C=C1 UZVVYDVVOHQVFV-UHFFFAOYSA-N 0.000 claims description 4
- GJICTISPMDMSQH-UHFFFAOYSA-N 1-cyclooctyl-n-hydroxy-4-(4-methoxyphenyl)sulfonylpiperidine-4-carboxamide Chemical compound C1=CC(OC)=CC=C1S(=O)(=O)C1(C(=O)NO)CCN(C2CCCCCCC2)CC1 GJICTISPMDMSQH-UHFFFAOYSA-N 0.000 claims description 4
- MWFBMGWABXFCCK-UHFFFAOYSA-N 1-ethyl-n-hydroxy-4-(4-methoxyphenyl)sulfonylpiperidine-4-carboxamide Chemical compound C1CN(CC)CCC1(C(=O)NO)S(=O)(=O)C1=CC=C(OC)C=C1 MWFBMGWABXFCCK-UHFFFAOYSA-N 0.000 claims description 4
- QZAKHVZDCIZWMH-UHFFFAOYSA-N 4-(4-butoxyphenyl)sulfonyl-1-[(4-fluorophenyl)methyl]-n-hydroxypiperidine-4-carboxamide Chemical compound C1=CC(OCCCC)=CC=C1S(=O)(=O)C1(C(=O)NO)CCN(CC=2C=CC(F)=CC=2)CC1 QZAKHVZDCIZWMH-UHFFFAOYSA-N 0.000 claims description 4
- GMRJGTBNERTZIB-UHFFFAOYSA-N 4-(4-butoxyphenyl)sulfonyl-n-hydroxy-1-(2-phenoxyethyl)piperidine-4-carboxamide Chemical compound C1=CC(OCCCC)=CC=C1S(=O)(=O)C1(C(=O)NO)CCN(CCOC=2C=CC=CC=2)CC1 GMRJGTBNERTZIB-UHFFFAOYSA-N 0.000 claims description 4
- WWVKBGIBCFSFOJ-UHFFFAOYSA-N 4-(4-butoxyphenyl)sulfonyl-n-hydroxy-1-(3-phenoxypropyl)piperidine-4-carboxamide Chemical compound C1=CC(OCCCC)=CC=C1S(=O)(=O)C1(C(=O)NO)CCN(CCCOC=2C=CC=CC=2)CC1 WWVKBGIBCFSFOJ-UHFFFAOYSA-N 0.000 claims description 4
- 239000004305 biphenyl Substances 0.000 claims description 4
- 235000010290 biphenyl Nutrition 0.000 claims description 4
- 230000002401 inhibitory effect Effects 0.000 claims description 4
- 230000001404 mediated effect Effects 0.000 claims description 4
- VUXKPYYMTYYYCJ-UHFFFAOYSA-N n-hydroxy-1-[2-(4-methoxyphenyl)ethyl]-4-(4-methoxyphenyl)sulfonylpiperidine-4-carboxamide Chemical compound C1=CC(OC)=CC=C1CCN1CCC(S(=O)(=O)C=2C=CC(OC)=CC=2)(C(=O)NO)CC1 VUXKPYYMTYYYCJ-UHFFFAOYSA-N 0.000 claims description 4
- YJOSMOCGEMCNLK-UHFFFAOYSA-N n-hydroxy-4-(4-methoxyphenyl)sulfonyl-1-(2-phenoxyethyl)piperidine-4-carboxamide Chemical compound C1=CC(OC)=CC=C1S(=O)(=O)C1(C(=O)NO)CCN(CCOC=2C=CC=CC=2)CC1 YJOSMOCGEMCNLK-UHFFFAOYSA-N 0.000 claims description 4
- KASLMAICRUMQME-UHFFFAOYSA-N n-hydroxy-4-(4-methoxyphenyl)sulfonyl-1-(2-phenylethyl)piperidine-4-carboxamide Chemical compound C1=CC(OC)=CC=C1S(=O)(=O)C1(C(=O)NO)CCN(CCC=2C=CC=CC=2)CC1 KASLMAICRUMQME-UHFFFAOYSA-N 0.000 claims description 4
- FBLQAKOTTHGGBJ-UHFFFAOYSA-N n-hydroxy-4-(4-methoxyphenyl)sulfonyl-1-(3-phenoxypropyl)piperidine-4-carboxamide Chemical compound C1=CC(OC)=CC=C1S(=O)(=O)C1(C(=O)NO)CCN(CCCOC=2C=CC=CC=2)CC1 FBLQAKOTTHGGBJ-UHFFFAOYSA-N 0.000 claims description 4
- FTWZRZIOCFAVKU-UHFFFAOYSA-N n-hydroxy-4-(4-methoxyphenyl)sulfonyl-1-(3-phenylpropyl)piperidine-4-carboxamide Chemical compound C1=CC(OC)=CC=C1S(=O)(=O)C1(C(=O)NO)CCN(CCCC=2C=CC=CC=2)CC1 FTWZRZIOCFAVKU-UHFFFAOYSA-N 0.000 claims description 4
- RBRSAOMOZVVQSQ-UHFFFAOYSA-N n-hydroxy-4-(4-methoxyphenyl)sulfonyl-1-methylpiperidine-4-carboxamide Chemical compound C1=CC(OC)=CC=C1S(=O)(=O)C1(C(=O)NO)CCN(C)CC1 RBRSAOMOZVVQSQ-UHFFFAOYSA-N 0.000 claims description 4
- IEGOFALJZJPJJD-UHFFFAOYSA-N n-hydroxy-4-(4-methoxyphenyl)sulfonyl-1-propan-2-ylpiperidine-4-carboxamide Chemical compound C1=CC(OC)=CC=C1S(=O)(=O)C1(C(=O)NO)CCN(C(C)C)CC1 IEGOFALJZJPJJD-UHFFFAOYSA-N 0.000 claims description 4
- 125000005010 perfluoroalkyl group Chemical group 0.000 claims description 4
- NAXMTMYDSBOGMZ-UHFFFAOYSA-N 4-(4-butoxyphenyl)sulfonyl-n-hydroxy-1-[(4-methoxyphenyl)methyl]piperidine-4-carboxamide Chemical compound C1=CC(OCCCC)=CC=C1S(=O)(=O)C1(C(=O)NO)CCN(CC=2C=CC(OC)=CC=2)CC1 NAXMTMYDSBOGMZ-UHFFFAOYSA-N 0.000 claims description 3
- 108091007505 ADAM17 Proteins 0.000 claims description 3
- LCQNQVIUMDNDJS-UHFFFAOYSA-N n-hydroxy-1-[(3-methoxyphenyl)methyl]-4-(4-methoxyphenyl)sulfonylpiperidine-4-carboxamide Chemical compound C1=CC(OC)=CC=C1S(=O)(=O)C1(C(=O)NO)CCN(CC=2C=C(OC)C=CC=2)CC1 LCQNQVIUMDNDJS-UHFFFAOYSA-N 0.000 claims description 3
- KLYIBVBIKFMTRO-UHFFFAOYSA-N n-hydroxy-1-[(4-methoxyphenyl)methyl]-4-(4-methoxyphenyl)sulfonylpiperidine-4-carboxamide Chemical compound C1=CC(OC)=CC=C1CN1CCC(S(=O)(=O)C=2C=CC(OC)=CC=2)(C(=O)NO)CC1 KLYIBVBIKFMTRO-UHFFFAOYSA-N 0.000 claims description 3
- PRBMKJZQAUSBQV-UHFFFAOYSA-N n-hydroxy-4-(4-methoxyphenyl)sulfonyl-1-[[4-(2-piperidin-1-ylethoxy)phenyl]methyl]piperidine-4-carboxamide Chemical compound C1=CC(OC)=CC=C1S(=O)(=O)C1(C(=O)NO)CCN(CC=2C=CC(OCCN3CCCCC3)=CC=2)CC1 PRBMKJZQAUSBQV-UHFFFAOYSA-N 0.000 claims description 3
- 125000005530 alkylenedioxy group Chemical group 0.000 claims description 2
- 125000002541 furyl group Chemical group 0.000 claims description 2
- 125000002883 imidazolyl group Chemical group 0.000 claims description 2
- 238000002360 preparation method Methods 0.000 claims description 2
- 125000004076 pyridyl group Chemical group 0.000 claims description 2
- 125000001544 thienyl group Chemical group 0.000 claims description 2
- QJGQUHMNIGDVPM-UHFFFAOYSA-N nitrogen group Chemical group [N] QJGQUHMNIGDVPM-UHFFFAOYSA-N 0.000 claims 3
- 241000124008 Mammalia Species 0.000 claims 2
- 231100000915 pathological change Toxicity 0.000 claims 2
- 230000036285 pathological change Effects 0.000 claims 2
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 129
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 114
- 238000000034 method Methods 0.000 description 86
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 82
- 239000007787 solid Substances 0.000 description 62
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 50
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 43
- 239000011541 reaction mixture Substances 0.000 description 42
- 239000003921 oil Substances 0.000 description 37
- 235000019198 oils Nutrition 0.000 description 36
- 238000005481 NMR spectroscopy Methods 0.000 description 26
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 24
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 23
- GQHTUMJGOHRCHB-UHFFFAOYSA-N 2,3,4,6,7,8,9,10-octahydropyrimido[1,2-a]azepine Chemical compound C1CCCCN2CCCN=C21 GQHTUMJGOHRCHB-UHFFFAOYSA-N 0.000 description 22
- 239000000843 powder Substances 0.000 description 19
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 18
- ZBCBWPMODOFKDW-UHFFFAOYSA-N diethanolamine Chemical compound OCCNCCO ZBCBWPMODOFKDW-UHFFFAOYSA-N 0.000 description 16
- 239000000203 mixture Substances 0.000 description 15
- FVAUCKIRQBBSSJ-UHFFFAOYSA-M sodium iodide Chemical compound [Na+].[I-] FVAUCKIRQBBSSJ-UHFFFAOYSA-M 0.000 description 15
- 239000002253 acid Substances 0.000 description 14
- 238000006243 chemical reaction Methods 0.000 description 14
- BWHMMNNQKKPAPP-UHFFFAOYSA-L potassium carbonate Chemical compound [K+].[K+].[O-]C([O-])=O BWHMMNNQKKPAPP-UHFFFAOYSA-L 0.000 description 14
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 13
- AVXURJPOCDRRFD-UHFFFAOYSA-N Hydroxylamine Chemical compound ON AVXURJPOCDRRFD-UHFFFAOYSA-N 0.000 description 13
- 239000000243 solution Substances 0.000 description 13
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 description 12
- CTSLXHKWHWQRSH-UHFFFAOYSA-N oxalyl chloride Chemical compound ClC(=O)C(Cl)=O CTSLXHKWHWQRSH-UHFFFAOYSA-N 0.000 description 12
- 238000010992 reflux Methods 0.000 description 12
- 239000000758 substrate Substances 0.000 description 12
- 239000007788 liquid Substances 0.000 description 11
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 11
- NEAQRZUHTPSBBM-UHFFFAOYSA-N 2-hydroxy-3,3-dimethyl-7-nitro-4h-isoquinolin-1-one Chemical class C1=C([N+]([O-])=O)C=C2C(=O)N(O)C(C)(C)CC2=C1 NEAQRZUHTPSBBM-UHFFFAOYSA-N 0.000 description 10
- CIHOLLKRGTVIJN-UHFFFAOYSA-N tert‐butyl hydroperoxide Chemical compound CC(C)(C)OO CIHOLLKRGTVIJN-UHFFFAOYSA-N 0.000 description 10
- 102000013382 Gelatinases Human genes 0.000 description 9
- 108010026132 Gelatinases Proteins 0.000 description 9
- 239000012442 inert solvent Substances 0.000 description 9
- 238000002844 melting Methods 0.000 description 9
- XEZNGIUYQVAUSS-UHFFFAOYSA-N 18-crown-6 Chemical compound C1COCCOCCOCCOCCOCCO1 XEZNGIUYQVAUSS-UHFFFAOYSA-N 0.000 description 8
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 8
- NHQDETIJWKXCTC-UHFFFAOYSA-N 3-chloroperbenzoic acid Chemical compound OOC(=O)C1=CC=CC(Cl)=C1 NHQDETIJWKXCTC-UHFFFAOYSA-N 0.000 description 7
- 239000004480 active ingredient Substances 0.000 description 7
- 239000003795 chemical substances by application Substances 0.000 description 7
- 150000002148 esters Chemical class 0.000 description 7
- 229910000027 potassium carbonate Inorganic materials 0.000 description 7
- 239000011347 resin Substances 0.000 description 7
- 229920005989 resin Polymers 0.000 description 7
- 125000000954 2-hydroxyethyl group Chemical group [H]C([*])([H])C([H])([H])O[H] 0.000 description 6
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 6
- 102000029816 Collagenase Human genes 0.000 description 6
- 108060005980 Collagenase Proteins 0.000 description 6
- 229910017912 NH2OH Inorganic materials 0.000 description 6
- 230000015572 biosynthetic process Effects 0.000 description 6
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 6
- 125000001475 halogen functional group Chemical group 0.000 description 6
- NPZTUJOABDZTLV-UHFFFAOYSA-N hydroxybenzotriazole Substances O=C1C=CC=C2NNN=C12 NPZTUJOABDZTLV-UHFFFAOYSA-N 0.000 description 6
- 239000003826 tablet Substances 0.000 description 6
- 238000012360 testing method Methods 0.000 description 6
- FYSNRJHAOHDILO-UHFFFAOYSA-N thionyl chloride Chemical compound ClS(Cl)=O FYSNRJHAOHDILO-UHFFFAOYSA-N 0.000 description 6
- DTQVDTLACAAQTR-UHFFFAOYSA-N trifluoroacetic acid Substances OC(=O)C(F)(F)F DTQVDTLACAAQTR-UHFFFAOYSA-N 0.000 description 6
- BDNKZNFMNDZQMI-UHFFFAOYSA-N 1,3-diisopropylcarbodiimide Chemical compound CC(C)N=C=NC(C)C BDNKZNFMNDZQMI-UHFFFAOYSA-N 0.000 description 5
- KIUMMUBSPKGMOY-UHFFFAOYSA-N 3,3'-Dithiobis(6-nitrobenzoic acid) Chemical compound C1=C([N+]([O-])=O)C(C(=O)O)=CC(SSC=2C=C(C(=CC=2)[N+]([O-])=O)C(O)=O)=C1 KIUMMUBSPKGMOY-UHFFFAOYSA-N 0.000 description 5
- 102000004190 Enzymes Human genes 0.000 description 5
- 108090000790 Enzymes Proteins 0.000 description 5
- 206010028980 Neoplasm Diseases 0.000 description 5
- 238000003556 assay Methods 0.000 description 5
- SRSXLGNVWSONIS-UHFFFAOYSA-N benzenesulfonic acid Chemical compound OS(=O)(=O)C1=CC=CC=C1 SRSXLGNVWSONIS-UHFFFAOYSA-N 0.000 description 5
- 229940092714 benzenesulfonic acid Drugs 0.000 description 5
- 239000003153 chemical reaction reagent Substances 0.000 description 5
- 229960002424 collagenase Drugs 0.000 description 5
- 239000002552 dosage form Substances 0.000 description 5
- 229940088598 enzyme Drugs 0.000 description 5
- 125000005843 halogen group Chemical group 0.000 description 5
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical class CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 5
- 239000012044 organic layer Substances 0.000 description 5
- 230000008569 process Effects 0.000 description 5
- 108090000765 processed proteins & peptides Proteins 0.000 description 5
- 235000009518 sodium iodide Nutrition 0.000 description 5
- 125000000475 sulfinyl group Chemical group [*:2]S([*:1])=O 0.000 description 5
- CYPYTURSJDMMMP-WVCUSYJESA-N (1e,4e)-1,5-diphenylpenta-1,4-dien-3-one;palladium Chemical compound [Pd].[Pd].C=1C=CC=CC=1\C=C\C(=O)\C=C\C1=CC=CC=C1.C=1C=CC=CC=1\C=C\C(=O)\C=C\C1=CC=CC=C1.C=1C=CC=CC=1\C=C\C(=O)\C=C\C1=CC=CC=C1 CYPYTURSJDMMMP-WVCUSYJESA-N 0.000 description 4
- MZOFCQQQCNRIBI-VMXHOPILSA-N (3s)-4-[[(2s)-1-[[(2s)-1-[[(1s)-1-carboxy-2-hydroxyethyl]amino]-4-methyl-1-oxopentan-2-yl]amino]-5-(diaminomethylideneamino)-1-oxopentan-2-yl]amino]-3-[[2-[[(2s)-2,6-diaminohexanoyl]amino]acetyl]amino]-4-oxobutanoic acid Chemical compound OC[C@@H](C(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CCCN=C(N)N)NC(=O)[C@H](CC(O)=O)NC(=O)CNC(=O)[C@@H](N)CCCCN MZOFCQQQCNRIBI-VMXHOPILSA-N 0.000 description 4
- ASOKPJOREAFHNY-UHFFFAOYSA-N 1-Hydroxybenzotriazole Chemical compound C1=CC=C2N(O)N=NC2=C1 ASOKPJOREAFHNY-UHFFFAOYSA-N 0.000 description 4
- UZZOWBRNVGRWPV-UHFFFAOYSA-N 4-(4-methoxyphenyl)sulfonyl-1-[[4-(2-piperidin-1-ylethoxy)phenyl]methyl]piperidine-4-carboxylic acid Chemical compound C1=CC(OC)=CC=C1S(=O)(=O)C1(C(O)=O)CCN(CC=2C=CC(OCCN3CCCCC3)=CC=2)CC1 UZZOWBRNVGRWPV-UHFFFAOYSA-N 0.000 description 4
- CDBYLPFSWZWCQE-UHFFFAOYSA-L Sodium Carbonate Chemical compound [Na+].[Na+].[O-]C([O-])=O CDBYLPFSWZWCQE-UHFFFAOYSA-L 0.000 description 4
- UCKMPCXJQFINFW-UHFFFAOYSA-N Sulphide Chemical compound [S-2] UCKMPCXJQFINFW-UHFFFAOYSA-N 0.000 description 4
- 108060008682 Tumor Necrosis Factor Proteins 0.000 description 4
- 102000000852 Tumor Necrosis Factor-alpha Human genes 0.000 description 4
- 239000000872 buffer Substances 0.000 description 4
- 239000000969 carrier Substances 0.000 description 4
- 239000000428 dust Substances 0.000 description 4
- 238000007429 general method Methods 0.000 description 4
- 230000008018 melting Effects 0.000 description 4
- NFHFRUOZVGFOOS-UHFFFAOYSA-N palladium;triphenylphosphane Chemical compound [Pd].C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1 NFHFRUOZVGFOOS-UHFFFAOYSA-N 0.000 description 4
- 238000007911 parenteral administration Methods 0.000 description 4
- MFRIHAYPQRLWNB-UHFFFAOYSA-N sodium tert-butoxide Chemical compound [Na+].CC(C)(C)[O-] MFRIHAYPQRLWNB-UHFFFAOYSA-N 0.000 description 4
- 238000003786 synthesis reaction Methods 0.000 description 4
- HQAGKFIGCAJZKE-UHFFFAOYSA-N 1-[(4-methoxyphenyl)methyl]-4-(4-methoxyphenyl)sulfonylpiperidine-4-carboxylic acid Chemical compound C1=CC(OC)=CC=C1CN1CCC(S(=O)(=O)C=2C=CC(OC)=CC=2)(C(O)=O)CC1 HQAGKFIGCAJZKE-UHFFFAOYSA-N 0.000 description 3
- JKMHFZQWWAIEOD-UHFFFAOYSA-N 2-[4-(2-hydroxyethyl)piperazin-1-yl]ethanesulfonic acid Chemical compound OCC[NH+]1CCN(CCS([O-])(=O)=O)CC1 JKMHFZQWWAIEOD-UHFFFAOYSA-N 0.000 description 3
- RLIOBDUNWLJVRN-UHFFFAOYSA-N 4-(4-butoxyphenyl)sulfonyl-1-[(4-methoxyphenyl)methyl]piperidine-4-carboxylic acid Chemical compound C1=CC(OCCCC)=CC=C1S(=O)(=O)C1(C(O)=O)CCN(CC=2C=CC(OC)=CC=2)CC1 RLIOBDUNWLJVRN-UHFFFAOYSA-N 0.000 description 3
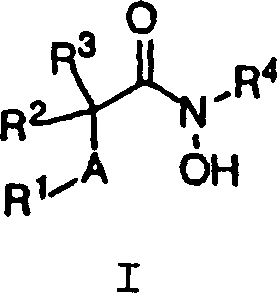
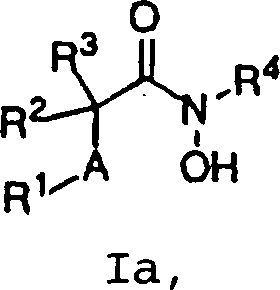
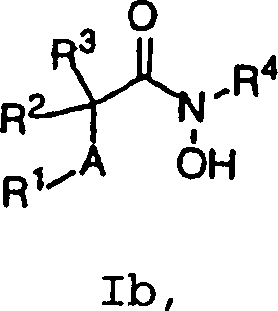
- 0 C*C(*)C(NOCc(cc1)ccc1OC1=CC=CC1)=O Chemical compound C*C(*)C(NOCc(cc1)ccc1OC1=CC=CC1)=O 0.000 description 3
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 3
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 3
- 239000007995 HEPES buffer Substances 0.000 description 3
- 102000000380 Matrix Metalloproteinase 1 Human genes 0.000 description 3
- 108010016113 Matrix Metalloproteinase 1 Proteins 0.000 description 3
- 150000001412 amines Chemical class 0.000 description 3
- 239000012131 assay buffer Substances 0.000 description 3
- 239000002775 capsule Substances 0.000 description 3
- 239000012230 colorless oil Substances 0.000 description 3
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 3
- 231100000673 dose–response relationship Toxicity 0.000 description 3
- 230000000694 effects Effects 0.000 description 3
- 239000003112 inhibitor Substances 0.000 description 3
- 238000012417 linear regression Methods 0.000 description 3
- 239000000314 lubricant Substances 0.000 description 3
- 238000004519 manufacturing process Methods 0.000 description 3
- URLYFRDHCDGEPS-UHFFFAOYSA-N n,n-bis(2-chloroethyl)-2-phenoxyethanamine Chemical compound ClCCN(CCCl)CCOC1=CC=CC=C1 URLYFRDHCDGEPS-UHFFFAOYSA-N 0.000 description 3
- SFQOTBMYWKTJKF-UHFFFAOYSA-N n,n-bis(2-chloroethyl)-3-phenoxypropan-1-amine Chemical compound ClCCN(CCCl)CCCOC1=CC=CC=C1 SFQOTBMYWKTJKF-UHFFFAOYSA-N 0.000 description 3
- 159000000001 potassium salts Chemical class 0.000 description 3
- 238000011160 research Methods 0.000 description 3
- 238000003756 stirring Methods 0.000 description 3
- 150000003457 sulfones Chemical class 0.000 description 3
- 125000000472 sulfonyl group Chemical group *S(*)(=O)=O 0.000 description 3
- MYRTYDVEIRVNKP-UHFFFAOYSA-N 1,2-Divinylbenzene Chemical compound C=CC1=CC=CC=C1C=C MYRTYDVEIRVNKP-UHFFFAOYSA-N 0.000 description 2
- RYHBNJHYFVUHQT-UHFFFAOYSA-N 1,4-Dioxane Chemical compound C1COCCO1 RYHBNJHYFVUHQT-UHFFFAOYSA-N 0.000 description 2
- DUWMUQJJAWJMKE-UHFFFAOYSA-N 1-[(3-methoxyphenyl)methyl]-4-(4-methoxyphenyl)sulfonylpiperidine-4-carboxylic acid Chemical compound C1=CC(OC)=CC=C1S(=O)(=O)C1(C(O)=O)CCN(CC=2C=C(OC)C=CC=2)CC1 DUWMUQJJAWJMKE-UHFFFAOYSA-N 0.000 description 2
- IWSJFFNNOGLAOF-UHFFFAOYSA-N 1-[(4-bromophenyl)methyl]-4-(4-methoxyphenyl)sulfonylpiperidine-4-carboxylic acid Chemical compound C1=CC(OC)=CC=C1S(=O)(=O)C1(C(O)=O)CCN(CC=2C=CC(Br)=CC=2)CC1 IWSJFFNNOGLAOF-UHFFFAOYSA-N 0.000 description 2
- CYUGJLVHBZRKNV-UHFFFAOYSA-N 1-[(4-fluorophenyl)methyl]-4-(4-methoxyphenyl)sulfonylpiperidine-4-carboxylic acid Chemical compound C1=CC(OC)=CC=C1S(=O)(=O)C1(C(O)=O)CCN(CC=2C=CC(F)=CC=2)CC1 CYUGJLVHBZRKNV-UHFFFAOYSA-N 0.000 description 2
- BZJNHCZGKWQZOC-UHFFFAOYSA-N 1-[2-(4-methoxyphenyl)ethyl]-4-(4-methoxyphenyl)sulfonylpiperidine-4-carboxylic acid Chemical compound C1=CC(OC)=CC=C1CCN1CCC(S(=O)(=O)C=2C=CC(OC)=CC=2)(C(O)=O)CC1 BZJNHCZGKWQZOC-UHFFFAOYSA-N 0.000 description 2
- XRTDXBYJYXOWDU-UHFFFAOYSA-N 1-benzyl-4-(4-butoxyphenyl)sulfonylpiperidine-4-carboxylic acid Chemical compound C1=CC(OCCCC)=CC=C1S(=O)(=O)C1(C(O)=O)CCN(CC=2C=CC=CC=2)CC1 XRTDXBYJYXOWDU-UHFFFAOYSA-N 0.000 description 2
- FECLWRWFWSXYKU-UHFFFAOYSA-N 1-benzyl-4-(4-methoxyphenyl)sulfonylpiperidine-4-carboxylic acid Chemical compound C1=CC(OC)=CC=C1S(=O)(=O)C1(C(O)=O)CCN(CC=2C=CC=CC=2)CC1 FECLWRWFWSXYKU-UHFFFAOYSA-N 0.000 description 2
- BSCVECPSZUDOGB-UHFFFAOYSA-N 1-butyl-4-(4-methoxyphenyl)sulfonylpiperidine-4-carboxylic acid Chemical compound C1CN(CCCC)CCC1(C(O)=O)S(=O)(=O)C1=CC=C(OC)C=C1 BSCVECPSZUDOGB-UHFFFAOYSA-N 0.000 description 2
- IRJDDGBEDQOZOG-UHFFFAOYSA-N 1-cyclooctyl-4-(4-methoxyphenyl)sulfonylpiperidine-4-carboxylic acid Chemical compound C1=CC(OC)=CC=C1S(=O)(=O)C1(C(O)=O)CCN(C2CCCCCCC2)CC1 IRJDDGBEDQOZOG-UHFFFAOYSA-N 0.000 description 2
- DWPQQYLEUVZYGC-UHFFFAOYSA-N 1-ethyl-4-(4-methoxyphenyl)sulfonylpiperidine-4-carboxylic acid Chemical compound C1CN(CC)CCC1(C(O)=O)S(=O)(=O)C1=CC=C(OC)C=C1 DWPQQYLEUVZYGC-UHFFFAOYSA-N 0.000 description 2
- DGPTVADDIGLETM-UHFFFAOYSA-N 1-tert-butyl-4-(4-methoxyphenyl)sulfonylpiperidine-4-carboxylic acid Chemical compound C1=CC(OC)=CC=C1S(=O)(=O)C1(C(O)=O)CCN(C(C)(C)C)CC1 DGPTVADDIGLETM-UHFFFAOYSA-N 0.000 description 2
- MLJSRWALBCZDCB-UHFFFAOYSA-N 1-tert-butyl-n-hydroxy-4-(4-methoxyphenyl)sulfonylpiperidine-4-carboxamide Chemical compound C1=CC(OC)=CC=C1S(=O)(=O)C1(C(=O)NO)CCN(C(C)(C)C)CC1 MLJSRWALBCZDCB-UHFFFAOYSA-N 0.000 description 2
- VOUWIXZCTHZNEH-UHFFFAOYSA-N 2-[2-hydroxyethyl(2-phenoxyethyl)amino]ethanol Chemical compound OCCN(CCO)CCOC1=CC=CC=C1 VOUWIXZCTHZNEH-UHFFFAOYSA-N 0.000 description 2
- RMLOQPUPBVVMCO-UHFFFAOYSA-N 2-[2-hydroxyethyl(2-phenylethyl)amino]ethanol Chemical compound OCCN(CCO)CCC1=CC=CC=C1 RMLOQPUPBVVMCO-UHFFFAOYSA-N 0.000 description 2
- DPSFVRWDVCJXKC-UHFFFAOYSA-N 2-[2-hydroxyethyl(3-phenoxypropyl)amino]ethanol Chemical compound OCCN(CCO)CCCOC1=CC=CC=C1 DPSFVRWDVCJXKC-UHFFFAOYSA-N 0.000 description 2
- VDVWWRRBJNNKQD-UHFFFAOYSA-N 2-[2-hydroxyethyl(3-phenylpropyl)amino]ethanol Chemical compound OCCN(CCO)CCCC1=CC=CC=C1 VDVWWRRBJNNKQD-UHFFFAOYSA-N 0.000 description 2
- KORPIWRPEFDZPH-UHFFFAOYSA-N 2-[2-hydroxyethyl-[(3-methoxyphenyl)methyl]amino]ethanol Chemical compound COC1=CC=CC(CN(CCO)CCO)=C1 KORPIWRPEFDZPH-UHFFFAOYSA-N 0.000 description 2
- BRKVKGWERTXEKT-UHFFFAOYSA-N 2-[2-hydroxyethyl-[(4-methoxyphenyl)methyl]amino]ethanol Chemical compound COC1=CC=C(CN(CCO)CCO)C=C1 BRKVKGWERTXEKT-UHFFFAOYSA-N 0.000 description 2
- DUUFGGOWUAPNDI-UHFFFAOYSA-N 2-[2-hydroxyethyl-[(4-methylphenyl)methyl]amino]ethanol Chemical compound CC1=CC=C(CN(CCO)CCO)C=C1 DUUFGGOWUAPNDI-UHFFFAOYSA-N 0.000 description 2
- YAUGGMXSAKUVKA-UHFFFAOYSA-N 2-[2-hydroxyethyl-[2-(4-methoxyphenyl)ethyl]amino]ethanol Chemical compound COC1=CC=C(CCN(CCO)CCO)C=C1 YAUGGMXSAKUVKA-UHFFFAOYSA-N 0.000 description 2
- XFYLJTALUWPUEI-UHFFFAOYSA-N 2-chloro-n-(2-chloroethyl)-n-[(4-fluorophenyl)methyl]ethanamine Chemical compound FC1=CC=C(CN(CCCl)CCCl)C=C1 XFYLJTALUWPUEI-UHFFFAOYSA-N 0.000 description 2
- IHOJMZYAFHCAST-UHFFFAOYSA-N 2-chloro-n-(2-chloroethyl)-n-[[4-(2-piperidin-1-ylethoxy)phenyl]methyl]ethanamine Chemical compound C1=CC(CN(CCCl)CCCl)=CC=C1OCCN1CCCCC1 IHOJMZYAFHCAST-UHFFFAOYSA-N 0.000 description 2
- DDPGQCHQLTZAEW-UHFFFAOYSA-N 4-(4-butoxyphenyl)sulfonyl-1-(2-phenoxyethyl)piperidine-4-carboxylic acid Chemical compound C1=CC(OCCCC)=CC=C1S(=O)(=O)C1(C(O)=O)CCN(CCOC=2C=CC=CC=2)CC1 DDPGQCHQLTZAEW-UHFFFAOYSA-N 0.000 description 2
- AIZQGRMSEBXCNI-UHFFFAOYSA-N 4-(4-butoxyphenyl)sulfonyl-1-(3-phenoxypropyl)piperidine-4-carboxylic acid Chemical compound C1=CC(OCCCC)=CC=C1S(=O)(=O)C1(C(O)=O)CCN(CCCOC=2C=CC=CC=2)CC1 AIZQGRMSEBXCNI-UHFFFAOYSA-N 0.000 description 2
- WNMXWPBLGZBPEV-UHFFFAOYSA-N 4-(4-butoxyphenyl)sulfonyl-1-[(4-fluorophenyl)methyl]piperidine-4-carboxylic acid Chemical compound C1=CC(OCCCC)=CC=C1S(=O)(=O)C1(C(O)=O)CCN(CC=2C=CC(F)=CC=2)CC1 WNMXWPBLGZBPEV-UHFFFAOYSA-N 0.000 description 2
- AEMURECWAJLPNX-UHFFFAOYSA-N 4-(4-methoxyphenyl)sulfonyl-1-(2-phenoxyethyl)piperidine-4-carboxylic acid Chemical compound C1=CC(OC)=CC=C1S(=O)(=O)C1(C(O)=O)CCN(CCOC=2C=CC=CC=2)CC1 AEMURECWAJLPNX-UHFFFAOYSA-N 0.000 description 2
- NIAJIVRYYJLXRC-UHFFFAOYSA-N 4-(4-methoxyphenyl)sulfonyl-1-(2-phenylethyl)piperidine-4-carboxylic acid Chemical compound C1=CC(OC)=CC=C1S(=O)(=O)C1(C(O)=O)CCN(CCC=2C=CC=CC=2)CC1 NIAJIVRYYJLXRC-UHFFFAOYSA-N 0.000 description 2
- ZONWCAFXWCFRRI-UHFFFAOYSA-N 4-(4-methoxyphenyl)sulfonyl-1-(3-phenoxypropyl)piperidine-4-carboxylic acid Chemical compound C1=CC(OC)=CC=C1S(=O)(=O)C1(C(O)=O)CCN(CCCOC=2C=CC=CC=2)CC1 ZONWCAFXWCFRRI-UHFFFAOYSA-N 0.000 description 2
- YENBIMVFSZPGNF-UHFFFAOYSA-N 4-(4-methoxyphenyl)sulfonyl-1-(3-phenylpropyl)piperidine-4-carboxylic acid Chemical compound C1=CC(OC)=CC=C1S(=O)(=O)C1(C(O)=O)CCN(CCCC=2C=CC=CC=2)CC1 YENBIMVFSZPGNF-UHFFFAOYSA-N 0.000 description 2
- FJKQZMAMXQZOFD-UHFFFAOYSA-N 4-(4-methoxyphenyl)sulfonyl-1-methylpiperidine-4-carboxylic acid Chemical compound C1=CC(OC)=CC=C1S(=O)(=O)C1(C(O)=O)CCN(C)CC1 FJKQZMAMXQZOFD-UHFFFAOYSA-N 0.000 description 2
- ZPYAYNWVYRRKRN-UHFFFAOYSA-N 4-(4-methoxyphenyl)sulfonyl-1-propan-2-ylpiperidine-4-carboxylic acid Chemical compound C1=CC(OC)=CC=C1S(=O)(=O)C1(C(O)=O)CCN(C(C)C)CC1 ZPYAYNWVYRRKRN-UHFFFAOYSA-N 0.000 description 2
- FTBCOQFMQSTCQQ-UHFFFAOYSA-N 4-bromobenzenethiol Chemical compound SC1=CC=C(Br)C=C1 FTBCOQFMQSTCQQ-UHFFFAOYSA-N 0.000 description 2
- 125000006281 4-bromobenzyl group Chemical group [H]C1=C([H])C(=C([H])C([H])=C1Br)C([H])([H])* 0.000 description 2
- 125000004176 4-fluorobenzyl group Chemical group [H]C1=C([H])C(=C([H])C([H])=C1F)C([H])([H])* 0.000 description 2
- 208000020084 Bone disease Diseases 0.000 description 2
- 208000031886 HIV Infections Diseases 0.000 description 2
- 208000037357 HIV infectious disease Diseases 0.000 description 2
- WTDHULULXKLSOZ-UHFFFAOYSA-N Hydroxylamine hydrochloride Chemical compound Cl.ON WTDHULULXKLSOZ-UHFFFAOYSA-N 0.000 description 2
- 206010061218 Inflammation Diseases 0.000 description 2
- 206010022489 Insulin Resistance Diseases 0.000 description 2
- 108010015302 Matrix metalloproteinase-9 Proteins 0.000 description 2
- 206010027476 Metastases Diseases 0.000 description 2
- KEAYESYHFKHZAL-UHFFFAOYSA-N Sodium Chemical compound [Na] KEAYESYHFKHZAL-UHFFFAOYSA-N 0.000 description 2
- 206010052779 Transplant rejections Diseases 0.000 description 2
- 230000002159 abnormal effect Effects 0.000 description 2
- DPXJVFZANSGRMM-UHFFFAOYSA-N acetic acid;2,3,4,5,6-pentahydroxyhexanal;sodium Chemical compound [Na].CC(O)=O.OCC(O)C(O)C(O)C(O)C=O DPXJVFZANSGRMM-UHFFFAOYSA-N 0.000 description 2
- 239000013543 active substance Substances 0.000 description 2
- 150000001298 alcohols Chemical class 0.000 description 2
- ZXKINMCYCKHYFR-UHFFFAOYSA-N aminooxidanide Chemical compound [O-]N ZXKINMCYCKHYFR-UHFFFAOYSA-N 0.000 description 2
- 230000033115 angiogenesis Effects 0.000 description 2
- 206010003246 arthritis Diseases 0.000 description 2
- 150000001543 aryl boronic acids Chemical class 0.000 description 2
- 210000002469 basement membrane Anatomy 0.000 description 2
- AZRWNJFEUSHORT-UHFFFAOYSA-N benzyl-bis(2-chloroethyl)azanium;chloride Chemical compound [Cl-].ClCC[NH+](CCCl)CC1=CC=CC=C1 AZRWNJFEUSHORT-UHFFFAOYSA-N 0.000 description 2
- 239000011230 binding agent Substances 0.000 description 2
- 125000001246 bromo group Chemical group Br* 0.000 description 2
- 239000001768 carboxy methyl cellulose Substances 0.000 description 2
- 239000003054 catalyst Substances 0.000 description 2
- 239000001913 cellulose Substances 0.000 description 2
- 229920002678 cellulose Polymers 0.000 description 2
- 235000010980 cellulose Nutrition 0.000 description 2
- 210000003169 central nervous system Anatomy 0.000 description 2
- 238000004140 cleaning Methods 0.000 description 2
- 238000003776 cleavage reaction Methods 0.000 description 2
- 230000006835 compression Effects 0.000 description 2
- 238000007906 compression Methods 0.000 description 2
- 239000006071 cream Substances 0.000 description 2
- 201000010099 disease Diseases 0.000 description 2
- 239000000839 emulsion Substances 0.000 description 2
- HRSATTGHPSBTNO-UHFFFAOYSA-N ethyl 1-[(3,4-dichlorophenyl)methyl]-4-(2-methoxyphenyl)sulfonylpiperidine-4-carboxylate Chemical compound C1CC(C(=O)OCC)(S(=O)(=O)C=2C(=CC=CC=2)OC)CCN1CC1=CC=C(Cl)C(Cl)=C1 HRSATTGHPSBTNO-UHFFFAOYSA-N 0.000 description 2
- MVWUKKXTCAGNNJ-UHFFFAOYSA-N ethyl 1-[[4-(4-methoxyphenyl)sulfonylnaphthalen-1-yl]methyl]piperidine-4-carboxylate Chemical compound C1CC(C(=O)OCC)CCN1CC1=CC=C(S(=O)(=O)C=2C=CC(OC)=CC=2)C2=CC=CC=C12 MVWUKKXTCAGNNJ-UHFFFAOYSA-N 0.000 description 2
- YRIRCZNJTKIDMG-UHFFFAOYSA-N ethyl 1-benzyl-4-(4-butoxyphenyl)sulfonylpiperidine-4-carboxylate Chemical compound C1=CC(OCCCC)=CC=C1S(=O)(=O)C1(C(=O)OCC)CCN(CC=2C=CC=CC=2)CC1 YRIRCZNJTKIDMG-UHFFFAOYSA-N 0.000 description 2
- GNWSAGQKHSUVLT-UHFFFAOYSA-N ethyl 1-benzyl-4-(4-methoxyphenyl)sulfonylpiperidine-4-carboxylate Chemical compound C1CC(C(=O)OCC)(S(=O)(=O)C=2C=CC(OC)=CC=2)CCN1CC1=CC=CC=C1 GNWSAGQKHSUVLT-UHFFFAOYSA-N 0.000 description 2
- FVNQRHTZLGYVPB-UHFFFAOYSA-N ethyl 1-butyl-4-(4-methoxyphenyl)sulfonylpiperidine-4-carboxylate Chemical compound C1CN(CCCC)CCC1(C(=O)OCC)S(=O)(=O)C1=CC=C(OC)C=C1 FVNQRHTZLGYVPB-UHFFFAOYSA-N 0.000 description 2
- NUXWDBFBHPVLBS-UHFFFAOYSA-N ethyl 1-cyclooctyl-4-(4-methoxyphenyl)sulfonylpiperidine-4-carboxylate Chemical compound C1CC(C(=O)OCC)(S(=O)(=O)C=2C=CC(OC)=CC=2)CCN1C1CCCCCCC1 NUXWDBFBHPVLBS-UHFFFAOYSA-N 0.000 description 2
- YJKSGYFKCIWOGH-UHFFFAOYSA-N ethyl 1-ethyl-4-(4-methoxyphenyl)sulfonylpiperidine-4-carboxylate Chemical compound C=1C=C(OC)C=CC=1S(=O)(=O)C1(C(=O)OCC)CCN(CC)CC1 YJKSGYFKCIWOGH-UHFFFAOYSA-N 0.000 description 2
- MSZXFLPUTGBOCD-UHFFFAOYSA-N ethyl 1-tert-butyl-4-(4-methoxyphenyl)sulfonylpiperidine-4-carboxylate Chemical compound C=1C=C(OC)C=CC=1S(=O)(=O)C1(C(=O)OCC)CCN(C(C)(C)C)CC1 MSZXFLPUTGBOCD-UHFFFAOYSA-N 0.000 description 2
- MFDBJTGAQFVAEB-UHFFFAOYSA-N ethyl 2-(4-methoxyphenyl)sulfanylacetate Chemical compound CCOC(=O)CSC1=CC=C(OC)C=C1 MFDBJTGAQFVAEB-UHFFFAOYSA-N 0.000 description 2
- HJUXYQLTIVYHIN-UHFFFAOYSA-N ethyl 2-(4-methoxyphenyl)sulfonylacetate Chemical compound CCOC(=O)CS(=O)(=O)C1=CC=C(OC)C=C1 HJUXYQLTIVYHIN-UHFFFAOYSA-N 0.000 description 2
- QQUKJPDPCXYTIS-UHFFFAOYSA-N ethyl 4-(4-butoxyphenyl)sulfonyl-1-(3-phenoxypropyl)piperidine-4-carboxylate Chemical compound C1=CC(OCCCC)=CC=C1S(=O)(=O)C1(C(=O)OCC)CCN(CCCOC=2C=CC=CC=2)CC1 QQUKJPDPCXYTIS-UHFFFAOYSA-N 0.000 description 2
- HSTSPDIMHZEZDT-UHFFFAOYSA-N ethyl 4-(4-butoxyphenyl)sulfonyl-1-[(4-methoxyphenyl)methyl]piperidine-4-carboxylate Chemical compound C1=CC(OCCCC)=CC=C1S(=O)(=O)C1(C(=O)OCC)CCN(CC=2C=CC(OC)=CC=2)CC1 HSTSPDIMHZEZDT-UHFFFAOYSA-N 0.000 description 2
- OBLAEDSPDBRSER-UHFFFAOYSA-N ethyl 4-(4-methoxyphenyl)sulfonyl-1-(3-methylbut-2-enyl)piperidine-4-carboxylate Chemical compound C=1C=C(OC)C=CC=1S(=O)(=O)C1(C(=O)OCC)CCN(CC=C(C)C)CC1 OBLAEDSPDBRSER-UHFFFAOYSA-N 0.000 description 2
- ZOCIWLKGUFBEST-UHFFFAOYSA-N ethyl 4-(4-methoxyphenyl)sulfonyl-1-methylpiperidine-4-carboxylate Chemical compound C=1C=C(OC)C=CC=1S(=O)(=O)C1(C(=O)OCC)CCN(C)CC1 ZOCIWLKGUFBEST-UHFFFAOYSA-N 0.000 description 2
- URNMBYWPWHBBHU-UHFFFAOYSA-N ethyl 4-(4-methoxyphenyl)sulfonyl-1-propan-2-ylpiperidine-4-carboxylate Chemical compound C=1C=C(OC)C=CC=1S(=O)(=O)C1(C(=O)OCC)CCN(C(C)C)CC1 URNMBYWPWHBBHU-UHFFFAOYSA-N 0.000 description 2
- 125000004494 ethyl ester group Chemical group 0.000 description 2
- 230000005284 excitation Effects 0.000 description 2
- 239000004744 fabric Substances 0.000 description 2
- 239000000945 filler Substances 0.000 description 2
- 239000000796 flavoring agent Substances 0.000 description 2
- 235000013355 food flavoring agent Nutrition 0.000 description 2
- 230000012010 growth Effects 0.000 description 2
- FFUAGWLWBBFQJT-UHFFFAOYSA-N hexamethyldisilazane Chemical compound C[Si](C)(C)N[Si](C)(C)C FFUAGWLWBBFQJT-UHFFFAOYSA-N 0.000 description 2
- 208000033519 human immunodeficiency virus infectious disease Diseases 0.000 description 2
- 238000000338 in vitro Methods 0.000 description 2
- 208000027866 inflammatory disease Diseases 0.000 description 2
- 230000004054 inflammatory process Effects 0.000 description 2
- 230000005764 inhibitory process Effects 0.000 description 2
- YNESATAKKCNGOF-UHFFFAOYSA-N lithium bis(trimethylsilyl)amide Chemical compound [Li+].C[Si](C)(C)[N-][Si](C)(C)C YNESATAKKCNGOF-UHFFFAOYSA-N 0.000 description 2
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Chemical compound [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 description 2
- 210000004379 membrane Anatomy 0.000 description 2
- 239000012528 membrane Substances 0.000 description 2
- NSYROPDQXYIHMF-UHFFFAOYSA-N n,n-bis(2-chloroethyl)-2-phenylethanamine Chemical compound ClCCN(CCCl)CCC1=CC=CC=C1 NSYROPDQXYIHMF-UHFFFAOYSA-N 0.000 description 2
- APMORDWSEGHCAQ-UHFFFAOYSA-N n,n-bis(2-chloroethyl)-3-phenylpropan-1-amine Chemical compound ClCCN(CCCl)CCCC1=CC=CC=C1 APMORDWSEGHCAQ-UHFFFAOYSA-N 0.000 description 2
- SXPGFJZLDDFUHA-UHFFFAOYSA-N n,n-bis(2-chloroethyl)butan-1-amine Chemical compound CCCCN(CCCl)CCCl SXPGFJZLDDFUHA-UHFFFAOYSA-N 0.000 description 2
- JZLVPSUROKRFMZ-UHFFFAOYSA-N n,n-bis(2-chloroethyl)cyclooctanamine Chemical compound ClCCN(CCCl)C1CCCCCCC1 JZLVPSUROKRFMZ-UHFFFAOYSA-N 0.000 description 2
- OABJAIADVRIARX-UHFFFAOYSA-N n-[(4-bromophenyl)methyl]-2-chloro-n-(2-chloroethyl)ethanamine Chemical compound ClCCN(CCCl)CC1=CC=C(Br)C=C1 OABJAIADVRIARX-UHFFFAOYSA-N 0.000 description 2
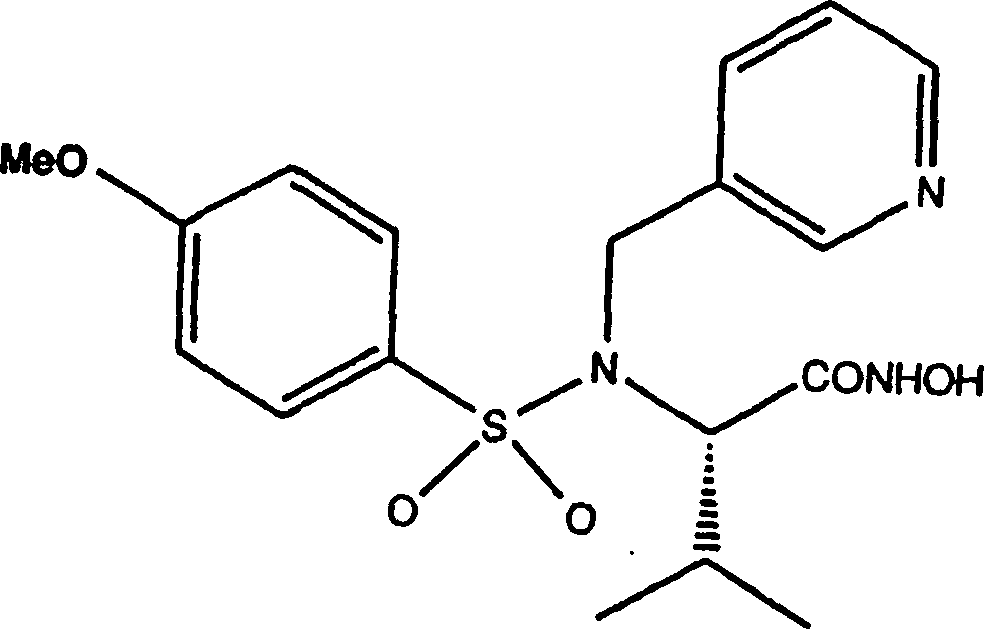
- BSIZUMJRKYHEBR-QGZVFWFLSA-N n-hydroxy-2(r)-[[(4-methoxyphenyl)sulfonyl](3-picolyl)amino]-3-methylbutanamide hydrochloride Chemical compound C1=CC(OC)=CC=C1S(=O)(=O)N([C@H](C(C)C)C(=O)NO)CC1=CC=CN=C1 BSIZUMJRKYHEBR-QGZVFWFLSA-N 0.000 description 2
- 239000002674 ointment Substances 0.000 description 2
- 230000003287 optical effect Effects 0.000 description 2
- 239000007800 oxidant agent Substances 0.000 description 2
- 208000028169 periodontal disease Diseases 0.000 description 2
- 239000003208 petroleum Substances 0.000 description 2
- 239000000546 pharmaceutical excipient Substances 0.000 description 2
- 206010039073 rheumatoid arthritis Diseases 0.000 description 2
- 230000007017 scission Effects 0.000 description 2
- 238000010898 silica gel chromatography Methods 0.000 description 2
- 229910000029 sodium carbonate Inorganic materials 0.000 description 2
- 235000019812 sodium carboxymethyl cellulose Nutrition 0.000 description 2
- 229920001027 sodium carboxymethylcellulose Polymers 0.000 description 2
- 239000012312 sodium hydride Substances 0.000 description 2
- 229910000104 sodium hydride Inorganic materials 0.000 description 2
- 239000008174 sterile solution Substances 0.000 description 2
- 150000003462 sulfoxides Chemical class 0.000 description 2
- YBBRCQOCSYXUOC-UHFFFAOYSA-N sulfuryl dichloride Chemical compound ClS(Cl)(=O)=O YBBRCQOCSYXUOC-UHFFFAOYSA-N 0.000 description 2
- 239000000375 suspending agent Substances 0.000 description 2
- 239000000725 suspension Substances 0.000 description 2
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 2
- 150000003568 thioethers Chemical class 0.000 description 2
- 150000003573 thiols Chemical class 0.000 description 2
- 208000001072 type 2 diabetes mellitus Diseases 0.000 description 2
- 230000029663 wound healing Effects 0.000 description 2
- 125000004169 (C1-C6) alkyl group Chemical group 0.000 description 1
- YZIFVWOCPGPNHB-UHFFFAOYSA-N 1,2-dichloro-4-(chloromethyl)benzene Chemical compound ClCC1=CC=C(Cl)C(Cl)=C1 YZIFVWOCPGPNHB-UHFFFAOYSA-N 0.000 description 1
- PMIAMRAWHYEPNH-UHFFFAOYSA-N 1-(2-chloroethyl)-4-methoxybenzene Chemical compound COC1=CC=C(CCCl)C=C1 PMIAMRAWHYEPNH-UHFFFAOYSA-N 0.000 description 1
- VGISFWWEOGVMED-UHFFFAOYSA-N 1-(chloromethyl)-3-methoxybenzene Chemical compound COC1=CC=CC(CCl)=C1 VGISFWWEOGVMED-UHFFFAOYSA-N 0.000 description 1
- MOHYOXXOKFQHDC-UHFFFAOYSA-N 1-(chloromethyl)-4-methoxybenzene Chemical compound COC1=CC=C(CCl)C=C1 MOHYOXXOKFQHDC-UHFFFAOYSA-N 0.000 description 1
- DMHZDOTYAVHSEH-UHFFFAOYSA-N 1-(chloromethyl)-4-methylbenzene Chemical compound CC1=CC=C(CCl)C=C1 DMHZDOTYAVHSEH-UHFFFAOYSA-N 0.000 description 1
- HLQZCRVEEQKNMS-UHFFFAOYSA-N 1-(chloromethyl)-4-phenylbenzene Chemical group C1=CC(CCl)=CC=C1C1=CC=CC=C1 HLQZCRVEEQKNMS-UHFFFAOYSA-N 0.000 description 1
- CVXCWPZVOYBWOJ-UHFFFAOYSA-N 1-[2-[4-(chloromethyl)phenoxy]ethyl]piperidine Chemical compound C1=CC(CCl)=CC=C1OCCN1CCCCC1 CVXCWPZVOYBWOJ-UHFFFAOYSA-N 0.000 description 1
- YLRBJYMANQKEAW-UHFFFAOYSA-N 1-bromo-4-(bromomethyl)benzene Chemical compound BrCC1=CC=C(Br)C=C1 YLRBJYMANQKEAW-UHFFFAOYSA-N 0.000 description 1
- IIASCQBFNHWZBE-UHFFFAOYSA-N 1-bromoethyl acetate Chemical compound CC(Br)OC(C)=O IIASCQBFNHWZBE-UHFFFAOYSA-N 0.000 description 1
- PJUPKRYGDFTMTM-UHFFFAOYSA-N 1-hydroxybenzotriazole;hydrate Chemical compound O.C1=CC=C2N(O)N=NC2=C1 PJUPKRYGDFTMTM-UHFFFAOYSA-N 0.000 description 1
- 238000005160 1H NMR spectroscopy Methods 0.000 description 1
- RUHJZSZTSCSTCC-UHFFFAOYSA-N 2-(bromomethyl)naphthalene Chemical compound C1=CC=CC2=CC(CBr)=CC=C21 RUHJZSZTSCSTCC-UHFFFAOYSA-N 0.000 description 1
- YXYOXGSDQLJFDP-UHFFFAOYSA-N 2-[(3,4-dichlorophenyl)methyl-(2-hydroxyethyl)amino]ethanol Chemical compound OCCN(CCO)CC1=CC=C(Cl)C(Cl)=C1 YXYOXGSDQLJFDP-UHFFFAOYSA-N 0.000 description 1
- YOYHVMIRZKMMPG-UHFFFAOYSA-N 2-[(4-bromophenyl)methyl-(2-hydroxyethyl)amino]ethanol Chemical compound OCCN(CCO)CC1=CC=C(Br)C=C1 YOYHVMIRZKMMPG-UHFFFAOYSA-N 0.000 description 1
- MIZIOHLLYXVEHJ-UHFFFAOYSA-N 2-[benzyl(2-hydroxyethyl)amino]ethanol Chemical compound OCCN(CCO)CC1=CC=CC=C1 MIZIOHLLYXVEHJ-UHFFFAOYSA-N 0.000 description 1
- GVNHOISKXMSMPX-UHFFFAOYSA-N 2-[butyl(2-hydroxyethyl)amino]ethanol Chemical compound CCCCN(CCO)CCO GVNHOISKXMSMPX-UHFFFAOYSA-N 0.000 description 1
- UTOSHYLAYAOIJO-UHFFFAOYSA-N 2-[cyclooctyl(2-hydroxyethyl)amino]ethanol Chemical compound OCCN(CCO)C1CCCCCCC1 UTOSHYLAYAOIJO-UHFFFAOYSA-N 0.000 description 1
- YUQUNWNSQDULTI-UHFFFAOYSA-N 2-bromobenzenethiol Chemical compound SC1=CC=CC=C1Br YUQUNWNSQDULTI-UHFFFAOYSA-N 0.000 description 1
- JDNKGGWYOJDWLC-UHFFFAOYSA-N 2-chloro-n-(2-chloroethyl)-n-(naphthalen-1-ylmethyl)ethanamine Chemical compound C1=CC=C2C(CN(CCCl)CCCl)=CC=CC2=C1 JDNKGGWYOJDWLC-UHFFFAOYSA-N 0.000 description 1
- AIIOOPQZGJBUBD-UHFFFAOYSA-N 2-chloro-n-(2-chloroethyl)-n-[(3,4-dichlorophenyl)methyl]ethanamine Chemical compound ClCCN(CCCl)CC1=CC=C(Cl)C(Cl)=C1 AIIOOPQZGJBUBD-UHFFFAOYSA-N 0.000 description 1
- XTUZOBLXVGEQEU-UHFFFAOYSA-N 2-chloro-n-(2-chloroethyl)-n-[(3-methoxyphenyl)methyl]ethanamine Chemical compound COC1=CC=CC(CN(CCCl)CCCl)=C1 XTUZOBLXVGEQEU-UHFFFAOYSA-N 0.000 description 1
- XVEHBTQWYNXBED-UHFFFAOYSA-N 2-chloro-n-(2-chloroethyl)-n-[(4-methoxyphenyl)methyl]ethanamine Chemical compound COC1=CC=C(CN(CCCl)CCCl)C=C1 XVEHBTQWYNXBED-UHFFFAOYSA-N 0.000 description 1
- VUZQZEAXMQHUMJ-UHFFFAOYSA-N 2-chloro-n-(2-chloroethyl)-n-[(4-methylphenyl)methyl]ethanamine Chemical compound CC1=CC=C(CN(CCCl)CCCl)C=C1 VUZQZEAXMQHUMJ-UHFFFAOYSA-N 0.000 description 1
- NNBBBGITTCDWNO-UHFFFAOYSA-N 2-chloro-n-(2-chloroethyl)-n-[(4-phenylphenyl)methyl]ethanamine Chemical compound C1=CC(CN(CCCl)CCCl)=CC=C1C1=CC=CC=C1 NNBBBGITTCDWNO-UHFFFAOYSA-N 0.000 description 1
- UQZPGHOJMQTOHB-UHFFFAOYSA-N 2-chloro-n-(2-chloroethyl)-n-ethylethanamine Chemical compound ClCCN(CC)CCCl UQZPGHOJMQTOHB-UHFFFAOYSA-N 0.000 description 1
- 125000001340 2-chloroethyl group Chemical group [H]C([H])(Cl)C([H])([H])* 0.000 description 1
- ISPYQTSUDJAMAB-UHFFFAOYSA-N 2-chlorophenol Chemical compound OC1=CC=CC=C1Cl ISPYQTSUDJAMAB-UHFFFAOYSA-N 0.000 description 1
- WJTZZPVVTSDNJJ-UHFFFAOYSA-N 2-fluorobenzenethiol Chemical compound FC1=CC=CC=C1S WJTZZPVVTSDNJJ-UHFFFAOYSA-N 0.000 description 1
- WMPPDTMATNBGJN-UHFFFAOYSA-N 2-phenylethylbromide Chemical compound BrCCC1=CC=CC=C1 WMPPDTMATNBGJN-UHFFFAOYSA-N 0.000 description 1
- VMKYTRPNOVFCGZ-UHFFFAOYSA-N 2-sulfanylphenol Chemical compound OC1=CC=CC=C1S VMKYTRPNOVFCGZ-UHFFFAOYSA-N 0.000 description 1
- NIDWUZTTXGJFNN-UHFFFAOYSA-N 3-bromopropoxybenzene Chemical compound BrCCCOC1=CC=CC=C1 NIDWUZTTXGJFNN-UHFFFAOYSA-N 0.000 description 1
- XMZQWZJMTBCUFT-UHFFFAOYSA-N 3-bromopropylbenzene Chemical compound BrCCCC1=CC=CC=C1 XMZQWZJMTBCUFT-UHFFFAOYSA-N 0.000 description 1
- ZHAJAVCIVZKBNX-UHFFFAOYSA-N 4-(4-methoxyphenyl)sulfonyl-1-(naphthalen-1-ylmethyl)piperidine-4-carboxylic acid Chemical compound C1=CC(OC)=CC=C1S(=O)(=O)C1(C(O)=O)CCN(CC=2C3=CC=CC=C3C=CC=2)CC1 ZHAJAVCIVZKBNX-UHFFFAOYSA-N 0.000 description 1
- OKIHXNKYYGUVTE-UHFFFAOYSA-N 4-Fluorothiophenol Chemical compound FC1=CC=C(S)C=C1 OKIHXNKYYGUVTE-UHFFFAOYSA-N 0.000 description 1
- IZMWJUPSQXIVDN-UHFFFAOYSA-N 4-bromo-2-methylbut-1-ene Chemical compound CC(=C)CCBr IZMWJUPSQXIVDN-UHFFFAOYSA-N 0.000 description 1
- HIQIXEFWDLTDED-UHFFFAOYSA-N 4-hydroxy-1-piperidin-4-ylpyrrolidin-2-one Chemical compound O=C1CC(O)CN1C1CCNCC1 HIQIXEFWDLTDED-UHFFFAOYSA-N 0.000 description 1
- NIFAOMSJMGEFTQ-UHFFFAOYSA-N 4-methoxybenzenethiol Chemical compound COC1=CC=C(S)C=C1 NIFAOMSJMGEFTQ-UHFFFAOYSA-N 0.000 description 1
- BXAVKNRWVKUTLY-UHFFFAOYSA-N 4-sulfanylphenol Chemical compound OC1=CC=C(S)C=C1 BXAVKNRWVKUTLY-UHFFFAOYSA-N 0.000 description 1
- 208000025494 Aortic disease Diseases 0.000 description 1
- 235000003911 Arachis Nutrition 0.000 description 1
- 244000105624 Arachis hypogaea Species 0.000 description 1
- 206010053555 Arthritis bacterial Diseases 0.000 description 1
- 201000001320 Atherosclerosis Diseases 0.000 description 1
- 238000006418 Brown reaction Methods 0.000 description 1
- DSELBNJHCLIKMR-UHFFFAOYSA-N CC(CCC1=CC=C(C=C1)S(=O)(=O)C2=CC=C(C=C2)OC)OC(=O)C3CCNCC3 Chemical compound CC(CCC1=CC=C(C=C1)S(=O)(=O)C2=CC=C(C=C2)OC)OC(=O)C3CCNCC3 DSELBNJHCLIKMR-UHFFFAOYSA-N 0.000 description 1
- GEWHAZAANQBQHF-UHFFFAOYSA-N CC(CCCC1=CC=C(C=C1)S(=O)(=O)C2=CC=C(C=C2)OC)OC(=O)C3CCNCC3 Chemical compound CC(CCCC1=CC=C(C=C1)S(=O)(=O)C2=CC=C(C=C2)OC)OC(=O)C3CCNCC3 GEWHAZAANQBQHF-UHFFFAOYSA-N 0.000 description 1
- UYUKQJLEFAMDRU-UHFFFAOYSA-N CC(CCCOC1=CC=C(C=C1)S(=O)(=O)C2=CC=C(C=C2)OC)OC(=O)C3CCNCC3 Chemical compound CC(CCCOC1=CC=C(C=C1)S(=O)(=O)C2=CC=C(C=C2)OC)OC(=O)C3CCNCC3 UYUKQJLEFAMDRU-UHFFFAOYSA-N 0.000 description 1
- BPRCHRRBNXYJFI-UHFFFAOYSA-N CC(OCCC1=CC=C(C=C1)S(=O)(=O)C2=CC=C(C=C2)OC)OC(=O)C3CCNCC3 Chemical compound CC(OCCC1=CC=C(C=C1)S(=O)(=O)C2=CC=C(C=C2)OC)OC(=O)C3CCNCC3 BPRCHRRBNXYJFI-UHFFFAOYSA-N 0.000 description 1
- BZEWJJXNGXGKHW-UHFFFAOYSA-N COC1=CC=C(C=C1)S(=O)(=O)C2CC(CCN2CC3=CC(=CC=C3)OC)C(=O)O Chemical compound COC1=CC=C(C=C1)S(=O)(=O)C2CC(CCN2CC3=CC(=CC=C3)OC)C(=O)O BZEWJJXNGXGKHW-UHFFFAOYSA-N 0.000 description 1
- 206010006895 Cachexia Diseases 0.000 description 1
- 206010007559 Cardiac failure congestive Diseases 0.000 description 1
- 102000004127 Cytokines Human genes 0.000 description 1
- 108090000695 Cytokines Proteins 0.000 description 1
- 208000016192 Demyelinating disease Diseases 0.000 description 1
- 229920001353 Dextrin Polymers 0.000 description 1
- 239000004375 Dextrin Substances 0.000 description 1
- 206010012689 Diabetic retinopathy Diseases 0.000 description 1
- LVGKNOAMLMIIKO-UHFFFAOYSA-N Elaidinsaeure-aethylester Natural products CCCCCCCCC=CCCCCCCCC(=O)OCC LVGKNOAMLMIIKO-UHFFFAOYSA-N 0.000 description 1
- 102000005593 Endopeptidases Human genes 0.000 description 1
- 108010059378 Endopeptidases Proteins 0.000 description 1
- 108010010803 Gelatin Proteins 0.000 description 1
- 206010019280 Heart failures Diseases 0.000 description 1
- 241000282412 Homo Species 0.000 description 1
- 208000004575 Infectious Arthritis Diseases 0.000 description 1
- 208000022559 Inflammatory bowel disease Diseases 0.000 description 1
- 206010060820 Joint injury Diseases 0.000 description 1
- 201000002287 Keratoconus Diseases 0.000 description 1
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 1
- 238000005684 Liebig rearrangement reaction Methods 0.000 description 1
- 238000006683 Mannich reaction Methods 0.000 description 1
- 102000001776 Matrix metalloproteinase-9 Human genes 0.000 description 1
- 102100030412 Matrix metalloproteinase-9 Human genes 0.000 description 1
- 208000029725 Metabolic bone disease Diseases 0.000 description 1
- 241001465754 Metazoa Species 0.000 description 1
- LSDPWZHWYPCBBB-UHFFFAOYSA-N Methanethiol Chemical class SC LSDPWZHWYPCBBB-UHFFFAOYSA-N 0.000 description 1
- 206010029113 Neovascularisation Diseases 0.000 description 1
- 206010049088 Osteopenia Diseases 0.000 description 1
- 208000003107 Premature Rupture Fetal Membranes Diseases 0.000 description 1
- 208000002158 Proliferative Vitreoretinopathy Diseases 0.000 description 1
- 206010038933 Retinopathy of prematurity Diseases 0.000 description 1
- 206010038934 Retinopathy proliferative Diseases 0.000 description 1
- 229910006124 SOCl2 Inorganic materials 0.000 description 1
- 206010040070 Septic Shock Diseases 0.000 description 1
- 208000021386 Sjogren Syndrome Diseases 0.000 description 1
- 229920002472 Starch Polymers 0.000 description 1
- 239000007983 Tris buffer Substances 0.000 description 1
- 208000025865 Ulcer Diseases 0.000 description 1
- 206010064996 Ulcerative keratitis Diseases 0.000 description 1
- 241000251539 Vertebrata <Metazoa> Species 0.000 description 1
- IINJDJPKAZFMJX-UHFFFAOYSA-O [OH2+]Cc(cc1)ccc1OC1C=CC=C1 Chemical compound [OH2+]Cc(cc1)ccc1OC1C=CC=C1 IINJDJPKAZFMJX-UHFFFAOYSA-O 0.000 description 1
- 238000010521 absorption reaction Methods 0.000 description 1
- 239000003377 acid catalyst Substances 0.000 description 1
- 150000007513 acids Chemical class 0.000 description 1
- 239000000654 additive Substances 0.000 description 1
- 239000000443 aerosol Substances 0.000 description 1
- 206010064930 age-related macular degeneration Diseases 0.000 description 1
- 150000001350 alkyl halides Chemical class 0.000 description 1
- 208000022531 anorexia Diseases 0.000 description 1
- 230000000259 anti-tumor effect Effects 0.000 description 1
- 239000007864 aqueous solution Substances 0.000 description 1
- 150000001502 aryl halides Chemical class 0.000 description 1
- AGEZXYOZHKGVCM-UHFFFAOYSA-N benzyl bromide Chemical compound BrCC1=CC=CC=C1 AGEZXYOZHKGVCM-UHFFFAOYSA-N 0.000 description 1
- MUALRAIOVNYAIW-UHFFFAOYSA-N binap Chemical group C1=CC=CC=C1P(C=1C(=C2C=CC=CC2=CC=1)C=1C2=CC=CC=C2C=CC=1P(C=1C=CC=CC=1)C=1C=CC=CC=1)C1=CC=CC=C1 MUALRAIOVNYAIW-UHFFFAOYSA-N 0.000 description 1
- 230000000903 blocking effect Effects 0.000 description 1
- 238000009835 boiling Methods 0.000 description 1
- 239000011575 calcium Substances 0.000 description 1
- 239000001506 calcium phosphate Substances 0.000 description 1
- 229910000389 calcium phosphate Inorganic materials 0.000 description 1
- 235000011010 calcium phosphates Nutrition 0.000 description 1
- 150000001718 carbodiimides Chemical class 0.000 description 1
- 150000001732 carboxylic acid derivatives Chemical class 0.000 description 1
- 210000000845 cartilage Anatomy 0.000 description 1
- 230000003197 catalytic effect Effects 0.000 description 1
- 208000015114 central nervous system disease Diseases 0.000 description 1
- 230000001684 chronic effect Effects 0.000 description 1
- 208000019425 cirrhosis of liver Diseases 0.000 description 1
- 235000019864 coconut oil Nutrition 0.000 description 1
- 239000003240 coconut oil Substances 0.000 description 1
- 239000003086 colorant Substances 0.000 description 1
- 210000002808 connective tissue Anatomy 0.000 description 1
- 201000007717 corneal ulcer Diseases 0.000 description 1
- 238000005859 coupling reaction Methods 0.000 description 1
- XUJNEKJLAYXESH-UHFFFAOYSA-N cysteine Natural products SCC(N)C(O)=O XUJNEKJLAYXESH-UHFFFAOYSA-N 0.000 description 1
- 235000018417 cysteine Nutrition 0.000 description 1
- 230000006378 damage Effects 0.000 description 1
- 206010061428 decreased appetite Diseases 0.000 description 1
- 230000003412 degenerative effect Effects 0.000 description 1
- 230000001419 dependent effect Effects 0.000 description 1
- 235000019425 dextrin Nutrition 0.000 description 1
- 206010012601 diabetes mellitus Diseases 0.000 description 1
- 125000003963 dichloro group Chemical group Cl* 0.000 description 1
- KJOZJSGOIJQCGA-UHFFFAOYSA-N dichloromethane;2,2,2-trifluoroacetic acid Chemical compound ClCCl.OC(=O)C(F)(F)F KJOZJSGOIJQCGA-UHFFFAOYSA-N 0.000 description 1
- 208000035475 disorder Diseases 0.000 description 1
- 239000003995 emulsifying agent Substances 0.000 description 1
- 229940066758 endopeptidases Drugs 0.000 description 1
- 125000003754 ethoxycarbonyl group Chemical group C(=O)(OCC)* 0.000 description 1
- RGPVWHXPNBITTA-UHFFFAOYSA-N ethyl 1-[(3-methoxyphenyl)methyl]-4-(4-methoxyphenyl)sulfonylpiperidine-4-carboxylate Chemical compound C1CC(C(=O)OCC)(S(=O)(=O)C=2C=CC(OC)=CC=2)CCN1CC1=CC=CC(OC)=C1 RGPVWHXPNBITTA-UHFFFAOYSA-N 0.000 description 1
- LYLYNHJJCZKNAF-UHFFFAOYSA-N ethyl 1-[(4-bromophenyl)methyl]-4-(4-methoxyphenyl)sulfonylpiperidine-4-carboxylate Chemical compound C1CC(C(=O)OCC)(S(=O)(=O)C=2C=CC(OC)=CC=2)CCN1CC1=CC=C(Br)C=C1 LYLYNHJJCZKNAF-UHFFFAOYSA-N 0.000 description 1
- JAVMYQBDIKNJKN-UHFFFAOYSA-N ethyl 1-[(4-fluorophenyl)methyl]-4-(4-methoxyphenyl)sulfonylpiperidine-4-carboxylate Chemical compound C1CC(C(=O)OCC)(S(=O)(=O)C=2C=CC(OC)=CC=2)CCN1CC1=CC=C(F)C=C1 JAVMYQBDIKNJKN-UHFFFAOYSA-N 0.000 description 1
- YRXBNIRWFMHAMS-UHFFFAOYSA-N ethyl 1-[(4-methoxyphenyl)methyl]-4-(4-methoxyphenyl)sulfonylpiperidine-4-carboxylate Chemical compound C1CC(C(=O)OCC)(S(=O)(=O)C=2C=CC(OC)=CC=2)CCN1CC1=CC=C(OC)C=C1 YRXBNIRWFMHAMS-UHFFFAOYSA-N 0.000 description 1
- RNUGWNKLIKCKOV-UHFFFAOYSA-N ethyl 1-[2-(4-methoxyphenyl)ethyl]-4-(4-methoxyphenyl)sulfonylpiperidine-4-carboxylate Chemical compound C1CC(C(=O)OCC)(S(=O)(=O)C=2C=CC(OC)=CC=2)CCN1CCC1=CC=C(OC)C=C1 RNUGWNKLIKCKOV-UHFFFAOYSA-N 0.000 description 1
- ZNGFQHMFLDYWDH-UHFFFAOYSA-N ethyl 2-(4-methoxyphenyl)sulfonyl-1-[(4-phenylphenyl)methyl]piperidine-4-carboxylate Chemical compound C=1C=C(OC)C=CC=1S(=O)(=O)C1CC(C(=O)OCC)CCN1CC(C=C1)=CC=C1C1=CC=CC=C1 ZNGFQHMFLDYWDH-UHFFFAOYSA-N 0.000 description 1
- ZQHXCTLYCWWBDB-UHFFFAOYSA-N ethyl 2-sulfonylacetate Chemical class CCOC(=O)C=S(=O)=O ZQHXCTLYCWWBDB-UHFFFAOYSA-N 0.000 description 1
- KHHADIVHVMPMRM-UHFFFAOYSA-N ethyl 4-(4-butoxyphenyl)sulfonyl-1-(2-phenoxyethyl)piperidine-4-carboxylate Chemical compound C1=CC(OCCCC)=CC=C1S(=O)(=O)C1(C(=O)OCC)CCN(CCOC=2C=CC=CC=2)CC1 KHHADIVHVMPMRM-UHFFFAOYSA-N 0.000 description 1
- FWHUHOBZYWQXCG-UHFFFAOYSA-N ethyl 4-(4-butoxyphenyl)sulfonyl-1-(2-phenylethoxy)piperidine-4-carboxylate Chemical compound C1=CC(OCCCC)=CC=C1S(=O)(=O)C1(C(=O)OCC)CCN(OCCC=2C=CC=CC=2)CC1 FWHUHOBZYWQXCG-UHFFFAOYSA-N 0.000 description 1
- CGTUSHQZZDHNDJ-UHFFFAOYSA-N ethyl 4-(4-butoxyphenyl)sulfonyl-1-[(4-fluorophenyl)methyl]piperidine-4-carboxylate Chemical compound C1=CC(OCCCC)=CC=C1S(=O)(=O)C1(C(=O)OCC)CCN(CC=2C=CC(F)=CC=2)CC1 CGTUSHQZZDHNDJ-UHFFFAOYSA-N 0.000 description 1
- RKGXYKXFAZIFTJ-UHFFFAOYSA-N ethyl 4-(4-methoxyphenyl)sulfonyl-1-(2-phenoxyethyl)piperidine-4-carboxylate Chemical compound C1CC(C(=O)OCC)(S(=O)(=O)C=2C=CC(OC)=CC=2)CCN1CCOC1=CC=CC=C1 RKGXYKXFAZIFTJ-UHFFFAOYSA-N 0.000 description 1
- ILOBLRACMDRJCE-UHFFFAOYSA-N ethyl 4-(4-methoxyphenyl)sulfonyl-1-(2-phenylethyl)piperidine-4-carboxylate Chemical compound C1CC(C(=O)OCC)(S(=O)(=O)C=2C=CC(OC)=CC=2)CCN1CCC1=CC=CC=C1 ILOBLRACMDRJCE-UHFFFAOYSA-N 0.000 description 1
- XVOZQUFANNBYBM-UHFFFAOYSA-N ethyl 4-(4-methoxyphenyl)sulfonyl-1-(3-phenoxypropyl)piperidine-4-carboxylate Chemical compound C1CC(C(=O)OCC)(S(=O)(=O)C=2C=CC(OC)=CC=2)CCN1CCCOC1=CC=CC=C1 XVOZQUFANNBYBM-UHFFFAOYSA-N 0.000 description 1
- QJEGYSPYCYGEQL-UHFFFAOYSA-N ethyl 4-(4-methoxyphenyl)sulfonyl-1-(3-phenylpropyl)piperidine-4-carboxylate Chemical compound C1CC(C(=O)OCC)(S(=O)(=O)C=2C=CC(OC)=CC=2)CCN1CCCC1=CC=CC=C1 QJEGYSPYCYGEQL-UHFFFAOYSA-N 0.000 description 1
- QXGVVHCUURXJMC-UHFFFAOYSA-N ethyl 4-(4-methoxyphenyl)sulfonyl-1-[(4-methylphenyl)methyl]piperidine-4-carboxylate Chemical compound C1CC(C(=O)OCC)(S(=O)(=O)C=2C=CC(OC)=CC=2)CCN1CC1=CC=C(C)C=C1 QXGVVHCUURXJMC-UHFFFAOYSA-N 0.000 description 1
- MFMDAOMSCGOFGX-UHFFFAOYSA-N ethyl 4-(4-methoxyphenyl)sulfonyl-1-[(4-phenylphenyl)methyl]piperidine-4-carboxylate Chemical compound C1CC(C(=O)OCC)(S(=O)(=O)C=2C=CC(OC)=CC=2)CCN1CC(C=C1)=CC=C1C1=CC=CC=C1 MFMDAOMSCGOFGX-UHFFFAOYSA-N 0.000 description 1
- VERVFCODAACEKU-UHFFFAOYSA-N ethyl 4-(4-methoxyphenyl)sulfonyl-1-[[4-(2-piperidin-1-ylethoxy)phenyl]methyl]piperidine-4-carboxylate Chemical compound C1CC(C(=O)OCC)(S(=O)(=O)C=2C=CC(OC)=CC=2)CCN1CC(C=C1)=CC=C1OCCN1CCCCC1 VERVFCODAACEKU-UHFFFAOYSA-N 0.000 description 1
- AFNKMWNGHGDSID-UHFFFAOYSA-N ethyl 4-(4-methoxyphenyl)sulfonylpiperidine-4-carboxylate Chemical compound C=1C=C(OC)C=CC=1S(=O)(=O)C1(C(=O)OCC)CCNCC1 AFNKMWNGHGDSID-UHFFFAOYSA-N 0.000 description 1
- LVGKNOAMLMIIKO-QXMHVHEDSA-N ethyl oleate Chemical compound CCCCCCCC\C=C/CCCCCCCC(=O)OCC LVGKNOAMLMIIKO-QXMHVHEDSA-N 0.000 description 1
- 229940093471 ethyl oleate Drugs 0.000 description 1
- 208000024519 eye neoplasm Diseases 0.000 description 1
- 239000003925 fat Substances 0.000 description 1
- 235000019197 fats Nutrition 0.000 description 1
- 239000012530 fluid Substances 0.000 description 1
- 239000007850 fluorescent dye Substances 0.000 description 1
- 125000001153 fluoro group Chemical group F* 0.000 description 1
- 235000003599 food sweetener Nutrition 0.000 description 1
- 230000000855 fungicidal effect Effects 0.000 description 1
- 239000000499 gel Substances 0.000 description 1
- 239000008273 gelatin Substances 0.000 description 1
- 229920000159 gelatin Polymers 0.000 description 1
- 235000019322 gelatine Nutrition 0.000 description 1
- 235000011852 gelatine desserts Nutrition 0.000 description 1
- 230000001434 glomerular Effects 0.000 description 1
- 150000002334 glycols Chemical class 0.000 description 1
- 238000004128 high performance liquid chromatography Methods 0.000 description 1
- 230000007062 hydrolysis Effects 0.000 description 1
- 238000006460 hydrolysis reaction Methods 0.000 description 1
- 230000002218 hypoglycaemic effect Effects 0.000 description 1
- 230000002757 inflammatory effect Effects 0.000 description 1
- 239000004615 ingredient Substances 0.000 description 1
- 208000028774 intestinal disease Diseases 0.000 description 1
- 238000007918 intramuscular administration Methods 0.000 description 1
- 239000007927 intramuscular injection Substances 0.000 description 1
- 238000007912 intraperitoneal administration Methods 0.000 description 1
- 239000007928 intraperitoneal injection Substances 0.000 description 1
- 238000001990 intravenous administration Methods 0.000 description 1
- 239000003456 ion exchange resin Substances 0.000 description 1
- 229920003303 ion-exchange polymer Polymers 0.000 description 1
- 208000017169 kidney disease Diseases 0.000 description 1
- 239000008101 lactose Substances 0.000 description 1
- 239000003446 ligand Substances 0.000 description 1
- 208000002780 macular degeneration Diseases 0.000 description 1
- 235000019359 magnesium stearate Nutrition 0.000 description 1
- 230000036210 malignancy Effects 0.000 description 1
- 239000000463 material Substances 0.000 description 1
- 239000011159 matrix material Substances 0.000 description 1
- HAWPXGHAZFHHAD-UHFFFAOYSA-N mechlorethamine Chemical compound ClCCN(C)CCCl HAWPXGHAZFHHAD-UHFFFAOYSA-N 0.000 description 1
- 230000009401 metastasis Effects 0.000 description 1
- 229920000609 methyl cellulose Polymers 0.000 description 1
- 239000001923 methylcellulose Substances 0.000 description 1
- 235000010981 methylcellulose Nutrition 0.000 description 1
- 235000013336 milk Nutrition 0.000 description 1
- 239000008267 milk Substances 0.000 description 1
- 210000004080 milk Anatomy 0.000 description 1
- 150000007522 mineralic acids Chemical class 0.000 description 1
- ZAHQPTJLOCWVPG-UHFFFAOYSA-N mitoxantrone dihydrochloride Chemical compound Cl.Cl.O=C1C2=C(O)C=CC(O)=C2C(=O)C2=C1C(NCCNCCO)=CC=C2NCCNCCO ZAHQPTJLOCWVPG-UHFFFAOYSA-N 0.000 description 1
- 238000002156 mixing Methods 0.000 description 1
- 238000012986 modification Methods 0.000 description 1
- 230000004048 modification Effects 0.000 description 1
- 208000001491 myopia Diseases 0.000 description 1
- 230000004379 myopia Effects 0.000 description 1
- QZPCOIZZKYRYQH-UHFFFAOYSA-N n,n-bis(2-chloroethyl)-1-(4-methoxyphenyl)ethanamine Chemical compound COC1=CC=C(C(C)N(CCCl)CCCl)C=C1 QZPCOIZZKYRYQH-UHFFFAOYSA-N 0.000 description 1
- BSXSSXPCEVBUSF-UHFFFAOYSA-N n,n-bis(2-chloroethyl)-2-methylpropan-2-amine Chemical compound ClCCN(C(C)(C)C)CCCl BSXSSXPCEVBUSF-UHFFFAOYSA-N 0.000 description 1
- WAEDMQMDOHQPFL-UHFFFAOYSA-N n,n-bis(2-chloroethyl)propan-2-amine Chemical compound ClCCN(C(C)C)CCCl WAEDMQMDOHQPFL-UHFFFAOYSA-N 0.000 description 1
- UPSFMJHZUCSEHU-JYGUBCOQSA-N n-[(2s,3r,4r,5s,6r)-2-[(2r,3s,4r,5r,6s)-5-acetamido-4-hydroxy-2-(hydroxymethyl)-6-(4-methyl-2-oxochromen-7-yl)oxyoxan-3-yl]oxy-4,5-dihydroxy-6-(hydroxymethyl)oxan-3-yl]acetamide Chemical compound CC(=O)N[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@H]1O[C@H]1[C@H](O)[C@@H](NC(C)=O)[C@H](OC=2C=C3OC(=O)C=C(C)C3=CC=2)O[C@@H]1CO UPSFMJHZUCSEHU-JYGUBCOQSA-N 0.000 description 1
- VLWJKVNMRMHPCC-UHFFFAOYSA-N n-benzyl-2-chloro-n-(2-chloroethyl)ethanamine Chemical compound ClCCN(CCCl)CC1=CC=CC=C1 VLWJKVNMRMHPCC-UHFFFAOYSA-N 0.000 description 1
- QUKJNGDEQKDQGY-UHFFFAOYSA-N n-hydroxy-2-sulfonylacetamide Chemical class ONC(=O)C=S(=O)=O QUKJNGDEQKDQGY-UHFFFAOYSA-N 0.000 description 1
- 208000021971 neovascular inflammatory vitreoretinopathy Diseases 0.000 description 1
- 210000000653 nervous system Anatomy 0.000 description 1
- 238000006386 neutralization reaction Methods 0.000 description 1
- 210000000440 neutrophil Anatomy 0.000 description 1
- 231100000252 nontoxic Toxicity 0.000 description 1
- 230000003000 nontoxic effect Effects 0.000 description 1
- 201000008106 ocular cancer Diseases 0.000 description 1
- 239000012663 orally bioavailable inhibitor Substances 0.000 description 1
- 229940044205 orally bioavailable inhibitor Drugs 0.000 description 1
- 150000007524 organic acids Chemical class 0.000 description 1
- 239000003960 organic solvent Substances 0.000 description 1
- 201000008482 osteoarthritis Diseases 0.000 description 1
- 230000001590 oxidative effect Effects 0.000 description 1
- 239000012057 packaged powder Substances 0.000 description 1
- 239000006072 paste Substances 0.000 description 1
- 230000001575 pathological effect Effects 0.000 description 1
- 230000007170 pathology Effects 0.000 description 1
- 125000001151 peptidyl group Chemical group 0.000 description 1
- 229920006316 polyvinylpyrrolidine Polymers 0.000 description 1
- 239000002243 precursor Substances 0.000 description 1
- 239000003755 preservative agent Substances 0.000 description 1
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 1
- 230000000770 proinflammatory effect Effects 0.000 description 1
- 230000006785 proliferative vitreoretinopathy Effects 0.000 description 1
- 235000018102 proteins Nutrition 0.000 description 1
- 102000004169 proteins and genes Human genes 0.000 description 1
- 108090000623 proteins and genes Proteins 0.000 description 1
- 201000001474 proteinuria Diseases 0.000 description 1
- 230000004044 response Effects 0.000 description 1
- 208000037803 restenosis Diseases 0.000 description 1
- 238000012552 review Methods 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- 201000001223 septic arthritis Diseases 0.000 description 1
- 230000036303 septic shock Effects 0.000 description 1
- 230000009759 skin aging Effects 0.000 description 1
- 150000003384 small molecules Chemical class 0.000 description 1
- 239000011734 sodium Substances 0.000 description 1
- 239000008247 solid mixture Substances 0.000 description 1
- 239000007790 solid phase Substances 0.000 description 1
- 239000003381 stabilizer Substances 0.000 description 1
- 239000008107 starch Substances 0.000 description 1
- 235000019698 starch Nutrition 0.000 description 1
- 239000007929 subcutaneous injection Substances 0.000 description 1
- 238000010254 subcutaneous injection Methods 0.000 description 1
- 239000000126 substance Substances 0.000 description 1
- 125000000547 substituted alkyl group Chemical group 0.000 description 1
- 150000005846 sugar alcohols Polymers 0.000 description 1
- 239000000829 suppository Substances 0.000 description 1
- 239000003765 sweetening agent Substances 0.000 description 1
- 239000006188 syrup Substances 0.000 description 1
- 235000020357 syrup Nutrition 0.000 description 1
- 230000009885 systemic effect Effects 0.000 description 1
- 239000003760 tallow Substances 0.000 description 1
- 239000002562 thickening agent Substances 0.000 description 1
- 210000001519 tissue Anatomy 0.000 description 1
- 230000009261 transgenic effect Effects 0.000 description 1
- 230000000472 traumatic effect Effects 0.000 description 1
- QORWJWZARLRLPR-UHFFFAOYSA-H tricalcium bis(phosphate) Chemical compound [Ca+2].[Ca+2].[Ca+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O QORWJWZARLRLPR-UHFFFAOYSA-H 0.000 description 1
- LENZDBCJOHFCAS-UHFFFAOYSA-N tris Chemical compound OCC(N)(CO)CO LENZDBCJOHFCAS-UHFFFAOYSA-N 0.000 description 1
- 230000004614 tumor growth Effects 0.000 description 1
- 239000002447 tumor necrosis factor alpha converting enzyme inhibitor Substances 0.000 description 1
- 230000036269 ulceration Effects 0.000 description 1
- 239000003981 vehicle Substances 0.000 description 1
- 239000001993 wax Substances 0.000 description 1
- 239000011701 zinc Substances 0.000 description 1
- 229910052725 zinc Inorganic materials 0.000 description 1
- 150000003751 zinc Chemical class 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D209/00—Heterocyclic compounds containing five-membered rings, condensed with other rings, with one nitrogen atom as the only ring hetero atom
- C07D209/02—Heterocyclic compounds containing five-membered rings, condensed with other rings, with one nitrogen atom as the only ring hetero atom condensed with one carbocyclic ring
- C07D209/44—Iso-indoles; Hydrogenated iso-indoles
- C07D209/48—Iso-indoles; Hydrogenated iso-indoles with oxygen atoms in positions 1 and 3, e.g. phthalimide
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/02—Stomatological preparations, e.g. drugs for caries, aphtae, periodontitis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/04—Drugs for disorders of the alimentary tract or the digestive system for ulcers, gastritis or reflux esophagitis, e.g. antacids, inhibitors of acid secretion, mucosal protectants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/14—Prodigestives, e.g. acids, enzymes, appetite stimulants, antidyspeptics, tonics, antiflatulents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/02—Drugs for dermatological disorders for treating wounds, ulcers, burns, scars, keloids, or the like
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/02—Drugs for skeletal disorders for joint disorders, e.g. arthritis, arthrosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/04—Drugs for skeletal disorders for non-specific disorders of the connective tissue
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/08—Drugs for skeletal disorders for bone diseases, e.g. rachitism, Paget's disease
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/08—Drugs for disorders of the metabolism for glucose homeostasis
- A61P3/10—Drugs for disorders of the metabolism for glucose homeostasis for hyperglycaemia, e.g. antidiabetics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/14—Antivirals for RNA viruses
- A61P31/18—Antivirals for RNA viruses for HIV
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/20—Antivirals for DNA viruses
- A61P31/22—Antivirals for DNA viruses for herpes viruses
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/04—Antineoplastic agents specific for metastasis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/06—Immunosuppressants, e.g. drugs for graft rejection
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P5/00—Drugs for disorders of the endocrine system
- A61P5/48—Drugs for disorders of the endocrine system of the pancreatic hormones
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/02—Non-specific cardiovascular stimulants, e.g. drugs for syncope, antihypotensives
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/04—Inotropic agents, i.e. stimulants of cardiac contraction; Drugs for heart failure
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C317/00—Sulfones; Sulfoxides
- C07C317/44—Sulfones; Sulfoxides having sulfone or sulfoxide groups and carboxyl groups bound to the same carbon skeleton
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C323/00—Thiols, sulfides, hydropolysulfides or polysulfides substituted by halogen, oxygen or nitrogen atoms, or by sulfur atoms not being part of thio groups
- C07C323/50—Thiols, sulfides, hydropolysulfides or polysulfides substituted by halogen, oxygen or nitrogen atoms, or by sulfur atoms not being part of thio groups containing thio groups and carboxyl groups bound to the same carbon skeleton
- C07C323/51—Thiols, sulfides, hydropolysulfides or polysulfides substituted by halogen, oxygen or nitrogen atoms, or by sulfur atoms not being part of thio groups containing thio groups and carboxyl groups bound to the same carbon skeleton having the sulfur atoms of the thio groups bound to acyclic carbon atoms of the carbon skeleton
- C07C323/60—Thiols, sulfides, hydropolysulfides or polysulfides substituted by halogen, oxygen or nitrogen atoms, or by sulfur atoms not being part of thio groups containing thio groups and carboxyl groups bound to the same carbon skeleton having the sulfur atoms of the thio groups bound to acyclic carbon atoms of the carbon skeleton with the carbon atom of at least one of the carboxyl groups bound to nitrogen atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D207/00—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom
- C07D207/02—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom with only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D207/04—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members
- C07D207/10—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D207/12—Oxygen or sulfur atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D211/00—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings
- C07D211/04—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D211/06—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members
- C07D211/36—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D211/60—Carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals
- C07D211/62—Carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals attached in position 4
- C07D211/66—Carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals attached in position 4 having a hetero atom as the second substituent in position 4
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D213/00—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members
- C07D213/02—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members
- C07D213/04—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D213/24—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom with substituted hydrocarbon radicals attached to ring carbon atoms
- C07D213/28—Radicals substituted by singly-bound oxygen or sulphur atoms
- C07D213/30—Oxygen atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D213/00—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members
- C07D213/02—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members
- C07D213/04—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D213/24—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom with substituted hydrocarbon radicals attached to ring carbon atoms
- C07D213/28—Radicals substituted by singly-bound oxygen or sulphur atoms
- C07D213/32—Sulfur atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D213/00—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members
- C07D213/02—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members
- C07D213/04—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D213/24—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom with substituted hydrocarbon radicals attached to ring carbon atoms
- C07D213/54—Radicals substituted by carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D213/00—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members
- C07D213/02—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members
- C07D213/04—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D213/24—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom with substituted hydrocarbon radicals attached to ring carbon atoms
- C07D213/54—Radicals substituted by carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals
- C07D213/56—Amides
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D213/00—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members
- C07D213/02—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members
- C07D213/04—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D213/60—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D213/62—Oxygen or sulfur atoms
- C07D213/70—Sulfur atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D215/00—Heterocyclic compounds containing quinoline or hydrogenated quinoline ring systems
- C07D215/02—Heterocyclic compounds containing quinoline or hydrogenated quinoline ring systems having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen atoms or carbon atoms directly attached to the ring nitrogen atom
- C07D215/12—Heterocyclic compounds containing quinoline or hydrogenated quinoline ring systems having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen atoms or carbon atoms directly attached to the ring nitrogen atom with substituted hydrocarbon radicals attached to ring carbon atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D215/00—Heterocyclic compounds containing quinoline or hydrogenated quinoline ring systems
- C07D215/02—Heterocyclic compounds containing quinoline or hydrogenated quinoline ring systems having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen atoms or carbon atoms directly attached to the ring nitrogen atom
- C07D215/16—Heterocyclic compounds containing quinoline or hydrogenated quinoline ring systems having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen atoms or carbon atoms directly attached to the ring nitrogen atom with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D215/36—Sulfur atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D215/00—Heterocyclic compounds containing quinoline or hydrogenated quinoline ring systems
- C07D215/02—Heterocyclic compounds containing quinoline or hydrogenated quinoline ring systems having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen atoms or carbon atoms directly attached to the ring nitrogen atom
- C07D215/16—Heterocyclic compounds containing quinoline or hydrogenated quinoline ring systems having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen atoms or carbon atoms directly attached to the ring nitrogen atom with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D215/48—Carbon atoms having three bonds to hetero atoms with at the most one bond to halogen
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D233/00—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings
- C07D233/54—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings having two double bonds between ring members or between ring members and non-ring members
- C07D233/64—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings having two double bonds between ring members or between ring members and non-ring members with substituted hydrocarbon radicals attached to ring carbon atoms, e.g. histidine
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D233/00—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings
- C07D233/54—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings having two double bonds between ring members or between ring members and non-ring members
- C07D233/66—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings having two double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D233/72—Two oxygen atoms, e.g. hydantoin
- C07D233/76—Two oxygen atoms, e.g. hydantoin with substituted hydrocarbon radicals attached to the third ring carbon atom
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D233/00—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings
- C07D233/54—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings having two double bonds between ring members or between ring members and non-ring members
- C07D233/66—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings having two double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D233/84—Sulfur atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D235/00—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, condensed with other rings
- C07D235/02—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, condensed with other rings condensed with carbocyclic rings or ring systems
- C07D235/04—Benzimidazoles; Hydrogenated benzimidazoles
- C07D235/24—Benzimidazoles; Hydrogenated benzimidazoles with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached in position 2
- C07D235/28—Sulfur atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D241/00—Heterocyclic compounds containing 1,4-diazine or hydrogenated 1,4-diazine rings
- C07D241/02—Heterocyclic compounds containing 1,4-diazine or hydrogenated 1,4-diazine rings not condensed with other rings
- C07D241/10—Heterocyclic compounds containing 1,4-diazine or hydrogenated 1,4-diazine rings not condensed with other rings having three double bonds between ring members or between ring members and non-ring members
- C07D241/12—Heterocyclic compounds containing 1,4-diazine or hydrogenated 1,4-diazine rings not condensed with other rings having three double bonds between ring members or between ring members and non-ring members with only hydrogen atoms, hydrocarbon or substituted hydrocarbon radicals, directly attached to ring carbon atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D257/00—Heterocyclic compounds containing rings having four nitrogen atoms as the only ring hetero atoms
- C07D257/02—Heterocyclic compounds containing rings having four nitrogen atoms as the only ring hetero atoms not condensed with other rings
- C07D257/04—Five-membered rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D263/00—Heterocyclic compounds containing 1,3-oxazole or hydrogenated 1,3-oxazole rings
- C07D263/52—Heterocyclic compounds containing 1,3-oxazole or hydrogenated 1,3-oxazole rings condensed with carbocyclic rings or ring systems
- C07D263/54—Benzoxazoles; Hydrogenated benzoxazoles
- C07D263/58—Benzoxazoles; Hydrogenated benzoxazoles with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached in position 2
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D277/00—Heterocyclic compounds containing 1,3-thiazole or hydrogenated 1,3-thiazole rings
- C07D277/02—Heterocyclic compounds containing 1,3-thiazole or hydrogenated 1,3-thiazole rings not condensed with other rings
- C07D277/20—Heterocyclic compounds containing 1,3-thiazole or hydrogenated 1,3-thiazole rings not condensed with other rings having two or three double bonds between ring members or between ring members and non-ring members
- C07D277/32—Heterocyclic compounds containing 1,3-thiazole or hydrogenated 1,3-thiazole rings not condensed with other rings having two or three double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D277/36—Sulfur atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D277/00—Heterocyclic compounds containing 1,3-thiazole or hydrogenated 1,3-thiazole rings
- C07D277/60—Heterocyclic compounds containing 1,3-thiazole or hydrogenated 1,3-thiazole rings condensed with carbocyclic rings or ring systems
- C07D277/62—Benzothiazoles
- C07D277/68—Benzothiazoles with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached in position 2
- C07D277/70—Sulfur atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D277/00—Heterocyclic compounds containing 1,3-thiazole or hydrogenated 1,3-thiazole rings
- C07D277/60—Heterocyclic compounds containing 1,3-thiazole or hydrogenated 1,3-thiazole rings condensed with carbocyclic rings or ring systems
- C07D277/62—Benzothiazoles
- C07D277/68—Benzothiazoles with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached in position 2
- C07D277/70—Sulfur atoms
- C07D277/74—Sulfur atoms substituted by carbon atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D295/00—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms
- C07D295/04—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms with substituted hydrocarbon radicals attached to ring nitrogen atoms
- C07D295/08—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms with substituted hydrocarbon radicals attached to ring nitrogen atoms substituted by singly bound oxygen or sulfur atoms
- C07D295/084—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms with substituted hydrocarbon radicals attached to ring nitrogen atoms substituted by singly bound oxygen or sulfur atoms with the ring nitrogen atoms and the oxygen or sulfur atoms attached to the same carbon chain, which is not interrupted by carbocyclic rings
- C07D295/088—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms with substituted hydrocarbon radicals attached to ring nitrogen atoms substituted by singly bound oxygen or sulfur atoms with the ring nitrogen atoms and the oxygen or sulfur atoms attached to the same carbon chain, which is not interrupted by carbocyclic rings to an acyclic saturated chain
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D307/00—Heterocyclic compounds containing five-membered rings having one oxygen atom as the only ring hetero atom
- C07D307/02—Heterocyclic compounds containing five-membered rings having one oxygen atom as the only ring hetero atom not condensed with other rings
- C07D307/34—Heterocyclic compounds containing five-membered rings having one oxygen atom as the only ring hetero atom not condensed with other rings having two or three double bonds between ring members or between ring members and non-ring members
- C07D307/38—Heterocyclic compounds containing five-membered rings having one oxygen atom as the only ring hetero atom not condensed with other rings having two or three double bonds between ring members or between ring members and non-ring members with substituted hydrocarbon radicals attached to ring carbon atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D309/00—Heterocyclic compounds containing six-membered rings having one oxygen atom as the only ring hetero atom, not condensed with other rings
- C07D309/02—Heterocyclic compounds containing six-membered rings having one oxygen atom as the only ring hetero atom, not condensed with other rings having no double bonds between ring members or between ring members and non-ring members
- C07D309/08—Heterocyclic compounds containing six-membered rings having one oxygen atom as the only ring hetero atom, not condensed with other rings having no double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D309/10—Oxygen atoms
- C07D309/12—Oxygen atoms only hydrogen atoms and one oxygen atom directly attached to ring carbon atoms, e.g. tetrahydropyranyl ethers
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D333/00—Heterocyclic compounds containing five-membered rings having one sulfur atom as the only ring hetero atom
- C07D333/02—Heterocyclic compounds containing five-membered rings having one sulfur atom as the only ring hetero atom not condensed with other rings
- C07D333/04—Heterocyclic compounds containing five-membered rings having one sulfur atom as the only ring hetero atom not condensed with other rings not substituted on the ring sulphur atom
- C07D333/26—Heterocyclic compounds containing five-membered rings having one sulfur atom as the only ring hetero atom not condensed with other rings not substituted on the ring sulphur atom with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D333/30—Hetero atoms other than halogen
- C07D333/34—Sulfur atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C2601/00—Systems containing only non-condensed rings
- C07C2601/06—Systems containing only non-condensed rings with a five-membered ring
- C07C2601/08—Systems containing only non-condensed rings with a five-membered ring the ring being saturated
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C2601/00—Systems containing only non-condensed rings
- C07C2601/12—Systems containing only non-condensed rings with a six-membered ring
- C07C2601/14—The ring being saturated
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C2601/00—Systems containing only non-condensed rings
- C07C2601/18—Systems containing only non-condensed rings with a ring being at least seven-membered
Landscapes
- Organic Chemistry (AREA)
- Chemical & Material Sciences (AREA)
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Veterinary Medicine (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Pharmacology & Pharmacy (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Engineering & Computer Science (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Medicinal Chemistry (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Virology (AREA)
- Diabetes (AREA)
- Cardiology (AREA)
- Physical Education & Sports Medicine (AREA)
- Immunology (AREA)
- Heart & Thoracic Surgery (AREA)
- Rheumatology (AREA)
- Oncology (AREA)
- Endocrinology (AREA)
- Orthopedic Medicine & Surgery (AREA)
- Molecular Biology (AREA)
- Communicable Diseases (AREA)
- Biomedical Technology (AREA)
- Hematology (AREA)
- Obesity (AREA)
- AIDS & HIV (AREA)
- Tropical Medicine & Parasitology (AREA)
- Pain & Pain Management (AREA)
- Transplantation (AREA)
- Nutrition Science (AREA)
- Biotechnology (AREA)
- Hospice & Palliative Care (AREA)
- Dermatology (AREA)
- Emergency Medicine (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
Description
- Hintergrund der Erfindung
- Matrix-Metalloproteinasen (MMPs) sind eine Gruppe von Enzymen, die in der pathologischen Zerstörung von Bindegewebe und Basismembranen verwickelt sind. Diese Zink enthaltenden Endopeptidasen bestehen aus mehreren Teilmengen von Enzymen, einschließlich Collagenasen, Stromelysinen und Gelatinasen. Von diesen Klassen ist von den Gelatinasen gezeigt worden, dass sie die MMPs sind, die am engsten mit dem Wachstum und der Verbreitung von Tumoren verbunden sind. Es ist bekannt, dass der Expressionsgrad von Gelatinase in Malignitäten erhöht ist und dass Gelatinase die Basismembran abbauen kann, was zu Tumormetastasen führt. Von Angiogenese, welches für das Wachstum von festen Tumoren notwendig ist, ist ebenfalls kürzlich gezeigt worden, dass es einen Gelatinasebestandteil zu seiner Pathologie aufweist. Ferner gibt es Hinweise, die darauf deuten, dass Gelatinase in Plaque-Riss in Verbindung mit Atherosklerose verwickelt ist. Weitere Zustände, welche durch MMPs vermittelt werden, sind Restenose, MMP-vermittelte Osteopenie, Entzündungserkrankungen des zentralen Nervensystems, Hautalterung, Tumorwachstum, Osteoarthritis, Rheumatoidarthritis, septische Arthritis, korneale Geschwürbildung, abnorme Wundheilung, Knochenerkrankung, Proteinurie, aneurysmatische Aortaerkrankung, degenerativer Knorpelverlust nach traumatischer Gelenkverletzung, demyelinisierende Erkrankungen des Nervensystems, Leberzirrhose, glomerulare Erkrankung der Nieren, vorzeitiger Riss fötaler Membranen, entzündliche Darmerkrankung, periodontale Erkrankung, altersbezogene Makuladegeneration, diabetische Retinopathie, proliferative Vitreoretinopathie, Frühgeborenenretinopathie, okulare Entzündung, Keratoconus, Sjögren-Syndrom, Myopie, okulare Tumore, okulare Angiogenese/Neovaskularisation und korneale Transplantatabstoßung. Für kürzliche Übersichten siehe: (1) Recent Advances in Matrix Metalloproteinase Inhibitor Research, R. P. Beckett, A. H. Davidson, A. H. Drummond, P. Huxley und M. Whittaker, Research Focus, Vol. 1, 16–26, (1996), (2) Curr. Opin. Ther. Patents (1994) 4(1): 7–16, (3) Curr. Medicinal Chem. (1995) 2: 743–762, (4) Exp. Opin. Ther. Patents (1995) 5(2): 1087–110, (5) Exp. Opin. Ther. Patents (1995) 5(12): 1287–1196.
- TNF-α umwandelndes Enzym (TACE) katalysiert die Bildung von TNF-α aus Membran-gebundenem TNF-α Vorläuferprotein. TNF-α ist ein Pro-Entzündungs-Cytokin, von dem nun angenommen wird, dass es eine Rolle bei Rheumatoidarthritis, septischem Schock, Transplantatabstoßung, Kachexie, Anorexie, Entzündung, kongestivem Herzversagen, Entzündungserkrankung des zentralen Nervensystems und entzündlicher Darmerkrankung, Insulinresistenz und HIV-Infektion spielt, und zwar zusätzlich zu seinen gut dokumentierten Antitumoreigenschaften. Zum Beispiel hat Forschung mit Anti-TNF-α Antikörpern und transgenen Tieren gezeigt, dass Blockieren der Bildung von TNF-α das Fortschreiten von Arthritis hemmt. Diese Beobachtung wurde kürzlich auch auf Menschen ausgedehnt.
- Es wird erwartet, dass kleinmolekülige Hemmer von MMPs und TACE daher das Potential zum Behandeln einer Vielzahl an Erkrankungszuständen haben. Während eine Vielfalt von MMP und TACE-Hemmern in der Literatur identifiziert und offenbart worden sind, sind die große Mehrzahl dieser Moleküle Peptid- oder Peptid-ähnliche Verbindungen, von welchen man erwarten würde, dass sie Probleme der biologischen Verfügbarkeit und pharmakokinetische Probleme aufweisen können, welche bei solchen Verbindungen üblich sind, die ihre klinische Wirksamkeit einschränken würden. Niedrigmolekulargewichtige, wirkkräftige, langwirkende, oral biologisch verfügbare Hemmer von MMPs und/oder TACE sind daher für die potentielle chronische Behandlung der oben erwähnten Erkrankungszustände hochgradig wünschenswert.
- Kürzlich sind zwei Verweise erschienen (US-5455258 und Europäische Patentanmeldung 606046), die Arylsulfonamido-substituierte Hydroxamsäuren offenbaren. Diese Dokumente decken Verbindungen ab, welche durch CGS 27023A beispielhaft dargestellt werden. Diese sind die bis jetzt einzigen veröffentlichten Nicht-Peptid Matrix-Metalloproteinasehemmer.
- Salah et al., Liebigs Ann. Chem. 195, (1973) offenbart einige Aryl-substituierte Thio- und Aryl-substituierte Sulfonylacetohydroxamsäurederivate der allgemeinen Formel 1. Diese Verbindungen wurden hergestellt, um die Mannich-Reaktion zu untersuchen. Nachfolgend wurden sie auf ihre fungizide Wirksamkeit getestet.
- Einige Sulfoncarbonsäuren werden in US-Patent 4933367 offenbart. Von diesen Verbindungen wurde gezeigt, dass sie hypoglykämische Wirksamkeit aufweisen.
- Zusammenfassung der Erfindung
- Die vorliegende Erfindung betrifft neuartige Nicht-Peptid Hemmer mit niedrigem Molekulargewicht von Matrix-Metalloproteinasen (MMPs) und TNF-α umwandelndem Enzym (TACE) zur Behandlung von Arthritis, Tumormetastasen, Gewebegeschwürbildung, abnormer Wundheilung, Periodontalerkrankung, Knochenerkrankung, Diabetes (Insulinresistenz) und HIV-Infektion.
- Gemäß dieser Erfindung wird eine Gruppe von Verbindungen der allgemeinen Formel I vorgesehen, worin
R1 für
Alkyl mit 1 bis 18 Kohlenstoffatomen, gegebenenfalls substituiert mit einer oder zwei Gruppen, unabhängig ausgewählt aus R5;
Alkenyl mit 3 bis 18 Kohlenstoffatomen mit 1 bis 3 Doppel bindungen, gegebenenfalls substituiert mit einer oder zwei Gruppen, unabhängig ausgewählt aus R5;
Alkinyl mit 3 bis 18 Kohlenstoffatomen mit 1 bis 3 Dreifachbindungen, gegebenenfalls substituiert mit einer oder zwei Gruppen, unabhängig ausgewählt aus R5;
Aryl mit 6 bis 10 Kohlenstoffatomen, gegebenfalls substituiert mit einer oder zwei Gruppen, unabhängig ausgewählt aus R5;
Cycloalkyl mit 3 bis 8 Kohlenstoffatomen, gegebenenfalls substituiert mit einer oder zwei Gruppen, unabhängig ausgewählt aus R5;
gesättigten oder ungesättigten 5- bis 10-gliedrigen mono- oder bicyclischen Heterocyclus, welcher ein Heteroatom enthält, ausgewählt aus O, S oder NR7, gegebenenfalls substituiert mit einer oder zwei Gruppen, unabhängig ausgewählt aus R5;
oder Heteroaryl-(CH2)0-6- steht, worin die Heteroarylgruppe 5- bis 6-gliedrig ist, mit einem oder zwei Heteroatomen, unabhängig ausgewählt aus O, S und N und gegebenenfalls mit einer oder zwei Gruppen substituiert sein kann, unabhängig ausgewählt aus R5;
A für -S-, -SO- oder SO2- steht;
R2 und R3 zusammengenommen mit dem Kohlenstoffatom, an welches sie gebunden sind, einen 5- bis 7-gliedrigen heterocyclischen Ring bilden, welcher O, S oder N-R7 enthält, gegebenenfalls mit einer oder zwei Doppelbindungen;
R4 für Wasserstoff,
Alkyl mit 1 bis 6 Kohlenstoffatomen, gegebenenfalls substituiert mit einer oder zwei Gruppen, unabhängig ausgewählt aus R5;
Alkenyl mit 3 bis 18 Kohlenstoffatomen mit 1 bis 3 Doppelbindungen, gegebenenfalls substituiert mit einer oder zwei Gruppen, unabhängig ausgewählt aus R5;
Alkinyl mit 3 bis 18 Kohlenstoffatomen mit 1 bis 3 Dreifachbindungen, gegebenenfalls substituiert mit einer oder zwei Gruppen, unabhängig ausgewählt aus R5;
Phenyl oder Naphthyl, gegebenenfalls substituiert mit einer oder zwei Gruppen, unabhängig ausgewählt aus R5;
C3- bis C8-Cycloalkyl oder Bicycloalkyl, gegebenenfalls sub stituiert mit einer oder zwei Gruppen, unabhängig ausgewählt aus R5;
gesättigten oder ungesättigten 5- bis 10-gliedrigen mono- oder bicyclischen Heterocyclus steht, welcher ein Heteroatom enthält, ausgewählt aus O, S oder NR7, gegebenenfalls substituiert mit einer oder zwei Gruppen, unabhängig ausgewählt aus R5;
R5 für H, C7-C11-Aroyl, C2-C6-Alkanoyl, C1- bis C12-Alkyl, C2- bis C12-Alkenyl, C2-C12-Alkinyl, F, Cl, Br, I, CN, CHO, C1-C6-Alkoxy, Aryloxy, Heteroaryloxy, C3-C6-Alkenyloxy, C3-C6-Alkinyloxy, C1-C6-Alkoxyaryl, C1-C6-Alkoxyheteroaryl, C1-C6-Alkylamino-C1-C6-alkoxy, C1-C2-Alkylendioxy, Aryloxy-C1-C6-alkylamin, C1-C12-Perfluoralkyl, S(O)n-C1-C6-Alkyl, S(O)n-Aryl, worin n 0, 1 oder 2 ist; OCOO-C1-C6-Alkyl, OCOO-Aryl, OCONR6, COOH, COO-C1-C6-Alkyl, COO-Aryl, CONR6R6, CONHOH, NR6R6, SO2NR6R6, NR6SO2-Aryl, -NR6CONR6R6, NHSO2CF3, SO2NH-Heteroaryl, SO2NHCO-Aryl, CONHSO2-C1-C6-Alkyl, CONHSO2-Aryl, SO2NHCO-Aryl, CONHSO2-C1-C6-Alkyl, CONHSO2-Aryl, NH2, OH, Aryl, Heteroaryl, C3- bis C8-Cycloalkyl; oder gesättigten oder ungesättigten 5- bis 10-gliedrigen mono- oder bicyclischen Heterocyclus steht, welcher ein Heteroatom enthält, ausgewählt aus O, S oder NR7, worin C1-C6-Alkyl gerade oder verzweigt ist, Heteroaryl eine 5–10-gliedrige mono- oder bicyclische Heteroarylgruppe mit 1 bis 3 Heteroatomen darstellt, unabhängig ausgewählt aus O, S oder NR7 und Aryl für Phenyl oder Naphthyl steht, gegebenenfalls substituiert durch 1 oder 2 Gruppen, ausgewählt aus Halogen, Cyano, Amino, Nitro, C1-C6-Alkyl, C1-C6-Alkoxy oder Hydroxy;
R6 für H, C1- bis C18-Alkyl, gegebenenfalls substituiert mit OH; C3- bis C6-Alkenyl, C3- bis C6-Alkinyl, C1- bis C6-Perfluoralkyl, S(O)n-C1-C6-Alkyl S(O)n-Aryl, worin n 0, 1 oder 2 ist; oder CO-Heteroaryl steht, worin Heteroaryl für eine 5–10-gliedrige mono- oder bicyclische Heteroarylgruppe mit 1 bis 3 Heteroatomen steht, unabhängig ausgewählt aus O, S oder NR7 und Aryl für Phenyl oder Naphthyl steht, gegebenenfalls substituiert durch 1 oder 2 Gruppen, ausgewählt aus Halogen, Cyano, Amino, Nitro, C1-C6-Alkyl, C1-C6-Alkoxy oder Hydroxy;
und R7 für
C7-C11-Aroyl, C2-C6-Alkanoyl, C1-C12-Perfluoralkyl, S(O)n-C1-C6-Alkyl, S(O)n-Aryl, worin n 0, 1 oder 2 ist; COO-C1-C6-Alkyl, COO-Aryl, CONHR6, CONR6R6, CONHOH, SO2NR6R6, SO2CF3, SO2NH-Heteroaryl, SO2NHCO-Aryl, CONHSO-C1-C6-Alkyl, CONHSO2-Aryl, Aryl oder Heteroaryl steht, worin Aryl für Phenyl oder Naphthyl steht, gegebenenfalls substituiert durch 1 oder 2 Gruppen, unabhängig ausgewählt aus Halogen, Cyano, Amino, Nitro, C1-C6-Alkyl, C1-C6-Alkoxy oder Hydroxy; und Heteroaryl eine 5–10-gliedrige mono- oder bicyclische Heteroarylgruppe mit 1 bis 3 Heteroatomen darstellt, unabhängig ausgewählt aus O, S oder N-C1-C6-Alkyl;
Alkyl mit 1 bis 18 Kohlenstoffatomen, gegebenenfalls substituiert mit einer oder zwei Gruppen, unabhängig ausgewählt aus R5;
Alkenyl mit 3 bis 18 Kohlenstoffatomen mit von 1 bis 3 Doppelbindungen, gegebenenfalls substituiert mit einer oder zwei Gruppen, unabhängig ausgewählt aus R5;
Alkinyl mit 3 bis 18 Kohlenstoffatomen mit von 1 bis 3 Dreifachbindungen, gegebenenfalls substituiert mit einer oder zwei Gruppen, unabhängig ausgewählt aus R5;
Arylalkyl mit 7 bis 16 Kohlenstoffatomen, wobei Aryl gegebenenfalls substituiert ist mit einer oder zwei Gruppen, unabhängig ausgewählt aus R5;
Biphenylalkyl mit 13 bis 18 Kohlenstoffatomen, worin Biphenyl gegebenenfalls substituiert ist mit einer oder zwei Gruppen, unabhängig ausgewählt aus R5;
Arylalkenyl mit 8 bis 16 Kohlenstoffatomen, worin Aryl gegebenenfalls substituiert ist mit einer oder zwei Gruppen, unabhängig ausgewählt aus R5;
Cycloalkylalkyl oder Bicycloalkylalkyl mit 4 bis 12 Kohlenstoffatomen, worin die Cycloalkyl- oder Bicycloalkylgruppe gegebenenfalls substituiert ist mit einer oder zwei Gruppen, unabhängig ausgewählt aus R5;
gesättigten oder ungesättigten mono- oder bicyclischen Heterocyclus, welcher ein Heteroatom enthält, ausgewählt aus O, S oder N-C1-C6-Alkyl, gegebenenfalls substituiert mit einer oder zwei Gruppen, unabhängig ausgewählt aus R5; oder
R8R9N-C1-C6-Alkoxyaryl-C1-C6-alkyl steht, worin R8 und R9 unabhängig ausgewählt werden aus C1-C6-Alkyl oder R8 und R9 zusammen mit dem dazwischen geschobenen Stickstoff einen 5–7-gliedrigen gesättigten heterocyclischen Ring bilden, welcher gegebenenfalls ein Sauerstoffatom enthält, worin die Arylgruppe für Phenyl oder Naphthyl steht;
und die pharmazeutisch annehmbaren Salze davon. - Ein bevorzugterer Aspekt der vorliegenden Erfindung ist die Gruppe von Verbindungen der allgemeinen Formel (Ia): worin:
R1 für
Alkyl mit 1 bis 18 Kohlenstoffatomen, gegebenenfalls substituiert mit einer oder zwei Gruppen, unabhängig ausgewählt aus R5;
Alkenyl mit 3 bis 18 Kohlenstoffatomen mit 1 bis 3 Doppelbindungen, gegebenenfalls substituiert mit einer oder zwei Gruppen, unabhängig ausgewählt aus R5;
Alkinyl mit 3 bis 18 Kohlenstoffatomen mit 1 bis 3 Dreifachbindungen, gegebenenfalls substituiert mit einer oder zwei Gruppen, unabhängig ausgewählt aus R5;
Aryl mit 6 bis 10 Kohlenstoffatomen, gegebenfalls substituiert mit einer oder zwei Gruppen, unabhängig ausgewählt aus R5;
Cycloalkyl mit 3 bis 8 Kohlenstoffatomen, gegebenenfalls substituiert mit einer oder zwei Gruppen, unabhängig ausgewählt aus R5;
gesättigten oder ungesättigten mono- oder bicyclischen Heterocyclus mit von 5 bis 10 Gliedern, welcher ein Heteroatom enthält, ausgewählt aus O, S oder NR7, gegebenenfalls substituiert mit einer oder zwei Gruppen, unabhängig ausgewählt aus R5;
oder Heteroaryl-(CH2)0-6- steht, worin die Heteroarylgruppe 5- bis 6-gliedrig ist, mit einem oder zwei Heteroatomen, unabhängig ausgewählt aus O, S und N, und gegebenenfalls mit einer oder zwei Gruppen substituiert sein kann, unabhängig ausgewählt aus R5;
A für -S-, -SO- oder SO2- steht;
R2 und R3 zusammen genommen mit dem Kohlenstoffatom, an wel ches sie gebunden sind, einen 5- bis 7-gliedrigen heterocyclischen Ring bilden, welcher O, S oder N-R7 enthält, gegebenenfalls mit einer oder zwei Doppelbindungen;
R4 für Wasserstoff,
Alkyl mit 1 bis 6 Kohlenstoffatomen, gegebenenfalls substituiert mit einer oder zwei Gruppen, unabhängig ausgewählt aus R5;
Alkenyl mit 3 bis 18 Kohlenstoffatomen mit 1 bis 3 Doppelbindungen, gegebenenfalls substituiert mit einer oder zwei Gruppen, unabhängig ausgewählt aus R5;
Alkinyl mit 3 bis 18 Kohlenstoffatomen mit 1 bis 3 Dreifachbindungen, gegebenenfalls substituiert mit einer oder zwei Gruppen, unabhängig ausgewählt aus R5;
Phenyl oder Naphthyl, gegebenenfalls substituiert mit einer oder zwei Gruppen, unabhängig ausgewählt aus R5;
C3- bis C8-Cycloalkyl oder Bicycloalkyl steht, gegebenenfalls substituiert mit einer oder zwei Gruppen, unabhängig ausgewählt aus R5;
R5 für H, F, Cl, Br, I, CN, CHO, C7-C11-Aroyl, C2-C6-Alkanoyl, C1- bis C12-Alkyl, C2- bis C12-Alkenyl, C2-C12-Alkinyl, C1-C6-Alkoxy, Aryloxy, Heteroaryloxy, C3-C6-Alkenyloxy, C3-C6-Alkinyloxy, C1-C6-Alkoxyaryl, C1-C6-Alkoxyheteroaryl, C1-C6-Alkylamino-C1-C6-alkoxy, C1-C2-Alkylendioxy, Aryloxy-C1-C6-alkylamin, C1-C12-Perfluoralkyl, S(O)n-C1-C6-Alkyl, S(O)n-Aryl, worin n 0, 1 oder 2 ist; OCOO-C1-C6-Alkyl, OCOO-Aryl, OCONR6, COOH, COO-C1-C6-Alkyl, COO-Aryl, CONR6R6, CONHOH, NR6R6, SO2NR6R6, NR6SO2-Aryl, NR6CONR6R6, NHSO2CF3, SO2NH-Heteroaryl, SO2NHCO-Aryl, CONHSO2-C1-C6-Alkyl, CONHSO2-Aryl, SO2NHCO-Aryl, CONHSO2-C1-C6-Alkyl, CONHSO2-Aryl, NH2, OH, Aryl, Heteroaryl, C3- bis C8-Cycloalkyl; oder gesättigten oder ungesättigten 5- bis 10-gliedrigen mono- oder bicyclischen Heterocyclus steht, welcher ein Heteroatom enthält, ausgewählt aus O, S oder N7, worin Heteroaryl eine 5–10-gliedrige mono- oder bicyclische Heteroarylgruppe mit 1 bis 3 Heteroatomen darstellt, unabhängig ausgewählt aus O, S oder N7 und Aryl für Phenyl oder Naphthyl steht, gegebenenfalls substituiert durch 1 oder 2 Gruppen, unabhängig ausgewählt aus Halogen, Cyano, Amino, Nitro, C1-C6-Alkyl, C1-C6-Alkoxy oder Hydroxy;
R6 für H, C1- bis C18-Alkyl, gegebenenfalls substituiert mit OH; C3-C6-Alkenyl, C3- bis C6-Alkinyl, C1- bis C6-Perfluoralkyl, S(O)n-Alkyl oder Aryl, worin n 0, 1 oder 2 ist; oder CO-Heteroaryl steht, worin Heteroaryl für eine 5–10-gliedrige mono- oder bicyclische Heteroarylgruppe mit 1 bis 3 Heteroatomen steht, unabhängig ausgewählt aus O, S oder NR7 und Aryl für Phenyl oder Naphthyl steht, gegebenenfalls substituiert durch 1 oder 2 Gruppen, ausgewählt aus Halogen, Cyano, Amino, Nitro, C1-C6-Alkyl, C1-C6-Alkoxy oder Hydroxy;
und R7 für
C7-C11-Aroyl, C2-C6-Alkanoyl, C1-C12-Perfluoralkyl, S(O)n-Alkyl, S(O)n-Aryl, worin n 0, 1 oder 2 ist; COO-Alkyl, COO-Aryl, CONHR6, CONR6R6, CONHOH, SO2NR6R6, SO2CF3, SO2NH-Heteroaryl, SO2NHCO-Aryl, CONHSO2-Alkyl, CONHSO2-Aryl, Aryl, Heteroaryl steht; worin C1-C6-Alkyl gerade oder verzweigt ist, Heteroaryl eine 5–10-gliedrige mono- oder bicyclische Heteroarylgruppe mit 1 bis 3 Heteroatomen darstellt, unabhängig ausgewählt aus O, S oder NR7 und Aryl für Phenyl oder Naphthyl steht, gegebenenfalls substituiert durch 1 oder 2 Gruppen, unabhängig ausgewählt aus Halogen, Cyano, Amino, Nitro, C1-C6-Alkyl, C1-C6-Alkoxy oder Hydroxy;
Alkyl mit 1 bis 18 Kohlenstoffatomen, gegebenenfalls substituiert mit einer oder zwei Gruppen, unabhängig ausgewählt aus R5;
Alkenyl mit 3 bis 18 Kohlenstoffatomen mit von 1 bis 3 Doppelbindungen, gegebenenfalls substituiert mit einer oder zwei Gruppen, unabhängig ausgewählt aus R5;
Alkinyl mit 3 bis 18 Kohlenstoffatomen mit von 1 bis 3 Dreifachbindungen, gegebenenfalls substituiert mit einer oder zwei Gruppen, unabhängig ausgewählt aus R5;
Arylalkyl mit 7 bis 16 Kohlenstoffatomen, worin Aryl gegebenenfalls substituiert ist mit einer oder zwei Gruppen, unabhängig ausgewählt aus R5;
Biphenylalkyl mit 13 bis 18 Kohlenstoffatomen, worin Biphenyl gegebenenfalls substituiert ist mit einer oder zwei Gruppen, unabhängig ausgewählt aus R5;
Arylalkenyl mit 8 bis 16 Kohlenstoffatomen, worin Aryl gegebenenfalls substituiert ist mit einer oder zwei Gruppen, unabhängig ausgewählt aus R5;
Cycloalkylalkyl oder Bicycloalkylalkyl mit 4 bis 12 Kohlenstoffatomen, worin Cycloalkyl oder Bicycloalkyl gegebenenfalls substituiert ist mit einer oder zwei Gruppen, unabhängig ausgewählt aus R5;
gesättigten oder ungesättigten mono- oder bicyclischen Heterocyclus, welcher ein Heteroatom enthält, ausgewählt aus O, S oder N-C1-C6-Alkyl, gegebenenfalls substituiert mit einer oder zwei Gruppen, unabhängig ausgewählt aus R5; oder
R8R9N-C1-C6-Alkoxyaryl-C1-C6-alkyl steht, worin R8 und R9 unabhängig ausgewählt werden aus C1-C6-Alkyl oder R8 und R9 zusammen mit dem dazwischen geschobenen Stickstoff einen 5–7-gliedrigen gesättigten heterocyclischen Ring bilden, welcher gegebenenfalls ein Sauerstoffatom enthält, wobei die Arylgruppe für Phenyl oder Naphthyl steht;
oder ein pharmazeutisch annehmbares Salz davon. - Die am meisten bevorzugte Gruppe von Verbindungen sind jene der folgenden Formel (Ib): R1 für Phenyl, Naphthyl, Alkyl mit 1–18 Kohlenstoffatomen oder Heteroaryl, wie Pyridyl, Thienyl, Imidazolyl oder Furanyl, gegebenenfalls substituiert mit C1-C6-Alkyl, C1-C6-Alkoxy, C6-C10-Aryloxy, Heteroaryloxy, C3-C6-Alkenyloxy, C3-C6-Alkinyloxy, Halogen; oder S(O)n-C1-C6-Alkyl-C1-C6-alkoxyaryl oder C1-C6-Alkoxyheteroaryl steht;
A für -S-, -SO- oder SO2- steht;
R2 und R3 zusammen genommen mit dem Kohlenstoffatom, an welches sie gebunden sind, einen 5- bis 7-gliedrigen heterocyclischen Ring bilden, welcher O, S oder N-R7 enthält, gegebenenfalls mit einer oder zwei Doppelbindungen;
R4 für Wasserstoff,
Alkyl mit 1 bis 6 Kohlenstoffatomen, gegebenenfalls substituiert mit einer oder zwei Gruppen, unabhängig ausgewählt aus R5;
Alkenyl mit 3 bis 18 Kohlenstoffatomen mit 1 bis 3 Doppelbindungen, gegebenenfalls substituiert mit einer oder zwei Gruppen, unabhängig ausgewählt aus R5;
Alkinyl mit 3 bis 18 Kohlenstoffatomen mit 1 bis 3 Dreifachbindungen, gegebenenfalls substituiert mit einer oder zwei Gruppen, unabhängig ausgewählt aus R5;
Phenyl oder Naphthyl, gegebenenfalls substituiert mit einer oder zwei Gruppen, unabhängig ausgewählt aus R5;
C3- bis C8-Cycloalkyl oder Bicycloalkyl steht, gegebenenfalls substituiert mit einer oder zwei Gruppen, unabhängig ausgewählt aus R5;
R5 für H, C7-C11-Aroyl, C2-C6-Alkanoyl, C1- bis C12-Alkyl, C2- bis C12-Alkenyl, C2-C12-Alkinyl, F, Cl, Br, I, CN, CHO, C1-C6-Alkoxy, Aryloxy, Heteroaryloxy, C3-C6-Alkenyloxy, C3-C6-Alkinyloxy, C1-C6-Alkylamino-C1-C6-alkoxy, C1-C2-Alkylendioxy, Aryloxy-C1-C6-alkylamin, C1-C12-Perfluoralkyl, S(O)n-C1-C6-Alkyl, S(O)n-Aryl, worin n 0, 1 oder 2 ist; OCOO-C1-C6-Alkyl, OCOO-Aryl, OCONR6, COOH, COO-C1-C6-Alkyl, COO-Aryl, CONR6R6, CONHOH, NR6R6, SO2NR6R6, NR6SO2-Aryl, -NR6CONR6R6, NHSO2CF3, SO2NH-Heteroaryl, SO2NHCO-Aryl, CONHSO2-C1-C6-Alkyl, CONHSO2-Aryl, SO2NHCO-Aryl, CONHSO2-C1-C6-Alkyl, CONHSO2-Aryl, NH2, OH, Aryl, Heteroaryl, C3- bis C8-Cycloalkyl; gesättigten oder ungesättigten 5- bis 10-gliedrigen mono- oder bicyclischen Heterocyclus steht, welcher ein Heteroatom enthält, ausgewählt aus O, S oder NR7, worin C1-C6-Alkyl gerade oder verzweigt ist, Heteroaryl eine 5–10-gliedrige mono- oder bicyclische Heteroarylgruppe mit 1 bis 3 Heteroatomen darstellt, unabhängig ausgewählt aus O, S oder NR7 und Aryl für Phenyl oder Naphthyl steht, gegebenenfalls substituiert durch 1 oder 2 Gruppen, unabhängig ausgewählt aus Halogen, Cyano, Amino, Nitro, C1-C6-Alkyl, C1-C6-Alkoxy oder Hydroxy;
R6 für H, C1- bis C18-Alkyl, gegebenenfalls substituiert mit OH; C3- bis C6-Alkenyl, C3- bis C6-Alkinyl, C1- bis C6-Perfluoralkyl, S(O)n-Alkyl oder Aryl, worin n 0, 1 oder 2 ist; oder CO-Heteroaryl steht, worin Heteroaryl für eine 5–10-gliedrige mono- oder bicyclische Heteroarylgruppe mit 1 bis 3 Heteroatomen steht, unabhängig ausgewählt aus O, S oder NR7 und Aryl für Phenyl oder Naphthyl steht, gegebenenfalls substituiert durch 1 oder 2 Gruppen, ausgewählt aus Halogen, Cyano, Amino, Nitro, C1-C6-Alkyl, C1-C6-Alkoxy oder Hydroxy;
und R7 für
C7-C11-Aroyl, C2-C6-Alkanoyl, C1-C12-Perfluoralkyl, S(O)n-Alkyl, S(O)n-Aryl, worin n 0, 1 oder 2 ist; COO-Alkyl, COO-Aryl, CONHR6, CONR6R6, CONHOH, SO2NR6R6, SO2CF3, SO2NH-Heteroaryl, SO2NHCO-Aryl, CONHSO2-Alkyl, CONHSO2-Aryl, Aryl oder Heteroaryl steht, worin Aryl für Phenyl oder Naphthyl steht, gegebenenfalls substituiert durch 1 oder 2 Gruppen, unabhängig ausgewählt aus Halogen, Cyano, Amino, Nitro, C1-C6-Alkyl, C1-C6-Alkoxy oder Hydroxy; und Heteroaryl eine 5–10-gliedrige mono- oder bicyclische Heteroarylgruppe mit 1 bis 3 Heteroatomen darstellt, unabhängig ausgewählt aus O, S oder N-C1-C6-Alkyl;
Alkyl mit 1 bis 18 Kohlenstoffatomen, gegebenenfalls substituiert mit einer oder zwei Gruppen, unabhängig ausgewählt aus R5;
Alkenyl mit 3 bis 18 Kohlenstoffatomen mit von 1 bis 3 Doppelbindungen, gegebenenfalls substituiert mit einer oder zwei Gruppen, unabhängig ausgewählt aus R5;
Alkinyl mit 3 bis 18 Kohlenstoffatomen mit von 1 bis 3 Dreifachbindungen, gegebenenfalls substituiert mit einer oder zwei Gruppen, unabhängig ausgewählt aus R5;
Arylalkyl mit 7 bis 16 Kohlenstoffatomen, gegebenenfalls substituiert mit einer oder zwei Gruppen, unabhängig ausgewählt aus R5;
Biphenylalkyl mit 13 bis 18 Kohlenstoffatomen, gegebenenfalls substituiert mit einer oder zwei Gruppen, unabhängig ausgewählt aus R5;
Arylalkenyl mit 8 bis 16 Kohlenstoffatomen, gegebenenfalls substituiert mit einer oder zwei Gruppen, unabhängig ausgewählt aus R5;
Cycloalkylalkyl oder Bicycloalkylalkyl mit 4 bis 12 Kohlenstoffatomen, gegebenenfalls substituiert mit einer oder zwei Gruppen, unabhängig ausgewählt aus R5;
gesättigten oder ungesättigten mono- oder bicyclischen Heterocyclus, welcher ein Heteroatom enthält, ausgewählt aus O, S oder NR-C1-C6-Alkyl, gegebenenfalls substituiert mit einer oder zwei Gruppen, unabhängig ausgewählt aus R5; oder
R8R9N-C1-C6-Alkoxyaryl-C1-C6-alkyl steht, worin R8 und R9 unabhängig ausgewählt werden aus C1-C6-Alkyl oder R8 und R9 zusammen mit dem dazwischen geschobenen Stickstoff einen 5–7-gliedrigen gesättigten heterocyclischen Ring bilden, welcher gegebenenfalls ein Sauerstoffatom enthält, wobei die Arylgruppe für Phenyl oder Naphthyl steht;
und die pharmazeutisch annehmbaren Salze davon. - Die am meisten bevorzugten Matrix-Metalloproteinase und TACE hemmenden Verbindungen dieser Erfindung sind:
1-Benzyl-4-(4-methoxy-benzolsulfonyl)-piperidin-4-carbonsäure-hydroxyamid;
4-(4-Methoxy-benzolsulfonyl)-1-(3-methoxy-benzyl)-piperidin-4-carbonsäure-hydroxyamid,
1-(3,4-Dichlorbenzyl)-4-(4-methoxy-benzolsulfonyl)-piperidin-4-carbonsäure-hydroxamid,
4-(4-Methoxy-benzolsulfonyl)-1-(4-methylbenzyl)-piperidin-4-carbonsäure-hydroxamid,
4-(4-Methoxy-benzolsulfonyl)-1-naphthalin-2-yl-methylpiperidin-4-carbonsäure-hydroxamid,
1-Biphenyl-4-ylmethyl-4-(4-methoxy-benzolsulfonyl)piperidin-4-carbonsäure-hydroxamid,
4-(4-Methoxy-benzolsulfonyl)-1-(3-methyl-but-2-enyl)piperidin-4-carbonsäure-hydroxamid,
1-(4-Brom-benzyl)-4-(4-methoxy-benzolsulfonyl)-piperidin-4-carbonsäure-hydroxyamid,
4-(4-Methoxy-benzolsulfonyl)-1-(3-phenyl-propyl)-piperidin-4-carbonsäure-hydroxyamid,
1-tert.-Butyl-4-(4-methoxy-benzolsulfonyl)-piperidin-4-carbonsäure-hydroxyamid,
1-Butyl-4-(4-methoxy-benzolsulfonyl)-piperidin-4-carbonsäure-hydroxyamid,
1-Cyclooctyl-4-(4-methoxy-benzolsulfonyl)-piperidin-4-carbonsäure-hydroxyamid,
1-Ethyl-4-(4-methoxy-benzolsulfonyl)-piperidin-4-carbonsäure-hydroxyamid,
1-Isopropyl-4-(4-methoxy-benzolsulfonyl)-piperidin-4-carbonsäure-hydroxyamid,
1-Methyl-4-(4-methoxy-benzolsulfonyl)-piperidin-4-carbonsäure-hydroxyamid,
1-Benzyl-4-(4-butoxy-benzolsulfonyl)-piperidin-4-carbonsäure-hydroxyamid,
1-(4-Fluorbenzyl)-4-(4-methoxy-benzolsulfonyl)-piperidin-4-carbonsäure-hydroxyamid,
1-(4-Fluorbenzyl)-4-(4-butoxy-benzolsulfonyl)-piperidin-4-carbonsäure-hydroxyamid,
4-(4-Methoxy-benzolsulfonyl)-1-(4-methoxy-benzyl)-piperidin-4-carbonsäure-hydroxyamid,
4-(4-Methoxy-benzolsulfonyl)-1-[2-(4-methoxyphenyl)-ethyl]-piperidin-4-carbonsäure-hydroxyamid,
4-(4-Methoxy-benzolsulfonyl)-1-(2-phenyl-ethyl)-piperidin-4-carbonsäure-hydroxyamid,
4-(4-n-Butoxy-benzolsulfonyl)-1-(4-methoxy-benzyl)-piperidin-4-carbonsäure-hydroxyamid,
4-(4-Methoxy-benzolsulfonyl)-1-(3-phenoxy-propyl)-piperidin-4-carbonsäure-hydroxyamid,
4-(4-n-Butoxy-benzolsulfonyl)-1-(3-phenoxy-propyl)-piperidin-4-carbonsäure-hydroxyamid,
4-(4-Methoxy-benzolsulfonyl)-1-(2-phenoxy-ethyl)-piperidin-4-carbonsäure-hydroxyamid,
4-(4-n-Butoxy-benzolsulfonyl)-1-(2-phenoxy-ethyl)-piperidin-4-carbonsäure-hydroxyamid und
4-(4-Methoxy-benzolsulfonyl)-1-[4-(2-piperidin-1-yl-ethoxy)-benzyl]-piperidin-4-carbonsäure-hydroxyamid. - Es versteht sich, dass die Definition der Verbindungen der Formeln I, Ia und Ib, worin R1, R2, R3 und R4 asymmetrische Kohlenstoffatome enthalten, alle möglichen Stereoisomere und Gemische daraus umfasst, welche die unten diskutierte Wirksamkeit besitzen. Insbesondere umfasst sie racemische Modifikationen und alle optischen Isomere, welche die angezeigte Wirksamkeit besitzen. Optische Isomere können in reiner Form durch Standardtrenntechniken erhalten werden. Wo nicht anders angeführt, betrifft der Begriff „Alkyl" eine gerade oder verzweigte C1-C6-Alkylgruppe und Aryl steht für Phenyl oder Naphthyl. Die pharmazeutisch annehmbaren Salze sind jene, welche von pharmazeutisch annehmbaren organischen und anorganischen Säuren hergeleitet werden, wie Milch-, Zitronen-, Essig-, Wein-, Bernstein-, Malein-, Malon-, Salz-, Bromwasserstoff-, Phosphor-, Salpeter-, Schwefel-, Me thansulfon- und ähnlichen bekannten, annehmbaren Säuren.
- Die vorliegende Erfindung sieht entsprechend eine pharmazeutische Zusammensetzung vor, welche eine Verbindung dieser Erfindung in Kombination oder Assoziation mit einem pharmazeutisch annehmbaren Träger umfasst. Insbesondere sieht die vorliegende Erfindung eine pharmazeutische Zusammensetzung vor, welche eine wirksame Menge an Verbindung dieser Erfindung und einen pharmazeutisch annehmbaren Träger umfasst.
- Die Zusammensetzungen werden vorzugsweise für orale Verabreichung angepasst. Jedoch können sie für andere Verabreichungsarten angepasst werden, zum Beispiel parenterale Verabreichung für Patienten.
- Um Verabreichungskonsistenz zu erreichen wird es bevorzugt, dass eine Zusammensetzung der Erfindung die Form einer Einheitsdosis hat. Geeignete Einheitsdosisformen schließen Tabletten, Kapseln und Pulver in Sachets oder Vialen ein. Solche Einheitsdosisformen können von 0,1 bis 100 mg einer Verbindung der Erfindung enthalten. Die Verbindungen der vorliegenden Erfindung können oral bei einem Dosisbereich von etwa 0,01 bis 100 mg pro kg verabreicht werden. Solche Zusammensetzungen können von 1 bis 6 Mal am Tag, üblicher von 1 bis 4 Mal am Tag verabreicht werden.
- Die Zusammensetzungen der Erfindung können mit herkömmlichen Exzipienten formuliert werden, wie Füllstoffen, einem Aufschlussmittel, einem Bindemittel, einem Schmiermittel, einem Geschmacksmittel und Ähnlichem. Sie werden auf herkömmliche Weise formuliert.
- Ebenfalls werden gemäß der vorliegenden Erfindung Verfahren zum Herstellen der Verbindungen der vorliegenden Erfindung vorgesehen.
- Verfahren der Erfindung
- Die Verbindungen der vorliegenden Erfindung können gemäß einem der unten skizzierten allgemeinen Verfahren hergestellt werden.
- Das passend substituierte Mercaptanderivat wurde unter Verwendung von entweder substituiertem (Schema 1) oder unsubstituiertem (Schema 2) α-Bromessigsäureesterderivat in refluxierendem Aceton unter Verwendung von K2CO3 als Base alkyliert. Das so erhaltene Sulfidderivat wurde unter Verwendung von m-Chlorperbenzoesäure in CH2Cl2 oder durch Verwendung von Oxon in Methanol/ Wasser oxidiert. Das aus dem oben erwähnten Verfahren erhaltene Sulfon kann entweder unter Verwendung einer Vielfalt an Alkylhalogeniden weiter alkyliert werden, um das disubstituierte Derivat zu erhalten, oder es kann unter Verwendung von NaOH/MeOH bei Raumtemperatur hydrolysiert werden. Jedoch kann anstelle der Verwendung des Ethylesters, falls der tert.-Butylester vorhanden ist, die Hydrolyse mit TFA/CH2Cl2 bei Raumtemperatur durchgeführt werden. Nachfolgend wurde die erhaltende Carbonsäure durch Umsetzung mit Oxalylchlorid/DMX (katalytisch) und Hydroxylamin/Triethylamin in das Hydroxamsäurederivat umgewandelt werden. Schema 1 Synthese
- a. K2CO3/Aceton/Rückfluss;
- b. m-Chlorperbenzoesäure;
- c. K2CO3/18-Crown-6/R3Br/Aceton/Rückfluss/
- d. NaOH/MeOH/THF/RT
- e. (COCl)2/CH2Cl2/Et3N/NH2OH·HCl.
- a. K2CO3/Aceton/Rückfluss;
- b. m-Chlorperbenzoesäure;
- c. K2CO3/18-Crown-6/R2Br/Aceton/Rückfluss/
- d. R3Br/10 N NaOH/BzN(Et)3/CH2Cl2/RT
- e. NaOH/MeOH/THF/RT
- f. (COCl)2/CH2Cl2/Et3N/NH2OH·HCl.
- Wie in Schema 3 skizziert, kann das Sulfidderivat unter Verwendung von Lithiumbis(trimethylsilyl)amid in THF bei 0°C weiter alkyliert werden. Die alkylierte oder mono-substituierte Verbindung wurde hydrolysiert und in das Hydroxamsäurederivat umgewandelt. Die Sulfinylderivate wurden durch Oxidieren der Sulfidhydroxamsäurederivate mit H2O2 in MeOH Lösung hergestellt. Schema 3 Synthese
- a. K2CO3/Aceton/Rückfluss;
- b. R3Br/HMDS/THF;
- c. NaOH/MeOH/THF/RT
- d. (COCl)2/CH2Cl2/Et3N/NH2OH·HCl.
- e. MeOH/H2O2/RT
- Die entsprechenden 1-substituierten-4-(4-Methoxy-benzolsulfonyl)-piperidin-4-carbonsäurehydroxamide wurden ausgehend von Diethanolamin und passend substituierten Alkyl oder Arylhalogeniden hergestellt (Schema 4). Die N-substituierten Diethanolaminderivate wurden unter Verwendung von Thionylchlorid in die Dichlorverbindungen umgewandelt. Die entsprechenden Dichloride wurden mit substituierten Sulfonylessigsäureethylesterderivaten in Gegenwart von K2CO3/18-Crown-6 in siedendem Aceton umgesetzt. So erhaltene 1-substituierte 4-(4-Methoxy-benzolsulfonyl)-piperidin-4-carbonsäureethylester wurden wie in Schema 4 skizziert in das Hydroxyamid umgewandelt. Alternativ können diese Verbindungsklassen und andere Heterocyclen wie in Schema 5 und 6 ange zeigt hergestellt werden. Schema 4
- a. K2CO3/RBr/Aceton/Rückfluss
- b. SOCl2/CH2Cl2
- c. R1SO2CH2COOEt/K2CO3/18-Crown-6/Aceton/Rückfluss
- d. NaOH/THF/MeOH/RT
- e. (COCl)2/NH2OH·HCl/Et3N
- a. RBr/R1SH/CHCl3/Rückfluss;
- b. Oxon/MeOH;
- e. (COCl)2/NH2OH·HCl/Et3N
- a. LiN(TMS)2/THF/0°C/CO2;
- b. (COCl)2/NH2OH·HCl/Et3N
- Alternativ zeigen Schemata 7 bis 11 Verfahren zur Herstel lung von Hydroxamsäureverbindungen unter Verwendung eines Festphasenträgers (P).
- Reagenzien und Bedingungen: a) 2-Halogensäure (3,0 äq.); 1-Hydroxybenzotriazolhydrat (HOBt, 6,0 äq.); 1,3-Diisopropylcarbodiimid (DIC, 4,0 äq.); DMF, 25°C; 2–16 Stunden. b) Thiol (5,0 äq.); Natriumiodid (5,0 äq.); 1,8-Diazabicyclo[5.4.0]undec-7-en (DBU, 3,0 äq.); THF; 25°C; 12–16 Stunden. c) 70% tert.-Butylhydroperoxid (40 äq.); Benzolsulfonsäure (2,0 äq.); DCM; 25°C; 12–24 Stunden. d) mCPBA (5,0 äq.); DCM; 25°C; 12–24 Stunden. e) TFA DCM (1 : 1); 25°C; 1 Stunde.
- Das 4-O-Methylhydroxylamin-phenoxymethyl-copoly(styrol-1%-divinylbenzol)harz (Hydroxylaminharz) kann mit einer 2-Halogensäure gekoppelt werden, um das Hydroxamatesterharz zu ergeben. Die Kopplungsumsetzung kann in Gegenwart von Carbodiimid, wie DIC, in einem inerten Lösungsmittel wie DMF bei Raumtemperatur durchgeführt werden. Die Halogengruppe kann mit einem Thiol in Gegenwart einer Base wie DBU in einem inerten Lösungsmittel wie THF bei Raumtemperatur ersetzt werden. Das Sulfid kann zu dem Sulfoxid durch Umsetzung mit einem Oxidationsmittel wie tert.-Butylhydroperoxid in Gegenwart eines Säurekatalysators wie Benzolsulfonsäure in einem inerten Lösungsmittel wie DCM bei Raumtemperatur oxidiert werden. Alternativ kann das Sulfid durch Umsetzung mit einem Oxidationsmittel wie meta-Chlorperoxybenzoesäure in einem inerten Lösungsmittel wie DCM bei Raumtemperatur zum Sulfon oxidiert werden. Das Sulfid, Sulfoxid oder Sulfon kann mit einer Säure wie Trifluoressigsäure in einem inerten Lösungsmittel wie DCM behandelt werden, um die freie Hydroxamsäure freizusetzen.
- Schema 8 zeigt ein Verfahren zum Herstellen von Hydroxamsäuren mit an den aromatischen Ring gebundene Alkoxygruppen.
- Reagenzien und Bedingungen: a) 2-Halogensäure (3,0 äq.); 1-Hydroxybenzotriazolhydrat (HOBt, 6,0 äq.); 1,3-Diisopropylcarbo diimid (DIC, 4,0 äq.); DMF, 25°C; 2–16 Stunden. b) 4-Fluorbenzolthiol (5,0 äq.); Natriumiodid (5,0 äq.); 1,8-Diazabicyclo[5.4.0]undec-7-en (DBU, 3,0 äq.); THF; 25°C; 12–16 Stunden. c) Alkohol (15,0 äq.); Natriumhydrid (15,0 äq.); DMF; 80°C; 15 Stunden d) 70% tert.-Butylhydroperoxid (40 äq.); Benzolsulfonsäure (2,0 äq.); DCM; 25°C; 12–24 Stunden. e) mCPBA (5,0 äq.); DCM; 25°C; 12–24 Stunden. f) TFA : DCM (1 : 1); 25°C; 1 Stunde.
- Das Hydroxylaminharz kann mit der 2-Halogensäure gekoppelt werden und die Halogengruppe kann wie vorher beschrieben durch Fluorbenzolthiol ersetzt werden. Die Fluorgruppe kann dann mit einem Alkohol in Gegenwart einer Base wie Natriumhydrid in einem inerten Lösungsmittel wie DMF bei etwa 80°C ersetzt werden. Der Alkoxybenzolsulfanylhydroxamatester kann dann wie vorher beschrieben entweder zu dem entsprechenden Sulfinyl oder Sulfonylhydroxamatester oxidiert werden. Die freien Hydroxamsäuren können wie vorher beschrieben freigesetzt werden.
- Schema 9 zeigt ein Verfahren zum Herstellen von 2-Bisarylsulfanyl-, Sulfinyl- und Sulfonylhydroxamsäuren.
- Reagenzien und Bedingungen: a) 2-Halogensäure (3,0 äq.); 1- Hydroxybenzotriazolhydrat (HOBt, 6,0 äq.); 1,3-Diisopropylcarbodiimid (DIC, 4,0 äq.); DMF, 25°C; 2–16 Stunden. b) 4-Brombenzolthiol (5,0 äq.); Natriumiodid (5,0 äq.); 1,8-Diazabicyclo[5.4.0]undec-7-en (DBU, 3,0 äq.); THF; 25°C; 12–16 Stunden. c) 70% tert.-Butylhydroperoxid (40 äq.); Benzolsulfonsäure (2,0 äq.); DCM; 25°C, 12–24 Stunden. d) mCPBA (5,0 äq.); DCM; 25°C; 12–24 Stunden. e) Arylboronsäure (2,0 äq); Tetrakis(triphenyl-phosphin)palladium(0) (0,1 äq.); 10% wässeriges Natriumcarbonat (10,0 äq.); DME; 80°C; 8 Stunden. f) TFR : DCM (1 : 1); 25°C; 1 Stunde.
- Das Hydroxylaminharz kann mit der 2-Halogensäure gekoppelt werden und die Halogengruppe kann wie vorher beschrieben durch Brombenzolthiol ersetzt werden. Der Brombenzolsulfanylhydroxamatester kann wie vorher beschrieben dann entweder zum entsprechenden Sulfinyl oder Sulfonylhydroxamatester oxidiert werden. Die Bromgruppe kann dann durch Umsetzung mit der Arylboronsäure in Gegenwart eines Katalysators wie Tetrakis(triphenylphosphin)palladium(0) und einer Base wie Natriumcarbonat in einem inerten Lösungsmittel wie DME bei etwa 80°C durch eine Arylgruppe ersetzt werden. Die freien Hydroxamsäuren können wie vorher beschrieben freigesetzt werden.
- Schema 10 zeigt ein Verfahren zum Herstellen von Hydroxamsäuren mit an den aromatischen Ring gebundenen Amingruppen.
- Reagenzien und Bedingungen: a) 2-Halogensäure (3,0 äq.); 1-Hydroxybenzotriazolhydrat (HOBt, 6,0 äq.); 1,3-Diisopropylcarbodiimid (DIC, 4,0 äq.); DMF, 25°C; 2–16 Stunden. b) 4-Brombenzolthiol (5,0 äq.); Natriumiodid (5,0 äq.); 1,8-Diazabicyclo[5.4.0]undec-7-en (DBU, 3,0 äq.); THF; 25°C; 12–16 Stunden. c) Amin (20,0 äq.); Tris(dibenzylidenaceton)-dipalladium(0) (0,2 äq.); (S)-(–)-2,2'-Bis(diphenylphosphino)-1,1'-binaphthyl ((S)-BINAP, 0,8 äq.); Natrium-tert.-butoxid (18,0 äq.); Dioxan; 80°C, 8 Stunden; d) TFA : DCM (1 : 1); 25°C; 1 Stunde.
- Das Hydroxylaminharz kann wie vorher beschrieben mit der 2-Halogensäure gekoppelt werden und die Halogengruppe kann durch Brombenzolthiol ersetzt werden. Die Bromgruppe kann dann mit einem Amin in Gegenwart eines Katalysators wie Tris(dibenzylidenaceton)-dipalladium(0) und einem Liganden wie (S)-BINAP und einer Base wie Natrium-tert.-butoxid in einem inerten Lösungsmittel wie Dioxan bei etwa 80°C ersetzt werden. Die freien Hydroxamsäuren können wie vorher beschrieben freigesetzt werden.
- Schema 11 zeigt ein Verfahren zum Herstellen von Hydroxamsäuren mit an den aromatischen Ring gebundenen Sulfonatgruppen.
- Reagenzien und Bedingungen: a) 2-Halogensäure (3,0 äq.); 1-Hydroxybenzotriazolhydrat (HOBt, 6,0 äq.); 1,3-Diisopropylcarbodiimid (DIC, 4,0 äq.); DMF, 25°C; 2–16 Stunden. b) 4-Hydroxybenzolthiol (5,0 äq.); Natriumiodid (5,0 äq.); 1,8-Diazabicyclo[5.4.0]undec-7-en (DBU, 3,0 äq.); THF; 25°C; 12–16 Stunden. c) Sulfonylchlorid (5,0 äq.); Triethylamin (2,0 äq.); DCM; 25°C; 8 Stunden. d) 70% tert.-Butylhydroperoxid (40 äq.); Benzolsulfonsäure (2,0 äq.); DCM; 25°C; 12–24 Stunden. e) mCPBA (5,0 äq.); DCM; 25°C; 12–24 Stunden. f) TFA : DCM (1 : 1); 25°C; 1 Stunde.
- Das Hydroxylaminharz kann mit der 2-Halogensäure gekoppelt werden und die Halogengruppe kann durch Hydroxybenzolthiol ersetzt werden, wie vorher beschrieben. Der Hydroxybenzolsulfanylhydroxamatester kann dann entweder in den entsprechenden Sulfinyl oder Sulfonylhydroxamatester oxidiert werden, wie vorher be schrieben. Die Hydroxygruppe kann dann durch Umsetzung mit einem Sulfonylchlorid in Gegenwart einer Base wie Triethylamin in einem inerten Lösungsmittel wie DCM bei etwa Raumtemperatur sulfonyliert werden. Die freien Hydroxamsäuren können wie vorher beschrieben freigesetzt werden.
- Die folgenden Beispiele werden präsentiert, um die Erfindung zu veranschaulichen. HPLC-Reinheit von durch kombinatorische Verfahren hergestellte Verbindungen wird als Bereich Prozentsatz bei einer vorgeschriebenen Wellenlänge dargestellt (% bei nm).
- Beispiel 1
- 1-Benzyl-4-(4-methoxy-benzolsulfonyl)-piperidin-4-carbonsäure-hydroxyamid
- Zu einer gerührten Lösung aus 4-Methoxybenzolthiol (2,8 g, 20 mmol) und wasserfreiem K2CO3 (10 g, Überschuss) in trockenem Aceton (100 ml) wurde α-Bromethylacetat (3,3 g, 20 mmol) in einem Rundkolben zugegeben und das Umsetzungsgemisch wurde bei Rückfluss für 8 Stunden unter gutem Rühren erhitzt. Am Ende durfte das Umsetzungsgemisch abkühlen und die Kaliumsalze wurden abfiltriert und das Umsetzungsgemisch wurde konzentriert. Der Rückstand wurde mit Chloroform extrahiert und mit H2O und 0,5 N NaOH-Lösung gewaschen. Die organische Schicht wurde weiter gut mit Wasser gewaschen, über MgSO4 getrocknet, filtriert und konzentriert. (4-Methoxy-phenylsulfanyl)-essigsäure-ethylester wurde als blass-gelbes Öl isoliert. Ausbeute: 4,4 g (100%); MS; 227 (M + H)+.
- Zu einer gerührten Lösung aus 60% 3-Chlorperoxybenzoesäure (14,0 g, 40 mmol) in Methylenchlorid (100 ml) bei 0°C wurde (4-Methoxy-phenylsulfanyl)-essigsäure-ethylester (4,4 g, 20 mmol) in CH2Cl2 (15 ml) langsam zugegeben. Das Umsetzungsgemisch wurde trübe und wurde bei Raumtemperatur für 6 Stunden gerührt. Das Umsetzungsgemisch wurde dann mit Hexanen (300 ml) verdünnt und für 15 Minuten gerührt. Die Feststoffe wurden abfiltriert und Na2SO3-Lösung wurde zu der organischen Schicht zugegeben, welche für mindestens 3 Stunden gerührt wurde, bevor das Gemisch mit CHCl3 extrahiert und mit H2O gewaschen wurde. Die organische Schicht wurde über MgSO4 getrocknet, filtriert und konzentriert und der farblose (4-Methoxy-phenylsulfonyl)-essigsäureethylester wurde als Öl isoliert. Ausbeute: 100; MS: 259,1 (M + H)+.
- Zu einer gerührten Lösung aus Diethanolamin (10,5 g, 100 mmol) und wasserfreiem K2CO3 (30 g, Überschuss) in trockenem Aceton (250 ml) wurde Benzylbromid (17,2 g, 100 mmol) in einem Rundkolben zugegeben und das Umsetzungsgemisch wurde bei Rückfluss für 8 Stunden unter gutem Rühren erhitzt. Am Ende durfte das Umsetzungsgemisch abkühlen und die Kaliumsalze wurden abfiltriert und das Umsetzungsgemisch wurde konzentriert. Der Rückstand wurde mit Chloroform extrahiert und mit H2O gewaschen. Die organische Schicht wurde weiter gut mit Wasser gewaschen, über MgSO4 getrocknet, filtriert und konzentriert. Farbloses Öl. Ausbeute: 19,0 g, 97%; MS: 196 (M + H).
- N-Benzyldiethanolamin (9,75 g, 50 mmol) wurde in gesättigter methanolischer Salzsäure gelöst und zu Trockenheit konzentriert. Das so gebildete Hydrochlorid wurde in Methylenchlorid (300 ml) gelöst und Thionylchlorid (20 g, Überschuss) wurde tropfenweise zugegeben und bei Raumtemperatur für 1 Std. gerührt. Am Ende wurde das Umsetzungsgemisch zu Trockenheit konzentriert und das Produkt Bis-(2-chlor-ethyl)-benzylamin-hydrochlorid wurde für weitere Umwandlung ohne jede Reinigung verwendet. Ausbeute: 13,0 g, 97%; Fp: MS: 232 (M + H).
- Zu einer gerührten Lösung aus Bis-(2-chlor-ethyl)-benzylamin-hydrochlorid (6,6 g, 24,7 mmol), 18-Crown-6 (500 mg) und wasserfreiem K2CO3 (30 g, Überschuss) in trockenem Aceton (250 ml) wurde (4-Methoxy-phenylsulfonyl)-essigsäureethylester (6,12 g, 24 mmol) in einem Rundkolben zugegeben und das Umsetzungsgemisch wurde bei Rückfluss für 16 Stunden unter gutem Rühren erhitzt. Am Ende durfte sich das Umsetzungsgemisch abkühlen und die Kaliumsalze wurden abfiltriert und das Umsetzungsgemisch wurde konzentriert. Der Rückstand wurde mit Chloroform extrahiert und mit H2O gewaschen. Die organische Schicht wurde weiter gut mit Wasser gewaschen, über MgSO4 getrocknet, filtriert und konzentriert. Das dunkelbraune Umsetzungsgemisch wurde durch Silicagel-Säulenchromatographie durch Eluieren mit 30% Ethylacetat : Hexan gereinigt und das Produkt 4-(4-Methoxy-benzolsulfonyl)-1-benzyl-piperidin-4-carbonsäure-ethylester wurde als braunes Öl isoliert. Ausbeute: 6,0 g; 60%; MS: 418 (M + H).
- 4-(4-Methoxy-benzolsulfonyl)-1-benzyl-piperidin-4-carbonsäure-ethylester (5,0 g, 11,9 mmol) wurde in MeOH/THF (1 : 1, 200 ml) gelöst und bei Raumtemperatur für 72 Std. gerührt. Am Ende wurde das Umsetzungsgemisch konzentriert und das Produkt wurde mit konz. HCl durch Lösung in Wasser (200 ml) neutralisiert. Nach der Neutralisation wurde das Umsetzungsgemisch zu Trockenheit konzentriert. Eiskaltes Wasser (100 ml) wurde zu dem Feststoff zugegeben und filtriert. Das Produkt 4-(4-Methoxy-benzolsulfonyl)-1-benzyl-piperidin-4-carbonsäure wurde bei 50°C getrocknet und ohne jede Reinigung zum nächsten Schritt genommen. Farbloser Feststoff. Ausbeute: 3,2 g, 69%; MS: 390 (M + H).
- Zu einer gerührten Lösung aus 4-(4-Methoxy-benzolsulfonyl)-1-benzyl-piperidin-4-carbonsäure (2,0 g, 5,1 mmol) und DMF (2 Tropfen) in CH2Cl2 (100 ml) bei 0°C wurde Oxalylchorid (1,0 g, 8 mmol) tropfenweise zugegeben. Nach der Zugabe wurde das Umsetzungsgemisch bei Raumtemperatur für 1 Std. gerührt. Gleichzeitig wurde in einem separaten Kolben ein Gemisch aus Hydroxylamin-hydrochlorid (2,0 g, 29 mmol) und Triethylamin (5 ml, Überschuss) in THF : Wasser (5 : 1, 30 ml) bei 0°C für 1 Stunde gerührt. Am Ende von 1 Stunde wurde das Oxalylchlorid-Umsetzungsgemisch konzentriert und der blass-gelbe Rückstand wurde in 10 ml CH2Cl2 gelöst und langsam zum Hydroxylamin bei 0°C zugegeben. Das Umsetzungsgemisch wurde bei Raumtemperatur für 24 Stunden gerührt und konzentriert. Der erhaltene Rückstand wurde mit Chloroform extrahiert und gut mit Wasser gewaschen. Das erhaltene Produkt wurde durch Silicagel Säulenchromatographie gereinigt und mit Chloroform eluiert. Das Produkt 4-(4-Methoxy-benzolsulfonyl)-1-benzyl-piperidin-4-carbonsäure-hydroxyamid wurde als farbloser Feststoff isoliert. Fp. 90–95°C; Ausbeute, 1,2 g, 48%; MS: 405 (M + H)+; 1H NMR (300 MHz, DMSO-d6): δ 2,29 (m, 3H), 2,76–2,79 (m, 2H), 3,43 (m, 4H), 4,30 (s, 2H), 7,14–7,17 (d, 2H), 7,50–7,73 (m, 5H), 9,37 (s, 1H), 10,53 (s, 1H), 11,18 (s, 1H).
- Beispiel 2
- 4-(4-Methoxy-benzolsulfonyl)-1-(3-methoxy-benzyl)-piperidin-4-carbonsäure-hydroxyamid
- 2-[(2-Hydroxy-ethyl)-(3-methoxy-benzyl)-amino]-ethanol wurde gemäß dem allgemeinen Verfahren wie in Beispiel 1 skizziert hergestellt, ausgehend von Diethanolamin (3,1 g, 29,5 mmol) und 3-Methoxybenzylchlorid (5 g, 31,9 mmol). Ausbeute 9,28 g, (99%); gelbes Öl; MS: 226 (M + H).
- 3-Methoxybenzyl-bis-(2-chlor-ethyl)-amin wurde gemäß dem allgemeinen Verfahren wie in Beispiel 1 skizziert hergestellt, ausgehend von 3-Methoxy-benzyl-diethanolamin (4,4 g, 20 mmol). Ausbeute 4,5 g (93%); gelber Feststoff, Fp. 86–88°C; MS: 263; (M + H)+.
- 4-(4-Methoxy-benzolsulfonyl)-1-(3-methoxy-benzyl)-piperidin-4-carbonsäure-ethylester wurde gemäß dem allgemeinen Verfahren wie in Beispiel 1 skizziert hergestellt, ausgehend von 4-(Methoxy-benzolsulfonyl)-essigsäure-ethylester (5,0 g, 22 mmol) und Bis-(2-chlorethyl)-(3-methoxy-benzyl)-amin (8,0 g, 23,5 mmol). Ausbeute: 2,4 g (24%); niedrig schmelzender Feststoff; MS: 447,9 (M + H)+.
- 4-(4-Methoxy-benzolsulfonyl)-1-(3-methoxy-benzyl)-piperidin-4-carbonsäure wurde hergestellt, ausgehend von 4-(4-Methoxy-benzolsulfonyl)-1-(3-methoxy-benzyl)-piperidin-4-carbonsäure-ethylester (2,4 g, 5,36 mmol), gelöst in Methanol (30 ml), 10 N Natriumhydroxid (10 ml), Tetrahydrofuran (20 ml). Das sich ergebende Umsetzungsgemisch wurde wie in Beispiel 1 skizziert aufgearbeitet. Ausbeute 710 mg (32%); weißer Feststoff, Fp. 199°C, MS: 419,9 (M + H)+.
- Ausgehend von 4-(4-Methoxy-benzolsulfonyl)-1-(3-methoxy-benzyl)-piperidin-4-carbonsäure (830 mg, 1,98 mmol) und dem Verfahren wie in Beispiel 1 skizziert folgend wurden 190 mg 4-(4-Methoxy-benzolsulfonyl)-1-(3-methoxy-benzyl)-piperidin-4-carbonsäure-hydroxamid als weißer Feststoff isoliert, Fp. 130°C; Ausbeute 20,4%; MS: 435,0 (M + H)+; 1H NMR (300 MHz, DMSO-d6): δ 2,24–2,32 (m, 2H), 2,51 (d, 2H), 2,73–2,83 (m, 2H), 3,37 (d, 2H), 3,76 (s, 3H), 3,88 (s, 3H), 4,32 (s, 2H), 7,01–7,77 (m, 8H), 9,38 (s, 1H), 10,1 (s, 1H).
- Beispiel 3
- 1-(3,4-Dichlorbenzyl)-4-(4-methoxy-benzolsulfonyl)-piperidin-4-carbonsäure-hydroxamid
- 2-[2-(Hydroxy-ethyl)-(3,4-dichlor-benzyl)-amino]-ethanol wurde gemäß dem allgemeinen Verfahren wie in Beispiel 1 skizziert hergestellt, ausgehend von Diethanolamin (4,84 g, 46 mmol) und 3,4-Dichlorbenzylchlorid (9,0 g, 46 mmol). Ausbeute 13,8 g (99%); farbloses Öl; MS: 264,3 (M + H)+.
- 3,4-Dichlorbenzyl-bis-(2-chlor-ethyl)-amin wurde gemäß dem allgemeinen Verfahren wie in Beispiel 1 skizziert hergestellt, ausgehend von 3,4-Dichlorbenzyl-diethanolamin (10,7 g, 41 mmol). Ausbeute 99%; gelber Feststoff, Fp. 218–220°C; MS: 301,8 (M + H)+.
- 1-(3,4-Dichlor-benzyl)-4-(methoxy-benzolsulfonyl)-piperidin-4-carbonsäure-ethylester wurden gemäß dem allgemeinen Verfahren hergestellt wie in Beispiel 1 skizziert, ausgehend von 4-(Methoxy-benzolsulfonyl)-essigsäure-ethylester (2,9 g, 11 mmol) und 3,4-Dichlorbenzyl-bis(2-chlorethyl)-amin (3,4 g, 11 mmol). Ausbeute 5,9 g (60%); braunes Öl; MS: 494,5 (M + H)+.
- 1-(3,4-Dichlor-benzyl)-4-(4-methoxy-benzolsulfonyl)-piperidin-4-carbonsäure wurde hergestellt, ausgehend von 1-(3,4-Dichlor-benzyl)-4-(methoxy-benzolsulfonyl)-piperidin-4-carbonsäure-ethylester (5,0 g, 10 mmol), gelöst in Methanol (50 ml), 10 N Natriumhydroxid (15 ml) und Tetrahydrofuran (75 ml). Das sich ergebende Umsetzungsgemisch wurde wie in Beispiel 1 skizziert aufgearbeitet. Ausbeute 2,94 g (62%), MS: 458,3 (M + H)+.
- Ausgehend von 1-(3,4-Dichlorbenzyl)-4-(4-methoxy-benzolsulfonyl)-piperidin-4-carbonsäure (2,67 g, 5,8 mmol) und dem Verfahren wie in Beispiel 1 skizziert folgend, wurden 0,2 g 1-(3,4-Dichlorbenzyl)-4-(4-methoxy-benzolsulfonyl)-piperidin-4-carbonsäure-hydroxamid als weißer Feststoff isoliert, Fp. 192–195°C; Ausbeute 10%; MS 472,9 (M + H)+; 1H NMR (300 MHz, DMSO-d6): δ 2,20–2,28 (m, 2H), 2,76–2,79 (m, 2H), 3,43–3,44 (m, 4H), 4,30 (s, 2H), 7,14–7,17 (d, J = 0,030, 2H), 7,50–7,73 (d, J = 0,027, 1H), 7,65–7,68 (d, J = 0,029, 2H), 7,72–7,75 (d, J = 0,027, 2H), 7,87 (s, 1H), 9,37 (s, 1H), 10,53 (s, 1H), 11,18 (s, 1H).
- Beispiel 4
- 4-(4-Methoxy-benzolsulfonyl)-1-(4-methylbenzyl)-piperidin-4-carbonsäure-hydroxamid
- 2-[(2-Hydroxy-ethyl)-(4-methyl-benzyl)-amino]-ethanol wurde gemäß dem allgemeinen Verfahren wie in Beispiel 1 skizziert hergestellt, ausgehend von Diethanolamin (4,8 g, 46 mmol) und 4-Methylbenzylchlorid (8,5 g, 46 mmol). Ausbeute 9,8 g (99%); MS: 209,9 (M + H)+.
- 4-Methylbenzyl-bis-(2-chlor-ethyl)-amin wurde gemäß dem allgemeinen Verfahren wie in Beispiel 1 skizziert hergestellt, ausgehend von 4-Methyl-benzyl-diethanolamin (6 g, 20 mmol). Ausbeute 5,2 g (84%); gelber Feststoff, Fp. 145–147°C; MS: 245,9 (M + H)+.
- 4-(4-Methoxy-benzolsulfonyl)-1-(4-methyl-benzyl)piperidin-4-carbonsäure-ethylester wurde gemäß dem allgemeinen Verfahren wie in Beispiel 1 skizziert hergestellt, ausgehend von 4-(Methoxy-benzolsulfonyl)-essigsäure-ethylester (7,0 g, 27 mmol) und 4-Methyl-bis-(2-chlor-ethyl)-amin (5,0 g, 17 mmol). Ausbeute 4,64 g (63%); niedrig schmelzender Feststoff; MS: 431,9 (M + H)+. 4-(4-Methoxy-benzolsulfonyl)-(4-methyl-benzyl)-piperidin-4-carbonsäure wurde hergestellt, ausgehend von 4-(4-Methoxy-benzol-sulfonyl)-piperidin-4-carbonsäure-ethylester (4,3 g, 9,9 mmol), gelöst in Methanol (30 ml), 10 N Natriumhydroxid (10 ml), Tetrahydrofuran (20 ml). Das sich ergebende Gemisch wurde wie in Beispiel 1 skizziert aufgearbeitet. Ausbeute 1,6 g (40%); weißer Feststoff, Fp. 207–208°C; MS: 404,3 (M + H)+.
- Ausgehend von 4-(4-Methoxy-benzolsulfonyl)-1-(4-methylbenzyl)-piperidin-4-carbonsäure (1,59 g, 3,9 mmol) und dem Verfahren wie in Beispiel 1 skizziert folgend, wurden 0,505 g 4-(4-Methoxy-benzolsulfonyl)-1-(4-methylbenzyl)-piperidin-4-carbonsäure-hydroxamid als weißer Feststoff isoliert, Fp. 176–177°C; Ausbeute 32%; MS: 419,0 (M + H)+; 1H NMR (300 MHz, DMSO-d6): δ 2,24–2,32 (m, 2H), 2,51 (t, 3H), 2,73–2,80 (m, 2H), 3,35–3,50 (m, 4H), 3,87 (s, 3H), 4,24 (s, 2H), 7,13–7,17 (d, J = 0,039, 2H), 7,23–7,60 (d, J = 0,036, 2H), 7,38–7,41 (d, J = 0,025, 2H), 7,65–7,68 (d, J = 0,039, 2H).
- Beispiel 5
- 4-(4-Methoxy-benzolsulfonyl)-1-naphthalin-2-yl-methylpiperidin-4-carbonsäure-hydroxamid
- 2-[(2-Hydroxy-ethyl)-(2-naphthyl-2-ylmethyl)-amino]-ethanol wurde gemäß dem allgemeinen Verfahren wie in Beispiel 1 skizziert hergestellt, ausgehend von Diethanolamin (6,18 g, 59 mmol) und 2-(Brommethyl)-naphthalin (10 g, 45 mmol). Ausbeute 12,7 g (96%); gelber Feststoff, Fp. 162–164°C; MS: 246,0 (M + H)+.
- 2-Naphthyl-2-ylmethyl-bis-(2-chlor-ethyl)-amin wurde gemäß dem allgemeinen Verfahren wie in Beispiel 1 skizziert hergestellt, ausgehend von 2-Naphthyl-ylmethyl-diethanolamin (10 g, 36 mmol). Ausbeute 9,1 g (79%); brauner Feststoff, Fp. 124–126°C; MS: 281,9 (M + H)+.
- 4-(4-Methoxy-benzolsulfonyl)-naphthalin-ylmethyl-piperidin-4-carbonsäure-ethylester wurde gemäß dem allgemeinen Verfahren wie in Beispiel 1 skizziert hergestellt, ausgehend von 4-(Methoxy-benzolsulfonyl)-essigsäure-ethylester (8,4 g, 32 mmol) und 1-Naphthalin-ylmethyl-bis-(2-chlor-ethyl)-amin (8,6 g, 27 mmol). Ausbeute 6,5 g (52%); niedrig schmelzender Feststoff; MS: 440,0 (M + H)+.
- 4-(4-Methoxy-benzolsulfonyl)-1-naphthalin-ylmethyl-piperi din-4-carbonsäure wurde hergestellt, ausgehend von 4-(4-Methoxy-benzolsulfonyl)-naphthalin-ylmethyl-piperidin-4-carbonsäure-ethylester (6,3 g, 13 mmol), gelöst in Methanol (30 ml), 10 N Natriumhydroxid (30 ml) und Tetrahydrofuran (30 ml). Das sich ergebende Umsetzungsgemisch wurde wie in Beispiel 1 skizziert aufgearbeitet. Ausbeute 2,3 g (36%); gelber Feststoff, Fp. 226–228°C; MS: 440,0 (M + H)+.
- Ausgehend von 4-(4-Methoxy-benzolsulfonyl)-1-naphthalin-2-yl-methylpiperidin-4-carbonsäure (2,18 g, 5,0 mmol) und dem Verfahren wie in Beispiel 1 skizziert folgend, wurden 0,753 g von 4-(4-Methoxy-benzol-sulfonyl)-1-naphthalin-2-yl-methylpiperidin-4-carbonsäure-hydroxamid als ein von weiß abweichender Feststoff isoliert, Fp. 168–170°C; Ausbeute 31%; MS 455,0 (M + H)+; 1H NMR (300 MHz, DMSO-d6): δ 2,29–2,33 (m, 2H), 2,86–2,89 (m, 2H), 3,42–3,46 (m, 4H), 3,85 (s, 3H), 4,46 (s, 2H), 7,13–7,16 (d, J = 0,030, 2H), 7,56–7,64 (m, 3H), 7,65–7,68 (d, J = 0,030, 2H), 7,98–8,00 (m, 3H), 8,21 (s, 1H), 10,70 (s, 1H), 11,20 (s, 1H).
- Beispiel 6
- 1-Biphenyl-4-ylmethyl-4-(4-methoxy-benzolsulfonyl)piperidin-4-carbonsäure-hydroxamid
- 2-[(2-Hydroxy-ethyl)-(1-biphenyl-4-ylmethyl))-amino]-ethanol wurde gemäß dem allgemeinen Verfahren wie in Beispiel 1 skizziert hergestellt, ausgehend von Diethanolamin (5,2 g, 49 mmol) und 4-(Chlormethyl)biphenyl (10 g, 49 mmol). Ausbeute 9,98 g (66%); weißer Feststoff, Fp. 160–162°C; MS: 271,9 (M + H)+. Dieses wurde wie in Beispiel 1 skizziert in das Dichlorid umgewandelt.
- 1-Biphenyl-4-ylmethyl-4-(4-methoxy-benzolsulfonyl)-piperidin-4-carbonsäure-ethylester wurde gemäß dem allgemeinen Verfahren wie in Beispiel 1 skizziert hergestellt, ausgehend von 4-(Methoxy-benzolsulfonyl)-essigsäure-ethylester (2,85 g, 11 mmol) und 1-Biphenyl-4-ylmethyl-bis-(2-chlor-ethyl)-amin (3,4 g, 11 mmol). Ausbeute 2,1 g (39%); beiger Feststoff, Fp. 176–178°C, MS: 494,1 (M + H)+.
- 1-Biphenyl-4-ylmethyl-4-(4-methoxy-benzolsulfonyl)-piperidin-4-carbonsäure wurde hergestelt, ausgehend von 1-Biphenyl-4-ylmethyl-(4-methoxy-benzolsulfonyl)-piperidin-4-carbonsäure-ethylester (5,7 g, 12 mmol), gelöst in Ethanol (20 ml), Tetrahydrofuran (20 ml) und 10 N Natriumhydroxid (10 ml). Das sich ergebende Umsetzungsgemisch wurde wie in Beispiel 1 skizziert aufge arbeitet. Ausbeute 2,1 g (39%); MS: 465,8 (M + H)+.
- Ausgehend von 1-Biphenyl-4-ylmethyl-4-(4-methoxy-benzolsulfonyl)-piperidin-4-carbonsäure (1,0 g, 2,2 mmol und dem Verfahren wie in Beispiel 1 skizziert folgend, wurden 0,132 g 1-Biphenyl-4-ylmethyl-4-(4-methoxy-benzolsulfonyl)piperidin-4-carbonsäure-hydroxamid als gelbbrauner Feststoff isoliert; Fp. 168°C; Ausbeute 20%; MS: 440,9 (M + H)+; 1H NMR (300 MHz, DMSO-d6): δ 2,30–2,35 (m, 2H), 2,83–2,87 (m, 2H), 3,35–3,5 (m, 4H), 3,87 (s, 3H), 7,15–7,21 (d, J = 0,059 Hz, 2H), 7,49–7,65 (m, 5H), 7,68–7,74 (d, J = 0,06 Hz, 2H), 9,3 (s, 1H), 10,3 (s, 1H), 11,15 (s, 1H).
- Beispiel 7
- 4-(4-Methoxy-benzol-sulfonyl)-1-(3-methyl-but-2-enyl)piperidin-4-carbonsäure-hydroxamid
- 2-[(2-Hydroxy-ethyl)-1-(3-methyl-but-2-enyl)-amino]-ethanol wurde gemäß dem allgemeinen Verfahren wie in Beispiel 1 skizziert hergestellt, ausgehend von Diethanolamin (4,1 g, 39 mmol) und 4-Brom-2-methyl-buten (6,0 g, 40 mmol). Ausbeute (98%); braunes Öl; MS: 173,8 (M + H)+.
- 1-(3-Methyl-but-2-enyl)-bis-(2-chlor-ethyl)-amin wurde gemäß dem allgemeinen Verfahren wie in Beispiel 1 skizziert hergestellt, ausgehend von 2-[(2-Hydroxy-ethyl)-1-(3-methyl-but-2-enyl)-amino]-ethanol (10,4 g, 50 mmol). Ausbeute 10,5 g (99%); brauner Feststoff; MS: 210,3 (M + H).
- 4-(4-Methoxy-benzolsulfonyl)-1-(3-methyl-but-2-enyl)-piperidin-4-carbonsäure-ethylester wurde gemäß dem allgemeinen Verfahren wie in Beispiel 1 skizziert hergestellt, ausgehend von 4-(Methoxy-benzolsulfonyl)-essigsäure-ethylester (11,32 g, 44 mmol) und 3-Methyl-but-2-enyl)-bis-(2-chlorethyl)-amin (10,4 g, 50 mmol). Ausbeute 6,2 g (36%); braunes Öl; MS: 395,6 (M + H)+.
- 4-(4-Methoxy-benzolsulfonyl)-1-(3-methyl-but-2-enyl)-piperidin-4-carbonsäure wurde hergestellt, ausgehend von 4-(4-Methoxy-benzolsulfonyl)-1-(3-methyl-but-2-enyl)-piperidin-4-carbonsäure-ethylester (6,2 g, 16 mmol), gelöst in Ethanol (15 ml), 10 N Natriumhydroxid (10 ml) und Tetrahydrofuran (75 ml). Das sich ergebende Umsetzungsgemisch wurde wie in Beispiel 1 skizziert aufgearbeitet. Ausbeute 1,2 g (21%); brauner Feststoff, Fp. 196–197°C; MS: 367,9 (M + H)+.
- Ausgehend von 4-(4-Methoxy-benzolsulfonyl)-1-(3-methyl-but-2-enyl)-piperidin-4-carbonsäure (1,0 g, 3,0 mmol) und dem Ver fahren wie in Beispiel 1 skizziert folgend, wurden 0,110 mg von 4-(4-Methoxy-benzol-sulfonyl)-1-(3-methyl-but-2-enyl)-piperidin-4-carbonsäure-hydroxamid als gelber Feststoff isoliert, Fp. 142–145°C; Ausbeute 12%; MS 382,9 (M + H)+; 1H NMR (300 MHz, DMSO-d6): δ 1,67 (s, 3H), 1,79 (s, 3H), 2,18–2,23 (m, 2H), 2,66–2,73 (m, 2H), 3,37–3,46 (m, 2H), 3,67–3,69 (m, 2H), 5,19–5,24 (m, 1H), 7,15–7,18 (d, J = 0,03, 2H), 7,67–7,70 (d, J = 0,030, 2H), 9,34 (s, 1H), 9,88 (s, 1H), 11,15 (s, 1H).
- Beispiel 8
- 1-(4-Brom-benzyl)-4-(4-methoxy-benzolsulfonyl)-piperidin-4-carbonsäure-hydroxyamid
- 2-[(4-Brombenzyl)-(2-hydroxy-ethyl)-amino]-ethanol wurde gemäß dem allgemeinen Verfahren wie in Beispiel 1 skizziert hergestellt, ausgehend von Diethanolamin (22,5 g, 150 mmol) und 4-Brombenzylbromid (25 g, 100 mmol). Ausbeute 33,66 g (99%); gelbes Öl; MS: 273,8 (M + H)+.
- (4-Brom-benzyl)-bis-(2-chlor-ethyl)-amin wurde gemäß dem allgemeinen Verfahren wie in Beispiel 1 skizziert hergestellt, ausgehend von 2-[(4-Brombenzyl)-(2-hydroxy-ethyl)-amino]-ethanol (33,28 g, 122 mmol). Ausbeute 47 g (99%); brauner Feststoff; Fp. 125°C; MS: 309,8 (M + H)+.
- 1-(4-Brom-benzyl)-4-(4-methoxy-benzolsulfonyl)-piperidin-4-carbonsäure-ethylester wurde gemäß dem allgemeinen Verfahren wie in Beispiel 1 skizziert hergestellt, ausgehend von 4-(Methoxy-benzolsulfonyl)-essigsäure-ethylester (8,6 g, 33,5 mmol) und (4-Brom-benzyl)-bis-(2-chlor-ethyl)-amin (13,3 g, 38,6 mmol). Ausbeute 17 g (44%); braunes Öl; MS: 497,8 (M + H)+.
- 1-(4-Brom-benzyl)-4-(4-methoxy-benzolsulfonyl)-piperidin-4-carbonsäure wurde hergestellt, ausgehend von 1-(4-Brom-benzyl)-4-(4-methoxy-benzolsulfonyl)-piperidin-4-carbonsäure-ethylester (16,5 g, 33,3 mmol), gelöst in THF : Methanol 3 : 1 und 10 N NaOH (20 ml). Das sich ergebende Umsetzungsgemisch wurde wie in Beispiel 1 skizziert aufgearbeitet. Ausbeute 6,18 g (40%); gelbbrauner Feststoff; Fp. 215°C; MS: 469,7 (M + H)+.
- Ausgehend von 1-(4-Brom-benzyl)-4-(4-methoxy-benzolsulfonyl)-piperidin-4-carbonsäure (1,95 g, 4,2 mmol) und dem Verfahren wie in Beispiel 1 skizziert folgend wurden 1,29 g von 1-(4-Brombenzyl)-4-(4-methoxy-benzolsulfonyl)-piperidin-4-carbonsäure-hydroxyamid als ein von weiß abweichender Feststoff isoliert. Ausbeute 60%; Fp. 180°C; MS: 484,7 (M + H)+; 1H NMR (300 MHz, DMSO-d6): δ 2,18–2,29 (m, 2H), 2,46 (d, 2H), 2,74–2,89 (m, 2H), 3,39 (d, 2H), 3,87 (s, 3H), 4,28 (s, 2H), 7,18 (d, J = 17 Hz, 2H), 7,49 (d, J = 8,1 Hz, 2H), 7,65–7,68 (m, 4H), 9,37 (s, 1H), 10,5 (s, 1H).
- Beispiel 9
- 4-(4-Methoxy-benzolsulfonyl)-1-(3-phenyl-propyl)-piperidin-4-carbonsäure-hydroxyamid
- 2-[(2-Hydroxy-ethyl)-(3-phenyl-propyl)-amino]-ethanol wurde gemäß dem allgemeinen Verfahren wie in Beispiel 1 skizziert hergestellt, ausgehend von Diethanolamin (15,8 g, 151 mmol) und 1-Brom-3-phenylpropan (20 g, 101 mmol). Ausbeute 21,31 g (95%); gelbes Öl; MS: 223,9 (M + H)+.
- Bis-(2-chlor-ethyl)-(3-phenyl-propyl)-amin wurde gemäß dem allgemeinen Verfahren wie in Beispiel 1 skizziert hergestellt, ausgehend von 2-[(2-Hydroxy-ethyl)-(3-phenyl-propyl)-amino]-ethanol (20,32 g, 90,7 mmol). Ausbeute 24,9 g (92%); braunes Öl; MS: 259,8 (M + H)+.
- 4-(4-Methoxy-benzolsulfonyl)-1-(3-phenyl-propyl)-piperidin-4-carbonsäure-ethylester wurde gemäß dem allgemeinen Verfahren wie in Beispiel 1 skizziert hergestellt, ausgehend von 4-(Methoxy-benzolsulfonyl)-essigsäure-ethylester (12 g, 46,5 mmol) und Bis-(2-chlor-ethyl)-(3-phenyl-propyl)-amin (24,8 g, 93,8 mmol). Ausbeute 11,24 g (54%); braunes Öl; MS: 446 (M + H)+.
- 4-(4-Methoxy-benzolsulfonyl)-1-(3-phenyl-propyl)-piperidin-4-carbonsäure wurde hergestellt, ausgehend von 4-(4-Methoxy-benzolsulfonyl)-1-(3-phenyl-propyl)-piperidin-4-carbonsäure-ethylester (10,74 g, 24,13 mmol), gelöst in THF : Methanol 3 : 1 und 10 N NaOH (40 ml). Das sich ergebende Gemisch wurde wie in Beispiel 1 skizziert aufgearbeitet. Ausbeute 4,67 g (47%); von weiß abweichendes Pulver; Fp. 203°C; MS: 418,2 (M + H)+.
- Ausgehend von 4-(4-Methoxy-benzolsulfonyl)-1-(3-phenyl-propyl)-piperidin-4-carbonsäure (4,37 g, 10,4 mmol) und dem Verfahren wie in Beispiel 1 skizziert folgend, wurden 1,64 g von 4-(4-Methoxy-benzolsulfonyl)-1-(3-phenyl-propyl)-piperidin-4-carbonsäure-hydroxyamid als ein von weiß abweichender Feststoff isoliert. Ausbeute 37%; Fp. 143°C; MS: 432,9 (M + H)+; 1H NMR (300 MHz, DMSO-d6): δ 1,92–1,97 (m, 2H), 2,18–2,29 (m, 2H), 2,47 (d, 2H), 2,58 (t, J = 7,7 Hz, 2H), 2,6–2,73 (m, 2H), 3,0–3,06 (m, 2H), 3,60 (d, J = 12,3 Hz, 2H), 3,87 (s, 2H), 7,15–7,30 (m, 7H), 7,68 (d, J = 9 Hz, 2H), 9,3 (s, 1H), 10,1 (s, 1H).
- Beispiel 10
- 1-tert.-Butyl-4-(4-methoxy-benzolsulfonyl)-piperidin-4-carbonsäure-hydroxyamid
- tert.-Butyl-bis-(2-chlor-ethyl)-amin wurde gemäß dem allgemeinen Verfahren wie in Beispiel 1 skizziert hergestellt, ausgehend von 1-tert.-Butyl-diethanolamin (6 g, 37,2 mmol). Ausbeute 11,15 g, (99%); weißer Feststoff; MS: 197,8 (M + H)+.
- 1-tert.-Butyl-4-(4-methoxy-benzolsulfonyl)-piperidin-4-carbonsäure-ethylester wurde gemäß dem Verfahren wie in Beispiel 1 skizziert hergestellt, ausgehend von 4-(Methoxy-benzolsulfonyl)-essigsäure-ethylester (10 g, 38,76 mmol) und tert.-Butyl-bis-(2-chlor-ethyl)-amin (5,25 g, 22,53 mmol). Ausbeute 5,37 g, (62%); braunes Öl; MS: 384 (M + H)+.
- 1-tert.-Butyl-4-(4-methoxy-benzolsulfonyl)-piperidin-4-carbonsäure wurde hergestellt, ausgehend von 1-tert.-Butyl-4-(4-methoxy-benzolsulfonyl)-piperidin-4-carbonsäure-ethylester (5,37 g, 14 mmol), gelöst in Methanol (300 ml) und 10 N NaOH (23 ml). Das sich ergebende Umsetzungsgemisch wurde wie in Beispiel 1 skizziert aufgearbeitet. Ausbeute 1,52 g (30,6%; weißes Pulver; Fp. 204°C; MS: 356 (M + H)+.
- Ausgehend von 1-tert.-Butyl-4-(4-methoxy-benzolsulfonyl)-piperidin-4-carbonsäure (320 mg, 0,9 mmol) und dem Verfahren wie in Beispiel 1 skizziert folgend, wurden 190 mg von 1-tert.-Butyl-4-(4-methoxy-benzolsulfonyl)-piperidin-4-carbonsäure-hydroxyamid als grüner Feststoff isoliert. Ausbeute 52%; Fp. 40°C; MS: 371,1 (M + H)+; 1H NMR (300 MHz, DMSO-d6): δ 1,29 (s, 9H), 1,54 (m, 2H), 1,66 (m, 2H), 2,39 (m, 2H), 2,98 (m, 2H), 3,88 (s, 3H), 7,18 (d, 2H), 7,67 (d, 2H).
- Beispiel 11
- 1-Butyl-4-(4-methoxy-benzolsulfonyl)-piperidin-4-carbonsäure-hydroxyamid
- Butyl-bis-(2-chlor-ethyl)-amin wurde gemäß dem allgemeinen Verfahren wie in Beispiel 1 skizziert hergestellt, ausgehend von N-Butyldiethanolamin (6 g, 37,2 mmol). Ausbeute 11,3 g (99%); weißes Pulver; Fp. 165°C; MS: 197,9 (M + H)+.
- 1-Butyl-4-(4-methoxy-benzolsulfonyl)-piperidin-4-carbonsäu re-ethylester wurde gemäß dem allgemeinen Verfahren wie in Beispiel 1 skizziert hergestellt, ausgehend von 4-(Methoxy-benzolsulfonyl)-essigsäure-ethylester (5 g, 19,38 mmol) und Butylbis-(2-chlor-ethyl)-amin (4,52 g, 19,38 mmol). Ausbeute 6,86 g, (93%); braunes Öl; MS: 384 (M + H)+.
- 1-Butyl-4-(4-methoxy-benzolsulfonyl)-piperidin-4-carbonsäure wurde hergestellt, ausgehend von 1-Butyl-4-(4-methoxy-benzolsulfonyl)-piperidin-4-carbonsäure-ethylester (6,42 g, 16,8 mmol), gelöst in Methanol (200 ml) und 10 N NaOH (20 ml). Das sich ergebende Umsetzungsgemisch wurde wie in Beispiel 1 skizziert aufgearbeitet. Ausbeute 1,6 g (27%); weißes Pulver; Fp. 206°C; MS: 356,4 (M + H)+.
- Ausgehend von 1-Butyl-4-(4-methoxy-benzolsulfonyl)-piperidin-4-carbonsäure (1,51 g, 4,3 mmol) und dem Verfahren wie in Beispiel 1 skizziert folgend, wurden 200 mg von 1-Butyl-4-(4-methoxy-benzolsulfonyl)-piperidin-4-carbonsäure-hydroxyamid als ein von weiß abweichender Feststoff isoliert. Ausbeute 9,3%; Fp. 75°C; MS: 371,1 (M + H)+; 1H NMR (300 MHz, DMSO-d6): δ 0,87 (t, J = 7,2 Hz, 3H), 1,27 (m, 2H), 1,59 (m, 2H), 2,27 (m, 2H), 2,45 (m, 2H), 2,50 (m, 2H), 2,65 (m, 2H), 2,97 (m, 2H), 3,88 (s, 3H), 7,18 (d, 2H), 7,69 (d, 2H).
- Beispiel 12
- 1-Cyclooctyl-4-(4-methoxy-benzolsulfonyl)-piperidin-4-carbonsäure-hydroxyamid
- Cyclooctyl-bis-(2-chlor-ethyl)-amin wurde gemäß dem allgemeinen Verfahren wie in Beispiel 1 skizziert hergestellt, ausgehend von N-Cyclooctyldiethanolamin (6 g, 28 mmol). Ausbeute 10 g, (99%); von weiß abweichender Feststoff; Fp. 158°C; MS: 251,9 (M + H)+.
- 1-Cyclooctyl-4-(4-methoxy-benzolsulfonyl)-piperidin-4-carbonsäure-ethylester wurde gemäß dem allgemeinen Verfahren wie in Beispiel 1 skizziert hergestellt, ausgehend von 4-(Methoxy-benzolsulfonyl)-essigsäure-ethylester (5 g, 19,4 mmol) und Cyclooctyl-bis-(2-chlor-ethyl)-amin (5,57 g, 19,4 mmol). Ausbeute 8,2 g (96%); braunes Öl; MS: 438 (M + H)+.
- 1-Cyclooctyl-4-(4-methoxy-benzolsulfonyl)-piperidin-4-carbonsäure wurde hergestellt, ausgehend von 1-Cyclooctyl-4-(4-methoxy-benzolsulfonyl)-piperidin-4-carbonsäure-ethylester (8 g, 18,3 mmol), gelöst in Methanol (200 ml) und 10 N NaOH (25 ml). Das sich ergebende Umsetzungsgemisch wurde wie in Beispiel 1 skizziert aufgearbeitet. Ausbeute 2,36 g (32%); weißes Pulver; Fp. 180°C; MS: 410 (M + H)+.
- Ausgehend von 1-Cyclooctyl-4-(4-methoxy-benzolsulfonyl)-piperidin-4-carbonsäure (2,26 g, 5,53 mmol) und dem Verfahren wie in Beispiel 1 skizziert folgend, wurden 570 mg von 1-Cyclooctyl-4-(4-methoxy-benzolsulfonyl)-piperidin-4-carbonsäure-hydroxyamid als weißes Pulver isoliert. Ausbeute 22%; Fp. > 200°C; MS: 425 (M + H)+; 1H NMR (300 MHz, DMSO-d6): δ 1,42–1,66 (m, 14H), 1,83 (m, 2H), 2,33 (m, 2H), 2,67 (m, 2H), 3,30–3,51 (m, 3H), 3,88 (s, 3H), 7,17 (d, 2H), 7,66 (d, 2H).
- Beispiel 13
- 1-Ethyl-4-(4-methoxy-benzolsulfonyl)-piperidin-4-carbonsäure-hydroxyamid
- 1-Ethyl-4-(4-methoxy-benzolsulfonyl)-piperidin-4-carbonsäure-ethylester wurde gemäß dem allgemeinen Verfahren wie in Beispiel 1 skizziert hergestellt, ausgehend von 4-(Methoxy-benzolsulfonyl)-essigsäure-ethylester (3 g, 11,6 mmol) und Ethyl-bis-(2-chlor-ethyl)-amin (2,39 g, 11,6 mmol). Ausbeute 3,09 g (75%); niedrig schmelzender brauner Feststoff; MS: 356 (M + H)+.
- 1-Ethyl-4-(4-methoxy-benzolsulfonyl)-piperidin-4-carbonsäure wurde hergestellt, ausgehend von 1-Ethyl-4-(4-methoxy-benzolsulfonyl)-piperidin-4-carbonsäure-ethylester (2,42 g, 6,8 mmol), gelöst in Methanol (100 ml) und 10 N NaOH (15 ml). Das sich ergebende Umsetzungsgemisch wurde wie in Beispiel 1 skizziert aufgearbeitet. Ausbeute 1,29 g (58%); weißer Feststoff; Fp. 209°C; MS: 328 (M + H)+.
- Ausgehend von 1-Ethyl-4-(4-methoxy-benzolsulfonyl)-piperidin-4-carbonsäure (1,23 g, 3,76 mmol) und dem Verfahren wie in Beispiel 1 skizziert folgend, wurden 1,02 g von 1-Ethyl-4-(4-methoxy-benzolsulfonyl)-piperidin-4-carbonsäure-hydroxyamid als ein von weiß abweichendes Pulver isoliert. Ausbeute 80%; Fp. 85°C; MS: 343 (M + H)+; 1H NMR (300 MHz, DMSO-d6): δ 0,926 (t, J = 7,1 Hz, 3H), 1,68–1,89 (m, 4H), 2,05–2,24 (m, 4H), 2,73 (q, 2H), 3,85 (s, 3H), 7,07 (d, 2H), 7,64 (d, 2H).
- Beispiel 14
- 1-Isopropyl-4-(4-methoxy-benzolsulfonyl)-piperidin-4-carbonsäure-hydroxyamid
- 1-Isopropyl-4-(4-methoxy-benzolsulfonyl)-piperidin-4-carbonsäure-ethylester wurde gemäß dem allgemeinen Verfahren wie in Beispiel 1 skizziert hergestellt, ausgehend von 4-(Methoxy-benzolsulfonyl)-essigsäure-ethylester (5,7 g, 22,2 mmol) und Isopropyl-bis-(2-chlor-ethyl)-amin (4,9 g, 22,2 mmol). Ausbeute 5,64 g (68%); niedrig schmelzender brauner Feststoff; MS: 370 (M + H)+.
- 1-Isopropyl-4-(4-methoxy-benzolsulfonyl)-piperidin-4-carbonsäure wurde hergestellt, ausgehend von 1-Isopropyl-4-(4-methoxy-benzolsulfonyl)-piperidin-4-carbonsäure-ethylester (5,6 g, 15,2 mmol), gelöst in Methanol (75 ml) und 10 N NaOH (25 ml). Das sich ergebende Umsetzungsgemisch wurde wie in Beispiel 1 skizziert aufgearbeitet. Ausbeute 2,18 g (42%); weißes Pulver; Fp. 204°C; MS: 341,9 (M + H)+.
- Ausgehend von 1-Isopropyl-4-(4-methoxy-benzolsulfonyl)-piperidin-4-carbonsäure (2,13 g, 6,25 mmol) und dem Verfahren wie in Beispiel 1 skizziert folgend, wurden 590 mg von 1-Isopropyl-4-(4-methoxy-benzolsulfonyl)-piperidin-4-carbonsäure-hydroxyamid als weißes Pulver isoliert. Ausbeute 2,4%; Fp. 75°C; MS: 357 (M + H)+; 1H NMR (300 MHz, DMSO-d6): δ 1,21 (d, J = 6,6 Hz, 6H), 2,33–3,53 (m, 9H), 3,88 (s, 3H), 7,16 (d, 2H), 7,66 (d, 2H).
- Beispiel 15
- 1-Methyl-4-(4-methoxy-benzolsulfonyl)-piperidin-4-carbonsäure-hydroxyamid
- 1-Methyl-4-(4-methoxy-benzolsulfonyl)-piperidin-4-carbonsäure-ethylester wurde gemäß dem allgemeinen Verfahren wie in Beispiel 1 skizziert hergestellt, ausgehend von 4-(Methoxy-benzolsulfonyl)essigsäure-ethylester (3 g, 11,6 mmol) und Methyl-bis-(2-chlor-ethyl)-amin (2,2 g, 11,6 mmol). Ausbeute 3,09 g (75%); niedrig schmelzender brauner Feststoff; MS: 342 (M + H)+.
- 1-Methyl-4-(4-methoxy-benzolsulfonyl)-piperidin-4-carbonsäure wurde hergestellt, ausgehend von 1-Methyl-4-(4-methoxy-benzolsulfonyl)-piperidin-4-carbonsäure-ethylester (8,7 g, 25,6 mmol), gelöst in Methanol (300 ml) und 10 N NaOH (35 ml). Das sich ergebende Umsetzungsgemisch wurde wie in Beispiel 1 skizziert aufgearbeitet. Ausbeute 3,23 g (41%); weißer Feststoff, Fp. 204°C; MS: 313,9 (M + H)+.
- Ausgehend von 1-Methyl-4-(4-methoxy-benzolsulfonyl)-piperidin-4-carbonsäure (2,0 g, 6,38 mmol) und dem Verfahren wie in Beispiel 1 skizziert folgend, wurden 1,10 g von 1-Methyl-4-(4-methoxy-benzolsulfonyl)-piperidin-4-carbonsäure-hydroxyamid als gelbes Pulver isoliert. Ausbeute 53%; Fp. 89°C; MS: 329 (M + H)+; 1H NMR (300 MHz, DMSO-d6): δ 1,67–1,76 (m, 2H), 1,85–1,96 (m, 2H), 2,05 (s, 3H), 2,17 (d, J = 11,4 Hz, 2H), 2,57 (d, J = 10,4 Hz, 2H) 3,83 (s, 3H), 7,02 (d, 2H), 7,62 (d, 2H).
- Beispiel 16
- 1-Benzyl-4-(4-butoxy-benzolsulfonyl)-piperidin-4-carbonsäure-hydroxyamid
- 1-Benzyl-4-(4-butoxy-benzolsulfonyl)-piperidin-4-carbonsäure-ethylester wurde gemäß dem allgemeinen Verfahren wie in Beispiel 1 skizziert hergestellt, ausgehend von 4-(Butoxy-benzolsulfonyl)essigsäure-ethylester (6 g, 20 mmol) und Bis-(2-chlor-ethyl)-benzylamin (10 g, 30 mmol). Ausbeute 5,15 g (56%); gelbes Öl; MS: 460 (M + H)+.
- 1-Benzyl-4-(4-butoxy-benzolsulfonyl)-piperidin-4-carbonsäure wurde hergestellt, ausgehend von 1-Benzyl-4-(4-butoxy-benzolsulfonyl)-piperidin-4-carbonsäure-ethylester (5,1 g, 11,1 mmol), gelöst in THF : Methanol 3 : 1 und 10 N NaOH (10 ml). Das sich ergebende Umsetzungsgemisch wurde wie in Beispiel 1 skizziert aufbereitet. Ausbeute 2,66 g (56%); von weiß abweichender Feststoff; Fp. 210°C; MS: 432 (M + H)+.
- Ausgehend von 1-Benzyl-4-(4-butoxy-benzolsulfonyl)-piperidin-4-carbonsäure (2,61 g, 6,06 mmol) und dem Verfahren wie in Beispiel 1 skizziert folgend, wurden 860 mg von 1-Benzyl-4-(4-butoxy-benzolsulfonyl)-piperidin-4-carbonsäure-hydroxyamid als ein von weiß abweichendes Pulver isoliert. Ausbeute 32%; Fp. 144°C; MS: 446,9 (M + H)+; 1H NMR (300 MHz, DMSO-d6): δ 0,94 (t, J = 7,3 Hz, 3H), 1,44 (q, J = 7,5 Hz, 2H), 1,70 (q, 2H), 2,28–2,32 (m, 2H), 2,50 (d, 2H), 2,74–2,83 (m, 2H), 3,35 (d, 2H), 4,08 (t, J = 6,3 Hz, 2H), 4,34 (s, 2H), 7,13 (d, J = 8,7, 2H), 7,45 (s, 3H), 7,54 (s, 2H), 7,74 (d, J = 8,7, 2H), 9,35 (s, 1H), 10,7 (s, 1H).
- Beispiel 17
- 1-(4-Fluor-benzyl)-4-(4-methoxy-benzolsulfonyl)-piperidin-4-carbonsäure-hydroxyamid
- 1-(4-Fluor-benzyl)-4-(4-methoxy-benzolsulfonyl)-piperidin-4-carbonsäure-ethylester wurde gemäß dem allgemeinen Verfahren wie in Beispiel 1 skizziert hergestellt, ausgehend von 4-(Methoxy- benzolsulfonyl)-essigsäure-ethylester (18,8 g, 72,8 mmol) und (4-Fluor-benzyl)-bis-(2-chlor-ethyl)-amin (20,8 g, 73 mmol). Ausbeute 25 g (79%); braunes Öl; MS: 436,9 (M + H)+.
- 1-(4-Fluor-benzyl)-4-(4-methoxy-benzolsulfonyl)-piperidin-4-carbonsäure wurde hergestellt, ausgehend von 1-(4-Fluor-benzyl)-4-(4-methoxy-benzolsulfonyl)-piperidin-4-carbonsäure-ethylester (17,4 g, 40 mmol), gelöst in THF : Methanol 3 : 1 und 10 N NaOH (40 ml). Das sich ergebende Umsetzungsgemisch wurde wie in Beispiel 1 skizziert aufgearbeitet. Ausbeute 10,8 g (66%); farbloser Feststoff; Fp. 154°C; MS: 408 (M + H)+.
- Ausgehend von 1-(4-Fluor-benzyl)-4-(4-methoxy-benzolsulfonyl)-piperidin-4-carbonsäure (8,14 g, 20 mmol) und dem Verfahren wie in Beispiel 1 skizziert folgend, wurden 4,3 g von 1-(4-Fluor-benzyl)-4-(4-methoxy-benzolsulfonyl)-piperidin-4-carbonsäure-hydroxyamid als ein von weiß abweichender Feststoff isoliert. Ausbeute 51%; Fp. 176–178°C; MS: 484,7 (M + H)+; 1H NMR (300 MHz, DMSO-d6): δ 2,12–2,20 (m, 2H), 2,64–2,79 (m, 2H), 3,32–3,45 (m, 4H), 3,87 (s, 3H), 4,31 (s, 2H), 7,14–7,19 (d, J = 17 Hz, 2H), 7,27–7,33 (d, J = 8,1 Hz, 2H), 7,50–7,54 (d, 2H), 7,65–7,68 (d, 2H), 9,38 (s, 1H), 9,75 (s, 1H).
- Beispiel 18
- 1-(4-Fluor-benzyl)-4-(4-butoxy-benzolsulfonyl)-piperidin-4-carbonsäure-hydroxyamid
- 1-(4-Fluor-benzyl)-4-(4-butoxy-benzolsulfonyl)-piperidin-4-carbonsäure-ethylester wurde gemäß dem allgemeinen Verfahren wie in Beispiel 1 skizziert hergestellt, ausgehend von 4-(Butoxy-benzolsulfonyl)-essigsäure-ethylester (6 g, 20 mmol) und (4-Fluor-benzyl)-bis-(2-chlor-ethyl)-amin (5,73 g, 20 mmol). Ausbeute 8,2 g (86%); gelbes Öl; MS: 478 (M + H)+.
- 1-(4-Fluor-benzyl)-4-(4-butoxy-benzolsulfonyl)-piperidin-4-carbonsäure wurde hergestellt, ausgehend von 1-(4-Fluor-benzyl)-4-(4-butoxy-benzolsulfonyl)-piperidin-4-carbonsäure-ethylester (4,77 g, 10 mmol), gelöst in THF : Methanol 3 : 1 und 10 N NaOH (10 ml). Das sich ergebende Umsetzungsgemisch wurde wie in Beispiel 1 skizziert aufgearbeitet. Ausbeute 3,5 g (79%); von weiß abweichender Feststoff; Fp. 114°C; MS: 450 (M + H)+.
- Ausgehend von 1-(4-Fluor-benzyl)-4-(4-butoxy-benzolsulfonyl)-piperidin-4-carbonsäure (2,24 g, 5,0 mmol) und dem Verfahren wie in Beispiel 1 skizziert folgend, wurden 200 mg von 1-(4- Fluor-benzyl)-4-(4-butoxy-benzolsulfonyl)-piperidin-4-carbonsäure-hydroxyamid als ein von weiß abweichendes Pulver isoliert. Ausbeute 9%; Fp. 112°C; MS: 465,9 (M + H)+; 1H NMR (300 MHz, DMSO-d6): δ 0,94 (t, J = 7,3 Hz, 3H), 1,35–1,50 (m, 2H), 1,68–1,77 (m, 2H), 2,20–2,28 (m, 2H), 2,66–2,77 (m, 2H), 3,77–3,78 (m, 4H), 4,06–4,10 (m, 2H), 4,19 (s, 2H), 7,14–7,19 (d, J = 8,7, 2H), 7,27–7,33 (d, 2H), 7,50–7,54 (d, 2H), 7,65–7,68 (d, 2H), 9,34 (s, 1H), 10,55 (s, 1H).
- Beispiel 19
- 4-(4-Methoxy-benzolsulfonyl)-1-(4-methoxy-benzyl)-piperidin-4-carbonsäure-hydroxyamid
- 2-[(2-Hydroxy-ethyl)-(4-methoxy-benzyl)-amino]-ethanol wurde gemäß dem allgemeinen Verfahren wie in Beispiel 1 skizziert hergestellt, ausgehend von Diethanolamin (12,0 g, 114 mmol) und 4-Methoxybenzylchlorid (14,2 g, 100 mmol). Ausbeute 17,5 g (77%); gelbes Öl; MS: 226 (M + H).
- 4-Methoxybenzyl-bis-(2-chlor-ethyl)-amin wurde gemäß dem allgemeinen Verfahren wie in Beispiel 1 skizziert hergestellt, ausgehend von 4-Methoxy-benzyl-diethanolamin (10 g, 44 mmol). Ausbeute 10 g (75%); gelber Feststoff; Fp. 55°C; MS: 263,1 (M + H)+.
- 4-(4-Methoxy-benzolsulfonyl)-1-(4-methoxy-benzyl)-piperidin-4-carbonsäure-ethylester wurde gemäß dem allgemeinen Verfahren wie in Beispiel 1 skizziert hergestellt, ausgehend von 4-(Methoxy-benzolsulfonyl)-essigsäure-ethylester (5,0 g, 20 mmol) und Bis-(2-chlor-ethyl)-4-methoxy-benzyl)-amin (7,0 g, 22 mmol). Ausbeute 5,0 g (56%); niedrig schmelzender Feststoff; MS: 448,5 (M + H)+.
- 4-(4-Methoxy-benzolsulfonyl)-(4-methoxy-benzyl)-piperidin-4-carbonsäure wurde hergestellt, ausgehend von 4-(4-Methoxy-benzolsulfonyl)-1-(4-methoxy-benzyl)-piperidin-4-carbonsäure-ethylester (4,2 g, 10 mmol), gelöst in Methanol (30 ml), 10 N Natriumhydroxid (10 ml), Tetrahydrofuran (20 ml). Das sich ergebende Umsetzungsgemisch wurde wie in Beispiel 1 skizziert aufgearbeitet. Ausbeute 3,0 g (71%); weißer Feststoff, Fp. 190°C; MS: 420,4 (M + H)+.
- Ausgehend von 4-(4-Methoxy-benzolsulfonyl)-1-(4-methoxy-benzyl)-piperidin-4-carbonsäure (2,0 g, 4,7 mmol) und dem Verfahren wie in Beispiel 1 skizziert folgend, wurden 1,2 g 4-(4-Methoxy- benzolsulfonyl)-1-(4-methoxy-benzyl)-piperidin-4-carbonsäure-hydroxamid als weißer Feststoff isoliert, Fp. 175°C (HCl); Ausbeute: 1,2 g, 59%; MS: 433,0 (M + H)+; 1H NMR (300 MHz, DMSO-d6): δ 1,8 (m, 4H), 2,3 (m, 2H), 2,73 (m, 2H), 3,37 (d, 2H), 3,76 (s, 3H), 3,88 (s, 3H), 6,87 (d, 2H), 7,11 (d, 2H), 7,21 (d, 2H), 7,65 (d, 2H), 9,2 (bs, 1H), 10,9 (bs, 1H).
- Beispiel 20
- 4-(4-Methoxy-benzolsulfonyl)-1-[2-(4-methoxyphenyl)-ethyl]-piperidin-4-carbonsäure-hydroxyamid
- 2-{(2-Hydroxy-ethyl)-[2-(4-methoxy-phenyl)-ethyl]-amino}-ethanol wurde gemäß dem allgemeinen Verfahren wie in Beispiel 1 skizziert hergestellt, ausgehend von Diethanolamin (10,0 g, Überschuss) und 1-(2-Chlorethyl)-4-methoxybenzol (8,5 g, 50 mmol). Ausbeute 11 g, (92%); gelbes Öl; MS: 240 (M + H)+.
- Das entsprechende Dichlorid, Bis-(2-chlor-ethyl)-(4-methoxy-phenyl-2-ethyl)-amin wurde gemäß dem allgemeinen Verfahren wie in Beispiel 1 skizziert hergestellt, ausgehend von 2-{(2-Hydroxy-ethyl)-[2-(4-methoxy-phenyl)-ethyl]-amino}-ethanol (10 g, 41,8 mmol). Ausbeute 11 g (95%); braunes Öl; MS: 277,2 (M + H)+.
- 4-(4-Methoxy-benzolsulfonyl)-1-[2-(4-methoxyphenyl)-ethyl]-piperidin-4-carbonsäure-ethylester wurde gemäß dem allgemeinen Verfahren wie in Beispiel 1 skizziert hergestellt, ausgehend von 4-(Methoxy-benzolsulfonyl)-essigsäure-ethylester (5,0 g, 20 mmol) und Bis-(2-chlor-ethyl)-(4-methoxyphenyl-2-ethyl)-amin (6,4 g, 20 mmol). Ausbeute 6,0 g (65%); braunes Öl; MS: 462,5 (M + H)+.
- 4-(4-Methoxy-benzolsulfonyl)-1-[2-(4-methoxyphenyl)-ethyl]-piperidin-4-carbonsäure wurde hergestellt, ausgehend von 4-(4-Methoxy-benzolsulfonyl)-1-[2-(4-methoxyphenyl)-ethyl]-piperidin-4-carbonsäure-ethylester (5,0 g, 10,8 mmol), gelöst in THF : Methanol 3 : 1 und 10 N NaOH (40 ml). Das sich ergebende Umsetzungsgemisch wurde wie in Beispiel 1 skizziert aufgearbeitet. Ausbeute 4,0 g (85%); von weiß abweichendes Pulver; Fp. 205°C; MS: 434,5 (M + H)+.
- Ausgehend von 4-(4-Methoxy-benzolsulfonyl)-1-[2-(4-methoxyphenyl)-ethyl]-piperidin-4-carbonsäure (1,5 g, 3,46 mmol) und dem Verfahren wie in Beispiel 1 skizziert folgend, wurden 900 mg von 4-(4-Methoxy-benzolsulfonyl)-1-[2-(4-methoxyphenyl)-ethyl]-piperidin-4-carbonsäure-hydroxyamid als ein von weiß abweichen der Feststoff isoliert. Ausbeute 58%; Fp. 206°C (HCl); MS: 449,5 (M + H)+; 1H NMR (300 MHz, DMSO-d6): δ 2,3 (m, 2H), 2,5 (m, 3H), 2,8 (m, 2H), 2,95 (m, 2H), 3,25 (m, 2H), 3,4 (m, 4H), 3,60 (d, J = 12,3 Hz, 2H), 3,77 (s, 3H), 3,99 (s, 3H), 6,9 (d, 2H), 7,1–7,25 (q, 4H), 7,7 (d, 2H), 9,3 (s, 1H), 10,6 (s, 1H).
- Beispiel 21
- 4-(4-Methoxy-benzolsulfonyl)-1-(2-phenyl-ethyl)-piperidin-4-carbonsäure-hydroxyamid
- 2-[(2-Hydroxy-ethyl)-(2-phenyl-ethyl)-amino]-ethanol wurde gemäß dem allgemeinen Verfahren wie in Beispiel 1 skizziert hergestellt, ausgehend von Diethanolamin (6,0 g, 57) und 2-Bromethylbenzol (9,0 g, 48,3 mmol). Ausbeute 9 g, (90%); gelbes Öl; MS: 210 (M + H)+.
- Bis-(2-chlor-ethyl)-(2-phenyl-ethyl)-amin wurde gemäß dem allgemeinen Verfahren wie in Beispiel 1 skizziert hergestellt, ausgehend von 2-[(2-Hydroxy-ethyl)-(2-phenyl-ethyl)-amino]-ethanol (8,5 g, 40,6 mmol). Ausbeute 11 g (95%); braunes Öl; MS: 247,1 (M + H)+.
- 4-(4-Methoxy-benzolsulfonyl)-1-(2-phenyl-ethyl)-piperidin-4-carbonsäure-ethylester wurde gemäß dem allgemeinen Verfahren wie in Beispiel 1 skizziert hergestellt, ausgehend von 4-(Methoxy-benzolsulfonyl)-essigsäure-ethylester (5,0 g, 20 mmol) und Bis-(2-chlor-ethyl)-(2-phenyl-ethyl)-amin (5,6 g, 20 mmol). Ausbeute 5,5 g (63%); braunes Öl; MS: 432,5 (M + H)+.
- 4-(4-Methoxy-benzolsulfonyl)-1-(2-phenyl-ethyl)-piperidin-4-carbonsäure wurde hergestellt, ausgehend von 4-(4-Methoxy-benzolsulfonyl)-1-(2-phenyl-ethyl)-piperidin-4-carbonsäure-ethylester (3,0 g, 6,9 mmol), gelöst in THF : Methanol 3 : 1 und 10 N NaOH (40 ml). Das sich ergebende Umsetzungsgemisch wurde wie in Beispiel 1 skizziert aufgearbeitet. Ausbeute 2,0 g (72%); von weiß abweichendes Pulver; Fp. 208°C; MS: 404,5 (M + H)+.
- Ausgehend von 4-(4-Methoxy-benzolsulfonyl)-1-(2-phenyl-ethyl)-piperidin-4-carbonsäure (1,5 g, 3,7 mmol) und dem Verfahren wie in Beispiel 1 skizziert folgend wurden 900 mg von 4-(4-Methoxy-benzolsulfonyl)-1-(2-phenyl-ethyl)-piperidin-4-carbonsäure-hydroxyamid als ein von weiß abweichender Feststoff isoliert. Ausbeute: 58%; Fp. 205°C (HCl); MS: 419,4 (M + H)+; 1H NMR (300 MHz, DMSO-d6): δ 2,3 (m, 2H), 2,5 (m, 3H), 2,8 (m, 2H), 2,95 (m, 2H), 3,25 (m, 2H), 3,4 (m, 4H), 3,9 (s, 3H), 7,22–7,8 (m, 9H), 10,6 (s, 1H), 11,2 (bs, 1H).
- Beispiel 22
- 4-(4-n-Butoxy-benzolsulfonyl)-1-(4-methoxy-benzyl)-piperidin-4-carbonsäure-hydroxyamid
- 4-(4-n-Butoxy-benzolsulfonyl)-1-(4-methoxy-benzyl)-piperidin-4-carbonsäure-ethylester wurde gemäß dem Verfahren wie in Beispiel 1 skizziert hergestellt, ausgehend von 4-(n-Butoxy-benzolsulfonyl)-essigsäure-ethylester (2,5 g, 10 mmol) und Bis-(2-chlorethyl)-4-methoxy-benzyl)-amin (3,0 g, 10 mmol). Ausbeute 3,5 g (71%); niedrig schmelzender Feststoff; MS: 490,5 (M + H)+.
- 4-(4-n-Butoxy-benzolsulfonyl)-1-(4-methoxy-benzyl)-piperidin-4-carbonsäure wurde hergestellt, ausgehend von 4-(4-Butoxy-benzolsulfonyl)-1-(4-methoxy-benzyl)-piperidin-4-carbonsäure-ethylester (3,0 g, 6,1 mmol), gelöst in Methanol (30 ml), 10 N Natriumhydroxid (10 ml), Tetrahydrofuran (20 ml). Das sich ergebende Umsetzungsgemisch wurde wie in Beispiel 1 skizziert aufgearbeitet. Ausbeute 1,5 g (53%); weißer Feststoff, Fp. 207°C; MS: 462,5 (M + H)+.
- Ausgehend von 4-(4-n-Butoxy-benzolsulfonyl)-1-(4-methoxy-benzyl)-piperidin-4-carbonsäure (1,0 g, 2,1 mmol) und dem Verfahren wie in Beispiel 1 skizziert folgend, wurden 1,2 g von 4-(4-Butoxy-benzolsulfonyl)-1-(4-methoxy-benzyl)-piperidin-4-carbonsäure-hydroxamid als weißer Feststoff isoliert; Fp. 173°C (HCl); Ausbeute: 800 mg, 77%; MS: 477,5 (M + H)+; 1H NMR (300 MHz, DMSO-d6): δ 0,9 (t, 3H), 1,4 (m, 2H), 1,7 (m, 2H), 2,3 (m, 2H), 2,5 (m, 2H), 2,7 (m, 2H), 3,3 (m, 2H), 3,5 (m, 2H), 4,1 (t, 2H), 4,3 (m, 2H), 6,97 (d, 2H), 7,14 (d, 2H), 7,48 (d, 2H), 7,7 (d, 2H), 9,4 (bs, 1H), 10,9 (bs, 1H).
- Beispiel 23
- 4-(4-Methoxy-benzolsulfonyl)-1-(3-phenoxy-propyl)-piperidin-4-carbonsäure-hydroxyamid
- 2-[(2-Hydroxy-ethyl)-(3-phenoxy-propyl)-amino]-ethanol wurde gemäß dem allgemeinen Verfahren wie in Beispiel 1 skizziert hergestellt, ausgehend von Diethanolamin (15,8 g, 151 mmol) und 3-Phenoxypropylbromid (21,5 g, 100 mmol). Ausbeute 21,31 g (95%); gelbes Öl; MS: 238,1 (M + H)+.
- Bis-(2-chlor-ethyl)-(3-phenoxy-propyl)-amin wurde gemäß dem allgemeinen Verfahren wie in Beispiel 1 skizziert hergestellt, ausgehend von 2-[(2-Hydroxy-ethyl)-(3-phenoxy-propyl)-amino]-ethanol (20,0 g, 84 mmol). Ausbeute 24,0 g (91%); braunes Öl; MS: 277,8 (M + H)+.
- 4-(4-Methoxy-benzolsulfonyl)-1-(3-phenoxy-propyl)-piperidin-4-carbonsäure-ethylester wurde gemäß dem allgemeinen Verfahren wie in Beispiel 1 skizziert hergestellt, ausgehend von 4-(Methoxy-benzolsulfonyl)-essigsäure-ethylester (5,2 g, 20 mmol) und Bis-(2-chlor-ethyl)-(3-phenoxy-propyl)-amin (7,0 g, 22 mmol). Ausbeute 6,5 g (70%); braunes Öl; MS: 462,5 (M + H)+.
- 4-(4-Methoxy-benzolsulfonyl)-1-(3-phenoxy-propyl)-piperidin-4-carbonsäure wurde hergestellt, ausgehend von 4-(4-Methoxy-benzolsulfonyl)-1-(3-phenoxy-propyl)-piperidin-4-carbonsäure-ethylester (4,2 g, 9,1 mmol), gelöst in THF : Methanol 3 : 1 und 10 N NaOH (40 ml). Das sich ergebende Umsetzungsgemisch wurde wie in Beispiel 1 skizziert aufgearbeitet. Ausbeute 3,0 g (75%); von weiß abweichendes Pulver; Fp. 195°C; MS: 434,5 (M + H)+.
- Ausgehend von 4-(4-Methoxy-benzolsulfonyl)-1-(3-phenoxy-propyl)-piperidin-4-carbonsäure (2,5 g, 5,77 mmol) und dem Verfahren wie in Beispiel 1 skizziert folgend, wurden 1,2 g von 4-(4-Methoxy-benzolsulfonyl)-1-(3-phenoxy-propyl)-piperidin-4-carbonsäure-hydroxyamid als ein von weiß abweichender Feststoff isoliert. Ausbeute 46%; Fp. 101°C; MS: 448,5 (M + H)+; 1H NMR (300 MHz, DMSO-d6): δ 2,18 (m, 2H), 2,3 (m, 2H), 2,58 (m, 2H), 2,6–2,73 (m, 2H), 3,0–3,06 (m, 2H), 3,60 (m, 2H), 3,87 (s, 3H), 4,01 (t, 2H), 6,9–7,7 (m, 9H), 9,33 (bs, 1H), 10,28 (bs, 1H).
- Beispiel 24
- 4-(4-n-Butoxy-benzolsulfonyl)-1-(3-phenoxy-propyl)-piperidin-4-carbonsäure-hydroxyamid
- 4-(4-n-Butoxy-benzolsulfonyl)-1-(3-phenoxy-propyl)-piperidin-4-carbonsäure-ethylester wurde gemäß dem allgemeinen Verfahren wie in Beispiel 1 skizziert hergestellt, ausgehend von 4-(Butoxy-benzolsulfonyl)-essigsäure-ethylester (3,0 g, 10 mmol) und Bis-(2-chlor-ethyl)-(3-phenoxy-propyl)-amin (3,0 g, 11 mmol). Ausbeute 4,5 g (89%); braunes Öl; MS: 504,6 (M + H)+.
- 4-(4-n-Butoxy-benzolsulfonyl)-1-(3-phenoxy-propyl)-piperidin-4-carbonsäure wurde hergestellt, ausgehend von 4-(4-n-Butoxy-benzolsulfonyl)-1-(3-phenoxy-propyl)-piperidin-4-carbonsäure-ethylester (4,0 g, 7,9 mmol), gelöst in THF : Methanol 3 : 1 und 10 N NaOH (40 ml). Das sich ergebende Umsetzungsgemisch wurde wie in Beispiel 1 skizziert aufgearbeitet. Ausbeute 3,0 g (79%); von weiß abweichendes Pulver; Fp. 191°C; MS: 476,5 (M + H)+.
- Ausgehend von 4-(4-n-butoxy-benzolsulfonyl)-1-(3-phenoxy-propyl)-piperidin-4-carbonsäure (700 mg, 1,4 mmol) und dem Verfahren wie in Beispiel 1 skizziert folgend, wurden 300 mg von 4-(4-n-Butoxy-benzolsulfonyl)-1-(3-phenoxy-propyl)-piperidin-4-carbonsäure-hydroxyamid als ein von weiß abweichender Feststoff isoliert. Ausbeute 43%; Fp. 84°C; MS: 491,5 (M + H)+; 1H NMR (300 MHz, DMSO-d6): δ 0,9 (t, 3H), 1,5 (m, 2H), 1,8 (m, 2H), 2,18 (m, 2H), 2,3 (m, 2H), 2,58 (m, 2H), 2,6–2,73 (m, 2H), 3,2 (m, 2H), 3,40 (m, 6H), 3,97 (t, 2H), 4,1 (t, 2H), 6,9–7,7 (m, 9H), 10,7 (bs, 1H), 11,28 (bs, 1H).
- Beispiel 25
- 4-(4-Methoxy-benzolsulfonyl)-1-(2-phenoxy-ethyl)-piperidin-4-carbonsäure-hydroxyamid
- 2-[(2-Hydroxy-ethyl)-(2-phenoxy-ethyl)-amino]-ethanol wurde gemäß dem allgemeinen Verfahren wie in Beispiel 1 skizziert hergestellt, ausgehend von Diethanolamin (15,0 g, 150) und 2-Chlorphenetol (15,6 g, 100 mmol). Ausbeute 18 g (80%); farbloses Öl; MS: 226 (M + H)+.
- Bis-(2-chlor-ethyl)-(2-phenoxy-ethyl)-amin wurde gemäß dem allgemeinen Verfahren wie in Beispiel 1 skizziert hergestellt, ausgehend von 2-[(2-Hydroxy-ethyl)-(2-phenoxy-ethyl)-amino)-ethanol (20,0 g, 88,8 mmol). Ausbeute 25 g (94%); braunes Öl; MS: 263,1 (M + H)+.
- 4-(4-Methoxy-benzolsulfonyl)-1-(2-phenoxy-ethyl)-piperidin-4-carbonsäure-ethylester wurden gemäß dem allgemeinen Verfahren wie in Beispiel 1 skizziert hergestellt, ausgehend von 4-(Methoxy-benzolsulfonyl)-essigsäure-ethylester (5,0 g, 20 mmol) und Bis-(2-chlor-ethyl)-(2-phenoxy-ethyl)-amin (6,0 g, 20 mmol). Ausbeute 5,8 g (64%); braunes Öl; MS: 448,5 (M + H)+.
- 4-(4-Methoxy-benzolsulfonyl)-1-(2-phenoxy-ethyl)-piperidin-4-carbonsäure wurde hergestellt, ausgehend von 4-(4-Methoxy-benzolsulfonyl)-1-(2-phenyl-ethoxy)-piperidin-4-carbonsäure-ethylester (5,0 g, 11,1 mmol), gelöst in THF : Methanol 3 : 1 und 10 N NaOH (40 ml). Das sich ergebende Umsetzungsgemisch wurde wie in Beispiel 1 skizziert aufgearbeitet. Ausbeute 3,0 g (63%); von weiß abweichendes Pulver; Fp. 235°C; MS: 420,5 (M + H)+.
- Ausgehend von 4-(4-Methoxy-benzolsulfonyl)-1-(2-phenoxy- ethyl)-piperidin-4-carbonsäure (2,5 g, 5,9 mmol) und dem Verfahren wie in Beispiel 1 skizziert folgend, wurden 1,3 g von 4-(4-Methoxy-benzolsulfonyl)-1-(2-phenoxy-ethyl)-piperidin-4-carbonsäure-hydroxyamid als ein von weiß abweichender Feststoff isoliert. Ausbeute 50%; Fp. 168–172°C (HCl); MS: 435,4 (M + H)+; 1H NMR (300 MHz, DMSO-d6): δ 2,3 (m, 2H), 2,5 (m, 2H), 2,9 (m, 2H), 3,4 (m, 4H), 3,5 (m, 2H), 3,7 (m, 2H), 3,9 (s, 3H), 4,4 (m, 2H), 6,9–7,8 (m, 9H), 9,3 (s, 1H), 10,2 (bs, 1H), 11,3 (s, 1H).
- Beispiel 26
- 4-(4-n-Butoxy-benzolsulfonyl)-1-(2-phenyloxy-ethyl)-piperidin-4-carbonsäure-hydroxyamid
- 4-(4-Butoxy-benzolsulfonyl)-1-(2-phenoxy-ethyl)-piperidin-4-carbonsäure-ethylester wurde gemäß dem allgemeinen Verfahren wie in Beispiel 1 skizziert hergestellt, ausgehend von 4-(Methoxy-benzolsulfonyl)-essigsäure-ethylester (2,5 g, 10 mmol) und Bis-(2-chlor-ethyl)-(2-phenoxy-ethyl)-amin (2,98 g, 10 mmol). Ausbeute 3,0 g (69%); braunes Öl; MS: 490,6 (M + H)+.
- 4-(4-n-Butoxy-benzolsulfonyl)-1-(2-phenoxy-ethyl)-piperidin-4-carbonsäure wurde hergestellt, ausgehend von 4-(4-n-Butoxy-benzolsulfonyl)-1-(2-phenyl-ethoxy)-piperidin-4-carbonsäure-ethylester (2,5 g, 5,76 mmol), gelöst in THF : Methanol 3 : 1 und 10 N NaOH (40 ml). Das sich ergebende Umsetzungsgemisch wurde wie in Beispiel 1 skizziert aufgearbeitet. Ausbeute 1,5 g (56%); von weiß abweichendes Pulver; Fp. 204°C; MS: 462,5 (M + H)+.
- Ausgehend von 4-(4-n-Butoxy-benzolsulfonyl)-1-(2-phenoxy-ethyl)-piperidin-4-carbonsäure (1,0 g, 2,16 mmol) und dem Verfahren wie in Beispiel 1 skizziert folgend, wurden 600 mg von 4-(4-Butoxy-benzolsulfonyl)-1-(2-phenoxy-ethyl)-piperidin-4-carbonsäure-hydroxyamid als ein von weiß abweichender Feststoff isoliert. Ausbeute 58%; Fp. 112° (HCl); MS: 477,4 (M + H)+; 1H NMR (300 MHz, DMSO-d6): δ 0,942 (t, 3H), 1,4 (m, 2H), 1,7 (m, 2H), 2,3 (m, 2H), 2,5 (m, 4H), 2,8 (m, 2H), 2,9–3,4 (m, 4H), 3,3 (m, 4H), 4,2 (t, 2H), 4,4 (m, 2H), 6,9–7,7 (m, 9H), 9,4 (s, 1H), 10,5 (bs, 1H), 11,3 (s, 1H).
- Beispiel 27
- 4-(4-Methoxy-benzolsulfonyl)-1-[4-(2-piperidin-1-yl-ethoxy)-benzyl)-piperidin-4-carbonsäure-hydroxyamid
- Bis-(2-chlor-ethyl)-[4-(2-piperidin-1-yl-ethoxy)-benzyl)- amin wurde gemäß dem allgemeinen Verfahren wie in Beispiel 1 skizziert hergestellt, ausgehend von Diethanolamin (15,0 g, 150) und 4-(2-Piperidin-1-yl-ethoxy)-benzylchlorid (5,9 g, 20 mmol). Ausbeute 5,5 g (85%); brauner halb-fester Stoff; MS: 323 (M + H)+.
- Bis-(2-chlor-ethyl)-[4-(2-piperidin-1-yl-ethoxy)-benzyl]-amin wurde gemäß dem allgemeinen Verfahren wie in Beispiel 1 skizziert hergestellt, ausgehend von 2-[(2-Hydroxy-ethyl)-[4-(2-piperidin-1-yl-ethoxy)-benzyl]amin (3,22 g, 10 mmol). Ausbeute 4,0 g (92%); brauner, halb-fester Stoff; MS: 361,1 (M + H)+.
- 4-(4-Methoxy-benzolsulfonyl)-1-[4-(2-piperidin-1-yl-ethoxy)-benzyl]-piperidin-4-carbonsäure-ethylester wurde gemäß dem allgemeinen Verfahren wie in Beispiel 1 skizziert hergestellt, ausgehend von 4-(Methoxy-benzolsulfonyl)-essigsäure-ethylester (5,0 g, 20 mmol) und Bis-(2-chlor-ethyl)-[4-(2-piperidin-1-yl-ethoxy)-benzyl]-amin (8,6 g, 20 mmol). Ausbeute 6,0 g (55%); braunes Öl; MS: 545,7 (M + H)+.
- 4-(4-Methoxy-benzolsulfonyl)-1-[4-(2-piperidin-1-yl-ethoxy)-benzyl]-piperidin-4-carbonsäure wurde hergestellt, ausgehend von 4-(4-Methoxy-benzolsulfonyl)-1-[4-(2-piperidin-1-yl-ethoxy)-benzyl]-piperidin-4-carbonsäure-ethylester (5,4 g, 10 mmol), gelöst in THF : Methanol 3 : 1 und 10 N NaOH (40 ml). Das sich ergebende Umsetzungsgemisch wurde wie in Beispiel 1 skizziert aufgearbeitet. Ausbeute 4,0 g (77%); von weiß abweichendes Pulver; Fp. 174°C; MS: 517,6 (M + H)+.
- Ausgehend von 4-(4-Methoxy-benzolsulfonyl)-1-[4-(2-piperidin-1-yl-ethoxy)-benzyl]-piperidin-4-carbonsäure (3,5 g, 6,78 mmol) und dem Verfahren wie in Beispiel 1 skizziert folgend, wurden 1,8 g von 4-(4-Methoxy-benzolsulfonyl)-1-[4-(2-piperidin-1-yl-ethoxy)-benzyl]-piperidin-4-carbonsäure-hydroxyamid als ein blass-gelber Feststoff isoliert. Ausbeute 49%; Fp. 114°C (HCl); MS: 532 (M + H)+; 1H NMR (300 MHz, DMSO-d6): δ 1,4–1,6 (m, 4H), 1,9 (m, 2H), 2,3 (m, 2H), 2,8 (m, 2H), 3,4 (m, 4H), 3,9 (s, 3H), 4,2 (m, 1H), 6,9–7,8 (m, 8H), 9,1 (s, 1H), 10,8 (bs, 1H).
- Verweis
-
- 1 Rickter, L. S.; Desai, M. C. Tetrahedron Letters, 1997, 38, 321–322.
- Die Verbindungen als Gegenstand der vorliegenden Erfindung wurden hinsichtlich ihrer biologischen Wirksamkeit gemäß den folgenden Verfahren getestet.
- Gelatinasetest in vitro
- Der Test basiert auf der Spaltung des Thiopeptidsubstrats ((Ac-Pro-Leu-Gly(2-mercapto-4-methyl-pentanoyl)-Leu-Gly-OEt), Bachem Bioscience) durch das Enzym Gelatinase, welches das Substratprodukt freisetzt, welches kolorimetrisch mit DTNB ((5,5'-Dithio-bis(2-nitro-benzoesäure)) reagiert. Die Enzymaktivität wird durch die Geschwindigkeit des Farbanstiegs gemessen.
- Das Thiopeptidsubstrat wird frisch als ein 20 mM Vorrat in 100 DMSO bereitet und das DTNB wird in 100 DMSO als 100 mM Vorrat gelöst und im Dunkeln bei Raumtemperatur gelagert. Sowohl das Substrat, als auch DTNB werden zusammen zu 1 mM mit Substratpuffer (50 mM HEPES pH 7,5, 5 mM CaCl2) vor der Verwendung verdünnt. Der Vorrat an humaner neutrophiler Gelatinase B wird mit Testpuffer (50 mM HEPES pH 7,5, 5 mM CaCl2, 0,02% Brij) zur Endkonzentration von 0,15 nM verdünnt.
- Testpuffer, Enzym, DTNB/Substrat (500 μM Endkonzentration) und Vehikel oder Hemmer werden zu einer 96-Mulden Schale zugegeben (Gesamtumsetzungsvolumen von 200 μl) und der Farbanstieg wird spektrophotometrisch für 5 Minuten bei 405 nm an einem Plattenleser überwacht.
- Der Anstieg an OD405 wird geplottet und die Neigung der Linie wird errechnet, welche die Umsetzungsgemischwindigkeit repräsentiert.
- Die Linearität der Umsetzungsgeschwindigkeit wird bestätigt (r2 > 0,85). Das Mittel (x ± sem) der Kontrollgeschwindigkeit wird errechnet und bezüglich statistischer Signifikanz (p < 0,05) mit den mit Arznei behandelten Geschwindigkeiten unter Verwendung eines Dunnett's multiplen Vergleichstest verglichen. Dosis-Response Beziehungen können unter Verwendung von multiplen Dosen an Arznei erzeugt werden und IC50-Werte mit 95% Cl werden unter Verwendung linearer Regression geschätzt (IPRED, HTB).
- Verweis: Weingarten, H. und Feder. J., Spectrophotometric assay for vertebrate collagenase, Anal. Biochem. 147, 437–440 (1985).
- Collagenasetest in vitro
- Der Test basiert auf der Spaltung eines Peptidsubstrats ((Dnp-Pro-Cha-Gly-Cys(Me)-His-Ala-Lys(NMa)-NH2), Peptide International, Inc.) durch Collagenase, was die fluoreszierende Nma-Gruppe freisetzt, welche am Fluorometer quantifiziert wird. Dnp löscht die NMa-Fluoreszenz im intakten Substrat. Der Test wird in HCBC-Testpuffer (50 mM HEPES, pH 7,0, 5 mM Ca+2, 0,02 Brij, 0,5% Cystein) mit humaner Rekombinant-Fibroblast Collagenase (gestutzt, mw = 18,828, WAR, Radnor) laufen gelassen. Substrat wird in Methanol gelöst und in 1 mM Aliquoten gefroren gelagert. Collagenase wird in Puffer in 25 μM Aliquoten gefroren gelagert. Für den Test wird das Substrat in HCBC-Puffer zu einer Endkonzentration von 10 μM und Collagenase zu einer Endkonzentration von 5 nM gelöst. Verbindungen werden in Methanol, DMSO oder HCBC gelöst. Das Methanol und DMSO werden in HCBC zu < 1,0% verdünnt. Verbindungen werden zu der 96-Mulden Schale zugegeben, welche das Enzym enthält, und die Umsetzung wird durch die Zugabe von Substrat begonnen.
- Die Umsetzung wird für 10 Min. abgelesen (Anregung 340 nm; Emission 444 nm) und der Anstieg der Fluoreszenz über den Zeitraum wird als lineare Linie geplottet. Die Neigung der Linie wird berechnet und repräsentiert die Umsetzungsgeschwindigkeit.
- Die Linearität der Umsetzungsgeschwindigkeit wird bestätigt (r2 > 0,85). Das Mittel (x ± sem) der Kontrollgeschwindigkeit wird errechnet und bezüglich statistischer Signifikanz (p < 0,05) mit den mit Arznei behandelten Geschwindigkeiten unter Verwendung eines Dunnett's multiplen Vergleichstest verglichen. Dosis-Response Beziehungen können unter Verwendung von multiplen Dosen an Arznei erzeugt werden und IC50-Werte mit 95% Cl werden unter Verwendung linearer Regression geschätzt (IPRED, HTB).
- Verweise: Bickett, D. M, et al., A high throughput fluorogenic substrate for interstitial collagenase (MMP-1) and gelatinase (MMP-9), Anal. Biochem. 212, 58–64 (1993).
- Verfahren zum Messen der TACE-Hemmung
- Unter Verwendung von schwarzen Mikrotiterschalen mit 96 Mulden erhält jede Mulde eine Lösung, zusammengesetzt aus 10 μl TACE (Immunex, Endkonzentration 1 μg/ml), 70 μl Tris-Puffer, pH 7,4, welcher 10% Glycerol enthält (Endkonzentration 10 mM) und 10 μl Testverbindungslösung in DMSO (Endkonzentration 1 μM, DMSO-Konzentration < 1%) und wurde für 10 Minuten bei Raumtemperatur inkubiert. Die Umsetzung wird durch Zugabe eines fluoreszierenden Peptidylsubstrats (Endkonzentration 100 μM) zu jeder Mulde und dann Schütteln auf einem Schüttler für 5 Sek. begonnen.
- Die Umsetzung wird für 10 Min. abgelesen (Anregung 340 nm; Emission 420 nm) und der Anstieg der Fluoreszenz über den Zeitraum wird als lineare Linie geplottet. Die Neigung der Linie wird berechnet und repräsentiert die Umsetzungsgeschwindigkeit.
- Die Linearität der Umsetzungsgeschwindigkeit wird bestätigt (r2 > 0,85). Das Mittel (x ± sem) der Kontrollgeschwindigkeit wird errechnet und bezüglich statistischer Signifikanz (p < 0,05) mit den mit Arznei behandelten Geschwindigkeiten unter Verwendung eines Dunnett's multiplen Vergleichstest verglichen. Dosis-Response Beziehungen können unter Verwendung von multiplen Dosen an Arznei erzeugt werden und IC50-Werte mit 95% Cl werden unter Verwendung linearer Regression geschätzt.
- Die für diese experimentellen Standardtestverfahren erhaltenen Ergebnisse werden in der folgenden Tabelle präsentiert.
- Pharmazeutische Zusammensetzung
- Zusammensetzungen dieser Erfindung können rein oder mit einem pharmazeutischen Träger an einen Patienten verabreicht werden, der dessen bedarf. Der pharmazeutische Träger kann fest oder flüssig sein.
- Anwendbare feste Träger können eine oder mehrere Substanzen einschließen, welche auch als Geschmacksmittel, Schmiermittel, Aufschlussmittel, Suspensionsmittel, Füllstoffe, Gleitmittel, Kompressionshilfen, Bindemittel oder Tablettenaufschlussmittel fungieren können, oder ein Einkapselungsmaterial. In Pulvern ist der Träger ein fein geteilter Feststoff, welcher sich in Vermischung mit dem fein geteilten Wirkstoff befindet. In Tabletten wird der Wirkstoff mit einem Träger mit den notwendigen Kompressionseigenschaften in geeigneten Proportionen gemischt und in die gewünschte Form und Größe gepresst. Die Pulver und Tabletten enthalten vorzugsweise bis zu 99% des Wirkstoffs. Geeignete feste Träger schließen zum Beispiel Calciumphosphat, Magnesiumstearat, Talg, Zucker, Lactose, Dextrin, Stärke, Gelatine, Cellulose, Methylcellulose, Natriumcarboxymethylcellulose, Polyvinylpyrrolidin, niedrig schmelzende Wachse und Ionenaustauschharze ein.
- Flüssige Träger können beim Herstellen von Lösungen, Suspensionen, Emulsionen, Sirupen und Elixieren verwendet werden. Der Wirkstoff dieser Erfindung kann in einem pharmazeutisch annehmbaren flüssigen Träger wie Wasser, einem organischen Lösungsmittel, einem Gemisch aus beidem oder pharmazeutisch annehmbaren Ölen oder Fetten gelöst oder suspendiert werden. Der flüssige Träger kann weitere geeignete pharmazeutische Zusatzstoffe enthalten, wie Aufschlussmittel, Emulgatoren, Puffer, Konservierungsstoffe, Süßstoffe, Geschmacksstoffe, Suspensionsmittel, Verdickungsmittel, Farbstoffe, Viskositätsregulatoren, Stabilisatoren oder Osmo-Regulatoren. Geeignete Beispiele für flüssige Träger zur oralen und parenteralen Verabreichung schließen Wasser (insbesondere Zusatzstoffe wie oben enthalten, z. B. Cellulosederivate, vorzugsweise Natriumcarboxymethylcelluloselösung), Alkohole (einschließlich einwertige Alkohole und mehrwertige Alkohole, z. B. Glycole) und ihre Derivate, und Öle (z. B. fraktioniertes Kokosöl und Arachisöl) ein. Zur parenteralen Verabreichung kann der Träger auch ein öliger Ester, wie Ethyloleat und Isopropylmyristat sein. Sterile flüssige Träger werden in Zusammensetzungen in steriler flüssiger Form zur parenteralen Verabreichung verwendet.
- Flüssige pharmazeutische Zusammensetzungen, welche sterile Lösungen oder Suspensionen sind, können zum Beispiel durch intramuskuläre, intraperitoneale oder subkutane Injektion genutzt werden. Sterile Lösungen können auch intravenös verabreicht werden. Orale Verabreichung kann entweder in flüssiger oder fester Zusammensetzungsform erfolgen.
- Die Verbindungen dieser Erfindung können rektal in Form eines herkömmlichen Zäpfchens verabreicht werden. Zur Verabreichung durch intranasale oder intrabronchiale Inhalation oder Insufflation können die Verbindungen dieser Erfindung in eine wässerige oder teilweise wässerige Lösung formuliert werden, welche dann in Form eines Aerosols genutzt werden kann. Die Verbindungen dieser Erfindung können auch transdermal durch die Verwendung eines transdermalen Pflasters verabreicht werden, welches den Wirkstoff und einen Träger enthält, der gegenüber dem Wirkstoff inert ist, gegenüber der Haut nicht toxisch ist und die Abgabe des Wirkstoffs für systemische Absorption in den Blutstrom durch die Haut erlaubt. Der Träger kann jede Anzahl an Formen annehmen, wie Cremes und Salben, Pasten, Gels und Okklusionsmittel. Die Cremes und Salben können viskose, flüssige oder halbflüssige Emulsionen entweder von der Art Öl-in-Wasser oder Wasser-in-Öl sein. Pasten welche aus absorptiven Pulvern, dispergiert in Petroleum oder hydrophilem Petroleum bestehen, welches den Wirkstoff enthält, können ebenfalls geeignet sein. Eine Vielzahl an Okklusionsmitteln kann verwendet werden, um den Wirkstoff in den Blutfluss abzugeben, wie eine halbdurchlässige Membran, welche ein Reservoir bedeckt, welches den Wirkstoff mit oder ohne Träger enthält, oder eine Matrix, welche den Wirkstoff enthält. Weitere Okklusionsmittel sind in der Literatur bekannt.
- Die bei der Behandlung eines bestimmten Patienten, der an einem MMP- oder TACE-abhängigen Zustand leidet, zu verwendende Dosierung muss subjektiv durch den behandelnden Arzt bestimmt werden. Die beteiligten Variablen schließen die Schwere der Störung und die Größe, das Alter und Responsemuster des Patienten ein. Die Behandlung wird im Allgemeinen mit kleinen Dosierungen von weniger als der optimalen Dosis der Verbindung begonnen. Danach wird die Dosierung erhöht, bis die optimale Wirkung unter den Umständen erreicht ist. Die genauen Dosierungen für orale, parenterale, nasale oder intrabronchiale Verabreichung werden durch den behandelnden Arzt bestimmt, und zwar basierend auf der Erfahrung mit der einzelnen behandelten Person und medizinischen Standardprinzipien.
- Vorzugsweise befindet sich die pharmazeutische Zusammensetzung in Einheitsdosierungsform, z. B. als Tabletten oder Kapseln. In solch einer Form wird die Zusammensetzung in Einheitsdosen unterteilt, welche passende Mengen des Wirkstoffs enthalten; die Einheitsdosierungsform kann verpackte Zusammensetzungen sein, zum Beispiel verpackte Pulver, Vialen, Ampullen, vorgefüllte Spritzen oder Sachets, welche Flüssigkeiten enthalten. Die Einheitsdosierungsform kann zum Beispiel eine Kapsel oder Tablette selbst, oder sie kann die passende Anzahl von jeder solcher Zusammensetzungen in verpackter Form sein.
Claims (8)
- Verbindung gemäß Formel I worin R1 für Alkyl mit 1 bis 18 Kohlenstoffatomen, gegebenenfalls substituiert mit einer oder zwei Gruppen, unabhängig ausgewählt aus R5; Alkenyl mit 3 bis 18 Kohlenstoffatomen mit 1 bis 3 Doppelbindungen, gegebenenfalls substituiert mit einer oder zwei Gruppen, unabhängig ausgewählt aus R5; Alkinyl mit 3 bis 18 Kohlenstoffatomen mit 1 bis 3 Dreifachbindungen, gegebenenfalls substituiert mit einer oder zwei Gruppen, unabhängig ausgewählt aus R5; Aryl mit 6 bis 10 Kohlenstoffatomen, gegebenfalls substituiert mit einer oder zwei Gruppen, unabhängig ausgewählt aus R5; Cycloalkyl mit 3 bis 8 Kohlenstoffatomen, gegebenenfalls substituiert mit einer oder zwei Gruppen, unabhängig ausgewählt aus R5; gesättigten oder ungesättigten 5- bis 10-gliedrigen mono- oder bicyclischen Heterocyclus, welcher ein Heteroatom enthält, ausgewählt aus O, S oder NR7, gegebenenfalls substituiert mit einer oder zwei Gruppen, unabhängig ausgewählt aus R5; oder Heteroaryl-(CH2)0-6- steht, worin die Heteroarylgruppe 5- bis 6-gliedrig ist, mit einem oder zwei Heteroatomen, unabhängig ausgewählt aus O, S und N und gegebenenfalls mit einer oder zwei Gruppen substituiert sein kann, unabhängig ausgewählt aus R5; A für -S-, -SO- oder SO2- steht; R2 und R3 zusammengenommen mit dem Kohlenstoffatom, an welches sie gebunden sind, einen 5- bis 7-gliedrigen heterocycli schen Ring bilden, welcher O, S oder N-R7 enthält, gegebenenfalls mit einer oder zwei Doppelbindungen; R4 für Wasserstoff, Alkyl mit 1 bis 6 Kohlenstoffatomen, gegebenenfalls substituiert mit einer oder zwei Gruppen, unabhängig ausgewählt aus R5; Alkenyl mit 3 bis 18 Kohlenstoffatomen mit 1 bis 3 Doppelbindungen, gegebenenfalls substituiert mit einer oder zwei Gruppen, unabhängig ausgewählt aus R5; Alkinyl mit 3 bis 18 Kohlenstoffatomen mit 1 bis 3 Dreifachbindungen, gegebenenfalls substituiert mit einer oder zwei Gruppen, unabhängig ausgewählt aus R5; Phenyl oder Naphthyl, gegebenenfalls substituiert mit einer oder zwei Gruppen, unabhängig ausgewählt aus R5; C3- bis C8-Cycloalkyl oder Bicycloalkyl, gegebenenfalls substituiert mit einer oder zwei Gruppen, unabhängig ausgewählt aus R5; gesättigten oder ungesättigten 5- bis 10-gliedrigen mono- oder bicyclischen Heterocyclus steht, welcher ein Heteroatom enthält, ausgewählt aus O, S oder NR7, gegebenenfalls substituiert mit einer oder zwei Gruppen, unabhängig ausgewählt aus R5; R5 für H, C7-C11-Aroyl, C2-C6-Alkanoyl, C1- bis C12-Alkyl, C2- bis C12-Alkenyl, C2-C12-Alkinyl, F, Cl, Br, I, CN, CHO, C1-C6-Alkoxy, Aryloxy, Heteroaryloxy, C3-C6-Alkenyloxy, C3-C6-Alkinyloxy, C1-C6-Alkoxyaryl, C1-C6-Alkoxyheteroaryl, C1-C6-Alkylamino-C1-C6-alkoxy, C1-C2-Alkylendioxy, Aryloxy-C1-C6-alkylamin, C1-C12-Perfluoralkyl, S(O)n-C1-C6-Alkyl, S(O)n-Aryl, worin n 0, 1 oder 2 ist; OCOO-C1-C6-Alkyl, OCOO-Aryl, OCONR6, COOH, COO-C1-C6-Alkyl, COO-Aryl, CONR6R6, CONHOH, NR6R6, SO2NR6R6, NR6SO2-Aryl, -NR6CONR6R6, NHSO2CF3, SO2NH-Heteroaryl, SO2NHCO-Aryl, CONHSO2-C1-C6-Alkyl, CONHSO2-Aryl, SO2NHCO-Aryl, CONHSO2-C1-C6-Alkyl, CONHSO2-Aryl, NH2, OH, Aryl, Heteroaryl, C3- bis C8-Cycloalkyl; oder gesättigten oder ungesättigten 5- bis 10-gliedrigen mono- oder bicyclischen Heterocyclus steht, welcher ein Heteroatom enthält, ausgewählt aus O, S oder NR7, worin C1-C6-Alkyl gerade oder verzweigt ist, Heteroaryl eine 5–10-gliedrige mono- oder bicyclische Heteroarylgruppe mit 1 bis 3 Heteroatomen darstellt, unabhängig ausgewählt aus O, S oder NR7 und Aryl für Phenyl oder Naphthyl steht, gegebenenfalls substituiert durch 1 oder 2 Gruppen, ausgewählt aus Halogen, Cyano, Amino, Nitro, C1-C6-Alkyl, C1-C6-Alkoxy oder Hydroxy; R6 für H, C1- bis C18-Alkyl, gegebenenfalls substituiert mit OH; C3- bis C6-Alkenyl, C3- bis C6-Alkinyl, C1- bis C6-Perfluoralkyl, S(O)n-C1-C6-Alkyl S(O)n-Aryl, worin n 0, 1 oder 2 ist; oder CO-Heteroaryl steht, worin Heteroaryl für eine 5–10-gliedrige mono- oder bicyclische Heteroarylgruppe mit 1 bis 3 Heteroatomen steht, unabhängig ausgewählt aus O, S oder NR7 und Aryl für Phenyl oder Naphthyl steht, gegebenenfalls substituiert durch 1 oder 2 Gruppen, ausgewählt aus Halogen, Cyano, Amino, Nitro, C1-C6-Alkyl, C1-C6-Alkoxy oder Hydroxy; und R7 für C7-C11-Aroyl, C2-C6-Alkanoyl, C1-C12-Perfluoralkyl, S(O)n-C1-C6-Alkyl, S(O)n-Aryl, worin n 0, 1 oder 2 ist; COO-C1-C6-Alkyl, COO-Aryl, CONHR6, CONR6R6, CONHOH, SO2NR6R6, SO2CF3, SO2NH-Heteroaryl, SO2NHCO-Aryl, CONHSO-C1-C6-Alkyl, CONHSO2-Aryl, Aryl oder Heteroaryl steht, worin Aryl für Phenyl oder Naphthyl steht, gegebenenfalls substituiert durch 1 oder 2 Gruppen, unabhängig ausgewählt aus Halogen, Cyano, Amino, Nitro, C1-C6-Alkyl, C1-C6-Alkoxy oder Hydroxy; und Heteroaryl eine 5–10-gliedrige mono- oder bicyclische Heteroarylgruppe mit 1 bis 3 Heteroatomen darstellt, unabhängig ausgewählt aus O, S oder N-C1-C6-Alkyl; Alkyl mit 1 bis 18 Kohlenstoffatomen, gegebenenfalls substituiert mit einer oder zwei Gruppen, unabhängig ausgewählt aus R5; Alkenyl mit 3 bis 18 Kohlenstoffatomen mit von 1 bis 3 Doppelbindungen, gegebenenfalls substituiert mit einer oder zwei Gruppen, unabhängig ausgewählt aus R5; Alkinyl mit 3 bis 18 Kohlenstoffatomen mit von 1 bis 3 Dreifachbindungen, gegebenenfalls substituiert mit einer oder zwei Gruppen, unabhängig ausgewählt aus R5; Arylalkyl mit 7 bis 16 Kohlenstoffatomen, wobei Aryl gegebenenfalls substituiert ist mit einer oder zwei Gruppen, unabhängig ausgewählt aus R5; Biphenylalkyl mit 13 bis 18 Kohlenstoffatomen, worin Biphenyl gegebenenfalls substituiert ist mit einer oder zwei Gruppen, unabhängig ausgewählt aus R5; Arylalkenyl mit 8 bis 16 Kohlenstoffatomen, worin Aryl gegebenenfalls substituiert ist mit einer oder zwei Gruppen, unabhängig ausgewählt aus R5; Cycloalkylalkyl oder Bicycloalkylalkyl mit 4 bis 12 Kohlenstoffatomen, worin die Cycloalkyl- oder Bicycloalkylgruppe gegebenenfalls substituiert ist mit einer oder zwei Gruppen, unabhängig ausgewählt aus R5; gesättigten oder ungesättigten mono- oder bicyclischen Heterocyclus, welcher ein Heteroatom enthält, ausgewählt aus O, S oder N-C1-C6-Alkyl, gegebenenfalls substituiert mit einer oder zwei Gruppen, unabhängig ausgewählt aus R5; oder R8R9N-C1-C6-Alkoxyaryl-C1-C6-alkyl steht, worin R8 und R9 unabhängig ausgewählt werden aus C1-C6-Alkyl oder R8 und R9 zusammen mit dem dazwischen geschobenen Stickstoff einen 5–7-gliedrigen gesättigten heterocyclischen Ring bilden, welcher gegebenenfalls ein Sauerstoffatom enthält, worin die Arylgruppe für Phenyl oder Naphthyl steht; oder ein pharmazeutisch annehmbares Salz davon.
- Verbindung wie in Anspruch 1 beansprucht, worin: R1 für Alkyl mit 1 bis 18 Kohlenstoffatomen, gegebenenfalls substituiert mit einer oder zwei Gruppen, unabhängig ausgewählt aus R5; Alkenyl mit 3 bis 18 Kohlenstoffatomen mit 1 bis 3 Doppelbindungen, gegebenenfalls substituiert mit einer oder zwei Gruppen, unabhängig ausgewählt aus R5; Alkinyl mit 3 bis 18 Kohlenstoffatomen mit 1 bis 3 Dreifachbindungen, gegebenenfalls substituiert mit einer oder zwei Gruppen, unabhängig ausgewählt aus R5; Aryl mit 6 bis 10 Kohlenstoffatomen, gegebenfalls substituiert mit einer oder zwei Gruppen, unabhängig ausgewählt aus R5; Cycloalkyl mit 3 bis 8 Kohlenstoffatomen, gegebenenfalls substituiert mit einer oder zwei Gruppen, unabhängig ausgewählt aus R5; gesättigten oder ungesättigten mono- oder bicyclischen Heterocyclus mit von 5 bis 10 Gliedern, welcher ein Heteroatom enthält, ausgewählt aus O, S oder NR7, gegebenenfalls substituiert mit einer oder zwei Gruppen, unabhängig ausgewählt aus R5; oder Heteroaryl-(CH2)0-6- steht, worin die Heteroarylgruppe 5- bis 6-gliedrig ist, mit einem oder zwei Heteroatomen, unabhängig ausgewählt aus O, S und N, und gegebenenfalls mit einer oder zwei Gruppen substituiert sein kann, unabhängig ausgewählt aus R5; A für -S-, -SO- oder SO2- steht; R2 und R3 zusammengenommen mit dem Kohlenstoffatom, an welches sie gebunden sind, einen 5- bis 7-gliedrigen heterocyclischen Ring bilden, welcher O, S oder N-R7 enthält, gegebenenfalls mit einer oder zwei Doppelbindungen; R4 für Wasserstoff, Alkyl mit 1 bis 6 Kohlenstoffatomen, gegebenenfalls substituiert mit einer oder zwei Gruppen, unabhängig ausgewählt aus R5; Alkenyl mit 3 bis 18 Kohlenstoffatomen mit 1 bis 3 Doppelbindungen, gegebenenfalls substituiert mit einer oder zwei Gruppen, unabhängig ausgewählt aus R5; Alkinyl mit 3 bis 18 Kohlenstoffatomen mit 1 bis 3 Dreifachbindungen, gegebenenfalls substituiert mit einer oder zwei Gruppen, unabhängig ausgewählt aus R5; Phenyl oder Naphthyl, gegebenenfalls substituiert mit einer oder zwei Gruppen, unabhängig ausgewählt aus R5; C3- bis C8-Cycloalkyl oder Bicycloalkyl steht, gegebenenfalls substituiert mit einer oder zwei Gruppen, unabhängig ausgewählt aus R5; R5 für H, F, Cl, Br, I, CN, CHO, C7-C11-Aroyl, C2-C6-Alkanoyl, C1- bis C12-Alkyl, C2- bis C12-Alkenyl, C2-C12-Alkinyl, C1-C6-Alkoxy, Aryloxy, Heteroaryloxy, C3-C6-Alkenyloxy, C3-C6-Alkinyloxy, C1-C6-Alkoxyaryl, C1-C6-Alkoxyheteroaryl, C1-C6-Alkylamino-C1-C6-alkoxy, C1-C2-Alkylendioxy, Aryloxy-C1-C6-alkylamin, C1-C12-Perfluoralkyl, S(O)n-C1-C6-Alkyl, S(O)n-Aryl, worin n 0, 1 oder 2 ist; OCOO-C1-C6-Alkyl, OCOO-Aryl, OCONR6, COOH, COO-C1-C6-Alkyl, COO-Aryl, CONR6R6, CONHOH, NR6R6, SO2NR6R6, NR6SO2-Aryl, -NR6CONR6R6, NHSO2CF3, SO2NH-Heteroaryl, SO2NHCO-Aryl, CONHSO2-C1-C6-Alkyl, CONHSO2-Aryl, SO2NHCO-Aryl, CONHSO2-C1-C6-Alkyl, CONHSO2-Aryl, NH2, OH, Aryl, Heteroaryl, C3- bis C8-Cycloalkyl; oder gesättigten oder ungesättigten 5- bis 10-gliedrigen mono- oder bicyclischen Heterocyclus steht, welcher ein Heteroatom enthält, ausgewählt aus O, S oder N7, worin Heteroaryl eine 5–10-gliedrige mono- oder bicyclische Heteroarylgruppe mit 1 bis 3 Heteroatomen darstellt, unabhängig ausgewählt aus O, S oder N7 und Aryl für Phenyl oder Naphthyl steht, gegebenenfalls substituiert durch 1 oder 2 Gruppen, unabhängig ausgewählt aus Halogen, Cyano, Amino, Nitro, C1-C6-Alkyl, C1-C6-Alkoxy oder Hydroxy; R6 für H, C1- bis C18-Alkyl, gegebenenfalls substituiert mit OH; C3-C6-Alkenyl, C3- bis C6-Alkinyl, C1- bis C6-Perfluoralkyl, S (O)n-Alkyl oder Aryl, worin n 0, 1 oder 2 ist; oder CO-Heteroaryl steht, worin Heteroaryl für eine 5–10-gliedrige mono- oder bicyclische Heteroarylgruppe mit 1 bis 3 Heteroatomen steht, unabhängig ausgewählt aus O, S oder N7 und Aryl für Phenyl oder Naphthyl steht, gegebenenfalls substituiert durch 1 oder 2 Gruppen, ausgewählt aus Halogen, Cyano, Amino, Nitro, C1-C6-Alkyl, C1-C6-Alkoxy oder Hydroxy; und R7 für C7-C11-Aroyl, C2-C6-Alkanoyl, C1-C12-Perfluoralkyl, S(O)n-Alkyl, S(O)n-Aryl, worin n 0, 1 oder 2 ist; COO-Alkyl, COO-Aryl, CONHR6, CONR6R6, CONHOH, SO2NR6R6, SO2CF3, SO2NH-Heteroaryl, SO2NHCO-Aryl, CONHSO2-Alkyl, CONHSO2-Aryl, Aryl, Heteroaryl steht; worin C1-C6-Alkyl gerade oder verzweigt ist, Heteroaryl eine 5–10-gliedrige mono- oder bicyclische Heteroarylgruppe mit 1 bis 3 Heteroatomen darstellt, unabhängig ausgewählt aus O, S oder NR7 und Aryl für Phenyl oder Naphthyl steht, gegebenenfalls substituiert durch 1 oder 2 Gruppen, unabhängig ausgewählt aus Halogen, Cyano, Amino, Nitro, C1-C6-Alkyl, C1-C6-Alkoxy oder Hydroxy; Alkyl mit 1 bis 18 Kohlenstoffatomen, gegebenenfalls substituiert mit einer oder zwei Gruppen, unabhängig ausgewählt aus R5; Alkenyl mit 3 bis 18 Kohlenstoffatomen mit von 1 bis 3 Doppelbindungen, gegebenenfalls substituiert mit einer oder zwei Gruppen, unabhängig ausgewählt aus R5; Alkinyl mit 3 bis 18 Kohlenstoffatomen mit von 1 bis 3 Dreifachbindungen, gegebenenfalls substituiert mit einer oder zwei Gruppen, unabhängig ausgewählt aus R5; Arylalkyl mit 7 bis 16 Kohlenstoffatomen, worin Aryl gegebenenfalls substituiert ist mit einer oder zwei Gruppen, unabhängig ausgewählt aus R5; Biphenylalkyl mit 13 bis 18 Kohlenstoffatomen, worin Biphenyl gegebenenfalls substituiert ist mit einer oder zwei Gruppen, unabhängig ausgewählt aus R5; Arylalkenyl mit 8 bis 16 Kohlenstoffatomen, worin Aryl gegebenenfalls substituiert ist mit einer oder zwei Gruppen, unabhängig ausgewählt aus R5; Cycloalkylalkyl oder Bicycloalkylalkyl mit 4 bis 12 Kohlenstoffatomen, worin Cycloalkyl oder Bicycloalkyl gegebenenfalls substituiert ist mit einer oder zwei Gruppen, unabhängig ausgewählt aus R5; gesättigten oder ungesättigten mono- oder bicyclischen Heterocyclus, welcher ein Heteroatom enthält, ausgewählt aus O, S oder N-C1-C6-Alkyl, gegebenenfalls substituiert mit einer oder zwei Gruppen, unabhängig ausgewählt aus R5; oder R8R9N-C1-C6-Alkoxyaryl-C1-C6-alkyl steht, worin R8 und R9 unabhängig ausgewählt werden aus C1-C6-Alkyl oder R8 und R9 zusammen mit dem dazwischen geschobenen Stickstoff einen 5–7-gliedrigen gesättigten heterocyclischen Ring bilden, welcher gegebenenfalls ein Sauerstoffatom enthält, wobei die Arylgruppe für Phenyl oder Naphthyl steht; oder ein pharmazeutisch annehmbares Salz davon.
- Verbindung wie in Anspruch 2 beansprucht, worin R1 für Phenyl, Naphthyl, Alkyl mit 1–18 Kohlenstoffatomen oder Heteroaryl, wie Pyridyl, Thienyl, Imidazolyl oder Furanyl, gegebenenfalls substituiert mit C1-C6-Alkyl, C1-C6-Alkoxy, C6-C10-Aryloxy, Heteroaryloxy, C3-C6-Alkenyloxy, C3-C6-Alkinyloxy, Halogen; oder S(O)n-C1-C6-Alkyl-C1-C6-alkoxyaryl oder C1-C6-Alkoxyheteroaryl steht; A für -S-, -SO- oder SO2- steht; R2 und R3 zusammengenommen mit dem Kohlenstoffatom, an welches sie gebunden sind, einen 5- bis 7-gliedrigen heterocyclischen Ring bilden, welcher O, S oder N-R7 enthält, gegebenenfalls mit einer oder zwei Doppelbindungen; R4 für Wasserstoff, Alkyl mit 1 bis 6 Kohlenstoffatomen, gegebenenfalls substituiert mit einer oder zwei Gruppen, unabhängig ausgewählt aus R5; Alkenyl mit 3 bis 18 Kohlenstoffatomen mit 1 bis 3 Doppelbindungen, gegebenenfalls substituiert mit einer oder zwei Gruppen, unabhängig ausgewählt aus R5; Alkinyl mit 3 bis 18 Kohlenstoffatomen mit 1 bis 3 Dreifachbindungen, gegebenenfalls substituiert mit einer oder zwei Gruppen, unabhängig ausgewählt aus R5; Phenyl oder Naphthyl, gegebenenfalls substituiert mit einer oder zwei Gruppen, unabhängig ausgewählt aus R5; C3- bis C8-Cycloalkyl oder Bicycloalkyl steht, gegebenenfalls substituiert mit einer oder zwei Gruppen, unabhängig ausgewählt aus R5; R5 für H, C7-C11-Aroyl, C2-C6-Alkanoyl, C1- bis C12-Alkyl, C2- bis C12-Alkenyl, C2-C12-Alkinyl, F, Cl, Br, I, CN, CHO, C1-C6-Alkoxy, Aryloxy, Heteroaryloxy, C3-C6-Alkenyloxy, C3-C6-Alkinyloxy, C1-C6-Alkylamino-C1-C6-alkoxy, C1-C2-Alkylendioxy, Aryloxy-C1-C6-alkylamin, C1-C12-Perfluoralkyl, S(O)n-C1-C6-Alkyl, S(O)n-Aryl, worin n 0, 1 oder 2 ist; OCOO-C1-C6-Alkyl, OCOO-Aryl, OCONR6, COOH, COO-C1-C6-Alkyl, COO-Aryl, CONR6R6, CONHOH, NR6R6, SO2NR6R6, NR6SO2-Aryl, -NR6CONR6R6, NHSO2CF3, SO2NH-Heteroaryl, SO2NHCO-Aryl, CONHSO2-C1-C6-Alkyl, CONHSO2-Aryl, SO2NHCO-Aryl, CONHSO2-C1-C6-Alkyl, CONHSO2-Aryl, NH2, OH, Aryl, Heteroaryl, C3- bis C8-Cycloalkyl; gesättigten oder ungesättigten 5- bis 10-gliedrigen mono- oder bicyclischen Heterocyclus steht, welcher ein Heteroatom enthält, ausgewählt aus O, S oder NR7, worin C1-C6-Alkyl gerade oder verzweigt ist, Heteroaryl eine 5–10-gliedrige mono- oder bicyclische Heteroarylgruppe mit 1 bis 3 Heteroatomen darstellt, unabhängig ausgewählt aus O, S oder NR7 und Aryl für Phenyl oder Naphthyl steht, gegebenenfalls substituiert durch 1 oder 2 Gruppen, unabhängig ausgewählt aus Halogen, Cyano, Amino, Nitro, C1-C6-Alkyl, C1-C6-Alkoxy oder Hydroxy; R6 für H, C1- bis C18-Alkyl, gegebenenfalls substituiert mit OH; C3- bis C6-Alkenyl, C3- bis C6-Alkinyl, C1- bis C6-Perfluoral kyl, S(O)n-Alkyl oder Aryl, worin n 0, 1 oder 2 ist; oder CO-Heteroaryl steht, worin Heteroaryl für eine 5–10-gliedrige mono- oder bicyclische Heteroarylgruppe mit 1 bis 3 Heteroatomen steht, unabhängig ausgewählt aus O, S oder NR7 und Aryl für Phenyl oder Naphthyl steht, gegebenenfalls substituiert durch 1 oder 2 Gruppen, ausgewählt aus Halogen, Cyano, Amino, Nitro, C1-C6-Alkyl, C1-C6-Alkoxy oder Hydroxy; und R7 für C7-C11-Aroyl, C2-C6-Alkanoyl, C1-C12-Perfluoralkyl, S(O)n-Alkyl, S(O)n-Aryl, worin n 0, 1 oder 2 ist; COO-Alkyl, COO-Aryl, CONHR6, CONR6R6, CONHOH, SO2NR6R6, SO2CF3, SO2NH-Heteroaryl, SO2NHCO-Aryl, CONHSO2-Alkyl, CONHSO2-Aryl, Aryl oder Heteroaryl steht, worin Aryl für Phenyl oder Naphthyl steht, gegebenenfalls substituiert durch 1 oder 2 Gruppen, unabhängig ausgewählt aus Halogen, Cyano, Amino, Nitro, C1-C6-Alkyl, C1-C6-Alkoxy oder Hydroxy; und Heteroaryl eine 5–10-gliedrige mono- oder bicyclische Heteroarylgruppe mit 1 bis 3 Heteroatomen darstellt, unabhängig ausgewählt aus O, S oder N-C1-C6-Alkyl; Alkyl mit 1 bis 18 Kohlenstoffatomen, gegebenenfalls substituiert mit einer oder zwei Gruppen, unabhängig ausgewählt aus R5; Alkenyl mit 3 bis 18 Kohlenstoffatomen mit von 1 bis 3 Doppelbindungen, gegebenenfalls substituiert mit einer oder zwei Gruppen, unabhängig ausgewählt aus R5; Alkinyl mit 3 bis 18 Kohlenstoffatomen mit von 1 bis 3 Dreifachbindungen, gegebenenfalls substituiert mit einer oder zwei Gruppen, unabhängig ausgewählt aus R5; Arylalkyl mit 7 bis 16 Kohlenstoffatomen, gegebenenfalls substituiert mit einer oder zwei Gruppen, unabhängig ausgewählt aus R5; Biphenylalkyl mit 13 bis 18 Kohlenstoffatomen, gegebenenfalls substituiert mit einer oder zwei Gruppen, unabhängig ausgewählt aus R5; Arylalkenyl mit 8 bis 16 Kohlenstoffatomen, gegebenenfalls substituiert mit einer oder zwei Gruppen, unabhängig ausgewählt aus R5; Cycloalkylalkyl oder Bicycloalkylalkyl mit 4 bis 12 Kohlenstoffatomen, gegebenenfalls substituiert mit einer oder zwei Gruppen, unabhängig ausgewählt aus R5; gesättigten oder ungesättigten mono- oder bicyclischen Heterocyclus, welcher ein Heteroatom enthält, ausgewählt aus O, S oder NR-C1-C6-Alkyl, gegebenenfalls substituiert mit einer oder zwei Gruppen, unabhängig ausgewählt aus R5; oder R8R9N-C1-C6-Alkoxyaryl-C1-C6-alkyl steht, worin R8 und R9 unabhängig ausgewählt werden aus C1-C6-Alkyl oder R8 und R9 zusammen mit dem dazwischen geschobenen Stickstoff einen 5–7-gliedrigen gesättigten heterocyclischen Ring bilden, welcher gegebenenfalls ein Sauerstoffatom enthält, wobei die Arylgruppe für Phenyl oder Naphthyl steht; oder ein pharmazeutisch annehmbares Salz davon.
- Verbindung wie in Anspruch 1 beansprucht, welche ausgewählt wird aus der Gruppe von Verbindungen, bestehend aus: 1-Benzyl-4-(4-methoxy-benzolsulfonyl)-piperidin-4-carbonsäure-hydroxyamid; 4-(4-Methoxy-benzolsulfonyl)-1-(3-methoxy-benzyl)-piperidin-4-carbonsäure-hydroxyamid, 1-(3,4-Dichlorbenzyl)-4-(4-methoxy-benzolsulfonyl)-piperidin-4-carbonsäure-hydroxamid, 4-(4-Methoxy-benzolsulfonyl)-1-(4-methylbenzyl)-piperidin-4-carbonsäure-hydroxamid, 4-(4-Methoxy-benzolsulfonyl)-1-naphthalin-2-yl-methylpiperidin-4-carbonsäure-hydroxamid, 1-Biphenyl-4-ylmethyl-4-(4-methoxy-benzolsulfonyl)piperidin-4-carbonsäure-hydroxamid, 4-(4-Methoxy-benzolsulfonyl)-1-(3-methyl-but-2-enyl)piperidin-4-carbonsäure-hydroxamid, 1-(4-Brom-benzyl)-4-(4-methoxy-benzolsulfonyl)-piperidin-4-carbonsäure-hydroxyamid, 4-(4-Methoxy-benzolsulfonyl)-1-[4-(2-piperidin-1-yl-ethoxy)-benzyl)-piperidin-4-carbonsäure-hydroxyamid und pharmazeutisch annehmbare Salze davon.
- Verbindung wie in Anspruch 1 beansprucht oder ein pharmazeutisch annehmbares Salz davon, welche ausgewählt wird aus der Gruppe von Verbindungen, bestehend aus: 4-(4-Methoxy-benzolsulfonyl)-1-(3-phenyl-propyl)-piperidin-4-carbonsäure-hydroxyamid, 1-tert.-Butyl-4-(4-methoxy-benzolsulfonyl)-piperidin-4-car bonsäure-hydroxyamid, 1-Butyl-4-(4-methoxy-benzolsulfonyl)-piperidin-4-carbonsäure-hydroxyamid, 1-Cyclooctyl-4-(4-methoxy-benzolsulfonyl)-piperidin-4-carbonsäure-hydroxyamid, 1-Ethyl-4-(4-methoxy-benzolsulfonyl)-piperidin-4-carbonsäure-hydroxyamid, 1-Isopropyl-4-(4-methoxy-benzolsulfonyl)-piperidin-4-carbonsäure-hydroxyamid, 1-Methyl-4-(4-methoxy-benzolsulfonyl)-piperidin-4-carbonsäure-hydroxyamid, 1-Benzyl-4-(4-butoxy-benzolsulfonyl)-piperidin-4-carbonsäure-hydroxyamid, 1-(4-Fluorbenzyl)-4-(4-methoxy-benzolsulfonyl)-piperidin-4-carbonsäure-hydroxyamid, 1-(4-Fluorbenzyl)-4-(4-butoxy-benzolsulfonyl)-piperidin-4-carbonsäure-hydroxyamid, 4-(4-Methoxy-benzolsulfonyl)-1-(4-methoxy-benzyl)-piperidin-4-carbonsäure-hydroxyamid, 4-(4-Methoxy-benzolsulfonyl)-1-[2-(4-methoxyphenyl)-ethyl]-piperidin-4-carbonsäure-hydroxyamid, 4-(4-Methoxy-benzolsulfonyl)-1-(2-phenyl-ethyl)-piperidin-4-carbonsäure-hydroxyamid, 4-(4-n-Butoxy-benzolsulfonyl)-1-(4-methoxy-benzyl)-piperidin-4-carbonsäure-hydroxyamid, 4-(4-Methoxy-benzolsulfonyl)-1-(3-phenoxy-propyl)-piperidin-4-carbonsäure-hydroxyamid, 4-(4-n-Butoxy-benzolsulfonyl)-1-(3-phenoxy-propyl)-piperidin-4-carbonsäure-hydroxyamid, 4-(4-Methoxy-benzolsulfonyl)-1-(2-phenoxy-ethyl)-piperidin-4-carbonsäure-hydroxyamid, 4-(4-n-Butoxy-benzolsulfonyl)-1-(2-phenoxy-ethyl)-piperidin-4-carbonsäure-hydroxyamid und 4-(4-Methoxy-benzolsulfonyl)-1-[4-(2-piperidin-1-yl-ethoxy)-benzyl]-piperidin-4-carbonsäure-hydroxyamid.
- Pharmazeutische Zusammensetzung, welche einen pharmazeutischen Träger und eine therapeutisch wirksame Menge einer Matrix-metalloproteinase oder TACE-hemmenden Verbindung umfasst, wie in einem der Ansprüche 1 bis 5 beansprucht.
- Verbindung wie in einem der Ansprüche 1 bis 5 beansprucht zur Verwendung als Medikament.
- Verwendung einer Verbindung wie in einem der Ansprüche 1 bis 5 beansprucht zur Herstellung eines Medikaments zum Hemmen pathologischer Veränderungen, vermittelt durch Matrix-metalloproteinasen in Säugern, oder zum Hemmen von pathologischen Veränderungen, vermittelt durch TNF-α umwandelndes Enzym (TACE) in Säugern.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US80672897A | 1997-02-27 | 1997-02-27 | |
| US806728 | 1997-02-27 | ||
| PCT/US1998/002987 WO1998037877A1 (en) | 1997-02-27 | 1998-02-17 | N-hydroxy-2-(alkyl, aryl or heteroaryl sulfanyl, sulfinyl or sulfonyl)-3-substituted alkyl, aryl or heteroarylamides as matrix metalloproteinase inhibitors |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| DE69823019D1 DE69823019D1 (de) | 2004-05-13 |
| DE69823019T2 true DE69823019T2 (de) | 2005-03-31 |
Family
ID=25194722
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| DE69823019T Expired - Fee Related DE69823019T2 (de) | 1997-02-27 | 1998-02-17 | N-hydroxy-2-(alkyl, aryl oder heteroaryl sulfanyl, sulfinyl oder sulfonyl)-3-substituierte alkyl-, aryl- oder heteroarylamide als matrixmetalloproteinaseinhibitoren |
| DE69820424T Expired - Fee Related DE69820424T2 (de) | 1997-02-27 | 1998-02-17 | N-Hydroxy-2-(Alkyl-, Aryl- oder Heteroaryl-Sulfanyl, -Sulfinyl oder -Sulfonyl)-3-substituierte Alkyl-, Aryl- oder Heteroarylamide als Matrix-Metalloproteinase-Inhibitoren |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| DE69820424T Expired - Fee Related DE69820424T2 (de) | 1997-02-27 | 1998-02-17 | N-Hydroxy-2-(Alkyl-, Aryl- oder Heteroaryl-Sulfanyl, -Sulfinyl oder -Sulfonyl)-3-substituierte Alkyl-, Aryl- oder Heteroarylamide als Matrix-Metalloproteinase-Inhibitoren |
Country Status (30)
| Country | Link |
|---|---|
| EP (2) | EP0970046B1 (de) |
| JP (2) | JP2001513771A (de) |
| KR (2) | KR20000075808A (de) |
| CN (2) | CN1252790A (de) |
| AR (1) | AR011451A1 (de) |
| AT (2) | ATE263554T1 (de) |
| AU (2) | AU726204B2 (de) |
| BG (2) | BG103757A (de) |
| BR (2) | BR9807802A (de) |
| CA (2) | CA2282656A1 (de) |
| CY (1) | CY2477B1 (de) |
| DE (2) | DE69823019T2 (de) |
| DK (2) | DK0973512T3 (de) |
| EA (2) | EA003836B1 (de) |
| EE (2) | EE04295B1 (de) |
| ES (2) | ES2217540T3 (de) |
| GE (2) | GEP20022627B (de) |
| HU (2) | HUP0002092A3 (de) |
| IL (2) | IL131257A0 (de) |
| NO (2) | NO314258B1 (de) |
| NZ (2) | NZ337298A (de) |
| PL (2) | PL335286A1 (de) |
| PT (2) | PT973512E (de) |
| SK (2) | SK115899A3 (de) |
| TR (2) | TR199901901T2 (de) |
| TW (1) | TW568900B (de) |
| UA (1) | UA58543C2 (de) |
| WO (2) | WO1998037877A1 (de) |
| YU (2) | YU40999A (de) |
| ZA (2) | ZA981628B (de) |
Families Citing this family (56)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6794511B2 (en) | 1997-03-04 | 2004-09-21 | G. D. Searle | Sulfonyl aryl or heteroaryl hydroxamic acid compounds |
| CA2283145A1 (en) * | 1997-03-04 | 1998-09-11 | Monsanto Company | Aromatic sulfonyl alpha-hydroxy hydroxamic acid compounds |
| US6696449B2 (en) | 1997-03-04 | 2004-02-24 | Pharmacia Corporation | Sulfonyl aryl hydroxamates and their use as matrix metalloprotease inhibitors |
| US6638952B1 (en) * | 1997-03-04 | 2003-10-28 | Pharmacia Corporation | Aromatic sulfonyl alpha-cycloamino hydroxamic acid compounds |
| US7115632B1 (en) | 1999-05-12 | 2006-10-03 | G. D. Searle & Co. | Sulfonyl aryl or heteroaryl hydroxamic acid compounds |
| AU757630C (en) * | 1997-10-15 | 2006-10-26 | Wyeth | Novel aryloxy-alkyl-dialkylamines |
| US6005102A (en) | 1997-10-15 | 1999-12-21 | American Home Products Corporation | Aryloxy-alkyl-dialkylamines |
| WO1999025687A1 (en) * | 1997-11-14 | 1999-05-27 | G.D. Searle & Co. | Aromatic sulfone hydroxamic acid metalloprotease inhibitor |
| US20010039287A1 (en) * | 1997-11-14 | 2001-11-08 | Thomas E Barta | Aromatic sulfone hydroxamic acid metalloprotease inhibitor |
| US6750228B1 (en) * | 1997-11-14 | 2004-06-15 | Pharmacia Corporation | Aromatic sulfone hydroxamic acid metalloprotease inhibitor |
| GB9725782D0 (en) | 1997-12-05 | 1998-02-04 | Pfizer Ltd | Therapeutic agents |
| TR200002423T2 (tr) * | 1998-02-19 | 2001-01-22 | American Cyanamid Company | Matriks metaloproteinaz inhibatörler. |
| US7045519B2 (en) | 1998-06-19 | 2006-05-16 | Chiron Corporation | Inhibitors of glycogen synthase kinase 3 |
| ES2213985T3 (es) * | 1998-11-05 | 2004-09-01 | Pfizer Products Inc. | Derivados de hidroxiamida de acido 5-oxo-pirrolidin-2-carboxilico. |
| US6753337B2 (en) | 1999-01-27 | 2004-06-22 | Wyeth Holdings Corporation | Alkynyl containing hydroxamic acid compounds as matrix metalloproteinase/tace inhibitors |
| US6340691B1 (en) | 1999-01-27 | 2002-01-22 | American Cyanamid Company | Alkynyl containing hydroxamic acid compounds as matrix metalloproteinase and tace inhibitors |
| US6946473B2 (en) | 1999-01-27 | 2005-09-20 | Wyeth Holdings Corporation | Preparation and use of acetylenic ortho-sulfonamido and phosphinic acid amido bicyclic heteroaryl hydroxamic acids as TACE inhibitors |
| AR035311A1 (es) * | 1999-01-27 | 2004-05-12 | Wyeth Corp | Derivados de acido hidroxamico que contienen alquinilo, como inhibidores de las metalloproteinasas de matriz y de la tace, composicion farmaceutica y el uso de los mismos para la manufactura de un medicamento |
| EP1147085B1 (de) * | 1999-01-27 | 2005-11-16 | Wyeth Holdings Corporation | Alkynyl substituierte hydroxamsäure derivate, deren herstellung und deren verwendung als matrix metalloproteinase (mmp) inhibitoren / tnf-alpha converting enzyme (tace) inhibitoren |
| AR035312A1 (es) * | 1999-01-27 | 2004-05-12 | Wyeth Corp | Compuestos de acido hidroxamico que contienen alquinilo como inhibidores de metaloproteinasa de matriz/tace, composicion farmaceutica que los comprenden y el uso de los mismos para la manufactura de un medicamento |
| US6800646B1 (en) | 1999-02-08 | 2004-10-05 | Pharmacia Corporation | Sulfamato hydroxamic acid metalloprotease inhibitor |
| SK11352001A3 (sk) | 1999-02-08 | 2002-09-10 | G. D. Searle & Co. | Metaloproteázový inhibítor kyselina sulfamátohydroxámová |
| SE9901572D0 (sv) | 1999-05-03 | 1999-05-03 | Astra Ab | New compounds |
| US6511993B1 (en) | 1999-06-03 | 2003-01-28 | Kevin Neil Dack | Metalloprotease inhibitors |
| CA2398561A1 (en) * | 2000-01-27 | 2001-08-02 | American Cyanamid Company | Method for preparing alpha-sulfonyl hydroxamic acid derivatives |
| US6683093B2 (en) | 2000-05-12 | 2004-01-27 | Pharmacia Corporation | Aromatic sulfone hydroxamic acids and their use as protease inhibitors |
| HRP20030901A2 (en) | 2001-05-11 | 2005-10-31 | Pharmacia Corporation | Aromatic sulfone hydroxamates and their use as protease inhibitors |
| US6683078B2 (en) | 2001-07-19 | 2004-01-27 | Pharmacia Corporation | Use of sulfonyl aryl or heteroaryl hydroxamic acids and derivatives thereof as aggrecanase inhibitors |
| PE20030701A1 (es) | 2001-12-20 | 2003-08-21 | Schering Corp | Compuestos para el tratamiento de trastornos inflamatorios |
| CA2476594C (en) | 2002-03-05 | 2012-10-09 | Transtech Pharma, Inc. | Mono-and bicyclic azole derivatives that inhibit the interaction of ligands with rage |
| US7119203B2 (en) | 2002-04-25 | 2006-10-10 | Pharmacia Corporation | Piperidinyl- and piperazinyl-sulfonylmethyl hydroxamic acids and their use as protease inhibitors |
| WO2004000811A1 (en) * | 2002-06-25 | 2003-12-31 | Pharmacia Corporation | Arylsulfonylhydroxamic acid and amide derivatives and their use as protease inhibitors |
| US7098241B2 (en) | 2002-12-16 | 2006-08-29 | Hoffmann-La Roche Inc. | Thiophene hydroxamic acid derivatives |
| US7423176B2 (en) | 2004-04-13 | 2008-09-09 | Cephalon, Inc. | Bicyclic aromatic sulfinyl derivatives |
| WO2007070760A2 (en) | 2005-12-15 | 2007-06-21 | Boehringer Ingelheim International Gmbh | Compounds which modulate the cb2 receptor |
| US7935715B2 (en) | 2006-07-28 | 2011-05-03 | Boehringer Ingelheim International Gmbh | Compounds which modulate the CB2 receptor |
| MX2009002888A (es) | 2006-09-25 | 2009-03-31 | Boehringer Ingelheim Int | Compuestos que modulan el receptor cb2. |
| AU2007307990A1 (en) | 2006-10-05 | 2008-04-17 | Janssen Pharmaceutica, N.V. | Heterocyclic derived metalloprotease inhibitors |
| WO2009008905A1 (en) * | 2007-02-01 | 2009-01-15 | Panthera Biopharma, Llc. | Hydroxamic acid derivatives of phenoxy-acetic acids and analogs useful as therapeutic agents for treating anthrax poisoning |
| CA2704684A1 (en) | 2007-11-07 | 2009-05-14 | Boehringer Ingelheim International Gmbh | Compounds which modulate the cb2 receptor |
| CA2730037A1 (en) | 2008-07-10 | 2010-01-14 | Boehringer Ingelheim International Gmbh | Sulfone compounds which modulate the cb2 receptor |
| PE20110397A1 (es) | 2008-09-25 | 2011-07-01 | Boehringer Ingelheim Int | Compuestos que modulan selectivamente el receptor cb2 |
| US8299103B2 (en) | 2009-06-15 | 2012-10-30 | Boehringer Ingelheim International Gmbh | Compounds which selectively modulate the CB2 receptor |
| JP5756800B2 (ja) | 2009-06-16 | 2015-07-29 | ベーリンガー インゲルハイム インターナショナル ゲゼルシャフト ミット ベシュレンクテル ハフツング | Cb2受容体を調節するアゼチジン2−カルボキサミド誘導体 |
| EP2480544A1 (de) | 2009-09-22 | 2012-08-01 | Boehringer Ingelheim International GmbH | Verbindungen für selektive cb2-rezeptormodulation |
| TWI517850B (zh) | 2009-09-30 | 2016-01-21 | Vtv治療有限責任公司 | 經取代之咪唑衍生物及其使用方法 |
| EP2488489A2 (de) * | 2009-10-13 | 2012-08-22 | Pfizer Inc. | C-verlinkte hydroxaminsäurederivate als antibakterielle wirkstoffe |
| EP2523936A1 (de) | 2010-01-15 | 2012-11-21 | Boehringer Ingelheim International GmbH | Cb2 rezeptor-modulierende verbindungen |
| US8329735B2 (en) | 2010-03-05 | 2012-12-11 | Boehringer Ingelheim International Gmbh | Tetrazole compounds which selectively modulate the CB2 receptor |
| WO2012012307A1 (en) | 2010-07-22 | 2012-01-26 | Boehringer Ingelheim International Gmbh | Sulfonyl compounds which modulate the cb2 rece |
| SG188545A1 (en) * | 2010-09-17 | 2013-04-30 | Univ Tokyo | Composition for maintaining function of platelets |
| CA2917604C (en) * | 2012-07-18 | 2021-08-10 | Josune Orbe Lopategui | New antifibrinolytic compounds |
| EP2803668A1 (de) | 2013-05-17 | 2014-11-19 | Boehringer Ingelheim International Gmbh | Neuartige (Cyano-dimethyl-methyl)-isoxazole und -[1,3,4]-thiadiazole |
| EA201692305A1 (ru) | 2014-05-16 | 2017-05-31 | Актелион Фармасьютиклз Лтд. | Антибактериальные хиназолин-4(3н)-оновые производные |
| CN107188837B (zh) * | 2017-06-06 | 2019-05-28 | 温州大学 | 一种α-酰基高烯丙基硫醚类化合物的合成方法 |
| EP3860608A1 (de) | 2018-10-04 | 2021-08-11 | INSERM (Institut National de la Santé et de la Recherche Médicale) | Egfr-inhibitoren zur behandlung von keratosen |
Family Cites Families (15)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPS50121218A (de) * | 1974-03-01 | 1975-09-23 | ||
| DE2424742C3 (de) * | 1974-05-21 | 1982-04-22 | Schering Ag, 1000 Berlin Und 4619 Bergkamen | Thiophenderivate Verfahren zu ihrer Herstellung und diese enthaltende Arzneimittel |
| US3994997A (en) * | 1975-05-09 | 1976-11-30 | Gulf Oil Corporation | O,O-diethyl-O-carboxamidophosphate esters |
| GB1520812A (en) * | 1975-10-02 | 1978-08-09 | Lafon Labor | Benzhydrylsulphinyl derivatives |
| GB1574822A (en) * | 1976-03-23 | 1980-09-10 | Lafon Labor | Acetohydroxamic acid derivatives and pharmaceutical compositions thereof |
| FR2528041A1 (fr) * | 1982-06-04 | 1983-12-09 | Lafon Labor | Acides halogenobenzhydrylsulfinylacetohydroxamiques, procede de preparation et utilisation en therapeutique |
| FR2561646B1 (fr) * | 1984-03-23 | 1987-10-09 | Lafon Labor | Derives d'acide (a-(alkylaminomethyl)-benzyl)-thioacetique, procede de preparation et utilisation en therapeutique |
| IL92915A0 (en) * | 1989-01-05 | 1990-09-17 | Ciba Geigy Ag | Certain pyrrolylphenyl-substituted hydroxamic acid derivatives |
| WO1993020047A1 (en) * | 1992-04-07 | 1993-10-14 | British Bio-Technology Limited | Hydroxamic acid based collagenase and cytokine inhibitors |
| US5455258A (en) * | 1993-01-06 | 1995-10-03 | Ciba-Geigy Corporation | Arylsulfonamido-substituted hydroxamic acids |
| FR2708201B1 (fr) * | 1993-06-30 | 1995-10-20 | Lafon Labor | Utilisation de dérivés d'acétamide pour la fabrication de médicaments. |
| GB9416897D0 (en) * | 1994-08-20 | 1994-10-12 | British Biotech Pharm | Metalloproteinase inhibitors |
| JPH11504646A (ja) * | 1995-05-10 | 1999-04-27 | カイロサイエンス・リミテッド | 金属プロテアーゼとtnfの放出を抑制するペプチド化合物およびその治療的使用 |
| US5665777A (en) * | 1995-11-14 | 1997-09-09 | Abbott Laboratories | Biphenyl hydroxamate inhibitors of matrix metalloproteinases |
| PT871439E (pt) * | 1996-01-02 | 2004-08-31 | Aventis Pharma Inc | Compostos do acido hidroxamico substituidos (arilo heteroarilo arilmetilo ou heteroarilmetilo) |
-
1998
- 1998-02-17 AU AU61686/98A patent/AU726204B2/en not_active Ceased
- 1998-02-17 AU AU64368/98A patent/AU748998B2/en not_active Ceased
- 1998-02-17 IL IL13125798A patent/IL131257A0/xx unknown
- 1998-02-17 PT PT98906468T patent/PT973512E/pt unknown
- 1998-02-17 BR BR9807802A patent/BR9807802A/pt not_active IP Right Cessation
- 1998-02-17 ES ES98906468T patent/ES2217540T3/es not_active Expired - Lifetime
- 1998-02-17 WO PCT/US1998/002987 patent/WO1998037877A1/en not_active Ceased
- 1998-02-17 NZ NZ337298A patent/NZ337298A/xx unknown
- 1998-02-17 HU HU0002092A patent/HUP0002092A3/hu unknown
- 1998-02-17 SK SK1158-99A patent/SK115899A3/sk unknown
- 1998-02-17 CA CA002282656A patent/CA2282656A1/en not_active Abandoned
- 1998-02-17 EE EEP199900371A patent/EE04295B1/xx not_active IP Right Cessation
- 1998-02-17 PL PL98335286A patent/PL335286A1/xx unknown
- 1998-02-17 NZ NZ337336A patent/NZ337336A/en unknown
- 1998-02-17 EA EA199900768A patent/EA003836B1/ru not_active IP Right Cessation
- 1998-02-17 CN CN98804329A patent/CN1252790A/zh active Pending
- 1998-02-17 HU HU0001463A patent/HUP0001463A3/hu unknown
- 1998-02-17 CN CNB988043335A patent/CN1210263C/zh not_active Expired - Fee Related
- 1998-02-17 WO PCT/US1998/003291 patent/WO1998038163A1/en not_active Ceased
- 1998-02-17 KR KR1019997007881A patent/KR20000075808A/ko not_active Ceased
- 1998-02-17 EA EA199900769A patent/EA001742B1/ru not_active IP Right Cessation
- 1998-02-17 CA CA002282655A patent/CA2282655A1/en not_active Abandoned
- 1998-02-17 UA UA99095311A patent/UA58543C2/uk unknown
- 1998-02-17 YU YU40999A patent/YU40999A/sh unknown
- 1998-02-17 JP JP53772498A patent/JP2001513771A/ja not_active Withdrawn
- 1998-02-17 DE DE69823019T patent/DE69823019T2/de not_active Expired - Fee Related
- 1998-02-17 EP EP98910022A patent/EP0970046B1/de not_active Expired - Lifetime
- 1998-02-17 GE GEAP19985007A patent/GEP20022627B/en unknown
- 1998-02-17 TR TR1999/01901T patent/TR199901901T2/xx unknown
- 1998-02-17 GE GEAP19985008A patent/GEP20022626B/en unknown
- 1998-02-17 JP JP53770698A patent/JP2001519777A/ja not_active Withdrawn
- 1998-02-17 YU YU41099A patent/YU41099A/sh unknown
- 1998-02-17 DK DK98906468T patent/DK0973512T3/da active
- 1998-02-17 TR TR1999/02095T patent/TR199902095T2/xx unknown
- 1998-02-17 PL PL98335401A patent/PL335401A1/xx unknown
- 1998-02-17 DK DK98910022T patent/DK0970046T3/da active
- 1998-02-17 AT AT98906468T patent/ATE263554T1/de not_active IP Right Cessation
- 1998-02-17 AT AT98910022T patent/ATE256107T1/de not_active IP Right Cessation
- 1998-02-17 EE EEP199900369A patent/EE04150B1/xx not_active IP Right Cessation
- 1998-02-17 PT PT98910022T patent/PT970046E/pt unknown
- 1998-02-17 KR KR1019997007882A patent/KR20000075809A/ko not_active Ceased
- 1998-02-17 ES ES98910022T patent/ES2212274T3/es not_active Expired - Lifetime
- 1998-02-17 SK SK1157-99A patent/SK115799A3/sk unknown
- 1998-02-17 IL IL13125898A patent/IL131258A0/xx not_active IP Right Cessation
- 1998-02-17 EP EP98906468A patent/EP0973512B1/de not_active Expired - Lifetime
- 1998-02-17 DE DE69820424T patent/DE69820424T2/de not_active Expired - Fee Related
- 1998-02-17 BR BR9807803-8A patent/BR9807803A/pt not_active IP Right Cessation
- 1998-02-26 ZA ZA9801628A patent/ZA981628B/xx unknown
- 1998-02-26 ZA ZA9801625A patent/ZA981625B/xx unknown
- 1998-02-27 AR ARP980100909A patent/AR011451A1/es not_active Application Discontinuation
- 1998-03-17 TW TW087102853A patent/TW568900B/zh active
-
1999
- 1999-08-26 NO NO19994124A patent/NO314258B1/no not_active IP Right Cessation
- 1999-08-26 NO NO19994125A patent/NO314302B1/no unknown
- 1999-09-24 BG BG103757A patent/BG103757A/bg unknown
- 1999-09-27 BG BG103760A patent/BG103760A/bg unknown
-
2004
- 2004-09-08 CY CY0400069A patent/CY2477B1/xx unknown
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| DE69823019T2 (de) | N-hydroxy-2-(alkyl, aryl oder heteroaryl sulfanyl, sulfinyl oder sulfonyl)-3-substituierte alkyl-, aryl- oder heteroarylamide als matrixmetalloproteinaseinhibitoren | |
| US6197791B1 (en) | N-hdroxy-2-(alkyl, aryl, or heteroaryl, sulfanyl, sulfinyl or sulfonyl)-3-substituted alkyl, aryl or heteroarylamides as matrix metalloproteinase inhibitors | |
| DE69709160T2 (de) | Herstellung und anwendung von ortho-sulfonamido-aryl-hydroxamsäuren als matrix-metalloproteinase- und tace-inhibitoren | |
| DE69519921T2 (de) | Imidazolidin-derivate und ihre verwendung | |
| DE60012883T2 (de) | 2,3,4,5-tetrahydro-1h-[1,4]benzodiazepin-3-hydroxamsäure als matrix metalloproteinaseinhibitoren | |
| AU757719B2 (en) | N-hydroxy-2-(alkyl, aryl, or heteroaryl sulfanyl, sulfinyl or sulfonyl)-3-substituted-alkyl, aryl or heteroarylamides as matrix metalloproteinase inhibitors | |
| DE3814504A1 (de) | (alpha)-substituierte 4-(chinolin-2-yl-methoxy)phenylessigsaeuren und -ester, verfahren zu ihrer herstellung und ihre verwendung in arzneimitteln | |
| US6342508B1 (en) | N-hydroxy-2-(Alkyl,Aryl or Heteroaryl sulfanyl, sulfinyl or sulfonyl) 3-substituted alkyl, aryl or heteroarylamides as matrix metalloproteinase inhibitors | |
| WO2000008014A1 (de) | Disubstituierte bicyclische heterocyclen mit insbesondere einer thrombinhemmenden wirkung | |
| SK12462001A3 (sk) | Inhibítory metaloproteáz | |
| DE60012303T2 (de) | Alkinylische hydroxamsäureverbindungen als tace inhibitoren | |
| SU1424733A3 (ru) | Способ получени солей имидазола | |
| EP0535463A1 (de) | Imidazolyl-propensäurederivate als Angiotensin II Antagonisten | |
| WO2000050419A1 (de) | Substituierte bicyclische heterocyclen und deren verwendung als thrombininhibitoren | |
| DE3044566A1 (de) | N-substituierte imidazol-derivate, ihre herstellung, diese enthaltende arzneimittel und ihre verwendung | |
| HK1024875B (en) | N-hydroxy-2-(alkyl, aryl or heteroaryl sulfanyl, sulfinyl or sulfonyl)-3-substituted alkyl, aryl or heteroarylamides as matrix metalloproteinase inhibitors | |
| DD234005A5 (de) | Verfahren zur herstellung neuer 1,2,4-triazacycloalkadienderivate | |
| DE3134956A1 (de) | Imidazolderivate | |
| EP0226023A1 (de) | 1H-Pyrido-[2,3-b][1,4]-thiazine | |
| CZ305999A3 (cs) | Inhibitory metalloproteinázy |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| 8332 | No legal effect for de | ||
| 8370 | Indication related to discontinuation of the patent is to be deleted | ||
| 8364 | No opposition during term of opposition | ||
| 8339 | Ceased/non-payment of the annual fee |