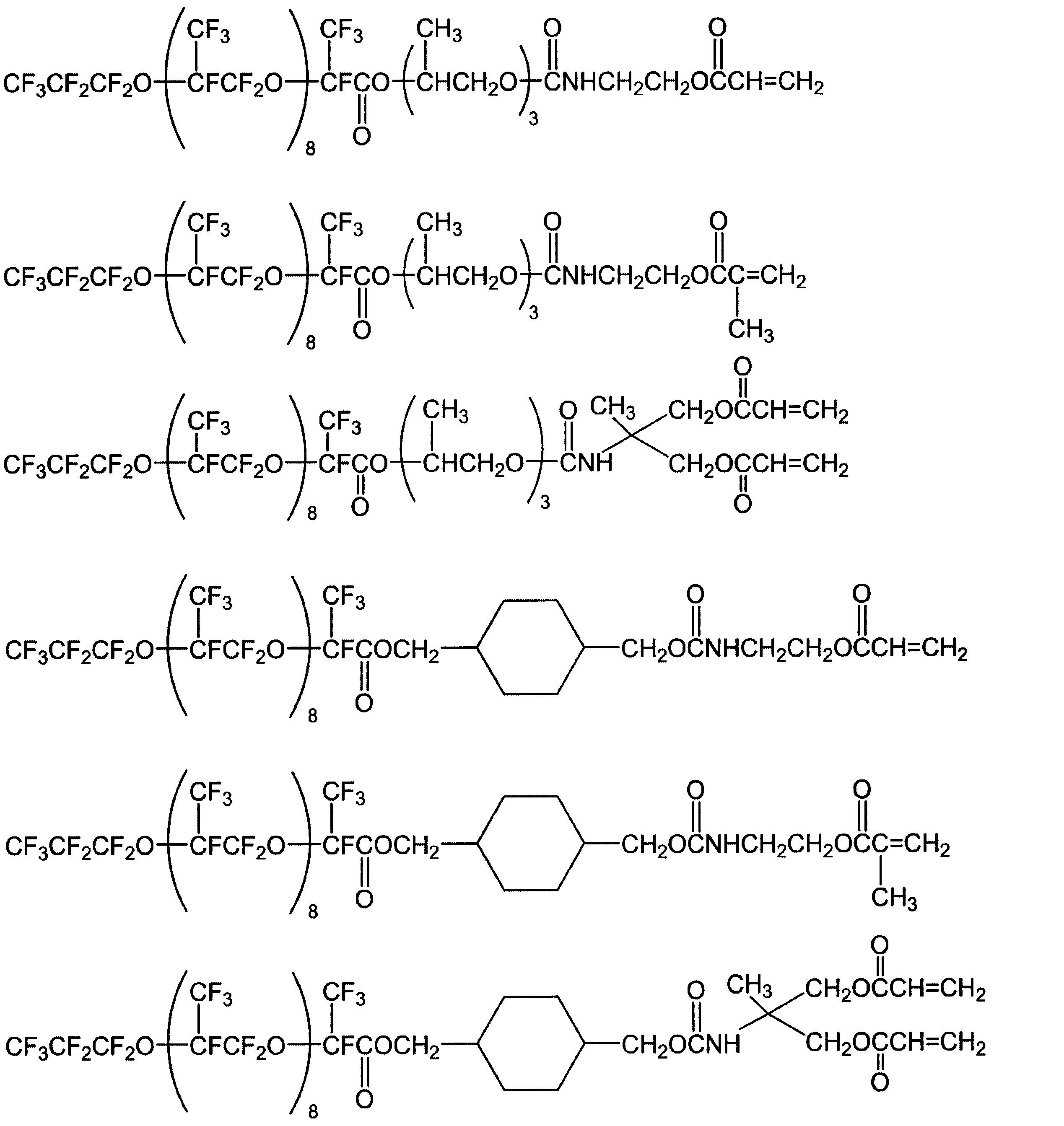WO2015151885A1 - 重合性官能基とフッ素原子団とを有するカルボン酸エステル・カルバメート化合物とその製造方法 - Google Patents
重合性官能基とフッ素原子団とを有するカルボン酸エステル・カルバメート化合物とその製造方法 Download PDFInfo
- Publication number
- WO2015151885A1 WO2015151885A1 PCT/JP2015/058619 JP2015058619W WO2015151885A1 WO 2015151885 A1 WO2015151885 A1 WO 2015151885A1 JP 2015058619 W JP2015058619 W JP 2015058619W WO 2015151885 A1 WO2015151885 A1 WO 2015151885A1
- Authority
- WO
- WIPO (PCT)
- Prior art keywords
- integer
- general formula
- represented
- iii
- carboxylic acid
- Prior art date
Links
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C271/00—Derivatives of carbamic acids, i.e. compounds containing any of the groups, the nitrogen atom not being part of nitro or nitroso groups
- C07C271/06—Esters of carbamic acids
- C07C271/08—Esters of carbamic acids having oxygen atoms of carbamate groups bound to acyclic carbon atoms
- C07C271/10—Esters of carbamic acids having oxygen atoms of carbamate groups bound to acyclic carbon atoms with the nitrogen atoms of the carbamate groups bound to hydrogen atoms or to acyclic carbon atoms
- C07C271/16—Esters of carbamic acids having oxygen atoms of carbamate groups bound to acyclic carbon atoms with the nitrogen atoms of the carbamate groups bound to hydrogen atoms or to acyclic carbon atoms to carbon atoms of hydrocarbon radicals substituted by singly-bound oxygen atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C269/00—Preparation of derivatives of carbamic acid, i.e. compounds containing any of the groups, the nitrogen atom not being part of nitro or nitroso groups
- C07C269/02—Preparation of derivatives of carbamic acid, i.e. compounds containing any of the groups, the nitrogen atom not being part of nitro or nitroso groups from isocyanates with formation of carbamate groups
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C269/00—Preparation of derivatives of carbamic acid, i.e. compounds containing any of the groups, the nitrogen atom not being part of nitro or nitroso groups
- C07C269/06—Preparation of derivatives of carbamic acid, i.e. compounds containing any of the groups, the nitrogen atom not being part of nitro or nitroso groups by reactions not involving the formation of carbamate groups
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08F—MACROMOLECULAR COMPOUNDS OBTAINED BY REACTIONS ONLY INVOLVING CARBON-TO-CARBON UNSATURATED BONDS
- C08F20/00—Homopolymers and copolymers of compounds having one or more unsaturated aliphatic radicals, each having only one carbon-to-carbon double bond, and only one being terminated by only one carboxyl radical or a salt, anhydride, ester, amide, imide or nitrile thereof
- C08F20/02—Monocarboxylic acids having less than ten carbon atoms, Derivatives thereof
- C08F20/10—Esters
- C08F20/22—Esters containing halogen
- C08F20/24—Esters containing halogen containing perhaloalkyl radicals
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08F—MACROMOLECULAR COMPOUNDS OBTAINED BY REACTIONS ONLY INVOLVING CARBON-TO-CARBON UNSATURATED BONDS
- C08F20/00—Homopolymers and copolymers of compounds having one or more unsaturated aliphatic radicals, each having only one carbon-to-carbon double bond, and only one being terminated by only one carboxyl radical or a salt, anhydride, ester, amide, imide or nitrile thereof
- C08F20/02—Monocarboxylic acids having less than ten carbon atoms, Derivatives thereof
- C08F20/10—Esters
- C08F20/34—Esters containing nitrogen, e.g. N,N-dimethylaminoethyl (meth)acrylate
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C2601/00—Systems containing only non-condensed rings
- C07C2601/12—Systems containing only non-condensed rings with a six-membered ring
- C07C2601/14—The ring being saturated
Definitions
- the present invention relates to a carboxylic acid ester / carbamate compound having a polymerizable functional group and a fluorine atom group, and a production method thereof.
- a compound having a fluorine atom in a molecule generally has excellent thermal stability and chemical stability, and also has good optical properties and surface active properties. For these reasons, compounds having fluorine atoms in the molecule are often used for applications such as antireflection films such as monitor screens, cladding agents such as optical fibers, and coating agents.
- Examples of the compound having a fluorine atom in the molecule include monomers such as a fluorinated ester compound and a fluorinated ether compound. Homopolymers and copolymers obtained from these monomers have been developed and used having various chemical structures for the above applications.
- Patent Document 1 discloses a fluorine-containing acrylic ester represented by the following general formula as a typical example of a monomer of a fluorine-containing ester compound.
- R is a divalent organic linking group
- R ′ is a hydrogen atom or a methyl group
- n is 0 or an integer
- m is an integer.
- the fluorine-containing monomer disclosed in Patent Document 1 exhibits water and oil repellency, but is difficult to dissolve in a general-purpose solvent and has a problem of phase separation when mixed with other resins. .
- an object of the present invention is to provide a fluorine-containing monomer that can be dissolved in a hydrocarbon solvent and has excellent water and oil repellency and a method for producing the same.
- the present inventors added various hydrocarbon groups to a monomer having a fluorine atom group (functional group having a large number of fluorine atoms) and a polymerizable functional group. Considered introduction. We also examined the chemical structure of the fluorine atom group and how to bond each functional group.
- the present invention has been achieved as a result of such studies. That is, the present invention has the following configuration.
- the carboxylic acid ester / carbamate compound of the present invention is a carboxylic acid ester / carbamate compound having a polymerizable functional group and a fluorine atom group represented by the general formula [I].
- C a F 2a + 1 O— (C b F 2b O) c —C 2 F 4 COO—Z— (CONHR) d [I]
- a is an integer of 1 to 3
- b is an integer of 1 to 4
- c is an integer of 0 to 50
- d is an integer of 1 to 3.
- Z is a divalent to tetravalent organic bonding group, and is — (C e H 2e O) f —, or —CH 2 (cyclo-C g H 2g-2 ) CH 2 O—, or —C h H 2h + 1 -i O i - is alcohol derivatives without peroxides represented by.
- e is an integer of 1 to 6
- f is an integer of 1 to 12
- g is an integer of 3 to 6
- h is an integer of 2 to 12
- i is an integer of 1 to 3 It is.
- R is a polymerizable functional group represented by the following general formula [II].
- R 1 is a hydrogen atom or a methyl group
- R 2 is a hydrogen atom or CH 2 ⁇ CHCOOCH 2 —
- R 3 is a hydrogen atom or a methyl group.
- the method for producing a carboxylic acid ester / carbamate according to the present invention includes a polyalkylene glycol represented by the general formula [III-1], a cycloalkanedimethanol represented by the general formula [III-2], or a general formula
- a linear or branched polyhydric alcohol represented by [III-3] is reacted with an isocyanate compound having a polymerizable functional group represented by the general formula [IV] to give a general formula [V- 1) or a hydroxycarbamate represented by general formula [V-2] or general formula [V-3], and then reacted with a perfluoropolyether carboxylic acid halide represented by general formula [VI]. It is said.
- e is an integer from 1 to 6
- f is an integer from 1 to 12
- g is an integer from 3 to 6
- h is an integer from 2 to 12
- i is from 1 to It is an integer of 3.
- R 1 is a hydrogen atom or a methyl group
- R 2 is a hydrogen atom or CH 2 ⁇ CHCOOCH 2 —
- R 3 is a hydrogen atom or a methyl group.
- e is an integer from 1 to 6
- f is an integer from 1 to 12
- g is an integer from 3 to 6
- h is an integer from 2 to 12
- i is from 1 to It is an integer of 3.
- R is a polymerizable functional group represented by the following general formula [II].
- R 1 is a hydrogen atom or a methyl group
- R 2 is a hydrogen atom or CH 2 ⁇ CHCOOCH 2 —
- R 3 is a hydrogen atom or a methyl group.
- X is a halogen atom
- a is an integer of 1 to 3
- b is an integer of 1 to 4
- c is an integer of 0 to 50.
- the fluorine-containing monomer of the present invention can be dissolved in a hydrocarbon solvent and has excellent water and oil repellency. Moreover, the manufacturing method of the fluorine-containing monomer of this invention can obtain the said fluorine-containing monomer with a high yield by a simple process.
- the method for producing a carboxylic acid ester / carbamate according to the present invention comprises: reacting an isocyanate having a polymerizable functional group with polyalkylene glycol, cycloalkanedimethanol or polyhydric alcohol; and an acid halide having a perfluoropolyether group; It is characterized by reacting.
- the reaction in the previous stage is a polyalkylene glycol represented by the general formula [III-1], a cycloalkanedimethanol represented by the general formula [III-2], or a polyalkylene glycol represented by the general formula [III-3].
- An isocyanate compound having a polymerizable functional group represented by the general formula [IV] is reacted with a monohydric alcohol, and the general formula [V-1], the general formula [V-2], or the general formula [V-3] ] It is reaction which obtains the hydroxy carbamate represented by this.
- the polyalkylene glycol is represented by the following general formula [III-1].
- e is an integer of 1 to 6
- f is an integer of 1 to 12.
- Cycloalkanedimethanol is represented by the following general formula [III-2].
- g is an integer of 3 to 6.
- the polyhydric alcohol is represented by the following general formula [III-3].
- h is an integer of 2 to 12
- i is an integer of 1 to 3.
- the carbon chain of the polyhydric alcohol may be linear or branched, and the bonding position of the hydroxyl group is not limited.
- the polyhydric alcohol does not contain a peroxide.
- polyalkylene glycol ethylene glycol, diethylene glycol, triethylene glycol, polyethylene glycol, propylene glycol, dipropylene glycol, tripropylene glycol, polypropylene glycol and the like are used.
- cycloalkanedimethanol cyclopropanedimethanol, cyclobutanedimethanol, cyclopentanedimethanol, cyclohexanedimethanol and the like are used.
- the bonding position of the hydroxyl group is not limited, and ethanediol, propanediol, butanediol, pentanediol, hexanediol, heptanediol, octanediol, nonanediol, decanediol, undecane Diol, dodecanediol, propanetriol, butanetriol, pentanetriol, hexanetriol, heptanetriol, octanetriol, nonanetriol, decanetriol, undecanetriol, dodecanetriol, butanetetraol, pentanetetraol, hexanetetraol, heptanetetraol , Octanetetraol, nonanetetraol, decanetetraol, undecanetetraol, dodecanete
- the isocyanate compound having a polymerizable functional group is represented by the following general formula [IV].
- H 2 C ⁇ C (R 1 ) COOCH 2 CR 2 R 3 —NCO [IV]
- R 1 is a hydrogen atom or a methyl group
- R 2 is a hydrogen atom or CH 2 ⁇ CHCOOCH 2 —
- R 3 is a hydrogen atom or a methyl group.
- isocyanate compound having a polymerizable functional group examples include isocyanatoalkyl acrylate, isocyanatoalkyl methacrylate, and (bisacryloyloxymethyl) alkyl isocyanate.
- isocyanate compounds such as isocyanatoalkyl (di) (meth) acrylates are represented by the formula (III-1), the general formula [III-2] or the general formula [III-3] (number of hydroxyl groups- The amount is usually 1 to 1.5 times the molar amount relative to 1).
- a solvent may or may not be used. When a solvent is used, aromatics, ketones, and ethers are used. Preferably, toluene, methyl isobutyl ketone, dibutyl ether and the like are used.
- the reaction temperature is not particularly limited, but is preferably about room temperature to 60 ° C. for the purpose of easy control and suppression of undesired polymerization in the reaction system.
- organometallic catalyst dibutyltin dilaurate, tin octylate, lead naphthenate, or the like can be used.
- Basic catalysts include 1,8-diazabicyclo [5.4.0] undec-7-ene, 1,4-diazabicyclo [2.2.2] octane, bis [(2-dimethylamino) ethyl] ether, 1,1 , 6,6, -tetramethylhexanediamine, etc.
- organometallic tin derivatives such as dibutyltin dilaurate and nitrogen-containing heterocyclic compound derivatives such as 1,8-diazabicyclo [5.4.0] undec-7-ene are used.
- Hydroxycarbamate is represented by the following general formula [V-1], general formula [V-2], or general formula [V-3].
- e is an integer from 1 to 6
- f is an integer from 1 to 12
- g is an integer from 3 to 6
- h is an integer from 2 to 12
- i is from 1 to It is an integer of 3.
- R is a polymerizable functional group represented by the following general formula [II].
- R 1 is a hydrogen atom or a methyl group
- R 2 is a hydrogen atom or CH 2 ⁇ CHCOOCH 2 —
- R 3 is a hydrogen atom or a methyl group.
- the subsequent reaction is a reaction in which the hydroxy carbamate is reacted with the perfluoropolyether carboxylic acid halide represented by the general formula [VI] to obtain a carboxylic acid ester / carbamate.
- the perfluoropolyether carboxylic acid halide is represented by the following general formula [VI].
- X is a halogen atom
- a is an integer of 1 to 3
- b is an integer of 1 to 4
- c is an integer of 0 to 50.
- perfluoropolyether carboxylic acid halide As specific examples of the perfluoropolyether carboxylic acid halide, the following can be used.
- B 2,4,4,5,7,7,8,10,10,11,13,13,14,16,16,17,17,17-octadecafluoro-3,6,9,12 , 15-pentaoxa-2,5,8,11,14-pentakis (Trifluoromethyl) heptadecanoyl fluoride
- the reaction of hydroxycarbamate with perfluoropolyether carboxylic acid halide is usually 1.1 times to 2 times of hydroxycarbamate [hydroxyl group-containing (di) (meth) acrylate] with respect to the acid halide containing perfluoroether group. It is carried out by dehydrohalogenation condensation reaction using a double mole. Any reaction solvent may be used as long as it is inert to this reaction. Generally, a fluorinated solvent is used.
- Asahi Clin AK225 (Asahi Glass), Asahi Clin AE3000 (Asahi Glass), Novec HFE (Sumitomo 3M), Bertrell XF (DuPont), Fluorinert FC-72 (Sumitomo 3M) Etc. are used.
- this reaction is a dehydrohalogenation reaction, it is preferably carried out in the presence of a hydrogen halide scavenger.
- a hydrogen halide scavenger lithium fluoride, sodium fluoride, and potassium fluoride that are alkali metal fluorides, and triethylamine and tributylamine that are organic amine compounds are generally used.
- alkali metal fluorides such as sodium fluoride and triethylamine are preferably used from the viewpoint of the ability to retain the generated hydrogen fluoride and the cost.
- the use ratio of the hydrogen halide scavenger is 2 to 8 times mol, preferably 2.1 to 3.0 times mol for the perfluoropolyether carboxylic acid halide.
- the obtained carboxylic acid ester / carbamate has a polymerizable functional group, it is preferable to carry out the reaction by adding methoquinone (p-methoxyphenol) or hydroquinone as a polymerization inhibitor into the reaction system.
- methoquinone p-methoxyphenol
- hydroquinone as a polymerization inhibitor
- Examples of the carboxylic acid ester / carbamate of the present invention synthesized as described above include the following compounds.
- the fluorine-containing polyether (di) (meth) acrylate which is a carboxylic acid ester / carbamate of the present invention has a polymerizable functional group, a fluorine atom group, and a hydrocarbon group in the molecule, so that it has water repellency, oil repellency, and fingerprint resistance. It is possible to exhibit solubility in general-purpose solvents and compatibility with curable resins without impairing properties and antifouling properties. Moreover, since it has many fluorine atoms in one molecule, it has excellent thermal stability and chemical stability, and has good optical properties and surface active properties.
- the carboxylate ester carbamate of the present invention can be cured by energy rays such as visible light, ultraviolet rays, and electron beams, it can be applied to photosensitive curable inks, paints, electron beam curable adhesives, and the like. Application is possible. Moreover, since it can also synthesize
- the carboxylic acid ester / carbamate of the present invention shows a low refractive index because of the high fluorine content in the molecule. For this reason, it can also be used as an antireflection film for a display or the like, or a clad material for an optical fiber or the like. Furthermore, it can be used for various release coating agents, surface modifiers, water and oil repellents, etc. by utilizing surface active properties.
- Example 1 To 200 g of toluene, 307.6 g (1.60 mol) of tripropylene glycol and 1.01 g of dibutyltin laurate (DBTDL) were added, and 430.8 g (1. 1) of 1,1- (bisacryloyloxymethyl) ethyl isocyanate was stirred. 80 mol) was added dropwise and stirred for 5 hours. The disappearance of 1,1- (bisacryloyloxymethyl) ethyl isocyanate was confirmed by GC (gas chromatograph), and the reaction was completed. The yield was 637.2 g and the yield was 92.3%.
- DBTDL dibutyltin laurate
- Example 1 The reaction of Example 1 is as shown in the following two chemical formulas.
- Example 1 The NMR identification result of the product of Example 1 was as follows. It was confirmed that the reaction of Example 1 proceeded and a carboxylic acid ester / carbamate having the following chemical structure was obtained.
- Example 2 To 200 g of toluene, 225.9 g (1.60 mol) of cyclohexanedimethanol and 1.01 g of dibutyltin laurate (DBTDL) were added, and 279.3 g (1.80 mol) of isocyanatoethyl methacrylate was added dropwise with stirring for 5 hours. Stir. The disappearance of isocyanatoethyl acrylate was confirmed by GC, and the reaction was completed. The yield was 431.8 g, and the yield was 90.1%.
- DBTDL dibutyltin laurate
- Example 2 The reaction of Example 2 is as shown in the following two chemical formulas.
- Example 2 The NMR identification result of the product of Example 2 was as follows. It was confirmed that the reaction of Example 2 described above proceeded and a carboxylic acid ester / carbamate having the following chemical structure was obtained.
- Example 3 To 102.6 g of toluene, 39.0 g (0.423 mol) of 1,2,3-propanetriol and 0.36 g of dibutyltin laurate (DBTDL) were added, and 1,1- (bisacryloyloxymethyl) ethyl was stirred. 300.1 g (1.25 mol) of isocyanate was added dropwise and stirred for 3 hours. The disappearance of 1,1- (bisacryloyloxymethyl) ethyl isocyanate was confirmed by GC, and the reaction was completed. The yield was 265.3 g, and the yield was 93.2%.
- DBTDL dibutyltin laurate
- Example 3 The reaction of Example 3 is as shown in the following two chemical formulas.
- the NMR identification result of the product of Example 3 was as follows. It was confirmed that the reaction of Example 3 proceeded and a carboxylic acid ester / carbamate having the following chemical structure was obtained.
- Example 4 To 101.8 g of toluene, 69.4 g (0.518 mol) of 1,2,6-hexanetriol and 0.44 g of dibutyltin laurate (DBTDL) were added, and 1,1- (bisacryloyloxymethyl) ethyl was stirred. 300.0 g (1.25 mol) of isocyanate was added dropwise and stirred for 3 hours. The disappearance of 1,1- (bisacryloyloxymethyl) ethyl isocyanate was confirmed by GC, and the reaction was completed. The yield was 318.6 g and the yield was 92.3%.
- DBTDL dibutyltin laurate
- Example 4 The reaction of Example 4 is as shown in the following two chemical formulas.
- the NMR identification result of the product of Example 4 was as follows. It was confirmed that the reaction of Example 4 proceeded and a carboxylic acid ester / carbamate having the following chemical structure was obtained.
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Polymers & Plastics (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
- Low-Molecular Organic Synthesis Reactions Using Catalysts (AREA)
Abstract
Description
CaF2a+1O-(CbF2bO)c-C2F4COO-Z-(CONHR)d [I]
ここで、aは、1~3の整数であり、bは、1~4の整数であり、cは、0~50の整数であり、dは、1~3の整数である。Zは2~4価の有機結合基であって、-(CeH2eO)f-、または-CH2(cyclo-CgH2g-2)CH2O-、または-ChH2h+1-iOi-で表される過酸化物を含まないアルコール誘導体である。eは、1~6の整数であり、fは、1~12の整数であり、gは、3~6の整数であり、hは2~12の整数であり、iは1~3の整数である。Rは、以下の一般式[II]で表される重合性官能基である。
H2C=C(R1)COOCH2CR2R3- [II]
ここで、R1は、水素原子またはメチル基であり、R2は、水素原子またはCH2=CHCOOCH2-であり、R3は、水素原子またはメチル基である。
HOCH2(cyclo-CgH2g-2)CH2OH [III-2]
HOChH2h+1-i(OH)i [III-3]
ここで、eは、1~6の整数であり、fは、1~12の整数であり、gは、3~6の整数であり、hは2~12の整数であり、iは1~3の整数である。
H2C=C(R1)COOCH2CR2R3-NCO [IV]
ここで、R1は、水素原子またはメチル基であり、R2は、水素原子またはCH2=CHCOOCH2-であり、R3は、水素原子またはメチル基である。
HO(CeH2eO)fCONHR [V-1]
HOCH2(cyclo-CgH2g-2)CH2OCONHR [V-2]
HOChH2h+1-i(OCONHR)i [V-3]
ここで、eは、1~6の整数であり、fは、1~12の整数であり、gは、3~6の整数であり、hは2~12の整数であり、iは1~3の整数である。Rは、以下の一般式[II]で表される重合性官能基である。
H2C=C(R1)COOCH2CR2R3- [II]
ここで、R1は、水素原子またはメチル基であり、R2は、水素原子またはCH2=CHCOOCH2-であり、R3は、水素原子またはメチル基である。
CaF2a+1O-(CbF2bO)c-C2F4CO-X [VI]
ここで、Xは、ハロゲン原子であり、aは、1~3の整数であり、bは、1~4の整数であり、cは、0~50の整数である。
前段の反応は、一般式[III-1]で表されるポリアルキレングリコール、または一般式[III-2]で表されるシクロアルカンジメタノール、または一般式[III-3]で表される多価アルコールに対して、一般式[IV]で表される重合性官能基を有するイソシアネート化合物を反応させて、一般式[V-1]または一般式[V-2]または一般式[V-3]で表されるヒドロキシカルバメートを得る反応である。
HO(CeH2eO)fH [III-1]
ここで、eは、1~6の整数であり、fは、1~12の整数である
また、シクロアルカンジメタノールは、下記一般式[III-2]で表される。
HOCH2(cyclo-CgH2g-2)CH2OH [III-2]
ここで、gは、3~6の整数である。
また、多価アルコールは、下記一般式[III-3]で表される。
HOChH2h+1-i(OH)i [III-3]
ここで、hは2~12の整数であり、iは1~3の整数である。当該多価アルコールの炭素鎖は直鎖型でも分岐型でも良く、水酸基の結合位置は限定されない。また、当該多価アルコールは過酸化物を含むものではない。
H2C=C(R1)COOCH2CR2R3-NCO [IV]
ここで、R1は、水素原子またはメチル基であり、R2は、水素原子またはCH2=CHCOOCH2-であり、R3は、水素原子またはメチル基である。
カレンズAOI:H2C=CHCOOCH2CH2NCO
カレンズMOI:H2C=C(CH3)COOCH2CH2NCO
カレンズBEI:(H2C=CHCOOCH2)2C(CH3)NCO
HO(CeH2eO)fCONHR [V-1]
HOCH2(cyclo-CgH2g-2)CH2OCONHR [V-2]
HOChH2h+1-i(OCONHR)i [V-3]
ここで、eは、1~6の整数であり、fは、1~12の整数であり、gは、3~6の整数であり、hは2~12の整数であり、iは1~3の整数である。Rは、以下の一般式[II]で表される重合性官能基である。
H2C=C(R1)COOCH2CR2R3- [II]
ここで、R1は、水素原子またはメチル基であり、R2は、水素原子またはCH2=CHCOOCH2-であり、R3は、水素原子またはメチル基である。
後段の反応は、上記のヒドロキシカルバメートと、一般式[VI]で表されるパーフルオロポリエーテルカルボン酸ハライドとを反応させて、カルボン酸エステル・カルバメートを得る反応である。
CaF2a+1O-(CbF2bO)c-C2F4CO-X [VI]
ここで、Xは、ハロゲン原子であり、aは、1~3の整数であり、bは、1~4の整数であり、cは、0~50の整数である。
(a)2,4,4,5,7,7,8,10,10,11,13,13,14,16,16,17,17,18,18,18-エイコサフルオロ-3,6,9,12,15-ペンタオキサ-2,5,8,11,14-ペンタキス
(トリフルオロメチル)オクタデカノイルフルオリド、
(b)2,4,4,5,7,7,8,10,10,11,13,13,14,16,16,17,17,17-オクタデカフルオロ-3,6,9,12,15-ペンタオキサ-2,5,8,11,14-ペンタキス
(トリフルオロメチル)ヘプタデカノイルフルオリド、
(c)2,4,4,5,7,7,8,10,10,11,13,13,14,16,16,16-ヘキサデカフルオロ-3,6,9,12,15-ペンタオキサ-2,5,8,11,14-ペンタキス(トリフルオロメチル)
ヘキサデカノイルフルオリド、
(d)2,4,4,5,7,7,8,10,10,11,13,13,14,16,16,17,19,19,20,22,22,23,25,25,26,28,28,29,29,30,30,30-ドトリアコンタフルオロ-3,6,9,12,15,18,
21,24,27-ノナオキサ-2,5,8,11,14,17,20,23,26-ノナキス(トリフルオロメチル)トリアコンタノイルフルオリド、
(e)2,4,4,5,7,7,8,10,10,11,13,13,14,16,16,17,19,19,20,22,22,23,25,25,26,28,28,29,29,29-トリアコンタフルオロ-3,6,9,12,15,18,21,24,27
-ノナオキサ-2,5,8,11,14,17,20,23,26-ノナキス(トリフルオロメチル)
ノナコサノイルフルオリド、
(f)2,4,4,5,7,7,8,10,10,11,13,13,14,16,16,17,19,19,20,22,22,23,25,25,26,28,28,28-オクタコサフルオロ-3,6,9,12,15,18,21,24,27-ノナオキサ
-2,5,8,11,14,17,20,23,26-ノナキス(トリフルオロメチル)
オクタコサノイルフルオリド、
(g)2,2,3,3,5,5,6,6,7,7,9,9,10,10,11,11,13,13,14,14,15,15,15-トリコサフルオロ-4,8,12-トリオキサペンタデカノイルフルオリド、
(h)2,2,3,3,5,5,6,6,7,7,9,9,10,10,11,11,13,13,14,14,15,15,17,17,18,18,19,19,21,21,22,22,23,23,25,25,26,26,27,27,29,29,30,30,31,31,31
-ヘプタテトラコンタフルオロ-4,8,12,16,20,24,28-ヘプタオキサヘントリアコンタノイルフルオリド。
これらの中で、好ましくは、
(a)2,4,4,5,7,7,8,10,10,11,13,13,14,16,16,17,17,18,18,18-エイコサフルオロ-3,6,9,12,15-ペンタオキサ-2,5,8,11,14-ペンタキス
(トリフルオロメチル)オクタデカノイルフルオリド、
(d)2,4,4,5,7,7,8,10,10,11,13,13,14,16,16,17,19,19,20,22,22,23,25,25,26,28,28,29,29,30,30,30-ドトリアコンタフルオロ-3,6,9,12,15,18,
21,24,27-ノナオキサ-2,5,8,11,14,17,20,23,26-ノナキス(トリフルオロメチル)トリアコンタノイルフルオリド、等が用いられる。
上記のパーフルオロポリエーテルカルボン酸ハライドの化学式を図示すると、以下のとおりである。
反応溶媒としては、この反応に不活性なものであれば任意なものが使用し得る。一般的には、フッ素系溶媒が使用される。具体的には、アサヒクリンAK225(旭硝子社製)、アサヒクリンAE3000(旭硝子社製)、ノベックHFE(住友スリーエム社製)、バートレルXF(デュポン社製)、フロリナートFC-72(住友スリーエム社製)などが用いられる。好ましくは、アサヒクリンAK225(旭硝子社製)である。
トルエン200gに、トリプロピレングリコール307.6g(1.60mol)と、ジブチルスズラウリレート(DBTDL)1.01gを加え、撹拌下、1,1-(ビスアクリロイルオキシメチル)エチルイソシアネート430.8g(1.80mol)を滴下し、5時間撹拌した。GC(ガスクロマトグラフ)によって、1,1-(ビスアクリロイルオキシメチル)エチルイソシアネートの消失を確認し、反応終了とした。収量637.2g、収率92.3%であった。
σ(ppm):-143.8:d, -130.2:f, -128.7:b, -81.4:c, -80.6:e, -79.1:a,g,h
1H-NMR[(CD3)2CO]
σ(ppm):1.0~1.4:k, 1.4:m, 3.5~4.1:i,j, 4.4:n, 5.9:q, 6.2:p, 6.4:o
トルエン200gに、シクロヘキサンジメタノール225.9g(1.60mol)と、ジブチルスズラウリレート(DBTDL)1.01gを加え、撹拌下、イソシアナトエチルメタクリレート279.3g(1.80mol)を滴下し、5時間撹拌した。GCによって、イソシアナトエチルアクリレートの消失を確認し、反応終了とした。収量431.8g、収率90.1%であった。
σ(ppm):-143.5:d, -130.0:f, -128.9:b, -82.5~-76.4:a,c,e,g,h 1H-NMR[(CD3)2CO]
σ(ppm):0.95~2.7:j,k,l,m, 1.92:r 3.4:p, 4.0~5.7:i,n,q, 5.6:s, 6.1:t, 6.5:o
トルエン102.6gに、1,2,3-プロパントリオール39.0g(0.423mol)と、ジブチルスズラウリレート(DBTDL)0.36gを加え、撹拌下、1,1-(ビスアクリロイルオキシメチル)エチルイソシアネート300.1g(1.25mol)を滴下し、3時間撹拌した。GCによって、1,1-(ビスアクリロイルオキシメチル)エチルイソシアネートの消失を確認し、反応終了とした。収量265.3g、収率93.2%であった。
σ(ppm):-143.9:d, -130.2:f, -128.6:b, -84.3~-76.3:a,c,e,g,h
1H-NMR[(CD3)2CO]
σ(ppm):1.5:m,s 3.8~4.3:i,j,k 4.4:n,t 5.9:q,w 6.2:p,v 6.4:o,u 6.5:l,r
トルエン101.8gに、1,2,6-ヘキサントリオール69.4g(0.518mol)と、ジブチルスズラウリレート(DBTDL)0.44gを加え、撹拌下、1,1-(ビスアクリロイルオキシメチル)エチルイソシアネート300.0g(1.25mol)を滴下し、3時間撹拌した。GCによって、1,1-(ビスアクリロイルオキシメチル)エチルイソシアネートの消失を確認し、反応終了とした。収量318.6g、収率92.3%であった。
σ(ppm):-143.9:d, -130.3:f, -128.5:b, -82.3~-76.4:a,c,e,g,h
1H-NMR[(CD3)2CO]
σ(ppm):1.4:p,v 1.5~1.8:k,l,m 3.7~4.3:i,j,n 4.8:q,w 5.9:t,z 6.2:s,y 6.3~6.5:o,r,u,x
Claims (6)
- 一般式[I]で表される、重合性官能基とフッ素原子団とを有するカルボン酸エステル・カルバメート化合物。
CaF2a+1O-(CbF2bO)c-C2F4COO-Z-(CONHR)d [I]
ここで、aは、1~3の整数であり、bは、1~4の整数であり、cは、0~50の整数であり、dは、1~3の整数である。Zは2~4価の有機結合基であって、-(CeH2eO)f-、または-CH2(cyclo-CgH2g-2)CH2O-、または-ChH2h+1-iOi-で表される過酸化物を含まないアルコール誘導体である。eは、1~6の整数であり、fは、1~12の整数であり、gは、3~6の整数であり、hは2~12の整数であり、iは1~3の整数である。Rは、以下の一般式[II]で表される重合性官能基である。
H2C=C(R1)COOCH2CR2R3- [II]
ここで、R1は、水素原子またはメチル基であり、R2は、水素原子またはCH2=CHCOOCH2-であり、R3は、水素原子またはメチル基である。 - 一般式[III-1]で表されるポリアルキレングリコール、または一般式[III-2]で表されるシクロアルカンジメタノール、または一般式[III-3]で表される直鎖型または分岐型の多価アルコールに対して、一般式[IV]で表される重合性官能基を有するイソシアネート化合物を反応させて、一般式[V-1]または一般式[V-2]または一般式[V-3]で表されるヒドロキシカルバメートとした後に、一般式[VI]で表されるパーフルオロポリエーテルカルボン酸ハライドを反応させることを特徴とするカルボン酸エステル・カルバメートの製造方法。
HO(CeH2eO)fH [III-1]
HOCH2(cyclo-CgH2g-2)CH2OH [III-2]
HOChH2h+1-i(OH)i [III-3]
ここで、eは、1~6の整数であり、fは、1~12の整数であり、gは、3~6の整数であり、hは2~12の整数であり、iは1~3の整数である。
H2C=C(R1)COOCH2CR2R3-NCO [IV]
ここで、R1は、水素原子またはメチル基であり、R2は、水素原子またはCH2=CHCOOCH2-であり、R3は、水素原子またはメチル基である。
HO(CeH2eO)fCONHR [V-1]
HOCH2(cyclo-CgH2g-2)CH2OCONHR [V-2]
HOChH2h+1-i(OCONHR)i [V-3]
ここで、eは、1~6の整数であり、fは、1~12の整数であり、gは、3~6の整数であり、hは2~12の整数であり、iは1~3の整数である。Rは、以下の一般式[II]で表される重合性官能基である。
H2C=C(R1)COOCH2CR2R3- [II]
ここで、R1は、水素原子またはメチル基であり、R2は、水素原子またはCH2=CHCOOCH2-であり、R3は、水素原子またはメチル基である。
CaF2a+1O-(CbF2bO)c-C2F4CO-X [VI]
ここで、Xは、ハロゲン原子であり、aは、1~3の整数であり、bは、1~4の整数であり、cは、0~50の整数である。 - 前記一般式[III-1]で表されるポリアルキレングリコール、または前記一般式[III-2]で表されるシクロアルカンジメタノール、または前記一般式[III-3]で表わされる多価アルコールと、前記一般式[IV]で表される重合性官能基を有するイソシアネート化合物とを反応させる際に、有機金属触媒または塩基性触媒を使用することを特徴とする請求項2に記載のカルボン酸エステル・カルバメートの製造方法。
- 前記有機金属触媒または前記塩基性触媒として、有機金属スズ誘導体または含窒素複素環式化合物誘導体を使用することを特徴とする請求項3に記載のカルボン酸エステル・カルバメートの製造方法。
- 前記一般式[V-1]または前記一般式[V-2]または前記一般式[V-3]で表されるヒドロキシカルバメートと、前記一般式[VI]で表されるパーフルオロポリエーテルカルボン酸ハライドとを反応させる際に、ハロゲン化水素捕捉剤の存在下で反応を行うことを特徴とする請求項2に記載のカルボン酸エステル・カルバメートの製造方法。
- 前記ハロゲン化水素捕捉剤として、アルカリ金属フッ化物を使用することを特徴とする請求項5に記載のカルボン酸エステル・カルバメートの製造方法。
Priority Applications (4)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US14/910,815 US9604918B2 (en) | 2014-04-04 | 2015-03-20 | Carboxylic acid ester/carbamate compound with polymerizable functional group and fluorine atom group, and manufacturing method therefor |
| JP2015543168A JP5873224B1 (ja) | 2014-04-04 | 2015-03-20 | 重合性官能基とフッ素原子団とを有するカルボン酸エステル・カルバメート化合物とその製造方法 |
| CN201580011351.5A CN106232575B (zh) | 2014-04-04 | 2015-03-20 | 具有聚合性官能团和氟原子团的羧酸酯·氨基甲酸酯化合物及其制造方法 |
| EP15774411.1A EP3127897B1 (en) | 2014-04-04 | 2015-03-20 | Carboxylic ester / carbamate compound with polymerizable functional group and fluorine atom group, and manufacturing method therefor |
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2014078190 | 2014-04-04 | ||
| JP2014-078190 | 2014-04-04 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| WO2015151885A1 true WO2015151885A1 (ja) | 2015-10-08 |
Family
ID=54240215
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| PCT/JP2015/058619 WO2015151885A1 (ja) | 2014-04-04 | 2015-03-20 | 重合性官能基とフッ素原子団とを有するカルボン酸エステル・カルバメート化合物とその製造方法 |
Country Status (5)
| Country | Link |
|---|---|
| US (1) | US9604918B2 (ja) |
| EP (1) | EP3127897B1 (ja) |
| JP (1) | JP5873224B1 (ja) |
| CN (1) | CN106232575B (ja) |
| WO (1) | WO2015151885A1 (ja) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2017110698A1 (ja) * | 2015-12-25 | 2017-06-29 | ユニマテック株式会社 | 重合性官能基とフッ素原子団とを有するカルボン酸エステル化合物とその製造方法 |
Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPS58194839A (ja) * | 1982-05-10 | 1983-11-12 | Nippon Mektron Ltd | アクリル酸エステルの製造法 |
| WO1995018194A1 (fr) * | 1993-12-29 | 1995-07-06 | Daikin Industries, Ltd. | Emulsion d'huile/eau fluoree et composition de traitement de surface |
| CN102002129A (zh) * | 2010-10-25 | 2011-04-06 | 江苏梅兰化工有限公司 | 一种含氟丙烯酸酯共聚物织物整理剂的制备方法 |
| KR20120104850A (ko) * | 2011-03-14 | 2012-09-24 | 한국화학연구원 | 저굴절률 및 방오성 투명 코팅을 위한 혼합물 및 이를 포함하는 조성물 |
Family Cites Families (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPS52106386A (en) * | 1976-03-05 | 1977-09-06 | Dainippon Ink & Chem Inc | Nonaqueous emulsion |
-
2015
- 2015-03-20 US US14/910,815 patent/US9604918B2/en active Active
- 2015-03-20 WO PCT/JP2015/058619 patent/WO2015151885A1/ja active Application Filing
- 2015-03-20 JP JP2015543168A patent/JP5873224B1/ja active Active
- 2015-03-20 CN CN201580011351.5A patent/CN106232575B/zh active Active
- 2015-03-20 EP EP15774411.1A patent/EP3127897B1/en active Active
Patent Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPS58194839A (ja) * | 1982-05-10 | 1983-11-12 | Nippon Mektron Ltd | アクリル酸エステルの製造法 |
| WO1995018194A1 (fr) * | 1993-12-29 | 1995-07-06 | Daikin Industries, Ltd. | Emulsion d'huile/eau fluoree et composition de traitement de surface |
| CN102002129A (zh) * | 2010-10-25 | 2011-04-06 | 江苏梅兰化工有限公司 | 一种含氟丙烯酸酯共聚物织物整理剂的制备方法 |
| KR20120104850A (ko) * | 2011-03-14 | 2012-09-24 | 한국화학연구원 | 저굴절률 및 방오성 투명 코팅을 위한 혼합물 및 이를 포함하는 조성물 |
Cited By (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2017110698A1 (ja) * | 2015-12-25 | 2017-06-29 | ユニマテック株式会社 | 重合性官能基とフッ素原子団とを有するカルボン酸エステル化合物とその製造方法 |
| JP6182291B1 (ja) * | 2015-12-25 | 2017-08-16 | ユニマテック株式会社 | 重合性官能基とフッ素原子団とを有するカルボン酸エステル化合物とその製造方法 |
| CN108473413A (zh) * | 2015-12-25 | 2018-08-31 | 优迈特株式会社 | 具有聚合性官能团和氟原子基团的羧酸酯化合物及其制造方法 |
Also Published As
| Publication number | Publication date |
|---|---|
| JP5873224B1 (ja) | 2016-03-01 |
| CN106232575B (zh) | 2020-02-21 |
| EP3127897A1 (en) | 2017-02-08 |
| EP3127897B1 (en) | 2019-11-27 |
| EP3127897A4 (en) | 2018-03-07 |
| JPWO2015151885A1 (ja) | 2017-04-13 |
| US20160185714A1 (en) | 2016-06-30 |
| CN106232575A (zh) | 2016-12-14 |
| US9604918B2 (en) | 2017-03-28 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US20100147191A1 (en) | Fluorine-containing acrylate | |
| EP3395794B1 (en) | Carboxylic acid ester compound having polymerizable functional group and fluorine atom group, and method for producing same | |
| JP2008038015A5 (ja) | ||
| WO2015056744A1 (ja) | 表面処理組成物 | |
| JP2013181014A (ja) | 含フッ素化合物、撥液性処理剤、及び硬化膜 | |
| JP7203835B2 (ja) | ハロアルキル及びハロアルケニルエーテル(メタ)アクリレートのポリマー | |
| JP5873224B1 (ja) | 重合性官能基とフッ素原子団とを有するカルボン酸エステル・カルバメート化合物とその製造方法 | |
| JP5206746B2 (ja) | 含フッ素ポリエーテルカルボン酸エステル | |
| JP2009102459A (ja) | ウレタン(メタ)アクリレート組成物及びエネルギー線硬化型樹脂組成物 | |
| JP4590703B2 (ja) | 含フッ素ポリエーテルカルボン酸エステル | |
| JP6187847B1 (ja) | 活性エネルギー線硬化型組成物及びプラスチックレンズ | |
| JP5338809B2 (ja) | 多官能含フッ素化合物及び該化合物の製造方法 | |
| JP4859473B2 (ja) | グリセリンカルボン酸ジエステルの製造方法 | |
| JP5114964B2 (ja) | 含フッ素(メタ)アクリル酸エステル、その製造方法及び防汚塗料 | |
| JP4409995B2 (ja) | エネルギー線硬化型樹脂組成物 | |
| JP2008297400A (ja) | 含フッ素コ−ティング剤及びそれを用いた減反射材 | |
| JP5177374B2 (ja) | (メタ)アクリル酸エステルおよびその製造方法 | |
| KR102470542B1 (ko) | 광경화 코팅용 조성물 및 코팅막 | |
| JP2009242350A (ja) | 多官能含フッ素化合物及び該化合物の製造方法 | |
| JP2008137973A (ja) | 含フッ素ポリエーテルカルボン酸エステルおよびその製造法 | |
| JP2004091479A (ja) | マレイミド化合物、それを含有する活性エネルギー線硬化性組成物、低屈折光学材料用重合体、及びマレイミド化合物の製造方法 | |
| JP2020002064A (ja) | (メタ)アクリレート化合物、硬化性組成物、硬化物及び物品 | |
| JP2008115106A (ja) | 含フッ素ポリエーテルカルボン酸エステルおよびその製造法 | |
| JP4643295B2 (ja) | 1つのオキセタニル基及び2つのカルボキシル基を有する化合物、重合物、放射線硬化性化合物、並びに、硬化物 | |
| JPWO2015012259A1 (ja) | 反応促進剤、およびこれを用いたウレタン化合物、チオウレタン化合物、アミド化合物またはウレア化合物の製造方法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| ENP | Entry into the national phase |
Ref document number: 2015543168 Country of ref document: JP Kind code of ref document: A |
|
| 121 | Ep: the epo has been informed by wipo that ep was designated in this application |
Ref document number: 15774411 Country of ref document: EP Kind code of ref document: A1 |
|
| REEP | Request for entry into the european phase |
Ref document number: 2015774411 Country of ref document: EP |
|
| WWE | Wipo information: entry into national phase |
Ref document number: 2015774411 Country of ref document: EP |
|
| WWE | Wipo information: entry into national phase |
Ref document number: 14910815 Country of ref document: US |
|
| NENP | Non-entry into the national phase |
Ref country code: DE |