RU2632103C2 - Комбинации и способы введения терапевтических средств и комбинированной терапии - Google Patents
Комбинации и способы введения терапевтических средств и комбинированной терапии Download PDFInfo
- Publication number
- RU2632103C2 RU2632103C2 RU2012106620A RU2012106620A RU2632103C2 RU 2632103 C2 RU2632103 C2 RU 2632103C2 RU 2012106620 A RU2012106620 A RU 2012106620A RU 2012106620 A RU2012106620 A RU 2012106620A RU 2632103 C2 RU2632103 C2 RU 2632103C2
- Authority
- RU
- Russia
- Prior art keywords
- composition
- treatment
- paclitaxel
- nanoparticles
- cancer
- Prior art date
Links
- 238000000034 method Methods 0.000 title claims description 192
- 239000003814 drug Substances 0.000 title abstract description 53
- 238000002648 combination therapy Methods 0.000 title description 8
- 229940124597 therapeutic agent Drugs 0.000 title description 5
- RCINICONZNJXQF-MZXODVADSA-N taxol Chemical compound O([C@@H]1[C@@]2(C[C@@H](C(C)=C(C2(C)C)[C@H](C([C@]2(C)[C@@H](O)C[C@H]3OC[C@]3([C@H]21)OC(C)=O)=O)OC(=O)C)OC(=O)[C@H](O)[C@@H](NC(=O)C=1C=CC=CC=1)C=1C=CC=CC=1)O)C(=O)C1=CC=CC=C1 RCINICONZNJXQF-MZXODVADSA-N 0.000 claims abstract description 443
- 239000000203 mixture Substances 0.000 claims abstract description 346
- 239000002105 nanoparticle Substances 0.000 claims abstract description 341
- 238000011282 treatment Methods 0.000 claims abstract description 222
- 229960001592 paclitaxel Drugs 0.000 claims abstract description 212
- 229930012538 Paclitaxel Natural products 0.000 claims abstract description 208
- 102000014914 Carrier Proteins Human genes 0.000 claims abstract description 94
- 108010078791 Carrier Proteins Proteins 0.000 claims abstract description 93
- 238000001959 radiotherapy Methods 0.000 claims abstract description 35
- 206010061535 Ovarian neoplasm Diseases 0.000 claims abstract description 23
- 206010033128 Ovarian cancer Diseases 0.000 claims abstract description 22
- 206010028980 Neoplasm Diseases 0.000 claims description 244
- 102000009027 Albumins Human genes 0.000 claims description 206
- 108010088751 Albumins Proteins 0.000 claims description 206
- 239000002246 antineoplastic agent Substances 0.000 claims description 171
- 229940127089 cytotoxic agent Drugs 0.000 claims description 165
- 201000011510 cancer Diseases 0.000 claims description 124
- -1 vinca alkaloids Substances 0.000 claims description 68
- ZDZOTLJHXYCWBA-VCVYQWHSSA-N N-debenzoyl-N-(tert-butoxycarbonyl)-10-deacetyltaxol Chemical compound O([C@H]1[C@H]2[C@@](C([C@H](O)C3=C(C)[C@@H](OC(=O)[C@H](O)[C@@H](NC(=O)OC(C)(C)C)C=4C=CC=CC=4)C[C@]1(O)C3(C)C)=O)(C)[C@@H](O)C[C@H]1OC[C@]12OC(=O)C)C(=O)C1=CC=CC=C1 ZDZOTLJHXYCWBA-VCVYQWHSSA-N 0.000 claims description 37
- 239000003795 chemical substances by application Substances 0.000 claims description 37
- 239000008389 polyethoxylated castor oil Substances 0.000 claims description 37
- BASFCYQUMIYNBI-UHFFFAOYSA-N platinum Chemical compound [Pt] BASFCYQUMIYNBI-UHFFFAOYSA-N 0.000 claims description 31
- 108091006905 Human Serum Albumin Proteins 0.000 claims description 19
- 102000008100 Human Serum Albumin Human genes 0.000 claims description 19
- 230000001225 therapeutic effect Effects 0.000 claims description 19
- 229910052697 platinum Inorganic materials 0.000 claims description 16
- 239000004037 angiogenesis inhibitor Substances 0.000 claims description 14
- 229960003668 docetaxel Drugs 0.000 claims description 14
- 239000002256 antimetabolite Substances 0.000 claims description 12
- 102000004169 proteins and genes Human genes 0.000 claims description 12
- 108090000623 proteins and genes Proteins 0.000 claims description 12
- 229940122803 Vinca alkaloid Drugs 0.000 claims description 11
- 239000002168 alkylating agent Substances 0.000 claims description 10
- 229940100198 alkylating agent Drugs 0.000 claims description 10
- 239000003817 anthracycline antibiotic agent Substances 0.000 claims description 10
- 229940079156 Proteasome inhibitor Drugs 0.000 claims description 9
- 239000003207 proteasome inhibitor Substances 0.000 claims description 9
- 229940121358 tyrosine kinase inhibitor Drugs 0.000 claims description 9
- 239000005483 tyrosine kinase inhibitor Substances 0.000 claims description 9
- 238000001990 intravenous administration Methods 0.000 claims description 8
- 230000000340 anti-metabolite Effects 0.000 claims description 7
- 229940100197 antimetabolite Drugs 0.000 claims description 7
- 239000003120 macrolide antibiotic agent Substances 0.000 claims description 7
- 239000003534 dna topoisomerase inhibitor Substances 0.000 claims description 6
- 229940044693 topoisomerase inhibitor Drugs 0.000 claims description 6
- 229940041033 macrolides Drugs 0.000 claims description 4
- 230000000694 effects Effects 0.000 abstract description 55
- 239000000126 substance Substances 0.000 abstract description 7
- 108010012934 Albumin-Bound Paclitaxel Proteins 0.000 description 239
- 229940028652 abraxane Drugs 0.000 description 233
- 229940123237 Taxane Drugs 0.000 description 189
- DKPFODGZWDEEBT-QFIAKTPHSA-N taxane Chemical class C([C@]1(C)CCC[C@@H](C)[C@H]1C1)C[C@H]2[C@H](C)CC[C@@H]1C2(C)C DKPFODGZWDEEBT-QFIAKTPHSA-N 0.000 description 171
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 106
- 201000010099 disease Diseases 0.000 description 104
- VSRXQHXAPYXROS-UHFFFAOYSA-N azanide;cyclobutane-1,1-dicarboxylic acid;platinum(2+) Chemical compound [NH2-].[NH2-].[Pt+2].OC(=O)C1(C(O)=O)CCC1 VSRXQHXAPYXROS-UHFFFAOYSA-N 0.000 description 99
- 229960004562 carboplatin Drugs 0.000 description 99
- 206010006187 Breast cancer Diseases 0.000 description 95
- 208000026310 Breast neoplasm Diseases 0.000 description 83
- 230000002062 proliferating effect Effects 0.000 description 78
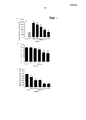
- 231100000682 maximum tolerated dose Toxicity 0.000 description 65
- 208000002154 non-small cell lung carcinoma Diseases 0.000 description 63
- RCINICONZNJXQF-XAZOAEDWSA-N taxol® Chemical compound O([C@@H]1[C@@]2(CC(C(C)=C(C2(C)C)[C@H](C([C@]2(C)[C@@H](O)C[C@H]3OC[C@]3(C21)OC(C)=O)=O)OC(=O)C)OC(=O)[C@H](O)[C@@H](NC(=O)C=1C=CC=CC=1)C=1C=CC=CC=1)O)C(=O)C1=CC=CC=C1 RCINICONZNJXQF-XAZOAEDWSA-N 0.000 description 63
- 208000029729 tumor suppressor gene on chromosome 11 Diseases 0.000 description 63
- 229940120638 avastin Drugs 0.000 description 48
- 229940022353 herceptin Drugs 0.000 description 46
- 241000699670 Mus sp. Species 0.000 description 45
- 210000004027 cell Anatomy 0.000 description 45
- 229940079593 drug Drugs 0.000 description 44
- 238000001356 surgical procedure Methods 0.000 description 44
- 206010055113 Breast cancer metastatic Diseases 0.000 description 41
- 238000002512 chemotherapy Methods 0.000 description 38
- 229960005277 gemcitabine Drugs 0.000 description 36
- SDUQYLNIPVEERB-QPPQHZFASA-N gemcitabine Chemical compound O=C1N=C(N)C=CN1[C@H]1C(F)(F)[C@H](O)[C@@H](CO)O1 SDUQYLNIPVEERB-QPPQHZFASA-N 0.000 description 36
- 230000005855 radiation Effects 0.000 description 34
- 239000002671 adjuvant Substances 0.000 description 33
- AOJJSUZBOXZQNB-TZSSRYMLSA-N Doxorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(=O)CO)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 AOJJSUZBOXZQNB-TZSSRYMLSA-N 0.000 description 29
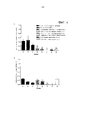
- 230000000259 anti-tumor effect Effects 0.000 description 27
- GAGWJHPBXLXJQN-UORFTKCHSA-N Capecitabine Chemical compound C1=C(F)C(NC(=O)OCCCCC)=NC(=O)N1[C@H]1[C@H](O)[C@H](O)[C@@H](C)O1 GAGWJHPBXLXJQN-UORFTKCHSA-N 0.000 description 26
- 239000004094 surface-active agent Substances 0.000 description 24
- 230000001965 increasing effect Effects 0.000 description 23
- 230000002829 reductive effect Effects 0.000 description 23
- 229940063683 taxotere Drugs 0.000 description 23
- XGALLCVXEZPNRQ-UHFFFAOYSA-N gefitinib Chemical compound C=12C=C(OCCCN3CCOCC3)C(OC)=CC2=NC=NC=1NC1=CC=C(F)C(Cl)=C1 XGALLCVXEZPNRQ-UHFFFAOYSA-N 0.000 description 22
- 230000001988 toxicity Effects 0.000 description 22
- 231100000419 toxicity Toxicity 0.000 description 22
- 108060006698 EGF receptor Proteins 0.000 description 21
- 102100030086 Receptor tyrosine-protein kinase erbB-2 Human genes 0.000 description 21
- 238000012360 testing method Methods 0.000 description 21
- 102000001301 EGF receptor Human genes 0.000 description 20
- 239000005411 L01XE02 - Gefitinib Substances 0.000 description 20
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 20
- 229960004316 cisplatin Drugs 0.000 description 20
- DQLATGHUWYMOKM-UHFFFAOYSA-L cisplatin Chemical compound N[Pt](N)(Cl)Cl DQLATGHUWYMOKM-UHFFFAOYSA-L 0.000 description 20
- 238000009472 formulation Methods 0.000 description 20
- 229960002584 gefitinib Drugs 0.000 description 20
- AOJJSUZBOXZQNB-VTZDEGQISA-N 4'-epidoxorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(=O)CO)[C@H]1C[C@H](N)[C@@H](O)[C@H](C)O1 AOJJSUZBOXZQNB-VTZDEGQISA-N 0.000 description 19
- HTIJFSOGRVMCQR-UHFFFAOYSA-N Epirubicin Natural products COc1cccc2C(=O)c3c(O)c4CC(O)(CC(OC5CC(N)C(=O)C(C)O5)c4c(O)c3C(=O)c12)C(=O)CO HTIJFSOGRVMCQR-UHFFFAOYSA-N 0.000 description 19
- GHASVSINZRGABV-UHFFFAOYSA-N Fluorouracil Chemical compound FC1=CNC(=O)NC1=O GHASVSINZRGABV-UHFFFAOYSA-N 0.000 description 19
- 101001012157 Homo sapiens Receptor tyrosine-protein kinase erbB-2 Proteins 0.000 description 19
- 229960001904 epirubicin Drugs 0.000 description 19
- 229960002949 fluorouracil Drugs 0.000 description 19
- 201000010536 head and neck cancer Diseases 0.000 description 19
- 208000014829 head and neck neoplasm Diseases 0.000 description 19
- 238000002560 therapeutic procedure Methods 0.000 description 19
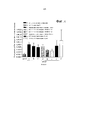
- 230000004614 tumor growth Effects 0.000 description 19
- BCFGMOOMADDAQU-UHFFFAOYSA-N lapatinib Chemical compound O1C(CNCCS(=O)(=O)C)=CC=C1C1=CC=C(N=CN=C2NC=3C=C(Cl)C(OCC=4C=C(F)C=CC=4)=CC=3)C2=C1 BCFGMOOMADDAQU-UHFFFAOYSA-N 0.000 description 18
- 206010058467 Lung neoplasm malignant Diseases 0.000 description 17
- 208000020816 lung neoplasm Diseases 0.000 description 17
- 210000001519 tissue Anatomy 0.000 description 17
- 201000005202 lung cancer Diseases 0.000 description 16
- CMSMOCZEIVJLDB-UHFFFAOYSA-N Cyclophosphamide Chemical compound ClCCN(CCCl)P1(=O)NCCCO1 CMSMOCZEIVJLDB-UHFFFAOYSA-N 0.000 description 15
- 108010017080 Granulocyte Colony-Stimulating Factor Proteins 0.000 description 15
- 102000004269 Granulocyte Colony-Stimulating Factor Human genes 0.000 description 15
- 239000002136 L01XE07 - Lapatinib Substances 0.000 description 14
- 238000004458 analytical method Methods 0.000 description 14
- 229960004397 cyclophosphamide Drugs 0.000 description 14
- 229960004891 lapatinib Drugs 0.000 description 14
- 229940086322 navelbine Drugs 0.000 description 14
- 229920000136 polysorbate Polymers 0.000 description 14
- 238000009097 single-agent therapy Methods 0.000 description 14
- CILBMBUYJCWATM-PYGJLNRPSA-N vinorelbine ditartrate Chemical compound OC(=O)[C@H](O)[C@@H](O)C(O)=O.OC(=O)[C@H](O)[C@@H](O)C(O)=O.C1N(CC=2C3=CC=CC=C3NC=22)CC(CC)=C[C@H]1C[C@]2(C(=O)OC)C1=CC([C@]23[C@H]([C@@]([C@H](OC(C)=O)[C@]4(CC)C=CCN([C@H]34)CC2)(O)C(=O)OC)N2C)=C2C=C1OC CILBMBUYJCWATM-PYGJLNRPSA-N 0.000 description 14
- 229940053867 xeloda Drugs 0.000 description 14
- 206010061902 Pancreatic neoplasm Diseases 0.000 description 13
- 230000012010 growth Effects 0.000 description 13
- 208000015486 malignant pancreatic neoplasm Diseases 0.000 description 13
- 208000008443 pancreatic carcinoma Diseases 0.000 description 13
- 208000033808 peripheral neuropathy Diseases 0.000 description 13
- 239000011780 sodium chloride Substances 0.000 description 13
- 239000000725 suspension Substances 0.000 description 13
- GAGWJHPBXLXJQN-UHFFFAOYSA-N Capecitabine Natural products C1=C(F)C(NC(=O)OCCCCC)=NC(=O)N1C1C(O)C(O)C(C)O1 GAGWJHPBXLXJQN-UHFFFAOYSA-N 0.000 description 12
- 206010027480 Metastatic malignant melanoma Diseases 0.000 description 12
- 230000001772 anti-angiogenic effect Effects 0.000 description 12
- 229960004117 capecitabine Drugs 0.000 description 12
- 210000002889 endothelial cell Anatomy 0.000 description 12
- 238000002347 injection Methods 0.000 description 12
- 229940090044 injection Drugs 0.000 description 12
- 239000007924 injection Substances 0.000 description 12
- 108010082117 matrigel Proteins 0.000 description 12
- 208000021039 metastatic melanoma Diseases 0.000 description 12
- 108090000765 processed proteins & peptides Proteins 0.000 description 12
- 230000035755 proliferation Effects 0.000 description 12
- 206010027476 Metastases Diseases 0.000 description 11
- 239000003086 colorant Substances 0.000 description 11
- 210000004088 microvessel Anatomy 0.000 description 11
- 229950001094 ortataxel Drugs 0.000 description 11
- BWKDAMBGCPRVPI-ZQRPHVBESA-N ortataxel Chemical compound O([C@@H]1[C@]23OC(=O)O[C@H]2[C@@H](C(=C([C@@H](OC(C)=O)C(=O)[C@]2(C)[C@@H](O)C[C@H]4OC[C@]4([C@H]21)OC(C)=O)C3(C)C)C)OC(=O)[C@H](O)[C@@H](NC(=O)OC(C)(C)C)CC(C)C)C(=O)C1=CC=CC=C1 BWKDAMBGCPRVPI-ZQRPHVBESA-N 0.000 description 11
- 235000018102 proteins Nutrition 0.000 description 11
- 102000005962 receptors Human genes 0.000 description 11
- 108020003175 receptors Proteins 0.000 description 11
- 230000009467 reduction Effects 0.000 description 11
- 239000002904 solvent Substances 0.000 description 11
- 210000004881 tumor cell Anatomy 0.000 description 11
- 239000003981 vehicle Substances 0.000 description 11
- 241001465754 Metazoa Species 0.000 description 10
- 206010060862 Prostate cancer Diseases 0.000 description 10
- 208000000236 Prostatic Neoplasms Diseases 0.000 description 10
- 206010041067 Small cell lung cancer Diseases 0.000 description 10
- 230000033115 angiogenesis Effects 0.000 description 10
- 230000015572 biosynthetic process Effects 0.000 description 10
- 238000001727 in vivo Methods 0.000 description 10
- 229960004768 irinotecan Drugs 0.000 description 10
- UWKQSNNFCGGAFS-XIFFEERXSA-N irinotecan Chemical compound C1=C2C(CC)=C3CN(C(C4=C([C@@](C(=O)OC4)(O)CC)C=4)=O)C=4C3=NC2=CC=C1OC(=O)N(CC1)CCC1N1CCCCC1 UWKQSNNFCGGAFS-XIFFEERXSA-N 0.000 description 10
- 201000001441 melanoma Diseases 0.000 description 10
- 238000009099 neoadjuvant therapy Methods 0.000 description 10
- 238000002360 preparation method Methods 0.000 description 10
- 230000004044 response Effects 0.000 description 10
- 229960002930 sirolimus Drugs 0.000 description 10
- 208000037844 advanced solid tumor Diseases 0.000 description 9
- 150000001413 amino acids Chemical class 0.000 description 9
- 210000002358 circulating endothelial cell Anatomy 0.000 description 9
- 150000001875 compounds Chemical class 0.000 description 9
- 230000001976 improved effect Effects 0.000 description 9
- 230000002401 inhibitory effect Effects 0.000 description 9
- 230000005764 inhibitory process Effects 0.000 description 9
- 210000004072 lung Anatomy 0.000 description 9
- 230000036457 multidrug resistance Effects 0.000 description 9
- 238000011227 neoadjuvant chemotherapy Methods 0.000 description 9
- 201000002528 pancreatic cancer Diseases 0.000 description 9
- QFJCIRLUMZQUOT-HPLJOQBZSA-N sirolimus Chemical compound C1C[C@@H](O)[C@H](OC)C[C@@H]1C[C@@H](C)[C@H]1OC(=O)[C@@H]2CCCCN2C(=O)C(=O)[C@](O)(O2)[C@H](C)CC[C@H]2C[C@H](OC)/C(C)=C/C=C/C=C/[C@@H](C)C[C@@H](C)C(=O)[C@H](OC)[C@H](O)/C(C)=C/[C@@H](C)C(=O)C1 QFJCIRLUMZQUOT-HPLJOQBZSA-N 0.000 description 9
- 239000000243 solution Substances 0.000 description 9
- 230000004083 survival effect Effects 0.000 description 9
- 238000011579 SCID mouse model Methods 0.000 description 8
- 238000000540 analysis of variance Methods 0.000 description 8
- 229960005395 cetuximab Drugs 0.000 description 8
- 230000000973 chemotherapeutic effect Effects 0.000 description 8
- 230000001472 cytotoxic effect Effects 0.000 description 8
- 230000007246 mechanism Effects 0.000 description 8
- CMEGANPVAXDBPL-INIZCTEOSA-N n-[(7s)-1,2,3-trimethoxy-10-methylsulfanyl-9-oxo-6,7-dihydro-5h-benzo[a]heptalen-7-yl]acetamide Chemical class C1([C@@H](NC(C)=O)CC2)=CC(=O)C(SC)=CC=C1C1=C2C=C(OC)C(OC)=C1OC CMEGANPVAXDBPL-INIZCTEOSA-N 0.000 description 8
- ZAHRKKWIAAJSAO-UHFFFAOYSA-N rapamycin Natural products COCC(O)C(=C/C(C)C(=O)CC(OC(=O)C1CCCCN1C(=O)C(=O)C2(O)OC(CC(OC)C(=CC=CC=CC(C)CC(C)C(=O)C)C)CCC2C)C(C)CC3CCC(O)C(C3)OC)C ZAHRKKWIAAJSAO-UHFFFAOYSA-N 0.000 description 8
- IAKHMKGGTNLKSZ-INIZCTEOSA-N (S)-colchicine Chemical compound C1([C@@H](NC(C)=O)CC2)=CC(=O)C(OC)=CC=C1C1=C2C=C(OC)C(OC)=C1OC IAKHMKGGTNLKSZ-INIZCTEOSA-N 0.000 description 7
- 241000282412 Homo Species 0.000 description 7
- 241000124008 Mammalia Species 0.000 description 7
- 229940009456 adriamycin Drugs 0.000 description 7
- 230000027455 binding Effects 0.000 description 7
- 210000004369 blood Anatomy 0.000 description 7
- 239000008280 blood Substances 0.000 description 7
- 238000006243 chemical reaction Methods 0.000 description 7
- 238000011284 combination treatment Methods 0.000 description 7
- 230000006378 damage Effects 0.000 description 7
- 239000012634 fragment Substances 0.000 description 7
- 230000002209 hydrophobic effect Effects 0.000 description 7
- 239000008194 pharmaceutical composition Substances 0.000 description 7
- 238000009101 premedication Methods 0.000 description 7
- 239000007787 solid Substances 0.000 description 7
- 230000008685 targeting Effects 0.000 description 7
- 102100033350 ATP-dependent translocase ABCB1 Human genes 0.000 description 6
- 206010020751 Hypersensitivity Diseases 0.000 description 6
- 239000005551 L01XE03 - Erlotinib Substances 0.000 description 6
- 241000700159 Rattus Species 0.000 description 6
- 229940110282 alimta Drugs 0.000 description 6
- 229940045799 anthracyclines and related substance Drugs 0.000 description 6
- 230000004663 cell proliferation Effects 0.000 description 6
- AAKJLRGGTJKAMG-UHFFFAOYSA-N erlotinib Chemical compound C=12C=C(OCCOC)C(OCCOC)=CC2=NC=NC=1NC1=CC=CC(C#C)=C1 AAKJLRGGTJKAMG-UHFFFAOYSA-N 0.000 description 6
- 238000002474 experimental method Methods 0.000 description 6
- 238000009093 first-line therapy Methods 0.000 description 6
- 230000003902 lesion Effects 0.000 description 6
- NYDXNILOWQXUOF-GXKRWWSZSA-L pemetrexed disodium Chemical compound [Na+].[Na+].C=1NC=2NC(N)=NC(=O)C=2C=1CCC1=CC=C(C(=O)N[C@@H](CCC([O-])=O)C([O-])=O)C=C1 NYDXNILOWQXUOF-GXKRWWSZSA-L 0.000 description 6
- 239000000546 pharmaceutical excipient Substances 0.000 description 6
- 238000011160 research Methods 0.000 description 6
- 229940120982 tarceva Drugs 0.000 description 6
- 231100000331 toxic Toxicity 0.000 description 6
- 230000002588 toxic effect Effects 0.000 description 6
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 6
- 230000004580 weight loss Effects 0.000 description 6
- 102100022749 Aminopeptidase N Human genes 0.000 description 5
- 206010059866 Drug resistance Diseases 0.000 description 5
- 101000773038 Human herpesvirus 7 (strain RK) U21 glycoprotein Proteins 0.000 description 5
- 241000699660 Mus musculus Species 0.000 description 5
- 229920002685 Polyoxyl 35CastorOil Polymers 0.000 description 5
- 102000004022 Protein-Tyrosine Kinases Human genes 0.000 description 5
- 108090000412 Protein-Tyrosine Kinases Proteins 0.000 description 5
- 239000004480 active ingredient Substances 0.000 description 5
- 238000009098 adjuvant therapy Methods 0.000 description 5
- 230000009286 beneficial effect Effects 0.000 description 5
- 230000037396 body weight Effects 0.000 description 5
- GXJABQQUPOEUTA-RDJZCZTQSA-N bortezomib Chemical compound C([C@@H](C(=O)N[C@@H](CC(C)C)B(O)O)NC(=O)C=1N=CC=NC=1)C1=CC=CC=C1 GXJABQQUPOEUTA-RDJZCZTQSA-N 0.000 description 5
- 229910002091 carbon monoxide Inorganic materials 0.000 description 5
- 238000009096 combination chemotherapy Methods 0.000 description 5
- 238000011161 development Methods 0.000 description 5
- 230000018109 developmental process Effects 0.000 description 5
- 229940115080 doxil Drugs 0.000 description 5
- 229960004679 doxorubicin Drugs 0.000 description 5
- 230000003511 endothelial effect Effects 0.000 description 5
- 229940082789 erbitux Drugs 0.000 description 5
- 239000003102 growth factor Substances 0.000 description 5
- 210000001630 jejunum Anatomy 0.000 description 5
- 230000003211 malignant effect Effects 0.000 description 5
- 230000009401 metastasis Effects 0.000 description 5
- 239000002777 nucleoside Substances 0.000 description 5
- 150000003833 nucleoside derivatives Chemical class 0.000 description 5
- 238000011580 nude mouse model Methods 0.000 description 5
- QUANRIQJNFHVEU-UHFFFAOYSA-N oxirane;propane-1,2,3-triol Chemical compound C1CO1.OCC(O)CO QUANRIQJNFHVEU-UHFFFAOYSA-N 0.000 description 5
- 230000001575 pathological effect Effects 0.000 description 5
- 102000004196 processed proteins & peptides Human genes 0.000 description 5
- 230000035939 shock Effects 0.000 description 5
- 238000010186 staining Methods 0.000 description 5
- AYUNIORJHRXIBJ-TXHRRWQRSA-N tanespimycin Chemical compound N1C(=O)\C(C)=C\C=C/[C@H](OC)[C@@H](OC(N)=O)\C(C)=C\[C@H](C)[C@@H](O)[C@@H](OC)C[C@H](C)CC2=C(NCC=C)C(=O)C=C1C2=O AYUNIORJHRXIBJ-TXHRRWQRSA-N 0.000 description 5
- 229960000303 topotecan Drugs 0.000 description 5
- UCFGDBYHRUNTLO-QHCPKHFHSA-N topotecan Chemical compound C1=C(O)C(CN(C)C)=C2C=C(CN3C4=CC5=C(C3=O)COC(=O)[C@]5(O)CC)C4=NC2=C1 UCFGDBYHRUNTLO-QHCPKHFHSA-N 0.000 description 5
- MLDQJTXFUGDVEO-UHFFFAOYSA-N BAY-43-9006 Chemical compound C1=NC(C(=O)NC)=CC(OC=2C=CC(NC(=O)NC=3C=C(C(Cl)=CC=3)C(F)(F)F)=CC=2)=C1 MLDQJTXFUGDVEO-UHFFFAOYSA-N 0.000 description 4
- 206010009944 Colon cancer Diseases 0.000 description 4
- UHDGCWIWMRVCDJ-CCXZUQQUSA-N Cytarabine Chemical compound O=C1N=C(N)C=CN1[C@H]1[C@@H](O)[C@H](O)[C@@H](CO)O1 UHDGCWIWMRVCDJ-CCXZUQQUSA-N 0.000 description 4
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 4
- 239000005511 L01XE05 - Sorafenib Substances 0.000 description 4
- 235000010643 Leucaena leucocephala Nutrition 0.000 description 4
- 240000007472 Leucaena leucocephala Species 0.000 description 4
- 230000009471 action Effects 0.000 description 4
- 239000000654 additive Substances 0.000 description 4
- 238000011226 adjuvant chemotherapy Methods 0.000 description 4
- 229940041181 antineoplastic drug Drugs 0.000 description 4
- 230000008901 benefit Effects 0.000 description 4
- 210000001772 blood platelet Anatomy 0.000 description 4
- 230000003034 chemosensitisation Effects 0.000 description 4
- 229960001338 colchicine Drugs 0.000 description 4
- 231100000433 cytotoxic Toxicity 0.000 description 4
- 230000001419 dependent effect Effects 0.000 description 4
- 231100000673 dose–response relationship Toxicity 0.000 description 4
- 230000009977 dual effect Effects 0.000 description 4
- 229940121647 egfr inhibitor Drugs 0.000 description 4
- VJJPUSNTGOMMGY-MRVIYFEKSA-N etoposide Chemical compound COC1=C(O)C(OC)=CC([C@@H]2C3=CC=4OCOC=4C=C3[C@@H](O[C@H]3[C@@H]([C@@H](O)[C@@H]4O[C@H](C)OC[C@H]4O3)O)[C@@H]3[C@@H]2C(OC3)=O)=C1 VJJPUSNTGOMMGY-MRVIYFEKSA-N 0.000 description 4
- 229960005420 etoposide Drugs 0.000 description 4
- 230000002349 favourable effect Effects 0.000 description 4
- 230000006872 improvement Effects 0.000 description 4
- 239000003112 inhibitor Substances 0.000 description 4
- 238000007912 intraperitoneal administration Methods 0.000 description 4
- 210000000265 leukocyte Anatomy 0.000 description 4
- 230000000670 limiting effect Effects 0.000 description 4
- 239000007788 liquid Substances 0.000 description 4
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Chemical compound [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 description 4
- 230000001394 metastastic effect Effects 0.000 description 4
- 208000037819 metastatic cancer Diseases 0.000 description 4
- 208000011575 metastatic malignant neoplasm Diseases 0.000 description 4
- 206010061289 metastatic neoplasm Diseases 0.000 description 4
- 230000004048 modification Effects 0.000 description 4
- 238000012986 modification Methods 0.000 description 4
- LBWFXVZLPYTWQI-IPOVEDGCSA-N n-[2-(diethylamino)ethyl]-5-[(z)-(5-fluoro-2-oxo-1h-indol-3-ylidene)methyl]-2,4-dimethyl-1h-pyrrole-3-carboxamide;(2s)-2-hydroxybutanedioic acid Chemical compound OC(=O)[C@@H](O)CC(O)=O.CCN(CC)CCNC(=O)C1=C(C)NC(\C=C/2C3=CC(F)=CC=C3NC\2=O)=C1C LBWFXVZLPYTWQI-IPOVEDGCSA-N 0.000 description 4
- 239000003960 organic solvent Substances 0.000 description 4
- 238000004806 packaging method and process Methods 0.000 description 4
- 210000005259 peripheral blood Anatomy 0.000 description 4
- 239000011886 peripheral blood Substances 0.000 description 4
- 239000002243 precursor Substances 0.000 description 4
- 238000002271 resection Methods 0.000 description 4
- 208000023504 respiratory system disease Diseases 0.000 description 4
- 208000000587 small cell lung carcinoma Diseases 0.000 description 4
- 229960003787 sorafenib Drugs 0.000 description 4
- 150000003431 steroids Chemical class 0.000 description 4
- 210000002784 stomach Anatomy 0.000 description 4
- 238000003860 storage Methods 0.000 description 4
- 231100001274 therapeutic index Toxicity 0.000 description 4
- WYWHKKSPHMUBEB-UHFFFAOYSA-N tioguanine Chemical compound N1C(N)=NC(=S)C2=C1N=CN2 WYWHKKSPHMUBEB-UHFFFAOYSA-N 0.000 description 4
- 238000011269 treatment regimen Methods 0.000 description 4
- VBEQCZHXXJYVRD-GACYYNSASA-N uroanthelone Chemical compound C([C@@H](C(=O)N[C@H](C(=O)N[C@@H](CS)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CS)C(=O)N[C@H](C(=O)N[C@@H]([C@@H](C)CC)C(=O)NCC(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)N[C@@H](CO)C(=O)NCC(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CS)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(O)=O)C(C)C)[C@@H](C)O)NC(=O)[C@H](CO)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CO)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@@H](NC(=O)[C@H](CC=1NC=NC=1)NC(=O)[C@H](CCSC)NC(=O)[C@H](CS)NC(=O)[C@@H](NC(=O)CNC(=O)CNC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CS)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)CNC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CO)NC(=O)[C@H](CO)NC(=O)[C@H]1N(CCC1)C(=O)[C@H](CS)NC(=O)CNC(=O)[C@H]1N(CCC1)C(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CO)NC(=O)[C@@H](N)CC(N)=O)C(C)C)[C@@H](C)CC)C1=CC=C(O)C=C1 VBEQCZHXXJYVRD-GACYYNSASA-N 0.000 description 4
- 229940099039 velcade Drugs 0.000 description 4
- GBABOYUKABKIAF-IELIFDKJSA-N vinorelbine Chemical compound C1N(CC=2C3=CC=CC=C3NC=22)CC(CC)=C[C@H]1C[C@]2(C(=O)OC)C1=CC([C@]23[C@H]([C@@]([C@H](OC(C)=O)[C@]4(CC)C=CCN([C@H]34)CC2)(O)C(=O)OC)N2C)=C2C=C1OC GBABOYUKABKIAF-IELIFDKJSA-N 0.000 description 4
- 229960002066 vinorelbine Drugs 0.000 description 4
- 230000003442 weekly effect Effects 0.000 description 4
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 3
- KLWPJMFMVPTNCC-UHFFFAOYSA-N Camptothecin Natural products CCC1(O)C(=O)OCC2=C1C=C3C4Nc5ccccc5C=C4CN3C2=O KLWPJMFMVPTNCC-UHFFFAOYSA-N 0.000 description 3
- 201000009030 Carcinoma Diseases 0.000 description 3
- DLGOEMSEDOSKAD-UHFFFAOYSA-N Carmustine Chemical compound ClCCNC(=O)N(N=O)CCCl DLGOEMSEDOSKAD-UHFFFAOYSA-N 0.000 description 3
- 206010052358 Colorectal cancer metastatic Diseases 0.000 description 3
- 108010092160 Dactinomycin Proteins 0.000 description 3
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 3
- 206010061818 Disease progression Diseases 0.000 description 3
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 3
- HKVAMNSJSFKALM-GKUWKFKPSA-N Everolimus Chemical compound C1C[C@@H](OCCO)[C@H](OC)C[C@@H]1C[C@@H](C)[C@H]1OC(=O)[C@@H]2CCCCN2C(=O)C(=O)[C@](O)(O2)[C@H](C)CC[C@H]2C[C@H](OC)/C(C)=C/C=C/C=C/[C@@H](C)C[C@@H](C)C(=O)[C@H](OC)[C@H](O)/C(C)=C/[C@@H](C)C(=O)C1 HKVAMNSJSFKALM-GKUWKFKPSA-N 0.000 description 3
- 206010016654 Fibrosis Diseases 0.000 description 3
- 108010010803 Gelatin Proteins 0.000 description 3
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 3
- 101000757160 Homo sapiens Aminopeptidase N Proteins 0.000 description 3
- FBOZXECLQNJBKD-ZDUSSCGKSA-N L-methotrexate Chemical compound C=1N=C2N=C(N)N=C(N)C2=NC=1CN(C)C1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 FBOZXECLQNJBKD-ZDUSSCGKSA-N 0.000 description 3
- 239000002147 L01XE04 - Sunitinib Substances 0.000 description 3
- 108010047230 Member 1 Subfamily B ATP Binding Cassette Transporter Proteins 0.000 description 3
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 3
- 108091000080 Phosphotransferase Proteins 0.000 description 3
- 102100024616 Platelet endothelial cell adhesion molecule Human genes 0.000 description 3
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 3
- 229930006000 Sucrose Natural products 0.000 description 3
- JXLYSJRDGCGARV-WWYNWVTFSA-N Vinblastine Natural products O=C(O[C@H]1[C@](O)(C(=O)OC)[C@@H]2N(C)c3c(cc(c(OC)c3)[C@]3(C(=O)OC)c4[nH]c5c(c4CCN4C[C@](O)(CC)C[C@H](C3)C4)cccc5)[C@@]32[C@H]2[C@@]1(CC)C=CCN2CC3)C JXLYSJRDGCGARV-WWYNWVTFSA-N 0.000 description 3
- 230000002411 adverse Effects 0.000 description 3
- 229940125715 antihistaminic agent Drugs 0.000 description 3
- 239000000739 antihistaminic agent Substances 0.000 description 3
- 239000012736 aqueous medium Substances 0.000 description 3
- 239000007900 aqueous suspension Substances 0.000 description 3
- 229940127093 camptothecin Drugs 0.000 description 3
- VSJKWCGYPAHWDS-FQEVSTJZSA-N camptothecin Chemical compound C1=CC=C2C=C(CN3C4=CC5=C(C3=O)COC(=O)[C@]5(O)CC)C4=NC2=C1 VSJKWCGYPAHWDS-FQEVSTJZSA-N 0.000 description 3
- WNRZHQBJSXRYJK-UHFFFAOYSA-N carboxyamidotriazole Chemical compound NC1=C(C(=O)N)N=NN1CC(C=C1Cl)=CC(Cl)=C1C(=O)C1=CC=C(Cl)C=C1 WNRZHQBJSXRYJK-UHFFFAOYSA-N 0.000 description 3
- 208000019065 cervical carcinoma Diseases 0.000 description 3
- 230000001186 cumulative effect Effects 0.000 description 3
- 208000035250 cutaneous malignant susceptibility to 1 melanoma Diseases 0.000 description 3
- 230000003013 cytotoxicity Effects 0.000 description 3
- 231100000135 cytotoxicity Toxicity 0.000 description 3
- 230000034994 death Effects 0.000 description 3
- 230000007423 decrease Effects 0.000 description 3
- 239000000539 dimer Substances 0.000 description 3
- 230000005750 disease progression Effects 0.000 description 3
- VSJKWCGYPAHWDS-UHFFFAOYSA-N dl-camptothecin Natural products C1=CC=C2C=C(CN3C4=CC5=C(C3=O)COC(=O)C5(O)CC)C4=NC2=C1 VSJKWCGYPAHWDS-UHFFFAOYSA-N 0.000 description 3
- 231100000371 dose-limiting toxicity Toxicity 0.000 description 3
- 239000003937 drug carrier Substances 0.000 description 3
- 238000005516 engineering process Methods 0.000 description 3
- 210000003743 erythrocyte Anatomy 0.000 description 3
- 229960005167 everolimus Drugs 0.000 description 3
- 230000004761 fibrosis Effects 0.000 description 3
- 239000000796 flavoring agent Substances 0.000 description 3
- 235000013355 food flavoring agent Nutrition 0.000 description 3
- 239000000499 gel Substances 0.000 description 3
- 239000008273 gelatin Substances 0.000 description 3
- 229920000159 gelatin Polymers 0.000 description 3
- 235000019322 gelatine Nutrition 0.000 description 3
- 235000011852 gelatine desserts Nutrition 0.000 description 3
- 229940045276 gemcitabine 1000 mg Drugs 0.000 description 3
- 239000001963 growth medium Substances 0.000 description 3
- 210000003958 hematopoietic stem cell Anatomy 0.000 description 3
- BWKDAMBGCPRVPI-FMWKWGOESA-N idn 5109 Chemical compound O([C@@H]1[C@]23OC(=O)O[C@H]2[C@@H](C(=C([C@@H](OC(C)=O)C(=O)[C@]2(C)[C@@H](O)C[C@H]4OC[C@]4(C21)OC(C)=O)C3(C)C)C)OC(=O)[C@H](O)[C@@H](NC(=O)OC(C)(C)C)CC(C)C)C(=O)C1=CC=CC=C1 BWKDAMBGCPRVPI-FMWKWGOESA-N 0.000 description 3
- 238000000338 in vitro Methods 0.000 description 3
- 230000006698 induction Effects 0.000 description 3
- 238000002721 intensity-modulated radiation therapy Methods 0.000 description 3
- 230000002601 intratumoral effect Effects 0.000 description 3
- 238000010253 intravenous injection Methods 0.000 description 3
- 239000003446 ligand Substances 0.000 description 3
- 210000004185 liver Anatomy 0.000 description 3
- 238000004519 manufacturing process Methods 0.000 description 3
- 230000010534 mechanism of action Effects 0.000 description 3
- 230000001404 mediated effect Effects 0.000 description 3
- 229960000485 methotrexate Drugs 0.000 description 3
- 239000013642 negative control Substances 0.000 description 3
- 229940071846 neulasta Drugs 0.000 description 3
- 201000001119 neuropathy Diseases 0.000 description 3
- 230000007823 neuropathy Effects 0.000 description 3
- 208000004235 neutropenia Diseases 0.000 description 3
- 229940127073 nucleoside analogue Drugs 0.000 description 3
- 210000000056 organ Anatomy 0.000 description 3
- 239000002245 particle Substances 0.000 description 3
- 108010044644 pegfilgrastim Proteins 0.000 description 3
- 150000003904 phospholipids Chemical class 0.000 description 3
- 102000020233 phosphotransferase Human genes 0.000 description 3
- 230000003389 potentiating effect Effects 0.000 description 3
- 239000003755 preservative agent Substances 0.000 description 3
- 230000000861 pro-apoptotic effect Effects 0.000 description 3
- 230000002035 prolonged effect Effects 0.000 description 3
- 230000000306 recurrent effect Effects 0.000 description 3
- 230000006335 response to radiation Effects 0.000 description 3
- 239000005720 sucrose Substances 0.000 description 3
- 229940034785 sutent Drugs 0.000 description 3
- 208000024891 symptom Diseases 0.000 description 3
- 230000002195 synergetic effect Effects 0.000 description 3
- 229960000575 trastuzumab Drugs 0.000 description 3
- 150000004917 tyrosine kinase inhibitor derivatives Chemical class 0.000 description 3
- 229960003048 vinblastine Drugs 0.000 description 3
- JXLYSJRDGCGARV-XQKSVPLYSA-N vincaleukoblastine Chemical compound C([C@@H](C[C@]1(C(=O)OC)C=2C(=CC3=C([C@]45[C@H]([C@@]([C@H](OC(C)=O)[C@]6(CC)C=CCN([C@H]56)CC4)(O)C(=O)OC)N3C)C=2)OC)C[C@@](C2)(O)CC)N2CCC2=C1NC1=CC=CC=C21 JXLYSJRDGCGARV-XQKSVPLYSA-N 0.000 description 3
- 229960004528 vincristine Drugs 0.000 description 3
- OGWKCGZFUXNPDA-XQKSVPLYSA-N vincristine Chemical compound C([N@]1C[C@@H](C[C@]2(C(=O)OC)C=3C(=CC4=C([C@]56[C@H]([C@@]([C@H](OC(C)=O)[C@]7(CC)C=CCN([C@H]67)CC5)(O)C(=O)OC)N4C=O)C=3)OC)C[C@@](C1)(O)CC)CC1=C2NC2=CC=CC=C12 OGWKCGZFUXNPDA-XQKSVPLYSA-N 0.000 description 3
- OGWKCGZFUXNPDA-UHFFFAOYSA-N vincristine Natural products C1C(CC)(O)CC(CC2(C(=O)OC)C=3C(=CC4=C(C56C(C(C(OC(C)=O)C7(CC)C=CCN(C67)CC5)(O)C(=O)OC)N4C=O)C=3)OC)CN1CCC1=C2NC2=CC=CC=C12 OGWKCGZFUXNPDA-UHFFFAOYSA-N 0.000 description 3
- RUDATBOHQWOJDD-UHFFFAOYSA-N (3beta,5beta,7alpha)-3,7-Dihydroxycholan-24-oic acid Natural products OC1CC2CC(O)CCC2(C)C2C1C1CCC(C(CCC(O)=O)C)C1(C)CC2 RUDATBOHQWOJDD-UHFFFAOYSA-N 0.000 description 2
- FDKXTQMXEQVLRF-ZHACJKMWSA-N (E)-dacarbazine Chemical compound CN(C)\N=N\c1[nH]cnc1C(N)=O FDKXTQMXEQVLRF-ZHACJKMWSA-N 0.000 description 2
- SNKAWJBJQDLSFF-NVKMUCNASA-N 1,2-dioleoyl-sn-glycero-3-phosphocholine Chemical compound CCCCCCCC\C=C/CCCCCCCC(=O)OC[C@H](COP([O-])(=O)OCC[N+](C)(C)C)OC(=O)CCCCCCC\C=C/CCCCCCCC SNKAWJBJQDLSFF-NVKMUCNASA-N 0.000 description 2
- VSNHCAURESNICA-NJFSPNSNSA-N 1-oxidanylurea Chemical compound N[14C](=O)NO VSNHCAURESNICA-NJFSPNSNSA-N 0.000 description 2
- QZDDFQLIQRYMBV-UHFFFAOYSA-N 2-[3-nitro-2-(2-nitrophenyl)-4-oxochromen-8-yl]acetic acid Chemical compound OC(=O)CC1=CC=CC(C(C=2[N+]([O-])=O)=O)=C1OC=2C1=CC=CC=C1[N+]([O-])=O QZDDFQLIQRYMBV-UHFFFAOYSA-N 0.000 description 2
- YXHLJMWYDTXDHS-IRFLANFNSA-N 7-aminoactinomycin D Chemical compound C[C@H]1OC(=O)[C@H](C(C)C)N(C)C(=O)CN(C)C(=O)[C@@H]2CCCN2C(=O)[C@@H](C(C)C)NC(=O)[C@H]1NC(=O)C1=C(N)C(=O)C(C)=C2OC(C(C)=C(N)C=C3C(=O)N[C@@H]4C(=O)N[C@@H](C(N5CCC[C@H]5C(=O)N(C)CC(=O)N(C)[C@@H](C(C)C)C(=O)O[C@@H]4C)=O)C(C)C)=C3N=C21 YXHLJMWYDTXDHS-IRFLANFNSA-N 0.000 description 2
- 108700012813 7-aminoactinomycin D Proteins 0.000 description 2
- 238000000737 ABX test Methods 0.000 description 2
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 2
- 241000416162 Astragalus gummifer Species 0.000 description 2
- 201000001320 Atherosclerosis Diseases 0.000 description 2
- 206010005003 Bladder cancer Diseases 0.000 description 2
- 102000004506 Blood Proteins Human genes 0.000 description 2
- 108010017384 Blood Proteins Proteins 0.000 description 2
- 206010065553 Bone marrow failure Diseases 0.000 description 2
- 108010049990 CD13 Antigens Proteins 0.000 description 2
- 206010008342 Cervix carcinoma Diseases 0.000 description 2
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 description 2
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 2
- 108020004414 DNA Proteins 0.000 description 2
- 102000003915 DNA Topoisomerases Human genes 0.000 description 2
- 108090000323 DNA Topoisomerases Proteins 0.000 description 2
- 229940123780 DNA topoisomerase I inhibitor Drugs 0.000 description 2
- 229940124087 DNA topoisomerase II inhibitor Drugs 0.000 description 2
- 101150029707 ERBB2 gene Proteins 0.000 description 2
- 102400001368 Epidermal growth factor Human genes 0.000 description 2
- 101800003838 Epidermal growth factor Proteins 0.000 description 2
- ULGZDMOVFRHVEP-RWJQBGPGSA-N Erythromycin Chemical compound O([C@@H]1[C@@H](C)C(=O)O[C@@H]([C@@]([C@H](O)[C@@H](C)C(=O)[C@H](C)C[C@@](C)(O)[C@H](O[C@H]2[C@@H]([C@H](C[C@@H](C)O2)N(C)C)O)[C@H]1C)(C)O)CC)[C@H]1C[C@@](C)(OC)[C@@H](O)[C@H](C)O1 ULGZDMOVFRHVEP-RWJQBGPGSA-N 0.000 description 2
- 108090000379 Fibroblast growth factor 2 Proteins 0.000 description 2
- JRZJKWGQFNTSRN-UHFFFAOYSA-N Geldanamycin Natural products C1C(C)CC(OC)C(O)C(C)C=C(C)C(OC(N)=O)C(OC)CCC=C(C)C(=O)NC2=CC(=O)C(OC)=C1C2=O JRZJKWGQFNTSRN-UHFFFAOYSA-N 0.000 description 2
- 206010018338 Glioma Diseases 0.000 description 2
- 102000003886 Glycoproteins Human genes 0.000 description 2
- 108090000288 Glycoproteins Proteins 0.000 description 2
- 206010053759 Growth retardation Diseases 0.000 description 2
- 208000017891 HER2 positive breast carcinoma Diseases 0.000 description 2
- WZUVPPKBWHMQCE-UHFFFAOYSA-N Haematoxylin Chemical compound C12=CC(O)=C(O)C=C2CC2(O)C1C1=CC=C(O)C(O)=C1OC2 WZUVPPKBWHMQCE-UHFFFAOYSA-N 0.000 description 2
- 101000738771 Homo sapiens Receptor-type tyrosine-protein phosphatase C Proteins 0.000 description 2
- VSNHCAURESNICA-UHFFFAOYSA-N Hydroxyurea Chemical compound NC(=O)NO VSNHCAURESNICA-UHFFFAOYSA-N 0.000 description 2
- 208000005726 Inflammatory Breast Neoplasms Diseases 0.000 description 2
- 206010021980 Inflammatory carcinoma of the breast Diseases 0.000 description 2
- 102000014150 Interferons Human genes 0.000 description 2
- 108010050904 Interferons Proteins 0.000 description 2
- XEEYBQQBJWHFJM-UHFFFAOYSA-N Iron Chemical compound [Fe] XEEYBQQBJWHFJM-UHFFFAOYSA-N 0.000 description 2
- 239000005517 L01XE01 - Imatinib Substances 0.000 description 2
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 2
- 229930195725 Mannitol Natural products 0.000 description 2
- 229920000168 Microcrystalline cellulose Polymers 0.000 description 2
- 102000029749 Microtubule Human genes 0.000 description 2
- 108091022875 Microtubule Proteins 0.000 description 2
- 206010029888 Obliterative bronchiolitis Diseases 0.000 description 2
- 206010033799 Paralysis Diseases 0.000 description 2
- 206010034133 Pathogen resistance Diseases 0.000 description 2
- 208000031481 Pathologic Constriction Diseases 0.000 description 2
- 206010034620 Peripheral sensory neuropathy Diseases 0.000 description 2
- 102000001253 Protein Kinase Human genes 0.000 description 2
- 201000004681 Psoriasis Diseases 0.000 description 2
- 101710100968 Receptor tyrosine-protein kinase erbB-2 Proteins 0.000 description 2
- 102100037422 Receptor-type tyrosine-protein phosphatase C Human genes 0.000 description 2
- 206010039897 Sedation Diseases 0.000 description 2
- 208000005718 Stomach Neoplasms Diseases 0.000 description 2
- NKANXQFJJICGDU-QPLCGJKRSA-N Tamoxifen Chemical compound C=1C=CC=CC=1C(/CC)=C(C=1C=CC(OCCN(C)C)=CC=1)/C1=CC=CC=C1 NKANXQFJJICGDU-QPLCGJKRSA-N 0.000 description 2
- 239000000365 Topoisomerase I Inhibitor Substances 0.000 description 2
- 239000000317 Topoisomerase II Inhibitor Substances 0.000 description 2
- 229920001615 Tragacanth Polymers 0.000 description 2
- 108090000704 Tubulin Proteins 0.000 description 2
- 102000004243 Tubulin Human genes 0.000 description 2
- 208000006105 Uterine Cervical Neoplasms Diseases 0.000 description 2
- 206010047700 Vomiting Diseases 0.000 description 2
- 230000002159 abnormal effect Effects 0.000 description 2
- 239000002253 acid Substances 0.000 description 2
- 229930183665 actinomycin Natural products 0.000 description 2
- RJURFGZVJUQBHK-UHFFFAOYSA-N actinomycin D Natural products CC1OC(=O)C(C(C)C)N(C)C(=O)CN(C)C(=O)C2CCCN2C(=O)C(C(C)C)NC(=O)C1NC(=O)C1=C(N)C(=O)C(C)=C2OC(C(C)=CC=C3C(=O)NC4C(=O)NC(C(N5CCCC5C(=O)N(C)CC(=O)N(C)C(C(C)C)C(=O)OC4C)=O)C(C)C)=C3N=C21 RJURFGZVJUQBHK-UHFFFAOYSA-N 0.000 description 2
- 229930013930 alkaloid Natural products 0.000 description 2
- 150000003797 alkaloid derivatives Chemical class 0.000 description 2
- 208000026935 allergic disease Diseases 0.000 description 2
- 208000007502 anemia Diseases 0.000 description 2
- 229940121369 angiogenesis inhibitor Drugs 0.000 description 2
- 239000005557 antagonist Substances 0.000 description 2
- 239000003242 anti bacterial agent Substances 0.000 description 2
- 230000000840 anti-viral effect Effects 0.000 description 2
- 238000013459 approach Methods 0.000 description 2
- 229960000397 bevacizumab Drugs 0.000 description 2
- 239000000090 biomarker Substances 0.000 description 2
- 238000004820 blood count Methods 0.000 description 2
- 210000004204 blood vessel Anatomy 0.000 description 2
- 210000001185 bone marrow Anatomy 0.000 description 2
- 201000008275 breast carcinoma Diseases 0.000 description 2
- 201000003848 bronchiolitis obliterans Diseases 0.000 description 2
- 208000023367 bronchiolitis obliterans with obstructive pulmonary disease Diseases 0.000 description 2
- 239000000872 buffer Substances 0.000 description 2
- 238000004364 calculation method Methods 0.000 description 2
- 230000010261 cell growth Effects 0.000 description 2
- 201000010881 cervical cancer Diseases 0.000 description 2
- 229940044683 chemotherapy drug Drugs 0.000 description 2
- 238000009104 chemotherapy regimen Methods 0.000 description 2
- 210000001072 colon Anatomy 0.000 description 2
- 239000003246 corticosteroid Substances 0.000 description 2
- 229960001334 corticosteroids Drugs 0.000 description 2
- 239000002254 cytotoxic agent Substances 0.000 description 2
- 231100000599 cytotoxic agent Toxicity 0.000 description 2
- 239000008121 dextrose Substances 0.000 description 2
- 239000003085 diluting agent Substances 0.000 description 2
- 208000035475 disorder Diseases 0.000 description 2
- 239000003995 emulsifying agent Substances 0.000 description 2
- 239000000839 emulsion Substances 0.000 description 2
- 230000002708 enhancing effect Effects 0.000 description 2
- 229940116977 epidermal growth factor Drugs 0.000 description 2
- 150000002148 esters Chemical class 0.000 description 2
- 210000003414 extremity Anatomy 0.000 description 2
- 239000012894 fetal calf serum Substances 0.000 description 2
- 238000000684 flow cytometry Methods 0.000 description 2
- 206010017758 gastric cancer Diseases 0.000 description 2
- QTQAWLPCGQOSGP-GBTDJJJQSA-N geldanamycin Chemical compound N1C(=O)\C(C)=C/C=C\[C@@H](OC)[C@H](OC(N)=O)\C(C)=C/[C@@H](C)[C@@H](O)[C@H](OC)C[C@@H](C)CC2=C(OC)C(=O)C=C1C2=O QTQAWLPCGQOSGP-GBTDJJJQSA-N 0.000 description 2
- 229940045280 gemcitabine 2000 mg Drugs 0.000 description 2
- 235000011187 glycerol Nutrition 0.000 description 2
- 239000008187 granular material Substances 0.000 description 2
- 210000003714 granulocyte Anatomy 0.000 description 2
- 231100000001 growth retardation Toxicity 0.000 description 2
- 230000003394 haemopoietic effect Effects 0.000 description 2
- 238000010562 histological examination Methods 0.000 description 2
- 238000000265 homogenisation Methods 0.000 description 2
- 229960001330 hydroxycarbamide Drugs 0.000 description 2
- 230000009610 hypersensitivity Effects 0.000 description 2
- KTUFNOKKBVMGRW-UHFFFAOYSA-N imatinib Chemical compound C1CN(C)CCN1CC1=CC=C(C(=O)NC=2C=C(NC=3N=C(C=CN=3)C=3C=NC=CC=3)C(C)=CC=2)C=C1 KTUFNOKKBVMGRW-UHFFFAOYSA-N 0.000 description 2
- 208000015181 infectious disease Diseases 0.000 description 2
- 201000004653 inflammatory breast carcinoma Diseases 0.000 description 2
- 238000001802 infusion Methods 0.000 description 2
- 238000001361 intraarterial administration Methods 0.000 description 2
- 238000007918 intramuscular administration Methods 0.000 description 2
- 229940084651 iressa Drugs 0.000 description 2
- 239000008101 lactose Substances 0.000 description 2
- 210000003141 lower extremity Anatomy 0.000 description 2
- 210000004698 lymphocyte Anatomy 0.000 description 2
- 235000019359 magnesium stearate Nutrition 0.000 description 2
- 210000005075 mammary gland Anatomy 0.000 description 2
- 239000000594 mannitol Substances 0.000 description 2
- 235000010355 mannitol Nutrition 0.000 description 2
- 238000005259 measurement Methods 0.000 description 2
- HAWPXGHAZFHHAD-UHFFFAOYSA-N mechlorethamine Chemical compound ClCCN(C)CCCl HAWPXGHAZFHHAD-UHFFFAOYSA-N 0.000 description 2
- 210000004379 membrane Anatomy 0.000 description 2
- 239000012528 membrane Substances 0.000 description 2
- 235000019813 microcrystalline cellulose Nutrition 0.000 description 2
- 239000008108 microcrystalline cellulose Substances 0.000 description 2
- 229940016286 microcrystalline cellulose Drugs 0.000 description 2
- 210000004688 microtubule Anatomy 0.000 description 2
- 210000004925 microvascular endothelial cell Anatomy 0.000 description 2
- 210000001700 mitochondrial membrane Anatomy 0.000 description 2
- 230000000394 mitotic effect Effects 0.000 description 2
- KKZJGLLVHKMTCM-UHFFFAOYSA-N mitoxantrone Chemical compound O=C1C2=C(O)C=CC(O)=C2C(=O)C2=C1C(NCCNCCO)=CC=C2NCCNCCO KKZJGLLVHKMTCM-UHFFFAOYSA-N 0.000 description 2
- 229960001156 mitoxantrone Drugs 0.000 description 2
- 230000000771 oncological effect Effects 0.000 description 2
- 230000003287 optical effect Effects 0.000 description 2
- 230000002085 persistent effect Effects 0.000 description 2
- 230000026731 phosphorylation Effects 0.000 description 2
- 238000006366 phosphorylation reaction Methods 0.000 description 2
- 229920000642 polymer Polymers 0.000 description 2
- 229920001184 polypeptide Polymers 0.000 description 2
- 239000000843 powder Substances 0.000 description 2
- 238000001556 precipitation Methods 0.000 description 2
- 230000000069 prophylactic effect Effects 0.000 description 2
- 108060006633 protein kinase Proteins 0.000 description 2
- 230000002285 radioactive effect Effects 0.000 description 2
- 238000011127 radiochemotherapy Methods 0.000 description 2
- 230000003439 radiotherapeutic effect Effects 0.000 description 2
- 208000037803 restenosis Diseases 0.000 description 2
- 230000002441 reversible effect Effects 0.000 description 2
- 229960004641 rituximab Drugs 0.000 description 2
- 229960005399 satraplatin Drugs 0.000 description 2
- 190014017285 satraplatin Chemical compound 0.000 description 2
- 230000036280 sedation Effects 0.000 description 2
- 201000005572 sensory peripheral neuropathy Diseases 0.000 description 2
- 238000000926 separation method Methods 0.000 description 2
- 239000003381 stabilizer Substances 0.000 description 2
- 210000000130 stem cell Anatomy 0.000 description 2
- 230000036262 stenosis Effects 0.000 description 2
- 208000037804 stenosis Diseases 0.000 description 2
- 201000011549 stomach cancer Diseases 0.000 description 2
- 238000007920 subcutaneous administration Methods 0.000 description 2
- 230000001629 suppression Effects 0.000 description 2
- 239000000375 suspending agent Substances 0.000 description 2
- 238000013268 sustained release Methods 0.000 description 2
- 239000012730 sustained-release form Substances 0.000 description 2
- 239000003826 tablet Substances 0.000 description 2
- 239000000454 talc Substances 0.000 description 2
- 229910052623 talc Inorganic materials 0.000 description 2
- 235000012222 talc Nutrition 0.000 description 2
- 229960003087 tioguanine Drugs 0.000 description 2
- 229960005267 tositumomab Drugs 0.000 description 2
- 235000010487 tragacanth Nutrition 0.000 description 2
- 239000000196 tragacanth Substances 0.000 description 2
- 229940116362 tragacanth Drugs 0.000 description 2
- 210000003606 umbilical vein Anatomy 0.000 description 2
- 230000008673 vomiting Effects 0.000 description 2
- 239000000080 wetting agent Substances 0.000 description 2
- AADVCYNFEREWOS-UHFFFAOYSA-N (+)-DDM Natural products C=CC=CC(C)C(OC(N)=O)C(C)C(O)C(C)CC(C)=CC(C)C(O)C(C)C=CC(O)CC1OC(=O)C(C)C(O)C1C AADVCYNFEREWOS-UHFFFAOYSA-N 0.000 description 1
- LNAZSHAWQACDHT-XIYTZBAFSA-N (2r,3r,4s,5r,6s)-4,5-dimethoxy-2-(methoxymethyl)-3-[(2s,3r,4s,5r,6r)-3,4,5-trimethoxy-6-(methoxymethyl)oxan-2-yl]oxy-6-[(2r,3r,4s,5r,6r)-4,5,6-trimethoxy-2-(methoxymethyl)oxan-3-yl]oxyoxane Chemical compound CO[C@@H]1[C@@H](OC)[C@H](OC)[C@@H](COC)O[C@H]1O[C@H]1[C@H](OC)[C@@H](OC)[C@H](O[C@H]2[C@@H]([C@@H](OC)[C@H](OC)O[C@@H]2COC)OC)O[C@@H]1COC LNAZSHAWQACDHT-XIYTZBAFSA-N 0.000 description 1
- BHQCQFFYRZLCQQ-UHFFFAOYSA-N (3alpha,5alpha,7alpha,12alpha)-3,7,12-trihydroxy-cholan-24-oic acid Natural products OC1CC2CC(O)CCC2(C)C2C1C1CCC(C(CCC(O)=O)C)C1(C)C(O)C2 BHQCQFFYRZLCQQ-UHFFFAOYSA-N 0.000 description 1
- VRYALKFFQXWPIH-PBXRRBTRSA-N (3r,4s,5r)-3,4,5,6-tetrahydroxyhexanal Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)CC=O VRYALKFFQXWPIH-PBXRRBTRSA-N 0.000 description 1
- MWWSFMDVAYGXBV-MYPASOLCSA-N (7r,9s)-7-[(2r,4s,5s,6s)-4-amino-5-hydroxy-6-methyloxan-2-yl]oxy-6,9,11-trihydroxy-9-(2-hydroxyacetyl)-4-methoxy-8,10-dihydro-7h-tetracene-5,12-dione;hydrochloride Chemical compound Cl.O([C@@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(=O)CO)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 MWWSFMDVAYGXBV-MYPASOLCSA-N 0.000 description 1
- VMSLCPKYRPDHLN-UHFFFAOYSA-N (R)-Humulone Chemical compound CC(C)CC(=O)C1=C(O)C(CC=C(C)C)=C(O)C(O)(CC=C(C)C)C1=O VMSLCPKYRPDHLN-UHFFFAOYSA-N 0.000 description 1
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 1
- 102100025573 1-alkyl-2-acetylglycerophosphocholine esterase Human genes 0.000 description 1
- IIZPXYDJLKNOIY-JXPKJXOSSA-N 1-palmitoyl-2-arachidonoyl-sn-glycero-3-phosphocholine Chemical compound CCCCCCCCCCCCCCCC(=O)OC[C@H](COP([O-])(=O)OCC[N+](C)(C)C)OC(=O)CCC\C=C/C\C=C/C\C=C/C\C=C/CCCCC IIZPXYDJLKNOIY-JXPKJXOSSA-N 0.000 description 1
- PNDPGZBMCMUPRI-HVTJNCQCSA-N 10043-66-0 Chemical compound [131I][131I] PNDPGZBMCMUPRI-HVTJNCQCSA-N 0.000 description 1
- RTQWWZBSTRGEAV-PKHIMPSTSA-N 2-[[(2s)-2-[bis(carboxymethyl)amino]-3-[4-(methylcarbamoylamino)phenyl]propyl]-[2-[bis(carboxymethyl)amino]propyl]amino]acetic acid Chemical compound CNC(=O)NC1=CC=C(C[C@@H](CN(CC(C)N(CC(O)=O)CC(O)=O)CC(O)=O)N(CC(O)=O)CC(O)=O)C=C1 RTQWWZBSTRGEAV-PKHIMPSTSA-N 0.000 description 1
- NDMPLJNOPCLANR-UHFFFAOYSA-N 3,4-dihydroxy-15-(4-hydroxy-18-methoxycarbonyl-5,18-seco-ibogamin-18-yl)-16-methoxy-1-methyl-6,7-didehydro-aspidospermidine-3-carboxylic acid methyl ester Natural products C1C(CC)(O)CC(CC2(C(=O)OC)C=3C(=CC4=C(C56C(C(C(O)C7(CC)C=CCN(C67)CC5)(O)C(=O)OC)N4C)C=3)OC)CN1CCC1=C2NC2=CC=CC=C12 NDMPLJNOPCLANR-UHFFFAOYSA-N 0.000 description 1
- BGWLYQZDNFIFRX-UHFFFAOYSA-N 5-[3-[2-[3-(3,8-diamino-6-phenylphenanthridin-5-ium-5-yl)propylamino]ethylamino]propyl]-6-phenylphenanthridin-5-ium-3,8-diamine;dichloride Chemical compound [Cl-].[Cl-].C=1C(N)=CC=C(C2=CC=C(N)C=C2[N+]=2CCCNCCNCCC[N+]=3C4=CC(N)=CC=C4C4=CC=C(N)C=C4C=3C=3C=CC=CC=3)C=1C=2C1=CC=CC=C1 BGWLYQZDNFIFRX-UHFFFAOYSA-N 0.000 description 1
- NMUSYJAQQFHJEW-KVTDHHQDSA-N 5-azacytidine Chemical compound O=C1N=C(N)N=CN1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 NMUSYJAQQFHJEW-KVTDHHQDSA-N 0.000 description 1
- HBAQYPYDRFILMT-UHFFFAOYSA-N 8-[3-(1-cyclopropylpyrazol-4-yl)-1H-pyrazolo[4,3-d]pyrimidin-5-yl]-3-methyl-3,8-diazabicyclo[3.2.1]octan-2-one Chemical class C1(CC1)N1N=CC(=C1)C1=NNC2=C1N=C(N=C2)N1C2C(N(CC1CC2)C)=O HBAQYPYDRFILMT-UHFFFAOYSA-N 0.000 description 1
- 201000004384 Alopecia Diseases 0.000 description 1
- APKFDSVGJQXUKY-KKGHZKTASA-N Amphotericin-B Natural products O[C@H]1[C@@H](N)[C@H](O)[C@@H](C)O[C@H]1O[C@H]1C=CC=CC=CC=CC=CC=CC=C[C@H](C)[C@@H](O)[C@@H](C)[C@H](C)OC(=O)C[C@H](O)C[C@H](O)CC[C@@H](O)[C@H](O)C[C@H](O)C[C@](O)(C[C@H](O)[C@H]2C(O)=O)O[C@H]2C1 APKFDSVGJQXUKY-KKGHZKTASA-N 0.000 description 1
- 206010002198 Anaphylactic reaction Diseases 0.000 description 1
- 101710095342 Apolipoprotein B Proteins 0.000 description 1
- 102100040202 Apolipoprotein B-100 Human genes 0.000 description 1
- 101100067974 Arabidopsis thaliana POP2 gene Proteins 0.000 description 1
- 208000006820 Arthralgia Diseases 0.000 description 1
- 108010024976 Asparaginase Proteins 0.000 description 1
- 102000052609 BRCA2 Human genes 0.000 description 1
- 108700020462 BRCA2 Proteins 0.000 description 1
- 108010006654 Bleomycin Proteins 0.000 description 1
- 229920002799 BoPET Polymers 0.000 description 1
- 241000283690 Bos taurus Species 0.000 description 1
- COVZYZSDYWQREU-UHFFFAOYSA-N Busulfan Chemical compound CS(=O)(=O)OCCCCOS(C)(=O)=O COVZYZSDYWQREU-UHFFFAOYSA-N 0.000 description 1
- 238000011735 C3H mouse Methods 0.000 description 1
- FVLVBPDQNARYJU-XAHDHGMMSA-N C[C@H]1CCC(CC1)NC(=O)N(CCCl)N=O Chemical compound C[C@H]1CCC(CC1)NC(=O)N(CCCl)N=O FVLVBPDQNARYJU-XAHDHGMMSA-N 0.000 description 1
- 101100314454 Caenorhabditis elegans tra-1 gene Proteins 0.000 description 1
- 241000759909 Camptotheca Species 0.000 description 1
- 241000282472 Canis lupus familiaris Species 0.000 description 1
- 241000283707 Capra Species 0.000 description 1
- 229930188120 Carbomycin Natural products 0.000 description 1
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 1
- 102000011632 Caseins Human genes 0.000 description 1
- 108010076119 Caseins Proteins 0.000 description 1
- 102000003727 Caveolin 1 Human genes 0.000 description 1
- 108090000026 Caveolin 1 Proteins 0.000 description 1
- 102400001244 Cerebellin Human genes 0.000 description 1
- 101800001299 Cerebellin Proteins 0.000 description 1
- 206010008479 Chest Pain Diseases 0.000 description 1
- ZAMOUSCENKQFHK-UHFFFAOYSA-N Chlorine atom Chemical compound [Cl] ZAMOUSCENKQFHK-UHFFFAOYSA-N 0.000 description 1
- 239000004380 Cholic acid Substances 0.000 description 1
- VYZAMTAEIAYCRO-UHFFFAOYSA-N Chromium Chemical compound [Cr] VYZAMTAEIAYCRO-UHFFFAOYSA-N 0.000 description 1
- 101150008206 Cilk1 gene Proteins 0.000 description 1
- PTOAARAWEBMLNO-KVQBGUIXSA-N Cladribine Chemical compound C1=NC=2C(N)=NC(Cl)=NC=2N1[C@H]1C[C@H](O)[C@@H](CO)O1 PTOAARAWEBMLNO-KVQBGUIXSA-N 0.000 description 1
- 102100022641 Coagulation factor IX Human genes 0.000 description 1
- 102100023804 Coagulation factor VII Human genes 0.000 description 1
- 241000189665 Colchicum autumnale Species 0.000 description 1
- 208000001333 Colorectal Neoplasms Diseases 0.000 description 1
- 229920002261 Corn starch Polymers 0.000 description 1
- 229920002785 Croscarmellose sodium Polymers 0.000 description 1
- 102000004127 Cytokines Human genes 0.000 description 1
- 108090000695 Cytokines Proteins 0.000 description 1
- FBPFZTCFMRRESA-FSIIMWSLSA-N D-Glucitol Natural products OC[C@H](O)[C@H](O)[C@@H](O)[C@H](O)CO FBPFZTCFMRRESA-FSIIMWSLSA-N 0.000 description 1
- FBPFZTCFMRRESA-JGWLITMVSA-N D-glucitol Chemical compound OC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-JGWLITMVSA-N 0.000 description 1
- SHZGCJCMOBCMKK-UHFFFAOYSA-N D-mannomethylose Natural products CC1OC(O)C(O)C(O)C1O SHZGCJCMOBCMKK-UHFFFAOYSA-N 0.000 description 1
- 101100481408 Danio rerio tie2 gene Proteins 0.000 description 1
- 229920002307 Dextran Polymers 0.000 description 1
- GZDFHIJNHHMENY-UHFFFAOYSA-N Dimethyl dicarbonate Chemical compound COC(=O)OC(=O)OC GZDFHIJNHHMENY-UHFFFAOYSA-N 0.000 description 1
- AADVCYNFEREWOS-OBRABYBLSA-N Discodermolide Chemical compound C=C\C=C/[C@H](C)[C@H](OC(N)=O)[C@@H](C)[C@H](O)[C@@H](C)C\C(C)=C/[C@H](C)[C@@H](O)[C@@H](C)\C=C/[C@@H](O)C[C@@H]1OC(=O)[C@H](C)[C@@H](O)[C@H]1C AADVCYNFEREWOS-OBRABYBLSA-N 0.000 description 1
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 1
- 102000002322 Egg Proteins Human genes 0.000 description 1
- 108010000912 Egg Proteins Proteins 0.000 description 1
- 241000283086 Equidae Species 0.000 description 1
- 102000003951 Erythropoietin Human genes 0.000 description 1
- 108090000394 Erythropoietin Proteins 0.000 description 1
- 208000000461 Esophageal Neoplasms Diseases 0.000 description 1
- 206010015866 Extravasation Diseases 0.000 description 1
- 108010076282 Factor IX Proteins 0.000 description 1
- 108010023321 Factor VII Proteins 0.000 description 1
- 108010054218 Factor VIII Proteins 0.000 description 1
- 102000001690 Factor VIII Human genes 0.000 description 1
- 108010014173 Factor X Proteins 0.000 description 1
- 208000002633 Febrile Neutropenia Diseases 0.000 description 1
- 241000282326 Felis catus Species 0.000 description 1
- 102000018233 Fibroblast Growth Factor Human genes 0.000 description 1
- 108050007372 Fibroblast Growth Factor Proteins 0.000 description 1
- 102000003974 Fibroblast growth factor 2 Human genes 0.000 description 1
- 102100024785 Fibroblast growth factor 2 Human genes 0.000 description 1
- 102000016359 Fibronectins Human genes 0.000 description 1
- 108010067306 Fibronectins Proteins 0.000 description 1
- PXGOKWXKJXAPGV-UHFFFAOYSA-N Fluorine Chemical compound FF PXGOKWXKJXAPGV-UHFFFAOYSA-N 0.000 description 1
- GYHNNYVSQQEPJS-OIOBTWANSA-N Gallium-67 Chemical compound [67Ga] GYHNNYVSQQEPJS-OIOBTWANSA-N 0.000 description 1
- 229930182566 Gentamicin Natural products 0.000 description 1
- CEAZRRDELHUEMR-URQXQFDESA-N Gentamicin Chemical compound O1[C@H](C(C)NC)CC[C@@H](N)[C@H]1O[C@H]1[C@H](O)[C@@H](O[C@@H]2[C@@H]([C@@H](NC)[C@@](C)(O)CO2)O)[C@H](N)C[C@@H]1N CEAZRRDELHUEMR-URQXQFDESA-N 0.000 description 1
- 240000008609 Gloriosa superba Species 0.000 description 1
- 108010015031 Glycochenodeoxycholic Acid Proteins 0.000 description 1
- 108010007979 Glycocholic Acid Proteins 0.000 description 1
- 108010017213 Granulocyte-Macrophage Colony-Stimulating Factor Proteins 0.000 description 1
- 102100039620 Granulocyte-macrophage colony-stimulating factor Human genes 0.000 description 1
- 208000002250 Hematologic Neoplasms Diseases 0.000 description 1
- 101100118549 Homo sapiens EGFR gene Proteins 0.000 description 1
- 101500025419 Homo sapiens Epidermal growth factor Proteins 0.000 description 1
- 101000851007 Homo sapiens Vascular endothelial growth factor receptor 2 Proteins 0.000 description 1
- XDXDZDZNSLXDNA-TZNDIEGXSA-N Idarubicin Chemical compound C1[C@H](N)[C@H](O)[C@H](C)O[C@H]1O[C@@H]1C2=C(O)C(C(=O)C3=CC=CC=C3C3=O)=C3C(O)=C2C[C@@](O)(C(C)=O)C1 XDXDZDZNSLXDNA-TZNDIEGXSA-N 0.000 description 1
- XDXDZDZNSLXDNA-UHFFFAOYSA-N Idarubicin Natural products C1C(N)C(O)C(C)OC1OC1C2=C(O)C(C(=O)C3=CC=CC=C3C3=O)=C3C(O)=C2CC(O)(C(C)=O)C1 XDXDZDZNSLXDNA-UHFFFAOYSA-N 0.000 description 1
- 108060003951 Immunoglobulin Proteins 0.000 description 1
- 206010061218 Inflammation Diseases 0.000 description 1
- 102000003815 Interleukin-11 Human genes 0.000 description 1
- 108090000177 Interleukin-11 Proteins 0.000 description 1
- 102000015696 Interleukins Human genes 0.000 description 1
- 108010063738 Interleukins Proteins 0.000 description 1
- ZCYVEMRRCGMTRW-AHCXROLUSA-N Iodine-123 Chemical compound [123I] ZCYVEMRRCGMTRW-AHCXROLUSA-N 0.000 description 1
- 108010077497 KLA peptide Proteins 0.000 description 1
- QIVBCDIJIAJPQS-VIFPVBQESA-N L-tryptophane Chemical compound C1=CC=C2C(C[C@H](N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-VIFPVBQESA-N 0.000 description 1
- OUYCCCASQSFEME-QMMMGPOBSA-N L-tyrosine Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-QMMMGPOBSA-N 0.000 description 1
- 102000004407 Lactalbumin Human genes 0.000 description 1
- 108090000942 Lactalbumin Proteins 0.000 description 1
- 102000008192 Lactoglobulins Human genes 0.000 description 1
- 108010060630 Lactoglobulins Proteins 0.000 description 1
- 102000004895 Lipoproteins Human genes 0.000 description 1
- 108090001030 Lipoproteins Proteins 0.000 description 1
- SMEROWZSTRWXGI-UHFFFAOYSA-N Lithocholsaeure Natural products C1CC2CC(O)CCC2(C)C2C1C1CCC(C(CCC(O)=O)C)C1(C)CC2 SMEROWZSTRWXGI-UHFFFAOYSA-N 0.000 description 1
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 1
- 239000004472 Lysine Substances 0.000 description 1
- 229930192392 Mitomycin Natural products 0.000 description 1
- 206010028116 Mucosal inflammation Diseases 0.000 description 1
- 201000010927 Mucositis Diseases 0.000 description 1
- 241000699666 Mus <mouse, genus> Species 0.000 description 1
- 101100481410 Mus musculus Tek gene Proteins 0.000 description 1
- 101100268066 Mus musculus Zap70 gene Proteins 0.000 description 1
- 208000000112 Myalgia Diseases 0.000 description 1
- 239000005041 Mylar™ Substances 0.000 description 1
- NWIBSHFKIJFRCO-WUDYKRTCSA-N Mytomycin Chemical compound C1N2C(C(C(C)=C(N)C3=O)=O)=C3[C@@H](COC(N)=O)[C@@]2(OC)[C@@H]2[C@H]1N2 NWIBSHFKIJFRCO-WUDYKRTCSA-N 0.000 description 1
- RFDAIACWWDREDC-UHFFFAOYSA-N Na salt-Glycocholic acid Natural products OC1CC2CC(O)CCC2(C)C2C1C1CCC(C(CCC(=O)NCC(O)=O)C)C1(C)C(O)C2 RFDAIACWWDREDC-UHFFFAOYSA-N 0.000 description 1
- 208000006098 Neonatal Hyperbilirubinemia Diseases 0.000 description 1
- 201000006346 Neonatal Jaundice Diseases 0.000 description 1
- 206010061309 Neoplasm progression Diseases 0.000 description 1
- 206010029260 Neuroblastoma Diseases 0.000 description 1
- 206010029350 Neurotoxicity Diseases 0.000 description 1
- IOVCWXUNBOPUCH-UHFFFAOYSA-M Nitrite anion Chemical compound [O-]N=O IOVCWXUNBOPUCH-UHFFFAOYSA-M 0.000 description 1
- 208000007571 Ovarian Epithelial Carcinoma Diseases 0.000 description 1
- 101150093908 PDGFRB gene Proteins 0.000 description 1
- 208000002193 Pain Diseases 0.000 description 1
- 208000037273 Pathologic Processes Diseases 0.000 description 1
- OAICVXFJPJFONN-UHFFFAOYSA-N Phosphorus Chemical compound [P] OAICVXFJPJFONN-UHFFFAOYSA-N 0.000 description 1
- 108010069381 Platelet Endothelial Cell Adhesion Molecule-1 Proteins 0.000 description 1
- 208000026149 Primary peritoneal carcinoma Diseases 0.000 description 1
- 241000288906 Primates Species 0.000 description 1
- 241000589516 Pseudomonas Species 0.000 description 1
- 108020004511 Recombinant DNA Proteins 0.000 description 1
- 208000015634 Rectal Neoplasms Diseases 0.000 description 1
- 241000283984 Rodentia Species 0.000 description 1
- 102000001332 SRC Human genes 0.000 description 1
- 108060006706 SRC Proteins 0.000 description 1
- 101100123851 Saccharomyces cerevisiae (strain ATCC 204508 / S288c) HER1 gene Proteins 0.000 description 1
- BUGBHKTXTAQXES-UHFFFAOYSA-N Selenium Chemical compound [Se] BUGBHKTXTAQXES-UHFFFAOYSA-N 0.000 description 1
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 1
- 206010040880 Skin irritation Diseases 0.000 description 1
- 231100000632 Spindle poison Toxicity 0.000 description 1
- 208000000102 Squamous Cell Carcinoma of Head and Neck Diseases 0.000 description 1
- 229920002472 Starch Polymers 0.000 description 1
- 235000021355 Stearic acid Nutrition 0.000 description 1
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical compound [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 description 1
- WBWWGRHZICKQGZ-UHFFFAOYSA-N Taurocholic acid Natural products OC1CC2CC(O)CCC2(C)C2C1C1CCC(C(CCC(=O)NCCS(O)(=O)=O)C)C1(C)C(O)C2 WBWWGRHZICKQGZ-UHFFFAOYSA-N 0.000 description 1
- GKLVYJBZJHMRIY-OUBTZVSYSA-N Technetium-99 Chemical compound [99Tc] GKLVYJBZJHMRIY-OUBTZVSYSA-N 0.000 description 1
- FOCVUCIESVLUNU-UHFFFAOYSA-N Thiotepa Chemical compound C1CN1P(N1CC1)(=S)N1CC1 FOCVUCIESVLUNU-UHFFFAOYSA-N 0.000 description 1
- 102000036693 Thrombopoietin Human genes 0.000 description 1
- 108010041111 Thrombopoietin Proteins 0.000 description 1
- 208000007536 Thrombosis Diseases 0.000 description 1
- 102000009843 Thyroglobulin Human genes 0.000 description 1
- 108010034949 Thyroglobulin Proteins 0.000 description 1
- AOBORMOPSGHCAX-UHFFFAOYSA-N Tocophersolan Chemical compound OCCOC(=O)CCC(=O)OC1=C(C)C(C)=C2OC(CCCC(C)CCCC(C)CCCC(C)C)(C)CCC2=C1C AOBORMOPSGHCAX-UHFFFAOYSA-N 0.000 description 1
- 206010044221 Toxic encephalopathy Diseases 0.000 description 1
- 102000004338 Transferrin Human genes 0.000 description 1
- 108090000901 Transferrin Proteins 0.000 description 1
- QIVBCDIJIAJPQS-UHFFFAOYSA-N Tryptophan Natural products C1=CC=C2C(CC(N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-UHFFFAOYSA-N 0.000 description 1
- 208000007097 Urinary Bladder Neoplasms Diseases 0.000 description 1
- 108010053099 Vascular Endothelial Growth Factor Receptor-2 Proteins 0.000 description 1
- 102000016549 Vascular Endothelial Growth Factor Receptor-2 Human genes 0.000 description 1
- 102000005789 Vascular Endothelial Growth Factors Human genes 0.000 description 1
- 108010019530 Vascular Endothelial Growth Factors Proteins 0.000 description 1
- 102100033177 Vascular endothelial growth factor receptor 2 Human genes 0.000 description 1
- 206010047249 Venous thrombosis Diseases 0.000 description 1
- VWQVUPCCIRVNHF-OUBTZVSYSA-N Yttrium-90 Chemical compound [90Y] VWQVUPCCIRVNHF-OUBTZVSYSA-N 0.000 description 1
- JLPULHDHAOZNQI-JLOPVYAASA-N [(2r)-3-hexadecanoyloxy-2-[(9e,12e)-octadeca-9,12-dienoyl]oxypropyl] 2-(trimethylazaniumyl)ethyl phosphate Chemical class CCCCCCCCCCCCCCCC(=O)OC[C@H](COP([O-])(=O)OCC[N+](C)(C)C)OC(=O)CCCCCCC\C=C\C\C=C\CCCCC JLPULHDHAOZNQI-JLOPVYAASA-N 0.000 description 1
- FQVHOULQCKDUCY-OGHXVOSASA-N [(2s,3s,4r,6s)-6-[(2r,3s,4r,5r,6s)-6-[[(1s,3r,7r,8s,9s,10r,12r,14e,16s)-7-acetyloxy-8-methoxy-3,12-dimethyl-5,13-dioxo-10-(2-oxoethyl)-4,17-dioxabicyclo[14.1.0]heptadec-14-en-9-yl]oxy]-4-(dimethylamino)-5-hydroxy-2-methyloxan-3-yl]oxy-4-hydroxy-2,4-dimeth Chemical compound O([C@@H]1[C@@H](C)O[C@H]([C@@H]([C@H]1N(C)C)O)O[C@H]1[C@@H](CC=O)C[C@@H](C)C(=O)/C=C/[C@@H]2O[C@H]2C[C@@H](C)OC(=O)C[C@H]([C@@H]1OC)OC(C)=O)[C@H]1C[C@@](C)(O)[C@@H](OC(=O)CC(C)C)[C@H](C)O1 FQVHOULQCKDUCY-OGHXVOSASA-N 0.000 description 1
- 210000000683 abdominal cavity Anatomy 0.000 description 1
- 230000001594 aberrant effect Effects 0.000 description 1
- 238000009825 accumulation Methods 0.000 description 1
- DPXJVFZANSGRMM-UHFFFAOYSA-N acetic acid;2,3,4,5,6-pentahydroxyhexanal;sodium Chemical compound [Na].CC(O)=O.OCC(O)C(O)C(O)C(O)C=O DPXJVFZANSGRMM-UHFFFAOYSA-N 0.000 description 1
- 230000021736 acetylation Effects 0.000 description 1
- 238000006640 acetylation reaction Methods 0.000 description 1
- RJURFGZVJUQBHK-IIXSONLDSA-N actinomycin D Chemical compound C[C@H]1OC(=O)[C@H](C(C)C)N(C)C(=O)CN(C)C(=O)[C@@H]2CCCN2C(=O)[C@@H](C(C)C)NC(=O)[C@H]1NC(=O)C1=C(N)C(=O)C(C)=C2OC(C(C)=CC=C3C(=O)N[C@@H]4C(=O)N[C@@H](C(N5CCC[C@H]5C(=O)N(C)CC(=O)N(C)[C@@H](C(C)C)C(=O)O[C@@H]4C)=O)C(C)C)=C3N=C21 RJURFGZVJUQBHK-IIXSONLDSA-N 0.000 description 1
- 230000004913 activation Effects 0.000 description 1
- 230000000996 additive effect Effects 0.000 description 1
- 210000000577 adipose tissue Anatomy 0.000 description 1
- 208000037842 advanced-stage tumor Diseases 0.000 description 1
- 238000005054 agglomeration Methods 0.000 description 1
- 230000002776 aggregation Effects 0.000 description 1
- 229960000548 alemtuzumab Drugs 0.000 description 1
- 235000010443 alginic acid Nutrition 0.000 description 1
- 229920000615 alginic acid Polymers 0.000 description 1
- 229940045714 alkyl sulfonate alkylating agent Drugs 0.000 description 1
- 150000008052 alkyl sulfonates Chemical class 0.000 description 1
- PMMURAAUARKVCB-UHFFFAOYSA-N alpha-D-ara-dHexp Natural products OCC1OC(O)CC(O)C1O PMMURAAUARKVCB-UHFFFAOYSA-N 0.000 description 1
- APKFDSVGJQXUKY-INPOYWNPSA-N amphotericin B Chemical compound O[C@H]1[C@@H](N)[C@H](O)[C@@H](C)O[C@H]1O[C@H]1/C=C/C=C/C=C/C=C/C=C/C=C/C=C/[C@H](C)[C@@H](O)[C@@H](C)[C@H](C)OC(=O)C[C@H](O)C[C@H](O)CC[C@@H](O)[C@H](O)C[C@H](O)C[C@](O)(C[C@H](O)[C@H]2C(O)=O)O[C@H]2C1 APKFDSVGJQXUKY-INPOYWNPSA-N 0.000 description 1
- 229960003942 amphotericin b Drugs 0.000 description 1
- 229960001220 amsacrine Drugs 0.000 description 1
- XCPGHVQEEXUHNC-UHFFFAOYSA-N amsacrine Chemical compound COC1=CC(NS(C)(=O)=O)=CC=C1NC1=C(C=CC=C2)C2=NC2=CC=CC=C12 XCPGHVQEEXUHNC-UHFFFAOYSA-N 0.000 description 1
- 208000003455 anaphylaxis Diseases 0.000 description 1
- 230000002491 angiogenic effect Effects 0.000 description 1
- 238000002399 angioplasty Methods 0.000 description 1
- 208000022531 anorexia Diseases 0.000 description 1
- 230000001093 anti-cancer Effects 0.000 description 1
- 230000000118 anti-neoplastic effect Effects 0.000 description 1
- 230000001028 anti-proliverative effect Effects 0.000 description 1
- 230000006023 anti-tumor response Effects 0.000 description 1
- 229940088710 antibiotic agent Drugs 0.000 description 1
- 229940045686 antimetabolites antineoplastic purine analogs Drugs 0.000 description 1
- 229940034982 antineoplastic agent Drugs 0.000 description 1
- 229940045713 antineoplastic alkylating drug ethylene imines Drugs 0.000 description 1
- 229940045688 antineoplastic antimetabolites pyrimidine analogues Drugs 0.000 description 1
- 239000003963 antioxidant agent Substances 0.000 description 1
- 210000000709 aorta Anatomy 0.000 description 1
- 210000002376 aorta thoracic Anatomy 0.000 description 1
- 230000001640 apoptogenic effect Effects 0.000 description 1
- 125000000637 arginyl group Chemical group N[C@@H](CCCNC(N)=N)C(=O)* 0.000 description 1
- 238000003556 assay Methods 0.000 description 1
- RYXHOMYVWAEKHL-OUBTZVSYSA-N astatine-211 Chemical compound [211At] RYXHOMYVWAEKHL-OUBTZVSYSA-N 0.000 description 1
- 229960002756 azacitidine Drugs 0.000 description 1
- 229960002170 azathioprine Drugs 0.000 description 1
- LMEKQMALGUDUQG-UHFFFAOYSA-N azathioprine Chemical compound CN1C=NC([N+]([O-])=O)=C1SC1=NC=NC2=C1NC=N2 LMEKQMALGUDUQG-UHFFFAOYSA-N 0.000 description 1
- 239000000022 bacteriostatic agent Substances 0.000 description 1
- 239000007640 basal medium Substances 0.000 description 1
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 1
- 239000003833 bile salt Substances 0.000 description 1
- 229940093761 bile salts Drugs 0.000 description 1
- 108091008324 binding proteins Proteins 0.000 description 1
- 230000003115 biocidal effect Effects 0.000 description 1
- 239000003124 biologic agent Substances 0.000 description 1
- 201000001531 bladder carcinoma Diseases 0.000 description 1
- 229960001561 bleomycin Drugs 0.000 description 1
- OYVAGSVQBOHSSS-UAPAGMARSA-O bleomycin A2 Chemical compound N([C@H](C(=O)N[C@H](C)[C@@H](O)[C@H](C)C(=O)N[C@@H]([C@H](O)C)C(=O)NCCC=1SC=C(N=1)C=1SC=C(N=1)C(=O)NCCC[S+](C)C)[C@@H](O[C@H]1[C@H]([C@@H](O)[C@H](O)[C@H](CO)O1)O[C@@H]1[C@H]([C@@H](OC(N)=O)[C@H](O)[C@@H](CO)O1)O)C=1N=CNC=1)C(=O)C1=NC([C@H](CC(N)=O)NC[C@H](N)C(N)=O)=NC(N)=C1C OYVAGSVQBOHSSS-UAPAGMARSA-O 0.000 description 1
- 210000000601 blood cell Anatomy 0.000 description 1
- 230000036770 blood supply Effects 0.000 description 1
- 210000000988 bone and bone Anatomy 0.000 description 1
- 210000002798 bone marrow cell Anatomy 0.000 description 1
- 229940098773 bovine serum albumin Drugs 0.000 description 1
- 210000000481 breast Anatomy 0.000 description 1
- 239000007975 buffered saline Substances 0.000 description 1
- 239000006172 buffering agent Substances 0.000 description 1
- 244000309464 bull Species 0.000 description 1
- 229960002092 busulfan Drugs 0.000 description 1
- DEGAKNSWVGKMLS-UHFFFAOYSA-N calcein Chemical compound O1C(=O)C2=CC=CC=C2C21C1=CC(CN(CC(O)=O)CC(O)=O)=C(O)C=C1OC1=C2C=C(CN(CC(O)=O)CC(=O)O)C(O)=C1 DEGAKNSWVGKMLS-UHFFFAOYSA-N 0.000 description 1
- 239000001506 calcium phosphate Substances 0.000 description 1
- 229910000389 calcium phosphate Inorganic materials 0.000 description 1
- 235000011010 calcium phosphates Nutrition 0.000 description 1
- 239000000378 calcium silicate Substances 0.000 description 1
- 229910052918 calcium silicate Inorganic materials 0.000 description 1
- 229960003340 calcium silicate Drugs 0.000 description 1
- 235000012241 calcium silicate Nutrition 0.000 description 1
- OYACROKNLOSFPA-UHFFFAOYSA-N calcium;dioxido(oxo)silane Chemical compound [Ca+2].[O-][Si]([O-])=O OYACROKNLOSFPA-UHFFFAOYSA-N 0.000 description 1
- 238000004422 calculation algorithm Methods 0.000 description 1
- 229940112129 campath Drugs 0.000 description 1
- 239000002775 capsule Substances 0.000 description 1
- CVXBEEMKQHEXEN-UHFFFAOYSA-N carbaryl Chemical compound C1=CC=C2C(OC(=O)NC)=CC=CC2=C1 CVXBEEMKQHEXEN-UHFFFAOYSA-N 0.000 description 1
- 229950005779 carbomycin Drugs 0.000 description 1
- 229910052799 carbon Inorganic materials 0.000 description 1
- 229960005243 carmustine Drugs 0.000 description 1
- 239000000969 carrier Substances 0.000 description 1
- 239000005018 casein Substances 0.000 description 1
- BECPQYXYKAMYBN-UHFFFAOYSA-N casein, tech. Chemical compound NCCCCC(C(O)=O)N=C(O)C(CC(O)=O)N=C(O)C(CCC(O)=N)N=C(O)C(CC(C)C)N=C(O)C(CCC(O)=O)N=C(O)C(CC(O)=O)N=C(O)C(CCC(O)=O)N=C(O)C(C(C)O)N=C(O)C(CCC(O)=N)N=C(O)C(CCC(O)=N)N=C(O)C(CCC(O)=N)N=C(O)C(CCC(O)=O)N=C(O)C(CCC(O)=O)N=C(O)C(COP(O)(O)=O)N=C(O)C(CCC(O)=N)N=C(O)C(N)CC1=CC=CC=C1 BECPQYXYKAMYBN-UHFFFAOYSA-N 0.000 description 1
- 235000021240 caseins Nutrition 0.000 description 1
- 210000004323 caveolae Anatomy 0.000 description 1
- 230000022131 cell cycle Effects 0.000 description 1
- 230000012292 cell migration Effects 0.000 description 1
- 239000006285 cell suspension Substances 0.000 description 1
- 230000001413 cellular effect Effects 0.000 description 1
- 230000019522 cellular metabolic process Effects 0.000 description 1
- 239000001913 cellulose Substances 0.000 description 1
- 235000010980 cellulose Nutrition 0.000 description 1
- 229920002678 cellulose Polymers 0.000 description 1
- 230000008859 change Effects 0.000 description 1
- RUDATBOHQWOJDD-BSWAIDMHSA-N chenodeoxycholic acid Chemical compound C([C@H]1C[C@H]2O)[C@H](O)CC[C@]1(C)[C@@H]1[C@@H]2[C@@H]2CC[C@H]([C@@H](CCC(O)=O)C)[C@@]2(C)CC1 RUDATBOHQWOJDD-BSWAIDMHSA-N 0.000 description 1
- 229960001091 chenodeoxycholic acid Drugs 0.000 description 1
- 229960004630 chlorambucil Drugs 0.000 description 1
- JCKYGMPEJWAADB-UHFFFAOYSA-N chlorambucil Chemical compound OC(=O)CCCC1=CC=C(N(CCCl)CCCl)C=C1 JCKYGMPEJWAADB-UHFFFAOYSA-N 0.000 description 1
- 239000000460 chlorine Substances 0.000 description 1
- 229910052801 chlorine Inorganic materials 0.000 description 1
- 235000019416 cholic acid Nutrition 0.000 description 1
- BHQCQFFYRZLCQQ-OELDTZBJSA-N cholic acid Chemical compound C([C@H]1C[C@H]2O)[C@H](O)CC[C@]1(C)[C@@H]1[C@@H]2[C@@H]2CC[C@H]([C@@H](CCC(O)=O)C)[C@@]2(C)[C@@H](O)C1 BHQCQFFYRZLCQQ-OELDTZBJSA-N 0.000 description 1
- 229960002471 cholic acid Drugs 0.000 description 1
- 229910052804 chromium Inorganic materials 0.000 description 1
- 239000011651 chromium Substances 0.000 description 1
- 230000001684 chronic effect Effects 0.000 description 1
- 229960002436 cladribine Drugs 0.000 description 1
- 238000005352 clarification Methods 0.000 description 1
- 238000011260 co-administration Methods 0.000 description 1
- 229910017052 cobalt Inorganic materials 0.000 description 1
- 239000010941 cobalt Substances 0.000 description 1
- GUTLYIVDDKVIGB-UHFFFAOYSA-N cobalt atom Chemical compound [Co] GUTLYIVDDKVIGB-UHFFFAOYSA-N 0.000 description 1
- 229940075614 colloidal silicon dioxide Drugs 0.000 description 1
- 208000029742 colonic neoplasm Diseases 0.000 description 1
- 230000002301 combined effect Effects 0.000 description 1
- 150000004814 combretastatins Chemical class 0.000 description 1
- 238000010835 comparative analysis Methods 0.000 description 1
- 238000013093 comparative effectiveness research Methods 0.000 description 1
- 230000009137 competitive binding Effects 0.000 description 1
- 238000001816 cooling Methods 0.000 description 1
- RYGMFSIKBFXOCR-AKLPVKDBSA-N copper-67 Chemical compound [67Cu] RYGMFSIKBFXOCR-AKLPVKDBSA-N 0.000 description 1
- 239000008120 corn starch Substances 0.000 description 1
- 229960001681 croscarmellose sodium Drugs 0.000 description 1
- 235000010947 crosslinked sodium carboxy methyl cellulose Nutrition 0.000 description 1
- 238000002681 cryosurgery Methods 0.000 description 1
- 210000004748 cultured cell Anatomy 0.000 description 1
- 229940108608 cyclophosphamide 500 mg Drugs 0.000 description 1
- 229960000684 cytarabine Drugs 0.000 description 1
- 230000009089 cytolysis Effects 0.000 description 1
- 229960000640 dactinomycin Drugs 0.000 description 1
- STQGQHZAVUOBTE-VGBVRHCVSA-N daunorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(C)=O)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 STQGQHZAVUOBTE-VGBVRHCVSA-N 0.000 description 1
- 206010061428 decreased appetite Diseases 0.000 description 1
- 230000003111 delayed effect Effects 0.000 description 1
- KXGVEGMKQFWNSR-UHFFFAOYSA-N deoxycholic acid Natural products C1CC2CC(O)CCC2(C)C2C1C1CCC(C(CCC(O)=O)C)C1(C)C(O)C2 KXGVEGMKQFWNSR-UHFFFAOYSA-N 0.000 description 1
- 230000008021 deposition Effects 0.000 description 1
- 239000003599 detergent Substances 0.000 description 1
- 238000001784 detoxification Methods 0.000 description 1
- UREBDLICKHMUKA-CXSFZGCWSA-N dexamethasone Chemical compound C1CC2=CC(=O)C=C[C@]2(C)[C@]2(F)[C@@H]1[C@@H]1C[C@@H](C)[C@@](C(=O)CO)(O)[C@@]1(C)C[C@@H]2O UREBDLICKHMUKA-CXSFZGCWSA-N 0.000 description 1
- 229960003957 dexamethasone Drugs 0.000 description 1
- 238000003745 diagnosis Methods 0.000 description 1
- 235000014113 dietary fatty acids Nutrition 0.000 description 1
- CITHEXJVPOWHKC-UHFFFAOYSA-N dimyristoyl phosphatidylcholine Chemical compound CCCCCCCCCCCCCC(=O)OCC(COP([O-])(=O)OCC[N+](C)(C)C)OC(=O)CCCCCCCCCCCCC CITHEXJVPOWHKC-UHFFFAOYSA-N 0.000 description 1
- 108010007093 dispase Proteins 0.000 description 1
- 239000006185 dispersion Substances 0.000 description 1
- 230000006334 disulfide bridging Effects 0.000 description 1
- 230000005059 dormancy Effects 0.000 description 1
- 239000002552 dosage form Substances 0.000 description 1
- 238000001647 drug administration Methods 0.000 description 1
- 239000000890 drug combination Substances 0.000 description 1
- 238000012377 drug delivery Methods 0.000 description 1
- 238000002651 drug therapy Methods 0.000 description 1
- 210000003981 ectoderm Anatomy 0.000 description 1
- 235000013345 egg yolk Nutrition 0.000 description 1
- 210000002969 egg yolk Anatomy 0.000 description 1
- 238000001077 electron transfer detection Methods 0.000 description 1
- 230000008030 elimination Effects 0.000 description 1
- 238000003379 elimination reaction Methods 0.000 description 1
- 230000001804 emulsifying effect Effects 0.000 description 1
- 210000003989 endothelium vascular Anatomy 0.000 description 1
- 239000002158 endotoxin Substances 0.000 description 1
- YQGOJNYOYNNSMM-UHFFFAOYSA-N eosin Chemical compound [Na+].OC(=O)C1=CC=CC=C1C1=C2C=C(Br)C(=O)C(Br)=C2OC2=C(Br)C(O)=C(Br)C=C21 YQGOJNYOYNNSMM-UHFFFAOYSA-N 0.000 description 1
- 210000002919 epithelial cell Anatomy 0.000 description 1
- 229930013356 epothilone Natural products 0.000 description 1
- HESCAJZNRMSMJG-KKQRBIROSA-N epothilone A Chemical class C/C([C@@H]1C[C@@H]2O[C@@H]2CCC[C@@H]([C@@H]([C@@H](C)C(=O)C(C)(C)[C@@H](O)CC(=O)O1)O)C)=C\C1=CSC(C)=N1 HESCAJZNRMSMJG-KKQRBIROSA-N 0.000 description 1
- 229960003276 erythromycin Drugs 0.000 description 1
- 229940105423 erythropoietin Drugs 0.000 description 1
- IIUMCNJTGSMNRO-VVSKJQCTSA-L estramustine sodium phosphate Chemical compound [Na+].[Na+].ClCCN(CCCl)C(=O)OC1=CC=C2[C@H]3CC[C@](C)([C@H](CC4)OP([O-])([O-])=O)[C@@H]4[C@@H]3CCC2=C1 IIUMCNJTGSMNRO-VVSKJQCTSA-L 0.000 description 1
- 150000002170 ethers Chemical class 0.000 description 1
- LIQODXNTTZAGID-OCBXBXKTSA-N etoposide phosphate Chemical compound COC1=C(OP(O)(O)=O)C(OC)=CC([C@@H]2C3=CC=4OCOC=4C=C3[C@@H](O[C@H]3[C@@H]([C@@H](O)[C@@H]4O[C@H](C)OC[C@H]4O3)O)[C@@H]3[C@@H]2C(OC3)=O)=C1 LIQODXNTTZAGID-OCBXBXKTSA-N 0.000 description 1
- 229960000752 etoposide phosphate Drugs 0.000 description 1
- 238000001704 evaporation Methods 0.000 description 1
- 230000008020 evaporation Effects 0.000 description 1
- 230000036251 extravasation Effects 0.000 description 1
- 229960004222 factor ix Drugs 0.000 description 1
- 229940012413 factor vii Drugs 0.000 description 1
- 229960000301 factor viii Drugs 0.000 description 1
- 229940012426 factor x Drugs 0.000 description 1
- 239000000194 fatty acid Substances 0.000 description 1
- 229930195729 fatty acid Natural products 0.000 description 1
- 150000004665 fatty acids Chemical class 0.000 description 1
- 230000001605 fetal effect Effects 0.000 description 1
- 239000000835 fiber Substances 0.000 description 1
- 229940126864 fibroblast growth factor Drugs 0.000 description 1
- 238000001914 filtration Methods 0.000 description 1
- 238000009459 flexible packaging Methods 0.000 description 1
- 238000005189 flocculation Methods 0.000 description 1
- 230000016615 flocculation Effects 0.000 description 1
- 238000000799 fluorescence microscopy Methods 0.000 description 1
- 239000011737 fluorine Substances 0.000 description 1
- 229910052731 fluorine Inorganic materials 0.000 description 1
- 235000013305 food Nutrition 0.000 description 1
- 235000003599 food sweetener Nutrition 0.000 description 1
- 210000005095 gastrointestinal system Anatomy 0.000 description 1
- 229940014259 gelatin Drugs 0.000 description 1
- 229960000578 gemtuzumab Drugs 0.000 description 1
- 229940020967 gemzar Drugs 0.000 description 1
- 230000014509 gene expression Effects 0.000 description 1
- 238000003633 gene expression assay Methods 0.000 description 1
- 238000001415 gene therapy Methods 0.000 description 1
- 229960002518 gentamicin Drugs 0.000 description 1
- 230000035784 germination Effects 0.000 description 1
- 229940080856 gleevec Drugs 0.000 description 1
- 102000034238 globular proteins Human genes 0.000 description 1
- 108091005896 globular proteins Proteins 0.000 description 1
- 239000008103 glucose Substances 0.000 description 1
- GHCZAUBVMUEKKP-GYPHWSFCSA-N glycochenodeoxycholic acid Chemical compound C([C@H]1C[C@H]2O)[C@H](O)CC[C@]1(C)[C@@H]1[C@@H]2[C@@H]2CC[C@H]([C@@H](CCC(=O)NCC(O)=O)C)[C@@]2(C)CC1 GHCZAUBVMUEKKP-GYPHWSFCSA-N 0.000 description 1
- RFDAIACWWDREDC-FRVQLJSFSA-N glycocholic acid Chemical compound C([C@H]1C[C@H]2O)[C@H](O)CC[C@]1(C)[C@@H]1[C@@H]2[C@@H]2CC[C@H]([C@@H](CCC(=O)NCC(O)=O)C)[C@@]2(C)[C@@H](O)C1 RFDAIACWWDREDC-FRVQLJSFSA-N 0.000 description 1
- 229940099347 glycocholic acid Drugs 0.000 description 1
- 230000013595 glycosylation Effects 0.000 description 1
- 238000006206 glycosylation reaction Methods 0.000 description 1
- 230000009036 growth inhibition Effects 0.000 description 1
- 208000024963 hair loss Diseases 0.000 description 1
- 230000003676 hair loss Effects 0.000 description 1
- 201000000459 head and neck squamous cell carcinoma Diseases 0.000 description 1
- 230000036541 health Effects 0.000 description 1
- 230000002489 hematologic effect Effects 0.000 description 1
- 210000000777 hematopoietic system Anatomy 0.000 description 1
- 230000023597 hemostasis Effects 0.000 description 1
- 231100000171 higher toxicity Toxicity 0.000 description 1
- 229940116978 human epidermal growth factor Drugs 0.000 description 1
- 229910052739 hydrogen Inorganic materials 0.000 description 1
- 239000001257 hydrogen Substances 0.000 description 1
- 125000004435 hydrogen atom Chemical class [H]* 0.000 description 1
- 201000001421 hyperglycemia Diseases 0.000 description 1
- 206010020718 hyperplasia Diseases 0.000 description 1
- 230000003463 hyperproliferative effect Effects 0.000 description 1
- 229960001001 ibritumomab tiuxetan Drugs 0.000 description 1
- 229960000908 idarubicin Drugs 0.000 description 1
- 229960001101 ifosfamide Drugs 0.000 description 1
- HOMGKSMUEGBAAB-UHFFFAOYSA-N ifosfamide Chemical compound ClCCNP1(=O)OCCCN1CCCl HOMGKSMUEGBAAB-UHFFFAOYSA-N 0.000 description 1
- 101150026046 iga gene Proteins 0.000 description 1
- 238000003384 imaging method Methods 0.000 description 1
- 229960002411 imatinib Drugs 0.000 description 1
- 102000018358 immunoglobulin Human genes 0.000 description 1
- 238000009169 immunotherapy Methods 0.000 description 1
- 230000001771 impaired effect Effects 0.000 description 1
- 238000011534 incubation Methods 0.000 description 1
- APFVFJFRJDLVQX-AHCXROLUSA-N indium-111 Chemical compound [111In] APFVFJFRJDLVQX-AHCXROLUSA-N 0.000 description 1
- 230000001939 inductive effect Effects 0.000 description 1
- 230000008595 infiltration Effects 0.000 description 1
- 238000001764 infiltration Methods 0.000 description 1
- 230000002757 inflammatory effect Effects 0.000 description 1
- 230000004054 inflammatory process Effects 0.000 description 1
- 239000007972 injectable composition Substances 0.000 description 1
- 230000003993 interaction Effects 0.000 description 1
- 229940079322 interferon Drugs 0.000 description 1
- 229940047124 interferons Drugs 0.000 description 1
- 229940074383 interleukin-11 Drugs 0.000 description 1
- 229940047122 interleukins Drugs 0.000 description 1
- 230000000968 intestinal effect Effects 0.000 description 1
- 230000003834 intracellular effect Effects 0.000 description 1
- 238000010255 intramuscular injection Methods 0.000 description 1
- 239000007927 intramuscular injection Substances 0.000 description 1
- 239000007928 intraperitoneal injection Substances 0.000 description 1
- 238000007913 intrathecal administration Methods 0.000 description 1
- 150000002500 ions Chemical class 0.000 description 1
- 229910052742 iron Inorganic materials 0.000 description 1
- 230000007794 irritation Effects 0.000 description 1
- 150000002576 ketones Chemical class 0.000 description 1
- 230000032297 kinesis Effects 0.000 description 1
- 238000002356 laser light scattering Methods 0.000 description 1
- 238000002430 laser surgery Methods 0.000 description 1
- 235000010445 lecithin Nutrition 0.000 description 1
- 239000000787 lecithin Substances 0.000 description 1
- 229940067606 lecithin Drugs 0.000 description 1
- 231100000636 lethal dose Toxicity 0.000 description 1
- 208000032839 leukemia Diseases 0.000 description 1
- 201000002364 leukopenia Diseases 0.000 description 1
- 231100001022 leukopenia Toxicity 0.000 description 1
- 230000029226 lipidation Effects 0.000 description 1
- 150000002632 lipids Chemical class 0.000 description 1
- 239000006193 liquid solution Substances 0.000 description 1
- SMEROWZSTRWXGI-HVATVPOCSA-N lithocholic acid Chemical compound C([C@H]1CC2)[C@H](O)CC[C@]1(C)[C@@H]1[C@@H]2[C@@H]2CC[C@H]([C@@H](CCC(O)=O)C)[C@@]2(C)CC1 SMEROWZSTRWXGI-HVATVPOCSA-N 0.000 description 1
- 238000011068 loading method Methods 0.000 description 1
- 230000033001 locomotion Effects 0.000 description 1
- 230000007774 longterm Effects 0.000 description 1
- 239000007937 lozenge Substances 0.000 description 1
- 239000000314 lubricant Substances 0.000 description 1
- 201000005296 lung carcinoma Diseases 0.000 description 1
- 230000002132 lysosomal effect Effects 0.000 description 1
- 210000002540 macrophage Anatomy 0.000 description 1
- 238000012423 maintenance Methods 0.000 description 1
- 230000014759 maintenance of location Effects 0.000 description 1
- 229960004961 mechlorethamine Drugs 0.000 description 1
- 239000002609 medium Substances 0.000 description 1
- 210000003593 megakaryocyte Anatomy 0.000 description 1
- 229960001924 melphalan Drugs 0.000 description 1
- SGDBTWWWUNNDEQ-LBPRGKRZSA-N melphalan Chemical compound OC(=O)[C@@H](N)CC1=CC=C(N(CCCl)CCCl)C=C1 SGDBTWWWUNNDEQ-LBPRGKRZSA-N 0.000 description 1
- GLVAUDGFNGKCSF-UHFFFAOYSA-N mercaptopurine Chemical compound S=C1NC=NC2=C1NC=N2 GLVAUDGFNGKCSF-UHFFFAOYSA-N 0.000 description 1
- 229960001428 mercaptopurine Drugs 0.000 description 1
- 210000003716 mesoderm Anatomy 0.000 description 1
- 239000002207 metabolite Substances 0.000 description 1
- 229920000609 methyl cellulose Polymers 0.000 description 1
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 1
- 239000001923 methylcellulose Substances 0.000 description 1
- 235000010981 methylcellulose Nutrition 0.000 description 1
- 239000000693 micelle Substances 0.000 description 1
- 238000000386 microscopy Methods 0.000 description 1
- 239000002480 mineral oil Substances 0.000 description 1
- 235000010446 mineral oil Nutrition 0.000 description 1
- 229960004857 mitomycin Drugs 0.000 description 1
- 210000001616 monocyte Anatomy 0.000 description 1
- 210000004400 mucous membrane Anatomy 0.000 description 1
- 210000003205 muscle Anatomy 0.000 description 1
- 230000035772 mutation Effects 0.000 description 1
- CMEGANPVAXDBPL-UHFFFAOYSA-N n-(1,2,3-trimethoxy-10-methylsulfanyl-9-oxo-6,7-dihydro-5h-benzo[a]heptalen-7-yl)acetamide Chemical compound C1CC(NC(C)=O)C2=CC(=O)C(SC)=CC=C2C2=C1C=C(OC)C(OC)=C2OC CMEGANPVAXDBPL-UHFFFAOYSA-N 0.000 description 1
- 230000001613 neoplastic effect Effects 0.000 description 1
- GVUGOAYIVIDWIO-UFWWTJHBSA-N nepidermin Chemical compound C([C@@H](C(=O)N[C@@H]([C@@H](C)CC)C(=O)NCC(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CS)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(O)=O)NC(=O)CNC(=O)[C@@H](NC(=O)[C@@H](NC(=O)[C@H](CS)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CS)NC(=O)[C@H](C)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CCCCN)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](C)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@@H](NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CCSC)NC(=O)[C@H](CS)NC(=O)[C@@H](NC(=O)CNC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC=1NC=NC=1)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CS)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)CNC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC=1NC=NC=1)NC(=O)[C@H](CO)NC(=O)[C@H](CC(C)C)NC(=O)[C@H]1N(CCC1)C(=O)[C@H](CS)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CO)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CO)NC(=O)[C@@H](N)CC(N)=O)C(C)C)[C@@H](C)CC)C(C)C)C(C)C)C1=CC=C(O)C=C1 GVUGOAYIVIDWIO-UFWWTJHBSA-N 0.000 description 1
- 230000007135 neurotoxicity Effects 0.000 description 1
- 231100000228 neurotoxicity Toxicity 0.000 description 1
- 230000007935 neutral effect Effects 0.000 description 1
- 239000002547 new drug Substances 0.000 description 1
- 238000012758 nuclear staining Methods 0.000 description 1
- 108020004707 nucleic acids Proteins 0.000 description 1
- 102000039446 nucleic acids Human genes 0.000 description 1
- 150000007523 nucleic acids Chemical class 0.000 description 1
- 235000015097 nutrients Nutrition 0.000 description 1
- QIQXTHQIDYTFRH-UHFFFAOYSA-N octadecanoic acid Chemical compound CCCCCCCCCCCCCCCCCC(O)=O QIQXTHQIDYTFRH-UHFFFAOYSA-N 0.000 description 1
- OQCDKBAXFALNLD-UHFFFAOYSA-N octadecanoic acid Natural products CCCCCCCC(C)CCCCCCCCC(O)=O OQCDKBAXFALNLD-UHFFFAOYSA-N 0.000 description 1
- 229960002378 oftasceine Drugs 0.000 description 1
- 238000011369 optimal treatment Methods 0.000 description 1
- 235000015205 orange juice Nutrition 0.000 description 1
- 230000003204 osmotic effect Effects 0.000 description 1
- 229940127075 other antimetabolite Drugs 0.000 description 1
- 230000002611 ovarian Effects 0.000 description 1
- 201000003733 ovarian melanoma Diseases 0.000 description 1
- 210000001672 ovary Anatomy 0.000 description 1
- 230000002018 overexpression Effects 0.000 description 1
- 229960001756 oxaliplatin Drugs 0.000 description 1
- DWAFYCQODLXJNR-BNTLRKBRSA-L oxaliplatin Chemical compound O1C(=O)C(=O)O[Pt]11N[C@@H]2CCCC[C@H]2N1 DWAFYCQODLXJNR-BNTLRKBRSA-L 0.000 description 1
- 229940108949 paclitaxel injection Drugs 0.000 description 1
- 230000036407 pain Effects 0.000 description 1
- 238000007911 parenteral administration Methods 0.000 description 1
- 230000036961 partial effect Effects 0.000 description 1
- 230000009054 pathological process Effects 0.000 description 1
- 230000037361 pathway Effects 0.000 description 1
- 230000010412 perfusion Effects 0.000 description 1
- 230000002093 peripheral effect Effects 0.000 description 1
- 201000002524 peritoneal carcinoma Diseases 0.000 description 1
- 230000000144 pharmacologic effect Effects 0.000 description 1
- 238000009522 phase III clinical trial Methods 0.000 description 1
- 208000001297 phlebitis Diseases 0.000 description 1
- 239000008363 phosphate buffer Substances 0.000 description 1
- WTJKGGKOPKCXLL-RRHRGVEJSA-N phosphatidylcholine Chemical compound CCCCCCCCCCCCCCCC(=O)OC[C@H](COP([O-])(=O)OCC[N+](C)(C)C)OC(=O)CCCCCCCC=CCCCCCCCC WTJKGGKOPKCXLL-RRHRGVEJSA-N 0.000 description 1
- 150000008105 phosphatidylcholines Chemical class 0.000 description 1
- 229910052698 phosphorus Inorganic materials 0.000 description 1
- 239000011574 phosphorus Substances 0.000 description 1
- 230000000704 physical effect Effects 0.000 description 1
- NUKCGLDCWQXYOQ-UHFFFAOYSA-N piposulfan Chemical compound CS(=O)(=O)OCCC(=O)N1CCN(C(=O)CCOS(C)(=O)=O)CC1 NUKCGLDCWQXYOQ-UHFFFAOYSA-N 0.000 description 1
- 229950001100 piposulfan Drugs 0.000 description 1
- 230000036470 plasma concentration Effects 0.000 description 1
- 239000004033 plastic Substances 0.000 description 1
- 229920003023 plastic Polymers 0.000 description 1
- 231100000614 poison Toxicity 0.000 description 1
- 239000002574 poison Substances 0.000 description 1
- 239000001267 polyvinylpyrrolidone Substances 0.000 description 1
- 235000013855 polyvinylpyrrolidone Nutrition 0.000 description 1
- 229920000036 polyvinylpyrrolidone Polymers 0.000 description 1
- 239000013641 positive control Substances 0.000 description 1
- OXCMYAYHXIHQOA-UHFFFAOYSA-N potassium;[2-butyl-5-chloro-3-[[4-[2-(1,2,4-triaza-3-azanidacyclopenta-1,4-dien-5-yl)phenyl]phenyl]methyl]imidazol-4-yl]methanol Chemical compound [K+].CCCCC1=NC(Cl)=C(CO)N1CC1=CC=C(C=2C(=CC=CC=2)C2=N[N-]N=N2)C=C1 OXCMYAYHXIHQOA-UHFFFAOYSA-N 0.000 description 1
- 229920001592 potato starch Polymers 0.000 description 1
- CPTBDICYNRMXFX-UHFFFAOYSA-N procarbazine Chemical compound CNNCC1=CC=C(C(=O)NC(C)C)C=C1 CPTBDICYNRMXFX-UHFFFAOYSA-N 0.000 description 1
- 229960000624 procarbazine Drugs 0.000 description 1
- 238000012545 processing Methods 0.000 description 1
- 238000004393 prognosis Methods 0.000 description 1
- 238000011321 prophylaxis Methods 0.000 description 1
- OLBCVFGFOZPWHH-UHFFFAOYSA-N propofol Chemical compound CC(C)C1=CC=CC(C(C)C)=C1O OLBCVFGFOZPWHH-UHFFFAOYSA-N 0.000 description 1
- 229960004134 propofol Drugs 0.000 description 1
- LZFIOSVZIQOVFW-UHFFFAOYSA-N propyl 2-hydroxybenzoate Chemical class CCCOC(=O)C1=CC=CC=C1O LZFIOSVZIQOVFW-UHFFFAOYSA-N 0.000 description 1
- 210000002307 prostate Anatomy 0.000 description 1
- 230000009979 protective mechanism Effects 0.000 description 1
- 239000012460 protein solution Substances 0.000 description 1
- 230000002685 pulmonary effect Effects 0.000 description 1
- 150000003212 purines Chemical class 0.000 description 1
- 150000003230 pyrimidines Chemical class 0.000 description 1
- 239000002534 radiation-sensitizing agent Substances 0.000 description 1
- 206010038038 rectal cancer Diseases 0.000 description 1
- 210000000664 rectum Anatomy 0.000 description 1
- 201000001275 rectum cancer Diseases 0.000 description 1
- 230000009703 regulation of cell differentiation Effects 0.000 description 1
- 230000021014 regulation of cell growth Effects 0.000 description 1
- 201000002793 renal fibrosis Diseases 0.000 description 1
- 230000010076 replication Effects 0.000 description 1
- 239000011347 resin Substances 0.000 description 1
- 229920005989 resin Polymers 0.000 description 1
- 230000000717 retained effect Effects 0.000 description 1
- 150000004508 retinoic acid derivatives Chemical class 0.000 description 1
- 238000012552 review Methods 0.000 description 1
- WUAPFZMCVAUBPE-IGMARMGPSA-N rhenium-186 Chemical compound [186Re] WUAPFZMCVAUBPE-IGMARMGPSA-N 0.000 description 1
- 150000003839 salts Chemical class 0.000 description 1
- 238000005070 sampling Methods 0.000 description 1
- 238000009094 second-line therapy Methods 0.000 description 1
- 238000011519 second-line treatment Methods 0.000 description 1
- 229910052711 selenium Inorganic materials 0.000 description 1
- 239000011669 selenium Substances 0.000 description 1
- 229960003440 semustine Drugs 0.000 description 1
- 210000002966 serum Anatomy 0.000 description 1
- 231100000004 severe toxicity Toxicity 0.000 description 1
- 238000002633 shock therapy Methods 0.000 description 1
- 210000003491 skin Anatomy 0.000 description 1
- 230000036556 skin irritation Effects 0.000 description 1
- 231100000475 skin irritation Toxicity 0.000 description 1
- 150000003384 small molecules Chemical class 0.000 description 1
- 210000000329 smooth muscle myocyte Anatomy 0.000 description 1
- 229940080274 sodium cholesteryl sulfate Drugs 0.000 description 1
- LMPVQXVJTZWENW-KPNWGBFJSA-M sodium;[(3s,8s,9s,10r,13r,14s,17r)-10,13-dimethyl-17-[(2r)-6-methylheptan-2-yl]-2,3,4,7,8,9,11,12,14,15,16,17-dodecahydro-1h-cyclopenta[a]phenanthren-3-yl] sulfate Chemical compound [Na+].C1C=C2C[C@@H](OS([O-])(=O)=O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@H]([C@H](C)CCCC(C)C)[C@@]1(C)CC2 LMPVQXVJTZWENW-KPNWGBFJSA-M 0.000 description 1
- 238000000527 sonication Methods 0.000 description 1
- 239000000600 sorbitol Substances 0.000 description 1
- 235000010356 sorbitol Nutrition 0.000 description 1
- 210000000952 spleen Anatomy 0.000 description 1
- 238000013222 sprague-dawley male rat Methods 0.000 description 1
- 206010041823 squamous cell carcinoma Diseases 0.000 description 1
- 230000000087 stabilizing effect Effects 0.000 description 1
- 238000010561 standard procedure Methods 0.000 description 1
- 235000019698 starch Nutrition 0.000 description 1
- 239000008117 stearic acid Substances 0.000 description 1
- 239000000758 substrate Substances 0.000 description 1
- 229910052717 sulfur Inorganic materials 0.000 description 1
- 239000011593 sulfur Substances 0.000 description 1
- 229960002812 sunitinib malate Drugs 0.000 description 1
- 239000003765 sweetening agent Substances 0.000 description 1
- 238000003786 synthesis reaction Methods 0.000 description 1
- 229920001059 synthetic polymer Polymers 0.000 description 1
- 229960001603 tamoxifen Drugs 0.000 description 1
- 229950007866 tanespimycin Drugs 0.000 description 1
- WBWWGRHZICKQGZ-GIHLXUJPSA-N taurocholic acid Chemical compound C([C@@H]1C[C@H]2O)[C@@H](O)CC[C@]1(C)[C@@H]1[C@@H]2[C@@H]2CC[C@@H]([C@@H](CCC(=O)NCCS(O)(=O)=O)C)[C@@]2(C)[C@H](O)C1 WBWWGRHZICKQGZ-GIHLXUJPSA-N 0.000 description 1
- NRUKOCRGYNPUPR-QBPJDGROSA-N teniposide Chemical compound COC1=C(O)C(OC)=CC([C@@H]2C3=CC=4OCOC=4C=C3[C@@H](O[C@H]3[C@@H]([C@@H](O)[C@@H]4O[C@@H](OC[C@H]4O3)C=3SC=CC=3)O)[C@@H]3[C@@H]2C(OC3)=O)=C1 NRUKOCRGYNPUPR-QBPJDGROSA-N 0.000 description 1
- 229960001278 teniposide Drugs 0.000 description 1
- MPLHNVLQVRSVEE-UHFFFAOYSA-N texas red Chemical compound [O-]S(=O)(=O)C1=CC(S(Cl)(=O)=O)=CC=C1C(C1=CC=2CCCN3CCCC(C=23)=C1O1)=C2C1=C(CCC1)C3=[N+]1CCCC3=C2 MPLHNVLQVRSVEE-UHFFFAOYSA-N 0.000 description 1
- 229940126585 therapeutic drug Drugs 0.000 description 1
- 229940126622 therapeutic monoclonal antibody Drugs 0.000 description 1
- 239000002562 thickening agent Substances 0.000 description 1
- 150000003573 thiols Chemical class 0.000 description 1
- 229960001196 thiotepa Drugs 0.000 description 1
- 230000002992 thymic effect Effects 0.000 description 1
- 229960002175 thyroglobulin Drugs 0.000 description 1
- 230000000451 tissue damage Effects 0.000 description 1
- 231100000827 tissue damage Toxicity 0.000 description 1
- 239000008181 tonicity modifier Substances 0.000 description 1
- 235000012184 tortilla Nutrition 0.000 description 1
- 231100000816 toxic dose Toxicity 0.000 description 1
- 231100000440 toxicity profile Toxicity 0.000 description 1
- 239000012581 transferrin Substances 0.000 description 1
- 230000001052 transient effect Effects 0.000 description 1
- 229910052723 transition metal Inorganic materials 0.000 description 1
- 150000003624 transition metals Chemical class 0.000 description 1
- 230000007723 transport mechanism Effects 0.000 description 1
- QORWJWZARLRLPR-UHFFFAOYSA-H tricalcium bis(phosphate) Chemical compound [Ca+2].[Ca+2].[Ca+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O QORWJWZARLRLPR-UHFFFAOYSA-H 0.000 description 1
- 230000005747 tumor angiogenesis Effects 0.000 description 1
- 230000005751 tumor progression Effects 0.000 description 1
- 208000025883 type III hypersensitivity disease Diseases 0.000 description 1
- OUYCCCASQSFEME-UHFFFAOYSA-N tyrosine Natural products OC(=O)C(N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-UHFFFAOYSA-N 0.000 description 1
- 125000001493 tyrosinyl group Chemical group [H]OC1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])C([H])(N([H])[H])C(*)=O 0.000 description 1
- 238000009281 ultraviolet germicidal irradiation Methods 0.000 description 1
- 201000005112 urinary bladder cancer Diseases 0.000 description 1
- 208000010570 urinary bladder carcinoma Diseases 0.000 description 1
- 210000002229 urogenital system Anatomy 0.000 description 1
- RUDATBOHQWOJDD-UZVSRGJWSA-N ursodeoxycholic acid Chemical compound C([C@H]1C[C@@H]2O)[C@H](O)CC[C@]1(C)[C@@H]1[C@@H]2[C@@H]2CC[C@H]([C@@H](CCC(O)=O)C)[C@@]2(C)CC1 RUDATBOHQWOJDD-UZVSRGJWSA-N 0.000 description 1
- GHCZAUBVMUEKKP-UHFFFAOYSA-N ursodeoxycholic acid glycine-conjugate Natural products OC1CC2CC(O)CCC2(C)C2C1C1CCC(C(CCC(=O)NCC(O)=O)C)C1(C)CC2 GHCZAUBVMUEKKP-UHFFFAOYSA-N 0.000 description 1
- 229960001661 ursodiol Drugs 0.000 description 1
- 229960000653 valrubicin Drugs 0.000 description 1
- ZOCKGBMQLCSHFP-KQRAQHLDSA-N valrubicin Chemical compound O([C@H]1C[C@](CC2=C(O)C=3C(=O)C4=CC=CC(OC)=C4C(=O)C=3C(O)=C21)(O)C(=O)COC(=O)CCCC)[C@H]1C[C@H](NC(=O)C(F)(F)F)[C@H](O)[C@H](C)O1 ZOCKGBMQLCSHFP-KQRAQHLDSA-N 0.000 description 1
- 230000002792 vascular Effects 0.000 description 1
- 210000004509 vascular smooth muscle cell Anatomy 0.000 description 1
- 210000005166 vasculature Anatomy 0.000 description 1
- 210000003462 vein Anatomy 0.000 description 1
- 229960004355 vindesine Drugs 0.000 description 1
- UGGWPQSBPIFKDZ-KOTLKJBCSA-N vindesine Chemical compound C([C@@H](C[C@]1(C(=O)OC)C=2C(=CC3=C([C@]45[C@H]([C@@]([C@H](O)[C@]6(CC)C=CCN([C@H]56)CC4)(O)C(N)=O)N3C)C=2)OC)C[C@@](C2)(O)CC)N2CCC2=C1N=C1[C]2C=CC=C1 UGGWPQSBPIFKDZ-KOTLKJBCSA-N 0.000 description 1
- GBABOYUKABKIAF-GHYRFKGUSA-N vinorelbine Chemical compound C1N(CC=2C3=CC=CC=C3NC=22)CC(CC)=C[C@H]1C[C@]2(C(=O)OC)C1=CC([C@]23[C@H]([C@]([C@H](OC(C)=O)[C@]4(CC)C=CCN([C@H]34)CC2)(O)C(=O)OC)N2C)=C2C=C1OC GBABOYUKABKIAF-GHYRFKGUSA-N 0.000 description 1
- 210000001835 viscera Anatomy 0.000 description 1
- 239000011782 vitamin Substances 0.000 description 1
- 235000013343 vitamin Nutrition 0.000 description 1
- 229940088594 vitamin Drugs 0.000 description 1
- 229930003231 vitamin Natural products 0.000 description 1
- 150000003722 vitamin derivatives Chemical class 0.000 description 1
- 239000008215 water for injection Substances 0.000 description 1
- 208000016261 weight loss Diseases 0.000 description 1
- 235000021241 α-lactalbumin Nutrition 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/14—Particulate form, e.g. powders, Processes for size reducing of pure drugs or the resulting products, Pure drug nanoparticles
- A61K9/141—Intimate drug-carrier mixtures characterised by the carrier, e.g. ordered mixtures, adsorbates, solid solutions, eutectica, co-dried, co-solubilised, co-kneaded, co-milled, co-ground products, co-precipitates, co-evaporates, co-extrudates, co-melts; Drug nanoparticles with adsorbed surface modifiers
- A61K9/146—Intimate drug-carrier mixtures characterised by the carrier, e.g. ordered mixtures, adsorbates, solid solutions, eutectica, co-dried, co-solubilised, co-kneaded, co-milled, co-ground products, co-precipitates, co-evaporates, co-extrudates, co-melts; Drug nanoparticles with adsorbed surface modifiers with organic macromolecular compounds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/16—Amides, e.g. hydroxamic acids
- A61K31/165—Amides, e.g. hydroxamic acids having aromatic rings, e.g. colchicine, atenolol, progabide
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/16—Amides, e.g. hydroxamic acids
- A61K31/17—Amides, e.g. hydroxamic acids having the group >N—C(O)—N< or >N—C(S)—N<, e.g. urea, thiourea, carmustine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/28—Compounds containing heavy metals
- A61K31/282—Platinum compounds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/335—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin
- A61K31/337—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin having four-membered rings, e.g. taxol
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/4353—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom ortho- or peri-condensed with heterocyclic ring systems
- A61K31/436—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom ortho- or peri-condensed with heterocyclic ring systems the heterocyclic ring system containing a six-membered ring having oxygen as a ring hetero atom, e.g. rapamycin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/505—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim
- A61K31/517—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim ortho- or peri-condensed with carbocyclic ring systems, e.g. quinazoline, perimidine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/505—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim
- A61K31/519—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim ortho- or peri-condensed with heterocyclic rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/535—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with at least one nitrogen and one oxygen as the ring hetero atoms, e.g. 1,2-oxazines
- A61K31/5375—1,4-Oxazines, e.g. morpholine
- A61K31/5377—1,4-Oxazines, e.g. morpholine not condensed and containing further heterocyclic rings, e.g. timolol
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/555—Heterocyclic compounds containing heavy metals, e.g. hemin, hematin, melarsoprol
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/66—Phosphorus compounds
- A61K31/675—Phosphorus compounds having nitrogen as a ring hetero atom, e.g. pyridoxal phosphate
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/69—Boron compounds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7028—Compounds having saccharide radicals attached to non-saccharide compounds by glycosidic linkages
- A61K31/7034—Compounds having saccharide radicals attached to non-saccharide compounds by glycosidic linkages attached to a carbocyclic compound, e.g. phloridzin
- A61K31/704—Compounds having saccharide radicals attached to non-saccharide compounds by glycosidic linkages attached to a carbocyclic compound, e.g. phloridzin attached to a condensed carbocyclic ring system, e.g. sennosides, thiocolchicosides, escin, daunorubicin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7042—Compounds having saccharide radicals and heterocyclic rings
- A61K31/7052—Compounds having saccharide radicals and heterocyclic rings having nitrogen as a ring hetero atom, e.g. nucleosides, nucleotides
- A61K31/706—Compounds having saccharide radicals and heterocyclic rings having nitrogen as a ring hetero atom, e.g. nucleosides, nucleotides containing six-membered rings with nitrogen as a ring hetero atom
- A61K31/7064—Compounds having saccharide radicals and heterocyclic rings having nitrogen as a ring hetero atom, e.g. nucleosides, nucleotides containing six-membered rings with nitrogen as a ring hetero atom containing condensed or non-condensed pyrimidines
- A61K31/7068—Compounds having saccharide radicals and heterocyclic rings having nitrogen as a ring hetero atom, e.g. nucleosides, nucleotides containing six-membered rings with nitrogen as a ring hetero atom containing condensed or non-condensed pyrimidines having oxo groups directly attached to the pyrimidine ring, e.g. cytidine, cytidylic acid
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7042—Compounds having saccharide radicals and heterocyclic rings
- A61K31/7052—Compounds having saccharide radicals and heterocyclic rings having nitrogen as a ring hetero atom, e.g. nucleosides, nucleotides
- A61K31/706—Compounds having saccharide radicals and heterocyclic rings having nitrogen as a ring hetero atom, e.g. nucleosides, nucleotides containing six-membered rings with nitrogen as a ring hetero atom
- A61K31/7064—Compounds having saccharide radicals and heterocyclic rings having nitrogen as a ring hetero atom, e.g. nucleosides, nucleotides containing six-membered rings with nitrogen as a ring hetero atom containing condensed or non-condensed pyrimidines
- A61K31/7068—Compounds having saccharide radicals and heterocyclic rings having nitrogen as a ring hetero atom, e.g. nucleosides, nucleotides containing six-membered rings with nitrogen as a ring hetero atom containing condensed or non-condensed pyrimidines having oxo groups directly attached to the pyrimidine ring, e.g. cytidine, cytidylic acid
- A61K31/7072—Compounds having saccharide radicals and heterocyclic rings having nitrogen as a ring hetero atom, e.g. nucleosides, nucleotides containing six-membered rings with nitrogen as a ring hetero atom containing condensed or non-condensed pyrimidines having oxo groups directly attached to the pyrimidine ring, e.g. cytidine, cytidylic acid having two oxo groups directly attached to the pyrimidine ring, e.g. uridine, uridylic acid, thymidine, zidovudine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K33/00—Medicinal preparations containing inorganic active ingredients
- A61K33/24—Heavy metals; Compounds thereof
- A61K33/243—Platinum; Compounds thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/38—Albumins
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
- A61K39/39533—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals
- A61K39/39558—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals against tumor tissues, cells, antigens
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/30—Macromolecular organic or inorganic compounds, e.g. inorganic polyphosphates
- A61K47/42—Proteins; Polypeptides; Degradation products thereof; Derivatives thereof, e.g. albumin, gelatin or zein
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/62—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being a protein, peptide or polyamino acid
- A61K47/64—Drug-peptide, drug-protein or drug-polyamino acid conjugates, i.e. the modifying agent being a peptide, protein or polyamino acid which is covalently bonded or complexed to a therapeutically active agent
- A61K47/643—Albumins, e.g. HSA, BSA, ovalbumin or a Keyhole Limpet Hemocyanin [KHL]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/69—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the conjugate being characterised by physical or galenical forms, e.g. emulsion, particle, inclusion complex, stent or kit
- A61K47/6921—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the conjugate being characterised by physical or galenical forms, e.g. emulsion, particle, inclusion complex, stent or kit the form being a particulate, a powder, an adsorbate, a bead or a sphere
- A61K47/6927—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the conjugate being characterised by physical or galenical forms, e.g. emulsion, particle, inclusion complex, stent or kit the form being a particulate, a powder, an adsorbate, a bead or a sphere the form being a solid microparticle having no hollow or gas-filled cores
- A61K47/6929—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the conjugate being characterised by physical or galenical forms, e.g. emulsion, particle, inclusion complex, stent or kit the form being a particulate, a powder, an adsorbate, a bead or a sphere the form being a solid microparticle having no hollow or gas-filled cores the form being a nanoparticle, e.g. an immuno-nanoparticle
- A61K47/6931—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the conjugate being characterised by physical or galenical forms, e.g. emulsion, particle, inclusion complex, stent or kit the form being a particulate, a powder, an adsorbate, a bead or a sphere the form being a solid microparticle having no hollow or gas-filled cores the form being a nanoparticle, e.g. an immuno-nanoparticle the material constituting the nanoparticle being a polymer
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K51/00—Preparations containing radioactive substances for use in therapy or testing in vivo
- A61K51/02—Preparations containing radioactive substances for use in therapy or testing in vivo characterised by the carrier, i.e. characterised by the agent or material covalently linked or complexing the radioactive nucleus
- A61K51/04—Organic compounds
- A61K51/08—Peptides, e.g. proteins, carriers being peptides, polyamino acids, proteins
- A61K51/10—Antibodies or immunoglobulins; Fragments thereof, the carrier being an antibody, an immunoglobulin or a fragment thereof, e.g. a camelised human single domain antibody or the Fc fragment of an antibody
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0019—Injectable compositions; Intramuscular, intravenous, arterial, subcutaneous administration; Compositions to be administered through the skin in an invasive manner
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/48—Preparations in capsules, e.g. of gelatin, of chocolate
- A61K9/50—Microcapsules having a gas, liquid or semi-solid filling; Solid microparticles or pellets surrounded by a distinct coating layer, e.g. coated microspheres, coated drug crystals
- A61K9/51—Nanocapsules; Nanoparticles
- A61K9/5107—Excipients; Inactive ingredients
- A61K9/513—Organic macromolecular compounds; Dendrimers
- A61K9/5169—Proteins, e.g. albumin, gelatin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61N—ELECTROTHERAPY; MAGNETOTHERAPY; RADIATION THERAPY; ULTRASOUND THERAPY
- A61N5/00—Radiation therapy
- A61N5/10—X-ray therapy; Gamma-ray therapy; Particle-irradiation therapy
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P15/00—Drugs for genital or sexual disorders; Contraceptives
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/06—Antipsoriatics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/04—Antineoplastic agents specific for metastasis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/08—Vasodilators for multiple indications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B82—NANOTECHNOLOGY
- B82Y—SPECIFIC USES OR APPLICATIONS OF NANOSTRUCTURES; MEASUREMENT OR ANALYSIS OF NANOSTRUCTURES; MANUFACTURE OR TREATMENT OF NANOSTRUCTURES
- B82Y5/00—Nanobiotechnology or nanomedicine, e.g. protein engineering or drug delivery
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K2121/00—Preparations for use in therapy
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K2300/00—Mixtures or combinations of active ingredients, wherein at least one active ingredient is fully defined in groups A61K31/00 - A61K41/00
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Medicinal Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Animal Behavior & Ethology (AREA)
- Veterinary Medicine (AREA)
- Pharmacology & Pharmacy (AREA)
- Epidemiology (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Immunology (AREA)
- Organic Chemistry (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Molecular Biology (AREA)
- Nanotechnology (AREA)
- Biomedical Technology (AREA)
- Physics & Mathematics (AREA)
- Optics & Photonics (AREA)
- Inorganic Chemistry (AREA)
- Gastroenterology & Hepatology (AREA)
- Dermatology (AREA)
- Oncology (AREA)
- Cardiology (AREA)
- Heart & Thoracic Surgery (AREA)
- Zoology (AREA)
- Mycology (AREA)
- Microbiology (AREA)
- Radiology & Medical Imaging (AREA)
- Pathology (AREA)
- Pulmonology (AREA)
- Vascular Medicine (AREA)
- Urology & Nephrology (AREA)
- Endocrinology (AREA)
- Reproductive Health (AREA)
- General Engineering & Computer Science (AREA)
Abstract
Изобретение относится к медицине, а именно к онкологии, и может быть использовано для лечения рака яичников у индивидуума. При этом лечение включает: a) первое лечение, включающее введение индивидууму эффективного количества композиции, содержащей наночастицы, включающие паклитаксел и белок-носитель, и b) второе лечение, включающее лучевую терапию, где первое лечение проводят перед вторым лечением. Изобретение обеспечивает лечение рака яичников у пациента. 21 з.п. ф-лы, 9 ил., 3 табл., 23 пр.
Description
2420-184354RU/031
Родственные заявки
Настоящая заявка испрашивает приоритет предварительной заявки 60/654245, поданной 18 февраля 2005 г., которая полностью включена сюда в качестве ссылки.
Область техники, к которой относится изобретение
Настоящее изобретение относится к способам и композициям для лечения пролиферативных заболеваний путем введения комбинации таксана и, по меньшей мере, одного другого или других лечебных средств, а также других методов лечения, которые можно использовать при лечении пролиферативных заболеваний. В частности, изобретение относится к применению наночастиц, содержащих паклитаксел и альбумин (таких как AbraxaneTM) в комбинации с другими химиотерапевтическими средствами или облучением, которые можно применять для лечения рака.
Описание предшествующего уровня техники
Отсутствие реакции значительного числа опухолей на медикаментозную и/или лучевую терапию представляет собой серьезную проблему при лечении рака. Действительно, это одна из основных причин того, почему многие из наиболее распространенных форм рака человека еще устойчивы к эффективному химиотерапевтическому вмешательству, несмотря на достижения в области химиотерапии.
В настоящее время рак в первую очередь лечат одним или комбинацией трех типов лечения: хирургического лечения, лучевой терапии и химиотерапии. Хирургическое лечение представляет собой традиционный подход, при котором вся или часть опухоли удаляется из организма. В целом, хирургическое лечение эффективно только для лечения ранних стадий рака. Хотя хирургическое лечение иногда эффективно при удалении опухолей, локализующихся в определенных участках, например, в молочной железе, ободочной кишке и коже, его нельзя использовать ни при лечении опухолей, расположенных в других областях, недоступных для хирургов, ни при лечении диссеминированных неопластических состояний, таких как лейкоз. Более чем 50% лиц, страдающих раком, ко времени, когда у них поставлен диагноз, больше не являются кандидатами на эффективное хирургическое лечение. Хирургические процедуры могут увеличить количество метастазов опухолей через систему кровообращения во время операции. Большинство лиц, страдающих раком, не умирают от рака во время постановки диагноза или операции, а скорее от метастазов и рецидива рака.
Другие способы лечения также часто неэффективны. Лучевая терапия эффективна только у лиц, которые имеют клинически локализованное заболевание на ранних или средних стадиях рака, и она неэффективна на поздних стадиях рака с метастазами. Облучение, в целом, направлено на определенную область тела индивидуума, которая содержит патологическую пролиферативную ткань, для доведения до максимума дозы, поглощенной патологической тканью, и минимизации дозы, поглощенной расположенной рядом нормальной тканью. Однако трудно (или невозможно) селективно направить терапевтическое облучение на патологическую ткань. Таким образом, нормальная ткань, расположенная рядом с патологической тканью, также подвержена воздействию потенциально повреждающих доз облучения в течение всего курса лечения. Имеются также некоторые способы лечения, которые требуют воздействия облучения на весь организм индивидуума при процедуре, называемой «полное облучение тела» или «TBI». Поэтому эффективность радиотерапевтических методик в разрушении патологических пролиферативных клеток уравновешивается связанными с ними цитотоксическими эффектами на расположенные рядом нормальные клетки. Ввиду этого, методики лучевой терапии имеют присущий им низкий терапевтический индекс, что приводит к неадекватному лечению большинства опухолей. Даже самые лучшие радиотерапевтические методики могут привести к неполной редукции опухоли, рецидиву опухоли, увеличению опухолевой нагрузки и индукции устойчивых к облучению опухолей.
Химиотерапия включает прерывание клеточной репликации или клеточного метаболизма. Химиотерапия может быть эффективной, но имеются тяжелые побочные эффекты, например, рвота, лейкопения, потеря волос, потеря массы тела и другие токсические эффекты. Ввиду крайне токсичных побочных эффектов многие индивидуумы, страдающие раком, не могут успешно завершить полную схему химиотерапии. Вызванные химиотерапией побочные эффекты оказывают значительное воздействие на качество жизни индивидуума и могут оказывать большое влияние на соблюдение предписанного лечения. Кроме того, неблагоприятные побочные эффекты при применении химиотерапевтических средств представляют собой, в целом, высокую ограничивающую дозу токсичность (DLT) при введении этих препаратов. Например, мукозит представляет собой основную ограничивающую дозу токсичность для нескольких противораковых средств, включая антиметаболитные цитотоксические средства 5-фторурацил, метотрексат и противоопухолевые антибиотики, такие как доксорубицин. Многие из этих вызванных химиотерапией побочных эффектов в случае, если они тяжелые, могут привести к госпитализации или требовать лечения анальгетиками для лечения боли. Некоторые индивидуумы, страдающие раком, умирают от химиотерапии вследствие низкой переносимости химиотерапии. Крайне выраженные побочные эффекты противораковых препаратов вызваны низкой целевой специфичностью таких препаратов. Препараты циркулируют через большинство здоровых органов индивидуума, а также предполагаемые опухоли-мишени. Низкая целевая специфичность, которая вызывает побочные эффекты, также снижает эффективность химиотерапии, потому что лишь часть препаратов правильно нацелена. Эффективность химиотерапии, кроме того, снижается низким удерживанием противораковых препаратов внутри опухолей-мишеней.
Ввиду тяжести и большого количества новообразований, опухолей и рака имеется большая потребность в эффективных способах лечения таких заболеваний или расстройств, которые преодолевают недостатки хирургического, химиотерапевтического и лучевого лечения.
Проблемы химиотерапевтических средств
Проблема лекарственной устойчивости является причиной дополнительного значения комбинированной химиотерапии, поскольку терапия и должна избежать возникновения устойчивых клеток, и уничтожить ранее существующие клетки, которые уже устойчивы к лекарственным препаратам.
Лекарственная устойчивость представляет собой название, которое характеризует обстоятельство, при котором заболевание не реагирует на лечение лекарственным препаратом или препаратами. Лекарственная устойчивость может быть или эндогенной, означающей, что заболевание никогда не реагировало на препарат или препараты, или она может быть приобретенной, означающей, что заболевание прекращает реагировать на препарат или препараты, на которые заболевание ранее реагировало. Устойчивость к множеству препаратов (MDR) представляет собой специфический тип лекарственной устойчивости, которая характеризуется перекрестной устойчивостью заболевания более чем к одной функциональности и/или структурно не связанных препаратов. Устойчивость к множеству препаратов в области онкологии более детально обсуждается в документах «Detoxification Mechanisms and Tumor Cell Resistance to Anticancer Drugs» Kuzmich и Tew, в частности, раздел VII «The Multidrug-Resistant Phenotype (MDR)» Medical Research Reviews, Vol.11, No.2, 185-217, (раздел VII, pp.208-213) (1991); и в «Multidrug Resistance and Chemosensitization: Therapeutic Implications for Cancer Chemotherapy» Georges, Sharom и Ling, Advances in Pharmacology, Vol.21, 185-220 (1990).
Одна форма устойчивости к множеству препаратов (MDR) опосредуется связанным с мембраной энергетически зависимым насосом выходящего потока 170-180 кД, обозначенным как Р-гликопротеид (P-gp). Было показано, что Р-гликопротеид играет основную роль в эндогенной и приобретенной устойчивости ряда человеческих опухолей к гидрофобным, натуральным продуктовым препаратам. Препараты, которые действуют в качестве субстратов для P-gp и в последующем детоксифицируются им, включают алкалоиды винки (винкристин и винбластин), антрациклины (адриамицин) и эпиподофиллотоксины (этопозид). Хотя связанная с P-gp MDR представляет собой основную детерминанту при устойчивости опухолевых клеток к химиотерапевтических средствам, ясно, что феномен MDR является многофакторным и включает ряд различных механизмов.
Основным осложнением химиотерапии рака и противовирусной химиотерапии является повреждение клеток костного мозга или подавление их функции. В частности, химиотерапия повреждает или разрушает гематопоэтические клетки-предшественники, в первую очередь обнаруживаемые в костном мозге и селезенке, нарушая продукцию новых клеток крови (гранулоцитов, лимфоцитов, эритроцитов, моноцитов, тромбоцитов и т.д.). Например, лечение лиц, страдающих раком, 5-фторурацилом снижает количество лейкоцитов (лимфоцитов и/или гранулоцитов) и может привести к повышенной восприимчивости индивидуумов к инфекции. Многие индивидуумы, страдающие раком, умирают от инфекции или других последствий гематопоэтической недостаточности вследствие химиотерапии. Химиотерапевтические средства могут также привести к субнормальному образованию тромбоцитов, что создает склонность к кровотечению. Ингибирование продукции эритроцитов может привести к анемии. У некоторых индивидуумов, страдающих раком, риск повреждения гематопоэтической системы или других важных тканей часто ограничивает возможность увеличения химиотерапевтических доз химиотерапевтических средств до достаточно высокого уровня, обеспечивающего хорошую противоопухолевую или противовирусную эффективность. Циклы химиотерапии повторными или высокими дозами могут быть ответственны за тяжелое истощение запасов стволовых клеток, ведущее к серьезным долгосрочным гематопоэтическим последствиям и истощению костного мозга.
Предотвращение или защита от побочных эффектов химиотерапии принесли бы большую пользу лицам, страдающим раком. По поводу угрожающих жизни побочных эффектов усилия были сконцентрированы на изменении дозы схем введения химиотерапевтических средств для снижения побочных эффектов. Становятся доступными другие варианты, такие как применение фактора, стимулирующего колонии гранулоцитов (G-CSF), фактора, стимулирующего колонии гранулоцитов-макрофагов (GM-CSF), эпидермального ростового фактора (EGF), интерлейкина 11, эритропоэтина, тромбопоэтина, фактора развития и роста мегакариоцитов, фактора стволовых клеток, FLT-лиганда, а также интерлейкинов 1, 3, 6 и 7 для увеличения количества нормальных клеток в различных тканях перед началом химиотерапии (см. Jimenez и Yunis, Cancer Research 52:413-415; 1992). Хотя механизмы защиты этими факторами не полностью понятны, они вероятнее всего связаны с увеличением количества нормальных имеющих решающее значение клеток-мишеней перед лечением цитотоксическими средствами, а не с увеличенным выживанием клеток после химиотерапии.
Нацеливание химиотерапевтических средств для лечения опухолей
И рост, и метастазирование солидных опухолей являются зависимыми от ангиогенеза (Folkman, J. Cancer Res., 46, 467-73 (1986); Folkman, J. Nat. Cancer Inst., 82, 4-6 (1989); Folkman et al., «Tumor Angiogenesis» Chapter 10, pp.206-32, in The Molecular Basis of Cancer, Mendelsohn et al., eds. (W.B. Saunders, 1995)). Например, было показано, что опухоли, которые увеличиваются до диаметра более чем 2 мм, должны получить свое собственное кровоснабжение, и они достигают этого индукцией роста новых капиллярных кровеносных сосудов. После того как эти новые кровеносные сосуды внедряются в опухоль, они обеспечивают поступление питательных веществ и ростовых факторов, существенных для роста опухоли, а также служат средством для проникновения опухолевых клеток в систему кровообращения и метастазирования в отдаленные участки, такие как печень, легкие или кости (Weidner, New Eng. J. Med., 324(1), 1-8 (1991)). При использовании в качестве лекарственных препаратов у животных, пораженных опухолями, естественные ингибиторы ангиогенеза могут предотвратить рост мелких опухолей (O’Reilly et al., Cell, 79, 315-28 (1994)). Действительно, в некоторых протоколах применение таких ингибиторов ведет к обратному развитию и состоянию покоя опухолей даже после прекращения лечения (O’Reilly et al., Cell, 88, 277-85 (1997)). Более того, подача ингибиторов ангиогенеза в определенные опухоли может потенцировать их реакцию на другие схемы лечения (например, химиотерапию) (см., например, Teischer et al., Int. J. Cancer, 57, 920-25 (1994)).
Протеин и тирозин киназы катализируют фосфорилирование определенных остатков тирозила в различных белках, участвующих в регуляции роста и дифференциации клеток (A.F. Wilks, Progress in Growth Factor Research, 1990, 2, 97-111; S.A. Courtneidge, Dev. Supp.l, 1993, 57-64; J.A. Cooper, Semin. Cell Biol., 1994, 5(6), 377-387; R.F. Paulson, Semin. Immunol., 1995, 7(4), 267-277; A.C. Chan, Curr. Opin. Immunol., 1996, 8(3), 394-401). Протеин тирозин киназы можно широко классифицировать как рецепторные (например, EGFr, c-erbB-2, c-met, tie-2, PDGFr, FGFr) или не рецепторные (например, c-src, Ick, Zap70) киназы. Неадекватная или неконтролируемая активация многих из этих киназ, т.е., было показано, что аберрантная активность протеин тирозин киназы, например, путем избыточной экспрессии или мутации, приводит к неконтролируемому клеточному росту. Например, повышенная активность рецептора эпидермального ростового фактора (EGFR) была вовлечена в патологический процесс при немелкоклеточном раке легких, мочевого пузыря и раковых опухолях головы и шеи, а повышенная активность c-erbB-2 – при раке молочной железы, яичников, желудка и поджелудочной железы. Таким образом, ингибирование протеин тирозин киназ должно быть полезным в качестве лечения по поводу таких опухолей, как те, которые описаны выше.
Ростовые факторы представляют собой вещества, которые вызывают пролиферацию клеток обычно связыванием со специфическими рецепторами на клеточных поверхностях. Эпидермальный ростовой фактор (EGF) вызывает пролиферацию разнообразных клеток in vivo и требуется для роста большинства культивированных клеток. Рецептор EGF представляет собой распределенный по мембране гликопротеид 170-180 кД, который можно выявить на широком разнообразии типов клеток. Внеклеточный N-концевой домен рецептора является высоко гликозилированным и связывает антитела против EGF, которые селективно связываются с EGFR. Средства, которые конкурентно связываются с EGFR, использовались для лечения определенных типов рака, поскольку многие опухоли мезодермального и эктодермального происхождения избыточно экспрессируют рецептор EGF. Например, было показано, что рецептор EGF избыточно экспрессирован во многих глиомах, плоскоклеточных карциномах, карциномах молочных желез, меланомах, инвазивных карциномах мочевого пузыря и раковых опухолях пищевода. Попытки использовать систему EGFR для противоопухолевой терапии, в целом, включали применение моноклональных антител против EGFR. Кроме того, исследования с первичными опухолями молочных желез показали корреляцию между высокой экспрессией EGFR и наличием метастазов, более высокими скоростями пролиферации и более коротким выживанием индивидуумов.
Herlyn et al. в патенте США № 5470571 описывают применение меченого радиоактивной меткой Mab 425 для лечения глиом, которые экспрессируют EGFR. Herlyn et al. сообщают, что антитела против EGFR могут или стимулировать, или ингибировать рост и пролиферацию раковых клеток. Сообщалось, что другие моноклональные антитела, имеющие специфичность к EGFR, или отдельно, или конъюгированному с цитотоксическим соединением, эффективны для лечения определенных типов рака. Bendig et al. в патенте США № 5558864 описывают терапевтические моноклональные антитела (Mab) против EGFR для конкурентного связывания с EGFR. Heimbrook et al. в патенте США № 5690928 описывают применение EGF, конденсированного с полученными из вида Pseudomonas эндотоксинами для лечения рака мочевого пузыря. Brown et al. в патенте США № 5859018 описывают способ лечения заболеваний, характеризуемых клеточной гиперпролиферацией, опосредованной, наряду с другими факторами, EGF.
Методы введения химиотерапевтических средств
Людей, у которых диагностирован рак, часто лечат одним или множественными химиотерапевтическими средствами для уничтожения раковых клеток в первичном опухолевом участке или в отдаленных участках, куда метастазировал рак. Химиотерапевтическое лечение обычно проводится одной или несколькими большими дозами или в течение различных периодов времени, от нескольких недель до нескольких месяцев. Однако химиотерапия повторными циклами или высокими дозами может быть ответственна за увеличенную токсичность и тяжелые побочные эффекты.
Новые исследования свидетельствуют о том, что метрономная химиотерапия, частое введение цитотоксических средств низкими дозами без длительных перерывов, без введения препаратов нацелена на активированные эндотелиальные клетки в сосудистой сети опухоли. Ряд преклинических исследований продемонстрировал более высокую противоопухолевую эффективность, сильные антиангиогенные эффекты и сниженную токсичность и побочные эффекты (например, миелосуппрессию) метрономных схем по сравнению со схемами введения максимальных переносимых доз (MTD) (Bocci et al., Cancer Res, 62:6938-6943, (2002); Bocci et al., PNAS, vol, 100(22):12917-12922, (2003); и Bertolini et al, Cancer Res, 63(15):4342-4346, (2003)). Остается неясным, все ли химиотерапевтические препараты оказывают одинаковые эффекты, или некоторые лучше подходят для таких схем, чем другие. Тем не менее, представляется, что метрономная химиотерапия эффективна в преодолении некоторых из основных недостатков, связанных с химиотерапией.
Химиотерапевтические средства
Было показано, что паклитаксел оказывает значительные антинеопластические и противораковые эффекты при устойчивом к медикаментозной терапии раке яичников и показал превосходную противоопухолевую активность при широком разнообразии моделей опухолей, а также ингибирует ангиогенез при использовании в очень низких дозах (Grant et al., Int. J. Cancer, 2003). Однако плохая растворимость паклитаксела в воде создает проблему для введения людям. Действительно, доставка препаратов, которым присуща нерастворимость или плохая растворимость в водной среде, может быть серьезно нарушена, если пероральная доставка неэффективна. Соответственно, используемые в настоящее время препаративные формы паклитаксела (например, Taxol®) требуют Cremophor® для солюбилизации препарата. Присутствие Cremophor® в этой препаративной форме было связано с тяжелыми реакциями гиперчувствительности у животных (Lorenz et al., Agents Actions 7:63-67 (1987)) и людей (Weiss et al., J. Clin. Oncol. 8:1263-68 (1990)) и, следовательно, требует предварительного введения индивидуумам кортикостероидов (дексаметазона) и антигистаминных препаратов. Сообщалось также, что клинически релевантные концентрации носителя препаративной формы Cremophor® EL в Taxol® сводит к нулю антиангиогенную активность паклитаксела, свидетельствуя о том, что может потребоваться применение этого средства или других противораковых препаратов, включенных в состав Cremophor® EL, в гораздо более высоких дозах, чем те, которые предполагаются для достижения эффективной метрономной химиотерапии (Ng et al., Cancer Res., 64:821-824 (2004)). Таким образом, может быть нивелировано преимущество отсутствия нежелательных побочных эффектов, связанных со схемами низких доз паклитаксела в сравнении с обычной химиотерапией MTD. См. также патентную публикацию США № 2004/0143004; WO 00/64437.
AbraxaneTM представляет собой лишенный Cremophor® EL связанный с альбумином паклитаксел в виде наночастиц
Преклинические модели показали значительное улучшение безопасности и эффективности AbraxaneTM, по сравнению с Taxol® (Desai et al., EORTC-NCI-AACR, 2004), и у индивидуумов с метастатическим раком молочных желез (O'Shaughnessy et al., San Antonio Breast Cancer Symposium, Abstract #1122, Dec. 2003). Возможно, это связано с отсутствием поверхностно-активных веществ (например, Cremophor® или Tween® 80, используемых соответственно в Taxol® и Taxotere®) в Abraxane® и/или предпочтительным использованием механизма транспорта на основе альбумина, использующего gp60/кавеолы на микрососудистых эндотелиальных клетках (Desai et al., EORTC-NCI-AACR, 2004). Кроме того, было показано, что и Cremophor®, и Tween® 80 сильно ингибируют связывание паклитаксела с альбумином, возможно, воздействуя на транспорт, основанный на альбумине (Desai et al., EORTC-NCI-AACR, 2004).
IDN5109 (Ortataxel) представляет собой новый таксан, проходящий в настоящее время фазу II испытания, выбранный за его отсутствие перекрестной устойчивости в линиях опухолевых клеток, экспрессирующих фенотип, устойчивый к множеству препаратов (MDR/Pgp), ингибирование Р-гликопротеина (Pgp) (Minderman; Cancer Chemother. Pharmacol. 2004; 53:363-9). Ввиду его гидрофобности, IDN5109 в настоящее время включен в состав в поверхностно-активном веществе Tween® 80 (тот же носитель, что и Taxotere®). Удаление поверхностно-активных веществ из препаративных форм таксана в случае связанного с альбумином паклитаксела в виде наночастиц (AbraxaneTM) проявило улучшения безопасности и эффективности в сравнении с их аналогами, содержащими поверхностно-активные вещества (O'Shaughnessy et al., San Antonio Breast Cancer Symposium, Abstract #1122, Dec. 2003). Tween® 80 также сильно ингибировал связывание таксана, паклитаксела с альбумином, возможно нарушая основанный на альбумине транспорт лекарственных препаратов через рецептор gp60 на микрососудистых эндотелиальных клетках (Desai et al., EORTC-NCI-AACR, 2004).
О противоопухолевой активности колхицина, который является основным алкалоидом осеннего крокуса Colchicum autumnale, и африканской глориозы Gloriosa superba впервые сообщалось в начале XX века. Выяснение его структуры было окончательно завершено по рентгеновским исследованиям и ряду случаев полного синтеза (см. Shiau et al., J. Pharm. Sci. 1978, 67(3) 394-397). Считают, что колхицин представляет собой митотический яд, в частности, в тимусных, кишечных и гематопоэтических клетках, который действует в качестве веретенного яда и блокирует кинез. Считают, что его воздействие на митотическое веретено представляет особый случай его воздействий на различные организованные, лабильные, волоконные системы, связанные со структурой и движением.
Димер тиоколхицина IDN5404 был выбран, благодаря его активности в подгруппе клеток яичников человека, устойчивой к цисплатину и топотекану A2780-CIS и A2780-TOP. Этот эффект был связан с двойными механизмами действия, т.е. активностью микротрубочек, как в алкалоидах винки, и ингибирующим эффектом топоизомеразы I, отличным от камптотецина (Raspaglio, Biochemical Pharmacology 69:113-121 (2005)).
Было обнаружено, что композиции таксана в виде наночастиц (такие как связанный с альбумином паклитаксел (AbraxaneTM)) имеют значительно более низкую токсичность, чем другие таксаны, подобные Taxol® и Taxotere®, со значительно улучшенными исходами и по безопасности, и по эффективности.
Было обнаружено, что комбинированная химиотерапия, например, комбинирование одного или более химиотерапевтических средств или других способов лечения, например, комбинирование химиотерапии с облучением или хирургическим лечением, более успешна, чем соответственно отдельные химиотерапевтические средства или отдельные способы лечения.
Другие ссылки включают патентную публикацию США № 2006/0013819; патентную публикацию США № 2006/0003931; WO 05/117986; WO 05/117978 и WO 05/000900.
Требуются более эффективные способы лечения по поводу пролиферативных заболеваний, в частности, рака.
Описания всех публикаций, патентов и патентных заявок и опубликованных патентных заявок, приводимых здесь, полностью включены сюда в качестве ссылки.
Краткое описание сущности изобретения
Настоящее изобретение предоставляет способы лечения пролиферативных заболеваний, таких как рак. Изобретение предоставляет способы комбинированной терапии для лечения пролиферативных заболеваний (таких как рак), включающие: а) первое лечение, содержащее введение индивидууму эффективного количества композиции, содержащей наночастицы, включающие таксан (такой как паклитаксел) и носитель-белок (такой как альбумин), и b) второе лечение, такое как химиотерапия, лучевая терапия, хирургическое лечение или их комбинация. В другом аспекте предоставляются способы введения индивидууму композиции, содержащей наночастицы, включающие таксан (такой как паклитаксел) и носитель-белок (такой как альбумин), на основании метрономной схемы.
В некоторых вариантах осуществления изобретение предоставляет способ лечения пролиферативного заболевания (такого как рак) у индивидуума, содержащий введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие таксан и белок-носитель (такой как альбумин), и b) эффективного количества, по меньшей мере, одного другого химиотерапевтического средства. В некоторых вариантах осуществления изобретение предоставляет способ лечения пролиферативного заболевания (такого как рак) у индивидуума, включающий введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие таксан и белок (такой как AbraxaneTM), и b) эффективного количества, по меньшей мере, одного другого химиотерапевтического средства. В некоторых вариантах осуществления химиотерапевтическое средство представляет собой любой из (а в некоторых вариантах осуществления выбран из группы, состоящей из) антиметаболитов (включая аналоги нуклеозидов); средства на основе платины, алкилирующие агенты, ингибиторы тирозин киназы, антрациклиновые антибиотики, алкалоиды винки, ингибиторы протеасом, макролиды и ингибиторы топоизомеразы. В некоторых вариантах осуществления химиотерапевтическое средство представляет собой средство на основе платины, такое как карбоплатин.
В некоторых вариантах осуществления композиция, содержащая наночастицы (также именуемая «композицией в виде наночастиц»), и химиотерапевтическое средство вводятся одновременно, или в одной и той же композиции, или в отдельных композициях. В некоторых вариантах осуществления композиция в виде наночастиц и химиотерапевтическое средство вводятся последовательно, т.е. композиция в виде наночастиц вводится или перед или после введения химиотерапевтического средства. В некоторых вариантах осуществления введение композиции в виде наночастиц и химиотерапевтического средства происходит одновременно, т.е. периоды введения композиции в виде наночастиц и химиотерапевтического средства перекрывают друг друга. В некоторых вариантах осуществления введение композиции в виде наночастиц и химиотерапевтического средства происходит не одновременно. Например, в некоторых вариантах осуществления, введение композиции в виде наночастиц прекращается перед введением химиотерапевтического средства. В некоторых вариантах осуществления введение химиотерапевтического средства прекращается перед введением композиции в виде наночастиц.
В некоторых вариантах осуществления первое терапевтическое средство таксан представляет собой паклитаксел, связанный с альбумином в виде частиц, описанный, например, в патенте США № 6566405, и имеющийся в продаже под торговым названием AbraxaneTM. Кроме того, первое терапевтическое средство таксан также считается представляющим собой доцетаксел, связанный с альбумином в виде наночастиц, описанный, например, в опубликованной заявке на патент США 2005/0004002А1.
В другом аспекте предоставляется способ лечения пролиферативного заболевания (такого как рак) у индивидуума, включающий: а) первое лечение, включающее введение индивидууму композиции, содержащей наночастицы, включающие таксан и белок-носитель (такой как альбумин), и b) второе лечение, включающее лучевую терапию, хирургическое лечение или их комбинацию. В некоторых вариантах осуществления предоставляется способ лечения пролиферативного заболевания (такого как рак) у индивидуума, включающий: а) первое лечение, включающее введение индивидууму композиции, содержащей наночастицы, включающие паклитаксел и альбумин (такой как AbraxaneTM), и b) второе лечение, включающее лучевую терапию, хирургическое лечение или их комбинацию. В некоторых вариантах осуществления второе лечение представляет собой лучевую терапию. В некоторых вариантах осуществления второе лечение представляет собой хирургическое лечение. В некоторых вариантах осуществления первое лечение проводится перед вторым лечением. В некоторых вариантах осуществления первое лечение проводится после второго лечения.
В другом аспекте способ включает проведение у млекопитающего, имеющего пролиферативное заболевание (такое как рак), комбинированного лечения, включающего первое лечение, включающее таксан, и второе лечение, выбранное из группы, состоящей из химиотерапевтического средства и облучения, или их комбинации. Комбинированное лечение можно проводить любыми из разнообразных путей, такими как последовательно или одновременно, и, в случае последовательного лечения, таксан можно вводить перед или после второго лечения, хотя предпочтительно, чтобы первое лечение, включающее таксан, проводилось первым. Также понятно, что второе лечение может включать более чем одно химиотерапевтическое средство.
Настоящее изобретение также предоставляет метрономные схемы лечения. В некоторых вариантах осуществления предоставляется способ введения композиции, содержащей наночастицы, включающие таксан и белок-носитель (такой как альбумин), где композиция в виде наночастиц вводится в течение периода, по меньшей мере, 1 месяц, где интервал между каждым введением составляет не более чем примерно 1 неделю, и где доза токсана при каждом введении составляет от примерно 0,25% до примерно 25% его максимальной переносимой дозы в соответствии с традиционными схемами введения. В некоторых вариантах осуществления предоставляется способ введения композиции, содержащей наночастицы, включающие паклитаксел и белок (такой как AbraxaneTM), где композиция в виде наночастиц вводится в течение периода, по меньшей мере, 1 месяц, где интервал между каждым введением составляет не более чем примерно 1 неделю, и где доза паклитаксела при каждом введении составляет от примерно 0,25% до примерно 25% его максимальной переносимой дозы в соответствии с традиционными схемами введения. В некоторых вариантах осуществления доза таксана (такого как паклитаксел, например, AbraxaneTM) на введение составляет менее чем примерно любая из доз, составляющих 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 11%, 12%, 13%, 14%, 15%, 18%, 20%, 22%, 24% или 25% максимальной переносимой дозы. В некоторых вариантах осуществления композиция в виде наночастиц вводится, по меньшей мере, с любой частотой из 1, 2, 3, 4, 5, 6, 7 (т.е. ежедневно) раз в неделю. В некоторых вариантах осуществления интервалы между введениями составляют менее чем примерно любой из периодов 7 дней, 6 дней, 5 дней, 4 дня, 3 дня, 2 дня и 1 день. В некоторых вариантах осуществления композиция в виде наночастиц вводится в течение периода, по меньшей мере, любой длительности из 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 18, 24, 30 и 36 месяцев.
В некоторых вариантах осуществления предоставляется способ введения композиции, содержащей наночастицы, включающие таксан и белок (такой как альбумин), где таксан вводится в течение периода, по меньшей мере, 1 месяц, где интервал между каждым приемом больше, чем, по меньшей мере, 1 неделя, и где доза таксана при каждом введении составляет от примерно 0,25 мг/м2 до примерно 25 мг/м2. В некоторых вариантах осуществления предоставляется способ введения композиции, содержащей наночастицы, включающие паклитаксел и альбумин (такой как AbraxaneTM), и белок-носитель (такой как альбумин), где паклитаксел вводится в течение периода, по меньшей мере, 1 месяц, где интервал между каждым введением составляет не более чем примерно 1 неделю, и где доза таксана при каждом введении составляет от примерно 0,25 мг/м2 до примерно 25 мг/м2. В некоторых вариантах осуществления доза таксана (такого как паклитаксел, например, AbraxaneTM) на введение составляет менее чем примерно любая из доз, составляющих 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 18, 20, 22 и 25 мг/м2. В некоторых вариантах осуществления композиция в виде наночастиц вводится, по меньшей мере, с любой частотой из 1, 2, 3, 4, 5, 6, 7 (т.е. ежедневно) раз в неделю. В некоторых вариантах осуществления интервалы между каждым введением составляют менее чем примерно любой из периодов 7 дней, 6 дней, 5 дней, 4 дня, 3 дня, 2 дня и 1 день. В некоторых вариантах осуществления композиция в виде наночастиц вводится в течение периода, по меньшей мере, любой длительности из 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 18, 24, 30 и 36 месяцев.
Способы по изобретению в целом включают введение композиции, содержащей наночастицы, включающие таксан и белок-носитель. В некоторых вариантах осуществления композиция в виде наночастиц содержит наночастицы, включающие паклитаксел и альбумин. В некоторых вариантах осуществления наночастицы паклитаксела/альбумина имеют средний диаметр не более чем примерно 200 нм. В некоторых вариантах осуществления композиция паклитаксела/альбумина в виде наночастиц по существу не содержит (например, не содержит) поверхностно-активное вещество (такое как Cremophor). В некоторых вариантах осуществления соотношение между массой альбумина и паклитаксела в композиции составляет примерно 18:1 или менее, например, примерно 9:1 или менее. В некоторых вариантах осуществления паклитаксел покрыт альбумином. В некоторых вариантах осуществления наночастицы паклитаксела/альбумина имеют средний диаметр не более чем примерно 200 нм, и композиция паклитаксела/альбумина по существу не содержит (например, не содержит) поверхностно-активное вещество (такое как Cremophor). В некоторых вариантах осуществления наночастицы паклитаксела/альбумина имеют средний диаметр не более чем примерно 200 нм, и паклитаксел покрыт альбумином. Предусмотрены также другие комбинации указанных выше характеристик. В некоторых вариантах осуществления композиция в виде наночастиц представляет собой AbraxaneTM. Композиции в виде наночастиц, содержащие другие таксаны (такие как доцетаксел и ортатаксел), могут также иметь одну или более из указанных выше характеристик.
Эти и другие аспекты и преимущества настоящего изобретения станут очевидными из последующего подробного описания и прилагаемой формулы изобретения. Следует понимать, что одно, некоторое или все свойства описанных здесь различных вариантов осуществления могут комбинироваться для образования других вариантов осуществления настоящего изобретения.
Краткое описание чертежей
На фиг.1А показано воздействие ABI-007 на ангиогенез аортальных колец крыс. На фиг.1В показано воздействие ABI-007 на пролиферацию эндотелиальных клеток человека. На фиг.1С показано воздействие ABI-007 на формирование трубки из эндотелиальных клеток.
На фиг.2 показано определение оптимальной биологической дозы ABI-007 для метрономного введения. Показаны уровни жизнеспособных циркулирующих эндотелиальных предшественников (СЕР) в периферической крови мышей Balb/cJ в ответ на возрастающие дозы ABI-007. Untr’d = необработанный контроль; S/A = контроль носителя солевой раствор/альбумин. Ограниченные отрезки = средняя величина ± стандартная ошибка. * значимо отличается (p<0,05) от необработанного контроля.
На фиг.3А и 3В показаны воздействия ABI-007 и таксола, используемых в метрономной схеме или схеме MTD, на рост опухоли MDA-MB-231 (А) и PC3 (B) у мышей SCID, пораженных опухолью. На фиг.3С и 3D показаны воздействия ABI-007 и таксола, используемых в метрономной схеме или схеме MTD, на массу тела мышей SCID, пораженных опухолью MDA-MB-231 (С) и PC3 (D).
На фиг.4А и 4В показаны изменения уровней жизнеспособных циркулирующих эндотелиальных предшественников (СЕР) в периферической крови мышей SCID, пораженных опухолью MDA-MB-231 (фиг.4А) и PC3 (фиг.4В), после лечения А, солевым раствором/альбумином; В, Cremophor EL контролем; С, метрономным таксолом 1,3 мг/кг; D, E и F, метрономным ABI-007 3, 6 и 10 мг/кг, соответственно; G, MTD таксолом; H, MTD ABI-007. Ограниченные отрезки = средняя величина ± стандартная ошибка. а значимо отличается (p<0,05) от контроля носителя солевого раствора/альбумина. b значимо отличается (p<0,05) от контроля носителя Cremophor EL.
На фиг.5А показана плотность микрососудов в опухоли ксенотрансплантатов MDA-MB-231 (■) и PC3 (□), обработанных А, солевым раствором/альбумином; В, Cremophor EL контролем; С, метрономным таксолом 1,3 мг/кг; D, E и F, метрономным ABI-007 3, 6 и 10 мг/кг, соответственно; G, MTD таксолом; H, MTD ABI-007. Ограниченные отрезки = средняя величина ± стандартная ошибка. На фиг.5В и 5C показана корреляция между плотностью микрососудов в опухоли и количеством жизнеспособных СЕР в периферической крови у мышей SCID, пораженных опухолью MDA-MB-231 (фиг.5В) и PC3 (фиг.5С).
На фиг.6 показаны воздействия ABI-007 и таксола, используемых в метрономной схеме или схеме MTD, на ангиогенез, вызванный основным фактором роста фибробластов (bFGF) в пробках из матригеля, инъецированных подкожно в бока мышей Balb/cJ. Виды обработки: А, солевым раствором/альбумином; В, Cremophor EL контролем; С, метрономным таксолом 1,3 мг/кг; D, E и F, метрономным ABI-007 3, 6 и 10 мг/кг, соответственно; G, MTD таксолом; H, MTD ABI-007. Матригель, имплантированный без bFGF (-bFGF) служил в качестве отрицательного контроля. Ограниченные отрезки = средняя величина ± стандартная ошибка.
На фиг.7А и фиг.7В показана цитотоксическая активность nab-рапамицина в комбинации с AbraxaneTM на сосудистые гладкомышечные клетки. Цитотоксичноть оценивали окрашиванием гомодимером-1 этидия (фиг.7А) или окрашиванием кальцеином (фиг.7В).
На фиг.8 показана цитотоксическая активность nab-рапамицина в комбинации с AbraxaneTM на модели ксенотрансплантата карциномы ободочной кишки человека НТ29.
На фиг.9 показана цитотоксическая активность nab-17-AAG в комбинации с AbraxaneTM на модели ксенотрансплантата карциномы легких человека Н358.
Подробное описание изобретения
Настоящее изобретение предоставляет способы комбинированного лечения, включающего первое лечение, включающее введение наночастиц, содержащих таксан и белок-носитель (такой как альбумин), в сочетании со вторым лечением, таким как облучение, хирургическое лечение, введение, по меньшей мере, одного другого химиотерапевтического средства или их комбинацию. Изобретение также предоставляет способы метрономной терапии.
Настоящее изобретение включает открытие того, что AbraxaneTM, ввиду его превосходящей противоопухолевой активности и сниженной токсичности и побочных эффектов, можно вводить в комбинации с другими терапевтическими препаратами и/или способами лечения и можно также применять при метрономной химиотерапии. Ввиду значительно улучшенных профилей безопасности при композициях, содержащих наночастицы лекарственного препарата/белка-носителя (таких как AbraxaneTM), заявители считают, что комбинированная химиотерапия с такими композициями в виде наночастиц (такими как AbraxaneTM) более эффективна, чем комбинированная химиотерапия с другими лекарственными препаратами. Кроме того, применение композиции в виде наночастиц (такой как AbraxaneTM), в комбинации с облучением, также считается более эффективным, чем комбинация других средств с облучением. Таким образом, композиции в виде наночастиц (в частности, композиции в виде наночастиц паклитаксела/альбумина, такие как AbraxaneTM), при использовании в комбинации с другими химиотерапевтическими средствами или при комбинации с другими способами лечения, должны быть очень эффективными и преодолеть недостатки хирургического лечения, лучевой терапии и химиотерапии при лечении пролиферативных заболеваний (таких как рак).
Настоящее изобретение в одном варианте осуществления представляет собой первое лечение, включающее введение таксана, такого как AbraxaneTM, в комбинации со вторым лечением, таким как другое химиотерапевтическое средство или средства, или им подобные, для лечения пролиферативных заболеваний, таких как рак. Первое лечение, включающее таксан, и второе лечение можно проводить у млекопитающего, имеющего пролиферативное заболевание, последовательно, или их можно проводить совместно, и даже проводить одновременно в одной и той же фармацевтической композиции.
Далее, было обнаружено, что схема метрономного введения с использованием AbraxaneTM более эффективна, чем традиционная схема введения MTD той же лекарственной композиции. Было также обнаружено, что такие схемы метрономного введения AbraxaneTM более эффективны, чем метрономное введение Taxol®.
Описанные здесь способы, в целом, можно применять для лечения заболеваний, в частности, пролиферативных заболеваний. Используемый здесь термин «лечение» представляет собой подход к получению благоприятных или желательных клинических результатов. В целях настоящего изобретения, благоприятные или желательные клинические результаты включают без ограничения любой эффект из облегчения одного или более симптомов, уменьшения степени заболевания, стабилизирования (т.е. не ухудшающегося) болезненного состояния, предотвращения или задержки распространения (например, метастазирования) заболевания, предотвращения или задержки возникновения или рецидива заболевания, задержки или замедления прогрессирования заболевания, облегчения патологического состояния и его ремиссии (частичной или полной). Термин «лечение» также охватывает уменьшение патологического последствия пролиферативного заболевания. Способы по изобретению предусматривают любой один или более из этих аспектов лечения.
Используемый здесь термин «пролиферативное заболевание» определяется как опухолевое заболевание (включая доброкачественное или раковое) и/или любые метастазы, независимо от локализации опухоли или метастаза, конкретнее, опухоль, выбранную из группы, включающую один или более из (и в некоторых вариантах осуществления выбрано из группы, состоящей из) рака молочной железы, рака мочеполовой системы, рака легких, рака желудочно-кишечной системы, эпидермоидного рака, меланомы, рака яичников, рака поджелудочной железы, нейробластомы, рака ободочной и прямой кишки, рака головы и шеи. В более широком смысле изобретения, пролиферативное заболевание может быть, кроме того, выбрано из гиперпролиферативных состояний, таких как гиперплазии, фиброз (в частности, легочный, но также другие типы фиброза, такие как почечный фиброз), ангиогенез, псориаз, атеросклероз и пролиферация гладких мышц в кровеносных сосудах, такая как стеноз или рестеноз после ангиопластики. В некоторых вариантах осуществления пролиферативное заболевание представляет собой рак. В некоторых вариантах осуществления пролиферативное заболевание представляет собой не раковое заболевание. В некоторых вариантах осуществления пролиферативное заболевание представляет собой доброкачественную или злокачественную опухоль. Когда здесь ранее и в последующем упоминается опухоль, опухолевое заболевание, карцинома или рак, также подразумеваются, альтернативно или в дополнение, независимо от локализации опухоли и/или метастаза, метастазы в первоначальный орган или ткань и/или в любой другой участок.
Используемый здесь термин «эффективное количество» относится к количеству соединения или композиции, достаточному для лечения определенного расстройства, состояния или заболевания, например, облегчения, паллиативного лечения, уменьшения и/или задержки возникновения одного или более его симптомов. В отношении различных форм рака или другой нежелательной клеточной пролиферации, эффективное количество включает количество, достаточное для того, чтобы вызвать сморщивание опухоли и/или уменьшение скорости роста опухоли (например, подавить рост опухоли) или предотвратить или отсрочить другую нежелательную клеточную пролиферацию. В некоторых вариантах осуществления эффективное количество представляет собой количество, достаточное для задержки развития. В некоторых вариантах осуществления эффективное количество представляет собой количество, достаточное для предотвращения или задержки возникновения и/или рецидива. Эффективное количество можно вводить одним или более введениями. В случае рака, эффективное количество препарата или композиции может: (i) уменьшить количество раковых клеток; (ii) уменьшить размер опухоли; (iii) ингибировать, в некоторой степени замедлить и предпочтительно прекратить инфильтрацию раковых клеток в периферические органы; (iv) ингибировать (т.е. в некоторой степени замедлить и предпочтительно остановить) метастазирование опухоли; (v) ингибировать рост опухоли; (vi) предотвратить или отсрочить возникновение и/или рецидив опухоли; и/или (vii) в некоторой степени облегчить один или более симптомов, связанных с раком.
В некоторых вариантах осуществления предоставляется способ лечения первичной опухоли. В некоторых вариантах осуществления предоставляется способ лечения метастатического рака (то есть рака, который метастазировал из первичной опухоли). В некоторых вариантах осуществления предоставляется способ лечения рака на поздней стадии (стадиях). В некоторых вариантах осуществления предоставляется способ лечения рака молочных желез (который может быть HER2-положительным или HER2-отрицательным), включая, например, запущенный рак молочных желез, рак молочных желез IV стадии, местно запущенный рак молочных желез и метастатический рак молочных желез. В некоторых вариантах осуществления предоставляется способ лечения рака легких, включая, например, немелкоклеточный рак легких (NSCLC, такой как запущенный NSCLC), мелкоклеточный рак легких (SCLC, такой как запущенный SCLC) и запущенные солидные злокачественные опухоли в легких. В некоторых вариантах осуществления предоставляется способ лечения любого из видов рака яичников, рака головы и шеи, злокачественных поражений желудка, меланомы (включая метастатическую меланому), рака ободочной и прямой кишки, рака поджелудочной железы и солидных опухолей (таких как запущенные солидные опухоли). В некоторых вариантах осуществления предоставляется способ уменьшения клеточной пролиферации и/или миграции клеток. В некоторых вариантах осуществления предоставляется способ лечения любого из следующих заболеваний: рестеноз, стеноз, фиброз, ангиогенез, псориаз, атеросклероз и пролиферация гладкомышечных клеток. Настоящее изобретение также предоставляет способы задержки развития любого из описанных здесь пролиферативных заболеваний.
Термин «индивидуум» обозначает млекопитающее, включая людей. Индивидуум включает без ограничения людей, коров, лошадей, кошек, собак, грызунов или приматов. В некоторых вариантах осуществления индивидуум представляет собой человека. У индивидуума (такого как человек) может быть запущенное заболевание или заболевание меньшей степени, такое как низкая опухолевая нагрузка. В некоторых вариантах осуществления индивидуум находится на ранней стадии пролиферативного заболевания (такого как рак). В некоторых вариантах осуществления индивидуум находится на запущенной стадии пролиферативного заболевания (такого как запущенный рак). В некоторых вариантах осуществления индивидуум является HER2-положительным. В некоторых вариантах осуществления индивидуум является HER2-отрицательным.
Способы могут осуществляться по адъювантной схеме. «Адъювантная схема» относится к клинической ситуации, при которой у индивидуумов в анамнезе было пролиферативное заболевание, в частности, рак, и в целом (но не обязательно) он реагировал на лечение, которое включает без ограничения хирургическое лечение (такое как хирургическая резекция), лучевую терапию и химиотерапию. Однако ввиду наличия у них в анамнезе пролиферативного заболевания (такого как рак), эти индивидуумы считаются имеющими риск развития заболевания. Лечение или проведение «адъювантной схемы» относится к последующему способу лечения. Степень риска (т.е. когда индивидуум, получающий лечение по адъювантной схеме, считается имеющим «высокий риск» или «низкий риск») зависит от нескольких факторов, чаще всего - степени заболевания при первом лечении. Предоставляемые здесь способы можно также осуществлять по не адъювантной схеме, т.е. способ может проводиться перед первичным/окончательным лечением. В некоторых вариантах осуществления индивидуум ранее получал лечение. В некоторых вариантах осуществления индивидуум ранее не получал лечение. В некоторых вариантах осуществления лечение представляет собой лечение первой линии.
Понятно, что описанные здесь аспекты и варианты осуществления изобретения включают «состоящие» и/или «по существу состоящие из» аспектов и вариантов осуществления.
Комбинированное лечение химиотерапевтическим средством
Настоящее изобретение предоставляет способы лечения пролиферативного заболевания (такого как рак) у индивидуума, включающие введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие таксан и белок-носитель (такой как альбумин); и b) эффективного количества, по меньшей мере, одного другого химиотерапевтического средства. В некоторых вариантах осуществления таксан представляет собой любой из (и в некоторых вариантах осуществления состоит по существу из) паклитаксела, доцетаксела и ортатаксела. В некоторых вариантах осуществления композиция в виде наночастиц включает AbraxaneTM. В некоторых вариантах осуществления химиотерапевтическое средство представляет собой любое из (и в некоторых вариантах осуществления, выбранное из группы, состоящей из) антиметаболитных средств (включая нуклеозидные аналоги), средств на основе платины, алкилирующих агентов, ингибиторов тирозин киназы, антрациклиновых антибиотиков, алкалоидов винки, ингибиторов протеасом, макролидов и ингибиторов топизомеразы.
В некоторых вариантах осуществления способ включает введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие паклитаксел и альбумин; и b) эффективного количества, по меньшей мере, другого химиотерапевтического средства. В некоторых вариантах осуществления наночастицы паклитаксела/альбумина имеют средний диаметр не более чем примерно 200 нм. В некоторых вариантах осуществления композиция паклитаксела/альбумина в виде наночастиц по существу не содержит (например, не содержит) поверхностно-активное вещество (такое как Cremophor). В некоторых вариантах осуществления массовое отношение альбумина к паклитакселу в композиции составляет примерно 18:1 или менее, например, примерно 9:1 или менее. В некоторых вариантах осуществления паклитаксел покрыт альбумином. В некоторых вариантах осуществления наночастицы паклитаксела/альбумина имеют средний диаметр не более чем примерно 200 нм, и композиция паклитаксела/альбумина по существу не содержит (например, не содержит) поверхностно-активное вещество (такое как Cremophor). В некоторых вариантах осуществления наночастицы паклитаксела/альбумина имеют средний диаметр не более чем примерно 200 нм, и паклитаксел покрыт альбумином. В некоторых вариантах осуществления композиция в виде наночастиц представляет собой AbraxaneTM.
В некоторых вариантах осуществления изобретение предоставляет способ лечения пролиферативного заболевания (такого как рак) у индивидуума, включающий введение индивидууму: а) эффективного количества AbraxaneTM и b) эффективного количества, по меньшей мере, одного другого химиотерапевтического средства. Предпочтительными лекарственными комбинациями для последовательного или совместного введения или одновременного введения с AbraxaneTM являются те, которые обеспечивают усиленную антипролиферативную активность, по сравнению с отдельными компонентами, особенно предпочтительны комбинации, которые приводят к регрессии пролиферативных тканей и/или излечивают пролиферативное заболевание.
Описанные здесь химиотерапевтические средства могут представлять собой сами средства, их фармацевтически приемлемые соли и их фармацевтически приемлемые сложные эфиры, а также стереоизомеры, энантиомеры, рацемические смеси и им подобные. Описанное здесь химиотерапевтическое средство или средства можно вводить так же как фармацевтическую композицию, содержащую средство (средства), где фармацевтическая композиция включает фармацевтически приемлемый носитель-основу, или подобный компонент.
Химиотерапевтическое средство может присутствовать в композиции в виде наночастиц. Например, в некоторых вариантах осуществления, предоставляется способ лечения пролиферативного заболевания (такого как рак) у индивидуума, содержащий введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие таксан и белок-носитель (такой как альбумин); и b) эффективного количества композиции, содержащей наночастицы, включающие, по меньшей мере, одно химиотерапевтическое средство и белок-носитель (такой как альбумин). В некоторых вариантах осуществления способ включает введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие паклитаксел и альбумин (такие как AbraxaneTM); и b) эффективного количества композиции, содержащей наночастицы, включающие, по меньшей мере, одно химиотерапевтическое средство и белок-носитель (такой как альбумин). В некоторых вариантах осуществления химиотерапевтическое средство представляет собой любое из (а в некоторых вариантах осуществления выбранное из группы, состоящей из) тиоколхицина или его производных (таких как димерный тиоколхицин, включая, например, nab-5404, nab-5800 и nab-5801), рапамицина или его производных и гелданамицина или его производных (таких как 17-аллиламиногелданамицин (17-AAG)). В некоторых вариантах осуществления химиотерапевтическое средство представляет собой рапамицин. В некоторых вариантах осуществления химиотерапевтическое средство представляет собой 17-AAG.
Здесь предоставляется иллюстративный и неограничивающий перечень предусмотренных химиотерапевтических средств. Подходящие химиотерапевтические средства включают, например, алкалоиды винки, средства, которые прерывают образование микротрубочек (такие как колхицины и их производные), антиангиогенные средства, терапевтические антитела, средства, нацеленные на EGFR, средства, нацеленные на тирозин киназу (такие как ингибиторы тирозин киназы), комплексы переходных металлов, ингибиторы протеасом, антиметаболиты (такие как аналоги нуклеозидов), алкилирующие агенты, агенты на основе платины, антрациклиновые антибиотики, ингибиторы топоизомеразы, макролиды, терапевтические антитела, ретиноиды (такие как полностью транс-ретиноевые кислоты или их производные), гельданамицин или его производные (такие как 17-AAG) и другие стандартные химиотерапевтические средства, хорошо известные в данной области.
В некоторых вариантах осуществления химиотерапевтическое средство представляет собой любое из (а в некоторых вариантах осуществления выбранное из группы, состоящей из) адриамицина, колхицина, циклофосфамида, актиномицина, блеомицина, дуанорубицина, доксорубицина, эпирубицина, митомицина, метотрексата, митоксантрона, фторурацила, карбоплатина, кармустина (BCNU), метил-CCNU, цисплатина, этопозида, интерферонов, камптотецина и его производных, фенестерина, таксанов и их производных (например, паклитаксела и его производных, таксотера и его производных и им подобных), топотекана, винбластина, винкристина, тамоксифена, пипосульфана, nab-5404, nab-5800, nab-5801, иринотекана, НКР, ортатаксела, гемцитабина, Herceptin®, винорелбина, Doxil®, капецитабина, Alimta®, Avastin®, Velcade®, Tarceva®, Neulasta®, лапатиниба, сорафениба, их производных, химиотерапевтических средств, известных в данной области, и им подобных. В некоторых вариантах осуществления химиотерапевтическое средство представляет собой композицию, содержащую наночастицы, включающие производное тиоколхицина и белок-носитель (такой как альбумин).
В некоторых вариантах осуществления химиотерапевтическое средство представляет собой антинеопластическое средство, включающее без ограничения карбоплатин, Navelbine® (винорелбин), антрациклин (Doxil®, лапатиниб (GW57016), Herceptin®, гемцитабин (Gemzar®), капецитабин (Xeloda®), Alimta®, цисплатин, 5-фторурацил, эпирубицин, циклофосфамид, Avastin®, Velcade® и т.д.
В некоторых вариантах осуществления химиотерапевтическое средство представляет собой антагонист других факторов, которые участвуют в опухолевом росте, таких как EGFR, ErbB2 (также известный как Herb), ErbB3, ErbB4 или TNF. Иногда, может быть благоприятно также введение индивидууму одного или более цитокинов. В некоторых вариантах осуществления терапевтическое средство представляет собой средство, ингибирующее рост. Подходящие дозировки для средства, ингибирующего рост, являются те, которые используются в настоящее время и могут быть снижены ввиду комбинированного действия (синергии) средства, ингибирующего рост, и таксана.
В некоторых вариантах осуществления химиотерапевтическое средство представляет собой химиотерапевтическое средство, отличное от антитела против VEGF, антитела против HER2, интерферона и антагониста HGFβ.
Упоминаемое здесь химиотерапевтическое средство относится к химиотерапевтическому средству или его производным, и, соответственно, изобретение предусматривает и включает любой из этих вариантов осуществления (средства; средство или производное (производные)). «Производные» или «аналоги» химиотерапевтического средства или химической части включают без ограничения соединения, которые структурно аналогичны химиотерапевтическому средству или его фрагменту или относятся к тому же общему химическому классу, что и химиотерапевтическое средство или его фрагмент. В некоторых вариантах осуществления химиотерапевтическое средство или его фрагмент сохраняет химическое и/или физическое свойство (включая, например, функциональность), аналогичное, химиотерапевтическому средству или его фрагменту.
В некоторых вариантах осуществления изобретение предоставляет способ лечения пролиферативного заболевания (такого как рак) у индивидуума, включающий введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие таксан и белок-носитель (такой как альбумин), и b) эффективного количества ингибитора тирозин киназы. В некоторых вариантах осуществления изобретение предоставляет способ лечения пролиферативного заболевания (такого как рак) у индивидуума, включающий введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие паклитаксел и альбумин (такой как AbraxaneTM), и b) эффективного количества ингибитора тирозин киназы. Подходящие ингибиторы тирозин киназы включают, например, иматиниб (Gleevec®), гефитиниб (Iressa®), Tarceva, Sutent® (сунитиниб малат) и лапатиниб. В некоторых вариантах осуществления ингибитор тирозин киназы представляет собой лапатиниб. В некоторых вариантах осуществления ингибитор тирозин киназы представляет собой Tarceva. Tarceva представляет собой мелкомолекулярный ингибитор человеческого эпидермального ростового фактора типа 1/рецептора эпидермального ростового фактора (HER1/EGFR), который в клиническом испытании фазы III продемонстрировал увеличенное выживание индивидуумов с запущенным немелкоклеточным раком легких (NSCLC). В некоторых вариантах осуществления предоставляется способ лечения рака молочных желез, включая лечение метастатического рака молочных желез и лечение рака молочных желез в неоадъювантной схеме. В некоторых вариантах осуществления предоставляется способ лечения запущенной солидной опухоли. В некоторых вариантах осуществления предоставляется способ ингибирования пролиферации опухолей, экспрессирующий EGFR, у млекопитающего, включающий введение млекопитающему, пораженному такими опухолями, AbraxaneTM и гефитиниба, где гефитиниб вводится пульсирующим введением.
В некоторых вариантах осуществления изобретение предоставляет способ лечения пролиферативного заболевания (такого как рак) у индивидуума, включающий введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие таксан и белок-носитель (такой как альбумин), и b) эффективного количества антиметаболического средства (такого как аналог нуклеозидов, включая, например, аналоги пуринов и аналоги пиримидина). В некоторых вариантах осуществления изобретение предоставляет способ лечения пролиферативного заболевания (такого как рак) у индивидуума, включающий введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие паклитаксел и альбумин (такой как AbraxaneTM), и b) эффективного количества антиметаболического средства. «Антиметаболическое средство» представляет собой средство, которое структурно аналогично метаболиту, но не может использоваться организмом продуктивным образом. Многие антиметаболические средства препятствуют продукции нуклеиновых кислот, РНК и ДНК. Например, антиметаболит может представлять собой нуклеозидный аналог, который включает без ограничения азацитидин, азатиоприн, капецитабин (Xeloda®), цитарабин, кладрибин, цитозин арабинозид (ara-C, цитозар), доксифлуридин, фторурацил (такой как 5-фторурацил), UFT, гидроксимочевину, гемцитабин, меркаптопурин, метотрексат, тиогуанин (такой как 6-тиогуанин). Другие антиметаболиты включают, например, L-аспарагиназу (элспа), декарбазин (DTIC), 2-деокси-D-глюкозу и прокарбазин (матулан). В некоторых вариантах осуществления нуклеозидный аналог представляет собой любой из (а в некоторых вариантах осуществления выбран из группы, состоящей из) гемцитабина, фторурацила и капецитабина. В некоторых вариантах осуществления способ предназначен для лечения метастатического рака молочной железы или местно запущенного рака молочной железы. В некоторых вариантах осуществления способ предназначен для лечения первой линии метастатического рака молочной железы. В некоторых вариантах осуществления способ предназначен для лечения рака молочной железы по адъювантной схеме. В некоторых вариантах осуществления способ предназначен для лечения любого NSCLC, метастатического рака ободочной и прямой кишки, рака поджелудочной железы или запущенной солидной опухоли.
В некоторых вариантах осуществления изобретение предоставляет способ лечения пролиферативного заболевания (такого как рак) у индивидуума, включающий введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие таксан и белок-носитель (такой как альбумин), и b) эффективного количества алкилирующего агента. В некоторых вариантах осуществления изобретение предоставляет способ лечения пролиферативного заболевания (такого как рак) у индивидуума, содержащий введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие паклитаксел и альбумин (такой как AbraxaneTM), и b) эффективного количества алкилирующего агента. Подходящие алкилирующие агенты включают без ограничения циклофосфамид (цитоксан), мехлоретамин, хлорамбуцил, мелфалан, кармустин (BCNU), тиотепа, бусульфан, алкилсульфонаты, этиленимины, аналоги азотистого иприта, эстрамустин натрий фосфат, ифосфамид, нитрозомочевины, ломустин и стрептозоцин. В некоторых вариантах осуществления алкилирующий агент представляет собой циклофосфамид. В некоторых вариантах осуществления циклофосфамид вводится перед введением композиции в виде наночастиц. В некоторых вариантах осуществления способ предназначен для лечения рака молочной железы на ранней стадии. В некоторых вариантах осуществления способ предназначен для лечения рака молочной железы в адъювантной или неоадъювантной схеме лечения.
В некоторых вариантах осуществления изобретение предоставляет способ лечения пролиферативного заболевания (такого как рак) у индивидуума, включающий введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие таксан и белок-носитель (такой как альбумин), и b) эффективного количества средства на основе платины. В некоторых вариантах осуществления изобретение предоставляет способ лечения пролиферативного заболевания (такого как рак) у индивидуума, включающий введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие паклитаксел и альбумин (такой как AbraxaneTM), и b) эффективного количества средства на основе платины. Подходящие средства на основе платины включают без ограничения карбоплатин, цисплатин и оксалиплатин. В некоторых вариантах осуществления средство на основе платины представляет собой карбаплатин. В некоторых вариантах осуществления способ предназначен для лечения рака молочной железы (HER2-положительного или HER2-отрицательного, включая метастатический рак молочной железы и запущенный рак молочной железы); рака легких (включая лечение первой линии запущенного NSCLC, NSCLC, SCLC и запущенных солидных злокачественных опухолей в легких); рака яичников; рака головы и шеи; и меланомы (включая метастатическую меланому).
В некоторых вариантах осуществления изобретение предоставляет способ лечения пролиферативного заболевания (такого как рак) у индивидуума, включающий введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие таксан и белок-носитель (такой как альбумин), и b) эффективного количества антрациклинового антибиотика. В некоторых вариантах осуществления изобретение предоставляет способ лечения пролиферативного заболевания (такого как рак) у индивидуума, включающий введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие паклитаксел и альбумин (такой как AbraxaneTM) и белок-носитель (такой как альбумин), и b) эффективного количества антрациклинового антибиотика. Подходящий антрациклиновый антибиотик включает без ограничения Doxil®, актиномицин, дактиномицин, даунорубицин (дауномицин), доксорубицин (адриамицин), эпирубицин, идарубицин, митоксантрон, валрубицин. В некоторых вариантах осуществления антрациклин представляет собой любой из (и в некоторых вариантах осуществления выбран из группы, состоящей из) Doxil®, эпирубцина и доксорубицина. В некоторых вариантах осуществления способ предназначен для лечения ранней стадии рака молочной железы. В некоторых вариантах осуществления способ предназначен для лечения рака молочной железы в адъювантной или неоадъювантной схеме.
В некоторых вариантах осуществления изобретение предоставляет способ лечения пролиферативного заболевания (такого как рак) у индивидуума, включающий введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие таксан и белок-носитель (такой как альбумин), и b) эффективного количества алкалоида винки. В некоторых вариантах осуществления изобретение предоставляет способ лечения пролиферативного заболевания (такого как рак) у индивидуума, включающий введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие паклитаксел и альбумин (такой как AbraxaneTM) и белок-носитель (такой как альбумин), и b) эффективного количества алкалоида винки. Подходящие алкалоиды винки включают, например, винбластин, винкристин, виндезин, винорелбин (Navelbine®) и VP-16. В некоторых вариантах осуществления способ предназначен для лечения рака молочной железы IV стадии и рака легких.
В некоторых вариантах осуществления изобретение предоставляет способ лечения пролиферативного заболевания (такого как рак) у индивидуума, включающий введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие таксан и белок-носитель (такой как альбумин), и b) эффективного количества макролида. В некоторых вариантах осуществления изобретение предоставляет способ лечения пролиферативного заболевания (такого как рак) у индивидуума, включающий введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие паклитаксел и альбумин (такой как AbraxaneTM) и белок-носитель (такой как альбумин), и b) эффективного количества макролида. Подходящие макролиды включают, например, рапамицин, карбомицин и эритромицин. В некоторых вариантах осуществления макролид представляет собой рапамицин или его производное. В некоторых вариантах осуществления способ предназначен для лечения солидной опухоли.
В некоторых вариантах осуществления изобретение предоставляет способ лечения пролиферативного заболевания (такого как рак) у индивидуума, включающий введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие таксан и белок-носитель (такой как альбумин), и b) эффективного количества ингибитора топоизомеразы. В некоторых вариантах осуществления изобретение предоставляет способ лечения пролиферативного заболевания (такого как рак) у индивидуума, включающий введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие паклитаксел и альбумин (такой как AbraxaneTM) и белок-носитель (такой как альбумин), и b) эффективного количества ингибитора топоизомеразы. В некоторых вариантах осуществления химиотерапевтическое средство представляет собой ингибитор топоизомеразы, включая, например, ингибитор топоизомеразы I и топоизомеразы II. Иллюстративные ингибиторы топоизомеразы I включают без ограничения камптотецин, такой как иринотекан и топотекан. Иллюстративные ингибиторы топоизомеразы II включают без ограничения амсакрин, этопозид, этопозид фосфат и тенипозид.
В некоторых вариантах осуществления изобретение предоставляет способ лечения пролиферативного заболевания (такого как рак) у индивидуума, включающий введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие таксан и белок-носитель (такой как альбумин), и b) эффективного количества антиангиогенного средства. В некоторых вариантах осуществления изобретение предоставляет способ лечения пролиферативного заболевания (такого как рак) у индивидуума, включающий введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие паклитаксел и альбумин (такой как AbraxaneTM) и белок-носитель (такой как альбумин), и b) эффективного количества антиангиогенного средства. В некоторых вариантах осуществления способ предназначен для лечения метастатического рака молочных желез, рака молочной железы в адъювантной схеме или в неоадъювантной схеме, рака легких (такого как лечение первой линии запущенного NSCLC и NSCLC), рака яичников и меланомы (включая метастатическую меланому).
В данной области были идентифицированы и известны многие антиангиогенные средства, включая средства, перечисленные Carmeliet и Jain (2000). Антиангиогенное средство может быть естественно встречающимся или нет. В некоторых вариантах осуществления химиотерапевтическое средство представляет собой антиангиогенный пептид. Например, ранее сообщалось, что обладающие антиангиогенной активностью мелкие синтетические про-апоптозные пептиды включают 2 функциональных домена, один, нацеленный на рецепторы CD13 (аминопептидаза N) на опухолевых доменах, а другой - разрушающий митохондриальную мембрану после интернализации (Nat. Med. 1999, 5(9):1032-8). Было обнаружено, что димерный пептид второго поколения, CNGRC-GG-d(KLAKLAK)2, названный НКР (пептид-«охотник-убийца»), обладает улучшенной противоопухолевой активностью. Соответственно, в некоторых вариантах осуществления, антиангиогенный пептид представляет собой НКР. В некоторых вариантах осуществления антиангиогенное средство отличается от антитела против VEGF (такого как Avastin®).
В некоторых вариантах осуществления изобретение предоставляет способ лечения пролиферативного заболевания (такого как рак) у индивидуума, включающий введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие таксан и белок-носитель (такой как альбумин), и b) эффективного количества ингибитора протеасомы. В некоторых вариантах осуществления изобретение предоставляет способ лечения пролиферативного заболевания (такого как рак) у индивидуума, включающий введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие паклитаксел и альбумин (такой как Abraxane™) и белок-носитель (такой как альбумин), и b) эффективного количества ингибитора протеасомы, такого как бортезомиб (Velcade).
В некоторых вариантах осуществления изобретение предоставляет способ лечения пролиферативного заболевания (такого как рак) у индивидуума, включающий введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие таксан и белок-носитель (такой как альбумин), и b) эффективного количества терапевтического антитела. В некоторых вариантах осуществления изобретение предоставляет способ лечения пролиферативного заболевания (такого как рак) у индивидуума, включающий введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие паклитаксел и альбумин (такой как Abraxane™) и белок-носитель (такой как альбумин), и b) эффективного количества терапевтического антитела. Подходящие терапевтические антитела включают без ограничения антитело против VEGF (такое как Avastin® (бевакизумаб)), антитело против HER2 (такое как Herceptin® (трастузумаб)), Erbitux® (цетуксимаб), Campath (алемтузумаб), Myelotarg (гемтузумаб), Zevalin (ибритумомаб тиуекстан), Rituxan (ритуксимаб) и Bexxar (тоситумомаб). В некоторых вариантах осуществления химиотерапевтическое средство представляет собой Erbitux® (цетуксимаб). В некоторых вариантах осуществления химиотерапевтическое средство представляет собой терапевтическое антитело, отличное от антитела против VEGF или HER2. В некоторых вариантах осуществления способ предназначен для лечения HER2-положительного рака молочной железы, включая лечение запущенного рака молочных желез, лечение метастатического рака молочных желез, лечение рака молочной железы в адъювантной схеме и лечение рака молочной железы в неоадъювантной схеме. В некоторых вариантах осуществления способ предназначен для лечения метастатического рака молочных желез, рака молочной железы в адъювантной схеме и рака молочной железы в неоадъювантной схеме, рака легких (такого как при лечении первой линии запущенного NSCLC и NSCLC), рака яичников, рака головы и шеи и меланомы (включая метастатическую меланому). Например, в некоторых вариантах осуществления, предоставляется способ лечения HER2-положительного метастатического рака молочной железы у индивидуума, включающий введение индивидууму 125 мг/м2 композиции паклитаксела/альбумина в виде наночастиц (такой как Abraxane™) 1 раз в неделю в течение 3 недель с перерывом в течение 4-ой недели, одновременно с введением Herceptin®.
В некоторых вариантах осуществления 2 или более химиотерапевтических средств вводятся в дополнение к таксану в композиции в виде наночастиц. Эти 2 или более химиотерапевтических средства могут (но необязательно) относиться к различным классам химиотерапевтических средств. Здесь представлены примеры этих комбинаций. Предусмотрены также другие комбинации.
В некоторых вариантах осуществления предоставляется способ лечения пролиферативного заболевания (такого как рак) у индивидуума, включающий введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие таксан и белок-носитель (такой как альбумин), и b) эффективного количества антиметаболита (такого как аналог нуклеозида, например, гемцитабин) и с) антрациклинового антибиотика (такого как эпирубицин). В некоторых вариантах осуществления предоставляется способ лечения пролиферативного заболевания (такого как рак) у индивидуума, включающий введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие паклитаксел и альбумин (такой как Abraxane™), b) эффективного количества антиметаболита (такого как аналог нуклеозида, например, гемцитабин) и с) эффективного количества антрациклинового антибиотика (такого как эпирубицин). В некоторых вариантах осуществления способ предназначен для лечения рака молочной железы в неоадъювантной схеме. Например, в некоторых вариантах осуществления, предоставляется способ лечения местно запущенного/воспалительного рака у индивидуума, включающий введение индивидууму 220 мг/м2 композиции паклитаксела/альбумина в виде наночастиц (такой как Abraxane™) 1 раз в 2 недели, 2000 мг/м2 гемцитабина 1 раз в 2 недели и 50 мг/м2 эпирубицина 1 раз в 2 недели. В некоторых вариантах осуществления предоставляется способ лечения рака молочной железы у индивидуума в адъювантной схеме, включающий введение индивидууму 175 мг/м2 композиции паклитаксела/альбумина в виде наночастиц (такой как Abraxane™) 1 раз в 2 недели, 2000 мг/м2 гемцитабина 1 раз в 2 недели и 50 мг/м2 эпирубицина 1 раз в 2 недели.
В некоторых вариантах осуществления предоставляется способ лечения пролиферативного заболевания (такого как рак) у индивидуума, включающий введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие таксан и белок-носитель (такой как альбумин), b) эффективного количества средства на основе платины (такого как карбоплатин) и с) терапевтического антитела (такого как антитело против HER2 (такое как Herceptin®) и антитела против VEGF (такого как Avastin®)). В некоторых вариантах осуществления предоставляется способ лечения пролиферативного заболевания (такого как рак) у индивидуума, включающий введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие паклитаксел и альбумин (такой как Abraxane™), b) эффективного количества средства на основе платины (такого как карбоплатин) и с) терапевтического антитела (такого как антитело против HER2 (такое как Herceptin®) и антитело против VEGF (такое как Avastin®)). В некоторых вариантах осуществления способ предназначен для лечения любого из запущенного рака молочной железы, метастатического рака молочной железы, рака молочной железы в адъювантной схеме и рака легких (включая NSCLC и запущенного NSCLC). В некоторых вариантах осуществления предоставляется способ лечения метастатического рака у индивидуума, включающий введение индивидууму 75 мг/м2 композиции паклитаксела/альбумина в виде наночастиц (такой как Abraxane™) и карбоплатина, AUC (площадь под кривой) =2, где введение проводят 1 раз в неделю в течение 3 недель с перерывом в течение 4-ой недели. В некоторых вариантах осуществления способ, кроме того, включает введение примерно 2-4 мг/кг Herceptin®.
В некоторых вариантах осуществления предоставляется способ лечения пролиферативного заболевания (такого как рак) у индивидуума, включающий введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие таксан и белок-носитель (такой как альбумин), b) эффективного количества средства на основе платины (такого как карбоплатин) и с) алкалоида винки (такого как Navelbine®). В некоторых вариантах осуществления предоставляется способ лечения пролиферативного заболевания (такого как рак) у индивидуума, включающий введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие паклитаксел и альбумин (такой как Abraxane™), b) эффективного количества средства на основе платины (такого как карбоплатин) и с) алкалоида винки (такого как Navelbine®). В некоторых вариантах осуществления способ предназначен для лечения рака легких.
В некоторых вариантах осуществления предоставляется способ лечения пролиферативного заболевания (такого как рак) у индивидуума, включающий введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие таксан и белок-носитель (такой как альбумин), b) эффективного количество алкилирующего средства (такого как циклофосфамид) и с) антрациклинового антибиотика (такого как адриамицин). В некоторых вариантах осуществления предоставляется способ лечения пролиферативного заболевания (такого как рак) у индивидуума, включающий введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие паклитаксел и альбумин, b) эффективного количества алкилирующего средства (такого как циклофосфамид) и с) антрациклинового антибиотика (такого как адриамицин). В некоторых вариантах осуществления способ предназначен для лечения ранней стадии рака молочной железы. В некоторых вариантах осуществления способ предназначен для лечения рака молочной железы в адъювантной или неоадъювантной схеме. Например, в некоторых вариантах осуществления, предоставляется способ лечения композиции ранней стадии рака молочной железы у индивидуума, включающий введение 260 мг/м2 композиции паклитаксела/альбумина в виде наночастиц (такой как Abraxane™), 60 мг/м2 адриамицина и 600 мг/м2 циклофосфамида, где введение проводят 1 раз в 2 недели.
Другие варианты осуществления представлены в таблице 1. Например, в некоторых вариантах осуществления, предоставляется способ лечения запущенного рака молочной железы у индивидуума, включающий введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие паклитаксел и альбумин (такой как Abraxane™), b) эффективного количества карбоплатина. В некоторых вариантах осуществления способ, кроме того, включает введение индивидууму эффективного количества Herceptin®. В некоторых вариантах осуществления предоставляется способ лечения метастатического рака молочной железы у индивидуума, включающий введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие паклитаксел и альбумин (такой как Abraxane™), b) эффективного количества гемцитабина. В некоторых вариантах осуществления предоставляется способ лечения запущенного немелкоклеточного рака легких у индивидуума, включающий введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие паклитаксел и альбумин (такой как Abraxane™), b) эффективного количества карбоплатина.
В некоторых вариантах осуществления предоставляется композиция, содержащая наночастицы, включающие таксан (такой как паклитаксел, доцетаксел или ортатаксел) и белок-носитель (такой как альбумин), и, по меньшей мере, одно другое химиотерапевтическое средство. Описанные здесь композиции могут содержать эффективные количества таксана и химиотерапевтического средства для лечения пролиферативного заболевания (такого как рак). В некоторых вариантах осуществления химиотерапевтическое средство и таксан присутствуют в композиции в заданном соотношении, таком как массовые соотношения, описанные здесь. В некоторых вариантах осуществления изобретение предоставляет синергическую композицию эффективного количества композиции, содержащей наночастицы, включающие таксан (такой как паклитаксел, доцетаксел или ортатаксел), и эффективное количество, по меньшей мере, одного другого химиотерапевтического средства.
В некоторых вариантах осуществления изобретение предоставляет фармацевтические композиции, содержащие наночастицы, включающие таксан и белок-носитель (такой как альбумин), для применения при лечении пролиферативного заболевания (такого как рак), где указанное применение включает одновременное и/или последовательное введение, по меньшей мере, одного другого химиотерапевтического средства. В некоторых вариантах осуществления изобретение предоставляет фармацевтическую композицию, содержащую химиотерапевтическое средство для применения при лечении пролиферативного заболевания (такого как рак), где указанное применение включает одновременное и/или последовательное введение композиции, содержащей наночастицы, включающие таксан и белок-носитель (такой как альбумин). В некоторых вариантах осуществления изобретение предоставляет содержащие таксан композиции в виде наночастиц и композиции, содержащие одно другое химиотерапевтическое средство для одновременного и/или последовательного применения для лечения пролиферативного заболевания (такого как рак).
Способы введения
Композиции, содержащие наночастицы, включающие таксан (также именуемые «композицией в виде наночастиц»), и химиотерапевтическое средство можно вводить одновременно (т.е. одновременное введение) и/или последовательно (т.е. последовательное введение).
В некоторых вариантах осуществления композиция в виде наночастиц и химиотерапевтическое средство (включая описанные здесь специфические химиотерапевтические средства) вводятся одновременно. Используемый здесь термин «одновременное введение» означает, что композиция в виде наночастиц и химиотерапевтическое средство вводятся с разделением во времени не более чем примерно 15 минут, например, не более чем примерно любой период из 10, 5 или 1 минуты. Когда препараты вводятся одновременно, препарат в виде наночастиц и химиотерапевтическое средство могут содержаться в одной и той же композиции (например, композиции, включающей и наночастицы, и химиотерапевтическое средство) или в отдельных композициях (например, наночастицы содержатся в одной композиции, а химиотерапевтическое средство содержится в другой композиции). Например, таксан и химиотерапевтическое средство могут присутствовать в одной композиции, содержащей, по меньшей мере, 2 различных вида наночастиц, где некоторые из наночастиц в композиции включают таксан и белок-носитель, а некоторые из других наночастиц в композиции включают химиотерапевтическое средство и белок-носитель. Изобретение предусматривает и охватывает такие композиции. В некоторых вариантах осуществления в наночастицах содержится только таксан. В некоторых вариантах осуществления одновременное введение препарата в композиции в виде наночастиц и химиотерапевтического средства может комбинироваться с дополнительными дозами таксана и/или химиотерапевтического средства.
В некоторых вариантах осуществления композиция в виде наночастиц и химиотерапевтическое средство вводятся последовательно. Используемый здесь термин «последовательное введение» означает, что препарат в композиции в виде наночастиц и химиотерапевтическое средство вводятся с разделением во времени более чем примерно 15 минут, например, более чем примерно любой из периодов 20, 30, 40, 50, 60 или более минут. Сначала можно вводить любой препарат из композиции в виде наночастиц и химиотерапевтического средства. Композиция в виде наночастиц и химиотерапевтическое средство содержатся в отдельных композициях, которые могут содержаться в одной и той же или различных упаковках.
В некоторых вариантах осуществления введение композиции в виде наночастиц и химиотерапевтического средства происходит одновременно, т.е. периоды введения композиции в виде наночастиц и химиотерапевтического средства перекрывают друг друга. В некоторых вариантах осуществления введение композиции в виде наночастиц и химиотерапевтического средства происходит не одновременно. Например, в некоторых вариантах осуществления, введение композиции в виде наночастиц прекращается перед тем, как вводится химиотерапевтическое средство. В некоторых вариантах осуществления введение химиотерапевтического средства прекращается перед тем, как вводится композиция в виде наночастиц. Период времени между этими двумя не одновременными введениями может находиться в диапазоне от примерно 2 до 8 недель, например, примерно 4 недели.
Частоту введения содержащей препараты композиции в виде наночастиц и химиотерапевтического средства можно регулировать в течение курса лечения на основании суждений проводящего лечение врача. При отдельном введении, содержащую препараты композицию в виде наночастиц и химиотерапевтическое средство можно вводить с различной частотой введения или интервалами. Например, содержащую препараты композицию в виде наночастиц можно вводить 1 раз в неделю, в то время как химиотерапевтическое средство можно вводить более или менее часто. В некоторых вариантах осуществления можно использовать препаративную форму продолжительного высвобождения содержащей препараты композиции в виде наночастиц и/или химиотерапевтического средства. В данной области известны различные препаративные формы и устройства для достижения пролонгированного высвобождения.
Композицию в виде наночастиц и химиотерапевтическое средство можно вводить, используя одинаковый путь введения, или различные пути введения. В некоторых вариантах осуществления (и для одновременного, и для последовательного введения) таксан в композиции в виде наночастиц и химиотерапевтическое средство вводятся в заданной дозе. Например, в некоторых вариантах осуществления массовое соотношение между таксаном в композиции в виде наночастиц и химиотерапевтическим средством составляет примерно один к одному. В некоторых вариантах осуществления массовое соотношение может составлять от примерно 0,001 до примерно 1 и от примерно 1000 до примерно 1, или от примерно 0,01 до примерно 1 и от 100 до примерно 1. В некоторых вариантах осуществления массовое соотношение между таксаном и химиотерапевтическим средством в композиции в виде наночастиц составляет любую величину из 100:1, 50:1, 30:1, 10:1, 9:1, 8:1, 7:1, 6:1, 5:1, 4:1, 3:1, 2:1 и 1:1. В некоторых вариантах осуществления массовое соотношение между таксаном в композиции в виде наночастиц и химиотерапевтическим средством составляет любую величину из 1:1, 2:1, 3:1, 4:1, 5:1, 6:1, 7:1, 8:1, 9:1, 30:1, 50:1, 100:1. Предусмотрены другие соотношения.
Дозы, требуемые для таксана и химиотерапевтического средства, могут (необязательно) быть ниже, чем обычно требуемые при отдельном введении каждого средства. Таким образом, в некоторых вариантах осуществления, препарат в композиции в виде наночастиц и/или химиотерапевтическое средство вводятся в субтерапевтическом количестве. «Субтерапевтическое количество» или «субтерапевтический уровень» относятся к количеству, которое меньше, чем терапевтическое количество. То есть, менее чем количество, обычно применяемое, когда препарат в композиции в виде наночастиц и/или химиотерапевтическое средство вводятся отдельно. Снижение может быть отражено с точки зрения количества, вводимого при данном введении, и/или количества, вводимого в течение данного периода времени (сниженная частота).
В некоторых вариантах осуществления вводится количество химиотерапевтического средства, достаточное для обеспечения возможности снижения обычной дозы препарата в композиции в виде наночастиц, требуемой для обеспечения такой же степени лечения, по меньшей мере, примерно на любую величину из 5%, 10%, 20%, 30%, 50%, 60%, 70%, 80%, 90% или более. В некоторых вариантах осуществления вводится количество химиотерапевтического средства, достаточное для обеспечения возможности снижения обычной дозы химиотерапевтического средства, требуемой для обеспечения такой же степени лечения, по меньшей мере, примерно на любую величину из 5%, 10%, 20%, 30%, 50%, 60%, 70%, 80%, 90% или более.
В некоторых вариантах осуществления доза таксана в композиции в виде наночастиц и химиотерапевтического средства снижается по сравнению с соответствующей обычной дозой каждого из них при отдельном введении. В некоторых вариантах осуществления таксан в композиции в виде наночастиц и химиотерапевтическое средство вводятся на субтерапевтическом, т.е. сниженном уровне. В некоторых вариантах осуществления доза композиции в виде наночастиц и/или химиотерапевтического средства по существу меньше, чем установленная максимальная токсическая доза (MTD). Например, доза композиции в виде наночастиц и/или химиотерапевтического средства меньше, чем примерно 50%, 40%, 30%, 20% или 10% MTD.
Можно использовать комбинацию описанных здесь конфигураций введения. Описанные здесь способы комбинированного лечения можно выполнять отдельно или в сочетании с другим лечением, таким как хирургическое лечение, облучение, химиотерапия, иммунотерапия, генная терапия и им подобные. Кроме того, лицо, имеющее повышенный риск развития пролиферативного заболевания, может получать способы лечения для ингибирования и/или задержки развития заболевания.
Как будет понятно средним специалистам в данной области, соответствующие дозы химиотерапевтических средств будут приблизительно представлять собой дозы, уже используемые при клинических схемах лечения, где химиотерапевтические средства вводятся отдельно или в комбинации с другими химиотерапевтическими средствами. Изменение дозировки, вероятно, произойдет в зависимости от подвергающегося лечению состояния. Как описано выше, в некоторых вариантах осуществления химиотерапевтические средства можно вводить при сниженном уровне дозировки.
Описанную здесь композицию в виде наночастиц можно вводить индивидууму (например, человеку) различными путями, такими как перентерально, включая внутривенное, внутриартериальное, внутрибрюшинное, внутрилегочное, пероральное, ингаляционное, интравезикулярное, внутримышечное, интратрехеальное, подкожное, внутриглазное, подоболочечное или трансдермальное введение. Например, композицию в виде наночастиц можно вводить ингаляцией для лечения заболеваний дыхательных путей. Композицию можно применять для лечения заболеваний дыхательных путей, таких как пневмосклероз, облитерирующий бронхиолит, рак легких, бронхоальвеолярная карцинома и им подобные. В некоторых вариантах осуществления композиция в виде наночастиц вводится внутривенно. В некоторых вариантах осуществления композиция в виде наночастиц вводится перорально.
Частота введения композиции в виде наночастиц зависит от природы комбинированного лечения и определенного заболевания, подвергаемого лечению. Иллюстративная частота введения включает без ограничения 1 раз в неделю без перерыва; 1 раз в неделю в течение трех из четырех недель; 1 раз в 3 недели; 1 раз в 2 недели; 1 раз в неделю в течение двух из трех недель. См. также таблицу 1.
Доза таксана в композиции в виде наночастиц будет варьироваться в зависимости от природы комбинированной терапии и конкретного подвергаемого лечению заболевания. Доза должна быть достаточной для получения желательной реакции, такой как терапевтическая или профилактическая реакция против конкретного заболевания. Иллюстративная доза таксана (в некоторых вариантах осуществления - паклитаксела) в композиции в виде наночастиц включает без ограничения примерно любую из доз 50 мг/м2, 60 мг/м2, 75 мг/м2, 80 мг/м2, 90 мг/м2, 100 мг/м2, 120 мг/м2, 160 мг/м2, 175 мг/м2, 200 мг/м2, 210 мг/м2, 220 мг/м2, 260 мг/м2 и 300 мг/м2. Например, доза таксана в композиции в виде наночастиц может находиться в диапазоне от 100 до 400 мг/м2, при введении по 3-х недельной схеме, или 50-250 мг/м2, при введении по еженедельной схеме. См. также таблицу 1.
Другие иллюстративные схемы введения композиции в виде наночастиц (такой как композиция паклитаксела/альбумина в виде наночастиц) включают без ограничения 100 мг/м2 1 раз в неделю без перерыва; 75 мг/м2 1 раз в неделю 3 из четырех недель; 100 мг/м2 1 раз в неделю 3 из четырех недель; 125 мг/м2 1 раз в неделю 3 из четырех недель; 125 мг/м2 1 раз в неделю 2 из 3 недель; 130 мг/м2 1 раз в неделю без перерыва; 175 мг/м2, 1 раз в 2 недели; 260 мг/м2 1 раз в 2 недели; 260 мг/м2 1 раз в 3 недели; 180-300 мг/м2 каждые 3 недели; 60-175 мг/м2 1 раз в неделю без перерыва. Кроме того, таксан (отдельно или в комбинированной терапии) можно вводить, следуя метрономной схеме введения, описанной здесь.
Иллюстративные схемы введения для комбинированной терапии композицией в виде наночастиц (такой как композиция паклитаксела/альбумина в виде наночастиц, например, AbraxaneTM) и другими средствами включают без ограничения 125 мг/м2 1 раз в неделю 2 из трех недель плюс 825 мг/м2 Xeloda® 1 раз в день; 260 мг/м2 1 раз в 2 недели плюс 60 мг/м2 адриамицина и 600 мг/м2 циклофосфамида 1 раз в 2 недели; 220-340 мг/м2 1 раз в 3 недели плюс карбоплатин, AUC=6, 1 раз в 3 недели; 100-150 мг/м2 1 раз в неделю плюс карбоплатин, AUC=6, 1 раз в 3 недели; 175 мг/м2 1 раз в 2 недели плюс 2000 мг/м2 гемцитабина и 50 мг/м2 эпирубицина 1 раз в 2 недели; и 75 мг/м2 1 раз в неделю 3 из 4 недель плюс карбоплатин, AUC=2, 1 раз в неделю 3 из 4 недель.
В некоторых вариантах осуществления композиция в виде наночастиц и химиотерапевтическое средство вводятся в соответствии с любой из схем введения, описанных в таблице 1.
В некоторых вариантах осуществления предоставляется способ лечения рака молочных желез у индивидуума, включающий введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие таксан (такой как паклитаксел) и альбумин, и b) эффективного количества, по меньшей мере, одного другого химиотерапевтического средства, как представлено в рядах 1-35 в таблице 1. В некоторых вариантах осуществления введение композиции в виде наночастиц и химиотерапевтического средства может производиться в соответствии с любой из схем введения, как указано в рядах 1-35 в таблице 1. В некоторых вариантах осуществления предоставляется способ лечения метастатического рака молочной железы у индивидуума, включающий введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие таксан (такой как паклитаксел) и альбумин, и b) эффективного количества, по меньшей мере, одного другого химиотерапевтического средства, как представлено в рядах 2, 4-8 и 10-15 в таблице 1. В некоторых вариантах осуществления введение композиции в виде наночастиц и химиотерапевтического средства может производиться в соответствии с любой из схем введения, как указано в рядах 2, 4-8 и 10-15 в таблице 1.
В некоторых вариантах осуществления предоставляется способ лечения запущенного рака молочной железы у индивидуума, включающий введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие таксан (такой как паклитаксел) и альбумин, и b) эффективного количества, по меньшей мере, одного другого химиотерапевтического средства, как представлено в рядах 1-16 в таблице 1. В некоторых вариантах осуществления введение композиции в виде наночастиц и химиотерапевтического средства может производиться в соответствии с любой из схем введения, как указано в рядах 1-16 в таблице 1. В некоторых вариантах осуществления предоставляется способ лечения рака молочной железы IV стадии у индивидуума, включающий введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие таксан (такой как паклитаксел) и альбумин, и b) эффективного количества, по меньшей мере, одного другого химиотерапевтического средства, как представлено в ряду 3 в таблице 1. В некоторых вариантах осуществления введение композиции в виде наночастиц и химиотерапевтического средства может производиться в соответствии с любой из схем введения, как указано в ряду 3 в таблице 1.
В некоторых вариантах осуществления предоставляется способ лечения рака молочной железы у индивидуума в адъювантной схеме, включающий введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие таксан (такой как паклитаксел) и альбумин, и b) эффективного количества, по меньшей мере, одного другого химиотерапевтического средства, как представлено в рядах 18-24 в таблице 1. В некоторых вариантах осуществления введение композиции в виде наночастиц и химиотерапевтического средства может производиться в соответствии с любой из схем введения, как указано в рядах 18-24 в таблице 1.
В некоторых вариантах осуществления предоставляется способ лечения рака молочной железы у индивидуума в неоадъювантной схеме, включающий введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие таксан (такой как паклитаксел) и альбумин, и b) эффективного количества, по меньшей мере, одного другого химиотерапевтического средства, как представлено в рядах 25-35 в таблице 1. В некоторых вариантах осуществления введение композиции в виде наночастиц и химиотерапевтического средства может производиться в соответствии с любой из схем введения, как указано в рядах 25-35 в таблице 1.
В некоторых вариантах осуществления предоставляется способ лечения рака легких у индивидуума, включающий введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие таксан (такой как паклитаксел) и альбумин, и b) эффективного количества, по меньшей мере, одного другого химиотерапевтического средства, как представлено в рядах 36-48 в таблице 1. В некоторых вариантах осуществления введение композиции в виде наночастиц и химиотерапевтического средства может производиться в соответствии с любой из схем введения, как указано в рядах 36-48 в таблице 1.
В некоторых вариантах осуществления предоставляется способ лечения NSCLC (включая лечение первой линии запущенного NSCLC и NSCLC) у индивидуума, включающий введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие таксан (такой как паклитаксел) и альбумин, и b) эффективного количества, по меньшей мере, одного другого химиотерапевтического средства, как представлено в рядах 36-40 и 42-43 в таблице 1. В некоторых вариантах осуществления введение композиции в виде наночастиц и химиотерапевтического средства может производиться в соответствии с любой из схем введения, как указано в рядах 36-40 и 42-43 в таблице 1. В некоторых вариантах осуществления предоставляется способ лечения запущенных солидных злокачественных опухолей в легких у индивидуума, включающий введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие таксан (такой как паклитаксел) и альбумин, и b) эффективного количества, по меньшей мере, одного другого химиотерапевтического средства, как представлено в ряду 41 в таблице 1. В некоторых вариантах осуществления введение композиции в виде наночастиц и химиотерапевтического средства может производиться в соответствии со схемами введения, как указано в ряду 41 в таблице 1. В некоторых вариантах осуществления предоставляется способ лечения SCLC у индивидуума, включающий введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие таксан (такой как паклитаксел) и альбумин, и b) эффективного количества, по меньшей мере, одного другого химиотерапевтического средства, как представлено в ряду 48 в таблице 1. В некоторых вариантах осуществления композиция в виде наночастиц и химиотерапевтическое средство вводятся в соответствии со схемами введения, как указано в ряду 48 в таблице 1.
В некоторых вариантах осуществления предоставляется способ лечения рака яичников у индивидуума, включающий введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие таксан (такой как паклитаксел) и альбумин, и b) эффективного количества, по меньшей мере, одного другого химиотерапевтического средства, как представлено в рядах 49-52 в таблице 1. В некоторых вариантах осуществления введение композиции в виде наночастиц и химиотерапевтического средства может производиться в соответствии с любой из схем введения, как указано в рядах 49-52 в таблице 1.
В некоторых вариантах осуществления предоставляется способ лечения рака головы и шеи у индивидуума, включающий введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие таксан (такой как паклитаксел) и альбумин, и b) эффективного количества, по меньшей мере, одного другого химиотерапевтического средства, как представлено в рядах 53-55 в таблице 1. В некоторых вариантах осуществления введение композиции в виде наночастиц и химиотерапевтического средства может производиться в соответствии с любой из схем введения, как указано в рядах 53-53 в таблице 1.
В некоторых вариантах осуществления предоставляется способ лечения солидной опухоли (включая запущенную солидную опухоль) у индивидуума, включающий введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие таксан (такой как паклитаксел) и альбумин, и b) эффективного количества, по меньшей мере, одного другого химиотерапевтического средства, как представлено в рядах 56-59 в таблице 1. В некоторых вариантах осуществления введение композиции в виде наночастиц и химиотерапевтического средства может производиться в соответствии с любой из схем введения, как указано в рядах 56-59 в таблице 1.
В некоторых вариантах осуществления предоставляется способ лечения меланомы (включая метастатическую меланому) у индивидуума, включающий введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие таксан (такой как паклитаксел) и альбумин, и b) эффективного количества, по меньшей мере, одного другого химиотерапевтического средства, как представлено в рядах 60-63 в таблице 1. В некоторых вариантах осуществления введение композиции в виде наночастиц и химиотерапевтического средства может производиться в соответствии с любой из схем введения, как указано в рядах 60-63 в таблице 1.
В некоторых вариантах осуществления предоставляется способ лечения метастатического рака ободочной и прямой кишки у индивидуума, включающий введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие таксан (такой как паклитаксел) и альбумин, и b) эффективного количества, по меньшей мере, одного другого химиотерапевтического средства, как представлено в ряду 64 в таблице 1. В некоторых вариантах осуществления введение композиции в виде наночастиц и химиотерапевтического средства может производиться в соответствии с любой из схем введения, как указано в ряду 64 в таблице 1.
В некоторых вариантах осуществления предоставляется способ лечения рака поджелудочной железы у индивидуума, включающий введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие таксан (такой как паклитаксел) и альбумин, и b) эффективного количества, по меньшей мере, одного другого химиотерапевтического средства, как представлено в рядах 65-66 в таблице 1. В некоторых вариантах осуществления введение композиции в виде наночастиц и химиотерапевтического средства может производиться в соответствии с любой из схем введения, как указано в рядах 65-66 в таблице 1.
| Таблица 1 | ||||
| № ряда | Комбинация | Схема/ дозировка |
Тип исследуемого лечения | Название протокола |
| 1. | АВХ + карбоплатин + Herceptin® | АВХ 100 мг/м2 д 1, 8, 15, q4wk×6 Carbo AUC=2 д 1, 8, 15, q4wk×6 Herceptin® 4 мг/кг в 1 неделю, 2 мг/кг все последующие недели |
Запущенный HER2+ рак молочной железы | Фаза II исследования с частым ежене-дельным режимом введения наночастиц паклитаксела (ABI-007), карбоплатина с Herceptin® в качестве первой или второй линии терапии запущенного HER2+ рака молочной железы |
| 2. | Один АВХ (+ Herceptin®) |
АВХ 125 мг/м2 qwk×3/4 | Метастатический рак молочной железы (МВС) | Фаза II испытания с еженедельной монотерапией путем введения AbraxaneTM для лечения 1-ой линии МВС (плюс Herceptin® для HER2+ пациенток) |
| 3. | АВХ + Herceptin® (± G-CSF) |
L (уровень) 1: АВХ 80 мг/м2, Navelbine® 15 мг/м2, L2: АВХ 90 мг/м2, Navelbine® 20 мг/м2, L3: АВХ 100 мг/м2, Navelbine® 22,5 мг/м2, L4: АВХ 110 мг/м2, Navelbine® 25 мг/м2, L5: АВХ 125 мг/м2, Navelbine® 25 мг/м2, qwk все уровни |
Рак молочной железы IV стадии | Фаза I-II исследования введения АВХ + Navelbine® 1 раз в неделю в комбинации или без G-CSF при раке молочной железы IV стадии |
| 4. | ABX + Xeloda® | АВХ 125 мг/м2 qwk×2/3, Xeloda® 825 мг/м2 д 1-14 q3wk |
Метастатический рак молочной железы | Фаза II испытания лечения 1-ой линии МВС ABX + Xeloda® |
| 5. | ABX + антрациклин | Метастатический рак молочной железы | Фаза I/II испытания ABX плюс Doxil® для МВС плюс ограниченный РК | |
| 6. | ABX + гемцитабин |
АВХ 125 мг/м2, гемцитабин 1000 мг/м2 qwk×2/3 |
Метастатический рак молочной железы | Фаза II рандомизиро-ванного испытания, введение 1 раз в неделю nab (связанного с наночастицами альбумина)-паклитаксела (nab-паклитак-села) в комбинции с гемцитабином у пациентов с HER2 отрицательным метастатическим раком молочной железы |
| 7. | АВХ + лапатиниб |
Метастатический рак молочной железы | Фаза I/II испытания AbraxaneTM + GW572016 | |
| 8. | АВХ + лапатиниб |
АВХ 100 мг/м2 qwk×3/4, лапатиниб, начиная с 1000 мг/день × 2 дня |
Метастатический рак молочной железы | Фаза I исследования, увеличение дозы пероральной химиосенси-билизации пульсирующим введением лапатиниба в течение 2-х дней, вводимым перед внутривенным введением 1 раз в неделю AbraxaneTM, у пациентов с запущенными солидными опухолями |
| 9. | ABX + FEC (+ Herceptin®) |
АВХ 220 мг/м2 q2wk×6 с последующим введением FEC: 4 цикла (+ Herceptin® для HER2+ пациенток) |
Рак молочной железы | Фаза II испытания предоперацион-ного применения AbraxaneTM с последующим введением FEC (+ Herceptin® при целесообраз-ности) при раке молочной железы |
| 10. | ABX + карбоплатин + Avastin® | АВХ 100 мг/м2 qwk д 1, 8, 15, карбоплатин AUC=2 qwk д 1, 8, 15, Avastin® 10 мг/м2 q2wk |
Метастатический рак молочной железы (HER2-, ER-, PR-) |
Фаза II исследования безопасности и переносимости AbraxaneTM, Avastin® и карбоплатина у пациенток с тройным отрицательным метастатичес-ким раком молочной железы |
| 11. | ABX + Avastin® | АВХ 130 мг/м2 qwk + Avastin® в сравнении с АВХ 260 мг/м2 q2wk + Avastin®, в сравнении с АВХ 260 мг/м2 q3wk + Avastin® |
Метастатический рак молочной железы | Фаза II трехплечевого испытания у HER2-отрицательных пациенток с МВС 1-ой линии |
| 12. | ABX + Avastin® | АВХ 125 мг/м2 qwk×3/4 + Avastin® |
Метастатический рак молочной железы | Одноплечевое исследование лечения AbraxaneTM и Avastin® при 1-ой линии МВС |
| 13. | ABX + Avastin® | АВХ + Avastin® qwk в сравнении с Taxol® + Avastin® qwk |
Метастатический рак молочной железы | Фаза III рандомизиро-ванного испытания лечения 1-ой и 2-ой линии при МВС с анализом биологических коррелятов |
| 14. | ABX + Xeloda® + лапатиниб | Метастатический рак молочной железы | Фаза II испытания AbraxaneTM в комбинации с Xeloda® и лапатинибом при метастати-ческом раке молочной железы |
| 15. | ABX + гемцитабин |
АВХ 3000 мг/м2 д 1 q3wk, гемцитабин 1250 мг/м2 д 1, 8 q3wk |
Метастатический рак молочной железы | Фаза II одноплечевого исследования лечения AbraxaneTM и гемцитабином по поводу МВС 1-ой линии |
| 16. | ABX + RAD001 | Запущенный рак молочной железы | Фаза I/II исследования AbraxaneTM в комбинации с RAD001 у пациенток с запущенным раком молочной железы | |
| 17. | ABX + Sutent® | Рак молочной железы | Фаза I исследования AbraxaneTM в комбинации с Sutent® | |
| 18. | ABX + AC + G-CSF (+ Herceptin®) |
AC + G-CSF q2wk×4 с последующим введением АВХ 260 мг/м2 q2wk×4 (+ Herceptin® для HER2+ положительных пациенток) |
Рак молочной железы – Адъювантная схема |
AbraxaneTM в дозозависимой химиотерапии для ранних стадий рака молочной железы |
| 19. | ABX + AC + G-CSF (+ Herceptin®) |
Частое введение АС + G-CSF с последующим введением АВХ (+ Herceptin® для HER2+ положительных пациенток) | Рак молочной железы – Адъювантная схема |
Фаза II пилотного адъювантного испытания AbraxaneTM при раке молочной железы |
| 20. | ABX + AC | АС с последующим введением ABX 260 мг/м2 в сравнении с АС с последующим введением Taxol® Rx длительность 16 недель |
Рак молочной железы – Адъювантная схема |
Адъювантное с чистым введением дозы, регистрационное исследование |
| 21. | ABX + AC (+ G-CSF) |
AC q2wk с последующим введением АВХ 260 мг/м2 + G-CSF q2wk Rx длительность 16 недель |
Рак молочной железы – Адъювантная схема |
Фаза II пилотного адъювантного исследования с частым введением дозы AbraxaneTM при раке молочной железы |
| 22. | ABX + AC (+ Avastin®) |
Частое введение АС с последующим введением ABX (+ Avastin® для HER2+ пациенток) | Рак молочной железы – Адъювантная схема |
Пилотное исследование адъювантного лечения рака молочной железы |
| 23. | ABX + AC | AC с последующим введением ABX q2wk или q3wk |
Рак молочной железы – Адъювантная схема |
Исследование BIG: Частое введение в сравнении со стандартной адъювантной химиотерапией |
| 24. | ABX (ABI-007) + AC + Neulasta® | AC с последующим введением ABX q2wk×4 |
Рак молочной железы – Адъювантная схема |
Фаза II – пилотное исследование, оценивающее безопасность схемы частого введения – АС×4⇒ABI-007 ×4 q 2 недели + Neulasta®, вводимый в качестве адъювантной химиотерапии у женщин с высоким риском при раннем раке молочной железы |
| 25. | ABX + FEC (+ Herceptin®) |
ABX 100 мг/м2 qwk×12 с последующим введением 5-FU 500 мг/м2 q3wk, эпирубицина 100 мг/м2 (без Herceptin®) или эпирубицин 75 мг/м2 (с Herceptin® для HER2+ пациенток), циклофосфамид 500 мг/м2 q3wk |
Локальная запущенная опухоль молочной железы – Неоадъювантная схема |
Фаза II исследования неоадъювантной химиотерапии с последовательным введением 1 раз в неделю связанного с наночастицами альбумина паклитаксела (AbraxaneTM) с последующим введением 5-фторурацила, эпирубицина, циклофосфамида (FEC) при локально запущенной опухоли молочной железы |
| 26. | ABX + гемцитабин + эпирубицин |
Плечо 1: Неоадъювантная схема: гемцитабин 2000 мг/м2, АВХ 175 мг/м2, эпирубицин 50 мг/м2, q2wk×6; Плечо 2: Адъювантная схема: гемцитабин 2000 мг/м2, АВХ 220 мг/м2 q2wk×4 |
Рак молочной железы – Неоадъювантная схема |
Фаза II испытания неоадъювантной терапии частым введением гемцитабина, эпирубицина, ABI-007 (GEA) при локально запущенной опухоли или воспалительном раке молочной железы |
| 27. | ABX + Herceptin® | ABX 260 мг/м2 q2wk + Herceptin® с последующим введением Navelbine® + Herceptin® |
Рак молочной железы – Неоадъювантная схема |
Фаза II много-центрового исследования неоадъювантной схемы лечения |
| 28. | ABX + карбоплатин (+ Herceptin®) +АС |
ТАС в сравнении с АС с последующим введением ABX + карбоплатина в сравнении с АС с последующим введением ABX + карбоплатина + Herceptin® |
Рак молочной железы – Неоадъювантная схема |
Фаза II 3-плечевого рандомизиро-ванного испытания, с частым введением дозы, при неоадъювантной химиотерапии у пациенток с раком молочной железы |
| 29. | ABX + капецитабин |
ABX 260 мг/м2 q3wk×4, Xeloda® 850 мг/м2 д 1-14 q3wk×4 |
Рак молочной железы – Неоадъювантная схема |
Фаза II испытания неоадъювантного лечения AbraxaneTM и капецитабином при локальном, запущенном раке молочной железы |
| 30. | ABX + карбоплатин (+ Avastin®) |
ABX qwk, карбоплатин qwk (+ Avastin® у HER2+ пациенток) |
Рак молочной железы – Неоадъювантная схема |
Фаза I/II испытания неоадъювантной химиотерапии (NCT) с введением 1 раз в неделю паклитаксела в виде наночастиц (ABI-007, AbraxaneTM) в комбинации с карбоплатином и Avastin® при I-III клинической стадии. |
| 31. | ABX + карбоплатин + Herceptin® + Avastin® |
ABX 100 мг/м2 qwk×3/4, карбоплатин AUC=5, + Herceptin® + Avastin® 4-недельный цикл × 6 |
Рак молочной железы – Неоадъювантная схема |
Фаза II исследования введения бевацизумаба 1 раз в неделю с введением 1 раз в неделю трастузумаба, ABI-007 и карбоплатина в качестве предоперацион-ной терапии при HER2-отрицательных генамплифици-рованных раковых опухолях молочной железы |
| 32. | ABX + лапатиниб |
ABX 260 мг/м2 q3wk, лапатиниб 1000 мг/д |
Рак молочной железы – Неоадъювантная схема |
Пилотное испытание неоадъювантной химиотерапии комбинацией ABI-007 (AbraxaneTM) и GW572016 (лапатиниб) |
| 33. | ABX + капецитабин |
ABX 200 мг/м2 q3wk×4, Xeloda® 1000 мг/м2 д 1-14 q3wk×4 |
Рак молочной железы – Неоадъювантная схема |
Фаза II испытания неоадъювантной химиотерапии AbraxaneTM и капецитабином при локальной, запущенной опухоли молочной железы |
| 34. | ABX ± Avastin® + АС (+ G-CSF) |
ABX qwk ± Avastin® с последующим введением А qwk + С 1 раз в день в сравнении с Taxol® qwk ± Avastin® с последующим введением А qwk + С 1 раз в день |
Рак молочной железы – Неоадъювантная схема |
Фаза III испытания паклитаксела в сравнении с AbraxaneTM с или без Avasnine® в комбинации с доксорубицином и циклофосфамидом плюс G-CSF |
| 35. | ABX + АС | ABX с последующим введением АС | Рак молочной железы – Неоадъювантная схема |
Фаза II испытания неоадъювантной химиотерапии с анализами генной экспрессии |
| 36. | ABX + карбоплатин + Avastin® |
ABX 300 мг/м2 q3wk, карбоплатин AUC=6 q3wk 4 цикла |
Лечение 1-ой линии запущенного NSCLC | Фаза II открытого испытания AbraxaneTM, карбоплатина и Avastin® у пациентов с запущенным неплоскоклето-чным, немелко-клеточным раком легких (NSCLC) |
| 37. | ABX + карбоплатин |
L1: ABX 225 мг/м2, L2: ABX 260 мг/м2, L3: ABX 300 мг/м2, Когорты 1-4: ABX q3wk, Когорты 5-7: ABX 1 раз в неделю, Когорта 8: 75 дополнительных пациентов, карбоплатин фиксированно при AUC=6 q3wk |
Запущенный NSCLC | Фаза II пилотного исследования токсичности AbraxaneTM и карбоплатина при запущенном немелкоклеточ-ном раке легких (NSCLC) |
| 38. | ABX + карбоплатин |
Карбоплатин AUC=6 + АВХ в сравнении с карбоплатином AUC=6 + Taxol®: 225 мг/м2 |
Лечение NSCLC 1-ой линии | Фаза III регистрации – лечение NSCLC 1-ой линии |
| 39. | ABX + карбоплатин |
ABX 100 мг/м2 д 1, 8, 15, карбоплатин AUC=6 q4wk, уточнение: ABX 125 мг/м2 д 1, 8, 15 |
Лечение NSCLC 1-ой линии | Фаза II испытания введения 1 раз в неделю AbraxaneTM плюс карбоплатина при лечении NSCLC 1-ой линии |
| 40. | ABX + карбоплатин + Avastin® |
1 раз в неделю | NSCLC |
| 41. | ABX + карбоплатин |
Плечо 1: ABX 100, 125, 150 мг/м2 д 1, 8, 15 q4wk, Плечо 2: ABX 220, 260, 300, 340 мг/м2 q3wk, Плечо 3: ABX 100, 125, 150 мг/м2 д 1, 8, карбоплатин AUC=6 во всех плечах |
Рак легких – запущенная солидная злокачественная опухоль | Фаза I испытания карбоплатина и AbraxaneTM по схеме введения 1 раз в неделю и 1 раз в 3 недели у пациентов с запущенными солидными злокачествен-ными опухолями |
| 42. | ABX + гемцитабин или ABX + Avastin® |
NSCLC | AbraxaneTM в комбинации с гемцитабином или Avastin® | |
| 43. | ABX + гемцитабин |
NSCLC | Фаза I испытания AbraxaneTM в комбинации с гемцитабином | |
| 44. | ABX + карбоплатин + Avastin® |
ABX 225, 260, 300 мг/м2, карбоплатин AUC=6 q3wk + Avastin® |
Рак легких | Фаза I/II исследования AbraxaneTM и карбоплатина AUC=6 плюс Avastin® (стандартная структура фазы I 3+3; фаза II: 40 пациентов) |
| 45. | ABX + Alimta® |
ABX 220, 260, 300 мг/м2 q3wk, пемтрексед 500 мг q3wk |
Рак легких | Фаза I/II исследования AbraxaneTM и Alimta® для лечения NSCLC 2-ой линии |
| 46. | ABX + цисплатин | Рак легких | Фаза I/II исследования AbraxaneTM плюс цисплатина при запущенном NSCLC | |
| 47. | ABX + Nevelbine® + цисплатин | Рак легких | Фаза I/II исследования AbraxaneTM, Nevelbine® и цисплатина для лечения запущенного NSCLC | |
| 48. | ABX + карбоплатин | ABX 300 мг/м2 q3wk, карбоплатин AUC=6 q3wk |
Мелкоклеточный рак легких SCLC | Фаза II испытания AbraxaneTM и карбоплатина при мелкоклеточном раке легких в стадии распростране-ния |
| 49. | ABX + карбоплатин | ABX 100 мг/м2 qwk×3/4, карбоплатин AUC=6 |
Рак яичников | Фаза II испытания AbraxaneTM + карбоплатина при рецидивирующем раке яичников |
| 50. | ABX + карбоплатин | ABX qwk, ABX q3w, карбоплатин AUC=6, оба плеча |
Рак яичников | Фаза I исследования AbraxaneTM плюс карбоплатина для лечения запущенного рака яичников |
| 51. | ABX + карбоплатин | ABX в комбинации с ABI-CA034 в сравнении с Taxol® 175 мг/м2, карбоплатином AUC=6 в обоих плечах |
Рак яичников | Регистрацион-ное испытание лечения 1-ой линии, оптимально сокращающее объем образования. Карбоплатин AUC=6+ABX в сравнении с карбоплатином + Taxol® 175 мг/м2. Исход: выживание без рецидива, выживание |
| 52. | ABX + Avastin® | ABX 100 мг/м2 qwk×3/4, Avastin® 10 мг/м2 q2wk |
Рак яичников | Фаза II исследования AbraxaneTM у пациенток с рецидивирующей, устойчивой к платине первичной эпителиальной карциномой яичников или первичной карциномой брюшины |
| 53. | ABX + 5-фторурацил + цисплатин |
ABX д 1, 5-фторурацил 750 мг/м2 CIV×5, цисплатин 75 мг/м2 д 1 с последующей рентгено-терапией и хирургическим лечением |
Рак головы и шеи | Фаза II испытания AbraxaneTM в комбинации с 5-фторурацилом и цисплатином при неоперабельном локализованном раке головы и шеи |
| 54. | ABX + 5-фторурацил + цисплатин |
5-фторурацил 750 мг/м2 CIV×5, цисплатин 75 мг/м2 д 1 ± АВХ д 1 с последующей рентгено-терапией и хирургическим лечением |
Рак головы и шеи | Фаза III испытания 5-фторурацила и цисплатина с AbraxaneTM или без него при неоперабельном локализованном раке головы и шеи |
| 55. | ABX + цетуксимаб |
Рак головы и шеи | Фаза II много-центрового испытания AbraxaneTM в комбинации с цетуксимабом при лечении 1-ой линии локально запущенного или метастати-ческого рака головы и шеи |
|
| 56. | ABX + рапамицин |
ABX 100 мг/м2 qwk, рапамицин 5-40 мг с увеличением дозы |
Солидные опухоли | Фаза I иссле-дования рапамицина в комбинации с AbraxaneTM при запущенных солидных опухолях |
| 57. | ABX + сатраплатин |
Солидные опухоли | Фаза I испытания AbraxaneTM и сатраплатина | |
| 58. | ABX + гемцитабин |
ABX 180, 220, 260, 300, 340 мг/м2 q3wk, гемцитабин 1000 мг/м2 д 1 и д 8 |
Запущенные солидные опухоли | Фаза I испытания AbraxaneTM в комбинации с гемцитабином |
| 59. | ABX + гефитиниб | ABX 100 мг/м2 qwk×3/4, гефитиниб, начиная с 1000 мг в день × 2 |
Запущенные солидные опухоли | Фаза I иссле-дования пульсирующей химиосенсиби-лизирующей терапии с увеличением дозы гефитинибом, вводимым перед введением AbraxaneTM 1 раз в неделю |
| 60. | ABX + Avastin® |
Метастатическая меланома | Фаза II исследования AbraxaneTM и Avastin® при метастатической меланоме | |
| 61. | ABX + Avastin® |
Меланома | AbraxaneTM и Avastin® в качестве лечения пациентов со злокачественной меланомой | |
| 62. | ABX + карбоплатин |
Метастатическая меланома | Фаза II исследования AbraxaneTM и карбоплатина при метастатической меланоме | |
| 63. | ABX + сорафениб + карбоплатин | ABX qwk, сорафениб д 2-19, карбоплатин AUC=6 д 1 |
Метастатическая меланома | Фаза II исследования AbraxaneTM в комбинации с карбоплатином и сорафенибом при метастатической меланоме |
| 64. | ABX + капецитабин | Метастатический рак ободочной и прямой кишки (после несостоятельности терапии на основе цисплатина и терапии на основе иринотекана) | Фаза II испытания AbraxaneTM в комбинации с Xeloda® для ранее получавших лечение пациентов с запущенным или метастатичес-ким раком ободочной и прямой кишки | |
| 65. | ABX + гемцитабин | 1 раз в неделю | Рак поджелудочной железы | Фаза I испытания AbraxaneTM в комбинации с гемцитабином при раке поджелудочной железы |
| 66. | ABX + гемцитабин | ABX + гемцитабин в сравнении с гемцитабином | Рак поджелудочной железы | Фаза III регистрационного испытания при раке поджелудочной железы |
| 67. | ABX + антиан-гиогенные средства | AbraxaneTM в комбинации с антиангиогенными средствами, например, Avastin® | ||
| 68. | ABX + ингибиторы протеасом | AbraxaneTM в комбинации с ингибиторами протеасом, например, Velcade® |
| 69. | ABX + ингибиторы EGFR | AbraxaneTM в комбинации с ингибиторами EGFR, например, Tarceva® |
Используемое здесь обозначение (например, в таблице 1) «АВХ» относится к AbraxaneTM; ПЦ572016 относится к лапатинибу; Xel относится к капецитабину или Xeloda®; бевакцизумаб также известен как Avastin®; трастузумаб также известен как Herceptine®; пемтрексед также известен как Alimta®; цетуксимаб также известен как Erbitux®; гефитиниб также известен как Iressa®; FEC относится к комбинации 5-фторурацила, эпирубицина и циклофосфамида; АС относится к комбинации адриамицина плюс циклофосфамида; ТАС относится к одобренной FDA (Федеральной Администрацией по пищевым продуктам и лекарственным средствам) схеме адъювантной терапии рака молочной железы; RAD001 относится к производному рапамицина; NSCLC относится к немелкоклеточному раку легких; а SCLC относится к мелкоклеточному раку легких.
Используемое здесь (например, в таблице 1) обозначение AUC относится к площади под кривой; q4wk относится к дозе, вводимой 1 раз в 4 недели; q3wk относится к дозе, вводимой 1 раз в 3 недели; q2wk относится к дозе, вводимой 1 раз в 2 недели; qwk относится к дозе, вводимой 1 раз в неделю; qwk×3/4 относится к дозе, вводимой 1 раз в неделю в течение 3 недель при 4-ой неделе, свободной от введения; qwk×2/3 относится к дозе, вводимой 1 раз в неделю в течение 2 недель при 3-ей неделе, свободной от введения.
Комбинированная терапия с лучевой терапией и хирургическим лечением
В другом аспекте настоящее изобретение предоставляет способ лечения пролиферативного заболевания (такого как рак), включающий первое лечение, включающее введение таксана (в частности, наночастиц, включающих таксан) и белок-носитель, и второе лечение, включающее лучевую терапию и/или хирургическое лечение.
В некоторых вариантах осуществления способ включает: а) первое лечение, включающее введение индивидууму композиции, содержащей наночастицы, включающие эффективное количество таксана и белок-носитель (такой как альбумин), и b) второе лечение, включающее лучевую терапию, хирургическое лечение или их комбинацию. В некоторых вариантах осуществления таксан покрыт белком-носителем (таким как альбумин). В некоторых вариантах осуществления второе лечение представляет собой лучевую терапию. В некоторых вариантах осуществления второе лечение представляет собой хирургическое лечение.
В некоторых вариантах осуществления способ включает: а) первое лечение, включающее введение индивидууму композиции, содержащей наночастицы, включающие паклитаксел и альбумин, и b) второе лечение, включающее лучевую терапию, хирургическое лечение или их комбинацию. В некоторых вариантах осуществления таксан покрыт белком-носителем (таким как альбумин). В некоторых вариантах осуществления второе лечение представляет собой лучевую терапию. В некоторых вариантах осуществления второе лечение представляет собой хирургическое лечение. В некоторых вариантах осуществления наночастицы паклитаксела/альбумина имеют средний диаметр не более чем примерно 200 нм. В некоторых вариантах осуществления композиция паклитаксела/альбумина в виде наночастиц по существу не содержит (например, лишена) поверхностно-активного вещества (такого как Cremophor). В некоторых вариантах осуществления весовое отношение альбумина к паклитакселу в композиции составляет примерно 18:1 или менее, например, примерно 9:1 или менее. В некоторых вариантах осуществления паклитаксел покрыт альбумином. В некоторых вариантах осуществления наночастицы паклитаксела/альбумина имеют средний диаметр не более чем примерно 200 нм, и композиция паклитаксела/альбумина в виде наночастиц по существу не содержит (например, лишена) поверхностно-активного вещества (такого как Cremophor). В некоторых вариантах осуществления наночастицы паклитаксела/альбумина имеют средний диаметр не более чем примерно 200 нм, и паклитаксел покрыт альбумином. В некоторых вариантах осуществления композиция в виде наночастиц представляет собой AbraxaneTM.
Композицию в виде наночастиц можно вводить перед облучением и/или хирургическим лечением, после облучения и/или хирургического лечения или одновременно с облучением и/или хирургическим лечением. Например, введение композиции в виде наночастиц может предшествовать или следовать за облучением и/или хирургическим лечением с интервалами в диапазоне от минут до недель. В некоторых вариантах осуществления период времени между первым и вторым лечением таков, чтобы таксан и облучение/хирургическое лечение были еще способны оказать преимущественно комбинированный эффект на клетку. Например, таксан (такой как паклитаксел) в композиции в виде наночастиц можно вводить в любую из точек времени менее чем примерно через 1, 3, 6, 9, 12, 18, 24, 48, 60, 72, 84, 96, 108, 120 часов перед облучением и/или хирургическим лечением. В некоторых вариантах осуществления композиция в виде наночастиц вводится менее чем примерно за 9 часов до облучения и/или хирургического лечения. В некоторых вариантах осуществления композиция в виде наночастиц вводится в любую из точек времени менее чем примерно через 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 дней перед облучением и/или хирургическим лечением. В некоторых вариантах осуществления таксан (такой как паклитаксел) в композиции в виде наночастиц вводится в любую из точек времени менее чем примерно через 1, 3, 6, 9, 12, 18, 24, 48, 60, 72, 84, 96, 108, 120 часов после облучения и/или хирургического лечения. В некоторых вариантах осуществления может быть желательно значительное продление периода времени лечения, где между двумя курсами лечения проходит от нескольких дней до нескольких недель.
Предусмотренное здесь облучение включает, например, γ-лучи, рентгеновские лучи (внешний пучок) и направленную доставку радиоизотопов к опухолевым клеткам. Предусмотрены также другие формы повреждающих ДНК факторов, такие как микроволны и УФ облучение. Облучение можно подавать одной дозой или серией небольших доз по схеме фракционированной дозы. Предусмотренное здесь количество облучения находится в диапазоне от примерно 1 до примерно 100 Гр, включая, например, от примерно 5 до примерно 80, от примерно 10 до примерно 50 Гр, или примерно 10 Грэй. Общую дозу можно подавать по фракционированной схеме. Например, схема может включать фракционированные отдельные дозы по 2 Грэя. Диапазоны доз для радиоизотопов варьируются в широких пределах и зависят от периода полураспада изотопа, силы и типа испускаемого излучения.
Когда облучение включает использование радиоактивных изотопов, то изотоп может быть сопряженно связан с нацеливающим агентом, таким как терапевтическое антитело, которое несет радионуклеотид к ткани-мишени. Подходящие радиоактивные изотопы включают без ограничения астатин211, 14углерод, 51хром, 36хлор, 57железо, 58кобальт, медь67, 152Eu, галлий67, 3водород, йод123, йод131 индий111, 59ион, 32фосфор, рений186, 75селен, 35серу, технеций99m и/или иттрий90.
В некоторых вариантах осуществления облучение подается индивидууму так, чтобы обеспечить возможность снижения обычной дозы таксана (такого как паклитаксел) в композиции в виде наночастиц, требуемой для обеспечения такой же степени лечения, по меньшей мере, примерно на любую величину из 5%, 10%, 20%, 30%, 50%, 60%, 70%, 80%, 90% или более. В некоторых вариантах осуществления вводится такое количество таксана в композиции в виде наночастиц, которое достаточно для обеспечения возможности снижения обычной дозы облучения, требуемой для обеспечения такой же степени лечения, по меньшей мере, примерно на любую величину из 5%, 10%, 20%, 30%, 50%, 60%, 70%, 80%, 90% или более. В некоторых вариантах осуществления доза таксана (такого как паклитаксел) в композиции в виде наночастиц и облучения снижены по сравнению с соответствующей обычной дозой каждого из них при отдельном применении.
В некоторых вариантах осуществления комбинация введения композиции в виде наночастиц и лучевой терапии создают сверхаддитивный эффект. В некоторых вариантах осуществления таксан (такой как паклитаксел) в композиции в виде наночастиц вводится однократно в дозе 90 мг/кг, а облучение производится 5 раз при 80 Гр/д.
Описанное здесь хирургическое лечение включает резекцию, при которой вся или часть раковой ткани физически удаляется, иссекается и/или разрушается. Резекция опухоли относится к физическому удалению, по меньшей мере, части опухоли. В дополнение к резекции опухоли хирургическое лечение включает лазерную хирургию, криохирургию, электрохирургию и хирургию, контролируемую микроскопией (хирургию Mohs). Также предусмотрено удаление поверхностных, предраковых или здоровых тканей.
Лучевую терапию и/или хирургическое лечение можно проводить в дополнение к введению химиотерапевтических средств. Например, индивидууму может быть сначала введена содержащая таксан композиция в виде наночастиц и, по меньшей мере, одно другое химиотерапевтическое средство, а в последующем он может подвергаться лучевой терапии и/или хирургическому лечению. Альтернативно, индивидуума можно сначала лечить лучевой терапией и/или хирургическим лечением, за которым затем следует введение композиции в виде наночастиц и, по меньшей мере, одного другого химиотерапевтического средства. Предусмотрены также другие комбинации.
Описанное выше введение композиций в виде наночастиц в сочетании с введением химиотерапевтического средства в равной степени применимо к тем, которые вводятся в сочетании с лучевой терапией и/или хирургическим лечением.
В некоторых вариантах осуществления композиция таксана в виде наночастиц и лучевой терапии и/или химиотерапевтическое средство вводятся в сочетании с облучением в соответствии с любой из схем введения, описанных в таблице 2.
В некоторых вариантах осуществления предоставляется способ лечения NSCLC у индивидуума, включающий: а) первое лечение, включающее введение индивидууму композиции, содержащей наночастицы, включающие таксан (такой как паклитаксел) и альбумин, и b) второе лечение, включающее облучение, как представлено в рядах 1-5 в таблице 2. В некоторых вариантах осуществления введение композиции в виде наночастиц и химиотерапевтического средства может производиться в соответствии с любой из схем введения, как указано в рядах 1-5 в таблице 2.
В некоторых вариантах осуществления предоставляется способ лечения рака головы и шеи у индивидуума, включающий: а) первое лечение, включающее введение индивидууму композиции, содержащей наночастицы, включающие таксан (такой как паклитаксел) и альбумин, и b) второе лечение, включающее облучение, как представлено в рядах 6-9 в таблице 2. В некоторых вариантах осуществления введение композиции в виде наночастиц и химиотерапевтического средства может производиться в соответствии с любой из схем введения, как указано в рядах 6-9 в таблице 2.
В некоторых вариантах осуществления предоставляется способ лечения рака поджелудочной железы у индивидуума, включающий: а) первое лечение, включающее введение индивидууму композиции, содержащей наночастицы, включающие таксан (такой как паклитаксел) и альбумин, и b) второе лечение, включающее облучение, как представлено в ряду 10 в таблице 2. В некоторых вариантах осуществления введение композиции в виде наночастиц и химиотерапевтического средства может производиться в соответствии с любой из схем введения, как указано в ряду 10 в таблице 2.
В некоторых вариантах осуществления предоставляется способ лечения злокачественных поражений желудка у индивидуума, включающий: а) первое лечение, включающее введение индивидууму композиции, содержащей наночастицы, включающие таксан (такой как паклитаксел) и альбумин, и b) второе лечение, включающее облучение, как представлено в ряду 11 в таблице 2. В некоторых вариантах осуществления введение композиции в виде наночастиц и химиотерапевтического средства может производиться в соответствии с любой из схем введения, как указано в ряду 11 в таблице 2.
| Таблица 2 | ||||
| № ряда | Комбинация | Схема/дозировка | Тип исследуемого лечения | Название протокола |
| 1 | АВХ + облучение | NSCLC | Фаза I/II испытания AbraxaneTM в комбинации с облучением | |
| 2 | АВХ + карбоплатин + облучение |
NSCLC | Фаза I/II испытания AbraxaneTM и карбоплатина в комбинации с облучением | |
| 3 | АВХ + карбоплатин + облучение |
1 цикл индукционная терапия АВХ/карбоплатином с последующим введением 2 или 3 раза в неделю АВХ + облучения | NSCLC | Фаза II, химиолучевое лечение при NSCLC |
| 4 | АВХ + карбоплатин + облучение |
NSCLC | Индукционная терапия Abraxaneтм/карбо-платином с последующим введением AbraxaneTM + облучения у пациентов с III стадией A&B PS2 NSCLC | |
| 5 | АВХ + карбоплатин + облучение |
АВХ qwk + карбоплатин + облучение c последующим введением АВХ q3wk + карбоплатина |
NSCLC | Фаза II исследования |
| 6 | АВХ + облучение | Рак головы и шеи | AbraxaneTM в качестве радиосенси-билизатора при раке головы и шеи | |
| 7 | АВХ + цетуксимаб + облучение |
Рак головы и шеи | Фаза I/II исследования AbraxaneTM в комбинации с цетуксимабом и облучением | |
| 8 | АВХ + карбоплатин + 5-фторурацил + гидроксимочевина + облучение |
Индукция: ABX 135 мг/м2 qwk + карбоплатин AUC=2 с последующим введением одновременного химиолучевого лечения ABX 100 мг/м2, 5-фторурацил 600 мг/м2, гидроксимочевина 5000 мг 2 раза в день |
Рак головы и шеи | Фаза I/II исследования индукционной химиотерапии AbraxaneTM и карбоплатина с последующим одновременным введением фторурацила, гидроксимочевины, AbraxaneTM и IMRT по поводу локально запущенных раковых опухолей головы и шеи |
| 9 | АВХ + карбоплатин + Erbitux® + облучение |
ABX 20-50 мг/м2 qwk×7 с возрастанием дозы, Erbitux® 400 мг/м2 д 7, 250 мг/м2 qwk×7, карбоплатин AUC=1,5 qwk×7 IMRT |
Локально запущенный рак головы и шеи | Фаза I испытания AbraxaneTM в комбинации с карбоплатином, цетуксимабом и IMRT при локально запущенном плоскоклеточном раке головы и шеи |
| 10 | АВХ + гемцитабин + облучение |
qwk | Рак поджелудочной железы | Фаза II рандомизиро-ванного испытания введения гемцитабина, AbraxaneTM и внешнего облучения по поводу локально запущенного рака поджелудочной железы |
| 11 | АВХ + цисплатин + облучение |
Злокачественные поражения желудка | Фаза I/II испытания комбинации AbraxaneTM/цис-платина и облучения для пациентов со злокачественными поражениями резекцированного желудка/желудочно-пищеводного соединения |
В некоторых вариантах осуществления изобретение предоставляет фармацевтические композиции, содержащие наночастицы, включающие таксан (такой как паклитаксел) и белок-носитель (такой как альбумин), для применения при лечении пролиферативного заболевания (такого как рак), где указанное применение включает второе лечение, включающее лучевую терапию, хирургическое лечение или их комбинации.
Метрономная терапия
Изобретение также предоставляет схему метрономной терапии. Предоставляется способ введения индивидууму композиции, содержащей наночастицы, включающие таксан (такой как паклитаксел, доцетаксел или ортатаксел) и белок-носитель (такой как альбумин), на основе схемы метрономного введения. Эти способы применимы к способам лечения, задерживающим развитие, или к другим клиническим схемам и конфигурациям, описанным здесь. Например, в некоторых вариантах осуществления, способы можно применять для лечения пролиферативных заболеваний (таких как рак).
Используемый здесь термин «схема метрономного введения» относится к частому введению таксана без длительных перерывов в дозе ниже установленной максимальной переносимой дозы посредством традиционной схемы с перерывами (также далее именуемой здесь «стандартной схемой MTD» или «стандартным курсом MTD»). При метрономном введении в течение определенного периода времени в конечном счете вводится такая же, более низкая или более высокая, кумулятивная доза, которая была бы введена посредством стандартной схемы MTD. В некоторых случаях это достигается расширением временной рамки и/или частоты проведения курса введения, в то же время уменьшая количество, вводимое с каждой дозой. В целом, таксан, вводимый посредством схемы метрономного введения по настоящему изобретению, лучше переносится индивидуумом. Метрономное введение можно также именовать поддерживающим введением или хроническим введением.
В некоторых вариантах осуществления предоставляется способ введения композиции, содержащей наночастицы, включающие таксан и белок-носитель (такой как альбумин), где композиция в виде наночастиц вводится в течение периода, по меньшей мере, 1 месяц, где интервал между каждым введением составляет не более чем примерно 1 неделю, и где доза таксана при каждом введении составляет примерно от 0,25% до примерно 25% максимальной переносимой дозы при соблюдении традиционной схемы введения. В некоторых вариантах осуществления предоставляется способ введения композиции, содержащей наночастицы, включающие паклитаксел и альбумин, где композиция в виде наночастиц вводится в течение периода, по меньшей мере, 1 месяц, где интервал между каждым введением составляет не более чем примерно 1 неделю, и где доза таксана при каждом введении составляет примерно от 0,25% до примерно 25% максимальной переносимой дозы при соблюдении традиционной схемы введения.
В некоторых вариантах осуществления дозировка таксана (такого как паклитаксел) в композиции в виде наночастиц на введение составляет менее чем примерно любая из долей 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 11%, 12%, 13%, 14%, 15%, 18%, 20%, 22%, 24% или 25% MTD для того же таксана (такого как паклитаксел), в той же препаративной форме при соблюдении данной традиционной схемы введения. Традиционная схема введения относится к схеме введения, которая в целом установлена в клиническом учреждении. Например, традиционная схема введения для AbraxaneTM представляет собой трехнедельную схему, т.е. введение композиции 1 раз в 3 недели.
В некоторых вариантах осуществления введение таксана (такого как паклитаксел) составляет от примерно 0,25% до примерно 25% соответствующей величины MTD, включая, например, любую долю от примерно 0,25% до примерно 20%, от примерно 0,25% до примерно 15%, от примерно 0,25% до примерно 10%, от примерно 0,25% до примерно 20%, и от примерно 0,25% до примерно 25% соответствующей величины MTD. Величина MTD для таксана при соблюдении традиционной схемы введения известна, или ее может легко определить специалист в данной области. Например, величина MTD при введении AbraxaneTM в соответствии с традиционной трехнедельной схемой введения составляет примерно 300 мг/м2.
В некоторых вариантах осуществления предоставляется способ введения композиции, содержащей наночастицы, включающие таксан и белок-носитель (такой как альбумин), где композиция в виде наночастиц вводится в течение периода, по меньшей мере, 1 месяц, где интервал между каждым введением составляет не более чем примерно 1 неделя, и где доза таксана при каждом введении составляет примерно от 0,25 мг/м2 до примерно 25 мг/м2. В некоторых вариантах осуществления предоставляется способ введения композиции, содержащей наночастицы, включающие паклитаксел и альбумин, где композиция в виде наночастиц вводится в течение периода, по меньшей мере, 1 месяц, где интервал между каждым введением составляет не более чем примерно 1 неделю, и где доза таксана при каждом введении составляет примерно от 0,25 мг/м2 до примерно 25 мг/м2.
В некоторых вариантах осуществления доза таксана (такого как паклитаксел) при каждом введении составляет менее чем примерно любая из доз 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 18, 20, 22, 25 или 30 мг/м2. Например, доза таксана (такого как паклитаксел) может находиться в диапазоне от примерно 0,25 мг/м2 до примерно 30 мг/м2, от примерно 0,25 мг/м2 до примерно 25 мг/м2, от примерно 0,25 мг/м2 до примерно 15 мг/м2, от примерно 0,25 мг/м2 до примерно 10 мг/м2, от примерно 0,25 мг/м2 до примерно 5 мг/м2.
Частота введения таксана (такого как паклитаксел) в композиции в виде наночастиц включает без ограничения любую частоту из, по меньшей мере, 1 раза в неделю, 2 раз в неделю, 3 раз в неделю, 4 раз в неделю, 5 раз в неделю или 1 раза в день. Обычно, интервал между каждым введением составляет менее чем примерно 1 неделю, например, менее чем примерно любой из периодов 6, 5, 4, 3, 2 или 1 день. В некоторых вариантах осуществления интервал между каждым введением является постоянным. Например, введение можно проводить 1 раз в день, 2 раза в день, 3 раза в день, 4 раза в день, 5 раз в день или 1 раз в неделю. В некоторых вариантах осуществления введение можно проводить 2 раза в день, 3 раза в день или чаще.
Описанные здесь схемы метрономного введения могут продолжаться в течение продолжительного периода времени, например, от примерно 1 месяца до примерно трех лет. Например, схема введения может продолжаться в течение периода примерно 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 18, 24, 30 и 36 месяцев. В целом в схеме введения нет перерывов.
Кумулятивная доза таксана (такого как паклитаксел), введенная по метрономной схеме, может быть выше, чем доза таксана, введенная в соответствии со стандартной схемой введения MTD в течение такого же периода времени. В некоторых вариантах осуществления кумулятивная доза таксана, введенная по метрономной схеме, равна или ниже дозы таксана, введенной в соответствии со стандартной схемой введения MTD в течение такого же периода времени.
Понятно, что изложенные здесь положения представлены только в качестве примеров, и что схему метрономного введения можно составить обычным способом в соответствии с предоставленными здесь положениями и на основании индивидуальной стандартной схемы MTD, и что схема метрономного введения, использованная в этих экспериментах, просто служит в качестве одного примера возможных изменений интервала и длительности введения, которые внесены в стандартную схему MTD, для достижения оптимальной схемы метрономного введения.
Описанную здесь схему метрономного введения можно применять отдельно в виде лечения пролиферативного заболевания, или проводить в контексте комбинированной терапии, такой как описанные здесь способы комбинированной терапии. В некоторых вариантах осуществления схему введения метрономной терапии можно применять в комбинации или в сочетании с другими назначенными способами лечения посредством стандартных схем MTD. Под термином «в комбинации или в сочетании» подразумевается, что метрономная схема введения по настоящему изобретению проводится или в то же самое время, что и стандартная схема MTD принятых способов лечения, или между курсами индукционной терапии для продления благоприятного эффекта, достигнутого у индивидуума индукционной терапией, с намерением продолжить ингибирование роста опухоли без нежелательного нанесения вреда здоровью индивидуума или способности индивидуума выдержать следующий курс индукционной терапии. Например, схема метрономной терапии может быть принята после первоначального, короткого курса химиотерапии MTD. Композиции в виде наночастиц, вводимые на основе описанной здесь метрономной схемы введения, можно также вводить индивидууму (такому как человек) различными путями, например, парентерально, включая внутривенное, внутриартериальное, внутрилегочное, пероральное, ингаляционное, внутрипузырное, внутримышечное, интратрахеальное, подкожное, внутриглазное, подоболочечное или трансдермальное введение. Например, композицию в виде наночастиц можно ввести ингаляцией для лечения заболеваний дыхательных путей. Композицию можно применять для лечения респираторных заболеваний, таких как пневмосклероз, облитерирующий бронхиолит, рак легких, бронхоальвеолярная карцинома и им подобные. В некоторых вариантах осуществления композиция в виде наночастиц вводится перорально.
Ниже представлены некоторые различные иллюстративные варианты осуществления.
В некоторых вариантах осуществления предоставляется способ введения композиции, содержащей наночастицы, включающие таксан и белок-носитель (такой как альбумин), где композиция в виде наночастиц вводится в течение периода, по меньшей мере, 1 месяц, где интервал между каждым введением составляет не более чем примерно 1 неделю, и где доза таксана при каждом введении составляет от примерно 0,25% до примерно 25% максимальной переносимой дозы при соблюдении традиционной схемы введения. В некоторых вариантах осуществления таксан покрыт белком-носителем (таким как альбумин). В некоторых вариантах осуществления доза таксана на введение составляет менее чем любая из долей 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 11%, 12%, 13%, 14%, 15%, 18%, 20%, 22%, 24% или 25% его максимальной переносимой дозы. В некоторых вариантах осуществления таксан вводится, по меньшей мере, с любой частотой из 1, 2, 3, 4, 5, 6, 7 (т.е. ежедневно) раз в неделю. В некоторых вариантах осуществления интервалы между каждым введением составляют менее чем любой из интервалов 7 дней, 6 дней, 5 дней, 4 дня, 3 дня, 2 дня и 1 день. В некоторых вариантах осуществления таксан вводится в течение периода, составляющего, по меньшей мере, любой из сроков 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 18, 24, 30 и 36 месяцев.
В некоторых вариантах осуществления предоставляется способ введения композиции, содержащей наночастицы, включающие паклитаксел и альбумин, где интервал между каждым введением составляет не более чем примерно 1 неделю, и где доза таксана при каждом введении составляет от примерно 0,25% до примерно 25% его максимальной переносимой дозы при соблюдении традиционной схемы введения. В некоторых вариантах осуществления наночастицы паклитаксела/альбумина имеют средний диаметр не более чем примерно 200 нм. В некоторых вариантах осуществления композиция паклитаксела/альбумина в виде наночастиц по существу не содержит (например, не содержит) поверхностно-активный агент (такой как Cremophor). В некоторых вариантах осуществления массовое отношение альбумина к паклитакселу в композиции составляет примерно 18:1 или менее, например, примерно 9:1 или менее. В некоторых вариантах осуществления паклитаксел покрыт альбумином. В некоторых вариантах осуществления наночастицы паклитаксела/альбумина имеют средний диаметр не более чем примерно 200 нм, и композиция паклитаксела/альбумина по существу не содержит (например, не содержит) поверхностно-активное вещество (такое как Cremophor). В некоторых вариантах осуществления наночастицы паклитаксела/альбумина имеют средний диаметр не более чем примерно 200 нм, и паклитаксел покрыт альбумином. В некоторых вариантах осуществления композиция в виде наночастиц представляет собой AbraxaneTM.
В некоторых вариантах осуществления предоставляется способ введения композиции, содержащей наночастицы, включающие таксан и белок-носитель (такой как альбумин), где композиция в виде наночастиц вводится в течение периода, по меньшей мере, 1 месяц, где интервал между каждым введением составляет не более чем примерно 1 неделя, и где доза таксана при каждом введении составляет от примерно 0,25 мг/м2 до примерно 25 мг/м2. В некоторых вариантах осуществления таксан покрыт белком-носителем (таким как альбумин). В некоторых вариантах осуществления доза таксана на введение составляет менее чем любая из доз 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 18, 20, 22 и 25 мг/м2. В некоторых вариантах осуществления таксан вводится, по меньшей мере, с любой частотой из 1, 2, 3, 4, 5, 6, 7 (т.е. ежедневно) раз в неделю. В некоторых вариантах осуществления интервалы между каждым введением составляют менее чем любой из интервалов 7 дней, 6 дней, 5 дней, 4 дня, 3 дня, 2 дня и 1 день. В некоторых вариантах осуществления таксан вводится в течение периода, составляющего, по меньшей мере, любой из сроков 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 18, 24, 30 и 36 месяцев.
В некоторых вариантах осуществления предоставляется способ введения композиции, содержащей наночастицы, включающие паклитаксел и альбумин, где композиция в виде наночастиц вводится в течение периода, по меньшей мере, 1 месяц, где интервал между каждым введением составляет не более чем примерно 1 неделя, и где доза таксана при каждом введении составляет от примерно 0,25 мг/м2 до примерно 25 мг/м2. В некоторых вариантах осуществления наночастицы паклитаксела/альбумина имеют средний диаметр не более чем примерно 200 нм. В некоторых вариантах осуществления композиция паклитаксела/альбумина в виде наночастиц по существу не содержит (например, не содержит) поверхностно-активный агент (такой как Cremophor). В некоторых вариантах осуществления массовое отношение альбумина к паклитакселу в композиции составляет примерно 18:1 или менее, например, примерно 9:1 или менее. В некоторых вариантах осуществления паклитаксел покрыт альбумином. В некоторых вариантах осуществления наночастицы паклитаксела/альбумина имеют средний диаметр не более чем примерно 200 нм, и композиция паклитаксела/альбумина по существу не содержит (например, не содержит) поверхностно-активный агент (такой как Cremophor). В некоторых вариантах осуществления наночастицы паклитаксела/альбумина имеют средний диаметр не более чем примерно 200 нм, и паклитаксел покрыт альбумином. В некоторых вариантах осуществления композиция в виде наночастиц представляет собой AbraxaneTM.
В некоторых вариантах осуществления AbraxaneTM (или другие композиции паклитаксела/альбумина в виде наночастиц) вводится в дозе от примерно 3 мг/кг до примерно 10 мг/кг в день. В некоторых вариантах осуществления AbraxaneTM вводится в дозе от примерно 6 мг/кг до примерно 10 мг/кг в день. В некоторых вариантах осуществления AbraxaneTM вводится в дозе от примерно 6 мг/кг в день. В некоторых вариантах осуществления AbraxaneTM вводится в дозе от примерно 3 мг/кг в день.
Изобретение также предоставляет композиции для применения в описанных здесь метрономных схемах. В некоторых вариантах осуществления предоставляется композиция, содержащая наночастицы, включающие таксан и белок-носитель (такой как альбумин), где указанная композиция вводится индивидууму посредством метрономной схемы введения, такой как схема введения, описанная здесь.
Другие аспекты изобретения
В других аспектах предоставляются способы лечения пролиферативных заболеваний, включающие введение композиции, содержащей наночастицы, включающие таксан (включая паклитаксел, доцетаксел или ортатаксел) и белок-носитель (такой как альбумин). В некоторых вариантах осуществления предоставляется способ лечения рака, включающий введение композиции, содержащей наночастицы, включающие ортатаксел и белок-носитель (такой как альбумин).
В некоторых вариантах осуществления предоставляются способы лечения пролиферативных заболеваний, включающие введение композиции, содержащей наночастицы, включающие тиоколхицин или его производные (такие как димерный тиоколхицин) и белок-носитель (такой как альбумин). В некоторых вариантах осуществления предоставляется способ лечения рака, включающий введение композиции, содержащей наночастицы, включающие димерный тиоколхицин и белок-носитель (такой как альбумин). В некоторых вариантах осуществления композиция в виде наночастиц представляет собой любую из (а в некоторых вариантах осуществления выбрана из группы, состоящей из) Nab-5404, Nab-5800 и Nab-5801.
В некоторых вариантах осуществления предоставляется способ лечения рака, включающий введение композиции, содержащей наночастицы, включающие паклитаксел, где композиция в виде наночастиц вводится в соответствии с любой из схем введения, описанных в таблице 3. В некоторых вариантах осуществления рак представляет собой устойчивый к таксану метастатический рак молочной железы.
| Таблица 3 | ||||
| № ряда | Комбинация | Схема/ дозировка |
Тип исследуемого лечения | Название протокола |
| 1. | Один АВХ | АВХ 125 мг/м2 qwk×3/4 | Метастатический рак молочной железы | Фаза II исследования лечения введением AbraxaneTM 1 раз в неделю у пациенток с устойчивым к таксану МВС |
| 2. | Один АВХ | Плечо 1: АВХ 130 мг/м2 qwk, Плечо 2: АВХ 260 мг/м2 q2wk, Плечо 3: АВХ 260 мг/м2 q3wk |
Метастатический рак молочной железы | Фаза II 3-плечевого испытания лечения 1-ой линии у Her-2- пациенток с МВС |
| 3. | Один АВХ (капксол) | АВХ 260 мг/м2 q3wk в сравнении с таксолом 175 мг/м2 q3wk |
Метастатический рак молочной железы | Фаза II контролируемого, рандомизированного, открытого исследования для оценки эффективности и безопасности капксола (не содержащей Cremophor композиции паклитаксела в виде наночастиц) и составленной с Cremophor инъекционной композиции паклитаксела у пациенток с метастатическим раком молочной железы |
| 4. | Один АВХ | Плечо 1: АВХ 1 раз в неделю, Плечо 2: АВХ q3wk, Плечо 3: таксол 1 раз в неделю |
Метастатический рак молочной железы | Фаза II 3-плечевого испытания лечения МВС 1-ой и 2-ой линии с анализом биологических коррелятов |
| 5. | Один АВХ | АВХ 300 мг/м2 q3wk | Рак молочной железы IIA, IIB, IIIA, IIIB и IV стадии | Фаза II испытания неоадъювантной химиотерапии (NCT) с наночастицами паклитаксела (ABI-007, Abraxane) у женщин с (интактными первичными) раковыми опухолями молочной железы IIA, IIB, IIIA, IIIB и IV стадии |
| 6. | Один АВХ | АВХ 125 мг/м2 qwk×3/4 | Лечение 1-ой линии запущенного NSCLC | Фаза I/II исследования монотерапии Abraxane при лечении 1-ой линии запущенного NSCLC |
| 7. | Один АВХ | АВХ 260 мг/м2 q3wk | Лечение 1-ой линии запущенного NSCLC | Фаза II исследования монотерапии АВХ при лечении 1-ой линии запущенного NSCLC |
| 8. | Один АВХ | Плечо 1: АВХ q3wk, Плечо 2: АВХ qwk Дозы TBD |
Лечение 2-ой линии NSCLC | Фаза II исследования монотерапии Abraxane при лечении 2-ой линии NSCLC |
| 9. | Один АВХ | АВХ 100 мг/м2 qwk в сравнении с АВХ 260 мг/м2 q3wk |
Рак предстательной железы | Фаза II рандомизированного исследования AbraxaneTM 1 раз в неделю в сравнении с введением 1 раз в 3 недели при лечении 1-ой линии рака предстательной железы |
| 10. | Один АВХ | АВХ qwk | Рак предстательной железы | Фаза II исследования АВХ при лечении 1-ой линии рака предстательной железы |
| 11. | Один АВХ | АВХ 150 мг/м2 qwk×3/4 в течение 2 циклов | Рак предстательной железы | Фаза II исследования неоадъювантного лечения |
| 12. | Один АВХ | АВХ 100 мг/м2 qwk (без перерыва) | Рак предстательной железы | Фаза II исследования АВХ 100 мг в неделю без перерывов |
| 13. | Один АВХ | АВХ 100 мг/м2 (ранее получавшие лечение), АВХ 150 мг/м2 (ранее не получавшие лечение) qwk×3/4 |
Злокачественная меланома | Фаза II исследования у пациентов со злокачественной меланомой, ранее получавших и не получавших лечение |
| 14. | Один АВХ | АВХ 125 мг/м2 qwk×3/4 | Карцинома шейки матки | Фаза II исследования АВХ при лечении стойкой или рецидивирующей карциномы шейки матки |
| 15. | Один АВХ | Рак шейки матки | Фаза II исследования Abraxane для лечения запущенного рака шейки матки (3-я линия) | |
| 16. | Один АВХ (ABI-007) |
Негематоло- гические злокачественные поражения |
Фаза II исследования применения одного ABI-007 для лечения негематологических злокачественных поражений. Применение для облегчения страданий |
Композиции в виде наночастиц
Описанные здесь композиции в виде наночастиц содержат наночастицы, включающие (в различных вариантах осуществления по существу состоящие из) таксан (такой как паклитаксел) и белок-носитель (такой как альбумин). Наночастицы плохо растворимых в воде лекарственных препаратов (таких как таксан) были описаны, например, в патентах США №№ 5916596; 6506405 и 6537579, а также в патентной публикации США № 2005/0004002A1. Хотя представленное ниже описание относится к таксану, понятно, что то же относится к другим лекарственным препаратам, таким как рапамицин, 17-AAG и димерный тиоколхицин.
В некоторых вариантах осуществления композиция включает наночастицы с усредненным или средним диаметром не более чем примерно 1000 нанометров (нм), например, не больше, чем примерно любая величина из 900, 800, 700, 600, 500, 400, 300, 200 и 100 нм. В некоторых вариантах осуществления усредненный или средний диаметр наночастиц составляет не более чем примерно 200 нм. В некоторых вариантах осуществления усредненный или средний диаметр наночастиц составляет не более чем примерно 150 нм. В некоторых вариантах осуществления усредненный или средний диаметр наночастиц составляет не более чем примерно 100 нм. В некоторых вариантах осуществления усредненный или средний диаметр наночастиц составляет от примерно 20 до примерно 400 нм. В некоторых вариантах осуществления усредненный или средний диаметр наночастиц составляет от примерно 40 до примерно 200 нм. В некоторых вариантах осуществления наночастицы могут стерилизоваться фильтрацией.
Описанные здесь наночастицы могут присутствовать в сухой препаративной форме (такой как лиофилизированная композиция) или могут быть суспендированы в биологически совместимой среде. Подходящие биологически совместимые среды включают без ограничения воду, забуференные водные среды, солевой раствор, забуференный солевой раствор, необязательно, забуференные растворы аминокислот, необязательно, забуференные растворы белков, необязательно, забуференные растворы сахаров, необязательно, забуференные растворы витаминов, необязательно, забуференные растворы синтетических полимеров, содержащие липиды, и им подобные.
Термин «белки» относится к полипептидам или полимерам аминокислот любой длины (включая полную длину или фрагменты), которые могут быть линейными или разветвленными, включать модифицированные аминокислоты и/или быть прерванными не аминокислотами. Этот термин также охватывает аминокислотный полимер, который был модифицирован или естественно, или вмешательством, например, образованием дисульфидной мостиковой связи, гликозилированием, липидированием, ацетилированием, фосфорилированием или любой другой манипуляцией или модификацией. В этот термин также включены, например, полипептиды, содержащие один или более аналогов аминокислоты (включая, например, неестественные аминокислоты, и т.д.), а также другие модификации, известные в данной области. Описанные здесь белки могут быть естественно встречающимися, т.е. полученными или происходящими из натурального источника (такого как кровь), или синтезированными (например, химически синтезированными или синтезированными методиками рекомбинантной ДНК).
Примеры подходящих белков-носителей включают белки, обычно обнаруживаемые в крови или плазме, которые включают без ограничения альбумин, иммуноглобулин, включая IgA, липопротеины, аполипопротеин В, альфа-кислый гликопротеин, бета-2-макроглобулин, тироглобулин, трансферин, фибронектин, фактор VII, фактор VIII, фактор IX, фактор X и им подобные. В некоторых вариантах осуществления белок-носитель представляет собой не кровяной белок, такой как казеин, α-лактальбумин и β-лактоглобулин. Белки-носители могут быть или натуральными по происхождению или полученными синтетически. В некоторых вариантах осуществления фармацевтически приемлемый носитель включает альбумин, такой как человеческий сывороточный альбумин. Человеческий сывороточный альбумин (HSA) представляет собой высоко растворимый глобулярный белок с Mr 65K и состоит из 585 аминокислот. HSA представляет собой самый изобильный белок в плазме, и он определяет 70-80% коллоидного осмотического давления человеческой плазмы. Аминокислотная последовательность HSA содержит всего 17 дисульфидных мостиковых связей, один свободный тиол (Cys 34) и один триптофан (Trp 214). Внутривенное применение раствора HSA было показано для профилактики и лечения гиповолюмического шока (см., например, Tullis, JAMA, 237, 355-360, 460-463, (1977) и Houser et al., Surgery, Gynecology and Obstetrics, 150, 811-816 (1980)) и в сочетании с обменным переливанием крови при лечении гипербилирубинемии новорожденных (см., например, Finlayson, Seminars in Thrombosis and Hemostasis, 6, 85-120, (1980)). Предусмотрены другие альбумины, такие как бычий сывороточный альбумин. Применение таких не человеческих альбуминов может быть целесообразным, например, в контексте применения этих композиций у млекопитающих, отличных от человека, например, в ветеринарии (включая домашних и сельскохозяйственных животных).
Человеческий сывороточный альбумин (HSA) имеет множественные гидрофобные участки связывания (всего 8 для жирных кислот, эндогенного лиганда HSA) и связывает разнообразный набор таксанов, особенно нейтральных и отрицательно заряженных гидрофобных соединений (Goodman et al., The Pharmacological Basis of Therapeutics, 9th ed, McGraw-Hill New York (1996)). 2 высоко аффинных сайта связывания были предложены в субдоменах IIA и IIIA HSA, которые представляют собой высоко удлиненные гидрофобные карманы с заряженными остатками лизина и аргинина около поверхности, которые функционируют в качестве точек прикрепления для полярных лигандных признаков. (См., например, Fehske et al., Biochem. Pharmcol, 30, 687-92 (198a), Vorum, Dan. Med. Bull, 46, 379-99 (1999), Kragh-Hansen, Dan. Med. Bull, 1441, 131-40 (1990), Curry et al., Nat. Struct. Biol, 5, 827-35 (1998), Sugio et al, Protein. Eng., 12, 439-46 (1999), He et al., Nature, 358, 209-15 (1996) и Carter et al., Adv. Protein. Chem., 45, 153-203 (1994)). Было показано, что паклитаксел и пропофол связывают HSA (см., например, Paal et al., Eur. J. Biochem., 268(7), 2187-91 (2000), Purcell et al., Biochim. Biophys. Acta, 1478(a), 61-8 (2000), Altmayer et al., Arzneimittelforschung, 45, 1053-6 (1995) и Garrido et al., Rev. Esp. Anestestiol. Reanim., 41, 308-12 (1994)). Дополнительно показано, что доцетоксел связывается с человеческими плазма протеинами (см., например, Urien et al., Invest. New Drugs, 14(b), 147-51 (1996)).
Белок-носитель (такой как альбумин) в композиции в целом служит в качестве носителя для таксана, т.е. белок-носитель в композиции делает таксан легче суспендируемым в водной среде или помогает поддерживать суспензию, по сравнению с композициями, не включающими белок-носитель. Это может позволить избежать применения токсичных растворителей (или поверхностно-активных веществ) для солюбилизации таксана и, посредством этого, может уменьшить один или более побочных эффектов введения таксана индивидууму (такому как человек). Таким образом, в некоторых вариантах осуществления, описанная здесь композиция по существу не содержит (например, не содержит) поверхностно-активных веществ, таких как Cremophor (включая Cremophor EL® (BASF)). В некоторых вариантах осуществления композиция в виде наночастиц по существу не содержит (например, не содержит) поверхностно-активных веществ. Композиция «по существу не содержит» или «по существу не содержит поверхностно-активное вещество Cremophor», если количество Cremophor или поверхностно-активного вещества в композиции недостаточно для того, чтобы вызвать один или более побочных эффектов у индивидуума, когда композиция в виде наночастиц вводится индивидууму.
Количество белка-носителя в описанной здесь композиции будет варьироваться в зависимости от других компонентов композиции. В некоторых вариантах осуществления композиция включает белок-носитель в количестве, которое достаточно для стабилизации таксана в водной суспензии, например, в форме устойчивой коллоидной суспензии (такой как устойчивая суспензия наночастиц). В некоторых вариантах осуществления белок-носитель содержится в количестве, которое снижает скорость осаждения таксана в водной среде. Для композиций, содержащих частицы, количество белка-носителя также зависит от размера и плотности наночастиц таксана.
Таксан «стабилизирован» в водной суспензии, если он остается суспендированным в водной среде (например, без видимой преципитации или осаждения) в течение продолжительного периода времени, такого как, по меньшей мере, любого из периодов примерно 0,1, 0,2, 0,25, 0,5, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 24, 36, 48, 60 или 72 часа. Суспензия в целом, но необязательно, подходит для введения индивидууму (такому как человек). Растворимость суспензии в целом (но необязательно) оценивается при температуре хранения (такой как комнатная температура (например, 20-25ºС) или в условиях охлаждения (например, 4ºС)). Например, суспензия устойчива при температуре хранения, если она не проявляет флоккуляции или агломерации частиц, видимой невооруженным глазом, или при осмотре под оптическим микроскопом при увеличении в 1000 раз, примерно через 15 мин после приготовления суспензии. Устойчивость можно также оценить в условиях ускоренного тестирования, например, при температуре, которая выше, чем примерно 40ºС.
В некоторых вариантах осуществления белок-носитель присутствует в количестве, которое достаточно для стабилизации таксана в водной суспензии в определенной концентрации. Например, концентрация таксана в композиции составляет от примерно 0,1 до примерно 100 мг/мл, включая, например, любую концентрацию из от примерно 0,1 до примерно 50 мг/мл, от примерно 0,1 до примерно 20 мг/мл, от примерно 1 до примерно 10 мг/мл, от примерно 2 до примерно 8 мг/мл, от примерно 4 до примерно 6 мг/мл, примерно 5 мг/мл. В некоторых вариантах осуществления концентрация таксана составляет, по меньшей мере, любую из величин 1,3 мг/мл, 1,5 мг/мл, 2 мг/мл, 3 мг/мл, 4 мг/мл, 5 мг/мл, 6 мг/мл, 7 мг/мл, 8 мг/мл, 9 мг/мл, 10 мг/мл, 15 мг/мл, 20 мг/мл, 25 мг/мл, 30 мг/мл, 40 мг/мл и 50 мг/мл. В некоторых вариантах осуществления белок-носитель присутствует в количестве, которое позволяет избегать использования поверхностно-активных веществ (таких как Cremophor), так что композиция не содержит или по существу не содержит поверхностно-активное вещество (такое как Cremophor).
В некоторых вариантах осуществления композиция, в жидкой форме, включает от примерно 0,1% до примерно 50% (масс./об.) (например, примерно 0,5% (масс./об.), примерно 5% (масс./об.), примерно 10% (масс./об.), примерно 15% (масс./об.), примерно 20% (масс./об.), примерно 30% (масс./об.), примерно 40% (масс./об.) или примерно 50% (масс./об.)) белка-носителя. В некоторых вариантах осуществления композиция, в жидкой форме, включает от примерно 0,5% до примерно 5% (масс./об.) белка-носителя.
В некоторых вариантах осуществления массовое отношение белка-носителя, например, альбумина, к таксану в композиции в виде наночастиц таково, что достаточное количество таксана связывается с клеткой или транспортируется ею. Хотя массовое отношение белка-носителя к таксану нужно будет оптимизировать для различных комбинаций белка-носителя и таксана, в целом массовое отношение белка-носителя, например, альбумина, к таксану (масс./масс.) составляет от примерно 0,01:1 до примерно 100:1, от примерно 0,02:1 до примерно 50:1, от примерно 0,05:1 до примерно 20:1, от примерно 0,1:1 до примерно 20:1, от примерно 1:1 до примерно 18:1, от примерно 2:1 до примерно 15:1, от примерно 3:1 до примерно 12:1, от примерно 4:1 до примерно 10:1, от примерно 5:1 до примерно 9:1, или примерно 9:1. В некоторых вариантах осуществления массовое отношение белка-носителя к таксану составляет примерно любую величину из 18:1 или менее, 15:1 или менее, 14:1 или менее, 13:1 или менее, 12:1 или менее, 11:1 или менее, 10:1 или менее, 9:1 или менее, 8:1 или менее, 7:1 или менее, 6:1 или менее, 5:1 или менее, 4:1 или менее и 3:1 или менее.
В некоторых вариантах осуществления белок-носитель позволяет вводить композицию индивидууму (такому как человек) без значительных побочных эффектов. В некоторых вариантах осуществления белок-носитель (такой как альбумин) содержится в количестве, которое эффективно для снижения одного или более побочных эффектов введения таксана человеку. Термин «снижение одного или более побочных эффектов введения таксана» относится к уменьшению, облегчению или устранению одного или более нежелательных эффектов, вызванных таксаном, а также побочных эффектов, вызванных носителями доставки (такими как растворители, которые делают таксаны подходящими для инъекции), используемыми для доставки таксана. Такие побочные эффекты включают, например, миелосуппрессию, нейротоксичность, гиперчувствительность, воспаление, раздражение вен, флебит, боль, раздражение кожи, периферическую нейропатию, нейтропеническую лихорадку, анафилактическую реакцию, венозный тромбоз, экстравазацию, и их комбинации. Однако эти побочные эффекты являются просто иллюстративными, и можно уменьшить другие побочные эффекты или комбинацию побочных эффектов, связанных с таксаном.
В некоторых вариантах осуществления композиция включает AbraxaneTM. AbraxaneTM представляет собой препаративную форму паклитаксела, стабилизированного человеческим альбумином по USP (Фармакопее США), который можно диспергировать в непосредственно инъецируемом физиологическом растворе. При дисперсии в подходящей водной среде, такой как 0,9% хлорид натрия для инъекций или 5% декстроза для инъекций, AbraxaneTM образует устойчивую коллоидную суспензию паклитаксела. Средний размер наночастиц в коллоидной суспензии составляет примерно 130 нм. Поскольку HSA свободно растворим в воде, AbraxaneTM можно растворять в широком диапазоне концентраций - от разведенного (0,1 мг/мл паклитаксела) до концентрированного (20 мг/мл паклитаксела), включая, например, от примерно 2 мг/мл до примерно 8 мг/мл, примерно 5 мг/мл.
Способы изготовления композиций в виде наночастиц известны в данной области. Например, наночастицы, содержащие таксаны (такие как паклитаксел) и белок-носитель (такой как альбумин) можно получить в условиях действия сил высокого сдвига (например, обработкой ультразвуком, гомогенизацией высоким давлением или им подобных). Эти способы описаны, например, в патентах США №№ 5916596; 6506405 и 6537579, а также в патентной публикации США № 2005/0004002A1.
Вкратце, таксан (такой как доцетаксел) растворяют в органическом растворителе, и растворитель можно добавить к раствору человеческого сывороточного альбумина. Смесь подвергают гомогенизации высоким давлением. Затем органический растворитель можно удалить выпариванием. Полученную дисперсию можно далее лиофилизировать. Подходящие органические растворители включают, например, кетоны, сложные эфиры, простые эфиры, хлорированные растворители и другие растворители, известные в данной области. Например, органический растворитель может представлять собой метиленхлорид и хлороформ/этанол (например, при соотношении 1:9, 1:8, 1:7, 1:6, 1:5, 1:4, 1:3, 1:2, 1:1, 2:1, 3:1, 4:1, 5:1, 6:1, 7:1, 8:1 или 9:1).
Другие компоненты в композициях в виде наночастиц
Описанные здесь наночастицы могут присутствовать в композиции, которая включает другие агенты, эксципиенты или стабилизаторы. Например, для увеличения устойчивости увеличением отрицательного зета потенциала наночастиц можно добавить определенные отрицательно заряженные компоненты. Такие отрицательно заряженные компоненты включают без ограничения желчные соли, состоящие из гликохолевой кислоты, холевой кислоты, хенодеоксихолевой кислоты, таурохолевой кислоты, гликохенодеоксихолевой кислоты, таурохенодеоксихолевой кислоты, литохолевой кислоты, урсодеоксихолевой кислоты, дигидрохолевой кислоты и других; фосфолипиды, включая лецитин (яичный желток), на основе фосфолипидов, которые включают следующие фосфатидилхолины: пальмитоилолеоилфосфатидилхолин, пальмитоиллинолеоилфосфатидилхолин, стеароиллинолеоилфосфатидилхолин, стеароилолеоилфосфатидилхолин, стеароиларахидоилфосфатидилхолин и дипальмитоилфосфатидилхолин. Другие фосфолипиды, включая L-α-димиристоилфосфатидилхолин (DMPC), диолеоилфосфатидилхолин (DOPC), дистеариолфосфатидилхолин (DSPC), гидрированный соевый фосфатидилхолин (HSPC) и другие родственные соединения. Отрицательно заряженные поверхностно-активные вещества или эмульгаторы также подходят в качестве добавок, например, холестерилсульфат натрия и ему подобные.
В некоторых вариантах осуществления композиция подходит для введения человеку. В некоторых вариантах осуществления композиция подходит для введения млекопитающему, например, в ветеринарии, домашним и сельскохозяйственным животным. Имеется широкое разнообразие подходящих препаративных форм композиции в виде наночастиц (см., например, патенты США №№ 5916596 и 6096331). Следующие препаративные формы и способы являются просто иллюстративными и ни в коей мере не ограничивающими. Препаративные формы, подходящие для перорального введения могут состоять из (а) жидких растворов, таких как эффективное количество соединения, растворенного в разбавителях, таких как вода, солевой раствор или апельсиновый сок, (b) капсул, саше или таблеток, каждая из которых содержит заданное количество активного ингредиента в виде твердых веществ или гранул, (с) суспензий в соответствующей жидкости и (d) подходящих эмульсий. Таблетированные формы могут включать одно или более из следующих веществ: лактозы, маннита, кукурузного крахмала, картофельного крахмала, микрокристаллической целлюлозы, акации, желатина, коллоидного диоксида кремния, кроскармеллозы натрия, талька, стеарата магния, стеариновой кислоты и других эксципиентов, красителей, разбавителей, забуферивающих агентов, смачивающих агентов, консервантов, ароматизирующих агентов и фармакологически совместимых эксципиентов. Формы в виде лепешек могут включать активный ингредиент в ароматической добавке, обычно сахарозе и акации или трагаканте, а также формы в виде пастилок могут включать активный ингредиент в инертной основе, такой как желатин и глицерин, или сахароза и акация, эмульсии, гели и им подобные, содержащие в дополнение к активному ингредиенту такие эксципиенты, которые известны в данной области.
Примеры подходящих носителей, эксципиентов и разбавителей включают без ограничения лактозу, декстрозу, сахарозу, сорбит, маннит, крахмалы, смолу акации, фосфат кальция, альгинаты, трагакант, желатин, силикат кальция, микрокристаллическую целлюлозу, поливинилпирролидон, целлюлозу, воду, солевой раствор, сироп, метилцеллюлозу, метил- и пропилгидроксибензоаты, тальк, стерата магния и минеральное масло. Препаративные формы могут, кроме того, включать смазывающие агенты, смачивающие агенты, эмульгирующие и суспендирующие агенты, консервирующие агенты, подслащивающие агенты или ароматизирующие агенты.
Препаративные формы, подходящие для парентерального введения, включают водные и неводные, изотонические стерильные инъекционные растворы, которые могут содержать антиоксиданты, буферы, бактериостатические средства и растворимые вещества, которые делают препаративную форму совместимой с кровью предполагаемого реципиента, и водные и неводные стерильные суспензии, которые могут включать суспендирующие агенты, солюбилизаторы, загущающие агенты, стабилизаторы и консерванты. Препаративные формы могут быть представлены в герметичных контейнерах, содержащих стандартную дозу или множественные дозы, такие как ампулы и флакончики, и могут храниться в засушенном, замороженном (лиофилизированном) состоянии, требующем только добавления стерильного жидкого эксципиента, например, воды для инъекций, непосредственно перед применением. Приготавливаемые непосредственно перед введением инъекционные растворы и суспензии можно получить из стерильных порошков, гранул и таблеток ранее описанного вида. Предпочтительны инъецируемые препаративные формы.
В некоторых вариантах осуществления композиция составляется так, чтобы диапазон рН был от примерно 4,5 до примерно 9,0, включая, например, диапазоны рН в любом из промежутков от примерно 5,0 до примерно 8,0, от примерно 6,5 до примерно 7,5 и от примерно 6,5 до примерно 7,0. В некоторых вариантах осуществления композиция составляется так, чтобы ее рН был не менее чем примерно 6, включая, например, не менее чем примерно любая из величин 6,5, 7 или 8 (например, примерно 8). Композиция также может быть изотоничной с кровью за счет добавления растворимых модификаторов тоничности, таких как глицерин.
Наборы
Изобретение также предоставляет наборы для применения в настоящих способах. Наборы по изобретению включают один или более контейнеров, включающих содержащие таксан композиции в виде наночастиц (или стандартные лекарственные формы и/или изделия изготовления) и/или химиотерапевтическое средство и, в некоторых вариантах осуществления, кроме того, включающих инструкции по применению в соответствии с любым из описанных здесь способов. Набор может, кроме того, включать описание выбора индивидуума, подходящего для лечения. Инструкции, поставляемые с наборами по изобретению, обычно представляют собой письменные инструкции на этикетке или упаковочном вкладыше (например, листе бумаги, включенном в набор), но также доступны инструкции, считываемые машиной (например, инструкции на носителе в виде магнитного или оптического накопительного диска).
В некоторых вариантах осуществления набор включает а) композицию, содержащую наночастицы, включающие таксан и белок-носитель (такой как альбумин), b) эффективное количество, по меньшей мере, одного другого химиотерапевтического средства и с) инструкции по одновременному или последовательному введению наночастиц и химиотерапевтического средства для лечения пролиферативного заболевания (такого как рак). В некоторых вариантах осуществления таксан представляет собой любой из паклитаксела, доцетаксела и ортатаксела. В некоторых вариантах осуществления набор содержит наночастицы, включающие а) композицию, содержащую наночастицы, включающие паклитаксел и альбумин (такие как AbraxaneTM), b) эффективное количество, по меньшей мере, одного другого химиотерапевтического средства и с) инструкции по одновременному или последовательному введению наночастиц и химиотерапевтического средства для эффективного лечения пролиферативного заболевания (такого как рак).
В некоторых вариантах осуществления набор содержит а) композицию, содержащую наночастицы, включающие таксан и белок-носитель (такой как альбумин), b) композицию, содержащую наночастицы, включающие, по меньшей мере, одно другое химиотерапевтическое средство и белок-носитель (такой как альбумин), и с) инструкции по одновременному или последовательному введению композиций в виде наночастиц для лечения пролиферативного заболевания (такого как рак). В некоторых вариантах осуществления набор содержит наночастицы, включающие а) композицию, содержащую наночастицы, включающие паклитаксел и альбумин (такие как AbraxaneTM), b) композицию, содержащую наночастицы, включающие, по меньшей мере, одно другое химиотерапевтическое средство и белок-носитель (такой как альбумин), и с) инструкции по одновременному и/или последовательному введению композиций в виде наночастиц для эффективного лечения пролиферативного заболевания (такого как рак).
Наночастицы и химиотерапевтическое средство могут присутствовать в отдельных контейнерах или в одном контейнере. Понятно, что набор может включать одну отдельную композицию или 2 или более композиций, где одна композиция содержит наночастицы, а другая композиция содержит химиотерапевтическое средство.
Наборы по изобретению находятся в подходящей упаковке. Подходящие упаковки включают без ограничения флакончики, бутыли, банки, гибкую упаковку (например, запаянные мешочки Mylar или пластиковые мешочки) и им подобные. Наборы могут необязательно предоставлять дополнительные компоненты, такие как буферы, и интерпретирующую информацию.
Инструкции, относящиеся к применению композиций в виде наночастиц, в целом включают информацию, относящуюся к дозировке, схеме введения и пути введения для предполагаемого лечения. Контейнеры могут представлять собой стандартные дозы, объемные упаковки (например, упаковки с множественными дозами) или субстандартные дозы. Например, могут быть предоставлены наборы, которые содержат достаточные дозировки таксана (такого как раскрытые здесь таксаны) для обеспечения эффективного лечения индивидуума в течение продолжительного периода, такого как любой из периодов 1 неделя, 2 недели, 3 недели, 4 недели, 6 недель, 8 недель, 3 месяца, 4 месяца, 5 месяцев, 7 месяцев, 8 месяцев, 9 месяцев или более. Наборы могут также включать множественные стандартные дозы таксана и фармацевтических композиций и инструкции по применению, упакованные в количествах, достаточных для хранения и применения в аптеках, например, больничных аптеках, и аптеках, готовящих препаративные формы.
Специалисту в данной области будет понятно, что в пределах объема и сущности настоящего изобретения можно осуществить несколько вариаций. Следующие примеры дополнительно иллюстрируют изобретение, но их, конечно, не следует рассматривать как в какой-то мере ограничивающие его объем.
ПРИМЕРЫ
Пример 1. Улучшенная реакция и сниженная токсичность AbraxaneTM по сравнению с Taxol® в фазе III исследования AbraxaneTM, вводимого 1 раз в 3 недели.
Значительно сниженная частота нейтропении и гиперчувствительности, отсутствие потребности в премедикации стероидами, более короткая длительность нейропатии, более короткое время вливания и более высокая доза.
ABI-007 (AbraxaneTM), первый биологически взаимодействующий связанный с альбумином паклитаксел в форме наночастиц, не содержащий какого-либо растворителя, сравнивали с паклитакселом на основе Cremophor® (Taxol®) у индивидуумов с метастатическим раком молочной железы (МВС). Эту фазу III исследования проводили для подтверждения преклинических исследований, демонстрирующих более высокую эффективность и сниженную токсичность ABI-007, по сравнению с Taxol®. Лица методом слепой выборки были включены в группы, получавшие 3-недельные циклы или ABI-007 в дозе 260 мг/м2 (внутривенно) в течение 30 мин без премедикации (n=229), или Taxol® в дозе 175 мг/м2 внутривенно в течение 3 часов с премедикацией (n=225). ABI-007 продемонстрировал значительно более высокие частоты реакции по сравнению с Taxol® (33% в сравнении с 19%; р=0,001) и значительно более продолжительное время до прогрессирования опухоли (23,0 в сравнении с 16,9 неделями; HR (выраженная реакция на лечение) =0,75; р=0,006). Наблюдалась тенденция к более длительному общему выживанию у лиц, которые получали ABI-007 (65,0 в сравнении с 55,7 неделями; р=0,374). При незапланированном анализе ABI-007 увеличил выживание у лиц, получавших лечение в виде терапии второй или больших линий (56,4 в сравнении с 46,7 неделями; HR=0,73; р=0,024). Частота нейтропении 4-ой степени была значительно ниже в группе ABI-007 (9% в сравнении с 22%; p<0,001), несмотря на дозу паклитаксела, превышающую на 49%. Сенсорная нейропатия 3-ей степени чаще наблюдалась в группе ABI-007, чем в группе Taxol® (10% в сравнении с 2%; p<0,001), но она легко устранялась и быстрее наступало улучшение (медиана 22 дня), чем для Taxol® (медиана 73 дня). Ни у одного индивидуума в группе ABI-007, несмотря на отсутствие премедикации и более короткое время введения, не возникли тяжелые (3-ей или 4-ой степени) реакции гиперчувствительности, связанные с лечением. Напротив, в группе Taxol®, несмотря на стандартную премедикацию, возникли реакции гиперчувствительности 3 типа (боль в грудной клетке: 2 индивидуума; аллергические реакции: 3 индивидуума). В соответствии с протоколом в группе ABI-007 индивидуумам обычно не вводили кортикостероиды и антигистаминные препараты; однако премедикацию вводили по поводу рвоты, миалгии/артралгии или анорексии у 18 индивидуумов (8%) в группе ABI-007 в 2% циклов лечения, тогда как 224 индивидуума (>99%) в группе Taxol® получали премедикацию в 95% циклов. Единственной клинической биохимической величиной, которая заметно отличалась в двух плечах лечения, были более высокие уровни глюкозы в сыворотке у индивидуумов, получавших лечение Taxol®, у которых также была более высокая частота гипергликемии, отмеченная как АЕ (неблагоприятные эффекты) (15 [7%] в сравнении с 3 [1%]; р=0,003). В целом, в этой отдельной популяции ABI-007 продемонстрировал большую эффективность и благоприятный профиль безопасности по сравнению с Taxol®. Улучшенный терапевтический показатель и устранение премедикации стероидами, требовавшейся для таксанов на основе растворителей, делают этот связанный с альбумином паклитаксел в виде наночастиц важным достижением в лечении МВС.
Пример 2. Введение AbraxaneTM 1 раз в неделю у лиц с устойчивым к таксанам метастатическим раком молочной железы
Недавно проведенная фаза II клинического исследования показала, что введение AbraxaneTM (паклитаксела, связанного с альбумином в виде наночастиц) в дозе 125 мг/м2 привело к длительному прекращению прогрессирования заболевания у лиц с метастатическим раком молочной железы, заболевание у которых прогрессировало, хотя их лечили Taxol® или Taxotere® (то есть, индивидуумов, которые устойчивы к таксанам).
Считают, что AbraxaneTM представляет первую биологически взаимодействующую композицию, которая использует рецепторно-опосредованный (gp60) путь, который, как обнаружено, является неотъемлемой частью для достижения высоких внутриклеточных концентраций активного ингредиента - паклитаксела. Эта фаза II исследования включала 75 лиц с устойчивым к таксанам метастатическим раком молочной железы. AbraxaneTM вводили 1 раз в неделю путем 30-минутного вливания в дозе 125 мг/м2 без премедикации стероидами/антигистаминными препаратами или профилактики G-CSF. Индивидуумы повторно через каждые 28 дней получали 1 раз в неделю 3 дозы с последующей 1 неделей отдыха. В отличие от Taxol® или Taxotere®, которые содержат детергенты, которые могут ингибировать захват опухолью, механизм действия связанного с альбумином паклитаксела в виде наночастиц может привести к улучшенным исходам, особенно у этой отдельной популяции, которую трудно лечить.
В частности, данные показали, что, несмотря на эту высокую еженедельную дозу 125 мг/м2 у этой отдельной популяции с предварительным лечением высокими дозами и ранее подвергавшейся действию таксанов, только у 3 из 75 индивидуумов (4%) пришлось прекратить введение AbraxaneTM вследствие периферической нейропатии. Кроме того, 80% лиц, которые испытали периферическую нейропатию 3 степени, были обычно способны возобновить лечение после задержки только на 1 или 2 недели и продолжали получать AbraxaneTM в сниженной дозе в среднем в течение 4 дополнительных месяцев. Это быстрое улучшение согласовывалось с наблюдением заявителей в фазе III испытания, что периферическая нейропатия, вызванная одним паклитакселом (т.е. без Cremophor®), быстро уменьшается по сравнению с периферической нейропатией, вызванной Taxol®. Эти наблюдения при клинических испытаниях AbraxaneTM предоставляют первую клиническую возможность оценки эффектов самого химиотерапевтического средства, паклитаксела, и дифференцировать их от эффектов растворителей. На основании опыта проведения и фаз II, III полученные данные свидетельствуют о том, что периферическая нейропатия, вызванная AbraxaneTM, несравнима с периферической нейропатией, вызванной Taxol® или Taxotere® в отношении длительности и воздействия на индивидуума.
В отношении клинического опыта лечения периферической нейропатии после введения Taxol® или Taxotere®, организация Abraxis Oncology недавно завершила опрос 200 онкологов, которых спрашивали о том, сколько времени, по их мнению, потребовалось для улучшения состояния и/или устранения периферической нейропатии, вызванной Taxol®: 25% сообщили: «7-12 месяцев», а еще 23% сообщили: «никогда не устранялась»; в отношении Taxotere®, соответствующие процентные доли составили 29% и 7%. Эти данные согласуются с указаниями в упаковочных вкладышах Taxotere® и Taxol®.
Анализ данных фазы II демонстрирует, что AbraxaneTM активен у этой отдельной популяции с неблагоприятным прогнозом (87% с поражением висцеральных органов (легких и печени), 69%>3 метастатических участков, 88% рост опухоли при введении таксанов) устойчивых к таксанам индивидуумов с метастатическим раком молочной железы. Наблюдения включали 44% случаев прекращения прогрессирования заболевания у лиц, устойчивых к Taxotere®, и 39% случаев прекращения прогрессирования заболевания у лиц, устойчивых к Taxol®. Из тех лиц, заболевание которых прогрессировало при введении одного Taxotere® в группе с метастатическими поражениями (n=27), после введения AbraxaneTM 1 раз в неделю была отмечена частота реакции, составившая 19%. Из тех лиц, заболевание которых прогрессировало при введении одного Taxol® в группе с метастатическими поражениями (n=23), после введения AbraxaneTM 1 раз в неделю была отмечена частота реакции, составившая 13%.
Было обнаружено, что AbraxaneTM хорошо переносим при введении 1 раз в неделю в течение 30 мин без профилактического введения стероидов или G-CSF: нейтропения 4 степени = 3% (без G-CSF); анемия 4 стадии = 1%; отсутствие тяжелых реакций гиперчувствительности (несмотря на отсутствие премедикации). У этих лиц, получавших интенсивное предварительное лечение, 75% лиц лечили всей высокой дозой AbraxaneTM 125 мг/м2 1 раз в неделю без снижения дозы вследствие токсических воздействий/неблагоприятных явлений. Из лиц, у которых развилась сенсорная нейропатия 3-ей степени, 77% были способны возобновить лечение AbraxaneTM в сниженной дозе (75-100 мг/м2), и они получили в среднем 12,2 (диапазон от 1 до 28) дополнительных доз AbraxaneTM. Было примечательным отметить, что из тех лиц, которые возобновили лечение AbraxaneTM, 80% (8 из 10) были способны возобновить прием препарата через 14 дней после снижения нейропатии до 1-2-ой степени. Эти результаты подтверждают наблюдения в фазе III основного испытания AbraxaneTM в дозе 260 мг/м2, вводимой 1 раз в 3 недели, в котором также было отмечено быстрое улучшение (медиана 22 дня). Взятые вместе, эти 2 клинических испытания свидетельствуют о том, что при введении одного паклитаксела возникающая нейропатия представляется кратковременной и легко устранимой.
AbraxaneTM использует путь на основе рецептора gp60 на эндотелиальных клетках микрососудов, и было показано, что Taxol® не транспортировался этим механизмом. Кроме того, связывающий альбумин белок, SPARC, был избыточно экспрессирован в опухолях молочных желез и может играть роль в увеличенном внутриопухолевом накоплении AbraxaneTM. Предложенный механизм свидетельствовал о том, что попав в интерстиций опухоли, комплекс альбумин-паклитаксел связался со SPARC, который присутствовал на поверхности опухолевой клетки, и быстро интернализировался в опухолевую клетку нелизосомным механизмом.
Кроме того, поверхностно-активные вещества/растворители, обычно используемые в современных препаративных формах таксанов, такие как Cremophor®, Tween® 80 и TPGS, сильно ингибируют связывание паклитаксела с альбумином, посредством этого ограничивая трансэндотелиальный транспорт. Дополнительные представленные данные показали статистически улучшенную эффективность AbraxaneTM, в сравнении с Taxotere®, в ксенотрансплантате карциномы молочной железы в одинаковой дозе.
В заключение, 75% лиц лечили полной высокой дозой без уменьшения дозы. Данные указывают на быстрое улучшение состояния при периферической нейропатии при введении одного связанного с альбумином паклитаксела в виде наночастиц, без растворителя Cremophor®. Дополнительные данные предоставляют еще одно доказательство того, что механизм действия может играть важную роль в улучшении отельных исходов.
Пример 3. AbraxaneTM (ABI-007) действует синергически с нацеленными антиангиогенными про-апоптозными пептидами (НКР) в ксенотрансплантатах человеческой опухоли MDA-MB-435
Ранее сообщалось об антиангиогенной активности мелких синтетических про-апоптозных пептидов, составленных из двух функциональных доменов, один нацелен на рецепторы CD13 (аминопептидаза N) на опухолевых микрососудах, а другой разрушает митохондриальную мембрану после интернализации. См. Nat Med. 1999 Sep; 5(9):1032-8. Было обнаружено, что димерный пептид второго поколения, CNGRC-GG-d(KLAKLAK)2, названный НКР (пептид-«охотник»-«убийца»), обладает повышенной противоопухолевой активностью. Поскольку антиангиогенные агенты, такие как Avastin®, проявляют синергизм в комбинации с цитотоксическими агентами, такими как 5-фторурацил, заявители оценили комбинацию антиангиогенного НКР с AbraxaneTM (ABI-007), паклитаксела с альбумином в виде наночастиц, который транспортируется рецептором gp60 в сосудистом эндотелии (Desai, SABCS 2003), в ксенотрансплантатах опухоли молочной железы человека MDA-MB-435.
Методы: Ксенотрансплантаты человеческих опухолей MDA-MB-435 были установлены при среднем объеме опухолей 100 мм3; мышей методом рандомизации делили на группы по 12-13 животных и лечили НКР, AbraxaneTM, или НКР и AbraxaneTM. НКР вводили внутривенно (250 мкм) 1 раз в неделю 16 недель. AbraxaneTM вводили внутривенно ежедневно в течение 5 дней в дозе 10 мг/кг в день только в течение первой недели лечения. Использованная доза AbraxaneTM была существенно ниже MTD (30 мг/кг в день, 4 раза в день × 5) для предотвращения полной регрессии опухоли; таким образом, можно было отметить эффект НКР.
Результаты: Через 19 недель лечения объем опухоли в группе НКР (4,372 мм3±2,470; р<0,05) или ABI-007 (3,909 мм3±506; p<0,01, в сравнении с контролем) был значительно уменьшен по сравнению с контрольной группой (10,298 мм3±2,570; p<0,05). Комбинация ABI-007 и НКР значительно уменьшала объем опухоли в сравнении с монотерапией (411 мм3±386; p<0,01, монотерапия AbraxaneTM или монотерапия НКР). Эти виды лечения хорошо переносились.
Вывод: Комбинация AbraxaneTM (ABI-007), связанного с альбумином паклитаксела в виде наночастиц, с сосудистым нацеливающим антиангиогенным димерным пептидом НКР (CNGRC-GG-d(KLAKLAK)2) против ксенотрансплантата опухоли молочной железы человека MDA-MB-435 проявила значительное уменьшение объема опухоли по сравнению с монотерапией каждым средством отдельно. Полученные результаты свидетельствуют о том, что комбинация AbraxaneTM с антиангиогенными средствами, такими как НКР или, возможно, Avastin®, может быть благоприятной.
Пример 4. Метрономная терапия ABI-007: Антиангиогенная и противоопухолевая активность связанного с альбумином паклитаксела в виде наночастиц
Пример 4а
Методы: Антиангиогенную активность ABI-007 оценивали с помощью анализов аортальных колец крыс, пролиферации эндотелиальных клеток пупочной вены человека (HUVEC) и формированием трубок. Оптимальную дозу ABI-007 для метрономной терапии определяли измерением уровней циркулирующих эндотелиальных предшественников (СЕР) в периферической крови мышей Balb/c, не имеющих опухолей (n=5/группу; введение: 1-30 мг/кг внутрибрюшинно, 4 раза в день × 7), проточной цитометрией (Shaked et al., Cancer Cell, 7:101-111 (2005)). В последующем, оценивали противоопухолевые эффекты метрономной (4 раза в день; внутрибрюшинно) и MTD (4 раза в день × 5, 1 цикл; внутривенно) терапии ABI-007 и Taxol® и сравнивали у мышей SCID, несущих ксенотрансплантаты рака молочной железы MDA-MD-231 и рака предстательной железы человека РС3.
Результаты: ABI-007 в количестве 5 нМ значимо (р<0,05) ингибировал разрастание микрососудов аорты крыс, пролиферацию эндотелиальных клеток человека и формирование трубок, соответственно, на 53%, 24% и 75%. На основании измерений СЕР установили, что оптимальная доза ABI-007 для метрономной терапии составляла 6-10 мг/кг. Метрономная терапия ABI-007 (6 мг/кг), но не Taxol® (1,3 мг/кг), значительно (р<0,05) подавляла рост опухоли в обеих моделях ксенотрансплантатов. Ни ABI-007, ни Taxol®, введенные метрономно, не вызывали какой-либо потери массы тела. Хотя MTD ABI-007 (30 мг/кг) ингибировала рост опухоли эффективнее, чем MTD Taxol® (13 мг/кг), значимая потеря массы тела была отмечена при первой. Представляет интерес, что противоопухолевый эффект метрономной терапии ABI-007 приближался к такому MTD Taxol®.
Вывод: ABI-007 проявляет высокую антиангиогенную и противоопухолевую активность при применении в метрономном режиме.
Пример 4b
Анализ аортальных колец крыс. 12-луночные планшеты для тканевой культуры покрывали Matrigel (Collaborative Biomedical Products, Bedford, MA) и предоставляли возможность образоваться гелю в течение 30 мин при 37°С и 5% СО2. Грудные аорты иссекали у 8-10-недельных самцов крыс Sprague-Dawley, разрезали на поперечные срезы длиной 1 мм, помещали на покрытые Matrigel лунки и покрывали дополнительным количеством Matrigel. После застывания второго слоя Matrigel кольца покрывали EGM-II и инкубировали в течение ночи при 37°С и 5% СО2. EGM-II состоит из базальной среды эндотелиальных клеток (EBM-II; Cambrex, Walkersville, MD) плюс факторов роста эндотелиальных клеток, предоставленных в виде EGM-II Bulletkit (Cambrex). Культуральную среду в последующем заменяли EBM-II с добавлением 2% FBS (фетальной телячьей сыворотки), 0,25 мкг/мл амфотерицина В и 10 мкг/мл гентамицина. Аортальные кольца обрабатывали EBM-II, содержащим носитель (0,9% солевой раствор/альбумин), карбоксиамидотриазола (CAI; 12 мкг/мл) или ABI-007 (0,05-10 нМ паклитаксела), в течение 4 дней и фотографировали на 5-й день. CAI, известное антиангиогенное средство, использовали в концентрации, более высокой, чем клинически достижимая, в качестве положительного контроля. Эксперименты повторяли 4 раза, используя аорты от 4 различных крыс. Площадь ангиогенного прорастания, представленную в квадратных пикселях, количественно определяли, используя программное обеспечение Adobe Photoshop 6.0.
Как показано на фиг.1А, ABI-007 значительно ингибировал разрастание аортальных микрососудов зависимым от концентрации образом относительно контроля носителя, достигая статистической значимости (p<0,05) при 5 нМ (ингибирование на 53%) и 10 нМ (ингибирование на 68%). Количество альбумина, присутствовавшее при каждой концентрации одного ABI-007, не ингибировало ангиогенез.
Анализ пролиферации эндотелиальных клеток. Эндотелиальные клетки человеческой пупочной вены (HUVEC; Cambrex) поддерживали в EGM-II при 37°С и 5% СО2. HUVEC высевали на 12-луночные планшеты при плотности 30000 клеток/лунку и давали возможность прикрепиться в течение ночи. Затем культуральную среду аспирировали и в каждую лунку добавляли свежую культуральную среду, содержащую или носитель (0,9% солевой раствор/альбумин), или ABI-007 (0,05-10 нМ паклитаксела). Через 48 часов клетки трипсинизировали и подсчитывали счетчиком Coulter Z1 (Coulter Corp., Hialeah, FL). Все эксперименты повторяли 3 раза.
Как показано на фиг.1В, пролиферация эндотелиальных клеток человека значительно ингибировалась ABI-007 при 5 нМ и 10 нМ, соответственно, на 36% и 41%.
Анализ формирования трубок эндотелиальными клетками. 8-луночные камеры предметных стекол покрывали Matrigel и давали возможность образоваться гелю при 37°С и 5% СО2 в течение 30 мин. Затем HUVEC высевали при 30000 клетках/лунку в EGM-II, содержащий или носитель (0,9% солевой раствор/альбумин), или ABI-007 (0,05-10 нМ паклитаксела) и инкубировали при 37°С и 5% СО2 в течение 16 ч. После инкубации предметные стекла промывали PBS (солевым раствором с фосфатным буфером), фиксировали в 100% метаноле в течение 10 с и окрашивали раствором Diff Quick II (Dade Behring Inc., Newark, DE) в течение 2 мин. Для анализа формирования трубок каждую лунку фотографировали цифровым фотоаппаратом, используя объектив 2,5х. Пороговый уровень был установлен для маскировки окрашенных трубок. Соответствующую площадь измеряли в виде количества пикселей, используя программное обеспечение MetaMorph (Universal Imaging, Downingtown, PA). Эксперименты повторяли 3 раза.
Как показано на фиг.1С, ABI-007 блокировал формирование трубок на 75% и при 5 нМ, и 10 нМ.
Определение оптимальной биологической дозы ABI-007 in vivo измерением циркулирующих эндотелиальных клеток (СЕС) и циркулирующих эндотелиальных предшественников (СЕР). Самок 6-8-недельных мышей Balb/cJ методом рандомизации включали в следующие 8 групп (n=5 каждая): не получавшие лечение, получавшие лечение внутрибрюшинной инъекцией болюса или носителя лекарственного препарата (0,9% солевой раствор/альбумин), или ABI-007 в дозе паклитаксела 1, 3, 6, 10, 15 или 30 мг/кг 1 раз в день в течение 7 дней. В конце периода лечения образцы крови брали пункцией сердца и собирали в содержащие EDTA пробирки «vacutainer» (Becton Dickinson, Franklin Lakes, NJ). CEC и CEP подсчитывали, используя четырехцветную проточную цитометрию. Моноклональные антитела, специфичные для CD45, использовали для исключения CD45 + гематопэтические клетки. СЕС и их субпопуляцию СЕР изображали, используя маркеры мышиного эндотелия киназы 1 фетальной печени/рецептора 2 VEGF (flk-1/VEGFR2), CD13 и CD117 (BD Pharmingen, San Diego, CA). Ядерное окрашивание (Procount; BD Biosciences, San Jose, CA) выполняли для исключения возможности помех тромбоцитов или клеточных фрагментов точности подсчета СЕС и СЕР. После лизиса эритроцитов клеточные суспензии оценивали FACSCalibur (BD Biosciences), используя аналитические «ворота», предназначенные для исключения мертвых клеток, тромбоцитов и клеточных фрагментов. Получали, по меньшей мере, 100000 событий/образец для анализа процентной доли СЕС и СЕР. Затем абсолютное число СЕС и СЕР подсчитывали в виде процентной доли событий, отмеченных в рамках подсчета СЕС и СЕР, умноженной на общее количество лейкоцитов. Определяли процентные доли окрашенных клеток и сравнивали с соответствующими отрицательными контролями. Положительное окрашивание определяли как большее, чем неспецифическое фоновое окрашивание. 7-аминоактиномицин D (7AAD) использовали для подсчета жизнеспособных клеток относительно апоптозных и мертвых клеток.
На фиг.2 показано, что ABI-007, вводимый внутрибрюшинно 1 раз в день в течение 7 дней в дозе 3, 10-30 мг/кг, значительно снижал уровни СЕР у мышей Balb/cJ, не имеющих опухоли. Однако ABI-007 в дозе 10-30 мг/кг был связан со значительным снижением количества лейкоцитов, указывающим на токсичность. Хотя снижение уровней СЕР ABI-007 в дозе 6 мг/кг не достигало статистической значимости, уменьшение количества лейкоцитов не было очевидным. Поэтому, был сделан вывод, что оптимальная биологическая доза для метрономного лечения ABI-007 in vivo составляла от 3 до 10 мг/кг. В одном исследовании метрономное лечение Taxol® в дозе 1,3, 3, 6 или 13 мг/кг, вводимых внутрибрюшинно в течение 7 дней, значимо не снижало жизнеспособные уровни СЕР, тогда как метрономное лечение Taxol® в дозе 30 мг/кг или выше привело к тяжелой токсичности и, в конечном счете, смертности у мышей. Ранее сообщалось, что внутрибрюшинное введение Taxol® в дозах, обычно используемых в клинике, привело к захвату паклитаксела в мицеллы Cremophor® EL в брюшной полости и, следовательно, незначительной концентрации паклитаксела в плазме (Gelderblom et al., Clin. Cancer Res. 8:1237-41 (2002)). Это могло бы объяснить, почему дозы метрономного Taxol® (1,3, 3, 6 или 13 мг/кг), которые не вызвали смерть, не смогли изменить уровни жизнеспособных СЕР. В этом случае внутрибрюшинное введение метрономного Taxol® в дозе 1,3 мг/кг совсем не отличалось бы от метрономного Taxol® в дозе 13 мг/кг. Поэтому для последующих экспериментов была выбрана более низкая доза, 1,3 мг/кг, для минимизации количества Cremophor® EL на введение паклитаксела.
Противоопухолевые эффекты ABI-007 в метрономной схеме и при введении MTD, по сравнению с Taxol® в метрономной схеме и при введении MTD. Линию клеток человеческого рака предстательной железы РС3 и линию клеток рака молочной железы человека MDA-MD-231 получали из Американской коллекции типовых культур (Manassas, VA). Клетки РС3 (5×106) инъецировали подкожно 6-8-недельным самцам мышей SCID, тогда как клетки MDA-MD-231 (2×106) имплантировали ортотопически в жировую подушечку молочной железы самок мышей SCID. Когда объем первичной опухоли достигал приблизительно 150-200 мм3, животных методом рандомизации включали в 8 групп (n=5-10/группу). Каждую группу лечили или контролем носителя 0,9% солевого раствора/альбумина, или контролем носителя Cremophor® EL, или метрономным Taxol® (1,3 мг/кг внутрибрюшинно 4 раза в день), или метрономным ABI-007 (3, 6 или 10 мг/кг паклитаксела внутрибрюшинно 4 раза в день), или MTD Taxol® (13 мг/кг внутрибрюшинно 4 раза в день × 5, 1 цикл), или MTD ABI-007 (30 мг/кг паклитаксела внутривенно 4 раза в день × 5, 1 цикл). Перпендикулярные диаметры опухолей измеряли циркулем 1 раз в неделю и рассчитывали их объемы. В конце периода лечения образцы крови брали пункцией сердца у мышей из всех групп. Подсчитывали СЕС и СЕР, как описано здесь.
В отличие от Taxol® (1,3 мг/кг) метрономный ABI-007 (3, 6 или 10 мг/кг), введенный внутрибрюшинно 1 раз в день в течение 4 недель, значительно (p<0,05) ингибировал рост и опухолей MDA-MB-231, и PC3 (фиг.3А и фиг.3В). Ни ABI-007, ни Taxol®, введенные метрономно, не вызывали никакой потери массы тела (фиг.3С и фиг.3D). Хотя MTD ABI-007 (30 мг/кг) ингибировал рост опухоли эффективнее, чем MTD Taxol® (13 мг/кг), при первом наблюдалась значительная потеря массы тела, указывающая на токсичность. Кроме того, у 2 из 5 мышей, получавших лечение MTD ABI-007, проявились признаки паралича в одной конечности через 6 дней после последней дозы препарата. Паралич был преходящим и разрешился в пределах 24-48 часов. Представляет интерес, что противоопухолевый эффект метрономного ABI-007 в дозе 6 мг/кг приближался к противоопухолевому эффекту MTD Taxol® на модели ксенотрансплантата MDA-MB-231 (фиг.3А). Представляется, что увеличение дозы метрономного ABI-007 до 10 мг/кг не придало более выраженного ингибирования роста опухоли. Напротив, метрономный ABI-007 вызывал более выраженную противоопухолевую реакцию в дозе 10 мг/кг, чем в дозах 3 и 6 мг/кг в ксенотрансплантатах РС3 (фиг.3В).
Метрономный ABI-007 значительно снижал уровни жизнеспособных СЕР зависимым от дозы образом у мышей, несущих опухоль MDA-MB-231 (фиг.4А). Уровни жизнеспособных СЕР также проявили зависимое от дозы уменьшение реакции на метрономный ABI-007 у мышей, несущих опухоль РС3, но достигли статистической значимости только при 10 мг/кг (фиг.4В). Уровни СЕР не изменялись метрономным Taxol® на обеих моделях ксенотрансплантатов (фиг.4А и 4В).
Исследовали воздействия метрономного и MTD ABI-007 и метрономного и MTD Taxol® на внутриопухолевую плотность микрососудов. Срезы толщиной 5 мкм, полученные из замороженных опухолей MDA-MB-231 и РС3, окрашивали H&E (гематоксилином и эозином) для гистологического исследования стандартными способами, известными специалисту в данной области. Для выявления микрососудов срезы окрашивали крысиным противомышиным CD31/PECAM-1 антителом (1:1000, BD Pharmingen) с последующим окрашиванием сопряженно связанного с техасским красным козьим противокрысиным вторичным антителом (1:200, Jackson ImmunoResearch Laboratories, Inc., West Grove, PA). Одиночный микрососуд был выявлен в виде дискретного кластера или одиночной клетки, положительно окрашенной на CD31/PECAM-1d, и присутствие просвета не требовалось для балльной оценки в качестве микрососуда. MVD для каждой опухоли выражали в виде средней величины трех наиболее плотно окрашенных полей, идентифицированных объективом 20х на системе флюоресцентной микроскопической визуализации Zeiss AxioVision 3.0. Анализировали 4-5 различных опухолей на каждый контроль носителя или группу лечения.
Представлялось, что в опухолях MDA-MB-231 метрономный ABI-007 в дозе 6 и 10 мг/кг, а также MTD ABI-007 незначительно снижали плотность микрососудов, хотя статистическая значимость не была достигнута (фиг.5А). Оказалось, что в опухолях РС3 метрономный ABI-007 в дозе 3 и 10 мг/кг снижал MVD, но без достижения статистической значимости (фиг.5А). Представляет интерес, что существовала значимая корреляция между MVD и уровнем жизнеспособных СЕР на модели MDA-MB-231 (фиг.5В; r=0,76, P=0,04), но не в РС3 (фиг.5С; r=0,071, P=0,88).
Проводили оценку ангиогенеза in vivo. Выполняли анализ перфузии с пробкой из матригеля при небольших модификациях способов, известных специалисту в данной области. Вкратце, 0,5 мл матригеля с добавкой 500 нг/мл основного фактора роста фибробластов (bFGF; R&D Systems Inc., Minneapolis, MN) инъецировали подкожно в 0-ой день в бока 10-недельных самок мышей Balb/cJ. На 3-й день животных методом случайной выборки включали в 8 групп (n=5 в каждой). Каждую группу лечили или контрольным носителем 0,9% солевого раствора/альбумина, или контролем носителя Cremophor® EL, или метрономным Taxol® (1,3 мг/кг внутрибрюшинно 4 раза в день), метрономным ABI-007 (3, 6 или 10 мг/кг паклитаксела внутрибрюшинно 4 раза в день), MTD Taxol® (13 мг/кг внутривенно 4 раза в день × 5), или MTD ABI-007 (30 мг/кг паклитаксела внутривенно 4 раза в день × 5). В качестве отрицательного контроля, пяти дополнительным самкам мышей Balb/cJ аналогичного возраста инъецировали один матригель. На 10-й день всем животным инъецировали внутривенно 0,2 мл 25 мг/мл FITC-декстрана (Sigma, St. Louis, MO). В последующем брали образцы плазмы. Пробки из матригеля удаляли, инкубировали с диспазой (Collaborative Biomedical Products, Bedford, MA) в течение ночи при 37°С и затем гомогенизировали. Показания флюоресценции получали с использованием считывающего устройства флюоресценции, планшет FL600 (Biotech Instruments, Winooski, VT). Ангиографическая реакция была выражена в виде отношения флюоресценции пробки матригеля к флюоресценции плазмы.
Оказалось, что ABI-007 в дозе 6 или 10 мг/кг уменьшает ангиогенез, хотя ингибирование не достигало статистической значимости (фиг.6). Представлялось, что ангиогенез не изменялся метрономным ABI-007 в дозе 3 мг/кг, MTD ABI-007, MTD и метрономным Taxol® относительно соответствующих контролей носителей (фиг.6). Эти наблюдения были аналогичны описанным здесь внутриопухолевым MVD результатам.
Пример 5. Nab-5109, связанный с наночастицами альбумина IDN5109 (nab-5109), проявляет повышенную эффективность и сниженную токсичность в сравнении с препаративной формой Tween® (Tween®-5109, ортатакселом)
Методы: nab-5109 в виде наночастиц получали, используя nab-технологию, и характеризовали рассеянием лазерного света. Nab-5109 и Tween-5109 тестировали против ксенотрансплантата карциномы ободочной кишки человека Pgp+DLD-1 (которая, как известно, устойчива против паклитаксела и доцетаксела – Vredenburg et al., JNCI93:1234-1245, 2001) у «голых» мышей (n=5/группу) в дозах 50 мг/кг (Tween®-5109, ранее показанный как MTD) и 75 мг/кг (nab-5109), вводимый 4 раза в день 3 дня × 4 внутривенно. Использовали также контрольные группы PBS и человеческого сывороточного альбумина (HSA).
Результаты: Nab-5109 давал наночастицы со средним размером ZAve=119 нм и Зета потенциал = 32,7 мВ. Nab-5109 лиофилизировали в сухой порошок, который легко диспергировался в солевом растворе. In vivo, имелась значимо большая потеря массы тела (ANOVA (вариационный анализ), p<0,001) у животных, несущих опухоль, при лечении Tween®-5109 (50 мг/кг, потеря массы тела 8,8%), чем при лечении nab-5109 (75 мг/кг, потеря массы тела 3,4%), указывая на существенно более низкую токсичность nab-5109, несмотря на 50% более высокую дозу. Наблюдалось значимое подавление опухоли nab-5109 и Tween®-5109 (ANOVA, p<0,0001 в сравнении с контролями) при задержке роста опухоли, соответственно, на 36 и 28 дней для nab-5109 (75 мг/кг) и Tween®-5109 (50 мг/кг). Nab-5109 был эффективнее, чем Tween®-5109 (ANOVA, p=0,0001) в подавлении роста опухоли. Не было различий между PBS и HSA с контрольной группой в отношении токсичности и эффективности.
Вывод: Связанный с альбумином nab-5109 в виде наночастиц был успешно получен, и его можно было вводить в дозе, на 50% выше, чем Tween®-5109 при более низкой токсичности, несмотря на более высокую дозу. При этой более высокой дозе, 75 мг/кг (4 раза в день 3 дня × 4), nab-5109 проявил существенно повышенную эффективность при ксенотрансплантате карциномы ободочной кишки человека Pgp+DLD-1 по сравнению с Tween®-5109.
Пример 6. Связанные с наночастицами альбумина (nab) димерные тиоколхицины nab-5404, nab-5800 и nab-5801: Сравнительная оценка противоопухолевой активности в сравнении с AbraxaneTM и иринотеканом
Методы: Колхицины в виде наночастиц получали, используя технологию nab. Цитотоксичность оценивали in vitro, противоопухолевую активность in vivo (против ксенотрансплантата опухоли ободочной кишки человека НТ29) у «голых» мышей сравнивали с иринотеканом и AbraxaneTM . Уровни доз для nab-колхицинов и иринотекана составляли 20 мг/кг и 40 мг/кг, вводимые 4 раза в день 3 дня × 4 внутривенно. AbraxaneTM вводили в его MTD, 30 мг/кг, вводимые 4 раза в день × 5.
Результаты: Гидрофобные димеры тиоколхицина давали наночастицы со средним размером ZAve (нм) 119, 93 и 84, соответственно, для nab-5404, nab-5800 и nab-5801. Суспензии наночастиц стерилизовали через фильтры 0,22 мкм и лиофилизировали. In vitro, nab-5404 был самым активным из трех аналогов против МХ-1 (p≤0,0005, ANOVA), (IC50 (мкг/мл): 18, 36 и 77, соответственно, для nab-5404, nab-5800 и nab-5801), а также против ксенотрансплантата НТ29 in vivo (p≤0,0001, ANOVA). Объем опухоли подавлялся на 93%, 79% и 48%, соответственно, при дозах nab-5404 40 мг/кг, 30 мг/кг и 20 мг/кг. Напротив, объем опухоли подавлялся на 31%, 16% и 21% только nab-5800; и на 17%, 30% и 23% nab-5801, соответственно, в дозе 40 мг/кг, 30 мг/кг и 20 мг/кг. Nab-5404 был эффективнее, чем иринотекан, при всех уровнях доз (p≤0,008, ANOVA) при подавлении объемов опухоли иринотеканом только на 48%, 34% и 29% при уровнях доз, соответственно, 40 мг/кг, 30 мг/кг и 20 мг/кг. При сравнении с AbraxaneTM Nab-5404 был активнее при эквитоксической дозе (ETD) на основании равной потери массы тела (p<0,0001, ANOVA). Объем опухоли подавлялся на 93% nab-5404 (40 мг/кг, 4 раза в день 4 дня × 3) и на 80% AbraxaneTM (30 мг/кг, 4 раза в день × 5) в их соответствующих ETD.
Выводы: Технологию Nab использовали для превращения 3 гидрофобных димерных тиоколхицинов (IDN5404, IDN5800, IDN5801) в наночастицы, подходящие для внутривенного введения. nab-5404 был более сильнодействующим, чем иринотекан в равной дозе. В эквитоксичной дозе, определяемой потерей массы тела, nab-5404 был более сильнодействующим, чем AbraxaneTM. Эти данные оправдывают дальнейшее исследование nab-5404.
Пример 7. AbraxaneTM в сравнении с Taxotere®: Преклиническое сравнение токсичности и эффективности
Методы: Токсичность AbraxaneTM и Taxotere® сравнивали в исследовании с изменяемой дозой у «голых» мышей, получавших препараты по схеме q4d×3. Уровни доз были для Taxotere® 7, 15, 22, 33 и 50 мг/кг, а для АВХ – 15, 30, 60, 120 и 240 мг/кг. Противоопухолевую активность AbraxaneTM и Taxotere® сравнивали у «голых» мышей с ксенотрансплантатами человеческой опухоли молочной железы МХ-1 в дозе 15 мг/кг 1 раз в неделю в течение 3 недель.
Результаты: В исследовании на мышах с повышением дозы максимальная переносимая доза Taxotere® составила 15 мг/кг, а летальная доза (LD100) составила 50 мг/кг. Напротив, MTD AbraxaneTM составила от 120 до 240 мг/кг, а LD100 составила 240 мг/кг. В опухолевом исследовании AbraxaneTM был эффективнее, чем равные дозы Taxotere®, в ингибировании опухолевого роста (79,8% в сравнении с 29,1%, p<0,0001, ANOVA).
Вывод: Связанный с альбумином паклитаксел в виде наночастиц (AbraxaneTM) превосходил Taxotere® при модели опухоли МХ-1 при тестировании в равных дозах. Кроме того, токсичность AbraxaneTM была значительно ниже, чем токсичность Taxotere®, что позволило бы вводить AbraxaneTM на существенно более высоких уровнях. Эти результаты аналогичны повышенному терапевтическому индексу, наблюдавшемуся при AbraxaneTM, по сравнению с Taxol®, и свидетельствуют о том, что присутствие поверхностно-активных веществ может нарушить транспорт, противоопухолевую активность и увеличить токсичность таксанов. Проводятся исследования на дополнительных моделях опухолей, сравнивающие AbraxaneTM и Taxotere®.
Пример 8. Связанный с альбумином димер тиоколхицина в виде наночастиц (nab-5404) с двойными механизмами действия на тубулин и топоизомеразу-1: Оценка активности in vitro и in vivo
Методы: IDN5404 тестировали на цитотоксическую активность, используя карциному молочной железы MCF7-S и ее устойчивый к многим препаратам вариант MCF7-R (pgp+). Также оценивали его цитотоксичность против набора клеточных линий человеческой опухоли NCI-60. Связанный с альбумином nab-5404 в виде наночастиц вводили внутривенно, используя различные схемы, мышам SCID, которым подкожно имплантировали ксенотрансплантат человеческой опухоли яичников А121.
Результаты: Материнское соединение колхицин продемонстрировало против клеточных линий MCF7 ингибирование опухолевого роста при величине IC50 (концентрация, ингибирующая на 50%) для клеток MCF7-S при 3,9±0,2 нМ. Устойчивый вариант MCF7-R продемонстрировал IC50 66±8,6 нМ, приблизительно 17-кратное увеличение вследствие устойчивости к лекарственным препаратам. IDN5404 продемонстрировал повышенную активность против обеих клеточных линий, проявляя величины IC50, соответственно, 1,7±0,1 и 40±3,8 нМ. Эти результаты были подтверждены в пределах набора клеточных линий человеческих опухолей NCI 60 при IDN5404, имеющем среднюю IC50<10-8M и более чем 10-кратную устойчивость между клеточными линиями MCF7-S и MCF7-R. Алгоритм COMPARE (сравнить) идентифицировал IDN5404 как связывающее тубулин соединение, аналогичное алкалоидам винки, подтверждая ранее полученные результаты. Эффективность и токсичность nab-5404 in vivo против ксенотрансплантата опухоли яичников А121 была зависимой от дозы и схемы. Nab-5404 в виде наночастиц был хорошо переносим и способен вызвать полную регрессию и излечение в дозе 24 мг/кг, введенной внутривенно 4 раза в день × 5 дней, 5 из 5 мышей выжили в течение длительного времени (LTS) без свидетельств наличия опухоли. Однако увеличение дозировки до 30 мг/кг привело к 5 из 5 случаев гибели мышей в результате токсического действия. При схеме q3d×4 доза 30 мг/кг привела к получению 4 из 5 мышей с LTS, а доза 50 мг/кг привела к 5 из 5 случаев гибели мышей в результате токсического действия. При использовании схемы q7d×3 доза 40 мг/кг привела к получению 3 из 5 мышей с LTS, а при дозе 50 мг/кг были отмечены 4 мыши с LTS.
Выводы: IDN5404, новый димер тиоколхицина, с двойным механизмом действия проявил активность на клеточных линиях, экспрессирующих pgp, устойчивых к цисплатину и топотекану. In vivo, связанный с альбумином nab-5404 в виде наночастиц был активен против ксенотрансплантатов опухоли яичников А121.
Пример 9. Исследование комбинации AbraxaneTM и других средств
Благодаря отмеченным выше преимущественным свойствам AbraxaneTM (АВХ, связанного с альбумином паклитаксела в виде наночастиц), он применялся и применяется в ряде исследований при различных способах введения и схемах, и в комбинации с другими онкологическими препаратами, а также с лучевой терапией. Они перечислены ниже:
При метастатическом раке молочной железы эти исследования включают:
| Фаза II рандомизированного испытания введения AbraxaneTM 1 раз в неделю в комбинации с гемцитабином у лиц с HER2-отрицательным метастатическим раком молочной железы | АВХ 125 мг/м2, гемцитабин 1000 мг/м2, д 1, 8; q3wk | Для оценки комбинации АВХ + гемцитабин при лечении 1-ой линии МВС. |
| Фаза II исследования ударной терапии введением 1 раз в неделю паклитаксела в виде наночастиц (ABI-007) карбоплатина с Herceptin® в качестве лечения первой или второй линии лечения запущенного HER2-положительного рака молочной железы | АВХ 100 мг/м2, карбоплатин AUC 2, оба д 1, 8, 15; Herceptin® 2 мг/кг (4 мг/кг в течение недели) q4wk×6 | Данные будут важны для применения АВХ в комбинации с карбоплатином и/или Herceptin®. Также полезны для других комбинаций. |
| Винорелбин и AbraxaneTM 1 раз в неделю с G-CSF или без него при раке молочной железы IV стадии: фаза I-II исследования | L1: ABX 80, Nav 15; L2: ABX 90, Nav 20; L3: ABX 100, Nav 22,5; L4: ABX 110, Nav 25; L5: ABX 125, Nav 25 qwk |
Многоцентровое исследование ABX с Navelbine® при лечении 1-ой линии МВС. |
| Фаза II испытания монотерапии введением AbraxaneTM 1 раз в неделю для лечения 1-ой линии МВС (плюс Herceptin® у Her2+ пациенток) | АВХ 125 мг/м2, q3/4wk | Относительно большая фаза II испытания монотерапии ABX 125 мг/м2 при лечении 1-ой линии МВС |
| Фаза I/II испытания AbraxaneTM плюс ограниченное РК | АВХ + антрациклин | |
| 3-плечевая фаза II испытания при лечении 1-ой линии МВС | ABX 1 раз в неделю (130 мг/м2) в сравнении с q2wk (260 мг/м2), в сравнении с q3wk (260 мг/м2) | Для оптимизации схемы монотерапии АВХ по поводу МВС |
| Фаза II трехплечевого испытания лечения МВС 1-ой и 2-ой линии с анализом биологических коррелятов | ABX 1 раз в неделю в сравнении с ABX q3wk, в сравнении с Taxol® 1 раз в неделю | Рандомизированное испытание АВХ при МВС для получения важных данных: ABX 1 раз в неделю в сравнении с Taxol® 1 раз в неделю; ABX 1 раз в неделю в сравнении с ABX 3 раза в неделю; плюс исследование биологических маркеров (кавеолин-1 и SPARC). |
| Фаза I/II испытания AbraxaneTM + GW572016 | TBD | Комбинация АВХ и GW572016 (двойной ингибитор EGFR и один из наиболее перспективных новых биологических средств для ВС). |
| Фаза I исследования увеличения дозы при 2-дневной пероральной хемосенсибилизации пульсирующим введением гефитиниба перед введением AbraxaneTM 1 раз в неделю у лиц с запущенными солидными опухолями | AbraxaneTM 100 мг/м2 1 раз в неделю 3 из 4 недель; гефитиниб, начиная с 1000 мг в день × 2 дня | Эта фаза I испытания предназначена для определения безопасности переносимости 2-дневного пульсирующего введения гефитиниба, вводимого перед введением AbraxaneTM. |
| Фаза II испытания лечения 1-ой линии МВС | ABX 1 раз в неделю (125 мг/м2, 2 недели введения и 1 неделя без введения) + Xeloda® 825 мг/м2, д 1-14 q3wk | Для оценки комбинации ABX и Xeloda® при лечении 1-ой линии МВС, используя схему 2 недели введения и 1 неделю без введения ABX |
| Фаза II поискового адъювантного испытания AbraxaneTM при раке молочной железы | Лечение ударной дозой АС + G CSF → ABX 1 раз в неделю → Avastin® | Пилотное адъювантное исследование «сверх ударной дозы» |
| AbraxaneTM при адъювантной химиотерапии ударными дозами по поводу ранней стадии рака молочной железы | AC q2wk×4 + G CSF → ABX q2wk×4 | Пилотное адъювантное исследование схемы ударной дозы АВХ – альтернативы стандартной адъювантной схемы |
| Фаза II поискового адъювантного испытания AbraxaneTM при раке молочной железы | AC q2wk → ABX q2wk + G-CSF | Пилотное адъювантное исследование при подготовке к фазе III адъювантного испытания |
Исследования неоадъювантных схем лечения при раке молочной железы включают:
| Фаза II испытания неоадъювантного лечения ударными дозами гемцитабина, эпирубицина, ABI-007 (GEA) при локально запущенном или воспалительном раке молочной железы | Неоадъювантное лечение: гемцитабин (Gem) 2000, эпирубицин (Epi) 60, АВХ 175 мг/м2, Neul 6 мг подкожно, все д 1 q2wk×6 Адъювантное лечение: Gem 2000, ABX 220, Neul 6 мг д 1 q2wk×4 |
Это неоадъювантное исследование основано на данных GET из Европы, которые проявили высокую активность. В современной схеме АВХ заместит Т или Taxol®. |
| Фаза II предоперационного испытания AbraxaneTM с последующим FEC (+ Herceptin® при целесообразности) при раке молочной железы | АВХ 220 мг/м2 q2wk×6 с последующим FEC×4 (+ Herceptin® для Her2+ пациенток) | |
| Преклиническое исследование взаимодействия между лекарственными препаратами | АВХ + другие средства | |
| Фаза II испытания неоадъювантного лечения | (АВХ + Herceptin®) с последующим введением (Navelbine® + Herceptin®) | |
| Фаза II рандомизированного испытания неоадъювантной химиотерапии у пациенток, страдающих раком молочной железы | ТАС в сравнении с АС (адъювантной химиотерапией) с последующим введением АВХ + карбоплатина (carbo) в сравнении с АС с последующим введением АВХ + карбоплатин + Herceptin® | Для оценки АС с последующим введением АВХ/carbo или комбинаций АВХ/carbo/Herceptin® в сравнении с ТАС (адъювантной схемой ВС, утвержденной FDA) при неоадъювантной схеме |
| Фаза II лечения AbraxaneTM и капецитабином при локально запущенном раке молочной железы | АВХ 200 мг/м2 д 1, Xel 1000 мг/м2 д 1-14, q3wk×4 |
|
| II фаза испытания неоадъювантной химиотерапии (NCT) паклитакселом в виде наночастиц (ABI-007, AbraxaneTM) у женщин с клинической стадией IIA, IIB, IIIA, IIIB и IV (при интактных первичных) опухолей молочной железы | АВХ 300 мг/м2 q3wk |
При раке легких исследования включают:
| Фаза I/II исследования монотерапии AbraxaneTM при лечении 1-ой линии запущенного NSCLC | АВХ 1 раз в неделю | Фаза II первого испытания АВХ в комбинации с carbo при NSCLC |
| Фаза II испытания AbraxaneTM плюс карбоплатина при лечении 1-ой линии NSCLC | АВХ 125 мг/м2 д 1, 8, 15; Carbo AUC 6 д 1; q4wk | |
| Фаза I испытания карбоплатина и AbraxaneTM при схеме введения 1 раз в неделю и 1 раз в 3 недели у лиц с запущенными злокачественными солидными опухолями | Плечо 1: АВХ 100, 125, 150 мг/м2 д 1, 8, 15 q4wk; Плечо 2: АВХ 220, 260, 300 мг/м2 д 1 q3wk. Carbo AUC 6 в обоих плечах | Это 2-плечевое исследование I фазы получит важные данные о комбинации АВХ/Carbo для дальнейших исследований этой комбинации при множественных заболеваниях |
| Фаза II исследования ABI 007 (AbraxaneTM) и карбоплатина при запущенном немелкоклеточном раке легких | АВХ Уровень(а): 225 мг/м2; Уровень(b): 260 мг/м2; Уровень(3): 300 мг/м2; q3wk, Carbo AUC 6 q3wk | Фаза II исследования при NSCLC получит данные для будущей фазы III регистрационного испытания при раке легких |
| Фаза I исследования ABI 007 (AbraxaneTM) и карбоплатина | АВХ q3wk | |
| Фаза I/II исследования AbraxaneTM + Alimta® для лечения 2-ой линии NSCLC | TBD | ABX и Alimta® могут быть перспективной комбинацией ввиду не перекрывающихся профилей токсичности |
| Фаза I/II испытания AbraxaneTM плюс цисплатина при запущенном NSCLC | ||
| Фаза I/II исследования AbraxaneTM, Navelbine® и цисплатина для лечения запущенного NSCLC | ||
| Фаза II испытания монотерапии АВХ при лечении 1-ой линии NSCLC | АВХ 260 мг/м2 q3wk | 1-ое испытание АВХ при NSCLC |
| Фаза II исследования монотерапии AbraxaneTM при лечении 2-ой линии NSCLC | Когорта 1: АВХ q3wk; Когорта 2: АВХ 1 раз в неделю. Дозы TBD |
|
| Фаза I/II испытания AbraxaneTM 1 раз в неделю и карбоплатина при запущенном NSCLC | Лечение 1-ой линии |
Исследования на предстательной железе включают:
| Фаза II рандомизированного испытания АВХ 1 раз в неделю в сравнении с q3wk при лечении 1-ой линии HRP | 100 мг/м2 1 раз в неделю в сравнении c 260 мг/м2 q3wk | |
| Фаза II испытания АВХ при лечении 1-ой линии рака предстательной железы |
АВХ 1 раз в неделю | Фаза II исследования АВХ 1 раз в неделю при лечении 1-ой линии HRPC |
| Фаза II исследования неоадъювантной терапии | TBD | Многоцентровое испытание неоадъювантной химиотерапии АВХ при раке предстательной железы плюс исследование биологических маркеров |
| Фаза II испытания АВХ по 100 мг 1 раз в неделю без перерывов |
Исследования при раке яичников включают:
| Фаза II исследования AbraxaneTM для лечения запущенного рака яичников (3-ей линии) | TBD | |
| Фаза I исследования AbraxaneTM плюс carbo для лечения запущенного рака яичников | АВХ 1 раз в неделю + Carbo AUC 6 | |
| Фаза II испытания AbraxaneTM/карбоплатина при рецидивирующем раке яичников |
Исследования химиолучевой терапии включают:
| Фаза I/II испытания AbraxaneTM в комбинации с облучением при NSCLC | ||
| AbraxaneTM в комбинации с облучением | Экспериментальная модель | |
| H&N (рак головы и шеи) | TBD |
Другие исследования включают:
| Фаза II исследования АВХ при лечении стойкой или рецидивирующей карциномы шейки матки | 125 мг/м2 д 1, 8, 15 q28 д | |
| Фаза II исследования при метастатической меланоме, ранее подвергавшейся лечению (100 АВХ) или не лечившейся (150 АВХ) | 26→70 |
| Фаза II исследования применения ABI-007 в качестве единственного средства для лечения негематологических злокачественных новообразований | ||
| AbraxaneTM в комбинации с антиангиогенными средствами, например, Avastin® | ||
| AbraxaneTM в комбинации с ингибиторами протеасом, например, Velcade® | ||
| AbraxaneTM в комбинации с ингибиторами EGFR, например, Tarceva® | ||
| Фаза II рандомизированного испытания введения 1 раз в неделю гемцитабина, AbraxaneTM и внешнего облучения по поводу локально запущенного рака поджелудочной железы |
Пример 10. Комбинация препаратов в виде наночастиц по изобретению с другими средствами и способами лечения
Более низкая токсичность описанных здесь лекарственных средств в виде наночастиц по изобретению позволяет комбинировать их с другими онкологическими препаратами и другими способами лечения при более благоприятном исходе. Они включают формы в виде наночастиц паклитаксела, доцетаксела, других таксанов и аналогов, гелданомицинов, колхицинов и аналогов, комбретастатинов и аналогов, гидрофобных пиримидиновых соединений, ломаивитицинов и аналогов, включая соединения со структурами ядра ломаивитицина, эпотилонов и аналогов, дискодермолида и аналогов и им подобные. Препараты по изобретению можно комбинировать с паклитакселом, доцетакселом, карбоплатином, цисплатином, другими платинами, доксорубицином, эпирубицином, циклофосфамидом, ифосфамидом, гемцитабином, капецитабином, винорелбином, топотеканом, иринотеканом, тамоксифеном, камптотецинами, 5-фторурацилом, EMP, этопозидом, метотрексатом и им подобными.
Пример 11. Комбинация AbraxaneTM с карбоплатином и Herceptin®
Комбинация Taxol® и карбоплатина проявила значительную эффективность против метастатического рака молочной железы. При схеме введения 1 раз в неделю в этой комбинации Taxol® можно вводить в дозе только до 80 мг/м2. Более высокие дозы не переносимы ввиду токсичности. Кроме того, HER-2-положительные пациентки получают большую выгоду, когда в схему их лечения включен Herceptin®. Это открытое исследование фазы II было проведено для определения синергического терапевтического эффекта ABI-007 (AbraxaneTM) с этими средствами. Настоящее исследование было инициировано для оценки безопасности и противоопухолевой активности ABI-007/карбоплатина с Herceptin® у пациенток с HER-2-положительным заболеванием. ABI-007 вводили в комбинации с карбоплатином и Herceptin®, вводимыми внутривенно 1 раз в неделю пациенткам с HER-2-положительным запущенным раком молочной железы. Когорта из 3 лиц получала ABI-007 в дозе 75 мг/м2 внутривенно с последующим вливанием карбоплатина при целевой AUC=2 1 раз в неделю и Herceptin® (4 мг/кг в 1-ю неделю и 2 мг/кг во все последующие недели) в течение 1 цикла. Эти лица переносили препарат очень хорошо, поэтому для последующих циклов и лиц доза ABI-007 была увеличена до 100 мг/м2. К настоящему времени лечение получили 6 пациенток. Из 4 лиц, у которых проводилась оценка для выявления реакции, все 4 (100%) проявили реакцию на лечение. Следует отметить, что ввиду более низкой токсичности AbraxaneTM, можно было вводить более высокую общую дозу паклитаксела, по сравнению с Taxol®, при итоговых благоприятных последствиях для пациенток.
Пример 12. Комбинация AbraxaneTM с карбоплатином
Комбинация Taxol® и карбоплатина проявила значительную эффективность при раке легких. В настоящее время проводится другое исследование AbraxaneTM в комбинации с карбоплатином по схеме введения 1 раз в 3 недели у лиц, страдающих раком легких.
Пример 13. Применение AbraxaneTM в комбинации с облучением
Пример 13а
AbraxaneTM в комбинации с клинической лучевой терапией усиливает терапевтическую эффективность и снижает обычную токсичность для тканей. AbraxaneTM применяется для увеличения терапевтического воздействия лучевой терапии на опухоли; для усиления реакции опухоли на однократное и фракционированное облучение; для усиления обычной тканевой реакции на облучение и для увеличения терапевтического соотношения лучевой терапии.
Используется карцинома яичников мышей, обозначенная как ОСа-I, которая была обширно исследована. Сначала определяется оптимальное время введения AbraxaneTM относительно локального облучения опухоли для обеспечения максимальной противоопухолевой эффективности. Опухоли генерируются в правой задней конечности мышей внутримышечной инъекцией опухолевых клеток, и лечение начинается, когда опухоли достигают размера 8 мм. На мышей воздействуют однократной дозой облучения 10 Гр, одной дозой AbraxaneTM, вводимой в различное время за 5 дней до 1-го дня после облучения. Применяется доза AbraxaneTM величиной от дозы, равной максимальной переносимой дозе паклитаксела, до дозы, примерно в 1,5 раза превышающей ее, доза 90 мг/кг. Итог эффективности представляет собой задержку роста опухоли. Группы состоят из 8 мышей каждая. Опухоли генерируют и лечат, как описано в примере 1. Итог эффективности представляет собой задержку роста опухоли. Опухоли облучают 5, 7,5 или 10 Гр, подаваемыми или одной дозой. Или фракционированными дозами по 1, 1,5 или 2 Грэя облучения 1 раз в день в течение 5 последовательных дней. Поскольку AbraxaneTM удерживается в опухоли в течение нескольких дней и оказывает свой усиливающий эффект при каждой из пяти ежедневных фракций, то AbraxaneTM вводится однократно в начале схемы облучения. Поскольку конечной целью клинической лучевой терапии является достижение излечения от опухоли, то определяется потенциальная способность AbraxaneTM усиливать излечимость опухоли лучевой терапией. Используется такая же схема, как описано для исследования задержки роста опухоли фракционированным облучением, за исключением того, что диапазон доз от 2 до 16 Гр подается ежедневно в течение 5 последовательных дней (общая доза облучения от 10 до 80 Гр). За опухолями наблюдают в течение срока до 120 дней после облучения для выявления обратного развития или повторного роста, когда определяется TCD50 (доза облучения, необходимая для получения локального излечения от опухоли у 50% животных). Производятся 2 анализа TCD50: для изолированного применения облучения и AbraxaneTM плюс облучения, и каждый анализ состоит из 10 облученных доз для групп, содержащих по 15 мышей каждая. Для обеспечения увеличения терапевтического воздействия любое средство, усиливающее действие облучения, включая AbraxaneTM, должно увеличивать реакцию на облучения больше, чем увеличение обычного повреждения ткани облучением. Оценивают повреждение слизистой оболочки тощей кишки, высоко пролиферативной ткани, на которую воздействуют таксаны. Используют анализ микроколоний тощей кишки для определения выживания эпителиальных клеток крипт в тощей кишке мышей, подвергнутых облучению. Мышей подвергают облучению всего тела (WBI) при суточных дозах рентгеновского излучения от 3 до 7 Гр в течение 5 последовательных дней. Мышей лечат AbraxaneTM в эквивалентной дозе паклитаксела 80 мг/кг, вводимой внутривенно за 24 часа до первой дозы WBI, и забивают через 3,5 дня после последней дозы WBI. Тощую кишку готовят для гистологического исследования и подсчитывают количество регенерировавшихся крипт в поперечном срезе тощей кишки. Для построения расхождения кривых выживания количество регенерировавшихся крипт превращают в количество выживших клеток.
Пример 13 b
Целью этого исследования была оценка того, обладает ли ABI-007 (а) в качестве единственного средства противоопухолевой активностью против синергической карциномы яичников OCa-I, и (b) усиливает ли он реакцию на облучение опухолей OCa-I при схеме комбинированного лечения, как описано в предыдущем примере, со следующими модификациями.
Клетки опухоли OCa-I инъецировали в заднюю конечность мышей С3Н. Когда опухоль выросла до среднего диаметра 7 мм, начинали лечение одним локальным облучением (10 Грэй) пораженной опухолью конечности, одним введением ABI-007 в дозе 90 мг/кг, или обоими методами. Для определения оптимальной схемы лечения ABI-007 вводили от 5 дней до 9 часов перед облучением, а также через 24 часа после облучения. Исход лечения представляла собой абсолютная задержка роста опухоли (AGD), определяемая как разность в днях роста от 7 до 12 мм в диаметре между подвергнутой лечению и не леченой опухолью. Для групп, получавших лечение комбинацией ABI-007 и облучения, фактор усиления (EF) рассчитывали как отношение разности в днях роста от 7 до 12 мм между опухолями, подвергнутыми лечению комбинацией, и опухолями, подвергнутыми лечению одним ABI-007, к AGD опухолей, подвергнутых лечению только облучением. Для оценки усиливающего воздействие облучения эффекта ABI-007 для схемы фракционного облучения на исход излечения от опухоли выполняли анализ TCD50 и анализировали через 140 дней после лечения. Общие дозы от 5 до 80 Гр по 5 фракций в день подавали или отдельно, или в комбинации с ABI-007 за 24 часа до первой дозы облучения.
ABI-007 в качестве единственного средства значительно продлевал задержку роста опухоли OCa-I (37 дней) в сравнении с 16 днями для опухолей, не подвергнутых лечению. ABI-007 в качестве единственного средства был эффективнее, чем одна доза 10 Грэй, которая привела к задержке, составившей 29 дней. Для схем комбинированного лечения ABI-007, введенный в любое время до 5 дней перед облучением, давал сверхаддитивный противоопухолевой эффект. EF составил 1,3, 1,4, 2,4, 2,3, 1,9 и 1,6 при интервалах между лечением, соответственно, 9 часов, 24 часа и 2, 3, 4 и 5 дней. Когда ABI-007 вводили после облучения, эффект комбинированного противоопухолевого лечения был меньше, чем аддитивный. Комбинированное лечение ABI-007 и облучением также оказывало существенный эффект на излечение от опухоли, сдвигая TCD50 55,3 Гр для опухолей, подвергнутых лечению только облучением, до 43,9 Гр для опухолей, подвергнутых лечению комбинацией (EF 1,3).
Этот эксперимент продемонстрировал, что ABI-007 обладает противоопухолевой активностью в качестве единственного средства против OCa-I и усиливает эффект лучевой терапии при введении за несколько дней до нее. Как ранее было продемонстрировано для паклитаксела и доцетаксела, усиление эффекта облучения, вероятно, является результатом воздействия множественных механизмов, причем преобладающим является остановка клеточного цикла в G2/M при коротких интервалах между лечением и реоксигенация опухоли при более длительных интервалах.
Пример 14. Комбинация AbraxaneTM и ингибиторов тирозин киназы
Пульсирующее введение гефитиниба в комбинации с применением AbraxaneTM можно применять для ингибирования пролиферации опухолей, экспрессирующих EGFr. 120 «голых» мышей инокулировали клетками опухоли ВТ474 для получения, по меньшей мере, 90 мышей, несущих ксенотрансплантаты опухолей ВТ474, и делили на 18 экспериментальных плечей (по 5 мышей каждое). Мыши плеча 1 получали контрольные внутривенные инъекции. Все другие мыши получали 1 раз в неделю внутривенные инъекции AbraxaneTM в дозе 50 мг/кг в течение 3 недель. В плече 2 мыши получали только AbraxaneTM. В плечах 3, 4, 5, 6, 7, 8 мыши получали AbraxaneTM 1 раз в неделю, чему предшествовало пульсирующее введение гефитиниба в течение 2 дней в увеличивающихся дозах. В плечах 9, 10, 11, 12, 13 мыши получали AbraxaneTM 1 раз в неделю, чему предшествовало пульсирующее введение гефитиниба в течение 1 дня в увеличивающихся дозах. В плечах 14, 15, 16, 17, 18 мыши получали AbraxaneTM 1 раз в неделю наряду с ежедневным введением гефитиниба в увеличивающихся дозах. Устанавливали максимальную переносимую дозу гефитиниба, которую можно вводить при 1- или 2-дневном ведении AbraxaneTM 1 раз в неделю или при непрерывном введении AbraxaneTM. Кроме того, измерение противоопухолевых реакций определит, существует ли связь между дозой и реакцией, и имеет ли преимущества 2-дневное или 1-дневное пульсирующее введение. Эти данные используют для выбора оптимальной дозы гефитиниба при пульсирующем введении и оптимальной дозы при непрерывном ежедневном введении гефитиниба с AbraxaneTM.
120 «голых» мышей инокулировали клетками опухоли ВТ474 для получения 90 мышей, несущих опухоли. Этих мышей делили на 6 групп (по 15 каждая). Мыши плеча 1 получали контрольные внутривенные инъекции. Мыши плеча 2 получали AbraxaneTM в дозе 50 мг/кг внутривенно 1 раз в неделю в течение 3 недель. Мыши плеча 3 получали перорально гефитиниб в дозе 150 мг/кг/день. Мыши плеча 4 получали AbraxaneTM в дозе 50 мг/кг наряду с ежедневным введением гефитиниба в ранее установленной дозе. Мыши плеча 5 получали AbraxaneTM в дозе 50 мг/кг, которому предшествовало пульсирующее введение гефитиниба в ранее установленной дозе и с ранее установленной длительностью. Мышам плеча 6 проводили пульсирующее введение только гефитиниба 1 раз в неделю в ранее установленной дозе. После лечения в течение 3 недель мышей наблюдали до тех пор, пока контроли не достигли максимально допустимых размеров опухоли.
Пример 15. Фаза II исследования введения nabTM-паклитаксела (AbraxaneTM), карбоплатина с трастузумабом® 1 раз в неделю в качестве лечения первой линии запущенного HER-2 положительного рака молочной железы
Целью этого исследования была оценка (1) безопасности и переносимости и (2) объективной частоты введения 1 раз в неделю ударной дозы трастузумаба/AbraxaneTM/карбоплатина в качестве цитотоксической терапии первой линии для пациенток с запущенным/метастатическим (аденокарцинома IV стадии) раком молочной железы, избыточно экспрессирующим HER-2. Трастузумаб представляет собой моноклональное антитело, также известное как Herceptin®, которое связывается с внеклеточным сегментом рецептора erbB2.
Вкратце, в исследование были включены пациентки без недавней цитотоксической или лучевой терапии. Дозы AbraxaneTM увеличивали с 75 мг/м2 в виде 30-минутных внутривенных вливаний на 1, 8, 15 день до 100 мг/м2 для последующих циклов в соответствии со стандартным правилом 3+3. Карбоплатин AUC=2 вводили в виде 30-60-минутных внутривенных вливаний в 1, 8, 15 дни и в течение первоначального 29-дневного цикла. Трастузумаб вводили в виде 30-90-минутных внутривенных вливаний в 1, 8, 15 22 дни в дозе 4 мг/кг в 1-ю неделю и 2 мг/кг все последующие недели.
У 8 из 9 пациенток, у которых можно было произвести оценку реакции (подтвержденной плюс не подтвержденной), частота реакции составила 63% при стабильном заболевании в 38% случаев. Самыми частыми видами токсичности были нейтропения (3-ей степени: 44%; 4-ой степени: 11%) и лейкоцитопения (33%).
Эти результаты свидетельствуют о том, что трастузумаб плюс AbraxaneTM плюс карбоплатин продемонстрировали высокую степень противоопухолевой активности с приемлемой переносимостью в качестве лечения первой линии по поводу МВС.
Пример 16. Фаза II испытания капецитабина плюс nabTM-паклитаксел (AbraxaneTM) при лечении первой линии метастатического рака молочной железы
Целью этого исследования фазы II была оценка безопасности, эффективности (время до прогрессирования и общее выживание) и качества жизни пациенток с МВС, которые получали капецитабин в комбинации с AbraxaneTM. Капецитабин представляет собой фторпиримидинкарбамат, также известный как Xeloda®, который, как было показано, обладает существенной эффективностью при отдельном применении и в комбинации с таксанами при лечении МВС.
В этом открытом, одноплечевом исследовании, AbraxaneTM в дозе 125 мг/м2 вводили внутривенным вливанием в 1-й день и 8-й день 1 раз в 3 недели плюс капецитабин 825 мг/м2, вводимый перорально 2 раза в день с 1 по 14-й дни 1 раз в 3 недели. У пациенток не проводили предшествующей химиотерапии по поводу метастатического заболевания, и они не получали предшествующего лечения капецитабином и предшествующего лечения фторпиримидином и химиотерапии паклитакселом, проводимой в виде адъювантной схемы.
В исследование были включены 12 пациенток с анализом безопасности, завершенным у первых 6 пациенток, и частотой реакции, которую можно было оценить после 2 циклов, у первых 8 пациенток. Не было случаев необычной или неожиданной токсичности при отсутствии случаев токсичности 4 степени или нейропатии, большей, чем нейропатия 1 степени. Данные по реакции были подтверждены только по первым 2 циклам лечения (первая точка оценки) у 6 пациенток. 2 пациентки завершили 6 циклов. 2 пациентки завершили 6 циклов при 1 частичной реакции и одном стабильном заболевании. Из первых 8 пациенток после 2 циклов было 2 частичных реакции и 4 пациентки со стабильным заболеванием.
Эти результаты показывают, что комбинация капецитабина и AbraxaneTM, вводимого 1 раз в неделю в эффективных дозах, может применяться, и к настоящему времени новые случаи токсичности не выявлены. Связанная с AbraxaneTM токсичность представляла собой главным образом нейтропению без клинических последствий, и синдром кистей и стоп представлял собой основную токсичность капецитабина.
Пример 17. Поисковое исследование введения ударных доз доксорубицина плюс циклофосфамида с последующим введением nabTM-паклитаксела (AbraxaneTM) у пациенток с ранней стадией рака молочной железы
Целью этого исследования была оценка токсичности доксорубицина (адриамицина) плюс циклофосфамида с последующим введением AbraxaneTM при ранней стадии рака молочной железы.
У пациенток была операбельная, подтвержденная аденокарцинома молочной железы ранней стадии. Пациентки получали доксорубицин (адриамицин) в дозе 60 мг/м2 плюс циклофосфамид 600 мг/м2 (АС) 1 раз в 2 недели в течение 4 циклов с последующим введением AbraxaneTM в дозе 260 мг/м2 1 раз в 2 недели в течение 4 циклов.
30 пациенток получили 4 цикла АС, и 27 из 29 пациенток получили 4 цикла AbraxaneTM; 33% пациенток получили пегфилграстим (Neulasta®) по поводу отсутствия восстановления ANC (абсолютного количества нейтрофилов) во время введения AbraxaneTM. У 9 пациенток (31%) было снижение дозы AbraxaneTM ввиду негематологической токсичности. Всего у 9 пациенток была периферическая нейропатия (PN) 2 степени, и у 4 пациенток была PN 3 степени; степень PN снизилась ≥1 степень в пределах медианы 28 дней.
Эти результаты указывают на то, что лечение ударной дозой доксорубицина (60 мг/м2) плюс циклофосфамидом (600 мг/м2) 1 раз в 2 недели в течение 4 циклов с последующим введением ударной дозы AbraxaneTM (260 мг/м2) 1 раз в 2 недели в течение 4 циклов хорошо переносилось пациентками с ранней стадией рака молочной железы.
Пример 18. Введение nabTM-паклитаксела (AbraxaneTM) в качестве лечения первой линии метастатического рака молочной железы при добавлении трастузумаба у Her-2/neu-положительных пациенток
Целью настоящего исследования было продвижение введения Abraxane 1 раз в неделю к схеме лечения первой линии и добавление трастузумаба для Her-2/neu-положительных пациенток.
В это открытое исследование фазы II были включены и 20 HER-2-положительных пациенток и 50 HER-2-отрицательных пациенток с локально запущенным или метастатическим раком молочной железы. AbraxaneTM вводили в дозе 125 мг/м2 30-минутным внутривенным вливанием в 1, 8 и 15-й день с последующей неделей отдыха. Трастузумаб вводили одновременно с исследованием лечения у пациенток, которые были HER-2-положительными. Первичным исходом была частота реакции, а вторичными исходами были время до прогрессирования (ТТР), общее выживание (OS) и токсичность.
В популяции безопасности 23 пациентки к настоящему времени получили в среднем 3 цикла AbraxaneTM. Самым частым связанным с лечением неблагоприятным явлением была нейтропения 3 степени (8,7%) при отсутствии неблагоприятных явлений 4 степени. 1 из 4 оцениваемых пациенток реагировала на лечение.
Пример 19. Фаза I испытания nabTM-паклитаксела (AbraxaneTM) и карбоплатина
Целью настоящего исследования было определение максимальной переносимой дозы AbraxaneTM (и 1 раз в неделю, и 1 раз в 3 недели) с карбоплатином AUC=6 и сравнение эффектов последовательности введения на фармакокинетику (РК).
В исследование были включены пациенты с гистологически или цитологически документированным злокачественным процессом, который прогрессировал после «стандартного лечения». Пациенты в плече 1 получали AbraxaneTM 1 раз в 3 недели в формате увеличения дозы на основании данных о токсичности в 1 цикле (220, 260, 300, 340 мг/м2) 1 раз в 3 недели с последующим введением карбоплатина AUC=6. Пациенты в плече 2 получали 1 раз в неделю (дни 1, 8, 15 с последующей 1 неделей без введения) AbraxaneTM (100, 125, 150 мг/м2) с последующим введением карбоплатина AUC=6. Для части РК исследования после введения AbraxaneTM следовало введение карбоплатина в 1 цикле, и порядок введения был обратным в цикле 2 при уровнях РК, определяемых в первые 6, 24, 48 и 72 часа.
При схеме введения 1 раз в 3 недели нейтропения, тромбоцитопения и нейропатия были самыми частыми видами токсичности 3/4 степени (3/17 каждый). При схеме введения 1 раз в неделю нейтропения 5/13 была самым частым видом токсичности 3/4 степени. Самыми лучшими реакциями на введение 1 раз в неделю в самой высокой дозе 125 мг/м2 (n=6) были 2 частичных реакции (рак поджелудочной железы, меланома) и 2 стабильных заболевания (NSCLC). Наилучшими реакциями на введение 1 раз в 3 недели в самой высокой дозе 340 мг/м2 (n=5) были 1 стабильное заболевание (NSCLC) и 2 частичных реакции (SCLC, пищеводный).
Эти данные указывают на активность комбинации AbraxaneTM и карбоплатина. MTD для введения 1 раз в неделю составила 300 мг/м2, а для введения 1 раз в 3 недели составила 100 мг/м2.
Пример 20. Фаза II испытания ударных доз гемцитабина, эпирубицина и nabTM-паклитаксела (AbraxaneTM) (GEA) при локально запущенном/воспалительном раке молочной железы
В фазе II открытого исследования режим индукционной/неоадъювантной терапии вводили перед локальным вмешательством. Схема лечения представляла собой гемцитабин 2000 мг/м2 внутривенно 1 раз в 2 недели в течение 6 циклов, эпирубицин 50 мг/м2 1 раз в 2 недели в течение 6 циклов, AbraxaneTM 175 мг/м2 1 раз в 2 недели в течение 6 циклов с пегфилграстимом 6 мг подкожно на 2-ой день 1 раз в 2 недели. Режим индукционной/неоадъювантной терапии после локального вмешательства представлял собой гемцитабин 2000 мг/м2 1 раз в 2 недели в течение 4 циклов, AbraxaneTM 220 мг/м2 1 раз в 2 недели в течение 4 циклов и пегфилграстим 6 мг подкожно на 2-ой день 1 раз в 2 недели. Пациентками были женщины с гистологически подтвержденной локально запущенной/воспалительной аденокарциномой молочной железы.
Пример 21. Цитотоксическая активность nab-рапамицина в комбинации с AbraxaneTM в отношении сосудистых гладкомышечных клеток
Сосудистые гладкомышечные клетки (VSMC) высевали на 96-луночные планшеты в присутствии возрастающих концентраций nab-рапамицина и 0 мкМ, 1 мкМ, 10 мкМ или 100 мкМ AbraxaneTM (ABI-007). Для оценки цитотоксического эффекта nab-рапамицина и AbraxaneTM обработанные VSMC окрашивали гомодимером-1 этидия (Invitrogen, Carlsbad CA) и анализировали на наличие красной флюоресценции. Гомодимер-1 этидия представляет собой высоко аффинную, флюоресцентную краску нуклеиновых кислот, которая способна проходить только через нарушенные мембраны мертвых клеток для окрашивания нуклеиновых кислот. Как показано на фиг.7А, nab-рапамицин, сам по себе, проявлял зависимое от дозы уничтожение клеток, как продемонстрировано увеличивающейся флюоресценцией. Уничтожение клеток nab-рапамицином не усиливалось AbraxaneTM в концентрации 1 мкМ или 10 мкМ; однако, оно значительно усиливалось AbraxaneTM в концентрации 100 мкМ (ANOVA, p<0,0001). Клетки, окрашенные гомодимером-1 этидия, как показано на фиг.7А, также контактировали с кальцеином. Кальцеин АМ (Invitrogen) представляет собой не флюоресцентную молекулу, которая гидролизуется во флюоресцентный кальцеин неспецифичными цитозольными эстеразами. Живые клетки, контактировавшие с АМ кальцеина, проявляют ярко зеленую флюоресценцию, т.к. они способны генерировать флюоресцентный продукт и удерживать его. Как показано на фиг.7В, nab-рапамицин проявил зависимую от дозы цитотоксическую активность, что проявлялось уменьшенным количеством флюоресцентного окрашивания кальцеином. Снижение флюоресценции усиливалось совместной инкубацией с AbraxaneTM зависимым от дозы образом. Статистический анализ методом ANOVA (методом вариационного анализа) дал p<0,0001 при всех концентрациях препарата AbraxaneTM.
Пример 22. Цитотоксическая активность nab-рапамицина в комбинации с AbraxaneTM против ксенотрансплантата опухоли НТ29 (карциномы ободочной кишки человека)
«Голым» мышам в правый бок имплантировали 106 клеток НТ29. Лечение начинали, когда опухоли становились пальпируемыми и были объемом больше, чем 100-200 мм3. Мышей методом случайной выборки включали в 4 группы (n=8 на группу). Группа 1 получала солевой раствор 3 раза в неделю в течение 4 недель внутривенно; группа 2 получала AbraxaneTM в дозе 10 мг/кг в день в течение 5 дней внутрибрюшинно; группа 3 получала nab-рапамицин в дозе 40 мг/кг 3 раза в неделю в течение 4 недель внутривенно; и группа 4 получала и nab-рапамицин (40 мг/кг 3 раза в неделю в течение 4 недель внутривенно), и AbraxaneTM (10 мг/кг в день в течение 5 дней внутрибрюшинно). Как показано на фиг.8, подавление опухоли было больше для комбинированного лечения AbraxaneTM плюс nab-рапамицин, чем для любой группы лечения одним препаратом.
Пример 23. Цитотоксическая активность nab-17-AAG в комбинации с AbraxaneTM против ксенотрансплантата опухоли Н358 (карцинома легких человека)
«Голым» мышам в правый бок имплантировали 107 клеток Н358. Лечение начинали, когда опухоли становились пальпируемыми и были объемом больше, чем 100-200 мм3. Мышей методом случайной выборки включали в 4 группы (n=8 на группу). Группа 1 получала солевой раствор 3 раза в неделю в течение 4 недель внутривенно; группа 2 получала AbraxaneTM в дозе 10 мг/кг в день в течение 5 дней внутрибрюшинно; группа 3 получала nab-17-AAG в дозе 80 мг/кг 3 раза в неделю в течение 4 недель внутривенно; и группа 4 получала и nab-17-AAG (80 мг/кг 3 раза в неделю в течение 4 недель внутривенно), и AbraxaneTM (10 мг/кг в день в течение 5 дней внутрибрюшинно). Как показано на фиг.9, подавление опухоли было больше для комбинированного лечения nab-17-AAG плюс AbraxaneTM, чем для любой группы лечения одним препаратом.
Хотя представленное выше изобретение было описано в некоторых деталях путем иллюстрации и примера в целях ясности и понимания, для специалистов в данной области очевидно, что в него могут быть внесены определенные небольшие изменения и модификации. Поэтому, описание и примеры не следует рассматривать как ограничивающие объем изобретения.
Все ссылки, включая публикации, патентные заявки и патенты, приведенные здесь, включены сюда в качестве ссылки в той же степени, как если бы каждая ссылка была отдельно и специально указана как включенная в качестве ссылки и полностью изложенная здесь.
Здесь описаны предпочтительные варианты осуществления настоящего изобретения, включая наилучший способ реализации изобретения, известный заявителям. Варианты этих предпочтительных вариантов осуществления могут стать очевидными средним специалистам в данной области по прочтении предыдущего описания. Заявители ожидают, что специалисты используют такие варианты соответствующим образом, и заявители предполагают, что изобретение будет осуществлено иным образом, чем конкретно описано в настоящем описании. Соответственно, настоящее изобретение включает все модификации и эквиваленты предмета изобретения, приведенного в прилагаемой формуле изобретения, что допускается применяемым законодательством. Кроме того, при отсутствии других указаний или ясных противоречий с контекстом, любая комбинация описанных выше элементов во всех возможных их вариантах охватывается изобретением.
Claims (24)
1. Способ лечения рака яичников у индивидуума, включающий:
a) первое лечение, включающее введение индивидууму эффективного количества композиции, содержащей наночастицы, включающие паклитаксел и белок-носитель, и
b) второе лечение, включающее лучевую терапию, где первое лечение проводят перед вторым лечением.
2. Способ по п. 1, где композиция содержит наночастицы, включающие паклитаксел, покрытый белком-носителем.
3. Способ по п. 1, где белок-носитель представляет собой альбумин.
4. Способ по п. 3, где альбумин представляет собой человеческий сывороточный альбумин.
5. Способ по п. 1, где средний диаметр наночастиц в композиции составляет не больше чем примерно 200 нм.
6. Способ по п. 5, где средний диаметр наночастиц, содержащих паклитаксел и белок-носитель не больше чем приблизительно 150 нм.
7. Способ по п. 6, где средний диаметр наночастиц, содержащих паклитаксел и белок-носитель не больше чем приблизительно 130 нм.
8. Способ по п. 1, где массовое отношение белка-носителя к паклитакселу составляет менее чем примерно 18:1.
9. Способ по п. 1, где массовое отношение белка-носителя в композиции составляет 10:1 или менее.
10. Способ по п. 1, где соотношение между массой альбумина и паклитаксела составляет примерно 9:1.
11. Способ по п. 10, где композиция в виде наночастиц, по существу, свободна от Cremophor.
12. Способ по п. 1, где индивидуум представляет собой человека.
13. Способ по п. 1, где композиция пригодна для введения внутривенно.
14. Способ по п. 1, где рак является устойчивым к лечению паклитакселом или доцетакселом.
15. Способ по п. 1, где композицию, содержащую паклитаксел и белок-носитель, вводят в дозе 50-250 мг/м2.
16. Способ по п. 18, где композицию, содержащую паклитаксел и белок-носитель, вводят в дозе 60-175 мг/м2.
17. Способ по п. 1, дополнительно включающий введение одного или нескольких дополнительных химиотерапевтических средств.
18. Способ по п. 17, где одно или несколько дополнительных химиотерапевтических средств выбрано из группы, состоящей из антиметаболитов, средств на основе платины, алкилирующих агентов, ингибиторов тирозинкиназы, антрациклиновых антибиотиков, алкалоидов винки, ингибиторов протеасом, макролидов, терапевтических антител, антиангиогенных средств и ингибиторов топоизомеразы.
19. Способ по п. 1, где композицию наночастиц вводят менее чем за 10 дней до лучевой терапии.
20. Способ по п. 1, где композицию наночастиц вводят менее чем за 5 дней до лучевой терапии.
21. Способ по п. 1, где композицию наночастиц вводят менее чем за 120 часов до лучевой терапии.
22. Способ по п. 1, где композицию наночастиц вводят от 9 часов до 5 дней перед облучением.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US65424505P | 2005-02-18 | 2005-02-18 | |
| US60/654,245 | 2005-02-18 |
Related Parent Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2007134571/15A Division RU2452482C2 (ru) | 2005-02-18 | 2006-02-21 | Комбинация и способы введения терапевтических средств и комбинированной терапии |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| RU2012106620A RU2012106620A (ru) | 2013-08-27 |
| RU2632103C2 true RU2632103C2 (ru) | 2017-10-02 |
Family
ID=36593193
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2007134571/15A RU2452482C2 (ru) | 2005-02-18 | 2006-02-21 | Комбинация и способы введения терапевтических средств и комбинированной терапии |
| RU2012106620A RU2632103C2 (ru) | 2005-02-18 | 2012-02-22 | Комбинации и способы введения терапевтических средств и комбинированной терапии |
Family Applications Before (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2007134571/15A RU2452482C2 (ru) | 2005-02-18 | 2006-02-21 | Комбинация и способы введения терапевтических средств и комбинированной терапии |
Country Status (25)
| Country | Link |
|---|---|
| US (11) | US8034375B2 (ru) |
| EP (4) | EP3248600B8 (ru) |
| JP (8) | JP5769358B2 (ru) |
| KR (8) | KR20140016402A (ru) |
| CN (4) | CN103169729A (ru) |
| AT (1) | ATE531365T1 (ru) |
| AU (1) | AU2006213999B2 (ru) |
| BR (1) | BRPI0607809A2 (ru) |
| CA (3) | CA2598239C (ru) |
| CY (4) | CY1112907T1 (ru) |
| DK (3) | DK1853250T3 (ru) |
| ES (3) | ES2678448T3 (ru) |
| HU (2) | HUE049789T2 (ru) |
| IL (4) | IL185288A (ru) |
| LT (2) | LT2301531T (ru) |
| LU (1) | LU92484I2 (ru) |
| MX (3) | MX339142B (ru) |
| NZ (2) | NZ595313A (ru) |
| PL (3) | PL1853250T3 (ru) |
| PT (3) | PT1853250E (ru) |
| RU (2) | RU2452482C2 (ru) |
| SG (1) | SG166775A1 (ru) |
| SI (3) | SI2301531T1 (ru) |
| WO (1) | WO2006089290A1 (ru) |
| ZA (1) | ZA200707491B (ru) |
Families Citing this family (203)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20070117862A1 (en) * | 1993-02-22 | 2007-05-24 | Desai Neil P | Novel formulations of pharmacological agents, methods for the preparation thereof and methods for the use thereof |
| US20030133955A1 (en) * | 1993-02-22 | 2003-07-17 | American Bioscience, Inc. | Methods and compositions useful for administration of chemotherapeutic agents |
| US5439686A (en) * | 1993-02-22 | 1995-08-08 | Vivorx Pharmaceuticals, Inc. | Methods for in vivo delivery of substantially water insoluble pharmacologically active agents and compositions useful therefor |
| US20070092563A1 (en) * | 1996-10-01 | 2007-04-26 | Abraxis Bioscience, Inc. | Novel formulations of pharmacological agents, methods for the preparation thereof and methods for the use thereof |
| PT1023050E (pt) * | 1997-06-27 | 2013-12-04 | Abraxis Bioscience Llc | Novas formulações de agentes farmacológicos, métodos para a sua preparação e métodos para a sua utilização |
| US20030199425A1 (en) * | 1997-06-27 | 2003-10-23 | Desai Neil P. | Compositions and methods for treatment of hyperplasia |
| US8853260B2 (en) | 1997-06-27 | 2014-10-07 | Abraxis Bioscience, Llc | Formulations of pharmacological agents, methods for the preparation thereof and methods for the use thereof |
| BR122012021252B8 (pt) | 2002-09-06 | 2021-05-25 | Cerulean Pharma Inc | polímeros à base de ciclodextrina para o fornecimento de agentes terapêuticos ligados a eles por covalência |
| EP2359859A1 (en) | 2002-12-09 | 2011-08-24 | Abraxis BioScience, LLC | Compositions comprising albumin nanoparticles and methods of delivery of pharmacological agents |
| DK1583562T3 (da) | 2003-01-06 | 2011-09-19 | Angiochem Inc | Angiopep-1, beslægtede forbindelser og anvendelser deraf |
| CA2598239C (en) | 2005-02-18 | 2019-10-29 | Abraxis Bioscience, Inc. | Nanoparticulate formulations of taxanes and carrier proteins for use in combination chemotherapy |
| US20070166388A1 (en) * | 2005-02-18 | 2007-07-19 | Desai Neil P | Combinations and modes of administration of therapeutic agents and combination therapy |
| US8735394B2 (en) | 2005-02-18 | 2014-05-27 | Abraxis Bioscience, Llc | Combinations and modes of administration of therapeutic agents and combination therapy |
| KR20080027253A (ko) * | 2005-06-16 | 2008-03-26 | 미리어드 제네틱스, 인크. | 약제학적 조성물 및 이의 용도 |
| DK2233156T3 (da) | 2005-07-15 | 2013-08-05 | Angiochem Inc | Anvendelse af aprotininpolypeptider som bærere i farmaceutiske konjugater |
| DE102005039579B4 (de) * | 2005-08-19 | 2022-06-30 | Magforce Ag | Verfahren zur Einschleusung von therapeutischen Substanzen in Zellen |
| AU2006284657B2 (en) * | 2005-08-31 | 2012-07-19 | Abraxis Bioscience, Llc | Compositions and methods for preparation of poorly water soluble drugs with increased stability |
| US7771751B2 (en) | 2005-08-31 | 2010-08-10 | Abraxis Bioscience, Llc | Compositions comprising poorly water soluble pharmaceutical agents and antimicrobial agents |
| WO2008022256A2 (en) * | 2006-08-16 | 2008-02-21 | Blagosklonny Mikhail V | Methods and compositions for preventing or treating age-related diseases |
| BRPI0622006A2 (pt) * | 2006-08-31 | 2011-12-20 | Abraxis Bioscience Llc | usos de proteìna-veìculo e dìmero de colchicina ou tiocolchicina, forma unitária de dosagem, composição farmacêutica e kits |
| US20080280987A1 (en) * | 2006-08-31 | 2008-11-13 | Desai Neil P | Methods of inhibiting angiogenesis and treating angiogenesis-associated diseases |
| US8173686B2 (en) | 2006-11-06 | 2012-05-08 | Poniard Pharmaceuticals, Inc. | Use of picoplatin to treat colorectal cancer |
| US8168662B1 (en) | 2006-11-06 | 2012-05-01 | Poniard Pharmaceuticals, Inc. | Use of picoplatin to treat colorectal cancer |
| US8168661B2 (en) | 2006-11-06 | 2012-05-01 | Poniard Pharmaceuticals, Inc. | Use of picoplatin to treat colorectal cancer |
| US8178564B2 (en) | 2006-11-06 | 2012-05-15 | Poniard Pharmaceuticals, Inc. | Use of picoplatin to treat colorectal cancer |
| DK2117520T3 (en) * | 2006-12-14 | 2019-01-07 | Abraxis Bioscience Llc | BREAST CANCER THERAPY BASED ON HORMON RECEPTOR STATUS WITH NANOPARTICLES INCLUDING TAXAN |
| US20080176958A1 (en) | 2007-01-24 | 2008-07-24 | Insert Therapeutics, Inc. | Cyclodextrin-based polymers for therapeutics delivery |
| AU2015271950B2 (en) * | 2007-03-07 | 2017-09-28 | Abraxis Bioscience, Llc | Nanoparticle comprising rapamycin and albumin as anticancer agent |
| LT2481409T (lt) | 2007-03-07 | 2018-10-25 | Abraxis Bioscience, Llc | Nanodalelės, apimančios rapamiciną ir albuminą, kaip priešvėžinį agentą |
| US8642067B2 (en) | 2007-04-02 | 2014-02-04 | Allergen, Inc. | Methods and compositions for intraocular administration to treat ocular conditions |
| WO2008124828A1 (en) * | 2007-04-10 | 2008-10-16 | Myriad Genetics, Inc. | Methods for treating vascular disruption disorders |
| EP2144886A4 (en) * | 2007-04-10 | 2012-10-03 | Myrexis Inc | METHOD OF TREATING MELANOMA |
| JP2010523696A (ja) * | 2007-04-10 | 2010-07-15 | ミリアド ファーマシューティカルズ, インコーポレイテッド | 脳腫瘍を治療する方法 |
| CA2720989A1 (en) * | 2007-04-10 | 2008-10-16 | Myrexis, Inc. | Methods for treating cancer |
| NZ580868A (en) * | 2007-04-10 | 2011-07-29 | Myriad Pharmaceuticals Inc | Dosages and methods for the treatment of cancer |
| US20100166869A1 (en) * | 2007-05-03 | 2010-07-01 | Desai Neil P | Methods and compositions for treating pulmonary hypertension |
| WO2008140751A1 (en) * | 2007-05-11 | 2008-11-20 | Champions Biotechnology, Inc. | Human leiosarcoma and non small cell lung cancer lung xenograft models |
| US9365634B2 (en) | 2007-05-29 | 2016-06-14 | Angiochem Inc. | Aprotinin-like polypeptides for delivering agents conjugated thereto to tissues |
| DK2155188T3 (da) * | 2007-06-01 | 2013-11-04 | Abraxis Bioscience Llc | Fremgangsmåder og sammensætninger til behandling af tilbagevendende kræft |
| WO2008149230A2 (en) * | 2007-06-04 | 2008-12-11 | Pfizer Products Inc. | Nanoparticles comprising drug, a non-ionizable cellulosic polymer and tocopheryl polyethylene glycol succinate |
| AU2008269179A1 (en) * | 2007-06-22 | 2008-12-31 | Scidose Llc | Solubilized formulation of docetaxel without Tween 80 |
| WO2009062138A1 (en) * | 2007-11-08 | 2009-05-14 | Virginia Tech Intellectual Properties, Inc. | Thiolated paclitaxels for reaction with gold nanoparticles as drug delivery agents |
| US9233078B2 (en) | 2007-12-06 | 2016-01-12 | Bend Research, Inc. | Nanoparticles comprising a non-ionizable polymer and an Amine-functionalized methacrylate copolymer |
| WO2009078755A1 (en) * | 2007-12-19 | 2009-06-25 | Ardenia Investments, Ltd. | Drug delivery system for administration of a water soluble, cationic and amphiphilic pharmaceutically active substance |
| AU2009221765B2 (en) * | 2008-03-05 | 2015-05-07 | Vicus Therapeutics, Llc | Compositions and methods for mucositis and oncology therapies |
| MX2010011165A (es) * | 2008-04-10 | 2011-02-22 | Abraxis Bioscience Llc | Composiciones de derivados de taxano hidrofobos y sus usos. |
| AU2009238187B2 (en) * | 2008-04-18 | 2014-03-06 | Angiochem Inc. | Pharmaceutical compositions of paclitaxel, paclitaxel analogs or paclitaxel conjugates and related methods of preparation and use |
| AU2009246926B2 (en) | 2008-05-15 | 2014-06-26 | Celgene Corporation | Oral formulations of cytidine analogs and methods of use thereof |
| CN102695520A (zh) * | 2008-05-27 | 2012-09-26 | 昂科利蒂克斯生物科技公司 | 调节间隙压力与溶瘤病毒的递送和分布 |
| UA104147C2 (ru) * | 2008-09-10 | 2014-01-10 | Новартис Аг | Производная пирролидиндикарбоновой кислоты и ее применение в лечении пролиферативных заболеваний |
| CA2740316A1 (en) | 2008-10-15 | 2010-04-22 | Angiochem Inc. | Conjugates of glp-1 agonists and uses thereof |
| CA2740317A1 (en) | 2008-10-15 | 2010-04-22 | Angiochem Inc. | Etoposide and doxorubicin conjugates for drug delivery |
| CA2745524C (en) | 2008-12-05 | 2020-06-09 | Angiochem Inc. | Conjugates of neurotensin or neurotensin analogs and uses thereof |
| AU2009324464B2 (en) * | 2008-12-11 | 2016-05-05 | Abraxis Bioscience, Llc | Combinations and modes of administration of therapeutic agents and combination therapy |
| BRPI0922611A2 (pt) | 2008-12-17 | 2018-11-06 | Angiochem Inc | inibidores de metaloproteína de matriz de membrana tipo 1 e usos dos mesmos |
| WO2010105172A1 (en) * | 2009-03-13 | 2010-09-16 | Abraxis Bioscience, Llc | Combination therapy with thiocolchicine derivatives |
| BRPI1014854A2 (pt) * | 2009-03-30 | 2016-05-03 | Cerulean Pharma Inc | "conjugados polímero-agente, partículas, composições, e métodos de uso relacionados" |
| WO2010114770A1 (en) * | 2009-03-30 | 2010-10-07 | Cerulean Pharma Inc. | Polymer-agent conjugates, particles, compositions, and related methods of use |
| WO2010114768A1 (en) * | 2009-03-30 | 2010-10-07 | Cerulean Pharma Inc. | Polymer-epothilone conjugates, particles, compositions, and related methods of use |
| AU2010236382B2 (en) | 2009-04-15 | 2016-01-14 | Abraxis Bioscience, Llc | Prion-free nanoparticle compositions and methods |
| US9173891B2 (en) | 2009-04-20 | 2015-11-03 | Angiochem, Inc. | Treatment of ovarian cancer using an anticancer agent conjugated to an angiopep-2 analog |
| US10363229B2 (en) * | 2009-06-05 | 2019-07-30 | Joan McInyre Caron | Methods and compositions for the treatment of cancer |
| EP2448965A4 (en) | 2009-07-02 | 2015-02-11 | Angiochem Inc | MULTIMEPEPTID CONJUGATES AND ITS USES |
| US9340697B2 (en) | 2009-08-14 | 2016-05-17 | Nano-C, Inc. | Solvent-based and water-based carbon nanotube inks with removable additives |
| WO2011025838A1 (en) * | 2009-08-25 | 2011-03-03 | Abraxis Bioscience, Llc | Combination therapy with nanoparticle compositions of taxane and hedgehog inhibitors |
| EP2478362B1 (en) * | 2009-09-18 | 2016-05-11 | Abraxis BioScience, LLC | Use of the sparc microenvironment signature in the treatment of cancer |
| US20110092579A1 (en) * | 2009-10-19 | 2011-04-21 | Scidose Llc | Solubilized formulation of docetaxel |
| US7772274B1 (en) | 2009-10-19 | 2010-08-10 | Scidose, Llc | Docetaxel formulations with lipoic acid |
| US8912228B2 (en) | 2009-10-19 | 2014-12-16 | Scidose Llc | Docetaxel formulations with lipoic acid |
| US8541465B2 (en) * | 2009-10-19 | 2013-09-24 | Scidose, Llc | Docetaxel formulations with lipoic acid and/or dihydrolipoic acid |
| US20130115295A1 (en) * | 2009-11-22 | 2013-05-09 | Qiang Wang | Rare Earth-Doped Up-Conversion Nanoparticles for Therapeutic and Diagnostic Applications |
| RU2558931C2 (ru) * | 2010-01-12 | 2015-08-10 | Нестек С.А. | Способы предсказания ответа трижды негативного рака молочной железы на терапию |
| NZ602382A (en) | 2010-03-26 | 2014-11-28 | Abraxis Bioscience Llc | Methods of treatment of hepatocellular carcinoma |
| MX2012011155A (es) | 2010-03-29 | 2012-12-05 | Abraxis Bioscience Llc | Metodos para mejorar suministros de farmacos y efectividad de agentes terapeuticos. |
| ES2600912T3 (es) | 2010-03-29 | 2017-02-13 | Abraxis Bioscience, Llc | Métodos para tratar el cáncer |
| WO2011127405A1 (en) * | 2010-04-08 | 2011-10-13 | Sanford-Burnham Medical Research Institute | Methods and compositions for enhanced delivery of compounds |
| EP2382993A1 (en) | 2010-04-19 | 2011-11-02 | KTB Tumorforschungsgesellschaft mbH | Combination of drugs with protein-binding prodrugs |
| US20130266659A1 (en) * | 2010-06-02 | 2013-10-10 | Neil P. Desai | Methods of treating bladder cancer |
| WO2011153485A2 (en) * | 2010-06-03 | 2011-12-08 | Abraxis Bioscience, Llc | Use of the sparc microenvironment signature in the treatment of cancer |
| WO2011153010A1 (en) * | 2010-06-04 | 2011-12-08 | Abraxis Biosciences, Llc | Methods of treatment of pancreatic cancer |
| MY166014A (en) * | 2010-06-07 | 2018-05-21 | Abraxis Bioscience Llc | Combination therapy methods for treating proliferative diseases |
| KR101223484B1 (ko) * | 2010-10-05 | 2013-01-17 | 한국과학기술연구원 | 사람 혈청 알부민-siRNA 나노입자 전달체 |
| US8884027B2 (en) | 2010-10-22 | 2014-11-11 | University Of Rochester | Melampomagnolide B derivatives as antileukemic and cytotoxic agents |
| JP2014505666A (ja) * | 2010-11-18 | 2014-03-06 | ザ ジェネラル ホスピタル コーポレイション | 癌治療のための降圧剤の組成物および使用 |
| KR102023207B1 (ko) | 2010-12-02 | 2019-11-25 | 온콜리틱스 바이오테크 인코포레이티드 | 동결건조 바이러스 제형 |
| EA201390810A1 (ru) | 2010-12-02 | 2013-09-30 | Онколитикс Байотек Инк. | Жидкие вирусные составы |
| JP6038123B2 (ja) | 2011-04-28 | 2016-12-07 | アブラクシス バイオサイエンス, エルエルシー | ナノ粒子組成物の脈管内送達およびそれらの使用 |
| PT2707030T (pt) | 2011-05-09 | 2020-05-22 | Mayo Found Medical Education & Res | Tratamentos de cancro |
| FI4241849T3 (fi) * | 2011-10-14 | 2024-11-12 | Hoffmann La Roche | Her2:n dimerisaation estäjä pertutsumabin käyttötapoja ja sitä sisältävä tuote |
| HK1200716A1 (zh) | 2011-11-01 | 2015-08-14 | 细胞基因公司 | 使用胞苷類似物的口服製劑治療癌症的方法 |
| WO2013085902A1 (en) | 2011-12-05 | 2013-06-13 | The University Of Texas M.D. | Combination therapy methods for treating an inflammatory breast cancer |
| SI2790675T1 (sl) | 2011-12-14 | 2019-11-29 | Abraxis Bioscience Llc | Uporaba polimernih pomožnih snovi za liofilizacijo ali zamrzovanje delcev |
| GB201121924D0 (en) * | 2011-12-20 | 2012-02-01 | Fahy Gurteen Labs Ltd | Detection of breast cancer |
| EP2630971B8 (en) | 2012-02-21 | 2017-12-13 | Vergell Medical S.A. | Combinations of albumin-based drug delivery systems |
| JP6042527B2 (ja) | 2012-04-04 | 2016-12-14 | ハロザイム インコーポレイテッド | 抗ヒアルロナン剤と腫瘍標的タキサンの組み合わせ治療 |
| WO2014026143A1 (en) * | 2012-08-09 | 2014-02-13 | Pono Corporation | Conjugated anti-microbial compounds and conjugated anti-cancer compounds and uses thereof |
| AU2013313050A1 (en) * | 2012-09-04 | 2015-03-26 | Novartis Ag | Method of adjuvant cancer treatment |
| EP2903610B1 (en) | 2012-10-01 | 2021-11-03 | Mayo Foundation For Medical Education And Research | Cancer treatments |
| US20140094432A1 (en) | 2012-10-02 | 2014-04-03 | Cerulean Pharma Inc. | Methods and systems for polymer precipitation and generation of particles |
| US9149455B2 (en) | 2012-11-09 | 2015-10-06 | Abraxis Bioscience, Llc | Methods of treating melanoma |
| MX2015005805A (es) | 2012-11-12 | 2016-04-15 | Ignyta Inc | Derivados de bendamustina y métodos para utilizarlos. |
| US9757432B2 (en) | 2012-11-14 | 2017-09-12 | Ohio State Innovation Foundation | Materials and methods useful for treating glioblastorna |
| NZ630786A (en) | 2012-11-30 | 2017-03-31 | Novomedix Llc | Substituted biaryl sulfonamides and the use thereof |
| JP6466339B2 (ja) * | 2012-12-04 | 2019-02-06 | エーザイ・アール・アンド・ディー・マネジメント株式会社 | 乳がんの処置におけるエリブリンの使用 |
| CN104688740A (zh) * | 2012-12-21 | 2015-06-10 | 百奥泰生物科技(广州)有限公司 | 类美登素衍生物及其制备方法和用途 |
| US9511046B2 (en) | 2013-01-11 | 2016-12-06 | Abraxis Bioscience, Llc | Methods of treating pancreatic cancer |
| US20140199405A1 (en) * | 2013-01-11 | 2014-07-17 | Abraxis Bioscience, Llc | Method for treating cancer based on mutation status of k-ras |
| US20140199404A1 (en) * | 2013-01-11 | 2014-07-17 | Abraxis Bioscience, Llc | Method for treating cancer based on level of a nucleoside transporter |
| WO2014121033A1 (en) * | 2013-02-04 | 2014-08-07 | Fl Therapeutics Llc | Soluble complexes of drug analogs and albumin |
| CA2900668A1 (en) | 2013-02-11 | 2014-08-14 | Abraxis Bioscience, Llc | Treatment of melanoma with nanoparticles comprising paclitaxel |
| EP3698784A1 (en) | 2013-03-12 | 2020-08-26 | Abraxis BioScience, LLC | Methods of treating lung cancer |
| US9688679B2 (en) | 2013-03-13 | 2017-06-27 | Oncoceutics, Inc. | 7-benzyl-4-(methylbenzyl)-2,4,6,7,8,9-hexahydroimidazo[1,2-A]pyrido[3,4-E]pyrimidin-5 (1H)-one, salts thereof and methods of using the same in combination therapy |
| RS59013B1 (sr) | 2013-03-13 | 2019-08-30 | Oncoceutics Inc | 7-benzil-10-(2-metilbenzil)-2,6,7,8,9,10-heksahidroimidazo[1,2-a]pirido[4,3-d]pirimidin-5(3h)-on za upotrebu u lečenju kancera |
| AU2014228386B2 (en) | 2013-03-13 | 2018-11-29 | Abraxis Bioscience, Llc | Methods of treatment of pediatric solid tumor |
| US9376437B2 (en) | 2013-03-13 | 2016-06-28 | Oncoceutics, Inc | 7-benzyl-4-(2-methylbenzyl)-2,4,6,7,8,9-hexahydroimidazo[1,2-a]pyrido[3,4-e]pyrimidin-5(1H)-one, salts thereof and methods of using the same in combination therapy |
| CN110934852A (zh) | 2013-03-14 | 2020-03-31 | 阿布拉科斯生物科学有限公司 | 治疗膀胱癌的方法 |
| WO2014165842A2 (en) * | 2013-04-05 | 2014-10-09 | Igdrasol | Nanoparticle formulations in biomarker detection |
| KR101329646B1 (ko) | 2013-05-02 | 2013-11-14 | 주식회사 지니스 | 표적지향증폭형 항암나노입자 및 이의 제조방법 |
| WO2015042234A1 (en) * | 2013-09-20 | 2015-03-26 | Igdrasol | Conditionally stable micelle compositions for cancer treatment including ovarian cancer |
| EP3049078B1 (en) * | 2013-09-27 | 2018-06-27 | BlueLink Pharmaceuticals, Inc. | Treatment of cancer |
| KR20160093609A (ko) * | 2013-10-25 | 2016-08-08 | 머케이터 메드시스템즈, 인크. | 세포독성제, 세포증식억제제 또는 항신생물제의 국소 전달에 의한 기관지 개방성의 유지 |
| US10842969B2 (en) | 2013-10-25 | 2020-11-24 | Mercator Medsystems, Inc. | Systems and methods of treating malacia by local delivery of hydrogel to augment tissue |
| HUE043291T2 (hu) * | 2013-11-15 | 2019-08-28 | Oncoceutics Inc | 7-benzil-4-(2-metilbenzil)-2,4,6,7,8,9-hexahidroimidazo[1,2-a] pirido[3,4-e]pirimidin-5(lH)-on, sói és alkalmazási eljárások |
| FI20130341L (fi) | 2013-11-19 | 2015-05-20 | Safemed Ltd Oy | Huonosti vesiliukoisten lääkeaineiden kuljetus metalli-ioneilla tasapainotetun alfafetoproteiinin mukana |
| CA2930359C (en) * | 2013-12-06 | 2022-03-01 | Novartis Ag | Dosage regimen for an alpha-isoform selective phosphatidylinositol 3-kinase inhibitor |
| NO2699580T3 (ru) | 2014-01-24 | 2018-02-24 | ||
| EP2924022A1 (en) * | 2014-03-27 | 2015-09-30 | INDENA S.p.A. | Amorphous form of a thiocolchicine derivative |
| JP6695286B2 (ja) | 2014-06-13 | 2020-05-20 | メイヨ・ファウンデーション・フォー・メディカル・エデュケーション・アンド・リサーチ | リンパ腫の処置 |
| JP6600651B2 (ja) | 2014-06-16 | 2019-10-30 | マヨ ファウンデーション フォー メディカル エデュケーション アンド リサーチ | 骨髄腫の治療 |
| WO2015195634A1 (en) | 2014-06-17 | 2015-12-23 | Celgne Corporation | Methods for treating epstein-barr virus (ebv) associated cancers using oral formulations of 5-azacytidine |
| WO2015200837A1 (en) | 2014-06-27 | 2015-12-30 | Fl Therapeutics Llc | Abiraterone derivatives and non-covalent complexes with albumin |
| CN104434808A (zh) | 2014-07-03 | 2015-03-25 | 石药集团中奇制药技术(石家庄)有限公司 | 一种治疗性纳米粒子及其制备方法 |
| US9446148B2 (en) | 2014-10-06 | 2016-09-20 | Mayo Foundation For Medical Education And Research | Carrier-antibody compositions and methods of making and using the same |
| US10201617B2 (en) | 2014-10-24 | 2019-02-12 | Zhuhai Beihai Biotech Co., Ltd. | 3-substituted piperidine-2, 6-diones and non-covalent complexes with albumin |
| WO2016065283A1 (en) * | 2014-10-24 | 2016-04-28 | Bishop Alexander James Roy | Methods and compositions for enhancing chemotherapy |
| SMT202500087T1 (it) | 2015-01-30 | 2025-03-12 | Oncoceutics Inc | Derivati di 7-benzil-4-(2-metilbenzil)-2,4,6,7,8,9-esaidroimidazo[1,2-a]pirido[3,4-e]pirimidin-5(1h)-one, loro sali e loro uso in terapia |
| US10705070B1 (en) | 2015-03-05 | 2020-07-07 | Abraxis Bioscience, Llc | Methods of assessing suitability of use of pharmaceutical compositions of albumin and poorly water soluble drug |
| US10527604B1 (en) | 2015-03-05 | 2020-01-07 | Abraxis Bioscience, Llc | Methods of assessing suitability of use of pharmaceutical compositions of albumin and paclitaxel |
| US10669311B2 (en) | 2015-04-23 | 2020-06-02 | Sanford Burnham Prebys Medical Discovery Institute | Targeted delivery system and methods of use therefor |
| DK3307326T3 (da) | 2015-06-15 | 2020-10-19 | Angiochem Inc | Fremgangsmåder til behandling af leptomeningeal karcinomatose |
| CN116585310A (zh) | 2015-06-29 | 2023-08-15 | 阿布拉科斯生物科学有限公司 | 治疗上皮样细胞肿瘤的方法 |
| TW201707725A (zh) | 2015-08-18 | 2017-03-01 | 美國馬友醫藥教育研究基金會 | 載體-抗體組合物及其製造及使用方法 |
| TW201713360A (en) | 2015-10-06 | 2017-04-16 | Mayo Foundation | Methods of treating cancer using compositions of antibodies and carrier proteins |
| EP3389720A1 (en) | 2015-12-18 | 2018-10-24 | The General Hospital Corporation | Polyacetal polymers, conjugates, particles and uses thereof |
| WO2017120501A1 (en) | 2016-01-07 | 2017-07-13 | Mayo Foundation For Medical Education And Research | Methods of treating cancer with interferon |
| WO2017139698A1 (en) | 2016-02-12 | 2017-08-17 | Mayo Foundation For Medical Education And Research | Hematologic cancer treatments |
| CN108700566A (zh) | 2016-02-19 | 2018-10-23 | 河谷控股Ip有限责任公司 | 免疫原性调节的方法 |
| US11878061B2 (en) | 2016-03-21 | 2024-01-23 | Mayo Foundation For Medical Education And Research | Methods for improving the therapeutic index for a chemotherapeutic drug |
| EP3432926A4 (en) | 2016-03-21 | 2019-11-20 | Mayo Foundation for Medical Education and Research | METHOD FOR REDUCING THE TOXICITY OF CHEMOTHERAPEUTICS |
| SG11201807770RA (en) | 2016-03-24 | 2018-10-30 | Nantcell Inc | Sequence arrangements and sequences for neoepitope presentation |
| US10618969B2 (en) | 2016-04-06 | 2020-04-14 | Mayo Foundation For Medical Education And Research | Carrier-binding agent compositions and methods of making and using the same |
| CN114224865A (zh) | 2016-06-02 | 2022-03-25 | 因华生技制药股份有限公司 | 供癌症医疗的节拍式口服吉西他宾 |
| CN109789190A (zh) | 2016-06-30 | 2019-05-21 | 河谷控股Ip有限责任公司 | Nant癌症疫苗 |
| WO2018026965A1 (en) | 2016-08-02 | 2018-02-08 | Isi Life Sciences, Inc. | Compositions and methods for detecting cancer cells in a tissue sample |
| EP3493854B1 (en) | 2016-08-05 | 2023-10-04 | Mayo Foundation for Medical Education and Research | Modified antibody-albumin nanoparticle complexes for cancer treatment |
| CN107714652B (zh) * | 2016-08-12 | 2021-03-02 | 四川科伦药物研究院有限公司 | 替西罗莫司白蛋白纳米组合物及其冻干制剂、制法和用途 |
| AU2017319260B2 (en) * | 2016-08-31 | 2020-01-30 | Fujifilm Corporation | Anti-tumor agent, anti-tumor effect enhancer, and anti-tumor kit |
| EP3506950A1 (en) | 2016-09-01 | 2019-07-10 | Mayo Foundation for Medical Education and Research | Methods and compositions for targeting t-cell cancers |
| US11548946B2 (en) | 2016-09-01 | 2023-01-10 | Mayo Foundation For Medical Education And Research | Carrier-PD-L1 binding agent compositions for treating cancers |
| KR20230011473A (ko) | 2016-09-06 | 2023-01-20 | 메이오 파운데이션 포 메디칼 에쥬케이션 앤드 리써치 | Pd-l1 발현 암의 치료 방법 |
| WO2018048815A1 (en) | 2016-09-06 | 2018-03-15 | Nantibodyfc, Llc | Methods of treating triple-negative breast cancer using compositions of antibodies and carrier proteins |
| KR20230010817A (ko) * | 2016-09-06 | 2023-01-19 | 메이오 파운데이션 포 메디칼 에쥬케이션 앤드 리써치 | 파클리탁셀-알부민-결합제 조성물 및 그의 사용 및 제조 방법 |
| CA3031691A1 (en) * | 2016-09-13 | 2018-03-22 | Rasna Research Inc. | Dactinomycin compositions and methods for the treatment of myelodysplastic syndrome and acute myeloid leukemia |
| AU2017361541A1 (en) | 2016-11-21 | 2019-07-11 | Bexion Pharmaceuticals, Inc. | A combination therapy including SapC-DOPS for the treatment of pancreatic cancer |
| AU2017362730B2 (en) | 2016-11-21 | 2021-04-08 | Nant Holdings Ip, Llc | Fractal combination therapy |
| CA3047523A1 (en) * | 2016-12-21 | 2018-06-28 | Prometic Biosciences Inc. | Methods and compositions for preventing or minimizing epithelial-mesenchymal transition |
| CA3052803A1 (en) | 2017-02-07 | 2018-08-16 | Nantcell, Inc. | Maximizing t-cell memory and compositions and methods therefor |
| US20180235936A1 (en) * | 2017-02-17 | 2018-08-23 | University Of Notre Dame Du Lac | Cancer treatment methods |
| KR20190096384A (ko) | 2017-03-02 | 2019-08-19 | 제넨테크, 인크. | Her2-양성 유방암 어쥬번트 치료 |
| AU2018258119B2 (en) | 2017-04-24 | 2021-04-01 | Nantcell, Inc. | Targeted neoepitope vectors and methods therefor |
| US10753942B2 (en) | 2017-05-15 | 2020-08-25 | Indicator Systems International, Inc. | Methods to detect remnant cancer cells |
| CN111479571A (zh) * | 2017-07-21 | 2020-07-31 | 瓦里安医疗系统公司 | 超高剂量率辐射和治疗剂的使用方法 |
| TWI785098B (zh) * | 2017-08-18 | 2022-12-01 | 開曼群島商科賽睿生命科學公司 | Tg02之多晶型 |
| US20200290978A1 (en) * | 2017-09-26 | 2020-09-17 | The Regents Of The University Of California | Compositions and methods for treating cancer |
| JP2021502345A (ja) | 2017-11-06 | 2021-01-28 | ラプト・セラピューティクス・インコーポレイテッド | 抗がん剤 |
| US11773187B2 (en) | 2018-01-17 | 2023-10-03 | Nantbio, Inc. | Enhanced immunogenicity for GPI-anchored antigens |
| ES3009668T3 (en) | 2018-01-26 | 2025-03-31 | Univ California | Methods and compositions for treatment of angiogenic disorders using anti-vegf agents |
| AU2019228717C1 (en) | 2018-03-01 | 2025-01-09 | Astrazeneca Ab | Pharmaceutical compositions comprising (2S)-N-{(1S)-1-cyano-2-[4-(3-methyl-2- oxo-2,3-dihydro-1,3-benzoxazol-5-yl)phenyl]ethyl}-1,4-oxazepane-2-carboxamide |
| AU2019239953B2 (en) | 2018-03-20 | 2025-01-02 | Abraxis Bioscience, Llc | Methods of treating central nervous system disorders via administration of nanoparticles of an mtor inhibitor and an albumin |
| CA3096036A1 (en) | 2018-04-03 | 2019-10-10 | Vaxess Technologies, Inc. | Microneedle comprising silk fibroin applied to a dissolvable base |
| US11823773B2 (en) | 2018-04-13 | 2023-11-21 | Nant Holdings Ip, Llc | Nant cancer vaccine strategies |
| MX2020012478A (es) | 2018-05-22 | 2021-03-09 | Abraxis Bioscience Llc | Metodos y composiciones para el tratamiento de la hipertension pulmonar. |
| CA3106269A1 (en) | 2018-07-17 | 2020-01-23 | Insmed Incorporated | Certain (2s)-n-[(1s)-1-cyano-2-phenylethyl]-1,4-oxazepane-2-carboxamides for treating lupus nephritis |
| US20220226473A1 (en) * | 2018-09-30 | 2022-07-21 | Bai Yao Zhi Da (Beijing) Nanobio Technology Co., Ltd. | Nucleic acid nanocarrier drug and preparation method thereof, pharmaceutical composition and application thereof |
| WO2020078219A1 (zh) * | 2018-10-16 | 2020-04-23 | 百药智达(北京)纳米生物技术有限公司 | 核酸纳米载体药物、其制备方法、药物组合物及应用 |
| WO2020112868A1 (en) * | 2018-11-30 | 2020-06-04 | Aileron Therapeutics, Inc. | Combination therapy of peptidomimetic macrocycles |
| RU2706347C1 (ru) * | 2019-07-24 | 2019-11-18 | ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ УЧРЕЖДЕНИЕ "РОССИЙСКИЙ НАУЧНЫЙ ЦЕНТР РАДИОЛОГИИ И ХИРУРГИЧЕСКИХ ТЕХНОЛОГИЙ ИМЕНИ АКАДЕМИКА А.М. ГРАНОВА" МИНИСТЕРСТВА ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ / ФГБУ "РНЦРХТ им. ак. А.М. Гранова" Минздрава России | Способ лечения операбельной аденокарциномы головки поджелудочной железы |
| EP4051241A4 (en) | 2019-10-28 | 2023-12-06 | Abraxis BioScience, LLC | PHARMACEUTICAL COMPOSITIONS OF ALBUMIN AND RAPAMYCIN |
| EP4065150A4 (en) | 2019-11-25 | 2023-12-06 | The Regents of the University of California | LONG-ACTING VEGF INHIBITORS FOR INTRAVASCULAR NEOVASCULARIZATION |
| CN116917009A (zh) | 2021-02-19 | 2023-10-20 | 美国迈胜医疗系统有限公司 | 用于粒子治疗系统的机架 |
| CN114949200B (zh) * | 2021-02-20 | 2025-08-19 | 北京大学人民医院 | 全反式维a酸联合低剂量利妥昔单抗在制备治疗激素耐药或复发itp的药物中的应用 |
| WO2022232420A1 (en) * | 2021-04-29 | 2022-11-03 | Insmed Incorporated | Certain n-(1-cyano-2-phenylethyl)-1,4-oxazepane-2-carboxamides for treating cancer |
| US20250177352A1 (en) | 2022-03-14 | 2025-06-05 | Laekna Limited | Combination treatment for cancer |
| CA3260638A1 (en) | 2022-06-24 | 2023-12-28 | Vaxess Technologies, Inc. | MEDICATION TAMP APPLICATOR |
| EP4577212A1 (en) * | 2022-08-26 | 2025-07-02 | Ideaya Biosciences, Inc. | Methods of treating uveal melanoma |
| WO2024081674A1 (en) | 2022-10-11 | 2024-04-18 | Aadi Bioscience, Inc. | Combination therapies for the treatment of cancer |
| CN120584108A (zh) | 2023-01-06 | 2025-09-02 | 英斯梅德股份有限公司 | 新型可逆dpp1抑制剂及其用途 |
| WO2024228964A1 (en) | 2023-04-30 | 2024-11-07 | Aadi Bioscience, Inc. | Treatments comprising an mtor inhibitor nanoparticle composition |
| WO2024243413A1 (en) | 2023-05-24 | 2024-11-28 | Aadi Bioscience, Inc. | Combination therapy with a mtor inhibitor and a multi-tyrosine kinase inhibitor for treating soft tissue sarcoma |
| WO2024263835A1 (en) | 2023-06-23 | 2024-12-26 | Vaxess Technologies, Inc. | Applicator for medicament patch |
| WO2025034870A1 (en) | 2023-08-08 | 2025-02-13 | Aadi Bioscience, Inc. | Combination of nab-sirolimus and an estrogen suppresor for use in the treatment of hormone-dependent cancers |
| WO2025049962A1 (en) | 2023-08-31 | 2025-03-06 | Aadi Bioscience, Inc. | Combination cancer treatments with a composition comprising an mtor pathway inhibitor |
| WO2025129108A1 (en) | 2023-12-14 | 2025-06-19 | Aadi Bioscience, Inc. | Methods of treating a cancer in an individual |
Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2001089522A1 (en) * | 2000-05-19 | 2001-11-29 | American Bioscience, Inc. | Compositions and methods for administration of pharmacologically active compounds |
Family Cites Families (148)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5206018A (en) * | 1978-11-03 | 1993-04-27 | Ayerst, Mckenna & Harrison, Inc. | Use of rapamycin in treatment of tumors |
| US5470571A (en) | 1988-01-27 | 1995-11-28 | The Wistar Institute | Method of treating human EGF receptor-expressing gliomas using radiolabeled EGF receptor-specific MAB 425 |
| FR2660556B1 (fr) | 1990-04-06 | 1994-09-16 | Rhone Poulenc Sante | Microspheres, leur procede de preparation et leur utilisation. |
| IL98528A0 (en) | 1990-06-21 | 1992-07-15 | Merck & Co Inc | Pharmaceutical compositions containing hybrid for killing bladder cancer cells |
| US5399363A (en) | 1991-01-25 | 1995-03-21 | Eastman Kodak Company | Surface modified anticancer nanoparticles |
| WO1992015683A1 (en) | 1991-03-06 | 1992-09-17 | MERCK Patent Gesellschaft mit beschränkter Haftung | Humanized and chimeric monoclonal antibodies |
| US6515009B1 (en) | 1991-09-27 | 2003-02-04 | Neorx Corporation | Therapeutic inhibitor of vascular smooth muscle cells |
| US5811447A (en) | 1993-01-28 | 1998-09-22 | Neorx Corporation | Therapeutic inhibitor of vascular smooth muscle cells |
| CA2086874E (en) * | 1992-08-03 | 2000-01-04 | Renzo Mauro Canetta | Methods for administration of taxol |
| US6306421B1 (en) | 1992-09-25 | 2001-10-23 | Neorx Corporation | Therapeutic inhibitor of vascular smooth muscle cells |
| FR2697752B1 (fr) * | 1992-11-10 | 1995-04-14 | Rhone Poulenc Rorer Sa | Compositions antitumorales contenant des dérivés du taxane. |
| US6491938B2 (en) | 1993-05-13 | 2002-12-10 | Neorx Corporation | Therapeutic inhibitor of vascular smooth muscle cells |
| US5981568A (en) | 1993-01-28 | 1999-11-09 | Neorx Corporation | Therapeutic inhibitor of vascular smooth muscle cells |
| US5665382A (en) | 1993-02-22 | 1997-09-09 | Vivorx Pharmaceuticals, Inc. | Methods for the preparation of pharmaceutically active agents for in vivo delivery |
| US5439686A (en) | 1993-02-22 | 1995-08-08 | Vivorx Pharmaceuticals, Inc. | Methods for in vivo delivery of substantially water insoluble pharmacologically active agents and compositions useful therefor |
| US5665383A (en) | 1993-02-22 | 1997-09-09 | Vivorx Pharmaceuticals, Inc. | Methods for the preparation of immunostimulating agents for in vivo delivery |
| PT693924E (pt) | 1993-02-22 | 2004-09-30 | American Biosciences | Processos para administracao (in vivo) de substancias biologicas e composicoes utilizadas nestes processos |
| US6749868B1 (en) | 1993-02-22 | 2004-06-15 | American Bioscience, Inc. | Protein stabilized pharmacologically active agents, methods for the preparation thereof and methods for the use thereof |
| US6528067B1 (en) | 1993-02-22 | 2003-03-04 | American Bioscience, Inc. | Total nutrient admixtures as stable multicomponent liquids or dry powders and methods for the preparation thereof |
| US20030068362A1 (en) | 1993-02-22 | 2003-04-10 | American Bioscience, Inc. | Methods and formulations for the delivery of pharmacologically active agents |
| US20030133955A1 (en) | 1993-02-22 | 2003-07-17 | American Bioscience, Inc. | Methods and compositions useful for administration of chemotherapeutic agents |
| US20070117862A1 (en) | 1993-02-22 | 2007-05-24 | Desai Neil P | Novel formulations of pharmacological agents, methods for the preparation thereof and methods for the use thereof |
| US6096331A (en) * | 1993-02-22 | 2000-08-01 | Vivorx Pharmaceuticals, Inc. | Methods and compositions useful for administration of chemotherapeutic agents |
| US5997904A (en) | 1993-02-22 | 1999-12-07 | American Bioscience, Inc. | Total nutrient admixtures as stable multicomponent liquids or dry powders and methods for the preparation thereof |
| US20030073642A1 (en) | 1993-02-22 | 2003-04-17 | American Bioscience, Inc. | Methods and formulations for delivery of pharmacologically active agents |
| US5650156A (en) | 1993-02-22 | 1997-07-22 | Vivorx Pharmaceuticals, Inc. | Methods for in vivo delivery of nutriceuticals and compositions useful therefor |
| US5362478A (en) | 1993-03-26 | 1994-11-08 | Vivorx Pharmaceuticals, Inc. | Magnetic resonance imaging with fluorocarbons encapsulated in a cross-linked polymeric shell |
| US6753006B1 (en) | 1993-02-22 | 2004-06-22 | American Bioscience, Inc. | Paclitaxel-containing formulations |
| US5916596A (en) * | 1993-02-22 | 1999-06-29 | Vivorx Pharmaceuticals, Inc. | Protein stabilized pharmacologically active agents, methods for the preparation thereof and methods for the use thereof |
| US5886026A (en) | 1993-07-19 | 1999-03-23 | Angiotech Pharmaceuticals Inc. | Anti-angiogenic compositions and methods of use |
| DK0797988T3 (da) | 1993-07-19 | 2009-05-11 | Univ British Columbia | Anti-angiogene præparater og fremgangsmåder til anvendelse deraf |
| US6441026B1 (en) * | 1993-11-08 | 2002-08-27 | Aventis Pharma S.A. | Antitumor compositions containing taxane derivatives |
| AU1831395A (en) | 1994-01-14 | 1995-08-01 | Cell Therapeutics, Inc. | Method for treating diseases mediated by cellular proliferation in response to pdgf, egf, fgf and vegf |
| US5626862A (en) | 1994-08-02 | 1997-05-06 | Massachusetts Institute Of Technology | Controlled local delivery of chemotherapeutic agents for treating solid tumors |
| US5662883A (en) | 1995-01-10 | 1997-09-02 | Nanosystems L.L.C. | Microprecipitation of micro-nanoparticulate pharmaceutical agents |
| US5534270A (en) | 1995-02-09 | 1996-07-09 | Nanosystems Llc | Method of preparing stable drug nanoparticles |
| US5510118A (en) | 1995-02-14 | 1996-04-23 | Nanosystems Llc | Process for preparing therapeutic compositions containing nanoparticles |
| AU716005B2 (en) | 1995-06-07 | 2000-02-17 | Cook Medical Technologies Llc | Implantable medical device |
| US5609629A (en) | 1995-06-07 | 1997-03-11 | Med Institute, Inc. | Coated implantable medical device |
| US5744460A (en) | 1996-03-07 | 1998-04-28 | Novartis Corporation | Combination for treatment of proliferative diseases |
| US6441025B2 (en) | 1996-03-12 | 2002-08-27 | Pg-Txl Company, L.P. | Water soluble paclitaxel derivatives |
| CZ297979B6 (cs) | 1996-03-12 | 2007-05-16 | Pg-Txl Company, L. P. | Kompozice obsahující protinádorové lécivo konjugované s ve vode rozpustným polymerem, její pouzití pro výrobu léciva a implantovatelná lékarská pomucka |
| SI1208847T1 (sl) | 1996-07-30 | 2007-06-30 | Novartis Ag | Farmacevtski sestavki za zdravljenje stanj zavračanja transplantatov in avtoimunskih ali vnetnih stanj |
| US20070092563A1 (en) | 1996-10-01 | 2007-04-26 | Abraxis Bioscience, Inc. | Novel formulations of pharmacological agents, methods for the preparation thereof and methods for the use thereof |
| US6495579B1 (en) | 1996-12-02 | 2002-12-17 | Angiotech Pharmaceuticals, Inc. | Method for treating multiple sclerosis |
| US6143276A (en) | 1997-03-21 | 2000-11-07 | Imarx Pharmaceutical Corp. | Methods for delivering bioactive agents to regions of elevated temperatures |
| US6884879B1 (en) | 1997-04-07 | 2005-04-26 | Genentech, Inc. | Anti-VEGF antibodies |
| US8853260B2 (en) | 1997-06-27 | 2014-10-07 | Abraxis Bioscience, Llc | Formulations of pharmacological agents, methods for the preparation thereof and methods for the use thereof |
| PT1023050E (pt) * | 1997-06-27 | 2013-12-04 | Abraxis Bioscience Llc | Novas formulações de agentes farmacológicos, métodos para a sua preparação e métodos para a sua utilização |
| US20030199425A1 (en) | 1997-06-27 | 2003-10-23 | Desai Neil P. | Compositions and methods for treatment of hyperplasia |
| US6258084B1 (en) | 1997-09-11 | 2001-07-10 | Vnus Medical Technologies, Inc. | Method for applying energy to biological tissue including the use of tumescent tissue compression |
| GB9800569D0 (en) | 1998-01-12 | 1998-03-11 | Glaxo Group Ltd | Heterocyclic compounds |
| JP2002512198A (ja) | 1998-04-16 | 2002-04-23 | アイダ ディベロップメント アクティーゼルスカブ | アルピニアガランガ中に存在する芳香族化合物及びテルペノイドを含む新規相乗組成物 |
| EP1100494A1 (en) * | 1998-07-30 | 2001-05-23 | Novopharm Biotech, Inc. | Pharmaceutically composition comprising an aqueous solution of paclitaxel and albumin |
| US6682758B1 (en) | 1998-12-22 | 2004-01-27 | The United States Of America As Represented By The Department Of Health And Human Services | Water-insoluble drug delivery system |
| US6740665B1 (en) | 1999-02-10 | 2004-05-25 | Ramachandran Murali | Tyrosine kinase inhibitors and methods of using the same |
| US6537585B1 (en) * | 1999-03-26 | 2003-03-25 | Guilford Pharmaceuticals, Inc. | Methods and compositions for treating solid tumors |
| EP1171117A4 (en) | 1999-04-22 | 2002-08-07 | American Bioscience Inc | LONG-TERM ADMINISTRATION OF PHARMACOLOGICALLY ACTIVE AGENTS |
| AU784416B2 (en) | 1999-05-21 | 2006-03-30 | Abraxis Bioscience, Llc | Protein stabilized pharmacologically active agents, methods for the preparation thereof and methods for the use thereof |
| JP2003500368A (ja) | 1999-05-24 | 2003-01-07 | ソーナス ファーマシューティカルス,インコーポレイテッド | 溶解度が不十分な薬剤のためのエマルジョンビヒクル |
| AU1916301A (en) | 1999-11-12 | 2001-06-06 | Children's Medical Center Corporation | Methods for administration of therapeutic agents on an antiangiogenic schedule |
| US7740841B1 (en) | 2000-01-28 | 2010-06-22 | Sunnybrook Health Science Center | Therapeutic method for reducing angiogenesis |
| IT1318401B1 (it) * | 2000-03-17 | 2003-08-25 | Indena Spa | Derivati di n-desacetiltiocolchicina e composizioni farmaceutiche cheli contengono. |
| EP1274404A1 (en) | 2000-04-10 | 2003-01-15 | Teva Pharmaceutical Industries Ltd. | Method and composition for treating cancer by administration of apoptosis-inducing chemotherapeutic agents |
| ITMI20001107A1 (it) * | 2000-05-18 | 2001-11-18 | Acs Dobfar Spa | Metodo per il trattamento di tumori solici mediante microparticelle di albumina incorporanti paclitaxel |
| KR100815681B1 (ko) | 2000-06-30 | 2008-03-20 | 글락소 그룹 리미티드 | 퀴나졸린 디토실레이트 염 화합물 |
| WO2002009696A1 (en) | 2000-07-28 | 2002-02-07 | Sloan-Kettering Institute For Cancer Research | Methods for treating cell proliferative disorders and viral infections |
| HUP0302599A3 (en) | 2000-09-22 | 2005-05-30 | Bristol Myers Squibb Co | Method for reducing toxicity of combined chemotherapic compositions |
| DE60203260T2 (de) | 2001-01-16 | 2006-02-02 | Glaxo Group Ltd., Greenford | Pharmazeutische kombination, die ein 4-chinazolinamin und paclitaxel, carboplatin oder vinorelbin enthält, zur behandlung von krebs |
| CA2434270A1 (en) | 2001-01-19 | 2002-07-25 | Bionumerik Pharmaceuticals, Inc. | Use of mesna compounds to prevent adverse reactions to anti-neoplastic compositions |
| US6548531B2 (en) | 2001-02-09 | 2003-04-15 | Hoffmann-La Roche Inc. | Method for cancer therapy |
| GB0103668D0 (en) | 2001-02-15 | 2001-03-28 | Biointeractions Ltd | Methods and clinical devices for the inhibition or prevention of mammalian cell growth |
| WO2002069949A2 (en) | 2001-03-06 | 2002-09-12 | Prendergast Patrick T | Combination therapy for reduction of toxycity of chemotherapeutic agents |
| HRP20030801A2 (en) | 2001-03-06 | 2004-08-31 | Bristol Myers Squibb Co | Method and dosage form for treating tumors by the administration of tegafur, uracil, folinic acid, paclitaxel and carboplatin |
| US6752922B2 (en) | 2001-04-06 | 2004-06-22 | Fluidigm Corporation | Microfluidic chromatography |
| US7638161B2 (en) | 2001-07-20 | 2009-12-29 | Applied Materials, Inc. | Method and apparatus for controlling dopant concentration during BPSG film deposition to reduce nitride consumption |
| US6872715B2 (en) | 2001-08-06 | 2005-03-29 | Kosan Biosciences, Inc. | Benzoquinone ansamycins |
| US7056338B2 (en) | 2003-03-28 | 2006-06-06 | Conor Medsystems, Inc. | Therapeutic agent delivery device with controlled therapeutic agent release rates |
| US20040033271A1 (en) | 2001-12-03 | 2004-02-19 | Seth Lederman | Methods for contemporaneous administration of levamisole and 5-fluorouracil |
| US20040143004A1 (en) | 2002-02-26 | 2004-07-22 | Joseph Fargnoli | Metronomic dosing of taxanes |
| ITMI20020680A1 (it) | 2002-03-29 | 2003-09-29 | Acs Dobfar Spa | Composizione antitumorale migliorata a base di paclitaxel e metodo per il suo ottenimento |
| ITMI20020681A1 (it) | 2002-03-29 | 2003-09-29 | Acs Dobfar Spa | Procedimento per la produzione di nanoparticelle di paclitaxel ed albumina |
| US20040126400A1 (en) * | 2002-05-03 | 2004-07-01 | Iversen Patrick L. | Delivery of therapeutic compounds via microparticles or microbubbles |
| US7794743B2 (en) | 2002-06-21 | 2010-09-14 | Advanced Cardiovascular Systems, Inc. | Polycationic peptide coatings and methods of making the same |
| AU2003251955A1 (en) | 2002-07-16 | 2004-02-02 | Sonus Pharmaceuticals, Inc. | Platinum compound |
| PL375713A1 (en) | 2002-08-19 | 2005-12-12 | Pfizer Products Inc. | Combination therapy for hyperproliferative diseases |
| US20040047835A1 (en) | 2002-09-06 | 2004-03-11 | Cell Therapeutics, Inc. | Combinatorial drug therapy using polymer drug conjugates |
| US20050158375A1 (en) * | 2002-11-15 | 2005-07-21 | Toshikiro Kimura | Pharmaceutical composition containing liposomes for treating cancer |
| US20050095267A1 (en) | 2002-12-04 | 2005-05-05 | Todd Campbell | Nanoparticle-based controlled release polymer coatings for medical implants |
| KR20110079741A (ko) * | 2002-12-09 | 2011-07-07 | 아브락시스 바이오사이언스, 엘엘씨 | 약리학적 물질의 조성물 및 그 전달방법 |
| EP2359859A1 (en) | 2002-12-09 | 2011-08-24 | Abraxis BioScience, LLC | Compositions comprising albumin nanoparticles and methods of delivery of pharmacological agents |
| US6979675B2 (en) | 2003-01-10 | 2005-12-27 | Threshold Pharmaceuticals, Inc. | Treatment of cancer with 2-deoxyglucose |
| US20050002983A1 (en) | 2003-03-28 | 2005-01-06 | Johnson Robert G. | Devices, methods, and compositions to prevent restenosis |
| EP1643971A2 (en) | 2003-05-22 | 2006-04-12 | Neopharm, Inc. | Liposomal formulations comprising a combination of two or more active agents |
| US20050026893A1 (en) | 2003-05-30 | 2005-02-03 | Kosan Biosciences, Inc. | Method for treating diseases using HSP90-inhibiting agents in combination with immunosuppressants |
| RS20050885A (sr) | 2003-05-30 | 2008-04-04 | Genentech | Lečenje sa anti-vegf antitelima |
| AR046510A1 (es) | 2003-07-25 | 2005-12-14 | Regeneron Pharma | Composicion de un antagonista de vegf y un agente anti-proliferativo |
| MXPA06003163A (es) | 2003-09-23 | 2006-06-05 | Novartis Ag | Combinacion de un inhibidor de receptor de vegf con un agente quimioterapeutico. |
| EP2286794B8 (en) | 2003-10-15 | 2016-06-01 | SynCore Biotechnology CO., LTD | Use of cationic liposomes comprising paclitaxel |
| DE602004027936D1 (de) | 2003-10-29 | 2010-08-12 | Sonus Pharmaceutical Inc | Tocopherolmodifizierte therapeutische arzneimittelverbindung |
| US20080045559A1 (en) | 2003-10-29 | 2008-02-21 | Sonus Pharmaceuticals, Inc. | Tocopherol-modified therapeutic drug compounds |
| US20050203174A1 (en) | 2004-03-09 | 2005-09-15 | Kosan Biosciences, Inc. | Combination therapies using leptomycin B |
| WO2005090372A2 (en) | 2004-03-15 | 2005-09-29 | Sonus Pharmaceuticals, Inc. | Platinum carboxylate anticancer compounds |
| US20060003931A1 (en) | 2004-05-06 | 2006-01-05 | Genentech, Inc. | Crystal structure of the hepatocyte growth factor and methods of use |
| MXPA06013191A (es) | 2004-05-14 | 2007-07-24 | Abraxis Bioscience Inc | Metodos de tratamiento que utilizan proteinas que enlazan albumina como objetivos. |
| US8420603B2 (en) | 2004-05-14 | 2013-04-16 | Abraxis Bioscience, Llc | SPARC and methods of use thereof |
| BRPI0510883B8 (pt) | 2004-06-01 | 2021-05-25 | Genentech Inc | composto conjugado de droga e anticorpo, composição farmacêutica, método de fabricação de composto conjugado de droga e anticorpo e usos de uma formulação, de um conjugado de droga e anticorpo e um agente quimioterapêutico e de uma combinação |
| AU2005249205A1 (en) * | 2004-06-03 | 2005-12-15 | F. Hoffmann-La Roche Ag | Treatment with gemcitabine and an EGFR-inhibitor |
| TW201422238A (zh) | 2004-06-04 | 2014-06-16 | Genentech Inc | Cd20抗體於治療多發性硬化症之用途及用於該用途之物品 |
| GT200500155A (es) | 2004-06-16 | 2006-05-15 | Terapia del càncer resistente al platino | |
| US8735394B2 (en) | 2005-02-18 | 2014-05-27 | Abraxis Bioscience, Llc | Combinations and modes of administration of therapeutic agents and combination therapy |
| US20070166388A1 (en) | 2005-02-18 | 2007-07-19 | Desai Neil P | Combinations and modes of administration of therapeutic agents and combination therapy |
| WO2006112930A2 (en) | 2005-02-18 | 2006-10-26 | Abraxis Bioscience, Inc. | Q3 sparc deletion mutant and uses thereof |
| CA2598239C (en) | 2005-02-18 | 2019-10-29 | Abraxis Bioscience, Inc. | Nanoparticulate formulations of taxanes and carrier proteins for use in combination chemotherapy |
| US9233094B2 (en) | 2005-05-04 | 2016-01-12 | Medigene Ag | Method of administering a cationic liposomal preparation |
| US20080221135A1 (en) | 2005-05-13 | 2008-09-11 | Bristol-Myers Squibb Company | Combination therapy |
| AU2006284657B2 (en) * | 2005-08-31 | 2012-07-19 | Abraxis Bioscience, Llc | Compositions and methods for preparation of poorly water soluble drugs with increased stability |
| US7771751B2 (en) | 2005-08-31 | 2010-08-10 | Abraxis Bioscience, Llc | Compositions comprising poorly water soluble pharmaceutical agents and antimicrobial agents |
| WO2007059116A2 (en) | 2005-11-14 | 2007-05-24 | Abraxis Bioscience, Inc. | Geldanamycin derivatives and pharmaceutical compositions thereof |
| MX2008011978A (es) | 2006-03-22 | 2009-04-22 | Medigene Ag | Tratamiento del cancer de seno negativo al triple receptor. |
| US9037257B2 (en) * | 2006-04-07 | 2015-05-19 | Medtronic, Inc. | Resonance tuning module for implantable devices and leads |
| SG136814A1 (en) | 2006-04-12 | 2007-11-29 | Tencube Pte Ltd | System for tracking mobile equipment and associated mobile subscribersæ identity |
| US20080280987A1 (en) * | 2006-08-31 | 2008-11-13 | Desai Neil P | Methods of inhibiting angiogenesis and treating angiogenesis-associated diseases |
| US20100112077A1 (en) | 2006-11-06 | 2010-05-06 | Abraxis Bioscience, Llc | Nanoparticles of paclitaxel and albumin in combination with bevacizumab against cancer |
| DK2117520T3 (en) | 2006-12-14 | 2019-01-07 | Abraxis Bioscience Llc | BREAST CANCER THERAPY BASED ON HORMON RECEPTOR STATUS WITH NANOPARTICLES INCLUDING TAXAN |
| LT2481409T (lt) | 2007-03-07 | 2018-10-25 | Abraxis Bioscience, Llc | Nanodalelės, apimančios rapamiciną ir albuminą, kaip priešvėžinį agentą |
| US20100166869A1 (en) | 2007-05-03 | 2010-07-01 | Desai Neil P | Methods and compositions for treating pulmonary hypertension |
| DK2155188T3 (da) | 2007-06-01 | 2013-11-04 | Abraxis Bioscience Llc | Fremgangsmåder og sammensætninger til behandling af tilbagevendende kræft |
| US20090018078A1 (en) | 2007-07-09 | 2009-01-15 | Vinod Labhasetwar | Apoptosis-Modulating Protein Therapy for Proliferative Disorders and Nanoparticles Containing the Same |
| MX2010011165A (es) * | 2008-04-10 | 2011-02-22 | Abraxis Bioscience Llc | Composiciones de derivados de taxano hidrofobos y sus usos. |
| AU2009324464B2 (en) | 2008-12-11 | 2016-05-05 | Abraxis Bioscience, Llc | Combinations and modes of administration of therapeutic agents and combination therapy |
| WO2010105172A1 (en) | 2009-03-13 | 2010-09-16 | Abraxis Bioscience, Llc | Combination therapy with thiocolchicine derivatives |
| BRPI1014160A2 (pt) | 2009-04-10 | 2015-08-25 | Abraxis Bioscience Llc | Formulações de nanopartículas e aplicações das mesmas |
| AU2010236382B2 (en) | 2009-04-15 | 2016-01-14 | Abraxis Bioscience, Llc | Prion-free nanoparticle compositions and methods |
| WO2011025838A1 (en) | 2009-08-25 | 2011-03-03 | Abraxis Bioscience, Llc | Combination therapy with nanoparticle compositions of taxane and hedgehog inhibitors |
| NZ602382A (en) | 2010-03-26 | 2014-11-28 | Abraxis Bioscience Llc | Methods of treatment of hepatocellular carcinoma |
| MX2012011155A (es) | 2010-03-29 | 2012-12-05 | Abraxis Bioscience Llc | Metodos para mejorar suministros de farmacos y efectividad de agentes terapeuticos. |
| ES2600912T3 (es) | 2010-03-29 | 2017-02-13 | Abraxis Bioscience, Llc | Métodos para tratar el cáncer |
| EP2563393B1 (en) | 2010-04-26 | 2016-06-08 | Abraxis BioScience, LLC | Sparc binding antibodies and uses thereof |
| US20130266659A1 (en) | 2010-06-02 | 2013-10-10 | Neil P. Desai | Methods of treating bladder cancer |
| WO2011153010A1 (en) | 2010-06-04 | 2011-12-08 | Abraxis Biosciences, Llc | Methods of treatment of pancreatic cancer |
| MY166014A (en) | 2010-06-07 | 2018-05-21 | Abraxis Bioscience Llc | Combination therapy methods for treating proliferative diseases |
| JP6038123B2 (ja) | 2011-04-28 | 2016-12-07 | アブラクシス バイオサイエンス, エルエルシー | ナノ粒子組成物の脈管内送達およびそれらの使用 |
| SI2790675T1 (sl) | 2011-12-14 | 2019-11-29 | Abraxis Bioscience Llc | Uporaba polimernih pomožnih snovi za liofilizacijo ali zamrzovanje delcev |
| US9149455B2 (en) | 2012-11-09 | 2015-10-06 | Abraxis Bioscience, Llc | Methods of treating melanoma |
| US9511046B2 (en) | 2013-01-11 | 2016-12-06 | Abraxis Bioscience, Llc | Methods of treating pancreatic cancer |
| US20140199404A1 (en) | 2013-01-11 | 2014-07-17 | Abraxis Bioscience, Llc | Method for treating cancer based on level of a nucleoside transporter |
| US20140199405A1 (en) | 2013-01-11 | 2014-07-17 | Abraxis Bioscience, Llc | Method for treating cancer based on mutation status of k-ras |
-
2006
- 2006-02-21 CA CA2598239A patent/CA2598239C/en active Active
- 2006-02-21 CN CN2013100757784A patent/CN103169729A/zh active Pending
- 2006-02-21 DK DK06735710.3T patent/DK1853250T3/da active
- 2006-02-21 EP EP17165979.0A patent/EP3248600B8/en not_active Revoked
- 2006-02-21 AU AU2006213999A patent/AU2006213999B2/en active Active
- 2006-02-21 KR KR1020137034986A patent/KR20140016402A/ko not_active Ceased
- 2006-02-21 ES ES10011106.1T patent/ES2678448T3/es active Active
- 2006-02-21 US US11/359,286 patent/US8034375B2/en active Active
- 2006-02-21 ES ES06735710T patent/ES2375828T3/es active Active
- 2006-02-21 LT LTEP10011106.1T patent/LT2301531T/lt unknown
- 2006-02-21 HU HUE17165979A patent/HUE049789T2/hu unknown
- 2006-02-21 SI SI200632272T patent/SI2301531T1/sl unknown
- 2006-02-21 PL PL06735710T patent/PL1853250T3/pl unknown
- 2006-02-21 CA CA2902071A patent/CA2902071C/en active Active
- 2006-02-21 SG SG201007821-0A patent/SG166775A1/en unknown
- 2006-02-21 EP EP10011106.1A patent/EP2301531B1/en active Active
- 2006-02-21 SI SI200632377T patent/SI3248600T1/sl unknown
- 2006-02-21 ZA ZA200707491A patent/ZA200707491B/xx unknown
- 2006-02-21 ES ES17165979T patent/ES2802541T3/es active Active
- 2006-02-21 MX MX2011009748A patent/MX339142B/es unknown
- 2006-02-21 KR KR1020197012570A patent/KR20190062506A/ko not_active Ceased
- 2006-02-21 KR KR1020157009103A patent/KR101625347B1/ko active Active
- 2006-02-21 DK DK10011106.1T patent/DK2301531T3/en active
- 2006-02-21 WO PCT/US2006/006167 patent/WO2006089290A1/en not_active Ceased
- 2006-02-21 HU HUE10011106A patent/HUE038768T2/hu unknown
- 2006-02-21 PT PT06735710T patent/PT1853250E/pt unknown
- 2006-02-21 CN CN2013102337091A patent/CN103285395A/zh active Pending
- 2006-02-21 CN CN2006800116779A patent/CN101160123B/zh active Active
- 2006-02-21 LT LTEP17165979.0T patent/LT3248600T/lt unknown
- 2006-02-21 NZ NZ595313A patent/NZ595313A/xx unknown
- 2006-02-21 KR KR1020207009782A patent/KR20200038337A/ko not_active Ceased
- 2006-02-21 JP JP2007556407A patent/JP5769358B2/ja active Active
- 2006-02-21 KR KR1020187031184A patent/KR101976003B1/ko active Active
- 2006-02-21 EP EP06735710A patent/EP1853250B1/en not_active Revoked
- 2006-02-21 PT PT171659790T patent/PT3248600T/pt unknown
- 2006-02-21 DK DK17165979.0T patent/DK3248600T3/da active
- 2006-02-21 CA CA3054535A patent/CA3054535A1/en not_active Abandoned
- 2006-02-21 KR KR1020177021183A patent/KR101914254B1/ko active Active
- 2006-02-21 SI SI200631217T patent/SI1853250T1/sl unknown
- 2006-02-21 CN CN201510411744.7A patent/CN105288630A/zh active Pending
- 2006-02-21 BR BRPI0607809-5A patent/BRPI0607809A2/pt not_active Application Discontinuation
- 2006-02-21 EP EP20154548.0A patent/EP3698783A1/en not_active Withdrawn
- 2006-02-21 PL PL17165979T patent/PL3248600T3/pl unknown
- 2006-02-21 PL PL10011106T patent/PL2301531T3/pl unknown
- 2006-02-21 MX MX2007009960A patent/MX2007009960A/es active IP Right Grant
- 2006-02-21 KR KR1020167013205A patent/KR101764375B1/ko active Active
- 2006-02-21 AT AT06735710T patent/ATE531365T1/de active
- 2006-02-21 PT PT100111061T patent/PT2301531T/pt unknown
- 2006-02-21 NZ NZ560879A patent/NZ560879A/en unknown
- 2006-02-21 RU RU2007134571/15A patent/RU2452482C2/ru active
- 2006-02-21 MX MX2015016754A patent/MX383644B/es unknown
- 2006-02-21 KR KR1020077021327A patent/KR20070114753A/ko not_active Ceased
- 2006-10-06 US US11/544,242 patent/US8257733B2/en active Active
-
2007
- 2007-07-20 US US11/880,314 patent/US7780984B2/en active Active
- 2007-08-15 IL IL185288A patent/IL185288A/en active IP Right Grant
-
2008
- 2008-12-12 US US12/334,115 patent/US7758891B2/en active Active
-
2011
- 2011-09-08 US US13/228,323 patent/US8268348B2/en active Active
-
2012
- 2012-01-05 CY CY20121100013T patent/CY1112907T1/el unknown
- 2012-02-22 RU RU2012106620A patent/RU2632103C2/ru active
- 2012-06-21 IL IL220547A patent/IL220547A0/en unknown
- 2012-07-12 JP JP2012156721A patent/JP2012193205A/ja not_active Withdrawn
- 2012-08-01 US US13/564,633 patent/US20130195922A1/en not_active Abandoned
- 2012-08-14 US US13/585,696 patent/US9101543B2/en active Active
-
2013
- 2013-01-09 JP JP2013001664A patent/JP2013064014A/ja not_active Withdrawn
- 2013-02-25 US US13/776,481 patent/US20140023717A1/en not_active Abandoned
- 2013-02-25 US US13/776,484 patent/US20140017315A1/en not_active Abandoned
-
2014
- 2014-06-18 LU LU92484C patent/LU92484I2/xx unknown
- 2014-06-19 CY CY2014023C patent/CY2014023I1/el unknown
- 2014-08-25 US US14/468,127 patent/US20150079177A1/en not_active Abandoned
- 2014-09-05 JP JP2014180852A patent/JP6092824B2/ja active Active
-
2015
- 2015-04-30 JP JP2015092577A patent/JP6513467B2/ja active Active
-
2016
- 2016-10-07 JP JP2016198882A patent/JP6685875B2/ja active Active
-
2017
- 2017-06-06 IL IL252715A patent/IL252715A0/en unknown
- 2017-10-18 US US15/787,586 patent/US20180169017A1/en not_active Abandoned
-
2018
- 2018-03-19 JP JP2018050735A patent/JP2018090643A/ja active Pending
- 2018-07-20 CY CY20181100760T patent/CY1120445T1/el unknown
-
2019
- 2019-10-28 JP JP2019195457A patent/JP2020012005A/ja not_active Withdrawn
-
2020
- 2020-04-02 IL IL273765A patent/IL273765A/en unknown
- 2020-06-25 CY CY20201100579T patent/CY1123110T1/el unknown
Patent Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2001089522A1 (en) * | 2000-05-19 | 2001-11-29 | American Bioscience, Inc. | Compositions and methods for administration of pharmacologically active compounds |
Non-Patent Citations (4)
| Title |
|---|
| BELLON J.R. et al. Concurrent radiation therapy and paclitaxel or docetaxel chemotherapy in high-risk breast cancer. Int J Radiat Oncol Biol Phys. 2000 Sep 1;48(2):393-397, . * |
| BELLON J.R. et al. Concurrent radiation therapy and paclitaxel or docetaxel chemotherapy in high-risk breast cancer. Int J Radiat Oncol Biol Phys. 2000 Sep 1;48(2):393-397, реферат. * |
| N.K. IBRAHIM et al. Phase I and Pharmacokinetic Study of ABI-007, a Cremophor-free, Protein-stabilized, Nanoparticle Formulation of Paclitaxel. Clin Cancer Res May 2002 8; 1038-1044, весь текст. SAFRAN H et al. Paclitaxel and concurrent radiation therapy for locally advanced adenocarcinomas of the pancreas, stomach, and gastroesophageal junction. Semin Radiat Oncol. 1999 Apr;9(2 Suppl 1):53-57, реферат. FORNENTI S.C. et al. Concurrent paclitaxel and radiation therapy for breast cancer. Semin Radiat Oncol. 1999 Apr;9(2 Suppl 1), 34-42. J. L. BLUM et al. Long term disease control in taxane-refractory metastatic breast cancer treated with nab paclitaxel. Journal of Clinical Oncology, 2004 ASCO Annual Meeting Proceedings (Post-Meeting Edition). Vol 22, No 14S (July 15 Supplement), 2004: 543. найдено в Иинтернет 17.05.2016, найдено на http://meeting.ascopubs.org/cgi/content/short/22/14_suppl/543. American Pharmaceutical Partners Presents Data on High Dose Weekly ABRAXANE(TM) in Taxane-Refra * |
| SAFRAN H et al. Paclitaxel and concurrent radiation therapy for locally advanced adenocarcinomas of the pancreas, stomach, and gastroesophageal junction. Semin Radiat Oncol. 1999 Apr;9(2 Suppl 1):53-57, . FORNENTI S.C. et al. Concurrent paclitaxel and radiation therapy for breast cancer. Semin Radiat Oncol. 1999 Apr;9(2 Suppl 1), 34-42. J. L. BLUM et al. Long term disease control in taxane-refractory metastatic breast cancer treated with nab paclitaxel. Journal of Clinical Oncology, 2004 ASCO Annual Meeting Proceedings (Post-Meeting Edition). Vol 22, No 14S (July 15 Supplement), 2004: 543. найдено в Иинтернет 17.05.2016, найдено на http://meeting.ascopubs.org/cgi/content/short/22/14_suppl/543. American Pharmaceutical Partners Presents Data on High Dose Weekly ABRAXANE(TM) in Taxane-Refractory Metastatic Breast Cancer Patients. Dec 13, 2004, 00:00 ET from American Pharmaceutical Partners, Inc. найдено в Иинтернет 17.05.2016, найдено на http://www.prnewswire.com/news-releases/american-ph * |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| RU2632103C2 (ru) | Комбинации и способы введения терапевтических средств и комбинированной терапии | |
| RU2673805C2 (ru) | Комбинации и способы введения терапевтических агентов и комбинированная терапия | |
| US8735394B2 (en) | Combinations and modes of administration of therapeutic agents and combination therapy | |
| AU2016204834B2 (en) | Combinations and modes of administration of therapeutic agents and combination therapy | |
| AU2012201568B2 (en) | Combinations and modes of administration of therapeutic agents and combination therapy | |
| HK40035869A (en) | Combinations and modes of administration of therapeutic agents and combination therapy | |
| HK1250006B (en) | Combinations and modes of administration of therapeutic agents and combination therapy | |
| HK1155067A (en) | Combinations and modes of administration of therapeutic agents and combination therapy | |
| HK1109589B (en) | Combinations and modes of administration of therapeutic agents and combination therapy | |
| HK1155067B (en) | Combinations and modes of administration of therapeutic agents and combination therapy | |
| HK1134256A (en) | Nanoparticles of paclitaxel and albumin in combination with bevacizumab against cancer | |
| HK1134256B (en) | Nanoparticles of paclitaxel and albumin in combination with bevacizumab against cancer |