RU2495882C2 - Гуманизированные антитела к cd19 и их применение для лечения онкологического, связанного с трансплантацией и аутоиммунного заболевания - Google Patents
Гуманизированные антитела к cd19 и их применение для лечения онкологического, связанного с трансплантацией и аутоиммунного заболевания Download PDFInfo
- Publication number
- RU2495882C2 RU2495882C2 RU2009112723/10A RU2009112723A RU2495882C2 RU 2495882 C2 RU2495882 C2 RU 2495882C2 RU 2009112723/10 A RU2009112723/10 A RU 2009112723/10A RU 2009112723 A RU2009112723 A RU 2009112723A RU 2495882 C2 RU2495882 C2 RU 2495882C2
- Authority
- RU
- Russia
- Prior art keywords
- seq
- antibody
- amino acid
- region
- acid sequence
- Prior art date
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2803—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/04—Drugs for disorders of the alimentary tract or the digestive system for ulcers, gastritis or reflux esophagitis, e.g. antacids, inhibitors of acid secretion, mucosal protectants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/08—Drugs for disorders of the alimentary tract or the digestive system for nausea, cinetosis or vertigo; Antiemetics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/16—Drugs for disorders of the alimentary tract or the digestive system for liver or gallbladder disorders, e.g. hepatoprotective agents, cholagogues, litholytics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
- A61P11/06—Antiasthmatics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/12—Drugs for disorders of the urinary system of the kidneys
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P15/00—Drugs for genital or sexual disorders; Contraceptives
- A61P15/08—Drugs for genital or sexual disorders; Contraceptives for gonadal disorders or for enhancing fertility, e.g. inducers of ovulation or of spermatogenesis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/02—Drugs for dermatological disorders for treating wounds, ulcers, burns, scars, keloids, or the like
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/04—Antipruritics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/06—Antipsoriatics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/14—Drugs for dermatological disorders for baldness or alopecia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/02—Drugs for skeletal disorders for joint disorders, e.g. arthritis, arthrosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/08—Drugs for skeletal disorders for bone diseases, e.g. rachitism, Paget's disease
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P21/00—Drugs for disorders of the muscular or neuromuscular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P27/00—Drugs for disorders of the senses
- A61P27/02—Ophthalmic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/02—Nutrients, e.g. vitamins, minerals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/08—Drugs for disorders of the metabolism for glucose homeostasis
- A61P3/10—Drugs for disorders of the metabolism for glucose homeostasis for hyperglycaemia, e.g. antidiabetics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/04—Antibacterial agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/02—Antineoplastic agents specific for leukemia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/04—Immunostimulants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/06—Immunosuppressants, e.g. drugs for graft rejection
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/08—Antiallergic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P5/00—Drugs for disorders of the endocrine system
- A61P5/14—Drugs for disorders of the endocrine system of the thyroid hormones, e.g. T3, T4
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P5/00—Drugs for disorders of the endocrine system
- A61P5/38—Drugs for disorders of the endocrine system of the suprarenal hormones
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P5/00—Drugs for disorders of the endocrine system
- A61P5/38—Drugs for disorders of the endocrine system of the suprarenal hormones
- A61P5/40—Mineralocorticosteroids, e.g. aldosterone; Drugs increasing or potentiating the activity of mineralocorticosteroids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
- A61P7/04—Antihaemorrhagics; Procoagulants; Haemostatic agents; Antifibrinolytic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
- A61P7/06—Antianaemics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/04—Inotropic agents, i.e. stimulants of cardiac contraction; Drugs for heart failure
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/14—Vasoprotectives; Antihaemorrhoidals; Drugs for varicose therapy; Capillary stabilisers
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2896—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against molecules with a "CD"-designation, not provided for elsewhere
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N5/00—Undifferentiated human, animal or plant cells, e.g. cell lines; Tissues; Cultivation or maintenance thereof; Culture media therefor
- C12N5/10—Cells modified by introduction of foreign genetic material
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/30—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants from tumour cells
- C07K16/3061—Blood cells
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/20—Immunoglobulins specific features characterized by taxonomic origin
- C07K2317/24—Immunoglobulins specific features characterized by taxonomic origin containing regions, domains or residues from different species, e.g. chimeric, humanized or veneered
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/40—Immunoglobulins specific features characterized by post-translational modification
- C07K2317/41—Glycosylation, sialylation, or fucosylation
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/52—Constant or Fc region; Isotype
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/55—Fab or Fab'
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
- C07K2317/565—Complementarity determining region [CDR]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
- C07K2317/567—Framework region [FR]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/73—Inducing cell death, e.g. apoptosis, necrosis or inhibition of cell proliferation
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/73—Inducing cell death, e.g. apoptosis, necrosis or inhibition of cell proliferation
- C07K2317/732—Antibody-dependent cellular cytotoxicity [ADCC]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/77—Internalization into the cell
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/90—Immunoglobulins specific features characterized by (pharmaco)kinetic aspects or by stability of the immunoglobulin
- C07K2317/92—Affinity (KD), association rate (Ka), dissociation rate (Kd) or EC50 value
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02A—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE
- Y02A50/00—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE in human health protection, e.g. against extreme weather
- Y02A50/30—Against vector-borne diseases, e.g. mosquito-borne, fly-borne, tick-borne or waterborne diseases whose impact is exacerbated by climate change
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Life Sciences & Earth Sciences (AREA)
- Medicinal Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Veterinary Medicine (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Pharmacology & Pharmacy (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Immunology (AREA)
- Diabetes (AREA)
- Genetics & Genomics (AREA)
- Hematology (AREA)
- Biochemistry (AREA)
- Endocrinology (AREA)
- Dermatology (AREA)
- Biophysics (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Molecular Biology (AREA)
- Pulmonology (AREA)
- Physical Education & Sports Medicine (AREA)
- Cardiology (AREA)
- Heart & Thoracic Surgery (AREA)
- Biomedical Technology (AREA)
- Oncology (AREA)
- Obesity (AREA)
- Orthopedic Medicine & Surgery (AREA)
- Rheumatology (AREA)
- Microbiology (AREA)
- Communicable Diseases (AREA)
- Zoology (AREA)
- Wood Science & Technology (AREA)
- Biotechnology (AREA)
- Reproductive Health (AREA)
Abstract
Настоящее изобретение относится к области иммунологии. Предложено гуманизированное моноклональное антитело против CD19 человека, полученное из антитела HB12B, и его фрагмент, охарактеризованные через аминокислотные последовательности вариабельных доменов. Также рассмотрены нуклеиновые кислоты, кодирующие полипептиды, содержащие последовательности вариабельных доменов, и клетка, экспрессирующая антитело по изобретению, а также фармацевтическая композиция и способ лечения В-клеточного заболевания или нарушения у человека. Настоящее изобретение может найти дальнейшее применение в лечении различные заболеваний, ассоциированных с CD19, в том числе аутоиммунных заболеваний, и предупреждении или лечении реакции трансплантат-против хозяина (GVHD), гуморального отторжения и посттрансплантационного лимфопролиферативного нарушения у человека-реципиента трансплантатов. 6 н. и 15 з.п. ф-лы, 45 ил., 40 табл., 7 пр.
Description
1. Введение
Настоящее изобретение относится к человеческим, гуманизированным или химерным антителам к CD19, которые связываются с человеческим антигеном CD19. Настоящее изобретение относится также к композициям, которые содержат человеческие, гуманизированные или химерные антитела к CD19, которые могут опосредовать один или несколько из следующих видов активности: комплементзависимая клеточно-опосредованная цитотоксичность (CDC), антителообусловленная клеточно-зависимая цитотоксичность (ADCC) и запрограммированная гибель клеток (апоптоз). Настоящее изобретение относится также к композициям, которые содержат человеческие, гуманизированные или химерные антитела к CD19 человеческого изотипа IgG1 и/или IgG3, а также к композициям, которые содержат человеческие, гуманизированные или химерные антитела к CD19 человеческого изотипа IgG2 и/или IgG4, которые могут опосредовать у человека ADCC, CDC или апоптоз. Настоящее изобретение относится также к способам лечения В-клеточных нарушений или заболеваний у человека, включая В-клеточные злокачественные состояния, с помощью терапевтических человеческих, гуманизированных или химерных антител к CD19, которые связываются с человеческим антигеном CD19. Настоящее изобретение относится к способам лечения и предупреждения аутоиммунного заболевания, а также лечения и предупреждения реакции «трансплантат-против-хозяина» (GVHD), гуморального отторжения и посттрансплантационного лимфопролиферативного нарушения людей-реципиентов трансплантатов с помощью человеческих, гуманизированных или химерных антител к CD19, которые связываются с человеческим антигеном CD19.
2. Предпосылки создания изобретения
В-клетки экспрессируют на клеточной поверхности широкий набор молекул в процессе своей дифференцировки и пролиферации. Их примерами являются такие маркеры поверхности лейкоцитов, как CD10, CD19, CD20, CD21, CD22, CD23, CD24, CD37, CD53, CD72, CD74, CD75, CD77, CD79a, CD79b, CD80, CD81, CD82, CD83, CD84, CD85 и CD86. Эти маркеры, как правило, рассматриваются в качестве мишеней для терапевтических агентов, предназначенных для лечения В-клеточных нарушений или заболеваний, таких как В-клеточные злокачественные состояния, аутоиммунные заболевания и отторжение трансплантата. Можно создавать антитела, которые специфически связываются с ними и некоторые из них прошли оценку в качестве терапевтического агента, предназначенного для лечения заболеваний и нарушений.
Например, установлено, что терапевтические подходы, основанные на применении химерного или меченного с помощью радиоактивной метки моноклонального антитела (МАт) к CD20, т.е. находящейся на клеточной поверхности молекулы, специфической в отношении зрелых В-клеток и их злокачественных копий, являются эффективными для лечения in vivo не-ходжкинской лимфомы (Tedder и др., Immunol. Today 15, 1994, cc.450-454; Press и др., Hematology, 2001, cc.221-240; Kaminski и др., N. Engl. J. Med. 329, 1993, cc.459-465; Weiner, Semin. Oncol. 26, 1999, cc.43-51; Onrust и др., Drugs 58, 1999, cc.79-88; McLaughlin и др., Oncology 12, 1998, cc.1763-1769; Reffn др., Blood 83, 1994, cc.435-445; Mloney и др., Blood 90, 1997, cc.2188-2195; Malone и др., J. Clin. Oncol. 15, 1997, cc.3266-3274; Anderson и др., Biochem. Soc. Transac. 25, 1997, cc.705-708). Установлено, что терапия, основанная на применении моноклональных антител к CD20, обладает в том числе эффективностью в отношении ослабления проявлений ревматоидного артрита, системной красной волчанки, идиопатической тромбоцитопенической пурпуры и гемолитической анемии, а также других опосредуемых иммунной системой заболеваний (Silverman и др., Arthritis Rheum. 48, 2002, cc.1484-1492; Edwards и др., Rheumatology 40, 2001, cc.1-7; De Vita и др., Arthritis Rheumatism 46, 2002, cc.2029-2033; Leandro и др., Ann. Rheum. Dis. 61, 2002, cc.883-888; Leandro и др., Arthritis Rheum. 46, 2001, cc.2673-2677). Антитело к CD20 (IgG1) ритуксан (RITUXAN) с успехом применяют для лечения определенных заболеваний, таких как иммунная тромбоцитопеническая пурпура взрослых, ревматоидный артрит и аутоиммунная гемолитическая анемия (Cured и др., WO 00/67796). Несмотря на эффективность указанных терапий, В-клеточное истощение (истощение популяции В-клеток (элиминация В-клеток)) происходит менее эффективно, когда В-клетки не экспрессируют CD20 или экспрессируют низкие уровни CD20 (например, на поверхности пре-В-клеток или незрелых В-клеток), или когда экспрессия CD20 отсутствует из-за направленной на CD20 иммунотерапии (Smith и др., Oncogene 22, 2003, cc.7359-7368).
В данной области известны мышиные моноклональные антитела к CD19, например HD37 (IgG1, каппа) (фирма DAKO North America, Inc, Карпинтерия, шт.Калифорния), BU12 (Callard и др., J. Immunology, 148(10), 1992, cc.2983-2987), 4G7 (IgG1) (Meeker и др., Hybridoma, 3(4), зима 1984 г., cc.305-320), J4.119 (фирма Beckman Coulter, Крефельд, Германия), В43 (фирма PharMingen, Сан-Диего, шт.Калифорния), SJ25C1 (фирма BD PharMingen, Сан-Диего, шт.Калифорния), FMC63 (IgG2a) (Zola и др., Immunol. Cell. Biol. 69 (РТб), 1991, cc.411-422); Nicholson и др., Mol. Immunol., 34:1157-1165 (1997); Pietersz и др., Cancer Immunol. Immonotherapy, 41, 1995, cc.), 89 В(В4) (IgG1) (фирма Beckman Coulter, Майами, шт.Флорида); Nadler и др., J. Immunol., 131, 1983, cc.244-250), и/или HD237 (IgG2b) (Fourth International Workshop on Human Leukocyte Differentiation Antigens, Vienna, Austria, 1989; и Pezzutto и др., J. Immunol., 138(9), 1987, cc.2793-2799). Антитела к CD19 или их конъюгаты могут также обладать терапевтическим потенциалом на различных созданных на животных моделях В-клеточных нарушений и заболеваний (Falvell и др., Br. J. Hematol. 134(2), 2006, cc.157-170; Vallera и др., din. Cancer Res. 11(21), 2005, cc.7920-7928; Yazawa и др., Proc. Natl. Acad. Sci. USA 102(42), 2005, cc.15178-15183). В частности, применение гуманизированных антител к CD19 описано для лечения В-клеточного заболевания, такого как лимфома, лейкоз или аутоиммунное заболевание (см. Hansen, опубликованная заявка на патент США 2005/0070693).
Несмотря на современные успехи в терапии рака, В-клеточные злокачественные состояния, такие как не-ходжкинские лимфомы В-клеточных подтипов и хронический лимфолейкоз, являются основными заболеваниями, с которыми связана смертность от рака. Таким образом, существует выраженная потребность в дополнительных, улучшенных терапевтических схемах лечения В-клеточных злокачественных состояний.
В настоящее время известно, что как клеточный (опосредуемый Т-клетками), так и гуморальный (антителообусловленный, опосредуемый В-клетками) иммунитет играет важную роль в отторжении трансплантатов. Хотя важная роль опосредуемого Т-клетками иммунитета в отторжении трансплантата хорошо изучена, в настоящее время только начинает проясняться решающая роль гуморального иммунитета в остром и хроническом отторжении. Таким образом, значительная часть успехов, достигнутых в лечении и предупреждении отторжения трансплантата, связана с созданием терапевтических агентов, мишенью которых является Т-клеточная активация. Первое терапевтическое моноклональное антитело, разрешенное FDA для лечения отторжения трансплантата, было мышиное моноклональное антитело ORTHOCLONE-OKT3™ (муромонаб-CD3), к СО3-рецептору Т-клеток. ОКТ3 объединяли с некоторыми другими антилимфоцитарными антителами, включая моноклональные антитела к CD52 CAMPATH™, CAMPATH-1G, САМРАТН-1Н (алемтузумаб), и САМРАТН-1М), и препаратами поликлональных антител к тимоцитам (обозначены как антитимоцитный глобулин, или «ATG», который называют также «тимоглобин» или «тимоглобулин»). Другие Т-клеточные антитела, разрешенные для предупреждения отторжения трансплантата, включают химерное моноклональное антитело SIMULECT™ (базиликсимаб) и гуманизированное моноклональное антитело ZENAPAX™ (даклизумаб), мишенью их обоих является высокоаффинный IL-2-рецептор активированных Т-клеток.
Первоначально считалось, что важность гуморального иммунитета в отторжении трансплантата ограничена гиперострым отторжением, при котором реципиент трансплантата несет антитела к HLA человека-донора перед трансплантацией, что приводит к быстрой деструкции трансплантата в отсутствии эффективной терапевтической схемы подавления антител. В настоящее время стало очевидно, что гуморальный иммунитет является также важным фактором, опосредующим как острое, так и хроническое отторжение. Например, клинические исследования продемонстрировали, что срок жизнеспособности трансплантата у пациентов, в организме которых могут образовываться аллоантитела к антигенам класса I или класса II HLA (обозначенные также как «аллоантитела к антигенам ГКГ (аллоантитела к ГКГ (главный комплекс гистосовместимости)), снижался по сравнению со сроком жизнеспособности трансплантата у пациентов, в организме которых не могли образовываться такие антитела. Клинические и экспериментальные данные свидетельствуют также о том, что другие специфические для донора аллоантитела и аутоантитела представляют собой имеющие решающее значение медиаторы отторжения. Обзор данных современных исследований, подтверждающих роль специфических для донора антител в отторжении аллотрансплантата, представлен у Rifle и др., Transplantation, 79, 2005, cc.14-18. Таким образом, из-за относительно недавнего понимания роли гуморального иммунитета в остром и хроническом отторжении трансплантата, современные терапевтические агенты и стратегии, направленные на гуморальный иммунитет, существенно менее развиты, чем направленные на клеточный иммунитет. Таким образом, в данной области существует необходимость в создании улучшенных реагентов и методов лечения и предупреждения отторжения трансплантата, т.е. реакции «трансплантат-против-хозяина» (GVHD), гуморального отторжения и посттрансплантационного лимфопролиферативного нарушения у человека-реципиента трансплантата.
Аутоиммунные заболевания в целом являются причиной высокого уровня заболеваемости и потери трудоспособности. Оценка данных о встречаемости, собранных с 1965 по 1995 гг., позволила предположить, что примерно у 1,2 миллиона человек может развиться новое аутоиммунное заболевание в следующие пять лет. Jacobsen с соавторами (Clin Immunol. Immunopathol. 84, 1997, с.223) изучили порядка 130 опубликованных исследований и определили, что в 1996 г. 8,5 миллионов человек в Соединенный Штатах (3,2% популяции) страдали по меньшей мере одним из 24 аутоиммунных заболеваний, которые оценивали в этих исследованиях. С учетом основной роли аутоиммунных заболеваний в общественном здравоохранении необходимо создание эффективных и безопасных путей лечения этих многочисленных нарушений. Таким образом, в данной области существует необходимость в улучшенных реагентах и методах лечения аутоиммунного заболевания.
3. Краткое изложение сущности изобретения
Настоящее изобретение относится к человеческим, гуманизированным или химерным антителам к CD19, которые связываются с человеческим антигеном CD19, а также к композициям, содержащим эти антитела. Одним из вариантов осуществления настоящего изобретения являются химерные и гуманизированные версии мышиных моноклональных антител к CD19, такие как НВ12А и НВ12В.
В другом варианте осуществления изобретения антитела к CD19, предлагаемые в изобретении, содержат один, два, три, четыре, пять или все шесть CDR HB12A (клон B410F12-2-A6-C2, депонированный в Американской коллекции типовых культур («АТСС») 11 февраля 2005 г., регистрационный номер АТСС РТА-6580) или НВ12В (клон В43Н12-3-В2-В6, депонированный в Американской коллекции типовых культур («АТСС») 11 февраля 2005 г., регистрационный номер АТСС РТА-6581).
Аминокислотные последовательности CDR1, CDR2 и CDR3 вариабельной области тяжелой цепи HB12A, определенные по номенклатуре Кэбота, представлены в SEQ ID NO:6, SEQ ID NO:8 и SEQ ID NO:10 соответственно. Аминокислотные последовательности CDR1, CDR2 и CDR3 вариабельной области легкой цепи HB12A определенные по номенклатуре Кэбота, представлены в SEQ ID NO:12, SEQ ID NO:14 и SEQ ID NO:16, соответственно. Аминокислотные последовательности CDR1, CDR2 и CDR3 вариабельной области тяжелой цепи НВ12В, определенные по номенклатуре Кэбота, представлены SEQ ID NO:22, SEQ ID NO:24 и SEQ ID NO:26 соответственно. Аминокислотные последовательности CDR1, CDR2 и CDR3 вариабельной области легкой цепи ИВ 12 В, определенные по номенклатуре Кэбота, представлены в SEQ ID NO:28, SEQ ID NO:30 и SEQ ID NO:32 соответственно. В одном из вариантов осуществления изобретения антитело к CD19, предлагаемое в изобретении, содержит один, два, три, четыре, пять или шесть CDR, которые имеют аминокислотную последовательность CDR, представленную в таблице 1.
В одном из вариантов осуществления изобретения антитело к CD19, предлагаемое в изобретении, может содержать один или несколько каркасных участков НВ12А или НВ12В. В одном из вариантов осуществления изобретения антитело, предлагаемое в изобретении, может содержать также каркасные участки (FW) тяжелой и/или легкой цепи из человеческого антитела (например, из последовательности антитела человеческой зародышевой линии, такой как VH3-72, JH4, Vk A10 или Jk4), где человеческие каркасные участки могут содержать одну или несколько мутаций, при которых человеческий остаток FW заменяют на соответствующий остаток, присутствующий в тяжелой или легкой цепи родительского мышиного антитела (например, НВ12А или НВ12В).
В одном из вариантов осуществления изобретения антитело к CD19, предлагаемое в изобретении, может содержать один или несколько CDR, имеющих аминокислотную последовательность CDR, представленную в таблице 1, и может содержать также один или несколько каркасных участков (FW) VH-области тяжелой цепи, обозначенной как HB12B-(3-72/JH4) (SEQ ID NO:34). В другом варианте осуществления изобретения антитело к CD19, предлагаемое в изобретении, содержит один или несколько CDR, которые имеют аминокислотную последовательность CDR, представленную в таблице 1, и содержит также один или несколько каркасных участков (FW) VH-области тяжелой цепи, обозначенной как HB12B-(3-72/JH4) (SEQ ID NO:34). В одном из вариантов осуществления изобретения антитело к CD19, предлагаемое в изобретении, может содержать один или несколько CDR, имеющих аминокислотную последовательность CDR, представленную в таблице 1, и может содержать также один или несколько каркасных участков (FW) VK-области легкой цепи, обозначенной как HB12B-(A10-Jk4) (SEQ ID NO:52). В одном из вариантов осуществления изобретения антитело к CD19, предлагаемое в изобретении, может содержать один или несколько CDR, имеющих аминокислотную последовательность CDR, представленную в таблице 1, и может содержать также один или несколько каркасных участков (FW) VK-области легкой цепи, обозначенной как HB12B-(A10-Jk4) (SEQ ID NO:52). В одном из вариантов осуществления изобретения антитело к CD19, предлагаемое в изобретении, может содержать один или несколько CDR, имеющих аминокислотную последовательность CDR, представленную в таблице 1, выше, и может содержать также один или несколько каркасных участков VK-области легкой цепи, обозначенной как HB12B-(A10-Jk4), и один или несколько каркасных участков VH-области тяжелой цепи, обозначенной HB12B-(3-72/JH4). В другом варианте осуществления изобретения антитело к CD19, предлагаемое в изобретении, может содержать один или несколько CDR, имеющих аминокислотную последовательность CDR, представленную в таблице 1, выше, и может содержать также один или несколько каркасных участков VK-области легкой цепи, обозначенной как HB12B-(A10-Jk4), и один или несколько каркасных участков VH-области тяжелой цепи, обозначенной как НВ12В-(3-72/JH4).
Например, в одном из вариантов осуществления изобретения гуманизированное антитело к CD19, предлагаемое в изобретении, может содержать вариабельную область тяжелой цепи, которая включает четыре каркасных участка, т.е. FW1, FW2, FW3 и FW4, где FW1 содержит аминокислотную последовательность SEQ ID NO:36, FW2 содержит аминокислотную последовательность SEQ ID NO:38, FW3 содержит аминокислотную последовательность SEQ ID NO:40 и FW4 содержит аминокислотную последовательность SEQ ID NO:42. В одном из вариантов осуществления изобретения гуманизированное антитело к CD19, предлагаемое в изобретении, содержит вариабельную область тяжелой цепи, которая включает четыре каркасных участка, т.е. FW1, FW2, FW3 и FW4, где FW1 содержит аминокислотную последовательность SEQ ID NO:36, FW2 содержит аминокислотную последовательность SEQ ID NO:38, FW3 содержит аминокислотную последовательность SEQ ID NO:40 и FW4 содержит аминокислотную последовательность SEQ ID NO:42.
Кроме того, гуманизированное моноклональное антитело к CD19, предлагаемое в изобретении, может содержать вариабельную область легкой цепи, которая включает четыре каркасных участка, т.е. FW1, FW2, FW3 и FW4, где FW1 сдержит аминокислотную последовательность SEQ ID NO:54; где FW2 содержит аминокислотную последовательность, выбранную из группы, включающей SEQ ID NO:56, SEQ ID NO:64 и SEQ ID NO:72; где FW3 содержит аминокислотную последовательность, выбранную из группы, включающей SEQ ID NO:58 и SEQ ID NO:66; и где FW4 содержит аминокислотную последовательность SEQ ID NO:60. В одном из вариантов осуществления изобретения гуманизированное моноклональное антитело к CD19, предлагаемое в изобретении, содержит вариабельную область легкой цепи, которая включает четыре каркасных участка, т.е. FW1, FW2, FW3 и FW4, где FW1 содержит аминокислотную последовательность SEQ ID NO:54; где FW2 содержит аминокислотную последовательность, выбранную из группы, включающей SEQ ID NO:56, SEQ ID NO:64 и SEQ ID NO:72; где FW3 содержит аминокислотную последовательность, выбранную из группы, включающей SEQ ID NO:58 и SEQ ID NO:66; и где FW4 содержит аминокислотную последовательность SEQ ID NO:60.
В одном из вариантов осуществления изобретения антитело к CD19, предлагаемое в изобретении, может содержать VH, включающую аминокислотную последовательность SEQ ID NO:237, или VL, включающую аминокислотную последовательность SEQ ID NO:238, где антитело связывается с человеческим антигеном CD19. В другом варианте осуществления изобретения антитело к CD19, предлагаемое в изобретении, содержит VH, включающую аминокислотную последовательность SEQ ID NO:237, и VL, включающую аминокислотную последовательность SEQ ID NO:238.
В конкретных вариантах осуществления изобретения антитело к CD19, предлагаемое в изобретении, может содержать вариабельную область легкой цепи, выбранную из группы, включающей НВ12В VK (SEQ ID NO:20), НВ12В-(A10-Jk4) (SEQ ID NO:52), HB12B-364987 (SEQ ID NO:62), HB12B-3649 (SEQ ID NO:68), HB12B-36 (SEQ ID NO:70), HB12A VK (SEQ ID NO:4), 7E12 VK (SEQ ID NO:110), 14H5 VK(SEQID NO:111), 15D1 VK (SEQ ID NO:112), 16C9 VK(SEQ ID NO:113), 3C3 VK (SEQ ID NO:193), 3E5 VK (SEQ ID NO:194), 3D4 VK (SEQ ID NO:195), 3F1 VK (SEQ ID NO:196), 5B5 VK (SEQ ID NO:197), 6F7 VK (SEQ ID NO:198), 1C11 VK (SEQ ID NO:199), 2B11 VK (SEQ ID NO:200), 2D10 VK (SEQ ID NO:201), 5C11 VK (SEQ ID NO:202), 5D4 VK (SEQ ID NO:203), 6C11 VK (SEQ ID NO:204), 9G7 VK (SEQ ID NO:205), 1H4 VK (SEQ ID NO:206) и 5С4 VK (SEQ ID NO:207).
Конкретными вариантами осуществления настоящего изобретения является также антитело к CD19, которое содержит вариабельную область тяжелой цепи, выбранную из группы, включающей НВ12В VH (SEQ ID NO:18), НВ12В-(3-72/JH4) (SEQ ID NO:34), HB12A VH (SEQ ID NO:2), 7E12 VH (SEQ ID NO:102), 14H5 VH (SEQ ID NO:103), 15D1 VH (SEQ ID NO:104), 15D7 VH (SEQ ID NO:105), 16C4 VH (SEQ ID NO:106), 14H5-YG (SEQ ID NO:107), 14H5-DG (SEQ ID NO:108), 14H5-LG (SEQ ID NO:109), 1A7 VH (SEQ ID NO:191),, 3C3 VH (SEQ ID NO:191), 6C11 VH (SEQ ID NO:191), 9G7 (SEQ ID NO:191), 3B4 VH (SEQ ID NO:236), и 3F11 VH (SEQ ID NO:192).
В конкретном варианте осуществления изобретения антитело к CD19, предлагаемое в изобретении, содержит вариабельную область легкой цепи НВ12В-3649 (SEQ ID NO:68) и вариабельную область тяжелой цепи НВ12В-(3-72/JH4) (SEQ ID NO:34). Клон ДНК гуманизированного антитела к HCD19, которое содержит VH HB12B-(3-72/JH4), депонирован в Американской коллекции типовых культур («АТСС») 26 октября 2006 г. Клон ДНК гуманизированного антитела к hCD19, которое содержит VK НВ12В-3649, депонирован в Американской коллекции типовых культур («АТСС») 26 октября 2006 г
В одном из вариантов осуществления изобретения гуманизированное антитело к CD19, предлагаемое в изобретении, может связываться с человеческим CD19 с аффинностью, сопоставимой с аффинностью мышиных моноклональных антител НВ12А и/или НВ12В, или с аффинностью, сопоставимой с аффинностью антитела chHB12B, которое содержит НВ12В VH (SEQ ID NO:18) и НВ12В VK (SEQ ID NO:20).
Изобретение относится также к полинуклеотидам, содержащим нуклеотидную последовательность, которая кодирует человеческое, гуманизированное или химерное антитело к CD19, предлагаемое в изобретении, или его фрагменты. Изобретение относится также к полинуклеотидам, которые гибридизуются в строгих или расслабленных условиях гибридизации, которые указаны в настоящем описании, с полинуклеотидами, которые кодируют человеческое, гуманизированное или химерное антитело, специфически связывающееся с человеческим CD19.
Другим вариантом осуществления изобретения является вектор, содержащий одну или несколько нуклеотидных последовательностей, которые кодируют представленное в описании человеческое, гуманизированное или химерное антитело к CD19, или его фрагменты.
Настоящее изобретение относится также в выделенной клетке, которая содержит вектор, где вектор несет одну или несколько нуклеотидных последовательностей, которые кодируют человеческое, гуманизированное или химерное антитело к CD19, предлагаемое в изобретении, или его фрагменты.
Химерные, человеческие и гуманизированные моноклональные антитела к CD19, представленные в описании, включают антитела человеческого изотипа IgG1, IgG2, IgG3 или IgG4.
В одном из вариантов осуществления изобретения гуманизированное антитело к CD19, представленное в описании, опосредует антителообусловленную клеточно-зависимую цитотоксичность (ADCC), комплементзависимую клеточно-обусловленную цитотоксичность (CDC) и/или апоптоз.
Еще в одном варианте осуществления изобретения гуманизированное антитело к CD19, представленное в описании, ингибирует стимулируемую анти-IgM/CpG В-клеточную пролиферацию.
Настоящее изобретение относится также к фармацевтическим композициям, содержащим химерное, человеческое и гуманизированное антитело к CD19.
Еще одним объектом настоящего изобретения является способ лечения В-клеточного злокачественного состояния у человека, заключающийся в том, что вводят человеку, который нуждается в этом, в терапевтически эффективном количестве химерное, человеческое или гуманизированное моноклональное антитело к CD19.
Еще одним объектом настоящего изобретения является способ лечения аутоиммунного заболевания или нарушения у человека, заключающийся в том, что человеку, который нуждается в этом, вводят в терапевтически эффективном количестве химерное, человеческое или гуманизированное моноклональное антитело к CD19.
Настоящее изобретение относится также к способу лечения или предупреждения гуморального отторжения у несущего человеческий трансплантат пациента, заключающийся в том, что вводят человеку, который нуждается в этом, в терапевтически эффективном количестве химерное, человеческое или гуманизированное моноклональное антитело к CD19.
3.1. Определения
В контексте настоящего описания понятия «антитело» и «антитела» (иммуноглобулины) относится к моноклональным антителам (включая полноразмерные моноклональные антитела), поликлональные антитела, мультиспецифические антитела (например, биспецифические антитела), образованные по меньшей мере из двух интактных антител, человеческие антитела, гуманизированные антитела, несущие участки верблюжьих антител (камелизированные (camelised)) антитела, химерные антитела, одноцепочечные Fv (scFv), одноцепочечные антитела, имеющие один домен антитела, доменные антитела, Fab-фрагменты, F(ab')2-фрагменты, фрагменты антител, которые обладают требуемой биологической активностью, связанные дисульфидными мостиками Fv-фрагменты (sdFv) и антиидиотипические (анти-Id) антитела (включая, например, анти-Id антитела к антителам, предлагаемым в изобретении), внутренние тельца и эпитопсвязывающие фрагменты любого из указанных выше антител. В частности, к антителам относятся молекулы иммуноглобулинов и иммунологически активные фрагменты молекул иммуноглобулинов, т.е. молекул, которые содержат антигенсвязывающий центр. Молекулы иммуноглобулинов могут относится к любому типу (например, IgG, IgE, IgM, IgD, IgA и IgY), классу (например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2) или подклассу.
Нативные антитела, как правило, представляют собой гетеротетрамерные гликопротеины массой примерно 150000 Да, состоящие из двух идентичных легких (L) цепей и двух идентичных тяжелых (Н) цепей. Каждая легкая цепь сцеплена с тяжелой цепью с помощью одной ковалентной дисульфидной связи, однако количество дисульфидных мостиков варьируется между тяжелыми цепями иммуноглобулинов различных изотипов. Каждая тяжелая и легкая цепь имеет также правильно расположенные внутри цепи дисульфидные мостики. Каждая тяжелая цепь имеет на одном конце вариабельную область (VH), за которой следует определенное количество константных областей. Каждая легкая цепь имеет вариабельную область на одном конце (VL) и константную область на другом ее конце; константная область легкой цепи соответствует первой константной области тяжелой цепи, а вариабельная область легкой цепи соответствует вариабельной области тяжелой цепи. Легкие цепи классифицируются как лямбда-цепи или каппа-цепи на основе аминокислотной последовательности константой области легкой цепи. Вариабельную область легкой каппа-цепи можно обозначать также VK. Понятие «вариабельная область» в контексте настоящего описания можно применять также для описания вариабельной области тяжелой цепи или легкой цепи. Конкретные аминокислотные остатки, вероятно, образуют поверхность раздела между вариабельными областями легкой и тяжелой цепи. Такие антитела можно получать из организма любого млекопитающего, включая, но, не ограничиваясь только ими, человека, обезьян, свиней, лошадей, кроликов, собак, кошек, мышей и т.д.
Понятие «вариабельный» отражает тот факт, что определенные участки вариабельных областей значительно отличаются по их последовательности между антителами, и они ответственны за специфичность связывания каждого конкретного антитела с его конкретным антигеном. Однако вариабельность неравномерно распределена в вариабельных областях антител. Она концентрируется в сегментах, которые называют определяющими комплементарность участками (гипервариабельными участками) (CDR), присутствующими в вариабельных областях и легкой цепи, и тяжелой цепи. Более высококонсервативные участки вариабельных областей называют каркасными участкам (FW). Вариабельные области нативных тяжелых и легких цепей все содержат четыре FW-участка, которые главным образом определяют β-складчатую конфигурацию, соединенные тремя CDR, которые образуют петли, соединяющие и в некоторых случаях образующие часть β-складчатой структуры. CDR в каждой цепи поддерживаются в тесной близости связи друг с другом с помощью FW-участков и вместе с CDR другой цепи участвуют в образовании антигенсвязывающего центра антител (см. Kabat и др., Sequences of Proteins of Immunological Interest, 5-е изд., изд-во Public Health Service, National Institutes of Health, Bethesda, MD, 1991). Константные области, как правило, не принимают непосредственного участия в связывании антигенов, но могут влиять на аффинность связывания антигенов и могут обладать различными эффекторными функциями, такими как участие антитела в ADCC, CDC и/или апоптозе.
Понятие «гипервариабельный участок» в контексте настоящего описания относится к аминокислотным остаткам антитела, которые ассоциированы со связыванием с антигеном. Гипервариабельные участки включают аминокислотные остатки из «определяющих комплементарность участков» или «CDR» (например, остатки 24-34 (L1), 50-56 (L2) и 89-97 (L3) вариабельной области легкой цепи и остатки 31-35 (H1), 50-65 (Н2) и 95-102 (Н3) вариабельной области тяжелой цепи; Kabat и др., Sequences of Proteins of Immunological Interest, 5-е изд., изд-во Public Health Service, National Institutes of Health, Bethesda, MD, 1991) и/или остатки из «гипервариабельной петли» (например, остатки 26-32 (LI), 50-52 (L2) и 91-96 (L3) вариабельной области легкой цепи и 26-32 (H1), 53-55 (Н2) и 96-101 (Н3) вариабельной области тяжелой цепи; Chothia и Lesk, J. Mol. Biol., 196, 1987, cc.901-917). Остатки «каркасного участка» или «FW» представляют собой остатки вариабельной области, фланкирующие CDR. Остатки FW присутствуют в химерных, гуманизированных, человеческих, доменных антителах, двойных антителах, антителах фирмы Vaccibody (vaccibody-антитела), линейных антителах и биспецифических антителах.
Понятие «моноклональное антитело» в контексте настоящего описания относится к антителу, полученному из популяции практически гомогенных антител, т.е. индивидуальные антитела, входящие в популяцию, идентичны за исключением возможных встречающихся в естественных условиях мутаций, которые могут присутствовать в минорных количествах. Моноклональные антитела являются высокоспецифическими, направленными против одной области детерминанты. Кроме того, в отличие от традиционных (поликлональных) препаратов антител, которые, как правило, включают различные антитела к различным детерминантам (эпитопам), каждое моноклональное антитело направлено к одной детерминанте на антигене. Помимо их специфичности, преимуществом моноклональных антител является то, что их можно синтезировать с помощью клеток гибридомы, незагрязненных другими продуцирующими иммуноглобулин клетками. Специалистам в данной области известны другие методы получения, например, моноклональное антитело можно получать с помощью клеток, стабильно или кратковременно трансфектированных генами тяжелых и легких цепей, кодирующими моноклональное антитело.
Прилагательное «моноклональное» указывает на тот факт, что антитело должно быть получено из практически гомогенной популяции антител, при этом не требуется, чтобы оно было создано помощью какого-либо конкретного метода. Понятие «моноклональное» в контексте настоящего описания относится к антителу, которое выведено из клональной популяции клеток, включая любой эукаритический, прокариотический или фаговый клон, но не к методу, с помощью которого антитело сконструировано. Например, моноклональные антитела, применяемые согласно настоящему изобретению, можно создавать с помощью метода гибридом, описанного у Kohler и др., Nature, 256, 1975, с.495, или его можно получать с помощью любого метода рекомбинантной ДНК (см., например, US 4816567), включая выделение из фаговых библиотек антител с помощью методов, которые описаны, например, у Clackson и др., Nature, 352, 1991, cc.624-628 и Marks и др., J. Mol. Biol., 222, 1991, cc.581-597 (1991). Эти методы можно применять для получения моноклональных антител млекопитающих, химерных, гуманизированных, человеческих, доменных антител, двойных антител, антител типа vaccibodies, линейных антител и биспецифических антител.
Понятие «химерные» антитела включает антитела, в которых по меньшей мере одна часть тяжелой и/или легкой цепи идентична или гомологична соответствующим последовательностям антител, полученным из конкретных видов, или принадлежащих к конкретному классу или подклассу антител, и по меньшей мере одна другая часть цепи(ей) идентична или гомологична соответствующим последовательностям антител, полученным из других видов, или принадлежащих другому классу или подклассу антител, включая фрагменты таких антител, в случае, если они обладают требуемой биологической активностью (US 4816567; и Morrison и др., Proc. Natl. Acad. Sci. USA, 81, 1984, cc.6851-6855). Представляющие интерес химерные антитела в контексте настоящего описания включают «приматизированные» антитела, которые содержат последовательности антигенсвязывающего центра вариабельной области, выведенные из примата кроме человека (например обезьян Старого Света, таких как павиан, макак резус или макак крабоед), и последовательности человеческих константах областей (US 5693780).
«Гуманизированные» формы антител животных, кроме человека (например, мыши), представляют собой химерные антитела, которые включают минимальную последовательность, полученную из иммуноглобулина животного, кроме человека. Основная часть гуманизированных антител представлена человеческими иммуноглобулинами (антитело-реципиент), в которых остатки нативной CDR заменены остатками из соответствующей CDR других видов, кроме человека (антитело-донор), таких как мышь, крыса, кролик или приматы, кроме человека, обладающими требуемой специфичностью, аффинностью и потенциалом. В некоторых случаях остатки FW-участка человеческого иммуноглобулина заменяют соответствующими остатками из других видов, кроме человека. Кроме того, гуманизированные антитела могут включать остатки, которые не присутствуют в антителе-реципиенте или в антителе-доноре. Эти модификации осуществляют с целью дополнительного усовершенствования характеристик антитела. В целом, гуманизированное антитело должно включать практически полностью по меньшей мере одну или несколько вариабельных областей, в которых все или практически все CDR соответствуют CDR указанных иммуноглобулинов других животных, кроме человека, а все или практически все FW соответствуют последовательности иммуноглобулина человека. В определенных вариантах осуществления изобретения гуманизированное антитело необязательно может включать также по меньшей мере часть константной области (Fc) иммуноглобулина, как правило, человеческого иммуноглобулина. Дополнительные более подробные данные см. у Jones и др., Nature, 321, 1986, cc.522-525; Reichmann и др., Nature, 332, 1988, cc.323-329 и у Presta, Curr. Op.Struct. Biol., 2, 1992, cc.593-596.
«Человеческое антитело» может представлять собой антитело, полученное из организма человека, или антитело, полученное из трансгенного организма, который был «сконструирован» для производства специфических человеческих антител в ответ на контрольное заражение антигеном и который можно создавать с помощью любого метода, известного в данной области. При применении определенных методик элементы локусов человеческих тяжелых и легких цепей интродуцируют в линии организмов, выведенных из линий эмбриональных стволовых клеток, которые содержат целенаправленные нарушения эндогенных локусов тяжелой цепи и легкой цепи. Трансгенный организм может синтезировать человеческие антитела, специфические в отношении человеческих антигенов, и организм можно применять для получения секретирующих человеческие антитела гибридом. Человеческое антитело может представлять собой также антитело, в котором тяжелые и легкие цепи кодируются нуклеотидной последовательностью, выведенной из одного или нескольких источников человеческой ДНК. Полностью человеческое антитело можно конструировать также с помощью методов генетической или хромосомной трансфекции, а также с помощью метода фаговой презентации или in vitro с помощью активированных В-клеток, которые все известны в данной области.
Понятие «антителообусловленная клеточно-зависимая цитотоксичность» или «ADCC» относится к опосредуемой клетками реакции, при которой неспецифические цитотоксические клетки (например, естественные клетки-киллеры (NK-клетки), нейтрофилы, макрофаги) распознают связанное антитело на клетке-мишени и затем вызывают лизис клетки-мишени. В одном из вариантов такие клетки представляют собой человеческие клетки. Не ограничиваясь каким-либо конкретным механизмом действия, эти цитотоксические клетки, которые опосредуют ADCC, как правило, экспрессируют Fc-рецепторы (FcR). Основные клетки, опосредующие ADCC, т.е. NK-клетки, экспрессируют только FcγRIII, в то время как моноциты экспрессируют FcγRI, FcγRII и FcγRIII. Данные об экспрессии FcR гематопоэтическими клетками обобщены у Ravetch и Kinet, Annu. Rev. Immunol 9, 1991, cc.457-492. Для оценки ADCC-активности представляющей интерес молекулы можно осуществлять анализ ADCC in vitro, например, описанный в US 5500362 или 5821337. Эффекторные клетки, которые можно применять для таких анализов, включают мононуклеарные клетки периферической крови (РВМС) и естественные клетки-киллеры (NK-клетки). В другом или дополнительном варианте для оценки ADCC-активности представляющей интерес молекулы можно применять анализ in vivo, например, с использованием в качестве моделей животных, согласно методу, описанному у Clynes и др., PNAS (USA), 95, 1998, cc.652-656.
Понятие «комплементзависимая цитотоксичность» или «CDC» обозначает способность молекулы инициировать активацию комплемента и вызывать лизис клетки-мишени в присутствии комплемента. Путь активации комплемента инициируется связыванием первого компонента системы комплемента (C1q) с молекулой (например, антителом), образующей комплекс с соответствующим ей антигеном. Для оценки активации комплемента можно применять метод анализа CDC, например, описанный у Gazzano-Santoro и др., J. Immunol. Methods, 202, 1996, с.163.
«Эффекторные клетки» представляют собой лейкоциты, которые экспрессируют один или несколько FcR и обладают эффекторными функциями. Предпочтительно клетки экспрессируют по меньшей мере FcγRI, FCγRII, FcγRIII и/или FcγRIV и обладают ADCC-эффекторным функциями. Примеры человеческих лейкоцитов, которые опосредуют ADCC, включают мононуклеарные клетки периферической крови (РВМС), естественные клетки-киллеры (NK-клетки), моноциты, цитотоксические Т-клетки и нейтрофилы.
Понятия «Fc-рецептор» или «FcR» относятся к рецептору, который связывается с Fc-фрагментом антитела. В одном из вариантов осуществления изобретения FcR имеет нативную последовательность человеческого FcR. Кроме того, в некоторых вариантах осуществления изобретения FcR представляет собой FcR, который связывается с антителом изотипа IgG (гамма-рецептор) и включает рецепторы подклассов FcγRI, FcγRII и FcγRIII, в том числе аллельные варианты и полученные в результате альтернативного сплайсинга формы этих рецепторов. FcγRII-рецепторы включают FcγRIIA («активирующий рецептор») и FcγRIIB («ингибирующий рецептор»), которые имеют сходные аминокислотные последовательности, но отличаются прежде всего своими цитоплазматическими доменами. Активирующий рецептор FcγRIIA содержит иммунорецепторный тирозинсодержащий активирующий мотив (ITAM) в своем цитоплазматическом домене. Ингибирующий рецептор FcγRIIB содержит иммунорецепторный тирозинсодержащий ингибирующий мотив (ITIM) в своем цитоплазматическом домене (обзор данных см. у М. Daeron, Ann. Rev. Immunol., 15, 1997, cc.203-243). Данные о FcR обобщены у Ravetch и Kinet, Ann. Rev. Immunol., 9, 1991, cc.457-492; Capel и др., Immunomethods, 4, 1994, cc.25-34 и у de Haas и др., J. Lab. Clin. Med., 126, 1995, cc.330-341. Другие FcR, включая FcR, которые будут обнаружены в будущем, подпадают под указанное понятие «FcR». Под это понятие подпадает также неонатальный рецептор, FcRn, который ответствен за перенос материнских IgG эмбриону (Guyer и др., J. Immunol., 117, 1976, с.587 и Kirn и др., J. Immunol., 24, 1994, с.249).
«Fv» представляет собой минимальный фрагмент антитела, который содержит полный антигенраспознающий и антигенсвязывающий центр. Эта область состоит из димера, который включает одну вариабельную область тяжелой цепи и одну вариабельную область легкой цепи в тесной нековалентной или ковалентной ассоциации. Именно в этой конфигурации три CDR каждой вариабельной области взаимодействуют с определенным антигенсвязывающим центром на поверхности VL-VH-димера. В целом, шесть CDR обусловливают специфичность антитела в отношении связывания с антигеном. Однако даже одна вариабельная область (или половина Fv, включающая только три CDR, специфических для антигена) обладает способностью распознавать антиген и связываться с ним, хотя и с более низкой аффинностью по сравнению с полным связывающим сайтом.
Понятие «аффинность» антитела к эпитопу применительно к обработке(ам), представленной(ым) в настоящем описании, является понятием, хорошо известным в данной области и означает степень или силу связывания антитела с эпитопом. Аффинность можно оценивать и/или выражать с помощью различных параметров, известных в данной области, включая, но, не ограничиваясь только ими, константу равновесия реакции диссоциации (KD или Kd), кажущуюся константу равновесия реакции диссоциации (KD' или Kd') и IC50 (количество, необходимое для осуществления 50%-ного ингибирования в конкурентном анализе). Следует понимать, что для целей настоящего изобретения, под аффинностью понимают усредненную аффинность для данной популяции антител, которые связываются с эпитопом. В настоящем описании значения KD' представлены в виде мг IgG на мл или мг/мл, что означает количество (в мг) Ig на мл сыворотки, хотя можно рассчитывать уровень в плазме. Когда аффинность антитела применяют в качестве базисной оценки при применении способов лечения, предложенных в настоящем изобретении, или выбора способов лечения, предложенных в настоящем изобретении, то аффинность антител можно оценивать до и/или в процессе лечения, и полученные значения клиницист может применять для решения вопроса о том, является ли больной человек соответствующим кандидатом для лечения.
В контексте настоящего описания понятие «авидность» относится к общей силе связывания (т.е. обоими плечами антитела), с которой антитело связывается с антигеном. Авидность антитела можно определять путем оценки диссоциации связи антиген-антитело в условиях избытка антигена с помощью любых методов, известных в данной области, включая, но, не ограничиваясь только им, модификацию метода непрямой оценки флуоресценции антител, описанного у Gray и др., J. Virol. Meth., 44, 1993, cc.11-24.
Понятие «эпитоп» хорошо известно в данной области и означает любой химический остаток, который обладает способностью специфически связываться с антителом. «Антиген» представляет собой остаток или молекулу, содержащую эпитоп, и который сам также специфически связывается с антителом.
Понятие «маркер В-клеточной поверхности» в контексте настоящего описания относится к антигену, экспрессируемому на поверхности В-клетки, который может быть мишенью для агента, который с ним связывается. Маркеры В-клеточной поверхности включают такие маркеры поверхности лейкоцитов, как CD10, CD19, CD20, CD21, CD22, CD23, CD24, CD25, CD37, CD53, CD72, CD73, CD74, CD75, CD77, CD79a, CD79b, CD80, CD81, CD82, CD83, CD84, CD85 и CD86. Представляющим наибольший интерес маркером В-клеточной поверхности является маркер, который в существенно большей степени экспрессируется на В-клетках по сравнению с не-В-клеточными тканями млекопитающих и может экспрессироваться как на предшественниках В-клеток, так и на линии зрелых В-клеток. В одном из вариантов осуществления изобретения маркер представляет собой CD19, который обнаружен на В-клетках на различных стадиях дифференцировки.
Понятие «время полужизни антитела» в контексте настоящего описания означает фармакокинетическую характеристику антитела, означающую меру продолжительности существования молекул антитела после их введения. Время полужизни антитела можно выражать в виде времени, необходимого для элиминации 50% от известно количества иммуноглобулина из организма пациент или его определенного компартмента, например, при измерении в сыворотке или плазме, т.е. время полужизни в кровотоке, или в других тканях. Время полужизни варьируется от одного иммуноглобулина или класса иммуноглобулинов к другому. В целом, повышение времени полужизни антитела приводит к повышению среднего резидентного времени (MRT) в кровотоке для введенного антитела.
Понятие «изотип» относится к классификации константных областей тяжелой или легкой цепи антитела. Константные области антител не участвуют в связывании с антигеном, но обладают различными эффекторными функциями. В зависимости от аминокислотной последовательности константной области тяжелой цепи данное человеческое антитело или иммуноглобулин можно отнести к одному из пяти основных классов иммуноглобулинов: IgA, IgD, IgE, IgG и IgM. Некоторые из этих классов можно дополнительно подразделять на подклассы (изотипы), например IgG1 (гамма 1), IgG2 (гамма 2), IgG3 (гамма 3) и IgG4 (гамма 4), а также IgA1 и IgA2. Константные области тяжелой цепи, которые соответствуют различным классам иммуноглобулинов, обозначают как α, δ, ε, γ и µ, соответственно. Структуры и трехмерные конфигурации различных классов иммуноглобулинов хорошо известны. Из различных классов человеческих иммуноглобулинов только для человеческих IgG1, IgG2, IgG3, IgG4 и IgM известна способность активировать комплемент. Известно, что человеческие IgG1 и IgG3 опосредуют ADCC у человека. Константные области человеческих легких цепей можно классифицировать на два основных класса, каппа и лямбда.
В контексте настоящего описания понятие «иммуногенность» означает, что соединение обладает способностью провоцировать иммунный ответ (стимулировать производство специфических антител и/или пролиферацию специфических Т-клеток).
В контексте настоящего описания понятие «антигенность» означает, что соединение распознается антителом или может связываться с антителом и влиять на иммунный ответ.
Под понятиями «лечить», «лечение» или «обработка» (или грамматическими эквивалентами этих понятий) подразумевают, что серьезность состояния индивидуума снижается или по меньшей мере частично улучшается или облегчается и/или что достигается облегчение, смягчение или снижение по меньшей мере одного клинического симптома, и/или происходит ингибирование или замедление развития состояния, и/или предупреждение или замедление начала возникновения заболевания или расстройства. Так, понятия «лечить», «лечение» или «обработка» (или грамматические эквиваленты этих понятий) относятся как к профилактическим, так и к терапевтическим схемам лечения.
В контексте настоящего описания понятие «достаточное количество» или «количество, достаточное для» достижения конкретного результата, относится к количеству антитела или композиции, предлагаемых в изобретении, которое является эффективным для получения требуемого эффекта, который необязательно представляет собой терапевтический эффект (т.е. при введении агента в терапевтически эффективном количестве). Например, «достаточное количество» или «количество, достаточное для» может представлять собой количество, которое является эффективным для В-клеточного истощения.
В контексте настоящего описания понятие «терапевтически эффективное количество» означает количество, которое обеспечивает некоторое улучшение или оказывает благоприятное действие на индивидуума. Другими словами, «терапевтически эффективное количество» означает количество, которое обеспечивает облегчение, смягчение или снижение по меньшей мере одного клинического симптома. Клинические симптомы, ассоциированные с нарушениями, которые можно лечить с помощью способов, предлагаемых в изобретении, хорошо известны специалистам в данной области. Кроме того, как должно быть очевидно специалистам в данной области, не является обязательным, чтобы терапевтические действия были полными или исцеляющими, они могут проявляться в оказании определенного благоприятного воздействия на индивидуума.
Краткое описание чертежей
На чертежах показано
На фиг.1А-Б - (А) Сравнительный анализ аминокислотных последовательностей вариабельных областей легких цепей НВ12В VK (SEQ ID NO:20), HB12B-(A10-Jk4) (SEQ ID NO:52), HB12B-364987 (SEQ ID NO:62), HB12B-3649 (SEQ ID NO:68) и НВ12В-36 (SEQ ID NO:70) Остатки в последовательностях пронумерованы в соответствии с номенклатурой Кэбота. Остатки CDR, которые соответствуют номенклатуре Кэбота, обозначены прямоугольниками. Верньерные, находящие между цепями и канонические остатки НВ12В VK (SEQ ID NO:20) обозначены заглавными буквами светлосерого цвета. Аминокислотные замены в вариабельной области HB12B-364987 (SEQ ID NO:62) (Y40F, К53Н, Y91F), HB12B-3649 (SEQ ID NO:68) (Y40F, K53H) и НВ12В-36 (SEQ ID NO:70) (Y40F) относительно трансплантированного антитела HB12B-(A10-Jk4) (SEQ ID NO:52) обозначены заглавными буквами темно-серого цвета. (Б) Сравнительный анализ аминокислотных последовательностей вариабельных областей тяжелых цепей НВ12В VH (SEQ ID NO:18), HB12B-(3-72/JH4) (SEQ ID NO:34) и HB12B-9m (SEQ ID NO:44). Остатки в последовательностях пронумерованы в соответствии с номенклатурой Кэбота. Остатки CDR, которые соответствуют номенклатуре Кэбота, обозначены прямоугольниками. Верньерные, находящие между цепями и канонические остатки НВ12В VH обозначены заглавными буквами светло-серого цвета. Аминокислотные замены в вариабельной области HB12B-9m (SEQ ID NO:44) (L20I, F27Y, Т28А, R38I, V49I, F67A, R71A, L80M, I91Y) относительно трансплантированного антитела HB12B-(3-72/JH4) (SEQ ID NO:34) обозначены заглавными буквами темно-серого цвета.
На фиг.2 - профиль связывания гуманизированного антитела к CD19 №1, содержащего HB12B-(3-72/JH4) VH (SEQ ID NO:34) и HB12B-364987 VK (SEQ ID NO:62), с экспрессирующими рекомбинантный человеческий CD19 300В4-клетками при анализе с помощью клеточного ELISA. Значения ОП450 для гуманизированного антитела к CD19 №1 обозначены незакрашенными квадратами. Химерное антитело НВ12В, содержащее НВ12В VH (SEQ ID NO:18) и НВ12В VK (SEQ ID NO:20), применяли в качестве референс-стандарта (закрашенные окружности). Человеческое антитело изотипа IgG1 неродственной специфичности включали в анализ в качестве отрицательного контроля (незакрашенные окружности). Профиль связывания гуманизированного антитела к CD19 №1 в значительной степени соответствовал профилю связывания химерного антитела к CD19.
На фиг.3 - профиль связывания гуманизированных антител к CD19 №1, №2 и №3 с экспрессирующими рекомбинантный человеческий CD19 300В4-клетками при анализе с помощью клеточного ELISA. Гуманизированное антитело к CD19 №1 содержит HB12B-(3-72/JH4) VH (SEQ ID NO:34) и НВ12В-364987 VK (SEQ ID NO:62). Гуманизированное антитело к CD19 №2 содержит HB12B-(3-72/JH4) VH (SEQ ID NO:34) и НВ12В-3649 VK (SEQ ID NO:68). Гуманизированное антитело к CD19 №3 содержит HB12B-(3-72/JH4) VH (SEQ ID NO:34) и НВ12В-36 VK (SEQ ID NO:70). Профили связывания гуманизированных антител к CD19 №1, №2 и №3 обозначены незакрашенными квадратами, незакрашенными окружностями и закрашенными окружностями соответственно. Химерное антитело НВ12В, содержащее НВ12В VH (SEQ ID NO:18) и НВ12В VK (SEQ ID NO:20), применяли в качестве референс-стандарта (закрашенные квадраты). Профили связывания гуманизированных антител к CD19 №1 и №2 в значительной степени соответствовали профилю связывания химерного антитела к CD19. Связывание гуманизированного антитела к CD19 №3 с экспрессирующими рекомбинантный человеческий CD19 300В4-клетками, оказался существенно слабее по сравнению с химерным антителом НВ12В.
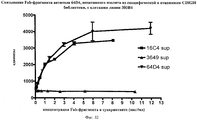
На фиг.4 - результаты анализа с помощью ДСН/ПААГ с окрашиванием кумасси бриллиантовым голубым очищенных антител к hCD19. С помощью ДСН/ПААГ анализировали 1 и 5 мкг фукозилированного (3649) и афукозилированного (3649-aFuc) очищенного гуманизированного антитела к CD19 №2. Очищенные препараты практически были свободны от белков-загрязнителей.
На фиг.5 (А) - средняя интенсивность флуоресценции подвергнутых иммунологическому окрашиванию клеток Дауди, которые инкубировали с различными концентрациями гуманизированного антитела к CD19 №2. Клетки Дауди инкубировали с различными концентрациями фукозилированного (3649) или афукозилированного (3649 aFuc-1 и 3649 aFuc-2) антитела к CD19 №2. Затем клетки окрашивали конъюгированным с RPE козьим антителом к F(ab)'2-фрагменту человеческого IgG и анализировали с помощью проточного цитометра в соответствии со стандартными протоколами. Клетки Дауди, которые инкубировали с антителом CD20, включали в анализ в качестве положительного контроля. Для фукозилированных и афукозилированных препаратов гуманизированного антитела к CD19 №2 обнаружены перекрывающиеся профили окрашивания. Средняя интенсивность флуоресценции окрашенных антителом к CD19 клеток оказалась ниже по сравнению с окрашенными антителом к CD20 клетками при всех изученных концентрациях антитела. На фиг.5 (Б)- данные о ADCC-активности in vitro гуманизированных антител к CD19. ADCC-активность in vitro препаратов фукозилированного (3649) и афукозилированного (3649 aFuc-1 и 3649 aFuc-2) антитела к CD19 №2 оценивали с помощью набора CytoTox 96™ (фирма Promega) согласно инструкциям производителя. В качестве мишеней применяли клетки Дауди. Анализ осуществляли также с использованием в качестве положительного контроля антитела к CD20. Как афукозилированные препараты гуманизированного антитела к CD19 №2, так и применяемое в качестве положительного контроля антитело CD20, обеспечивали аналогичную сильную ADCC-активность. ADCC-активность, опосредуемая фукозилированным антителом к CD19 №2, в применяемых условиях оказалась ниже.
На фиг.6 - данные о ADCC-активности т vitro гуманизированных антител к CD19. ADCC-активность in vitro фукозилированного (3649) и афукозилированного (3649 aFuc) антитела к CD19 №2 оценивали с помощью набора CytoTox 96™ (фирма Promega) согласно инструкциям производителя. В качестве мишеней применяли клетки Дауди. Анализ осуществляли также с использованием в качестве положительного контроля антитела к CD20. Fc-вариант антитела к CD19 №2 (3649-ТМ), у которого отсутствует способность опосредовать ADCC, применяли в качестве отрицательного контроля. Афукозилированное гуманизированное антитело к CD19 №2 (3649-aFuc) и применяемое в качестве положительного контроля антитело CD20 обеспечивали аналогичную сильную ADCC-активность. ADCC-активность, опосредуемая фукозилированным антителом к CD19 №2, в указанных условиях оказалась ниже. Применяемый в качестве отрицательного контроля Fc-вариант антитела к CD19 №2 вообще не опосредовал ADCC-активность в указанных условиях.
На фиг.7 - профили экспрессии CD19, CD20 и CD22 на клетках линий Раджи, Рамоса, Дауди и Намальвы. Клетки Раджи, Рамоса, Дауди и Намальвы подвергали иммунологическому окрашиванию, используя в качестве первичных антитела к CD19, CD20 или CD22, и в качестве вторичных антител конъюгированные с РЕ козьи антитела к мышиному IgG и затем анализировали с помощью проточного цитометра. На столбиковых диаграммах представлены соотношение средних значений канальной флуоресценции, полученной для подвергнутых иммунологическому окрашиванию и окрашенных только вторичным антителом контрольных образцов. Клетки множественной миеломы линии RPMI 8226, которые не экспрессируют ни CD19, ни CD20, ни CD22, применяли в качестве отрицательного контроля. Значительный уровень экспрессии всех трех молекул обнаружен на поверхности клеток Раджи, Рамоса и Дауди. На поверхности клеток Намальвы происходила экспрессия CD19 и CD22, но не CD20.
На фиг.8 - данные о чувствительности клеток Раджи (А), клеток Дауди (Б), клеток Рамоса (В) и клеток Намальвы (Г) к опосредуемой антителом к CD19 №2 ADCC. Анализ ADCC осуществляли с помощью набора CytoTox 96™ (фирма Promega) согласно инструкциям производителя. Использовали следующие антитела: (I) афукозилированное антитело к CD19 №2 (3649-aFuc), (II) 3M Fc-вариант антитела к CD19 №2 (3649-3М) и (III) и контрольное антитело к CD20. Соотношение эффектора и мишени составляло 2,5 к 1. Все четыре линии клеток обладали чувствительностью к опосредуемой антителом к CD19 №2 ADCC. Только клетки Раджи, Дауди и Рамоса обладали чувствительностью к опосредуемой антителом к CD20 ADCC.
На фиг.9 - данные о чувствительности свежезаготовленных тонзиллярных В-клеток к опосредуемой антителом к CD19 №2 ADCC. Анализ ADCC осуществляли с помощью набора CytoTox 96™ (фирма Promega) согласно инструкциям производителя. Использовали следующие антитела: (I) афукозилированное антитело к CD19 №2 (3649-aFuc), (II) 3M Fc-вариант антитела к CD19 №2 (3649-3М) и (III) и контрольное антитело к CD20. Соотношение эффектора и мишени составляло 2 к 1. Тонзиллярные В-клетки обладали чувствительностью к ADCC, опосредуемой всеми тремя изученными антителами.
На фиг.10 - данные об интенсивности окрашивания В-лимфоцитов в кровотоке. Лимфоциты кровотока выделяли из мышей линий С57 В16 hCD19 tg +/-, С57 В16 hCD19 tg +/+, Balb/c hCD20 tg +/- и Balb/c. Выделенные клетки окрашивали с помощью конъюгированного с PerCP антитела к мышиному CD19 (α-mCD19), конъюгированного с РЕ антитела к CD3, конъюгированного с Alexa488 антитела к человеческому CD19 (α-hCD19) и конъюгированного с Alexa647 антитела к человеческому CD20 (α-hCD20). n обозначает число проанализированных животных в каждой группе. На фиг.10(А) - средняя интенсивность флуоресценции CD3-клеток, оцененная в специфических для hCD19, hCD20 и mCD19 каналах в виде столбиковой диаграммы. На фиг 10(Б) - процент (CD3-mCD19+)-лимфоцитов в различных генетических фенотипах.
На фиг.11 - данные о В-клеточном истощении in vivo под воздействием антитела к CD19 №2. (А) Животных линий С57 В16 hCD19 tg +/+ и (Б) С57 В16 hCD19 tg +/- обрабатывали i.v. одной дозой, составляющей 250 или 50 мкг, антитела к CD19 №2 (3649). Применяемые в качестве отрицательного контроля антитела представляли собой (I) аномальный с позиций ADCC (с пониженной ADCC-активностью) Fc-вариант антитела №2 (3649 ТМ) и (II) антитело неродственной специфичности (R347). Находящиеся в кровотоке лимфоциты выделяли через 7 дней после обработки. Клетки окрашивали с помощью конъюгированного с PerCP антитела к мышиному CD19 (α-mCD19), конъюгированного с РЕ антитела к CD3. Представлены данные о процентном содержании (mCD19+CD3-)-B-клеток. n обозначает число проанализированных животных в каждой группе. Обработка одной дозой антитела к CD19 №2 приводила к практическому полному истощению В-клеток.
На фиг.12 - данные о В-клеточном истощении in vivo под воздействием антитела к CD19 №2. Животных линий С57 В16 hCD19 tg +/+ и С57 В16 hCD19 tg +/- обрабатывали i.v. одной дозой, составляющей 250 или 50 мкг, антитела к CD19 №2 (3649). Применяемые в качестве отрицательного контроля антитела представляли собой (I) аномальный с позиций ADCC (с пониженной ADCC-активностью) Fc-вариант антитела №#2 (3649 ТМ) и (II) антитело неродственной специфичности (R347). Селезеночные клетки выделяли через 7 дней после обработки. Клетки окрашивали с помощью конъюгированного с PerCP антитела к мышиному CD19 (α-mCD19), конъюгированного с РЕ антитела к CD3. Представлены данные о процентном содержании (mCD19+CD3-)-B клеток в селезеночных лимфоцитах, n обозначает число проанализированных животных в каждой группе. Обработка одной дозой антитела к CD19 №2 приводила к практическому полному истощению В-клеток.
На фиг.13 - данные о том, что антитело к CD19 №2 в значительной степени снижает рост опухолей in vivo на модельной системе. SCID-мышам линии СВ 17 инъецировали s.c. в заднюю часть боковой области 5×106 Раджи-клеток в день 1. Животных обрабатывали пятью применяемыми дважды в неделю дозами антитела из расчета 10 мг/кг, начиная с дня 4. Применяемые антитела представляли собой: (I) антитело к CD19 №2 (3649), (II) Fc-вариант антитела к CD19 №2 с пониженной ADCC-активностью (3649-ТМ), (III) антитело к CD20 и (IV) применяемое в качестве контроля изотипа антитело с неродственной специфичностью (R347). Группу контрольных животных обрабатывали только ЗФР. Размер опухоли оценивали дважды в неделю с помощью стандартных процедур.
На фиг.14 - данные о том, что антитело к CD19 №2 существенно снижает рост опухоли in vivo на модельной системе. SCID-мышам линии СВ17 инъецировали s.c. в заднюю часть боковой области 5×106 Раджи-клеток в день 1. Животных обрабатывали пятью применяемыми дважды в неделю дозами антитела из расчета 10 мг/кг или 2,5 мг/кг, начиная с дня 4. Применяемые антитела представляли собой: (I) антитело к CD19 №2 в дозе 10 мг/кг или 2,5 мг/кг (3649, 10 мг/кг и 3649* 2,5 мг/кг), (II) Fc-вариант антитела к CD19 №2 с пониженной AD С С-активностью в дозе 10 мг/кг (3649-ТМ), (III) Fc-вариант антитела к CD19 №2 с повышенной ADCC-активностью в дозе 10 мг/кг (3649-3М), (IV) антитело к CD20 в дозе 10 мг/кг и (V) применяемое в качестве контроля изотипа антитело с неродственной специфичностью в дозе 10 мг/кг (R347). Группу контрольных животных обрабатывали только ЗФР. Размер опухоли оценивали дважды в неделю с помощью стандартных процедур.
На фиг.15 - профили связывания антител 3649, 3649-3М и 3649-aFuc к CD19 к FcγRIIIA, несущему 158У-аллель, полученные с помощью ELISA. Антитело к CD20 включали в анализ в качестве референс-контроля. Аффинность к связыванию 3649-3М Fc-варианта антитела и афукозилированного антитела 3649-aFuc с FcγRIIIA оказалась существенно выше, чем у фукозилированного антитела 3649. Антитело 3649 и антитело к CD20 имели идентичные профили связывания.
На фиг.16 - данные о том, что генотип FcγRIIIA эффекторных клеток оказывает влияние in vitro на ADCC-активность антитела к CD19 №2. Анализ ADCC осуществляли с помощью набора CytoTox 96™ (фирма Promega) согласно инструкциям производителя. Использовали следующие антитела: (I) афукозилированное антитело к CD19 №2 (3649-aFuc), (II) 3М Fc-вариант антитела к CD19 №2 (3649-3М) и (III) применяемое в качестве контроля антитело к CD20. Клетки Дауди служили в качестве мишеней. В качестве эффекторных клеток применяли либо линию NK-клеток (А), либо свежевыделенные NK-клетки (Б-Д). Оценивали NK-клетки с генотипом V158/V158 (В), V158/F158 (Г) и F158/F158 (Д) FcγRIIIA-рецептора. NK-клетки, которые содержат по меньшей мере одну высокоаффинную копию изоформы FcγRIIIA-рецептора (генотипы V158/V158 и V158/F158), являются более эффективными эффекторными клетками, чем NK-клетки, гомозиготные по низкоаффинным аллелям (генотип F158/F158). Обнаруженная ADCC-активность, зависимая от фукозилированного антитела (3649), опосредуемая V158/V158 - или V158/F158 - NK-клетками (В, Г), оказалась сопоставимой с зависимой от афукозилированного антитела (3649-aFuc) ADCC-активностью, опосредуемой F158/F158 - NK-клетками (Д).
На фиг.17- идентификационная схема поднаборов В-клеток (А) в кровотоке, (Б) селезенке, (В) костном мозге и (Г) брюшной области на основе фенотипа экспрессии антигена на клеточной поверхности. Флуоресцентно-окрашенные выделенные клеточные популяции анализировали с помощью проточного цитометра. Поднаборы В-клеток идентифицировали и оценивали путем последовательного применения дискриминационных окон. Последовательная схема процесса обозначена жирными серыми стрелками. Например, фолликулярные В-клетки селезенки идентифицировали следующим образом: (I) живые клетки выявляли на основе низкого уровня 7AAD-окрашивания, (II) лимфоциты из фракции живых клеток идентифицировали на основе их характерного FSC- и SSC- фенотипа, (III) В-клетки среди живых лимфоцитов идентифицировали, используя для окрашивания антитело к mCD19 и антитело к В220, (IV) B1a-клетки отделяли от В-клеток на основе различий в экспрессии В220, (V) зрелую и находящуюся на переходной стадии В-клеточную популяцию отличали друг от друга на основе различной экспрессии CD93, (VI) фолликулярную В-клеточную субпопуляцию зрелых В-клеток отделяли от В-клеточной фракции маргинальной зоны на основе различий в экспрессии CD23.
На фиг.18 - профиль связывания Fab-фрагментов антитела к CD19 3649 с созревшей аффинностью с экспрессирующими рекомбинантный человеческий CD19 300В4-клетками, определенный с помощью клеточного ELISA. Представлены результаты, полученные с использованием репрезентативного образца Fab-фрагментов, содержащих замены одной аминокислоты в VH CDR3. Fab-фрагмент антитела к CD19 3649 (3649 peri) применяли в качестве референс-стандарта. Аффинность Fab-фрагментов 4G6 и 4В7 к экспрессирующим рекомбинантный человеческий CD19 300В4-клеткам оказалась существенно выше по сравнению с контрольным Fab 3649. Все другие изученные Fab-фрагменты обладали аффинностью, сходной с аффинностью контрольного Fab 3649.
На фиг.19 - профиль связывания Fab-фрагментов антитела к CD19 3649 с созревшей аффинностью с экспрессирующими рекомбинантный человеческий CD19 300В4-клетками, определенный с помощью ELISA. Характеризуемые Fab-фрагменты были идентифицированы из библиотеки, включающей все возможные комбинации оказывающих благоприятное действие замен одной аминокислоты, которые выявлены в проведенных ранее специфических скринингах CDR. Представлен профиль связывания шести Fab-фрагментов, обладающих наиболее высокой аффинностью в отношении экспрессирующих рекомбинантный человеческий CD19 300В4-клеток. Fab-фрагмент антитела к CD19 3649 (3649 peri) применяли в качестве референс-стандарта. Аффинность к экспрессирующим рекомбинантный человеческий CD19 300В4-клеткам всех шести Fab-фрагментов с созревшей аффинностью оказалась выше, чем у контрольного Fab 3649.
На фиг.20 - профиль связывания антител к CD19 3649 с созревшей аффинностью с экспрессирующими рекомбинантный человеческий CD19 300В4-клетками, определенный с помощью ELISA. Антитело к CD19 3649 применяли в качестве референс-стандарта. Профиль связывания IgG 16C9 оказался таким же, что и профиль связывания у контрольного антитела 3649. Аффинность связывания антител с созревшей аффинностью 14Н5, 15D1, 15D7, 16С4 и 7Е12 оказалась выше, чем у контрольного антитела 3649.
На фиг.21 - профиль связывания антител к CD19 3649 с созревшей аффинностью с экспрессирующими человеческий CD19 Раджи-клетками, определенный с помощью ELISA. Антитело к CD19 3649 применяли в качестве референс-стандарта. Аффинность к связыванию у всех шести антител (14Н5, 15D1, 15D7, 16С4, 16С9 и 7Е12) оказалась выше, чем у контрольного антитела 3649.
На фиг.22 - профиль связывания антител к CD19 3649 с созревшей аффинностью с экспрессирующими человеческий CD19 клетками Дауди, определенный с помощью ELISA. Антитело к CD19 3649 применяли в качестве референс-стандарта. Аффинность к связыванию у всех шести антител (14Н5, 15D1, 15D7, 16С4, 16С9 и 7Е12) оказалась выше, чем у контрольного антитела 3649.
На фиг.23 - профиль связывания антител к CD19 3649 с созревшей аффинностью с экспрессирующими рекомбинантный человеческий CD19 300В4-клетками, определенный с помощью ELISA. 14H5-YG, 14H5-DG, H14H5-LG представляют собой несущие одну аминокислотную замену 14Н5-варианты антитела к CD19 3649 с созревшей аффинностью. Варианты 14Н4 и 16С4 антитела к CD19 3649 с созревшей аффинностью применяли в качестве референс-стандарта. Аффинность к связыванию у антител 14H5-YG, 14H5-DG и 14H5-LG оказалась ниже, чем у контрольных антител 14Н5 и 16С4.
На фиг.24 - Сравнение кинетических характеристик диссоциации антител к CD19 3649 с созревшей аффинностью. (А) Клетки Рамоса инкубировали с антителами к CD19 с созревшей аффинностью, промывали и дополнительно инкубировали при 37°С в течение 0, 30 или 60 мин. Клетки окрашивали флуоресцентным вторичным антителом в конце периода инкубации и анализировали с помощью проточного цитометра. Представлены данные о средней интенсивности флуоресценции клеток после инкубации в течение 0, 30, и 60 мин. Среднюю интенсивность флуоресценции (MFI) в момент времени 0 применяли за 100% для каждого изученного антитела. Антитело к CD19 3649 и антитело к CD20 применяли в качестве референс-стандартов. Элиминация всех шести антител к CD19 3649 с созревшей аффинностью (14Н5, 15D1, 15D7, 16С4, 16С9 и 7Е12) с клеточной поверхности оказалась ниже, чем у референс-стандартов. (Б) Клетки Рамоса окрашивали конъюгированными с Alexa 647 антителами к CD19 НВ12В, 3649 или 16С4, промывали и инкубировали при 37°С в течение 0, 30 или 60 мин. По окончании периода инкубации клетки анализировали с помощью проточного цитометра. Непосредственно конъюгированное антитело к CD20 включали в эксперимент в качестве референс-контроля. Среднюю интенсивность флуоресценции (MFI), измеренную после различных периодов инкубации, выражали относительно значения MFI, измеренного в момент времени 0. Снижение MFI после окрашивания антителом к CD19 16С4 с созревшей аффинностью оказалось существенно более медленным по сравнению с потерей сигнала, обнаруженной при использовании антител к CD19 3649 и НВ12В.
На фиг.25 - профиль связывания антител к CD19 3649 с созревшей аффинностью с клетками Дауди. Клетки Дауди окрашивали антителами к CD19 с созревшей аффинностью 14Н5, 15D1, 15D7, 16С4, 16С9 или 7Е12 и флуоресцентно-меченным вторичным антителом. Антитело к CD19 3649 применяли в качестве референс-стандарта. На диаграмме представлены значения медианной интенсивности флуоресценции (медианная FI), обнаруженные при применении различных концентраций антител. Медианная FI для антител к CD19 3649 с созревшей аффинностью оказалась выше по сравнению с референс-стандартом.
На фиг.26 - данные о ADCC-активности in vitro антител к CD19 3649 с созревшей аффинностью. (А) ADCC-активность in vitro антител к CD19 с созревшей аффинностью 14Н5, 14H5-DG и 16С4 анализировали, используя в качестве клеток-мишеней клетки Дауди. Антитело к CD19 3649 применяли в качестве референс-стандарта. ADCC-активность всех трех антител с созревшей аффинностью оказалась выше по сравнению с референс-стандартом при применении антител в низкой концентрации (0,01 и 0,1 мкг антитела/мл). ADCC-активность всех трех антител с созревшей аффинностью оказалась близкой к активности референс-стандарта при применении антител в высоких концентрациях (1 и 10 мкг антитела/мл). (Б) ADCC-активность афукозилированного антитела 16С4 (16C4-aFuc) определяли в анализе in vitro, используя клетки Дауди в качестве клеток-мишеней. ADCC-активность 16C4-aFuc оказалась существенно выше, чем применяемых в качестве референс-контроля 3649-aFuc, антитела к CD20 и фукозилированного антитела 16С4.
На фиг.27 - данные ИЭФ (изоэлектрическое фокусирование)-ПААГ при окрашивании кумасси бриллиантовым голубым антител к CD19 с созревшей аффинностью. Изоэлектрические точки антител 16С4, 16С9, 7Е12, 14Н5, 15D7, 15D1, 14H5-DG и 3649 составляли соответственно 7,83, 8,04, 7,69, 7,76, 7,61, 7,72, 7,48 и 7,75.
На фиг.28 - данные о В-клеточном истощении in vitro при использовании афукозилированного антитела к CD19 3649. Животных линии С57 В16 hCD19 tg +/- обрабатывали i.v. одной дозой, составляющей 10, 50 или 250 мкг, фукозилированного антитела к CD19 3649 (3649) или афукозилированного антитела к CD19 3649 (3649-aFuc). Применяемые в качестве отрицательного контроля животные представляли собой животных, обработанных (I) аномальным с позиций ADCC Fc-вариантом антитела к CD19 (3649 ТМ) или (II) антителом неродственной специфичности (R347). Находящиеся в кровотоке лимфоциты (А) или лимфоциты селезенки (Б) выделяли через 7 дней после обработки антителом. Выделенные клетки подвергали иммуноокрашиванию, как представлено в таблице 5, для идентификации различных В-клеточных популяций. Представлен процент (В220+CD19+)-B-клеток. Афукозилированное антитело к CD19 3649 вызывало наиболее высокий уровень истощения В-клеток по сравнению с взятым в таком же количестве фукозилированным антителом к CD19. Никакого В-клеточного истощения не обнаружено у животных, обработанных контрольным антителом 3649ТМ.
На фиг.29 - данные о повышенной активации NK-клеток у обработанных афукозилированным антителом к CD19 3649 мышей. Животных линии С57 В16 hCD19 tg +/- обрабатывали i.v. одной дозой, составляющей 10 мкг, фукозилированного антитела к CD19 3649 (3649) или афукозилированного антитела к CD19 3649 (3649-aFuc). Применяемых в качестве контроля животных обрабатывали таким же количеством антитела неродственной специфичности соответствующего изотипа (R347). Лимфоциты кровотока выделяли через 7 дней после обработки антителом. Выделенные клетки окрашивали флуоресцентно-меченными антителами knki.i, DX5 и CD107a. Представлен график зависимости CD107a относительно NK1.1 в виде выявленных (в дискриминационном окне) живых (NK1.1+)-, (DX5+)-лимфоцитов. Выявлен более высокий процент NK-клеток, выделенных из организма животных, обработанных афукозилированным антителом к CD19 3649, которые несут CD107a на клеточной поверхности, чем процент NK-клеток, выделенных из животных, обработанных фукозилированным антителом к CD19 3649.
На фиг.30 - данные о том, что афукозилированное антитело к CD19 №2 (3649-aFuc) существенно снижает рост опухолей in vivo в модельной системе. SCID-мышам линии СВ17 инъецировали s.c. в заднюю часть боковой области 5×106 Раджи-клеток в день 1. Животных обрабатывали пятью применяемыми дважды в неделю дозами антитела из расчета 10 мг/кг или 2 5 мг/кг, начиная с дня 4. Применяемые антитела представляли собой: (I) фукозилированное антитело к CD19 №2 в дозе 10 мг/кг (3649), (II) афукозилированное антитело к CD19 в дозе 10 мг/кг или 2,5 мг/кг (3649-aFuc), (III) антитело к CD20 в дозе 10 мг/кг и (IV) применяемый в качестве контроля изотип антитела с неродственной специфичностью в дозе 10 мг/кг (R347). Группу контрольных животных обрабатывали только ЗФР. Размер опухоли оценивали дважды в неделю с помощью стандартных процедур.
На фиг.31 - данные о В-клеточном истощении in vitro при использовании антител к CD19 с созревшей аффинностью 16С4 и 14Н5. Животных линии С57 В16 hCD19 tg +/- обрабатывали i.v. одной дозой, составляющей 10, 50 или 250 мкг, фукозилированного антитела к CD19 16С4 с созревшей аффинностью (16С4) или антитела к CD19 14H5DG с созревшей аффинностью (14H5DG). Применяемых в качестве референс-контроля животных обрабатывали: (I) антителом к CD19 3649 (3649), (II) аномальным с позиций ADCC Fc-вариантом антитела к CD19 (3649 3М) и (III) афукозилированным антителом к CD19 3649 (3649-aFuc). Применяемых в качестве отрицательного контроля животных обрабатывали: (I) аномальным с позиций ADCC Fc-вариантом антитела к CD19 (3649 ТМ) или (II) антителом неродственной специфичности (R347). Лимфоциты кровотока (А) или лимфоциты селезенки (Б) выделяли через 7 дней после обработки антителами. Выделенные клетки подвергали иммуноокрашиванию, как представлено в таблице 5, для идентификации различных В-клеточных популяций. Представлен процент (В220+CD19+)-B-клеток. При обработке антителом к CD19 16С4 с созревшей аффинностью обнаружено несколько более высокий уровень истощения В-клеток, чем при применении родительского антитела к CD19 3649. Антитела 3649-aFuc и 3649 3М вызывали более высокое истощение, чем антитело к CD19 16С4 с созревшей аффинностью. Антитело к CD19 14H5DG с созревшей аффинностью оказалось наименее эффективным в отношении истощения В-клеток, чем родительское антитело к CD19 3649.
Данные внутри панели (А) представляют собой процент истощения, вызываемого указанным антителом.
На фиг.32 - данные об активности связывания Fab-фрагмента антитела 64D4 с созревшей аффинностью с экспрессирующими рекомбинантный человеческий CD19 300В4-клетками при использовании клеточного анализа связывания (Lu и др., J. Immunol. Methods 314, 2006, cc.74-79). 64D4 представляет собой вариант 16С4 антитела к CD19, содержащий одну аминокислотную замену в VH-CDR2. Fab-фрагменты антител к CD19 16С4 и 3649 (16C4sup и 3649sup соответственно) применяли в качестве референс-стандартов. Аффинность Fab 64D4 к экспрессирующим рекомбинантный человеческий CD19 300В4-клеткам оказалась существенно выше по сравнению с применяемыми в качестве контроля Fab-фрагментами 16С4 и 3649.
На фиг.33 - характеризация Fab-фрагментов варианта с созревшей аффинностью антитела к CD19, выделенных из комбинаторной фаговой дисплейной библиотеки. Оценивали профиль связывания вариантов с созревшей аффинностью Fab-фрагмента 16С4 с клеточной поверхностью, презентующей человеческий антиген CD19, с помощью клеточного анализа связывания с применением (А) 300В4-клеток и (Б) Раджи-клеток (Lu и др., J. Immunol. Methods 314, 2006, cc.74-79). Fab-фрагменты антител к CD19 16С4 и 3649 (16C4sup и 3649sup соответственно) применяли в качестве референс-стандартов. Аффинность к связыванию Fab-фрагментов антител с созревшей аффинностью 6С11, 2В11, 3В4, 5С11, 3C3, 9G7, 1Н4 и 5С4 с 300В4-клетками и Раджи-клетками оказалась выше по сравнению с контрольными Fab-фрагментами 3649 и 16С4. (В) Аминокислотную последовательность Fab-клонов с созревшей аффинностью определяли с помощью стандартных лабораторных методов. Представлена CDR-последовательность уникальных Fab-клонов. Аминокислотные остатки, отличающиеся от остатков родительской последовательности 16С4, обозначены с помощью однобуквенных кодов аминокислот; остатки, идентичные родительской последовательности, обозначены «-».
На фиг.34 - профиль связывания антител 2В11, 3С3, 5С4, 6С11, 6F7 и 9G7 к CD19 изотипа IgG с созревшей аффинностью с экспрессирующими рекомбинантный человеческий CD19 300В4-клетками. Активность связывания определяли с помощью клеточного анализа (Lu и др., J. Immunol. Methods 314, 2006, cc.74-79). Антитела к CD19A 16С4 и 3649 применяли в качестве референс-стандартов. Аффинность к связыванию изученных антител к CD19 с созревшей аффинностью с 300В4-клетками оказалась выше по сравнению с референс-антителами 16С4 и 3649.
На фиг.35 - профиль связывания антител к CD19 с созревшей аффинностью 16С4 с (А) Раджи-клетками и (Б) клетками Дауди. Клетки окрашивали антителами к CD19 с созревшей аффинностью 3C3, 6С11 или 9G7 и флуоресцентно-меченным вторичным антителом. Антитело к CD19 16С4 применяли в качестве референса-стандарт. Окрашенные клетки анализировали с помощью проточного цитометра. На диаграмме представлена медианная интенсивность флуоресценции (медианная FI), обнаруженная при применении различных концентраций антител. Значения медианной FI клеток, окрашенных 16С4-вариантом с созревшей аффинностью антитела к CD19, оказались выше по сравнению с окрашенными референс-стандартом клетками при применении первичной концентрации антитела 0,0625-0,125 мкг/мл. Значения медианной FI, полученные при применении антител с созревшей аффинностью, оказались практически такими же, что и у референс-антитела при применении в концентрациях 0,25-10 мкг/мл.
На фиг.36 - данные о ADCC-активности in vitro варианта антител к CD19 с созревшей аффинностью 16С4. In vitro ADCC-активность антител к CD19 с созревшей аффинностью 3С3, 6С11 или 9G7 оценивали с использованием в качестве мишени Раджи-клеток. Вариант 16С4 антитела к CD19 применяли в качестве референс-стандарта. ADCC-активность всех трех антител с созревшей аффинностью оказалась практически такой же как у референс-стандарта при оценке во всех изученных концентрациях (0,01-10 мкг/мл).
На фиг.37 - данные о ADCC-активности in vitro варианта антител к CD19 с созревшей аффинностью 16С4. In vitro ADCC-активность антител к CD19 с созревшей аффинностью 3С3, 6С11 или 9G7 оценивали с использованием в качестве мишени клеток Дауди. Вариант 16С4 антитела к CD19 применяли в качестве референс-стандарта. ADCC-активность всех трех антител с созревшей аффинностью оказалась практически такой же, как у референс-стандарта при оценке во всех изученных концентрациях (0,01-10 мкг/мл).
На фиг.38 - данные о продолжительности восстановления В-клеток и уровнях сывороточных иммуноглобулинов после В-клеточного истощения с помощью i.v.-введения одной дозы афукозилированного варианта 16С4 антитела к CD19. (А) Протокол эксперимента. Группам мышей линии huCD19 tg +/- по 4-5 особей в каждой вводили в виде одной i.v.-дозы 250, 50 или 10 мкг афукозилированного антитела к CD19 16С4 (16С4 aFuc). Контрольные группы обрабатывали либо ЗФР, либо 250 мкг контрольного антитела неродственной специфичности (R347). У животных брали образцы крови один раз каждые две недели; первый отбор крови осуществляли за 7 дней до введения осуществляющего истощения антитела. Данные, полученные в течение первых 11 недель, обобщены на панелях. (Б) Вес тела животных во всех группах животных оставался в норме. Уровни В-клеток крови выражали в виде (В) фракции лимфоцитов или в виде (Г) количества В-клеток на микролитр крови. При использовании антитела 16С4 aFuc во всех трех дозах достигалось полное В-клеточное истощение. Восстановление В-клеток завершалось к 5 недели и 9 недели у животных, обработанных 10 и 50 мкг антитела 16С4 aFuc соответственно. Восстановление В-клеток оказалось еще неполным через 11 недель после введения 250 мкг антитела 16С4 aFuc. Уровни в сыворотке (Д) IgM, (Е) IgG1 и (Ж) IgG2b не изменялись после введения 50 или 250 мкг 16С4 aFuc. Уровни сывороточного иммуноглобулина повышались после введения 10 мкг антитела 16С4 aFuc, или контрольного антитела R347, или ЗФР. Эти данные свидетельствуют о том, что антитело 16С4 aFuc подавляло начало производства иммуноглобулина, но оказывало минимальное влияние на ранее существующий уровень иммуноглобулина в сыворотке.
На фиг.39 - данные о том, что антитело к CD19 индуцирует внутриклеточную передачу сигнала. (А-Б) Обработка антителами 3649, 3649-ТМ, 3649-3М, 3649-aFuc или 16С4 существенно повышала уровень фосфорилирования тирозина CD19 в Раджи-клетках. (В-Г) Обработка антителом к CD19 не ингибировала индуцированное обработкой анти-IgM фосфорилирование ERK1/2.
На фиг.40 - данные о том, что обработка антителом к CD19 ингибирует опосредуемую анти-IgM/CD40 В-клеточную пролиферацию.
На фиг.41 - данные о том, что обработка антителом к CD19 ингибирует индуцируемую анти-IgM/CpG пролиферацию очищенных периферических В-клеток. (А) Профиль интенсивности флуоресценции окрашенных с помощью флуоресцентного красителя CFSE (сукцинимидильный эфир карбоксифлуоресцеина) очищенных В-клеток периферической крови после инкубации в течение 4 дней в присутствии анти-IgM (1 мкг/мл) и CpG (2 мкг/мл). СР8Е-профили первой популяции нестимулированных контрольных клеток и стимулированных только CpG второй популяции контрольных клеток включены в качестве референс-стандартов. (Б) CFSE-профили В-клеток после 4-дневной стимуляции анти-IgM/CpG в присутствии антитела 16С4 к CD19 или контрольного антитела R347. Индуцируемая анти-IgM/CpG В-клеточная пролиферация существенно снижалась в присутствии антитела 16С4.
На фиг.42 - данные о том, что вариант 3649-3М Fc антитела к CD19 является более эффективным ингибитором индуцируемой анти-IgM/CpG В-клеточной пролиферации, чем вариант 3649-ТМ Fc антитела. Представлены CFSE-профили В-клеток после 4-дневной стимуляции анти-IgM/CpG в присутствии (А) R347 в качестве контроля, (Б) варианта 3649-ТМ антитела к CD19 или (В) варианта 3649-3М антитела к CD19.
На фиг.43 - данные о том, что индуцируемая антителом 3649-3М передача сигнала через CD19 и Fc-гамма RIIВ-рецепторы синергетически ингибирует опосредуемую анти-IgM/CpG В-клеточную пролиферацию.
На фиг.44 - данные о том, что связанное с поверхностью клеток антитело к CD19 эффективно интернализуется Раджи-клетками. 35% связанного с поверхностью 16С4 и 55% связанных с поверхностью антител НВ12В и 3649 к CD19 интернализовалось после 60-минутной инкубации при 37°С.
На фиг.45. Экспрессия на клеточной поверхности CD19 существенно снижается через 24 ч после обработки антителом к CD19. Экспрессия CD19 на клеточной поверхности снижалась на 55-90% (А) Раджи-клеток и (Б) очищенных периферических В-клеток после 24-часовой инкубации в присутствии антитела к CD19 3649, 3649-ТМ, 3649-3М, 3649-aFuc или 16С4.
5. Подробное описание изобретения
Настоящее изобретение относится к человеческим, гуманизированным или химерным антителам к CD19, которые связываются с человеческим антигеном CD19, а также к композициям, содержащим указанные антитела. В определенных вариантах осуществления изобретения человеческое, гуманизированное или химерное антитело к CD19 может опосредовать антитело-обусловленную клеточно-зависимую цитотоксичность (ADCC). Другими вариантами осуществления настоящего изобретения являются композиции, которые содержат человеческое, гуманизированное или химерное антитело к CD19 человеческого изотипа IgG1 и/или IgG3, а также человеческое, гуманизированное или химерное антитело к CD19 человеческого изотипа IgG2 и/или IgG4, которые могут опосредовать у человека ADCC, CDC и/или апоптоз. В других вариантах осуществления изобретения человеческое, гуманизированное или химерное антитело к CD19 может ингибировать стимулируемую анти-IgM/CpG В-клеточную пролиферацию.
Настоящее изобретение относится к химерным и гуманизированным версиям мышиных моноклональных антител к CD19 НВ12А и НВ12В. В одном из вариантов осуществления изобретения гуманизированное антитело к CD19, предлагаемое в изобретении, может связываться с человеческим CD19 с аффинностью, сопоставимой с аффинностью связывания НВ12А или НВ12В, или сопоставимой с аффинностью связывания химерного антитела НВ12В.
В одном из вариантов осуществления изобретения гуманизированное моноклональное антитело к CD19, предлагаемое в изобретении, может содержать VH и VK, где VH содержит четыре каркасных участка, FW1, FW2 и FW3 сегмента V3-72 VH человеческой зародышевой линии (описан как DP29 у Tomlinson I. М. и др., J. Mol. Biol., 227, 1992, cc.776-798), а также FW4 JH4-сегмента человеческой зародышевой линии (Mattila P. S. и др., Eur. J. Immunol., 25, 1995, cc.2578-2582); и три CDR-последовательности VH антитела НВ12В, CDR1 (SEQ ID NO:22), CDR2 (SEQ ID NO:24) и CDR3 (SEQ ID NO:26); a VK содержит четыре каркасных участка, FW1, FW2, FW3 А10-сегмента человеческой зародышевой линии V-каппа (Straubinger В. I и др., Biol. Chem. Hoppe-Seyler, 369, 1988, cc.601-607), а также FW4 J4-ceгмента человеческой зародышевой линии каппа-цепи иммуноглобулина (Hiete P. А. и др., J. Biol. Chem., 257, 1982, cc.1516-1522); и три CDR-последовательности VK антитела НВ12В, CDR1 (SEQ ID NO:28), CDR2 (SEQ ID NO:30) и CDR3 (SEQ ID NO:32). В одном из вариантов осуществления изобретения антитело к CD19, предлагаемое в изобретении, может содержать VH и VK, где VH содержит четыре каркасных участка, FW1, FW2 и FW3 сегмента V3-72 человеческой зародышевой линии VH (описан как DP29 у Tomlinson I. М. и др., J. Mol. Biol., 227, 1992, cc.776-798), а также FW4.1Н4-сегмента человеческой зародышевой линии (Mattila Р.S. и др., Eur. J. Immunol., 25, 1995, cc.2578-2582); и по меньшей мере один CDR, который имеет аминокислотную последовательность CDR, представленную в таблице 1; a VK содержит четыре каркасных участка FW1, FW2, FW3 А10-сегмента человеческой зародышевой линии V-каппа (Straubinger В. I и др., Biol. Chem. Hoppe-Seyler, 369, 1988, cc.601-607), а также FW4 J4-сгемента человеческой зародышевой линии каппа-цепи иммуноглобулина (Hiete Р. А. и др., J. Biol. Chem., 257, 1982, cc.1516-1522); и по меньшей мере один CDR, который имеет аминокислотную последовательность CDR, представленную в таблице 1. В одном из вариантов осуществления изобретения это антитело может содержать одну или несколько мутаций в каркасном участке VK, выбранную из группы, включающей Y40F, К53Н и Y91F. В одном из вариантов осуществления изобретения каркасный участок VK может содержать каждую из точковых мутаций Y40F, К53Н и Y91F. В другом варианте осуществления изобретения каркасный участок VK может содержать только точковые мутации Y40F и К53Н. В следующем варианте осуществления изобретения каркасный VK участок может содержать только точковую мутацию Y40F.
5.1.1. CDR-участки антител к CD19
В определенных вариантах осуществления изобретения антитело к CD19, предлагаемое в изобретении, может содержать вариабельную область тяжелой цепи, VH, включающую по меньшей мере один CDR, аминокислотная последовательность которого выбрана из группы, включающей SEQ ID NO:22, SEQ ID NO:24 и SEQ ID NO:26; и может содержать также по меньшей мере один FW-участок, аминокислотная последовательность которого выбрана из группы, включающей SEQ ID NO:36, SEQ ID NO:38, SEQ ID NO:40 и SEQ ID NO:42. В другом варианте осуществления изобретения антитело к CD19, предлагаемое в изобретении, может содержать вариабельную область тяжелой цепи, VH, включающую по меньшей мере один CDR, аминокислотная последовательность которого выбрана из группы, включающей SEQ ID NO:22, SEQ ID NO:24 и SEQ ID NO:121; и может содержать также по меньшей мере один FW-участок, аминокислотная последовательность которого выбрана из группы, включающей SEQ ID NO:36, SEQ ID NO:38, SEQ ID NO:40 и SEQ ID NO:42. Еще в одном варианте осуществления изобретения антитело к CD19, предлагаемое в изобретении, может содержать вариабельную область тяжелой цепи, VH, включающую по меньшей мере один CDR, аминокислотная последовательность которого выбрана из группы, включающей SEQ ID NO:22, SEQ ID NO:116 и SEQ ID NO:121; и может содержать также по меньшей мере один FW-участок, аминокислотная последовательность которого выбрана из группы, включающей, SEQ ID NO:36, SEQ ID NO:38, SEQ ID NO:40 и SEQ ID NO:42. Еще в одном варианте осуществления изобретения антитело к CD19, предлагаемое в изобретении, может содержать вариабельную область тяжелой цепи, VH, включающую по меньшей мере один CDR, аминокислотная последовательность которого выбрана из группы, включающей SEQ ID NO:208, SEQ ID NO:116 и SEQ ID NO:121; и может содержать также по меньшей мере один FW-участок, аминокислотная последовательность которого выбрана из группы, включающей, SEQ ID NO:36, SEQ ID NO:38, SEQ ID NO:40 и SEQ ID NO:42. Еще в одном варианте осуществления изобретения антитело к CD19, предлагаемое в изобретении, может содержать вариабельную область тяжелой цепи, VH, включающую по меньшей мере один CDR, аминокислотная последовательность которого выбрана из группы, включающей SEQ ID NO:208, SEQ ID NO:210 и SEQ ID NO:121; и может содержать также по меньшей мере один FW-участок, аминокислотная последовательность которого выбрана из группы, включающей, SEQ ID NO:36, SEQ ID NO:38, SEQ ID NO:40 и SEQ ID NO:42. В другом варианте осуществления изобретения антитело к CD19, предлагаемое в изобретении, может содержать вариабельную область тяжелой цепи, VH, содержащую по меньшей мере один CDR, который имеет аминокислотную последовательность VH CDR1, VH CDR2 или VH CDR3, представленную в таблице 1, и может содержать также по меньшей мере один FW-участок, аминокислотная последовательность которого выбрана из группы, включающей SEQ ID NO:36, SEQ ID NO:38, SEQ ID NO:40 и SEQ ID NO:42.
В других вариантах осуществления изобретения антитело к CD19, предлагаемое в изобретении, может содержать вариабельную область тяжелой цепи, VH, включающую по меньшей мере один CDR, аминокислотная последовательность которого выбрана из группы, включающей SEQ ID NO:22, SEQ ID NO:24 и SEQ ID NO:26.
В следующих вариантах осуществления изобретения антитело к CD19, предлагаемое в изобретении, может содержать вариабельную область тяжелой цепи, VH, включающую по меньшей мере один CDR, аминокислотная последовательность которого выбрана из группы, включающей SEQ ID NO:6, SEQ ID NO:8 и SEQ ID NO:10.
В одном из вариантов осуществления изобретения антитело к CD19, предлагаемое в изобретении, может содержать вариабельную область тяжелой цепи, VH, включающую по меньшей мере один CDR, аминокислотная последовательность которого выбрана из группы, включающей SEQ ID NO:22, SEQ ID NO:24 и SEQ ID NO:121. В другом варианте осуществления изобретения антитело к CD19, предлагаемое в изобретении, может содержать вариабельную область тяжелой цепи, VH, включающую по меньшей мере один CDR, аминокислотная последовательность которого выбрана из группы, включающей SEQ ID NO:22, SEQ ID NO:116 и SEQ ID NO: 121. В другом варианте осуществления изобретения антитело к CD19, предлагаемое в изобретении, может содержать вариабельную область тяжелой цепи, VH, включающую по меньшей мере один CDR, аминокислотная последовательность которого выбрана из группы, включающей SEQ ID NO:208, SEQ ID NO:116 и SEQ ID NO:121. В другом варианте осуществления изобретения антитело к CD19, предлагаемое в изобретении, может содержать вариабельную область тяжелой цепи, VH, включающую по меньшей мере один CDR, аминокислотная последовательность которого выбрана из группы, включающей SEQ ID NO:208, SEQ ID NO:210 и SEQ ID NO: 121.
В другом варианте осуществления изобретения антитело к CD19, предлагаемое в изобретении, может содержать вариабельную область тяжелой цепи, VH, включающую по меньшей мере один CDR, который имеет аминокислотную последовательность VH CDR1, VH CDR2 или VH CDR3, представленную в таблице 1.
В другом варианте осуществления изобретения антитело к CD19, предлагаемое в изобретении, может содержать вариабельную область тяжелой цепи, VH, включающую аминокислотные последовательности VH CDR1, VH CDR2 и VH CDR3 любого из антител, представленных в таблице 1. Антитело к CD19, предлагаемое в изобретении, может содержать также вариабельную область легкой цепи, VL.
В другом варианте осуществления изобретения антитело к CD19, предлагаемое в изобретении, может содержать вариабельную область легкой цепи, VL, включающую аминокислотные последовательности VL CDR1, VL CDR2 и VL CDR3 любого из антител, представленных в таблице 1.
Антитело к CD19, предлагаемое в изобретении, может содержать также вариабельную область тяжелой цепи, VH.
В другом варианте осуществления изобретения антитело к CD19, предлагаемое в изобретении, может включать аминокислотные последовательности VH CDR1, VH CDR2, VH CDR3, VL CDR1, VL CDR2, и VL CDR3 любого из антител, представленных в таблице 1.
В определенных вариантах осуществления изобретения антитело к CD19 может содержать последовательность VH-области гуманизированной VH, обозначенной как HB12B-(3-72/JH4) (SEQ ID NO:34).
В одном из вариантов осуществления изобретения антитело к CD19, представленное в описании, может содержать вариабельная область тяжелой цепи, VH, которая имеет аминокислотную последовательность, выбранную из группы, включающей SEQ ID NO:103, 106, 191 и 192. В другом варианте осуществления изобретения антитело к CD19, представленное в описании, может содержать вариабельная область тяжелой цепи, VH, которая имеет аминокислотную последовательность VH-области, представленной в таблице 1.
В определенных вариантах осуществления изобретения антитело к CD19, предлагаемое в изобретении, может содержать вариабельную область легкой цепи, VK, включающую по меньшей мере один CDR, который имеет аминокислотную последовательность, выбранную из группы, включающей SEQ ID NO: 28, SEQ ID NO: 30 и SEQ ID NO:32, и может содержать также по меньшей мере один FW-участок, который имеет аминокислотную последовательность, выбранную из группы, включающей SEQ ID NO:54, SEQ ID NO:56, SEQ ID NO:72, SEQ ID NO:82, SEQ ID NO:64, SEQ ID NO:58, SEQ ID NO:66 и SEQ ID NO:60.
В одном из вариантов осуществления изобретения антитело к CD19, предлагаемое в изобретении, может содержать вариабельную область легкой цепи, VK, включающую по меньшей мере один CDR, который имеет аминокислотную последовательность, выбранную из группы, включающей SEQ ID NO: 28, SEQ ID NO: 125 и SEQ ID NO:32, и может также включать по меньшей мере один FW-участок, который имеет аминокислотную последовательность, выбранную из группы, включающей SEQ ID NO:54, SEQ ID NO:56, SEQ ID NO:72, SEQ ID NO:82. SEQ ID NO:64, SEQ ID NO:58, SEQ ID NO:66 и SEQ ID NO:60. В другом варианте осуществления изобретения антитело к CD19, предлагаемое в изобретении, может содержать вариабельную область легкой цепи, VK, включающую по меньшей мере один CDR, который имеет аминокислотную последовательность, выбранную из группы, включающей SEQ ID NO:211, SEQ ID NO:218 и SEQ ID NO:222, и может также включать по меньшей мере один FW-участок, который имеет аминокислотную последовательность, выбранную из группы, включающей SEQ ID NO:54, SEQ ID NO:56, SEQ ID NO:72, SEQ ID NO:82, SEQ ID NO:64, SEQ ID NO:58, SEQ ID NO:66 и SEQ ID NO:60. В другом варианте осуществления изобретения антитело к CD19, предлагаемое в изобретении, может содержать вариабельную область легкой цепи, VK, включающую по меньшей мере один CDR, который имеет аминокислотную последовательность, выбранную из группы, включающей SEQ ID NO:28, SEQ ID NO:220 и SEQ ID NO:229, и может также включать по меньшей мере один FW-участок, который имеет аминокислотную последовательность, выбранную из группы, включающей SEQ ID NO:54, SEQ ID NO:56, SEQ ID NO:72, SEQ ID NO:82, SEQ ID NO:64, SEQ ID NO:58, SEQ ID NO:66 и SEQ ID NO:60. В другом варианте осуществления изобретения антитело к CD19, предлагаемое в изобретении, может содержать вариабельную область легкой цепи, VK, включающую по меньшей мере один CDR, который имеет аминокислотную последовательность, выбранную из группы, включающей SEQ ID NO:215, SEQ ID NO:221 и SEQ ID NO:222, и может также включать по меньшей мере один FW-участок, который имеет аминокислотную последовательность, выбранную из группы, включающей SEQ ID NO:54, SEQ ID NO:56, SEQ ID NO:72, SEQ ID NO:82, SEQ ID NO:64, SEQ ID NO:58, SEQ ID NO:66 и SEQ ID NO:60. В другом варианте осуществления изобретения антитело к CD19, предлагаемое в изобретении, может содержать вариабельную область легкой цепи, VK, включающую по меньшей мере один CDR, который имеет аминокислотную последовательность VK CDR1, VK CDR2 или VK CDR3, представленную в таблице 1; и может также включать по меньшей мере один FW-участок, который имеет аминокислотную последовательность, выбранную из группы, включающей SEQ ID NO:54, SEQ ID NO:56, SEQ ID NO:72, SEQ ID NO:82, SEQ ID NO:64, SEQ ID NO:58, SEQ ID NO:66 и SEQ ID NO:60.
В других вариантах осуществления изобретения антитело к CD19, предлагаемое в изобретении, может содержать вариабельную область легкой цепи, VK, включающую по меньшей мере один CDR, последовательность которого выбрана из группы, включающей SEQ ID NO:28, 30 и 32.
В следующих вариантах осуществления изобретения антитело к CD19, предлагаемое в изобретении, может содержать вариабельную область легкой цепи, VK, включающую по меньшей мере один CDR, последовательность которого выбрана из группы, включающей SEQ ID NO:12, 14 и 16.
В одном из вариантов осуществления изобретения антитело к CD19, предлагаемое в изобретении, может содержать вариабельную область легкой цепи, VK, включающую по меньшей мере один CDR, последовательность которого выбрана из группы, включающей SEQ ID NO: 28, SEQ ID NO: 125 и SEQ ID NO:32. В одном из вариантов осуществления изобретения антитело к CD19, предлагаемое в изобретении, может содержать вариабельную область легкой цепи, VK, включающую по меньшей мере один CDR, последовательность которого выбрана из группы, включающей SEQ ID NO: 211, SEQ ID NO: 218 и SEQ ID NO:222. В одном из вариантов осуществления изобретения антитело к CD19, предлагаемое в изобретении, может содержать вариабельную область легкой цепи, VK, включающую по меньшей мере один CDR, последовательность которого выбрана из группы, включающей SEQ ID NO: 28, SEQ ID NO: 220 и SEQ ID NO:229. В одном из вариантов осуществления изобретения антитело к CD19, предлагаемое в изобретении, может содержать вариабельную область легкой цепи, VK, включающую по меньшей мере один CDR, последовательность которого выбрана из группы, включающей SEQ ID NO: 215, SEQ ID NO: 221 и SEQ ID NO:222. В другом варианте осуществления изобретения антитело к CD19, предлагаемое в изобретении, может содержать вариабельную область легкой цепи, VK, включающую по меньшей мере один CDR, который имеет аминокислотную последовательность VK CDR1, VK CDR2 или VK CDR3, представленную в таблице 1.
В определенных вариантах осуществления изобретения антитело к CD19 может содержать последовательность гуманизированной VK-области, выбранную из группы, включающей HB12B-(A10-Jk4) (SEQ ID NO:52), НВ12В-364987 (SEQ ID NO:62), HB12B-3649 (SEQ ID NO:68), HB12B-36 (SEQ ID NO:70), 7E12 VK (SEQ ID NO:110), 14H5 VK (SEQ ID NO:111), 16C9 VK (113), 15D1 VK(SEQID NO:112), 3C3 VK(SEQID NO:193), 6C11 VK (SEQ ID NO:204) и 9G7 VK (SEQ ID NO:205).
Настоящее изобретение относится к антителам, которые связываются с человеческим CD19, которые включают производные VH-областей, VH CDR1, VH CDR2, VH CDR3, VK-областей, VK CDR1, VK CDR2 или VK CDR3, представленных в настоящем описании, которые могут связываться с человеческим CD19 (см, например, варианты, представленные в таблице 1). Для интродукции мутаций в нуклеотидную последовательность, кодирующую антитело, можно применять стандартные методы, известные специалистам в данной области (например, добавления, делеции и/или замены), включая, например, сайтнаправленный мутагенез и опосредуемый ПЦР мутагенез, которые традиционно применяют для создания аминокислотный замен. В одном из вариантов осуществления изобретения производные VH и/или VK CDR могут включать менее 25 аминокислотных замен, менее 20 аминокислотных замен, менее 15 аминокислотных замен, менее 10 аминокислотных замен, менее 5 аминокислотных замен, менее 4 аминокислотных замен, менее 3 аминокислотных замен, менее 2 аминокислотных замен или 1 аминокислотную замену относительно исходных VH и/или VK CDR антитела к CD19 НВ12А или НВ12В. В другом варианте осуществления изобретения производные VH и/или VK CDR могут иметь консервативные аминокислотные замены (например, указанные выше) одного или нескольких аминокислотных остатков, которые рассматриваются как заменимые (т.е. аминокислотных остатков, которые не имеют решающего значения для специфического связывания антитела с человеческим CD19). Мутации можно интродуцировать также произвольно во всю или в часть кодирующих последовательностей VH и/или VK CDR, например, с помощью насыщающего мутагенеза, и образовавшиеся мутанты можно подвергать скринингу в отношении биологической активности для идентификации мутантов, сохранивших активность. После мутагенеза можно осуществлять экспрессию кодируемого антитела и определять активность антитела. В одном из вариантов осуществления изобретения, антитела, предлагаемые в изобретении, которые представлены в настоящем описании, могут не содержать VH CDR1 и VH CDR2 антитела hA19, описанного в US 2005/0070693 A1.
В одном из вариантов осуществления изобретения человеческое или гуманизированное антитело к CD19, представленное в настоящем описании, может содержать вариант одного из VH CDR, перечисленных в таблице 1, где указанный вариант VH CDR содержит аминокислотную замену. В конкретном варианте осуществления изобретения антитело к CD19, предлагаемое в изобретении, содержат вариант VH CDR, представленный в таблице 1, где вариант VH CDR содержит один или несколько следующих встречающихся в естественных условиях или замещенных аминокислотных остатков: треонин (Т) в положении 32 VH CDR1, тирозин (Y) в положении 60 VH CDR2, аспарагиновая кислота (D) в положении 60 VH CDR2, лейцин (L) в положении 60 VH CDR2, аланин (А) в положении 61 VH CDR2, валин (V) в положении 61 VH CDR2, тирозин (Y) в положении 100 В VH CDR3, аргинин (R) в положении 100 В VH CDR3 и аспарагин (N) в положении 100 В VH CDR3, где нумерация соответствует номенклатуре Кэбота.
В одном из вариантов осуществления изобретения человеческое или гуманизированное антитело к CD19, представленное в настоящем описании, может содержать вариант VH CDR, представленный в таблице 1, где вариант VH CDR содержит один или несколько следующих встречающихся в естественных условиях или замещенных аминокислотных остатков: глутаминовая кислота (Е) в положении 33 VH CDR1, лейцин (L) в положении 33 VH CDR1, фенилаланин (F) в положении 35 VH CDR1, тирозин (Y) в положении 35 VH CDR1, аспарагиновая кислота (D) в положении 35 VH CDR1, лейцин (L) в положении 35 VH CDR1, серии (S) в положении 57 VH CDR2, пролин (Р) в положении 57f VH CDR2, аспарагин (N) в положении 57 VH CDR2, гистидин (Н) в положении 100 В VH CDR3, фенилаланин (F) в положении 100 В VH CDR3 и пролин (Р) в положении 99 VH CDR3, где нумерация соответствует номенклатуре Кэбота.
В одном из вариантов осуществления изобретения человеческое или гуманизированное антитело к CD19, представленное в настоящем описании, может содержать вариант VH CDR, представленный в таблице 1, где вариант VH CDR содержит один или несколько следующих встречающихся в естественных условиях или замещенных аминокислотных остатков: валин (V) в положении 32 VH CDR1 и лейцин (L) в положении 52А VH CDR2, где нумерация соответствует номенклатуре Кэбота.
В другом варианте осуществления изобретения человеческое или гуманизированное антитело к CD19, предлагаемое в изобретении, может содержать вариант VK CDR, представленный в таблице 1, где указанный VK CDR содержит один или несколько следующих встречающихся в естественных условиях или замещенных аминокислотных остатков: гистидин (Н) в положении 27D VK CDR1, изолейцин (I) в положении 33 VK CDR1, глутаминовая кислота (Е) в положении 50 VK CDR2, треонин (Т) в положении 91 в VK CDR3 и изолейцин (I) в положении 96 VK CDR3, где нумерация соответствует номенклатуре Кэбота.
В другом варианте осуществления изобретения человеческое или гуманизированное антитело к CD19, предлагаемое в изобретении, может содержать вариант VK CDR, представленный в таблице 1, где указанный VK CDR содержит один или несколько следующих встречающихся в естественных условиях или замещенных аминокислотных остатков: изолейцин (I) в положении 27С VK CDR1, лейцин (L) в положении 30 VK CDR1, аргинин (R) в положении 33 VK CDR1, треонин (Т) в положении 33 VK CDR1, тирозин (Y) в положении 50 VK CDR2, треонин (Т) в положении 54 VK CDR2, пролин (Р) в положении 54 VK CDR2, тирозин (Y) в положении 55 VK CDR2 и аспарагин (N) в положении 96 VK CDR3, где нумерация соответствует номенклатуре Кэбота.
В другом варианте осуществления изобретения человеческое или гуманизированное антитело к CD19, предлагаемое в изобретении, может содержать вариант VK CDR, представленный в таблице 1, где указанный VK CDR содержит один или несколько следующих встречающихся в естественных условиях или замещенных аминокислотных остатков: аргинин (R) в положении 54 VK CDR2, треонин (Т) в положении 54 VK CDR2, аланин (А) в положении 54 VK CDR2 и аланин (А) в положении 89 VK CDR3, где нумерация соответствует номенклатуре Кэбота.
Настоящее изобретение относится также к антителам, которые связываются с человеческим CD19, где антитела или фрагменты антител содержат один или несколько CDR, где CDR имеют аминокислотную последовательность, которая по меньшей мере на 45%, по меньшей мере на 50%, по меньшей мере на 55%, по меньшей мере на 60%, по меньшей мере на 65%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95% или по меньшей мере на 99% идентичная аминокислотной последовательности одного или нескольких CDR антитела к CD19 НВ12А или НВ12В. Процент идентичности двух аминокислотных последовательностей можно определять любым методом, известным специалисту в данной области, включая, но, не ограничиваясь только ими, анализ белков с помощью BLAST.
5.1.2. Каркасные участки антител к CD19
В одном из вариантов осуществления изобретения VH гуманизированного моноклонального антитела к CD19, предлагаемого в изобретении, может содержать каркасный участок, аминокислотная последовательность которого идентична на примерно 64 - 100% соответствующим каркасным участкам (т.е., FW1 антитела Х относительно FW1 антитела Y) HB12B-(3-72/JH4) VH (SEQ ID NO:34). В некоторых аспектах этого варианта осуществления изобретения каркасные участки человеческих или гуманизированных VH антител, представленных в настоящем описании, могут иметь аминокислотную последовательность, идентичную HB12B-(3-72/JH4) VH (SEQ ID NO:34) по меньшей мере на 64%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90% или по меньшей мере на 95%.
В конкретных вариантах осуществления изобретения каркасные участки человеческих или гуманизированных VH антител к CD19, представленных в настоящем описании, могут иметь аминокислотную последовательность, в которой по меньшей мере 56 из 87 аминокислот (56/87) идентичны аминокислотам последовательности соответствующих каркасных участков VH HB12B-(3-72/JH4) (SEQ ID NO:34) В конкретных вариантах осуществления изобретения идентичность аминокислот последовательности каркасного участка VH может составлять по меньшей мере 56/87, 57/87, 58/87, 59/87, 60/87, 61/87, 62/87, 63/87, 64/87, 65/87, 66/87, 67/87, 68/87, 69/87, 70/87, 71, 87, 72/87, 73/87 74/87, 75/87, 76/87, 77/87, 78/87, 79/87, 80/87, 81/87, 82/87, 83/87, 84/87, 85/87, 86/87 или 87/87 аминокислот. VH-последовательности антител к CD19, представленных в настоящем описании, могут иметь высокую идентичность последовательности верньерным аминокислотным остаткам HB12B-(3-72/JH4), например идентичны верньерной последовательности по меньшей мере на уровне 10 из 16 (10/16), по меньшей мере 11/16, по меньшей мере 12/16, по меньшей мере 13/16, по меньшей мере 14/16 или по меньшей мере 15/16 верньерных остатков. В другом варианте осуществления изобретения несовпадающий с верньерным аминокислотный остаток может представлять собой консервативную аминокислотную замену. Несовпадение, представляющее собой консервативную аминокислотную замену, представляет собой ситуацию, когда несовпадающая аминокислота имеет физические и химические свойства, сходные со свойствами верньерных аминокислот, например, «ошибочный» остаток имеет сходные характеристики полярности (полярный или неполярный), кислотности (кислый или основный), структуры боковых цепей (например, разветвленные или прямоцепочечные, или содержащие фенильное кольцо, гидроксильный остаток или остаток серы) с верньерным остатком.
В других вариантах осуществления изобретения несовпадающий с верньерным аминокислотный остаток может представлять собой неконсервативную аминокислотную замену. Несовпадение, представляющее собой неконсервативную аминокислотную замену, представляет собой ситуацию, когда несовпадающая аминокислота не имеет физические и химические свойства, сходные со свойствами верньерных аминокислот, например, «ошибочный» остаток имеет другую полярность, кислотность или структуру боковой цепи (например, разветвленную или прямоцепочечную, или содержит фенильное кольцо, гидроксильный остаток или остаток серы) по сравнению с верньерным остатком, который он заменяет.
В других вариантах осуществления изобретения человеческое или гуманизированное антитело к CD19, предлагаемое в изобретении, может содержать каркасные участки VH, где каркасные участки VH могут содержать один или несколько следующих остатков: лейцин (L) в положении 20 каркасного участка 1, фенилаланин (F) в положении 27 каркасного участка 1, треонин (Т) в положении 28 каркасного участка 1, аргинин (R) в положении 38 каркасного участка 2, валин (V) в положении 48 каркасного участка 2, фенилаланин (F) в положении 67 каркасного участка 3, аргинин (R) в положении 71 каркасного участка 3, лейцин (L) в положении 80 каркасного участка 3 и тирозин (Y) в положении 91 каркасного участка 3, где нумерация соответствует номенклатуре Кэбота.
Нумерация Кэбота основана на основополагающей работе Kabat и др. (1991) Sequences of Proteins of Immunological Interest, публикация №91-3242, опубликована в виде трехтомника издательством National Institutes of Health, National Technical Information Service (далее цитируется как «по Кэботу»). Кэбот провел сравнительный анализ множества последовательностей цепей иммуноглобулинов из многочисленных изотипов антител разных видов. Сравниваемые последовательности нумеруют согласно единой системе нумерации, т.е. согласно номенклатуре Кэбота. После первой публикации в 1991 г. последовательности Кэбота были модернизированы и в настоящее время они доступны в виде электронной базы данных последовательностей (последняя загружаемая версия 1997 г.). Любую последовательность иммуноглобулина можно пронумеровать в соответствии с номенклатурой Кэбота, осуществляя сравнительный анализ с референс-последовательностью Кэбота. Таким образом, номенклатура Кэбота представляет собой единую систему нумерации цепей иммуноглобулинов. Если не указано иное, то все аминокислотные последовательности иммуноглобулинов, представленные в настоящем описании, пронумерованы согласно номенклатуре Кэбота. Аналогично этому все индивидуальные аминокислотные положения в контексте настоящего описания пронумерованы согласно номенклатуре Кэбота.
В других конкретных вариантах осуществления изобретения каркасные участки человеческих или гуманизированных VH антител к CD19, представленных в настоящем описании, могут иметь каркасные участки, выбранные на основе идентичности или с учетом консервативных несовпадений в одном или нескольких положениях верньерных, находящихся на границе раздела или канонических остатков: 20, 22, 24, 26, 27, 28, 29, 30, 36, 37, 39, 45, 47, 48, 49, 67, 69, 71, 73, 78, 80, 90, 91, 92, 93, 94 и 103. Один или несколько несовпадающих верньерных, находящихся на границе раздела или канонических остатков, можно заменять, например, путем мутагенеза, для совпадения с соответствующим аминокислотным остатком каркасного участка VH HB12A или НВ12В.
В одном из вариантов осуществления изобретения каркасные участки человеческих или гуманизированных VK антител к CD19, представленных в настоящем описании, могут иметь аминокислотную последовательность, идентичную на примерно 65 - 100% последовательности каркасных участков VK HB12B-(A10-Jk4) (SEQ ID NO:52). В конкретных аспектах этого варианта осуществления изобретения каркасные участки человеческих или гуманизированных VK антител, представленных в настоящем описании, могут иметь аминокислотную последовательность, идентичную VK антитела НВ12В-(A10-Jk4) по меньшей мере на 65%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, или по меньшей мере на 95%.
В конкретных вариантах осуществления изобретения каркасные участки человеческих или гуманизированных VK антител, представленных в настоящем описании, могут иметь аминокислотную последовательность, идентичную последовательности соответствующих каркасных участков (т.е. FW1 антитела Х относительно FW1 антитела Y) VK HB12B-(A10-Jk4) (SEQ ID NO:52), в которой идентичны по меньшей мере 52 из 80 аминокислот (52/80). В конкретных вариантах осуществления изобретения идентичность аминокислот последовательности каркасного участка VK может составлять по меньшей мере 52/80, 53/80, 54/80, 55/80, 56/80, 57/80, 58/80, 59/80, 60/80, 61/80, 62/80, 63/80, 64/80, 65/80, 66/80, 67/80, 68/80, 69/80, 70/80, 71, 80, 72/80, 73/80, 74/80, 75/80, 76/80, 77/80, 78/80, 79/80 или 80/80 аминокислот. VK-последовательности антител к CD19, представленных в настоящем описании, могут иметь высокую идентичность последовательности с верньерными аминокислотными остатками НВ12В (см. фиг.1), например идентичны верньерной последовательности по меньшей мере на уровне 9 из 14 (9/14), по меньшей мере 10/14, по меньшей мере 11/14, по меньшей мере 12/14, по меньшей мере 13/14 верньерных остатков. В другом варианте осуществления изобретения несовпадающий с верньерным аминокислотный остаток может представлять собой консервативную аминокислотную замену. Несовпадение, представляющее собой консервативную аминокислотную замену, представляет собой ситуацию, когда несовпадающая аминокислота имеет физические и химические свойства, сходные со свойствами верньерных аминокислот, например, «ошибочный» остаток имеет сходные характеристики полярности (полярный или неполярный), кислотности (кислый или основный), структуры боковых цепей (например, разветвленные или прямоцепочечные, или содержащие фенильное кольцо, гидроксильный остаток или остаток серы) с верньерным остатком.
В других вариантах осуществления изобретения несовпадающий с верньерным аминокислотный остаток может представлять собой неконсервативную аминокислотную замену. Несовпадение, представляющее собой неконсервативную аминокислотную замену, представляет собой ситуацию, когда несовпадающая аминокислота не имеет физические и химические свойства, сходные со свойствами верньерных аминокислот, например, «ошибочный» остаток имеет другую полярность, кислотность или структуру боковой цепи (например, разветвленную или прямоцепочечную, или содержит фенильное кольцо, гидроксильный остаток или остаток серы) по сравнению с верньерным остатком, который он заменяет.
В других вариантах осуществления изобретения каркасные участки человеческих или гуманизированных VK, представленных в настоящем описании, могут содержать один или несколько следующих остатков: фенилаланин (F) в положении 36 каркасного участка 2, гистидин (Н) в положении 49 каркасного участка 2, и фенилаланин (F) в положении 87 каркасного участка 3, где нумерация указана согласно номенклатуре Кэбота.
В других конкретных вариантах осуществления изобретения каркасные участки человеческих или гуманизированных VK антител, представленных в настоящем описании, могут иметь каркасные участки, выбранные на основе идентичности или консервативных несовпадений в одном или нескольких положений верньерных, находящихся на границе раздела или канонических остатков: 2, 3, 4, 23, 35, 36, 38, 44, 56, 47, 48, 49, 64, 66, 68, 69, 71, 87, 88 и 98. Один или несколько несовпадающих верньерных, находящихся на поверхности раздела или канонических остатков можно заменять, например, путем мутагенеза, для совпадения с соответствующим аминокислотным остатком каркасного участка VK HB12A или НВ12В.
В конкретных вариантах осуществления изобретения тяжелую цепь, содержащую гуманизированную VH, предлагаемую в изобретении, можно экспрессировать вместе с легкой цепью, содержащей гуманизированную VK, предлагаемую в изобретении, с получением гуманизированного антитела к CD19. В конкретном варианте осуществления изобретения гуманизированное антитело к CD19, предлагаемое в изобретении, может содержать VH-последовательность, выбранную из группы последовательностей, обозначенных как HB12B-(3-72/JH4) (SEQ ID NO:34), 7Е12 VH (SEQ ID NO:102), 14H5 VH (SEQ ID NO:103), 15D1 VH (SEQ ID NO:104), 15D7 VH (SEQ ID NO:105), 16C4 VH (SEQ ID NO:106), 14H5-YG (SEQ ID NO:107), 14H5-DG (SEQ ID NO:108), 14H5-LG (SEQ ID NO:109), 1A7 VH (SEQ ID NO:191), 3C3 VH (SEQ ID NO:191), 6C11 VH (SEQ ID NO:191), 9G7 (SEQ ID NO:191), 3B4 VH (SEQ ID NO:236) и 3F11 VH (SEQ ID NO:192); и могут содержать также VK-последовательность, выбранную из группы последовательностей, обозначенных как НВ12В-(А10/JK4) (SEQ ID NO:52); НВ12В-364987 (или 364987) (SEQ ID NO:62); HB12B-3649 (или 3649) (SEQ ID NO:68); HB12B-36 (или 36) (SEQ ID NO:70), 7E12 VK (SEQ ID NO:110), 14H5 (SEQ ID NO:111), 15D1 (SEQ ID NO:112), 16C9 (SEQ ID NO:113), 3C3 VK (SEQ ID NO:193), 3E5 VK (SEQ ID NO:194), 3D4 VK (SEQ ID NO:195), 3F1 VK (SEQ ID NO:196), 5B5 VK (SEQ ID NO:197), 6F7 VK (SEQ ID NO:198), 1C11 VK (SEQ ID NO:199), 2B11 VK (SEQ ID NO:200), 2D10 VK (SEQ ID NO:201), 5C11 VK (SEQ ID NO:202), 5D4 VK (SEQ ID NO:203), 6C11 VK (SEQ ID NO:204), 9G7 VK (SEQ ID NO:205), 1H4 VK (SEQ ID NO:206) и 5С4 VK (SEQ ID NO:207). В конкретном варианте осуществления изобретения гуманизированное антитело к CD19 содержит VH-последовательность НВ12В-(3-72/JH4) (SEQ ID NO:34) и VK-последовательность НВ12В-364987 (SEQ ID NO:62). В конкретном варианте осуществления изобретения гуманизированное антитело к CD19 содержит VH-последовательность HB12B-(3-72/JH4) (SEQ ID NO:34) и VK-последовательность HB12B-3649 (SEQ ID NO:68). Еще в одном варианте осуществления изобретения гуманизированное антитело к CD19 содержит VH-последовательность HB12B-(3-72/JH4) (SEQ ID NO:34) и VK-последовательность HB12B-36 (SEQ ID NO:70).
В конкретном варианте осуществления изобретения антитело к CD19, предлагаемое в изобретении, содержит VH-последовательность 7E12 VH (SEQ ID NO:102) и VK-последовательность 7E12 VK (SEQ ID NO:110). В конкретном варианте осуществления изобретения антитело к CD19, предлагаемое в изобретении, содержит VH-последовательность 14H5 VH (SEQ ID NO:103) и VK последовательность 14H5 VK (SEQ ID NO:111). В конкретном варианте осуществления изобретения антитело к CD19, предлагаемое в изобретении, содержит VH-последовательность 14H5-YG VH (SEQ ID NO:107) и VK-последовательность 14H5 VK (SEQ ID NO:111). В конкретном варианте осуществления изобретения антитело к CD19, предлагаемое в изобретении, содержит VH-последовательность 14H5-DG VH (SEQ ID NO:108) и VK-последовательность 14H5 VK (SEQ ID NO:111). В конкретном варианте осуществления изобретения антитело к CD19, предлагаемое в изобретении, содержит VH-последовательность 14H5-LG VH (SEQ ID NO:109) и VK-последовательность 14H5 VK (SEQ ID NO:111). В конкретном варианте осуществления изобретения антитело к CD19, предлагаемое в изобретении, содержит VH-последовательность 14Н5 VH (SEQ ID NO:103) и VK-последовательность 16С9 VK (SEQ ID NO:113). В конкретном варианте осуществления изобретения антитело к CD19, предлагаемое в изобретении, содержит VH-последовательность 15D1 VH (SEQ ID NO:104) и VK последовательность 15D1 VK (SEQ ID NO:112). В конкретном варианте осуществления изобретения антитело к CD19, предлагаемое в изобретении, содержит VH-последовательность 15D7 VH (SEQ ID NO:105) и VK-последовательность 14Н5 VK (SEQ ID NO:111). В конкретном варианте осуществления изобретения антитело к CD19, предлагаемое в изобретении, содержит VH-последовательность 16С4 VH (SEQ ID NO:106) и VK-последовательность 14Н5 VK (SEQ ID NO:111). В конкретном варианте осуществления изобретения антитело к CD19, предлагаемое в изобретении, содержит VH-последовательность 1А7 VH (SEQ ID NO:191) и VK-последовательность 14Н5 VK (SEQ ID NO:111). В конкретном варианте осуществления изобретения антитело к CD19, предлагаемое в изобретении, содержит VH-последовательность 1А7 VH (SEQ ID NO:191) и VK-последовательность 3С3 VK (SEQ ID NO:193). В конкретном варианте осуществления изобретения антитело к CD19, предлагаемое в изобретении, содержит VH-последовательность 1А7 VH (SEQ ID NO:191) и VK-последовательность 3Е5 VK (SEQ ID NO:194). В конкретном варианте осуществления изобретения антитело к CD19, предлагаемое в изобретении, содержит VH-последовательность 1А7 VH (SEQ ID NO:191) и VK-последовательность 3D4 VK (SEQ ID NO:195). В конкретном варианте осуществления изобретения антитело к CD19, предлагаемое в изобретении, содержит VH-последовательность 1А7 VH (SEQ ID NO:191) и VK-последовательность 5В5 VK (SEQ ID NO:197). В конкретном варианте осуществления изобретения антитело к CD19, предлагаемое в изобретении, содержит VH-последовательность 1А7 VH (SEQ ID NO:191) и VK-последовательность 6F7 VK (SEQ ID NO:198). В конкретном варианте осуществления изобретения антитело к CD19, предлагаемое в изобретении, содержит VH-последовательность 1А7 VH (SEQ ID NO:191) и VK-последовательность 2D10 VK (SEQ ID NO:201). В конкретном варианте осуществления изобретения антитело к CD19, предлагаемое в изобретении, содержит VH-последовательность 1А7 VH (SEQ ID NO:191) и VK-последовательность 5С11 VK (SEQ ID NO:202). В конкретном варианте осуществления изобретения антитело к CD19, предлагаемое в изобретении, содержит VH-последовательность 1А7 VH (SEQ ID NO:191) и VK-последовательность 9G7 VK (SEQ ID NO:205). В конкретном варианте осуществления изобретения антитело к CD19, предлагаемое в изобретении, содержит VH-последовательность 1А7 VH (SEQ ID NO:191) и VK-последовательность 1Н4 VK (SEQ ID NO:206). В конкретном варианте осуществления изобретения антитело к CD19, предлагаемое в изобретении, содержит VH-последовательность 1А7 VH (SEQ ID NO:191) и VK-последовательность 5С4 VK (SEQ ID NO:207). В конкретном варианте осуществления изобретения антитело к CD19, предлагаемое в изобретении, содержит VH-последовательность 3В4 VH (SEQ ID NO:236) и VK-последовательность 14Н5 VK (SEQ ID NO:111). В конкретном варианте осуществления изобретения антитело к CD19, предлагаемое в изобретении, содержит VH-последовательность 3F11 VH (SEQ ID NO:192) и VK-последовательность 3F11 VK (SEQ ID NO:196). В конкретном варианте осуществления изобретения антитело к CD19, предлагаемое в изобретении, содержит VH-последовательность 16С4 VH (SEQ ID NO:106) и VK-последовательность 1C11 VK (SEQ ID NO:199). В конкретном варианте осуществления изобретения антитело к CD19, предлагаемое в изобретении, содержит VH-последовательность 16С4 VH (SEQ ID NO:106) и VK-последовательность 2В11 VK (SEQ ID NO:200). В конкретном варианте осуществления изобретения антитело к CD19, предлагаемое в изобретении, содержит VH-последовательность 16С4 VH (SEQ ID NO:106) и VK-последовательность 5D4 VK (SEQ ID NO:203). В конкретном варианте осуществления изобретения антитело к CD19, предлагаемое в изобретении, содержит VH-последовательность 16С4 VH (SEQ ID NO:106) и VK-последовательность 6F7 VK (SEQ ID NO:198). В конкретном варианте осуществления изобретения антитело к CD19, предлагаемое в изобретении, содержит VH-последовательность 3F11 VH (SEQ ID NO:192) и VK-последовательность 6С11 VK (SEQ ID NO:204). В конкретном варианте осуществления изобретения антитело к CD19, предлагаемое в изобретении, содержит любую комбинацию VH и VL, представленных в таблице 1.
В определенных вариантах осуществления изобретения легкую цепь, содержащую гуманизированные VK, предлагаемые в изобретении, можно экспрессировать вместе тяжелой цепью, содержащей гуманизированную VH, предлагаемую в изобретении, с получением гуманизированного антитела к CD19. В одном из вариантов осуществления изобретения гуманизированное антитело к CD19, представленное в настоящем описании, содержит VK-последовательность, выбранную из группы, которая включает последовательности, обозначенные как HB12B-(A10/JK4) (SEQ ID NO:52); НВ12В-364987 (или 364987) (SEQ ID NO:62); HB12B-3649 (или 3649) (SEQ ID NO:68); HB12B-36 (или 36) (SEQ ID NO:70), 7E12 VK (SEQ ID NO:110), 14H5 (SEQ ID NO: 111), 15D1 (SEQ ID NO:112), 16C9 (SEQ ID NO:113), 3C3 (SEQ ID NO:193), 3E5 (SEQ ID NO:194), 3D4 (SEQ ID NO:195), 3F11 (SEQ ID NO:196), 5B5 (SEQ ID NO:197), 6F7 (SEQ ID NO:198), 1C11 (SEQ ID NO:199), 2B11 (SEQ ID NO:200), 2D10 (SEQ ID NO:201), 5C11 (SEQ ID NO:202), 5D4 (SEQ ID NO:203), 6C11 (SEQ ID NO:204), 9G7 (SEQ ID NO:205), 1H4 (SEQ ID NO:206), AND 5C4 (SEQ ID NO:207). Указанную выше VK-последовательность можно спаривать с VH-последовательностью, где аминокислотная последовательность каркасного участка выбрана из группы, включающей SEQ ID NO:36, 38, 40 и 42.
В определенных вариантах осуществления изобретения тяжелую цепь, содержащую гуманизированную VH, предлагаемую в изобретении, можно экспрессировать вместе легкой цепью, содержащей гуманизированную VK, предлагаемую в изобретении, с получением гуманизированного антитела к CD19. В одном из вариантов осуществления изобретения гуманизированное антитело к CD19, представленное в настоящем описании, содержит VH-последовательность, выбранную из группы, которая включает последовательности, обозначенные как HB12B-(3-72/JH4) (SEQ ID NO:34), 7E12 VH (SEQ ID NO:102), 14H5 VH (SEQ ID NO:103), 15D1 VH (SEQ ID NO:104), 15D7 VH (SEQ ID NO:105), 16C4 VH (SEQ ID NO:106), 14H5-YG (SEQ ID NO:107), 14H5-DG (SEQ ID NO:108), 14H5-LG (SEQ ID NO:109), 1A7 (SEQ ID NO:191), 3C3 VH (SEQ ID NO:191), 6C11 VH (SEQ ID NO:191), 9G7 (SEQ ID NO:191), 3B4 VH (SEQ ID NO:236) и 3F11 VH (SEQ ID NO:192). Указанную выше VH-последовательность можно спаривать с VK-последовательностью, где аминокислотная последовательность каркасного участка выбрана из группы, включающей SEQ ID NO:54, SEQ ID NO:56, SEQ ID NO:72, SEQ ID NO:82, SEQ ID NO:64, SEQ ID NO:58, SEQ ID NO:66 и SEQ ID NO:60.
В определенных вариантах осуществления изобретения гуманизированную VH или VK, выведенную из родительской гибридомы НВ12А или НВ12В, можно экспрессировать в виде химерной легкой цепи иммуноглобулина или химерной тяжелой цепи иммуноглобулина с получением химерного антитела к CD19. В конкретном варианте осуществления изобретения гуманизированную VH можно экспрессировать в виде химерного антитела, содержащего НВ12А VK (SEQ ID NO:4) или НВ12В VK (SEQ ID NO:20). В другом конкретном варианте осуществления изобретения гуманизированную VK можно экспрессировать в виде химерного антитела, содержащего НВ12А VH (SEQ ID NO:2) или НВ12В VH (SEQ ID NO:18). В другом варианте осуществления изобретения химерное антитело к CD19 может содержать VK-последовательность НВ12А (SEQ ID NO:4) или VK-последовательность НВ12В (SEQ ID NO:20) и может дополнительно содержать VH-последовательность НВ12А (SEQ ID NO:2) или VH-последовательность НВ12В (SEQ ID NO:18).
В конкретном варианте осуществления изобретения гуманизированная VH, предлагаемая в изобретении, может содержать также лидерную последовательность MGDNDIHFAFLSTGVHS (SEQ ID NO:83).
В другом варианте осуществления изобретения гуманизированная VK, предлагаемая в изобретении, может содержать также лидерную последовательность MDMRVPAQLLGLLLLWLPGAKC (SEQ ID NO:84), выбранную из лидерного пептида человеческого гена VKI-L12.
Антитела к CD19, представленные в настоящем описании, могут обладать высокой аффинностью к связыванию с человеческим антигеном CD19 (hCD19). Например, антитело, представленное в настоящем описании, может характеризоваться константой скорости ассоциации или kon-скоростью (антитело (Ab) + антиген (Ag)kon → Ab-Ag) по меньшей мере 2×105 М-1с-1, по меньшей мере 5×105 М-1с-1, по меньшей мере 106 М-1с-1, по меньшей мере 5×106 М-1с-1, по меньшей мере 107 М-1с-1, по меньшей мере 5×107 М-1с-1 или по меньшей мере 108 М-1с-1.
В другом варианте осуществления изобретения антитело к CD19, предлагаемое в изобретении, может характеризоваться скоростью реакции диссоциации (koff-скорость)((Ab-Ag)koff → антитело (Ab) + антиген (Ag)) менее чем 5×10-1 c-1, менее чем 10-1 c-1, менее чем 5×10-2 с-1, менее чем 10-2 с-1, менее чем 5×10-3 с-1, менее чем 10-3 с-1, менее чем 5×10-4 с-1 или менее чем 10-4 с-1. В другом варианте осуществления изобретения антитело, предлагаемое в изобретении, характеризуется значением koff менее чем 5×10-5 с-1, менее чем 10-5 c-1, менее чем 5×10-6 с-1, менее чем 10-6 c-1, менее чем 5×10-7 с-1, менее чем 10-7 c-1, менее чем 5×10-8 с-1, менее чем 10-8 c-1, менее чем 5×10-9 с-1 s-1, менее чем 10-9 c-1 или менее чем 10-10 c-1.
В другом варианте осуществления изобретения антитело к CD19, предлагаемое в изобретении, может характеризоваться константной аффинности или Ка (kon/koff), составляющей по меньшей мере 102 M-1, по меньшей мере 5×102 M-1, по меньшей мере 103 M-1, по меньшей мере 5×103 M-1, по меньшей мере 104 M-1, по меньшей мере 5×104 M-1, по меньшей мере 105 M-1, по меньшей мере 5×105 M-1, по меньшей мере 106 M-1, по меньшей мере 5×106 М-1, по меньшей мере 107 M-1, по меньшей мере 5×107 M-1, по меньшей мере 108 M-1, по меньшей мере 5×108 M-1, по меньшей мере 109 M-1, по меньшей мере 5×109 M-1, по меньшей мере 1010 M-1, по меньшей мере 5×1010 M-1, по меньшей мере 1011 M-1, по меньшей мере 5×1011 M-1, по меньшей мере 1012 M-1, по меньшей мере 5×1012 M-1, по меньшей мере 1013 M-1, по меньшей мере 5×1013 M-1, по меньшей мере 1014 M-1, по меньшей мере 5×1014 М-1, по меньшей мере 1015 M-1 или по меньшей мере 5×1015 M-1. Еще в одном варианте осуществления изобретения антитело к CD19, предлагаемое в изобретении, может характеризоваться константной диссоциации или Kd (koff/kon) менее чем 5×10-2 M, менее чем 10-2 M, менее чем 5×10-3 M, менее чем 10-3 M, менее чем 5×10-4 M, менее чем 10-4 M, менее чем 5×10-5 M, менее чем 10-5 M, менее чем 5×10-6 M, менее чем 10-6 M, менее чем 5×10-7 M, менее чем 10-7 M, менее чем 5×10-8 M, менее чем 10-8 M, менее чем 5×10-9 M, менее чем 10-9 M, менее чем 5×10-10 M, менее чем 10-10 M, менее чем 5×10-11 M, менее чем 10-11 M, менее чем 5×10-12 M, менее чем 10-12 M, менее чем 5×10-13 M, менее чем 10-13 M, менее чем 5×10-14 M, менее чем 10-14 M, менее чем 5×10-15 M или менее чем 10-15 M.
В одном из вариантов осуществления изобретения антитело, предлагаемое в изобретении, которое применяют согласно способу, представленному в настоящем описании, может иммуноспецифически связываться с человеческим CD19, и это связывание может характеризоваться константой диссоциации (Kd), составляющей менее чем 3000, менее чем 2500, менее чем 2000, менее чем 1500, менее чем 1000, менее чем 750, менее чем 500, менее чем 250, менее чем 200, менее чем 150, менее чем 100, менее чем 75 пМ при оценке методом, представленном в настоящем описании или известным специалисту в данной области (например, BIAcore-анализ, ELISA) (фирма Biacore International AB, Уппсала, Швеция). В конкретном варианте осуществления изобретения антитело, предлагаемое в изобретении, которое применяют согласно способу, представленному в настоящем описании, может иммуноспецифически связываться с человеческим антигеном CD19, и это связывание может характеризоваться константой диссоциации (Kd), составляющей от 25 до 3400, от 25 до 3000, от 25 до 2500, от 25 до 2000, от 25 до 1500, от 25 до 1000, от 25 до 750, от 25 до 500, от 25 до 250, от 25 до 100, от 25 до 75, от 25 до 50 пМ, при оценке методом, представленном в настоящем описании или известным специалисту в данной области (например, BIAcore-анализ, ELISA). В другом варианте осуществления изобретения антитело к CD19, предлагаемое в изобретении, которое применяют согласно способу, представленному в настоящем описании, может иммуноспецифически связываться с hCD19, и это связывание может характеризоваться константой диссоциации (Kd), составляющей 500, 100, 75 или 50 пМ, при оценке методом, представленном в настоящем описании или известным специалисту в данной области (например, BIAcore-анализ, ELISA).
Изобретение относится также к полинуклеотидам, содержащим нуклеотидную последовательность, кодирующую человеческое, гуманизированное или химерное антитело к CD19, представленное в настоящем описании, или его фрагменты. Изобретение относится также к полинуклеотидам, которые гибридизуются в строгих или расслабленных условиях гибридизации, например, представленных в настоящем описании, с полинуклеотидами, которые кодируют человеческое, гуманизированное или химерное антитело, представленное в настоящем описании, которое связывается с hCD19.
Строгие условия гибридизации включают, но, не ограничиваясь только ими, гибридизацию со связанной с фильтром ДНК в 6-кратном (6×) растворе хлорид натрия /цитрат натрия (SSC) примерно при 45°С с последующей одной или несколькими отмывкам в 0,2×SSC/0,1% ДСН примерно при 50-65°С, очень строгие условия, такие как гибридизация со связанной с фильтром ДНК в 6×SSC примерно при 45°С с последующей одной или несколькими отмывками в 0,1×SSC/0,2% ДСН примерно при 60°С, или любые другие строгие условия гибридизации известны специалистам в данной области (см., например, Current Protocols in Molecular Biology, т.1, под ред. Ausubel F.M. и др., изд-во Green Publishing Associates, Inc. и John Wiley and Sons, Inc., NY, 1989, на cc.6.3.1 -6.3.6 и 2.10.3).
Полинуклеотиды можно получать и определять нуклеотидную последовательность полинуклеотидов с помощью любых методов, известных в данной области. Например, если нуклеотидная последовательность антитела является известной, то полинуклеотид, кодирующий антитело, можно собирать из химически синтезированных олигонуклеотидов (например, согласно методу, описанному у Kutmeier и др., BioTechniques 17, 1994, с.242), который, в целом, состоит в том, что синтезируют перекрывающиеся олигонуклеотиды, содержащие участки последовательностей, кодирующих антитело, ренатурируют и лигируют эти олигонуклеотиды, а затем амплифицируют лигированные олигонуклеотиды с помощью ПЦР.
Полинуклеотид, кодирующий антитело, можно создавать также из нуклеиновой кислоты, выделенной из приемлемого источника. Если клон, содержащий нуклеиновую кислоту, которая кодирует антитело, не доступен, но последовательность молекулы антитела известна, то нуклеиновую кислоту, которая кодирует иммуноглобулин, можно химически синтезировать или получать из приемлемого источника (например, библиотеки кДНК антител или библиотеки кДНК, созданной из (или нуклеиновой кислоты, предпочтительно полиА+РНК, выделенной из любой ткани или клеток, экспрессирующих антитело, таких как клетки гибридомы, отобранные для экспрессии антитела) с помощью ПЦР-амплификации с использованием синтетических праймеров, которые могут гибридизоваться с 3'- и 5'-концами последовательности, или с помощью олигонуклеотидного зонда, специфического для конкретной генной последовательности, подлежащей идентификации, например клона кДНК из библиотеки кДНК, которая кодирует антитело. Амплифицированные нуклеиновые кислоты, созданные с помощью ПЦР, затем можно клонировать в реплицируемых клонирующих векторах с помощью любого метода, известного в данной области.
Настоящее изобретение относится также к полинуклеотидным последовательностям, которые кодируют каркасные участки и CDR VH и VK антител, представленных в настоящем описании, а также экспрессионным векторам, предназначенным для их эффективной экспрессии в клетках млекопитающих.
Настоящее изобретение относится также к антителам, которые обладают способностью эффективно истощать В-клетки, экспрессирующие молекулу рекомбинантного человеческого CD19, на модели hCD'19-трангенных мышей (см. Yazawa и др., Proc Nati Acad Sci USA, 102(42) 2005, cc.15178-15183). В конкретном варианте осуществления изобретения при применении антитела к CD19, предлагаемого в изобретении, В-клеточное истощение может достигать по меньшей мере 20%, по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90%, по меньшей мере 95% или по меньшей мере 100% относительно истощения, которое достигается при применении моноклонального антитела НВ12В. В другом варианте осуществления изобретения при применении антитела к CD19, предлагаемого в изобретении, В-клеточное истощение может более полным, чем истощение, которое достигается при применении антитела НВ12В. В одном из вариантов осуществления изобретения антитело к CD19, предлагаемое в изобретении, может приводить к истощению находящихся в кровотоке В-клеток, В-клеток крови, селезеночных В-клеток, В-клеток маргинальной зоны, фолликулярных В-клеток, перитонеальных В-клеток и/или В-клеток костного мозга. В одном из вариантов осуществления изобретения антитело к CD19, предлагаемое в изобретении, может приводить к истощению предшественников В-клеток, ранних про-В-клеток, поздних про-В-клеток, больших пре-В-клеток, малых пре-В-клеток, незрелых В-клеток, зрелых В-клеток, стимулированных антигеном В-клеток и/или плазматических клеток. В одном из вариантов осуществления изобретения В-клеточное истощение, вызываемое антителом к CD19, предлагаемым в изобретении, может сохраняться в течение по меньшей мере 1 дня, по меньшей мере 2 дней, по меньшей мере 3 дней, по меньшей мере 4 дней, по меньшей мере 5 дней, по меньшей мере 6 дней, по меньшей мере 7 дней, по меньшей мере 8 дней, по меньшей мере 9 дней, по меньшей мере 10 дней, по меньшей мере 15 дней, по меньшей мере 20 дней, по меньшей мере 25 дней или по меньшей мере 30 дней. В другом варианте осуществления изобретения В-клеточное истощение, вызываемое антителом к CD19, предлагаемым в изобретении, может сохраняться в течение по меньшей мере 1 недели, по меньшей мере 2 недель, по меньшей мере 3 недель, по меньшей мере 4 недель, по меньшей мере 5 недель, по меньшей мере 6 недель, по меньшей мере 7 недель, по меньшей мере 8 недель, по меньшей мере 9 недель или по меньшей мере 10 недель. Еще в одном варианте осуществления изобретения В-клеточное истощение, вызываемое антителом к CD19, предлагаемым в изобретении, может сохраняться в течение по меньшей мере 1 месяца, по меньшей мере 2 месяцев, по меньшей мере 3 месяцев, по меньшей мере 4 месяцев, по меньшей мере 5 месяцев, по меньшей мере 6 месяцев, по меньшей мере 7 месяцев, по меньшей мере 8 месяцев, по меньшей мере 9 месяцев, по меньшей мере 10 месяцев, по меньшей мере 11 месяцев или по меньшей мере 12 месяцев.
Настоящее изобретение относится также к антителам, которые вызывают эффективное истощение В-клеток у человека. В конкретном варианте осуществления изобретения при применении антитела к CD19, предлагаемого в изобретении, В-клеточное истощение может достигать по меньшей мере примерно 20%, по меньшей мере примерно 30%, по меньшей мере примерно 40%, по меньшей мере примерно 50%, по меньшей мере примерно 60%, по меньшей мере примерно 70%, по меньшей мере примерно 80%, по меньшей мере примерно 90%, по меньшей мере примерно 95% или примерно 100%. В другом варианте осуществления изобретения антитело к CD19, предлагаемое в изобретении, может вызывать истощение В-клеточных субпопуляций у человека. В конкретном варианте осуществления изобретения антитело к CD19, предлагаемое в изобретении, может приводить к истощению находящихся в кровотоке В-клеток, В-клеток крови, селезеночных В-клеток, В-клеток маргинальной зоны, фолликулярных В-клеток, перитонеальных В-клеток и/или В-клеток костного мозга. CD19 присутствует на поверхности В-клеток при всех стадиях развития. Поэтому антитело к CD19 может вызывать В-клеточное истощение на всех стадиях развития. В конкретном варианте осуществления изобретения антитело к CD19, предлагаемое в изобретении, может приводить к истощению предшественников В-клеток, ранних про-В-клеток, поздних про-В-клеток, больших пре-В-клеток, малых пре-В-клеток, незрелых В-клеток, зрелых В-клеток, стимулированных антигеном В-клеток и/или плазматических клеток. Истощение В-клеток может сохраняться в течение пролонгированных периодов времени. В одном из вариантов осуществления изобретения В-клеточное истощение, вызываемое антителом к CD19, предлагаемым в изобретении, может сохраняться в течение по меньшей мере 1 дня, по меньшей мере 2 дней, по меньшей мере 3 дней, по меньшей мере 4 дней, по меньшей мере 5 дней, по меньшей мере 6 дней, по меньшей мере 7 дней, по меньшей мере 8 дней, по меньшей мере 9 дней, по меньшей мере 10 дней, по меньшей мере 15 дней, по меньшей мере 20 дней, по меньшей мере 25 дней или по меньшей мере 30 дней. В другом варианте осуществления изобретения В-клеточное истощение, вызываемое антителом к CD19, предлагаемым в изобретении, может сохраняться в течение по меньшей мере 1 недели, по меньшей мере 2 недель, по меньшей мере 3 недель, по меньшей мере 4 недель, по меньшей мере 5 недель, по меньшей мере 6 недель, по меньшей мере 7 недель, по меньшей мере 8 недель, по меньшей мере 9 недель или по меньшей мере 10 недель. Еще в одном варианте осуществления изобретения В-клеточное истощение, вызываемое антителом к CD19, предлагаемым в изобретении, может сохраняться в течение по меньшей мере 1 месяца, по меньшей мере 2 месяцев, по меньшей мере 3 месяцев, по меньшей мере 4 месяцев, по меньшей мере 5 месяцев, по меньшей мере 6 месяцев, по меньшей мере 7 месяцев, по меньшей мере 8 месяцев, по меньшей мере 9 месяцев, по меньшей мере 10 месяцев, по меньшей мере 11 месяцев или по меньшей мере 12 месяцев.
В одном из вариантов осуществления изобретения антитело к CD19, предлагаемое в изобретении, обеспечивает истощение по меньшей мере примерно 20%, по меньшей мере примерно 30%, по меньшей мере примерно 40%, по меньшей мере примерно 50%, по меньшей мере примерно 60%, по меньшей мере примерно 70%, по меньшей мере примерно 80%, по меньшей мере примерно 90%, по меньшей мере примерно 95% или примерно 100% находящихся в кровотоке В-клеток. В одном из вариантов осуществления изобретения антитело к CD19, предлагаемое в изобретении, обеспечивает истощение по меньшей мере примерно 20%, по меньшей мере примерно 30%, по меньшей мере примерно 40%, по меньшей мере примерно 50%, по меньшей мере примерно 60%, по меньшей мере примерно 70%, по меньшей мере примерно 80%, по меньшей мере примерно 90%, по меньшей мере примерно 95% или примерно 100% В-клеток крови. В одном из вариантов осуществления изобретения антитело к CD19, предлагаемое в изобретении, обеспечивает истощение по меньшей мере примерно 20%, по меньшей мере примерно 30%, по меньшей мере примерно 40%, по меньшей мере примерно 50%, по меньшей мере примерно 60%, по меньшей мере примерно 70%, по меньшей мере примерно 80%, по меньшей мере примерно 90%, по меньшей мере примерно 95% или примерно 100% селезеночных В-клеток. В одном из вариантов осуществления изобретения антитело к CD19, предлагаемое в изобретении, обеспечивает истощение по меньшей мере примерно 20%, по меньшей мере примерно 30%, по меньшей мере примерно 40%, по меньшей мере примерно 50%, по меньшей мере примерно 60%, по меньшей мере примерно 70%, по меньшей мере примерно 80%, по меньшей мере примерно 90%, по меньшей мере примерно 95% или примерно 100% В-клеток маргинальной зоны. В одном из вариантов осуществления изобретения антитело к CD19, предлагаемое в изобретении, обеспечивает истощение по меньшей мере примерно 20%, по меньшей мере примерно 30%, по меньшей мере примерно 40%, по меньшей мере примерно 50%, по меньшей мере примерно 60%, по меньшей мере примерно 70%, по меньшей мере примерно 80%, по меньшей мере примерно 90%, по меньшей мере примерно 95% или примерно 100% фолликулярных В-клеток. В одном из вариантов осуществления изобретения антитело к CD19, предлагаемое в изобретении, обеспечивает истощение по меньшей мере примерно 20%, по меньшей мере примерно 30%, по меньшей мере примерно 40%, по меньшей мере примерно 50%, по меньшей мере примерно 60%, по меньшей мере примерно 70%, по меньшей мере примерно 80%, по меньшей мере примерно 90%, по меньшей мере примерно 95% или примерно 100% перитонеальных В-клеток. В одном из вариантов осуществления изобретения антитело к CD19, предлагаемое в изобретении, обеспечивает истощение по меньшей мере примерно 20%, по меньшей мере примерно 30%, по меньшей мере примерно 40%, по меньшей мере примерно 50%, по меньшей мере примерно 60%, по меньшей мере примерно 70%, по меньшей мере примерно 80%, по меньшей мере примерно 90%, по меньшей мере примерно 95% или примерно 100% В-клеток костного мозга. В одном из вариантов осуществления изобретения антитело к CD19, предлагаемое в изобретении, обеспечивает истощение по меньшей мере примерно 20%, по меньшей мере примерно 30%, по меньшей мере примерно 40%, по меньшей мере примерно 50%, по меньшей мере примерно 60%, по меньшей мере примерно 70%, по меньшей мере примерно 80%, по меньшей мере примерно 90%, по меньшей мере примерно 95% или примерно 100% предшественников В-клеток. В одном из вариантов осуществления изобретения антитело к CD19, предлагаемое в изобретении, обеспечивает истощение по меньшей мере примерно 20%, по меньшей мере примерно 30%, по меньшей мере примерно 40%, по меньшей мере примерно 50%, по меньшей мере примерно 60%, по меньшей мере примерно 70%, по меньшей мере примерно 80%, по меньшей мере примерно 90%, по меньшей мере примерно 95% или примерно 100% ранних про-В-клеток. В одном из вариантов осуществления изобретения антитело к CD19, предлагаемое в изобретении, обеспечивает истощение по меньшей мере примерно 20%, по меньшей мере примерно 30%, по меньшей мере примерно 40%, по меньшей мере примерно 50%, по меньшей мере примерно 60%, по меньшей мере примерно 70%, по меньшей мере примерно 80%, по меньшей мере примерно 90%, по меньшей мере примерно 95% или примерно 100% поздних про-В-клеток. В одном из вариантов осуществления изобретения антитело к CD19, предлагаемое в изобретении, обеспечивает истощение по меньшей мере примерно 20%, по меньшей мере примерно 30%, по меньшей мере примерно 40%, по меньшей мере примерно 50%, по меньшей мере примерно 60%, по меньшей мере примерно 70%, по меньшей мере примерно 80%, по меньшей мере примерно 90%, по меньшей мере примерно 95% или примерно 100% больших пре-В-клеток. В одном из вариантов осуществления изобретения антитело к CD19, предлагаемое в изобретении, обеспечивает истощение по меньшей мере примерно 20%, по меньшей мере примерно 30%, по меньшей мере примерно 40%, по меньшей мере примерно 50%, по меньшей мере примерно 60%, по меньшей мере примерно 70%, по меньшей мере примерно 80%, по меньшей мере примерно 90%, по меньшей мере примерно 95% или примерно 100% малых пре-В-клеток. В одном из вариантов осуществления изобретения антитело к CD19, предлагаемое в изобретении, обеспечивает истощение по меньшей мере примерно 20%, по меньшей мере примерно 30%, по меньшей мере примерно 40%, по меньшей мере примерно 50%, по меньшей мере примерно 60%, по меньшей мере примерно 70%, по меньшей мере примерно 80%, по меньшей мере примерно 90%, по меньшей мере примерно 95% или примерно 100% незрелых В-клеток. В одном из вариантов осуществления изобретения антитело к CD19, предлагаемое в изобретении, обеспечивает истощение по меньшей мере примерно 20%, по меньшей мере примерно 30%, по меньшей мере примерно 40%, по меньшей мере примерно 50%, по меньшей мере примерно 60%, по меньшей мере примерно 70%, по меньшей мере примерно 80%, по меньшей мере примерно 90%, по меньшей мере примерно 95% или примерно 100% зрелых В-клеток. В одном из вариантов осуществления изобретения антитело к CD19, предлагаемое в изобретении, обеспечивает истощение по меньшей мере примерно 20%, по меньшей мере примерно 30%, по меньшей мере примерно 40%, по меньшей мере примерно 50%, по меньшей мере примерно 60%, по меньшей мере примерно 70%, по меньшей мере примерно 80%, по меньшей мере примерно 90%, по меньшей мере примерно 95% или примерно 100% стимулированных антигеном В-клеток. В одном из вариантов осуществления изобретения антитело к CD19, предлагаемое в изобретении, обеспечивает истощение по меньшей мере примерно 20%, по меньшей мере примерно 30%, по меньшей мере примерно 40%, по меньшей мере примерно 50%, по меньшей мере примерно 60%, по меньшей мере примерно 70%, по меньшей мере примерно 80%, по меньшей мере примерно 90%, по меньшей мере примерно 95% или примерно 100% плазматических клеток. Истощение В-клеток может сохраняться в течение пролонгированных периодов времени. В одном из вариантов осуществления изобретения В-клеточное истощение, вызываемое антителом к CD19, предлагаемым в изобретении, может сохраняться в течение по меньшей мере 1 дня, по меньшей мере 2 дней, по меньшей мере 3 дней, по меньшей мере 4 дней, по меньшей мере 5 дней, по меньшей мере 6 дней, по меньшей мере 7 дней, по меньшей мере 8 дней, по меньшей мере 9 дней, по меньшей мере 10 дней, по меньшей мере 15 дней, по меньшей мере 20 дней, по меньшей мере 25 дней или по меньшей мере 30 дней. В другом варианте осуществления изобретения В-клеточное истощение, вызываемое антителом к CD19, предлагаемым в изобретении, может сохраняться в течение по меньшей мере 1 недели, по меньшей мере 2 недель, по меньшей мере 3 недель, по меньшей мере 4 недель, по меньшей мере 5 недель, по меньшей мере 6 недель, по меньшей мере 7 недель, по меньшей мере 8 недель, по меньшей мере 9 недель или по меньшей мере 10 недель. Еще в одном варианте осуществления изобретения В-клеточное истощение, вызываемое антителом к CD19, предлагаемым в изобретении, может сохраняться в течение по меньшей мере 1 месяца, по меньшей мере 2 месяцев, по меньшей мере 3 месяцев, по меньшей мере 4 месяцев, по меньшей мере 5 месяцев, по меньшей мере 6 месяцев, по меньшей мере 7 месяцев, по меньшей мере 8 месяцев, по меньшей мере 9 месяцев, по меньшей мере 10 месяцев, по меньшей мере 11 месяцев или по меньшей мере 12 месяцев.
Связанные с В-клетками злокачественные состояния отличаются патологическим увеличением специфических В-клеточных субпопуляций, например, связанный с предшественниками В-клеток лимфобластный лейкоз отличается аномальным увеличением В-клеток, соответствующих таким стадиям развития В-клеток, как про-В-клетки/пре-В-клетки. У злокачественных В-клеток сохраняется экспрессия на клеточной поверхности характерных для здоровых клеток В-клеточных маркеров, таких как CD19. Таким образом, антитело к CD19 может приводить к истощению злокачественных В-клеток у человека. В конкретном варианте осуществления изобретения при применении антитела к CD19, предлагаемого в изобретении, может достигаться по меньшей мере 20%, по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90%, по меньшей мере 95% или по меньшей мере 100% истощение злокачественных В-клеток у человека.
В одном из вариантов осуществления изобретения гуманизированное антитело к CD19, представленное в настоящем описании, опосредует антитело-обусловленную клеточно-зависимую цитотоксичность (ADCC), комплементзависимую цитотоксичность (CDC) и/или апоптоз. В одном из вариантов осуществления изобретения гуманизированное антитело к CD19, предлагаемое в изобретении, усиливает антитело-обусловленную клеточнозависимую цитотоксичность (ADCC) и/или апоптоз. В одном из вариантов осуществления изобретения антитело к CD19, предлагаемое в изобретении, усиливает антитело-обусловленную клеточно-зависимую цитотоксичность (ADCC). В одном из вариантов осуществления изобретения антитело к CD19, предлагаемое в изобретении, содержит вариант Fc-фрагмента, который опосредует усиление антитело-обусловленной клеточно-зависимой цитотоксичности (ADCC). В одном из вариантов осуществления изобретения антитело к CD19, предлагаемое в изобретении, содержит Fc-фрагмент, который несет комплекс сцепленных с N-гликозидом сахарных цепей, связанных с остатком Asn297, в котором фукоза не связана с N-ацетилглюкозамином на восстанавливающем конце молекулы, где Fc-фрагмент опосредует усиленную антитело-обусловленную клеточно-зависимую цитотоксичность (ADCC).
Настоящее изобретение относится также к антителам к CD19, которые могут эффективно ингибировать in vitro стимулированную В-клеточную пролиферацию. Пролиферацию выделенных периферических В-клеток можно индуцировать различными стимулами, например, но, не ограничиваясь только ими, с помощью антитела к IgM (анти-IgM), CD40 или CpG. Эти стимулы можно вводить индивидуально или в сочетании друг с другом.
В одном из вариантов осуществления изобретения антитело к CD19, предлагаемое в изобретении, ингибирует in vitro стимулированную В-клеточную пролиферацию. В другом варианте осуществления изобретения антитело к CD19, представленное в настоящем описании, ингибирует in vitro В-клеточную пролиферацию, индуцированную стимуляцией анти-IgM/CpG или анти-IgM/CD40. В одном из вариантов осуществления изобретения антитело к CD19, предлагаемое в изобретении, ингибирует in vitro стимулированную В-клеточную пролиферация по меньшей мере примерно на 10%, по меньшей мере примерно на 20%, по меньшей мере примерно на 30%, по меньшей мере примерно на 40%, по меньшей мере примерно на 50% или по меньшей мере примерно на 75%.
В одном из вариантов осуществления изобретения Fc-вариант антитела к CD19, предлагаемого в изобретении, ингибирует in vitro В-клеточную пролиферацию, индуцированную стимуляцией анти-IgM/CpG или анти-IgM/CD40, где указанный Fc-вариант обладает измененной аффинностью к связыванию с одним или несколькими Fc-лигандами относительно соответствующей не представляющей собой вариант молекулы. В конкретном варианте осуществления изобретения Fc-вариант антитела к CD19, предлагаемого в изобретении, ингибирует in vitro В-клеточную пролиферацию, индуцированную стимуляцией анти-IgM/CpG или анти-IgM/CD40, где указанный Fc-вариант обладает повышенной способностью связываться с рецептором Fc-гамма IIВ относительно соответствующего не представляющего собой вариант Fc-домена. В следующем конкретном варианте осуществления изобретения Fc-вариант антитела к CD19, предлагаемого в изобретении, ингибирует in vitro стимулированную В-клеточную пролиферацию по меньшей мере примерно на 10%, по меньшей мере примерно на 20%, по меньшей мере примерно на 30%, по меньшей мере примерно на 40%, по меньшей мере примерно на 50% или по меньшей мере примерно на 75%. В другом варианте осуществления изобретения Fc-вариант антитела к CD19, предлагаемого в изобретении, ингибирует in vitro стимулированную В-клеточную пролиферацию, где указанный вариант Fc-домена обладает аффинностью к рецептору Fc-гамма IIB по меньшей мере в 2 раза или по меньшей мере в 3 раза, или по меньшей мере в 5 раз, или по меньшей мере в 7 раз, или по меньшей мере в 10 раз, или по меньшей мере в 20 раз, или по меньшей мере в 30 раз, или по меньшей мере в 40 раз, или по меньшей мере в 50 раз, или по меньшей мере в 60 раз, или по меньшей мере в 70 раз, или по меньшей мере в 80 раз, или по меньшей мере в 90 раз, или по меньшей мере в 100 раз, или по меньшей мере в 200 раз более сильно по сравнению с соответствующим доменом, не представляющим собой указанный вариант Fc-домена.
Настоящее изобретение относится также к способу лечения связанного с В-клетками злокачественного состояния у человека, заключающемуся в том, что вводят человеку, который нуждается в этом, человеческое, гуманизированное или химерное антитело к CD19, которое может опосредовать антитело-обусловленную клеточно-зависимую цитотоксичность (ADCC), комплементзависимую цитотоксичность (CDC) и/или апоптоз, в количестве, достаточном для истощения находящихся в кровотоке В-клеток. Конкретным объектом настоящего изобретения являются также способы лечения связанного с В-клетками злокачественного состояния у человека, заключающимся в том, что вводят в терапевтически эффективном количестве человеческое, гуманизированное или химерное антитело к CD19, которое относится к человеческому изотипу IgG1 или IgG3.
Настоящее изобретение относится также к способу лечения аутоиммунного заболевания или нарушения у человека, заключающемуся в том, что вводят человеку, который нуждается в этом, человеческое, гуманизированное или химерное антитело к CD19, которое может опосредовать у человека ADCC, CDC и/или апоптоз, в количестве, достаточном для истощения находящихся в кровотоке В-клеток. Настоящее изобретение относится также к способам лечения аутоиммунных нарушений, заключающимся в том, что вводят в терапевтически эффективном количестве человеческое, гуманизированное или химерное антитело к CD19, которое относится к человеческому изотипу IgG1 или IgG3.
Настоящее изобретение относится также к способам лечения или предупреждения гуморального отторжения трансплантата у человека-реципиента, который нуждается в этом, заключающимся в том, что вводят реципиенту человеческое, гуманизированное или химерное антитело к CD19, предлагаемое в изобретении, в количестве, которое может истощать находящиеся в кровотоке В-клетки или находящийся в кровотоке иммуноглобулин, или и то и другое. В других вариантах осуществления изобретения предложены способы предупреждения отторжения трансплантата или реакции трансплантат-против-хозяина у человека-реципиента трансплантата, который нуждается в этом, заключающиеся в том, что трансплантат перед трансплантацией приводят в контакт с таким количеством человеческого, гуманизированного или химерного антитела к CD19, которое может вызывать истощение В-клеток в трансплантате.
5.2. Получение гуманизированных антител к CD19
Гуманизированные антитела, представленные в настоящем описании, можно получать с помощью различных методов, известных в данной области, включая, но, не ограничиваясь только ими, CDR-трансплантацию (см., например, европейский патент ЕР 239,400; международную заявку на патент WO 91/09967; и US 5225539, 5530101 и 5585089, содержание каждого из указанных документов полностью включено в настоящее описание в качестве ссылки), «облицовку» или повторное нанесение покрытия (см., например, европейские патенты ЕР 592106 и ЕР 519596; Padlan, Molecular Immunology 28(4/5), 1991, cc.489-498; Studnicka и др., Protein Engineering, 7(6), 1994, cc.805-814; и Roguska и др., Proc. Natl. Acad. Sci., 91, 1994, cc.969-973, содержание каждой публикации полностью включено в настоящее описание в качестве ссылки), перестановку цепи (см., например, US 5565,32, полностью включенный в настоящее описание в качестве ссылки) и методы, описанные, например, в US 6407213, US 5766886, публикации международной заявки на патент WO 9317105, Tan и др., J. Immunol., 169, 2002, cc.1119-1125, Caldas и др., Protein Eng., 13(5), 2000, cc.353-360, Morea и др., Methods, 20(3), 2000, cc.267-279, Васа и др., J. Biol. Chem., 272(16), 1997, cc.10678-10684, Roguska и др., Protein Eng., 9(10), 1996, cc.895-904, Couto и др., Cancer Res., 55, (приложение 23), 1995, cc.5973-5977, Couto и др., Cancer Res., 55(8), 1995, cc.1717-1722, Sandhu JS, Gene, 150(2), 1994, cc.409-410 и Pedersen и др., J. Mol. Biol., 235(3), 1994, cc.959-973, содержание каждого из указанных документов полностью включено в настоящее описание в качестве ссылки). Часто FW-остатки в FW-участках могут быть замещены соответствующим остатком из CDR донорского антитела для изменения, предпочтительно улучшения, связывания с антигеном. Эти замены в FW идентифицируют с помощью методов, хорошо известных в данной области, например, путем моделирования взаимодействий остатков CDR и FW с целью идентификации FW-остатков, важных для связывания с антигеном, и сравнения последовательностей с целью идентификации необычных FW-остатков в конкретных положениях (см., например, Queen и др., US 5585089; и Riechmann и др., Nature, 332, 1988, с.323, содержание которых полностью включено в настоящее описание в качестве ссылки).
Гуманизированное антитело к CD19 несет один или несколько аминокислотных остатков, интродуцированных в него из источника, отличного от человека. Эти полученные из источника, отличного от человека, аминокислотные остатки часто называют «импортными» остатками, поскольку их обычно получают из «импортной» вариабельной области. Таким образом, гуманизированные антитела содержат один или несколько CDR из молекулы нечеловеческого иммуноглобулина и каркасные участки из человеческого иммуноглобулина. Гуманизация антител хорошо известная в данной области и ее можно осуществлять в целом согласно методу, описанному у Winter с соавторами (Jones и др., Nature, 321, 1986, cc.522-525; Riechmann и др., Nature, 332, 1988, cc.323-327; Verhoeyen и др., Science, 239, 1988, cc.1534-1536), путем замены CDR или CDR-последовательностей грызунов на соответствующие последовательности человеческого антитела, т.е. путем CDR-трансплантации (ЕР 239400; публикация РСТ WO 91/09967; и US 4816567; 6331415; 5225539; 5530101; 5585089; 6548640, содержание которых полностью включено в настоящее описание в качестве ссылки). В таких гуманизированных химерных антителах участки, существенно меньшие, чем интактная человеческая вариабельная область, заменены соответствующей последовательностью из видов, кроме человека. На практике гуманизированные антитела, как правило, представляют собой человеческие антитела, в которых некоторые остатки CDR и возможно некоторые остатки FW заменены остатками из аналогичных сайтов в антителах грызунов. Для гуманизации антител к CD19 можно применять также «облицовку» или повторное нанесение покрытия (ЕР 592106; ЕР 519596; Padlan, Molecular Immunology 28(4/5), 1991, cc.489-498; Studnicka и др., Protein Engineering, 7(6), 1994, cc.805-814; и Roguska и др., Proc. Natl. Acad. Sci., 91, 1994, cc.969-973) или перестановку цепи (US 5565332), содержание которых полностью включено в настоящее описание в качестве ссылки.
Выбор человеческих вариабельных областей как легкой, так и тяжелой цепи, предназначенных для получения гуманизированных антител, важен для снижения антигенности. Согласно так называемому методу «наилучшего подбора» последовательность вариабельной области антитела грызунов подвергают скринингу относительно полной библиотеки известных последовательностей человеческих вариабельных областей. Человеческие последовательности, которые наиболее близки к последовательности из организма грызунов, затем применяют для скрининга в отношении присутствия специфических остатков, которые могут иметь решающее значение для связывания с антигеном, соответствующей структуры и/или стабильности рассматриваемого гуманизированного МАт (Sims и др., J. Immunol., 151, 1993, с.2296; Chothia и др., J. Mol. Biol., 196, 1987, с.901, содержание которых полностью включено в настоящее описание в качестве ссылки). Образовавшиеся FW-последовательности удовлетворяют требуемым критериям и поэтому их можно применять в качестве человеческих донорских FW-участков для гуманизированного антитела.
В другом методе используют определенный FW, полученный из консенсусной последовательности определенной подгруппы легких или тяжелых цепей всех человеческих антител. Один и тот же FW можно применять для нескольких различных гуманизированных антител к CD19 (Carter и др., Proc. Natl. Acad. Sci. USA: 89, 1992, с.4285; Presta и др., J. Immunol., 151, 1993, с.2623, содержание указанных публикаций полностью включено в настоящее описание в качестве ссылки).
Антитела к CD19 можно гуманизировать с сохранением высокой аффинности к CD19 и других важных биологических свойств. Согласно одному из объектов изобретения гуманизированные антитела получают с помощью анализа родительских последовательностей и различных гуманизированных продуктов с использованием умозрительных трехмерных моделей родительских и гуманизированных последовательностей. Трехмерные модели иммуноглобулинов общедоступны и хорошо известны специалистам в данной области. Известны компьютерные программы, которые иллюстрируют и отображают возможные трехмерные конформационные структуры выбранных перспективных последовательностей (последовательности-“кандидаты”) иммуноглобулинов. Изучение этих изображений позволяет осуществлять анализ возможной роли остатков в функции перспективной последовательности иммуноглобулина, т.е. анализ остатков, которые влияют на способность перспективного иммуноглобулина (иммуноглобулина-«кандидата») связываться с CD19. Таким путем можно выбирать остатки в FW и объединять с реципиентными и импортными последовательностями для достижения требуемых характеристик антитела, таких как повышенная аффинность к CD19. Как правило, остатки в CDR оказывают непосредственное и наиболее существенное влияние на связывание антигена.
«Гуманизированное» антитело может сохранять антигенную специфичность, сходную с антигенной специфичностью исходного антитела, т.е. в настоящем изобретении, способность связываться с человеческим антигеном CD19. Однако с помощью определенных методов гуманизации можно изменять аффинность и/или специфичность связывания антитела с человечески антигеном CD19, например, используя методы «направленной эволюции», описанные у Wu и др., J. Mol. Biol., 294, 1999, с.151, содержание публикации полностью включено в настоящее описание в качестве ссылки.
Гуманизированные антитела к CD19, представленные в настоящем описании, можно конструировать путем отбора определенных человеческих каркасных участков для трансплантации определяющих комлементарность участков или «CDR» антител НВ12А или НВ12В, как описано в приведенных ниже разделах. Изобретение относится к различным гуманизированным версиям мышиного антитела НВ12А и НВ12В, а также химерным версиям, обозначенным как chHB2A и chHB12B.
5.3. Моноклональные антитела к CD19
Моноклональное антитело к CD19 характеризуется специфичностью связывания с человеческим антигеном CD19 и может опосредовать у человека ADCC, CDC и/или механизмы апоптоза. Указанное антитело можно создавать с помощью широкого разнообразия методов, известных в данной области, включая применение гибридомы, рекомбинации и методов фаговой презентации, или их комбинацию. Антитела являются высокоспецифическими, поскольку их мишенью является одна индивидуальная область детерминанты. Для конструирования антитела к CD19 можно применять любой известный в данной области метод, включая, но, не ограничиваясь только ими, описанные ниже методики и усовершенствованные указанные методики. Полупромышленное получение с высоким выходом, как правило, предусматривает культивирование клетки-хозяина, которая продуцирует созданное антитело к CD19, и выделение антитела к CD19 из культуры клетки-хозяина.
5.3.1. Метод гибридом
Моноклональные антитела можно получать, используя метод гибридом, в том числе на основе методик, известных в данной области и описанных, например, у Harlow и др., Antibodies: A Laboratory Manual (изд-во Cold Spring Harbor Laboratory Press, 2-ое изд. 1988); Hammerling и др., в: Monoclonal Antibodies and Т Cell Hybridomas, 563-681 (изд-во Elsevier, N.Y., 1981) (содержание указанных публикаций полностью включено в настоящее описание в качестве ссылки). Например, при осуществления метода гидридом мышь или другое пригодное животное-хозяин, такое как хомяк или макак, иммунизируют с целью образования лимфоцитов, которые продуцируют или обладают способностью продуцировать антитела, специфически связывающиеся в белком, применяемым для иммунизации. Лимфоциты можно иммунизировать также in vitro. Затем лимфоциты сливают с клетками миеломы с помощью приемлемого агента для слияния, такого как полиэтиленгликоль, с получением клетки гибридомы (Goding, Monoclonal Antibodies: Principles and Practice, 1986, cc.59-103, изд-во Academic Press).
Клетки гибридомы, полученные таким образом, высевают и выращивают в приемлемой культуральной среде, которая содержит одну или несколько субстанций, которые ингибируют рост или выживание не слитых родительских клеток миеломы. Например, если в родительских клетках миеломы отсутствует фермент гипокстантин-гуанин-фосфорибозилтрансфераза (HGPRT или HPRT), то культуральная среда для гибридом, как правило, должна включать гипоксантин, аминоптерин и тимидин (НАТ-среда), т.е. субстанции, которые предотвращают рост клеток с дефицитом HGPRT.
Конкретные варианты применения клеток миеломы включают применение клеток, которые пригодны для эффективного слияния, поддерживают стабильное с высоким выходом производство антитела при отборе продуцирующих антитела клеток и обладают чувствительностью к среде, такой как НАТ-среда. Среди указанных линий клеток миеломы следует упомянуть мышиные линии миеломы, например, полученные из мышиных опухолей линий МОРС-21 и МРС-11, которые доступны от Salk Institute Cell Distribution Center, Сан-Диего, шт.Калифорния, США, и клетки линии SP-2 или X63-Ag8.653, которые можно получать из Американской коллекции типовых культур, Роквилл, шт.Мэриленд, США. Кроме того, для получения человеческих моноклональных антител можно применять также линии клеток человеческой миеломы и мышиной-человеческой гетеромиеломы (Kozbor, J. Immunol., 133, 1984, с.3001; Brodeur и др., Monoclonal Antibody Production Techniques and Applications, 1987, cc.51-63, изд-во Marcel Dekker, Inc., New York).
Культуральные среды, в которых выращивают клетки миеломы, оценивают в отношении производства моноклональных антител к человеческому антигену CD19. Специфичность связывания моноклональных антител, полученных с помощью клеток гибридромы, можно определять путем иммунопреципитации или путем анализа связывания in vitro, такого как радиоиммуноанализ (РИА) или твердофазный иммуноферментный анализ (ELISA).
После идентификации клеток гибридом, которые продуцируют антитела требуемой специфичности, аффинности и/или активности, клоны можно субклонировать с помощью процедур ограничивающего разведения и выращивания стандартными методами (Goding, Monoclonal Antibodies: Principles and Practice, 1986, cc.59-103, изд-во Academic Press,). Приемлемыми для этих целей культуральными средами являются, например, среда D-MEM или RPMI 1640. Кроме того, клетки гибридомы можно выращивать in vivo в виде асцитов опухолей у животных.
Моноклональные антитела, секретируемые субклонами, можно выделять из культуральной среды, асцитической жидкости или сыворотки общепринятыми методами очистки иммуноглобулинов, такими, например, хроматография на протеин А-сефарозе, гидроксиапатитная хроматография, гель-электрофорез, диализ или аффинная хроматография.
5.3.2. Методы рекомбинантной ДНК
ДНК, кодирующую антитело к CD19, представленное в настоящем описании, легко выделять и секвенировать с помощью общепринятых процедур (например, используя олигонуклеотидые зонды, которые обладают способностью специфически связываться с генами, кодирующими тяжелые и легкие цепи антител к CD19). Клетки гибридомы служат в качестве источника такой ДНК. После выделения ДНК можно вносить в экспрессионные векторы, которыми затем трансфектируют клетки-хозяева, такие как клетки Е. coli, COS-клетки обезьян, клетки яичника китайского хомячка (СНО) или клетки миеломы, которые иначе не продуцируют белок иммуноглобулина, что приводит к синтезу антител к CD19 в рекомбинантных клетках-хозяевах.
При применении методов фаговой презентации функциональные домены антитела помещают на поверхность фаговых частиц, которые несут полинуклеотидные последовательности, кодирующие их. В частности, последовательности ДНК, кодирующие VH- и VL-области, амплифицируют из библиотек кДНК животных (например, человеческих или мышиных библиотек кДНК пораженных тканей). ДНК, кодирующую VH- и VL-области, объединяют путем рекомбинации с scFv-линкером с помощью ПЦР и клонируют в фагмидном векторе. Вектором трансфектируют путем электропорации Е. coli и Е. coli заражают фагом-хелпером. Применяемый в этом методе фаг, как правило, представляет собой нитчатый фаг, включая fd и М13, и VH- и VL-области, как правило, рекомбинантно сливают с фаговым геном либо III, либо VIII. Фаг, экспрессирующий антигенсвязывающий центр, который связывается с конкретным антигеном, можно отирать или идентифицировать с помощью антигена, например, применяя меченый антиген или антиген, связанный или иммобилизованный на твердой поверхности или грануле. Примерами методов фаговой презентации, которые можно применять для получения антител, предлагаемых в настоящем изобретении, являются методы, описанные у Brinkman и др., J. Immunol. Methods, 182, 1995, cc.41-50; Ames и др., J. Immunol. Methods, 184, 1995, cc.177-186; Kettleborough и др., Eur. J. Immunol., 24, 1994, cc.952-958; Persic и др., Gene, 187, 1997, cc.9-18; Burton и др., Advances in Immunology, 57, 1994, cc.191-280; в международной заявке PCT/GB91/01 134; опубликованных международных заявках WO 90/02809, WO 91/10737, WO 92/01047, WO 92/18619, WO 93/11236, WO 95/15982, WO 95/20401 и W097/13844; и в US 5698426,5223409, 5403484, 5580717, 5427908, 5750753, 5821047, 5571698, 5427908, 5516637, 5780225, 5658727, 5733743 и 5969108; содержание всех документов полностью включено в настоящее описание в качестве ссылки.
Как описано в приведенных выше ссылках, после отбора фага кодирующую антитело область фага можно выделять и применять для создания полных антител, включая человеческие антитела, или любых других требуемых антигенсвязывающих фрагментов и экспрессировать в любом пригодном хозяине, включая клетки млекопитающих, клетки насекомых, клетки растений, дрожжи и бактерии, например, указанные ниже. Методики рекомбинантного получения Fab-, Fab'- и F(ab')2-фрагментов можно применять также с использованием методов, известных в данной области, например, описанных в публикации РСТ WO 92/22324; Mullinax и др., BioTechniques, 12(6), 1992, cc.864-869; Sawai и др., AJRI, 34, 1995, cc.26-34; и Better и др., Science, 240, 1988, cc.1041-1043 (содержание всех документов полностью включено в настоящее описание в качестве ссылки).
Антитела можно выделять из фаговых библиотек антител с помощью методов, представленных у McCafferty и др., Nature, 348, 1990, cc.552-554., Clackson и др., Nature, 352, 1991, cc.624-628, Marks и др., J, Mol. Biol., 1991. cc.222:581-597, в указанных публикациях описано выделение мышиных и человеческих антител соответственно с помощью фаговых библиотек. Для получения обладающих высокой аффинностью (нМ-диапазон) человеческих антител можно применять перестановку цепи (Marks и др., Bio/Technology, 10, 1992, cc.779-783), а также комбинаторное заражение и рекомбинацию in vivo в качестве стратегии конструирования очень больших фаговых библиотек (Waterhouse и др., Nuc. Acids. Res., 21, 1993, cc.2265-2266). Таким образом, эти методики доступны в качестве альтернатив традиционным методам получения моноклонального антитела с использованием гибридом для выделения антител к CD19.
Для создания полных антител можно применять ПЦР-праймеры, включающие нуклеотидные последовательности VH или VL, сайт рестрикции и фланкирующую последовательность с целью защиты сайта рестрикции для амплификации VH- или VL-последовательностей в scFv-клонах. Применение методик клонирования известно специалистам в данной области, амплифицированные с помощью ПЦР VH-области можно клонировать в векторах, экспрессирующих константную область тяжелой цепи, например, константную область человеческой гамма 4-цепи, а амплифицированные с помощью ПЦР VL-области можно клонировать в векторах, экспрессирующих константную область легкой цепи, например, константные области человеческой каппа- или лямбда-цепи. Векторы, предназначенные для экспрессии VH- или VL-доменов, могут содержать промотор EF-1α, сигнал секреции, сайт клонирования для вариабельной области, константные области и селектируемый маркер, такой как неомицин. VH- и VL-области можно клонировать также в одном векторе, экспрессирующем требуемые константные области. Конверсионными векторами тяжелой цепи и конверсионными векторами легкой цепи затем котрансфектируют клеточные линии для создания клеточных линий, которые обладают способностью стабильно или кратковременно экспрессировать полноразмерные антитела, например, IgG, с помощью методов, известных в данной области.
ДНК можно модифицировать также, например, путем замены кодирующей последовательности константных областей человеческой тяжелой и легкой цепи на гомологичные мышиные последовательности (US 4816567; Morrison и др., Proc. Natl. Acad. Sci. USA, 81, 1984, с.6851), или путем ковалентного связывания с кодирующей последовательностью иммуноглобулина всей или части кодирующей последовательности полипептида, не относящегося к иммуноглобулинам.
5.4. Химерные антитела
Антитела к CD19 в контексте настоящего описания включают в частности химерные антитела (иммуноглобулины), в которых часть тяжелой и/или легкой цепи идентична или гомологична соответствующим последовательностям в антителах, выведенных из конкретных видов или принадлежащих к конкретному классу или подклассу антител, а другая часть цепи(ей) идентична или гомологична соответствующим последовательностям в антителах, выведенных из других видов или принадлежащих к другому классу или подклассу антител, а также фрагменты указанных антител, если они обладают требуемой биологической активностью (US 4816567; Morrison и др., Proc. Natl. Acad. Sci. USA, 81, 1984, cc.6851-6855). Представляющие интерес химерные антитела в контексте настоящего описания включают «приматизированные» антитела, которые содержат последовательности антигенсвязывающего центра вариабельной области, выведенные из примата, кроме человека (например, обезьян Старого Света, таких как павиан, макак резус или макак крабоед), и последовательности человеческих константах областей (US 5693780).
5.5. Измененные/мутантные антитела
Антитела к CD19, применяемые в композициях и способах, представленных в настоящем описании, могут представлять собой мутантые антитела. В контексте настоящего описания понятие «мутантное антитело» или «измененное антитело» относится к варианту аминокислотной последовательности антитела к CD19, в котором модифицирован один или несколько аминокислотных остатков антитела к CD19. Модификации аминокислотной последовательности антитела к CD19 включают модификации последовательности, которые могут улучшать аффинность или авидность антитела к его антигену, и/или модификации Fc-фрагмента антитела, которые могут улучшать эффекторную функцию.
Таким образом, настоящее изобретение относится к человеческим, гуманизированным или химерным антителам к CD19, представленным в настоящем описании, а также к их измененным/мутантным производным, включая, но, не ограничиваясь только ими, антитела, которые обладают измененными характеристиками связывания с человеческим CD19; например, измененные значения констант ассоциации kon, констант диссоциации koff, и/или константы равновесия или аффинности к связыванию, KD. В определенных вариантах осуществления изобретения значение KD антитела к CD19, представленного в настоящем описании, или его измененного/мутантного производного, в отношении человеческого CD19 может составлять не более чем примерно 10-6 М, 10-7 М, 10-8 М или 10-9 М. Методы и реагенты, пригодные для определения указанных характеристики связывания антитела, предлагаемого в настоящем изобретении, или его измененного/мутантного производного, известны в данной области и/или поступают в продажу (см. выше, и, например, US 6849425, US 6632926, US 6294391 и US 6143574, содержание каждого из которых полностью включено в настоящее описание в качестве ссылки). Кроме того, поступают в продажу оборудование и программное обеспечение, созданное для таких кинетических анализов (например, устройства Biacore A 100 и Biacore® 2000; фирма Biacore International AB, Уппсала, Швеция).
Модификации можно вносить в любые известные антитела к CD19 или антитела к CD19, идентифицированные при создании настоящего изобретения. Последовательности таких измененных антител обязательно должны быть менее чем на 100% идентичны или подобны последовательности известного антитела к CD19. Например, последовательность измененного антитела может быть идентична или подобна от примерно на 25% до примерно на 95% аминокислотной последовательности вариабельной области либо тяжелой, либо легкой цепи антитела к CD19, представленного в настоящем описании. Последовательность измененного антитела может быть идентична или подобна по меньшей мере на 25%, 35%, 45%, 55%, 65%, 75%, 80%, 85%, 90% или 95% аминокислотной последовательности вариабельной области либо тяжелой, либо легкой цепи антитела к CD19, представленного в настоящем описании. В другом варианте осуществления изобретения аминокислотная последовательность измененного антитела может быть идентична или подобна по меньшей мере на 25%, 35%, 45%, 55%, 65%, 75%, 80%, 85%, 90% или 95% аминокислотной последовательности CDR1, CDR2 или CDR3 тяжелой цепи антитела к CD19, представленного в настоящем описании. В одном из вариантов осуществления изобретения измененное антитело может сохранять способность к связыванию с человеческим CD19. В определенных вариантах осуществления изобретения антитело к CD19, представленное в настоящем описании, может содержать VH, последовательность которой по меньшей мере или примерно на 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95% или более идентична аминокислотной последовательности HB12B-(3-72/JH4) (SEQ ID NO:34), HB12A VH (SEQ ID NO:2) HB12B VH (SEQ ID NO:18), 7E12 VH (SEQ ID NO:102), 14H5 VH (SEQ ID NO:103), 15D1 VH (SEQ ID NO:104), 15D7 VH (SEQ ID NO:105), 16C4 VH (SEQ ID NO:106), 14H5-YG (SEQ ID NO:107), 14H5-DG (SEQ ID NO:108), 14H5-LG (SEQ ID NO:109), 1A7 VH, 3C3 VH, 3E5 VH, 3D4VH, 9G7 VH (SEQ ID NO:191), 3B4 VH (SEQ ID NO: 236), 3F11 VH или 6С11 VH (SEQ ID NO:192). В определенных вариантах осуществления изобретения антитело к CD19, представленное в настоящем описании, может содержать VH, последовательность которой по меньшей мере или примерно на 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95% или более идентична аминокислотной последовательности любых VH-областей, VL-областей или CDR, представленных в таблице 1.
В другом варианте осуществления изобретения измененное антитело может иметь аминокислотную последовательность, идентичную или подобную по меньшей мере на 25%, 35%, 45%, 55%, 65%, 75%, 80%, 85%, 90% или 95% аминокислотной последовательности FW1, FW2, FW3 или FW4 НВ12В-(3-72/JH4) (SEQ ID NO:34), HB12A VH (SEQ ID NO:2), HB12B VH (SEQ ID NO:18), 7Е12 VH (SEQ ID NO:102), 14H5 VH (SEQ ID NO:103), 15D1 VH (SEQ ID NO:104), 15D7 VH (SEQ ID NO:105), 16C4 VH (SEQ ID NO:106), 14H5-YG (SEQ ID NO:107), 14H5-DG (SEQ ID NO:108), 14H5-LG (SEQ ID NO:109), 1A7 VH, 3C3 VH, 3E5 VH, 3D4 VH, 9G7 VH (SEQ ID NO:191), 3B4 VH (SEQ ID NO: 236), 3F11 VH или 6С11 VH (SEQ ID NO:192). В другом варианте осуществления изобретения измененное антитело может иметь аминокислотную последовательность, идентичную или подобную по меньшей мере на 25%, 35%, 45%, 55%, 65%, 75%, 80%, 85%, 90% или 95% аминокислотной последовательности FW1, FW2, FW3 или FW4 любых VH- или VL-областей, представленных в таблице 1.
В другом варианте осуществления изобретения измененное антитело может иметь аминокислотную последовательность, идентичную или подобную по меньшей мере на 25%, 35%, 45%, 55%, 65%, 75%, 80%, 85%, 90% или 95% аминокислотной последовательности CDR1, CDR2 или CDR3 антитела к CD19, представленного в настоящем описании. В определенных вариантах осуществления изобретения антитело к CD19, предлагаемое в изобретении, может содержать VL, последовательность, которой по меньшей мере или примерно на 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95% или более идентична аминокислотной последовательности НВ12А VK (SEQ ID NO:4), НВ12В VK (SEQ ID NO:20), HB12B-(A10-Jk4) (SEQ ID NO:52), HB12B-364987 (или 364987) (SEQ ID NO:62), HB12B-3649 (или 3649) (SEQ ID NO:68), HB12B-36 (или 36) (SEQ ID NO:70), 7Е12 VK (SEQ ID NO:110), 14H5 (SEQ ID NO:111), 15D1 (SEQ ID NO:112), 16C9 (SEQ ID NO:113), 3C3 VK (SEQ ID NO:193), 3E5 VK (SEQ ID NO:194), 3D4 VK (SEQ ID NO:195), 3F1 VK (SEQ ID NO:196), 5B5 VK (SEQ ID NO:197), 6F7 VK (SEQ ID NO: 198), 1C11 VK (SEQ ID NO:199), 2B11 VK (SEQ ID NO:200), 2D10 VK (SEQ ID NO:201), 5C11 VK (SEQ ID NO:202), 5D4 VK (SEQ ID NO:203), 6С11 VK (SEQ ID NO:204), 9G7 VK (SEQ ID NO:205), 1H4 VK (SEQ ID NO:206) или 5C4 VK (SEQ ID NO:207).
В другом варианте осуществления изобретения измененное антитело может иметь аминокислотную последовательность, идентичную или подобную по меньшей мере на 25%, 35%, 45%, 55%, 65%, 75%, 80%, 85%, 90% или 95% аминокислотной последовательности FW1, FW2, FW3 или FW4 НВ12А VK (SEQ ID NO:4), НВ12В VK (SEQ ID NO:20), HB12B-(A10-Jk4) (SEQ ID NO:52), НВ12В-364987 (или 364987) (SEQ ID NO:62), HB12B-3649 (или 3649) (SEQ ID NO:68), HB12B-36 (или 36) (SEQ ID NO:70), 7E12 VK (SEQ ID NO:110), 14H5 (SEQ ID NO: 111), 15D1 (SEQ ID NO:112), 16C9 (SEQ ID NO:113), 3C3 VK (SEQ ID NO:193), 3E5 VK (SEQ ID NO:194), 3D4 VK (SEQ ID NO:195), 3F1 VK (SEQ ID NO:196), 5B5 VK(SEQ ID NO:197), 6F7 VK (SEQ ID NO:198), 1C11 VK (SEQ ID NO:199), 2B11 VK (SEQ ID NO:200), 2D10 VK (SEQ ID NO:201), 5C11 VK (SEQ ID NO:202), 5D4 VK (SEQ ID NO:203), 6C11 VK (SEQ ID NO:204), 9G7 VK (SEQ ID NO:205), 1H4 VK (SEQ ID NO:206) или 5C4 VK (SEQ ID NO:207).
Идентичность или сходство относительно представленной в настоящем описании последовательности определяют как процент аминокислотных остатков в рассматриваемой последовательности (последовательности-кандидате), идентичных (т.е. этот же остаток) или подобных (т.е. аминокислотный остаток из этой же группы с позиций общих свойств боковой цепи, см. ниже) остаткам антитела к CD19, после линеаризации последовательностей и интродукции при необходимости брешей для достижения максимального процента идентичности последовательности. Ни N-концевые, ни С-концевые, ни внутренние удлинения, делеции или инсерции в последовательности антитела вне вариабельной области не должны рассматриваться как влияющие на идентичность или сходство последовательности.
«Процент идентичности», как известно в данной области, является мерой взаимного соответствия двух полинуклеотидов или двух полипептидов, которое определяют путем сравнения их последовательностей. В целом, две последовательности, подлежащие сравнению, линеаризуют для получения максимальной корреляции между последовательностями. Проводят сравнительный анализ первичной структуры двух последовательностей и определяют количество положений, для которых характерно точное соответствие аминокислот или нуклеотидов двух последовательностей, делят эту величину на общую длину первичной структуры и умножают на 100, получая величину % идентичности. Эту величину, т.е. % идентичности, можно определять по всей длине подлежащих сравнению последовательностей, что наиболее пригодно для последовательностей одинаковой или очень близкой длины и имеющих высокий уровень гомологии, или можно определять для более коротких участков определенной длины, что наиболее пригодно для последовательностей разной длины или имеющих более низкий уровень гомологии.
Например, последовательности можно выравнивать с помощью программного обеспечения clustalw в системе Unix, которая создает файл с расширением «.aln», затем этот файл можно импортировать в программу Bioedit (Hall Т.A., BioEdit: a user-friendly biological sequence alignment editor and analysis program for Windows 95/98/NT. Nucl. Acids. Symp.Ser. 41, 1999, cc.95-98), которая открывает файл «.а1n». В окне программы Bioedit можно выбирать индивидуальные последовательности (одновременно две) и осуществлять их сравнительный анализ. Этот метод позволяет осуществлять сравнение полной последовательности.
Методы сравнения идентичности двух или большего количества последовательностей хорошо известны в данной области. Так, например, доступны программы Wisconsin Sequence Analysis Package, версия 9.1 (Devereux J. и др., Nucleic Acids Res., 12, 1984, cc.387-39, фирмы Genetics Computer Group, Мэдисон, шт.Висконсин, США). Определение процента идентичности двух последовательностей можно осуществлять с помощью математического алгоритма. Например, можно применять программы BESTFIT и GAP для определения % идентичности двух полинуклеотидных и % идентичности двух полипептидных последовательностей. В программе BESTFIT используется алгоритм «локальной гомологии» Смита и Уотермана (Advances in Applied Mathematics, 2, 1981, cc.482-489), и она позволяет выявлять одну область наибольшего сходства между двумя последовательностями. BESTFIT более пригодна для сравнения двух полинуклеотидных или двух полипептидных последовательностей, не сходных по длине, в программе заложено, что более короткая последовательность представляет собой часть более длинной. Для сравнения, при использовании программы GAP при сравнении двух последовательностей осуществляет поиск «максимального сходства» согласно алгоритму, описанному у Neddleman и Wunsch, J. Mol. Biol., 48, 1970, cc.443-354, 1970. GAP более пригодна для сравнения последовательностей, которые имеют примерно одинаковую длину, и поэтому ожидается, что сравнительный анализ первичной структуры должен проводиться по всей длине. Предпочтительные, применяемые в каждой программе параметры «вес бреши» (Gap Weight) и «вес длины» (Length Weight) соответствуют 50 и 3 для полинуклеотидов и 12 и 4 для полипептидов соответственно. Предпочтительно % идентичности и сходства определяют, когда две последовательности, подлежащие сравнению, оптимально выровнены.
Другие программы определения идентичности и/или сходства двух последовательностей также известны в данной области, например, семейство программ BLAST (Kariin и Altschul, Proc. Natl. Acad. Sci. USA, 87, 1990, cc.2264-2268, модифицированных Kariin и Altschul, Proc. Natl. Acad. Sci. USA, 90, 1993, cc.5873-5877, фирмы National Center for Biotechnology Information (NCB), Бетесда, шт.Мэриленд, США, и они доступны на «домашней» странице NCBI на сайте www.ncbi.nlm.nih.gov). Эти программы представляют собой примеры, но, не ограничиваясь только ими, математического алгоритма, применяемого для сравнения двух последовательностей. Такой алгоритм включен в программы NBLAST и XBLAST, описанные у Altschul и др., J. Mol. Biol., 215, 1990, cc.403-410. Поиск нуклеотидов с помощью BLAST можно осуществлять с использованием программы NBLAST, в которой балл равен 100, длина слова равна 12, для получения нуклеотидных последовательностей, гомологичных молекуле нуклеиновой кислоты, кодирующей все или часть антитела к CD19, предлагаемого в изобретении. Анализ белков с помощью BLAST можно осуществлять с использованием программы XBLAST, в которой балл равен 50, длина слова равна 3, для получения аминокислотных последовательностей, гомологичных молекуле белка, предлагаемой в изобретении. Для осуществления сравнительного анализа первичной структуры с учетом брешей можно применять программу Gapped BLAST, описанную у Altschul и др., Nucleic Acids Res., 25, 1997, cc.3389-3402. Можно применять также программу PSI-Blast для осуществления повторяющегося поиска, позволяющего выявлять отдаленные сходства между молекулами (Id.). При применении программ BLAST, Gapped BLAST и PSI-Blast можно использовать принимаемые по умолчанию параметры соответствующих программ (например, XBLAST и NBLAST, см. http://www.ncbi.nlm.nih.gov.)
Другим примером, но не ограничиваясь только ею, программы для определения идентичности и/или сходства между последовательностями, известной в данной области, является PASTA (Pearson W.R. и Lipman D.J., Proc. Natl. Acad. Sci. USA, 85, 1988, cc.2444-2448, которая является частью пакета программ Wisconsin Sequence Analysis Package). Предпочтительно матрицу аминокислотных замен BLOSUM62 (Henikoff S. и Henikoff J.G., Proc. Natl. Acad. Sci. USA, 89, 1992, cc.10915-10919) применяют для сравнения полипептидных последовательностей, включая ситуацию, когда нуклеотидные последовательности сначала транслируют в аминокислотные последовательности перед осуществление сравнения.
Еще одним примером, но не ограничиваясь только ею, программы для определения идентичности и/или сходства между аминокислотными последовательностями, известной в данной области, является программа SeqWeb Software (web-интерфейсный порт в GCG Wisconsin Package: Gap program), которая основана на алгоритме принимаемых по умолчанию параметров и установленных параметров программы: blosum62, вес бреши 8, вес длины 2.
Процент идентичности между двумя последовательностями можно определять с помощью методик, аналогичных описанным выше, с разрешением на создание бреши или без него. При расчете процента идентичности, как правило, подсчитывают точные совпадения.
Предпочтительно программу BESTFIT применяют для определения % идентичности изучаемой запрашиваемой полинуклеотидной или полипептидной последовательности относительно полинуклеотидной или полипептидной последовательности, предлагаемой в настоящем изобретении, запрашиваемая и референс-последовательность должны быть оптимально выровнены, и параметры программы должны быть заданы в виде принимаемых по умолчанию параметров.
Для создания измененного антитела изменение одной или нескольких аминокислот (например, замены) интродуцируют в один или несколько гипервариабельных участков характерного для определенного вида антитела. Одно или несколько изменений (например, замен) каркасного участка можно интродуцировать в антитело к CD19, если это приводит к улучшению аффинности к связыванию мутантного антитела с антигеном из других видов млекопитающих. Примеры остатков каркасных участков, которые можно модифицировать, включают остатки, которые осуществляют непосредственное нековалентное связывание антигена (Amit и др., Science, 233, 1986, cc.747-753); взаимодействуют с/оказывают влияние на конформацию CDR (Chothia и др., J. Mol. Biol., 196, 1987, cc.901-917); и/или участвуют в области контакта VL-VH (ЕР 239400 В1). В определенных вариантах осуществления изобретения модификация одного или нескольких указанных каркасных участков приводит к повышению аффинности к связыванию антитела с антигеном из других видов млекопитающих. Согласно этому варианту осуществления изобретения можно изменять, например, от примерно одного до примерно пяти остатков каркасного участка. Иногда это может быть достаточно для получения мутантного антитела, пригодного для доклинических опытов, даже если не изменен ни один из остатков гипервариабельного участка. Однако, как правило, измененное антитело должно содержать также изменение(я) в гипервариабельном участке.
Модифицированные остатки гипервариабельного участка можно изменять произвольно, прежде всего, если исходная аффинность к связыванию антитела к CD19 с антигеном из других видов млекопитающих является такой, что полученное в результате произвольного изменения антитело можно легко отбирать путем скрининга.
Одной из важных процедур создания указанного измененного антитела является так называемый «аланин-сканирующий мутагенез» (Cunningham и Wells, Science, 244, 1989, cc.1081-1085). Согласно этому методу один или несколько остатков гипервариабельного участка заменяют на остаток(и) аланина или полиаланина, оказывая тем самым воздействие на взаимосвязь аминокислот с антигеном из других видов млекопитающих. Тот/те остаток/остатки гипервариабельного участка, для которого/которых установлена функциональная чувствительность к заменам, затем подвергают усовершенствованию путем интродукции дополнительных или других мутаций в сайтах, в которых производят замену. Таким образом, в то время как сайт, в который интродуцируют вариант аминокислотной последовательности, является предопределенным, не требуется, чтобы природа мутации per se была предопределена. Несущие а1а мутанты, полученные таким образом, подвергают скринингу в отношении их биологической активности с использованием представленного в настоящем описании анализа.
Другой процедурой получения указанного измененного антитела является созревание аффинности с использованием фаговой презентации (Hawkins и др., J. Mol. Biol., 254, 1992, cc.889-896 и Lowman и др., Biochemistry, 30(45), 1991, cc.10832-10837). В целом, метод состоит в следующем: несколько сайтов гипервариабельного участка (например, 6-7 сайтов) подвергают мутации, получая все возможные аминокислотные замены в каждом сайте. Полученные таким образом мутанты антитела презентуются в одновалентной форме на поверхности частиц нитчатого фага в виде слияний с продуктом гена III фага М13, который присутствует в каждой частице. Мутанты, которые презентуются фагом, затем подвергают скринингу в отношении их биологической активности (например, аффинности к связыванию) согласно методикам, приведенным в настоящем описании.
Мутации в последовательностях антител могут включать замены, делеции, в том числе внутренние делеции, добавления, в том числе добавления, приводящие к образованию слитых белков, или консервативные замены аминокислотных остатков внутри аминокислотной последовательности и/или по соседству с ней, но которые приводят к «молчащей» замене, при которой изменение позволяет получать функционально эквивалентное антитело к CD19. Консервативные аминокислотные замены можно осуществлять на основе сходства полярности, заряда, растворимости, гидрофобности, гидрофильности, и/или амфипатической природы включенных остатков. Например, неполярными (гидрофобными) аминокислотами являются аланин, лейцин, изолейцин, валин, пролин, фенилаланин, триптофан и метионин; полярными нейтральными аминокислотами являются глицин, серин, треонин, цистеин, тирозин, аспарагин и глутамин; положительно заряженными (основными) аминокислотами являются аргинин, лизин и гистидин; а отрицательно заряженными (кислыми) аминокислотами являются аспарагиновая кислота и глутаминовая кислота. Кроме того, глицин и пролин представляют собой остатки, которые могут влиять на ориентацию цепей. Неконсервативные замены должны предусматривать замену представителя одного из этих классов на представителя другого класса. Кроме того, при необходимости не являющиеся классическими аминокислоты или химические аналоги аминокислот можно интродуцировать в качестве замены или добавления в последовательность антитела. Неклассические аминокислоты включают, но, не ограничиваясь только ими, D-изомеры обычных аминокислот, α-аминоизомасляную кислоту, 4-аминомасляную кислоту, Abu, 2-аминомасляную кислоту, γ-Abu, ε-Ahx, 6-аминогексановую кислоту, Aib, 2-аминоизомасляную кислоту, 3-аминопропионовую кислоту, орнитин, норлейцин, норвалин, гидроксипролин, саркозин, цитруллин, цистеиновую кислоту, трет-бутилглицин, трет-бутилаланин, фенилглицин, циклогексилаланин, β-аланин, фторсодержащие аминокислоты, сконструированные аминокислоты, такие как β-метиламинокислоты, Сα-метиламинокислоты, Nαa-метиламинокислоты и аналоги аминокислот в целом.
В другом варианте осуществления изобретения сайты, отобранные для модификации, подвергают созреванию аффинности с помощью фаговой презентации (см. выше).
Любую методику мутагенеза, известную в данной области, можно применять для модификации индивидуальных нуклеотидов в последовательности ДНК с целью создание аминокислотных(ой) замен(ы) в последовательности антитела или создания/делеции сайтов рестрикции с целью облегчения дальнейших манипуляций. Такие методики включают, но не ограничиваясь только ими, химический мутагенез, in vitro сайтнаправленный мутагенез (Kunkel, Proc. Natl. Acad. Sci. USA, 82, 1985, с.488; Hutchinson С.и др., J. Biol. Chem., 253, 1978, с.6551), сайтнаправленный мутагенез с использованием в олигонуклеотидов (Smith, Ann. Rev. Genet, 19, 1985, с.с 423-463; Hill и др., Methods Enzymol., 155, 1987, cc.558-568), метод перекрывающегося удлинения на основе ПЦР (Но и др., Gene, 77, 1989, cc.51-59), основанный на ПЦР мутагенез с применением мегапраймерной схемы (Sarkar и др., Biotechniques, 8, 1990, cc.404-407) и т.д. Модификацию можно подтверждать с помощью дидезоксисеквенирования двухцепочечной ДНК.
В определенных вариантах осуществления изобретения антитело к CD19 можно модифицировать с получением слитых белков, т.е. антитела или его фрагмента, слитого с гетерологичным белком, полипептидом или пептидом. В некоторых вариантах осуществления изобретения белок, слитый с частью антитела к CD19, представляет собой ферментный компонент антитело-направленной фермент пролекарственной терапии (ADEPT). Примерами других белков или полипептидов, которые можно создавать в виде слитого белка с антителом к CD19, являются, но не ограничиваясь только ими, токсины, такие как рицин, абрин, рибонуклеаза, ДКАза I, стафилококковый энтеротоксин-А, антивирусный белок фитолакки американской, гелонин, дифтерийный токсин, экзотоксин Pseudomonas и эндотоксин Pseudomonas (см., например, Pastan и др., Cell, 47, 1986, с.641 и Goldenberg и др., Cancer Journal for Clinicians, 44, 1994, с.43). Обладающие ферментативной активностью токсины и их фрагменты, которые можно применять, включают А-цепь дифтерийного токсина, несвязывающиеся активные фрагменты дифтерийного токсина, А-цепь экзотоксина (из Pseudomonas aeruginosd), А-цепь рицина, А-цепь абрина, А-цепь модецина, альфа-сарцин, белки Aleurites fordii, белки диантина, белки фитолакки американской (PAPI, PAPII и PAP-S), ингибитор из Momordica charantia, курцин, кротин, ингибитор из Sapaonaria officinalis, гелонин, митогеллин, рестриктоцин, феномицин, эномицин и трикотецены (см., например, WO 93/21232, опубликованную 28 октября 1993 г.).
Дополнительные слитые белки можно создавать с помощью методов генной перестановки, перестановки мотивов, перестановки экзонов и/или перестановки кодонов (обозначенных в целом как «перестановка ДНК»). Перестановку ДНК можно применять для изменения активности антитела к CD19 или его фрагментов (например, антитела или его фрагмента, которые обладают более высокими аффинностями или меньшими скорости диссоциации) (см. в целом US 5605793; 5811238; 5830,21; 5834252 и 5837458, и Patten и др., Curr. Opinion BiotechnoL, 8, 1997, cc.724-33; Harayama, Trends Biotechnol. 16(2), 1998, cc.76-82; Hansson и др., J. Mol. Biol., 287, 1999, cc.265-76; и Lorenzo и Blasco, Biotechniques 24(2), 1998, cc.308-313 (содержание всех патентов и публикаций полностью включено в настоящее описание в качестве ссылки). Антитело может также представлять собой белок, слитый со связывающим доменом иммуноглобулина, как описано в публикации US 20030118592, публикации US 200330133939 и публикации РСТ WO 02/056910, все на имя Ledbetter с соавторами, содержание которых полностью включено в настоящее описание в качестве ссылки).
5.6. Доменные антитела
Антитела к CD19, которые применяют в композициях и способах, предлагаемых в изобретении, могут представлять собой доменные антитела (доменные мини-антитела), например, антитела, которые содержат небольшие функциональные связывающие компоненты, соответствующие вариабельным областям тяжелых (VH) или легких (VL) цепей человеческих антител. Примерами доменных антител являются, но не ограничиваясь только ими, антитела, доступные от фирмы Domantis Limited (Кэмбридж, Великобритания) и от фирмы Domantis Inc. (Кэмбридж, шт.Массачусетс, США), которые являются специфическими для терапевтических мишеней (см., например, WO 04/058821; WO 04/003019; US 6291158; 6582915; 6696245; и 6593081). Доступные на коммерческой основе библиотеки доменных антител можно применять для идентификации доменных антител к CD19. В определенных вариантах осуществления изобретения антитела к CD19 содержат функциональный связывающий компонент CD19 и функциональный компонент, связывающий рецептор Fc гамма.
В одном из вариантов осуществления изобретения доменное антитело к CD19 может содержать любой один или любую комбинацию CDR тяжелых или легких цепей моноклональных антител НВ12А или НВ12В.
В другом варианте осуществления изобретения доменное антитело к CD19 может содержать CDR3 VH-областей НВ12А или НВ12В в сочетании с любой комбинацией CDR, входящих в вариабельные области тяжелых или легких цепей моноклональных антител НВ12А или НВ12В.
Доменное антитело к CD19 может содержать CDR3 VK-областей НВ12А, НВ12В в сочетании с любой комбинацией CDR, входящих в вариабельные области тяжелых или легких цепей моноклональных антител НВ12А или НВ12В.
Еще в одном варианте осуществления изобретения доменное антитело к CD19 может содержать CDR3 VH-областей НВ12А или НВ12В. Доменное антитело к CD19 может содержать также CDR3 VK-областей НВ12А или НВ12В.
5.7. Двойные антитела
В определенных вариантах осуществления изобретения антитела к CD19 представляют собой «двойные антитела» Понятие «двойные антитела» относится к небольшим фрагментам антител с двумя антигенсвязывающими центрами, при этом фрагменты содержат вариабельную область тяжелой цепи (VH), соединенную с вариабельной область легкой цепи (VL) в такую же полипептидную цепь (VH-VL). С использованием линкера, который является слишком коротким для того, чтобы обеспечивать спаривание между двумя доменами на одной и той же цепи, области могут спариваться с комплементарными доменами другой цепи и создавать два антигенсвязывающих центра. Двойные антитела наиболее полно описаны, например, в ЕР 404097; WO 93/11161; и у Hollinger и др., Proc. Natl. Acad. Sci. USA, 90, 1993, cc.6444-6448).
5.8. Антитела фирмы Vaccibody (vaccibody-антитела)
В определенных вариантах осуществления изобретения антитела к CD19 представляют собой антитела фирмы Vaccibody (vaccibody-антитела). Vaccibody-антитела представляют собой димерные полипептиды. Каждый мономер vaccibody-антитела состоит из scFv, который обладает специфичностью в отношении поверхностной молекулы на АПК, связанного через шарнирную область и Сγ3-домен со вторым scFv. В других вариантах осуществления изобретения vaccibody-антитела, содержащие в качестве одного из scFv' фрагмент антитела к CD19, можно применять для выявления тех В-клеток, которые подлежат деструкции, и эффекторных клеток, которые опосредуют ADCC (см., например, Bogen и др., опубликованная заявка на патент US 20040253238).
5.9. Линейные антитела
В определенных вариантах осуществления изобретения антитела к CD19 представляют собой линейные антитела. Линейные антитела содержат образующую тандем пару Fd-сегментов (VH-CH1-VH-CH1), которые формируют пару антигенсвязывающих центров. Линейные антитела могут быть биспецифическими или моноспецифическими (см. Zapata и др., Protein Eng., 8(10), 1995, cc.1057-1062).
5.10. Родительское антитело +
В определенных вариантах осуществления изобретения антитело к CD19 представляет собой родительское антитело. Понятие «родительское антитело» означает антитело, содержащее аминокислотную последовательность, в которой может отсутствовать или находиться в меньшем количестве один или несколько аминокислотных остатков в одном или нескольких гипервариабельных участков или по соседству с ним(и), по сравнению с измененным/мутантным антителом, представленным в настоящем описании. Таким образом, родительское антитело может иметь укороченный гипервариабельный участок по сравнению с соответствующим гипервариабельным участком мутантного антитела, представленного в настоящем описании. Родительский полипептид может содержать нативную последовательность антитела (т.е. встречающуюся в естественных условиях, включая встречающийся в естественных условиях аллельный вариант) или последовательность антитела с ранее существующими модификациями аминокислотной последовательности (такими как другие инсерции, делеции и/или замены) встречающейся в естественных условиях последовательности. Родительское антитело может представлять собой гуманизированное антитело или человеческое антитело.
5.11 Фрагменты антител
«Фрагменты антител» содержат часть полноразмерного антитела, как правило, его антигенсвязывающий центр или вариабельную область. Примерами фрагментов антител являются Fab-, Fab'-, F(ab')2- и Fv-фрагменты; двойные антитела; линейные антитела; одноцепочечные молекулы антител; и мультиспецифические антитела, образованные из фрагментов антител.
Как правило, эти фрагменты получают путем протеолитического расщепления интактых антител (см., например. Morimoto и др., Journal of Biochemical and Biophysical Methods, 24, 1992, cc.107-117 и Brennan и др., Science, 229, 1985, с.81). Однако эти фрагменты в настоящее время можно получать непосредственно в рекомбинантных клетках-хозяевах. Например, фрагменты антител можно выделять из фаговых библиотек антител, описанных выше. Fab'-SH-фрагменты можно также выделять непосредственно из Е. coli и химически сшивать с получением Р(ab')2-фрагментов (Carter и др., Bio/Technology, 10, 1992, cc.163-167). Согласно другому подходу F(ab')2-фрагменты можно выделять непосредственно из культуры рекомбинантных клеток-хозяев. Другие методы получения фрагментов антител должны быть очевидны специалистам в данной области. В других вариантах осуществления изобретения отобранное антитело представляет собой одноцепочечный Fv-фрагмент (scFv) (см., например, WO 93/16185). В определенных вариантах осуществления изобретения антитело не представляет собой Fab-фрагмент.
5.12. Биспецифические антитела
Биспецифические антитела представляют собой антитела, которые обладают способностью к специфическому связыванию по меньшей мере с двумя различными эпитопами. Например, биспецифические антитела могут связываться с двумя различными эптопами поверхностного маркера В-клеток. Другие такие антитела могут связываться с первым В-клеточным маркером, а также связываться со вторым поверхностным маркером В-клеток. Плечо антитела, связывающееся с В-клеточным маркером, можно объединять также с плечом, которое связывается с обеспечивающей направленный перенос молекулой на лейкоците, такой как молекула Т-клеточного рецептора (например, CD2 или CD3), или Fc-рецепторы для IgG (FcγR), так, чтобы фокусировать клеточные защитные механизмы на В-клетке. Биспецифические антитела можно применять также для локализации цитотоксических агентов на В-клетке. Эти антитела несут плечо, связывающееся с В-клеточным маркером, и плечо, которое связывается с цитотоксическим агентом (например, сапорин, антитело к интерферону-α, алкалоид барвинка, А-цепь рицина, метола-эксат (methola-exate) или радиоактивный изотоп гаптена). Биспецифические антитела можно получать в виде полноразмерных антител или фрагментов антител (например, F(ab'): биспецифические антитела).
Методы создания биспецифических антител известны в данной области (см., например, Millstein и др., Nature, 305, 1983, cc.537-539; Traunecker и др., EMBO J., 10, 1991, cc.3655-3659; Suresh и др., Methods in Enzymology, 121, 1986, с.210; Kostelny и др., J. ImmunoL, 148(5), 1992, cc.1547-1553); Hollinger и др., Proc. Nati Acad. Sci. USA, 90, 1993, cc.6444-6448; Gruber и др., J. Immunol., 152, 1994,с.5368); US 4474893; 4714681; 4925648; 5573920; 560181; 95731168; 4676980 и 4676980, WO 94/04690; WO 91/00360; WO 92/200373; WO 93/17715; WO 92/08802 и ЕР 03089).
В одном из вариантов осуществления изобретения антитело к CD19, применяемое в композициях и способах, предлагаемых в изобретении, является биспецифическим, при этом антитело к CD19 может быть человеческим или гуманизированным и может обладать специфичностью в отношении человеческого CD19 и эпитопа на Т-клетке или может обладать способностью связываться с человеческой эффекторной клеткой, такой, например, как моноцит/макрофаг и/или естественная клетка-киллер, для обеспечения уничтожения клетки.
В одном из вариантов осуществления изобретения антитело к CD19, предлагаемое в изобретении, представляет собой биспецифическое антитело, обладающее способностью специфически связываться с первым и вторым антигеном, где первый антиген представляет собой человеческий CD19, а второй антиген представляет собой рецептор Рсгамма, выбранный из группы, включающей FcγRI, FcγRIIA, FcγRIIB, FcγRIIIA и/или FcγRIV. В другом варианте осуществления изобретения антитело к CD19, предлагаемое в изобретении, представляет собой биспецифическое антитело, обладающее способностью специфически связываться с человеческим CD19 и FcγRIIB. В другом варианте осуществления изобретения антитело к CD19, предлагаемое в изобретении, представляет собой биспецифическое антитело, обладающее способностью специфически связываться с человеческим CD19 и человеческим FcγRIIB.
5.13. Варианты Fc-фрагментов
Настоящее изобретение относится к препаративным формам белков, содержащих вариант Fc-фрагмента. Это означает невстречающийся в естественных условиях Fc-фрагмент, например Fc-фрагмент, содержащий один или несколько не встречающихся в естественных условиях аминокислотных остатков. Под понятие вариант Fc-фрагментов, предлагаемых в изобретении, подпадают Fc-фрагменты, которые содержат аминокислотные делеции, добавления и/или модификации.
Следует понимать, что понятие «Fc-фрагмент» в контексте настоящего описания относится к полипептидам, содержащим константную область антитела за исключением первого домена константной области иммуноглобулина. Таким образом, Fc означает последних два домена константной области иммуноглобулина IgA, IgD и IgG и последние три домена константной области иммуноглобулина IgE и IgM, и гибкую шарнирную область на N-конце относительно этих доменов. В случае IgA и IgM Fc может включать J-цепь. В случае IgG Fc содержит домены иммуноглобулина Сгамма2 и Сгамма3 (Сγ2 и Сγ3) и шарнир между Сгамма1 (Сγ1) и Сгамма2 (Сγ2). Хотя пограничные области Fc-фрагмента могут варьироваться, как правило, в тяжелой цепи человеческого IgG Fc-фрагмент содержит остатки С226 или Р230 на карбокси-конце, при этом нумерация соответствует EU-индексу, представленному у Kabat и др. (NIH Publication 91-3242, 1991, изд-во National Technical Information Service, Springfield, VA). Понятие «EU-индекс, представленный у Кэбота» означает, что нумерация остатков в человеческом EU-антителе типа IgG1 соответствует описанной у Кэбота и др., выше. Понятие «Fc» может относиться к этой области в выделенном состоянии, или этой области в контексте антитела, фрагмента антитела или включающего Fc слитого белка. Вариант белка Fc может представлять собой антитело, Fc-слияние или любой белок, или белковый домен, который содержит Fc-фрагмент, включая, но не ограничиваясь только ими, белки, которые содержат вариант Fc-фрагментов, которые представляют собой невстречающиеся в естественных условиях варианты Fc. Следует отметить, что: обнаружен полиморфизм в номерах положений Fc, включая, но не ограничиваясь только ими, положения по Кэботу 270, 272, 312, 315, 356 и 358, и поэтому могут иметь место небольшие различия между предлагаемыми в изобретении последовательностями и последовательностями, известным в данной области.
Настоящее изобретение относится к вариантам Fc-белков, которые имеют альтернативные способности к связыванию Fc-лиганда (например, Fc-рецептора, C1q) относительно сравниваемой молекулы (например, белка, который имеет такую же аминокислотную последовательность за исключением наличия Fc-фрагмента дикого типа). Примерами характеристик способности к связыванию являются, но не ограничиваясь только ими, специфичность связывания, константа равновесия диссоциации (KD), скорости диссоциации и ассоциации (koff и kon соответственно), аффинность к связыванию и/или авидность. В целом, считается, что связывающая молекула (например, вариант Fc-белка, такого как антитело), характеризующаяся низким значением KD, может быть предпочтительнее связывающей молекулы, характеризующейся высоким значением KD. Однако в некоторых случаях может быть более информативным использовать значение kon или koff, а не значение KD. Специалист в данной области может определить, какой из кинетических параметров является наиболее важным для данного применения антитела.
Аффинность и способность к связыванию Fc-рецептора с его лигандом можно определять с помощью различных методов in vitro (биохимические или иммунологические анализы), известных в данной области, которые предназначены для определения взаимодействий Fc-FcγR, т.е. специфического связывания Fc-фрагмента с FcγR, включая, но не ограничиваясь только ими, методы для равновесных систем (например, твердофазный иммуноферментный анализ (ELISA) или радиоиммуноанализ (РИА)), или кинетические (например, BIACOPE®-анализ), и другие методы, такие как непрямые (опосредованные) анализы связывания, анализы конкурентного ингибирования, флуоресцентный резонансный перенос энергии (FRET), гель-электрофорез и хроматография (например, гель-фильтрация). Эти и другие методы можно применять для введения метки на один или несколько из компонентов, подлежащих оценке, и/или для применения в различных методах выявления, включая, но не ограничиваясь только ими, хромогенные, флуоресцентные, люминесцентные или изотопные метки. Подробное описание методов определения аффинности к связыванию и кинетических характеристик можно найти в публикации Fundamental Immunology, 4-ое изд., под ред. Paul W.E., изд-во Lippincott-Raven, Philadelphia, 1999, в которой сделан упор на взаимодействия антитело-иммуноген.
В одном из вариантов осуществления изобретения вариант Fc-белка обладает повышенной способностью к связыванию с одним или несколькими Fc-лигандами относительно молекулы, с которой проводится сравнение. В другом варианте осуществления изобретения вариант Fc-белка имеет аффинность к Fc-лиганду, которая по меньшей мере в 2 раза или по меньшей мере в 3 раза, или по меньшей мере в 5 раз, или по меньшей мере в 7 раз, или по меньшей мере в 10 раз, или по меньшей мере в 20 раз, или по меньшей мере в 30 раз, или по меньшей мере в 40 раз, или по меньшей мере в 50 раз, или по меньшей мере в 60 раз, или по меньшей мере в 70 раз, или по меньшей мере в 80 раз, или по меньшей мере в 90 раз, или по меньшей мере в 100 раз, или по меньшей мере в 200 раз выше, чем у молекулы, с которой проводится сравнение. В конкретном варианте осуществления изобретения вариант Fc-белка обладает повышенной способностью к связыванию с Fc-рецептором. В другом конкретном варианте осуществления изобретения вариант Fc-белка обладает повышенной способностью к связыванию с Fc-рецептором FcγRIIIA. В другом конкретном варианте осуществления изобретения вариант Fc-белка обладает повышенной способностью к связыванию с Fc-рецептором FcγRIIB. Еще в одном конкретном варианте осуществления изобретения вариант Fc-белка обладает повышенной способностью к связыванию с Fc-рецептором FcRn. И еще в одном конкретном варианте осуществления изобретения вариант Fc-белка обладает повышенной способностью к связыванию с C1q относительно молекулы, с которой проводится сравнение.
В одном из вариантов осуществления изобретения антитело к CD19, предлагаемое в изобретении, содержит вариант Fc-фрагмента, при этом вариант Fc-фрагмента обладает повышенной аффинностью к связыванию с рецептором Fс-гамма IIB относительно соответствующего не представляющего собой вариант Fc-фрагмента. В другом варианте осуществления изобретения антитело к CD19, предлагаемое в изобретении, содержит вариант Fc-фрагмента, где для варианта Fc-фрагмента характерна аффинность к связыванию рецептором Fс-гамма IIB, которая по меньшей мере в 2 раза, ил по меньшей мере в 3 раза, или по меньшей мере в 5 раз, или по меньшей мере в 7 раз, или по меньшей в 10 раз, или по меньшей мере в 20 раз, или по меньшей мере в 30 раз, или по меньшей мере в 40 раз, или по меньшей мере в 50 раз, или по меньшей мере в 60 раз, или по меньшей мере в 70 раз, или по меньшей мере в 80 раз, или по меньшей мере в 90 раз, или по меньшей мере в 100 раз, или по меньшей мере в 200 раз выше по сравнению с соответствующим не представляющим собой вариант Fc-фрагментом.
Время полужизни в сыворотке белков, представляющих собой Fc-фрагменты, можно увеличивать путем повышения аффинности к связыванию Fc-фрагмент с FcRn. В одном из вариантов осуществления изобретения вариант Fc-белка обладает увеличенным временем полужизни в сыворотке относительно молекулы, с которой проводится сравнение.
Понятие «антитело-обусловленная клеточно-зависимая цитотоксичность» или «ADCC» относится к форме цитотоксичности, при которой секретируемый Ig, связанный с Fc-рецепторами (FcR), присутствует на определенных цитотоксических клетках (например, естественных клетках-киллерах (NK-клетки), нейтрофилах и макрофагах), что дает возможность этим цитотоксическим эффекторным клеткам связываться специфически с несущей антиген клеткой-мишенью и затем уничтожать клетку-мишень цитотоксинами. Специфические обладающие высокой аффинностью антитела типа IgG, направленные к поверхности клетки-мишени, «вооружают» цитотоксические клетки, и они абсолютно необходимы для осуществления уничтожения. Лизис клетки-мишени является внеклеточным, требует непосредственного контакта клетка-клетка и в нем не принимает участие комплемент. Считается, что помимо антител другие белки, содержащие Fc-фрагменты, прежде всего содержащие Fc слитые белки, которые обладают способностью специфически связываться с несущей антиген клеткой-мишенью, могут принимать участие в клеточно-опосредуемой цитотоксичности. Для простоты в контексте настоящего описания клеточно-опосредуемую цитотоксичность, являющуюся результатом активности содержащего Fc слитого белка, также относят к ADCC-активности.
Можно оценивать способность любого конкретного варианта Fc-белка опосредовать лизис клетки-мишени с помощью ADCC. Для оценки ADCC-активности вариант Fc-белка, представляющий интерес, добавляют к клеткам-мишеням в сочетании с иммунными эффекторными клетками, которые могут активироваться комплексами антиген-антитело, что приводит к цитолизису клетки-мишени. Цитолизис, как правило, выявляют по высвобождению метки (например, радиоактивных субстратов, флуоресцентных красителей или натуральных внутриклеточных белков) из лизированных клеток. Пригодными для таких анализов эффекторными клетками являются мононуклеарные клетки периферической крови (РВМС) и естественные клетки-киллеры (NK-клетки). Конкретные анализы in vitro ADCC описаны у Wisecarver и др., 79, 1985, cc.277-282; Bruggemann и др., J Exp Med 166, 1987, cc.1351-1361; Wilkinson и др., J Immunol Methods 258, 2001, cc.183-191; Patel и др., J Immunol Methods 184, 1995, cc.29-38. ADCC-активность представляющего интерес варианта Fc-белка можно оценивать также in vivo, например, на созданных на животных моделях, например, описанных у Clynes и др., Proc. Natl. Acad. Sci. USA 95, 1998, cc.652-656.
В одном из вариантов осуществления изобретения вариант Fc-белка обладает повышенной ADCC-активностью относительно молекулы, с которой проводится сравнение. В конкретном варианте осуществления изобретения вариант Fc-белка обладает ADCC-активностью, которая по меньшей мере в 2 раза, или по меньшей мере в 3 раза, или по меньшей мере в 5 раз, или по меньшей мере в 10 раз, или по меньшей мере в 50 раз, или по меньшей мере в 100 раз выше по сравнению с активностью молекулы, с которой проводится сравнение. В другом конкретном варианте осуществления изобретения вариант Fc-белка обладает повышенной способностью связываться с Fc-рецептором FcγRIIIA и обладает повышенной ADCC-активностью относительно молекулы, с которой проводится сравнение. В других вариантах осуществления изобретения вариант Fc-белка обладает как повышенной ADCC-активностью, так и увеличенным временем полужизни в сыворотке относительно молекулы, с которой проводится сравнение.
В одном варианте осуществления изобретения вариант Fc-белка обладает пониженной ADCC-активностью относительно молекулы, с которой проводится сравнение. В конкретном варианте осуществления изобретения вариант Fc-белка обладает ADCC-активностью, которая по меньшей мере в 2 раза, или по меньшей мере в 3 раза, или по меньшей мере в 5 раз, или по меньшей мере в 10 раз, или по меньшей мере в 50 раз, или по меньшей мере в 100 раз ниже по сравнению с активностью молекулы, с которой проводится сравнение. В другом конкретном варианте осуществления изобретения вариант Fc-белка обладает пониженной способностью связываться с Fc-рецептором FcγRIIIA и обладает пониженной ADCC-активностью относительно молекулы, с которой проводится сравнение. В других вариантах осуществления изобретения вариант Fc-белка обладает как пониженной ADCC-активностью, так и укороченным временем полужизни в сыворотке относительно молекулы, с которой проводится сравнение.
Понятие «комплементзависимая цитотоксичность» и «CDC» относится к лизису клетки-мишени в присутствии комплемента. Путь активации комплемента инициируется связыванием первого компонента системы комплемента (C1q) с молекулой, например антителом, в комплексе с родственным антигеном. Для оценки активации комплемента можно применять CDC-анализ, описанный, например, у Gazzano-Santoro и др., J. Immunol. Methods, 202, 1996, с.163. В одном из вариантов осуществления изобретения вариант Fc-белка обладает повышенной CDC-активностью относительно молекулы, с которой проводится сравнение. В конкретном варианте осуществления изобретения вариант Fc-белка обладает CDC-активностью, которая по меньшей мере в 2 раза, или по меньшей мере в 3 раза, или по меньшей мере в 5 раз, или по меньшей мере в 10 раз, или по меньшей мере в 50 раз, или по меньшей мере в 100 раз выше по сравнению с активностью молекулы, с которой проводится сравнение. В других вариантах осуществления изобретения вариант Fc-белка обладает как повышенной CDC-активностью, так и увеличенным временем полужизни в сыворотке относительно молекулы, с которой проводится сравнение.
В одном из вариантов осуществления изобретения вариант Fc-белка обладает пониженной способностью связываться с одним или несколькими Fc-лигандами относительно молекулы, с которой проводится сравнение. В другом варианте осуществления изобретения вариант Fc-белка обладает аффинностью к Fc-лиганду, которая по меньшей мере в 2 раза, или по меньшей мере 3 раза, или по меньшей мере в 5 раз, или по меньшей мере в 7 раз, или по меньшей мере в 10 раз, или по меньшей мере в 20 раз, или по меньшей мере в 30 раз, или по меньшей мере в 40 раз, или по меньшей мере в 50 раз, или по меньшей мере в 60 раз, или по меньшей мере в 70 раз, или по меньшей мере в 80 раз, или по меньшей мере в 90 раз, или по меньшей мере в 100 раз, или по меньшей мере в 200 раз ниже по сравнению с активностью молекулы, с которой проводится сравнение. В конкретном варианте осуществления изобретения вариант Fc-белка обладает пониженной способностью к связыванию с Fc-рецептором. В другом конкретном варианте осуществления изобретения вариант Fc-белка обладает пониженной способностью к связыванию с Fc-рецептором FcγRIIIA. В другом конкретном варианте осуществления изобретения Fc-вариант, представленный в настоящем описании, обладает аффинностью к Fc-рецептору FcγRIIIA, которая по меньшей мере примерно в 5 раз ниже по сравнению с аффинностью молекулы, с которой проводится сравнение, при этом Fc-вариант обладает аффинностью к Fc-рецептору FcγRIIB, которая по меньшей мере примерно в 2 раза ниже по сравнению с аффинностью молекулы, с которой проводится сравнение. Еще в одном конкретном варианте осуществления изобретения вариант Fc-белка обладает пониженной способностью связываться с Fc-рецептором FcRn. Еще в одном конкретном варианте осуществления изобретения вариант Fc-белка обладает пониженной способностью связываться с C1q, по сравнению с молекулой, с которой проводится сравнение.
Одним из вариантов осуществления настоящего изобретения являются Fc-варианты, в которых Fc-фрагмент содержит не встречающийся в естественных условиях аминокислотный остаток в одном или нескольких положениях, выбранных из группы, включающей 234, 235, 236, 237, 238, 239, 240, 241, 243, 244, 245, 247, 251, 252, 254, 255, 256, 262, 263, 264, 265, 266, 267, 268, 269, 279, 280, 284, 292, 296, 297, 298, 299, 305, 313, 316, 325, 326, 327, 328, 329, 330, 331, 332, 333, 334, 339, 341, 343, 370, 373, 378, 392, 416, 419, 421, 440 и 443, где нумерация дана согласно EU-индексу, представленному у Кэбота. Необязательно Fc-фрагмент может содержать не встречающийся в естественных условиях аминокислотный остаток в дополнительных и/или альтернативных положениях, которые известны специалистам в данной области (см., например, US 5624821; 6277375; 6737056; публикации РСТ WO 01/58957; WO 02/06919; WO 04/016750; WO 04/029207; WO 04/035752; WO 04/074455; WO 04/099249; WO 04/063351; WO 05/070963; WO 05/040217, WO 05/092925 и WO 06/020114).
Одним из вариантов осуществления настоящего изобретения являются препаративные формы, в которых Fc-фрагмент содержит не встречающийся в естественных условиях аминокислотный остаток в одном или нескольких положениях, выбранных из группы, включающей 234, 235, 236, 237, 238, 239, 240, 241, 243, 244, 245, 247, 251, 252, 254, 255, 256, 262, 263, 264, 265, 266, 267, 268, 269, 279, 280, 284, 292, 296, 297, 298, 299, 305, 313, 316, 325, 326, 327, 328, 329, 330, 331, 332, 333, 334, 339, 341, 343, 370, 373, 378, 392, 416, 419, 421, 440 и 443, где нумерация дана согласно EU-индексу, представленному у Кэбота. Необязательно Fc-фрагмент может содержать не встречающийся в естественных условиях аминокислотный остаток в дополнительных и/или альтернативных положениях, которые известны специалистам в данной области (см., например, US 5624821; 6277375; 6737056; публикации РСТ WO 01/58957; WO 02/06919; WO 04/016750; WO 04/029207; WO 04/035752; WO 04/074455; WO 04/099249; WO 04/063351; WO 05/070963; WO 05/040217, WO 05/092925 и WO 06/020114).
Конкретным вариантом осуществления настоящего изобретения является Fc-вариант, в котором Fc-фрагмент содержит по меньшей мере один не встречающийся в естественных условиях аминокислотный остаток, выбранный из группы, включающей 234D, 234Е, 234N. 234Q, 234Т, 234Н, 234Y, 2341, 234V, 234F, 235А, 235D, 235R, 235W, 235Р, 235S, 235N, 235Q, 235Т, 235Н, 235Y, 2351, 235V, 235F, 236Е, 239D, 239Е, 239N, 239Q, 239F, 239Т, 239Н, 239Y, 2401, 240A, 240T, 240M, 241W, 241L, 241Y, 241E, 241R, 243W, 243L 243Y, 243R, 243Q, 244H, 245A, 247L, 247V, 247G, 251F, 252Y, 254T, 255L, 256E, 256M, 2621, 262A, 262T, 262E, 2631, 263A, 263T, 263M, 264L, 2641, 264W, 264T, 264R, 264F, 264M, 264Y, 264E, 265G, 265N, 265Q, 265Y, 265F, 265V, 2651, 265L, 265H, 265T, 2661, 266A, 266T, 266M, 267Q, 267L, 268E, 269H, 269Y, 269F, 269R, 270E, 280A, 284M, 292P, 292L, 296E, 296Q, 296D, 296N, 296S, 296T, 296L, 2961, 296H, 269G, 297S, 297D, 297E, 298H, 2981, 298T, 298F, 2991, 299L, 299A, 299S, 299V, 299H, 299F, 299E, 3051. 313F, 316D, 3250, 325L, 3251, 325D, 325E, 325A, 325T, 325V, 325H, 327G, 327W, 327N, 327L, 328S, 328M, 328D, 328E, 328N, 328Q, 328F, 3281, 328V, 328T, 328H, 328A, 329F, 329H, 329Q, 330K, 330G, 330Т, 330С, 330L, 330Y, 330V, 3301, 330F, 330R, 330H, 331G, 331A, 331L, 331M, 331F, 331W, 331K, 331Q, 331E, 331S, 331V, 3311, 331C, 331Y, 331H, 331R, 331N, 331D, 331T, 332D, 332S, 332W, 332F, 332E, 332N, 332Q, 332T, 332H, 332Y, 332A, 339T, 370E, 370N, 378D, 392T, 396L, 416G, 419H, 421K, 440Y и 434W, где нумерация дана согласно EU-индексу, представленному у Кэбота. Необязательно Fc-фрагмент может содержать не встречающийся в естественных условиях аминокислотный остаток в дополнительных и/или альтернативных положениях, которые известны специалистам в данной области (см., например, US 5624821; 6277375; 6737056; публикации РСТ WO 01/58957; WO 02/06919; WO 04/016750; WO 04/029207; WO 04/035752 и WO 05/040217).
Конкретным вариантом осуществления настоящего изобретения является Fc-вариант, в котором Fc-фрагмент содержит по меньшей мере один не встречающийся в естественных условиях аминокислотный остаток, выбранный из группы, включающей 234D, 234Е, 234N, 234Q, 234Т, 234Н, 234Y, 2341, 234V, 234F, 235А, 235D, 235R, 235W, 235Р, 235S, 235N, 235Q, 235Т, 235Н, 235Y, 2351, 235V, 235F, 236Е, 239D, 239Е, 239N, 239Q, 239F, 239Т, 239Н, 239Y, 2401, 240A, 240T, 240M, 241W, 241L, 241Y, 241E, 241R, 243W, 243L 243Y, 243R, 243Q, 244H, 245A, 247L, 247V, 247G, 251F, 252Y, 254T, 255L, 256E, 256M, 2621, 262A, 262T, 262E, 2631, 263A, 263T, 263M, 264L, 2641, 264W, 264T, 264R, 264F, 264M, 264Y, 264E, 265G, 265N, 265Q, 265Y, 265F, 265V, 2651, 265L, 265H, 265T, 2661, 266A, 266T, 266M, 267Q, 267L, 268E, 269H, 269Y, 269F, 269R, 270E, 280A, 284M, 292P, 292L, 296E, 296Q, 296D, 296N, 296S, 296T, 296L, 2961, 296H, 269G, 297S, 297D, 297E, 298H, 2981, 298T, 298F, 2991, 299L, 299A, 299S, 299V, 299H, 299F, 299E, 3051, 313F, 316D, 325Q, 325L, 3251, 325D, 325E, 325A, 325T, 325V, 325H, 327G, 327W, 327N, 327L, 328S, 328M, 328D, 328E, 328N, 328Q, 328F, 3281, 328V, 328T, 328H, 328A, 329F, 329H, 329Q, 330K, 330G, 330Т, 330С, 330L, 330Y, 330V, 3301, 330F, 330R, 330H, 331G, 331A, 331L, 331M, 331F, 331W, 331K, 331Q, 331E, 331S, 331V, 3311, 331C, 331Y, 331H, 331R, 331N, 331D, 331T, 332D, 332S, 332W, 332F, 332E, 332N, 332Q, 332T, 332H, 332Y, 332A, 339T, 370E, 370N, 378D, 392T, 396L, 416G, 419H. 421K, 440Y и 434W, где нумерация дана согласно EU-индексу, представленному у Кэбота. Необязательно Fc-фрагмент может содержать не встречающийся в естественных условиях аминокислотный остаток в дополнительных и/или альтернативных положениях, которые известны специалистам в данной области (см., например, US 5624821; 6277375; 6737056; публикации РСТ WO 01/58957; WO 02/06919; WO 04/016750; WO 04/029207; WO 04/035752 и WO 05/040217).
Еще одним вариантом осуществления настоящего изобретения является Fc-вариант, в котором Fc-фрагмент содержит по меньшей мере одну не встречающуюся в естественных условиях аминокислоту в одном или нескольких положениях, выбранных из группы, включающей 239, 330 и 332, где нумерация дана согласно EU-индексу, представленному у Кэбота. Конкретным вариантом осуществления настоящего изобретения является Fc-вариант, в котором Fc-фрагмент содержит по меньшей мере одну не встречающуюся в естественных условиях аминокислоту, выбранную из группы, включающей 239D, 330L и 332E, где нумерация дана согласно EU-индексу, представленному у Кэбота. Необязательно Fc-фрагмент может содержать дополнительную не встречающуюся в естественных условиях аминокислоту в одном или нескольких положениях, выбранных из группы, включающей 252, 254 и 256, где нумерация дана согласно EU-индексу, представленному у Кэбота. Конкретным вариантом осуществления настоящего изобретения является Fc-вариант, в котором Fc-фрагмент содержит по меньшей мере одну не встречающуюся в естественных условиях аминокислоту, выбранную из группы, включающей 239D, 330L и 332Е, где нумерация дана согласно EU-индексу, представленному у Кэбота, и по меньшей мере одну не встречающуюся в естественных условиях аминокислоту, выбранную из группы, включающей 252Y, 254Т и 256Е, где нумерация дана согласно EU-индексу, представленному у Кэбота.
Другим вариантом осуществления настоящего изобретения является Fc-вариант, в котором Fc-фрагмент содержит по меньшей мере одну не встречающуюся в естественных условиях аминокислоту в одном или нескольких положениях, выбранных из группы, включающей 234, 235 и 331, где нумерация дана согласно EU-индексу, представленному у Кэбота. Конкретным вариантом осуществления настоящего изобретения является Fc-вариант, в котором Fc-фрагмент содержит по меньшей мере одну не встречающуюся в естественных условиях аминокислоту, выбранную из группы, включающей 234F, 235F, 235Y и 33 IS, где нумерация дана согласно EU-индексу, представленному у Кэбота. В дополнительном конкретном варианте осуществления изобретения Fc-вариант, предлагаемый в изобретении, содержит 234F, 235F и 331S, которые представляют собой не встречающиеся в естественных условиях аминокислотные остатки, где нумерация дана согласно EU-индексу, представленному у Кэбота. В другом конкретном варианте осуществления изобретения Fc-вариант, предлагаемый в изобретении, содержит 234F, 235Y и 331S, которые представляют собой не встречающиеся в естественных условиях аминокислотные остатки, где нумерация дана согласно EU-индексу, представленному у Кэбота. Необязательно Fc-фрагмент может содержать дополнительную не встречающуюся в естественных условиях аминокислоту в одном или нескольких положениях, выбранных из группы, включающей 252, 254 и 256, где нумерация дана согласно EU-индексу, представленному у Кэбота. Конкретным вариантом осуществления настоящего изобретения является Fc-вариант, в котором Fc-фрагмент содержит по меньшей мере одну не встречающуюся в естественных условиях аминокислоту, выбранную из группы, включающей 234F, 235F, 235Y и 331S, где нумерация дана согласно EU-индексу, представленному у Кэбота; и по меньшей мере одну не встречающуюся в естественных условиях аминокислоту, выбранную из группы, включающей 252Y, 254Т и 256Е, где нумерация дана согласно EU-индексу, представленному у Кэбота.
Другим вариантом осуществления настоящего изобретения является содержащая вариант Fc-белка препаративная форма, в которой Fc-фрагмент содержит по меньшей мере не встречающуюся в естественных условиях аминокислоту в одном или нескольких положениях, выбранных из группы, включающей 239, 330 и 332, где нумерация дана согласно EU-индексу, представленному у Кэбота. Конкретным вариантом осуществления настоящего изобретения является содержащая вариант Fc-белка препаративная форма, в которой Fc-фрагмент содержит по меньшей мере одну не встречающуюся в естественных условиях аминокислоту в одном или нескольких положениях, выбранных из группы, включающей 239D, 330L и 332Е, где нумерация дана согласно EU-индексу, представленному у Кэбота. Необязательно Fc-фрагмент может содержать также дополнительную не встречающуюся в естественных условиях аминокислоту в одном или нескольких положениях, выбранных из группы, включающей 252, 254 и 256, где нумерация дана согласно EU-индексу, представленному у Кэбота. Конкретным вариантом осуществления настоящего изобретения является содержащая вариант Fc-белка препаративная форма, в которой Fc-фрагмент содержит по меньшей мере не встречающуюся в естественных условиях аминокислоту в одном или нескольких положениях, выбранных из группы, включающей 239D, 330L и 332Е, где нумерация дана согласно EU-индексу, представленному у Кэбота, и по меньшей мере одну не встречающуюся в естественных условиях аминокислоту в одном или нескольких положениях, выбранных из группы, включающей 252Y, 254Т и 25 6Е, где нумерация дана согласно EU-индексу, представленному у Кэбота.
Другим вариантом осуществления настоящего изобретения является содержащая вариант Fc-белка препаративная форма, в которой Fc-фрагмент содержит по меньшей мере не встречающуюся в естественных условиях аминокислоту в одном или нескольких положениях, выбранных из группы, включающей 234, 235 и 331, где нумерация дана согласно EU-индексу, представленному у Кэбота. Конкретным вариантом осуществления настоящего изобретения является содержащая вариант Fc-белка препаративная форма, в которой Fc-фрагмент содержит по меньшей мере одну не встречающуюся в естественных условиях аминокислоту, выбранную из группы, включающей 234F, 235F, 235Y и 331S, где нумерация дана согласно EU-индексу, представленному у Кэбота. Необязательно Fc-фрагмент может содержать также дополнительную не встречающуюся в естественных условиях аминокислоту в одном или нескольких положениях, выбранных из группы, включающей 252, 254 и 256, где нумерация дана согласно EU-индексу, представленному у Кэбота. Конкретным вариантом осуществления настоящего изобретения является содержащая вариант Fc-белка препаративная форма, в которой Fc-фрагмент содержит по меньшей мере одну не встречающуюся в естественных условиях аминокислоту, выбранную из группы, включающей 234F, 235F, 235Y и 331S, где нумерация дана согласно EU-индексу, представленному у Кэбота; и по меньшей мере одну не встречающуюся в естественных условиях аминокислоту в одном или нескольких положениях, выбранных из группы, включающей 252Y, 254Т и 256Е, где нумерация дана согласно EU-индексу, представленному у Кэбота.
В одном из вариантов осуществления изобретения Fc-варианты, предлагаемые в настоящем изобретении, можно объединять в другими известными Fc-вариантами, например, описанными у Ghetie и др., Nat Biotech. 15, 1997, cc.637-640; Duncan и др. Nature 332, 1988, cc.563-564; Lund и др., J. Immunol 147, 1991, cc.2657-2662; Lund и др, Mol Immunol 29, 1992, cc.53-59; Alegre и др, Transplantation 57, 1994, cc.1537-1543; Hutchins и др., Proc Natl. Acad Sci USA 92, 1995, cc.11980-11984; Jefferis и др., Immunol Lett. 44, 1995, cc.111-117; Lund и др., Faseb J 9, 1995, cc.115-119; Jefferis и др„ Immunol Lett 54, 1996, cc.101-104; Lund и др., J Immunol 157, 1996, cc.4963-4969; Armour и др., Eur J Immunol 29, 1999, cc.2613-2624; Idusogie и др., J Immunol 164, 2000, cc.4178-4184; Reddy и др, J Immunol 164, 2000, cc.1925-1933; Xu и др., Cell Immunol 200, 2000, cc.16-26; Idusogie и др, J Immunol 166, 2001, cc.2571-2575; Shields и др., J Biol Chem 276, 2001, cc.6591-6604; Jefferis и др., Immunol Lett 82, 2002, cc.57-65; Presta и др., Biochem Soc Trans 30, 2002, cc.487-490); US 5624821; 5885573; 5677425; 6165745; 6277375; 5869046; 6121022; 5624821; 5648260; 6528624; 6194551; 6737056; 6821505; 6277375; публикация US 2004/0002587 и публикации РСТ WO 94/29351; WO 99/58572; WO 00/42072; WO 02/060919; WO 04/029207; WO 04/099249; WO 04/063351. Кроме того, под объем настоящего изобретения подпадают Fc-фрагменты, которые содержат делеции, добавления и/или модификации. Другие модификации/замены/добавления/делеции Fc-фрагмента очевидны специалисту в данной области.
Методы создания не встречающихся в естественных условиях Fc-фрагментов известны в данной области. Например, аминокислотные замены и/или делеции можно создавать методами мутагенеза, включая, но, не ограничиваясь только ими, сайтнаправленный мутагенез (Kunkel, Proc. Natl. Acad. Sci. USA, 82, 1985, cc.488-492), ПЦР-мутагенез (Higuchi в: «PCR Protocols: A Guide to Methods and Applications», изд-во Academic Press, San Diego, 1990, cc.177-183) и кассетный мутагенез (Wells и др., Gene 34, 1985, cc.315-323). Предпочтительно сайтнаправленный мутагенез осуществляют с помощью ПЦР путем перекрывающегося удлинения (Higuchi в: «PCR Technology: Principles and Applications for DNA Amplification», изд-во Stockton Press, New York, 1989, cc.61-70). Методику перекрывающегося удлинения с использованием ПЦР (Higuchi, там же) можно применять также для интродукции любой(ых) требуемой(ых) мутации(й) в последовательность-мишень (исходную ДНК). Например, первый цикл ПЦР при осуществлении перекрывающегося удлинения включает амплификацию последовательности-мишени с внешним праймером (праймер 1) и внутренним предназначенным для мутагенеза праймером (праймер 3), и отдельно со вторым внешним праймер (праймер 4) и внутренним праймером (праймер 2), с получением двух ПЦР-сегментов (сегменты А и Б). Предназначенный для мутагенеза внутренний праймер (праймер 3) создают так, чтобы он содержал ошибочные спаривания с последовательностью-мишенью, специфичные для требуемой(ых) мутации(й). Во втором цикле ПЦР продукты, полученные в первом цикле ПЦР (сегменты А и Б), амплифицируют с помощью ПЦР с использованием двух внешних праймеров (праймеры 1 и 4). Образовавшийся полноразмерный ПЦР-сегмент (сегмент В) расщепляют рестриктазами и полученный рестрикционный фрагмент клонируют в соответствующем векторе. В качестве первой стадии мутагенеза исходную ДНК (например, кодирующую содержащий Fc слитый белок, антитело или просто Fc-фрагмент) функционально клонируют в векторе для мутагенеза. Создают праймеры, обеспечивающие требуемую аминокислотную замену. В данной области известны и другие методы, пригодные для создания вариантов Fc-фрагментов (см., например, US 5624821; 5885573; 5677425; 6165745; 6277375; 5869046; 6121022; 5624821; 5648260; 6528624; 6194551; 6737056; 6821505; 6277375; публикация US 2004/0002587 и публикации РСТ WO 94/29351; WO 99/58572; WO 00/42072; WO 02/060919; WO 04/029207; WO 04/099249; WO 04/063351).
В некоторых вариантах осуществления изобретения вариант Fc-белка содержит одну или несколько созданных гликоформ, т.е. углеводную композицию, ковалентно связанную с молекулой, которая содержит Fc-фрагмент. Созданные гликоформы можно применять для различных целей, включая, но не ограничиваясь только ими, повышение или снижение эффекторной функции. Созданные гликоформы можно конструировать любым методом, известным специалисту в данной области, например, используя созданные или экспрессирующие вариант линии, путем коэкспрессии с одним или несколькими ферментами, например DI N-ацетилглюкозаминилтрансферазой III (GnTIll), путем экспрессии молекулы, которая содержит Fc-фрагмент, в различных организмах или клеточных линиях из различных организмов, или путем модификации с помощью углевода(ов) после экспрессии молекулы, содержащей Fc-фрагмент. Методы создания гликоформ известны в данной области и включают, но не ограничиваясь только ими, методы, описанные у Umana и др., Nat. Biotechnol 17, 1999, cc.176-180; Davies и др., Biotechnol Bioeng 74, 2001, cc.288-294; Shields и др., J Biol Chem 277, 2002, cc.26733-26740; Shinkawa и др., J Biol Chem 278, 2003, cc.3466-3473, US 6602684; US, сер. №10/277370; US сер.№10/113929; РСТ WO 00/61739A1; РСТ WO 01/292246A1; РСТ WO 02/311140A1; РСТ WO 02/30954A1; с использованием метода Potillegent™ (фирма Biowa, Inc., Принстон, шт.Нью-Джерси); методики создания гликозилирования GlycomAT™ (фирма GLYCART biotechnology AG, Цюрих, Швейцария) (см., например, WO 00061739; ЕА 01229125; US 20030115614; Okazaki и др., JMB, 336, 2004, cc.1239-1249).
Очевидно, что Fc-вариант, представленный в настоящем описании, можно создавать из любого антитела, представленного в настоящем описании, или вариант Fc-фрагмента, представленный в настоящем описании, можно интродуцировать в любое антитело, известное в данной области, включая, но не ограничиваясь только ими, моноклональное антитело к флуоресцеину 4-4-20 (Kranz и др., J. Biol. Chem. 257(12), 1982, cc.6987-6995), гуманизированное антитело к TAG72 (СС49) (Sha и др., Cancer Biother. 9(4), 1994, cc.341-349), антитело, которое специфически связывается с Eph-рецептором, включая, но не ограничиваясь только ими, антитела, описанные в публикациях РСТ 04/014292, WO 03/094859 и заявке на патент США, сер. №10/863729, антитела, которые специфически связываются с интегрином αVβ3, включая, но не ограничиваясь только ими, LM609 (фирма Scripps), мышиное моноклональное антитело LM609 (публикация РСТ WO 89/015155 и US 5753230); гуманизированное моноклональное антитело MEDI-522 (известное также как VITAXIN®, фирма Medlmmune, Inc., Геттисберг, шт.Мэриленд); Wu и др., PNAS USA 95(11), 1988, cc.6037-6042; публикация РСТ WO 90/33919 и WO 00/78815), антитело к интерферону альфа, описанное в WO/2005/05059106, антитело к рецептору 1 интерферона, описанное в WO/2006/059106, Erbitux™ (известное также как IMC-С225) (фирма ImClon Systems Inc.), химерное моноклональное антитело к EGFR; HERCEPTIN® (Трастузумаб) (фирма Genentech, шт.Калифорния), которое представляет собой гуманизированное моноклональное антитело к HER2, предназначенное для лечения пациентов, страдающих метастазирующим раком молочной железы; REOPRO® (абциксимаб) (фирма Centocor), представляющее собой антитело к рецептору гликопротеина IIb/IIIa на поверхности тромбоцитов, которое предназначено для предупреждения образования сгустков; ZENAPAX® (даклизумаб) (фирма Roche Pharmaceuticals, Швейцария), которое представляет собой иммуносупрессорное гуманизированное моноклональное антитело к CD25, предназначенное для предупреждения острого отторжения почечного аллотрансплантата. Другими примерами являются гуманизированное антитело к CD18 F(ab')2 (фирма Genentech); CDP860, представляющее собой гуманизированное антитело к CD18 F(ab')2 (фирма Celltech, Великобритания); PR0542, представляющее собой антитело к gp120 ВИЧ, слитое с CD4 (фирма Progenics/Genzyme Transgenics); С14, представляющее собой антитело к CD14 (фирма ICOS Pharm); гуманизированное антитело к VEGF типа IgG1 (фирма Genentech); OVAREX™, представляющее собой мышиное антитело к СА 125 (фирма Altarex); PANOREX™, представляющее собой мышиное антитело к находящемуся на клеточной поверхности антигену 17-IA типа IgG2a (фирма Glaxo Wellcome/Centocor); IMC-C225, представляющее собой химерное антитело к EGFR типа IgG (ImClon System); VITAXIN™, представляющее собой гуманизированное антитело к интегрину αVβ3 (фирма Applied Molecular Evolution/MedImmune); Campath 1H/LDP-03, представляющее собой гуманизированное антитело к CD52 типа IgG1 (фирма Leukosite); Smart M195, представляющее собой гуманизированное антитело к CD33 типа IgG (фирма Protein Design Lab/Kanebo); RITUXAN™, представляющее собой химерное антитело к CD20 типа IgG1 (фирма IDEC Pharm/Genentech, Roche/Zettyaku); LYMPHOCIDE™, представляющее собой гуманизированное антитело к CD22 типа IgG (фирма Immunomedics); Smart ID 10, представляющее собой гуманизированное антитело к HLA (фирма Protein Design Lab); ONCOLYM™ (Lym-1), представляющее собой радиоактивно-меченное мышиное антитело к HLA DR (фирма Techniclon); антитело к CDlla, представляющее собой гуманизированное антитело типа IgG1 (фирма Genetech/Xoma); ICM3, представляющее собой гуманизированное антитело к ICAM3 (фирма ICOS Pharm); IDEC-114, представляющее собой приматизированное антитело к CD80 (фирма IDEC Pharm/Mitsubishi); ZEVALIN™, представляющее собой радиоактивно-меченное мышиное антитело к CD20 (фирма IDEC/Schering AG); IDEC-131, представляющее собой гуманизированное антитело к CD40L (фирма IDEC/Eisai); IDEC-151, представляющее собой приматизированное антитело к CD4 (фирма IDEC); IDEC-152, представляющее собой приматизированное антитело к CD23 (фирма IDEC/Seikagaku); SMART, антитело к CD3, представляющее собой гуманизированное антитело к CD3 типа IgG (фирма Protein Design Lab); 5G1.1, представляющее собой гуманизированное антитело к фактору 5 комплемента (С5) (фирма Alexion Pharm); IDEC-151, представляющее собой приматизированное антитело к CD4 типа IgG1 (фирма IDEC Pharm/SmithKline Beecham); MDX-CD4, представляющее собой человеческое антитело к CD4 типа IgG (фирма Medarex/Eisai/Genmat); CDP571, представляющее собой гуманизированное антитело к TNF-α типа IgG4 (фирма Celltech); LDP-02, представляющее собой гуманизированное антитело к α4β7 (фирма LeukoSite/Genentech); OrthoClon OKT4A, представляющее собой гуманизированное антитело к CD4 типа IgG (фирма Ortho Biotech); ANTOVA™, представляющее собой гуманизированное антитело к CD40L типа IgG (фирма Biogen); ANTEGREN™, представляющее собой гуманизированное антитело к VLA-4 типа IgG (фирма Elan); MDX-33, представляющее собой человеческое антитело к CD64 (FcγR) (фирма Medarex/Centeon); rhumat-E25, представляющее собой гуманизированное антитело к IgE типа IgG1 (фирма Genentech/Norvartis/Tanox Biosystems); IDEC-152, представляющее собой приматизированное антитело к CD23 (фирма IDEC Pharm); ABX-CBL, представляющее собой мышиное антитело к CD-147 типа IgM (фирма Abgenix); BTI-322, представляющее собой крысиное антитело к CD2 типа IgG (фирма Medimmune/Bio Transplantat); Orthoclon/ОКТЗ, представляющее собой мышиное антитело к CD3 типа IgG2a (фирма ortho Biotech); SIMULECT™, представляющее собой химерное антитело к CD25 типа IgG1 (фирма Novartis Pharm); LDP-01, представляющее собой гуманизированное антитело к β2-интегрину типа IgG (фирма LeukoSite); анти-LFA-1, представляющее собой мышиное антитело к CD 18 F(ab')2 (фирма Pasteur-Merieux/Immunotech); CAT-152, представляющее собой человеческое антитело к TGF-β2 (фирма Cambridge Ab Tech); и Corsevin M, представляющее собой химерное антитело к фактору VII (фирма Centocor).
Другие антитела, которые могут содержать вариант Fc-фрагмента, представленный в настоящем описании, и могут специфически связываться с раковым или опухолевым антигеном, например, включают, но не ограничиваясь только ими, карциномный пан-антиген KS 1/4 (Perez и Walker, J. Immunol. 142, 1999, cc.3662-3667; Bumal, Hybridoma 7(4), 1998, cc.407-415), антиген карциномы яичника (СА125) (Yu и др., Cancer Res. 51(2), 1991, cc.468-475), простатический кислый фосфат (Tailor и др., Nucl. Acids Res. 18(16), 1990, с.4928), простатический антиген (Henttu and Vihko, Biochem. Biophys. Res. Comm. 160(2), 1989, cc.903-910; Israeli и др., Cancer Res. 53, 1993, cc.227-230), ассоциированный с меланомой антиген р97 (Estin и др.,, J. Natl. Cancer Instit. 81(6), 1989, cc.445-446), меланомный антиген gp75 (Vijayasardahl и др., J. Exp. Med. 171(4), 1990, cc.1375-1380), высокомолекулярный меланомный антиген (HMW-MAA) (Natali и др., Cancer 59, 1987, cc.55-63; Mittelman и др., J. Clin. Invest. 86, 1990, cc.2136-2144), простатический мембранный антиген, карциноэмбриональный антиген (СЕА) (Foon и др., Proc. Am. Soc. Clin. Oncol. 13, 1994, cc.294), полиморфный эпителиальный муциновый антиген, человеческий антиген капелек молочного жира, ассоциированные с колоректальной опухолью антигены, такие как: СЕА, TAG-72 (Yokata и др., Cancer Res. 52, 1992, cc.3402-3408), С017-1А (Ragnhammar и др., Int. J. Cancer 53, 1993. cc.751-758); GICA 19-9 (Herlyn и др., J. Clin. Immunol. 2, 1982, с.135), СТА-1 и LEA, антиген-38.13 лимфомы Беркитта, CD19 (Ghetie и др., Blood 83, 1994, cc.1329-1336), антиген CD20 человеческой В-лимфомы (Reffn др.,, Blood 83, 1994, cc.435-445), CD33 (Sgouros и др., J. Nucl. Med. 34, 1993, cc.422-430), специфические для меланомы антигены, такие как ганглиозид GD2 (Saleh и др., J. Immunol., 151, 1993, cc.3390-3398), ганглиозид GD3 (Shitara и др., Cancer Immunol. Immunother. 36, 1993, cc.373-380), ганглиозид GM2 (Livingston и др., J. Clin. Oncol. 12, 1994, cc.1036-1044), ганглиозид GM3 (Нооn и др., Cancer Res. 53, 1993, cc.5244-5250), опухолеспецифический трансплантационный находящийся на клеточной поверхности антиген (TSTA), такой как антигены индуцируемой вирусом опухоли, включая Т-антиген опухоли, индуцируемой ДНКовым вирусом, и оболочечные антигены опухолей, индуцируемых РНКовым вирусом, онкофетальный антиген (альфа-фетопротеин), такой как СЕА ободочной кишки, онкофетальный антиген опухоли мочевого пузыря (Hellstrom и др., Cancer. Res. 45, 1985, cc.2210-2188), дифференцировочный антиген, такой как антиген L6, L20 человеческой карциномы легкого (Hellstrom и др., Cancer Res. 46, 1986, cc.3917-3923), антигены фибросаркомы, антиген-β37 человеческого Т-клеточного лейкоза (Bhattacharya-Chatterjee и др., J. oflmmun. 141, 1988, cc.1398-1403), неогликопротеин, сфинголипиды, антиген рака молочной железы, такой как EGFR (рецептор эпидермального фактора роста), антиген HER2 (pl85HER2), полиморфный эпителиальный муцин (РЕМ) (Hilkens и др., Trends in Bio. Chem. Sci. 17, 1992, с.359), антиген-АРО-1 злокачественных человеческих лимфоцитов (Bernhard и др., Science 245, 1989, cc.301-304), дифференцировочный антиген (Feizi Nature 314, 1985, cc.53-57), такой как I-антиген, обнаруженный в фетальных эритроцитах, 1-антиген первичной эндодермы, обнаруженный в эритроцитах взрослых, зародышах до имплантации, 1(Ма), обнаруженный при желудочных аденокарциномах. Ml 8, М39, обнаруженный в эпителии молочной железы, SSEA-1, обнаруженный в миелоидных клетках, VEP8, VEP9, Myl, VIM-D5, D 156-22, обнаруженные при колоректальном раке, TRA-1-85 (группа крови Н), С14, обнаруженный при аденокарциноме ободочной кишки, F3, обнаруженный при легочной аденокарциноме, АН6, обнаруженный при раке желудка, Y-гаптен, Ley, обнаруженный в клетках эмбриональных карциномы, TL5 (группа крови А), EGF-рецептор, обнаруженный в А431-клетках, серии Е1 (группа крови В), обнаруженный при раке поджелудочной железы, FC10.2, обнаруженный в клетках эмбриональных карцином, антиген желудочной аденокарциномы СО-514 (группа крови Lea), обнаруженный при аденокарциноме, NS-10, обнаруженный при аденокарциномах, СО-43 (группа крови Leb), G49, обнаруженный в EGF-рецепторе А431-клеток, МН2 (группа крови ALeb/Ley), обнаруженный при аденокарциноме ободочной кишки, 19.9, обнаруженный при раке ободочной кишки, муцины рака желудка, Т5А7, обнаруженный в миелоидных клетках, R24, обнаруженный при меланоме, 4.2, GD3, D1.1, OFA-1, GM2, OFA-2, GD2 и M1: 22:25:8, обнаруженные в клетках эмбриональной карциномы, и SSEA-3 и SSEA-4, обнаруженные в зародышах на стадии 4-8-клеток. В одном из вариантов осуществления изобретения антиген представляет собой выведенный из Т-клеточного рецептора пептид, характерный для кожной Т-клеточной лимфомы (см. Edelson, The Cancer Journal 4, 1998, с.62).
Fc-вариант, представленный в настоящем описании, можно создавать из любого антитела или вариант Fc-фрагмента, представленный в настоящем описании, можно интродуцировать в любое антитело. Кроме того, вариант Fc-фрагмента, представленный в настоящем описании, можно применять для создания содержащего Fc слитого белка. Таким образом, практически любая молекула может являться мишенью и/или может быть включена в антитело и/или содержащий Fc слитый белок, который содержит Fc-вариант, представленный в настоящем описании, включая, но, не ограничиваясь только ими, следующие белки, а также субъединицы, домены, мотивы и эпитопы, принадлежащие следующим перечисленным белкам: ренин; гормон роста, включая человеческий гормон роста и бычий гормон роста; рилизинг-фактор гормона роста; паратиреоидный гормон; тиреотропный гормон; липопротеины; альфа-1-антитрипсин; А-цепь инсулина; В-цепь инсулина; проинсулин, фолликулостимулирующий гормон; кальцитонин; лютеинизирующий гормон; глюкагон; факторы свертывания, такие как фактор VII, фактор VIIIC, фактор IX, тканевый фактор (TF) и фактор Виллебранда; препятствующие свертыванию крови факторы, такие как белок С; предсердный натрийуретический фактор; легочный сурфактант; активатор плазминогена, такой как урокиназа или человеческий мочевой или тканевой активатор пламиногена (t-PA); бомбесин; тромбин; гемопоэтический ростовой фактор; фактор-альфа и -бета некроза опухоли; энкефалиназа; RANTES (регулятор активации нормальной Т-клеточной экспрессии и секреции); человеческий воспалительный белок макрофагов (MIP-1-альфа); сывороточный альбумин, такой как человеческий сывороточный альбумин; ингибирующая субстанция Мюллериана; А-цепь релаксина; В-цепь релаксина; прорелаксин; мышиный гонадотропин-ассоциированный пептид; микробный белок, такой как бета-лактамаза; ДНКаза; IgE; антиген, ассоциированный с цитотоксическими Т-лимфоцитами (CTLA), такой как CTLA-4; ингибин; активин; сосудистый эндотелиальный фактор роста (VEGF); рецепторы для гормонов или факторов роста, такие, например, как EGFR, VEGFR; интерфероны, такие как альфа-интерферон (α-IFN), бета-интерферон (β-IFN) и гамма-интерферон (γ-IFN); компоненты рецепторов интерферона, такие как рецептор 1 интерферона; белок А или D; ревматоидный факторы; нейротрофический фактор, такой как нейротрофический фактор головного мозга (BDNF), нейротрофин-3, -4, -5 или -6 (NT-3, NT-4, NT-5 или NT-6), или фактор роста нерва; тромбоцитарный фактор роста (PDGF); фактор роста фибробластов, такой как αFGF и βFGF; эпидермальный фактор роста (EGF); трансформирующий фактор роста (TGF), такой как TGF-альфа и TGF-бета, включая TGF-1, TGF-2, TGF-3, TGF-4 или TGF-5; инсулиноподобный ростовой фактор-1 и -II (IGF-I и IGF-II); дез(1-3)-IGF-I (IGF-I головного мозга, белки, связывающиеся с инсулиноподобным ростовым фактором; CD-белки, такие как CD2, CD3, CD4, CD 8, CD11a, CD14, CD18, CD19, CD20, CD22, CD23, CD25, CD33, CD34, CD40, CD40L, CD52, CD63, CD64, CD80 и CD147; эритропоэтин; остеоиндуктивные факторы; иммунотоксины; белок, участвующий в остеогенезе (BMP); интерферон, такой как интерферон-альфа, -бета и -гамма; колониестимулирующие факторы (CSF), такие как M-CSF, GM-CSF и G-CSF; интерлейкины (IL), например, IL-1-IL-13; TNFα, HMGB1; HMGB2; супероксиддисмутаза; Т-клеточные рецепторы; поверхностные мембранные белки; усиливающий расщепление фактор; вирусный антиген, такой, например, как часть оболочки вируса СПИДа, например gp120; транспортные белки; хоминг-рецепторы; аддрессины; регуляторные белки; молекулы клеточной адгезии, такие как LFA-1, Mac 1, р150.95, VLA-4, ICAM-1, ICAM-3 и VCAM, а4/р7-интегрин и (включая Xv/р3-интегрин или любые их субъединицы, субъединицы интегрина-альфа, такие как CD49a, CD49b, CD49c, CD49d, CD49e, CD49f, альфа7, альфа8, альфа9, альфаD, CD11a, CD11b, CD51, CD11e, CD41, альфа11b, альфаIELb; бета-субъединицы интегрина, такие как CD29, CD18, CD61, CD104, бета5, бета6, бета7 и бета8; комбинации субъединиц интегрина, включая, но не ограничиваясь только ими, αVβ3, αVβ5 и α4β7; фактор, участвующий в пути апоптоза; IgE; антигены группы крови; flk2/flt3-рецептор; рецептор ожирения (OB); mpl-рецептор; CTLA-4; белок С; хитиназа или хитиназоподобная молекула, такая как YKL-40 и АМСаза (кислая хитиназа млекопитающих); Eph-рецептор, такой как EphA2, EphA4, EphB2 и т.д.; человеческий антиген главного комплекса гистосовместимости (HLA), такой как HLA-DR; белки комплемента, такие как рецептор комплемента CR1, C1Rq и другие факторы комплемента, такие как С3, и С5; гликопротеиновый рецептор, такой как GpIbα, GPIIb/IIIa и CD200; костимулирующие молекулы, такие как CD28/CTLA-4, ICOS/AILIM, PD-1.
Другие молекулы, которые могут содержать вариант Fc-фрагмента, представленный в настоящем описании, включают молекулы, которые специфически связываются с раковыми антигенами, включают, но не ограничиваясь только ими, ALK-рецептор (рецептор плейотрофина), плейотрофин, карциномный пан-антиген KS 1/4; антиген карциномы яичника (СА125); простатический кислый фосфат; простатический антиген; ассоциированный с меланомой антиген р97; меланомный антиген gp75; высокомолекулярный меланомный антиген (HMW-MAA); простатический мембранный антиген; карциноэмбриональный антиген (СЕА); полиморфный эпителиальный муциновый антиген; человеческий антиген капелек молочного жира; ассоциированные с колоректальной опухолью антигены, такие как: СЕА, TAG-72, СО 17-1 A, GICA 19-9, СТА-1 и LEA; антиген-38.13 лимфомы Беркитта; CD19; антиген CD20 человеческой В-лимфомы; CD33; специфические для меланомы антигены, такие как ганглиозид GD2, ганглиозид GD3, ганглиозид GM2 и ганглиозид GM3; опухолеспецифический трансплантационный находящийся на клеточной поверхности антиген (TSTA); антигены индуцируемой вирусом опухоли, включая Т-антиген опухоли, индуцируемой ДНКовым вирусом, и оболочечные антигены опухолей, индуцируемых РНКовым вирусом; онкофетальный антиген (альфа-фетопротеин), такой как СЕА ободочной кишки, онкофетальный трофобластный гликопротеин 5Т4 и онкофетальный антиген опухоли мочевого пузыря; дифференцировочный антиген, такой как антиген L6, L20 человеческой карциномы легкого; антигены фибросаркомы; антиген-Gp37 человеческого Т-клеточного лейкоза; неогликопротеин; сфинголипиды; антиген рака молочной железы, такой как EGFR (рецептор эпидермального фактора роста) и антиген HER2 (p185HER2); полиморфный эпителиальный муцин (РЕМ); антиген-АРО-1 злокачественных человеческих лимфоцитов; дифференцировочный антиген, такой как I-антиген, обнаруженный в фетальных эритроцитах; 1-антиген первичной эндодермы, обнаруженный в эритроцитах взрослых; зародышах до имплантации; I(Ма), обнаруженный при желудочных аденокарциномах; M18, М39, обнаруженный в эпителии молочной железы; SSEA-1, обнаруженный в миелоидных клетках; VEP8, VEP9, My1, VIM-D5, D 156-22, обнаруженные при колоректальном раке; TRA-1-85 (группа крови Н); SCP-1, обнаруженный при раке яичек и яичника; С14, обнаруженный при аденокарциноме ободочной кишки; F3, обнаруженный при легочной аденокарциноме; АН6, обнаруженный при раке желудка; Y-гаптен; Ley, обнаруженный в клетках эмбриональной карциномы; TL5 (группа крови А); EGF-рецептор, обнаруженный в А431-клетках, серии Е1 (группа крови В), обнаруженные при раке поджелудочной железы; FC10.2, обнаруженный в клетках эмбриональной карциномы; антиген желудочной аденокарциномы СО-514 (группа крови Lea), обнаруженный при аденокарциноме; NS-10, обнаруженный аденокарциномах; СО-43 (группа крови Leb); G49, обнаруженный в EGF-рецепторе А431-клеток; МН2 (группа крови ALeb/Ley), обнаруженный при аденокарциноме ободочной кишки; 19.9, обнаруженный при раке ободочной кишки; муцины рака желудка; Т5А7, обнаруженный в миелоидных клетках; R24, обнаруженный при меланоме; 4.2, GD3, D1.1, OFA-1, GM2, OFA-2, GD2 и М1:22:25:8, обнаруженные в клетках эмбриональной карциномы; и SSEA-3 и SSEA-4, обнаруженные в зародышах на стадии 4-8-клеток; антиген кожной Т-клеточной лимфомы; антиген MART-1; антиген Sialy Tn (STn); антиген рака ободочной кишки NY-CO-45; антиген рака легкого NY-LU-12, вариант А; антиген аденокарциномы ART1; паранеопластический ассоциированный с раком головного мозга-яичек антиген (онконейральный антиген МА2; паранеопластический нейронный антиген); нейроонкологический вентральный антиген 2 (NOVA2); антигены гена 520 печеночно-клеточной карциномы; ассоциированный с опухолью антиген СО-029; ассоциированные с опухолью антигены MAGE-C1 (антиген рака/яичек СТ7), MAGE-B1 (антиген MAGE-XPn), MAGE-B2 (DAM6), MAGE-2, MAGE-4a, MAGE-4b и MAGE-X2; антиген рака яичек (NY-EOS-1); YKL-40 и фрагменты любых вышеперечисленных полипептидов.
5.14 Гликозилирование антител
Согласно еще одному варианту осуществления изобретения модифицируют гликозилирование антител, применяемых согласно изобретению. Например, можно создавать агликозилированное антитело (т.е. антитело, в котором отсутствует гликозилирование). Гликозилирование можно изменять, например, для повышения аффинности антитела к антигену-мишени. Указанные углеводные модификации можно осуществлять, например, путем изменения одного или нескольких сайтов гликозилирования в последовательности антитела. Например, можно осуществлять одну или несколько аминокислотных замен, что приводит к элиминации сайтов гликозилирования в одном или нескольких каркасных участках вариабельной области, в результате чего устраняется гликозилирование в этом сайте. Такое агликозилирование может повышать аффинность антитела к антигену. Указанный подход описан более подробно в US 5714350 и 6350861. Можно осуществлять также одну или несколько аминокислотных замен, что приводит к элиминации сайта гликозилирования, присутствующего в Fc-фрагменте (например, аспарагин 297 IgG). Кроме того, агликозилированные антитела можно получать в бактериальных клетках, в которых отсутствует необходимый механизм гликозилирования.
Антитело можно создавать также таким образом, чтобы оно имело измененный тип гликозилирования, например, гипофукозилированное антитело, которое имеет пониженное количество фукозильных остатков, или антитело, имеющее повышенное содержание бисекционных GlcNAc-структур. Известно, что такие измененные схемы гликозилирования повышают ADCC-активность антител. Указанные углеводные модификации можно осуществлять, например, путем экспрессии антитела в клетке-хозяине с измененным механизмом гликозилирования. Клетки с измененным механизмом гликозилирования описаны в данной области и их можно применять для экспрессии клеток-хозяев, в которых экеспрессируют рекомбинантные антитела, предлагаемые в изобретении, получая тем самым антитело с измененным гликозилированием (см., например. Shields R.L. и др., J. Biol. Chem. 277, 2002, cc.926733-26740; Umana и др., Nat. Biotech. 17, 1999, cc.176-171, а также US US 6946292; европейский патент ЕР 1176195; публикации РСТ WO 03/035835; WO 99/54342, содержание которых полностью включено в настоящее описание в качестве ссылки).
5.15. Создание эффекторных функций
Может оказаться желательным модифицировать антитело к CD19, предлагаемое в изобретении, в отношении эффекторной функции, для повышения эффективности антитела в отношении лечения, например, В-клеточных злокачественных состояний. Например, цистеиновый(ые) остаток(и) можно интродуцировать в Fc-фрагмент, что способствует образованию дисульфидных мостиков между цепями в этой области. Полученное таким образом гомодимерное антитело может обладать повышенной способностью к интернализации и/или комплементопосредуемой клеточной цитотоксичности и/или антитело-обусловленной клеточнозависимой цитотоксичности (ADCC) (см. Caron и др., J.. Exp Med., 176, 1992, cc.1191-1195 и Shopes В., J. ImmunoL, 148, 1992, cc.2918-2922). Гомодимерные антитела с повышенной противоопухолевой активностью можно получать также с помощью гетеробифункциональных перекрестносшивающих агентов, описанных у Wolff и др., Cancer Research, 53, 1993, cc.2560-2565. Можно создавать также антитело, имеющее двойные Fc-фрагменты, и тем самым можно повышать связанный с комплементом лизис и ADCC-активность (см., Stevenson и др., Anti-Cancer Drug Design, 3, 1989, cc.219-230).
Другие методы создания Fc-фрагментов антител с целью изменения эффекторных функций известны в данной области (см., например, публикацию US 2004/0185045 и публикацию РСТ Р WO 2004/016750, обе на имя Koenig и др., в которых описано изменение Fc-фрагмента с целью повышения аффинности к связыванию с FcγRIIB по сравнению с аффинностью к связыванию с FCyRIIA; см. также публикации РСТ WO 99/58572 на имя Armour и др., WO 99/51642 на имя Idusogie и др. и US 6395272 на имя Deo и др.; содержание которых полностью включено в настоящее описание в качестве ссылки). Методы модификации Fc-фрагмента с целью снижения аффинности к связыванию с FcγRIIB также известны в данной области (см., например, публикацию US 20010036459 и публикацию РСТ WO 01/79299, обе на имя Ravetch и др., содержание которых полностью включено в настоящее описание в качестве ссылки). Описаны также модифицированные антитела, имеющие варианты Fc-фрагментов с повышенной аффинностью к связыванию с FcγRIIIA и/или FcγRIIA по сравнению Fc-фрагментом дикого типа (см., например, публикацию РСТ WO 2004/063351 на имя Stavenhagen и др., содержание которой полностью включено в настоящее описание в качестве ссылки).
В данной области известны анализы in vitro, которые можно применять для решения вопроса о том, обладают ли способностью представленные в настоящем описании антитела к CD19, применяемые в композициях и способах, предлагаемых в изобретении, опосредовать ADCC.
5.16. Получение/приготовления антител к CD19
После конструирования требуемого антитела к CD19 антитело к CD19 можно получать в имеющем коммерческое значение масштабе с помощью методов, хорошо известных в данной области для полупромышленного производства антител. Например, для этой цели можно применять рекомбинантные экспрессионные системы, например, но не ограничиваясь только ими, описанные ниже.
5.17. Системы для рекомбинантной экспрессии
Для рекомбинантной экспрессии антитела или его варианта, как правило, требуется конструировать экспрессионный вектор, содержащий полинуклеотид, который кодирует антитело. После получения полинуклеотида, кодирующего молекулу антитела или тяжелую, или легкую цепь антитела, или его фрагмент, вектор для производства молекулы антитела можно создавать методом рекомбинантной ДНК, хорошо известным в данной области (см., например, US 6331415, содержание которого полностью включено в настоящее описание в качестве ссылки). Так, методы получения белка путем экспрессии полинуклеотида, который содержит нуклеотидную последовательность, кодирующую антитело, представлены в настоящем описании. Методы, хорошо известные специалистам в данной области, можно применять для конструирования экспрессионных векторов, содержащих кодирующие последовательности антитела и соответствующие сигналы контроля транскрипции и трансляции. Эти методы включают, например, методики in vitro рекомбинантной ДНК, методики синтеза генетической рекомбинации in vivo. Таким образом, изобретение относится к реплицируемым векторам, которые содержат нуклеотидную последовательность, кодирующую молекулу антитела, тяжелую или легкую цепь антитела, вариабельную область тяжелой или легкой цепи антитела или ее часть или CDR тяжелой или легкой цепи, функционально связанную с промотором. Указанные векторы могут включать нуклеотидную последовательность, кодирующую константную область молекулы антитела (см., например, публикации международных заявок WO 86/05807 и WO 89/01036; и US 5122464) и вариабельную область антитела, которые можно клонировать в указанном векторе для экспрессии полной тяжелой, полной легкой цепи или и полной тяжелой и полной легкой цепей.
В другом варианте осуществления изобретения антитела к CD19 можно создавать с использованием целенаправленной гомологичной рекомбинации с получением всего антитела к CD19 или его частей (см. US 6063630, 6187305 и 6692737). В определенных вариантах осуществления изобретения антитела к CD19 можно создавать с помощью методов случайной рекомбинации с получением всего антитела к CD19 или его частей (см. US 6361972, 6524818, 6541221 и 6623958). Антитела к CD19 можно создавать также в клетках, экспрессирующих антитело из геномной последовательности клетки, содержащей модифицированный локус иммуноглобулина, с помощью опосредованной Сrе сайтспецифической гомологичной рекомбинации (см. US 6091001).
Линия клеток-хозяев может иметь человеческое происхождение или ее можно выводить из видов, кроме человека, включая, но не ограничиваясь только ими, мышь и китайского хомячка. Если требуется получить человеческое или гуманизированное антитело, линия клеток-хозяев должна представлять собой человеческую линию клеток. Эти методы предпочтительно применяют для создания стабильный линий клеток, которые перманентно экспрессируют молекулу антитела.
После того как экспрессионный вектор переносят в клетку-хозяина общепринятыми методами, трансфектированные клетки культивируют традиционными методами с получением антитела. Таким образом, изобретение относится к клеткам-хозяевам, содержащим полинуклеотид, который кодирует антитело, предлагаемое в изобретении, или его фрагмент, или его тяжелую или легкую цепь, или часть их, или одноцепочечное антитело, предлагаемое в изобретении, функционально слитое с гетерологичным промотором. В определенных вариантах осуществления изобретения для экспрессии двухцепочечных антител векторы, которые кодируют и тяжелую и легкую цепи, можно совместно экспрессировать в клетке-хозяине для экспрессии полной молекулы иммуноглобулина, что более подробно будет описано ниже.
Различные векторные системы для экспрессии в хозяине можно применять для экспрессии антитело к CD19 или его фрагменты, которые можно применять для конструирования и создания антител к CD19 (см., например, US 5807715). Например, клетки млекопитающих, такие как клетки яичника китайского хомячка (СНО), в сочетании с вектором, таким как вектор, имеющий в качестве основного промежуточного звена промоторный элемент раннего гена человеческого цитомегаловируса, представляет собой эффективную систему для экспрессии антител (Foecking и др., Gene, 45, 1986, с.101; и Cockett и др., Bio/Technology, 8, 1990, с.2). Кроме того, можно выбирать линию клеток-хозяев, которые модулируют экспрессию встроенных последовательностей антител или модифицируют и процессируют продукт гена антитела специфическим требуемым образом. Такие модификации (например, гликозилирование) и процессинг (например, расщепление) белковых продуктов могут быть важными для функции белка. Различные клетки-хозяева имеют характерные и специфические механизмы посттрансляционного процессинга и модификации белков и генных продуктов. Можно выбирать соответствующие линии клеток или системы хозяев для гарантии правильной модификации и процессинга экспрессируемого антитела или его фрагмента. Для этой цели можно применять эукариотические клетки-хозяева, которые имеют клеточный механизм для соответствующего процессинга первичного транскрипта, гликозилирования и фосфорилирования генного продукта. Такие клетки млекопитающих-хозяева представляют собой, но не ограничиваясь только ими, клетки СНО, VERY, ВНК, Hela, COS, MDCK, 293, 3T3, W138, ВТ483, Hs578T, HTB2, BT20 и T47D, NSO (линия клеток мышиной миеломы, которая не обладает способностью продуцировать эндогенно какую-либо функциональную цепь иммуноглобулинов), CRL7030 и HsS78Bst.
В одном из вариантов осуществления изобретения человеческие линии клеток, созданные путем иммортализации человеческих лимфоцитов, можно применять для рекомбинантного получения моноклональных человеческих антител к CD19. В одном из вариантов осуществления изобретения человеческую линию клеток PER.С6. (фирма Crucell, Нидерланды) можно применять для рекомбинантного получения моноклональных человеческих антител к CD19.
В бактериальных системах многочисленные экспрессионные векторы целесообразно выбирать в зависимости от предполагаемого применения молекулы антитела, подлежащей экспрессии. Например, когда требуется получать большое количество такого антитела, предназначенного для создания фармацевтических композиций, содержащих антитело к CD19, могут оказаться предпочтительными векторы, в которых происходит непосредственная экспрессия высокий уровней слитых белковых продуктов, которые легко очищать. Такие векторы представляют собой, но не ограничиваясь только ими, экспрессионный вектор Е. coli pUR278 (Ruther и др., ЕМВО, 12, 1983, с.1791), в котором кодирующую последовательность антитела можно лигировать индивидуально в векторе в рамке считывания с кодирующей областью lac Z, в результате чего получают слитый белок; векторы pIN (Inouye и Inouye, Nucleic Acids Res. 13, 1985, cc.3101-3109; Van Heeke и Schuster, J. Biol. Chem., 24, 1989, cc.5503-5509); и т.п. Можно применять также векторы pGEX для экспрессии чужеродных полипептидов в виде слитых белков с глутатион-3-трансферазой (GST). В целом, такие слитые белки являются растворимыми и их легко очищать из лизированных клеток путем адсорбции и связывания с глутатион-агарозной аффинной матрицей с последующей элюцией в присутствии свободного глутатиона. Векторы pGEX v создают для интродукции сайтов протеазного расщепления атромбина и/или фактор Ха в экспрессируемый полипептид так, чтобы клонируемый продукт гена-мишени можно было легко высвобождать из GST-фрагмента.
В системе на основе клеток насекомых вирус ядерного полиэдроза Autographa calif ornica (AcNPV) применяют для экспрессии чужеродных генов. Вирус выращивают в клетках Spodopterafrugiperda. Кодирующую последовательность антитела можно клонировать индивидуально в неимеющих решающее значение областях (например, гена полиэдроза) вируса и помещать под контроль AcNPV-промотора (например, промотора полиэдроза).
В клетках млекопитающих-хозяевах можно применять различные экспрессионные системы. Когда аденовирус применяют в качестве экспрессионного вектора представляющую интерес кодирующую последовательность антитела можно встраивать путем лигирования в контролирующий комплекс транскрипции/трансляции аденовируса, например, поздний промотор и состоящую из трех частей лидерную последовательность. Этот химерный ген затем можно встраивать в аденовирусный геном путем in vitro или in vivo рекомбинации. Встраивание в неимеющую решающего значения область вирусного генома (например, область Е1 или ЕЗ) может приводить к получению рекомбинантного вируса, который является жизнеспособным и обладает способностью экспрессировать молекулу антитела в зараженных хозяевах (см., например, Logan и Shenk, Proc. Natl. Acad. Sci. USA, 81, 1984, cc.355-359). Могут также требоваться специфические сайты инициации для эффективной трансляции встроенных кодирующих последовательностей антител. Эти сигналы включают инициирующий кодон ATG и смежные последовательности. Кроме того, инициирующий кодон, как правило, должен находиться в одной рамке считывания с требуемой кодирующей последовательностью для гарантии трансляции всей вставки. Эти экзогенные трансляционные контролирующие сигналы и инициирующие кодоны могут иметь различное происхождение, они могут представлять собой как встречающиеся в естественных условиях, так и синтетические элементы. Эффективность экспрессии можно повышать путем включения соответствующих элементов-энхансеров транскрипции, терминаторов транскрипции и т.д. (см., например, Bittner и др., Methods in Enzymol., 153, 1987, cc.51-544).
Стабильную экспрессию можно применять для долговременного производства с высоким выходом рекомбинантных белков, Например, можно создавать клеточные линии, стабильно экспрессирующие молекулу антитела. Клетки-хозяева можно трансформировать соответствующим сконструированным вектором, содержащим контролирующие экспрессию элементы (например, промотор, энхансер, терминаторы транскрипции, сайты полиаденилирования и т.д.) и селектируемый маркерный ген. После интродукции чужеродной ДНК клеткам можно давать расти в течение 1-2 дней в обогащенных средах, а затем пересевать в селективные среды. Селектируемый маркер в рекомбинантной плазмиде придает устойчивость к фактору селекции и позволяет клеткам, в хромосомы которых стабильно интегрирована плазмида, расти и образовывать очаги, которые, в свою очередь, можно клонировать и размножать с получением клеточных линий. Плазмиды, которые кодируют антитело к CD19, можно применять для интродукции гена/кДНК в любую клеточную линию, пригодную для производства в культуре.
Можно применять многочисленные системы селекции, включая, но не ограничиваясь только ими, гены тимидинкиназы вируса герпеса простого (Wigler и др., Cell, 11, 1977, с.223), гипоксантингуанинфосфорибозилтрансферазы (Szybalska и Szybalski, Proc. Natl. Acad. Sci. USA, 48, 1992, с.202) и аденинфосфорибозилтрансферазы (Lowy и др., Cell, 22, 1980, с.с.8-17), которые можно применять в клетках tk-, hgprt- или aprT- соответственно. Кроме того, устойчивость к антиметаболитам можно применять в качестве основы для селекции с использованием следующих генов: dhfr, который придает устойчивость к метотрексату (Wigler и др., Natl. Acad. Sci. USA, 77, 1980, с.357; O'Hare и др., Proc. Natl. Acad. Sci. USA, 78, 1981, с.1527); gpt, который придает устойчивость к микофеноловой кислоте (Mulligan и Berg, Proc. Natl. Acad. Sci. USA, 78, 1981, с.2072); neo, который придает устойчивость к аминогликозиду G-418 (Wu и Wu, Biotherapy 3, 1991, cc.87-95; Tolstoshev, Ann. Rev. Pharmacol. Toxicol. 32, 1993, cc.573-596; Mulligan, Science 260, 1993, cc.926-932; и Morgan и Anderson, Ann. Rev. Biochem. 62, 1993, cc.191-217; May, TIB TECH 11(5), 1993, cc.155-215); и hygro, который придает устойчивость к гигромицину (Santerre и др., Gene, 30, 1984, с.147). Методы рекомбинантной ДНК, хорошо известные в данной области, можно, как правило, применять для селекции требуемого рекомбинантного клона, и эти методы, описаны, например, в: Current Protocols in Molecular Biology, под ред. Ausubel и др., изд-во John Wiley & Sons, NY, 1993; Kriegler, Gene Transfer and Expression, A Laboratory Manual, изд-во Stockton Press, NY, 1990; и в главах 12 и 13, Current Protocols in Human Genetics, под ред. Dracopoli и др., изд-во John Wiley & Sons, NY, 1994; Colberre-Garapin и др., J. Mol. Biol., 150, 1981, c.1, содержание которых полностью включено в настоящее описание в качестве ссылки.
Уровни экспрессии молекулы антитела можно повышать путем амплификации вектора (см. обзор у Bebbington и Hentschel, The use of vectors based on gene amplification for the expression cloned genes in mammalian cells in DNA cloning, т.3. изд-во Academic Press, New York, 1987). Когда маркер в векторной системе, экспрессирующей антитело, является амплифицируемым, то повышение уровня ингибитора, присутствующего в культуре клетки-хозяина, должно приводить к повышению количества копий маркерного гена. Поскольку амплифицируемая область ассоциирована с геном антитела, производство антитела также должно возрастать (Crouse и др., Mol. Cell. Biol., 3, 1983, с.257). Уровни экспрессии антитела можно амплифицировать путем применения методов и инструментов для рекомбинации, известных специалистам в области получения рекомбинантных белков, включая методы, заключающиеся в том, что ремоделируют окружающий хроматин и повышают экспрессию трансгена в форме активного искусственного транскрипционного домена.
Клетки-хозяева можно подвергать котрансфекции двумя экспрессионными векторами, где первый вектор кодирует полипептид тяжелой цепи, а второй вектор кодирует полипептид легкой цепи. Два вектора могут содержать идентичные или различные селектируемые маркеры. Можно применять также один вектор, который кодирует и обладает способностью экспрессировать полипептиды и тяжелой, и легкой цепей. В таких случаях легкую цепь следует помещать в 5'-направлении относительно тяжелой цепи, для того, чтобы избежать токсического воздействия избыточного количества свободной тяжелой цепи (Proudfbot, Nature 322, 1986, cc.562-565; и Kohler, Proc. Natl. Acad. Sci. USA, 77, 1980, с.2197). Кодирующие последовательности тяжелой и легкой цепей могут содержать кДНК или геномную ДНК.
Полученную с помощью рекомбинантной экспрессии молекулу антитела можно очищать любым методом, известным в данной области, который предназначен для очистки молекулы иммуноглобулина, например, с помощью хроматографии (например, ионообменной, аффинной, прежде всего на основе аффинности к специфическим антигенам протеина А или протеина G, и колоночной гель-фильтрации), центрифугирования, на основе различной растворимости или с помощью любого другого стандартного метода очистки белков. Кроме того, антитела, предлагаемые в настоящем изобретении, или их фрагменты можно сливать с гетрологичными полипептидными последовательностями, представленными в настоящем описании, или другими, известными в данной области, которые облегчают очистку.
5.17.1 Очистка и выделение антител
При использовании методов рекомбинантной ДНК антитело можно получать внутри клетки, в периплазматическом пространстве или в виде непосредственного секретируемого в среду антитела. Если антитело получают внутри клетки, то в качестве первой стадии удаляют состоящий из частиц дебрис либо клеток хозяев, либо лизированных фрагментов, например, центрифугированием или ультрафильтрацией. Carter и др., Bio/Technology, 10, 1992, cc.163-167 (1992) описали процедуру выделения антител, которые секретируются в периплазматическое пространство Е. coll. В целом, метод состоит в следующем: клеточную пасту подвергают оттаиванию в присутствии ацетата натрия (рН 3,5), ЭДТК и фенилметилсульфонилфторида (ФМСФ) в течение примерно 30 мин. Клеточный дебрис можно удалять центрифугированием. Когда мутантное антитело секретируется в среду, то супернатанты таких экспрессионных систем, как правило, сначала концентрируют с помощью поступающего в продажу фильтра для концентрирования белков, например, устройство для ультрафильтрации типа Amicon или Millipore Pellicon. Протеазный ингибитор, такой как ФМСФ, можно включать в любую из вышеизложенных стадий для ингибирования протеолиза, а антибиотики можно включать для предупреждения роста случайных загрязнителей.
Композицию антитела, полученную из клеток, можно очищать, например, с помощью гидроксилапатитной хроматографии, хроматографии, основанной на гидрофобных взаимодействиях, ионообменной хроматографии, гель-электрофореза, диализа, и/или аффинной хроматографии, используя их индивидуально или в сочетании с другими стадиями очистки. Пригодность протеина А в качестве аффинного лиганда зависит от видов и изотипов любого Fc-фрагмента иммуноглобулина, который присутствует в мутантном антителе. Протеин А можно применять для очистки антител, основой которых являются человеческие тяжелые γ1-; γ2- или γ4-цепи (Lindmark и др., J. Immunol. Methods, 62, 1983, cc.1-13). Протеин G рекомендован для всех мышиных изотипов и для человеческого γ3 (Guss и др., ЕМВО J., 5, 1986, cc.1567-1575). Матрица, к которой присоединен аффинный лиганд, чаще всего представляет собой агарозу, но можно применять другие матрицы. Механически стабильные матрицы, такие как стекло, с контролируемым размером пор или поли(стиролдивинил)бензольные, обеспечивают более высокие скорости потока и укорачивают время обработки по сравнению с агарозой. Если антитело содержит СН3-домен, то для очистки можно применять смолу типа Bakerbond АВХ (фирма J.T. Baker, Филлипсбург, шт.Нью-Джерси). Другие методы очистки белков, такие как фракционирование на ионообменной колонке, осаждение этанолом, ЖХВР с обращенной фазой, хроматография на силикагеле, хроматография на гепарине, сефарозная хроматография на анионо- или катионообменной смоле (такой как полиаспарагиновая кислота в качестве сорбента колонки), хроматофокусирование, ДСН-ПААГ и осаждение сульфатом аммония, также можно применять в зависимости от антитела, подлежащего выделению.
После любой(ых) предварительной(ых) стадии(й) очистки смесь, содержащую представляющее интерес антитело и загрязнители, можно подвергать основанной на гидрофобных взаимодействиях хроматографии при низких значениях рН, используя буфер для элюции при значениях рН, составляющих примерно 2,5-4,5, и используя низкие концентрации солей (например, применяя примерно 0-0,25 М соль).
5.18. Терапевтические антитела к CD19
Антитело к CD19, применяемое в композициях и способах, предлагаемых в изобретении, может представлять собой человеческое антитело или гуманизированное антитело, которое опосредует апоптоз В-клеточных линий и/или ADCC у человека, или их можно выбирать из известных антител к CD19, которые опосредуют апоптоз В-клеточных линий и/или ADCC у человека. В определенных вариантах осуществления изобретения антитела к CD19 могут представлять собой химерные антитела. В конкретных вариантах осуществления изобретения антитело к CD19 может представлять собой моноклональное, человеческое, гуманизированное или химерное антитело к CD19. Антитело к CD19, применяемое в композициях и способах, предлагаемых в изобретении, может представлять собой человеческое антитело или гуманизированное антитело человеческого изотипа IgG1 или IgG3 или любой аллель IgG1 или IgG3, присутствующий в человеческой популяции. В других вариантах осуществления изобретения антитело к CD19, применяемое в композициях и способах, предлагаемых в изобретении, может представлять собой человеческое антитело или гуманизированное антитело человеческого изотипа IgG2 или IgG4 или любой аллель IgG2 или IgG4, присутствующий в человеческой популяции.
Поскольку такие антитела можно создавать с помощью описанных выше методов, в других вариантах осуществления изобретения мышиные антитела НВ12А и НВ12В, представленные в настоящем описании, или другие поступающие в продажу антитела к CD19 можно химеризовать, гуманизировать или превращать в человеческие антитела.
Например, известные антитела к CD19, которые можно применять, представляют собой, но не ограничиваясь только ими, HD37 (IgG1, каппа) (фирма DAKO North America, Inc, Карпинтерия, шт.Калифорния), BU12 (Callard и др., J. Immunology, 148(10), 1992, cc.2983-2987), 4G7 (IgG1) (Meeker и др., Hybridoma, 3(4), зима 1984 г., cc.305-320), J4.119 (фирма Beckman Coulter, Крефельд, Германия), В43 (фирма PharMingen, Сан-Диего, шт.Калифорния), SJ25C1 (фирма BD PharMingen, Сан-Диего, шт.Калифорния), FMC63 (IgG2a) (Zola и др., Immunol. Cell. Biol., 69(РТ6), 1991, cc.411-422); Nicholson и др., Mol. Immunol., 34, 1997, cc.1157-1165; Pietersz и др., Cancer Immunol.Immunotherapy, 41, 1995, cc.53-60 (1995)), 89B(B4) (IgG1) (фирма Beckman Coulter, Майами, шт.Флорида; Nadler и др., J. Immunol., 131, 1983, cc.244-250)), и/или HD237 (IgG2b) (4-ая международная рабочая группа по дифференцировочным антигенам человеческих лейкоцитов (International Workshop on Human Leukocyte Differentiation Antigens), Вена, Австрия, 1989; и Pezzutto и др., J. Immunol., 138(9), 1987, cc.2793-2799).
В определенных вариантах осуществления изобретения антитело представляет собой вариант с переключенным изотипом известного антитела (например, на человеческий изотип IgG1 или IgG3), в частности описанное выше.
Антитела к CD19, применяемые в композициях и способах, предлагаемых в изобретении, могут представлять собой оголенные антитела, иммуноконъюгаты или слитые белки. Антитела к CD19, описанные выше, предназначенные для применения в композициях и способах, предлагаемых в изобретении, могут обладать способностью снижать уровни или истощать В-клетки и находящиеся в кровотоке иммуноглобулины у обработанного антителами человека. Истощение В-клеток может затрагивать находящиеся в кровотоке В-клетки или В-клетки в конкретных тканях, таких как, но, не ограничиваясь только ими, костный мозг, селезенка, ассоциированные с кишкой лимфоидные ткани и/или лимфатические узлы. Указанное истощение можно достигать различными механизмами, такими как антитело-обусловленная клеточно-зависимая цитотоксичность (ADCC), и/или блокада взаимодействия CD19 с соответствующим ему лигандом, и/или комплементзависимая цитотоксичность (CDC), ингибирование В-клеточной пролиферации и/или индукция гибели В-клеток (например, посредством апоптоза). Под «истощением» В-клеток понимают снижение уровня находящихся в кровотоке В-клеток и/или В-клеток в конкретной(ых) ткани(ях) по меньшей мере примерно на 25%, 40%, 50%, 65%, 75%, 80%, 85%, 90%, 95% или более. В конкретных вариантах осуществления изобретения практически все обнаруживаемые В-клетки исчезают из кровотока и/или конкретной(ых) ткани(ей). Под «истощением» находящегося в кровотоке иммуноглобулина (Ig) понимают снижение по меньшей мере примерно на 25%, 40%, 50%, 65%, 75%, 80%, 85%, 90%, 95% или более. В конкретных вариантах осуществления изобретения практически весь обнаруживаемый Ig исчезает из кровотока.
5.18.1. Скрининг антител в отношении связывания с человеческим CD19
Анализы связывания можно применять для идентификации антител, которые связываются с человеческим антигеном CD19. Анализы связывания можно осуществлять либо в виде прямых анализов связывания, либо анализов конкурентного связывания. Связывание можно выявлять с помощью стандартного ELISA или стандартного анализа с использованием проточной цитометрии. При прямых анализах связывания антитело-кандидат оценивают в отношении связывания с человеческим антигеном CD19. В определенных вариантах осуществления изобретения методы скрининга включают на второй стадии определение способности вызывать клеточную гибель или апоптоз В-клеток, экспрессирующих человеческий CD19. Анализы конкурентного связывания, с другой стороны, позволяют оценивать способность антитела-кандидата конкурировать с известным антителом к CD19 или другим соединением, которое связывается с человеческим CD19.
При прямом анализе связывания человеческий антиген CD19 приводят в контакт с антителом-кандидатом в условиях, которые позволяют связываться антителу-кандидату с человеческим антигеном CD19, Связывание может иметь место в растворе или на твердой поверхности. Антитело-кандидат можно предварительно метить с целью выявления. Для мечения можно использовать любое выявляемое соединение, такое как, но, не ограничиваясь только ими, люминесцентный, флуоресцентный или радиоактивный изотоп или группу, содержащую его, неизотопную метку, такую как фермент или краситель. После периода инкубации, достаточного для того, чтобы произошло связывание, реакционную смесь подвергают действию условий или манипуляций, которые приводят к удалению избытка неспецифически связанного антитела. Как правило, это включает отмывку соответствующим буфером. И, наконец, выявляют присутствие комплекса СD19-антитело.
При конкурентном анализе связывания антитело-кандидат оценивают в отношении его способности ингибировать или смещать связывание известного антитела к CD19 (или другого соединения) с человеческим антигеном CD19. Меченый известный обладающий способностью к связыванию с CD19 агент можно смешивать с антителом-кандидатом и помещать в условия, в которых в норме должно происходить взаимодействие между ними, при добавлении антитела-кандидата или без него. Можно сравнивать количество меченого известного обладающего способностью к связыванию с CD19 агента, который связывается человеческим CD19, с количеством, связанным в присутствии и в отсутствии антитела-кандидата.
В одном из вариантов осуществления изобретения анализ связывания осуществляют с использованием одного или нескольких компонентов, иммобилизованных на твердой поверхности, для облегчения формирования и выявления комплекса антитело-антиген. В различных вариантах осуществления изобретения твердая подложка может представлять собой, но не ограничиваясь только ими, поливинилиденфторид, поликарбонат, полистирол, полипропилен, полиэтилен, стекло, нитроцеллюлозу, декстран, найлон, полиакриламид и агарозу. Конфигурация подложки может представлять собой гранулы, мембраны, микрочастицы, внутреннюю поверхность реакционного сосуда, такого как титрационный микропланшет, лабораторная пробирка или другой реакционный сосуд. Иммобилизацию человеческого CD19 или другого компонента можно осуществлять с помощью ковалентных или нековалентных связей. В одном из вариантов осуществления изобретения присоединение может быть опосредованным, например, через присоединенное антитело. В другом варианте осуществления изобретения человеческий антиген CD19 и отрицательные контроли метятся эпитопом, таким как глутатион-В-трансфераза (GST), в результате чего присоединение к твердой поверхности можно опосредовать с помощью поступающего в продажу антитела, такого как анти-GST (фирма Santa Cruz Biotechnology).
Например, указанный анализ аффинности к связыванию можно осуществлять с использованием человеческого антигена CD19, который иммобилизован на твердой подложке. Как правило, неиммобилизованный компонент реакции связывания, в данной случае антитело-кандидат к CD19, метят с целью обнаружения. Известны и можно применять различные методы мечения, такие как люминисцентный, хромофорный, флуоресцентный или радиоактивный изотоп или группа, содержащая его, неизотопная метка, такая как ферменты или красители. В одном из вариант осуществления изобретения антитело- кандидат к CD19 метят с помощью флуорофора, такого как флуоресцеинизотиоцианат (ФИТЦ, фирмы Sigma Chemicals, Сент-Луис). Указанный анализ аффинности к связыванию можно осуществлять с использованием человеческого антигена CD19, иммобилизованного на твердой поверхности. Затем антитела к CD19 инкубируют с антигеном и специфически связывающиеся антитела выявляют методами, известными в данной области, включая, но, не ограничиваясь только ими, BiaCore-анализы, ELISA, FMET и РИА.
И, наконец, метку, оставшуюся на твердой поверхности, можно выявлять любым методом обнаружения, известным в данной области. Например, если антитело-кандидат к CD19 метят флуорофором, то для выявления комплексов можно применять флуориметр.
Человеческий антиген CD19 можно добавлять для анализов связывания в форме интактных клеток, которые экспрессируют человеческий антиген CD19, или выделенных мембран, содержащих человеческий антиген CD19. Таким образом, непосредственное связывание с человеческим антигеном CD19 можно анализировать в интактных клетках в культуре или на созданных на животных моделях в присутствии или в отсутствии антитела-кандидата к CD19. Меченое антитело-кандидат к CD19 можно смешивать с клетками, которые экспрессируют человеческий антиген CD19, или с неочищенными экстрактами, полученными из таких клеток, и можно добавлять антитело-кандидат к CD19. Выделенные мембраны можно применять для идентификации антител-кандидатов с CD19, которые взаимодействуют с человеческим CD19. Например, в типичном эксперименте, осуществляемом с использованием выделенных мембран, клетки можно создавать с помощью генной инженерии для экспрессии человеческого антигена CD19. Мембраны можно собирать стандартными методиками и применять в анализе связывания in vitro. Меченое антитело-кандидат к CD19 (например, флуоресцентно-меченное антитело) связывают с мембранами и оценивают в отношении специфической активности; специфическое связывание определяют путем сравнения с анализами связывания, осуществляемыми в присутствии избытка немеченого («холодного») антитела-кандидата к CD19. Растворимый человеческий антиген CD19 может представлять собой также рекомбинантно экспрессируемый антиген и его можно применять в неклеточных анализах связывания для идентификации антител, которые связываются с человеческим антигеном CD19. Рекомбинантно-экспресируемые человеческие полипептиды CD19 можно применять в неклеточных скрининговых анализах. Пептиды, соответствующие одному или нескольким связывающимся фрагментам человеческого антигена CD19, или слитые белки, содержащие один или несколько связывающихся фрагментов человеческого антигена CD19, можно применять также в неклеточных системах анализа для идентификации антител, которые связываются с фрагментами человеческого антигена CD19. В неклеточных анализах рекомбинантно экспрессируемый человеческий CD19 присоединяют к твердому субстрату, такому как лабораторная пробирка, лунка титрационного микропланшета или колонка, с помощью методов, хорошо известных в данной области (см. Ausubel и др., выше). Затем тестируемые антитела анализируют в отношении их способности связываться с человеческим антигеном CD19.
Реакцию связывания можно осуществлять также в растворе. В этом анализе меченому компоненту дают прийти во взаимодействие с партнером(ами) по связыванию в растворе. Если такое разделение основано на различиях в размерах между меченым компонентом и его партнером(ами) по связыванию, то для достижения разделения можно пропускать продукты реакции связывания через ультрафильтр, через поры которого проходит несвязанный меченый компонент, но не проходит(ят) его партнер(ы) по связыванию или меченый компонент, связанный с его партнером(ами) по связыванию. Для достижения разделения можно применять также любой реагент, обладающий способностью «захватывать» из раствора партнер по связыванию меченого компонента, такой как антитело к партнеру по связыванию и т.д.
В одном из вариантов осуществления изобретения, например, фаговую библиотеку можно подвергать скринингу, пропуская фаг из непрерывной фаговой дисплейной библиотеки через колонку, содержащую очищенный человеческий антиген CD19 или его производное, аналог, фрагмент или домен, связанный с твердой фазой, такой как пластиковые гранулы. Путем изменения силы буфера для отмывки можно обогащать фаг, экспрессирующий пептиды, которые обладают высокой аффинностью к человеческому антигену CD19. Фаг, выделенный из колонки, можно клонировать и аффинность можно оценивать непосредственно. На основе знаний о том, какие антитела и их аминокислотные последовательности характеризуются самой высокой способностью к связыванию с человеческим антигеном CD19, можно применять компьютерные модели для идентификации молекулярных контактов между антигеном CD19 и антителом-кандидатом.
В другом конкретном варианте осуществления изобретения твердая подложка представляет собой мембрану, содержащую человеческий антиген CD19, прикрепленный к титрационному микропланшету. Например, антитела-кандидаты могут связываться с клетками, которые экспрессируют библиотеку антител, культивируемых в условиях, которые позволяют осуществлять экспрессию компонентов библиотеки в титрационном микропланшете. Компоненты библиотеки, которые связываются с человеческим CD19, собирают. Такие методы описаны в целом, например, у Parmley и Smith, Gene, 73, 1988, cc.305-318; Fowlkes и др., BioTechniques, 13, 1992, cc.422-427; публикация РСТ WO 94/18318; и в процитированных в них ссылках. Антитела, для которых установлена их способность связываться с человеческим антигеном CD19, могут представлять собой антитела любых типов или модификаций, описанных выше.
5.18.2. Скрининг антител в отношении эффекторной функции ADCC у человека
Антитела, относящиеся к человеческому IgG-классу, которые обладают функциональными характеристиками, такими как удлиненное время полужизни и сыворотке и способность опосредовать различные эффекторные функции, применяют в некоторых вариантах осуществления изобретения (Monoclonal Antibodies: Principles and Applications, изд-во Wiley-Liss, Inc., глава 1, 1995). Антитела человеческого IgG-класса дополнительно разделяют на 4 следующих подкласса: IgG1, IgG2, IgG3 и IgG4. Большая часть известных к настоящему времени исследований ADCC и CDC в качестве эффекторных функций проведена для антител IgG-класса и установлено, что среди антител человеческого IgG-класса подкласс IgG1 обладает самой высокой ADCC-активностью и CDC-активностью в организме человека (Chemical Immunology, 65, 1997, с.88).
Экспрессия ADCC-активности и CDC-активности человеческими антителами IgG1-подкласса, как правило, включает связывание Fc-фрагмента антитела с рецептором для антитела (обозначен далее в контексте настоящего описания как «FcγR»), присутствующим на поверхности эффекторных клеток, таких как клетки-киллеры, естественные клетки-киллеры или активированные макрофаги. Могут быть связаны различные компоненты комплемента. Касательно связывания можно предположить, что несколько аминокислотных остатков в шарнирной области и втором домене С-области (обозначены далее в контексте настоящего описания как «Сγ2-домен») антитела являются важными (Eur. J. Immunol., 23, 1993, с.1098; Immunology, 86, 1995, с.319; Chemical Immunology, 65, 1997, с.88) и что сахарная цепь в Сγ2-домене (Chemical Immunology, 65, 1997, с.88) также является важной.
Антитела к CD19 можно модифицировать в отношении эффекторной функции, например, так, чтобы повышать ADCC и/или связанную с комплементом цитотоксичность (CDC) антитела. Для этой цели можно интродуцировать одну или несколько аминокислотных замен в Fc-фрагмент антитела. Остаток(и) цистеина можно интродуцировать также в Fc-фрагмент, что позволяет образоваться дисульфидному мостику внутри цепи в этой области. Таким путем можно создавать гомодимерное антитело, которое может обладать повышенной способностью к интернализации или повышенной комплемент-опосредуемой способности уничтожать клетки, а также ADCC (Caron и др., J. Exp. Med., 176, 1992, cc.1191-1195 и Shopes, J. Immunol., 148, 1992, cc.2918-2922). Гетеробифункциональные перекрестносшивающие агенты можно применять также для создания гомодимерных антител с повышенной противоопухолевой активностью (Wolfi и др., Cancer Research, 53, 1993, cc.2560-2565). Можно создавать также антитела с двумя или большим количеством Fc-фрагментов, что приводит к повышенному связанному с комплементом лизису и ADCC-активности (Stevenson и др., Anti-Cancer Drug Design, (3), 1989, cc.219-230).
Другие методы создания Fc-фрагментов антител с целью изменения эффекторных функций известны в данной области (например, публикация заявки на патент США №20040185045 и публикация РСТ WO 2004/016750, обе на имя Koenig и др., в которых описано изменение Fc-фрагмента для повышения аффинности к связыванию с FcγRIIB по сравнению с аффинностью к связыванию с FQyRIIA; см. также публикации РСТ WO 99/58572 на имя Armour и др., WO 99/51642 на имя Idusogie и др., и US 6395272 на имя Deo и др.; содержание которых полностью включено в настоящее описание в качестве ссылки). Методы модификации Fc-фрагментов с целью понижения аффинности к связыванию с FcγRIIB также известны в данной области (например, публикация заявки на патент США №20010036459 и публикация РСТ. WO 01/79299, обе на имя Ravetch и др., содержание которых полностью включено в настоящее описание в качестве ссылки). Описаны также модифицированные антитела, имеющие вариант Fc-фрагментов с повышенной аффинностью к связыванию с FcγRIIIA и/или FcγRIIA по сравнению с Fc-фрагментом дикого типа (например, публикация РСТ WO 2004/063351, на имя Stavenhagen и др.; содержание которой полностью включено в настоящее описание в качестве ссылки).
Известно по меньшей мере четыре различных типа FcγR, которые обозначают соответственно как FcγRI (CD64), FcγRII (CD32), FcγRIII (CD16) и FcγRIV. У человека FcγRII и FcγRIII дополнительно подразделяют на FcγRIIa и FcγRIIb, а также FcγRIIIa и FcγRIIIb соответственно. FcγR представляет собой мембранный белок, принадлежащий к суперсемейству иммуноглобулинов, FcγRII, FcγRIII и FcγRIV имеет α-цепь, несущую внеклеточную область, которая содержит два иммуноглобулинподобных домена, FcγRI имеет α-цепь, несущую внеклеточную область, которая содержит три иммуноглобулинподобных домена, в качестве основного компонента, и α-цепь участвует в активности связывания IgG. Кроме того, FcγRI и FcγRIII имеют γ-цепь или α-цепь в качестве основного компонента, который обладает функцией трансдукции сигнала в сочетании с α-цепью (Annu. Rev. Immunol., 18, 2000, с.709; Aimu. Rev. ImmunoL, 19, 2001, с.275.). FcγRIV описан у Bruhns и др., Clin. Invest. Med., (Канада) 27, 2004, с.3D.
Для оценки ADCC-активности представляющего интерес антитела к CD19 можно применять анализ in vitro ADCC, например, описанный в US 5500362 или 5821337. Анализ можно осуществлять с помощью поступающего в продажу набора, например CytoTox 96 ® (фирма Promega). Приемлемыми для такого анализа эффекторные клетками являются, но не ограничиваясь только ими, мононуклеарные клетки периферической крови (РВМС), естественные клетки-киллеры (NK-клетки) и линии NK-клеток. Линии NK-клеток, которые экспрессируют трансгенный Fc-рецептор (например, CD 16) и ассоциированный сигнальный полипептид (например, FCεRI-γ), могут служить в качестве эффекторных клеток (см., например WO 2006/023148 А2 на имя Campbell). Например, можно оценивать способность любого конкретного антитела опосредовать лизис клетки-мишени путем активации комплемента и/или ADCC. Представляющие интерес клетки выращивают и метят in vitro; антитело добавляют в клеточную культуру в сочетании с иммунными клетками, которые можно активировать с помощью комплексов антиген-антитело; т.е. эффекторные клетки участвуют в ADCC-ответе. Антитело можно оценивать также в отношении активации комплемента. В любом случае цитолизис клеток-мишеней выявляют по высвобождению метки из лизированной клетки. Степень лизиса клетки-мишени можно определять также путем выявления высвобождения цитоплазматических белков (например, LDH) в супернатант. Фактически антитела можно подвергать скринингу с использованием собственной сыворотки пациента в качестве источника комплемента и/или иммунных клеток. Антитела, которые обладают способностью опосредовать у человека ADCC в опыте in vitro, можно затем применять в качестве терапевтических для конкретного пациента. ADCC-активность представляющей интерес молекулы можно оценивать также in vivo, например, на созданных на животных моделях, например, описанных у Clynes и др., Proc. Natl. Acad. Sci. (USA) 95, 1998, cc.652-656. Кроме того, методы модулирования (т.е. повышения или понижения) уровня ADCC и необязательно CDC-активности антитела хорошо известны в данной области (см., например, US 6194551). Антитела, предлагаемые в настоящем изобретении, могут обладать или могут быть модифицированы так, чтобы они обладали способностью индуцировать ADCC и/или CDC. Анализы определения ADCC-функции на практике можно осуществлять с использованием человеческих эффекторных клеток для оценки у человека ADCC-функции. Такие анализы могут включать анализы, рассматриваемые для скрининга антител, которые индуцируют, опосредуют, повышают, блокируют клеточную гибель в результате некроза и/или механизмов апоптоза. Такие методы включают анализы, основанные на использовании красителей для оценки жизнеспособности, методы выявления и анализ каспаз и анализы расщепления ДНК, которые можно применять для оценки апоптозной активности клеток, культивируемых in vitro, с представляющим интерес антителом к CD19.
Например, мечение концевых «ников» с помощью дУТФ, опосредуемого Аннексином V или TdT (TUNEL-анализы), можно осуществлять согласно методу, описанному у Decker и др., Blood (USA) 103, 2004, cc.2718-2725, для выявления апоптозной активности. TUNEL-анализ включает культивирование представляющих интерес клеток в присутствии меченного флуоресцеином дУТФ для включения в разрывы цепей ДНК. Затем клетки процессируют для анализа методом проточной цитометрии. Анализ с использованием Аннексина V позволяет выявлять появление фосфатилсерина (PS) на наружной поверхности плазматической мембраны апоптозных клеток с использованием конъюгированного с флуоресцеином Аннексина V, который специфически распознает выставленные на поверхности молекулы PS. И в другом варианте краситель для оценки жизнеспособности, такой как йодид пропидия, можно применять для исключения клеток на поздней стадии апоптоза. Клетки окрашивают меченым Аннексином V и анализируют с помощью проточной цитомерии.
5.18.3. Иммуноконъюгаты и слитые белки
Согласно конкретным объектам изобретения терапевтические агенты или токсины можно конъюгировать с химеризованными, человеческими или гуманизированными антителами к CD19 для применения в композициях и способах, предлагаемых в изобретении. В определенных вариантах осуществления изобретения эти конъюгаты можно создавать в виде слитых белков. Примерами терапевтических агентов и токсинов являются, но не ограничиваясь только ими, представители семейства энедииновых молекул, таких как калихеамицин и эсперамицин. Химические токсины можно выбирать также из группы, включающей дуокармицин (см., например, US 5703080 и US 4923990), метотрексат, доксорубицин, мелфалан, хлорамбуцил, ARA-C, виндесин, митомицин С, цис-платину, этопосид, блеомицин и 5-фторурацил. Примерами химиотерапевтических агентов являются также адриамицин, доксорубицин, 5-фторурацил, цитозина арабинозид (Ara-С), циклофосфамид, тиотепа, таксотере (доцетаксел), бусульфан, цитоксин, таксол, метотрексат, цисплатин, мелфалан, винбластин, блеомицин, этопосид, ифосфамид, митомицин С, митоксантрон, винкристин, винорелбин, карбоплатин, тенипозид, дауномицин, карминомицин, аминоптерин, дактиномицин, митомицины, эсперамицины (см. US 4675187), мелфалан и другие азотистые производные горчичного газа.
В некоторых вариантах осуществления изобретения антитела к CD19 конъюгируют с цитостатическим, цитотоксическим агентом или иммуносупрессором, где цитотоксический агент выбирают из группы, включающей энедиин, лекситропсин, дуокармицин, таксан, пуромицин, доластатин, майтансиноид и алкалоид барвинка. В некоторых более конкретных вариантах осуществления изобретения цитотоксический агент представляет собой паклитаксел, доцетаксел, СС-1065, SN-38, топотекан, морфолинодоксорубицин, ризоксин, цианморфолинодоксорубицин, доластатин-10, эхиномицин, комбретастатин, калихеамицин, майтансин, DM-1, аурестатин Е, АЕВ, AEVB, AEFP, ММАЕ (см. заявку на патент США №10/983340) или нетропсин.
В некоторых вариантах осуществления изобретения цитотоксический агент, входящий в состав конъюгата антитело к CD19-цитотоксический агент, предлагаемый в изобретении, представляет собой антитубулиновые производные. В конкретных вариантах осуществления изобретения цитотоксический агент выбирают из группы, включающей алкалоид барвинка, подофиллотоксин, таксан, бактиновое производное, криптофисин, майтансиноид, комбретастатин и доластатин. В других вариантах осуществления изобретения цитотоксический агент представляет собой винкристин, винбластин, виндесин, винорелбин, VP-16, камптотецин, паклитаксел, доцетаксел, эпитилон А, эпитилон В, нокодазол, колхицин, колцимид, эстрамустин, цематодин, дискодермолид, майтансин, DM-1, AEFP, аурестатин Е, АЕВ, AEVB, AEFP, ММАЕ или элеутеробин.
В конкретных вариантах осуществления изобретения антитело к CD19 конъюгируют с цитотоксическим агентом через линкер, где линкер представляет собой пептидный линкер. В других вариантах осуществления изобретения антитело к CD19 конъюгируют с цитотоксическим агентом через линкер, где линкер представляет собой линкер типа val-cit, линкер типа phe-lys, гидразоновый линкер или дисульфидный линкер.
В определенных вариантах осуществления изобретения антитело к CD19, входящее в состав конъюгата антитело к CD19-цитотоксический агент, конъюгируют с цитотоксическим агентом через линкер, где линкер может гидролизоваться при рН менее чем 5,5. В конкретном варианте осуществления изобретения линкер может гидролизоваться при рН менее чем 5,0.
В определенных вариантах осуществления изобретения антитело к CD19, входящее в состав конъюгата антитело к СD19-цитотоксический агент, конъюгируют с цитотоксическим агентом через линкер, где линкер может расщепляться протеазой. В конкретном варианте осуществления изобретения протеаза представляет собой лизосомальную протеазу. В других вариантах осуществления изобретения протеаза среди прочего представляет собой ассоциированную с мембраной протеазу, внутриклеточную протеазу или эндосомальную протеазу.
Другие токсины, которые можно применять в иммуноконъюгатах, предлагаемых в изобретении, включают ядовитые лектины, растительные токсины, такие как рицин, абрин, модецин, ботулин и дифтерийный токсин. Естественно, комбинации различных токсинов можно также сшивать с любой молекулой антитела, придавая тем самым приемлемую вариабельную цитотоксичность. Приведенные в качестве иллюстрации токсины, которые можно применять для комбинированных терапий, предлагаемых в изобретении, представляют собой рицин, абрин, рибонуклеазу, ДНКазу I, стафилококковый энтеротоксин-А, антивирусный белок фитоллаки американской, гелонин, дифтерийный токсин, экзотоксин Pseudomonas и эндотоксин Pseudomonas (см., например, Pastan и др., Cell, 47, 1986, с.641 и Goldenberg и др., Cancer Journal for Clinicians, 44, 1994, с.43). Обладающие ферментативной активностью токсины и их фрагменты, которые можно применять, включают А-цепь дифтерийного токсина, несвязывающиеся активные фрагменты А-цепи дифтерийного токсина, А-цепь экзотоксина А (из Pseudomonas aeruginosa), А-цепь рицина, А-цепь абрина, А-цепь модецина, альфа-сарцин, белки Aleurites fordii, белки диантина, белки фитолакки американской (PAPI, PAPII и PAP-S), ингибитор из Momordica charantia, курцин, кротин, ингибитор из Sapaonaria officinalis, гелонин, митогеллин, рестриктоцин, феномицин, эномицин и трикотецены (см., например, WO 93/21232, опубликованную 28 октября 1993 г.).
Приемлемые токсины и химиотерапевтические агенты описаны в Remington's Pharmaceutical Sciences, 19-е изд. (изд-во Mack Publishing Co. 1995), и в Goodman And Gilman's The Pharmacological Basis of Therapeutics, 7-ое изд. (изд-во MacMillan Publishing Co., 1985). Другие приемлемые токсины и/или химиотерапевтические агенты известны специалистам в данной области.
Настоящее изобретение относится также к антителам (включая фрагменты антител или их варианты), которые содержат или конъюгированы с радиоактивным агентом, пригодным для диагностических целей. Примерами приемлемых радиоактивных субстанций являются, но, не ограничиваясь только ими, йод (121I, 123I, 125I, 131I), углерод (14С), сера (35S), тритий (3Н), индий (111In, 112In, 113mIn, 115mIn), технеций (99Tc, 99mTc), таллий (201Ti), галлий (68Ga, 67Ga), палладий (103Pd), молибден (99Мо), ксенон (135Хе), фтор (18F), 153Sm, 177Lu, 159Gd, 149Pm, 140La, 175Yb, 166Ho, 90Y, 47Sc, 186Re, 188Re, 142Pr, 105Rh и 97Ru.
Кроме того, антитело к CD19, предлагаемое в изобретении (включая scFv или другие молекулы, которые содержат или в другом варианте состоят из фрагментов антитела или его вариантов), можно сшивать или конъюгировать с ионом радиоактивного металла, который можно применять в терапевтических целях. Примерами приемлемых радиоактивных ионов являются, но не ограничиваясь только ими, излучатели альфа-частиц, такие как 213Bi, или другие радиоизотопы, такие как 103Pd, 135Xe, 131I, 68Ge, 57Co, 65Zn, 85Sr, 32P, 35S, 90Y, 153Sm, 153Gd, 169Yb, 51Cr, 54Mn, 75Se, 113 Sn, 90Y, 117Tin, 186Re, 188Re и 166Но. В конкретных вариантах осуществления изобретения антитело или его фрагмент присоединяют к макроциклическим хелаторам, так, что образуется комплекс хелатирующих радиоактивных ионов металлов, включая, но, не ограничиваясь только ими, 177Lu, 90Y, 166Ho и 153Sm, с полипептидами. В конкретных вариантах осуществления изобретения макроциклический хелатор представляет собой 1,4,7,10-тетрациклодекан-N,N',N'',N'''-тетрауксусную кислоту (DOTA). В других конкретных вариантах осуществления изобретения DOTA присоединяют к антителу, предлагаемому в изобретении, или его фрагменту через линкерную молекулу. Примерами линкерных молекул, которые можно применять для конъюгации DOTA с полипептидом, являются хорошо известные в данной области линкеры, например описанные у DeNardo и др., Clin Cancer Res 4(10), 1998, cc.2483-2490; Peterson и др., Bioconjug Chem 10(4), 1999, cc.553-557; и Zimmerman и др., Nucl Med Biol 26(8), 1999, cc.943-950, содержание которых полностью включено в настоящее описание в качестве ссылки.
Антитело к CD19, предлагаемое в настоящем изобретении, можно применять также для терапии типа ADEPT путем конъюгации антитела с активирующим пролекарство ферментом, который превращает пролекарство (например, пептидильный химиотерапевтический агент, см. WO 81/01145) в активное противораковое лекарственное средство (см., например, WO 88/07378 и US 4975278). Ферментный компонент иммуноконъюгата, который можно применять для ADEPT, включает любой фермент, который может активировать пролекарство таким образом, что оно превращается в более активную цитотоксическую форму.
Ферменты, которые можно применять в способе, предлагаемом в настоящем изобретении, включают, но не ограничиваясь только ими, щелочную фосфатазу, служащую для превращения содержащих фосфат пролекарств в свободные лекарственные средства; арилсульфатазу, служащую для превращения содержащих сульфат пролекарств в свободные лекарственные средства; цитозиндеаминазу, служащую для превращения нетоксичного 5-фторцитозина в противораковое лекарственное средство, 5-фторурацил;
протеазы, такие как протеаза Serratia, термолизин, субтилизин, карбоксипептидазы и катепсины (такие как катепсины В и L), служащие для превращения содержащих пептиды пролекарств в свободные лекарственные средства; D-аланилкарбоксипептидазы, служащие для превращения пролекарств, которые содержат D-аминокислотные заместители; углеводрасщепляющие ферменты, такие как β-галактозидаза и нейраминидаза, служащие для превращения гликозилированных пролекарств в свободные лекарственные средства; β-лактамаза, служащая для превращения дериватизированных α-лактамами лекарственных средств в свободные лекарственные средства; и пенициллинамидазы, такие как пенициллин-V-амидаза или пенициллин-G-амидаза, служащие для превращения лекарственных средств, дериватизированных на азотах амина феноксиацетильными или фенилацетильными группами соответственно, в свободные лекарственные средства. Антитела, обладающие ферментативной активностью, которые в данной области обозначают также как «абзимы», можно применять также для превращения пролекарств в свободные лекарственные средства (см., например, Massey, Nature 328, 1987, cc.457-458). Конъюгаты антитело-абзим можно получать согласно настоящему описанию для введения при необходимости абзима в области в организме человека, пораженного В-клеточным злокачественным заболеванием.
Антитела, предлагаемые в настоящем изобретении, можно ковалентно связывать с ферментами с помощью методов, хорошо известных в данной области, например, с применением гетеробифункциональных перекрестносшивающих реагентов, описанных выше. Слитые белки, которые содержат по меньшей мере антигенсвязывающий центр антитела к CD19, сцепленный по меньшей мере с функционально активной областью фермента, можно конструировать также с помощью методов рекомбинантной ДНК, хорошо известных в данной области (см., например, Neuberger и др., Nature, 312, 1984, cc.604-608).
Ковалентные модификации антитела к CD19 подпадают под объем настоящего изобретения. Их можно осуществлять путем химического синтеза или при необходимости ферментативного или химического расщепления антитела. Другие типы ковалентных модификаций антитела к CD19 интродуцируют в молекулу путем взаимодействия с являющимися мишенями аминокислотными остатками антитела с органическим дериватизирующим агентом, который обладает способностью взаимодействовать с отобранными боковыми цепями или с N- или С-концевыми остатками.
Цистеинильные остатки наиболее часто подвергают взаимодействию с α-галоацетатами (и соответствующими аминами), такими как хлоруксусная кислота или хлорацетамид, с получением карбокиметильных или карбокиамидометильных производных. Аналогично этому, можно применять также йодсодержащие реагенты. Цистеинильные остатки дериватизируют также путем взаимодействия с бромтрифторацетоном, α-бром-β-(5-имидозоил)пропионовой кислотой, хлорацетилфосфатом, N-алкилмалеимидами, 3-нитро-2-пиридилдисульфидом, метил-2-пиридилдисульфидом, пара-хлорбензоатом ртути, 2-хлор-4-нитрофенилом ртути или хлор-7-нитробензо-2-окса-1,3-диазолом.
Гистидильные остатки дериватизируют путем взаимодействия с диэтилпирокарбонатом при рН 5,5-7,0, поскольку этот агент является относительно специфическим для гистидильной боковой цепи. Можно применять также пара-бромфенацилбромид; реакцию можно осуществлять в 0,1 М какодилате натрия при рН 6,0.
Лизильные и аминоконцевые остатки подвергают взаимодействию с янтарным или другими ангидридами карбоновых кислот. Дериватизация с помощью этих агентов приводит к обратимости заряда лизинильных остатков. Другие реагенты, пригодные для дериватизации α-аминосодержащих остатков и/или α-аминосодержащих остатков, включают сложные имидоэфиры, такие как метилпиколинимидат, пиридоксалфосфат, пиридоксал, хлорборогидрид, тринитробензолсульфоновую кислоту, O-метилизомочевину, 2,4-пентандион и катализируемую трансаминазами реакцию с глиоксилатом.
Аргинильные остатки модифицируют путем взаимодействия одного или нескольких общепринятых реагентов, таких как фенилглиоксаль, 2,3-бутандион, 1,2-циклогександион и нингидрин. Для дериватизации аргинильных остатков, как правило, требуется проводить реакцию в щелочных условиях, из-за высокого значения рКа гуанидиновой функциональной группы. Кроме того, эти реагенты можно подвергать взаимодействию с ε-аминогруппами лизина, а также аргининовой эпсилон-аминогруппой.
Наиболее предпочтительным вариантом специфической модификации тирозильных остатков является интродукция спектральных меток в тирозильные остатки путем взаимодействия с ароматическими диазониевыми производными или тетранитрометаном. Наиболее часто применяют N-ацетилимидазол и тетранитрометан для формирования O-ацетилтирозильных производных и 3-нитропроизводных соответственно. Тирозильные остатки йодируют, используя 125I или 131I для получения меченных белков, применяемых в радиоиммуноанализе.
Карбоксильные боковые группы (аспартил или глутамил) избирательно модифицируют путем взаимодействия с карбодиимидами (R-N=C=N-R'), в которых R и R' обозначают различные алкильные группы, такие как 1-циклогексил-3-(2-морфолинил-4-этил)карбодиимид или 1-этил-3-(4-азониа-4,4-диметилпентил)карбодиимид. Кроме того, аспартильные и глутамильные остатки превращают в аспаргинильные и глутаминильные остатки путем взаимодействия с ионами аммония.
Глутаминильные и аспаргинильные остатки часто деамидируют до соответствующих глутамильных и аспартильных остатков соответственно. Эти остатки деамидируют в нейтральных или основных условиях. Деамидированные формы этих остатков подпадают под объем настоящего изобретения.
Другие модификации включают гидроксилирование пролина и лизина, фосфорилирование гидроксильных групп серильных или треонильных остатков, метилирование α-аминогрупп боковых цепей лизина, аргинина и гистидина (Т.Е. Creighton, Proteins: Structure and Molecular Properties, изд-во W.H. Freeman & Co., San Francisco, 1983, cc.79-86), ацетилирование N-концевого амина и амидирование любой С-концевой карбоксильной группы.
Другой тип ковалентной модификации включает химическое или ферментативное сочетание гликозидов с антителом. Эти процедуры являются предпочтительными, потому что они не требуют получения антитела в клетке-хозяине, обладающей способностью осуществлять гликозилирование, такое как N- или O-связанное гликозилирование. В зависимости от применяемого метода сочетания сахар(а) можно присоединять к (а) аргинину и гистидину, (б) свободным карбоксильным группам, (в) свободным сульфгидрильным группам, таким как группы цистеина, (г) свободным гидроксильным группам, таким как группы серина, треонина или гидроксипролина, (д) ароматическим остаткам, таким как остатки фенилаланина, тирозина или триптофана, или (е) амидогруппе глутамина. Эти методы описаны в WO 87/05330, опубликованной 11 сентября 1987 г., и у Aplin и Wriston, CRC Crit. Rev. Biochem., 1981, cc.259-306.
5.19. Химиотерапевтические комбинации
В других вариантах осуществления изобретения МАт к CD19 можно вводить в сочетании с одним или несколькими дополнительными химиотерапевтическими агентами. Например, «CVB» (1,5 г/м2 циклофосфамида, 200-400 мг/м2 этопосида и 150-200 мг/м2 кармустина) можно применять в совместных терапиях, предлагаемых в изобретении. CVB представляет собой лечебную схему, применяемую для лечения не-ходжкинской лимфомы (Patti и др., Eur. J. HaematoL, 51, 1993, с.18). Другие приемлемые комбинации химиотерапевтических схем лечения хорошо известны специалистам в данной области (см., например, Freedman и др., «Non-Hodgkin's Lymphomas», в: Cancer Medicine, том 2, 3-е изд., под ред. Holland и др., 1993, cc.2028-2068, изд-во Lea & Febiger). В качестве примера, первые созданные Химиотерапевтические схемы лечения не-ходжкинской лимфомы средней степени злокачественности включают С-МОРР (циклофосфамид, винкристин, прокарбазин и преднизон) и CHOP (циклофосфамид, доксорубицин, винкристин и преднизон). Пригодная химиотерапевтическая схема лечения второго поколения представляет собой m-BACOD (метотрексат, блеомицин, доксорубицин, циклофосфамид, винкристин, дексаметазон и леуковорин), а схема лечения третьего поколения представляет собой МАСОР-В (метотрексат, доксорубицин, циклофосфамид, винкристин, преднизон, блеомицин и леуковорин). Дополнительные лекарственные средства, которые можно применять, представляют собой фенилбутират и бростатин-1.
Согласно изобретению рак или один или несколько связанных с ним симптомов можно предупреждать, лечить, контролировать или облегчать путем введения МАт к CD19 в сочетании с применением одной или нескольких терапий, включая, но не ограничиваясь только ими, химиотерапии, лучевые терапии, гормональные терапии и/или биологические терапии /иммунотерапии.
В конкретных вариант осуществления изобретения способы, предлагаемые в изобретении, заключаются в том, что вводят один или несколько антагонистов ангиогенеза, таких как, но не ограничиваясь только ими: ангиоостатин (фрагмент плазминогена); антиангиогенный антитромбин III; ангиозим; АВТ-627; Bay 12-9566; бенефин; бевасизумаб; BMS-275291; полученный из хрящевой ткани ингибитор (CDI); CAI; фрагмент комплемента CD59-; СЕР-7055; Col 3; комбретастатин А-4; эндостатин (фрагмент коллагена XVIII); фрагмент фибронектина; Gro-бета; галофугинон; гепариназы; фрагмент гепарингексасахарида; HMV833; человеческий хорионический гонадотропин (hCG); IM-862; интерферон альфа/бета/гамма; индуциуемый интерфероном белок (IP-10); интерлейкин-12; Kringle 5 (фрагмент плазминогена); маримастат; ингибиторы металлопротеиназы (TIMP); 2-метоксиэстрадиол; MMI 270 (CGS 27023А); MoAb IMC-1C11; неовастат; NM-3; панзем; PI-88; ингибитор плацентарной рибонуклеазы; ингибитор активатора плазминогена; тромбоцитарный фактор-4 (PF4); приномастат; фрагмент пролактина 16 кДа; родственный пролиферину белок (PRP); РТК 787/ZK 222594; ретиноиды; солимастат; скваламин; SS 3304; SU 5416; SU6668; SU11248; тетрагидрокортизол-S; тетратиомолибдат; талидомид; тромбоспондин-1 (TSP-1); TNP-470; трансформирующий фактор роста бета (TGF-b); васкулостатин; вазостатин (фрагмент кальретикулина); ZD6126; ZD 6474; ингибиторы фарнезилтрансферазы (FTI); и бисфосфонаты (такие как, но не ограничиваясь только ими, алендронат, клодронат, этидронат, ибандронат, памидронат, резидронат, тилудронат и золедронат).
В конкретных вариантах осуществления изобретения способы, предлагаемые в изобретении, заключаются в том, что вводят один или несколько иммуномодуляторов, таких как, но не ограничиваясь только ими, химиотерапевтические агенты и нехимиотерапевтические иммуномодуляторы. Примерами химиотерапевтических агентов являются, но не ограничиваясь только ими, метотрексат, циклоспорин А, лефлуномид, цисплатин, ифосфамид, таксаны, такие как таксол и паклитаксол, ингибиторы топоизомеразы I (например, СРТ-11, топотекан, 9-АС и GG-211), гемцитабин, винорелбин, оксалиплатин, 5-фторурацил (5-ФУ), леуковорин, винорелбин, темодал, цитохаласин В, грамицидин D, эмитин, митомицин, этопосид, тенопосид, винкристин, винбластин, колхицин, доксорубицин, даунорубицин, дигидроксиантрациндион, митоксантрон, митрамицин, актиномицин D, 1-дегидротестостерон, глюкокортикоиды, прокаин, тетракаин, лидокаин, пропранолол и пуромициновые гомологи и цитоксан. Примерами нехимиотерапевтических иммуномодуляторов являются, но не ограничиваясь только ими, антитела к Т-клеточным рецепторам (например, антитела к CD4 (например, сМ-Т412 (фирма Boeringer), IDEC-CE9.1® (фирма IDEC и 8KB), МАт 4162W94, ортоклон и OKTcdr4a (фирма Janssen-Cilag)), антитела к CD3 (например, нувион (фирма Product Design Labs), ОКТЗ (фирма Johnson & Johnson) или ритуксан (фирма IDEC)), антитела к CD5 (например, иммуноконъюгат антитела к CD5, сцепленного с рицином), антитела к CD7 (например, СНН-380 (фирма Novartis)), антитела к CD8, моноклональные антитела к лиганду CD40 (например, IDEC-131 (фирма IDEC)), антитела к CD52 (например, CAMPATH 1H (Ilex)), антитела к CD2 (например, MEDI-507 (фирма Medlmmune, Inc., публикации международных заявок WO 02/098370 и WO 02/069904), антитела к CD11a (например, ксанелим (Xanelim) (фирма Genentech)) и антитела к В7 (например, IDEC-114) (фирма IDEC)); антитела к цитокиновому рецептору (например, антитела к IFN-рецептору, антитела к IL-2-рецептору (например, зенапакс (Zenapax) (фирма Protein Design Labs)), антитела к IL-4-рецептору, антитела к IL-6-рецептору, антитела к IL-10-рецептору и антитела к IL-12-рецептору), антицитокиновые антитела (например, антитела к IFN, антитела к TNF-α, антитела к IL-1(3, антитела к IL-6, антитела к IL-8 (например, ABX-IL-8 (фирма Abgenix)), антитела к IL-12 и антитела к IL-23)); CTLA4-иммуноглобулины; LFA-3TIP (фирма Biogen, публикация международной заявки WO 93/08656 и US 6162432); растворимые цитокиновые рецепторы (например, внеклеточный домен TNF-α-рецептора или его фрагмент, внеклеточный домен IL-1β-рецептора или его фрагмент и внеклеточный домен IL-6-рецептора или его фрагмент); цитокины или их фрагменты (например, интерлейкин (IL)-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-10, IL-11, IL-12, IL-15, IL-23, TNF-α, TNF-β, интерферон (IFN)-α, IFN-β, IFN-γ и GM-CSF); и антицитокиновые антитела (например, антитела к IL-2, антитела к IL-4, антитела к IL-6, антитела к IL-10, антитела к IL-12, антитела к IL-15, антитела к TNF-α и антитела к IFN-γ), и антитела, которые иммуноспецифически связываются с ассоциированными с опухолями антигенами (например, Herceptin®). В определенных вариантах осуществления изобретения иммуномодулятор представляет собой иммуномодулятор, отличный от химиотерапевтического агента. В других вариантах осуществления изобретения иммуномодулятор представляет собой иммуномодулятор, отличный от цитокина или гематопоэтического фактора, такого как IL-1, IL-2, IL-4, IL-12, IL-15, TNF, IFN-α, IFN-β, IFN-γ, M-CSF, G-CSF, IL-3 или эритропоэтин. В следующих вариантах осуществления изобретения иммуномодулятор представляет собой агент, отличный от химиотерапевтического агента и цитокина или гематопоэтического фактора.
В конкретном варианте осуществления изобретения способы, предлагаемые в изобретении, заключаются в том, что вводят один или несколько противовоспалительных агентов, таких как, но не ограничиваясь только ими, нестероидные противовоспалительные средства (НСПВС), стероидные противовоспалительные средства, бета-агонисты, антихолинергические агенты и метилксантины. Примерами НСПВС являются, но не ограничиваясь только ими, аспирин, ибупрофен, целекоксиб (CELEBREX™), диклофенак (VOLTAREN™), этодолак (LODINE™), фенопрофен (NALFON™), индометацин (INDOCIN™), кеторалак (TORADOL™), оксапрозин (DAYPRO™), набументон (RELAFEN™), сулиндак (CLINORIL™), толмептирин (TOLECTRIN™), рофекоксиб (VIOXX™), напроксен (ALEVE™, NAPROSYN™), кетопрофен (ACTRON™) и набуметон (RELAFEN™). Функцией указанных НСПВС является ингибирование фермента циклооксигеназы (например, СОХ-1 и/или СОХ-2). Примерами стероидных противовоспалительных средств являются, но не ограничиваясь только ими, глюкокортикоиды, дексаметазон (DECADRON™), кортизон, гидрокортизон, преднизон (DELTASONE™), преднизолон, триамцинолон, азульфидин и эйкозаноиды, такие как простагландины, тромбоксаны и лейкотриены.
В другом конкретном варианте осуществления изобретения способы, предлагаемые в изобретении, заключаются в том, что вводят одно или несколько противовирусных средств (например, амантадин, рибавирин, римантадин, ацикловир, фамцикловир, фоскарнет, ганцикловир, трифлуридин, видарабин, диданосин, ставидин, залцитабин, зидовудин, интерферон), антибиотики (например, дактиномицин (прежнее название актиномицин), блеомицин, митрамицин и антрамицин (АМС)), противорвотные средства (например, алпразолам, дексаметазон, домперидон, дронабинол, дроперидол, гранисетрон, галоперидол, лоразепам, метилпреднизолон, метоклопрамид, набилон, ондансетрон, прохлорперазин), противогрибковые средства (например, амфотерицин, клотримазол, эконазол, флуконазол, флуцитозин, гризеофульвин, итраконазол, кетоконазол, миконазол и нистатин), противопаразитарные средства (например, дегидроэмитин, дилоксанида фуроат, эмитин, мефлохин, меларсопрол, метронидазол, нифуртимокс, паромомицин, пентабин, пентамидина изетионат, примахин, хинакрин, хинидин) или их комбинации.
Конкретными примерами противораковых средств, которые можно применять в различных вариантах осуществления изобретения, включая фармацевтические композиции и лекарственные формы и наборы, являются, но не ограничиваясь только ими: ацивицин; акларубицин; акодазола гидрохлорид; акронин; адозелезин; альдеслейкин; алтретамин; амбомицин; аметантрона ацетат; аминоглутетимид; амсакрин; анастрозол; антрамицин; аспарагиназа; асперлин; азацитидин; азетепа; азотомицин; батимастат; бензодепа; бикалутамид; бисантрена гидрохлорид; биснафида димесулат; бизелезин; блеомицина сульфат; бреквинар натрия; бропиримин; бусульфан; сактиномицин; калустерон; карацемид; карбетимер; карбоплатин; кармустин; карубицина гидрохлорид; карзелесин; цедефингол; хлорамбуцил; циролемицин; цисплатин; кладрибин; криснатола мезилат; циклофосфамид; цитарабин; дакарбазин; дактиномицин; даунорубицина гидрохлорид; децитабин; дексормаплатин; дезагуанин; дезагуанина мезилат; диазиквон; доцетаксел; доксорубицин; доксорубицина гидрохлорид; дролоксифен; дролоксифена цитрат; дромостанолона пропионат; дуазомицин; эдатрексат; эфлорнитина гидрохлорид; элсамитруцин; энлоплатин; энпромат; эпипропидин; эпирубицина гидрохлорид; эрбулозол; эзорубицина гидрохлорид; эстрамустин; эстрамустина фосфат натрия; этанидазол; этопосид; этопосида фосфат; этоприн; фадрозола гидрохлорид; фазарабин; фенретинид; флоксуридин; флударабина фосфат; фторурацил; флуроцитабин; фосхидон; натриевая соль фостриецина; гемцитабин; гемцитабина гидрохлорид; гидроксимочевина; идарубицина гидрохлорид; ифосфамид; илмофосин; интерлейкин II (включая рекомбинантный интерлейкин II или rIL2), интерферон альфа-2а; интерферон альфа-2b; интерферон альфа-n1; интерферон альфа-n3; интерферон бета-Ia; интерферон гамма-Ib; ипроплатин; иринотекана гидрохлорид; ланреотида ацетат; летрозол; леупролида ацетат; лиарозола гидрохлорид; натриевая соль лометрексола; ломустин; лозоксантрона гидрохлорид; масопрокол; майтансин; мехорэтамина гидрохлорид; мегестрола ацетат; меленгестрола ацетат; мелфалан; меногарил; меркаптопурин; метотрексат; метотрексат натрия; метоприн; метуредепа; митиндомид; митокарцин; митокромин; митогиллин; митомалцин; митомицин; митоспер; митотан; митоксантрона гидрохлорид; микофеноловая кислота; нокодазол; ногамицин; ормаплатин; оксисуран; паклитаксел; пегаспаргаз; пелиомицин; пентамустин; пепломицина сульфат; перфосфамид; пипоброман; пипосульфан; пироксантрона гидрохлорид; пликармицин; пломестан; порфимер натрия; порфиромицин; преднимустин; прокарбазина гидрохлорид; пуромицин; пуромицина гидрохлорид; пиразофурин; рибоприн; роглетимид; сафингол; сафингола гидрохлорид; семустин; симтразен; спарфосат натрия; спарсомицин; спирогермания гидрохлорид; спиромустин; спироплатин; стрептонигрин; стрептозоцин; сулофенур; тализомицин; текогалан натрия; тегафур; телоксантрона гидрохлорид; темопорфин; тенипозид; тероксирон; тестолактон; тиамиприн; тиогуанин; тиотепа; тиазофурин; тирапазамин; торемифена цитрат; трестолона ацетат; трицирибина фосфат; триметрексат; триметрексата глукуронат; трипторелин; тубулозола гидрохлорид; азотистоипритовое производное урацила; уредепа; вапреотид; вертепорфин; винбластина сульфат; винкристина сульфат; виндесин; виндесина сульфат; винепидина сульфат; винглицината сульфат; винлеурозина сульфат; винорелбина тартрат; винросидина сульфат; винзолидина сульфат; ворозол; зениплатин; зиностатин; зорубицина гидрохлорид. К другом противораковым лекарственным средствам относятся, но не ограничиваясь только ими, 20-эпи-1,25-дигидроксивитамин D3; 5-этинилурацил; абиратерон; акларубицин; ацилфулвен; адеципенол; адозелесин; альдеслейкин; антагонисты ALL-TK; алтретамин; амбамустин; амидокс; амифостин; аминолевулиновая кислота; амрубицин; амсакрин; анагрелид; анастрозол; андрографолид; ингибиторы ангиогенеза; антагонист D; антагонист G; антареликс; антидорсализирующий морфогенетический белок-1; антиандроген, при карциноме предстательной железы; антиэстроген; антинеопластон; антисмысловые олигонуклеотиды; афидиколина глицинат; гены-модуляторы апоптоза; регуляторы апоптоза; апуриновая кислота; ara-CDP-DL-PTBA; аргининдеаминаза; асулакрин; атаместан; атримустин; аксинастатин 1; аксинастатин 2; аксинастатин 3; азасетрон; азатоксин; азатирозин; производные баккатина III; баланол; батимастат; антагонисты BCR/ABL; бензохлорины; бензоилстауроспорин; производные бета-лактама; бета-алетин; бетакламицин В; бетулиновая кислота; ингибитор bFGF; бикалутамид; бисантрен; бисазиридинилспермин; биснафид; бистратен А; бизелесин; брефлат; бропримин; будотитан; бутионина сульфоксимин; кальципотриол; калфостин С; производные камптотецина; канарипокс IL-2; капецитабин; карбоксамид-амино-триазол; карбоксиамидотриазол; CaRest М3; CARN 700; ингибитор, выделенный из хряща; карзелесин; ингибиторы казеинкиназы (ICOS); кастаноспермин; цекропин В; цетрореликс; хлорины; хлорохиноксалина сульфонамид; цикапрост; цис-порфирин; кладрибин; аналоги кломифена; клотримазол; коллисмицин А; коллисмицин В; комбретастатин А4; аналог комбретастатина; конагенин; крамбесцидин 816; криснатол; криптофицин 8; производные криптофицина А; курацин А; циклопентантрахиноны; циклоплатам; ципермицин; цитарабина окфосфат; цитолитический фактор; цитостатин; дакликсимаб; децитабин; дегидродидемнин В; деслорелин; дексаметазон; дексифосфамид; дексразоксан; дексверапамил; диазиквон; дидемнин В; дидокс; диэтилнорспермин; дигидро-5-азацитидин; дигидротаксол, 9-; диоксамицин; дифенилспиромустин; доцетаксел; докозанол; доласетрон; доксифлуридин; дролоксифен; дронабинол; дуокармицин SA; эбселен; экомустин; эдельфосин; эдреколомаб; эфлорнитин; элемен; эмитефур; эпирубицин; эпристерид; аналог эстрамустина; агонисты эстрогена; антагонисты эстрогена; этанидазол; этопосида фосфат; эксеместан; фадрозол; фазарабин; фенретинид; филграстим; финастерид; флавопиридол; флезеластин; флуастерон; флударабин; флуородаунорубицина гидрохлорид; форфенимекс; форместан; фостриецин; фотемустин; гадолиния тексафирин; галлия нитрат; галоцитабин; ганиреликс; ингибиторы желатиназы; гемцитабин; ингибиторы глутатиона; гепсульфам; герегулин; гексаметилена бисацетамид; гиперицин; ибандроновая кислота; идарубицин; иодоксифен; идрамантон; илмофосин; иломастат; имидазоакридоны; имихимод; иммуностимулирующие пептиды; ингибитор рецептора инсулинподобного фактора роста 1; агонисты интерферона; интерфероны; интерлейкины; иобенгуан; иододоксорубицин; ипомеанол, 4-; иропласт; ирсогладин; изобенгазол; изогомогаликондрин В; итасетрон; джасплакинолид; кагалалид F; ламелларина-N триацетат; ланреотид; лейнамицин; ленограстим; лентинана сульфат; лептолстатин; летрозол; лейкозингибирующий фактор; лейкоцитарный интерферон альфа; леупролид + эстроген + прогестерон; леупрорелин; левамизол; лиарозол; аналог линейного полиамина; липофильный дисахаридный пептид; липофильные соединения платины; лиссоклинамид 7; лобаплатин; ломбрицин; лометрексол; лонидамин; лозоксантрон; ингибитор HMG-CoA-редуктазы (такой как, но не ограничиваясь только ими, ловастатин, правастатин, флувастатин, статин, симвастатин и аторвастатин); локсорибин; луртотекан; лютеция тексафирин; лизофиллин; литические пептиды; майтансин; манностатин А; маримастат; мазопрокол; маспин; ингибиторы матрилизина; ингибиторы матричных металлопротеиназ; меногарил; мербарон; метерелин; метиониназа; метоклопрамид; ингибитор MIF; мифепристон; милтефозин; миримостим; двухцепочечная РНК с ошибочным спариванием оснований; митогуазон; митолактол; аналоги митомицина; митонафид; митотоксин фактор роста фибробластов-сапорин; митоксантрон; мофаротен; молграмостим; моноклональное антитело, человеческий хорионический гонадотропин; монофосфориловый липид А+оболочка микобактериальной клетки sk; мопидамол; ингибитор гена устойчивости ко многим лекарственным средствам; терапия на основе супрессора 1 многих опухолей; противораковое средство на основе горчичного газа; микапероксид В; экстракт оболочки микобактериальной клетки; мириапорон; N-ацетилдиналин; N-замещенные бензамиды; нафарелин; нагрестип; налоксон+пентазопин; напавин; нафторпин; нартогастрим; недаплатин; неморубицин; неридроновая кислота; нейтральная эндопептидаза; нилутамид; низамицин; модуляторы оксида азота; нитроксидный антиоксидант; нитруллин; O-6-бензилгуанин; октреотид; окиценон; олигонуклеотиды; онапристон; ондансетрон; орацин; оральный цитокиновый индуктор; ормаплатин; озатерон; оксалиплатин; оксауномицин; паклитаксел; аналоги паклитаксела; производные паклитаксела; палауамин; пальмитоилризоксин; памидроновая кислота; панакситриол; паномифен; парабактин; пазеллиптин; пегаспаргаза; пелдезин; пентозанполисульфат натрия; пентостатин; пентрозол; перфлуброн; перфосфамид; периллиловый спирт; феназиномицин; фенилацетат; ингибиторы фосфатазы; пицибанил; пилокарпина гидрохлорид; пирарубицин; пиритрексим; плацетин А; плацетин В; ингибитор активатора плазминогена; платиновый комплекс; платиновые соединения; платина-триаминовый комплекс; порфимер натрия; порфиромицин; преднизон; пропил-бис-акридон; простагландин J2; ингибиторы протеосомы; иммунный модулятор на основе белка А; ингибитор протеинкиназы С; ингибиторы протеинкиназы С, микроводоросли; ингибиторы протеинтирозинфосфатазы; ингибиторы пуринрнуклеозидфосфорилазы; пурпурины; пиразолоакридин; конъюгат пиридоксилированного гемоглобина и полиоксиэтилена; антагонисты raf; ралтитрексед; рамосетрон; ингибиторы фарнезилпротеинтрансферазы ras; ингибиторы ras; ингибитор ras-GAP; ретеллиптин деметилированный; рения Re 186 этидронат; ризоксин; рибизимы; ретинамид RII; роглетимид; рогитукин; ромуртид; роквинимекс; рубигинон В1; рубоксил; сафингол; сайнтопин; SarCNU; саркофитол А; саргамостим; миметики Sdi 1; семустин; ингибитор 1, выведенный из старых клеток; смысловые олигонуклеотиды; ингибиторы трансдукции сигнала; модуляторы трансдукции сигнала; одноцепочечный антигенсвязывающий белок; сизофиран; собузоксан; натрия борокаптат; натрия фенилацетат; солверол; соматомединсвязывающий белок; сонермин; спарфозовая кислота; спикамицин D; спиромустин; спленопентин; спонгистатин 1; скваламин; ингибитор стволовых клеток; ингибиторы деления стволовых клеток; стипиамид; ингибиторы стромелизина; сульфинозин; антагонист суперактивного вазоактивного интестинального пептида; сурадиста; сурамин; свайнсонин; синтетические гликозаминогликаны; таллимустин; тамоксифена метиодид; тауромустин; тазаротен; натриевая соль текогалана; тегафур; теллурапирилиум; ингибиторы теломеразы; темопорфин; темозоломид; тенипозид; тетрахлородекаоксид; тетразомин; талибластин; тиокоралин; тромбопоэтин; миметик тромбопоэтина; тималфазин; агонист рецептора тимопоэтина; тимотринан; тироидстимулирующий гормон; тинэтилэтиопурпурин; тирапазамин; титаноцена бихлорид; топсентин; торемифен; фактор тотипотентных стволовых клеток; ингибиторы трансляции; третиноин; триацетилуридин; трицирибин; триметрексат; трипторелин; трописетрон; туростерид; ингибиторы тирозинкиназы; тирфостины; ингибиторы UBC; убенимекс; выведенный из урогенитального синуса ингибирующий рост фактор; антагонисты рецептора урокиназы; вапреотид; вариолин В; векторная система, генная терапия эритроцитов; веларезол; верамин; вердинс; вертепорфин; винорелбин; винксалтин; Vitaxin®; ворозол; занотерон; зениплатин; зиласкорб; и зиностатина стималамер. Дополнительными противораковыми лекарственными средствами являются 5-фторурацил и леуковорин. Эти два средства можно использовать, когда в способах применяют талидомид и ингибитор топоизомеразы. В конкретных вариантах осуществления изобретения противораковое средство не представляет собой химиотерапевтический агент.
В более конкретных вариантах осуществления настоящего изобретения предусматривается также введение МАт к CD19 в сочетании с применением одного или нескольких терапевтических средств, таких как, но не ограничиваясь только ими, противораковые средства, перечисленные в таблице 1, которые предназначены для лечения рака молочной железы, яичника, меланомы, рака предстательной железы, ободочной кишки и легкого и которые описаны выше. При применении для совместной терапии можно снижать дозы и/или частоту введения, которые представлены в таблице 2.
Изобретение относится также к введению МАт к CD19 в сочетании с лучевой терапией, включающей применение рентгеновских лучей, гамма-лучей и других источников радиации для разрушения раковых клеток. В конкретных вариантах осуществления изобретения лучевую терапию применяют в виде внешнего лучевого излучения или дистанционной лучевой терапии, при которой излучение поступает из отдаленного источника. В других вариантах осуществления изобретения лучевую обработку применяют в качестве внутренней терапии или близкофокусной лучевой терапии, при которой радиоактивный источник помещают внутрь организма вблизи раковых клеток или массы опухоли.
Противораковые терапии и дозы, пути введения и рекомендации по применению известны в данной области и описаны в литературе, например, в справочнике врача (56-ое изд., 2002).
5.20. Фармацевтические композиции
Изобретение относится также к иммунотерапевтическим композициям и способам лечения В-клеточных заболеваний и нарушений у человека, таких как, но не ограничиваясь только ими, В-клеточные злокачественные состояния, к иммунотерапевтическим композициям и способам лечения предупреждения GVHD, отторжения трансплантата и посттрансплантационного лимфоцитарного пролиферативного нарушения у людей-реципиентов трансплантата, и к иммунотерапевтическим композициям и способам лечения аутоиммунных заболеваний и нарушений у человека с использованием терапевтических антител, которые связываются с антигеном CD19 и могут опосредовать ADCC у человека.
Настоящее изобретение относится к фармацевтическим композициям, содержащим человеческие, гуманизированные или химерные антитела к CD19 человеческого изотипа IgG1 или IgG3. Настоящее изобретение относится также к фармацевтическим композициям, содержащим человеческие или гуманизированные антитела к CD19 человеческого изотипа IgG2 или IgG4, которые опосредуют ADCC у человека. Конкретными вариантами осуществления настоящего изобретения являются также фармацевтические композиции, содержащие моноклональные человеческие, гуманизированные или химеризованные антитела к CD19, которые можно получать методами, известными в данной области.
Описаны терапевтические лекарственные формы и схемы лечения людей, у которых диагностированы В-клеточные злокачественные состояния, связанные с В-клетками и их предшественниками, включая, но не ограничиваясь только ими, острый лимфобластный лейкоз (ALL), лимфомы Ходжкина, не-ходжкинские лимфомы, В-клеточные хронические лимфолейкозы (CLL), множественную миелому, фолликулярную лимфому, лимфому из клеток мантии, про-лимфолейкозы, волосковоклеточные лейкозы, общие острые лимфолейкозы и некоторые острые лимфобластные лейкозы нуль-клеточного типа.
В других вариантах осуществления изобретения антитела к CD19 могут опосредовать ADCC, комплементзависимую клеточную цитотоксичность или апоптоз. Преимуществом композиций и способов, предлагаемых в настоящем изобретении, может быть направленное действие в отношении более широкой популяции В-клеток, по сравнению с другими имунотерапиями, мишенью которых являются В-клетки. Например, антитела к CD19, предлагаемые в настоящем изобретении, могут обладать эффективным целенаправленным действием на клетки костного мозга, находящиеся в кровотоке В-клетки и зрелые, секретирующие антитела В-клетки. Таким образом, способы и композиции, предлагаемые в изобретении, могут эффективно снижать уровень или истощать находящиеся в кровотоке В-клетки, а также находящиеся в кровотоке иммуноглобулины.
Таким образом, одним из объектов изобретения являются композиции и способы лечения и предупреждения GVHD, отторжения трансплантата и посттрансплантационного лимфопролиферативного нарушения, при использовании которых снижается лихорадка, и/или наблюдаются менее серьезные осложнения по сравнению с менее целенаправленными терапевтическими агентами и схемами лечения. В одном из вариантов осуществления изобретения в композициях и способах, предлагаемых в изобретении, применяют традиционные терапевтические агенты в более низких дозах по сравнению с теми, которые можно применять без использования способов и композиций, предлагаемых в изобретении. В другом варианте осуществления изобретения композиции и способы, предлагаемые в изобретении, устраняют необходимость в более серьезной форме терапии, такой как лучевая терапия, химиотерапия с использованием высоких доз или спленектомия.
В некоторых вариантах осуществления изобретения антитела к CD19 и композиции можно вводить пациенту-реципиенту трансплантата до или после трансплантации индивидуально или в сочетании с другими терапевтическими агентами или схемами для лечения или предупреждения GVHD и отторжения трансплантата. Например, антитела к CD19 и композиции можно применять для истощения аллоантител у реципиента трансплантата до или после трансплантации аллогенного трансплантата. Антитела к CD19 и композиции можно применять также для истощения продуцирующих антитела клеток из трансплантата ex vivo, до трансплантации или у донора или для профилактики GVHD и отторжения трансплантата.
5.21.Фармацевтические формы, введение и дозировки
Фармацевтические формы, предлагаемые в изобретении, содержат в качестве действующего вещества человеческие, гуманизированные или химерные антитела к CD19. Формы содержат оголенные антитела, иммуноконъюгаты или слитые белки в количестве, эффективном для получения требуемого ответа на единицу массы или объема, которые можно вводить пациенту-человеку и которые предпочтительно являются стерильными. Ответ можно оценивать, например, определяя физиологические воздействия композиции, содержащей антитело к CD19, такие как, но не ограничиваясь только ими, В-клеточное истощение в кровотоке, В-клеточное истощение в ткани, регресс В-клеточной злокачественности или снижение симптомов болезни. Другие анализы известны обычному специалисту и их можно применять для оценки уровней ответа.
5.21.1. Фармацевтические формы
Композиции антитела к CD19 можно приготавливать с использованием фармацевтически приемлемого носителя. Понятие «фармацевтически приемлемый» означает один или несколько нетоксичных материалов, которые не оказывают воздействия на уровень биологической активности действующих веществ. Такие препараты, как правило, могут содержать соли, забуферивающие агенты, консерванты, совместимые носители и необязательно другие терапевтические вещества. Указанные фармацевтически приемлемые препараты могут, как правило, содержать также совместимые твердые или жидкие наполнители, разбавители или капсулирующие субстанции, которые можно применять для введения человеку. Для применения в медицине соли должны представлять собой фармацевтически приемлемые соли, но может оказаться целесообразным применять фармацевтически неприемлемые соли для получения их фармацевтически приемлемых солей, и они не исключены из объема изобретения. Указанные фармакологически и фармацевтически приемлемые соли включают, но не ограничиваясь только ими, соли, полученные из следующих кислот: соляная, бромистоводородная, серная, азотная, фосфорная, малеиновая, уксусная, салициовая, лимонная, борная, муравьиная, малоновая, янтарная кислота и т.п. Кроме того, фармацевтически приемлемые соли можно получать в виде солей щелочных металлов или щелочноземельных металлов, такие как натриевые, калиевые или кальциевые соли. Понятие «носитель» означает органический или неорганический ингредиент, встречающийся в естественных условиях, или синтетический, с которым объединяют действующее вещество для облегчения применения. Компоненты фармацевтических композиций можно также смешивать с антителами, предлагаемыми в настоящем изобретении, и друг с другом таким образом, чтобы не происходило взаимодействия, которое может оказывать существенное влияние на фармацевтическую эффективность.
Согласно определенным объектам изобретения композиции антитела к CD19 можно получать в виде, предназначенном для хранения, путем смешения антитела или иммуноконъюгата, имеющего требуемую степень чистоты, с необязательными физиологически приемлемыми носителями, эксципиентами или стабилизаторами (Remington's Pharmaceutical Sciences, 16-ое изд., под ред. Osol A., 1999), в форме лиофилизированных препаратов или водных растворов. Приемлемые носители, эксципиенты или стабилизаторы являются нетоксичными для реципиентов в применяемых дозах и концентрациях и включают буферы, такие как фосфатный, нитратный и буферы на основе других органических кислот; антиоксиданты, включая аскорбиновую кислоту и метионин; консерванты (такие как хлорид октадецилдиметилбезиламмония; гексаметонийхлорид; бензалконийхлорид, бензетонийхлорид; фенол, бутиловый или бензиловый спирт; алкилпарабены, такие как метил- или пропилпарабен; катехол; резорцинол; циклогексанол; 3-пентанол; и мета-крезол); низкомолекулярные (состоящее менее чем примерно из 10 остатков) полипептиды; белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпиролидон; аминокислоты, такие как глицин, глутамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу или декстрины; хелатирующие агенты, такие как ЭДТК; сахара, такие как сахароза, маннит, трегалоза или сорбит; солеобразующие противоионы, такие как натрий; комплексы с металлами (например, комплексы Zn-белок); и/или неионогенные поверхностно-активные вещества, такие как TWEEN, PLURONICS™ или полиэтиленгликоль (ПЭГ).
Композиции антитела к CD19 могут содержать также необязательно приемлемые консерванты, такие как: бензалконийхлорид; хлорбутанол; парабены и тимеросал.
Целесообразно, чтобы композиции, содержащие антитело к CD19, присутствовали в виде стандартной лекарственной формы и их можно получать с помощью любых методов, хорошо известных в области фармации. Все методы включают стадию приведения действующего вещества в контакт с носителем, который представляет собой одно или несколько вспомогательных веществ. В целом, композиции, содержащие антитело к CD19, получают путем однородного и тесного приведения в контакт действующего вещества с жидким носителем, тонкоизмельченным твердым носителем или ими обоими и затем при необходимости придания продукту формы.
Композиции, пригодные для парентерального введения, могут содержать стерильный водный или неводный препарат антитела к CD19, который предпочтительно является изотоничным крови реципиента. Указанный препарат можно получать известными методами с использованием приемлемых диспергирующих или смачивающих агентов и суспендирующих агентов. Стерильный предназначенный для инъекции препарат может представлять собой стерильный предназначенный для инъекции раствор или суспензию в нетоксичном приемлемом для парентерального введения разбавителе или растворителе например, в виде раствора в 1,3-бутандиоле. Из приемлемых наполнителей, которые можно применять, следует упомянуть воду, раствор Рингера и изотоничный раствор хлорида натрия. Кроме того, стерильные нелетучие масла удобно применять в качестве растворителя или суспендирующей среды. Для этой цели можно применять любое мягкое нелетучее масло, включая синтетические моно- или диглицериды. Кроме того, в препаратах для инъекции можно применять жирные кислоты, такие как олеиновая кислота. Применяемые для приготовления препаративных форм носители, которые можно применять для орального, подкожного, внутривенного, внутримышечного и т.д. введения, описаны в Remington's Pharmaceutical Sciences, изд-во Mack Publishing Co., Easton, PA. В определенных вариантах осуществления изобретения состав носителя, пригодного для различных путей введения, может быть таким же или аналогичным описанному для RITUXAN™ (см. Справочник врача (изд-во Medical Economics Company, Inc., Montvale, NJ, cc.958-960 и 1354-1357, 2005, содержание которого полностью включено в настоящее описание в качестве ссылки). В определенных вариантах осуществления изобретения композиции, содержащие антитело к CD19, приготавливают в форме для внутривенного введения с хлоридом натрия, дигидратом цитрата натрия, полисорбатом 80 и стерильной водой, при этом значение рН композиции доводят примерно до 6,5. Специалистам в данной области очевидно, что внутривенная инъекция представляет собой пригодный путь введения благодаря тому, что прямое введение в кровоток приводит к быстрому распределению антител. Однако внутривенное введение ограничено сосудистым барьером, состоящим из эндотелиальных клеток сосудистой сети и субэндотелиального матрикса. В связи с этим сосудистый барьер является наиболее серьезной проблемой для проникновения терапевтических антител в плотные опухоли. Скорость потока крови через лимфому является относительно высокой, что определяет эффективность введения антител. Внутрилимфатический путь введения, такой как подкожная или внутримышечная инъекция или катетеризация лимфатических сосудов, также представляет собой важные средства лечения В-клеточных лимфом. В определенных вариантах осуществления изобретения антитела к CD19, которые применяют в композициях и способах, предлагаемых в изобретении, пациенты вводят себе сами подкожно. В таких вариантах осуществления изобретения композиция имеет форму лиофилизированного лекарственного средства или находится в жидком буфере (например, ЗФР и/или цитратный буфер) в концентрации примерно 50 мг/мл.
Препаративные формы, представленные в настоящем описании, могут содержать также более одного действующего вещества, если это необходимо для конкретного показания, подлежащего лечению, предпочтительно вещества с дополнительной активностью, которые не оказывают вредного воздействия друг на друга. Например, может оказаться желательным дополнительно включать иммуносупрессор. Такие молекулы могут присутствовать в комбинации в количествах, эффективных для рассматриваемой цели.
Действующие вещества можно также включать в микрокапсулы, полученные, например, методами коацервации или межфазной полимеризации, например, в гидроксиметилцеллюлозные или желатиновые микрокапсулы и поли(метилметакрилатные) микрокапсулы соответственно, в коллоидные системы для введения лекарственных средств (например, липосомы, альбуминовые микросферы, микроэмульсии, наночастицы и нанокапсулы) или в микроэмульсии. Такие методы описаны в Remington's Pharmaceutical Sciences 16-е изд., под ред. Osol A., 1980.
Препаративные формы, применяемые для введения in vivo, как правило, являются стерильными. Это легко осуществлять с помощью фильтрации через стерильные мембранные фильтры.
Можно получать препараты с замедленным высвобождением. Конкретными примерами препаратов с замедленным высвобождением являются полупроницаемые матрицы из твердых гидрофобных полимеров, содержащих антитело к CD19, эти матрицы имеют форму изделий, например, пленок или микрокапсул. Примерами матриц с замедленным высвобождением являются сложные полиэфиры, гидрогели (например, поли(2-гидроксиэтилметакрилат) или поли(виниловый спирт), полилактиды (US 3773919), сополимеры L-глуминовой кислоты и γ-этил-L-глутамата, неразложимый этиленвинилацетат, разложимые сополимеры молочной кислоты-гликолевой кислоты, такие как LUPRON DEPOT™ (предназначенные для инъекции микросферы, состоящие из сополимера молочной кислоты-гликолевой кислоты и леупролидацетата), и поли-D-(-)-3-гидроксимасляная кислота. В то время как полимеры, такие как этиленвинилацетат и молочная кислота-гликолевая кислота могут обеспечивать высвобождение молекул в течение 100 дней, из некоторых гидрогелей высвобождение белков происходит в более короткие периоды времени. Когда капсулированные антитела сохраняются в организме в течение длительного времени, они могут денатурироваться или агрегироваться в результате действия влаги при 37°С, что приводит к потере биологической активности и возможным изменениям иммуногенности. Рациональные стратегии можно создавать для стабилизации в зависимости от участвующего механизма. Например, если обнаруженный механизм агрегации включает формирование межмолекулярной S-S-связи через тио-дисульфидный обмен, то для достижения стабилизации можно модифицировать сульфгидрильные остатки, осуществлять лиофилизацию из кислых растворов, контролировать содержание влаги, применять соответствующие добавки и разрабатывать специфические композиции полимерных матриксов. В определенных вариантах осуществления изобретения фармацевтически приемлемые носители, применяемые в композициях, предлагаемых в изобретении, не оказывают воздействие на ADCC или CDC у человека.
Композиции, содержащие антитело к CD19, представленные в настоящем описании, можно приготавливать также в форме иммунолипосом. «Липосома» представляет собой небольшой пузырек, состоящий из различных типов липидов, фосфолипидов и/или поверхностно-активных веществ, которые можно применять для введения лекарственного средства (такого как антитела к CD19, представленные в настоящем описании) человеку. Компоненты липосомы можно организовывать в виде бислоя, подобно расположению липидов в биологических мембранах. Липосомы, содержащие антитела, предлагаемые в изобретении, приготавливают методами, известными в данной области, например, описанными у Epstein и др., Proc. Natl. Acad. Sci. USA, 82, 1985, с.3688; Hwang и др., Proc. Natl. Acad. Sci. USA, 77, 1980, с.4030; US 4485045 и 4544545. Липосомы с повышенным временем нахождения в кровотоке описаны в US 5013556. Наиболее предпочтительные липосомы можно получать методом выпаривания с обратной фазой с использованием липидной композиции, которая включает фосфотидилхолин, холестерин и дериватизированный ПЭГ фосфатидилэтаноламин (ПЭГ-ФЭ). Липосомы экструдируют через фильтры с определенным размером пор с получением липосом требуемого диаметра. Антитело, предлагаемое в настоящем изобретении, можно конъюгировать с липосомами согласно методу, описанному у Martin и др., J. Biol. Chem., 257, 1982, cc.286-288 путем реакции дисульфидного обмена. С липосомами можно объединять также терапевтический агент (см. Gabizon и др., J. National Cancer Inst., (19), 1989, с.1484).
Некоторые фармацевтические формы включают, но не ограничиваясь только ими:
(а) стерильный, не содержащий консерванты жидкий концентрат для внутривенного (i.v.) введения антитела к CD19, поставляемый в концентрации 10 мг/мл либо в содержащих 100 мг (10 мл), либо 500 мг (50 мл) одноразовых пузырьках. Продукт может приготавливать для i.v.-введения, используя хлорид натрия, дигидрат цитрата натрия, полисорбат и стерильную воду для инъекций. Например, можно приготавливать в 9,0 мг/мл хлориде натрия, 7,35 мг/мл дигидрата цитрата натрия, 0,7 мг/мл полисорбата 80 и стерильной воде инъекций. Значение рН доводят до 6,5;
(б) стерильный, лиофилизированный порошок в одноразовых стеклянных пузырьках для подкожной (s.c.) инъекции. Продукт можно приготавливать с использованием сахарозы, моногидрата гидрохлорида L-гистидина, L-гистидина и полисорбата 20. Например, каждый одноразовый пузырек может содержать 150 мг антитела к CD19, 123,2 мг сахарозы, 6,8 мг моногидрата гидрохлорида L-гистидина, 4,3 мг L-гистидина и 3 мг полисорбата 20. Восстановление содержимого одноразового пузырька с помощью 1,3 мл стерильной воды для инъекций позволяет получать примерно 1,5 мл раствора для введения 125 мг на 1,25 мл (100 мг/мл) антитела;
(в) стерильный, не содержащий консерванты лиофилизированный порошок для внутривенного (i.v.) введения. Продукт можно приготавливать с использованием дигидрата α-трегалозы, L-гистидина×HCl, гистидина и полисорбата 20, USP. Например, каждый пузырек может содержать 440 мг антитела к CD19, 400 мг дигидрата α,α-трегалозы, 9,9 мг L-гистидина×HCl, 6,4 мг L-гистидина и 1,8 мг полисорбата 20, USP. Восстановление с помощью 20 мл бактериостатической воды инъекций (BWFI), USP, содержащей 1,1% бензилового спирта в качестве консерванта, позволяет получать включающий несколько доз раствор, содержащий 21 мг/мл антитела, при рН примерно 6;
(г) стерильный, лиофилизированный порошок для внутривенной инфузии, в котором антитело к CD19 объединено с сахарозой, полисорбатом, моногидратом первичного кислого фосфата натрия и дигидратом вторичного кислого фосфата натрия. Например, каждый одноразовый пузырек может содержать 100 мг антитела, 500 мг сахарозы, 0,5 мг полисорбата 80, 2,2 мг моногидрата первичного кислого фосфата натрия и 6,1 мг дигидрата вторичного кислого фосфата натрия. Консерванты отсутствуют. После восстановления 10 мл стерильной воды инъекции, USP значение рН образовавшегося раствора составляет примерно 7,2;
(д) стерильный, не содержащий консерванты раствор для подкожного введения, поставляемый в виде одноразовых 1-миллилитровых предварительно заполненных шприцев. Продукт можно приготавливать с использованием хлорида натрия, дигидрата первичного кислого фосфата натрия, дигидрата вторичного кислого фосфата натрия, цитрата натрия, моногидрата лимонной кислоты, маннита, полисорбата 80 и воды инъекций, USP. Можно добавлять гидроксид натрия до доведения значения рН примерно до 5,2.
Например, каждый шприц может быть предназначен для введения 0,8 мл (40 мг) лекарственного продукта. Каждые 0,8 мл включают 40 мг антитела к CD19, 4,93 мг хлорида натрия, 0,69 мг дигидрата первичного кислого фосфата натрия, 1,22 мг дигидрата вторичного кислого фосфата натрия, 0, 24 мг цитрата натрия, 1, 04 мг моногидрата лимонной кислоты, 9,6 маннита, 0,8 мг полисорбата 80 и воду для инъекций, USP;
(е) стерильный, не содержащий консерванты, лиофилизированный порошок в одноразовом пузырьке, который восстанавливают стерильной водой для инъекций (SWFI), USP, и вводят в виде подкожной (s.c.) инъекции. Продукт можно приготавливать с использованием сахарозы, моногидрата гидрохлорида гистидина, L-гистидина и полисорбата. Например, 75-миллиграммовый пузырек может включать 129,6 мг или 112,5 мг антитела к CD19, 93,1 мг сахарозы, 1,8 мг моногидрата гидрохлорида L-гистидина, 1,2 мг L-гистидина и 0,3 мг полисорбата 20, и он предназначен для введения 75 мг антитела в 0,6 мл после восстановления 0,9 мл SWFI, USP. 150-миллиграммовый пузырек может содержать 202,5 мг или 175 мг антитела к CD19, 145,5 мг сахарозы, 2,8 мг моногидрата гидрохлорида L-гистидина, 1,8 мг L-гистидина и 0,5 мг полисорбата 20, и он предназначен для введения 150 мг антитела в 1,2 мл после восстановления 1,2 мл SWFI, USP;
(ж) стерильный, лиофилизированный продукт, предназначенный для восстановления стерильной водой для инъекций. Продукт можно приготавливать в виде одноразовых пузырьков для внутримышечной (IM) инъекции, используя маннит, гистидин и глицин. Например, каждый одноразовый пузырек может содержать 100 мг антитела к CD19, 67,5 мг маннита, 8,7 мг гистидина и 0,3 мг глицина, и он предназначен для введения 100 мг антитела в 1,0 мл при восстановлении 1,0 мл стерильной воды для инъекций. В другом примере каждый одноразовый флакон может содержать 50 мг антитела к CD19, 40,5 мг маннита, 5,2 мг гистидина и 0,2 мг глицина, и он предназначен для введения 50 мг антитела после восстановлении 0,6 мл стерильной воды для инъекций;
(з) стерильный, не содержащий консерванты раствор для внутримышечных (IM) инъекций, поставляемый в концентрации 100 мг/мл. Продукт можно приготавливать в виде одноразовых пузырьков, используя гистидин, глицин и стерильную воду инъекций. Например, каждый одноразовый пузырек может содержать 100 мг антитела, 4,7 мг гистидина и 0,1 мг глицина в объеме 1,2 мл, и он предназначен для введения 100 мг антитела в 1 мл. В другом примере каждый одноразовый флакон может содержать 50 мг антитела, 2,7 мг гистидина и 0,08 мг глицина в объеме 0,7 мл или 0,5 мл, и он предназначен для введения 50 мг антитела в 0,5 мл.
В определенных вариантах осуществления изобретения фармацевтическая композиция, предлагаемая в изобретении, является стабильной при 4°С. В определенных вариантах осуществления изобретения фармацевтическая композиция, предлагаемая в изобретении, стабильна при комнатной температуре.
5.21.2. Время полужизни антитела
В определенных вариантах осуществления изобретения время полужизни антитела к CD19, применяемого в композициях и способах, предлагаемых в изобретении, составляет по меньшей мере примерно 4-7 дней. В некоторых вариантах осуществления изобретения среднее время полужизни антитела к CD19, применяемого в композициях и способах, предлагаемых в изобретении, составляет по меньшей мере примерно 2-5, 3-6,, 4-7, 5-8, 6-9, 7-10, 8-11, 8-12, 9-13, 10-14, 11-15, 12-16, 13-17, 14-18, 15-19 или 16-20 дней. В других вариантах осуществления изобретения среднее время полужизни антитела к CD19 применяемого в композициях и способах, предлагаемых в изобретении, составляет по меньшей мере примерно 17-21, 18-22, 19-23, 20-24, 21-25, 22-26, 23-27, 24-28, 25-29 или 26-30 дней. В следующих вариантах осуществления изобретения время полужизни антитела к CD19, применяемого в композициях и способах, предлагаемых в изобретении, может составлять примерно 50 дней. В определенных вариантах осуществления изобретения время полужизни антител, применяемых в композициях и способах, предлагаемых в изобретении, можно пролонгировать с помощью методов, известных в данной области. Такая пролонгация может в свою очередь снижать количество и/или частоту введения дозы композиций антител. Антитела с увеличенным временем полужизни in vivo и методы их получения описаны в US 6277375 и в международных публикациях WO 98/23289 и WO 97/3461.
Время нахождения в сыворотке антител к CD19 in vivo можно пролонгировать также путем присоединения инертных полимерных молекул, таких как высокомолекулярный полиэтиленгликоль (ПЭГ), к антителам с применением многофункционального линкера или без него или посредством сайтспецифической конъюгации ПЭГ с N- или С-концом антител, либо через эпсилон-аминогруппы на лизильных остатках. Таким образом, следует применять дериватизацию линейным или разветвленным полимером, которая приводит к минимальной потере биологической активности. Степень конъюгации можно с достаточной точностью оценивать с помощью ДСН-ПААГ и масс-спектрометрии для гарантии правильной конъюгации молекул ПЭГ с антителами. Непрореагировавший ПЭГ можно отделять от конъюгатов антитело-ПЭГ с помощью гель-фильтрации или ионообменной хроматографии. Дериватизированные ПЭГ антитела можно оценивать в отношении связывающей активности, а также эффективности in vivo с помощью методов, известных специалистам в данной области, например, с помощью иммуноанализов, представленных в настоящем описании.
Кроме того, антитела, применяемые в композициях и способах, предлагаемых в изобретении, можно конъюгировать с альбумином для создания антитела, более стабильного in vivo или имеющего более длинное время полужизни in vivo. Эти методы хорошо известны в данной области, например, они описаны международных в публикациях WO 93/15199, WO 93/15200 и WO 01/77137 и в европейском патенте ЕР 413 622, содержание которых полностью включено в настоящее описание в качестве ссылки.
5.21.3. Введение и дозы
Введение композиций, предлагаемых в изобретении, больному человеку можно осуществлять любым путем, включая, но не ограничиваясь только ими, внутривенно, внутрикожно, трансдермально, подкожно, внутримышечно, путем ингаляции (например, в помощью аэрозоля), трансбуккально (например, подъязычно), место (т.е. через поверхность как кожи, так и слизистой, включая поверхности дыхательных путей), внутриоболочечно, внутрисуставно, интраплеврально, интрацеребрально, внутриартериально, внутрибрюшинно, орально, в лимфатическую систему, интраназально, ректально или вагинально, путем перфузии через региональный катетер или путем инъекции непосредственно в область повреждения. В одном из вариантов осуществления изобретения композиции, предлагаемые в изобретении, вводят путем внутривенного впрыскивания или внутривенной инфузии, осуществляемой в течение определенного периода времени (например, 0,5-2 ч). Композиции, предлагаемые в изобретении, можно вводить с использованием перистальтических средств или в виде депо, хотя наиболее приемлемый путь в любом случае должен зависеть, как хорошо известно в данной области, от таких факторов, как вид, возраст, пол и общее состояние индивидуума, природа и серьезность состояния, подлежащего лечению, и/или природа конкретной композиции (т.е. доза, форма), предназначенной для введения. В конкретных вариантах осуществления изобретения введение осуществляют с помощью болюса или непрерывной инфузии в течение определенного периода времени, один или два раза в неделю. В других конкретных вариантах осуществления изобретения введение осуществляют путем подкожной инъекции, необязательно один или два раза в неделю. В одном из вариантов осуществления изобретения композиции и/или способы, предлагаемые в изобретении, применяют для амбулаторного введения.
В определенных вариантах осуществления изобретения дозу композиции, содержащей антитело к CD19, определяют в таких единицах, как мг/кг веса тела пациента. В других вариантах осуществления изобретения дозу композиции, содержащей антитело к CD19, определяют в таких единицах как мг/кг тощей массы пациента (т.е. вес тела за вычетом содержания жировой массы). В следующих вариантах осуществления изобретения дозу композиции, содержащей антитело к CD19, определяют в таких единицах как мг/м площади поверхности тела пациента. И еще в одних вариантах осуществления изобретения дозу композиции, содержащей антитело к CD19, определяют в таких единицах как мг на дозу, вводимую пациенту. Для композиций и способов, предлагаемых в изобретении, можно применять любое определение дозы и стандартную дозу можно пересчитывать методами, известными в данной области.
Специалистам в данной области должно быть очевидно, что дозы можно выбирать в зависимости от многих факторов, включая возраст, пол, вид и состояние пациента (например, стадия В-клеточного злокачественного состояния), требуемого уровня клеточного истощения, заболевания, подлежащего лечению, и/или конкретного применяемого антитела или антигенсвязывающего фрагмента, и их может определять специалист в данной области. Например, эффективные количества композиций, предлагаемых в изобретении, можно экстраполировать с учетом кривых дозовой зависимости, полученных in vitro, с использованием тест-систем или на моделях, созданных с использованием животных (например, хлопковый хомяк или обезьяна). Модели и методы оценки воздействий антител известны в данной области (Wooldridge и др., Blood, 89(8), 1997, cc.2994-2998), публикация полностью включена в настоящее описание в качестве ссылки). В определенных вариантах осуществления изобретения для конкретного В-клеточного злокачественного состояния можно применять терапевтические схемы, стандартные в области терапии с использованием антител, в сочетании с композициями и способами, предлагаемыми в изобретении.
Примерами схем приема лекарственного средства, которые можно применять в способах, предлагаемых в изобретении, являются, но не ограничиваясь только ими, ежедневно, три раза в неделю (прерывисто), еженедельно или каждые 14 дней. В определенных вариантах осуществления изобретения схема приема лекарственного средства включает, но не ограничиваясь только ими, ежемесячное применение или введение каждые 6-8 недель.
Специалистам в данной области должно быть очевидно, что, как правило, в начале лечения используют более высокие дозы и/или частоту введения, чем при использовании поддерживающих режимов.
В некоторых вариантах осуществления изобретения антитела к CD19 связываются с В-клетками и могут приводить в более эффективному (т.е. при применении низкой дозы) В-клеточному истощению (как представлено в настоящем описании). Более высокую степень связывания можно достигать, если плотность человеческого CD19 на поверхности В-клеток пациента является высокой. В определенных вариантах осуществления изобретения дозы антитела (необязательно в фармацевтически приемлемом носителе, который является частью фармацевтической композиции) составляют по меньшей мере примерно 0,0005, 0,001, 0,05, 0,075, 0,1, 0,25, 0,375, 0,5, 1, 2,5, 5, 10, 20, 37,5 или 50 мг/м2 и/или менее чем примерно 500, 475, 450, 425, 400, 375, 350, 325, 300, 275, 250, 225, 200, 175, 150, 125, 100, 75, 60, 50, 37,5, 20, 15, 10, 5, 2,5, 1, 0,5, 0,375, 0,1, 0,075 или 0,01 мг/м2. В определенных вариантах осуществления изобретения применяют дозу, составляющую от примерно 0,0005 до примерно 200 мг/м, от примерно 0,001 до 150 мг/м2, примерно от 0,075 до 125 мг/м2, примерно от 0,375 до 100 мг/м2, примерно от 2,5 до 75 мг/м2, примерно от 10 до 75 мг/м2 и примерно от 20 до 50 мг/м2. В родственных вариантах осуществления изобретения применяют дозу антитела к CD19, составляющую по меньшей мере примерно 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1, 1,5, 2, 2,5, 3, 3,5, 4, 4,5, 5, 5,5, 6, 6,5, 7, 7,5, 8, 8,5, 9, 9,5, 10, 10,5, 11, 11,5, 12, 12,5, 13, 13,5, 14, 14,5, 15, 15,5, 16, 16,5, 17, 17,5, 18, 18,5, 19, 19,5, 20, 20,5 мг/кг веса тела пациента. В некоторых вариантах осуществления изобретения применяют дозу оголенного антитела к CD19, составляющую по меньшей мере примерно 1-10, 5-15, 10-20 или 15-25 мг/кг веса тела пациента. В некоторых вариантах осуществления изобретения применяют дозу антитела к CD19, составляющую по меньшей мере примерно 1-20, 3-15 или 5-10 мг/кг веса тела пациента. В других вариантах осуществления изобретения применяют дозу антитела к CD19, составляющую по меньшей мере примерно 5, 6, 7, 8, 9 или 10 мг/кг веса тела пациента. В определенных вариантах осуществления изобретения однократная стандартная доза антитела (необязательно в фармацевтически приемлемом носителе, который является частью фармацевтической композиции) может составлять по меньшей мере примерно 0,5, 1, 2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28, 30, 32, 34, 36, 38, 40, 42, 44, 46, 48, 50, 52, 54, 56, 58, 60, 62, 64, 66, 68, 70, 72, 74, 76, 78, 80, 82, 84, 86, 88, 90, 92, 94, 96, 98, 100, 102, 104, 106, 108, 110, 112, 114, 116, 118, 120, 122, 124, 126, 128, 130, 132, 134, 136, 138, 140, 142, 144, 146, 148, 150, 152, 154, 156, 158, 160, 162, 164, 166, 168, 170, 172, 174, 176, 178, 180, 182, 184, 186, 188, 190, 192, 194, 196, 198, 200, 204, 206, 208, 210, 212, 214, 216, 218, 220, 222, 224, 226, 228, 230, 232, 234, 236, 238, 240, 242, 244, 246, 248 или 250 мкг/м2. В других вариантах осуществления изобретения доза составляет вплоть до 1 г на однократную стандартную дозу.
Все вышеуказанные дозы приведены в качестве примера и их можно использовать в сочетании с композициями и способами, предлагаемыми в изобретении, однако, когда антитело к CD19 применяют в сочетании с токсином или радиотерапевтическим агентом, то предпочтительными могут оказаться более низкие дозы. В определенных вариантах осуществления изобретения в случаях, когда пациент имеет низкую плотность CD19, можно применять более низкие по сравнению с описанными дозы.
В определенных вариантах осуществления изобретения, когда применяют химерные антитела к CD19, доза или количество химерного антитела составляет более чем примерно 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15 или 16 мг/кг веса тела пациента. В других вариантах осуществления изобретения, когда применяют химерные антитела к CD19, доза или количество химерного антитела составляет менее чем примерно 1, 0,9, 0,8, 0,7, 0,6, 0,5, 0,4, 0,3, 0,2 или 0,1 мг/кг веса тела пациента.
В некоторых вариантах способов, предлагаемых в настоящем изобретении, антитела и/или композиции, предлагаемые в настоящем изобретении, можно вводить в дозе ниже чем примерно 375 мг/м2; дозе ниже чем примерно 37,5 мг/м2; дозе ниже чем примерно 0,375 мг/м2; и/или в дозе от примерно 0,075 до примерно 125 мг/м2. В определенных вариантах способов, предлагаемых в изобретении, схемы приема лекарственного средства включают применение низких доз, которые вводят через повторяющиеся интервалы. Например, в одном из вариантов осуществления изобретения композиции, предлагаемые в изобретении, можно вводить в дозе ниже чем примерно 375 мг/м2 с интервалами примерно каждые 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25, 30, 35, 40, 45, 50, 60, 70, 80, 90, 100, 125, 150, 175 или 200 дней.
Указанная доза может вызывать В-клеточное истощение у человека, которого лечат с помощью композиций и способов, предлагаемых в изобретении, в течение по меньшей мере примерно 1, 2, 3, 5, 7, 10, 14, 20, 30, 45, 60, 75, 90, 120, 150 или 180 дней или более. В определенных вариантах осуществления изобретения происходит истощение пре-В-клеток (которые не экспрессируют поверхностный иммуноглобулин). В определенных вариантах осуществления изобретения происходит истощение зрелых В-клеток (которые экспрессируют поверхностный иммуноглобулин). В других вариантах осуществления изобретения может происходить истощение незлокачественных типов В-клеток. Любые эти типы В-клеток можно применять для оценки В-клеточного истощения. В-клеточное истощение можно оценивать в общей воде организма, такой как сыворотка крови, или тканях, таких как костный мозг. В определенных вариантах способов, предлагаемых в изобретении, В-клеточное истощение составляет по меньшей мере 30%, 40%, 50%, 60%, 70%, 80%, 90% или 100% по сравнению с уровнем В-клеток у пациента, которого подвергали лечению до применения композиций и способов, предлагаемых в изобретении. В других вариантах осуществления способов, предлагаемых в изобретении, В-клеточное истощение составляет по меньшей мере 30%, 40%, 50%, 60%, 70%, 80%, 90% или 100% по сравнению с обычными стандартными уровнями В-клеток у человека. В родственных вариантах осуществления изобретения типичные стандартные уровни В-клеток у человека определяют у пациентов, сопоставимых с обработанными пациентами, с точки зрения возраста, пола, веса и других факторов.
В определенных вариантах осуществления изобретения доза, составляющая примерно 125 мг/м2 или менее антитела или антигенсвязывающего фрагмента, приводит к В-клеточному истощению в течение периода, составляющего по меньшей мере примерно 7, 14, 21, 30, 45, 60, 90, 120, 150 или 200 дней. В другом репрезентативном варианте осуществления изобретения доза, составляющая примерно 37,5 мг/м2 или менее, приводит к В-клеточному истощению в течение периода, составляющего по меньшей мере примерно 7, 14, 21, 30, 45, 60, 90, 120, 150 или 200 дней. В других вариантах осуществления изобретения доза, составляющая примерно 0,375 мг/м2 или менее, приводит к В-клеточному истощению в течение периода, составляющего по меньшей мере примерно 7, 14, 21, 30, 45 или 60 дней. В другом варианте осуществления изобретения доза, составляющая примерно 0,075 мг/м2 или менее, приводит к В-клеточному истощению в течение периода, составляющего по меньшей мере примерно 7, 14, 21, 30, 45, 60, 90, 120, 150 или 200 дней. В следующих вариантах осуществления изобретения, доза, составляющая примерно 0,01, 0,005 или даже 0,001 мг/м2 или менее, приводит к В-клеточному истощению в течение периода, составляющего по меньшей мере примерно 3,5, 7, 10, 14, 21, 30, 45, 60, 90, 120, 150 или 200 дней. Согласно этим вариантам осуществления изобретения дозу можно вводить любым приемлемым путем, но необязательно ее вводят подкожно.
Согласно другому объекту изобретения для достижения В-клеточного истощения и/или лечения В-клеточных нарушений можно применять более низкие дозы антител или фрагментов антител по сравнению с применяемыми в доступных к настоящему времени методах. Таким образом, другим вариантом осуществления изобретения является способ истощения В-клеток и/или лечения В-клеточного нарушения, заключающийся в том, что вводят человеку в эффективном количестве антитело, которое специфически связывается с CD19, при этом доза, составляющая примерно 500, 475, 450, 425, 400, 375, 350, 325, 300, 275, 250, 225, 200, 175, 150, 125, 100, 75, 60, 50, 37,5, 20, 10, 5, 2,5, 1, 0,5, 0,375, 0,25, 0,1, 0,075, 0,05, 0,001, 0,0005 мг/м2 или менее приводит к истощению В-клеток (находящихся в кровотоке и/или в ткани В-клеток) на 25%, 35%, 50%, 60%, 75%, 80%, 85%, 90%, 95%, 98% или более в течение периода времени, составляющего по меньшей мере примерно 3, 5, 7, 10, 14, 21, 30, 45, 60, 75, 90, 120, 150, 180 или 200 дней или более. В репрезентативных вариантах осуществления изобретения доза примерно 125 или 75 мг/м2 или менее приводит по меньшей мере примерно к 50%, 75%, 85% или 90%-ному истощению В-клеток в течение по меньшей мере примерно 7, 14, 21, 30, 60, 75, 90, 120, 150 или 180 дней. В других вариантах осуществления изобретения доза примерно 50, 37,5 или 10 мг/м2 приводит по меньшей мере примерно к 50%, 75%, 85% или 90%-ному истощению В-клеток в течение по меньшей мере примерно 7, 14, 21, 30, 60, 75, 90, 120 или 180 дней. В других вариантах осуществления изобретения доза примерно 0,375 или 0,1 мг/м2 приводит по меньшей мере примерно к 50%, 75%, 85% или 90%-ному истощению В-клеток в течение по меньшей мере примерно 7, 14, 21, 30, 60, 75 или 90 дней. В дополнительных вариантах осуществления изобретения доза примерно 0,075, 0,01, 0,001 или 0,0005 мг/м2 приводит по меньшей мере примерно к 50%, 75%, 85% или 90%-ному истощению В-клеток в течение по меньшей мере примерно 7, 14, 21, 30 или 60 дней.
В определенных вариантах осуществления изобретения дозу можно повышать или снижать для поддержания постоянной дозы в крови или ткани, такой как, но не ограничиваясь только им, костный мозг. В родственных вариантах осуществления изобретения дозу повышают или снижают примерно на 2%, 5%, 8%, 10%, 15%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% и 95% для того, чтобы поддерживать определенный уровень антитела, применяемого в композициях и способах, предлагаемых в изобретении.
В определенных вариантах осуществления изобретения дозу можно регулировать и/или скорость инфузии можно снижать в зависимости от иммуногенного ответа пациента на композиции и способы, предлагаемые в изобретении.
Согласно одному из варианту способов, предлагаемых в изобретении, сначала можно вводить ударную дозу антитела к CD19 и/или композиции, предлагаемой в изобретении, а затем использовать поддерживающую дозу вплоть до начала прогрессирования подлежащего лечению В-клеточного злокачественного состояния или затем использовать определенный курс лечения (например, CAMPATH™, MYLOTARG™ или RITUXAN™, в последнем случае пациентов обрабатывают определенным количеством доз, которые повышают при получении дополнительных данных).
Согласно другому варианту способов, предлагаемых в изобретении, пациента можно предварительно лечить с использованием композиций и способов, предлагаемых в изобретении, для выявления минимального иммунного ответа или минимальных побочных действий композиций и способов, предлагаемых в изобретении.
5.21.4. Оценка токсичности
Переносимость, токсичность и/или эффективность композиций и/или лечебных схем, предлагаемых в настоящем изобретении, можно определять с помощью стандартных фармацевтических процедур с использованием культур клеток или экспериментальных животных, например, для определения LD50 (доза, летальная для 50% популяции), и ED50 (доза, обладающая терапевтической эффективностью для 50% популяции), и ID50 (доза, при применении которой достигается 50%-ное ингибирование). В одном из вариантов осуществления изобретения доза представляет собой дозу, при использовании которой достигается по меньшей мере 60%, 70%, 80%, 90%, 95% или 99%-ое истощение находящихся в кровотоке В-клеток или находящегося в кровотоке иммуноглобулина, или их обоих. Соотношение токсических и терапевтических воздействий представляет собой терапевтический индекс и его можно выражать в виде отношения LD50/ED50. Предпочтительными могут являться терапии, характеризующиеся высокими терапевтическими индексами. При применении терапий, сопровождающихся токсическими побочными действиями, внимание следует уделять созданию системы введения для направленного воздействия таких агентов на CD19-экспрессирующие клетки с целью минимизации потенциального повреждения CD19-негативных клеток и тем самым снижения побочных действий.
Данные, полученные в анализах на клеточных культурах и в опытах на животных, можно применять для разработки диапазонов доз композиций и/или схем лечения для применения на человеке. Доза указанных агентов может находиться в диапазоне концентраций в кровотоке, которые включают ED50, не обладающие или обладающие низкой токсичностью. Доза может варьироваться в этом диапазоне в зависимости от применяемой лекарственной формы и применяемого пути введения. При применении любой терапии, в которой используют способы, предлагаемые в изобретении, терапевтически эффективную дозу можно определять на соответствующих созданных на животных моделях. В зависимости от вида животного-модели дозу можно пересчитывать на дозу для человека согласно принятым в данной области формулам расчета, например, представленных у Freireich и др., Quantitative comparison oftoxicity ofanticancer agents in mouse, rat, monkey, dog, and human, Cancer Chemotherapy Reports, NCI, 40, 1966, cc.219-244. Полученные на клеточных культурах данные могут быть ценными для прогнозирования возможной токсичности. Опыты на животных можно проводить для создания препаративных форм для конкретной дозы, предназначенных для достижения концентрации в плазме крови, которая включает IC50 (т.е. концентрацию тестируемого соединения, при применении которой достигается ингибирование симптомов, составляющее половину от максимального), определенную на клеточной культуре. Указанную информацию можно применять для более точного определения доз, которые можно применять для человека. Уровни лекарственного средства в плазме можно оценивать, например, с помощью жидкостной хроматографии высокого разрешения, ELISA или клеточных анализов.
5.22. Диагностирование пациентов, определение стадии заболевания и терапевтические схемы
Онкология
Согласно определенным объектам настоящего изобретения схему лечения и дозу, в которой применяют композиции и способы, предлагаемые в изобретении, выбирают на основе ряда факторов, включая, но не ограничиваясь только ими, стадию В-клеточного заболевания или нарушения, подлежащего лечению. Специалист в данной области может определять приемлемые схемы лечения для конкретных стадий В-клеточного заболевания или нарушения у пациента или популяции пациентов. Кривые дозовой зависимости можно создавать с помощью стандартных для данной области протоколов для того, что определять эффективное количество композиций, предлагаемых в изобретении, для лечения пациентов, которые имеют различные стадии В-клеточного заболевания или нарушения. В целом, для пациентов с более продвинутыми стадиями В-клеточного заболевания или нарушениями требуются более высокие дозы и/или более частое введение доз, которые можно вводить в течение более длительных периодов времени по сравнению с теми, которые используют для пациентов с более ранней стадией В-клеточного заболевания или нарушения.
Антитела к CD19, композиции и способы, предлагаемые в изобретении, можно применять на практике для лечения В-клеточных заболеваний, включая В-клеточные злокачественные состояния. Понятие «В-клеточное злокачественное состояние» включает любое злокачественное состояние, связанное с клеткой В-клеточной линии. Примерами В-клеточных злокачественных состояний являются, но не ограничиваясь только ими: не-ходжкинская лимфома (NHL) В-клеточного подтипа, включая низкой степени злокачественности/фолликулярную NHL, NHL малых лимфоцитов (SL), средней степени злокачественности/фолликулярную NHL, средней степени злокачественности диффузную NHL, высокозлокачественную и иммунобластную NHL, высокозлокачественную лимфобластную NHL, высокозлокачественную NHL малых клеток с нерасщепленными ядрами; лимфома из клеток мантии и повсеместная NHL; лимфома Беркитта; множественная миелома; пре-В-клеточный острый лимфобластный лейкоз и другие злокачественные состояния, связанные с ранними предшественниками В-клеток; общий острый лимфолейкоз (ALL); хронический лимфолейкоз (CLL), включая CLL с мутированным статусом гена иммуноглобулина и CLL с немутированным статусом гена иммуноглобулина; волосковоклеточный лейкоз; острый лимфобластный лейкоз нуль-клеточного типа; Вальденстрема макроглобулинемия; диффузная В-клеточная крупноклеточная лимфома (DLBCL), включая тип DLBCL из В-клеток герминального центра (GCB), тип DLBCL из активированных В-клеток (АВС) и тип 3 DLBCL; про-лимфолейкоз; болезнь легких цепей; плазмацитома; остеосклеротическая миелома; лейкоз плазматических клеток; моноклональная гаммапатия неустановленной этиологии (MGUS); сливающаяся множественная миелома (SMM); индолентная множественная миелома (IMM); лимфома Ходжкина, включая лимфому классического типа и узелковую с лимфоидным преобладанием; лимфоплазмацитоидная лимфома (LPL); лимфома маргинальной зоны, включая лимфому ассоциированной со слизистой желудка лимфоидной ткани (MALT).
В другом варианте осуществления изобретения его можно применять для лечения связанных со зрелыми В-клетками злокачественных состояний (т.е. экспрессирующих Ig на клеточной поверхности), включая, но, не ограничиваясь только ими, фолликулярную лимфому, лимфому из клеток мантии, лимфому Беркитта, множественную миелому, диффузную В-клеточную крупноклеточную лимфому (DLBCL, включая тип DLBCL из В-клеток герминального центра (GCB), тип DLBCL из активированных В-клеток (АВС) и тип 3 DLBCL, лимфому Ходжкина, включая лимфому классического и узелковую с лимфоидным преобладанием, лимфоплазмацитоидную лимфому, лимфому маргинальной зоны, включая лимфому ассоциированной со слизистой желудка лимфоидной ткани (MALT), и хронический лимфолейкоз (CLL), включая CLL с мутированным статусом гена иммуноглобулина и CLL с немутированным статусом гена иммуноглобулина.
Кроме того, CD19 экспрессируется на более ранних стадиях развития В-клеток, чем, например, CD20, и поэтому это можно использовать прежде всего для лечения связанных с пре-В-клетками и незрелыми В-клетками злокачественных состояний (т.е. клетками, которые не экспрессируют Ig на клеточной поверхности), например, в костном мозге. Приведенные в качестве примера связанные с пре-В-клетками и незрелыми В-клетками злокачественные состояния включают, но не ограничиваясь только ими, острый лимфобластный лейкоз.
В других конкретных вариантах осуществления изобретения можно применять на практике для лечения экстранодальных опухолей.
5.21.1. Диагностика и определение стадии заболевания В-клеточных злокачественных состояний
Развитие рака, такого как В-клеточное заболевание или нарушение, приводящее к образованию опухоли (например, не-ходжкинская лимфома, диффузная В-клеточная крупноклеточная лимфома, фолликулярная лимфома и лимфома Беркитта), как правило, характеризуют по степени распространения рака в организме, и часто разделяют на следующие четыре стадии в зависимости от прогноза исхода. Стадия I: рак локализован в конкретной ткани и не распространяется в лимфатические узлы. Стадия II: рак распространился в ближайшие лимфатические узлы, т.е. образует метастазы. Стадия III: рак обнаружен в лимфатических узлах в областях организма, удаленных от исходной ткани, и может содержать массивные или не одну, а множественные опухоли. Стадия IV: Рак распространился в отдаленную часть организма. Стадию рака можно определять путем клинических обследований и с помощью методов оценки, известных специалистам в данной области. Описанные выше стадии рака традиционно применяют в сочетании с клинической диагностикой рака, характеризующегося формированием опухоли, и их можно применять в сочетании с композициями и способами, предлагаемыми в настоящем изобретении, при лечении В-клеточных заболеваний и нарушений. Как правило, ранняя стадия болезни означает, что болезнь остается локализованной в конкретной области организма пациента или не метастазирует.
Касательно не связанных с образованием опухоли В-клеточных заболеваний и нарушений, таких как, но не ограничиваясь только ими, множественная миелома, критерии определения стадии заболевания являются другими. Широко используют систему стадий Дюри-Салмон (Dune-Salmon). В этой системе стадий клиническую стадию болезни (стадия I, II или III) определяют на основе нескольких измерений, включая уровни белка М, количество литических повреждений кости, уровни гемоглобина и уровни кальция в сыворотке. Стадии дополнительно подразделяются в зависимости от ренальной (почечной) функции (классифицируются как А или Б). Согласно системе стадий Дюри-Сальмон стадия I в системе стадий (низкая клеточная масса) полностью характеризуется следующими параметрами: уровень гемоглобина >10 г/дл; уровень кальция в сыворотке нормальный или ≤12 мг/дл; рентгеноскопия кости свидетельствует о нормальной структуре кости (балл 0) или только о наличии единичных костных плазмацитом; и низкая скорость образования М-компонента: уровень IgG<5 г/дл, уровень IgA<3 г/дл, уровень белка Бенса Джонса<4 г/24 ч. У пациентов, имеющих стадией I, как правило, не обнаружены поражения или симптомы в родственном органе или ткани. Стадия II (средний уровень клеточной массы) характеризуется тем, что не соответствует ни стадии I, ни стадии III. Стадия III (высокий уровень клеточной массы) характеризуется тем, что удовлетворяет одному или нескольким следующим параметрам: уровень гемоглобина <8.5 г/дл; уровень кальция в сыворотке >12 мг/дл; прогрессирующие литические повреждения кости (балл 3); высокая скорость образования М-компонента: уровень IgG>7 г/дл, уровень IgA>5 г/дл, уровень белка Бенса Джонса >12 г/24 ч; подклассификация (либо А, либо Б), где А соответствует относительно нормальной почечной функции (уровень креатинина в сыворотке <2,0 мг/дл), а Б соответствует аномальной почечной функции (уровень креатинина в сыворотке >2,0 мг/дл).
Другой системой стадий для миелом является международная система стадий (стадирования) (ISS) миелом. Эта система позволяет более эффективно отличать группы стадий, и она основана на ранней оценке уровней бета-2-микроглобулин (β2-М) и альбумина в сыворотке. Согласно ISS для миеломы, стадия I характеризуется уровнем β2-М<3,5 и альбумина ≥3,5, стадия II характеризуется уровнем β2-М<3,5 и альбумина <3,5 или β2-М 3,5-5,5, а стадия III характеризуется уровнем β2-M>5,5 (Multiple Myeloma Research Foundation, Нью-Канаан, шт.Коннектикут).
Стадию В-клеточного злокачественного состояния у пациента определяют в клинических условиях. Как указано выше касательно плотных опухолей, распространение, локализация и количество опухолей являются первичными факторами в клиническом определении стадии. Определение стадии у пациентов, страдающих не образующими опухолей В-клеточными злокачественными состояниями, может быть более комплексным с необходимостью определения уровней в сыворотке, как указано выше.
Определение стадий В-клеточных заболеваний и нарушений не ограничено вышеуказанными. Другие известные в данной области характеристики для диагностики В-клеточных заболеваний и нарушений можно применять в качестве критериев для определения у пациентов стадий В-клеточных заболеваний или нарушений.
5.22.2. Клинические критерии для диагностирования В-клеточных злокачественных состояний
Диагностические критерии для различных В-клеточных злокачественных состояний известны в данной области. Исторически диагноз, как правило, был основан на комбинации микроскопических данных и иммунофенотипа. В последнее время методы молекулярной биологии, такие как определение профиля генной экспрессии, начали применять для характеризации В-клеточных злокачественных состояний на молекулярном уровне (см., например, Shaffer и др., Nature 2, 2002, cc.920-932). Примеры методов клинической диагностики конкретных В-клеточных злокачественных состояний представлены ниже. Другие пригодные методы должны быть очевидны специалистам в данной области.
5.22.2.1. Фолликулярная NHL
Как правило, основная часть NHL (за исключением лимфомы из клеток мантии) имеют высокомутированный статус генов иммуноглобулина, что, вероятно, является результатом соматической гипермутации (SHM). Наиболее часто встречающимися генетическим аномалиями при NHL являются транслокации и мутации гена BCL6.
Фолликулярная NHL часто представляет собой индолентную В-клеточную лимфому с фолликулярной схемой роста. Это вторая из наиболее распространенных лимфом в Соединенных Штатах и Западной Европе. Средний возраст больных, у которых обнаружено это заболевание, составляет 60 лет и при этом несколько чаще оно встречается у женщин. Безболезненная лимфаденопатия является наиболее общим симптомом. Анализы часто свидетельствуют о поражении болезнью костного мозга и иногда периферической крови. Фолликулярную NHL разделяют на цитологические стадии на основе доли крупных клеток в фолликулах с непрерывной градацией от фолликулярных мелких клеток с расщепленными ядрами до преобладания крупных клеток (см., Freedman и др., Follicular Lymphoma, cc.367-388, в: Non-Hodgkin's Lymphomas, под ред. Р.Mauch и др., изд-во Lippincott Williams & Wilkins, Philadelphia, PA, 2004; Т.Lister и др., Follicular Lymphoma, cc.309-324, в: Malignant Lymphoma, под ред. В.Hancock и др., изд-во Oxford University Press, New York, N.Y., 2000).
Наиболее часто фолликулярная NHL характеризуется транслокацией между хромосомами 14 и 18, приводящей к сверхэкспрессии BCL2. Фолликулярная NHL характеризуется как наличием SHM, так и распространением SHM, и профилем генной экспрессии, сходным с профилем В-клеток герминального центра (GC) (см., например, Shaffer и др., Nature 2, 2002, cc.920-932), которые представляют собой клетки, которые, вероятно, являются исходными для этого злокачественного состояния. Типичными являются перестановки в тяжелых и легких цепях. Опухолевые клетки при этом заболевании экспрессируют моноклональный поверхностный иммуноглобулин, прежде всего экспрессируют IgM. Практически все опухолевые клетки при фолликулярной NHL экспрессируют антигены CD19, CD20, CD22, CD79a, CD21, CD35 и CD10, но в них отсутствует экспрессия CD5 и CD43. В костном мозге обнаружена паратрабекулярная инфильтрация мелких клеток с расщепленными ядрами (см., Freedman и др., Follicular Lymphoma, cc.367-388, в: Non-Hodgkin's Lymphomas, под ред. Р.Mauch и др., изд-во Lippincott Williams & Wilkins, Philadelphia, PA, 2004; Т.Lister и др., Follicular Lymphoma, cc.309-324, в: Malignant Lymphoma, под ред. В.Hancock и др., изд-во Oxford University Press, New York, N.Y., 2000).
Диагностика фолликулярной NHL, как правило, основана на биопсии, полученной из лимфатического узла, которую проводят с целью оценки архитектуры и цитологических особенностей. Аспирации тонкой иглой обычно не позволяют получать соответствующий результат, поскольку эта процедура является менее эффективной с позиций получения достаточного количества ткани для дополнительных анализов. Показаны также билатеральные биопсии костного мозга, поскольку они позволяют получать бляшку. Дополнительные диагностические процедуры включают рентгеноскопию грудной клетки, компьютерную топографию (КТ) грудной клетки, живота, шеи и тазовой области, определение полного анализа крови и химического профиля. Проточную цитометрию и иммуногистохимию можно применять для проведения различия между фолликулярной NHL и другими связанными со зрелыми В-клетками лимфомами (см., Freedman и др., Follicular Lymphoma, cc.367-388, в: Non-Hodgkin's Lymphomas, под ред. P.Mauch и др., изд-во Lippincott Williams & Wilkins, Philadelphia, PA, 2004; Т. Lister и др., Follicular Lymphoma, cc.309-324, в: Malignant Lymphoma, под ред. В.Hancock и др., изд-во Oxford University Press, New York, N.Y., 2000).
5.22.2.2. Лимфома из клеток мантии
Лимфома из клеток мантии локализована в мантийной зоне вторичных фолликулов и характеризуется узелковой и/или диффузной схемой роста. Средний возраст пациентов, у которых обнаружена лимфома из клеток мантии, составляет 60-65 лет, и это заболевание поражает в основном мужчин. Наиболее распространенным признаком, применяемым для диагностики, является генерализованная лимфаденопатия. Кроме того, часто увеличена селезенка. Эта В-клеточная лимфома ассоциирована с t(11;14) между локусом IgH и геном циклина D1, что приводит к сверхэкспрессии циклина D1. Более чем в 50% случаев встречаются дополнительные хромосомные аномалии. Лимфома из клеток мантии, как правило, не характеризуется наличием SHM. (см., W.Hiddemann и др., Mantle Cell Lymphoma, cc.461-476, в: Non-Hodgkin's Lymphomas, под ред. P.Mauch и др., изд-во Lippincott Williams & Wilkins, Philadelphia, PA, 2004; D. Weisenburger и др., Mantle Cell Lymphoma, cc.28-41, в: Malignant Lymphoma, под ред. В.Hancock и др., изд-во Oxford University Press, New York, N.Y., 2000).
Иммунофенотипирующая (проточная цитометрия или в замороженных срезах) иммуногистохимия клеток лимфомы из клеток мантии свидетельствует о том, что они практически все являются моноклональными, несущими на поверхности IgM. Установлено также, что клетки лимфомы из клеток мантии несут поверхностный IgD. Клетки экспрессируют антигены CD19, CD20, CD22 и CD24, но не CD23. Они экспрессируют также поверхностные антигены CD5, но не CD10, что является их отличительным признаком от лимфом из клеток фолликулярного центра лимфатических узлов, которые практически всегда являются CD5-негативными. Часто обнаружено включение экстранодальной области, включая инфильтрацию костного мозга и опухоли печени и желудочно-кишечного тракта. Слабая анемия и увеличение лейкоза не являются редкими при лимфоме из клеток мантии (см. A.Lal и др., Role of Fine Needle Aspiration in Lymphoma, cc.181-220, в: Hematopathology in Oncology, под ред. W.Finn и др., изд-во Kluwer Academic Publishers, Norwell, MA, 2004; W.Hiddemann и др., Mantle Cell Lymphoma, cc.461-476, в: Non-Hodgkin's Lymphomas, под ред. Р.Mauch и др., изд-во Lippincott Williams & Wilkins, Philadelphia, PA, 2004).
Диагностирование лимфомы из клеток мантии включает оценку периферической крови, а также биопсию костного мозга и лимфатических узлов. Кроме того, для дифференциального диагноза можно применять цитогенетические исследования и иммунофенотипирование (см. W.Hiddemann и др., Mantle Cell Lymphoma, cc.461-476, в: Non-Hodgkin's Lymphomas, под ред. Р.Mauch и др., изд-во Lippincott Williams & Wilkins, Philadelphia, PA, 2004; D. Weisenburger и др., Mantle Cell Lymphoma, cc.28-41, в: Malignant Lymphoma, под ред. В.Hancock и др., изд-во Oxford University Press, New York, N.Y., 2000).
5.22.2.3. Лимфома Беркитта
Лимфома Беркитта представляет собой агрессивную В-клеточную лимфому, как правило, встречающуюся у детей и молодых людей, и ее обычно ассоциируют с комплексным заболеванием челюстей и/или живота. Примерно у 20% пациентов затронут костный мозг. Эндемической формой лимфомы Беркитта является заражение вирусом Эпштейна-Барра (EBV) злокачественных клеток; спорадическая форма не зависит от заражения EBV. Для этой болезни характерна транслокация c-myc в локус иммуноглобулина, что приводит к нарушению регуляции гена c-myc (t(8;14)(q24;q32)). Важно отметить, что делеция последовательностей c-myc, вероятно, принимает участие в спорадической форме заболевания, для эндемической формы характерно наличие точковых мутаций или инсерций (см., V.Рарра и др., Molecular Biology, cc.133-157, в: Malignant Lymphoma, под ред. В.Hancock и др., изд-во Oxford University Press, New York, N.Y., 2000). Для лимфомы Беркитта характерны также SHM, а злокачественные клетки имеют профиль генной экспрессии, сходный с профилем В-клеток GC, что позволяет предположить, что это злокачественное состояние происходит из В-клеток GC.
Иммунофенотипирование лимфомы Беркитта показывает, что при этом заболевании клетки экспрессируют CD19, CD20, CD22 и CD79a, но не экспрессируют CD5, CD23, циклин D или концевую дезоксинуклеотидил-трансферазу. Часто эти клетки являются позитивными по CD10 и BCL6 и обычно негативными по BCL2 (см. I.Magrath и др., Burkitt's Lymphoma, cc.477-501, в: Non-Hodgkin's Lymphomas, под ред. Р.Mauch и др., изд-во Lippincott Williams & Wilkins, Philadelphia, PA, 2004).
Высокозлокачественная В-клеточная напоминающая лимфому Беркитта лимфома представляет собой лимфому, пограничную между лимфомой Беркитта и В-клеточной крупноклеточной лимфомой. Клетки этой лимфомы экспрессируют CD19, CD20, и CD22, но экспрессия CD10, что практически всегда характерно для истинной лимфомы Беркитта, часто отсутствует. На основе этой и некоторых других характерных особенностей можно в определенной степени предположить, что эту лимфому можно классифицировать как диффузную В-клеточную крупноклеточную лимфому (см., К.Maclennan, Diffuse Aggressive В cell Lymphoma, cc.49-54, в: Malignant Lymphoma, под ред. В.Hancock и др., изд-во Oxford University Press, New York, N.Y., 2000).
Диагностирование лимфомы Беркитта обычно основано на выявлении транслокации, ассоциированной с этой лимфомой; таким образом, как правило, осуществляют принятый цитогенетический анализ. Описано применение ПЦР протяженных фрагментов и флуоресцентной in situ гибридизации (FISH) для выявления стыков Ig-myc в транслокациях и других генетических изменений, ассоциированных с этим заболеванием (см., R.Siebert и др., Blood 91, 1998, cc.984-990; Т.Denyssevych и др., Leukemia, 16, 2002, cc.276-283).
5.22.2.4. Диффузная В-клеточная крупноклеточная лимфома (DLBCL)
DLBCL представляет собой наиболее распространенную не-ходжкинскую лимфому, и она может возникать из В-клеточной мелкоклеточной лимфомы, фолликулярной лимфомы или лимфомы маргинальной зоны. Как правило, для пациентов характерна лимфаденопатия; однако у большего процента пациентов опухоль присутствует также в экстранодальных областях, при этом наиболее часто затрагивает желудочно-кишечный тракт. Поражение костного мозга обнаружено примерно у 15% пациентов (см. Armitage и др., Diffuse Large В cell Lymphoma, cc., 427-453, в: Non-Hodgkin's Lymphomas, под ред. Р.Mauch и др., изд-во Lippincott Williams & Wilkins, Philadelphia, PA, 2004).
Гетерогенность клинических, биологических и морфологических характеристик затрудняет дополнительную классификацию этой группы лимфом. Однако идентифицировано две различные подгруппы, одна из которых экспрессирует гены, характерные для В-клеток герминального центра (GC-DLBCL), а другая сверхэкспрессирует гены в В-клетках периферической крови. Коэффициент выживаемости существенно лучший для пациентов с GC-DLBCL, чем для пациентов, страдающих DLBCL из активированных В-клеток (ABC)-DLBCL (см. W.Chan, Archives of Pathology and Laboratory Medicine 128(12), 2004, cc.1379-1384).
DLBCL экспрессируют на клеточной поверхности антигены CD19, CD20, CD22 и CD79a. CD10 экспрессируется в огромном большинстве случаев, экспрессия CD5 обнаружена примерно в 10% случаев (см. К.Maclennan, Diffuse Aggressive В cell Lymphoma, cc.49-54, в: Malignant Lymphoma, под ред. В.Hancock и др., изд-во Oxford University Press, New York, N.Y., 2000). DLBCL часто характеризуется аномалиями в BCL6 и/или транслокациями BCL2 в локус IgH. GC-B-клеткам подобная (GC) DLBCL характеризуется SHM с высокомутированным статусом генов иммуноглобулина и распространением SHM в злокачественные клоны с подобным GC-B-клеткам профилем экспрессии. Для большинства GC-DLBCL характерно переключение класса иммуноглобулина. ABC-DLBCL характеризуется высоким уровнем экспрессии генов-мишеней NF-кВ, включая BCL2, интерферон-регулирующего фактора 4, CD44, FLIP и циклина D. Присутствует SHM, но не распространяющаяся SHM, a для ABC-DLBCL не характерен GC-B-клеточный профиль генной экспрессии. Почти всегда при ABC-DLBCL происходит экспрессия высоких уровней IgM.
5.22.2.5. Экстранодальная лимфома маргинальной зоны
Экстранодальная лимфома маргинальной зоны представляет собой экстранодальную лимфому, локализованную в органах, в которых в норме отсутствует организованная лимфоидная ткань (например, желудок, слюнные железы, легкие и щитовидные железы). Главным образом, это заболевание поражает престарелых людей, средний возраст которых составляет свыше 60 лет.Часто хроническое воспаление или аутоиммунные процессы предшествуют развитию лимфомы. Лимфома, ассоциированная со слизистыми оболочками (MALT) желудка, является наиболее широко распространенным типом лимфомы маргинальной зоны, ассоциированной с заражением Helicobacter pylori. Исследования позволили установить снижение симптомов по мере искоренения заражения Н. pylori после лечения антибиотиками. Известные симптомы желудочной лимфомы MALT-типа включают неспецифическую диспепсию, эпигастральную боль, тошноту, желудочно-кишечное кровотечение и анемию. Системные симптомы являются нехарактерными, поскольку связаны с повышенными уровнями дегидрогеназы молочной кислоты (см. J.Yahalom и др., Extranodal Marginal Zone В cell Lymphoma of Mucosa- Associated Lymphoid Tissue, cc.345-360, в: Non-Hodgkin's Lymphomas, под ред. P.Mauch и др., изд-во Lippincott Williams & Wilkins, Philadelphia, PA, 2004; J. Radford, Other Low-Grade Non-Hodgkin's Lymphomas, cc.325-330, в: Malignant Lymphoma, под ред. В.Hancock и др., изд-во Oxford University Press, New York, N.Y., 2000). Системные В-клеточные симптомы включают повышение температуры выше 38°С в течение более 2 недель без признаков инфекции, ночную испарину, очень сильную утомляемость или непреднамеренную потерю веса на уровне или превышающем 10% веса тела в течение предыдущих 6 месяцев.
Для иммунофенотипа MALT-лимфомы характерна экспрессия CD19, CD20, CD79a, CD21 и CD35 и отсутствие экспрессии CD5, CD23 и CD10. Примерно половина MALT-лимфом экспрессируют CD43. Иммуноглобулин, который, как правило, экспрессируется на опухолевых клетках, с которым связано этот заболевание, представляет собой IgM, в то время как IgD не экспрессируется. Эти признаки имеют решающее значение для того, чтобы отличать эту лимфому от других В-клеточных мелкоклеточных лимфом, таких как лимфома из клеток мантии, лимфоцитарная лимфома и фолликулярная лимфома. Трисомия 3 выявлена в 60% случаев MALT-лимфом. В 25-40% случаев желудочной и легочной MALT-лимфом обнаружена t(11;18). Эта транслокация встречается менее часто в других MALT-лимфомах. Т(11;18) ассоциирована с ядерной экспрессией BCL10 (см. J.Yahalom и др., Extranodal Marginal Zone В cell Lymphoma of Mucosa- Associated Lymphoid Tissue, cc.345-360, в: Non-Hodgkin's Lymphomas, под ред. P.Mauch и др., изд-во Lippincott Williams & Wilkins, Philadelphia, PA, 2004). Лимфомы маргинальной зоны обычно характеризуются наличием SHM и распространением SHM.
Диагностические процедуры включают иммунофенотипирование или применение проточной цитометрии для определения идентичности маркеров клеточной поверхности. Кроме того, следует проводить молекулярный генетический анализ для выявления присутствия t(11;18), так как ее наличие является индикатором того, что болезнь не чувствительна к антибиотикам. Гистологически можно определять присутствие Н. pylori. Дополнительные анализы могут включать проведение полного анализа крови, основные биохимические тесты, включая определение дегидрогеназы молочной кислоты; КТ живота, грудной клетки и тазовой области и биопсию костного мозга (см., J.Yahalom и др., Extranodal Marginal Zone В cell Lymphoma of Mucosa- Associated Lymphoid Tissue, cc.345-360, в: Non-Hodgkin's Lymphomas, под ред. P.Mauch и др., изд-во Lippincott Williams & Wilkins, Philadelphia, PA, 2004)
5.22.2.6. Нодальная В-клеточная лимфома маргинальной зоны
Нодальная В-клеточная лимфома маргинальной зоны представляет собой относительно недавно классифицированную лимфому, поэтому относительно немного опубликованных данных, касающихся этого заболевания. Указанная первичная нодальная В-клеточная лимфома имеет генетические и морфологические характеристики, сходные с экстранодальной и селезеночной лимфомами маргинальной зоны, но не локализована в селезенке или экстранодально. Известно, что вирус гепатита С ассоциирован с этой лимфомой, поскольку имеет место синдром Шегрегна (см. F.Berger и др., Nodal Marginal Zone В cell Lymphoma, cc.361-365, в: Non-Hodgkin's Lymphomas, под ред. P.Mauch и др., изд-во Lippincott Williams & Wilkins, Philadelphia, PA, 2004).
Нодальная лимфома маргинальной зоны характеризуется гетерогенной цитологией и морфологией. Из-за относительно высокой доли крупных клеток в этой лимфоме, в отличие от других лимфом маргинальной зоны (селезеночная и экстранодальная), ее нельзя классифицировать как истинную низкой степени злокачественности В-клеточную лимфому. Генетический и иммунологический фенотип нодальной лимфомы маргинальной зоны включает экспрессию CD19, CD20, CD22, BCL2, 0sIgM и цитоплазматического IgG (cIg). Эти клетки не экспрессируют CD5, CD10, CD23, CD43 или циклин D1. Транслокация, характерная для MALT-лимфомы, т.е. t(11;18), не обнаружена в нодальной лимфоме маргинальной зоны. Эти характерные особенности служат для дифференцированного диагноза этой лимфомы от других В-клеточных мелкоклеточных лимфом (см. F.Berger и др., Nodal Marginal Zone В cell Lymphoma, cc.361-365, в: Non-Hodgkin's Lymphomas, под ред. P.Mauch и др., изд-во Lippincott Williams & Wilkins, Philadelphia, PA, 2004).
5.22.2.7. Селезеночная лимфома маргинальной зоны
Селезеночная лимфома маргинальной зоны представляет собой индолентную микронодулярную В-клеточную лимфому с характерными клиническим признаком выраженной спленомегалии и инфильтрации периферической крови и костного мозга. Кроме того, описан относительно высокий уровень поражения печени. Для этой лимфомы постулируется роль вируса гепатита С. Иммунофенотип селезеночной лимфомы маргинальной зоны, как правило, характеризуется экспрессией CD19+, CD20+, IgD+, BCL2+, p27+, CD3-, CD5-, CD10-, CD23-, CD38-, CD43-, BCL-6- и циклина D1-. Генетические характеристики включают делецию 7q, изменения р53 и SHM (см. М.Piris и др., Splenic Marginal Zone Lymphoma, cc.275-282, в: Non-Hodgkin's Lymphomas, под ред. P.Mauch и др., изд-во Lippincott Williams & Wilkins, Philadelphia, PA, 2004).
Диагноз, как правило, основан на иммунофенотипировании для определения идентичности маркеров клеточной поверхности. Генетический и биохимический анализ в сочетании с данными о маркерах клеточной поверхности помогают отличать эту лимфому от других В-клеточных мелкоклеточных лимфом. (см. М.Piris и др., Splenic Marginal Zone Lymphoma, cc.275-282, в: Non-Hodgkin's Lymphomas, под ред. P.Mauch и др., изд-во Lippincott Williams & Wilkins, Philadelphia, PA, 2004).
5.22.2.8. Острый (В-клеточный) лимфолейкоз (ALL)
ALL представляет собой неоплазму, связанную с костным мозгом, в основном поражающую детей возрастом 1-5 лет. Наиболее общими симптомами являются утомляемость, заторможенность, лихорадка и боль костей и суставов. Утомляемость и заторможенность коррелируют со степенью анемии. Как правило, наблюдается повышенный уровень лейкоцитов. Радиография грудной клетки часто показывает повреждения скелета. Обычным является экстрамедуллярное распространение, и оно затрагивает центральную нервную систему, яички, лимфатические узлы, печень, селезенку и почку. Скопления в передних средостенных лимфатических узлах обнаружены только примерно в 5-10% вновь диагностированных случаев (см. J.Whitlock и др., Acute Lymphocytic Leukemia, cc.2241-2271, в: Wintrobe's Clinical Hematology, 10-e изд., под ред. G.Lee и др., изд-во Williams & Wilkins, Baltimore, MD, 1999). Иммунофенотип ALL характеризуется CD10+, CD19+, CD20+, CD22 и CD24+. Клетки при пре-В-клеточном ALL экспрессируют цитоплазматический, а не поверхностный иммуноглобулин, в то время как связанный со зрелыми В-клетками ALL (на долю которого приходится только 1-2% ALL) отличается от других видов лейкозов В-клеточной линии экспрессией поверхностного иммуноглобулина. Цитогенетические характеристики ALL включают t(8;14), t(2;8) и t(8;22). Хотя транслокация t(12;21) редко встречается на цитогенетическом уровне, возможно, она является наиболее общей цитогенетической аномалией, ассоциированной с детским ALL (обнаружена примерно в 25% случаев) (см. М.Kinney и др., Classification and Differentation of the Lymphocytic Leukemias, cc.2209-2240, в: Wintrobe's Clinical Hematology, 10-е изд., под ред. G.Lee и др., изд-во. Williams & Wilkins, Baltimore, MD, 1999; J Whitlock и др., Acute Lymphocytic Leukemia, cc.2241-2271, в: Wintrobe's Clinical Hematology, 10-e изд., под ред. G.Lee и др., изд-во. Williams & Wilkins, Baltimore, MD, 1999).
Для точного диагноза острого лейкоза, как правило, проводят аспирацию и биопсию костной ткани. Мазки аспирата применяют для морфологического, иммунологического и цитологического исследований. Присутствие лимфобластов в костном мозге является диагностическим признаком ALL. Присутствие более 5% лейкозных лимфобластных клеток в костном мозге подтверждает диагноз ALL, но для окончательного диагноза требуется присутствие более 25%. Поясничные пункции применяют для диагностики поражения болезнью нервной системы. Обнаружено, что при ALL повышены уровни в сыворотке мочевых кислот и уровни лактатдегидрогеназы (см. М.Kinney и др., Classification and Differentation of the Acute Leukemias, cc 2209-2240, в: Wintrobe's Clinical Hematology, 10-e изд., под ред. G.Lee и др., изд-во Williams & Wilkins, Baltimore, MD, 1999; J.Whitlock и др., Lymphocytic Leukemia, cc.2241-2271, в: Wintrobe's Clinical Hematology, 10-е изд., под ред. G.Lee и др., изд-во. Williams & Wilkins, Baltimore, MD, 1999).
5.22.2.9. Хронический лимфолейкоз (CLD/B-клеточная мелкоклеточная лимфома (SLL)
CLL/SLL является наиболее распространенным типом лейкоза. Когда болезнь поражает периферическую кровь и костный мозг, ее обозначают как CLL. Однако, когда происходит инфильтрация в лимфатические узлы и другие ткани клеток, которые иммунологически и морфологически аналогичны клеткам CLL, но когда при этом отсутствует лейкозный характер заболевания, то болезнь обозначают как SLL. Это заболевание в основном поражает людей престарелого возраста, при этом более часто заболевание встречается у мужчин, чем у женщин. Безболезненная лимфаденопатия является наиболее общим признаком. Гипогаммаглобулинемия являются обычной в большинстве случаев CLL/SLL, она характеризуется снижением уровнем всех иммуноглобулинов, а не иммуноглобулинов какого-либо конкретного подкласса. У не имеющих симптомов пациентов часто диагноз устанавливается при обычном анализе крови (количество лейкоцитов превышает 5000×109/л). Примерно в 20% случаев CLL/SLL обнаружены В-клеточные симптомы. Дополнительным диагностическим признаком является инфильтрация в костный мозг более 30% незрелых лимфоцитов. Биопсия лимфатических узлов, как правило, свидетельствует об инфильтрации в пораженные узлы хорошо дифференцированными лимфоцитами. Аутоиммунный феномен часто ассоциированный с CLL/SLL, включает аутоиммунную гемолитическую анемию и иммунную тромбоцитопению (см., J.Gribben и др., Small В cell Lymphocytic Lymphoma/Chronic Lymphocytic Leukemia and Prolymphocytic Leukemia, cc.243-261, в: Non-Hodgkin's Lymphomas, под ред. P.Mauch и др., изд-во Lippincott Williams & Wilkins, Philadelphia, PA, 2004; К.Maclennan, Diffuse Indolent В cell Neoplasms, cc.43-47, в: Malignant Lymphoma, под ред. В.Hancock и др., изд-во Oxford University Press, New York, N.Y., 2000; Clinic Oncology, A.Neal и др., изд-во Neal, Hoskin and Oxford University Press, совместная публикация. New York, NY, 2003).
В отличие от многих В-клеточных злокачественных состояний низкой степени злокачественности, неслучайные реципрокные транслокации редко встречаются при CLL/SLL. Однако другие известные цитогенетические аномалии включают делеции 13q14, 11q22-23 и 17q13, где две последние включают локус р53. Примерно в 20% случаев обнаружена трисомия 12. Повышенный уровень β-2 микроглобулина, повышенные уровни экспрессии CD38 и производство фактора-альфа некроза опухоли все являются характерными признаками CLL/SLL. Иммунофенотип CLL/SLL хорошо диагностируется и включает слабую экспрессию поверхностного иммуноглобулина, как правило, IgM или IgM и IgG, а также экспрессию клеточных антигенов CD19, CD22, CD20 и, как правило, CD5 и CD23. (см., J.Gribben и др., Small В cell Lymphocytic Lymphoma/Chronic Lymphocytic Leukemia and Prolymphocytic Leukemia, cc.243-261, в: Non-Hodgkin's Lymphomas, под ред. P.Mauch и др., изд-во Lippincott Williams & Wilkins, Philadelphia, PA, 2004; К.Maclennan, Diffuse Indolent В cell Neoplasms, cc.43-47, в: Malignant Lymphoma, под ред. В.Hancock и др., изд-во Oxford University Press, New York, N.Y., 2000). 5.22.2.10 В-клеточный пролимфоцитарный лейкоз (PLL)
PLL, который считался вариантом CLL, в настоящее время рассматривается как индивидуальное заболевание. PLL, как правило, представляет собой болезнь престарелых мужчин и характеризуется очень высоким уровнем лейкоцитов (более 200×109/л) и спленомегалией. Дополнительными симптомами являются анемия и тромбоцитопения. На долю пролимфоцитов при PLL приходится более 55% клеток крови и костного мозга. В отличие от CLL, аутоиммунный феномен часто обнаружен при PLL (см., J.Gribben и др., Small В cell Lymphocytic Lymphoma/Chronic Lymphocytic Leukemia and Prolymphocytic Leukemia, cc.243-261, в: Non-Hodgkin's Lymphomas, под ред. P.Mauch и др., изд-во Lippincott Williams & Wilkins, Philadelphia, PA, 2004).
Иммунофенотип PLL характеризуется экспрессией CD19, CD21, CD22, CD24 и FMC7. PLL-клетки не экспрессируют CD23 и в большинстве случае не экспрессируют CD5. PLL-клетки характеризуются комплексными хромосомными аномалиями, при этом наиболее часто встречаются делеции 13q14 и 11q23. Схема мутации р53 в PLL-клетках отличается от обнаруженной при CLL. Дифференцированный диагноз, как правило, основан на клиническом анализе крови, гистологических, иммунофенотипических и генетических анализах (см., J.Gribben и др., Small В cell Lymphocytic Lymphoma/Chronic Lymphocytic Leukemia and Prolymphocytic Leukemia, cc.243-261, в: Non-Hodgkin's Lymphomas, под ред. P.Mauch и др., изд-во Lippincott Williams & Wilkins, Philadelphia, PA, 2004).
5.22.2.11. Волосковоклеточный лейкоз (HCL)
HCL представляет собой редкий индолентный хронический лейкоз, поражающий в большей степени мужчин, чем женщин, и в основном людей среднего возраста. Типичные симптомы включают массивную спленомегалию и панцитопению. В периферической крови и костном мозге присутствуют типичные «волосковые клетки», которые представляют собой В-лимфоциты с цитоплазматическими выростами. Примерно у 90% страдающих HCL пациентов наблюдается инфильтрация в костный мозг (см. Clinic Oncology, A.Neal и др., изд-во Neal, Hoskin and Oxford University Press, совместная публикация. New York, NY, 2003; J. Johnston, Hairy Cell Leukemia, cc.2428-2446, в: Wintrobe's Clinical Hematology, 10-е изд., под ред. G.Lee и др., изд-во Williams & Wilkins, Baltimore, MD, 1999).
Цитогенетический анализ свидетельствует о том, что клональные аномалии присутствуют в 19% случаев и они включают количественные и структурные аномалии хромосом 5, 7 и 14. Уровень в сыворотке TNF-α повышен при волосковоклеточном лейкозе и коррелирует с опухолевой массой. Клетки волосковоклеточного лейкоза экспрессируют поверхностные иммуноглобулины (IgG и IgM) и CD11c, CD19, CD20, CD22 и, как правило, CD25. Кроме того, происходит экспрессия FMC7, НС-2 и CD103. HCL-клетки не экспрессируют CD5 или CD10. Для постановки диагноза применяют аспираты костного мозга, цитогенетические анализы, мазки крови и иммунофенотипирование (см. Clinic Oncology, A.Neal и др., изд-во Neal, Hoskin and Oxford University Press, совместная публикация. New York, NY, 2003; J. Johnston, Hairy Cell Leukemia, cc.2428-2446, в: Wintrobe's Clinical Hematology, 10-е изд., под ред. G.Lee и др., изд-во Williams & Wilkins, Baltimore, MD, 1999).
5.22.2.12. Лимфобластная лимфома из предшественников В-клеток/острый лимфобластный лейкоз из пре-В-клеток /лимфобластная лимфома
Лимфобластная лимфома из предшественников В-клеток/ острый лимфобластный лейкоз из пре-В-клеток /лимфобластная лимфома представляет собой заболевание предшественников Т- или В-клеток. Т- и В-клеточные лимфобластные лимфомы являются морфологически идентичными, но их клиническое разделение можно осуществлять на основе степени инфильтрации в костный мозг или поражения болезнью костного мозга. 85-90% лимфобластных лимфомы образуются из Т-клеток, а остальные из В-клеток. Средний возраст возникновения лимфобластных лимфом составляет 20 лет, при этом заболевание в основном поражает мужчин. Поражение болезнью периферических лимфатических узлов является общим признаком при описании случаев, прежде всего лимфатических узлов цервикальной, надключичной и подмышечной областей. Это заболевание часто поражает костный мозг. Центральная нервная система поражается реже, но часто это происходит при рецидиве. Другие места поражения болезнью могут включать печень, селезенку, кость, кожу, глотку и яички (см. J.Sweetenham и др., Precursor В- and T-Cell Lymphoblastic Lymphoma, cc.503-513, в: Non-Hodgkin's Lymphomas, под ред. P.Mauch и др., изд-во Lippincott Williams & Wilkins, Philadelphia, PA, 2004).
Лимфобластные лимфомы из предшественников В-клеток экспрессируют маркеры незрелых В-клеток, такие как CD99, CD34 и терминальную дезоксинуклеотидил-трансферазу. Эти клетки экспрессируют также CD79a, CD19, CD22 и иногда CD20, и у них, как правило, отсутствует экспрессия CD45 и поверхностного иммуноглобулина. Наличие транслокации в 11q23, а также t(9;22)(q34;q11.2) и t(12;21)(p13;q22) ассоциировано с неблагоприятным прогнозом. Благоприятный прогноз ассоциирован с гипердиплоидным кариотипом, прежде всего с трисомией 4, 10 и 17 и t(12;21)(p13;q22) (см. J.Sweetenham и др., Precursor В- and T-Cell Lymphoblastic Lymphoma, cc.503-513, в: Non-Hodgkin's Lymphomas, под ред. P.Mauch и др., изд-во Lippincott Williams & Wilkins, Philadelphia, PA, 2004).
Диагностические анализы включают биопсии лимфатических узлов, анализы крови, рентгеноскопию, КТ и поясничные пункции для оценки спинномозговой жидкости в отношении злокачественных клеток.
5.22.2.13. Первичная медиастинальная В-крупноклеточная лимфома
Первичная медиастинальная В-крупноклеточная лимфома представляет собой диффузную В-клеточную крупноклеточную лимфому, встречающуюся в основном у молодых женщин и характеризующуюся местной инвазией передней медиастинальной массы, начинающейся в тимусе. Дистантное распространение в периферические узлы и костный мозг не является характерным. Системные симптомы являются обычными. Хотя это заболевание напоминает нодальные крупноклеточные лимфомы, оно отличается генетическими, иммунологическими и морфологическими характеристиками.
Иммунофенотип опухолевых клеток первичной медиастинальной В-крупноклеточной лимфомы часто является негативным по поверхностным иммуноглобулинам, но характеризуется экспрессией таких ассоциированных с В-клетками антигенов, как CD19, CD20, CD22 и CD79a. Как правило, экспрессируются CD 10 и BCL6. Экспрессия ассоциированных с плазматическими клетками маркеров CD 15, CD30, эпителиального мембранного антигена (ЕМА) встречается редко. Строение гена BCL6 и c-myc также является необычным. Присутствие клональных иммуноглобулиновых перестановок, гипермутация вариабельной области иммуноглобулина и генная гипермутация наряду с гипермутацией BCL6 позволяет предположить, что эта лимфома образуется из зрелых В-клеток герминального центра или В-клеток постгерминального уровня. Хромосомные транслокации, вероятно, ассоциированные с опухолями при этом заболевании, сходны с транслокациями в клетках, обнаруженных при других формах диффузной крупноклеточной лимфомы (см., Р.Zinzan и др., Primary Mediastinal Large В cell Lymphoma, cc.455-460, в: Non-Hodgkin's Lymphomas, под ред. P.Mauch и др., изд-во Lippincott Williams & Wilkins, Philadelphia, PA, 2004).
Диагностическая оценка первичной медиастинальной В-крупноклеточной лимфомы, как правило, включает полное медицинское обследование, полный гематологический и биохимический анализ и компьютерную томографию всего организма и биопсию костного мозга. Сканирование с галлием-67 является важным анализом для определения стадии, реакции на лечение и оценки рецидива (см., Р.Zinzan и др., Primary Mediastinal Large В cell Lymphoma, cc.455-460, в: Non-Hodgkin's Lymphomas, под ред. P.Mauch и др., изд-во Lippincott Williams & Wilkins, Philadelphia, PA, 2004).
5.22.2.14. Лимфоплазматическая лимфома (LPL/лимфоплазматическая иммуноцитома /макроглобулинемия Вальденстрема
LPL/лимфоплазматическая иммуноцитома/макроглобулинемия Вальденстрема представляет собой надальную лимфому, которая, как правило, является индолентной и часто затрагивает костный мозг, лимфатические узлы и селезенку. Это заболевание обычно встречается у престарелых людей, причем, несколько более часто у мужчин. У большинства пациентов в сыворотке присутствует парапротеин моноклонального IgM (>3 г/дл), что приводит к повышенной вязкости сыворотки. Опухолевые клетки имеют плазматическую морфологию. Субпопуляция LPL характеризуется рекуррентными транслокациями между хромосомами 9 и 14, которые включают РАХ5 и локус тяжелой цепи иммуноглобулина. LPL характеризуется наличием SHM, а также распространением SHM и, вероятно, образуется из В-клеток постгерминального уровня (пост-GC) (см. Rohatiner и др., Lymphoplasmacytic Lymphoma and Waldstrom's Macroglobulinemia, cc.263-273, в: Non-Hodgkin's Lymphomas, под ред. P.Mauch и др., изд-во Lippincott Williams & Wilkins, Philadelphia, PA, 2004; К.Maclennan, Diffuse Indolent В cell Neoplasms, cc.43-47, в: Malignant Lymphoma, под ред. В.Hancock и др., изд-во Oxford University Press, New York, N.Y., 2000; A.Lal и др., Role of Fine Needle Aspiration in Lymphoma, cc.181-220, в: Hematopathology in Oncology, под ред. W.Finn и др., изд-во. Kluwer Academic Publishers, Norwell, MA, 2004).
Для иммунофенотипа этого заболевания характерна экспрессия ассоциированных с В-клетками антигенов CD19, CD20, CD22 и CD79a и отсутствие экспрессии CD5, CD10 и CD23. Наличие высокого уровня поверхностного иммуноглобулина и CD20, отсутствие экспрессии CD5 и CD23 и присутствие цитоплазматического иммуноглобулина являются характеристиками, которые позволяют отличать это заболевание от хронического лимфолейкоза. Также диагностическим признаком этого заболевания является t(9;14)(p13;q32). (см. Rohatiner и др., Lymphoplasmacytic Lymphoma and Waldstrom's Macroglobulinemia, cc.263-273, в: Non-Hodgkin's Lymphomas, под ред. P.Mauch и др., изд-во Lippincott Williams & Wilkins, Philadelphia, PA, 2004; К.Maclennan, Diffuse Indolent В cell Neoplasms, cc.43-47, в: Malignant Lymphoma, под ред. В.Hancock и др., изд-во Oxford University Press, New York, N.Y., 2000; R.Chaganti и др., Cytogenetics of Lymphoma, cc.809-824, в: Non-Hodgkin's Lymphomas, под ред. P.Mauch и др., изд-во Lippincott Williams & Wilkins, Philadelphia, PA, 2004).
Диагностические анализы, как правило, включают клинический анализ крови, оценку почечной и печеночной функции, КТ, биопсию и аспирацию костного мозга, электрофорез белков для количественной оценки и характеризации парапротеина и вязкости сыворотки. В качестве прогностического критерия определяют β2-микроглобулин (см. Rohatiner и др., Lymphoplasmacytic Lymphoma and Waldstrom's Macroglobulinemia, cc.263-273, в: Non-Hodgkin's Lymphomas, под ред. P.Mauch и др., изд-во Lippincott Williams & Wilkins, Philadelphia, PA, 2004).
5.22.2.15. Острый лимфобластный лейкоз нуль-клеточного типа.
Острый лимфобластный лейкоз нуль-клеточного типа является субпопуляцией ALL, в котором отсутствуют В- или Т-клеточные характеристики. Фенотипический анализ лейкозных бластных клеток свидетельствует о типичной схеме ALL нуль-клеточного типа, т.е., CD 10-(обычный для ALL антиген-негативной, выражено HLA-DR-позитивный и CD19 (В4)-позитивный тип (см. Katz и др. Blood 71(5), 1988, cc.1438-1447).
5.22.2.16 Лимфома Ходжкина
Лимфома Ходжкина, как правило, возникает в лимфатических узлах молодых людей. Ее можно подразделять на классический подтип и менее распространенный нодулярный подтип с лимфоидным преобладанием. Для классического типа характерно наличие SHM, но не распространение SHM, и отсутствие профиля генной экспрессии GC-B-клеточного типа. Нодулярный подтип с лимфоидным преобладанием характеризуется SHM и распространением SHM и профилей генной экспрессии GC-B-клеточного типа. Хотя два типа отличаются клинически и биологически, они имеют определенные сходные признаки, такие как отсутствие неопластических клеток на фоне доброкачественных воспалительных клеток (В. Schnitzer и др., Hodgkin Lymphoma, cc.259-290, в: Hematopathology in Oncology, под. ред. W.Finn и L.Peterson, изд-во Academic Publishers, Norwell, MA, 2004).
Наиболее общим признаком является безболезненное увеличение лимфатических узлов, как правило, в области шеи, но иногда в паховой области. Для этой болезни характерны также мягкость и болезненность узлов. В-клеточные симптомы обнаружены примерно у одной трети пациентов. Изолированные экстранодальные поражения болезнью являются редкими и в случаях, когда произошла диссеминация, экстранодальное поражение болезнью обнаружено в течение примерно 10-20% случаев (см. Р. Johnson и др., Hodgkin's Disease: Clinic Features, cc.181-204, в: Malignant Lymphoma, под ред. В.Hancock и др., изд-во Oxford University Press, New York, N.Y., 2000).
Клетки Рида-Штернберга (RS) представляют собой злокачественные клети лимфомы Ходжкина. RS-клетки и их варианты экспрессируют CD15, CD25, CD30 и рецептор трансферрина. Кроме того, эти клетки экспрессируют поликлональный цитоплазматический иммуноглобулин. В большинстве случаев лимфомы Ходжкина RS-клетки не экспрессируют CD45, этот признак позволяет отличать это заболевание от не-ходжкинских лимфом. Продемонстрировано, что вирус Эпштейна-Барра присутствует в клетках Рида-Штернберга примерно в половине случаев лимфомы Ходжкина, но его роль является неясной.
Диагноз наиболее часто основан на биопсии лимфатических узлов. Дополнительные диагностические анализы включают полный клинический анализ крови (часто гематологические анализы являются нормальными; количество лейкоцитов на уровне менее чем 1,0×109/л обнаруживают примерно в 20% случаев), реакции оседания эритроцитов (часто повышена при запущенных стадиях заболевания), биохимические анализы, включая определение электролитов, мочевины, креатинина, урата, кальция (гиперкальциемия редко, но все же встречается при интенсивном поражении болезнью кости), анализы печеночной крови, лактатдегидрогеназы (повышенные уровни часто ассоциированы с запущенными стадиями заболевания), альбумина и бета2-микроглобулина (β2-М). Для идентификации аномальных лимфатических узлов и степени экстранодального поражения болезнью важными являются лимфангиограммы и рентгеноскопия грудной клетки и КТ грудной клетки, живота и тазовой области. Биопсию костной ткани, как правило, рассматривают как необязательную, поскольку поражение костного мозга не является обычным явлением, и результаты такой биопсии, как правило, не влияют на клиническое лечение или прогноз. В настоящее время, как правило, не проводят спленэктомию, поскольку это редко влияет на лечение, а КТ или ЯМР-томография дает информацию о состоянии селезенки. Существенно повышенные уровни р55, TNF и sICAM-1 коррелируют со стадией заболевания, наличием симптомов и полным уровнем ответа (см. Р. Johnson и др., Hodgkin's Disease/ Clinic Features, cc.181-204, в: Malignant Lymphoma, под ред. В.Hancock и др., изд-во Oxford University Press, New York, N.Y., 2000; Clinic Oncology, A.Neal и др., изд-во Neal, Hoskin and Oxford University Press, совместная публикация, New York, NY, 2003; R. Stein, Hodgkin's Disease, cc.2538-2571, в: Wintrobe's Clinical Hematology, 10-е изд., под ред. G.Lee и др., изд-во. Williams & Wilkins, Baltimore, MD, 1999).
5.22.2.17. Множественная миелома
Множественная миелома представляет собой злокачественное состояние плазматических клеток. Для этого заболевания характерно наличие неопластических клеток в костном мозге и остеолитические повреждения кости. Реципрокные хромосомные транслокации между одним из локусов иммуноглобулина и различными другими генами, например, циклина D1, циклина D3, c-MAF, MMSET (содержащий SET-домен белок множественной миеломы) или рецептор 3 фактора роста фибробластов, вероятно, являются первичными онкогенными событиями. Множественная миелома характеризуется SHM, и предполагаемыми исходными клетками являются пост-GC-В-клетки. Множественную миелому, как правило, первоначально идентифицируют по таким симптомам, как рекуррентная инфекция, утомляемость, боль и проблемы с почками, и подтверждают клинической оценкой (см., например, Cancer: Principles and Practice of Oncology. 6-е изд., под ред. DeVita V.T., Hellman S. и Rosenberg, S. А., изд-во Lippincott Williams and Wilkins Philadelphia, PA 19106, 2001, cc.2465-2499).
В определенных вариантах осуществления изобретения пациентов (кандидатов), которых предполагается лечить с помощью композиций и способов, предлагаемых в изобретении, можно подвергать дополнительным диагностическим анализам крови и/или мочи для подтверждения диагноза или подозрения на множественную миелому, которые включают, но, не ограничиваясь только ими, клинический анализ крови (СВС) для того, чтобы определить подпадают ли типы клеток, обнаруженные при СВС, в их нормальные диапазоны, известные в данной области, химический профиль крови для определения, отклоняются ли уровни различных компонентов крови, таких как альбумин, азот мочевины крови (BUN), кальций, креатинин и лактатдегидрогеназа (LDH), от стандартных значений. Можно определять также уровни в сыворотке бета2-микроглобулина (β2-М) и суррогатных маркеров IL-6, фактора роста клеток миеломы. Анализ мочи можно применять для оценки уровней белка в моче. Электрофорез можно применять для определения уровней различных белков в крови, включая белок М в крови (так называемый электрофорез сывороточных белков или SPEP), или белков мочи (так называемый электрофорез белков мочи или UEP). Дополнительный анализ, называемый иммунофиксирующим электрофорезом (IFE) или иммуноэлектрофорезом, можно применять также для получения более точной информации о типе присутствующих аномальных белков антител. Выявленные изменения и соотношения различных белков, в частности белка М, можно применять для оценки пути развития миеломы и ответа на режимы лечения. Множественная миелома отличается значительным увеличением уровня белка М, который секретируется клетками опухоли миеломы.
Диагностические анализы кости можно проводить также для подтверждения диагноза или подозрения на множественную миелому, включая, но, не ограничиваясь только ими, рентгеноскопию и другие визуализирующие анализы, в том числе обследование костей (скелета), визуализацию методом ядерно-магнитного резонанса (ЯМР-томография) и компьютерную трансаксиальную томографию (КАТ), которую называют также компьютерной томографией (КТ), можно применять для анализа изменения костной структуры и определения количества и размера опухолей в кости. Аспирацию костного мозга или биопсию костного мозга можно применять также для выявления увеличения количества плазматических клеток в костном мозге. Аспирация позволяет получать образец жидкого костного мозга, а биопсия позволяет получать образец плотной ткани. При осуществлении обоих анализов образцы можно отбирать из тазовой области (тазовая кость). Для аспирации костного мозга можно использовать также грудину (грудную кость).
Пациентов с множественной миеломой, как правило, разделяют на три следующие группы, что позволяет определять эффективные схемы лечения. Моноклональная гаммапатия неустановленной этиологии (MGUS), как правило, характеризуется уровнями в сыворотке белка М менее чем 3 г/дл, клональных плазматических клеток менее чем 10%, отсутствием других В-клеточных нарушений и отсутствием повреждения родственных органов или тканей, таких как гиперкальцемия (повышенные уровни сывороточного кальция), нарушенная почечная функция, выражающаяся в повышенном уровне сывороточного креатинина, анемия или повреждения кости. Асимптоматические миеломы, как правило, соответствуют стадии I и включают сливающуюся множественную миелому (SMM) и индолентную множественную миелому (IMM). SMM характеризуется уровнями в сыворотке белка М, превышающими или равными 3 г/дл, а IMM характеризуется тем, что уровень клональных плазматических клеток костного мозга превышает или равен 10% от клеток костного мозга. Симптоматическая миелома характеризуется наличием белка М в сыворотке и/или моче и соответствует стадии II множественной миеломы, которая характеризуется присутствием клональных плазматических клеток или плазмацитомы в костном мозге, а стадия III множественной миеломы характеризуется поражением родственного органа или ткани.
Остеосклеротическая миелома является компонентом редкого синдрома POEMS (полинейропатия, органомегалия, эндокринопатия, моноклональная гаммапатия и поражения кожи) (полинейропатия с органомегалией). Пик встречаемости приходится на 40-50 лет. Системные признаки включают повреждения скелета, уровень плазматических клеток костного мозга <5%, нормальные показатели СВС (полный клинический анализ крови), повышенный уровень тромбоцитов и органомегалию. В СМЖ выявляют высокий уровень белка и отсутствие клеток. Уровни белка М низкие (<3 г/дл, медианные - 1,1 г/дл); тяжелые цепи, как правило, α- или γ-класса; легкие цепи, как правило, λ-класса; редкая моноклональная и периодическая криоглобулинемия. Нейропатия встречается у 50% пациентов с ослаблением как в проксимальной, так и в дистальной областях, потеря сенсорной чувствительности в большей степени в крупных, чем в малых волокнах; и демиелинизация и длительная дистальная латентность.
Пациенты, страдающие сливающейся множественной миеломой, как правило, имеют стабильное состояние болезни в течение месяцев/лет; не имеют анемии, повреждений кости, почечной недостаточности или гиперкальцемии; у них присутствует >10% плазматических клеток в костном мозге и моноклональный сывороточный белок. Критерии сливающейся множественной миелома соответствуют диагнозу множественной миеломы; однако для нее не характерно прогрессивное развитие. Известны случаи медленного прогрессирования, при этом масса опухолевых клеток остается такой же, как и при установлении диагноза, и процентное содержание плазматических клеток в костном мозге, находящихся на S-фазе, является низким (<0,5%). Характерные клинические показатели включают: уровни белка М в сыворотке >3 г/дл и/или уровень плазматических клеток в костном мозге ≥10%; отсутствие анемии, почечную недостаточность, гиперкальцемию, литические повреждения кости.
Индолентная (или асимптоматическая) множественная миелома представляет собой множественную миелому, которая диагностируется случайно при отсутствии симптомов, как правило, после скрининговых лабораторных исследований. Индолентная множественная миелома напоминает сливающуюся миелому, но отличается менее выраженными повреждениями кости и анемией средней тяжести. В большинстве случаев индолентная множественная миелома развивается во множественную миелому в течение 3 лет. Диагностические критерии являются такими же, что и для множественной миеломы, за исключением: отсутствуют повреждения кости или имеется одно асимптоматическое литическое повреждение (рентгеноскопическое обследование); уровень М-компонента <3 г/дл для IgG, 2 г/дл для легких цепей IgA в моче <4 г/24 ч; гемоглобин >10 г/дл, уровень сывороточного кальция нормальный, сывороточного креатинина <2 мг/дл и отсутствие инфекций.
5.22.2.18. Единичная плазмацитома
Единичная плазмацитома представляет собой одну из спектра неоплазм плазматических клеток, которые включают заболевания от доброкачественной моноклональной гаммапатии до единичной плазмацитомы и до множественной миеломы. Примерно 70% всех случаев единичных плазмацитом в конце концов превращаются во множественную миелому. Эти заболевания характеризуются пролиферацией В-клеток, которые продуцируют характерный парапротеин. Единичная плазмацитома выражается в пролиферации клональных плазматических клеток в единичной области, как правило, одной кости или в области экстрамедуллярной ткани. Диагностическими критериями единичной плазмацитомы являются гистологически подтвержденное единичное повреждение, нормальный результат биопсии кости, отрицательный результат обследования скелета, нормальный уровень кальция и почечная функция. В большинстве случаев обнаружены минимально повышенные уровни в сыворотке М-белка (парапротеин). Средний возраст обнаружения заболевания составляет 50-55 лет, что примерно на 5-10 лет меньше, чем средний возраст для множественной миеломы. (см. С.Wilson, The Plasma Cell Dycrasias, cc.113-144, в: Hematopathology in Oncology, под. ред. W.Finn и L.Peterson, изд-во Kluwer Academic Publishers, Norwell, MA, 2004; S.Chaganti и др., Cetogenetics of Lymphoma, cc.809-824, в: Non-Hodgkin's Lymphomas, под ред. P.Mauch и др., изд-во Lippincott Williams & Wilkins, Philadelphia, PA, 2004).
Иммунофенотипические и генетические показатели плазмацитомы напоминают признаки множественной миеломы.
5.22.2.19. Болезнь легких цепей/болезнь отложения легких цепей (LCDD)
LCDD представляет собой дискразийные нарушения, вызываемые избыточном синтезом легких цепей иммуноглобулина (как правило, легких каппа-цепей), которые откладываются в тканях. У пациентов обычно наблюдается дисфункция органов, слабость, утомляемость и потеря веса. Примерно в 80% случаев LCDD выявляется моноклональный иммуноглобулин. Выявление моноклональных легкий каппа-цепей с помощью методов иммунофлуоресценции ограничено тенденцией легких цепей давать избыточное фоновое окрашивание, поэтому может оказаться необходимым осуществлять ультраструктурное мечение иммунозолотом (см., С.Wilson, The Plasma Cell Dycrasias, cc.113-144, в: Hematopathology in Oncology, под ред. W.Finn и L.Peterson, изд-во Kluwer Academic Publishers, Norwell, MA, 2004).
5.22.2.20. Лейкоз плазматических клеток (PCL)
PCL, дискразия плазматических клеток, представляет собой редкий агрессивный вариант множественной миеломы. Критериями лейкоза плазматических клеток является абсолютное количество плазматических клеток в периферической крови более 2×109/л или на долю плазматических клеток приходится более 20% лейкоцитов. Выявление присутствия CD138+-популяции с рестрикцией цитоплазматических легких цепей с помощью проточной цитометрии позволяет отличать PCL от лимфоидной неоплазмы с плазматическими признаками. PCL-клетки характеризуются также отсутствием поверхностной легкой цепи, экспрессией CD19 и CD22 и либо слабой экспрессией, либо отсутствием экспрессии CD45. Примерно в 50% случаев PCL-клетки экспрессируют CD20 и примерно в 50% случаев отсутствует экспрессия CD56. Генетические аномалии, обнаруженные у страдающих PCL пациентов, такие же, как и у пациентов с множественной миеломой, но при PCL они встречаются чаще. (см. С.Wilson, The Plasma Cell Dycrasias, cc.113-144, в: Hematopathology in Oncology, под ред. W.Finn и L.Peterson, изд-во Kluwer Academic Publishers, Norwell, MA, 2004).
Лейкоз плазматических клеток имеет две формы: если первоначальный диагноз основан на лейкозной фазе миеломы, то присутствует первичная форма, в другом случае присутствует вторичная форма. Первичный лейкоз плазматических клеток, который встречается в более молодом возрасте, ассоциирован с гепатоспленомегалией, лимфаденопатией и меньшими литическими повреждения кости, и он характеризуется более неблагоприятным прогнозом, чем вторичная форма. В периферической крови страдающих лейкозом плазматических клеток пациентов присутствует более 20% плазматических клеток, при этом абсолютное количество составляет 2000/мл или более.
5.22.2.21 Моноклональная гаммапатия неустановленной этиологии (MGUS)
MGUS является относительно распространенным состоянием, характеризующимся присутствием электрофоретически гомогенных иммуноглобулинов или доброкачественных М-компонентов. Частота встречаемости такого состояния повышается с возрастом. У большинства индивидуумов, несущих М-компоненты, никогда не развивается злокачественная дискразия плазматических клеток, такая как множественная миелома. Однако у некоторых индивидуумов это состояние становится ассоциированным со злокачественными состояниями. Симптомами у пациентов является увеличение печени или селезенки и плевронейропатия (см. J.Foerster, Plasma Cell Dycrasias: General Considerations, cc.2612-2630, в: Wintrobe's Clinical Hematology, 10-e изд., под ред. G.Lee и др., изд-во Williams & Wilkins, Baltimore, MD, 1999). MGUS можно отличать от множественной миеломы по наличию повышенного количества моноклональных плазматических клеток, циркулирующих в периферической крови. Серологические характеристики М-компонентов идентичны другим дискразиям плазматических клеток, однако общая концентрация М-компонента составляет, как правило, менее чем 30 г/л. Парапротеин представляет собой как правило, IgG; однако могут присутствовать различные парапротеины, включая IgG, IgA, IgM. Относительное количество каждого из индивидуальных классов иммуноглобулинов, как правило, пропорционально присутствующему в сыворотке здорового человека. Протеинемия или протеунурия встречаются редко. Серийные оценки уровней М-белка в крови и моче и постоянный мониторинг клинических и лабораторных признаков (включая белковый электрофорез) представляют собой наиболее надежный метод, позволяющий отличить MGUS от ранней стадии дискразии плазматических клеток (см. в: Wintrobe's Clinical Hematology, 10-e изд., под ред. G.Lee и др., изд-во Williams & Wilkins, Baltimore, MD, 1999).
5.22.2.22. Злокачественные состояния, связанные со зрелыми В-клетками
Согласно следующему варианту осуществления изобретения изобретение можно применять для лечения злокачественных состояний, связанных со зрелыми В-клетками, включая, но не ограничиваясь только ими, фолликулярную лимфому, лимфому из клеток мантии, лимфому Беркитта, множественную миелому, диффузную В-клеточную крупноклеточную лимфому (DLBCL), включая тип DLBCL из В-клеток герминального центра (GCB), тип DLBCL из активированных В-клеток (АВС) и тип 3 DLBCL, лимфому Ходжкина, включая классический и нодулярный подтип с лимфоидным преобладанием, лимфоплазматическую лимфому (LPL); лимфому маргинальной зоны, включая лимфому ассоциированной со слизистой желудка лимфоидной ткани (MALT), и хронический лимфолейкоз (CLL), включая CLL с мутированным статусом гена иммуноглобулина и CLL с немутированным статусом гена иммуноглобулина.
5.22.2.23. Злокачественные состояния, связанные с пре-В-клетками
Кроме того, CD19 экспрессируется на более ранних стадиях развития В-клеток, чем например CD20, и поэтому специфические для CD19 средства прежде всего пригодны для лечения связанных с пре-В-клетками и незрелыми В-клетками злокачественных состояний, например, в костном мозге. Репрезентативными связанными с пре-В-клетками и незрелыми В-клетками злокачественными состояниями являются, но не ограничиваясь только ими, лимфома из клеток мании, пре-В-клеточный острый лимфобластный лейкоз, лимфобластная лимфома из предшественников В-клеток и другие злокачественные состояния, для которых характерна экспрессия CD19.
5.23. Диагностирование пациентов и терапевтические схемы при трансплантации
Согласно определенным объектам изобретения схемы лечения и дозы, при использовании композиций и способов, предлагаемых в изобретении, выбирают в зависимости от ряда факторов, включая, например, клиническое проявление, позволяющее предположить наличие у пациента риска развития гуморального отторжения, или клинические данные о том, что указанное отторжение развивается. Понятия «гуморальный» и «антителообусловленный» в контексте настоящего описания применяют взаимозаменяемо.
Критерии оценки риска развития у пациента гуморального отторжения создают на основе научных данных, и они известны специалистам в данной области. В одном из вариантов осуществления изобретения положительная проба на комплементзависимую цитотоксичность или усиленную антиглобулином комплементзависимую цитотоксичность свидетельствует о том, что у пациента есть высокий риск гуморального отторжения. В одном из вариантов осуществления изобретения положительная проба на совместимость или полученная ранее положительная проба на комплементзависимую цитотоксичность или усиленную антиглобулином комплементзависимую цитотоксичность свидетельствуют о том, что пациент имеет средний риск гуморального отторжения. В одном из вариантов осуществления изобретения отрицательная проба на совместимость свидетельствует о том, что пациент имеет невысокий риск гуморального отторжения.
В другом варианте осуществления изобретения реципиента трансплантата, который нуждается в профилактике отторжения трансплантата, можно идентифицировать как пациента или популяцию пациентов, у которых в кровотоке выявлены аллоантитела к HLA до трансплантации. В другом примере пациента или популяцию пациентов можно идентифицировать по признаку наличия у них панели реактивных антител перед трансплантацией. Присутствие в кровотоке выявляемых аллоантител к HLA у реципиента трансплантата после трансплантации можно использовать также для идентификации пациента или популяции пациентов, которые нуждаются в лечении гуморального отторжения согласно изобретению. Пациента или популяции пациентов, которые нуждаются также в лечении гуморального отторжения, можно идентифицировать по другим клиническим критериям, которые показывают, что реципиент трансплантата имеет риск развития гуморального отторжения или у него уже развилось гуморальное отторжение. Например реципиента трансплантата, который нуждается в лечении гуморального отторжения, можно идентифицировать как пациента или популяцию пациентов на ранней стадии гуморального отторжения, например по латентному гуморальному ответу, характеризующемуся наличием в кровотоке антидонорских аллоантител. На ранней стадии гуморального отторжения может иметь место также «молчащий» ответ, характеризующийся наличием в кровотоке антидонорских аллоантител и отложением C4d, или доклиническое отторжение, характеризующееся наличием в кровотоке антидонорских аллоантител, отложением C4d и патологией ткани. На более поздних стадиях реципиента идентифицируют как пациента или популяцию пациентов, которые имеют клинические признаки гуморального отторжения, согласно научным данным и известным специалистам в данной области данным, например, по наличию в кровотоке антидонорских аллоантител, отложения C4d, патологии ткани и дисфункции трансплантата.
Настоящее изобретение относится к композициям, терапевтическим формам, способам и схемам, которые обладают эффективностью в отношении снижения частоты, серьезности или продолжительности GVHD, эпизодов отторжения или посттрансплантационного лимфопролиферативного нарушения. В определенных вариантах осуществления изобретения композиции и способы, предлагаемые в изобретении, обладают эффективностью в отношении ослабления реакции хозяина на повреждение, связанное с ишемической реперфузией плотной ткани или трансплантата органа. В одном из вариантов осуществления изобретения композиции и способы, предлагаемые в изобретении, обладают эффективностью в отношении пролонгирования срока жизнеспособности трансплантата у реципиента трансплантата.
Настоящее изобретение относится к трансплантатам, которые являются аутологичными, аллогенными или ксеногенными для реципиента. Типы трансплантатов, подпадающие под объем изобретения, включают трансплантаты ткани и органа, включая, но не ограничиваясь только ими, трансплантаты костного мозга, трансплантаты периферических стволовых клеток, кожные трансплантаты, артериальные и венозные трансплантаты, трансплантаты панкреатических островковых клеток и трансплантаты почки, печени, поджелудочной железы, щитовидной железы и сердца. Понятия «имплантат» и «трансплантат» в контексте настоящего описания используют взаимозаменяемо. В одном из вариантов осуществления изобретения аутологичный трансплантат представляет собой трансплантат костного мозга, артериальный трансплантат, венозный трансплантат или кожный трансплантат. В одном из вариантов осуществления изобретения аллотрансплантат представляет собой трансплантат костного мозга, трансплантат роговицы, трансплантат почки, трансплантат панкреатических островковых клеток или комбинированный трансплантат почки и поджелудочной железы. В одном из вариантов осуществления изобретения трансплантат представляет собой ксенотрансплантат, где возможные животные-доноры представляют собой, но не ограничиваясь только ими, свиней. Композиции и способы, предлагаемые в настоящем изобретении, можно применять также для подавления вредного иммунного ответа на небиологический трансплантат или имплантат, включая, но не ограничиваясь только ими, искусственный сустав, стент или пейсмекер.
Антитела к CD19, композиции и способы, предлагаемые в изобретении, можно применять для лечения или предупреждения GVHD, гуморального отторжения или посттрансплантационного лимфопролиферативного нарушения вне зависимости от конкретных показаний, которые первоначально привели к необходимости осуществления трансплантации или конкретного типа трансплантированной ткани.
Терапевтические формы и схемы, предлагаемые в настоящем изобретении, предназначены для лечения людей, у которых диагностированы аутоиммунные заболевания или нарушения, включая, но не ограничиваясь только ими, ревматоидный артрит, системную красную волчанку (SLE), идиопатическую тромбоцитопению (ITP), родственные пузырчатке нарушения, диабет и склеродермию.
Специалист в данной области может определять соответствующие схемы лечения для конкретного пациента или популяции пациентов. В конкретных вариантах осуществления изобретения схема лечения представляет собой направленную на улучшение состояния до трансплантации схему, посттрансплантационную поддерживающую схему или посттрансплантационную схему лечения острого или хронического отторжения. В определенных вариантах осуществления изобретения конкретная схема варьируется для пациента, который согласно оценке имеет высокий или средний риск развития гуморального ответа, по сравнению со схемой для пациента, который согласно оценке имеет низкий риск развития гуморального ответа. В определенных вариантах осуществления изобретения конкретная схема варьируется в зависимости от стадии гуморального отторжения, при этом более агрессивная терапия показана для пациентов, имеющих более поздние стадии отторжения. Стадии гуморального отторжения можно классифицировать согласно принятым в данной области показателям. Например, стадии гуморального отторжения можно классифицировать как одну из стадий I-IV согласно следующим критериям: стадия I - латентный ответ, характеризующийся присутствием в кровотоке антидонорских аллоантител, прежде всего антител к HLA; стадия II - «молчащий» ответ, характеризующийся присутствием в кровотоке антидонорских аллоантител, прежде всего антител к HLA, и отложением C4d, но без гистологических изменений или дисфункции трансплантата; стадия III - субклиническое отторжение: характеризующееся присутствием в кровотоке антидонорских аллоантител, прежде всего антител к HLA, отложением C4d и патологией ткани, но без дисфункции трансплантата; стадия IV - гуморальное отторжение: характеризующееся присутствием в кровотоке антидонорских аллоантител, прежде всего антител к HLA, отложением C4d, патологией ткани и дисфункцией трансплантата.
Кривые дозовой зависимости можно создавать с помощью стандартных для данной области протоколов для определения эффективного количества композиций, предлагаемых в изобретении, для применения в конкретной схеме, например, в направленной на улучшение состояния перед трансплантацией схеме и посттрансплантационных схемах для профилактики и лечения GVHD, гуморального отторжения или посттрансплантационных лимфопролиферативных нарушений. В целом, для пациентов, которые имеют высокий риск развития гуморального отторжения и у которых уже присутствует один или несколько клинических показателей отторжения, требуются более высокие дозы и/или более частое введение доз, которые можно вводить в течение более длительных периодов времени, чем для пациентов, которые не имеют высокий риск или у которых нет признаков активного отторжения.
Антитела к CD19, композиции и способы, предлагаемые в изобретении, можно применять на практике для лечения или предупреждения GVHD, гуморального отторжения или посттрансплантационных лимфопролиферативных нарушений либо индивидуально, либо в сочетании с другими терапевтическими агентами или схемами лечения. Другие терапевтические схемы, предназначенные для лечения или предупреждения GVHD, гуморального отторжения или посттрансплантационных лимфопролиферативных нарушений, могут включать, например, одну или несколько из следующих терапий: антилимфоцитарная терапия, стероидная терапия, направленная на истощение антител терапия, иммуносупрессорная терапия и плазмаферез.
Антилимфоцитарная терапия может включать введение реципиенту трансплантата антитимоцитных глобулинов, которые обозначают также как тимоглобулин. Антилимфоцитарная терапия может включать также введение одного или нескольких моноклональных антител к антигенам поверхности Т-клеток. Примерами таких антител являются, но не ограничиваясь только ими, ОКТ3™ (муромонаб-CD3), САМРАТН™-1Н (алемтузумаб), CAMPATH™-1G, САМРАТН™-1М, SIMULECT™ (базиликсимаб) и ZENAPAX™ (даклизумаб). В конкретном варианте осуществления изобретения антилимфоцитарная терапия включает применение одного или нескольких дополнительных антител к В-клеткам, включая, но не ограничиваясь только ими, RITUXAN™ (ритуксимаб).
Стероидная терапия может включать введение реципиенту трансплантата одного или нескольких стероидов, выбранных из группы, включающей кортизол, преднизон, метилпреднизолон, дексаметазон и индометацин. Один или несколько стероидов может(ут) представлять собой кортикостероиды, включая, но не ограничиваясь только ими, кортизол, преднизон и метилпреднизолон.
Направленная на истощение антител терапия может включать, например, введение реципиенту трансплантата внутривенно иммуноглобулина. Направленная на истощение антител терапия может включать также иммуноадсорбционную терапию, которую применяют к трансплантату ex vivo, до трансплантации. Иммуноадсорбцию можно осуществлять с помощью любого пригодного метода, например, на основе аффинности к протеину А или аффинности к антителу, используя антитела к поверхностным маркерам Т-клеток или В-клеток, таких как антитела к CD3, антитела к CD19, антитела к CD20 и антитела к CD19.
Иммуносупрессорная терапия может включать введение одного или несколько иммуносупрессоров, таких как ингибиторы транскрипции цитокинов (например, циклоспорин А, такролимус), синтеза нуклеотидов (например, азатиопурин, микофенолата мофетил), трансдукции сигнала факторов роста (например, сиролимус, рапамицин) и Т-клеточного рецептора интерлейкина 2 (например, даклизумаб, базиликсимаб). В конкретном варианте осуществления изобретения иммуносупрессор, применяемый в комбинации с композициями и способами, предлагаемыми в изобретении, включает один или несколько из следующих агентов: адриамицин, азатиопурин, бусульфан, циклофосфамид, циклоспорин А ("CyA"), цитоксин, флударабин, 5-фторурацил, метотрексат, микофенолата мофетил (МОФЕТИЛ), нестероидные противовоспалительные средства (НСПВС), рапамицин и такролимус (FK506). Иммуносупрессоры могут включать также ингибиторы комплемента, например, растворимого рецептора-1 комплемента, антитело к С5 или низкомолекулярный ингибитор С1, например, описанный у Buerke и др., J. Immunol., 167, 2001, cc.5375-5380.
В одном из вариантов осуществления изобретения композиции и способы, предлагаемые в изобретении, предусматривают применение в сочетании с одним или несколькими терапевтическими схемами подавления гуморального отторжения, включая, но не ограничиваясь только ими, терапию на основе такролимуса и микофенолата мофетила, иммуноадсорбцию, внутривенную иммуноглобулиновую терапию и плазмаферез.
5.23.1. Диагноз и клинические критерии
Настоящее изобретение относится к антителам, композициям и способам, предназначенным для лечения и предупреждения GVHD, гуморального отторжения и посттрансплантационного лимфопролиферативного нарушения у людей-реципиентов трансплантатов. Композиции и способы, предлагаемые в изобретении, можно применять вне зависимости от конкретного показания, для которого необходимо применять трансплантат. Аналогично этому, применение композиций и способов, предлагаемых в изобретении, для лечения и предупреждения GVHD, гуморального отторжения и посттрансплантационных лимфопролиферативных нарушений не ограничено конкретным типом ткани, предназначенной для трансплантации или уже трансплантированной.
Одним из вариантов осуществления изобретения являются композиции и способы предупреждения гуморального отторжения у человека-реципиента трансплантата, где реципиент трансплантата идентифицирован как пациент или популяция пациентов, имеющих высокий риск развития гуморального отторжения. Указанных пациентов можно обозначать также как «сенсибилизированные пациенты». Критерии идентификации сенсибилизированных пациентов известны специалистам в данной области. Такие критерии могут включать, например, пациентов, которые имеют выявляемые уровни в кровотоке антител к антигенам HLA, например, аллоантител к HLA. Указанные критерии могут включать также пациентов, имеющих ранее трансплантации, беременность или несколько переливаний крови. К пациентам, имеющим высокий риск гуморального отторжения, относятся также пациенты, для которых характерна неудовлетворительная проба на совместимость донор-реципиент по HLA, и пациенты с несовместимыми по группе крови АВО трансплантациями. Сенсибилизированные индивидуумы являются кандидатами для предварительной обработки или осуществления улучшения состояния перед трансплантацией. Сенсибилизированные индивидуумы также являются кандидатами для посттрансплантационных поддерживающих схем обработки с целью предупреждения гуморального отторжения.
В одном из вариантов осуществления изобретения антитела, композиции и способы, предлагаемые в изобретении, включают или их применяют в сочетании с терапевтической схемой лечения острого или хронического отторжения. В конкретных вариантах осуществления изобретения отторжение характеризуется как гуморальное отторжение стадии I, стадии II, стадии III или стадии IV.
В одном из вариантов осуществления изобретения антитела, композиции и способы, предлагаемые в изобретении, включают или их применяют в сочетании с терапевтической схемой лечения ранней стадии гуморального отторжения. В конкретных вариантах осуществления изобретения ранняя стадия гуморального отторжения представляет собой стадию I, II или III отторжения. Клинические признаки ранней стадии гуморального отторжения определяет специалист в данной области на основе его знаний и компетенции, и они могут включать, например, появление в кровотоке пациента антител, специфических для HLA донора, наличие активности маркеров комплемента антитела, такой как отложения C4d и C3d в биопсиях трансплантата, и присутствие антител к HLA в биопсиях трансплантата. Другие показатели ранней стадии гуморального отторжения известны специалистам в данной области и могут включать, например, возникновение антиэндотелиальных антител, прежде всего антител к виментину, и возникновение аллоантител к неклассической родственной ГКГ класса I цепи A (MICA).
В одном из вариантов осуществления изобретения композиции и способы, предлагаемые в изобретении, включают или их применяют в сочетании с терапевтической схемой лечения гуморального отторжения, характеризующегося в том числе дисфункцией трансплантата. В конкретных вариантах осуществления изобретения пациента или популяцию пациентов, нуждающихся в лечении гуморального отторжения, идентифицируют согласно критериям, известным в данной области для дисфункции трансплантата. Примеры указанных критериев для конкретных типов трансплантатов представлены в приведенных ниже разделах. В других вариантах осуществления изобретения пациента или популяцию пациентов, нуждающихся в лечении гуморального отторжения, идентифицируют по другим критериям, которые применяют для конкретного типа ткани трансплантата, таким как гистологические критерии. Примеры таких критериев также представлены в приведенных иже разделах.
5.23.2. Трансплантаты костного мозга
Композиции и способы, предлагаемые в изобретении, можно применять для лечения или предупреждения GVHD, гуморального отторжения и посттрансплантационного лимфопролиферативного нарушения у реципиента трансплантата костного мозга. В одном из вариантов осуществления изобретения композиции и способы, предлагаемые в изобретении, включают или их применяют в сочетании со схемой улучшения состояния до трансплантации.
В одном из вариантов осуществления изобретения композиции и способы, предлагаемые в изобретении, применяют для В-клеточного истощения трансплантата до трансплантации. Трансплантат можно получать из любого приемлемого источника, например, стволовых клеток пуповинной крови, стволовых клеток периферической крови или из жидкости, откачанной из костного мозга. Стволовые клетки периферической крови можно собирать из крови донора после воздействия на него приемлемой схемы улучшения состояния. Приемлемые схемы известны в данной области и могут включать, например, введение донору перед сбором крови донора одного или нескольких следующих агентов: нейпоген, цитокины, такие как GM-CSF, химиотерапевтические схемы с низкими дозами и хемокины. Трансплантат может быть либо аллогенным, либо аутологичным относительно реципиента трансплантата. Трансплантат может представлять собой также ксенотрансплантат.
Композиции и способы можно применять в различных контекстах, когда имеется гематопоэтическое показание для трансплантации костного мозга. В одном из вариантов осуществления изобретения применение аутологичного трансплантата костного мозга показано при В-клеточном лейкозе или лимфоме, включая, но не ограничиваясь только ими, острый лимфобластный лейкоз («ALL») или не-ходжкинскую лимфому, и композиции и способы, предлагаемые в изобретении, можно применять для истощения оставшихся злокачественных клеток, загрязняющих трансплантат.В одном из вариантов осуществления изобретения применение аутологичного трансплантата костного мозга показано для пациентов, которые не могут справиться с вирусной инфекцией, например, вирусной инфекцией, ассоциированной с вирусом Эпштейна-Барра (EBV), вирусом иммунодефицита человека (ВИЧ) или цитомегаловирусом (CMV), и композиции и способы, предлагаемые в изобретении, можно применять для элиминации из трансплантата В-клеток, которые могут нести вирус. В другом варианте осуществления изобретения трансплантат представляет собой аллогенный трансплантат и композиции и способы, предлагаемые в изобретении, можно применять для элиминации донорских В-клеток из трансплантата в качестве профилактики GVHD.
В одном из вариантов осуществления изобретения показание представляет собой ассоциированное с В-клетками аутоиммунное состояние и композиции и способы, предлагаемые в изобретении, можно применять для элиминации вредных В-клеток из организма пациента без необходимости в осуществлении химиотерапии или лучевой терапии в схемах улучшения состояния. В одном из вариантов осуществления изобретения композиции, предлагаемые в изобретении, вводят в сочетании со схемой химиотерапии или лучевой терапии, где указанная схема включает применение в более низкой дозе одного или нескольких химиотерапевтических агентов или в более низкой дозе излучения по сравнению с дозой, которую вводят в отсутствии композиций, предлагаемых в изобретении. В одном из вариантов осуществления изобретения пациенту приживляют аутологичный трансплантат костного мозга после химиотерапии или лучевой терапии, при этом из трансплантата элиминируют вредные В-клетки перед трансплантацией с помощью композиций и способов, представленных в настоящем описании.
Пациента или популяцию пациентов, которые нуждаются или на которые может оказывать благоприятное воздействие трансплантат костного мозга, идентифицирует специалист в данной области на основе его знаний и компетенции. Примеры пациентов, которые могут быть кандидатами для трансплантации костного мозга, включают пациентов, которых подвергали химиотерапии или лучевой терапии с целью лечения рака или аутоиммунного заболевания или нарушения, и пациентов, которые не могут справиться с вирусной инфекцией, сохранившейся в клетках иммунной системы.
5.23.3. Трансплантаты печени
Композиции и способы, предлагаемые в изобретении, можно применять для лечения или предупреждения GVHD, гуморального отторжения и посттрансплантационного лимфопролиферативного нарушения у реципиента трансплантата печени. В конкретных вариантах осуществления изобретения отторжение представляет собой острое или хроническое отторжение. В одном из вариантов осуществления изобретения композиции и способы, предлагаемые в изобретении, применяют для предупреждения GVHD, гуморального отторжения и посттрансплантационного лимфопролиферативного нарушения у реципиента трансплантата печени. В одном из вариантов осуществления изобретения композиции и способы, предлагаемые в изобретении, включают или их применяют в сочетании со схемой улучшения состояния до трансплантации. В одном из вариантов осуществления изобретения композиции, предлагаемые в изобретении, вводят реципиенту трансплантата. В одном варианте осуществления изобретения композиции, предлагаемые в изобретении, приводят в контакт с трансплантатом, ex vivo, до трансплантации.
Трансплантат печени можно получать из любого приемлемого источника, который может определять специалист в данной области на основе его знаний и компетенции. В одном из вариантов осуществления изобретения печень представляет собой совместимый по HLA аллогенный трансплантат. В другом варианте осуществления изобретения печень представляет собой ксенотрансплантат из свиньи-донора. В одном из вариантов осуществления изобретения печень применяют ех vivo для фильтрации крови пациента, например, экстракорпоральной перфузии. Экстракорпоральная перфузия представляет собой форму печеночного диализа, при которой пациента хирургически соединяют с печенью, находящейся вне организма. Эту процедур иногда называют «биоискусственная печень». Согласно этому варианту осуществления изобретения композиции и способы, предлагаемые в изобретении, применяют для предупреждения возникновения антител к антигенам печени, которые могут загрязнять кровь пациента.
В одном из вариантов осуществления изобретения композиции и способы, предлагаемые в изобретении, представляют собой улучшенную терапевтическую схему лечения и предупреждения GVHD, гуморального отторжения и посттрансплантационного лимфопролиферативного нарушения. В конкретном варианте осуществления изобретения композиции и способы, предлагаемые в изобретении, представляют собой улучшенную терапевтическую схему, где улучшение заключается в снижении количества случаев и/или серьезности осложнений, ассоциированных с традиционными иммуносупрессорами. В одном из вариантов осуществления изобретения количество случаев и/или серьезности нефротоксичности, гепатотоксичности и гирсутизма снижается по сравнению с традиционными схемами, основанными на применении циклоспорина А или других ингибиторов кальцинеурина. В одном из вариантов осуществления изобретения снижают количество случаев и/или серьезность ожирения, остеодистрофии, сахарного диабета и чувствительности к бактериальным и вирусным инфекциям по сравнению с традиционными схемами, основанными на применении кортикостероидов.
В одном из вариантов осуществления изобретения композиции и способы, предлагаемые в изобретении, применяют в сочетании с более низкими дозами одного или нескольких традиционных иммуносупрессоров по сравнению с дозами, которые применяют в отсутствие антилифоцитарной терапии с использованием антител. Более низкие дозы могут снижать количество случаев и/или серьезность одного или нескольких осложнений, ассоциированных с одним или несколькими традиционными иммуносупрессорами.
Пациента или популяцию пациентов, которые нуждаются или на которые может оказывать благоприятное воздействие трансплантат печени, идентифицирует специалист в данной области на основе его знаний и компетенции. Примеры пациентов, которые могут быть кандидатами для трансплантации печени, включают людей, имеющих одно или несколько из следующих состояний, заболеваний или нарушений: острая печеночная недостаточность, амилоидоз, нарушения экскреции билирубина, билиарная атрезия, синдром Бадда-Киари, хронический активный аутоиммунный гепатит, цирроз (ассоциированный с вирусными гепатитами, включая гепатит В и гепатит С, алкогольный цирроз или первичный билиарный цирроз), холангит, врожденное нарушение фактора VIII или IX, нарушения метаболизма меди, муковисцидоз, гликогенез, гиперхолестеролемия, липидозы, мукополисахаридоз, первичный склерозирующий холангит, нарушения метаболизма порфирина, нарушения метаболизма пурина и пиримидина и первичные доброкачественные и злокачественные неоплазмы, прежде всего печени и внутрипеченочных желчных протоков, билиарной системы, билиарных путей или пищеварительной системы.
Клинические критерии идентификации пациента или популяции пациентов, которые нуждаются или на которые может оказывать благоприятное воздействие трансплантат печени, определяет специалист в данной области на основе его знаний и компетенции. Такие критерии могут включать, например, один или несколько следующих симптомов: утомляемость, потеря веса, боль в верхней абдоминальной области, пуриты, желтуха, увеличение печени, изменение цвета мочи, повышенная активность щелочной фосфатазы и гамма-глутамилпептидазы, повышенные уровни билирубина, пониженные уровни сывороточного альбумина, повышенные уровни специфических для печени ферментов, низкий уровень производства желчи, повышенный уровень в крови азота мочевины, повышенный уровень креатинина и/или присутствие титров антител к нейтрофилам цитоплазмы (ANCA), периодическое кровотечение из варикозно расширенных вен, трудноизлечимые асциты, спонтанный бактериальный перитонит, стойкая энцефалопатия, серьезная желтуха, обострение искусственной дисфункции, внезапное физиологическое ухудшение и молниеносная печеночная недостаточность.
5.23.4. Трансплантаты почки (ренальные трансплантаты)
Композиции и способы, предлагаемые в изобретении, можно применять для лечения или предупреждения GVHD, гуморального отторжения и посттрансплантационного лимфопролиферативного нарушения у реципиента ренального трансплантата. В контексте настоящего описания понятие «ренальный трансплантат» включает трансплантат почки и объединенный трансплантат почки и поджелудочной железы. В конкретных вариантах осуществления изобретения отторжение характеризуется как острое отторжение или хроническое отторжение.
В одном из вариантов осуществления изобретения композиции и способы, предлагаемые в изобретении, включают или их можно применять в сочетании со схемой улучшения состояния до трансплантации. В одном из вариантов осуществления изобретения однократная доза одной или нескольких композиций, предлагаемых в настоящем изобретении, обладает эффективностью в отношении снижения панели реактивных антител и В-клеточного истощения у пациента или популяции пациентов. В другом варианте осуществления изобретения несколько доз одной или нескольких композиций, предлагаемых в настоящем изобретении, обладает эффективностью в отношении уменьшения панели реактивных антител и В-клеточного истощения у пациента или популяции пациентов. В одном из вариантов осуществления изобретения однократную дозу одной или нескольких композиций, предлагаемых в настоящем изобретении, вводят в сочетании с одним или несколькими иммуносупрессорами, и она обладает эффективностью в отношении снижения панели реактивных антител и В-клеточного истощения у пациента или популяции пациентов.
В определенных вариантах осуществления изобретения композиции и способы, предлагаемые в изобретении, предназначены для лечения или предупреждение GVHD и отторжения трансплантата у пациентов с ренальным трансплантатом. В одном из вариантов осуществления изобретения у пациента не проявляются клинические симптомы отторжения. В родственном варианте осуществления изобретения композиции и способы, предлагаемые в изобретении, включают или их можно применять в сочетании с поддерживающей схемой лечения с целью предупреждения отторжения трансплантата у реципиента трансплантата. В одном из вариантов осуществления изобретения композиции и способы, предлагаемые в изобретении, предназначены для лечения субклинического гуморального отторжения. В родственном варианте осуществления изобретения пациента или популяцию пациентов, которые нуждаются в лечении субклинического гуморального отторжения, идентифицируют путем выявления отложения Cd4 в полученных с помощью биопсии образцах трансплантата или путем выявления в кровотоке антител к HLA.
В одном из вариантов осуществления изобретения композиции и способы, предлагаемые в изобретении, включают или их можно применять в сочетании с терапевтической схемой лечения эпизода острого или хронического отторжения у реципиента трансплантата. В одном из вариантов осуществления изобретения пациента или популяцию пациентов, которые нуждаются в лечении эпизода острого или хронического отторжения, идентифицируют путем выявления одного или нескольких клинических индикаторов отторжения. В конкретных вариантах осуществления изобретения один или несколько клинических индикаторов отторжения выявляют через 1-6 недель после трансплантации. В одном из вариантов осуществления изобретения один или несколько клинических индикаторов отторжения выявляют через 6, 12, 18, 24, 36, 48 или 60 месяцев после трансплантации. В одном из вариантов осуществления изобретения острое отторжение представляет собой подтвержденное с помощью биопсии острое гуморальное отторжение.
В одном из вариантов осуществления изобретения одну или несколько композиций, предлагаемых в изобретении, применяют в терапевтической схеме лечения острого отторжения. В конкретном варианте осуществления изобретения терапевтическая схема включает также применение одного или нескольких следующих средств: плазмаферез, применение такролимуса/микофенолата, внутривенное введение иммуноглобулина, иммуноадсорбция с использованием протеина А и применение антитела к CD20. В одном из вариантов осуществления изобретения пациента подвергали протоколу лечения с использованием иммуносупрессора перед развитием отторжения. В конкретном варианте осуществления изобретения протокол на основе иммуносупрессора включает применение одного или нескольких из следующих средств: циклоспорин, азатиоприн и стероидная терапия.
Клинические индикаторы острого гуморального отторжения известны в данной области и включают, например, внезапное серьезное ухудшение почечной функции, развитие олигурии и аномальной почечной перфузии. Дополнительными индикаторами являются, например, наличие воспалительных клеток в перитубулярных капиллярах при биопсии донорспецифических аллоантител в кровотоке. В одном из вариантов осуществления изобретения пациент удовлетворяет одному или нескольким из следующих диагностических критериев гуморального отторжения ренального аллотрансплантата: (1) морфологическое доказательство острого отторжения ткани; (2) доказательство активности антител, такое как отложения C4d или иммуноглобулина и комплемента в артериальном фиброиноидном некрозе; и (3) обнаруживаемые антитела в кровотоке к HLA-антигенам донора или эндотелиальным антигенам донора. В одном из вариантов осуществления изобретения пациент удовлетворяет всем трем из вышеуказанных диагностических критериев.
В одном из вариантов осуществления изобретения пациент удовлетворяет одному из вышеизложенных критериев острого гуморального отторжения и композиции, предлагаемые в настоящем изобретении, применяют в сочетании с одним или несколькими из следующих иммуносупрессоров для лечения острого гуморального отторжения: внутривенно введенный иммуноглобулин, антитимоцитные глобулины, антитела к CD20, микофенолата мофетил или такролимус. В другом варианте осуществления изобретения композиции, предлагаемые в изобретении, применяют в сочетании с одним или несколькими иммуносупрессорами и процедурами, предназначенными для удаления аллоантител из пациента, такими как плазмаферез или иммуноадсорбция.
В одном из вариантов осуществления изобретения композиции и способы, предлагаемые в изобретении, включают или их применяют в сочетании с терапевтической схемой лечения хронического отторжения ренальных аллотрансплантатов. В одном из вариантов осуществления изобретения одну или несколько композиций, предлагаемых в изобретении, применяют индивидуально или в сочетании с одним или несколькими иммуносупрессорами, включая, например, антитела к CD154 (CD40L), такролимус, сиролимус и мизорибин. В одном из вариантов осуществления изобретения одно или несколько антител к CD19 применяют в сочетании с такролимусом и микофенолатом.
Клинические индикаторы хронического отторжения в почках известны в данной области и могут включать, например, фиброз артериальной интимы, характеризующийся присутствием мононуклеарных клеток (хроническая васкулопатия аллотрансплантата), удвоение гломерулярных базальных мембран (хроническая гломерулопатия аллотрансплантата), расслоение перитубулярной базальной мембраны, наличие C4d в перитубулярных капиллярах и наличие выявляемых реактивных в отношении донорских HLA антител. В одном из вариантов осуществления изобретения композиции и способы, предлагаемые в изобретении, включают или их применяют в сочетании с терапевтической схемой для лечения хронического отторжения до развития повреждения трансплантата.
В другом варианте осуществления изобретения пациента или популяцию пациентов, которым необходимо лечение, идентифицируют по присутствию у них одного или нескольких клинических индикаторов гломерулопатии трансплантата. В родственном варианте осуществления изобретения композиции, предлагаемые в изобретении, включают или их применяют в сочетании с терапевтической схемой, основанной на применении одного или нескольких терапевтических агентов. В определенных вариантах осуществления изобретения терапевтическая схема обладает эффективностью в отношении стабилизации почечной функции и ингибирует отторжение трансплантата. В конкретном варианте осуществления изобретения один или несколько терапевтических агентов представляют собой ингибиторы ангиотензинпревращающего фермента (АСЕ) и/или антагонисты его рецепторов, внутривенно введенный иммуноглобулин, антитимоцитные глобулины, антитело к CD20, микофенолата мофетил или такролимус. Антитела к CD19 можно применять в сочетании с микофенолата мофетилом и такролимусом, а также с другими терапевтическими средствами или без них. Плазмаферез можно применять также в качестве части терапевтической схемы.
Пациента или популяцию пациентов, которые нуждаются или на которые может оказывать благоприятное воздействие ренальный трансплантат, идентифицирует специалист в данной области на основе его знаний и компетенции. Примерами пациентов, которые могут быть кандидатами для ренальной трансплантации, являются пациенты, у которых диагностирован амилоидоз, диабет (типа I или типа II), гломерулярное заболевание (например, гломерулонефрит), подагра, гемолитический уремический синдром, ВИЧ, наследственная болезнь почек (например, поликистоз почек, врожденная обструктивная уропатия, цистоиноз или синдром недостаточности мышц живота), или болезнь почек (например, приобретенная обструктивная нефропатия, острый тубулярный некроз, острый интерстициальный нефрит), ревматоидный артрит, системная красная волчанка или серповидно-клеточная анемия. Другими кандидатами для ренальной трансплантации являются пациенты, которые имеют дефицит инсулина, высокое кровяное давление, серьезное повреждение или ожоги, обширное операционное вмешательство, болезнь сердца или сердечный приступ, болезнь печени или печеночную недостаточность, сосудистое заболевание (например, прогрессирующий системный склероз, тромбоз почечной артерии, склеродермия), везикоуретеральный рефлюкс и некоторые типа рака (например, распространенная карцинома, лимфома, множественная миелома, почечно-клеточная карцинома, опухоль Вильмса). Другие кандидаты для ренальной трансплантации могут представлять собой, например, потребителей героина, людей, у которых ранее было отторжение трансплантата почки или поджелудочной железы, и людей, которые подвергаются лечению согласно терапевтической схеме, включающей применение антибиотиков, циклоспорина, или химиотерапии.
Клинические критерии, предназначенные для идентификации пациента или популяции пациентов, которые нуждаются или на которые может оказывать благоприятное воздействие трансплантата почек, идентифицирует специалист в данной области на основе его знаний и компетенции. Такие критерии могут включать, например, один или несколько следующих симптомов: относящиеся к моче проблемы, кровотечение, предрасположенность к образованию гематом, утомляемость, спутанность сознания, тошнота и рвота, потеря аппетита, бледность кожи (в результате анемии), боль в мышцах, суставах, в боку и грудной клетки, боль или переломы кости и зуд.
5.23.5. Трансплантаты сердца
Композиции и способы, предлагаемые в изобретении, можно применять для лечения или предупреждения GVHD, гуморального отторжения и посттрансплантационного лимфопролиферативного нарушения у реципиента трансплантата сердца. В конкретных вариантах осуществления изобретения отторжение представляет собой острое или хроническое отторжение. В одном из вариантов осуществления изобретения композиции и способы, предлагаемые в изобретении, включают или их применяют в сочетании со схемой улучшения состояния до трансплантации.
В определенных вариантах осуществления изобретения композиции и способы, предлагаемые в изобретении, включают или их можно применять в сочетании с терапевтической схемой для лечения острого гуморального отторжения у реципиента трансплантата сердца. В конкретном варианте осуществления изобретения терапевтическая схема включает также применение одного или нескольких из следующих средств: плазмаферез, внутривенное введение иммуноглобулина и терапия с использованием антитела к CD20. Пациента или популяцию пациентов, которые нуждаются в лечении острого гуморального отторжения, идентифицируют путем определения одного или нескольких клинических показаний острого гуморального отторжения. Примеры клинических индикаторов острого гуморального отторжения могут включать один или несколько из следующих показателей: гемодинамическая дисфункция, выявленная по наличию шока, гипотензия, снижение сердечного выброса и повышение капиллярного заклинивающего давления или давления в легочной артерии. В конкретном варианте осуществления изобретения острое гуморальное отторжение диагностируется через 6, 12, 18, 24, 36, 48 или 60 месяцев после трансплантации.
В одном из вариантов осуществления изобретения композиции и способы, предлагаемые в изобретении, включают или их применяют в сочетании с терапевтической схемой для предупреждения отторжения у реципиента трансплантата сердца. В одном из вариантов осуществления изобретения реципиента трансплантата, который нуждается в профилактике отторжения, идентифицируют как пациента или популяцию пациентов, которые имеют один или несколько из следующих факторов риска: женский пол, серопозитивность к цитомегаловирусу, повышенный ответ на панель реактивных антител, позитивная проба на совместимость до и/или после трансплантации и предварительная сенсибилизация иммуносупрессорами.
В одном из вариантов осуществления изобретения композиции и способы, предлагаемые в изобретении, предназначены для лечения или предупреждения повреждения трансплантата у реципиента трансплантата сердца. В одном из вариантов осуществления изобретения реципиента трансплантата, который нуждается в лечении или профилактике повреждения трансплантата, идентифицируют как пациента или популяцию пациентов, которые имеют один или несколько следующих клинических признаков гуморального отторжения:
отложение иммуноглобулина, наличие C1q, C3 и/или C4d в капиллярах, доказательство присутствия СD68-позитивных клеток в капиллярах и доказательство инфильтрации трансплантата воспалительными клетками при биопсии. В одном из вариантов осуществления изобретения композиции, предлагаемые в настоящем изобретении, применяют в сочетании с одним или несколькими из следующих иммуносупрессоров для лечения повреждения трансплантата у реципиент трансплантата сердца: внутривенно введенный иммуноглобулин, антитимоцитные глобулины, антитело к CD20, микофенолата мофетил или такролимус.В другом варианте осуществления изобретения содержащие антитело к CD19 композиции можно применять в сочетании с одним или несколькими иммуносупрессорами и процедурами, предназначенными для удаления аллоантител из организма пациента, такими как плазмаферез или иммуноадсорбция.
В одном из вариантов осуществления изобретения композиции и способы, предлагаемые в изобретении, включают или их применяют в сочетании с терапевтической схемой для лечения хронического отторжения сердца, например хронической васкулопатии аллотрансплантата, которую обозначают также как коронарное артериальное заболевание трансплантата. В другом варианте осуществления изобретения композиции и способы, предлагаемые в изобретении, включают или их применяют в сочетании с терапевтической схемой для предупреждения коронарного артериального заболевания трансплантата у пациента или популяции пациентов из группы риска. Критерии идентификации пациента или популяции пациентов, которые имеют риск развития коронарного артериального заболевания трансплантата, известны в данной области и могут включать, например, пациентов с плохо совместимыми трансплантатами, пациентов, у которых в кровотоке присутствуют антитела к HLA, и пациентов, у которых развился один или несколько клинических признаков гуморального отторжения вскоре после трансплантации сердца.
Пациента или популяцию пациентов, которые нуждаются или на которых может оказывать благоприятное действие трансплантат сердца, определяет специалист в данной области на основе его знаний и компетенции. Примеры пациентов, которые могут быть кандидатами для трансплантации сердца, включают пациентов, у которых диагностировано любое из следующих заболеваний и нарушений: коронарное артериальное заболевание, кардиомиопатия (невоспалительная болезнь сердца), заболевание сердечного клапана с застойной сердечной недостаточностью, опасная для жизни аномалия сердечного ритма, не дающая ответ на другую терапию, идиопатическая кардиомиопатия, ишемическая кардиомиопатия, дилатационная кардиомиопатия, ишемическая кардиомиопатия и врожденное заболевание сердца, для которого не существует принятой терапии или которое не поддается лечению с помощью принятой терапии.
Клинические критерии для идентификации пациента или популяции пациентов, которые нуждаются или на которых может оказывать благоприятное действие трансплантат сердца, определяет специалист в данной области на основе его знаний и компетенции. Такие критерии могут включать, например, один или несколько из следующих показаний: фракция выброса менее чем 25%, трудноизлечимая стенокардия или злокачественные сердечные аритмии, нечувствительные к общепринятой терапии, и легочное сосудистое сопротивление, составляющее менее 2 единиц Вуда. Кроме того, пациента или популяцию пациентов, которые нуждаются трансплантации сердца, можно идентифицировать, осуществляя серии анализов, которые известны и находятся в компетенции специалистов данной области. Такие анализы включают, например, эхокардиограммы в состоянии покоя и стресса, ЭКГ, анализ уровней креатинина в крови, коронарную артериографию и кардиопульмонарную оценку, включая катетеризацию правых и левых отделов сердца.
5.23.6. Трансплантат легкого
Композиции и способы, предлагаемые в изобретении, можно применять для лечения или предупреждения GVHD, гуморального отторжения и посттрансплантационного лимфопролиферативного нарушения у реципиента трансплантата легкого. В конкретных вариантах осуществления изобретения отторжение характеризуется как острое или хроническое отторжение. В одном из вариантов осуществления изобретения композиции и способы, предлагаемые в изобретении, включают или их применяют в сочетании со схемой улучшения состояния до трансплантации.
Пациента или популяцию пациентов, которые нуждаются или на которых может оказывать благоприятное действие трансплантат легкого, определяет специалист в данной области на основе его знаний и компетенции. Примеры пациентов, которые могут быть кандидатами для трансплантации легкого, включают пациентов, у которых диагностировано любое из следующих заболеваний или состояний: бронхоэктаз, хроническое обструктивное заболевание легких, муковисцидоз, синдром Айзенменгера или врожденное заболевание сердца с синдромом Айзенменгера, эмфизема, эозинофильная гранулема легкого или гистоцитоз X, травма, вызванная ингаляцией/ожогом, лимфангиолеймиоматоз (LAM), первичная легочная гипертензия, легочный фиброз (рубцевание легкого) или саркоидоз.
Клинические критерии для идентификации пациента или популяции пациентов, которые нуждаются или на которых может оказывать благоприятное действие трансплантат легкого, может определять специалист в данной области на основе его знаний и компетенции. Такие критерии могут включать, например, одно или несколько из следующих показаний: хроническое обструктивное заболевание легких (COPD) и эмфизема, связанная с дефицитом альфа1-антитрипсина, которая характеризуется одним или несколькими из следующих показателей: постбронходиляторный односекундный объем воздуха при форсированном выдохе (ОФВ1) менее 25% от ожидаемого, гипоксемия в покое, т.е. РаО2 менее чем 55-60 мм Hg, гиперкапния, вторичная легочная гипертензия, быстрая скорость снижения ОФВ1 или опасные для жизни обострения болезней; муковисцидоз, характеризующийся одним или несколькими из следующих показателей: постбронходиляторный ОФВ1 менее чем 30% от ожидаемого, гипоксемия в покое, гиперкапния или повышение скорости и серьезности обострения болезней; идиопатический легочный фиброз, характеризующийся одним или несколькими из следующих показателей: жизненная емкость легких (ЖЕЛ) и общая емкость легких (ОЕЛ) менее чем 60-65% от ожидаемого и гипоксемия в покое; вторичная легочная гипертензия, характеризующаяся клиническим, радиографическим или физиологическим прогрессированием на фоне медицинского лечения; первичная легочная гипертензия, характеризующаяся одним или несколькими из следующих показателей: согласно NYHA (Классификация сердечной недостаточности Нью-Иорской ассоциации кардиологов) как функциональный класс III или IV, среднее давление в правом предсердии более 10 мм Hg, среднее легочное артериальное давление более 50 мм Hg, сердечный индекс менее чем 2,5 л/мин/м и безуспешность терапии на основе продолжительной инфузии простациклина.
5.23.7. Лимфопролиферативное нарушение после трансплантации
Иммуносупрессия, необходимая для успешной трансплантации, может приводить к посттрансплантационному лимфопролиферативному нарушению В-клеточного происхождения. Как правило, посттрансплантационное Лимфопролиферативное нарушение ассоциировано с зараженными вирусом Эпштейна-Барра клетками. Посттрансплантационное Лимфопролиферативное нарушение (посттрансплантационный лимфопролиферативнй синдром, PTLD) может проявляться в нескольких формах от доброкачественного самокупирующегося напоминающего мононуклеоз синдрома до агрессивной не-ходжкинской лимфомы. Композиции и способы, предлагаемые в настоящем изобретении, можно применять для лечения PTLD, возникшего при любой трансплантации. Трансплантат может представлять собой трансплантат плотного органа, например трансплантат сердца, трансплантат печени, трансплантат почки или комбинированный трансплантат почки-поджелудочной железы. В одном из вариантов осуществления изобретения композиции и способы, предлагаемые в изобретении, применяют для лечения PTLD в качестве части терапевтической схемы, которая включает временное прекращение или снижение нагрузки другой иммуносупрессорной терапии.
В одном из вариантов осуществления изобретения содержащие антитело к CD19 композиции применяют в виде части терапевтической схемы, включающей применение одного или нескольких из следующих средств: внутривенное введение высокой дозы гамма-глобулинов, цитокина, противовирусного агента и моноклоального антитела к CD20. Терапевтическая схема может включать временное прекращение или снижение нагрузки иммуносупрессорной терапии. В одном из вариантов осуществления изобретения гамма-глобулин вводят внутривенно, используя суточную дозу 0,4 г/кг в течение 1-5 дней, предпочтительно 3 дней, и цитокин, представляющий собой интерферон альфа, вводят по меньшей мере в течение 7 дней. В одном из вариантов осуществления изобретения в схеме лечения можно применять один или несколько цитокинов. В одном из вариантов осуществления изобретения один или несколько противовирусных агентов применяют в схеме лечения. Противовирусный агент можно выбирать из любого пригодного агента, известного специалисту в данной области. В одном из вариантов осуществления изобретения противовирусный агент представляет собой ацикловир или ганцикловир. Противовирусный агент можно вводить по меньшей мере в течение одной или двух недель. Противовирусный агент можно вводить также в течение более длительных периодов времени, например, в течение 1, 2, 3, 4 или 5 месяцев.
5.24. Диагностирование пациентов и терапевтические схемы: аутоиммунное заболевание
Согласно некоторым объектам изобретения схему лечения и применяемые дозы композиций и способы, предлагаемые в изобретении, выбирают в зависимости от ряда факторов, включая, но не ограничиваясь только ими, стадию аутоиммунного заболевания или нарушения, подлежащего лечению. Соответствующие лечебные схемы может определять специалист в данной области для конкретных стадий аутоиммунного заболевания или нарушения у пациента или популяции пациентов. Кривые дозовой зависимости можно создавать с помощью стандартных для данной области протоколов с целью определения эффективного количества композиций, предлагаемых в изобретении, для лечения пациентов с различными стадиями аутоиммунного заболевания или нарушения. В целом, для пациентов с более высокой активностью аутоиммунного заболевания или нарушения должны требоваться более высокие дозы и/или более частое введение доз, которые можно вводить в течение более длительных периодов времени, по сравнению с требуемыми для пациентов с менее активным аутоиммунным заболеванием или нарушением.
Антитела к CD19, композиции и способы, предлагаемые в изобретении, можно применять на практике для лечения аутоиммунного заболевания или нарушения. Понятие «аутоиммунное заболевание или нарушение» относится к состоянию у индивидуума, характеризующемуся повреждением на уровне клеток, ткани и/или органа, которое вызывается иммунологической реакцией у индивидуума на его собственные клетки, ткани и/или органы. Понятие «воспалительное заболевание» применяют взаимозаменяемо с понятием «воспалительное нарушение» для обозначения состояния у индивидуума, которое характеризуется воспалением, включая, но не ограничиваясь только им, хроническое воспаление. Аутоиммунные нарушения могут быть ассоциированы с воспалением или не ассоциированы с ним. Кроме того, воспаление может вызываться или не вызываться аутоиммунным нарушением. Таким образом, определенные нарушения можно классифицировать и как аутоиммунные, и как воспалительные нарушения. Примерами аутоиммунных заболеваний или нарушений являются, но не ограничиваясь только ими: гнездная алопеция, анкилозирующий спондилоартрит, антифосфолипидный синдром, аутоиммунная болезнь Аддисона, аутоиммунные заболевания надпочечника, аутоиммунная гемолитическая анемия, аутоиммунный гепатит, аутоиммунный оофорит и орхит, аутоиммунная тромбоцитопения, болезнь Бехчета, буллезный пемфигус, кардиомиопатия, дерматит типа целиакии-спру, синдром хронической утомляемости иммунной дисфункции (CFIDS), хроническая воспалительная демиелинизирующая полинейропатия, синдром Чержа-Стросса, рубцовый пемфигоид, CREST-синдром, болезнь холодного агглютинина, болезнь Крона, дискоидная красная волчанка, эссенциальная смешанная криоглобулинемия, диабет, эозинофильный фасцит, фибромиаглия-фибромиозит, гломерулонефрит, болезнь Грейвса, синдром Гийена-Барре, Хасимото тиреоидит, пурпуру Геноха-Шенлейна, идиопатический легочный фиброз, идиопатическая/аутоиммунная тромбоцитопения (ITP), IgA-нейропатия, ювенильный артрит, красный плоский лишай, красная волчанка, болезнь Меньера, смешанное заболевание соединительной ткани, рассеянный склероз, сахарный диабет типа 1 или опосредуемый иммунной системой, тяжелая псевдопаралитическая миастения, родственные пузырчатке нарушения (например, пузырчатка обыкновенная), пернициозная анемия, нодозный полиартериит, полихондрит, полигландулярные синдромы, полимиалгия ревматическая, полимиозит и дерматомиозит, первичная агаммаглобулинемия, первичный билиарный цирроз, псориаз, псориатический артрит, феномен Рейно, синдром Рейтера, ревматоидный артрит, саркоидоз, склеродермия, синдром Шегрегна, синдром негнущегося человека, системная красная волчанка (SLE), синдром Свита, болезнь Стилла, красная волчанка, Такаясу артерит, темпоральный артериит/гигантоклеточный артрит, неспецифический язвенный колит, увеит, васкулитиды, такие как кожный герпетиформный васкулит, витилиго и гранулематоз Вегенера. Примерами воспалительных нарушений являются, но не ограничиваясь только ими, астма, энцефалит, воспалительное заболевание кишечника, хроническое обструктивное заболевание легких (COPD), аллергические нарушения, септический шок, легочный фиброз, недифференцированная спондилоартропатия, недифференцированная артропатия, артрит, воспалительный остеолиз, реакция «трансплантат-против-хозяина», крапивница, синдром Фогта-Коянаги-Харады и хроническое воспаление, являющееся результатом хронических вирусных или бактериальных инфекций.
Анти-CD19 иммунотерапия предусматривает введение антитела к CD19 в качестве индивидуального терапевтического средства для лечения аутоиммунного заболевания или нарушения. В одном из вариантов осуществления изобретения анти-CD19 иммунотерапия, предлагаемая в изобретении, предусматривает введение антитела к CD19, которое обладает способностью ингибировать in vitro стимулированную В-клеточную пролиферацию. В другом варианте осуществления изобретения анти-CD19 иммунотерапия, предлагаемая в изобретении, предусматривает введение Fc-варианта антитела к CD19, где Fc-вариант имеет измененную аффинность к связыванию с одним или несколькими Fc-лигандами по сравнению с не представляющей собой вариант молекулой. В конкретном варианте осуществления изобретения анти-CD19 иммунотерапия, предлагаемая в изобретении, предусматривает введение Fc-варианта антитела к CD19, где Fc-вариант обладает повышенной способностью к связыванию с Fc-гамма-рецептором ПВ по сравнению с не представляющим собой вариант Fc-фрагментом.
Анти-CD19 иммунотерапия предусматривает также введение биспецифического антитела к CD19 в качестве индивидуального терапевтического средства для лечения аутоиммунного заболевания или нарушения. В одном из вариантов осуществления изобретения анти-CD19 иммунотерапия, предлагаемая в изобретении, предусматривает введение биспецифического антитела к CD19, обладающего способностью специфически связываться с первым и вторым антигеном, где первый антиген представляет собой человеческий CD19, а второй антиген представляет собой Fc-гамма-рецептор, выбранный из группы, включающей FcγRI, FcγRIIA, FcγRIIB, FcγRIIIA и/или FcγRIV. В другом варианте осуществления изобретения анти-CD19 иммунотерапия, предлагаемая в изобретении, предусматривает введение биспецифического антитела к CD19, которое обладает способностью специфически связываться с человеческим CD19 и FcγRIIB.
CD19 экспрессируется на незрелых В-клетках, поэтому МАт к CD19 наиболее предпочтительно применять для истощения пре-В-клеток и незрелых В-клеток, например, в костном мозге.
5.24.1. Диагностика аутоиммунных заболеваний или нарушений
Диагностика аутоиммунных заболеваний или нарушений осложняется тем, что каждый тип аутоиммунного заболевания или нарушения проявляется по разному у пациентов. Такая гетерогенность симптомов определяет, как правило, необходимость оценивать множество факторов для постановки клинического диагноза. Как правило, клиницисты применяют такие факторы, как, но не ограничиваясь только ими, присутствие аутоантител, повышенные уровни цитокинов, специфическая дисфункция органа, кожная сыпь, припухлость суставов, боль, ремоделирование кости и/или потеря ее подвижности, в качестве основных индикаторов аутоиммунного заболевания или нарушения. Для некоторых аутоиммунных заболеваний или нарушений, таких как РА (ревматоидный артрит) и SLE, стандарты, применяемые для диагноза, известны в данной области. Для некоторых аутоиммунных заболеваний или нарушений, стадии болезни охарактеризованы и хорошо известны в данной области. Указанные методы распознавания для диагностики аутоиммунных заболеваний и нарушений, а также стадий болезни и баллы активности и/или серьезности болезни, которые хорошо известны в данной области, можно применять для идентификации пациентов и популяции пациентов, у которых необходимо лечить аутоиммунное заболевание или нарушение с помощью композиций и способов, предлагаемых в изобретении.
5.24.2. Клинические критерии диагностирования аутоиммунных заболеваний или нарушений
Диагностические критерии различных аутоиммунных заболеваний или нарушений известны в данной области. Исторически диагноз, как правило, основан на комбинации физических симптомов. В последние годы методы молекулярной биологии, такие как определение профиля генной экспрессии, начали применять для разработки определения на молекулярном уровне аутоиммунных заболеваний или нарушений. Примеры методов клинической диагностики конкретных аутоиммунных заболеваний или нарушений приведены ниже. Специалистам в данной области должны быть очевидны другие пригодные для этой цели методы.
В определенных вариантах осуществления изобретения можно идентифицировать пациентов с низкими уровнями активности аутоиммунного заболевания или пациентов, имеющих раннюю стадию аутоиммунного заболевания (в случае болезней, для которых существует разделение на стадии), которых можно подвергать лечению с помощью содержащих антитело к CD19 композиций и способов. Ранняя диагностика аутоиммунного заболевания является трудной из-за общих симптомов и перекрывания симптомов различных заболеваний. В указанных вариантах осуществления изобретения пациент, которого лечат на ранней стадии или при низких уровнях активности аутоиммунного заболевания, имеет симптомы, включающие по меньшей мере один симптом аутоиммунного заболевания или нарушения. В родственных вариантах осуществления изобретения пациент, которого лечат на ранней стадии или при низких уровнях активности аутоиммунного заболевания, имеет симптомы, включающие по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15 симптомов аутоиммунного заболевания или нарушения. Симптомы могут представлять собой симптомы любых аутоиммунных заболеваний и нарушений или их комбинации. Ниже описаны примеры симптомов аутоиммунных заболеваний и нарушений.
5.24.3. Ревматоидный артрит
Ревматоидный артрит представляет собой хроническое заболевание, характеризующееся главным образом воспалением выстилки или синовиальной оболочки суставов. Оно может приводить к длительному повреждению сустава, результатом которого является хроническая боль, потеря функции и потеря трудоспособности. Идентификация пациентов или популяции пациентов, нуждающихся в лечении ревматоидного артрита, представляет собой длительный процесс. Не существует никакого окончательного теста, который позволяет поставить положительный или отрицательный диагноз ревматоидного артрита. Клиницисты основываются на целом ряде инструментов, включая историю болезни, физические обследования, лабораторные анализы и рентгеноскопию.
Физические симптомы сильно варьируются от пациента к пациенту и, как правило, включают, но, не ограничиваясь только ими, припухлость сустава, болезненность сустава, потерю двигательной способности суставов, смещение сустава, ремоделирование кости, утомляемость, тугоподвижность (прежде всего по утрам и при нахождении в сидячем положении в течение длительных периодов времени), слабость, напоминающие грипп симптомы (включая слабое проявление лихорадки), боль, ассоциированную с пролонгированным нахождением в сидячем положении, наличие внезапных обострений болезни после ремиссии или неактивной фазы заболевания, ревматоидные узлы или шишки ткани под кожей (как правило, присутствующие в локтевой области, они могут свидетельствовать о более серьезной активности заболевания), мышечную боль, потерю аппетита, депрессию, потерю веса, анемию, холодные и/или потные руки и ноги и поражение болезнью желез вокруг глаз и рта, что приводит к пониженному производству слез и слюны (синдром Шегрена). Информацию касательно конкретно синдрома Шегрена можно найти в следующих ссылках: Fox и др. Arthritis Rheum., 29, 1986, cc.577-586 и Vitali и др. Ann. Rheum. Dis., 61, 2002, cc.554-558.
Помимо физических симптомов клиницисты, как правило, применяют такие тесты, как, но не ограничиваясь только ими, клинический анализ крови, скорость оседания эритроцитов (СОЭ или скорость оседания (sed rate)), С-реактивный белок, ревматоидный фактор, антитела к ДНК, антиядерные антитела (ANA), антитела к кардиолипину, визуализирующие исследования, рентгенограммы (Х-лучи), визуализация методом ядерно-магнитного резонанса (ЯМР-томография) суставов или органов, ультразвуковое обследование сустава, сканирование кости и денситометрия кости (DEXA). Эти тесты являются примерами тестов, которые можно применять в сочетании с композициями и способами, предлагаемыми в изобретении, для оценки аномалий, которые могут существовать (т.е. для идентификации пациентов или популяции пациентов, которые нуждаются в лечении) или для мониторинга побочных действий лекарственных средств и регистрации прогресса.
Ранние симптомы ревматоидного артрита обычно можно обнаружить в более мелких суставах пальцев, кистей рук и запястий. Поражение болезнью суставов, как правило, является симметричным, это означает, что, если состав поврежден на левой кисти, то этот же сустав будет поражен на правой кисти. В целом, более серьезная эрозия сустава свидетельствует о более серьезной активности заболевания.
Симптомы активности более запущенной стадии болезни включают повреждение хряща, сухожилий, связок и кости, что вызывает деформацию и нестабильность суставов. Повреждение может приводить в ограниченному диапазону подвижности, результатом этого является то, что становится все труднее выполнять ежедневные функции (сжимать вилку, расчесывать волосы, застегивать пуговицы на рубашке). Кожные язвы, повышение чувствительности к инфекциям и общее ухудшение состояния здоровья также являются индикаторами более запущенной активности заболевания.
Развитие ревматоидного артрита, как правило, подразделяют на три стадии. На первой стадии имеет место опухание синовиальной выстилки, вызывающее боль, повышение температуры, тугоподвижность, покраснение и опухание вокруг сустава. Вторая стадия характеризуется быстрым делением и ростом клеток или паннусом, который приводит к утолщению синовиальной оболочки. На третьей стадии из воспаленных клеток высвобождаются ферменты, которые могут разрушать кость и хрящ, что часто приводит к потере формы и структуры пораженного сустава, усилению боли и потере подвижности.
Для идентификации пациентов или популяции пациентов, которые нуждаются в лечении, можно применять также методы молекулярной биологии. Например, установлено, что ревматоидный артрит ассоциирован с аллельными полиморфизмами генов человеческого лейкоцитарного антигена (HLA)-DR4 и HLA-DRB1 (Oilier и Winchester, 1999, Genes and Genetics of Autoimmunity, Basel, Switzerland; Stastny N. Engl J Med 298, 1978, cc.869-871; и Gregersen и др. Arthritis Rheum 30, 1987, cc.1205-1213). У страдающих ревматоидным артритом пациентов часто происходит экспрессия двух ассоциированных с заболеванием аллелелей HLA-DRB1*04 (Weyand и др., Ann Intern Med 117, 1992, cc.801-806). Пациентов можно подвергать анализу в отношении аллельного полиморфизма с помощью стандартных для данной области методов. Гены ГКГ не являются единственными генами зародышевой линии, которые влияют на чувствительность к RA, которые можно применять для диагностики или идентификации пациентов или популяции пациентов, нуждающихся в лечении. Особи женского пола выражено имеют более высокий риск, причем у больных женщин развивается фенотип болезни, отличный от фенотипа у больных мужчин. Любые молекулярные индикаторы ревматоидного артрита можно применять для идентификации пациентов или популяции пациентов, нуждающихся в лечении содержащей антитело к CD19 композицией или способом.
Методы определения активности ревматоидного артрита у пациента в зависимости от уровня активности хорошо известны в данной области и их можно применять в сочетании с фармацевтическими композициями и способами, предлагаемыми в изобретении. Например, можно применять систему Американского Колледжа Ревматологов (ACR-балл) для определения активности ревматоидного артрита у пациента или популяции пациентов. Согласно этому методу пациентам присваивают балл, который коррелирует с положительной динамикой. Например, пациентам, у которых обнаружено 20%-ное улучшение факторов, определяемых согласно ACR, должен быть присвоен балл ACR20.
Первоначально пациента, у которого обнаружены симптомы ревматоидного артрита, можно лечить аналгетиками. В других вариантах осуществления изобретения пациента, у которого диагностированы или который имеет симптомы ревматоидного артрита, первоначально лечат нестероидными противовоспалительными (НСПВС) соединениями. По мере развития болезни и/или повышения серьезности симптомов, ревматоидный артрит можно лечить путем введения стероидов, таких как, но не ограничиваясь только ими, дексаметазон и преднизон. В более серьезных случаях можно применять химиотерапевтический агент, такой как, но не ограничиваясь только ими, метотрексат или цитоксин, для облегчения симптомов ревматоидного артрита.
В некоторых случаях ревматоидный артрит можно лечить путем введения золота, а в других случаях биологических средств, например, можно вводить антитело или рецептор (или аналог рецептора). Примерами терапевтических антител являются ритуксин и ремикад. Приведенным в качестве примера растворимым рецептором, который можно вводить для лечения ревматоидного артрита, является Enbrel.
В очень серьезных случаях ревматоидного артрита может быть показана операция. Хирургические подходы могут включать, но не ограничиваясь только ими: синовектомию для уменьшения количества воспалительной ткани путем удаления пораженной болезнью синовиальной оболочки или выстилки сустава; артроскопическую хирургию для получения образцов ткани, удаления пораженного хряща, репарации разрывов, сглаживания шершавой поверхности или удаления пораженной болезнью синовиальной ткани; остеотомию, которую обозначают как «разрезание кости», эту процедуру применяют для повышения стабильности путем перераспределения нагрузки на состав; хирургическую замену сустава или артропластику для хирургической реконструкции или замены сустава; или артродез или слияние для соединения двух костей вместе.
В определенных вариантах способов, предлагаемых в изобретении, пациента можно лечить антителом к CD19 до, одновременно или после применения одной из описанных выше терапий. Кроме того, антитела к CD19, предлагаемые в настоящем изобретении, можно вводить в сочетании с аналгетиками, НСПВС, стероидами или химиотерапевтическими агентами, указанными выше, а также в сочетании с биологическими агентами, которые применяют для лечения ревматоидного артрита.
5.24.4. Системная красная волчанка (SLE)
Системная красная волчанка (SLE) представляет собой хроническое (долго протекающее) ревматическое заболевание, которое поражает суставы, мышцы и другие части организма. Пациентов или популяцию пациентов, которые нуждаются в лечении SLE, можно идентифицировать путем оценки физических симптомов и/или по результатам лабораторных анализов. Физические симптомы значительно варьируются от пациента к пациенту. Например, при SLE, как правило, 4 из перечисленных ниже 11 симптомов, присутствуют до того, как у пациента диагностирована SLE: 1) сыпь на скулах: сыпь вокруг щек; 2) дискоидная сыпь: наличие красных пятен; 3) фоточувствительность: реакция на солнечные лучи, что приводит к развитию или усилению кожной сыпи; 4) язвы во рту: язвы в носу или ротовой полости, как правило, безболезненные; 5) артрит: неэрозивный артрит, затрагивающий два или большее количество периферических суставов (артрит, при котором кости вокруг суставов не разрушаются); 6) серозитный плеврит или перикардит: (воспаление выстилки легкого или сердца); 7) ренальное нарушение: избыточный уровень белка в моче (более 0,5 г/день или 3+на индикаторных полосках) и/или клеточные цилиндры (аномальные элементы в моче, образовавшиеся из эритроцитов и/или лейкоцитов и/или клеток почечного канальца); 8) нейрологические нарушения: эпилептические припадки (конвульсии) и/или психоз в отсутствие связанных с лекарственными средствами или метаболическими нарушениями, которые, как известно, могут вызывать такие действия; 9) гематологические нарушения: гемолитическая анемия или лейкопения (количество лейкоцитов менее 4000 клеток на кубический миллиметр) или лифопения (менее чем 1500 лимфоцитов на кубический миллиметр), или тромбоцитопения (менее чем 100000 тромбоцитов на кубический миллиметр) (лейкопению и лимфопению можно выявлять в каждом втором или большем количестве случаев. Тромбоцитопению можно выявлять в отсутствии лекарственных средств, которые, как известно, могут ее индуцировать); 10) антиядерные антитела: положительные результаты анализа на антиядерные антитела (ana) в отсутствие лекарственных средств, которые, как известно, могут индуцировать их появление); и/или 11) иммунологическое нарушение: положительные результаты анализа на антитела к двухцепочечным ДНК, положительные результаты анализа на анти-Sm-антитела (антитела к Sm), положительные результаты анализа на антифосфолипидное антитело, такое как антитело к кардиолипину, или ложноположительный тест на сифилис (vdrl).
Другие физические симптомы, которые можно выявлять при SLE, включают, но, не ограничиваясь только ими, анемию, утомляемость, лихорадку, кожную сыпь, тупую боль в мышцах, тошноту, рвоту и диарею, опухшие железы, отсутствие аппетита, чувствительность к холоду (феномен Рейно) и снижение веса.
Лабораторные анализы можно применять также для идентификации пациентов или популяции пациентов, нуждающихся в лечении. Например, анализ крови можно применять для выявления аутоантител, присутствующих в крови почти всех страдающих SLE людей. Такие анализы могут включать, но не ограничиваясь только ими, анализы антиядерных антител (ANA) в отсутствие лекарственных средств, которые, как известно, могут индуцировать их появление) (Rahman А. и Hiepe F., Lupus, 11(12), 2002, cc.770-773), антител к двухцепочечным ДНК (Keren D.F., Clin. Lab. Med., 22(2), 2002. cc.447-474.), антифосфолипидного антитела к Sm, такого как антитело к кардиолипину (Gezer S. Dis. Mon. 49(12), 203, cc.696-741) или ложноположительный тест на сифилис (VDRL).
Другие анализы могут включать оценку комплемента (С3, С4, СН50, СН100), их можно применять для определения количества белков комплемента в кровотоке (Manzi и др. Lupus, 13(5), 2004, cc.298-303), скорость осаждения (ESR) или С-реактивный белок (CRP) можно применять для определения уровней воспаления, анализ мочи можно применять для выявления проблем с почками, рентгеноскопию грудной клетки можно применять для выявления поражения легких, а ЭКГ можно использовать для выявления проблем с сердцем.
Хроническая SLE ассоциирована с накоплением коллатерального повреждения органа, прежде всего почки. Таким образом, желательным является раннее терапевтическое вмешательство, т.е., например, до появления почечной недостаточности. Приемлемыми путями лечения SLE является те же пути, которые описаны для ревматоидного артрита. Они включают первоначальное лечение аналгетиками и нестероидными противовоспалительными (НСПВС) соединениями. По мере развития болезни и/или повышения серьезности симптомов SLE можно лечить путем введения стероидов, таких как, но не ограничиваясь только ими, дексаметазон и преднизон.
В более серьезных случаях можно применять химиотерапевтические агенты, такие как, но не ограничиваясь только ими, метотрексат или цитоксин, для облегчения симптомов SLE. Однако этот подход не является предпочтительным, если пациент представляет собой женщину детородного возраста. В таких случаях предпочтительными являются терапевтические подходы, которые не оказывают воздействия на продуктивную способность пациента.
В некоторых случаях SLE можно лечить путем введения биологических средств, таких как антитело или рецептор (или аналог рецептора). Примерами таких терапевтических антител являются ритуксин и ремикад. Приведенным в качестве примера растворимым рецептором воспалительного цитокина, который можно вводить для лечения SLE, является Enbrel.
В определенных вариантах способов, предлагаемых в изобретении, пациента можно лечить антителом к CD19 до, одновременно или после применения одной из описанных выше терапий, которые применяют для лечения SLE. Кроме того, антитела к CD19, предлагаемые в настоящем изобретении, можно вводить в сочетании с аналгетиками, НСПВС, стероидами или химиотерапевтическими агентами, указанными выше, а также в сочетании с биологическими агентами, которые применяют для лечения.
5.24.5. Идиопатическая/аутоиммунная тромбоцитопения (ITP)
Идиопатическая/аутоиммунная тромбоцитопения (ITP) представляет собой нарушение крови, характеризующееся наличием аутоантител, относящихся к иммуноглобулину G (IgG), которые взаимодействуют с тромбоцитами и приводят к деструкции указанных тромбоцитов. Как правило, антитела являются специфическими для гликопротеинов мембраны тромбоцитов. Нарушение может быть острым (временное, продолжающееся в течение менее 2 месяцев) или хроническим (сохраняющееся в течение более 6 месяцев). Пациентов или популяцию пациентов, которые нуждаются в лечении ITP, можно идентифицировать путем изучения истории болезни пациента, физических симптомов и/или результатов лабораторных анализов. (Provan D. и Newland, A., Br. J. Haematol. 118(4), 2002, cc.933-944; George J.N. Curr. Hematol. 2(5), 2003, cc.381-387; Karptkin S., Autoimmunity, 37(4). 2004, cc.363-368; Cines D.B. и Blanchette V. S., N. Engl. J. Med. 346(13), 2002, cc.995-1008).
Физические симптомы включают наличие багровых участков на коже и слизистых оболочках (таких как выстилка ротовой полости), в которых происходит кровотечение в результате снижения уровня тромбоцитов. Основным симптомом является кровотечение, которое может включать гематомы («экхимоз») и тонкие красные точки на коже или слизистых оболочках («петехия»). В некоторых случаях может иметь место кровотечение из носа, десен, пищеварительного или мочевого пути. Редко происходит кровотечение в головном мозге. Общими признаками, симптомами и факторами развития являются, но не ограничиваясь только ими, раннее начало (детская ITP), отложенное начало (ITP взрослых), непальпируемая петехия, пурпура, гиперменорея, носовое кровотечение, кровоточивость десен, геморрагические волдыри на слизистых оболочках, признаки кровотечения в ЖК (желудочно-кишечном тракте), меномерорея, признаки внутричерепного кровоизлияния, непальпируемая селезенка, кровотечения в сетчатке, недавняя иммунизация живым вирусом (детская ITP), недавнее вирусное заболевание (детская ITP), спонтанное кровотечение, когда количество тромбоцитов менее чем 20000/мм3, и тенденция к образованию гематом.
Лабораторные анализы, которые можно применять для диагностирования ITP, включают, но не ограничиваясь только ими, клинический анализ крови или оценку костного мозга для проверки того, что происходит адекватное образование тромбоцитов (мегакариоцит) в костном мозге и исключения других болезней, таких как метастазирующий рак и лейкоз. Установленная тромбоцитопения является имеющим решающее значение фактором при лабораторной оценке. Присутствие гигантских тромбоцитов в мазке периферической крови свидетельствует о врожденной тромбоцитопении. КТ-сканирование головы может быть гарантией того, что внутричерепное кровоизлияние, если оно присутствует, будет выявлено.
Современные пути лечения ITP включают трансфузии тромбоцитов и спленэктомию. Другие пути лечения включают введение глюкокортикостероидов, введение иммуносупрессоров, введение агентов, которые усиливают производство тромбоцитов, таких как IL-11, и агентов, которые активируют производство мегакариоцитами тромбоцитов, таких как тромбопоэтин (ТРО).
В более тяжелых случаях для облегчения симптомов ITP можно вводить химиотерапевтические агенты, такие как, но не ограничиваясь только ими, винкристин и винбластин. Однако этот подход не является предпочтительным, если пациент представляет собой женщину детородного возраста. В таких случаях предпочтительными являются терапевтические подходы, которые не оказывают воздействия на продуктивную способность пациента.
В некоторых случаях ITP можно лечить путем введения биологических средств, таких как антитело или рецептор (или аналог рецептора). Примерами таких терапевтических антител являются антитела к CD20, такие как ритуксимаб.
В определенных вариантах способов, предлагаемых в изобретении, пациента можно лечить антителом к CD19 до, одновременно или после применения одной из описанных выше терапий, которые применяют для лечения ITP. Кроме того, антитела к CD19, предлагаемые в настоящем изобретении, можно вводить в сочетании с любым из указанных выше агентов, а также в комбинации с биологическими средствами, которые вводят для лечения ITP.
5.24.6. Пузырчатка и напоминающие пемфигоид нарушения
Как пузырчатка, так и напоминающие пемфигоид нарушения представляют собой гетерогенную группу аутоиммунных заболеваний, характеризующихся образованием волдырей на коже и/или поверхностях слизистых оболочек. При обоих заболеваниях образование волдырей вызывается аутоиммунными антителами, которые распознают различные белки, экспрессируемые на поверхности эпителиальных клеток в дерме и/или эпидермисе.
У пациентов с напоминающим пузырчатку заболеванием образование волдырей происходит внутри эпидермиса и является результатом связывания аутоантител, специфических для десмоглеина 1 (Dsg1) и/или десмоглеина 3 (Dsg3). Классические типы пузырчатки можно различать по наличию специфических антител к десмоглеину. У пациентов, страдающих листовидной пузырчаткой (PF), образуются только антитела к Dsg1. У пациентов, страдающих только пузырчаткой обыкновенной (PV) и паранеопластической пузырчаткой (PNP), образуются антитела к Dsg3, если поражение заболеванием ограничено слизистыми тканями. В отличие от этого, у страдающих PV и PNP пациентов с повреждениями кожи и слизистой, продуцируются как аутоантитела к Dsg1, так и аутоантитела к Dsg3 (Nagasaka Т. и др., J. Clin. Invest., 114, 2004, cc.1484-1492; Seishema M. и др., Arch Dermatol. 140(12), 2004, cc.1500-1503; Amagai M., J. Dermatol. Sci., 20(2), 1999, cc.92-102).
У пациентов с напоминающим пемфигоид заболеванием, включая, но не ограничиваясь только ими, буллезный пемфигоид, относящийся к крапивнице буллезный пемфигоид, рубцовый пемфигоид, врожденный буллезный эпидермолиз и буллезный дерматоз с линейным свечением IgA, образование волдырей происходит на поверхности раздела дермы и эпидермиса. Наиболее распространенной формой пемфигоидного заболевания является буллезный пемфигоид (ВР), который характеризуется присутствием аутоантител, которые связываются с антигеном 180 буллезного пемфигоида (ВР180), антигеном 230 буллезного пемфигоида (ВР230), ламинином 5 и/или бета-4-интегрином (Fontao L. и др., Mol. Biol. Cell., 14(5), 2003, cc.1978-1992; Challacombe S. J. и др, Acta Odontol. Scand.,. 59(4), 2001, cc.226-234.)
Пациентов или популяцию пациентов, которые нуждаются в лечении пузырчатки или напоминающих пемфигоид нарушений, можно идентифицировать путем изучения истории болезни пациента, физических симптомов и/или результатов лабораторных анализов (см. обзор у: Mutasim D.F., Drugs Aging., 20(9), 2003, cc.663-681; Yeh S.W. и др., Dermatol. Ther, 16(3), 2003, cc.214-223; Rosenkrantz W.S., Vet. Dermatol., 15(2), cc.90-98.).
Как правило, для постановки диагноза пузырчатки или напоминающих пемфигоид нарушений используют биопсию кожи. Образец биопсии кожи исследуют микроскопически для выявления анатомической области локализации волдыря (например, эпидермис или между дермой и эпидермисом). Эти данные сопоставляют с результатами, полученными с помощью прямого или непрямого иммуногистохимического анализа, для выявления присутствия аутоантител в области повреждения. Оценивают также образы сыворотки из организма пациентов в отношении присутствия в кровотоке аутоантител с помощью анализа на основе ELISA для конкретных белков. Несколько анализов на основе ELISA описано для выявления антител к десмоглеину в полученных из организма человека образцах (Hashimoto Т., Arch. Dermatol. Res., 295, приложение, 2003, cc.2-11). Присутствие этих аутоантител к десмоглеину в полученных с помощью биопсии образцах является диагностическим признаком пузырчатки.
Клинически пузырчатку обыкновенную можно диагностировать по присутствию волдырей во рту. Воспаление или эрозия могут присутствовать также в выстилке глаза и века и в мембранах носа или половых путей. У половины пациентов образуются также волдыри или возникает эрозия кожи, часто в области паха, подмышек, лица, волосистой части кожи головы и грудной клетки. Листовидная пузырчатка представляет собой неглубокую относительно слабую форму пузырчатки. Она, как правило, проявляется на лице и волосистой части кожи головы, но затрагивает также область спины и грудной клетки. Повреждения не встречаются во рту. Волдыри в основном ограничены самой наружной поверхностью и часто зудят. Паранеопластическая пузырчатка является очень редкой и, как правило, встречается у раковых больных.
Повреждения являются болезненными и часто встречаются во рту, на губах и в пищеводе (глотательная трубка), а также на коже. Из-за поражения болезнью дыхательных путей могут присутствовать признаки респираторного заболевания, и они могут быть опасными для жизни.
Современные пути лечения пузырчатки или напоминающего пемфигоид заболевания включают местное применение кремов и мазей для облегчения дискомфорта, ассоциированного с состоянием кожи, введение противовоспалительных средств или введение иммуносупрессоров.
В определенных вариантах способов, предлагаемых в изобретении, пациента можно лечить антителом к CD19 до, одновременно или после применения любой из описанных выше терапий, которые применяют для лечения пемфигоида или напоминающего пемфигоид заболевания. Кроме того, антитела к CD19, предлагаемые в настоящем изобретении, можно вводить в сочетании с любым из указанных выше агентов.
5.24.7. Аутоиммунный диабет
Согласно некоторым объектам изобретения пациента, который нуждается в лечении аутоиммунного диабета, известного также как диабет типа 1А, можно также лечить с помощью содержащих антитело к CD19 композиций и способов. Диабет типа 1А представляет собой аутоиммунное заболевание, которое вызывается синергетическими действиями генетических, связанных с окружающей средой и иммунологических факторов, которые в конце концов разрушают бета-клетки поджелудочной железы. Результатом деструкции бета-клеток поджелудочной железы является снижение массы бета-клеток, снижение производства/секреции инсулина и постепенное повышение уровней глюкозы в крови.
Пациентов или популяцию пациентов, которые нуждаются в лечении диабета типа 1А, можно идентифицировать путем изучения истории болезни пациента, физических симптомов и/или результатов лабораторных анализов. Симптомы часто возникают внезапно и включают, но не ограничиваясь только ими, низкие уровни или отсутствие инсулина в крови, повышенное чувство жажды, повышенное мочеиспускание, постоянный голод, снижение веса, «пелена перед глазами» и/или утомляемость. Явный диабет, как правило, не проявляется до тех пор пока не разрушится основная часть бета-клеток (>80%). Как правило, диабет диагностируется клинически, если у пациента случайная (безотносительно к времени после последнего приема пищи) концентрация глюкозы в крови ≥11,1 ммоля/л (200 мг/дл) и/или натощак (без поглощения калорий по меньшей мере в течение 8 ч) концентрация глюкозы в плазме ≥7,0 ммолей/л (126 мг/дл) и/или уровень двухчасовой глюкозы в плазме ≥11,1 ммоля/л (200 мг/дл). В идеале, эти анализы необходимо повторять в другие дни с сопоставимыми результатами перед подтверждение диагноза (Harrison's Principles of Internal Medicine, 16-oe изд., под ред Dennis L. Kasper и др., изд-во The McGraw-Hill Companies, Inc., New York, New York, 2005).
Хотя точная этиология диабета типа 1А не установлена, существует четкая генетическая связь со специфическим HLA-серотипом. В частности, аутоиммунный диабет ассоциирован с серотипами HLA DR3 и DR4. Присутствие и DR3, и DR4 подтверждает наиболее высокий из известных генетический риск. Чувствительность к аутоиммунному диабету связана также с HLA класса II (HLA-DQB 1*0302). В противоположность этому HLA-галотипы, включающие DRB1-1501 и DQA1-0102-DQB1-0602, ассоциированы с защитой от диабета типа 1А (Redondo M. J. и др., J. Clin. Endocrmol. Metabolism, 10, 2000, cc.3793-3797.)
Деструкция инсулинпродуцирующих островковых бета-клеток может осуществляться аутоантителами островковых клеток, инфильтратами активированных лимфоцитов в поджелудочной железу и дренирующих лимфатические узлы, Т-лимфоцитами, чувствительными к белкам островковых клеток, и высвобождением воспалительных цитокинов в островки (Harrison's Principles of Internal Medicine, 16-oe изд., под ред Dennis L. Kasper и др., изд-во The McGraw-Hill Companies, Inc., New York, New York, 2005).
Аутоантитела, ассоциированные с диабетом типа 1А, включают, но не ограничиваясь только ими, антитела, которые связывают инсулин, декарбоксилазу глутаминовой кислоты (GAD), ICA-512/IA-2, фогрин, островковый ганглиозид и карбоксипептидазу Н (Gianani R. и Eisenbarth G.S., Immunol. Rev., 204, 2005, cc.232-249; Kelemen К. и др, J. Immunol., 172(6), 2004, cc.3955-3962); Falorni А. и Borozzetti A. Best Pract. Res. Clin. Endocrinol. Metab., 19(1), 2005, cc.119-133.)
Современные пути лечения аутоиммунного диабета включают введение витамина D, кортикостероидов, средств, которые контролируют кровяное давление, и средств, которые контролируют гликемию (уровни сахара в крови).
В определенных вариантах способов, предлагаемых в изобретении, пациента можно лечить антителом к CD19 до, одновременно или после применения любой из описанных выше терапий, которые применяют для лечения аутоиммунного диабета. Кроме того, антитела к CD19, предлагаемые в настоящем изобретении, можно вводить в сочетании с любым из указанных выше агентов.
5.24.8. Системный склероз (склеродермия) и родственные нарушения
Системный склероз, известный также как склеродермия, представляет собой гетерогенную группу болезней, включая, но не ограничиваясь только ими, ограниченное кожное заболевание, диффузное кожное заболевание, сохраняющуюся в течение неопределенного срока склеродермию, недифференцированную болезнь соединительной ткани, «перекрестные» синдромы, локализованную склеродермию, очаговую склеродермию, линейную склеродермию, склеродермию, напоминающую рубец от удара саблей (En coup de saber), склеродермию взрослых Бушке, склеромикседему, хроническую реакцию трансплантат-против-хозяина, эозинофильный фасцит, пальцевидный склероз при диабете и первичный амилоидоз и амилоидоз, ассоциированный с множественной миеломой (см. обзор в Harrison's Principles of Internal Medicine, 16-oe изд., под ред. Dennis L. Kasper и др., изд-во The McGraw-Hill Companies, Inc., New York, New York, 2005).
Клинические признаки, ассоциированные со склеродермией, могут включать феномен Рейно, утолщение кожи, подкожный кальциноз, телеангиэктазию, артралгию/артрит, миопатию, нарушение моторики пищевода, легочный фиброз, изолированную легочную артериальную гипертензию, застойную сердечную недостаточность и почечный криз. Степень проявления у пациента одного или нескольких этих симптомов болезни может влиять на диагноз и возможный план лечения.
Аутоантитела включают: антитела к топоизомеразе 1, антитела к центромере, антитела к РНК-полмеразе I, II, и/или III, анти-Th RNP, анти-U, RNP (антитела к фибрилларину), анти-PM/Sci, антиядерные антитела (ANA).
Идентификация пациентов и популяции пациентов, которые нуждаются в лечении склеродермии, может быть основана на клинической истории болезни и физических показаниях. Пациентов или популяцию пациентов, которые нуждаются в лечении склеродермии, можно идентифицировать путем изучения истории болезни пациента, физических симптомов и/или результатов лабораторных анализов. Постановка диагноза может быть задержана у пациентов, не имеющих выраженного утолщения кожи. Лабораторные анализы, рентгеноскопию, оценку функцию легких и биопсию кожи или ренальную (почечную) биопсию можно применять для определения степени и серьезности поражения болезнью внутренних органов.
В первые месяцы или годы после начала болезни склеродермия может напоминать много других болезней соединительной ткани, таких как, но не ограничиваясь только ими, системная красная волчанка, полимиозит и ревматоидный артрит.
Наиболее классическим симптомом системного склероза (склеродермии) является склеродактилия. Начальные симптомы включают опухание кистей рук, которое иногда прогрессирует, приводя к сужению к концу и деформации типа «птичьей лапы». Не у всех пораженных склеродермией пациентов развивается такая степень кожного затвердения. Другие симптомы могут включать очаговую склеродермию, линейную склеродактилию (отвердение пальцев), синдром Рейно, кальциноз и телеангиэктазию.
Анализ крови, такой как выявление антиядерного антитела (ANA), можно применять для диагностирования как локализованной, так и системной склеродермии. Например, наличие антитела к центромере (АСА) и антитела к Scl-70 является показателем того, что у пациентов необходимо лечить системный склероз (Но и др., Arthritis Артрит Res Ther. 5, 2003, cc.80-93);
наличие антитела к топоизомеразе II альфа является показателем того, что у пациентов необходимо лечить локальную склеродермию; наличие антитела к топоизомеразе I альфа является показателем того, что у пациентов необходимо лечить системную склеродермию. Несколько типов склеродермии и методы диагностирования этих типов хорошо известны в данной области, включая, но не ограничиваясь только ими, ювенильную склеродермию (Foeldvari, Curr Opin Rheumatol 14, 2002, cc.699-703; Cefle и др., Int J Clin Pract. 58, 2004, cc.635-638; локализованную склеродермию; узелковую склеродермию (Cannick, J Rheumatol. 30, 2003, cc.2500-2502; и системную склеродермию, включая, но не ограничиваясь только ими, кальциноз, синдром Рейно, нарушение моторики пищевода, склеродактилию и телеангиэктазию (CREST), ограниченную системную склеродермию и диффузную системную склеродермию. Системную склеродермию называют также as системным склерозом (SSc). Ее можно обозначать также как прогрессирующий системный склероз (PSSc) или семейный прогрессирующий системный склероз (FPSSc) (Nadashkevich и др., Med Sci Monit. 10, 2004, cc.615-621; Frances и др., Rev Prat. 52, 2002, cc.1884-1890). Системный склероз представляет собой мультисистемное нарушение, характеризующееся присутствием склероза соединительной ткани, сосудистых аномалий, касающихся малых по размеру артерий и микроциркуляции, и аутоиммунных изменений.
Тип системной склеродермии, известный как CREST, не характеризуется никаким кожным уплотнением. CREST характеризуется кальцинозом (отложение кальция), как правило, в пальцах; синдромом Рейно; снижением мышечного контроля пищевода, что может сильно затруднять глотание; склеродактилией, сужением к концу костей пальцев; и телеангиэктазией, небольшими красными пятнами на коже пальцев, лице или внутренней стороне рта. Как правило, наличие двух из этих симптомов является достаточным для постановки диагноза CREST. CREST может встречаться индивидуально или в сочетании с другой формой склеродермии или другими аутоиммунными заболеваниями.
Ограниченная склеродермия характеризуется уплотнение кожи, ограниченным пальцами, наряду либо с язвами на пальцах в виде оспин (вторичный синдром Рейно) и/или легочным фиброзом. Кожа на лице и шеи может также быть поражена ограниченной склеродермией.
Диффузная склеродермия всегда диагностируется по наличию проксимальных уплотнений на коже. Проксимальный означает локализованный наиболее близко к рассматриваемой точке. Проксимальное уплотнение кожи может представлять собой кожное уплотнение над запястьями или над локтями. Как правило, если у пациента имеются кожные уплотнения только между локтями и запястьями, то у него может быть диагностирована либо диффузная, либо ограниченная системная склеродермия, в зависимости от того, какое значение вкладывает клиницист в понятие проксимально.
Современные средства лечения склеродермии включают экстракорпоральный фотофорез после применения 6-метоксипсоралена и трансплантацию аутологичных стволовых клеток.
Современные схемы лечения склеродермии включают введение следующих средств: пеницилламин, колхицин, интерферон альфа, интерферон гамма, хлорамбуцил, циклоспорин, 5-фторурацил, циклофосфамид, миноциклин, талидомид, этанерцепт или метотрексат.
В определенных вариантах способов, предлагаемых в изобретении, пациента можно лечить антителом к CD19 до, одновременно или после применения любой из описанных выше терапий, которые применяют для лечения аутоиммунного диабета. Кроме того, антитела к CD19, предлагаемые в настоящем изобретении, можно вводить в сочетании с любым из указанных выше агентов.
5.25. Определение плотности CD19 в образце или у индивидуума
Необязательно анализы плотности CD19 можно применять также для дополнительного уточнения диагноза у пациента. Методы определения плотности связывания антител с клетками известны специалистам в данной области (см., например, Sato и др., J. Immunology 165, 2000, cc.6635-6643; где описан метод определения плотности на клеточной поверхности специфических CD-антигенов). Другие стандартные методы включают анализ Скэтчарда. Например, антитело или его фрагмент можно выделять, метить с помощью радиоактивного изотопа и определять удельную активность радиоактивномеченного антитела. Затем антитело можно приводить в контакт с клеткой-мишенью, которая экспрессирует CD19. Радиоактивность, связанную с клеткой, можно оценивать и на основе удельной активности определять количество антитела или фрагмента антитела, связанного с клеткой.
Можно применять также проточную цитометрию с возбуждением флуоресценции. Как правило, антитело или фрагмент антитела связывают с клеткой-мишенью, экспрессирующей CD19. Затем добавляют второй реагент, который связывается с антителом, например, меченное флуорохромом антитело к иммуноглобулину. Затем можно измерять окрашивание флуорохромом и определять плотность связывания с клеткой антитела или фрагмента антитела.
В другом приемлемом методе антитело или фрагмент антитела можно непосредственно метить выявляемой меткой, такой как флуорофор, и связывать с клеткой-мишенью. Долю меченого белка определяют и сравнивают со стандартными гранулами, с известным количеством связанной с ними метки. Сравнение количества метки, связанной с клеткой, с известными стандартами можно применять для расчета количества антитела, связанного с клеткой.
Еще одним объектом настоящего изобретения является способ выявления in vitro или in vivo присутствия и/или плотности CD19 в образце или в организме индивидуума. Его можно применять также для мониторинга болезни и воздействия лечения и для определения и регулирования дозы антитела, подлежащей введению. Способ in vivo можно осуществлять, используя методы визуализации, такие как PET (эмиссионная позитронная топография) или SPECT (однофотонная эмиссионная компьютерная томография). Можно также метить антитело к CD19 индием, используя ковалентно связанный хелатор. Образовавшееся антитело можно визуализировать с помощью стандартных камер гамма-лучей, аналогично тому, как применяют ZEVALIN™ (меченное индием МАт к CD20) (фирма Biogen Idee, Кэмбридж, шт.Массачусетс) для визуализации антигена CD20.
В одном из вариантов осуществления изобретения способ in vivo можно осуществлять, приводя в контакт подлежащей оценке образец, необязательно наряду с контрольным образцом, с человеческим антителом к CD19 в условиях, которые позволяют образовываться комплексу между антителом, предлагаемым в изобретении, и человеческим антигеном CD19. Затем выявляют образовавшийся комплекс (например, используя проточную цитометрии с возбуждением флуоресценции или Вестерн-блоттинг). При использовании контрольного образца наряду с тестируемым образцом, выявляют комплекс в обоих образцах и любое статистически значимое различие в формировании комплексов между образцами, является показателем присутствия человеческого CD19 в тестируемом образце.
В одном из вариантов осуществления изобретения среднюю интенсивность флуоресценции можно применять в качестве меры плотности CD19. В таких вариантах осуществления изобретения В-клетки выделяют из пациента и окрашивают антителами к CD19, которые были помечены с помощью флоуоресцентой метки, и интенсивность флуоресценции измеряют с помощью проточной цитометрии. Интенсивности флуоресценции можно определять и выражать в виде усредненной интенсивности на В-клетку. С помощью указанных методов средние интенсивности флуоресценции, которые характеризуют плотность CD19, можно сравнивать у пациента до и после лечения с помощью способов и композиций, предлагаемых в изобретении, или между обнаруженными у пациентов и нормальными уровнями hCD19 на В-клетках.
У пациентов, для которых определена плотность экспрессии CD19 на В-клетках, на плотность CD19 можно влиять путем определения и/или регулирования дозы и/или схемы лечения, которые основаны на применении содержащих антитело к CD19 композиций и способов, предлагаемых в изобретении. Например, если плотность CD19 является высокой, то можно применять антитела к CD19, которые менее эффективно опосредуют ADCC у человека. В определенных вариантах осуществления изобретения, если у пациента, которого лечили с помощью композиций и способов, предлагаемых в изобретении, низкая плотность CD19, то можно применять более высокую дозу антител к CD19 в композициях и способах, предлагаемых в изобретении. В других вариантах осуществления изобретения, если у пациента, которого лечили с помощью композиций и способов, предлагаемых в изобретении, низкая плотность CD19, то можно применять низкую дозу антител к CD19 в композициях и способах, предлагаемых в изобретении. В определенных вариантах осуществления изобретения, если у пациента, которого лечили с помощью композиций и способов, предлагаемых в изобретении, имеется высокая плотность CD19, то можно применять более низкую дозу антител к CD19 в композициях и способах, предлагаемых в изобретении. В определенных вариантах осуществления изобретения плотность CD19 можно сравнивать с плотностью CD20 у пациента, плотность CD19 можно сравнивать со средней плотностью CD19 в организме человека или в конкретной популяции пациентов, или плотность CD19 можно сравнивать с уровнями CD19 у пациента до лечения или до начала В-клеточного заболевания или нарушения. В определенных вариантах осуществления изобретения пациент, которого лечат с помощью композиций и способов, предлагаемых в изобретении, имеет В-клеточное злокачественное состояние, при котором CD19 присутствует на поверхности В-клеток.
5.26. Иммунотерапевтические протоколы
Композиции, содержащие антитело к CD19, которые применяют в терапевтической схеме/протоколах, обозначенные в контексте настоящего описания как «анти-CD19 иммунотерапия», могут включать оголенные антитела, иммуноконъюгаты и/или слитые белки. Композиции, предлагаемые в изобретении, можно применять в качестве терапии на основе индивидуального средства или в сочетании с другими терапевтическими агентами или схемами. Антитела к CD19 или иммуноконъюгаты можно вводить до, одновременно или после введения одного или нескольких терапевтических средств. Терапевтические средства, которые можно применять в комбинированных терапевтических схемах с композициями, предлагаемыми в изобретении, включают любые субстанции, которые ингибируют или препятствуют функции клеток и/или вызывают деструкцию клеток. Их примерами являются, но не ограничиваясь только ими, радиоактивные изотопы, химиотерапевтические агенты и токсины, такие как ферментативно активные токсины бактериального, грибного, растительного или животного происхождения или их фрагменты.
Терапевтические схемы, представленные в настоящем описании, или любую требуемую лечебную схему можно оценивать в отношении эффективности, используя созданные на трансгенных животных модели, которые экспрессируют человеческий антиген CD19 вместо нативного антигена CD19. Таким образом, схему лечения с помощью антитела к CD19 можно оценивать на созданной на животном модели для определения эффективности перед введением человеку.
Антитела к CD19, композиции и способы можно применять на практике для лечения В-клеточных заболеваний, включая В-клеточные злокачественные состояния. Понятие «В-клеточное злокачественное состояние» относится к любому злокачественному состоянию, обусловленному клетками, относящимися к линии В-клеток. Примерами В-клеточных злокачественных состояний являются, но не ограничиваясь только ими: не-ходжкинская лимфома (NHL) В-клеточного подтипа, включая низкой степени злокачественности/фолликулярную NHL, NHL малых лимфоцитов (SL), средней степени злокачественности/фолликулярную NHL, средней степени злокачественности диффузную NHL, высокозлокачественную и иммунобластную NHL, высокозлокачественную лимфобластную NHL, высокозлокачественную NHL малых клеток с нерасщепленными ядрами; лимфома из клеток мантии и повсеместная NHL; лимфома Беркитта; множественная миелома; пре-В-клеточный острый лимфобластный лейкоз и другие злокачественные состояния, связанные с ранними предшественниками В-клеток; общий острый лимфолейкоз (ALL); хронический лимфолейкоз (CLL), включая CLL с мутированным статусом гена иммуноглобулина и CLL с немутированным статусом гена иммуноглобулина; волосковоклеточный лейкоз; острый лимфобластный лейкоз нуль-клеточного типа; Вальденстрема макроглобулинемия; диффузная В-клеточная крупноклеточная лимфома (DLBCL), включая тип DLBCL из В-клеток герминального центра (GCB), тип DLBCL из активированных В-клеток (АВС) и тип 3 DLBCL; про-лимфолейкоз; болезнь легких цепей; плазмацитома;
остеосклеротическая миелома; лейкоз плазматических клеток; моноклональная гаммапатия неустановленной этиологии (MGUS); сливающаяся множественная миелома (SMM); индолентная множественная (IMM); лимфома Ходжкина, включая лимфому классического типа и узелковую с лимфоидным преобладанием; лимфоплазматическая лимфома (LPL); лимфома маргинальной зоны, включая лимфому ассоциированной со слизистой желудка лимфоидной ткани (MALT).
В другом варианте осуществления изобретения его можно применять для злокачественных состояний, связанных со зрелыми В-клетками (т.е. клетками, которые экспрессируют Ig на клеточной поверхности), включая, но, не ограничиваясь только ими, фолликулярная лимфому, лимфому из клеток мантии, лимфому Беркитта, множественную миелому, диффузную В-клеточную крупноклеточную лимфому (DLBCL), включая тип DLBCL из В-клеток герминального центра (GCB), тип DLBCL из активированных В-клеток (АВС) и тип 3 DLBCL, лимфому Ходжкина, включая лимфому классического типа и узелковую с лимфоидным преобладанием; лимфоплазматическую лимфому (LPL), лимфому маргинальной зоны, включая лимфому ассоциированной со слизистой желудка лимфоидной ткани (MALT), и хронический лимфолейкоз (CLL), включая CLL с мутированным статусом гена иммуноглобулина и CLL с немутированным статусом гена иммуноглобулина.
Кроме того, CD19 экспрессируется на более ранней стадии развития В-клеток, чем, например, CD20, и поэтому является наиболее пригодным для лечения злокачественных состояний, связанных с пре-В-клеткой и незрелой В-клеткой (т.е. с клетками, которые не экспрессируют Ig на клеточной поверхности), например, в костном мозге. Приведенным в качестве иллюстрации примером связанных с пре-В-клетками и незрелыми В-клетками злокачественными состояний является, но не ограничиваясь только им, острый лимфобластный лейкоз.
В других конкретных вариантах осуществления изобретения его можно применять на практике для лечения экстранодальных опухолей.
5.27. Анти-СР19 иммунотерапия
Согласно настоящему изобретению «анти-CD19 иммунотерапия» предусматривает введение любых антител к CD19, предлагаемых в изобретении, согласно любой терапевтической схеме, представленной в настоящем описании. Антитела к CD19 можно вводить в виде оголенных антител или иммуноконъюгатов, или слитых белков.
Анти-CD19 иммунотерапия предусматривает введение антитела к CD19 в качестве терапии на основе индивидуального средства для лечения В-клеточного злокачественного состояния. Анти-CD19 иммунотерапия включает методы лечения ранней стадии заболевания, которое является результатом В-клеточного злокачественного состояния. Анти-CD19 иммунотерапия включает методы лечения В-клеточного злокачественного состояния, при котором антитело к CD19 опосредует ADCC. Анти-CD19 иммунотерапия включает методы лечения В-клеточного злокачественного состояния, при котором антитело к CD19 вводят до того, как пациент начал получать какое-либо лечение злокачественного состояния, где эта терапия представляет собой химиотерапию, основанную на радиоактивных химических соединениях терапию и лечение хирургическим путем.
В одном из вариантов осуществления изобретения человека, имеющего В-клеточное злокачественное состояние, можно лечить путем введения человеческого или гуманизированного антитела, которое может опосредовать ADCC у человека. В случаях ранней стадии болезни или применения терапии на основе индивидуального средства любое антитело к CD19, которое может опосредовать ADCC, можно применять на человеке (включая мышиное и химерное антитела); однако предпочтительными могут быть человеческие и гуманизированные антитела.
Антитела человеческих изотипов IgG1 или IgG3 являются в некоторых случаях предпочтительными для терапии. Однако можно применять также человеческие изотипы IgG2 или IgG4, при условии, что они обладают соответствующей эффекторной функцией, например, опосредуют ADCC у человека. Указанную эффекторную функцию можно оценивать, измеряя способность представляющего интерес антитела опосредовать лизис клеток-мишеней с помощью эффекторных клеток in vitro или in vivo.
В одном из вариантов осуществления изобретения доза применяемого антитела должна быть достаточной для истощения в кровотоке В-клеток. Успех терапии можно оценивать у пациента путем анализа образцов крови. Другие признаки клинического улучшения можно применять для мониторинга терапии.
Методы оценки истощения В-клеток, которые можно применять в сочетании с композициями и способами, предлагаемыми в изобретении, хорошо известны в данной области и включают, но не ограничиваясь только ими, следующие варианты осуществления изобретения. В одном из вариантов осуществления изобретения В-клеточное истощение можно оценивать с помощью проточной цитометрии, используя реагент, отличный от антитела к CD19, которое связывается с В-клетками, для определения количества В-клеток. В других вариантах осуществления изобретения уровень В-клеток в крови можно оценивать, используя стандартный анализ сыворотки. В указанных вариантах осуществления изобретения В-клеточное истощение можно оценивать опосредованно, определяя количество антитела, которое, как известно, продуцируется В-клетками. Затем оценивают уровень указанного антитела для определения истощения и/или функционального истощения В-клеток. В другом варианте осуществления изобретения В-клеточное истощение можно определять путем иммунохимического окрашивания для идентификации В-клеток. В таких вариантах осуществления изобретения В-клетки или ткани, или сыворотку, содержащую В-клетки, экстрагированные из пациента, можно помещать на предметные стекла для микроскопа, метить и оценивать в отношении их присутствия или отсутствия. В родственных вариантах осуществления изобретения осуществляют сравнение между В-клетками, экстрагированными для лечения и после лечения, определяя различия в присутствующих В-клетках.
Можно оценивать опухолевую массу, и эти данные применять в сочетании с композициями и способами, предлагаемыми в изобретении. Методы определения опухолевой массы хорошо известны в данной области и включают, но не ограничиваясь только ими, следующие варианты осуществления изобретения. В определенных вариантах осуществления изобретения можно применять РЕТ-сканограммы для оценки метаболической активности и идентификации областей повышенной активности, которые свидетельствуют о наличии опухоли. КТ-сканограммы и ЯМР-томограммы можно применять также для оценки мягких тканей в отношении присутствия в них опухолей и их размера. В других вариантах осуществления изобретения сканограмму кости можно применять для определения объема и локализации опухоли. В следующих вариантах осуществления изобретения опухолевую массу можно определять, оценивая поток крови, входящий и выходящий из опухоли, с помощью доплеровского метода (например, с помощью ультразвука). В указанных вариантах осуществления изобретения изменения потока крови в течение времени или отклонения от нормального потока крови в соответствующей ткани пациента можно использовать для расчетной оценки опухолевой массы. Такие методы оценки опухолевой массы можно применять до и после применения способов лечения, предлагаемых в изобретении.
В определенных вариантах способов, предлагаемых в изобретении, В-клетки истощают и/или опухолевую массу снижают, сохраняя при этом ADCC-функцию.
В вариантах осуществления изобретения, в которых антитело к CD19 применяют в качестве терапии на основе индивидуального средства, изобретение предусматривает применение различных лекарственных схем.
Согласно определенным объектам изобретения антитело к CD19, применяемое в композициях и способах, предлагаемых в изобретении, представляет собой оголенное антитело. В родственных вариантах осуществления изобретения применяемая доза оголенного антитела к CD19 составляет по меньшей мере примерно 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1, 1,5, 2, 2,5, 3, 3,5, 4, 4,5, 5, 5,5, 6, 6,5, 7, 7,5, 8, 8,5, 9, 9,5, 10, 10,5, 11, 11,5, 12, 12,5, 13, 13,5, 14, 14,5, 15, 15,5, 16, 16,5, 17, 17,5, 18, 18,5, 19, 19,5, 20, 20,5 мг/кг веса тела пациента. В определенных вариантах осуществления изобретения применяемая доза оголенного антитела к CD19 составляет по меньшей мере примерно 1-10, 5-15, 10-20 или 15-25 мг/кг веса тела пациента. В определенных вариантах осуществления изобретения применяемая доза оголенного антитела к CD19 составляет по меньшей мере примерно 1-20, 3-15 или 5-10 мг/кг веса тела пациента. В других вариантах осуществления изобретения применяемая доза оголенного антитела к CD19 составляет по меньшей мере примерно 5, 6, 7, 8, 9, или 10 мг/кг веса тела пациента.
В определенных вариантах осуществления изобретения дозу, содержащую примерно 375 мг/м2 антитела к CD19, вводят еженедельно в течение 4-8 последовательных недель. В определенных вариантах осуществления изобретения доза составляет по меньшей мере примерно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15 мг/кг веса тела пациента и ее вводят еженедельно в течение 4-8 последовательных недель.
Примеры доз антитела к CD19, описанного выше, которые можно вводить, описаны в разделе 5.21.3. В одном из вариантов осуществления изобретения указанные выше дозы применяют в виде однократных инъекций. В других вариантах осуществления изобретения дозы вводят в течение определенного периода времени. В других вариантах осуществления изобретения дозы вводят многократно в течение определенного периода времени. Период времени можно измерять в днях, неделях или месяцах. Несколько доз антитела к CD19 можно вводить с интервалами, пригодными для достижения терапевтического благоприятного действия, сохраняя баланс с токсическими побочными действиями. Например, при применении нескольких доз может оказаться предпочтительным использовать интервалы времени, которые позволяют восстановить количество моноцитов у пациента перед повторным лечением антителом. С помощью этой схемы введения лекарственного средства можно оптимизировать эффективность лечения, поскольку популяция моноцитов отражает ADCC-функцию у пациента.
В определенных вариантах осуществления изобретения композиции, предлагаемые в изобретении, вводят больному человеку в течение всего срока, пока пациент отвечает на терапию. В других вариантах осуществления изобретения композиции, предлагаемые в изобретении, вводят больному человеку до тех пор, пока у пациента не происходит прогресс заболевания. В родственных вариантах осуществления изобретения композиции, предлагаемые в изобретении, вводят больному человеку до тех пор, пока у пациента не происходит прогресс заболевания или в течение периода отсутствия прогресса, после чего пациенту не вводят композиции, предлагаемые в изобретении, если болезнь не возобновляется или вновь не начинается ее прогресс. Например, пациента можно лечить с использованием любой из указанных выше доз в течение примерно 4-8 недель, в течение этого времени осуществляют мониторинг прогрессирования болезни у пациента. Если прогрессирование прекращается или происходит ее реверс, то пациенту не следует вводить композиции, предлагаемые в изобретении, до возникновения в пациента рецидивов, т.е. болезнь следует лечить, когда она возобновляется или вновь начинается ее прогрессирование. При таком возобновлении или прогрессировании пациента можно лечить вновь, используя первоначально применяемую схему введения лекарственного средства, или с помощью других указанных выше доз.
В определенных вариантах осуществления изобретения композиции, предлагаемые в изобретении, можно применять в виде ударных доз с последующим применением нескольких более низких доз (поддерживающие дозы) в течение определенного периода времени. В таких вариантах осуществления изобретения дозы можно регулировать по времени и регулировать их количество для поддержания эффективного В-клеточного истощения. В определенных вариантах осуществления изобретения ударная доза составляет примерно 10, 11, 12, 13, 14, 15, 16, 17 или 18 мг/кг веса тела пациента, а поддерживающая доза составляет по меньшей мере примерно 5-10 мг/кг веса тела пациента. В других вариантах осуществления изобретения поддерживающую дозу вводят с интервалами каждые 7, 10, 14 или 21 день. Поддерживающие дозы могут оставаться идентичными до возникновения токсичности, до снижения количества тромбоцитов, до прогрессирования заболевания, до обнаружения у пациента иммуногенности или до прогрессирования болезни до конечной стадии. В следующих вариантах осуществления изобретения композиции, предлагаемые в изобретении, вводят больному человеку до тех пор, пока не произойдет прогрессирование болезни до конечной стадии.
В вариантах осуществления изобретения, в которых осуществляют мониторинг уровней моноцитов в кровотоке в качестве части лекарственной схемы, используемые дозы антитела к CD19 можно вводить с интервалами, позволяющими восстановиться количеству моноцитов. Например композицию, предлагаемую в изобретении, можно вводить с интервалами каждые 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29 или 30 дней.
В вариантах осуществления изобретения, в которых антитело к CD19 конъюгируют или вводят в сочетании с токсином, специалисту в данной области должно быть очевидно, что дозу антитела к CD19 можно регулировать в зависимости от дозы токсина и что доза токсина должна зависеть от конкретного типа применяемого токсина. Как правило, если применяют токсин, то доза антитела к CD19 должны быть ниже дозы, применяемой при использовании оголенного антитела к CD19. Соответствующую дозу можно определять для конкретного токсина с помощью методов, хорошо известных в данной области. Например, можно проводить эксперимент по определению диапазона доз с целью выявления максимальной переносимой дозы антитела к CD19 при введении в сочетании или в виде конъюгата с токсином.
В вариантах осуществления изобретения, в которых антитело к CD19 конъюгируют или водят в сочетании с радиотерапевтическим агентом, доза антитела к CD19 должна варьироваться в зависимости от применяемого радиотерапевтического агента. В определенных вариантах осуществления изобретения применяют двухстадийный процесс. На первой стадии больному человеку вводят композицию, содержащую оголенное антитело к CD19 и примерно спустя 6, 7, 8, 9 или 10 дней вводят небольшое количество радиотерапевтического агента. На второй стадии после определения переносимости, распределения и клиренса терапии на основе низкой дозы пациенту вводят дозу оголенного антитела к CD19 с последующим введением в терапевтическом количестве радиотерапевтического агента. Такие лечебные схемы аналогичны принятым для лечения не-ходжкинской лимфомы с помощью ZEVALIN™ (меченное индием МАт к CD20) (фирма Biogen Idee) или BEXXAR™ (GSK, фирма Coulter Pharmaceutical).
5.28. Комбинация с химиотерапевтическими средствами
Анти-CD19 иммунотерапию (с использованием оголенного антитела, иммуноконъюгатов или слитых белков) можно применять в сочетании с другой терапией, включая, но не ограничиваясь только ими, химиотерапию, радиоиммунотерапию (RIT), химиотерапию и дистанционную лучевую терапию (терапия комбинированного воздействия, СМТ) или радиоиммунотерапию комбинированного воздействия (CMRIT) индивидуально или в сочетании и т.д. В определенных вариантах осуществления изобретения терапию на основе антитела к CD19, предлагаемого в настоящем изобретении, можно применять в сочетании с CHOP (циклофосфамид-гидроксидоксорубицин-онковин (винкристин)-преднизолон), наиболее широкого применяемой химиотерапевтической схемой лечения не-ходжкинской лимфомы. В контексте настоящего описания понятие «введение в сочетании с» означает, что анти-CD19 иммунотерапию можно применять до, в процессе или после другой применяемой терапии.
В определенных вариантах осуществления изобретения анти-CD19 иммунотерапию применяют в сочетании с цитотоксическим радионуклидом или радиотерапевтическим изотопом. Например, можно применять испускающий альфа-лучи изотоп, такой как 225Ас, 224Ас, 211At, 212Bi, 213Bi, 212Pb, 224Ra или 223Ra. Цитотоксический радионуклид может представлять собой испускающий бета-лучи изотоп, такой как 186Re, 188Re, 90Y, 131I, 67Cu, 177Lu, 153Sm, 166Ho или 64Cu. Кроме того, цитотоксический радионуклид может испускать оже-электроны и низкоэнергетические электроны, к таким радионуклидам относятся изотопы 125I, 123I или 77Br. В других вариантах осуществления изобретения изотоп может представлять собой 198Au, 32P и т.п. В определенных вариантах осуществления изобретения количество радионуклида, вводимое индивидууму, составляет от примерно 0,001 до примерно 10 мКи/кг.
В некоторых вариантах осуществления изобретения количество радионуклида, вводимое индивидууму, составляет от примерно 0,1 до примерно 1,0 мКи/кг. В других вариантах осуществления изобретения количество радионуклида, вводимое индивидууму, составляет от примерно 0,005 до примерно 0,1 мКи/кг.
В определенных вариантах осуществления изобретения анти-СВ19 иммунотерапию применяют в сочетании с химическим токсином или химиотерапевтическим средством. Химический токсин или химиотерапевтическое средство можно выбирать из группы, включающей энедиин, такой как калихеамицин и эсперамицин; дуокармицин, метотрексат, доксорубицин, мелфалан, хлорамбуцил, ARA-C, виндесин, митомицин С, цисплатину, этопосид, блеомицин и 5-фторурацил.
Приемлемые химические токсины или химиотерапевтические средства, которые можно применять в совместной терапии с анти-СВ19 иммунотерапией, включают представителей семейства молекул из класса энедиинов, таких как калихеамицин и эсперамицин. Химические токсины можно выбирать также из группы, включающей дуокармицин (см., например, US 5703080 и US 4923990), метотрексат, доксорубицин, мелфалан, хлорамбуцил, ARA-C, виндесин, митомицин С, цисплатину, этопосид, блеомицин и 5-фторурацил. Примерами химиотерапевтических средств являются также адриамицин, доксорубицин, 5-фторурацил, цитозина арабинозид («Ara-С»), циклофосфамид, тиотепа, таксотер (доцетаксел), бусульфан, цитоксин, таксол, метотрексат, цисплатин, мелфалан, винбластин, блеомицин, этопосид, ифосфамид, митомицин С, митоксантрон, винкристин, винорелбин, карбоплатин, тенипозид, дауномицин, карминомицин, аминоптерин, дактиномицин, митомицины, эсперамицины (см., US 4675187), мелфалан и другие родственные азотистые производные горчичного газа.
В других вариантах осуществления изобретения можно применять, например, «CVB» (1,5 г/м2 циклофосфамида, 200-400 мг/м2 этопосида и 150-200 мг/м кармустина) в совместной терапии, предлагаемой в изобретении. CVB представляет собой схему, применяемую для лечения не-ходжкинской лимфомы (Patti и др., Eur. J. Haematol. 51, 1993, с.18). Другие комбинации химиотерапевтических схем хорошо известны специалистам в данной области (см., например, Freedman и др., «Non-Hodgkin's Lymphomas» в: CANCER MEDICINE, т.2, 3-е изд., под ред. Holland и др., cc.2028-2068 (Lea & Febiger 1993). В качестве иллюстрации, химиотерапевтическая схема первого поколения для лечения средней степени злокачественности не-ходжкинской лимфомы включает С-МОРР (циклофосфамид, винкристин, прокарбазин и преднизон) и CHOP (циклофосфамид, доксорубицин, винкристин и преднизон). Приемлемая химиотерапевтическая схема второго поколения включает m-BACOD (метотрексат, блеомицин, доксорубицин, циклофосфамид, винкристин, дексаметазон и леуковорин), а пригодная схема третьего поколения включает МАСОР-В (метотрексат, доксорубицин, циклофосфамид, винкристин, преднизон, блеомицин и леуковорин). Дополнительные приемлемые лекарственные средства представляют собой фенилбутират и бростатин-1. В обладающей несколькими воздействиями терапии как химиотерапевтические лекарственные средства, так и цитокины вводят совместно с антителом, иммуноконъюгатом или слитым белком, предлагаемым в настоящем изобретении. Цитокины, химиотерапевтические лекарственные средства, антитело, иммуноконъюгат или слитый белок можно вводить в любом порядке или вместе.
Другие токсины, которые можно применять в композициях и способах, предлагаемых в изобретении, включают ядовитые пектины, растительные токсины, такие как рицин, абрин, модецин, ботулин и дифтерийные токсины.
Естественно, комбинации различных токсинов можно сшивать с одной молекулой антитела, придавая тем самым различную цитотоксичность. Приведенными в качестве иллюстрации токсинам, которые можно применять в совместной терапии, предлагаемой в изобретении, являются рицин, абрин, рибонуклеаза, ДНКаза I, стафилококковый энтеротоксин-А, противовирусный белок фитоллаки американской, гелонин, дифтерийный токсин, экзотоксин Pseudomonas и эндотоксин Pseudomonas (см., например, Pastan и др., Cell 47, 1986, с.641 и Goldenberg и др., Cancer Journal for Clinicians 44, 1994, с.43). Обладающие ферментативной активностью токсины и их фрагменты, которые можно применять, включают А-цепь дифтерийного токсина, несвязывающиеся активные фрагменты дифтерийного токсина, А-цепь экзотоксина (из Pseudomonas aeruginosa), А-цепь рицина, А-цепь абрина, А-цепь модецина, альфа-сарцин, белки Aleurites fordii, белки диантина, белки фитолакки американской (PAPI, PAPII и PAP-S), ингибитор из Momordica charantia, курцин, кротин, ингибитор из Sapaonaria officinalis, гелонин, митогеллин, рестриктоцин, феномицин, эномицин и трикотецены (см., например, WO 93/21232, опубликованную 28 октября 1993 г.).
Приемлемые токсины и химиотерапевтические средства описаны в Remington's Pharmaceutical Sciences, 19-е изд. (изд-во Mack Publishing Co. 1995), и в Goodman And Gilman's The Pharmacological Basis of Therapeutics, 7-ое изд. (изд-во MacMillan Publishing Co., 1985). Специалистам в данной области известны другие приемлемые токсины и/или химиотерапевтические средства.
Анти-CD19 иммунотерапию, предлагаемую в настоящем изобретении, можно применять также в сочетании с активирующим пролекарство ферментом, который превращает пролекарство (например, пептидильный химиотерапевтический агент, см. WO 81/01145) в активное противораковое лекарственное средство (см., например, WO 88/07378 и US 4975278). Представляющий собой фермент компонент таких комбинаций включает любой фермент, обладающий способностью действовать на пролекарство таким образом, чтобы превращать его в более активную цитотоксическую форму. Понятие «пролекарство» в контексте настоящего описания относится к предшественнику или производному фармацевтически активной субстанции, которые является менее цитотоксическим для опухолевых клеток по сравнению с родительским лекарственным средством и обладает способностью ферментативно активироваться или превращаться в более активную родительскую форму (см., например, Wilman, «Prodrugs in Cancer Chemotherapy», Biochemical Society Transactions, 14, 1986, cc.375-382, 615-й Meeting Belfast и Stella и др., «Prodrugs; A Chemical Approach to Targeted Drug Delivery», Directed Drug Delivery, под ред. Borchardt и др., 1985, cc.247-267, изд-во Humana Press). Пролекарства, которые можно применять в сочетании с антителами к CD19, включают, но не ограничиваясь только ими, фосфатсодержащие Пролекарства, тиофосфатсодержащие Пролекарства, сульфатсодержащие Пролекарства, пептидсодержащие Пролекарства, модифицированные D-аминокислотами Пролекарства, гликозилированные Пролекарства, α-лактамсодержащие Пролекарства, содержащие необязательно замещенный феноксиацетамид Пролекарства или содержащие необязательно замещенный фенилацетамид Пролекарства, 5-фторцитозин и другие 5-фторуридиновые Пролекарства, которые могут превращаться в более активное цитотоксическое свободное лекарственное средство. Примерами цитотоксических лекарственных средств, которые можно дериватизировать в пролекарственную форму, предназначенные для применения согласно настоящему изобретению, являются, но не ограничиваясь только ими, описанные выше химиотерапевтические средства.
В определенных вариантах осуществления изобретения применение композиций и способов, предлагаемых в изобретении, может отсрочить применение токсической терапии и может помочь избежать нежелательных побочных действий и рисков осложнений, ассоциированных с химиотерапией, и замедлить развитие устойчивости к химиотерапии. В определенных вариантах осуществления изобретения применение токсической терапии и/или устойчивость к токсической терапии откладывает у пациентов, для лечения которых используют композиции и способы, предлагаемые в изобретении, причем, откладывается на срок вплоть до примерно 6 месяцев, 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 лет.
5.29. Комбинация с терапевтическими антителами Анти-CD19 иммунотерапию, описанную выше, можно применять в сочетании с другими антителами, включая, но не ограничиваясь только ими, МАт к CD20, МАт к CD52, антитело к CD22 и антитела к CD20, такие как RITUXAN™ (C2B8; RITUXIMAB™; фирма IDEC Pharmaceuticals). Другими примерами терапевтических антител, которые можно применять в сочетании с антителами, предлагаемыми в изобретении, или применять в композициях, предлагаемых в изобретении, являются, но не ограничиваясь только ими, HERCEPTIN™ (трастузумаб; фирма Genentech), MYLOTARG™ (гемтузумаба озогамицин; фирма Wyeth Pharmaceuticals), CAMPATH™ (алемтузумаб; фирма Berlex), ZEVALIN™ (ипритумомаба тиуксетан; фирма Biogen Idee), BEXXAR™ (тоситумомаб; фирма GlaxoSmithKline Corixa), ERBITUX™ (цетуксимаб; фирма Imclon) и AVASTIN™ (бевасизумаб; фирма Genentech).
Анти-CD19 иммунотерапию, описанную выше, можно применять в сочетании с антителом, специфическим в отношении Fc-рецептора, выбранного из группы, включающей FcγRI, FcγRIIA, FcγRIIB, FcγRIII и/или FcγRIV. В конкретном варианте осуществления изобретения анти-CD19 иммунотерапию, описанную выше, можно применять в сочетании с антителом, специфическим в отношении FcγRIIB. Антитела к FcγRIIB, пригодные для этой цели, описаны в публикации заявки на патент США 2004185045, публикациях РСТ WO 05/051999А, WO 05/018669 и WO 04/016750.
В определенных вариантах осуществления изобретения можно применять МАт к CD19 и к CD20 и/или к CD22 и/или МАт к CD52, необязательно в одной и той же фармацевтической композиции в любом приемлемом соотношении. Например, соотношение антитела к CD19 и к CD20 может составлять примерно 1000:1, 500:1, 250:1, 100:1, 90:1, 80:1, 70:1, 60:1, 50:1, 40:1, 30:1, 20:1, 19:1, 18:1, 17:1, 16:1, 15:1, 14:1, 13:1, 12:1, 11:1, 10:1, 9:1, 8:1, 7:1, 6:1, 5:1, 4:1, 3:1, 2:1, 1:1, 1:2, 1:3, 1:4, 1:5, 1:6, 1:7, 1:8, 1:9, 1:10, 1:11, 1:12, 1:13, 1:14, 1:15, 1:16, 1:17, 1:18, 1:19, 1:20, 1:30, 1:40, 1:50, 1:60, 1:70, 1:80, 1:90, 1:100, 1:250, 1:500 или 1:1000, или более. Аналогично соотношение антитела к CD19 и к CD22 может составлять примерно 1000:1, 500:1, 250:1, 100:1, 90:1, 80:1, 70:1, 60:1, 50:1, 40:1, 30:1, 20:1, 19:1, 18:1, 17:1, 16:1, 15:1, 14:1, 13:1, 12:1, 11:1, 10:1, 9:1, 8:1, 7:1, 6:1, 5:1, 4:1, 3:1, 2:1, 1:1, 1:2, 1:3, 1:4, 1:5, 1:6, 1:7, 1:8, 1:9, 1:10, 1:11, 1:12, 1:13, 1:14, 1:15, 1:16, 1:17, 1:18, 1:19, 1:20, 1:30, 1:40, 1:50, 1:60, 1:70, 1:80, 1:90. 1:100, 1:250, 1:500, или 1:1000, или более. Аналогично соотношение антитела к CD19 и к CD52 может составлять примерно 1000:1, 500:1, 250:1, 100:1, 90:1, 80:1, 70:1, 60:1, 50:1, 40:1, 30:1, 20:1, 19:1, 18:1, 17:1, 16:1, 15:1, 14:1, 13:1, 12:1, 11:1, 10:1, 9:1, 8:1, 7:1, 6:1, 5:1, 4:1, 3:1, 2:1, 1:1, 1:2, 1:3, 1:4, 1:5, 1:6, 1:7, 1:8, 1:9, 1:10, 1:11, 1:12, 1:13, 1:14, 1:15, 1:16, 1:17, 1:18, 1:19, 1:20, 1:30, 1:40, 1:50, 1:60, 1:70, 1:80, 1:90, 1:100, 1:250, 1:500, или 1:1000, или более.
5.30. Комбинация соединений, которые усиливают функцию моноцитов или макрофагов
В определенных вариантах способов, предлагаемые в изобретении, соединение, которое усиливает функцию моноцитов или макрофагов (например, по меньшей мере примерно на 25%, 50%, 75%, 85%, 90%, 95% или более), можно применять в сочетании с анти-CD19 иммунотерапией. Такие соединения известны в данной области и включают, но не ограничиваясь только ими, цитокины, такие как интерлейкины (например, IL-12) и интерфероны (например, альфа- или гамма-интерферон).
Соединение, которое усиливает функцию моноцитов или макрофагов, т.е. «усилитель», можно включать в состав той же фармацевтической композиции, что и антитело, иммуноконъюгат или антигенсвязывающий фрагмент. При раздельном введении антитело/фрагмент и соединение можно вводить одновременно (в пределах нескольких часов друг за другом), можно вводить во время этого же курса терапии, или можно вводить по отдельности (т.е. пациента сначала подвергают курсу лечения антителом/фрагментом, а затем курсу лечения соединением, которое усиливает функцию макрофагов/моноцитов, или наоборот). В таких вариантах осуществления изобретения соединение, которое усиливает функцию моноцитов или макрофагов, вводят человеку до, одновременно или после лечения другими терапевтическими схемами и/или композициями, предлагаемыми в изобретении. В одном из вариантов осуществления изобретения у человека количество в крови лейкоцитов, моноцитов, нейтрофилов, лимфоцитов и/или базофилов находятся в нормальных для человека пределах. Нормальные для крови человека пределы содержания лейкоцитов (общие) составляют от примерно 3,5 до примерно 10,5 (109/л). Нормальные для крови человека пределы содержания нейтрофилов составляют от примерно 1,7 до примерно 7,0 (109/л), моноцитов от примерно 0,3 до примерно 0,9 (109/л), лимфоцитов от примерно 0,9 до примерно 2,9 (109/л), базофилов от примерно 0 до примерно 0,3 (109/л) и эозинофилов от примерно 0,05 до примерно 0,5 (109/л). В других вариантах осуществления изобретения у человека количество в крови лейкоцитов ниже нормального содержания для человека, например, составляет по меньшей мере примерно 0,01, 0,05, 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7 или 0,8 (109/л) лейкоцитов.
Это вариант осуществления изобретения можно применять на практике в сочетании с антителами, иммуноконъюгатами или фрагментами антител, предлагаемыми в изобретении, или с другими антителами, известными в данной области, и прежде всего для лечения индивидуумов, устойчивых к терапии на основе антител к CD22, к CD52 и/или к CD20 (например, терапии с использованием существующих антител, например, С2В8), индивидуумов, которых одновременно подвергают или ранее подвергали химиотерапии, индивидуумов, которые имеют рецидив В-клеточного нарушения, индивидуумов, имеющих иммунные аномалии, или индивидуумов, у которых по другим причинам нарушена функция макрофагов или моноцитов. В основном это относится к пациентам, устойчивым к терапии или имеющим рецидив В-клеточного нарушения, по меньшей мере частично, с нарушенной функцией макрофагов или моноцитов. Таким образом, изобретение относится к способам повышения ADCC и/или функции макрофагов и/или моноцитов, которые применяют в сочетании со способами применения антител к CD19 и антигенсвязывающих фрагментов.
5.31. Комбинация с иммунорегуляторами
Анти-CD19 иммунотерапию, предлагаемую в изобретении, можно применять также в сочетании с иммунорегулятором. При таком подходе можно применять химерное, человеческое или гуманизированное антитело к CD19. Понятие «иммунорегулятор» в контексте настоящего описания применительно к совместной терапии относится к субстанциям, активность которых заключается в подавлении, маскировке или усилении иммунной системы хозяина. К ним относятся субстанции, которые подавляют производство цитокинов, оказывают понижающее действие или подавляют экспрессию аутоантигенов или маскируют антигены ГКГ. Примерами таких соединения являются 2-амино-6-арил-5-замещенные пиримидины (см. US 4665077), азатиоприн (или циклофосфамид, если имеет место обратная реакция не азатиоприн); бромкриптин; глутаровый альдегид (который маскирует антигены ГКГ, что описано в US 4120649); антиидиотические антитела к антигенам ГКГ и фрагментам ГКГ; циклоспорин А; стероиды, такие как глюкокортикостероиды, например, преднизон, метилпреднизолон и дексаметазон; антагонисты цитокинов или цитокиновых рецепторов, включая антитела к интерферону-γ, -β, или -α; антитела к фактору-α некроза опухолей; антитела к фактору-β некроза опухолей; антитела к интерлейкину-2 и антитела к IL-2-рецептору; антитела к L3T4; гетерологичный антилимфоцитарный глобулин; антитела к ran-Т, например, антитела к CD3 или к CD4/CD4a; растворимый пептид, содержащий связывающий домен LFA-3 (WO 90/08187, опубликованная 26 июля 1990 г.); стрептокиназа; TGF-β; стрептодорназа; РНК или ДНК из хозяина; FK506; RS-61443; дезоксиспергуалин; рапамицин; Т-клеточный рецептор (US 5114721); фрагменты Т-клеточного рецептора (Offner и др., Science 251, 1991. cc.430-432; WO 90/11294; и WO 91/01133); и антитела к Т-клеточному рецептору (ЕР 340109), такие как Т10 В9. Примерами цитокинов являются, но не ограничиваясь только ими, лимфокины, монокины и традиционные полипептидные гормоны. Среди цитокинов следует упомянуть гормон роста, такой как человеческий гормон роста, N-метионильный человеческий гормон роста и бычий гормон роста; паратиреоидный гормон; тироксин; инсулин; проинсулин; релаксин; прорелаксин; гликопротеиновые гормоны, такие как фолликулостимулирующий гормон (FSH), тиреотропный гормон (TSH) и лютеинизирующий гормон (LH); гепацитарный фактор роста; фактор роста фибробластов; пролактин; плацентарный лактоген; фактор-α некроза опухоли; мюллерианингибирующая субстанция; мышиный ассоциированный с гонадотропином пептид; ингибин; активин; сосудистый эндотелиальный фактор роста; интегрин; тромбопоэтин (ТРО); фактор роста нервов, такой как NGF-α; тромбоцитарный фактор роста; трансформирующие факторы роста (TGF), такие как TGF-α и TGF-α; инсулиноподобный фактор-I и -II роста; эритропоэтин (ЕРО); остеоиндуктивные факторы; интерфероны; колониестимулирующие факторы (CSF), такие как CSF макрофагов (M-CSF); CgP-гранулоцитов и макрофагов (GM-CSF); CSF гранулоцитов (G-CSF); интерлейкины (IL), такие как IL-1, IL-1a, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-11, IL-12, IL-15; фактор некроза опухолей, такой как TNF-α или TNF-β; и другие полипептидные факторы, включая LIF и набор лигандов (KL). В контексте настоящего описания понятие цитокин включает белки из встречающихся в естественных условиях источников или из рекомбинантных клеточных культур и биологически активные эквиваленты нативных последовательностей цитокинов. В определенных вариантах осуществления изобретения способы дополнительно заключаются в том, что вводят индивидууму один или несколько иммуномодуляторов, например цитокин. Приемлемые цитокины можно выбирать из группы, включающей интерлейкин-1 (IL-1), IL-2, IL-3, IL-12, IL-15, IL-18, G-CSF, GM-CSF, тромбопоэтин и γ-интерферон.
Эти иммунорегуляторы вводят одновременно с антителами к CD19 или в другое время. Выбор предпочтительного иммунорегулятора зависит от многочисленных факторов, включая тип нарушения, подлежащего лечению, а также историю болезни пациента, но наиболее часто иммунорегулятор выбирают из циклоспорина А, глюкокортикостероида (например, преднизона или метилпреднизолона), моноклонального антитела ОКТ-3, азатиоприна, бромкриптина, гетерологичного антилимфоцитарного глобулина или их смеси.
5.32. Комбинация с другими терапевтическими средствами
Средства, которые оказывают воздействие на опухоль новой сосудистой сети, можно применять также в сочетании с анти-CD19 иммунотерапией, и они включают связывающие тубулин агенты, такие как комбрестатин А4 (Griggs и др., Lancet Oncol. 2, 2001, с.82,) и ангиоостатин и эндостатин (см. обзор у Rosen, Oncologist 5, 2000, с.20, включенный в настоящее описание в качестве ссылки). Иммуномодуляторы, которые можно применять в сочетании с антителами к CD19, включают, но не ограничиваясь только ими, α-интерферон, γ-интерферон и фактор альфа некроза опухолей (TNFα). В определенных вариантах осуществления изобретения терапевтические средства, которые применяют в совместных терапиях, включающих использование композиций и способов, предлагаемых в изобретении, представляют собой пептиды.
В определенных вариантах осуществления изобретения анти-CD19 иммунотерапию применяют в сочетании с одной или несколькими молекулами калихеамицина. Семейство калихеамициновых антибиотиков обладает способностью продуцировать разрывы двухцепочечных ДНК при их применении в субпикомолярных концентрациях. Структурные аналоги калихеамицина, которые можно применять, включают, но не ограничиваясь только ими, γ1I, γ2I, γ3I, N-ацетил- γ1I, PSAG и 011 (Hinman и др., Cancer Research 53, 1993, cc.3336-3342 и Lode и др., Cancer Research 58, 1998, cc.2925-2928).
Слитый белок, включающий антитело к CD19 и цитотоксический агент, можно создавать также, например, методами рекомбинации или путем пептидного синтеза.
В еще одном варианте осуществления изобретения антитело к CD19 можно конъюгировать с «рецептором» (таким как стрептавидин) для применения для предварительного переноса в опухоль, когда пациенту вводят конъюгат антагонист-рецептор, с последующим удалением несвязанного конъюгата из кровотока с помощью осветляющего агента и затем вводят «лиганд» (например, авидин), конъюгированный с терапевтическим агентом (например, радионуклеотидом).
В определенных вариантах осуществления изобретения лечебная схема включает соединения, которые смягчают цитотоксические действия содержащей антитело к CD19 композиции. Такие соединения представляют собой аналгетики (например, ацетаминофен), бисфосфонаты, антигистаминные средства (например, хлорфенирамина малеат) и стероиды (например, дексаметазон, ретиноиды, делтоиды, бетаметазон, кортизол, кортизон, преднизон, дегидротестостерон, глюкокортикоиды, минералокортикоиды, эстроген, тестостерон, прогестины).
В определенных вариантах осуществления изобретения терапевтический агент, применяемый в сочетании с анти-CD19 иммунотерапией, представляет собой небольшую молекулу (т.е. неорганические или органические соединения с молекулярной массой менее чем примерно 2500 Да). Например, библиотеки небольших молекул можно приобретать у фирмы Specs and BioSpecs B.V. (Рийсвик, Недерланды), фирмы Chembridge Corporation (Сан-Диего, шт.Калифорния), фирмы Comgenex USA Inc. (Принстон, шт.Нью-Джерси) и фирмы Maybridge Chemicals Ltd. (Корнуолл, PL34 OHW, Великобритания).
В определенных вариантах осуществления изобретения анти-CD19 иммунотерапию можно применять в сочетании с антибактериальным агентом. Примерами антибактериальных агентов являются, но не ограничиваясь только ими, белки, полипептиды, пептиды, слитые белки, антитела, молекулы нуклеиновых кислот, органические молекулы, неорганические молекулы и небольшие молекулы, которые ингибируют и/или снижают бактериальную инфекцию, ингибируют и/или снижают репликацию бактерий или ингибируют и/или снижают распространение бактерий в другие клетки или в другие особи. Конкретными примерами антибактериальных агентов являются, но не ограничиваясь только ими, антибиотики, такие как пенициллин, цефалоспорин, имипенем, акстреонам, ванкомицин, циклосерин, бацитрацин, хлорамфеникол, эритромицин, клиндамицин, тетрациклин, стрептомицин, тобрамицин, гентамицин, амикацин, канамицин, неомицин, спектиномицин, триметоприм, норфлоксацин, рифампин, полимиксин, амфотерицин В, нистатин, кетоканозол изониазид, метронидазол и пентамидин.
В определенных вариантах осуществления изобретения анти-CD19 иммунотерапию можно применять в сочетании с противогрибным агентом. Конкретными примерами противогрибных агентов являются, но не ограничиваясь только ими, азольные лекарственные средства (например, миконазол, кетоконазол (NIZORAL®), каспофунгина ацетат (CANCIDAS®), имидазол, триазолы (например, флуконазол (DIFLUCAN®)) и итраконазол (SPORANOX®)), полиены (например, нистатин, амфотерицин В (FUNGIZONE®), липидный комплекс амфотерицина В («ABLC») (ABELCET®), коллоидная дисперсия амфотерицина В («ABCD») (АМРНОТЕС®), включенный в липосому амфотерицин В (AMBISONE®)), йодид калия (KI), пиримидины (например, флуцитозин (ANCOBON®) и вориконазол (VFEND®)). Введение антибактериальных и противогрибных агентов может смягчать действия или снижать развитие инфекционной болезни, что может происходить при применении способов, предлагаемых в изобретении, когда у пациента произошло значительное В-клеточное истощение.
В определенных вариантах осуществления изобретения анти-CD19 иммунотерапию можно применять в сочетании с одним или несколькими описанными выше агентами для смягчения токсических побочных действий, которые сопровождают введение композиций, предлагаемых в изобретении. В других вариантах осуществления изобретения анти-CD19 иммунотерапию можно применять в сочетании с одним или несколькими агентами, хорошо известными в данной области, для смягчения побочных действий, связанных с введением антител, химиотерапевтических средств, токсинов или лекарственных средств.
В определенных вариантах осуществления изобретения, когда анти-СВ19 иммунотерапию применяют для лечения множественной миеломы, композиции, предлагаемые в изобретении, можно вводить в сочетании с лечебными схемами или в лечебных схемах, включающих химиотерапию высокими дозами (мелфалан, мелфалан/преднизон (МР), винкристин/доксорубицин/дексаметазон (VAD), включенный в липосому доксорубицин/винкристин, дексаметазон (DVd), циклофосфамид, этопосид/дексаметазон/цитарабин, цисплатин (EDAP)), трансплантаты стволовых клеток (например, при аутологичной трансплантации стволовых клеток или аллогенной трансплантации стволовых клеток и/или миниаллогенной (не миелоаблативной) трансплантации стволовых клеток), в сочетании с лучевой терапией, стероидами (такими, например, как кортикостероиды, дексаметазон, талидомид/дексаметазон, преднизон, мелфалан/преднизон), поддерживающей терапией (используя, например, бисфосфонаты, факторы роста, антибиотики, внутривенно иммуноглобулин, лучевую терапию с низкими дозами, и/или ортопедические вмешательства), THALOMID™ (талидомид, фирма Celgene) и/или VELCADE™ (бортезомиб, фирма Millennium).
В вариантах осуществления изобретения, в которых анти-CD19 иммунотерапию применяют в сочетании с другим(и) антителом или антителами и/или агентам, дополнительное(ые) антитело или антитела и/или агенты можно вводить в любой последовательности относительно введения антитела, предлагаемого в настоящем изобретении. Например, дополнительное антитело или антитела можно вводить до, одновременно и/или после введения антитела к CD19 или иммуноконъюгата человеку. Дополнительное антитело или антитела может/могут присутствовать в той же фармацевтической композиции, что и антитело, предлагаемое в изобретении, и/или присутствовать в другой фармацевтической композиции. Доза и путь введения антитела, предлагаемого в настоящем изобретении, и доза дополнительного антитела или антител может быть одинаковой или различной и соответствовать любым указанным дозам и путям введения, которые представлены в настоящем описании и хорошо известны в данной области.
5.33. Применение антител к CD19 для диагностики В-клеточных злокачественных состояний
Настоящее изобретение относится также к антителам к CD19 и содержащим их композициям, которые иммуноспецифически связываются с человеческим антигеном CD19, где антитела к CD19 конъюгируют с диагностическим или выявляемым агентом. В определенных вариантах осуществления изобретения антитела представляют собой человеческие или гуманизированные антитела к CD19. Такие антитела к CD19 можно применять для мониторинга или прогнозирования развития В-клеточного злокачественного состояния в качестве части клинической процедуры тестирования, такой как определение эффективности конкретной терапии. Указанное диагностирование и выявление можно осуществлять путем сшивания антитела к CD19, которое иммуноспецифически связывается с человеческим антигеном CD19, с выявляемой субстанцией, включающей, но не ограничиваясь только ими, различные ферменты, такие как, но не ограничиваясь только ими, пероксидаза из хрена, щелочная фосфатаза, бета-галактозидаза или ацетилхолинэстераза;
простатическими группами, такими как, но не ограничиваясь только ими, стрептавидин/биотин и авидин/биотин; флуоресцентные материалы, такие как, но не ограничиваясь только ими, умбеллиферон, флуоресцеин, флуоресцеина изотиоцианат, родамин, дихлортриазиниламин флуоресцеина, дансилхлорид или фикоэритрин; люминисцентные материалы, такие как, но не ограничиваясь только ими, люминол; биолюминисцентые материалы, такие как, но не ограничиваясь только ими, люцифераза, люциферин и экворин; радиоактивные материалы, такие как, но, не ограничиваясь только ими, йод (131I, 125I, 123I, 121I,), углерод (14С), сера (35S), тритий (3Н), индий (115In, 113In, 112In, 111In,) и технеций (99Tc), таллий (201Ti), галлий (68Ga, 67Ga), палладий (103Pd), молибден (99Мо), ксенон (133Хе), фтор (18F), 153Sm, 177Lu, 159Gd, 149Pm, 140La, 175Yb, 166Ho, 90Y, 47Sc, 186Re, 188Re, 142Pr, 105Rh, 97Ru, 68Ge, 57Co, 65Zn, 85Sr, 32P, 153Gd, 169Yb, 51Cr, 54Mn, 75Se, 113Se и 117Tin; испускающие позитроны металлы, применяемые в различных методах эмиссионной позитронной томографии, нерадиоактивные парамагнитные ионы металлов и молекулы, которые метят с помощью радиоактивной метки или конъюгируют с определенными радиоизотопами. Любую выявляемую метку, которую легко оценивать, можно конъюгировать с антителом к CD19 и применять для диагностики В-клеточных злокачественных состояний. Выявляемую субстанцию можно сшивать или конъюгировать с антителом либо прямо, либо косвенно через промежуточный элемент (такой, например, как линкер, известный в данной области) с помощью методов, известных в данной области (см., например, US 474900, в котором описаны ионы металлов, которые можно конъюгировать с антителами для применения в методах диагностики согласно настоящему изобретению). В определенных вариантах осуществления изобретения предложены диагностические наборы, которые содержат антитело к CD19, конъюгированное с диагностическим или выявляемым агентом.
5.34. Применение антител к CD19 для мониторинга восстановления иммунной системы
Настоящее изобретение относится также к антителам к CD19 и содержащим их композициям, которые иммуноспецифически связываются с человеческим антигеном CD19, где антитела к CD19 конъюгируют с диагностическим или выявляемым агентом. В определенных вариантах осуществления изобретения антитела представляют собой человеческие или гуманизированные антитела к CD19. Указанные антитела к CD19 можно применять для мониторинга восстановления иммунной системы после иммуносупрессорной терапии или трансплантации костного мозга. Указанный мониторинг можно осуществлять, сшивая антитело к CD19, которое иммуноспецифически связывается с человеческим антигеном CD19, с выявляемой субстанцией, включая, но не ограничиваясь только ими, различные ферменты, такие как, но не ограничиваясь только ими, пероксидаза из хрена, щелочная фосфатаза, бета-галактозидаза или ацетилхолинэстераза; простатическими группами, такими как, но не ограничиваясь только ими, стрептавидин/биотин и авидин/биотин; флуоресцентные материалы, такие как, но не ограничиваясь только ими, умбеллиферон, флуоресцеин, флуоресцеина изотиоцианат, родамин, дихлортриазиниламин флуоресцеина, дансилхлорид или фикоэритрин; люминисцентные материалы, такие как, но не ограничиваясь только ими, люминол; биолюминисцентые материалы, такие как, но не ограничиваясь только ими, люцифераза, люциферин и экворин; радиоактивные материалы, такие как, но не ограничиваясь только ими, йод (131I, 125I, 123I, 121I,), углерод (14С), сера (35S), тритий (3Н), индий (115In, 113In, 112In, 111In,) и технеций (99Tc), таллий (201Ti), галлий (68Ga, 67Ga), палладий (103Pd), молибден (99Мо), ксенон (133Хе), фтор (18F), 153Sm, 177Lu, 159Gd, 149Pm, 140La, 175Yb, 166Ho, 90Y, 47Sc, 186Re, 188Re, 142Pr, 105Rh, 97Ru, 68Ge, 57Co, 65Zn, 85Sr, 32P, 153Gd, 169Yb, 51Cr, 54Mn, 75Se, 113Se и 117Tin; испускающие позитроны металлы, применяемые в различных методах эмиссионной позитронной томографии, нерадиоактивные парамагнитные ионы металлов и молекулы, которые метят с помощью радиоактивной метки или конъюгируют с определенными радиоизотопами. Любую выявляемую метку, которую легко оценивать, можно конъюгировать с антителом к CD19 и применять для диагностики аутоиммунного заболевания или нарушения. Выявляемую субстанцию можно сшивать или конъюгировать с антителом либо прямо, либо косвенно через промежуточный элемент (такой, например, как линкер, известный в данной области) с помощью методов, известных в данной области (см., например, US 474900, в котором описаны ионы металлов, которые можно конъюгировать с антителами для применения в методах диагностики согласно настоящему изобретению). В определенных вариантах осуществления изобретения предложены диагностические наборы, которые содержат антитело к CD19, конъюгированное с диагностическим или выявляемым агентом.
5.35. Применение антител к CD19 для диагностики аутоиммунных заболеваний или нарушений
Настоящее изобретение относится также к антителам к CD19 и содержащим их композициям, которые иммуноспецифически связываются с человеческим антигеном CD19, где антитела к CD19 конъюгируют с диагностическим или выявляемым агентом. В определенных вариантах осуществления изобретения антитела представляют собой человеческие или гуманизированные антитела к CD19. Указанные антитела к CD19 можно применять для мониторинга или прогнозирования развития или прогрессирования аутоиммунного заболевания или нарушения в качестве части клинической процедуры тестирования, такой как определение эффективности конкретной терапии. Указанное диагностирование и выявление можно осуществлять путем сшивания антитела к CD19, которое иммуноспецифически связывается с человеческим антигеном CD19, с выявляемой субстанцией, включающей, но не ограничиваясь только ими, различные ферменты, такие как, но не ограничиваясь только ими, пероксидаза из хрена, щелочная фосфатаза, бета-галактозидаза или ацетилхолинэстераза; простатическими группами, такими как, но не ограничиваясь только ими, стрептавидин/биотин и авидин/биотин; флуоресцентные материалы, такие как, но не ограничиваясь только ими, умбеллиферон, флуоресцеин, флуоресцеина изотиоцианат, родамин, дихлортриазиниламин флуоресцеина, дансилхлорид или фикоэритрин; люминисцентные материалы, такие как, но не ограничиваясь только ими, люминол; биолюминисцентые материалы, такие как, но, не ограничиваясь только ими, люцифераза, люциферин и экворин; радиоактивные материалы, такие как, но не ограничиваясь только ими, йод (131I, 125I, 123I, 121I,), углерод (14С), сера (35S), тритий (3Н), индий (115In, 113In, 112In, 111In,) и технеций (99Tc), таллий (201Ti), галлий (68Ga, 67Ga), палладий (103Pd), молибден (99Мо), ксенон (133Хе), фтор (18F), 153Sm, 177Lu, 159Gd, 149Pm, 140La, 175Yb, 166Ho, 90Y, 47Sc, 186Re, 188Re, 142Pr, 105Rh, 97Ru, 68Ge, 57Co, 65Zn, 85Sr, 32P, 153Gd, 169Yb, 51Cr, 54Mn, 75Se, 113Se и 117Tin; испускающие позитроны металлы, применяемые в различных методах эмиссионной позитронной томографии, нерадиоактивные парамагнитные ионы металлов и молекулы, которые метят с помощью радиоактивной метки или конъюгируют с определенными радиоизотопами. Любую выявляемую метку, которую легко оценивать, можно конъюгировать с антителом к CD19 и применять для диагностики аутоиммунного заболевания или нарушения. Выявляемую субстанцию можно сшивать или конъюгировать с антителом либо прямо, либо косвенно через промежуточный элемент (такой, например, как линкер, известный в данной области) с помощью методов, известных в данной области (см., например, US 474900, в котором описаны ионы металлов, которые можно конъюгировать с антителами для применения в методах диагностики согласно настоящему изобретению). В определенных вариантах осуществления изобретения предложены диагностические наборы, которые содержат антитело к CD19, конъюгированное с диагностическим или выявляемым агентом.
5.36. Наборы
Изобретение относится к фармацевтической упаковке или набору, содержащему один или несколько контейнеров, которые заполнены композицией, предлагаемой в изобретении, предназначенному для предупреждения, лечения, оказания помощи или облегчения В-клеточного злокачественного состояния или одного или нескольких его симптомов, усиленных В-клеточным злокачественным состоянием, или усиливающих его.
В настоящем изобретении предложены наборы, которые можно применять в описанных выше способах. В одном из вариантов осуществления изобретения набор содержит композицию, предлагаемую в изобретении, в одном или нескольких контейнерах. В другом варианте осуществления изобретения набор содержит композицию, предлагаемую в изобретении, в одном или нескольких контейнерах, и одно или несколько профилактических или терапевтических средств, которые можно применять для предупреждения, оказания помощи или лечения В-клеточного злокачественного состояния или одного или нескольких его симптомов, усиленных В-клеточным злокачественным состоянием, или усиливающих его, которые находятся в одном или нескольких других контейнерах. Набор может включать также инструкции по предупреждению, лечению, оказанию помощи или облегчению В-клеточного злокачественного состояния, а также о побочных действиях и информацию о дозах, применяемых для конкретного метода введения. Необязательно указанный(ые) контейнер(ы) может(гут) содержать предупреждение в форме, предписанной правительственным агентством, регулирующим производство, применение или продажу фармацевтических или биологических продуктов, где в предупреждении отражены требования агентства, касающиеся производства, применения или продажи для применения на человеке.
6. Конкретные варианты осуществления изобретения
1. Химерное, гуманизированное или человеческое моноклональное антитело или его фрагмент, которое/который связывается с человеческим антигеном CD19.
2. Антитело по варианту осуществления изобретения 1, содержащее по меньшей мере один CDR, который имеет аминокислотную последовательность, выбранную из группы, включающей SEQ ID NO: 6, 8, 10, 12, 14, 16, 22, 24, 26, 28, 30, 32, 114, 115, 116, 117, 118, 119, 120,121, 122, 123, 124, 125, 126 и 127.
3. Антитело по варианту осуществления изобретения 1, содержащее по меньшей мере один каркасный участок HB12B-(A10-Jk4), HB12B-3649 или НВ12В-364987 вариабельных областей легкой цепи.
4. Антитело по варианту осуществления изобретения 1, содержащее по меньшей мере один каркасный участок HB12B-(3-72\JH4) или НВ12В-9m вариабельных областей тяжелой цепи.
5. Антитело по варианту осуществления изобретения 1, содержащее по меньшей мере один полипептид тяжелой цепи, который имеет аминокислотную последовательность, выбранную из группы, включающей: SEQ ID NO: 2, 18, 34, 44, 102, 103, 104, 105, 106, 107, 108 и 109.
6. Антитело по варианту осуществления изобретения 1, содержащее по меньшей мере один полипептид легкой цепи, который имеет аминокислотную последовательность, выбранную из группы, включающей: SEQ ID NO: 4, 20, 52, 62, 68, 70, 110, 111, 112 и 113.
7. Антитело по варианту осуществления изобретения 5, дополнительно содержащее по меньшей мере один CDR легкой цепи, который имеет аминокислотную последовательность, выбранную из группы, включающей: SEQ ID NO: 12, 14, 16, 28, 30, 32, 123, 124, 125, 126 и 127.
8. Антитело по варианту осуществления изобретения 3, дополнительно содержащее по меньшей мере один CDR тяжелой цепи, который имеет аминокислотную последовательность, выбранную из группы, включающей: SEQ ID NO: 6, 8, 10, 22, 24, 26, 114, 115, 116, 117, 118, 119, 120, 121 и 122.
9. Антитело по варианту осуществления изобретения 1, содержащее по меньшей мере один полипептид тяжелой цепи, который имеет аминокислотную последовательность, выбранную из группы, включающей: SEQ ID NO: 2, 18, 34, 44, 102, 103, 104, 105, 106, 107, 108 и 109, и по меньшей мере один полипептид легкой цепи, который имеет аминокислотную последовательность, выбранную из группы, включающей: SEQ ID NO: 4, 20, 52, 62, 68, 70, 110, 111, 112 и 113.
10. Антитело по варианту осуществления изобретения 1, содержащее по меньшей мере один полипептид легкой цепи и по меньшей мере один полипептид тяжелой цепи, где полипептид легкой цепи имеет аминокислотную последовательность, выбранную из группы, включающей: НВ12А VK (SEQ ID NO: 4) и НВ12В VK (SEQ ID NO:20), и где полипептид тяжелой цепи имеет аминокислотную последовательность, выбранную из группы, включающей: НВ12А VH (SEQ ID NO: 2) и НВ12В VH (SEQ ID NO:18).
11. Антитело по варианту осуществления изобретения 1, содержащее вариабельную область тяжелой цепи HB12B-(3-72\JH4) и вариабельную область легкой цепи НВ12В-3649.
12. Антитело по варианту осуществления изобретения 1, содержащее VH и VK, где VH включает аминокислотную последовательность SEQ ID NO: 106 и где VK включает аминокислотную последовательность SEQ ID NO: 111.
13. Нуклеиновая кислота, кодирующая полипептид, который содержит аминокислотную последовательность, выбранную из группы, включающей: SEQ ID NO: 2, 18, 34, 36, 38, 40, 42, 44, 102, 103, 104, 105, 106, 107, 108 и 109.
14. Нуклеиновая кислота, кодирующая полипептид, который содержит аминокислотную последовательность, выбранную из группы, включающей: SEQ ID NO: 4, 20, 52, 62, 64, 66, 68, 70, 110, 111, 112 и 113.
15. Вектор, содержащий нуклеиновую кислоту по варианту осуществления изобретения 13 и/или 14.
16. Выделенная клетка, содержащая вектор по варианту осуществления изобретения 15.
17. Выделенная клетка, экспрессирующая антитело по одному из вариантов осуществления изобретения 1-12.
18. Способ получения антитела, заключающийся в том, что культивируют выделенную клетку по варианту осуществления изобретения 17 в условиях, пригодных для получения антитела и выделения антитела из культуры.
19. Фармацевтическая композиция, содержащая антитело по одному из вариантов осуществления изобретения 1-12 в фармацевтически приемлемом носителе.
20. Фармацевтическая композиция по варианту осуществления изобретения 19, в которой антитело относится к человеческому изотипу IgG1, IgG2, IgG3 или IgG4.
21. Способ лечения В-клеточного злокачественного состояния у человека, заключающийся в том, что вводят человеку, который нуждается в этом, в терапевтически эффективном количестве антитело по одному из вариантов осуществления изобретения 1-12.
22. Способ лечения аутоиммунного заболевания или нарушения у человека, заключающийся в том, что вводят человеку, который нуждается в этом, в терапевтически эффективном количестве антитело по одному из вариантов осуществления изобретения 1-12.
23. Способ лечения или предупреждения гуморального отторжения у больного человека, имеющего трансплантат, заключающийся в том, что вводят человеку, который нуждается в этом, в терапевтически эффективном количестве антитело по одному из вариантов осуществления изобретения 1-12.
24. Антитело по одному из вариантов осуществления изобретения 1-12, где антитело вызывает истощение В-клеток с такой же эффективностью, что и мышиное моноклональное антитело НВ12В.
25. Антитело по одному из вариантов осуществления изобретения 1-12, где антитело индуцирует апоптоз В-клеток.
26. Антитело по одному из вариантов осуществления изобретения 1-12, где антитело содержит комплекс сшитых к N-гликозидом сахарных цепей, связанных с Fc-фрагментом, в котором фукоза не связана с N-ацетилглюкозамином на восстанавливающем конце сахарной цепи.
27. Антитело по одному из вариантов осуществления изобретения 1-12, где антитело представляет собой имеющее Fc-вариант антитело, где Fc-вариант содержит мутации, приводящие к повышенной ADCC-активности.
28. Способ истощения В-клеток у больного человека, заключающийся в том, что вводят человеку, который нуждается в этом, в терапевтически эффективном количестве антитело по одному из вариантов осуществления изобретения 24-27.
29. Антитело по одному из вариантов осуществления изобретения 1-12, где антитело представляет собой имеющее Fc-вариант антитело, где Fc-вариант имеет аффинность к Fc-рецептору FcγRIIIA по меньшей мере примерно в 5 раз ниже, чем у молекулы, с которой проводится сравнение, где Fc-вариант имеет примерно 2-кратную аффинность к Fc-рецептору FcγRIIA, по отношению к молекуле, с которой проводится сравнение.
30. Способ истощения В-клеток у больного человека, заключающийся в том, что вводят человеку, который нуждается в этом, в терапевтически эффективном количестве антитело по варианту осуществления изобретения 29.
7. Примеры
7.1. Конструирование, экспрессия и характеристики связывания гуманизированных антител к CD19
В следующих разделах описано создание и конструкция химерного варианта родительского антитела НВ12В (chHB12B), в котором мышиные константные области тяжелой цепи и легкой цепи заменены человеческой IgHγ1-и человеческой IgLK-областью соответственно. В этих разделах описаны также стратегии создания гуманизированных вариантов вариабельных областей тяжелой и легкой цепи НВ12В.
Описана также CD19-связывающая активность антител, полученных из различных комбинаций (химерных или гуманизированных) вариабельных областей тяжелой и легкой цепи. Например, гуманизированные формы НВ12В, которые обладают профилем связывания с CD19, сопоставимым с профилем chHB12B.
В приведенных ниже разделах описано несколько мутаций человеческих каркасных участков, которые при их интродукции в определенные гуманизированные антитела к CD19 приводят к связыванию с человеческим CD19, сопоставимому со связыванием референс-антитела, т.е. chHB12B, содержащего НВ12В VH и НВ12В VK. В VK эти остатки представляют собой, например, верньерные остатки F36 и Н49 и находящийся между цепями остаток F87.
7.1.1. Сборка генов и клонирующая экспрессия
Конструкции создавали с помощью основанного на ПЦР метода сборки генов, впервые описанного у Stemmer (Stemmer, W. Р. и др., Gene, 164, 1995, cc.49-53). Этот метод включает осуществление четырех стадий: синтез олигонуклеотидов; сборка генов; амплификация и клонирование генов. Синтезировали восемь генспецифических праймеров для каждого сегмента VH и VK. Репрезентативные наборы праймеров для сборки VH-области НВ12В-(3-72/JH4) и VK-области HB12B-(A10-Jk4) представлены в таблице 3; наборы праймеров для вариантов VH- и VK-областей, содержащих конкретные аминокислотные замены, создавали путем модификации нуклеотидной последовательности праймеров, кодирующей данный аминокислотный остаток. Праймеры создавали для перекрывания 15-20 нуклеотидов и лигировали с полной вариабельной областью во время циклизации в термоячейке. В случае VH дополнительный специфический для вектора праймер (универсальный VH FW в таблице 3) включали в опосредуемый ПЦР процесс сборки гена. Внешние 5'- и 3'- праймеры для VH-области включали уникальный сайт, распознаваемый рестриктазой XbaI и ApaI соответственно, для обеспечения последующих стадий клонирования. Внешние 5'- и 3'-праймеры для VK-области включали уникальный сайт, распознаваемый рестриктазой XmaI и BsiWI соответственно, для обеспечения последующих стадий клонирования. ПЦР-продукты правильного размера расщепляли рестриктазами и встраивали путем лигирования в рамке считывания в экспрессионный вектор, в котором VH-области расщепляли XbaI и ApaI, a VK-области расщепляли XmaI и BsiWI согласно инструкциям производителя. Вектор, применяемый для сборки тяжелой цепи, содержал эукариотические контролирующие транскрипцию элементы, функционально связанные с полинуклеотидом, кодирующим лидерную последовательность VH MGDNDIHFAFLSTGVHS (SEQ ID NO:83), и константную область человеческой IgHγI, в которой контролирующие транскрипцию элементы представляли собой немедленно-ранний промотор CMV и дополнительный сигнал поли-А SV40. Применение соответствующим образом созданных для сборки праймеров VH гарантировало, что полинуклеотидные последовательности, которые кодируют VH-лидера, VH-область и константную область IgHγI, сцеплены в рамке считывания с экспрессирующим вектором конечной тяжелой цепи. Вектор, применяемый для сборки легкой цепи, содержал эукариотические контролирующие транскрипцию элементы, функционально связанные с полинуклеотидом, кодирующим лидерную последовательность человеческого VKI-L12 (аминокислотная последовательность MDMRVPAQLLGLLLLWLPGAKC (SEQ ID NO:84); Bentley D. L. И Rabbitts Т. H., Nature 288,1980, cc.730-733) и константную область IgLK, в которой контролирующие транскрипцию элементы представляли собой немедленно-ранний промотор CMV и дополнительный сигнал поли-А SV40. Применение соответствующим образом созданных для сборки праймеров VK гарантировало, что полинуклеотидые последовательности, которые кодируют VK1-L12-лидера, VK-область и константную область IgLK, сцеплены в рамке считывания с экспрессирующим вектором конечной легкой цепи. Полученный в результате лигирования продукт применяли для трансформации компетентных клеток DH10B Е. coli согласно протоколам производителя. Колонии, содержащие плазмиду и вставку правильного размера, можно идентифицировать с помощью различных методов, известных в данной области (например, путем расщепления рестриктазами препарата векторной ДНК, ПЦР-амплификации векторных последовательностей). Плазмидные клоны с вставкой правильного размера секвенировали с помощью реакции дидезокси-секвенирования (например, с помощью набора BigDye® Terminator v3.0 Cycle Sequencing Ready Reaction, фирма ABI). Плазмидную ДНК получали из отобранных клонов с помощью набора QIAGEN Mini and Maxi Plasmid согласно протоколам производителя.
Пары препаратов, содержащих плазмидную ДНК экспрессионных векторов, кодирующих гуманизированную или химерную тяжелую цепь иммуноглобулина и гуманизированную или химерную легкую цепь иммуноглобулина, применяли для котрансфекции НЕК293-клеток. Эти котрансфектированные НЕК293-клетки культивировали в течение трех дней, получая содержащую антитело кондиционированную среду, в которой можно определять концентрации общего IgG и активность связывания CD19.
Концентрации общего Ig в супернатантах НЕК293-клеток оценивали с помощью анализа ELISA с иммобилизованным реагентом. Молекулу IgG иммобилизовывали на 96-луночном планшете с помощью иммобилизованного козьего специфического для человеческого IgG H+L антитела и выявляли с использованием конъюгированного с HRP антитела к человеческой легкой каппа-цепи. Для калибровки анализа применяли референс-МАт типа IgG1 неродственной специфичности.
Таблица 3. Репрезентативные наборы праймеров для сборки VH-области HB12B-(3-72/JH4) и VK-области HB12B-(A10-Jk4). Специфические для гена нуклеотиды обозначены заглавными буками, специфические для вектора нуклеотиды обозначены прописными буками. Сайты, распознаваемые рестриктазами, которые применяли для клонирования VH- и VK-фрагментов, подчеркнуты.
7.1.2. Анализ связывания с 300B4-CD19
Активность связывания с CD19 оценивали с помощью клеточного анализа ELISA с использованием рекомбинантного человеческого CD19, причем анализ осуществляли, используя эквивалентные концентрации каждого гуманизированного или химерного антитела, что облегчало непосредственное сравнение между альтернативными гуманизированными версиями антитела НВ12В и chHB12B.
Способность chHB12B и его гуманизированных вариантов связываться с hCD19 оценивали с помощью клеточного анализа связывания CD19 с использованием 300В4-клеток, экспрессирующих на клеточной поверхности рекомбинантный человеческий CD19 в качестве иммобилизованного агента. Клетки линии 300В4 культивировали согласно стандартному протоколу в среде RPMI 1640, содержащей L-глутамин и дополненной 10% фетальной телячьей сыворотки, β-меркаптоэтанолом, в присутствии 1 мг/мл G418. Можно применять стандартный протокол ELISA для клеточного анализа связывания CD19. Например, в индивидуальные лунки 96-луночного планшета с U-образным дном высевали 1×105 300В4-клеток и инкубировали в течение ночи. Клетки однократно отмывали буфером для ELISA перед инкубацией на льду с человеческими, гуманизированными или химерными антителами НВ12В. Реакции связывания осуществляли в трех повторностях для каждой оцениваемой концентрации антитела. В анализ следует включать лунки, представляющие собой отрицательный контроль, содержащих антитело соответствующего изотипа неродственной специфичности. После инкубации с антителом 300В4-клетки отмывали трижды 200 мкл буфера для ELISA. Количество химерных, гуманизированных или человеческих антител к CD19, связанных с 300В4-клетками, выявляли с помощью козьего антитела к человеческой каппа-цепи, конъюгированного с пероксидазой из хрена, согласно стандартным протоколам.
7.1.3. Конструирование, экспрессия и характеристики связывания chHB12B
Конструировали экспрессионный вектор, кодирующий тяжелую цепь chHB12B, которая содержала VH-область мышиного НВ12В и человеческие константные области IgHγ1, согласно методам, описанным в разделе 6.1. Конструировали экспрессинный вектор, кодирующий легкую цепь chHB12B, которая содержала VK-область мышиного НВ12В и человеческие константные области IgLK согласно методам, описанным в разделе 6.1.
НЕК293-клетки котрансфектировали одновременно экспрессионными векторами, кодирующими тяжелую и легкую цепи chHB12B. Указанные трансфектированные клетки культивировали в течение трех дней, давая образоваться антителам. Культуральную среду, содержащую растворимое секретируемое антитело chHB12b, собирали и определяли концентрацию антитела chHB12B согласно методу, описанному в разделе 6.1.
Связывание chHB12B с человеческим CD19 оценивали с использованием 300В4-клеток с помощью анализа ELISA, описанного в разделе 6.2. Человеческое антитело соответствующего изотипа с неродственной специфичностью включали в анализ в качестве отрицательного контроля. Результаты, полученные с помощью клеточного ELISA, продемонстрировали, что при концентрациях антитела, превышающих 100 нг/мл, обнаружено выраженное связывание химерного антитела с рекомбинантным человеческим CD19, который экспрессируется на поверхности 300В4-клеток, это свидетельствует о том, что chHB12B сохраняет активность связывания с hCD19 (фиг.2).
7.1.4. Конструирование экспрессионных векторов, кодирующих гуманизированную VH-область НВ12В
В следующих разделах описано создание гуманизированных вариантов VH-области НВ12В, которые содержат CDR-участки мышиного НВ12В и приемлемые человеческие или практически человеческие каркасные участки. В этих разделах описаны также общие стратегии создания вариантов тяжелых цепей гуманизированного НВ12В Ig.
7.1.4.1. Идентификация акцепторных каркасных участков человеческой тяжелой цепи
Компилировали базу данных аминокислотных последовательностей, содержащих каркасные остатки всех V-, D- и J- сегментов тяжелой цепи иммуноглобулина человеческой зародышевой линии. Необходимую информацию можно получать из различных источников, например, из V Base:
база данных генов человеческих антител (http://vbase.mrc-cpe.cam.ac.uk/). В базе данных запрашивали информацию о V- и J-сегментах человеческой зародышевой линии, которые обладали сходством последовательностей с соответствующими каркасными участками VH-области мышиного HB12b, в качестве имеющих решающее значение остатков, например, канонических, расположенных между цепями и верньерных остатков.
Сегменты человеческой зародышевой линии V3-72 (Tomlinson I. M. и др., J. Mol. Biol., 227, 1992, cc.776-798) и JH4 (Ravetch J. V. и др., Cell 27, 1981, cc.583-591) отбирали в качестве акцепторного каркаса для гуманизации мышиного антитела НВ12В к CD19.
7.1.4.2. Создание гуманизированных тяжелых цепей НВ12В
HB12B-(3-72/JH4) VH (SEQ ID NO:34) создавали путем объединения CDR из НВ12В VH с каркасными остатками У3-72ЛН4-сегментов человеческой зародышевой линии. Экспрессионный вектор, содержащий HB12B-(3-72/JH4) VH, создавали согласно методу, описанному в разделе 6.1.
HB12B-9m VH (SEQ ID NO:44) представляет собой вариант НВ12В-(3-72/JH4) VH, содержащий следующие девять аминокислотных замен: L20I, F27Y, Т28А, R38I, V49I, F67A, R71A, L80M, 191Y (где нумерация остатков соответствует номенклатуре Кэбота). Ген специфические праймеры для HB12B-9m создавали согласно методу, описанному в разделе 6.1. Экспрессионный вектор, содержащий HB12B-9m VH, создавали согласно методам, описанным в разделе 6.1.
7.1.5. Конструирование экспрессионных векторов, кодирующих гуманизированную легкую цепь НВ12В Ig
В следующих разделах описано создание гуманизированных вариантов VK-области НВ12В, которые содержат CDR-участки мышиного НВ12В и приемлемые человеческие или практически человеческие каркасные участки. В этих разделах описаны также стратегии создания вариантов легких цепей гуманизированного НВ12В Ig.
7.1.5.1. Идентификация акцепторных каркасных участков человеческой легкой цепи
Компилировали базу данных аминокислотных последовательностей, содержащих каркасные остатки всех V- и J- сегментов легкой цепи иммуноглобулина человеческой зародышевой линии. Необходимую информацию можно получать из различных источников, например, из V Base: база данных генов человеческих антител (http://vbase.mrc-cpe.cam.ac.uk/). В базе данных запрашивали информацию о V- и J-сегментах человеческой зародышевой линии, которые обладали сходством последовательностей с соответствующими каркасными участками VK -области мышиного НВ12В, в качестве имеющих решающее значение остатков, например, канонических, расположенных между цепями и верньерных остатков.
Сегменты человеческой зародышевой линии Vk A10 (Straubinger В. и др., Biol. Chem. Hoppe-Seyler 369, 1988, cc.601-607) и Jk4 (Hieter P. А. и др., J. Biol. Chem. 257, 1982, cc.1516-1522)) отбирали в качестве акцепторного каркаса для гуманизации мышиного антитела НВ12В к CD19.
7.1.5.2. Создание гуманизированных легких цепей НВ12В
HB12B-(A10-Jk4) VK (SEQ ID NO:52) создавали путем объединения CDR из НВ12В VK с каркасными остатками A-10/Jk4-сегментов человеческой зародышевой линии. Экспрессионный вектор, содержащий HB12B-(A10-Jk4) VK, создавали согласно методам, описанным в разделе 6.1.
НВ12В-364987 VK (SEQ ID NO:62) представляет собой вариант НВ12В-(A10-Jk4) VK, содержащий следующие три аминокислотные замены: Y40F, К53Н, Y91F (где нумерация остатков соответствует номенклатуре Кэбота). Генспецифические праймеры для НВ12В-364987 создавали согласно методам, описанным в разделе 6.1. Экспрессионный вектор, содержащий НВ12В-364987 VK, создавали согласно методам, описанным в разделе 6.1.
7.1.6. Характеристики связывания гуманизированных антител НВ12В
Препараты, содержащие пары экспрессионных векторов плазмидной ДНК, кодирующих (гуманизированные или химерные) тяжелые и легкие цепи иммуноглобулина, применяли для трансфекции НЕК293-клеток. Эти трансфектированные НЕК293-клетки культивировали в течение трех дней, получая содержащую антитело кондиционированную среду, в которой можно определять концентрации общего IgG и активность связывания CD19.
Активность связывания с человеческим CD19 химерных и гуманизированных антител НВ12В оценивали с использованием 300В4-клеток с помощью анализа ELISA, описанного в разделе 6.2. Человеческое антитело соответствующего изотипа с неродственной специфичностью включали в анализ в качестве отрицательного контроля. Как видно из фиг.2, связывание химерного антитела, содержащего тяжелую цепь chHB12B и легкую цепь chHB12B, и нового гуманизированного антитела №1, содержащего VH-область НВ12В-(3-72/JH4) и VK-область НВ12В-364987, оказалось сопоставимым. При применении антитела в концентрациях, превышающих 100 нг/мл, обнаружено выраженное связывание обоих антител с CD19, это свидетельствует о том, что гуманизированное антитело к CD19 №1, содержащее VH-область НВ12В-(3-72/JH4) и VIC-область НВ12В-364987, сохраняет активность в отношении связывания CD19. При создании изобретения неожиданно было установлено, что гуманизированные антитела, содержащие VH-область НВ12В-9 т, характеризуются заметным снижением активности в отношении CD19 по сравнению с контрольным антителом chHB12B.
Оценивали пары химерных или гуманизированных тяжелых и легких цепей НВ12В, и их активность связывания с человеческим CD19 обобщена в таблице 4.
| Таблица 4 | |||
| Связывание с CD19 химерных и гуманизированных антител НВ12В. CD19-связывающую активность различных химерных и гуманизированных антител НВ12В оценивали с помощью клеточного анализа ELISA. Комбинации VH-VK, для которых характерна выраженная активность связывания обозначены «++». Комбинации VH-VK, для которых не обнаружено заметное связывание с человеческим CD19, обозначены «-» | |||
| chHB12B VH | НВ12В-(3-72/JH4)VH | НВ12В-9m VH | |
| ChHB12B VK | ++ | ++ | - |
| HB12B-(A10-Jk4) VK | |||
| НВ12В-364987 VK | ++ | ++ | - |
7.1.7. Конструирование, экспрессия и характеристики связывания НВ12В с гуманизированными легкими цепями
При осуществлении протоколов гуманизации антител, как правило, пытаются ограничивать количество нечеловеческих каркасных участков с целью минимизации НАМА-ответа. Таким образом, создавали дополнительные варианты гуманизированных НВ12В VK и оценивали их активность связывания chCD19.
НВ12В-3649 VK (SEQ ID NO:68) представляет собой вариант НВ12В-(А10-Jk4) VK, содержащий две следующие аминокислотные замены: Y40F, К53Н (где нумерация остатков соответствует номенклатуре Кэбота). Экспрессионный вектор, содержащий НВ12В-3649 VK, создавали путем сайтнаправленного мутагенеза, используя набор QuickChange (фирма Stratagene, Ла-Джолла, шт.Калифорния) на препарате ДНК экспрессионного вектора, содержащего НВ12В-364987 VK, согласно инструкции производителя.
НВ12В-3687 VK (SEQ ID NO:74) представляет собой вариант НВ12В-(А10-Jk4) VK, содержащий две следующие аминокислотные замены: Y40F и Y91F (где нумерация остатков соответствует номенклатуре Кэбота). Экспрессионный вектор, содержащий НВ12В-3687 VK, создавали путем сайтнаправленного мутагенеза, используя набор QuickChange (фирма Stratagene, Ла-Джолла, шт.Калифорния) на препарате ДНК экспрессионного вектора, содержащего НВ12В-364987 VK, согласно инструкции производителя.
НВ12В-4987 VK (SEQ ID NO:76) представляет собой вариант НВ12В-(А10-Jk4) VK, содержащий две аминокислотные замены: К53Н и Y91F (где нумерация остатков соответствует номенклатуре Кэбота). Экспрессионный вектор, содержащий НВ12В-4987 VK, создавали путем сайтнаправленного мутагенеза, используя набор QuickChange (фирма Stratagene, Ла-Джолла, шт.Калифорния) на препарате ДНК экспрессионного вектора, содержащего НВ12В-364987 VK, согласно инструкции производителя.
НВ12В-36 VK (SEQ ID NO:70) представляет собой вариант НВ12В-(А10-Jk4) VK, содержащий следующую аминокислотную кислотную замену: Y40F (где нумерация остатков соответствует номенклатуре Кэбота). Экспрессионный вектор, содержащий НВ12В-36 VK, создавали путем сайтнаправленного мутагенеза, используя набор QuickChange (фирма Stratagene, Ла-Джолла, шт. Калифорния) на препарате ДНК экспрессионного вектора, содержащего НВ12В-(A10-Jk4), согласно инструкции производителя.
НВ12В-49 VK (SEQ ID NO:80) представляет собой вариант НВ12В-(А10-Jk4) VK, содержащий следующую аминокислотную замену: К53Н (где нумерация остатков соответствует номенклатуре Кэбота) Экспрессионный вектор, содержащий НВ12В-49 VK, создавали путем сайтнаправленного мутагенеза, используя набор QuickChange (фирма Stratagene, Ла-Джолла, шт.Калифорния) на препарате ДНК экспрессионного вектора, содержащего НВ12В-(A10-Jk4) VK, согласно инструкции производителя.
НВ12В-87 VK (SEQ ID NO:78) представляет собой вариант ofHB12B-(A10-Jk4) VK, содержащий следующую аминокислотную замену: Y91F (где нумерация остатков соответствует номенклатуре Кэбота).Экспрессионный вектор, содержащий НВ12В-87 VK, создавали путем сайтнаправленного мутагенеза, используя набор QuickChange (фирма Stratagene, Ла-Джолла, шт.Калифорния) на препарате ДНК экспрессионного вектора, содержащего НВ12В-(A10-Jk4) VK, согласно инструкции производителя.
Препараты, содержащие пары экспрессионных векторов плазмидной ДНК, кодирующих тяжелую цепь, которая содержит HB12B-(3-72/JH4) VH, и каждый из вариантов VK, описанных в разделе 6.1.7., применяли для котрансфекции НЕК293-клеток. Эти котрансфектированные НЕК293-клетки культивировали в течение трех дней, получая содержащую антитело кондиционированную среду, в которой можно определять концентрации общего IgG и активность связывания hCD19.
Активность связывания с человеческим CD19 гуманизированных антител НВ12В оценивали, используя 300В4-клетки с помощью анализа ELISA, описанного в разделе 6.1.2. chHB12B включали в анализ в качестве положительного контроля. Как видно из фиг.3, связывание антитела chHB12B, содержащего chHB12B VH и chHB12B VK, и нового гуманизированного антитела НВ12В №2, которое содержит HB12B-(3-72/JH4) VH и НВ12В-3649 VK, оказалось сопоставимым. При использовании концентраций антитела, превышающих 100 нг/мл, обнаружено выраженное специфическое связывание обоих антител с hCD19, это свидетельствует о том, что гуманизированное антитело, содержащее HB12B-(3-72/JH4) VH и НВ12В-3649 VK, сохранило активность связывания hCD19. Гуманизированное антитело НВ12В №1, содержащее НВ12В-364987 VK, также обладало способностью связывать человеческий CD19. Гуманизированное антитело НВ12В №3, содержащее НВ12В-36 VK, обладало существенно более низкой способностью связывать hCD19 по сравнению со связыванием контрольного антитела chHB12B.
В совокупности эти данные свидетельствуют о том, что был создан ряд гуманизированных версий VH- и VK-цепей НВ12В, которые сохраняли способность к связыванию, характерную для родительского мышиного антитела, выведенного из гибридомы НВ12В.
7.2. In vitro ADCC-активность гуманизированных антител к CD19
В представленных ниже разделах приведены характеристики in vitro ADCC-активности гуманизированных антител к CD19.
7.2.1. Препараты гуманизированных антител к CD19
Очищенное гуманизированное антитело к CD19 №2, содержащее НВ12В-(3-72/JH4) VH, HB12B-3649 VK и константную область тяжелой цепи IgG1 (обозначено далее в контексте настоящего описания как «антитело 3649» или «3649»), получали с помощью стандартных методов. В целом, метод состоял в следующем: препарат содержащего плазмидную ДНК экспрессионного вектора, кодирующего тяжелую и легкую цепи 3649, применяли для трансфекции НЕК293Р-клеток. Трансфектированные клетки подпитывали в дни 3 и 6 и содержащую антитело кондиционированную среду собирали в день 9. Антитело очищали из кондиционированной среды с помощью заранее подготовленной колонки с протеином А (фирма GE Healthcare). Антитело элюировали из колонки с помощью буфера с низким значением рН, нейтрализовали и осуществляли диализ в противотоке ЗФР. Рассчитывали концентрацию очищенного антитела по оптической плотности раствора при 280 нм.
Экспрессионный вектор для антитела, который кодирует Fc-вариант 3649, содержащий аминокислотные замены S239D, A330L и I332E (обозначен далее в контексте настоящего описания как «3649-3М»), создавали с помощью методов, описанных в US 2004/0132101 и US 2005/0054832, оба на имя Lazar и др. В целом, метод состоял в следующем: экспрессионный вектор для антитела, кодирующий 3649, модифицировали с помощью набора для сайтнаправленного мутагенеза (например, QuickChange (фирма Promega)) путем интродукции необходимых замен нуклеотидных остатков в полинуклеотидную последовательность, кодирующую константную область тяжелой цепи, создавая экспрессионный вектор для антитела 3649-3М. Очищенное антитело 3649-3М создавали путем трансфекции НЕК239Р-клеток экспрессионным вектором для 3649-3М. Трансфектированные клетки подпитывали в дни 3 и 6 и содержащую антитело кондиционированную среду собирали в день 9. Антитело очищали из кондиционированной среды с помощью заранее подготовленной колонки с протеином А (фирма GE Healthcare). Антитело элюировали из колонки с помощью буфера с низким значением рН, нейтрализовали и осуществляли диализ в противотоке ЗФР. Рассчитывали концентрацию очищенного антитела по оптической плотности раствора при 280 нм.
Экспрессионный вектор для антитела, который кодирует Ре-вариант 3649, содержащий аминокислотные замены L234F, L235E и P331S (обозначен далее в контексте настоящего описания как «3649-ТМ»), создавали с помощью методов, описанных в US 2004/0132101 и US 2005/0054832, оба на имя Lazar и др., каждый из которых полностью включен в настоящее описание в качестве ссылки. В целом, метод состоял в следующем: экспрессионный вектор для антитела, кодирующий 3649, модифицировали с помощью набора для сайтнаправленного мутагенеза (например, QuickChange (фирма Promega)) путем интродукции необходимых замен нуклеотидных остатков в полинуклеотидную последовательность, кодирующую константную область тяжелой цепи, создавая экспрессионный вектор для антитела 3649-ТМ. Очищенное антитело 3649-ТМ создавали путем трансфекции НЕК239Р-клеток экспрессионным вектором для 3649-ТМ. Трансфектированные клетки подпитывали в дни 3 и 6 и содержащую антитело кондиционированную среду собирали в день 9. Антитело очищали из кондиционированной среды с помощью заранее подготовленной колонки с протеином А (фирма GE Healthcare). Антитело элюировали из колонки с помощью буфера с низким значением рН, нейтрализовали и осуществляли диализ в противотоке ЗФР. Рассчитывали концентрацию очищенного антитела по оптической плотности раствора при 280 нм.
Композицию антител 3649 (обозначенную далее к контексте настоящего описания как 3649-aFuc), которая содержала множество антител, которые несут комплекс сцепленных с N-гликозидом сахарных цепей, связанных с остатком Asn297 Fc-фрагмента, в котором фукоза не связана с N-ацетилглюкозамином на восстанавливающем конце молекулы, получали согласно методам, описанным в US 6946292 на имя Kanda и др., который полностью включен в настоящее описание в качестве ссылки. В целом, метод состоял в следующем: СНО-клетки с «выключенной» фукозилтрансферазой трансфектировали препаратом содержащего плазмидную ДНК экспрессионного вектора, кодирующего тяжелую и легкую цепи 3649. Трансфектированные клетки подпитывали в дни 3 и 6 и содержащую антитело кондиционированную среду собирали в день 9. Антитело очищали из кондиционированной среды с помощью заранее подготовленной колонки с протеином А (фирма GE Healthcare). Антитело элюировали из колонки с помощью буфера с низким значением рН, нейтрализовали и осуществляли диализ в противотоке ЗФР. Рассчитывали концентрацию очищенного антитела из раствор с оптической плотностью 280 нм.
Препараты антител практически не имели загрязняющих белков, что продемонстрировано на фиг.4. Аффинность к связыванию с антигеном 3649-aFuc сопоставима с аффинностью 3649, что видно из фиг.5.
7.2.2. In vitro анализ АРСС
Анализ CytoTox 96® для нерадиоактивной оценки цитотоксичности (фирма Promega) представляет собой колориметрический анализ, являющийся альтернативной анализов цитотоксичности на основе высвобождения 51Cr. Анализ CytoTox 96® позволяет осуществлять количественное измерение лактатдегидрогеназы (LDH), стабильного цитозольного фермента, который высвобождается при клеточном лизисе. Уровень высвободившейся LDH в супернатантах культур оценивали с помощью 30-минутного сцепленного ферментативного анализа, основной которого является оценка превращения соли тетразолия (INT) в красный формазановый продукт.Интенсивность полученной окраски пропорциональна количеству лизированных клеток.
Анализы осуществляли согласно руководствам производителя. В целом, метод состоял в следующем: клетки-мишени отмывали ЗФР, ресуспендировали в среде RPMI-5, свободной от фенола, при клеточной плотности 0,4×106/мл. Эффекторные NK-клетки промывали однократно ЗФР и ресуспендировали в среде RPMI-5, свободной от фенола, при клеточной плотности 1×106/мл. Анализы осуществляли в 96-луночных планшетах с U-образным дном. В каждом анализе использовали комбинацию экспериментальных и контрольных лунок. Экспериментальные лунки заполняли смесью, содержащей 50 мкл соответствующего разведения антитела, 50 мкл суспензии клеток-мишеней и 50 мкл суспензии эффекторных клеток. Применение указанной выше клеточной плотности приводило к тому, что соотношение клеток мишеней и клеток эффекторов составляло 1:2,5; маточный раствор эффекторных клеток можно дополнительно разводить или концентрировать, если требуются различные соотношения мишеней и эффекторов. Применяли несколько различных типов контрольных лунок для определения (I) спонтанного высвобождения LDH из клеток-мишеней (спонтанное высвобождение из мишени (Target Spontaneous)), (II) спонтанного высвобождения LDH из эффекторных клеток (спонтанное высвобождение из эффектора (Effector Spontaneous), (III) максимальное высвобождение LDH из клеток-мишеней (максимальное высвобождение из мишени (Target Maximum)) и (IV) присутствия загрязнителей в культуральной среде (фон. Background). Все лунки в 96-луночном планшете содержали один и тот же конечный объем. Реакции проводили в трех повторностях. После их заполнения планшеты вращали при 120×g в течение 3 мин до получения клеточного дебриса. Планшет инкубировали при 37°С/5% CO2 в течение 4 ч. За 45 мин до конца инкубации по 15 мкл полученного от производителя буфера для лизиса добавляли в контрольные лунки для определения максимального высвобождения из клеток-мишеней («Target Cell Maximum Release Control»). После инкубации планшет центрифугировали при 120xg в течение 4 мин. По 50 мкл супернатанта из каждой лунки переносили в новый плоскодонный 96-луночный планшет. Добавляли по 50 мкл восстановленной субстратной смеси (составленной из предоставленных производителем компонентов) и планшет инкубировали при комнатной температуре 10-20 мин, защищая от света. Добавляли по 50 мкл стоп-буфера, полученного от производителя, и определяли абсорбцию при 490 или 492 нм с помощью планшет-ридера. Процент цитотоксичности рассчитывали по формуле («Experimental» - «Effector spontaneous» - «Target Spontaneous») / («Target Maximum» - «Target Spontaneous»). Перед расчетом % цитотоксичности все значения снижали, вычитая фон.
Антитело 3649 эффективно вызывало рекрутмент эффекторных клеток под влиянием экспрессирующих человеческий CD20 клеток-мишеней при анализе ADCC. ADCC-активность афукозилированной формы (3649-aFuc) являлась даже более сильно. Fc-варианты с повышенной (3649-3М) или пониженной (3649-ТМ) аффинностью в отношении Fcγ-рецепторов, как и ожидалось, обладали повышенной или пониженной соответственно ADCC-активностью. ADCC-активность обнаружена при использовании как иммортализованных, так и свежевыделенных человеческих клеток-мишеней. Репрезентативный образец экспериментальных данных, подтверждающих это утверждение, представлен на фиг.5-9.
7.2.3. На опосредуемую антителом к CD19 in vitro ADCC-активность влияет аффинность Fc-фрагмента к рецептору FcγRIIIA
Относительную аффинность к связыванию различных препаратов гуманизированных антител к CD19 с человеческим рецептором FcγRIII (CD 16) можно определять с помощью анализа ELISA. Титрационные микропланшеты сенсибилизировали 50 мкл препарата антитела (50 мкг/мл) при 4°С в течение ночи. Любые оставшиеся сайты связывания блокировали 4%-ным обезжиренным молоком в ЗФР-буфере (блокирующий буфер) в течение 1 ч при 37°С. После отмывки лунок по 50 мкл серийно разведенного мономерного белка FcγRIIIA-flag добавляли в каждую лунку и инкубировали в течение 60 мин при 37°С. По 50 мкл 2,5 мкг/мл комплекса анти-flag-МЕ-биотин (фирма Sigma) добавляли к каждую лунку и инкубировали в течение 30 мин при 37°С. Лунки отмывали между инкубациямии с помощью каждого из следующих реагентов. По 50 мкл 0,1 мкг/мл авидина, конъюгированного с HRP (фирма PIERCE), добавляли в каждую лунку и инкубировали в течение 30 мин при 37°С. Обнаружение осуществляли добавляя 30 мкл тетраметилбензидина (ТМВ) в качестве субстрата (фирма Pierce) с последующей нейтрализацией с помощью 30 мкл 0,2М H2S04. Абсорбцию определяли при 450 нм.
Как видно из фиг.15, аффинность к связыванию обладающего повышенной ADCC-активностью Fc-варианта антитела 3649 (3649-3М) и афукозилированного антитела 3649 (3649-aFuc) с FcgRIIIA оказалась выше, по сравнению с фукозилированным антителом 3649 дикого типа. Эксперимент осуществляли с использованием белка FcγRIIIA-flag, который содержал внеклеточный домен высокоаффинной изоформы VI 5 8 человеческого FcγRIIIA.
На взаимодействие Fc-рецептор - Fc-фрагмент и в результате на эффекторную функцию антитела оказывали также воздействие аллельные вариации в Fc-рецепторе. Воздействие высоаффинных и низкоффинных рецепторов FcγRIIIA на ADCC можно изучать также, осуществляя ADCC-реакции с использованием свежевыделенных эффекторных NK-клеток, содержащих различные аллелльные варианты рецепторов. На фиг.16 обобщены результаты указанного эксперимента. ADCC-реакции осуществляли согласно описанному выше методу с использованием клеток Дауди в качестве клеток-мишеней. Оценивали и фукозилированное (3649), и афукозилированное (3649-aFuc) антитело к CD19 №2. Контрольные реакции осуществляли с использованием антитела к CD20. Эффекторные NK-клетки выделяли из здорового донора стандартными протоколами. Генотип NK-клеток можно определять используя специфические для аллелей ПЦР (см. Leppers-van de Straat и др., J Immunol Methods 242(1-2), 2000, cc.127-132). На фиг.16 А и Б показано, что все три изученных антитела обладали ADCC-активностью в применяемых реакционных условиях. ADCC-активность определяли с использованием либо линии NK-клеток (А) или свежевыделенных NK-клеток (Б) в качестве эффекторов. NK-клетки, которые содержали по меньшей мере одну копию высокоаффинной изоформы FcγRIIIA-рецептора (генотипы V158/V158 и V158/F158), оказались более эффективными эффекторными клетками по сравнению с NK-клетками, гомозиготными по аллелям низкоаффинной формы рецептора (генотип F158/F158) (фиг.16 В-Д). Отсутствие фукозилирования повышало ADCC-активность антитела вне зависимости от генотипа FcγRIIIA эффекторных клеток. Обнаруженная ADCC-активность, зависимая от фукозилированного антитела (3649), опосредуемая V158/V158- или V158/F158-NK-клетками (В,Г), сопоставима с ADCC-активностью, зависимой от афукозилированного антитела (3649-aFuc), опосредуемой F158/F158-NK-клетками (Д).
7.3. Антитела и иммунофлуоресцентные анализы
Антитела к CD19, описанные выше, которые связываются с человеческим антигеном CD19, можно применять в описанных ниже подходах. Другие антитела, которые можно применять в описанных ниже экспериментах, представляют собой моноклональные мышиные антитела к CD22, которые связываются с мышиным CD22, например HIB22 (Abeam; Dorken В и др., J Immunol, 136, 1986, cc.4470-4479); моноклональные мышиные, специфические для CD20 антитела (Uchida и др., Intl. Immunol., 16, 2004, cc.119-129); антитело к В220 RA3-6B2 (фирма DNAX Corp., Пало-Альто, шт.Калифорния); и антитела к CD5, CD43 и CD25 (фирма BD PHARMINGEN™, Франклин-Лейке, шт.Нью-Джерси). Изотипспецифические и мышиные антитела типа Ig или IgM можно получать от фирмы Southern Biotechnology Associates, Inc. (Бирмингем, шт.Алабама).
Восемь линий мышиных пре-В-клеток, трансфектированных кДНК hCD19, которые можно создавать с помощью методов и материалов, известных в данной области (см., например Alt и др., Cell, 27, 1981, cc.381-388 и Tedder и Isaacs, J. Immunol., 143, 1989, cc.712-717), или суспензию индивидуальных лейкоцитов окрашивали на льду, используя предварительно определенные оптимальные концентрации каждого флуоресцентномеченного антитела, в течение 20-30 мин согласно принятым методам (Zhou и др., Mol. Cell. Biol., 14, 1994, cc.3884-3894). Клетки, обладающие характерным для лейкоцитов рассеянием света в направлении его распространения и в боковом направлении, затем можно анализировать с помощью проточных цитометров FACCSCAN® или FACSCALIBUR® (фирма Becton Dickinson, Сан-Хосе, шт.Калифорния). Фоновое окрашивание можно определять с помощью нереактивных контрольных антител (CALTAG™ Laboratories, Берлингейм, шт.Калифорния) с такой установкой дискриминационного окна, чтобы исключать нежизнеспособные клетки. Для каждого оцениваемого образца анализировали по 10000 клеток, обладающих характерным для мононуклеарных клеток рассеянием света в направлении его распространения и в боковом направлении, при возможности, при этом интенсивности флуоресценции представлены на четырехдекадной логарифмической шкале.
Мыши. Трансгенных мышей, экспрессирующих hCD19, и их детенышей дикого типа (WT) можно получать согласно методам, известным в данной области (Zhou и др., Mol. Cell. Biol., 14, 1994, cc.3884-3894). Например, мышей линии hCD19tg можно создавать из исходных LCD19-прародителей (например, C57BL/6 × B6/SJL), а затем скрещивать с основной линией C57BL/6 в течение по меньшей мере 7 поколений. После осуществления обратных скрещиваний в течение нескольких поколений можно получать мышей, у которых на поверхности В-происходит высокий уровень экспрессии (создающий высокую плотность) человеческого CD19, примерно с такой же плотностью, которая обнаружена на человеческих В-клетках.
Линию мышей с дефицитом FcR (Fc-рецептора) общих у-цепей (FcRγ) (FcRγ-/-, B6.129P2-Fcerg1tml) можно получать от фирмы Taconic Farms (Германтаун, шт.Нью-Йорк) и ее можно применять для создания линий hCD19 FcRγ-/- и WT-детенышей. Мыши, гемизиготные по трансгену с-Мус (Eµ-cMycTG, C57B1/6J-TgN(IghMyc); фирма The Jackson Laboratory, Бар-Харбор, шт.Мэн) описаны в данной области (Harris и др., J. Exp.Med., 167, 1988, с.353 и Adams и др., Nature, 318, 1985, с.533)). Мыши линии c-MycTG (основная линия В6/129) можно скрещивать с мышами линии hCD19tg с получением гемизиготного потомства hCD19tg cMycTG+/-, которое можно идентифицировать с помощью ПЦР-скрининга. Мышей линии Rag1-/- (В6.129S7-Rag1tm1Mom/J) можно получать от фирмы The Jackson Laboratory. Мышей с дефицитом макрофагов можно создавать путем инъекций капсулированного в липосомы клодроната (0,1 мл/10 г веса тела; фирма Sigma Chemical Co., Сент-Луис, шт.Миссури) в хвост мышей линии C57BL/6 в день -2, 1 и 4 согласно стандартным методам (Van Rooijen и Sanders, J. Immunol. Methods, 174, 1994, cc.83-93). Всех мышей следует содержать в специальных обеспечивающих барьер для патогенов устройствах и первоначально применять для опытов в возрасте 6-9 недель.
ELISA. Концентрации сывороточного Ig определяли с помощью ELISA, используя очищенные на основе аффинности мышиные IgM, IgG1, IgG2a, IgG2b, IgG3 и IgA (фирма Southern Biotechnology Associates, Inc., Бирмингем, шт.Алабама), получая стандартные кривые согласно описанному методу (Engel и др., Immunity, 3, 1995, с.39). Уровни сывороточных аутоантител IgM и IgG против dsДHK, ssДHK и гистона определяли с помощью ELISA, используя сенсибилизированные двухцепочечной (ds) ДНК из тимуса телят (фирма Sigma-Aldrich, Сент-Луис, шт.Миссури), полученной после кипячения тимуса телят ДНК (которая содержит одноцепочечную (ss) ДНК), или гистоном (фирма Sigma-Aldrich) титрационные микропланшеты согласно описанному методу (Sato и др., J. Immunol., 157, 1996, с.4371).
Иммунотерапия. Стерильные антитела к CD19 и не реактивные применяемые для контроля изотипа антитела (0,5-250 мкг) в 200 мкл забуференного фосфатом физиологического раствора (ЗФР) инъецировали через латеральные хвостовые вены. Например, в экспериментах можно применять фиксированное количество (например 250 мкг) антитела. Количество лейкоцитов в крови определяли с помощью гемоцитометра после лизиса эритроцитов, частоту встречаемости (B220+)-B-клеток определяли с помощью анализа иммунофлуоресцентного окрашивания на основе проточной цитометрии. Для сравнения доз антител в организме человека и мыши можно применять калькулятор типа Oncology Tool Dose Calculator (www.fda.gov/cder/cancer/animalframe.htm).
Иммунизации. Двухмесячных WT-мышей иммунизировали i.p. с помощью 50 мкг конъюгированного с 2,4,6-тринитрофенилом (TNP) липополисахарида (LPS) (фирма Sigma, Сент-Луис, шт.Миссури) или 25 мкг конъюгированного с 2,4-диитрофенолом (DNP)-FICOLL® (фирма Biosearch Technologies, Сант-Рафаэль, шт.Калифорния) в физиологическом растворе. Мышей иммунизировали также путем i.p.инъекции 100 мкг конъюгированного с DNP гемоцианина лимфы улитки (DNP-KLH, фирма CALBIOCHEM -NOVABIOCHEM® Corp., Ла-Джолла, шт.Калифорния) в полном адъюванте Фрейнда и подвергали повторной иммунизации через 21 день DNP-KLH в неполном адъюванте Фрейнда. У мышей брали образцы крови до и после иммунизации согласно принятому протоколу. Титры специфических в отношении DNP или TNP антител в индивидуальных образцах сыворотки оценивали в двух повторностях, используя предназначенные для ELISA планшеты, сенсибилизированные DNP-БСА (фирма CALBIOCHEM®-NOVABIOCHEM® Corp., Ла-Джолла, шт.Калифорния) или сенсибилизированные TNP-БСА (фирма Biosearch Technologies, Сан-Рафаэль, шт.Калифорния), согласно стандартным методам (Engel и др., Immunity, 3, 1995, cc.39-50). Сыворотку из иммунизированных TNP-LPS мышей разводили в соотношении 1:400, а сыворотку из иммунизированных DNP-FICOLL и DNP-БСА мышей разводили в соотношении 1:1000 для осуществления анализа ELISA.
Статистический анализ. Все данные представлены в виде средних значений ±СКО, при этом t-критерий Стьюдента применяли для определения достоверности различий между полученными для образцов средними значениями.
7.4. Экспрессия человеческого CD19 в трансгенных мышах
Трансгенных мышей линии hCD19tg, для создания которых можно применять метод, представленный в настоящем описании, или других трансгенных животных, экспрессирующих человеческий CD19, можно применять для оценки различных терапевтических схем, включающих антитела к CD19, например, отличающихся вводимыми концентрациями, количеством и временем введения. Эффективность в отношении больных людей различных терапевтических схем можно прогнозировать на основе двух описанных ниже показателей, т.е. В-клеточного истощения в определенных жидкостях организма и/или тканях и способности моноклонального человеческого или гуманизированного антитела к CD19 связываться с В-клетками. В конкретных вариантах осуществления изобретения лечебные схемы, эффективные в отношении несущих человеческий CD19 трансгенных мышей, можно применять в композициях и способах, предлагаемых в изобретении, для лечения у человека В-клеточных нарушений и заболеваний, включая, но не ограничиваясь только ими, В-клеточные злокачественные состояния и аутоиммунные заболевания или нарушения.
Для определения того, происходит ли экспрессия человеческого CD19 на В-клетках трансгенных мышей (hCD19tg), которые экспрессируют трансген человеческого CD19, В-клетки следует экстрагировать из спинного мозга, крови, селезенки и перитонеального лаважа этих мышей. Экспрессию человеческого CD19 и мышиного CD19 можно оценивать в этих клетках, приводя эти клетки в контакт с антителами к CD19, которые специфически связываются с человеческим CD19 или мышиным CD19 (mCD19). Связывание антитела с линией В-клеток можно оценивать, используя иммунофлуоресцентное окрашивание двумя красителя с помощью проточной цитометрии. Относительные уровни экспрессии mCD19 и hCD19 можно оценивать, определяя среднюю интенсивность флуоресценции (антитела к hCD19 в случае hCD19 и антитела к mCD19 в случае mCD19) соответственно.
Уровни экспрессии трансгенов человеческих CD19 и человеческих CD20 определяли в целом согласно описанным выше методам. Выделяли находящиеся в кровотоке лимфоциты из мышей линий С57 В16 hCD19 tg +/-, С57 В16 hCD19 tg +/+, Balb/c hCD20 tg +/- и мышей дикого типа Balb/c с помощью стандартных процедур. Животных содержали в свободном от патогенов устройстве. Возраст и количество используемых животных каждого фенотипа приведены на фиг.10. Выделенные клетки окрашивали конъюгированным с PerCP Cy5.5 антителом к мышиному CD19 (клон 1D3, фирма BD Biosciences), конъюгированным с РЕ антителом к CD3 (например, клон 17А2, фирма BD Biosciences), конъюгированным с Alexa Fluor® 488 антителом к человеческому CD19 (клон HIB19, фирма BD Biosciences) и конъюгированным с Alexa Fluor® 647 антителом к человеческому CD20 (например, клон 2Н7, фирма AbD serotec). Иммуноокрашенные клетки анализировали с помощью проточного цитометра. В-клеточную популяцию определяли как позитивную по антителам к мышиному CD19 (анти-мышиный CD19+), негативную по антителам к CD3 (анти-CDS-) популяцию клеток. Данные о средней интенсивности флуоресценции (антимышиный CD19+, анти-CD3-)-клеток в hCD19- и hCD20-каналах представлены на фиг.10А. Экспрессия человеческого CD19, как и ожидалась, обнаружена только на (hCD19-)-трансгенных клетках. Экспрессия hCD19 зависела от дозы; уровень окрашивания на (tg+/+)-В-клетках примерно в 2 раза превышал уровень окрашивания, обнаруженный на (tg+/-)-В-клетках. Уровень экспрессии hCD19 оказался стабильным по всех изученных возрастных группах.
Процентное содержание В-клеток в находящихся в кровотоке лимфоцитах рассчитывали для всех образцов. Для целей расчета В-клетки определяли как (антимышиный CD19+, анти-CD3-)-клетки. Результаты представлены на фиг.10Б. Животные, несущие hCD19-rpaHcreH, имели пониженное количество В-клеток среди находящихся в кровотоке лимфоцитов. Снижение количества В-клеток оказалось более выраженным у животных линии hCD19 tg +/+. Эти результаты согласуются с ранее опубликованным данными (Zhou и др., Мо1. Cell. Biol., 14, 1994, cc.3884-3894).
7.5. Опосредуемое антителом к CD19 истощение В-клеток in vivo
Антитела к CD19, предлагаемые в изобретении, которые связываются с человеческим CD19, можно оценивать в отношении их способности истощать В-клетки в крови, селезенке и лимфатических узлах мышей линии hCD19tg in vivo. Например, каждое антитело можно вводить мышам из расчета либо 250, либо 50 мкг/мышь в виде однократной дозы, которая примерно в 10-50 раз ниже, чем доза 375 мг/м2, которую первоначально вводят четыре раза при основанной на использовании антитела к CD20 терапии человека (Maloney и др., J. Clin. Oncol., 15, 1997, cc.3266-3274 и McLaughlin и др., Clinic status and optimal use of rituximab В cell lymphomas. Oncology (изд-во Williston Park), 12, 1998, cc.1763-1769). Элиминацию В-клеток из крови, селезенки и лимфатических узлов мышей линии hCD19tg можно определять путем иммунофлуоресцентного окрашивания с помощью проточной цитометрии. Результаты, полученные с использованием антител к CD19, для которых идентифицирована способность вызывать В-клеточное истощение, можно рассматривать как коррелирующие с применением на человеке, и антитела, имеющие свойства идентифицированных антител, можно применять в композициях и способах, предлагаемых в изобретении, для лечения у человека В-клеточных нарушений и заболевания, включая, но не ограничиваясь только ими, В-клеточные злокачественные состояния и аутоиммунные заболевания или нарушения.
Гуманизированное антитело к CD19 3649 тестировали в отношении В-клеточного истощения с помощью анализа, практически соответствующего описанному выше. Мышам линий С57 В16 hCD19 tg +/- и С57 В16 hCD19 tg +/+ вводили однократную i.v.-дозу, составляющую 50 или 250 мкг антитела 3649. Использовали две контрольные группы. Животным в первой группе вводили 50 или 250 мкг антитела R347 неродственной специфичности; животным второй группы вводили 50 или 250 мкг Fc-варианта 3649-ТМ с пониженной ADCC-активностью (см. фиг.6). Количество животных в каждой группе указано на фиг.11 и 12. Животных содержали в свободных от патогенов устройствах. Через 7 дней после обработки выделяли мононуклеарные клетки из кровотока и селезенки. Выделенные клетки окрашивали конъюгированным с PerCP Cy5.5 антителом к мышиному CD19 (клон 1D3, фирма BD Biosciences) и конъюгированным с Арс-Cy5,5 антителом к мышиному В220 (клон RA3-6B2, фирма Invitrogen). Иммуноокрашенные образцы анализировали с помощью проточного цитометра. Для целей эксперимента В-клетки определяли как позитивные по антителам к мышиному CD19 (антимышиный CD19+)-KneTKH и позитивные по антителам к мышиному В220 (антимышиный В220+)-клетки. Данные о процентном содержании В-клеток относительно находящихся в кровотоке лимфоцитов представлены на фиг.11. Данные о процентном и абсолютном количестве В-клеток относительно клеток селезенки представлены на фиг.12. Оказалось, что однократной дозы 50 мг антитела к CD19 3649 достаточно для достижения существенного истощения находящихся в кровотоке и в селезенке В-клеток. На уровень истощения влияла доза антитела и поверхностная плотность hCD19. Истощение было практически полным у животных линии hCD19 tg +/+, которым вводили 250 мкг антитела. Истощение в большей степени затрагивало лимфоциты, находящиеся в кровотоке, чем лимфоциты, находящиеся в селезенке, во всех изученных группах животных.
Другой опыт осуществляли также для определения способности различных препаратов антитела к CD19 3649 вызывать истощение В-клеточных популяций в кровотоке, селезенке, брюшной полости и костном мозге у животных линии hCD19 tg +/-. Эксперимент осуществляли следующим образом: подобранным по полу мышам линии С57 В16 hCD19 tg +/- возрастом 3-4 месяца инъецировали через латеральные хвостовые вены стерильные свободные от эндотоксинов препараты антител к CD19, разведенные в ЗФР, из расчета 10, 50 или 250 мкг на мышь. Были изучены следующие антитела к CD19: фукозилированное антитело к CD19 №2 (3649), афукозилированное антитело к CD19 №2 (3649-aFuc), Fc-вариант антитела к CD19 №2 (3649-3М) с усиленной способностью вызывать ADCC и Fc-вариант антитела к CD19 №2 (3649-ТМ) с пониженной способностью вызывать ADCC. Группе контрольных животных инъецировали контрольное антитело соответствующего изотипа с неродственной специфичностью (R347). Через 7 дней после инъекции мышей умерщвляли и собирали клетки из крови, селезенки, костного мозга и брюшной полости. Эритроциты лизировали согласно стандартным протоколам и общее количество жизнеспособных клеток подсчитывали с помощью автоматического устройства для подсчета клеток Via-Cell. Суспензии выделенных индивидуальных клеток подвергали иммуноокрашиванию и анализировали с помощью проточного цитометра согласно стандартным протоколам. Антитела, которые применяли для иммуноокрашивания, представлены в таблице 5. Результаты оценки истощения обобщены в таблицах 6-21. Результаты по истощению, полученные с использованием афукозилированного антитела к CD19 №2 (3649-aFuc), представлены на фиг.28. Данные о фенотипе NK-клеточной активации животных, обработанных афукозилированным или фукозилированным антителом к CD19 №2 (3649-aFuc или 3649 соответственно), представлены на фиг.29. В процессе анализа применяли следующие характеристики В-клеточной субпопуляции:
| Кровь: | В-клетки: В220+, мышиный CD19+ |
| Селезенка: | В-клетки: В220+, мышиный CD19+ |
| В-клетки переходной стадии: после установки дискриминационного окна на В-клетки, CD93+ | |
| В-клетки переходной стадии (1) (Tl): IgM+, CD23- | |
| В-клетки переходной стадии (Т2): IgM+, CD23+ | |
| В-клетки переходной стадии (ТЗ): IgMнизкий, CD23+ | |
| Зрелые В-клетки: после установки дискриминационного окна на В-клетки, CD93+ |
| Фолликулярные В-клетки: IgM+, CD23+ | |
| В-клетки маргинальной зоны: IgMвысокий, | |
| CD23- | |
| Костный мозг: | В-клетки: В220+, мышиный CD19+ |
| Про-В-клетки: после установки дискриминационного окна на В-клетки, CD43+, IgM-Пре-В-клетки: после установки дискриминационного окна на В-клетки, CD43-, IgM-Незрелые и зрелые В-клетки: после установки дискриминационного окна на В-клетки, CD43-, IgM+ | |
| Незрелые В-клетки: CD43-, IgM+, CD93+ Зрелые В-клетки: CD43-, IgM+, CD93+низкий/- | |
| Брюшная полость: | В-клетки: IgM+ |
Таблица 5. Антитела, применяемые для идентификации В-клеток в экспериментах по истощению in vivo. Мертвые клетки выявляли с помощью окрашивания 7-AAD
Таблица 6. Обобщенные результаты о В-клеточном истощении в кровотоке. Антитела 3649, 3649-3М, 3649-ТМ или контрольное антитело R347 вводили мышам линии hCD19tg +/- согласно описанному выше протоколу. % В-клеток определяли в виде (В220+, мышиный CD19+)-4)paKmra лимфоцитов крови; популяцию лимфоцитов выявляли на основе характеристик рассеяния света в направлении его распространения и в боковом направлении (см. более подробно на фиг.17А). % истощения рассчитывали как 100 × (% В-клеток (контрольное антитело) - % В-клеток (экспериментальное антитело)) / % В-клеток (контрольное антитело). Применяли отрицательные значения уровня истощения, когда размер клеточной популяции в обработанном животном превышал соответствующий размер в контрольном животном.
| Антитело | Доза(мкг/мышь) | % В-клеток | % истощения |
| R347 | 10 | 26,% | Н/O |
| R347 | 50 | 37,9% | Н/O |
| R347 | 250 | 22,2% | Н/O |
| 3649 | 10 | 16,9% | 36,94% |
| 3649 | 50 | 1,5% | 96,12% |
| 3649 | 250 | 1,0% | 95,64% |
| 3649-3М | 10 | 1,1% | 95,82% |
| 3649-3М | 50 | 0,1% | 99,84% |
| 3649-ТМ | 50 | 32,8% | 13,47% |
| 3649-ТМ | 250 | 26,4% | (-18,7%) |
Таблица 7. Обобщенные результаты о истощении селезеночных В-клеток в селезенке. Антитела 3649, 3649-3М, 3649-ТМ или контрольное антитело R347 вводили мышам линии hCD19tg +/- согласно описанному выше протоколу. % В-клеток определяли в виде (В220+, мышиный CD19+)-фракции лимфоцитов (см. более подробно на фиг.17Б). % истощения рассчитывали как 100 × (количество клеток (контрольное антитело) - количество клеток (экспериментальное антитело)) / количество клеток (контрольное антитело). Применяли отрицательные значения уровня истощения, когда размер клеточной популяции в обработанном животном превышал соответствующий размер в контрольном животном.
| Антитело | Доза (мкг/мышь) | % В-клеток | Количество клеток / животное | % истощения |
| R347 | 10 | 17,2% | 5991451 | H/O |
| R347 | 50 | 22,5% | 4620997 | H/O |
| R347 | 250 | 25.7% | 5317874 | H/O |
| 3649 | 10 | 13,4% | 3267904 | 45,5% |
| 3649 | 50 | 6,8% | 773147 | 83,3% |
| 3649 | 250 | 7,8% | 947293 | 82,2% |
| 3649-3М | 10 | 4,1% | 532244 | 91,1% |
| 3649-3М | 50 | 1,6% | 102285 | 97,8% |
| 3649-ТМ | 50 | 28.,% | 6199144 | (-34,1%) |
| 3649-ТМ | 250 | 21,8% | 4182489 | 21,4% |
Таблица 8. Обобщенные результаты о истощении селезеночных В-клеток переходной стадии. Антитела 3649, 3649-3М, 3649-ТМ или контрольное антитело R347 вводили мышам линии hCD19tg +/- согласно описанному выше протоколу. % В-клеток переходной стадии определяли в виде (С093+)-фракции В-клеток (см. более подробно на фиг.17Б). % истощения рассчитывали как 100 × (количество клеток (контрольное антитело) - количество клеток (экспериментальное антитело))/количество клеток (контрольное антитело).
| Антитело | Доза (мкг/мышь) | % В-клеток переходной стадии | Количество клеток/животное | % истощения |
| R347 | 10 | 17,4% | 1131356 | H/O |
| R347 | 50 | 18,4% | 937279 | H/O |
| R347 | 250 | 17,0% | 975450 | H/O |
| 3649 | 10 | 11,1% | 402770 | 64,4% |
| 3649 | 50 | 3,0% | 24173 | 97,4% |
| 3649 | 250 | 4,0% | 39299 | 96,0% |
| 3649-3М | 10 | 7,2% | 43106 | 96,2% |
| 3649-3М | 50 | 5,2% | 5272 | 99,4% |
| 3649-ТМ | 50 | 12,4% | 840608 | 10,3% |
| 3649-ТМ | 250 | 10,2% | 455248 | 53,3% |
Таблица 9. Обобщенные результаты о истощении селезеночных В-клеток стадии Т1. Антитела 3649, 3649-3М, 3649-ТМ или контрольное антитело R347 вводили мышам линии hCD19tg +/- согласно описанному выше протоколу. Т1-В-клетки определяли в виде (IgM+, CD93-)-фракции В-клеток (см. более подробно на фиг.17Б). % истощения рассчитывали как 100 × (количество клеток (контрольное антитело) - количество клеток (экспериментальное антитело)) / количество клеток (контрольное антитело).
| Антитело | Доза(мкг/мышь) | % Т1-В-клеток | Количество клеток/ животное | % истощения |
| R347 | 10 | 28,8% | 335185 | H/O |
| R347 | 50 | 36,0% | 332727 | H/O |
| R347 | 250 | 34,6% | 367735 | H/O |
| 3649 | 10 | 27,2% | 107298 | 68.0% |
| 3649 | 50 | 23,3% | 5845 | 98,2% |
| 3649 | 250 | 30,4% | 12678 | 96,6% |
| 3649-3М | 10 | 24,2% | 10438 | 96,9% |
| 3649-3М | 50 | 20,4% | 1168 | 99,6% |
| 3649-ТМ | 50 | 29,4% | 253730 | 23,7% |
| 3649-ТМ | 250 | 27,3% | 125491 | 65,9% |
Таблица 10. Обобщенные результаты о истощении селезеночных В-клеток стадии Т2. Антитела 3649, 3649-3М, 3649-ТМ или контрольное антитело R347 вводили мышам линии hCD19tg +/- согласно описанному выше протоколу. Т2-В-клетки определяли в виде (IgM+, СВ93-)-фракции В-клеток (см. более подробно на фиг.17Б). % истощения рассчитывали как 100 × (количество клеток (контрольное антитело) - количество клеток (экспериментальное антитело)) / количество клеток (контрольное антитело).
| Антитело | Доза (мкг/мышь) | % Т2-В-клеток | Количество клеток/ животное | % истощения |
| R347 | 10 | 21,3% | 242018 | H/O |
| R347 | 50 | 17,3% | 166575 | H/O |
| R347 | 250 | 23,0% | 212106 | H/O |
| 3649 | 10 | 23,4% | 95554 | 60,5% |
| 3649 | 50 | 18,9% | 4322 | 97,4% |
| 3649 | 250 | 16,6% | 6945 | 96,7% |
| 3649-3М | 10 | 26,4% | 11368 | 95,3% |
| 3649-3М | 50 | 10,9% | 607 | 99,6% |
| 3649-ТМ | 50 | 16,7% | 135944 | 18,4% |
| 3649-ТМ | 250 | 21,6% | 93662 | 55,8% |
Таблица 11. Обобщенные результаты о истощении селезеночных В-клеток стадии Т3. Антитела 3649, 3649-3М, 3649-ТМ или контрольное антитело R347 вводили мышам линии hCD19tg +/- согласно описанному выше протоколу. Т3-В-клетки определяли в виде (CD93+, IgM низкий, СВ23+)-фракции В-клеток (см. более подробно на фиг.17Б). % истощения рассчитывали как 100 × (количество клеток (контрольное антитело) - количество клеток (экспериментальное антитело))/количество клеток (контрольное антитело). Применяли отрицательные значения уровня истощения, когда размер клеточной популяции в обработанном животном превышал соответствующий размер в контрольном животном.
| Антитело | Доза(мкг/мышь) | % Т3-В клеток | Количество клеток/ животное | % истощения |
| R347 | 10 | 34,3% | 378181 | H/O |
| R347 | 50 | 25,2% | 242767 | H/O |
| R347 | 250 | 30,7% | 306514 | H/O |
| 3649 | 10 | 33,1% | 135097 | 64,3% |
| 3649 | 50 | 25,4% | 5652 | 97,7% |
| 3649 | 250 | 21,1% | 8062 | 97,4% |
| 3649-3М | 10 | 26,2% | 11148 | 97,1% |
| 3649-3М | 50 | 9,4% | 518 | 99,8% |
| 3649-ТМ | 50 | 47,8% | 399685 | (-64,6%) |
| 3649-ТМ | 250 | 37,9% | 172129 | 43,8% |
Таблица 12. Обобщенные результаты о истощении зрелых селезеночных В-клеток. Антитела 3649, 3649-3М, 3649-ТМ или контрольное антитело R347 вводили мышам линии hCD19tg +/- согласно описанному выше протоколу. Зрелые В-клетки определяли в виде (CD93-)-фракции В-клеток (см. более подробно на фиг.17Б). % истощения рассчитывали как 100 × (количество клеток (контрольное антитело) - количество клеток (экспериментальное антитело)) / количество клеток (контрольное антитело). Применяли отрицательные значения уровня истощения, когда размер клеточной популяции в обработанном животном превышал соответствующий размер в контрольном животном.
| Антитело | Доза (мкг/мышь) | % зрелых В-клеток | Количество клеток/ животное | % истощения |
| R347 | 10 | 80,0% | 5175585 | H/O |
| R347 | 50 | 80,7% | 3883914 | H/O |
| R347 | 250 | 82,1% | 4454167 | H/O |
| 3649 | 10 | 86,3% | 3042745 | 41,2% |
| 3649 | 50 | 96,2% | 794477 | 79,5% |
| 3649 | 250 | 94,3% | 933936 | 79,0% |
| 3649-3М | 10 | 88,7% | 532482 | 89,7% |
| 3649-3М | 50 | 93,5% | 108806 | 97,2% |
| 3649-ТМ | 50 | 87,5% | 5724882 | (-47,4%) |
| 3649-ТМ | 250 | 87,5% | 3792089 | 14,9% |
Таблица 13. Обобщенные результаты о истощении фолликулярных селезеночных В-клеток. Антитела 3649, 3649-3М, 3649-ТМ или контрольное антитело R347 вводили мышам линии hCD19tg +/- согласно описанному выше протоколу. Фолликулярные В-клетки определяли в виде (IgM+, CD23+)-фракции зрелых В-клеток (см. более подробно на фиг.17Б). % истощения рассчитывали как 100 × (количество клеток (контрольное антитело) - количество клеток (экспериментальное антитело)) / количество клеток (контрольное антитело). Применяли отрицательные значения уровня истощения, когда размер клеточной популяции в обработанном животном превышал соответствующий размер в контрольном животном
| Антитело | Доза (мкг/мышь) | % фолликулярных В-клеток | Количество клеток/ животное | % истощения |
| R347 | 10 | 78,2% | 4053717 | H/O |
| R347 | 50 | 69,3% | 2731740 | H/O |
| R347 | 250 | 74,4% | 3298335 | H/O |
| 3649 | 10 | 76,9% | 2345011 | 42,2% |
| 3649 | 50 | 38,8% | 310160 | 88,6% |
| 3649 | 250 | 45,6% | 427691 | 87,0% |
| 3649-3М | 10 | 58,2% | 306833 | 92,4% |
| 3649-3М | 50 | 40,6% | 40611 | 98,5% |
| 3649-ТМ | 50 | 79,9% | 4573294 | (-67,4%) |
| 3649-ТМ | 250 | 81,6% | 3091310 | 6,3% |
Таблица 14. Обобщенные результаты о истощении селезеночных В-клеток маргинальной зоны. Антитела 3649, 3649-3М, 3649-ТМ или контрольное антитело R347 вводили мышам линии hCD19tg +/- согласно описанному выше протоколу. В-клетки маргинальной зоны определяли в виде (IgM высокий, СВ23-)-фракции зрелых В-клеток (см. более подробно на фиг.17Б). % истощения рассчитывали как 100 × (количество клеток (контрольное антитело) -количество клеток (экспериментальное антитело)) / количество клеток (контрольное антитело). Применяли отрицательные значения уровня истощения, когда размер клеточной популяции в обработанном животном превышал соответствующий размер в контрольном животном.
| Антитело | Доза(мкг/мышь) | % В-клеток маргиальной зоны | Количество клеток/ животное | % истощения |
| R347 | 10 | 10,6% | 546769 | H/O |
| R347 | 50 | 14,3% | 526975 | H/O |
| R347 | 250 | 19,0% | 861171 | H/O |
| 3649 | 10 | 10,8% | 326581 | 40,3% |
| 3649 | 50 | 36,9% | 291707 | 44,6% |
| 3649 | 250 | 40,1% | 375834 | 56,4% |
| 3649-3М | 10 | 20,6% | 110411 | 79,8% |
| 3649-3М | 50 | 22,0% | 26845 | 94,9% |
| 3649-ТМ | 50 | 14,6% | 835215 | (-58,54%) |
| 3649-ТМ | 250 | 7,9% | 297329 | 65,5% |
Таблица 15. Обобщенные результаты о В-клеточном истощении в костном мозге. Антитела 3649, 3649-3М, 3649-ТМ или контрольное антитело R347 вводили мышам линии hCD19tg +/- согласно описанному выше протоколу. В-клетки определяли в виде (В220+, мышиный CD19+)-фракции лимфоцитов (см. более подробно на фиг.17В). % истощения рассчитывали как 100 × (количество клеток (контрольное антитело) - количество клеток (экспериментальное антитело)) / количество клеток (контрольное антитело).
| Антитело | Доза (мкг/мышь) | % В-клеток | Количество клеток/ животное | % истощения |
| R347 | 10 | 36,5% | 1423555 | H/O |
| R347 | 50 | 23,0% | 1253562 | H/O |
| R347 | 250 | 49,0% | 1638383 | H/O |
| 3649 | 10 | 23,9% | 828302 | 41,8% |
| 3649 | 50 | 5,3% | 192629 | 84,6% |
| 3649 | 250 | 15,1% | 325810 | 80,1% |
| 3649-3М | 10 | 12,2% | 380642 | 73,3% |
| 3649-3М | 50 | 3,6% | 100271 | 92,0% |
| 3649-ТМ | 50 | 28,6% | 1192432 | 4,9% |
| 3649-ТМ | 250 | 59,2% | 1551662 | 5,3% |
Таблица 16. Обобщенные результаты о истощении про-В-клеток в костном мозге. Антитела 3649, 3649-3М, 3649-ТМ или контрольное антитело R347 вводили мышам линии hCD19tg +/- согласно описанному выше протоколу. Про-В-клетки определяли в виде (CD43+, IgM-)-фракции В-клеток (см. более подробно на фиг.17 В). % истощения рассчитывали как 100 × (количество клеток (контрольное антитело) - количество клеток (экспериментальное антитело)) / количество клеток (контрольное антитело). Применяли отрицательные значения уровня истощения, когда размер клеточной популяции в обработанном животном превышал соответствующий размер в контрольном животном.
| Антитело | Доза (мкг/мышь) | % про-В-клеток | Количество клеток/ животное | % истощения |
| R347 | 10 | 8,0% | 106735 | H/O |
| R347 | 50 | 10,8% | 135709 | H/O |
| R347 | 250 | 12,9% | 298552 | H/O |
| 3649 | 10 | 17,6% | 143882 | (-34.8%) |
| 3649 | 50 | 44,6% | 87312 | 35,7% |
| 3649 | 250 | 59,7% | 233214 | 21.9% |
| 3649-3М | 10 | 42,2% | 160572 | (-50,4%) |
| 3649-3М | 50 | 49,5% | 50159 | 63,0% |
| 3649-ТМ | 50 | 9,1% | 110932 | 18,3% |
| 3649-ТМ | 250 | 18,9% | 298063 | 0,2% |
Таблица 17. Обобщенные результаты о истощении пре-В-клеток в костном мозге. Антитела 3649, 3649-3М, 3649-ТМ или контрольное антитело R347 вводили мышам линии hCD19tg +/- согласно описанному выше протоколу. Пре-В-клетки определяли в виде (CD43-, IgM-)-фракции В-клеток (см. более подробно на фиг.17В). % истощения рассчитывали как 100 × (количество клеток (контрольное антитело) - количество клеток (экспериментальное антитело)) / количество клеток (контрольное антитело).
| Антитело | Доза (мкг/мышь) | % пре-В-клеток | Количество клеток/ животное | % истощения |
| R347 | 10 | 54,2% | 786256 | H/O |
| R347 | 50 | 53,4% | 665597 | H/O |
| R347 | 250 | 44,9% | 1037445 | H/O |
| 3649 | 10 | 44,3% | 368091 | 53,2% |
| 3649 | 50 | 44,3% | 82854 | 87,6% |
| 3649 | 250 | 28,7% | 112154 | 89,2% |
| 3649-3М | 10 | 44,0% | 166139 | 78,9% |
| 3649-3М | 50 | 43,4% | 42831 | 93,6% |
| 3649-ТМ | 50 | 52,5% | 618151 | 7,1% |
| 3649-ТМ | 250 | 40,8% | 631574 | 39,1% |
Таблица 18. Обобщенные результаты о истощении незрелых/зрелых В-клеток в костном мозге. Антитела 3649, 3649-3М, 3649-ТМ или контрольное антитело R347 вводили мышам линии hCD19tg +/- согласно описанному выше протоколу. Незрелые/зрелые В-клетки определяли в виде (CD43+, IgM+)-фракции В-клеток (см. более подробно на фиг.17 В). % истощения рассчитывали как 100 × (количество клеток (контрольное антитело) - количество клеток (экспериментальное антитело)) / количество клеток (контрольное антитело). Применяли отрицательные значения уровня истощения, когда размер клеточной популяции в обработанном животном превышал соответствующий размер в контрольном животном.
| Антитело | Доза (мкг/мышь) | % незрелых/ зрелых В-клеток | Количество клеток/ животное | % истощения |
| R347 | 10 | 34,7% | 488578 | H/O |
| R347 | 50 | 30,3% | 382746 | H/O |
| R347 | 250 | 36,1% | 835327 | H/O |
| 3649 | 10 | 32,5% | 267869 | 45,2% |
| 3649 | 50 | 7,8% | 16149 | 95,8% |
| 3649 | 250 | 7,4% | 27688 | 96.7% |
| 3649-3М | 10 | 9,9% | 38723 | 92,1% |
| 3649-3М | 50 | 4,3% | 4340 | 98,9% |
| 3649-ТМ | 50 | 35,0% | 421214 | (-10,1%) |
| 3649-ТМ | 250 | 34,6% | 532935 | 36,2% |
Таблица 19. Обобщенные результаты о истощении незрелых В-клеток в костном мозге. Антитела 3649, 3649-3М, 3649-ТМ или контрольное антитело R347 вводили мышам линии hCD19tg +/- согласно описанному выше протоколу. Незрелые В-клетки определяли в виде (СВ93+)-фракции незрелых/зрелых В-клеток (см. более подробно на фиг.17 В). % истощения рассчитывали как 100 × (количество клеток (контрольное антитело) - количество клеток (экспериментальное антитело)) / количество клеток (контрольное антитело). Применяли отрицательные значения уровня истощения, когда размер клеточной популяции в обработанном животном превышал соответствующий размер в контрольном животном.
| Антитело | Доза(мкг/мышь) | % В-клеток | Количество клеток/ животное | % истощения |
| R347 | 10 | 46,4% | 230643 | H/O |
| R347 | 50 | 47,6% | 181178 | H/O |
| R347 | 250 | 43,9% | 183209 | H/O |
| 3649 | 10 | 33,2% | 89491 | 61,2% |
| 3649 | 50 | 43,6% | 7542 | 95,8% |
| 3649 | 250 | 18,2% | 2515 | 98,6% |
| 3649-3М | 10 | 65,6% | 24592 | 89,3% |
| 3649-3М | 50 | 41,9% | 1780 | 99,0% |
| 3649-ТМ | 50 | 39,4% | 161537 | 10,8% |
| 3649-ТМ | 250 | 37,1% | 204694 | (-11,7%) |
Таблица 30. Обобщенные результаты о истощении зрелых В-клеток в костном мозге. Антитела 3649, 3649-3М, 3649-ТМ или контрольное антитело R347 вводили мышам линии hCD19tg +/- согласно описанному выше протоколу. Зрелые В-клетки определяли в виде (CD93 низкий/-)-фракции незрелых/зрелых В-клеток (см. более подробно на фиг.17 В). % истощения рассчитывали как 100 × (количество клеток (контрольное антитело) - количество клеток (экспериментальное антитело)) / количество клеток (контрольное антитело). Применяли отрицательные значения уровня истощения, когда размер клеточной популяции в обработанном животном превышал соответствующий размер в контрольном животном.
| Антитело | Доза (мкг/мышь) | % зрелых В-клеток | Количество клеток/ животное | % истощения |
| R347 | 10 | 52,0% | 249983 | H/O |
| R347 | 50 | 41,3% | 159933 | H/O |
| R347 | 250 | 49,2% | 205556 | H/O |
| 3649 | 10 | 63,6% | 169712 | 32,1% |
| 3649 | 50 | 22,6% | 3904 | 97,6% |
| 3649 | 250 | 39,2% | 5435 | 97,4% |
| 3649-3М | 10 | 31,4% | 13102 | 94,8% |
| 3649-3М | 50 | 18,7% | 802 | 99,5% |
| 3649-ТМ | 50 | 58,9% | 252755 | (-58,0%) |
| 3649-ТМ | 250 | 55,8% | 290984 | (-41,6%) |
Таблица 31. Обобщенные результаты о В-клеточном истощении в брюшной полости. Антитела 3649, 3649-3М, 3649-ТМ или контрольное антитело R347 вводили мышам линии hCD19tg +/- согласно описанному выше протоколу. В-клетки брюшной полости определяли в виде (IgМ+)-фракции лимфоцитов брюшной полости (см. более подробно на фиг.17Г). % истощения рассчитывали как 100 × (% В-клеток (контрольное антитело) - % В-клеток (экспериментальное антитело)) / % В-клеток (контрольное антитело). Применяли отрицательные значения уровня истощения, когда размер клеточной популяции в обработанном животном превышал соответствующий размер в контрольном животном.
| Антитело | Доза (мкг/мышь) | % В-клеток | % истощения |
| R347 | 10 | 25,9% | H/O |
| R347 | 50 | 30,3% | H/O |
| R347 | 250 | 55,6% | H/O |
| 3649 | 10 | 16,8% | 35,3% |
| 3649 | 50 | 20,1% | 33,6% |
| 3649 | 250 | 35,8% | 35,6% |
| 3649-3М | 10 | 15,3% | 41,1% |
| 3649-3М | 50 | 13,1% | 56,9% |
| 3649-ТМ | 50 | 26,7% | 11,9% |
| 3649-ТМ | 250 | 56,5% | (-1,65%) |
| НВ12В | 50 | 23,6% | 22,0% |
| НВ12В | 250 | 23,3% | 58,2% |
7.5.1. Влияние плотности CD19 на эффективность индуцированного антителом к CD19 В-клеточного истощения
Для решения вопроса о том, зависит ли способность антитела к CD19 истощать В-клетки от плотности CD19, антитела к CD19, предлагаемые в изобретении, можно вводить мышам с различными уровнями экспрессия CD19. Полученные результаты должно продемонстрировать может ли плотность человеческого CD19 на В-клетках и изотип антитела влиять на истощение В-клеток в присутствии антитела к CD19. Этот же анализ можно применять для решения вопроса о том, могут ли другие антитела к CD19 эффективно истощать В-клетки. Эти результаты можно переносить на лечение больных людей, имеющих разные уровни экспрессии CD19. Таким образом, способы оценки присутствия и плотности CD19, представленные в настоящем описании, можно применять на человеке для идентификации пациентов или популяции пациентов, у которых определенные антитела к CD19 могут вызывать истощение В-клеток, и/или для определения приемлемых доз.
Для решения вопроса о том, влияет ли плотность CD19 на эффективность индуцированного антителом к CD19 В-клеточного истощения, в качестве примера можно оценивать В-клеточное истощение в крови и селезенке у мышей линии in hCD19tg после обработки антителами к CD19, предлагаемыми в изобретении (7 дней, 250 мкг/мышь). Ожидается, что результаты должны продемонстрировать, что плотность CD19 влияет на эффективность В-клеточного истощения антителами к CD19 in vivo. Например, следует ожидать, что низкие уровни экспрессии CD19 у мышей линии hCD19tg должны оказывать заметное воздействие на истощение В-клеток в кровотоке или ткани при введении антитела. В-клеточный клиренс можно оценивать через 24 ч после введения антитела к CD19 или контрольного МАт каждой мыши.
7.5.2. Определение зависимости В-клеточного истощения в тканях от FcγR
Для решения вопроса о том, может ли введение МАт к CD19, предлагаемых в изобретении, приводить к В-клеточному истощению в тканях, можно применять следующие анализы для демонстрации зависимости от экспрессии FcγR. В процессе интербридинга мышей линии hCD19tg с мышами, у которых отсутствует экспрессия FcγR, можно создавать мышей, у которых происходит экспрессия hCD19 и отсутствует экспрессия FcγR. Таких мышей можно применять для анализов с целью оценки способности антител к CD19 истощать В-клетки посредством путей, в которых принимает участие экспрессия FcγR, например, ADCC. Таким образом, антитела к CD19, идентифицированные в этих анализах, можно применять для создания химерных, человеческих или гуманизированных антител к CD19 с помощью описанных выше методов. Такие антитела можно в свою очередь применять в композициях и способах, предлагаемых в изобретении, для лечения человеческих В-клеточных нарушений и заболеваний, включая, но не ограничиваясь только ими, аутоиммунные заболевания и нарушения.
Врожденная иммунная система опосредует В-клеточное истощение после обработки антителом к CD20 через FcγR-зависимые процессы. Мышиные эффекторные клетки экспрессируют четыре различных класса FcγR для IgG, высокоаффинные молекулы FcγRI (CD64) и низкоаффинные молекулы FcγRII (CD32), FcγRIII (CD 16) и FcγRIV. FcγRI, FcγRIII и FcγRIV представляют собой гетероолигомерные комплексы, в которых соответствующие лигандсвязывающие α-цепи ассоциированы с общей γ-цепью (FcRγ). Экспрессия FcRγ-цепи необходима для сборки FcγR и для запуска FcγR эффекторных функций, включая фагоцитоз макрофагами. Поэтому у мышей линии FcRγ-/- отсутствуют молекулы высокоаффинного FcγRI (CD64) и молекулы низкоаффинного FcγRIII (CD 16) и FcγRIV, то мышей линии FcRγ-/-, экспрессирующих hCD19, можно применять для оценки роли FcγR в В-клеточном истощении в тканях после обработки антителом к CD19.
7.5.3. Продолжительность индуцированного антителом к CD19 В-клеточного истощения
Для оценки эффективности и продолжительности В-клеточного истощения мышам линии hCD19tg можно вводить путем инъекции однократную низкую дозу (например, 250 мкг) антитела к CD19 и определять продолжительность и ответ на дозу в виде В-клеточного истощения в зависимости от времени. Ожидается, что результаты должны продемонстрировать, что истощение находящихся в кровотоке В-клеток происходит в течение значительного периода времени (например, от одной недели до шести месяцев), с последующем постепенным восстановлением В-клеток крови.
7.6. Персистентность CD19 на поверхности В-клеток после введения антитела к CD19
Может ли интернализация CD19 влиять на В-клеточное истощение in vivo можно оценивать путем сравнения экспрессии CD19 на клеточной поверхности после введения антител к CD19, предлагаемых в настоящем изобретении. Например, экспрессию CD19 на клеточной поверхности и клиренс В-клеток можно оценивать in vivo на мышах линии hCD19tg, обработанных антителом к CD19, предлагаемым в настоящем изобретении, или контрольным антителом соответствующего изотипа (250 мкг), как функцию от времени. Так, селезеночные В-клетки можно собирать и оценивать в отношении CD19 в момент времени нуль (0) (до обработки антителом к CD19) и через 1, 4 и 24 ч после введения антитела. Выделенные В-клетки можно обрабатывать также in vitro, используя насыщающие концентрации каждого антитела к CD19 плюс вторичного антитела соответствующего изотипа in vitro, с помощью анализа методом проточной цитометрии для визуализации полной экспрессии CD19 на клеточной поверхности. Если уровень CD19 на поверхности В-клеток поддерживается, это должно свидетельствовать о сохранении чувствительности к ADCC, CDC и апоптозу. Если CD19 остается на клеточной поверхности после связывания с антителом к CD19, то В-клетки должны сохранять чувствительность к ADCC, CDC или апоптозу. Такие результаты должны продемонстрировать, в частности, почему антитела к CD19 и лечебные схемы, предлагаемые в изобретении, должны обладать эффективностью в качестве терапии человеческих В-клеточных нарушений и заболеваний, включая, но не ограничиваясь только ими, связанные с трансплантацией и аутоиммунные заболевания и нарушения.
7.7. Обработка антителом к CD19 может аннулировать гуморальный иммунитет и аутоиммунитет
В случае, когда терапия на основе CD19 снижает В-клеточную популяцию, то анализы, описанные в этом примере, можно использовать для демонстрации того, что антитела к CD19, предлагаемые в изобретении, обладают способностью элиминировать или ослаблять иммунные ответы. Эти анализы можно применять также для идентификации других антител к CD19, которые можно использовать для создания химерных, человеческих или гуманизированных антител к CD19 с помощью различных описанных выше методов. Указанные антитела в свою очередь можно применять в композициях и способах, предлагаемых в изобретении, для лечения аутоиммунных заболеваний и нарушений у человека, а также для трансплантационной терапии.
Воздействие индуцированного антителом к CD19 В-клеточного истощения на уровни в сыворотке антител можно оценивать после введения мышам линии hCD19tg однократной инъекции антитела к CD19 и последующего анализа снижения уровней иммуноглобулинов у этих мышей. Например, двухмесячных детенышей можно обрабатывать путем однократной инъекции антитела к CD19, предлагаемого в настоящем изобретении, или контрольного антитела (например, 250 мкг) в день 0. Затем определяют уровни антитела с помощью ELISA. Ожидается, что эти результаты должны позволить установить, что через 1-2 недели уровни в сыворотке антител типа IgM, IgG2b, IgG3 и IgA должны существенно снижаться и пониженные уровни должны сохраняться в течение по меньшей мере 10 недель.
Влияние В-клеточного истощения на независимый от Т-клеток гуморальный иммунный ответ типа 1 (TI-1) и ответ типа 2 (TI-2) можно оценивать путем иммунизации мышей линии hCD19tg с помощью TNP-LPS или DNP-Фиколл (в день 0), через 7 дней после обработки антителом к CD19 или контрольным антителом. Выраженные гаптенспецифические гуморальные иммунные ответы в виде IgM, IgG и IgA, как ожидается, не должны быть обнаружены в обработанных антителом к CD19 мышах, иммунизированных любым из указанных антигенов. Гуморальные иммунные ответы на зависимый от Т-клеток (TD) антиген (Аг), т.е. DNP-KLH, можно оценивать также, используя мышей, обработанных антителом к CD19 за 7 дней до иммунизации, при этом ожидается, что у иммунизированных DNP-KLH мышей, обработанных антителом к CD19, должен быть понижен гуморальный иммунитет.
7.8. Обработка антителом к CD19 в сочетании с обработкой антителом к CD22
Представленный анализ можно применять для решения вопроса о том, оказывает ли совместная терапия, например, на основе антител к CD19, в сочетании с химиотерапией, основанной на применении токсинов терапии или лучевой терапии, благоприятное действие, например, аддитивное или превышающее аддитивное действие в отношении В-клеточного истощения. Результаты изученной совместной терапии на созданных на животных моделях можно переносить на человека с помощью хорошо известных в данной области методов.
Антитела к CD20 обладают эффективностью в отношении В-клеточного истощения у человека и мыши in vivo. В связи с этим благоприятное воздействие одновременного лечения антителом к CD19, предлагаемым в настоящем изобретении, и антителами к CD20 (например, МВ20-11; см. Yazawa и др., Proc Nail Acad Sci U S A 102(42), 2005, cc.15178-15183) можно оценивать для выяснения их влияния на усиление В-клеточного истощения. Мышей можно обрабатывать субоптимальными дозами (например, 2, 5, 10, 20 или 50 мкг) каждого антитела либо индивидуально, либо в виде комбинации обоих антител. Ожидается, что эти результаты должны продемонстрировать, что одновременная обработка антителом к CD19 и к CD20 оказывает благоприятное действие. Аналогичным образом можно определять эффективность комбинации антитела к CD19, предлагаемого в настоящем изобретении, и антитела к CD22 или комбинации антитела к CD19, предлагаемого в настоящем изобретении, антитела к CD20 и антитела к CD22.
7.9. Терапевтическая эффективность подкожного (s.c.) введения антитела к CD19, предлагаемого в изобретении
Представленный анализ можно применять для решения вопроса о том, может антитело к CD19, предлагаемое в изобретении, при подкожном пути введения эффективно истощать В-клетки. Данные об эффективности различных изученных путем введения, полученные на созданных на животных моделях, можно переносить на человека с помощью хорошо известных в данной области методов.
Например, мышей линии hCD19tg можно обрабатывать антителом к CD19, предлагаемым в изобретении, в дозе 250 мкг либо подкожно (s.c.), либо внутрибрюшинно (i.p.), либо внутривенно (i.v.). Определяют среднее количество (±СКО) в крови (на мл), костном мозге, селезенке, лимфатическом узле и брюшной полости (B220+)-B-клеток в день 7 с помощью проточной цитометрии. Ожидается, что результаты должны продемонстрировать, что при подкожном (s.c.), внутрибрюшинном (i.p.) и внутривенном (i.v.) введении антитело к CD19, предлагаемое в изобретении, должно эффективно вызывать истощение В-клеток в кровотоке и тканях in vivo.
Настоящее изобретение не ограничено представленными конкретными вариантами осуществления изобретения. Так, различные модификации, предлагаемые в изобретении, помимо описанных выше, должны стать очевидными специалистами в данной области из представленного выше описания и прилагаемых чертежей. Подразумевается, что такие модификации подпадают под объем прилагаемой формулы изобретения.
7.10. Антитела к CD19 снижают рост опухолей на модели лимфомы in vivo
Антитела к CD19, предлагаемые в изобретении, которые связываются с человеческим CD19, можно оценивать в отношении их способности снижать рост опухолей in vivo на созданных на животных моделях. Например, мышам линии SCID можно инъецировать линии клеток человеческой лимфомы для создания ксенотрансплантата опухоли (например, s.c.-инъекция клеток Раджи). Затем мышам можно вводить несколько доз антитела к CD19, предлагаемого в изобретении (например, 100 мкг антитела/мышь, 5 раз). Рост опухоли можно оценивать стандартными методами (например, объем опухоли, вес животных, паралич). Воздействие обработки антителом к CD19 на рост опухоли можно определять путем сравнения животных, обработанных антителом к CD19 или обработанных контрольным антителом. Результаты, полученные при использовании антител к CD19, у которых выявлена способность снижать рост опухоли, можно переносить для применения на человеке, и антитела, обладающие способностью снижать рост опухоли, можно применять в композициях и способах, предлагаемых в изобретении, для лечения у человека В-клеточных нарушений и заболеваний, включая, но не ограничиваясь только ими, В-клеточные злокачественные состояния.
Для решения вопроса о том, зависит ли способность антитела к CD19 снижать рост опухоли от плотности CD19, можно оценивать линии опухолевых клеток с различными профилями экспрессии CD19 с помощью различных описанных выше анализов in vivo роста опухоли. Например, клетки Дауди, Раджи, Намальвы и Рамоса все имеют различные уровни экспрессии CD19 на их клеточной поверхности; с другой стороны, линия клеток множественной миеломы RPMI 8226 не экспрессирует CD19. Полученные результаты могут продемонстрировать, может ли плотность человеческого CD19 на поверхности опухолевых клеток влиять на активность антитела к CD19 в отношении снижения роста опухоли. Эти результаты можно переносить на лечение больных людей, имеющих различные уровни экспрессии CD19. Таким образом, представленные в настоящем описании методы оценки присутствия и плотности CD19 можно применять для анализа людей с целью идентификации пациентов или популяции пациентов, у которых определенные антитела к CD19 могут снижать рост злокачественных В-клеток и/или для определения пригодных доз.
Для решения вопроса о том, зависит ли способность антитела к CD19 снижать рост опухоли от FcγR, можно осуществлять описанный выше анализ in vivo роста опухоли с использованием SCID-мышей с аномальной активностью Fcγ-рецептора (например, FcRγ-/-). В процессе интербридинга SCID-мышей с мышами, у которых отсутствует экспрессия определенных FcγR, можно создавать SCID-мышей, у которых также отсутствует экспрессия определенных FcγR (например, мышей линии SCID, FcRγ-/-). Таких мышей можно применять для анализов с целью оценки способности антител к CD19 снижать рост опухоли посредством путей, в которых принимает участие экспрессия FcγR, например, ADCC. На основе этих результатов можно создавать антитела к CD19 с повышенной ADCC-активностью с помощью описанных выше методов. Указанные антитела, в свою очередь, можно применять в композициях и способах, предлагаемых в изобретении, для лечения у человека В-клеточных нарушений и заболеваний, включая, но не ограничиваясь только ими, В-клеточные злокачественные состояния.
Ниже приведено подробное описание экспериментов, демонстрирующих способность гуманизированного антитела к CD19 3649 снижать рост опухоли in vivo на созданных на животных моделях. В день 1 эксперимента 4-6-недельным самкам мышей линии СВ-17 SCID инъецировали s.c. 5×106 Раджи-клеток человеческой лимфомы в заднюю боковую область. Клетки Раджи экспрессируют значительные уровни CD19 на их поверхности и обладают чувствительностью к обусловленной 3649 ADCC (см. фиг.7 и 8). Животных в группах, состоящих из 10 особей, которым инъецировали клетки Раджи, обрабатывали гуманизированным антителом к CD19, контрольным антителом к CD20, применяемым в качестве контроля изотипа антителом неродственной специфичности. Одновременно можно оценивать несколько различных доз антител. В качестве не ограничивающей объем изобретения лечебной схемы можно указать обработку 5 вводимыми дважды в неделю i.p.-дозами по 10 мг/кг антитела, начиная с дня 4. В опыт включали также дополнительную контрольную группу животных, которым вводили только ЗФР. Объем опухоли определяли стандартными методами. Животных, у которых объем опухоли превышал 2000 мм3 или которые имели выраженные признаки болезненного состояния, гуманно умерщвляли. Определяли рост опухоли в зависимости от времени.
В эксперименте, результаты которого обобщены на фиг.13, десяти животным инъецировали клетки Раджи, затем каждое животное обрабатывали 5 вводимыми дважды в неделю i.р.-дозами по 10 мг/кг (I) антитела к CD20, (II) Fc-варианта 3649-ТМ со сниженной ADCC-активностью, (III) антитела 3649 или (IV) контрольного антитела R347, начиная с дня 4. Дополнительной контрольной группе, состоящей из 10 животных, вводили только ЗФР. Обработка антителом к CD19 3649 и применяемым в качестве положительного контроля антителом к CD20 существенно снижала рост опухолей. Стандартное отклонение размера опухолей для групп, обработанных антителом 3649 или антителом к CD20, возрастало с течением времени из-за присутствия не содержащих никаких опухолей животных в обеих обрабатываемых группах. Fc-вариант 3649-ТМ не оказывал существенного воздействия на рост опухолей, что позволяет предположить, что действие, обусловливающее снижение роста опухолей, гуманизированного антитело к CD19 3649, опосредуется через ADCC.
В эксперименте, результаты которого обобщены на фиг.14, десяти животным инъецировали клетки Раджи, затем каждое животное обрабатывали 5 вводимыми дважды в неделю i.р.-дозами (I) антитела к CD20 в дозе 10 мг/кг (анти-CD20), (II) Fc-варианта 3649-ТМ со сниженной ADCC-активностью в дозе 10 мг/кг (3649ТМ), (III) антитела 3649 в дозе 10 мг/кг (3649), (IV) антитела 3649 в дозе 2,5 мг/кг (3649*) или (V) контрольного антитела R347 в дозе 10 мг/кг, начиная с дня 4. Обработка антителом к CD19 3649, вариантом антитела к CD19 3649-3М с повышенной ADCC-активностью для человека и применяемым в качестве положительного контроля антителом к CD20 существенно снижала рост опухолей. Fc-вариант 3649-ТМ антитела к CD19 не оказывал существенного воздействия на рост опухолей, что позволяет предположить, что действие, обусловливающее снижение роста опухолей, антитело 3649, опосредуется через ADCC.
В эксперименте, результаты которого обобщены на фиг.30, десяти животным инъецировали клетки Раджи, затем каждое животное обрабатывали 5 вводимыми дважды в неделю i.р.-дозами (I) антитела к CD20 в дозе 10 мг/кг (анти-CD20), (II) антитела 3649 в дозе 10 мг/кг (3649), (III) афукозилированного антитела 3649 в дозе 2,5 или 10 мг/кг (3649-aFuc) или (IV) контрольного антитела R347 в дозе 10 мг/кг, начиная с дня 4. Обработка антителом к CD19 3649, антителом к CD19 3649-aFuc и применяемым в качестве положительного контроля антителом к CD20 существенно снижала рост опухолей.
7.11. Антитела 3649 к CD19 с созревшей аффинностью
В представленных ниже разделах описана идентификация вариантов с созревшей аффинностью CDR антитела 3649 к CD19, которые характеризуются повышенной аффинностью к связыванию с находящемся на клеточной поверхности человеческим антигеном CD19 по сравнению с родительским антителом 3649 к CD19. В разделе описано получение характеристик in vitro антител к CD19 с созревшей аффинностью.
7.11.1. Идентификация вариантов антител 3649 с повышенной аффинностью
Варианты антител 3649 к CD19 идентифицировали путем скрининга библиотек Fab-фрагментов, содержащих варианты последовательностей CDR (см. заявку на патент США US 2006/0121042; Wu H., Methods Mol Biol., 207, 2003. cc.197-212; Wu и An, Methods Mol Biol., 207, 2003, cc.213-233; Wu и др., J. Mol. Biol., 350, 2005, cc.126-144; Wu и др., Proc. Natl. Acad. Sci. USA 95, 1998, cc.6037-6042).
Реагенты: Все химические вещества были аналитически чистыми. Рестриктазы, ДНК-модифицирующие ферменты, лигазу Т4- и ДНК-полимеразу Т7 приобретали у фирмы New England Biolabs, Inc. (Беверли, шт.Массочусетс). Обычные олигонуклеотиды синтезировали на фирме Орегоп (Хантсвилл, шт.Алабама). Покрытие стрептавидином магнитные гранулы приобретали у фирмы Dynal (Лейк-Суссекс, шт.Нью-Йорк).
Конструирование фагового экспрессионного вектора Fab 3649:
Полинуклеотиды, кодирующие VH- и VK-области антитело 3649 к CD19, клонировали в экспрессионном векторе на основе фага М13, что облегчало экспрессию Fab-фрагментов под контролем промотора lacZ (Dall'Acqua и др., Methods 36, 2005, cc.43-60). Вектор содержал первую константную область человеческой тяжелой у 1-цепи, константную область человеческой легкой каппа-(к)-цепи и два сайта ренатурации для клонирования генов VH и VK. Клонирование осуществляли путем гибридизации методом мутагенеза (Kunkel и др., Proc Natl. Acad. Sci. USA 82, 1985, cc.4778-4782) согласно протоколу, описанному у Wu и An, Methods Mol Biol., 207, 2003, cc.213-233. В целом, метод состоял в следующем: полинуклеотиды, кодирующие VH- и VK-область 3649, амплифицировали, используя примерно по 0,5 пмоля каждого из следующих генспецифических олигонуклеотидных праймеров: 3649 VH Fab Fw (SEQ ID NO:128), 3649 VH Fab Rev (SEQ ID NO:129), 3649 VK Fab Fw (SEQ ID NO:130) и 3649 VK Fab Rev (SEQ ID NO:131) (см. таблицу 32). Нуклеотидная 5'-последовательность каждого праймера содержала специфические для М13-вектора последовательности, позволяющие осуществлять ренатурацию с образованием связей между ПЦР-продуктами и одноцепочечным вектором. Нуклеотидная последовательность праймеров 3649 VH Fab Fw (SEQ ID NO:128) и 3649 VK Fab Fw (SEQ ID NO:130) содержит состоящую из 28/25 нуклеотидов последовательность соответственно, которая соответствует гену 3 лидерной последовательности М13. Нуклеотидная 5'- последовательность праймеров 3649 VH Fab Rev (SEQ ID NO:129) и 3649 VK Fab Rev (SEQ ID NO:131) содержит состоящую из 28/30 нуклеотидов последовательность, которая соответствует первой константной области человеческой тяжелой γ1-цепи и константной области человеческой легкой каппа-(κ)-цепи соответственно. «Прямые» праймеры 3649 VH Fab Fw (SEQ ID NO:128) и 3649 VK Fab Fw (SEQ ID NO:130) биотинилировали для выделения минус-цепи из ПЦР-фрагментов. Полинуклеотиды, кодирующие гены VH и VK 3649, амплифицировали с помощью ПЦР из соответствующих экспрессионных конструкций 3649 IgG, описанных выше, с помощью комбинаций праймеров 3649 VH Fab Fw (SEQ ID NO:128)/ 3649 VH Fab Rev (SEQ ID NO:129) и 3649 VK Fab Fw (SEQ ID NO:130)/ 3649 VK Fab Rev (SEQ ID NO:131) соответственно. ПЦР-продукты очищали путем электрофореза на агарозном геле/ электроэлюции и затем фосфорилировали с помощью полинуклеотид-киназы Т4 (фирма Roche). Минус-цепь ПЦР-фрагментов выделяли путем диссоциации двухцепочечного ПЦР-продукта гидроксидом натрия, элиминируя биотинилированную плюс-цепь с помощью покрытых стрептавидином магнитных гранул и восстанавливая минус-цепи осаждением этанолом. Эквимолярные количества выделенной минус-цепи ПЦР-фрагментов VH и VK ренатурировали с уридинилированной одноцепочечной матрицей М13 MD101-5A и обрабатывали ДНК-полимеразой Т4 (фирма Roche), ДНК-лигазой Т4 (фирма Roche) согласно инструкциям производителя. Специфические для М13 нуклеотидные последовательности, встроенные в выделенные полинуклеотиды минус-цепей VH и VK, специфически ренатурировали с получением двух отдельных областей векторной ДНК М13, каждая из которых содержала палиндромную петлю, включающую сайт, распознаваемый рестриктазой ХЬа I. Поскольку для палиндромных петель характерна саморенатурация даже в присутствии ренатурированных последовательностей VH или VK, расщепление с помощью XbaI ренатурированных, обработанных ДНК-полимеразой Т4/ДНК-лигазой Т4 комплексов ДНК, позволяло отбирать вновь синтезированные векторные минус-цепи, содержащие VH- и VK-области, слитые в рамке считывания с человеческой константной областью каппа-(κ)-цепи и первой человеческой константной областью γ1-цепи соответственно, на основе плюс-цепи расщепленной родительской матрицы. Реакционный продукт расщепляли XbaI, инактивировали тепловой обработкой и переносили путем электропорации в DHlOB-клетки. Трансформированные DH10B-клетки титровали на бактериальных планшетах с газоном штамма Escherichia coli XL-1 Blue. Фаговую ДНК, выделенную из нескольких независимых бляшек, секвенировали с целью идентификации клона, кодирующего Fab-фрагмент 3649.
Таблица 32. ПЦР-праймеры, применяемые для создания кодирующих VH и VK полинуклеотидов 3649, которые использовали для гибридизации методом мутагеназа. Специфические для 3649 остатки подчеркнуты.
Создание сфокусированных на одном CDR библиотек Fab: Создавали по две различные несущие одну аминокислотную замену библиотеки для каждого из шести CDR-участков антитела 3649. Библиотеки «NSS» содержали все возможные варианты замен одной аминокислоты данного CDR, где замененная аминокислота представляла собой одну из восьми аминокислот, которая кодировалась вырожденным кодоном NSS. Библиотеки «NWS» содержали все возможные варианты замен одной аминокислоты данного CDR, где замененная аминокислота представляла собой одну из двенадцати аминокислот, которая кодировалась вырожденным кодоном NWS. Индивидуальные библиотеки получали путем гибридизации методом мутагенеза описанных выше фаговых векторов, кодирующих Fab 3649 (Kunkel и др., Proc. Natl. Acad. Sci. USA 82, 1985, cc.4778-44782; Wu и An, Methods Mol Biol., 207, 2003, cc.213-233). В целом, метод состоял в следующем: два набора вырожденных олигонуклеотидов минус-цепи получали для каждого из шести CDR. Наборы «NSS» и «NWS» содержали все возможные замены одного кодона CDR-участка до получения вырожденного кодона NSS или NWS соответственно. Олигонуклеотидные наборы, применяемые для создания библиотек, сфокусированных на CDR1 тяжелой цепи, представлены в качестве примера в таблице 33. Каждый вырожденный олигонуклеотид минус-цепи фосфорилировали перед ренатурацией в молярном соотношении 10:1 относительно уридинилированной одноцепочечной фаговой ДНК-матрицы 3649 Fab. Температуру реакции ренатурации понижали с 95°С до 55°С в течение 1 ч. Добавляли лигазу Т4 и ДНК-полимеразу Т7 к ренатурированному продукту и инкубировали в течение 1,5 ч при 37°С. Объединяли конечные продукты синтеза отрицательной цепи, полученные с использованием различных олигонуклеотидов из специфического для одного CDR набора; при этом NSS- и NWS-пулы сохраняли по отдельности и подвергали скринингу независимо друг от друга. Как правило, по 1 мкл объединенного продукта реакции синтеза отрицательной цепи переносили путем электропорации в штамм XL1-Blue для образования бляшек на бактериальном газоне XL1-Blue. Индивидуальные фаговые клоны элюировали 200 мкл буфера, содержащего 10 мМ Трис (рН 7,4), 100 мМ NaCl, и хранили при 4°С. Библиотеку можно характеризовать секвенированием 24 произвольно отобранных фаговых клонов для определения распределения мутаций в CDR, а также для расчета частоты мутаций.
Таблица 33. Олигонуклеотиды, применяемые для создания сфокусированных на CDR1 библиотек тяжелой цепи 3649. Содержащие кодон NSS и NWS олигонуклеотиды применяли для создания отдельных «NSS»- и «NSS»-библиотек. Нуклеотиды, кодирующие остатки CDR, подчеркнуты.
Первичный скрининг сфокусированных на одном CDR библиотек Fab: II
первичный скрининг включал осуществление одноточечного ELISA (SPE) с использованием 1 мл супернатанта фаговых культур, содержащих секретируемый Fab и экспрессирующих рекомбинантный человеческий CD19 300В4-клеток в качестве иммобилизованного агента. Исчерпывающего скрининга библиотеки можно, как правило, достигать путем оценки количества индивидуальных клонов, равного трехкратному размеру библиотеки, принимая во внимание частоту мутаций. Например, для достижения исчерпывающего скрининга содержащих VH CDR1 (5 аминокислотных остатков) включающих замены «NSS»-библиотек (8 возможных аминокислот, кодируемых вырожденным кодоном NSS) при частоте мутаций 50% можно оценивать 5×8×2=80 произвольно отобранных индивидуальных клонов. Однако в эксперименте, представленном в настоящем описании, ~400 клонов подвергали скринингу, для каждой библиотеки вне зависимости от длины CDR или эффективности синтеза. Супернатант фаговых культур, полученных в маломасштабном эксперименте, выделяли согласно методу, описанному у Wu и An, Methods Mol Biol., 207, 2003, cc.213-233. В целом, метод состоял в следующем: 0,75 мл находящихся на стадии экспоненциального роста TG1-клеток инокулировали 75 мкл элюированного маточного раствора фага в присутствии 0,5 мМ ИПТГ и инкубировали при 37°С в течение 1 ч в 96-луночных планшетах. Культуральные планшеты переносили в помещение с комнатной температурой и выращивали в течение ночи на орбитальном шейкере. Бактерии из полученных в течение ночи культур объемом 0,36 мл собирали фильтрацией через найлоновую мембрану с низкой способностью связывать белки (например, планшет типа Silent scren фирмы Nalgene) и обрабатывали на фильтре 200 мкл TES-буфера (30 мМ Трис, рН 8,0, 2 мМ ЭДТК, 20% сахарозы), содержащего 2 мг/мл лизоцима, в течение 10 мин при комнатной температуре для высвобождения секретируемого Fab из периплазматического пространства. Содержащие Fab-фрагмент экстракты собирали фильтрацией. Определяли концентрацию в экстракте Fab-фрагмента с помощью стандартных анализов. Осуществляли согласно описанному выше методу основанный на применении 300В4-клеток ELISA. В качестве положительного контроля включали в клеточный ELISA фаговый клон, экспрессирующий родительский Fab 3649. Относительную аффинность к связыванию вариантов Fab-фрагментов сравнивали путем определения зависимости сигнала ELISA от концентрации Fab. Например, на фиг.18 представлены результаты, полученные с вариантами Fab-фрагментов 3649, содержащими произвольную замену одной кислоты в VH CDR3. Fab 4B7 и 4G6 характеризовались существенно увеличенной аффинностью к связыванию с экспрессирующими человеческий CD19 300В4-клетками по сравнению с родительским Fab 3649.
Вторичный скрининг сфокусированных на одном CDR библиотек Fab: H
Несущие варианты CDR клоны Fab, для которых полученный при первичном скрининге сигнал ELISA был по меньшей мере на 10% выше, чем сигнал родительского Fab 3649, повторно выращивали в 15-миллилитровом масштабе и повторно анализировали с помощью такого же основанного на применении 300В4-клеток ELISA, используя взятые с дублированием лунки для подтверждения положительного результата. Получали в 15-миллилитровом масштабе экстракт Fab согласно протоколу, описанному у Wu H., Methods Mol Biol., 207, 2003, cc.197-212. Концентрацию Fab определяли стандартными анализами. Осуществляли согласно описанному выше методу основанный на применении 300В4-клеток ELISA. В качестве положительного контроля включали родительский Fab 3649. Клоны, для которых при вторичном скрининге сигнал был по меньшей мере на 10% выше, чем сигнал контрольного Fab 3649, секвенировали для определения идентичности замен одной аминокислоты, приводящих в повышенному связыванию с человеческим антигеном CD19. Идентифицированные секвенированием аминокислотные замены выделенных обладающих повышенной аффинностью клонов Fab-фрагментов антитела к CD19 представлены в таблице 34.
Таблица 34. Перечень оказывающих благоприятное действие замен одной аминокислоты, выделенных из сфокусированных на одном CDR библиотек Fab. Нумерация аминокислот дана согласно номенклатуре Кэбота.
Создание комбинаторной библиотеки Fab: Две комбинаторные библиотеки, содержащие все возможные оказывающих благоприятное действие замены одной аминокислоты, которые идентифицированы на основе сфокусированных на CDR библиотек, создавали путем гибридизации методом мутагенеза. Первую комбинаторную библиотеку создавали с использованием набора вырожденных олигонуклеотидов, которые кодируют как остатки родительского 3649, так и идентифицированные оказывающие благоприятное действие замены одной аминокислоты (таблица 35). Вторую комбинаторную библиотеку создавали, используя другой набор вырожденных олигонуклеотидов, которые кодируют только остатки, оказывающих наиболее благоприятное действие при замене одной аминокислоты, но не кодируют остатки родительского 3649 (таблица 36). Две библиотеки создавали и подвергали скринингу независимо друг от друга. Создание библиотек осуществляли согласно методу, описанному у Wu H., Methods Mol Biol., 207, 2003, cc.197-212; Wu и An, Methods Mol Biol., 207, 2003, cc.213-233. В целом, метод состоял в следующем: синтезировали и фосфорилировали наборы вырожденных праймеров. Осуществляли гибридизацию методом мутагенеза, используя все праймеры в одной реакции ренатурации и синтеза. Создание библиотек, их оценку и скрининг осуществляли согласно описанным выше методам. Профили ELISA шести комбинаторных Fab-клонов, обладающих наиболее высокой аффинностью к экспрессирующим человеческий рекомбинантный CD19 300В4-клеткам, показан на фиг.19. Клон 7Е12 выделяли из первой комбинаторной библиотеки, созданной с использованием вырожденных олигонуклеотидов, которые кодируют как родительские, так и оказывающие благоприятное действие замены остатков CDR. Клоны 14Н5, 15D7, 15D1, 16С9 и 16С4 выделены из второй комбинаторной библиотеки, созданной с использованием вырожденных олигонуклеотидов, которые кодируют только оказывающие наиболее благоприятное действие замены остатков CDR. Все фаговые клоны, представленные на фиг.19, секвенировали для определения аминокислотной последовательности вариантов CDR-участков, обладающих повышенной аффинностью к человеческому CD19.
Таблица 35. Вырожденные олигонуклеотиды, применяемые для создания комбинаторной фаговой библиотеки. Перечисленные олигонуклеотиды кодируют как родительские остатки, так и оказывающие благоприятное действие замены остатков, идентифицированные с помощью сфокусированных на одной замене в CDR библиотек.
Таблица 36. Вырожденные олигонуклеотиды, применяемые для создания комбинаторной фаговой библиотеки. Перечисленные олигонуклеотиды кодируют только оказывающие наиболее благоприятное действие замены остатков, идентифицированные с помощью сфокусированных на одной замене в CDR библиотек.
| Название | SEQ ID NO. | |
| L24CDR1Lp7Iтолько | AACTAATGCCAAAaGTAatAACACTTTCGCTGGC TCTG | 165 |
| L25CDR1Lp7Ip9Hтолько | CATAAAACTAATGCCAAAatgAatAACACTTTCG CTGGCTCTGCAGG | 166 |
| L26CDR1Lр8Нтолько | CCAGTTCATAAAACTAATGCCAAAatgATCAAC ACTTTCGCTGGCTC | 167 |
| L27CDR2Lp1Eтолько | GGATCCTTGATTGGATGCctCATGGATGAGGAG CTTTGG | 168 |
| L28CDR3Lp8I/Nтолько | GTCCCTCCGCCGAACGTGwtTGGAACCTCCTTA CTTTGC | 169 |
| Н29СОР1Нр3Етолько | CCTGGCGGACCCAGTTCATCtcAGAGCTACTGA AGGTGAATCC | 170 |
| H30CDR1Hp3Ep5Yтолько | CCTGGCGGACCCAGTaCATCtcAGAGCTACTGA AGGTGAATCC | 171 |
| Н31СОР1Нр5Yтолько | CCTGGCGGACCCAGTaCATCCAAGAGCTACTGA AGGTGAATCC | 172 |
| Н32СОР2Нр13Атолько | GAATCTGCCCTTGAACTTCgCATTGTAGTTAGT ATCTCCATC | 173 |
| Н33СОР3Нр8Ртолько | CTTGGCCCCAGTAGTCAAAGTCTcgAACCGTAG TAATAAATCCTG | 174 |
| H34CDR3Hp8R/Hтолько | CTTGGCCCCAGTAGTCAAAGTCgygAACCGTAG TAATAAATCCTG | 175 |
7.11.2. Характеристики вариантов антител к СР19 с повышенной аффинностью
Полинуклеотиды, кодирующие вариабельные области вариантов 7Е12, 14Н5, 15D7, 15D1, 16С9 и 16С4 Fab-фрагментов, обладающих повышенной способностью к связыванию антител к CD19, амплифицировали с помощью ПЦР из соответствующих кодирующих V-область векторов на основе фага М13 с помощью ДНК-полимеразы pfu (см. Dall'Acqua и др., Methods 36, 2005, cc.43-60). Затем полинуклеотиды индивидуально клонировали в экспрессионных векторах млекопитающих, которые кодируют основной энхансер немедленно-раннего промотора человеческого циомегаловируса (hCMVie), промотор и 5'-нетранслируемую область (М. Boshart и др., Cell 41, 1985, cc.521-530). В этой системе человеческая γ1-цепь секретируется наряду с человеческой к-цепью (S. Johnson и др., Infect. Dis. 176, 1997, cc.1215-1224). Различные конструкции подвергали кратковременной экспрессии в клетках линии НЕК-293 и собирали через 72 и 144 ч после трансфекции. Секретируемые растворимые человеческие IgG1 непосредственно очищали из кондиционированной среды, используя 1 мл колонку HiTrap с протеином А, согласно инструкциям производителя (фирма APBiotech, Inc., Пискатавей, шт.Нью-Джерси). Очищенные человеческие IgG1 (как правило, гомогенность которых >95% по данным ДСН-ПААГ) подвергали диализу в противотоке забуференного фосфатом физиологического раствора (ЗФР), быстро замораживали и хранили при -70°С.
7.11.2.1. Анализы с помощью клеточного ELISA
Способность антител IgG-типа 7Е12, 14Н5, 15D7, 15D1, 16С9 и 16С4 связываться с человеческим CD19 оценивали с помощью клеточных анализов связывания CD19. Использовали три различные клеточные линии в качестве иммобилизованных реагентов: (I) экспрессирующие человеческий рекомбинантный CD19 300В4-клетки (фиг.20), (II) Раджи-клетки (фиг.21) и (III) клетки Дауди (фиг.22). Все три клеточные линии культивировали согласно стандартным протоколам. Стандартную процедуру ELISA можно применять для клеточного анализа связывания CD19. Например, индивидуальные лунки 96-луночного планшета с U-образным дном засевали 1×105 300В4-клеток и инкубировали в течение ночи. Клетки однократно промывали буфером для ELISA перед инкубацией на льду с различными количествами антител к CD19. Реакции связывания осуществляли в трех повторностях для каждой изучаемой концентрации антитела. При анализе в качестве положительного контроля использовали лунки с антителом 3649 к CD19. После инкубации с антителом 300В4-клетки трижды отмывали 200 мкл буфера для ELISA. Связанные с клеточной поверхностью антитела к CD19 выявляли, используя козье антитело к человеческой каппа-цепи, конъюгированное с пероксидазой из хрена, согласно стандартным протоколам.
Полученные с помощью ELISA кривые связывания антител 3649 к CD19 IgG-типа 7Е12, 14Н5, 15D7, 15D1, 16С9 и 16С4 при использовании 300В4-клеток, Раджи-клеток или клеток Дауди в качестве иммобилизованных реагентов представлены на фиг.20-22. Все изученные антитела за исключением 16С9 и 15D1 характеризовались более высокой аффинностью к связыванию с клеточной поверхностью, несущей человеческий CD19, чем контрольные антитела 3649. Аффинность к связыванию 6С9 и 15D1 соответствовала аффинности антитела 3649, когда в качестве иммобилизованного реагента применяли 300В4-клетки. Аффинность к связыванию антител 16С9 и 15D1 с человеческим CD19 превышала аффинность контрольного антитела 3649, когда в качестве иммобилизованного реагента применяли Раджи-клетки или клетки Дауди.
7.11.2.2. 14Н5-варианты антитела к CD19 с модифицированным сайтом деамидирования
Первичные аминокислотные последовательности антител 3649, 7Е12, 14Н5, 15D7 и 16С9 содержат мотив деамидирования NG (остатки 60-61 VH CDR2). Создавали три варианта 14Н5 с «минус деамидинованием» путем замены остатка аспарагина (N) в положении 60 по Кэботу на тирозин (Y), аспарагиновую кислоту (D) или лейцин (L). Содержащие Y60, D60 и L60 варианты VH-области 14Н5 создавали в виде 14H5-YG (SEQ ID NO:107), 14H5-DG (SEQID NO:108) и 14H5-LG (SEQ ID NO:109) соответственно. Экспрессионные векторы антител, содержащие полинуклеотиды, которые кодируют варианты 14Н5 с «минус деамидинованием», создавали с помощью стандартных методов молекулярного клонирования. Полученные в результате кратковременной экспрессии антитела к CD19 IgG-типа 14H5-YG, 14H5-DG и 14H5-LG очищали согласно описанному выше методу. Аффинность к связыванию антител 14H5-YG, 14H5-DG и 14H5-LG оценивали с помощью клеточного анализа ELISA, используя экспрессирующие человеческий рекомбинантный CD19 300В4-клетки в качестве иммобилизованного реагента. Антитела к CD19 14Н5 и 16С4 применяли в качестве положительного контроля. Полученные результаты представлены на фиг.23. Аффинность к связыванию антител 14H5-YG, 14H5-DG и 14H5-LG с экспрессирующими рекомбинантный человеческий CD19 300В4-клетками оказалась ниже, чем у антител 14Н5 или 16С4.
7.11.2.3. Кинетика диссоциации антител к CD19 с созревшей аффинностью
Кинетику диссоциации антител к CD19 IgG-типа 7Е12, 14Н5, 15D7, 15D1, 16С9 и 16С4 оценивали по элиминации в течение времени связанных с клеточной поверхностью антител к CD19. В целом, метод состоял в следующем: клетки Рамоса инкубировали с антителом к CD19 с созревшей аффинностью 7Е12, 14Н5, 15D7, 15D1, 16С9 или 16С4 в соответствии со стандартными протоколами окрашивания. Клетки отмывали после инкубации для элиминации любого несвязанного первичного антитела и затем инкубировали при 37°С в течение 0, 30 или 60 мин. В конце периода инкубации клетки окрашивали конъюгированным с RPE мышиным антителом к Fc-фрагменту IgG человека в качестве вторичного реагента согласно стандартным протоколам и анализировали проточной цитометрией. Контрольные образцы клеток инкубировали с антителом 3649 к CD19 или применяемым в качестве контроля референс-антителом к CD20 перед инкубацией при 37°С. Данные о средней интенсивности флуоресценции, измеренные в различные моменты времени с использованием различных антител, представлены на фиг.24А. 100%-ная средняя интенсивность флуоресценции соответствует интенсивности окрашивания, обнаруженной в момент времени 0, для данного антитела.
Снижение средней интенсивности флуоресценции, обнаруженная для антител к CD19 с созревшей аффинностью 7Е12, 14Н5, 15D7, 15D1, 16С9 и 16С4, ниже, чем обнаруженная для применяемого в качестве контроля референс-антитела к CD20. В противоположность этому, при окраске антителом 3649 к CD19 клеток Рамоса, характерно более быстрое снижение средней интенсивности флуоресценции по сравнению с применяемым в качестве контроля референс-антителом к CD20 (фиг.24А).
В другом эксперименте клетки Рамоса окрашивали конъюгированным с Alexa 647 антителом к CD19 16С4, 3649 или НВ12В согласно стандартным протоколам. После окрашивания клетки отмывали для удаления несвязанного антитела и затем инкубировали при 37°С в течение 0, 30 или 60 мин. Затем клетки анализировали с помощью проточного цитометра. Конъюгированное с флуоресцентной меткой антитело к CD20 включали в эксперименты в качестве референс-контроля. Данные о средней интенсивности флуоресценции (MFI), полученные в различные моменты времени, представлены на фиг.24Б. MFI выражали в виде фракции значений MFI, обнаруженных в момент времени 0. Снижение MFI, обнаруженное для антитела к CD19 с созревшей аффинностью 16С4, оказалось существенно более медленным, чем потеря MFI, обнаруженная в случае антител к CD19 3649 или НВ12В. Для применяемого в качестве контроля референс-антитела к CD20 характерна такая же скорость диссоциации, что и для антитела к CD19 3649 или НВ12В.
7.11.2.4. Окрашивание клеточной поверхности антителами к CD19 с созревшей аффинностью
Осуществляли иммуноокрашивание клеток Дауди антителами к CD19 7Е12, 14Н5, 15D7, 15D1, 16С9 и 16С4 к CD19 и конъюгированным с RPE козьим антителом к (Fab')2-фрагменту IgG человека в качестве вторичного реагента согласно стандартным протоколам. Иммуноокрашенные клетки анализировали с помощью проточного цитометра. Данные о медианной интенсивности флуоресценции (MFI) клеток, окрашенных различными концентрациями первичного антитела, представлены на фиг.25. Клетки, окрашенные антителом 3649 к CD19, включали в качестве референс-контроля. Интенсивность окрашивания, выявленная для антител к CD19 7Е12, 14Н5, 15D7, 16С9 и 16С4, оказалась выше по сравнению с интенсивностью окрашивания клеток антителом 3649 при всех изученных концентрациях. Интенсивность окрашивания, выявленная для антитела 15D1, оказалась такой же, что и интенсивность окрашивания клеток антителом 3649 при использовании антитела в низких концентрациях (0,5 мг/мл или менее). MFI окрашенных 15D1 клеток оказалась выше, чем интенсивность окрашивания клеток антителом 3649 при использовании антитела в более высоких концентрациях (1 мг/мл или более).
In vitro ADCC-активность антител к CD19 с созревшей аффинностью оценивали с помощью представленных в настоящем описании анализов. Например, результаты, полученные для антител 16С4, 14Н5 и 14H5-DG, при использовании клеток Дауди в качестве клеток-мишеней, представлены на фиг.26. Антитело 3649 к CD19 применяли в качестве референс-контроля. Все три антитела с созревшей аффинностью характеризовались повышенной ADCC-активностью при применении антител в концентрациях 0,1 мг/мл или менее по сравнению с применяемым в качестве контроля референс-антителом 3649.
ADCC-активность антител 16С4, 14Н5 и 14H5-DG соответствовала активности антитела 3649 при применении антитела к концентрациях 1 мг/мл или выше.
ADCC-активность in vitro афукозилированных антител к CD19 с созревшей аффинностью также оценивали с помощью представленных в настоящем описании анализов. Например, опосредуемую афукозилированным антителом 16С4 (16C4-aFuc) ADCC оценивали, используя клетки Дауди в качестве клеток-мишеней (фиг.26). В эксперименты включали также 16С4, 3649-aFuc и антитело к CD20 в качестве контрольных референс-антител. Опосредуемая 16C4-aFuc ADCC оказалась существенно более высокой, чем активность 3649-aFuc, антитела к CD20 или фукозилированного антитела 16С4 в качестве референс-антител. Опосредуемая 16C4-aFuc ADCC оказалась сопоставимой с активностью антител.
ADCC-активность in vitro антител к CD19 16С4, 16C4-aFuc и 3649-aFuc характеризовали с помощью стандартизованного анализа in vitro ADCC с помощью различных клеток-мишеней. Антитело к CD20 включали в анализ в качестве контроля. Применяемые клетки-мишени характерны для различных В-клеточных злокачественных состояний, а также отличаются различной плотностью CD19 на клеточной поверхности (таблица 37). Относительную экспрессию CD19 и CD20 на поверхности клеток-мишеней определяли проточной цитометрией согласно стандартным протоколам. В таблице 37 представлены данные о средней интенсивности флуоресценции (MFI) на клетках-мишениях, окрашенных флуоресцентно-меченными антителом к CD20 или антителом к CD19 16С4. ADCC -реакцию осуществляли согласно описанным выше протоколам. Реакции проводили в трех повторностях, используя по 50000 эффекторных клеток и 20000 клеток-мишеней, что обеспечивало соотношение Е:Т 2,5:1. Трансгенные NK-клетки, экспрессирующие CD 16 и ассоциированные с осуществляющим передачу сигнала полипептидом FCεRI-γ, служили в качестве эффекторных клеток. ADCC-реакциям давали проходить в течение 4 ч при 37°С. ADCC-активность определяли при различных концентрациях антител. Данные выражали в виде % цитотоксичности как функции от концентрации антитела. Максимальное уничтожение клеток и значения ЕС50 (концентрации антител, необходимые для достижения цитотоксичности, составляющей половину от максимальной в применяемых условиях) определяли для комбинаций клетка-мишень/антитело с помощью стандартных методов. В таблице 37 представлены конечные результаты. Клетки Oci-LY19, KArpas-422, Nalm-6 и Намальвы представляют собой клетки, обнаруженные при DLCL, NHL, ALL и лимфоме Беркитта соответственно, оказались чувствительными к опосредуемой антителом 16С4-aFuc цитотоксичности, но в основном не чувствительными к опосредуемой антителом к CD20 ADCC. Клетки Дауди, Толедо, RL и Раджи оказались более чувствительными к опосредуемой антителом 16C4-aFuc цитотоксичности, чем к опосредуемой антителом к CD20 ADCC.
7.11.2.6. В-клеточное истощение in vivo с помощью антител к CD19 с созревшей аффинностью
Антитела к CD19 с созревшей аффинностью оценивали в анализе В-клеточного истощения, в целом, согласно описанному выше методу. Животных линии С57 В16 hCD19 tg +/- обрабатывали однократно i.v. дозой 10, 50 или 250 мкг антитела к CD19 с созревшей аффинностью 16С4 (16С4) или антитела к CD19 с созревшей аффинностью 14H5DG (14H5DG). Применяемых в качестве референс-контроля животных обрабатывали (I) антителом к CD19 3649 (3649), (II) Ре-вариантом антитела к CD19 3649 с повышенной ADCC-активностью (3649 3М) и (III) афукозилированным антителом к CD19 3649 (3649-aFuc). Применяемых в качестве отрицательного контроля животных обрабатывали (I) Fc-вариантом антитела к CD19 3649 с аномальной ADCC-активностью (3649 ТМ) или (II) антителом неродственной специфичности (R347). Находящиеся в кровотоке лимфоциты и селезеночные лимфоциты выделяли через 7 дней после обработки антителом. Выделенные клетки подвергали иммуноокрашиванию, как описано в таблице 5, для идентификации различных В-клеточных популяций. Образцы анализировали с помощью проточного цитометра согласно стандартным протоколам.
При использовании антитела к CD19 с созревшей аффинностью 16С4 обнаружен несколько более высокий уровень истощения В-клеток, чем при применении родительского антитела к CD19 3649. При использовании антител 3649-aFuc и 3649 3М обнаружено более выраженное истощение, чем при применении антитела 16С4 с созревшей аффинностью. Антитело к CD19 14H5DG с созревшей аффинностью оказалось менее эффективным в отношении истощения В-клеток, чем родительское антитело к CD19 3649.
7.11.2.7. Продолжительность восстановления уровня В-лимфоцитов после обработки однократной дозой антител к CD19 с созревшей аффинностью
Изучали продолжительность восстановления В-клеточного компартмента после введения однократной вызывающей истощение дозы моноклонального антитела к CD19 16C4-aFuc. Двадцать пять мышей линии С57 В16 hCD19 tg +/-(13 самцов, 12 самок возрастом 2,5-3 месяца) разделяли на 5 групп. За 1 неделю до обработки экспериментальными антителами (неделя -1) у животных оценивали общее состояние здоровья, взвешивали и отбирали небольшие аликвоты крови для каждого из анализов. В день 0 эксперимента 250 мкг МАт 16C4-aFuc, 50 мкг МАт 16C4-aFuc, 10 мкг МАт 16C4-aFuc, 250 мг контрольного антитела неродственной специфичности R347 или ЗФР вводили внутривенно животным из групп 1,2, 3, 4 и 5 соответственно. В день 7 (неделя 1) и после этого с еженедельными интервалами обследовали мышей в каждой группе и брали у них образцы крови. Образцы крови подвергали анализу методом проточной цитометрии для определения количества В-клеток, Т-клеток, NK.-T-клеток, нейтрофилов, моноцитов и дендритных клеток. Образцы крови дополнительно анализировали для определения сывороточных концентраций IgM, IgG1, IgG2b, IgG2c, IgG3, IgA, анти-dsДНК IgM, анти-dsДНК IgG, анти-ssДНК IgM, анти-ssДНК IgG, а также уровни в сыворотке IL-7, CXCL12, CXCL13 и BAFF. Измерения осуществляли согласно стандартным процедурам. Схема эксперимента и полученные результаты представлены на фиг.38.
Не выявлено никаких заметных побочных действий в процессе обработки лекарственным средством. Животные во всех экспериментальных группах сохраняли нормальные уровни активности и вес (фиг.38Б). Уровни В-клеток у животных, которых обрабатывали антителом к CD19 16C4-aFuc, оказались существенно ниже, чем у контрольных животных (фиг.38В и Г). В-клеточное истощение оказалось полным даже у животных, которых обрабатывали 10 мг 16C4-aFuc. Продолжительность В-клеточного истощения зависела от дозы; продолжительность истощения возрастала при применении более высокой дозы антитела 16C4-aFuc. В-клетки у животных, которых обрабатывали 10 мкг 16C4-aFuc, начинали восстанавливаться на неделе 3 и их уровень достигал нормы на неделе 5. Восстановление у животных, которых обрабатывали 50 мкг 16C4-aFuc, произошло на 9 неделе. У животных, которых обрабатывали 250 мкг 16C4-aFuc, сохранялось практически полное отсутствие В-клеток на неделе 11 эксперимента. Концентрация в крови Т-клеток, NK-T-клеток, NK-клеток, дендритных клеток, нейтрофилов и моноцитов не изменялась под воздействием антитела 16C4-aFuc (данные не представлены). Уровни в сыворотке IgM, IgG1 и IgG2b также снижались в результате обработки антителом 16C4-aFuc (фиг.38Д-Ж). Снижение уровней иммуноглобулина зависело от дозы; выраженное снижение уровней обнаружено только у животных, обработанных 50 или 250 мкг антитела 16C4-aFuc. Восстановление уровней иммуноглобулина в целом происходило параллельно с восстановлением В-клеточного компартмента.
7.11.2.8. ИЭФ-ПААГ-анализ антител к CD19
Осуществляли нативный анализ методом изоэлектрического фокусирования-электрофореза в полиакриламидном геле (ИЭФ-ПААГ) антител к CD19 16С4, 16С9, 7Е12, 14Н5, 15D7, 15D1, 14H5-DG и 3649 согласно стандартным протоколам. В предварительно подготовленные амфолиновые гели (фирма Amersham Biosciences, значение pI 3,5-9,5) вносили 8 мкг очищенного белка. Образцы белка подвергали диализу в противотоке 10 мМ гистидинового буфера, рН 6,0 перед внесением в гель. Применяли стандартные маркеры с широким диапазоном значений рI (фирма Amersham, диапазон pI 3-10,8 мкл) для определения относительных значений pI. Электрофорез осуществляли при 1500 В, 50 мА в течение 105 мин. Гели фиксировали в течение 45 мин и окрашивали в течение ночи при комнатной температуре красителем Simp1y Blue (фирма Invitrogen). Обесцвечивание осуществляли с помощь раствора 25% этанола, 8% уксусной кислоты. Изоэлектрические точки определяли с помощью денситометра Bio-Rad GS-800 с использованием программного обеспечения Quantity One Imaging. Результаты окрашивания геля кумасси бриллиантовым голубым представлены на фиг.27. Изоэлектрические точки антител 16С4, 16С9, 7Е12, 14Н5, 15D7, 15D1, 14H5-DG и 3649 составляли 7,83, 8,04, 7,69, 7,76, 7,61, 7,72, 7,48 и 7,75 соответственно.
7.11.3. Fc-вариант с созревшей аффинностью антител к CD19
Создавали экспрессионные векторы для антител, кодирующие Ре-вариант антитела 16С4, содержащий аминокислотные замены L234F/L235F/P331S или L234F/L235Y/P331S (обозначены далее как «16C4-235F» и «16C4-235Y» соответственно), с помощью методов, описанных в US 2004/0132101 и US 2005/0054832, оба на имя Lazar и др. В целом, метод состоял в следующем: экспрессионный вектор для антитела, кодирующий 16С4, модифицировали с помощью набора для сайтнаправленного мутагенеза (например, QuickChange (фирма Promega)) путем интродукции необходимых замен нуклеотидых остатков в полинуклеотидную последовательность, кодирующую константную область тяжелой цепи, для создания экспрессионного вектора для антител 16C4-235F или 16C4-235Y. Очищенный Fc-вариант антитела 16С4 создавали путем трансфекции клеток линии HEK239F соответствующим экспрессионным вектором для антитела. Трансфектированные клетки подпитывали в день 3 и 6 и собирали содержащую антитело кондиционированную среду в день 9. Антитело очищали из кондиционированной среды, используя предварительно подготовленную колонку с протеином А (фирма GE Healthcare). Антитело элюировали из колонки с помощью буфера с низким значением рН, нейтрализовали и подвергали диализу в противотоке ЗФР. Концентрацию очищенного антитела рассчитывали на основе оптической плотности раствора, измеренной при 280 нм.
Определение констант равновесия связывания (KD): Константы равновесия связывания для всех Fcγ-рецепторов (человеческие FcγRI, FcγRIIA, FcγRIIB, FcγRIIIA-V158, а также мышиные FcγRIIB, FcγRIII и FcγRIV) с 16С4 и его Fc-вариантами определяли с помощью устройства BIAcore 3000 (Уппсала, Швеция). В целом, метод состоял в следующем: все IgG иммобилизовывали на различных проточных ячейках двух сенсорных чипов типа СМ5, используя стандартную химию аминового сочетания согласно рекомендациям производителя. Уровни иммобилизованных IgG составляли от 8194 до 8725 относительных единиц (RU). Готовили маточные растворы рекомбинантно экспрессируемых внеклеточных доменов всех FcγR с концентрацией либо 4000, либо 16000нМ и затем осуществляли их серийное разведение до требуемых концентраций, используя прилагаемый к устройству буфер (50 мМ HBS-буфер, содержащий 0,01М HEPES, рН 7,4, 0,15М NaCl, 3 мМ ЭДТК и 0,005% Р-20). Затем осуществляли с дублированием инъекции FcγR во всех концентрациях на поверхность всех чипов с иммобилизованными IgG со скоростью потока 5 мкл/мин. Получали данные о связывании в течение примерно 50 мин, после чего в течение 30 с впрыскивали 5 мМ НС1 между инъекциями для регенерации находящихся на поверхности IgG. Также осуществляли несколько впрыскиваний буфера между сериями инъекций. Одну из таких инъекций буфера применяли для получения данных для референс-ячейки для коррекции наборов исходных данных. После объединения всех данных о связывании наборы индивидуальных данных усредняли для каждой концентрации FcγR, после чего аппроксимировали для изотермы связывания 1:1, из которой выводили константы равновесия связывания KD. Для осуществления этого применяли программное обеспечение BIAevaluation, версия 4.1. Значения KD (нМ) представлены в таблице 38.
| Таблица 38 | |||
| Аффинности к связыванию (KD, нМ) различных человеческих IgG1 с человеческими и мышиными FcγR | |||
| 16С4 | 16C4-235F | 16C4-235Y | |
| Человеческий FcγRI | 19 | 1530 | 8650 |
| Человеческий FcγRIIA | 1280 | 6360 | 6980 |
| Человеческий FcγRIIB | 14500 | 6810 | 17100 |
| Человеческий FcγRIIIA (V158) | 574 | 4610 | 5140 |
| Мышиный FcγRIIB | 1470 | 2820 | 2670 |
| Мышиный FcγRIV | 329 | 11100 | H/O |
| Мышиный FcγRIII | 6360 | 10900 | 9240 |
7.12. Выделение вариантов антитела к CD19 16С4 с созревшей аффинностью
Варианты антитела 16С4 с созревшей аффинностью идентифицировали, используя представленные в настоящем описании протоколы. Скрининг включал две стадии. На первой стадии основной задачей являлась идентификация вариантов Fab-фрагментов 16С4, имеющих замену одной аминокислоты, что приводило к повышенной активности связывания антител с находящимся на клеточной поверхности человеческим CD19. Варианты Fab-фрагментов 16С4, имеющих одну оказывающую благоприятное воздействие аминокислотную замену, идентифицировали путем скрининга сфокусированных на одном CDR фаговых дисплейных библиотек. Вторая стадия скрининга включала скрининг комбинаторной библиотеки Fab-клонов, которая включала все возможные оказывающие благоприятное воздействие замены одной аминокислоты, идентифицированные либо (I) на первой стадии процесса созревания аффинности 16С4, либо (II) в процессе созревания аффинности антитела к CD19 3649.
CDR-специфические фаговые дисплейные библиотеки создавали согласно описанному выше методу. Библиотеки подвергали скринингу путем тестирования большого количества фаговых клонов (примерно 400 клонов на библиотеку) с использованием одноточечного клеточного анализа связывания (Lu и др., J. Immunol. Methods 314, 2006, cc.74-79). Реагенты и устройства приобретали у фирмы Meso Scale Discovery; анализы осуществляли согласно инструкциям производителя. В целом, метод состоял в следующем: высевали 5000 клеток Раджи или 300В4-клеток/лунку и инкубировали в течение 1 ч при КТ в 25 мкл 1× ЗФР; лунки блокировали 25 мкл 30% FBS в течение 20 мин при КТ; супернатант отбрасывали; добавляли 25 мкл Ат к CD19 в каждую лунку и инкубировали в течение 1 ч при КТ; лунки отмывали трижды 1 × ЗФР; добавляли в каждую лунку по 25 мкл 0,25 мкг/мл козьего антитела к человеческому (Fab')2, конъюгированного с меткой MSD, и инкубировали в течение 1 ч при КТ; лунки отмывали трижды 1× ЗФР; считывали сигнал с использованием 150 мкл 1× буфера Т Read. Кривая связывания репрезентативного клона, содержащего оказывающую благоприятное воздействие аминокислотную замену в VH CDR2, представлена на фиг.32. Оказывающие благоприятное воздействие аминокислотные замены, идентифицированные с помощью библиотек, специфических для CDR 16C4, представлены в таблице 39.
| Таблица 39 | |||
| Оказывающие благоприятное воздействие аминокислотные замены, идентифицированные с помощью CDR-специфических фаговых дисплейных библиотек антитела 16C4 | |||
| Клон | Замена | Положение | |
| CDR1 VH | 17В7 | Ser>Val | 32 |
| CDR2 VH | 64D4 | Pro>Leu | 52A |
| CDR2 VL | 40А5 | Gln>Arg | 54 |
| 40С10 | Gln>Thr | 54 | |
| 43А10 | Gln>Ala | 54 | |
| CDR3 VL | 2F7 | Gln>Ala | 89 |
Комбинаторные фаговые дисплейные библиотеки получали согласно описанному выше методу. Специфические для Fab 16C4 олигонуклеотиды, которые применяли для создания библиотеки, перечислены в таблице 40. Индивидуальные Fab-клоны из комбинаторной библиотеки оценивали в отношении связывания с клетками 300В4 и Раджи (Lu и др., J. Immunol. Methods 314, 2006, cc.74-79). Кривые связывания репрезентативных Fab-клонов представлены на фиг.33А-Б. Fab-клоны с повышенной активностью к связыванию с клетками 300В4, клетками Раджи или с обоими типами клеток секвенировали с помощью стандартных методов. Обобщенные данные о аминокислотных заменах, обнаруженных в последовательностях CDR уникальных Fab-клонов, представлены на фиг.33В.
Шесть Fab-клонов вариантов с созревшей аффинностью антитела 16С4, которые обладали повышенной связывающей активностью с находящимся на клеточной поверхности человеческим антигеном CD19, трансформировали с получением полноразмерных антител типа IgG1 с помощью представленных в настоящем описании методов. Связывающую активность антител к CD19 с созревшей аффинностью 3C3, 6F7, 2 В11, 6С11, 9G7 и 5С4 характеризовали с помощью различных клеточных анализов. На фиг.34 представлены результаты, полученные с помощью ECL-анализа с использованием клеток линии 300.В4 (Lu и др., J. Immunol. Methods 314, 2006, cc.74-79). Активность связывания с CD19 вариантов антитела 16С4 с созревшей аффинностью оказалась выше, чем у контрольных антител 16С4 или 3649.
Окрашивание клеточной поверхности антителами к CD19 с созревшей аффинностью: Осуществляли иммуноокрашивание клеток Дауди и клеток Раджи с помощью антител к CD19 3С3, 6С11 и 9G7 и конъюгированного с RPE козьего антитела к (Fab')2-фрагменту IgG человека в качестве вторичного реагента согласно стандартным протоколам. Иммуноокрашенные клетки анализировали с помощью проточного цитометра. Данные о медианной интенсивности флуоресценции (MFI) окрашенных клеток с использованием различных концентраций первичного антитела представлены на фиг.35. Клетки, окрашенные антителом к CD19 16С4, включали в анализ в качестве референс-контроля. Интенсивность окрашивания антителами с созревшей аффинностью 3С3 и 6С11 клеток Раджи при применении концентрации антитела 0,0625-0,25 мкг/мл оказалась выше, чем обнаруженная для применяемого в качестве контроля 16С4. Интенсивность окрашивания клеток Раджи антителами с созревшей аффинностью и контрольными антителами оказалась одинаковой при применении антител в концентрации 0,5-10 мкг/мл. Окрашивание клеток Раджи антителом 9G7 оказалось таким же, что и контрольным антителом при применении антител в более низких концентрациях (0,0625-0,25 мкг/мл) и более слабой, чем при использовании контрольных антител в более высоких концентрациях (0,5-10 мкг/мл). Значение медианной FI окрашенных 9G7 и 6С11 клеток Дауди оказалась выше, чем окрашенных 16С4 клеток. Значение медианной FI окрашенных 3C3 клеток Дауди оказалась выше, чем окрашенных контрольными антителами клеток в концентрациях 0,0625 и 0,125 мкг/мл, и практически такой же, что и у окрашенных контрольными антителами клеток в концентрациях 0,25-10 мкг/мл.
АРСС-активность in vitro вариантов антител к CD19 с созревшей аффинностью 16С4: ADCC-активность in vitro антител к CD19 с созревшей аффинностью оценивали с помощью анализов, представленных в настоящем описании. Например, результаты, полученные при применении антител 3C3, 6С11 и 9G7 и клеток Раджи и Дауди в качестве клеток-мишеней, представлены на фиг.36 и 37 соответственно. Антитело к CD19 16С4 применяли в качестве референс-контроля. У всех трех антител с созревшей аффинностью обнаружена практически такая же ADCC-активность, что и у контрольного антитела в изученных концентрациях (0,0001-10 мкг/мл).
Специалистам в данной области должно быть очевидно, что варианты с созревшей аффинностью антитела к CD19 16С4 можно дополнительно модифицировать с помощью протоколов, представленных в настоящем описании. В частности антитела 3C3, 6С11 и 9G7 можно модифицировать с целью включения в них любого из вариантов Fc-фрагментов, представленных в настоящем описании. Можно получать также афукозилированную версию антител. Антитела с созревшей аффинностью можно характеризовать также с помощью анализов, представленных в настоящем описании. В частности, с помощью протоколов, представленных в настоящем описании, можно оценивать способность антител 3C3, 6С11 и 9G7 опосредовать ADCC, вызывать in vivo истощение В-клеток, снижать размер ксенотрансплантатов опухолей, ингибировать стимулированную анти-IgM/CpG В-клеточную пролиферацию.
7.13. Опосредуемое антителом к CD19 ингибирование В-клеточной пролиферации
7.13.1. Индуцированное обработкой антителом к CD19 фосфорилирование CD19
Инкубировали 10 миллионов клеток в течение 15 мин в присутствии 5 мкг/мл антитела к CD19 3649, 3649-3М, 3649-aFuc, 3649-TM или 16С4. Контрольные клетки, обработанные антителом R347 неродственной специфичности, а также контрольные клетки, не обработанные антителом, включали в эксперимент в качестве отрицательных контролей. После инкубации получали клеточные лизаты и подвергали иммунопреципитации согласно стандартным протоколам. Продукт, полученный в результате иммунопреципитации и включающий клеточный лизат, разделяли с помощью ДСН-ПААГ методом Лэммли, переносили на твердую подложку (нитроцеллюлоза, фирмы Invitrogen, каталожный номер LC2001) и подвергали Вестерн-блоттингу. Иммунопреципитацию осуществляли с использованием 2 мкг антитела к CD19 НВ12В согласно стандартным протоколам. Уровни общего белка CD19 и фосфорилированного CD19 определяли в продукте, полученном в результате иммунопреципитации Вестерн-блоттингом, используя (1:1000) антитело к CD19 (фирма Cell Signaling Technology, №3574) или (1:250) антитело к фосфотирозину (PY20) (фирма Santa Cruz Biotechnology. №sc-508 HRP) соответственно. Уровни фосфорилированного белка Erk1/2 и общего белка Erk1/2 в клеточном лизате выявляли Вестерн-блоттингом, используя (1:2000) антитело к фосфоЕгк1/2 (фирма Cell Signaling Technology. №9106S) и (1:1000) антитело к Erk1/2 (фирма Cell Signaling Technology, №9102) соответственно.
На фиг.39 показаны результаты иммунопреципитации (IP) HB12B после Вестерн-блоттинга. Кроме полученных в результате иммунопреципитации образцов из различных экспериментальных клеточных лизатов («3649», «3649-3М», «3649-aFuc», «3649-TM» или «16С4») и лизатов контрольных клеток («nil» и «R347»), мембраны содержали также антитело HB12B только в полосе, соответствующей контролю («только Ат»). Общие уровни белка CD19 оказались практически идентичными во всех полученных в результате иммунопреципитации образцах. Уровни фосфорилированного CD19 оказались существенно выше в образцах, полученных после иммунопреципитации клеточных лизатов из обработанных антителами к CD19 клеток, чем в контрольных образцах. На фиг.39Б представлены результаты, полученные методом Вестерн-блоттинга, лизатов цельных клеток. Общие уровни белка Erk1/2 оказались практически одинаковыми в лизатах цельных клеток. Уровни фосфорилированного Erk1/2 оказались существенно выше в клеточных лизатах, полученных из обработанных антителами к CD19 клеток, чем в контрольных образцах.
7.13.2. Обработка антителами к CD19 не ингибирует опосредуемую анти-IgM активацию Erk1/2
Один миллион клеток стимулировали 5 мкг/мл антитела к IgM или РМА (50 нг/мл)/иономицин (1 мкМ) в течение 5 или 10 мин в присутствии либо 10 мкг/мл антитела к CD19 3648-3М, либо 10 мкг/мл контрольного антитела R347. Клетки, обработанные только 3649 или R347, включали в качестве контрольных клеток. Клетки собирали и лизировали в конце периода инкубации. Лизат цельных клеток разделяли с помощью ДСН-ПААГ методом Лэммли, переносили на нитроцеллюлозную подложку-мембрану и подвергали Вестерн-блоттингу, используя стандартные протоколы. Осуществляли Вестерн-блоттинг, используя антитело к фосфоЕгН/2 и антитело к Erk1/2, для определения уровней фосфорилированного Erk1/2 и общего Erk1/2 соответственно в клеточных лизатах. Результаты представлены на фиг.39 В-Г.
Общие уровни Erk1/2 оказались практически идентичными в лизатах цельных клеток. Основной уровень фосфорилированного Erk1/2 в обработанных только антителом 3649 клетках оказался существенно выше, чем в обработанных только R347 клетках. Стимуляция анти-IgM или РМА/иономицином приводила к повышению уровней фосфорилированного Erk1/2, которые превышали основной уровень в клетках, обработанных и 3649, и R347. Уровень фосфорилирования Erk1/2 оказался существенно более высоким после стимуляции РМА/иономицином, чем после стимуляции антителом к IgM.
7.13.3. Обработка антителом к CD19 ингибирует индуцированную анти-IgM/CD40 В-клеточную пролиферацию
Периферические В-клетки очищали из 200 мл крови с помощью набора для выделения В-клеток (фирма Miltenyi Biotec, №130-091-151). Высевали 100000 клеток в 96-луночный планшет с U-образным дном (100 мкл 1х10 клеток/ мл). Затем к клеткам добавляли в объеме 50 мкл антитело в соответствующей концентрации. Планшет возвращали в термостат на 15 мин. Затем добавляли к клеткам стимулирующие агенты в объеме 50 мкл. Конечный объем смеси клетки /антитело/стимулирующий агент составлял 200 мкл. Клетки инкубировали в течение 3 дней. Определяли количество клеток в день 3 с помощью анализа жизнеспособности клеток типа CellTiter-Glo® Luminescent Cell Viability Assay (фирма Promega). Эксперименты на иммортализованных линиях клеток проводили используя 10000 клеток на лунку.
Данные о воздействии обработки антителом к CD19 на индуцированную анти-IgM/CD40 В-клеточную пролиферацию представлены на фиг.40. В -клетки высевали в присутствии 10 мкг/мл антител к CD19 3649, 3649-ТМ и 3649-3М. Через 15 мин В-клетки стимулировали только анти-IgM (5 мкг/мл), анти-IgM (5 мкг/мл)/СВ40 (1 мкг/мл) или только CpG (1 мкг/мл). В-клеточную симуляцию проводили в течение трех дней. Количество жизнеспособных клеток подсчитывали в конце эксперимента с помощью анализа жизнеспособных клеток CellTiter-Glo® Luminescent Cell Viability Assay (фирма Promega). В качестве контроля включали клетки, обработанные антителом R347 неродственной специфичности. Количество жизнеспособных клеток возрастало при стимуляции анти-IgM/CD40 или CpG, но не возрастало при стимуляции только антителом к IgM. Индуцированная aHra-IgM/CD40 клеточная пролиферация существенно в большей степени ингибировалась обработкой антителом к CD19. Уровень ингибирования (40%) был идентичным для всех изученных антител к CD19. На индуцированную CpG клеточную пролиферацию обработка антителом к CD19 не оказывала воздействия.
7.13.4. Обработка антителом к CD19 ингибирует индуцированную анти-IgM/CpG В-клеточную пролиферацию
Клеточную пролиферацию в ответ на различные стимулы оценивали с помощью анализа с использованием витального флуоресцентного красителя CFSE. В целом, метод состоял в следующем: очищенные В-клетки ресуспендировали в забуференном фосфатом физиологическом растворе (ЗФР) из расчета примерно 10 миллионов клеток на миллилитр. К этому конечному объему добавляли 1 мкМ CFSE в ЗФР. Конечная концентрация CFSE составляла 0,5 мкМ, а общее количество клеток составляла 5 миллионов на миллилитр. Суспензию выдерживали в темноте в течение 10 мин. Добавляли к смеси равный объем фетальной телячьей сыворотки (FCS) для удаления внеклеточного CFSE. Клетки отмывали и разводили средой. Высевали 100000 меченных с помощью CFSE клеток в 96-луночный планшет с U-образным дном (100 мкл 1×106 клеток/мл). Затем к клеткам добавляли в объеме 50 мкл антитело в соответствующей концентрации. Планшет возвращали в термостат на 15 мин. Затем добавляли к клеткам стимулирующие агенты в объеме 50 мкл. Конечный объем смеси клетки/антитело/стимулирующий агент составлял 200 мкл. Клетки инкубировали в течение 4 дней. В конце периода инкубации клетки отмывали, окрашивали 7-аминоактиномицином D (7-AAD) (фирма BD Bioscience) и анализировали с помощью проточного цитометра. Выявляли CFSE-сигнал живых клеток. Снижение CFSE-сигнала в CFSE-профиле клеточной популяции свидетельствует о клеточном делении. Уровень CFSE-сигнала коррелировал с уровнями клеточной пролиферации.
Очищенные периферические В-клетки стимулировали анти-IgM (1 мкг/мл)/ CpG (2 мкг/мл) или только CpG (2 мкг/мл) в течение четырех дней. Клеточную пролиферацию оценивали с помощью CFSE-анализа. На фиг.41 А показан CFSE-профиль стимулированных и нестимулированных контрольных клеток. CFSE-сигнал стимулированных IgM (1 мкг/мл)/ CpG (2 мкг/мл) клеток был существенно ниже, чем сигнал контрольных клеток, что свидетельствует о том что стимуляция IgM (1 мкг/мл)/ CpG (2 мкг/мл) приводила к значительной клеточной пролиферации. CFSE-профиль стимулированных только CpG клеток свидетельствует о лишь ограниченной клеточной пролиферации.
Антитело к CD19 16С4 ингибирует индуцированную анти-IgM/CpG В-клеточную пролиферацию
Очищенные периферические В-клетки стимулировали анти-IgM (1 мкг/мл)/ CpG (2 мкг/мл) в присутствии 5 мкг/мл контрольного антитела R347 или 5 мкг/мл антитела к CD19 16С4 в течение четырех дней. Клеточную пролиферацию оценивали с помощью CFSE-анализа. На фиг.41 Б показан CFSE-профиль В-клеток, стимулированных анти-IgM (1 мкг/мл)/ CpG (2 мкг/мл) в присутствии антитела R347 или 16С4. CFSE-профиль В-клеток, стимулированных анти-IgM (1 мкг/мл)/СрС (2 мкг/мл) в присутствии антитела R347, свидетельствует о значительной клеточной пролиферации. CFSE-профиль В-клеток, стимулированных анти-IgM (1 мкг/мл)/СрО (2 мкг/мл) в присутствии антитела к CD19 16С4 свидетельствует о менее существенной клеточной пролиферации по сравнению с контрольными клетками.
7.13.5. Fc-вариант антител к CD19 характеризуется измененными свойствами ингибирования
Очищенные периферические В-клетки стимулировали в течение четырех дней анти-IgM (1 мкг/мл)/ CpG (2 мкг/мл) в присутствии 5 мкг/мл контрольного антитела R347, Fc-варианта 3649-3М антитела к CD19 или Fc- варианта 3649-ТМ антитела к CD19. Клеточную пролиферацию оценивали с помощью CFSE-анализа. На фиг.42А показан CFSE-профиль В-клеток, стимулированных анти-IgM (1 мкг/мл)/ CpG (2 мкг/мл) в присутствии контрольного антитела R347. CFSE-профиль свидетельствовал о том, что 23,5+26,5+23,2=73,2% В-клеток прошли по меньшей мере один цикл клеточного деления. На фиг.42Б и В показаны CFSE-профиль В-клеток, стимулированных анти-IgM (1 мкг/мл)/ CpG (2 мкг/мл) в присутствии Fc-варианта 3649-ТМ и 3649-3М антитела к CD19 соответственно. CFSE-профиль свидетельствовал о том, что 44,8% и 30,3% В-клеток, стимулированных в присутствии Fc-вариантов 3649-ТМ и 3649-3М антитела к CD19 соответственно, прошли по меньшей мере один цикл клеточного деления в течение 4-дневного периода инкубации. Более детальный анализ всех трех CFSE-профилей продемонстрировал, что не только количество клеток, прошедших по меньшей мере один цикл деления, но также и количество клеток, прошедших более одного цикла деления с наиболее высокими и наиболее низкими уровнями клеточной пролиферации, обнаружено в присутствии R347 и 3649-3М соответственно. Обработка 3649-ТМ ингибировала клеточную пролиферацию менее эффективно, чем 3649-3М.
Очищенные В-клетки стимулировали в течение четырех дней анти-IgM (5 мкг/мл)/CpG (1 мкг/мл) в присутствии взятых в концентрации 5 мкг/мл следующих антител: R347, Fc-вариант R347-3M, 3649, Fc-вариант 3649-3М или Fc-вариант 3649-ТМ. Клеточную пролиферацию оценивали с помощью CFSE-анализа. CFSE-профиль В-клеток, стимулированных в присутствии R347, включали во все панели в качестве референс-стандарта. CFSE-профили В-клеток, стимулированных в присутствии Fc-варианта R347-3M, 3649, Fc-варианта 3649-3М или Fc-варианта 3649-ТМ R347-3M, представлены на панелях А-Г. Клеточная пролиферация в присутствии Fc-варианта R347-3M оказалась такой же, что и присутствии R347 в качестве референс-стандарта. Клеточная пролиферация ингибировалась всеми тремя антителами к CD19. Антитела дикого типа 3649 и Ре-вариант 3649-ТМ ингибировали клеточную пролиферацию в такой же степени. 3649-3М оказался более эффективным в отношении ингибирования В-клеточной пролиферации, чем антитела 3649 или 3649-ТМ.
Синергизм ингибирования антителами к CD19 и антителами к рецептору Рсгамма ИВ (TcyRIIb) или CD32b:
Приведенный ниже план эксперимента должен продемонстрировать также существует ли синергетическое взаимодействие между опосредуемым антителами к CD32b и антителом к CD19 ингибированием В-клеточной пролиферации. Очищенные В-клетки стимулировали в течение 4 дней анти-IgM (2 мкг/мл)/ CpG (2 мкг/мл) в присутствии (I) антитела к CD32b (например, AT 10), (II) антитела к CD19 или (III) и антитела к CD32b, и антитела к CD19. Клеточную пролиферацию можно оценивать с помощью CFSE-анализа. Как ожидается, синергизм между опосредуемым антителом к CD32b и антителом к CD19 игибированием В-клеточной пролиферации должен приводить к более низкой В-клеточной пролиферации в присутствии обоих антител, чем В-клеточная пролиферация, обнаруженная в присутствии любого одного антитела.
7.13.6. Антитела к CD19 эффективно интерализуются
Анализ интернализации антител: Клетки инкубировали с 5 мкг/мл меченных Alexa Flour 488 антител при 37°С в течение вплоть до 60 мин. Аликвоты клеток отбирали с 10-минутными интервалами, отмывали, разделяли на две части и помещали на лед. Одну половину аликвоты не обрабатывали, оставляя на льду. Вторую половину алкивоты обрабатывали в течение 45 с раствором ЗФР с низким значением рН (2,0), содержащим 0,03 М сахарозу и 10% FCS, для отделения всех связанных с клеточной поверхностью молекул. И обработанные кислотой, и необработанные образцы отмывали, фиксировали 4% параформальдегидом и анализировали с помощью проточного цитометра. Процент интернализированного антитела рассчитывали как соотношение сигнала флуоресценции промытых кислотой клеток (только внутренний сигнал) и сигнала необработанных клеток (общий сигнал от клеточной поверхности и внутренних компартментов).
На фиг.44 представлены данные о интернализации антител НВ12В, 3649 и 16С4 клетками Раджи в течение 60 мин. Из кривых интернализации следует, что поглощение антител к CD19 достигало максимума примерно через 20-30 мин. Максимум интернализации составлял примерно 50% для антител НВ12В и 3649 и -30% для антитела 16С4.
7.13.7. Потеря CD19 с клеточной поверхности через 24 ч после обработки антителом к CD19
Клетки инкубировали в присутствии антитела к CD19 в течение 24 ч. Популяцию контрольных клеток инкубировали в присутствии антитела R347 неродственной специфичности. После инкубации клетки собирали, промывали и инкубировали на льду в течение 10 мин в окрашивающем растворе, содержащем 5 мкг/мл антитела к CD19. Связанное с поверхностью антитело к CD19 выявляли путем окрашивания клеток в течение 10 мин конъюгированным с РЕ вторичным козьим антителом к человеческому IgG. Иммуноокрашенные клетки фиксировали в 4% параформальдегида и анализировали с помощью проточного цитометра. Уменьшение CD19 на поверхности рассчитывали путем сравнения средней интенсивности флуоресценции (MFI) обработанных антителом к CD19 клеток и MFI иммуноокрашенных обработанных R347 клеток (потеря с поверхности 0%) и окрашенных только вторичным антителом обработанных R347 клеток (потеря с поверхности 100%).
На фиг.45 представлены данные о потере CD19 с поверхности клеток линии Раджи и первичных В-клеток после инкубации в течение 24 ч в присутствии 5 мкг/мл антител к CD19 3649, 3649-3М, 3649-ТМ, 3648-aFuc и 16С4. Снижение уровня экспрессии CD19 на 55-70% и 65-90% на поверхности выявлено для клеток Раджи и первичных В-клеток соответственно после обработки антителами к CD19.
Специалистам в данной области должны быть очевидны или они могут установить с помощью не более чем общепринятых экспериментов многочисленные эквиваленты конкретных вариантов осуществления изобретения, предлагаемых в изобретении. Указанные эквиваленты подпадают под объем прилагаемой формулы изобретения.
В настоящем описании процитированы различные публикации, которые для всех целей полностью включены в настоящее описание в качестве ссылки. Описание предварительных заявок на патент US №60/842935, поданной 8 сентября 2006 г., 60/866917, поданной 22 ноября 2006 г., 60/911397, поданной 12 апреля 2007 г., 60/915309, поданной 1 мая 2007 г, и 60/939429, поданной 22 мая 2007 г., для всех целей полностью включены в настоящее описание в качестве ссылки.
Хотя выше изобретение описано с указанием с целью иллюстрации некоторых деталей и описанием примеров для облегчения понимания, должно быть очевидно, что при воплощении изобретения на практике можно осуществлять определенные изменения и модификации, которые подпадают под объем формулы изобретения.
Claims (21)
1. Выделенное очищенное гуманизированное моноклональное антитело, содержащее VH- и VL-область, где VH-область содержит аминокислотную последовательность, выбранную из группы, состоящей из: SEQ ID NО: 34, 102, 103, 104, 105, 106, 107, 108, 109, 191, 192 и 236; где VL-область содержит аминокислотную последовательность, выбранную из группы, состоящей из: SEQ ID NO: 62, 68, 110, 111, 112, 113, 193, 194, 195, 196, 197, 198, 199, 200, 202, 204, 205, 206 и 207; и где указанное антитело связывается с антигеном CD19 человека, или
его фрагмент, содержащий указанные выше VH- и VL-области, который связывается с антигеном CD19 человека.
его фрагмент, содержащий указанные выше VH- и VL-области, который связывается с антигеном CD19 человека.
2. Антитело по п.1, где указанное антитело выбрано из группы, состоящей из:
а) антитела, которое содержит VH-область, включающую аминокислотную последовательность SEQ ID NО: 34, и VL-область, включающую аминокислотную последовательность SEQ ID NO: 68,
b) антитела, которое содержит VH-область, включающую аминокислотную последовательность SEQ ID NO: 102, и VL-область, включающую аминокислотную последовательность SEQ ID NО: 110,
c) антитела, которое содержит VH-область, включающую аминокислотную последовательность SEQ ID NO: 103, и VL-область, включающую аминокислотную последовательность SEQ ID NO: 111,
d) антитела, которое содержит VH-область, включающую аминокислотную последовательность SEQ ID NО: 103, и VL-область, включающую аминокислотную последовательность SEQ ID NO: 113,
e) антитела, которое содержит VH-область, включающую аминокислотную последовательность SEQ ID NO: 104, и VL-область, включающую аминокислотную последовательность SEQ ID NО: 112,
f) антитела, которое содержит VH-область, включающую аминокислотную последовательность SEQ ID NО: 105, и VL-область, включающую аминокислотную последовательность SEQ ID NO: 111,
g) антитела, которое содержит VH-область, включающую аминокислотную последовательность SEQ ID NО: 106, и VL-область, включающую аминокислотную последовательность SEQ ID NО: 111,
h) антитела, которое содержит VH-область, включающую аминокислотную последовательность SEQ ID NО: 107, и VL-область, включающую аминокислотную последовательность SEQ ID NO: 111,
i) антитела, которое содержит VH-область, включающую аминокислотную последовательность SEQ ID NО: 108, и VL-область, включающую аминокислотную последовательность SEQ ID NО: 111,
j) антитела, которое содержит VH-область, включающую аминокислотную последовательность SEQ ID NО: 109, и VL-область, включающую аминокислотную последовательность SEQ ID NО: 111,
k) антитела, которое содержит VH-область, включающую аминокислотную последовательность SEQ ID NО: 191, и VL-область, включающую аминокислотную последовательность SEQ ID NО: 111,
l) антитела, которое содержит VH-область, включающую аминокислотную последовательность SEQ ID NО: 191, и VL-область, включающую аминокислотную последовательность SEQ ID NО: 193,
m) антитела, которое содержит VH-область, включающую аминокислотную последовательность SEQ ID NО: 191, и VL-область, включающую аминокислотную последовательность SEQ ID NО: 194,
n) антитела, которое содержит VH-область, включающую аминокислотную последовательность SEQ ID NO: 191, и VL-область, включающую аминокислотную последовательность SEQ ID NО: 195,
о) антитела, которое содержит VH-область, включающую аминокислотную последовательность SEQ ID NО: 192, и VL-область, включающую аминокислотную последовательность SEQ ID NО: 196,
р) антитела, которое содержит VH-область, включающую аминокислотную последовательность SEQ ID NО: 191, и VL-область, включающую аминокислотную последовательность SEQ ID NО: 197,
q) антитела, которое содержит VH-область, включающую аминокислотную последовательность SEQ ID NО: 191, и VL-область, включающую аминокислотную последовательность SEQ ID NО: 198,
r) антитела, которое содержит VH-область, включающую аминокислотную последовательность SEQ ID NО: 106, и VL-область, включающую аминокислотную последовательность SEQ ID NО: 199,
s) антитела, которое содержит VH-область, включающую аминокислотную последовательность SEQ ID NО: 106, и VL-область, включающую аминокислотную последовательность SEQ ID NО: 200,
t) антитела, которое содержит VH-область, включающую аминокислотную последовательность SEQ ID NО: 191, и VL-область, включающую аминокислотную последовательность SEQ ID NО: 202,
u) антитела, которое содержит VH-область, включающую аминокислотную последовательность SEQ ID NО: 106, и VL-область, включающую аминокислотную последовательность SEQ ID NО: 198,
v) антитела, которое содержит VH-область, включающую аминокислотную последовательность SEQ ID NО: 192, и VL-область, включающую аминокислотную последовательность SEQ ID NО: 204,
w) антитела, которое содержит VH-область, включающую аминокислотную последовательность SEQ ID NO: 191, и VL-область, включающую аминокислотную последовательность SEQ ID NО: 205,
х) антитела, которое содержит VH-область, включающую аминокислотную последовательность SEQ ID NО: 191, и VL-область, включающую аминокислотную последовательность SEQ ID NО: 206,
y) антитела, которое содержит VH-область, включающую аминокислотную последовательность SEQ ID NО: 191, и VL-область, включающую аминокислотную последовательность SEQ ID NО: 197, и
z) антитела, которое содержит VH-область, включающую аминокислотную последовательность SEQ ID NО: 191, и VL-область, включающую аминокислотную последовательность SEQ ID NО: 207.
а) антитела, которое содержит VH-область, включающую аминокислотную последовательность SEQ ID NО: 34, и VL-область, включающую аминокислотную последовательность SEQ ID NO: 68,
b) антитела, которое содержит VH-область, включающую аминокислотную последовательность SEQ ID NO: 102, и VL-область, включающую аминокислотную последовательность SEQ ID NО: 110,
c) антитела, которое содержит VH-область, включающую аминокислотную последовательность SEQ ID NO: 103, и VL-область, включающую аминокислотную последовательность SEQ ID NO: 111,
d) антитела, которое содержит VH-область, включающую аминокислотную последовательность SEQ ID NО: 103, и VL-область, включающую аминокислотную последовательность SEQ ID NO: 113,
e) антитела, которое содержит VH-область, включающую аминокислотную последовательность SEQ ID NO: 104, и VL-область, включающую аминокислотную последовательность SEQ ID NО: 112,
f) антитела, которое содержит VH-область, включающую аминокислотную последовательность SEQ ID NО: 105, и VL-область, включающую аминокислотную последовательность SEQ ID NO: 111,
g) антитела, которое содержит VH-область, включающую аминокислотную последовательность SEQ ID NО: 106, и VL-область, включающую аминокислотную последовательность SEQ ID NО: 111,
h) антитела, которое содержит VH-область, включающую аминокислотную последовательность SEQ ID NО: 107, и VL-область, включающую аминокислотную последовательность SEQ ID NO: 111,
i) антитела, которое содержит VH-область, включающую аминокислотную последовательность SEQ ID NО: 108, и VL-область, включающую аминокислотную последовательность SEQ ID NО: 111,
j) антитела, которое содержит VH-область, включающую аминокислотную последовательность SEQ ID NО: 109, и VL-область, включающую аминокислотную последовательность SEQ ID NО: 111,
k) антитела, которое содержит VH-область, включающую аминокислотную последовательность SEQ ID NО: 191, и VL-область, включающую аминокислотную последовательность SEQ ID NО: 111,
l) антитела, которое содержит VH-область, включающую аминокислотную последовательность SEQ ID NО: 191, и VL-область, включающую аминокислотную последовательность SEQ ID NО: 193,
m) антитела, которое содержит VH-область, включающую аминокислотную последовательность SEQ ID NО: 191, и VL-область, включающую аминокислотную последовательность SEQ ID NО: 194,
n) антитела, которое содержит VH-область, включающую аминокислотную последовательность SEQ ID NO: 191, и VL-область, включающую аминокислотную последовательность SEQ ID NО: 195,
о) антитела, которое содержит VH-область, включающую аминокислотную последовательность SEQ ID NО: 192, и VL-область, включающую аминокислотную последовательность SEQ ID NО: 196,
р) антитела, которое содержит VH-область, включающую аминокислотную последовательность SEQ ID NО: 191, и VL-область, включающую аминокислотную последовательность SEQ ID NО: 197,
q) антитела, которое содержит VH-область, включающую аминокислотную последовательность SEQ ID NО: 191, и VL-область, включающую аминокислотную последовательность SEQ ID NО: 198,
r) антитела, которое содержит VH-область, включающую аминокислотную последовательность SEQ ID NО: 106, и VL-область, включающую аминокислотную последовательность SEQ ID NО: 199,
s) антитела, которое содержит VH-область, включающую аминокислотную последовательность SEQ ID NО: 106, и VL-область, включающую аминокислотную последовательность SEQ ID NО: 200,
t) антитела, которое содержит VH-область, включающую аминокислотную последовательность SEQ ID NО: 191, и VL-область, включающую аминокислотную последовательность SEQ ID NО: 202,
u) антитела, которое содержит VH-область, включающую аминокислотную последовательность SEQ ID NО: 106, и VL-область, включающую аминокислотную последовательность SEQ ID NО: 198,
v) антитела, которое содержит VH-область, включающую аминокислотную последовательность SEQ ID NО: 192, и VL-область, включающую аминокислотную последовательность SEQ ID NО: 204,
w) антитела, которое содержит VH-область, включающую аминокислотную последовательность SEQ ID NO: 191, и VL-область, включающую аминокислотную последовательность SEQ ID NО: 205,
х) антитела, которое содержит VH-область, включающую аминокислотную последовательность SEQ ID NО: 191, и VL-область, включающую аминокислотную последовательность SEQ ID NО: 206,
y) антитела, которое содержит VH-область, включающую аминокислотную последовательность SEQ ID NО: 191, и VL-область, включающую аминокислотную последовательность SEQ ID NО: 197, и
z) антитела, которое содержит VH-область, включающую аминокислотную последовательность SEQ ID NО: 191, и VL-область, включающую аминокислотную последовательность SEQ ID NО: 207.
3. Антитело по п.1, где указанное антитело обладает функциональной активностью, выбранной из группы, состоящей из: повышенной ADCC-активности, индукции В-клеточного апоптоза, ингибирования В-клеточной пролиферации и способности вызывать in vivo В-клеточное истощение.
4. Антитело по п.1, где указанное антитело имеет комплекс сцепленных N-гликозидом сахарных цепей, связанных с Fc-фрагментом, в котором фукоза не связана с N-ацетилглюкозамином на восстанавливающем конце в сахарной цепи.
5. Антитело по п.4, где указанное антитело эффективно опосредует in vitro ADCC-активность в отношении клеточных линий Karpas-422, Karpas-1106P и DB, но не в отношении клеточной линии Granta-519.
6. Антитело по п.4, где указанное антитело обладает способностью вызывать В-клеточное истощение на созданной на животных модели, где указанные В-клетки выбраны из группы, состоящей из: находящихся в кровотоке В-клеток, В-клеток крови, селезеночных В-клеток, В-клеток маргинальной зоны, фолликулярных В-клеток, перитонеальных В-клеток и/или В-клеток костного мозга.
7. Антитело по п.6, где указанное истощение снижает уровни В-клеток по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 80%, по меньшей мере на 90% или по меньшей мере на 95% через 7 дней после введения указанного антитела в дозе 2,5 мг/кг.
8. Антитело по п.1, где указанное антитело содержит вариант Fc-фрагмента, где указанный вариант Fc-фрагмента обладает измененной аффинностью в отношении одного или нескольких лигандов Fc, выбранных из группы, состоящей из: Clq, FcγRI, FcγRIIA, FcγRIIB, FcγRIIIA и FcγRIV.
9. Антитело по п.8, где указанный вариант Fc-фрагмента обладает аффинностью в отношении Fc-рецептора FcγRIIIA, которая по меньшей мере примерно в 5 раз ниже, чем аффинность соответствующей молекулы, с которой проводится сравнение, и где указанный вариант Fc-фрагмента обладает примерно 2-кратной аффинностью в отношении Fc-рецептора FcγRIIB по сравнению с аффинностью соответствующей молекулы, с которой проводится сравнение.
10. Антитело по п.9, где указанный вариант Fc-фрагмента содержит мутации, приводящие к повышенной ADCC-активности.
11. Выделенная нуклеиновая кислота, кодирующая полипептид, который содержит аминокислотную последовательность, выбранную из группы, состоящей из: SEQ ID NO: 34, 102, 103, 104, 105, 106, 107, 108, 109, 191, 192 и 236, где полипептид представляет собой VH-область антитела по пп.1-10.
12. Выделенная нуклеиновая кислота, кодирующая полипептид, который содержит аминокислотную последовательность, выбранную из группы, состоящей из: SEQ ID NO: 62, 68, 110, 111, 112, 113, 193, 194, 195, 196, 197, 198, 199, 200, 202, 204, 205, 206 и 207, где полипептид представляет собой VL-область антитела по пп.1-10.
13. Выделенная клетка, экспрессирующая антитело по п.1, где клетка содержит нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, выбранную из группы, состоящей из: SEQ ID NO: 34, 102, 103, 104, 105, 106, 107, 108, 109, 191, 192 и 236, и полипептид, содержащий аминокислотную последовательность, выбранную из группы, состоящей из: SEQ ID NO: 62, 68, 110, 111, 112, 113, 193, 194, 195, 196, 197, 198, 199, 200, 202, 204, 205, 206 и 207.
14. Фармацевтическая композиция для лечения В-клеточного заболевания или нарушения, содержащая терапевтически эффективное количество антитела по п.1 в фармацевтически приемлемом носителе.
15. Способ лечения В-клеточного заболевания или нарушения у человека, заключающийся в том, что вводят человеку, который нуждается в этом, в терапевтически эффективном количестве антитело,
a) где указанное антитело представляет собой гуманизированное моноклональное антитело или его фрагмент,
b) где указанное антитело или его фрагмент содержит VH- и VL-область, где
(i) указанная VH-область содержит аминокислотную последовательность, выбранную из группы, состоящей из: SEQ ID NО: 34, 102, 103, 104, 105, 106, 107, 108, 109, 191, 192 и 236, и
(ii) указанная VL-область содержит аминокислотную последовательность, выбранную из группы, состоящей из: SEQ ID NO: 62, 68, 110, 111, 112, 113, 193, 194, 195, 196, 197, 198, 199, 200, 202, 204, 205, 206 и 207,
c) где указанное антитело или его фрагмент связывается с антигеном CD19 человека, и
d) где указанное заболевание или нарушение выбрано из группы, состоящей из: В-клеточного злокачественного состояния, аутоиммунного заболевания, аутоиммунного нарушения, гуморального отторжения трансплантата у больного человека, реакции трансплантат против хозяина (GVHD) и посттрансплантационного лимфопролиферативного нарушения у человека-реципиента трансплантата.
a) где указанное антитело представляет собой гуманизированное моноклональное антитело или его фрагмент,
b) где указанное антитело или его фрагмент содержит VH- и VL-область, где
(i) указанная VH-область содержит аминокислотную последовательность, выбранную из группы, состоящей из: SEQ ID NО: 34, 102, 103, 104, 105, 106, 107, 108, 109, 191, 192 и 236, и
(ii) указанная VL-область содержит аминокислотную последовательность, выбранную из группы, состоящей из: SEQ ID NO: 62, 68, 110, 111, 112, 113, 193, 194, 195, 196, 197, 198, 199, 200, 202, 204, 205, 206 и 207,
c) где указанное антитело или его фрагмент связывается с антигеном CD19 человека, и
d) где указанное заболевание или нарушение выбрано из группы, состоящей из: В-клеточного злокачественного состояния, аутоиммунного заболевания, аутоиммунного нарушения, гуморального отторжения трансплантата у больного человека, реакции трансплантат против хозяина (GVHD) и посттрансплантационного лимфопролиферативного нарушения у человека-реципиента трансплантата.
16. Способ по п.15, в котором указанное антитело выбрано из группы, состоящей из:
a) антитела, которое содержит VH-область, включающую аминокислотную последовательность SEQ ID NО: 34, и VL-область, включающую аминокислотную последовательность SEQ ID NO: 68,
b) антитела, которое содержит VH-область, включающую аминокислотную последовательность SEQ ID NО: 102, и VL-область, включающую аминокислотную последовательность SEQ ID NО: 110,
c) антитела, которое содержит VH-область, включающую аминокислотную последовательность SEQ ID NО: 103, и VL-область, включающую аминокислотную последовательность SEQ ID NO: 111,
d) антитела, которое содержит VH-область, включающую аминокислотную последовательность SEQ ID NО: 103, и VL-область, включающую аминокислотную последовательность SEQ ID NО: 113,
e) антитела, которое содержит VH-область, включающую аминокислотную последовательность SEQ ID NО: 104, и VL-область, включающую аминокислотную последовательность SEQ ID NО: 112,
f) антитела, которое содержит VH-область, включающую аминокислотную последовательность SEQ ID NО: 105, и VL-область, включающую аминокислотную последовательность SEQ ID NO: 111,
g) антитела, которое содержит VH-область, включающую аминокислотную последовательность SEQ ID NО: 106, и VL-область, включающую аминокислотную последовательность SEQ ID NO: 111,
h) антитела, которое содержит VH-область, включающую аминокислотную последовательность SEQ ID NО: 107, и VL-область, включающую аминокислотную последовательность SEQ ID NО: 111,
i) антитела, которое содержит VH-область, включающую аминокислотную последовательность SEQ ID NО: 108, и VL-область, включающую аминокислотную последовательность SEQ ID NО: 111,
j) антитела, которое содержит VH-область, включающую аминокислотную последовательность SEQ ID NО: 109, и VL-область, включающую аминокислотную последовательность SEQ ID NO: 111,
k) антитела, которое содержит VH-область, включающую аминокислотную последовательность SEQ ID NО: 191, и VL-область, включающую аминокислотную последовательность SEQ ID NO: 111,
l) антитела, которое содержит VH-область, включающую аминокислотную последовательность SEQ ID NО: 191, и VL-область, включающую аминокислотную последовательность SEQ ID NО: 193,
m) антитела, которое содержит VH-область, включающую аминокислотную последовательность SEQ ID NО: 191, и VL-область, включающую аминокислотную последовательность SEQ ID NО: 194,
n) антитела, которое содержит VH-область, включающую аминокислотную последовательность SEQ ID NО: 191, и VL-область, включающую аминокислотную последовательность SEQ ID NО: 195,
о) антитела, которое содержит VH-область, включающую аминокислотную последовательность SEQ ID NО: 192, и VL-область, включающую аминокислотную последовательность SEQ ID NО: 196,
р) антитела, которое содержит VH-область, включающую аминокислотную последовательность SEQ ID NО: 191, и VL-область, включающую аминокислотную последовательность SEQ ID NО: 197,
q) антитела, которое содержит VH-область, включающую аминокислотную последовательность SEQ ID NО: 191, и VL-область, включающую аминокислотную последовательность SEQ ID NО: 198,
r) антитела, которое содержит VH-область, включающую аминокислотную последовательность SEQ ID NО: 106, и VL-область, включающую аминокислотную последовательность SEQ ID NО: 199,
s) антитела, которое содержит VH-область, включающую аминокислотную последовательность SEQ ID NО: 106, и VL-область, включающую аминокислотную последовательность SEQ ID NО: 200,
t) антитела, которое содержит VH-область, включающую аминокислотную последовательность SEQ ID NО: 191, и VL-область, включающую аминокислотную последовательность SEQ ID NО: 202,
u) антитела, которое содержит VH-область, включающую аминокислотную последовательность SEQ ID NО: 106, и VL-область, включающую аминокислотную последовательность SEQ ID NО: 198,
v) антитела, которое содержит VH-область, включающую аминокислотную последовательность SEQ ID NО: 192, и VL-область, включающую аминокислотную последовательность SEQ ID NО: 204,
w) антитела, которое содержит VH-область, включающую аминокислотную последовательность SEQ ID NО: 191, и VL-область, включающую аминокислотную последовательность SEQ ID NО: 205,
х) антитела, которое содержит VH-область, включающую аминокислотную последовательность SEQ ID NО: 191, и VL-область, включающую аминокислотную последовательность SEQ ID NО: 206,
y) антитела, которое содержит VH-область, включающую аминокислотную последовательность SEQ ID NО: 191, и VL-область, включающую аминокислотную последовательность SEQ ID NО: 197, и
z) антитела, которое содержит VH-область, включающую аминокислотную последовательность SEQ ID NО: 191, и VL-область, включающую аминокислотную последовательность SEQ ID NО: 207.
a) антитела, которое содержит VH-область, включающую аминокислотную последовательность SEQ ID NО: 34, и VL-область, включающую аминокислотную последовательность SEQ ID NO: 68,
b) антитела, которое содержит VH-область, включающую аминокислотную последовательность SEQ ID NО: 102, и VL-область, включающую аминокислотную последовательность SEQ ID NО: 110,
c) антитела, которое содержит VH-область, включающую аминокислотную последовательность SEQ ID NО: 103, и VL-область, включающую аминокислотную последовательность SEQ ID NO: 111,
d) антитела, которое содержит VH-область, включающую аминокислотную последовательность SEQ ID NО: 103, и VL-область, включающую аминокислотную последовательность SEQ ID NО: 113,
e) антитела, которое содержит VH-область, включающую аминокислотную последовательность SEQ ID NО: 104, и VL-область, включающую аминокислотную последовательность SEQ ID NО: 112,
f) антитела, которое содержит VH-область, включающую аминокислотную последовательность SEQ ID NО: 105, и VL-область, включающую аминокислотную последовательность SEQ ID NO: 111,
g) антитела, которое содержит VH-область, включающую аминокислотную последовательность SEQ ID NО: 106, и VL-область, включающую аминокислотную последовательность SEQ ID NO: 111,
h) антитела, которое содержит VH-область, включающую аминокислотную последовательность SEQ ID NО: 107, и VL-область, включающую аминокислотную последовательность SEQ ID NО: 111,
i) антитела, которое содержит VH-область, включающую аминокислотную последовательность SEQ ID NО: 108, и VL-область, включающую аминокислотную последовательность SEQ ID NО: 111,
j) антитела, которое содержит VH-область, включающую аминокислотную последовательность SEQ ID NО: 109, и VL-область, включающую аминокислотную последовательность SEQ ID NO: 111,
k) антитела, которое содержит VH-область, включающую аминокислотную последовательность SEQ ID NО: 191, и VL-область, включающую аминокислотную последовательность SEQ ID NO: 111,
l) антитела, которое содержит VH-область, включающую аминокислотную последовательность SEQ ID NО: 191, и VL-область, включающую аминокислотную последовательность SEQ ID NО: 193,
m) антитела, которое содержит VH-область, включающую аминокислотную последовательность SEQ ID NО: 191, и VL-область, включающую аминокислотную последовательность SEQ ID NО: 194,
n) антитела, которое содержит VH-область, включающую аминокислотную последовательность SEQ ID NО: 191, и VL-область, включающую аминокислотную последовательность SEQ ID NО: 195,
о) антитела, которое содержит VH-область, включающую аминокислотную последовательность SEQ ID NО: 192, и VL-область, включающую аминокислотную последовательность SEQ ID NО: 196,
р) антитела, которое содержит VH-область, включающую аминокислотную последовательность SEQ ID NО: 191, и VL-область, включающую аминокислотную последовательность SEQ ID NО: 197,
q) антитела, которое содержит VH-область, включающую аминокислотную последовательность SEQ ID NО: 191, и VL-область, включающую аминокислотную последовательность SEQ ID NО: 198,
r) антитела, которое содержит VH-область, включающую аминокислотную последовательность SEQ ID NО: 106, и VL-область, включающую аминокислотную последовательность SEQ ID NО: 199,
s) антитела, которое содержит VH-область, включающую аминокислотную последовательность SEQ ID NО: 106, и VL-область, включающую аминокислотную последовательность SEQ ID NО: 200,
t) антитела, которое содержит VH-область, включающую аминокислотную последовательность SEQ ID NО: 191, и VL-область, включающую аминокислотную последовательность SEQ ID NО: 202,
u) антитела, которое содержит VH-область, включающую аминокислотную последовательность SEQ ID NО: 106, и VL-область, включающую аминокислотную последовательность SEQ ID NО: 198,
v) антитела, которое содержит VH-область, включающую аминокислотную последовательность SEQ ID NО: 192, и VL-область, включающую аминокислотную последовательность SEQ ID NО: 204,
w) антитела, которое содержит VH-область, включающую аминокислотную последовательность SEQ ID NО: 191, и VL-область, включающую аминокислотную последовательность SEQ ID NО: 205,
х) антитела, которое содержит VH-область, включающую аминокислотную последовательность SEQ ID NО: 191, и VL-область, включающую аминокислотную последовательность SEQ ID NО: 206,
y) антитела, которое содержит VH-область, включающую аминокислотную последовательность SEQ ID NО: 191, и VL-область, включающую аминокислотную последовательность SEQ ID NО: 197, и
z) антитела, которое содержит VH-область, включающую аминокислотную последовательность SEQ ID NО: 191, и VL-область, включающую аминокислотную последовательность SEQ ID NО: 207.
17. Способ по п.15, который включает истощение В-клеток, выбранных из группы, состоящей из: находящихся в кровотоке В-клеток, В-клеток крови, селезеночных В-клеток, В-клеток маргинальной зоны, фолликулярных В-клеток, перитонеальных В- клеток и/или В-клеток костного мозга.
18. Способ по п.15, который включает истощение В-клеток, выбранных из группы, состоящей из: предшественников В-клеток, ранних про-В-клеток, поздних про-В-клеток, больших пре-В-клеток, малых пре-В-клеток, незрелых В-клеток, зрелых В-клеток, стимулированных антигеном В-клеток и/или плазматических клеток.
19. Способ по п.15, в котором указанное антитело имеет повышенную ADCC-активность.
20. Способ по п.19, в котором указанное истощение снижает уровни В-клеток по меньшей мере примерно на 20%, по меньшей мере примерно на 30%, по меньшей мере примерно на 40%, по меньшей мере примерно на 50%, по меньшей мере примерно на 60%, по меньшей мере примерно на 70%, по меньшей мере примерно на 80%, по меньшей мере примерно на 90%, по меньшей мере примерно на 95% или примерно на 100%.
21. Способ по п.19, в котором указанное истощение сохраняется в течение периода времени, выбранного из группы, состоящей из: по меньшей мере 1 недели, по меньшей мере 2 недель, по меньшей мере 3 недель, по меньшей мере 4 недель, по меньшей мере 5 недель, по меньшей мере 6 недель, по меньшей мере 7 недель, по меньшей мере 8 недель, по меньшей мере 3 месяцев, по меньшей мере 4 месяцев, по меньшей мере 5 месяцев, по меньшей мере 6 месяцев, по меньшей мере 7 месяцев, по меньшей мере 8 месяцев, по меньшей мере 9 месяцев, по меньшей мере 10 месяцев, по меньшей мере 11 месяцев или по меньшей мере 12 месяцев.
Applications Claiming Priority (11)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US84293506P | 2006-09-08 | 2006-09-08 | |
| US60/842,935 | 2006-09-08 | ||
| US86691706P | 2006-11-22 | 2006-11-22 | |
| US60/866,917 | 2006-11-22 | ||
| US91139707P | 2007-04-12 | 2007-04-12 | |
| US60/911,397 | 2007-04-12 | ||
| US91530907P | 2007-05-01 | 2007-05-01 | |
| US60/915,309 | 2007-05-01 | ||
| US93942907P | 2007-05-22 | 2007-05-22 | |
| US60/939,429 | 2007-05-22 | ||
| PCT/US2007/077916 WO2008031056A2 (en) | 2006-09-08 | 2007-09-07 | Humanized anti-cd19 antibodies and their use in treatment of oncology, transplantation and autoimmune disease |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| RU2009112723A RU2009112723A (ru) | 2010-10-20 |
| RU2495882C2 true RU2495882C2 (ru) | 2013-10-20 |
Family
ID=39158111
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2009112723/10A RU2495882C2 (ru) | 2006-09-08 | 2007-09-07 | Гуманизированные антитела к cd19 и их применение для лечения онкологического, связанного с трансплантацией и аутоиммунного заболевания |
Country Status (21)
| Country | Link |
|---|---|
| US (5) | US8323653B2 (ru) |
| EP (1) | EP2066349B1 (ru) |
| JP (1) | JP5401314B2 (ru) |
| KR (1) | KR101456728B1 (ru) |
| CN (1) | CN103694349A (ru) |
| AT (1) | ATE551071T1 (ru) |
| AU (1) | AU2007294575B2 (ru) |
| CA (1) | CA2662340C (ru) |
| CY (1) | CY1112883T1 (ru) |
| DK (1) | DK2066349T3 (ru) |
| ES (1) | ES2383710T3 (ru) |
| FR (1) | FR22C1052I2 (ru) |
| HU (1) | HUS2200044I1 (ru) |
| LT (1) | LTPA2022520I1 (ru) |
| LU (1) | LUC00281I2 (ru) |
| MX (1) | MX2009002414A (ru) |
| NL (1) | NL301196I2 (ru) |
| PL (1) | PL2066349T3 (ru) |
| PT (1) | PT2066349E (ru) |
| RU (1) | RU2495882C2 (ru) |
| WO (1) | WO2008031056A2 (ru) |
Cited By (10)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US10533055B2 (en) | 2014-08-28 | 2020-01-14 | Juno Therapeutics, Inc. | Antibodies and chimeric antigen receptors specific for CD19 |
| RU2728430C2 (ru) * | 2015-09-18 | 2020-07-29 | Чугаи Сейяку Кабусики Кайся | Il-8-связывающие антитела и их применения |
| RU2731156C1 (ru) * | 2015-10-01 | 2020-08-31 | Ф. Хоффманн-Ля Рош Аг | Гуманизированные антитела к cd19 человека и способы их применения |
| RU2733315C2 (ru) * | 2015-06-12 | 2020-10-01 | Макродженикс, Инк. | Комбинированная терапия для лечения злокачественной опухоли |
| US11053308B2 (en) | 2016-08-05 | 2021-07-06 | Chugai Seiyaku Kabushiki Kaisha | Method for treating IL-8-related diseases |
| RU2752049C2 (ru) * | 2016-05-27 | 2021-07-22 | Эббви Байотерапьютикс Инк. | Антитела к cd40 и пути их применения |
| US11180548B2 (en) | 2015-02-05 | 2021-11-23 | Chugai Seiyaku Kabushiki Kaisha | Methods of neutralizing IL-8 biological activity |
| RU2761077C1 (ru) * | 2015-10-02 | 2021-12-03 | Ф. Хоффманн-Ля Рош Аг | Антитела против cd19 человека, обладающие высокой аффинностью |
| US11359194B2 (en) | 2008-04-11 | 2022-06-14 | Chugai Seiyaku Kabushiki Kaisha | Antigen-binding molecule capable of binding two or more antigen molecules repeatedly |
| US11454633B2 (en) | 2014-12-19 | 2022-09-27 | Chugai Seiyaku Kabushiki Kaisha | Anti-myostatin antibodies, polypeptides containing variant Fc regions, and methods of use |
Families Citing this family (109)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US7902338B2 (en) * | 2003-07-31 | 2011-03-08 | Immunomedics, Inc. | Anti-CD19 antibodies |
| ES2399726T3 (es) * | 2004-07-16 | 2013-04-03 | I.N.S.E.R.M. Institut National De La Santé Et De La Recherche Medicale | La fosfolipasa A2 (sPLA2) secretora como marcador pronóstico y diagnóstico para enfermedades cardiovasculares |
| US20110123440A1 (en) * | 2005-03-29 | 2011-05-26 | Genevieve Hansen | Altered Antibody FC Regions and Uses Thereof |
| US9486408B2 (en) | 2005-12-01 | 2016-11-08 | University Of Massachusetts Lowell | Botulinum nanoemulsions |
| WO2007114319A1 (ja) | 2006-03-31 | 2007-10-11 | Chugai Seiyaku Kabushiki Kaisha | 抗体の血中動態を制御する方法 |
| EP1884571A1 (en) * | 2006-07-31 | 2008-02-06 | INSERM (Institut National de la Santé et de la Recherche Médicale) | Use of spla2 activity for the diagnosis of a cardiovascular event |
| ES2402591T3 (es) | 2006-08-14 | 2013-05-07 | Xencor Inc. | Anticuerpos optimizados que seleccionan como diana CD19 |
| EP2066349B1 (en) * | 2006-09-08 | 2012-03-28 | MedImmune, LLC | Humanized anti-cd19 antibodies and their use in treatment of tumors, transplantation and autoimmune diseases |
| EP2097514A4 (en) * | 2006-12-01 | 2010-09-22 | Cedars Sinai Medical Center | TESTS FOR PREDICTING AND FOLLOWING MEDIATED REJECTION BY TRANSPLANT ALLOGENIC GRAFT ANTIBODIES |
| EP2708557A1 (en) * | 2007-05-30 | 2014-03-19 | Xencor, Inc. | Method and compositions for inhibiting CD32B expressing cells |
| CN101874042B9 (zh) | 2007-09-26 | 2019-01-01 | 中外制药株式会社 | 利用cdr的氨基酸取代来改变抗体等电点的方法 |
| LT2211904T (lt) | 2007-10-19 | 2016-11-25 | Seattle Genetics, Inc. | Cd19 surišantys agentai ir jų panaudojimas |
| WO2009092381A1 (en) | 2008-01-23 | 2009-07-30 | Herlev Hospital, Region Hovedstaden | Ykl-40 as a general marker for non-specific disease |
| WO2009129538A2 (en) * | 2008-04-18 | 2009-10-22 | Xencor, Inc. | Human equivalent monoclonal antibodies engineered from nonhuman variable regions |
| CA2726811C (en) | 2008-06-06 | 2019-11-26 | The United States Of America, As Represented By The Secretary, Dept. Of Health And Human Services | Survival predictor for diffuse large b cell lymphoma |
| WO2010019702A2 (en) * | 2008-08-12 | 2010-02-18 | Oncomed Pharmaceuticals, Inc. | Ddr1-binding agents and methods of use thereof |
| NZ592241A (en) | 2008-09-15 | 2012-11-30 | Herlev Hospital | Ykl-40 as a marker for gastrointestinal cancers |
| CA2743469C (en) * | 2008-11-12 | 2019-01-15 | Medimmune, Llc | Antibody formulation |
| CN102413839A (zh) * | 2009-03-06 | 2012-04-11 | 医学免疫有限责任公司 | 人源化抗cd19抗体制剂 |
| BRPI1016209A2 (pt) | 2009-04-16 | 2016-11-08 | Charité Universitätsmedizin Berlin | agente de alvejamento de linfócito-b para uso em um método para o tratamento de uma doença |
| US8709424B2 (en) | 2009-09-03 | 2014-04-29 | Merck Sharp & Dohme Corp. | Anti-GITR antibodies |
| SG10201408415PA (en) * | 2009-12-21 | 2015-01-29 | Regeneron Pharma | HUMANIZED FCγ R MICE |
| WO2011147834A1 (en) | 2010-05-26 | 2011-12-01 | Roche Glycart Ag | Antibodies against cd19 and uses thereof |
| US8192429B2 (en) | 2010-06-29 | 2012-06-05 | Theravant, Inc. | Abnormality eradication through resonance |
| EP2409993A1 (en) | 2010-07-19 | 2012-01-25 | International-Drug-Development-Biotech | Anti-CD19 antibody having ADCC function with improved glycosylation profile |
| EP2409712A1 (en) | 2010-07-19 | 2012-01-25 | International-Drug-Development-Biotech | Anti-CD19 antibody having ADCC and CDC functions and improved glycosylation profile |
| EP2409989A1 (en) * | 2010-07-19 | 2012-01-25 | International-Drug-Development-Biotech | Method to improve glycosylation profile for antibody |
| CN105251003B (zh) | 2010-10-27 | 2019-08-02 | 安进研发(慕尼黑)股份有限公司 | 用于治疗dlbcl的装置和方法 |
| CN103228291A (zh) * | 2010-11-15 | 2013-07-31 | 米迪缪尼有限公司 | 用于b细胞淋巴瘤的联合疗法 |
| EP2647706B1 (en) | 2010-11-30 | 2023-05-17 | Chugai Seiyaku Kabushiki Kaisha | Antigen-binding molecule capable of binding to plurality of antigen molecules repeatedly |
| RU2610336C2 (ru) | 2011-04-21 | 2017-02-09 | Сиэтл Дженетикс, Инк. | Новые конъюгаты связывающее соединение - активное соединение (adc) и их применение |
| EP2524929A1 (en) * | 2011-05-17 | 2012-11-21 | Sanofi | Use of anti-CD19 maytansinoid immunoconjugate antibody for the treatment of CD19+ B-cell malignancies syptoms |
| EP2550975A1 (en) * | 2011-07-29 | 2013-01-30 | Sanofi | Combination therapy for the treatment of CD19+ B-cell malignancies symptoms comprising an anti-CD19 maytansinoid immunoconjugate and rituximab |
| KR20200058583A (ko) | 2011-08-16 | 2020-05-27 | 모르포시스 아게 | 항-cd19 항체 및 질소 머스타드를 사용한 조합 요법 |
| HUE058855T2 (hu) | 2011-08-16 | 2022-09-28 | Morphosys Ag | Kombinációs terápia, CD19 elleni ellenanyag és purinanalóg alkalmazásával |
| JP6850528B2 (ja) | 2012-02-13 | 2021-03-31 | シアトル チルドレンズ ホスピタル ドゥーイング ビジネス アズ シアトル チルドレンズ リサーチ インスティテュート | 二重特異性キメラ抗原受容体およびその治療的使用 |
| RU2014141056A (ru) * | 2012-03-12 | 2016-05-10 | МЕДИММЬЮН, ЭлЭлСи | Лечение рассеянного склероза при помощи антитела к cd19 |
| EP2844289B1 (en) * | 2012-04-30 | 2019-07-17 | MedImmune, LLC | Molecules with reduced effector function and extended half-lives, compositions, and uses thereof |
| US9844582B2 (en) | 2012-05-22 | 2017-12-19 | Massachusetts Institute Of Technology | Synergistic tumor treatment with extended-PK IL-2 and therapeutic agents |
| JP2015522567A (ja) * | 2012-06-13 | 2015-08-06 | ユニバーシティ オブ バージニア パテント ファウンデーション ディー/ビー/エイ ユニバーシティ オブ バージニア ライセンシング アンド ベンチャーズ グループUniversity Of Virginiapatent Foundation,D/B/A University Of Virginia Licensing & Ventures Group | がんを治療するための組成物及び方法 |
| CA2876730A1 (en) | 2012-07-13 | 2014-01-16 | The Trustees Of The University Of Pennsylvania | Enhancing activity of car t cells by co-introducing a bispecific antibody |
| AU2013306700B2 (en) | 2012-08-24 | 2019-05-02 | Chugai Seiyaku Kabushiki Kaisha | FcgammaRIIb-specific Fc region variant |
| US11236168B2 (en) | 2012-08-24 | 2022-02-01 | Chugai Seiyaku Kabushiki Kaisha | Mouse FcγammaRII-specific Fc antibody |
| US9534044B2 (en) * | 2013-02-28 | 2017-01-03 | United Arab Emirates University | Alpha-synuclein antibodies and uses thereof |
| CN105025925A (zh) * | 2013-03-15 | 2015-11-04 | 拜尔健康护理有限责任公司 | 抗-催乳素受体抗体制剂 |
| AU2014250434B2 (en) | 2013-04-02 | 2019-08-08 | Chugai Seiyaku Kabushiki Kaisha | Fc region variant |
| US9393177B2 (en) | 2013-08-20 | 2016-07-19 | Anutra Medical, Inc. | Cassette assembly for syringe fill system |
| CA2934617A1 (en) | 2013-12-23 | 2015-07-02 | Bayer Pharma Aktiengesellschaft | Antibody drug conjugates (adcs) with kinesin spindle protein (ksp) |
| WO2015134631A2 (en) * | 2014-03-04 | 2015-09-11 | Medlmmune, Llc | Compositions and methods for identifying b cell malignancies responsive to b cell depleting therapy |
| USD763433S1 (en) | 2014-06-06 | 2016-08-09 | Anutra Medical, Inc. | Delivery system cassette |
| USD750768S1 (en) | 2014-06-06 | 2016-03-01 | Anutra Medical, Inc. | Fluid administration syringe |
| USD774182S1 (en) | 2014-06-06 | 2016-12-13 | Anutra Medical, Inc. | Anesthetic delivery device |
| US20170224777A1 (en) | 2014-08-12 | 2017-08-10 | Massachusetts Institute Of Technology | Synergistic tumor treatment with il-2, a therapeutic antibody, and a cancer vaccine |
| AR102918A1 (es) | 2014-12-05 | 2017-04-05 | Genentech Inc | Anticuerpos anti-cd79b y métodos de uso |
| CN105837689B (zh) * | 2015-01-13 | 2020-06-19 | 博生吉安科细胞技术有限公司 | 抗cd19单克隆抗体及其制备方法 |
| US10722523B2 (en) | 2015-03-17 | 2020-07-28 | The Regents Of The University Of California | Chemoimmunotherapy for epithelial cancer |
| CN114601931B (zh) | 2015-05-26 | 2023-09-01 | 莫佛塞斯公司 | 抗-cd19抗体和布鲁顿酪氨酸激酶抑制剂的组合及其用途 |
| JP6971858B2 (ja) | 2015-06-22 | 2021-11-24 | バイエル ファーマ アクチエンゲゼルシャフト | 酵素開裂性基を有する抗体薬物複合体(adc)および抗体プロドラッグ複合体(apdc) |
| EP3322735A4 (en) | 2015-07-15 | 2019-03-13 | Zymeworks Inc. | BISPECIFIC ANTIGEN-BINDING CONSTRUCTS CONJUGATED TO A MEDICINAL PRODUCT |
| WO2017032679A1 (en) | 2015-08-21 | 2017-03-02 | Morphosys Ag | Combinations and uses thereof |
| MA44909A (fr) | 2015-09-15 | 2018-07-25 | Acerta Pharma Bv | Association thérapeutique d'un inhibiteur du cd19 et d'un inhibiteur de la btk |
| WO2017060322A2 (en) | 2015-10-10 | 2017-04-13 | Bayer Pharma Aktiengesellschaft | Ptefb-inhibitor-adc |
| CN107531793B (zh) * | 2015-10-13 | 2022-01-11 | 优瑞科生物技术公司 | 对人类cd19具有专一性的抗体药剂和其用途 |
| IL314725A (en) | 2015-10-23 | 2024-10-01 | Eureka Therapeutics Inc ׂ A Delaware Corp | Antibody/T-cell receptor chimeric structures and their uses |
| US11359009B2 (en) | 2015-12-25 | 2022-06-14 | Chugai Seiyaku Kabushiki Kaisha | Anti-myostatin antibodies and methods of use |
| MX2018011627A (es) | 2016-03-24 | 2019-01-10 | Bayer Pharma AG | Profarmacos de farmacos citotoxicos que tienen grupos enzimaticamente escindibles. |
| BR112018069332A2 (pt) * | 2016-03-28 | 2019-01-22 | Toray Industries | composição e combinação farmacêutica para tratamento e/ou prevenção do câncer, anticorpo ou fragmento do mesmo e método para tratar e/ou prevenir um câncer |
| SI3465214T1 (sl) | 2016-05-30 | 2021-12-31 | Morphosys Ag | Postopki za napovedovanje terapevtske koristi terapije proti CD19 pri pacientih |
| EP4371570A3 (en) | 2016-06-08 | 2024-07-17 | Xencor, Inc. | Treatment of igg4-related diseases with anti-cd19 antibodies crossbinding to cd32b |
| CN109310781B (zh) | 2016-06-15 | 2024-06-18 | 拜耳制药股份公司 | 具有ksp抑制剂和抗-cd123-抗体的特异性抗体-药物-缀合物(adc) |
| DK3475303T3 (da) | 2016-06-27 | 2021-05-31 | Morphosys Ag | Anti-cd19-antistofformuleringer |
| SG10201607778XA (en) | 2016-09-16 | 2018-04-27 | Chugai Pharmaceutical Co Ltd | Anti-Dengue Virus Antibodies, Polypeptides Containing Variant Fc Regions, And Methods Of Use |
| CN117457097A (zh) * | 2016-09-30 | 2024-01-26 | 分子装置有限公司 | 用于检测最优候选化合物的计算机装置及其方法 |
| LT3532098T (lt) | 2016-10-28 | 2021-06-25 | Morphosys Ag | Anti cd19 antikūno derinys su bcl-2 inhibitoriumi, ir jo naudojimas |
| WO2018093465A1 (en) | 2016-11-21 | 2018-05-24 | Eirion Therapeutics, Inc. | Transdermal delivery of large agents |
| CN106977605A (zh) * | 2016-12-13 | 2017-07-25 | 无锡傲锐东源生物科技有限公司 | 抗cd19蛋白单克隆抗体及其用途 |
| CA3047491A1 (en) | 2016-12-21 | 2018-06-28 | Bayer Aktiengesellschaft | Prodrugs of cytotoxic active agents having enzymatically cleavable groups |
| JP7066714B2 (ja) | 2016-12-21 | 2022-05-13 | バイエル・ファルマ・アクティエンゲゼルシャフト | 酵素的に切断可能な基を有する抗体薬物コンジュゲート(adc) |
| EP3558387B1 (de) | 2016-12-21 | 2021-10-20 | Bayer Pharma Aktiengesellschaft | Spezifische antikörper-wirkstoff-konjugate (adcs) mit ksp-inhibitoren |
| SG10202102897PA (en) | 2017-01-20 | 2021-04-29 | Magenta Therapeutics Inc | Compositions and methods for the depletion of cd137+ cells |
| WO2018195339A1 (en) | 2017-04-19 | 2018-10-25 | Board Of Regents, The University Of Texas System | Immune cells expressing engineered antigen receptors |
| SG10201913656TA (en) | 2017-04-26 | 2020-03-30 | Eureka Therapeutics Inc | Cells expressing chimeric activating receptors and chimeric stimulating receptors and uses thereof |
| AU2018276384A1 (en) | 2017-05-31 | 2019-11-07 | Incyte Corporation | Treatment paradigm for an anti-CD19 antibody and venetoclax combination treatment |
| US11634488B2 (en) | 2017-07-10 | 2023-04-25 | International—Drug—Development—Biotech | Treatment of B cell malignancies using afucosylated pro-apoptotic anti-CD19 antibodies in combination with anti CD20 antibodies or chemotherapeutics |
| CN115819588A (zh) * | 2017-09-21 | 2023-03-21 | 上海药明生物技术有限公司 | 新型抗cd19抗体 |
| JP7080514B2 (ja) * | 2017-12-22 | 2022-06-06 | アブクロン・インコーポレイテッド | 悪性b細胞を特異的に認知する抗体またはその抗原結合断片、これを含むキメラ抗原受容体及びその用途 |
| US11672827B2 (en) * | 2017-12-23 | 2023-06-13 | Uwell Biopharma Inc. | Pharmaceutical chimeric receptor composition and method thereof |
| MX2020009296A (es) | 2018-03-15 | 2020-11-13 | Chugai Pharmaceutical Co Ltd | Anticuerpos anti-virus del dengue que tienen reactividad cruzada con el virus zika y metodos de uso. |
| JP2022515543A (ja) | 2018-12-30 | 2022-02-18 | エフ.ホフマン-ラ ロシュ アーゲー | 抗ウサギcd19抗体および使用方法 |
| US11235032B2 (en) | 2019-01-23 | 2022-02-01 | Massachusetts Institute Of Technology | Combination immunotherapy dosing regimen for immune checkpoint blockade |
| CN110009008B (zh) * | 2019-03-18 | 2020-11-06 | 四川大学 | 基于提取的免疫固定电泳图特征对其进行自动分类的方法 |
| BR112021020924A2 (pt) * | 2019-04-24 | 2022-04-19 | Viela Bio Inc | Uso de um anticorpo anti-cd19 para tratar doença autoimune |
| SG11202111343TA (en) | 2019-05-03 | 2021-11-29 | Morphosys Ag | Anti-cd19 therapy in patients having a limited number of nk cells |
| US20210038684A1 (en) | 2019-06-11 | 2021-02-11 | Alkermes Pharma Ireland Limited | Compositions and Methods for Cancer Immunotherapy |
| JP2022538974A (ja) | 2019-06-26 | 2022-09-07 | マサチューセッツ インスチテュート オブ テクノロジー | 免疫調節融合タンパク質-金属水酸化物錯体およびその方法 |
| JP2022550435A (ja) | 2019-10-04 | 2022-12-01 | ウルトラジェニックス ファーマシューティカル インコーポレイテッド | 組換えaavの改善された治療的使用のための方法 |
| KR20220103969A (ko) | 2019-10-31 | 2022-07-25 | 모르포시스 아게 | 백혈병 또는 림프종의 치료를 위해 레날리도마이드와 조합된 항-cd19 요법 |
| EP4051710A1 (en) | 2019-10-31 | 2022-09-07 | MorphoSys AG | Anti-tumor combination therapy comprising anti-cd19 antibody and gamma delta t-cells |
| TWI790548B (zh) * | 2020-02-28 | 2023-01-21 | 美商美國禮來大藥廠 | 抗人類cd19抗體 |
| CA3153085A1 (en) | 2020-06-19 | 2021-12-23 | F. Hoffmann-La Roche Ag | Antibodies binding to cd3 and cd19 |
| JP2023530499A (ja) | 2020-06-22 | 2023-07-18 | モルフォシス・アーゲー | 抗CD19抗体及びSIRPα-CD47自然免疫チェックポイントを遮断するポリペプチドを含む抗腫瘍組み合わせ療法 |
| MX2023003997A (es) | 2020-10-06 | 2023-06-15 | Xencor Inc | Biomarcadores, métodos y composiciones para el tratamiento de la enfermedad autoinmunitaria, que incluye el lupus eritematoso sistémico (les). |
| MX2023006538A (es) | 2020-12-04 | 2023-08-08 | Morphosys Ag | Terapia combinada de anticuerpo anti cúmulo de diferenciación 19 (cd19). |
| JP2024518410A (ja) | 2021-05-07 | 2024-05-01 | ビエラ バイオ インコーポレイテッド | 重症筋無力症を治療するための抗cd19抗体の使用 |
| MX2024001826A (es) | 2021-08-11 | 2024-05-08 | Viela Bio Inc | Inebilizumab y metodos de uso del mismo en el tratamiento o prevencion de la enfermedad relacionada con igg4. |
| WO2023073645A1 (en) | 2021-10-29 | 2023-05-04 | Takeda Pharmaceutical Company Limited | Therapy comprising anti-cd19 antibody and sumo-activating enzyme inhibitor |
| WO2024025602A1 (en) | 2022-07-27 | 2024-02-01 | Viela Bio, Inc. | Inebilizumab and methods of using the same for sustained b-cell depletion |
| WO2024038115A1 (en) | 2022-08-17 | 2024-02-22 | Morphosys Ag | Therapy comprising anti-cd19 antibody and ezh2 modulators |
| US12030945B2 (en) | 2022-10-25 | 2024-07-09 | Seismic Therapeutic, Inc. | Variant IgG Fc polypeptides and uses thereof |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2228202C2 (ru) * | 1998-04-21 | 2004-05-10 | Микромет Аг | Cd19xcd3-специфические полипептиды и их применение |
| US20060233791A1 (en) * | 2005-02-15 | 2006-10-19 | Duke University | Anti-CD19 antibodies and uses in oncology |
Family Cites Families (89)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| IL85035A0 (en) | 1987-01-08 | 1988-06-30 | Int Genetic Eng | Polynucleotide molecule,a chimeric antibody with specificity for human b cell surface antigen,a process for the preparation and methods utilizing the same |
| WO1988007089A1 (en) | 1987-03-18 | 1988-09-22 | Medical Research Council | Altered antibodies |
| US5677425A (en) | 1987-09-04 | 1997-10-14 | Celltech Therapeutics Limited | Recombinant antibody |
| US5506126A (en) * | 1988-02-25 | 1996-04-09 | The General Hospital Corporation | Rapid immunoselection cloning method |
| GB8824869D0 (en) | 1988-10-24 | 1988-11-30 | Stevenson G T | Synthetic antibody |
| US5530101A (en) * | 1988-12-28 | 1996-06-25 | Protein Design Labs, Inc. | Humanized immunoglobulins |
| WO1991013974A1 (en) | 1990-03-14 | 1991-09-19 | The Biomembrane Institute | Monoclonal antibody and immunoconjugates for the treatment and detection of b cell disorders |
| GB9022543D0 (en) * | 1990-10-17 | 1990-11-28 | Wellcome Found | Antibody production |
| WO1992022653A1 (en) | 1991-06-14 | 1992-12-23 | Genentech, Inc. | Method for making humanized antibodies |
| SK285960B6 (sk) | 1991-07-25 | 2007-12-06 | Biogen Idec Inc. | Rekombinantné protilátky na liečenie ľudí |
| CA2372813A1 (en) | 1992-02-06 | 1993-08-19 | L.L. Houston | Biosynthetic binding protein for cancer marker |
| US5714350A (en) * | 1992-03-09 | 1998-02-03 | Protein Design Labs, Inc. | Increasing antibody affinity by altering glycosylation in the immunoglobulin variable region |
| AU4116793A (en) | 1992-04-24 | 1993-11-29 | Board Of Regents, The University Of Texas System | Recombinant production of immunoglobulin-like domains in prokaryotic cells |
| US5686072A (en) * | 1992-06-17 | 1997-11-11 | Board Of Regents, The University Of Texas | Epitope-specific monoclonal antibodies and immunotoxins and uses thereof |
| WO1994009363A1 (en) | 1992-10-14 | 1994-04-28 | Board Of Regents, The University Of Texas System | Cancer diagnosis and therapy |
| US5885573A (en) | 1993-06-01 | 1999-03-23 | Arch Development Corporation | Methods and materials for modulation of the immunosuppressive activity and toxicity of monoclonal antibodies |
| CA2163345A1 (en) | 1993-06-16 | 1994-12-22 | Susan Adrienne Morgan | Antibodies |
| US5417972A (en) * | 1993-08-02 | 1995-05-23 | The Board Of Trustees Of The Leland Stanford Junior University | Method of killing B-cells in a complement independent and an ADCC independent manner using antibodies which specifically bind CDIM |
| US5831142A (en) * | 1994-01-07 | 1998-11-03 | Dana Farber Cancer Institute, Inc. | Regulatory elements controlling tissue-specific gene expression |
| US5837458A (en) | 1994-02-17 | 1998-11-17 | Maxygen, Inc. | Methods and compositions for cellular and metabolic engineering |
| US5834252A (en) | 1995-04-18 | 1998-11-10 | Glaxo Group Limited | End-complementary polymerase reaction |
| US5605793A (en) | 1994-02-17 | 1997-02-25 | Affymax Technologies N.V. | Methods for in vitro recombination |
| US6121022A (en) | 1995-04-14 | 2000-09-19 | Genentech, Inc. | Altered polypeptides with increased half-life |
| US5869046A (en) | 1995-04-14 | 1999-02-09 | Genentech, Inc. | Altered polypeptides with increased half-life |
| JPH11505704A (ja) | 1995-05-17 | 1999-05-25 | リージェンツ・オブ・ザ・ユニバーシティ・オブ・ミネソタ | アンチcd−19抗体の単鎖可変領域フラグメントを含む免疫コンジュゲート |
| US6410690B1 (en) * | 1995-06-07 | 2002-06-25 | Medarex, Inc. | Therapeutic compounds comprised of anti-Fc receptor antibodies |
| US6277375B1 (en) | 1997-03-03 | 2001-08-21 | Board Of Regents, The University Of Texas System | Immunoglobulin-like domains with increased half-lives |
| JP3988200B2 (ja) * | 1997-03-14 | 2007-10-10 | 株式会社ジェイテクト | 衝撃吸収式ステアリング装置 |
| US6306393B1 (en) * | 1997-03-24 | 2001-10-23 | Immunomedics, Inc. | Immunotherapy of B-cell malignancies using anti-CD22 antibodies |
| WO1999002567A2 (en) * | 1997-07-08 | 1999-01-21 | Board Of Regents, The University Of Texas System | Compositions and methods for producing homoconjugates of antibodies which induce growth arrest or apoptosis of tumor cells |
| EP1469883A2 (en) * | 1998-02-19 | 2004-10-27 | Xcyte Therapies, Inc. | Compositions and methods for regulating lymphocyte activation |
| US6528624B1 (en) * | 1998-04-02 | 2003-03-04 | Genentech, Inc. | Polypeptide variants |
| US6194551B1 (en) | 1998-04-02 | 2001-02-27 | Genentech, Inc. | Polypeptide variants |
| DK2180007T4 (da) * | 1998-04-20 | 2017-11-27 | Roche Glycart Ag | Glycosyleringsteknik for antistoffer til forbedring af antistofafhængig cellecytotoxicitet |
| DE19819846B4 (de) * | 1998-05-05 | 2016-11-24 | Deutsches Krebsforschungszentrum Stiftung des öffentlichen Rechts | Multivalente Antikörper-Konstrukte |
| GB9809951D0 (en) | 1998-05-08 | 1998-07-08 | Univ Cambridge Tech | Binding molecules |
| US6737056B1 (en) | 1999-01-15 | 2004-05-18 | Genentech, Inc. | Polypeptide variants with altered effector function |
| KR20060067983A (ko) | 1999-01-15 | 2006-06-20 | 제넨테크, 인크. | 효과기 기능이 변화된 폴리펩티드 변이체 |
| EP2275541B1 (en) * | 1999-04-09 | 2016-03-23 | Kyowa Hakko Kirin Co., Ltd. | Method for controlling the activity of immunologically functional molecule |
| MXPA01011279A (es) | 1999-05-07 | 2002-07-02 | Genentech Inc | Tratamiento de enfermedades autoinmunes con antagonistas que se unene a los marcadores de superficie, de celulas b. |
| EP1194167B1 (en) * | 1999-06-09 | 2009-08-19 | Immunomedics, Inc. | Immunotherapy of autoimmune disorders using antibodies which target b-cells |
| US6451284B1 (en) * | 1999-08-11 | 2002-09-17 | Idec Pharmaceuticals Corporation | Clinical parameters for determining hematologic toxicity prior to radioimmunotheraphy |
| AU6929100A (en) | 1999-08-23 | 2001-03-19 | Biocrystal Limited | Methods and compositions for immunotherapy of b cell involvement in promotion ofa disease condition comprising multiple sclerosis |
| US7504256B1 (en) | 1999-10-19 | 2009-03-17 | Kyowa Hakko Kogyo Co., Ltd. | Process for producing polypeptide |
| FR2801056B1 (fr) * | 1999-11-12 | 2003-03-28 | Commissariat Energie Atomique | Proteine presente a la surface des cellules souches hematopoietiques de la lignee lymphoide et des cellules nk, et ses applications |
| CN1981868A (zh) * | 2000-03-31 | 2007-06-20 | 拜奥根Idec公司 | 抗细胞因子抗体或拮抗剂与抗-cd20在b细胞淋巴瘤治疗中的联合应用 |
| JP2003531149A (ja) * | 2000-04-13 | 2003-10-21 | ザ・ロツクフエラー・ユニバーシテイ | 抗体由来の免疫応答の増強 |
| WO2002022212A2 (en) * | 2000-09-18 | 2002-03-21 | Idec Pharmaceuticals Corporation | Combination therapy for treatment of autoimmune diseases using b cell depleting/immunoregulatory antibody combination |
| US7064191B2 (en) * | 2000-10-06 | 2006-06-20 | Kyowa Hakko Kogyo Co., Ltd. | Process for purifying antibody |
| US6946292B2 (en) * | 2000-10-06 | 2005-09-20 | Kyowa Hakko Kogyo Co., Ltd. | Cells producing antibody compositions with increased antibody dependent cytotoxic activity |
| AU2001297703B2 (en) * | 2000-11-07 | 2006-10-19 | City Of Hope | CD19-specific redirected immune cells |
| ATE489395T1 (de) | 2000-12-12 | 2010-12-15 | Medimmune Llc | Moleküle mit längeren halbwertszeiten, zusammensetzungen und deren verwendung |
| DE10063048A1 (de) | 2000-12-18 | 2002-07-11 | Deutsches Krebsforsch | Einzelketten-Antikörper mit verbesserter Stabilität |
| US7829084B2 (en) | 2001-01-17 | 2010-11-09 | Trubion Pharmaceuticals, Inc. | Binding constructs and methods for use thereof |
| EP1383800A4 (en) * | 2001-04-02 | 2004-09-22 | Idec Pharma Corp | RECOMBINANT ANTIBODIES CO-EXPRESSED WITH GNTIII |
| US6661602B2 (en) * | 2001-09-10 | 2003-12-09 | Hewlett-Packard Development Company, L.P. | Methods and apparatus for transporting data cartridges between adjacent cartridge libraries |
| IL161418A0 (en) * | 2001-10-15 | 2004-09-27 | Immunomedics Inc | Direct targeting binding proteins |
| AU2002337935B2 (en) * | 2001-10-25 | 2008-05-01 | Genentech, Inc. | Glycoprotein compositions |
| DE60127143T2 (de) * | 2001-11-14 | 2007-11-15 | Affimed Therapeutics Ag | Bispezifische Antikörper gegen CD19 und CD16 und deren Verwendung |
| US20040002587A1 (en) | 2002-02-20 | 2004-01-01 | Watkins Jeffry D. | Fc region variants |
| US20040132101A1 (en) | 2002-09-27 | 2004-07-08 | Xencor | Optimized Fc variants and methods for their generation |
| US7317091B2 (en) * | 2002-03-01 | 2008-01-08 | Xencor, Inc. | Optimized Fc variants |
| DK1534335T4 (en) * | 2002-08-14 | 2015-10-05 | Macrogenics Inc | FCGAMMARIIB-SPECIFIC ANTIBODIES AND PROCEDURES FOR USE THEREOF |
| DK1553832T3 (da) | 2002-09-27 | 2007-10-01 | Bioe Inc | Præparater og fremgangsmåder til celleseparering |
| EP3502133A1 (en) | 2002-09-27 | 2019-06-26 | Xencor, Inc. | Optimized fc variants and methods for their generation |
| AU2003303521A1 (en) * | 2002-12-31 | 2004-07-29 | Genta Incorporated | Combination of gallium compounds with nonchemotherapeutic anticancer agents in the treatment of neoplasia |
| EP2368578A1 (en) | 2003-01-09 | 2011-09-28 | Macrogenics, Inc. | Identification and engineering of antibodies with variant Fc regions and methods of using same |
| WO2004091657A2 (en) * | 2003-04-09 | 2004-10-28 | Genentech, Inc. | Therapy of autoimmune disease in a patient with an inadequate response to a tnf-alpha inhibitor |
| EP2281577B1 (en) * | 2003-05-14 | 2016-11-16 | ImmunoGen, Inc. | Drug conjugate composition |
| AU2004242846A1 (en) * | 2003-05-31 | 2004-12-09 | Micromet Ag | Pharmaceutical compositions comprising bispecific anti-CD3, anti-CD19 antibody constructs for the treatment of B-cell related disorders |
| CA2534639C (en) * | 2003-07-31 | 2013-07-30 | Immunomedics, Inc. | Anti-cd19 antibodies |
| CA2542840A1 (en) * | 2003-10-22 | 2005-05-12 | University Of Rochester | Anti-thymocyte antiserum and use thereof to trigger b cell apoptosis |
| PT1691833E (pt) * | 2003-11-28 | 2010-06-08 | Micromet Ag | Composições compreendendo polipéptidos |
| CA3052445C (en) | 2004-07-10 | 2023-08-22 | Kerry S. Campbell | Genetically modified human natural killer cell lines |
| CN1775808A (zh) * | 2004-11-15 | 2006-05-24 | 中国医学科学院血液学研究所 | 用于靶向结合淋巴细胞白血病细胞的抗cd19的工程抗体及其用途 |
| MX2007012817A (es) * | 2005-04-15 | 2007-12-12 | Immunogen Inc | Eliminacion de poblacion celular heterogenea o mezclada en tumores. |
| JP5047947B2 (ja) | 2005-05-05 | 2012-10-10 | デューク ユニバーシティ | 自己免疫疾患のための抗cd19抗体治療 |
| US20060263367A1 (en) * | 2005-05-23 | 2006-11-23 | Fey Georg H | Bispecific antibody devoid of Fc region and method of treatment using same |
| EP1904101A4 (en) * | 2005-06-08 | 2011-06-15 | Univ Duke | ANTI-CD19 ANTIBODY THERAPY FOR TRANSPLANTATION |
| EP1899379B1 (en) | 2005-06-20 | 2018-04-11 | E. R. Squibb & Sons, L.L.C. | Cd19 antibodies and their uses |
| US7612181B2 (en) * | 2005-08-19 | 2009-11-03 | Abbott Laboratories | Dual variable domain immunoglobulin and uses thereof |
| WO2007033110A2 (en) * | 2005-09-12 | 2007-03-22 | Alza Corporation | Liposomes for treatment of multiple myeloma |
| US7759076B2 (en) * | 2005-10-14 | 2010-07-20 | Esoterix, Inc. | Quantitative ZAP-70 assay |
| EP2270050B1 (en) | 2005-12-30 | 2013-06-05 | Merck Patent GmbH | Anti-CD19 antibodies with reduced immunogenicity |
| US20070166306A1 (en) * | 2006-01-17 | 2007-07-19 | Fey Georg H M | Anti-CD19 antibody composition and method |
| US20070196274A1 (en) * | 2006-01-20 | 2007-08-23 | Le Sun | Immunoconjugates with improved efficacy for the treatment of diseases |
| US20070178103A1 (en) * | 2006-01-30 | 2007-08-02 | Fey Georg H | CD19-specific immunotoxin and treatment method |
| WO2008108776A1 (en) * | 2006-04-07 | 2008-09-12 | Chimeros, Inc. | Compositions and methods for treating b- cell malignancies |
| EP2066349B1 (en) * | 2006-09-08 | 2012-03-28 | MedImmune, LLC | Humanized anti-cd19 antibodies and their use in treatment of tumors, transplantation and autoimmune diseases |
-
2007
- 2007-09-07 EP EP07842083A patent/EP2066349B1/en active Active
- 2007-09-07 US US11/852,106 patent/US8323653B2/en active Active
- 2007-09-07 MX MX2009002414A patent/MX2009002414A/es active IP Right Grant
- 2007-09-07 WO PCT/US2007/077916 patent/WO2008031056A2/en active Application Filing
- 2007-09-07 CN CN201310460492.8A patent/CN103694349A/zh active Pending
- 2007-09-07 RU RU2009112723/10A patent/RU2495882C2/ru active
- 2007-09-07 DK DK07842083.3T patent/DK2066349T3/da active
- 2007-09-07 AT AT07842083T patent/ATE551071T1/de active
- 2007-09-07 JP JP2009527592A patent/JP5401314B2/ja active Active
- 2007-09-07 PL PL07842083T patent/PL2066349T3/pl unknown
- 2007-09-07 PT PT07842083T patent/PT2066349E/pt unknown
- 2007-09-07 AU AU2007294575A patent/AU2007294575B2/en active Active
- 2007-09-07 ES ES07842083T patent/ES2383710T3/es active Active
- 2007-09-07 KR KR1020097007247A patent/KR101456728B1/ko active IP Right Grant
- 2007-09-07 CA CA2662340A patent/CA2662340C/en active Active
-
2012
- 2012-06-28 CY CY20121100579T patent/CY1112883T1/el unknown
- 2012-10-26 US US13/661,138 patent/US8883992B2/en active Active
-
2014
- 2014-10-08 US US14/509,457 patent/US9896505B2/en active Active
-
2018
- 2018-01-05 US US15/863,144 patent/US20180273621A1/en not_active Abandoned
-
2020
- 2020-05-26 US US16/883,273 patent/US20210061906A1/en not_active Abandoned
-
2022
- 2022-09-21 NL NL301196C patent/NL301196I2/nl unknown
- 2022-10-03 LT LTPA2022520C patent/LTPA2022520I1/lt unknown
- 2022-10-11 LU LU00281C patent/LUC00281I2/fr unknown
- 2022-10-17 FR FR22C1052C patent/FR22C1052I2/fr active Active
- 2022-10-17 HU HUS2200044C patent/HUS2200044I1/hu unknown
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2228202C2 (ru) * | 1998-04-21 | 2004-05-10 | Микромет Аг | Cd19xcd3-специфические полипептиды и их применение |
| US20060233791A1 (en) * | 2005-02-15 | 2006-10-19 | Duke University | Anti-CD19 antibodies and uses in oncology |
Non-Patent Citations (5)
Cited By (14)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US11371039B2 (en) | 2008-04-11 | 2022-06-28 | Chugai Seiyaku Kabushiki Kaisha | Antigen-binding molecule capable of binding to two or more antigen molecules repeatedly |
| US11359194B2 (en) | 2008-04-11 | 2022-06-14 | Chugai Seiyaku Kabushiki Kaisha | Antigen-binding molecule capable of binding two or more antigen molecules repeatedly |
| US11827714B2 (en) | 2014-08-28 | 2023-11-28 | Juno Therapeutics, Inc. | Antibodies and chimeric antigen receptors specific for CD19 |
| US10533055B2 (en) | 2014-08-28 | 2020-01-14 | Juno Therapeutics, Inc. | Antibodies and chimeric antigen receptors specific for CD19 |
| RU2741105C2 (ru) * | 2014-08-28 | 2021-01-22 | Джуно Терапьютикс, Инк. | Антитела и химерные антигенные рецепторы, специфичные к cd19 |
| US11454633B2 (en) | 2014-12-19 | 2022-09-27 | Chugai Seiyaku Kabushiki Kaisha | Anti-myostatin antibodies, polypeptides containing variant Fc regions, and methods of use |
| US11180548B2 (en) | 2015-02-05 | 2021-11-23 | Chugai Seiyaku Kabushiki Kaisha | Methods of neutralizing IL-8 biological activity |
| RU2733315C2 (ru) * | 2015-06-12 | 2020-10-01 | Макродженикс, Инк. | Комбинированная терапия для лечения злокачественной опухоли |
| RU2728430C2 (ru) * | 2015-09-18 | 2020-07-29 | Чугаи Сейяку Кабусики Кайся | Il-8-связывающие антитела и их применения |
| RU2731156C1 (ru) * | 2015-10-01 | 2020-08-31 | Ф. Хоффманн-Ля Рош Аг | Гуманизированные антитела к cd19 человека и способы их применения |
| RU2761077C1 (ru) * | 2015-10-02 | 2021-12-03 | Ф. Хоффманн-Ля Рош Аг | Антитела против cd19 человека, обладающие высокой аффинностью |
| RU2752049C2 (ru) * | 2016-05-27 | 2021-07-22 | Эббви Байотерапьютикс Инк. | Антитела к cd40 и пути их применения |
| US11053308B2 (en) | 2016-08-05 | 2021-07-06 | Chugai Seiyaku Kabushiki Kaisha | Method for treating IL-8-related diseases |
| US11780912B2 (en) | 2016-08-05 | 2023-10-10 | Chugai Seiyaku Kabushiki Kaisha | Composition for prophylaxis or treatment of IL-8 related diseases |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US20210061906A1 (en) | Humanized anti-cd19 antibodies and their use in treatment of oncology, transplantation and autoimmune disease | |
| JP5824473B2 (ja) | ヒト化抗cd22抗体、並びに腫瘍、移植及び自己免疫疾患の治療におけるこれらの使用 | |
| AU2006244445B2 (en) | Anti-CD19 antibody therapy for autoimmune disease | |
| EP1999148B1 (en) | Humanized anti-cd22 antibodies and their use in treatment of oncology, transplantation and autoimmune disease | |
| KR20110125664A (ko) | 인간화된 항-cd19 항체 제형 | |
| CN101534859A (zh) | 人源化抗cd19抗体及其在治疗癌症、移植病和自身免疫病中的应用 | |
| BRPI0716611B1 (pt) | Anticorpo monoclonal e composição farmacêutica |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PC41 | Official registration of the transfer of exclusive right |
Effective date: 20211208 |