KR20230019152A - Tigit에 대한 항체 - Google Patents
Tigit에 대한 항체 Download PDFInfo
- Publication number
- KR20230019152A KR20230019152A KR1020227046210A KR20227046210A KR20230019152A KR 20230019152 A KR20230019152 A KR 20230019152A KR 1020227046210 A KR1020227046210 A KR 1020227046210A KR 20227046210 A KR20227046210 A KR 20227046210A KR 20230019152 A KR20230019152 A KR 20230019152A
- Authority
- KR
- South Korea
- Prior art keywords
- seq
- antibody
- sequence identity
- sequence
- chain variable
- Prior art date
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2803—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily
- C07K16/2809—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily against the T-cell receptor (TcR)-CD3 complex
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2803—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2803—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily
- C07K16/2818—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily against CD28 or CD152
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
- A61K2039/507—Comprising a combination of two or more separate antibodies
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2299/00—Coordinates from 3D structures of peptides, e.g. proteins or enzymes
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/20—Immunoglobulins specific features characterized by taxonomic origin
- C07K2317/24—Immunoglobulins specific features characterized by taxonomic origin containing regions, domains or residues from different species, e.g. chimeric, humanized or veneered
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/30—Immunoglobulins specific features characterized by aspects of specificity or valency
- C07K2317/33—Crossreactivity, e.g. for species or epitope, or lack of said crossreactivity
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/30—Immunoglobulins specific features characterized by aspects of specificity or valency
- C07K2317/34—Identification of a linear epitope shorter than 20 amino acid residues or of a conformational epitope defined by amino acid residues
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/55—Fab or Fab'
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
- C07K2317/565—Complementarity determining region [CDR]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/73—Inducing cell death, e.g. apoptosis, necrosis or inhibition of cell proliferation
- C07K2317/734—Complement-dependent cytotoxicity [CDC]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/76—Antagonist effect on antigen, e.g. neutralization or inhibition of binding
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/90—Immunoglobulins specific features characterized by (pharmaco)kinetic aspects or by stability of the immunoglobulin
- C07K2317/92—Affinity (KD), association rate (Ka), dissociation rate (Kd) or EC50 value
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02A—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE
- Y02A50/00—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE in human health protection, e.g. against extreme weather
- Y02A50/30—Against vector-borne diseases, e.g. mosquito-borne, fly-borne, tick-borne or waterborne diseases whose impact is exacerbated by climate change
Abstract
본 개시내용은 TIGIT에 특이적으로 결합하는 항체를 제공한다. 항체는 CD155에 대한 TIGIT의 결합을 억제함으로써 T 세포 및 자연 살해 세포의 실질적인 활성화를 위한 능력을 갖는다. 항체는 다른 응용 중에서도 암 및 감염성 질환의 치료에 사용될 수 있다.
Description
본 명세서에는, 특히, TIGIT에 특이적으로 결합하는 항체뿐만 아니라, 다른 응용 중에서도 암 및 감염성 질환의 치료를 위한 그의 용도가 제공된다.
기술분야
관련 출원의 교차 참조
본 출원은 2020년 6월 2일자로 출원된 미국 가특허 출원 제63/033,609호에 대한 우선권을 주장하며, 이의 개시내용은, 임의의 도면을 포함하여, 전체적으로 본 명세서에 참고로 포함된다.
서열 목록의 포함
본 출원은 전체적으로 본 명세서에 참고로 포함된 서열 목록을 포함한다. 파일명이 050658_531001WO_Sequence_Listing_ST25인 첨부된 서열 목록 텍스트 파일은 2021년 5월 31일에 생성되었고 143 KB이다.
종양에는, T 세포 및 NK 세포의 기능이 세포 표면 체크포인트 수용체에 의해 조절되어 암 세포가 면역계를 회피하도록 하는 고도로 억제성인 미세환경이 존재한다. 억제성 체크포인트 수용체, 예컨대 세포독성 T-림프구-관련 단백질 4(CTLA-4) 및 세포 예정사 1(PD-1)의 기능적 차단은 환자에 대한 고무적인 결과를 산출하였으며, 이는 잠재적인 간섭 표적으로서 작용할 수 있는 추가의 공동-억제성 분자를 모색함에 있어서 실질적인 관심을 생성한다.
세포질 꼬리에서 면역수용체 티로신-기반 억제성 모티프(ITIM)를 갖는 면역글로불린 수퍼패밀리의 구성원인 TIGIT(Ig 및 ITIM 도메인을 갖는 T 세포 면역수용체)는 조절 T 세포(Treg), 활성화된 T 세포, 및 자연 살해(NK) 세포에 의해 발현되는 공동-억제성 수용체이다. 몇몇 그룹이 다양한 종양에서 CD8+ 종양 침윤 림프구(TIL) 및 Treg 상에서 TIGIT 발현이 상승되었음을 보고하였다. 혈액에서의 HIV 감염 및 림프 조직에서의 SIV 감염 중에 이펙터 CD8+ T 세포가 더 높은 수준의 TIGIT를 나타낸다는 것이 또한 보고되어 있다. 또한, TIGIT 차단은 인간 T 세포 배양에서 활성화 활성을 나타냈고, 상이한 종양의 동물 모델에서 치료 이익을 나타냈다. 따라서, TIGIT는 항-종양 면역에서 중요한 역할을 하며, 암 및 다른 다양한 질환 및 병태의 관리를 위한 유망한 치료 표적으로서 작용할 수 있다. 그러므로, 유익한 치료 목적으로 TIGIT 결합을 방해할 수 있는 분자에 대한 필요성이 존재한다.
본 개시내용은, 특히, 항-TIGIT 항체에 관한 것이다.
본 명세서에는, (a) 서열 번호 36에 대해 80% 이상의 서열 동일성을 갖는 중쇄(HC) 상보성 결정 영역(CDR) 1, 서열 번호 37에 대해 80% 이상의 서열 동일성을 갖는 HC-CDR2, 및 서열 번호 38에 대해 80% 이상의 서열 동일성을 갖는 HC-CDR3을 포함하는 중쇄 가변 영역; 및 서열 번호 39에 대해 80% 이상의 서열 동일성을 갖는 경쇄(LC) CDR1, 서열 번호 40에 대해 80% 이상의 서열 동일성을 갖는 LC-CDR2, 및 서열 번호 41에 대해 80% 이상의 서열 동일성을 갖는 LC-CDR3을 포함하는 경쇄 가변 영역; (b) 서열 번호 42에 대해 80% 이상의 서열 동일성을 갖는 HC-CDR1, 서열 번호 43에 대해 80% 이상의 서열 동일성을 갖는 HC-CDR2, 및 서열 번호 44에 대해 80% 이상의 서열 동일성을 갖는 HC-CDR3을 포함하는 중쇄 가변 영역; 및 서열 번호 45에 대해 80% 이상의 서열 동일성을 갖는 LC-CDR1, 서열 번호 46에 대해 80% 이상의 서열 동일성을 갖는 LC-CDR2, 및 서열 번호 47에 대해 80% 이상의 서열 동일성을 갖는 LC-CDR3을 포함하는 경쇄 가변 영역; (c) 서열 번호 48에 대해 80% 이상의 서열 동일성을 갖는 HC-CDR1, 서열 번호 49에 대해 80% 이상의 서열 동일성을 갖는 HC-CDR2, 및 서열 번호 50에 대해 80% 이상의 서열 동일성을 갖는 HC-CDR3을 포함하는 중쇄 가변 영역; 및 서열 번호 51에 대해 80% 이상의 서열 동일성을 갖는 LC-CDR1, 서열 번호 52에 대해 80% 이상의 서열 동일성을 갖는 LC-CDR2, 및 서열 번호 53에 대해 80% 이상의 서열 동일성을 갖는 LC-CDR3을 포함하는 경쇄 가변 영역; (d) 서열 번호 54에 대해 80% 이상의 서열 동일성을 갖는 HC-CDR1, 서열 번호 55에 대해 80% 이상의 서열 동일성을 갖는 HC-CDR2, 및 서열 번호 56에 대해 80% 이상의 서열 동일성을 갖는 HC-CDR3을 포함하는 중쇄 가변 영역; 및 서열 번호 57에 대해 80% 이상의 서열 동일성을 갖는 LC-CDR1, 서열 번호 58에 대해 80% 이상의 서열 동일성을 갖는 LC-CDR2, 및 서열 번호 59에 대해 80% 이상의 서열 동일성을 갖는 LC-CDR3을 포함하는 경쇄 가변 영역; (e) 서열 번호 60에 대해 80% 이상의 서열 동일성을 갖는 HC-CDR1, 서열 번호 61에 대해 80% 이상의 서열 동일성을 갖는 HC-CDR2, 및 서열 번호 62에 대해 80% 이상의 서열 동일성을 갖는 HC-CDR3을 포함하는 중쇄 가변 영역; 및 서열 번호 63에 대해 80% 이상의 서열 동일성을 갖는 LC-CDR1, 서열 번호 64에 대해 80% 이상의 서열 동일성을 갖는 LC-CDR2, 및 서열 번호 65에 대해 80% 이상의 서열 동일성을 갖는 LC-CDR3을 포함하는 경쇄 가변 영역; (f) 서열 번호 60에 대해 80% 이상의 서열 동일성을 갖는 HC-CDR1, 서열 번호 66에 대해 80% 이상의 서열 동일성을 갖는 HC-CDR2, 및 서열 번호 67에 대해 80% 이상의 서열 동일성을 갖는 HC-CDR3을 포함하는 중쇄 가변 영역; 및 서열 번호 63에 대해 80% 이상의 서열 동일성을 갖는 LC-CDR1, 서열 번호 68에 대해 80% 이상의 서열 동일성을 갖는 LC-CDR2, 및 서열 번호 65에 대해 80% 이상의 서열 동일성을 갖는 LC-CDR3을 포함하는 경쇄 가변 영역; (g) 서열 번호 69에 대해 80% 이상의 서열 동일성을 갖는 HC-CDR1, 서열 번호 55에 대해 80% 이상의 서열 동일성을 갖는 HC-CDR2, 및 서열 번호 70에 대해 80% 이상의 서열 동일성을 갖는 HC-CDR3을 포함하는 중쇄 가변 영역; 및 서열 번호 71에 대해 80% 이상의 서열 동일성을 갖는 LC-CDR1, 서열 번호 68에 대해 80% 이상의 서열 동일성을 갖는 LC-CDR2, 및 서열 번호 65에 대해 80% 이상의 서열 동일성을 갖는 LC-CDR3을 포함하는 경쇄 가변 영역; (h) 서열 번호 72에 대해 80% 이상의 서열 동일성을 갖는 HC-CDR1, 서열 번호 73에 대해 80% 이상의 서열 동일성을 갖는 HC-CDR2, 및 서열 번호 67에 대해 80% 이상의 서열 동일성을 갖는 HC-CDR3을 포함하는 중쇄 가변 영역; 및 서열 번호 63에 대해 80% 이상의 서열 동일성을 갖는 LC-CDR1, 서열 번호 68에 대해 80% 이상의 서열 동일성을 갖는 LC-CDR2, 및 서열 번호 65에 대해 80% 이상의 서열 동일성을 갖는 LC-CDR3을 포함하는 경쇄 가변 영역; 또는 (i) 서열 번호 74에 대해 80% 이상의 서열 동일성을 갖는 HC-CDR1, 서열 번호 75에 대해 80% 이상의 서열 동일성을 갖는 HC-CDR2, 및 서열 번호 67에 대해 80% 이상의 서열 동일성을 갖는 HC-CDR3을 포함하는 중쇄 가변 영역; 및 서열 번호 63에 대해 80% 이상의 서열 동일성을 갖는 LC-CDR1, 서열 번호 68에 대해 80% 이상의 서열 동일성을 갖는 LC-CDR2, 및 서열 번호 65에 대해 80% 이상의 서열 동일성을 갖는 LC-CDR3을 포함하는 경쇄 가변 영역을 포함하는 항-TIGIT 항체 또는 이의 항원-결합 단편이 제공된다.
일부 실시 형태에서, 항-TIGIT 항체 또는 이의 항원-결합 단편은 (a) 서열 번호 1에 대해 80% 이상의 서열 동일성을 갖는 중쇄 가변 영역, 및 서열 번호 2에 대해 80% 이상의 서열 동일성을 갖는 경쇄 가변 영역; (b) 서열 번호 3에 대해 80% 이상의 서열 동일성을 갖는 중쇄 가변 영역, 및 서열 번호 4에 대해 80% 이상의 서열 동일성을 갖는 경쇄 가변 영역; (c) 서열 번호 5에 대해 80% 이상의 서열 동일성을 갖는 중쇄 가변 영역, 및 서열 번호 6에 대해 80% 이상의 서열 동일성을 갖는 경쇄 가변 영역; (d) 서열 번호 7에 대해 80% 이상의 서열 동일성을 갖는 중쇄 가변 영역, 및 서열 번호 8에 대해 80% 이상의 서열 동일성을 갖는 경쇄 가변 영역; (e) 서열 번호 9에 대해 80% 이상의 서열 동일성을 갖는 중쇄 가변 영역, 및 서열 번호 10에 대해 80% 이상의 서열 동일성을 갖는 경쇄 가변 영역; (f) 서열 번호 11에 대해 80% 이상의 서열 동일성을 갖는 중쇄 가변 영역, 및 서열 번호 12에 대해 80% 이상의 서열 동일성을 갖는 경쇄 가변 영역; (g) 서열 번호 13에 대해 80% 이상의 서열 동일성을 갖는 중쇄 가변 영역, 및 서열 번호 14에 대해 80% 이상의 서열 동일성을 갖는 경쇄 가변 영역; (h) 서열 번호 15에 대해 80% 이상의 서열 동일성을 갖는 중쇄 가변 영역, 및 서열 번호 16에 대해 80% 이상의 서열 동일성을 갖는 경쇄 가변 영역; (i) 서열 번호 17에 대해 80% 이상의 서열 동일성을 갖는 중쇄 가변 영역, 및 서열 번호 12에 대해 80% 이상의 서열 동일성을 갖는 경쇄 가변 영역; (j) 서열 번호 76에 대해 80% 이상의 서열 동일성을 갖는 중쇄 가변 영역, 및 서열 번호 77에 대해 80% 이상의 서열 동일성을 갖는 경쇄 가변 영역; (k) 서열 번호 78에 대해 80% 이상의 서열 동일성을 갖는 중쇄 가변 영역, 및 서열 번호 77에 대해 80% 이상의 서열 동일성을 갖는 경쇄 가변 영역; (l) 서열 번호 76에 대해 80% 이상의 서열 동일성을 갖는 중쇄 가변 영역, 및 서열 번호 79에 대해 80% 이상의 서열 동일성을 갖는 경쇄 가변 영역; 또는 (m) 서열 번호 78에 대해 80% 이상의 서열 동일성을 갖는 중쇄 가변 영역, 및 서열 번호 79에 대해 80% 이상의 서열 동일성을 갖는 경쇄 가변 영역을 포함한다.
본 명세서에는, 하기 TIGIT의 아미노산 잔기 중 하나 이상을 포함하는 에피토프에 결합하는 항-TIGIT 항체, 또는 이의 항원-결합 단편이 제공된다: 서열 번호 80의 T55, Q56, N58, E60, D72, S80, 및 K82. 일부 실시 형태에서, 항-TIGIT 항체는 적어도 하기 TIGIT의 잔기를 포함하는 에피토프에 결합한다: 서열 번호 80의 D72 및 서열 번호 80의 T55, Q56, N58, E60, S80, 및 K82 중 하나 이상. 일부 실시 형태에서, 항-TIGIT 항체는 적어도 하기 TIGIT의 잔기를 포함하는 에피토프에 결합한다: 서열 번호 80의 E60 및 D72 및 임의로 서열 번호 80의 T55, Q56, N58, S80, 및 K82 중 하나 이상. 일부 실시 형태에서, 항-TIGIT 항체는 적어도 하기 TIGIT의 잔기를 포함하는 에피토프에 결합한다: 서열 번호 80의 D72 및 K82 및 임의로 서열 번호 80의 T55, Q56, N58, E60, 및 S80 중 하나 이상. 일부 실시 형태에서, 항-TIGIT 항체는 적어도 하기 TIGIT의 잔기를 포함하는 에피토프에 결합한다: 서열 번호 80의 E60, D72, 및 K82 및 임의로 서열 번호 80의 T55, Q56, N58, 및 S80 중 하나 이상. 일부 실시 형태에서, 항체는 본 명세서에 기재된 바와 같은 CDR 및 가변 서열의 구조적 특징을 갖는다.
본 개시내용의 항-TIGIT 항체는 단리된 항체일 수 있다. 일부 실시 형태에서, 항-TIGIT 항체 또는 이의 항원-결합 단편은 단일클론 항체이다. 일부 실시 형태에서, 항-TIGIT 항체 또는 이의 항원-결합 단편은 키메라, 인간화, 또는 베니어(veneered) 항체이다. 일부 실시 형태에서, 키메라 항체는 인간 IgG1/카파 Fab 불변 도메인을 포함한다. 일부 실시 형태에서, 항-TIGIT 항체 또는 이의 항원-결합 단편은 인간 항체이다. 일부 실시 형태에서, 항-TIGIT 항체 또는 이의 항원 결합 단편은 CD155에 대한 TIGIT의 결합을 억제한다.
본 명세서에는, 본 개시내용에 기재된 바와 같은 항-TIGIT 항체 및 약제학적으로 허용가능한 담체를 포함하는 약제학적 조성물이 제공된다.
본 명세서에는, 암을 치료하거나 암의 예방을 달성하는 방법으로서, 암을 갖거나 암의 위험이 있는 대상체에게 본 개시내용에 기재된 임의의 항-TIGIT 항체의 효과적인 요법 또는 치료적 유효량을 투여하는 단계를 포함하는, 방법을 제공한다. 일부 실시 형태에서, 암은 혈액학적 암이다. 일부 실시 형태에서, 암은 급성 골수성 백혈병 또는 성인 T-세포 백혈병이다. 일부 실시 형태에서, 암은 고형 종양, 비-소세포 폐 암종, 흑색종, 자궁경부암, 다발성 골수종, 림프종, 비-호지킨 림프종, 미만성 거대 B-세포 림프종, 위암, 위식도 접합부 선암종, 또는 식도암이다. 일부 실시 형태에서는, 종양 침윤 T 세포가 또한 대상체에게 투여된다. 일부 실시 형태에서는, 암에 대한 면역 반응을 유도하는 백신이 또한 대상체에게 투여된다. 일부 실시 형태에서, 백신은 암 세포의 표면 상에 발현되는 항원 또는 이의 단편을 포함한다. 일부 실시 형태에서는, 자연 살해 세포가 또한 대상체에게 투여되며, 암에 대한 이의 세포독성은 항체에 의해 향상된다. 일부 실시 형태에서는, 암의 세포의 표면 상에 발현되는 항원에 특이적으로 결합하는 제2 항체가 대상체에게 추가로 투여되며, 여기서 암에 대한 제2 항체의 이펙터 매개 세포독성은 본 개시내용의 항-TIGIT 항체에 의해 향상된다. 일부 실시 형태에서는, 면역 세포의 표면 상에 발현되는 항원에 특이적으로 결합하는 제2 항체가 대상체에게 추가로 투여된다. 일부 실시 형태에서, 면역 세포는 T 세포 또는 자연 살해 세포이다. 일부 실시 형태에서, 항원은 CTLA-4, PD-1, 또는 PD-L1이다. 일부 실시 형태에서는, 화학요법, 방사선, 세포-기반 요법, 및 수술로 이루어진 군으로부터 선택된 하나 이상의 요법이 대상체에게 추가로 투여된다. 일부 실시 형태에서는, 하나 이상의 면역-체크포인트 수용체 또는 리간드의 억제제가 대상체에게 추가로 투여된다. 일부 실시 형태에서, 하나 이상의 면역-체크포인트 수용체 또는 리간드는 CTLA-4, PD-1, PD-L1, TIM-3, LAG-3, PVRIG, BTLA, VISTA, CD96, A2aR, A2bR, A2a/A2bR, 아르기나제, CD39, CD73, IDO, 및 TDO로 이루어진 군으로부터 선택된다. 일부 실시 형태에서, 하나 이상의 면역-체크포인트 수용체 또는 리간드는 CTLA-4, PD-1, PD-L1, A2aR, A2bR, A2a/A2bR, 아르기나제, CD39, 및 CD73으로 이루어진 군으로부터 선택된다. 일부 실시 형태에서, 억제제는 이필리무맙, 트레멜리무맙, 니볼루맙, 펨브롤리주맙, 람브롤리주맙, 세미플리맙, 티스렐리주맙, 짐베렐리맙, 두르발루맙, 및 아테졸리주맙으로 이루어진 군으로부터 선택된다.
본 명세서에는, 암의 치료를 보조하는 방법으로서, 암을 갖는 대상체에게 본 명세서에 기재된 항-TIGIT 항체 중 임의의 것의 치료적 유효량을 투여하는 단계를 포함하는, 방법이 제공된다. 일부 실시 형태에서, 암은 혈액학적 암이다. 일부 실시 형태에서, 암은 급성 골수성 백혈병 또는 성인 T-세포 백혈병이다. 일부 실시 형태에서, 암은 고형 종양, 비-소세포 폐 암종, 흑색종, 자궁경부암, 다발성 골수종, 림프종, 비-호지킨 림프종, 미만성 거대 B-세포 림프종, 위암, 위식도 접합부 선암종, 또는 식도암이다. 일부 실시 형태에서는, 항체에 의해 활성화되는 종양 침윤 T 세포가 또한 대상체에게 투여된다. 일부 실시 형태에서는, 암에 대한 면역 반응을 유도하는 백신이 또한 대상체에게 투여되며, 이는 항체에 의해 향상된다. 일부 실시 형태에서, 백신은 암 세포의 표면 상에 발현되는 항원 또는 이의 단편을 포함한다. 일부 실시 형태에서는, 자연 살해 세포가 또한 대상체에게 투여되며, 암에 대한 이의 세포독성은 본 개시내용의 항-TIGIT 항체에 의해 향상된다. 일부 실시 형태에서는, 암의 세포의 표면 상에 발현되는 항원에 특이적으로 결합하는 제2 항체가 대상체에게 또한 투여되며, 여기서 암에 대한 제2 항체의 이펙터 매개 세포독성은 본 개시내용의 항-TIGIT 항체에 의해 향상된다. 일부 실시 형태에서는, 면역 세포의 표면 상에 발현되는 항원에 특이적으로 결합하는 제2 항체가 대상체에게 추가로 투여된다. 일부 실시 형태에서, 면역 세포는 T 세포 또는 자연 살해 세포이다. 일부 실시 형태에서, 항원은 CTLA-4, PD-1, 또는 PD-L1이다. 일부 실시 형태에서는, 화학요법, 방사선, 세포-기반 요법, 및 수술로 이루어진 군으로부터 선택된 하나 이상의 요법이 대상체에게 추가로 투여된다. 일부 실시 형태에서는, 하나 이상의 면역-체크포인트 수용체 또는 리간드의 억제제가 대상체에게 추가로 투여된다. 일부 실시 형태에서, 하나 이상의 면역-체크포인트 수용체 또는 리간드는 CTLA-4, PD-1, PD-L1, TIM-3, LAG-3, PVRIG, BTLA, VISTA, CD96, A2aR, A2bR, A2a/A2bR, 아르기나제, CD39, CD73, IDO, 및 TDO로 이루어진 군으로부터 선택된다. 일부 실시 형태에서, 하나 이상의 면역-체크포인트 수용체 또는 리간드는 CTLA-4, PD-1, PD-L1, A2aR, A2bR, A2a/A2bR, 아르기나제, CD39, 및 CD73으로 이루어진 군으로부터 선택된다. 일부 실시 형태에서, 억제제는 이필리무맙, 트레멜리무맙, 니볼루맙, 펨브롤리주맙, 람브롤리주맙, 세미플리맙, 티스렐리주맙, 짐베렐리맙, 두르발루맙, 및 아테졸리주맙으로 이루어진 군으로부터 선택된다.
실시 형태 또는 태양의 문맥으로부터 명시적으로 또는 명확하게 배제되지 않는 한, 본 명세서에 기재된 태양 및 실시 형태 각각은 함께 사용될 수 있다.
도 1a는 21F8의 성숙 VH(서열 번호 1) 및 21F8의 성숙 VL(서열 번호 2)의 아미노산 서열을 나타낸다. VH의 CDR1, CDR2, 및 CDR3 아미노산 서열은 밑줄로 표시되고 각각 HC-CDR1(서열 번호 36), HC-CDR2(서열 번호 37), 및 HC-CDR3(서열 번호 38)으로서 식별된다. VL의 CDR1, CDR2, 및 CDR3 아미노산 서열은 밑줄로 표시되고 각각 LC-CDR1(서열 번호 39), LC-CDR2(서열 번호 40), 및 LC-CDR3(서열 번호 41)으로서 식별된다.
도 1b는 30M18의 성숙 VH(서열 번호 3) 및 30M18의 성숙 VL(서열 번호 4)의 아미노산 서열을 나타낸다. VH의 CDR1, CDR2, 및 CDR3 아미노산 서열은 밑줄로 표시되고 각각 HC-CDR1(서열 번호 42), HC-CDR2(서열 번호 43), 및 HC-CDR3(서열 번호 44)으로서 식별된다. VL의 CDR1, CDR2, 및 CDR3 아미노산 서열은 밑줄로 표시되고 각각 LC-CDR1(서열 번호 45), LC-CDR2(서열 번호 46), 및 LC-CDR3(서열 번호 47)으로서 식별된다.
도 1c는 24F8의 성숙 VH(서열 번호 5) 및 24F8의 성숙 VL(서열 번호 6)의 아미노산 서열을 나타낸다. VH의 CDR1, CDR2, 및 CDR3 아미노산 서열은 밑줄로 표시되고 각각 HC-CDR1(서열 번호 48), HC-CDR2(서열 번호 49), 및 HC-CDR3(서열 번호 50)으로서 식별된다. VL의 CDR1, CDR2, 및 CDR3 아미노산 서열은 밑줄로 표시되고 각각 LC-CDR1(서열 번호 51), LC-CDR2(서열 번호 52), 및 LC-CDR3(서열 번호 53)으로서 식별된다.
도 1d는 5J24의 성숙 VH(서열 번호 7) 및 5J24의 성숙 VL(서열 번호 8)의 아미노산 서열을 나타낸다. VH의 CDR1, CDR2, 및 CDR3 아미노산 서열은 밑줄로 표시되고 각각 HC-CDR1(서열 번호 54), HC-CDR2(서열 번호 55), 및 HC-CDR3(서열 번호 56)으로서 식별된다. VL의 CDR1, CDR2, 및 CDR3 아미노산 서열은 밑줄로 표시되고 각각 LC-CDR1(서열 번호 57), LC-CDR2(서열 번호 58), 및 LC-CDR3(서열 번호 59)으로서 식별된다.
도 1e는 21B9의 성숙 VH(서열 번호 9) 및 21B9의 성숙 VL(서열 번호 10)의 아미노산 서열을 나타낸다. VH의 CDR1, CDR2, 및 CDR3 아미노산 서열은 밑줄로 표시되고 각각 HC-CDR1(서열 번호 60), HC-CDR2(서열 번호 61), 및 HC-CDR3(서열 번호 62)으로서 식별된다. VL의 CDR1, CDR2, 및 CDR3 아미노산 서열은 밑줄로 표시되고 각각 LC-CDR1(서열 번호 63), LC-CDR2(서열 번호 64), 및 LC-CDR3(서열 번호 65)으로서 식별된다.
도 1f는 22B22의 성숙 VH(서열 번호 11) 및 22B22의 성숙 VL(서열 번호 12)의 아미노산 서열을 나타낸다. VH의 CDR1, CDR2, 및 CDR3 아미노산 서열은 밑줄로 표시되고 각각 HC-CDR1(서열 번호 60), HC-CDR2(서열 번호 66), 및 HC-CDR3(서열 번호 67)으로서 식별된다. VL의 CDR1, CDR2, 및 CDR3 아미노산 서열은 밑줄로 표시되고 각각 LC-CDR1(서열 번호 63), LC-CDR2(서열 번호 68), 및 LC-CDR3(서열 번호 65)으로서 식별된다.
도 1g는 28P24의 성숙 VH(서열 번호 13) 및 28P24의 성숙 VL(서열 번호 14)의 아미노산 서열을 나타낸다. VH의 CDR1, CDR2, 및 CDR3 아미노산 서열은 밑줄로 표시되고 각각 HC-CDR1(서열 번호 69), HC-CDR2(서열 번호 55), 및 HC-CDR3(서열 번호 70)으로서 식별된다. VL의 CDR1, CDR2, 및 CDR3 아미노산 서열은 밑줄로 표시되고 각각 LC-CDR1(서열 번호 71), LC-CDR2(서열 번호 68), 및 LC-CDR3(서열 번호 65)으로서 식별된다.
도 1h는 21B16의 성숙 VH(서열 번호 15) 및 21B16의 성숙 VL(서열 번호 16)의 아미노산 서열을 나타낸다. VH의 CDR1, CDR2, 및 CDR3 아미노산 서열은 밑줄로 표시되고 각각 HC-CDR1(서열 번호 72), HC-CDR2(서열 번호 73), 및 HC-CDR3(서열 번호 67)으로서 식별된다. VL의 CDR1, CDR2, 및 CDR3 아미노산 서열은 밑줄로 표시되고 각각 LC-CDR1(서열 번호 63), LC-CDR2(서열 번호 68), 및 LC-CDR3(서열 번호 65)으로서 식별된다.
도 1i는 28O12의 성숙 VH(서열 번호 17) 및 28O12의 성숙 VL(서열 번호 12)의 아미노산 서열을 나타낸다. VH의 CDR1, CDR2, 및 CDR3 아미노산 서열은 밑줄로 표시되고 각각 HC-CDR1(서열 번호 74), HC-CDR2(서열 번호 75), 및 HC-CDR3(서열 번호 67)으로서 식별된다. VL의 CDR1, CDR2, 및 CDR3 아미노산 서열은 밑줄로 표시되고 각각 LC-CDR1(서열 번호 63), LC-CDR2(서열 번호 68), 및 LC-CDR3(서열 번호 65)으로서 식별된다.
도 1j는 Hu24F8.1의 성숙 VH(서열 번호 76) 및 Hu24F8.1의 성숙 VL(서열 번호 77)의 아미노산 서열을 나타낸다. VH의 CDR1, CDR2, 및 CDR3 아미노산 서열은 밑줄로 표시되고 각각 HC-CDR1(서열 번호 48), HC-CDR2(서열 번호 49), 및 HC-CDR3(서열 번호 50)으로서 식별된다. VL의 CDR1, CDR2, 및 CDR3 아미노산 서열은 밑줄로 표시되고 각각 LC-CDR1(서열 번호 51), LC-CDR2(서열 번호 52), 및 LC-CDR3(서열 번호 53)으로서 식별된다.
도 1k는 Hu24F8.2의 성숙 VH(서열 번호 78) 및 Hu24F8.2의 성숙 VL(서열 번호 77)의 아미노산 서열을 나타낸다. VH의 CDR1, CDR2, 및 CDR3 아미노산 서열은 밑줄로 표시되고 각각 HC-CDR1(서열 번호 48), HC-CDR2(서열 번호 49), 및 HC-CDR3(서열 번호 50)으로서 식별된다. VL의 CDR1, CDR2, 및 CDR3 아미노산 서열은 밑줄로 표시되고 각각 LC-CDR1(서열 번호 51), LC-CDR2(서열 번호 52), 및 LC-CDR3(서열 번호 53)으로서 식별된다.
도 1l은 Hu24F8.3의 성숙 VH(서열 번호 78) 및 Hu24F8.3의 성숙 VL(서열 번호 79)의 아미노산 서열을 나타낸다. VH의 CDR1, CDR2, 및 CDR3 아미노산 서열은 밑줄로 표시되고 각각 HC-CDR1(서열 번호 48), HC-CDR2(서열 번호 49), 및 HC-CDR3(서열 번호 50)으로서 식별된다. VL의 CDR1, CDR2, 및 CDR3 아미노산 서열은 밑줄로 표시되고 각각 LC-CDR1(서열 번호 51), LC-CDR2(서열 번호 52), 및 LC-CDR3(서열 번호 53)으로서 식별된다.
도 1m은 Hu24F8.4의 성숙 VH(서열 번호 76) 및 Hu24F8.4의 성숙 VL(서열 번호 79)의 아미노산 서열을 나타낸다. VH의 CDR1, CDR2, 및 CDR3 아미노산 서열은 밑줄로 표시되고 각각 HC-CDR1(서열 번호 48), HC-CDR2(서열 번호 49), 및 HC-CDR3(서열 번호 50)으로서 식별된다. VL의 CDR1, CDR2, 및 CDR3 아미노산 서열은 밑줄로 표시되고 각각 LC-CDR1(서열 번호 51), LC-CDR2(서열 번호 52), 및 LC-CDR3(서열 번호 53)으로서 식별된다.
도 2는 Ch24F8, Ch28O12, 및 Ch22B22가 시노 CD4+ 및 CD8+ 세포 상에 발현되는 시노 TIGIT에 결합할 수 있었음을 나타낸다. 형광 강도의 기하 평균(gMFI)이 얻어졌으며, 데이터는 동종형 대조군에 비교한 gMFI의 배수로서 제시되었다.
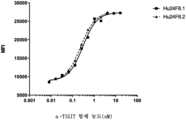
도 3a는 인간 TIGIT를 과발현하는 CHO-K1 세포에 대한 인간화 항-TIGIT 항체의 결합을 나타내는 그래프이다.
도 3b는 시노몰구스 원숭이 TIGIT를 과발현하는 CHO-K1 세포에 대한 인간화 항-TIGIT 항체의 결합을 나타내는 그래프이다.
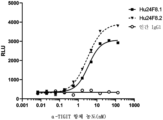
도 4a는 마우스 TIGIT를 과발현하는 CHO-K1 세포에 대한 인간화 항-TIGIT의 결합을 나타내는 그래프이다.
도 4b는 래트 TIGIT를 과발현하는 CHO-K1 세포에 대한 인간화 항-TIGIT의 결합을 나타내는 그래프이다.
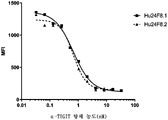
도 5a는 인간 비활성화 CD8+ T 세포에 대한 인간화 항-TIGIT 항체의 결합을 나타내는 그래프이다.
도 5b는 인간 활성화 CD8+ T 세포에 대한 인간화 항-TIGIT 항체의 결합을 나타내는 그래프이다.
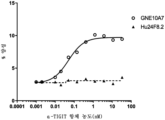
도 6은 인간화 항-TIGIT 항체에 의한, 인간 TIGIT를 과발현하는 CHO-K1 세포에 대한 인간 CD155 결합의 억제를 나타내는 그래프이다.
도 7은 Jurkat 이중 리포터 세포주 차단 검정(Jurkat Dual Reporter Cell Line Blockade Assay)에서 인간화 항-TIGIT 항체에 의한, 인간 TIGIT에 대한 인간 CD155 결합의 억제를 나타내는 그래프이다.
도 8은 TIGIT에 대한 Fab24F8의 결합을 나타낸다.
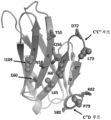
도 9는 Fab24F8과 수소 결합, 염 가교, 및 반 데르 발스 상호작용을 갖는 TIGIT 잔기를 나타낸다.
도 10a 및 도 10b는 TIGIT에 대한 CD155의 결합이 Fab24F8에 의해 차단됨을 나타낸다. 도 10a는 인간 TIGIT(분자 표면으로서 나타냄)에 결합된 인간 CD155(리본 표현으로)의 복합체 구조의 개략도를 나타낸다. 도 10b는 도 10a와 동일한 배향으로, TIGIT에 결합된 Fab24F8의 결정 구조 복합체(각각 분자 표면에 의해 나타냄)의 개략도 상의 CD155의 중첩을 나타낸다.
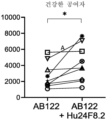
도 11은 Hu24F8.2-IgG1, AB122, AB122, 및 Hu24F8.2-IgG1, 또는 동종형 대조군의 존재 하에, 단일 대상체, SEA에 대한 IL-2 반응을 나타낸다. 막대 및 오차는 평균 ± 표준 오차 평균을 도시한다. ** p<0.01, *** p<0.001, **** p<0.0001, 시닥 다중 비교 검정(Sidak's multiple comparisons test)을 갖는 일원 ANOVA(각각의 농도에 대해 Hu24F8.2-IgG1 대 IgG1, 및 AB122 + Hu24F8.2-IgG1 대 AB122 단독 또는 Hu24F8.2-IgG1 단독).
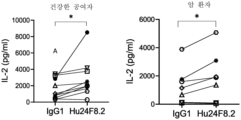
도 12a는 Hu24F8.2-IgG1 또는 동종형 대조군의 존재 하에 SEA에 대한 건강한 대상체 또는 암 대상체 PBMC의 IL-2 반응을 나타낸다. 각각의 기호는 개별 대상체를 나타낸다. * p<0.05, 대응표본 t-검정.
도 12b는 AB122 및 Hu24F8.2-IgG1에 비교하여 AB122의 존재 하에 SEA에 대한 건강한 대상체 PBMC의 IL-2 반응을 나타낸다. 각각의 기호는 개별 대상체를 나타낸다. * p<0.05, 대응표본 t-검정.
도 1b는 30M18의 성숙 VH(서열 번호 3) 및 30M18의 성숙 VL(서열 번호 4)의 아미노산 서열을 나타낸다. VH의 CDR1, CDR2, 및 CDR3 아미노산 서열은 밑줄로 표시되고 각각 HC-CDR1(서열 번호 42), HC-CDR2(서열 번호 43), 및 HC-CDR3(서열 번호 44)으로서 식별된다. VL의 CDR1, CDR2, 및 CDR3 아미노산 서열은 밑줄로 표시되고 각각 LC-CDR1(서열 번호 45), LC-CDR2(서열 번호 46), 및 LC-CDR3(서열 번호 47)으로서 식별된다.
도 1c는 24F8의 성숙 VH(서열 번호 5) 및 24F8의 성숙 VL(서열 번호 6)의 아미노산 서열을 나타낸다. VH의 CDR1, CDR2, 및 CDR3 아미노산 서열은 밑줄로 표시되고 각각 HC-CDR1(서열 번호 48), HC-CDR2(서열 번호 49), 및 HC-CDR3(서열 번호 50)으로서 식별된다. VL의 CDR1, CDR2, 및 CDR3 아미노산 서열은 밑줄로 표시되고 각각 LC-CDR1(서열 번호 51), LC-CDR2(서열 번호 52), 및 LC-CDR3(서열 번호 53)으로서 식별된다.
도 1d는 5J24의 성숙 VH(서열 번호 7) 및 5J24의 성숙 VL(서열 번호 8)의 아미노산 서열을 나타낸다. VH의 CDR1, CDR2, 및 CDR3 아미노산 서열은 밑줄로 표시되고 각각 HC-CDR1(서열 번호 54), HC-CDR2(서열 번호 55), 및 HC-CDR3(서열 번호 56)으로서 식별된다. VL의 CDR1, CDR2, 및 CDR3 아미노산 서열은 밑줄로 표시되고 각각 LC-CDR1(서열 번호 57), LC-CDR2(서열 번호 58), 및 LC-CDR3(서열 번호 59)으로서 식별된다.
도 1e는 21B9의 성숙 VH(서열 번호 9) 및 21B9의 성숙 VL(서열 번호 10)의 아미노산 서열을 나타낸다. VH의 CDR1, CDR2, 및 CDR3 아미노산 서열은 밑줄로 표시되고 각각 HC-CDR1(서열 번호 60), HC-CDR2(서열 번호 61), 및 HC-CDR3(서열 번호 62)으로서 식별된다. VL의 CDR1, CDR2, 및 CDR3 아미노산 서열은 밑줄로 표시되고 각각 LC-CDR1(서열 번호 63), LC-CDR2(서열 번호 64), 및 LC-CDR3(서열 번호 65)으로서 식별된다.
도 1f는 22B22의 성숙 VH(서열 번호 11) 및 22B22의 성숙 VL(서열 번호 12)의 아미노산 서열을 나타낸다. VH의 CDR1, CDR2, 및 CDR3 아미노산 서열은 밑줄로 표시되고 각각 HC-CDR1(서열 번호 60), HC-CDR2(서열 번호 66), 및 HC-CDR3(서열 번호 67)으로서 식별된다. VL의 CDR1, CDR2, 및 CDR3 아미노산 서열은 밑줄로 표시되고 각각 LC-CDR1(서열 번호 63), LC-CDR2(서열 번호 68), 및 LC-CDR3(서열 번호 65)으로서 식별된다.
도 1g는 28P24의 성숙 VH(서열 번호 13) 및 28P24의 성숙 VL(서열 번호 14)의 아미노산 서열을 나타낸다. VH의 CDR1, CDR2, 및 CDR3 아미노산 서열은 밑줄로 표시되고 각각 HC-CDR1(서열 번호 69), HC-CDR2(서열 번호 55), 및 HC-CDR3(서열 번호 70)으로서 식별된다. VL의 CDR1, CDR2, 및 CDR3 아미노산 서열은 밑줄로 표시되고 각각 LC-CDR1(서열 번호 71), LC-CDR2(서열 번호 68), 및 LC-CDR3(서열 번호 65)으로서 식별된다.
도 1h는 21B16의 성숙 VH(서열 번호 15) 및 21B16의 성숙 VL(서열 번호 16)의 아미노산 서열을 나타낸다. VH의 CDR1, CDR2, 및 CDR3 아미노산 서열은 밑줄로 표시되고 각각 HC-CDR1(서열 번호 72), HC-CDR2(서열 번호 73), 및 HC-CDR3(서열 번호 67)으로서 식별된다. VL의 CDR1, CDR2, 및 CDR3 아미노산 서열은 밑줄로 표시되고 각각 LC-CDR1(서열 번호 63), LC-CDR2(서열 번호 68), 및 LC-CDR3(서열 번호 65)으로서 식별된다.
도 1i는 28O12의 성숙 VH(서열 번호 17) 및 28O12의 성숙 VL(서열 번호 12)의 아미노산 서열을 나타낸다. VH의 CDR1, CDR2, 및 CDR3 아미노산 서열은 밑줄로 표시되고 각각 HC-CDR1(서열 번호 74), HC-CDR2(서열 번호 75), 및 HC-CDR3(서열 번호 67)으로서 식별된다. VL의 CDR1, CDR2, 및 CDR3 아미노산 서열은 밑줄로 표시되고 각각 LC-CDR1(서열 번호 63), LC-CDR2(서열 번호 68), 및 LC-CDR3(서열 번호 65)으로서 식별된다.
도 1j는 Hu24F8.1의 성숙 VH(서열 번호 76) 및 Hu24F8.1의 성숙 VL(서열 번호 77)의 아미노산 서열을 나타낸다. VH의 CDR1, CDR2, 및 CDR3 아미노산 서열은 밑줄로 표시되고 각각 HC-CDR1(서열 번호 48), HC-CDR2(서열 번호 49), 및 HC-CDR3(서열 번호 50)으로서 식별된다. VL의 CDR1, CDR2, 및 CDR3 아미노산 서열은 밑줄로 표시되고 각각 LC-CDR1(서열 번호 51), LC-CDR2(서열 번호 52), 및 LC-CDR3(서열 번호 53)으로서 식별된다.
도 1k는 Hu24F8.2의 성숙 VH(서열 번호 78) 및 Hu24F8.2의 성숙 VL(서열 번호 77)의 아미노산 서열을 나타낸다. VH의 CDR1, CDR2, 및 CDR3 아미노산 서열은 밑줄로 표시되고 각각 HC-CDR1(서열 번호 48), HC-CDR2(서열 번호 49), 및 HC-CDR3(서열 번호 50)으로서 식별된다. VL의 CDR1, CDR2, 및 CDR3 아미노산 서열은 밑줄로 표시되고 각각 LC-CDR1(서열 번호 51), LC-CDR2(서열 번호 52), 및 LC-CDR3(서열 번호 53)으로서 식별된다.
도 1l은 Hu24F8.3의 성숙 VH(서열 번호 78) 및 Hu24F8.3의 성숙 VL(서열 번호 79)의 아미노산 서열을 나타낸다. VH의 CDR1, CDR2, 및 CDR3 아미노산 서열은 밑줄로 표시되고 각각 HC-CDR1(서열 번호 48), HC-CDR2(서열 번호 49), 및 HC-CDR3(서열 번호 50)으로서 식별된다. VL의 CDR1, CDR2, 및 CDR3 아미노산 서열은 밑줄로 표시되고 각각 LC-CDR1(서열 번호 51), LC-CDR2(서열 번호 52), 및 LC-CDR3(서열 번호 53)으로서 식별된다.
도 1m은 Hu24F8.4의 성숙 VH(서열 번호 76) 및 Hu24F8.4의 성숙 VL(서열 번호 79)의 아미노산 서열을 나타낸다. VH의 CDR1, CDR2, 및 CDR3 아미노산 서열은 밑줄로 표시되고 각각 HC-CDR1(서열 번호 48), HC-CDR2(서열 번호 49), 및 HC-CDR3(서열 번호 50)으로서 식별된다. VL의 CDR1, CDR2, 및 CDR3 아미노산 서열은 밑줄로 표시되고 각각 LC-CDR1(서열 번호 51), LC-CDR2(서열 번호 52), 및 LC-CDR3(서열 번호 53)으로서 식별된다.
도 2는 Ch24F8, Ch28O12, 및 Ch22B22가 시노 CD4+ 및 CD8+ 세포 상에 발현되는 시노 TIGIT에 결합할 수 있었음을 나타낸다. 형광 강도의 기하 평균(gMFI)이 얻어졌으며, 데이터는 동종형 대조군에 비교한 gMFI의 배수로서 제시되었다.
도 3a는 인간 TIGIT를 과발현하는 CHO-K1 세포에 대한 인간화 항-TIGIT 항체의 결합을 나타내는 그래프이다.
도 3b는 시노몰구스 원숭이 TIGIT를 과발현하는 CHO-K1 세포에 대한 인간화 항-TIGIT 항체의 결합을 나타내는 그래프이다.
도 4a는 마우스 TIGIT를 과발현하는 CHO-K1 세포에 대한 인간화 항-TIGIT의 결합을 나타내는 그래프이다.
도 4b는 래트 TIGIT를 과발현하는 CHO-K1 세포에 대한 인간화 항-TIGIT의 결합을 나타내는 그래프이다.
도 5a는 인간 비활성화 CD8+ T 세포에 대한 인간화 항-TIGIT 항체의 결합을 나타내는 그래프이다.
도 5b는 인간 활성화 CD8+ T 세포에 대한 인간화 항-TIGIT 항체의 결합을 나타내는 그래프이다.
도 6은 인간화 항-TIGIT 항체에 의한, 인간 TIGIT를 과발현하는 CHO-K1 세포에 대한 인간 CD155 결합의 억제를 나타내는 그래프이다.
도 7은 Jurkat 이중 리포터 세포주 차단 검정(Jurkat Dual Reporter Cell Line Blockade Assay)에서 인간화 항-TIGIT 항체에 의한, 인간 TIGIT에 대한 인간 CD155 결합의 억제를 나타내는 그래프이다.
도 8은 TIGIT에 대한 Fab24F8의 결합을 나타낸다.
도 9는 Fab24F8과 수소 결합, 염 가교, 및 반 데르 발스 상호작용을 갖는 TIGIT 잔기를 나타낸다.
도 10a 및 도 10b는 TIGIT에 대한 CD155의 결합이 Fab24F8에 의해 차단됨을 나타낸다. 도 10a는 인간 TIGIT(분자 표면으로서 나타냄)에 결합된 인간 CD155(리본 표현으로)의 복합체 구조의 개략도를 나타낸다. 도 10b는 도 10a와 동일한 배향으로, TIGIT에 결합된 Fab24F8의 결정 구조 복합체(각각 분자 표면에 의해 나타냄)의 개략도 상의 CD155의 중첩을 나타낸다.
도 11은 Hu24F8.2-IgG1, AB122, AB122, 및 Hu24F8.2-IgG1, 또는 동종형 대조군의 존재 하에, 단일 대상체, SEA에 대한 IL-2 반응을 나타낸다. 막대 및 오차는 평균 ± 표준 오차 평균을 도시한다. ** p<0.01, *** p<0.001, **** p<0.0001, 시닥 다중 비교 검정(Sidak's multiple comparisons test)을 갖는 일원 ANOVA(각각의 농도에 대해 Hu24F8.2-IgG1 대 IgG1, 및 AB122 + Hu24F8.2-IgG1 대 AB122 단독 또는 Hu24F8.2-IgG1 단독).
도 12a는 Hu24F8.2-IgG1 또는 동종형 대조군의 존재 하에 SEA에 대한 건강한 대상체 또는 암 대상체 PBMC의 IL-2 반응을 나타낸다. 각각의 기호는 개별 대상체를 나타낸다. * p<0.05, 대응표본 t-검정.
도 12b는 AB122 및 Hu24F8.2-IgG1에 비교하여 AB122의 존재 하에 SEA에 대한 건강한 대상체 PBMC의 IL-2 반응을 나타낸다. 각각의 기호는 개별 대상체를 나타낸다. * p<0.05, 대응표본 t-검정.
본 개시내용은, 특히, TIGIT의 세포외 도메인에 특이적으로 결합하는 항체를 제공한다. 본 명세서에서 "항-TIGIT 항체"로도 지칭되는 본 개시내용의 항체는 CD155에 대한 TIGIT의 결합을 억제하고, 이에 의해 T 세포 및/또는 NK 세포를 활성화시킬 수 있다. 항체는 또한, 다른 응용 중에서도 암 및 감염성 질환의 치료에 사용될 수 있다. 본 개시내용의 항-TIGIT 항체의 추가의 구조적 및 기능적 특징은 하기에 추가로 상세히 기재되어 있다.
I.
정의
달리 정의되지 않는 한, 본 명세서에 사용된 모든 기술 용어, 주석, 및 다른 과학 용어 또는 용어법은 본 개시내용이 속하는 기술분야의 당업자에 의해 일반적으로 이해되는 의미를 갖는 것으로 의도된다. 일부 경우에, 명확성 및/또는 용이한 참조를 위해 일반적으로 이해되는 의미를 갖는 용어가 본 명세서에서 정의되며, 본 명세서에서 그러한 정의의 포함이 반드시 당업계에서 일반적으로 이해되는 것에 비해 실질적인 차이를 나타내는 것으로 해석되어야 하는 것은 아니다. 본 명세서에 기재되거나 언급된 다수의 기술 및 절차는 당업자에 의해 통상적인 방법론을 사용하여 잘 이해되고 일반적으로 사용된다.
단수형 "a", "an", 및 "the"는 문맥이 명확하게 달리 지시하지 않는 한, 복수의 지시 대상을 포함한다. 예를 들어, 용어 "세포"는 이들의 혼합물을 포함하는 하나 이상의 세포를 포함한다. "A 및/또는 B"는 본 명세서에서 하기의 대안들 모두를 포함하기 위해 사용된다: "A", "B", "A 또는 B", 및 "A 및 B".
용어 "항체"는 단일 항원에 특이적으로 결합하거나 다중 항원에 특이적으로 결합하는 온전한 항체 및 이의 결합 단편을 포함한다(예를 들어, 이중특이적 항체, 삼중특이적 항체 등과 같은 다중특이적 항체). 따라서, 항체에 대한 임의의 언급은 문맥상 달리 요구되지 않는 한 온전한 형태 또는 결합 단편인 항체를 지칭하는 것으로 이해되어야 한다. 본 개시내용과 관련하여 고려되는 추가의 기능성(예를 들어, 항원 결합)은 항-PD-1, 항-PD-LI, 항-TIM-3, 항-LAG-3, 항-PVRIG, 항-VISTA, 항-CTLA-4, 항-4-1BB, 항-BTLA, 항-CD39, 항-CD73, 항-OX40L, 및 항-OX40 단편을 포함한다.
"항원-결합 단편"과 상호교환적으로 사용될 수 있는 용어 "결합 단편"은 본 명세서에서 하나 이상의 CDR, 또는 항원에 특이적으로 결합하지만 온전한 천연 항체 구조를 포함하지 않는 임의의 다른 항체 단편을 포함하는 항체의 일부로부터 형성된 항체 단편을 지칭한다. 항원-결합 단편의 예는 다이아바디, Fab, Fab′, F(ab′)2, F(ab)c, Fv 단편, 다이설파이드 안정화된 Fv 단편(dsFv), (dsFv)2, 이중특이적 dsFv(dsFv-dsFv′), 다이설파이드 안정화된 다이아바디(ds 다이아바디), 트라이아바디, 테트라바디, 단일쇄 항체 분자(scFv), scFv 이량체, 다중특이적 항체, 낙타화 단일 도메인 항체, 나노바디, 미니바디, 도메인 항체, 2가 도메인 항체, IgNAR, V-NAR, 및 hcIgG를 제한 없이 포함한다. 전형적으로, 결합 단편은 특이적 결합에 대해 이들이 유래된 온전한 항체와 경쟁한다. 결합 단편은 재조합 DNA 기술에 의해, 또는 온전한 면역글로불린의 효소적 또는 화학적 분리에 의해 생성될 수 있다.
항체와 관련하여 "Fab"는 다이설파이드 결합에 의해 단일 중쇄의 가변 영역 및 제1 불변 영역에 결합된 단일 경쇄(가변 및 불변 영역 둘 모두)로 이루어진 항체의 부분을 지칭한다.
"Fab'"는 힌지 영역의 일부를 포함하는 Fab 단편을 지칭한다.
"F(ab′)2"는 Fab′의 이량체를 지칭한다.
항체와 관련하여 "Fc"는 다이설파이드 결합을 통해 제2 중쇄의 제2 및 제3 불변 영역에 결합된 제1 중쇄의 제2 및 제3 불변 영역으로 이루어진 항체의 부분을 지칭한다. 항체의 Fc 부분은 ADCC 및 CDC와 같은 다양한 이펙터 기능을 담당하지만, 항원 결합에는 기능하지 않는다.
항체와 관련하여 "Fv"는 완전한 항원 결합 부위를 보유하는 항체의 가장 작은 단편을 지칭한다. Fv 단편은 단일 중쇄의 가변 영역에 결합된 단일 경쇄의 가변 영역으로 이루어진다.
"단일쇄 Fv 항체" 또는 "scFv"는 직접 또는 펩티드 링커 서열을 통해 서로 연결된 경쇄 가변 영역 및 중쇄 가변 영역으로 이루어진 조작된 항체를 지칭한다(문헌[Huston J. S. et al., Proc Natl Acad Sci USA, 85:5879(1988)]).
"단일쇄 Fv-Fc 항체" 또는 "scFv-Fc"는 항체의 Fc 영역에 연결된 scFv로 이루어진 조작된 항체를 지칭한다.
"카멜화된 단일 도메인 항체", "중쇄 항체", 또는 "HCAb"는 2개의 VH 도메인을 함유하고 경쇄를 함유하지 않는 항체를 지칭한다(문헌[Riechmann L. and Muyldermans S., J Immunol Methods. December 10; 231(1-2): 25-38 (1999)]; 문헌[Muyldermans S., J Biotechnol. June; 74(4):277-302 (2001)]; WO94/04678; WO94/25591; 미국 특허 제6,005,079호). 중쇄 항체는 원래 낙타과(낙타, 단봉 낙타, 및 라마)로부터 유래되었다. 경쇄가 없지만, 낙타화 항체는 정확한 항원-결합 레퍼토리를 갖는다(문헌[Hamers-Casterman C. et al., Nature. June 3; 363(6428):446-8 (1993)]; 문헌[Nguyen V. K. et al. "Heavy-chain antibodies in Camelidae; a case of evolutionary innovation," Immunogenetics. April; 54(1):39-47 (2002)]; 문헌[Nguyen V. K. et al. Immunology. May; 109(1):93-101 (2003)]). 중쇄 항체의 가변 도메인(VHH 도메인)은 적응성 면역 반응에 의해 생성된 가장 작은 알려진 항원-결합 단위를 나타낸다(문헌[Koch-Nolte F. et al., FASEB J. November; 21(13):3490-8. Epub 2007 Jun. 15 (2007)]).
"나노바디"는 중쇄 항체로부터의 VHH 도메인 및 2개의 불변 도메인, CH2 및 CH3으로 이루어진 항체 단편을 지칭한다.
"다이아바디"는 2개의 항원-결합 부위를 갖는 작은 항체 단편을 포함하며, 여기서 단편은 동일한 폴리펩티드 사슬 내의 VL 도메인에 연결된 VH 도메인을 포함한다(VH-VL 또는 VL-VH)(예를 들어, 문헌[Holliger P. et al., Proc Natl Acad Sci USA. July 15; 90(14):6444-8 (1993)]; EP404097; WO93/11161 참조). 너무 짧아서 동일한 사슬 상의 2개의 도메인 사이에 대합을 허용하지 않는 링커를 사용함으로써, 도메인들은 다른 사슬의 상보적 도메인들과 대합할 수밖에 없게 되어 2개의 항원-결합 부위를 생성한다. 항원-결합 부위는 동일하거나 상이한 항원(또는 에피토프)을 표적화할 수 있다.
"도메인 항체"는 중쇄의 가변 영역 또는 경쇄의 가변 영역만을 함유하는 항체 단편을 지칭한다. 소정의 경우에는, 2개 이상의 VH 도메인이 펩티드 링커와 공유적으로 연결되어 2가 또는 다가 도메인 항체를 생성한다. 2가 도메인 항체의 2개의 VH 도메인은 동일하거나 상이한 항원을 표적화할 수 있다.
소정 실시 형태에서, "(dsFv)2"는 3개의 펩티드 사슬을 포함한다: 펩티드 링커에 의해 연결되고 다이설파이드 가교에 의해 2개의 VL 모이어티에 결합된 2개의 VH 모이어티.
소정 실시 형태에서, "이중특이적 ds 다이아바디"는 VH1과 VL1 사이의 다이설파이드 가교를 통해 VL1-VH2(또한 펩티드 링커에 의해 연결됨)에 결합된 VH1-VL2(펩티드 링커에 의해 연결됨)를 포함한다.
소정 실시 형태에서, "이중특이적 dsFv" 또는 dsFv-dsFv′"는 3개의 펩티드 사슬을 포함한다: 중쇄가 펩티드 링커(예를 들어, 긴 가요성 링커)에 의해 연결되고 다이설파이드 가교를 통해 각각 VL1 및 VL2 모이어티에 결합되며, 여기서 각각의 다이설파이드 대합 중쇄 및 경쇄는 상이한 항원 특이성을 갖는 VH1-VH2 모이어티.
소정 실시 형태에서, "scFv 이량체"는, 하나의 모이어티의 VH'이 다른 모이어티의 VL'과 배위되고 동일한 항원(또는 에피토프) 또는 상이한 항원(또는 에피토프)을 표적화할 수 있는 2개의 결합 부위를 형성하도록 다른 VH-VL 모이어티와 이량체화된 VH-VL(펩티드 링커에 의해 연결됨)을 포함하는 2가 다이아바디 또는 2가 ScFv(BsFv)이다. 다른 실시 형태에서, "scFv 이량체"는, VH1 및 VL1이 배위되고 VH2 및 VL2이 배위되고 각각의 배위된 쌍은 상이한 항원 특이성을 갖도록 VL1-VH2(또한 펩티드 링커에 의해 연결됨)와 연계된 VH1-VL2(펩티드 링커에 의해 연결됨)를 포함하는 이중특이적 다이아바디이다. "단리된" 항체는 그의 천연 환경의 성분으로부터 분리된 것이다. 일부 실시 형태에서, 단리된 항체는 당업계에 알려진 방법에 의해 결정되는 바와 같이 95% 또는 99% 초과의 순도로 정제된다.
본 명세서에 사용되는 바와 같이, "단일클론 항체"는, 예를 들어, 임의의 진핵생물, 원핵생물, 또는 파지 클론을 포함하는 단일 카피 또는 클론으로부터 유래된 항체를 지칭한다. "단일클론 항체"는 임의의 특정 방법에 의해 생성된 항체로 제한되지 않는다. 예를 들어, 단일클론 항체는 하이브리도마 기술뿐만 아니라 재조합 기술, 파지 디스플레이 기술, 합성 기술, 또는 그러한 기술과 당업계에 용이하게 알려진 다른 기술의 조합을 사용하여 생성될 수 있다.
본 명세서에 사용되는 바와 같이, 용어 "인간화 항체"는 인간 및 비-인간(예를 들어, 마우스 또는 래트) 항체 둘 모두로부터의 서열을 함유하는 항체를 지칭한다.
본 명세서에 사용되는 바와 같이, 용어 "인간 항체"는, 항체가 인간 또는 인간 면역 세포에 의해 생성된 항체의 것에 상응하거나, 인간 항체 레퍼토리 또는 다른 인간 항체-인코딩 서열을 이용하는 유전자이식 비-인간 동물과 같은 비-인간 공급원으로부터 유래되는 아미노산 서열(들), 특히 항원-결합 잔기를 갖거나 이로 이루어짐을 의미한다. 소정 실시 형태에서, 완전 인간 항체는 비-인간 항체로부터 유래된 아미노산 잔기(특히 항원-결합 잔기)를 포함하지 않는다.
예를 들어, 천연의 온전한 항체에 의해 예시된 바와 같은 기본 항체 구조 단위는 서브유닛의 사량체이다. 각각의 사량체는 2개의 동일한 쌍의 폴리펩티드 사슬을 포함하며, 각각의 쌍은 하나의 "경쇄"(약 25 kDa) 및 하나의 "중쇄"(약 50 내지 70 kDa)를 갖는다. 각각의 사슬의 아미노-말단 부분은 항원 인식을 주로 담당하는 약 100 내지 110개, 또는 그 이상의 아미노산의 가변 영역을 포함한다. 이러한 가변 영역은 초기에 발현되고, 절단가능한 신호 펩티드에 연결된다. 신호 펩티드가 없는 가변 영역은 때때로 성숙 가변 영역으로 지칭된다. 따라서, 예를 들어, 경쇄 성숙 가변 영역은 경쇄 신호 펩티드가 없는 경쇄 가변 영역을 의미한다. 각각의 사슬의 카르복시-말단 부분은 주로 이펙터 기능을 담당하는 불변 영역을 정의한다.
경쇄는 카파 또는 람다로 분류된다. 중쇄는 감마, 뮤, 알파, 델타, 또는 엡실론으로 분류되며, 각각 IgG, IgM, IgA, IgD, 및 IgE로서 항체의 동종형을 정의한다. 경쇄 및 중쇄 내에서, 가변 및 불변 영역은 약 12개 이상의 아미노산의 "J" 영역에 의해 연결되며, 중쇄는 또한 약 10개 이상의 아미노산의 "D" 영역을 포함한다. (일반적으로, 문헌[Fundamental Immunology (Paul, W., ed., 2nd ed. Raven Press, N.Y., 1989), Ch. 7] 참조)(모든 목적을 위해 전체적으로 참고로 포함됨).
각각의 경쇄/중쇄 쌍의 성숙 가변 영역은 항체 결합 부위를 형성한다. 따라서, 온전한 천연 항체는 2개의 동일한 결합 부위를 갖고; 이중특이적 항체는 2개의 동일하지 않은 결합 부위를 갖고; 삼중특이적 항체는 3개의 동일하지 않은 결합 부위를 갖는 등이다. 중쇄 및 경쇄의 성숙 가변 영역은 모두 상보성 결정 영역 또는 CDR로도 불리는 3개의 초가변 영역에 의해 연결된 상대적으로 보존된 프레임워크 영역(FR)의 동일한 일반 구조를 나타낸다. 각각의 쌍의 2개의 사슬로부터의 CDR은 특이적 에피토프에 대한 결합을 가능하게 하는, 프레임워크 영역에 의해서 정렬된다. N-말단부터 C-말단까지, 경쇄 및 중쇄 둘 모두는 도메인 FR1, CDR1, FR2, CDR2, FR3, CDR3, 및 FR4를 포함한다. 각각의 도메인에 대한 아미노산의 할당은 문헌[Kabat, Sequences of Proteins of Immunological Interest (National Institutes of Health, Bethesda, MD, 1987 and 1991)], 또는 문헌[Chothia & Lesk, J. Mol. Biol. 196:901-917 (1987)]; 문헌[Chothia et al., Nature 342:878-883 (1989)]의 정의에 따른다. Kabat는 또한, 상이한 중쇄들 사이 또는 상이한 경쇄들 사이의 상응하는 잔기들이 동일한 번호로 할당되는 광범위하게 사용되는 넘버링 규약(Kabat 넘버링)을 제공한다.
용어 "에피토프"는 항체가 결합하는 항원 상의 부위를 지칭한다. 에피토프는 인접 아미노산, 또는 하나 이상의 단백질의 3차 접힘에 의해 병치된 비인접 아미노산으로부터 형성될 수 있다. 인접 아미노산으로부터 형성된 에피토프(선형 에피토프로도 알려짐)는 전형적으로 변성 용매에 대한 노출 시에 유지되는 반면, 3차 접힘에 의해 형성된 에피토프(입체구조적 에피토프로도 알려짐)는 전형적으로 변성 용매로 처리 시 손실된다. 에피토프는 전형적으로 특유의 공간 입체구조로 적어도 3개, 더욱 일반적으로는 적어도 5개, 또는 8개 내지 10개의 아미노산을 포함한다. 에피토프의 공간 입체구조를 결정하는 방법은, 예를 들어, X-선 결정학 및 2-차원 핵 자기 공명을 포함한다. 예를 들어, 문헌[Epitope Mapping Protocols, in Methods in Molecular Biology, Vol. 66, Glenn E. Morris, Ed. (1996)]을 참조한다.
동일하거나 중첩하는 에피토프를 인식하는 항체는 하나의 항체가 표적 항원에 대한 다른 항체의 결합과 경쟁하는 능력을 보여주는 단순 면역검정에서 확인될 수 있다. 항체의 에피토프는 또한 접촉 잔기를 식별하기 위해 그의 항원에 결합된 항체의 X-선 결정학에 의해 정의될 수 있다. 대안적으로, 하나의 항체의 결합을 감소 또는 제거하는 항원 내의 모든 아미노산 돌연변이가 다른 항체의 결합을 감소 또는 제거하는 경우에 두 항체는 동일한 에피토프를 갖는다. 하나의 항체의 결합을 감소시키거나 제거하는 일부(그러나 전체는 아님) 아미노산 돌연변이가 다른 항체의 결합을 감소시키거나 제거하는 경우에 2개의 항체는 중첩하는 에피토프를 갖는다.
항체들 사이의 경쟁은 시험 조건 하에 항체가 공통 항원에 대한 참조 항체의 특이적 결합을 억제하는 검정에 의해 결정된다(예를 들어, 문헌[Junghans et al., Cancer Res. 50:1495, 1990] 참조). 과량의 시험 항체(예를 들어, 적어도 2x, 3x, 4x, 5x, 6x, 7x, 8x, 9x, 10x,15x, 20x, 25x, 30x, 35x, 40x, 45x, 50x, 60x, 70x, 80x, 90x, 100x 이상, 이러한 값들 사이에 들어오는 숫자들을 포함함)가 참조 항체의 결합을 약 50% 이상만큼, 예컨대 약 75%, 90%, 또는 99% 이상만큼 억제하는 경우, 시험 항체는 참조 항체와 경쟁한다. 다른 실시 형태에서, 경쟁 결합 검정에서 측정되는 바와 같이, 과량의 시험 항체가 약 55%, 60%, 65%, 70%, 75%, 76%, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 또는 100% 이상 중 임의의 것만큼 참조 항체의 결합을 억제하는 경우, 시험 항체는 참조 항체와 경쟁한다. 경쟁 검정에 의해 확인된 항체(경쟁 항체)는 참조 항체와 동일한 에피토프에 결합하는 항체 및 입체 장애가 발생하도록 참조 항체에 의해 결합된 에피토프에 충분히 근접한 인접 에피토프에 결합하는 항체를 포함한다. 참조 항체는 치료 항체 후보와 유사한 기능을 갖는 구매가능한 단일클론 항체, 관심 표적 단백질과 기능적으로 상호작용하는 다중클론 항체, 또는 공개 도메인에서 이용가능한 서열로부터 재구성된 항체일 수 있다. 예를 들어, 제한 없이, TIGIT에 결합하는 참조 항체는 서열 번호 92를 포함하는 아미노산 서열을 갖는 중쇄 및 서열 번호 93을 포함하는 아미노산 서열을 갖는 경쇄를 포함한다.
본 명세서에 사용되는 바와 같이, 용어 "특이적 결합" 및 "특이적으로 결합하다"는 항원(예를 들어, TIGIT)과 항체 사이의 결합과 같은 측정가능하고 재현가능한 상호작용을 지칭한다. 예를 들어, 항원에 특이적으로 결합하는 항체는 그것이 다른 항원에 결합하는 것보다 더 큰 친화성, 결합력으로, 더 용이하게, 및/또는 더 긴 지속기간으로 이러한 표적에 결합하는 항체이다. 친화성과 항원에 대한 분자의 평형 해리 상수 (KD)는 반비례한다. 항원에 대한 높은 친화성은 낮은 KD 값에 의해 측정된다. 본 명세서에 사용되는 바와 같이, 항원에 특이적으로 결합하는 항체는, 표면 플라즈몬 공명에 의해 측정된 10-6 M 이하, 대안적으로 10-7 M 이하, 대안적으로 10-8 M 이하, 대안적으로 10-9 M 이하, 대안적으로 10-10 M 이하, 대안적으로 10-11 M 이하의 항원에 대한 KD; 또는 10-6 M 내지 10-13 M, 또는 10-9 M 내지 10-13 M, 또는 10-9 M 내지 10-12 M, 또는 10-10 M 내지 10-13 M, 또는 10-10 M 내지 10-12 M, 또는 10-11 M 내지 10-13 M, 또는 10-10 M 내지 10-11 M, 또는 10-11 M 내지 10-12 M 범위의 KD를 갖는다. 일 실시 형태에서, 용어 "특이적 결합"은 분자가 임의의 다른 폴리펩티드 또는 폴리펩티드 에피토프에 실질적으로 결합하지 않으면서 특정 폴리펩티드 또는 특정 폴리펩티드 상의 에피토프에 결합하는 결합을 지칭한다.
본 명세서에 사용되는 바와 같이, "개체" 또는 "대상체"는 동물, 예컨대 인간(예를 들어, 인간 개체) 및 비-인간 동물을 포함한다. 일부 실시 형태에서, "개체" 또는 "대상체"는 의사의 치료 하의 환자이다. 따라서, 대상체는 관심 질환(예를 들어, 암) 및/또는 질환의 하나 이상의 증상을 갖거나, 가질 위험이 있거나, 갖는 것으로 의심되는 인간 환자 또는 개체일 수 있다. 대상체는 또한 진단 시점 또는 이후에 관심 병태의 위험이 있는 것으로 진단된 개체일 수 있다. 용어 "비-인간 동물"은 모든 척추동물, 예를 들어, 포유류, 예를 들어, 설치류, 예를 들어, 마우스, 비-인간 영장류, 및 다른 포유류, 예를 들어, 양, 개, 소, 닭, 및 비-포유류, 예컨대 양서류, 파충류 등을 포함한다.
본 명세서에 사용되는 바와 같이, 참조 아미노산 서열의 아미노산 잔기에 "상응하는" 또는 "상응하고 있는" 또는 "대응하는" 관심 아미노산 서열의 아미노산 잔기는, 관심 서열의 아미노산 잔기가 참조 아미노산 서열 내의 열거된 잔기와 상동성이거나 등가인 위치에 있음을 표시한다. 당업자는 TIGIT 폴리펩티드와 같은 폴리펩티드 내의 특정 아미노산 잔기 위치가 상동성 참조 서열의 것에 상응하는지 여부를 결정할 수 있다. 예를 들어, 알려진 기술(예를 들어, 기본 국소 정렬 검색 툴(BLAST), ClustalW2, 구조 기반 서열 정렬 프로그램(STRAP) 등)을 사용하여 TIGIT 폴리펩티드의 서열을 참조 서열의 것과 정렬할 수 있다. 부가적으로, 참조 서열의 결정 구조 좌표를 사용하여 상동성 폴리펩티드 잔기의 3-차원 구조의 결정을 보조할 수 있다(문헌[Stengel et al., Proc. Natl. Acad. Sci. USA, 109:5399-5404, 2012]). 다른 태양에서, 등가의 잔기는 3차 구조의 수준에서 상동성을 결정함으로써 식별될 수 있다. 그러한 방법을 사용하여, TIGIT 폴리펩티드 변이체의 아미노산 잔기는 참조 서열의 상응하는 아미노산 잔기 위치 넘버링에 따라 넘버링될 수 있다. 예를 들어, 서열 번호 80의 아미노산 서열은 관심 인간 TIGIT 변이체 또는 에피토프의 각각의 아미노산 잔기의 아미노산 잔기 위치 넘버링을 결정하기 위해 사용될 수 있다. 일부 실시 형태에서, 하나의 아미노산 서열은 그것이 약 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 또는 100% 이상의 서열 동일성을 공유하는 경우에 다른 아미노산 서열에 상응한다.
아미노산 치환을 보존적 치환 또는 비보존적 치환으로 분류하기 위해, 아미노산은 하기와 같이 그룹화된다: 그룹 I (소수성 측쇄): met, ala, val, leu, ile; 그룹 II (중성 친수성 측쇄): cys, ser, thr; 그룹 III (산성 측쇄): asp, glu; 그룹 IV (염기성 측쇄): asn, gln, his, lys, arg; 그룹 V (사슬 배향에 영향을 주는 잔기): gly, pro; 및 그룹 VI (방향족 측쇄): trp, tyr, phe. 보존적 치환은 동일한 부류의 아미노산들 사이의 치환을 포함한다. 비보존적 치환은 이들 부류 중 하나의 구성원을 다른 부류의 구성원으로 교환하는 것으로 이루어진다.
백분율 서열 동일성은 Kabat 넘버링 규약에 의해 최대로 정렬된 항체 서열로 결정된다. 정렬 후에, 대상 항체 영역(예를 들어, 중쇄 또는 경쇄의 전체 성숙 가변 영역)이 참조 항체의 동일한 영역과 비교되는 경우, 대상 항체 영역과 참조 항체 영역 사이의 백분율 서열 동일성은 대상 항체 영역 및 참조 항체 영역 둘 모두에서 동일한 아미노산에 의해 점유된 위치의 수를 2개의 영역의 정렬된 위치의 총 수로 나누고(갭은 계수되지 않음) 100을 곱하여 백분율로 전환한 것이다.
하나 이상의 언급된 요소를 "포함하는" 또는 "포괄하는"(또는 이의 임의의 문법적 변형어) 조성물 또는 방법은 구체적으로 언급되지 않은 다른 요소를 포함할 수 있다. 예를 들어, 항체를 포함하는 조성물은 항체를 단독으로 또는 다른 성분들과 조합하여 함유할 수 있다.
소정 범위는 용어 "약"이 선행하는 수치 값으로 본 명세서에 제시된다. 용어 "약"은, "대략"이라는 그의 원래 의미를 가지며, 그것이 선행하는 정확한 숫자뿐만 아니라, 그 용어가 선행하는 숫자에 가깝거나 근사치인 숫자에 대한 문언적 지원을 제공하기 위해 본 명세서에 사용된다. 숫자가 구체적으로 언급된 숫자에 가깝거나 근사치인지 여부를 결정함에 있어서, 가깝거나 근사치인 언급되지 않은 숫자는 그것이 제시된 문맥에서 구체적으로 언급된 숫자의 실질적인 등가물을 제공하는 숫자일 수 있다. 예를 들어, 근사의 정도가 달리 문맥으로부터 명확하지 않은 경우, "약"은 제공된 값을 포함하는 모든 경우에 제공된 값의 플러스 또는 마이너스 10% 이내를 의미하거나 가장 가까운 유효 숫자로 반올림된다. 범위가 제공되는 경우, 이들은 경계 값을 포함한다.
본 명세서에 사용되는 바와 같이, 용어 "실질적으로" 및 이의 임의의 문법적 변형어는 광범위한 용어이며, "거의 전체적으로" 또는 "전적으로는 아니지만 큰 정도로"임을 제한 없이 포함하는 그의 통상적인 의미로 사용된다. 예를 들어, 이 용어는 전체 수치 값의 100%가 아닐 수 있는 수치 값을 지칭할 수 있으며, 여기서 수치 값은 전체 수치 값의 0.1% 미만, 0.5% 미만, 약 1% 미만, 약 2% 미만, 약 3% 미만, 약 4% 미만, 약 5% 미만, 약 6% 미만, 약 7% 미만, 약 8% 미만, 약 9% 미만, 약 10% 미만, 약 11% 미만, 약 12% 미만, 약 13% 미만, 약 14% 미만, 약 15% 미만, 약 16% 미만, 약 17% 미만, 약 18% 미만, 약 19% 미만, 또는 약 20% 미만일 수 있다. 예를 들어, 대상 항체 또는 이의 항원-결합 단편이 상응하는 참조 항체 또는 이의 항원-결합 단편에 대해 약 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99.5%, 또는 99.9% 이상의 서열 동일성을 갖는 경우에 대상 항체 또는 이의 항원-결합 단편은 실질적으로 상응하는 참조 항체 또는 이의 항원-결합 단편으로부터의 것일 수 있다. 다른 예에서, 대상 항체 내의 CDR이 상응하는 참조 항체 내의 CDR에 대해 약 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99.5%, 또는 99.9% 이상의 서열 동일성을 갖는 경우에 대상 항체 내의 CDR은 실질적으로 상응하는 참조 항체 내의 CDR로부터의 것일 수 있다. 또 다른 예에서, 제한 없이, 상응하는 참조 항체 내의 CDR에 대해 대상 항체 내의 CDR에 2개 이하의 아미노산이 치환되거나, 결실되거나, 부가된 경우에 대상 항체 내의 CDR은 실질적으로 상응하는 참조 항체 내의 CDR로부터의 것일 수 있다.
명료함을 위하여, 별도의 실시 형태와 관련하여 기재된 본 개시내용의 소정 특징은 또한 단일 실시 형태에서 조합되어 제공될 수 있음이 인정된다. 역으로, 간결함을 위하여, 단일 실시 형태와 관련하여 기재된 본 개시내용의 다양한 특징은 또한 별도로 또는 임의의 적합한 하위조합으로 제공될 수 있다. 본 개시내용에 관한 실시 형태의 모든 조합은 본 개시내용에 의해 구체적으로 포함되며, 각각의 그리고 모든 조합이 개별적으로 그리고 명시적으로 개시된 것처럼 본 명세서에 개시된다. 부가적으로, 다양한 실시 형태 및 이의 요소의 모든 하위조합이 또한 본 개시내용에 의해 구체적으로 포함되며, 본 명세서에 각각의 그리고 모든 그러한 하위조합이 개별적으로 그리고 명시적으로 개시된 것처럼 본 명세서에 개시된다.
II.
표적 분자
달리 표시되지 않는 한 TIGIT는 인간 TIGIT(hTIGIT)를 의미한다. 시노 TIGIT 또는 cTIGIT는 시노몰구스 원숭이 TIGIT를 지칭한다.
예시적인 hTIGIT 서열은 Swiss-Prot 수탁 번호 Q495A1로 할당된다. 완전한 hTIGIT 서열은 244개의 아미노산(서열 번호 80)을 가지며, 이들 중 아미노산 1 내지 21은 신호 펩티드이고, 22 내지 244는 성숙 단백질(서열 번호 81)을 구성한다. 대략 잔기 22 내지 141은 hTIGIT의 세포외 도메인(서열 번호 82)을 구성한다. 대략 잔기 142 내지 162는 hTIGIT의 막관통 도메인을 구성하고, 대략 잔기 163 내지 244는 hTIGIT의 세포질 도메인을 구성한다. 일부 실시 형태에서, 세포외 도메인 hTIGIT는 HIS 태깅된다(서열 번호 83). 예시적인 시노 TIGIT 서열은 Swiss-Prot A0A2K5UW92로 할당된다. 완전한 시노 TIGIT 서열은 312개의 아미노산(서열 번호 84)을 갖는다. 일부 실시 형태에서, 시노 TIGIT의 세포외 도메인은 HIS 태깅된다(서열 번호 85).
달리 표시되지 않는 한, CD155는 이러한 단백질의 인간 형태를 지칭한다. 인간 CD155에 대한 예시적인 인간 서열은 Swiss-Prot P15151로 지정되며, 이는 417개 아미노산의 단백질이고, 이 중 대략 잔기 1 내지 20은 신호 펩티드이고, 21 내지 343은 세포외 도메인(서열 번호 86)을 구성하고, 344 내지 367은 막관통 도메인을 구성하고, 368 내지 417은 세포질 도메인을 구성한다.
문맥으로부터 달리 명백하지 않는 한, 상기 단백질 중 하나에 대한 언급은 적어도 단백질의 세포외 도메인 및 일반적으로 절단가능한 신호 펩티드 이외의 완전한 단백질을 의미한다.
III.
본 개시내용의 항체
A.
결합 특이성 및 기능적 특성
본 개시내용은 TIGIT, 더욱 특히 TIGIT 단백질의 세포외 도메인 내의 에피토프에 특이적으로 결합하는 항체를 제공한다. 소정 실시 형태에서, 본 개시내용의 항-TIGIT 항체는 표면 플라즈몬 공명(SPR)에 의해 측정된 10-8 M 이하(예를 들어, 10-8, 10-9, 10-10 등)의 TIGIT에 대한 KD를 갖는다. 다양한 실시 형태에서, 본 개시내용의 항-TIGIT 항체는 약 1x10-9 M 내지 약 1x10-13 M, 또는 약 1x10-9 M 내지 약 1x10-12 M, 또는 약 1x10-10 M 내지 약 1x10-13 M, 또는 약 1x10-10 M 내지 약 1x10-12 M, 또는 약 1x10-11 M 내지 약 1x10-13 M, 또는 약 1x10-10 M 내지 약 1x10-11 M, 또는 약 1x10-11 M 내지 약 1x10-12 M 범위의 TIGIT에 대한 KD를 갖는다. 21F8, 30M18, 24F8, 5J24, 21B9, 22B22, 28P24, 21B16, 및 28O12로 지정된 항체는 9개의 그러한 예시적인 마우스 항체이다. Ch22B22, Ch21B16, Ch28O12, Ch5J24, Ch21B9, Ch24F8, 및 Ch30M18로 지정된 항체는 7개의 그러한 예시적인 키메라 항체이다. Hu24F8.1, Hu24F8.2, Hu24F8.3, 및 Hu24F8.4로 지정된 항체는 예시적인 인간화 항체이다. 마우스 및 인간화 항체의 중쇄 및 경쇄 성숙 가변 영역 및 CDR의 서열은 각각 표 1 및 표 2에 나타낸다.
[표 1]
[표 2]
본 개시내용의 일부 항체는 21F8, 30M18, 24F8, 5J24, 21B9, 22B22, 28P24, 21B16, 또는 28O12로 지정된 항체, 또는 Hu24F8.1, Hu24F8.2, Hu24F8.3, 또는 Hu24F8.4로 지정된 항체와 동일하거나 중첩되는 에피토프에 결합한다. 그러한 결합 특이성을 갖는 다른 항체는 원하는 에피토프를 포함하는 TIGIT 또는 이의 일부로 마우스를 면역화하는 단계, 및 임의로 21F8, 30M18, 24F8, 5J24, 21B9, 22B22, 28P24, 21B16, 28O12, Hu24F8.1, Hu24F8.2, Hu24F8.3, 또는 Hu24F8.4와의 경쟁 중에 세포외 도메인에 대한 TIGIT의 결합에 대해 생성되는 항체를 스크리닝하는 단계에 의해 생성될 수 있다. 항체를 또한 TIGIT 항원의 돌연변이화된 형태에 대해 스크리닝하여, 돌연변이 변화의 집합에 대해 21F8, 30M18, 24F8, 5J24, 21B9, 22B22, 28P24, 21B16, 28O12, Hu24F8.1, Hu24F8.2, Hu24F8.3, 또는 Hu24F8.4와 동일하거나 유사한 결합 프로파일을 나타내는 항체를 식별할 수 있다. 돌연변이는, TIGIT 항체의 세포외 도메인 전체에 걸쳐, 또는 에피토프가 존재하는 것으로 알려진 이의 섹션에 걸쳐, 한번에 1개의 잔기, 또는 더 넓게 이격된 간격의, 알라닌(또는 알라닌이 이미 존재하는 경우에는 세린)에 의한 체계적 대체 치환일 수 있다. 일부 실시 형태에서, 본 개시내용의 일부 항체는 하기 TIGIT의 에피토프 잔기 중 하나 이상에 결합한다: 서열 번호 80의 T55, Q56, N58, E60, D72, S80, 및 K82. 일부 실시 형태에서, 본 개시내용의 일부 항체는 하기 TIGIT의 에피토프 잔기 중 2, 3, 4, 5, 또는 6개에 결합한다: 서열 번호 80의 T55, Q56, N58, E60, D72, S80, 및 K82. 일부 실시 형태에서, 본 개시내용의 일부 항체는 하기 TIGIT의 에피토프 잔기에 결합한다: T55, Q56, N58, E60, D72, S80, 및 K82. 일부 실시 형태에서, 항-TIGIT 항체는 적어도 하기 TIGIT의 잔기를 포함하는 에피토프에 결합한다: 서열 번호 80의 D72 및 서열 번호 80의 T55, Q56, N58, E60, S80, 및 K82 중 하나 이상. 일부 실시 형태에서, 항-TIGIT 항체는 적어도 하기 TIGIT의 잔기를 포함하는 에피토프에 결합한다: 서열 번호 80의 E60 및 D72 및 임의로 서열 번호 80의 T55, Q56, N58, S80, 및 K82 중 하나 이상. 일부 실시 형태에서, 항-TIGIT 항체는 적어도 하기 TIGIT의 잔기를 포함하는 에피토프에 결합한다: 서열 번호 80의 D72 및 K82 및 임의로 서열 번호 80의 T55, Q56, N58, E60, 및 S80 중 하나 이상. 일부 실시 형태에서, 항-TIGIT 항체는 적어도 하기 TIGIT의 잔기를 포함하는 에피토프에 결합한다: 서열 번호 80의 E60, D72, 및 K82 및 임의로 서열 번호 80의 T55, Q56, N58, 및 S80 중 하나 이상.
선택된 뮤린 항체(예를 들어, 21F8, 30M18, 24F8, 5J24, 21B9, 22B22, 28P24, 21B16, 또는 28O12) 또는 선택된 인간화 항체(예를 들어, Hu24F8.1, Hu24F8.2, Hu24F8.3, 또는 Hu24F8.4)의 결합 특이성을 갖는 항체는 또한 파지 디스플레이 방법의 변형을 사용하여 생성될 수 있다. Winter의 WO 92/20791을 참조한다. 이 방법은 특히 인간 항체를 생성하기에 적합하다. 이 방법에서는, 선택된 뮤린 항체의 중쇄 또는 경쇄 가변 영역이 출발 물질로 사용된다. 예를 들어, 경쇄 가변 영역이 출발 물질로서 선택되는 경우, 구성원이 동일한 경쇄 가변 영역(즉, 뮤린 출발 물질) 및 상이한 중쇄 가변 영역을 디스플레이하는 파지 라이브러리가 작제된다. 중쇄 가변 영역은, 예를 들어, 재배열된 인간 중쇄 가변 영역의 라이브러리로부터 얻어질 수 있다. TIGIT에 대한 강한 특이적 결합(예를 들어, 108 M-1 이상 또는 109 M-1 이상)을 나타내는 파지가 선택된다. 이러한 파지로부터의 중쇄 가변 영역은 이어서 추가의 파지 라이브러리를 작제하기 위한 출발 물질로서 작용한다. 이 라이브러리에서, 각각의 파지는 동일한 중쇄 가변 영역(즉, 제1 디스플레이 라이브러리로부터 식별된 영역) 및 상이한 경쇄 가변 영역을 디스플레이한다. 경쇄 가변 영역은, 예를 들어, 재배열된 인간 가변 경쇄 영역의 라이브러리로부터 얻어질 수 있다. 다시, TIGIT에 대한 강한 특이적 결합을 나타내는 파지가 선택된다. 생성되는 항체는 일반적으로 뮤린 출발 물질과 동일하거나 유사한 에피토프 특이성을 갖는다.
일부 항체는, 전적으로 또는 실질적으로 mAb 21F8로부터의 HC-CDR1, HC-CDR2, 및 HC-CDR3을 포함하는 성숙 중쇄 가변 영역 및 LC-CDR1, LC-CDR2, 및 LC-CDR3을 포함하는 성숙 경쇄 영역을 갖는다. 일부 항체는, 전적으로 또는 실질적으로 mAb 30M18로부터의 HC-CDR1, HC-CDR2, 및 HC-CDR3을 포함하는 성숙 중쇄 가변 영역 및 LC-CDR1, LC-CDR2, 및 LC-CDR3을 포함하는 성숙 경쇄 영역을 갖는다. 일부 항체는, 전적으로 또는 실질적으로 mAb 24F8로부터의 HC-CDR1, HC-CDR2, 및 HC-CDR3을 포함하는 성숙 중쇄 가변 영역 및 LC-CDR1, LC-CDR2, 및 LC-CDR3을 포함하는 성숙 경쇄 영역을 갖는다. 일부 항체는, 전적으로 또는 실질적으로 mAb 5J24로부터의 HC-CDR1, HC-CDR2, 및 HC-CDR3을 포함하는 성숙 중쇄 가변 영역 및 LC-CDR1, LC-CDR2, 및 LC-CDR3을 포함하는 성숙 경쇄 영역을 갖는다. 일부 항체는, 전적으로 또는 실질적으로 mAb 21B9로부터의 HC-CDR1, HC-CDR2, 및 HC-CDR3을 포함하는 성숙 중쇄 가변 영역 및 LC-CDR1, LC-CDR2, 및 LC-CDR3을 포함하는 성숙 경쇄 영역을 갖는다. 일부 항체는, 전적으로 또는 실질적으로 mAb 22B22로부터의 HC-CDR1, HC-CDR2, 및 HC-CDR3을 포함하는 성숙 중쇄 가변 영역 및 LC-CDR1, LC-CDR2, 및 LC-CDR3을 포함하는 성숙 경쇄 영역을 갖는다. 일부 항체는, 전적으로 또는 실질적으로 mAb 28P24로부터의 HC-CDR1, HC-CDR2, 및 HC-CDR3을 포함하는 성숙 중쇄 가변 영역 및 LC-CDR1, LC-CDR2, 및 LC-CDR3을 포함하는 성숙 경쇄 영역을 갖는다. 일부 항체는, 전적으로 또는 실질적으로 mAb 21B16으로부터의 HC-CDR1, HC-CDR2, 및 HC-CDR3을 포함하는 성숙 중쇄 가변 영역 및 LC-CDR1, LC-CDR2, 및 LC-CDR3을 포함하는 성숙 경쇄 영역을 갖는다. 일부 항체는, 전적으로 또는 실질적으로 mAb 28O12로부터의 HC-CDR1, HC-CDR2, 및 HC-CDR3을 포함하는 성숙 중쇄 가변 영역 및 LC-CDR1, LC-CDR2, 및 LC-CDR3을 포함하는 성숙 경쇄 영역을 갖는다. CDR은 하기 표 3에 나타낸 바와 같은 Kabat, Chothia, Kabat 및 Chothia 복합, AbM, 또는 Contact 정의를 포함하는 임의의 통상적인 정의에 의해 정의될 수 있다:
[표 3]
다른 항체는 21F8, 30M18, 24F8, 5J24, 21B9, 22B22, 28P24, 21B16, 또는 28O12와 같은 예시적인 항체의 중쇄 및 경쇄를 인코딩하는 cDNA의 돌연변이유발에 의해 얻어질 수 있다. 성숙 중쇄 및/또는 경쇄 가변 영역의 아미노산 서열에 있어서 21F8, 30M18, 24F8, 5J24, 21B9, 22B22, 28P24, 21B16, 또는 28O12와 약 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% 또는 100% 중 임의의 것 이상만큼 동일하고 그의 기능적 특성을 유지하는 항체, 및/또는 소수의 기능적으로 중요하지 않은 아미노산 치환(예를 들어, 보존적 치환), 결실, 또는 삽입에 의해 각각의 항체와는 상이한 항체가 또한 본 개시내용에 포함된다. 결합을 위해 중요할 가능성이 있는 가변 영역 프레임워크 내의 아미노산은 하기 인간화에 대한 섹션에 기재된 바와 같이 식별될 수 있다. Kabat에 의해 정의된 바와 같이 21F8, 30M18, 24F8, 5J24, 21B9, 22B22, 28P24, 21B16, 또는 28O12의 상응하는 CDR과 약 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 또는 100% 중 임의의 것만큼 동일한 하나 이상의 CDR(들), 및 일부 실시 형태에서는 6개의 CDR(들) 모두를 갖는 항체가 또한 포함된다.
일부 실시 형태에서, 항체는 하기 특징 중 하나 이상을 갖는다: (i) 인간 CD155에 대한 인간 TIGIT의 결합을 억제함, (ii) CD112 및 CD113과 같은 다른 리간드에 대한 TIGIT의 결합을 억제함, (iii) 항원-특이적 T 세포 반응을 증가시킴, (iv) 자연 살해 세포를 활성화시킴, (v) 내재적 T 세포 활성화를 자극함, (vi) 하나 이상의 면역자극성 사이토카인의 생성을 자극하고/하거나 T 세포 및 면역계의 다른 세포에 의한 하나 이상의 면역억제성 사이토카인의 생성을 감소시킴.
일부 실시 형태에서, 본 명세서에 기재된 항체는 CD155에 대한 TIGIT의 결합을 완전히 또는 부분적으로 억제한다. 본 개시내용의 항-TIGIT 항체는 그러한 상호작용을 실시예 1에서와 같이 측정된 약 0.1 nM 내지 약 10 nM, 또는 약 0.1 nM 내지 약 8 nM, 또는 약 0.1 nM 내지 약 5 nM, 또는 약 0.1 nM 내지 약 4 nM, 또는 약 0.1 nM 내지 약 3 nM, 또는 약 0.1 nM 내지 약 2 nM, 또는 약 0.1 nM 내지 약 1 nM의 억제에 대한 반수 최대 억제 농도(IC50)로 억제할 수 있다. 소정 실시 형태에서, 본 개시내용의 일부 항-TIGIT 항체는 CD155에 대한 TIGIT의 결합을 실시예 1에서와 같이 측정된 약 0.1 nM 내지 약 2 nM 또는 약 0.2 nM 내지 약 2 nM의 IC50으로 억제할 수 있다. 소정 실시 형태에서, 본 개시내용의 일부 항-TIGIT 항체는 CD155에 대한 TIGIT의 결합을 실시예 1에서와 같이 측정된 약 0.2 nM 내지 약 2 nM, 약 0.2 nM 내지 약 0.8 nM, 약 0.4 nM 내지 약 0.8 nM, 또는 약 0.6 nM 내지 약 0.8 nM의 IC50으로 억제할 수 있다. 일부 항체는 그러한 상호작용을 실시예 1에서와 같이 측정된 약 25 내지 300 ng/ml, 25 내지 75 ng/ml, 25 내지 50 ng/ml, 40 내지 75 ng/ml, 50 내지 75 ng/ml, 50 내지 90 ng/ml, 50 내지 100 ng/ml, 75 내지 100 ng/ml, 50 내지 150, 75 내지 175 ng/ml, 100 내지 200 ng/ml, 125 내지 225 ng/ml, 100 내지 250 ng/ml, 150 내지 300 ng/ml, 175 내지 250 ng/ml, 200 내지 300 ng/ml, 25 내지 275 ng/ml, 250 내지 300 ng/ml, 49 +/-10% ng/ml, 65 +/-10% ng/ml, 또는 76 +/-10% ng/ml 중 임의의 것의 억제에 대한 반수 최대 억제 농도(IC50)로 억제할 수 있다. 다른 실시 형태에서, 항체는 CD155에 대한 TIGIT의 결합을 적어도 약 25 ng/ml, 50 ng/ml, 75 ng/ml, 100 ng/ml, 125 ng/ml, 150 ng/ml, 175 ng/ml, 200 ng/ml, 225 ng/ml, 250 ng/ml, 275 ng/ml, 또는 300 ng/ml 이상(이러한 값들 사이에 들어오는 농도를 포함함) 중 임의의 것의 IC50으로 완전히 또는 부분적으로 억제할 수 있다. 부가적으로, 일부 항체는 항원-특이적 T 세포 반응을 1.5 내지 3배, 예컨대 약 1.5, 1.6, 1.7, 1.8, 1.9, 2, 2.1, 2.2, 2.3, 2.4, 2.5, 2.6, 2.7, 2.8, 2.9, 또는 3배 이상 중 임의의 것만큼 증가시킬 수 있다. 대안적으로 또는 부가적으로, 일부 항체는 NK 세포 및/또는 T 세포에 의한 IL-2, IL-6, TNFα, 및 IFNγ 중 1개, 2개, 3개, 또는 모두의 생성을 1.5 내지 3배, 예컨대 약 1.5, 1.6, 1.7, 1.8, 1.9, 2, 2.1, 2.2, 2.3, 2.4, 2.5, 2.6, 2.7, 2.8, 2.9, 또는 3배 이상 중 임의의 것만큼 증가시킬 수 있다. 대안적으로 또는 부가적으로, 일부 항체는 내재적 T 세포 활성화를 1.5 내지 3배, 예컨대 약 1.5, 1.6, 1.7, 1.8, 1.9, 2, 2.1, 2.2, 2.3, 2.4, 2.5, 2.6, 2.7, 2.8, 2.9, 또는 3배 이상 중 임의의 것만큼 증가시킬 수 있다. 대안적으로, 또는 부가적으로, 일부 항체는 동물 모델 또는 임상 시험에서 나타난 바와 같이 암 또는 감염성 질환을 억제할 수 있다. 인간 암 세포가 면역결핍 실험실 동물, 예컨대 마우스 또는 래트에 주사되는 암의 동물 모델이 광범위하게 이용가능하다.
예시적인 실시 형태에서, 항체는 TIGIT에 특이적으로 결합하며, 전적으로 또는 실질적으로 항체 24F8로부터의 HC-CDR1, HC-CDR2, 및 HC-CDR3을 포함하는 성숙 중쇄 가변 영역 및 LC-CDR1, LC-CDR2, 및 LC-CDR3을 포함하는 성숙 경쇄 영역을 포함한다. 다양한 실시 형태에서, 항체는 (i) 표면 플라즈몬 공명에 의해 측정된 약 0.01x10-11 M 내지 약 100x10-11 M, 약 0.1x10-11 M 내지 약 100x10-11 M, 약 0.1x10-11 M 내지 약 10x10-11 M, 약 1x10-11 M 내지 약 100x10-11 M의 평형 결합 상수(KD)를 갖고/갖거나 (ii) 세포 표면 인간 TIGIT에 대한 가용성 인간 CD155 리간드의 결합을 실시예 1에서와 같이 측정된 약 0.2 nM 내지 약 2 nM, 약 0.2 nM 내지 약 0.8 nM, 약 0.4 nM 내지 약 0.8 nM, 또는 약 0.6 nM 내지 약 0.8 nM의 반수 최대 억제제 농도(IC50)로 차단할 수 있다. 상기 개별적인 결합 및 차단 특성 또는 이들의 조합에 대해 대안적으로 및 또는 부가적으로, 일부 실시 형태에서 항체는 적어도 하기 TIGIT의 잔기를 포함하는 에피토프에 결합한다: (i) 서열 번호 80의 D72 및 서열 번호 80의 T55, Q56, N58, E60, S80, 및 K82 중 하나 이상, (ii) 서열 번호 80의 E60 및 D72 및 임의로 서열 번호 80의 T55, Q56, N58, S80, 및 K82 중 하나 이상, (iii) 서열 번호 80의 D72 및 K82 및 임의로 서열 번호 80의 T55, Q56, N58, E60, 및 S80 중 하나 이상, (iv) 서열 번호 80의 E60, D72, 및 K82 및 임의로 서열 번호 80의 T55, Q56, N58, 및 S80 중 하나 이상, 또는 (v) 서열 번호 80의 T55, Q56, N58, E60, D72, S80, 및 K82.
항체를 인간화하거나 키메라화하는 것은 출발 마우스 항체에 비해 생체내 반감기를 증가시킨다. 생성되는 반감기는, 예를 들어, 인간에서 10 내지 50 일일 수 있다. 반감기는, 예컨대 문헌[Kim et al, Eur J of Immunol 24:542 (1994)]에 의해 기재된 약동학 연구에 의해 측정될 수 있다.
B.
비-인간 항체
TIGIT에 대한 다른 비-인간, 예를 들어, 뮤린, 기니 피그, 영장류, 토끼, 닭, 또는 래트 항체의 생성은, 예를 들어, 동물을 TIGIT 또는 이의 단편, 또는 TIGIT를 보유하는 세포로 면역화함으로써 달성될 수 있다. 문헌[Harlow & Lane, Antibodies, A Laboratory Manual (CSHP NY, 1988)](모든 목적을 위해 참고로 포함됨)을 참조한다. 그러한 면역원은 천연 공급원으로부터, 펩티드 합성에 의해, 또는 재조합 발현에 의해 얻어질 수 있다. 임의로, 면역원은 담체 단백질과 융합되거나 달리 복합체화되어 투여될 수 있다. 임의로, 면역원은 애쥬번트(adjuvant)와 함께 투여될 수 있다. 몇몇 유형의 애쥬번트가 하기에 기재된 바와 같이 사용될 수 있다. 완전 프로인트 애쥬번트에 이어서 불완전 애쥬번트가 실험실 동물의 면역화에 사용될 수 있다. 토끼 또는 기니 피그는 전형적으로 다중클론 항체를 제조하기 위해 사용된다. 마우스는 전형적으로 단일클론 항체를 제조하기 위해 사용된다. TIGIT에 대한 특이적 결합에 대해 항체를 스크리닝한다. 임의로, 특이적 영역에 대한 TIGIT의 결합에 대해 항체를 추가로 스크리닝한다. 그러한 스크리닝은 TIGIT의 결실 돌연변이체의 집합에 대한 항체의 결합을 결정하는 단계 및 어느 결실 돌연변이체가 항체에 결합하는지를 결정하는 단계에 의해 달성될 수 있다. 결합은, 예를 들어, 웨스턴 블롯, FACS, 또는 ELISA에 의해 평가될 수 있다.
C.
인간화 항체
HAMA(인간 항-마우스(인간 항-래트 또는 인간 항-토끼 또는 인간 항-햄스터 등에도 적용가능함) 항체) 반응의 감소 또는 제거는 적합한 치료제의 임상 개발의 유의한 태양이다. 예를 들어, 문헌[Khaxzaeli et al., J. Natl. Cancer Inst. (1988), 80:937]; 문헌[Jaffers et al., Transplantation (1986), 41:572]; 문헌[Shawler et al., J. Immunol. (1985), 135:1530]; 문헌[Sears et al., J. Biol. Response Mod. (1984), 3:138]; 문헌[Miller et al., Blood (1983), 62:988]; 문헌[Hakimi et al., J. Immunol. (1991), 147:1352]; 문헌[Reichmann et al., Nature (1988), 332:323]; 문헌[Junghans et al., Cancer Res. (1990), 50:1495]을 참조한다. 본 명세서에 기재된 바와 같이, 본 개시내용은 HAMA 반응이 감소되거나 제거되도록 인간화된 항체를 제공한다. 이러한 항체의 변이체는 당업계에 알려진 일상적인 방법을 사용하여 추가로 얻어질 수 있으며, 이들 중 일부는 하기에 추가로 기재되어 있다.
인간화 항체는 비-인간 "공여자" 항체로부터의 CDR이 인간 "수용자" 항체 서열 내로 그라프트되는 유전자 조작된 항체이다(예를 들어, Queen의 US 5,530,101 및 5,585,089; Winter의 US 5,225,539, Carter의 US 6,407,213, Adair의 US 5,859,205 6,881,557, Foote의 US 6,881,557 참조). 수용자 항체 서열은, 예를 들어, 성숙 인간 항체 서열, 이러한 서열의 복합체, 인간 항체 서열의 공통 서열, 또는 생식세포계열 영역 서열일 수 있다. 따라서, 인간화 항체는 전체적으로 또는 실질적으로 공여자 항체로부터의 일부 또는 모든 CDR 및 존재하는 경우, 전체적으로 또는 실질적으로 인간 항체 서열로부터의 가변 영역 프레임워크 서열 및 불변 영역을 갖는 항체이다. 유사하게, 인간화 중쇄는 전적으로 또는 실질적으로 공여자 항체 중쇄로부터의 적어도 1개, 2개, 및 일반적으로 3개 모두의 CDR, 및 존재하는 경우, 실질적으로 인간 중쇄 가변 영역 프레임워크 및 불변 영역 서열로부터의 중쇄 가변 영역 프레임워크 서열 및 중쇄 불변 영역을 갖는다. 유사하게, 인간화 경쇄는 전적으로 또는 실질적으로 공여자 항체 경쇄로부터의 적어도 1개, 2개, 및 일반적으로 3개 모두의 CDR, 및 존재하는 경우, 실질적으로 인간 경쇄 가변 영역 프레임워크 및 불변 영역 서열로부터의 경쇄 가변 영역 프레임워크 서열 및 경쇄 불변 영역을 갖는다. 본 출원의 다른 곳에서와 같이 여기에서도, 상응하는 잔기(Kabat에 의해 정의된 바와 같음)의 약 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 또는 100% 이상이 각각의 CDR 사이에서 동일한 경우에 대상 항체 내의 CDR은 실질적으로 참조 항체 내의 상응하는 CDR로부터의 것이지만; 상응하는 잔기(Kabat에 의해 정의된 바와 같음)의 약 65%, 66%, 67%, 68%, 69%, 70%, 71%, 72%, 73%, 74%, 75%, 76%, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 또는 100% 이상이 각각의 CDR 사이에서 동일한 경우에 대상 항체 내의 Kabat에 의해 정의된 바와 같은 CDR H2는 실질적으로 참조 항체 내의 상응하는 CDR로부터의 것이다. Kabat에 의해 정의된 상응하는 잔기의 약 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 또는 100% 이상이 동일한 경우에 항체 사슬의 가변 영역 프레임워크 서열 또는 항체 사슬의 불변 영역은 실질적으로 각각 인간 가변 영역 프레임워크 서열 또는 인간 불변 영역으로부터의 것이다.
인간화 항체는 종종 비-인간(예를 들어, 마우스) 항체로부터의 6개 모두의 CDR(예컨대 Kabat에 의해 정의된 바와 같음)을 포함하지만, 이들은 또한 비-인간 항체로부터의 모든 CDR 미만(예를 들어, 3, 4, 또는 5개 이상)의 CDR로 제조될 수 있다(예를 들어, 문헌[Pascalis et al., J. Immunol. 169:3076, 2002]; 문헌[Vajdos et al., Journal of Molecular Biology, 320: 415-428, 2002]; 문헌[Iwahashi et al., Mol. Immunol. 36:1079-1091, 1999]; 문헌[Tamura et al, Journal of Immunology, 164:1432-1441, 2000]).
일부 항체에서는 CDR의 일부, 즉, SDR로 명명된 결합에 필요한 CDR 잔기의 서브세트만이 인간화 항체에서 결합을 유지하기 위해 필요하다. 항원에 접촉되지 않고 SDR에 존재하지 않는 CDR 잔기는 이전의 연구에 기초하여(예를 들어, CDR H2 내의 잔기 H60 내지 H65는 종종 필요하지 않음), Chothia 초가변 루프 외부에 있는 Kabat CDR의 영역으로부터(문헌[Chothia, J. Mol. Biol. 196:901, 1987]), 분자 모델링에 의해 및/또는 경험적으로, 또는 문헌[Gonzales et al., Mol. Immunol. 41: 863, 2004]에 기재된 바와 같이 식별될 수 있다. 그러한 인간화 항체에서는, 하나 이상의 공여자 CDR 잔기가 부재하거나 전체 공여체 CDR이 생략된 위치에서, 그 위치를 점유하는 아미노산은 수용자 항체 서열 내의 상응하는 위치(Kabat 넘버링에 의함)를 점유하는 아미노산일 수 있다. 포함할 CDR에서 공여자 아미노산에 대한 수용자의 그러한 치환의 수는 경쟁적 고려 사항의 균형을 반영한다. 그러한 치환은 인간화 항체 내의 마우스 아미노산의 수를 감소시키고 결과적으로 잠재적 면역원성을 감소시킴에 있어서 잠재적으로 유리하다. 그러나, 치환은 또한 친화성의 변화를 야기할 수 있으며, 친화성의 유의한 감소는 회피될 수 있다. CDR 내의 치환을 위한 위치 및 치환할 아미노산은 또한 경험적으로 선택될 수 있다.
수용자는, 그것이 인간 면역글로불린 또는 인간 공통 프레임워크로부터의 것인지 여부에 무관하게, 선택된 인간 프레임워크 서열과 서열이 동일할 수 있지만, 본 개시내용은 수용자 서열이 인간 면역글로불린 서열 또는 인간 공통 프레임워크 서열에 비해 기존의 아미노산 치환을 포함할 수 있음을 고려한다. 이러한 기존의 치환은 최소일 수 있으며; 일반적으로 인간 면역글로불린 서열 또는 공통 프레임워크 서열에 비해 단지 4개, 3개, 2개, 또는 1개의 아미노산 차이이다.
인간 수용자 서열 가변 영역 프레임워크와 공여자 항체 사슬의 상응하는 가변 영역 프레임워크 사이의 높은 정도의 서열 동일성(예를 들어, 65 내지 85% 동일성)을 제공하기 위해, 인간 수용자 항체 서열은 다수의 알려진 인간 항체 서열 중에서 임의로 선택할 수 있다.
CDR 입체구조에 대한 가능한 영향 및/또는 항원에 대한 결합에 기초하여 인간 가변 영역 프레임워크 잔기로부터의 소정 아미노산을 치환을 위해 선택할 수 있다. 그러한 가능한 영향의 조사는 모델링, 특정 위치에서의 아미노산의 특징의 검사, 또는 특정 아미노산의 치환 또는 돌연변이유발의 효과의 경험적 관찰에 의한 것이다.
예를 들어, 비-인간 가변 영역 프레임워크 잔기와 선택된 인간 가변 영역 프레임워크 잔기 사이에서 아미노산이 상이할 경우, 아미노산이 하기와 같음이 합리적으로 예상된다면, 인간 프레임워크 아미노산은 비-인간 항체로부터의 등가의 프레임워크 아미노산에 의해 치환될 수 있다:
(1) 항원에 직접 비공유 결합함,
(2) CDR 영역에 인접함,
(3) CDR 영역과 달리 상호작용함(예를 들어, CDR 영역의 약 6 Å 이내임).
치환을 위한 다른 후보는 그 위치에서 인간 면역글로불린에 대해 이례적인 수용자 인간 프레임워크 아미노산이다. 이러한 아미노산은 비-인간 공여자 항체의 등가 위치 또는 더욱 전형적인 인간 면역글로불린의 등가 위치로부터의 아미노산으로 치환될 수 있다. 치환을 위한 다른 후보는 그 위치에서 인간 면역글로불린에 대해 이례적인 수용자 인간 프레임워크 아미노산이다.
일부 실시 형태에서, 인간화 항-TIGIT 항체는 0 내지 2개의 아미노산 치환 또는 결실을 갖는 서열 번호 48의 아미노산 서열을 포함하는 CDR1, 0 내지 2개의 아미노산 치환 또는 결실을 갖는 서열 번호 49의 아미노산 서열을 포함하는 CDR2, 0 내지 2개의 아미노산 치환 또는 결실을 갖는 서열 번호 50의 아미노산 서열을 포함하는 CDR3을 포함하는 성숙 중쇄 가변 영역, 및 GenBank 수탁 번호 AAV40102.1의 프레임워크 영역 또는 GenBank 수탁 번호 ADX65334.1의 프레임워크 영역에 대해 약 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 또는 100% 이상의 동일성을 갖는 프레임워크 영역을 가지며; 0 내지 2개의 아미노산 치환 또는 결실을 갖는 서열 번호 51의 아미노산 서열을 포함하는 CDR1, 0 내지 2개의 아미노산 치환 또는 결실을 갖는 서열 번호 52의 아미노산 서열을 포함하는 CDR2, 0 내지 2개의 아미노산 치환 또는 결실을 갖는 서열 번호 53의 아미노산 서열을 포함하는 CDR3을 포함하는 성숙 경쇄 가변 영역, 및 GenBank 수탁 번호 ACY78416.1의 프레임워크 영역 또는 GenBank 수탁 번호 ADU32611.1의 프레임워크 영역에 대해 약 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 또는 100% 이상의 동일성을 갖는 프레임워크 영역을 갖는다. AAV40102.1, ADX65334.1, ACY78416.1, 및 ADU32611.1에 대한 프레임워크 영역은 Kabat 정의에 따라 결정되며, 실시예 2를 참조하거나 AAV40102.1, ADX65334.1, ACY78416.1, 및 ADU32611.1의 프레임워크 영역 및 공여자 CDR을 함유하는 서열 번호 76 내지 79를 참조한다. 일부 실시 형태에서, 성숙 중쇄 가변 영역은 중쇄 불변 영역의 적어도 일부에 연결되고, 성숙 경쇄 가변 영역은 경쇄 불변 영역의 적어도 일부에 연결된다. 일부 실시 형태에서, 전장 항체의 발현을 위해, 성숙 중쇄 가변 영역은 중쇄 불변 영역에 연결되고, 성숙 경쇄 가변 영역은 경쇄 불변 영역에 연결된다. 적합한 불변 영역은 섹션 III(F)에 추가로 상세히 기재되어 있다. 상기의 소정 실시 형태에서, 중쇄 불변 영역은 기능성 FcγR 결합 능력을 갖는다. 추가의 실시 형태에서, 중쇄 불변 영역은 서열 번호 94를 포함하거나 이로 이루어지고 경쇄 불변 영역은 서열 번호 95를 포함하거나 이로 이루어진다. 상기의 소정 실시 형태에서, 중쇄 불변 영역은 감소된 기능성 FcγR 결합 능력을 갖는다. 추가의 실시 형태에서, 중쇄 불변 영역은 서열 번호 97을 포함하거나 이로 이루어지고 경쇄 불변 영역은 서열 번호 95를 포함하거나 이로 이루어진다. 추가의 실시 형태에서, 중쇄 불변 영역은 서열 번호 101을 포함하거나 이로 이루어지고 경쇄 불변 영역은 서열 번호 95를 포함하거나 이로 이루어진다. 상기의 소정 실시 형태에서, 중쇄 불변 영역은 향상된 기능성 FcγR 결합 능력을 갖는다. 추가의 실시 형태에서, 중쇄 불변 영역은 서열 번호 99를 포함하거나 이로 이루어지고 경쇄 불변 영역은 서열 번호 95를 포함하거나 이로 이루어진다.
일부 실시 형태에서, 인간화 항-TIGIT 항체는 서열 번호 76에 대해 약 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% 이상, 또는 100% 미만의 동일성을 갖는 성숙 중쇄 가변 영역 및 서열 번호 77에 대해 약 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% 이상, 또는 100% 미만의 동일성을 갖는 성숙 경쇄 가변 영역을 갖는다. 일부 실시 형태에서, 결합에 중요할 가능성이 있는 것으로 식별된 것들 이외의 가변 영역 프레임워크 잔기에서 임의의 변이가 발생한다. 일부 실시 형태에서, 임의의 변이는 보존적 아미노산 치환이다. 일부 실시 형태에서, 항체는 서열 번호 76의 서열을 갖는 성숙 중쇄 가변 영역 및 서열 번호 77의 서열을 갖는 성숙 경쇄 가변 영역을 포함한다. 본 개시내용의 Hu24F8.1 항체는 서열 번호 76의 서열을 갖는 성숙 중쇄 가변 영역 및 서열 번호 77의 서열을 갖는 성숙 경쇄 가변 영역을 포함한다. 상기의 일부 실시 형태에서, 성숙 중쇄 가변 영역은 중쇄 불변 영역의 적어도 일부에 연결되고, 성숙 경쇄 가변 영역은 경쇄 불변 영역의 적어도 일부에 연결된다. 일부 실시 형태에서, 전장 항체의 발현을 위해, 성숙 중쇄 가변 영역은 중쇄 불변 영역에 연결되고, 성숙 경쇄 가변 영역은 경쇄 불변 영역에 연결된다. 적합한 불변 영역은 섹션 III(F)에 추가로 상세히 기재되어 있다. 상기의 소정 실시 형태에서, 중쇄 불변 영역은 구매가능한 항체-의존성 세포-매개 독성 보고 생물검정 키트에서 제조사의 설명서에 따라 측정된 Fcγ 수용체(FcγR)-매개 신호전달을 유도할 수 있다. 추가의 실시 형태에서, 중쇄 불변 영역은 서열 번호 94를 포함하거나 이로 이루어지고 경쇄 불변 영역은 서열 번호 95를 포함하거나 이로 이루어진다. 다른 실시 형태에서, 중쇄 불변 영역은 구매가능한 항체-의존성 세포-매개 독성 보고 생물검정 키트에서 제조사의 설명서에 따라 측정된 Fcγ 수용체(FcγR)-매개 신호전달을 유도하지 않는다.
일부 실시 형태에서, 인간화 항-TIGIT 항체는 서열 번호 78에 대해 약 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% 이상, 또는 100% 미만의 동일성을 갖는 성숙 중쇄 가변 영역 및 서열 번호 77에 대해 약 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% 이상, 또는 100% 미만의 동일성을 갖는 성숙 경쇄 가변 영역을 갖는다. 일부 실시 형태에서, 결합에 중요할 가능성이 있는 것으로 식별된 것들 이외의 가변 영역 프레임워크 잔기에서 임의의 변이가 발생한다. 일부 실시 형태에서, 임의의 변이는 보존적 아미노산 치환이다. 일부 실시 형태에서, 항체는 서열 번호 78의 서열을 갖는 성숙 중쇄 가변 영역 및 서열 번호 77의 서열을 갖는 성숙 경쇄 가변 영역을 포함한다. 본 개시내용의 Hu24F8.2 항체는 서열 번호 78의 서열을 갖는 성숙 중쇄 가변 영역 및 서열 번호 77의 서열을 갖는 성숙 경쇄 가변 영역을 포함한다. 상기의 일부 실시 형태에서, 성숙 중쇄 가변 영역은 중쇄 불변 영역의 적어도 일부에 연결되고, 성숙 경쇄 가변 영역은 경쇄 불변 영역의 적어도 일부에 연결된다. 일부 실시 형태에서, 전장 항체의 발현을 위해, 성숙 중쇄 가변 영역은 중쇄 불변 영역에 연결되고, 성숙 경쇄 가변 영역은 경쇄 불변 영역에 연결된다. 적합한 불변 영역은 섹션 III(F)에 추가로 상세히 기재되어 있다. 상기의 소정 실시 형태에서, 중쇄 불변 영역은 구매가능한 항체-의존성 세포-매개 독성 보고 생물검정 키트에서 제조사의 설명서에 따라 측정된 Fcγ 수용체(FcγR)-매개 신호전달을 유도할 수 있다. 추가의 실시 형태에서, 중쇄 불변 영역은 서열 번호 94를 포함하거나 이로 이루어지고 경쇄 불변 영역은 서열 번호 95를 포함하거나 이로 이루어진다. 다른 실시 형태에서, 중쇄 불변 영역은 구매가능한 항체-의존성 세포-매개 독성 보고 생물검정 키트에서 제조사의 설명서에 따라 측정된 Fcγ 수용체(FcγR)-매개 신호전달을 유도하지 않는다. 일부 실시 형태에서, 중쇄 불변 영역은 서열 번호 97을 포함하거나 이로 이루어지고 경쇄 불변 영역은 서열 번호 95를 포함하거나 이로 이루어진다. 다른 실시 형태에서, 중쇄 불변 영역은 서열 번호 101을 포함하거나 이로 이루어지고 경쇄 불변 영역은 서열 번호 95를 포함하거나 이로 이루어진다. 다른 실시 형태에서, 중쇄 불변 영역은 구매가능한 항체-의존성 세포-매개 독성 보고 생물검정 키트에서 제조사의 설명서에 따라 측정된 향상된 Fcγ 수용체(FcγR)-매개 신호전달을 유도한다. 일부 실시 형태에서, 중쇄 불변 영역은 서열 번호 99를 포함하거나 이로 이루어지고 경쇄 불변 영역은 서열 번호 95를 포함하거나 이로 이루어진다.
일부 실시 형태에서, 인간화 항-TIGIT 항체는 서열 번호 76에 대해 약 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% 이상, 또는 100% 미만의 동일성을 갖는 성숙 중쇄 가변 영역 및 서열 번호 79에 대해 약 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% 이상, 또는 100% 미만의 동일성을 갖는 성숙 경쇄 가변 영역을 갖는다. 일부 실시 형태에서, 결합에 중요할 가능성이 있는 것으로 식별된 것들 이외의 가변 영역 프레임워크 잔기에서 임의의 변이가 발생한다. 일부 실시 형태에서, 임의의 변이는 보존적 아미노산 치환이다. 일부 실시 형태에서, 항체는 서열 번호 76의 서열을 갖는 성숙 중쇄 가변 영역 및 서열 번호 79의 서열을 갖는 성숙 경쇄 가변 영역을 포함한다. 본 개시내용의 Hu24F8.3 항체는 서열 번호 78의 서열을 갖는 성숙 중쇄 가변 영역 및 서열 번호 79의 서열을 갖는 성숙 경쇄 가변 영역을 포함한다. 상기의 일부 실시 형태에서, 성숙 중쇄 가변 영역은 중쇄 불변 영역의 적어도 일부에 연결되고, 성숙 경쇄 가변 영역은 경쇄 불변 영역의 적어도 일부에 연결된다. 일부 실시 형태에서, 전장 항체의 발현을 위해, 성숙 중쇄 가변 영역은 중쇄 불변 영역에 연결되고, 성숙 경쇄 가변 영역은 경쇄 불변 영역에 연결된다. 적합한 불변 영역은 섹션 III(F)에 추가로 상세히 기재되어 있다. 상기의 소정 실시 형태에서, 중쇄 불변 영역은 구매가능한 항체-의존성 세포-매개 독성 보고 생물검정 키트에서 제조사의 설명서에 따라 측정된 Fcγ 수용체(FcγR)-매개 신호전달을 유도할 수 있다. 추가의 실시 형태에서, 중쇄 불변 영역은 서열 번호 94를 포함하거나 이로 이루어지고 경쇄 불변 영역은 서열 번호 95를 포함하거나 이로 이루어진다. 다른 실시 형태에서, 중쇄 불변 영역은 구매가능한 항체-의존성 세포-매개 독성 보고 생물검정 키트에서 제조사의 설명서에 따라 측정된 Fcγ 수용체(FcγR)-매개 신호전달을 유도하지 않는다. 일부 실시 형태에서, 중쇄 불변 영역은 서열 번호 97을 포함하거나 이로 이루어지고 경쇄 불변 영역은 서열 번호 95를 포함하거나 이로 이루어진다. 다른 실시 형태에서, 중쇄 불변 영역은 서열 번호 101을 포함하거나 이로 이루어지고 경쇄 불변 영역은 서열 번호 95를 포함하거나 이로 이루어진다. 다른 실시 형태에서, 중쇄 불변 영역은 구매가능한 항체-의존성 세포-매개 독성 보고 생물검정 키트에서 제조사의 설명서에 따라 측정된 향상된 Fcγ 수용체(FcγR)-매개 신호전달을 유도한다. 일부 실시 형태에서, 중쇄 불변 영역은 서열 번호 99를 포함하거나 이로 이루어지고 경쇄 불변 영역은 서열 번호 95를 포함하거나 이로 이루어진다.
일부 실시 형태에서, 인간화 항-TIGIT 항체는 서열 번호 78에 대해 약 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% 이상, 또는 100% 미만의 동일성을 갖는 성숙 중쇄 가변 영역 및 서열 번호 79에 대해 약 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% 이상, 또는 100% 미만의 동일성을 갖는 성숙 경쇄 가변 영역을 갖는다. 일부 실시 형태에서, 결합에 중요할 가능성이 있는 것으로 식별된 것들 이외의 가변 영역 프레임워크 잔기에서 임의의 변이가 발생한다. 일부 실시 형태에서, 임의의 변이는 보존적 아미노산 치환이다. 일부 실시 형태에서, 항체는 서열 번호 78의 서열을 갖는 성숙 중쇄 가변 영역 및 서열 번호 79의 서열을 갖는 성숙 경쇄 가변 영역을 포함한다. 본 개시내용의 Hu24F8.4 항체는 서열 번호 76의 서열을 갖는 성숙 중쇄 가변 영역 및 서열 번호 79의 서열을 갖는 성숙 경쇄 가변 영역을 포함한다. 상기의 일부 실시 형태에서, 성숙 중쇄 가변 영역은 중쇄 불변 영역의 적어도 일부에 연결되고, 성숙 경쇄 가변 영역은 경쇄 불변 영역의 적어도 일부에 연결된다. 일부 실시 형태에서, 전장 항체의 발현을 위해, 성숙 중쇄 가변 영역은 중쇄 불변 영역에 연결되고, 성숙 경쇄 가변 영역은 경쇄 불변 영역에 연결된다. 적합한 불변 영역은 섹션 III(F)에 추가로 상세히 기재되어 있다. 상기의 소정 실시 형태에서, 중쇄 불변 영역은 구매가능한 항체-의존성 세포-매개 독성 보고 생물검정 키트에서 제조사의 설명서에 따라 측정된 Fcγ 수용체(FcγR)-매개 신호전달을 유도할 수 있다. 추가의 실시 형태에서, 중쇄 불변 영역은 서열 번호 94를 포함하거나 이로 이루어지고 경쇄 불변 영역은 서열 번호 95를 포함하거나 이로 이루어진다. 다른 실시 형태에서, 중쇄 불변 영역은 구매가능한 항체-의존성 세포-매개 독성 보고 생물검정 키트에서 제조사의 설명서에 따라 측정된 Fcγ 수용체(FcγR)-매개 신호전달을 유도하지 않는다. 일부 실시 형태에서, 중쇄 불변 영역은 서열 번호 97을 포함하거나 이로 이루어지고 경쇄 불변 영역은 서열 번호 95를 포함하거나 이로 이루어진다. 다른 실시 형태에서, 중쇄 불변 영역은 서열 번호 101을 포함하거나 이로 이루어지고 경쇄 불변 영역은 서열 번호 95를 포함하거나 이로 이루어진다. 다른 실시 형태에서, 중쇄 불변 영역은 구매가능한 항체-의존성 세포-매개 독성 보고 생물검정 키트에서 제조사의 설명서에 따라 측정된 향상된 Fcγ 수용체(FcγR)-매개 신호전달을 유도한다. 일부 실시 형태에서, 중쇄 불변 영역은 서열 번호 99를 포함하거나 이로 이루어지고 경쇄 불변 영역은 서열 번호 95를 포함하거나 이로 이루어진다.
상기의 각각에 대한 추가의 실시 형태에서, 인간화 항-TIGIT 항체는 (i) 표면 플라즈몬 공명에 의해 측정된 약 0.01x10-11 M 내지 약 100x10-11 M, 약 0.1x10-11 M 내지 약 100x10-11 M, 약 0.1x10-11 M 내지 약 10x10-11 M, 약 1x10-11 M 내지 약 100x10-11 M, 또는 심지어 약 1x10-11 M 내지 약 10x10-11 M의 평형 결합 상수(KD)를 갖고/갖거나, (ii) 세포 표면 인간 TIGIT에 대한 가용성 인간 CD155 리간드의 결합을 실시예 1에서와 같이 측정된 약 0.2 nM 내지 약 2 nM, 약 0.2 nM 내지 약 0.8 nM, 약 0.4 nM 내지 약 0.8 nM, 또는 약 0.6 nM 내지 약 0.8 nM의 반수 최대 억제제 농도(IC50)로 차단할 수 있다. 상기 개별적인 결합 및 차단 특성 또는 이들의 조합에 대해 대안적으로 및 또는 부가적으로, 일부 실시 형태에서 인간화 항-TIGIT 항체는 적어도 하기 TIGIT의 잔기를 포함하는 에피토프에 결합한다: (i) 서열 번호 80의 D72 및 서열 번호 80의 T55, Q56, N58, E60, S80, 및 K82 중 하나 이상, (ii) 서열 번호 80의 E60 및 D72 및 임의로 서열 번호 80의 T55, Q56, N58, S80, 및 K82 중 하나 이상, (iii) 서열 번호 80의 D72 및 K82 및 임의로 서열 번호 80의 T55, Q56, N58, E60, 및 S80 중 하나 이상, (iv) 서열 번호 80의 E60, D72, 및 K82 및 임의로 서열 번호 80의 T55, Q56, N58, 및 S80 중 하나 이상, 또는 (v) 서열 번호 80의 T55, Q56, N58, E60, D72, S80, 및 K82.
D.
키메라 및 베니어 항체
본 개시내용은 비-인간 항체의 키메라 및 베니어 형태, 특히 실시예의 21F8, 30M18, 24F8, 5J24, 21B9, 22B22, 28P24, 21B16, 및 28O12 항체를 추가로 제공한다.
키메라 항체는 비-인간 항체(예를 들어, 마우스)의 경쇄 및 중쇄의 성숙 가변 영역이 인간 경쇄 및 중쇄 불변 영역과 조합된 항체이다. 그러한 항체는 비-인간 항체의 결합 특이성을 실질적으로 또는 전적으로 유지하며, 인간 서열의 약 2/3이다.
베니어 항체는, 비-인간 항체의 CDR의 일부 및 일반적으로 전부 및 비-인간 가변 영역 프레임워크 잔기의 일부를 유지하지만 B- 또는 T 세포 에피토프에 기여할 수 있는 다른 가변 영역 프레임워크 잔기, 예를 들어 노출된 잔기(문헌[Padlan, Mol. Immunol. 28:489, 1991])를 인간 항체 서열의 상응하는 위치의 잔기로 대체하는 인간화 항체의 유형이다. 결과는 CDR이 전체적으로 또는 실질적으로 비인간 항체로부터 유래되고 비인간 항체의 가변 영역 프레임워크가 치환에 의해 더 인간과 유사하게 만들어지는 항체이다. 21F8, 30M18, 24F8, 5J24, 21B9, 22B22, 28P24, 21B16, 또는 28O12 항체의 베니어 형태는 본 개시내용에 포함된다.
일부 실시 형태에서, TIGIT 키메라 항체는 마우스 가변 도메인 및 인간 IgG1/카파 불변 도메인을 갖는 마우스 인간 키메라이다. 일 실시 형태에서, TIGIT 키메라 항체는 마우스 21F8VH(서열 번호 1) 및 21F8VL(서열 번호 2) 도메인 및 인간 IgG1/카파 Fab 불변 도메인(Ch21F8)으로부터 작제된 키메라 Fab ㎷H+㎷L이다. 일 실시 형태에서, TIGIT 키메라 항체는 마우스 30M18VH(서열 번호 3) 및 30M18VL(서열 번호 4) 도메인 및 인간 IgG1/카파 Fab 불변 도메인(Ch30M18)으로부터 작제된 키메라 Fab ㎷H+㎷L이다. 일 실시 형태에서, TIGIT 키메라 항체는 마우스 24F8VH(서열 번호 5) 및 24F8VL(서열 번호 6) 도메인 및 인간 IgG1/카파 Fab 불변 도메인(Ch24F8)으로부터 작제된 키메라 Fab ㎷H+㎷L이다. 일 실시 형태에서, TIGIT 키메라 항체는 마우스 5J24VH(서열 번호 7) 및 5J24VL(서열 번호 8) 도메인 및 인간 IgG1/카파 Fab 불변 도메인(Ch5J24)으로부터 작제된 키메라 Fab ㎷H+㎷L이다. 일 실시 형태에서, TIGIT 키메라 항체는 마우스 21B9VH(서열 번호 9) 및 21B9VL(서열 번호 10) 도메인 및 인간 IgG1/카파 Fab 불변 도메인(Ch21B9)으로부터 작제된 키메라 Fab ㎷H+㎷L이다. 일 실시 형태에서, TIGIT 키메라 항체는 마우스 22B22VH(서열 번호 11) 및 22B22VL(서열 번호 12) 도메인 및 인간 IgG1/카파 Fab 불변 도메인(Ch22B22)으로부터 작제된 키메라 Fab ㎷H+㎷L이다. 일 실시 형태에서, TIGIT 키메라 항체는 마우스 28P24VH(서열 번호 13) 및 28P24VL(서열 번호 14) 도메인 및 인간 IgG1/카파 Fab 불변 도메인(Ch28P24)으로부터 작제된 키메라 Fab ㎷H+㎷L이다. 일 실시 형태에서, TIGIT 키메라 항체는 마우스 21B16VH(서열 번호 15) 및 21B16VL(서열 번호 16) 도메인 및 인간 IgG1/카파 Fab 불변 도메인(Ch21B16)으로부터 작제된 키메라 Fab ㎷H+㎷L이다. 일 실시 형태에서, TIGIT 키메라 항체는 마우스 28O12VH(서열 번호 17) 및 28O12VL(서열 번호 12) 도메인 및 인간 IgG1/카파 Fab 불변 도메인(Ch28O12)으로부터 작제된 키메라 Fab ㎷H+㎷L이다.
E.
인간 항체
TIGIT에 대한 인간 항체는 하기 기재된 다양한 기술에 의해 제공된다. 일부 인간 항체는 경쟁 결합 실험에 의해, 상기 Winter의 파지 디스플레이 방법에 의해, 또는 다른 방법으로, 실시예에 기재된 마우스 단일클론 항체 중 하나와 같은 특정 마우스 항체와 동일한 에피토프 특이성을 갖도록 선택된다. 인간 항체는 또한, 표적 항원으로서 TIGIT의 단편만을 사용하고/하거나 TIGIT의 결실 돌연변이체의 집합에 대한 항체를 스크리닝함으로써 특정 에피토프 특이성에 대해 스크리닝될 수 있다.
인간 항체를 생성하기 위한 방법은 문헌[Oestberg et al., Hybridoma 2:361-367 (1983)]; Oestberg의 미국 특허 제4,634,664호; 및 Engleman 등의 미국 특허 제4,634,666호의 트리오마(trioma) 방법, 인간 면역글로불린 유전자를 포함하는 유전자이식 마우스의 사용(예를 들어, Lonberg 등의 WO93/12227(1993); US 5,877,397, US 5,874,299, US 5,814,318, US 5,789,650, US 5,770,429, US 5,661,016, US 5,633,425, US 5,625,126, US 5,569,825, US 5,545,806, 문헌[Nature 148, 1547-1553 (1994)], 문헌[Nature Biotechnology 14, 826 (1996)], 문헌[Kucherlapati, WO 91/10741 (1991)] 참조), 및 파지 디스플레이 방법(예를 들어, Dower 등의 WO 91/17271 및 McCafferty 등의 WO 92/01047, US 5,877,218, US 5,871,907, US 5,858,657, US 5,837,242, US 5,733,743, 및 US 5,565,332 참조)을 포함한다.
F.
불변 영역의 선택
키메라, 인간화(베니어 포함), 또는 인간 항체의 중쇄 및 경쇄 가변 영역은 각각 인간 불변 영역의 적어도 일부에 연결될 수 있다. 일부 실시 형태에서, 상기 섹션에 기재된 중쇄 가변 도메인은 인간 중쇄 불변 영역의 일부에 연결되고, 상기 섹션에 기재된 경쇄 가변 도메인은 인간 경쇄 불변 영역의 일부에 연결된다. 일부 실시 형태에서, 상기 섹션에 기재된 중쇄 가변 도메인은 인간 중쇄 불변 영역의 일부에 연결되고, 상기 섹션에 기재된 경쇄 가변 도메인은 전장 인간 경쇄 불변 영역에 연결된다. 중쇄 불변 영역은, 세포 표면 수용체(Fc 수용체)와 상호작용하는 항체 및 보체 시스템의 일부 단백질의 꼬리 영역인 Fc(결정화가능한 단편) 영역을 포함한다. 일부 실시 형태에서, 상기 섹션에 기재된 중쇄 가변 도메인은 전장 인간 중쇄 불변 영역에 연결되고, 상기 섹션에 기재된 경쇄 가변 도메인은 전장 인간 경쇄 불변 영역에 연결된다.
불변 영역(또는 이의 절단체)의 선택은, 부분적으로, 이펙터 기능을 원하는지, 또는 심지어 향상될 필요가 있는지 여부에 따라 달라진다. "이펙터 기능"은 항체의 Fc 영역에 기인할 수 있고 항체 동종형에 따라 변동되는 생물학적 활성을 지칭한다. 항체 이펙터 기능의 비제한적인 예는 하기를 포함한다: C1 복합체에 대한 C1q 결합 및 보체 의존성 세포독성(CDC); Fc 수용체 결합; 항체-의존성 세포-매개 세포독성(ADCC); 식세포작용; 세포 표면 수용체(예를 들어, B 세포 수용체)의 하향 조절; 및 B 세포 활성화. 인간 항체는 이들의 중쇄에 따라 5개의 동종형(IgM, IgD, IgG, IgA, 및 IgE)으로 분류되며, 각각은 상이한 기능을 제공한다. IgG는 각각 상이한 중쇄를 함유하는 4개의 인간 하위부류(IgG1, IgG2, IgG3, 및 IgG4)로 이루어진다. 이들은 고도로 상동성이고 주로 힌지 영역 및 이들이 숙주 면역계를 활성화시키는 정도에 있어서 상이하다. 예를 들어, 인간 동위원소 IgG1 및 IgG3은 보체-매개 세포독성을 매개할 수 있고, 인간 동종형 IgG2 및 IgG4는 이를 매개하지 않거나 매우 낮은 수준으로 매개한다. 경쇄 불변 영역은 하위부류 람다 또는 카파의 것일 수 있다. TIGIT를 발현하지 않는 암 또는 병원체에 대한 면역요법의 경우, 인간 IgG1 및 IgG3에 대해 부가적으로, 인간 IgG2 또는 IgG4 또는 감소된 이펙터 기능을 갖는 인간 IgG1의 약화된 형태가 사용될 수 있다. 인간 IgG4의 경우, Fab-아암 교환을 방지하기 위해 중쇄 상의 S228P(Eu 넘버링) 조작된 돌연변이의 포함을 사용할 수 있다. 그러나, 면역억제를 위해 TIGIT를 발현하는 암 세포(예를 들어, T 세포 또는 NK 세포의 종양)의 제거를 위해, 인간 IgG1 또는 IgG3이 사용될 수 있다. 예를 들어, TIGIT를 발현하는 암 세포(예를 들어, 일부 혈액학적 악성종양)의 직접 사멸화를 위해 또는 면역억제를 위해, Fc 이펙터 기능을 갖는 항체(예를 들어, 인간 IgG1 또는 IgG3)를 사용할 수 있다. 인간 IgG1 또는 IgG3에 대한 적합한 서열은 당업계에 알려져 있으며, 예를 들어, 서열 번호 94, 및 US 5,624,821에 개시된 인간 IgG3을 포함한다.
인간 불변 영역은 상이한 개체 간의 동종이형(allotypic) 변이 및 아이소동종이형(isoallotypic) 변이를 보여주며, 즉, 불변 영역은 하나 이상의 다형성(polymorphic) 위치에서 상이한 개체에서 상이할 수 있다. 아이소동종이형은, 아이소동종이형을 인식하는 혈청이 하나 이상의 다른 동종형의 비-다형성 영역에 결합한다는 점에서 동종이형과는 상이하다. 인간 불변 영역에 대한 참조는 임의의 천연 동종이형을 갖는 불변 영역 또는 천연 동종이형에서 다형성 위치를 점유하는 잔기의 임의의 순열(permutation)을 포함한다.
중쇄의 C-말단 라이신과 같은 경쇄 및/또는 중쇄의 아미노 또는 카복시 말단에 있는 하나 이상의 아미노산은 분자의 일부 또는 전부에서 누락되거나 유도체화될 수 있다. 피로글루타메이트의 형성을 방지하기 위해 중쇄 또는 경쇄의 N-말단 글루타민을 글루타메이트 잔기로 치환할 수 있다. 불변 영역에서 치환을 실행하여 보체-매개 세포독성(CDC) 또는 항체-의존성 세포-매개 세포독성(ADCC)과 같은 이펙터 기능을 감소 또는 증가시키거나(예를 들어, Winter 등의 미국 특허 제5,624,821호; Tso 등의 미국 특허 제5,834,597호; 및 문헌[Lazar et al., Proc. Natl. Acad. Sci. USA, 103:4005, 2006] 참조), 인간에서의 반감기를 연장할 수 있다(예를 들어, 문헌[Hinton et al., J. Biol. Chem. 279:6213, 2004] 참조). 예시적인 치환은 항체의 반감기를 증가시키기 위한 위치 250에서의 Gln 및/또는 위치 428에서의 Leu(Eu 넘버링)를 포함한다.
일부 실시 형태에서, 본 명세서에 기재된 항체는 상기 기재된 바와 같은 야생형 중쇄 불변 영역을 포함한다. 일부 실시 형태에서, 야생형 중쇄 불변 영역은 서열 번호 94이다. 서열 번호 92는 서열 번호 94의 야생형 불변 영역을 포함하는 예시적인 중쇄 아미노산 서열이다. 다른 실시 형태에서, 본 명세서에 기재된 항체는 변이체 인간 IgG1, 변이체 인간 IgG2, 변이체 인간 IgG3, 또는 변이체 인간 IgG4로부터 선택된 야생형 중쇄 불변 영역(또는 이의 절단체)의 변이체를 갖는다. 일부 실시 형태에서, 변이체 중쇄 불변 영역은 서열 번호 97, 서열 번호 99, 또는 서열 번호 101이다. 서열 번호 96, 98, 및 100은 변이체 중쇄 불변 영역을 포함하는 예시적인 중쇄 아미노산 서열이다.
본 개시내용의 일부 항체는 돌연변이(들)가 없는 동일한 항체와 비교하여 CDC 및 ADCC 또는 항체-의존성 세포 식세포작용(ADCP)과 같은 이펙터 기능이 감소된 불변 영역 돌연변이(들)의 도입에 의해 조작된다. 일부 실시 형태에서, 이러한 이펙터 기능은 각각 또는 모두 돌연변이가 없는 항체와 비교하여 50%, 75%, 90%, 또는 95% 이상 감소된다. 다른 검정은 문헌[Shields et al, 2001 J. Biol. Chem., Vol. 276, p 6591-6604]; 문헌[Chappel et al, 1993 J. Biol. Chem., Vol 268, p 25124-25131]; 문헌[Lazar et al, 2006 PNAS, 103; 4005-4010]에 의해 기재되어 있다.
위치 234, 235, 236, 및/또는 237 중 임의의 것 또는 모두의 치환은 Fcγ 수용체, 특히 FcγRI 수용체에 대한 친화성을 감소시킨다(예를 들어, US 6,624,821호 참조). 일부 실시 형태에서, 알라닌 잔기는 이펙터 기능을 감소시키기 위해 L234A/L235A 이중 돌연변이와 같은 치환에 사용된다. 감소된 이펙터 기능을 갖는 돌연변이의 다른 조합은 L234A/L235A/G237A, E233P/L234V/L235A/ΔG236, A327G/A330S/P331S, K322A, L234A 및 L235A, L234F/L235E/P331S(Eu 넘버링)를 포함한다. 임의로, 인간 IgG2 내의 위치 234, 236, 및/또는 237이 알라닌으로 치환되고 위치 235가 글루타민으로 치환된다. (예를 들어, US 5,624,821 참조) Eu 인덱스 위치 330 및 331에서 보체 C1q 결합 부위 내의 2개의 아미노산 치환은 보체 고정을 감소시킨다(문헌[Tao et al., J. Exp. Med. 178:661 (1993)] 및 문헌[Canfield and Morrison, J. Exp. Med. 173:1483 (1991)] 참조). 위치 233 내지 236에서 인간 IgG1 내로의 IgG2 잔기의 치환 및 위치 327, 330, 및 331에서 IgG4 잔기의 치환은 ADCC 및 CDC를 감소시킨다(예를 들어, 문헌[Armour KL. et al., 1999 Eur J Immunol. 29(8):2613-24]; 및 문헌[Shields RL. et al., 2001. J Biol Chem. 276(9):6591-604] 참조). N297A, N297Q, 또는 N297G(Eu 넘버링) 돌연변이는 글리코실화를 감소시킴으로써 이펙터 기능을 감소시킨다.
본 개시내용의 항체는 일부 실시 형태에서 Fc 이펙터 기능을 향상시키기 위해 조작될 수 있다. 예를 들어, FcγR 결합은 아미노산 조작에 의해 향상될 수 있다. 일부 실시 형태에서, 이는 Fc 영역 내의 하나 이상의 아미노산의 치환에 의해 실행될 수 있다. 바람직한 돌연변이는, 예를 들어, 알라닌 스캐닝 또는 합리적 설계 및 라이브러리 스크리닝에 의해 결정될 수 있다. 이러한 기술을 사용하여 FcR에 대한 향상된 결합 및 향상된 이펙터 기능을 갖는 IgG 변이체를 식별할 수 있다. 대안적으로, Fc 수용체 영역에 대한 몇몇 돌연변이는, 예를 들어, 문헌[Smith P. et al (2012) PNAS 6181-6186]에 기재된 바와 같이 당업계에 알려져 있다.
일부 실시 형태에서, 본 명세서에 기재된 항체는, 변형이 없는 야생형 IgG1에 비교하여 ADCC를 매개하는 항체의 능력을 증가시키는 변형된 IgG1 불변 도메인을 포함한다. 변형된 IgG1 도메인은 L235V, S239D, F243L, R292P, A330L, I332E, P396L(Eu 넘버링) 중 하나 이상에서의 아미노산 치환을 특징으로 할 수 있다. 다른 실시 형태에서, 변형된 IgG1 도메인은 S239D, A330L, 및 I332E(Eu 넘버링)에서의 치환을 특징으로 한다. 일부 실시 형태에서 본 명세서에 기재된 바와 같은 항체의 치료적 유효량은 당업계에 기재된 방법에 의해 평가되는 바와 같이 1, 2, 또는 3 시간 이내에 20% 이상, 25% 이상, 30% 이상, 35% 이상, 40% 이상, 45% 이상, 50% 이상, 55% 이상, 60% 이상, 또는 65% 이상의 TIGIT-발현 세포에서 세포 사멸을 유도할 수 있다.
대안적으로, 당형태 섭동(glycoform perturbation)을 사용하여 Fc-매개 치료 항체 기능을 향상시킬 수 있다. IgG1 항체 상의 N-연결된 Fc 글리코실화는 이펙터 기능을 위해 중요하다. 시알릴화, 갈락토실화, 이등분 당(bisecting sugar), 및 푸코실화는 모두 IgG 분자의 결합 및 활성에 영향을 줄 수 있다. 치료 항체 상의 글리코실화 패턴을 제어하는 단계는 다수의 상이한 방식으로 실행될 수 있다. 재조합 항체를 생성하는 세포의 유형 및 그의 배양 조건은 치료 항체의 글리코실화 및 활성에 영향을 줄 수 있다. 추가로, 생물 반응기 조건 및 하류 가공은 또한 글리칸 미세불균질성에 영향을 줄 수 있다. 낮은 푸코실화 항체 또는 푸코실화되지 않은 항체는 Fc-매개 특성을 향상시키는 것으로 나타났다. 당조작에 의한 푸코스 수준의 이러한 감소를 달성하는 다수의 방식이 당업계에 잘 알려져 있다. 일 방식은 항체의 번역후 변형에 관여하는 효소를 조작하는 것이다. 이는 글루코시다제, 예컨대 β-1-4-N-아세틸글루코사미닐트랜스페라제 III의 과발현, 푸코실트랜스페라제의 녹 아웃, 또는 천연적으로 푸코스-결핍되거나 낮은 푸코실화 수준을 발현하도록 돌연변이화된 세포주의 사용을 포함할 수 있다. 또한, 낮은 푸코스를 보유하는 IgG 분자를 얻기 위해 카스타노스페르민과 같은 N-연결된 글루코시다제의 억제제를 또한 사용할 수 있다.
일부 실시 형태에서, 아미노산 조작된 변이체는 다수의 FcγR에 대해 더 광범위하게 향상된 친화성을 가질 수 있는 반면에, 당형태 조작된 항체는 일반적으로 향상된 FcγRIIIa 결합에 대해 더 특이적인 친화성을 가질 수 있다. 당형태는 Fc 부분 상의 근위 아미노산과 상호작용하며, Ig 올리고당과 접촉되는 아미노산의 대체는 상이한 당형태 구조를 유발할 수 있다.
G.
재조합 항체의 발현
키메라, 인간화(베니어 포함), 및 인간 항체는 전형적으로 재조합 발현에 의해 생성된다. 따라서, 본 개시내용은 또한, 이 섹션 IIIA-G의 항-TIGIT 항체를 인코딩하는 폴리뉴클레오티드, 폴리뉴클레오티드를 포함하는 벡터, 및 벡터를 포함하는 숙주 세포를 제공한다.
본 개시내용의 항-TIGIT 항체를 인코딩하는 폴리뉴클레오티드는 증폭, 발현, 또는 추가의 최적화를 위해 벡터 내로 삽입될 수 있다. 다수의 벡터가 이용 가능하다. 일부 실시 형태에서, 벡터 시스템은 포유류, 박테리아, 효모 시스템 등을 포함하며, 예컨대 pALTER, pBAD, pcDNA, pCal, pL, pET, pGEMEX, pGEX, pCI, pCMV, pEGFP, pEGFT, pSV2, pFUSE, pVITRO,pVIVO, pMAL, pMONO, pSELECT, pUNO, pDUO, Psg5L, pBABE, pWPXL, pBI, p15TV-L, pPro18, pTD, pRS420, pLexA, pACT2.2 등 및 다른 실험실 벡터 및 구매가능한 벡터를 포함하지만 이로 제한되지 않는다. 적합한 벡터는 플라스미드, 또는 바이러스 벡터(예를 들어, 복제 결함 레트로바이러스, 아데노바이러스, 및 아데노-관련 바이러스)를 포함할 수 있다. 벡터 성분은 일반적으로 하기 중 하나 이상을 포함하지만 이로 제한되지 않는다: 신호 서열, 복제 기점, 하나 이상의 마커 유전자, 인핸서 요소, 프로모터(예를 들어 SV40, CMV, EF-1α), 및 전사 종결 서열. 발현을 위해, 재조합 폴리뉴클레오티드 작제물은, 천연적으로 관련되거나 이종성인 프로모터 영역을 포함하는, 항체 사슬의 코딩 서열에 작동가능하게 연결된 발현 조절 서열을 전형적으로 포함한다. 일부 실시 형태에서, 발현 조절 서열은 진핵 숙주 세포를 형질전환시키거나 형질감염시킬 수 있는 벡터 내의 진핵 프로모터 시스템이다. 일단 벡터가 적절한 숙주 내로 혼입되면, 숙주는 뉴클레오티드 서열의 고수준 발현 및 재조합 항체의 수집 및 정제에 적합한 조건 하에 유지된다.
본 개시내용의 항-TIGIT 항체를 인코딩하는 폴리뉴클레오티드 서열을 포함하는 벡터는 클로닝 또는 유전자 발현을 위해 숙주 세포에 도입될 수 있다. 본 명세서의 벡터 내의 폴리뉴클레오티드 서열을 클로닝하거나 발현하기에 적합한 숙주 세포는 원핵생물 및 진핵생물 세포를 포함한다. 적합한 원핵생물의 비제한적인 예는 진정세균, 예컨대 그램-음성 또는 그램-양성 유기체, 예를 들어, 엔테로박테리아(Enterobacteriaceae), 예컨대 에스케리키아(Escherichia), 예를 들어, E. 콜라이(E. Coli), 엔테로박터(Enterobacter), 에르위니아(Erwinia), 클렙시엘라(Klebsiella), 프로테우스(Proteus), 살모넬라(Salmonella), 예를 들어, 살모넬라 티피무리움(Salmonella typhimurium), 세라티아(Serratia), 예를 들어, 세라티아 마르세센스(Serratia marcescans), 및 시겔라(Shigella)뿐만 아니라 바실러스(Bacilli), 예컨대 B. 서브틸리스(B. subtilis) 및 B. 리체니포르미스(B. Licheniformis),), 슈도모나스(Pseudomonas), 예컨대 P. 아에루기노사(P. aeruginosa), 및 스트렙토마이세스(Streptomyces)를 포함한다. 원핵생물에 대해 부가적으로, 사상 진균 또는 효모와 같은 진핵 미생물은 항-TIGIT 항체-인코딩 벡터에 적합한 클로닝 또는 발현 숙주이다. 비제한적인 예는 사카로마이세스 세레비시아에(Saccharomyces cerevisiae), 스키조사카로마이세스 폼베(Schizosaccharomyces pombe); 클루이베로마이세스(Kluyveromyces) 숙주, 예를 들어, K.락티스(K. lactis), K. 프라질리스(K. fragilis)(ATCC 12,424), K. 불가리쿠스(K. bulgaricus)(ATCC 16,045), K. 위케라미(K. wickeramii)(ATCC 24,178), K. 왈티(K. waltii)(ATCC 56,500), K. 드로소필라룸(K. drosophilarum)(ATCC 36,906), K. 테르모톨레란스(K. Thermotolerans), 및 K. 마르시아누스(K. Marxianus); 야로위아(yarrowia)(EP 402,226); 피키아 파스토리스(Pichia pastoris)(EP 183,070); 칸디다(Candida); 트리코데르마 레세이(Trichoderma reesia)(EP 244,234); 뉴로스포라 크라사(Neurospora crassa); 슈반니오마이세스(Schwanniomyces), 예컨대 슈반니오마이세스 옥시덴탈리스(Schwanniomyces occidentalis); 및 사상 진균, 예를 들어, 뉴로스포라, 페니실리움(Penicillium), 톨리포클라디움(Tolypocladium), 및 아스페르길루스(Aspergillus) 숙주, 예컨대 A. 니둘란스(A. Nidulans) 및 A. 니게르(A. Niger)를 포함한다. 적합한 숙주 세포는 또한 다세포 유기체로부터 유래될 수 있다. 무척추동물 세포의 예는 식물 및 곤충 세포를 포함한다. 스포도프테라 프루기페르다(Spodoptera frugiperda)(유충), 아에데스 아에집티(Aedes aegypti)(모기), 아에데스 알보픽투스(Aedes albopictus)(모기), 드로소필라 멜라노가스터(Drosophila melanogaster)(초파리), 및 봄빅스 모리(Bombyx mori)와 같은 숙주로부터 다수의 바큘로바이러스 균주 및 변이체 및 상응하는 증식 허용(permissive) 곤충 숙주 세포가 식별되었다. 형질감염을 위한 다양한 바이러스 균주, 예를 들어, 아우토그라파 칼리포르니카(Autographa californica) NPV의 L-1 변이체 및 봄빅스 모리 NPV의 Bm-5 균주가 공개적으로 이용가능하며, 그러한 바이러스는 본 발명에 따라 본 명세서의 바이러스로서, 특히 스포도프테라 프루기페르다 세포의 형질감염을 위해 사용될 수 있다. 면, 옥수수, 감자, 대두, 페투니아(petunia), 토마토, 및 담배의 식물 세포 배양물이 또한 숙주로서 이용될 수 있다. 일부 실시 형태에서, 포유류 세포는 면역글로불린 또는 이의 단편을 인코딩하는 뉴클레오티드 세그먼트를 발현하기 위한 숙주 세포로 사용된다. 문헌[Winnacker, From Genes to Clones, (VCH Publishers, NY, 1987)]을 참조한다. 온전한 이종성 단백질을 분비할 수 있는 다수의 적합한 숙주 세포주가 당업계에 개발되어 있으며, CHO 세포주, 다양한 COS 세포주, HeLa 세포, HEK293 세포, L 세포, 및 Sp2/0 및 NS0을 포함하는 비-항체-생성 골수종을 포함한다. 일부 실시 형태에서, 세포는 비-인간이다. 이러한 세포에 대한 발현 벡터는 발현 조절 서열, 예컨대 복제 기점, 프로모터, 인핸서(문헌[Queen et al., Immunol. Rev. 89:49 (1986)]), 및 필요한 가공 정보 부위, 예컨대 리보솜 결합 부위, RNA 스플라이스(splice) 부위, 폴리아데닐화 부위, 및 전사 종결자 서열을 포함할 수 있다. 일부 실시 형태에서, 발현 조절 서열은 내인성 유전자, 사이토메갈로바이러스, SV40, 아데노바이러스, 소 유두종바이러스 등으로부터 유래된 프로모터이다. 문헌[Co et al., J. Immunol. 148:1149 (1992)]을 참조한다.
항-TIGIT 항체 생성을 위한 상기 기재된 발현 또는 클로닝 벡터로 숙주 세포를 형질전환시키고, 프로모터를 유도하거나, 형질전환체를 선택하거나, 원하는 서열을 인코딩하는 유전자를 증폭시키기 위해 적절한 바와 같이 변형된 통상적인 영양 배지 중에 배양한다. 일단 발현되면, 항체는 HPLC 정제, 컬럼 크로마토그래피, 겔 전기영동 등을 포함하는 당업계의 표준 절차에 따라 정제될 수 있다(일반적으로, 문헌[Scopes, Protein Purification (Springer-Verlag, NY, 1982)] 참조).
IV.
치료적 응용
본 개시내용의 항-TIGIT 항체는 암 및 감염성 질환의 치료에서 면역 반응을 향상시키기 위해 사용될 수 있다. 본 개시내용의 항체에 의해 치료가능한 장애는 혈액학적 악성종양, 고형 종양, 메르켈 세포 암종, 요로상피, 두경부 편평 세포, B-세포 림프종, 자궁, 자궁경부, 고환, 위장관(예를 들어, 식도, 위식도 접합부의 암, 구인두, 위, 소장 또는 대장, 결장, 또는 직장), 방광, 골, 골수, 피부, 담낭, 심장, 폐, 침샘, 부신, 갑상선, 신경절, 중추 신경계(CNS), 및 말초 신경계(PNS)의 암, 및 조혈계 및 면역계(예를 들어, 비장 또는 흉선)의 암을 포함하는 암을 제한 없이 포함한다.
본 개시내용은 또한, 예를 들어, 면역원성 종양, 비-면역원성 종양, 휴면성 종양(dormant tumor), 바이러스-유도 암(예를 들어, 상피세포암, 내피세포암, 편평 세포 암종, 및 유두종바이러스), 선암종, 기형암종, 화학-유도 암, 전이, 및 혈관신생을 포함하는 다른 암-관련 질환, 장애, 또는 병태를 치료하거나 예방하는 방법을 제공한다. 특정 실시 형태에서, 종양 또는 암은 결장암, 난소암, 유방암, 흑색종, 폐암, 교모세포종, 또는 백혈병이다. 용어(들) 암-관련 질환, 장애, 및 병태의 사용은 암과 직접적으로 또는 간접적으로 관련된 병태를 광범위하게 지칭하고자 하는 것이며, 예를 들어, 혈관신생 및 전암 병태, 예컨대 이형성을 포함한다. 소정 실시 형태에서, 암은 전이성이거나 전이성이 될 위험이 있을 수 있거나, 혈액 또는 골수의 암(예를 들어, 백혈병)을 포함하여, 미만성 조직(diffuse tissue)에서 발생할 수 있다.
그러한 암은 TIGIT 또는 CD155를 발현하거나 발현하지 않을 수 있다. CD155와의 TIGIT 상호작용의 억제는 그러한 암에 대한 면역 반응을 자극하기 때문에 TIGIT에 대한 항체는 TIGIT를 발현하지 않는 암에 대해 효과적이다. 혈액학적 악성종양의 예는 급성 골수성 백혈병, 성인 T-세포 백혈병, T 세포 거대 과립 림프구 백혈병, 급성 림프모구성 백혈병, 만성 림프구성 백혈병, 만성 골수원성 백혈병, 급성 단핵구성 백혈병, 호지킨 및 비-호지킨 림프종, 및 다발성 골수종을 포함하는 백혈병, 림프종, 및 골수종을 포함한다. 고형 종양의 예는 난소암, 자궁내막암, 유방암, 폐암(소세포 또는 비-소세포), 결장암, 전립선암, 자궁경부암, 췌장암, 위암, 식도암, 간세포 암종(간암), 신세포 암종(신장암), 두경부 종양, 중피종, 흑색종, 육종, 및 뇌종양(예를 들어, 신경교종, 예컨대 교모세포종)을 제한 없이 포함한다.
본 개시내용의 방법은 애쥬번트 환경에서 실시될 수 있다. "애쥬번트 환경"은 대상체가 증식성 질환, 특히 암의 이력을 가지며, 일반적으로(그러나 필수적이지는 않음) 수술, 방사선요법, 및/또는 화학요법을 포함하지만 이로 제한되지 않는 요법에 대해 반응성이었던 임상 환경을 지칭한다. 그러나, 증식성 질환의 이력 때문에, 이러한 대상체는 그 질환이 발생할 위험이 있는 것으로 간주된다. "애쥬번트 환경"에서의 치료 또는 투여는 후속 치료 모드를 지칭한다. 일부 실시 형태에서 본 명세서에는, 암을 치료하거나 암의 예방을 달성하기 위한 방법으로서, 암을 갖거나 암의 위험이 있는 대상체에게 본 명세서에 개시된 항체 중 임의의 것의 치료적 유효량을 애쥬번트 환경에서 투여하는 단계를 포함하는, 방법이 제공된다.
본 명세서에 제공된 방법은 또한 "네오애쥬번트 환경"에서 실시될 수 있으며, 즉, 본 방법은 1차/최종 요법 전에 실행될 수 있다. 일부 태양에서, 대상체는 이전에 치료된 적이 있다. 다른 태양에서, 대상체는 이전에 치료된 적이 없다. 일부 태양에서, 치료는 제1 요법 라인이다. 일부 실시 형태에서 본 명세서에는, 암을 치료하거나 암의 예방을 달성하기 위한 방법으로서, 암을 갖거나 암의 위험이 있는 대상체에게 본 명세서에 개시된 항체 중 임의의 것의 치료적 유효량을 네오애쥬번트 환경에서 투여하는 단계를 포함하는, 방법이 제공된다.
본 개시내용의 항체에 의해 치료가능한 다른 장애는 바이러스, 박테리아, 진균, 원충, 및 다른 병원체(예를 들어, 간염(A, B, 또는 C), 헤르페스 바이러스(예를 들어, VZV, HSV-1, HAV-6, HSV-II, 및 CMV, 엡스타인 바 바이러스), 아데노바이러스, 인플루엔자 바이러스, 플라비바이러스, 에코바이러스, 리노바이러스, 콕사키 바이러스, 코르노바이러스, 호흡기 세포융합 바이러스, 이하선염 바이러스, 로타바이러스, 홍역 바이러스, 풍진 바이러스, 파르보바이러스, 우두 바이러스, HTLV 바이러스, 뎅기 바이러스, 유두종바이러스, 연속종 바이러스, 폴리오바이러스, 광견병 바이러스, JC 바이러스, HIV, SIV, 및 아르보바이러스 뇌염 바이러스, 클라미디아, 리케치아 박테리아, 마이코박테리아, 스타필로코키, 트렙토키, 뉴모노코키, 메닝고코키 및 코노코키, 클렙시엘라, 프로테우스, 세라티아, 슈도모나스, 레지오넬라, 디프테리아, 살모넬라, 바실리, 콜레라, 파상풍, 보툴리눔 식중독, 탄저병, 페스트, 렙토스피라증, 및 라임병 박테리아의 감염성 질환을 포함한다.
A.
항체의 투여
본 명세서에 기재된 항체는 발병을 지연시키고/시키거나, 중증도를 감소시키고/시키거나, 추가의 악화를 억제하고/하거나, 장애의 하나 이상의 징후 또는 증상을 개선하는 투여량, 투여 경로, 및 투여 빈도를 의미하는 효과적인 요법으로 투여된다. 대상체가 이미 장애를 앓고 있는 경우, 요법은 치료적으로 효과적인 요법으로 지칭될 수 있다. 대상체가 일반 집단에 비해 장애의 위험이 높지만 아직 증상을 경험하지 않는 경우, 요법은 예방적으로 효과적인 요법으로 지칭될 수 있다. 일부 경우에, 치료적 또는 예방적 효능은 동일한 대상체에서 과거 대조군 또는 과거 경험과 비교하여 개별 대상체에서 관찰될 수 있다. 다른 경우에, 치료적 또는 예방적 효능은 치료되지 않은 대상체의 대조군 집단과 비교하여 치료된 대상체의 집단에서의 전임상 또는 임상 시험에서 입증될 수 있다.
일부 경우에, 대상체는 PD-L1 양성, CD155 양성, TIGIT 양성, MSI 높음, 침윤 T 세포를 가짐, 활성화된 T 세포를 가짐, 높은 수준의 항원 처리 및 제시와 관련된 분자를 가짐, TMB 높음, 또는 이들의 임의의 조합으로서 식별된다. 일부 실시 형태에서 환자는, 대조군 집단에 비해, 예를 들어, CD8+ 세포 및/또는 CD4+ 세포 및/또는 NK 세포 상의 TIGIT의 높은 발현에 기초하여, 본 명세서에 기재된 항체를 이용한 치료에 대해 선택된다. 일부 경우에, 대상체는 종양유전자 유도 암을 갖는 것으로 식별되며, TP53, VHL, KRAS, BRAF, MET, FUBP1, RAC1, EGFR, CDK4, CTCF, PGR, RET, RASA1, JAK1, PHF6, NF1, CIC, ARID1A, ZFHX3, ZCCHC12, GNA11, SMAD4, USP9X, CDKN2A, FAT1, PIK3R1, SCAF4, PMS2, RNF43, SMC1A, BCOR, FGFR2, COL5A1, ATM, KMT2B, CTNNB1, MYC, RAD21, PTEN, AXL, HIF1A, EPAS1, PAK4, RHOB, TBL1XR1, KEAP1, ZFP36L2, FGFR3, FOXA1, FLT3, TRAF3, RNF111, PPP2R1A, TXNIP, STAG2, RIT1, TGIF1, FOXQ1, ATR, CYSLTR2, PCBP1, PIK3R2, ASXL1, HIST1H1C, KLF5, PIK3CB, SPOP, MECOM, CACNA1A, CTNND1, DACH1, XPO1, ZNF750, FBXW7, MUC6, KDM6A, GATA3, ZBTB20, PIK3CA, RB1, SOX17, SMARCA4, KIT, CHD8, CHD4, 및 APOB로 이루어진 군으로부터 선택된 하나 이상의 유전자 내에 돌연변이를 갖는다.
일부 태양에서, 본 명세서에 기재된 방법 중 임의의 것은 본 명세서에 기재된 항-TIGIT 항체 중 하나 이상의 치료적 유효량을 이를 필요로 하는 대상체에게 투여하는 단계를 포함한다. 본 명세서에 사용되는 바와 같이, 항암 요법(예컨대, 본 명세서에 기재된 항-TIGIT 항체 중 임의의 것)의 "치료적 유효량" 또는 "치료적 유효 투여량"은 유익하거나 원하는 결과를 달성하기에 충분한 양이다. 치료적 용도를 위해, 유익하거나 원하는 결과는 암으로부터 유발되는 하나 이상의 증상을 감소시키는 것, 암을 앓고 있는 대상체의 삶의 질을 증가시키는 것, 암을 치료하기 위해 필요한 다른 약물의 용량을 감소시키는 것, 예컨대 표적화를 통해 다른 약물의 효과를 향상시키는 것, 질환의 진행을 지연시키는 것, 및/또는 생존을 연장하는 것과 같은 임상 결과를 포함하지만 이로 제한되지 않는다. 유효 투여량은 1회 이상의 투여로 투여될 수 있다. 본 개시내용의 목적을 위해, 항암 요법의 유효 투여량은 직접적으로 또는 간접적으로 치료적 또는 예방적 치료를 달성하기에 충분한 양이다. 임상적 맥락에서 이해되는 바와 같이, 항암 요법의 치료적 유효 투여량은 다른 항암 요법과 함께 달성되거나 달성되지 않을 수 있다.
본 명세서에 기재된 항체 중 임의의 것에 대한 예시적인 투여량은 고정 투여량으로서 약 0.1 내지 20 mg/㎏ 또는 0.5 내지 5 mg/㎏ 체중(예를 들어, 약 0.5 mg/㎏, 1 mg/㎏, 2 mg/㎏, 3 mg/㎏, 4 mg/㎏, 5 mg/㎏, 6 mg/㎏, 7 mg/㎏, 8 mg/㎏, 9 mg/㎏, 10 mg/㎏, 11 mg/㎏, 12 mg/㎏, 13 mg/㎏, 14 mg/㎏, 15 mg/㎏, 16 mg/㎏, 17 mg/㎏, 18 mg/㎏, 19 mg/㎏, 또는 20 mg/㎏) 또는 10 내지 1600 mg(예컨대 10 mg, 20 mg, 30 mg, 40 mg, 50 mg, 60 mg, 70 mg, 80 mg, 90 mg, 100 mg, 150 mg, 200 mg, 250 mg, 300 mg, 350 mg, 400 mg, 450 mg, 500 mg, 550 mg, 600 mg, 650 mg, 700 mg, 750 mg, 800 mg, 850 mg, 900 mg, 950 mg, 1000 mg, 1100 mg, 1200 mg, 1300 mg, 1400 mg, 1500 mg 미만, 또는 1600 mg 이상 중 임의의 것, 이러한 숫자들 사이의 값을 포함함)이다. 일 실시 형태에서, 본 명세서에 기재된 항체는 3 주마다 약 300 내지 1500 mg의 양으로 주어진다. 다른 실시 형태에서, 본 명세서에 기재된 항체는 4 주마다 약 300 내지 1800 mg의 양으로 주어진다. 투여량은, 다른 요인들 중에서도, 대상체의 병태 및 이전 치료에 대한 반응(존재하는 경우), 치료가 예방적인지 또는 치료적인지의 여부, 및 장애가 급성인지 또는 만성인지의 여부에 따라 달라진다.
투여는 비경구, 정맥내, 경구, 피하, 동맥내, 두개내, 척추강내, 복강내, 종양내, 국소, 비강내, 또는 근육내일 수 있다. 일부 실시 형태에서, 전신 순환 내로의 투여는 정맥내 또는 피하 투여에 의한 것이다. 정맥내 투여는, 예를 들어, 30 내지 90분과 같은 기간에 걸친 주입(infusion)에 의해 이루어질 수 있다.
투여 빈도는 다른 요인들 중에서도 순환 중의 항체의 반감기, 대상체의 병태, 및 투여 경로에 따라 달라진다. 빈도는 매일, 매주, 매월, 매분기, 또는 대상체의 병태의 변화 또는 치료되는 장애의 진행에 반응하여 불규칙적인 간격일 수 있다. 일 실시 형태에서, 빈도는 2-주 주기일 수 있다. 다른 실시 형태에서, 빈도는 3-주 주기일 수 있다. 다른 실시 형태에서, 빈도는 4-주 주기이다. 다른 실시 형태에서, 빈도는 6-주 주기이다. 정맥내 투여에 대한 예시적인 빈도는 치료의 지속적인 원인에 대해 매주 및 분기마다이지만, 다소 빈번한 투여도 가능하다. 피하 투여의 경우, 예시적인 투여 빈도는 매일 내지 매달이지만, 다소 빈번한 투여도 가능하다.
투여량의 투여 횟수는 장애가 급성인지 또는 만성인지의 여부 및 치료에 대한 장애의 반응에 따라 좌우된다. 급성 장애 또는 만성 장애의 급성 악화의 경우, 1 내지 10회의 용량이 종종 충분하다. 때때로, 선택적으로 분할된 형태의, 단일 볼루스 용량이 급성 장애 또는 만성 장애의 급성 악화에 충분하다. 치료는 급성 장애 또는 급성 악화의 재발에 대해 반복될 수 있다. 만성 장애의 경우, 항체는 1, 5, 또는 10 년 이상 동안, 또는 환자의 생애 동안 규칙적인 간격으로, 예를 들어, 매주, 격주, 매월, 매분기, 6 개월마다 투여될 수 있다.
항-TIGIT 항체를 포함하는 치료는, 암을 갖는 대상체의 중위 무진행 생존 또는 전체 생존 시간을 대조군 대상체에 비교하여 약 30%, 31%, 32%, 33%, 34%, 35%, 36%, 37%, 38%, 39%, 40%, 41%, 42%, 43%, 44%, 45%, 46%, 47%, 48%, 49%, 50%, 51%, 52%, 53%, 54%, 55%, 56%, 57%, 58%, 59%, 60%, 61%, 62%, 63%, 64%, 65%, 66%, 67%, 68%, 69%, 70%, 71%, 72%, 73%, 74%, 75%, 76%, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 또는 심지어 100% 이상만큼 증가시킴으로써, 또는 이러한 시간 중 어느 하나를 2 주, 1, 2, 또는 3 개월만큼, 또는 4 또는 6 개월 또는 심지어 9 개월 또는 1 년만큼 증가시킴으로써, 질환을 완화할 수 있다. 부가적으로 또는 대안적으로, 항-TIGIT 항체를 포함하는 치료는, 대상체의 완전 반응률, 부분 반응률, 또는 객관적 반응률(완전+부분)을 대조군 대상체에 비교하여 약 30%, 31%, 32%, 33%, 34%, 35%, 36%, 37%, 38%, 39%, 40%, 41%, 42%, 43%, 44%, 45%, 46%, 47%, 48%, 49%, 50%, 51%, 52%, 53%, 54%, 55%, 56%, 57%, 58%, 59%, 60%, 61%, 62%, 63%, 64%, 65%, 66%, 67%, 68%, 69%, 70%, 71%, 72%, 73%, 74%, 75%, 76%, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 또는 심지어 100% 이상만큼 증가시킬 수 있다. 대조군 대상체는 항-TIGIT 항체를 제외하고는 항-TIGIT 항체를 받는 대상체와 동일한 치료를 받는다. 따라서, 대조군 대상체는 위약 단독 또는 항-TIGIT 항체 이외의 일부 화학치료제와 위약의 조합을 받을 수 있다(항-TIGIT 항체를 받는 대상체가 또한 그러한 것을 받는 경우).
본 명세서에 개시된 항-TIGIT 항체는 CD155-발현 세포(비제한적인 예를 들어, K562 세포)의 NK 세포-매개 세포독성을, 본 명세서에 개시된 항-TIGIT 항체 중 하나의 부재 하의 CD155-발현 세포의 NK 세포-매개 세포독성의 양에 비해, 약 10%, 11%, 12%, 13%, 14%, 15%, 16%, 17%, 18%, 19%, 20%, 21%, 22%, 23%, 24%, 25% 26% 27%, 28%, 29%, 30%, 31%, 32%, 33%, 34%, 35% 이상 중 임의의 것만큼 향상시킬 수 있다.
전형적으로, 임상 시험(예를 들어, II 상, II/III 상, 또는 III 상 시험)에서, 항-TIGIT 항체로 치료된 대상체의 중위 무진행 생존 및/또는 반응률의 증가는, 대조군의 대상체에 비해, 예를 들어, p=0.05 또는 0.01 또는 심지어 0.001 수준에서 통계적으로 유의하다. 완전 및 부분 반응률은, 예를 들어, 국립 암 연구소 및/또는 식품 의약청에 의해 열거되거나 인정되는 바와 같고, 예를 들어, 특히 종양 부피, 종양의 수, 전이, 생존 시간, 및 삶의 질 척도를 포함할 수 있는, 암에 대한 임상 시험에 일반적으로 사용되는 객관적 기준에 의해 결정된다.
비경구 투여용 약제학적 조성물은 멸균되고 실질적으로 등장성이며 GMP 조건 하에서 제조될 수 있다. 약제학적 조성물은 단위 투여형(즉, 단일 투여를 위한 투여량)으로 제공될 수 있다. 약제학적 조성물은 하나 이상의 생리학적으로 허용가능한 담체, 희석제, 부형제, 또는 보조제를 사용하여 제형화될 수 있다. 제형은 선택된 투여 경로에 따라 다르다. 주사의 경우, 항체는 수용액 중에, 예컨대 생리학적으로 상용성인 완충제, 예컨대 행크 용액(Hank's solution), 링거 용액(Ringer's solution), 또는 생리 식염수 또는 아세테이트 완충액 중에 제형화될 수 있다(주사 부위의 불편함을 감소시키기 위함). 용액은 현탁제, 안정화제 및/또는 분산제와 같은 제형화제를 함유할 수 있다. 대안적으로, 항체는 사용 전에 적합한 비히클, 예를 들어, 멸균 무-발열원(pyrogen-free) 물을 이용하여 구성하기 위한 동결 건조된 형태일 수 있다. 액체 제형 중의 항체의 농도는, 예를 들어, 약 10 내지 150 mg/ml로 변동될 수 있다. 일부 제형에서, 농도는 약 20 내지 80 mg/ml이다.
B.
조합 요법
본 개시내용은 단독으로 또는 하나 이상의 활성 치료제와 조합된 항-TIGIT 항체의 용도를 고려한다. 추가의 활성 치료제는 화학적 소분자; 단백질, 항체, 펩티바디, 펩티드, DNA, RNA와 같은 거대분자, 또는 그러한 거대분자의 단편; 또는 세포 또는 유전자 요법일 수 있다. 조합 요법은 상이하지만 상보적인 작용 기전을 표적화할 수 있으며, 이에 의해 기저 질환, 장애, 또는 병태에 대한 상승적인 치료적 또는 예방적 효과를 갖는다. 부가적으로 또는 대안적으로, 조합 요법은 제제 중 하나 이상의 용량 감소를 허용함으로써, 제제 중 하나 이상과 관련된 유해 효과를 개선하거나, 감소시키거나, 제거할 수 있다.
그러한 조합 요법에서 활성 치료제는 단일 조성물로서 또는 별도의 조성물로서 제형화될 수 있다. 별도로 투여되는 경우, 조합 내의 각각의 치료제는 동일한 시간 또는 그 부근에, 또는 다른 시간에 주어질 수 있다. 추가로, 환자의 요법 경로 중에 치료제는 이들이 상이한 투여 형태를 갖더라도(예를 들어, 경구 캡슐 및 정맥내) "조합되어" 투여되거나, 상이한 투여 간격으로 이들이 주어지거나, 하나의 치료제는 일정한 투여 계획으로 주어지는 반면에 다른 것은 상향 적정(titrated up)되거나, 하향 적정(titrated down)되거나, 중단되거나, 조합 내의 각각의 치료제가 독립적으로 상향 적정되거나, 하향 적정되거나, 용량이 증가 또는 감소되거나, 중단 및/또는 재개된다. 조합이 별도의 조성물로서 제형화되는 경우, 일부 실시 형태에서, 별도의 조성물은 키트 내에 함께 제공된다.
소정 실시 형태에서, 본 명세서에 개시된 항-TIGIT 항체 중 임의의 것은 추가의 활성 치료제 중 하나 이상에 대해 순차적으로 투여되거나 적용되며, 예를 들어, 여기서 추가의 활성 치료제 중 하나 이상은 본 개시내용에 따른 항-TIGIT 항체의 투여 전 또는 후에 투여된다. 다른 실시 형태에서, 항체는 추가의 활성 치료제 중 하나 이상과 동시에 투여되며, 예를 들어, 여기서 항-TIGIT 항체는 추가의 치료제 중 하나 이상과 동일한 시간 또는 그 부근에 투여되고; 항-TIGIT 항체 및 추가의 치료제 중 하나 이상은 2개 이상의 별도의 제형 내에 존재하거나 단일 제형 내로 조합될 수 있다(즉, 공동-제형). 추가의 제제(들)가 항-TIGIT 항체와 동시에 또는 순차적으로 투여되는지 여부에 무관하게, 이들은 본 개시내용의 목적을 위해 조합되어 투여되는 것으로 간주된다.
본 개시내용의 항체는 상황 하에 적절한 임의의 방식으로 하나 이상의 다른 (활성) 제제와 조합되어 사용될 수 있다. 일 실시 형태에서, 하나 이상의 활성 제제 및 하나 이상의 본 개시내용의 항-TIGIT 항체를 이용한 치료는 소정 기간에 걸쳐 유지된다. 다른 실시 형태에서, 하나 이상의 활성 제제를 이용한 치료는 감소되거나 중단되는 반면에(예를 들어, 대상체가 안정적인 경우), 본 개시내용의 항-TIGIT 항체를 이용한 치료는 일정한 투여 계획으로 유지된다. 추가의 실시 형태에서, 하나 이상의 활성 제제를 이용한 치료는 감소되거나 중단되는 반면에(예를 들어, 대상체가 안정적인 경우), 본 개시내용의 항-TIGIT 항체를 이용한 치료는 감소된다(예를 들어, 더 낮은 용량, 덜 빈번한 투여, 또는 더 짧은 치료 계획). 또 다른 실시 형태에서, 하나 이상의 활성 제제를 이용한 치료는 감소되거나 중단되고(예를 들어, 대상체가 안정적인 경우), 본 개시내용의 항-TIGIT 항체를 이용한 치료는 증가된다(예를 들어, 더 높은 용량, 더 빈번한 투여, 또는 더 긴 치료 계획). 또 다른 실시 형태에서, 하나 이상의 활성 제제를 이용한 치료는 유지되고 본 개시내용의 항-TIGIT 항체를 이용한 치료는 감소되거나 중단된다(예를 들어, 더 낮은 용량, 덜 빈번한 투여, 또는 더 짧은 치료 계획). 또 다른 실시 형태에서, 하나 이상의 활성 제제를 이용한 치료 및 본 개시내용의 항-TIGIT 항체를 이용한 치료는 감소되거나 중단된다(예를 들어, 더 낮은 용량, 덜 빈번한 투여, 또는 더 짧은 치료 계획).
본 개시내용의 항체를 이용한 치료는 치료되는 장애에 대해 효과적인 다른 치료와 조합될 수 있다. 증식성 병태, 암, 종양, 또는 전암 질환, 장애, 또는 병태의 치료에 사용되는 경우, 본 개시내용의 항체는 화학요법, 방사선(예를 들어, 국소 방사선 요법 또는 전신 방사선 요법), 줄기 세포 치료, 수술, 또는 다른 생물제제를 이용한 치료와 조합될 수 있다.
본 개시내용의 항체는 암에 대한 면역 반응을 유발하는 백신과 함께 투여될 수 있다. 그러한 면역 반응은 본 개시내용의 항체에 의해 향상된다. 백신은, 임의로 담체 분자에 연결된, 면역 반응을 유도하기에 효과적인 암성 세포 및/또는 종양의 표면 상에 발현된 항원 또는 이의 단편을 포함할 수 있다.
일부 실시 형태에서, 추가의 치료제 중 하나 이상은 면역조절제이다. 본 개시내용에 사용될 수 있는 적합한 면역조절제는 CD40L, B7, 및 B7RP1; 자극성 수용체에 대한 활성화 단일클론 항체(mAb), 예컨대 항-CD40, 항-CD38, 항-ICOS, 및 4-IBB 리간드; 수지상 세포 항원 로딩(시험관내 또는 생체내); 항암 백신, 예컨대 수지상 세포 암 백신; 사이토카인/케모카인, 예컨대 IL1, IL2, IL12, IL18, ELC/CCL19, SLC/CCL21, MCP-1, IL-4, IL-18, TNF, IL-15, MDC, IFN®/β, M-CSF, IL-3, GM-CSF, IL-13, 및 항-IL-10; 박테리아 지질다당류(LPS); 인돌아민 2,3-다이옥시게나제 1(IDO1) 억제제 및 면역-자극성 올리고뉴클레오티드를 포함한다.
소정 실시 형태에서, 본 개시내용은 종양 성장의 억제를 위한 방법으로서, 종양 성장의 상가적 또는 상승적 억제를 달성하기 위해 신호 전달 억제제(STI)와 조합된 본 명세서에 기재된 항-TIGIT 항체를 투여하는 단계를 포함하는, 방법을 제공한다. 본 명세서에 사용되는 바와 같이, 용어 "신호 전달 억제제"는 신호전달 경로에서 하나 이상의 단계를 선택적으로 억제하는 제제를 지칭한다. 본 개시내용에 의해 고려되는 신호 전달 억제제(STI)는 하기를 포함한다: (i) bcr/abl 키나제 억제제(예를 들어, 이마티닙 메실레이트, GLEEVEC®); (ii) 표피 성장 인자(EGF) 수용체 억제제, 예를 들어 키나제 억제제(예를 들어, 게피티닙, 에를로티닙, 아파티닙, 및 오시메르티닙) 및 항체; (iii) her-2/neu 수용체 억제제(예를 들어, HERCEPTIN®); (iv) Akt 패밀리 키나제 또는 Akt 경로의 억제제(예를 들어, 라파마이신); (v) 세포 주기 키나제 억제제(예를 들어, 플라보피리돌); 및 (vi) 포스파티딜 이노시톨 키나제 억제제. 면역조절에 관여하는 제제는 또한 암 환자에서 종양 성장의 억제를 위해 본 명세서에 기재된 항-TIGIT 항체와 조합되어 사용될 수 있다.
일부 실시 형태에서, 추가의 치료제 중 하나 이상은 화학치료제이다. 화학치료제의 예는 알킬화제, 예컨대 티오테파 및 사이클로포스파미드; 부설판(busulfan), 임프로설판(improsulfan) 및 피포설판(piposulfan)과 같은 알킬 설포네이트류; 벤조도파(benzodopa), 카르보퀀(carboquone), 메투레도파(meturedopa) 및 우레도파(uredopa)와 같은 아지리딘류; 알트레타민, 트라이에틸렌멜라민, 트라이에틸렌포스포르아미드, 트라이에틸렌티오포스포르아미드, 및 트라이메틸올로멜라민을 포함하는 에틸렌이민 및 메틸라멜라민; 질소 머스타드, 예컨대 클로람부실, 클로르나파진, 콜로포스파미드, 에스트라무스틴, 이포스파미드, 메클로레타민, 메클로레타민 옥사이드 하이드로클로라이드, 멜팔란, 노벰비킨, 페네스테린, 프레드니무스틴, 트로포스파미드, 우라실 머스타드; 카르무스틴(carmustine), 클로로조토신(chlorozotocin), 포테무스틴(fotemustine), 로무스틴(lomustine), 니무스틴(nimustine), 라니무스틴(ranimustine)과 같은 니트로소우레아류; 항생제, 예컨대 아클라시노마이신, 악티노마이신, 아우트라마이신, 아자세린, 블레오마이신, 칵티노마이신, 칼리키아마이신, 카라비신, 카미노마이신, 카르지노필린, 크로모마이신, 닥티노마이신, 다우노루비신, 데토루비신, 6-다이아조-5-옥소-L-노르류신, 독소루비신, 에피루비신, 에소루비신, 이다루비신, 마르셀로마이신, 미토마이신, 마이코페놀산, 노갈라마이신, 올리보마이신, 페플로마이신, 포말리도미드 포트피로마이신, 퓨로마이신, 쿠엘라마이신, 로도루비신, 스트렙토니그린, 스트렙토조신, 투베르시딘, 우베니멕스, 지노스타틴, 조루비신; 항대사물질, 예컨대 메토트렉세이트 및 5-플루오로우라실(5-FU); 데노프테린, 메토트렉세이트, 프테로프테린, 트리메트렉세이트와 같은 엽산 유사체; 퓨린 유사체, 예컨대 플루다라빈, 6-메르캅토퓨린, 티아미프린, 티오구아닌; 피리미딘 유사체, 예컨대 안시타빈, 아자시티딘, 6-아자우리딘, 카르모푸르, 사이타라빈, 다이데옥시우리딘, 독시플루리딘, 에노시타빈, 플록수리딘, 5-FU; 안드로겐, 예컨대 칼루스테론, 드로모스타놀론 프로피오네이트, 에피티오스타놀, 메피티오스탄, 테스토락톤; 항아드레날, 예컨대 아미노글루테티미드, 미토탄, 트릴로스탄; 폴린산과 같은 엽산 보충제; 아세글라톤(aceglatone); 알도포스파미드 글리코시드(aldophosphamide glycoside); 아미노레불린산(aminolevulinic acid); 암사크린(amsacrine); 베스트라부실(bestrabucil); 비산트렌(bisantrene); 에다트락세이트(edatraxate); 데포파민(defofamine); 데메콜신(demecolcine); 디아지퀀(diaziquone); 엘포르미틴(elformithine); 엘립티늄 아세테이트(elliptinium acetate); 에토글루시드(etoglucid); 갈륨 니트레이트; 히드록시우레아; 렌티난(lentinan); 로니다민(lonidamine); 미토구아존(mitoguazone); 미톡산트론; 모피다몰(mopidamol); 니트라크린(nitracrine); 펜토스타틴(pentostatin); 페나메트(phenamet); 피라루비신(pirarubicin); 포도필린산(podophyllinic acid); 2-에틸하이드라지드; 프로카르바진(procarbazine); 라족산; 시조피란(sizofiran); 스피로게르마늄; 테누아존산(tenuazonic acid); 트리아지쿠온; 2,2',2''-트라이클로로트라이에틸아민; 우레탄; 빈데신(vindesine); 다카르바진(dacarbazine); 만노무스틴(mannomustine); 미토브로니톨(mitobronitol); 미토락톨(mitolactol); 피포브로만(pipobroman); 가시토신(gacytosine); 아라비노사이드(Ara-C); 시클로포스파미드; 티오테파; 탁소이드, 예를 들어, 파클리탁셀, nab-파클리탁셀, 및 도세탁셀; 클로람부실; 젬시타빈(gemcitabine); 6-티오구아닌; 메르캅토퓨린; 메토트렉세이트; 백금 및 백금 배위 착물, 예컨대 시스플라틴, 카르보플라틴, 및 옥살리플라틴; 빈블라스틴(vinblastine); 에토포시드(etoposide)(VP-16); 이포스파미드; 미토마이신 C; 미톡산트론; 빈크리스틴(vincristine); 비노렐빈(vinorelbine); 나벨빈(navelbine); 노반트론(novantrone); 테니포시드(teniposide); 다우노마이신(daunomycin); 아미노프테린(aminopterin); 젤로다(xeloda); 이반드로네이트(ibandronate); CPT11; 토포아이소머라제 억제제; 다이플루오로메틸오르니틴(DMFO); 레티노산; 에스페라마이신(esperamicin); 카페시타빈; 안트라사이클린; 및 상기 중 임의의 것의 약제학적으로 허용가능한 염, 산, 또는 유도체를 포함하지만 이로 제한되지 않는다.
화학치료제는 또한, 예를 들어 타목시펜, 랄록시펜, 아로마타제 억제 4(5)-이미다졸, 4-하이드록시타목시펜, 트리옥시펜, 케옥시펜, 오나프리스톤, 및 토레미펜을 포함하는 항-에스트로겐; 및 아비라테론, 엔잘루타미드, 아팔루타미드, 다롤루타미드, 플루타미드, 닐루타미드, 비칼루타미드, 류프롤라이드, 및 고세렐린과 같은 항안드로겐과 같은, 종양에 대한 호르몬 작용을 조절하거나 억제하도록 작용하는 항-호르몬제; 및 상기 중 임의의 것의 약제학적으로 허용가능한 염, 산, 또는 유도체를 포함한다. 소정 실시 형태에서, 조합 요법은 하나 이상의 화학치료제를 포함하는 화학요법 계획을 포함한다. 소정 실시 형태에서, 조합 요법은 호르몬 또는 관련 호르몬제의 투여를 포함한다.
항-TIGIT 항체와 조합되어 사용될 수 있는 추가의 치료 양식은 방사선요법, 종양 항원에 대한 항체, 항체와 독소의 복합체, T 세포 애쥬번트, 골수 이식, 또는 항원 제시 세포(예를 들어, 수지상 세포 요법)(그러한 항원 제시 세포를 자극하기 위해 사용되는 TLR 작용제를 포함함)를 포함한다.
소정 실시 형태에서, 본 개시내용은 유전자 발현을 침묵시키기 위한 RNA 간섭-기반 요법과 조합된 본 명세서에 기재된 항-TIGIT 항체의 용도를 고려한다. RNAi는 더 긴 이중-가닥 RNA의 작은 간섭 RNA(siRNA)로의 절단으로 시작된다. siRNA의 하나의 가닥은 RNA-유도 침묵화 복합체(RISC)로서 알려진 리보핵산단백질 복합체 내에 혼입되며, 이는 이어서 혼입된 siRNA 가닥에 적어도 부분적으로 상보적인 mRNA 분자를 식별하기 위해 사용된다. RISC는 mRNA에 결합하거나 이를 절단할 수 있으며, 이들 둘 모두는 번역을 억제한다.
소정 실시 형태에서, 본 개시내용은 아데노신의 수준을 조절하는 제제와 조합된 본 명세서에 기재된 항-TIGIT 항체의 용도를 고려한다. 그러한 치료제는 ATP의 아데노신으로의 전환을 촉매하는 엑토뉴클레오티드에 작용할 수 있으며, 이는 ATP를 ADP로, 그리고 ADP를 AMP로 가수분해하는 엑토뉴클레오시드 트라이포스페이트 다이포스포하이드롤라제 1(ENTPD1, CD39 또는 분화 클러스터 39로도 알려짐), 및 AMP를 아데노신으로 전환하는 5'-뉴클레오티다제, 엑토(NT5E 또는 5NT, CD73 또는 분화 클러스터 73으로도 알려짐)를 포함한다. 일 실시 형태에서, 본 개시내용은 WO 2017/120508, WO 2018/094148, 및 WO 2018/067424에 기재된 것들과 같은 CD73 억제제와의 조합을 고려한다. 일 실시 형태에서, CD73 억제제는 AB680이다. 다른 접근법에서는, 아데노신 A2a 및 A2b 수용체가 표적화된다. A2a 및/또는 A2b 수용체의 길항제와의 조합이 또한 고려된다. 일 실시 형태에서, 본 개시내용은 WO/2018/136700 또는 WO 2018/204661에 기재된 아데노신 수용체 길항제와의 조합을 고려한다. 일 실시 형태에서, 아데노신 수용체 길항제는 AB928(에트루마데난트)이다.
소정 실시 형태에서, 본 개시내용은 포스파티딜이노시톨 3-키나제(PI3K), 특히 PI3Kγ 동형의 억제제와 조합된 본 명세서에 기재된 항-TIGIT 항체의 용도를 고려한다. 예컨대 억제성 골수 세포를 억제함으로써, 면역-억제성 종양-침윤 대식세포를 약화시킴으로써, 또는 효과적인 T 세포 반응에 기여하여 감소된 암 발생 및 확산을 유발하는 사이토카인을 제조하도록 대식세포 및 수지상 세포를 자극함으로써, PI3Kγ 억제제는 골수 세포의 조절을 통해 항암 면역 반응을 자극할 수 있다. 본 명세서에 기재된 항-TIGIT 항체와 조합될 수 있는 예시적인 PI3Kγ 억제제는 WO 2020/0247496A1에 기재된 것들을 포함한다. 일 실시 형태에서, PI3Kγ 억제제는 IPI-549이다.
소정 실시 형태에서, 본 개시내용은 아르기나제의 억제제와 조합된 본 명세서에 기재된 항-TIGIT 항체의 용도를 고려하며, 이는 염증-촉발된 면역 기능장애, 종양 면역 탈출, 감염성 질환의 면역억제 및 면역병리를 담당하거나 이에 참여하는 것으로 나타났다. 예시적인 아르기나제 화합물은, 예를 들어, PCT/US2019/020507 및 WO/2020/102646에서 확인할 수 있다.
소정 실시 형태에서, 본 개시내용은 낮은 산소 이용가능성에 대한 세포 반응에서 필수적인 역할을 하는 HIF-2α의 억제제를 갖는 본 개시내용에 따른 항-TIGIT 항체의 용도를 고려한다. 저산소 조건 하에, 저산소증-유도성 인자(HIF) 전사 인자는 대사, 혈관신생, 세포 증식 및 생존, 면역 회피, 및 염증성 반응을 조절하는 유전자의 발현을 활성화시킬 수 있다. HIF-2α 과발현은 다양한 암을 갖는 환자에서 불량한 임상 결과와 관련되었고; 저산소증은 또한 염증성 장 질환 및 류마티스 관절염과 같은 다수의 급성 및 만성 염증성 장애에서 일반적이다.
본 개시내용은 또한 본 명세서에 기재된 항-TIGIT 항체와 하나 이상의 RAS 신호전달 억제제의 조합을 고려한다. RAS 유전자 패밀리, 예를 들어, HRAS, KRAS, 및 NRAS에서의 종양유전자 돌연변이는 다양한 암과 관련된다. 예를 들어, 특히 KRAS 유전자 패밀리에서 G12C, G12D, G12V, G12A, G13D, Q61H, G13C, 및 G12S의 돌연변이가 다수의 종양 유형에서 관찰되었다. 돌연변이체 RAS 신호전달의 억제를 위해 직접 및 간접 억제 전략이 조사되었다. 간접 억제제는 RAS 신호전달 경로에서 RAS 이외의 이펙터를 표적화하며, RAF, MEK, ERK, PI3K, PTEN, SOS(예를 들어, SOS1), mTORC1, SHP2(PTPN11), 및 AKT의 억제제를 포함하지만 이로 제한되지 않는다. 개발 중인 간접 억제제의 비제한적인 예는 RMC-4630, RMC-5845, RMC-6291, RMC-6236, JAB-3068, JAB-3312, TNO155, RLY-1971, BI1701963을 포함한다. RAS 돌연변이체의 직접 억제제가 또한 탐색되었으며, 일반적으로 KRAS-GTP 복합체 또는 KRAS-GDP 복합체를 표적화한다. 개발 중인 예시적인 직접 RAS 억제제는 소토라시브(AMG510), MRTX849, mRNA-5671, 및 ARS1620을 포함하지만 이로 제한되지 않는다. 일부 실시 형태에서, 하나 이상의 RAS 신호전달 억제제는 RAF 억제제, MEK 억제제, ERK 억제제, PI3K 억제제, PTEN 억제제, SOS1 억제제, mTORC1 억제제, SHP2 억제제, 및 AKT 억제제로 이루어진 군으로부터 선택된다. 다른 실시 형태에서, 하나 이상의 RAS 신호전달 억제제는 RAS 돌연변이체를 직접 억제한다.
일부 실시 형태에서, 본 개시내용은 본 개시내용에 따른 항-TIGIT 항체와 하나 이상의 아넥셀렉토(즉, AXL)의 억제제의 조합에 관한 것이다. AXL 신호전달 경로는 종양 성장 및 전이와 관련되며, 다양한 암 요법에 대한 내성을 매개하는 것으로 여겨진다. 개발 중인 다양한 AXL 억제제가 있으며, 이들은 또한 TAM 패밀리 내의 다른 키나제(즉, TYRO3, MERTK)뿐만 아니라, 특히 MET, FLT3, RON, 및 AURORA를 포함하는 다른 수용체 티로신 키나제를 억제한다. 예시적인 멀티키나제 억제제는 길테리티닙, 메레스티닙, 카보잔티닙, BMS777607, 및 포레티닙을 포함한다. AXL 특이적 억제제, 예를 들어, SGI-7079, TP-0903(즉, 두베르마티닙), BGB324(즉, 벰센티닙), 및 DP3975가 또한 개발되어 왔다.
소정 실시 형태에서 본 개시내용은, 항-종양 활성을 갖는 면역 세포가 암 환자에게 투여되는 신규하고 유망한 형태의 개인화된 면역요법인, 입양 세포 요법과 조합된 본 명세서에 기재된 항-TIGIT 항체의 용도를 고려한다. 종양-침윤 림프구(TIL) 및, 예를 들어, 키메라 항원 수용체(CAR) 또는 T 세포 수용체(TCR)를 발현하도록 조작된 T 세포를 사용하여 입양 세포 요법이 탐색되고 있다. 입양 세포 요법은 개체로부터 T 세포를 수집하는 단계, 특이적 항원을 표적화하거나 이들의 항-종양 효과를 향상시키기 위해 이들을 유전적으로 변형시키는 단계, 이들을 충분한 수로 증폭시키는 단계, 및 유전적으로 변형된 T 세포를 암 환자에게 주입하는 단계를 일반적으로 포함한다. T 세포는 확장된 세포가 이후에 재주입되는 환자로부터 수집될 수 있거나(예를 들어, 자가유래), 공여자 환자로부터 수집될 수 있다(예를 들어, 동종이계).
T 세포-매개 면역은 다수의 순차적 단계를 포함하며, 이들 각각은 반응을 최적화하기 위해 자극성 신호와 억제성 신호의 균형을 맞춤으로써 조절된다. 면역 반응에서 거의 모든 억제 신호는 궁극적으로 세포내 신호전달 경로를 조절하지만, 다수는 막 수용체를 통해 개시되며, 이들의 리간드는 막-결합 또는 가용성이다(사이토카인). T 세포 활성화를 조절하는 공동-자극성 및 억제성 수용체 및 리간드는 흔히 정상 조직에 비해 암에서 과발현되지 않지만, 조직에서 T 세포 이펙터 기능을 조절하는 억제성 리간드 및 수용체는 일반적으로 종양 세포 또는 종양 미세환경과 관련된 형질전환되지 않은 세포 상에서 과발현된다. 가용성 및 막-결합 수용체(리간드 면역 체크포인트)의 기능은 작용제 항체(공동-자극성 경로의 경우) 또는 길항제 항체(억제성 경로의 경우)를 사용하여 조절될 수 있다. 따라서, 암 요법에 대해 현재 승인된 대부분의 항체와는 대조적으로, 면역 체크포인트를 차단하거나 효능작용하는 항체는 종양 세포를 직접적으로 표적화하는 것이 아니라, 내인성 항종양 활성을 향상시키기 위해 림프구 수용체 또는 이의 리간드를 표적화한다. [문헌[Pardoll, (April 2012) Nature Rev. Cancer 12:252-64] 참조].
차단을 위한 후보인, 이들 중의 일부는 다양한 유형의 종양 세포에서 선택적으로 상향조절되는, 면역 체크포인트(리간드 및 수용체)의 예는 PD-1(세포 예정사 단백질 1); PD-L1(세포 예정사 1 리간드 1); BTLA(B 및 T 림프구 감쇠물질); CTLA4(세포독성 T-림프구 관련 항원 4); TIM-3(T 세포 면역글로불린 뮤신 단백질 3); LAG-3(림프구 활성화 유전자 3); TIGIT(Ig 및 ITIM 도메인을 갖는 T 세포 면역수용체); 및 살해 억제성 수용체(이는 이들의 구조적 특징에 기초하여 하기 2개의 부류로 나누어질 수 있음: i) 살해 세포 면역글로불린-유사 수용체(KIR), 및 ii) C-유형 렉틴 수용체(유형 II 막관통 수용체 패밀리의 구성원))를 포함한다. 다른 덜 잘 정의된 면역 체크포인트가 문헌에 기재되어 있으며, 이는 수용체(예를 들어, 2B4(CD244로도 알려짐) 수용체) 및 리간드(예를 들어, 소정의 B7 패밀리 억제성 리간드, 예컨대 B7-H3(CD276으로도 알려짐) 및 B7-H4(B7-S1, B7x, 및 VCTN1로도 알려짐)) 둘 모두를 포함한다. [문헌[Pardoll, (April 2012) Nature Rev. Cancer 12:252-64] 참조].
본 개시내용은 전술한 면역-체크포인트 수용체 및 리간드뿐만 아니라, 아직 기재되지 않은 면역-체크포인트 수용체 및 리간드의 억제제와 조합된 본 명세서에 기재된 항-TIGIT 항체의 용도를 고려한다. 면역 체크포인트의 소정의 조절제는 현재 승인되어 있고, 다수의 다른 것들이 개발 중이다. 2011년에 흑색종의 치료에 대해 그것이 승인되었을 때, 완전 인간화 CTLA4 단일클론 항체 이필리무맙(예를 들어, YERVOY®; Bristol Myers Squibb)은 미국에서 규제 승인을 받은 최초의 면역 체크포인트 억제제가 되었다. CTLA4 및 항체(CTLA4-Ig; 아바트셉트(예를 들어, ORENCIA®; Bristol Myers Squibb))를 포함하는 융합 단백질은 류마티스 관절염의 치료에 사용되었고, 다른 융합 단백질은 엡스타인 바 바이러스에 대해 민감화된 신장 이식 환자에서 효과적인 것으로 나타냈다. 규제 승인을 받을 다음 부류의 면역 체크포인트 억제제는 PD-1 및 그의 리간드 PD-L1 및 PD-L2에 대한 것이었다. 승인된 항-PD-1 항체는 편평 세포 암종, 전형적 호지킨 림프종, 및 요로상피 암종을 포함하는 다양한 암에 대한 니볼루맙(예를 들어, OPDIVO®; Bristol Myers Squibb) 및 펨브롤리주맙(예를 들어, KEYTRUDA®; Merck)을 포함한다. 승인된 항-PD-L1 항체는 요로상피 암종을 포함하는 소정의 암에 대한 아벨루맙(예를 들어, BAVENCIO®; EMD Serono & Pfizer), 아테졸리주맙(예를 들어, TECENTRIQ®; Roche/Genentech), 및 두르발루맙(예를 들어, IMFINZI®; AstraZeneca)을 포함한다. 본 명세서에 제공된 일부 조합에서, 면역 체크포인트 억제제는 MEDI-0680 니볼루맙, 펨브롤리주맙, 아벨루맙, 아테졸리주맙, 부디갈리맙, BI-754091, 캄렐리주맙, 코시벨리맙, 두르발루맙, 도스타를리맙, 세미플리맙, 신틸리맙, 티스렐리주맙, 토리팔리맙, 레티판리맙, 사산리맙, 및 짐베렐리맙(AB122)으로부터 선택된다. 일부 실시 형태에서, 면역 체크포인트 억제제는 MEDI-0680(AMP-514; WO2012/145493) 또는 피딜리주맙(CT-011)이다. PD-1 수용체를 표적화하기 위한 다른 접근법은 AMP-224로 불리는, IgGl의 Fc 부분에 융합된 PD-L2(B7-DC)의 세포외 도메인으로 구성된 재조합 단백질이다. 일 실시 형태에서, 본 개시내용은 PD-1 항체를 갖는 본 개시내용에 따른 항-TIGIT 항체의 용도를 고려한다. 일 특정 실시 형태에서, PD-1 억제제는 짐베렐리맙이다. 일부 실시 형태에서, 항-TIGIT 항체는 3 주마다 약 200 내지 1500 mg의 양으로 제공되고, 항-PD-1 항체는 3 주마다 약 100 내지 1200 mg의 양으로 제공된다. 다른 실시 형태에서, 본 명세서에 기재된 항-TIGIT 항체는 4 주마다 약 300 내지 1800 mg의 양으로 주어지고, 항-PD-1 항체는 4 주마다 약 200 내지 1500 mg의 양으로 제공된다. 또 다른 실시 형태에서, 항-PD-1 항체는 짐베렐리맙이고 3 주 또는 4 주마다 약 360 mg 또는 480 mg의 양으로 제공된다.
다른 태양에서 본 개시내용은, 면역 반응을 자극하기 위해, T 세포 활성화를 억제하는 사이토카인(예를 들어, IL-6, IL-10, TGF-B, VEGF, 및 다른 면역억제성 사이토카인) 또는 T 세포 활성화를 자극하는 사이토카인과의 조합을 고려한다.
또 다른 태양에서, T 세포 반응은 개시된 항-TIGIT 항체 및 (i) T 세포 활성화를 억제하는 단백질, 예컨대 CTLA-4, PD-1, PD-L1, PD-L2, LAG-3, TIM-3, PVRIG, 갈렉틴 9, CEACAM-1, BTLA, CD69, 갈렉틴-1, CD113, GPR56, VISTA, 2B4, CD48, GARP, PD1H, LAIR1, TIM-1, 및 TIM-4의 길항제(예를 들어, 면역 체크포인트 억제제), 및/또는 (ii) T 세포 활성화를 자극하는 단백질, 예컨대 B7-1, B7-2, CD28, 4-1BB(CD137), 4-1BBL, ICOS, ICOS-L, OX40, OX40L, GITR, GITRL, CD70, CD27, CD40, DR3, 및 CD2의 작용제 중 하나 이상의 조합에 의해 자극될 수 있다. 암의 치료를 위해 본 개시내용의 항-TIGIT 항체와 조합될 수 있는 다른 제제는 NK 세포 상의 억제성 수용체의 길항제 또는 NK 세포 상의 활성화 수용체의 작용제를 포함한다. 예를 들어, 본 명세서에 기재된 항-TIGIT 항체는 리릴루맙과 같은 KIR의 길항제와 조합될 수 있다.
조합 요법을 위한 또 다른 제제는, RG7155(WO11/70024, WO11/107553, W)11/131407, WO13/87699, WO13/119716, WO13/132044) 또는 FPA-008(WO11/140249; WO13169264; WO14/036357)을 포함하는 CSF-1R 길항제 항체와 같은 CSF-1R 길항제를 포함하지만 이로 제한되지 않는, 대식세포 또는 단핵구를 억제하거나 고갈시키는 제제를 포함한다.
다른 태양에서, 개시된 항-TIGIT 항체는 하기 중 하나 이상과 조합될 수 있다: 양성 공동자극성 수용체를 라이게이션하는 효능작용성 제제, 억제성 수용체, 길항제, 및 항-종양 T 세포의 빈도를 전신적으로 증가시키는 하나 이상의 제제를 통해 신호전달을 약화시키는 차단제, 종양 미세환경 내에서 별개의 면역 억제성 경로를 극복하는 제제(예를 들어, 억제성 수용체 결합(예를 들어, PD-Ll/PD-1 상호작용)을 차단하거나, Treg를 고갈시키거나 억제하거나(예를 들어, 항-CD25 단일클론 항체(예를 들어, 다클리주맙)를 사용하여, 또는 생체외 항-CD25 비드 고갈에 의해), T 세포 면역성 결핍 또는 소진을 역전/방지함), 및 종양 부위에서 선천 면역 활성화 및/또는 염증을 촉발하는 제제.
일 태양에서, 면역-종양학 제제는 길항작용성 CTLA-4 항체와 같은 CTLA-4 길항제이다. 적합한 CTLA-4 항체는, 예를 들어, 이필리무맙(예를 들어, YERVOY®; Bristol Myers Squibb) 또는 트레멜리무맙을 포함한다. 다른 태양에서, 면역-종양학 제제는 길항작용성 PD-Ll 항체와 같은 PD-Ll 길항제이다. 적합한 PD-Ll 항체는, 예를 들어, 아테졸리주맙(MPDL3280A; WO2010/077634)(예를 들어, TECENTRIQ®; Roche/Genentech), 두르발루맙(MEDI4736), BMS-936559(WO2007/005874), 및 MSB0010718C(WO2013/79174)를 포함한다. 다른 태양에서, 면역-종양학 제제는 길항작용성 LAG-3 항체와 같은 LAG-3 길항제이다. 적합한 LAG-3 항체는, 예를 들어, BMS-986016(WO10/19570, WO14/08218), 또는 IMP-731 또는 IMP-321(WO08/132601, WO09/44273)을 포함한다. 다른 태양에서, 면역-종양학 제제는 효능작용성 CD137 항체와 같은 CD137(4-1BB) 작용제이다. 적합한 CD137 항체는, 예를 들어, 우렐루맙 및 PF-05082566(WO12/32433)을 포함한다. 다른 태양에서, 면역-종양학 제제는 효능작용성 GITR 항체와 같은 GITR 작용제이다. 적합한 GITR 항체는, 예를 들어, BMS-986153, BMS-986156, TRX-518(WO06/105021, WO09/009116), 및 MK-4166(WO11/028683)을 포함한다. 다른 태양에서, 면역-종양학 제제는 효능작용성 OX40 항체와 같은 OX40 작용제이다. 적합한 OX40 항체는, 예를 들어 MEDI-6383 또는 MEDI-6469를 포함한다. 다른 태양에서, 면역-종양학 제제는 길항작용성 OX40 항체와 같은 OX40L 길항제이다. 적합한 OX40L 길항제는, 예를 들어, RG-7888(WO06/029879)을 포함한다. 다른 태양에서, 면역-종양학 제제는 효능작용성 CD40 항체와 같은 CD40 작용제이다. 또 다른 실시 형태에서, 면역-종양학 제제는 길항작용성 CD40 항체와 같은 CD40 길항제이다. 적합한 CD40 항체는, 예를 들어, 루카투무맙 또는 다세투주맙을 포함한다. 다른 태양에서, 면역-종양학 제제는 효능작용성 CD27 항체와 같은 CD27 작용제이다. 적합한 CD27 항체는, 예를 들어, 바를리루맙을 포함한다. 다른 태양에서, 면역-종양학 제제는 MGA271(B7H3에 대해)(WO11/109400)이다. 또 다른 실시 형태에서는, Trop-2에 지향된 제제, 예를 들어, 항체 약물 접합체, 사시투주맙 고비테칸-hziy와 본 개시내용에 따른 항-TIGIT 항체의 조합이 고려된다. 또 다른 실시 형태에서는, CD47-SIRPα 경로를 억제하는 제제와 본 명세서에 기재된 항-TIGIT 항체의 조합이 고려된다. 항-CD47 항체의 예는 마그롤리맙이다.
심혈관 및/또는 대사-관련 질환, 장애, 및 병태의 치료를 위한 조합 요법에 유용한 치료제의 예는 콜레스테롤의 효소적 합성을 억제하는 스타틴(예를 들어, CRESTOR®, LESCOL®, LIPITOR®, MEVACOR®, PRAVACOL®, 및 ZOCOR®); 콜레스테롤을 격리하고 그의 흡수를 방지하는 담즙산 수지(예를 들어, COLESTID®, LO-CHOLEST®, PREVALITE®, QUESTRAN®, 및 WELCHOL®); 콜레스테롤 흡수를 차단하는 에제티미브(ZETIA®); 트라이글리세라이드를 감소시키고 HDL을 보통 정도로 증가시킬 수 있는 피브르산(예를 들어, TRICOR®); LDL 콜레스테롤 및 트라이글리세라이드를 보통 정도로 저감하는 니아신(예를 들어, NIACOR®); 및/또는 전술한 것들의 조합(예를 들어, VYTORIN®(에제티미브와 심바스타틴)을 포함한다. 본 명세서에 기재된 항-TIGIT 항체와 조합하여 사용하기 위한 후보일 수 있는 대안적인 콜레스테롤 치료는 다양한 보충제 및 허브(예를 들어, 마늘, 폴리코사놀, 및 구굴)를 포함한다.
면역- 및 염증-관련 질환, 장애, 또는 병태에 대한 조합 요법에 유용한 치료제의 예는 하기를 포함하지만 이로 제한되지 않는다: 비-스테로이드 항-염증 약물(NSAID), 예컨대 아스피린, 이부프로펜, 및 다른 프로피온산 유도체(알미노프로펜, 베녹사프로펜, 부클록스산, 카르프로펜, 펜부펜, 페노프로펜, 플루프로펜, 플루르비프로펜, 인도프로펜, 케토프로펜, 미로프로펜, 나프록센, 옥사프로진, 피르프로펜, 프라노프로펜, 수프로펜, 티아프로펜산, 및 티옥사프로펜), 아세트산 유도체(인도메타신, 아세메타신, 알클로페낙, 클리다낙, 디클로페낙, 펜클로페낙, 펜클로즈산, 펜티아작, 푸이로페낙, 이부페낙, 이속세팍, 옥스피낙, 설린닥, 티오피낙, 톨메틴, 지도메타신, 및 조메피락), 페남산 유도체(플루페남산, 메클로페남산, 메페남산, 니플룸산, 및 톨페남산), 바이페닐카르복실산 유도체(디플루니살 및 플루페니살), 옥시캄(이속시캄, 피록시캄, 수독시캄, 및 테녹시칸), 살리실레이트(아세틸 살리실산, 설파살라진), 및 피라졸론(아파존, 베즈피페릴론, 페프라존, 모페부타존, 옥시펜부타존, 페닐부타존). 다른 조합은 사이클로옥시게나제-2(COX-2) 억제제를 포함한다.
조합을 위한 다른 활성 제제는 스테로이드, 예컨대 프레드니솔론, 프레드니손, 메틸프레드니솔론, 베타메타손, 덱사메타손, 또는 하이드로코르티손을 포함한다. 필요한 스테로이드 용량을 테이퍼링함으로써 스테로이드의 하나 이상의 유해 효과가 감소되거나 심지어 제거될 수 있으므로, 그러한 조합은 특히 유리할 수 있다.
예를 들어, 류마티스 관절염을 치료하기 위해 조합되어 사용될 수 있는 활성 제제의 추가의 예는 사이토카인 억제성 항-염증 약물(들)(CSAID); 다른 인간 사이토카인 또는 성장 인자, 예를 들어, TNF, LT, IL-10, IL-2, IL-6, IL-7, IL-8, IL-15, IL-16, IL-18, EMAP-II, GM-CSF, FGF, 또는 PDGF에 대한 항체 또는 이들의 길항제를 포함한다.
활성 제제의 특정 조합은 자가면역 및 후속의 염증 캐스케이드 내의 상이한 지점에서 개입할 수 있으며, TNF 길항제, 예컨대 키메라, 인간화, 또는 인간 TNF 항체, REMICADE®, HUMIRA®, 항-TNF 항체 단편(예를 들어, CDP870), 및 가용성 p55 또는 p75 TNF 수용체, 이들의 유도체, p75TNFRIgG(ENBREL®) 또는 p55TNFR1gG(레네르셉트), 가용성 IL-13 수용체(sIL-13), 및 또한 TNF®-전환 효소(TACE) 억제제를 포함하고; 유사하게, IL-1 억제제(예를 들어, 인터류킨-1-전환 효소 억제제)가 효과적일 수 있다. 다른 조합은 인터류킨 11, 항-P7, 및 p-셀렉틴 당단백질 리간드(PSGL)를 포함한다. 본 명세서에 기재된 A2AR/A2BR 억제제와의 조합에 유용한 제제의 다른 예는 인터페론-131a(AVONEX®); 인터페론-13lb(BETASERON®); 코팍손; 고압 산소; 정맥내 면역글로불린; 클라브리빈; 및 다른 인간 사이토카인 또는 성장 인자에 대한 항체 또는 이들의 길항제(예를 들어, CD40 리간드 및 CD80에 대한 항체)를 포함한다.
일부 실시 형태에서, 조합은 대조군 정상 조직에 비해 암 세포 상에서 우선적으로 발현되는 표면 항원에 지향된 제2 항체를 갖는 본 개시내용의 항체이다. 암의 치료를 위해 본 개시내용의 항체와의 조합 요법으로 투여될 수 있는 항체의 일부 예는 HER2 항원에 대한 Herceptin®(트라스투주맙), VEGF에 대한 Avastin®(베바시주맙), 또는 EGF 수용체에 대한 항체, 예컨대(Erbitux®, 세툭시맙), 및 Vectibix®(파니투무맙)를 포함한다. 투여될 수 있는 다른 제제는 PD-1, PD-L1, CTLA-4, 4-1BB, BTLA, PVRIG, VISTA, TIM-3, 및 LAG-3 중 임의의 것의 항체 또는 다른 억제제; 또는 다른 하류 신호전달 억제제, 예를 들어, mTOR 및 GSK3β 억제제; 및 사이토카인, 예를 들어, 인터페론-γ, IL-2, 및 IL-15를 포함한다. 추가의 제제의 일부 특이적 예는 하기를 포함한다: 이필리무맙, 파조파닙, 서니티닙, 다사티닙, 펨브롤리주맙, INCR024360, 다브라페닙, 트라메티닙, 아테졸리주맙(MPDL3280A), 에를로티닙(예를 들어, TARCEVA®), 코비메티닙, 니볼루맙, 및 짐베렐리맙. 조합 요법을 위한 제2 항체 또는 다른 제제의 선택은 치료되는 암에 따라 달라진다. 임의로, 적절한 항체의 선택을 유도하기 위해 항원의 발현 또는 우선적인 발현에 대해 암을 시험한다. 일부 실시 형태에서, 제2 항체의 동종형은 ADCC, CDC, 및 식세포작용과 같은 이펙터 기능을 촉진하기 위한 인간 IgG1이다.
유사한 조합 요법이 바이러스, 박테리아, 진균, 및 기생충 질환, 장애, 및 병태와 같은 감염성 질환뿐만 아니라 이와 관련된 장애의 치료 또는 예방에 사용될 수 있다. 예를 들어, 본 개시내용의 항체는, 예를 들어, 라우스 육종 바이러스에 대한 팔리비주맙과 같은, 병원체에 대해 지향된 항체 또는 병원체에 대한 백신과 조합될 수 있다. 백신은 면역 반응을 유도하기에 효과적인 병원체의 단백질 또는 이의 단편일 수 있다. 본 개시내용의 항체는 병원체에 대해 지향된 항체 또는 백신의 면역 반응을 향상시킨다. 본 개시내용의 항체는 또한 생체외에서 확장된 T 세포 또는 자연 살해 세포와 함께 투여될 수 있다.
그러한 조합 요법은, 하기를 포함하지만 이로 제한되지 않는, 다양한 바이러스 생활사 단계를 표적화하며 상이한 작용 기전을 갖는 항-바이러스제를 포함한다: 바이러스 탈각의 억제제(예를 들어, 아만타딘 및 리만티딘); 역전사효소 억제제(예를 들어, 아시클로비르, 지도부딘, 및 라미부딘); 인테그라제를 표적화하는 제제; 바이러스 DNA에 대한 전사 인자의 부착을 차단하는 제제; 번역에 영향을 주는(예를 들어, 포미비르센) 제제(예를 들어, 안티센스 분자); 번역/리보자임 기능을 조절하는 제제; 프로테아제 억제제; 바이러스 조립 조절제(예를 들어, 리팜피신); 예를 들어, 뉴클레오시드 유사체 역전사효소 억제제와 같은 항레트로바이러스제(예를 들어, 아지도티미딘(AZT), ddl, ddC, 3TC, d4T); 비-뉴클레오시드 역전사효소 억제제(예를 들어, 에파비렌즈, 네비라핀); 뉴클레오티드 유사체 역전사효소 억제제; 및 바이러스 입자의 방출을 방지하는 제제(예를 들어, 자나미비르 및 오셀타미비르). 소정의 바이러스 감염(예를 들어, HIV)의 치료 및/또는 예방은 흔히 항바이러스제의 군("칵테일")을 수반한다.
본 명세서에 개시된 항-TIGIT 항체 중 임의의 것과 조합하여 사용하기 위해 고려되는 다른 항바이러스제는 하기를 포함하지만 이로 제한되지 않는다: 아바카비르, 아데포비르, 아만타딘, 암프레나비르, 암플리젠, 아르비돌, 아타자나비르, ATRIPLA®, 보세프레비르에르테트, 시도포비르, 콤비비르, 다루나비르, 델라비르딘, 디다노신, 도코사놀, 에독수딘, 엠트리시타빈, 엔푸비르티드, 엔테카비르, 팜시클로비르, 포삼프레나비르, 포스카르넷, 포스포넷, 간시클로비르, 이바시타빈, 이뮤노비르, 이독수리딘, 이미퀴모드, 인디나비르, 이노신, 다양한 인터페론(예를 들어, 페그인터페론 알파-2a), 로피나비르, 로비리드, 마라비록, 모록시딘, 메티사존, 넬피나비르, 넥사비르, 펜시클로비르, 페라미비르, 플레코나릴, 포도필로톡신, 랄테그라비르, 리바비린, 리토나비르, 피라미딘, 사퀴나비르, 스타부딘, 텔라프레비르, 테노포비르, 티프라나비르, 트리플루리딘, 트리지비르, 트로만타딘, TRUVADA®, 발라시클로비르, 발간시클로비르, 비크리비록, 비다라빈, 비라미딘, 및 잘시타빈.
본 개시내용은 항기생충제와 조합된 본 명세서에 개시된 항-TIGIT 항체 중 임의의 것의 용도를 고려한다. 그러한 제제는 티아벤다졸, 피란텔 파모에이트, 메벤다졸, 프라지쿠안텔, 니클로사미드, 비티오놀, 옥삼니퀸, 메트리포네이트, 이베르멕틴, 알벤다졸, 에플로르니틴, 멜라르소프롤, 펜타미딘, 벤즈니다졸, 니푸르티목스, 및 니트로이미다졸을 포함하지만 이로 제한되지 않는다. 당업자는 기생충 장애의 치료에 유용할 수 있는 다른 제제를 인식한다.
본 개시내용의 실시 형태는 박테리아 장애의 치료 또는 예방에 유용한 제제와 조합된 본 명세서에 개시된 항-TIGIT 항체 중 임의의 것의 용도를 고려한다. 항박테리아제는 다양한 방식으로, 예를 들어 작용 기전에 기초하여, 화학 구조에 기초하여, 그리고 활성 스펙트럼에 기초하여 분류될 수 있다. 항박테리아제의 예는 박테리아 세포벽(예를 들어, 세팔로스포린 및 페니실린) 또는 세포막(예를 들어, 폴리믹신)을 표적화하는 것들, 또는 필수 박테리아 효소를 방해하는 것들(예를 들어, 설폰아미드, 리파마이신, 및 퀴놀린)을 포함한다. 단백질 합성을 표적화하는 대부분의 항박테리아제(예를 들어, 테트라사이클린 및 마크롤라이드)는 정균성인 반면에, 아미노글리코시드와 같은 제제는 살균성이다. 항박테리아제를 분류하는 다른 수단은 이들의 표적 특이성에 기초하며; "좁은 스펙트럼" 제제는 특이적 유형의 박테리아(예를 들어, 스트렙토코커스와 같은 그램-양성 박테리아)를 표적화하는 반면에, "넓은 스펙트럼" 제제는 더 넓은 범위의 박테리아에 대한 활성을 갖는다. 당업자는 특이적 박테리아 감염에 사용하기에 적절한 항-박테리아제의 유형을 인식한다.
본 개시내용의 실시 형태는 진균 장애의 치료 또는 예방에 유용한 제제와 조합된 본 명세서에 개시된 항-TIGIT 항체 중 임의의 것의 용도를 고려한다. 항진균제는 폴리엔(예를 들어, 암포테리신, 니스타틴, 및 피마리신); 아졸(예를 들어, 플루코나졸, 이트라코나졸, 및 케토코나졸); 알릴아민(예를 들어, 나프티핀 및 테르비나핀) 및 모르폴린(예를 들어, 아모롤핀); 및 항대사물질(예를 들어, 5-플루오로시토신)을 포함한다.
본 개시내용은 상기 중 임의의 것의 약제학적으로 허용가능한 염, 산, 또는 유도체를 포함한다.
V.
다른 응용
본 개시내용의 항-TIGIT 항체는 임상 진단 또는 치료와 관련하여, 또는 연구에서 TIGIT를 검출하기 위해 사용될 수 있다. 예를 들어, 대상체가 치료에 적합한 암 또는 감염성 질환을 앓고 있다는 지표로서 T 세포, 자연 살해 세포, 및 암 세포 상의 TIGIT의 존재를 검출하기 위해 항체가 사용될 수 있다. 암 또는 감염성 질환을 앓고 있는 대상체의 T 세포, 자연 살해 세포, 및/또는 암 세포 상의 TIGIT의 발현은 또한, 암 또는 감염성 질환이 본 개시내용의 항체를 이용한 치료에 적합하다는 지표를 제공한다. 항체는 또한 T 세포, 자연 살해 세포, 및 암 세포, 및 다양한 자극에 대한 이들의 반응을 검출함에 있어서 실험실 연구를 위한 연구 시약으로서 판매될 수 있다. 그러한 용도에서, 항체는 형광 분자, 스핀-표지된 분자, 효소, 또는 방사성 동위원소를 포함하지만 이로 제한되지 않는 하나 이상의 검출가능한 신호로 표지될 수 있으며, TIGIT에 대한 검정을 수행하기 위해 필요한 모든 시약을 갖는 키트의 형태로 제공될 수 있다. 본 개시내용의 항-TIGIT 항체는 또한, 예를 들어, 친화성 크로마토그래피에 의해 TIGIT를 정제하기 위해 사용될 수 있다.
VI.
키트
TIGIT에 대한 항체는 키트의 성분으로서 공동-요법에 사용하기 위해 기재된 제2 항체 또는 제제 중 임의의 것과 조합될 수 있다. 본 명세서에 개시된 개시내용은 본 명세서에 개시된 항체 중 하나 이상뿐만 아니라 하나 이상의 약제학적으로 허용가능한 부형제 또는 담체(비제한적인 예를 들어, 포스페이트 완충 식염 용액, 물, 멸균수, 폴리에틸렌 글리콜, 폴리비닐 피롤리돈, 레시틴, 아라키스 오일, 참기름, 에멀젼, 예컨대 수중유 에멀젼 또는 유중수 에멀젼, 마이크로에멀젼, 나노담체, 및 다양한 유형의 습윤제)를 함유하는 하나 이상의 키트를 제공한다. 첨가제, 예컨대 알코올, 오일, 글리콜, 보존제, 향미제, 착색제, 현탁화제 등이 또한 담체, 희석제, 또는 부형제와 함께 본 개시내용의 키트에 포함될 수 있다. 일 실시 형태에서, 본 명세서에 개시된 항체 조성물에 사용하기에 적절한 약제학적으로 허용가능한 담체는 멸균되고/되거나, 병원체가 없고/없거나 그 밖에 관련 감염 및 다른 과도한 유해 부작용의 위험 없이 대상체에게 투여하기에 안전하다. 키트 내에는, 조합 후의 투여에 대한 설명서 또는 별도의 투여에 대한 설명서와 함께, 각각의 제제가 별도의 바이알 내에 제공될 수 있다. 키트는 또한 본 명세서에 개시된 항-TIGIT 항체 중 임의의 것의 적절한 취급 및 저장에 대한 서면 설명서를 포함할 수 있다.
VII.
실시 형태
실시 형태 1. (a) 서열 번호 36에 대해 80% 이상의 서열 동일성을 갖는 중쇄(HC) 상보성 결정 영역(CDR) 1, 서열 번호 37에 대해 80% 이상의 서열 동일성을 갖는 HC-CDR2, 및 서열 번호 38에 대해 80% 이상의 서열 동일성을 갖는 HC-CDR3을 포함하는 중쇄 가변 영역; 및 서열 번호 39에 대해 80% 이상의 서열 동일성을 갖는 경쇄(LC) CDR1, 서열 번호 40에 대해 80% 이상의 서열 동일성을 갖는 LC-CDR2, 및 서열 번호 41에 대해 80% 이상의 서열 동일성을 갖는 LC-CDR3을 포함하는 경쇄 가변 영역; (b) 서열 번호 42에 대해 80% 이상의 서열 동일성을 갖는 HC-CDR1, 서열 번호 43에 대해 80% 이상의 서열 동일성을 갖는 HC-CDR2, 및 서열 번호 44에 대해 80% 이상의 서열 동일성을 갖는 HC-CDR3을 포함하는 중쇄 가변 영역; 서열 번호 45에 대해 80% 이상의 서열 동일성을 갖는 LC-CDR1, 서열 번호 46에 대해 80% 이상의 서열 동일성을 갖는 LC-CDR2, 및 서열 번호 47에 대해 80% 이상의 서열 동일성을 갖는 LC-CDR3을 포함하는 경쇄 가변 영역; (c) 서열 번호 48에 대해 80% 이상의 서열 동일성을 갖는 HC-CDR1, 서열 번호 49에 대해 80% 이상의 서열 동일성을 갖는 HC-CDR2, 및 서열 번호 50에 대해 80% 이상의 서열 동일성을 갖는 HC-CDR3을 포함하는 중쇄 가변 영역; 및 서열 번호 51에 대해 80% 이상의 서열 동일성을 갖는 LC-CDR1, 서열 번호 52에 대해 80% 이상의 서열 동일성을 갖는 LC-CDR2, 및 서열 번호 53에 대해 80% 이상의 서열 동일성을 갖는 LC-CDR3을 포함하는 경쇄 가변 영역; (d) 서열 번호 54에 대해 80% 이상의 서열 동일성을 갖는 HC-CDR1, 서열 번호 55에 대해 80% 이상의 서열 동일성을 갖는 HC-CDR2, 및 서열 번호 56에 대해 80% 이상의 서열 동일성을 갖는 HC-CDR3을 포함하는 중쇄 가변 영역; 및 서열 번호 57에 대해 80% 이상의 서열 동일성을 갖는 LC-CDR1, 서열 번호 58에 대해 80% 이상의 서열 동일성을 갖는 LC-CDR2, 및 서열 번호 59에 대해 80% 이상의 서열 동일성을 갖는 LC-CDR3을 포함하는 경쇄 가변 영역; (e) 서열 번호 60에 대해 80% 이상의 서열 동일성을 갖는 HC-CDR1, 서열 번호 61에 대해 80% 이상의 서열 동일성을 갖는 HC-CDR2, 및 서열 번호 62에 대해 80% 이상의 서열 동일성을 갖는 HC-CDR3을 포함하는 중쇄 가변 영역; 및 서열 번호 63에 대해 80% 이상의 서열 동일성을 갖는 LC-CDR1, 서열 번호 64에 대해 80% 이상의 서열 동일성을 갖는 LC-CDR2, 및 서열 번호 65에 대해 80% 이상의 서열 동일성을 갖는 LC-CDR3을 포함하는 경쇄 가변 영역; (f) 서열 번호 60에 대해 80% 이상의 서열 동일성을 갖는 HC-CDR1, 서열 번호 66에 대해 80% 이상의 서열 동일성을 갖는 HC-CDR2, 및 서열 번호 67에 대해 80% 이상의 서열 동일성을 갖는 HC-CDR3을 포함하는 중쇄 가변 영역; 및 서열 번호 63에 대해 80% 이상의 서열 동일성을 갖는 LC-CDR1, 서열 번호 68에 대해 80% 이상의 서열 동일성을 갖는 LC-CDR2, 및 서열 번호 65에 대해 80% 이상의 서열 동일성을 갖는 LC-CDR3을 포함하는 경쇄 가변 영역; (g) 서열 번호 69에 대해 80% 이상의 서열 동일성을 갖는 HC-CDR1, 서열 번호 55에 대해 80% 이상의 서열 동일성을 갖는 HC-CDR2, 및 서열 번호 70에 대해 80% 이상의 서열 동일성을 갖는 HC-CDR3을 포함하는 중쇄 가변 영역; 및 서열 번호 71에 대해 80% 이상의 서열 동일성을 갖는 LC-CDR1, 서열 번호 68에 대해 80% 이상의 서열 동일성을 갖는 LC-CDR2, 및 서열 번호 65에 대해 80% 이상의 서열 동일성을 갖는 LC-CDR3을 포함하는 경쇄 가변 영역; (h) 서열 번호 72에 대해 80% 이상의 서열 동일성을 갖는 HC-CDR1, 서열 번호 73에 대해 80% 이상의 서열 동일성을 갖는 HC-CDR2, 및 서열 번호 67에 대해 80% 이상의 서열 동일성을 갖는 HC-CDR3을 포함하는 중쇄 가변 영역; 및 서열 번호 63에 대해 80% 이상의 서열 동일성을 갖는 LC-CDR1, 서열 번호 68에 대해 80% 이상의 서열 동일성을 갖는 LC-CDR2, 및 서열 번호 65에 대해 80% 이상의 서열 동일성을 갖는 LC-CDR3을 포함하는 경쇄 가변 영역; 또는 (i) 서열 번호 74에 대해 80% 이상의 서열 동일성을 갖는 HC-CDR1, 서열 번호 75에 대해 80% 이상의 서열 동일성을 갖는 HC-CDR2, 및 서열 번호 67에 대해 80% 이상의 서열 동일성을 갖는 HC-CDR3을 포함하는 중쇄 가변 영역; 및 서열 번호 63에 대해 80% 이상의 서열 동일성을 갖는 LC-CDR1, 서열 번호 68에 대해 80% 이상의 서열 동일성을 갖는 LC-CDR2, 및 서열 번호 65에 대해 80% 이상의 서열 동일성을 갖는 LC-CDR3을 포함하는 경쇄 가변 영역을 포함하는, 인간 TIGIT에 특이적으로 결합하는 항-TIGIT 항체 또는 이의 항원-결합 단편.
실시 형태 2. 실시 형태 1에 있어서, (a) 서열 번호 36을 포함하는 아미노 서열을 갖는 HC-CDR1, 서열 번호 37을 포함하는 아미노 서열을 갖는 HC-CDR2, 및 서열 번호 38을 포함하는 아미노 서열을 갖는 HC-CDR3을 포함하는 중쇄 가변 영역; 및 서열 번호 39에 대한 동일성을 포함하는 아미노 서열을 갖는 LC-CDR1, 서열 번호 40을 포함하는 아미노 서열을 갖는 LC-CDR2, 및 서열 번호 41을 포함하는 아미노 서열을 갖는 LC-CDR3을 포함하는 경쇄 가변 영역; (b) 서열 번호 42를 포함하는 아미노 서열을 갖는 HC-CDR1, 서열 번호 43을 포함하는 아미노 서열을 갖는 HC-CDR2, 및 서열 번호 44를 포함하는 아미노 서열을 갖는 HC-CDR3을 포함하는 중쇄 가변 영역; 및 서열 번호 45를 포함하는 아미노 서열을 갖는 LC-CDR1, 서열 번호 46을 포함하는 아미노 서열을 갖는 LC-CDR2, 및 서열 번호 47을 포함하는 아미노 서열을 갖는 LC-CDR3을 포함하는 경쇄 가변 영역; (c) 서열 번호 48을 포함하는 아미노 서열을 갖는 HC-CDR1, 서열 번호 49를 포함하는 아미노 서열을 갖는 HC-CDR2, 및 서열 번호 50을 포함하는 아미노 서열을 갖는 HC-CDR3을 포함하는 중쇄 가변 영역; 및 서열 번호 51을 포함하는 아미노 서열을 갖는 LC-CDR1, 서열 번호 52를 포함하는 아미노 서열을 갖는 LC-CDR2, 및 서열 번호 53을 포함하는 아미노 서열을 갖는 LC-CDR3을 포함하는 경쇄 가변 영역; (d) 서열 번호 54를 포함하는 아미노 서열을 갖는 HC-CDR1, 서열 번호 55를 포함하는 아미노 서열을 갖는 HC-CDR2, 및 서열 번호 56을 포함하는 아미노 서열을 갖는 HC-CDR3을 포함하는 중쇄 가변 영역; 및 서열 번호 57을 포함하는 아미노 서열을 갖는 LC-CDR1, 서열 번호 58을 포함하는 아미노 서열을 갖는 LC-CDR2, 및 서열 번호 59를 포함하는 아미노 서열을 갖는 LC-CDR3을 포함하는 경쇄 가변 영역; (e) 서열 번호 60을 포함하는 아미노 서열을 갖는 HC-CDR1, 서열 번호 61을 포함하는 아미노 서열을 갖는 HC-CDR2, 및 서열 번호 62를 포함하는 아미노 서열을 갖는 HC-CDR3을 포함하는 중쇄 가변 영역; 및 서열 번호 63을 포함하는 아미노 서열을 갖는 LC-CDR1, 서열 번호 64를 포함하는 아미노 서열을 갖는 LC-CDR2, 및 서열 번호 65를 포함하는 아미노 서열을 갖는 LC-CDR3을 포함하는 경쇄 가변 영역; (f) 서열 번호 60을 포함하는 아미노 서열을 갖는 HC-CDR1, 서열 번호 66을 포함하는 아미노 서열을 갖는 HC-CDR2, 및 서열 번호 67을 포함하는 아미노 서열을 갖는 HC-CDR3을 포함하는 중쇄 가변 영역; 및 서열 번호 63을 포함하는 아미노 서열을 갖는 LC-CDR1, 서열 번호 68을 포함하는 아미노 서열을 갖는 LC-CDR2, 및 서열 번호 65를 포함하는 아미노 서열을 갖는 LC-CDR3을 포함하는 경쇄 가변 영역; (g) 서열 번호 69를 포함하는 아미노 서열을 갖는 HC-CDR1, 서열 번호 55를 포함하는 아미노 서열을 갖는 HC-CDR2, 및 서열 번호 70을 포함하는 아미노 서열을 갖는 HC-CDR3을 포함하는 중쇄 가변 영역; 및 서열 번호 71을 포함하는 아미노 서열을 갖는 LC-CDR1, 서열 번호 68을 포함하는 아미노 서열을 갖는 LC-CDR2, 및 서열 번호 65를 포함하는 아미노 서열을 갖는 LC-CDR3을 포함하는 경쇄 가변 영역; (h) 서열 번호 72를 포함하는 아미노 서열을 갖는 HC-CDR1, 서열 번호 73을 포함하는 아미노 서열을 갖는 HC-CDR2, 및 서열 번호 67을 포함하는 아미노 서열을 갖는 HC-CDR3을 포함하는 중쇄 가변 영역; 및 서열 번호 63을 포함하는 아미노 서열을 갖는 LC-CDR1, 서열 번호 68을 포함하는 아미노 서열을 갖는 LC-CDR2, 및 서열 번호 65를 포함하는 아미노 서열을 갖는 LC-CDR3을 포함하는 경쇄 가변 영역; 또는 (i) 서열 번호 74를 포함하는 아미노 서열을 갖는 HC-CDR1, 서열 번호 75를 포함하는 아미노 서열을 갖는 HC-CDR2, 및 서열 번호 67을 포함하는 아미노 서열을 갖는 HC-CDR3을 포함하는 중쇄 가변 영역; 및 서열 번호 63을 포함하는 아미노 서열을 갖는 LC-CDR1, 서열 번호 68을 포함하는 아미노 서열을 갖는 LC-CDR2, 및 서열 번호 65를 포함하는 아미노 서열을 갖는 LC-CDR3을 포함하는 경쇄 가변 영역을 포함하는, 항-TIGIT 항체 또는 이의 항원-결합 단편.
실시 형태 3. 실시 형태 1 또는 실시 형태 2에 있어서, (a) 서열 번호 1에 대해 80% 이상의 서열 동일성을 갖는 중쇄 가변 영역, 및 서열 번호 2에 대해 80% 이상의 서열 동일성을 갖는 경쇄 가변 영역; (b) 서열 번호 3에 대해 80% 이상의 서열 동일성을 갖는 중쇄 가변 영역, 및 서열 번호 4에 대해 80% 이상의 서열 동일성을 갖는 경쇄 가변 영역; (c) 서열 번호 5에 대해 80% 이상의 서열 동일성을 갖는 중쇄 가변 영역, 및 서열 번호 6에 대해 80% 이상의 서열 동일성을 갖는 경쇄 가변 영역; (d) 서열 번호 7에 대해 80% 이상의 서열 동일성을 갖는 중쇄 가변 영역, 및 서열 번호 8에 대해 80% 이상의 서열 동일성을 갖는 경쇄 가변 영역; (e) 서열 번호 9에 대해 80% 이상의 서열 동일성을 갖는 중쇄 가변 영역, 및 서열 번호 10에 대해 80% 이상의 서열 동일성을 갖는 경쇄 가변 영역; (f) 서열 번호 11에 대해 80% 이상의 서열 동일성을 갖는 중쇄 가변 영역, 및 서열 번호 12에 대해 80% 이상의 서열 동일성을 갖는 경쇄 가변 영역; (g) 서열 번호 13에 대해 80% 이상의 서열 동일성을 갖는 중쇄 가변 영역, 및 서열 번호 14에 대해 80% 이상의 서열 동일성을 갖는 경쇄 가변 영역; (h) 서열 번호 15에 대해 80% 이상의 서열 동일성을 갖는 중쇄 가변 영역, 및 서열 번호 16에 대해 80% 이상의 서열 동일성을 갖는 경쇄 가변 영역; (i) 서열 번호 17에 대해 80% 이상의 서열 동일성을 갖는 중쇄 가변 영역, 및 서열 번호 12에 대해 80% 이상의 서열 동일성을 갖는 경쇄 가변 영역; (j) 서열 번호 76에 대해 80% 이상의 서열 동일성을 갖는 중쇄 가변 영역, 및 서열 번호 77에 대해 80% 이상의 서열 동일성을 갖는 경쇄 가변 영역; (k) 서열 번호 78에 대해 80% 이상의 서열 동일성을 갖는 중쇄 가변 영역, 및 서열 번호 77에 대해 80% 이상의 서열 동일성을 갖는 경쇄 가변 영역; (l) 서열 번호 76에 대해 80% 이상의 서열 동일성을 갖는 중쇄 가변 영역, 및 서열 번호 79에 대해 80% 이상의 서열 동일성을 갖는 경쇄 가변 영역; 또는 (m) 서열 번호 78에 대해 80% 이상의 서열 동일성을 갖는 중쇄 가변 영역, 및 서열 번호 79에 대해 80% 이상의 서열 동일성을 갖는 경쇄 가변 영역을 포함하는, 항-TIGIT 항체 또는 이의 항원-결합 단편.
실시 형태 4. 실시 형태 1 내지 실시 형태 3 중 어느 한 실시 형태에 있어서, 단일클론 항체인, 항-TIGIT 항체 또는 이의 항원-결합 단편.
실시 형태 5. 실시 형태 1 내지 실시 형태 4 중 어느 한 실시 형태에 있어서, 키메라, 인간화, 또는 베니어 항체인, 항-TIGIT 항체 또는 이의 항원-결합 단편.
실시 형태 6. 실시 형태 5에 있어서, 키메라 항체는 인간 IgG1/카파 Fab 불변 도메인을 포함하는, 항-TIGIT 항체 또는 이의 항원-결합 단편.
실시 형태 7. 실시 형태 1 내지 실시 형태 3 중 어느 한 실시 형태에 있어서, 인간 항체인, 항-TIGIT 항체 또는 이의 항원-결합 단편.
실시 형태 8. 실시 형태 1 내지 실시 형태 7 중 어느 한 실시 형태에 있어서, CD155에 대한 TIGIT의 결합을 억제하며, 임의로 여기서 결합은 실시예 1에서와 같이 측정된 약 0.1 nM 내지 약 10 nM, 약 0.1 nM 내지 약 5 nM, 약 0.2 nM 내지 약 2 nM, 약 0.2 nM 내지 약 0.8 nM, 약 0.4 nM 내지 약 0.8 nM, 또는 약 0.6 nM 내지 약 0.8 nM의 IC50으로 억제하는, 항-TIGIT 항체 또는 이의 항원-결합 단편.
실시 형태 9. 실시 형태 1 내지 실시 형태 5 또는 실시 형태 7 또는 실시 형태 8 중 어느 한 실시 형태에 있어서, 항체는 변이체 인간 IgG1, 변이체 인간 IgG2, 변이체 인간 IgG3, 또는 변이체 인간 IgG4로부터 선택된 변이체 중쇄 불변 영역, 및 임의로 인간 경쇄 불변 영역을 추가로 포함하는, 항-TIGIT 항체 또는 이의 항원 결합 단편.
실시 형태 10. 실시 형태 9에 있어서, 변이체 중쇄 불변 영역은 야생형 중쇄 불변 영역에 대해 향상되거나 감소된 이펙터 기능을 갖는, 항-TIGIT 항체 또는 이의 항원 결합 단편.
실시 형태 11. 실시 형태 10에 있어서, 변이체 인간 IgG 중쇄 불변 영역은 서열 번호 97, 서열 번호 99, 또는 서열 번호 101을 포함하는, 항-TIGIT 항체 또는 이의 항원 결합 단편.
실시 형태 12. 실시 형태 1 내지 실시 형태 5 또는 실시 형태 7 또는 실시 형태 8 중 어느 한 실시 형태에 있어서, 항체는 야생형 인간 IgG 중쇄 불변 영역, 및 임의로 인간 경쇄 불변 영역을 추가로 포함하는, 항-TIGIT 항체 또는 이의 항원 결합 단편.
실시 형태 13. 실시 형태 12에 있어서, 야생형 인간 IgG 중쇄 불변 영역은 서열 번호 94를 포함하는, 항-TIGIT 항체 또는 이의 항원 결합 단편.
실시 형태 14. 실시 형태 12 또는 실시 형태 13에 있어서, 인간 경쇄 카파 불변 영역을 포함하며, 임의로 여기서 인간 경쇄 불변 영역은 서열 번호 95를 포함하는, 항-TIGIT 항체 또는 이의 항원 결합 단편.
실시 형태 15. 실시 형태 1 내지 실시 형태 5 또는 실시 형태 7 또는 실시 형태 8 중 어느 한 실시 형태에 있어서, 항체는 중쇄 및 경쇄를 가지며, 여기서 (a) 중쇄는 서열 번호 92를 포함하는 아미노산 서열을 갖고, 경쇄는 서열 번호 93을 포함하는 아미노산 서열을 갖거나; (b) 중쇄는 서열 번호 96을 포함하는 아미노산 서열을 갖고, 경쇄는 서열 번호 93을 포함하는 아미노산 서열을 갖거나; (c) 중쇄는 서열 번호 98을 포함하는 아미노산 서열을 갖고, 경쇄는 서열 번호 93을 포함하는 아미노산 서열을 갖거나; (d) 중쇄는 서열 번호 100을 포함하는 아미노산 서열을 갖고, 경쇄는 서열 번호 93을 포함하는 아미노산 서열을 갖는, 항-TIGIT 항체 또는 이의 항원 결합 단편.
실시 형태 16. 실시 형태 1 내지 실시 형태 15 중 어느 한 실시 형태에 있어서, (a) 표면 플라즈몬 공명에 의해 측정된 약 0.01×10-11 M 내지 약 100×10-11 M, 약 0.1×10-11 M 내지 약 100×10-11 M, 약 0.1×10-11 M 내지 약 10×10-11 M, 약 1×10-11 M 내지 약 100×10-11 M, 또는 약 1×10-11 M 내지 약 10×10-11 M의 평형 결합 상수(KD)를 갖거나; (b) 세포 표면 인간 TIGIT에 대한 가용성 인간 CD155 리간드의 결합을 실시예 1에서와 같이 측정된 약 0.2 nM 내지 약 2 nM, 약 0.2 nM 내지 약 0.8 nM, 약 0.6 nM 내지 약 0.8 nM, 또는 약 0.6 nM 내지 약 0.8 nM의 반수 최대 억제제 농도(IC50)로 차단하거나; (c) 적어도 하기 TIGIT의 잔기, (i) 서열 번호 80의 D72 및 서열 번호 80의 T55, Q56, N58, E60, S80, 및 K82 중 하나 이상; (ii) 서열 번호 80의 E60 및 D72 및 임의로 서열 번호 80의 T55, Q56, N58, S80, 및 K82 중 하나 이상; (iii) 서열 번호 80의 D72 및 K82 및 임의로 서열 번호 80의 T55, Q56, N58, E60, 및 S80 중 하나 이상; (iv) 서열 번호 80의 E60, D72, 및 K82 및 임의로 서열 번호 80의 T55, Q56, N58, 및 S80 중 하나 이상; 또는 (v) 서열 번호 80의 T55, Q56, N58, E60, D72, S80, 및 K82를 포함하는 에피토프에 결합하거나; (d) (a), (b), 및 (c)의 임의의 조합인, 항-TIGIT 항체 또는 이의 항원 결합 단편.
실시 형태 17. 실시 형태 16에 있어서, TIGIT에 대한 결합에 대해 실시 형태 1 내지 실시 형태 17 중 어느 한 실시 형태의 항체 또는 이의 항원-결합 단편과 경쟁하는, 항-TIGIT 항체 또는 이의 항원 결합 단편.
실시 형태 18. 실시 형태 16 또는 실시 형태 17에 있어서, 과량의 항체 또는 이의 항원-결합 단편은, 경쟁 결합 검정에서 측정되는 바와 같이, TIGIT에 대한 결합에 대해 약 55%, 60%, 65%, 70%, 75%, 76%, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 또는 100% 이상만큼 참조 항체와 경쟁하며, 여기서 참조 항체는 서열 번호 92를 포함하는 아미노산 서열을 갖는 중쇄 및 서열 번호 93을 포함하는 아미노산 서열을 갖는 경쇄를 포함하는, 항-TIGIT 항체 또는 이의 항원 결합 단편.
실시 형태 19. 서열 번호 92를 포함하는 아미노산 서열을 갖는 중쇄 및 서열 번호 93을 포함하는 아미노산 서열을 갖는 경쇄를 포함하는, 인간 TIGIT에 특이적으로 결합하는 항-TIGIT 항체 또는 이의 항원-결합 단편.
실시 형태 20. CD155에 대한 TIGIT의 결합을 억제하는 방법으로서, 실시 형태 1 내지 실시 형태 19 중 어느 한 실시 형태의 항-TIGIT 항체 또는 이의 항원-결합 단편과 TIGIT를 접촉시키는 단계를 포함하는, 방법.
실시 형태 21. 병원체로 감염된 대상체를 치료하는 방법으로서, 실시 형태 1 내지 실시 형태 20 중 어느 한 실시 형태의 항체의 효과적인 요법 또는 치료적 유효량을 대상체에게 투여하는 단계를 포함하는, 방법.
실시 형태 22. 실시 형태 21에 있어서, 병원체는 바이러스, 박테리아, 진균, 또는 원충인, 방법.
실시 형태 23. 실시 형태 22에 있어서, 병원체는 HIV, SIV, 간염, 헤르페스 바이러스, 아데노바이러스, 인플루엔자 바이러스, 플라비바이러스, 에코바이러스, 리노바이러스, 콕사키 바이러스, 코르노바이러스, 호흡기 세포융합 바이러스, 이하선염 바이러스, 로타바이러스, 홍역 바이러스, 풍진 바이러스, 파르보바이러스, 우두 바이러스, HTLV 바이러스, 뎅기 바이러스, 유두종바이러스, 연속종 바이러스, 폴리오바이러스, 광견병 바이러스, JC 바이러스, 아르보바이러스 뇌염 바이러스, 클라미디아, 리케치아 박테리아, 마이코박테리아, 스타필로코키, 트렙토키, 뉴모노코키, 메닝고코키, 코노코키, 클렙시엘라, 프로테우스, 세라티아, 슈도모나스, 레지오넬라, 디프테리아, 살모넬라, 바실리, 콜레라, 파상풍, 보툴리눔 식중독, 탄저병, 페스트, 렙토스피라증, 및 라임병 박테리아인, 방법.
실시 형태 24. 실시 형태 21 내지 실시 형태 23 중 어느 한 실시 형태에 있어서, 대상체는 병원체에 대한 면역 반응을 유도하는 백신으로 치료되며, 이는 항체에 의해 향상되는, 방법.
실시 형태 25. 실시 형태 24에 있어서, 백신은 병원체의 단백질 또는 이의 단편을 포함하는, 방법.
실시 형태 26. 실시 형태 21 내지 실시 형태 25 중 어느 한 실시 형태에 있어서, 대상체에게 병원체에 대한 제2 항체를 추가로 투여하며, 여기서 병원체에 대한 제2 항체의 이펙터 매개 세포독성은 항체에 의해 향상되는, 방법.
실시 형태 27. 실시 형태 21 내지 실시 형태 26 중 어느 한 실시 형태에 있어서, 대상체에게 항바이러스제, 항기생충제, 항박테리아제, 또는 항진균제 중 하나 이상을 추가로 투여하는, 방법.
실시 형태 28. 암을 치료하거나 암의 예방을 달성하는 방법으로서, 암을 갖거나 암의 위험이 있는 대상체에게 실시 형태 1 내지 실시 형태 27 중 어느 한 실시 형태의 항-TIGIT 항체 중 어느 하나 또는 이의 항원-결합 단편의 효과적인 요법 또는 치료적 유효량을 투여하는 단계를 포함하는, 방법.
실시 형태 29. 실시 형태 28에 있어서, 암은 혈액학적 악성종양, 고형 종양, 메르켈 세포 암종, 요로상피암, 두경부 편평 세포 암종, B-세포 림프종, 자궁암, 자궁경부암, 고환암, 위장관암, 방광암, 골암, 골수, 피부암, 담낭암, 심장암, 폐암, 침샘암, 부신암, 갑상선암, 신경절암, 중추 신경계(CNS) 및 말초 신경계(PNS) 암, 및 조혈계의 암, 면역계의 암인, 방법.
실시 형태 30. 실시 형태 28 또는 실시 형태 29에 있어서, 대상체에게 종양 침윤 T 세포를 투여하며, 이는 항체 또는 이의 항원-결합 단편에 의해 활성화되는, 방법.
실시 형태 31. 실시 형태 28 내지 실시 형태 30 중 어느 한 실시 형태에 있어서, 대상체에게 암에 대한 면역 반응을 유도하는 백신을 투여하며, 이는 항체 또는 이의 항원-결합 단편에 의해 향상되는, 방법.
실시 형태 32. 실시 형태 31에 있어서, 백신은 암 세포의 표면 상에 발현되는 항원 또는 이의 단편을 포함하는, 방법.
실시 형태 33. 실시 형태 28 내지 실시 형태 32 중 어느 한 실시 형태에 있어서, 대상체에게 자연 살해 세포를 투여하며, 이의 암에 대한 세포독성은 항체 또는 이의 항원-결합 단편에 의해 향상되는, 방법.
실시 형태 34. 실시 형태 28 내지 실시 형태 33 중 어느 한 실시 형태에 있어서, 대상체에게 암의 세포의 표면 상에 발현되는 항원에 대한 제2 항체를 추가로 투여하며, 여기서 암에 대한 제2 항체의 이펙터 매개 세포독성은 항체 또는 이의 항원-결합 단편에 의해 향상되는, 방법.
실시 형태 35. 실시 형태 28 내지 실시 형태 33 중 어느 한 실시 형태에 있어서, 대상체에게 면역 세포의 표면 상에 발현되는 항원에 대한 제2 항체를 추가로 투여하는, 방법.
실시 형태 36. 실시 형태 35에 있어서, 면역 세포는 T 세포 또는 자연 살해 세포인, 방법.
실시 형태 37. 실시 형태 35 또는 실시 형태 36에 있어서, 항원은 CTLA-4, PD-1, 또는 PD-L1인, 방법.
실시 형태 38. 실시 형태 28 내지 실시 형태 37 중 어느 한 실시 형태에 있어서, 대상체에게 화학요법, 방사선, 세포-기반 요법, 및 수술로 이루어진 군으로부터 선택된 하나 이상의 요법을 추가로 투여하는, 방법.
실시 형태 39. 실시 형태 28 내지 실시 형태 38 중 어느 한 실시 형태에 있어서, 대상체에게 하나 이상의 면역-체크포인트 수용체 또는 리간드의 억제제를 추가로 투여하는, 방법.
실시 형태 40. 실시 형태 39에 있어서, 하나 이상의 면역-체크포인트 수용체 또는 리간드는 CTLA-4, PD-1, PD-L1, TIM-3, LAG-3, PVRIG, BTLA, VISTA, CD96, A2aR, A2bR, A2a/A2bR, 아르기나제, CD39, CD73, IDO, 및 TDO로 이루어진 군으로부터 선택되는, 방법.
실시 형태 41. 실시 형태 39에 있어서, 억제제는 이필리무맙, 트레멜리무맙, 니볼루맙, 펨브롤리주맙, 람브롤리주맙, 세미플리맙, 티스렐리주맙, 짐베렐리맙, 두르발루맙, 및 아테졸리주맙으로 이루어진 군으로부터 선택되는, 방법.
실시 형태 42. 실시 형태 1 내지 실시 형태 19 중 어느 한 실시 형태의 항체 또는 이의 항원-결합 단편 및 약제학적으로 허용가능한 담체를 포함하는, 약제학적 조성물.
실시 형태 43. 하기 서열 번호 80의 아미노산 잔기 중 하나 이상을 포함하는 인간 TIGIT의 에피토프에 결합하는, 항-TIGIT 항체 또는 이의 항원 결합 단편: T55, Q56, N58, E60, D72, S80, 및 K82.
실시 형태 44. 실시 형태 43에 있어서, 적어도 하기 TIGIT의 잔기를 포함하는 에피토프에 결합하는, 항-TIGIT 항체 또는 이의 항원-결합 단편: (i) 서열 번호 80의 D72 및 서열 번호 80의 T55, Q56, N58, E60, S80, 및 K82 중 하나 이상; (ii) 서열 번호 80의 E60 및 D72 및 임의로 서열 번호 80의 T55, Q56, N58, S80, 및 K82 중 하나 이상; (iii) 서열 번호 80의 D72 및 K82 및 임의로 서열 번호 80의 T55, Q56, N58, E60, 및 S80 중 하나 이상; (iv) 서열 번호 80의 E60, D72, 및 K82 및 임의로 서열 번호 80의 T55, Q56, N58, 및 S80 중 하나 이상; 또는 (v) 서열 번호 80의 T55, Q56, N58, E60, D72, S80, 및 K82.
실시 형태 45. 실시 형태 43 또는 실시 형태 44에 있어서, TIGIT에 대한 결합에 대해 실시 형태 1 내지 실시 형태 19 중 어느 한 실시 형태의 항체 또는 이의 항원-결합 단편과 경쟁하는, 항-TIGIT 항체 또는 이의 항원-결합 단편.
실시 형태 46. 실시 형태 43 또는 실시 형태 44에 있어서, 과량의 항체 또는 이의 항원-결합 단편은, 경쟁 결합 검정에서 측정되는 바와 같이, TIGIT에 대한 결합에 대해 약 55%, 60%, 65%, 70%, 75%, 76%, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 또는 100% 이상만큼 참조 항체와 경쟁하며, 여기서 참조 항체는 서열 번호 92를 포함하는 아미노산 서열을 갖는 중쇄 및 서열 번호 93을 포함하는 아미노산 서열을 갖는 경쇄를 포함하는, 항-TIGIT 항체 또는 이의 항원 결합 단편.
실시 형태 47. 실시 형태 1 내지 실시 형태 19 중 어느 한 실시 형태에 있어서, 하기 서열 번호 80의 아미노산 잔기 중 하나 이상을 포함하는 인간 TIGIT의 에피토프에 결합하는, 항-TIGIT 항체 또는 이의 항원 결합 단편: T55, Q56, N58, E60, D72, S80, 및 K82.
본 명세서 전체에 걸쳐 주어진 모든 최대 수치 한계는, 더 낮은 수치 한계가 본 명세서에 명시적으로 기재된 것처럼, 모든 더 낮은 수치 한계를 포함하는 것으로 의도된다. 본 명세서 전체에 걸쳐 주어진 모든 최소 수치 한계는, 더 높은 수치 한계가 본 명세서에 명시적으로 기재된 것처럼, 모든 더 높은 수치 한계를 포함할 것이다. 본 명세서 전체에 걸쳐 주어진 모든 수치 범위는, 더 좁은 수치 범위가 모두 명시적으로 본 명세서에 기재된 것처럼, 더 넓은 수치 범위 내에 들어오는 모든 더 좁은 수치 범위를 포함할 것이다.
상기 또는 하기에 인용된 모든 특허 출원, 웹사이트, 기타 간행물, 수탁 번호 등은, 각각의 개별 항목이 참조로 그렇게 포함되는 것으로 구체적으로 그리고 개별적으로 표시되는 것과 동일한 정도로 모든 목적을 위해 전체적으로 참고로 포함된다. 한 서열의 상이한 버전이 상이한 시간에 한 수탁 번호와 관련되어 있는 경우, 본 출원의 유효 출원일에서의 수탁 번호와 관련된 버전을 의미한다. 유효 출원일은 실제 출원일 또는 적용가능한 경우 수탁 번호를 언급하는 우선권 출원의 출원일 중 빠른 날짜를 의미한다. 마찬가지로, 간행물, 웹사이트 등의 상이한 버전이 상이한 시간에 공개된 경우, 달리 표시되지 않은 한, 본 출원의 유효 출원일에 가장 최근에 공개된 버전을 의미한다. 구체적으로 달리 표시되지 않은 한, 본 개시내용의 임의의 특징, 단계, 요소, 실시 형태, 또는 양태는 임의의 다른 것과 조합하여 사용될 수 있다.
본 개시내용이 명료함 및 이해를 목적으로 예시 및 예를 통해 다소 상세히 기재되어 있지만, 첨부된 청구범위의 범주 내에서 소정의 변경 및 변형이 실시될 수 있음이 명백할 것이다.
실시예
하기 실시예는 인간 TIGIT에 대한 항체의 생성, 특성화, 및 인간화를 논의하며, 또한 본 출원에 기재된 항체에 의한 결합 특징이 결정될 수 있는 예시적인 방법을 제공한다.
실시예 1. 항-TIGIT 항체의 생성
항-TIGIT 항체는 면역화된 마우스로부터 얻어졌다. 서열 번호 83을 갖는 His-태깅된 인간 TIGIT 단백질(hTIGIT-His) 및 서열 번호 85를 갖는 시노 TIGIT 단백질(cTIGIT-His) 세포외 도메인을 HEK293 세포에서 일시적으로 발현시키고 항-His 친화성 크로마토그래피에 의해 정제하였다. 재조합 hTIGIT-His 및 cTIGIT-His 단백질의 혼합물로 BALB/c 마우스의 RIMMS 면역화를 수행하였다. 최종 부스트 전에 면역원에 대한 ELISA 검정에 의해 혈장 역가를 시험하여 양호한 역가를 확인하였다. 최종 부스트 후에, 비장, 서혜부, 상완, 액와, 및 경부 림프절과 함께 말단 혈액(terminal bleed)을 수집하였다. 초기 스크리닝을 위한 하이브리도마를 생성하기 위해 융합 전에 수집된 물질에 B-세포 정제를 적용하였다.
융합 후 10 일에 ELISA 검정을 사용하여 하이브리도마의 1차 스크리닝을 수행하였다. 384-웰 ELISA 플레이트를 1 ㎍/mL hTIGIT-His 단백질로 코팅하고, 플레이트를 차단한 후, 20 μL의 하이브리도마 상청액을 첨가하고, 플레이트 코팅된 TIGIT에 결합시켰다. 실온에서 인큐베이션한 후, 플레이트를 세척하고, 이어서 플레이트 코팅된 TIGIT에 결합된 항체를 HRP 접합된 염소 항-마우스 IgG 항체를 사용하여 검출하였다.
이어서 양성 하이브리도마 세포를 48-웰 플레이트 내로 확장시키고, 상청액을 수집하여 ELISA 검정에서 항체 특이성을 시험하였다. ELISA 플레이트를 hTIGIT-His 단백질, 또는 cTIGIT-His 단백질로 코팅하고, CD47-His 단백질(Acro Biosystems, Cat# CD7-H5227)을 대조군 카운터 검정으로 사용하여 면역원 단백질의 His-태그를 인식하는 항체를 배제하였다. 이어서, His-태깅된 대조군 단백질에 대해 음성이면서, 인간 및 시노 TIGIT 둘 모두에 대한 양성 결합을 나타내는 항체를, TIGIT/CD155 결합의 기능적 차단에 대해 시험하였다.
인간 TIGIT 세포외 도메인을 마우스 Fc 서열에 융합시키고, 이러한 hTIGIT-mFc(서열 번호 87) 단백질을 HEK293 세포에서 발현시키고, 단백질 A 친화성 크로마토그래피에 의해 정제하였다. R&D Systems(Cat# 9174-CD-01M)로부터의 인간 Fc 서열(hCD155-hFc)에 융합된 세포외 도메인을 포함하는 재조합 인간 CD155를 사용하여 CD155/TIGIT 상호작용 차단 검정을 확립하였다. 항체의 기능적 차단 활성을 시험하기 위해, 0.5 ㎍/mL hTIGIT-mFc 단백질을 사용하여 ELISA 플레이트를 코팅하고, 차단 후에, 하이브리도마 상청액을 0.5 ㎍/mL hCD155-hFc 단백질과 함께 첨가하였다. 인큐베이션 후에, ELISA 플레이트를 세척하고, 결합된 hCD155-hFc를 HRP 접합된 염소 항-인간 IgG 항체를 사용하여 검출하였다. 인간 및 시노-TIGIT 둘 모두에 결합할 수 있는 클론이 식별되었으며, 그 항체 결합은 CD155/TIGIT 상호작용을 차단할 수 있었다.
이러한 클론을 추가로 확장시키고, 단백질 G 컬럼을 사용하여 항체를 정제하였다. 이러한 정제된 항체를 유세포 분석법에 의해 세포 표면 상에 발현된 인간 및 시노 TIGIT에 대한 결합에 대해 시험하였다. 전장 인간 TIGIT 클론 2A7(Swiss-Prot Q495A1; 서열 번호 80) 또는 전장 시노 TIGIT 클론 C10(Swiss-Prot A0A2K5UW92; 서열 번호 84)을 발현하는 안정적인 CHO-K1 세포주가 개발되었다. 유동 검정을 위해, 세포를 수집하고, 4℃에서 1 시간 동안 다양한 농도의 항체의 존재(또는 부재) 하에 100 μL의 HBSS 완충액 중에 인큐베이션하였다. HBSS로 세척한 후, 세포 상의 항체 결합을 4℃에서 30 분 동안 2 ㎍/mL의 Alexa488-표지된 염소 항-마우스 IgG 항체(ThermoFisher Scientific, Cat# A-11001)로 검출하였다. 이어서 세포를 세척하고, PBS에 재현탁시키고, Attune NxT 유세포 분석기(ThermoFisher Scientific, 미국 매사추세츠주 월섬 소재)를 사용하는 유세포 분석법을 적용하였다. 전체 단일 세포 집단에 대해 형광 강도의 기하 평균이 얻어졌다. 세포 표면 상에 발현된 인간 및 시노 TIGIT 둘 모두에 결합할 수 있는 항체를, CHO 세포의 표면 상의 인간 TIGIT에 결합하는 재조합 인간 CD155에 대한 이들의 차단 활성에 대해 추가로 시험하였다. 다양한 농도의 항체의 존재 하에 실온에서 1 시간 동안 CHO-hTIGIT 세포(105 세포)를 2.5 ㎍/mL hCD155-Fc 단백질과 함께 인큐베이션하였다. HBSS 완충액으로 세척한 후, hTIGIT-CHO 세포에 결합하는 hCD155-Fc를 PerCP-eFluor 710 접합된 항-CD155 항체(ThermoFisher, Cat# 1550-42)로 검출하였다. 이어서 세포를 세척하고 유세포 분석을 적용하였다. 표 4는 인간 및 시노 TIGIT에 결합하는 항체의 반수 최대 유효 농도(EC50)(n=2)뿐만 아니라, TIGIT에 결합하는 CD155의 억제에 대한 IC50을 나타낸다.
[표 4]
상위 하이브리도마 세포주는 인간 및 시노 TIGIT 둘 모두에 대한 이들의 결합 친화성, 및 TIGIT와의 CD155 결합을 차단하는 이들의 능력에 기초하여 선택되었다. 이러한 클론의 하이브리도마를 확장시키고 마우스 항-TIGIT 항체의 중쇄 및 경쇄 가변 영역(각각 VH 및 VL) 서열의 결정을 표준 절차에 따라 실행하였다. 항체 21F8, 30M18, 24F8, 5J24, 21B9, 22B22, 28P24, 21B16, 및 28O12의 성숙 VH 및 VL의 아미노산 서열을 도 1a 내지 도 1i에 나타내며, 이들의 CDR은 밑줄로 나타낸다. CDR 서열의 할당 및 아미노산 위치의 넘버링은 Kabat 정의에 따른다.
도 1a 내지 도 1i에 나타낸 항체 중 7개는 마우스 가변 도메인 및 인간 IgG1/카파 불변 도메인을 갖는 마우스 인간 키메라로서 재조합적으로 발현되었다. 재조합 단백질을 HEK293 세포로부터 발현시키고, 단백질 A 친화성 크로마토그래피에 의해 정제하였다.
세포 표면 과발현된 인간 및 시노 TIGIT에 대한 이러한 키메라 항-TIGIT 항체의 결합 능력을 이전에 기재된 유세포 분석법 검정을 이용하여 확인하였다. hTIGIT-CHO 또는 cTIGIT-CHO와 키메라 항-TIGIT 항체의 인큐베이션 후에, Alexa488 접합된 염소 항-인간 IgG 항체(ThermoFisher Scientific, Cat# A-11013)를 사용하여 결합된 항체를 검출하였다. hTIGIT-CHO-K1 세포에 결합하는 재조합 hCD155-hFc를 억제함에 있어서의 항체 기능적 활성을 이전에 기재된 바와 같은 유동 검정을 사용하여 또한 결정하였다. 인간 및 시노 TIGIT에 결합하는 항-TIGIT 키메라 항체의 EC50뿐만 아니라, hTIGIT 발현 세포에 결합하는 hCD155의 억제에 대한 IC50을 결정하였으며, 표 5에 제시하였다.
[표 5]
단리된 인간 CD4+ 및 CD8+ 세포 상에 내인성으로 발현된 TIGIT에 결합하는 키메라 항-TIGIT 항체의 능력을 유세포 분석법 검정을 사용하여 시험하였다. 각각 RosetteSepTM 인간 CD4+ T 세포 농축 칵테일(Stemcell, Cat# 15022) 또는 인간 CD8+ T 세포 농축 칵테일(Stemcell, Cat# 15022)을 사용하여, 인간 전혈로부터 인간 CD4+ 또는 CD8+ T 세포를 단리하였다. 표 6에 나타낸 바와 같이, 인간 CD4+ 또는 CD8+ 세포에 결합하는 재조합 항-TIGIT 항체에 대한 유사한 EC50이 관찰되었으며, 이는 CHO-K1 세포 상의 과발현된 전장 인간 TIGIT에 대한 이들의 결합 친화성과 유사하였다. 그러나, 클론들 사이에서 최대 결합 활성(MFImax)의 차이가 관찰되었다.
[표 6]
시노몰구스 원숭이 전혈에 결합하는 재조합 항-TIGIT 키메라 항체를 시험하여 CD4+ 및 CD8+ 세포 상의 내인성 시노 TIGIT 단백질에 결합하는 항체의 능력을 확인하였다. 시노몰구스 원숭이 전혈을 20 ㎍/mL, 5 ㎍/mL, 1 ㎍/mL, 및 0.2 ㎍/mL의 재조합 항-TIGIT 키메라 항체와 함께 인큐베이션하였다. 4℃에서 30 분 인큐베이션 후에, 실온에서 15 분 동안 RBC 용해를 수행하였다. 이어서 세포를 세척하고, 원심분리에 의해 수집하고, Fc block(BD Biosciences, Cat# 564219) 및 Live-dead fixable Aqua(Invitrogen, Cat# L34957)를 함유하는 칵테일로 차단하였다. 세포 결합된 항-TIGIT 항체를 항-인간 IgG Fc-바이오틴(Southern Biotech, Cat# 9040-08)으로 30 분 동안 4℃에서 검출하였으며, 세포를 세척하고 원심분리하는 단계 및 30 분 동안 4℃에서 PE-접합된 스트렙타비딘(Invitrogen, Cat# 12-4317-87)을 이용한 제2 인큐베이션이 이어졌다. 야생형 인간 IgG1 항체를 동종형 대조군으로 사용하였고, 직접 접합된 항-인간 TIGIT-PE(eBiosciences, Cat# 12-9500-42)를 양성 대조군으로 사용하였다. 도 2는 Ch24F8, Ch28O12, 및 Ch22B22가 시노 CD4+ 및 CD8+ 세포 상에 발현되는 시노 TIGIT에 결합할 수 있었음을 나타낸다. 형광 강도의 기하 평균(gMFI)이 얻어졌으며, 데이터는 동종형 대조군에 비교한 gMFI의 배수로서 제시되었다.
인간 TIGIT에 대한 이러한 재조합 항-TIGIT 항체의 동역학적 결합은 Bio-Rad ProteOn XPR36 기기를 사용하는 표면 플라즈몬 공명(SPR)에 의해 결정되었다. 단백질 A 코팅된 GLC 센서 칩을 사용하여 재조합 항체를 고정시키고, 가용성 His-태깅된 TIGIT(Acro Biosystems, Cat# No. TIT-H52H3)를 분석물로 사용하였다. 결합 상수는 25℃에서 결정되었다. 표 7에 나타낸 바와 같이, 평형 해리 상수(KD)에 의해 측정된 바와 같이 클론 24F8은 7개의 시험된 재조합 항-TIGIT 키메라 항체 중에서 가장 높은 결합 친화성을 갖는다.
[표 7]
실시예 2. 인간화 항-TIGIT 항체의 생성
CDR 그라프팅 기술을 사용하는 인간화를 위해 마우스 항체 24F8을 선택하였다(문헌[Queen et al, Proc. Natl. Acad. Sci. USA. 86:10029-10033, 1989]). 24F8의 마우스 가변 중쇄(VH) 및 가변 경쇄(VL) 서열을 사용하여 각각의 사슬에 대해 가장 가까운 2개의 인간 생식세포계열을 식별하였다. VH의 경우, 70% 서열 동일성을 갖는 IGHV4-34*09, 및 66% 동일성을 갖는 IGHV4-4*02가 확인되었다. VL의 경우, 70% 서열 동일성을 갖는 IGKV1-33*01, 및 67% 동일성을 갖는 IGKV3-15*01이 확인되었다(표 8).
[표 8]
VH 사슬 내의 3개의 중쇄 CDR(HC-CDR) 서열 및 VL 사슬 내의 3개의 경쇄 CDR(LC-CDR) 서열의 위치설정은 Kabat에 따라 정의되었다.
VH 및 VL 프레임워크에 대한 인간 수용자를 GenBank 데이터베이스 내에서 검색하였고(문헌[Benson et al., Nucleic Acids Res. 2005, 33, D34-D38]), 인간 cDNA를 코딩하는 VH 및 VL 서열을 식별하였다(표 8 참조).
VH 수용자에 대해 HC-CDR1(서열 번호 48), HC-CDR2(서열 번호 49), 및 HC-CDR3(서열 번호 50)을 사용하고, VL 수용자에 대해 LC-CDR1(서열 번호 51), LC-CDR2(서열 번호 52), 및 LC-CDR3(서열 번호 53)을 사용하여, 각각의 인간 수용자에 대해 CDR 그라프팅을 수행하였다. 생성된 서열은 임의의 잠재적인 번역후 변형 또는 화학적 분해 부위의 도입에 대해 검사되었고, 그러한 문제점이 없는 것으로 확인되었다. 항체 상동성 그래픽 모델링을 사용하여 마우스 역돌연변이에 대한 추정 잔기를 또한 식별하였다.
올리고뉴클레오티드는 2개의 VH 및 2개의 VL 그라프트된 인간 수용자에 대한 인간 IgG1/카파 불변 도메인을 갖는 Fab 단편으로서 설계되고 합성되었으며, 단백질 정제에 대한 필요 없이, 발현 수준 및 생물물리학적 특성의 고 처리량 스크리닝을 위해 벡터 시스템 내로 삽입되었다(Zhang & Hirama, 특허 출원 공개 US 2012/0178110). VH1(서열 번호 76) 또는 VH2(서열 번호 78)과 VL1(서열 번호 79) 또는 VL2(서열 번호 77)의 4개의 조합 모두(도 1j 내지 도 1m)를 마우스 24F8VH(서열 번호 5) 및 24F8VL(서열 번호 6) 도메인 및 인간 IgG1/카파 Fab 불변 도메인으로부터 작제된 키메라 Fab ㎷H+㎷L과 함께 스크리닝하였다. SASA(혈청 알부민에 대한 단일-도메인 항체) 융합 단백질로서 분비된 Fab의 상청액을, BSA 코팅된 칩 및 가용성 His-태깅된 TIGIT를 분석물로 사용하는 Fab 포획과 함께 Biacore 8K 기기를 사용하는 표면 플라즈몬 공명(SPR)에 의해 분석하였다. 인간 및 시노 TIGIT에 대한 동역학적 결합 데이터를 표 9에 5개의 Fab 단편에 대해 나타낸다.
[표 9]
이러한 데이터는 평형 해리 상수(KD)에 의해 측정된 바와 같이 VH1+VL2 및 VH2+VL2의 인간화 가변 도메인 조합은 인간 및 시노 TIGIT 둘 모두에 가장 단단하게 결합되었으며, 또한 마우스/인간 키메라 Fab의 결합 친화성의 대부분을 유지하였음을 입증하였다. 그 결과로서, 마우스 프레임워크 잔기 역돌연변이를 함유하는 작제물은 조사하지 않았다. 각각 전장 Hu24F8.1 및 Hu24F8.2 IgG1/카파 항체의 작제물 설계를 위해 이러한 2개의 VH/VL 조합(도 1j 및 도 1k)을 선택하였다.
Hu24F8.1-IgG1.AA 및 Hu24F8.2-IgG1.AA는 서열 번호 97의 아미노산 서열을 갖는 중쇄 불변 영역 및 서열 번호 95의 아미노산 서열을 갖는 경쇄 불변 영역을 갖는 IgG1/카파 항체이다. "IgG1.AA" 지정은 중쇄 불변 영역이 위치 234 및 235(Eu 넘버링)에서 류신으로부터 알라닌으로의 아미노산 치환을 갖는다는 것을 표시한다. 대조적으로, "IgG1" 지정은 야생형 IgG1 Fc 영역을 표시한다. 예를 들어, Hu24F8.2-IgG1은 서열 번호 94의 아미노산 서열을 갖는 중쇄 불변 영역 및 서열 번호 95의 아미노산 서열을 갖는 경쇄 불변 영역을 갖는 IgG1/카파 항체이다. 이러한 실시예에 사용된 Hu24F8.1-IgG1.AA, Hu24F8.2-IgG1.AA, 및 Hu24F8.2-IgG1 항체는 HEK293 또는 CHO 세포에서 재조합적으로 생성되었고 단백질 A 친화성 크로마토그래피에 의해 정제되었다.
정제된 전장 항체 Hu24F8.1-IgG1.AA(VH1+VL2를 함유함) 및 Hu24F8.2-IgG1.AA(VH2+VL2를 함유함)를, 24F8 마우스 VH+VL 및 인간 IgG1/카파 불변 도메인의 전장 키메라 항체(Ch24F8)와 함께, 항-인간 IgG 코팅된 칩 및 가용성 hTIGIT-His 또는 cTIGIT-His를 분석물로 사용하는 항체 포획과 함께 Biacore T200 기기를 사용하는 SPR에 의해 분석하였다. 인간 및 시노 TIGIT에 대한 동역학적 결합 데이터를 표 10에 나타낸다.
[표 10]
둘 모두의 전장 인간화 항체에 대한 동역학적 결합 친화성 데이터에 의해, 마우스 항체의 결합 친화성이 완전히 유지되었고 임의의 마우스 프레임워크 잔기 역돌연변이를 도입할 필요가 없음이 확인되었다.
실시예 3. 항-TIGIT 항체의 시험관내 결합 연구
세포 표면 상에 발현된 TIGIT에 대한 항체 Hu24F8.1-IgG1.AA 및 Hu24F8.2-IgG1.AA의 결합을 유세포 분석법에 의해 검사하였다. 세포 표면 상에 TIGIT를 발현하는 세포를 수집하고, 4℃에서 1 시간 동안 다양한 농도의 항체의 존재(또는 부재) 하에 100 μL의 HBSS 완충액 중에 인큐베이션하였다. HBSS로 세척한 후, 세포 상의 항체 결합을 4℃에서 30 분 동안 2 ㎍/mL의 Alexa488-표지된 염소 항-인간 IgG 항체(ThermoFisher Scientific, Cat# A-11013)로 검출하였다. 이어서 세포를 세척하고, PBS에 재현탁시키고, Attune NxT 유세포 분석기(ThermoFisher Scientific, 미국 매사추세츠주 월섬 소재)를 사용하는 유세포 분석법을 적용하였다. 전체 단일 세포 집단에 대해 형광 강도의 기하평균을 얻었으며, 일시적인 형질감염을 위해, 형질감염되지 않은 세포를 사용하여 양성 결합 세포 집단에 대해 게이팅하여 양성 세포의 백분율을 얻었다. 표준 4-파라미터 곡선 피팅을 사용하여 GraphPad Prism에 의해 데이터를 계산하였다.
상기 기재된 바와 같이, Hu24F8.1-IgG1.AA 및 Hu24F8.2-IgG1.AA를 각각 인간 TIGIT 및 시노 TIGIT에 대한 이들의 결합에 대해 시험하기 위해, 인간 TIGIT(클론 2A7) 및 시노 TIGIT(클론 C10)를 발현하는 안정적인 CHO-K1 세포주를 사용하였다. Hu24F8.1-IgG1.AA는 인간 TIGIT에 EC50 0.447 ± 0.22 nM(n=8)로 결합하였고(도 3a) 시노 TIGIT에 0.237 ± 0.33 nM(n=6)의 EC50으로 결합하였다(도 3b). Hu24F8.2-IgG1.AA는 인간 TIGIT에 EC50 0.29 ± 0.15 nM(n=8)로 결합하였고(도 3a) 시노 TIGIT에 0.35 ± 0.16 nM(n=6)의 EC50으로 결합하였다(도 3b). 이러한 결과는 Hu24F8.1-IgG1.AA 및 Hu24F8.2-IgG1.AA 둘 모두가 세포 표면 상에 발현된 인간 및 시노 TIGIT에 단단히 결합함을 나타낸다.
마우스 TIGIT(Swiss-Prot Q86176; 서열 번호 88) 및 래트 TIGIT(Swiss-Prot D3ZTQ2; 서열 번호 89)에 대한 Hu24F8.2-IgG1.AA의 결합을 전장 마우스 또는 래트 TIGIT 발현 작제물로 일시적으로 형질감염된 CHO-K1 세포를 사용하여 검사하였다. 마우스 TIGIT 발현은 대조군 항체 GNE10A7(미국 특허 제9,499,596호, Clark 등, 2016)을 사용하여 확인하였고, 래트 TIGIT 발현은 대조군 항체 eBioscience™ G1GD7(Invitrogen, Cat# 12-9501-82)을 사용하여 확인하였다. Hu24F8.2-IgG1.AA는 최대 30 nM의 항체로 시험할 경우에 마우스 TIGIT(도 4a) 또는 래트 TIGIT(도 4b)에 결합하지 않는다.
단리된 인간 CD8+ T 세포에 대한 Hu24F8.2-IgG1.AA의 결합을 유세포 분석법에 의해 검사하였다. 제조사 권장에 따라 RosetteSepTM 인간 CD8+ T 세포 농축 칵테일(Stemcell, Cat# 15023)을 사용하여 CD8+ T 세포를 단리하였다. 이어서 7 내지 9 일 동안 20 U/mL rhIL-2 보충제를 갖는 항-CD3/CD28 비드로 세포를 활성화시켰다. 활성화되거나 활성화되지 않은 CD8+ 세포를 인간 Fc block(BD Biosciences, Cat# 564219)으로 차단한 후, 유세포 분석법 항체 결합 검정을 적용하였다. 도 5a 및 도 5b에 나타낸 바와 같이, 각각 활성화되지 않은 세포의 경우에는 0.098 ± 0.013 nM(n =2), 그리고 활성화된 CD8+ 세포의 경우에는 0.14 ± 0.036 nM(n =2)의 EC50으로, Hu24F8.2-IgG1.AA는 CD8+ 세포에 결합한다. 활성화된 CD8+ 세포 및 활성화되지 않은 CD8+ 세포에 대해 결합 EC50은 유사하더라도, 최대 결합 신호에는 유의한 차이가 있으며, 이는 활성화시의 세포 표면 상의 CD8+ 상의 상승된 TIGIT 발현과 일치한다.
실시예 4. 항-TIGIT 항체의 시험관내 차단 연구
실시예 1에 기재된 바와 같이, 인간 TIGIT(CHO-hTIGIT) 및 인간 CD155-Fc 융합 재조합 가용성 단백질(hCD155-Fc)을 안정적으로 과발현하는 CHO 세포를 사용하는 유세포 분석법에 의해, TIGIT와 CD155의 상호작용을 차단하는 Hu24F8.1-IgG1.AA 및 Hu24F8.2-IgG1.AA의 활성을 분석하였다. 도 6에 나타낸 바와 같이, Hu24F8.1-IgG1.AA 및 Hu24F8.2-IgG1.AA 둘 모두는 세포 표면 상의 hCD155-Fc와 CHO-hTIGIT 사이의 상호작용을 용량-의존적 방식으로 차단하였다. Hu24F8.1-IgG1.AA의 경우에 TIGIT-CD155 상호작용을 차단하는 IC50은 0.68 nM이었고, Hu24F8.2-IgG1.AA의 경우에 그것은 0.67 nM이었다.
실시예 5. 항-TIGIT 항체의 Jurkat 이중 리포터 세포주 특성화
Promega의 TIGIT/CD155 차단 생물검정(Promega, Cat# J2205)을 사용하여, 인간 TIGIT 수용체를 차단하는 Hu24F8.1-IgG1.AA 및 Hu24F8.2-IgG1.AA의 기능적 활성을 검정하였다. 이러한 검정에서, 이펙터 세포주는 과발현된 TIGIT뿐만 아니라 T 세포 수용체(TCR)의 하류에서 활성화되는 루시페라제 리포터를 갖는 Jurkat 세포주이다. 다른 안정적인 세포주는, TCR에 결합하고 활성화시키는 T 세포 활성화제 단백질에 대해 부가적으로, 인간 CD155를 과발현하는 CHO-K1 세포주이다. 이러한 CD155 aAPC/CHO-K1 세포주는 인공 항원-제시 세포로서 기능한다. 이러한 2개의 세포주의 공동-배양은 CHO-K1 세포 상의 aAPC에 의한 TCR 활성화를 유발하고, 이는 리포터 작제물을 활성화시킬 것이지만, 그러한 경로 활성화는 TIGIT/CD155 상호작용에 의해 억제되어 낮은 루시페라제 신호를 유발한다. 항-TIGIT 항체의 존재는 TIGIT/CD155 상호작용을 억제할 것이며, 이는 TIGIT 억제 효과를 방출하여, 증가된 루시페라제 신호를 유발한다. 제조사의 프로토콜에 따라 검정이 수행되었으며, 약술하면, 이펙터 Jurkat 세포를 세포 배양 인큐베이터에서 96-웰 플레이트 내에 하룻밤 회복시키고, 시험 항체를 연속 희석하여 이펙터 세포에 첨가하고, 이어서 항원 제시 CD155 aAPC/CHO-K1 세포를 첨가하였다. 37℃ 5% CO2에서 6 시간 공동-배양 후에, 루시페라제 기질 Bio-Glo 시약을 첨가하고, Envision(PerkinElmer) 상에서 발광 신호를 판독하였다. 도 7에 나타낸 바와 같이, Hu24F8.1-IgG1.AA는 3.35 ± 0.26 nM(n=3)의 EC50으로 리포터 활성을 용량 의존적으로 향상시킬 수 있었으며, 반면에 Hu24F8.2-IgG1.AA는 2.78 ± 0.83 nM(n=3)의 EC50을 나타냈다. 인간 IgG1 대조군은 임의의 효과를 나타내지 않았다.
실시예 6. 항-TIGIT 항체의 분자 분석
TIGIT 및 Fab 발현, 정제, 결정화
인간 TIGIT(잔기 22 내지 130)의 성숙 세포외 도메인의 가용성 단백질을 HEK293 세포에서 재조합적으로 발현시켰다. 작제물(서열 번호 90)은 (Gly)4-Ala-(Gly)4 링커를 갖는 C-말단 헥사-히스티딘 태그를 함유하였고, N-글리코실화를 위한 부위를 제거하기 위해 아스파라긴 잔기 32 및 101은 글루타민으로 돌연변이화되었다. 청징화된 상청액을 Nickel Sepharose Excel(GE Healthcare Life Sciences) 컬럼을 사용하는 친화성 크로마토그래피에 이어서 Superdex 200 pg(GE Healthcare Life Sciences) 컬럼을 사용하는 크기 배제 크로마토그래피(SEC)에 의해 정제하였다. TIGIT 단백질은 8.4 mg/mL의 농도로 20 mM Tris pH 7.0, 100 mM NaCl의 최종 완충액 제형 내에 존재하였으며, 액체 질소로 급속 냉동시켰다.
포스페이트 완충 식염수 중에 37℃에서 3 시간 동안의 파파인(Thermo Scientific, Cat. #20341) 분해에 이어서, 실온에서의 하룻밤 분해에 의해 인간 IgG1 항체 Hu24F8.2-IgG1.AA의 가용성 Fab 단편(Fab24F8)을 제조하였다. MabSelect SuRe 단백질 A(GE Healthcare Life Sciences) 컬럼을 사용하여 절단된 Fc 단편을 제거하고 Superdex 200 pg(GE Healthcare Life Sciences) 컬럼을 사용하는 SEC에 의해 관류액을 추가로 정제하였다. Fab24F8 단백질은 28 mg/mL의 농도로 20 mM Tris pH 7.0, 100 mM NaCl의 최종 완충액 제형 내에 존재하였으며, 액체 질소로 급속 냉동시켰다.
4℃에서 60 분 동안 교반하면서 TIGIT를 Fab24F8 단백질과 1:1의 몰비로 혼합하여 Fab-TIGIT 복합체를 형성하였으며, Superdex 200 pg(GE Healthcare Life Sciences) 컬럼 및 44 mg/mL의 단백질 용출액의 농도를 사용하는 최종 SEC 정제가 이어졌다. 정제된 복합체는 대략 1500개의 상이한 조건을 갖는 표준 스크리닝을 사용하는 20℃에서의 결정화 시험에 사용되었다. 초기에 얻어진 조건은 표준 전략, 결정화에 중요하게 영향을 미치는 체계적으로 변동되는 파라미터를 사용하여 최적화되었다. 이러한 조건은 체계적으로 변동되는 pH 또는 침전제 농도에 의해 추가로 정련되었다. 시팅 드롭 증기 확산(sitting drop vapor diffusion) 기술을 사용하여 0.1 μL의 단백질 용액(20 mM Tris pH 7.0; 100 mM NaCl 중의 15 mg/mL)을 0.1 μL의 저장 용액(20%(w/v) PEG3350; 0.20 M LiSO4)과 혼합함으로써 구조 규명에 적합한 Fab-TIGIT 복합체의 결정을 얻었다.
데이터 수집 및 구조 해석
결정을 급속 냉동시키고 100 K의 온도에서 측정하였다. 극저온 조건을 사용하는 Canadian Light Source(CLS, 캐나다 새스커툰 소재)에서 Fab-TIGIT 복합체의 결정으로부터 X-선 회절 데이터를 수집하였다. 결정은 공간군 P 1에 속한다. 컴퓨터 소프트웨어 프로그램 autoPROC, XDS, 및 AIMLESS(문헌[The CCP4 Suite: Programs for Protein Crystallography". Acta Cryst. D50, 760-763])를 사용하여 데이터를 처리하였으며, 표 11을 참조한다.
[표 11]
구조를 결정하고 분석하기 위해 필요한 위상 정보는 분자 대체에 의해 얻어졌다. 이전에 해석된 Fab(문헌[Bohrmann et al., J. Alzheimers Dis. 28:49-69, 2012]) 및 TIGIT(문헌[Stengel et al., Proc. Natl. Acad. Sci. USA, 2012])의 구조를 검색 모델로 사용하였다. 결정학적 비대칭 단위 내에 Fab-TIGIT 복합체의 3개의 분자가 존재한다. 후속 모델 구축 및 정련은 각각 프로그램 COOT 및 소프트웨어 패키지 CCP4를 이용한 표준 프로토콜에 따라 수행되었다. 최종 모델의 정확성을 교차-검증하기 위한 척도인 자유 R-인자의 계산을 위해, 측정된 반사의 약 4.6%가 정련 절차로부터 배제되었다. TLS 정련(CCP4 프로그램 REFMAC5를 사용함)을 실행하였으며, 이는 더 낮은 R-인자 및 전자 밀도 맵의 더 높은 품질을 유발하였다. 자동으로 생성된 국소 NCS 구속을 적용하였다. 3.0 σ에서 컨투어링된 Fo-Fc 맵의 피크에 물 분자를 넣은 후에 REFMAC5로 정련하고 COOT의 검증 툴로 모든 물을 점검함으로써 COOT의 "Find waters" 알고리즘으로 물 모델을 구축하였다. 의심스러운 물의 목록에 대한 기준은, 80 Å2 초과의 B-인자, 1.2 σ 미만의 2Fo-Fc 맵, 2.3 Å 미만 또는 3.5 Å 초과의 가장 가까운 접점까지의 거리이다. 73.5 내지 2.24 Å의 해상도 범위 내의 데이터가 정련의 최종 주기 내에 있었으며 R결정 및 R자유 R-인자는 각각 22.3 및 26.8%였다. 최종 모델의 라마찬드란 플롯은 가장 바람직한 영역에서 모든 잔기의 89.8%, 추가로 허용되는 영역에서 8.8%, 및 관대하게 허용되는 영역에서 0.7%를 나타낸다. 정련의 요약에 대해서는 표 12를 참조한다.
[표 12]
인간 TIGIT에 결합된 Fab24F8의 구조
결정학적 비대칭 단위 내에 복합체의 3개의 독립적인 분자가 존재하며, 이의 원자 좌표는 모든 비-수소 원자에 대해 0.53 내지 1.13 Å의 제곱-평균-제곱근 편차로 서로 쌍별 중첩된다. 최종 모델은 Fab 중쇄의 Gln1 내지 Ser223, Fab 경쇄의 Gln1 내지 Cys214, 및 TIGIT의 Met22 내지 Ser129를 포함한다. 일부 짧은 루프 영역은 전자 밀도에 의해 완전히 정의되지 않았으며 최종 모델에 포함되지 않는다.
Fab 중쇄 HC-CDR2 및 HC-CDR3 및 경쇄의 LC-CDR 3개 모두는 TIGIT의 거대 β-시트 구조, 즉, 서열 번호 80의 폴리펩티드 사슬 55TQVNWEQQDQLLAICNADLGWHISPSFK82 및 109IYH111로 구성되는 β-가닥 C, C', C'' 및 F 및 루프 C'C'' 및 C''D와 광범위한 상호작용을 형성한다(도 8 및 도 9). 이러한 결합 상호작용은 Fab 단편과 TIGIT 사이에(PISA, EMBL-EBI) 표면적이 790 ±10 Å2(n=3)인 단백질-단백질 계면을 생성한다. 이러한 상호작용의 분자적 성질은 친수성 및 소수성 둘 모두이다. TIGIT 잔기 Thr55, Gln56, Asn58, Glu60, Asp72, Ser80, 및 Lys82(도 9에 스틱 표현으로 나타냄)는 Fab 중쇄 및 경쇄 CDR의 잔기와 직접 또는 물-매개 수소 결합 상호작용(3.1 Å 이하의 공여자/수용자 원자간 거리)을 형성한다. 부가적으로, TIGIT 잔기 Glu60은 Fab 경쇄 상의 Arg30과 염 가교를 형성한다(표 13). TIGIT 소수성 잔기 Leu65, Ile68, Leu73, Pro79, 및 Ile109(도 9에 구에 의해 나타냄)는 Fab 중쇄 및 경쇄의 잔기와 반 데르 발스 접촉을 이룬다.
[표 13]
도 10a는, 문헌[Stengel et al., 2012]에 의해 보고된 바와 같이, 인간 TIGIT(분자 표면으로서 나타냄)에 결합된 인간 CD155(리본 표현으로)의 N-말단 Ig-유사 도메인(서열 번호 91)의 복합체 구조의 개략도를 나타낸다. 도 10b는 도 10a와 동일한 배향으로, TIGIT에 결합된 Fab24F8의 결정 구조 복합체(각각 분자 표면에 의해 나타냄)의 개략도 상의 CD155의 중첩을 나타낸다. TIGIT의 세포외 도메인에 결합하는, Hu24F8.2, 또는 마우스 항체 24F8로부터 유래된 다른 항체는 CD155가 TIGIT에 결합하는 것을 차단할 것임이 명확하게 입증될 수 있다.
실시예 7. 항-TIGIT 항체는 단독으로 또는 항-PD-1 항체와 조합하여 둘 모두 T 세포 반응을 향상시킨다
본 실시예는 Hu24F8.2-IgG1이 단독으로 또는 AB122와 같은 항-PD-1 항체와 조합되어 건강한 대상체 또는 암 대상체 인간 1차 T 세포 반응을 향상시킨다는 것을 입증한다. 0.1, 1, 또는 10 ㎍/mL Hu24F8.2-IgG1로 치료된 건강한 대상체 및 암 대상체 PBMC는 동종형 대조군과 비교하여 IL-2 농도를 유의하게 증가시켰다. 건강한 대상체로부터의 PBMC에서, 10 ㎍/mL Hu24F8.2-IgG1 및 1 ㎍/mL 항-인간 PD-1 항체(AB122, 짐베렐리맙)의 조합을 이용한 치료는 AB122 단독과 비교하여 유의하게 더 높은 IL-2 수준을 가졌다.
건강한 대상체로부터의 PBMC는 Leukoreduction System(LRS) 챔버로부터 단리되었고, 암 대상체로부터의 PBMC는 CPT 튜브로부터 단리되었고, 0.1, 1, 또는 10 ㎍/mL Hu24F8.2, 1 ㎍/mL AB122, 또는 10 ㎍/mL Hu24F8.2-IgG1 및 1 ㎍/mL Ab122의 조합과 함께, 시험관내에서 1 ng/mL의 SEA의 존재 하에 배양되었다. 4 일 후에, 상청액 내의 IL-2 농도를 세포계측 비드 어레이(CBA)에 의해 측정하였다. IgG1 동종형을 음성 대조군으로서 포함시켰다.
방법
건강한 대상체 PBMC는 LRS 챔버로부터 단리된 반면에, 암 대상체 PBMC는 CPT 튜브로부터 단리되었다. PBMC를 2 x 106 세포/mL의 농도로 재현탁시키고 100 μL/웰을 96-웰 둥근-바닥 플레이트 내에 분주하였다. CTS Optimizer 배지에 재현탁된 50 μL/웰의 4x 농축된 항체를 적절한 웰에 첨가하였다: Hu24F8.2-IgG1 또는 인간 IgG1 동종형 대조군은 0.1, 1, 및 10 ㎍/mL의 최종 농도에 대해 첨가하였고, AB122 또는 인간 IgG4 동종형 대조군은 1 ㎍/mL의 최종 농도에 대해 첨가하였다. 검정 플레이트를 37℃, 5% CO2에서 1 시간 동안 인큐베이션하였다. CTS Optimizer 배지에 재현탁된 50 μL/웰의 4x 농축된 스타필로코커스 장독소 A(SEA)를 1 ng/mL의 최종 농도에 대해 적절한 웰에 첨가하였다. 200 μL의 최종 웰 부피를 갖는 검정 플레이트를 37℃, 5% CO2에서 4 일 동안 인큐베이션하고, 분비된 IL-2의 후속 정량화를 위해 상청액을 수집하였다. 상청액을 인간 가용성 단백질 마스터 완충액 키트로부터의 검정 희석제에 1:2로 희석하였다. 제조사의 설명서에 따라 인간 가용성 단백질 마스터 완충액 키트와 함께 인간 IL-2 Flex 세트를 사용하여 검정 실행, 데이터 획득, 및 정량화를 수행하였다.
결과
연구에 사용된 모든 공여자로부터의 PBMC는 CD14+ 단핵구 집단 상의 CD155(TIGIT에 대한 리간드) 및 SEA 자극에 반응하는 비-T 조절 세포 CD4+ T 세포 집단 상에 TIGIT를 발현하는 것으로 확인되었다. 10 명의 건강한 대상체 및 7 명의 암 대상체로부터 단리된 PBMC를 1 ng/mL의 SEA의 존재 하에 0.1, 1, 또는 10 ㎍/mL Hu24F8.2-IgG1 단독, 1 ㎍/mL AB122 단독, 또는 10 ㎍/mL Hu24F8.2-IgG1 및 1 ㎍/mL AB122의 조합과 함께 각각 배양하였다. 4 일 후에 상층액에서 IL-2 농도를 측정하였다. Hu24F8.2 치료군으로부터의 IL-2 수준은 각각의 IgG1 동종형 대조군 치료군으로부터의 IL-2 수준에 비교한 반면에, AB122 및 Hu24F8.2-IgG1 조합 치료군으로부터의 IL-2 수준은 AB122 단독 치료군으로부터의 IL-2 수준에 비교하였다(표 14 및 표 15). 도 11에는 시험된 Hu24F8.2-IgG1의 모든 농도에 대해 1 명의 건강한 대상체(#566)에 대한 IL-2 수준의 예를 나타낸다. 이러한 2 명의 대상체의 경우, 각각의 IgG1 동종형 대조군에 비교하여 시험된 Hu24F8.2-IgG1의 모든 농도에서 IL-2 분비의 통계적으로 유의한 증가가 있었다. 건강한 대상체 #566의 경우, AB122 치료 단독과 비교하여 AB122 및 Hu24F8.2-IgG1 조합 치료에 의한 IL-2 분비의 통계적으로 유의한 증가가 또한 있었다. 코호트 수준에서, 건강한 대상체 및 암 대상체 PBMC 둘 모두에서의 IgG1 동종형 대조군에 비교하여 10 ㎍/mL Hu24F8.2-IgG1 치료에 의한 IL-2 분비의 통계적으로 유의한 증가가 있었고(도12a), 건강한 대상체 PBMC에서의 AB122 치료 단독과 비교하여 AB122 및 Hu24F8.2-IgG1 조합 치료에 의한 IL-2 분비의 통계적으로 유의한 증가가 있었다(도 12b). 요약하면, 0.1 ㎍/mL Hu24F8.2-IgG1은 6/10 건강한 대상체 PBMC 샘플(1.1 내지 3.4-배) 및 2/5 암 대상체 PBMC 샘플(1.6 내지 1.7-배)에서 IL-2 농도를 유의하게 증가시켰고(동종형 대비), 1 ㎍/mL Hu24F8.2-IgG1은 7/10 건강한 대상체 PBMC 샘플(1.4 내지 4.0-배) 및 4/7 암 대상체 PBMC 샘플(1.6 내지 2.0-배)에서 IL-2 농도를 유의하게 증가시켰고(동종형 대비), 10 ㎍/mL Hu24F8.2-IgG1은 7/10 건강한 대상체 PBMC 샘플(1.2 내지 4.0-배) 및 4/7 암 대상체 PBMC 샘플(1.3 내지 2.0-배)에서 IL-2 농도를 유의하게 증가시켰고(동종형 대비), 10 ㎍/mL Hu24F8.2-IgG1 + AB122는 6/10 건강한 대상체 PBMC 샘플(1.9 내지 8.3-배)에서 IL-2 농도를 증가시켰다(AB122 단독 대비).
[표 14]
[표 15]
이러한 데이터는 Hu24F8.2-IgG1이 단독으로 또는 AB122와 같은 항-PD-1 항체와 조합되어 건강한 대상체 또는 암 대상체 인간 1차 T 세포 반응을 향상시킨다는 것을 입증한다.
실시예 8. 시험관내 보체-의존성 세포독성(CDC) 검정에 의한 항체 특성화
CDC는 항체의 단편 결정화가능(Fc) 영역에 대한 보체 성분 1q(C1q)의 결합을 통해 보체 시스템이 항체-의존성 세포 사멸화에 관여하는 면역 반응이다. 이는 보체 캐스케이드 반응을 개시하여 항체의 Fab 영역에 의해 인식되는 표적 단백질을 발현하는 표적 세포의 세포막을 손상시키는 막 공격 복합체의 형성을 유발한다. 본 실시예에서는, 정상 인간 혈청 보체(NHSC, Quidel)의 존재 하에 GS-J1/TIGIT 세포(GenScript M00693)를 사용하여 Hu24F8.2-IgG1의 CDC 활성을 특성화하였다.
CDC에 의한 세포 용해는 Cell Titer-Glo® 검정 키트(Promega)에 의해 결정되었으며, 이는 ATP의 정량화에 기초하여 배양물 내의 생존 세포의 수를 결정한다. 약술하면, 5%, 10%, 또는 20% NHSC의 존재 하에 37℃에서 5% CO2로 4 시간 동안 GS-J1/TIGIT 세포(5000 세포/웰)를 10 ㎍/mL의 Hu24F8.2-IgG1 또는 인간 IgG1(Abcam) 음성 대조군으로 처리하거나(%NHSC 최적화 검정), 5% NHSC의 존재 하에 37℃에서 5% CO2로 4 시간 동안 GS-J1/TIGIT 세포(5000 세포/웰)를 Hu24F8.2-IgG1(10 ㎍/mL) 또는 인간 IgG1(10 ㎍/mL)의 연속 희석액으로 처리하였다(CDC 농도 반응 연구). 양성 대조군으로서, 5% NHSC의 존재 하에 37℃에서 5% CO2로 4 시간 동안 Raji 세포(ATCC CCL-86, (5000 세포/웰))를 리툭시맙(10 ㎍/mL)의 연속 희석액으로 처리하였다. 시험 항체 또는 대조군 항체와 함께 인큐베이션한 후에, Cell Titer-Glo® 시약을 첨가하고, 샘플을 추가의 10 내지 30 분 동안 실온에서 인큐베이션하고, PHERAstar FSX(BMG LabTech) 상에서 발광을 판독하였다. CDC로 인한 세포 용해는 하기 수학식으로 계산하였다: % 세포 용해 = 100% x (1- (RLU샘플 - RLUNHSC) / (RLU세포+NHSC - RLUNHSC)).
시스템 제어(Raji 세포에 대한 리툭시맙)의 결과는 둘 모두의 시험에서 품질 관리 표준을 충족시켰다. 그러나, 시험 샘플(Hu24F8.2-IgG1) 또는 음성 대조군(인간 IgG1)의 농도 의존성 CDC 활성은 %NHSC 최적화 검정 또는 CDC 농도 반응 연구에서 관찰되지 않았다. 결과는 각각 표 16 및 표 17에 요약되어 있다. GS-J1/TIGIT 세포에 결합하는 Hu24F8.2-IgG1의 FACS 분석을 사용하여, CDC의 결여는 표적 세포 결합의 부재로 인한 것이 아니었음을 확인하였다(데이터는 나타내지 않음).
[표 16]
[표 17]
실시예 9. SPR에 의한 항체 특성화
Hu24F8.2-IgG1은 6개의 상이한 밀도로 항-인간 IgG 코팅된 칩 또는 단백질 A 코팅된 칩을 사용하는 항체 포획과 함께 BioRad ProteOn XPR36 기기를 사용하는 SPR에 의해 분석하였다. 분석물은 가용성 hTIGIT-His(33.3 μM로 제조된 스톡 용액)였으며, 이를 최고 농도로서 33 nM로 희석하고 3-배 연속 희석으로 Hu24F8.2-IgG1 표면 위에서 삼중실험으로 시험하였다. 실행 완충액은 10 mM HEPES, 150 mM NaCl, 0.05% tween-20, 및 0.2 mg/mL BSA를 함유하였다. 모든 데이터는 25℃에서 수집되었다. 6개의 표면 밀도 모두로부터의 데이터는 국소 Rmax를 사용하여 1:1 상호작용 모델에 전체적으로 피팅되었다. 결과는 표 18에 나타낸다.
[표 18]
SEQUENCE LISTING
<110> Arcus Biosciences, Inc.
<120> Antibodies to TIGIT
<130> 050658-531001WO
<140> Herewith
<141> Herewith
<150> US 63/033,609
<151> 2020-06-02
<160> 101
<170> PatentIn version 3.5
<210> 1
<211> 120
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic construct
<220>
<221> MISC_FEATURE
<223> Mouse mAb 21F8 heavy chain, amino acid
<400> 1
Ser Asp Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser
1 5 10 15
Gln Ser Leu Ser Leu Thr Cys Thr Val Thr Gly Tyr Ser Ile Thr Ser
20 25 30
Asp Tyr Ala Trp Asn Trp Ile Arg Gln Phe Pro Gly Asn Lys Leu Glu
35 40 45
Trp Met Gly Tyr Ile Ser Tyr Ser Gly Ser Thr Ser Tyr Asn Pro Ser
50 55 60
Leu Lys Ser Arg Ile Ser Ile Thr Arg Asp Thr Ser Lys Asn Gln Phe
65 70 75 80
Phe Leu Gln Leu Asn Ser Val Thr Thr Glu Asp Thr Ala Thr Tyr Tyr
85 90 95
Cys Ala Arg Phe Met Ile Thr Thr Phe Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Ala Val Thr Val Ser Ser
115 120
<210> 2
<211> 107
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic construct
<220>
<221> MISC_FEATURE
<223> Mouse mAb 21F8 light chain, amino acid
<400> 2
Asp Ile Val Met Thr Gln Ser His Lys Phe Met Ser Thr Ser Val Gly
1 5 10 15
Asp Arg Val Ser Ile Thr Cys Lys Ala Ser Gln His Val Ser Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Pro Tyr Arg Tyr Thr Gly Val Pro Asp Arg Phe Thr Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Val Gln Ala
65 70 75 80
Glu Asp Leu Ala Val Tyr Tyr Cys Gln Gln His Tyr Asn Thr Leu Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 3
<211> 119
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic construct
<220>
<221> MISC_FEATURE
<223> Mouse mAb 30M18 heavy chain, amino acid
<400> 3
Glu Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Thr Ser Gly Tyr Thr Phe Thr Glu Tyr
20 25 30
Thr Met His Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu Trp Ile
35 40 45
Gly Gly Ile Asn Pro Asn Asn Gly Gly Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Gly His Met Asp Tyr Gly Tyr Val Tyr Trp Gly Gln Gly
100 105 110
Thr Thr Leu Thr Val Ser Ser
115
<210> 4
<211> 107
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic construct
<220>
<221> MISC_FEATURE
<223> Mouse mAb 30M18 light chain, amino acid
<400> 4
Asp Ile Val Met Thr Gln Ser His Lys Phe Met Ser Thr Ser Val Gly
1 5 10 15
Asp Arg Val Ser Ile Thr Cys Lys Ala Ser Gln Tyr Val Ser Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Pro Ser Tyr Arg Tyr Thr Gly Val Pro Asp Arg Phe Thr Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Val Gln Ala
65 70 75 80
Glu Asp Leu Ala Val Tyr Tyr Cys Gln Gln His Tyr Ser Thr Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 5
<211> 122
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic construct
<220>
<221> MISC_FEATURE
<223> Mouse mAb 24F8 heavy chain, amino acid
<400> 5
Ser Asp Val Gln Leu Gln Glu Ser Gly Pro Asp Leu Val Lys Pro Ser
1 5 10 15
Gln Ser Leu Ser Leu Thr Cys Thr Val Thr Gly Tyr Ser Ile Thr Ser
20 25 30
Gly Tyr Ser Trp His Trp Ile Arg Gln Phe Pro Gly Asn Lys Leu Asp
35 40 45
Trp Met Gly Tyr Val His Tyr Ser Gly Ser Thr Asn Tyr Asn Pro Ser
50 55 60
Leu Lys Ser Arg Ile Ser Ile Thr Arg Asp Thr Ser Lys Asn Gln Phe
65 70 75 80
Phe Leu Gln Leu Asn Ser Val Thr Thr Glu Asp Thr Ala Thr Phe Tyr
85 90 95
Cys Ala Arg Met Asp Tyr Gly Asn Tyr Gly Gly Ala Met Asp Tyr Trp
100 105 110
Gly Gln Gly Thr Ser Val Thr Val Ser Ser
115 120
<210> 6
<211> 107
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic construct
<220>
<221> MISC_FEATURE
<223> Mouse mAb 24F8 light chain, amino acid
<400> 6
Glu Ile Val Met Thr Gln Ser His Lys Phe Met Ser Thr Ser Val Gly
1 5 10 15
Asp Arg Val Ser Ile Thr Cys Lys Ala Ser Gln Asp Val Arg Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Tyr Arg Tyr Thr Gly Val Pro Asp Arg Phe Thr Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Val Gln Ala
65 70 75 80
Glu Asp Leu Ala Val Tyr Tyr Cys Gln Gln Tyr Tyr Ser Thr Gln Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 7
<211> 120
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic construct
<220>
<221> MISC_FEATURE
<223> Mouse mAb 5J24 heavy chain, amino acid
<400> 7
Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Val Arg Pro Gly Thr
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ala Gly Tyr Thr Phe Thr Asn His
20 25 30
Trp Ile Gly Trp Val Lys Gln Arg Pro Gly His Gly Leu Glu Trp Ile
35 40 45
Gly Asp Ile Tyr Pro Gly Gly Gly Tyr Thr Asn Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Ala Asp Thr Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Tyr Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Ile Tyr Tyr Cys
85 90 95
Ala Arg Ser Tyr Gly Tyr Asp Leu Tyr Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Ser Val Thr Val Ser Ser
115 120
<210> 8
<211> 107
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic construct
<220>
<221> MISC_FEATURE
<223> Mouse mAb 5J24 light chain, amino acid
<400> 8
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
Glu Arg Val Ser Leu Thr Cys Arg Ala Ser Gln Glu Ile Ser Gly Tyr
20 25 30
Leu Ser Trp Leu Gln Gln Lys Pro Asp Gly Thr Ile Lys Arg Leu Ile
35 40 45
Tyr Ala Ala Ser Thr Leu Gly Ser Gly Val Pro Lys Arg Phe Ser Gly
50 55 60
Ser Arg Ser Gly Ser Asp Tyr Ser Leu Thr Ile Ser Ser Leu Glu Ser
65 70 75 80
Glu Asp Phe Ala Asp Tyr Tyr Cys Leu Gln Tyr Asp Ser Tyr Pro Phe
85 90 95
Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys
100 105
<210> 9
<211> 119
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic construct
<220>
<221> MISC_FEATURE
<223> Mouse mAb 21B9 heavy chain, amino acid
<400> 9
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Lys Leu Ser Cys Thr Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ser Pro Glu Lys Arg Leu Glu Trp Val
35 40 45
Ala Glu Ile Ser Ser Gly Gly Ser Tyr Thr Tyr Tyr Thr Asp Thr Val
50 55 60
Thr Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr
65 70 75 80
Leu Glu Met Ser Ser Leu Arg Ser Glu Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Lys Arg Arg Asp Tyr Tyr Gly Met Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Ser Val Thr Val Ser Ser
115
<210> 10
<211> 107
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic construct
<220>
<221> MISC_FEATURE
<223> Mouse mAb 21B9 light chain, amino acid
<400> 10
Asp Val Gln Ile Thr Gln Ser Pro Ser Tyr Leu Ala Ala Ser Pro Gly
1 5 10 15
Glu Thr Ile Thr Ile Asn Cys Arg Ala Ser Lys Ser Ile Ser Lys Tyr
20 25 30
Leu Ala Trp Tyr Gln Glu Lys Pro Gly Lys Thr Asn Lys Leu Leu Ile
35 40 45
Tyr Ser Gly Ser Thr Leu Gln Thr Gly Ile Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Met Tyr Tyr Cys Gln Gln His Asn Glu Tyr Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 11
<211> 119
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic construct
<220>
<221> MISC_FEATURE
<223> Mouse mAb 22B22 heavy chain, amino acid
<400> 11
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ser Pro Glu Lys Arg Leu Glu Trp Val
35 40 45
Ala Glu Ile Ser Ser Gly Gly Ser Tyr Thr Tyr Tyr Pro Asp Thr Val
50 55 60
Thr Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr
65 70 75 80
Leu Glu Met Ser Ser Leu Arg Ser Glu Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Lys Arg Arg Asp Tyr Tyr Ala Met Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Ser Val Thr Val Ser Ser
115
<210> 12
<211> 107
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic construct
<220>
<221> MISC_FEATURE
<223> Mouse mAb 22B22 and Mouse mAb 28O12 light chain, amino acid
<400> 12
Asp Val Gln Ile Thr Gln Ser Pro Ser Tyr Leu Ala Ala Ser Pro Gly
1 5 10 15
Glu Thr Ile Thr Ile Asn Cys Arg Ala Ser Lys Ser Ile Ser Lys Tyr
20 25 30
Leu Ala Trp Tyr Gln Glu Lys Pro Gly Lys Thr Asn Lys Leu Leu Ile
35 40 45
Tyr Ser Gly Ser Thr Leu Gln Ser Gly Ile Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Met Tyr Tyr Cys Gln Gln His Asn Glu Tyr Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 13
<211> 118
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic construct
<220>
<221> MISC_FEATURE
<223> Mouse mAb 28P24 heavy chain, amino acid
<400> 13
Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Val Arg Pro Gly Thr
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ala Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Phe Ile Gly Trp Val Lys Gln Arg Pro Gly His Gly Leu Asp Trp Ile
35 40 45
Gly Asp Ile Tyr Pro Gly Gly Gly Tyr Thr Asn Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Ala Asp Thr Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Ile Tyr Tyr Cys
85 90 95
Val Arg Phe Tyr Gly Asn Tyr Val Phe Ala Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ala
115
<210> 14
<211> 107
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic construct
<220>
<221> MISC_FEATURE
<223> Mouse mAb 28P24 light chain, amino acid
<400> 14
Asp Val Gln Ile Thr Gln Ser Pro Ser Cys Leu Ala Ala Ser Pro Gly
1 5 10 15
Glu Thr Ile Thr Ile Asn Cys Arg Ala Ser Lys Thr Ile Ser Lys Tyr
20 25 30
Leu Ala Trp Tyr Gln Glu Lys Pro Gly Lys Thr Asn Lys Leu Leu Ile
35 40 45
Tyr Ser Gly Ser Thr Leu Gln Ser Gly Ile Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Met Tyr Tyr Cys Gln Gln His Asn Glu Tyr Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 15
<211> 119
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic construct
<220>
<221> MISC_FEATURE
<223> Mouse mAb 21B16 heavy chain, amino acid
<400> 15
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Thr Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ser Pro Glu Lys Arg Leu Glu Trp Val
35 40 45
Ala Glu Ile Ser Ser Gly Gly Thr Tyr Thr Tyr Phe Pro Asp Thr Val
50 55 60
Thr Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr
65 70 75 80
Leu Glu Met Ser Ser Leu Arg Ser Glu Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Lys Arg Arg Asp Tyr Tyr Ala Met Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Ser Val Thr Val Ser Ser
115
<210> 16
<211> 107
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic construct
<220>
<221> MISC_FEATURE
<223> Mouse mAb 21B16 light chain, amino acid
<400> 16
Asp Val Gln Ile Thr Gln Ser Pro Ser Tyr Leu Ala Ala Ser Pro Gly
1 5 10 15
Glu Thr Ile Thr Ile Asn Cys Arg Ala Ser Lys Ser Ile Ser Lys Tyr
20 25 30
Leu Ala Trp Tyr Gln Glu Lys Pro Gly Lys Thr Asn Lys Leu Leu Ile
35 40 45
Tyr Ser Gly Ser Thr Leu Gln Ser Gly Ile Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln His Asn Glu Tyr Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 17
<211> 119
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic construct
<220>
<221> MISC_FEATURE
<223> Mouse mAb 28O12 heavy chain, amino acid
<400> 17
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ser Pro Glu Lys Arg Leu Glu Trp Val
35 40 45
Ala Glu Ile Ser Gly Gly Gly Ser Tyr Thr Tyr His Pro Asp Thr Val
50 55 60
Thr Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr
65 70 75 80
Leu Glu Met Ser Ser Leu Arg Ser Glu Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Lys Arg Arg Asp Tyr Tyr Ala Met Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Ser Val Thr Val Ser Ser
115
<210> 18
<211> 360
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic construct
<220>
<221> MISC_FEATURE
<223> Mouse mAb 21F8 heavy chain, nucleotide
<400> 18
Thr Cys Thr Gly Ala Thr Gly Thr Gly Cys Ala Gly Cys Thr Thr Cys
1 5 10 15
Ala Gly Gly Ala Gly Thr Cys Gly Gly Gly Ala Cys Cys Thr Gly Gly
20 25 30
Cys Cys Thr Gly Gly Thr Gly Ala Ala Ala Cys Cys Thr Thr Cys Thr
35 40 45
Cys Ala Gly Thr Cys Thr Cys Thr Gly Thr Cys Cys Cys Thr Cys Ala
50 55 60
Cys Cys Thr Gly Cys Ala Cys Thr Gly Thr Cys Ala Cys Thr Gly Gly
65 70 75 80
Cys Thr Ala Cys Thr Cys Ala Ala Thr Cys Ala Cys Cys Ala Gly Thr
85 90 95
Gly Ala Thr Thr Ala Thr Gly Cys Cys Thr Gly Gly Ala Ala Cys Thr
100 105 110
Gly Gly Ala Thr Cys Cys Gly Gly Cys Ala Gly Thr Thr Thr Cys Cys
115 120 125
Ala Gly Gly Ala Ala Ala Cys Ala Ala Ala Cys Thr Gly Gly Ala Gly
130 135 140
Thr Gly Gly Ala Thr Gly Gly Gly Cys Thr Ala Cys Ala Thr Ala Ala
145 150 155 160
Gly Cys Thr Ala Cys Ala Gly Thr Gly Gly Thr Ala Gly Cys Ala Cys
165 170 175
Thr Ala Gly Cys Thr Ala Cys Ala Ala Cys Cys Cys Ala Thr Cys Thr
180 185 190
Cys Thr Cys Ala Ala Ala Ala Gly Thr Cys Gly Ala Ala Thr Cys Thr
195 200 205
Cys Thr Ala Thr Cys Ala Cys Thr Cys Gly Ala Gly Ala Cys Ala Cys
210 215 220
Ala Thr Cys Cys Ala Ala Gly Ala Ala Cys Cys Ala Gly Thr Thr Cys
225 230 235 240
Thr Thr Cys Cys Thr Gly Cys Ala Gly Thr Thr Gly Ala Ala Thr Thr
245 250 255
Cys Thr Gly Thr Gly Ala Cys Thr Ala Cys Thr Gly Ala Gly Gly Ala
260 265 270
Cys Ala Cys Ala Gly Cys Cys Ala Cys Ala Thr Ala Thr Thr Ala Cys
275 280 285
Thr Gly Thr Gly Cys Ala Ala Gly Ala Thr Thr Thr Ala Thr Gly Ala
290 295 300
Thr Thr Ala Cys Gly Ala Cys Gly Thr Thr Thr Gly Cys Thr Ala Thr
305 310 315 320
Gly Gly Ala Cys Thr Ala Cys Thr Gly Gly Gly Gly Thr Cys Ala Ala
325 330 335
Gly Gly Ala Ala Cys Cys Gly Cys Ala Gly Thr Cys Ala Cys Cys Gly
340 345 350
Thr Cys Thr Cys Cys Thr Cys Ala
355 360
<210> 19
<211> 321
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic construct
<220>
<221> MISC_FEATURE
<223> Mouse mAb 21F8 light chain, nucleotide
<400> 19
Gly Ala Cys Ala Thr Thr Gly Thr Gly Ala Thr Gly Ala Cys Cys Cys
1 5 10 15
Ala Gly Thr Cys Thr Cys Ala Cys Ala Ala Ala Thr Thr Cys Ala Thr
20 25 30
Gly Thr Cys Ala Ala Cys Ala Thr Cys Ala Gly Thr Ala Gly Gly Ala
35 40 45
Gly Ala Cys Ala Gly Gly Gly Thr Cys Ala Gly Cys Ala Thr Cys Ala
50 55 60
Cys Cys Thr Gly Cys Ala Ala Gly Gly Cys Cys Ala Gly Thr Cys Ala
65 70 75 80
Gly Cys Ala Thr Gly Thr Gly Ala Gly Thr Ala Cys Thr Gly Cys Thr
85 90 95
Gly Thr Ala Gly Cys Cys Thr Gly Gly Thr Ala Thr Cys Ala Ala Cys
100 105 110
Ala Gly Ala Ala Ala Cys Cys Ala Gly Gly Ala Cys Ala Ala Thr Cys
115 120 125
Thr Cys Cys Thr Ala Ala Ala Cys Thr Ala Cys Thr Gly Ala Thr Thr
130 135 140
Thr Ala Cys Thr Cys Gly Gly Cys Ala Cys Cys Cys Thr Ala Cys Cys
145 150 155 160
Gly Gly Thr Ala Cys Ala Cys Thr Gly Gly Ala Gly Thr Cys Cys Cys
165 170 175
Thr Gly Ala Thr Cys Gly Cys Thr Thr Cys Ala Cys Thr Gly Gly Cys
180 185 190
Ala Gly Thr Gly Gly Ala Thr Cys Thr Gly Gly Gly Ala Cys Gly Gly
195 200 205
Ala Thr Thr Thr Cys Ala Cys Thr Thr Thr Cys Ala Cys Cys Ala Thr
210 215 220
Cys Ala Gly Cys Ala Gly Thr Gly Thr Gly Cys Ala Gly Gly Cys Thr
225 230 235 240
Gly Ala Ala Gly Ala Cys Cys Thr Gly Gly Cys Ala Gly Thr Thr Thr
245 250 255
Ala Thr Thr Ala Cys Thr Gly Thr Cys Ala Gly Cys Ala Ala Cys Ala
260 265 270
Thr Thr Ala Thr Ala Ala Thr Ala Cys Thr Cys Thr Gly Thr Gly Gly
275 280 285
Ala Cys Gly Thr Thr Cys Gly Gly Thr Gly Gly Ala Gly Gly Cys Ala
290 295 300
Cys Cys Ala Ala Gly Cys Thr Gly Gly Ala Ala Ala Thr Cys Ala Ala
305 310 315 320
Ala
<210> 20
<211> 357
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic construct
<220>
<221> MISC_FEATURE
<223> Mouse mAb 30M18 heavy chain, nucleotide
<400> 20
Gly Ala Gly Gly Thr Cys Cys Ala Gly Cys Thr Gly Cys Ala Ala Cys
1 5 10 15
Ala Gly Thr Cys Thr Gly Gly Ala Cys Cys Thr Gly Ala Gly Cys Thr
20 25 30
Gly Gly Thr Gly Ala Ala Gly Cys Cys Thr Gly Gly Gly Gly Cys Thr
35 40 45
Thr Cys Ala Gly Thr Gly Ala Ala Gly Ala Thr Ala Thr Cys Cys Thr
50 55 60
Gly Cys Ala Ala Gly Ala Cys Thr Thr Cys Thr Gly Gly Ala Thr Ala
65 70 75 80
Cys Ala Cys Ala Thr Thr Cys Ala Cys Thr Gly Ala Ala Thr Ala Cys
85 90 95
Ala Cys Cys Ala Thr Gly Cys Ala Cys Thr Gly Gly Gly Thr Gly Ala
100 105 110
Ala Gly Cys Ala Gly Ala Gly Cys Cys Ala Thr Gly Gly Ala Ala Ala
115 120 125
Gly Ala Gly Cys Cys Thr Thr Gly Ala Gly Thr Gly Gly Ala Thr Thr
130 135 140
Gly Gly Ala Gly Gly Thr Ala Thr Thr Ala Ala Thr Cys Cys Thr Ala
145 150 155 160
Ala Cys Ala Ala Thr Gly Gly Thr Gly Gly Thr Ala Cys Thr Ala Gly
165 170 175
Thr Thr Ala Thr Ala Ala Cys Cys Ala Gly Ala Ala Gly Thr Thr Thr
180 185 190
Ala Ala Gly Gly Gly Cys Ala Ala Gly Gly Cys Cys Ala Cys Ala Thr
195 200 205
Thr Gly Ala Cys Thr Gly Thr Ala Gly Ala Cys Ala Ala Gly Thr Cys
210 215 220
Cys Thr Cys Cys Ala Gly Cys Ala Cys Ala Gly Cys Cys Thr Ala Cys
225 230 235 240
Ala Thr Gly Gly Ala Gly Cys Thr Cys Cys Gly Cys Ala Gly Cys Cys
245 250 255
Thr Gly Ala Cys Ala Thr Cys Thr Gly Ala Gly Gly Ala Thr Thr Cys
260 265 270
Thr Gly Cys Ala Gly Thr Cys Thr Ala Thr Thr Ala Cys Thr Gly Thr
275 280 285
Gly Cys Ala Ala Gly Ala Thr Cys Gly Gly Gly Gly Cys Ala Thr Ala
290 295 300
Thr Gly Gly Ala Cys Thr Ala Cys Gly Gly Cys Thr Ala Cys Gly Thr
305 310 315 320
Cys Thr Ala Cys Thr Gly Gly Gly Gly Cys Cys Ala Ala Gly Gly Cys
325 330 335
Ala Cys Cys Ala Cys Thr Cys Thr Cys Ala Cys Ala Gly Thr Cys Thr
340 345 350
Cys Cys Thr Cys Ala
355
<210> 21
<211> 321
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic construct
<220>
<221> MISC_FEATURE
<223> Mouse mAb 30M18 light chain, nucleotide
<400> 21
Gly Ala Cys Ala Thr Thr Gly Thr Gly Ala Thr Gly Ala Cys Cys Cys
1 5 10 15
Ala Gly Thr Cys Thr Cys Ala Cys Ala Ala Ala Thr Thr Cys Ala Thr
20 25 30
Gly Thr Cys Cys Ala Cys Ala Thr Cys Ala Gly Thr Ala Gly Gly Ala
35 40 45
Gly Ala Cys Ala Gly Gly Gly Thr Cys Ala Gly Cys Ala Thr Cys Ala
50 55 60
Cys Cys Thr Gly Cys Ala Ala Gly Gly Cys Cys Ala Gly Thr Cys Ala
65 70 75 80
Ala Thr Ala Thr Gly Thr Gly Ala Gly Thr Ala Cys Thr Gly Cys Thr
85 90 95
Gly Thr Ala Gly Cys Cys Thr Gly Gly Thr Ala Thr Cys Ala Ala Cys
100 105 110
Ala Gly Ala Ala Ala Cys Cys Ala Gly Gly Ala Cys Ala Ala Thr Cys
115 120 125
Thr Cys Cys Thr Ala Ala Ala Cys Thr Ala Cys Thr Gly Ala Thr Thr
130 135 140
Thr Ala Cys Thr Cys Gly Cys Cys Ala Thr Cys Cys Thr Ala Cys Cys
145 150 155 160
Gly Gly Thr Ala Cys Ala Cys Thr Gly Gly Ala Gly Thr Cys Cys Cys
165 170 175
Thr Gly Ala Thr Cys Gly Cys Thr Thr Cys Ala Cys Thr Gly Gly Cys
180 185 190
Ala Gly Thr Gly Gly Ala Thr Cys Thr Gly Gly Gly Ala Cys Gly Gly
195 200 205
Ala Thr Thr Thr Cys Ala Cys Thr Thr Thr Cys Ala Cys Cys Ala Thr
210 215 220
Cys Ala Gly Cys Ala Gly Thr Gly Thr Gly Cys Ala Gly Gly Cys Thr
225 230 235 240
Gly Ala Ala Gly Ala Cys Cys Thr Gly Gly Cys Ala Gly Thr Thr Thr
245 250 255
Ala Thr Thr Ala Cys Thr Gly Thr Cys Ala Gly Cys Ala Ala Cys Ala
260 265 270
Thr Thr Ala Thr Ala Gly Thr Ala Cys Thr Cys Cys Gly Thr Gly Gly
275 280 285
Ala Cys Gly Thr Thr Cys Gly Gly Thr Gly Gly Ala Gly Gly Cys Ala
290 295 300
Cys Cys Ala Ala Gly Cys Thr Gly Gly Ala Ala Ala Thr Cys Ala Ala
305 310 315 320
Ala
<210> 22
<211> 366
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic construct
<220>
<221> MISC_FEATURE
<223> Mouse mAb 24F8 heavy chain, nucleotide
<400> 22
Thr Cys Thr Gly Ala Thr Gly Thr Gly Cys Ala Gly Cys Thr Thr Cys
1 5 10 15
Ala Gly Gly Ala Gly Thr Cys Ala Gly Gly Ala Cys Cys Thr Gly Ala
20 25 30
Cys Cys Thr Gly Gly Thr Gly Ala Ala Ala Cys Cys Thr Thr Cys Thr
35 40 45
Cys Ala Gly Thr Cys Ala Cys Thr Thr Thr Cys Ala Cys Thr Cys Ala
50 55 60
Cys Cys Thr Gly Cys Ala Cys Thr Gly Thr Cys Ala Cys Thr Gly Gly
65 70 75 80
Cys Thr Ala Cys Thr Cys Cys Ala Thr Cys Ala Cys Cys Ala Gly Thr
85 90 95
Gly Gly Thr Thr Ala Thr Ala Gly Cys Thr Gly Gly Cys Ala Cys Thr
100 105 110
Gly Gly Ala Thr Cys Cys Gly Gly Cys Ala Gly Thr Thr Thr Cys Cys
115 120 125
Ala Gly Gly Ala Ala Ala Cys Ala Ala Ala Cys Thr Gly Gly Ala Thr
130 135 140
Thr Gly Gly Ala Thr Gly Gly Gly Cys Thr Ala Cys Gly Thr Thr Cys
145 150 155 160
Ala Cys Thr Ala Cys Ala Gly Thr Gly Gly Thr Ala Gly Cys Ala Cys
165 170 175
Thr Ala Ala Cys Thr Ala Cys Ala Ala Cys Cys Cys Ala Thr Cys Thr
180 185 190
Cys Thr Cys Ala Ala Ala Ala Gly Thr Cys Gly Ala Ala Thr Cys Thr
195 200 205
Cys Thr Ala Thr Cys Ala Cys Thr Cys Gly Ala Gly Ala Cys Ala Cys
210 215 220
Ala Thr Cys Cys Ala Ala Gly Ala Ala Cys Cys Ala Gly Thr Thr Cys
225 230 235 240
Thr Thr Cys Cys Thr Gly Cys Ala Gly Thr Thr Gly Ala Ala Thr Thr
245 250 255
Cys Thr Gly Thr Gly Ala Cys Thr Ala Cys Thr Gly Ala Gly Gly Ala
260 265 270
Cys Ala Cys Ala Gly Cys Cys Ala Cys Ala Thr Thr Thr Thr Ala Cys
275 280 285
Thr Gly Thr Gly Cys Ala Ala Gly Ala Ala Thr Gly Gly Ala Cys Thr
290 295 300
Ala Thr Gly Gly Thr Ala Ala Cys Thr Ala Cys Gly Gly Gly Gly Gly
305 310 315 320
Gly Gly Cys Thr Ala Thr Gly Gly Ala Cys Thr Ala Cys Thr Gly Gly
325 330 335
Gly Gly Thr Cys Ala Ala Gly Gly Ala Ala Cys Cys Thr Cys Ala Gly
340 345 350
Thr Cys Ala Cys Cys Gly Thr Cys Thr Cys Cys Thr Cys Ala
355 360 365
<210> 23
<211> 321
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic construct
<220>
<221> MISC_FEATURE
<223> Mouse mAb 24F8 light chain, nucleotide
<400> 23
Gly Ala Gly Ala Thr Thr Gly Thr Gly Ala Thr Gly Ala Cys Cys Cys
1 5 10 15
Ala Gly Thr Cys Thr Cys Ala Cys Ala Ala Ala Thr Thr Cys Ala Thr
20 25 30
Gly Thr Cys Cys Ala Cys Ala Thr Cys Ala Gly Thr Ala Gly Gly Gly
35 40 45
Gly Ala Cys Ala Gly Gly Gly Thr Cys Ala Gly Cys Ala Thr Cys Ala
50 55 60
Cys Cys Thr Gly Cys Ala Ala Gly Gly Cys Cys Ala Gly Thr Cys Ala
65 70 75 80
Gly Gly Ala Thr Gly Thr Gly Ala Gly Ala Ala Cys Thr Gly Cys Thr
85 90 95
Gly Thr Ala Gly Cys Cys Thr Gly Gly Thr Ala Thr Cys Ala Ala Cys
100 105 110
Ala Gly Ala Ala Ala Cys Cys Ala Gly Gly Ala Cys Ala Ala Thr Cys
115 120 125
Thr Cys Cys Thr Ala Ala Ala Cys Thr Ala Cys Thr Gly Ala Thr Thr
130 135 140
Thr Ala Thr Thr Cys Gly Gly Cys Ala Thr Cys Cys Thr Ala Cys Cys
145 150 155 160
Gly Gly Thr Ala Cys Ala Cys Thr Gly Gly Ala Gly Thr Cys Cys Cys
165 170 175
Thr Gly Ala Thr Cys Gly Cys Thr Thr Cys Ala Cys Thr Gly Gly Cys
180 185 190
Ala Gly Thr Gly Gly Ala Thr Cys Thr Gly Gly Gly Ala Cys Gly Gly
195 200 205
Ala Thr Thr Thr Cys Ala Cys Thr Thr Thr Cys Ala Cys Cys Ala Thr
210 215 220
Cys Ala Gly Cys Ala Gly Thr Gly Thr Gly Cys Ala Gly Gly Cys Thr
225 230 235 240
Gly Ala Ala Gly Ala Cys Cys Thr Gly Gly Cys Ala Gly Thr Thr Thr
245 250 255
Ala Thr Thr Ala Cys Thr Gly Thr Cys Ala Gly Cys Ala Ala Thr Ala
260 265 270
Thr Thr Ala Thr Ala Gly Thr Ala Cys Thr Cys Ala Gly Thr Gly Gly
275 280 285
Ala Cys Gly Thr Thr Cys Gly Gly Thr Gly Gly Ala Gly Gly Cys Ala
290 295 300
Cys Cys Ala Ala Gly Cys Thr Gly Gly Ala Ala Ala Thr Cys Ala Ala
305 310 315 320
Ala
<210> 24
<211> 360
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic construct
<220>
<221> MISC_FEATURE
<223> Mouse mAb 5J24 heavy chain, nucleotide
<400> 24
Cys Ala Gly Gly Thr Cys Cys Ala Gly Cys Thr Gly Cys Ala Gly Cys
1 5 10 15
Ala Gly Thr Cys Thr Gly Gly Ala Gly Cys Thr Gly Ala Gly Cys Thr
20 25 30
Gly Gly Thr Ala Ala Gly Gly Cys Cys Thr Gly Gly Gly Ala Cys Thr
35 40 45
Thr Cys Ala Gly Thr Gly Ala Ala Gly Ala Thr Gly Thr Cys Cys Thr
50 55 60
Gly Cys Ala Ala Gly Gly Cys Thr Gly Cys Thr Gly Gly Ala Thr Ala
65 70 75 80
Cys Ala Cys Cys Thr Thr Cys Ala Cys Thr Ala Ala Cys Cys Ala Cys
85 90 95
Thr Gly Gly Ala Thr Ala Gly Gly Thr Thr Gly Gly Gly Thr Ala Ala
100 105 110
Ala Gly Cys Ala Gly Ala Gly Gly Cys Cys Thr Gly Gly Ala Cys Ala
115 120 125
Thr Gly Gly Cys Cys Thr Thr Gly Ala Gly Thr Gly Gly Ala Thr Thr
130 135 140
Gly Gly Ala Gly Ala Thr Ala Thr Thr Thr Ala Cys Cys Cys Thr Gly
145 150 155 160
Gly Ala Gly Gly Thr Gly Gly Thr Thr Ala Thr Ala Cys Thr Ala Ala
165 170 175
Cys Thr Ala Cys Ala Ala Thr Gly Ala Gly Ala Ala Gly Thr Thr Cys
180 185 190
Ala Ala Gly Gly Gly Cys Ala Ala Gly Gly Cys Cys Ala Cys Ala Cys
195 200 205
Thr Gly Ala Cys Thr Gly Cys Ala Gly Ala Cys Ala Cys Ala Thr Cys
210 215 220
Cys Thr Cys Cys Ala Gly Cys Ala Cys Ala Gly Cys Cys Thr Ala Cys
225 230 235 240
Ala Thr Gly Thr Ala Cys Cys Thr Cys Ala Gly Cys Ala Gly Cys Cys
245 250 255
Thr Gly Ala Cys Ala Thr Cys Thr Gly Ala Gly Gly Ala Cys Thr Cys
260 265 270
Thr Gly Cys Cys Ala Thr Cys Thr Ala Thr Thr Ala Cys Thr Gly Thr
275 280 285
Gly Cys Ala Ala Gly Ala Thr Cys Cys Thr Ala Thr Gly Gly Thr Thr
290 295 300
Ala Cys Gly Ala Cys Cys Thr Thr Thr Ala Thr Gly Cys Thr Ala Thr
305 310 315 320
Gly Gly Ala Cys Thr Ala Cys Thr Gly Gly Gly Gly Thr Cys Ala Ala
325 330 335
Gly Gly Ala Ala Cys Cys Thr Cys Ala Gly Thr Cys Ala Cys Cys Gly
340 345 350
Thr Cys Thr Cys Cys Thr Cys Ala
355 360
<210> 25
<211> 321
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic construct
<220>
<221> MISC_FEATURE
<223> Mouse mAb 5J24 light chain, nucleotide
<400> 25
Gly Ala Cys Ala Thr Cys Cys Ala Gly Ala Thr Gly Ala Cys Cys Cys
1 5 10 15
Ala Gly Thr Cys Thr Cys Cys Ala Thr Cys Cys Thr Cys Cys Thr Thr
20 25 30
Ala Thr Cys Thr Gly Cys Cys Thr Cys Thr Cys Thr Gly Gly Gly Ala
35 40 45
Gly Ala Ala Ala Gly Ala Gly Thr Cys Ala Gly Thr Cys Thr Cys Ala
50 55 60
Cys Thr Thr Gly Thr Cys Gly Gly Gly Cys Ala Ala Gly Thr Cys Ala
65 70 75 80
Gly Gly Ala Ala Ala Thr Thr Ala Gly Thr Gly Gly Thr Thr Ala Cys
85 90 95
Thr Thr Ala Ala Gly Cys Thr Gly Gly Cys Thr Thr Cys Ala Gly Cys
100 105 110
Ala Gly Ala Ala Ala Cys Cys Ala Gly Ala Thr Gly Gly Ala Ala Cys
115 120 125
Thr Ala Thr Thr Ala Ala Ala Cys Gly Cys Cys Thr Gly Ala Thr Cys
130 135 140
Thr Ala Cys Gly Cys Cys Gly Cys Ala Thr Cys Cys Ala Cys Thr Thr
145 150 155 160
Thr Ala Gly Gly Thr Thr Cys Thr Gly Gly Thr Gly Thr Cys Cys Cys
165 170 175
Ala Ala Ala Ala Ala Gly Gly Thr Thr Cys Ala Gly Thr Gly Gly Cys
180 185 190
Ala Gly Thr Ala Gly Gly Thr Cys Thr Gly Gly Gly Thr Cys Ala Gly
195 200 205
Ala Thr Thr Ala Thr Thr Cys Thr Cys Thr Cys Ala Cys Cys Ala Thr
210 215 220
Cys Ala Gly Cys Ala Gly Cys Cys Thr Thr Gly Ala Gly Thr Cys Thr
225 230 235 240
Gly Ala Ala Gly Ala Thr Thr Thr Thr Gly Cys Ala Gly Ala Cys Thr
245 250 255
Ala Thr Thr Ala Cys Thr Gly Thr Cys Thr Ala Cys Ala Ala Thr Ala
260 265 270
Thr Gly Ala Thr Ala Gly Thr Thr Ala Thr Cys Cys Gly Thr Thr Cys
275 280 285
Ala Cys Gly Thr Thr Cys Gly Gly Thr Gly Cys Thr Gly Gly Gly Ala
290 295 300
Cys Cys Ala Ala Gly Cys Thr Gly Gly Ala Gly Cys Thr Gly Ala Ala
305 310 315 320
Ala
<210> 26
<211> 357
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic construct
<220>
<221> MISC_FEATURE
<223> Mouse mAb 21B9 heavy chain, nucleotide
<400> 26
Gly Ala Ala Gly Thr Gly Cys Ala Gly Cys Thr Gly Gly Thr Gly Gly
1 5 10 15
Ala Gly Thr Cys Thr Gly Gly Gly Gly Gly Ala Gly Gly Cys Thr Thr
20 25 30
Ala Gly Thr Gly Ala Ala Gly Cys Cys Thr Gly Gly Ala Gly Gly Gly
35 40 45
Thr Cys Cys Cys Thr Gly Ala Ala Ala Cys Thr Cys Thr Cys Cys Thr
50 55 60
Gly Thr Ala Cys Ala Gly Cys Cys Thr Cys Thr Gly Gly Ala Thr Thr
65 70 75 80
Cys Ala Cys Thr Thr Thr Cys Ala Gly Thr Ala Gly Cys Thr Ala Thr
85 90 95
Gly Cys Cys Ala Thr Gly Thr Cys Thr Thr Gly Gly Gly Thr Thr Cys
100 105 110
Gly Cys Cys Ala Gly Thr Cys Thr Cys Cys Ala Gly Ala Gly Ala Ala
115 120 125
Gly Ala Gly Gly Cys Thr Gly Gly Ala Gly Thr Gly Gly Gly Thr Cys
130 135 140
Gly Cys Ala Gly Ala Ala Ala Thr Thr Ala Gly Thr Ala Gly Thr Gly
145 150 155 160
Gly Thr Gly Gly Thr Ala Gly Thr Thr Ala Cys Ala Cys Cys Thr Ala
165 170 175
Cys Thr Ala Thr Ala Cys Ala Gly Ala Cys Ala Cys Thr Gly Thr Gly
180 185 190
Ala Cys Gly Gly Gly Cys Cys Gly Ala Thr Thr Cys Ala Cys Cys Ala
195 200 205
Thr Cys Thr Cys Cys Ala Gly Ala Gly Ala Cys Ala Ala Thr Gly Cys
210 215 220
Cys Ala Ala Gly Ala Ala Cys Ala Cys Cys Cys Thr Gly Thr Ala Cys
225 230 235 240
Cys Thr Gly Gly Ala Ala Ala Thr Gly Ala Gly Cys Ala Gly Thr Cys
245 250 255
Thr Gly Ala Gly Gly Thr Cys Thr Gly Ala Gly Gly Ala Cys Ala Cys
260 265 270
Gly Gly Cys Cys Ala Thr Gly Thr Ala Thr Thr Ala Cys Thr Gly Thr
275 280 285
Gly Cys Ala Ala Gly Gly Ala Ala Ala Cys Gly Ala Cys Gly Gly Gly
290 295 300
Ala Thr Thr Ala Cys Thr Ala Thr Gly Gly Thr Ala Thr Gly Gly Ala
305 310 315 320
Cys Thr Ala Cys Thr Gly Gly Gly Gly Thr Cys Ala Ala Gly Gly Ala
325 330 335
Ala Cys Cys Thr Cys Ala Gly Thr Cys Ala Cys Cys Gly Thr Cys Thr
340 345 350
Cys Cys Thr Cys Ala
355
<210> 27
<211> 321
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic construct
<220>
<221> MISC_FEATURE
<223> Mouse mAb 21B9 light chain, nucleotide
<400> 27
Gly Ala Thr Gly Thr Cys Cys Ala Gly Ala Thr Ala Ala Cys Cys Cys
1 5 10 15
Ala Gly Thr Cys Thr Cys Cys Ala Thr Cys Thr Thr Ala Thr Cys Thr
20 25 30
Thr Gly Cys Thr Gly Cys Ala Thr Cys Thr Cys Cys Thr Gly Gly Ala
35 40 45
Gly Ala Ala Ala Cys Cys Ala Thr Thr Ala Cys Thr Ala Thr Thr Ala
50 55 60
Ala Thr Thr Gly Cys Ala Gly Gly Gly Cys Ala Ala Gly Thr Ala Ala
65 70 75 80
Gly Ala Gly Cys Ala Thr Thr Ala Gly Cys Ala Ala Ala Thr Ala Thr
85 90 95
Thr Thr Ala Gly Cys Cys Thr Gly Gly Thr Ala Thr Cys Ala Ala Gly
100 105 110
Ala Gly Ala Ala Ala Cys Cys Thr Gly Gly Gly Ala Ala Ala Ala Cys
115 120 125
Thr Ala Ala Thr Ala Ala Gly Cys Thr Thr Cys Thr Thr Ala Thr Cys
130 135 140
Thr Ala Thr Thr Cys Thr Gly Gly Ala Thr Cys Cys Ala Cys Thr Thr
145 150 155 160
Thr Gly Cys Ala Ala Ala Cys Thr Gly Gly Ala Ala Thr Thr Cys Cys
165 170 175
Ala Thr Cys Ala Ala Gly Gly Thr Thr Cys Ala Gly Thr Gly Gly Cys
180 185 190
Ala Gly Thr Gly Gly Ala Thr Cys Thr Gly Gly Thr Ala Cys Ala Gly
195 200 205
Ala Thr Thr Thr Cys Ala Cys Thr Cys Thr Cys Ala Cys Cys Ala Thr
210 215 220
Cys Ala Gly Thr Ala Gly Cys Cys Thr Gly Gly Ala Gly Cys Cys Thr
225 230 235 240
Gly Ala Ala Gly Ala Thr Thr Thr Thr Gly Cys Ala Ala Thr Gly Thr
245 250 255
Ala Thr Thr Ala Cys Thr Gly Thr Cys Ala Ala Cys Ala Gly Cys Ala
260 265 270
Thr Ala Ala Thr Gly Ala Ala Thr Ala Cys Cys Cys Gly Thr Gly Gly
275 280 285
Ala Cys Gly Thr Thr Cys Gly Gly Thr Gly Gly Ala Gly Gly Cys Ala
290 295 300
Cys Cys Ala Ala Gly Cys Thr Gly Gly Ala Ala Ala Thr Cys Ala Ala
305 310 315 320
Ala
<210> 28
<211> 357
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic construct
<220>
<221> MISC_FEATURE
<223> Mouse mAb 22B22 heavy chain, nucleotide
<400> 28
Gly Ala Ala Gly Thr Gly Cys Ala Gly Cys Thr Gly Gly Thr Gly Gly
1 5 10 15
Ala Gly Thr Cys Thr Gly Gly Gly Gly Gly Ala Gly Gly Cys Thr Thr
20 25 30
Ala Gly Thr Gly Ala Ala Gly Cys Cys Thr Gly Gly Ala Gly Gly Gly
35 40 45
Thr Cys Cys Cys Thr Gly Ala Ala Ala Cys Thr Cys Thr Cys Cys Thr
50 55 60
Gly Thr Gly Cys Ala Gly Cys Cys Thr Cys Thr Gly Gly Ala Thr Thr
65 70 75 80
Cys Ala Cys Thr Thr Thr Cys Ala Gly Thr Ala Gly Cys Thr Ala Thr
85 90 95
Gly Cys Cys Ala Thr Gly Thr Cys Thr Thr Gly Gly Gly Thr Thr Cys
100 105 110
Gly Cys Cys Ala Gly Thr Cys Thr Cys Cys Ala Gly Ala Gly Ala Ala
115 120 125
Gly Ala Gly Gly Cys Thr Gly Gly Ala Gly Thr Gly Gly Gly Thr Cys
130 135 140
Gly Cys Ala Gly Ala Ala Ala Thr Thr Ala Gly Thr Ala Gly Thr Gly
145 150 155 160
Gly Thr Gly Gly Thr Ala Gly Thr Thr Ala Cys Ala Cys Cys Thr Ala
165 170 175
Cys Thr Ala Thr Cys Cys Ala Gly Ala Cys Ala Cys Thr Gly Thr Gly
180 185 190
Ala Cys Gly Gly Gly Cys Cys Gly Ala Thr Thr Cys Ala Cys Cys Ala
195 200 205
Thr Cys Thr Cys Cys Ala Gly Ala Gly Ala Cys Ala Ala Thr Gly Cys
210 215 220
Cys Ala Ala Gly Ala Ala Cys Ala Cys Cys Cys Thr Gly Thr Ala Cys
225 230 235 240
Cys Thr Gly Gly Ala Ala Ala Thr Gly Ala Gly Cys Ala Gly Thr Cys
245 250 255
Thr Gly Ala Gly Gly Thr Cys Thr Gly Ala Gly Gly Ala Cys Ala Cys
260 265 270
Gly Gly Cys Cys Ala Thr Gly Thr Ala Thr Thr Ala Cys Thr Gly Thr
275 280 285
Gly Cys Ala Ala Gly Gly Ala Ala Ala Cys Gly Ala Cys Gly Gly Gly
290 295 300
Ala Thr Thr Ala Cys Thr Ala Thr Gly Cys Thr Ala Thr Gly Gly Ala
305 310 315 320
Cys Thr Ala Cys Thr Gly Gly Gly Gly Thr Cys Ala Ala Gly Gly Ala
325 330 335
Ala Cys Cys Thr Cys Ala Gly Thr Cys Ala Cys Cys Gly Thr Cys Thr
340 345 350
Cys Cys Thr Cys Ala
355
<210> 29
<211> 321
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic construct
<220>
<221> MISC_FEATURE
<223> Mouse mAb 22B22 light chain, nucleotide
<400> 29
Gly Ala Thr Gly Thr Cys Cys Ala Gly Ala Thr Ala Ala Cys Cys Cys
1 5 10 15
Ala Gly Thr Cys Thr Cys Cys Ala Thr Cys Thr Thr Ala Thr Cys Thr
20 25 30
Thr Gly Cys Thr Gly Cys Ala Thr Cys Thr Cys Cys Thr Gly Gly Ala
35 40 45
Gly Ala Ala Ala Cys Cys Ala Thr Thr Ala Cys Thr Ala Thr Thr Ala
50 55 60
Ala Thr Thr Gly Cys Ala Gly Gly Gly Cys Ala Ala Gly Thr Ala Ala
65 70 75 80
Gly Ala Gly Cys Ala Thr Thr Ala Gly Cys Ala Ala Ala Thr Ala Thr
85 90 95
Thr Thr Ala Gly Cys Cys Thr Gly Gly Thr Ala Thr Cys Ala Ala Gly
100 105 110
Ala Gly Ala Ala Ala Cys Cys Thr Gly Gly Gly Ala Ala Ala Ala Cys
115 120 125
Thr Ala Ala Thr Ala Ala Gly Cys Thr Thr Cys Thr Thr Ala Thr Cys
130 135 140
Thr Ala Cys Thr Cys Thr Gly Gly Ala Thr Cys Cys Ala Cys Thr Thr
145 150 155 160
Thr Gly Cys Ala Ala Thr Cys Thr Gly Gly Ala Ala Thr Thr Cys Cys
165 170 175
Ala Thr Cys Ala Ala Gly Gly Thr Thr Cys Ala Gly Thr Gly Gly Cys
180 185 190
Ala Gly Thr Gly Gly Ala Thr Cys Thr Gly Gly Thr Ala Cys Ala Gly
195 200 205
Ala Thr Thr Thr Cys Ala Cys Thr Cys Thr Cys Ala Cys Cys Ala Thr
210 215 220
Cys Ala Gly Thr Ala Gly Cys Cys Thr Gly Gly Ala Gly Cys Cys Thr
225 230 235 240
Gly Ala Ala Gly Ala Thr Thr Thr Thr Gly Cys Ala Ala Thr Gly Thr
245 250 255
Ala Thr Thr Ala Cys Thr Gly Thr Cys Ala Ala Cys Ala Gly Cys Ala
260 265 270
Thr Ala Ala Thr Gly Ala Ala Thr Ala Cys Cys Cys Gly Thr Gly Gly
275 280 285
Ala Cys Gly Thr Thr Cys Gly Gly Thr Gly Gly Ala Gly Gly Cys Ala
290 295 300
Cys Cys Ala Ala Gly Cys Thr Gly Gly Ala Ala Ala Thr Cys Ala Ala
305 310 315 320
Ala
<210> 30
<211> 354
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic construct
<220>
<221> MISC_FEATURE
<223> Mouse mAb 28P24 heavy chain, nucleotide
<400> 30
Cys Ala Gly Gly Thr Cys Cys Ala Gly Cys Thr Gly Cys Ala Gly Cys
1 5 10 15
Ala Gly Thr Cys Thr Gly Gly Ala Gly Cys Thr Gly Ala Ala Cys Thr
20 25 30
Gly Gly Thr Ala Ala Gly Gly Cys Cys Thr Gly Gly Gly Ala Cys Thr
35 40 45
Thr Cys Ala Gly Thr Gly Ala Ala Gly Ala Thr Gly Thr Cys Cys Thr
50 55 60
Gly Cys Ala Ala Gly Gly Cys Thr Gly Cys Thr Gly Gly Ala Thr Ala
65 70 75 80
Cys Ala Cys Cys Thr Thr Cys Ala Cys Thr Ala Ala Cys Thr Ala Cys
85 90 95
Thr Thr Thr Ala Thr Ala Gly Gly Thr Thr Gly Gly Gly Thr Ala Ala
100 105 110
Ala Gly Cys Ala Gly Ala Gly Gly Cys Cys Thr Gly Gly Ala Cys Ala
115 120 125
Thr Gly Gly Cys Cys Thr Thr Gly Ala Cys Thr Gly Gly Ala Thr Thr
130 135 140
Gly Gly Ala Gly Ala Thr Ala Thr Thr Thr Ala Cys Cys Cys Thr Gly
145 150 155 160
Gly Ala Gly Gly Thr Gly Gly Thr Thr Ala Thr Ala Cys Thr Ala Ala
165 170 175
Cys Thr Ala Cys Ala Ala Thr Gly Ala Gly Ala Ala Gly Thr Thr Cys
180 185 190
Ala Ala Gly Gly Gly Cys Ala Ala Gly Gly Cys Cys Ala Cys Ala Cys
195 200 205
Thr Gly Ala Cys Thr Gly Cys Ala Gly Ala Cys Ala Cys Ala Thr Cys
210 215 220
Cys Thr Cys Cys Ala Gly Cys Ala Cys Ala Gly Cys Cys Thr Ala Cys
225 230 235 240
Ala Thr Gly Cys Ala Gly Cys Thr Cys Ala Gly Cys Ala Gly Cys Cys
245 250 255
Thr Gly Ala Cys Ala Thr Cys Thr Gly Ala Gly Gly Ala Cys Thr Cys
260 265 270
Thr Gly Cys Cys Ala Thr Cys Thr Ala Thr Thr Ala Cys Thr Gly Thr
275 280 285
Gly Thr Ala Ala Gly Ala Thr Thr Cys Thr Ala Thr Gly Gly Thr Ala
290 295 300
Ala Cys Thr Ala Cys Gly Thr Gly Thr Thr Thr Gly Cys Thr Thr Ala
305 310 315 320
Cys Thr Gly Gly Gly Gly Cys Cys Ala Ala Gly Gly Gly Ala Cys Thr
325 330 335
Cys Thr Gly Gly Thr Cys Ala Cys Thr Gly Thr Cys Thr Cys Thr Gly
340 345 350
Cys Ala
<210> 31
<211> 321
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic construct
<220>
<221> MISC_FEATURE
<223> Mouse mAb 28P24 light chain, nucleotide
<400> 31
Gly Ala Thr Gly Thr Cys Cys Ala Gly Ala Thr Ala Ala Cys Cys Cys
1 5 10 15
Ala Gly Thr Cys Thr Cys Cys Ala Thr Cys Thr Thr Gly Thr Cys Thr
20 25 30
Thr Gly Cys Thr Gly Cys Ala Thr Cys Thr Cys Cys Thr Gly Gly Ala
35 40 45
Gly Ala Ala Ala Cys Cys Ala Thr Thr Ala Cys Thr Ala Thr Thr Ala
50 55 60
Ala Thr Thr Gly Cys Ala Gly Gly Gly Cys Ala Ala Gly Thr Ala Ala
65 70 75 80
Ala Ala Cys Cys Ala Thr Thr Ala Gly Cys Ala Ala Ala Thr Ala Thr
85 90 95
Thr Thr Ala Gly Cys Cys Thr Gly Gly Thr Ala Thr Cys Ala Ala Gly
100 105 110
Ala Gly Ala Ala Ala Cys Cys Thr Gly Gly Gly Ala Ala Ala Ala Cys
115 120 125
Thr Ala Ala Thr Ala Ala Gly Cys Thr Thr Cys Thr Thr Ala Thr Cys
130 135 140
Thr Ala Cys Thr Cys Thr Gly Gly Ala Thr Cys Cys Ala Cys Thr Thr
145 150 155 160
Thr Gly Cys Ala Ala Thr Cys Thr Gly Gly Ala Ala Thr Thr Cys Cys
165 170 175
Ala Thr Cys Ala Ala Gly Gly Thr Thr Cys Ala Gly Thr Gly Gly Cys
180 185 190
Ala Gly Thr Gly Gly Ala Thr Cys Thr Gly Gly Thr Ala Cys Ala Gly
195 200 205
Ala Thr Thr Thr Cys Ala Cys Thr Cys Thr Cys Ala Cys Cys Ala Thr
210 215 220
Cys Ala Gly Thr Ala Gly Cys Cys Thr Gly Gly Ala Gly Cys Cys Thr
225 230 235 240
Gly Ala Ala Gly Ala Thr Thr Thr Thr Gly Cys Ala Ala Thr Gly Thr
245 250 255
Ala Thr Thr Ala Cys Thr Gly Thr Cys Ala Ala Cys Ala Gly Cys Ala
260 265 270
Thr Ala Ala Thr Gly Ala Ala Thr Ala Cys Cys Cys Gly Thr Gly Gly
275 280 285
Ala Cys Gly Thr Thr Cys Gly Gly Thr Gly Gly Ala Gly Gly Cys Ala
290 295 300
Cys Cys Ala Ala Gly Cys Thr Gly Gly Ala Ala Ala Thr Cys Ala Ala
305 310 315 320
Ala
<210> 32
<211> 357
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic construct
<220>
<221> MISC_FEATURE
<223> Mouse mAb 21B16 heavy chain, nucleotide
<400> 32
Gly Ala Ala Gly Thr Gly Cys Ala Gly Cys Thr Gly Gly Thr Gly Gly
1 5 10 15
Ala Gly Thr Cys Thr Gly Gly Gly Gly Gly Ala Gly Gly Cys Thr Thr
20 25 30
Ala Gly Thr Gly Ala Ala Gly Cys Cys Thr Gly Gly Ala Gly Gly Gly
35 40 45
Thr Cys Cys Cys Thr Gly Ala Ala Ala Cys Thr Cys Thr Cys Cys Thr
50 55 60
Gly Thr Gly Cys Ala Gly Cys Cys Thr Cys Thr Gly Gly Ala Thr Thr
65 70 75 80
Cys Ala Cys Thr Thr Thr Cys Ala Gly Thr Ala Cys Cys Thr Ala Thr
85 90 95
Gly Cys Cys Ala Thr Gly Thr Cys Thr Thr Gly Gly Gly Thr Thr Cys
100 105 110
Gly Cys Cys Ala Gly Thr Cys Thr Cys Cys Ala Gly Ala Gly Ala Ala
115 120 125
Gly Ala Gly Gly Cys Thr Gly Gly Ala Gly Thr Gly Gly Gly Thr Cys
130 135 140
Gly Cys Ala Gly Ala Ala Ala Thr Thr Ala Gly Thr Ala Gly Thr Gly
145 150 155 160
Gly Thr Gly Gly Thr Ala Cys Thr Thr Ala Cys Ala Cys Cys Thr Ala
165 170 175
Cys Thr Thr Thr Cys Cys Ala Gly Ala Cys Ala Cys Thr Gly Thr Gly
180 185 190
Ala Cys Gly Gly Gly Cys Cys Gly Ala Thr Thr Cys Ala Cys Cys Ala
195 200 205
Thr Cys Thr Cys Cys Ala Gly Ala Gly Ala Cys Ala Ala Thr Gly Cys
210 215 220
Cys Ala Ala Gly Ala Ala Cys Ala Cys Cys Cys Thr Gly Thr Ala Cys
225 230 235 240
Cys Thr Gly Gly Ala Ala Ala Thr Gly Ala Gly Cys Ala Gly Thr Cys
245 250 255
Thr Gly Ala Gly Gly Thr Cys Thr Gly Ala Gly Gly Ala Cys Ala Cys
260 265 270
Gly Gly Cys Cys Ala Thr Gly Thr Ala Thr Thr Ala Cys Thr Gly Thr
275 280 285
Gly Cys Ala Ala Gly Gly Ala Ala Ala Cys Gly Ala Cys Gly Ala Gly
290 295 300
Ala Thr Thr Ala Cys Thr Ala Thr Gly Cys Thr Ala Thr Gly Gly Ala
305 310 315 320
Cys Thr Ala Cys Thr Gly Gly Gly Gly Thr Cys Ala Ala Gly Gly Ala
325 330 335
Ala Cys Cys Thr Cys Ala Gly Thr Cys Ala Cys Cys Gly Thr Cys Thr
340 345 350
Cys Cys Thr Cys Ala
355
<210> 33
<211> 321
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic construct
<220>
<221> MISC_FEATURE
<223> Mouse mAb 21B16 light chain, nucleotide
<400> 33
Gly Ala Thr Gly Thr Cys Cys Ala Gly Ala Thr Ala Ala Cys Cys Cys
1 5 10 15
Ala Gly Thr Cys Thr Cys Cys Ala Thr Cys Thr Thr Ala Thr Cys Thr
20 25 30
Thr Gly Cys Thr Gly Cys Ala Thr Cys Thr Cys Cys Thr Gly Gly Ala
35 40 45
Gly Ala Ala Ala Cys Cys Ala Thr Thr Ala Cys Thr Ala Thr Thr Ala
50 55 60
Ala Thr Thr Gly Cys Ala Gly Gly Gly Cys Ala Ala Gly Thr Ala Ala
65 70 75 80
Gly Ala Gly Cys Ala Thr Thr Ala Gly Cys Ala Ala Ala Thr Ala Thr
85 90 95
Thr Thr Ala Gly Cys Cys Thr Gly Gly Thr Ala Thr Cys Ala Ala Gly
100 105 110
Ala Gly Ala Ala Ala Cys Cys Thr Gly Gly Gly Ala Ala Ala Ala Cys
115 120 125
Thr Ala Ala Thr Ala Ala Gly Cys Thr Thr Cys Thr Thr Ala Thr Cys
130 135 140
Thr Ala Cys Thr Cys Thr Gly Gly Ala Thr Cys Cys Ala Cys Thr Thr
145 150 155 160
Thr Gly Cys Ala Ala Thr Cys Thr Gly Gly Ala Ala Thr Thr Cys Cys
165 170 175
Ala Thr Cys Ala Ala Gly Gly Thr Thr Cys Ala Gly Thr Gly Gly Cys
180 185 190
Ala Gly Thr Gly Gly Ala Thr Cys Thr Gly Gly Thr Ala Cys Ala Gly
195 200 205
Ala Thr Thr Thr Cys Ala Cys Thr Cys Thr Cys Ala Cys Cys Ala Thr
210 215 220
Cys Ala Gly Thr Ala Gly Cys Cys Thr Gly Gly Ala Gly Cys Cys Thr
225 230 235 240
Gly Ala Ala Gly Ala Thr Thr Thr Thr Gly Cys Ala Gly Thr Gly Thr
245 250 255
Ala Thr Thr Ala Cys Thr Gly Thr Cys Ala Ala Cys Ala Gly Cys Ala
260 265 270
Thr Ala Ala Thr Gly Ala Ala Thr Ala Cys Cys Cys Gly Thr Gly Gly
275 280 285
Ala Cys Gly Thr Thr Cys Gly Gly Thr Gly Gly Ala Gly Gly Cys Ala
290 295 300
Cys Cys Ala Ala Gly Cys Thr Gly Gly Ala Ala Ala Thr Cys Ala Ala
305 310 315 320
Ala
<210> 34
<211> 357
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic construct
<220>
<221> MISC_FEATURE
<223> Mouse mAb 28O12 heavy chain, nucleotide
<400> 34
Gly Ala Ala Gly Thr Gly Cys Ala Gly Cys Thr Gly Gly Thr Gly Gly
1 5 10 15
Ala Gly Thr Cys Thr Gly Gly Gly Gly Gly Ala Gly Gly Cys Thr Thr
20 25 30
Ala Gly Thr Gly Ala Ala Gly Cys Cys Thr Gly Gly Ala Gly Gly Gly
35 40 45
Thr Cys Cys Cys Thr Gly Ala Ala Ala Cys Thr Cys Thr Cys Cys Thr
50 55 60
Gly Thr Gly Cys Ala Gly Cys Cys Thr Cys Thr Gly Gly Ala Thr Thr
65 70 75 80
Cys Ala Cys Thr Thr Thr Cys Ala Gly Thr Ala Ala Cys Thr Ala Thr
85 90 95
Gly Cys Cys Ala Thr Gly Thr Cys Thr Thr Gly Gly Gly Thr Thr Cys
100 105 110
Gly Thr Cys Ala Gly Thr Cys Thr Cys Cys Ala Gly Ala Gly Ala Ala
115 120 125
Gly Ala Gly Gly Cys Thr Gly Gly Ala Gly Thr Gly Gly Gly Thr Cys
130 135 140
Gly Cys Ala Gly Ala Ala Ala Thr Thr Ala Gly Thr Gly Gly Thr Gly
145 150 155 160
Gly Thr Gly Gly Thr Ala Gly Thr Thr Ala Cys Ala Cys Gly Thr Ala
165 170 175
Cys Cys Ala Thr Cys Cys Ala Gly Ala Cys Ala Cys Thr Gly Thr Gly
180 185 190
Ala Cys Gly Gly Gly Cys Cys Gly Ala Thr Thr Cys Ala Cys Cys Ala
195 200 205
Thr Cys Thr Cys Cys Ala Gly Ala Gly Ala Cys Ala Ala Thr Gly Cys
210 215 220
Cys Ala Ala Gly Ala Ala Cys Ala Cys Cys Cys Thr Gly Thr Ala Cys
225 230 235 240
Cys Thr Gly Gly Ala Ala Ala Thr Gly Ala Gly Cys Ala Gly Thr Cys
245 250 255
Thr Gly Ala Gly Gly Thr Cys Thr Gly Ala Gly Gly Ala Cys Ala Cys
260 265 270
Gly Gly Cys Cys Ala Thr Gly Thr Ala Thr Thr Ala Cys Thr Gly Thr
275 280 285
Gly Cys Ala Ala Gly Gly Ala Ala Ala Cys Gly Ala Cys Gly Gly Gly
290 295 300
Ala Thr Thr Ala Cys Thr Ala Thr Gly Cys Thr Ala Thr Gly Gly Ala
305 310 315 320
Cys Thr Ala Cys Thr Gly Gly Gly Gly Thr Cys Ala Ala Gly Gly Ala
325 330 335
Ala Cys Cys Thr Cys Ala Gly Thr Cys Ala Cys Cys Gly Thr Cys Thr
340 345 350
Cys Cys Thr Cys Ala
355
<210> 35
<211> 322
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic construct
<220>
<221> MISC_FEATURE
<223> Mouse mAb 28O12 light chain, nucleotide
<400> 35
Gly Ala Thr Gly Thr Cys Cys Ala Gly Ala Thr Ala Ala Cys Cys Cys
1 5 10 15
Ala Gly Thr Cys Thr Cys Cys Ala Thr Cys Thr Thr Ala Thr Cys Thr
20 25 30
Thr Gly Cys Thr Gly Cys Ala Thr Cys Thr Cys Cys Thr Gly Gly Ala
35 40 45
Gly Ala Ala Ala Cys Cys Ala Thr Thr Ala Cys Thr Ala Thr Thr Ala
50 55 60
Ala Thr Thr Gly Cys Ala Gly Gly Gly Cys Ala Ala Gly Thr Ala Ala
65 70 75 80
Gly Ala Gly Cys Ala Thr Thr Ala Gly Cys Ala Ala Ala Thr Ala Thr
85 90 95
Thr Thr Ala Gly Cys Cys Thr Gly Gly Thr Ala Thr Cys Ala Ala Gly
100 105 110
Ala Gly Ala Ala Ala Cys Cys Thr Gly Gly Gly Ala Ala Ala Ala Cys
115 120 125
Thr Ala Ala Thr Ala Ala Gly Cys Thr Thr Cys Thr Thr Ala Thr Cys
130 135 140
Thr Ala Cys Thr Cys Thr Gly Gly Ala Thr Cys Cys Ala Cys Thr Thr
145 150 155 160
Thr Gly Cys Ala Ala Thr Cys Thr Gly Gly Ala Ala Thr Thr Cys Cys
165 170 175
Ala Thr Cys Ala Ala Gly Gly Thr Thr Cys Ala Gly Thr Gly Gly Cys
180 185 190
Ala Gly Thr Gly Gly Ala Thr Cys Thr Gly Gly Thr Ala Cys Ala Gly
195 200 205
Ala Thr Thr Thr Cys Ala Cys Thr Cys Thr Cys Ala Cys Cys Ala Thr
210 215 220
Cys Ala Gly Thr Ala Gly Cys Cys Thr Gly Gly Ala Gly Cys Cys Thr
225 230 235 240
Gly Ala Ala Gly Ala Thr Thr Thr Thr Gly Cys Ala Ala Thr Gly Thr
245 250 255
Ala Thr Thr Ala Cys Thr Gly Thr Cys Ala Gly Cys Ala Gly Cys Ala
260 265 270
Thr Ala Ala Thr Gly Ala Ala Thr Ala Cys Cys Cys Gly Thr Gly Gly
275 280 285
Ala Cys Gly Thr Thr Cys Gly Gly Thr Gly Gly Ala Gly Gly Cys Ala
290 295 300
Cys Cys Ala Ala Gly Cys Thr Gly Gly Ala Ala Ala Thr Cys Ala Ala
305 310 315 320
Ala Cys
<210> 36
<211> 6
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic construct
<220>
<221> MISC_FEATURE
<223> mAb 21F8 HC-CDR1
<400> 36
Ser Asp Tyr Ala Trp Asn
1 5
<210> 37
<211> 16
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic construct
<220>
<221> MISC_FEATURE
<223> mAb 21F8 HC-CDR2
<400> 37
Tyr Ile Ser Tyr Ser Gly Ser Thr Ser Tyr Asn Pro Ser Leu Lys Ser
1 5 10 15
<210> 38
<211> 10
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic construct
<220>
<221> MISC_FEATURE
<223> mAb 21F8 HC-CDR3
<400> 38
Phe Met Ile Thr Thr Phe Ala Met Asp Tyr
1 5 10
<210> 39
<211> 11
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic construct
<220>
<221> MISC_FEATURE
<223> mAb 21F8 LC-CDR1
<400> 39
Lys Ala Ser Gln His Val Ser Thr Ala Val Ala
1 5 10
<210> 40
<211> 7
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic construct
<220>
<221> MISC_FEATURE
<223> mAb 21F8 LC-CDR2
<400> 40
Ser Ala Pro Tyr Arg Tyr Thr
1 5
<210> 41
<211> 9
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic construct
<220>
<221> MISC_FEATURE
<223> mAb 21F8 LC-CDR3
<400> 41
Gln Gln His Tyr Asn Thr Leu Trp Thr
1 5
<210> 42
<211> 5
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic construct
<220>
<221> MISC_FEATURE
<223> mAb 30M18 HC-CDR1
<400> 42
Glu Tyr Thr Met His
1 5
<210> 43
<211> 17
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic construct
<220>
<221> MISC_FEATURE
<223> mAb 30M18 HC-CDR2
<400> 43
Gly Ile Asn Pro Asn Asn Gly Gly Thr Ser Tyr Asn Gln Lys Phe Lys
1 5 10 15
Gly
<210> 44
<211> 10
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic construct
<220>
<221> MISC_FEATURE
<223> mAb 30M18 HC-CDR3
<400> 44
Ser Gly His Met Asp Tyr Gly Tyr Val Tyr
1 5 10
<210> 45
<211> 11
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic construct
<220>
<221> MISC_FEATURE
<223> mAb 30M18 LC-CDR1
<400> 45
Lys Ala Ser Gln Tyr Val Ser Thr Ala Val Ala
1 5 10
<210> 46
<211> 7
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic construct
<220>
<221> MISC_FEATURE
<223> mAb 30M18 LC-CDR2
<400> 46
Ser Pro Ser Tyr Arg Tyr Thr
1 5
<210> 47
<211> 9
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic construct
<220>
<221> MISC_FEATURE
<223> mAb 30M18 LC-CDR3
<400> 47
Gln Gln His Tyr Ser Thr Pro Trp Thr
1 5
<210> 48
<211> 6
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic construct
<220>
<221> MISC_FEATURE
<223> mAb 24F8 HC-CDR1
<400> 48
Ser Gly Tyr Ser Trp His
1 5
<210> 49
<211> 16
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic construct
<220>
<221> MISC_FEATURE
<223> mAb 24F8 HC-CDR2
<400> 49
Tyr Val His Tyr Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu Lys Ser
1 5 10 15
<210> 50
<211> 12
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic construct
<220>
<221> MISC_FEATURE
<223> mAb 24F8 HC-CDR3
<400> 50
Met Asp Tyr Gly Asn Tyr Gly Gly Ala Met Asp Tyr
1 5 10
<210> 51
<211> 11
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic construct
<220>
<221> MISC_FEATURE
<223> mAb 24F8 LC-CDR1
<400> 51
Lys Ala Ser Gln Asp Val Arg Thr Ala Val Ala
1 5 10
<210> 52
<211> 7
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic construct
<220>
<221> MISC_FEATURE
<223> mAb 24F8 LC-CDR2
<400> 52
Ser Ala Ser Tyr Arg Tyr Thr
1 5
<210> 53
<211> 9
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic construct
<220>
<221> MISC_FEATURE
<223> mAb 24F8 LC-CDR3
<400> 53
Gln Gln Tyr Tyr Ser Thr Gln Trp Thr
1 5
<210> 54
<211> 5
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic construct
<220>
<221> MISC_FEATURE
<223> mAb 5J24 HC-CDR1
<400> 54
Asn His Trp Ile Gly
1 5
<210> 55
<211> 17
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic construct
<220>
<221> MISC_FEATURE
<223> mAb 5J24 and
mAb 28P24 HC-CDR2
<400> 55
Asp Ile Tyr Pro Gly Gly Gly Tyr Thr Asn Tyr Asn Glu Lys Phe Lys
1 5 10 15
Gly
<210> 56
<211> 11
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic construct
<220>
<221> MISC_FEATURE
<223> mAb 5J24 HC-CDR3
<400> 56
Ser Tyr Gly Tyr Asp Leu Tyr Ala Met Asp Tyr
1 5 10
<210> 57
<211> 11
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic construct
<220>
<221> MISC_FEATURE
<223> mAb 5J24 LC-CDR1
<400> 57
Arg Ala Ser Gln Glu Ile Ser Gly Tyr Leu Ser
1 5 10
<210> 58
<211> 7
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic construct
<220>
<221> MISC_FEATURE
<223> mAb 5J24 LC-CDR2
<400> 58
Ala Ala Ser Thr Leu Gly Ser
1 5
<210> 59
<211> 9
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic construct
<220>
<221> MISC_FEATURE
<223> mAb 5J24 LC-CDR3
<400> 59
Leu Gln Tyr Asp Ser Tyr Pro Phe Thr
1 5
<210> 60
<211> 5
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic construct
<220>
<221> MISC_FEATURE
<223> mAb 21B9 and
mAb 22B22 HC-CDR1
<400> 60
Ser Tyr Ala Met Ser
1 5
<210> 61
<211> 17
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic construct
<220>
<221> MISC_FEATURE
<223> mAb 21B9 HC-CDR2
<400> 61
Glu Ile Ser Ser Gly Gly Ser Tyr Thr Tyr Tyr Thr Asp Thr Val Thr
1 5 10 15
Gly
<210> 62
<211> 10
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic construct
<220>
<221> MISC_FEATURE
<223> mAb 21B9 HC-CDR3
<400> 62
Lys Arg Arg Asp Tyr Tyr Gly Met Asp Tyr
1 5 10
<210> 63
<211> 11
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic construct
<220>
<221> MISC_FEATURE
<223> mAb 21B9, mAb 22B22,
mAb 21B16, mAb 21B16, and mAb 28O12 LC-CDR1
<400> 63
Arg Ala Ser Lys Ser Ile Ser Lys Tyr Leu Ala
1 5 10
<210> 64
<211> 7
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic construct
<220>
<221> MISC_FEATURE
<223> mAb 21B9 LC-CDR2
<400> 64
Ser Gly Ser Thr Leu Gln Thr
1 5
<210> 65
<211> 9
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic construct
<220>
<221> MISC_FEATURE
<223> mAb 21B9, mAb 22B22,
mAb 28P24, mAb 21B16, and mAb 28O12 LC-CDR3
<400> 65
Gln Gln His Asn Glu Tyr Pro Trp Thr
1 5
<210> 66
<211> 17
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic construct
<220>
<221> MISC_FEATURE
<223> mAb 22B22 HC-CDR2
<400> 66
Glu Ile Ser Ser Gly Gly Ser Tyr Thr Tyr Tyr Pro Asp Thr Val Thr
1 5 10 15
Gly
<210> 67
<211> 10
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic construct
<220>
<221> MISC_FEATURE
<223> mAb 22B22, mAb 21B16, and mAb 28O12 HC-CDR3
<400> 67
Lys Arg Arg Asp Tyr Tyr Ala Met Asp Tyr
1 5 10
<210> 68
<211> 7
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic construct
<220>
<221> MISC_FEATURE
<223> mAb 22B22, mAb 28P24,
mAb 21B16, and
mAb 28O12 LC-CDR2
<400> 68
Ser Gly Ser Thr Leu Gln Ser
1 5
<210> 69
<211> 5
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic construct
<220>
<221> MISC_FEATURE
<223> mAb 28P24 HC-CDR1
<400> 69
Asn Tyr Phe Ile Gly
1 5
<210> 70
<211> 9
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic construct
<220>
<221> MISC_FEATURE
<223> mAb 28P24 HC-CDR3
<400> 70
Phe Tyr Gly Asn Tyr Val Phe Ala Tyr
1 5
<210> 71
<211> 11
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic construct
<220>
<221> MISC_FEATURE
<223> mAb 28P24 LC-CDR1
<400> 71
Arg Ala Ser Lys Thr Ile Ser Lys Tyr Leu Ala
1 5 10
<210> 72
<211> 5
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic construct
<220>
<221> MISC_FEATURE
<223> mAb 21B16 HC-CDR1
<400> 72
Thr Tyr Ala Met Ser
1 5
<210> 73
<211> 17
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic construct
<220>
<221> MISC_FEATURE
<223> mAb 21B16 HC-CDR2
<400> 73
Glu Ile Ser Ser Gly Gly Thr Tyr Thr Tyr Phe Pro Asp Thr Val Thr
1 5 10 15
Gly
<210> 74
<211> 5
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic construct
<220>
<221> MISC_FEATURE
<223> mAb 28O12 HC-CDR1
<400> 74
Asn Tyr Ala Met Ser
1 5
<210> 75
<211> 17
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic construct
<220>
<221> MISC_FEATURE
<223> mAb 28O12 HC-CDR2
<400> 75
Glu Ile Ser Gly Gly Gly Ser Tyr Thr Tyr His Pro Asp Thr Val Thr
1 5 10 15
Gly
<210> 76
<211> 121
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic construct
<220>
<221> MISC_FEATURE
<223> Hu24F8.1 AND HU24F8.4 heavy chain, amino acid
<400> 76
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Tyr Gly Tyr Ser Ile Thr Ser Gly
20 25 30
Tyr Ser Trp His Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp
35 40 45
Ile Gly Tyr Val His Tyr Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu
50 55 60
Lys Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe Ser
65 70 75 80
Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Met Asp Tyr Gly Asn Tyr Gly Gly Ala Met Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 77
<211> 107
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic construct
<220>
<221> MISC_FEATURE
<223> Hu24F8.1 AND HU24F8.2 light chain, amino acid
<400> 77
Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Lys Ala Ser Gln Asp Val Arg Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Tyr Arg Tyr Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Tyr Ser Thr Gln Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 78
<211> 121
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic construct
<220>
<221> MISC_FEATURE
<223> Hu24F8.2 AND HU24F8.3 heavy chain, amino acid
<400> 78
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Gly
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Ser Gly Tyr Ser Ile Thr Ser Gly
20 25 30
Tyr Ser Trp His Trp Val Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp
35 40 45
Ile Gly Tyr Val His Tyr Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu
50 55 60
Lys Ser Arg Val Thr Ile Ser Val Asp Lys Ser Lys Asn Gln Phe Ser
65 70 75 80
Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Met Asp Tyr Gly Asn Tyr Gly Gly Ala Met Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 79
<211> 107
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic construct
<220>
<221> MISC_FEATURE
<223> HU24F8.3 AND Hu24F8.4 light chain, amino acid
<400> 79
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asp Val Arg Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Tyr Arg Tyr Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Gln Tyr Tyr Ser Thr Gln Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 80
<211> 244
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic construct
<220>
<221> MISC_FEATURE
<223> hTIGIT full length, amino acid
<400> 80
Met Arg Trp Cys Leu Leu Leu Ile Trp Ala Gln Gly Leu Arg Gln Ala
1 5 10 15
Pro Leu Ala Ser Gly Met Met Thr Gly Thr Ile Glu Thr Thr Gly Asn
20 25 30
Ile Ser Ala Glu Lys Gly Gly Ser Ile Ile Leu Gln Cys His Leu Ser
35 40 45
Ser Thr Thr Ala Gln Val Thr Gln Val Asn Trp Glu Gln Gln Asp Gln
50 55 60
Leu Leu Ala Ile Cys Asn Ala Asp Leu Gly Trp His Ile Ser Pro Ser
65 70 75 80
Phe Lys Asp Arg Val Ala Pro Gly Pro Gly Leu Gly Leu Thr Leu Gln
85 90 95
Ser Leu Thr Val Asn Asp Thr Gly Glu Tyr Phe Cys Ile Tyr His Thr
100 105 110
Tyr Pro Asp Gly Thr Tyr Thr Gly Arg Ile Phe Leu Glu Val Leu Glu
115 120 125
Ser Ser Val Ala Glu His Gly Ala Arg Phe Gln Ile Pro Leu Leu Gly
130 135 140
Ala Met Ala Ala Thr Leu Val Val Ile Cys Thr Ala Val Ile Val Val
145 150 155 160
Val Ala Leu Thr Arg Lys Lys Lys Ala Leu Arg Ile His Ser Val Glu
165 170 175
Gly Asp Leu Arg Arg Lys Ser Ala Gly Gln Glu Glu Trp Ser Pro Ser
180 185 190
Ala Pro Ser Pro Pro Gly Ser Cys Val Gln Ala Glu Ala Ala Pro Ala
195 200 205
Gly Leu Cys Gly Glu Gln Arg Gly Glu Asp Cys Ala Glu Leu His Asp
210 215 220
Tyr Phe Asn Val Leu Ser Tyr Arg Ser Leu Gly Asn Cys Ser Phe Phe
225 230 235 240
Thr Glu Thr Gly
<210> 81
<211> 223
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic construct
<220>
<221> MISC_FEATURE
<223> mature human TIGIT, amino acid
<400> 81
Met Met Thr Gly Thr Ile Glu Thr Thr Gly Asn Ile Ser Ala Glu Lys
1 5 10 15
Gly Gly Ser Ile Ile Leu Gln Cys His Leu Ser Ser Thr Thr Ala Gln
20 25 30
Val Thr Gln Val Asn Trp Glu Gln Gln Asp Gln Leu Leu Ala Ile Cys
35 40 45
Asn Ala Asp Leu Gly Trp His Ile Ser Pro Ser Phe Lys Asp Arg Val
50 55 60
Ala Pro Gly Pro Gly Leu Gly Leu Thr Leu Gln Ser Leu Thr Val Asn
65 70 75 80
Asp Thr Gly Glu Tyr Phe Cys Ile Tyr His Thr Tyr Pro Asp Gly Thr
85 90 95
Tyr Thr Gly Arg Ile Phe Leu Glu Val Leu Glu Ser Ser Val Ala Glu
100 105 110
His Gly Ala Arg Phe Gln Ile Pro Leu Leu Gly Ala Met Ala Ala Thr
115 120 125
Leu Val Val Ile Cys Thr Ala Val Ile Val Val Val Ala Leu Thr Arg
130 135 140
Lys Lys Lys Ala Leu Arg Ile His Ser Val Glu Gly Asp Leu Arg Arg
145 150 155 160
Lys Ser Ala Gly Gln Glu Glu Trp Ser Pro Ser Ala Pro Ser Pro Pro
165 170 175
Gly Ser Cys Val Gln Ala Glu Ala Ala Pro Ala Gly Leu Cys Gly Glu
180 185 190
Gln Arg Gly Glu Asp Cys Ala Glu Leu His Asp Tyr Phe Asn Val Leu
195 200 205
Ser Tyr Arg Ser Leu Gly Asn Cys Ser Phe Phe Thr Glu Thr Gly
210 215 220
<210> 82
<211> 120
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic construct
<220>
<221> MISC_FEATURE
<223> hTIGIT extracellular domain, amino acid
<400> 82
Met Met Thr Gly Thr Ile Glu Thr Thr Gly Asn Ile Ser Ala Glu Lys
1 5 10 15
Gly Gly Ser Ile Ile Leu Gln Cys His Leu Ser Ser Thr Thr Ala Gln
20 25 30
Val Thr Gln Val Asn Trp Glu Gln Gln Asp Gln Leu Leu Ala Ile Cys
35 40 45
Asn Ala Asp Leu Gly Trp His Ile Ser Pro Ser Phe Lys Asp Arg Val
50 55 60
Ala Pro Gly Pro Gly Leu Gly Leu Thr Leu Gln Ser Leu Thr Val Asn
65 70 75 80
Asp Thr Gly Glu Tyr Phe Cys Ile Tyr His Thr Tyr Pro Asp Gly Thr
85 90 95
Tyr Thr Gly Arg Ile Phe Leu Glu Val Leu Glu Ser Ser Val Ala Glu
100 105 110
His Gly Ala Arg Phe Gln Ile Pro
115 120
<210> 83
<211> 128
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic construct
<220>
<221> MISC_FEATURE
<223> hTIGIT-His, amino acid
<400> 83
Met Met Thr Gly Thr Ile Glu Thr Thr Gly Asn Ile Ser Ala Glu Lys
1 5 10 15
Gly Gly Ser Ile Ile Leu Gln Cys His Leu Ser Ser Thr Thr Ala Gln
20 25 30
Val Thr Gln Val Asn Trp Glu Gln Gln Asp Gln Leu Leu Ala Ile Cys
35 40 45
Asn Ala Asp Leu Gly Trp His Ile Ser Pro Ser Phe Lys Asp Arg Val
50 55 60
Ala Pro Gly Pro Gly Leu Gly Leu Thr Leu Gln Ser Leu Thr Val Asn
65 70 75 80
Asp Thr Gly Glu Tyr Phe Cys Ile Tyr His Thr Tyr Pro Asp Gly Thr
85 90 95
Tyr Thr Gly Arg Ile Phe Leu Glu Val Leu Glu Ser Ser Gly Gly Gly
100 105 110
Gly Ala Gly Gly Gly Gly His His His His His His His His His His
115 120 125
<210> 84
<211> 312
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic construct
<220>
<221> MISC_FEATURE
<223> cTIGIT full length, amino acid
<400> 84
Met Ala Phe Leu Val Ala Pro Pro Met Gln Phe Val Tyr Leu Leu Lys
1 5 10 15
Thr Leu Cys Val Phe Asn Met Val Phe Ala Lys Pro Gly Phe Ser Glu
20 25 30
Thr Val Phe Ser His Arg Leu Ser Phe Thr Val Leu Ser Ala Val Gly
35 40 45
Tyr Phe Arg Trp Gln Lys Arg Pro His Leu Leu Pro Val Ser Pro Leu
50 55 60
Gly Arg Ser Met Arg Trp Cys Leu Phe Leu Ile Trp Ala Gln Gly Leu
65 70 75 80
Arg Gln Ala Pro Leu Ala Ser Gly Met Met Thr Gly Thr Ile Glu Thr
85 90 95
Thr Gly Asn Ile Ser Ala Lys Lys Gly Gly Ser Val Ile Leu Gln Cys
100 105 110
His Leu Ser Ser Thr Met Ala Gln Val Thr Gln Val Asn Trp Glu Gln
115 120 125
His Asp His Ser Leu Leu Ala Ile Arg Asn Ala Glu Leu Gly Trp His
130 135 140
Ile Tyr Pro Ala Phe Lys Asp Arg Val Ala Pro Gly Pro Gly Leu Gly
145 150 155 160
Leu Thr Leu Gln Ser Leu Thr Met Asn Asp Thr Gly Glu Tyr Phe Cys
165 170 175
Thr Tyr His Thr Tyr Pro Asp Gly Thr Tyr Arg Gly Arg Ile Phe Leu
180 185 190
Glu Val Leu Glu Ser Ser Val Ala Glu His Ser Ala Arg Phe Gln Ile
195 200 205
Pro Leu Leu Gly Ala Met Ala Met Met Leu Val Val Ile Cys Ile Ala
210 215 220
Val Ile Val Val Val Val Leu Ala Arg Lys Lys Lys Ser Leu Arg Ile
225 230 235 240
His Ser Val Glu Ser Gly Leu Gln Arg Lys Ser Thr Gly Gln Glu Glu
245 250 255
Gln Ile Pro Ser Ala Pro Ser Pro Pro Gly Ser Cys Val Gln Ala Glu
260 265 270
Ala Ala Pro Ala Gly Leu Cys Gly Glu Gln Gln Gly Asp Asp Cys Ala
275 280 285
Glu Leu His Asp Tyr Phe Asn Val Leu Ser Tyr Arg Ser Leu Gly Ser
290 295 300
Cys Ser Phe Phe Thr Glu Thr Gly
305 310
<210> 85
<211> 129
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic construct
<220>
<221> MISC_FEATURE
<223> cTIGIT-His extracellular domain, amino acid
<400> 85
Met Met Thr Gly Thr Ile Glu Thr Thr Gly Asn Ile Ser Ala Lys Lys
1 5 10 15
Gly Gly Ser Val Ile Leu Gln Cys His Leu Ser Ser Thr Met Ala Gln
20 25 30
Val Thr Gln Val Asn Trp Glu Gln His Asp His Ser Leu Leu Ala Ile
35 40 45
Arg Asn Ala Glu Leu Gly Trp His Ile Tyr Pro Ala Phe Lys Asp Arg
50 55 60
Val Ala Pro Gly Pro Gly Leu Gly Leu Thr Leu Gln Ser Leu Thr Met
65 70 75 80
Asn Asp Thr Gly Glu Tyr Phe Cys Thr Tyr His Thr Tyr Pro Asp Gly
85 90 95
Thr Tyr Arg Gly Arg Ile Phe Leu Glu Val Leu Glu Ser Ser Gly Gly
100 105 110
Gly Gly Ala Gly Gly Gly Gly His His His His His His His His His
115 120 125
His
<210> 86
<211> 323
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic construct
<220>
<221> MISC_FEATURE
<223> Mature extracellular region of human CD155, amino acid
<400> 86
Trp Pro Pro Pro Gly Thr Gly Asp Val Val Val Gln Ala Pro Thr Gln
1 5 10 15
Val Pro Gly Phe Leu Gly Asp Ser Val Thr Leu Pro Cys Tyr Leu Gln
20 25 30
Val Pro Asn Met Glu Val Thr His Val Ser Gln Leu Thr Trp Ala Arg
35 40 45
His Gly Glu Ser Gly Ser Met Ala Val Phe His Gln Thr Gln Gly Pro
50 55 60
Ser Tyr Ser Glu Ser Lys Arg Leu Glu Phe Val Ala Ala Arg Leu Gly
65 70 75 80
Ala Glu Leu Arg Asn Ala Ser Leu Arg Met Phe Gly Leu Arg Val Glu
85 90 95
Asp Glu Gly Asn Tyr Thr Cys Leu Phe Val Thr Phe Pro Gln Gly Ser
100 105 110
Arg Ser Val Asp Ile Trp Leu Arg Val Leu Ala Lys Pro Gln Asn Thr
115 120 125
Ala Glu Val Gln Lys Val Gln Leu Thr Gly Glu Pro Val Pro Met Ala
130 135 140
Arg Cys Val Ser Thr Gly Gly Arg Pro Pro Ala Gln Ile Thr Trp His
145 150 155 160
Ser Asp Leu Gly Gly Met Pro Asn Thr Ser Gln Val Pro Gly Phe Leu
165 170 175
Ser Gly Thr Val Thr Val Thr Ser Leu Trp Ile Leu Val Pro Ser Ser
180 185 190
Gln Val Asp Gly Lys Asn Val Thr Cys Lys Val Glu His Glu Ser Phe
195 200 205
Glu Lys Pro Gln Leu Leu Thr Val Asn Leu Thr Val Tyr Tyr Pro Pro
210 215 220
Glu Val Ser Ile Ser Gly Tyr Asp Asn Asn Trp Tyr Leu Gly Gln Asn
225 230 235 240
Glu Ala Thr Leu Thr Cys Asp Ala Arg Ser Asn Pro Glu Pro Thr Gly
245 250 255
Tyr Asn Trp Ser Thr Thr Met Gly Pro Leu Pro Pro Phe Ala Val Ala
260 265 270
Gln Gly Ala Gln Leu Leu Ile Arg Pro Val Asp Lys Pro Ile Asn Thr
275 280 285
Thr Leu Ile Cys Asn Val Thr Asn Ala Leu Gly Ala Arg Gln Ala Glu
290 295 300
Leu Thr Val Gln Val Lys Glu Gly Pro Pro Ser Glu His Ser Gly Met
305 310 315 320
Ser Arg Asn
<210> 87
<211> 339
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic construct
<220>
<221> MISC_FEATURE
<223> hTIGIT-mFc, amino acid
<400> 87
Met Met Thr Gly Thr Ile Glu Thr Thr Gly Asn Ile Ser Ala Glu Lys
1 5 10 15
Gly Gly Ser Ile Ile Leu Gln Cys His Leu Ser Ser Thr Thr Ala Gln
20 25 30
Val Thr Gln Val Asn Trp Glu Gln Gln Asp Gln Leu Leu Ala Ile Cys
35 40 45
Asn Ala Asp Leu Gly Trp His Ile Ser Pro Ser Phe Lys Asp Arg Val
50 55 60
Ala Pro Gly Pro Gly Leu Gly Leu Thr Leu Gln Ser Leu Thr Val Asn
65 70 75 80
Asp Thr Gly Glu Tyr Phe Cys Ile Tyr His Thr Tyr Pro Asp Gly Thr
85 90 95
Tyr Thr Gly Arg Ile Phe Leu Glu Val Leu Glu Ser Ser Gly Gly Gly
100 105 110
Gly Ala Gly Gly Gly Gly Cys Lys Pro Cys Ile Cys Thr Val Pro Glu
115 120 125
Val Ser Ser Val Phe Ile Phe Pro Pro Lys Pro Lys Asp Val Leu Thr
130 135 140
Ile Thr Leu Thr Pro Lys Val Thr Cys Val Val Val Asp Ile Ser Lys
145 150 155 160
Asp Asp Pro Glu Val Gln Phe Ser Trp Phe Val Asp Asp Val Glu Val
165 170 175
His Thr Ala Gln Thr Gln Pro Arg Glu Glu Gln Phe Asn Ser Thr Phe
180 185 190
Arg Ser Val Ser Glu Leu Pro Ile Met His Gln Asp Trp Leu Asn Gly
195 200 205
Lys Glu Phe Lys Cys Arg Val Asn Ser Ala Ala Phe Pro Ala Pro Ile
210 215 220
Glu Lys Thr Ile Ser Lys Thr Lys Gly Arg Pro Lys Ala Pro Gln Val
225 230 235 240
Tyr Thr Ile Pro Pro Pro Lys Glu Gln Met Ala Lys Asp Lys Val Ser
245 250 255
Leu Thr Cys Met Ile Thr Asp Phe Phe Pro Glu Asp Ile Thr Val Glu
260 265 270
Trp Gln Trp Asn Gly Gln Pro Ala Glu Asn Tyr Lys Asn Thr Gln Pro
275 280 285
Ile Met Asp Thr Asp Gly Ser Tyr Phe Val Tyr Ser Lys Leu Asn Val
290 295 300
Gln Lys Ser Asn Trp Glu Ala Gly Asn Thr Phe Thr Cys Ser Val Leu
305 310 315 320
His Glu Gly Leu His Asn His His Thr Glu Lys Ser Leu Ser His Ser
325 330 335
Pro Gly Lys
<210> 88
<211> 249
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic construct
<220>
<221> MISC_FEATURE
<223> MTIGIT full length, amino acid
<400> 88
Met His Gly Trp Leu Leu Leu Val Trp Val Gln Gly Leu Ile Gln Ala
1 5 10 15
Ala Phe Leu Ala Thr Ala Ile Gly Ala Thr Ala Gly Thr Ile Asp Thr
20 25 30
Lys Arg Asn Ile Ser Ala Glu Glu Gly Gly Ser Val Ile Leu Gln Cys
35 40 45
His Phe Ser Ser Asp Thr Ala Glu Val Thr Gln Val Asp Trp Lys Gln
50 55 60
Gln Asp Gln Leu Leu Ala Ile Tyr Ser Val Asp Leu Gly Trp His Val
65 70 75 80
Ala Ser Val Phe Ser Asp Arg Val Val Pro Gly Pro Ser Leu Gly Leu
85 90 95
Thr Phe Gln Ser Leu Thr Met Asn Asp Thr Gly Glu Tyr Phe Cys Thr
100 105 110
Tyr His Thr Tyr Pro Gly Gly Ile Tyr Lys Gly Arg Ile Phe Leu Lys
115 120 125
Val Gln Glu Ser Ser Asp Asp Arg Asn Gly Leu Ala Gln Phe Gln Thr
130 135 140
Ala Pro Leu Gly Gly Thr Met Ala Ala Val Leu Gly Leu Ile Cys Leu
145 150 155 160
Met Val Thr Gly Val Thr Val Leu Ala Arg Lys Asp Lys Ser Ile Arg
165 170 175
Met His Ser Ile Glu Ser Gly Leu Gly Arg Thr Glu Ala Glu Pro Gln
180 185 190
Glu Trp Asn Leu Arg Ser Leu Ser Ser Pro Gly Ser Pro Val Gln Thr
195 200 205
Gln Thr Ala Pro Ala Gly Pro Cys Gly Glu Gln Ala Glu Asp Asp Tyr
210 215 220
Ala Asp Pro Gln Glu Tyr Phe Asn Val Leu Ser Tyr Arg Ser Leu Glu
225 230 235 240
Ser Phe Ile Ala Val Ser Lys Thr Gly
245
<210> 89
<211> 242
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic construct
<220>
<221> MISC_FEATURE
<223> RTIGIT full length, amino acid
<400> 89
Met His Gly Trp Met Leu Leu Val Trp Val Gln Gly Leu Thr Glu Thr
1 5 10 15
Ala Phe Leu Ala Ala Gly Ala Thr Ala Gly Thr Met Glu Thr Lys Gly
20 25 30
Asn Ile Ser Ala Glu Glu Gly Gly Ser Val Val Leu Gln Cys His Phe
35 40 45
Ser Ser Asp Thr Ala Glu Val Thr Gln Val Asn Trp Glu Gln Arg Asp
50 55 60
Gln Leu Leu Ala Val Tyr Ser Val Asp Leu Gly Trp Tyr Val Pro Ser
65 70 75 80
Val Phe Ser Asp Arg Val Val Pro Gly Pro Ser Leu Gly Leu Thr Phe
85 90 95
Gln Ser Leu Thr Thr Asn Asp Thr Gly Glu Tyr Phe Cys Thr Tyr His
100 105 110
Thr Tyr Pro Asp Gly Ile Tyr Lys Gly Arg Ile Phe Leu Lys Val Gln
115 120 125
Glu Ser Ser Val Ala His Phe Gln Ile Ala Leu Pro Gly Gly Thr Met
130 135 140
Ala Ala Val Leu Gly Leu Ile Cys Leu Met Ala Thr Gly Val Thr Val
145 150 155 160
Leu Ala Arg Lys Lys Ser Ile Arg Met His Ser Val Glu Ser Gly Leu
165 170 175
Gly Arg Thr Glu Ala Glu Pro Gln Glu Trp Asn Leu Arg Ile Leu Leu
180 185 190
Ser Pro Ser Gly Pro Val Gln Thr Gln Ala Ala Pro Ala Asp Leu Cys
195 200 205
Gly Glu Gln Thr Glu Asp Asp Tyr Thr Asp Pro Gln Asp Tyr Phe Asn
210 215 220
Val Leu Ser Tyr Arg Ser Leu Glu Ser Phe Ile Ala Leu Ser Lys Thr
225 230 235 240
Gly Gln
<210> 90
<211> 124
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic construct
<220>
<221> MISC_FEATURE
<223> HTIGIT-HIS, amino acid (crystallography)
<400> 90
Met Met Thr Gly Thr Ile Glu Thr Thr Gly Gln Ile Ser Ala Glu Lys
1 5 10 15
Gly Gly Ser Ile Ile Leu Gln Cys His Leu Ser Ser Thr Thr Ala Gln
20 25 30
Val Thr Gln Val Asn Trp Glu Gln Gln Asp Gln Leu Leu Ala Ile Cys
35 40 45
Asn Ala Asp Leu Gly Trp His Ile Ser Pro Ser Phe Lys Asp Arg Val
50 55 60
Ala Pro Gly Pro Gly Leu Gly Leu Thr Leu Gln Ser Leu Thr Val Gln
65 70 75 80
Asp Thr Gly Glu Tyr Phe Cys Ile Tyr His Thr Tyr Pro Asp Gly Thr
85 90 95
Tyr Thr Gly Arg Ile Phe Leu Glu Val Leu Glu Ser Ser Gly Gly Gly
100 105 110
Gly Ala Gly Gly Gly Gly His His His His His His
115 120
<210> 91
<211> 116
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic construct
<220>
<221> MISC_FEATURE
<223> CD155 extracellular domain, amino acid (crystallography)
<400> 91
Asp Val Val Val Gln Ala Pro Thr Gln Val Pro Gly Phe Leu Gly Asp
1 5 10 15
Ser Val Thr Leu Pro Cys Tyr Leu Gln Val Pro Asn Met Glu Val Thr
20 25 30
His Val Ser Gln Leu Thr Trp Ala Arg His Gly Glu Ser Gly Ser Met
35 40 45
Ala Val Phe His Gln Thr Gln Gly Pro Ser Tyr Ser Glu Ser Lys Arg
50 55 60
Leu Glu Phe Val Ala Ala Arg Leu Gly Ala Glu Leu Arg Asn Ala Ser
65 70 75 80
Leu Arg Met Phe Gly Leu Arg Val Glu Asp Glu Gly Asn Tyr Thr Cys
85 90 95
Leu Phe Val Thr Phe Pro Gln Gly Ser Arg Ser Val Asp Ile Trp Leu
100 105 110
Arg Val Leu Ala
115
<210> 92
<211> 451
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic construct
<220>
<221> MISC_FEATURE
<223> 24F8.2 heavy chain full length amino acid IgG1; wild-type IMGT
allele IGHG1*01
<400> 92
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Gly
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Ser Gly Tyr Ser Ile Thr Ser Gly
20 25 30
Tyr Ser Trp His Trp Val Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp
35 40 45
Ile Gly Tyr Val His Tyr Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu
50 55 60
Lys Ser Arg Val Thr Ile Ser Val Asp Lys Ser Lys Asn Gln Phe Ser
65 70 75 80
Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Met Asp Tyr Gly Asn Tyr Gly Gly Ala Met Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser
115 120 125
Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala
130 135 140
Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val
145 150 155 160
Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala
165 170 175
Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val
180 185 190
Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His
195 200 205
Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys
210 215 220
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly
225 230 235 240
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
245 250 255
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
260 265 270
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
275 280 285
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
290 295 300
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
305 310 315 320
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
325 330 335
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
340 345 350
Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser
355 360 365
Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
370 375 380
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
385 390 395 400
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val
405 410 415
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
420 425 430
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
435 440 445
Pro Gly Lys
450
<210> 93
<211> 214
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic construct
<220>
<221> MISC_FEATURE
<223> 24F8.2 Light Chain Full length Amino acid sequence (kappa IMGT
allele IGKC*01)
<400> 93
Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Lys Ala Ser Gln Asp Val Arg Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Tyr Arg Tyr Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Tyr Ser Thr Gln Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 94
<211> 330
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic construct
<220>
<221> MISC_FEATURE
<223> heavy chain constant region IGG1; wild-type IMGT allele IGHG1*01
- EU numbering 118-447
<400> 94
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys
1 5 10 15
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
65 70 75 80
Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys
100 105 110
Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
115 120 125
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
130 135 140
Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp
145 150 155 160
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
165 170 175
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
180 185 190
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
195 200 205
Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
210 215 220
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu
225 230 235 240
Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
245 250 255
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
260 265 270
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
275 280 285
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
290 295 300
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
305 310 315 320
Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
325 330
<210> 95
<211> 107
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic construct
<220>
<221> MISC_FEATURE
<223> Light chain constant region, kappa IMGT allele IGKC*01
<400> 95
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
1 5 10 15
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
20 25 30
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
35 40 45
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
50 55 60
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
65 70 75 80
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
85 90 95
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
100 105
<210> 96
<211> 451
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic construct
<220>
<221> MISC_FEATURE
<223> 24F8.2 heavy chain full length amino acid IgG1.AA; IMGT allele
IGHG1*01 (L234A, L235A) eu numbering
<400> 96
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Gly
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Ser Gly Tyr Ser Ile Thr Ser Gly
20 25 30
Tyr Ser Trp His Trp Val Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp
35 40 45
Ile Gly Tyr Val His Tyr Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu
50 55 60
Lys Ser Arg Val Thr Ile Ser Val Asp Lys Ser Lys Asn Gln Phe Ser
65 70 75 80
Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Met Asp Tyr Gly Asn Tyr Gly Gly Ala Met Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser
115 120 125
Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala
130 135 140
Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val
145 150 155 160
Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala
165 170 175
Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val
180 185 190
Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His
195 200 205
Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys
210 215 220
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly
225 230 235 240
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
245 250 255
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
260 265 270
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
275 280 285
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
290 295 300
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
305 310 315 320
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
325 330 335
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
340 345 350
Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser
355 360 365
Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
370 375 380
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
385 390 395 400
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val
405 410 415
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
420 425 430
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
435 440 445
Pro Gly Lys
450
<210> 97
<211> 330
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic construct
<220>
<221> MISC_FEATURE
<223> heavy chain constant region IgG1.AA; IMGT allele IGHG1*01 (L234A,
L235A) eu numbering
<400> 97
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys
1 5 10 15
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
65 70 75 80
Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys
100 105 110
Pro Ala Pro Glu Ala Ala Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
115 120 125
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
130 135 140
Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp
145 150 155 160
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
165 170 175
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
180 185 190
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
195 200 205
Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
210 215 220
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu
225 230 235 240
Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
245 250 255
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
260 265 270
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
275 280 285
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
290 295 300
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
305 310 315 320
Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
325 330
<210> 98
<211> 451
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic construct
<220>
<221> MISC_FEATURE
<223> 24F8.2 heavy chain full length amino acid IgG1.DLE; IMGT allele
IGHG1*01 (S239D, A330L, I332E) eu numbering
<400> 98
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Gly
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Ser Gly Tyr Ser Ile Thr Ser Gly
20 25 30
Tyr Ser Trp His Trp Val Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp
35 40 45
Ile Gly Tyr Val His Tyr Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu
50 55 60
Lys Ser Arg Val Thr Ile Ser Val Asp Lys Ser Lys Asn Gln Phe Ser
65 70 75 80
Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Met Asp Tyr Gly Asn Tyr Gly Gly Ala Met Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser
115 120 125
Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala
130 135 140
Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val
145 150 155 160
Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala
165 170 175
Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val
180 185 190
Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His
195 200 205
Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys
210 215 220
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly
225 230 235 240
Gly Pro Asp Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
245 250 255
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
260 265 270
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
275 280 285
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
290 295 300
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
305 310 315 320
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Leu Pro Glu
325 330 335
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
340 345 350
Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser
355 360 365
Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
370 375 380
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
385 390 395 400
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val
405 410 415
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
420 425 430
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
435 440 445
Pro Gly Lys
450
<210> 99
<211> 330
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic construct
<220>
<221> MISC_FEATURE
<223> heavy chain constant region IgG1.DLE; IMGT allele IGHG1*01
(S239D, A330L, I332E) eu numbering
<400> 99
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys
1 5 10 15
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
65 70 75 80
Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys
100 105 110
Pro Ala Pro Glu Leu Leu Gly Gly Pro Asp Val Phe Leu Phe Pro Pro
115 120 125
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
130 135 140
Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp
145 150 155 160
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
165 170 175
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
180 185 190
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
195 200 205
Lys Ala Leu Pro Leu Pro Glu Glu Lys Thr Ile Ser Lys Ala Lys Gly
210 215 220
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu
225 230 235 240
Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
245 250 255
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
260 265 270
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
275 280 285
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
290 295 300
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
305 310 315 320
Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
325 330
<210> 100
<211> 448
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic construct
<220>
<221> MISC_FEATURE
<223> 24F8.2 heavy chain full length amino acid IgG4.P; IMGT allele
IGHG4*01 (S228P) EU Numbering
<400> 100
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Gly
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Ser Gly Tyr Ser Ile Thr Ser Gly
20 25 30
Tyr Ser Trp His Trp Val Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp
35 40 45
Ile Gly Tyr Val His Tyr Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu
50 55 60
Lys Ser Arg Val Thr Ile Ser Val Asp Lys Ser Lys Asn Gln Phe Ser
65 70 75 80
Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Met Asp Tyr Gly Asn Tyr Gly Gly Ala Met Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser
115 120 125
Val Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala
130 135 140
Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val
145 150 155 160
Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala
165 170 175
Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val
180 185 190
Pro Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His
195 200 205
Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly
210 215 220
Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly Pro Ser
225 230 235 240
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg
245 250 255
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro
260 265 270
Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
275 280 285
Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val
290 295 300
Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr
305 310 315 320
Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr
325 330 335
Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu
340 345 350
Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys
355 360 365
Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
370 375 380
Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp
385 390 395 400
Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser
405 410 415
Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala
420 425 430
Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
435 440 445
<210> 101
<211> 327
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic construct
<220>
<221> MISC_FEATURE
<223> heavy chain constant region IgG4.P; IMGT allele IGHG4*01 (S228P)
eu numbering
<400> 101
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg
1 5 10 15
Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr
65 70 75 80
Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro
100 105 110
Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
115 120 125
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
130 135 140
Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp
145 150 155 160
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe
165 170 175
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
180 185 190
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu
195 200 205
Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
210 215 220
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys
225 230 235 240
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
245 250 255
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
260 265 270
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
275 280 285
Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser
290 295 300
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
305 310 315 320
Leu Ser Leu Ser Leu Gly Lys
325
Claims (40)
- (a) 서열 번호 36에 대해 80% 이상의 서열 동일성을 갖는 중쇄(HC) 상보성 결정 영역(CDR) 1, 서열 번호 37에 대해 80% 이상의 서열 동일성을 갖는 HC-CDR2, 및 서열 번호 38에 대해 80% 이상의 서열 동일성을 갖는 HC-CDR3을 포함하는 중쇄 가변 영역; 및 서열 번호 39에 대해 80% 이상의 서열 동일성을 갖는 경쇄(LC) CDR1, 서열 번호 40에 대해 80% 이상의 서열 동일성을 갖는 LC-CDR2, 및 서열 번호 41에 대해 80% 이상의 서열 동일성을 갖는 LC-CDR3을 포함하는 경쇄 가변 영역;
(b) 서열 번호 42에 대해 80% 이상의 서열 동일성을 갖는 HC-CDR1, 서열 번호 43에 대해 80% 이상의 서열 동일성을 갖는 HC-CDR2, 및 서열 번호 44에 대해 80% 이상의 서열 동일성을 갖는 HC-CDR3을 포함하는 중쇄 가변 영역; 서열 번호 45에 대해 80% 이상의 서열 동일성을 갖는 LC-CDR1, 서열 번호 46에 대해 80% 이상의 서열 동일성을 갖는 LC-CDR2, 및 서열 번호 47에 대해 80% 이상의 서열 동일성을 갖는 LC-CDR3을 포함하는 경쇄 가변 영역;
(c) 서열 번호 48에 대해 80% 이상의 서열 동일성을 갖는 HC-CDR1, 서열 번호 49에 대해 80% 이상의 서열 동일성을 갖는 HC-CDR2, 및 서열 번호 50에 대해 80% 이상의 서열 동일성을 갖는 HC-CDR3을 포함하는 중쇄 가변 영역; 및 서열 번호 51에 대해 80% 이상의 서열 동일성을 갖는 LC-CDR1, 서열 번호 52에 대해 80% 이상의 서열 동일성을 갖는 LC-CDR2, 및 서열 번호 53에 대해 80% 이상의 서열 동일성을 갖는 LC-CDR3을 포함하는 경쇄 가변 영역;
(d) 서열 번호 54에 대해 80% 이상의 서열 동일성을 갖는 HC-CDR1, 서열 번호 55에 대해 80% 이상의 서열 동일성을 갖는 HC-CDR2, 및 서열 번호 56에 대해 80% 이상의 서열 동일성을 갖는 HC-CDR3을 포함하는 중쇄 가변 영역; 및 서열 번호 57에 대해 80% 이상의 서열 동일성을 갖는 LC-CDR1, 서열 번호 58에 대해 80% 이상의 서열 동일성을 갖는 LC-CDR2, 및 서열 번호 59에 대해 80% 이상의 서열 동일성을 갖는 LC-CDR3을 포함하는 경쇄 가변 영역;
(e) 서열 번호 60에 대해 80% 이상의 서열 동일성을 갖는 HC-CDR1, 서열 번호 61에 대해 80% 이상의 서열 동일성을 갖는 HC-CDR2, 및 서열 번호 62에 대해 80% 이상의 서열 동일성을 갖는 HC-CDR3을 포함하는 중쇄 가변 영역; 및 서열 번호 63에 대해 80% 이상의 서열 동일성을 갖는 LC-CDR1, 서열 번호 64에 대해 80% 이상의 서열 동일성을 갖는 LC-CDR2, 및 서열 번호 65에 대해 80% 이상의 서열 동일성을 갖는 LC-CDR3을 포함하는 경쇄 가변 영역;
(f) 서열 번호 60에 대해 80% 이상의 서열 동일성을 갖는 HC-CDR1, 서열 번호 66에 대해 80% 이상의 서열 동일성을 갖는 HC-CDR2, 및 서열 번호 67에 대해 80% 이상의 서열 동일성을 갖는 HC-CDR3을 포함하는 중쇄 가변 영역; 및 서열 번호 63에 대해 80% 이상의 서열 동일성을 갖는 LC-CDR1, 서열 번호 68에 대해 80% 이상의 서열 동일성을 갖는 LC-CDR2, 및 서열 번호 65에 대해 80% 이상의 서열 동일성을 갖는 LC-CDR3을 포함하는 경쇄 가변 영역;
(g) 서열 번호 69에 대해 80% 이상의 서열 동일성을 갖는 HC-CDR1, 서열 번호 55에 대해 80% 이상의 서열 동일성을 갖는 HC-CDR2, 및 서열 번호 70에 대해 80% 이상의 서열 동일성을 갖는 HC-CDR3을 포함하는 중쇄 가변 영역; 및 서열 번호 71에 대해 80% 이상의 서열 동일성을 갖는 LC-CDR1, 서열 번호 68에 대해 80% 이상의 서열 동일성을 갖는 LC-CDR2, 및 서열 번호 65에 대해 80% 이상의 서열 동일성을 갖는 LC-CDR3을 포함하는 경쇄 가변 영역;
(h) 서열 번호 72에 대해 80% 이상의 서열 동일성을 갖는 HC-CDR1, 서열 번호 73에 대해 80% 이상의 서열 동일성을 갖는 HC-CDR2, 및 서열 번호 67에 대해 80% 이상의 서열 동일성을 갖는 HC-CDR3을 포함하는 중쇄 가변 영역; 및 서열 번호 63에 대해 80% 이상의 서열 동일성을 갖는 LC-CDR1, 서열 번호 68에 대해 80% 이상의 서열 동일성을 갖는 LC-CDR2, 및 서열 번호 65에 대해 80% 이상의 서열 동일성을 갖는 LC-CDR3을 포함하는 경쇄 가변 영역; 또는
(i) 서열 번호 74에 대해 80% 이상의 서열 동일성을 갖는 HC-CDR1, 서열 번호 75에 대해 80% 이상의 서열 동일성을 갖는 HC-CDR2, 및 서열 번호 67에 대해 80% 이상의 서열 동일성을 갖는 HC-CDR3을 포함하는 중쇄 가변 영역; 및 서열 번호 63에 대해 80% 이상의 서열 동일성을 갖는 LC-CDR1, 서열 번호 68에 대해 80% 이상의 서열 동일성을 갖는 LC-CDR2, 및 서열 번호 65에 대해 80% 이상의 서열 동일성을 갖는 LC-CDR3을 포함하는 경쇄 가변 영역을 포함하는, 인간 TIGIT에 특이적으로 결합하는 항-TIGIT 항체 또는 이의 항원-결합 단편. - 제1항에 있어서,
(a) 서열 번호 36을 포함하는 아미노 서열을 갖는 HC-CDR1, 서열 번호 37을 포함하는 아미노 서열을 갖는 HC-CDR2, 및 서열 번호 38을 포함하는 아미노 서열을 갖는 HC-CDR3을 포함하는 중쇄 가변 영역; 및 서열 번호 39에 대한 동일성을 포함하는 아미노 서열을 갖는 LC-CDR1, 서열 번호 40을 포함하는 아미노 서열을 갖는 LC-CDR2, 및 서열 번호 41을 포함하는 아미노 서열을 갖는 LC-CDR3을 포함하는 경쇄 가변 영역;
(b) 서열 번호 42를 포함하는 아미노 서열을 갖는 HC-CDR1, 서열 번호 43을 포함하는 아미노 서열을 갖는 HC-CDR2, 및 서열 번호 44를 포함하는 아미노 서열을 갖는 HC-CDR3을 포함하는 중쇄 가변 영역; 및 서열 번호 45를 포함하는 아미노 서열을 갖는 LC-CDR1, 서열 번호 46을 포함하는 아미노 서열을 갖는 LC-CDR2, 및 서열 번호 47을 포함하는 아미노 서열을 갖는 LC-CDR3을 포함하는 경쇄 가변 영역;
(c) 서열 번호 48을 포함하는 아미노 서열을 갖는 HC-CDR1, 서열 번호 49를 포함하는 아미노 서열을 갖는 HC-CDR2, 및 서열 번호 50을 포함하는 아미노 서열을 갖는 HC-CDR3을 포함하는 중쇄 가변 영역; 및 서열 번호 51을 포함하는 아미노 서열을 갖는 LC-CDR1, 서열 번호 52를 포함하는 아미노 서열을 갖는 LC-CDR2, 및 서열 번호 53을 포함하는 아미노 서열을 갖는 LC-CDR3을 포함하는 경쇄 가변 영역;
(d) 서열 번호 54를 포함하는 아미노 서열을 갖는 HC-CDR1, 서열 번호 55를 포함하는 아미노 서열을 갖는 HC-CDR2, 및 서열 번호 56을 포함하는 아미노 서열을 갖는 HC-CDR3을 포함하는 중쇄 가변 영역; 및 서열 번호 57을 포함하는 아미노 서열을 갖는 LC-CDR1, 서열 번호 58을 포함하는 아미노 서열을 갖는 LC-CDR2, 및 서열 번호 59를 포함하는 아미노 서열을 갖는 LC-CDR3을 포함하는 경쇄 가변 영역;
(e) 서열 번호 60을 포함하는 아미노 서열을 갖는 HC-CDR1, 서열 번호 61을 포함하는 아미노 서열을 갖는 HC-CDR2, 및 서열 번호 62를 포함하는 아미노 서열을 갖는 HC-CDR3을 포함하는 중쇄 가변 영역; 및 서열 번호 63을 포함하는 아미노 서열을 갖는 LC-CDR1, 서열 번호 64를 포함하는 아미노 서열을 갖는 LC-CDR2, 및 서열 번호 65를 포함하는 아미노 서열을 갖는 LC-CDR3을 포함하는 경쇄 가변 영역;
(f) 서열 번호 60을 포함하는 아미노 서열을 갖는 HC-CDR1, 서열 번호 66을 포함하는 아미노 서열을 갖는 HC-CDR2, 및 서열 번호 67을 포함하는 아미노 서열을 갖는 HC-CDR3을 포함하는 중쇄 가변 영역; 및 서열 번호 63을 포함하는 아미노 서열을 갖는 LC-CDR1, 서열 번호 68을 포함하는 아미노 서열을 갖는 LC-CDR2, 및 서열 번호 65를 포함하는 아미노 서열을 갖는 LC-CDR3을 포함하는 경쇄 가변 영역;
(g) 서열 번호 69를 포함하는 아미노 서열을 갖는 HC-CDR1, 서열 번호 55를 포함하는 아미노 서열을 갖는 HC-CDR2, 및 서열 번호 70을 포함하는 아미노 서열을 갖는 HC-CDR3을 포함하는 중쇄 가변 영역; 및 서열 번호 71을 포함하는 아미노 서열을 갖는 LC-CDR1, 서열 번호 68을 포함하는 아미노 서열을 갖는 LC-CDR2, 및 서열 번호 65를 포함하는 아미노 서열을 갖는 LC-CDR3을 포함하는 경쇄 가변 영역;
(h) 서열 번호 72를 포함하는 아미노 서열을 갖는 HC-CDR1, 서열 번호 73을 포함하는 아미노 서열을 갖는 HC-CDR2, 및 서열 번호 67을 포함하는 아미노 서열을 갖는 HC-CDR3을 포함하는 중쇄 가변 영역; 및 서열 번호 63을 포함하는 아미노 서열을 갖는 LC-CDR1, 서열 번호 68을 포함하는 아미노 서열을 갖는 LC-CDR2, 및 서열 번호 65를 포함하는 아미노 서열을 갖는 LC-CDR3을 포함하는 경쇄 가변 영역; 또는
(i) 서열 번호 74를 포함하는 아미노 서열을 갖는 HC-CDR1, 서열 번호 75를 포함하는 아미노 서열을 갖는 HC-CDR2, 및 서열 번호 67을 포함하는 아미노 서열을 갖는 HC-CDR3을 포함하는 중쇄 가변 영역; 및 서열 번호 63을 포함하는 아미노 서열을 갖는 LC-CDR1, 서열 번호 68을 포함하는 아미노 서열을 갖는 LC-CDR2, 및 서열 번호 65를 포함하는 아미노 서열을 갖는 LC-CDR3을 포함하는 경쇄 가변 영역을 포함하는, 항-TIGIT 항체 또는 이의 항원-결합 단편. - 제1항 또는 제2항에 있어서,
(a) 서열 번호 1에 대해 80% 이상의 서열 동일성을 갖는 중쇄 가변 영역, 및 서열 번호 2에 대해 80% 이상의 서열 동일성을 갖는 경쇄 가변 영역;
(b) 서열 번호 3에 대해 80% 이상의 서열 동일성을 갖는 중쇄 가변 영역, 및 서열 번호 4에 대해 80% 이상의 서열 동일성을 갖는 경쇄 가변 영역;
(c) 서열 번호 5에 대해 80% 이상의 서열 동일성을 갖는 중쇄 가변 영역, 및 서열 번호 6에 대해 80% 이상의 서열 동일성을 갖는 경쇄 가변 영역;
(d) 서열 번호 7에 대해 80% 이상의 서열 동일성을 갖는 중쇄 가변 영역, 및 서열 번호 8에 대해 80% 이상의 서열 동일성을 갖는 경쇄 가변 영역;
(e) 서열 번호 9에 대해 80% 이상의 서열 동일성을 갖는 중쇄 가변 영역, 및 서열 번호 10에 대해 80% 이상의 서열 동일성을 갖는 경쇄 가변 영역;
(f) 서열 번호 11에 대해 80% 이상의 서열 동일성을 갖는 중쇄 가변 영역, 및 서열 번호 12에 대해 80% 이상의 서열 동일성을 갖는 경쇄 가변 영역;
(g) 서열 번호 13에 대해 80% 이상의 서열 동일성을 갖는 중쇄 가변 영역, 및 서열 번호 14에 대해 80% 이상의 서열 동일성을 갖는 경쇄 가변 영역;
(h) 서열 번호 15에 대해 80% 이상의 서열 동일성을 갖는 중쇄 가변 영역, 및 서열 번호 16에 대해 80% 이상의 서열 동일성을 갖는 경쇄 가변 영역;
(i) 서열 번호 17에 대해 80% 이상의 서열 동일성을 갖는 중쇄 가변 영역, 및 서열 번호 12에 대해 80% 이상의 서열 동일성을 갖는 경쇄 가변 영역;
(j) 서열 번호 76에 대해 80% 이상의 서열 동일성을 갖는 중쇄 가변 영역, 및 서열 번호 77에 대해 80% 이상의 서열 동일성을 갖는 경쇄 가변 영역;
(k) 서열 번호 78에 대해 80% 이상의 서열 동일성을 갖는 중쇄 가변 영역, 및 서열 번호 77에 대해 80% 이상의 서열 동일성을 갖는 경쇄 가변 영역;
(l) 서열 번호 76에 대해 80% 이상의 서열 동일성을 갖는 중쇄 가변 영역, 및 서열 번호 79에 대해 80% 이상의 서열 동일성을 갖는 경쇄 가변 영역; 또는
(m) 서열 번호 78에 대해 80% 이상의 서열 동일성을 갖는 중쇄 가변 영역, 및 서열 번호 79에 대해 80% 이상의 서열 동일성을 갖는 경쇄 가변 영역을 포함하는, 항-TIGIT 항체 또는 이의 항원-결합 단편. - 제1항 내지 제3항 중 어느 한 항에 있어서, 단일클론 항체인, 항-TIGIT 항체 또는 이의 항원-결합 단편.
- 제1항 내지 제4항 중 어느 한 항에 있어서, 키메라, 인간화, 또는 베니어(veneered) 항체인, 항-TIGIT 항체 또는 이의 항원-결합 단편.
- 제5항에 있어서, 키메라 항체는 인간 IgG1/카파 Fab 불변 도메인을 포함하는, 항-TIGIT 항체 또는 이의 항원-결합 단편.
- 제1항 내지 제3항 중 어느 한 항에 있어서, 인간 항체인, 항-TIGIT 항체 또는 이의 항원-결합 단편.
- 제1항 내지 제7항 중 어느 한 항에 있어서, CD155에 대한 TIGIT의 결합을 억제하며, 임의로 여기서 결합은 실시예 1에서와 같이 측정된 약 0.1 nM 내지 약 10 nM, 약 0.1 nM 내지 약 5 nM, 약 0.2 nM 내지 약 2 nM, 약 0.2 nM 내지 약 0.8 nM, 약 0.4 nM 내지 약 0.8 nM, 또는 약 0.6 nM 내지 약 0.8 nM의 IC50으로 억제하는, 항-TIGIT 항체 또는 이의 항원-결합 단편.
- 제1항 내지 제5항 또는 제7항 또는 제8항 중 어느 한 항에 있어서, 항체는 변이체 인간 IgG1, 변이체 인간 IgG2, 변이체 인간 IgG3, 또는 변이체 인간 IgG4로부터 선택된 변이체 중쇄 불변 영역, 및 임의로 인간 경쇄 불변 영역을 추가로 포함하는, 항-TIGIT 항체 또는 이의 항원 결합 단편.
- 제9항에 있어서, 변이체 중쇄 불변 영역은 야생형 중쇄 불변 영역에 대해 향상되거나 감소된 이펙터 기능을 갖는, 항-TIGIT 항체 또는 이의 항원 결합 단편.
- 제10항에 있어서, 변이체 인간 IgG 중쇄 불변 영역은 서열 번호 97, 서열 번호 99, 또는 서열 번호 101을 포함하는, 항-TIGIT 항체 또는 이의 항원 결합 단편.
- 제1항 내지 제5항 또는 제7항 또는 제8항 중 어느 한 항에 있어서, 항체는 야생형 인간 IgG 중쇄 불변 영역, 및 임의로 인간 경쇄 불변 영역을 추가로 포함하는, 항-TIGIT 항체 또는 이의 항원 결합 단편.
- 제12항에 있어서, 야생형 인간 IgG 중쇄 불변 영역은 서열 번호 94를 포함하는, 항-TIGIT 항체 또는 이의 항원 결합 단편.
- 제12항 또는 제13항에 있어서, 인간 경쇄 카파 불변 영역을 포함하며, 임의로 여기서 인간 경쇄 불변 영역은 서열 번호 95를 포함하는, 항-TIGIT 항체 또는 이의 항원 결합 단편.
- 제1항 내지 제5항 또는 제7항 또는 제8항 중 어느 한 항에 있어서, 항체는 중쇄 및 경쇄를 가지며, 여기서
(a) 중쇄는 서열 번호 92를 포함하는 아미노산 서열을 갖고, 경쇄는 서열 번호 93을 포함하는 아미노산 서열을 갖거나;
(b) 중쇄는 서열 번호 96을 포함하는 아미노산 서열을 갖고, 경쇄는 서열 번호 93을 포함하는 아미노산 서열을 갖거나;
(c) 중쇄는 서열 번호 98을 포함하는 아미노산 서열을 갖고, 경쇄는 서열 번호 93을 포함하는 아미노산 서열을 갖거나;
(d) 중쇄는 서열 번호 100을 포함하는 아미노산 서열을 갖고, 경쇄는 서열 번호 93을 포함하는 아미노산 서열을 갖는, 항-TIGIT 항체 또는 이의 항원 결합 단편. - 제1항 내지 제15항 중 어느 한 항에 있어서,
(a) 표면 플라즈몬 공명에 의해 측정된 약 0.01×10-11 M 내지 약 100×10-11 M, 약 0.1×10-11 M 내지 약 100×10-11 M, 약 0.1×10-11 M 내지 약 10×10-11 M, 약 1×10-11 M 내지 약 100×10-11 M, 또는 약 1×10-11 M 내지 약 10×10-11 M의 평형 결합 상수(KD)를 갖거나;
(b) 세포 표면 인간 TIGIT에 대한 가용성 인간 CD155 리간드의 결합을 실시예 1에서와 같이 측정된 약 0.2 nM 내지 약 2 nM, 약 0.2 nM 내지 약 0.8 nM, 약 0.6 nM 내지 약 0.8 nM, 또는 약 0.6 nM 내지 약 0.8 nM의 반수 최대 억제제 농도(IC50)로 차단하거나;
(c) 적어도 하기 TIGIT의 잔기,
(i) 서열 번호 80의 D72 및 서열 번호 80의 T55, Q56, N58, E60, S80, 및 K82 중 하나 이상,
(ii) 서열 번호 80의 E60 및 D72 및 임의로 서열 번호 80의 T55, Q56, N58, S80, 및 K82 중 하나 이상,
(iii) 서열 번호 80의 D72 및 K82 및 임의로 서열 번호 80의 T55, Q56, N58, E60, 및 S80 중 하나 이상,
(iv) 서열 번호 80의 E60, D72, 및 K82 및 임의로 서열 번호 80의 T55, Q56, N58, 및 S80 중 하나 이상, 또는
(v) 서열 번호 80의 T55, Q56, N58, E60, D72, S80, 및 K82를 포함하는 에피토프에 결합하거나;
(d) (a), (b), 및 (c)의 임의의 조합인, 항-TIGIT 항체 또는 이의 항원 결합 단편. - 제16항에 있어서, TIGIT에 대한 결합에 대해 제1항 내지 제17항 중 어느 한 항의 항체 또는 이의 항원-결합 단편과 경쟁하는, 항-TIGIT 항체 또는 이의 항원 결합 단편.
- 제16항 또는 제17항에 있어서, 과량의 항체 또는 이의 항원-결합 단편은, 경쟁 결합 검정에서 측정되는 바와 같이, TIGIT에 대한 결합에 대해 약 55%, 60%, 65%, 70%, 75%, 76%, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 또는 100% 이상만큼 참조 항체와 경쟁하며, 여기서 참조 항체는 서열 번호 92를 포함하는 아미노산 서열을 갖는 중쇄 및 서열 번호 93을 포함하는 아미노산 서열을 갖는 경쇄를 포함하는, 항-TIGIT 항체 또는 이의 항원 결합 단편.
- 서열 번호 92를 포함하는 아미노산 서열을 갖는 중쇄 및 서열 번호 93을 포함하는 아미노산 서열을 갖는 경쇄를 포함하는, 인간 TIGIT에 특이적으로 결합하는 항-TIGIT 항체 또는 이의 항원-결합 단편.
- CD155에 대한 TIGIT의 결합을 억제하는 방법으로서, 제1항 내지 제19항 중 어느 한 항의 항-TIGIT 항체 또는 이의 항원-결합 단편과 TIGIT를 접촉시키는 단계를 포함하는, 방법.
- 암을 치료하거나 암의 예방을 달성하는 방법으로서, 암을 갖거나 암의 위험이 있는 대상체에게 제1항 내지 제20항 중 어느 한 항의 항-TIGIT 항체 중 어느 하나 또는 이의 항원-결합 단편의 효과적인 요법 또는 치료적 유효량을 투여하는 단계를 포함하는, 방법.
- 제21항에 있어서, 암은 혈액학적 악성종양, 고형 종양, 메르켈 세포 암종, 요로상피암, 두경부 편평 세포 암종, B-세포 림프종, 자궁암, 자궁경부암, 고환암, 위장관암, 방광암, 골암, 골수, 피부암, 담낭암, 심장암, 폐암, 침샘암, 부신암, 갑상선암, 신경절암, 중추 신경계(CNS) 및 말초 신경계(PNS) 암, 및 조혈계의 암, 면역계의 암인, 방법.
- 제21항 또는 제22항에 있어서, 대상체에게 종양 침윤 T 세포를 투여하며, 이는 항체 또는 이의 항원-결합 단편에 의해 활성화되는, 방법.
- 제21항 내지 제23항 중 어느 한 항에 있어서, 대상체에게 암에 대한 면역 반응을 유도하는 백신을 투여하며, 이는 항체 또는 이의 항원-결합 단편에 의해 향상되는, 방법.
- 제24항에 있어서, 백신은 암 세포의 표면 상에 발현되는 항원 또는 이의 단편을 포함하는, 방법.
- 제21항 내지 제25항 중 어느 한 항에 있어서, 대상체에게 자연 살해 세포를 투여하며, 이의 암에 대한 세포독성은 항체 또는 이의 항원-결합 단편에 의해 향상되는, 방법.
- 제21항 내지 제26항 중 어느 한 항에 있어서, 대상체에게 암의 세포의 표면 상에 발현되는 항원에 대한 제2 항체를 추가로 투여하며, 여기서 암에 대한 제2 항체의 이펙터 매개 세포독성은 항체 또는 이의 항원-결합 단편에 의해 향상되는, 방법.
- 제21항 내지 제26항 중 어느 한 항에 있어서, 대상체에게 면역 세포의 표면 상에 발현되는 항원에 대한 제2 항체를 추가로 투여하는, 방법.
- 제28항에 있어서, 면역 세포는 T 세포 또는 자연 살해 세포인, 방법.
- 제27항 또는 제28항에 있어서, 항원은 CTLA-4, PD-1, 또는 PD-L1인, 방법.
- 제21항 내지 제30항 중 어느 한 항에 있어서, 대상체에게 화학요법, 방사선, 세포-기반 요법, 및 수술로 이루어진 군으로부터 선택된 하나 이상의 요법을 추가로 투여하는, 방법.
- 제21항 내지 제31항 중 어느 한 항에 있어서, 대상체에게 하나 이상의 면역-체크포인트 수용체 또는 리간드의 억제제를 추가로 투여하는, 방법.
- 제30항에 있어서, 하나 이상의 면역-체크포인트 수용체 또는 리간드는 CTLA-4, PD-1, PD-L1, TIM-3, LAG-3, PVRIG, BTLA, VISTA, CD96, A2aR, A2bR, A2a/A2bR, 아르기나제, CD39, CD73, IDO, 및 TDO로 이루어진 군으로부터 선택되는, 방법.
- 제32항에 있어서, 억제제는 이필리무맙, 트레멜리무맙, 니볼루맙, 펨브롤리주맙, 람브롤리주맙, 세미플리맙, 티스렐리주맙, 짐베렐리맙, 두르발루맙, 및 아테졸리주맙으로 이루어진 군으로부터 선택되는, 방법.
- 제1항 내지 제19항 중 어느 한 항의 항체 또는 이의 항원-결합 단편 및 약제학적으로 허용가능한 담체를 포함하는, 약제학적 조성물.
- 하기 서열 번호 80의 아미노산 잔기 중 하나 이상을 포함하는 인간 TIGIT의 에피토프에 결합하는, 항-TIGIT 항체 또는 이의 항원 결합 단편: T55, Q56, N58, E60, D72, S80, 및 K82.
- 제36항에 있어서, 적어도 하기 TIGIT의 잔기를 포함하는 에피토프에 결합하는, 항-TIGIT 항체 또는 이의 항원-결합 단편:
(i) 서열 번호 80의 D72 및 서열 번호 80의 T55, Q56, N58, E60, S80, 및 K82 중 하나 이상;
(ii) 서열 번호 80의 E60 및 D72 및 임의로 서열 번호 80의 T55, Q56, N58, S80, 및 K82 중 하나 이상;
(iii) 서열 번호 80의 D72 및 K82 및 임의로 서열 번호 80의 T55, Q56, N58, E60, 및 S80 중 하나 이상;
(iv) 서열 번호 80의 E60, D72, 및 K82 및 임의로 서열 번호 80의 T55, Q56, N58, 및 S80 중 하나 이상; 또는
(v) 서열 번호 80의 T55, Q56, N58, E60, D72, S80, 및 K82. - 제36항 또는 제37항에 있어서, TIGIT에 대한 결합에 대해 제1항 내지 제19항 중 어느 한 항의 항체 또는 이의 항원-결합 단편과 경쟁하는, 항-TIGIT 항체 또는 이의 항원-결합 단편.
- 제36항 또는 제37항에 있어서, 과량의 항체 또는 이의 항원-결합 단편은, 경쟁 결합 검정에서 측정되는 바와 같이, TIGIT에 대한 결합에 대해 약 55%, 60%, 65%, 70%, 75%, 76%, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 또는 100% 이상만큼 참조 항체와 경쟁하며, 여기서 참조 항체는 서열 번호 92를 포함하는 아미노산 서열을 갖는 중쇄 및 서열 번호 93을 포함하는 아미노산 서열을 갖는 경쇄를 포함하는, 항-TIGIT 항체 또는 이의 항원 결합 단편.
- 제1항 내지 제19항 중 어느 한 항에 있어서, 하기 서열 번호 80의 아미노산 잔기 중 하나 이상을 포함하는 인간 TIGIT의 에피토프에 결합하는, 항-TIGIT 항체 또는 이의 항원 결합 단편: T55, Q56, N58, E60, D72, S80, 및 K82.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US202063033609P | 2020-06-02 | 2020-06-02 | |
| US63/033,609 | 2020-06-02 | ||
| PCT/US2021/035268 WO2021247591A1 (en) | 2020-06-02 | 2021-06-01 | Antibodies to tigit |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20230019152A true KR20230019152A (ko) | 2023-02-07 |
Family
ID=76601830
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020227046210A KR20230019152A (ko) | 2020-06-02 | 2021-06-01 | Tigit에 대한 항체 |
Country Status (18)
| Country | Link |
|---|---|
| US (1) | US11820824B2 (ko) |
| EP (1) | EP4157875A1 (ko) |
| JP (1) | JP2023528036A (ko) |
| KR (1) | KR20230019152A (ko) |
| CN (1) | CN115698068A (ko) |
| AR (1) | AR122493A1 (ko) |
| AU (1) | AU2021284273A1 (ko) |
| BR (1) | BR112022024221A2 (ko) |
| CA (1) | CA3176246A1 (ko) |
| CL (1) | CL2022003397A1 (ko) |
| CO (1) | CO2022017348A2 (ko) |
| CR (1) | CR20220611A (ko) |
| DO (1) | DOP2022000272A (ko) |
| IL (1) | IL298111A (ko) |
| MX (1) | MX2022015157A (ko) |
| PE (1) | PE20231078A1 (ko) |
| TW (1) | TW202210514A (ko) |
| WO (1) | WO2021247591A1 (ko) |
Families Citing this family (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| TW202325279A (zh) | 2021-10-29 | 2023-07-01 | 美商阿克思生物科學有限公司 | HIF-2α抑制劑及其使用方法 |
| WO2023105281A1 (en) * | 2021-12-11 | 2023-06-15 | Fundaciò Privada Institut De Recerca De La Sida-Caixa | Soluble tigit recombinant proteins |
| WO2024015251A1 (en) | 2022-07-15 | 2024-01-18 | Arcus Biosciences, Inc. | Inhibitors of hpk1 and methods of use thereof |
| WO2024020034A1 (en) | 2022-07-20 | 2024-01-25 | Arcus Biosciences, Inc. | Cbl-b inhibitors and methods of use thereof |
| WO2024059142A1 (en) | 2022-09-14 | 2024-03-21 | Arcus Biosciences, Inc. | Dispersions of etrumadenant |
| WO2024081385A1 (en) | 2022-10-14 | 2024-04-18 | Arcus Biosciences, Inc. | Hpk1 inhibitors and methods of use thereof |
| WO2024086718A1 (en) | 2022-10-20 | 2024-04-25 | Arcus Biosciences, Inc. | Lyophilized formulations of cd73 compounds |
Family Cites Families (155)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CH652145A5 (de) | 1982-01-22 | 1985-10-31 | Sandoz Ag | Verfahren zur in vitro-herstellung von hybridomen welche humane monoklonale antikoerper erzeugen. |
| US4634666A (en) | 1984-01-06 | 1987-01-06 | The Board Of Trustees Of The Leland Stanford Junior University | Human-murine hybridoma fusion partner |
| US4879231A (en) | 1984-10-30 | 1989-11-07 | Phillips Petroleum Company | Transformation of yeasts of the genus pichia |
| US5225539A (en) | 1986-03-27 | 1993-07-06 | Medical Research Council | Recombinant altered antibodies and methods of making altered antibodies |
| GB8610600D0 (en) | 1986-04-30 | 1986-06-04 | Novo Industri As | Transformation of trichoderma |
| DE3883899T3 (de) | 1987-03-18 | 1999-04-22 | Sb2 Inc | Geänderte antikörper. |
| US5530101A (en) | 1988-12-28 | 1996-06-25 | Protein Design Labs, Inc. | Humanized immunoglobulins |
| EP0402226A1 (en) | 1989-06-06 | 1990-12-12 | Institut National De La Recherche Agronomique | Transformation vectors for yeast yarrowia |
| DE3920358A1 (de) | 1989-06-22 | 1991-01-17 | Behringwerke Ag | Bispezifische und oligospezifische, mono- und oligovalente antikoerperkonstrukte, ihre herstellung und verwendung |
| US5859205A (en) | 1989-12-21 | 1999-01-12 | Celltech Limited | Humanised antibodies |
| ATE356869T1 (de) | 1990-01-12 | 2007-04-15 | Amgen Fremont Inc | Bildung von xenogenen antikörpern |
| US5427908A (en) | 1990-05-01 | 1995-06-27 | Affymax Technologies N.V. | Recombinant library screening methods |
| CA2109602C (en) | 1990-07-10 | 2002-10-01 | Gregory P. Winter | Methods for producing members of specific binding pairs |
| GB9015198D0 (en) | 1990-07-10 | 1990-08-29 | Brien Caroline J O | Binding substance |
| US5874299A (en) | 1990-08-29 | 1999-02-23 | Genpharm International, Inc. | Transgenic non-human animals capable of producing heterologous antibodies |
| US5661016A (en) | 1990-08-29 | 1997-08-26 | Genpharm International Inc. | Transgenic non-human animals capable of producing heterologous antibodies of various isotypes |
| US5789650A (en) | 1990-08-29 | 1998-08-04 | Genpharm International, Inc. | Transgenic non-human animals for producing heterologous antibodies |
| US5814318A (en) | 1990-08-29 | 1998-09-29 | Genpharm International Inc. | Transgenic non-human animals for producing heterologous antibodies |
| US5877397A (en) | 1990-08-29 | 1999-03-02 | Genpharm International Inc. | Transgenic non-human animals capable of producing heterologous antibodies of various isotypes |
| US5625126A (en) | 1990-08-29 | 1997-04-29 | Genpharm International, Inc. | Transgenic non-human animals for producing heterologous antibodies |
| US5770429A (en) | 1990-08-29 | 1998-06-23 | Genpharm International, Inc. | Transgenic non-human animals capable of producing heterologous antibodies |
| US5633425A (en) | 1990-08-29 | 1997-05-27 | Genpharm International, Inc. | Transgenic non-human animals capable of producing heterologous antibodies |
| US5545806A (en) | 1990-08-29 | 1996-08-13 | Genpharm International, Inc. | Ransgenic non-human animals for producing heterologous antibodies |
| ES2108048T3 (es) | 1990-08-29 | 1997-12-16 | Genpharm Int | Produccion y utilizacion de animales inferiores transgenicos capaces de producir anticuerpos heterologos. |
| US5858657A (en) | 1992-05-15 | 1999-01-12 | Medical Research Council | Methods for producing members of specific binding pairs |
| DE69230142T2 (de) | 1991-05-15 | 2000-03-09 | Cambridge Antibody Tech | Verfahren zur herstellung von spezifischen bindungspaargliedern |
| LU91067I2 (fr) | 1991-06-14 | 2004-04-02 | Genentech Inc | Trastuzumab et ses variantes et dérivés immuno chimiques y compris les immotoxines |
| ES2136092T3 (es) | 1991-09-23 | 1999-11-16 | Medical Res Council | Procedimientos para la produccion de anticuerpos humanizados. |
| ATE207080T1 (de) | 1991-11-25 | 2001-11-15 | Enzon Inc | Multivalente antigen-bindende proteine |
| EP0746609A4 (en) | 1991-12-17 | 1997-12-17 | Genpharm Int | NON-HUMAN TRANSGENIC ANIMALS CAPABLE OF PRODUCING HETEROLOGOUS ANTIBODIES |
| US5733743A (en) | 1992-03-24 | 1998-03-31 | Cambridge Antibody Technology Limited | Methods for producing members of specific binding pairs |
| US6005079A (en) | 1992-08-21 | 1999-12-21 | Vrije Universiteit Brussels | Immunoglobulins devoid of light chains |
| ES2162823T5 (es) | 1992-08-21 | 2010-08-09 | Vrije Universiteit Brussel | Inmunoglobulinas desprovistas de cadenas ligeras. |
| JP3720353B2 (ja) | 1992-12-04 | 2005-11-24 | メディカル リサーチ カウンシル | 多価および多重特異性の結合タンパク質、それらの製造および使用 |
| DK0698097T3 (da) | 1993-04-29 | 2001-10-08 | Unilever Nv | Produktion af antistoffer eller (funktionaliserede) fragmenter deraf afledt af Camelidae-immunoglobuliner med tung kæde |
| ES2155854T3 (es) | 1993-06-09 | 2001-06-01 | Unilever Nv | Procedimiento de produccion de proteinas de fusion que comprende fragmentos de scfv con la ayuda de un molde transformado. |
| US5877218A (en) | 1994-01-10 | 1999-03-02 | Teva Pharmaceutical Industries, Ltd. | Compositions containing and methods of using 1-aminoindan and derivatives thereof and process for preparing optically active 1-aminoindan derivatives |
| US7473423B2 (en) | 1994-04-29 | 2009-01-06 | Mayo Foundation For Medical Education And Research | Human IgM antibodies, and diagnostic and therapeutic uses thereof particularly in the central nervous system |
| EP0918858A1 (en) | 1996-05-10 | 1999-06-02 | Biogen, Inc. | Common gamma chain blocking agents |
| US5834597A (en) | 1996-05-20 | 1998-11-10 | Protein Design Labs, Inc. | Mutated nonactivating IgG2 domains and anti CD3 antibodies incorporating the same |
| CN100489892C (zh) | 1999-02-05 | 2009-05-20 | 三星电子株式会社 | 恢复描述图像的纹理特征的图像纹理描述符的方法及装置 |
| MXPA03010804A (es) | 2001-06-01 | 2004-11-22 | Cornell Res Foundation Inc | Anticuerpos modificados para antigeno de membrana especifico de la prostata y usos de los mismos. |
| MXPA05000511A (es) | 2001-07-12 | 2005-09-30 | Jefferson Foote | Anticuepros super humanizados. |
| EP1575480A4 (en) | 2002-02-22 | 2008-08-06 | Genentech Inc | COMPOSITIONS AND METHODS FOR TREATING DISEASES RELATED TO THE IMMUNE SYSTEM |
| US7193069B2 (en) | 2002-03-22 | 2007-03-20 | Research Association For Biotechnology | Full-length cDNA |
| EP2085096A3 (en) | 2002-09-11 | 2009-08-12 | Genentech, Inc. | Novel composition and methods for the treatment of immune related diseases |
| KR101224235B1 (ko) | 2003-04-11 | 2013-01-25 | 메디뮨 엘엘씨 | 재조합 il9 항체 및 그의 용도 |
| TWI309240B (en) | 2004-09-17 | 2009-05-01 | Hoffmann La Roche | Anti-ox40l antibodies |
| DK1866339T3 (da) | 2005-03-25 | 2013-09-02 | Gitr Inc | GTR-bindende molekyler og anvendelser heraf |
| JP5004154B2 (ja) | 2005-04-06 | 2012-08-22 | 一般財団法人化学及血清療法研究所 | 組換え抗ボツリヌス神経毒素抗体 |
| US20070054360A1 (en) | 2005-05-12 | 2007-03-08 | Zeren Gao | Compositions and methods for modulating immune responses |
| US7736647B2 (en) | 2005-06-15 | 2010-06-15 | Monoclonal Antibodies Therapeutics | Anti-CD71 monoclonal antibodies and uses thereof for treating malignant tumor cells |
| JP5252635B2 (ja) | 2005-07-01 | 2013-07-31 | メダレックス インコーポレーティッド | プログラム死リガンド1(pd−l1)に対するヒトモノクローナル抗体 |
| JP2009538120A (ja) | 2006-04-13 | 2009-11-05 | ザイモジェネティクス, インコーポレイテッド | 四量体化ポリペプチドおよび使用方法 |
| FI20075059A0 (fi) | 2007-01-29 | 2007-01-29 | Valtion Teknillinen | Allergeeniä sitovat monoklonaaliset IgE-vasta-aineet ja hypoallergeenit:tyypin l lgE:n ja allergeenin immunokompleksivuorovaikutus |
| JP2010516747A (ja) | 2007-01-29 | 2010-05-20 | バルティオン テクニリーネン トゥトキムスケスクス | IgEを主成分とする新規試薬の製造方法 |
| US8163279B2 (en) | 2007-04-13 | 2012-04-24 | Stemline Therapeutics, Inc. | IL3Rα antibody conjugates and uses thereof |
| EP1987839A1 (en) | 2007-04-30 | 2008-11-05 | I.N.S.E.R.M. Institut National de la Sante et de la Recherche Medicale | Cytotoxic anti-LAG-3 monoclonal antibody and its use in the treatment or prevention of organ transplant rejection and autoimmune disease |
| CA2693677C (en) | 2007-07-12 | 2018-02-13 | Tolerx, Inc. | Combination therapies employing gitr binding molecules |
| EP2044949A1 (en) | 2007-10-05 | 2009-04-08 | Immutep | Use of recombinant lag-3 or the derivatives thereof for eliciting monocyte immune response |
| WO2009064944A2 (en) | 2007-11-16 | 2009-05-22 | Nuvelo, Inc. | Antibodies to lrp6 |
| WO2009073163A1 (en) | 2007-12-03 | 2009-06-11 | American Type Culture Collection (Atcc) | Avian influenza antibodies, compositions, and methods thereof |
| KR101855381B1 (ko) | 2008-04-09 | 2018-05-09 | 제넨테크, 인크. | 면역 관련 질병의 치료를 위한 신규한 조성물 및 방법 |
| US8410251B2 (en) | 2008-06-20 | 2013-04-02 | National University Corporation Okayama University | Antibody against calcified globule and use of the same |
| FR2933702A1 (fr) | 2008-07-08 | 2010-01-15 | Sanofi Aventis | Antagonistes specifiques du recepteur fgf-r4 |
| AR072999A1 (es) | 2008-08-11 | 2010-10-06 | Medarex Inc | Anticuerpos humanos que se unen al gen 3 de activacion linfocitaria (lag-3) y los usos de estos |
| US8183346B2 (en) | 2008-12-05 | 2012-05-22 | Eli Lilly And Company | Anti-ferroportin 1 monoclonal antibodies and uses thereof |
| LT4209510T (lt) | 2008-12-09 | 2024-03-12 | F. Hoffmann-La Roche Ag | Anti-pd-l1 antikūnai ir jų panaudojimas t ląstelių funkcijos pagerinimui |
| US9090679B2 (en) | 2009-04-17 | 2015-07-28 | Immunas Pharma, Inc. | Antibodies that specifically bind to A beta oligomers and use thereof |
| DK2462161T3 (en) | 2009-08-06 | 2017-06-06 | Immunas Pharma Inc | Antibodies specifically binding to A-beta oligomers and their use |
| WO2011020183A1 (en) | 2009-08-18 | 2011-02-24 | National Research Council Canada | Screening of protein candidates |
| CN102574924A (zh) | 2009-09-03 | 2012-07-11 | 先灵公司 | 抗-gitr抗体 |
| EP2488867B1 (en) | 2009-10-14 | 2020-09-30 | Janssen Biotech, Inc. | Methods of affinity maturing antibodies |
| RS58693B1 (sr) | 2009-12-10 | 2019-06-28 | Hoffmann La Roche | Antitela koja poželjno vezuju ekstracelularni domen 4 humanog csf1r, i njihova primena |
| CA2789963C (en) | 2010-02-26 | 2019-09-03 | Bioarctic Neuroscience Ab | Protofibril-binding antibodies and their use in therapeutic and diagnostic methods for parkinson's disease, dementia with lewy bodies and other alpha-synucleinopathies |
| JP5998060B2 (ja) | 2010-03-04 | 2016-09-28 | マクロジェニクス,インコーポレーテッド | B7−h3と反応性のある抗体、その免疫学的に活性なフラグメントおよびその使用 |
| KR101656548B1 (ko) | 2010-03-05 | 2016-09-09 | 에프. 호프만-라 로슈 아게 | 인간 csf-1r에 대한 항체 및 이의 용도 |
| EP2542588A1 (en) | 2010-03-05 | 2013-01-09 | F. Hoffmann-La Roche AG | Antibodies against human csf-1r and uses thereof |
| FR2959416B1 (fr) | 2010-05-03 | 2012-06-22 | Monoclonal Antibodies Therapeutics Mat Biopharma | Utilisation d'anticorps anti-cd71 pour la preparation d'un medicament |
| TWI713942B (zh) | 2010-05-04 | 2020-12-21 | 美商戊瑞治療有限公司 | 與集落刺激因子1受體(csf1r)結合之抗體類 |
| US8822642B2 (en) | 2010-06-09 | 2014-09-02 | Zymogenetics, Inc. | Dimeric fusion proteins and related compositions and methods |
| JP2012021943A (ja) | 2010-07-16 | 2012-02-02 | National Cancer Center | 子宮体がんの検査方法、子宮体がんの検査薬、並びに子宮体がん抗原に対する抗体 |
| BR112013002940A2 (pt) | 2010-08-13 | 2019-09-24 | Baylor Res Institute | adjuvantes de nova vacina baseados no direcionamento dos adjuvantes para os anticorpos diretamente às células que apresentam antígenos |
| SG10201506906VA (en) | 2010-09-09 | 2015-10-29 | Pfizer | 4-1bb binding molecules |
| US8962804B2 (en) | 2010-10-08 | 2015-02-24 | City Of Hope | Meditopes and meditope-binding antibodies and uses thereof |
| SG189929A1 (en) | 2010-10-29 | 2013-06-28 | Immunogen Inc | Novel egfr-binding molecules and immunoconjugates thereof |
| WO2012078793A2 (en) | 2010-12-07 | 2012-06-14 | Board Of Regents, The University Of Texas System | Methods and compositions related to tazarotene-induced gene 1 (tig1) |
| AU2011360938B2 (en) | 2010-12-08 | 2016-07-28 | Abbvie Stemcentrx Llc | Novel modulators and methods of use |
| TW201247706A (en) | 2011-03-08 | 2012-12-01 | Baylor Res Inst | Novel vaccine adjuvants based on targeting adjuvants to antibodies directly to antigen-presenting cells |
| WO2012129227A1 (en) | 2011-03-22 | 2012-09-27 | Baylor Research Institute | Dendritic cells (dcs) targeting for tuberculosis (tb) vaccine |
| TW201300418A (zh) | 2011-03-25 | 2013-01-01 | Baylor Res Inst | 用於抗c型肝炎病毒免疫之組合物及方法 |
| CA2833636A1 (en) | 2011-04-20 | 2012-10-26 | Amplimmune, Inc. | Antibodies and other molecules that bind b7-h1 and pd-1 |
| US9127061B2 (en) | 2011-06-24 | 2015-09-08 | Perseus Proteomics Inc. | Anti-human P-cadherin (CDH3) recombinant antibody |
| AU2012344260B2 (en) | 2011-11-28 | 2017-09-07 | Merck Patent Gmbh | Anti-PD-L1 antibodies and uses thereof |
| RU2658603C2 (ru) | 2011-12-15 | 2018-06-21 | Ф.Хоффманн-Ля Рош Аг | Антитела против человеческого csf-1r и их применения |
| RU2014136332A (ru) | 2012-02-06 | 2016-03-27 | Дженентек, Инк. | Композиции и способы применения ингибиторов csf1r |
| PL2818483T3 (pl) | 2012-02-21 | 2018-01-31 | Toray Industries | Kompozycja lecznicza do leczenia i/lub zapobiegania nowotworowi |
| HUE044611T2 (hu) | 2012-02-21 | 2019-11-28 | Toray Industries | Gyógyászati készítmény rák kezelésére |
| SG11201405130UA (en) | 2012-02-24 | 2014-11-27 | Stemcentrx Inc | Anti sez6 antibodies and methods of use |
| AR090263A1 (es) | 2012-03-08 | 2014-10-29 | Hoffmann La Roche | Terapia combinada de anticuerpos contra el csf-1r humano y las utilizaciones de la misma |
| JP6107654B2 (ja) | 2012-03-30 | 2017-04-05 | 東レ株式会社 | 肝臓癌の治療及び/又は予防用医薬組成物 |
| PL2832366T3 (pl) | 2012-03-30 | 2018-04-30 | Toray Industries, Inc. | Kompozycja farmaceutyczna do leczenia i/lub zapobiegania rakowi pęcherzyka żółciowego |
| AU2013243570B2 (en) | 2012-04-03 | 2017-12-14 | Novelmed Therapeutics, Inc. | Humanized and chimeric anti-factor Bb antibodies and uses thereof |
| JP6113717B2 (ja) | 2012-04-04 | 2017-04-12 | 株式会社ペルセウスプロテオミクス | 抗cdh3(p−カドヘリン)抗体の薬剤コンジュゲート |
| CA2871445C (en) | 2012-05-11 | 2020-07-07 | Five Prime Therapeutics, Inc. | Methods of treating conditions with antibodies that bind colony stimulating factor 1 receptor (csf1r) |
| RU2014145633A (ru) | 2012-05-14 | 2016-07-10 | Дженентек, Инк. | Композиции и способы для диагностики и лечения опухолей |
| AU2013271515A1 (en) | 2012-06-06 | 2015-01-15 | Oncomed Pharmaceuticals, Inc. | Binding agents that modulate the Hippo pathway and uses thereof |
| AR091649A1 (es) | 2012-07-02 | 2015-02-18 | Bristol Myers Squibb Co | Optimizacion de anticuerpos que se fijan al gen de activacion de linfocitos 3 (lag-3) y sus usos |
| WO2014036357A1 (en) | 2012-08-31 | 2014-03-06 | Five Prime Therapeutics, Inc. | Methods of treating conditions with antibodies that bind colony stimulating factor 1 receptor (csf1r) |
| CN104968364A (zh) | 2012-12-03 | 2015-10-07 | 百时美施贵宝公司 | 强化免疫调变性Fc融合蛋白的抗癌活性 |
| CA2892831A1 (en) | 2012-12-04 | 2014-06-12 | Oncomed Pharmaceuticals, Inc. | Immunotherapy with binding agents |
| SG11201509566RA (en) | 2013-05-20 | 2015-12-30 | Genentech Inc | Anti-transferrin receptor antibodies and methods of use |
| WO2014190305A2 (en) | 2013-05-24 | 2014-11-27 | Biogen Idec Ma Inc. | Anti-gpiib/iiia antibodies or uses thereof |
| TW201536811A (zh) | 2013-05-31 | 2015-10-01 | Biogen Idec Inc | 嵌合fvii-xten分子及其用途 |
| PT3021869T (pt) | 2013-07-16 | 2020-09-10 | Hoffmann La Roche | Métodos de tratamento do cancro com antagonistas da ligação ao eixo pd-1 e inibidores do tigit |
| JP2015066079A (ja) | 2013-09-27 | 2015-04-13 | オリンパス株式会社 | 超音波処置具、及び手術システム |
| PE20210107A1 (es) | 2013-12-17 | 2021-01-19 | Genentech Inc | Anticuerpos anti-cd3 y metodos de uso |
| AU2014370404A1 (en) | 2013-12-24 | 2016-07-07 | Novelmed Therapeutics, Inc. | Compositions and methods of treating ocular diseases |
| TWI680138B (zh) | 2014-01-23 | 2019-12-21 | 美商再生元醫藥公司 | 抗pd-l1之人類抗體 |
| TWI681969B (zh) | 2014-01-23 | 2020-01-11 | 美商再生元醫藥公司 | 針對pd-1的人類抗體 |
| JOP20200094A1 (ar) | 2014-01-24 | 2017-06-16 | Dana Farber Cancer Inst Inc | جزيئات جسم مضاد لـ pd-1 واستخداماتها |
| JOP20200096A1 (ar) | 2014-01-31 | 2017-06-16 | Children’S Medical Center Corp | جزيئات جسم مضاد لـ tim-3 واستخداماتها |
| WO2015133882A1 (ko) | 2014-03-07 | 2015-09-11 | 사회복지법인 삼성생명공익재단 | ScFv 항체 라이브러리, 이의 제조방법 및 이를 이용한 ScFv 항체 스크리닝 방법 |
| BR112016018408A2 (pt) | 2014-03-14 | 2017-12-26 | Immutep Sas | moléculas de anticorpo à lag-3 e usos das mesmas |
| RU2016142476A (ru) | 2014-03-31 | 2018-05-07 | Дженентек, Инк. | Комбинированная терапия, включающая антиангиогенезные агенты и агонисты, связывающие ох40 |
| EP3169363A4 (en) | 2014-07-16 | 2018-02-21 | F. Hoffmann-La Roche AG | Methods of treating cancer using tigit inhibitors and anti-cancer agents |
| BR112017002433A2 (pt) | 2014-08-07 | 2017-11-28 | Ceram Therapeutics | anticorpos anticeramida |
| TWI790593B (zh) | 2014-08-19 | 2023-01-21 | 美商默沙東有限責任公司 | 抗tigit抗體 |
| MX2017005929A (es) | 2014-11-06 | 2017-11-20 | Genentech Inc | Terapia de combinacion con agonistas de unión ox40 e inhibidores de tigit. |
| EP3221362B1 (en) | 2014-11-19 | 2019-07-24 | F.Hoffmann-La Roche Ag | Anti-transferrin receptor antibodies and methods of use |
| EP3221361B1 (en) | 2014-11-19 | 2021-04-21 | Genentech, Inc. | Anti-transferrin receptor / anti-bace1 multispecific antibodies and methods of use |
| EP4249066A3 (en) | 2014-12-23 | 2023-11-22 | Bristol-Myers Squibb Company | Antibodies to tigit |
| TWI715587B (zh) | 2015-05-28 | 2021-01-11 | 美商安可美德藥物股份有限公司 | Tigit結合劑和彼之用途 |
| TWI747841B (zh) | 2015-09-25 | 2021-12-01 | 美商建南德克公司 | 抗tigit抗體及使用方法 |
| BR112018013827B1 (pt) | 2016-01-08 | 2024-02-20 | Arcus Biosciences, Inc | Moduladores de 5-nucleotidase, ecto, composição farmacêutica, combinação, kit e uso dos mesmos |
| KR102355950B1 (ko) | 2016-03-04 | 2022-01-26 | 제이엔 바이오사이언시즈 엘엘씨 | Tigit에 대한 항체 |
| SI3347379T1 (sl) | 2016-08-17 | 2020-04-30 | Compugen Ltd. | ANTI-TIGIT protitelesa, ANTI-PVRIG protitelesa in njihove kombinacije |
| US11058704B2 (en) | 2016-10-03 | 2021-07-13 | Arcus Biosciences, Inc. | Inhibitors of adenosine 5′-nucleotidase |
| CN110022881B (zh) | 2016-11-18 | 2023-05-02 | 艾库斯生物科学有限公司 | Cd73介导的免疫抑制的抑制剂 |
| AU2018210272B2 (en) | 2017-01-20 | 2022-02-24 | Arcus Biosciences, Inc. | Azolopyrimidine for the treatment of cancer-related disorders |
| CA3053486A1 (en) | 2017-02-28 | 2018-09-07 | Seattle Genetics, Inc. | Anti-tigit antibodies |
| EP3618829B1 (en) | 2017-05-05 | 2023-06-07 | Arcus Biosciences, Inc. | Quinazoline-pyridine derivatives for the treatment of cancer-related disorders |
| GB201709808D0 (en) | 2017-06-20 | 2017-08-02 | Kymab Ltd | Antibodies |
| WO2019023504A1 (en) | 2017-07-27 | 2019-01-31 | Iteos Therapeutics Sa | ANTI-TIGIT ANTIBODIES |
| TW202400654A (zh) | 2017-12-30 | 2024-01-01 | 英屬開曼群島商百濟神州有限公司 | 抗tigit抗體及其作為治療和診斷的用途 |
| AU2019218516B2 (en) * | 2018-02-06 | 2021-10-21 | I-Mab Biopharma (Hangzhou) Co., Ltd. | Antibodies to T cell immunoreceptor with Ig and ITIM domains (TIGIT) and uses thereof |
| TWI754157B (zh) | 2018-07-25 | 2022-02-01 | 大陸商信達生物製藥(蘇州)有限公司 | 抗tigit抗體及其用途 |
| MX2021002002A (es) | 2018-08-23 | 2021-05-31 | Seagen Inc | Anticuerpos anti inmunorreceptor de celulas t con dominios ig y motivo inhibidor inmunorreceptor basado en tirosina (tigit). |
| CN109384846B (zh) * | 2018-09-25 | 2020-03-03 | 合肥瑞达免疫药物研究所有限公司 | 能够结合tigit的抗体或其抗原结合片段及用途 |
| CN111196852A (zh) | 2018-11-16 | 2020-05-26 | 四川科伦博泰生物医药股份有限公司 | 抗tigit抗体及其用途 |
| TWI828800B (zh) | 2018-11-16 | 2024-01-11 | 美商阿克思生物科學有限公司 | Arg1及/或arg2之抑制劑 |
| BR112021013397A2 (pt) | 2019-01-07 | 2021-12-07 | iTeos Belgium SA | Anticorpos anti-tigit |
| JP2022535120A (ja) | 2019-06-04 | 2022-08-04 | アーカス バイオサイエンシーズ インコーポレイテッド | 2,3,5-三置換ピラゾロ[1,5-a]ピリミジン化合物 |
| EP3985025A4 (en) | 2019-06-13 | 2023-09-13 | Green Cross Corporation | ANTIBODIES TO TIGIT AND THEIR USE |
| AU2020314129A1 (en) | 2019-07-15 | 2022-02-24 | Shanghai Junshi Biosciences Co., Ltd. | Anti-tigit antibodies and application thereof |
-
2021
- 2021-06-01 MX MX2022015157A patent/MX2022015157A/es unknown
- 2021-06-01 US US17/336,181 patent/US11820824B2/en active Active
- 2021-06-01 JP JP2022573465A patent/JP2023528036A/ja active Pending
- 2021-06-01 CA CA3176246A patent/CA3176246A1/en active Pending
- 2021-06-01 CR CR20220611A patent/CR20220611A/es unknown
- 2021-06-01 BR BR112022024221A patent/BR112022024221A2/pt unknown
- 2021-06-01 PE PE2022002843A patent/PE20231078A1/es unknown
- 2021-06-01 AR ARP210101484A patent/AR122493A1/es unknown
- 2021-06-01 IL IL298111A patent/IL298111A/en unknown
- 2021-06-01 KR KR1020227046210A patent/KR20230019152A/ko unknown
- 2021-06-01 CN CN202180038748.9A patent/CN115698068A/zh active Pending
- 2021-06-01 EP EP21734720.2A patent/EP4157875A1/en active Pending
- 2021-06-01 WO PCT/US2021/035268 patent/WO2021247591A1/en unknown
- 2021-06-01 TW TW110119852A patent/TW202210514A/zh unknown
- 2021-06-01 AU AU2021284273A patent/AU2021284273A1/en active Pending
-
2022
- 2022-12-01 CO CONC2022/0017348A patent/CO2022017348A2/es unknown
- 2022-12-01 CL CL2022003397A patent/CL2022003397A1/es unknown
- 2022-12-01 DO DO2022000272A patent/DOP2022000272A/es unknown
Also Published As
| Publication number | Publication date |
|---|---|
| CA3176246A1 (en) | 2021-12-09 |
| US20220064294A1 (en) | 2022-03-03 |
| US11820824B2 (en) | 2023-11-21 |
| TW202210514A (zh) | 2022-03-16 |
| IL298111A (en) | 2023-01-01 |
| PE20231078A1 (es) | 2023-07-17 |
| JP2023528036A (ja) | 2023-07-03 |
| AU2021284273A1 (en) | 2022-12-15 |
| WO2021247591A1 (en) | 2021-12-09 |
| CN115698068A (zh) | 2023-02-03 |
| DOP2022000272A (es) | 2023-01-15 |
| MX2022015157A (es) | 2023-01-16 |
| CL2022003397A1 (es) | 2023-07-28 |
| CO2022017348A2 (es) | 2023-02-16 |
| CR20220611A (es) | 2023-06-07 |
| BR112022024221A2 (pt) | 2022-12-20 |
| AR122493A1 (es) | 2022-09-14 |
| EP4157875A1 (en) | 2023-04-05 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US11723971B2 (en) | Antibodies to TIGIT | |
| US11820824B2 (en) | Antibodies to TIGIT | |
| WO2021023117A1 (zh) | 抗ctla4-抗pd-1双特异性抗体及其用途 | |
| CN112513080A (zh) | Vista抗原结合分子 | |
| JP2022538733A (ja) | 新規抗cd25抗体 | |
| TW201805305A (zh) | Gitr抗體,方法及用途 | |
| JP2023550446A (ja) | 抗cd25抗体 | |
| JP2024504547A (ja) | 抗cd25抗体 | |
| WO2023164872A1 (en) | Anti-cd39 antibodies and use thereof | |
| US11970543B2 (en) | Anti-CD39 antibodies and use thereof | |
| WO2022223048A1 (en) | Tim-3-targetting antibodies and uses thereof | |
| CA3155172A1 (en) | Combination of anti-garp antibody and immunomodulator | |
| NZ785761A (en) | Antibodies to TIGIT | |
| TW202409084A (zh) | 針對tigit之抗體 |