KR20170033873A - 조영제 및 이의 중간체를 합성하는 방법 및 장치 - Google Patents
조영제 및 이의 중간체를 합성하는 방법 및 장치 Download PDFInfo
- Publication number
- KR20170033873A KR20170033873A KR1020177004163A KR20177004163A KR20170033873A KR 20170033873 A KR20170033873 A KR 20170033873A KR 1020177004163 A KR1020177004163 A KR 1020177004163A KR 20177004163 A KR20177004163 A KR 20177004163A KR 20170033873 A KR20170033873 A KR 20170033873A
- Authority
- KR
- South Korea
- Prior art keywords
- contrast agent
- reaction
- optionally substituted
- quot
- subject
- Prior art date
Links
- 0 *c1ccccc1 Chemical compound *c1ccccc1 0.000 description 12
- ZNIQYSJFWPBUHW-UHFFFAOYSA-N CC(C)(C)N(C1=O)N=CC(OCc2ccc(CBr)cc2)=C1Cl Chemical compound CC(C)(C)N(C1=O)N=CC(OCc2ccc(CBr)cc2)=C1Cl ZNIQYSJFWPBUHW-UHFFFAOYSA-N 0.000 description 2
- MXUKRXSLPIYIJT-UHFFFAOYSA-N CCOCc1ccc(COC(C=NN(C(C)(C)C)C2=O)=C2Cl)cc1 Chemical compound CCOCc1ccc(COC(C=NN(C(C)(C)C)C2=O)=C2Cl)cc1 MXUKRXSLPIYIJT-UHFFFAOYSA-N 0.000 description 2
- POAJFTIGNNLJET-UHFFFAOYSA-N CC(C)(C)N(C1=O)N=CC(OCc(cc2)ccc2C(OC)=O)=C1Cl Chemical compound CC(C)(C)N(C1=O)N=CC(OCc(cc2)ccc2C(OC)=O)=C1Cl POAJFTIGNNLJET-UHFFFAOYSA-N 0.000 description 1
- LHUDFFWVULZGCX-UHFFFAOYSA-N CC(C)(C)N(C1=O)N=CC(OCc2ccc(C3OCCO3)cc2)=C1Cl Chemical compound CC(C)(C)N(C1=O)N=CC(OCc2ccc(C3OCCO3)cc2)=C1Cl LHUDFFWVULZGCX-UHFFFAOYSA-N 0.000 description 1
- VMGLCLBNRWFFMH-UHFFFAOYSA-N CC(c1ccc(C2OCCO2)cc1)=O Chemical compound CC(c1ccc(C2OCCO2)cc1)=O VMGLCLBNRWFFMH-UHFFFAOYSA-N 0.000 description 1
- LTHAIAJHDPJXLG-UHFFFAOYSA-N CCCC(C)c1ccccc1 Chemical compound CCCC(C)c1ccccc1 LTHAIAJHDPJXLG-UHFFFAOYSA-N 0.000 description 1
- OSSSEXIGKVKXPO-UHFFFAOYSA-N OCc1ccc(C2OCCO2)cc1 Chemical compound OCc1ccc(C2OCCO2)cc1 OSSSEXIGKVKXPO-UHFFFAOYSA-N 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K51/00—Preparations containing radioactive substances for use in therapy or testing in vivo
- A61K51/02—Preparations containing radioactive substances for use in therapy or testing in vivo characterised by the carrier, i.e. characterised by the agent or material covalently linked or complexing the radioactive nucleus
- A61K51/04—Organic compounds
- A61K51/041—Heterocyclic compounds
- A61K51/044—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine, rifamycins
- A61K51/0459—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine, rifamycins having six-membered rings with two nitrogen atoms as the only ring hetero atoms, e.g. piperazine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K49/00—Preparations for testing in vivo
- A61K49/04—X-ray contrast preparations
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K49/00—Preparations for testing in vivo
- A61K49/06—Nuclear magnetic resonance [NMR] contrast preparations; Magnetic resonance imaging [MRI] contrast preparations
- A61K49/08—Nuclear magnetic resonance [NMR] contrast preparations; Magnetic resonance imaging [MRI] contrast preparations characterised by the carrier
- A61K49/10—Organic compounds
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D237/00—Heterocyclic compounds containing 1,2-diazine or hydrogenated 1,2-diazine rings
- C07D237/02—Heterocyclic compounds containing 1,2-diazine or hydrogenated 1,2-diazine rings not condensed with other rings
- C07D237/06—Heterocyclic compounds containing 1,2-diazine or hydrogenated 1,2-diazine rings not condensed with other rings having three double bonds between ring members or between ring members and non-ring members
- C07D237/10—Heterocyclic compounds containing 1,2-diazine or hydrogenated 1,2-diazine rings not condensed with other rings having three double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D237/14—Oxygen atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D237/00—Heterocyclic compounds containing 1,2-diazine or hydrogenated 1,2-diazine rings
- C07D237/02—Heterocyclic compounds containing 1,2-diazine or hydrogenated 1,2-diazine rings not condensed with other rings
- C07D237/06—Heterocyclic compounds containing 1,2-diazine or hydrogenated 1,2-diazine rings not condensed with other rings having three double bonds between ring members or between ring members and non-ring members
- C07D237/10—Heterocyclic compounds containing 1,2-diazine or hydrogenated 1,2-diazine rings not condensed with other rings having three double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D237/14—Oxygen atoms
- C07D237/16—Two oxygen atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D405/00—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom
- C07D405/02—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom containing two hetero rings
- C07D405/12—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D407/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having oxygen atoms as the only ring hetero atoms, not provided for by group C07D405/00
- C07D407/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having oxygen atoms as the only ring hetero atoms, not provided for by group C07D405/00 containing two hetero rings
- C07D407/12—Heterocyclic compounds containing two or more hetero rings, at least one ring having oxygen atoms as the only ring hetero atoms, not provided for by group C07D405/00 containing two hetero rings linked by a chain containing hetero atoms as chain links
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- General Health & Medical Sciences (AREA)
- Epidemiology (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Optics & Photonics (AREA)
- Physics & Mathematics (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Radiology & Medical Imaging (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
- Plural Heterocyclic Compounds (AREA)
- Low-Molecular Organic Synthesis Reactions Using Catalysts (AREA)
- Cameras In General (AREA)
Abstract
본 발명은 일반적으로 조영제 및 이의 전구체를 합성하는 방법과 이를 위한 시스템에 관한 것이다. 본 발명의 방법은 수율이 개선될 수 있으며, 조영제, 예를 들어 방사성 동위 원소(예를 들어 18F)를 포함하는 조영제를 대규모로 합성할 수 있다. 본 발명의 다양한 구체예는 센서 및 진단 도구 등으로서 유용할 수 있다. 몇몇 경우에서, 관류, 예를 들어 심근 관류를 평가하는 방법이 제공된다. 본 발명의 합성 방법은 또한 방사성 동위 원소를 포함하는 조영제를 제조 및 정제하기 위한 자동화 합성 유닛과 퉁합되기도 한다. 몇몇 구체예에서, 본 발명은, 조영제 1을 포함하는 조성물을 주사, 주입 또는 임의의 기타 공지된 방법을 통해 피험체에 투여하는 단계와, 피험체의 구역을 조영하는 단계(여기서, 관심 현상의 위치 파악)를 포함하는 방법을 포함하여 조영제 1을 사용하는 신규의 방법과 이 조영제 1을 포함하는 시스템을 제공한다.
Description
관련 출원
본 출원은 35 U.S.C.§119(e)에 따라서, 2010년 2월 8일자로 출원하고 명칭이 “Methods and Apparatus for Synthesizing Contrast Agents, Including Radiolabeled Contrast Agents”인 미국 가출원 U.S.S.N. 제61/302,477호; 2010년 3월 18일자로 출원하고 명칭이 “Methods for Synthesizing Contrast Agents and Precursors Thereof”인 미국 가출원 U.S.S.N. 제61/315,376호; 및 2010년 5월 11일자로 출원하고 명칭이 “Compositions, Methods, and Systems for Imaging”인 미국 가출원 U.S.S.N. 제61/333,693호의 우선권을 주장하며, 이들 각각은 본원에 참조로 포함되어 있다.
발명의 분야
본 발명은 조영제 및 이의 전구체를 합성하기 위한 시스템, 조성물, 방법 및 장치에 관한 것이다.
미토콘드리아는 대부분의 진핵 생물 세포의 세포 기질에 분포되어 있는, 막으로 둘러 싸인 세포소기관이다. 미토콘드리아는 특히 심근 조직에 집중되어 있다.
복합체 1(“MC-1”)은 46개의 상이한 서브유닛의 막 결합 단백질 복합체이다. 이 효소 복합체는 포유 동물의 미토콘드리아 내의 호흡 사슬(respiratory chain)을 구성하는 3가지 에너지 전달 복합체 중 하나이다. NADH-유비퀴논 산화 환원 효소는 호흡 사슬을 횡단하는 다수의 전자를 위한 진입점이며, 최종적으로는 산소를 물로 환원시킨다(Q. Rev. Biophys . 1992, 25, 253-324). MC-1 억제제의 예로서는 데구엘린, 피에리시딘 A, 유비시딘-3, 롤리니아스타틴-1, 롤리니아스타틴-2(불라타신), 캡사이신, 피리다벤, 펜피록시메이트, 아미탈, MPP+, 퀴놀린 및 퀴놀론을 포함한다(BBA 1998, 1364, 222-235). 연구는, 미토콘드리아의 정상적인 기능을 방해하는 것이 미토콘드리아 내에, 따라서 미토콘드리아 풍부 심근 조직 내에 임의의 화합물을 유리하게 집중시킬 수 있음을 보였다. 조영 부(imaging moiety)(예를 들어 18F)를 포함하는 화합물은 이와 같은 화합물의 증가를 측정하여 심근 관류 조영에 유익한 진단 마커를 제공하는데 유용할 수 있다. 뿐만 아니라, 이러한 화합물은 관상 동맥 질환(CAD)의 진단에도 사용될 수 있다.
CAD는 현대 산업화 국가에 있어서 주요 사망 원인이며, 휴식을 취할 때와 스트레스를 받을 때(운동 중이거나 약리학적 관상 동맥 혈관 확장시) 국소 심근 관류를 평가하는 것은 CAD의 비관혈적 진단에 유익함이 이전에 밝혀졌다. 양전자 방출 단층 촬영(PET)을 이용한 심근 관류 조영(MPI)은 몇몇 구체예에 있어서 단일 광자 단층 촬영(SPECT)보다 우수한 것으로 보였으나, PET MPI의 광범위한 임상적 사용은 이전에 사용가능한 PET 심근 관류 추적자에 의해 제한되었다.
몇몇 PET 혈류 추적자, 예를 들어 루비듐-82(82Rb) 염화물, 질소-13(13N) 암모니아 및 산소-15(15O) 물은 심근 관류 평가용으로 개발되어 유효하였다. 13N 및 15O는 반감기가 짧은 사이클로트론 생성 동위 원소이다. 그러므로, 이들의 사용은 현장 사이클로트론(on-site cyclotron)을 포함하는 설비에 제한된다. 82Rb는 발전기에서 생성되는 추적자이지만, 이것의 짧은 반감기, 발전기의 높은 비용, 그리고 트레드밀 가동과 함께 연구 수행의 불능은 이 추적자를 범용함에 있어서 불가능하도록 만들었다. 그러나, 18F를 포함하는 추적자는 조영제로서 잠재적인 적용성이 발견되었다.
조영 부를 포함하는 화합물을 제조하는 현재의 방법들은 [18F]-플루오르화 화학 기술을 포함하며, 다수의 방법이 플루오르화 칼륨(KF)을 사용하는 친핵성 [18F]-플루오르화 화학 기술에 초점을 맞추고 있다. 특징적으로, 이러한 방법은, 예를 들어 탄산칼륨(K2CO3)과 사이클로트론에서 생성된 [18F] 함유 종 사이의 음이온 교환을 통해 원소 플루오르화물 공급원을 생성시키고, 종종 아자-크라운 에테르인 크립토픽스? 222(Kryptofix? 222)(4,7,13,16,21,24-헥사옥사-1,10-디아자비시클로[8.8.8]-헥사코산)를 부가하여 반응성을 증강시켜 줄 필요가 있다. 이러한 방법은 추적자가 임상학적 양을 생산하는데에는 적당하지만, 이러한 방법의 중간 정도 효율, 까다로운 정제 및 복잡한 실행은 광범위한 상업적 적용에 적당하지 않을 수 있다.
따라서, 조영제를 합성하는 개선된 방법, 시스템 및 장치가 필요하다.
본 발명은 넓은 의미에서 조영제, 이의 전구체를 합성하는 방법, 조영제 전구체인 화합물, 및 이의 사용 방법을 제공한다.
하나의 양태에서, 본 발명은 하기 화학식을 포함하는 조영제를 합성하는 방법을 제공하며,
(상기 식 중, W는 임의 치환되는 알킬 또는 헤테로알킬이고; R1은 임의 치환되는 알킬이며; R2는 수소 또는 할로겐화물이고; R3은 각각 동일하거나 상이할 수 있는 것으로서, 조영 부로 임의 치환되는 알킬 또는 조영 부로 임의 치환되는 헤테로알킬이며; n은 1, 2, 3, 4 또는 5임)
이 방법은 다음과 같은 단계들을 포함한다:
하기 화학식을 포함하는 전구체 화합물을 에테르화하여,
(상기 식 중, n은 1, 2, 3, 4 또는 5이고; R1은 임의 치환되는 알킬이며; R2는 수소 또는 할로겐화물이고; R3은 동일하거나 상이할 수 있는 것으로서, 각각 임의 치환되는 알킬, 헤테로알킬 또는 카보닐 함유 기이며; R5는 하이드록실 또는 할로겐화물이고; R6은 각각 임의 치환되는 알킬, 헤테로알킬 또는 카보닐 함유 기이며, 여기서 R5가 하이드록실일 때, R6 및 R3 중 하나 이상은 이탈기를 포함하거나; 또는 R5가 할로겐화물일 때, R6 및 R3 중 하나 이상은 하이드록실을 포함함)
하기 화학식을 포함하는 화합물을 생성하는 단계;
(상기 식 중, W는 임의 치환되는 알킬 또는 헤테로알킬이고; R1은 임의 치환되는 알킬이며; R2는 수소 또는 할로겐화물이고; R3은 각각 동일하거나 상이할 수 있는 것으로서, 하이드록실로 임의 치환되는 알킬 또는 하이드록실로 임의 치환되는 헤테로알킬이며; 여기서, 하나 이상의 R3은 하이드록실을 포함하고; n은 1, 2, 3, 4 또는 5이며; R1은 임의 치환되는 알킬이고; R2는 수소 또는 할로겐화물이며; R3은 동일하거나 상이할 수 있는 것으로서, 각각 임의 치환되는 알킬, 헤테로알킬 또는 카보닐 함유 기임)
하기 화학식을 포함하는 화합물을 설폰산염 함유 종과 반응시켜,
(상기 식 중, W는 임의 치환되는 알킬 또는 헤테로알킬이고; R1은 임의 치환되는 알킬이며; R2는 수소 또는 할로겐화물이고; R3은 각각 동일하거나 상이할 수 있는 것으로서, 하이드록실로 임의 치환되는 알킬 또는 하이드록실로 임의 치환되는 헤테로알킬이며; 하나 이상의 R3은 하이드록실을 포함하고; n은 1, 2, 3, 4 또는 5임)
하기 화학식을 포함하는 설폰산염 함유 화합물을 생성하는 단계;
(상기 식 중, W는 임의 치환되는 알킬 또는 헤테로알킬이고; R1은 임의 치환되는 알킬이며; R2는 수소 또는 할로겐화물이고; R3은 각각 동일하거나 상이할 수 있는 것으로서, 설폰산염 함유 기로 임의 치환되는 알킬 또는 설폰산염 함유 기로 임의 치환되는 헤테로알킬이며; 하나 이상의 R3은 설폰산염 함유 기를 포함하고; n은 1, 2, 3, 4 또는 5임)
설폰산염 함유 화합물의 설폰산염 함유 기를 조영 부로 대체하여, 하기 화학식을 포함하는 화합물을 생성하는 단계.
(상기 식 중, W는 임의 치환되는 알킬 또는 헤테로알킬이고; R1은 임의 치환되는 알킬이며; R2는 수소 또는 할로겐화물이고; R3은 각각 동일하거나 상이할 수 있는 것으로서, 조영 부로 임의 치환되는 알킬 또는 조영 부로 임의 치환되는 헤테로알킬이며; n은 1, 2, 3, 4 또는 5이되; 다만, 하나 이상의 플루오르 종이 상기 화합물 내에 존재함)
하나의 양태에서, 본 발명은 하기 화학식을 포함하는 화합물을 18F 표지화하는 방법을 제공한다.
(상기 식 중, R1은 알킬이고; R2는 수소 또는 할로겐이며; R3은 설폰산염 함유 기로 치환되는 알킬, 설폰산염 함유 기로 치환되는 알콕시 또는 설폰산염 함유 기로 치환되는 알콕시알킬임) 상기 방법은 암모늄 염 또는 중탄산염의 존재 하에 상기 화합물을 18F 종과 반응시켜, 18F 종을 포함하는 생성물을 생성하는 단계를 포함한다.
몇몇 구체예에서, R3은 설폰산염 함유 기로 치환되는 알콕시알킬이다. 몇몇 구체예에서, 상기 설폰산염 함유 기는 메실산염, 토실산염, 트리플산염 또는 1,2-시클릭 황산염이다. 몇몇 구체예에서, R2는 할로겐이다. 하나의 구체예에서, R2는 염화물이다. 몇몇 구체예에서, R1은 메틸, 에틸, 프로필, n-부틸, s-부틸 또는 t-부틸이다. 몇몇 구체예에서, R1은 t-부틸이다. 몇몇 구체예에서, 상기 생성물은 하기 화학식을 포함한다.
다른 양태에서, 본 발명은 하기 화학식 III을 포함하는 화합물과 친핵체를 반응시키는 단계를 포함하는, 조영제에 대한(또는 조영제의) 전구체를 합성하는 방법을 제공하는데, 이 화학식 III은 하기 구조를 포함하며, 상기 친핵체는 하나 이상의 이탈기를 대체하여 생성물(또는 전구체)을 생성한다.
[화학식 III]
(상기 식 중, W는 임의 치환되는 알킬 또는 헤테로알킬이고; R1은 임의 치환되는 알킬이며; R2는 수소 또는 할로겐화물이고; R3은 각각 동일하거나 상이할 수 있는 것으로서, 이탈기로 임의 치환되는 알킬 또는 이탈기로 임의 치환되는 헤테로알킬이되, 다만, R3은 하나 이상의 이탈기를 포함하고; n은 1, 2, 3, 4 또는 5이되, 다만, 하나 이상의 R3은 이탈기로 치환됨)
몇몇 구체예에서, 친핵체는 에틸렌 글리콜이다. 몇몇 구체예에서, 상기 화합물을 친핵체와 반응시키는 것은 염기의 존재 하에 진행된다. 염기는 금속 또는 금속 염일 수 있으나, 이에 한정되는 것은 아니다. 염기는 나트륨 금속, 수소화 나트륨, t-부톡시화 칼륨, 탄산 칼륨 또는 수산화 칼륨일 수 있다. 몇몇 구체예에서, 염기는 t-부톡시화 칼륨 또는 수산화 칼륨이다. 몇몇 구체예에서, 염기는 t-부톡시화 칼륨이다.
몇몇 구체예에서, 상기 화합물을 친핵체와 반응시키는 것은 촉매의 존재 하에 진행된다. 촉매는 요오드화 테트라알킬암모늄, 예를 들어 요오드화 테트라에틸암모늄(이에 한정되는 것은 아님)일 수 있다.
몇몇 구체예에서, 이탈기는 할로겐화물, 예를 들어 브롬화물이나, 이에 한정되는 것은 아니다.
몇몇 구체예에서, W는 -O(CH2)-이고; R1은 t-부틸이며; R2는 염화물이고; R3 은 이탈기로 치환되는 알킬이다.
몇몇 구체예에서, 화학식 III을 포함하는 화합물은 하기 구조를 포함한다.
몇몇 구체예에서, 화학식 III을 포함하는 화합물은 하기 구조를 포함한다.
몇몇 구체예에서, 생성물(또는 전구체)은 하기 화학식을 포함한다.
몇몇 구체예에서, 생성물(또는 전구체)은 하기 화학식을 포함한다.
몇몇 구체예에서, 본 발명의 방법은 하기 화학식 IV를 포함하는 화합물을, 이탈기를 포함하는 반응 물질과 반응시켜, 상기 화학식 III을 포함하는 화합물을 생성하는 단계를 추가로 포함하며, 여기서 하기 화학식 IV는 하기 구조를 포함한다.
[화학식 IV]
(상기 식 중, W는 임의 치환되는 알킬 또는 헤테로알킬이고; R1은 임의 치환되는 알킬이며; R2는 수소 또는 할로겐화물이고; 각각의 R4는 동일하거나 상이할 수 있는 것으로서, 하이드록실로 임의 치환되는 알킬 또는 하이드록실로 임의 치환되는 헤테로알킬이되, 다만 R4는 하나 이상의 하이드록실기를 포함하고; n은 1, 2, 3, 4 또는 5이며; 여기서 하나 이상의 하이드록실은 이탈기로 대체됨)
몇몇 구체예에서, 화학식 IV를 포함하는 화합물을 반응시키는 것은 할로겐화 시약의 존재 하에 수행된다. 몇몇 구체예에서, 할로겐화 시약은 브롬화 시약이다. 브롬화 시약은 삼브롬화 인, 이브롬화 피리디늄 또는 사브롬화 탄소와 트리페닐포스핀의 조합일 수 있으나, 이에 한정되는 것은 아니다.
몇몇 구체예에서, W는 -O(CH2)-이고; R1은 t-부틸이며; R2는 염화물이고; R4는 하이드록실로 치환되는 알킬이다.
몇몇 구체예에서, 화학식 IV를 포함하는 화합물은 하기 구조를 포함한다.
몇몇 구체예에서, 화학식 IV를 포함하는 화합물은 하기 구조를 포함한다.
몇몇 구체예에서, 생성물은 하기 화학식을 포함한다.
몇몇 구체예에서, 생성물은 하기 화학식을 포함한다.
몇몇 구체예에서, 화학식 IV를 포함하는 화합물은, 하기 화학식 IVa 및 하기 화학식 IVb를 포함하는 전구체 화합물의 에테르화에 의해 형성된다.
[화학식 IVa]
및
[화학식 IVb]
(상기 식 중, m은 1, 2, 3, 4 또는 5 이상이고; R1은 임의 치환되는 알킬이며; R2는 수소 또는 할로겐화물이고; R5는 하이드록실 또는 할로겐화물이고; R6 및 R7은 동일하거나 상이할 수 있는 것으로서, 각각 알킬, 헤테로알킬 또는 카보닐 함유 기이며, 이것들은 각각 임의로 및 독립적으로 치환될 수 있고, R5가 하이드록실일 때, R6 및 R7 중 하나 이상은 이탈기를 포함하거나 또는 이탈기로 대체될 수 있는 기를 포함하거나, 또는 R5가 할로겐화물일 때, R6 및 R7 중 하나 이상은 하이드록실을 포함함)
몇몇 구체예에서, 화학식 IV를 포함하는 화합물은 하기 화학식을 포함하는 화합물의 에테르화에 의해 형성된다.
(상기 식 중, m은 1 이상이고; R1은 임의 치환되는 알킬이며; R2는 수소 또는 할로겐화물이고; R5는 하이드록실 또는 할로겐화물이고; R6 및 R7은 동일하거나 상이할 수 있는 것으로서, 각각 알킬, 헤테로알킬 또는 카보닐 함유 기이며, 이것들 중 임의의 것은 치환될 수 있고, 여기서, R5가 하이드록실일 때, R6 및 R7 중 하나 이상은 이탈기를 포함하거나 또는 이탈기로 대체될 수 있는 기를 포함하거나, 또는 R5가 할로겐화물일 때, R6 및 R7 중 하나 이상은 하이드록실을 포함함)
몇몇 구체예에서, 화학식 IV를 포함하는 화합물은 하기 화학식 IVa 및 화학식 IVd를 포함하는 전구체 화합물의 에테르화에 의해 형성된다.
[화학식 IVa]
및
[화학식 IVd]
(상기 식 중, R1은 임의 치환되는 알킬이고; R2는 수소 또는 할로겐화물이며; R5는 하이드록실 또는 할로겐화물이고; R6 및 R7은 동일하거나 상이할 수 있는 것으로서, 각각 알킬, 헤테로알킬 또는 카보닐 함유 기이고, 이들은 각각 임의로 및 독립적으로 치환될 수 있으며, 여기서 R5가 하이드록실일 때 R6 및 R7 중 하나 이상은 이탈기를 포함하거나, 또는 R5가 할로겐화물일 때 R6 및 R7 중 하나 이상은 하이드록실을 포함함)
몇몇 구체예에서, 화학식 IV를 포함하는 화합물은 하기 화학식을 포함하는 화합물의 에테르화에 의해 형성된다.
(상기 식 중, R1은 임의 치환되는 알킬이고; R2는 수소 또는 할로겐화물이며; R5는 하이드록실 또는 할로겐화물이고; R6 및 R7은 동일하거나 상이할 수 있는 것으로서, 각각 알킬, 헤테로알킬 또는 카보닐 함유 기이고, 이것들 중 임의의 것은 치환될 수 있으며, 여기서 R5가 하이드록실일 때 R6 및 R7 중 하나 이상은 이탈기를 포함하거나, 또는 R5가 할로겐화물일 때 R6 및 R7 중 하나 이상은 하이드록실을 포함함)
몇몇 구체예에서, 에테르화는 염기의 존재 하에서 전구체 화합물을 반응시키는 단계를 포함한다. 몇몇 구체예에서, 염기는 탄산염 이온을 포함한다.
몇몇 구체예에서, R5는 할로겐화물이고; R6 및 R7은 각각 치환된 알킬이다.
몇몇 구체예에서, R5는 염화물이고; R6 및 R7은 각각 하이드록실로 치환되는 알킬이다.
몇몇 구체예에서, 화학식 IV를 포함하는 화합물은 하기 화학식을 포함하는 전구체 화합물을 에테르화하여,
[화학식 IVe]
및
[화학식 IVf]
(상기 식 중, R1은 임의 치환되는 알킬이고; R2는 수소 또는 할로겐화물임)
하기 화학식을 포함하는 생성물을 형성함으로써 합성된다.
몇몇 구체예에서, 화학식 IV를 포함하는 화합물은 하기 화학식을 포함하는 화합물을 에테르화하여,
하기 화학식을 포함하는 생성물을 생성함으로써 합성된다.
몇몇 구체예에서, R5는 하이드록실이고; R6은 카보닐 함유 기이며, R7은 치환되는 알킬이다. 몇몇 구체예에서, R5는 하이드록실이고; R6은 에스테르이며, R7은 이탈기로 치환되는 알킬이다.
몇몇 구체예에서, 화학식 IV를 포함하는 화합물은, 하기 화학식을 포함하는 화합물을 에테르화하여,
하기 화학식을 포함하는 생성물을 형성함으로써 합성된다.
몇몇 구체예에서, 본 발명의 방법은 생성물을 환원제에 노출시켜, 에스테르기를 알코올로 전환시키는 단계를 추가로 포함한다. 환원제는 수소화 리튬 알루미늄, 수소화 붕소 리튬 또는 수소화 디이소부틸알루미늄(DIBAL-H)일 수 있으나, 이에 한정되는 것은 아니다.
다른 양태에서, 본 발명은 이탈기를 대체하는 플루오르화물 종이 생성되는 조건 하에서 조영제 전구체를 플루오르화물 종, 및 암모늄 염과 접촉시켜, 플루오르화물 종을 포함하는 조영제를 생성하는 단계를 포함하는 조영제 합성 방법을 제공하며, 여기서 암모늄 염 대 조영제 전구체의 몰 비는 1.5:1 미만, 예를 들어 약 1:1 이하이다.
몇몇 구체예에서, 암모늄 염 대 조영제 전구체의 몰 비는 약 1:1 이하, 또는 약 0.75:1 이하, 또는 약 0.5:1 이하, 또는 약 0.25:1 이하, 또는 약 0.05:1 이하이다. 몇몇 구체예에서, 암모늄 염 대 조영제 전구체의 몰 비는 약 1:1 ~ 약 0.5:1이다. 몇몇 구체예에서, 암모늄 염 대 조영제 전구체의 몰 비는 약 1.4:1 ~ 약 0.05:1의 범위이다.
몇몇 구체예에서, 암모늄 염은 중탄산 암모늄, 수산화 암모늄, 아세트산 암모늄, 젖산 암모늄, 트리플루오로아세트산 암모늄, 메탄설폰산 암모늄, p-톨루엔설폰산 암모늄, 질산 암모늄, 요오드화 암모늄 또는 중황산 암모늄이다. 몇몇 구체예에서, 암모늄 염은 테트라알킬암모늄 염이다. 암모늄 염은 R4NHCO3일 수 있는데, 여기서, R은 알킬이다. 암모늄 염은 Et4NHCO3일 수 있다.
다른 양태에서, 본 발명은, 이탈기를 대체하는 플루오르화물 종이 생성되는 조건 하에서, 조영제 전구체와 플루오르화물 종 및 중탄산염을 접촉시켜, 플루오르화물 종을 포함하는 조영제를 생성하는 단계를 포함하는 조영제 합성 방법을 제공하는데, 여기서, 중탄산염 대 조영제 전구체의 몰 비는 1.5:1 미만, 예를 들어 약 1:1 이하이다.
몇몇 구체예에서, 중탄산염 대 조영제 전구체의 몰 비는 약 1:1 이하, 또는 약 0.75:1 이하, 또는 약 0.5:1 이하, 또는 약 0.25:1 이하, 또는 0.05:1이다. 몇몇 구체예에서, 중탄산염 대 조영제 전구체의 몰 비는 약 1:1 ~ 약 0.5:1이다. 몇몇 구체예에서, 중탄산염 대 조영제 전구체의 몰 비는 약 1.4:1 ~ 약 0.05:1이다.
몇몇 구체예에서, 중탄산염 대 조영제 전구체의 몰 비는 약 0.5:1 ~ 약 1:1이다.
몇몇 구체예에서, 중탄산염은 금속 중탄산염이다. 중탄산염은 중탄산 나트륨, 중탄산 칼슘, 중탄산 칼륨 또는 중탄산 마그네슘일 수 있으나, 이에 한정되는 것은 아니다.
몇몇 구체예에서, 중탄산염은 중탄산 암모늄이다. 몇몇 구체예에서, 중탄산염은 중탄산 테트라알킬암모늄이다. 중탄산염은 화학식 R4NHCO3(식 중, R은 알킬임)을 포함한다. 중탄산염은 Et4NHCO3일 수 있다.
몇몇 구체예에서, 조영제 전구체는 크립탠드, 예를 들어 4,7,13,16,21,24-헥사옥사-1,10-디아자비시클로[8.8.8]-헥사코산(이에 한정되는 것은 아님)에 추가로 노출된다.
몇몇 구체예에서, 접촉 단계는, 탄산염, 예를 들어 탄산 칼륨(이에 한정되는 것은 아님)의 부재 하에서 수행된다.
몇몇 구체예에서, 접촉 단계는, 크립탠드, 예를 들어 4,7,13,16,21,24-헥사옥사-1,10-디아자비시클로[8.8.8]-헥사코산(이에 한정되는 것은 아님)의 부재 하에서 수행된다.
다른 양태에서, 본 발명은 이탈기를 대체하는 플루오르화물 종을 생성하는 조건 하에서 조영제 전구체를 플루오르화물 종과 접촉시켜, 플루오르화물 종을 포함하는 조영제를 생성하는 단계를 포함하는 조영제 합성 방법을 제공하는데, 여기서, 상기 접촉 단계는 pH 7 미만에서 수행된다. 몇몇 구체예에서, 접촉 단계는 pH 6 미만, 또는 pH 5 미만, 또는 pH 5 내지 6에서 수행된다.
몇몇 구체예에서, 이탈기는 설폰산염 함유 기이다. 이탈기는 메실산염, 토실산염, 트리플산염 또는 1,2-시클릭 황산염 기일 수 있다. 몇몇 구체예에서, 이탈기는 토실산염기이다. 몇몇 구체예에서, 플루오르화물 종은 18F 이온이다.
몇몇 구체예에서, 조영제 전구체는 하기 화학식 I을 포함한다.
[화학식 I]
(상기 식 중, J는 N(R28), S, O, C(=O), C(=O)O, NHCH2CH2O, 결합 및 C(=O)N(R27)로 이루어진 군으로부터 선택되고; K가 존재할 때, 이 K는 수소, 이탈기로 임의 치환되는 알콕시알킬, 이탈기로 임의 치환되는 알킬옥시, 이탈기로 임의 치환되는 아릴, 이탈기로 임의 치환되는 C1-C6알킬, 이탈기로 임의 치환되는 헤테로아릴 및 이탈기로 이루어진 군으로부터 선택되며; L이 존재할 때, 이 L은 수소, 이탈기로 임의 치환되는 알콕시알킬, 이탈기로 임의 치환되는 알킬옥시, 이탈기로 임의 치환되는 아릴, 이탈기로 임의 치환되는 C1-C6알킬, 이탈기로 임의 치환되는 헤테로아릴 및 이탈기로 이루어진 군으로부터 선택되고; M은 수소, 이탈기로 임의 치환되는 알콕시알킬, 이탈기로 임의 치환되는 알킬옥시, 이탈기로 임의 치환되는 아릴, 이탈기로 임의 치환되는 C1-C6알킬, 이탈기로 임의 치환되는 헤테로아릴 및 이탈기로 이루어진 군으로부터 선택되거나; 또는 L 및 M은 이것들이 결합하는 원자와 함께 3원, 4원, 5원 또는 6원 탄소환 고리를 형성할 수 있으며; Q는 할로 또는 할로알킬이고; n은 0, 1, 2 또는 3이고; R21, R22, R27 및 R28은 독립적으로 수소, 이탈기로 임의 치환되는 C1-C6알킬 및 이탈기로부터 선택되며; R23, R24, R25 및 R26은 독립적으로 수소, 할로겐, 하이드록실, 알킬옥시, 이탈기로 임의 치환되는 C1-C6알킬 및 이탈기로부터 선택되고; R29는 이탈기로 임의 치환되는 C1-C6알킬이며; Y는 결합, 탄소 및 산소로 이루어진 군으로부터 선택되되; 다만, Y가 결합일 때, K 및 L은 존재하지 않고, M은 이탈기로 임의 치환되는 아릴 및 이탈기로 임의 치환되는 헤테로아릴로 이루어진 군으로부터 선택되고; 또한 Y가 산소일 때, K 및 L은 존재하지 않고, M은 수소, 이탈기로 임의 치환되는 알콕시알킬, 이탈기로 임의 치환되는 아릴, 이탈기로 임의 치환되는 C1-C6알킬 및 이탈기로 임의 치환되는 헤테로아릴로부터 선택되며; 또한 화학식 I에는 하나 이상의 이탈기가 존재함)
몇몇 구체예에서, 조영제는 하기 화학식 II를 포함한다.
[화학식 II]
(상기 식 중, J는 N(R28), S, O, C(=O), C(=O)O, NHCH2CH2O, 결합 및 C(=O)N(R27)로 이루어진 군으로부터 선택되고; K가 존재할 때, 이 K는 수소, 조영 부로 임의 치환되는 알콕시알킬, 조영 부로 임의 치환되는 알킬옥시, 조영 부로 임의 치환되는 아릴, 조영 부로 임의 치환되는 C1-C6알킬, 조영 부로 임의 치환되는 헤테로아릴 및 조영 부로 이루어진 군으로부터 선택되며; L이 존재할 때, 이 L은 수소, 조영 부로 임의 치환되는 알콕시알킬, 조영 부로 임의 치환되는 알킬옥시, 조영 부로 임의 치환되는 아릴, 조영 부로 임의 치환되는 C1-C6알킬, 조영 부로 임의 치환되는 헤테로아릴 및 조영 부로 이루어진 군으로부터 선택되고; M은 수소, 조영 부로 임의 치환되는 알콕시알킬, 조영 부로 임의 치환되는 알킬옥시, 조영 부로 임의 치환되는 아릴, 조영 부로 임의 치환되는 C1-C6알킬, 조영 부로 임의 치환되는 헤테로아릴 및 조영 부로 이루어진 군으로부터 선택되거나; 또는 L 및 M은 이것들이 결합하는 원자와 함께 3원 또는 4원 탄소환 고리를 형성할 수 있으며; Q는 할로 또는 할로알킬이고; n은 0, 1, 2 또는 3이고; R21, R22, R27 및 R28은 독립적으로 수소, 조영 부로 임의 치환되는 C1-C6알킬 및 조영 부로부터 선택되며; R23, R24, R25 및 R26은 독립적으로 수소, 할로겐, 하이드록실, 알킬옥시, 조영 부로 임의 치환되는 C1-C6알킬 및 조영 부로부터 선택되고; R29는 조영 부로 임의 치환되는 C1-C6알킬이며; Y는 결합, 탄소 및 산소로 이루어진 군으로부터 선택되되; 다만, Y가 결합일 때, K 및 L은 존재하지 않고, M은 조영 부로 임의 치환되는 아릴 및 조영 부로 임의 치환되는 헤테로아릴로 이루어진 군으로부터 선택되고; 또한 Y가 산소일 때, K 및 L은 존재하지 않고, M은 수소, 조영 부로 임의 치환되는 알콕시알킬, 조영 부로 임의 치환되는 아릴, 조영 부로 임의 치환되는 C1-C6알킬 및 조영 부로 임의 치환되는 헤테로아릴로부터 선택되며; 또한 화학식 II에는 하나 이상의 조영 부가 존재하고, 여기서 조영 부는 18F임)
몇몇 구체예에서, J는 O이다. 몇몇 구체예에서, R29는 메틸, 에틸, n-프로필, i-프로필, n-부틸, i-부틸 또는 t-부틸이며, 이것들은 각각 이탈기로 임의 치환된다. 몇몇 구체예에서, R29는 t-부틸이다. 몇몇 구체예에서, Q는 클로로이다. 몇몇 구체예에서, R21, R22, R23, R24, R25, R26 및 R27은 각각 수소이다.
몇몇 구체예에서, Y는 탄소이고, K 및 L은 수소이며, M은 이탈기로 임의 치환되는 알콕시알킬, 이탈기로 임의 치환되는 알킬옥시, 이탈기로 임의 치환되는 아릴, 이탈기로 임의 치환되는 C1-C6알킬, 이탈기로 임의 치환되는 헤테로아릴 및 이탈기로 이루어진 군으로부터 선택된다.
몇몇 구체예에서, Y는 탄소이고, K 및 L은 각각 수소이며, M은 이탈기로 임의 치환되는 알킬옥시이다.
몇몇 구체예에서, 조영제 전구체는 하기 화학식을 포함한다.
(상기 식 중, L은 이탈기임)
몇몇 구체예에서, 조영제는 하기 화학식 X를 포함한다.
[화학식 X]
(상기 식 중, Im은 조영 부임)
몇몇 구체예에서, 조영제 전구체는 하기 구조를 포함한다.
(상기 식 중, L은 이탈기임)
몇몇 구체예에서, 조영제는 하기 화학식을 포함한다.
(상기 식 중, Im은 조영 부임)
몇몇 구체예에서, 조영제 전구체는 하기 화학식을 포함한다.
몇몇 구체예에서, 플루오르화물 종을 포함하는 조영제는 하기 화학식을 포함한다.
몇몇 구체예에서, 본 발명의 방법은 하나 이상의 정제 기술을 사용하여 조영제를 정제하는 단계를 추가로 포함한다. 몇몇 구체예에서, 정제 기술은 크로마토그래피, 예를 들어 HPLC이나, 이에 한정되는 것은 아니다. 몇몇 구체예에서, 정제 기술은 여과, 예를 들어 C18 수지를 통한 여과이나, 이에 한정되는 것은 아니다.
몇몇 구체예에서, 본 발명의 방법은 조영제와 안정화제를 합하는 단계를 추가로 포함한다. 몇몇 구체예에서, 안정화제는 아스코르브산 또는 이의 염이다.
다른 양태에서, 본 발명은 하기 화학식을 포함하는 조영제를 제조하는 방법을 제공하며,
이 방법은, (a) 하기 화학식을 포함하는 토실산염 전구체를 암모늄 염과 결합된 무수 플루오르화물 종과 접촉시키는 단계;
(b) 상기 (a) 단계의 혼합물을 가열하는 단계; (c) 가열된 혼합물을 냉각시키는 단계; (d) 냉각된 혼합물에 H2O를 첨가하는 단계; (e) HPLC(용리물 = H2O/MeCN)를 사용하여 혼합물을 (d) 단계의 수화된 혼합물로부터 정제하는 단계; 및 (f) 상기 용리물을 아스코르브산 또는 이의 염 용액으로 희석하는 단계를 포함한다.
몇몇 구체예에서, 상기 단계 (b)는 상기 혼합물을 온도 50℃ 내지 250℃로 가열하는 단계를 포함한다. 몇몇 구체예에서, 상기 단계 (b)는 상기 혼합물을 5분 미만, 10분 미만, 20분 미만 또는 30분 미만 동안 가열하는 단계를 포함한다.
몇몇 구체예에서, 본 발명의 방법은 (g) 단계 (f)의 희석된 용리물을 C18 수지와 접촉시키는 단계; (h) 접촉된 C18 수지를 아스코르브산 또는 이의 염 용액으로 세정하는 단계; (i) 무수 EtOH를 사용하여 를 C18 수지로부터 용리하는 단계; 및 (j) 단계 (i)의 용리물을 아스코르브산 또는 이의 염 용액으로 희석하는 단계를 추가로 포함한다.
몇몇 구체예에서, 본 발명의 방법은 (k) 단계 (j)의 희석된 용리물을 무균 여과하는 단계, 및 (l) 임의로는 단계 (k)의 무균 여과물 샘플 중에 가 존재하는지 여부를 확인하는 단계를 추가로 포함한다.
다른 양태에서, 본 발명은 상기 방법들 중 임의의 방법에 의해 제조된 조영제를 제공한다.
그러므로, 하나의 양태에서, 본 발명은 하기 화학식을 포함하는 조영제를 제공하며,
여기서, 상기 조영제는, (a) 하기 화학식을 포함하는 토실산염 전구체를 암모늄염과 결합된 무수 플루오르화물 종과 접촉시키는 단계;
(b) 단계 (a)의 혼합물을 가열하는 단계; (c) 가열된 혼합물을 냉각시키는 단계; (d) 냉각된 혼합물에 H2O를 첨가하는 단계; (e) HPLC(용리물 = H2O/MeCN)를 사용하여 혼합물을 (d) 단계의 수화된 혼합물로부터 정제하는 단계; 및 (f) 상기 용리물을 아스코르브산 또는 이의 염 용액으로 희석하는 단계를 포함한다.
몇몇 구체예에서, 상기 단계 (b)는 상기 혼합물을 온도 50℃ 내지 250℃로 가열하는 단계를 포함한다. 몇몇 구체예에서, 상기 단계 (b)는 상기 혼합물을 5분 미만, 10분 미만, 20분 미만 또는 30분 미만 동안 가열하는 단계를 포함한다.
몇몇 구체예에서, 본 발명의 제조 방법은 (g) 단계 (f)의 희석된 용리물을 C18 수지와 접촉시키는 단계; (h) 접촉된 C18 수지를 아스코르브산 또는 이의 염 용액으로 세정하는 단계; (i) 무수 EtOH를 사용하여 를 C18 수지로부터 용리하는 단계; 및 (j) 단계 (i)의 용리물을 아스코르브산 또는 이의 염 용액으로 희석하는 단계를 추가로 포함한다.
몇몇 구체예에서, 본 발명의 제조 방법은 (k) 단계 (j)의 희석된 용리물을 무균 여과하는 단계 및 (l) 임의로는 단계 (k)의 무균 여과물 샘플 중에 가 존재하는지 여부를 확인하는 단계를 추가로 포함한다.
다른 양태에서, 본 발명은 탄산염 또는 중탄산염의 존재 하에서 (i) 할로겐화물 또는 설폰산염 함유 기로 치환되는 알콕시알킬기를 포함하는 플루오르화 화합물의 전구체를, (ii) 플루오르화물 종 및 약하게 배위 결합하는 양이온을 포함하는 염과 반응시키는 단계를 포함하는, 플루오르화 화합물을 합성하는 방법을 제공한다.
몇몇 구체예에서, 알콕시알킬기는 설폰산염 함유 기로 치환된다. 몇몇 구체예에서, 설폰산염 함유 기는 메실산염, 토실산염, 트리플산염 또는 1,2-시클릭 황산염이다. 몇몇 구체예에서, 설폰산염 함유 기는 토실산염이다. 몇몇 구체예에서, 약하게 배위 결합하는 양이온은 테트라알킬암모늄 양이온이다. 몇몇 구체예에서, 플루오르화물 종은 18F 동위 원소가 농축된 것이다.
다른 양태에서, 본 발명은 탄산염 또는 중탄산염의 존재 하에 (i) 할로겐화물 또는 설폰산염 함유 기로 치환되는 알콕시알킬을 포함하는 플루오르화 화합물의 전구체를, (ii) 18F 동위 원소와 반응시키는 단계를 포함하는, 플루오르화 화합물을 합성하는 방법을 제공한다.
다른 양태에서, 본 발명은 중탄산 테트라알킬암모늄 또는 탄산 테트라알킬암모늄의 존재 하에, (i) 할로겐화물 또는 설폰산염 함유 기로 치환되는 알콕시알킬을 포함하는 플루오르화 화합물의 전구체를, (ii) 18F 동위 원소와 반응시키는 단계를 포함하는, 플루오르화 화합물을 합성하는 방법을 제공한다. 몇몇 구체예에서, 반응은 중탄산 테트라알킬암모늄의 존재 하에 수행된다.
몇몇 구체예에서, 중탄산 테트라알킬암모늄은 중탄산 테트라에틸암모늄, 중탄산 테트라부틸암모늄 또는 중탄산 테트라헥실암모늄이다.
다른 양태에서, 본 발명은 하기 화학식을 포함하는 화합물의 18F 표지화 방법을 제공하며,
(상기 식 중, R은 저급 알킬 설폰산염이고, R1은 C1-C10 알킬이며, R2는 H 또는 할로겐임) 이 방법은 중탄산 테트라알킬암모늄 또는 탄산 테트라알킬암모늄의 존재 하에 상기 화합물을 18F와 반응시키는 단계를 포함한다. 몇몇 구체예에서, R은 -(CH2)O(CH2)n-설폰산염 함유 기로서, 여기서, n은 1에서 5 사이의 정수이다. 몇몇 구체예에서, 설폰산염 함유 기는 메실산염, 토실산염, 트리플산염 또는 1,2-시클릭 황산염이다. 몇몇 구체예에서, R2는 할로겐이다. 몇몇 구체예에서, R2는 염화물이다. 몇몇 구체예에서, R1은 메틸, 에틸, 프로필 또는 부틸이다. 몇몇 구체예에서, R1은 t-부틸이다. 몇몇 구체예에서, R은 -CH2-O-CH2-CH2-토실산염이고, R1은 t-부틸이며, R2는 염화물이다.
다른 양태에서, 본 발명은 하기 화학식 V를 포함하는 화합물을 친핵체 또는 라디칼 종과 반응시켜,
[화학식 V]
(상기 식 중, W는 임의 치환되는 알킬 또는 헤테로알킬이고; R1은 임의 치환되는 알킬이며; R2는 수소 또는 할로겐화물임)
하기 화학식 VI을 포함하는 화합물을 생성하는 단계를 포함하는,
[화학식 VI]
조영제에 대한 전구체를 합성하는 방법을 제공한다.
몇몇 구체예에서, 상기 화학식 V를 포함하는 화합물(식 중, W는 -OCH2-임)은 하기 화학식 Va 및 화학식 Vb를 포함하는 전구체 화합물을 에테르화하여,
[화학식 Va]
및
[화학식 Vb]
하기 화학식을 포함하는 생성물을 생성함으로써 합성된다.
몇몇 구체예에서, R1은 t-부틸이고 R2는 Cl이다.
몇몇 구체예에서, 에테르화는 염기의 존재 하에 전구체 화합물을 반응시키는 단계를 포함한다. 몇몇 구체예에서, 염기는 탄산염 이온을 포함한다. 몇몇 구체예에서, 염기는 수산화물 이온을 포함한다. 몇몇 구체예에서, 염기는 수산화 나트륨 또는 수산화 테트라메틸 암모늄이다. 몇몇 구체예에서, 에테르화 반응은 수산화 나트륨 및 염화 벤질 트리에틸암모늄에 노출시키는 단계를 포함한다.
몇몇 구체예에서, 상기 화학식 Vb를 포함하는 화합물은 하기 화학식을 포함하는 화합물을
환원제에 노출시킴으로써 생성된다. 몇몇 구체예에서, 환원제는 수소화 리튬 알루미늄 또는 수소화 붕소 리튬이다. 몇몇 구체예에서, 환원제는 수소화 리튬 알루미늄이다.
몇몇 구체예에서, 하기 화학식을 포함하는 화합물은, 산의 존재 하에 4-포르밀벤조산 메틸과 에틸렌 글리콜을 반응시킴으로써 생성된다.
다른 양태에서, 본 발명은 하기 화학식을 포함하는 화합물을 설폰산염 함유 종과 반응시켜,
조영제의 설폰산염 함유 전구체를 포함하는 생성물을 형성하는 단계를 포함하는, 조영제의 설폰산염 함유 전구체를 형성하는 방법을 제공한다.
몇몇 구체예에서, 설폰산염 함유 기는 메실산염, 토실산염 또는 트리플산염이다. 몇몇 구체예에서, 설폰산염 함유 기는 토실산염이다. 몇몇 구체예에서, 조영제의 설폰산염 함유 전구체는 하기 화학식을 포함한다.
몇몇 경우에 있어서, 설폰산염 함유 전구체는 조영 부와 반응하여 조영제를 형성한다.
몇몇 구체예에서, 조영 부는 방사성 동위 원소이다. 몇몇 구체예에서, 조영 부는 11C, 13N, 18F, 123I, 125I, 99mTc, 95Tc, 111In, 62Cu, 64Cu, 67Ga 또는 68Ga 이다. 몇몇 구체예에서, 조영 부는 18F이다.
몇몇 구체예에서, 조영 부는 하기 구조를 가진다.
다른 양태에서, 본 발명은 에테르화 반응에 의하여 하기 화학식을 포함하는 전구체 화합물을 반응시켜,
하기 화학식을 포함하는 제1 화합물을 형성하는 단계;
상기 제1 화합물을 환원제에 노출시켜 벤질 알코올을 포함하는 제2 화합물을 형성하는 단계; 상기 제2 화합물을 삼브롬화 인으로 처리하여, 브롬화 벤질을 포함하는 제3 화합물을 형성하는 단계; 상기 제3 화합물을 에틸렌 글리콜과 반응시켜 하기 화학식을 포함하는 제4 화합물을 형성하는 단계; 및
상기 제4 화합물을 설폰산염 함유 종과 반응시켜, 조영제의 설폰산염 함유 전구체를 포함하는 생성물을 형성하는 단계를 포함하는, 조영제를 합성하는 방법을 제공한다. 몇몇 경우에 있어서, 본 발명의 방법은 조영제의 설폰산염 함유 전구체를 조영 부와 반응시켜 조영제를 형성하는 단계를 추가로 포함한다.
다른 양태에서, 본 발명은 하기 구조를 가지는 화합물을 제공한다.
(상기 화합물은 전술한 방법들 중 임의의 방법을 이용하여 합성됨)
다른 양태에서, 본 발명은 하기 화학식을 포함하는 화합물을 제공한다.
다른 양태에서, 본 발명은 하기 화학식을 포함하는 화합물을 제공한다.
다른 양태에서, 본 발명은 하기 화학식을 포함하는 화합물을 제공한다.
다른 양태에서, 본 발명은 하기 화학식을 포함하는 화합물을 제공한다.
다른 양태에서, 본 발명은 하기 화학식을 포함하는 조영제 제1 선량을 약 1mCi 내지 약 4mCi의 양으로 피험체에 투여하는 단계;
피험체의 일부의 제1 이미지 하나 이상을 수집하는 단계; 피험체에 스트레스를 가하는 단계; 스트레스를 받고 있는 피험체에 조영제 제2 선량을, 조영제 제1 선량 초과의 양(조영제 제1 선량의 약 1.5배 이상)으로 투여하는 단계; 및 피험체의 일부의 제2 이미지 하나 이상을 수집하는 단계를 포함하는, 피험체를 조영하는 방법을 제공한다.
몇몇 구체예에서, 조영제의 제2 선량은 제1 이미지 하나 이상을 수집한 후 약 48시간, 24시간, 18시간, 12시간, 6시간, 5시간, 4시간, 3시간, 2시간, 1시간, 30분 또는 15분 미만 이내에 투여된다. 몇몇 구체예에서, 조영제의 제2 선량은 조영제의 제1 선량의 2.0배 이상이다. 몇몇 구체예에서, 제1 이미지는 1분 내지 20분의 이미지 수집 기간 동안에 얻어진다. 몇몇 구체예에서, 제2 이미지는 1분 내지 20분의 이미지 수집 기간 동안에 얻어진다. 몇몇 구체예에서, 피험체의 일부는 적어도 심혈관계의 일부이다. 몇몇 구체예에서, 심혈관계의 일부는 적어도 심장의 일부이다. 몇몇 구체예에서, 이미지 수집시에는 양전자 방출 단층 촬영을 사용한다.
몇몇 구체예에서, 본 발명의 방법은 피험체에 심혈관 질환 또는 병태가 발병하였는지 아니면 발병하지 않았는지를 확인하는 단계를 추가로 포함한다. 몇몇 구체예에서, 심혈관 질환은 관상 동맥 질환 또는 심근 허혈이다.
몇몇 구체예에서, 조영제는 물, 약 5% 미만의 에탄올, 그리고 약 50㎎/㎖ 미만의 아스코르브산 나트륨을 포함하는 제제로서 투여된다. 몇몇 구체예에서, 본 발명의 조영제를 포함하는 제제는 정맥 내 볼루스 주사에 의해 투여된다. 몇몇 구체예에서, 스트레스는 피험체를 운동시켜 유도된다. 몇몇 구체예에서, 조영제의 제2 선량은 운동 중에 투여된다.
몇몇 구체예에서, 조영제의 제1 선량은 약 1.0mCi 내지약 2.5mCi이다. 몇몇 구체예에서, 조영제의 제1 선량은 약 1.7mCi 내지 약 2.0mCi이다. 몇몇 구체예에서, 조영제의 제1 선량은 약 2.5mCi 내지 약 3.0mCi이다.
몇몇 구체예에서, 피험체 일부의 제1 이미지 하나 이상을 수집하는 단계와 피험체에 조영제 제2 선량을 투여하는 단계 사이의 대기 시간(wait time)은 60분이다. 몇몇 구체예에서, 조영제의 제2 선량은, 조영제의 제1 선량의 2.5배 이상 또는 3.0배 이상인 양으로 투여된다. 몇몇 구체예에서, 조영제의 제2 선량은, 조영제의 제1 선량의 2.5배 내지 약 5.0배, 또는 2.5배 내지 4.0배, 또는 3.0배 내지 4.0배 초과이거나, 또는 3.0배 내지 5.0배 초과의 양으로 투여된다. 몇몇 구체예에서, 조영제의 제2 선량은 약 8.6mCi 내지 약 9.0mCi, 또는 약 8.6mCi 내지 약 9.5mCi, 또는 약 9.0mCi 내지 약 9.5mCi이다.
몇몇 구체예에서, 스트레스는 약리학적 스트레스이다. 몇몇 구체예에서, 약리학적 스트레스는 피험체에 약리학적 스트레스 제제를 투여함으로써 유도된다. 몇몇 구체예에서, 약리학적 스트레스 제제는 혈관 확장제이다. 몇몇 구체예에서, 혈관 확장제는 아데노신이다. 몇몇 구체예에서, 조영제의 제2 선량은 피험체에 약리학적 스트레스 제제가 투여된 이후에 투여된다. 몇몇 구체예에서, 조영제의 제2 선량은, 약리학적 스트레스 제제에 의해 피험체의 혈관 확장이 최고조에 이르렀을 때 투여된다.
몇몇 구체예에서, 조영제의 제1 선량은 약 2.0mCi 내지 약 3.5mCi이다. 몇몇 구체예에서, 조영제의 제1 선량은 약 2.4mCi 내지 약 3.0mCi, 또는 약 2.4mCi 내지 약 2.9mCi이다. 몇몇 구체예에서, 조영제의 제1 선량은 약 2.5mCi 내지 약 3.0mCi, 또는 약 2.5mCi 내지 약 3.5mCi이다.
몇몇 구체예에서, 피험체 일부의 제1 이미지 하나 이상을 수집하는 단계와 피험체에 조영제 제2 선량을 투여하는 단계 사이의 대기 시간은 30분이다. 몇몇 구체예에서, 조영제의 제2 선량은, 조영제의 제1 선량의 2.0배 이상인 양으로 투여된다. 몇몇 구체예에서, 조영제의 제2 선량은 조영제의 제1 선량의 2배 내지 3배인 양, 예를 들어, 2.1배, 2.2배, 2.3배, 2.4배, 2.5배, 2.6배, 2.7배, 2.8배 또는 2.9배 이상인 양으로 투여된다.
몇몇 구체예에서, 조영제의 제2 선량은 약 5.7mCi 내지 약 6.2mCi이다. 몇몇 구체예에서, 조영제의 제2 선량은 약 6.0mCi 내지 약 6.5mCi, 또는 약 5.7mCi 내지 약 6.5mCi이다. 몇몇 구체예에서, 조영제의 제1 선량 및 제2 선량의 총량은 약 14mCi를 넘지 않는다.
다른 양태에서, 본 발명은 하기 화학식을 포함하는 조영제를 포함하는 시린지 조성물을 제공하는데,
여기서, 상기 시린지는 조영제의 20%, 19%, 18%, 17%, 16%, 15%, 14%, 13%, 12%, 11%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1% 또는 0.5% 미만을 흡착한다. 몇몇 경우에 있어서, 시린지는 약 1% 내지 약 20%, 또는 약 5% 내지 약 15%, 또는 약 1% 내지 약 15%, 또는 약 2% 내지 약 10%, 또는 약 5% 내지 약 20%를 흡착한다.
몇몇 구체예에서, 시린지는 조영제의 20%, 19%, 18%, 17%, 16%, 15%, 14%, 13%, 12%, 11%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1% 또는 0.5% 미만을 흡착하는 플런저를 포함한다. 몇몇 구체예에서, 시린지는 팁 부분이 고무가 아닌 플런저를 포함한다. 몇몇 구체예에서, 시린지는 라텍스 불포함 시린지이다. 몇몇 구체예에서, 시린지는 고무 및 실리콘 윤활제를 포함하지 않는다. 몇몇 구체예에서, 시린지는 비 반응성 시린지이다. 몇몇 경우에 있어서, 시린지는 약 1% 내지 약 20%, 또는 약 5% 내지 약 15%, 또는 약 1% 내지 약 15%, 또는 약 2% 내지 약 10%, 또는 약 5% 내지 약 20%를 흡착한다.
몇몇 구체예에서, 시린지는 아스코르브산 나트륨, 에탄올 및 물을 추가로 포함한다. 몇몇 구체예에서, 조영제는 수 중 4% 미만의 에탄올과 50㎎/㎖ 미만의 아스코르브산 나트륨을 포함하는 용액 중에 존재한다.
몇몇 구체예에서, 조영제는 시린지 중에 선량 약 1.5mCi 내지 약 14mCi로 존재한다.
다른 양태에서, 본 발명은, 피험체에 스트레스를 가하는 단계; 이 피험체에 하기 화학식을 포함하는 조영제 제1 선량을 약 1mCi 내지 약 4mCi의 양으로 투여하는 단계;
피험체 일부의 제1 이미지 하나 이상을 수집하는 단계; 피험체에 조영제 제2 선량을, 조영제 제1 선량보다 많은 양으로 투여하는 단계; 및 피험체의 일부의 제2 이미지 하나 이상을 수집하는 단계를 포함하는, 피험체를 조영하는 방법을 제공한다.
몇몇 구체예에서, 제2 선량의 양은 제1 선량의 양의 1.5배 이상이다.
다른 구체예에서, 본 발명은 피험체에 스트레스를 가하는 단계; 피험체에 하기 화학식을 포함하는 조영제의 선량을 20mCi 미만의 양으로 투여하는 단계; 및
피험체 일부의 제1 이미지 하나 이상을 수집하는 단계를 포함하는, 피험체를 조영하는 방법을 제공한다.
몇몇 구체예에서, 선량은 14mCi 미만이다. 몇몇 구체예에서, 선량은 1mCi 내지 4mCi이다.
다른 양태에서, 본 발명은 하기 화학식을 포함하는 조영제를 제조하기 위한 카세트(cassette)를 제공하며,
이 카세트는
(i) 하기 화학식을 포함하는 조영제 전구체를 담는 용기와,
(ii) 18F의 공급원을 첨가하기 위한 도관을 포함한다.
다른 양태에서, 본 발명은 상기 카세트를 포함하는 자동화 반응 시스템을 제공한다. 다른 양태에서, 본 발명은 [18O]H2O 회수 시스템, 가스 유입구, 조영제 전구체 용액 저장기, 바이알, 음이온 교환 카트리지, C18 카트리지, 시린지, 용매 저장기, 반응 용기, HPLC 시스템, 수집 용기, 아스코르브산 또는 이의 염 용액 저장기 및 배기 가스 유출구로 이루어진 군으로부터 선택되는 구성요소들 중 하나 이상과 연결되어 있는 스톱콕 매니폴드(stopcock manifold) 다수 개로 이루어진 선형 배열을 포함하는, 조영제 합성 장치를 제공한다.
몇몇 구체예에서, 본 발명의 장치는 튜브를 추가로 포함한다. 몇몇 구체예에서, 본 발명의 장치는 조영제 합성 모듈을 추가로 포함하는데, 여기서 상기 모듈은 본 발명의 장치와 유체 공학적으로 연결되어 있다. 몇몇 구체예에서, 본 발명의 장치는 본원에 기술된 방법을 수행할 수 있다. 몇몇 구체예에서, 본 발명의 장치는 하기 화학식을 포함하는 조영제를 제조할 수 있다.
몇몇 구체예에서, 본 발명은 도 8에 도시한 바와 같이 배열된 구성요소들을 포함하는 장치를 제공한다. 몇몇 경우에 있어서, 상기 구성요소들은 다음과 같은 순서로 배열되어 있다: (1) 가스 유입구; (2) [18O]H2O 회수 시스템; (3) 음이온 교환 카트리지; (4) MeCN 저장기; (5) 시린지; (6) 조영제 전구체 용액을 담는 저장기; (7) 반응 용기; (8) HPLC 시스템; (9) 아스코르브산 또는 이의 염 용액을 담는 저장기; (10) 수집 용기; (11) 에탄올 저장기; (12) 최종 생성물을 담는 바이알; (13) 셉-팩 카트리지(Sep-pack cartridge); (14) 아스코르브산 또는 이의 염 용액을 담는 저장기; (15) 반응 용기; 및 (16) 배기 가스 유출구.
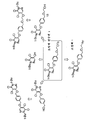
도 1은 조영제 전구체와 플루오르화물 공급원을 사용하여 조영제를 제조하기 위한 친핵 [18F]-플루오르화 반응의 예를 나타낸다.
도 2는 친핵 플루오르화 반응이 진행되는 동안 조영제 전구체의 다양한 반응 경로를 나타낸다.
도 3은 중간체 화합물의 예시적인 합성 과정을 나타낸다.
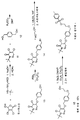
도 4는 중간체 화합물의 대안적 합성 과정을 나타낸다.
도 5는 중간체 화합물의 또 다른 대안적 합성 과정을 나타낸다.
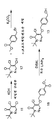
도 6은 조영제를 합성하는 방법을 설명한 흐름도를 나타낸다.
도 7은 변형된 엑스플로라 GN 합성 모듈(Explora GN synthesis module)을 사용하여 조영제를 합성하는 시스템을 개략적으로 도시한 것이다.
도 8은 변형된 GE-트레이서랩-MX 합성 모듈(GE-Tracerlab-MX synthesis module)을 사용하여 조영제를 합성하기 위한 시약 및 컬럼들과 연결되어 있는 카세트를 개략적으로 도시한 것이다.
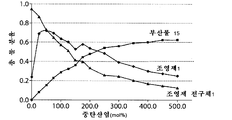
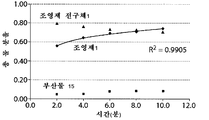
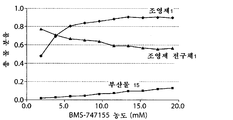
도 9는, 중탄산염의 몰 농도 함수인 생성물 분포 변화를 도시한 그래프(도 9a), 반응 시간 함수인 생성물 분포를 도시한 그래프(도 9b) 및 조영제 전구체의 몰 농도 함수인 생성물 분포 변화를 도시한 그래프(도 9c)를 포함한다.
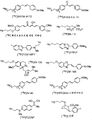
도 10은 몇몇 구체예에 있어서, 본원에 기술된 플루오르화 방법을 이용하여 제조될 수 있는 조영제의 비 제한적 예를 도시한 것이다.
도 11은 조영제 1을 투여한 후 상이한 시점에 있어서 대표적인 사람 피험체의 심근 높이에 있는 전신 관상 동맥 구획을 나타낸다.
도 12는 대조군 및 만성 심근 경색(MI) 토끼에 있어서 조영제 1의 대표적인 심장 이미지를 나타낸다.
도 13은 비 제한적인 구체예에 따라서, 이미지 판독자의 스코어 대 피험체에 조영제 1을 주사 투여한 후 연구의 휴식기 이미지 데이터에 대한 최대 수치로부터의 백분율 감소량의 그래프를 나타낸다.
본 발명의 기타 양태, 구체예 및 특징들은 첨부된 도면들을 함께 참고로 하였을 때 이하 상세한 설명으로부터 명백해질 것이다. 첨부된 도면은 개략적인 것으로서 일정 비율로 축소하여 도시하고자 한 것은 아니다. 도면에 도시한 바가 당업자들이 본 발명을 이해하는데 필요한 것이 아닌 경우에는, 본 발명을 명확히 하기 위하여, 모든 도면의 모든 구성 요소들을 표시하지는 않았으며, 본 발명의 각각의 구체예의 모든 구성 요소들을 나타내지도 않았다. 본원에 참조로 포함된 모든 특허 출원 및 특허는 전체가 참조로 포함된다. 분쟁이 일어날 경우, 용어의 정의를 포함하는 본 발명의 명세서가 우선할 것이다.
도 2는 친핵 플루오르화 반응이 진행되는 동안 조영제 전구체의 다양한 반응 경로를 나타낸다.
도 3은 중간체 화합물의 예시적인 합성 과정을 나타낸다.
도 4는 중간체 화합물의 대안적 합성 과정을 나타낸다.
도 5는 중간체 화합물의 또 다른 대안적 합성 과정을 나타낸다.
도 6은 조영제를 합성하는 방법을 설명한 흐름도를 나타낸다.
도 7은 변형된 엑스플로라 GN 합성 모듈(Explora GN synthesis module)을 사용하여 조영제를 합성하는 시스템을 개략적으로 도시한 것이다.
도 8은 변형된 GE-트레이서랩-MX 합성 모듈(GE-Tracerlab-MX synthesis module)을 사용하여 조영제를 합성하기 위한 시약 및 컬럼들과 연결되어 있는 카세트를 개략적으로 도시한 것이다.
도 9는, 중탄산염의 몰 농도 함수인 생성물 분포 변화를 도시한 그래프(도 9a), 반응 시간 함수인 생성물 분포를 도시한 그래프(도 9b) 및 조영제 전구체의 몰 농도 함수인 생성물 분포 변화를 도시한 그래프(도 9c)를 포함한다.
도 10은 몇몇 구체예에 있어서, 본원에 기술된 플루오르화 방법을 이용하여 제조될 수 있는 조영제의 비 제한적 예를 도시한 것이다.
도 11은 조영제 1을 투여한 후 상이한 시점에 있어서 대표적인 사람 피험체의 심근 높이에 있는 전신 관상 동맥 구획을 나타낸다.
도 12는 대조군 및 만성 심근 경색(MI) 토끼에 있어서 조영제 1의 대표적인 심장 이미지를 나타낸다.
도 13은 비 제한적인 구체예에 따라서, 이미지 판독자의 스코어 대 피험체에 조영제 1을 주사 투여한 후 연구의 휴식기 이미지 데이터에 대한 최대 수치로부터의 백분율 감소량의 그래프를 나타낸다.
본 발명의 기타 양태, 구체예 및 특징들은 첨부된 도면들을 함께 참고로 하였을 때 이하 상세한 설명으로부터 명백해질 것이다. 첨부된 도면은 개략적인 것으로서 일정 비율로 축소하여 도시하고자 한 것은 아니다. 도면에 도시한 바가 당업자들이 본 발명을 이해하는데 필요한 것이 아닌 경우에는, 본 발명을 명확히 하기 위하여, 모든 도면의 모든 구성 요소들을 표시하지는 않았으며, 본 발명의 각각의 구체예의 모든 구성 요소들을 나타내지도 않았다. 본원에 참조로 포함된 모든 특허 출원 및 특허는 전체가 참조로 포함된다. 분쟁이 일어날 경우, 용어의 정의를 포함하는 본 발명의 명세서가 우선할 것이다.
본 발명은 일반적으로 조영제 및 이의 전구체를 합성하기 위한 시스템, 조성물, 카세트, 방법 및 장치에 관한 것이다. 몇몇 양태에서, 본 발명은 본원에 기술된 방법을 이용하여 합성된 조영제에 관한 것이다.
몇몇 구체예에서, 본 발명은, 예를 들어 조영제 전구체와 조영 부 공급원을 반응시켜 조영제를 합성하는 방법에 관한 것이다. 몇몇 경우에서, 본원에 기술된 바에 의하면, 본 발명의 방법은 화학 반응을 촉진할 수 있는 첨가제(예를 들어 염) 하나 이상을 사용하는 것을 포함한다. 본 발명의 방법은 수율이 개선될 수 있으며, 조영제, 예를 들어 방사성 동위 원소(예를 들어 18F)을 포함하는 조영제를 광범위하게 합성할 수 있다. 본 발명의 조영제는 센서 및 진단 도구 등으로서 유용할 수 있다. 조영제를 제조하는 합성 방법은 또한 방사성 동위 원소를 포함하는 조영제를 제조 및 정제하기 위한 자동화 합성 시스템을 사용하도록 디자인되었다. 몇몇 양태에서, 본 발명은 PET 제조 설비(PMF)에서 통상적으로 사용 가능한 친핵 반응 시스템, 예를 들어 엑스플로라 GN 또는 RN 합성 시스템(지멘스 메디칼 솔루션스 USA, 인코포레이션(Siemens Medical Solutions USA, Inc.), GE-트레이서랩-MX 합성 시스템(GE 헬스케어(GE Healthcare)), 엑커트 & 지글러 모듈라-랩 합성 시스템(Eckert & Zeigler Modular-Lab Synthesis system) 등(이에 한정되는 것은 아님)을 사용하여 방사능 표지화된 조영제를 제조할 수 있다.
몇몇 구체예에서, 본 발명은 조영제 전구체를 합성하는 방법을 제공하는데, 여기서, 상기 조영제 전구체는 조영 부 공급원과 반응하여 조영제로 생성된다. 당업자들이 이해할 바와 같이, 반응의 수율이 높고 합성 단계 및/또는 정제 단계의 수가 비교적 적은 방법을 이용하는 것이 유리하다. 그러므로, 본원에 제공된 조영제 전구체 합성 방법들 중 다수의 방법들은 이전에 보고되었던 바보다 적은 수의 단계로 더욱 용이하게 합성하고/합성하거나 고수율로 조영제 전구체를 제공한다.
몇몇 구체예에서, 본 발명은 조영 방법, 예를 들어 (예를 들어 본원에 기술된 바와 같은 조영제 1을 포함하는) 조성물 또는 제제를, 주사, 주입 또는 임의의 투여 방법을 통해 피험체에 투여하는 단계와, 관심 있는 피험체의 신체 영역을 조영하는 단계를 포함하는, 피험체 내 조영 방법을 제공한다. 관심 있는 영역으로서는 심장, 심혈관계, 심혈관, 혈관(예를 들어 동맥 및 정맥), 뇌 및 기타 장기를 포함할 수 있으나, 이에 한정되는 것은 아니다. 관심 있는 매개 변수, 예를 들어 혈류, 심벽 운동 또는 관류는, 본 발명의 방법 및/또는 시스템을 사용하여 조영 및 관찰될 수 있다. 몇몇 경우에 있어서, 관류, 예를 들어 심근 관류를 평가하는 방법이 제공된다.
본원에 사용된 “조영제”란 용어는, 그 자체가 검출 가능한 신호를 발생시킬 수 있거나 또는 외부 에너지 공급원(예를 들어 전자기 복사선, 초음파)에 노출되었을 때 검출 가능한 신호를 발생시킬 수 있는, 하나 이상의 원자 또는 원자단을 포함하는 임의의 종을 말한다. 통상적으로, 조영제는 피험체(예를 들어 사람)의 적어도 신체 일부와 관련된 정보를 제공하기 위해 피험체에 투여될 수 있다. 몇몇 경우에 있어서, 조영제는 피험체의 특정 구역을 밝게 비추어 도드라지게 하여, 장기, 혈관, 조직 및/또는 기타 신체 일부를 검출이 더욱 잘 되도록 만들고 더욱 선명하게 조영되도록 만드는데 사용될 수 있다. 연구중인 대상의 검출능 및/또는 화질을 증가시킴으로써 질병 및/또는 손상의 존재와 그 정도가 확인될 수 있다. 조영제는 핵 의학 조영을 위한 방사성 동위 원소를 포함할 수 있다. 조영제(본원에서는 조영제 1이라고도 칭함)의 비 제한적인 예는 하기 화학식을 포함한다.
본원에 사용된 “조영 부(imaging moiety)”란, 그 자체가 검출 가능한 신호를 발생시킬 수 있거나 외부 에너지 공급원에 노출시 검출 가능한 신호를 발생시킬 수 있는 원자 또는 원자단을 말한다(예를 들어 조영 부를 포함하는 조영제는 병태, 병리학적 질환 및/또는 질병의 존재 및/또는 진행 상태를 검출, 조영 및/또는 모니터할 수 있다). 핵 의학용 조영제는 조영 부로서 11C, 13N, 18F, 123I, 125I, 99mTc,3 95Tc, 111In, 62Cu, 64Cu, 67Ga 및 68Ga를 포함할 수 있다. 몇몇 구체예에서, 조영 부는 18F이다. 18F을 주성분으로 하는 조영제는 저산소증 및 암을 조영하는데 사용되고 있다(Drugs of the Future 2002, 27, 655-667).
몇몇 구체예에서, 화합물(예를 들어 조영제, 플루오르화물 종)은 18F으로 동위 원소 농축될 수 있다. “동위 원소 농축”이란, 조성물이 임의의 원소의 동위 원소를 함유하게 되었을 때, 이 때 생성된 동위 원소성 조성물이 해당 원소의 천연 동위 원소 조성물 이외의 것인 경우를 의미한다. 본원에 제공된 화합물과 관련하여, 특정 원자 위치를 18F로 명명하였을 때, 그 위치에서의 18F의 존재비는, 18F의 천연 존재비(본질적으로는 0임)보다 실질적으로 큰 것으로 이해할 수 있다. 몇몇 구체예에서, 18F로 명명된 플루오르의 최소 동위 원소 농축 계수(isotopic enrichment factor)는 약 0.01%, 약 0.05%, 약 0.1%, 약 0.2%, 약 0.3%, 약 0.4%, 약 0.5%, 약 0.75%, 약 1%, 약 2%, 약 3%, 약 4%, 약 5%, 약 10%, 약 15%, 약 20%, 약 30%, 약 40%, 약 50%, 약 60%, 약 70%, 약 80%, 약 90%, 약 95% 이상이다. 본원에 제공된 화합물의 동위 원소 농축은 당업자에게 공지된 통상의 분석 방법, 예를 들어 질량 분광 분석법 및 HPLC를 사용하여 확인될 수 있다.
조영제를 합성하는 예시적인 방법
본 발명은 조영제를 합성하는 방법을 제공한다. 몇몇 경우에 있어서, 조영제는, 조영제 전구체와 조영 부를 반응시킴으로써 생성된다. 임의의 구체예에서, 본 발명의 방법은 이탈기를 포함하는 조영제 전구체와 조영 부 공급원(예를 들어 플루오르화물 종)을 반응시키는 단계를 포함한다.
예를 들어 조영 부는 치환 반응, 예를 들어 SN2 또는 SN1 반응을 통하여 이탈기를 대체한다. 즉, 반응 동안에, 조영 부는 이탈기를 대체하여 조영제로 생성되는 것이다.
본원에 기술된 방법들은 조영제 전구체로부터 매우 다양한 조영제를 합성하는데 사용될 수 있다. 일반적으로, 조영제 전구체는 조영 부, 예를 들어 18F 종으로 치환될 수 있는 이탈기를 하나 이상 포함할 수 있다. 조영제 전구체는 당업자에게 공지되어 있으며 이하에 기술된 바와 같은 방법들을 이용하여 합성될 수 있다.
몇몇 구체예에서, 본 발명의 조영제 전구체는 하기 화학식 I을 포함한다.
[화학식 I]
(상기 식 중,
J는 N(R28), S, O, C(=O), C(=O)O, NHCH2CH2O, 결합 및 C(=O)N(R27)로 이루어진 군으로부터 선택되고;
K가 존재할 때, 이 K는 수소, 이탈기로 임의 치환되는 알콕시알킬, 이탈기로 임의 치환되는 알킬옥시, 이탈기로 임의 치환되는 아릴, 이탈기로 임의 치환되는 C1-C6알킬, 이탈기로 임의 치환되는 헤테로아릴 및 이탈기로 이루어진 군으로부터 선택되며;
L이 존재할 때, 이 L은 수소, 이탈기로 임의 치환되는 알콕시알킬, 이탈기로 임의 치환되는 알킬옥시, 이탈기로 임의 치환되는 아릴, 이탈기로 임의 치환되는 C1-C6알킬, 이탈기로 임의 치환되는 헤테로아릴 및 이탈기로 이루어진 군으로부터 선택되고;
M은 수소, 이탈기로 임의 치환되는 알콕시알킬, 이탈기로 임의 치환되는 알킬옥시, 이탈기로 임의 치환되는 아릴, 이탈기로 임의 치환되는 C1-C6알킬, 이탈기로 임의 치환되는 헤테로아릴 및 이탈기로 이루어진 군으로부터 선택되거나; 또는
L 및 M은 이것들이 결합하는 원자와 함께 3원, 4원, 5원 또는 6원 탄소환 고리를 형성할 수 있으며;
Q는 할로 또는 할로알킬이고;
n은 0, 1, 2 또는 3이고;
R21, R22, R27 및 R28은 독립적으로 수소, 이탈기로 임의 치환되는 C1-C6알킬 및 이탈기로부터 선택되며;
R23, R24, R25 및 R26은 독립적으로 수소, 할로겐, 하이드록실, 알킬옥시, 이탈기로 임의 치환되는 C1-C6알킬 및 이탈기로부터 선택되고;
R29는 이탈기로 임의 치환되는 C1-C6알킬이며;
Y는 결합, 탄소 및 산소로 이루어진 군으로부터 선택되되; 다만, Y가 결합일 때, K 및 L은 존재하지 않고, M은 이탈기로 임의 치환되는 아릴 및 이탈기로 임의 치환되는 헤테로아릴로 이루어진 군으로부터 선택되고; 또한 Y가 산소일 때, K 및 L은 존재하지 않고, M은 수소, 이탈기로 임의 치환되는 알콕시알킬, 이탈기로 임의 치환되는 아릴, 이탈기로 임의 치환되는 C1-C6알킬 및 이탈기로 임의 치환되는 헤테로아릴로부터 선택되며; 또한
화학식 I에는 하나 이상의 이탈기가 존재함).
몇몇 구체예에서, 본 발명의 방법은 하기 화학식 II를 포함하는 조영제를 제조하는 단계를 포함한다.
[화학식 II]
(상기 식 중, J는 N(R28), S, O, C(=O), C(=O)O, NHCH2CH2O, 결합 및 C(=O)N(R27)로 이루어진 군으로부터 선택되고;
K가 존재할 때, 이 K는 수소, 조영 부로 임의 치환되는 알콕시알킬, 조영 부로 임의 치환되는 알킬옥시, 조영 부로 임의 치환되는 아릴, 조영 부로 임의 치환되는 C1-C6알킬, 조영 부로 임의 치환되는 헤테로아릴 및 조영 부로 이루어진 군으로부터 선택되며;
L이 존재할 때, 이 L은 수소, 조영 부로 임의 치환되는 알콕시알킬, 조영 부로 임의 치환되는 알킬옥시, 조영 부로 임의 치환되는 아릴, 조영 부로 임의 치환되는 C1-C6알킬, 조영 부로 임의 치환되는 헤테로아릴 및 조영 부로 이루어진 군으로부터 선택되고;
M은 수소, 조영 부로 임의 치환되는 알콕시알킬, 조영 부로 임의 치환되는 알킬옥시, 조영 부로 임의 치환되는 아릴, 조영 부로 임의 치환되는 C1-C6알킬, 조영 부로 임의 치환되는 헤테로아릴 및 조영 부로 이루어진 군으로부터 선택되거나; 또는
L 및 M은 이것들이 결합하는 원자와 함께 3원, 4원, 5원 또는 6원 탄소환 고리를 형성할 수 있으며;
Q는 할로 또는 할로알킬이고;
n은 0, 1, 2 또는 3이고;
R21, R22, R27 및 R28은 독립적으로 수소, 조영 부로 임의 치환되는 C1-C6알킬 및 조영 부로부터 선택되며;
R23, R24, R25 및 R26은 독립적으로 수소, 할로겐, 하이드록실, 알킬옥시, 조영 부로 임의 치환되는 C1-C6알킬 및 조영 부로부터 선택되고;
R29는 조영 부로 임의 치환되는 C1-C6알킬이며;
Y는 결합, 탄소 및 산소로 이루어진 군으로부터 선택되되; 다만, Y가 결합일 때, K 및 L은 존재하지 않고, M은 조영 부로 임의 치환되는 아릴 및 조영 부로 임의 치환되는 헤테로아릴로 이루어진 군으로부터 선택되고; 또한 Y가 산소일 때, K 및 L은 존재하지 않고, M은 수소, 조영 부로 임의 치환되는 알콕시알킬, 조영 부로 임의 치환되는 아릴, 조영 부로 임의 치환되는 C1-C6알킬 및 조영 부로 임의 치환되는 헤테로아릴로부터 선택되며;
또한 화학식 II에는 하나 이상의 조영 부가 존재함). 다시 말해서, 화학식 II를 포함하는 조영제는 화학식 I을 포함하는 조영제 전구체로 형성되며, 이 화학식 I을 포함하는 조영제 전구체의 이탈기는 조영 부로 대체된다. 몇몇 구체예에서, 조영 부는 18F이다.
몇몇 경우에 있어서, J는 N(R27), S, O, C(=O), C(=O)O, NHCH2CH2O, 결합 또는 C(=O)N(R27)로부터 선택된다. 몇몇 경우에 있어서, K가 존재할 때, 이 K는 수소, 이탈기로 임의 치환되는 알콕시알킬, 알킬옥시, 아릴, 이탈기로 임의 치환되는 C1-C6알킬, 헤테로아릴 및 이탈기로부터 선택된다. 몇몇 경우에 있어서, L이 존재할 때, 이 L은 수소, 이탈기로 임의 치환되는 알콕시알킬, 알킬옥시, 아릴, 이탈기로 임의 치환되는 C1-C6알킬, 헤테로아릴 및 이탈기로부터 선택된다. 몇몇 경우에 있어서, M은 수소, 이탈기로 임의 치환되는 알콕시알킬, 알킬옥시, 아릴, 이탈기로 임의 치환되는 C1-C6알킬, 헤테로아릴 및 이탈기로부터 선택된다. 몇몇 경우에 있어서, L 및 M은 이것들이 결합하는 원자와 함께 3원 또는 4원 탄소환 고리를 형성한다. 몇몇 경우에 있어서, Q는 할로 또는 할로알킬이다. 몇몇 경우에 있어서, n은 0, 1, 2 또는 3이다. 몇몇 경우에 있어서, R21, R22, R23, R24, R25, R26 및 R27은 독립적으로 수소, 이탈기로 임의 치환되는 C1-C6알킬 및 이탈기로부터 선택된다. 몇몇 경우에 있어서, R29는 이탈기로 임의 치환되는 C1-C6알킬이다. 몇몇 경우에 있어서, Y는 결합, 탄소 및 산소로 이루어진 군으로부터 선택되되; 다만, Y가 결합일 때, K 및 L은 존재하지 않고, M은 아릴 및 헤테로아릴로부터 선택되고; 또한 Y가 산소일 때, K 및 L은 존재하지 않고, M은 수소, 이탈기로 임의 치환되는 알콕시알킬, 아릴, 이탈기로 임의 치환되는 C1-C6알킬 및 헤테로아릴로부터 선택된다.
몇몇 경우에 있어서, J는 O이다. 몇몇 경우에 있어서, R29는 메틸, 에틸, n-프로필, i-프로필, n-부틸, i-부틸 또는 t-부틸이며, 이것들은 각각 이탈기로 임의 치환될 수 있다. 특정 구체예에서, R29는 t-부틸이다. 몇몇 경우에 있어서, Q는 클로로이다. 몇몇 경우에 있어서, R21, R22, R23, R24, R25, R26 및 R27은 모두 수소이다. 몇몇 경우에 있어서, Y는 탄소이고, K 및 L은 수소이며, M은 이탈기로 임의 치환되는 알콕시알킬, 이탈기로 임의 치환되는 알킬옥시, 이탈기로 임의 치환되는 아릴, 이탈기로 임의 치환되는 C1-C6알킬, 이탈기로 임의 치환되는 헤테로아릴 또는 이탈기이다. 몇몇 경우에 있어서, Y는 탄소이고, K 및 L은 수소이며, M은 이탈기로 임의 치환되는 알킬옥시이다.
몇몇 구체예에서, 조영제 전구체는 하기 화학식을 포함한다:
(상기 식 중, R21, R22, R29, Q, J 및 n은 본원에 기술한 바와 같으며, L은 이탈기임).
몇몇 구체예에서, 조영제는 하기 화학식을 포함한다.
(상기 식 중, R21, R22, R29, Q, J 및 n은 본원에 기술된 바와 같으며, Im은 조영 부임)
몇몇 구체예에서, 조영제 전구체는 하기 화학식을 포함한다.
(상기 식 중, R29 및 Q는 본원에 기술된 바와 같으며, L은 이탈기임)
몇몇 구체예에서, 조영제는 하기 화학식을 포함한다.
(상기 식 중, R29 및 Q는 본원에 기술된 바와 같으며, Im은 조영 부임)
하나의 구체예 세트에서, 조영제 전구체(본원에서는 조영제 전구체 1이라 칭함)(도 1 참조)는 하기 화학식을 포함한다.
몇몇 경우에 있어서, 조영제(본원에서는 조영제 1이라 칭함)(도 1 참조)는 하기 화학식을 포함한다.
본 발명의 플루오르화 방법을 이용하여 제조될 수 있는 조영제에 관한 기타 비 제한적인 예를 도 10에 보였다. 몇몇 경우에 있어서, 조영제 전구체는 염이 아니다.
화학식 I의 조영제 전구체를 합성하는데 다양한 방법, 예를 들어 2개의 알코올 간, 또는 페놀과 알코올 간 에테르화 반응(예를 들어 미츠노부 반응(Mitsonobu reaction))을 이용할 수 있다. 몇몇 경우에 있어서, 이탈기는, 예를 들어 염기(예를 들어 DMAP)의 존재 하에 염화 p-톨루엔설폰산염과의 반응을 통하여, 하이드록실기를 토실산염기 또는 기타 이탈기로 전환함으로써 부가될 수 있다. 화학식 II를 포함하는 구조를 가지는 조영제 또는 화학식 I을 포함하는 구조를 가지는 조영제 전구체를 합성하는 부가의 방법에 관하여는, 그 내용이 본원에 참조로 포함되어 있는 국제 출원 공개 WO 제2005/079391호에 개시되어 있다.
몇몇 구체예에서, 조영제를 합성하는 방법은, 이탈기를 대체하는 플루오르화물 종이 생성되는 조건 하에서, 조영제 전구체(예를 들어 화학식 I을 포함하는 화합물)를 플루오르화물 종 및 암모늄 염과 접촉시켜, 플루오르 종을 포함하는 조영제(예를 들어 화학식 II를 포함하는 화합물)를 생성하는 단계를 포함하며, 여기서 암모늄 염 대 조영제 전구체의 몰 비는 약 1.5:1 미만, 또는 약 1:1 이하(또는 본원에 기술된 임의의 몰 비)이다.
몇몇 구체예에서, 조영제를 합성하는 방법은, 이탈기를 대체하는 플루오르화물 종이 생성되는 조건 하에서 조영제 전구체(예를 들어 화학식 I을 포함하는 화합물)를 플루오르화물 종 및 중탄산염과 접촉시켜, 플루오르 종을 포함하는 조영제(예를 들어 화학식 II를 포함하는 화합물)를 생성하는 단계를 포함하며, 여기서 중탄산염 대 조영제 전구체의 몰 비는 약 1.5:1 미만이거나 약 1:1 이하(또는 본원에 기술된 임의의 몰 비)이다.
몇몇 구체예에서, 조영제를 합성하는 방법은, 이탈기를 대체하는 플루오르화물 종이 생성되는 조건 하에서 조영제 전구체(예를 들어 화학식 I을 포함하는 화합물)를 플루오르화물 종과 접촉시켜, 플루오르 종을 포함하는 조영제(예를 들어 화학식 II를 포함하는 화합물)를 생성하는 단계를 포함하며, 여기서, 상기 접촉 단계는 pH 7 미만에서 수행된다.
몇몇 구체예에서, 하기 화학식을 포함하는 화합물을 18F 표지화하는 방법은,
(상기 식 중,
R1은 임의 치환되는 알킬이고;
R2는 수소 또는 할로겐이며;
R3은 설폰산염 함유 기로 치환되는 알킬, 설폰산염 함유 기로 치환되는 알콕시 또는 설폰산염 함유 기로 치환되는 알콕시알킬임)
암모늄 염 또는 중탄산염의 존재 하에 18F 종과 상기 화합물을 반응시켜, 18F 종을 포함하는 생성물을 형성하는 단계를 포함한다.
몇몇 구체예에서, 하기 화학식을 포함하는 조영제를 제조하는 방법은,
(a) 하기 화학식을 포함하는 토실산염 전구체를 암모늄 염과 결합된 플루오르화물 종과 접촉시키는 단계;
(b) 상기 단계 (a)의 혼합물을 가열하는 단계;
(c) 가열된 혼합물을 냉각시키는 단계;
(d) 냉각된 혼합물에 H2O를 첨가하는 단계;
(e) HPLC(용리물 = H2O/MeCN)를 이용하여 상기 단계 (d)의 수화된 혼합물로부터 혼합물을 정제하는 단계; 및
(f) 아스코르브산 또는 이의 염 용액으로 용리물을 희석하는 단계
를 포함한다.
몇몇 경우에 있어서, 단계 (b)는 혼합물을 온도 50℃ 내지 250℃로 가열하는 단계를 포함한다. 몇몇 경우에 있어서, 가열 단계 (b)는 5분 미만, 10분 미만, 20분 미만 또는 30분 미만 동안 혼합물을 가열하는 단계를 포함한다. 몇몇 경우에 있어서, 본 발명의 방법은 다음의 단계들을 추가로 포함한다:
(g) 단계 (f)의 희석된 용리물을 C18 수지와 접촉시키는 단계;
(h) 아스코르브산 또는 이의 염 용액으로 상기 접촉된 C18 수지를 세정하는 단계;
(i) 무수 에탄올을 사용하여 상기 C18 수지로부터
를 용리하는 단계; 및
(j) 단계 (i)의 용리물을, 아스코르브산 또는 이의 염(예를 들어 나트륨 염) 용액으로 희석하는 단계.
몇몇 경우에 있어서, 본 발명의 방법은 다음과 같은 단계들을 추가로 포함한다:
(k) 단계 (j)의 희석 용리물을 무균 여과하는 단계; 및
(l) 임의로는, 단계 (k)의 무균 여과물 샘플 중에
이 존재하는지 여부를 확인하는 단계.
몇몇 구체예에서, 하기 화학식을 포함하는 조영제는,
(a) 하기 화학식을 포함하는 토실산염 전구체를, 암모늄 염과 결합된 무수 플루오르화물 종과 접촉시키는 단계;
(b) 상기 단계 (a)의 혼합물을 가열하는 단계;
(c) 가열된 혼합물을 냉각시키는 단계;
(d) 냉각된 혼합물에 H2O를 첨가하는 단계;
(e) HPLC(용리물 = H2O/MeCN)를 이용하여 상기 단계 (d)의 수화된 혼합물로부터 혼합물을 정제하는 단계; 및
(f) 아스코르브산 또는 이의 염 용액으로 용리물을 희석하는 단계
를 포함하는 방법에 의하여 제조된다.
몇몇 경우에 있어서, 단계 (b)는 혼합물을 온도 50℃ 내지 250℃로 가열하는 단계를 포함한다. 몇몇 경우에 있어서, 가열 단계 (b)는 혼합물을 5분 미만, 10분 미만, 20분 미만 또는 30분 미만 동안 가열하는 단계를 포함한다. 몇몇 경우에 있어서, 상기 제조 방법은 다음과 같은 단계들을 추가로 포함한다:
(g) 단계 (f)의 희석된 용리물을 C18 수지와 접촉시키는 단계;
(h) 아스코르브산 또는 이의 염 용액으로 상기 접촉된 C18 수지를 세정하는 단계;
(i) 무수 에탄올을 사용하여 C18 수지로부터
를 용리하는 단계; 및
(j) 상기 단계 (i)의 용리물을 아스코르브산 또는 이의 염 용액으로 희석하는 단계.
몇몇 경우에서, 상기 제조 방법은 다음과 같은 단계들을 추가로 포함한다:
(k) 상기 단계 (j)의 희석된 용리물을 무균 여과하는 단계; 및
(l) 임의로, 상기 단계 (k)의 무균 여과물 샘플 중에
이 존재하는지 여부를 확인하는 단계.
몇몇 구체예에서, 플루오르화 화합물을 합성하는 방법은, 탄산염 또는 중탄산염 이온의 존재 하에서, (i) 할로겐화물 또는 설폰산염 함유 기로 치환되는 알콕시알킬기를 포함하는, 플루오르화 화합물의 전구체와, (ii) 플루오르화물 종과 약하게 배위 결합된 양이온을 포함하는 염을 반응시키는 단계를 포함한다.
본원에 사용된 “이탈기”란 용어는, 유기 합성 화학 분야에서 통상적으로 통하는 의미를 가지며, 친핵체에 의해 치환될 수 있는 원자 또는 기를 말한다. 적당한 이탈기의 예로서는 할로겐화물(예를 들어, 염화물, 브롬화물 또는 요오드화물), 알콕시카보닐옥시, 아릴옥시카보닐옥시, 알칸설포닐옥시, 아렌설포닐옥시, 알킬-카보닐옥시(예를 들어 아세톡시), 아릴카보닐옥시, 아릴옥시, 메톡시, N,O-디메틸하이드록실아미노, 픽실 및 할로포름산염 등을 포함하나, 이에 한정되는 것은 아니다. 몇몇 경우에서, 이탈기로서는 설폰산 에스테르, 예를 들어 톨루엔설폰산염(토실산염, TsO), 메탄설폰산염(메실산염, MsO) 또는 트리플루오로메탄설폰산염(트리플산염, TfO)이 있다. 몇몇 경우에 있어서, 이탈기는 브로실레이트, 예를 들어 p-브로모벤젠설포닐일 수 있다. 몇몇 경우에 있어서, 이탈기는 노실레이트, 예를 들어 2-니트로벤젠설포닐일 수 있다. 이탈기는 또한, 산화 포스핀(예를 들어 미츠노부 반응을 통해 생성) 또는 내부 이탈기, 예를 들어 에폭시화물 또는 시클릭 황산염일 수도 있다. 몇몇 구체예에서, 이탈기는 설폰산염 함유기이다. 몇몇 구체예에서, 이탈기는 토실산염기이다.
임의의 구체예에서, 본 발명은 할로겐을 포함하는 조영제를 합성하는 방법을 제공한다. 예를 들어 본 발명의 방법은 할로겐화 반응을 포함할 수 있다. 몇몇 구체예에서, 플루오르화물을 포함하는(예를 들어 18F가 농축된) 조영제를 합성하는 방법이 제공된다. 본 발명의 방법은 전구체의 이탈기를 대체하는 플루오르화물이 생성되는 조건 하에서 플루오르화물 공급원과 조영제 전구체를 접촉시켜, 플루오르화물 종을 포함하는 조영제를 생성하는 단계를 포함한다. 임의의 구체예에서, 본 발명의 방법은 친핵성 플루오르화 반응을 포함한다. 다시 말해서, 이탈기를 포함하는 조영제 전구체는 플루오르화물 종의 존재 하에 반응함으로써, 플루오르화물 종에 의한 이탈기의 SN2 또는 SN1 치환이 일어나고, 그 결과 조영제가 생성되는 것이다. 몇몇 구체예에서, 플루오르화물 종은 18F가 농축되었다. 도 1은 예시적인 예를 보이는 것으로서, 여기서, 조영제 전구체 1은 18F로 처리되며, 그 결과, 치환 반응을 통해 조영제 1이 생성된다.
몇몇 구체예에서, 하나 이상의 첨가제가, 조영제 전구체 및 플루오르화물 종의 반응 혼합물에 혼입될 수 있다. 몇몇 경우에 있어서, 첨가제는 조영제 전구체와 플루오르화물 종 사이의 반응을 촉진할 수 있으며/있거나 조영제를 안정화시키는 것을 도울 수도 있다. 예를 들어 플루오르화물 종은 반응성(예를 들어 친핵성)이 비교적 낮을 수 있으며, 첨가제를 첨가하면 플루오르화물 종의 반응성이 증강될 수 있다. 예시적인 구체예로서, 플루오르 종은 음으로 하전된 플루오르화물 이온(예를 들어 동위 원소 농축 18F 이온)일 수 있으며, 첨가제를 사용하여 반응 혼합물 중에 존재하는 임의의 양 하전 반대 이온을 결합시킴으로써, 플루오르화물 이온의 반응성이 증강될 수 있다. 몇몇 구체예에서, 첨가제는 이하에 기술한 바와 같이, 원치 않는 부반응 속도를 감소시킬 수 있다.
몇몇 경우에 있어서, 첨가제는 조영제 전구체와 접촉하기 전에 플루오르화물 종과 합하여질 수 있다. 예를 들어 임의의 구체예에서, 플루오르화물 종과 첨가제를 포함하는 용액이 제조되는데, 이 때, 상기 용액은 조영제 전구체에 첨가된다. 다른 구체예에서, 플루오르화물 종과 첨가제를 포함하는 고체가 제조되는데, 여기서, 상기 고체는 조영제 전구체와 접촉된다. 임의의 구체예에서, 플루오르화물 종은 고체 지지체(예를 들어 음이온 교환 컬럼) 상에 흡착되며, 첨가제를 포함하는 용액은 이 고체 지지체로부터 플루오르화물 종을 용리하는데 사용된다. 이후, 용리된 용액은 조영제 전구체와 접촉하게 되거나, 또는 농축되어 고체로 생성되며, 이 고체는 추후 조영제 전구체와 접촉하게 된다.
몇몇 구체예에서, 첨가제는 중탄산염이다. 임의의 구체예에서, 탄산염을 중탄산염(예를 들어 KHCO3)으로 바꾸면 플루오르화 효율과 출발 물질의 일체성 둘 다가 상당히 개선된다는 것을 알게 되었다. 본원에 사용된 “중탄산염”이란 용어는, 중탄산염 또는 탄산 수소 이온(HCO3 - 이온)을 포함하는 염을 말한다. 중탄산염은 금속 중탄산염, 예를 들어 중탄산 나트륨, 중탄산 칼슘, 중탄산 칼륨 및 중탄산 마그네슘 등일 수 있다. 임의의 구체예에서, 중탄산염은 중탄산 칼륨(KHCO3)이다. 몇몇 구체예에서, 중탄산염은 비 금속 반대 이온, 예를 들어 중탄산 암모늄을 포함한다. 예를 들어 중탄산염은 화학식 R4NHCO3(식 중, R은 알킬임)인 중탄산 테트라알킬암모늄일 수 있다. 몇몇 구체예에서, R은 저급 알킬, 예를 들어 메틸, 에틸, 프로필, 부틸, 펜틸 또는 헥실 등일 수 있다. 임의의 구체예에서, 암모늄 염은 Et4NHCO3이다. 다른 구체예에서, 염은 Me4NHCO3, i-Pr4NHCO3, n-Pr4NHCO3, n-Bu4NHCO3, i-Bu4NHCO3 또는 t-Bu4NHCO3이다.
실시예 14에 추가로 기술된 바와 같이, 플루오르화 속도 차가 더욱 커지는 것을 촉진하는 반응 조건은 공정을 더욱 효율적이고 화학 선택성이 되도록 만들 것으로 생각되는데; 다시 말해서, 가수 분해 속도는 감소하고, 플루오르화 속도는 증가할 것으로 생각된다. 본원에 개략적으로 기술된 연구들을 통하여, K2CO3는 음이온 교환에 필요하지만, 플루오르화 반응을 기준 수준에 비하여 그다지 많이 증강시키지는 않으며, 오히려 플루오르화 반응에 주로 유해한 영향을 미친다는 것이 규명되었다. 그러나, 이와는 반대로, KHCO3를 첨가하면 동일 농도 범위의 K2CO3를 첨가하였을 때에 비하여 플루오르화가 눈에 띄게 촉진되되, 분해 경로는 그다지 차이가 없는 상태로 유지된다. 이와 같은 사실들은, 테트라알킬암모늄 양이온과 [18F]NaF 교환을 통해서 고도로 활성을 가지는 친핵성 플루오르화물 공급원이 직접 생산될 수 있다는 관찰 결과와 함께, 플루오르화 속도를 증가시키는 관련 짝이온 효과를 확인하기 위한 노력의 일환으로서 일련의 염들에 관한 연구가 행해질 수 있도록 한다.
암모늄 염의 종합적 스크린을 통하여 중탄산염 음이온의 존재 하에 플루오르화 효율이 극적으로 증가한다는 것을 파악하였으며(표 1 참조); 오로지 알킬 치환기의 크기에 대한 보통의 의존성만이 메틸 → 에틸 → 부틸 순으로 관찰되었다(실시예 14 참조).
염 화학 양론에 관한 추후의 최적화를 통해, 중탄산 테트라알킬암모늄 대 조영제 전구체의 몰% 수준이 25mol%로 낮을 때(예를 들어 몰 비가 0.25:1일 때), 조영제 전구체가 조영제로 거의 완전히 전환되고; 또한 염기의 농도가 증가함에 따라서 출발 물질의 비 생산적인 소모가 일어난다는 것이 규명되었다(이는 변형된 반응 조건에 대한 최적의 화학 양론 범위를 말해줌). 최적 전구체 농도 측정에 관한 관련 연구를 통하여 최소 농도가 규명되었다.
이러한 시약 혼합 사용 방법은, K2CO3/크립토픽스? 222 방법에 비하여 플루오르화에 대한 화학 선택성을 상당히 개선하고, 전환을 신속히 진행시킨다는 것이 입증되었다. 실제로, 미정제 반응 혼합물을 대상으로 하는 더욱 상세한 평가를 통하여, 가수 분해성 불순물의 부재에 의해 입증되는 바와 같은, 전체 분해 속도의 극적인 감소가 규명되었으며(예를 들어 실시예 14에 기술된 바와 같음); 또한 크립토픽스? 222 부재 하에 낮은 용액 pH에 기인할 수 있는 결과가 규명되었다(5 ~ 6 vs 9 ~ 10).
몇몇 구체예에서, 첨가제는 플루오르화물 종과 약한 배위 결합 염을 형성하는 양이온 포함 염이다. 본원에 사용된 “플루오르화물 종과 약한 배위 결합 염을 형성하는 양이온”이란, 플루오르화 반응에서 플루오르화물 종을 반응성으로 만드는 양이온을 말한다. 예를 들어 양이온은 플루오르화물 종과 강하게 결합할 수 없으며, 친핵성 플루오르화 반응 동안 이 플루오르화물 종이 친핵체로서의 역할을 할 수 있도록 한다. 당업자들은 플루오르화물 종의 약하게 배위 결합하는 짝이온으로서 적당할, 적합한 양이온을 선택할 수 있을 것이다. 예를 들어 양이온은 원자 반지름이 비교적 클 수 있으며/있거나 약한 루이스 염기일 수 있다. 몇몇 경우에 있어서, 양이온은 친지성인 것으로 선택될 수 있다. 몇몇 경우에 있어서, 양이온은 하나 이상의 알킬기를 포함할 수 있다. 약하게 배위 결합하는 양이온의 예로서는 세슘 이온 및 암모늄 이온 등을 포함한다. 약하게 배위 결합하는 양이온의 예로서는 헥사메틸피페리디늄, S(NMe2)3, P(NMe2)4, 테트라알킬포스포늄 염, 테트라아릴포스포늄 염, (예를 들어 테트라페닐포스포늄), 헥사키스(디메틸아미노)디포스파제늄, 트리스(디메틸아미노)설포늄 등의 약하게 배위 결합하는 염을 포함한다.
몇몇 구체예에서, 첨가제는 암모늄 염, 즉 치환 또는 비 치환 암모늄 이온을 포함하는 염이다. 몇몇 경우에 있어서, 암모늄 이온은 약하게 배위 결합하는 양이온이다. 몇몇 경우에 있어서, 암모늄 염은 화학식 R4NX를 가지는데, 여기서 R은 각각 동일하거나 상이한 것일 수 있으며, 알킬, 헤테로알킬, 아릴, 헤테로아릴 또는 복소환(각각은 임의 치환됨)이고, X는 음으로 하전된 짝이온이다. 몇몇 경우에 있어서, R은 알킬, 헤테로알킬, 아릴, 헤테로아릴 또는 복소환으로서, 이것들은 각각 임의 치환된다. 암모늄 염은 다양한 범위의 음으로 하전된 짝이온, 예를 들어 할로겐화물, 탄산염 및 중탄산염 등을 포함할 수 있다. 암모늄 염의 예로서는 중탄산 암모늄 염, 수산화 암모늄 염, 아세트산 암모늄 염, 젖산 암모늄 염, 트리플루오로아세트산 암모늄 염, 메탄설폰산 암모늄 염, p-톨루엔설폰산 암모늄 염, 질산 암모늄 염, 할로겐화 암모늄 염(예를 들어 요오드화 암모늄 염) 및 중황산 암모늄 염 등을 포함하나, 이에 한정되는 것은 아니다.
하나의 구체예 세트에서, 암모늄 염은 테트라알킬암모늄 염, 예를 들어 중탄산 테트라알킬암모늄 염이다. 예를 들어 암모늄 염은 화학식 R4NHCO3(식 중, R은 각각 독립적으로 알킬임)를 가질 수 있다. 몇몇 경우에 있어서, R은 임의 치환된다. 몇몇 구체예에서, 알킬기는 저급 C1-C6알킬기이다. 몇몇 구체예에서, 테트라알킬암모늄 염은 염기성 테트라알킬암모늄 염이다.
염 첨가제(예를 들어 중탄산염 및/또는 암모늄 염)는 반응에서 사용될 수 있으며, 이 경우, 염 첨가제 대 조영제 전구체의 몰 비는 약 1.5:1 미만이다. 몇몇 경우에 있어서, 몰 비는 약 1.5:1 이하, 약 1.4:1 이하, 약 1.3:1 이하, 약 1.25:1 이하, 약 1.2:1 이하, 약 1.1:1 이하, 약 1:1 이하, 약 0.75:1 이하, 약 0.5:1 이하, 약 0.25:1 이하, 약 0.1:1 이하, 또는 약 0.05:1 이하이다. 몇몇 경우에 있어서, 몰 비는 약 0.05:1 초과, 약 0.01:1 초과, 또는 약 0.25:1 초과이다. 몇몇 구체예에서, 염 첨가제 대 조영제 전구체의 몰 비는 약 0.5:1 내지 약 1:1, 또는 약 0.25:1 내지 약 1:1, 또는 약 0.25:1 내지 약 0.75:1, 또는 약 1.49:1 내지 약 0.05:1, 또는 약 1.4:1 내지 약 0.25:1, 또는 약 0.25:1 내지 약 1.4:1, 또는 약 0.25:1 내지 약 1.25:1이다.
이론에 국한되기 바라지 않지만, 중탄산염 및 암모늄 염을 사용하면, 경쟁 반응, 예를 들어 조영제 전구체의 친핵성 플루오르화 중 가수 분해 반응의 속도를 감소시키는 것을 보조할 수 있다.
몇몇 구체예에서, 첨가제는 플루오르화물 종의 반응성을 증강시킬 수 있거나 조영제 전구체의 조영제로의 전환을 촉진할 수 있는 종과 함께 사용될 수 있다. 예를 들어 상기 종은 반응 혼합물 중에 존재할 수 있는 하나 이상의 이온(예를 들어 금속 이온)을 킬레이트화할 수 있는 화합물일 수 있다. 이론에 국한되기 바라지 않지만, 상기 종은 플루오르화물 종에 대한 짝이온, 예를 들어 칼륨 이온을 킬레이트화하여, 플루오르화물 종의 반응성(예를 들어 친핵성)을 증가시키는데 사용될 수 있다. 임의의 구체예에서, 첨가제는 금속 이온을 킬레이트화할 수 있는 여러 자리 리간드, 예를 들어 크라운 에테르 또는 크립탠드와 함께 사용된다. 여러 자리 리간드(예를 들어 크립탠드)는 킬레이트화될 금속 이온을 기준으로 선택될 수 있다. 여러 자리 리간드는, 예를 들어 4,7,13,16,21,24-헥사옥사-1,10-디아자비시클로[8.8.8]-헥사코산(예를 들어 크립토픽스? 222)일 수 있다. 기타 크립탠드는 당업자에게 공지될 것이다.
몇몇 구체예는 4,7,13,16,21,24-헥사옥사-1,10-디아자비시클로[8.8.8]-헥사코산과 함께 중탄산염을 사용하는 것을 포함할 수 있다. 특정 구체예에서, 중탄산 칼륨은 4,7,13,16,21,24-헥사옥사-1,10-디아자비시클로[8.8.8]-헥사코산과 함께 사용될 수 있다.
다른 구체예 세트에 있어서, 크립탠드의 부재 하에 본원에 기술된 방법을 이용하는 것이 유리할 수 있다. “크립탠드”라는 용어는, 업계에서 통상적으로 가지는 의미로서 사용되는 것으로서, 양이온에 대한 이환 또는 다환 여러 자리 리간드를 말한다. 예를 들어 본 발명의 방법은 크립탠드(예를 들어 4,7,13,16,21,24-헥사옥사-1,10-디아자비시클로[8.8.8]-헥사코산)의 부재 하에 암모늄 염을 사용하여 수행될 수 있다.
다른 구체예 세트에 있어서, 본 발명의 방법은 탄산염의 부재 하에서 수행된다.
몇몇 구체예에서, 반응에 염 첨가제를 사용하면 반응의 수율을, 본질적으로 동일한 조건이되 염 첨가제가 존재하지 않는 조건 하에서 진행되는 반응을 수행할 경우에 비하여, 약 10%, 약 20%, 약 30%, 약 40%, 약 50%, 약 60%, 약 70%, 약 80%, 약 90%, 약 100%, 약 200%, 약 300%, 약 400%, 약 500% 이상 증가시킨다.
당업자들은 특정 용도로서 사용하기 적당한, 적합한 반응 조건 세트(예를 들어 농도, 온도, 압력, 반응 시간 및 용매 등)를 선택 및/또는 결정할 수 있을 것이다. 조영제는 하나 이상의 정제 기술을 사용하여 추가로 처리될 수 있으며, 임의로는 부가 성분, 예를 들어 안정화제와 혼합될 수도 있다.
당업자들은 본원에 기술된 방법에서 사용하기 적당한 플루오르화물 종의 공급원을 선택할 수 있을 것이다. 본원에 사용된 “플루오르화물 종”이란 용어는, 하나 이상의 플루오르화물 원자를 포함하는 원자단 또는 플루오르화물 원자를 말하며, 여기서 상기 플루오르화물 원자는 다른 화합물(예를 들어 조영제 전구체)과 반응할 수 있다. 몇몇 구체예에서, 동위 원소 농축 18F 종은 사이클로트론 내에서 [18O]H2O의 양자 충돌에 의해서 진행되는 핵내 반응 18O(p,n)18F 에 의해 제조될 수 있다. 본 발명의 방법은 18F 종의 용액을 처리하여 임의의 불순물, 예를 들어 미반응 [18O]H2O를 제거하는 단계를 포함할 수 있다. 예를 들어 18F 종의 용액은 음이온 교환 컬럼을 통해서 여과될 수 있으며, 여기서, 18F 종은, [18O]H2O가 용리될 때 양이온 수지 매트릭스상에 체류한다. 이후, 18F 종은, 음이온 교환 컬럼을 용매와 임의의 첨가제(예를 들어 염 첨가제)의 다양한 혼합물로 세정하여, 18F 함유 용액을 생성함으로써 제거된다. 몇몇 경우에 있어서, 음이온 교환 컬럼은 염, 예를 들어 KHCO3 또는 Et4NHCO3의 수용액으로 세정된다.
몇몇 경우에 있어서, 18F 함유 용액은 조영제 전구체와의 반응 전 부가 성분들과 혼합된다. 예를 들어 하나 이상의 용매는 18F 함유 용액을 선택된 농도로 희석하기 위해 첨가될 수 있다. 하나의 구체예 세트에 있어서, 18F 함유 용액은 아세토니트릴로 희석된다.
몇몇 경우에 있어서, 18F 함유 용액은, 고온 및/또는 감압에 노출되어 농축 건조될 수 있는데, 그 결과, 무수 18F 함유 고체가 생성된다. 몇몇 구체예에서, 18F 함유 고체는 하나 이상의 첨가제(예를 들어 염 첨가제)를 추가로 포함할 수 있다. 18F 함유 고체의 화학 조성은 18F 함유 용액의 제조에 사용된 첨가제의 수와 종류에 따라서 달라질 수 있다. 예를 들어 중탄산 칼륨의 용액은 음이온 교환 컬럼으로부터 18F 종을 용리하여, [18F]KF를 포함하는 18F 함유 고체를 생성하는데 사용될 수 있다. 다른 예에서, 중탄산 암모늄 용액은 음이온 교환 컬럼으로부터 18F 종을 용리하여, [18F]Et4NF를 포함하는 18F 함유 고체를 생성하는데 사용된다.
몇몇 경우에 있어서, 18F 종을 포함하는 용액은 실온에서 약 200℃의 온도 범위로 가열된다. 몇몇 구체예에서, 용액은 90℃ 내지 120℃의 온도 범위로 가열된다. 몇몇 경우에 있어서, 용액은 약 75℃, 약 85℃, 약 95℃, 약 105℃, 약 115℃, 약 125℃ 이상으로 가열된다. 몇몇 경우에 있어서, 용액은 약 100mmHg, 약 125mmHg, 약 150mmHg, 약 175mmHg, 약 200mmHg, 약 225mmHg, 약 250mmHg, 약 275mmHg, 약 300mmHg, 약 325mmHg, 약 350mmHg, 약 375mmHg, 약 400mmHg 이상의 감압 하에 방치된다. 몇몇 경우에 있어서, 용액은 약 100mbar, 약 125mbar, 약 150mbar, 약 175mbar, 약 200mbar, 약 225mbar, 약 250mbar, 약 275mbar, 약 280mbar, 약 300mbar, 약 325mbar, 약 350mbar, 약 375mbar, 약 400mbar, 약 450mbar, 약 500mbar 이상의 감압 하에 방치된다. 당업자들은 특정 반응에 적당한 조건을 선택 및/또는 결정할 수 있을 것이다. 몇몇 구체예에서, 용액은 약 150mmHg 및 약 115℃에서 농축 건조된다. 몇몇 구체예에서, 용액은 약 375mmHg 및 약 115℃에서 농축 건조된다. 몇몇 구체예에서, 용액은 약 400mbar 및 약 110℃ 내지 150℃에서 농축 건조된다. 몇몇 구체예에서, 용액은 약 280mbar 및 약 95℃ 내지 115℃에서 농축 건조된다.
만일 플루오르화물 종 및/또는 첨가제가 존재하면, 이 플루오르화물 종 및/또는 첨가제는, 친핵성 플루오르화를 통하여 조영제 전구체를 조영제 생성물로 전환시키는 조건 하에서 조영제 전구체와 접촉된다. 당업자들은 특정 반응에 사용하기 적당한 조건을 선택할 수 있을 것이다. 예를 들어 플루오르화물 종 대 조영제 전구체의 비는 약 1:10,000 이상, 약 1:5000 이상, 약 1:3000 이상, 약 1:2000 이상, 1:1000 이상, 1:500 이상, 1:100 이상, 1:50 이상, 1:10 이상, 1:5 이상이 되도록 선택될 수 있으며, 몇몇 경우에는 1:1 이상이 되도록 선택될 수 있다. 몇몇 구체예에서, 플루오르화물 종은 조영제 전구체의 양에 대하여 약 10mol%, 또는 약 5mol%, 또는 약 3mol%, 또는 약 2mol%, 또는 약 1mol%, 또는 약 0.5mol%, 또는 약 0.1mol%, 또는 약 0.05mol%, 또는 약 0.01mol%로 존재할 수 있다. 몇몇 구체예에서, 제공된 플루오르화물 종은 적어도 18F가 농축된다. 예를 들어 18F 종 대 조영제 전구체의 비는 약 1:1,000,000 이상, 또는 약 1:500,000 이상, 또는 약 1:250,000 이상, 또는 약 1:100,000 이상, 또는 약 1:50,000 이상, 또는 약 1:25,000 이상, 또는 약 1:10,000 이상, 약 1:5000 이상, 약 1:3000 이상, 약 1:2000 이상, 1:1000 이상, 1:500 이상, 1:100 이상, 1:50 이상, 1:10 이상, 1:5 이상이 되도록 선택될 수 있으며, 몇몇 경우에는 1:1 이상이 되도록 선택될 수 있다.
몇몇 구체예에서, 친핵성 플루오르화 반응은 하나 이상의 용매, 예를 들어 유기 용매, 비 유기 용매(예를 들어 수성 용매) 또는 이것들의 혼합물의 존재 하에서 진행된다. 몇몇 경우에 있어서, 용매는 극성 용매 또는 비극성 용매이다. 몇몇 구체예에서, 용매는 수용액, 예를 들어 물이다. 용매는 약 0.001% 이상의 물, 약 0.01% 이상의 물, 약 0.1% 이상의 물, 약 1% 이상의 물, 약 5% 이상의 물, 약 10% 이상의 물, 약 20% 이상의 물, 약 30% 이상의 물, 약 40% 이상의 물, 약 50% 이상, 또는 그 이상의 물을 포함한다. 몇몇 경우에 있어서, 용매는 약 0.1% 내지 100%의 물, 약 1% 내지 90%의 물, 약 1% 내지 70%의 물, 약 1% 내지 50%의 물, 또는 약 10% 내지 약 50%의 물을 포함할 수 있다. 몇몇 경우에 있어서, 용매는 10% 이하의 물, 5% 이하의 물, 4% 이하의 물, 3% 이하의 물, 2% 이하의 물, 1% 이하의 물, 또는 0.5% 이하의 물을 포함한다. 몇몇 경우에 있어서, 용매는 약 0.01% 내지 5%의 물, 또는 약 0.01% 내지 2%의 물, 또는 약 0.1% 내지 0.2%의 물을 포함한다.
본 발명의 방법에 유용한 용매의 기타 비 제한적인 예로서는 비 할로겐화 탄화수소 용매(예를 들어 펜탄, 헥산, 헵탄, 시클로헥산 등), 할로겐화 탄화수소 용매(예를 들어 디클로로메탄, 클로로포름, 플루오로벤젠, 트리플루오로메틸벤젠 등), 방향족 탄화수소 용매(예를 들어 톨루엔, 벤젠, 자일렌 등), 에스테르 용매(예를 들어 아세트산 에틸 등), 에테르 용매(예를 들어 테트라하이드로푸란, 디옥산, 디에틸 에테르, 디메톡시에탄 등) 및 알코올 용매(예를 들어 에탄올, 메탄올, 프로판올, 이소프로판올 등)를 포함하나, 이에 한정되는 것은 아니다. 용매에 관한 기타 비 제한적인 예로서는 아세톤, 아세트산, 포름산, 설폭시화 디메틸, 디메틸 포름아미드, 아세토니트릴 및 피리딘을 포함한다. 몇몇 구체예에서, 반응은 극성 용매, 예를 들어 아세토니트릴 중에서 수행된다.
하나의 구체예 세트에 있어서, 임의로는 첨가제를 포함하는 무수 18F 함유 고체는 조영제 전구체(예를 들어 토실산염 전구체) 용액과 접촉될 수 있으며, 그 결과 생성된 용액은 특정 기간 동안 고온으로 가열된다. 용액은 예를 들어 아세토니트릴 용액일 수 있다. 다른 구체예에서, 18F 종 및 첨가제의 용액이 존재한다면, 이 용액은 고체 조영제 전구체 또는 조영제 전구체 용액과 접촉된다.
몇몇 구체예는, pH가 약 7 미만, 약 6 미만, 또는 약 5 미만인 용액 중에서 조영제 전구체와 플루오르화물 종을 접촉시키는 단계를 포함한다. 몇몇 경우에 있어서, 용액의 pH는 약 5 내지 약 6, 또는 약 5 내지 약 7, 또는 약 4 내지 약 7이다.
몇몇 경우에 있어서, 18F 종, 조영제 전구체, 그리고 임의로는 첨가제를 포함하는 용액은 일정 기간 동안 고온으로 가열된다. 예를 들어 용액은 5분 이하, 10분 이하, 20분 이하, 30분 이하의 기간 동안, 약 50℃, 약 60℃, 약 70℃, 약 80℃, 약 90℃, 약 100℃, 약 110℃, 약 120℃, 약 150℃, 약 170℃, 약 200℃, 약 225℃, 약 250℃ 이상으로 가열될 수 있다. 기타 온도 및 반응 시간도 적용할 수 있음이 이해되어야 할 것이다. 반응이 종결되면, 반응 혼합물은 (예를 들어 실온으로) 냉각되며, 임의로는 용매, 예를 들어 물로 희석된다.
플루오르화 반응이 종결되면, 그 결과 생성된 조영제는 임의로 하나 이상의 정제 단계를 거치게 된다. 몇몇 경우에 있어서, 조영제(예를 들어 화학식 II를 포함하는 화합물)의 합성, 정제 및/또는 제제화는 카세트를 포함하는 자동화 반응 시스템을 이용하여 수행될 수 있으며, 여기서, 상기 카세트는 합성 모듈, 정제 모듈 및/또는 제제화 모듈을 포함할 수 있다. 자동화 반응 시스템 및 카세트는 본원에 기술되어 있다.
정제 및 분리는 당업자에게 공지된 방법, 예를 들어 크로마토그래피와 같은 분리 기술을 사용하거나, 또는 당업계에 공지된 다양한 분리 기술, 예를 들어 추출, 증류 및 결정화를 조합하여 수행될 수 있다. 하나의 구체예에서, 고성능 액체 크로마토그래피(HPLC)는 용리물로서 용매, 용매 혼합물을 사용하여 생성물을 회수한다. 몇몇 경우에 있어서, 용리물은 물과 아세토니트릴의 혼합물, 예를 들어 45:55의 물:아세토니트릴 혼합물을 포함한다. 용리물 중 물의 함량은, 예를 들어 약 1% 내지 약 50%로 상이할 수 있다. 몇몇 경우에 있어서, HPLC는 C18 컬럼을 사용하여 수행될 수 있다.
생성물은 부가의 정제 기술, 예를 들어 여과를 통하여 추가로 처리될 수 있다. 몇몇 경우에 있어서, 조영제는 HPLC를 사용하여 정제될 수 있으며, 그 결과, HPLC 이동상과 조영제의 용액이 생성된다. HPLC 이동상은 추후, C18 수지(예를 들어 C18 셉-팩? 카트리지)를 통한 여과에 의해서 아스코르브산 또는 이의 염 용액, 그리고 에탄올 용액으로 교환될 수 있다. 몇몇 구체예에서, HPLC 이동상 및 조영제의 용액은 C18 수지를 통해 여과되는데, 이 경우, 조영제는 수지 상에 잔류하고, 다른 성분들, 예를 들어 아세토니트릴 및/또는 기타 용매 또는 성분들은 용리를 통해 분리된다. C18 수지는 아스코르브산 또는 이의 염 용액으로 추가로 세정될 수 있으며, 이때 생성되는 여과물은 폐기된다. 정제된 조영제를 회수하기 위하여, C18 수지는 용매, 예를 들어 에탄올로 세정되고, 그 결과 생성된 용액은, 본원에 기술된 바와 같이, 임의로는 아스코르브산 또는 이의 염 용액으로 추가로 희석된다.
임의로, 회수된 생성물은 하나 이상의 안정화제, 예를 들어 아스코르브산 또는 이의 염과 혼합된다. 예를 들어 정제된 조영제를 포함하는 용액은 아스코르브산 또는 이의 염 용액으로 추가 희석될 수 있다. 본원에 기술된 바와 같이, 제제는 카세트를 포함하는 자동화 반응 시스템을 통해 제조될 수 있다.
몇몇 경우에 있어서, 조영제 생성물을 포함하는 용액은 (예를 들어 지름 13㎜의 밀리포어(Millipore), 밀렉스 PVDF(Millex PVDF) 0.22㎛ 멸균화 필터를 사용하여) 멸균 생성물 바이알 내로 멸균 여과될 수 있다. 멸균 생성물 바이알은 시판중인 예비 멸균 처리 유닛으로서, 사용전 격벽을 통해 임의의 조영제(또는 기타 성분)가 무균 혼입될 수 있으므로, 생성물 처리 과정 중에는 개방되지 않는다. 당업자들은 적당한 바이알과 생산 부품들, 예를 들어 시판중인 것으로서, 예비 멸균 처리된 유닛(공극 크기가 0.22㎛인 막 통기 필터 및 품질 제어 샘플 채취 시린지 포함)을 선택할 수 있을 것이다.
무균 여과후, 각각의 선량은 시린지 내에 충전될 수 있으며, 이는 라벨을 붙여 의료 기관에 배송될 수 있다. 조영제를 합성하기 위한 선량 투여 기술, 키트, 카세트, 방법 및 시스템(예를 들어 자동화 반응 시스템)과, 테스트 방법에 관하여는 본원에 기술되어 있다. 몇몇 구체예에서, 생성물은 3㎖ 또는 5㎖들이 시린지에 나누어 담기며, 분배를 위해서 이 시린지에 라벨을 붙인다. 라벨은 방사성 의약품 제조국에서 제조되며, 시린지 쉴드 및 배송용 용기에 적용된다. 의료 기관 기록에 포함시키기 위해 배송 용기에 추가의 라벨을 붙일 수 있다.
본 발명의 조영제는 피험체의 조영 방법, 예를 들어 본원에 기술된 바와 같이, 주사, 주입 또는 기타 임의의 방법에 의해 환자에게 조영제를 투여하는 단계와, 환자의 신체 구역을 조영하는 단계를 포함하는 환자의 조영 방법에 사용될 수 있다. 몇몇 구체예에서, 환자의 심장의 일부가 조영된다.
조영제 전구체 합성을 위한 예시적인 방법
조영제 전구체와 이의 중간체를 합성하기 위한 방법도 또한 제공된다. 몇몇 경우에 있어서, 조영제 전구체(예를 들어 화학식 I을 포함하는 화합물)를 합성하는 방법은 수율을 개선하며/개선하거나 조영제 전구체 및/또는 이의 중간체를 다량으로 합성할 수 있다. 몇몇 구체예는 시간이 많이 소모되고/소모되거나 비용이 많이 들며 생성물의 손실이 따를 수 있는 정제 방법, 예를 들어 크로마토그래피를 수행하지 않고도 원하는 생성물을 합성할 수 있는 능력을 제공한다. 전술한 바와 같이, 도 1은 심근 관류를 조영하기 위한 조영제를 합성함에 있어서 사용된 조영제 전구체의 예시적인 일례를 나타낸다. 본원에 기술된 바와 같이, 이탈기(즉, 토실산염기)가 조영 부, 예를 들어 18F로 대체됨으로써 조영제가 형성된다.
몇몇 구체예에서, 조영제 전구체는 반응, 즉 이종 원자와 알킬, 헤테로알킬, 아릴 또는 헤테로아릴기 사이의 결합이 생성되는 반응을 통해서 생성된다. 예를 들어 반응은 알킬화 반응, 예를 들어 에테르화 반응일 수 있다. 몇몇 구체예에서, 반응은 친전자성 종과 반응하여 에테르 결합을 형성하는, 하이드록실 함유 친핵성 종이 관여한다. 본원에 사용된 “에테르” 또는 “에테르 결합”이라는 용어에는 당업계에서 통상적으로 사용되는 의미가 부여되며, 이 용어는 Ra-O-Rb 기(식 중, Ra 및 Rb는 동일하거나 상이한 것일 수 있으며, 알킬, 헤테로알킬, 아릴 또는 헤테로아릴로서 이것들 중 임의의 것은 치환될 수 있음)를 말한다. 예를 들어 반응은 하이드록실 함유 종의 산소 원자를 친전자성 종에 친핵 부가하는 단계를 포함할 수 있다. 몇몇 구체예에서, 반응은, 예를 들어 미츠노부 반응을 통해 2개의 알코올 사이에 결합을 형성하는 단계를 포함할 수 있다.
몇몇 경우에 있어서, 에테르화 반응은, 산소 원자와 알킬, 아릴, 헤테로알킬, 헤테로아릴, 탄소환 또는 복소환 기 사이에 결합을 형성하는 단계를 포함한다. 도 3은 벤질 알코올(13)을 생성하는, 벤젠디메탄올(12)과 디클로로피리다지논(11) 사이의 에테르화 반응에 관한 예시적인 구체예를 나타낸다. 다른 구체예에서, 도 4는 피리다지논 에스테르(18)를 생성하는, 하이드록시클로로피리다지논(17) 및 4-브로모메틸벤조산 메틸 사이의 에테르화 반응을 나타낸다.
몇몇 구체예에서, 본 발명의 방법은 하기 화학식 III을 포함하는 화합물을 친핵체와 반응시키는 단계를 포함하는데,
[화학식 III]
(상기 식 중,
W는 임의 치환되는 알킬 또는 헤테로알킬이고;
R1은 임의 치환되는 알킬이며;
R2는 수소 또는 할로겐화물이고;
R3은 각각 동일하거나 상이할 수 있는 것으로서, 이탈기로 임의 치환되는 알킬 또는 이탈기로 임의 치환되는 헤테로알킬이며;
n은 1, 2, 3, 4 또는 5임)
여기서, 상기 친핵체는 이탈기를 대체하여 생성물을 생성한다. 예를 들어, 친핵체는 에틸렌 글리콜일 수 있으며, 에테르화 반응은 본원에 기술된 바와 같이 수행될 수 있다. 몇몇 구체예에서, 반응은 염기, 예를 들어 t-부톡시화 칼륨 또는 수산화 칼륨의 존재 하에 수행된다. 몇몇 경우에 있어서, R3은 이탈기로 치환되는 알킬이며/알킬이거나 n은 1이다. 몇몇 구체예에서, 화학식 III을 포함하는 화합물은 하기 구조를 포함한다.
(상기 식 중, 이탈기는 Br이며, 반응의 생성물은 하기 화학식을 포함함)
(상기 식 중, R1 및 R2는 본원에 정의된 바와 같음)
몇몇 구체예에서, 화학식 III을 포함하는 화합물은 하기 구조식을 포함하며,
에테르화 반응의 생성물은 하기 화학식을 포함한다.
몇몇 경우에 있어서, 화학식 III을 포함하는 화합물은 친핵체로서 작용할 수 있으며, 친핵체와 반응하여 생성물을 생성할 수 있다. 예를 들어 R3은 -CH2OH일 수 있으며, 친핵체는 산화 에틸렌일 수 있다.
몇몇 구체예에서, 본 발명의 방법은 하기 화학식 IV를 포함하는 화합물을 반응물과 반응시키는 단계를 포함하는데,
[화학식 IV]
(상기 식 중,
R1은 임의 치환되는 알킬이며;
R2는 수소 또는 할로겐화물이고;
W는 임의 치환되는 알킬 또는 헤테로알킬이며;
R4는 각각 동일하거나 상이할 수 있는 것으로서, 하이드록실로 임의 치환되는 알킬 또는 하이드록실로 임의 치환되는 헤테로알킬이고;
n은 1, 2, 3, 4 또는 5임)
여기서, 하이드록실기는 반응물의 일부로 대체되어, 상기 화합물과 결합된 이탈기를 형성한다. 몇몇 경우에 있어서, R4는 하이드록실로 치환되는 알킬이고/알킬이거나 n은 1이다. 몇몇 구체예에서, 화학식 IV를 포함하는 화합물을 반응시키는 단계는, 할로겐화 시약, 예를 들어 삼브롬화 인, 이브롬화 피리디늄, 또는 사브롬화 탄소와 트리페닐포스핀의 혼합물에 노출시키는 단계를 포함한다. 몇몇 구체예에서, 할로겐화 시약은 삼브롬화 인이다.
몇몇 구체예에서, W는 -O(CH2)-이고; R1은 t-부틸이며; R2는 염화물이고; R4는 하이드록실로 치환되는 알킬이다. 몇몇 경우에 있어서, n은 1이다.
몇몇 구체예에서, 화학식 IV를 포함하는 화합물은 하기 구조를 포함하며
생성물은 하기 구조를 포함한다.
몇몇 구체예에서, 화학식 IV를 포함하는 화합물은 하기 구조를 포함하며
생성물은 하기 구조를 포함한다.
몇몇 경우에 있어서, 화학식 IV를 포함하는 화합물을 합성하는 방법이 제공된다. 몇몇 경우에 있어서, 본 발명의 방법은, 하기 화학식 IVa 및 화학식 IVb를 포함하는 화합물 간 에테르화 반응을 통해서 화학식 IV를 포함하는 화합물을 합성하는 단계를 포함한다.
[화학식 IVa]
및
[화학식 IVb]
(상기 식 중,
R1은 임의 치환되는 알킬이며;
R2는 수소 또는 할로겐화물이고;
m은 1, 2, 3, 4 또는 5 이상이며;
R5는 하이드록실 또는 할로겐화물이고;
R6 및 R7은 각각 동일하거나 상이할 수 있는 것으로서, 각각 임의 치환되는 알킬, 헤테로알킬 또는 아실 기이며;
R5가 하이드록실일 때 R6 및 R7 중 하나 이상은 이탈기를 포함하거나 또는 이탈기(예를 들어 하이드록실)로 대체될 수 있는 부를 포함하거나, 또는 R5가 할로겐화물일 때 R6 및 R7 중 하나 이상은 하이드록실을 포함함)
몇몇 경우에서, 화학식 IVa를 포함하는 화합물은 하기 구조를 포함한다.
(상기 식 중, R5는 본원에 기술한 바와 같음)
하나의 구체예 세트에 있어서, 화학식 II를 포함하는 화합물은 하기 화학식 IVa 및 화학식 IVd를 포함하는 화합물 간 에테르화 반응에 의해 합성된다:
[화학식 IVa]
및
[화학식 IVd]
(상기 식 중,
R1은 임의 치환되는 알킬이며;
R2는 수소 또는 할로겐화물이고;
R5는 하이드록실 또는 할로겐화물이고;
R6 및 R7은 동일하거나 상이할 수 있는 것으로서, 각각 임의로 치환되는 알킬, 헤테로알킬 또는 카보닐 기이며,
여기서, R5가 하이드록실일 때 R6 및 R7 중 하나 이상은 이탈기를 포함하거나, 또는 R5가 할로겐화물일 때 R6 및 R7 중 하나 이상은 하이드록실을 포함함). 하나의 구체예 세트에 있어서, R5는 하이드록실이고, R6은 카보닐기이며, R7은 치환되는 알킬이다. 몇몇 경우에 있어서, R5는 하이드록실이고, R6은 에스테르이며, R7은 이탈기로 치환되는 알킬이다.
몇몇 경우에 있어서, 화학식 IVa를 포함하는 화합물은 하기 구조를 포함한다.
(상기 식 중, R5는 본원에 정의된 바와 같음)
에테르화 반응은 본원에 기술된 바와 같이 진행될 수 있으며, 또한 염기, 예를 들어 탄산 칼륨에 전구체 화합물을 노출시키는 단계를 포함할 수 있다.
몇몇 구체예에서, R5는 할로겐화물이고; R6 및 R7은 각각 임의 치환되는 알킬이다. 몇몇 구체예에서, R5는 염화물이고; R6 및 R7은 각각 하이드록실로 치환되는 알킬이다. 하나의 구체예에서, 하기 화학식 IVe 및 화학식 IVf를 포함하는 화합물 간 에테르화 반응은,
[화학식 IVe]
및
[화학식 IVf]
하기 화학식을 포함하는 생성물을 생성한다.
하나의 구체예에서, 하기 화학식을 포함하는 화합물 간 에테르화 반응은,
하기 화학식을 포함하는 생성물을 생성한다.
하나의 구체예에서, 하기 화학식을 포함하는 화합물 간 에테르화 반응은,
하기 화학식을 포함하는 생성물을 생성한다.
생성물은 환원제, 예를 들어 수소화 리튬 알루미늄, 수소화 붕소 리튬 또는 수소화 디이소부틸알루미늄(DIBAL-H)로 환원될 수 있으며, 그 결과, 에스테르기가 알코올로 전환될 수 있다.
도 3의 예시적인 구체예에 보인 바와 같이, 벤젠디메탄올(12) 및 디클로로피리다지논(11)은 DMF 중 탄산 칼륨의 존재 하에 진행되는 에테르화 반응을 통하여 반응할 수 있으며, 그 결과, 벤질 알코올(13)이 형성된다. 몇몇 구체예에서, 이치환 불순물도 형성되는데, 이 경우, 벤젠디메탄올(12)은 두 개의 하이드록실기가 알킬화되고, 이 불순물은 추후 크로마토그래피 정제를 통해 제거될 수 있다. 벤질 알코올(13)로부터 브롬화 벤질(14)로의 전환은 다양한 브롬화제, 예를 들어 디클로로메탄 중 삼브롬화 인을 사용하여 수행될 수 있다. 브롬화 벤질(14)로부터 알코올(15)로의 후속 전환은, 몇몇 경우, 고온에서 테트라하이드로푸란 중 t-부톡시화 칼륨의 존재 하에 진행되는 에틸렌 글리콜과의 반응에 의해 종결될 수 있다. 이후, 알코올(15)은 컬럼 크로마토그래피에 의해 정제될 수 있으며, 그 결과, 벤질 알코올(13) 합성시 생성된 임의의 불순물, 예를 들어 이치환 불순물이 제거될 수 있다. 이후, 알코올(15)은 DMAP, 트리에틸아민 및 디클로로메탄의 존재 하에 염화 p-톨루엔설포닐과 추가로 반응할 수 있으며, 그 결과, 재결정화에 의해 정제될 수 있는 조영제 전구체 1이 형성될 수 있다. 도 5에 보인 방법을 사용하면, 화합물(11)(예를 들어 2-(t-부틸)-4,5-디클로로피리다진-3(2H)-온) 및 화합물(12)(예를 들어 1,4-벤젠디메탄올)로부터 알코올(15)을 합성할 때 그 전체 수율(정제 방법으로서 크로마토그래피 사용)은 10% 이상, 20% 이상, 30% 이상 또는 40% 이상일 수 있다. 몇몇 경우에 있어서, 화합물(11) 및 화합물(12)로부터 알코올(15)을 합성할 때 그 전체 수율(정제 방법으로서 크로마토그래피 사용)은 약 43%이다.
도 4는 에틸렌 글리콜 중 디클로로피리다지논(11)과 수산화 칼륨을 반응시켜 클로로하이드록시피리다지논(17)을 생성하는 단계를 포함하는, 알코올(13)의 합성에 대한 대안적인 접근 방법을 보이는데, 이 때, 상기 클로로하이드록시피리다지논은 추후 DMF 중 탄산 칼륨의 존재 하에 4-브로모메틸 벤조산 메틸과 반응하여, 피리다지논 에스테르(18)로 생성될 수 있다. 그 다음, 예를 들어 DIBAL-H 또는 수소화 리튬 알루미늄 중 어느 하나를 사용하여 피리다지논 에스테르(18)를 환원시키면, 본원에 기술된 바와 같이, 벤질 알코올(13)이 생성되며, 이 벤질 알코올은 이후 알코올(15)과 조영제 전구체 1로 전환될 수 있다. 도 4에 보인 합성 반응식에 관한 한 가지 유리한 특징은, 도 3에 보인 합성 반응식에서 형성될 수 있는 이치환 불순물이 감소하거나 제거된다는 점이다. 이로써 크로마토그래피를 수행하지 않고도 벤질 알코올(13)을 정제할 수 있다. 몇몇 경우에 있어서, 재결정화 방법은 단독으로 순도가 매우 높은 중간체 화합물을 생성하는데 사용될 수 있다. 예를 들어 벤질 알코올(13)은 아세트산 이소프로필로부터 재결정화에 의해 정제될 수 있다. 부가적으로, 도 4에 보인 합성 반응식은 더욱 간단한 방법을 제공할 수 있는데, 이 방법은 고수율의 반응을 통해 수행될 수 있으며, 이 경우 추가의 보호 단계/탈보호 단계는 필요하지 않다. 도 4에 보인 방법을 이용하면, 화합물(17)(예를 들어 2-(t-부틸)-4-클로로-5-하이드록시피리다진-3(2H)-온) 및 4-브로모메틸벤조산 메틸 로부터 알코올(15)을 합성할 때의 전체 수율은 10% 이상, 20% 이상, 30% 이상 또는 40% 이상일 수 있으며, 이 경우, 정제시 크로마토그래피를 사용하지 않아도 된다. 몇몇 경우에 있어서, 화합물(17) 및 4-브로모메틸벤조산 메틸로부터 알코올(15)을 합성할 때의 전체 수율은 48%이며, 정제 방법으로서 크로마토그래피를 사용하지 않는다.
몇몇 구체예에서, 에테르화 반응(예를 들어 도 3, 즉 벤질 알코올(13)을 형성하는 에테르화 반응 참조)은 염기의 존재 하에 수행된다. 염기는, 예를 들어 금속 또는 금속 염, 예를 들어 탄산염 또는 금속 알콕시화물 등일 수 있다. 몇몇 구체예에서, 염기는 유기 부, 예를 들어 아민일 수 있다. 염기의 예로서는 금속(예를 들어 나트륨 금속), 알콕시화물, 예를 들어 t-부톡시화 나트륨 또는 t-부톡시화 칼륨, 알칼리 금속 아미드, 예를 들어 나트륨 아미드, 리튬 디이소프로필아미드 또는 알칼리 금속 비스(트리알킬실릴)아미드, 예를 들어 리튬 비스(트리메틸실릴)아미드 또는 나트륨 비스(트리메틸실릴)아미드, 아민(예를 들어 트리에틸아민, 트리메틸아민, Et(i-Pr)2N, Cy2MeN, 4-(디메틸아미노)피리딘(DMAP), 2,6-루타디엔, N-메틸피롤리딘(NMP), 퀴뉴클리딘), 1,5-디아자비시클[4.3.0]논-5-엔(DBN), 1,5-디아자비시클로[5.4.0]운덱-5-엔(DBU), 암모늄 염(예를 들어 수산화 암모늄, 수산화 테트라메틸 암모늄), 알칼리 및 알칼리 토 탄산염, 알칼리 및 알칼리 토 중탄산염, 알칼리 및 알칼리 토 수산화물(예를 들어 수산화 나트륨, 수산화 칼륨), 그리고 알칼리 및 알칼리 토 수소화물(예를 들어 NaH, LiH, KH, K2CO3, Na2CO3, Tl2CO3, Cs2CO3, K(Ot-Bu), Li(Ot-Bu), Na(Ot-Bu) K(OPh), Na(OPh))을 포함하나, 이에 한정되는 것은 아니다. 몇몇 구체예에서, 염기는 나트륨 금속, 수소화 나트륨, t-부톡시화 칼륨, 메톡시화 나트륨, 탄산 칼륨, 탄산 나트륨, 탄산 세슘 또는 수산화 칼륨이다. 몇몇 구체예에서, 염기는 탄산 세슘이다. 몇몇 구체예에서, 염기는 수산화 칼륨이다. 몇몇 구체예에서, 염기는 수산화 나트륨이다. 몇몇 구체예에서, 염기는 t-부톡시화 칼륨이다. 몇몇 구체예에서, 염기는 수산화 테트라메틸 암모늄이다. 에테르화 반응은 또한 염기의 부재 하에서도 수행될 수 있음이 이해되어야 할 것이다.
하나 이상의 첨가제가 에테르화 반응 혼합물에 혼입되어 이 반응을 촉진할 수 있다. 몇몇 경우에 있어서, 에테르화 반응은 촉매의 존재 하에서 수행될 수 있다. 예를 들어 촉매는 염, 예를 들어 암모늄 염일 수 있다. 몇몇 구체예에서, 촉매는 할로겐화 테트라알킬암모늄, 예를 들어 요오드화 테트라에틸암모늄(이에 한정되는 것은 아님)일 수 있다. 몇몇 구체예에서, 촉매는 상간 이동 촉매(phase transfer catalyst)일 수 있다. 본원에 사용된 “상간 이동 촉매”란 용어는, 예를 들어 화학 반응 과정 중 화합물의, 제1 상에서 제2 상, 즉 상이한 상으로의 이동을 촉진할 수 있는 임의의 화학 종을 말한다. 몇몇 구체예에서, 상간 이동 촉매는 임의의 화합물이 하나의 상에서 다른 상으로 이동하는 것을 촉진하는데, 이 때, 화학 반응이 일어난다. 상간 이동 촉매의 몇몇 예로서는 염화 벤질 트리에틸암모늄, 염화 테트라부틸암모늄, 염화 테트라에틸 암모늄, 황산 테트라부틸암모늄, 황산 테트라옥틸암모늄 및 수산화 테트라메틸 암모늄을 포함하나, 이에 한정되는 것은 아니다. 상간 이동 촉매는, 예를 들어 염기 또는 기타 화학 시약과 함께 사용될 수 있다. 몇몇 구체예에서, 반응은 수산화 나트륨 및 상간 이동 촉매, 예를 들어 염화 벤질 트리에틸암모늄에 노출하는 단계를 포함한다.
에테르화 반응은 임의로 하나 이상의 용매의 존재 하에 수행될 수 있다. 용매는, 예를 들어 유기 용매(예를 들어 톨루엔), 수성 용매 또는 이것들의 조합일 수 있다. 몇몇 경우에 있어서, 용매는 극성 용매(예를 들어 극성 양성자성 용매, 극성 비 양성자성 용매)일 수 있다. 극성 용매의 예로서는 아세톤, 아세트산 에틸, 디메틸포름아미드(DMF), 설폭시화 디메틸(DMSO), 아세토니트릴, 알코올 또는 이것들의 조합을 포함하나, 이에 한정되는 것은 아니다. 하나의 구체예 세트에 있어서, 에테르화 반응은 DMF의 존재 하에서 수행된다. 하나의 구체예 세트에 있어서, 에테르화 반응은 THF의 존재 하에서 수행된다. 몇몇 경우에 있어서, 에테르화 반응은 이온성 액체의 존재 하에서 수행될 수 있다. 몇몇 구체예에서, 에테르화 반응은 용매의 존재 하에서 수행된다. 예를 들어 화합물은 순수한 에틸렌 글리콜 중에서 반응할 수 있다.
몇몇 경우에 있어서, 에테르화 반응의 성분들은 일정 기간 동안 약 0℃ 내지 약 200℃ 중 임의의 온도로 가열 또는 냉각된다. 몇몇 구체예에서, 용액은 약 20℃ 내지 약 100℃, 또는 약 40℃ 내지 약 70℃의 온도로 가열된다. 몇몇 경우에서, 용액은 약 20℃, 약 30℃, 약 40℃, 약 50℃, 약 60℃, 약 70℃, 약 80℃ 이상으로 가열될 수 있다. 몇몇 구체예에서, 에테르화 반응 혼합물의 온도는 약 20℃로 유지된다. 몇몇 구체예에서, 에테르화 반응 혼합물의 온도는 실온으로 유지된다. 몇몇 구체예에서, 에테르화 반응 혼합물은 약 60℃로 가열된다. 몇몇 구체예에서, 에테르화 반응 혼합물은 약 65℃로 가열된다. 반응물은 특정 온도에서 특정 기간, 예를 들어 약 1시간, 약 2시간, 약 3시간, 약 4시간, 약 5시간, 약 10시간, 약 15시간, 약 20시간, 약 25시간, 약 30시간 이하, 또는 그 이상의 기간 동안 가열/냉각/유지될 수 있다. 하나의 구체예 세트에 있어서, 반응 혼합물은 약 4시간 동안 약 65℃로 가열된다. 다른 구체예 세트에 있어서, 반응 혼합물의 온도는 약 18시간 동안 약 20℃로 유지된다. 기타 온도 및 반응 시간도 적용될 수 있음을 이해해야 한다.
몇몇 구체예에 있어서, 본 발명의 방법은 환원 반응(예를 들어 도 4, 즉 피리다지논 에스테르(18)의 환원 반응)을 포함한다. “환원 반응”이라는 용어는, 당업계에서 통상적으로 통하는 의미가 부여되며, 하나 이상의 원자의 산화 상태가 감소하는 화학 반응을 말한다. 예를 들어 환원 반응은 에스테르 또는 케톤을 알코올로 환원하는 과정을 포함할 수 있다. 환원 반응은 다양한 용매, 예를 들어 테트라하이드로푸란, 메틸테트라하이드로푸란 및 디클로로메탄 중, 당업자에게 공지된 환원 시약, 예를 들어 수소화 리튬 알루미늄, 수소화 붕소 리튬(메탄올 첨가제와 함께 사용 또는 함께 사용되지 않음) 및 수소화 디이소부틸알루미늄(DIBAL-H)을 사용하여 수행될 수 있다. 하나의 구체예 세트에 있어서, 환원 시약은 보조 용매로서 2-메틸테트라하이드로푸란을 사용하는, 톨루엔 중 DIBAL-H의 25% w/w 용액일 수 있다.
몇몇 구체예에서, 본 발명은 이탈기를 포함하는 화합물(예를 들어 중간체 화합물)의 합성 방법을 제공한다. 이탈기에 관하여는 본원에 기술되어 있다. 몇몇 구체예에서, 이탈기는 할로겐화물, 예를 들어 브롬화물이다.
몇몇 경우에 있어서, 본 발명의 화합물은 이탈기로 용이하게 전환될 수 있는 부(예를 들어 하이드록실)를 포함한다. 예를 들어 본 발명의 화합물은 염화 p-톨루엔설포닐과 반응할 때 토실산염기로 전환되는 하이드록실기를 포함할 수 있다. 다른 구체예에서, 화합물은 이탈기를 생성하는 미츠노부 화학 반응을 통해 포스핀(예를 들어 트리페닐포스핀, TPP) 및 디에틸아조디카복실레이트(DEAD)로 처리될 수 있는 하이드록실기를 포함할 수 있다.
하나의 구체예 세트에 있어서, 본 발명의 방법은, 하이드록실기를 이탈기로 전환하는 단계를 포함한다. 예를 들어 본 발명의 방법은, 하이드록실기를 이탈기, 예를 들어 할로겐화물(예를 들어 브롬화물)로 대체하는 단계를 포함할 수 있다. 몇몇 구체예에서, 하이드록실기로 치환되는 화합물은 할로겐화 시약에 노출된다. 몇몇 경우에 있어서, 할로겐화 시약으로서는 브롬화 시약, 예를 들어 삼브롬화 인, 이브롬화 피리디늄 또는 테트라브롬화 탄소 및 트리페닐포스핀의 조합이 있다. 하나의 구체예 세트에 있어서, 브롬화 시약은 삼브롬화 인이다.
할로겐화 반응은 하나 이상의 용매의 존재 하에 수행될 수 있다. 몇몇 구체예에서, 용매는 유기 용매, 예를 들어 디클로로메탄, 클로로포름, 벤젠 또는 톨루엔이다. 하나의 구체예 세트에 있어서, 사용된 용매는 디클로로메탄이다.
몇몇 경우에 있어서, 할로겐화 반응 혼합물은 일정 기간 동안 0℃ 내지 200℃ 중 임의의 온도로 가열 또는 냉각된다. 몇몇 구체예에서, 용액은 약 20℃ 내지 약 100℃의 온도로 가열된다. 몇몇 경우에 있어서, 용액은 약 20℃, 약 30℃, 약 40℃, 약 50℃ 이상(이 온도들 사이의 온도 포함)으로 가열된다. 몇몇 구체예에서, 할로겐화 반응 혼합물의 온도는 20℃로 유지된다. 반응물은 일정 기간, 예를 들어 10분, 30분, 1시간, 2시간, 3시간, 4시간, 5시간, 10시간 이하, 또는 그 이상 동안 특정 온도로 가열/냉각/유지될 수 있다. 다른 구체예 세트에 있어서, 반응 혼합물의 온도는 30분 동안 20℃로 유지된다. 기타 온도 및 반응 시간이 적용될 수도 있다는 것이 이해되어야 할 것이다.
조영제 전구체의 합성은 기타 반응들, 예를 들어 개환 반응, 환원 반응, 보호/탈보호 반응 등을 포함할 수 있다.
임의의 반응후, 본원에 기술된 화합물(예를 들어 중간체, 생성물)은 하나 이상의 정제 단계를 거칠 수 있다. 정제 및 분리는 당업자에게 공지된 방법, 예를 들어 크로마토그래피와 같은 분리 기술, 또는 당업계에 공지된 다양한 분리 기술의 조합을 통해서 수행될 수 있다. 몇몇 구체예에서, 컬럼 크로마토그래피는 정지상으로서 실리카 또는 알루미늄을, 용리물로서 용매 또는 용매의 혼합물을 사용하여 수행되며, 그 결과, 생성물이 회수된다. 몇몇 경우에 있어서, 용리물은 비극성 용매와 극성 용매의 혼합물을 포함할 수 있다. 예를 들어 용리물은 헵탄 및 아세트산 에틸의 혼합물을 포함할 수 있다.
몇몇 경우에 있어서, 합성 또는 특정 반응은 정제 과정을 수행할 필요 없이 수행될 수 있다. 몇몇 구체예에서, 본 발명의 화합물 또는 중간체는, 생성물을 원하는 순도로 얻을 때까지 반복 수행될 수 있는 방법인 재결정화를 통하여 정제될 수 있다. 하나의 구체예에서, 본 발명의 화합물 또는 중간체는 원하는 수준의 순도를 얻기 위해서 1회 이상, 2회 이상, 3회 이상 또는 4회 이상 재결정화된다. 예를 들어 본 발명의 화합물 또는 중간체는 50%, 80%, 85%, 90%, 95%, 97%, 98%, 98.5% 또는 99.8% 이상의 순도로 얻어질 수 있다. 재결정화는 하나의 용매 또는 여러 용매들의 조합을 사용하여 수행될 수 있다. 몇몇 경우에 있어서, 재결정화는, 고온에서 화합물 또는 중간체를 용매, 예를 들어 헥산 중에 용해시킨 다음, 이 용액을 냉각시켜 침전물을 생성함으로써 진행된다. 임의의 구체예에서, 본 발명의 화합물은 헥산으로부터 재결정화된다.
몇몇 구체예는 개환 반응을 포함할 수 있다. 예를 들어 개환 반응은 고리를 포함하는 화합물을, 임의로는 촉매의 존재 하에서, 친핵체에 노출시킴으로써 수행될 수 있다. 몇몇 구체예에서, 친핵체는 수소화물(예를 들어 H-)일 수 있다. 몇몇 구체예에서, 개환 반응은 금속 함유 촉매, 예를 들어 염화 지르코늄의 존재 하에 수행될 수 있다.
몇몇 구체예에서, 본 발명의 방법은 하기 화학식 V를 포함하는 화합물을 친핵체 또는 라디칼 종과 반응시켜,
[화학식 V]
(상기 식 중,
W는 임의 치환되는 알킬 또는 헤테로알킬이고;
R1은 임의 치환되는 알킬이며;
R2는 수소 또는 할로겐화물임)
하기 화학식 VI을 포함하는 화합물을 생성하는 단계를 포함한다.
[화학식 VI]
몇몇 구체예는 화학식 V를 포함하는 화합물을 친핵체에 노출시키는 단계를 포함한다. 몇몇 구체예에서, 친핵체는 수소화물 이온(예를 들어 H-)이다. 몇몇 경우에 있어서, 화합물을 반응시키는 단계는 화합물을 수소화 디이소부틸알루미늄(DIBAL-H)과 접촉시키는 단계를 포함한다.
개환 반응은 또한 라디칼 반응을 통해 일어날 수도 있다. 예를 들어 화학식 V를 포함하는 화합물은 라디칼 종, 예를 들어 수소 라디칼(예를 들어 에 노출될 수 있으며, 그 결과, 화학식 VI을 포함하는 화합물이 생성된다. 몇몇 구체예에서, 라디칼 종은 촉매, 예를 들어 SmI2에 의해 생성될 수 있다.
몇몇 구체예에 있어서, 화학식 VI을 포함하는 화합물을 합성하는 방법이 제공된다. 예를 들어 에테르화 반응은 하기 화학식 Va 및 화학식 Vb를 포함하는 화합물 사이에서 수행되며,
[화학식 Va]
및
[화학식 Vb]
그 결과, 하기 화학식을 포함하는 생성물이 생성된다.
(상기 식 중,
R1은 임의 치환되는 알킬이고;
R2는 수소 또는 할로겐화물임)
예를 들어 하기 화학식을 포함하는 화합물 사이의 에테르화 반응에 의하면,
하기 화학식을 포함하는 생성물이 생성된다.
이와 같은 에테르화 반응은 본원에 기술된 바와 같이 수행될 수 있으며, 또한 임의로는 상간 이동 촉매의 존재 하에 염기(예를 들어 탄산 세슘, 수산화 나트륨, 수산화 테트라메틸 암모늄)에 노출시키는 단계를 포함할 수 있다. 몇몇 구체예에서, 에테르화 반응은 수산화 나트륨 및 염화 벤질 트리에틸암모늄에 노출시키는 단계를 포함한다. 몇몇 경우에 있어서, 에테르화 반응은 상간 이동 촉매 및 이온성 액체의 존재 하에서 수행된다.
하나의 구체예 세트에 있어서, 미츠노부 조건(예를 들어, PPh3 및 DEAD) 하에서, 하기 화학식 Vc 및 화학식 Vb를 포함하는 화합물 사이의 에테르화 반응에 의하면,
[화학식 Vc]
및
[화학식 Vb]
하기 화학식을 포함하는 생성물이 생성된다.
(상기 식 중, R1은 임의 치환되는 알킬이고; R2는 수소 또는 할로겐화물임)
예를 들어 미츠노부 조건(예를 들어, PPh3 및 DEAD) 하에서, 하기 화학식을 포함하는 화합물 사이의 에테르화 반응에 의하면,
하기 화학식을 포함하는 생성물이 생성된다.
몇몇 구체예는 하기 화학식 VII을 포함하는 화합물의 합성 단계를 추가로 포함할 수 있다.
[화학식 VII]
(상기 식 중, Ra는 수소, 하이드록실, 할로겐화물(예를 들어 염화물), O-알킬, O-헤테로알킬, O-아릴, O-헤테로아릴, S-알킬, S-헤테로알킬, S-아릴, S-헤테로아릴, 알킬, 헤테로알킬, 아릴 또는 헤테로아릴일 수 있으며, 이것들 중 임의의 것들은 임의 치환될 수 있음) 몇몇 경우에 있어서, Ra는 O-알킬, 예를 들어 O-메틸, O-에틸 및 O-프로필 등이다. 몇몇 구체예에서, Ra는 O-메틸이다. 예를 들어 본 발명의 방법은, 산의 존재 하에서, 4-포르밀벤조산 메틸과 에틸렌 글리콜을 반응시켜, 화학식 VII을 포함하는 화합물을 생성하는 단계를 포함할 수 있다. 화학식 VII을 포함하는 화합물은, 예를 들어 이 화합물에 이탈기를 부가하기 위해 추가로 반응할 수 있다. 몇몇 경우에 있어서, 이탈기는 하이드록실기이다. 하나의 구체예 세트에 있어서, Ra는 메틸이고, 카복시기는 환원제, 예를 들어 수소화 리튬 알루미늄, 수소화 나트륨 비스(2-메톡시에톡시)알루미늄 또는 수소화 붕소 리튬으로 처리되어 벤질 알코올로 생성된다.
도 5는 개환 반응을 통하여 알코올(15)을 합성하는 예시적인 구체예를 나타낸다. 제1 단계는, 산의 존재 하에서, 에틸렌 글리콜과의 반응을 통해서, 4-포르밀벤조산 에테르 메틸 또는 4-프로밀벤조산을 상응하는 아세탈로 전환시키는 단계를 포함한다. 몇몇 구체예에서, 4-포르밀벤조산 메틸 및 에틸렌 글리콜은 톨루엔설폰산 및 톨루엔의 존재 하에 반응한다. 용매는 공비 증류법을 통해 환류하에 가열되어, 생성된 물을 제거함으로써 반응을 종결시킬 수 있다. 이후, 생성된 산 또는 에스테르(19)는 수소화 리튬 알루미늄, 수소화 나트륨 비스(2-메톡시에톡시)알루미늄, 수소화 붕소 리튬(예를 들어 에스테르용) 또는 보란(예를 들어 산용)에 의해 벤질 알코올(20)로 환원될 수 있다. 몇몇 경우에 있어서, 수소화 리튬 알루미늄 또는 수소화 나트륨 비스(2-메톡시에톡시)알루미늄이 환원제로서 사용될 수 있다. 이후, 벤질 알코올(20)은 본원에 기술된 바와 같은 에테르화 반응을 통하여 디클로로피리다지논(11)과 반응할 수 있으며, 그 결과, 화합물(21)이 생성된다. 예를 들어 에테르화 반응은, 다양한 상간 이동 촉매 시약, 예를 들어 염화 벤질 트리에틸암모늄(이에 한정되는 것은 아님)의 존재 하에서, 탄산 세슘, 탄산 칼륨 또는 수산화 나트륨을 사용하여 수행될 수 있다. 하나의 구체예 세트에 있어서, 에테르화 반응은 디메틸포름아미드 중 탄산 세슘을 사용하는 것을 포함한다. 다른 구체예 세트에 있어서, 에테르화 반응은 톨루엔 중 1% 내지 10%의 염화 벤질 트리에틸암모늄과 수산화 나트륨을 사용하는 것을 포함한다.
이후, 화합물(21)의 아세탈 고리는 수소화 디이소부틸알루미늄(DIBAL-H)을 사용하여 상응하는 알코올(15)로 개환될 수 있다. 몇몇 경우에 있어서, 개환 반응은 촉매, 예를 들어 금속 함유 촉매(예를 들어 염화 지르코늄) 또는 유기 촉매(예를 들어 9-보라비시클로노난(9-BBN) 이량체)의 존재 하에 수행될 수 있다.
몇몇 경우에 있어서, 개환 반응 성분들은 일정 기간 동안 약 -78℃ 내지 약 200℃ 중 임의의 온도로 가열 또는 냉각된다. 몇몇 구체예에서, 반응 혼합물의 온도는 약 -78℃ 내지 실온 중 임의의 온도로 유지될 수 있다. 몇몇 경우에 있어서, 반응 혼합물의 온도는 약 -60℃, 약 -50℃, 약 -40℃, 약 -30℃, 약 -20℃, 약 -10℃, 약 0℃(이 온도들 사이의 모든 온도 또는 그 이상의 온도도 포함)로 유지될 수 있다. 몇몇 구체예에서, 개환 반응 혼합물의 온도는 -40℃로 유지될 수 있다. 몇몇 구체예에서, 개환 반응 혼합물의 온도는 실온으로 유지될 수 있다. 반응은 특정 기간, 예를 들어 약 10분, 약 30분, 약 1시간, 약 2시간, 약 3시간, 약 4시간, 약 5시간, 약 10시간 또는 이 사이의 임의의 시간 또는 그 이상의 시간 동안 특정 온도로 가열/냉각/유지될 수 있다. 다른 구체예 세트에 있어서, 반응 혼합물의 온도는 약 1시간 동안 약 -40℃의 온도로 유지될 수 있다. 기타 온도 및 반응 시간도 적용될 수 있음이 이해되어야 할 것이다.
화합물(16)은 큐멘 및/또는 아세트산 이소부틸로부터 연속적으로 재결정화함으로써 정제될 수 있다. 예를 들어 실시예 37E를 참조한다.
도 6에 보인 방법을 사용하면, 4-포르밀벤조산 메틸로부터 알코올(15)을 합성할 때의 전체 수율은 10% 이상, 20% 이상, 30% 이상, 40% 이상 또는 50% 이상일 수 있으며, 이 경우, 정제를 위해 크로마토그래피가 실시되지 않거나 실시된다. 몇몇 경우에 있어서, 4-포르밀벤조산 메틸로부터 알코올(15)을 합성할 때의 전체 수율은 약 50%이며, 이 경우, 정제를 위해 크로마토그래피가 실시되지 않는다.
본원에 기술된 조영제 전구체를 합성하는 방법 중 임의의 방법은, 하기 화학식 VIII을 포함하는 화합물을 이탈기를 포함하는 시약에 노출시켜,
[화학식 VIII]
하기 화학식 IX를 포함하는 화합물을 생성하는 단계를 추가로 포함할 수 있다.
[화학식 IX]
(식 중,
W는 임의 치환되는 알킬 또는 헤테로알킬이고;
R1은 임의 치환되는 알킬이며;
R2는 수소 또는 할로겐화물이고;
L은 이탈기임)
몇몇 경우에 있어서, 시약은 설폰산염 함유 종이고, 이탈기는 설폰산염 함유 기(예를 들어 조영제의 설폰산염 함유 전구체)이다.
몇몇 구체예에서, 설폰산염 함유 기는 메실산염, 토실산염 또는 트리플산염이다. 하나의 구체예 세트에 있어서, 설폰산염 함유 기는 토실산염이다. 이탈기의 부가 예에 관하여는 본원에 기술되어 있다.
예를 들어, 하기 화학식을 포함하는 화합물을 이탈기를 포함하는 반응물에 노출시키면,
하기 화학식을 포함하는 생성물이 생성된다.
(상기 식 중, R1, R2 및 L은 본원에 기술된 바와 같음)
하나의 구체예에서, 하기 화학식을 포함하는 화합물을 토실산염기를 포함하는 반응물에 노출시키면,
하기 화학식을 포함하는 생성물이 생성된다.
본원에 기술된 조영제 전구체를 합성하는 몇몇 구체예는, 신규의 화합물(예를 들어 중간체)을 제공한다. 몇몇 구체예에서, 본 발명의 화합물은 하기 구조를 포함한다:
조영제에 관한 예시적인 방법 및 적용
몇몇 구체예에서, 본 발명은, 조영제 1을 포함하는 조성물 또는 제제를 주사, 주입 또는 기타 임의의 공지된 방법을 통해 피험체에 투여하는 단계와, 관심 있는 피험체의 신체 영역을 조영하는 단계를 포함하는, 피험체를 조영하는 방법을 포함하는 조영 방법에 관한 것이다. 본원에 기술된 바와 같이, (2-t-부틸-4-클로로-5-[4-(2-(18F)플루오로에톡시메틸)-벤질옥시]-2H-피리다진-3-1 또는 조영제 1은 하기 화학식을 포함한다.
조영제 1은 전자 전달 연쇄계의 미토콘드리아 복합체 I과 높은 친화도로 결합한다. 조영제 1은 심근에 미토콘드리아가 고밀도로 존재하므로 선택적으로 심장에 흡수되는 양상을 나타낸다. 관심 있는 영역으로서는 심장, 심혈관계, 심혈관, 혈관(예를 들어 동맥, 정맥), 뇌 및 기타 장기를 포함할 수 있으나, 이에 한정되는 것은 아니다. 관심 있는 매개 변수, 예를 들어 혈류, 심벽 운동 등은 본 발명의 방법 및/또는 시스템을 이용하여 조영 및 검출될 수 있다. 본 발명의 몇몇 양태에 있어서, 관류, 예를 들어 심근 관류를 평가하는 방법이 제공된다.
몇몇 구체예에서, 본 발명의 방법은, (a) 조영제 1을 포함하는 조성물을 피험체에 투여하는 단계와, (b) 피험체의 적어도 일부의 이미지를 하나 이상 수집하는 단계를 포함한다. 몇몇 경우에 있어서, 이미지를 수집하는 단계에서는 양전자 방출 단층 촬영(PET)을 사용하여 피험체의 적어도 일부 내 조영제 1의 분포가 가시화된다. 당업자에 의해 이해될 바와 같이, 본 발명의 방법을 이용하는 조영은, 피험체의 전신 조영, 또는 관심 있는 피험체의 특정 신체 영역 또는 조직의 조영을 포함할 수 있다. 예를 들어, 만일 피험체에 심근 허혈이 발병하였거나 발병이 의심되면, 본 발명의 방법을 사용하여 피험체의 심장이 조영될 수 있다. 몇몇 구체예에서, 조영의 대상은 심장에 국한될 수 있거나, 아니면 심장 및 이와 관련된 혈관계를 포함할 수 있다.
본 발명의 몇몇 구체예에서, 질병 또는 병태를 진단하거나 진단을 보조하는 방법, 질병 또는 병태의 치료 효능을 평가하는 방법, 또는 공지되었거나 의심되는 심혈관 질병 또는 병태를 앓고 있는 피험체를 조영하는 방법이 제공된다. 심혈관 질병은 혈관계에 의해 영양을 공급받는 심장 또는 기타 장기나 조직에서 발생하는 임의의 질병일 수 있다. 혈관계는 관상 동맥과, 말초 혈관계와 뇌에 영양을 공급하는 모든 말초 동맥, 그리고 정맥, 소동맥, 세정맥 및 모세혈관을 포함한다. 심혈관 질병의 예로서는 심장의 질병, 예를 들어 관상 동맥 질병, 심근 경색, 심근 허혈, 협심증, 울혈성 심부전, 심근증(선천성 또는 후천성), 부정맥 또는 심장 판막증을 포함한다. 몇몇 구체예에서, 본원에 개시된 방법은 관상 동맥 질병 및/또는 심근 관류를 모니터 및 측정하는데 유용하다. 예를 들어 본원에 기술된 방법은 관상 동맥 질병의 발병 여부 및/또는 심근 경색의 발병 여부를 확인할 수 있다. 심장에 관한 병태로서는, 손상(질병으로부터 기인한 것이 아닌, 부상으로부터 기인한 손상), 예를 들어 외상성 부상, 수술로 인한 부상을 포함할 수 있다. 몇몇 경우에 있어서, 본 발명의 방법은, 심근 허혈, 정지(R) 및/또는 스트레스(S) 심근 혈류량(MBF), 관상 혈류 예비력(CFR), 관상 동맥 질병(CAD), 좌심실 박출 계수(LVEF), 수축 종기 용량(ESV) 및 확장 종기 용량(EDV) 등에 관한 매개 변수 또는 이것들의 존부를 확인하는 단계를 포함할 수 있다.
몇몇 경우에 있어서, 본 발명의 방법이 적용되는 피험체는 심근 허혈 또는 심근 경색을 암시하는 징후 또는 증상을 나타낼 수 있다. 몇몇 경우에 있어서, 본 발명의 방법은, 피험체의 질병 발병 위험이 증가하였음을 암시하는 조기 또는 준질병 병태를 확인하는데 사용될 수 있다. 몇몇 경우에 있어서, 본 발명의 방법은 미래에 심장과 관련된 현상들, 예를 들어 심근 경색 또는 심장사가 피험체에 발생할 위험도를 측정하는데 사용될 수 있다. 본 발명의 조영 방법은 심근 허혈 질환 또는 병태가 발생한 것으로 이미 진단된 피험체, 또는 이와 같은 병태에 관한 병력이나 진단을 받은 경험이 없는 피험체에서 심근 허혈을 확인하는데 사용될 수 있다. 다른 경우에 있어서, 본 발명의 방법은, 심근 허혈 질환 또는 병태에 관한 진단을 제공하거나, 이의 진단을 보조하는 평가 결과를 얻는데 사용될 수 있다. 몇몇 경우에 있어서, 피험체는 심근 허혈 질환 또는 병태에 대한 약물 치료가 이미 진행중인 피험체일 수도 있으며, 다른 경우에 있어서, 피험체는 심근 허혈에 대한 치료가 진행중이지 않은 피험체일 수도 있다. 몇몇 구체예에서, 본 발명의 방법은 질병 또는 병태의 치료 효능을 평가하는데 사용될 수 있다. 예를 들어 심장은, 피험체의 심장에 발병한 병태를 치료하기 전, 치료하는 중 및/또는 치료한 후, 본 발명의 조영제를 사용하여 가시화될 수 있다. 이와 같은 가시화 작업은 질병 또는 병태를 평가하는데 사용될 수 있으며, 피험체의 치료 계획, 예를 들어 치료 방법, 수술 방법 또는 약물을 선택하는 것을 보조하는데 사용될 수 있다.
PET 조영제는 초회 통과 추출 계수(first-pass extraction fraction)가 높을 수 있으며, 넓은 범위에 걸쳐 국소 심근 혈류량을 추적할 수 있다. 이러한 특징으로 말미암아, 관상 혈류 예비력이 약간 감소하는 것을 확인할 수 있으며, 절대 심근 혈류량(MBF)을 정확하게 추정할 수 있다. 본 발명의 PET 조영제는 이와 같은 특징들과 기타 특징들을 제공할 뿐만 아니라, 국소 PET 방사성 약물의 단위 투여형으로서도 사용될 수 있으므로, 현장 사이클로트론 또는 고비용의 Rb-82 생성기를 사용할 필요가 없게 만든다.
본 발명의 몇몇 구체예에서, 조영제 1은 양전자 방출 단층 촬영(PET) 또는 기타 조영 방법, 예를 들어 SPECT 조영법(이에 한정되는 것은 아님)이 수행될 때 조영제로서 사용된다. 본 발명의 몇몇 구체예에서, 조영제 1은 피험체에 투여되어, PET을 이용하여 피험체 내에서 조영된다. 당업자에게 알려질 바와 같이, PET은 일정 기간에 걸쳐 하나의 피험체에 대한 연속 이미지를 얻을 수 있으며, 피험체를 대상으로 측정이 수행될 수 있도록 해주는 비관혈적(non-invasive) 기술이다. 본 발명의 방법에서 사용된 PET 조영은 공지의 시스템, 방법 및/또는 장치를 사용하여 수행될 수 있다. 본 발명의 몇몇 구체예에서, PET 조영은 심장 조영 시스템을 이용하여 수행된다. 심장 조영 시스템은 PET 조영 설비 및 피험체에 조영제 1을 투여하기 전, 투여하는 중 및/또는 투여한 후에, 조영 설비로 인하여 피험체의 신체 일부를 대상으로 PET 조영 방법을 수행할 수 있도록 구성된 제어 유닛을 포함할 수 있다. 몇몇 경우에 있어서, 제어 유닛은 조영 설비가 PET 조영 방법을 수행할 수 있도록 구성되어 있다. 제어 유닛은 컴퓨터 시스템 및/또는 소프트웨어를 포함할 수 있다. 이와 같은 경우에 있어서, 컴퓨터 시스템은 이미지를 수집 및/또는 분석하는데 필요한 방법을 수행하도록 프로그래밍 또는 구성될 수 있다. 뿐만 아니라, 상기 시스템은 기기에 의해 판독 가능하고, 상기 기기에 의해 실행 가능한 지시 세트를 구체화하여 이미지를 수집 및/또는 분석하는데 필요한 방법을 수행할 수 있는 데이터 저장 장치를 포함할 수 있다.
투여될 조영제의 유효 선량과 구체적인 투여 방식은, 본원에 기술된 바와 같으며 또한 당업자들이 용이하게 파악할 수 있을 바와 같이, 연령, 체중 및 조영될 특정 영역, 그리고 사용된 특정 조영제, 고려되는 진단상 용도와, 제제의 형태, 예를 들어 현탁액, 에멀젼, 미소구, 리포좀 등과 같은 인자들에 따라서 다양할 것이다.
몇몇 구체예에서, 조영제는 낮은 선량으로 투여되며, 이 선량은 원하는 진단 효과가 얻어질 때까지 증가될 것이다. 하나의 구체예에서, 전술한 조영제는 정맥 내 주사(일반적으로는 염수 용액 중)를 통해, 체중 70㎏당 약 0.1mCi 내지 약 100mCi(및 이 선량 범위와 그 범위에 속하는 구체적인 선량 간의 모든 조합 및 종속 조합)의 선량으로 투여될 수 있거나, 또는 약 0.5mCi 내지 약 50mCi, 또는 약 0.1mCi 내지 약 30mCi, 또는 약 0.5mCi 내지 약 20mCi의 선량으로 투여될 수 있다. 핵 의학 조영제로서 사용되기 위하여, 정맥 내 주사에 의해 투여되는 조영제의 선량 범위는 약 0.1pmol/㎏ 내지 약 1000pmol/㎏(및 이 선량 범위와 그 범위에 속하는 구체적인 선량 간의 모든 조합 및 종속 조합)일 수 있으며, 몇몇 구체예에서, 조영제의 선량은 150pmol/㎏ 미만일 수 있다.
조영 시스템과 이를 구성하는 구성요소들은 당업자들에게 공지될 것이다. 다수의 조영 시스템과 이를 구성하는 구성요소들(예를 들어 카메라, 이미지 분석용 소프트웨어 등)은 공지되어 있을 뿐만 아니라 시판되고 있는데, 지멘스(Siemens)의 바이오그래프-64 스캐너(Biograph-64 scanner)를 예로 들 수 있다. 이미지 수집시 환자가 움직임으로 인해서 공간의 흔들림 현상과 인공 음영이 생길 수 있기 때문에, 정지 관류 이미지의 이동을 줄이거나 없애는 임의의 기술, 소프트웨어 또는 장비가 본 발명의 방법에 사용될 수 있다. 본 발명의 임의의 구체예에서, 이미지는 리스트모드로 수집될 수 있으며, 또한 정지, 이동 또는 동기 이미지일 수도 있다. 적당한 이미지 수집 기간은 당업자에 의해 결정될 수 있으며, 이 기간은 심장 조영 시스템, 조영제(예를 들어 선량, 조영제 조성, 피사체 매개 변수, 관심 구역)에 따라서 달라질 수 있다. 본원에 사용된 “이미지 수집 기간”또는 “이미지 수집 시기”란, 하나의 연속 이미지를 수집하는 기간일 수 있거나, 또는 하나 이상의 개별적인 별도 이미지가 수집되는 동안의 기간일 수 있다. 그러므로, 이미지 수집 기간은 피험체 신체 영역 하나 이상의 이미지가 하나 이상 수집되는 기간일 수 있다.
본 발명의 몇몇 구체예에서, 본 발명의 조영제를 피험체에 투여한 후의 이미지 수집 기간은 약 30초 내지 약 60분, 약 1분 내지 약 30분, 약 5분 내지 약 20분, 또는 약 1분, 약 3분, 약 5분, 약 6분, 약 7분, 약 8분, 약 9분, 약 10분, 약 15분, 약 20분, 약 30분, 약 45분, 약 60분 또는 그 이상일 수 있다. 예를 들어 휴식/스트레스 조영 프로토콜에 있어서, 이미지 수집 기간은 휴식 분절에 상응하는 기간 1회 이상 및 스트레스 분절에 상응하는 기간 1회 이상으로, 전체 2회 이상 있을 수 있다. 몇몇 구체예에서, 조영은 조영 기간 내내 연속적으로 수행될 수 있거나, 아니면 이미지는 일정 간격을 두고 수집될 수 있다(예를 들어 주기적 조영(periodic imaging) 또는 동기 조영(gated imaging)).
본 발명의 몇몇 양태에 있어서, 동기 이미지 수집 방법은 본 발명의 방법에 의해 제조된 조영제, 예를 들어 조영제 1이 투여된 피험체로부터 이미지를 수집하는데 사용된다. 동기 조영법은 본 발명의 다양한 양태에서 사용될 수 있으며, 예를 들어 피험체의 뛰고 있는 심장의 이미지를 제공할 수 있을 뿐만 아니라, 심장이 얼마나 잘 뛰고 있는지를 기능상 평가하는데 사용될 수도 있다. 동기 조영법은 이미지를 수집하는 기간 동안 일정 간격을 두고 피험체로부터 개별 이미지들을 수집함으로써 수행될 수 있다. 동기 조영법의 비 제한적인 예로서는 이미지 수집 기간이 약 10분일 경우가 있으며, 이 경우 이미지는 이 10분의 기간 동안 일정 간격을 여러 번 두고 수집된다. 상기 기간 동안의 이미지 수집 횟수는 작동자에 의해 설정될 수 있으며, 예를 들어 수집 횟수는 약 1msec, 약 5msec, 약 10msec, 약 20msec, 약 50msec, 약 100msec, 약 125msec, 약 250msec, 또는 그 이상의 시간마다 1회일 수 있다. 현상, 예를 들어 심장 R파(cardiac R wave)에 의해서 촉발될 간격의 길이는 작동자에 의해 설정되며, 이 경우, 상기 간격의 길이는 R파 간격에 대한, R파당 원하는 시간 구간(time bin)의 수에 의해 한정된다. 당업자는 동기 이미지 수집의 개념과 방법에 익숙할 것이며, 조영제로서 조영제 1을 사용하여 동기 이미지를 얻는 공지의 방법을 이용할 수 있다.
동기 조영법에서 이미지를 수집하는 과정은 일정 간격을 두고 촉발될 수 있는데, 예를 들어 이미지 수집 과정은 심장의 EKG를 사용하여 촉발될 수 있다. 비 제한적인 예에서, R파 동기 스캐너는 이미지의 수집을 촉발할 수 있으며, 또한 심장의 R파 하나와 그 다음 R파 사이의 시간의 평균 길이는 저장될 수 있다. 이후, 수집되는 이미지의 수가 측정될 수 있다. 예를 들어 첫 번째 이미지는 125msec에 수집될 수 있고, 두 번째 이미지는 250msec에 수집될 수 있으며, 세 번째 이미지는 375msec에 수집될 수 있으므로, R 간격 중 이미지는 간격 125msec에 수집될 수 있는 것이다. 그 다음 R 간격이 개시될 때, 이미지 수집 조건은 재설정되고, 이후, 이미지 데이터는 R 간격 개시 시간으로부터 125msec 경과시에 “첫 번째”이미지로 수집되고, 그 다음에는 R 간격 개시 시간으로부터 250msec 경과시에 수집된“두 번째”이미지로 수집되는 식으로 진행된다. 그러므로, 각각의 R 간격 내에서 이미지 수집은 일련의 이미지들 중 처음 이미지로 부가되어 일련의 연속 이미지들로 축적되며, 일련의 이미지들은 원하는 횟수만큼 수집되는데, 이 경우, 각각의 R 간격이 시작되는 시점은 0시간(zero time)으로서 재설정된다. 수집된 동기 이미지는 심장의 운동에 관한 이미지를 제공하는데 사용될 수 있으며, 심벽의 두께에 대한 정보를 제공할 수 있고, 또한 심장의 구획들 중 하나 이상이 움직이거나 뛰는지 여부에 대한 정보(예를 들어, 심벽의 운동 결손)도 제공할 수 있다. 동기 조영법을 이용하면, 심장의 관류, 예를 들어 박출 계수를 판단하고, 심벽의 운동 감소, 부재, 기이성 또는 비동기성을 가시화 및 확인하기 위한 데이터가 제공될 수 있다. 동기 조영법을 이용하면, 심근 관류 평가를 개선하고, 심장 기능을 판단하며, 비동기성 심벽 운동을 가시화 및 확인하기 위한 데이터도 제공될 수 있다.
몇몇 경우에 있어서, PET 조영법은 이와 같은 기술이 심근 허혈의 대사 반응을 입증할 수 있는 효능을 통해서 심근의 활력을 평가하는데 사용될 수 있다. PET 조영법을 사용하면 혈행 재건술 이후 개선될 것으로 보이는 심근 부분을 확인할 수 있다. 몇몇 경우에 있어서, PET 조영법은 관상 동맥 질병을 확인하는데 사용될 수 있으며, 트레드밀 운동 스트레스 테스트를 수행할 수 없는 피험체에 대한 대안적인 테스트 방법으로서 활용될 수도 있다. 몇몇 구체예에서, 스트레스 테스트 방법(예를 들어 약리학적 스트레스, 운동 스트레스)은, 조영제 주입 중 심장 기능에 관한 매개 변수 하나 이상을 분석적으로 또는 정량적으로 평가하기 위한, 본 발명의 방법을 사용하는 PET를 수행할 때 실시될 수 있다. 예를 들어 운동 스트레스 또는 약리학적 스트레스를 이용하여 스트레스를 유발하는 제제 및 이와 같은 유발 방법은 당업계에 널리 공지되어 있다. 스트레스는, 확립되어 공지된 제제와 방법을 사용하여 적당히 유발될 수 있다. 다양한 구체예에서, 본 발명의 방법을 이용하여 유용하게 측정되는 기능으로서는 심근 관류 조영, 심실 기능 조영 또는 측정, 그리고 관상 혈류 속도 측정을 포함하나, 이에 한정되는 것은 아니다.
몇몇 경우에 있어서, 피험체의 심장을 조영하는 방법은, 피험체가 휴식기에 있을 때 조영제 1의 제1 선량을 피험체에 투여하는 단계, 심장의 첫 번째 이미지를 하나 이상 수집한 후, 이 피험체에 스트레스(예를 들어 운동 스트레스 또는 약리학적 스트레스)를 가하는 단계, 피험체가 스트레스기 중에 있을 때 피험체에 조영제 1의 제2 선량을 투여하는 단계, 및 심장의 기타 이미지를 하나 이상 수집하는 단계를 포함할 수 있다.
몇몇 구체예에서, 휴식/스트레스 프로토콜에 있어서 운동으로 유발되는 스트레스기 동안 사용될 조영제 1의 선량은, 약리학적으로 유발되는 스트레스기 동안 필요한 선량보다 많으며, 이 경우, 운동 유발 스트레스 선량 대 약리학적으로 유발되는 스트레스 선량의 비는 약 1.2, 약 1.3, 약 1.4, 약 1.5, 약 1.6, 약 1.7, 약 1.8, 약 1.9 이상이다. 약리학적 스트레스에 관한, 휴식/스트레스 조영 방법을 포함하는 본 발명의 몇몇 구체예에 있어서, 약리학적 스트레스기 동안 조영을 위해 투여되는 조영제 1의 선량은, 휴식기에 조영을 위해 투여되는 조영제 1의 선량의 2배 이상이다. 운동 스트레스에 관한, 휴식/스트레스 조영 방법을 포함하는 본 발명의 몇몇 구체예에 있어서, 운동 유발 스트레스기 동안 조영을 위해 투여되는 조영제 1의 선량은, 휴식기에 조영을 위해 투여되는 조영제 1의 선량의 3배 이상이다. 본 발명의 몇몇 구체예에 있어서, 휴식기때 처음 조영한 후 스트레스기일 때 두 번째로 조영함에 있어서, 휴식기때 투여된 조영제 1의 선량은 스트레스기일 때 투여된 조영제 1의 선량보다 적을 것이다.
몇몇 경우에 있어서, 본 발명의 조영 방법은, 본원에 기술된 바와 같이, 하루만에(예를 들어 약 24시간 미만, 약 12시간 미만, 약 6시간 미만, 약 4시간 미만, 약 2시간 미만, 약 1시간 미만에) 끝낼 수 있다. 다른 경우에 있어서, 본 발명의 방법은 더욱 긴 기간 안에(예를 들어 약 24시간, 약 36시간 또는 약 48시간 초과의 기간에 걸쳐서) 끝낼 수 있다.
조영제 1은 임의의 적당한 형태, 예를 들어 약학적으로 허용 가능한 형태로 제공될 수 있다. 몇몇 경우에 있어서, 조영제 1은 약학적으로 허용 가능한 조성물 중에 포함된다. 몇몇 구체예에서, 조영제 1은 에탄올, 아스코르브산 나트륨 및 물을 포함하는 조성물로서 제공된다. 몇몇 경우에 있어서, 본 발명의 조성물은 20중량% 미만의 에탄올, 15중량% 미만의 에탄올, 10중량% 미만의 에탄올, 8중량% 미만의 에탄올, 6중량% 미만의 에탄올, 5중량% 미만의 에탄올, 4중량% 미만의 에탄올, 3중량% 미만의 에탄올, 또는 그 이하 중량%의 에탄올을 포함한다. 몇몇 경우에 있어서, 본 발명의 조성물은 수 중 100㎎/㎖ 미만, 75㎎/㎖ 미만, 60㎎/㎖ 미만, 50㎎/㎖ 미만, 40㎎/㎖ 미만, 30㎎/㎖ 미만, 또는 그 이하의 양의 아스코르브산 나트륨을 포함한다. 비 제한적인 특정 구체예에서, 조영제 1은 수 중 에탄올 4% 미만과 아스코르브산 나트륨 50㎎/㎖ 미만을 포함하는 수중 용액으로서 제공된다.
주사용 조영제 1 조성물은 주사용 시린지 내에 제조될 수 있다. 조영제 1은 (예를 들어 본원에 기술된 방법을 이용하여) 방사성 약물 공급처 및/또는 PET 제작 센터에 의해 제조되어, 건강 관리 전문 기관에 공급되어 투여될 수 있다. 본 발명의 몇몇 양태에 있어서, 조영제 1은, 예를 들어 수 중 50㎎/㎖ 이하의 아스코르브산 나트륨, 4wt% 이하의 에탄올, 그리고 약 1mCi 내지 14mCi의 조영제 1이 담긴 시린지 또는 다른 용기 내에 담겨 제공된다. 조영제 1의 양은 휴식 선량(rest dose) 또는 스트레스 선량(stress dose)이 투여되는지 여부에 따라서 달라질 수 있다. 예를 들어 휴식 선량이 투여될 때 사용되도록 시린지 내에 담겨 제공될 때의 양보다 많은 양의 조영제 1이 스트레스 선량이 투여될 때 사용되도록 시린지 또는 용기 내에 담겨 제공될 수 있다. 조영제 1의 선량은, 실제 사용될 투여 용량을 만들기 위해서 필요하면, (예를 들어 본원에 기술된 바와 같이) 염수로 희석될 수 있다. 예를 들어 만일 조영제 1의 활성 농도가 매우 높아서 피험체에 적당한 선량을 만들 때 0.1㎖만이 필요하면, 용액은, 예를 들어 멸균 염수로 희석될 수 있으므로, 시린지는 투여용 조영제 1 용액을 0.5㎖ 내지 4㎖ 이상 수용한다. 본 발명의 몇몇 구체예에서, 조영제 1의 주사 용량은 0.5㎖ 내지 5㎖, 1㎖ 내지 4㎖, 2㎖ 내지 3㎖, 0.5㎖, 1㎖, 2㎖, 3㎖, 4㎖, 5㎖, 6㎖, 7㎖, 8㎖, 9㎖, 10㎖ 이상이다. 당업자는 조영제 1을 희석하여 투여에 충분한 투여 용량을 만드는 방법을 알 것이다. 본 발명의 몇몇 양태에서, 조영제 1은 용기, 예를 들어 바이알, 병 또는 시린지 내에 담겨 제공되며, 필요에 따라서는, 투여에 적당한 용기, 예를 들어 시린지에 옮겨 담길 수 있다.
흡착성 플런저 팁을 포함하는 시린지는 주사 후 시린지 내에 잔류하는 조영제 1 활성을 원래 시린지에 담겨 있던 경우의 10% 내지 25%로 만들 수 있다. 흡착성 플런저 팁을 포함하지 않는 시린지, 예를 들어 3㎖ 또는 5㎖들이 놈-젝트(NORM-JECT)(메사추세츠, 더들리 소재, 헨케 사스 울프(Henke Sass Wolf)) 또는 기타 흡착성 플런저 팁을 포함하지 않는, 상기와 동급의 시린지가 사용될 수도 있다. 시린지 내 흡착량을 줄이면, 본 발명의 방법을 수행함에 있어서 시린지로부터 이동하여 피험체에 투여되는 조영제 1의 양이 증가할 수 있다. 본 발명의 방법에 사용되는 시린지는 조영제 1을 포함할 수 있으며, 이 시린지는 비 흡착성 시린지 또는 흡착성이 감소한 시린지일 수 있다. 몇몇 구체예에서, 비 흡착성 시린지 또는 흡착성이 감소한 시린지는 조영제 1의 흡착량을 줄이도록 코팅 또는 처리된 시린지이다. 몇몇 구체예에서, 비 흡착성 시린지 또는 흡착성이 감소한 시린지는 흡착성 플런저 팁을 포함하지 않는 시린지이다. 몇몇 구체예에서, 본 발명에 사용된 시린지는 그것이 담고 있는 조영제 1을 20%, 19%, 18%, 17%, 16%, 15%, 14%, 13%, 12%, 11%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1% 또는 0.5% 미만으로 흡착한다. 본 발명의 임의의 양태에서, 조영제 1이 담겨있는 시린지는 플런저에 고무 또는 라텍스 팁을 포함하지 않는다. 몇몇 경우에 있어서, 본 발명의 방법에 사용되는 시린지는, 이 시린지에 담겨 있는 조영제 1을 20%, 19%, 18%, 17%, 16%, 15%, 14%, 13%, 12%, 11%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1% 또는 0.5% 미만으로 흡착하는 플런저를 포함한다. 본 발명의 시린지는 또한 아스코르브산 나트륨, 에탄올 및 물을 포함할 수도 있으며, 본 발명의 임의의 구체예는 수 중 4% 미만의 에탄올과 50㎎/㎖ 미만의 아스코르브산 나트륨을 포함하는 용액 중 조영제 1을 담고 있는 시린지를 포함한다. 본 발명의 시린지는 라텍스, 고무 및/또는 윤활제를 포함하지 않는 시린지일 수 있다. 본 발명의 시린지는 조영제 1을 약 1.5mCi 내지 약 14mCi의 양으로 담을 수 있다. 본 발명의 시린지는 조영제 1을 약 20mCi 이하로 담을 수 있다.
조영제 1을 포함하는 조성물의 성분들은, 피험체에의 투여 형태에 따라서 선택될 수 있다. 본 발명의 조영제를 원하는 조직, 세포, 장기 또는 체액에 효과적으로 전달하는 다양한 투여 형태는 당업자가 알 것이다. 몇몇 구체예에서, 조영제는 당업자에게 공지된 방법을 이용하여 정맥 내 투여된다(예를 들어 정맥 내 볼루스 주사). 본원에 사용된, “피험체에 투여되는” 선량이란, 피험체의 체 내에 도입되는 조영제, 예를 들어 조영제 1의 양을 의미한다. 몇몇 구체예에서, 인자들, 예를 들어 시린지, 튜브, 바늘, 카테터 또는 조영제를 피험체에 투여하는데 사용되는 기타 장비 내에서의 조영제, 예를 들어 조영제 1의 부분 잔류량으로 인하여, 시린지 또는 기타 투여를 위해 제조된 장비 내에서 측정 또는 결정되는 조영제, 예를 들어 조영제 1의 양은 피험체에 투여되는 선량보다 많을 수 있다. 몇몇 구체예에서, 조영제가 주사된 후, 이 피험체에는 이 조영제 1을 투여하는데 사용된 것과 동일한 튜브, 바늘 또는 포트 등을 이용하여 표준 염수가 플러싱 주사(flushing injection)된다. 플러싱은 조영제 1을 투여한 직후, 또는 투여 후 1분, 2분, 3분, 5분 이하, 또는 그 이상이 경과한 후에 수행될 수 있다. 염수 또는 기타 제제의 플러싱 용량은 5㎖, 6㎖, 7㎖, 8㎖, 9㎖, 10㎖, 15㎖, 20㎖ 이하, 또는 그 이상일 수 있다. 당업자에게 이해될 바와 같이, 조영제 1이 시린지 또는 기타 용기를 통해 투여되는 구체예에서, 피험체에 투여되는 조영제 1의 실제량은, 상기 용기 내에 잔류하는 임의의 조영제 1을 기준으로 수정될 수 있다. 예를 들어 용기, 튜브 및 바늘, 또는 용기에서 피험체로 조영제를 운반하는 전달 기구 내에 잔류하는 방사능 양은, 상기 조영제가 피험체에 투여된 후에 측정될 수 있으며, 방사능의 초기량과 투여 후 잔류량 사이의 차이는 피험체에 전달된 양을 예측할 수 있도록 해준다. 몇몇 경우에 있어서, 용기 또는 주사 장치(예를 들어 카테터, 시린지)는 조영제 1을 투여한 후 용액(예를 들어 염수 용액)으로 헹구어질 수 있다.
본 발명의 몇몇 구체예에서, 소정의 기간, 예를 들어 1분기에 걸쳐 피험체에 투여된 조영제 1의 총량은 약 50mCi 이하, 40mCi 이하, 30mCi 이하, 20mCi 이하, 18mCi 이하, 16mCi 이하, 15mCi 이하, 14mCi 이하, 13mCi 이하, 12mCi 이하, 10mCi 이하, 8mCi 이하, 6mCi 이하, 4mCi 이하, 2mCi 이하, 1mCi 이하, 0.5mCi 이하이다. 투여될 총량은 소정의 시간, 즉 1분, 10분, 30분, 1시간, 2시간, 6시간, 12시간, 24시간, 48시간 이하, 또는 그 이상의 시간 이내에 피험체에 투여된 1회 선량 또는 복수 선량을 기준으로 결정될 수 있다.
방사선량 연구를 바탕으로 하였을 때, 피험체에 투여되는, 바람직한 최대 선량은, 당업자에 의해 이해될 바와 같이, 방사선량을 결정 장기에 대해 약 5rem으로 제한하고/제한하거나 약 1rem 이하의 유효 선량(ED)으로 제한하는 조영제 1의 양을 측정하는 것을 기준으로 결정될 수 있다. 특정 구체예에서, 투여된 조영제 1의 바람직한 최대 선량 또는 총 선량은, 30분, 1시간, 2시간, 6시간, 12시간, 24시간, 48시간 이하, 또는 그 이상의 기간에 걸쳐 약 25mCi 이하, 또는 약 14mCi 이하이다. 몇몇 구체예에서, 피험체에 투여된 조영제 1의 최대 선량은 1일 체중 50㎏당 3.5㎍ 미만일 수 있다. 다시 말하면, 본 발명의 몇몇 구체예에서, 피험체에 투여된 조영제 1의 최대 선량은 1일 체중 1㎏당 조영제 1 약 0.07㎍ 미만일 수 있다.
몇몇 구체예에서, 본 발명의 방법은, 피험체가 휴식기에 있을 때 조영제 1의 제1 선량(예를 들어 휴식 선량(rest dose))을 피험체에 투여하는 단계, 제1 PET 조영 방법(예를 들어 PET 휴식 조영 방법)을 수행하는 단계, 그리고 피험체 일부의 적어도 첫 번째 이미지를 수집하는 단계를 포함한다. 몇몇 경우에 있어서, 피험체가 휴식기에 있을 때 조영제, 예를 들어 조영제 1을 투여한 후, 피험체에 스트레스가 가하여질 수 있으며, 스트레스기일 때 조영제, 예를 들어 조영제 1의 제2 선량(예를 들어 스트레스 선량(stress dose))이 피험체에 투여될 수 있고, 또한 피험체를 대상으로 제2 PET 조영 방법(예를 들어 PET 스트레스 조영 방법)이 수행되며, 그 결과 피험체 일부의 기타 이미지 하나 이상이 수집될 수 있다. 상기한 바는 휴식-스트레스 테스트(rest-stress test)라고 칭하여질 수 있는 방법의 일례이다. 첫 번째 PET 조영 방법 종결시와 두 번째 조영제 선량 투여시 사이의 시간을 대기 시간이라 부른다. 몇몇 경우에 있어서, 휴식-스트레스 테스트는 48시간 미만, 36시간 미만, 24시간 미만, 12시간 미만, 6시간 미만, 5시간 미만, 4시간 미만, 3시간 미만, 2시간 미만, 1시간 미만, 30분 미만, 또는 그 이하의 기간 안에 종결될 수 있다.
몇몇 구체예에서, 휴식기에 있는 피험체에 제1 선량(예를 들어 휴식-스트레스 테스트에 있어서 휴식 선량)으로 투여된 조영제 1의 양은 약 1mCi 내지 약 5mCi, 약 2mCi 내지 약 4mCi, 약 2.5mCi 내지 약 3.5mCi, 또는 약 3mCi이다. 조영제 1의 제1 선량을 투여한 후, PET 조영 방법을 수행할 수 있으며, 피험체의 적어도 일부에 관한 첫 번째 이미지 하나 이상이 수집될 수 있다.
몇몇 경우에 있어서, 스트레스기 중 피험체에 투여되는 조영제 1의 양은 휴식기에 있는 피험체에 투여된 조영제 1의 양을 기준으로 할 수 있다. 다시 말해서, 스트레스기 중 투여는 적어도 부분적으로는 투여율(DR)(예를 들어 스트레스-선량 대 휴식-선량의 비율)을 바탕으로 할 수 있다. DR은 당업자들에게 공지될 다수의 인자들에 의존적일 수 있으며, 몇몇 경우에 있어서는 피험체에서 스트레스를 유발하는 방법에 의존적일 수 있다. 몇몇 경우에 있어서, DR은 1 ~ 5, 1 ~ 4, 1 ~ 3, 2 ~ 5, 또는 2 ~ 4이다. 몇몇 경우에 있어서, DR은 1 이상, 1.5 이상, 2 이상, 3 이상, 4 이상 또는 5 이상이다. 몇몇 경우에 있어서, 상기 DR은, 조영제의 제1 선량에 대한 DR보다 2.5 ~ 5.0, 또는 2.5 ~ 4.0, 또는 3.0 ~ 4.0, 또는 3.0 ~ 5.0배 크다. 몇몇 경우에 있어서, 운동 스트레스가 가하여진 피험체가 필요로 하는 DR은 약리학적 스트레스가 가하여진 피험체에 적용되는 DR 및/또는 시간 간격보다 크다. 이는, 부분적으로는 운동함에 따라서 심근의 전체 방사능 흡수량이 낮아지는 것에 기인할 수 있다. 몇몇 경우에 있어서, 대기 시간이 15분, 30분, 1시간, 1.5시간 또는 2시간 이상 등인 구체예에서, 운동 스트레스가 가하여진 피험체에 적용된 DR은 2 ~ 4, 2.5 ~ 3.5, 또는 3.0 이상, 3.5 이상, 4.0 이상, 또는 그 이상이다. 몇몇 경우에 있어서, 대기 시간이 15분, 30분, 1시간, 1.5시간 또는 2시간 이상 등인 구체예에서, 약리학적 스트레스가 가하여진 피험체에 적용된 DR은 1 ~ 3, 또는 1.5 ~ 2.5, 또는 2.0 이상, 2.2 이상, 또는 2.5 이상, 또는 그 이상이다. 특정 구체예에서, 약리학적 스트레스가 가하여진 피험체에 있어서, 대기 시간 15분 이상 또는 30분 이상 동안의 DR은 2.2 이상이고/이상이거나, 운동 스트레스가 가하여진 피험체에 대해서는, 대기 시간 30분 이상 또는 1시간 이상 동안의 DR은 3.0 이상이다.
몇몇 경우에 있어서, 조영제의 선량은 약 2.0mCi 내지 약 3.5mCi, 또는 약 2.4mCi 내지 약 2.9mCi, 또는 약 2.5mCi 내지 약 3.0mCi, 또는 약 2.5mCi 내지 약 3.5mCi이다.
특정 구체예에서, 약리학적 스트레스(예를 들어 아데노신 또는 레가데노손 투여에 의해 유발되는 혈관 확장제 스트레스)에 대해서는, 휴식기 중에는 약 2.9mCi 내지 약 3.4mCi의 선량이 제공되고, 스트레스기 중에는 상기 휴식기 선량의 약 2.0배 내지 약 2.4배에 해당하는 선량이 제공되며, 이 경우 대기 시간은 약 15분 이상 또는 약 30분 이상이다.
몇몇 경우에서, 조영제의 제2 선량은 약 5.7mCi 내지 약 6.2mCi, 또는 약 6.0mCi 내지 약 6.5mCi, 및 약 5.7mCi 내지 약 6.5mCi이다.
다른 구체예에서, 운동 스트레스에 대해서는, 휴식기 중에는 약 1.7mCi 내지 약 2.0mCi의 선량이 제공되고, 스트레스기 중에는 상기 휴식기 선량의 약 3.0배 내지 약 3.6배에 해당하는 선량이 제공되며, 이 경우 대기 시간은 약 30분 이상 또는 약 60분 이상이다. 몇몇 경우에 있어서, 조영제의 제2 선량은 약 8.6mCi 내지 약 9.0mCi, 또는 약 9.0mCi 내지 약 9.5mCi, 또는 약 8.6mCi 내지 약 9.5mCi이다.
몇몇 구체예에서, 약리학적 스트레스에 대해서는, 휴식기 중에는 약 2.4mCi 내지 약 2.9mCi의 선량이 투여되고, 스트레스기 중에는 약 5.7mCi 내지 약 6.2mCi의 선량이 투여되며(예를 들어 DR은 약 2 이상), 이 경우 대기 시간은 약 15분 이상 또는 약 30분 이상이다. 다른 구체예에서, 운동 스트레스에 대해서는, 휴식기 중에는 약 1.7mCi 내지 약 2.0mCi의 선량이 투여되고, 스트레스기 중에는 약 8.6mCi 내지 약 9.0mCi의 선량이 투여되며(예를 들어 DR은 약 3 이상), 이 경우 대기 시간은 30분 이상 또는 60분 이상이다.
특정 구체예에서, 약리학적 스트레스에 대해서는, 휴식기 중에는 약 2.9mCi 내지 약 3.3mCi의 선량이 제공되며, 스트레스기 중에는 이 휴식기 선량의 2.0배 내지 2.4배에 해당하는 선량이 제공되는데, 이 경우 대기 시간은 15분 이상 또는 30분 이상이다. 다른 구체예에서, 운동 스트레스에 대해서는, 휴식기 중에는 약 2.9mCi 내지 약 3.3mCi의 선량이 제공되고, 스트레스기 중에는 이 휴식기 선량의 약 3.0배 약 3.6배에 해당하는 선량이 제공되는데, 이 경우 대기 시간은 30분 이상 또는 60분 이상이다.
또 다른 구체예에서, 약리학적 스트레스에 대해서는, 휴식기 중에는 약 2.5mCi 내지 약 3.0mCi의 선량이 제공되고, 스트레스기 중에는 약 6mCi 내지 약 6.5mCi의 선량이 제공된다. 또 다른 구체예에서, 운동 스트레스에 대해서는, 휴식기 중에는 약 2.5mCi 내지 약 3.0mCi의 선량이 제공되고, 스트레스기 중에는 약 9mCi 내지 약 9.5mCi의 선량이 제공된다.
몇몇 구체예에서, 스트레스기 중 투여는 휴식기 조영을 마친 후 일정 기간(예를 들어 대기 시간) 이내에 제2 선량의 투여를 개시하는 것을 포함한다. 몇몇 경우에 있어서, 휴식기 조영 방법을 종결한 이후, 5분, 10분, 15분, 20분, 30분, 40분, 45분, 50분, 60분, 70분, 80분, 90분, 2시간, 4시간, 6시간, 12시간, 24시간 이상의 기간 경과시에 제2 선량이 투여될 수 있다. 몇몇 경우에 있어서, 휴식기 조영 방법을 종결한 이후, 5분 내지 30일, 5분 내지 20일, 5분 내지 10일, 5분 내지 5일, 5분 내지 4일, 5분 내지 3일, 5분 내지 48시간, 5분 내지 24시간, 5분 내지 12시간, 5분 내지 2시간, 5분 내지 90분, 10분 내지 60분의 기간 경과시에 제2 선량이 투여된다.
본 발명의 방법에서 스트레스 테스트를 함에 있어서, 당업자에게 공지된 방법을 사용하여 피험체에 스트레스를 가할 수 있다. 몇몇 경우에 있어서, 방법, 예를 들어 운동 스트레스 및/또는 약리학적 스트레스를 가하는 방법을 통해서, 피험체에 스트레스를 가할 수 있다. 약리학적 스트레스는, 피험체에 약리학적 제제, 예를 들어 혈관 확장제를 투여함으로써 유발될 수 있다. 유용한 약리학적 스트레스 제제의 예로서는 아데노신, 도부타민, 디피리다몰, 레가데노손, 비노데네손, 아파데네손 및 기타 아데노신 A2a 수용체 작동제를 포함하나, 이에 한정되는 것은 아니다. 약리학적 스트레스 유발제, 예를 들어 혈관 확장제의 선량 및 투여 방법은 당업계에 널리 공지되어 있으며, 이와 같은 선량 및 투여 방법은 본 발명의 방법 및 시스템과 함께 사용할 수 있도록 결정될 수 있다. 운동 스트레스는 트레드밀, 자전거 타기, 핸드 크랭크, 또는 운동 강도를 높여 피험체의 심박수를 증가시키는데 적당한 기타 장비를 사용하여 유발될 수 있다.
본 발명의 몇몇 구체예에서, 휴식/스트레스 방법(rest/stress method)이 후속 수행된다. 휴식/스트레스 방법에 있어서, 휴식 및 조영 기간 이후에는 스트레스 및 조영 기간이 따르며, 이 경우, 휴식기가 먼저 오고 그 다음에 스트레스기가 따른다. 본 발명의 임의의 구체예에서, 스트레스/휴식 방법(stress/rest method)이 사용될 수 있다. 스트레스/휴식 방법에 있어서, 스트레스 및 조영 기간 이후에는 휴식 및 조영 기간이 따르며, 이 경우, 스트레스기가 먼저 오고 그 다음에 휴식기가 따른다. 본 발명의 몇몇 양태에 있어서, 조영제 1은 “스트레스만 가하는” 방법(stress only method)에 사용될 수 있으며, 여기서, 스트레스는 조영제 1을 사용하여 조영할 때 피험체에서 유도되며, 이 분기 동안에는 휴식기 조영이 진행하지 않는다. 본 발명의 몇몇 구체예에서, 조영제 1은 “휴식기만 부여하는” 방법(rest only method)에 사용될 수 있으며, 여기서, 피험체를 대상으로는 스트레스를 유발시키지 않지만, 이 분기에는 휴식기에 조영제 1을 사용하여 피험체를 조영하기만 한다.
예시적인 카세트 및 반응 시스템
몇몇 구체예에서, 시스템, 방법, 키트 및 카세트는 조영제(예를 들어 조영제 1)의 합성용으로서 제공된다. 몇몇 구체예에서, 조영제는 1회용 또는 1회 사용 카세트를 포함하는 자동화 반응 시스템을 사용하여 제조될 수 있다. 이 카세트는 모든 비 방사성 시약, 용매, 튜브, 밸브, 반응 용기 및 조영제의 소정 회분을 제조하는데 필요한 기타 장치 및/또는 구성요소들을 포함할 수 있다. 카세트는, 간단히 카세트를 바꿔줌으로써 반응 시스템이 가변성을 가지도록 만들어, 상호 오염의 위험이 최소인, 상이한 조영제들을 여러 가지 만들 수 있다. “카세트”란 용어는, 자동화 반응 시스템 상에서 탈착 가능하도록, 그리고 호환적으로 끼워 맞추어져서, 자동화 반응 시스템의 이동부가 기계적으로 움직임에 따라서 카세트의 외부로부터(즉 외부적으로) 카세트의 작동을 제어하도록 디자인된 장치의 일부분을 의미한다. 임의의 구체예에서, 다양한 시약, 카트리지, 시린지 및/또는 바이알이 격막으로 밀봉된 바이알의 바늘 구멍 또는 기밀의 결합 이음부에 의해 부착될 수 있는 경우, 카세트는 각각 포트와 연결되어 있는 밸브들의 선형 배열을 포함한다. 각각의 밸브는 자동화 합성 장치의 이동식 암(moving arm)에 상응하여 맞닿아 있는 암수 이음부를 가질 수 있다. 암이 외부에서 회전하면, 카세트가 자동화 반응 시스템에 결합할 때 밸브의 개방 및 폐쇄가 제어될 수 있다. 자동화 반응 시스템의 추가 이동부는, 시린지 플런저 팁 상부를 찝어서 시린지 몸통을 들어 올리거나 끌어 내리도록 디자인된다. 자동화 반응 시스템은 제어 장치 및 이 제어 장치와 전기적으로 소통하는 하나 이상의 제어 가능 밸브를 추가로 포함할 수 있다. 자동화 반응 시스템은 또한 추가의 용기, 밸브, 센서, 가열 장치, 가압 부품 등을 이 제어 장치와 전기적으로 소통하도록 포함할 수도 있다. 자동화 반응 시스템은 밸브의 개방 및 폐쇄, 가열, 냉각, 압력 수준, 유체 이동 및 유속 등을 제어하는데 적당한 소프트웨어를 사용하는 제어 장치에 의해 작동될 수 있다. 자동화 반응 시스템은 임의로 컴퓨터 운영 시스템, 소프트웨어, 제어부 또는 기타 구성요소 등을 포함할 수도 있다. 뿐만 아니라, 자동화 반응 시스템은 카세트 탑재물을 포함할 수 있다.
자동화 반응 시스템(예를 들어 친핵 반응 시스템)의 예로서는, PET 제조 시설에서 일반적으로 사용되고 있는, 엑스플로라 GN 또는 RN 합성 시스템(지멘스 메디칼 솔루션스 USA 인코포레이선), GE-트레이서랩-MX 합성 시스템(GE 헬스케어), 엑커트 & 지글러 모듈라-랩 합성 시스템 등을 포함하나, 이에 한정되는 것은 아니다.
도 6에 개략적으로 도시한 바와 같이, 자동화 반응 시스템은 다수의 단계들, 예를 들어 18F 플루오르화물 종을 제조하는 단계, 임의로는 용액의 형태를 가지는 조영제 전구체(예를 들어 본원에 기술된 바와 같이, 아세토니트릴 중 조영제 1)를 제공하는 단계, 임의로는 합성 모듈 중 방사능 표지화 반응(예를 들어 조영제를 생성하기 위한 18F 종과 조영제 전구체의 반응)을 수행하는 단계, (예를 들어 분석용 HPLC에 의한) 정제 단계, (예를 들어 셉팩에 의한) 용매 교환 단계, 무균 여과 단계 및 용기에의 배출 단계(이에 한정되는 것은 아님)를 수행할 수 있다. 예를 들어 실시예 9, 10 및 11을 참조한다.
몇몇 구체예에서, 자동화 반응 시스템은 정제 모듈 및/또는 제제화 모듈과 유체를 통해 연결된 반응 모듈을 포함하는 카세트를 이용할 수 있다. 도 7과 도 8은 반응 모듈, 정제 모듈 및/또는 제제화 모듈을 포함하는, 조영제를 합성하기 위한 예시적인 반응 시스템과 연결되어 있는 카세트를 개략적으로 도시한 도면을 나타낸다.
예를 들어 반응 모듈은 조영제 전구체를 조영제로 전환시키는 반응 챔버를 포함할 수 있다. 반응 모듈은 플루오르화물 종 공급원(예를 들어 18F), 조영제 전구체 공급원, 첨가제(예를 들어 염 첨가제) 공급원 및 기타 부가 성분들, 예를 들어 용매의 공급원을 포함할 수 있는데, 이것들은 각각 임의로 반응 챔버에 유체를 통해 결합될 수도 있다. 반응 모듈은 또한 반응 챔버에 플루오르화물 종을 도입하기 전, 이 플루오르화물 종을 정제하기 위한 음이온 교환 컬럼을 포함할 수도 있다.
반응시, 이 반응의 결과로 생성된 조영제 생성물은 반응 모듈로부터 정제 모듈로 운반되어, 추가로 가공, 처리 및/또는 정제된다. 정제 모듈은, 예를 들어 용리물로서 사용될 용매 공급원 하나 이상과 유체에 의해 연결된 컬럼(예를 들어 HPLC 컬럼)을 포함할 수 있다. 정제 모듈은, (예를 들어 HPLC에 의한) 정제시 조영제에 첨가될 수 있는 안정화제(예를 들어 아스코르브산 또는 이의 염) 공급원을 추가로 포함할 수 있다. 이후, 정제된 조영제는 제제화 모듈에 운반되는데, 이 경우, 정제 및 제제화가 추가로 수행될 수 있다. 제제화 모듈은 무균 여과용 필터 및/또는 용매 교환용 C18 컬럼을 포함할 수 있다.
다른 구체예에서, 카세트는 반응 모듈과 제제화 모듈을 포함한다. 본 발명의 반응 모듈은 18F 공급원, 미반응 [18O]H2O를 제거하기 위한 필터, 암모늄 염 공급원, 18F의 희석제 공급원, 조영제 전구체(예를 들어 도 1에 보인 조영제 전구체 1, 또는 기타 조영제 전구체) 공급원, 조영제 전구체용 H2O 희석제 공급원, 18F 및 조영제 전구체 반응을 위한 반응 용기, 반응 용기와 유체를 통해 소통하는 고상 추출 컬럼(예를 들어 C18 컬럼 또는 기타 적당한 컬럼)을 포함할 수 있다. 고상 추출 컬럼은 흡착제에 방사능 표지화된 조영제 생성물을 흡착시키는 고체 흡착제를 포함한다. 잔류하는 반응 불순물 중 적어도 일부는 이 흡착제에 흡착되지 않고 고상 추출 컬럼을 통과한다. 반응 모듈은 또한, 흡착제에 잔류하는 불순물을 용리하기 위해 세정 용액을 제공하는 세정 용액 공급원도 포함하며, 이 세정 용액 공급원은 고상 추출 컬럼과 유체를 통해 소통하며, 이 반응 모듈은 흡착제로부터 방사능 표지된 조영제 생성물을 탈착시켜 용리하기 위한 용리물(예를 들어 H2O/MeCN, 또는 기타 적당한 용리물) 공급원을 포함하며, 이 용리물 공급원은 고상 추출 컬럼과 유체를 통해 소통한다. 반응 모듈은 또한 용리된 방사능 표지화 조영제의 희석제 공급원도 포함할 수 있다.
본 발명의 장치의 제제화 모듈은 반응 모듈과 유체를 통해 소통될 수 있으며, 또한 희석된 방사능 표지화 조영제를 흡착하는 고체 흡착제(예를 들어 C18 또는 기타 적당한 흡착제), 흡착제에 잔류하는 임의의 불순물을 세정하여 제거하는 세정 용액을 제공하기 위한 것으로서, 고상 추출 카트리지와 유체를 통해 소통하는, (예를 들어 아스코르브산, 이의 염 또는 기타 적당한 세정 용액을 포함하는) 세정 용액 공급원, 그리고 흡착제로부터 방사능 표지화 조영제 생성물을 탈착시켜 용리하기 위한 것으로서, 고상 추출 카트리지와 유체를 통해 소통하는, 용리 유체(예를 들어 에탄올 또는 기타 적당한 용리 유체) 공급원을 포함할 수 있다. 제제화 모듈은 또한 용리된 방사능 표지화 조영제를 희석하기 위한 (예를 들어 아스코르브산, 이의 염 또는 기타 적당한 희석제를 포함하는) 희석제 공급원을 포함할 수도 있다. 제제화 모듈은 또한 멸균 필터 (예를 들어 밀리포어 밀렉스 GV PVDF 멸균 필터 또는 기타 적당한 멸균 필터)와 유체를 통해 소통할 수도 있다.
특정 구체예에서, 자동화 합성 모듈, 예를 들어 GE 트레이서랩 MX 합성 모듈과 함께 사용될 카세트가 제공된다. 하나의 구체예에서, 카세트는, 자동화 합성 모듈(예를 들어 GE 트레이서랩 MX 합성 모듈)과 함께 사용되도록 특별히 디자인된, 주조 스톱콕 매니폴드의 1회용 멸균 조립체를 포함한다. 각각의 매니폴드는 선형 또는 비 선형 형태로 연결되며, 그 결과, 조영제(예를 들어 조영제 1) 주사액 제조에 사용되는 시약의 흐름도(flow path)를 나타내는 지향성 어레이(directional array)로 제조된다. 몇몇 구체예에서, 카세트 본체는 다수의 매니폴드 위치(예를 들어 스톱콕)를 포함하는 하나 이상의 매니폴드를 포함한다. 예를 들어, 본체는 1개 이상, 2개 이상, 3개 이상, 4개 이상의 매니폴드를 포함할 수 있다. 카세트는 1개 내지 20개의 매니폴드 위치, 1개 내지 15개의 매니폴드 위치, 5개 내지 20개의 매니폴드 위치, 5개 내지 15개의 매니폴드 위치를 포함할 수 있다. 매니폴드는 각각 대칭형일 수 있거나 그렇지 않을 수도 있다. 하나의 구체예에서, 카세트 본체는 3개의 플라스틱 매니폴드를 포함하는데, 이 매니폴드는 각각 5개의 표준 주조 스톱콕과 끼워 맞추어지므로, 결과적으로는 총 15개의 매니폴드 위치를 가진다. 각각의 스톱콕에는 용매, 시약, 시린지 및 기체와 액체를 취급하는데 필요한 튜브 등을 수용하기 위한 루어 피팅(luer fitting)이 장착되어 있다. 스톱콕은 용매 및 시약용으로 적합하며, 펀치 바이알이 거꾸로인 상태로 위치하게 될 때 플라스틱 스파이크와 끼워 맞추어질 수 있는 반면에, 튜브 및 시린지를 특징으로 하는 것은 기능에 따라서 수-루어 연결부(male luer connection)와 끼워 맞추어진다. 몇몇 구체예에서, 카세트는 가스 유입구, 음이온 교환 카트리지, C18 카트리지, 시린지, 용매 저장기, 반응 용기, HPLC 시스템, 수집 용기, 아스코르브산 또는 이의 염 용액 저장기 및 배기 가수 유출구로 이루어진 군으로부터 선택되는 구성요소들 중 하나 이상과 연결된 다수의 스톱콕 매니폴드의 선형 배열을 포함한다. 몇몇 경우에 있어서, 카세트는 튜브를 추가로 포함한다. 몇몇 경우에 있어서, 카세트는 조영제 합성 모듈을 추가로 포함하며, 본 발명의 장치는 이 카세트와 유체를 통해 연결된다. 몇몇 경우에 있어서, 본 발명의 장치는 본원에 기술된 바와 같이 조영제를 합성하는 방법(예를 들어 조영제 1을 합성하는 방법)을 수행할 수 있다.
조영제 1 주사액을 제조하는데 필요한 카세트 배열은 도 8에 도시되어 있다. 이하, 15개의 매니폴드 위치 각각에 대한 부착부에 관하여 기술하고자 한다: 1) 루어 연결부(2) - 기체 유입 및 [18O]H2O 회수; 2) 음이온 교환 카트리지 - QMA 라이트(QMA Light); 3) 스파이크 연결부 - MeCN; 4) 시린지 - 비어 있음; 5) 스파이크 연결부 - 조영제 전구체 1; 6) 루어 연결부 - 반응 용기; 7) HPLC 유입구; 8) 스파이크 연결부 - 아스코르브산; 9) 루어 연결부 - 수집 용기; 10) 시린지 - EtOH; 11) 루어 연결부 - 최종 생성물 바이알; 12) 스파이크 연결부 - SWFI; 13) 스파이크 연결부 - 아스코르브산; 14) 시린지 - 비어 있음; 15) 루어 연결부(2) - 반응 용기 및 배출구. 매니폴드 1(스톱콕 1 ~ 5)은, 짧은 길이의 실리콘 튜브와 끼워 맞추어지는 수-루어 연결부 2개를 통해 매니폴드 2(스톱콕 6 ~ 10)와 연결된다. 매니폴드 2는 C18 셉-팩? 및 적당한 루어 어댑터를 통해 매니폴드 3(스톱콕 11 ~ 15)과 연결된다. 각각의 매니폴드 연결부, 루어 피팅 및 모든 실리콘 튜브는 상업적 공급처로부터 용이하게 구입 가능하다.
몇몇 구체예에서, 본 발명은 하기 화학식을 포함하는 조영제를 제조하기 위한 카세트를 제공하며,
이 카세트는, (i) 하기 화학식을 포함하는 조영제 전구체를 담고 있는 용기, 및
(ii) 18F 공급원을 첨가하기 위한 도관을 포함한다.
약학 조성물
일단 조영제 또는 조영제 전구체가 제조되거나 생성되면, 이것은 하나 이상의 약학적으로 허용 가능한 부형제와 혼합되어, 사람을 포함하는 피험체에 투여하기 적당한 약학 조성물로 생성될 수 있다. 당업자에게 이해되는 바와 같이, 부형제는, 예를 들어 이하에 기술된 바와 같은 투여 경로, 전달될 제제, 제제의 전달 시간 및/또는 피험체의 건강/몸 상태를 바탕으로 선택될 수 있다.
본 발명의 약학 조성물 및 본 발명에 따라서 사용되는 조성물은 약학적으로 허용 가능한 부형제 또는 담체를 포함할 수 있다. 본원에 사용된 “약학적으로 허용 가능한 부형제” 또는 “약학적으로 허용 가능한 담체”란 용어는, 임의의 형태의 물질 또는 제제화 보조제를 내포하는 무독성, 비활성 고체, 반고체 또는 액체 충전물, 희석제를 의미한다. 약학적으로 허용 가능한 담체로서 사용될 수 있는 물질의 몇 가지 예로서는 당, 예를 들어 락토스, 글루코스 및 수크로스; 전분, 예를 들어 옥수수 전분 및 감자 전분; 셀룰로스 및 이의 유도체, 예를 들어 소듐 카복시메틸 셀룰로스, 에틸 셀룰로스 및 아세트산 셀룰로스; 분말형 트래거칸트; 맥아; 젤라틴; 활석; 부형제, 예를 들어 코코아 버터 및 좌제 왁스; 오일, 예를 들어 땅콩 오일, 목화씨 오일; 홍화 오일; 참기름; 올리브 오일; 옥수수 오일 및 대두 오일; 글리콜, 예를 들어 프로필렌 글리콜; 에스테르, 예를 들어 올레산 에틸 및 라우린산 에틸; 아가; 세제, 예를 들어 트윈(Tween) 80; 완충제, 예를 들어 수산화 마그네슘 및 수산화 알루미늄; 알긴산; 무 발열원 수; 등장성 염수; 링거 용액; 에틸 알코올; 및 인산염 완충 용액, 그리고 기타 혼화 가능한 무독성 윤활제, 예를 들어 황산 소듐 라우릴 및 스테아르산 마그네슘과, 발색제, 이형제, 코팅제, 감미제, 풍미제 및 향장제, 보존제 및 항산화제가 있으며, 이러한 물질들은 또한 제조자의 판단에 따라서 본 발명의 조성물에 혼합될 수 있다.
본 발명의 약학 조성물은 비 경구 경로, 비강 내 경로, 복강 내 경로 또는 비강 스프레이를 통해 사람 및/또는 동물에게 투여될 수 있다. 투여 방식은 의도로 하는 용도에 따라서 다양할 수 있는 것으로 당업계에 널리 알려져 있다. 대안적으로, 본 발명의 제제는 비 경구적으로(정맥 내, 근육 내 또는 피하) 주사 투여될 수 있다. 이러한 제제는 통상의 수단에 의해 제조될 수 있으며, 원한다면, 본 발명의 조성물은 임의의 통상적인 첨가제와 혼합될 수 있다.
주사 가능한 제제, 예를 들어 멸균 주사 수성 현탁액 또는 유질 현탁액이, 적당한 분산제 또는 습윤제 및 현탁제를 사용하여 당업계에 알려진 바와 같이 제제화될 수 있다. 주사용 멸균 제제는 또한, 무독성의 비 경구적으로 허용 가능한 희석제 또는 용매 중 주사용 멸균 용액, 현탁액 또는 에멀젼(예를 들어 1,3-부탄디올 중 용액)일 수도 있다. 사용될 수 있는 허용 가능 비이클 및 용매로서는 물, 링거 용액, U.S.P. 및 등장성 염화 나트륨 용액이 있다. 뿐만 아니라, 멸균의 불휘발성 오일은 통상적으로 용매 또는 현탁 매질로서 사용된다. 이러한 목적으로, 임의의 완하성 지방유, 예를 들어 합성 모노글리세라이드 또는 디글리세라이드가 사용될 수 있다. 뿐만 아니라, 주사액 제조시에는 지방산, 예를 들어 올레산이 사용된다.
주사용 제제는, 예를 들어 박테리아 보류 필터(bacteria retaining filter)를 통한 여과에 의하거나, 또는 사용전 멸균수 또는 기타 주사용 멸균 매질 중에 용해 또는 분산될 수 있는 멸균 고체 조성물의 형태인 멸균제를 혼입함으로써 멸균될 수 있다.
예시적인
키트
몇몇 구체예에서, 조영제(예를 들어 조영제 1)를 제조하기 위한 시스템, 방법, 키트 및 카세트 키트가, 심근 관류를 검출, 조영 및/또는 모니터하기 위해 제공된다. 몇몇 구체예에서, 조영제(예를 들어 조영제 1)를 투여하기 위한 키트가 제공된다. 본 발명의 키트는, 예를 들어 조영제 또는 조영제 전구체를 포함하는 용기와 이의 사용 지침을 포함할 수 있다. 키트는 소정량의 조영제(예를 들어 조영제 1)와, 임의로는 기타 성분들을 포함하는 멸균의 무발열원성 제제를 포함할 수 있다. 본 발명의 몇몇 양태에 있어서, 키트는 피험체에 투여하기 위해 제조될 조영제(예를 들어 조영제 1)를 함유하는 시린지를 하나 이상 포함할 수 있다. (예를 들어 피험체에 조영제(예를 들어 조영제 1)를 전달 및/또는 투여하기 위하여) 조영제(예를 들어 조영제 1)와 함께 사용될 수 있는 용기는, 시린지, 병, 바이알, 튜브 등일 수 있다. 본 발명의 키트에 포함될 수 있는 예시적인 시린지로서는, 흡착성 플런저 팁을 포함하지 않는 시린지, 예를 들어 3㎖ 또는 5㎖들이 놈-젝트(NORM-JECT)(메사추세츠, 더들리 소재, 헨케 사스 울프(Henke Sass Wolf)) 또는 기타 흡착성 플런저 팁을 포함하지 않는, 상기와 동급의 시린지가 있다. 조영제(예를 들어 조영제 1)는 키트 내에 담긴 채로 제공될 수 있으며, 추가의 제조 방법은, 조영제를 사용하기 전에 임의로 조영제를 사용 가능한 농도로 희석하는 단계를 포함할 수 있다. 본 발명의 키트 내에 포함된 지침은 방법, 예를 들어 본 발명의 조영제를 희석하는 방법, 본 발명의 조영제를 피험체에 투여하여 진단학상으로 조영하는 방법과 관련될 수 있거나, 또는 기타 사용에 대한 지침과 관련될 수 있다.
몇몇 경우에 있어서, 키트는 또한 피험체(예를 들어 사람)에 투여할 조영제(예를 들어 조영제 1) 조성물 제조용 희석제가 담긴 바이알 하나 이상을 포함할 수도 있다. 희석제 바이알에는 조영제(예를 들어 조영제 1) 희석용인 희석제, 예를 들어 생리학적 염수, 물, 완충 용액 등이 담겨 있을 수 있다. 예를 들어 조영제(예를 들어 조영제 1)는 주사 대비 제제 중에 포함되어 키트 내에 포장될 수 있거나, 또는 몇몇 재구성 또는 희석 단계를 거쳐 주사용 또는 주입용 최종 조성물/제제로 제조될 수 있다.
본 발명의 키트 중에 포함된 지침은, 또한 피험체에 조영제(예를 들어 조영제 1)를 투여하기 위한 지침을 포함할 수도 있으며, 또한 선량, 투여 시간, 스트레스 유발 등에 관한 정보를 포함할 수도 있다. 예를 들어 키트는, 제제의 의도된 용도와 적당한 투여 방법에 관해 기술하는 지침과 함께, 본원에 기술된 조영제를 포함할 수 있다. 본원에 사용된 “지침”이란, 지침 및/또는 판촉 구성 요소를 정의할 수 있으며, 통상적으로는 본 발명의 포장물 위에 기재되었거나 이 포장물과 결합된 지침을 포함한다. 지침은 또한, 지침이 키트와 관련되어 있다는 것을 사용자가 명백히 파악할 수 있는 임의의 형태, 예를 들어 시청각(예를 들어 비디오테잎, DVD 등), 인터넷 및/또는 웹 기반 커뮤니케이션 등의 형태로서 제공되는 임의의 입말 지침(oral instruction) 또는 전자 지침(electronic instruction)을 포함할 수도 있다. 기재된 지침은, 약품 또는 생물학적 제품의 제조, 사용 또는 판매를 규제하는 정부 기관에 의해 규정된 형태를 취할 수 있는데, 이 지침은 또한 제조, 사용 또는 판매를 규제하는 기관에 의한 승인, 즉 사람에게 사용해도 된다는 승인을 반영할 수도 있다. 몇몇 경우에 있어서, 지침은 특정량의 희석제와 특정량의 조영제 농축 용액 또는 조영제 고체 제제를 혼합하는 것에 관한 지침을 포함할 수 있으므로, 최종 주사 또는 주입 제제는, 예를 들어 생성되는 용액의 농도가 피험체에 투여되기 적당한 농도(예를 들어 본원에 기술된 농도)가 되도록 제조된다. 키트는 본 발명의 화합물의 전체 치료 계획(예를 들어 휴식 선량 및 스트레스 선량)을 포함할 수 있다.
본 발명의 키트는 하나 이상의 용기에, 본원에 기술된 성분들 중 임의의 것 하나 이상을 담을 수 있다. 예를 들어 하나의 구체예에서, 키트는 키트 중에 포함된 하나 이상의 성분들을 혼합하는 것 및/또는 샘플을 분리 및 혼합하는 것, 그리고 피험체에 투여하는 것에 대한 지침을 포함할 수 있다. 본 발명의 키트는 본원에 기술된 제제를 수용하는 용기를 포함할 수 있다. 본 발명의 제제는 액체, 겔 또는 고체(분말)의 형태를 가질 수 있다. 본 발명의 제제는 멸균 조건 하에서 제조되어, 시린지 내에 포장된 후 냉장 배송될 수 있다. 대안적으로, 본 발명의 제제는 바이알 또는 기타 보관용 용기 내에 수용될 수 있다. 제2의 용기는 멸균 조건 하에서 제조된 기타 제제들을 담을 수 있다. 대안적으로, 본 발명의 키트는 시린지, 바이알, 튜브 또는 기타 용기 내에서 예비 혼합되어 배송된 활성 제제를 포함할 수 있다. 본 발명의 키트는 환자에게 제제를 투여하는데 필요한 구성요소들, 예를 들어 시린지, 국소 투여 장치 또는 iv 주사 튜브 및 백 중 하나 이상 또는 전부를 포함할 수 있다.
본 발명의 키트 내 성분들을 담는 용기들이 병, 바이알(예를 들어, 격막 포함 바이알), 앰플 또는 주입 백 등이건 간에, 이 용기들은 부가의 지표, 예를 들어 제제가 고압 멸균되거나 멸균 처리되었을 때 변색되는 통상의 마킹을 포함할 수 있음을 또한 이해할 것이다. 본 발명의 키트는 기타 구성요소, 예를 들어 시린지, 라벨, 바이알, 튜브, 카테터, 바늘 및 포트 등을 추가로 포함할 수 있다. 본 발명의 몇몇 양태에 있어서, 키트는 투여에 충분한 조영제(예를 들어 조영제 1)를 담고 있는 하나의 시린지를 포함할 수 있으며, 본 발명의 몇몇 양태에 있어서, 키트는 2개의 별도 시린지들을 포함할 수 있는데, 이 시린지 중 하나는 휴식기 조영시 피험체에 투여될 조영제 1을 담고, 다른 하나는 스트레스기 조영시 피험체에 투여될 조영제 1을 담는다.
본 발명의 조영제와 키트 제조에 유용한 완충제로서는, 예를 들어 인산염, 시트르산염, 설포살리실산염 및 아세트산염 완충제를 포함한다. 더욱 완전한 목록은 미국 약전에서 살펴볼 수 있다. 본 발명의 조영제와 키트를 제조하는데 유용한 동결 건조 보조제로서는, 예를 들어 만니톨, 락토스, 솔비톨, 덱스트란, 피콜(FICOLL)? 중합체 및 폴리비닐피롤리딘(PVP)를 포함한다. 본 발명의 조영제와 키트를 제조하는데 유용한 안정화 보조제로서는, 예를 들어 아스코르브산, 시스테인, 모노티오글리세롤, 중아황산 나트륨, 메타 중아황산 나트륨, 겐티신산 및 이노시톨을 포함한다. 조영제 및 키트를 제조하는데 유용한 가용화 보조제로서는, 예를 들어 에탄올, 글리세린, 폴리에틸렌 글리콜, 프로필렌 글리콜, 모노올레산 폴리옥시에틸렌 솔비탄, 모노올레산 솔비탄, 폴리솔베이트, 폴리(옥시에틸렌)-폴리(옥시프로필렌)-폴리(옥시에틸렌) 블록 공중합체(“플루로닉스(Pluronics)”) 및 레시틴을 포함한다. 임의의 구체예에서, 가용화 보조제로서는 폴리에틸렌 글리콜, 시클로덱스트린 및 플루로닉스가 있다. 본 발명의 조영제와 키트를 제조하는데 유용한 정균제로서는, 예를 들어 벤질 알코올, 염화 벤잘코늄, 클로르부탄올 및 메틸, 프로필 또는 부틸 파라벤을 포함한다.
정의
편의를 위해서, 본 발명의 상세한 설명, 실시예 및 첨부된 특허 청구의 범위에서 사용된 임의의 용어들을 여기에 나열하고자 한다.
특정 작용기 및 화학 용어의 정의는 이하에 더욱 상세히 기술되어 있다. 본 발명을 위해서, 화학 원소들은 원소 주기율표(CAS 버전, 문헌(Handbook of Chemistry and Physics, 75th)의 내부 커버)에 따라서 확인되며, 특정 작용기들은 일반적으로 본원에 기술한 바와 같이 정의된다. 부가적으로, 유기 화학의 일반 원칙과 특정 작용부 및 이의 반응성에 관하여는, 전체 내용이 본원에 참조로 포함되어 있는 문헌[“Organic Chemistry,” Thomas Sorrell, University Science Books, Sausalito: 1999]에 기술되어 있다.
본 발명의 임의의 화합물은 특정 기하학적 형태 또는 입체 이성체의 형태로 존재할 수 있다. 본 발명은 이러한 모든 화합물, 예를 들어 시스- 및 트랜스-이성체, R- 및 S-거울상 이성체, 부분 입체 이성체, (D)-이성체, (L)-이성체, 이것들의 라세미체 혼합물, 그리고 이것들의 기타 혼합물을 고려하며, 이것들은 본 발명의 범위 내에 포함되는 것이다. 부가의 비대칭 탄소 원자는 치환기, 예를 들어 알킬기 내에 존재할 수 있다. 이와 같은 이성체들과 이의 혼합물들은 전부 본 발명에 포함된다.
이성체 비율이 다양한 가운데 이성체들을 임의의 비율로 함유하는 이성체 혼합물이 본 발명에 따라서 사용될 수 있다. 예를 들어 오직 2개의 이성체들만이 포함되는 경우, 이성체 비율이 50:50, 60:40, 70:30, 80:20, 90:10, 95:5, 96:4, 97:3, 98:2, 99:1 또는 100:0인 혼합물들은 모두 본 발명에 의해 고려된다. 당업자들은 유사한 비율이 더욱 복잡한 이성체 혼합물에 대해 고려된다는 것을 용이하게 이해할 것이다.
예를 들어 만일 본 발명의 화합물의 특정 거울상 이성체를 원한다면, 이는 비대칭 합성 또는 키랄 보조제를 사용하는 유도화에 의해 제조될 수 있으며, 이 경우, 결과로 생성되는 부분 입체 이성체 혼합물은 분리되고, 보조기는 절단되어, 원하는 순수 거울상 이성체가 생성된다. 대안적으로, 분자가 염기 작용기, 예를 들어 아미노, 또는 산 작용기, 예를 들어 카복실을 함유하는 경우, 적당한 광학 활성 산 또는 염기를 사용하면 부분 입체 이성체 염이 생성되고, 그 다음, 이와 같이 생성된 부분 입체 이성체는 당업계에 널리 공지된 크로마토그래피 방법 또는 분별 결정화에 의해 분석되며, 이후, 순수한 거울상 이성체가 회수된다.
본원에 사용된 “알킬”이란 용어는 당업계에서 통상적으로 통하는 의미를 가지며, 포화된 지방족 기의 라디칼, 예를 들어 직쇄 알킬기, 분지쇄 알킬기, 시클로알킬(지환)기, 알킬 치환되는 시클로알킬기 및 시클로알킬 치환되는 알킬기를 말한다. 몇몇 경우에 있어서, 알킬기는 저급 알킬기, 즉 1개 내지 10개의 탄소 원자를 가지는 알킬기(예를 들어 메틸, 에틸, 프로필, 부틸, 펜틸, 헥실, 헵틸, 옥틸, 노닐 또는 데실 등)일 수 있다. 몇몇 구체예에서, 직쇄 또는 분지쇄 알킬은 자체의 주쇄 내에 30개 이하의 탄소 원자를 가질 수 있으며, 몇몇 경우에는, 20개 이하의 탄소 원자를 가질 수 있다. 몇몇 구체예에서, 직쇄 또는 분지쇄 알킬은 자체의 주쇄 내에 12개 이하의 탄소 원자를 가질 수 있거나(예를 들어 직쇄의 경우에는 C1-C12, 분지쇄의 경우에는 C3-C12), 6개 이하의 탄소 원자를 가질 수 있거나, 또는 4개 이하의 탄소 원자를 가질 수 있다. 이와 유사하게, 시클로알킬은 자체의 고리 구조 내에 3개 내지 10개의 탄소 원자를 가질 수 있거나, 고리 구조 내에 5개, 6개 또는 7개의 탄소를 가질 수 있다. 알킬기의 예로서는 메틸, 에틸, 프로필, 이소프로필, 시클로프로필, 부틸, 이소부틸, t-부틸, 시클로부틸, 헥실 및 시클로헥실 등을 포함하나, 이에 한정되는 것은 아니다.
“알케닐” 및 “알키닐”이란 용어는 당업계에서 통상적으로 통하는 의미를 가지며, 길이가 유사하고, 전술한 바와 같이 알킬에 일어날 수 있는 치환을 포함하되, 각각 하나 이상의 이중 결합 또는 삼중 결합을 포함하는 불포화 지방족 기를 말한다.
임의의 구체예에서, 본 발명에 사용된 알킬, 알케닐 및 알키닐 기는 1개 내지 20개의 지방족 탄소 원자를 함유한다. 기타 임의의 구체예에서, 본 발명에 사용된 알킬, 알케닐 및 알키닐 기는 1개 내지 10개의 지방족 탄소 원자를 함유한다. 또 다른 구체예에서, 본 발명에 사용된 알킬, 알케닐 및 알키닐 기는 1개 내지 8개의 지방족 탄소 원자를 함유한다. 또 다른 구체예에서, 본 발명에 사용된 알킬, 알케닐 및 알키닐 기는 1개 내지 6개의 지방족 탄소 원자를 함유한다. 또 다른 구체예에서, 본 발명에 사용된 알킬, 알케닐 및 알키닐 기는 1개 내지 4개의 탄소 원자를 함유한다. 그러므로, 예시적인 지방족 기는, 예를 들어 메틸, 에틸, n-프로필, 이소프로필, 알릴, n-부틸, sec-부틸, 이소부틸, t-부틸, n-펜틸, sec-펜틸, 이소펜틸, t-펜틸, n-헥실, sec-헥실 부 등을 포함하나, 이에 한정되는 것은 아니며, 상기 부는 또한 하나 이상의 치환기들을 보유할 수 있다. 알케닐기로서는, 예를 들어 에테닐, 프로페닐, 부테닐 및 1-메틸-2-부텐-1-일 등을 포함하나, 이에 한정되는 것은 아니다. 대표적인 알키닐기로서는 에티닐, 2-프로피닐(프로파길 1) 및 1-프로피닐 등을 포함하나, 이에 한정되는 것은 아니다.
본원에 사용된“시클로알킬”이란 용어는 특히, 3개 내지 10개, 바람직하게는 3개 내지 7개의 탄소 원자를 가지는 기를 말한다. 적당한 시클로알킬로서는 시클로프로필, 시클로부틸, 시클로펜틸, 시클로헥실 및 시클로헵틸 등을 포함하나, 이에 한정되는 것은 아니지만, 이것들은 기타 지방족, 헤테로 지방족 또는 복소환 부의 경우에서와 같이, 지방족; 헤테로 지방족; 아릴; 헤테로아릴; 아릴알킬; 헤테로아릴알킬; 알콕시; 아릴옥시; 헤테로알콕시; 헤테로아릴옥시; 알킬티오; 아릴티오; 헤테로알킬티오; 헤테로아릴티오; -F; -Cl; -Br; -I; -OH; -NO2; -CN; -CF3; -CH2CF3; -CHCl2; -CH2OH; -CH2CH2OH; -CH2NH2; -CH2SO2CH3; -C(O)Rx; -CO2(Rx); -CON(Rx)2; -OC(O)Rx; -OCO2Rx; -OCON(Rx)2; -N(Rx)2; -S(O)2Rx; -NRx(CO)Rx를 포함하는(이에 한정되는 것은 아님) 치환기로 임의 치환될 수 있으며, 여기서, 상기 화학식 중, Rx의 각각의 존재는 독립적으로 지방족, 헤테로지방족, 아릴, 헤테로아릴, 아릴알킬 또는 헤테로아릴알킬을 포함하나, 이에 한정되는 것은 아니고, 본원에서 전술한 지방족, 헤테로지방족, 아릴알킬 또는 헤테로아릴알킬 치환기 중 임의의 것은 치환 또는 비치환, 분지형 또는 비분지형, 시클릭 또는 비시클릭일 수 있으며, 본원에서 전술한 아릴 또는 헤테로아릴 치환기들 중 임의의 것은 치환될 수 있거나 치환되지 않을 수 있다. 일반적으로 대입 가능한 치환기의 추가 예는 본원에 기술된 실시예에 보인 특정 구체예에 의해 예시된다.
“헤테로알킬”이라는 용어는 당업계에서 통상적으로 통하는 의미를 가지며, 하나 이상의 탄소 원자가 이종 원자로 대체되는, 본원에 기술된 알킬기를 말한다. 적당한 이종 원자로서는 산소, 황, 질소 및 인 등을 포함한다. 헤테로알킬기의 예로서는 알콕시, 아미노, 티오에스테르, 폴리(에틸렌 글리콜), 알킬 치환되는 아미노, 테트라하이드로푸라닐, 피페리디닐, 모폴리닐 등을 포함하나, 이에 한정되는 것은 아니다.
“헤테로알케닐” 및 “헤테로알키닐”이라는 용어는 당업계에서 통상적으로 통하는 의미를 가지며, 길이가 유사하고, 전술한 바와 같이 헤테로알킬에 일어날 수 있는 치환을 포함하되, 각각 하나 이상의 이중 결합 또는 삼중 결합을 포함하는 불포화 지방족 기를 말한다.
본 발명의 화합물의 전술한 지방족 (및 기타) 부의 치환기에 관한 몇몇 예로서는 지방족; 헤테로지방족; 아릴; 헤테로아릴; 알킬아릴; 알킬헤테로아릴; 알콕시; 아릴옥시; 헤테로알콕시; 헤테로아릴옥시; 알킬티오; 아릴티오; 헤테로알킬티오; 헤테로아릴티오; F; Cl; Br; I; -OH; -NO2; -CN; -CF3; -CHF2; -CH2F; -CH2CF3; -CHCl2; -CH2OH; -CH2CH2OH; -CH2NH2; -CH2SO2CH3; -C(O)Rx; -CO2(Rx); -CON(Rx)2; -OC(O)Rx; -OCO2Rx; -OCON(Rx)2; -N(Rx)2; -S(O)2Rx; -NRx(CO)Rx를 포함하나, 이에 한정되는 것은 아니며, 여기서, 상기 화학식 중, Rx의 각각의 존재는 독립적으로 지방족, 지환족, 헤테로지방족, 복소환, 아릴, 헤테로아릴, 알킬아릴 또는 알킬헤테로아릴을 포함하나, 이에 한정되는 것은 아니고, 본원에서 전술한 지방족, 헤테로지방족, 알킬아릴 또는 알킬헤테로아릴 치환기 중 임의의 것은 치환 또는 비치환, 분지형 또는 비분지형, 시클릭 또는 비시클릭일 수 있으며, 본원에서 전술한 아릴 또는 헤테로아릴 치환기들 중 임의의 것은 치환될 수 있거나 치환되지 않을 수 있다. 일반적으로 대입 가능한 치환기의 추가 예는 본원에 기술된 실시예에 보인 특정 구체예에 의해 예시된다.
“아릴”이란 용어는 당업계에서 통상적으로 통하는 의미를 가지며, 임의 치환되며, 하나의 고리를 가지는 방향족 탄소환기(예를 들어 페닐), 다수개의 고리를 가지는 방향족 탄소환기(예를 들어 비페닐), 또는 하나 이상의 고리가 방향족 고리인 다수개의 융합 고리들을 가지는 방향족 탄소환기(예를 들어 1,2,3,4-테트라하이드로나프틸, 나프틸, 안트릴 또는 페난트릴)를 말한다. 다시 말해서, 하나 이상의 고리는 공액 파이 전자 시스템을 가지는 반면에, 이웃하는 다른 고리들은 시클로알킬, 시클로알케닐, 시클로알키닐, 아릴 및/또는 헤테로시클릴일 수 있다. 아릴기는 본원에 기술된 바와 같이 임의 치환될 수 있다. 치환기로서는 전술한 치환기들 중 임의의 것, 즉 지방족 부에 관하여 언급된 치환기들, 또는 본원에 개시된 기타 부들에 관하여 언급된 치환기들 중 임의의 것을 포함하나, 이에 한정되는 것은 아니며, 이 치환기들은 안정적인 화합물을 형성한다. 몇몇 경우에 있어서, 아릴기는 바람직하게 3 ~ 14개의 탄소 원자를 가지는 안정적인 모노시클릭 또는 다환 불포화 부이며, 이 부들은 각각 치환될 수 있거나 치환되지 않을 수 있다. “탄소환 아릴기”란, 방향족 고리 상에 존재하는 고리 원자들이 탄소 원자인 아릴기를 말한다. 탄소환 아릴기는 모노시클릭 탄소환 아릴기 및 다환 또는 융합 화합물(예를 들어 인접하는 2개 이상의 고리 원자들이 인접하는 2개의 고리들에 공통으로 존재하는 화합물), 예를 들어 나프틸기를 포함한다.
“헤테로아릴”이란 용어는 당업계에서 통상적으로 통하는 의미를 가지며, 고리 원자로서 하나 이상의 이종 원자를 포함하는 아릴기를 말한다. “헤테로아릴”은 바람직하게는 3개 내지 14개의 탄소 원자들을 가지는 안정적인 헤테로시클릭 또는 폴리헤테로시클릭 불포화 부이며, 이 부는 각각 치환될 수 있거나 치환되지 않을 수 있다. 치환기로서는 상기 언급한 치환기들 중 임의의 것, 즉 지방족 부에 대해 언급된 치환기들, 또는 본원에 개시된 기타 부들에 대해 언급된 치환기들 중 임의의 것을 포함하나, 이에 한정되는 것은 아니며, 이 치환기들은 안정적인 화합물을 형성한다. 몇몇 경우에 있어서, 헤테로아릴은 5개 내지 10개의 고리 원자들을 가지는 시클릭 방향족 라디칼로서, 이 라디칼에 있어서 하나의 고리 원자는 S, O 및 N으로부터 선택되고; 0개, 1개 또는 2개의 고리 원자들은 독립적으로 S, O 및 N으로부터 선택되는 부가의 이종 원자들이며; 나머지 고리 원자들은 탄소이고, 라디칼, 예를 들어 피리딜, 피라지닐, 피리미디닐, 피롤릴, 피라졸릴, 이미다졸릴, 티아졸릴, 옥사졸릴, 이소옥사졸릴, 티아디아졸릴, 옥사디아졸릴, 티오페닐, 푸라닐, 퀴놀리닐, 이소퀴놀리닐 등은 고리 원자들 중 임의의 원자를 통해 분자의 나머지 부분과 결합한다.
본원에 정의된 아릴 및 헤테로아릴 부는 알킬 또는 헤테로알킬 부를 통해 결합될 수 있으므로, -(알킬)아릴, -(헤테로알킬)아릴, -(헤테로알킬)헤테로아릴 및 -(헤테로알킬)헤테로아릴 부를 포함하기도 한다는 것을 이해할 것이다. 그러므로, 본원에 사용된 “아릴 또는 헤테로아릴 부” 및 “아릴, 헤테로아릴, -(알킬)아릴, -(헤테로알킬)아릴, -(헤테로알킬)헤테로아릴 및 -(헤테로알킬)헤테로아릴”이란 어구는 호환 사용 가능하다. 치환기로서는 상기 언급한 치환기들 중 임의의 것, 즉 지방족 부에 대해 언급된 치환기들, 또는 본원에 개시된 기타 부들에 대해 언급된 치환기들 중 임의의 것을 포함하나, 이에 한정되는 것은 아니며, 상기 치환기들은 안정적인 화합물을 형성한다.
아릴 및 헤테로아릴 기(이환 아릴기 포함)는 치환되지 않거나 치환될 수 있다는 것을 이해할 것인데, 이 경우, 치환은 상기 기에 존재하는 수소 원자들 중 하나 이상의, 다음과 같은 것들을 포함하는 부들(이에 한정되는 것은 아님) 중 임의의 것 하나 이상으로의 독립적인 대체를 포함한다: 지방족; 지환족, 헤테로지방족; 복소환; 방향족; 헤테로방향족; 아릴; 헤테로아릴; 알킬아릴; 헤테로알킬아릴; 알킬헤테로아릴; 헤테로알킬헤테로아릴; 알콕시; 아릴옥시; 헤테로알콕시; 헤테로아릴옥시; 알킬티오; 아릴티오; 헤테로알킬티오; 헤테로아릴티오; F; Cl; Br; I; -OH; -NO2; -CN; -CF3; -CH2F; -CHF2; -CH2CF3; -CHCl2; -CH2OH; -CH2CH2OH; -CH2NH2; -CH2SO2CH3; -C(O)Rx; -CO2(Rx); -CON(Rx)2; -OC(O)Rx; -OCO2Rx; -OCON(Rx)2; -N(Rx)2; -S(O)Rx; -S(O)2Rx; -NRx(CO)Rx (상기 식 중, Rx의 각각의 존재는 독립적으로 지방족, 지환족, 헤테로지방족, 복소환, 방향족, 헤테로방향족, 아릴, 헤테로아릴, 알킬아릴, 알킬헤테로아릴, 헤테로알킬아릴 또는 헤테로알킬헤테로아릴을 포함하나, 이에 한정되는 것은 아니며, 본원에서 전술한 지방족, 지환족, 헤테로지방족, 복소환, 알킬아릴 또는 알킬헤테로아릴 치환기들 중 임의의 것은 치환 또는 비치환, 분지형 또는 비분지형, 포화 또는 불포화될 수 있으며, 본원에서 전술한 방향족, 헤테로방향족, 아릴, 헤테로아릴, -(알킬)아릴 또는 -(알킬)헤테로아릴 치환기들 중 임의의 것은 치환될 수 있거나 치환되지 않을 수 있음). 부가적으로, 임의의 인접한 기들 2개는 모두 4원, 5원, 6원 또는 7원 치환 또는 비치환 지환족 부 또는 복소환 부를 나타낼 수 있음을 이해할 것이다. 일반적으로 대입할 수 있는 치환기들에 관한 부가 예는 본원에 기술된 특정 구체예에 의해 예시된다.
“복소환”이라는 용어는 당업계에서 통상적으로 통하는 의미를 가지며, 고리 원자로서 하나 이상의 이종 원자를 함유하는 시클릭기를 말하는데, 몇몇 경우에 있어서, 고리 원자들 중 1개 내지 3개는 이종 원자이고, 이 경우, 고리 원자들 중 나머지는 탄소 원자이다. 적당한 이종 원자로서는 산소, 황, 질소 및 인 등을 포함한다. 몇몇 경우에 있어서, 복소환은 3원 내지 10원 고리 구조 또는 3원 내지 7원 고리 구조를 가질 수 있으며, 이와 같은 고리 구조는 1개 내지 4개의 이종 원자를 포함한다.
“복소환”이라는 용어는 헤테로아릴기, 포화 복소환(예를 들어 시클로헤테로알킬) 기 또는 이것들의 조합을 포함할 수 있다. 복소환은 포화 분자일 수 있거나, 아니면 하나 이상의 이중 결합을 포함할 수 있다. 몇몇 경우에 있어서, 복소환은 질소 복소환으로서, 여기서, 하나 이상의 고리는 하나 이상의 질소 고리 원자를 포함한다. 복소환은 다른 고리들과 융합되어 다환 복소환을 형성할 수 있다. 복소환은 또한 스피로시클릭(spirocyclic)기에 융합될 수도 있다. 몇몇 경우에 있어서, 복소환은 고리 내 질소 또는 탄소 원자를 통해 화합물과 결합할 수 있다.
복소환은, 예를 들어 티오펜, 벤조티오펜, 티안트렌, 푸란, 테트라하이드로푸란, 피란, 이소벤조푸란, 크로멘, 잔텐, 페녹사틴, 피롤, 디하이드로피롤, 피롤리딘, 이미다졸, 피라졸, 피라진, 이소티아졸, 이속사졸, 피리딘, 피리미딘, 피리다진, 인돌리진, 이소인돌, 인돌, 인다졸, 퓨린, 퀴놀리진, 이소퀴놀린, 퀴놀린, 프탈라진, 나프티리딘, 퀴녹살린, 퀴나졸린, 신놀린, 프테리딘, 카바졸, 카볼린, 트리아졸, 테트라졸, 옥사졸, 티아졸, 페난트리딘, 아크리딘, 페난트롤린, 페나진, 페날사진, 페노티아진, 푸라잔, 페녹사진, 옥솔란, 티올란, 옥사진, 피페리딘, 호모피페리딘(헥삼네틸렌이민), 피페라진(예를 들어 N-메틸 피페라진), 모폴린, 락톤, 락탐, 예를 들어 아제티디논 및 피롤리디논, 술탐, 술톤 및 이것들의 기타 포화 및/또는 불포화 유도체 등을 포함한다. 복소환 고리는 하나 이상의 위치에서 본원에 기술된 치환기들로 임의 치환될 수 있다. 몇몇 경우에 있어서, 복소환은 이종 원자 고리 원자(예를 들어 질소)를 통해 화합물과 결합할 수 있다. 몇몇 경우에 있어서, 복소환은 탄소 고리 원자를 통해 화합물과 결합할 수 있다. 몇몇 경우에 있어서, 복소환은 피리딘, 이미다졸, 피라진, 피리미딘, 피리다진, 아크리딘, 아크리딘-9-아민, 비피리딘, 나프티리딘, 퀴놀린, 벤조퀴놀린, 벤조이소퀴놀린 또는 페난트리딘-1,9-디아민 등이다.
본원에 사용된“할로” 및 “할로겐”이라는 용어는 플루오르, 염소, 브롬 및 요오드로부터 선택되는 원자를 말한다.
“할로알킬”이라는 용어는, 상기 정의한 바와 같이, 1개, 2개 또는 3개의 할로겐 원자가 결합된 알킬기를 의미하는 것으로서, 클로로메틸, 브로모에틸 및 트리플루오로메틸 등과 같은 기를 예로 들 수 있다.
본원에 사용된“아미노”라는 용어는, 1차(-NH2), 2차(-NHRx), 3차(-NRxRy) 또는 4차(-N+RxRyRz) 아민을 말하는데, 여기서, Rx, Ry 및 Rz는 독립적으로 본원에 정의된 바와 같은 지방족, 지환족, 헤테로지방족, 복소환, 아릴 또는 헤테로아릴 부이다. 아미노기의 예로서는, 메틸아미노, 디메틸아미노, 에틸아미노, 디에틸아미노, 디에틸아미노카보닐, 메틸에틸아미노, 이소-프로필아미노, 피페리디노, 트리메틸아미노 및 프로필아미노를 포함하나, 이에 한정되는 것은 아니다.
“알킨”이라는 용어는 당업계에서 통상적으로 통하는 의미를 가지며, 하나 이상의 삼중 결합을 함유하는 분지형 또는 비분지형 불포화 탄화수소기를 말한다. 알킨의 비 제한적 예로서는 아세틸렌, 프로핀, 1-부틴 및 2-부틴 등을 포함한다. 알킨기는 치환될 수 있으며/있거나, 작용기, 예를 들어 하이드록실, 할로겐, 알콕시 및/또는 아릴 기로 대체되는 수소 원자 하나 이상을 가질 수 있다.
본원에 사용된“알콕시”(또는 “알킬옥시”) 또는 “티오알킬”이라는 용어는, 산소 원자 또는 황 원자를 통하여 모 분자 부에 결합된, 상기 정의된 바와 같은 알킬기를 말한다. 임의의 구체예에서, 알킬기는 1개 내지 20개의 지방족 탄소 원자를 함유한다. 기타 임의의 구체예에서, 알킬기는 1개 내지 10개의 지방족 탄소 원자를 함유한다. 또 다른 구체예에서, 본 발명에서 사용된 알킬, 알케닐 및 알키닐 기는 1개 내지 8개의 지방족 탄소 원자를 함유한다. 또 다른 구체예에서, 알킬기는 1개 내지 6개의 지방족 탄소 원자를 함유한다. 또 다른 구체예에서, 알킬기는 1개 내지 4개의 지방족 탄소 원자를 함유한다. 알콕시의 예로서는 메톡시, 에톡시, 프로폭시, 이소프로폭시, n-부톡시, t-부톡시, 네오펜톡시 및 n-헥속시 를 포함하나, 이에 한정되는 것은 아니다. 티오알킬의 예로서는 메틸티오, 에틸티오, 프로필티오, 이소프로필티오 및 n-부틸티오 등을 포함하나, 이에 한정되는 것은 아니다.
“아릴옥시”라는 용어는, -O-아릴기를 말한다. “아실옥시”라는 용어는, -O-아실기를 말한다.
“알콕시알킬”이란 용어는, 하나 이상의 알콕시기(예를 들어, 1개, 2개 또는 3개 이상의 알콕시기)로 치환되는 알킬기를 말한다. 예를 들어 알콕시알킬기는 임의 치환되는 -(C1-6-알킬)-O-(C1-6-알킬)일 수 있다. 몇몇 경우에 있어서, 알콕시알킬기는 임의 치환되는 다른 알킬옥시알킬기(예를 들어 -(C1-6-알킬)-O-(C1-6-알킬)-O-(C1-6-알킬))로 임의 치환될 수 있다.
본원에 기술된 상기 기 및/또는 화합물은 임의의 수의 치환기 또는 작용부로 임의 치환될 수 있음을 이해할 것이다. 다시 말해서, 상기 기들 중 임의의 것은 임의 치환될 수 있다. 본원에 사용된 “치환되는”이란 용어는, 유기 화합물의 모든 허용 가능한 치환기들을 포함할 때를 말하며, “허용 가능한”이란 용어는, 당업자에게 공지된 원자가의 화학 규칙에 포함될 때를 말한다. 일반적으로, “치환되는”이란 용어는, 그것의 앞에 “임의로”라는 용어가 있거나 없거나, 본 발명의 화학식에 포함된 치환기에 대해서 사용될 때, 소정의 구조 내에 존재하는 수소 라디칼이 특정 치환기의 라디칼로 대체될 때를 말한다. 소정의 구조 내에 존재하는 둘 이상의 위치가 특정 그룹으로부터 선택되는 치환기 둘 이상으로 치환될 수 있을 때, 이 치환기는 모든 위치에서 동일하거나 상이할 수 있다. “치환되는”이라는 용어는 또한 치환으로 인하여 안정적인 화합물(예를 들어 재배열(rearrangement), 고리화(cyclization) 및 제거(elimination) 등에 의해 자발적으로는 변형되지 않는 화합물)을 생성할 때를 포함하기도 한다는 점을 이해할 것이다. 몇몇 경우에 있어서, “치환되는”이라는 용어는 일반적으로 수소가 본원에 기술된 바와 같은 치환기로 대체되는 때를 말할 수 있다. 그러나, 본원에 사용된 “치환되는”이라는 용어는, 하나의 분자가 다른 분자와 식별되도록 만드는 중요 작용기가 대체 및/또는 변형되는 때는 포함하지 않는데, 예를 들어 치환이 일어날 경우 그 치환된 작용기가 상이한 작용기가 되는 때는 포함하지 않는다. 예를 들어 “치환되는 페닐기”는 변함 없이 페닐부를 포함하여야 하며, 상기 정의에 따르면, 치환에 의해서 변형되어 예를 들어 피리딘 고리가 될 수는 없다. 광범위한 양태에 있어서, 허용 가능한 치환기들로서는 유기 화합물의 비시클릭 및 시클릭, 분지형 및 비분지형, 탄소환 및 복소환, 방향족 및 비방향족 치환기를 포함한다. 예시적인 치환기로서는, 예를 들어 본원에 기술된 것들을 포함한다. 허용 가능한 치환기는 적당한 유기 화합물당 하나 이상일 수 있으며, 동일하거나 상이할 수 있다. 본 발명을 위하여, 이종 원자, 예를 들어 질소는 본원에 기술된 유기 화합물의 수소 치환기 및/또는 임의의 허용 가능한 치환기를 가질 수 있으며, 여기서 상기 치환기는 이종 원자의 원자가를 만족시키는 것이다. 뿐만 아니라, 본 발명은 유기 화합물의 허용 가능한 치환기들에 의해 임의의 방식으로 한정되지는 않을 것이다. 본 발명에 의해 구체화되는 치환기 및 변수의 조합은, 바람직하게는 조영제 또는 조영제 전구체를 생성하는데 유용한 안정 화합물을 형성하는 조합이다. 본원에 사용된“안정적인”이란 용어는, 바람직하게는 화합물이 제조되기 충분한 안정성을 가지며, 검출되기 충분한 기간 및 바람직하게는 본원에 상세히 기술된 목적에 유용할, 충분한 기간 동안 화합물의 일체성을 유지할 때를 말한다.
치환기의 예로서는 할로겐, 아지드, 알킬, 아랄킬, 알케닐, 알키닐, 시클로알킬, 하이드록실, 알콕실, 아미노, 니트로, 설프히드릴, 이미노, 아미도, 포스포네이트, 포스피네이트, 카보닐, 카복실, 실릴, 에테르, 알킬티오, 설포닐, 설폰아미도, 케톤, 알데히드, 에스테르, 헤테로시클릴, 방향족 또는 헤테로 방향족 부, -CF3, -CN, 아릴, 아릴옥시, 퍼할로알콕시, 아랄콕시, 헤테로아릴, 헤테로아릴옥시, 헤테로아릴알킬, 헤테로아랄콕시, 아지도, 아미노, 할로겐화물, 알킬티오, 옥소, 아실알킬, 카복시 에스테르, -카복사미도, 아실옥시, 아미노알킬, 알킬아미노아릴, 알킬아릴, 알킬아미노알킬, 알콕시아릴, 아릴아미노, 아랄킬아미노, 알킬설포닐, -카복사미도알킬아릴, -카복사미도아릴, 하이드록시알킬, 할로알킬, 알킬아미노알킬카복시-, 아미노카복사미도알킬-, 시아노, 알콕시알킬, 퍼할로알킬 및 아릴알킬옥시알킬 등을 포함하나, 이에 한정되는 것은 아니다.
본원에 사용된 “측정”이라는 용어는, 일반적으로 종 또는 신호를 예를 들어 정량적으로나 정질적으로 분석하는 것, 및/또는 종 또는 신호의 존재 또는 부재를 확인하는 것을 말한다. “측정”은 또한 2개 이상의 종 또는 신호 사이의 상호 작용을 예를 들어 정량적으로나 정질적으로 분석하는 것, 및/또는 상호 작용의 존재 또는 부재를 확인하는 것을 말하는 것일 수도 있다.
본원에 사용된 이미지의“수집”이라는 용어는, 이미지를 얻는 것을 의미한다.
본원에 사용된 “진단학적 조영”이란 용어는, 조영제를 검출하는데 사용되는 방법을 말한다.
“진단학적 키트” 또는 “키트”는 진단학적 방사성 의약품을 합성하기 위해서 임상학적 또는 약학적 세팅에 사용되는 성분들을 하나 이상의 바이알에 모아놓은 것(collection)(일명 제제)을 포함한다. 예를 들어 본 발명의 키트는 진단학적 방사성 의약품을 합성 및/또는 사용하기 위해서 최종 사용자가 임상학적 또는 약학적 세팅을 수행함으로써 사용될 수 있다. 몇몇 구체예에서, 키트는 일반적으로 최종 사용자가 사용할 수 있는 성분, 예를 들어 주사용 물 또는 염수를 제외한, 진단학적 약품을 합성 및/또는 사용하는데 필수적인 모든 성분들을 제공할 수 있으며, 필요하다면 방사성 핵종 용액, 방사성 의약품의 합성 및 취급시 키트를 프로세싱할 수 있는 장비, 피험체에 방사성 의약품을 투여하는데 필요한 장비, 예를 들어 시린지, 실딩(shielding) 및 조영 장비등을 제공할 수 있다. 몇몇 구체예에서, 조영제는 제제 중 최종 사용 투여형(통상적으로 동결 건조 고체 또는 수용액으로서 하나의 바이알이나 시린지에 담김)으로서 최종 사용자에게 제공될 수 있다.
본원에 사용된 “피험체의 일부”란, 피험체의 특정 영역, 피험체의 국소부를 말한다. 예를 들어 피험체의 일부는 피험체의 뇌, 심장, 혈관 조직 또는 심혈관일 수 있다.
본원에 사용된 테스트 “분기(session)”는 연구가 진행되는 단일 테스트 프로토콜일 수 있다. 몇몇 경우에 있어서, 분기는 휴식기/스트레스기 조영 프로토콜; 스트레스기/휴식기 조영 프로토콜; 휴식기만을 둔 조영 프로토콜; 또는 스트레스기만을 둔 조영 프로토콜을 포함할 수 있다. 테스트 분기는 24시간 미만 또는 48시간 미만 안에 진행될 수 있다.
본원에 사용된 “피험체”란 용어는, 사람 또는 사람 이외의 포유 동물 또는 동물을 말한다. 사람 이외의 포유 동물로서는 가축, 반려 동물, 실험실 동물 및 사람 이외의 영장류를 포함한다. 사람 이외의 피험체로서는 또한 구체적으로 말, 소, 돼지, 염소, 개, 고양이, 마우스, 래트, 기니아 피그, 저빌 쥐, 햄스터, 밍크 및 토끼를 포함하나, 이에 한정되는 것은 아니다. 본 발명의 몇몇 구체예에서, 피험체는 “환자”를 말한다. 몇몇 구체예에서, 환자 또는 피험체는 전문의나 기타 건강 관리 전문가의 관리 하에 있을 수 있으며, 그 예로서는 이들 전문의나 기타 건강 관리 전문가와 상담을 하거나, 이들로부터 조언을 얻거나, 또는 이들로부터 처방 또는 기타 권유를 받은 사람(이에 한정되는 것은 아님)을 포함한다.
본원에 기술된 화합물 중 임의의 화합물은 다양한 형태, 예를 들어 염, 용매화물, 수화물, 호변 이성체 및 이성체(이에 한정되는 것은 아님)를 가질 수 있다.
임의의 구체예에서, 조영제는 조영제의 약학적으로 허용 가능한 염이다. 본원에 사용된“약학적으로 허용 가능한 염”이란 용어는, 합리적인 의학적 판단 범위 내에서, 적당하지 않은 독성, 자극 및 알레르기 반응 등을 일으키지 않고 사람 및 하등 동물 조직과 접촉하는데 적당하고, 이익/위험도 비율도 이에 걸맞게 합리적인 염을 말한다. 약학적으로 허용 가능한 염은 당업계에 널리 공지되어 있다. 예를 들어 버지(Berge) 등의 문헌에는 약학적으로 허용 가능한 염에 관하여 상세히 기술되어 있으며, 이에 관하여는 본원에 참조로 포함되어 있는 문헌[J. Pharmaceutical Sciences, 1977, 66, 1-19]을 참조한다. 본 발명의 화합물의 약학적으로 허용 가능한 염으로서는 적당한 무기 산과 유기 산, 그리고 무기 염기와 유기 염기로부터 유래하는 염들을 포함한다. 약학적으로 허용 가능한 무독성 산 부가 염의 예로서는 무기산, 예를 들어 염산, 브롬화수소산, 인산, 황산 및 과염소산과의 반응으로 생성된 아미노기의 염, 또는 유기산 예를 들어 아세트산, 옥살산, 말레산, 타르타르산, 시트르산, 숙신산 또는 말론산과의 반응으로 생성된 아미노기의 염, 또는 당업계에서 사용되는 기타 방법, 예를 들어 이온 교환법으로 생성된 아미노기의 염이 있다. 기타 약학적으로 허용 가능한 염으로서는 아디프산염, 알긴산염, 아스코르브산염, 아스파르트산염, 벤젠설폰산염, 벤조산염, 중황산염, 붕산염, 부티르산염, 장뇌산염, 캄포설폰산염, 시트르산염, 시클로펜탄프로피온산염, 디글루콘산염, 도데실황산염, 에탄설폰산염, 포름산염, 푸마르산염, 글루코헵톤산염, 글리세로인산염, 글루콘산염, 헤미황산염, 헵타논산염, 헥사논산염, 하이드로요오드화물, 2-하이드록시-에탄설폰산염, 락토비온산염, 젖산염, 라우르산염, 황산 라우릴, 말산염, 말레산염, 말론산염, 메탄설폰산염, 2-나프탈렌설폰산염, 니코틴산염, 질산염, 올레산염, 옥살산염, 팔미트산염, 파모산염, 펙틴산염, 과황산염, 3-페닐프로피온산염, 인산염, 피크르산염, 피발산염, 프로피온산염, 스테아르산염, 숙신산염, 황산염, 타르타르산염, 티오시안산염, p-톨루엔설폰산염, 운데카노산염 및 발레르산염 등을 포함한다. 적당한 염기로부터 유래하는 염으로서는 알칼리 금속, 알칼리 토 금속, 암모늄 및 N+(C1- 4알킬)4 염을 포함한다. 대표적인 알칼리 또는 알칼리 토 금속 염으로서는 나트륨, 리튬, 칼륨, 칼슘 및 마그네슘 등을 포함한다. 추가의 약학적으로 허용 가능한 염으로서는, 적당하다면, 짝이온, 예를 들어 할로겐화물, 수산화물, 카복실레이트, 황산염, 인산염, 질산염, 저급 설폰산 알킬 및 저급 설폰산 아릴을 사용하여 생성된 무독성 암모늄, 4차 암모늄 및 아민 양이온을 포함한다.
임의의 구체예에서, 본 발명의 화합물은 수화물 또는 용매화물의 형태를 가진다. 본원에 사용된“수화물”이란 용어는, 하나 이상의 물 분자와 비공유 결합된 화합물을 말한다. 이와 유사하게, “용매화물”이란 용어는, 하나 이상의 유기 용매 분자와 비공유 결합된 화합물을 말한다.
임의의 구체예에서, 본원에 기술된 화합물은 다양한 호변 이성체 형으로서 존재할 수 있다. 본원에 사용된“호변 이성체”란 용어는, 수소 원자의 하나 이상의 정형적 이동과 하나 이상의 원자가 변화(예를 들어 단일 결합 → 이중 결합, 삼중 결합 → 단일 결합, 또는 이의 반대)로부터 기인하는 상호 전환 가능한 화합물 2개 이상을 포함한다. 호변 이성체들의 정확한 비율은 몇 가지 요소들, 예를 들어 온도, 용매 및 pH에 따라서 달라진다. 호변 이성체화(즉 호변 이성체 쌍을 제공하는 반응)는 산이나 염기에 의해 촉매화될 수 있다. 예시적인 호변 이성체화로서는, 케토-대-에놀; 아미드-대-이미드; 락탐-대-락팀; 에나민-대-이민; 및 에나민-대-(상이한) 에나민 호변 이성체화를 포함한다.
임의의 구체예에서, 본원에 기술된 화합물은 다양한 이성체 형태로서 존재할 수 있다. 본원에 사용된 “이성체”란 용어는, 임의의 그리고 모든 기하학적 이성체와 입체 이성체(예를 들어 거울상 이성체 및 부분 입체 이성체 등)를 포함한다. 예를 들어 “이성체”로서는, 본 발명의 범위 내에 포함되는, 시스- 및 트랜스-이성체, E- 및 Z-이성체, R- 및 S-거울상 이성체, 부분 입체 이성체, (D)-이성체, (L)-이성체, 이것들의 라세미체 혼합물, 그리고 이것들의 기타 혼합물을 포함한다. 몇몇 구체예에서, 예를 들어 상응하는 거울상 이성체가 실질적으로 존재하지 않는 이성체/거울상 이성체가 제공될 수 있으며, 이를 “광학적으로 농축된”이성체라고 칭할 수도 있다. 본원에 사용된“광학적으로 농축된”이란, 화합물이 상당히 높은 비율의 한가지 거울상 이성체로 구성된 것을 의미한다. 임의의 구체예에서, 본 발명의 화합물은 바람직한 거울상 이성체 약 90중량% 이상으로 구성되어 있다. 다른 구체예에서, 본 발명의 화합물은 바람직한 거울상 이성체 약 95중량% 이상, 약 98중량% 이상 또는 약 99중량% 이상으로 구성되어 있다. 바람직한 거울상 이성체는 당업자에게 공지된 임의의 방법, 예를 들어 키랄 고압 액체 크로마토그래피(HPLC) 및 키랄 염의 생성 및 결정화에 의해 라세미체 혼합물로부터 분리될 수 있거나, 또는 비대칭 합성법에 의해 제조될 수 있다. 예를 들어 문헌[Jacques, et al., Enantiomers, Racemates and Resolutions (Wiley Interscience, New York, 1981); Wilen, S.H., et al., Tetrahedron 33:2725 (1977); Eliel, E.L. Stereochemistry of Carbon Compounds (McGraw-Hill, NY, 1962); Wilen, S.H. Tables of Resolving Agents and Optical Resolutions p. 268 (E.L. Eliel, Ed., Univ. of Notre Dame Press, Notre Dame, IN 1972)]을 참조한다.
본 발명의 이와 같은 양태들 및 기타 양태들은 이하 실시예를 참고로 하였을 때 더욱 잘 이해될 것이며, 실시예는 본 발명의 임의의 특정 구체예를 예시하기 위한 것이지, 본 발명의 특허 청구의 범위에 의해 한정되는 본 발명의 범위를 한정하고자 하는 것은 아니다.
실시예
실시예
1
4-(2-하이드록시에톡시메틸)벤조산 메틸 에스테르의 합성
디워(Dewar) 응축기가 장착된 2목 둥근 바닥 플라스크에, 무수 디클로로메탄(30㎖) 중 4-하이드록시메틸벤조산 메틸 에스테르(2.50g, 0.015mol) 용액을 첨가한 후, 이를 염/얼음 조에서 냉각시켰다(-10℃). 산화 에틸렌(1.10㎖)을 상기 냉각된 교반 용액에 적가한 후, 에테르산 삼플루오르화 붕소(0.51㎖)를 첨가하였다. 반응 혼합물을 45분 동안 교반한 다음, 30분 동안 실온으로 승온시켜 이 반응 혼합물로부터 과량의 산화 에틸렌을 증발시켰다. 이후, 반응 혼합물을 염수로 희석하였다. 수성 층을 디클로로메탄으로 추출하였다(3회). 유기 층들 전부를 합한 다음, 이를 Na2SO4 상에서 건조시킨 후 여과 및 농축시켜 오일을 생성시켰다. 실리카 겔 크로마토그래피(펜탄:아세트산 에틸 = 4:1)를 이용하여 미정제 물질을 정제한 결과, 원하는 생성물(537㎎, 2.56mmol)(수율 = 17%)이 생성되었다. 1H (CDCl38.36, 600 MHz): δ (2H, d, J=8.4 Hz), 7.41 (2H, d, J=8.5 Hz), 4.62 (3H, s), 3.92 (2H, s), 3.78 (m, 2H), 3.63 (2H, m); 13C (CDCl3167.1, 143.5, 130.0, 129.8, 127.5, 72.9, 72.0, 150 MHz): δ 62.1, 52.3.
실시예
2
4-[2-(t-부틸디메틸실라닐옥시)에톡시메틸]벤조산 메틸 에스테르의 합성
무수 DMF(26㎖) 중 실시예 1의 생성물(544.5㎎, 2.59mmol) 용액에, 이미다졸(264㎎, 3.89mmol)과 TBDMS-Cl(586㎎, 3.89mmol)을 첨가하였다. 반응 혼합물을 실온에서 밤새도록 교반한 후 물로 급랭시켰다. 수성 층을 아세트산 에틸로 추출하였다(3회). 합한 유기층들 전부를 Na2SO4 상에서 건조시킨 후 여과 및 농축시켰다. 실리카 겔 크로마토그래피(펜탄 : 아세트산 에틸 = 4:1)를 사용하여 미정제 물질을 정제한 결과, 원하는 생성물(677.5㎎, 2.19mmol)(수율 = 84%)이 생성되었다. 1H (CDCl3 8.01, 600 MHz): δ (2H, d, J=8.3 Hz), 7.42 (2H, d, J=8.4 Hz), 4.63 (2H, s), 3.91 (2H, s), 3.82 (2H, t, J=5.0), 3.58 (2H, t, J=5.1 Hz), 0.91 (9H, s), 0.07 (6H, s); 13C (CDCl3166.5, 143.5, 129.2, 128.8, 126.5, 72.1, 71.6, 150 MHz): δ 62.3, 51.5, 25.4, 17.9, -5.8.
실시예
3
{4-[2-(t-부틸디메틸실라닐옥시)에톡시메틸]페닐}메탄올의 합성
무수 THF(22㎖) 중에 용해된 실시예 2의 생성물(670㎎, 2.18mmol) 용액에, LAH 용액(THF 중 1.0M 용액, 2.18㎖, 2.18mmol)을 적가하였다. 적가를 마친 후, 반응 혼합물을 3시간 동안 실온에서 교반하였다. 반응 혼합물을 물로 희석하였다. 수성 층을 아세트산 에틸로 추출하였다(3회). 합한 유기층들 전부를 Na2SO4 상에서 건조시킨 후 여과 및 농축시킨 결과, 오일(587㎎, 1.98mmol)이 생성되었는데, 이 오일은 어떠한 추가의 정제 과정도 거치지 않고 다음 단계에서 사용되었다(수율 = 91%). 1H (CDCl3 7.34 (4H, s), 4.68 (2H, s), 4.57 (2H, s), 3.80, 600 MHz): δ (2H, t, J=5.2 Hz), 3.56 (2H, t, J=5.3 Hz), 1.69 (1H, br s), 0.90 (9H, s), 0.07 (6H, s); 13C (CDCl3 140.4, 138.3, 128.0, 127.2, 73.2, 71.9, 65.4, 150 MHz): δ 63.0, 26.2, 18.6, -5.0.
실시예
4
2-t-부틸-5-{4-[2-(t-부틸디메틸실라닐옥시)에톡시메틸]벤질옥시}-4-클로로-2H-피리다진-3-온의 합성
무수 THF(12㎖) 중에 용해된 실시예 3의 생성물(437㎎, 1.48mmol) 및 2-t-부틸-4-클로로-5-하이드록시-2H-피리다진-3-온(250㎎, 1.23mmol) 용액에, 고체 PPh3(485㎎, 1.85mmol) 및 아조디카복실산 디이소프로필(DIAD, 0.358㎖, 1.85mmol)을 첨가하였다. 첨가를 마친 후 반응 혼합물을 실온에서 계속 교반하였다. 20시간 경과 후, 반응 혼합물을 물로 희석하였다. 수성 층이 분리되었으며, 이를 아세트산 에틸로 추출하였다(3회). 합한 유기층들 전부를 Na2SO4 상에서 건조시킨 후 여과 및 농축시킨 결과, 오일이 생성되었다. 미정제 물질을 실리카 겔 크로마토그래피(펜탄 : 아세트산 에틸 = 4:1)를 사용하여 정제한 결과, 원하는 생성물(528㎎, 1.10mmol)(수율 = 89%)이 생성되었다. 1H (CDCl3 7.70 (1H, s), 7.38 (4H, m), 5.30 (2H, s), 4.58, 600 MHz): δ (2H, s), 3.80 (2H, t, J= 5.4 Hz), 3.57 (2H, t, J=5.4 Hz), 1.63 (9H, br s), 0.90 (9H, s), 0.07 (6H, s); 13C (CDCl3159.0, 153.7, 138.8, 134.4, 128.3, 127.3, 150 MHz): δ 125.1, 118.5, 72.8, 71.7, 71.6, 66.4, 61.9, 29.7, 27.9, 25.6, -5.1.; C24H37ClN2O4Si에 대한 HRMS 추정치: 481.228389, 실측치 481.2282.
실시예
5
2-t-부틸-4-클로로-5-[4-(2-하이드록시에톡시메틸)벤질옥시]-2H-피리다진-3-온의 합성
무수 THF(11㎖) 중에 용해된 실시예 4의 생성물(528㎎, 1.09mmol) 용액에, TBAF 용액(THF 중 1.0M 용액, 1.65㎖, 1.65mmol)을 적가하였다. 첨가를 마친 후 반응물을 실온에서 1시간 동안 교반한 다음 물로 급랭시켰다. 수성 층이 분리되었으며, 이를 아세트산 에틸로 추출하였다(3회). 합한 유기층들 전부를 Na2SO4 상에서 건조시킨 후 여과 및 농축시킨 결과, 오일이 생성되었다. 미정제 물질을 실리카 겔 크로마토그래피(헥산 : 아세트산 에틸 = 4:1)를 사용하여 정제한 결과, 원하는 생성물(311㎎, 0.850mmol)(수율 = 78%)이 생성되었다. 1H (CDCl3, 600 MHz): δ 7.70 (1H, s), 7.38 (4H, m), 5.30 (2H, s), 4.56 (2H, s), 3.76 (2H, t, J=4.9 Hz), 3.60 (2H, t, J=4.8 Hz), 2.00 (1H, br s), 1.61 (9H, br s); 13C (CDCl3159.0, 153.6, 150 MHz): δ 138.8, 134.4, 128.2, 127.2, 125.1, 118.3, 72.8, 71.6, 71.6, 66.4, 61.9, 27.8; C18H23ClN2O4에 대한 HRMS 추정치: 367.141911, 실측치 367.1419.
실시예
6
톨루엔-4-설폰산 2-[4-(1-t-부틸-5-클로로-6-옥소-1,6-디하이드로-피리다진-4-일옥시메틸)-벤질옥시]-에틸 에스테르의 합성
무수 디클로로메탄(5.50㎖) 중에 용해된 실시예 5의 생성물(200㎎, 0.546mmol) 용액에, TsCl(125㎎, 0.656mmol), DMAP(100㎎, 0.819mmol) 및 트리에틸아민(0.091㎖, 0.656mmol)을 첨가하였다. 반응 혼합물을 실온에서 계속 교반하였다. 22시간 경과 후, 반응 혼합물을 물로 희석하였다. 수성 층이 분리되었으며, 이를 아세트산 에틸로 추출하였다(3회). 합한 유기층들 전부를 Na2SO4 상에서 건조시킨 후 여과 및 농축시킨 결과, 오일이 생성되었다. 미정제 물질을 실리카 겔 크로마토그래피(펜탄 : 아세트산 에틸 = 3:2)를 사용하여 정제한 결과, 원하는 생성물(232㎎, 0.447mmol)(수율 = 82%)이 생성되었다. 1H (CDCl37.79, 600 MHz): δ (2H, d, J=8.3 Hz), 7.71 (1H, s), 7.38 (2H, d, J=8.2 Hz), 7.32 (4H, m), 5.30 (2H, s), 4.50 (2H, s), 4.21 (2H, m), 3.69 (2H, m), 2.43 (3H, s), 1.63 (9H, br s); 13C (CDCl3 159.0, 153.7, 144.8, 138.8, 150 MHz): δ 134.4, 133.1, 129.8, 128.1, 128.0, 127.2, 125.1, 118.4, 72.8, 71.7, 69.2, 67.8, 66.4, 27.9, 21.6; C25H29ClN2O6에 대한 HRMS 추정치: 521.150762, 실측치 521.1503.
실시예
7
[18F]플루오르화물의 제조
사이클로트론 내에서 [18O]H2O를 양자 충돌시켜 [18F]플루오르화물을 제조하였는데; 핵내 화학 변형을 이하에 보였으며, 이는 18O(p,n)18F로 요약될 수 있다. 충돌을 위하여, 18O의 화학적 형태는 H2 18O로 하였다. 생성된 18F의 화학적 형태는 플루오르화물 이온이었다.
18O + 양자 → 18F + 중성자
확립된 업계 방법에 따르면, 하바(Havar)? 호일을 이용하여 탄탈럼 표적체 내에 수용된 [18O]H2O(2㎖ 내지 3㎖)를 11MeV 양자와 충돌시켰는데(공칭 에너지(nominal energy)); 이 경우, 반응에 대한 양자 최소 에너지는 2.57MeV였으며, 최대 단면 에너지는 5MeV였다. 표적 용량, 충돌 시간 및 양자 에너지는 각각 생성된 [18F]플루오르화물의 양을 관리하도록 조절될 수 있었다.
실시예
8
조영제 전구체 1 아세토니트릴 농축물의 제조
도 1에 보인 조영제 전구체 1(20.4g, 39.2mmol)를 무수 MeCN(3400㎖) 중에 용해한 후, 옵티캡(Opticap) XL2 듀라포어(Durapore) 필터(0.2㎛)에 통과시켜 5㎖들이 유리 바이알로 옮겼다(충전 용량 = 2㎖). 이후, 상기 바이알에 고무 중격을 끼워 맞춘 다음, 알루미늄 크림프로 밀봉하여 사용전까지 상온에 보관하여 두었다.
실시예
9
조영제 1의 일반적인 제조 방법
이하 실시예는, 도 1에 보인 조영제 1을 합성하는 일반적인 방법에 대해 기술하였다. 실시예 7에서 제조된 수성 [18F]플루오르화물을 사이클로트론으로부터 합성 모듈로 옮긴 다음, 음이온 교환 컬럼을 통해 여과하여 미반응 [18O]H2O를 제거하였으며; [18F]플루오르화물은 양이온 수지 매트릭스 내에 잔류시켰다. 이후, 컬럼을 수성 Et4NHCO3로 세정하고 나서, 반응 용기로 옮겼다. 생성된 용액을 MeCN으로 희석한 다음, 고온 및 감압 하에서 농축 건조시켰다. 이와 같이 생성된 무수 [18F]Et4NF 및 Et4NHCO3의 혼합물을 실시예 8에서 제조된 조영제 전구체 1의 아세토니트릴 용액으로 처리한 다음, 90℃ 내지 100℃로 승온시켰으며 이 온도를 10분 내지 20분 동안 유지시켰다. 이 용액을 냉각시킨 후 이를 H2O로 희석한 다음, 워터스 엑스테라 MS C18 컬럼(Waters Xterra MS C18 column)(용리물 = H2O/MeCN) 상에서의 HPLC를 통해 직접 정제하였다. 주요 피크를 나타내는 생성물을 수집하고, 아스코르브산으로 희석한 다음, 제제화 모듈로 옮겼다. 다른 경우에 있어서는, 용액을 85℃ 내지 120℃로 승온시키고 이 온도를 5분 내지 20분 동안 유지한 후, 냉각하여 1:1 H2O/MeCN으로 희석하였다는 것을 제외하고는 상기한 바와 유사한 단계들 및 조건들을 적용하였다.
실시예
10
엑스플로라 RN 합성 모듈을 사용하여 조영제 1을 제조하는 방법
실시예 7의 생성물을 사이클로트론에서 합성 모듈로 옮긴 다음, 음이온 교환 컬럼으로 여과하여 미반응 [18O]H2O를 제거하였으며; [18F]플루오르화물은 양이온 수지 매트릭스 내에 잔류시켰다. 이후, 컬럼을 Et4NHCO3(5.75μmol; 0.500㎖, H2O 중 11.5mM 용액)로 세정하고 나서, 반응 용기로 옮겼다. 생성된 용액을 MeCN(0.500㎖)으로 희석한 다음 농축 건조시켰다(150mmHg, 115℃, 4분). 이와 같이 생성된 무수 [18F]Et4NF 및 Et4NHCO3의 혼합물을 실시예 8의 생성물(11.5μmol; MeCN 중 11.5mM 용액 1.00㎖)로 처리한 다음, 90℃로 승온시켰으며 이 온도를 20분 동안 유지시켰다. 이 용액을 35℃로 냉각시킨 후 이를 H2O(1.00㎖)로 희석한 다음, 워터스 엑스테라 MS C18 컬럼(10㎛; 10×250㎜)(용리물; H2O/MeCN = 45:55)(유속 = 5㎖/분) 상에서의 HPLC를 통해 직접 정제하였다. 주요 피크를 나타내는 생성물(11분 경과시 용리된 것)을 수집하고, 아스코르브산으로 희석한 다음(H2O 중 0.28M 용액 10㎖; pH2), 제제화 모듈로 옮겼다(붕괴 보정 방사성 화학 물질 수율 = 58%).
다른 경우에 있어서는, Et4NHCO3는 11.5μmol(H2O 중 23.0mM 용액 0.500㎖)이고; 용액은 280mbar 및 95℃ 내지 115℃에서 4분 동안 농축 건조하였으며; 실시예 8의 생성물로 처리된 무수 [18F]Et4NF 및 Et4NHCO3의 혼합물을 90℃로 승온시키고 10분 동안 유지시켰다는 것을 제외하고는 상기한 바와 유사한 단계 및 조건을 적용하였으며; 이때, 생성물의 붕괴 보정 방사성 화학 물질 수율은 61%였다.
실시예
11a
엑커트 & 지글러 모듈라-랩 합성 모듈을 사용하여 조영제 1을 제조하는 방법
실시예 7의 생성물을 사이클로트론에서 합성 모듈로 옮긴 다음, 음이온 교환 컬럼을 통해 여과하여 미반응 [18O]H2O를 제거하였으며; [18F]플루오르화물은 양이온 수지 매트릭스 내에 잔류시켰다. 이후, 컬럼을 Et4NHCO3(11.5μmol; 0.500㎖, H2O 중 23.0mM 용액)로 세정하고 나서, 반응 용기로 옮겼다. 생성된 용액을 MeCN(0.500㎖)으로 희석한 다음 농축 건조시켰다(375mmHg, 115℃, 10분). 이와 같이 생성된 무수 [18F]Et4NF 및 Et4NHCO3의 혼합물을 실시예 8의 생성물(11.5μmol; MeCN 중 11.5mM 용액 1.00㎖)로 처리한 다음, 110℃로 승온시켰으며 이 온도를 10분 동안 유지시켰다. 이 용액을 20℃로 냉각시킨 후 이를 H2O(1.00㎖)로 희석한 다음, 워터스 엑스테라 MS C18 컬럼(10㎛; 10×250㎜)(용리물; H2O/MeCN = 45:55)(유속 = 5㎖/분) 상에서의 HPLC를 통해 직접 정제하였다. 주요 피크를 나타내는 생성물(11분 경과시 용리된 것)을 수집하고, 아스코르브산으로 희석한 다음(H2O 중 0.28M 용액 10㎖; pH2), 제제화 모듈로 옮겼다(붕괴 보정 방사성 화학 물질 수율 = 68%).
다른 경우에 있어서는, 생성 용액을 400mbar 및 110℃ 내지 150℃에서 10분 동안 농축 건조하였으며; 실시예 8의 생성물로 처리된 무수 [18F]Et4NF 및 Et4NHCO3의 혼합물을 120℃로 승온시켜 이 온도를 10분 동안 유지시키고; 냉각은 35℃에서 수행하였다는 것을 제외하고는 상기한 바와 유사한 단계 및 조건을 적용하였다.
실시예
11b
엑스플로라 GN 합성 모듈을 사용하여 조영제 1을 제조하는 방법
실시예 7의 생성물을 사이클로트론에서 합성 모듈로 옮긴 다음, 음이온 교환 컬럼으로 여과하여 미반응 [18O]H2O를 제거하였으며; [18F]플루오르화물은 양이온 수지 매트릭스 내에 잔류시켰다. 이후, 컬럼을 Et4NHCO3(11.5μmol; 1.00㎖, H2O 중 11.5mM 용액)로 세정하고 나서, 반응 용기로 옮겼다. 생성된 용액을 MeCN(1.00㎖)으로 희석한 다음 농축 건조시켰다(110℃ 내지 115℃). 이후, MeCN(1.50㎖)을 추가로 첨가하고 나서 용액을 한번 더 농축 건조시켰다. 이와 같이 생성된 무수 [18F]Et4NF 및 Et4NHCO3의 혼합물을 실시예 8의 생성물(11.5μmol; MeCN 중 11.5mM 용액 1.00㎖)로 처리한 다음, 120℃로 승온시켰으며 이 온도를 10분 동안 유지시켰다. 이 용액을 60℃로 냉각시킨 후 이를 H2O/MeCN(3.00㎖; 2:1 v/v)으로 희석한 다음, 워터스 엑스테라 MS C18 컬럼(10㎛; 10×250㎜)(용리물; H2O/MeCN = 45:55)(유속 = 5㎖/분) 상에서의 HPLC를 통해 직접 정제하였다. 주요 피크를 나타내는 생성물(11분 경과시 용리된 것)을 수집하고, 아스코르브산으로 희석한 다음(H2O 중 0.28M 용액 10㎖; pH2), 제제화 모듈로 옮겼다(붕괴 보정 방사성 화학 물질 수율 = 68%).
실시예
11c
GE 트레이서랩 MX 합성 모듈을 사용하여 조영제 1을 제조하는 방법
실시예 7의 생성물을 사이클로트론에서 합성 모듈로 옮긴 다음, 음이온 교환 컬럼으로 여과하여 미반응 [18O]H2O를 제거하였으며; [18F]플루오르화물은 양이온 수지 매트릭스 내에 잔류시켰다. 이후, 컬럼을 Et4NHCO3(23.0μmol; 0.500㎖, 1:1 H2O/MeCN 중 46.0mM 용액)로 세정하고 나서, 반응 용기로 옮겼다. 생성된 용액을 MeCN으로 희석한 다음 농축 건조시켰다(150mbar, 105℃, 8분). 이후, MeCN을 추가로 첨가하고 나서 건조 과정을 반복 수행하였는데; MeCN 첨가 과정 이후에는 증발 과정을 반복 수행하였다(3회). 이와 같이 생성된 무수 [18F]Et4NF 및 Et4NHCO3의 혼합물을 실시예 8의 생성물(23.0μmol; MeCN 중 11.5mM 용액 2.00㎖)로 처리한 다음, 85℃로 승온시켰으며 이 온도를 10분 동안 유지시켰다. 이후, 생성된 용액을 H2O(2.00㎖)로 희석한 후, 워터스 엑스테라 MS C18 컬럼(10㎛; 10×250㎜)(용리물; H2O/MeCN = 45:55)(유속 = 5㎖/분) 상에서의 HPLC를 통해 직접 정제하였다. 주요 피크를 나타내는 생성물(11분 경과시 용리된 것)을 수집하고, 아스코르브산으로 희석한 다음(H2O 중 0.28M 용액 10㎖; pH2), 제제화 모듈로 옮겼다(붕괴 보정 방사성 화학 물질 수율 = 63%).
실시예
12
용매 교환 방법
실시예 10 또는 11의 생성물을 정제 장치로부터 제제화 모듈로 옮긴 다음, C18 셉-팩? 카트리지에 통과시켜 여과하여 MeCN을 제거하고; 조영제 1은 C18 수지 매트릭스 내에 잔류시키고 여과물은 따라 버렸다. 상기 카트리지를 아스코르브산(H2O 중 0.28M 용액 10㎖; pH2)으로 연속 세정하고, 여과물은 따라 버렸으며, 무수 EtOH(0.50㎖) 및 여과물은 수집하였다. 이와 같이 생성된 조영제 1의 에탄올 농축물을 최종 무균 여과하기 위해, 제제 중 아스코르브산(H2O 중 0.28M 용액 10.0㎖)으로 추가 희석하였다.
실시예
13
무균 여과 방법
다음과 같은 예비 무균 처리 부품으로 최종 생성물 바이알 조립체를 제조하였다: 30㎖ 생성물 바이알 1개, 밀리포어 밀렉스 GV4 배출 필터(0.22㎛ × 4㎜) 1개, 튜버쿨린 시린지(1㎖) 1개 및 인슐린 시린지(0.5㎖) 1개. 이후, 실시예 12의 생성물을, 제제화 모듈로부터 밀리포어 밀렉스 GV PVDF 멸균 필터(0.22㎛ × 13㎜)를 통과시켜 최종 생성물 바이알 조립체로 옮겼다. 이후, 시린지 조립체를 사용해서 품질 관리 샘플을 분리해내어, 생성물 배출 조건을 모두 갖추게 하였다.
실시예
14
K2CO3/크립토픽스? 222를 사용하여 조영제 전구체 1(도 1)의 친핵 플루오르화 중 몇몇 실험 매개 변수를 평가하였을 때, K2CO3를 첨가하면 전체 반응의 복잡성이 증가함이 보였으며; 시약의 화학 양론과는 상관 없이 플루오르화 효율이 거의 동일함이 관찰되었다. 염기(예를 들어 탄산염)의 수준이 증가하는 것은 단순히 출발 물질(예를 들어 조영제 전구체)의 비 생산적인 소모와 상관이 있었다. K2CO3를 KHCO3로 치환하면, 플루오르화 효율과 출발 물질 일체성 둘 다가 상당 수준으로 개선되었다. 용액의 pH는 염기의 동일성과 시약의 화학 양론과는 상관 없이 균일하게 유지되었으며; 크립토픽스? 222의 존재 또는 부재는 용액의 전체 pH를 결정하였다. 플루오르화 효율은 시약의 화학 양론과는 상관 없이 안정적으로 유지되었는데, 이는 곧, 첨가된 염기의 반응 협응에서의 역할이 더욱 복잡함을 암시하는 것이다.
도 2는 가능한 반응 경로 여러 가지를 보이는 것으로서, 이 경로는 출발 물질의 비생산적 소모를 일련의 염기 매개 가수 분해 반응과 이량체화 현상으로 추적한다. 시간과 온도가 가변적인 실험을 통해서, 도 1에 보인 친핵성 플루오르화 반응(K2CO3의 존재 하에 K2CO3/크립토픽스? 222 사용)에서의 가수 분해 및 플루오르화 속도가 거의 동일하다는 것이 확인되었다. 그러므로, 더욱 효율적이고 화학 선택적인 방법을 가속화하기 위해서는 플루오르화 시차 속도(differential rate)를 증가시키는 것을 촉진하는 반응 조건(즉, 감소한 가수 분해 속도 및/또는 증가한 플루오르화 속도)이 바람직하다.
전술한 바와 같이, K2CO3는 플루오르화 수준을 기준 수준에 비하여 조금 증가시켰으며, 주로 반응에 불리한 역할을 담당하였다. 이와는 반대로, 첨가된 KHCO3는 동일한 동적 범위에 걸쳐 플루오르화를 눈에 띄게 증가시켰으며, 이때, 분해 경로는 거의 변화가 없는 채로 유지되었다. 이와 같은 사실은, 테트라알킬암모늄 양이온과 [18F]NaF의 교환이 방사능이 높은 친핵성 플루오르화물 공급원을 직접 생성하는 것으로 알려져 있다는 사실과 함께, 플루오르화 속도를 증가시키는 관련 짝이온 효과를 확인하기 위한 노력의 일환으로서 시판중인 일련의 염들에 대한 연구가 이루어지도록 한다(예를 들어 도 1 참조).
이하의 방법에 따라서, 일련의 상이한 염기들을 플루오르화물 공급원(상기 보임)으로서 TBAF를 사용하는 토실산염 전구체의 친핵성 플루오르화에 사용하였다. 2㎖들이 유리 바이알을 Bu4NF(1.15μmol; H2O 중 85.9mM 용액 13.4㎕) 및 Bu4NHCO3(10.4μmol; H2O 중 75.0mM 용액 138㎕)로 충전시킨 다음, 무수 질소 기류 하에 95℃로 승온시키고, 이 온도를 10분 동안 유지시켰다. 생성된 고체 혼합물을 실시예 8의 생성물(11.5μmol; MeCN 중 11.5mM 용액 1.00㎖)로 처리한 다음, 이를 90℃로 승온시키고, 이 온도를 10분 동안 유지시켰다. 생성된 용액을 22℃로 냉각시킨 후, 이 용액을 H2O로 희석한 다음, 조르박스(Zorbax) SB-C18 컬럼(4.6 × 50㎜) 상에서 행해지는 HPLC(0.1% HCO2H 함유 H2O/MeCN 구배 적용, 유속 = 1.00㎖/분)에 의해 직접 분석하였다. 이후, 미정제 반응 혼합물 중 생성물에 대한 통합 피크 면적을 진정 표준 생성물의 통합 피크 면적과 비교하여 반응 수율을 계산하였으며(표 1); 몇 가지 대안적인 염 형태를 치환하여 생성된 결과들도 비교용으로 제공하였다.
중탄산염 음이온의 존재 하에서는 플루오르화 효율이 증가되는 것이 관찰되었다. 뿐만 아니라, R이 메틸 → 에틸 → 부틸일 때, 알킬 치환기의 크기에 대한 의존성이 중간 정도임이 관찰되었다(데이터는 보이지 않음).
염을 전혀 첨가하지 않다가 1 당량의 탄산 칼륨과 1 당량의 중탄산 칼륨을 첨가하였을 때, 수율은 약 1.5배 개선되는 것이 관찰되었다(KF-크립토픽스? 222 사용).
| 염 형태의 동일성과 플루오르화 수율의 비교 | |
| 염 형태 | 수율 % |
| 중탄산염 | 81.4 |
| 수산화물 | 35.5 |
| 아세트산염 | 2.8 |
| 젖산염 | 38.7 |
| 트리플루오로아세트산염 | 3.7 |
| 메탄설폰산염 | 39.6 |
| p-톨루엔설폰산염 | 15.0 |
| 질산염 | 45.1 |
| 요오드화물 | 44.6 |
| 중황산염 | <2% |
| 무 | 44.1 |
또한, 염 첨가제의 양에는, 출발 물질(예를 들어 조영제 전구체)의 양에 상대적인 변화를 가하였는데, 이는 염 첨가제의 농도가 반응에 미치는 영향을 연구하기 위한 것이었다. 도 9a는 중탄산염의 몰 농도 함수인 생성물 분포 변화를 도시하는 그래프이고, 도 9b는 반응 시간 함수인 생성물 분포를 도시하는 그래프이다. 염 화학 양론에 관한 연구를 통하여, 전환을 종결시키기 위해서는 중탄산 테트라알킬암모늄 25mol%(또는 조영제 전구체에 대하여 0.25 당량)가 필요하며, 염기의 농도가 증가함에 따라서 출발 물질의 비생산적인 소모가 일어났음이 밝혀졌다(이는 변형 반응 조건에 대한 최적 화학 양론 범위를 나타냄). 최적 전구체 농도 측정에 관한 관련 연구가 행하여진 결과, 최소 농도가 더욱 확실히 밝혀졌다. 도 9c는 최소값이 3㎎/㎖를 초과하였음을 나타낸다.
친핵 플루오르화 중 크립토픽스? 222의 부재 하에서 중탄산 테트라알킬암모늄을 첨가제로서 사용하면, 원하는 생성물로 신속하게 전환되었으며, 플루오르화에 대한 화학 선택성이, K2CO3/크립토픽스? 222 방법을 수행하였을 때에 비하여 유의적으로 개선되었다. 미정제 반응 혼합물에 대하여 보다 면밀히 평가한 결과, 중탄산 테트라알킬암모늄이 사용되었을 때 전체 분해 속도는 극적으로 감소하였음이 밝혀졌는데, 이는 K2CO3/크립토픽스? 222 방법이 수행되었을 때 존재하던 4개의 가수 분해 불순물이 존재하지 않는다는 사실로써 입증되었다. 어떠한 이론에도 국한되기 바라지 않지만, 상기와 같은 사실은 중탄산 테트라알킬암모늄을 사용하면 절대 pH가 낮을 때(예를 들어 pH가 약 5 ~ 6일 때) 반응이 수행될 수 있다는 사실에 기인할 수 있다.
실시예
15
이하 실시예는 친핵 플루오르화 반응에 있어서 탄산 칼륨이 존재할 때의 그 효과를 연구한 결과이다. 탄산 칼륨이 존재할 때의 수율은 36%였던 반면에, 탄산 칼륨이 존재하지 않을 때의 수율은 35%였다.
실시예
16
이하 실시예는 상이한 염 첨가제가 친핵 플루오르화에 미칠 수 있는 효과를 기술한 것이다. 탄산 칼륨이 존재할 때의 수율은 35%였던 반면에, 중탄산 칼륨이 존재할 때의 수율은 71%였다.
실시예
17
이하 실시예는 친핵 플루오르화 반응에 있어서 상이한 플루오르화물 공급원을 사용하였을 때 얻어진 결과를 기술한 것이다. KF/크립토픽스? 222가 존재할 때의 수율은 71%였던 반면에, 플루오르화 테트라부틸암모늄이 존재할 때의 수율은 83%였다.
실시예
18
이하 실시예는 플루오르화물 염으로서 플루오르화 테트라부틸암모늄을 이용하는 친핵 플루오르화 반응에서 상이한 염기를 사용하였을 때 얻어진 결과를 기술한 것이다. 중탄산염 염기가 존재할 때의 수율은 83%였던 반면에, 수산화물 염기가 존재할 때의 수율은 36%였다.
실시예
19
이하 실시예는 심근 허혈을 확인하기 위하여 조영제 1과 82Rb PET 대 SPECT를 비교하는 것에 대해 기술하였다. 전임상 연구에 있어서, 심근의 조영제 1 흡수율은, 201Tl, 99mTc 세스타미비 및 82Rb 흡수율보다는, 일정 범위의 도달 가능 혈류량에 걸친 심근 혈류량과 더욱 밀접한 상관 관계를 나타냈다. 이하 실험은, 조영제 1의 추출 효율과 예비력이 개선될 경우, 조영제 1 대 82Rb에 의한 PET 및 SPECT 허혈 확인에 있어서 차이가 많이 나게 되는지 여부를 확인하기 위해 수행하였다.
방법: 제2차 임상 실험시 하나의 센터에서 6개월 이내에 99mTc 세스타미비 SPECT 및 조영제 1 PET을 수행한 환자 26명(남자 20명)을, 임상 상태에 변화가 없은지 6개월 이내에 99mTc 세스타미비 SPECT 및 82Rb PET(25mCi 내지 50mCi)을 수행한 환자(SPECT에 대한 합산 차 스코어(Summed Difference Score; SDS)와 매치되는 환자) 23명과 비교하였다. 휴식기 때 조영제 1(2.3mCi 내지 3.9mCi)을 투여하고, 이로부터 60분 또는 24시간 후에는 운동 또는 아데노신 스트레스를 가하여(7.3mCi 내지 8.6mCi) PET를 수행하였다. SPECT 및 PET에 있어서의 관류 결손(perfusion defect)은 컴퓨터 보조 가시 해석법(computer-assisted visual interpretation)에 의해 평가하였는데, 이 경우, 표준 17 분절, 5점-스코어링 모델(0 = 정상; 4 = 흡수되지 않음)을 이용하였다. 허혈의 정도와 중증도(SDS)는, 합산 스트레스 스코어(summed stress score; SSS) 및 합산 휴식 스코어(summed rest score; SRS) 차로부터 구하였다.
결과: SPECT 결과가 비정상이었던 환자 14명(SSS ≥4)에 있어서, 조영제 1을 사용하였을 때의 평균 SDS는, SPECT를 수행하였을 때의 평균 SDS보다 더욱 컸다(9.6 ± 1.8 대 5.4 ± 0.7, p=0.02). SPECT 결과가 비정상이었던 13명의 환자로 이루어진 매칭 그룹에 있어서 평균 SDS는 82Rb PET 및 SPECT를 수행한 그룹의 평균 SDS와 유사하였다(4.9 ± 1.4 대 4.6± 1.3, p=0.8). SPECT 결과가 정상적이었던 환자들(SSS<4)에 있어서, SPECT가 행해진 경우와 비교하였을 때 조영제 1 PET이 수행되었거나(n=12) 또는 82Rb PET이 수행된 때(n=10)에는 SDS에 차이가 없었음이 관찰되었다.
조영제 1 PET은, 99mTc 세스미타비 SPECT에 비하여, 거의 동일한 환자 그룹 내에서 행해진 82Rb PET과 SPECT의 결과를 비교하였을 때에는 보이지 않았던 허혈 정도의 증가를 더욱 잘 보여주었다. 이와 같은 결과들은, PET을 SPECT와 비교하였을 때, 조영제 1을 사용하였을 때의 심근 허혈 확인 효능이, 82Rb를 사용하였을 때보다 더욱 개선된다는 것을 암시하는 것이다.
실시예
20
이하는 스트레스 및 휴식 심장 PET에 대한 작동 한계와 정상 관류에 관한 다중심적 개선에 대하여 기술하고 있다. 본 연구는 정상 관류 분포 한계의 개선과, 심장 관류 18F계 제제(조영제 1)에 의해 측정되는 정상 심장 관류의 특성 규명을 포함하였다.
방법: 유사도가 낮은 15명의 환자들(여성 = 7명 및 남성 = 8명; 평균 연령 = 54.7세; 평균 체중 = 74.2㎏)로부터 정상 한계를 확립하였는데, 이때, 트레드밀 운동 스트레스/휴식 데이터세트(총 30개의 데이터세트)를 얻었으며, 참가자는 18F 조영제 1 관류 제제에 대한 임상 실험(제2차)에서 모집하였고, 지멘스 바이오그래프-64 PET/CT 스캐너 사용 결과는 리스트모드로 수집하였다. 표준적인 재구성법(2D 감쇠 가중 순차 서브셋 기대 최대화; 2D Attenuation Weighted Ordered Subsets Expectation Maximization)(복셀 크기 = 2.6×2.6×2.0㎜; 8-빈 동기화)을 사용하여 동기화 재구성을 수행하였다. 5분간의 재구성 결과는, 스트레스기 및 휴식기 동안 동위 원소를 주사한 후 약 5분 경과시에 생성된 것으로 판단하였다. 세다스-시나이(Cedars-Sinai) QPET PET 작동 및 관류 분석 소프트웨어를 사용하여 모든 프로세싱을 진행시키고 정상 관류 데이터베이스를 형성하였다. 동기화 연구에 있어서는 30개의 스캔 결과들 중 2개(6.7%)를, 그리고 비 동기화 연구에 있어서는 30개의 스캔 결과들 중 1개(3.3%)를 수집하는 것은 좌심실(LV)을 한정함에 있어서 수동적 개입을 필요로 하였으나, 이 이외의 모든 프로세싱은 완전 자동으로 진행되었다.
결과: 좌심실 카운트는, 스트레스기 범위(22.76 ~ 44.29)에서는 33.33±6.44 백만 카운트였으며, 휴식기 범위(5.12 ~ 11.77)에서는 7.56±1.86 백만 카운트였다. 스트레스/휴식 카운트 비율은 4.53±0.88(2.88 ~ 6.16)였다. 평균 경-허혈 팽창률(average trans-ischemic dilation; TID)은 0.974±0.124였는데, 이 경우 정상 상한치는 1.22였다. 스트레스기 스캔 및 휴식기 스캔에 대하여 QPET 상대 관류 정상 한계를 형성하였다. 스트레스기 및 휴식기에 있어서 정단 세선화(apical thinning)에 관한 증거가 존재하였으며, 이 경우, 정단 카운트는 각각 80/79%였다. 정상 데이터베이스 중 카운트 변화율은, 17개의 모든 AHA 분절 내에서 5% 내지 9%에 해당하였다. 작동 매개 변수를 이하 표 2에 제시하였다:
| 스트레스기 및 휴식기 스캔 결과로부터 얻은 작동 매개 변수 | |||||
| EDV | ESV | EF | PFR | TTPF | |
| 스트레스기 | 96.1±25.2㎖ | 33.5±14.2㎖ | 65.9±6.3% (52.5-74.4%) | 2.12±0.49 | 205±51ms |
| 휴식기 | 91.2±20.0㎖ | 31.6±12.7㎖ | 66.5%±8.4% (50-80%) | 2.39±0.50 | 162±24.8ms |
실시예
21
이하는 정상의 피험체와 관상 동맥 질환 환자를 대상으로 조영제 1 PET를 수행하여 휴식기와 스트레스기의 심근 혈류량을 절대 정량화하였을 때의 결과에 대하여 기술하고 있다. 조영제 1은 미토콘드리아 복합체 1을 표적화하는 신규의 심근 관류 PET 추적자이다. 본 연구에서는, 정상인 피험체와 관상 동맥 질환(CAD) 환자를 대상으로 휴식기(R) 및 스트레스기(S) 심근 혈류량(MBF) 및 관상 혈류 예비력(CFR)을 상기 추적자를 사용하여 정량하였다.
방법: 휴식기 및 아데노신 약리학적 혈관 최고 확장시, 11명의 환자(이들 중 8명은 CAD 가능성이 낮고, 3명은 CAD와 가역적 결손이 발생함)에게 조영제 1을 IV 주사하였다. 상기 추적자를 투여하는 것을 시작으로 하여 10분 동안 동적 PET 이미지를 얻었다. 단축 이미지를 재배향할 때, 관심 있는 영역을 심근의 정상 영역 및 결손 영역, 그리고 좌심실 혈액 풀 위에 두었으며, 이로부터 시간 방사능 곡선(Time Activity Curve; TAC)을 작성하였다. 혈액 풀 TAC를 입력 함수로서 사용하는 패트랙(Patlak) 분석법을 심근 TAC(약 0.4분 내지 1.5분)에 대해 수행하여, 심근의 흡수 상수(K)를 구하였다. 부분 용량 및 스필오버 보정치를 혈액 풀 및 심근 TAC에 적용하여, 패트랙 그래프 상 회귀선 절편이 0에 근접하도록 만들었다. 사람에 있어서 조영제 1에 대한 초회 통과 추출 계수는 0.94로 가정하였는데(즉, MBF = K/0.94), 이는 선행 연구에서 관찰되는 계수와 동일하였다(예를 들어 문헌[Huisman et al., J Nucl Med 2008;49:630-6] 참조).
결과: S MBF는 LL 환자들의 심근 영역에 있어서 유사하였는데(p = NS), 이 영역은 CAD 환자의 정상 관상 동맥(NCA)에 의해 제공되었다. 그러나, R MBF는, LL보다는 NCA에서 더욱 많았으므로(p < 0.05), NCA 환자에 있어서 CFR은 더욱 작았다(p < 0.05). 이와는 반대로, S MBF와 CFR은 CAD 영역에서 상당히 작았다(표 3 참조). 이와 같은 결과들은 공표된 문헌에 개시된 바(N-13 암모니아 PET를 수행하였을 때의 결과)와 일치하였다.
| 휴식기 MBF | 스트레스기 MBF | CFR | |
| LL | 0.66+0.12 | 2.36+0.49 | 3.73+1.24 |
| NCA | 0.90+0.15 | 2.38+0.23 | 2.68+0.32 |
| CAD | 0.76+0.13 | 1.18+0.25 | 1.58+0.33 |
상기 연구 데이터는, 절대 MBF는 조영제 1 심근 관류 PET 조영을 사람에게 수행하여(휴식기 및 스트레스기) 정량될 수 있다는 것을 보여 주었다.
실시예
22
이하는 주사된 추적자의 선량과 18F-표지화된 심근 관류 추적자 조영제 1에 대한 수집 시간을 최적화하는 반복적 기술에 대하여 기술하고 있다. 대중과 전문 인력은, 선량, 수집 시간 및 이미지 노이즈들을 서로 최적으로 상쇄시키기 위해서 방사능 노출시 선량 수집 시간 프로덕트(Dosage Acquisition Time Product; DATP)가 최적화되어야 하는지에 대해 관심이 많다. 작업 제한적 노이즈 수준을 바탕으로 최적 선량과 수집 시간을 측정하도록 반복적 알고리즘을 개발하였다.
방법: 심근의 관심 있는 영역으로부터 평균 및 표준 편차(SD)를 측정하여, 비율, 즉 평균/SD(MSD)를 규정하였다. SD와 “노이즈”에 대한 대체 변수를 사용함에 있어서는 다음과 같은 한계가 있었다: 1) 부분 용량과 추적자 흡수율로 인한 내재 카운트 변동성, 2) 재구성 및 필터링 후 데이터의 비 푸아송(non-Poisson) 특성. 반복적 알고리즘을 사용하여 모델을 제한적 MSD에 피팅(fitting)하였다. 이로부터, 5% 관류 결손을 확인하기 위해 목표 MSD에 대한 최적 수집 시간을 결정하였다.
데이터 수집: 바이오그래프 64 슬라이스 PET/CT 스캐너(리스트모드 수집 시간 = 30분)로써 환자 분포 및 40% 중격 결손을 시뮬레이션하는 팬텀 데이터(phantom data)를 수집하였다. 이 기술을 또한 18명의 피험체를 대상으로 테스트하였다. 환자들에게 2mCi를 투여하고(휴식기), 그 다음날에는 약 2mCi를 투여하였다(스트레스기). 주사 후 10분 경과시 10, 20, 40, 80, 160 및 320초 동안 일련의 동적 이미지들을 수집하였다. 최대 심근 복셀 한계치의 70% 를 초과하는 값을 이용하여 별도의 600초 수집 단계로부터 심근 ROI를 구하였다.
데이터 분석: 팬텀 데이터는 이론상의 DATP(9.5mCi(시뮬레이션하여 구함)*분)에 수렴하였다. 환자들의 경우, 반복적 알고리즘은 18 휴식기, 9 아데노신 스트레스기 및 8 운동 스트레스기 솔루션에 수렴하였다. 그 결과를 표 4에 요약하였다.
| 5% 결손 확인용 DATP. 95% 시간은, 환자의 95%에서 5% 결손이 확인될 한계치임 |
|||
| 평균 | STDEV | (1mCi에 대한) 95% ACQ 시간 | |
| 휴식기 | 2.48 | 1.25 | 4.98 |
| EX 스트레스기 | 1.80 | 0.57 | 2.94 |
| AD 스트레스기 | 1.22 | 0.55 | 2.32 |
최적 선량 수집 시간 프로덕트를 해결하는 반복적 기술은 팬텀 데이터 및 환자 연구로 수렴하였다. 이러한 결과를 이용하여 휴식기, 아데노신 스트레스기 및 운동 스트레스기의 최적 수집 시간을 결정하였다. 뿐만 아니라, 상기 알고리즘은 대안적 필터링과 검출 한계를 테스트하고, 감도가 낮은 스캐너의 성능을 추론하는데 사용될 수 있음을 확인하였다.
실시예
23
이하는 광범위한 수집 시간에 걸친 심근 작동 매개 변수(LVEF, EDV 및 ESV)의 독립성(방사능 추적자, 즉 조영제 1로 측정)에 대하여 기술하고 있다. 심근 관류 PET를 사용하여 작동 매개 변수를 정확히 측정하기 위해서는 충분한 카운트 밀도를 필요로 한다. 기능 매개 변수들(좌심실 박출 계수(LVEF), 수축 종기 용량(ESV) 및 확장 종기 용량(EDV)) 간 상관성을 수집 시간에 따라서 측정하였다.
방법: 카운트 밀도 가변성에 대한 작동상 측정치의 견고함을 분석하기 위하여, “리스트모드” 데이터로부터 저 카운트(1, 3, 5분 아데노신(AD), 3, 5분 휴식, 5, 10분 운동(EX)) → 고 카운트(15분 AD, 10분 휴식, 15분 EX) ECG 동기(16 타임 빈) PET 데이터 세트를 연속으로 얻었다. QPET 분석 프로그램을 이용하여 LVEF, ESV 및 EDV를 측정하였다.
데이터 수집: 2개의 연구 센터로부터 모집한 23명의 환자들을 대상으로 함. 휴식 스트레스 연구를 같은 날에 수행하여 본 연구에 대한 데이터를 수집하였다. 환자들에게 조영제를 약 2mCi의 선량으로 투여하고(휴식기), 또한 조영제를 약 6mCi의 선량으로 투여하였다(“같은 날(same day)” 스트레스; 8EX, 13AD). 짧은 리비닝 시간(rebinning time)에 얻은 작동 수치들을 최장 수집 시간 데이터세트와 비교하였다. 선형 회귀 분석을 통해 상관성을 분석하였다.
결과: 관찰을 수행한 이미지 수집 시간 전체에 걸친, 회귀 직선 기울기는 유니티의 10% 이내에 해당하였다(다만, 아데노신을 1분간 투여하였을 경우에는 20%). 상관 계수는 표 5에 제시하였다.
| 리스트 리비닝과 최장 수집 간 상관 계수 | |||
| EDV | ESV | LVEF | |
| 3분 - 휴식 | 0.970 | 0.985 | 0.985 |
| 5분 - 휴식 | 0.995 | 0.990 | 0.985 |
| 1분 - AD | 0.970 | 0.975 | 0.906 |
| 10분 - AD | 0.997 | 0.998 | 0.995 |
| 5분 - EX | 0.990 | 0.995 | 0.990 |
| 10분 - EX | 0.999 | 0.999 | 0.999 |
심장 조영제 1 심근 관류 PET 이미지에 존재하는 고 카운트 밀도는, 광범위한 카운트 밀도에서 견고한 작동 측정이 가능하다는 것을 보여주었다. 카운트 밀도에 영향을 미치는 보통의 매개 변수 가변성, 예를 들어 BMI 및 선량 가변성은 작동상 측정치를 바꾸지 못하는 것으로 보인다.
실시예
24
이하는 조영제 1 PET 심근 관류를 대상으로 하는 1일 휴식기-스트레스기 프로토콜에 있어서 주사 간 최소 간격을 측정하는 방법의 개선에 대하여 기술하고 있다. 심근 관류 조영(MPI)을 위한 1일 휴식기-스트레스기 프로토콜에서는, 스트레스/휴식 투여율(DR)을 더욱 크게 만들기 위해서 시간이 단축되어야 하므로 주사 시간들 사이의 대기 시간(WT)을 최소화하여야 하며, 최소 휴식 선량은 이미지 통계에 의해 지정된다. WT에 대한 DR의 의존성을 분석하고, 허용 가능한 총 선량에 대한 WT를 확인하는 방법이 개선되었다.
방법: Tc-99m MPI에 대한 가역적 결손이 알려진 20명의 환자의 심장을 대상으로 얻은(아데노신(AD) 스트레스기 5회 및 운동(EX) 스트레스기 5회) 2일 휴식기-스트레스기 조영제 1 PET 이미지 데이터들을 합하여, 휴식기 이미지의 16%, 23%, 48% 또는 100%를 스트레스기 이미지에 부가함으로써 인공 결합 이미지를 생성하였다. 이 데이터를 휴식기 이미지 및 2일 스트레스기 이미지와 쌍을 이루게 한 다음, 3명의 맹검 판독자들에 의해 그 결과를 판독하였다. 결과를, 분절(판독자 반응(RR)(0 ~ 4) 및 정량 결손 중증도(QDS)) 감소%에 따라서 기록하였다.
결과: RR은 QDS와 선형 관계에 있는 것으로 파악되었다. 일반적으로, 최대치가 80% 넘게 감소하는 경우는 0으로, 70% 내지 80% 감소하는 경우는 1로, 60% 내지 70% 감소하는 경우는 2로, 50% 내지 60% 감소하는 경우는 3으로, 그리고 50% 미만 감소하는 경우는 4로 판독하였다. RR을 분석한 결과, 일반적으로 오로지 48% 및 100% 결합 이미지 세트에 대한 판독자 반응에 있어서 2일 데이터로부터 1 유닛 넘게 변화되는 것이 관찰되었음을 알게 되었다. 그러므로, 23%는 최대 관용 휴식-대-스트레스 오염(rest-to-stress contamination)인 것으로 간주하였다. 휴식기-스트레스기 오염 및 투여 사이의 상호 관계를 이용하면, AD에 대해서는 최소 DR이 2.2이어야 하고(WT = 0.5시간), EX에 대해서는 최소 DR이 3.0이어야 함(WT = 1시간)을 알게 되었다.
최대 관용 휴식-대-스트레스 오염 수준은 모델링된 이미지들로부터 측정하였다. 관상 혈류 속도가 증가한 조영제 1의 흡수 특성은 AD 연구에 있어서는 비교적 작은 DR과 짧은 WT를 관용할 수 있도록 하였지만, EX 연구에 있어서는 긴 WT와 큰 DR이 필요하였다.
실시예
25
이하는 휴식기 및 스트레스기, 그리고 휴식 투여와 스트레스 투여 사이 간격 둘 다에 대한 조영 시간과 선량을 선택해야 하는 1일 휴식기-스트레스기 PET MPI 프로토콜 디자인에 대하여 기술하고 있다.
이와 같은 매개 변수들은 심근 관류 조영에 있어서 조영제 1의 다음과 같은 3가지 특성들을 이용하여 측정하였다: 1) 휴식기에 주사된 선량으로서, 소정의 수집 시간 동안 진단학상으로 사용할 수 있는 화질의 이미지를 얻을 수 있는 양, 2) 휴식 선량의 스트레스기 이미지에 대한 최대 허용 기여도 및 3) 방사선 선량을 고려하여 투여될 수 있는 최대 총 주사 선량.
카운트 관련 신호-대-노이즈가 판독자 오차에 유의적으로 기여하지는 않았던, 소정의 이미지 수집 시간 동안의 최소 휴식 선량을 측정하였다. 이는 데이터 량이 점차적으로 증가하는, 환자 휴식기 연구를 다수회 리비닝하여 선량을 증가시키는 것을 시뮬레이션함으로써 수행되었다. 본 방법은, 선량 및/또는 수집 기간을 증가시켰을 때를 모델링하는 이미지들을 생성하기 위하여 연속적으로 리비닝을 수행함에 있어서 코인시던스 현상(coincidence event)의 수를 증가시키는 원리를 이용하였다. 이 방법은 방사능 농도가 비교적 낮은 경우, 예를 들어 본원에 기술된 경우에 유효하였다.
선량과 수집 시간 사이의 상호 관계가 알려져 있을 때, 코호트(Cohort) 2에 대한 휴식 선량을 계산하였다. 일정 범위의 수집 시간(최소 2분에서 최대 10분까지)에 필요한 선량을 고려하였을 때, 5분을 선택하였다. 이는, 휴식기 수집에 있어서 초기 선량이 2.9mCi이 되도록 하였다.
소정의 휴식 선량에 대한 스트레스 선량을 결정하기 위하여, 투여율을 결정하였다. 이를 위해서, 우선, 휴식 선량의 스트레스기 이미지에 대한 최대 허용 기여도를 측정하였다. 이는, 제1 일 휴식 연구 및 제2 일 스트레스 연구로부터 얻은 데이터들을 결합하고, 일정 범위의 휴식 선량 기여도를 이용하여 시뮬레이션된 스트레스기 이미지들을 생성함으로써 평가하였다.
본 방법의 최종 단계에서, 총 선량이 한계치인 14mCi 미만으로 유지될 필요가 있는데, 이 경우, 방사능 선량을, 결정 장기에 대해서는 5rem로 한정하고 유효 선량(ED)은 1rem 이하로 한정하는, 부가 한계치가 몇 가지 존재하였다.
분석을 통해 얻은 스트레스기 이미지에 대한 최대 휴식 기여도를 이용하면, 일정 범위의 투여 간격은 최소 15분(본질적으로는 15분)에서 최대 2 시간(실질적 한계치)으로 간주되었다. 이를 바탕으로 하였을 때, 아데노신 스트레스에 대해서는 30분의 간격을 둘 수 있었는데, 이로써 스트레스 선량 대 휴식 선량의 상응하는 비율은 2.0이었다.
운동 스트레스에 있어서는, 운동으로 인하여 방사능의 전체 심근 흡수율이 낮아지므로, 투여 간격을 더욱 길게 함과 아울러 투여율은 더욱 크게할 필요가 있었다. 그러므로, 투여 간격을 60분으로 선택하였는데, 이는 투여율 3.0에 해당하는 것이었다. 휴식기 수집 시간을 7분까지 연장하고, 휴식 선량은 1.7mCi로 감소시킨 결과, 필요 스트레스/휴식 선량 비율이 더욱 증가할 수 있었으며, 이때, 상기 선량은 편리하게는 총 14mCi 한계치 이내로 유지될 수 있었다.
몇몇 선량 범위를 허용함과 아울러 선량에 변화가 생겨서 본 연구의 일체성을 손상시키지 않도록 하기 위하여, 상기 선량과 투여율 수치는, 각각의 변수에 대한 하한치는 15% 내지 20% 범위로 두고, 수집 시간은 모든 수집 단계에 있어서 최소 15분까지 연장시켜, 2D PET 스캐너의 감도가 낮아질 가능성을 설명할 수 있도록 설정하였다. 각각의 분기마다 데이터 수집 시기를 두어서, 필요에 따라서는 단축된 수집 시간에 얻은 이미지들을 동일 데이터로부터 얻을 수 있었다. 이로써, 특정화한 최종 휴식 선량은 2.9mCi 내지 3.4mCi였으며, 아데노신 스트레스에 대한 스트레스 선량은 휴식 선량의 2.0배 내지 2.4배였다. 운동 스트레스에 있어서, 최종 선량은 1.7mCi 내지 2.0mCi로 설정하였으며(휴식기), 스트레스 선량은 휴식 선량의 3.0배 내지 3.6배로 설정하였다. 이러한 선량은 실제 주사된 전체 방사능량을 반영하는 것이므로, 시린지의 흡착과 불용 용량(dead volume)으로 인한 손실을 보상하도록, 주사 전 시린지에는 부가의 방사성 성분이 있어야 하였다.
실시예
26
이하는 18F-표지화된 조영제 1 심근 관류 PET 추적자의 사람에 대한 안전성, 선량 측정, 생체 분포 및 휴식기-스트레스기 심근 조영 특징에 대하여 기술하고 있다. 18F-표지화된 조영제 1은 미토콘드리아 복합체 1을 표적화하는 신규의 심근 관류 조영 PET 추적자이다. 이 추적자의 사람에 대한 안전성, 선량 측정, 생체 분포 및 심근 조영 특징에 대한 연구를 평가하였다.
방법: 2개의 연구에 있어서 25명의 정상인 피험체를 등록하였다: 이들 중 13명에는 222MBq를 I.V. 투여하였다. 휴식기(R) 때에는 오로지 12명 이상의 피험체에만 94MBq를 투여하였으며(R기), 그 다음 날, 최고 아데노신 스트레스기(아데노, n = 6) 또는 최고 트레드밀 운동기(EX, n = 6)에는 124MBq를 투여하였다. 주사 전과 주사 후에 신체 검사, 실험 결과, 활력 징후, ECG 및 EEG를 모니터하였다. 일정 시간에 걸쳐 얻은 연속 PET 이미지들로부터 심근(Myo), 간, 혈액 풀 및 폐의 표준화 흡수 계수(Standardized Uptake Value; SUV)를 측정하였다. 다양한 장기에 대한 평균 선량과 평균 유효 선량(ED, mSv/MBq)을 산정하였다.
결과: 추적자와 관련된 부작용은 없었다. R기에 최고 선량이 투여된 장기는 신장이었으며, 아데노신 및 운동 스트레스가 가하여진 장기는 심장이었다. ED는 R기때 0.019였으며, 아데노 및 Ex 스트레스기때 ED는 0.015였다. 미오(Myo) SUV는 조영시 높게 유지되었다. 골격근 흡수율이 높았기 때문에 EX 미오 SUV는 이 보다 낮았다. 골격근 흡수율이 높았기 때문에 EX 미오 SUV는 EX시 더욱 낮았다. 미오/간은 EX → 아데노 및 R순으로 진행되었을 때 EX시 가장 높았다(표 6 참조). 미오/혈액과 미오/폐는 높았으며 시간이 경과함에 따라서 신속하게 증가하였다.
| 10분 | 30분 | 60분 | 90분 | 149분 | |
| 휴식기 미오 SUV | 3.9±0.9 | 4.2±1.1 | 4.5±1.2 | 4.3±1.3 | 4.1±1.4 |
| 휴식기 미오/간 | 1.0±0.3 | 0.9±0.2 | 1.1±0.2 | 1.4±0.2 | 2.1±0.3 |
| 아데노 미오 SUV | 10.5±1.5 | 10.8±2.1 | 10.3±2.1 | 9.6±2.1 | 8.4±2.1 |
| 아데노 미오/간 | 1.9±0.6 | 2.0±0.5 | 2.2±0.5 | 2.6±0.5 | 3.8±1.0 |
| 운동시 미오 SUV | 6.2±2.1 | 5.5±1.0 | 5.1±0.9 | 4.9±0.9 | 4.5±0.8 |
| 운동시 미오/간 | 28.0±33.6 | 5.6±1.0 | 5.6±1.3 | 5.8±1.5 | 5.5±1.5 |
실시예
27
다양한 조건 하에서 조영제 1에 대한 투여 프로토콜을 결정하기 위해 피험체를 대상으로 연구를 수행하였다. 투여 프로토콜을 결정하는 방법은, 매개 변수, 예를 들어 피험체 체 내에 주사된 조영제 1의 양(mCi); 시린지로부터 주사된 조영제 1의 양(mCi); 주사 후 이미지 수집 시간; 휴식 연구와 스트레스 연구 사이의 지연 시간을 평가하는 것을 포함하였다. 매개 변수는 휴식기와 스트레스기때 달랐는데, 예를 들어 운동 스트레스기때 (체 내) 주사된 선량은 휴식기때 (체 내) 주사된 선량의 3배 이상이었다. 뿐만 아니라, 약리학적 스트레스에 있어서 (체 내) 주사된 선량은 휴식기때 (체 내) 주사된 선량의 2배 이상이었다. 그 결과들을 이하 표 7에 보였다.
| 운동 스트레스 및 약리학적 스트레스에 대한 조영제 1 선량, 수집 시간 및 투여 지연 시간 | |||||
| 스트레스 테스트 | 연구 | 체 내 주사된 선량 (mCi) |
시린지 내 주사된 선량 (mCi) |
수집 시간 (분) |
연구 간 지연 시간 (분) |
| 운동 | 휴식기 | 1.7 - 2.0 | 2.5 - 3.0 |
10 | 60 |
| 스트레스 기 |
8.6 to 9.0 |
9.0 - 9.5 | |||
| 약리학적 테스트 | 휴식 대 스트레스 비율 |
휴식기 주사 선량의 최소 3배 |
|||
| 휴식 | 2.4 - 2.9 | 2.5 - 3.0 | 10 | 30 | |
| 스트레스 | 5.7 - 6.2 | 6.0 - 6.5 | |||
| 휴식 대 스트레스 비율 |
휴식기 주사 선량의 최소 2배 | ||||
사람 피험체에 조영제 1을 투여할 때의 다양한 매개 변수들, 예를 들어 주사 선량, 연구 간 지연 시간, 휴식 대 스트레스 투여의 비율 및 시린지로부터 주사 투여되는 양에 대한 시린지내 함유량을 측정하였다.
실시예
28
이하는 건강한 피험체에 있어서 조영제 1의 1회 투여 선량 측정, 생체 분포 및 안전성 실험에 관한 연구로부터 얻어진 결과들을 제공하고 있다. 주사 후 약 10분, 30분, 50분, 2시간, 2.5시간, 3.83시간 및 4.5시간 경과시 조영제 1을 사용하여 12명의 건강한 지원자에 대한 전신 PET 이미지 데이터를 얻었다. 조영 위치에서 보정된 이미지 데이터는 감쇠하였으며, 또한 선량 측정 분석 실험실, CDE 선량 측정 서비스(CDE)에 의한 방법, 즉 유의적인 방사능 흡수율을 보이는 모든 장기 내 동력학적 데이터를 측정하기 위한 방법 16가지에서 적용된 의학적 내부 방사선 선량(Medical Internal Radiation Dose; MIRD)을 바탕으로 정량되었다. 체류 시간을 측정하기 위하여 정량화된 이미지 데이터를 동력학적으로 모델링하는 방법과 표준 MIRD 방법을 통해 선량 측정 추정치를 얻었다. 이와 같은 추정치들은 방광 배뇨 간격(2.0, 3.5 및 4.8시간)에 관한 3가지 가정을 이용하여 계산하였다. 개개인의 동력학적 데이터, 체류 시간 및 선량 측정 추정치를 보고하였으며, 통계학으로 요약하여 기록하였다.
용어의 정의: 유효 선량(ED): 작업적 방사선 보호를 위해 ICRP에 의해 규정된 양으로서, ED는 균일한 외부 선량과 불균일 내부 선량의 방사선 손실을 비교할 수 있도록 해준다. 불균일 내부 선량에 대하여 결정된 1rem ED에 대한 위험도는, 1rem 균일 외부 노출량(체 내 총 선량)으로 인한 위험도와 동일하다. ICRP 공보 60[ICRP-60 1991]에 정의된 바와 같다.
유효 등가 선량(EDE): 작업적 방사선 보호를 위해 ICRP에 의해 규정된 양으로서, EDE는 균일한 외부 선량과 불균일 내부 선량으로부터의 방사선 손실을 비교할 수 있도록 해준다. 불균일 내부 선량에 대하여 결정된 1rem EDE에 대한 위험도는, 1rem 균일 외부 노출량(체 내 총 선량)으로 인한 위험도와 동일하다. ICRP 공보 30[ICRP-30 1981]에 정의된 바와 같다.
MIRD 방법: 방사선 흡수율의 측정을 위하여 의학적 내부 방사선 위원회에 의해 개발된 방법이다. 이 방법은, 방사선 수송 인자(S-값)와 생체 동력학적 매개 변수(체류 시간)를 사용하는 것을 포함하였다. 문헌[MIRD Primer, Society of Nuclear Medicine, 1991]에 정의된 바와 같다.
%CV는 변이 계수(표준 편차 대 평균의 비율 × 100)이다.
전신 이미지로부터의 주사 선량% 대 시간. 시간의 함수인 주사 방사능%를 뇌, 심벽, 신장, 간, 폐, 적색 골수(요부), 침샘, 비장, 위벽, 갑상샘 및 방광에 대해 측정하였다. 평균적으로, 최고 흡수율이 가장 큰 장기는 간이었다(주사 방사능의 약 19.1%; 데이터는 보이지 않음). 그 다음으로 최고 흡수율이 가장 큰 장기는 신장이었다(주사 방사능의 약 9.4%; 데이터는 보이지 않음).
선량 측정 추정치. 평균적으로, 방광 배뇨 간격이 3.5시간인 경우, 흡수 선량이 가장 큰 장기는 신장(0.24rem/mCi)(0.066mSv/MBq)과, 심벽(0.18rem/mCi)(0.048mSv/MBq)이었다. 평균 ED(유효 선량)는 0.071rem/mCi(0.019mSv/MBq)이었다. 표 8은 흡수 선량 추정치(rem/mCi)였다. 상기 나열된 장기에 대한 평균 흡수 선량은 표 8의 첫 번째 컬럼에 제시하였다.
| 평균 | %CV | 최소치 | 최대치 | |
| 부신 | 5.8E-02 | 7% | 4.9E-02 | 6.4E-02 |
| 뇌 | 9.4E-02 | 25% | 5.7E-02 | 1.3E-01 |
| 유방 | 3.2E-02 | 8% | 2.8E-02 | 3.5E-02 |
| 담낭 벽 | 6.4E-02 | 8% | 5.4E-02 | 7.1E-02 |
| LLI 벽 | 4.3E-02 | 8% | 3.7E-02 | 4.8E-02 |
| 소장 | 4.7E-02 | 8% | 4.0E-02 | 5.2E-02 |
| 위벽 | 1.5E-01 | 26% | 9.0E-02 | 2.3E-01 |
| ULI 벽 | 4.7E-02 | 7% | 4.1E-02 | 5.2E-02 |
| 심벽 | 1.8E-01 | 17% | 1.2E-01 | 2.4E-01 |
| 신장 | 2.4E-01 | 22% | 1.6E-01 | 3.5E-01 |
| 간 | 1.5E-01 | 19% | 1.0E-01 | 1.9E-01 |
| 폐 | 4.2E-02 | 7% | 3.6E-02 | 4.6E-02 |
| 근육 | 3.8E-02 | 8% | 3.2E-02 | 4.1E-02 |
| 난소 | 4.5E-02 | 8% | 3.9E-02 | 5.0E-02 |
| 췌장 | 5.9E-02 | 8% | 4.8E-02 | 6.7E-02 |
| 적색 골수 | 6.0E-02 | 11% | 4.7E-02 | 6.9E-02 |
| 골 형성 세포 | 6.9E-02 | 8% | 5.7E-02 | 7.8E-02 |
| 침샘 | 1.3E-01 | 38% | 8.6E-02 | 2.5E-01 |
| 피부 | 2.9E-02 | 8% | 2.5E-02 | 3.2E-02 |
| 비장 | 6.0E-02 | 21% | 4.0E-02 | 7.6E-02 |
| 고환 | 3.4E-02 | 9% | 3.0E-02 | 3.8E-02 |
| 흉선 | 4.1E-02 | 8% | 3.5E-02 | 4.5E-02 |
| 갑상샘 | 1.2E-01 | 30% | 7.1E-02 | 1.8E-01 |
| 방광 벽 | 8.4E-02 | 18% | 6.5E-02 | 1.1E-01 |
| 자궁 | 4.6E-02 | 8% | 4.0E-02 | 5.1E-02 |
| 전신 | 4.5E-02 | 7% | 3.7E-02 | 4.9E-02 |
| EDE | 8.0E-02 | 11% | 6.3E-02 | 9.1E-02 |
| ED | 7.1E-02 | 12% | 5.5E-02 | 8.9E-02 |
실시예
29
심근 관류 PET 조영용 조영제 1, 즉 신규 18F-표지화 추적자를 사용하여 수행되는, 사람을 대상으로 하는 연구와 관련된 결과들, 즉 휴식기에 1회 주사한 후의 선량 측정 결과, 생체 분포, 안전성 및 조영 특징이 기술되었다.
방법: 연구군. 건강한 성인들(의학적 기록, 신체 검사, 활력 징후, ECG, EEG, 신경학적 검사 및 임상 실험 테스트에 의해 확인)(연령 = 18세 내지 40세)이 본 연구에 참여하였다. 피험체로서 등록되기 위해서는, 피험체들은 모든 프로토콜-특정 포함 기준에 부합하여야 했으며, 제외 기준에는 부합하지 않아야 했다.
연구 디자인: 본 연구는 비 무작위화, 공개 진행, 단일 선량 연구로 진행되었다. 총 13명의 건강한 성인 피험체들이 등록되었으며, 미국 단일 연구 센터에서 이 피험체에 조영제 1을 단일 선량으로 투여하였다. 피험체가 본 연구의 조건에 적합한지 여부를 확인하기 위해서, 등록하기 전 14일 이내에 피험체를 스크린하였으며, 연구 약물 투여 전날 연구 센터에서 사전 평가를 개시하였다. 제 2일 안전성 평가 연구가 끝날 때까지 피험체들은 연구 센터에 머물렀다(투여 후 24 ± 8시간). 투여 후 48 ± 8시간 경과시 피험체들에게 전화를 걸어서 부작용(AE)이 일어났는지 여부에 대해 모니터하였다. 투여 후 약 1주일(5일 내지 7일) 경과시 다시 연구 센터를 방문한 모든 피험체들을 대상으로 후속 안전성 평가를 수행하였으며, 투여 후 약 14일 내지 17일 경과시 전화로 피험체들에게 연락하여 심각한 AE가 일어났는지 여부에 대해 최종적으로 모니터하였다.
선량의 결정 및 투여 방법: 적당한 카운트 통계를 제공하기 위해 표적 선량을 8mCi로 선택하였으며, 전임상 데이터를 기준으로 하는 최대 허용 방사선 노출량보다 훨씬 적은 양의 선량을 조사하였다. 이 데이터는 50mSv(5rem)을 넘지 않는 선량으로 사람(표적)에게 투여될 수 있는 조영제 1의 최대 선량이 742MBq(20.0mCi)이며, 유효 선량(ED)이 ≤10mSv(1rem)인 주사 선량은 666MBq(18.0mCi)였음을 보여주었다(Stabin, M G, Sparks, RB, et al, OLINDA/EXM: the second-generation personal computer software for internal dose assessment in nuclear medicine." J Nucl Med 2005 46(6):1023-7).
제1 일에, 각각의 피험체에 수 중 아스코르브산 나트륨 ≤50㎎/㎖ 및 ≤5% 에탄올을 함유하는 멸균 용액 중 조영제 1을, 1㎖ 내지 3㎖ 정맥 내 볼루스 주사하였는데, 여기서, 상기 양은 주사시 조영제 1이 표적 선량에 가까운 양으로 전달되도록 계산된 양이다. 선량은 10초 미만의 시간 이내에 투여되었으며, 투여 직후에는 3㎖ 내지 5㎖의 염수를 플러싱하였다.
전체 주사 선량은, 주사 전 시린지 내에서 분석된 붕괴 보정 방사능량으로부터 주사 후 시린지 및 주사용 튜브 내 붕괴 보정 방사능량을 공제하여 계산하였다.
PET 조영 프로토콜: 프로토콜에서 특정된 시간대에, 전신(즉 두부에서 대퇴부 중간까지) PET 조영을 수행하였다.
선량 측정 분석: OLINDA/EXM 소프트웨어를 사용하여, 남성 및 여성 성인의 표준 장기 및 침샘에 대한 방사선 선량 측정 추정치와 유효 등가 선량(EDE)(International Commission on Radiological Protection (ICRP), Recommendations of the International Commission on Radiological Protection, Publication 26. Ann ICRP. 1977; 1(3)) 및 유효 선량 (ED)(International Commission on Radiological Protection (ICRP), 1990 Recommendations of the International Commission on Radiological Protection, 60. Ann ICRP. 1990; 21(1-3))을 측정하였다(Stabin, M G, Sparks, RB, et al, OLINDA/EXM: the second-generation personal computer software for internal dose assessment in nuclear medicine." J Nucl Med 2005 46(6):1023-7). 방사선 선량 측정의 평가는 MIRD 팜플렛 제16호에 기술된 방법과 부합하는 방법을 이용하는 MIRD 방법을 바탕으로 하였는데, 이 방법에서는 조영 연구로부터 얻은 데이터를 이용하였다(Siegel JA, Thomas SR, Stubbs JB, et al. MIRD pamphlet no. 16: Techniques for quantitative radiopharmaceutical biodistribution data acquisition and analysis for use in human radiation dose estimates. J Nucl Med. 1999 Feb;40(2):37S-61S).
주문형 소프트웨어를 이용하여, 감쇠 보정 횡단 이미지 데이터 슬라이스 단면들을 각 시점에서의 각각의 피험체에 대한 단일 3차원 이미지 매트릭스에 결합시켰다. 이후, 이미지들을, 각 시점에서의 각각의 피험체에 대한 결합 관상면 이미지 데이터의 6개의 이미지 세트(“전방부(anterior)”, “후방부(posterior)”, “침샘”, “갑상샘”, “선원” 및 “전신”)로 나누었는데, 여기서, 그룹으로 구분한 장기들의 전방부에서 후방부까지의 길이는 유사하였다. 이는 ROI 생성을 최적화하고, 각각의 결합 관상면 이미지에 포함된 장기에 대한 백그라운드 기여도를 최소화하기 위해 수행하였다. 상기 “전방부” 이미지는 위벽, 심벽 및 방광의 이미지를 포함하였다. “후방부” 이미지는 신장, 요추 및 비장의 이미지(눈으로 확인 가능)를 포함하였다. “침샘” 이미지는 침샘(귀밑샘 및 턱밑샘)의 이미지를 포함하였다. “갑상샘” 이미지는 감상샘의 이미지를 포함하였다. “전신” 이미지는 피험체 이미지 데이터를 포함하고, 뇌와 간을 정량하는데 사용된 관상 이미지면 전부를 포함하였다. “선원” 이미지는 교정용 선원 이미지를 포함하였다.
이와 같은 목적을 위해 개발되어 승인된 주문형 소프트웨어를 사용하여, 흡수율이 기준치 이상이었던 모든 장기들의 주위에 관심 영역을 표시하는 선을 그렸다. 교정용 선원 이미지로부터 유래하는 교정 인자로 ROI 합을 정규화하여 절대 방사능량을 측정하였다. 영역 카운트도 관심 있는 백그라운드 영역을 이용하여 정량화되는 장기 또는 조직의 일부가 아닌, 내부에 존재하는 조직 및 외부에 존재하는 조직의 방사능을 포함하는 방사능에 대해 조정하였다. 신체 영역의 총 카운트도 또한 신체 외부 백그라운드 카운트에 대해 보정하였다. 장기와 이의 인접한 영역의 영역 크기를 적당히 정규화하였다. 필요할 경우, 기타 방사능을 가지는 장기와 유의적으로 중첩되는 장기의 비 방해 영역도 사용되었다. (조영화되지 않은) 하지 내 방사능을 추정하기 위하여, 상부 대퇴의 관심 영역을 이용하였다. 주사된 방사능의 100%를 설명하고 흡수된 선량을 보존적으로 측정(약간의 과다 추정이 이루어진 측정)하기 위해서 필요할 경우, 방사능도 정규화하였다. 조영 계획의 마지막 단계를 지난 시점에서 소변 배출 데이터를 얻을 수 있었을 때, 이 데이터를 사용하여 전신 예비력을 측정하였다.
이미지 정량 방법을 이용하여, 본 연구에 참여한 피험체의 뇌, 심벽, 신장, 간, 적색 골수(요추 영역 이용), 침샘, 비장, 위벽, 갑상샘 및 방광에 대한 동력학적 데이터를 측정하였다. 절대 방사능을 투여된 총 방사능으로 나누어, 분할 선량으로 전환하였다. 장기와 조직에 대한 데이터는 비 선형 최소 제곱 회귀법을 사용하여 피팅하였는데, 이 경우, 하기 등식 1에 보인 공식 중 지수들을 모두 합하였다.
[등식 1]
(상기 식 중, f 및 λ는 피팅 과정에서 결정되는 모델 매개 변수이고, ?Fij(t)는 총 주사 방사능 계수이며, t는 주사 후 경과 시간이고, i는 i번째 ROI이며, j는 j번째 피험체이고, k는 k번째 지수 함수임) 적당한 경우, 1차 지수 및 4차 지수 함수를 사용하였다.
동력학적 데이터를 일시적으로 변화시키고, 사용자에 의해 선택되는 다양한 시점에서의 방사능 시나리오에 대해서 사전에 표로 작성한 추정치들을 사용하는 것을 바탕으로 하는 초기 매개 변수 수치를 결정하는 주문형 소프트웨어를 사용하여 회귀법을 수행하였다. 일단 이와 같은 데이터가 피팅되면, 체류 시간은 실험을 통해 정의하는 함수를 합하여(지수를 합하여) 결정하였다(물리적 붕괴를 고려하였을 때 0시간 내지 무한대). 신체 내 체류 시간의 나머지 값은 전신 체류 시간으로부터 적당한 장기내 체류 시간을 공제하여 결정하였다. 방광 내 체류 시간은, 방광 배뇨 간격이 3.5시간인 OLINDA/EXM 소프트웨어에서 실행되는 바와 같이 전신 방사능 데이터를 방광 모델에 대해 피팅하여 결정되는 매개 변수들을 이용하여 결정하였다. 적색 골수 체류 시간은, 요추 일부 위에 선을 그려 표시한 관심 영역을 바탕으로 결정하였다. 요추는 총 적색 골수의 16.1%를 포함하는 것으로 가정하였다(International Commission on Radiological Protection (ICRP) Publication 23, Report of the Task Group on Reference Man. Pergamon Press. 1975, page 125).
장기/조직 선량 측정 추정. “남성” 성인 모델을 이용하는, OLINDA/EXM 소프트웨어를 사용하여 모든 표적 장기에 대한 흡수 선량 추정치를 결정하였다. 결과로 생성된 흡수 선량 추정치는, 방사선 수송 팬텀(radiation transport phantom)의 총 질량에 대한 각 피험체의 총 체질량을 바탕으로 등급을 매겼다. 침샘 선량 측정은, 귀밑샘과 턱밑 침샘(International Commission on Radiological Protection (ICRP) Publication 23, Report of the Task Group on Reference Man. Pergamon Press. 1975, page 125)의 기준 남자 성인의 총 질량을 바탕으로 하는, 침샘에 대한 S-값의 보존적 추정치를 사용하고, 그 형태가 구형이라고 가정하여 수행하였다. 구에 대한 S-값은 OLINDA/EXM 소프트웨어로 구하였으며, 피험체의 총 체질량에 대한 기준 남성의 상대적 총 체질량을 바탕으로 하여 선형 등급을 매겼다. 이후, 이러한 S-값들을 체류 시간으로 곱하여 최종 침샘 선량 추정치를 구하였다.
통계학적 분석. 모든 통계학적 분석과 모든 요약 표 그리고 목록은 SAS? 공개 9.1.3(SAS Institute, Inc., Cary, NC)을 사용하여 작성하였다. 표준적인 기술 요약은, N, 평균, 중앙값, 표준 편차(SD) 및/또는 변이의 상관 계수(%CV), 연속 변수에 대한 최소값 및 최대값과, 명목 변인의 수와 %를 포함하였다.
결과: 환자 인구학. 스크리닝된 26명의 피험체들 중 13명의 피험체(남성 12명, 여성 1명)에 조영제 1을 투여하고 나서, 모든 안전성 평가를 마쳤다. 평균 연령은 23.4세 였으며(연령 범위 = 19세 내지 34세), 평균 BMI는 23.4였다(범위 = 20 ~ 26). 한 명의 환자는 표준 마련시 선량 교정 장치 분석 데이터를 확인할 수 없었기 때문에, 선량 측정, 생체 분포 및 방사능 동력학 분석에 포함시키지 않았다.
방사선 선량 측정. 주사시 18F를 8mCi 이하로 전달하기 위한 정맥 내 볼루스 주사량을 산정하였다. 평균(SD) 최종 붕괴 보정 선량은 18F이 6(0.6)mCi였으며, 붕괴 보정 선량 범위는 4.6mCi 내지 6.6mCi(170MBq 내지 244MBq)였다. 시린지 내에 조영제 1이 예비되어 있었으므로 표적 선량과 최종 선량에는 차이가 있었다.
흡수된 선량 요약 통계 결과를 이하 표 9에 제시하였다(mSv/MBq). 최대 평균 흡수 선량으로 조사된 장기는 신장이었으며(0.066mSv/MBq)(0.24rem/mCi), 그 다음은 심벽(0.048mSv/MBq)(0.18rem/mCi)이었다. 평균 ED는 0.019mSv/MBq (0.072rem/mCi)였다.
| 흡수 선량 추정치(mSv/MBq) (N = 12, 배뇨 간격 = 3.5시간) |
||||
| 평균 | %CV | 최소값 | 최대값 | |
| 부신 | 1.6E a -02 | 7% | 1.3E-02 | 1.7E-02 |
| 뇌 | 2.5E-02 | 25% | 1.5E-02 | 3.6E-02 |
| 유방 | 8.8E-03 | 8% | 7.5E-03 | 9.6E-03 |
| 담낭 벽 | 1.7E-02 | 8% | 1.5E-02 | 1.9E-02 |
| LLI 벽 | 1.2E-02 | 8% | 1.0E-02 | 1.3E-02 |
| 소장 | 1.3E-02 | 8% | 1.1E-02 | 1.4E-02 |
| 위벽 | 4.0E-02 | 26% | 2.4E-02 | 6.2E-02 |
| ULI 벽 | 1.3E-02 | 7% | 1.1E-02 | 1.4E-02 |
| 심벽 | 4.8E-02 | 17% | 3.4E-02 | 6.4E-02 |
| 신장 | 6.6E-02 | 22% | 4.4.E-02 | 9.5E-02 |
| 간 | 3.9E-02 | 19% | 2.7E-02 | 5.2E-02 |
| 폐 | 1.1E-02 | 7% | 9.7E-03 | 1.2E-02 |
| 근육 | 1.0E-02 | 8% | 8.7E-03 | 1.3E-02 |
| 난소 | 1.2E-02 | 8% | 1.1E-02 | 1.3E-02 |
| 췌장 | 1.6E-02 | 8% | 1.3E-02 | 1.8E-02 |
| 적색 골수 | 1.6E-02 | 11% | 1.3E-02 | 1.9E-02 |
| 골 형성 세포 | 1.9E-02 | 8% | 1.6E-02 | 2.1E-02 |
| 침샘 | 3.5E-02 | 38% | 2.3E-02 | 6.8E-02 |
| 피부 | 7.9E-03 | 8% | 6.8E-03 | 8.7E-03 |
| 비장 | 1.6E-02 | 21% | 1.1E-02 | 2.1E-02 |
| 고환 | 9.2E-03 | 9% | 8.1E-03 | 1.0E-02 |
| 흉선 | 1.1E-02 | 8% | 9.6E-03 | 1.2E-02 |
| 갑상샘 | 3.2E-02 | 30% | 1.9E-02 | 4.9E-02 |
| 방광벽 | 2.3E-02 | 18% | 1.7E-02 | 3.0E-02 |
| 자궁 | 1.2E-02 | 8% | 1.1E-02 | 1.4E-02 |
| 전신 | 1.2E-02 | 7% | 1.0E-02 | 1.3E-02 |
| EDE | 2.2E-02 | 11% | 1.7E-02 | 2.5E-02 |
| ED | 1.9E-02 | 12% | 1.5E-02 | 2.4E-02 |
a “E”다음에 있는“-”는 십진법으로 제시한 수치에 대한 3가지 관례에 따른 지수 곱을 의미함.
전체 장기의 생체 분포. 뇌, 심벽, 신장, 간, 폐, 적색 골수(요추 영역), 침샘, 비장, 위벽, 갑상샘 및 방광에 대하여, 시간의 함수인 전체 장기 주사 방사능%로서 산정되는 조영제 1의 생체 분포가 확인되었다(표 10 및 도 11). 도 11은 조영제 1을 투여한 후 상이한 시점에서 각각의 피험체로부터 얻은 심근이 신체에서 차지하는 높이에 있어서의 전신 관상 이미지를 나타낸다. 이미지는 18F 붕괴에 대해 보정하였다. 심장은 초기 이미지로부터 주사 후 약 5시간 경과시의 이미지에 이르기까지 18F을 높은 수준으로, 그리고 지속적으로 예비하였다. 간은 또한 일반적으로 심장의 방사능 세기와 유사한 방사능 세기를 나타냈는데, 이 방사능 세기는 주사 후 10분 내지 30분 사이에 최고조에 이르렀으며, 약 2시간 경과시에 방사능은 소멸하였다. 평균 최고 흡수율이 가장 높았던 장기는 간이었는데, 간은 주사된 방사능의 약 19.1%를 나타냈다. 그 다음으로 평균 최고 흡수율이 높았던 장기는 신장이었는데, 신장은 주사된 방사능의 약 9.4%를 나타냈으며, 그 다음은 뇌로서, 뇌는 주사된 방사능의 약 8.3%를 나타냈다. 본 연구에 참여한 피험체들로부터 얻은 데이터는, 표준적인 모델을 이용하여 방광 내 방사능 체류 시간과 각 피험체의 소변 배출률을 측정하는데 사용되었는데, 이 경우, 이론상 고정 배뇨 간격은 투여 후 3.5시간이었다. 나머지 신체 부분에 있어서 가장 길었던 평균 체류 시간은 다음과 같았다: 나머지 조직(1.8시간), 간(0.28시간) 및 뇌(0.14시간). 요약 체류 시간을 통계학적으로 분석한 결과를 표 11에 제시하였다.
| 투여된 선량의 평균 퍼센트(%) 대 시간(투여 후 경과 시간) (N = 12, 18F 붕괴 보정) |
|||||||
| 0.17 hr a | 0.50 hr | 0.83 hr | 2.0 hr |
2.5 hr |
3.83 hr | 4.5 hr |
|
| 전신 | 100.0% | 99.8% | 99.7% | 98.2% | 98.1% | 96.8% | 96.9% |
| 뇌 | 8.3% | 7.9% | 7.3% | 4.7% | 4.1% | 3.2% | 2.9% |
| GI 위벽 | 2.5% | 2.4% | 2.2% | 0.7% | 0.7% | 0.6% | 0.6% |
| 심벽 | 3.1% | 3.2% | 3.4% | 2.4% | 2.5% | 2.1% | 2.1% |
| 신장 | 9.4% | 6.5% | 4.9% | 1.6% | 1.6% | 1.2% | 1.1% |
| 간 | 19.1% | 18.0% | 16.4% | 7.5% | 7.0% | 4.5% | 4.7% |
| 골수(요추) | 0.3% | 0.3% | 0.3% | NA | NA | NA | NA |
| 침샘 | 0.6% | 0.7% | 0.6% | 0.5% | 0.5% | 0.4% | 0.4% |
| 비장 | 0. 9% | 0.6% | 0.4% | 0.3% | 0.3% | 0.3% | NA |
| 갑상샘 | 0.1% | 0.1% | 0.1% | 0.1% | 0.1% | 0.1% | 0.1% |
| 방광 | 0.3% | 0.2% | 0.3% | 0.9% | 1.1% | 1.4% | 1.7% |
a 투여 후 명목 시간(시)(시간 대의 시작점), NA = 측정 불가.
| 체류 시간(시) 요약 통계 분석 결과 (N = 12, 배뇨 간격 = 3.5시간) |
||||
| 평균 | %CV | 최소값 | 최대값 | |
| 뇌 | 1.38E-01 | 2.69E-01 | 8.68E-02 | 2.08E-01 |
| GI 위벽 | 3.30E-02 | 4.46E-01 | 1.53E-02 | 6.11E-02 |
| 심벽 | 7.28E-02 | 1.83E-01 | 4.82E-02 | 1.01E-01 |
| 신장 | 9.52E-02 | 2.35E-01 | 6.10E-02 | 1.43E-01 |
| 간 | 2.77E-01 | 2.22E-01 | 1.83E-01 | 3.94E-01 |
| 적색 골수 | 8.86E-02 | 2.10E-01 | 6.72E-02 | 1.17E-01 |
| 침샘 | 1.48E-02 | 3.24E-01 | 9.68E-03 | 2.63E-02 |
| 비장 | 1.01E-02 | 1.87E-01 | 7.26E-03 | 1.25E-02 |
| 갑상샘 | 3.31E-03 | 3.13E-01 | 1.72E-03 | 5.06E-03 |
| 방광 | 2.65E-02 | 3.35E-01 | 1.40E-02 | 4.50E-02 |
| 신체의 나머지 부분 |
1.84E+00 | 7.86E-02 | 1.65E+00 | 2.08E+00 |
a “E”다음에 있는“-”는 십진법으로 제시한 수치에 대한 3가지 관례에 따른 지수 곱을 의미함.
소변 중 18 F의 조기 소멸. 투여 전 수집된 소변(기준)과 투여 후 8시간 이내의 모든 소변을 수집하여 18F이 존재하는지에 대해 분석하였다. 그러나, 채혈할 때와 마찬가지로, 소변 수집은 프로토콜 중 특정 시점, 즉 최소 7시간 이내에 마쳤다. 약 7시간의 배뇨 간격에 걸친 평균 소변 배출량은 4.83%ID였으며, 이 경우, %CV는 64.7이었고, %ID 범위는 0.64에서 12.41이었다. 이와 같은 관찰 결과들은 PET 조영에 의해 측정된 누적 소변 배출률(5%)과 거의 일치하였다.
고찰: 조영제 1의 결정 장기는 신장이었으며, 평균 추정 선량은 0.066mSv/MBq(0.24rem/mCi)이었다. 그러므로, 결정 장기에 50mSv를 넘지 않는 양으로 투여될 수 있는 화합물의 최대 주사 선량은 770MBq였다. 이는 약물 평가 및 연구 센터(Center for Drug Evaluation and Research; CDER)에 의해 널리 적용되는 지침서([18F]-FDG를 제조하는데 운영되는 시설에 대하여 안내하는 권고 포장 삽입물에 대해 기술)에 나와 있는 권고량인 185MBq 내지 370MBq보다 약간 많은 양이었다(PET Drug Applications - Content and Format for NDAs and ANDAs: Fludeoxyglucose F 18 Injection, Ammonia N 13 Injection, Sodium Fluoride F 18 Injection, Attachment II, Sample Formats; Labeling for Ammonia N 13 Injection, Fludeoxyglucose F 18 Injection and Sodium Fluoride F 18 Injection, Attachment II (CDER 2000)). 이와 같은 거동은 투여 직후 다량의 [18F]-FDG가 소변으로 매우 신속하게 배출되어, 방광의 [18F]-FDG에 대한 노출량이, 방광의 조영제 1에 대한 노출량보다 실질적으로 더 많았기 때문이다. 조영제 1로 인한 ED(0.019msv/MBq)는 [18F]-FDG의 ED와 동일하였다(International Commission on Radiological Protection (ICRP), Radiation Dose to Patients from Radiopharmaceuticals, Addendum 2 to ICRP Publication 53, Publication 80, Ann ICRP. 1999;28(3)). 그러므로, 조영제 1의 방사능 선량은 [18F]-FDG의 방사능 선량과 거의 동일하거나 조금 작다는 결론을 내릴 수 있었다.
조영제 1에 대한 평균 추정 유효 선량(ED)은 0.019mSv/MBq(0.072rem/mCi)이므로, 10mSv ED를 넘지 않고 투여될 수 있는 최대 주사 선량은 521MBq였다.
본 연구로부터 구한 방사능 선량 추정치는 사람을 제외한 영장류의 방사능 선량 추정치와 일치하였으며(Lazewatsky J, Azure M, Guaraldi M et al. Dosimetry of BMS747158, a novel 18F labeled tracer for myocardial perfusion imaging, in nonhuman primates at rest. J Nucl Med. 2009;49(Supplement 1):15p.), 심장 내 조영제 1의 크고도 지속적인 예비력에 관한 데이터는 사람을 제외한 영장류와 기타 종에서 얻어지는 데이터와 일치하였다(Yu M, Guaraldi MT, Mistry M, Kagan M, McDonald JL, Drew K, Radeke H, Purohit A, Azure M, Casebier DS, Robinson SP. BMS-747158-02: a Novel PET Myocardial Perfusion Imaging Agent. Journal Nuclear Cardiology 2007 Nov-Dec;14(6):789-98). 영장류 유래 추정치를 나타내는 결정 장기는 심벽인 것으로 보였지만, 이와 같은 연구에 있어서 심벽에 대한 추정 사람 방사능 선량은 0.067mSv/MBq였는데, 이는 결정 장기 수치(0.066mSv/MBq)(본 연구에서는 신장에서 측정됨)와 매우 유사하였다. 상기 두 장기에 대한 선량은 사람 이외의 영장류로부터 유래하는 결과와 본 연구 결과 둘 다에서 가장 많았으며, 또한 상호간 2개의 표준 편차에 속하였다.
조영제 1은 널리 관용되고 있었으며, 임상학적으로 유의적인 안전성에 있어서도 문제가 없었다. 활력 징후, 실측 수치(혈액학, 응고, 임상 화학 및 소변 분석), ECG 및 EEG에 있어서 기준치로부터 변화가 있었는데, 이와 같은 변화는 임상학적으로 유의적인 것은 아니었다. 잠재 심장 독성(응고 연구와 트로포닌-T 수준의 변화를 통해 암시됨)은 나타나지 않았다. 신체 검사와 신경학적 검사를 통해서는 투여 전 또는 투여 후 그 어떤 이상 현상도 확인되지 않았다. DMC는, 안전성 데이터를 주기적으로 검토한 후에는 안전성에 대한 관심을 상승시키지 않았다.
본 연구에서 얻은 결과들은, 조영제 1이 안전한 것으로 보이며, 널리 관용되고 심근에서 상당하고 지속적인 예비력을 보였음을 입증하였다. 조영제 1을 휴식기에 주사한 후 결정 장기를 대상으로 선량을 측정한 결과 0.066mSv/MBq였다(신장). 관찰된 평균 ED를 기준으로 하였을 때, 1rem ED를 넘지 않고 투여될 수 있는 최대 주사 선량은 14mCi(521MBq)였다. 조영제 1의 ED는 [18F]-FDG의 ED와 동일하였던 반면에, 조영제 1의 결정 장기(신장) 선량은 [18F]-FDG의 결정 장기(방광) 선량보다 유의적으로 적었다.
실시예
30
이하 실시예는 만성 심근 기능 장애 토끼에 있어서 조영제 1, 즉 신규의 PET 심근 관류 조영제의 안전성 평가 및 심장 조영에 관한 연구에 대해 기술하고 있다.
조영제 1은 양전자 방출 단층 촬영(PET)을 사용하는 심근 관류 조영(MPI)에 사용되는 18F 표지화 조영제이다(Yu M, Guaraldi MT, Mistry M, Kagan M, McDonald JL, Drew K et al.: a novel PET myocardial perfusion imaging agent. J Nucl Cardiol 2007;14:789-98). 상기 조영제를 사용하는 심장 조영을 통해서, 급성 관상 결찰 및 허혈 재관류 손상에 대한 동물 모델에서 급성 심근 허혈 및 조직 괴사를 확인하였으며, 또한 심근을 뚜렷이 관찰하였다(Yu M, Guaraldi MT, Mistry M, Kagan M, McDonald JL, Drew K et al.: a novel PET myocardial perfusion imaging agent. J Nucl Cardiol 2007;14:789-98; Nekolla SG, Reder S, Higuchi T, Dzewas G, Poethko T, Preissl A et al. Assessment of Imaging Properties of a New F-18 Labelled Flow Tracer in a Pig Model. J Am Coll Cardiol 2008;51:A170; and Maddahi J, Schiepers C, Czernin J, Huang H, Schelbert H, Wijatyk A et al. First human study of BMS747158, a novel F-18 labeled tracer for myocardial perfusion imaging. J Nucl Med 2008;49:70P). 모델 시스템에서 조영제 1은 현재 사용되고 있는 MPI 제제에 비하여 우수한 특징들을 가졌음이 확인되었다. 단일 광자 단층 촬영(SPECT)에 사용되는 제제(99mTc-세스타미비 및 201탈륨)과는 대조적으로, 조영제 1은, 절대 기간 동안 심근 관류를 정확히 감쇠 보정하고 정량하는 PET 기술에 이점을 제공하였다. 뿐만 아니라, 조영제 1의 심장 흡수율은, 광범위한 시험관 내 유속 범위와, 생체 내 휴식기 및 스트레스기 조건에서 심근 관류와의 상관성이 더욱 우수하였다(Nekolla SG, Reder S, Saraste A, Higuchi T, Dzewas G, Preissel A et al. Evaluation of the novel myocardial perfusion positron-emission tomography tracer 18F-BMS-747158-02: comparison to 13N-ammonia and validation with microspheres in a pig model. Circulation 2009;119:2333-42). 현재 사용되고 있는 PET 제제, 예를 들어 13N-암모니아 및 82루비듐과는 대조적으로, 18F의 긴 반감기(110분)는 조영제 1이 방사능 합성되어 중앙으로 공급될 수 있도록 해준다. 이는 약리학적 스트레스기 이외에도, 운동 스트레스기에 조영 기회를 제공해주기도 하였다.
다수의 정상 종에 대한 안전성 및 방사능 선량 측정 연구는, 조영제 1이 임상학적 개발용으로 허용 가능한 안전성 한계를 가짐을 보여 주었다(Mistry M, Onthank D, Green J, Cicio S, Casebier D, Robinson S et al. Toxicological Evaluation of BMS-747158, a PET Myocardial Perfusion Imaging Agent. The Toxicologist 2008;102:476; and Lazewatsky J, Azure M, Guaraldi M, Kagan M, MacDonald J, Yu M et al. Dosimetry of BMS747158, a novel 18F labeled tracer for myocardial perfusion imaging, in nonhuman primates at rest. J Nucl Med 2009;49:15p). 방사능 조사용 결정 장기는 심장이었으며, 방사능 선량은 시판중인 제제 18F-플루오로데옥시글루코스의 방사능 선량과 거의 동일하였다(Lazewatsky J, Azure M, Guaraldi M, Kagan M, MacDonald J, Yu M et al. Dosimetry of BMS747158, a novel 18F labeled tracer for myocardial perfusion imaging, in nonhuman primates at rest. J Nucl Med 2009;49:15p).
방법: 심근 경색 토끼 모델. 수컷 뉴질랜드 토끼(체중 = 2.5㎏ 내지 3.5㎏)를 할란(Harlan)(미주리주 오크우드 소재)으로부터 구입하여, AAALAC-공인 동물 관리 시설(란테우스 의료 조영 (Lantheus Medical Imaging))에서 생육시켰다. 연구 프로토콜은 동물 실험 윤리 위원회의 승인을 받았다. 심근 경색(MI) 토끼 모델을 제작하는 과정은 이전에 기술된 방법(Fujita M, Morimoto Y, Ishihara M, Shimizu M, Takase B, Maehara T et al. A new rabbit model of myocardial infarction without endotracheal intubation. J Surg Res 2004;116:124-8)과 유사하였다. 요약하면, 토끼를 케타민(40㎎/㎏, im) 및 자일라진(9㎎/㎏, im)으로 마취시킨 후, 배와위로 놓았다. 수술은 무균 조건 하에서 수행되었다. 중앙 흉골 절개를 조심스럽게 행하여 벽측 흉막이 손상되지 않도록 하였다. 심낭을 노출시킨 후 절개하였다. 좌심실 전방벽 및 측벽을 노출시켰으며, 좌측 관상 동맥의 주요 가지 혈관(major branch)을 결찰하였다. 결찰의 성공 여부는 좌심실 벽의 발병 구역의 색이 창백하게 변하는지 여부에 의해서 확인하였다. 이후, 가슴을 봉합하고 실험 동물을 회복시켰다. 수술 후 4주 경과시, 토끼를 조영 및 심혈관 평가 연구용으로 사용하였다.
조영 및 심혈관 평가. 정상인 토끼와 MI 토끼 둘 다를 대상으로 PET 이미지와 심혈관 매개 변수를 평가하였다. 조영하기 전, 토끼를 케타민(25㎎/㎏, im)과 자일라진(5㎎/㎏, im)으로 마취시키고, 연변 정맥(marginal ear vein)에 카테터를 꽂아 조영제 1을 주사하였다. 우측 넓적 다리 동맥을 분리해 낸 다음 여기에 캐뉼러를 꽂아(밀러 카테터 사용)(SPC340, 텍사스 휴스톤 소재, 밀라 인스트루먼츠(Millar Instruments)) 동맥 혈압을 측정하였다. 그 다음, 동물을 마이크로 PET 카메라(포커스220(Focus220), 테네시 녹스빌 소재, CTI 몰리큘라 이미징 인코포레이션(CTI Molecular Imaging, Inc))에 눕혀 심장 조영을 수행하였다. 밀러 카테터를 컴퓨터 구동 데이터 수집 시스템(MP35, 캘리포니아 골레타 소재, 바이오팩 시스템즈(BIOPAC Systems))과 연결시켜 평균 동맥 혈압(MAP)과 수축 종기 및 확장 종기 동맥 혈압(SAP 및 DAP)을 측정하였다. 또한, 바이오팩 시스템을 이용하는 리드 II(lead II) 배열에서 비관혈적 사지 유도를 3회 수행하여 심전도(ECG)도 기록하였다. 심박수(HR)와 QT 간격은 ECG 기록으로부터 도출하였다. 안정화 시기를 거친 후, 심혈관 매개 변수(MAP, SBP, DBP 및 ECG)를, 조영제 1(약 1.5mCi) 정맥 내 주사 5분 전에 기록하였으며, 주사 후에도 계속해서 20분 더 기록하였다. 토끼는 30분 동안 조영하였다.
이미지 재구성 및 분석. 이미지 수집 후, 이 이미지들을 매트릭스(256 × 250 픽셀)에서 재구성하였으며, 이 경우, OSEM2D 알고리즘을 사용하여 95개의 횡단 슬라이스를 생성하고, 붕괴 보정을 수행하였다(마이크로PET 매니저 및 ASIPro; 테네시주 녹스빌 소재, CTI 몰리큘러 이미징 인코포레이션). 픽셀 크기는 0.47㎜였으며, 슬라이스 두께는 0.80㎜로 하였다. 이미지는 심장 축을 기준으로 재배향되었으며, 이후, 10분 동안(20분으로부터 30분까지) 연속적으로 단층 촬영한 심장 이미지 프레임을 생성하였다. 그 다음, 재구성된 심장 단축 이미지로 극 지도(polar map)를 작성하였다(QPS 2008 소프트웨어 사용)(캘리포니아주 로스 엔젤레스 소재, 세다스-시나이 메디컬 센터(Cedars-Sinai Medical Center)).
방사성 약학 제제. 조영제 1의 화학 구조와 방사 합성에 관하여는 이미 개시된 바 있다(Yu M, Guaraldi MT, Mistry M, Kagan M, McDonald JL, Drew K et al.: a novel PET myocardial perfusion imaging agent. J Nucl Cardiol 2007;14:789-98; and Purohit A, Radeke H, Azure M, Hanson K, Benetti R, Su F et al. Synthesis and biological evaluation of pyridazinone analogues as potential cardiac positron emission tomography tracers. J Med Chem 2008;51:2954-70). 본 연구에 사용된 방사 화학 물질의 순도는 99.1% 내지 99.9%였으며, 비 활성(specific activity)은 3265Ci/mmol 내지 7016Ci/mmol이었다. 상기 제제를, 임상 프로토콜을 거친 수 중 5% 에탄올(v/v)과 아스코르브산 50㎎/㎖ 중에 제조하였다.
데이터 분석. 데이터를 평균 ± SD로 표시하였으며, 비쌍형 스튜던트 t-테스트(불균등 분산으로 가정)를 수행하여 대조군과 MI 토끼 간 기준치를 비교하였다. P<0.05는 통계학적으로 유의적인 것으로서 간주되었다. 각각의 시점에서(조영제 1 주사 전과, 주사 후 1, 5, 10 및 20분 경과시), MAP, SAP 및 DAP는 평균적으로 10초마다 동맥 내 측정하였으며, ECG 기록시 생기는 HR 및 QTc 간격은 평균적으로 12 심박시마다 측정하였다. QT 간격은 한 명의 관찰자가 직접 정의하였으며, QTc는 프리데리시아법(Fridericia method)을 사용하여 RR 간격으로 보정된 QT로부터 구하였다(QTc=QT/RR1/3).9
결과: 연구 진행시 대조군과 MI 토끼의 체중은 유사하였다(3.35±0.19㎏ 대 3.06±0.28㎏).
심장 이미지. 대조군과 MI 토끼의 대표적인 심장 단축 단면 이미지, 장축 단면 이미지 및 극 지도는 도 12에 나타내어져 있다. 도 12는 대조군과 만성 심근 경색(MI) 토끼에 있어서 조영제 1에 의한 대표적인 심장 이미지를 나타낸다. 이 이미지들은 조영제 1을 주사한 후 20분 내지 30분 경과시에 수집하였으며, 심장 단축 및 장축 단면 이미지와 극 지도로 제시하였다. MI 토끼에서는 결손 구역이 선명하게 확인되었다. 대조군 토끼에서, 심근은 방사능이 균일하게 분포되고 백그라운드 간섭도 최소인 것이 선명하게 보였다. MI 토끼에 있어서, 좌심실 벽의 관류 결손 구역은 심장 단축 및 장축 단면 이미지와 극 지도에서 선명하게 관찰되었다.
ECG 평가. 표 12에 보인 바와 같이, 리드 II 배열에 기록된 기준 ECG 추적(조영제 1 주사 전)은 정규 파형(포지티브 QRS 복합체) 및 T파(대조군 토끼)를 보여 주었다. 이와는 대조적으로, QRS 복합체와 T파는 네거티브였는데, 이 경우, MI 토끼에서는 Q파가 확대되었다. 본 연구에서는 대조군 토끼와 심근 경색(MI) 토끼에 조영제 1을 주사하기 전과, 주사한 후 1분 및 5분 경과시 ECG 추적 결과를 얻었다. 표 12는 대조군 토끼와 MI 토끼에 조영제 1을 주사한 후 1, 5, 10 및 20분 경과시 QTc 간격의 기준치(프리데리시아법으로 보정)와 기준치로부터의 평균 변화량을 나타낸다. 대조군과 유사하게, MI 토끼에 주사한 후 ECG 파형과 QTc 간격에는 차이가 관찰되지 않았다.
| 주사후 기준치로부터의 변화량 | |||||
| QTc (msec) |
기준치 | 1분 | 5분 | 10분 | 20분 |
| 대조군(n=3) | 319±17 | 2±15 | -1±11 | 6±20 | 9±15 |
| MI(n=4) | 288±17 | 8±5 | 4±6 | 4±8 | 3±12 |
그러나, QTc 및 HR의 기준치(표 12 및 표 13)는 상기 두 그룹에서 거의 동일하였다. 대조군 토끼 또는 MI 토끼에 조영제 1을 정맥 내 투여하였을 때, 주사 후 1, 5, 10 및 20분 경과시 ECG 파형, 심박, HR 및 QTc 간격은 기준치와 달라지지 않았다. 본 연구는 부분적으로, 조영제 1을 투여하기 5분 전과, 조영제 1을 투여한지 20분 후에 대조군과 심근 경색(MI) 토끼의 평균 심박(HR) 추적 결과를 보여 주었다. 표 13은 대조군 토끼와 MI 토끼에 주사후 1, 5, 10 및 20분 경과시 HR의 기준치와 이 기준치로부터의 평균 변화량을 보여 준다. 대조군과 유사하게, MI 토끼에 조영제 1을 주사한 후 HR에는 변화가 관찰되지 않았다.
| 주사후 기준치로부터의 변화량 | |||||
| 심박 (심박수/분) |
기준치 | 1분 | 5분 | 10분 | 20분 |
| 대조군 | 159±8 | -4±2 | -2±1 | -2±4 | -4±4 |
| MI | 162±36 | 6±5 | 3±8 | 1±6 | -7±10 |
동맥 혈압 측정. HR 및 QTc와는 대조적으로, MAP, SAP 및 DAP의 기준치(표 14 및 표 15)는 대조군 토끼에서보다 MI 토끼에서 유의적으로 낮았다. 대조군 토끼에 조영제 1을 주사하였을 때 MAP(표 14), SAP 및 DAP(표 15)에는 변화가 생기지 않았다. 대조군 동물과 마찬가지로, 조영제 1을 투여하는 중과 투여한 후 MI 토끼에서는 상기 매개 변수들에 변화가 없었다. 본 연구는 부분적으로, 조영제 1을 투여하기 5분 전과, 투여한지 20분 후, 대조군 토끼와 심근 경색(MI) 토끼의 평균 동맥 혈압(AP)을 추적한 결과를 보여주었다. 표 14는 대조군과 MI 토끼에 주사한지 1, 5, 10 및 20분 후, 평균 AP의 기준치와 이 기준치로부터의 평균 변화량을 나타낸다. 대조군과 유사하게, MI 토끼에 주사한 후에는 평균 AP에 변화가 관찰되지 않았다. *는 p<0.05인 경우 대 대조군을 비교한 결과를 나타내는 것이다. 본 연구는 부분적으로, 조영제 1을 투여하기 5분 전과, 투여한지 20분 후에 대조군 토끼와 심근 경색(MI) 토끼의 평균 수축 종기 동맥 혈압과 확장 종기 동맥 혈압(AP)을 추적한 결과를 보여주었다. 표 15는 대조군 토끼와 MI 토끼에 주사한지 1, 5, 10 및 20분 경과시 수축 종기 AP와 확장 종기 AP의 기준치 및 이 기준치로부터의 평균 변화량을 나타낸다. 대조군과 유사하게, MI 토끼에 주사한 후에는 평균 AP에 변화가 관찰되지 않았다. *는 p<0.05인 경우 대 대조군을 비교한 결과를 나타내는 것이다.
| 주사후 기준치로부터의 변화량 | |||||
| 평균 AP (mmHg) |
기준치 | 1분 | 5분 | 10분 | 20분 |
| 대조군 | 89±11 | 0±0 | -2±0 | -2±3 | -1±6 |
| MI | 61±6* | 2±1 | 2±2 | -1±2 | 2±3 |
| 주사후 기준치로부터의 변화량 | |||||
| AP (mmHg) |
기준치 | 1분 | 5분 | 10분 | 20분 |
| 수축 종기 AP 대조군 |
114±11 | 0±1 | -2±1 | -1±6 | 0±5 |
| MI | 79±11* | 1±2 | 2±2 | 0±1 | 1±7 |
| 확장 종기 AP 대조군 |
76±10 | 0±1 | -1±2 | 0±5 | 0±5 |
| MI | 53±4* | 1±1 | 2±2 | 1±1 | 2±2 |
고찰: 본 연구는 관상 심혈관 질환의 진단과 예후에 있어서 심근 관류를 평가하기 위한 PET 조영제로서의 조영제 1을 연구하기 위해 디자인되었다. 정상인 동물에 있어서의 안전성이 평가되었으며, 허혈-재관류 손상에 의해 유도된 급성 심근 허혈과 MI에 관한 동물 모델이 조영되었다(Yu M, Guaraldi MT, Mistry M, Kagan M, McDonald JL, Drew K et al.: a novel PET myocardial perfusion imaging agent. J Nucl Cardiol 2007;14:789-98; Nekolla SG, Reder S, Higuchi T, Dzewas G, Poethko T, Preissl A et al. Assessment of Imaging Properties of a New F-18 Labelled Flow Tracer in a Pig Model. J Am Coll Cardiol 2008;51:A170; and Mistry M, Onthank D, Green J, Cicio S, Casebier D, Robinson S et al. Toxicological Evaluation of BMS-747158, a PET Myocardial Perfusion Imaging Agent. The Toxicologist 2008;102:476). 본 연구는 만성 심장 기능 장애 동물 모델에서 조영제 1을 추가로 평가하도록 디자인되었다. 모델은 토끼의 관상 동맥을 오랜 기간 동안 결찰하여 제작하였다. 이러한 토끼 모델은 몇 가지 특징들을 바탕으로 선택되었다: 1) 사람과는 유사하고 기타 종들과는 다르게, 토끼는 심장의 부행 순환이 좋지 않아서, 갑자기 관상 동맥이 막힐 경우 쉽게 MI로 갈 수 있음(Bell DR. Special Circulations. In: Rhoades R, Bell DR, editors. Medical Physiology: Principles for Clinical Medicine. 3rd ed. 2008. p. 290-304; and Maxwell MP, Hearse DJ, Yellon DM. Species variation in the coronary collateral circulation during regional myocardial ischaemia: a critical determinant of the rate of evolution and extent of myocardial infarction. Cardiovasc Res 1987;21:737-46). 2) 토끼에 있어서, 심근 손상 후 상처 치유에 중요한 역할을 하는 심장 섬유 아세포 및 콜라겐 생합성의 조절 과정은, 사람에 있어서 안지오텐신 시스템과 관련하여 관찰되는 섬유 아세포 및 콜라겐 생합성의 조절 과정과 유사함(Gallagher AM, Bahnson TD, Yu H, Kim NN, Printz MP. Species variability in angiotensin receptor expression by cultured cardiac fibroblasts and the infarcted heart. Am J Physiol 1998;274:H801-H809). 3) 관상 결찰 후, 혈장과 심근의 노르에프네프린 수준은 증가함(Makino T, Hattori Y, Matsuda N, Onozuka H, Sakuma I, Kitabatake A. Effects of angiotensin-converting enzyme inhibition and angiotensin II type 1 receptor blockade on beta-adrenoceptor signaling in heart failure produced by myocardial Infarction in rabbits: reversal of altered expression of beta-adrenoceptor kinase and G i alpha. J Pharmacol Exp Ther 2003;304:370-9; and Fujii T, Yamazaki T, Akiyama T, Sano S, Mori H. Extraneuronal enzymatic degradation of myocardial interstitial norepinephrine in the ischemic region. Cardiovasc Res 2004;64:125-31). 4) 사람에서와 유사하게, 토끼 심장에서의 노르에피네프린 소멸은 주로 신경 노르에피네프린 운반체(Gao DW, Stillson CA, O'Connell JW. Absence of MIBG uptake in the denervated rabbit heart. J Nucl Med 1996;37:106p)에 의한다(Eisenhofer G, Friberg P, Rundqvist B, Quyyumi AA, Lambert G, Kaye DM et al. Cardiac sympathetic nerve function in congestive heart failure. Circulation 1996;93:1667-76). 5) 종의 크기는 ECG를 동시에 모니터할 수 있도록 해주는 마이크로PET 카메라에서 고 화질 PET 조영에 적당함. 대조군 토끼의 ECG 파형과는 대조적으로, MI 토끼 내 리드 II 배열에서는 Q파가 확대된 네거티브 QRS 복합체와 반전 T파가 관찰되었는데, 이는 곧, 비정상적인 심실 탈분극과 재분극이 일어난다는 것을 말해주는 것이다. 관상 동맥 가지의 폐색(관상 결찰)이 종결된 후, 그 영역으로 운반되는 산소는 부행 순환에 따라서 감소하거나 운반이 중지되며, 이로써 세포 사멸과 조직 괴사가 초래된다. 이와 같은 경우, 급속한 조직 수복 과정이 개시되는데, 이 과정은 초기 염증 과정 → 혈관 신생 과정 → 섬유 아세포 증식, 콜라겐 생성 및 침착 증가 과정을 포함한다. 이와 같은 변화들은 궁극적으로 심장의 괴사 영역(10군데)을 재건하는 상처 조직을 형성하게 된다(Abbate A, Biondi-Zoccai GG, Van Tassell BW, Baldi A. Cellular preservation therapy in acute myocardial infarction. Am J Physiol Heart Circ Physiol 2009;296:H563-H565; and Sun Y, Weber KT. Infarct scar: a dynamic tissue. Cardiovasc Res 2000;46:250-6). 조직 검사를 통하여, 증가한 섬유 아세포 증식과 상처 형성 과정은 각각 토끼 내에서 관상 결찰이 수행된지 약 2일 및 약 18일 후에 개시됨을 알 수 있었다(Morales C, Gonzalez GE, Rodriguez M, Bertolasi CA, Gelpi RJ. Histopathologic time course of myocardial infarct in rabbit hearts. Cardiovasc Pathol 2002;11:339-45). 본 연구에 있어서, 관상 결찰이 수행된 지 4주 후, 실험 대상인 토끼의 좌심실에 상처 조직이 형성되는 것은 ECG 20과 기타 유사한 연구에서 확대된 Q파가 관찰되는 것과 부합한다(Gonzalez GE, Palleiro J, Monroy S, Perez S, Rodriguez M, Masucci A et al. Effects of the early administration of losartan on the functional and morphological aspects of postmyocardial infarction ventricular remodeling in rabbits. Cardiovasc Pathol 2005;14:88-95; and Connelly CM, Vogel WM, Wiegner AW, Osmers EL, Bing OH, Kloner RA et al. Effects of reperfusion after coronary artery occlusion on post-infarction scar tissue. Circ Res 1985;57:562-77). 앞서, 조영제 1은 래트, 토끼 및 돼지에서 관상 결찰과 허혈 재관류 손상에 의해 유도되는 급성 심근 허혈과 괴사 발생 영역을 확인시켜줄 수 있다고 입증된 바 있다(Yu M, Guaraldi MT, Mistry M, Kagan M, McDonald JL, Drew K et al.: a novel PET myocardial perfusion imaging agent. J Nucl Cardiol 2007;14:789-98l; Nekolla SG, Reder S, Saraste A, Higuchi T, Dzewas G, Preissel A et al. Evaluation of the novel myocardial perfusion positron-emission tomography tracer 18F-BMS-747158-02: comparison to 13N-ammonia and validation with microspheres in a pig model. Circulation 2009;119:2333-42; and Higuchi T, Nekolla SG, Huisman MM, Reder S, Poethko T, Yu M et al. A new 18F-labeled myocardial PET tracer: myocardial uptake after permanent and transient coronary occlusion in rats. J Nucl Med 2008;49:1715-22). 만성 MI 토끼 모델에서 행해진 본 연구에 있어서 조영은, 조영제 1을 사용하는 조영을 통해 만성 MI, 즉 ECG와 기타 연구에 의해 제안된 생성 가능 상처 조직을 확인할 수 있음을 명백하게 보여주었다. 정상인 래트와 개의 경우, 조영제 1의 미토콘드리아 복합체 I에 대한 친화도는 컸으며, 농도가 매우 높을 때(≥200㎍/㎏)에는 일시적인 임상 징후, 예를 들어 가쁘고 무리한 호흡, 활동성 감소, 구부정한 자세, 배뇨가 유도되었다(Mistry M, Onthank D, Green J, Cicio S, Casebier D, Robinson S et al. Toxicological Evaluation of BMS-747158, a PET Myocardial Perfusion Imaging Agent. The Toxicologist 2008;102:476). 그러나, 이와 같은 징후들은 선량이 100㎍/㎏ 이하일 때에는 관찰되지 않았다. 마취된 미처리 개의 경우, 조영제 1을 10㎍/㎏ 이하의 선량으로 정맥 내 주사할 때와 주사한 후에는 심혈관 변화(MAP, HR, 좌심실 수축 등)가 관찰되지 않았다(데이터는 공개하지 않음). 이는, 최대 임상학적 조영제 1의 선량이 0.07㎍/㎏ 이상일 때 안전성 한계가 더욱 커짐을 말해주는 것이다.
본 연구에 있어서, MAP, SAP 및 DAP의 기준치는 대조군 토끼에서보다는 MI 토끼에서 더욱 낮았는데, 이는 곧, 만성 MI가 상기와 같은 토끼들에 있어서 심혈관계의 기능을 방해한다는 것을 말해주는 것이다. 토끼 조영에 사용된 조영제 1의 선량은 임상학적 제제 중 약 0.5mCi/kg(3㎏의 토끼에 있어서 약 1.5mCi)인데, 이는 임상학적 선량보다 약 3배 많은 양이기도 하다(전체 휴식기 및 스트레스기때 투여(11회): 60㎏의 개체에 있어서 약 10mCi). 이와 같은 선량 조건과 심장 기능 장애가 발생하는 조건 하에서, 동맥 혈압, 심박수 및 ECG 파형은 변함이 없었다. 이러한 관찰 결과들은, 조영제 1을 사용하는 조영은 심장 기능 장애가 발생한 조건일 때조차도 안전하다는 것을 말해주는 것이다.
이와 같은 결과들은 조영제 1을 사용하여 심장 PET 조영을 하면 급성 심근 허혈 및 괴사 이외에도 만성 심근 경색(섬유증 및 상처 형성)이 확인됨을 보여 주었다. 조영제 1은 그것이 조영 선량 수준으로 투여되면 심장 기능 장애가 발생한 조건(적어도 토끼)에서 조차도 안전하게 사용된다.
실시예
31
이하 실시예는 래트에 있어서 조영제 1의 뇌 조영 및 혈뇌 장벽 투과도 평가에 대해 기술하고 있다. 동물과 사람을 대상으로 하는 PET 조영은, 조영제 1이 정상의 혈뇌 장벽(BBB)을 통과하여 CNS 질병을 조영할 수 있다는 것을 보여준다. 지금까지의 연구들은 조영제 1이 어떻게 효율적으로 BBB를 통과하는지에 대해서는 평가하지 않았다. 본 연구에서는 BBB가 파괴되었거나 파괴되지 않았을 때 래트의 뇌 내 흡수율을 비교하였다.
방법: 수컷 스프라그-돌리 래트를 소듐 펜토바비탈로 마취시킨 다음, 좌측 외경동맥(내경동맥 및 외경동맥 분지에 가까운 부분)에 캐뉼러를 꽂았다. 대조군으로서 염수를 사용하고, 고장 용액으로서는 25% D-만니톨을 사용하였을 때, 이것들 각각은 30초 동안 6마리의 동물에서 역행 관류되었다(0.3㎖/㎏/초). 이로부터 2분 경과 후, 약 1mCi의 조영제 1을 꼬리 정맥을 통해 주사하였으며, 뇌는 마이크로PET 카메라로 조영하였다(30분). 에반스 블루(evans blue)도 정맥 내 주사하였는데(2%, 5㎖/㎏), 에반스 블루 염색으로 BBB가 파괴되었음이 명백히 입증된 동물들만 본 연구에 포함시켰다. 조영 과정을 마친 후, 뇌를 수집하여 사진 촬영을 하고 좌측 및 우측 반구, 그리고 소뇌로 절개하였다. 조영제 1의 조직 내 방사능 양은 감마 카운터로 측정하였으며, 에반스 블루 수준은 형광도법으로 측정하여, 조직 1g당 주사된 선량%와 조직 1g당 에반스 블루 양(㎍)을 각각 산정하였다.
결과: 표 16을 참조하시오. 25%의 D-만니톨이 주사되었을 경우, 염수 투여 대조군에 비하여, 좌측 뇌 반구의 에반스 블루 흡수율은 눈에 띄게 증가하였으며(633%), 우측 뇌 반구의 에반스 블루 흡수율은 약간 증가하였고(216%), 소뇌의 에반스 블루 흡수율도 약간 증가하였다(186%). 정상 래트와 염수가 주사된 대조군 래트에 있어서, 투여 직후 뇌에는 조영제 1이 높은 수준으로 축적되었다. PET 조영은, 염수 대조군 래트에 있어서 조영제 1의 높은 흡수율은 오로지 BBB 파괴 후 뇌 영역에서 최소한으로 증가하였음을 보여 주었다.
조영제 1은 BBB 투과도가 높으며(이 투과도는 오로지 BBB 파괴 후 최소한으로 증가함), 또한 뇌 조영에 사용될 수 있다.
| 뇌 흡수율 | 우측 반구 | 좌측 반구 | 소뇌 | |||
| 대조군 | BBBD | 대조군 | BBBD | 대조군 | BBBD | |
| 에반스 블루 (㎍/g) |
19±2 | 60±8 | 21±2 | 154±13 | 29±4 | 83±12 |
| 조영제 1 (%ID/g) |
0.72± 0.03 |
0.81± 0.04 |
0.72± 0.03 |
0.93± 0.06 |
0.78± 0.03 |
0.95± 0.05 |
실시예
32
이하 실시예는, Tc-99m 세스타미비 SPECT보다 정도가 더욱 심하고 고도인 스트레스로 유발된 심근 허혈을 더욱 잘 확인할 수 있는, 18F 표지화 조영제 1 PET 심근 관류 조영에 관한 것이다. 본 연구에서, 휴식기-스트레스기 Tc-99m 세스타미비 SPECT와 조영제 1 PET MPI는, 스트레스 유발 심근 관류 이상의 평가 효능에 대해서 비교되었다.
방법: 동일 센터에서 소집한 13명의 환자들을 대상으로, 휴식기-스트레스기 Tc-99m 세스타미비 SPECT MPI, 휴식기-스트레스기 조영제 1 PET MPI 및 관상 혈관 조영 검사를 진행하였다. 각각의 환자에 있어서, 17개의 심근 분절을 대상으로 휴식 및 스트레스기 이미지에 대해 눈으로 스코어를 메겼다(기타 모든 결과에 대해 맹검 상태인 독립적 관찰자들에 의해 행해짐). 각각의 환자에 있어서, 분절 스코어(segmental score)로부터 합산 스트레스 스코어(SSS), 합산 휴식 스코어(SRS) 및 합산 차 스코어(SDS)를 구하였다. 각각의 관상 동맥이 좁아지는 %는 맹검 방식으로 평가되었으며, 관강 내 지름이 70%로 좁아지는 경우를 유의적인 것으로 간주하였다.
결과: 15개의 발병 관상 동맥; 즉, 좌측 전방 하행 관상 동맥 7개, 좌측 회선 관상 동맥 5개 및 우측 관상 동맥 3개가 사용되었다. 발병된 관상 동맥으로부터 유래하는 심근 분절의 경우, SSS와 SDS는 SPECT보다는 PET에서 유의적으로 높았다(표 17).
이와 같은 데이터는, 세스타미비 SPECT에 비해서, 휴식기-스트레스기 18F 표지화 조영제 1 PET MPI가, 발병 관상 동맥으로부터 유래하는 심근 영역 내에서의 정도가 더욱 심하고 고도인 스트레스로 유발된 관류 이상을 더욱 잘 확인할 수 있다는 것을 보여주었다.
| 조영제 1 PET | Tc-99m 세스타미비 SPECT | P 수치 | |
| SSS | 16.1±7.8 | 8.6±5.8 | <0.001 |
| SDS | 12.3±7 | 5.4±4.2 | <0.05 |
| SRS | 3.8±6.6 | 3.1±3.3 | NS |
실시예
33
이하 실시예는 99mTc 세스타미비 SPECT를 사용하였을 때와 조영제 1 PET를 사용하였을 때 심근 스트레스 관류 결손 평가 효능을 비교하는 것에 대해 기술하고 있다. 조영제 1을 심근에 흡수시켰을 때, 도달할 수 있는 유속 범위에 있어서 이 조영제 1의 심근 혈류와의 상관 관계가 99mTc 세스타미비의 심근 혈류와의 상관 관계보다 더욱 강함을 확인할 수 있었다. 조영제 1 PET와 99mTc 세스타미비 SPECT로 심근 관류 결손을 평가한 결과를 비교하였다.
방법 및 결과: 6개월 이내에 26명의 환자(남성 20명)들을 대상으로 SPECT와 PET를 수행하였다. PET은, 휴식기에는 조영제 1을 투여하여 수행하였고(2.9mCi 내지 3.9mCi), 이로부터 60분(n = 18) 또는 24시간(n = 8) 경과 후에는 운동 스트레스(n = 16) 또는 아데노신 스트레스(n = 10)를 가하고 조영제 1을 투여하여 수행하였다(7.3mCi 내지 8.6mCi). SPECT와 PET의 이미지 품질은 독립 맹검 판독자 2명의 합의에 따라서 평가하였다(평가 등급: 뛰어남(excellect), 우수(good) 또는 양호(fair)). SPECT 및 PET에 있어서 스트레스 및 휴식 관류 결손은 상기와 동일한 판독자들에 의하여 컴퓨터 보조 가시 해석(표준 분절 17개, 5점-스코어링 모델(0 = 정상; 4 = 흡수가 일어나지 않음))을 통해 평가하였다. 허혈의 정도와 중증도(합산 차 스코어(SDS))는 합산 스트레스 스코어(SSS)와 합산 휴식 스코어(SRS) 사이의 차이로부터 구하였다. PET 이미지 품질은 24명의 환자에 있어서는 뛰어났고, 2명의 환자에 있어서는 우수하였다. 이와는 대조적으로, SPECT에 의한 이미지 품질 연구에 있어서 7명은 뛰어났고, 18명은 우수하였으며, 1명은 양호하였다(p < 0.001). SPECT 결과가 비정상인(SSS ≥4) 14명의 환자에 있어서, 평균 SDS는 PET를 수행한 경우가 SPECT를 수행한 경우보다 더욱 컸다(9.6 ± 1.8 vs. 5.4 ± 0.7, p=0.02). SPECT 결과가 정상인(SSS < 4) 12명의 환자 모두에 있어서, PET 및 SPECT에 의한 SDS는 0이었다.
99mTc 세스타미비 SPECT에 비하여, 조영제 1 PET은 이미지 화질을 더욱 우수하게 만들었으며, SPECT 결과가 비정상인 환자에 있어서 SDS를 유의적으로 증가시켰다. 이와 같은 결과들은, 조영제 1을 사용하는 PET 조영이 SPECT 조영보다 심근 허혈 등급 평가 효능이 더욱 우수하다는 것을 보여주었다.
실시예
34
이하는 조영제 1 추적자를 사용하는 1일 휴식/스트레스 심근 관류(MP1) PET 조영에 대한 선량 주사 매개 변수의 심장 팬텀 시뮬레이션(cardiac phantom simulation)에 대하여 기술하고 있다. 조영제 1을 사용하는 MPI에 대한 1일 휴식/스트레스(RS) 프로토콜에서는 스트레스기 이미지에서 상호 오염(cross contamination)(CC)이 발생할 수 있었다. 팬텀 시뮬레이션은 일정 범위의 조건에 대해서 이미지 특징들에 대한 CC의 영향을 평가하기 위해 수행하였다.
방법: 정상 휴식기를 시뮬레이션하는 F18 팬텀(심근(M) = 0.21uCi/㎖ 및 간(L)=0.22)을, 30분 동안 지멘스 바이오그래프-64 PET/CT 상에서 스캔하였다. 이것을 세정하여 재충전하고 나서(이때 L은 0.42였고, 몸통은 0.09였으며, M은 0.9였고, 중격에서는 결손이 40%임), 30분 더 스캔하였다. 제2차 실험이 진행중인 환자들 12명의 SUV는 체감 시뮬레이션을 보증하는데 사용하였다. 등록된 RS 이미지들을 결합하여 투여율(DR = 1 ~ 5)과, RS 주사간 대기 시간(WT = 30 내지 120분)을 합하였을 때의 CC를 시뮬레이션하였는데, 이때, M-SUV, DR, 휴식 선량 붕괴 및 WT에 의해 결정되는 결합 계수(blending coefficient)를 이용하였다. 결합된 이미지 세트를 대상으로 결손 콘트라스트(DC)((SUVn-SUVd)/SUVn 적용), 결손 용량(DV)(결손의 픽셀값이 >(SUVn+SUVd)/2를 만족), 그리고 벽의 균일성(WU)(정상인 벽의 (SD/평균) 적용)을 각각 측정하였다. DC, DV 및 WU에 대한 분해율(<10%)을 적용하여 DR에 대한 최소 WT를 결정하였다.
결과: 임의의 형태의 스트레스에 대한 WU(<7.6%) 및 DV(<2%)는 임의의 조합에 의해 유의적으로 영향을 받지 않았다. DC 분해율은 DR, WT 또는 이것들 둘 다를 증가시킴으로써 허용 범위로 감소되었다.
실시예
35
이하는 신규 18F 조영제, 즉 조영제 1을 이용하는 고화질 심장 관류 PET에 대하여 기술하고 있다. 기술은, 재구성된 PET 이미지에 대한 신호-대-노이즈와 공간 해상도를 개선하지만(IEEE TMI 2006:25:7:907-921), 루비듐에 의해 방출되는 양전자의 열 경로는 82Rb 관류 이미지 생성에 있어서 이 기술의 이점을 제한한다. 상기 기술의 고해상도 심장 조영에 대한 완전한 잠재성을 평가하기 위해서, 신규 18F계 제제(조영제 1)를 사용하여 생성된 심근 관류 이미지를 이용하는 를 평가하였다.
방법: 조영제 1 관류 제제에 관한 연구에서 피험체 15명의 이미지를 4-링 지멘스 바이오그래프-64를 사용하여 수집하였다. 표준 재구성법(SR - 2D 감쇠 가중 순차 서브셋 기대 최대화) 및 를 이용하여, 정지 이미지 및 8-빈 ECG-동기화 이미지를 생성하였다. 벽(wall)/강(cavity) 콘트라스트와 콘트라스트-대-노이즈 비율(CNR), 그리고 결손 콘트라스트에 대한 최대치를 연산하였다. 3가지 상이한 높이(기저, 중간 및 정단)의 심장 벽 두께, 벽의 운동성, 벽의 비후화 여부 및 박출 계수(EF)도 자동화 정량법을 통해 추정하였다.
결과: 는 SR에 비하여 유의적인 콘트라스트 변화를 보여주었다 (+32.3±17.9%, p<0.05). 수행시 CNR도 또한 개선되었다(+26.7±22.3% vs. SR, p<0.05). 심근 내 최대값과 15명의 환자의 22개 결손 사이의 평균 콘트라스트는, SR의 경우(3.2±1.2, p<0.05)에 비하여, HD PET를 사용하였을 때(4.0±1.7) 증가하였다. 평균 벽 두께는 16:3±2.9㎜였으며, SR(기저, 중간 및 정단)은 16.7±2.9min 및 15.6±2.2min였던 것에 비하여, 의 경우에는 14.7±2.8㎜, 14.1±3.0min 및 13.0±1.7mm임이 확인되었다(p<0.05). EF, 벽의 운동성과 벽의 비후화는 를 수행하여 확인한 결과 그다지 큰 차이를 보여주지는 않았다.
결론: 조영제 1을 사용하는 관류 연구는, 재구성법을 수행하였을 때의 이미지 해상도, 콘트라스트 및 콘트라스트-대-노이즈가 표준 재구성 기술을 수행하였을 때보다 유의적으로 개선됨을 보여 주었다.
실시예
36
조영제 1 PET를 사용하는 추적자 동력학 모델링을 실행할 경우, 심근 혈류량(MBF)의 절대 정량법은 유속이 빠를 때 조차도 실행될 수 있는 것으로 보였다. 본 연구에서는, 예비력 및 SUV 산정치가 돼지 모델에서 관상 혈류 예비력(CFR) 평가에 적당한지 여부를 조사하였다.
방법: 9마리의 돼지들을 대상으로 동적 PET 조영을 수행하였다(휴식기 및 스트레스기, 조영제 1 100MBq 내지 200MBq). MBF는 조영제 1 PET 3-구획 모델링과 공동 주사된 미소구 둘 다를 이용하여 평가되었다. 예비력은 5분 내지 10분 및 10분 내지 20분 사이의 흡수율을 입력 함수를 적분한 값으로 나누어 산정하였다. 동일한 시점에서의 표준 SUV 산정치도 사용하였다.
결과: MBF는 0.5㎖/min/g 내지 2.8㎖/min/g 범위에 있었다. 예비력 및 SUV 둘 다와, 조영제 1 및 미소구 MBF의 상호 관계는 우수하였다(5min 내지 10min: 예비력의 경우, r=0.69, p<0.05 및 0.69, p<0.05이었으며, SUV의 경우, r=0.86, p<0.001 및 0.88, p<0.001이었음). 선형 회귀 분석 결과, 초기의 간격에 대해서만 우수한 결과가 얻어지며(예비력의 경우, y=8.27x+1.45 및 7.11x+3.63이었으며, SUV의 경우, 1.11x+0.01 및 0.99x+0.26이었음), 후기 간격에서는 과소 평가된 결과를 얻었다. 예비력과 SUV에 대한 스트레스/휴식 비율의 산정 결과를 이용하여 CFR을 평가할 수 있었다. 예비력 및 SUV 유래 CFR와, 조영제 1 및 미소구 CFR 둘 다를 일치시킴으로써, 초기 간격의 평균 차(보통 정도, 예비력의 경우, 0.1 및 -0.05였으며, SUV의 경우, 0.05 및 -0.09였음)와 후기 간격의 편차(더욱 큼, 예비력의 경우, -0.47 및 -0.62였으며, SUV의 경우 -0.4 및 -0.54였음)를 구하였다.
조영제 1을 사용하여, 간편화된 동력학적 분석 모델(MBF 지수 및 CFR 평가용)을 구현할 수 있었다. 뿐만 아니라, SUV 유래 수치들은 조영 장치 외부에서 행해지는 추적자 주사에 적합하여, 물리적 스트레스 테스트를 수행할 수 있었다. 이와 같은 결과들은 통상의 임상학적 세팅에 있어서 간편화 정량 연구의 기초를 제공하였다.
실시예
37
이하 실시예는 도 3에 보인 반응식에 따라서 조영제 전구체 1을 합성하는 과정을 기술하고 있다.
실시예
37A
2-(t-부틸)-4,5-디클로로피리다진-3(2H)-온(화합물 11)의 합성
상온에서, 고체인 t-부틸 히드라진 하이드로클로라이드(1당량)를, 10% 물/톨루엔 혼합물(6vol) 중에 용해된 수산화 나트륨(0.95당량)의 교반된 용액에 첨가하였다. 결과로 생성된 백색의 현탁액을 약간 냉각시켰으며, 이때, 뮤코 염소산(1당량)을 천천히 첨가하였다. 첨가를 마친 후, 반응 혼합물을 상온에서 20분 내지 30분 동안 교반한 다음, 아세트산(0.95 당량)을 적가하였다. 출발 물질이 소모될 때까지(HPLC로 확인 가능함) 반응 혼합물을 45℃ 내지 50℃로 가열하고 18시간 동안 교반하였다. 반응 용액을 상온으로 냉각시키고 나서, 물(약 7vol)로 희석하였더니 유기 층이 분리되었다. 이 유기층을 0℃로 냉각시키고 30% NaOH(3.6vol)로 세정한 후, 35% HCl(3.6vol) 및 물(2×3.6vol)로도 세정하였다. 유기 용액을 진공 하에서 농축시키고, 메탄올(1.5vol)로 다시 스트리핑한 결과, 갈색 고체인 화합물 11이 생성되었는데, 이 화합물 11을 35℃의 진공 하에서 건조시켰다(수율 = 65% 내지 75%, HPLC에 의한 순도 = 100%).
실시예
37B
2-(t-부틸)-4-클로로-5-((4-(하이드록시메틸)벤질)옥시)피리다진-3(2H)-온(화합물 13)의 합성
무수 디메틸포름아미드(780㎖) 중 화합물 11(222g) 용액을 무수 디메틸포름아미드(2.22ℓ)(65℃로 가열) 중 1,4-페닐렌디메탄올(화합물 2, 690g) 및 탄산 세슘(1.3㎏)의 교반된 혼합물에 천천히 첨가하였다. 반응물이 냉각 및 여과될 때, 생성된 혼합물을 4시간 더 교반하였다(65℃). 여과물을 5% 염수로 희석하고 나서 톨루엔으로 추출하였다. 합한 톨루엔 추출물들을 5% 염수로 2회 세정하고, 유기물은 감압 하에서 농축시켰다. 생성된 미정제 물질을 고온의 메탄올/물 혼합물로부터 결정화하여 여과하고 나서, 메탄올/물로 세정하고, 진공 하에서 건조시킨 결과(40℃ 내지 45℃), 회백색 분말인 화합물 3(224g)이 생성되었는데(수율 = 69%), 이 경우, 상기 분말은 화합물 12 및 화합물 11의 디알킬화 생성물 6%로 오염되어 있었다.
실시예
37C
5-((4-(브로모메틸)벤질)옥시)-2-(t-부틸)-4-클로로피리다진-3(2H)-온(화합물 14)의 합성
건조된 용기를 무수 디클로로메탄(670㎖)과 화합물 13(224g)으로 충전하였다. 디클로로메탄(345㎖) 중 삼브롬화 인의 1.0M 용액을 25℃에서 30분에 걸쳐 상기 혼합물에 첨가하고 나서, 이 용액을 30분 더 교반하였다. 반응물을 디클로로메탄(450㎖)과 물(670㎖)로 희석하였더니, 층들이 분리되었는데, 이 층들 중 수성 상을 디클로로메탄(670㎖)으로 추출하였다. 합한 유기 층들을 5% 염수로 2회 세정하고, 진공 하에서 농축시킨 다음, 40℃의 진공 하에서 34시간 동안 건조시킨 결과, 회백색 고체인 화합물 14(258g, 수율 = 96%)가 생성되었다.
실시예
37D
2-(t-부틸)-4-클로로-5-((4-((2-하이드록시에톡시)메틸)벤질)옥시)피리다진-3(2H)-온(화합물 15)의 합성
에틸렌 글리콜(2.9ℓ)을 건조 용기에 충전시킨 다음, 이를 고체 t-부톡시화 칼륨(74g)으로 처리하였다. 현탁액을 60℃로 가열하여 용액을 만든 다음 이를 20℃ 내지 25℃로 냉각시켰다. 무수 THF(1.45ℓ) 중 화합물 14(290g) 용액을 교반중인 글리콕시화 에틸렌 용액에 1부씩 첨가하였다. 그 결과로 생성된 혼합물을 60℃로 가열한 후 이 온도에서 16.5시간 동안 교반하고 나서, 25℃로 냉각시키고, 물(2.9ℓ)과 톨루엔(4.35ℓ)으로 희석하였다. 유기 층이 분리되었는데, 이 유기 층을 물로 3회 세정한 다음 진공 하에서 농축시켰다. 톨루엔(4.35ℓ)을 더 충전하여 첨가한 다음 진공 하에서 다시 농축시킨 결과, 점성의 갈색 오일인 미정제 화합물 15(260g, 수율 = 95%)가 생성되었다.
미정제 화합물 15(690g)를 디클로로메탄(0.5㎏/ℓ) 중에 용해시키고 나서 크로마토그래피(실리카 컬럼, 헵탄/아세트산 에틸 = 1:1, 유속 = 6ℓ/분, 10ℓ 분획)로 정제하였다. 합한 분획들을 합하여 진공 하에서 농축시킨 결과, 투명하고 점성인 오일(520g, 수율 = 70%)인 화합물 15가 생성되었다.
실시예
37D-1
이하 실시예는 실시예 37D에 대한 대안인 합성법을 이용하여 화합물 15를 합성하는 것에 관하여 기술하였다. 깨끗하고 건조한 반응기로서 오버헤드 교반기와 온도 프로브가 장착된 반응기에 무수 에틸렌 글리콜(2900㎖)을 충전시킨 다음, t-부톡시화 칼륨(42.2g)을 충전시켰다(상온). 상기 용액을 55℃ 내지 60℃로 가열한 결과 투명한 글리콕시화 에틸렌 용액이 생성되었으며, 이후 비활성 대기 하에서 이것을 20℃ 내지 30℃로 냉각시켰다. 이 용액을 총 염기 함량에 대해 분석하였다. 상온에서, 별도의 용기에 무수 테트라하이드로푸란(725㎖)과 화합물 14(145g)을 충전하여 교반한 결과, 용액이 생성되었다. 20℃ 내지 30℃에서 글리콕시화 에틸렌 용액에 이 용액을 1부 직접 첨가하였다. 혼합물을 60℃로 가열한 다음, 이 온도에서 교반하였다. 반응이 종결되었을 때, 상기 혼합물을 20℃로 냉각시킨 다음, 여기에 톨루엔(2200㎖)과 물(2200㎖)을 첨가하고 나서 교반하여 침강되도록 방치한 결과, 2개의 층이 형성되었다. 층들이 분리되었는데, 이 중 유기 층을 중탄산 나트륨 용액과 물 2200㎖ 각각으로 세정하였다(2회). 진공 하 50℃ 이하의 온도에서 유기 층을 농축시킨 결과, 점성 오일인 화합물 15(133.4g, 잔류 톨루엔에 대해 보정하였을 때 91%)가 생성되었다.
실시예
37E
콘트라스트 제제 전구체 1의 합성
건조 반응기에 디클로로메탄(6.6ℓ), 디클로로메탄(1.1ℓ) 중에 용해된 화합물 15(510g), 트리에틸아민(0.25ℓ), 염화 p-톨루엔설포닐(305g) 및 디메틸아미노피리딘(7g)을 연속 충전하였다. 용액을 상온에서 28시간 동안 교반하였는데, 이때, 이 용액을 1.0M HCl(2×10ℓ), 물(10ℓ), 5% 중탄산 나트륨(2×10ℓ), 그리고 물(10ℓ)로 세정하였다. 유기 용액을 여과한 다음, 감압 하에서 디클로로메탄을 제거한 결과, 진한 오일인 조영제 전구체 1이 생성되었다.
미정제 조영제 전구체 1(21.5g)을 큐멘(125㎖)에 첨가하고 나서 60℃로 가열하여 고체를 용해시켰다. 이것을 40℃로 냉각시키고, 1%w/w의 조영제 전구체 1 결정을 첨가하여 결정화 시드를 마련하였다. 이 용액을 35℃에 3시간 동안 방치하여 결정화를 개시한 후, 상온으로 냉각시키고 나서 6시간 동안 교반하여 결정화를 마쳤다. 고체를 여과하고, 진공 하에서 간단히 건조시킨 후, 아세트산 이소부틸(125㎖)에 첨가하였다. 70℃로 가열하여 고체를 용해시킨 후, 용액을 40℃ 내지 50℃로 냉각시키고 나서 1%w/w의 조영제 전구체 1로 시딩(seeding)하였다. 40℃ 내지 50℃에서 5시간 동안 방치한 다음, 2시간에 걸쳐 슬러리를 상온으로 냉각시키고 다시 12시간 동안 방치하여 두었다. 결과로 생성된 고체를 여과하고, 냉각 아세트산 이소부틸로 헹군 후, 진공 하에서 건조시킨 결과, 조영제 전구체 1(화합물 15로부터 생성, 60%) 12.8g이 생성되었다.
몇몇 경우에 있어서, 트리에틸아민 화학 양론 수치를 약 1.15 당량에서 약 1.40 당량으로 상승시켰다. 몇몇 경우에 있어서, 염화 p-톨루엔설포닐 화학 양론 수치를 약 1.15 당량에서 약 1.20 당량으로 상승시켰다. 몇몇 경우에 있어서, 디메틸아미노피리딘 화학 양론 수치를 약 0.04 당량에서 약 0.10 당량으로 상승시켰다.
몇몇 구체예에서, 큐멘 결정화는 다음과 같은 조건일 때 종결시켰다: 희석: 10.0 용량; 시딩 온도: 45℃; 시딩 온도에서의 결정화 지속 시간: 3시간; 냉각 속도: 5℃/h; 과립화 온도: 20℃; 과립화 시간: 3시간 초과; 여과 온도: 20℃.
다른 구체예에서, 큐멘 결정화는 다음과 같은 조건일 때 종결시켰다: 희석: 6.5 용량; 시딩 온도: 50℃; 시딩 온도에서의 결정화 지속 시간: 6시간; 냉각 속도: 10℃/h; 과립화 온도: 10℃; 과립화 시간: > 8시간; 여과 온도: 10℃.
임의의 구체예에서, 화합물 16(20.0g)은 큐멘(6.5 용량) 중에 현탁하였으며, 이후 68℃로 승온시켰다. 그 결과 생성된 용액을 50℃로 냉각시키고 나서, 화합물 16으로 시딩한 결과; 침전물이 천천히 생성되는 것이 관찰되었다. 생성된 현탁액을 50℃에 6시간 동안 방치한 후, 10℃로 냉각시키고 나서(10℃/h), 이 상태를 12시간 동안 유지시킨 다음, 여과 및 세정하였다. 60℃에서 진공 건조시킨 결과, 화합물 6이 16.4g 생성되었다(회수율 = 82%; 96% 용매 및 순도 조정).
몇몇 구체예에서, 아세트산 이소부틸 결정화는 다음과 같은 조건 하에서 수행되었다: 희석: 8 용량; 시딩 온도: 50℃; 시딩 온도에서의 결정화 지속 시간: 3시간; 냉각 속도: 시간 당 5℃; 과립화 온도: 20℃; 과립화 시간: > 10시간; 여과 온도: 20℃.
다른 구체예에서, 아세트산 이소부틸 결정화는 다음과 같은 조건 하에서 수행되었다: 희석: 5 용량; 시딩 온도: 48℃; 시딩 온도에서의 결정화 지속 시간: 10시간; 냉각 속도: 2.5℃/h; 과립화 시간: 0시간; 여과 온도: 10℃.
임의의 구체예에서, 큐멘 결정화된 화합물 16(15.40g)을 아세트산 이소부틸(5 용량) 중에 현탁시키고 나서 68℃로 승온시켰다. 생성된 용액을 48℃로 냉각시킨 후 BMS-747155-01(0.1%w/w)로 시딩한 결과; 곧 바로 침전물이 생성되는 것이 관찰되었다. 생성된 현탁액을 10시간 동안 48℃에 방치한 다음 10℃로 냉각시키고 나서(2.5℃/h), 여과 및 세정하였다. 60℃에서 진공 건조시킨 결과, 화합물 16(13.10g)(85% 회수)이 생성되었는데, 이는 모든 조건을 충족하는 것이었다.
실시예
38
이하 실시예는 도 4에 보인 바와 같은, 2-(t-부틸)-4-클로로-5-((4-(하이드록시메틸)벤질)옥시)피리다진-3(2H)-온(화합물 13)을 합성하는 대안적인 경로에 대해 기술하고 있다.
실시예
38A
2-(t-부틸)-4-클로로-5-하이드록시피리다진-3(2H)-온(화합물 17)의 합성
건조 용기에 화합물 11(100g), 수산화 칼륨(76.1g) 및 에틸렌 글리콜(1ℓ)을 연속 충전하면서 교반하였다. 생성된 현탁액을 115℃로 가열하고 나서 이 온도에서 5시간 동안 교반하였다. 갈색 용액을 0℃로 냉각한 다음, 여기에 1M 염산 용액(1ℓ)을 천천히 첨가하면서 교반하였는데(60분에 걸쳐 수행), 이때, 첨가시 온도는 25℃ 미만으로 유지시켰으며, 그 결과, 밝은 갈색의 고체가 침전되었다. 슬러리를 2시간 동안 교반하고 여과하였는데, 이때 생성된 케이크를 냉수(4×500㎖) 및 에탄올(100㎖)로 세정하였다. 이렇게 얻은 미정제 화합물 17을 이후 고온의 에탄올(1ℓ)로부터 재결정화한 후, 여과하고 나서, 진공 하에 건조시킨 결과(34시간, 45℃), 순수한 화합물 17(68.3g, 75% 수율)이 생성되었다.
실시예
38B
벤조산 메틸 4-(((1-(t-부틸)-5-클로로-6-옥소-1,6-디하이드로피리다진-4-일)옥시)메틸)(화합물 18)의 합성
질소 대기 하의 건조 용기를 화합물 17(66g), 디메틸포름아미드(660㎖) 및 탄산 칼륨(45g)으로 연속 충전하였다. 여기에 4-(브로모메틸)벤조산 메틸(78g)을 첨가하고, 생성된 현탁액을 20℃에서 18시간 동안 교반하였다. 30분에 걸쳐 물(700㎖)을 첨가하여 생성물을 침전시키고, 잔류 염을 용해시켰다. 슬러리를 1.5시간 동안 교반하고, 생성된 고체를 여과한 다음, 물(4×300㎖) 및 시클로헥산(2×150㎖)으로 세정하여, 진공 및 45℃에서 건조시킨 결과, 백색 분말인 화합물 18(112.8g, 99%)이 생성되었다.
실시예
38C
2-(t-부틸)-4-클로로-5-((4-(하이드록시메틸)벤질)옥시) 피리다진-3(2H)-온(화합물 13)의 대안적 합성
건조 질소 대기 하에서 오버헤드 교반 장치가 장착된 건조 용기를, 2-메틸테트라하이드로푸란(500㎖) 및 화합물 18(50g)로 충전하였다(상온). 생성된 현탁액을 -7℃로 냉각시키고, 톨루엔 중 수소화 디이소부틸알루미늄 용액(1.5M, 119㎖)을 1시간에 걸쳐 적가하였는데, 이때 온도는 3℃ 미만으로 유지시켰다. -5℃ 내지 0℃에서 1.5시간 동안 교반한 후, 프로판-2-올(50㎖)을 일정 속도로 첨가하여 반응물을 급랭시킨 다음 온도를 4℃ 미만으로 유지하였다. 이후, 급랭된 반응 혼합물을 75분에 걸쳐 염산 용액(2M, 500㎖)에 적가하였는데, 이때 온도는 7℃ 미만으로 유지시켰다. 2상 용액을 22℃로 승온시켰더니 층들이 분리되었다. 이후, 유기 층을 각각의 2M 염산, 포화 중탄산 나트륨 용액 및 물 500㎖로 세정한 다음, 감압 하에서 농축시킨 결과, 회백색 고체인 미정제 화합물 13(42.4g)이 생성되었다. 이는 고온의 아세트산 이소프로필(200㎖)로부터 재결정화되었는데, 이때, 용액의 시딩은 65℃에서 진행되었고, 이 온도를 1시간 동안 유지시켰으며, 이후, 4시간에 걸쳐 0℃로 냉각시켰다. 생성된 백색의 고체를 여과하고 진공 및 45℃에서 건조시킨 결과, 화합물 13(35g, 수율 = 76%)이 생성되었다.
몇몇 경우에 있어서, 전술한 실험은 수소화 리튬 알루미늄과 수소화 나트륨 비스(2-메톡시에톡시)알루미늄(레드 Al), 그리고 수소화 디이소부틸알루미늄(DIBAL-H)을 사용하여 진행하였다. 몇몇 경우에 있어서, 디클로로메탄, 톨루엔 및 헥산 중 DIBAL-H 용액을 사용하였다. 몇몇 경우에 있어서, 2-MeTHF(대 THF)를 보조 용매로서 선택하였는데, 이유는 상기 2-MeTHF의 수용해성이 작기 때문이었다. 몇몇 경우에 있어서, 스트레스 연구 결과, DIBAL은 특히 -15℃ 내지 +10℃의 온도에서 환원이 잘 된다는 것이 밝혀졌다. 몇몇 경우에 있어서, DIBAL-H를 2부 충전시켰는데, 만일 반응이 불완전하게 진행되는 것으로 관찰되면 추가의 시약을 첨가하여 2.20당량으로 만들었다. 몇몇 경우에 있어서, 잔류하는 물은 가수 분해된 DIBAL-H를 포함하며 불순물 프로필은 바뀌지 않고 유지되는 것으로 확인되었다.
몇몇 구체예에서, 반응은 다음과 같은 조건 하에서 진행되었다: -15℃ 내지 +10℃; 약 2.35당량 이하의 DIBAL-H; 전구체 중 5%(w/w) 이하의 H2O; < 0.75%의 전구체가 완전히 전환된 상태로 유지됨.
실시예
39
이하 실시예는 도 5에 보인 바와 같은, 2-(t-부틸)-4-클로로-5-((4-((2-하이드록시에톡시)메틸)벤질)옥시) 피리다진-3(2H)-온(화합물 15)의 대안적 합성 경로에 대해 기술하고 있다.
실시에 39A
벤조산 메틸 4-(1,3-디옥솔란-2-일)(화합물 19)의 제조
4-포르밀벤조산 메틸(3.28g, 20.0mmol)을 에틸렌 글리콜(4.46㎖, 80.0mmol) 중에 현탁한 다음, 이를 22℃에서 오르토포름산 트리에틸(3.66㎖, 22.0mmol) 및 Me3NPhBr3(376㎎, 1.00mmol)으로 연속 처리하였는데; 5분 이내에 고체가 모두 용해되었다. 생성된 오렌지색 용액을 0.5시간 동안 교반한 다음, 포화 수성 NaHCO3(50㎖)로 희석하고 나서, 분리 깔대기로 옮기고, EtOAc로 세정하였다(3×50㎖). 합한 EtOAc 세정물을 MgSO4 상에서 건조시킨 다음, 진공 하에 여과 및 농축시킨 결과, 무색의 오일이 생성되었다(4:1 펜탄/EtOAc 중 R f 0.4, KMnO4). 이 물질은 추후 추가의 정제 과정 없이 환원 단계에서 사용되었다.
실시예
39B
(4-(1,3-디옥솔란-2-일)페닐)메탄올(화합물 20)의 제조
미정제 아세탈(이론상 20.0mmol)을 무수 THF(100㎖) 중에 용해시키고 나서, 0℃로 냉각시킨 다음, LiAlH4(20.00mmol; THF 중 1.0M 용액 20.00㎖)로 처리하였다(유속 = 1.0㎖/분, 시린지 펌프 사용). 첨가 과정을 마치자, H2O(800 ㎕)를 조심스럽게 첨가하였을 때 과량의 LiAlH4가 소모되었다. 주의: 가스가 격렬하게 발생함! 생성된 백색의 현탁액을 15% 수성 NaOH(800㎕)와 H2O(2.40㎖)로 연속 처리한 다음, 0.5시간 동안 교반하여 순백색의 슬러리를 만들었다. 셀라이트 패드를 통해 여과하여 고체를 분리한 후, Et2O로 철저히 세정하였다. 합한 여과물을 진공 하에서 농축시킨 결과 무색의 오일이 생성되었으며, 이를 실리카 상 크로마토그래피(50×175㎜)(1:1 펜탄/EtOAc)로 정제하였다. 주 생성물 피크(470㎖ 내지 790㎖ 용리 시점)를 나타내는 분획을 수집하여 풀링하고, 진공 하에서 농축시킨 결과, 무색의 오일이 생성되었는데, 이를 냉동고에서 고화시켰다(2.46g, 13.7mmol; 2단계에 걸쳐 68.3%)
실시예
39C
(4-(1,3-디옥솔란-2-일)페닐)메탄올(화합물 20)의 합성
무수 톨루엔(50.0㎖) 중에 4-포르밀벤조산 메틸(4.92g, 30.0mmol)을 용해시키고, 이를 에틸렌 글리콜(1.84㎖, 33.0mmol) 및 p-TsOH·H2O(57.1㎎, 0.30mmol)로 연속 처리한 후, 딘-스타크(Dean-Stark) 조건 하에서 환류 가열하였는데; 이로부터 1시간 이내에 아세탈 형성이 종결되었다. 이후, 용액을 22℃로 냉각시키고 수소화 나트륨 비스(2-메톡시에톡시)알루미늄(45.0mmol; 톨루엔 중 70.3wt% 용액 12.7㎖)으로 처리하였다(시린지 펌프 사용, 유속 = 0.5㎖/분). 주의: 가스가 격렬하게 발생함! 첨가를 마쳤을 때, 생성된 용액을 0℃로 추가로 냉각시키고, 이를 K,Na-타르타르산염(100㎖)의 포화 수용액으로 조심스럽게 처리한 다음, 1시간 동안 격렬하게 교반하였더니; 투명한 용액이 안정적으로 생성되는 것이 관찰되었다. 이후, 생성된 2상을 EtOAc(50㎖)로 희석하고 나서, 이를 원뿔형 깔대기로 옮겼더니, 층들이 분리되었다. 그 다음, 수성 층을 EtOAc로 세정한 다음(3×50㎖), 합한 EtOAc와 톨루엔 용액을 MgSO4 상에서 건조시키고 나서, 진공 하에서 여과 및 농축시킨 결과 무색의 오일이 생성되었다. 이후, 미정제 생성물을 실리카 상 크로마토그래피(50×135㎜)(1:1 펜탄/EtOAc)로 정제하였다. 주 생성물 피크(425㎖ 내지 725㎖ 용리 시점)를 나타내는 분획을 수집하여 풀링하고, 진공 하에서 농축시킨 결과, 무색의 오일이 생성되었는데, 이를 냉동고에서 고화시켰다(4.50g, 2단계에 걸쳐 83.2%)
실시예
39D
2-(t-부틸)-4-클로로-5-[(4-(1,3-디옥솔란-2-일)페닐)메톡시]-2-하이드로피리다진-3-온(화합물 21)의 합성
무수 DMF(12.5㎖) 중 2-(t-부틸)-4,5-디클로로-2-하이드로피리다진-3-온(829㎎, 3.75mmol) 및 화합물 10(451㎎, 2.50mmol)의 용액을 Cs2CO3(1.63g, 5.00mmol)(1부)로 처리하였다(22℃). 이후, 생성된 현탁액을 예비 가열한 오일조(65℃)에 담근 후, 6시간 동안 계속 격렬하게 교반하였다. 현탁액을 상온으로 냉각시킨 후, 이 현탁액을 EtOAc 및 H2O(각각 50㎖) 사이에 분배하고 나서, 원뿔형 깔대기로 옮겼더니 층들이 분리되었다. 잔류하는 수성 층을 추가의 EtOAc로 세정한 다음(3×50㎖) 따라내었다. 합한 EtOAc 용액들을 포화 수성 NaCl로 추가 세정한 다음(5×50㎖), MgSO4 상에서 건조시키고, 진공 하에서 여과 및 농축시킨 결과, 회백색 고체가 생성되었다. 몇몇 경우에 있어서는, 소 용량의 펜탄 몇 가지로 분쇄하여 고체를 생성시켰다. 이후, 미정제 생성물을 고온의 EtOAc/헥산으로부터 재결정화한 결과, 무색의 바늘 형태 물질이 생성되었는데, 이 바늘 형태의 물질을 공극도가 중간 정도인 소결 유리 깔대기로 수집하여 펜탄으로 철저히 세정하고 진공 하에서 건조하였다(573㎎, 62.8%).
실시예
39E
2-(t-부틸)-4-클로로-5-[(4-(1,3-디옥솔란-2-일)페닐)메톡시]-2-하이드로피리다진-3-온(화합물 21)의 합성
(4-(1,3-디옥솔란-2-일)페닐)메탄올(20g, 110mmol), 염화 벤질트리에틸암모늄(2.27g, 10mmol), 톨루엔(100㎖) 및 수산화 나트륨(수 중 50%, 22㎖, 420mmol)으로 충전된 용기에, 톨루엔(100㎖) 중 2-(t-부틸)-4,5-디클로로-2-하이드로피리다진-3-온(22.1g, 100mmol) 용액을 5분에 걸쳐 첨가하였다. 점진적이고 가속적으로 발열이 되어 최종 내부 온도가 39℃가 되었다. 2.5시간 경과 후, 교반을 멈추고 MTBE(50㎖) 및 물(100㎖)을 첨가하였다. 상들이 분리되었는데, 이 상들 중 유기층은 물(100㎖)과 염수(100㎖)로 세정하였다. 유기 추출물을 건조(MgSO4), 여과, 및 진공 하에서 농축시킨 결과, 황갈색 고체(39g)가 생성되었다. 이 고체를 톨루엔/헵탄(430㎖, 1:1) 중에서 슬러리화하고 나서(40℃, 2시간), 상온으로 냉각시킨 다음, 진공 하에서 여과 및 건조시켰다(40℃, 24시간)(29.7g, 69%).
실시예
39F
2-(t-부틸)-4-클로로-5-({4-[(2-하이드록시에톡시)메틸]페닐}메톡시)-2-하이드로피리다진-3-온(화합물 15)의 합성
무수 CH2Cl2(10.0㎖) 중 화합물 21(365㎎, 1.00mmol) 용액을 -40℃로 냉각시킨 후(드라이아이스/MeCN 조 사용), DIBAL-H(4.00mmol; CH2Cl2 중 1.0M 용액, 4.00㎖)로 처리하였다(유속 = 0.25㎖/분, 시린지 펌프 사용). 냉각조에 주기적으로 드라이아이스를 첨가하면서 이 용액을 1시간 동안 방치한 후, 이를 습윤 MeOH(1㎖)로 조심스럽게 처리하여 22℃로 승온시켰다. 생성된 용액을 EtOAc(20㎖)로 희석한 다음, 동 용량의 포화 수성 K,Na-타르타르산염으로 처리하고 나서, 1시간 동안 격렬하게 교반하였는데; 이때, 투명한 용액이 안정적으로 생성되는 것이 관찰되었다. 생성된 2상을 H2O(50㎖)로 추가 희석하였는데, 이를 원뿔형 깔대기로 옮겼더니, 층들이 분리되었다. 그 다음, 수성 층을 EtOAc로 세정한 다음(3×50㎖), 따라 내었다. 합한 EtOAc 세정액을 MgSO4 상에서 건조시키고, 진공 하에서 여과 및 농축시킨 결과, 무색의 오일이 생성되었다(1:1 펜탄/EtOAc 중 R f 0.2, KMnO4). 미정제 생성물을 실리카(30×190㎜) 상 크로마토그래피로 정제하였다(1:1 펜탄/EtOAc(250㎖) → 3:2 펜탄/EtOAc(500㎖)로서, 단계적으로 구배를 걸어줌). 415㎖ 내지 580㎖ 사이에 용리된 주요 생성물을 수집하고, 풀링하여 진공 하에서 농축시킨 결과, 무색의 오일(286㎎, 0.780mmol; 78%)이 생성되었다.
실시예
40
2-((4-(((1-(t-부틸)-5-클로로-6-옥소-1,6-디하이드로피리다진-4-일)옥시)메틸)벤질)옥시)에틸 4-메틸벤젠설폰산염(조영제 전구체 1)의 합성
건조 반응기를, 디클로로메탄(6.6ℓ), 디클로로메탄(1.1ℓ) 중에 용해된 화합물 15(510g), 트리에틸아민(0.25ℓ), 염화 p-톨루엔설포닐(305g) 및 디메틸아미노피리딘(7g)으로 연속 충전하였다. 용액을 28시간 동안 상온에서 교반하였는데, 이때, 이 용액을 1.0M HCl(2×10ℓ), 물(10ℓ), 5% 중탄산 나트륨(2×10ℓ) 및 물(10ℓ)로 세정하였다. 유기 용액을 여과하고, 디클로로메탄을 아세트산 에틸로 바꾸어 주었다. 이 용액을 0℃ 내지 5℃로 서서히 냉각시킨 결과, 고온의 1:1 헵탄/아세트산에틸(약 11ℓ)로부터 생성물이 결정화되었다. 생성된 고체를 여과하고, 냉각 아세트산 에틸/헵탄으로 세정하여 건조시킨 결과(진공 하, 40℃, 42시간 동안), 조영제 전구체 1(555g, 수율 = 77%)이 생성되었다.
실시예
41
이하는 조영제 1 심근 관류에 사용되는 것으로서, 표준화된 팬텀 절차를 이용하는 PET 및 PET/CT 스캐너의 원격 카메라 인증(RCQ)에 대하여 기술하고 있다.
당 업자들에게 알려져 있는 바와 같이, 의학 조영 임상 실험에 있어서, 카메라 인증은 각각의 임상 위치(CS)가 프로토콜을 수행할 수 있는 능력을 가지는지 여부를 평가함에 있어서 중요한 단계라고 할 수 있다. 몇몇 경우에서, 특정 위치 스캐너가 임상 실험에 사용될 수 있게 되기 위한 연구 조건을 충족하는지 여부를 효과적으로 확인할 수 있는 작업-특이적 팬텀 및 관련 인증 절차를 표준화하는 방법에 어려움이 따른다.
방법. 다양한 카메라를 사용할 때, 각각의 스캐너 모델에 맞추어 제작한 조영 매뉴얼을 활용하는 RCQ 절차는 CS에 대한 단계별 지침을 활용하였으며 또한 이를 따랐다. 저비용의 표준화된 것으로서, 2리터 들이 소다병을 사용하고, 아크릴 막대(L = 21㎝, D = 2㎝)가 캡 내부에 밀봉되어 있는 팬텀을 각각의 CS에 제공하였다(실시예 42에 더욱 상세히 기술되어 있음). 각 시스템에 있어서 이미지 데이터를 수집하고 현존하는 심장 등록 오류(MR) 보정 소프트웨어를 테스트하기 위해서, CS에 3mCi 내지 4mCi F18 용액을 주사하고, 이를 물이 충전된 팬텀에 가하였다. 필요할 경우 전화의 지원을 받아서 CS에 의해 RCQ 절차를 수행하였다. 모든 이미지 데이터는 조영 중심 연구소로 보내어 졌는데, 여기에서 정량적 조영 매개 변수의 관점에서 분석되었다. 성능이 수용 기준에 부합하지 않는 카메라를 가려내기 위한 최소의 성능 기준을 확립하였다. 그 결과를 표 18에 보였다.
| 동적 수집의 부합성 | 동기 수집의 부합성 | 동기 수집의 노이즈 변화 | 이미지 콘트라스트 | 공간 해상도 (㎜) |
이미지 균일성 |
교정 인자의 정확성 | |
| 전용 PET (MR 부재) |
93.36%± 2.72% |
98.25%± 1.88% |
19.94%± 6.18% |
0.91± 0.04 |
8.36± 1.40 |
2.58%± 0.86% |
64.62%± 20.00% |
| PET/CT (MR 부재) |
93.57%± 3.96% |
98.24%± 0.66% |
14.30%± 5.41% |
0.97± 0.03 |
6.77± 1.20 |
2.58%± 0.46% |
93.66%± 3.84% |
| PET/CT (MR 보정) |
93.70%± 3.60% |
98.05%± 0.91% |
16.02%± 4.44% |
0.95± 0.03 |
7.42± 0.75 |
3.18%± 0.56% |
94.37%± 2.87% |
| 최소 조건 | >85% | >85% | <25% | >0.9 | <10 mm | <5% | >90% |
결론. 표준화된 팬텀, 종합 조영 매뉴얼, 완전한 기술상의 지원과 원격 카메라 인증 절차가 통합되면, 중앙 집중 데이터 분석은 규모가 큰 임상 실험에서 PET 및 PET/CT 스캐너 성능을 평가하는데 효과적이고 비용 효율적인 방법이 될 수 있다.
실시예
42
이하 실시예는 PET 스캐너 표준화를 위한 저 비용의 재충전 가능한 팬텀에 관하여 기술하고 있다.
조영 방법과 스캐너 성능의 표준화 및 조화는 PET을 사용하는 임상 연구의 성공 여부를 좌우한다(예를 들어 실시예 41에 기술된 바와 같음). 일반적으로 이는, 팬텀이라고 불리는 테스트 대상(적당한 양의 방사성 물질이 로딩되어 있으며, 각각의 스캐너를 사용하여 동일한 방식으로 조영됨)으로 이루어질 수 있다. 필요에 따라서, 팬텀은 반감기가 긴 양전자 방출자가 매립되어 있는 고체 물질들 중 어느 하나로 구성될 수 있거나, 아니면 물과 반감기가 짧은 방사성 물질이 첨가되어 충전될 수 있다. 필요에 따라서는, 관찰된 조영 성능의 차이로 인하여, 방법을 수정하거나 장비를 개조하여, 사용된 모든 시스템들 간 화질의 균일성을 보장할 수 있다. 통상의 팬텀들, 즉 고체로 재충전 가능한 팬텀은 매우 비싸서, 다수의 위치에서 동시에 행해지는 평가에 드는 비용이 엄청나다. 본 실시예에 기술된 장치는 간편한 작업-특이적 팬텀(심장 PET용)으로서, 종래의 재충전 가능한 팬텀 가격의 약 1%에 해당하는 가격으로 구성될 수 있는, 용이하게 입수 가능한 물질을 이용하는 것이다. 통상의 화질 제어 기능이 결합될 때, 상기 팬텀은 PET 심장 임상 실험에 있어서 표준화를 위한 다수의 PET 및 PET-CT 시스템을 동시에 특성 규명할 수 있다.
재료 및 방법. 팬텀은 표준 2리터 들이 소다 병으로 구성되어 있다. 아크릴 플라스틱 막대(길이 = 8과 1/4인치, 지름 = 3/4인치)를 중앙에 배치한 다음, 이를 외부 나사를 이용하여 병 캡의 내부에 고정하였다. 최종적으로 나사를 조이기 전, 막대 말단과 캡 내부, 그리고 나사 헤드 아래에 있는 표면을, 글루(glue)로서 적당한 물질로 밀봉한 후, 팬텀의 누수 여부를 테스트하였다.
팬텀은 다음과 같은 방법으로 충전하였다:
1. 팬텀을 흡착성 표면에 놓거나, 또는 바람직하게 싱크대에 놓고, 팬텀의 상부까지를 수돗물로 충전하였다. 병에 흘러 들어가는 물의 유속을 늦추어 기포가 생성되는 것을 최소화하였다.
2. (캡에 부착된) 아크릴 막대를 소다 병에 완전히 삽입시킨 다음 캡을 조여 고정시켰다. 내용물이 전체적으로 흘러 넘치게 하여 내용물 일부를 팬텀으로부터 제거하였다. 이때, 팬텀이 눌리지 않도록 하는 것이 중요하였다. 나사를 풀어주어 캡이 헐겁게 되도록 만든 다음, 막대를 천천히 꺼내어 이 막대에 남아있는 물을 제거하고 다시 팬텀에 넣었다.
3. 깨끗한 시린지를 사용하여 팬텀으로부터 물 2㎖를 빼냈다.
약 10방울의 액체 비누를 팬텀에 첨가하여 FDG 또는 기타 F18 화합물이 병 또는 막대의 내부 표면에 부착되지 않도록 하였다. 팬텀을 30초 이상 위 아래로(즉 수직으로) 기울여 가면서 진탕시켜, 액체 비누가 고르게 분포하도록 하였다.
4. 시린지 내 18F 방사능(3mCi 내지 4mCi) 및 용량(수 ㎖)을 측정한 다음, 용량 및 분석 시간 등을 기록하였다.
5. 18F을 팬텀에 천천히 주사하고 나서, 시린지를 3회 격렬하게 흡출 및 흡인 하여, 잔류하는 방사성 물질을 시린지로부터 플러싱하였다.
6. 동일한 시린지를 사용하여 팬텀으로부터 일정 용량, 즉 시린지에 주사된 18F 용액 1㎖가 더하여진 용량의 액체를 조심스럽게 흡출하였다. 이로써, 막대를 교환할 때 용액이 넘치지 않도록 하였으며 또한 이 용액에 작은 기포를 포함시켜 혼합 과정이 가속화되도록 만들었다.
7. 시린지 내 18F 방사능을 측정하고, 방사능과 분석 시간을 기록하였다.
8. 막대를 팬텀에 다시 삽입하고, 캡을 손으로 조여 고정시켜, 이 캡이 확실하게 누수를 막아주도록 만들었다.
9. 팬텀 표면을 종이 타올로 닦아서 이 팬텀이 방사성 물질로 오염되었는지 여부를 검사하고 나서 종이 타올을 폐기하였다.
10. 이후, 평가될 임의의 조건 또는 수집 세팅 하에서 임의의 PET 스캐너를 사용하여 평가될 이미지 데이터를 수집하였다.
종래의 도구들을 사용하여, 생성된 이미지 데이터를 평가하였다. 아크릴 막대를 포함하지 않는 몇몇 슬라이스의 중심부 60%로 둘러싸인, 크기가 큰 관심 영역을 사용하여, 균일함의 정도와 교정 인자의 보정 여부를 확인할 수 있었다. 아크릴 막대를 포함하는 하나 이상의 슬라이스를 사용하는 관심 영역 분석은 또한 방사성 물질이 충전된 용량과 방사성 물질을 제외한, 아크릴 막대 내부 구역 사이의 콘트라스트를 측정하는데 사용될 수 있었다. 라인 프로필, 예를 들어 막대와 액체가 닿는 경계를 통합하여, 해상도를 평가하는데 사용할 수 있었다. 적당한 데이터 수집 과정을 통하여, 기타 다양한 인자들, 예를 들어 PET-CT 미스매치 보정의 교정 선형성(calibration linearity), 효능 및 정확도도 평가할 수 있었다.
실시예
43
이하 실시예는 래트에서 심근 경색이 일어난 후 좌심실의 생존 능력을 평가하기 위해 사용되는 조영제 1과 18F 플루오로데옥시글루코스(FDG)를 비교하는 것에 대해 기술하고 있다.
심장의 18F 플루오로데옥시글루코스(FDG) 조영은 심근의 생존 능력을 평가하는데 사용된다. 본 실시예는 정상 래트 및 심근 경색(MI) 래트의 좌심실내 생존 조직에 있어서, 조영제 1 조영으로 측정되는 생존 조직의 용적과 FDG 조영으로 확인되는 생존 조직의 용적을 비교하는 것에 관해 기술하고 있다.
방법. MI는, 30분 동안 관상 폐색 이후 재관류시킴으로써 래트 내에서 유도하였다. 재관류 수술 전, 수술 후 2일 경과시(초기 MI)와 4주 경과시(말기 MI)의 래트 내에서, 2일 간격으로 조영제 1(1mCi) 및 FDG(1mCi) 심장 조영을 수행하였다. 심장 흡수율이 증가하도록 만들기 위해서 글루코스 및 인슐린 투여 계획은 EDG 조영 전에 진행하였다. 이미지에서 생존하는 좌심실을 정량하였다(최대 방사능의 50% 이상에 해당하는 용량 측정에 의함).
결과. 대조군 래트에서, 조영제 1과 FDG 둘다를 사용하는 심장 조영은 명확히 규정된 좌심실 벽을 보여주었으며, 수술 전 좌심실 용적은 각각 1.17±0.04㎤ 및 1.11±0.07㎤로 측정되었다. 초기 및 말기 MI 래트에 있어서, 심근 결손 구역은 상기 제제 둘 다를 사용하여 조영하였을 경우 뚜렷하게 확인되었다. 조영제 1로 측정된 생존 좌심실 조직의 용적은 FDG로 측정된 생존 조직 구역의 용적보다 약간 컸다(0.94±0.01㎤ vs. 0.75±0.04㎤ 및 1.18±0.04㎤ vs. 0.99±0.09㎤, 초기 및 말기 MI). 뿐만 아니라, 조영제 1 조영은, 초기 및 말기 MI에 있어서 (재충전 없이) 주사한 후 20분 및 80분 경과시 확인 가능한 유사 좌심실 구역을 보여주었다. 본 실시예는, 인슐린 전처리를 수행할 필요 없이, FDG와 마찬가지로 조영제 1이 심근의 생존 능력을 평가하는데 사용될 가능성을 가진다는 것을 보여주었다.
실시예
44
이하는 정량적이고 지각된 결손의 중증도는 조영제 1 PET 심근 관류 조영과 비례한다는 것에 대하여 기술하고 있다.
조영제 1의 최소 휴식 선량을 확인하기 위하여, 기록 판독자가 분절 스코어를 1로 바꿀 확률을 50%로 만들, 결손 중증도의 최소 변화와 정상 심근의 카운트 관련 변화를 비교하였다. 이와 같은 제한이 결손의 중증도에 변화를 일으킬지 여부를 확인하기 위하여, 맹검 상태에서 이루어진 판독의 결과로부터 메긴 판독자 스코어와, 상응하는 정량적 결손의 중증도들을 비교하였다.
방법. SPECT 연구에 있어서 적어도 부분적으로 가역적인 결손 하나 이상에 대해 선택된 환자들을, 부분적으로는 조영제 1의 제2차 연구에 있어서 첫 번째 코호트로서 평가하였다. 휴식기 및 스트레스기 이미지는 맹검 상태인 판독자 3명으로 이루어진 패널에 의해 판독되었다. 17 분절 모델을 이용하여 처음에 20명의 환자들로부터만 얻은 휴식기 이미지 데이터로부터 구한 판독자 스코어를, 표준 심장 MPI 분석 소프트웨어(세다스 QPS)에 의해 산정된, 각각의 이미지에 있어서 최대 수치로부터의 감소율(%)과 비교하였다. 수치들을 이용하여 그래프를 작성하였으며, 선형 회귀법으로는 각각의 판독자로부터 얻은 데이터를 산정하였다(도 13 참조).
결과. 판독자 스코어 수치(%SD = 이미지 최대값의 약 20%) 각각에는 정량적 중증도 수치의 유의적 범위가 존재하는데, 데이터를 간편한 선형 회귀법을 이용하여 제대로 모델링한 결과, 판독자 1, 2 및 3 각각에 대한 R2 수치는 1.00, 0.978 및 0.984였다. 인터셉트 값(intercept value)은 각각 84.18%, 82.33% 및 84.96%였던 반면에, 기울기는 각각 -13.8, -9.86 및 -8.53이었다.
고찰. 이와 같은 결과들은, 적어도 조영제 1을 사용하면 정규 데이터베이스를 이용할 필요 없이, 최대값의 정량 계수와 간단한 선형 상관성을 이용하여, 판독자 반응을 추정할 수 있음을 암시하는 것이다. 평균 기울기(-10.7)을 기준으로, 판독자 스코어가 1점 바뀔 확률 50%는 정량적 중증도를 5.4% 변화시킨다고 추정할 수 있다.
실시예
45
이하 실시예는 제2차 임상 실험에서 스트레스 유도 심근 허혈의 중증도와 정도를 확인하기 위해서, 조영제 1 및 Tc-99m 표지화 SPECT 심근 관류 조영을 비교하는 것에 대하여 기술하고 있다.
이와 같은 제2차 다중심 연구에 있어서, 조영제 1 및 Tc-99m 표지화 SPECT 휴식기-스트레스기 MPI를, 관상 동맥 질환(CAD) 환자(Pt)에 있어 스트레스 유도 심근 관류 이상을 평가하기 위해 비교하였다.
방법: 21개 센터에서 모집된 84명의 환자로서, 중등도에서 고도의 CAD 예비 테스트 가능성을 나타내는 환자를 대상으로, 휴식기-스트레스기 Tc-99m 표지화 SPECT MPI, 조영제 1 PET MPI 및 관상 혈관 조영 검사를 수행하였다. 이 환자들의 평균 연령은 64.5세(범위: 36 ~ 85)였으며, 이들 중 68명은 남성이었다. 각각의 환자에 있어서, 17개의 심근 분절은 휴식기 및 스트레스기 이미지를 3명의 독립된 맹검 상태 판독자가 눈으로 확인하면서 스코어를 메겼다. 각각의 환자에 있어서, 분절 스코어로부터 합산 차 스코어(SDS)를 측정하였다. 각각의 관상 동맥이 좁아진 %를 정량적으로 그리고 맹검 상태에서 측정하였으며, 관강 지름의 50% 이상이 좁아진 경우를 유의적인 경우로 간주하였다. 84명의 환자들 중 52명은 CAD가 발병하였으며, 32명은 유의적이지 않은 CAD가 발병하였고 관상 동맥은 정상이었다.
결과. 52명의 환자에서는 105개의 발병 관상 동맥이 존재하였는데; 이것들 중 40개는 좌측 전방 하행 관상 동맥이었고, 30개는 좌측 회선 관상 동맥이었으며, 35개는 우측 관상 동맥이었다. 하나 이상의 발병 동맥을 가지는 환자에 있어서, 3명의 판독자에 의해 메겨진 평균(SD) PET SDS 스코어는 6.8(5.75) ~ 9.4(7.51)이었으며, 평균(SD) SPECT SDS 스코어는 4.1(4.75) ~ 5.7(6.51)이었다. PET 및 SPECT 간 SDS 스코어 차는 모든 판독자들에 있어서 통계학적으로 유의적이었다(p < 0.01). 복수 혈관 질환이 발병한 52명의 환자들과 다수의 판독자들 중, 조정된 평균 PET SDS 스코어는 조정된 평균 SPECT SDS 스코어보다 유의적으로 높았다(p < 0.001).
결론. 이와 같은 데이터들은, Tc-99m SPECT에 비하여, 휴식기-스트레스기 조영제 1 PET MPI가 발병 관상 동맥에 의해 공급되는 심근 영역에서 더욱 심각하고 과도한 스트레스로 유도된 관류 이상을 보여줌을 암시하는 것이었다.
실시예
46
이하 실시예는 관상 동맥 질환의 진단을 위한, 조영제 1 주사 PET 및 Tc-99m 표지화 SPECT 심근 관류 조영의 제2차 임상 비교에 대하여 기술하고 있다.
제2차 연구에서는, 조영제 1 주사의 임상학적 안전성을 평가하였으며, 이 주사의 관상 동맥 질환(CAD) 확인시의 진단 성능은 휴식기-스트레스기 Tc-99m 표지화 SPECT MPI와 비교하였다.
방법. 21개 센터에서 모집된 143명의 환자로서, 광범위한 CAD 예비 테스트 가능성을 나타내는 환자를 대상으로, 휴식기-스트레스기 Tc-99m 표지화 SPECT MPI 및 조영제 1 PET MPI를 수행하였다. 중등도에서 고도의 CAD 발병 가능성을 나타내는 환자 143명 중 84명을 대상으로 관상 혈관 조영 검사를 실시하였다. 이 환자들의 평균 연령은 64.5세(범위: 36 ~ 85)였으며, 이들 중 68명은 남성이었다. 각각의 관상 동맥이 좁아진 %는 맹검 상태에서 정량하였다. 84명의 환자들 중 52명은 CAD가 유의적으로 발병하였으며(관강 지름의 50% 이상이 좁아짐), 84명의 환자들 중 32명은 유의적이지 않은 CAD가 발병하였고 관상 동맥은 정상이었다. 각각의 환자에 있어서, 17개의 심근 분절은 휴식기 및 스트레스기 이미지를 3명의 독립된 맹검 상태 판독자가 눈으로 확인하면서 스코어를 메겼는데, 각각의 환자에 있어서 PET 연구와 SPECT 연구 둘 다에 대해 다수결 원칙에 의한 해석이 제공되었다. PET의 진단학적 성능은 ROC 분석을 이용하여 SPECT의 진단학적 성능과 비교하였다.
결과. 이미지들 중 유의적으로 높은 %를 나타내는 이미지는, PET vs. SPECT 스트레스기 이미지에 대해서는 “뛰어남” 또는 “양호”로서 등급이 메겨졌으며(99.2% vs. 88.8%, p < 0.01), 휴식기 이미지에 대해서도 등급이 메겨졌다(96.8% vs. 64.8%, p < 0.01). 해석의 진단학적 확실성(한정적으로 비정상/정상인 해석이 내려진 경우의 %)은 PET vs. SPECT에서 유의적으로 높았다(92.0% vs. 76.8%, p < 0.01). CAD를 전체적으로 진단하기 위한 ROC 곡선 아래 면적은 PET vs. SPECT에서 유의적으로 높았다(0.79+0.05 vs. 0.67+0.05, p<0.05). 143명의 환자들 중 61명에서는 100가지의 치료 응급 부작용(AE)이 나타났다고 보고되었다. 이들 환자들 중 2명에서 보고된 7가지의 AE는 연구 지연과 관련되어 있는 것으로 판단되었으나, 그 어떤 것도 정도가 심각하지는 않았다. 실험실에서의 임상학적 변화(기준치 기준)는 TEAE로서 보고되지 않았거나 임상학적으로 유의적인 것으로 간주되었다. 휴식기에서의 ECG 데이터는, 심박수, 방실 전도(PR 간격), 탈분극(QRS 지속 기간) 또는 재분극(QTcF 지속 기간)에 대한 어떠한 임상학적 관련 효과에 대한 증거도 제시하지 않았다.
결론. 제2차 임상 실험 동안, 조영제 1은 안전하며, 화질, 이미지 해석에 대한 확실성 그리고 CAD의 전반적인 진단 효능의 관점에서 Tc-99m 표지화 SPECT보다 우수한 것으로 보였다.
실시예
47
이하는 정상인 피험체와 관상 동맥 질환이 발병한 환자에 있어서 조영제 1 주사 PET를 사용하는, 휴식기 및 스트레스기 절대 심근 혈류량의 능률적인 정량법에 대하여 기술하고 있다.
목적. 휴식기(R) 및 스트레스기(S) 심근 혈류량(MBF)과 관상 혈류 예비력(MBF)의 능률적인 정량법(정상인 피험체와 관상 동맥 질환(CAD) 환자(Pt)를 대상으로 임상학적으로 사용하기 위해 조영제 1 사용)의 실행 가능성을 평가하였다.
방법. 휴식기(R) 및 아데노신 최다 투여기(S)에서, 10명의 환자들(이들 중 6명은 CAD일 가능성이 낮으며, 4명은 CAD(> 50% 협착증)와 가역적 결손을 가짐)에게 조영제 1을 주사 투여한 다음, 10분 동안 동적 이미지를 수집하였다. R-S 조영 프로토콜은 같은 날 5명의 환자들을 대상으로 진행하였으며, 또 다른 날에 5명의 환자들을 대상으로 진행하였다. R 및 S 극 지도는 합산 동적 스캔(주사 후 0.5분 내지 2분)으로부터 자동으로 작성되었으며, 3개의 관상 영역(LAD, RCA, LCX)과 좌심실 혈액 풀(LV)은 자동으로 한정되었다. 가역적 결손은 극 지도에 수동으로 표시되었는데, 이것으로부터 시간 방사능 곡선(TAC)이 그려졌다. 비가역적 흡수 상수(K)와 혈액 풀 방사능의 스필오버(spillover)를 포함하는 단일 구획 모델을 사용하여, 조기(0분 내지 2분) 조직 TAC에 피팅하였다. LV TAC는 입력 함수로서 사용하였다. 심근의 부분 용적 효과로 인한 회수 상관 계수는 (1-spf)로서 추정되었는데, 여기서, spf는 모델 피팅 과정에서 측정된 혈액 스필오버 계수를 나타내는 것이다. 사람에 있어서 조영제 1에 대한 초회 통과 추출 계수는 전임상 연구에서 관찰되는 그것과 동일하게 0.94인 것으로 가정하였다. CFR은 S/R MBF로서 산정하였다.
결과. MBF와 CFR을, 18개의 정상 영역(가능성이 낮은 환자 6명)과 5개의 가역적 결손 영역(CAD 관상 동맥에 의해 제공) 간에 비교하였다(표 19, * = p < 0.05). 결과는 발표된 문헌에 개시된 바(N-13 암모니아 PET를 사용하는 경우)와 일치하였다.
| 정상 | CAD | |||
| LAD | RCA | LCX | 가역적 결손 | |
| RMBF | 0.76+0.15 | 0.75+0.17 | 0.74+0.10 | 0.69+0.22 |
| SMBF | 2.48+0.50 | 2.78+0.43 | 2.66+0.62 | 1/12+0.19* |
| CFR | 3.25+0.25 | 3.72+0.49 | 3.60+0.86 | 1.71+0.41* |
결론. 조영제 1 주사 PET 심근 관류 조영을 수행하여 MBF를 정량하는 방법은 임상 분야에서 능률적으로 진행될 수 있으며, 이로써 확실한 MBF 결과를 얻을 수 있다.
실시예
48
5-((4-((2-브로모에톡시)메틸)벤질)옥시)-2-(t-부틸)-4-클로로피리다진-3(2H)-온의 합성
무수 아세톤(10.0㎖) 중 조영제 전구체 1(0.521g, 1.00mmol) 용액을, LiBr(0.261g, 3.00mmol) 1부로 처리한 후(22℃), 다시 56℃로 승온시키고, 이 온도를 2.5시간 동안 유지시켰다. 상기 불균일한 반응 혼합물을 상온으로 냉각시키고, 모든 휘발성 물질들을 진공 하에서 제거하였다. 이후, 미정제 생성물을 실리카(30×190㎜)상 크로마토그래피(3:1 펜탄/EtOAc 사용)로 정제하였다. 180㎖ 내지 360㎖가 용리되는 시점에서의 주요 생성물 피크를 나타내는 분획을 수집하여, 풀링하고, 진공 하에서 농축시킨 결과, 무색의 오일이 생성되었다. 따뜻한 EtOAc 및 펜탄으로부터 재결정화를 통하여 최종적으로 정제한 결과, 백색의 결정질 고체가 생성되었다(0.369g, 0.859mmol; 85.9%).
실시예
48
조영제 1의 시린지 흡착
2원 시린지 3개(헨케 사스 울프)와 3원 시린지 3개(벡톤 앤드 딕킨슨(Becton and Dickinson)) 각각에, 조영제 1 용액(< 50㎎/㎖아스코르브산 함유 H2O 중 < 5 용량% EtOH) 1㎖를 충전하였는데; 여기서, 각 시린지 내 초기 총 방사능은 거의 동일하였다. 충전된 시린지들 2세트의 온도 및 습도는 3시간, 즉 시린지 내용물이 깨끗한 5cc들이 유리 바이알에 주사되고; 조영제 1의 용량이 각각의 시린지의 허브 내에 일정하게(0.1㎖) 유지되는 시간 동안, 상온 및 주변 습도로 유지시켰다. 바이알과 시린지 둘 다의 총 방사능 함량을 측정한 후, 이를 붕괴 보정하고 예비력%를 산정하였다. 각각의 시린지 내에 담긴 물질의 방사능 수치(%)를 표 20에 요약하여 두었다. 잔류하는 물질의 방사능 수치(%) 간 차는 95% 신뢰도 수준에서 통계학적으로 유의적이었다(즉 Prob >|t| 0.0005).
| 시린지에 담긴 조영제 1의 편집 데이터 편집딘 데이터 |
|
| 시린지 | 잔류 방사능[%] |
| B&D | 32.4 |
| B&D | 35.2 |
| B&D | 38.9 |
| HSW | 11.3 |
| HSW | 7.0 |
| HSW | 5.1 |
| B&D = 벡톤 & 딕킨슨 HSW = 헨켈 사스 울프 |
|
실시예
49
조영제 1의 시린지 부품 흡착
조영제 1의 시린지 내 예비력에 기여하는 접촉면 재료를 자세히 확인하기 위하여, 3개의 부가 B&D 시린지 각각을 조영제 1 용액 1㎖로 충전한 다음, 3시간 동안 온도는 상온으로, 그리고 습도는 주변 습도로 유지시켰다. 실시예 1에 기술된 바와 같이, 각각의 선량을 옮긴 후, 시린지 배럴 및 부틸 고무 팁 플런저를 분리하여, 잔류하는 방사능을 측정한 다음, 이를 붕괴 보정하였다. 각각의 시린지 부품에 대한 잔류 방사능 수치(%)를 표 21에 요약하였다. 잔류하는 물질의 방사능 수치(%) 간 차는 95% 신뢰도 수준에서 통계학적으로 유의적이었다(즉 Prob >|t| 0.0017).
| 주사후 B&D시린지 부품에 잔류하는 조영제1(%) |
|
| 시린지 부품 | 잔류 방사능[%] |
| 플런저 | 30.9 |
| 플런저 | 27.7 |
| 플런저 | 21.8 |
| 배럴 | 6.9 |
| 배럴 | 5.5 |
| 배럴 | 7.0 |
| B&D = 벡톤 & 딕킨슨 | |
본 출원에 개시된 사항은 전술한 예시적인 실시예에 한정되는 것이 아니며, 이와 같이 개시된 사항은 자체의 본질적인 속성으로부터 벗어나지 않고 기타 특정 형태로 구체화될 수 있다는 것은 당 업자에게 분명할 것이다. 그러므로, 모든 관점에서 실시예는 예시적이되 제한적이지는 않은 것으로 간주되고, 전술한 실시예들보다는 첨부된 청구항들을 참고로 하며, 청구항의 균등 범위와 의미 내에 포함되는 모든 변화는 본 발명에 포함되는 것이 바람직하다.
본 발명의 몇몇 구체예들이 본원에 기술 및 예시되어 있을 때, 당 업자는 본원에 기술된 이점들 중 하나 이상 및/또는 본원에 기술된 결과들을 얻고/얻거나 기능을 수행하기 위해서, 다양한 기타 수단들 및/또는 구조들을 용이하게 구현할 것이며, 이와 같은 변화 및/또는 변형은 각각 본 발명의 범위 내에 포함될 것으로 보인다. 더욱 일반적으로, 당 업자들은 본원에 기술된 모든 매개 변수들, 수치들, 재료들 그리고 배열들은 예시적인 것이며, 또한 실제 매개 변수들, 수치들, 재료들 및/또는 배열들은 본 발명이 교시하는 바가 이용되는 특정 분야 또는 분야들에 따라서 달라질 것이라는 사실을 용이하게 이해할 것이다. 당 업자들은 통상의 실험 수준을 넘지 않는 실험을 통해, 본원에 기술된 발명의 특정 구체예에 대한 다수의 균등물을 인지할 것이거나 인지할 수 있을 것이다. 그러므로, 전술한 구체예들은 오로지 예시로서 제공되는 것이며, 본 발명은 첨부된 특허 청구의 범위와 이에 대한 균등물 범위 내에서 구체적으로 기술 및 청구되는 바대로 실시될 수 있다는 것이 이해될 것이다. 본 발명은 본원에 기술된 각각의 특징, 시스템, 물품, 재료, 키트 및/또는 방법에 관한 것이다. 뿐만 아니라, 만약 이와 같은 특징, 시스템, 물품, 재료, 키트 및/또는 방법이 상호 불일치하지 않으면, 상기 특징, 시스템, 물품, 재료, 키트 및/또는 방법 중 2개 이상을 조합한 것은 본 발명의 범위 내에 포함된다.
본원의 명세서와 특허 청구의 범위에서 사용된 부정 관사 “하나(an/an)”는, 반대로 명백히 규정하지 않는 한, “하나 이상”을 의미하는 것으로 이해되어야 한다.
본원의 명세서와 특허 청구의 범위에서 사용된 “및/또는”이라는 어구는, 결합된 요소들, 즉 어떤 경우에는 연합하여 존재하고 다른 경우에는 분리되어 존재하는 요소들 중 “어느 하나 또는 둘 다”를 의미하는 것으로 이해되어야 한다. 반대로 명백히 규정하지 않는 한, 구체적으로 규정된 요소들과 관련이 있건 아니면 관련이 없건 간에, “및/또는”이라는 구절에 의해 구체적으로 정의되는 요소들 이외의 다른 요소들도 존재할 수도 있다. 그러므로, 비 제한적인 예로서, “A 및/또는 B”라는 어구가 제약을 두지 않는 어구, 예를 들어 “포함하는”과 함께 사용될 때, 하나의 구체예에서, 이 어구는 B를 포함하지 않는 A(임의로는 B 이외의 요소들을 포함하는 A)를 말하는 것일 수 있고; 다른 구체예에서, 이 어구는 A를 포함하지 않는 B(임의로는 A 이외의 요소들을 포함하는 B)를 말하는 것일 수 있으며; 또 다른 구체예에서, 이 어구는 A와 B 둘 다를 포함하는 경우(임의로는 다른 요소들도 포함하는 경우)를 말하는 것일 수도 있다.
본 발명의 명세서와 특허 청구의 범위에서 사용된 “또는”이라는 용어는, 상기 정의한 “및/또는”과 동일한 의미를 가지는 것으로 이해되어야 한다. 예를 들어 목록 중 항목들을 나눌 때, “또는”이나 “및/또는”은 포함하는 의미, 즉 다수의 요소들 또는 요소들의 나열, 및 임의로는 나열되지 않은 부가의 항목들 중 하나 이상을 포함할 뿐만 아니라, 하나보다 많은 경우도 포함하는 의미로서 해석되어야 할 것이다. 반대로 명백히 규정한 용어들, 예를 들어 “~중 오로지 하나” 또는 “~중 정확히 하나”, 또는 “이루어진”(특허 청구의 범위에서 사용되는 경우)과 같은 어구들은 정확히 하나의 요소 또는 요소들의 나열을 포함하는 의미를 가질 것이다. 일반적으로, 본원에 사용된 “또는”이란 용어는, 배타성을 나타내는 용어, 예를 들어 “둘 중 하나”, “~중 하나”, “~중 오로지 하나” 또는 “~중 정확히 하나” 다음에 사용될 때, 오로지 배타적인 대안들(즉 “하나 또는 다른 하나이되 둘 다는 아님”)을 나타내는 것으로 해석되어야 한다. “본질적으로 ~로 이루어진”이라는 어구가 특허 청구의 범위에서 사용될 때, 이 어구는 특허법에서 사용되는 통상의 의미를 가질 것이다.
본 발명의 명세서와 특허 청구의 범위에서 사용되는 “하나 이상”이라는 어구는, 하나 이상의 요소들로 이루어진 나열을 참고로 하였을 때, 요소들의 나열 중에 존재하는 임의의 요소 하나 이상으로부터 선택되는 요소 하나 이상을 의미하되, 요소들의 나열 내에 구체적으로 나열된 각각의 요소와 모든 요소들 중 하나 이상을 반드시 포함하는 것은 아니며, 요소들의 나열 중에 존재하는 요소들의 임의의 조합을 배제하는 것도 아님을 의미하는 것으로 이해되어야 할 것이다. 이와 같은 정의는 또한, 구체적으로 규정된 요소들과 관련이 있건 아니면 관련이 없건 간에, “하나 이상”이라는 어구가 가리키는 요소들의 나열 내에 구체적으로 규정된 요소들 이외의 요소들이 임의로 존재할 수 있도록 허용 한다. 그러므로, 비 제한적인 예로서, “A 및 B 중 하나 이상”(또는 균등하게는, “A 또는 B 중 하나 이상” 또는 균등하게는 “A 및/또는 B 중 하나 이상”)은, 하나의 구체예에서는 임의로 하나 보다 많은 경우를 포함하여 하나 이상의 A가 존재하고 B는 존재하지 않는(임의로는 B이외의 요소를 포함하는) 경우를 말하는 것이고; 다른 구체예에서는 임의로 하나 보다 많은 경우를 포함하여 하나 이상의 B가 존재하고 A는 존재하지 않는(임의로는 A이외의 요소를 포함하는) 경우를 말하는 것이며; 또 다른 구체예에서는 임의로 하나 보다 많은 경우를 포함하여 하나 이상의 A가 존재하고, 임의로 하나 보다 많은 경우를 포함하여 하나 이상의 B가 존재하는 경우(또한 임의로는 기타 요소들을 포함하는 경우)를 말하는 것이다.
청구의 범위와 전술한 발명의 상세한 설명에서, 모든 전환 어구, 예를 들어 “포함하는(comprising, including)”, “운반하는”, “가지는”, “함유하는”, “포함하는(involving)”, “보유하는” 등은 제약을 두지 않은 경우, 즉 “포함하나 이에 한정되는 것은 아닌” 경우를 의미하는 것으로 이해되어야 한다. 오로지 전환 어구 “이루어진”과 “본질적으로 ~로 이루어진”만이 제약을 둔(closed) 전환 어구 또는 절반의 제약을 둔(semi-closed) 전환 어구이어야 할 것이다(특허 심사 절차에 관한 미국 특허청 매뉴얼, 섹션 2111.03 참조).
Claims (1)
Applications Claiming Priority (7)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US30247710P | 2010-02-08 | 2010-02-08 | |
| US61/302,477 | 2010-02-08 | ||
| US31537610P | 2010-03-18 | 2010-03-18 | |
| US61/315,376 | 2010-03-18 | ||
| US33369310P | 2010-05-11 | 2010-05-11 | |
| US61/333,693 | 2010-05-11 | ||
| PCT/US2011/024109 WO2011097649A2 (en) | 2010-02-08 | 2011-02-08 | Methods and apparatus for synthesizing imaging agents, and intermediates thereof |
Related Parent Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020127023380A Division KR101709372B1 (ko) | 2010-02-08 | 2011-02-08 | 조영제 및 이의 중간체를 합성하는 방법 및 장치 |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020187013968A Division KR20180055933A (ko) | 2010-02-08 | 2011-02-08 | 조영제 및 이의 중간체를 합성하는 방법 및 장치 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20170033873A true KR20170033873A (ko) | 2017-03-27 |
Family
ID=44356121
Family Applications (5)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020127023380A KR101709372B1 (ko) | 2010-02-08 | 2011-02-08 | 조영제 및 이의 중간체를 합성하는 방법 및 장치 |
| KR1020187013968A KR20180055933A (ko) | 2010-02-08 | 2011-02-08 | 조영제 및 이의 중간체를 합성하는 방법 및 장치 |
| KR1020217035027A KR102438133B1 (ko) | 2010-02-08 | 2011-02-08 | 조영제 및 이의 중간체를 합성하는 방법 및 장치 |
| KR1020177004163A KR20170033873A (ko) | 2010-02-08 | 2011-02-08 | 조영제 및 이의 중간체를 합성하는 방법 및 장치 |
| KR1020197015985A KR20190067255A (ko) | 2010-02-08 | 2011-02-08 | 조영제 및 이의 중간체를 합성하는 방법 및 장치 |
Family Applications Before (3)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020127023380A KR101709372B1 (ko) | 2010-02-08 | 2011-02-08 | 조영제 및 이의 중간체를 합성하는 방법 및 장치 |
| KR1020187013968A KR20180055933A (ko) | 2010-02-08 | 2011-02-08 | 조영제 및 이의 중간체를 합성하는 방법 및 장치 |
| KR1020217035027A KR102438133B1 (ko) | 2010-02-08 | 2011-02-08 | 조영제 및 이의 중간체를 합성하는 방법 및 장치 |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020197015985A KR20190067255A (ko) | 2010-02-08 | 2011-02-08 | 조영제 및 이의 중간체를 합성하는 방법 및 장치 |
Country Status (20)
| Country | Link |
|---|---|
| US (5) | US8936777B2 (ko) |
| EP (3) | EP3323810B1 (ko) |
| JP (3) | JP6092628B2 (ko) |
| KR (5) | KR101709372B1 (ko) |
| CN (3) | CN113058046A (ko) |
| AU (3) | AU2011213568B2 (ko) |
| BR (1) | BR112012019789A2 (ko) |
| CA (1) | CA2789044C (ko) |
| DK (2) | DK3323810T3 (ko) |
| ES (2) | ES2909318T3 (ko) |
| HK (1) | HK1255702A1 (ko) |
| IL (2) | IL221253B (ko) |
| MX (1) | MX348958B (ko) |
| NO (1) | NO2534136T3 (ko) |
| NZ (1) | NZ602291A (ko) |
| PT (2) | PT2534136T (ko) |
| RU (1) | RU2631500C2 (ko) |
| SG (2) | SG183134A1 (ko) |
| TW (4) | TWI686370B (ko) |
| WO (1) | WO2011097649A2 (ko) |
Families Citing this family (43)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US7344702B2 (en) | 2004-02-13 | 2008-03-18 | Bristol-Myers Squibb Pharma Company | Contrast agents for myocardial perfusion imaging |
| US7485283B2 (en) | 2004-04-28 | 2009-02-03 | Lantheus Medical Imaging | Contrast agents for myocardial perfusion imaging |
| EP2474525B1 (en) | 2006-12-26 | 2020-04-15 | Lantheus Medical Imaging, Inc. | Ligands for imaging cardiac innervation |
| PT2257315T (pt) | 2008-02-29 | 2020-01-27 | Lantheus Medical Imaging Inc | Agentes de contraste para aplicações incluindo imagiologia de perfusão |
| PT2419096T (pt) | 2009-04-15 | 2020-02-19 | Lantheus Medical Imaging Inc | Estabilização de composições radiofarmacêuticas utilizando ácido ascórbico |
| US10109385B2 (en) | 2009-09-23 | 2018-10-23 | Abt Molecular Imaging, Inc. | Dose synthesis card for use with automated biomarker production system |
| PT2534136T (pt) * | 2010-02-08 | 2017-12-15 | Lantheus Medical Imaging Inc | Métodos para sintetizar agentes de imagiologia, e seus intermediários |
| CA2798488C (en) | 2010-05-11 | 2019-06-04 | Lantheus Medical Imaging, Inc. | Compositions, methods, and systems for the synthesis and use of imaging agents |
| US11129911B2 (en) | 2011-05-05 | 2021-09-28 | Cedars-Sinai Medical Center | Assessment of coronary heart disease with carbon dioxide |
| CA2845308C (en) * | 2011-05-05 | 2021-01-26 | Cedars-Sinai Medical Center | Assessment of coronary heart disease with carbon dioxide |
| CN104159890B (zh) * | 2011-09-09 | 2018-04-10 | 蓝瑟斯医学影像公司 | 用于合成和使用显像剂的组合物、方法和系统 |
| CA2852395C (en) * | 2011-10-21 | 2020-04-28 | Lantheus Medical Imaging, Inc. | Compositions comprising ascorbic acid and pyridaben and pyridaben analogs attached to an imaging moiety and related methods |
| WO2013070471A1 (en) | 2011-11-11 | 2013-05-16 | Lantheus Medical Imaging, Inc. | Evaluation of presence of and vulnerability to atrial fibrillation and other indications using matrix metalloproteinase-based imaging |
| EP2836241B1 (en) * | 2012-04-10 | 2019-02-20 | Lantheus Medical Imaging, Inc. | Radiopharmaceutical synthesis methods |
| CA2794281C (en) * | 2012-04-30 | 2019-07-02 | Elazar A. Bienenstock | Single photon emission computed tomography imaging method |
| WO2013172979A1 (en) * | 2012-05-14 | 2013-11-21 | University Of Southern California | Methods and compositions for positron emission tomography myocardial perfusion imaging |
| AU2013203000B9 (en) * | 2012-08-10 | 2017-02-02 | Lantheus Medical Imaging, Inc. | Compositions, methods, and systems for the synthesis and use of imaging agents |
| WO2015021078A1 (en) | 2013-08-05 | 2015-02-12 | Cedars-Sinai Medical Center | Methods for reducing ischemia-reperfusion injury |
| JP6190240B2 (ja) | 2013-10-16 | 2017-08-30 | 浜松ホトニクス株式会社 | 癌に対する治療効果の診断剤 |
| US9031300B1 (en) | 2013-10-25 | 2015-05-12 | General Electric Company | System and method reconstructing a nuclear medicine image using deformed attenuation image |
| CN107530455A (zh) * | 2015-02-10 | 2018-01-02 | Abt分子成像公司 | 与自动化生物标记物生产系统联用的剂量合成卡 |
| NL2014828B1 (en) * | 2015-05-20 | 2017-01-31 | Out And Out Chemistry S P R L | Method of performing a plurality of synthesis processes of preparing a radiopharmaceutical in series, a device and cassette for performing this method. |
| CN105553594B (zh) * | 2015-12-09 | 2018-02-16 | 沈阳东软医疗系统有限公司 | 一种pet时钟同步方法和装置 |
| US11109819B2 (en) | 2016-04-11 | 2021-09-07 | The General Hospital Corporation | System and method for quantitatively mapping mitochondrial membrane potential |
| JP6060302B1 (ja) * | 2016-06-10 | 2017-01-11 | 日本メジフィジックス株式会社 | 心筋核医学画像データの解析方法及び解析装置 |
| TWI649067B (zh) * | 2017-03-01 | 2019-02-01 | 醫百科技股份有限公司 | Positioning corrector |
| CN108129673B (zh) * | 2017-12-26 | 2020-10-13 | 武汉大学 | 一种高灵敏度水溶性树枝状大分子f19显影剂的制备及其应用 |
| GB201805253D0 (en) * | 2018-03-29 | 2018-05-16 | Ge Healthcare Ltd Ip | Solid phase extraction |
| CN108658868A (zh) * | 2018-05-07 | 2018-10-16 | 四川大学 | 一种碳酸氢盐离子液体及其制备方法以及一种三氨基三硝基苯的重结晶方法 |
| EP3671511B1 (en) | 2018-12-19 | 2022-07-06 | Rohde & Schwarz GmbH & Co. KG | Communication system and method |
| CN109806822B (zh) * | 2019-01-30 | 2021-07-30 | 杭州吉蕊科技有限公司 | 一种模块化、多功能的pet探针自动化合成系统 |
| CN109896934A (zh) * | 2019-03-08 | 2019-06-18 | 山东省药学科学院 | 一种高纯度2-苄氧基溴乙烷的制备方法 |
| GB201915206D0 (en) | 2019-10-21 | 2019-12-04 | Ge Healthcare Ltd | Use of cyclodextrins as a radiostabilizer |
| GB201919016D0 (en) * | 2019-12-20 | 2020-02-05 | Ge Healthcare Ltd | Apparatus and method for solid phase extraction |
| CN111333638A (zh) * | 2020-03-17 | 2020-06-26 | 四川大学华西医院 | 18f标记的异喹啉并哒嗪酮类化合物及其合成方法和应用 |
| JP7362561B2 (ja) * | 2020-07-30 | 2023-10-17 | 富士フイルム株式会社 | 放射線画像処理装置、方法およびプログラム |
| WO2022261502A1 (en) * | 2021-06-11 | 2022-12-15 | Jubilant Draximage Inc. | Non-invasive imaging methods of diagnosing peripheral arterial disease |
| GB202108608D0 (en) | 2021-06-16 | 2021-07-28 | Ge Healthcare Ltd | Preparation of a ph-adjusted ascorbic acid solution |
| GB202108605D0 (en) | 2021-06-16 | 2021-07-28 | Ge Healthcare Uk Ltd | Effect of water content |
| CN114700006B (zh) * | 2022-06-07 | 2023-03-24 | 北京先通国际医药科技股份有限公司 | 一种液体组合物的生产设备及其制备方法和用途 |
| CN114716415B (zh) * | 2022-06-09 | 2022-09-02 | 北京先通国际医药科技股份有限公司 | 生产液体组合物的设备及其制备方法和用途 |
| CN114732918B (zh) * | 2022-06-10 | 2022-09-13 | 北京先通国际医药科技股份有限公司 | 一种液体组合物的生产设备及其制备方法和用途 |
| CN114773179B (zh) * | 2022-06-23 | 2022-09-16 | 北京先通国际医药科技股份有限公司 | 一种化合物ⅰ液体组合物的制备方法、及其在心肌代谢pet显像上的用途 |
Family Cites Families (126)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB1073999A (en) | 1965-01-29 | 1967-06-28 | Ncr Co | Process for forming stable images in photochromic material |
| US4510125A (en) | 1982-12-08 | 1985-04-09 | Mallinckrodt, Inc. | Process for making lyophilized radiographic imaging kit |
| JPS604173A (ja) | 1983-06-23 | 1985-01-10 | Nissan Chem Ind Ltd | ピリダジノン誘導体,その製造法および殺虫・殺ダニ・殺菌剤 |
| DE3574870D1 (de) | 1984-06-23 | 1990-01-25 | Nissan Chemical Ind Ltd | Verfahren zu herstellung von 2-tert.-butyl-4,5-dichloro-3(2h)-pyridazinon. |
| JPH07116161B2 (ja) | 1984-07-04 | 1995-12-13 | 日産化学工業株式会社 | ピリダジノン誘導体 |
| JPS61130275A (ja) | 1984-11-29 | 1986-06-18 | Nissan Chem Ind Ltd | ピリダジノン誘導体,その製造法および殺虫・殺ダニ・殺菌剤 |
| DE3578304D1 (de) | 1984-11-29 | 1990-07-26 | Nissan Chemical Ind Ltd | Pyridazinonderivate, deren herstellung und insektizidische, acaricidische, nematicidische, fungizidische zusammensetzungen. |
| CA1265798A (en) | 1984-12-10 | 1990-02-13 | Motoo Mutsukado | 3(2h)pyridazinone, process for its preparation and anti-allergic agent containing it |
| US5393512A (en) | 1985-01-14 | 1995-02-28 | Vanderheyden; Jean-Luc | Stable therapeutic radionuclide compositions and methods for preparation thereof |
| JPH0641454B2 (ja) | 1985-02-27 | 1994-06-01 | 日産化学工業株式会社 | ピリダジノン誘導体 |
| JPS61260018A (ja) * | 1985-05-14 | 1986-11-18 | Nissan Chem Ind Ltd | 抗アレルギ−剤 |
| YU134686A (en) | 1985-07-30 | 1988-02-29 | Nissan Chemical Ind Ltd | Process for preparing new derivatives 3-(2h)-pyridazinone |
| JPH0739397B2 (ja) | 1985-07-30 | 1995-05-01 | 日産化学工業株式会社 | ピリダジノン誘導体および害虫防除剤 |
| JPH07110815B2 (ja) | 1985-11-18 | 1995-11-29 | ボ−ド・オブ・リ−ジェンツ、ザ・ユニバ−シティ−・オブ・テキサス・システム | 画像及びスペクトル向上(およびスペクトルシフト)のためのポリキレ−ト剤 |
| JPS6315974A (ja) | 1986-07-09 | 1988-01-23 | 小泉コンピユ−タ−株式会社 | ボ−リングゲ−ム点数表表示装置 |
| US5252317A (en) | 1986-11-10 | 1993-10-12 | The State Of Oregon Acting By And Through The State Board Of Higher Education On Behalf Of The University Of Oregon | Amplifier molecules for diagnosis and therapy derived from 3,5-bis[1-(3-amino-2,2-bis (aminomethyl)-propyl) oxymethyl] benzoic acid |
| US5567411A (en) | 1986-11-10 | 1996-10-22 | State Of Oregon Acting By And Through The State Board Of Higher Education On Behalf Of The University Of Oregon | Dendritic amplifier molecules having multiple terminal active groups stemming from a benzyl core group |
| JPS63159372A (ja) | 1986-12-24 | 1988-07-02 | Nissan Chem Ind Ltd | ピリダジノン化合物および殺虫、殺ダニ、殺線虫剤 |
| JPS63159374A (ja) | 1986-12-24 | 1988-07-02 | Nissan Chem Ind Ltd | ピリダジノン誘導体および殺虫、殺ダニ、殺線虫剤 |
| JPS63159373A (ja) | 1986-12-24 | 1988-07-02 | Nissan Chem Ind Ltd | ピリダジノン類および殺虫、殺ダニ、殺線虫剤 |
| DE3824210A1 (de) | 1988-07-16 | 1990-01-18 | Basf Ag | 3(2h)-pyridazinonderivate zur bekaempfung von schnecken |
| IT1229684B (it) | 1989-04-05 | 1991-09-06 | Mini Ricerca Scient Tecnolog | Piridazinoni ad attivita' insetticida ed acaricida |
| JPH02279676A (ja) | 1989-04-19 | 1990-11-15 | Otsuka Chem Co Ltd | ピリダジノン誘導体 |
| US5087440A (en) | 1989-07-31 | 1992-02-11 | Salutar, Inc. | Heterocyclic derivatives of DTPA used for magnetic resonance imaging |
| GB8923843D0 (en) | 1989-10-23 | 1989-12-13 | Salutar Inc | Compounds |
| US5377681A (en) | 1989-11-13 | 1995-01-03 | University Of Florida | Method of diagnosing impaired blood flow |
| US5585112A (en) | 1989-12-22 | 1996-12-17 | Imarx Pharmaceutical Corp. | Method of preparing gas and gaseous precursor-filled microspheres |
| US5228446A (en) | 1989-12-22 | 1993-07-20 | Unger Evan C | Gas filled liposomes and their use as ultrasonic contrast agents |
| US5088499A (en) | 1989-12-22 | 1992-02-18 | Unger Evan C | Liposomes as contrast agents for ultrasonic imaging and methods for preparing the same |
| US5679810A (en) | 1990-01-19 | 1997-10-21 | Salutar, Inc. | Linear oligomeric polychelant compounds |
| JPH03220177A (ja) | 1990-01-25 | 1991-09-27 | Nissan Chem Ind Ltd | 殺虫、殺ダニ剤組成物 |
| WO1992017215A1 (en) | 1990-03-28 | 1992-10-15 | Nycomed Salutar, Inc. | Contrast media |
| GB9006977D0 (en) | 1990-03-28 | 1990-05-23 | Nycomed As | Compositions |
| JPH04235975A (ja) | 1991-01-21 | 1992-08-25 | Nissan Chem Ind Ltd | ピリダジノン誘導体および害虫防除剤 |
| US5205290A (en) | 1991-04-05 | 1993-04-27 | Unger Evan C | Low density microspheres and their use as contrast agents for computed tomography |
| US5093105A (en) | 1991-04-09 | 1992-03-03 | Merck Frosst Canada, Inc. | Radiopharmaceutical bacteriostats |
| US5306482A (en) | 1991-04-09 | 1994-04-26 | Merck Frosst Canada, Inc. | Radiopharmaceutical bacteriostats |
| ES2150916T3 (es) | 1991-08-29 | 2000-12-16 | Mallinckrodt Medical Inc | Utilizacion del acido gentisico o del alcohol gentisilico para estabilizar peptidos y proteinas radiomarcados. |
| US5169942A (en) | 1991-11-21 | 1992-12-08 | General Electric Company | Method for making 2-(18F)fluoro-2-deoxy-D-glucose |
| WO1994012479A1 (en) | 1992-12-03 | 1994-06-09 | Otsuka Kagaku Kabushiki Kaisha | Pyridazinone derivative and insecticidal and miticidal agent |
| US5760191A (en) | 1993-02-05 | 1998-06-02 | Nycomed Imaging As | Macrocyclic complexing agents and targeting immunoreagents useful in therapeutic and diagnostic compositions and methods |
| WO1994021653A1 (en) | 1993-03-22 | 1994-09-29 | General Electric Company | Method for making 2-fluoro-2-deoxyglucose |
| CA2158249A1 (en) | 1993-03-31 | 1994-10-13 | James W. Brodack | Radiopharmaceutical formulations having non-stannous reductants |
| US5417959A (en) | 1993-10-04 | 1995-05-23 | Mallinckrodt Medical, Inc. | Functionalized aza-crytand ligands for diagnostic imaging applications |
| US5493026A (en) | 1993-10-25 | 1996-02-20 | Organix, Inc. | Substituted 2-carboxyalkyl-3-(fluorophenyl)-8-(3-halopropen-2-yl) nortropanes and their use as imaging for agents for neurodegenerative disorders |
| JPH07252236A (ja) | 1994-01-28 | 1995-10-03 | Takeda Chem Ind Ltd | 抗癌剤 |
| EP0665223A1 (en) | 1994-01-28 | 1995-08-02 | Takeda Chemical Industries, Ltd. | Antitumor agent, novel 3(2H)-pyridazinone derivatives and their preparation |
| AU7312694A (en) | 1994-06-03 | 1996-01-04 | Mallinckrodt Medical, Inc. | Rapidly clearing technetium-99m phosphonate skeletal imaging agents |
| US5520904A (en) | 1995-01-27 | 1996-05-28 | Mallinckrodt Medical, Inc. | Calcium/oxyanion-containing particles with a polymerical alkoxy coating for use in medical diagnostic imaging |
| EP0727225A3 (en) | 1995-02-14 | 1997-01-15 | Sonus Pharma Inc | Compositions and methods for directed ultrasonic imaging |
| US5587491A (en) | 1995-03-15 | 1996-12-24 | Regents Of The University Of Minnesota | Method for the synthesis of bis-tetrahydrofuranyl Annonaceous acetogenins |
| US5801228A (en) | 1995-06-07 | 1998-09-01 | Nycomed Imaging As | Polymeric contrast agents for medical imaging |
| US5811073A (en) | 1995-06-19 | 1998-09-22 | President And Fellows Of Harvard College | Method for radioisotopic detection and localization of inflammation in a host |
| US5827073A (en) | 1995-07-05 | 1998-10-27 | Ludwig Institute For Cancer Research | Photoreactive peptide derivatives |
| US6066309A (en) | 1996-02-02 | 2000-05-23 | Rhomed Incorporated | Post-labeling stabilization of radiolabeled proteins and peptides |
| US5804161A (en) | 1996-05-14 | 1998-09-08 | Nycomed Salutar Inc. | Contrast agents |
| US5846517A (en) | 1996-09-11 | 1998-12-08 | Imarx Pharmaceutical Corp. | Methods for diagnostic imaging using a renal contrast agent and a vasodilator |
| US6565889B2 (en) | 1996-12-02 | 2003-05-20 | The Regents Of The University Of California | Bilayer structure which encapsulates multiple containment units and uses thereof |
| US5961955A (en) | 1997-06-03 | 1999-10-05 | Coulter Pharmaceutical, Inc. | Radioprotectant for peptides labeled with radioisotope |
| AU5671699A (en) | 1998-08-14 | 2000-03-06 | Smithkline Beecham Corporation | Grp receptor ligands |
| US6056939A (en) | 1998-08-28 | 2000-05-02 | Desreux; Jean F. | Self-assembling heteropolymetallic chelates as imaging agents and radiopharmaceuticals |
| EP1119356B1 (en) | 1998-09-29 | 2009-08-19 | Merck & Co., Inc. | Radiolabeled neurokinin-1 receptor antagonists |
| US6645508B1 (en) | 1999-06-18 | 2003-11-11 | Jivn-Ren Chen | Stable L-ascorbic acid composition |
| WO2001087354A2 (en) | 2000-05-17 | 2001-11-22 | Bristol-Myers Squibb Pharma Company | Use of small molecule radioligands for diagnostic imaging |
| GB0019357D0 (en) | 2000-08-07 | 2000-09-27 | Melacure Therapeutics Ab | Novel phenyl guanidines |
| WO2002020008A1 (en) | 2000-09-06 | 2002-03-14 | The Scripps Research Institute | Inhibitors of nadh:ubiquinone oxidoreductase |
| TWI247609B (en) | 2001-01-23 | 2006-01-21 | Nihon Mediphysics Co Ltd | Agent for diagnosis of tissue proliferation activity or the treatment of proliferative disease |
| GB0115927D0 (en) | 2001-06-29 | 2001-08-22 | Nycomed Amersham Plc | Solid-phase nucleophilic fluorination |
| US20030044354A1 (en) | 2001-08-16 | 2003-03-06 | Carpenter Alan P. | Gas microsphere liposome composites for ultrasound imaging and ultrasound stimulated drug release |
| US7344702B2 (en) * | 2004-02-13 | 2008-03-18 | Bristol-Myers Squibb Pharma Company | Contrast agents for myocardial perfusion imaging |
| US20030082191A1 (en) | 2001-08-29 | 2003-05-01 | Poduslo Joseph F. | Treatment for central nervous system disorders |
| US7186241B2 (en) * | 2001-10-03 | 2007-03-06 | Medical Instill Technologies, Inc. | Syringe with needle penetrable and laser resealable stopper |
| JP2005529840A (ja) | 2001-10-16 | 2005-10-06 | ヒプニオン, インコーポレイテッド | Cns標的モジュレータを使用するcns障害の治療 |
| JP4530665B2 (ja) | 2002-02-06 | 2010-08-25 | ジョンズ ホプキンス ユニバーシティ | 放射性標識された親油性の塩を使用することによる、ミトコンドリアのための非浸襲性の画像診断技術 |
| EA009334B1 (ru) | 2002-03-29 | 2007-12-28 | Янссен Фармацевтика Н.В. | Меченные радиоактивными изотопами производные хинолина и их применение в качестве лигандов метаботропного глутаматного рецептора |
| AU2003224747A1 (en) | 2002-04-08 | 2003-10-27 | Biostream, Inc. | Technetium-labeled rotenone derivatives, and methods of use thereof |
| GB0229683D0 (en) | 2002-12-20 | 2003-01-29 | Imaging Res Solutions Ltd | Preparation of radiopharmaceuticals |
| CN1984660B (zh) | 2003-07-03 | 2010-12-15 | 美瑞德生物工程公司 | 作为天冬氨酸特异性半胱氨酸蛋白酶活化剂和细胞程序死亡诱导剂的4-芳基氨基-喹唑啉 |
| WO2005007632A1 (en) | 2003-07-18 | 2005-01-27 | Pharmacia Corporation | Substituted pyridazinones as inhibitors of p38 |
| CA2783275A1 (en) | 2003-07-24 | 2005-02-03 | Bracco Imaging S.P.A. | Stable radiopharmaceutical compositions and methods for their preparation |
| GB0317920D0 (en) | 2003-07-31 | 2003-09-03 | Amersham Plc | Solid-phase synthesis |
| US7927616B2 (en) | 2004-01-16 | 2011-04-19 | Thomas T. Yamashita | Pesticide compositions and methods for their use |
| AU2005216949B2 (en) * | 2004-02-24 | 2011-09-22 | The General Hospital Corporation | Catalytic radiofluorination |
| WO2005085200A1 (ja) | 2004-03-05 | 2005-09-15 | Banyu Pharmaceutical Co., Ltd. | ピリドン誘導体 |
| AT500838B1 (de) | 2004-04-20 | 2007-11-15 | Veterinaermedizinische Uni Wie | Multiple hse |
| US7485283B2 (en) | 2004-04-28 | 2009-02-03 | Lantheus Medical Imaging | Contrast agents for myocardial perfusion imaging |
| US20060083681A1 (en) | 2004-10-18 | 2006-04-20 | Ajay Purohit | Compounds for myocardial perfusion imaging |
| US7534418B2 (en) | 2004-12-10 | 2009-05-19 | The Regents Of The University Of Michigan | Imaging agents |
| KR100789847B1 (ko) | 2004-12-15 | 2007-12-28 | (주)퓨쳐켐 | 알코올 용매하에서 유기플루오로 화합물의 제조방법 |
| EP1893244A4 (en) | 2005-06-23 | 2009-06-24 | Univ Emory | CONTRAST AGENTS |
| US7824659B2 (en) | 2005-08-10 | 2010-11-02 | Lantheus Medical Imaging, Inc. | Methods of making radiolabeled tracers and precursors thereof |
| JP2007112725A (ja) * | 2005-10-18 | 2007-05-10 | Inst Nuclear Energy Research Rocaec | 無支持体の18Fで標識したアミノ酸O−(2−[18F]fluoroethyl)−L−Tyrosineの製造方法。 |
| GB0524851D0 (en) * | 2005-12-06 | 2006-01-11 | Ge Healthcare Ltd | Radiolabelling method using polymers |
| US7871623B2 (en) * | 2005-12-21 | 2011-01-18 | The Board Of Trustees Of The Leland Stanford Junior University | Compositions and methods for imaging pain and stress in vivo |
| EP2023919A4 (en) | 2006-05-08 | 2010-12-22 | Molecular Neuroimaging Llc | COMPOUNDS AND AMYLOID PROBES FOR THERAPY AND IMAGING USES |
| US10328164B2 (en) | 2006-06-21 | 2019-06-25 | Ge Healthcare Limited | Radiopharmaceutical products |
| WO2008022979A1 (en) | 2006-08-25 | 2008-02-28 | Boehringer Ingelheim International Gmbh | New pyridone derivatives with mch antagonistic activity and medicaments comprising these compounds |
| WO2009110894A1 (en) * | 2008-03-05 | 2009-09-11 | Rhino Technologies Llc | Tensionable spiral bolt with resin nut and related method |
| GB0625523D0 (en) | 2006-12-21 | 2007-01-31 | Ge Healthcare Ltd | In vivo imaging agents |
| EP2474525B1 (en) | 2006-12-26 | 2020-04-15 | Lantheus Medical Imaging, Inc. | Ligands for imaging cardiac innervation |
| JP5504563B2 (ja) | 2006-12-27 | 2014-05-28 | 住友化学株式会社 | 組成物及び該組成物を用いてなる発光素子 |
| CA2683433C (en) | 2007-04-05 | 2016-10-11 | Siemens Medical Solutions Usa, Inc. | Nitro-imidazole hypoxia imaging agents |
| GB0718386D0 (en) | 2007-09-21 | 2007-10-31 | Ge Healthcare As | Improved radiopharmaceutical formulation |
| CN101157649A (zh) * | 2007-10-23 | 2008-04-09 | 江苏省原子医学研究所 | 18F-Fallypride自动化合成的方法 |
| KR101068835B1 (ko) * | 2007-10-26 | 2011-09-30 | 한국과학기술연구원 | 베타-아밀로이드 집적체 및 피브릴에 우수한 결합 친화도를가지는 이소인돌론 화합물 및 이의 제조 방법 |
| CL2008003785A1 (es) | 2007-12-21 | 2009-10-09 | Du Pont | Compuestos derivados de piridazina; composiciones herbicidas que comprenden a dichos compuestos; y método para controlar el crecimiento de la vegetación indeseada. |
| WO2009103478A1 (en) | 2008-02-19 | 2009-08-27 | Boehringer Ingelheim International Gmbh | Pyridone and pyridazinone derivatives as mch antagonists |
| WO2010011367A2 (en) | 2008-02-22 | 2010-01-28 | Illinois Institute Of Technology | Bimodal ligands with macrocyclic and acyclic binding moieties, complexes and compositions thereof, and methods of using |
| PT2257315T (pt) * | 2008-02-29 | 2020-01-27 | Lantheus Medical Imaging Inc | Agentes de contraste para aplicações incluindo imagiologia de perfusão |
| US8258134B2 (en) | 2008-04-16 | 2012-09-04 | Hoffmann-La Roche Inc. | Pyridazinone glucokinase activators |
| WO2009146388A1 (en) | 2008-05-28 | 2009-12-03 | The Trustees Of Columbia University In The City Of New York | Voxel-based methods for assessing subjects using positron emission tomography |
| KR20110121632A (ko) * | 2009-02-25 | 2011-11-07 | 포컬 테크놀러지스 코퍼레이션 | 광섬유 로터리 조인트에 사용되는 저손실 시준기 |
| EP2406233B1 (en) | 2009-03-09 | 2013-11-13 | Bristol-Myers Squibb Company | Aza pyridone analogs useful as melanin concentrating hormone receptor-1 antagonists |
| PT2419096T (pt) | 2009-04-15 | 2020-02-19 | Lantheus Medical Imaging Inc | Estabilização de composições radiofarmacêuticas utilizando ácido ascórbico |
| CN101555232B (zh) | 2009-05-21 | 2011-01-05 | 北京师范大学 | 氟-18标记哒嗪酮类化合物及制备方法和应用 |
| KR20120051641A (ko) | 2009-07-11 | 2012-05-22 | 바이엘 파마 악티엔게젤샤프트 | 비-극성 및 극성 이탈기 |
| PT2534136T (pt) | 2010-02-08 | 2017-12-15 | Lantheus Medical Imaging Inc | Métodos para sintetizar agentes de imagiologia, e seus intermediários |
| CA2798488C (en) | 2010-05-11 | 2019-06-04 | Lantheus Medical Imaging, Inc. | Compositions, methods, and systems for the synthesis and use of imaging agents |
| DE102010036356A1 (de) * | 2010-07-12 | 2012-01-12 | Abx Advanced Biochemical Compounds Gmbh | Vorrichtung zur Synthese radioaktiv markierter Verbindungen |
| JP5842594B2 (ja) | 2010-12-27 | 2016-01-13 | 住友化学株式会社 | ピリダジノン化合物、それを含有する除草剤及び有害節足動物防除剤 |
| CN102336741B (zh) | 2011-07-06 | 2013-04-10 | 北京师范大学 | 氟-18标记的心肌灌注显像剂及其制备方法和应用 |
| CN104159890B (zh) | 2011-09-09 | 2018-04-10 | 蓝瑟斯医学影像公司 | 用于合成和使用显像剂的组合物、方法和系统 |
| CA2852395C (en) | 2011-10-21 | 2020-04-28 | Lantheus Medical Imaging, Inc. | Compositions comprising ascorbic acid and pyridaben and pyridaben analogs attached to an imaging moiety and related methods |
| AU2013203000B9 (en) | 2012-08-10 | 2017-02-02 | Lantheus Medical Imaging, Inc. | Compositions, methods, and systems for the synthesis and use of imaging agents |
| US20150246143A1 (en) | 2012-08-13 | 2015-09-03 | Lantheus Medical Imaging, Inc. | System and method for quantitative mapping of mitochondrial complex 1 |
| WO2014047446A1 (en) | 2012-09-21 | 2014-03-27 | The General Hospital Corporation | System and method for single-scan rest-stress cardiac pet |
-
2011
- 2011-02-08 PT PT117405464T patent/PT2534136T/pt unknown
- 2011-02-08 WO PCT/US2011/024109 patent/WO2011097649A2/en active Application Filing
- 2011-02-08 SG SG2012057279A patent/SG183134A1/en unknown
- 2011-02-08 US US13/577,674 patent/US8936777B2/en active Active
- 2011-02-08 DK DK17189439.7T patent/DK3323810T3/da active
- 2011-02-08 KR KR1020127023380A patent/KR101709372B1/ko active IP Right Grant
- 2011-02-08 CN CN202110332645.5A patent/CN113058046A/zh active Pending
- 2011-02-08 CN CN201811073733.2A patent/CN109200296B/zh active Active
- 2011-02-08 ES ES17189439T patent/ES2909318T3/es active Active
- 2011-02-08 CA CA2789044A patent/CA2789044C/en active Active
- 2011-02-08 MX MX2012009174A patent/MX348958B/es active IP Right Grant
- 2011-02-08 KR KR1020187013968A patent/KR20180055933A/ko not_active Application Discontinuation
- 2011-02-08 DK DK11740546.4T patent/DK2534136T3/en active
- 2011-02-08 NZ NZ602291A patent/NZ602291A/en unknown
- 2011-02-08 KR KR1020217035027A patent/KR102438133B1/ko active IP Right Grant
- 2011-02-08 EP EP17189439.7A patent/EP3323810B1/en active Active
- 2011-02-08 TW TW107133234A patent/TWI686370B/zh active
- 2011-02-08 KR KR1020177004163A patent/KR20170033873A/ko not_active Application Discontinuation
- 2011-02-08 KR KR1020197015985A patent/KR20190067255A/ko not_active Application Discontinuation
- 2011-02-08 SG SG10201500929XA patent/SG10201500929XA/en unknown
- 2011-02-08 RU RU2012138262A patent/RU2631500C2/ru active
- 2011-02-08 TW TW106115472A patent/TWI664169B/zh active
- 2011-02-08 BR BR112012019789A patent/BR112012019789A2/pt not_active Application Discontinuation
- 2011-02-08 NO NO11740546A patent/NO2534136T3/no unknown
- 2011-02-08 ES ES11740546.4T patent/ES2651466T3/es active Active
- 2011-02-08 CN CN201180016758.9A patent/CN102858752B/zh active Active
- 2011-02-08 JP JP2012552155A patent/JP6092628B2/ja active Active
- 2011-02-08 EP EP21216335.6A patent/EP4046990A1/en active Pending
- 2011-02-08 EP EP11740546.4A patent/EP2534136B1/en active Active
- 2011-02-08 TW TW105121479A patent/TWI660947B/zh active
- 2011-02-08 TW TW100104222A patent/TWI589302B/zh active
- 2011-02-08 PT PT171894397T patent/PT3323810T/pt unknown
- 2011-02-08 AU AU2011213568A patent/AU2011213568B2/en active Active
-
2012
- 2012-08-01 IL IL221253A patent/IL221253B/en active IP Right Grant
-
2014
- 2014-12-05 US US14/561,594 patent/US9603951B2/en active Active
-
2015
- 2015-09-14 JP JP2015181159A patent/JP6254126B2/ja active Active
-
2016
- 2016-08-11 AU AU2016213781A patent/AU2016213781A1/en not_active Abandoned
-
2017
- 2017-02-15 US US15/433,387 patent/US10022462B2/en active Active
- 2017-11-29 JP JP2017229034A patent/JP6685269B2/ja active Active
-
2018
- 2018-02-21 US US15/901,286 patent/US10842892B2/en active Active
- 2018-03-16 AU AU2018201916A patent/AU2018201916C1/en active Active
- 2018-11-21 HK HK18114852.8A patent/HK1255702A1/zh unknown
- 2018-12-06 IL IL263543A patent/IL263543B/en active IP Right Grant
-
2020
- 2020-10-05 US US17/062,757 patent/US20210187131A1/en active Pending
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR101709372B1 (ko) | 조영제 및 이의 중간체를 합성하는 방법 및 장치 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A107 | Divisional application of patent | ||
| A201 | Request for examination | ||
| A302 | Request for accelerated examination | ||
| E902 | Notification of reason for refusal | ||
| E601 | Decision to refuse application | ||
| E90F | Notification of reason for final refusal | ||
| A107 | Divisional application of patent | ||
| WITB | Written withdrawal of application |