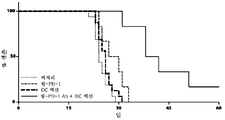
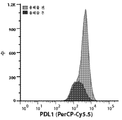
KR20160093012A - 암 치료를 위한 체크포인트 억제제 및 치료제의 배합물 - Google Patents
암 치료를 위한 체크포인트 억제제 및 치료제의 배합물 Download PDFInfo
- Publication number
- KR20160093012A KR20160093012A KR1020167014867A KR20167014867A KR20160093012A KR 20160093012 A KR20160093012 A KR 20160093012A KR 1020167014867 A KR1020167014867 A KR 1020167014867A KR 20167014867 A KR20167014867 A KR 20167014867A KR 20160093012 A KR20160093012 A KR 20160093012A
- Authority
- KR
- South Korea
- Prior art keywords
- cancer
- cell
- tumor
- checkpoint inhibitor
- cells
- Prior art date
Links
- 206010028980 Neoplasm Diseases 0.000 title claims abstract description 283
- 229940076838 Immune checkpoint inhibitor Drugs 0.000 title claims abstract description 187
- 239000012274 immune-checkpoint protein inhibitor Substances 0.000 title claims abstract description 187
- 201000011510 cancer Diseases 0.000 title claims abstract description 123
- 239000003814 drug Substances 0.000 title claims abstract description 70
- 238000000034 method Methods 0.000 claims abstract description 114
- 229940124597 therapeutic agent Drugs 0.000 claims abstract description 61
- 238000002648 combination therapy Methods 0.000 claims abstract description 23
- 210000001744 T-lymphocyte Anatomy 0.000 claims description 152
- 210000004027 cell Anatomy 0.000 claims description 121
- 238000011282 treatment Methods 0.000 claims description 62
- 229940029030 dendritic cell vaccine Drugs 0.000 claims description 60
- 239000000427 antigen Substances 0.000 claims description 59
- 102000036639 antigens Human genes 0.000 claims description 59
- 108091007433 antigens Proteins 0.000 claims description 59
- 229960005486 vaccine Drugs 0.000 claims description 53
- 230000000735 allogeneic effect Effects 0.000 claims description 44
- 102100039498 Cytotoxic T-lymphocyte protein 4 Human genes 0.000 claims description 43
- 238000002659 cell therapy Methods 0.000 claims description 42
- 210000000987 immune system Anatomy 0.000 claims description 38
- 239000000203 mixture Substances 0.000 claims description 35
- 239000003446 ligand Substances 0.000 claims description 32
- 108010021064 CTLA-4 Antigen Proteins 0.000 claims description 30
- 102000015696 Interleukins Human genes 0.000 claims description 27
- 108010063738 Interleukins Proteins 0.000 claims description 27
- 102100034458 Hepatitis A virus cellular receptor 2 Human genes 0.000 claims description 22
- 102100024213 Programmed cell death 1 ligand 2 Human genes 0.000 claims description 22
- 230000006023 anti-tumor response Effects 0.000 claims description 22
- 206010039491 Sarcoma Diseases 0.000 claims description 20
- 108010002586 Interleukin-7 Proteins 0.000 claims description 19
- 102000000704 Interleukin-7 Human genes 0.000 claims description 19
- 239000003112 inhibitor Substances 0.000 claims description 19
- 201000001441 melanoma Diseases 0.000 claims description 19
- 102100024263 CD160 antigen Human genes 0.000 claims description 18
- 101000761938 Homo sapiens CD160 antigen Proteins 0.000 claims description 18
- 230000000694 effects Effects 0.000 claims description 18
- 206010033128 Ovarian cancer Diseases 0.000 claims description 17
- 102100024216 Programmed cell death 1 ligand 1 Human genes 0.000 claims description 17
- 208000002154 non-small cell lung carcinoma Diseases 0.000 claims description 17
- 102100029822 B- and T-lymphocyte attenuator Human genes 0.000 claims description 16
- 102100038078 CD276 antigen Human genes 0.000 claims description 16
- 101710185679 CD276 antigen Proteins 0.000 claims description 16
- 101000864344 Homo sapiens B- and T-lymphocyte attenuator Proteins 0.000 claims description 16
- 101001117317 Homo sapiens Programmed cell death 1 ligand 1 Proteins 0.000 claims description 16
- 101000666896 Homo sapiens V-type immunoglobulin domain-containing suppressor of T-cell activation Proteins 0.000 claims description 16
- 102000017578 LAG3 Human genes 0.000 claims description 16
- 206010061535 Ovarian neoplasm Diseases 0.000 claims description 16
- 108010079206 V-Set Domain-Containing T-Cell Activation Inhibitor 1 Proteins 0.000 claims description 16
- 102100038929 V-set domain-containing T-cell activation inhibitor 1 Human genes 0.000 claims description 16
- 102100038282 V-type immunoglobulin domain-containing suppressor of T-cell activation Human genes 0.000 claims description 16
- 230000000977 initiatory effect Effects 0.000 claims description 16
- 101150051188 Adora2a gene Proteins 0.000 claims description 15
- 206010006187 Breast cancer Diseases 0.000 claims description 15
- 208000026310 Breast neoplasm Diseases 0.000 claims description 15
- 102100031351 Galectin-9 Human genes 0.000 claims description 15
- 101100229077 Gallus gallus GAL9 gene Proteins 0.000 claims description 15
- 101001068133 Homo sapiens Hepatitis A virus cellular receptor 2 Proteins 0.000 claims description 15
- 101001137987 Homo sapiens Lymphocyte activation gene 3 protein Proteins 0.000 claims description 15
- 101001117312 Homo sapiens Programmed cell death 1 ligand 2 Proteins 0.000 claims description 15
- 101000611936 Homo sapiens Programmed cell death protein 1 Proteins 0.000 claims description 15
- 101000777277 Homo sapiens Serine/threonine-protein kinase Chk2 Proteins 0.000 claims description 15
- 102000002698 KIR Receptors Human genes 0.000 claims description 15
- 108010043610 KIR Receptors Proteins 0.000 claims description 15
- 108010061593 Member 14 Tumor Necrosis Factor Receptors Proteins 0.000 claims description 15
- 102100031075 Serine/threonine-protein kinase Chk2 Human genes 0.000 claims description 15
- 102100028785 Tumor necrosis factor receptor superfamily member 14 Human genes 0.000 claims description 15
- 230000000259 anti-tumor effect Effects 0.000 claims description 15
- 230000002708 enhancing effect Effects 0.000 claims description 15
- IJJVMEJXYNJXOJ-UHFFFAOYSA-N fluquinconazole Chemical compound C=1C=C(Cl)C=C(Cl)C=1N1C(=O)C2=CC(F)=CC=C2N=C1N1C=NC=N1 IJJVMEJXYNJXOJ-UHFFFAOYSA-N 0.000 claims description 15
- 101000834898 Homo sapiens Alpha-synuclein Proteins 0.000 claims description 14
- 101000652359 Homo sapiens Spermatogenesis-associated protein 2 Proteins 0.000 claims description 14
- 208000006265 Renal cell carcinoma Diseases 0.000 claims description 14
- 206010073071 hepatocellular carcinoma Diseases 0.000 claims description 14
- 231100000844 hepatocellular carcinoma Toxicity 0.000 claims description 14
- 210000004881 tumor cell Anatomy 0.000 claims description 14
- 102000000588 Interleukin-2 Human genes 0.000 claims description 13
- 208000021712 Soft tissue sarcoma Diseases 0.000 claims description 13
- 206010009944 Colon cancer Diseases 0.000 claims description 12
- 108010002350 Interleukin-2 Proteins 0.000 claims description 12
- 102100040678 Programmed cell death protein 1 Human genes 0.000 claims description 12
- 206010060862 Prostate cancer Diseases 0.000 claims description 12
- 208000000236 Prostatic Neoplasms Diseases 0.000 claims description 12
- 208000005718 Stomach Neoplasms Diseases 0.000 claims description 12
- 108020001507 fusion proteins Proteins 0.000 claims description 12
- 102000037865 fusion proteins Human genes 0.000 claims description 12
- 206010017758 gastric cancer Diseases 0.000 claims description 12
- 208000032839 leukemia Diseases 0.000 claims description 12
- 201000011549 stomach cancer Diseases 0.000 claims description 12
- 101100463133 Caenorhabditis elegans pdl-1 gene Proteins 0.000 claims description 11
- 101000777293 Homo sapiens Serine/threonine-protein kinase Chk1 Proteins 0.000 claims description 11
- 102000003812 Interleukin-15 Human genes 0.000 claims description 11
- 108090000172 Interleukin-15 Proteins 0.000 claims description 11
- 102100031081 Serine/threonine-protein kinase Chk1 Human genes 0.000 claims description 11
- 230000003308 immunostimulating effect Effects 0.000 claims description 11
- 230000005764 inhibitory process Effects 0.000 claims description 11
- 230000005855 radiation Effects 0.000 claims description 11
- 150000003384 small molecules Chemical class 0.000 claims description 11
- 206010055113 Breast cancer metastatic Diseases 0.000 claims description 10
- 229940045513 CTLA4 antagonist Drugs 0.000 claims description 10
- 206010052358 Colorectal cancer metastatic Diseases 0.000 claims description 10
- 229940088597 hormone Drugs 0.000 claims description 10
- 239000005556 hormone Substances 0.000 claims description 10
- 206010061902 Pancreatic neoplasm Diseases 0.000 claims description 9
- 206010035226 Plasma cell myeloma Diseases 0.000 claims description 9
- 208000000102 Squamous Cell Carcinoma of Head and Neck Diseases 0.000 claims description 9
- 201000000459 head and neck squamous cell carcinoma Diseases 0.000 claims description 9
- 229960001438 immunostimulant agent Drugs 0.000 claims description 9
- 239000003022 immunostimulating agent Substances 0.000 claims description 9
- 208000015486 malignant pancreatic neoplasm Diseases 0.000 claims description 9
- 201000002528 pancreatic cancer Diseases 0.000 claims description 9
- 208000008443 pancreatic carcinoma Diseases 0.000 claims description 9
- 230000004614 tumor growth Effects 0.000 claims description 9
- 208000031261 Acute myeloid leukaemia Diseases 0.000 claims description 8
- 208000001333 Colorectal Neoplasms Diseases 0.000 claims description 8
- 208000000461 Esophageal Neoplasms Diseases 0.000 claims description 8
- 206010058467 Lung neoplasm malignant Diseases 0.000 claims description 8
- 208000034578 Multiple myelomas Diseases 0.000 claims description 8
- 208000033776 Myeloid Acute Leukemia Diseases 0.000 claims description 8
- 201000004101 esophageal cancer Diseases 0.000 claims description 8
- 201000005202 lung cancer Diseases 0.000 claims description 8
- 208000020816 lung neoplasm Diseases 0.000 claims description 8
- 208000032791 BCR-ABL1 positive chronic myelogenous leukemia Diseases 0.000 claims description 7
- 206010030155 Oesophageal carcinoma Diseases 0.000 claims description 7
- 206010041067 Small cell lung cancer Diseases 0.000 claims description 7
- 208000035250 cutaneous malignant susceptibility to 1 melanoma Diseases 0.000 claims description 7
- 208000005017 glioblastoma Diseases 0.000 claims description 7
- 201000010536 head and neck cancer Diseases 0.000 claims description 7
- 208000014829 head and neck neoplasm Diseases 0.000 claims description 7
- 230000003211 malignant effect Effects 0.000 claims description 7
- 230000002265 prevention Effects 0.000 claims description 7
- 208000000587 small cell lung carcinoma Diseases 0.000 claims description 7
- 238000002626 targeted therapy Methods 0.000 claims description 7
- 230000001988 toxicity Effects 0.000 claims description 7
- 231100000419 toxicity Toxicity 0.000 claims description 7
- 201000009030 Carcinoma Diseases 0.000 claims description 6
- 208000010833 Chronic myeloid leukaemia Diseases 0.000 claims description 6
- 208000002030 Merkel cell carcinoma Diseases 0.000 claims description 6
- 201000003793 Myelodysplastic syndrome Diseases 0.000 claims description 6
- 208000033761 Myelogenous Chronic BCR-ABL Positive Leukemia Diseases 0.000 claims description 6
- 206010029266 Neuroendocrine carcinoma of the skin Diseases 0.000 claims description 6
- 208000008385 Urogenital Neoplasms Diseases 0.000 claims description 6
- 208000017763 cutaneous neuroendocrine carcinoma Diseases 0.000 claims description 6
- 230000000683 nonmetastatic effect Effects 0.000 claims description 6
- 208000037964 urogenital cancer Diseases 0.000 claims description 6
- 206010006007 bone sarcoma Diseases 0.000 claims description 5
- 230000030833 cell death Effects 0.000 claims description 5
- 230000006872 improvement Effects 0.000 claims description 5
- 239000008194 pharmaceutical composition Substances 0.000 claims description 5
- 208000029742 colonic neoplasm Diseases 0.000 claims description 4
- 208000006178 malignant mesothelioma Diseases 0.000 claims description 4
- 208000024893 Acute lymphoblastic leukemia Diseases 0.000 claims description 3
- 208000014697 Acute lymphocytic leukaemia Diseases 0.000 claims description 3
- 206010061218 Inflammation Diseases 0.000 claims description 3
- 208000006664 Precursor Cell Lymphoblastic Leukemia-Lymphoma Diseases 0.000 claims description 3
- 206010054094 Tumour necrosis Diseases 0.000 claims description 3
- 230000008602 contraction Effects 0.000 claims description 3
- 230000012010 growth Effects 0.000 claims description 3
- 230000006698 induction Effects 0.000 claims description 3
- 230000004054 inflammatory process Effects 0.000 claims description 3
- 101710089372 Programmed cell death protein 1 Proteins 0.000 claims description 2
- 230000001464 adherent effect Effects 0.000 claims description 2
- 230000004547 gene signature Effects 0.000 claims description 2
- 102100026882 Alpha-synuclein Human genes 0.000 claims 4
- 230000000973 chemotherapeutic effect Effects 0.000 claims 2
- 201000010255 female reproductive organ cancer Diseases 0.000 claims 2
- 206010004446 Benign prostatic hyperplasia Diseases 0.000 claims 1
- 208000002250 Hematologic Neoplasms Diseases 0.000 claims 1
- 208000004403 Prostatic Hyperplasia Diseases 0.000 claims 1
- 230000003394 haemopoietic effect Effects 0.000 claims 1
- 230000009826 neoplastic cell growth Effects 0.000 claims 1
- 230000004044 response Effects 0.000 abstract description 32
- 230000009286 beneficial effect Effects 0.000 abstract description 4
- 210000004443 dendritic cell Anatomy 0.000 description 99
- 230000028993 immune response Effects 0.000 description 44
- 241000699670 Mus sp. Species 0.000 description 37
- -1 CGEN- Proteins 0.000 description 32
- 206010018338 Glioma Diseases 0.000 description 32
- 229940022511 therapeutic cancer vaccine Drugs 0.000 description 32
- 208000032612 Glial tumor Diseases 0.000 description 30
- 230000005975 antitumor immune response Effects 0.000 description 25
- 230000002401 inhibitory effect Effects 0.000 description 20
- 210000004698 lymphocyte Anatomy 0.000 description 20
- 108090000623 proteins and genes Proteins 0.000 description 18
- 102000004169 proteins and genes Human genes 0.000 description 17
- 230000004083 survival effect Effects 0.000 description 16
- 238000002255 vaccination Methods 0.000 description 16
- 230000008901 benefit Effects 0.000 description 15
- 208000029729 tumor suppressor gene on chromosome 11 Diseases 0.000 description 15
- 229940022399 cancer vaccine Drugs 0.000 description 14
- 238000009566 cancer vaccine Methods 0.000 description 14
- 230000037361 pathway Effects 0.000 description 14
- 101000889276 Homo sapiens Cytotoxic T-lymphocyte protein 4 Proteins 0.000 description 13
- 238000001727 in vivo Methods 0.000 description 13
- 210000003491 skin Anatomy 0.000 description 13
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 12
- 238000002560 therapeutic procedure Methods 0.000 description 12
- 102000004127 Cytokines Human genes 0.000 description 11
- 108090000695 Cytokines Proteins 0.000 description 11
- 230000001154 acute effect Effects 0.000 description 11
- 210000003719 b-lymphocyte Anatomy 0.000 description 11
- 239000003795 chemical substances by application Substances 0.000 description 11
- 239000012634 fragment Substances 0.000 description 11
- 230000001939 inductive effect Effects 0.000 description 11
- 239000002243 precursor Substances 0.000 description 11
- 108020004414 DNA Proteins 0.000 description 10
- 206010025323 Lymphomas Diseases 0.000 description 10
- 210000002865 immune cell Anatomy 0.000 description 10
- 206010061289 metastatic neoplasm Diseases 0.000 description 10
- 230000035935 pregnancy Effects 0.000 description 10
- 239000000126 substance Substances 0.000 description 10
- 208000003174 Brain Neoplasms Diseases 0.000 description 9
- 101000914514 Homo sapiens T-cell-specific surface glycoprotein CD28 Proteins 0.000 description 9
- 241001529936 Murinae Species 0.000 description 9
- 102100027213 T-cell-specific surface glycoprotein CD28 Human genes 0.000 description 9
- 210000001185 bone marrow Anatomy 0.000 description 9
- 229940030156 cell vaccine Drugs 0.000 description 9
- 230000001394 metastastic effect Effects 0.000 description 9
- 238000002600 positron emission tomography Methods 0.000 description 9
- 230000002829 reductive effect Effects 0.000 description 9
- 210000000952 spleen Anatomy 0.000 description 9
- 210000001519 tissue Anatomy 0.000 description 9
- 101000914484 Homo sapiens T-lymphocyte activation antigen CD80 Proteins 0.000 description 8
- 108700030875 Programmed Cell Death 1 Ligand 2 Proteins 0.000 description 8
- 102100027222 T-lymphocyte activation antigen CD80 Human genes 0.000 description 8
- 239000002246 antineoplastic agent Substances 0.000 description 8
- 230000000903 blocking effect Effects 0.000 description 8
- 210000004369 blood Anatomy 0.000 description 8
- 239000008280 blood Substances 0.000 description 8
- 230000001684 chronic effect Effects 0.000 description 8
- 210000001151 cytotoxic T lymphocyte Anatomy 0.000 description 8
- 229940127089 cytotoxic agent Drugs 0.000 description 8
- 230000007423 decrease Effects 0.000 description 8
- 229940079593 drug Drugs 0.000 description 8
- 238000009472 formulation Methods 0.000 description 8
- 230000001965 increasing effect Effects 0.000 description 8
- 230000003993 interaction Effects 0.000 description 8
- 210000001165 lymph node Anatomy 0.000 description 8
- 210000000822 natural killer cell Anatomy 0.000 description 8
- 101710083479 Hepatitis A virus cellular receptor 2 homolog Proteins 0.000 description 7
- 101100407308 Mus musculus Pdcd1lg2 gene Proteins 0.000 description 7
- 229940126547 T-cell immunoglobulin mucin-3 Drugs 0.000 description 7
- 230000004913 activation Effects 0.000 description 7
- 239000000090 biomarker Substances 0.000 description 7
- 210000002798 bone marrow cell Anatomy 0.000 description 7
- 239000000306 component Substances 0.000 description 7
- 201000010099 disease Diseases 0.000 description 7
- 230000006870 function Effects 0.000 description 7
- 238000002347 injection Methods 0.000 description 7
- 239000007924 injection Substances 0.000 description 7
- 238000007917 intracranial administration Methods 0.000 description 7
- 239000000463 material Substances 0.000 description 7
- 108090000765 processed proteins & peptides Proteins 0.000 description 7
- 230000035755 proliferation Effects 0.000 description 7
- 102000005962 receptors Human genes 0.000 description 7
- 108020003175 receptors Proteins 0.000 description 7
- 230000001105 regulatory effect Effects 0.000 description 7
- 206010005003 Bladder cancer Diseases 0.000 description 6
- 241000699666 Mus <mouse, genus> Species 0.000 description 6
- 208000007097 Urinary Bladder Neoplasms Diseases 0.000 description 6
- 239000003124 biologic agent Substances 0.000 description 6
- 230000003915 cell function Effects 0.000 description 6
- 230000010261 cell growth Effects 0.000 description 6
- 238000004519 manufacturing process Methods 0.000 description 6
- 230000001225 therapeutic effect Effects 0.000 description 6
- 201000005112 urinary bladder cancer Diseases 0.000 description 6
- 239000013598 vector Substances 0.000 description 6
- 208000023275 Autoimmune disease Diseases 0.000 description 5
- 206010008342 Cervix carcinoma Diseases 0.000 description 5
- 206010014733 Endometrial cancer Diseases 0.000 description 5
- 206010014759 Endometrial neoplasm Diseases 0.000 description 5
- 101001057504 Homo sapiens Interferon-stimulated gene 20 kDa protein Proteins 0.000 description 5
- 101001055144 Homo sapiens Interleukin-2 receptor subunit alpha Proteins 0.000 description 5
- 102100027268 Interferon-stimulated gene 20 kDa protein Human genes 0.000 description 5
- NWIBSHFKIJFRCO-WUDYKRTCSA-N Mytomycin Chemical compound C1N2C(C(C(C)=C(N)C3=O)=O)=C3[C@@H](COC(N)=O)[C@@]2(OC)[C@@H]2[C@H]1N2 NWIBSHFKIJFRCO-WUDYKRTCSA-N 0.000 description 5
- 208000034176 Neoplasms, Germ Cell and Embryonal Diseases 0.000 description 5
- 208000006105 Uterine Cervical Neoplasms Diseases 0.000 description 5
- 241000700605 Viruses Species 0.000 description 5
- 201000010881 cervical cancer Diseases 0.000 description 5
- 238000002512 chemotherapy Methods 0.000 description 5
- 208000035475 disorder Diseases 0.000 description 5
- 210000003128 head Anatomy 0.000 description 5
- 238000003384 imaging method Methods 0.000 description 5
- 238000009169 immunotherapy Methods 0.000 description 5
- 229940047122 interleukins Drugs 0.000 description 5
- 230000000527 lymphocytic effect Effects 0.000 description 5
- 239000006166 lysate Substances 0.000 description 5
- 230000007246 mechanism Effects 0.000 description 5
- 230000015654 memory Effects 0.000 description 5
- 210000001616 monocyte Anatomy 0.000 description 5
- 239000002953 phosphate buffered saline Substances 0.000 description 5
- 102000004196 processed proteins & peptides Human genes 0.000 description 5
- 150000003839 salts Chemical class 0.000 description 5
- 208000024891 symptom Diseases 0.000 description 5
- 238000012360 testing method Methods 0.000 description 5
- 238000002054 transplantation Methods 0.000 description 5
- 108700028369 Alleles Proteins 0.000 description 4
- 206010003571 Astrocytoma Diseases 0.000 description 4
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 4
- 108010041986 DNA Vaccines Proteins 0.000 description 4
- 229940021995 DNA vaccine Drugs 0.000 description 4
- AOJJSUZBOXZQNB-TZSSRYMLSA-N Doxorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(=O)CO)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 AOJJSUZBOXZQNB-TZSSRYMLSA-N 0.000 description 4
- GHASVSINZRGABV-UHFFFAOYSA-N Fluorouracil Chemical compound FC1=CNC(=O)NC1=O GHASVSINZRGABV-UHFFFAOYSA-N 0.000 description 4
- 208000017604 Hodgkin disease Diseases 0.000 description 4
- 208000021519 Hodgkin lymphoma Diseases 0.000 description 4
- 208000010747 Hodgkins lymphoma Diseases 0.000 description 4
- 102000004388 Interleukin-4 Human genes 0.000 description 4
- 108090000978 Interleukin-4 Proteins 0.000 description 4
- 208000028018 Lymphocytic leukaemia Diseases 0.000 description 4
- 241001465754 Metazoa Species 0.000 description 4
- ZDZOTLJHXYCWBA-VCVYQWHSSA-N N-debenzoyl-N-(tert-butoxycarbonyl)-10-deacetyltaxol Chemical compound O([C@H]1[C@H]2[C@@](C([C@H](O)C3=C(C)[C@@H](OC(=O)[C@H](O)[C@@H](NC(=O)OC(C)(C)C)C=4C=CC=CC=4)C[C@]1(O)C3(C)C)=O)(C)[C@@H](O)C[C@H]1OC[C@]12OC(=O)C)C(=O)C1=CC=CC=C1 ZDZOTLJHXYCWBA-VCVYQWHSSA-N 0.000 description 4
- 208000015914 Non-Hodgkin lymphomas Diseases 0.000 description 4
- 229930012538 Paclitaxel Natural products 0.000 description 4
- 230000005867 T cell response Effects 0.000 description 4
- 238000009825 accumulation Methods 0.000 description 4
- 239000002253 acid Substances 0.000 description 4
- 210000004556 brain Anatomy 0.000 description 4
- 231100000433 cytotoxic Toxicity 0.000 description 4
- 230000001472 cytotoxic effect Effects 0.000 description 4
- 229960002949 fluorouracil Drugs 0.000 description 4
- 230000001976 improved effect Effects 0.000 description 4
- 238000000338 in vitro Methods 0.000 description 4
- 230000000670 limiting effect Effects 0.000 description 4
- 201000007270 liver cancer Diseases 0.000 description 4
- 208000003747 lymphoid leukemia Diseases 0.000 description 4
- 210000002540 macrophage Anatomy 0.000 description 4
- 230000004048 modification Effects 0.000 description 4
- 238000012986 modification Methods 0.000 description 4
- 229960001592 paclitaxel Drugs 0.000 description 4
- 238000012545 processing Methods 0.000 description 4
- 239000000523 sample Substances 0.000 description 4
- 230000011664 signaling Effects 0.000 description 4
- UCSJYZPVAKXKNQ-HZYVHMACSA-N streptomycin Chemical compound CN[C@H]1[C@H](O)[C@@H](O)[C@H](CO)O[C@H]1O[C@@H]1[C@](C=O)(O)[C@H](C)O[C@H]1O[C@@H]1[C@@H](NC(N)=N)[C@H](O)[C@@H](NC(N)=N)[C@H](O)[C@H]1O UCSJYZPVAKXKNQ-HZYVHMACSA-N 0.000 description 4
- RCINICONZNJXQF-MZXODVADSA-N taxol Chemical compound O([C@@H]1[C@@]2(C[C@@H](C(C)=C(C2(C)C)[C@H](C([C@]2(C)[C@@H](O)C[C@H]3OC[C@]3([C@H]21)OC(C)=O)=O)OC(=O)C)OC(=O)[C@H](O)[C@@H](NC(=O)C=1C=CC=CC=1)C=1C=CC=CC=1)O)C(=O)C1=CC=CC=C1 RCINICONZNJXQF-MZXODVADSA-N 0.000 description 4
- 229960000575 trastuzumab Drugs 0.000 description 4
- STQGQHZAVUOBTE-UHFFFAOYSA-N 7-Cyan-hept-2t-en-4,6-diinsaeure Natural products C1=2C(O)=C3C(=O)C=4C(OC)=CC=CC=4C(=O)C3=C(O)C=2CC(O)(C(C)=O)CC1OC1CC(N)C(O)C(C)O1 STQGQHZAVUOBTE-UHFFFAOYSA-N 0.000 description 3
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 3
- 102000019034 Chemokines Human genes 0.000 description 3
- 108010012236 Chemokines Proteins 0.000 description 3
- CMSMOCZEIVJLDB-UHFFFAOYSA-N Cyclophosphamide Chemical compound ClCCN(CCCl)P1(=O)NCCCO1 CMSMOCZEIVJLDB-UHFFFAOYSA-N 0.000 description 3
- UHDGCWIWMRVCDJ-CCXZUQQUSA-N Cytarabine Chemical compound O=C1N=C(N)C=CN1[C@H]1[C@@H](O)[C@H](O)[C@@H](CO)O1 UHDGCWIWMRVCDJ-CCXZUQQUSA-N 0.000 description 3
- 239000006144 Dulbecco’s modified Eagle's medium Substances 0.000 description 3
- 102100039620 Granulocyte-macrophage colony-stimulating factor Human genes 0.000 description 3
- 208000031886 HIV Infections Diseases 0.000 description 3
- 102000037982 Immune checkpoint proteins Human genes 0.000 description 3
- 108091008036 Immune checkpoint proteins Proteins 0.000 description 3
- 108060003951 Immunoglobulin Proteins 0.000 description 3
- 108010002386 Interleukin-3 Proteins 0.000 description 3
- 102100039064 Interleukin-3 Human genes 0.000 description 3
- FBOZXECLQNJBKD-ZDUSSCGKSA-N L-methotrexate Chemical compound C=1N=C2N=C(N)N=C(N)C2=NC=1CN(C)C1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 FBOZXECLQNJBKD-ZDUSSCGKSA-N 0.000 description 3
- 208000003445 Mouth Neoplasms Diseases 0.000 description 3
- FOCVUCIESVLUNU-UHFFFAOYSA-N Thiotepa Chemical compound C1CN1P(N1CC1)(=S)N1CC1 FOCVUCIESVLUNU-UHFFFAOYSA-N 0.000 description 3
- 206010064390 Tumour invasion Diseases 0.000 description 3
- 239000002671 adjuvant Substances 0.000 description 3
- 230000001093 anti-cancer Effects 0.000 description 3
- 210000000612 antigen-presenting cell Anatomy 0.000 description 3
- 238000003556 assay Methods 0.000 description 3
- 229940037642 autologous vaccine Drugs 0.000 description 3
- 229960000397 bevacizumab Drugs 0.000 description 3
- 229960000074 biopharmaceutical Drugs 0.000 description 3
- 230000009400 cancer invasion Effects 0.000 description 3
- 208000002458 carcinoid tumor Diseases 0.000 description 3
- 230000001413 cellular effect Effects 0.000 description 3
- 238000006243 chemical reaction Methods 0.000 description 3
- 150000001875 compounds Chemical class 0.000 description 3
- STQGQHZAVUOBTE-VGBVRHCVSA-N daunorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(C)=O)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 STQGQHZAVUOBTE-VGBVRHCVSA-N 0.000 description 3
- 238000011161 development Methods 0.000 description 3
- 230000018109 developmental process Effects 0.000 description 3
- 230000004069 differentiation Effects 0.000 description 3
- 229960003668 docetaxel Drugs 0.000 description 3
- VJJPUSNTGOMMGY-MRVIYFEKSA-N etoposide Chemical compound COC1=C(O)C(OC)=CC([C@@H]2C3=CC=4OCOC=4C=C3[C@@H](O[C@H]3[C@@H]([C@@H](O)[C@@H]4O[C@H](C)OC[C@H]4O3)O)[C@@H]3[C@@H]2C(OC3)=O)=C1 VJJPUSNTGOMMGY-MRVIYFEKSA-N 0.000 description 3
- 229960005420 etoposide Drugs 0.000 description 3
- 235000012907 honey Nutrition 0.000 description 3
- 230000002267 hypothalamic effect Effects 0.000 description 3
- 102000018358 immunoglobulin Human genes 0.000 description 3
- 230000008595 infiltration Effects 0.000 description 3
- 238000001764 infiltration Methods 0.000 description 3
- 210000004153 islets of langerhan Anatomy 0.000 description 3
- 210000003734 kidney Anatomy 0.000 description 3
- 210000002751 lymph Anatomy 0.000 description 3
- 239000011159 matrix material Substances 0.000 description 3
- 239000002609 medium Substances 0.000 description 3
- GLVAUDGFNGKCSF-UHFFFAOYSA-N mercaptopurine Chemical compound S=C1NC=NC2=C1NC=N2 GLVAUDGFNGKCSF-UHFFFAOYSA-N 0.000 description 3
- 229960000485 methotrexate Drugs 0.000 description 3
- 229960004857 mitomycin Drugs 0.000 description 3
- 210000005087 mononuclear cell Anatomy 0.000 description 3
- 210000004498 neuroglial cell Anatomy 0.000 description 3
- 201000008968 osteosarcoma Diseases 0.000 description 3
- 230000001575 pathological effect Effects 0.000 description 3
- 229920001184 polypeptide Polymers 0.000 description 3
- 210000003289 regulatory T cell Anatomy 0.000 description 3
- 201000000849 skin cancer Diseases 0.000 description 3
- 239000000243 solution Substances 0.000 description 3
- 210000001541 thymus gland Anatomy 0.000 description 3
- 206010044412 transitional cell carcinoma Diseases 0.000 description 3
- 239000000107 tumor biomarker Substances 0.000 description 3
- 230000003827 upregulation Effects 0.000 description 3
- 210000000626 ureter Anatomy 0.000 description 3
- 210000000239 visual pathway Anatomy 0.000 description 3
- 230000004400 visual pathway Effects 0.000 description 3
- FPVKHBSQESCIEP-UHFFFAOYSA-N (8S)-3-(2-deoxy-beta-D-erythro-pentofuranosyl)-3,6,7,8-tetrahydroimidazo[4,5-d][1,3]diazepin-8-ol Natural products C1C(O)C(CO)OC1N1C(NC=NCC2O)=C2N=C1 FPVKHBSQESCIEP-UHFFFAOYSA-N 0.000 description 2
- WYWHKKSPHMUBEB-UHFFFAOYSA-N 6-Mercaptoguanine Natural products N1C(N)=NC(=S)C2=C1N=CN2 WYWHKKSPHMUBEB-UHFFFAOYSA-N 0.000 description 2
- 208000030507 AIDS Diseases 0.000 description 2
- 206010060971 Astrocytoma malignant Diseases 0.000 description 2
- 108010006654 Bleomycin Proteins 0.000 description 2
- 206010006143 Brain stem glioma Diseases 0.000 description 2
- 101150050673 CHK1 gene Proteins 0.000 description 2
- DLGOEMSEDOSKAD-UHFFFAOYSA-N Carmustine Chemical compound ClCCNC(=O)N(N=O)CCCl DLGOEMSEDOSKAD-UHFFFAOYSA-N 0.000 description 2
- 206010007953 Central nervous system lymphoma Diseases 0.000 description 2
- 108010071942 Colony-Stimulating Factors Proteins 0.000 description 2
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 2
- 208000021309 Germ cell tumor Diseases 0.000 description 2
- 108010017213 Granulocyte-Macrophage Colony-Stimulating Factor Proteins 0.000 description 2
- 241001326189 Gyrodactylus prostae Species 0.000 description 2
- 208000037357 HIV infectious disease Diseases 0.000 description 2
- 101000946889 Homo sapiens Monocyte differentiation antigen CD14 Proteins 0.000 description 2
- VSNHCAURESNICA-UHFFFAOYSA-N Hydroxyurea Chemical compound NC(=O)NO VSNHCAURESNICA-UHFFFAOYSA-N 0.000 description 2
- 102000037978 Immune checkpoint receptors Human genes 0.000 description 2
- 108091008028 Immune checkpoint receptors Proteins 0.000 description 2
- 206010062016 Immunosuppression Diseases 0.000 description 2
- 102000014150 Interferons Human genes 0.000 description 2
- 108010050904 Interferons Proteins 0.000 description 2
- 108050003558 Interleukin-17 Proteins 0.000 description 2
- 102000013691 Interleukin-17 Human genes 0.000 description 2
- 206010061252 Intraocular melanoma Diseases 0.000 description 2
- 208000031671 Large B-Cell Diffuse Lymphoma Diseases 0.000 description 2
- 206010023825 Laryngeal cancer Diseases 0.000 description 2
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 2
- 239000004472 Lysine Substances 0.000 description 2
- 208000006644 Malignant Fibrous Histiocytoma Diseases 0.000 description 2
- 206010027480 Metastatic malignant melanoma Diseases 0.000 description 2
- 102100035877 Monocyte differentiation antigen CD14 Human genes 0.000 description 2
- 241000699660 Mus musculus Species 0.000 description 2
- 201000007224 Myeloproliferative neoplasm Diseases 0.000 description 2
- 208000010505 Nose Neoplasms Diseases 0.000 description 2
- 238000012879 PET imaging Methods 0.000 description 2
- 229930182555 Penicillin Natural products 0.000 description 2
- JGSARLDLIJGVTE-MBNYWOFBSA-N Penicillin G Chemical compound N([C@H]1[C@H]2SC([C@@H](N2C1=O)C(O)=O)(C)C)C(=O)CC1=CC=CC=C1 JGSARLDLIJGVTE-MBNYWOFBSA-N 0.000 description 2
- 201000000582 Retinoblastoma Diseases 0.000 description 2
- 239000006146 Roswell Park Memorial Institute medium Substances 0.000 description 2
- 208000004337 Salivary Gland Neoplasms Diseases 0.000 description 2
- 206010061934 Salivary gland cancer Diseases 0.000 description 2
- 208000000453 Skin Neoplasms Diseases 0.000 description 2
- 230000006044 T cell activation Effects 0.000 description 2
- 206010042971 T-cell lymphoma Diseases 0.000 description 2
- 208000027585 T-cell non-Hodgkin lymphoma Diseases 0.000 description 2
- NKANXQFJJICGDU-QPLCGJKRSA-N Tamoxifen Chemical compound C=1C=CC=CC=1C(/CC)=C(C=1C=CC(OCCN(C)C)=CC=1)/C1=CC=CC=C1 NKANXQFJJICGDU-QPLCGJKRSA-N 0.000 description 2
- 208000024770 Thyroid neoplasm Diseases 0.000 description 2
- 208000015778 Undifferentiated pleomorphic sarcoma Diseases 0.000 description 2
- 201000005969 Uveal melanoma Diseases 0.000 description 2
- 108091008605 VEGF receptors Proteins 0.000 description 2
- 102000009484 Vascular Endothelial Growth Factor Receptors Human genes 0.000 description 2
- JXLYSJRDGCGARV-WWYNWVTFSA-N Vinblastine Natural products O=C(O[C@H]1[C@](O)(C(=O)OC)[C@@H]2N(C)c3c(cc(c(OC)c3)[C@]3(C(=O)OC)c4[nH]c5c(c4CCN4C[C@](O)(CC)C[C@H](C3)C4)cccc5)[C@@]32[C@H]2[C@@]1(CC)C=CCN2CC3)C JXLYSJRDGCGARV-WWYNWVTFSA-N 0.000 description 2
- 208000036142 Viral infection Diseases 0.000 description 2
- 239000013543 active substance Substances 0.000 description 2
- 208000020990 adrenal cortex carcinoma Diseases 0.000 description 2
- 208000007128 adrenocortical carcinoma Diseases 0.000 description 2
- 239000000556 agonist Substances 0.000 description 2
- 229940100198 alkylating agent Drugs 0.000 description 2
- 239000002168 alkylating agent Substances 0.000 description 2
- 230000003110 anti-inflammatory effect Effects 0.000 description 2
- 230000005809 anti-tumor immunity Effects 0.000 description 2
- 238000009175 antibody therapy Methods 0.000 description 2
- 239000012298 atmosphere Substances 0.000 description 2
- VSRXQHXAPYXROS-UHFFFAOYSA-N azanide;cyclobutane-1,1-dicarboxylic acid;platinum(2+) Chemical compound [NH2-].[NH2-].[Pt+2].OC(=O)C1(C(O)=O)CCC1 VSRXQHXAPYXROS-UHFFFAOYSA-N 0.000 description 2
- 229960001561 bleomycin Drugs 0.000 description 2
- OYVAGSVQBOHSSS-UAPAGMARSA-O bleomycin A2 Chemical compound N([C@H](C(=O)N[C@H](C)[C@@H](O)[C@H](C)C(=O)N[C@@H]([C@H](O)C)C(=O)NCCC=1SC=C(N=1)C=1SC=C(N=1)C(=O)NCCC[S+](C)C)[C@@H](O[C@H]1[C@H]([C@@H](O)[C@H](O)[C@H](CO)O1)O[C@@H]1[C@H]([C@@H](OC(N)=O)[C@H](O)[C@@H](CO)O1)O)C=1N=CNC=1)C(=O)C1=NC([C@H](CC(N)=O)NC[C@H](N)C(N)=O)=NC(N)=C1C OYVAGSVQBOHSSS-UAPAGMARSA-O 0.000 description 2
- 210000005013 brain tissue Anatomy 0.000 description 2
- 238000009395 breeding Methods 0.000 description 2
- 230000001488 breeding effect Effects 0.000 description 2
- 238000004364 calculation method Methods 0.000 description 2
- 229960004562 carboplatin Drugs 0.000 description 2
- 229960005243 carmustine Drugs 0.000 description 2
- 239000006285 cell suspension Substances 0.000 description 2
- 210000003169 central nervous system Anatomy 0.000 description 2
- 201000007335 cerebellar astrocytoma Diseases 0.000 description 2
- 208000030239 cerebral astrocytoma Diseases 0.000 description 2
- 229960005395 cetuximab Drugs 0.000 description 2
- 229960004630 chlorambucil Drugs 0.000 description 2
- JCKYGMPEJWAADB-UHFFFAOYSA-N chlorambucil Chemical compound OC(=O)CCCC1=CC=C(N(CCCl)CCCl)C=C1 JCKYGMPEJWAADB-UHFFFAOYSA-N 0.000 description 2
- 208000006990 cholangiocarcinoma Diseases 0.000 description 2
- DQLATGHUWYMOKM-UHFFFAOYSA-L cisplatin Chemical compound N[Pt](N)(Cl)Cl DQLATGHUWYMOKM-UHFFFAOYSA-L 0.000 description 2
- 229960004316 cisplatin Drugs 0.000 description 2
- 239000000470 constituent Substances 0.000 description 2
- 229960004397 cyclophosphamide Drugs 0.000 description 2
- 229960000684 cytarabine Drugs 0.000 description 2
- 229960000975 daunorubicin Drugs 0.000 description 2
- 230000034994 death Effects 0.000 description 2
- 231100000517 death Toxicity 0.000 description 2
- 230000007850 degeneration Effects 0.000 description 2
- 230000003111 delayed effect Effects 0.000 description 2
- 230000001419 dependent effect Effects 0.000 description 2
- 206010012818 diffuse large B-cell lymphoma Diseases 0.000 description 2
- POULHZVOKOAJMA-UHFFFAOYSA-N dodecanoic acid Chemical compound CCCCCCCCCCCC(O)=O POULHZVOKOAJMA-UHFFFAOYSA-N 0.000 description 2
- 229960004679 doxorubicin Drugs 0.000 description 2
- 229950009791 durvalumab Drugs 0.000 description 2
- 230000007717 exclusion Effects 0.000 description 2
- OVBPIULPVIDEAO-LBPRGKRZSA-N folic acid Chemical compound C=1N=C2NC(N)=NC(=O)C2=NC=1CNC1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 OVBPIULPVIDEAO-LBPRGKRZSA-N 0.000 description 2
- 230000004927 fusion Effects 0.000 description 2
- CHPZKNULDCNCBW-UHFFFAOYSA-N gallium nitrate Chemical compound [Ga+3].[O-][N+]([O-])=O.[O-][N+]([O-])=O.[O-][N+]([O-])=O CHPZKNULDCNCBW-UHFFFAOYSA-N 0.000 description 2
- 238000001415 gene therapy Methods 0.000 description 2
- 230000002068 genetic effect Effects 0.000 description 2
- 102000054766 genetic haplotypes Human genes 0.000 description 2
- 239000003102 growth factor Substances 0.000 description 2
- 210000002768 hair cell Anatomy 0.000 description 2
- 210000003958 hematopoietic stem cell Anatomy 0.000 description 2
- 208000029824 high grade glioma Diseases 0.000 description 2
- 208000033519 human immunodeficiency virus infectious disease Diseases 0.000 description 2
- 229960001330 hydroxycarbamide Drugs 0.000 description 2
- 206010020718 hyperplasia Diseases 0.000 description 2
- 229960001101 ifosfamide Drugs 0.000 description 2
- HOMGKSMUEGBAAB-UHFFFAOYSA-N ifosfamide Chemical compound ClCCNP1(=O)OCCCN1CCCl HOMGKSMUEGBAAB-UHFFFAOYSA-N 0.000 description 2
- 230000036737 immune function Effects 0.000 description 2
- 238000003364 immunohistochemistry Methods 0.000 description 2
- 230000001506 immunosuppresive effect Effects 0.000 description 2
- 239000003018 immunosuppressive agent Substances 0.000 description 2
- 238000002513 implantation Methods 0.000 description 2
- 238000001802 infusion Methods 0.000 description 2
- UWKQSNNFCGGAFS-XIFFEERXSA-N irinotecan Chemical compound C1=C2C(CC)=C3CN(C(C4=C([C@@](C(=O)OC4)(O)CC)C=4)=O)C=4C3=NC2=CC=C1OC(=O)N(CC1)CCC1N1CCCCC1 UWKQSNNFCGGAFS-XIFFEERXSA-N 0.000 description 2
- 206010023841 laryngeal neoplasm Diseases 0.000 description 2
- 230000002045 lasting effect Effects 0.000 description 2
- 208000012987 lip and oral cavity carcinoma Diseases 0.000 description 2
- 239000007788 liquid Substances 0.000 description 2
- 208000014018 liver neoplasm Diseases 0.000 description 2
- 230000007774 longterm Effects 0.000 description 2
- 238000002595 magnetic resonance imaging Methods 0.000 description 2
- 208000030883 malignant astrocytoma Diseases 0.000 description 2
- 201000011614 malignant glioma Diseases 0.000 description 2
- 230000035800 maturation Effects 0.000 description 2
- 230000001404 mediated effect Effects 0.000 description 2
- 229960001924 melphalan Drugs 0.000 description 2
- SGDBTWWWUNNDEQ-LBPRGKRZSA-N melphalan Chemical compound OC(=O)[C@@H](N)CC1=CC=C(N(CCCl)CCCl)C=C1 SGDBTWWWUNNDEQ-LBPRGKRZSA-N 0.000 description 2
- 229960001428 mercaptopurine Drugs 0.000 description 2
- 208000021039 metastatic melanoma Diseases 0.000 description 2
- 229960001156 mitoxantrone Drugs 0.000 description 2
- KKZJGLLVHKMTCM-UHFFFAOYSA-N mitoxantrone Chemical compound O=C1C2=C(O)C=CC(O)=C2C(=O)C2=C1C(NCCNCCO)=CC=C2NCCNCCO KKZJGLLVHKMTCM-UHFFFAOYSA-N 0.000 description 2
- 208000025113 myeloid leukemia Diseases 0.000 description 2
- 210000003643 myeloid progenitor cell Anatomy 0.000 description 2
- 208000037830 nasal cancer Diseases 0.000 description 2
- 229960001420 nimustine Drugs 0.000 description 2
- VFEDRRNHLBGPNN-UHFFFAOYSA-N nimustine Chemical compound CC1=NC=C(CNC(=O)N(CCCl)N=O)C(N)=N1 VFEDRRNHLBGPNN-UHFFFAOYSA-N 0.000 description 2
- 229910052757 nitrogen Inorganic materials 0.000 description 2
- 229960003301 nivolumab Drugs 0.000 description 2
- 102000039446 nucleic acids Human genes 0.000 description 2
- 108020004707 nucleic acids Proteins 0.000 description 2
- 150000007523 nucleic acids Chemical class 0.000 description 2
- 235000015097 nutrients Nutrition 0.000 description 2
- 201000002575 ocular melanoma Diseases 0.000 description 2
- 210000001328 optic nerve Anatomy 0.000 description 2
- 210000001672 ovary Anatomy 0.000 description 2
- 230000036961 partial effect Effects 0.000 description 2
- 229940049954 penicillin Drugs 0.000 description 2
- 229960002340 pentostatin Drugs 0.000 description 2
- FPVKHBSQESCIEP-JQCXWYLXSA-N pentostatin Chemical compound C1[C@H](O)[C@@H](CO)O[C@H]1N1C(N=CNC[C@H]2O)=C2N=C1 FPVKHBSQESCIEP-JQCXWYLXSA-N 0.000 description 2
- 238000009520 phase I clinical trial Methods 0.000 description 2
- 238000009521 phase II clinical trial Methods 0.000 description 2
- 208000010626 plasma cell neoplasm Diseases 0.000 description 2
- BASFCYQUMIYNBI-UHFFFAOYSA-N platinum Chemical compound [Pt] BASFCYQUMIYNBI-UHFFFAOYSA-N 0.000 description 2
- 208000016800 primary central nervous system lymphoma Diseases 0.000 description 2
- 230000002062 proliferating effect Effects 0.000 description 2
- RXWNCPJZOCPEPQ-NVWDDTSBSA-N puromycin Chemical compound C1=CC(OC)=CC=C1C[C@H](N)C(=O)N[C@H]1[C@@H](O)[C@H](N2C3=NC=NC(=C3N=C2)N(C)C)O[C@@H]1CO RXWNCPJZOCPEPQ-NVWDDTSBSA-N 0.000 description 2
- 238000001959 radiotherapy Methods 0.000 description 2
- 229960003876 ranibizumab Drugs 0.000 description 2
- 230000010076 replication Effects 0.000 description 2
- 238000002271 resection Methods 0.000 description 2
- 201000009410 rhabdomyosarcoma Diseases 0.000 description 2
- 229960004641 rituximab Drugs 0.000 description 2
- 238000009097 single-agent therapy Methods 0.000 description 2
- 208000037968 sinus cancer Diseases 0.000 description 2
- 210000004872 soft tissue Anatomy 0.000 description 2
- 241000894007 species Species 0.000 description 2
- 238000010186 staining Methods 0.000 description 2
- 230000004936 stimulating effect Effects 0.000 description 2
- 230000000638 stimulation Effects 0.000 description 2
- 229960005322 streptomycin Drugs 0.000 description 2
- 229960001052 streptozocin Drugs 0.000 description 2
- ZSJLQEPLLKMAKR-GKHCUFPYSA-N streptozocin Chemical compound O=NN(C)C(=O)N[C@H]1[C@@H](O)O[C@H](CO)[C@@H](O)[C@@H]1O ZSJLQEPLLKMAKR-GKHCUFPYSA-N 0.000 description 2
- 150000003467 sulfuric acid derivatives Chemical class 0.000 description 2
- 239000006228 supernatant Substances 0.000 description 2
- 238000001356 surgical procedure Methods 0.000 description 2
- 230000002459 sustained effect Effects 0.000 description 2
- 229940021747 therapeutic vaccine Drugs 0.000 description 2
- 229960001196 thiotepa Drugs 0.000 description 2
- 208000008732 thymoma Diseases 0.000 description 2
- 201000002510 thyroid cancer Diseases 0.000 description 2
- MNRILEROXIRVNJ-UHFFFAOYSA-N tioguanine Chemical compound N1C(N)=NC(=S)C2=NC=N[C]21 MNRILEROXIRVNJ-UHFFFAOYSA-N 0.000 description 2
- 229960003087 tioguanine Drugs 0.000 description 2
- 238000011830 transgenic mouse model Methods 0.000 description 2
- 229940124676 vascular endothelial growth factor receptor Drugs 0.000 description 2
- 230000002861 ventricular Effects 0.000 description 2
- 229960003048 vinblastine Drugs 0.000 description 2
- JXLYSJRDGCGARV-XQKSVPLYSA-N vincaleukoblastine Chemical compound C([C@@H](C[C@]1(C(=O)OC)C=2C(=CC3=C([C@]45[C@H]([C@@]([C@H](OC(C)=O)[C@]6(CC)C=CCN([C@H]56)CC4)(O)C(=O)OC)N3C)C=2)OC)C[C@@](C2)(O)CC)N2CCC2=C1NC1=CC=CC=C21 JXLYSJRDGCGARV-XQKSVPLYSA-N 0.000 description 2
- 229960004528 vincristine Drugs 0.000 description 2
- OGWKCGZFUXNPDA-XQKSVPLYSA-N vincristine Chemical compound C([N@]1C[C@@H](C[C@]2(C(=O)OC)C=3C(=CC4=C([C@]56[C@H]([C@@]([C@H](OC(C)=O)[C@]7(CC)C=CCN([C@H]67)CC5)(O)C(=O)OC)N4C=O)C=3)OC)C[C@@](C1)(O)CC)CC1=C2NC2=CC=CC=C12 OGWKCGZFUXNPDA-XQKSVPLYSA-N 0.000 description 2
- OGWKCGZFUXNPDA-UHFFFAOYSA-N vincristine Natural products C1C(CC)(O)CC(CC2(C(=O)OC)C=3C(=CC4=C(C56C(C(C(OC(C)=O)C7(CC)C=CCN(C67)CC5)(O)C(=O)OC)N4C=O)C=3)OC)CN1CCC1=C2NC2=CC=CC=C12 OGWKCGZFUXNPDA-UHFFFAOYSA-N 0.000 description 2
- 230000009385 viral infection Effects 0.000 description 2
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 2
- CGMTUJFWROPELF-YPAAEMCBSA-N (3E,5S)-5-[(2S)-butan-2-yl]-3-(1-hydroxyethylidene)pyrrolidine-2,4-dione Chemical compound CC[C@H](C)[C@@H]1NC(=O)\C(=C(/C)O)C1=O CGMTUJFWROPELF-YPAAEMCBSA-N 0.000 description 1
- FDKXTQMXEQVLRF-ZHACJKMWSA-N (E)-dacarbazine Chemical compound CN(C)\N=N\c1[nH]cnc1C(N)=O FDKXTQMXEQVLRF-ZHACJKMWSA-N 0.000 description 1
- LKJPYSCBVHEWIU-KRWDZBQOSA-N (R)-bicalutamide Chemical compound C([C@@](O)(C)C(=O)NC=1C=C(C(C#N)=CC=1)C(F)(F)F)S(=O)(=O)C1=CC=C(F)C=C1 LKJPYSCBVHEWIU-KRWDZBQOSA-N 0.000 description 1
- DSSYKIVIOFKYAU-XCBNKYQSSA-N (R)-camphor Chemical compound C1C[C@@]2(C)C(=O)C[C@@H]1C2(C)C DSSYKIVIOFKYAU-XCBNKYQSSA-N 0.000 description 1
- AGNGYMCLFWQVGX-AGFFZDDWSA-N (e)-1-[(2s)-2-amino-2-carboxyethoxy]-2-diazonioethenolate Chemical compound OC(=O)[C@@H](N)CO\C([O-])=C\[N+]#N AGNGYMCLFWQVGX-AGFFZDDWSA-N 0.000 description 1
- GZCWLCBFPRFLKL-UHFFFAOYSA-N 1-prop-2-ynoxypropan-2-ol Chemical compound CC(O)COCC#C GZCWLCBFPRFLKL-UHFFFAOYSA-N 0.000 description 1
- BTOTXLJHDSNXMW-POYBYMJQSA-N 2,3-dideoxyuridine Chemical compound O1[C@H](CO)CC[C@@H]1N1C(=O)NC(=O)C=C1 BTOTXLJHDSNXMW-POYBYMJQSA-N 0.000 description 1
- BOMZMNZEXMAQQW-UHFFFAOYSA-N 2,5,11-trimethyl-6h-pyrido[4,3-b]carbazol-2-ium-9-ol;acetate Chemical compound CC([O-])=O.C[N+]1=CC=C2C(C)=C(NC=3C4=CC(O)=CC=3)C4=C(C)C2=C1 BOMZMNZEXMAQQW-UHFFFAOYSA-N 0.000 description 1
- QCXJFISCRQIYID-IAEPZHFASA-N 2-amino-1-n-[(3s,6s,7r,10s,16s)-3-[(2s)-butan-2-yl]-7,11,14-trimethyl-2,5,9,12,15-pentaoxo-10-propan-2-yl-8-oxa-1,4,11,14-tetrazabicyclo[14.3.0]nonadecan-6-yl]-4,6-dimethyl-3-oxo-9-n-[(3s,6s,7r,10s,16s)-7,11,14-trimethyl-2,5,9,12,15-pentaoxo-3,10-di(propa Chemical compound C[C@H]1OC(=O)[C@H](C(C)C)N(C)C(=O)CN(C)C(=O)[C@@H]2CCCN2C(=O)[C@H](C(C)C)NC(=O)[C@H]1NC(=O)C1=C(N=C2C(C(=O)N[C@@H]3C(=O)N[C@H](C(N4CCC[C@H]4C(=O)N(C)CC(=O)N(C)[C@@H](C(C)C)C(=O)O[C@@H]3C)=O)[C@@H](C)CC)=C(N)C(=O)C(C)=C2O2)C2=C(C)C=C1 QCXJFISCRQIYID-IAEPZHFASA-N 0.000 description 1
- PWMYMKOUNYTVQN-UHFFFAOYSA-N 3-(8,8-diethyl-2-aza-8-germaspiro[4.5]decan-2-yl)-n,n-dimethylpropan-1-amine Chemical compound C1C[Ge](CC)(CC)CCC11CN(CCCN(C)C)CC1 PWMYMKOUNYTVQN-UHFFFAOYSA-N 0.000 description 1
- AOJJSUZBOXZQNB-VTZDEGQISA-N 4'-epidoxorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(=O)CO)[C@H]1C[C@H](N)[C@@H](O)[C@H](C)O1 AOJJSUZBOXZQNB-VTZDEGQISA-N 0.000 description 1
- DODQJNMQWMSYGS-QPLCGJKRSA-N 4-[(z)-1-[4-[2-(dimethylamino)ethoxy]phenyl]-1-phenylbut-1-en-2-yl]phenol Chemical compound C=1C=C(O)C=CC=1C(/CC)=C(C=1C=CC(OCCN(C)C)=CC=1)/C1=CC=CC=C1 DODQJNMQWMSYGS-QPLCGJKRSA-N 0.000 description 1
- TVZGACDUOSZQKY-LBPRGKRZSA-N 4-aminofolic acid Chemical compound C1=NC2=NC(N)=NC(N)=C2N=C1CNC1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 TVZGACDUOSZQKY-LBPRGKRZSA-N 0.000 description 1
- IDPUKCWIGUEADI-UHFFFAOYSA-N 5-[bis(2-chloroethyl)amino]uracil Chemical compound ClCCN(CCCl)C1=CNC(=O)NC1=O IDPUKCWIGUEADI-UHFFFAOYSA-N 0.000 description 1
- NMUSYJAQQFHJEW-KVTDHHQDSA-N 5-azacytidine Chemical compound O=C1N=C(N)N=CN1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 NMUSYJAQQFHJEW-KVTDHHQDSA-N 0.000 description 1
- WYXSYVWAUAUWLD-SHUUEZRQSA-N 6-azauridine Chemical compound O[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1N1C(=O)NC(=O)C=N1 WYXSYVWAUAUWLD-SHUUEZRQSA-N 0.000 description 1
- 229960005538 6-diazo-5-oxo-L-norleucine Drugs 0.000 description 1
- YCWQAMGASJSUIP-YFKPBYRVSA-N 6-diazo-5-oxo-L-norleucine Chemical compound OC(=O)[C@@H](N)CCC(=O)C=[N+]=[N-] YCWQAMGASJSUIP-YFKPBYRVSA-N 0.000 description 1
- ZGXJTSGNIOSYLO-UHFFFAOYSA-N 88755TAZ87 Chemical compound NCC(=O)CCC(O)=O ZGXJTSGNIOSYLO-UHFFFAOYSA-N 0.000 description 1
- SHGAZHPCJJPHSC-ZVCIMWCZSA-N 9-cis-retinoic acid Chemical compound OC(=O)/C=C(\C)/C=C/C=C(/C)\C=C\C1=C(C)CCCC1(C)C SHGAZHPCJJPHSC-ZVCIMWCZSA-N 0.000 description 1
- HDZZVAMISRMYHH-UHFFFAOYSA-N 9beta-Ribofuranosyl-7-deazaadenin Natural products C1=CC=2C(N)=NC=NC=2N1C1OC(CO)C(O)C1O HDZZVAMISRMYHH-UHFFFAOYSA-N 0.000 description 1
- 208000002008 AIDS-Related Lymphoma Diseases 0.000 description 1
- 102000013563 Acid Phosphatase Human genes 0.000 description 1
- 108010051457 Acid Phosphatase Proteins 0.000 description 1
- CEIZFXOZIQNICU-UHFFFAOYSA-N Alternaria alternata Crofton-weed toxin Natural products CCC(C)C1NC(=O)C(C(C)=O)=C1O CEIZFXOZIQNICU-UHFFFAOYSA-N 0.000 description 1
- 206010061424 Anal cancer Diseases 0.000 description 1
- 208000007860 Anus Neoplasms Diseases 0.000 description 1
- 229940122815 Aromatase inhibitor Drugs 0.000 description 1
- CIWBSHSKHKDKBQ-JLAZNSOCSA-N Ascorbic acid Chemical compound OC[C@H](O)[C@H]1OC(=O)C(O)=C1O CIWBSHSKHKDKBQ-JLAZNSOCSA-N 0.000 description 1
- NOWKCMXCCJGMRR-UHFFFAOYSA-N Aziridine Chemical compound C1CN1 NOWKCMXCCJGMRR-UHFFFAOYSA-N 0.000 description 1
- 108091008875 B cell receptors Proteins 0.000 description 1
- 208000010839 B-cell chronic lymphocytic leukemia Diseases 0.000 description 1
- 108010074708 B7-H1 Antigen Proteins 0.000 description 1
- 102000008096 B7-H1 Antigen Human genes 0.000 description 1
- 229940125431 BRAF inhibitor Drugs 0.000 description 1
- 241000894006 Bacteria Species 0.000 description 1
- VGGGPCQERPFHOB-MCIONIFRSA-N Bestatin Chemical compound CC(C)C[C@H](C(O)=O)NC(=O)[C@@H](O)[C@H](N)CC1=CC=CC=C1 VGGGPCQERPFHOB-MCIONIFRSA-N 0.000 description 1
- 206010005949 Bone cancer Diseases 0.000 description 1
- 208000018084 Bone neoplasm Diseases 0.000 description 1
- 238000009010 Bradford assay Methods 0.000 description 1
- 102000010910 CD28 Antigens Human genes 0.000 description 1
- 108010062433 CD28 Antigens Proteins 0.000 description 1
- 239000012275 CTLA-4 inhibitor Substances 0.000 description 1
- KLWPJMFMVPTNCC-UHFFFAOYSA-N Camptothecin Natural products CCC1(O)C(=O)OCC2=C1C=C3C4Nc5ccccc5C=C4CN3C2=O KLWPJMFMVPTNCC-UHFFFAOYSA-N 0.000 description 1
- 241000282472 Canis lupus familiaris Species 0.000 description 1
- GAGWJHPBXLXJQN-UORFTKCHSA-N Capecitabine Chemical compound C1=C(F)C(NC(=O)OCCCCC)=NC(=O)N1[C@H]1[C@H](O)[C@H](O)[C@@H](C)O1 GAGWJHPBXLXJQN-UORFTKCHSA-N 0.000 description 1
- GAGWJHPBXLXJQN-UHFFFAOYSA-N Capecitabine Natural products C1=C(F)C(NC(=O)OCCCCC)=NC(=O)N1C1C(O)C(O)C(C)O1 GAGWJHPBXLXJQN-UHFFFAOYSA-N 0.000 description 1
- 208000005623 Carcinogenesis Diseases 0.000 description 1
- 206010007275 Carcinoid tumour Diseases 0.000 description 1
- 102000014914 Carrier Proteins Human genes 0.000 description 1
- 102000000844 Cell Surface Receptors Human genes 0.000 description 1
- 108010001857 Cell Surface Receptors Proteins 0.000 description 1
- 206010057248 Cell death Diseases 0.000 description 1
- JWBOIMRXGHLCPP-UHFFFAOYSA-N Chloditan Chemical compound C=1C=CC=C(Cl)C=1C(C(Cl)Cl)C1=CC=C(Cl)C=C1 JWBOIMRXGHLCPP-UHFFFAOYSA-N 0.000 description 1
- MKQWTWSXVILIKJ-LXGUWJNJSA-N Chlorozotocin Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](C=O)NC(=O)N(N=O)CCCl MKQWTWSXVILIKJ-LXGUWJNJSA-N 0.000 description 1
- VYZAMTAEIAYCRO-UHFFFAOYSA-N Chromium Chemical compound [Cr] VYZAMTAEIAYCRO-UHFFFAOYSA-N 0.000 description 1
- 241000723346 Cinnamomum camphora Species 0.000 description 1
- 102000029816 Collagenase Human genes 0.000 description 1
- 108060005980 Collagenase Proteins 0.000 description 1
- 102000007644 Colony-Stimulating Factors Human genes 0.000 description 1
- 241000195493 Cryptophyta Species 0.000 description 1
- 239000012625 DNA intercalator Substances 0.000 description 1
- 229940123780 DNA topoisomerase I inhibitor Drugs 0.000 description 1
- 229940124087 DNA topoisomerase II inhibitor Drugs 0.000 description 1
- 108010092160 Dactinomycin Proteins 0.000 description 1
- ZBNZXTGUTAYRHI-UHFFFAOYSA-N Dasatinib Chemical compound C=1C(N2CCN(CCO)CC2)=NC(C)=NC=1NC(S1)=NC=C1C(=O)NC1=C(C)C=CC=C1Cl ZBNZXTGUTAYRHI-UHFFFAOYSA-N 0.000 description 1
- WEAHRLBPCANXCN-UHFFFAOYSA-N Daunomycin Natural products CCC1(O)CC(OC2CC(N)C(O)C(C)O2)c3cc4C(=O)c5c(OC)cccc5C(=O)c4c(O)c3C1 WEAHRLBPCANXCN-UHFFFAOYSA-N 0.000 description 1
- 102000016911 Deoxyribonucleases Human genes 0.000 description 1
- 108010053770 Deoxyribonucleases Proteins 0.000 description 1
- BWGNESOTFCXPMA-UHFFFAOYSA-N Dihydrogen disulfide Chemical compound SS BWGNESOTFCXPMA-UHFFFAOYSA-N 0.000 description 1
- 102000001301 EGF receptor Human genes 0.000 description 1
- 108060006698 EGF receptor Proteins 0.000 description 1
- SAMRUMKYXPVKPA-VFKOLLTISA-N Enocitabine Chemical compound O=C1N=C(NC(=O)CCCCCCCCCCCCCCCCCCCCC)C=CN1[C@H]1[C@@H](O)[C@H](O)[C@@H](CO)O1 SAMRUMKYXPVKPA-VFKOLLTISA-N 0.000 description 1
- 102000004190 Enzymes Human genes 0.000 description 1
- 108090000790 Enzymes Proteins 0.000 description 1
- HTIJFSOGRVMCQR-UHFFFAOYSA-N Epirubicin Natural products COc1cccc2C(=O)c3c(O)c4CC(O)(CC(OC5CC(N)C(=O)C(C)O5)c4c(O)c3C(=O)c12)C(=O)CO HTIJFSOGRVMCQR-UHFFFAOYSA-N 0.000 description 1
- OBMLHUPNRURLOK-XGRAFVIBSA-N Epitiostanol Chemical compound C1[C@@H]2S[C@@H]2C[C@]2(C)[C@H]3CC[C@](C)([C@H](CC4)O)[C@@H]4[C@@H]3CC[C@H]21 OBMLHUPNRURLOK-XGRAFVIBSA-N 0.000 description 1
- HKVAMNSJSFKALM-GKUWKFKPSA-N Everolimus Chemical compound C1C[C@@H](OCCO)[C@H](OC)C[C@@H]1C[C@@H](C)[C@H]1OC(=O)[C@@H]2CCCCN2C(=O)C(=O)[C@](O)(O2)[C@H](C)CC[C@H]2C[C@H](OC)/C(C)=C/C=C/C=C/[C@@H](C)C[C@@H](C)C(=O)[C@H](OC)[C@H](O)/C(C)=C/[C@@H](C)C(=O)C1 HKVAMNSJSFKALM-GKUWKFKPSA-N 0.000 description 1
- 208000012468 Ewing sarcoma/peripheral primitive neuroectodermal tumor Diseases 0.000 description 1
- 208000001382 Experimental Melanoma Diseases 0.000 description 1
- 241000282326 Felis catus Species 0.000 description 1
- 208000022072 Gallbladder Neoplasms Diseases 0.000 description 1
- 241000287828 Gallus gallus Species 0.000 description 1
- 201000003741 Gastrointestinal carcinoma Diseases 0.000 description 1
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Chemical compound OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 1
- BLCLNMBMMGCOAS-URPVMXJPSA-N Goserelin Chemical compound C([C@@H](C(=O)N[C@H](COC(C)(C)C)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCN=C(N)N)C(=O)N1[C@@H](CCC1)C(=O)NNC(N)=O)NC(=O)[C@H](CO)NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H](CC=1NC=NC=1)NC(=O)[C@H]1NC(=O)CC1)C1=CC=C(O)C=C1 BLCLNMBMMGCOAS-URPVMXJPSA-N 0.000 description 1
- 108010069236 Goserelin Proteins 0.000 description 1
- 108010017080 Granulocyte Colony-Stimulating Factor Proteins 0.000 description 1
- 102000004269 Granulocyte Colony-Stimulating Factor Human genes 0.000 description 1
- 102000006354 HLA-DR Antigens Human genes 0.000 description 1
- 108010058597 HLA-DR Antigens Proteins 0.000 description 1
- 101001021491 Homo sapiens HERV-H LTR-associating protein 2 Proteins 0.000 description 1
- 101001002657 Homo sapiens Interleukin-2 Proteins 0.000 description 1
- 101001012157 Homo sapiens Receptor tyrosine-protein kinase erbB-2 Proteins 0.000 description 1
- 101000984753 Homo sapiens Serine/threonine-protein kinase B-raf Proteins 0.000 description 1
- 206010062904 Hormone-refractory prostate cancer Diseases 0.000 description 1
- 206010020649 Hyperkeratosis Diseases 0.000 description 1
- 102000001284 I-kappa-B kinase Human genes 0.000 description 1
- 108060006678 I-kappa-B kinase Proteins 0.000 description 1
- 102100034980 ICOS ligand Human genes 0.000 description 1
- 101710093458 ICOS ligand Proteins 0.000 description 1
- MPBVHIBUJCELCL-UHFFFAOYSA-N Ibandronate Chemical compound CCCCCN(C)CCC(O)(P(O)(O)=O)P(O)(O)=O MPBVHIBUJCELCL-UHFFFAOYSA-N 0.000 description 1
- 206010061598 Immunodeficiency Diseases 0.000 description 1
- 102000037984 Inhibitory immune checkpoint proteins Human genes 0.000 description 1
- 108091008026 Inhibitory immune checkpoint proteins Proteins 0.000 description 1
- 102100022297 Integrin alpha-X Human genes 0.000 description 1
- 108010002352 Interleukin-1 Proteins 0.000 description 1
- 102000000589 Interleukin-1 Human genes 0.000 description 1
- 102000003815 Interleukin-11 Human genes 0.000 description 1
- 108090000177 Interleukin-11 Proteins 0.000 description 1
- 108010017535 Interleukin-15 Receptors Proteins 0.000 description 1
- 102000004556 Interleukin-15 Receptors Human genes 0.000 description 1
- 108010038453 Interleukin-2 Receptors Proteins 0.000 description 1
- 102100030704 Interleukin-21 Human genes 0.000 description 1
- 102000017761 Interleukin-33 Human genes 0.000 description 1
- 108010067003 Interleukin-33 Proteins 0.000 description 1
- 108010002616 Interleukin-5 Proteins 0.000 description 1
- 102000000743 Interleukin-5 Human genes 0.000 description 1
- 108090001005 Interleukin-6 Proteins 0.000 description 1
- 102000004889 Interleukin-6 Human genes 0.000 description 1
- PIWKPBJCKXDKJR-UHFFFAOYSA-N Isoflurane Chemical compound FC(F)OC(Cl)C(F)(F)F PIWKPBJCKXDKJR-UHFFFAOYSA-N 0.000 description 1
- 208000007766 Kaposi sarcoma Diseases 0.000 description 1
- YQEZLKZALYSWHR-UHFFFAOYSA-N Ketamine Chemical compound C=1C=CC=C(Cl)C=1C1(NC)CCCCC1=O YQEZLKZALYSWHR-UHFFFAOYSA-N 0.000 description 1
- 208000008839 Kidney Neoplasms Diseases 0.000 description 1
- ONIBWKKTOPOVIA-BYPYZUCNSA-N L-Proline Chemical compound OC(=O)[C@@H]1CCCN1 ONIBWKKTOPOVIA-BYPYZUCNSA-N 0.000 description 1
- FEWJPZIEWOKRBE-JCYAYHJZSA-L L-tartrate(2-) Chemical compound [O-]C(=O)[C@H](O)[C@@H](O)C([O-])=O FEWJPZIEWOKRBE-JCYAYHJZSA-L 0.000 description 1
- 239000005517 L01XE01 - Imatinib Substances 0.000 description 1
- 239000005411 L01XE02 - Gefitinib Substances 0.000 description 1
- 239000005551 L01XE03 - Erlotinib Substances 0.000 description 1
- 239000002147 L01XE04 - Sunitinib Substances 0.000 description 1
- 239000002067 L01XE06 - Dasatinib Substances 0.000 description 1
- 239000002136 L01XE07 - Lapatinib Substances 0.000 description 1
- 239000002118 L01XE12 - Vandetanib Substances 0.000 description 1
- 239000002144 L01XE18 - Ruxolitinib Substances 0.000 description 1
- 101150030213 Lag3 gene Proteins 0.000 description 1
- 239000005639 Lauric acid Substances 0.000 description 1
- 229920001491 Lentinan Polymers 0.000 description 1
- 108010000817 Leuprolide Proteins 0.000 description 1
- 206010061523 Lip and/or oral cavity cancer Diseases 0.000 description 1
- GQYIWUVLTXOXAJ-UHFFFAOYSA-N Lomustine Chemical compound ClCCN(N=O)C(=O)NC1CCCCC1 GQYIWUVLTXOXAJ-UHFFFAOYSA-N 0.000 description 1
- 208000031422 Lymphocytic Chronic B-Cell Leukemia Diseases 0.000 description 1
- 206010025312 Lymphoma AIDS related Diseases 0.000 description 1
- 208000004059 Male Breast Neoplasms Diseases 0.000 description 1
- 206010025557 Malignant fibrous histiocytoma of bone Diseases 0.000 description 1
- 208000032271 Malignant tumor of penis Diseases 0.000 description 1
- 241000124008 Mammalia Species 0.000 description 1
- 102000018697 Membrane Proteins Human genes 0.000 description 1
- 108010052285 Membrane Proteins Proteins 0.000 description 1
- 206010027201 Meningitis aseptic Diseases 0.000 description 1
- 206010027406 Mesothelioma Diseases 0.000 description 1
- 206010063569 Metastatic squamous cell carcinoma Diseases 0.000 description 1
- 229930192392 Mitomycin Natural products 0.000 description 1
- 208000014767 Myeloproliferative disease Diseases 0.000 description 1
- OVBPIULPVIDEAO-UHFFFAOYSA-N N-Pteroyl-L-glutaminsaeure Natural products C=1N=C2NC(N)=NC(=O)C2=NC=1CNC1=CC=C(C(=O)NC(CCC(O)=O)C(O)=O)C=C1 OVBPIULPVIDEAO-UHFFFAOYSA-N 0.000 description 1
- 206010028851 Necrosis Diseases 0.000 description 1
- 206010029260 Neuroblastoma Diseases 0.000 description 1
- 201000004404 Neurofibroma Diseases 0.000 description 1
- SYNHCENRCUAUNM-UHFFFAOYSA-N Nitrogen mustard N-oxide hydrochloride Chemical compound Cl.ClCC[N+]([O-])(C)CCCl SYNHCENRCUAUNM-UHFFFAOYSA-N 0.000 description 1
- 206010033268 Ovarian low malignant potential tumour Diseases 0.000 description 1
- 239000012270 PD-1 inhibitor Substances 0.000 description 1
- 239000012668 PD-1-inhibitor Substances 0.000 description 1
- 239000012271 PD-L1 inhibitor Substances 0.000 description 1
- SHGAZHPCJJPHSC-UHFFFAOYSA-N Panrexin Chemical compound OC(=O)C=C(C)C=CC=C(C)C=CC1=C(C)CCCC1(C)C SHGAZHPCJJPHSC-UHFFFAOYSA-N 0.000 description 1
- 206010033701 Papillary thyroid cancer Diseases 0.000 description 1
- 208000002471 Penile Neoplasms Diseases 0.000 description 1
- 206010034299 Penile cancer Diseases 0.000 description 1
- 108091000080 Phosphotransferase Proteins 0.000 description 1
- 208000007913 Pituitary Neoplasms Diseases 0.000 description 1
- 241000206607 Porphyra umbilicalis Species 0.000 description 1
- 241000288906 Primates Species 0.000 description 1
- 102000043850 Programmed Cell Death 1 Ligand 2 Human genes 0.000 description 1
- 101710094000 Programmed cell death 1 ligand 1 Proteins 0.000 description 1
- ONIBWKKTOPOVIA-UHFFFAOYSA-N Proline Natural products OC(=O)C1CCCN1 ONIBWKKTOPOVIA-UHFFFAOYSA-N 0.000 description 1
- XBDQKXXYIPTUBI-UHFFFAOYSA-M Propionate Chemical compound CCC([O-])=O XBDQKXXYIPTUBI-UHFFFAOYSA-M 0.000 description 1
- 229940079156 Proteasome inhibitor Drugs 0.000 description 1
- 201000008183 Pulmonary blastoma Diseases 0.000 description 1
- 206010037596 Pyelonephritis Diseases 0.000 description 1
- 108091030071 RNAI Proteins 0.000 description 1
- AHHFEZNOXOZZQA-ZEBDFXRSSA-N Ranimustine Chemical compound CO[C@H]1O[C@H](CNC(=O)N(CCCl)N=O)[C@@H](O)[C@H](O)[C@H]1O AHHFEZNOXOZZQA-ZEBDFXRSSA-N 0.000 description 1
- 241000700159 Rattus Species 0.000 description 1
- 102100030086 Receptor tyrosine-protein kinase erbB-2 Human genes 0.000 description 1
- 208000015634 Rectal Neoplasms Diseases 0.000 description 1
- 206010038389 Renal cancer Diseases 0.000 description 1
- 241001338644 Retinia Species 0.000 description 1
- 102100027103 Serine/threonine-protein kinase B-raf Human genes 0.000 description 1
- 208000009359 Sezary Syndrome Diseases 0.000 description 1
- 208000021388 Sezary disease Diseases 0.000 description 1
- 230000024932 T cell mediated immunity Effects 0.000 description 1
- 230000006052 T cell proliferation Effects 0.000 description 1
- 108091008874 T cell receptors Proteins 0.000 description 1
- 102000016266 T-Cell Antigen Receptors Human genes 0.000 description 1
- NAVMQTYZDKMPEU-UHFFFAOYSA-N Targretin Chemical compound CC1=CC(C(CCC2(C)C)(C)C)=C2C=C1C(=C)C1=CC=C(C(O)=O)C=C1 NAVMQTYZDKMPEU-UHFFFAOYSA-N 0.000 description 1
- CGMTUJFWROPELF-UHFFFAOYSA-N Tenuazonic acid Natural products CCC(C)C1NC(=O)C(=C(C)/O)C1=O CGMTUJFWROPELF-UHFFFAOYSA-N 0.000 description 1
- 208000024313 Testicular Neoplasms Diseases 0.000 description 1
- 206010057644 Testis cancer Diseases 0.000 description 1
- 210000000447 Th1 cell Anatomy 0.000 description 1
- 201000009365 Thymic carcinoma Diseases 0.000 description 1
- 239000000365 Topoisomerase I Inhibitor Substances 0.000 description 1
- 239000000317 Topoisomerase II Inhibitor Substances 0.000 description 1
- UMILHIMHKXVDGH-UHFFFAOYSA-N Triethylene glycol diglycidyl ether Chemical compound C1OC1COCCOCCOCCOCC1CO1 UMILHIMHKXVDGH-UHFFFAOYSA-N 0.000 description 1
- FYAMXEPQQLNQDM-UHFFFAOYSA-N Tris(1-aziridinyl)phosphine oxide Chemical compound C1CN1P(N1CC1)(=O)N1CC1 FYAMXEPQQLNQDM-UHFFFAOYSA-N 0.000 description 1
- 229920004890 Triton X-100 Polymers 0.000 description 1
- 239000013504 Triton X-100 Substances 0.000 description 1
- GLNADSQYFUSGOU-GPTZEZBUSA-J Trypan blue Chemical compound [Na+].[Na+].[Na+].[Na+].C1=C(S([O-])(=O)=O)C=C2C=C(S([O-])(=O)=O)C(/N=N/C3=CC=C(C=C3C)C=3C=C(C(=CC=3)\N=N\C=3C(=CC4=CC(=CC(N)=C4C=3O)S([O-])(=O)=O)S([O-])(=O)=O)C)=C(O)C2=C1N GLNADSQYFUSGOU-GPTZEZBUSA-J 0.000 description 1
- 108060008682 Tumor Necrosis Factor Proteins 0.000 description 1
- 102000000852 Tumor Necrosis Factor-alpha Human genes 0.000 description 1
- 206010046431 Urethral cancer Diseases 0.000 description 1
- 206010046458 Urethral neoplasms Diseases 0.000 description 1
- 206010047741 Vulval cancer Diseases 0.000 description 1
- 208000004354 Vulvar Neoplasms Diseases 0.000 description 1
- 208000033559 Waldenström macroglobulinemia Diseases 0.000 description 1
- HCHKCACWOHOZIP-UHFFFAOYSA-N Zinc Chemical compound [Zn] HCHKCACWOHOZIP-UHFFFAOYSA-N 0.000 description 1
- IHGLINDYFMDHJG-UHFFFAOYSA-N [2-(4-methoxyphenyl)-3,4-dihydronaphthalen-1-yl]-[4-(2-pyrrolidin-1-ylethoxy)phenyl]methanone Chemical compound C1=CC(OC)=CC=C1C(CCC1=CC=CC=C11)=C1C(=O)C(C=C1)=CC=C1OCCN1CCCC1 IHGLINDYFMDHJG-UHFFFAOYSA-N 0.000 description 1
- 238000010521 absorption reaction Methods 0.000 description 1
- 150000007513 acids Chemical class 0.000 description 1
- 229930183665 actinomycin Natural products 0.000 description 1
- 230000003213 activating effect Effects 0.000 description 1
- 230000003044 adaptive effect Effects 0.000 description 1
- 230000004721 adaptive immunity Effects 0.000 description 1
- 238000011374 additional therapy Methods 0.000 description 1
- 210000004404 adrenal cortex Anatomy 0.000 description 1
- 208000037844 advanced solid tumor Diseases 0.000 description 1
- 229960000548 alemtuzumab Drugs 0.000 description 1
- 229960001445 alitretinoin Drugs 0.000 description 1
- 230000002009 allergenic effect Effects 0.000 description 1
- 125000003275 alpha amino acid group Chemical group 0.000 description 1
- 150000001413 amino acids Chemical group 0.000 description 1
- 229960003437 aminoglutethimide Drugs 0.000 description 1
- ROBVIMPUHSLWNV-UHFFFAOYSA-N aminoglutethimide Chemical compound C=1C=C(N)C=CC=1C1(CC)CCC(=O)NC1=O ROBVIMPUHSLWNV-UHFFFAOYSA-N 0.000 description 1
- 229960002749 aminolevulinic acid Drugs 0.000 description 1
- 229960003896 aminopterin Drugs 0.000 description 1
- 229960001220 amsacrine Drugs 0.000 description 1
- XCPGHVQEEXUHNC-UHFFFAOYSA-N amsacrine Chemical compound COC1=CC(NS(C)(=O)=O)=CC=C1NC1=C(C=CC=C2)C2=NC2=CC=CC=C12 XCPGHVQEEXUHNC-UHFFFAOYSA-N 0.000 description 1
- 238000004458 analytical method Methods 0.000 description 1
- 239000003098 androgen Substances 0.000 description 1
- 229940030486 androgens Drugs 0.000 description 1
- 239000003242 anti bacterial agent Substances 0.000 description 1
- 230000002280 anti-androgenic effect Effects 0.000 description 1
- 230000003388 anti-hormonal effect Effects 0.000 description 1
- 230000000340 anti-metabolite Effects 0.000 description 1
- 230000000692 anti-sense effect Effects 0.000 description 1
- 239000000051 antiandrogen Substances 0.000 description 1
- 229940030495 antiandrogen sex hormone and modulator of the genital system Drugs 0.000 description 1
- 229940088710 antibiotic agent Drugs 0.000 description 1
- 229940124691 antibody therapeutics Drugs 0.000 description 1
- 230000010056 antibody-dependent cellular cytotoxicity Effects 0.000 description 1
- 229940100197 antimetabolite Drugs 0.000 description 1
- 239000002256 antimetabolite Substances 0.000 description 1
- 229940045687 antimetabolites folic acid analogs Drugs 0.000 description 1
- 229940045988 antineoplastic drug protein kinase inhibitors Drugs 0.000 description 1
- 201000011165 anus cancer Diseases 0.000 description 1
- 238000003782 apoptosis assay Methods 0.000 description 1
- 230000006907 apoptotic process Effects 0.000 description 1
- 150000008209 arabinosides Chemical class 0.000 description 1
- SCJNCDSAIRBRIA-DOFZRALJSA-N arachidonyl-2'-chloroethylamide Chemical compound CCCCC\C=C/C\C=C/C\C=C/C\C=C/CCCC(=O)NCCCl SCJNCDSAIRBRIA-DOFZRALJSA-N 0.000 description 1
- 239000003886 aromatase inhibitor Substances 0.000 description 1
- 230000010455 autoregulation Effects 0.000 description 1
- 229940120638 avastin Drugs 0.000 description 1
- 229960002756 azacitidine Drugs 0.000 description 1
- 229950011321 azaserine Drugs 0.000 description 1
- 150000001541 aziridines Chemical class 0.000 description 1
- 230000001580 bacterial effect Effects 0.000 description 1
- 229960001212 bacterial vaccine Drugs 0.000 description 1
- 229960002938 bexarotene Drugs 0.000 description 1
- 229960000997 bicalutamide Drugs 0.000 description 1
- 108091008324 binding proteins Proteins 0.000 description 1
- 239000003139 biocide Substances 0.000 description 1
- 239000012620 biological material Substances 0.000 description 1
- 230000031018 biological processes and functions Effects 0.000 description 1
- 230000015572 biosynthetic process Effects 0.000 description 1
- 238000010352 biotechnological method Methods 0.000 description 1
- 230000017531 blood circulation Effects 0.000 description 1
- 239000012503 blood component Substances 0.000 description 1
- 210000004204 blood vessel Anatomy 0.000 description 1
- 210000000988 bone and bone Anatomy 0.000 description 1
- 208000012172 borderline epithelial tumor of ovary Diseases 0.000 description 1
- 229960001467 bortezomib Drugs 0.000 description 1
- GXJABQQUPOEUTA-RDJZCZTQSA-N bortezomib Chemical compound C([C@@H](C(=O)N[C@@H](CC(C)C)B(O)O)NC(=O)C=1N=CC=NC=1)C1=CC=CC=C1 GXJABQQUPOEUTA-RDJZCZTQSA-N 0.000 description 1
- 210000000133 brain stem Anatomy 0.000 description 1
- 201000002143 bronchus adenoma Diseases 0.000 description 1
- 239000000872 buffer Substances 0.000 description 1
- 239000006172 buffering agent Substances 0.000 description 1
- 108700002839 cactinomycin Proteins 0.000 description 1
- 229950009908 cactinomycin Drugs 0.000 description 1
- 229930195731 calicheamicin Natural products 0.000 description 1
- HXCHCVDVKSCDHU-LULTVBGHSA-N calicheamicin Chemical compound C1[C@H](OC)[C@@H](NCC)CO[C@H]1O[C@H]1[C@H](O[C@@H]2C\3=C(NC(=O)OC)C(=O)C[C@](C/3=C/CSSSC)(O)C#C\C=C/C#C2)O[C@H](C)[C@@H](NO[C@@H]2O[C@H](C)[C@@H](SC(=O)C=3C(=C(OC)C(O[C@H]4[C@@H]([C@H](OC)[C@@H](O)[C@H](C)O4)O)=C(I)C=3C)OC)[C@@H](O)C2)[C@@H]1O HXCHCVDVKSCDHU-LULTVBGHSA-N 0.000 description 1
- 229960000846 camphor Drugs 0.000 description 1
- 229930008380 camphor Natural products 0.000 description 1
- 229940127093 camptothecin Drugs 0.000 description 1
- VSJKWCGYPAHWDS-FQEVSTJZSA-N camptothecin Chemical compound C1=CC=C2C=C(CN3C4=CC5=C(C3=O)COC(=O)[C@]5(O)CC)C4=NC2=C1 VSJKWCGYPAHWDS-FQEVSTJZSA-N 0.000 description 1
- 230000036952 cancer formation Effects 0.000 description 1
- 230000005907 cancer growth Effects 0.000 description 1
- 239000012830 cancer therapeutic Substances 0.000 description 1
- 229960004117 capecitabine Drugs 0.000 description 1
- 229910002091 carbon monoxide Inorganic materials 0.000 description 1
- 231100000504 carcinogenesis Toxicity 0.000 description 1
- 108010047060 carzinophilin Proteins 0.000 description 1
- 230000020411 cell activation Effects 0.000 description 1
- 230000022534 cell killing Effects 0.000 description 1
- 230000004663 cell proliferation Effects 0.000 description 1
- 238000001516 cell proliferation assay Methods 0.000 description 1
- 230000008614 cellular interaction Effects 0.000 description 1
- 230000036755 cellular response Effects 0.000 description 1
- 210000001638 cerebellum Anatomy 0.000 description 1
- 230000002490 cerebral effect Effects 0.000 description 1
- 235000013330 chicken meat Nutrition 0.000 description 1
- 208000011654 childhood malignant neoplasm Diseases 0.000 description 1
- 229960001480 chlorozotocin Drugs 0.000 description 1
- 229910052804 chromium Inorganic materials 0.000 description 1
- 239000011651 chromium Substances 0.000 description 1
- ZYVSOIYQKUDENJ-WKSBCEQHSA-N chromomycin A3 Chemical compound O([C@@H]1C[C@@H](O[C@H](C)[C@@H]1OC(C)=O)OC=1C=C2C=C3C[C@H]([C@@H](C(=O)C3=C(O)C2=C(O)C=1C)O[C@@H]1O[C@H](C)[C@@H](O)[C@H](O[C@@H]2O[C@H](C)[C@@H](O)[C@H](O[C@@H]3O[C@@H](C)[C@H](OC(C)=O)[C@@](C)(O)C3)C2)C1)[C@H](OC)C(=O)[C@@H](O)[C@@H](C)O)[C@@H]1C[C@@H](O)[C@@H](OC)[C@@H](C)O1 ZYVSOIYQKUDENJ-WKSBCEQHSA-N 0.000 description 1
- 208000032852 chronic lymphocytic leukemia Diseases 0.000 description 1
- 239000004927 clay Substances 0.000 description 1
- 229960002424 collagenase Drugs 0.000 description 1
- 229940047120 colony stimulating factors Drugs 0.000 description 1
- 230000004154 complement system Effects 0.000 description 1
- 239000002872 contrast media Substances 0.000 description 1
- 230000001276 controlling effect Effects 0.000 description 1
- 238000011254 conventional chemotherapy Methods 0.000 description 1
- 238000000315 cryotherapy Methods 0.000 description 1
- 230000009089 cytolysis Effects 0.000 description 1
- 230000003013 cytotoxicity Effects 0.000 description 1
- 231100000135 cytotoxicity Toxicity 0.000 description 1
- 238000002784 cytotoxicity assay Methods 0.000 description 1
- 231100000263 cytotoxicity test Toxicity 0.000 description 1
- 229960002806 daclizumab Drugs 0.000 description 1
- 229960002448 dasatinib Drugs 0.000 description 1
- 230000003247 decreasing effect Effects 0.000 description 1
- 230000007812 deficiency Effects 0.000 description 1
- 230000004041 dendritic cell maturation Effects 0.000 description 1
- 229960001251 denosumab Drugs 0.000 description 1
- WVYXNIXAMZOZFK-UHFFFAOYSA-N diaziquone Chemical compound O=C1C(NC(=O)OCC)=C(N2CC2)C(=O)C(NC(=O)OCC)=C1N1CC1 WVYXNIXAMZOZFK-UHFFFAOYSA-N 0.000 description 1
- 229950002389 diaziquone Drugs 0.000 description 1
- 125000001028 difluoromethyl group Chemical group [H]C(F)(F)* 0.000 description 1
- 239000003085 diluting agent Substances 0.000 description 1
- LOKCTEFSRHRXRJ-UHFFFAOYSA-I dipotassium trisodium dihydrogen phosphate hydrogen phosphate dichloride Chemical compound P(=O)(O)(O)[O-].[K+].P(=O)(O)([O-])[O-].[Na+].[Na+].[Cl-].[K+].[Cl-].[Na+] LOKCTEFSRHRXRJ-UHFFFAOYSA-I 0.000 description 1
- 238000004090 dissolution Methods 0.000 description 1
- VSJKWCGYPAHWDS-UHFFFAOYSA-N dl-camptothecin Natural products C1=CC=C2C=C(CN3C4=CC5=C(C3=O)COC(=O)C5(O)CC)C4=NC2=C1 VSJKWCGYPAHWDS-UHFFFAOYSA-N 0.000 description 1
- 239000003534 dna topoisomerase inhibitor Substances 0.000 description 1
- AOARVGJNIOXRPG-UHFFFAOYSA-L dodecyl-[3-[dodecyl(dimethyl)azaniumyl]-2-hydroxypropyl]-dimethylazanium;dibromide Chemical compound [Br-].[Br-].CCCCCCCCCCCC[N+](C)(C)CC(O)C[N+](C)(C)CCCCCCCCCCCC AOARVGJNIOXRPG-UHFFFAOYSA-L 0.000 description 1
- ZWAOHEXOSAUJHY-ZIYNGMLESA-N doxifluridine Chemical compound O[C@@H]1[C@H](O)[C@@H](C)O[C@H]1N1C(=O)NC(=O)C(F)=C1 ZWAOHEXOSAUJHY-ZIYNGMLESA-N 0.000 description 1
- 229950005454 doxifluridine Drugs 0.000 description 1
- 238000001647 drug administration Methods 0.000 description 1
- 239000003937 drug carrier Substances 0.000 description 1
- 238000007876 drug discovery Methods 0.000 description 1
- 230000004064 dysfunction Effects 0.000 description 1
- 238000002592 echocardiography Methods 0.000 description 1
- 239000012636 effector Substances 0.000 description 1
- 230000008030 elimination Effects 0.000 description 1
- 238000003379 elimination reaction Methods 0.000 description 1
- 229950000549 elliptinium acetate Drugs 0.000 description 1
- 210000002889 endothelial cell Anatomy 0.000 description 1
- 238000005516 engineering process Methods 0.000 description 1
- 229950011487 enocitabine Drugs 0.000 description 1
- 229940088598 enzyme Drugs 0.000 description 1
- 210000002615 epidermis Anatomy 0.000 description 1
- 229960001904 epirubicin Drugs 0.000 description 1
- 210000000981 epithelium Anatomy 0.000 description 1
- 229950002973 epitiostanol Drugs 0.000 description 1
- 229960001433 erlotinib Drugs 0.000 description 1
- AAKJLRGGTJKAMG-UHFFFAOYSA-N erlotinib Chemical compound C=12C=C(OCCOC)C(OCCOC)=CC2=NC=NC=1NC1=CC=CC(C#C)=C1 AAKJLRGGTJKAMG-UHFFFAOYSA-N 0.000 description 1
- 229950002017 esorubicin Drugs 0.000 description 1
- ITSGNOIFAJAQHJ-BMFNZSJVSA-N esorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(=O)CO)[C@H]1C[C@H](N)C[C@H](C)O1 ITSGNOIFAJAQHJ-BMFNZSJVSA-N 0.000 description 1
- 150000002148 esters Chemical class 0.000 description 1
- 229960001842 estramustine Drugs 0.000 description 1
- FRPJXPJMRWBBIH-RBRWEJTLSA-N estramustine Chemical compound ClCCN(CCCl)C(=O)OC1=CC=C2[C@H]3CC[C@](C)([C@H](CC4)O)[C@@H]4[C@@H]3CCC2=C1 FRPJXPJMRWBBIH-RBRWEJTLSA-N 0.000 description 1
- 229960005237 etoglucid Drugs 0.000 description 1
- 238000011156 evaluation Methods 0.000 description 1
- 229960005167 everolimus Drugs 0.000 description 1
- 210000004700 fetal blood Anatomy 0.000 description 1
- 239000000945 filler Substances 0.000 description 1
- 239000000834 fixative Substances 0.000 description 1
- 238000000684 flow cytometry Methods 0.000 description 1
- 229960000390 fludarabine Drugs 0.000 description 1
- GIUYCYHIANZCFB-FJFJXFQQSA-N fludarabine phosphate Chemical compound C1=NC=2C(N)=NC(F)=NC=2N1[C@@H]1O[C@H](COP(O)(O)=O)[C@@H](O)[C@@H]1O GIUYCYHIANZCFB-FJFJXFQQSA-N 0.000 description 1
- 238000001943 fluorescence-activated cell sorting Methods 0.000 description 1
- 239000007850 fluorescent dye Substances 0.000 description 1
- 229960002074 flutamide Drugs 0.000 description 1
- MKXKFYHWDHIYRV-UHFFFAOYSA-N flutamide Chemical compound CC(C)C(=O)NC1=CC=C([N+]([O-])=O)C(C(F)(F)F)=C1 MKXKFYHWDHIYRV-UHFFFAOYSA-N 0.000 description 1
- 229960000304 folic acid Drugs 0.000 description 1
- 235000019152 folic acid Nutrition 0.000 description 1
- 239000011724 folic acid Substances 0.000 description 1
- 150000002224 folic acids Chemical class 0.000 description 1
- 239000012737 fresh medium Substances 0.000 description 1
- 201000010175 gallbladder cancer Diseases 0.000 description 1
- 229940044658 gallium nitrate Drugs 0.000 description 1
- 230000002496 gastric effect Effects 0.000 description 1
- 208000017211 gastric neuroendocrine tumor G1 Diseases 0.000 description 1
- 229960002584 gefitinib Drugs 0.000 description 1
- XGALLCVXEZPNRQ-UHFFFAOYSA-N gefitinib Chemical compound C=12C=C(OCCCN3CCOCC3)C(OC)=CC2=NC=NC=1NC1=CC=C(F)C(Cl)=C1 XGALLCVXEZPNRQ-UHFFFAOYSA-N 0.000 description 1
- 229960005277 gemcitabine Drugs 0.000 description 1
- SDUQYLNIPVEERB-QPPQHZFASA-N gemcitabine Chemical compound O=C1N=C(N)C=CN1[C@H]1C(F)(F)[C@H](O)[C@@H](CO)O1 SDUQYLNIPVEERB-QPPQHZFASA-N 0.000 description 1
- 229960000578 gemtuzumab Drugs 0.000 description 1
- 230000009368 gene silencing by RNA Effects 0.000 description 1
- 210000004907 gland Anatomy 0.000 description 1
- 239000011521 glass Substances 0.000 description 1
- 229960002913 goserelin Drugs 0.000 description 1
- 239000001963 growth medium Substances 0.000 description 1
- 231100001261 hazardous Toxicity 0.000 description 1
- 230000036541 health Effects 0.000 description 1
- 210000002216 heart Anatomy 0.000 description 1
- 229940022353 herceptin Drugs 0.000 description 1
- 230000013632 homeostatic process Effects 0.000 description 1
- 230000003054 hormonal effect Effects 0.000 description 1
- 238000001794 hormone therapy Methods 0.000 description 1
- 102000048362 human PDCD1 Human genes 0.000 description 1
- 230000002390 hyperplastic effect Effects 0.000 description 1
- 230000003463 hyperproliferative effect Effects 0.000 description 1
- 210000003026 hypopharynx Anatomy 0.000 description 1
- 210000003016 hypothalamus Anatomy 0.000 description 1
- 229940015872 ibandronate Drugs 0.000 description 1
- 229960002411 imatinib Drugs 0.000 description 1
- KTUFNOKKBVMGRW-UHFFFAOYSA-N imatinib Chemical compound C1CN(C)CCN1CC1=CC=C(C(=O)NC=2C=C(NC=3N=C(C=CN=3)C=3C=NC=CC=3)C(C)=CC=2)C=C1 KTUFNOKKBVMGRW-UHFFFAOYSA-N 0.000 description 1
- 229960003685 imatinib mesylate Drugs 0.000 description 1
- YLMAHDNUQAMNNX-UHFFFAOYSA-N imatinib methanesulfonate Chemical compound CS(O)(=O)=O.C1CN(C)CCN1CC1=CC=C(C(=O)NC=2C=C(NC=3N=C(C=CN=3)C=3C=NC=CC=3)C(C)=CC=2)C=C1 YLMAHDNUQAMNNX-UHFFFAOYSA-N 0.000 description 1
- RAXXELZNTBOGNW-UHFFFAOYSA-N imidazole Substances C1=CNC=N1 RAXXELZNTBOGNW-UHFFFAOYSA-N 0.000 description 1
- 230000008004 immune attack Effects 0.000 description 1
- 230000037451 immune surveillance Effects 0.000 description 1
- 230000000899 immune system response Effects 0.000 description 1
- 230000006058 immune tolerance Effects 0.000 description 1
- 238000011532 immunohistochemical staining Methods 0.000 description 1
- 230000006054 immunological memory Effects 0.000 description 1
- 229960003444 immunosuppressant agent Drugs 0.000 description 1
- 230000001861 immunosuppressant effect Effects 0.000 description 1
- 229940125721 immunosuppressive agent Drugs 0.000 description 1
- 238000002650 immunosuppressive therapy Methods 0.000 description 1
- 239000007943 implant Substances 0.000 description 1
- 238000011534 incubation Methods 0.000 description 1
- 208000015181 infectious disease Diseases 0.000 description 1
- 229960000598 infliximab Drugs 0.000 description 1
- 108091008042 inhibitory receptors Proteins 0.000 description 1
- 210000005007 innate immune system Anatomy 0.000 description 1
- 238000003780 insertion Methods 0.000 description 1
- 230000037431 insertion Effects 0.000 description 1
- 239000000138 intercalating agent Substances 0.000 description 1
- 229940079322 interferon Drugs 0.000 description 1
- 229940047124 interferons Drugs 0.000 description 1
- 230000004073 interleukin-2 production Effects 0.000 description 1
- 108010074108 interleukin-21 Proteins 0.000 description 1
- 229940028885 interleukin-4 Drugs 0.000 description 1
- 210000002570 interstitial cell Anatomy 0.000 description 1
- 201000002313 intestinal cancer Diseases 0.000 description 1
- 230000003834 intracellular effect Effects 0.000 description 1
- 238000007912 intraperitoneal administration Methods 0.000 description 1
- 230000002601 intratumoral effect Effects 0.000 description 1
- 238000001990 intravenous administration Methods 0.000 description 1
- 229960005386 ipilimumab Drugs 0.000 description 1
- 229960004768 irinotecan Drugs 0.000 description 1
- 229960002725 isoflurane Drugs 0.000 description 1
- 229960003299 ketamine Drugs 0.000 description 1
- 201000010982 kidney cancer Diseases 0.000 description 1
- 210000003292 kidney cell Anatomy 0.000 description 1
- 230000002147 killing effect Effects 0.000 description 1
- 210000001821 langerhans cell Anatomy 0.000 description 1
- 229960004891 lapatinib Drugs 0.000 description 1
- BCFGMOOMADDAQU-UHFFFAOYSA-N lapatinib Chemical compound O1C(CNCCS(=O)(=O)C)=CC=C1C1=CC=C(N=CN=C2NC=3C=C(Cl)C(OCC=4C=C(F)C=CC=4)=CC=3)C2=C1 BCFGMOOMADDAQU-UHFFFAOYSA-N 0.000 description 1
- 229940115286 lentinan Drugs 0.000 description 1
- 210000000265 leukocyte Anatomy 0.000 description 1
- GFIJNRVAKGFPGQ-LIJARHBVSA-N leuprolide Chemical compound CCNC(=O)[C@@H]1CCCN1C(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](CC(C)C)NC(=O)[C@@H](NC(=O)[C@H](CO)NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H](CC=1N=CNC=1)NC(=O)[C@H]1NC(=O)CC1)CC1=CC=C(O)C=C1 GFIJNRVAKGFPGQ-LIJARHBVSA-N 0.000 description 1
- 229960004338 leuprorelin Drugs 0.000 description 1
- 229960002247 lomustine Drugs 0.000 description 1
- 229940076783 lucentis Drugs 0.000 description 1
- 210000004072 lung Anatomy 0.000 description 1
- 210000001365 lymphatic vessel Anatomy 0.000 description 1
- 208000001419 lymphocytic choriomeningitis Diseases 0.000 description 1
- 210000003563 lymphoid tissue Anatomy 0.000 description 1
- 229940124302 mTOR inhibitor Drugs 0.000 description 1
- 201000000564 macroglobulinemia Diseases 0.000 description 1
- 201000003175 male breast cancer Diseases 0.000 description 1
- 208000010907 male breast carcinoma Diseases 0.000 description 1
- 230000036210 malignancy Effects 0.000 description 1
- 239000003628 mammalian target of rapamycin inhibitor Substances 0.000 description 1
- VXYRWKSIAWIQMG-UHFFFAOYSA-K manganese(2+) N-[2-(sulfidocarbothioylamino)ethyl]carbamodithioate triphenylstannyl acetate Chemical compound [Mn++].[S-]C(=S)NCCNC([S-])=S.CC(=O)O[Sn](c1ccccc1)(c1ccccc1)c1ccccc1 VXYRWKSIAWIQMG-UHFFFAOYSA-K 0.000 description 1
- 230000010534 mechanism of action Effects 0.000 description 1
- 229960004961 mechlorethamine Drugs 0.000 description 1
- HAWPXGHAZFHHAD-UHFFFAOYSA-N mechlorethamine Chemical compound ClCCN(C)CCCl HAWPXGHAZFHHAD-UHFFFAOYSA-N 0.000 description 1
- 210000000716 merkel cell Anatomy 0.000 description 1
- 108020004999 messenger RNA Proteins 0.000 description 1
- 239000002207 metabolite Substances 0.000 description 1
- 208000011645 metastatic carcinoma Diseases 0.000 description 1
- HPNSFSBZBAHARI-UHFFFAOYSA-N micophenolic acid Natural products OC1=C(CC=C(C)CCC(O)=O)C(OC)=C(C)C2=C1C(=O)OC2 HPNSFSBZBAHARI-UHFFFAOYSA-N 0.000 description 1
- 244000005700 microbiome Species 0.000 description 1
- 230000000116 mitigating effect Effects 0.000 description 1
- 229960003539 mitoguazone Drugs 0.000 description 1
- MXWHMTNPTTVWDM-NXOFHUPFSA-N mitoguazone Chemical compound NC(N)=N\N=C(/C)\C=N\N=C(N)N MXWHMTNPTTVWDM-NXOFHUPFSA-N 0.000 description 1
- 229960000350 mitotane Drugs 0.000 description 1
- 238000010172 mouse model Methods 0.000 description 1
- 206010051747 multiple endocrine neoplasia Diseases 0.000 description 1
- 229960000951 mycophenolic acid Drugs 0.000 description 1
- HPNSFSBZBAHARI-RUDMXATFSA-N mycophenolic acid Chemical compound OC1=C(C\C=C(/C)CCC(O)=O)C(OC)=C(C)C2=C1C(=O)OC2 HPNSFSBZBAHARI-RUDMXATFSA-N 0.000 description 1
- 201000005962 mycosis fungoides Diseases 0.000 description 1
- 201000000050 myeloid neoplasm Diseases 0.000 description 1
- 230000017074 necrotic cell death Effects 0.000 description 1
- 230000017128 negative regulation of NF-kappaB transcription factor activity Effects 0.000 description 1
- QZGIWPZCWHMVQL-UIYAJPBUSA-N neocarzinostatin chromophore Chemical compound O1[C@H](C)[C@H](O)[C@H](O)[C@@H](NC)[C@H]1O[C@@H]1C/2=C/C#C[C@H]3O[C@@]3([C@@H]3OC(=O)OC3)C#CC\2=C[C@H]1OC(=O)C1=C(O)C=CC2=C(C)C=C(OC)C=C12 QZGIWPZCWHMVQL-UIYAJPBUSA-N 0.000 description 1
- 229960002653 nilutamide Drugs 0.000 description 1
- XWXYUMMDTVBTOU-UHFFFAOYSA-N nilutamide Chemical compound O=C1C(C)(C)NC(=O)N1C1=CC=C([N+]([O-])=O)C(C(F)(F)F)=C1 XWXYUMMDTVBTOU-UHFFFAOYSA-N 0.000 description 1
- OSTGTTZJOCZWJG-UHFFFAOYSA-N nitrosourea Chemical compound NC(=O)N=NO OSTGTTZJOCZWJG-UHFFFAOYSA-N 0.000 description 1
- 239000002777 nucleoside Substances 0.000 description 1
- 150000003833 nucleoside derivatives Chemical class 0.000 description 1
- 229960000470 omalizumab Drugs 0.000 description 1
- 238000011275 oncology therapy Methods 0.000 description 1
- 208000022982 optic pathway glioma Diseases 0.000 description 1
- 150000002894 organic compounds Chemical class 0.000 description 1
- 230000008520 organization Effects 0.000 description 1
- 229940047091 other immunostimulants in atc Drugs 0.000 description 1
- 208000021284 ovarian germ cell tumor Diseases 0.000 description 1
- 229960001756 oxaliplatin Drugs 0.000 description 1
- DWAFYCQODLXJNR-BNTLRKBRSA-L oxaliplatin Chemical compound O1C(=O)C(=O)O[Pt]11N[C@@H]2CCCC[C@H]2N1 DWAFYCQODLXJNR-BNTLRKBRSA-L 0.000 description 1
- 201000002530 pancreatic endocrine carcinoma Diseases 0.000 description 1
- 229940096763 panretin Drugs 0.000 description 1
- 239000012188 paraffin wax Substances 0.000 description 1
- 244000052769 pathogen Species 0.000 description 1
- 229940121655 pd-1 inhibitor Drugs 0.000 description 1
- 229940121656 pd-l1 inhibitor Drugs 0.000 description 1
- 229960002621 pembrolizumab Drugs 0.000 description 1
- 230000010412 perfusion Effects 0.000 description 1
- 210000005259 peripheral blood Anatomy 0.000 description 1
- 239000011886 peripheral blood Substances 0.000 description 1
- JGWRKYUXBBNENE-UHFFFAOYSA-N pexidartinib Chemical compound C1=NC(C(F)(F)F)=CC=C1CNC(N=C1)=CC=C1CC1=CNC2=NC=C(Cl)C=C12 JGWRKYUXBBNENE-UHFFFAOYSA-N 0.000 description 1
- 239000000825 pharmaceutical preparation Substances 0.000 description 1
- 229940127557 pharmaceutical product Drugs 0.000 description 1
- 102000020233 phosphotransferase Human genes 0.000 description 1
- 230000001766 physiological effect Effects 0.000 description 1
- 230000035790 physiological processes and functions Effects 0.000 description 1
- 230000006461 physiological response Effects 0.000 description 1
- 210000004560 pineal gland Anatomy 0.000 description 1
- 208000010916 pituitary tumor Diseases 0.000 description 1
- 229920003023 plastic Polymers 0.000 description 1
- 239000004033 plastic Substances 0.000 description 1
- 238000007747 plating Methods 0.000 description 1
- 229910052697 platinum Inorganic materials 0.000 description 1
- 229920000642 polymer Polymers 0.000 description 1
- 108091033319 polynucleotide Proteins 0.000 description 1
- 102000040430 polynucleotide Human genes 0.000 description 1
- 239000002157 polynucleotide Substances 0.000 description 1
- 210000003240 portal vein Anatomy 0.000 description 1
- 238000002360 preparation method Methods 0.000 description 1
- 239000013630 prepared media Substances 0.000 description 1
- 230000037452 priming Effects 0.000 description 1
- 210000001948 pro-b lymphocyte Anatomy 0.000 description 1
- CPTBDICYNRMXFX-UHFFFAOYSA-N procarbazine Chemical compound CNNCC1=CC=C(C(=O)NC(C)C)C=C1 CPTBDICYNRMXFX-UHFFFAOYSA-N 0.000 description 1
- 229960000624 procarbazine Drugs 0.000 description 1
- 239000000047 product Substances 0.000 description 1
- 238000004393 prognosis Methods 0.000 description 1
- 230000005522 programmed cell death Effects 0.000 description 1
- 230000000770 proinflammatory effect Effects 0.000 description 1
- 230000002035 prolonged effect Effects 0.000 description 1
- 210000002307 prostate Anatomy 0.000 description 1
- 239000003207 proteasome inhibitor Substances 0.000 description 1
- 239000003909 protein kinase inhibitor Substances 0.000 description 1
- 229940034080 provenge Drugs 0.000 description 1
- WOLQREOUPKZMEX-UHFFFAOYSA-N pteroyltriglutamic acid Chemical compound C=1N=C2NC(N)=NC(=O)C2=NC=1CNC1=CC=C(C(=O)NC(CCC(=O)NC(CCC(=O)NC(CCC(O)=O)C(O)=O)C(O)=O)C(O)=O)C=C1 WOLQREOUPKZMEX-UHFFFAOYSA-N 0.000 description 1
- 210000001147 pulmonary artery Anatomy 0.000 description 1
- 210000003492 pulmonary vein Anatomy 0.000 description 1
- 230000000541 pulsatile effect Effects 0.000 description 1
- 150000003212 purines Chemical class 0.000 description 1
- 229950010131 puromycin Drugs 0.000 description 1
- 150000003230 pyrimidines Chemical class 0.000 description 1
- 150000003254 radicals Chemical class 0.000 description 1
- 229960004622 raloxifene Drugs 0.000 description 1
- GZUITABIAKMVPG-UHFFFAOYSA-N raloxifene Chemical compound C1=CC(O)=CC=C1C1=C(C(=O)C=2C=CC(OCCN3CCCCC3)=CC=2)C2=CC=C(O)C=C2S1 GZUITABIAKMVPG-UHFFFAOYSA-N 0.000 description 1
- 229960002185 ranimustine Drugs 0.000 description 1
- ZAHRKKWIAAJSAO-UHFFFAOYSA-N rapamycin Natural products COCC(O)C(=C/C(C)C(=O)CC(OC(=O)C1CCCCN1C(=O)C(=O)C2(O)OC(CC(OC)C(=CC=CC=CC(C)CC(C)C(=O)C)C)CCC2C)C(C)CC3CCC(O)C(C3)OC)C ZAHRKKWIAAJSAO-UHFFFAOYSA-N 0.000 description 1
- 230000009257 reactivity Effects 0.000 description 1
- 210000003370 receptor cell Anatomy 0.000 description 1
- 229960000160 recombinant therapeutic protein Drugs 0.000 description 1
- 206010038038 rectal cancer Diseases 0.000 description 1
- 201000001275 rectum cancer Diseases 0.000 description 1
- 230000009467 reduction Effects 0.000 description 1
- 208000019465 refractory cytopenia of childhood Diseases 0.000 description 1
- 229940116176 remicade Drugs 0.000 description 1
- 238000011160 research Methods 0.000 description 1
- 230000029058 respiratory gaseous exchange Effects 0.000 description 1
- SHGAZHPCJJPHSC-YCNIQYBTSA-N retinoic acid group Chemical class C\C(=C/C(=O)O)\C=C\C=C(\C=C\C1=C(CCCC1(C)C)C)/C SHGAZHPCJJPHSC-YCNIQYBTSA-N 0.000 description 1
- 238000012552 review Methods 0.000 description 1
- 239000011435 rock Substances 0.000 description 1
- VHXNKPBCCMUMSW-FQEVSTJZSA-N rubitecan Chemical compound C1=CC([N+]([O-])=O)=C2C=C(CN3C4=CC5=C(C3=O)COC(=O)[C@]5(O)CC)C4=NC2=C1 VHXNKPBCCMUMSW-FQEVSTJZSA-N 0.000 description 1
- 229960000215 ruxolitinib Drugs 0.000 description 1
- HFNKQEVNSGCOJV-OAHLLOKOSA-N ruxolitinib Chemical compound C1([C@@H](CC#N)N2N=CC(=C2)C=2C=3C=CNC=3N=CN=2)CCCC1 HFNKQEVNSGCOJV-OAHLLOKOSA-N 0.000 description 1
- 210000004761 scalp Anatomy 0.000 description 1
- 230000028327 secretion Effects 0.000 description 1
- 229960000714 sipuleucel-t Drugs 0.000 description 1
- 229960002930 sirolimus Drugs 0.000 description 1
- QFJCIRLUMZQUOT-HPLJOQBZSA-N sirolimus Chemical compound C1C[C@@H](O)[C@H](OC)C[C@@H]1C[C@@H](C)[C@H]1OC(=O)[C@@H]2CCCCN2C(=O)C(=O)[C@](O)(O2)[C@H](C)CC[C@H]2C[C@H](OC)/C(C)=C/C=C/C=C/[C@@H](C)C[C@@H](C)C(=O)[C@H](OC)[C@H](O)/C(C)=C/[C@@H](C)C(=O)C1 QFJCIRLUMZQUOT-HPLJOQBZSA-N 0.000 description 1
- 201000008261 skin carcinoma Diseases 0.000 description 1
- 210000003625 skull Anatomy 0.000 description 1
- 239000007787 solid Substances 0.000 description 1
- 210000001082 somatic cell Anatomy 0.000 description 1
- 229950006315 spirogermanium Drugs 0.000 description 1
- 206010041823 squamous cell carcinoma Diseases 0.000 description 1
- 210000000130 stem cell Anatomy 0.000 description 1
- 238000011476 stem cell transplantation Methods 0.000 description 1
- 235000000346 sugar Nutrition 0.000 description 1
- 150000008163 sugars Chemical class 0.000 description 1
- 229960001796 sunitinib Drugs 0.000 description 1
- WINHZLLDWRZWRT-ATVHPVEESA-N sunitinib Chemical compound CCN(CC)CCNC(=O)C1=C(C)NC(\C=C/2C3=CC(F)=CC=C3NC\2=O)=C1C WINHZLLDWRZWRT-ATVHPVEESA-N 0.000 description 1
- 239000013589 supplement Substances 0.000 description 1
- 230000000153 supplemental effect Effects 0.000 description 1
- 239000000725 suspension Substances 0.000 description 1
- 238000013268 sustained release Methods 0.000 description 1
- 239000012730 sustained-release form Substances 0.000 description 1
- 229940036185 synagis Drugs 0.000 description 1
- 238000003786 synthesis reaction Methods 0.000 description 1
- 238000007910 systemic administration Methods 0.000 description 1
- 229960001603 tamoxifen Drugs 0.000 description 1
- 229940095064 tartrate Drugs 0.000 description 1
- 229940063683 taxotere Drugs 0.000 description 1
- 201000003120 testicular cancer Diseases 0.000 description 1
- 210000001550 testis Anatomy 0.000 description 1
- BPEWUONYVDABNZ-DZBHQSCQSA-N testolactone Chemical compound O=C1C=C[C@]2(C)[C@H]3CC[C@](C)(OC(=O)CC4)[C@@H]4[C@@H]3CCC2=C1 BPEWUONYVDABNZ-DZBHQSCQSA-N 0.000 description 1
- 229960005353 testolactone Drugs 0.000 description 1
- 230000004797 therapeutic response Effects 0.000 description 1
- 208000030045 thyroid gland papillary carcinoma Diseases 0.000 description 1
- YFTWHEBLORWGNI-UHFFFAOYSA-N tiamiprine Chemical compound CN1C=NC([N+]([O-])=O)=C1SC1=NC(N)=NC2=C1NC=N2 YFTWHEBLORWGNI-UHFFFAOYSA-N 0.000 description 1
- 229950011457 tiamiprine Drugs 0.000 description 1
- 229940044693 topoisomerase inhibitor Drugs 0.000 description 1
- 229960000303 topotecan Drugs 0.000 description 1
- UCFGDBYHRUNTLO-QHCPKHFHSA-N topotecan Chemical compound C1=C(O)C(CN(C)C)=C2C=C(CN3C4=CC5=C(C3=O)COC(=O)[C@]5(O)CC)C4=NC2=C1 UCFGDBYHRUNTLO-QHCPKHFHSA-N 0.000 description 1
- XFCLJVABOIYOMF-QPLCGJKRSA-N toremifene Chemical compound C1=CC(OCCN(C)C)=CC=C1C(\C=1C=CC=CC=1)=C(\CCCl)C1=CC=CC=C1 XFCLJVABOIYOMF-QPLCGJKRSA-N 0.000 description 1
- 229960005026 toremifene Drugs 0.000 description 1
- 238000012546 transfer Methods 0.000 description 1
- 230000001131 transforming effect Effects 0.000 description 1
- 230000009261 transgenic effect Effects 0.000 description 1
- 230000032258 transport Effects 0.000 description 1
- 238000011269 treatment regimen Methods 0.000 description 1
- 229950007217 tremelimumab Drugs 0.000 description 1
- IUCJMVBFZDHPDX-UHFFFAOYSA-N tretamine Chemical compound C1CN1C1=NC(N2CC2)=NC(N2CC2)=N1 IUCJMVBFZDHPDX-UHFFFAOYSA-N 0.000 description 1
- 229950001353 tretamine Drugs 0.000 description 1
- 229960001670 trilostane Drugs 0.000 description 1
- KVJXBPDAXMEYOA-CXANFOAXSA-N trilostane Chemical compound OC1=C(C#N)C[C@]2(C)[C@H]3CC[C@](C)([C@H](CC4)O)[C@@H]4[C@@H]3CC[C@@]32O[C@@H]31 KVJXBPDAXMEYOA-CXANFOAXSA-N 0.000 description 1
- 229950000212 trioxifene Drugs 0.000 description 1
- 208000029387 trophoblastic neoplasm Diseases 0.000 description 1
- HDZZVAMISRMYHH-LITAXDCLSA-N tubercidin Chemical compound C1=CC=2C(N)=NC=NC=2N1[C@@H]1O[C@@H](CO)[C@H](O)[C@H]1O HDZZVAMISRMYHH-LITAXDCLSA-N 0.000 description 1
- 229940030325 tumor cell vaccine Drugs 0.000 description 1
- 230000005909 tumor killing Effects 0.000 description 1
- 210000003171 tumor-infiltrating lymphocyte Anatomy 0.000 description 1
- 239000005483 tyrosine kinase inhibitor Substances 0.000 description 1
- 229950009811 ubenimex Drugs 0.000 description 1
- 208000018417 undifferentiated high grade pleomorphic sarcoma of bone Diseases 0.000 description 1
- 229960001055 uracil mustard Drugs 0.000 description 1
- 208000037965 uterine sarcoma Diseases 0.000 description 1
- 206010046885 vaginal cancer Diseases 0.000 description 1
- 208000013139 vaginal neoplasm Diseases 0.000 description 1
- 229960000241 vandetanib Drugs 0.000 description 1
- UHTHHESEBZOYNR-UHFFFAOYSA-N vandetanib Chemical compound COC1=CC(C(/N=CN2)=N/C=3C(=CC(Br)=CC=3)F)=C2C=C1OCC1CCN(C)CC1 UHTHHESEBZOYNR-UHFFFAOYSA-N 0.000 description 1
- 230000002792 vascular Effects 0.000 description 1
- 229940126580 vector vaccine Drugs 0.000 description 1
- 210000005135 veiled cell Anatomy 0.000 description 1
- GBABOYUKABKIAF-GHYRFKGUSA-N vinorelbine Chemical compound C1N(CC=2C3=CC=CC=C3NC=22)CC(CC)=C[C@H]1C[C@]2(C(=O)OC)C1=CC([C@]23[C@H]([C@]([C@H](OC(C)=O)[C@]4(CC)C=CCN([C@H]34)CC2)(O)C(=O)OC)N2C)=C2C=C1OC GBABOYUKABKIAF-GHYRFKGUSA-N 0.000 description 1
- 229960002066 vinorelbine Drugs 0.000 description 1
- 229960004854 viral vaccine Drugs 0.000 description 1
- 230000003612 virological effect Effects 0.000 description 1
- 201000005102 vulva cancer Diseases 0.000 description 1
- BPICBUSOMSTKRF-UHFFFAOYSA-N xylazine Chemical compound CC1=CC=CC(C)=C1NC1=NCCCS1 BPICBUSOMSTKRF-UHFFFAOYSA-N 0.000 description 1
- 229960001600 xylazine Drugs 0.000 description 1
- 210000005253 yeast cell Anatomy 0.000 description 1
- 229940055760 yervoy Drugs 0.000 description 1
- 239000011701 zinc Substances 0.000 description 1
- 229910052725 zinc Inorganic materials 0.000 description 1
- 229950009268 zinostatin Drugs 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/0005—Vertebrate antigens
- A61K39/0011—Cancer antigens
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61F—FILTERS IMPLANTABLE INTO BLOOD VESSELS; PROSTHESES; DEVICES PROVIDING PATENCY TO, OR PREVENTING COLLAPSING OF, TUBULAR STRUCTURES OF THE BODY, e.g. STENTS; ORTHOPAEDIC, NURSING OR CONTRACEPTIVE DEVICES; FOMENTATION; TREATMENT OR PROTECTION OF EYES OR EARS; BANDAGES, DRESSINGS OR ABSORBENT PADS; FIRST-AID KITS
- A61F7/00—Heating or cooling appliances for medical or therapeutic treatment of the human body
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K35/00—Medicinal preparations containing materials or reaction products thereof with undetermined constitution
- A61K35/12—Materials from mammals; Compositions comprising non-specified tissues or cells; Compositions comprising non-embryonic stem cells; Genetically modified cells
- A61K35/14—Blood; Artificial blood
- A61K35/15—Cells of the myeloid line, e.g. granulocytes, basophils, eosinophils, neutrophils, leucocytes, monocytes, macrophages or mast cells; Myeloid precursor cells; Antigen-presenting cells, e.g. dendritic cells
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K35/00—Medicinal preparations containing materials or reaction products thereof with undetermined constitution
- A61K35/12—Materials from mammals; Compositions comprising non-specified tissues or cells; Compositions comprising non-embryonic stem cells; Genetically modified cells
- A61K35/14—Blood; Artificial blood
- A61K35/17—Lymphocytes; B-cells; T-cells; Natural killer cells; Interferon-activated or cytokine-activated lymphocytes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/19—Cytokines; Lymphokines; Interferons
- A61K38/20—Interleukins [IL]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/19—Cytokines; Lymphokines; Interferons
- A61K38/20—Interleukins [IL]
- A61K38/2046—IL-7
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/19—Cytokines; Lymphokines; Interferons
- A61K38/20—Interleukins [IL]
- A61K38/2086—IL-13 to IL-16
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/39—Medicinal preparations containing antigens or antibodies characterised by the immunostimulating additives, e.g. chemical adjuvants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
- A61K39/39533—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals
- A61K39/3955—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals against proteinaceous materials, e.g. enzymes, hormones, lymphokines
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
- A61K39/39533—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals
- A61K39/39558—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals against tumor tissues, cells, antigens
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/46—Cellular immunotherapy
- A61K39/461—Cellular immunotherapy characterised by the cell type used
- A61K39/4615—Dendritic cells
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/46—Cellular immunotherapy
- A61K39/462—Cellular immunotherapy characterized by the effect or the function of the cells
- A61K39/4622—Antigen presenting cells
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/46—Cellular immunotherapy
- A61K39/464—Cellular immunotherapy characterised by the antigen targeted or presented
- A61K39/4643—Vertebrate antigens
- A61K39/4644—Cancer antigens
- A61K39/464499—Undefined tumor antigens, e.g. tumor lysate or antigens targeted by cells isolated from tumor
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61N—ELECTROTHERAPY; MAGNETOTHERAPY; RADIATION THERAPY; ULTRASOUND THERAPY
- A61N5/00—Radiation therapy
- A61N5/10—X-ray therapy; Gamma-ray therapy; Particle-irradiation therapy
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/02—Antineoplastic agents specific for leukemia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/04—Immunostimulants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2803—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily
- C07K16/2818—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily against CD28 or CD152
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/51—Medicinal preparations containing antigens or antibodies comprising whole cells, viruses or DNA/RNA
- A61K2039/515—Animal cells
- A61K2039/5154—Antigen presenting cells [APCs], e.g. dendritic cells or macrophages
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/545—Medicinal preparations containing antigens or antibodies characterised by the dose, timing or administration schedule
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/555—Medicinal preparations containing antigens or antibodies characterised by a specific combination antigen/adjuvant
- A61K2039/55511—Organic adjuvants
- A61K2039/55516—Proteins; Peptides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/555—Medicinal preparations containing antigens or antibodies characterised by a specific combination antigen/adjuvant
- A61K2039/55511—Organic adjuvants
- A61K2039/55522—Cytokines; Lymphokines; Interferons
- A61K2039/55527—Interleukins
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K2239/00—Indexing codes associated with cellular immunotherapy of group A61K39/46
- A61K2239/31—Indexing codes associated with cellular immunotherapy of group A61K39/46 characterized by the route of administration
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K2239/00—Indexing codes associated with cellular immunotherapy of group A61K39/46
- A61K2239/38—Indexing codes associated with cellular immunotherapy of group A61K39/46 characterised by the dose, timing or administration schedule
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K2239/00—Indexing codes associated with cellular immunotherapy of group A61K39/46
- A61K2239/46—Indexing codes associated with cellular immunotherapy of group A61K39/46 characterised by the cancer treated
- A61K2239/47—Brain; Nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K2300/00—Mixtures or combinations of active ingredients, wherein at least one active ingredient is fully defined in groups A61K31/00 - A61K41/00
Abstract
본 발명은 하나 이상의 사이클 및/또는 용량의 체크포인트 억제제 및 치료제를 어느 순서든 순차적으로 또는 실질적으로 동시에 포함하는 병용 치료 요법이 몇몇 피험자에서 암을 치료하는데 더욱 효과적일 수 있고/있거나 면역 세포의 활성 및/또는 수 또는 종양에 의한 의학적으로 유리한 반응을 개시하거나 가능하게 하거나 증가시키거나 향상시키거나 연장시킬 수 있다는 중대한 인식으로부터 적어도 부분적으로 비롯된다.
Description
관련 출원에 대한 교차 참조
본원은 35 USC §119(e) 하에 2013년 11월 5일자로 출원된 미국 출원 제61/900,309호 및 2013년 11월 5일자로 제출된 미국 출원 제61/900,355호에 대한 우선권의 이익을 주장한다. 선행 출원의 개시내용은 본원의 개시내용의 일부로 여겨지며 이의 전문이 본원의 개시내용에 참조로 포함되어 있다.
본 발명의 분야
본 발명은 일반적으로 암을 치료하는 방법, 더 구체적으로는 체크포인트 억제제 및 치료제의 배합물을 사용하여 암을 치료하는 방법에 관한 것이다.
점점 더 증가하는 증거에 의하면 신체의 면역 반응을 앞지르는 능력이 종양 발생의 특징임을 시사한다. 이와 같이, 연구자들은 본질적으로 면역계를 치료함으로써 암을 직접적으로 치료하는, 표적화된 제제에 의해 면역 반응을 복귀시키는 방법을 검토하기 시작했다. 상기와 같이 실행하기 위한 특히 촉망되는 한 가지 전략은 면역계의 T 세포에 오프-스위치(off-switch)로서 작용하는, 소위 면역 체크포인트를 표적화하는 것이다.
존재하는 면역 반응을 '차단해제'하거나 면역 반응의 개시를 차단해제하는 체크포인트 억제제 요법은 하위그룹의 피험자에서 암을 치료하는데 매우 효과적이다. 그러나, 하위그룹의 피험자는 암 피험자 집단 중 단지 대략 25%를 구성하는 비교적 소 집단(즉, "반응 피험자 집단")이다. 따라서, 체크포인트 억제제가 반응 피험자 집단에서 암을 치료하는데 대단히 효과적일지라도, 대략 75%의 암 피험자는 요법에 반응하지 않을 것이다. 또한, 심지어 반응 집단에서도 반응은 항상 완전하거나 최적이지 않다.
다수의 면역 체크포인트가 특이적 수용체 및 리간드 쌍 사이의 상호작용에 의해 조절되기 때문에, 단클론 항체 또는 다른 제제는 이러한 상호작용을 차단하고 면역억제를 방지하는데 사용될 수 있다. 최근에 가장 많은 주목을 받는 2개의 체크포인트 수용체는 CTLA-4 및 PD-1이다.
CTLA-4, PD-1 및 이의 리간드는 T-세포 기능 및 다른 세포 기능의 모든 단계들에 걸쳐 중요한 역할을 하는 공동-신호전달 분자의 CD28-B7 패밀리의 일원이다. PD-1 수용체는 활성화된 T 세포(및 B 세포)의 표면에서 발현되며, 정상 상황 하에, 항원-제시 세포, 예를 들면, 수지상 세포 또는 대식세포의 표면에서 발현되는 이의 리간드(PD-L1 및 PD-L2)에 결합한다. 이러한 상호작용은 신호를 T 세포로 전달하고 본질적으로 T 세포를 스위치 오프(switch off)하거나 억제한다. 암세포는 이의 표면에서 PD-L1의 발현을 높은 수준으로 유도함으로써 이러한 시스템을 이용한다. 이는 암세포가 PD-1 경로의 통제권을 쥐게 하여 종양 미세환경으로 도입될 수 있는 PD-1을 발현시키는 T 세포를 스위치 오프시키며, 이에 따라 항암 면역 반응을 억제시킨다.
퍼스트-인-클래스(first-in-class) 면역요법, 이필리무맙(여보이(Yervoy)), T 세포의 표면상에 세포독성 T-림프구-관련된 항원 4(CTLA-4)를 표적화하는 단클론 항체는 흑색종의 치료에 승인되었다. 현재, 예정된 사멸-1(PD-1) T-세포 수용체 또는 이의 리간드(PD-L1 또는 PD-L2)를 겨냥하는 새로운 표적화 면역요법이 이필리무맙보다 더 효과적이며 심지어 더 안전한 것으로 입증될 수 있다. 추가의 체크포인트 표적이 또한 예를 들면, TIM-3, LAG-3, 다양한 B-7 리간드, CHK 1 및 CHK2 키나제, BTLA, A2aR 등에 효과적인 것으로 입증될 수 있다.
현재, 적어도 7개의 체크포인트 억제제 제제가 임상시험중이다. 전장 사람 및 사람화된 단클론 항-PD-1 항체, 뿐만 아니라 전장 사람 항-PD-L1 항체, 및 PD-L2의 세포외 도메인 및 IgG1을 조합한 융합 단백질이 이들 중에 대표적이다. 각각의 이들 제제는 PD-1 및 이의 리간드 사이의 상호작용을 차단하여 T-세포(또는 다른 세포) 온/오프 스위치를 "온" 위치로 유지시키도록 디자인되지만, 이들 각각은 약간 상이한 작용 기전을 갖는다.
암의 치료를 위한 또 다른 전략은 체크포인트 억제제를 치료제와 배합하는 것이다. 항체 및 백신을 포함하는, 생물학적 치료제는 암의 치료에 효과적인 것으로 입증되었다. 체크포인트 억제제 및 치료제(예를 들면, 생물제제)의 병용은 피험자에서 항종양 반응을 향상시키거나 연장시킬 수 있다. 추가로, 체크포인트 억제제와 함께 생물학적 치료제의 투여는 상기 체크포인트 억제제의 효과를 향상 또는 연장시키거나, 피험자가 체크포인트 억제제에 반응하게 하거나, 체크포인트 억제제의 독성 또는 용량을 감소시킬 수 있다.
따라서, 비반응 피험자 집단 및 반응 피험자 집단 모두에서 체크포인트 억제제의 유효성을 개시시키거나 향상시키기 위한 방법 및 병용 요법을 개발하는 것이 필요하다. 본 발명은 이후 체크포인트 억제제에 대한 피험자 또는 종양 반응을 가능하게 하거나 향상시키거나 개선시키기 위한 항종양 면역 반응을 개시시키거나 가능하게 하거나 향상시키거나 개선시키는 방법 및 병용 요법을 개시한다.
본 발명은 하나 이상의 사이클 및/또는 용량의 체크포인트 억제제 및 치료제를 어느 순서든 순차적으로 또는 실질적으로 동시에 포함하는 병용 치료 요법이 몇몇 피험자에서 암을 치료하는데 더욱 효과적일 수 있고/있거나 면역 세포의 활성 및/또는 수 또는 종양에 의한 의학적으로 유리한 반응을 개시하거나 가능하게 하거나 증가시키거나 향상시키거나 연장시킬 수 있다는 중대한 인식으로부터 적어도 부분적으로 비롯된다.
따라서, 한 양태에서, 본 발명은 피험자에게 치료제를 체크포인트 억제제와 함께 투여함을 포함하여, 암의 치료 또는 항종양 반응의 개시, 향상 또는 연장을 필요로 하는 피험자에서 암을 치료하거나 항종양 반응을 개시, 향상 또는 연장시키는 방법을 제공한다. 한 측면에서, 상기 체크포인트 억제제는 생물학적 치료제 또는 소분자이다. 또 다른 측면에서, 상기 체크포인트 억제제는 단클론 항체, 사람화된 항체, 전장 사람 항체, 융합 단백질 또는 이들의 조합이다. 추가의 측면에서, 상기 체크포인트 억제제는 CTLA-4, PDL1, PDL2, PD1, B7-H3, B7-H4, BTLA, HVEM, TIM3, GAL9, LAG3, VISTA, KIR, 2B4, CD160, CGEN-15049, CHK 1, CHK2, A2aR, B-7 패밀리 리간드 또는 이들의 조합일 수 있는 체크포인트 단백질을 억제한다. 추가의 측면에서, 상기 체크포인트 억제제는 CTLA-4, PDL1, PDL2, PD1, B7-H3, B7-H4, BTLA, HVEM, TIM3, GAL9, LAG3, VISTA, KIR, 2B4, CD160, CGEN-15049, CHK 1, CHK2, A2aR, B-7 패밀리 리간드 또는 이들의 조합일 수 있는 체크포인트 단백질의 리간드와 상호작용한다. 한 측면에서, 치료제는 면역자극제, T 세포 성장 인자, 인터류킨, 항체, 백신 또는 이들의 조합이다. 추가의 측면에서, 상기 인터류킨은 IL-7 또는 IL-15이다. 구체적인 측면에서, 상기 인터류킨은 글리코실화된 IL-7이다. 추가의 측면에서, 상기 백신은 수지상 세포(DC) 백신이다.
추가의 측면에서, 상기 체크포인트 억제제 및 상기 치료제는 동시에 또는 어느 순서든 순차적으로 투여된다. 추가의 측면에서, 상기 치료제는 상기 체크포인트 억제제의 투여 전에 투여된다. 구체적인 측면에서, 상기 치료제는 백신이고 상기 체크포인트 억제제는 PD-1 억제제이다. 추가의 측면에서, 상기 백신은 수지상 세포 백신이다.
한 측면에서, 치료는 임상적 결과; T 세포에 의한 항종양 활성의 증가, 향상 또는 연장; 치료 전의 수치와 비교하여 항종양 T 세포 또는 활성화된 T 세포의 수치의 증가 또는 이들의 조합에 의해 결정된다. 또 다른 측면에서, 임상적 결과는 종양 퇴행; 종양 수축; 종양 괴사; 면역계에 의한 항종양 반응; 종양 확대, 재발 또는 확산 또는 이들의 조합이다. 추가의 측면에서, 상기 치료 효과는 T 세포의 존재, T 세포 염증을 표시하는 유전자 서명(gene signature)의 존재 또는 이들의 조합에 의해 예측된다.
또 다른 측면에서, 상기 피험자는 암을 갖는다. 추가의 측면에서, 상기 암은 비뇨생식기암(예를 들면, 전립선암, 신장 세포암, 방광암), 부인과암(예를 들면, 난소암, 자궁경부암, 자궁내막암), 폐암, 위장암(예를 들면, 비-전이성 또는 전이성 결장직장암, 췌장암, 위암, 식도암, 간세포암, 담관세포암), 두경부암(예를 들면, 두경부 편평세포 암), 악성 교모세포종, 악성 중피종, 비-전이성 또는 전이성 유방암(예를 들면, 호르몬 무반응성 전이성 유방암), 악성 흑색종, 메르켈 세포 암종 또는 골 및 연조직 육종 및 혈액 신생물, 예를 들면, 다발성 골수종, 급성 골수성 백혈병, 만성 골수성 백혈병, 골수이형성 증후군 및 급성 림프모구 백혈병을 포함하는, 임의의 고형 종양 또는 액상 암(liquid cancer)이다. 바람직한 양태에서, 상기 질환은 비-소(小)세포 폐암(NSCLC), 유방암(예를 들면, 호르몬 무반응성 전이성 유방암), 두경부암(예를 들면, 두경부 편평세포 암), 전이성 결장직장암, 호르몬 민감성 또는 호르몬 무반응성 전립선암, 결장직장암, 난소암, 간세포암, 신장 세포암, 연조직 육종 또는 소(小)세포 폐암이다.
추가의 측면에서, 상기 방법은 병용 요법으로의 치료 전, 치료와 동시에 또는 치료 후 피험자에게 화학요법제, 표적화된 요법 또는 방사선을 투여함을 추가로 포함한다. 추가의 측면에서, 상기 종양은 치료제 및 체크포인트 억제제의 투여 전에 절제될 수 있다.
또 다른 양태에서, 본 발명은 체크포인트 억제제의 효과를 향상 또는 연장시키거나, 피험자가 체크포인트 억제제에 반응하게 하거나, 체크포인트 억제제의 독성 또는 용량을 감소시키는 방법으로서, 치료제를 체크포인트 억제제와 함께 이를 필요로 하는 피험자에게 투여함을 포함하고, 상기 피험자는 암을 갖는, 방법을 제공한다. 한 측면에서, 상기 체크포인트 억제제는 생물학적 치료제 또는 소분자이다. 또 다른 측면에서, 상기 체크포인트 억제제는 단클론 항체, 사람화된 항체, 전장 사람 항체, 융합 단백질 또는 이들의 조합이다. 추가의 측면에서, 상기 체크포인트 억제제는 CTLA-4, PDL1, PDL2, PD1, B7-H3, B7-H4, BTLA, HVEM, TIM3, GAL9, LAG3, VISTA, KIR, 2B4, CD160, CGEN-15049, CHK 1, CHK2, A2aR, B-7 패밀리 리간드 또는 이들의 조합일 수 있는 체크포인트 단백질을 억제한다. 한 측면에서, 체크포인트 억제제는 CTLA-4, PDL1, PDL2, PD1, B7-H3, B7-H4, BTLA, HVEM, TIM3, GAL9, LAG3, VISTA, KIR, 2B4, CD160, CGEN-15049, CHK 1, CHK2, A2aR, B-7 패밀리 리간드 또는 이들의 조합일 수 있는 체크포인트 단백질의 리간드와 상호작용한다. 추가의 측면에서, 상기 치료제는 면역자극제, T 세포 성장 인자, 인터류킨, 항체 및 백신 또는 이들의 조합이다. 추가의 측면에서, 상기 인터류킨은 IL-7 또는 IL-15이다. 구체적인 측면에서, 상기 인터류킨은 글리코실화된 IL-7이다. 한 측면에서, 상기 백신은 수지상 세포(DC) 백신이다.
추가의 측면에서, 상기 체크포인트 억제제 및 상기 치료제는 동시에 또는 어느 순서든 순차적으로 투여된다. 추가의 측면에서, 상기 치료제는 상기 체크포인트 억제제의 투여 전에 투여된다. 구체적인 측면에서, 상기 치료제는 백신이고 상기 체크포인트 억제제는 PD-1 억제제이다. 추가의 측면에서, 상기 백신은 수지상 세포 백신이다.
또 다른 측면에서, 상기 암은 비뇨생식기암(예를 들면, 전립선암, 신장 세포암, 방광암), 부인과암(예를 들면, 난소암, 자궁경부암, 자궁내막암), 폐암, 위장암(예를 들면, 비-전이성 또는 전이성 결장직장암, 췌장암, 위암, 식도암, 간세포암, 담관세포암), 두경부암(예를 들면, 두경부 편평세포 암), 악성 교모세포종, 악성 중피종, 비-전이성 또는 전이성 유방암(예를 들면, 호르몬 무반응성 전이성 유방암), 악성 흑색종, 메르켈 세포 암종 또는 골 및 연조직 육종 및 혈액 신생물, 예를 들면, 다발성 골수종, 급성 골수성 백혈병, 만성 골수성 백혈병, 골수이형성 증후군 및 급성 림프모구 백혈병을 포함하는, 임의의 고형 종양 또는 액상 암이다. 바람직한 양태에서, 상기 질환은 비-소세포 폐암(NSCLC), 유방암(예를 들면, 호르몬 무반응성 전이성 유방암), 두경부암(예를 들면, 두경부 편평세포 암), 전이성 결장직장암, 호르몬 민감성 또는 호르몬 무반응성 전립선암, 결장직장암, 난소암, 간세포암, 신장 세포암, 연조직 육종 또는 소세포 폐암이다.
추가의 측면에서, 상기 방법은 병용 요법으로의 치료 전, 치료와 동시에 또는 치료 후 피험자에게 화학요법제, 표적화된 요법 또는 방사선을 투여함을 추가로 포함한다. 추가의 측면에서, 상기 종양은 치료제 및 체크포인트 억제제의 투여 전 절제될 수 있다.
추가의 양태에서, 본 발명은 체크포인트 억제제를 치료제와 함께 포함하는 약제학적 조성물을 제공한다. 한 측면에서, 상기 치료제는 생물 제제이고 생물학적 치료제는 백신이다.
한 양태에서, 본원은 입양(adoptive) T 세포 요법 및 체크포인트 억제제를 포함하는, 암 치료용 병용 요법을 제공한다. 한 측면에서, 상기 입양 T 세포 요법은 자가 및/또는 동종이형 T-세포를 포함한다. 또 다른 측면에서, 상기 자가 및/또는 동종이형 T-세포는 종양 항원에 대해 표적화된다. 추가의 측면에서, 상기 체크포인트 억제제는 PD-1 또는 PDL-1 체크포인트 억제제이다.
추가의 양태에서, 본 발명은 피험자에게 입양 T 세포 요법 및 체크포인트 억제제를 투여함을 포함하는, 항종양 또는 항암 면역 반응을 향상시키는 방법을 제공한다. 한 측면에서, 상기 입양 T 세포 요법은 상기 체크포인트 억제제의 투여 전에 투여된다. 추가의 측면에서, 상기 입양 T 세포 요법은 상기 체크포인트 억제제의 투여 1 내지 30일 전에 투여된다. 추가의 측면에서, 상기 항종양 반응은 종양 성장의 억제; 종양 세포사의 유도; 종양 퇴행; 종양의 재발, 성장, 또는 확산의 예방 또는 지연; 또는 종양 제거이다.
한 양태에서, 본 발명은 (a) 치료적 암 백신 또는 입양 T 세포 요법 및 (b) 체크포인트 억제제를 포함하는, 암 치료용 병용 요법을 위한 방법을 제공한다. 일 측면에서, 상기 치료적 암 백신은 수지상 세포 백신이다. 구체적인 측면에서, 상기 치료적 암 백신은 수지상 세포 백신이다. 구체적인 측면에서, 상기 수지상 세포 백신은 자가 수지상 세포 및/또는 동종이형 수지상 세포로 구성된다. 구체적인 측면에서 상기 자가 또는 동종이형 수지상 세포는 피험자로의 투여 전 암 항원과 결합된다. 구체적인 측면에서, 상기 자가 또는 동종이형 수지상 세포는 종양으로의 직접적인 투여를 통해 암 항원과 결합된다. 구체적인 측면에서, 상기 입양 T 세포 요법은 자가 및/또는 동종이형 T-세포를 포함한다. 구체적인 측면에서, 상기 자가 및/또는 동종이형 T-세포는 종양 항원에 대해 표적화된다. 구체적인 양태에서, 상기 체크포인트 억제제는 PD-1, PDL-1 또는 CTLA-4 체크포인트 억제제이다.
또 다른 양태에서, 본 발명은 피험자에게 (a) 치료적 암 백신 또는 입양 T 세포 요법 및 (b) 체크포인트 억제제를 투여함을 포함하는, 항종양 면역 반응을 개시, 지속 또는 향상시키는 방법을 제공한다. 구체적인 측면에서, 상기 치료적 암 백신 또는 입양 T 세포 요법은 상기 체크포인트 억제제의 투여 전에 투여된다. 구체적인 양태에서, 상기 치료적 암 백신 또는 입양 T 세포 요법은 상기 체크포인트 억제제의 투여 1 내지 30일 전 투여된다. 구체적인 측면에서, 상기 항종양 반응은 종양 특이적 반응, 임상적 반응, 종양 크기의 감소, 종양 특이적 바이오마커의 감소, 사량체 염색의 증가, 항종양 사이토카인의 증가 또는 이들의 조합이다. 구체적인 측면에서, 상기 임상적 반응은 종양 성장의 감소 및/또는 종양 크기의 감소이다. 구체적인 측면에서, 상기 치료적 암 백신 또는 입양 T 세포 요법은 암세포 백신이다. 구체적인 측면에서, 상기 입양 T 세포 요법은 자가 및/또는 동종이형 T-세포를 포함한다. 구체적인 측면에서, 상기 자가 및/또는 동종이형 T-세포는 종양 항원에 대해 표적화된다. 구체적인 측면에서, 상기 치료적 암 백신은 수지상 세포 백신이다. 구체적인 측면에서, 상기 수지상 세포 백신은 자가 수지상 세포 및/또는 동종이형 수지상 세포를 포함한다. 구체적인 측면에서, 상기 체크포인트 억제제는 PD-1, PDL-1 및/또는 CTLA-4 체크포인트 억제제이다. 구체적인 측면에서, 항종양 면역 반응의 개시, 지속 또는 향상은 암의 치료를 위한 것이다.
추가의 양태에서, 본 발명은 피험자에게 (a) 치료적 암 백신 또는 입양 T 세포 요법 및 (b) 체크포인트 억제제를 투여함을 포함하는, 체크포인트 억제제의 효능을 향상시키거나, 피험자가 체크포인트 억제제에 반응하게 하는 방법을 제공한다. 구체적인 측면에서, 30%, 40%, 50%, 60%, 70%, 80% 또는 90%의 피험자가 치료적 암 백신 또는 입양 T 세포 요법 및 체크포인트 억제제의 투여에 반응한다. 구체적인 측면에서, 상기 치료적 암 백신 또는 입양 T 세포 요법은 TH1 T-세포를 활성화시킨다. 구체적인 측면에서, 상기 입양 T 세포 요법은 자가 및/또는 동종이형 T-세포를 포함한다. 구체적인 측면에서, 상기 자가 및/또는 동종이형 T-세포는 종양 항원에 대해 표적화된다. 구체적인 측면에서, 상기 치료적 암 백신은 암세포 백신 또는 수지상 세포 백신이다. 구체적인 측면에서, 상기 수지상 세포 백신은 자가 수지상 세포 및/또는 동종이형 수지상 세포를 포함한다. 구체적인 측면에서, 상기 체크포인트 억제제는 PD-1, PDL-1 및/또는 CTLA-4 체크포인트 억제제이다. 구체적인 측면에서, 상기 효능의 향상은 암의 치료를 위한 것이다. 구체적인 측면에서, 상기 피험자는 암을 갖는다.
한 양태에서, 본 발명은 (a) 치료적 암 백신 또는 입양 T 세포 요법 및 (b) 체크포인트 억제제를 투여함을 포함하는, 암을 치료하는 방법을 제공한다. 구체적인 양태에서, 상기 치료적 암 백신 또는 입양 T 세포 요법은 상기 체크포인트 억제제의 투여 전에 투여된다. 구체적인 측면에서, 상기 치료적 암 백신 또는 입양 T 세포 요법은 상기 체크포인트 억제제의 투여 1 내지 30일 전에 투여된다. 구체적인 측면에서, 30%, 40%, 50%, 60%, 70%, 80% 또는 90%의 피험자는 치료적 암 백신 또는 입양 T 세포 요법 및 체크포인트 억제제의 투여에 반응한다. 구체적인 측면에서, 상기 치료적 암 백신 또는 입양 T 세포 요법은 TH1 T-세포를 활성화시킨다. 구체적인 측면에서, 상기 치료적 암 백신 또는 입양 T 세포 요법은 암세포 백신 또는 수지상 세포 백신이다. 구체적인 측면에서, 상기 암세포 백신은 자가 및/또는 동종이형 T-세포를 포함한다. 구체적인 측면에서, 상기 자가 및/또는 동종이형 T-세포는 종양 항원에 대해 표적화된다. 구체적인 측면에서, 상기 수지상 세포 백신은 자가 및/또는 동종이형 수지상 세포를 포함한다. 구체적인 측면에서, 상기 체크포인트 억제제는 PD-1, PDL-1 및/또는 CTLA-4 체크포인트 억제제이다.
한 양태에서, 본 발명은 (a) 치료적 암 백신 또는 입양 T 세포 요법 및 (b) 체크포인트 억제제를 투여함을 포함하는, 종양 성장의 억제, 종양 세포사의 유도, 종양 퇴행 또는 종양 제거를 위한 방법을 제공한다. 구체적인 측면에서, 상기 치료적 암 백신 또는 입양 T 세포 요법은 상기 체크포인트 억제제의 투여 전에 투여된다. 구체적인 측면에서, 상기 치료적 암 백신 또는 입양 T 세포 요법은 상기 체크포인트 억제제의 투여 1 내지 30일 전에 투여된다. 구체적인 측면에서, 30%, 40%, 50%, 60%, 70%, 80% 또는 90%의 피험자는 치료적 암 백신 또는 입양 T 세포 요법 및 체크포인트 억제제의 투여에 반응한다. 구체적인 측면에서, 상기 치료적 암 백신 또는 입양 T 세포 요법은 TH1 T-세포를 활성화시킨다. 구체적인 양태에서, 상기 치료적 암 백신 또는 입양 T 세포 요법은 암세포 백신 또는 수지상 세포 백신이다. 구체적인 측면에서, 상기 암세포 백신은 자가 및/또는 동종이형 T-세포를 포함한다. 구체적인 측면에서, 상기 자가 및/또는 동종이형 T-세포는 종양 항원에 대해 표적화된다. 구체적인 측면에서, 상기 수지상 세포 백신은 자가 및/또는 동종이형 수지상 세포를 포함한다. 구체적인 측면에서, 상기 체크포인트 억제제는 PD-1, PDL-1 및/또는 CTLA-4 체크포인트 억제제이다.
추가의 양태에서, 본 발명은 피험자에게 치료적 암 백신 또는 입양 T 세포 요법 및 본원에 기재된 체크포인트 억제제를 투여함을 포함하는, 종양 재발, 종양 성장 또는 종양 확산을 예방하거나 지연시키는 방법을 제공한다.
또 다른 양태에서, 본 발명은 피험자에게 치료적 암 백신 또는 입양 T 세포 요법 및 본원에 기재된 체크포인트 억제제를 투여함을 포함하는, 체크포인트 억제제의 독성을 감소시키거나 저용량의 체크포인트 억제제로 치료 효과를 얻게 할 수 있는 방법을 제공한다.
추가의 양태에서, 본 발명은 자가 또는 동종이형(예를 들면, 세포주 유래) 종양 항원이 결합된 자가 또는 동종이형 수지상 세포 또는 자가 또는 동종이형 T 세포를 사용하여 항종양 면역 반응을 개시시키거나 이를 가능하게 한 후 본원에 기재된 하나 이상의 체크포인트 억제제를 투여함을 포함하는, 체크포인트 억제제의 투여 전 면역 반응을 유도하는 방법을 제공한다.
한 양태에서, 본 발명은 자가 또는 동종이형 (예를 들면, 세포주 유래) 종양 항원이 결합된 자가 또는 동종이형 수지상 세포 또는 자가 또는 동종이형 T 세포를 사용하여 기존의 항종양 면역 반응을 향상시킨 후 본원에 기재된 하나 이상의 체크포인트 억제제를 투여함을 포함하는, 체크포인트 억제제의 투여 전에 면역 반응을 유도하는 방법을 제공한다.
또 다른 양태에서, 본 발명은 생체내 항원 결합을 위해 종양으로 직접적으로 투여되거나 종양 주위에 투여된 자가 또는 동종이형 수지상 세포를 사용하여 항종양 면역 반응을 개시시키거나 가능하게 한 후 본원에 기재된 하나 이상의 체크포인트 억제제를 투여함을 포함하는, 체크포인트 억제제의 투여 전에 면역 반응을 유도하는 방법을 제공한다.
추가의 양태에서, 본 발명은 생체내 항원 결합을 위해 종양으로 직접적으로 투여되거나 종양 주위에 투여된 자가 또는 동종이형 수지상 세포를 사용하여 기존의 항종양 면역 반응을 향상시킨 후 본원에 기재된 하나 이상의 체크포인트 억제제를 투여함을 포함하는, 체크포인트 억제제의 투여 전에 면역 반응을 유도하는 방법을 제공한다.
한 양태에서, 본 발명은 자가 종양 항원이 결합된 동종이형 수지상 세포를 사용하여 항종양 면역 반응을 개시시킨 후 본원에 기재된 하나 이상의 체크포인트 억제제를 투여함을 포함하는, 체크포인트 억제제의 투여 전에 면역 반응을 유도하는 방법을 제공한다.
추가의 양태에서, 본 발명은 자가 종양 항원이 결합된 동종이형 수지상 세포를 사용하여 기존의 항종양 면역 반응을 향상시킨 후 본원에 기재된 하나 이상의 체크포인트 억제제를 투여함을 포함하는, 체크포인트 억제제의 투여 전에 면역 반응을 유도하는 방법을 제공한다.
또 다른 양태에서, 본 발명은 생체내 항원 결합을 위해 종양으로 직접적으로 투여되거나 종양 주위에 투여된 동종이형 수지상 세포를 사용하여 항종양 면역 반응을 개시시킨 후 본원에 기재된 하나 이상의 체크포인트 억제제를 투여함을 포함하는, 체크포인트 억제제의 투여 전에 면역 반응을 유도하는 방법을 제공한다.
추가의 양태에서, 본 발명은 생체내 항원 결합을 위해 종양으로 직접적으로 투여되거나 종양 주위에 투여된 동종이형 수지상 세포를 사용하여 기존의 항종양 면역 반응을 향상시킨 후 본원에 기재된 하나 이상의 체크포인트 억제제를 투여함을 포함하는, 체크포인트 억제제의 투여 전에 면역 반응을 유도하는 방법을 제공한다.
한 양태에서, 본 발명은 생체 외(ex vivo)에서 확장되고/되거나 활성화된 자가 항종양 T 세포를 사용하여 항종양 면역 반응을 개시시킨 후 본원에 기재된 하나 이상의 체크포인트 억제제를 투여함을 포함하는, 체크포인트 억제제의 투여 전에 면역 반응을 유도하는 방법을 제공한다.
또 다른 양태에서, 본 발명은 생체 외에서 확장되고/되거나 활성화된 항종양 T 세포를 사용하여 기존의 항종양 면역 반응을 향상시킨 후 본원에 기재된 하나 이상의 체크포인트 억제제를 투여함을 포함하는, 체크포인트 억제제의 투여 전에 면역 반응을 유도하는 방법을 제공한다.
추가의 양태에서, 본 발명은 (a) 치료적 암 백신 또는 입양 T 세포 요법 및 (b) 체크포인트 억제제를 사용하여 종양 반응을 유도하거나 향상시키는 방법을 제공한다. 구체적인 양태에서, 상기 종양 반응은 유발된 세포 예정사(programmed cell death)이다. 구체적인 양태에서, 상기 종양 반응은 종양 세포 수의 감소이다. 구체적인 양태에서, 상기 종양 반응은 종양 성장 속도의 감소이다. 구체적인 양태에서, 상기 종양 반응은 키나제 경로의 차단이다. 구체적인 양태에서, 상기 종양 반응은 TH1 세포의 활성화이다. 구체적인 양태에서, 상기 종양 반응은 활성화된 T-세포 반응이다. 구체적인 양태에서, 상기 종양 반응의 품질은 TH1 대 TH2 반응의 비율에 의해 측정될 수 있으며, 여기서 높은 TH1 반응은 고 품질 반응을 표시한다.
추가의 양태에서, 본원에 기재된 체크포인트 억제제는 하나 이상의 개별적인 체크포인트 억제제를 포함할 수 있다. 게다가, 본원에 기재된 (a) 치료적 암 백신 또는 입양 T 세포 요법 및 (b) 체크포인트 억제제의 투여는 피험자 또는 환자에게 투여되는 체크포인트 억제제의 유효량을 감소시킬 수 있다. 추가로, 상기 체크포인트 억제제의 감소된 양은 상기 체크포인트 억제제의 독성을 감소시키며 상기 체크포인트 억제제에 대한 피험자의 내성을 증가시킬 수 있다.
도 1a 내지 1c는 DC 백신이 확립된 신경아교종에서 치료적 이점 없이 활성화된 림프구 침윤을 촉진시킴을 보여준다. (A) DC 백신은 대조군에 비해 림프구(CD3+)의 유의미한 종양 침윤을 촉진시켰다. (B) 상당 부분의 이들 세포는 활성화된 림프구(CD3+ CD8+ CD25+)였다. (C) DC 백신과 대조 그룹 사이의 생존 이익(survival benefit)은 관찰되지 않았다.
도 2a 및 2b는 DC 백신 후 종양 미세환경에서 억제성 골수 세포의 축적이 증가되었음을 보여준다. (A) 종양-보유 대조군은 종양-침윤 골수 세포(Thy1.2- Ly6C+)의 증가를 보여주었다. 이러한 집단은 DC 백신으로 처리된 마우스에서 유의미하게 더 컸다. (B) 상당한 비율의 이들 골수 세포는 PD-L1(Thy1.2- Ly6C+ PD-L1+)을 발현시켰다.
도 3a 내지 3g는 PD-1의 차단이 억제성 골수 세포의 축적을 방지하고 치료적 이점을 가지면서 활성화된 림프구 침윤을 촉진시킴을 보여준다. (A) DC 백신화된 마우스 및 보조 항-PD-1 Ab로 처리된 DC 백신 마우스(DC 백신/항-PD-1 Ab) 사이에는 림프절에서 CD8+ 집단의 차이가 없었다. (B) 최소 집단의 활성화된 CD8+ CD25+ T 세포가 각각의 처리 그룹의 림프절에서 발견되었으며 통계상 두드러지지 않았다. (C, D) 억제성 골수 집단은 단지 DC 백신화된 그룹과 비교할 때 DC 백신/항-PD-1 처리된 마우스에서 유의미하게 감소되었다. (E) DC 백신화 단독과 비교하여 DC 백신/항-PD-1 처리된 마우스에서 활성화된 세포독성 종양-침윤 림프구 집단은 유사했다. (F) 조합 DC 백신/항-PD-1 처리는 유의미한 생존 이익을 나타내었다. (G) (F)로부터의 생존 DC 백신/항-PD-1 처리된 마우스를 추가 처리 없이 75일째에 GL261 뮤린(murine) 신경아교종의 반대쪽 두개내 이식으로 재투여하였다. 대조군 마우스와 비교하여 유의미한 생존 이익이 관찰되었다.
도 4a 및 4b는 종양 용해물-펄싱된(pulsed) 수지상 세포가 PD-L1의 발현을 하향-조절함을 보여준다. (A) 용해물 펄싱(pulsing)전 및 용해물 펄싱후 PD-L1 발현의 변화를 도시하는 대표적인 히스토그램. (B) 종양 용해물로 24시간 펄싱한 후 PD-L1 발현에 대해 분석된 수지상 세포. PD-L1 발현의 중앙 형광 강도(MFI)를 그래프로 나타냈다.
도 2a 및 2b는 DC 백신 후 종양 미세환경에서 억제성 골수 세포의 축적이 증가되었음을 보여준다. (A) 종양-보유 대조군은 종양-침윤 골수 세포(Thy1.2- Ly6C+)의 증가를 보여주었다. 이러한 집단은 DC 백신으로 처리된 마우스에서 유의미하게 더 컸다. (B) 상당한 비율의 이들 골수 세포는 PD-L1(Thy1.2- Ly6C+ PD-L1+)을 발현시켰다.
도 3a 내지 3g는 PD-1의 차단이 억제성 골수 세포의 축적을 방지하고 치료적 이점을 가지면서 활성화된 림프구 침윤을 촉진시킴을 보여준다. (A) DC 백신화된 마우스 및 보조 항-PD-1 Ab로 처리된 DC 백신 마우스(DC 백신/항-PD-1 Ab) 사이에는 림프절에서 CD8+ 집단의 차이가 없었다. (B) 최소 집단의 활성화된 CD8+ CD25+ T 세포가 각각의 처리 그룹의 림프절에서 발견되었으며 통계상 두드러지지 않았다. (C, D) 억제성 골수 집단은 단지 DC 백신화된 그룹과 비교할 때 DC 백신/항-PD-1 처리된 마우스에서 유의미하게 감소되었다. (E) DC 백신화 단독과 비교하여 DC 백신/항-PD-1 처리된 마우스에서 활성화된 세포독성 종양-침윤 림프구 집단은 유사했다. (F) 조합 DC 백신/항-PD-1 처리는 유의미한 생존 이익을 나타내었다. (G) (F)로부터의 생존 DC 백신/항-PD-1 처리된 마우스를 추가 처리 없이 75일째에 GL261 뮤린(murine) 신경아교종의 반대쪽 두개내 이식으로 재투여하였다. 대조군 마우스와 비교하여 유의미한 생존 이익이 관찰되었다.
도 4a 및 4b는 종양 용해물-펄싱된(pulsed) 수지상 세포가 PD-L1의 발현을 하향-조절함을 보여준다. (A) 용해물 펄싱(pulsing)전 및 용해물 펄싱후 PD-L1 발현의 변화를 도시하는 대표적인 히스토그램. (B) 종양 용해물로 24시간 펄싱한 후 PD-L1 발현에 대해 분석된 수지상 세포. PD-L1 발현의 중앙 형광 강도(MFI)를 그래프로 나타냈다.
본 발명은 하나 이상의 사이클 및/또는 용량의 체크포인트 억제제 및 치료제를 어느 순서든 순차적으로 또는 실질적으로 동시에 포함하는 병용 치료 요법이 몇몇 피험자에서 암을 치료하는데 더 효과적일 수 있고/있거나 면역 세포의 활성 및/또는 수 또는 종양에 의한 의학적으로 유리한 반응을 개시하거나 가능하게 하거나 증가시키거나, 향상시키거나 연장시킬 수 있다는 중대한 인식으로부터 적어도 부분적으로 비롯된다.
본 조성물 및 방법을 기재하기 전에, 본 발명은, 기재된 특정 조성물, 방법 및 조건이 변화될 수 있기 때문에, 기재된 특정 조성물, 방법 및 실험 조건에 제한되지 않는 것으로 이해되어야 한다. 또한, 본원에 사용된 용어는, 본 발명의 범위가 첨부된 청구범위로만 제한될 것이기 때문에, 특정 양태만을 기재하기 위한 것이며 제한하고자 하는 것이 아님을 이해해야 한다.
달리 정의되지 않는 한, 본원에 사용된 모든 기술 및 과학 용어들은 본 발명이 속하는 분야의 숙련가에 의해 통상적으로 이해되는 바와 동일한 의미를 갖는다. 본원에 기재된 것과 유사하거나 동등한 임의의 방법 및 재료가 본 발명의 실시 또는 시험에 사용될 수 있지만, 바람직한 방법 및 재료가 이하 기재된다.
본 명세서 및 첨부된 청구범위에 사용된 바와 같이, 단수형("a", "an" 및 "the")은 달리 문맥상 명확히 지시되지 않는 한 복수의 지시대상을 포함한다. 따라서, 예를 들면, "방법"에 대한 언급은 본 개시내용 등을 판독할 때 당업자에게 분명할 하나 이상의 방법 및/또는 본원에 기재된 유형의 단계를 포함한다.
본원에 사용된 용어 "치료제(therapeutic)" 또는 "치료제(therapeutic agent)"는 피험자에게 치료적 반응을 야기하는 임의의 의료 물품을 나타낸다.
본원에 사용된 용어 "생물학적 치료제" 또는 "생물약제(biopharmaceutical)"는 생물학적 공급원으로 제조되거나 생물학적 공급원으로부터 추출된 임의의 의료 물품을 나타낸다. 생물약제는 화학적으로 합성된 의약품(pharmaceutical product)과는 다르다. 생물약제의 예는 백신, 혈액 또는 혈액 성분, 알레르게닉스(allergenics), 체세포, 유전자 요법, 조직, 항체 치료제 및 융합 단백질을 포함하는 재조합 치료 단백질, 및 생세포를 포함한다. 생물제제는 당, 단백질 또는 핵산 또는 이들 물질들의 복합적 조합으로 이루어질 수 있거나 살아있는 개체, 예를 들면, 세포 및 조직일 수 있다. 생물제제는 다양한 천연 공급원 - 사람, 동물 또는 미생물로부터 단리되고 생명공학 방법 및 다른 기술에 의해 생산될 수 있다. 생물학적 치료제의 구체적인 예는 면역자극제, T 세포 성장 인자, 인터류킨, 항체, 융합 단백질 및 백신, 예를 들면, 암 백신을 포함하지만, 이들에 제한되지 않는다.
본원에 사용된 용어 "항체"는 면역글로불린 또는 이의 일부를 나타내고, 공급원, 기원 종, 제조 방법 및 특징과 무관한 항원-결합 부위를 포함하는 임의의 폴리펩타이드를 포함한다. 항체는 중쇄 및/또는 경쇄 또는 이의 단편으로 이루어질 수 있다. 본 발명의 항체 또는 이의 항원-결합 단편, 변이체 또는 유도체는 다클론, 단클론, 다중특이적, 사람, 사람화된, 영장류화된(primatized) 또는 키메라 항체, 단일쇄 항체, 에피토프-결합 단편, 예를 들면, Fab, Fab' 및 F(ab')2, Fd, Fvs, 단일쇄 Fvs(scFv), 단일쇄 항체, 디설파이드-결합된 Fvs(sdFv), VL 또는 VH 도메인을 포함하는 단편, Fab 발현 라이브러리에 의해 생성된 단편 및 항-이디오타입(항-Id) 항체를 포함하지만, 이들에 제한되지 않는다. ScFv 분자는 당해 분야에 공지되어 있고, 예를 들면, 미국 특허 제5,892,019호에 기재되어 있다. 본 발명의 면역글로불린 또는 항체 분자는 면역글로불린 분자의 임의의 유형(예를 들면, IgG, IgE, IgM, IgD, IgA 및 IgY), 부류(예를 들면, IgG1, IgG2, IgG3, IgG4, IgA1 및 IgA2) 또는 아부류일 수 있다.
세포 표면 수용체는 항체 요법에 통상적인 표적이며 표피 성장 인자 수용체 및 HER2를 포함한다. 항체는, 암 항원에 결합되면, 항체-의존적 세포-매개된 세포독성을 유도하거나 보체계(complement system)를 활성화시키거나 수용체가 이의 리간드와 상호작용하는 것을 방지하거나 화학요법 또는 방사선의 페이로드(payload)를 전달할 수 있으며, 이들 모두 세포사를 초래할 수 있다. 치료제로서 승인된 항체는 리툭산(리툭시맙); 제나팍스(다클리주맙); 시물렉트(바실릭시맙); 시나기스(팔리비주맙); 레미케이드(인플릭시맙); 허셉틴(트라스투주맙); 마일로타르그(겜투주맙 오조가미신); 캠파스(알렘투주맙); 제발린(이브리투모맙 티욱세탄); 휴미라(아달리무맙); 졸레어(오말리주맙); 벡사르(토시투모맙-I-131); 랍티바(에팔리주맙); 어비툭스(세툭시맙); 아바스틴(베바시주맙); 타이사브리(나탈리주맙); 악템라(토실리주맙); 벡티빅스(파니투무맙); 루센티스(라니비주맙); 솔리리스(에쿨리주맙); 심지아(세르톨리주맙 페골); 심포니(골리무맙); 일라리스(카나키누맙); 스텔라라(우스테키누맙); 아르제라(오파투무맙); 프롤리아(데노수맙); 누막스(모타비주맙); 에이비트락스(락시바쿠맙); 벤리스타(벨리무맙); 여보이(이필리무맙); 애드세트리스(브렌툭시맙 베도틴); 퍼제타(퍼투주맙); 캐드실라(아도-트라스투주맙 엠탄신); 및 가지바(오비누투주맙)를 포함한다.
본원에 사용된 용어 "융합 단백질"은, 예를 들면, 적어도 하나의 표적 결합 부위를 갖는 면역글로불린 항원-결합 도메인, 및 적어도 하나의 이종 부위, 즉, 사실상 천연적으로 연결되지 않은 부위를 포함하는 키메라 분자를 나타낸다. 아미노산 서열은 통상적으로 융합 폴리펩타이드에서 합쳐진 별개의 단백질로 존재할 수 있거나 이것은 통상적으로 동일한 단백질에 존재하지만 융합 폴리펩타이드에서 새롭게 배열될 수 있다. 융합 단백질은, 예를 들면, 화학적 합성에 의해 생성될 수 있거나 펩타이드 부위가 목적하는 관계로 인코딩된 폴리뉴클레오타이드를 생성하고 번역함으로써 생성될 수 있다.
본원에 사용된 용어 "표적화된 요법"은 면역계의 임의의 측면을 표적화하는 임의의 치료 분자를 나타낸다.
본원에 사용된 용어 "암"은 시험관내(예를 들면, 형질전환된 세포) 또는 생체내에서 과증식성 세포 성장을 특징으로 하는 광범위한 부류의 장애를 나타낸다. 본 발명의 조성물 및 방법에 의해 치료되거나 예방될 수 있는 병태는, 예를 들면, 양성 또는 악성 종양을 포함하는 다양한 신생물, 다양한 과형성 등을 포함한다. 본 발명의 화합물 및 방법은 이러한 병태에 연루된 원하지 않는 과증식성 세포 성장의 억제 및/또는 역전을 달성할 수 있다. 암의 구체적인 예는 급성 림프모구 백혈병, 성인; 급성 림프모구 백혈병, 소아기; 급성 골수성 백혈병, 성인; 부신피질 암종; 부신피질 암종, 소아기; AIDS-관련된 림프종; AIDS-관련된 악성종양; 항문암; 성상세포종, 소아기 소뇌; 성상세포종, 소아기 대뇌; 담관암, 간외; 방광암; 방광암, 소아기; 골암, 골육종/악성 섬유 조직구종; 뇌줄기 신경아교종, 소아기; 뇌종양, 성인; 뇌종양, 뇌줄기 신경아교종, 소아기; 뇌 종양, 소뇌 성상세포종, 소아기; 뇌 종양, 대뇌 성상세포종/악성 신경아교종, 소아기; 뇌 종양, 뇌실막세포종, 소아기; 뇌 종양, 수모세포종, 소아기; 뇌 종양, 천막상 원시신경외배엽 종양, 소아기; 뇌 종양, 시각 경로 및 시상하부 신경아교종, 소아기; 뇌 종양, 소아기(기타); 유방암; 유방암 및 임신; 유방암, 소아기; 유방암, 남성; 기관지 선종/카르시노이드, 소아기: 카르시노이드 종양, 소아기; 카르시노이드 종양, 위장; 암종, 부신피질; 암종, 섬세포; 원인 불명의 암종; 중추 신경계 림프종, 원발성; 소뇌 성상세포종, 소아기; 대뇌 성상세포종/악성 신경아교종, 소아기; 자궁경부암; 소아기 암; 만성 림프구 백혈병; 만성 골수성 백혈병; 만성 골수증식 장애; 건초의 투명 세포 육종; 결장암; 결장직장암, 소아기; 피부 T-세포 림프종; 자궁내막암; 뇌실막세포종, 소아기; 상피암, 난소; 식도암; 식도암, 소아기; 유잉(Ewing) 패밀리의 종양; 두개외 배세포 종양, 소아기; 고환외 배세포 종양; 간외 담관암; 안암, 안구내 흑색종; 안암, 망막모세포종; 담낭암; 위암; 위암, 소아기; 위장 카르시노이드 종양; 배세포 종양, 두개외, 소아기; 배세포 종양, 고환외; 배세포 종양, 난소; 임신 영양막 종양; 신경아교종. 소아기 뇌줄기; 신경아교종. 소아기 시각 경로 및 시상하부; 모발 세포 백혈병; 두경부암; 간세포(간) 암, 성인(원발성); 간세포(간) 암, 소아기(원발성); 호지킨(Hodgkin) 림프종, 성인; 호지킨 림프종, 소아기; 임신중 호지킨 림프종; 하인두암; 시상하부 및 시각 경로 신경아교종, 소아기; 안구내 흑색종; 섬세포 암종(내분비성 췌장); 카포시(Kaposi) 육종; 신장암; 후두암; 후두암, 소아기; 백혈병, 급성 림프아구성, 성인; 백혈병, 급성 림프아구성, 소아기; 백혈병, 급성 골수성, 성인; 백혈병, 급성 골수성, 소아기; 백혈병, 만성 림프구성; 백혈병, 만성 골수성; 백혈병, 모발 세포; 입술 및 구강 암; 간암, 성인(원발성); 간암, 소아기(원발성); 폐암, 비-소세포; 폐암, 소세포; 림프모구 백혈병, 성인 급성; 림프모구 백혈병, 소아기 급성; 림프구성 백혈병, 만성; 림프종, AIDS-관련됨; 림프종, 중추 신경계(원발성); 림프종, 피부 T-세포; 림프종, 호지킨, 성인; 림프종, 호지킨; 소아기; 림프종, 임신중 호지킨; 림프종, 비-호지킨, 성인; 림프종, 비-호지킨, 소아기; 림프종, 임신중 비-호지킨; 림프종, 일차 중추 신경계; 고분자글로불린혈증, 발덴스트롬(Waldenstrom); 남성 유방암; 악성 중피종, 성인; 악성 중피종, 소아기; 악성 흉선종; 수모세포종, 소아기; 흑색종; 흑색종, 안구내; 메르켈 세포 암종; 중피종, 악성; 잠복 원발성의 전이성 편평 경부암; 다발성 내분비 신생물 증후군, 소아기; 다발성 골수종/형질 세포 신생물; 균상식육종; 골수이형성 증후군; 골수성 백혈병, 만성; 골수성 백혈병, 소아기 급성; 골수종, 다발성; 골수증식 장애, 만성; 비강 및 부비동 암; 코인두암; 코인두암, 소아기; 신경모세포종; 신경섬유종; 비-호지킨 림프종, 성인; 비-호지킨 림프종, 소아기; 임신중 비-호지킨 림프종; 비-소세포 폐암; 구강암, 소아기; 구강 및 입술 암; 입인두암; 골육종/골의 악성 섬유 조직구종; 난소암, 소아기; 난소 상피암; 난소 배세포 종양; 난소 낮은 악성 잠재 종양; 췌장암; 췌장암, 소아기, 췌장암, 섬세포; 부비동 및 비강 암; 부갑상선암; 음경암; 크롬친화세포종; 솔방울샘 및 천막상 원시신경외배엽 종양, 소아기; 뇌하수체 종양; 형질 세포 신생물/다발성 골수종; 흉막폐 모세포종; 임신 및 유방암; 임신 및 호지킨 림프종; 임신 및 비-호지킨 림프종; 일차 중추 신경계 림프종; 원발성 간암, 성인; 원발성 간암, 소아기; 전립선암; 직장암; 신세포(신장) 암; 신장 세포암, 소아기; 신우 및 요관, 이행 세포 암; 망막모세포종; 횡문근육종, 소아기; 침샘 암; 침샘 암, 소아기; 육종, 유잉 패밀리의 종양; 육종, 카포시; 육종(골육종)/골의 악성 섬유 조직구종; 육종, 횡문근육종, 소아기; 육종, 연조직, 성인; 육종, 연조직, 소아기; 세자리(Sezary) 증후군; 피부암; 피부암, 소아기; 피부암(흑색종); 피부암종, 메르켈 세포; 소세포 폐암; 소장암; 연조직 육종, 성인; 연조직 육종, 소아기; 잠복 원발성의 편평 경부암, 전이성; 위암; 위암, 소아기; 천막상 원시신경외배엽 종양, 소아기; T-세포 림프종, 피부; 고환암; 흉선종, 소아기; 흉선종, 악성; 갑상선암; 갑상선암, 소아기; 신우 및 요관의 이행 세포 암; 영양막 종양, 임신성; 알려지지 않은 원발 부위, 이의 암, 소아기; 소아기의 드문 암; 요관 및 신우, 이행 세포 암; 요도암; 자궁 육종; 질암; 시각 경로 및 시상하부 신경아교종, 소아기; 외음부암; 발덴스트롬 마크로 글로불린혈증; 및 윌름스(Wilms) 종양을 포함한다.
본원에 사용된 용어 "생존의 개선"은 암 또는 증식성 질환으로 고통받는 피험자의 수명 또는 삶의 질의 증가를 나타낸다. 예를 들면, 생존의 개선은 또한 암 완화의 촉진, 종양 침입의 방지, 종양 재발의 방지, 종양 성장을 늦춤, 종양 성장의 방지, 종양 크기의 감소 및 총 암세포 수의 감소를 포함한다.
본원에 사용된 용어 "장애의 예방"은 절대적인 용어로서 의도되지 않는다. 대신에, 예를 들면, 암의 예방은 개시의 지연, 증상의 빈도 감소, 피험자가 장애와 관련된 증상을 나타내거나 본원에 기재된 방법, 조성물 또는 치료 중 적어도 하나를 수용하지 않은 유사한 피험자와 비교하여 장애를 획득할 가능성의 감소 또는 암과 관련된 증상의 중증도의 감소를 나타낸다. 따라서, 예방은 당업자에 의해 이해될 광범위한 예방적 조치를 나타낸다. 몇몇 상황에서는, 증상의 빈도 및 중증도가, 예를 들면, 비-병적 수준으로 감소되어 개체가 침습성 암 치료, 예를 들면, 적극적인 화학요법 및 수술을 지연할 수 있다.
본원에 사용된 용어 "암의 치료"는 절대적인 용어로서 의도되지 않는다. 몇몇 측면에서, 본 발명의 조성물 및 방법은 종양의 크기 또는 암세포의 수를 감소시키거나 암이 차도를 나타내게 하거나 암세포의 크기 또는 세포 수에서의 성장을 방지하려고 한다. 몇몇 상황에서, 치료는 개선된 예후를 초래한다.
본원에 사용된 용어 "치료를 필요로 하는 피험자"는 암 또는 세포 증식성 장애로 진단된 개체 또는 피험자를 나타낸다.
용어 "치료적으로 효과적인", "치료적 유효량", "유효량" 또는 "효과적인 양으로"는 목적하는 생리적 반응을 촉진시키기에 충분한 양 또는 투여량을 나타내지만, 예를 들면, T-세포 반응을 촉진시키기에 충분한 양 또는 투여량으로 제한되지 않는다.
본원에 사용된 용어 "PD-1 항체"는 PD-1을 아고나이징(agonizing)하여 림프구의 활성 및/또는 증식을 길항하는 항체를 나타낸다. 용어 "활성을 길항하다"는 적어도 약 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% 또는 그 이상의 림프구 증식 또는 활성의 감소(또는 축소)에 관한 것이다. 용어 "길항하다"는 용어 "억제성" 및 "억제하다"와 상호교환적으로 사용될 수 있다. PD-1-매개된 활성은 본원에 기재된 T 세포 증식 검정을 사용하여 정량적으로 측정될 수 있다.
본 발명의 한 측면은 PD-1의 작용제(agonist)로서 작용하여 PD-1에 의해 조절된 면역 반응을 조절할 수 있는 항체를 제공한다. 한 양태에서, 항-PD-1 항체는 신규한 항원-결합 단편일 수 있다. 본원에 개시된 항-PD-1 항체는 사람 PD-1을 포함하는 것에 결합하여 PD-1을 아고나이징하며, 이에 의해 PD-1을 발현시키는 면역 세포의 기능을 억제할 수 있다. 몇몇 양태에서, 면역 세포는 활성화된 림프구, 예를 들면, T-세포, B-세포 및/또는 PD-1을 발현시키는 단핵구이다.
본원에 사용된 용어 "종양 반응"은 유발된 세포예정사를 포함하지만 이에 제한되지 않는 세포 반응을 나타낸다.
본원에 사용된 용어 "항종양 반응"은 항원을 공격하는 T-세포 또는 항원 제시 세포를 활성화시킴을 포함하지만 이에 제한되지 않는 면역계 반응을 나타낸다.
본원에 사용된 용어 "개시하는"은 제1 항종양 반응의 개시 또는 제2 또는 "향상된" 항종양 반응의 개시를 나타낸다.
본원에 사용된 용어 "가능하게 하는"은 피험자가 본원에 개시된 치료에 반응하게 하거나 종양 세포가 본원에 개시된 치료에 반응하게 하는 것을 나타내며, 여기서 상기 피험자 또는 종양 세포는 이전에 치료에 반응하지 않거나 치료에 낮은 반응을 가졌다.
본원에 사용된 용어 "향상시키는"은 피험자 또는 종양 세포가 본원에 개시된 치료에 반응하는 능력이 개선됨을 나타낸다. 예를 들면, 향상된 반응은 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95% 또는 98% 또는 그 이상의 반응성의 증가를 포함할 수 있다. 본원에 사용된 "향상시키는"은 또한 치료, 예를 들면, 체크포인트 억제제 요법에 반응하는 피험자의 수를 높이는 것을 나타낼 수 있다. 예를 들면, 향상된 반응은 치료에 반응하는 피험자의 총 백분율을 나타낼 수 있으며, 여기서 상기 백분율은 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95% 또는 98% 또는 그 초과의 백분율이다.
본원에 사용된 용어 "소분자"는 대략 10-9m의 크기를 갖는, 생물학적 공정을 조절하는 것을 도울 수 있는 저분자량(<900달톤) 유기 화합물을 나타낸다. 대부분의 약물은 소분자이다.
본 발명은 적응(adaptive) 면역 내성의 활성화를 토대로 하는 신규한 병용 치료를 기재한다. 적응 면역 내성 기전은, 유도된 면역-체크포인트 단백질을 차단할 수 있는 제제가, 기존의 항종양 면역 반응(즉, 활성화된 T-세포)이 존재할 때에만 작용할 것이기 때문에, 최소로 효과적일 것임을 암시한다. 기존의 항종양 반응을 갖지 않는 환자의 경우, 상기 체크포인트 억제제는 효과적이지 않을 것이다. 따라서, 항종양 활성(즉, 항종양 면역 반응)을 활성화시키고 체크포인트를 억제할 수 있는 병용 치료는 단독 치료에 반응하지 않는 피험자가 조합된 치료로부터 이익을 얻게 할 수 있기 때문에 바람직하다.
수지상 세포(DC)는 T 세포 항종양 반응을 조정하는 것으로 나타났고, 교모세포종 피험자에서 항종양 면역을 유도하기 위한 DC를 사용한 능동 백신화 전략을 시험하였다. 다수의 연구는 DC 백신 처리 후 유의미하고 효과적인 면역 반응을 보고한다. 내인성 자가조절 기전의 보조적 조절과 함께 이러한 면역요법을 추가로 진행시킬 가능성이 흥미롭다.
수지상 세포는 다양한 림프구 및 비-림프구 조직에서 발견되는 다양한 항원 제시 세포 집단이다(참조: Liu, Cell 106:259-62 (2001); Steinman, Ann. Rev. Immunol. 9:271-96 (1991)). 수지상 세포는 비장의 림프구 수지상 세포, 표피의 랑게르한스 세포 및 혈액 순환 중 베일 세포(veiled cell)를 포함한다. 총괄하여, 수지상 세포는 이의 형태, 고 수준의 표면 MHC-부류 II 발현, 및 T 세포, B 세포, 단핵구 및 자연 살해 세포에서 발현되는 특정한 다른 표면 마커의 부재를 기준으로 한 그룹으로 분류된다. 특히, 단핵구-유도된 수지상 세포(또한 단구성 수지상 세포로도 지칭됨)는 통상적으로 CD11c, CD80, CD86을 발현시키며, HLA-DR+이지만 CD14-는 아니다.
반대로, 단구성 수지상 세포 전구체(통상적으로 단핵구)는 통상적으로 CD14+이다. 단구성 수지상 세포 전구체는 이들이 체류하는 임의의 조직, 특히 림프구 조직, 예를 들면, 비장, 골수, 림프절 및 흉선으로부터 수득될 수 있다. 단구성 수지상 세포 전구체는 또한 순환계로부터 단리될 수 있다. 말초 혈액은 단구성 수지상 세포 전구체의 용이하게 이용가능한 공급원이다. 제대혈은 단구성 수지상 세포 전구체의 또 다른 공급원이다. 단구성 수지상 세포 전구체는 면역 반응이 유도될 수 있는 다양한 유기체로부터 단리될 수 있다. 이러한 유기체는, 예를 들면, 사람 및 비-사람 동물, 예를 들면, 영장류, 포유동물(개, 고양이, 마우스 및 랫트 포함), 조류(닭 포함) 뿐만 아니라 이의 유전자 이식(transgenic) 종들을 포함하는 동물을 포함한다. 특정 양태에서, 단구성 수지상 세포 전구체 및/또는 미성숙 수지상 세포는 건강한 피험자 또는 면역자극을 필요로 하는 피험자, 예를 들면, 암 피험자 또는 세포 면역자극이 유리하거나 바람직할 수 있는 기타 피험자(즉, 박테리아 또는 바이러스 감염 등을 갖는 피험자)로부터 단리될 수 있다. 수지상 세포 전구체 및/또는 미성숙 수지상 세포는 또한 부분적인 활성화 및 면역자극을 필요로 하는 HLA-매칭된 피험자로의 투여를 위해 HLA-매칭된(matched) 건강한 개체로부터 수득될 수 있다.
수지상 세포 전구체를 단리하고 변형하는 방법은 미국 특허 공보 제20060057120호에서 발견될 수 있으며, 이는 참조로 본원에 포함되어 있다.
면역 체크포인트는 면역계에서 T 세포 기능을 조절한다. T 세포는 세포-매개된 면역에서 중추적인 역할을 한다. 체크포인트 단백질은 T 세포로 신호를 전송하는 특정 리간드와 상호작용하여 본질적으로 T 세포 기능을 스위치 오프하거나 억제한다. 암세포는 종양 미세환경으로 도입되는 T 세포의 표면상에서 체크포인트 단백질을 발현시키는 T 세포를 조절하여 이의 표면상에서 높은 수준의 체크포인트 단백질 발현을 유도함으로써 이 시스템을 활용하며, 이에 따라 항암 면역 반응을 억제한다. 이와 같이, 체크포인트 단백질의 억제는 T 세포 기능 및 암세포에 대한 면역 반응을 회복시킬 것이다. 체크포인트 단백질의 예는 CTLA-4, PDL1, PDL2, PD1, B7-H3, B7-H4, BTLA, HVEM, TIM3, GAL9, LAG3, VISTA, KIR, 2B4(분자의 CD2 패밀리에 속하고 NK, γδ 및 메모리 CD8+(αβ) T 세포 모두에서 발현됨), CD160(BY55로도 지칭됨), CGEN-15049, CHK 1 및 CHK2 키나제, A2aR 및 다양한 B-7 패밀리 리간드를 포함하지만, 이들에 제한되지 않는다.
세포 예정사 단백질 1(PD-1)은 288개의 아미노산 세포 표면 단백질 분자이며 T 세포 및 프로(pro)-B 세포에서 발현되며 이의 죽음/분화에 작용한다. PD-1은 2개의 리간드 PD-L1 및 PD-L2를 가지며, 이는 B7 패밀리의 일원이다. PD-L1 단백질은 LPS 및 GM-CSF 처리에 반응하여 대식세포 및 수지상 세포(DC) 상에서 상향조절되고 TCR 및 B 세포 수용체 신호전달시 T 세포 및 B 세포 상에서 상향조절되지만, 휴식중인 마우스에서 PD-L1 mRNA는 심장, 폐, 흉선, 비장 및 신장에서 검출될 수 있다. PD-1은 T 세포 반응을 음성적으로 조절한다.
PD-1은 T 세포 활성화 및 만성 항원(chronic antigen)에 반응하는 T 세포 내성 사이에 균형을 조절하는데 관여하는 것으로 나타났다. 예를 들면, PD-1 발현은 HIV 감염에서 광범위하게 연구되었다. HIV1 감염 동안, PD-1의 발현은 CD4+ T 세포에서 증가되는 것으로 밝혀졌다. PD-1 상향조절은, HIV 감염의 경우에서와 같이 T-세포 기능이상이 만성 항원 노출의 존재 하에 관찰될 때 T 세포 소모(주요 작동인자(effector) 기능의 점진적인 손실로서 정의됨)에 의존적인 것으로 사료된다. PD-1 상향조절은 또한 만성 바이러스 감염 동안 이들 동일한 세트의 세포에서 세포사멸(apoptosis) 증가와 관련될 수 있다(참조: Petrovas et al, (2009) J Immunol. 183 (2):1120-32).
PD-1은 또한 면역 감시로부터의 종양-특이적 도피에 작용한다. PD-1은 만성 골수성 백혈병(CML) 및 급성 골수성 백혈병(AML) 둘 모두의 종양-특이적 세포독성 T 림프구(CTL)에서 고도로 발현되는 것으로 입증되었다. PD-1은 또한 흑색종 침윤 T 림프구(TIL)에서 상향조절된다(참조: Dotti (2009) Blood 114 (8): 1457-58). 종양은 PD-1 리간드(PDL-1 및 PDL-2)를 발현시키는 것으로 밝혀졌으며, 이는 CTL에서 PD-1의 상향조절과 조합될 때, T 세포 기능을 감소시키고 CTL이 효과적인 항종양 반응을 매개하지 못하게 하는데 기여하는 인자일 수 있다. 연구자들은, 림프구성 맥락수막염 바이러스(LCMV)로 만성으로 감염된 마우스에서, 항-PD-1 항체의 투여가 PD-1-PDL 상호작용을 차단했으며 몇몇 T 세포 기능(증식 및 사이토카인 분비)을 회복시킬 수 있었으며, 바이러스 로드를 감소시켰음을 보여주었다(참조: Barber et al (2006) Nature 439 (9): 682-687).
종양 세포 자체는 PD-L1을 발현시키고 이러한 기전을 통해 T 세포 반응을 제한하는 것으로 사료된다. PD-1의 억제가 B16 흑색종 모델에서 작동인자 T 세포를 확장시키고 T 조절 세포 집단을 제한하는 것으로 추가로 나타났다. PD-1, CTLA-4 또는 IDO의 차단은 IL-2 생산을 회복시키고 종양 미세환경에 존재하는 CD8+ T 세포의 증식을 증가시킨다. 항-PDL1 처리는 종양을 거부하는 항원-특이적 백신-생성 CD8+ T 세포를 지키고 이를 확장시키는 것으로 나타났다. 이들 데이타는 PD-1/PD-L1 축이 활성화된 종양-특이적 T 세포를 조절함을 시사한다.
흑색종에서의 임상시험은 항-PD-1 차단과 함께 확고한 항종양 반응을 나타내었다. 진행된 흑색종, 비-소세포 폐암, 전립선암, 신장 세포암 및 결장직장암의 경우에 PD-1 억제에 의한 유의미한 이익이 또한 기재되었다. 뮤린 모델 연구에서는 이러한 증명을 신경아교종 요법에 응용하였다. 방사선에 대한 항-PD-1 차단 보강제는 신경아교종 종양을 갖는 마우스에서 세포독성 T 세포 집단 및 관련된 장기간 생존 이점을 증진시켰다. IDO, CTLA-4 및 PD-L1 억제제의 조합 치료가 투여될 때 종양-침윤 Treg의 감소 및 생존 증가가 기재되었다.
현재 임상시험에서 시험중인 몇몇 PD-1 억제제가 있다. CT-011은 PD-1에 대한 사람화된 IgG1 단클론 항체이다. 자가 줄기세포 이식술을 받은 미만성 거대 B-세포 림프종(DLBCL)을 갖는 피험자에서의 II상 임상시험이 최근에 완료되었다. 예비 결과는 대조 그룹에서의 47%와 비교하여 70%의 피험자가 추적조사 기간 종료시 진행이 없었으며, 대조 그룹에서의 62%와 비교하여 82%의 피험자가 생존했음을 나타냈다. 이러한 시험은 CT-011이 PD-1 기능을 차단할 뿐만 아니라 자연 살해 세포의 활성을 증대시켜 항종양 면역 반응을 증강시키는 것으로 확인되었다.
BMS 936558은 PD-1 제제를 표적화하는 전장 사람 IgG4 단클론 항체이다. I상 시험에서, 진행된, 치료-무반응성 악성종양을 갖는 피험자에게 BMS-936558의 격주 투여는 지속적인 부분적 또는 완전한 퇴행을 나타냈다. 대부분의 유의미한 반응률은 흑색종(28%) 및 신세포 암종(27%)을 갖는 피험자에서 관찰되었지만, 비-소세포 폐암(NSCLC)을 갖는 피험자에서도 실질적인 임상적 활성이 관찰되었고 일부 반응은 1년이 넘는 기간 동안 지속되었다. 이는 또한 비교적 잘 허용되었고; 14%의 피험자에서 등급 ≥3의 유해 사건이 일어났다.
BMS 936559는 PD-1 리간드 PD-L1을 표적화하는 전장 사람 IgG4 단클론 항체이다. I상 결과는 이 약물의 격주 투여가 특히 흑색종을 갖는 피험자에서 지속적인 반응을 야기했음을 보여주었다. 객관적 반응률(objective response rate)은 진행-단계 NSCLC, 흑색종, RCC 또는 난소암을 갖는 피험자에서 암 유형에 따라 6% 내지 17%의 범위였으며, 몇몇 피험자는 1년 이상 지속되는 반응을 경험했다.
MK 3475는 진행성, 국소 진행된, 또는 전이성 암종, 흑색종 또는 NSCLC를 갖는 피험자에서 약물의 투여, 안전성 및 내약성을 평가하는 5-파트 연구에서의 I상 전개시 사람화된 IgG4 항-PD-1 단클론 항체이다.
MPDL 3280A는 또한 PD-L1을 표적화하는 단클론 항체로서, BRAF V600-돌연변이 전이성 흑색종을 갖는 피험자에서 BRAF 억제제 베무라페닙과 함께 I상 시험 진행중이고 진행된 고형 종양을 갖는 피험자에서 화학요법의 존재 또는 부재 하에 혈관 내피 성장 인자 수용체(VEGFR)를 표적화하는 베바시주맙과 함께 I상 시험 진행중이다.
AMP 224는 PD-L2/PD-1 상호작용을 차단하는 잠재력을 갖는, 제2 PD-1 리간드, PD-L2 및 IgG1의 세포외 도메인의 융합 단백질이다. AMP-224는 진행암을 갖는 피험자에서 단일요법으로서 현재 I상 시험을 진행하고 있다.
Medi 4736은 진행된 악성 흑색종, 신세포 암종, NSCLC 및 결장직장암을 갖는 피험자에서 I상 임상 시험중인 항-PD-L1 항체이다.
CTLA4(세포독성 T-림프구-관련 단백질)는 면역계를 하향 조절하는 단백질 수용체이다. CTLA4는 T 세포의 표면상에서 발견되며, 항원에 대해 세포 면역 공격을 일으킨다. T 세포 공격은 T 세포 상의 CD28 수용체를 자극하여 개시될 수 있다. T 세포 공격은 CTLA4 수용체를 자극하여 정지될 수 있다. 퍼스트-인-클래스 면역요법, 이필리무맙(여보이), T 세포의 표면상의 CTLA-4를 표적화하는 단클론 항체가 흑색종의 치료를 위한 것이었다.
따라서, 한 양태에서, 본 발명은 피험자에게 치료제를 체크포인트 억제제와 함께 투여함을 포함하는, 암의 치료 또는 항종양 반응의 개시, 향상 또는 연장을 필요로 하는 피험자에서 암을 치료하거나 항종양 반응을 개시, 향상 또는 연장시키는 방법을 제공한다. 한 측면에서, 상기 체크포인트 억제제는 생물학적 치료제 또는 소분자이다. 또 다른 측면에서, 상기 체크포인트 억제제는 단클론 항체, 사람화된 항체, 전장 사람 항체, 융합 단백질 또는 이들의 조합이다. 추가의 측면에서, 상기 체크포인트 억제제는 CTLA-4, PDL1, PDL2, PD1, B7-H3, B7-H4, BTLA, HVEM, TIM3, GAL9, LAG3, VISTA, KIR, 2B4, CD160, CGEN-15049, CHK 1, CHK2, A2aR, B-7 패밀리 리간드 또는 이들의 조합일 수 있는 체크포인트 단백질을 억제한다. 추가의 측면에서, 상기 체크포인트 억제제는 CTLA-4, PDL1, PDL2, PD1, B7-H3, B7-H4, BTLA, HVEM, TIM3, GAL9, LAG3, VISTA, KIR, 2B4, CD160, CGEN-15049, CHK 1, CHK2, A2aR, B-7 패밀리 리간드 또는 이들의 조합일 수 있는 체크포인트 단백질의 리간드와 상호작용한다. 한 측면에서, 치료제는 면역자극제, T 세포 성장 인자, 인터류킨, 항체, 백신 또는 이들의 조합이다. 추가의 측면에서, 상기 인터류킨은 IL-7 또는 IL-15이다. 구체적인 측면에서, 상기 인터류킨은 글리코실화된 IL-7이다. 추가의 측면에서, 상기 백신은 수지상 세포 백신이다.
추가의 측면에서, 상기 체크포인트 억제제 및 상기 치료제는 동시에 또는 어느 순서든 순차적으로 투여된다. 추가의 측면에서, 상기 치료제는 상기 체크포인트 억제제의 투여 전에 투여된다. 구체적인 측면에서, 상기 치료제는 백신이고 상기 체크포인트 억제제는 PD-1 억제제이다. 추가의 측면에서, 상기 백신은 수지상 세포 백신이다.
한 측면에서, 치료는 임상적 결과; T 세포에 의한 항종양 활성의 증가, 향상 또는 연장; 치료 전의 수와 비교하여 항종양 T 세포 또는 활성화된 T 세포의 수의 증가 또는 이들의 조합에 의해 결정된다. 또 다른 측면에서, 임상적 결과는 종양 퇴행; 종양 수축; 종양 괴사; 면역계에 의한 항종양 반응; 종양 확장, 재발 또는 확산 또는 이들의 조합이다. 추가의 측면에서, 상기 치료 효과는 T 세포의 존재, T 세포 염증을 표시하는 유전자 서명의 존재 또는 이들의 조합에 의해 예측된다.
또 다른 측면에서, 상기 피험자는 암을 갖는다. 추가의 측면에서, 상기 암은 비뇨생식기암(예를 들면, 전립선암, 신장 세포암, 방광암), 부인과암(예를 들면, 난소암, 자궁경부암, 자궁내막암), 폐암, 위장암(예를 들면, 비-전이성 또는 전이성 결장직장암, 췌장암, 위암, 식도암, 간세포암, 담관세포암), 두경부암(예를 들면, 두경부 편평세포암), 악성 교모세포종, 악성 중피종, 비-전이성 또는 전이성 유방암(예를 들면, 호르몬 무반응성 전이성 유방암), 악성 흑색종, 메르켈 세포 암종 또는 골 및 연조직 육종 및 혈액 신생물, 예를 들면, 다발성 골수종, 급성 골수성 백혈병, 만성 골수성 백혈병, 골수이형성 증후군 및 급성 림프모구 백혈병을 포함하는, 임의의 고형 종양 또는 액상 암이다. 바람직한 양태에서, 상기 질환은 비-소세포 폐암(NSCLC), 유방암(예를 들면, 호르몬 무반응성 전이성 유방암), 두경부암(예를 들면, 두경부 편평세포암), 전이성 결장직장암, 호르몬 민감성 또는 호르몬 무반응성 전립선암, 결장직장암, 난소암, 간세포암, 신장 세포암, 연조직 육종 또는 소세포 폐암이다.
추가의 측면에서, 상기 방법은 병용 요법으로의 치료 전, 치료와 동시에 또는 치료 후 피험자에게 화학요법제, 표적화된 요법 또는 방사선을 투여함을 추가로 포함한다. 추가의 측면에서, 상기 종양은 치료제 및 체크포인트 억제제의 투여 전 절제될 수 있다.
체크포인트 억제제는 면역계의 억제 경로를 통계적으로 유의미한 방식으로 차단하거나 억제하는 임의의 제제를 포함한다. 이러한 억제제는 소분자 억제제를 포함할 수 있거나, 면역 체크포인트 수용체에 결합하여 이를 차단하거나 억제하는 항체 또는 이의 항원 결합 단편 또는 면역 체크포인트 수용체 리간드에 결합하여 이를 차단하거나 억제하는 항체를 포함할 수 있다. 차단 또는 억제를 위해 표적화될 수 있는 예시적인 체크포인트 분자는 CTLA-4, PDL1, PDL2, PD1, B7-H3, B7-H4, BTLA, HVEM, GAL9, LAG3, TIM3, VISTA, KIR, 2B4(분자의 CD2 패밀리에 속하고 NK, γδ 및 메모리 CD8+(αβ) T 세포 모두에서 발현됨), CD160(BY55로도 지칭됨), CGEN-15049, CHK 1 및 CHK2 키나제, A2aR 및 다양한 B-7 패밀리 리간드를 포함하지만, 이들에 제한되지 않는다. B7 패밀리 리간드는 B7-1, B7-2, B7-DC, B7-H1, B7-H2, B7-H3, B7-H4, B7-H5, B7-H6 및 B7-H7을 포함하지만, 이들에 제한되지 않는다. 체크포인트 억제제는 CTLA-4, PDL1, PDL2, PD1, BTLA, HVEM, TIM3, GAL9, LAG3, VISTA, KIR, 2B4, CD160 및 CGEN-15049 중 하나 이상에 결합하여 이의 활성을 차단하거나 억제하는, 항체, 또는 이의 항원 결합 단편, 다른 결합 단백질, 생물학적 치료제 또는 소분자를 포함한다. 예시적인 면역 체크포인트 억제제는 트레멜리무맙(CTLA-4 차단 항체), 항-OX40, PD-L1 단클론 항체(항-B7-H1; MEDI4736), MK-3475(PD-1 차단제), 니볼루맙(항-PD1 항체), CT-011(항-PD1 항체), BY55 단클론 항체, AMP224(항-PDL1 항체), BMS-936559(항-PDL1 항체), MPLDL3280A(항-PDL1 항체), MSB0010718C(항-PDL1 항체) 및 여보이/이필리무맙(항-CTLA-4 체크포인트 억제제)을 포함한다. 체크포인트 단백질 리간드는 PD-L1, PD-L2, B7-H3, B7-H4, CD28, CD86 및 TIM-3을 포함하지만, 이들에 제한되지 않는다.
하나의 특정 양태에서, 본 발명은 면역 체크포인트 수용체 세포 예정사 단백질 1(PD-1) 및 이의 리간드 PDL-1 사이의 상호작용을 차단하는 약물인 특정 부류의 체크포인트 억제제의 사용을 포함한다(참조: A. Mullard, "New checkpoint inhibitors ride the immunotherapy tsunami," Nature Reviews: Drug Discovery (2013), 12:489-492). PD-1은 T-세포상에서 발현되어 이의 활성을 조절한다. 구체적으로는, PD-1이 PDL-1에 결합되지 않을 때, T-세포는 표적 세포를 사로잡아 사멸시킬 수 있다. 그러나, PD-1이 PDL-1에 결합되면, 이는 T-세포가 표적 세포를 사로잡아 사멸시키는 것을 중단시킨다. 더욱이, PD-1은, 다른 체크포인트와 달리, PDL이 암세포 상에서 직접적으로 과발현되어 PD-1 발현 T-세포로의 결합을 증가시키도록 인접하여 작용한다.
본 발명의 한 측면은 PD-1의 작용제로서 작용하여 PD-1에 의해 조절된 면역 반응을 조절할 수 있는 항체인 체크포인트 억제제를 제공한다. 한 양태에서, 항-PD-1 항체는 항원-결합 단편일 수 있다. 본원에 개시된 항-PD-1 항체는 사람 PD-1에 결합하여 PD-1의 활성을 아고나이징할 수 있으며, 이에 의해 PD-1을 발현시키는 면역 세포의 기능을 억제할 수 있다.
하나의 특정 양태에서, 본 발명은 CTLA-4를 억제하는 약물인 특정 부류의 체크포인트 억제제의 사용을 포함한다. 본 발명의 방법에 사용하기에 적합한 항-CTLA4 길항제(antagonist) 제제는, 비제한적으로, 항-CTLA4 항체, 사람 항-CTLA4 항체, 마우스 항-CTLA4 항체, 포유동물 항-CTLA4 항체, 사람화된 항-CTLA4 항체, 단클론 항-CTLA4 항체, 다클론 항-CTLA4 항체, 키메라 항-CTLA4 항체, MDX-010(이필리무맙), 트레멜리무맙, 항-CD28 항체, 항-CTLA4 애드넥틴, 항-CTLA4 도메인 항체, 단일쇄 항-CTLA4 단편, 중쇄 항-CTLA4 단편, 경쇄 항-CTLA4 단편, 공동-자극(co-stimulatory) 경로를 아고나이징하는 CTLA4 억제제, PCT 공보 제WO 2001/014424호에 개시된 항체, PCT 공보 제WO 2004/035607호에 개시된 항체, 미국 공보 제2005/0201994호에 개시된 항체 및 승인된 유럽 특허 제EP 1212422 B1호에 개시된 항체를 포함한다. 추가의 CTLA-4 항체는 미국 특허 제5,811,097호, 제5,855,887호, 제6,051,227호 및 제6,984,720호; PCT 공보 제WO 01/14424호 및 제WO 00/37504호; 및 미국 공보 제2002/0039581호 및 제2002/086014호에 기재되어 있다. 본 발명의 방법에 사용될 수 있는 다른 항-CTLA-4 항체는, 예를 들면, 문헌(참조: 제WO 98/42752호; 미국 특허 제6,682,736호 및 제6,207,156호; Hurwitz et al., Proc. Natl. Acad. Sci. USA, 95(17):10067-10071 (1998); Camacho et al., J. Clin. Oncology, 22(145):Abstract No. 2505 (2004) (antibody CP-675206); Mokyr et al., Cancer Res., 58:5301-5304 (1998), 및 미국 특허 제5,977,318호, 제6,682,736호, 제7,109,003호 및 제7,132,281호)에 개시된 것들을 포함한다.
추가의 항-CTLA4 길항제는 하기를 포함하지만, 이들에 제한되지 않는다: CD28 항원의 이의 동족(cognate) 리간드로의 결합 능력을 파괴하고, CTLA4의 이의 동족 리간드로의 결합 능력을 억제하고, 공동-자극 경로를 통해 T 세포 반응을 증강시키고, B7의 CD28 및/또는 CTLA4로의 결합 능력을 파괴하고, 공동-자극 경로를 활성화시키는 B7의 능력을 파괴하고, CD80의 CD28 및/또는 CTLA4로의 결합 능력을 파괴하고, 공동-자극 경로를 활성화시키는 CD80의 능력을 파괴하고, CD86의 D28 및/또는 CTLA4로의 결합 능력을 파괴하고, 공동-자극 경로를 활성화시키는 CD86의 능력을 파괴하고, 일반적으로 활성화된 것으로부터 공동-자극 경로를 파괴할 수 있는 임의의 억제제. 이것은 필연적으로 다른 항-CTLA4 길항제 중에서도, 공동-자극 경로의 다른 일원들 중에서 CD28, CD80, CD86, CTLA4의 소분자 억제제; 공동-자극 경로의 다른 일원들 중에서 CD28, CD80, CD86, CTLA4로 유도되는 항체; 공동-자극 경로의 다른 일원들 중에서 CD28, CD80, CD86, CTLA4에 대해 유도된 안티센스 분자; 공동-자극 경로의 다른 일원들 중에서 CD28, CD80, CD86, CTLA4에 대해 유도된 애드넥틴, 공동-자극 경로의 다른 일원들 중에서 CD28, CD80, CD86, CTLA4의 RNAi 억제제(단일 가닥 및 이중 가닥 둘 모두)를 포함한다.
하나의 특정 양태에서, 본 발명은 TIM-3을 억제하는 약물인 특정 부류의 체크포인트 억제제의 사용을 포함한다. 리간드에 의한 TIM-3 활성화의 차단은 Th1 세포 활성화를 증가시킨다. 더욱이, TIM-3은 소모성 CD8+ T 세포에 의해 발현되는 중요한 억제 수용체로 확인되었다. TIM-3은 또한 핵산 매개된 항종양 면역의 주요 조절인자인 것으로 보고되었다. 일 예로, TIM-3은 종양-관련 수지상 세포(TADC) 상에서 상향조절되는 것으로 나타났다.
하나의 특정 양태에서, 본 발명은 면역자극제, T 세포 성장 인자 및 인터류킨의 사용에 관한 것이다. 면역자극제는 면역계 성분 중 어느 것의 활성화를 유도하거나 면역계 성분 중 어느 것의 활성을 증가시켜 면역계를 자극하는 물질(약물 및 영양소)이다. 면역자극제는 박테리아 백신, 집락 자극 인자, 인터페론, 인터류킨, 기타 면역자극제, 치료 백신, 백신 배합물 및 바이러스 백신을 포함한다.
T 세포 성장 인자는 T 세포의 증식을 자극하는 단백질이다. T 세포 성장 인자의 예는 Il-2, IL-7, IL-15, IL-17, IL21 및 IL-33을 포함한다.
인터류킨은 처음에 백혈구에 의해 발현되는 것으로 나타난 사이토카인 그룹이다. 면역계의 기능은 대부분 인터류킨에 의존적이며, 이들 중 다수의 드문 결핍이 기재되었으며, 모두 자가면역 질환 또는 면역 결핍을 특징으로 한다. 대다수의 인터류킨은 헬퍼(helper) CD4 T 림프구에 의해서 뿐만 아니라 단핵구, 대식세포 및 내피 세포를 통해 합성된다. 이것은 T 및 B 림프구 및 조혈 세포의 발달 및 분화를 촉진시킨다. 인터류킨의 예는 IL-1, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-10, IL-11, IL-12, IL-13, IL-14, IL-15 및 IL-17을 포함한다.
IL-15는 IL-2/IL-15 수용체 베타 사슬(CD122) 및 통상의 감마 사슬(감마-C, CD132)로 구성된 복합체에 결합하여 이를 통해 신호를 전달하는 사이토카인이다. IL-15는 바이러스에 의한 감염 후 단핵성 포식세포에 의해 분비된다. 이 사이토카인은 자연 살해 세포; 주요 역할이 바이러스 감염된 세포를 사멸시키는 것인 선천적 면역계의 세포의 세포 증식을 유도한다.
IL-7은 골수 및 흉선의 간질 세포에 의해 분비된 조혈 성장 인자이다. IL-7은 (IL-3에 의해 분화가 자극되는 골수성 전구 세포와 달리) 다분화능(multipotent) 및 전분화능(pluripotent) 조혈 줄기세포의 림프구 전구 세포로의 분화를 자극한다. 이는 또한 림프구 계통(B 세포, T 세포 및 NK 세포)에서 모든 세포의 증식을 자극한다. B-세포 성숙, T 및 NK 세포 생존, 발달 및 항상성의 특정 단계 동안의 증식이 중요하다. IL-7은 글리코실화될 수 있다.
본원에 기재된 특정 방법 또는 조성물에서, 추가의 제3, 제4, 제5, 제6, 제7, 제8, 제9 또는 제10 제제. 특정 양태에서, 상기 추가의 제3, 제4, 제5, 제6, 제7, 제8, 제9 또는 제10 제제는 화학요법제, 사이토카인 요법, 인터페론 요법(예를 들면, INF-α), 인터류킨 요법(예를 들면, IL-2, IL-7 또는 IL-11), 집락-자극 인자 요법(예를 들면, G-CSF), 항체 요법, 바이러스 요법, 유전자 요법 또는 이들의 조합이다. 특정 양태에서, 상기 추가의 제3, 제4, 제5, 제6, 제7, 제8, 제9 또는 제10 제제는 본원에 기재된 방법 또는 조성물 중 어느 것으로의 치료 전, 치료와 동시에 또는 치료 후 사용될 수 있다.
암 치료제 또는 화학요법제의 예는 알킬화제, 예를 들면, 티오테파 및 사이클로포스파미드(CYTOXAN); 알킬 설포네이트, 예를 들면, 부설판, 임프로설판 및 피포설판; 아지리딘, 예를 들면, 벤조도파, 카보쿠온, 메투레도파 및 우레도파; 알트레타민, 트리에틸렌멜라민, 트리에틸렌포스포르아미드, 트리에틸렌티오포스파오르아미드 및 트리메틸올로멜라민을 포함하는 에틸렌이민 및 메틸아멜라민; 질소 머스타드, 예를 들면, 클로람부실, 클로르나파진, 콜로포스파미드, 에스트라무스틴, 이포스파미드, 메클로레타민, 메클로레타민 옥사이드 하이드로클로라이드, 멜팔란, 노벰비킨, 페네스테린, 프레드니무스틴, 트로포스파미드, 우라실 머스타드; 니트로스우레아, 예를 들면, 카르무스틴, 클로로조토신, 포테무스틴, 로무스틴, 니무스틴, 라니무스틴; 항생제, 예를 들면, 아클라시노마이신, 악티노마이신, 오트라마이신, 아자세린, 블레오마이신, 칵티노마이신, 칼리키아미신, 카라비신, 카미노마이신, 카르지노필린, 크로모마이신, 닥티노마이신, 다우노루비신, 데토루비신, 6-디아조-5-옥소-L-노르류신, 독소루비신, 에피루비신, 에소루비신, 이다루비신, 마르셀로마이신, 미토마이신, 마이코페놀산, 노갈라마이신, 올리보마이신, 페플로마이신, 포트피로마이신, 푸로마이신, ?라마이신, 로도루비신, 스트렙토니그린, 스트렙토조신, 투베르시딘, 우베니멕스, 지노스타틴, 조루비신; 항-대사물질, 예를 들면, 메토트렉세이트 및 5-플루오로우라실(5-FU); 엽산 유사체, 예를 들면, 데놉테린, 메토트렉세이트, 프테롭테린, 트리메트렉세이트; 퓨린 유사체, 예를 들면, 플루다라빈, 6-머캅토퓨린, 티아미프린, 티오구아닌; 피리미딘 유사체, 예를 들면, 안시타빈, 아자시티딘, 6-아자우리딘, 카르모푸르, 시타라빈, 디데옥시우리딘, 독시플루리딘, 에노시타빈, 플록수리딘, 5-FU; 안드로겐, 예를 들면, 칼루스테론, 드로모스타놀론 프로피오네이트, 에피티오스타놀, 메피티오스탄, 테스토락톤; 항부신제(anti-adrenal), 예를 들면, 아미노글루테티미드, 미토탄, 트릴로스탄; 엽산 보충물, 예를 들면, 프롤린산; 아세글라톤; 알도포스파미드 글리코시드; 아미노레불린산; 암사크린; 베스트라부실; 비스안트렌; 에다트락세이트; 데포파민; 데메콜신; 디아지쿠온; 엘포르미틴; 엘립티늄 아세테이트; 에토글루시드; 갈륨 니트레이트; 하이드록시우레아; 렌티난; 로니다민; 미토구아존; 미톡산트론; 모피다몰; 니트라크린; 펜토스타틴; 페나메트; 피라루비신; 포도필린산; 2-에틸하이드라지드; 프로카바진; PSK.RTM.; 라족산; 시조피란; 스피로게르마늄; 테누아존산; 트리아지쿠온; 2,2',2"-트리클로로트리에틸아민; 우레탄; 빈데신; 다카르바진; 만노무스틴; 미토브로니톨; 미토락톨; 피포브로만; 가사이토신; 아라비노사이드("Ara-C"); 사이클로포스파미드; 티오테파; 탁소이드, 예를 들면, 파클리탁셀(탁솔(TAXOL™), Bristol-Myers Squibb Oncology, Princeton, N.J.) 및 도세탁셀(탁소테레(TAXOTERE™), Rhne-Poulenc Rorer, Antony, France); 클로람부실; 겜시타빈; 6-티오구아닌; 머캅토퓨린; 메토트렉세이트; 백금 유사체, 예를 들면, 시스플라틴 및 카보플라틴; 빈블라스틴; 트라스투주맙, 도세탁셀, 백금; 에토포사이드(VP-16); 이포스파미드; 미토마이신 C; 미톡산트론; 빈크리스틴; 비노렐빈; 나벨빈; 노반트론; 테니포사이드; 다우노마이신; 아미놉테린; 젤로다; 이반드로네이트; CPT-11; 토포이소머라제 억제제 RFS 2000; 디플루오로메틸로미틴(DMFO); 레티노산 유도체, 예를 들면, 타르그레틴™(벡사로텐), 판레틴™(알리트레티노인); ONTAKT™(데니류킨 디프티톡스); 에스페라마이신; 카페시타빈; 및 상기 중 어느 것의 약제학적으로 허용되는 염, 산 또는 유도체를 포함한다. 예를 들면, 타목시펜, 랄록시펜, 아로마타제 억제 4(5)-이미다졸, 4-하이드록시타목시펜, 트리옥시펜, 케옥시펜, LY117018, 오나프리스톤 및 토레미펜(파레스톤)을 포함하는 항-에스트로겐; 및 항-안드로겐, 예를 들면, 플루타미드, 닐루타미드, 비칼루타미드, 류프롤리드 및 고세렐린; 및 상기 중 어느 것의 약제학적으로 허용되는 염, 산 또는 유도체와 같이, 종양에 대한 호르몬 작용을 조절하거나 억제하는데 작용하는 항-호르몬제도 이러한 정의 내에 포함된다. 추가의 암 치료제는 소라페닙 및 기타 단백질 키나제 억제제, 예를 들면, 아파티닙, 악시티닙, 베바시주맙, 세툭시맙, 크리조티닙, 다사티닙, 에를로티닙, 포스타마티닙, 게피티닙, 이마티닙, 라파티닙, 렌바티닙, 무브리티닙, 닐로티닙, 파니투무맙, 파조파닙, 페갑타닙, 라니비주맙, 룩솔리티닙, 트라스투주맙, 반데타닙, 베무라페닙 및 수니티닙; 시롤리무스(라파마이신), 에베롤리무스 및 기타 mTOR 억제제를 포함한다.
추가 화학요법제의 예는 토포이소머라제 I 억제제(예를 들면, 이리노테칸, 토포테칸, 캄프토테신 및 이들의 유사체 및 대사물질, 및 독소루비신); 토포이소머라제 II 억제제(예를 들면, 에토포사이드, 테니포사이드 및 다우노루비신); 알킬화제(예를 들면, 멜팔란, 클로람부실, 부설판, 티오테파, 이포스파미드, 카르무스틴, 로무스틴, 세무스틴, 스트렙토조신, 데카르바진, 메토트렉세이트, 미토마이신 C 및 사이클로포스파미드); DNA 삽입제(intercalator)(예를 들면, 시스플라틴, 옥살리플라틴 및 카보플라틴); DNA 삽입제 및 자유 라디칼 발생제, 예를 들면, 블레오마이신; 및 뉴클레오사이드 미메틱(mimetic)(예를 들면, 5-플루오로우라실, 카페시티빈, 겜시타빈, 플루다라빈, 시타라빈, 머캅토퓨린, 티오구아닌, 펜토스타틴 및 하이드록시우레아)을 포함한다. 게다가, 세포 복제를 파괴하는 예시적인 화학요법제는 파클리탁셀, 도세탁셀 및 관련 유사체; 빈크리스틴, 빈블라스틴 및 관련 유사체; 탈미도마이드, 레날리도마이드 및 관련 유사체(예를 들면, CC-5013 및 CC-4047); 단백질 티로신 키나제 억제제(예를 들면, 이마티닙 메실레이트 및 게피티닙); 프로테아솜 억제제(예를 들면, 보르테조밉); IκB 키나제의 억제제를 포함하는 NF-κB 억제제; 암에서 과발현된 단백질에 결합하는 항체, 및 암에서 상향조절되거나, 과발현된거나 활성화되는 것으로 알려진 단백질 또는 효소의 다른 억제제(이의 억제는 세포 복제를 하향조절한다)를 포함한다.
하나의 특정 양태에서, 본 발명은 암 백신 및 수지상 세포 백신을 포함하는 치료 백신의 용도에 관한 것이다. 암 백신의 목표는 체내 암세포에 대한 공격을 면역계에 탑재시키는 것이다. 다시 말해, 암 백신은 체내에서 암세포를 공격하도록 면역계를 프라이밍(priming)함으로써 작동한다. 따라서, 암 백신은, 질환을 예방하는 대신에, 이미 존재하는 질환을 면역계가 공격하게 함을 의미한다. 암 백신은 체내에 이미 존재하는 암세포에 대한 면역 반응을 증가시키도록 암세포, 세포의 일부 또는 순수한 항원을 사용한다.
암 백신은, 전통적인 면역 상승 요법과 달리, 단지 일반적으로 면역계를 향상시키지 않으며, 이는 면역계가 하나 이상의 특이적 항원을 갖는 세포를 공격하게 하고 면역계에서 "공격 메모리"를 생성한다. 이러한 "공격 메모리"는 암이 진행되는 것을 방지하고/하거나 회복될 때 암이 복귀되는 것을 방지하도록 면역계가 암세포를 계속 공격하게 한다.
암 백신은 피험자로부터 제거되었던 실제 암세포로부터 제조될 수 있다. 암세포는, 일단 제거되면, 실험실에서, 통상적으로 방사선으로 변형되어 암세포가 더 많은 종양을 형성할 수 없게 된다. 실험실에서, 암세포를 추가로 변형시키는 것은 과학자에게 또한 통상적이다. 예를 들면, 암세포는 종종, 상기 세포가 면역계에 의해 이물질로 관찰될 가능성을 더 높이기 위해, 화학물질 또는 신규 유전자를 부가하여 변형된다. 이어서 변형된 세포는 피험자에게 다시 주입된다. 면역계는 이들 세포 상의 항원을 인식할 수 있으며 자연스런 생리적 과정을 통해 의도된 항원을 발현시키는 세포를 찾아내고 이를 공격/사멸시킨다.
대부분의 백신은 자가 백신이다. 자가 백신은 이것이 이후에 사용될 사람과 동일한 사람으로부터 채취된 사멸된 세포로부터 제조된다(예를 들면, 방사선 또는 화합물질로 처리하여 복제할 수 없는 암세포가 되게 함). 다시 말해, 피험자로부터 세포를 채취하고, 변형시킨 후 다시 동일한 피험자에게 주사된다.
다른 백신은 동종이형 백신이다. 동종이형 백신은 한 피험자로부터 채취된 세포로부터 제조된 후 제2의 상이한 피험자에게 주사된다. 동종이형 백신이 자가 백신보다 더 용이하게 제조되지만, 피험자에게 외래 세포의 도입을 피하는 자가 백신을 사용하는 것이 이로울 수 있다.
다양한 유형의 암 백신이 있다. 암 백신의 비제한적인 예는 종양 세포 백신, 항원 백신, 수지상 세포 백신, DNA 백신 및 벡터 기반 백신을 포함한다.
항원 백신은 수천 개의 항원을 함유하는 전체 종양 세포와 달리, 하나 이상의 항원을 사용하여 면역계를 상승시킨다. 이들 항원은 일반적으로 펩타이드이다. 항원 백신은 각각의 종양 유형이 특이적 항원 프로파일에 의해 식별될 수 있기 때문에 특정 유형의 암에 특이적일 수 있다. 이들 백신의 효능을 최대화하기 위해, 특정 암의 항원 프로파일에 따라 백신에서 다수의 항원들을 조합하는 것이 유리할 수 있다.
수지상 세포 백신은 종종 자가 백신이며 종종 각각의 피험자에 대해 개별적으로 제조되어야 한다. 상기 백신을 제조하는데 사용된 방법은 복잡하며 고가이다. 의사들은 혈액으로부터 몇몇 면역 세포를 제거하고 실험실에서 이들을 암세포 또는 암 항원, 뿐만 아니라 이들을 수지상 세포로 전환시키고 이들이 성장하는 것을 돕는 다른 화학물질에 노출시킨다. 이어서 수지상 세포를 피험자에게 다시 주사하며, 여기서 상기 세포는 체내에서 암세포에 대해 면역 반응을 유발하여야 한다. 수지상 백신의 비제한적인 예는 시푸류셀(Sipuleucel)-T(하기 기재됨)이다.
DNA 백신은 세 번째 비제한적인 암세포 백신이다. 전통적인 암세포 백신의 한 가지 한계는 종양 세포 또는 항원이 백신으로서 체내에 주사될 때, 이들은 처음에는 목적하는 면역 반응을 유발할 수 있지만 시간이 경과하면서 덜 효과적이 된다는 점이다. 이는 면역계가 이들을 이물질로서 인식하고 재빨리 이들을 파괴하기 때문이다. 임의의 추가 자극이 없으면, 면역계는 종종 이의 정상(전-백신(pre-vaccine)) 상태의 활성으로 복귀한다. 계속적인 면역 반응을 촉진시키는 하나의 방법은 DNA 백신을 사용하는 것이다.
DNA는 세포가 만드는 단백질에 대한 유전 부호를 함유하는 세포 내의 물질이다. 벡터는 피험자에게 주사될 수 있는 특정 DNA를 함유하도록 엔지니어링되어 세포에 의해 받아들여지는 DNA를 초래할 수 있다. 세포가 DNA를 받아들이면, DNA는 세포가 특이적 항원을 만들도록 프로그래밍할 것이고, 이는 이후 목적하는 면역 반응을 유발할 수 있다.
네 번째 비제한적인 암 백신은 벡터 조성물이다. 벡터 백신은 DNA 백신의 DNA를 투여하는데 사용될 수 있다. 벡터는 특정 바이러스, 박테리아, 효모 세포, 또는 피험자의 세포에서 항원 또는 DNA를 얻는데 사용될 수 있는 기타 구조물이다. 벡터는 하나 이상의 암 항원을 한번에 전달하는데 사용될 수 있기 때문에 특히 유용하며, 이는 피험자의 면역계에서 반응을 더욱 증가시킬 수 있게 할 수 있다. 벡터는 또한 (임의의 추가의 DNA 또는 항원의 부재 하에) 스스로 면역 반응을 일으킬 수 있기 때문에 특히 유용하며, 이는 DNA 및/또는 항원과 조합될 때 더 강력한 면역 반응을 가져올 것이다.
수지상 세포는 종양의 수술적 제거 또는 절제 후 종양, 종양 층(tumor bed)에 직접적으로, 종양주위로, 종양과 직접적으로 접촉하고 있는 배출 림프절(draining lymph node)에, 종양 또는 종양이 이환된 장기에 연결되거나 공급되는 혈관 또는 림프관, 예를 들면, 문맥 또는 폐정맥 또는 동맥 등에 투여될 수 있다. 부분적으로 성숙한 수지상 세포의 투여는 종양을 위한 다른 치료, 예를 들면, 화학요법 또는 방사선 요법과 동시에 또는 이후일 수 있다. 추가로, 부분적으로 성숙한 수지상 세포는 수지상 세포의 성숙 및/또는 종양 또는 종양 근처 또는 인접 부위 내에서 항원의 프로세싱에 대한 보강제로서 작용하는 또 다른 제제와 공동-투여될 수 있다. 또한, 상기 수지상 세포는 또한 종양 또는 종양 층 내 또는 주변 영역으로 이식하기 위한 서방형(slow release) 매트릭스에 제형화되거나 화합되어 세포가 종양 항원과 접촉되도록 종양 또는 종양 층으로 서서히 방출될 수 있다.
부분적으로 성숙한 수지상 세포는 또한 제형화 및 투여 방식에 적절한 임의의 수단에 의해 투여될 수 있다. 예를 들면, 상기 세포는 약제학적으로 허용되는 담체와 배합될 수 있고 시린지, 카테터, 캐뉼라 등으로 투여될 수 있다. 상기와 같이, 상기 세포는 서방형 매트릭스 내에 제형화될 수 있다. 상기 제형은 이러한 방식으로 투여될 때 사용된 매트릭스에 적절한 수단에 의해 투여될 수 있다. 본 발명에 적용될 수 있는 기타 투여 방법 및 투여 방식은 숙련가에게 익히 알려져 있다.
수지상 세포 조성물은 그 자체로 개체의 치료에 사용될 수 있다. 또한, 상기 조성물은 종양을 치료하는 임의의 다른 방법과 함께 사용될 수 있다. 예를 들면, 본 발명의 방법은 종양의 수술적 절제, 화학요법(세포독성 약물, 세포사멸제, 항체 등), 방사선 요법, 냉동요법, 근접치료, 면역 요법(항원 특이적 성숙한 활성화된 수지상 세포, NK 세포, 종양 항원에 특이적인 항체 등의 투여) 등과 함께 사용될 수 있다. 이들 방법들 중 어느 것 및 모두는 또한 임의의 조합으로 사용될 수 있다. 병용 치료는 동시 또는 순차적일 수 있으며 치료 의사에 의해 결정된 바와 같이 임의의 순서로 투여될 수 있다.
상업적으로 이용가능한 암 백신의 일 예는 시푸류셀-T 또는 프로벤지(Provenge®)이다. 이는 전통적인 화학요법제 또는 호르몬 요법에 의해 치료되지 않는 진행된 전립선암을 치료하는데 사용되는 암세포 백신이다. 이러한 백신을 위해, 피험자 자신의 면역 세포를 피험자로부터 단리한 후 면역 세포를 화학물질에 노출시켜 이들을 수지상 세포로 전환시킨다. 수지상 세포를, 피험자에게 재도입될 때 전립선암에 대한 면역 반응을 생성하는 전립선 산 포스파타제(PAP)에 노출시킨다. 특히 중요한 것은, 변형된 세포가 피험자에게 재도입되면, 피험자의 면역계는 "공격 메모리"를 생성하고 피험자 내의 다른 면역 세포를 암 공격 세포로 전환시킨다.
수지상 세포 백신의 일 예는 DCVax이다. DCVax는 암을 공격하는 면역계를 소생시키고 훈련시키도록 디자인된, 활성화된 수지상 세포(면역계의 모세포(master cell))를 이용하하는 플랫폼 기술이다. DCVax는 암에 대한 다수의 표적을 타격하는 다수의 활성 제제를 사용한다(참조: Liau, LM et al. Journal of Neurosurgery 90: 1115-1124, 1999; Prins RM et al. J Immunother. 2013 Feb; 36(2):152-7).
암을 치료하는데 효과적인 백신을 만드는, DCVax를 포함하는 수지상 세포 백신의 3가지 주요 측면이 있다: (1) 수지상 세포 백신은 전체 면역계에서 다수의 상이한 카테고리의 면역 제제들 중의 단지 하나가 아닌, 전체 면역계를 동원하도록 디자인된다. 상기 기재된 바와 같이, DCVax는 활성화된, 훈련된 수지상 세포로 구성되며 수지상 세포는 면역계의 모세포이며, 이는 전체 면역계를 동원하거나 이를 돕는다. 완전한 면역계는 다수 유형의 항체 및 또한 항체 이외에 많은 다른 종류의 물질을 수반한다. 수지상 세포는 전체 면역계 "아미(army)"를 포함하는 이들 상이한 카테고리의 물질 모두를 서로 조합하여 그리고 서로 이들의 자연적인 관계로 동원한다. (2) 수지상 세포 백신은 피험자의 종양에서 단지 하나가 아닌 완전한 세트의 바이오마커를 표적화하도록 디자인되며, 이는 종양이 돌연변이되거나 전이되기 더욱 어렵게 할 수 있다. (3) 수지상 세포 백신은 개개인에게 맞춰지고 피험자의 종양에서 발현되는 특정 바이오마커를 표적화한다.
피험자를 위한 수지상 세포 백신을 제조하기 위해, 피험자의 면역 세포는 채혈을 통해 수득된다. 전신 투여를 위해, 단핵구는 수지상 세포로 분화되고, 성숙되고, 활성화되고 피험자 자신의 종양 조직으로부터의 바이오마커에 결합된다. 수지상 세포로의 바이오마커에의 결합은 면역계가 공격을 필요로 하는 것에 대해 세포를 "훈련한다". 이어서 활성화된, 훈련된 수지상 세포는 매우 고순도로 단리되고 상완에 단순한 피내 주사를 통해 피험자에게 투여된다. 이어서 수지상 세포는 종양 바이오마커 정보를 남은 면역계 물질(T 세포, B 세포 등)에 전달한 후 이들 바이오마커를 갖는 세포를 표적화한다.
종양내 투여의 경우, 단핵구는 수지상 세포로 분화되고 부분적으로 성숙된다. 이어서 상기 세포를 종양으로 직접 주사하여 투여된다. 종양으로의 주사 후, 수지상 세포는 제자리에서 종양 바이오마커를 수집하고 종양 바이오마커 정보를 남은 면역계 물질(T 세포, B 세포 등)에게 전달한 후 이들 바이오마커를 갖는 세포를 표적화한다.
중요하게는, 각각 백신에서 활성화되고, 훈련된 수지상 세포는 수백의 T 세포 및 기타 면역 세포를 동원하는 큰 승수 효과(multiplier effect)를 갖는다. 그 결과, 소 용량의 이러한 수지상 세포는 크고 지속된 면역 반응을 동원할 수 있다.
한 양태에서, 수지상 세포 조성물은 제1 치료로서 또는 제2 체크포인트 억제제 치료를 위한 프라이머(primer)로서 사용될 수 있다. 상기 체크포인트 억제제(들)의 투여 전 수지상 세포 조성물을 투여함으로써, 면역계(구체적으로는 T-세포)를 활성화시키고 이는 체크포인트 억제제에 대한 반응을 향상시킨다.
한 양태에서, 상기 체크포인트 억제제를 우선 투여하여 면역 반응의 개시를 '차단해제(unblock)'하고 나서 암 백신 요법으로 이어진다. 예를 들면, 체크포인트 억제제가 피험자에게 투여된 후 수지상 세포 조성물이 투여된다.
특정 양태에서, 수지상 세포 및 수용 피험자는 동일한 MHC(HLA) 하플로타입(haplotype)을 갖는다. 피험자의 HLA 하플로타입을 결정하는 방법은 당해 분야에 공지되어 있다. 관련 양태에서, 부분적으로 성숙한 수지상 세포는 수용 피험자에 대해 동종이형이다. 동종이형 세포는 통상적으로 적어도 하나의 MHC 대립유전자에 대해 매칭된다(예를 들면, 적어도 하나이지만 모든 MHC 대립유전자가 아닌 MHC 대립유전자를 공유함). 덜 통상적인 양태에서, 수지상 세포 및 수용 피험자는 서로에 대해 모두 동종이형이지만, 모두는 공통적으로 적어도 하나의 MHC 대립유전자를 갖는다.
투여는 치료제, 예를 들면, IL-7 또는 IL-15와 같은 인터류킨 또는 수지상 백신과 같은 백신의 투여 전, 투여와 동시에 또는 투여 후 하나 이상의 사이클 또는 용량의 체크포인트 억제제의 투여를 포함하거나 이와 반대의 투여를 포함한다. 당업자는 피험자의 암 및 이들의 면역 상태(예를 들면, T-세포, B 세포 또는 NK 세포 활성 및/또는 수)에 따라 피험자별로 치료 요법이 피험자에게 적절한지를 결정할 수 있다.
체크 포인트 억제제 및 치료제의 배합물은 몇몇 피험자에서 암을 치료하는데 더욱 효과적일 수 있고/있으며 면역 세포(T-세포, B 세포, NK 세포 및/또는 기타 세포)의 활성 및/또는 수를 개시하거나 가능하게 하거나 증가시키거나 향상시키거나 연장시킬 수 있거나 종양에 의한 의학적으로 유리한 반응(이의 퇴행, 괴사 또는 제거 포함)을 전달할 수 있다.
특정 측면에서, 면역 반응은 체크포인트 억제제의 투여 전에 자가 또는 동종이형(예를 들면, 세포주 유래) 종양 항원이 결합된 자가 또는 동종이형 수지상 세포를 사용하여 항종양 면역 반응을 개시하거나 가능하게 하도록 유도한 후 체크포인트 억제제(들)를 투여한다.
특정 측면에서, 면역 반응은 체크포인트 억제제의 투여 전에 자가 또는 동종이형(예를 들면, 세포주 유래) 종양 항원이 결합된 자가 또는 동종이형 수지상 세포를 사용하여 기존의 항종양 면역 반응을 향상시키도록 유도한 후 체크포인트 억제제(들)를 투여한다.
특정 측면에서, 면역 반응은 체크포인트 억제제의 투여 전에 자가 종양 항원에 특이적인 자가 또는 동종이형 T 세포를 사용하여 기존의 항종양 면역 반응을 향상시키도록 유도하거나 향상시킨 후 체크포인트 억제제(들)를 투여한다.
특정 측면에서, 면역 반응은 체크포인트 억제제의 투여 전에 생체내 항원 결합을 위한 종양으로 직접적으로 또는 종양 주위에 투여되는 자가 또는 동종이형 수지상 세포를 사용하여 항종양 면역 반응을 개시하거나 가능하게 하도록 유도한 후 체크포인트 억제제(들)를 투여한다.
특정 측면에서, 면역 반응은 체크포인트 억제제의 투여 전에 생체내 항원 결합을 위한 종양으로 직접적으로 또는 종양 주위에 투여되는 자가 또는 동종이형 수지상 세포를 사용하여 기존의 항종양 면역 반응을 향상시키도록 유도한 후 체크포인트 억제제(들)를 투여한다.
특정 측면에서, 면역 반응은 체크포인트 억제제의 투여 전에 자가 종양 항원이 결합된 동종이형 수지상 세포를 사용하여 항종양 면역 반응을 개시하도록 유도한 후 체크포인트 억제제(들)를 투여한다.
특정 측면에서, 면역 반응은 체크포인트 억제제의 투여 전에 자가 종양 항원이 결합된 동종이형 수지상 세포를 사용하여 기존의 항종양 면역 반응을 향상시키도록 유도한 후 체크포인트 억제제(들)를 투여한다.
특정 측면에서, 면역 반응은 체크포인트 억제제의 투여 전에 생체내 항원 결합을 위한 종양으로 직접적으로 또는 종양 주위에 투여되는 동종이형 수지상 세포를 사용하여 항종양 면역 반응을 개시하도록 유도한 후 체크포인트 억제제(들)를 투여한다.
특정 측면에서, 면역 반응은 체크포인트 억제제의 투여 전에 생체내 항원 결합을 위한 종양으로 직접적으로 또는 종양 주위에 투여되는 동종이형 수지상 세포를 사용하여 기존의 항종양 면역 반응을 향상시키도록 유도한 후 체크포인트 억제제(들)를 투여한다.
특정 측면에서, 면역 반응은 체크포인트 억제제의 투여 전에 생체 외에서 확장되고/되거나 활성화된 자가 항종양 T 세포를 사용하여 항종양 면역 반응을 개시시키도록 유도한 후 체크포인트 억제제(들)를 투여한다.
특정 측면에서, 면역 반응은 체크포인트 억제제의 투여 전에 생체 외에서 확장되고/되거나 활성화된 항종양 T-세포를 사용하여 기존의 항종양 면역 반응을 향상시키도록 유도한 후 체크포인트 억제제(들)를 투여한다.
본 발명의 특정 양태에서, 치료적 암 백신 또는 입양 T 세포 요법은 체크포인트 억제제의 투여 전에 연대순으로 투여된다. 특정 양태에서, 치료적 암 백신 또는 입양 T 세포 요법은 체크포인트 억제제가 투여되기 1시간, 2시간, 3시간, 4시간, 5시간, 6시간, 7시간, 8시간, 9시간, 10시간, 11시간, 12시간, 1일, 2일, 3일, 4일, 5일, 6일, 7일, 8일, 9일, 10일, 11일, 12일, 13일, 14일, 15일, 16일, 17일, 18일, 19일, 20일, 21일, 22일, 23일, 24일, 25일, 26일, 27일, 28일, 29일, 1개월 또는 이들의 임의의 조합 전에 투여된다.
본 발명의 특정 양태에서, 치료적 암 백신 또는 입양 T 세포 요법은 체크포인트 억제제와 동시에 연대순으로 투여된다.
본 발명의 특정 양태에서, 치료적 암 백신 또는 입양 T 세포 요법은 체크포인트 억제제의 투여 후 연대순으로 투여된다. 특정 양태에서, 체크포인트 억제제는 치료적 암 백신 또는 입양 T 세포 요법이 투여되기 1시간, 2시간, 3시간, 4시간, 5시간, 6시간, 7시간, 8시간, 9시간, 10시간, 11시간, 12시간, 1일, 2일, 3일, 4일, 5일, 6일, 7일, 8일, 9일, 10일, 11일, 12일, 13일, 14일, 15일, 16일, 17일, 18일, 19일, 20일, 21일, 22일, 23일, 24일, 25일, 26일, 27일, 28일, 29일, 1개월 또는 이들의 임의의 조합 전에 투여된다.
상기 기재된 측면들 모두에서, 항종양 반응 또는 면역 반응을 유도하거나 개시하거나 향상시키는 방법은 우선 체크포인트 억제제를 투여한 후 항종양 반응 또는 면역 반응을 유도하거나 개시하거나 향상시키는 제2 제제를 이후 시점에 투여하여 달성될 수 있다.
또 다른 양태에서, 본 발명은 체크포인트 억제제의 효과를 향상시키거나 연장하거나, 피험자가 체크포인트 억제제에 반응하게 하거나, 체크포인트 억제제의 독성 또는 용량을 감소시키는 것을 필요로 하는 피험자에게 치료제를 체크포인트 억제제와 함께 투여함을 포함하는, 체크포인트 억제제의 효과를 향상시키거나 연장하거나, 피험자가 체크포인트 억제제에 반응하게 하거나, 체크포인트 억제제의 독성 또는 용량을 감소시키는 방법을 제공하며, 여기서 상기 피험자는 암을 갖는다. 한 측면에서, 상기 체크포인트 억제제는 생물학적 치료제 또는 소분자이다. 또 다른 측면에서, 상기 체크포인트 억제제는 단클론 항체, 사람화된 항체, 전장 사람 항체, 융합 단백질 또는 이들의 조합이다. 추가의 측면에서, 상기 체크포인트 억제제는 CTLA-4, PDL1, PDL2, PD1, B7-H3, B7-H4, BTLA, HVEM, TIM3, GAL9, LAG3, VISTA, KIR, 2B4, CD160, CGEN-15049, CHK 1, CHK2, A2aR, B-7 패밀리 리간드 또는 이들의 조합일 수 있는 체크포인트 단백질을 억제한다. 일 측면에서, 체크포인트 억제제는 CTLA-4, PDL1, PDL2, PD1, B7-H3, B7-H4, BTLA, HVEM, TIM3, GAL9, LAG3, VISTA, KIR, 2B4, CD160, CGEN-15049, CHK 1, CHK2, A2aR, B-7 패밀리 리간드 또는 이들의 조합일 수 있는 체크포인트 단백질의 리간드와 상호작용한다. 추가의 측면에서, 상기 치료제는 면역자극제, T 세포 성장 인자, 인터류킨, 항체 및 백신 또는 이들의 조합으로 이루어진 그룹으로부터 선택된다. 추가의 측면에서, 상기 인터류킨은 IL-7 또는 IL-15이다. 구체적인 측면에서, 상기 인터류킨은 글리코실화된 IL-7이다. 한 측면에서, 상기 백신은 수지상 세포 백신이다.
추가의 측면에서, 상기 체크포인트 억제제 및 상기 치료제는 동시에 또는 어느 순서든 순차적으로 투여된다. 추가의 측면에서, 상기 치료제는 상기 체크포인트 억제제의 투여 전에 투여된다. 구체적인 측면에서, 상기 치료제는 백신이고 상기 체크포인트 억제제는 PD-1 억제제이다. 추가의 측면에서, 상기 백신은 수지상 세포 백신이다.
또 다른 측면에서, 상기 암은 비뇨생식기암(예를 들면, 전립선암, 신장 세포암, 방광암), 부인과암(예를 들면, 난소암, 자궁경부암, 자궁내막암), 폐암, 위장암(예를 들면, 비-전이성 또는 전이성 결장직장암, 췌장암, 위암, 식도암, 간세포암, 담관세포암), 두경부암(예를 들면, 두경부 편평세포암), 악성 교모세포종, 악성 중피종, 비-전이성 또는 전이성 유방암(예를 들면, 호르몬 무반응성 전이성 유방암), 악성 흑색종, 메르켈 세포 암종 또는 골 및 연조직 육종 및 혈액 신생물, 예를 들면, 다발성 골수종, 급성 골수성 백혈병, 만성 골수성 백혈병, 골수이형성 증후군 및 급성 림프모구 백혈병을 포함하는, 임의의 고형 종양 또는 액상 암이다. 바람직한 양태에서, 상기 질환은 비-소세포 폐암(NSCLC), 유방암(예를 들면, 호르몬 무반응성 전이성 유방암), 두경부암(예를 들면, 두경부 편평세포암), 전이성 결장직장암, 호르몬 민감성 또는 호르몬 무반응성 전립선암, 결장직장암, 난소암, 간세포암, 신장 세포암, 연조직 육종 또는 소세포 폐암이다.
추가의 측면에서, 상기 방법은 추가로 병용 요법으로의 치료 전, 치료와 동시에 또는 치료 후 피험자에게 화학요법제, 표적화된 요법 또는 방사선을 투여함을 포함한다. 추가의 측면에서, 상기 종양은 치료제 및 체크포인트 억제제의 투여 전 절제될 수 있다. 추가의 양태에서, 본 발명은 체크포인트 억제제를 생물학적 치료제와 함께 포함하는 약제학적 조성물을 제공한다. 한 측면에서, 상기 생물학적 치료제는 백신이다.
구체적인 양태에서, 면역 반응은 암세포 백신을 사용하여 유도되거나 개시되거나 향상된다. 구체적으로, 상기 암 백신은 수지상 세포 백신일 수 있다. 구체적인 양태에서, 면역 반응은 항종양 T-세포를 사용하여 유도되거나 개시되거나 향상될 수 있다. 구체적인 양태에서, 면역 반응은 세포독성 T-세포의 유도를 통해 유도되거나 개시되거나 향상될 수 있다.
구체적인 양태에서, 본원에 기재된 방법 및 조성물은 암을 치료하는데 사용될 수 있다. 구체적으로, 본원에 기재된 방법 및 조성물은 고형 종양의 크기를 감소시키거나 암의 암세포 수를 감소시키는데 사용될 수 있다. 본원에 기재된 방법 및 조성물은 암세포 성장률을 늦추는데 사용될 수 있다. 본원에 기재된 방법 및 조성물은 암세포 성장률을 중지시키는데 사용될 수 있다.
본원에 개시된 치료제, 체크포인트 억제제, 생물학적 치료제 또는 약제학적 조성물은, 예를 들면, 경구로 또는 비경구로, 예를 들면, 정맥내로, 근육내로, 피하로, 안와내로, 관절낭내로, 복강내로, 직장내로, 수조내로, 종양내로, 혈관내로, 피내로 또는 예를 들면, 각각 피부 패치 또는 경피 이온이동법을 사용한 피부를 통한 수동 또는 촉진된 흡수에 의한 것을 포함하는 다양한 경로에 의해 개체에게 투여될 수 있다. 치료제, 체크포인트 억제제, 생물학적 치료제 또는 약제학적 조성물은 또한 병적 상태의 부위, 예를 들면, 종양에 공급되는 혈관에 정맥내로 또는 동맥내로 투여될 수 있다.
본 발명의 방법을 실시하는데 투여되는 제제의 총량은 비교적 짧은 기간에 걸쳐 볼루스로서 또는 주입에 의해 단일 용량으로 피험자에게 투여될 수 있거나 다수의 용량이 장기간에 걸쳐 투여되는 분할된 치료 프로토콜을 사용하여 투여될 수 있다. 당업자는 피험자에서 병적 상태를 치료하는 조성물의 양이 피험자의 연령 및 일반적인 건강 뿐만 아니라 투여 경로 및 투여되는 치료의 수를 포함하는 다수의 인자에 의존적이라는 것을 알 것이다. 이러한 인자들을 고려하여, 숙련가는 필요한 경우 특정 용량으로 조정할 것이다. 일반적으로, 조성물의 제형 및 투여 경로 및 빈도는 I상 및 II상 임상시험을 사용하여 초기에 결정된다.
특정 양태에서, 체크포인트 억제제는 0.01mg/kg, 0.05mg/kg, 0.1mg/kg, 0.2mg/kg, 0.3mg/kg, 0.5mg/kg, 0.7mg/kg, 1mg/kg, 2mg/kg, 3mg/kg, 4mg/kg, 5mg/kg, 6mg/kg, 7mg/kg, 8mg/kg, 9mg/kg, 10mg/kg 또는 이들의 임의의 조합 용량으로 투여된다. 특정 양태에서 상기 체크포인트 억제제는 주당 1회, 주당 2회, 주당 3회, 2주당 1회 또는 매달 1회 투여된다. 특정 양태에서, 상기 체크포인트 억제제는 단일 용량으로, 2회 용량으로, 3회 용량으로, 4회 용량으로, 5회 용량으로 또는 6회 이상 용량으로 투여된다.
특정 양태에서, 본원에 기재된 방법 및 조성물은 키트의 형태로 패키징된다. 특정 양태에서, 방법을 수행하고 조성물을 사용하는 지침서가 키트에 포함된다.
다른 양태에서, 상기 기재된 장애의 치료에 유용한 물질을 함유하는 제조 물품이 제공된다. 제조 물품은 용기 및 라벨을 포함한다. 적합한 용기는, 예를 들면, 병, 바이알, 시린지 및 시험관을 포함한다. 용기는 다양한 재료, 예를 들면, 유리 또는 플라스틱으로부터 형성될 수 있다. 용기는 병태를 치료하는데 효과적인 조성물을 보유하고 멸균한 접근 포트를 가질 수 있다(예를 들면, 상기 용기는 피하 주사 바늘에 의해 관통되는 스토퍼(stopper)를 갖는 정맥내 용액 백 또는 바이알일 수 있다). 조성물 중 활성제는 항체이다. 용기 상의 또는 용기와 결합된 라벨은 상기 조성물이 선택된 병태를 치료하는데 사용된다는 것을 지시한다. 제조 물품은 추가로 약제학적으로-허용되는 완충제, 예를 들면, 포스페이트-완충된 염수, 링거액 및 덱스트로스 용액을 포함하는 제2 용기를 포함할 수 있다. 제조 물품은 추가로 다른 완충제, 희석제, 충전제, 바늘, 시린지 및 사용 지침을 갖는 패키지 삽입물을 포함하는, 상업적 및 사용자 관점에서 바람직한 기타 재료를 포함할 수 있다.
도면 및 실시예에 나타난 바와 같이, 신경아교종 미세환경에서 PD-1/PD-L1 음성 공동-자극 축이 특성화되고, 증가된 종양-침윤 조절 세포 집단(Tregs, iAPCs)은 용해물-펄싱된 수지상 세포 백신화와 관련된다는 것을 알게 되었다. 보강제 항-PD-1 Ab에 의한 이러한 기전의 차단은 세포독성 T 세포 활성화 및 종양으로의 트래피킹(trafficking)을 초래하고 비-억제성 종양 환경을 촉진한다. 조합적 DC 백신화 및 항-PD-1 Ab 요법은 뮤린 신경아교종 모델에서 유의미한 장기간 생존을 촉진시킨다. 이들 기전은 도표로 표시되었고 생체내의 면역 기능을 비-침입적으로 특성화하는 MR 및 신규 PET 이미지화 프로브를 사용하여 관련된 실제적인 임상 이미지화를 제공한다.
구체적으로, 도면은, 확립된 두개내 신경아교종을 지닌 마우스에서, 종양 용해물-펄싱된 DC 백신화가 임의의 임상적 이점은 없지만 여전히 활성화된 T 림프구의 유의미한 침윤을 초래함을 보여준다. 추가로, 억제성 골수 세포 집단은 두개내 GL261 신경아교종 내에 축적되고 이 집단은 DC 백신화 후 유의미하게 증가한다. 종양 용해물-펄싱된 DC 백신화와 함께 PD-1 차단 항체의 보조적 치료는 두개내 GL261 신경아교종 내의 억제성 골수 세포의 향상된 축적을 방지한다. 이것은 활성화된 T 림프구의 종양내 축적의 유의미한 증가, 급격한 생존 연장 및 종양에 대한 면역 메모리의 생성을 초래한다. 추가로, DC에 종양 용매물의 밤새 펄싱은 이들 세포를 활성화시키고 PD-L1의 발현을 감소시키며, 이는 억제성 골수 세포가 DC 및 대식세포의 골수-유도된 전구체 집단이기 때문에 활성화 및/또는 성숙이 억제성 면역 기능을 감소시킬 것임을 시사한다.
당업자는, 본 개시내용을 고려하여, 다수의 변화 또는 변경이 개시된 구체적인 양태들에서 이루어질 수 있으며 본 발명의 진의 및 범위를 벗어나지 않으면서 동일하거나 유사한 결과를 여전히 얻을 수 있음을 이해해야 한다. 본 발명은 본원에 기재된 구체적인 양태들에 의한 범위로 제한되지 않아야 하며(이는 본 발명의 측면의 예시로서만 의도됨) 기능적으로 동등한 방법 및 성분도 본 발명의 범위 내에 있다. 실제로, 본원에 나타나고 기재된 것들 이외에, 본 발명의 다양한 변형이 앞선 기재내용으로부터 당업자에게 분명할 것이다.
하기 실시예는 본 발명의 양태를 추가로 예시하도록 제공되지만, 본 발명의 범위를 제한하는 것으로 의도되지 않는다. 이것이 전형적으로 사용될 수 있는 것들일지라도, 당업자에게 공지된 다른 절차, 방법 또는 기술이 대안적으로 사용될 수 있다.
실시예
1
신경아교종
미세환경은 DC
백신화에
의해 촉진된 항종양 면역 반응을 무효화한다.
GL261 뮤린 신경아교종으로 두개내로 이식된 C57BL/6 마우스에서 종양에 대한 내인성 면역 반응이 제한될 수 있다(도 1a). 마우스에 GL261 뮤린 신경아교종을 두개내로 이식한 후 종양 이식후 3일 및 13일째에 PBS(1x) 또는 용해물-펄싱된 DC 백신을 피하로 투여했다. 16일째에, 제2 처리 72시간 후, 마우스를 안락사시키고 비장, 림프 및 뇌 반구를 프로세싱을 위해 수거했다. 용해물-펄싱된 수지상 세포로의 백신화는 CD3+ 림프구의 유의미한 종양 침윤을 촉진시키고, 이의 대다수는 활성화된 CD8+ CD25+ 림프구이다. 이들 세포 집단의 전체적인 생리적 효과를 결정하기 위해, 2 그룹의 GL261 신경아교종-보유 마우스(대조군 및 DC 백신-처리됨)를 유지시키고 생존을 모니터링했다. DC 백신화가 거대 두개내 종양에 주어질 때 2 그룹 사이의 생존 이익은 나타나지 않았다(도 1c).
실시예
2
PD-1/PD-
L1
T 세포-
신경아교종
상호작용은 항-염증성 종양 미세환경을
촉진시킨다
.
PD-1/PD-L1 종양-T 세포 상호작용의 효과를 평가하기 위해, Pmel-1 TCR 유전자 이식 마우스로부터 gp-100-특이적 T 세포를 항-PD-1 mAb의 존재 하에 GL261-gp100 뮤린 신경아교종 세포와 공동-배양했다. 24시간 후 수집된 상청액을 프로세싱하고 마우스 32-plex 사이토카인/케모카인 루미넥스(cytokine/chemokine Luminex) 검정으로 분석했다. 전염증성 사이토카인 IFNγ 및 TNFα는 유의미한 증가를 나타냈지만, 항-염증성 신호전달(IL-10 및 IL-4)은 PD-1 억제에 의해 감소했다. 세포독성은 T 세포에 의한 종양 사멸의 실시간, 임피던스-기반 판독을 제공하는 xCELLigence 시스템을 사용하여 평가했다. PD-1의 억제는 사실상 10시간 시점에서 더 큰 퍼센트의 종양 세포 사멸을 지지했다.
실시예
3
신경아교종
-보유 마우스에서 PD-1/PD-
L1
음성 공동-자극 축의 억제는 항종양 반응을 촉진시킨다.
백신화 처리에 의해 촉진된 항종양 반응은 종양 미세환경에서 PD-1/PD-L1 신호전달에 의해 완화된다는 것이 가정되었다. DC 백신-처리된 마우스로부터 수거된 종양에 존재하는 PD-L1을 발현시키는 유의미한 억제성 골수 집단(Ly6C+)이 존재했으며, 이는 대조군 마우스에서는 존재하지 않았다. 이 집단을 평가하기 위해, 대조군 및 DC-백신 처리에 대해 2개의 추가 요법들을 시험했다: 항-PD-1 mAb-처리 및 항-PD-1 mAb-처리된 그룹을 사용한 병용 DC 백신. 이식후 16일째(제2 처리 후 72시간)에 프로세싱을 위해 비장, 림프 및 뇌 반구를 수거했다. DC 백신/항-PD-1 처리된 마우스에서 유의미하게 활성화된 세포독성 TIL 및 림프절이 관찰되었다. 억제성 골수 집단이 DC 백신/항-PD-1 처리된 마우스에서 지속되더라도, DC 백신 처리 단독과 비교하여 유의미하게 감소되었다. 항-PD-1 마우스에서, 억제성 골수 집단은 유의미하게 검출되지 않았다. 치료 이익을 평가하기 위해, 마우스는 이식되고, 처리되고 생존에 대해 모니터링되었다. 병용 DC 백신/항-PD-1 처리는 다른 그룹에 비해 유의미한 생존 이익을 나타냈다.
억제성 골수 집단은 Ly6C 소모 Ab 또는 임상적으로-관련된 CSF1r 억제 약물 PLX3397을 사용하여 소모되었다. GL261-보유 마우스에서 이들 세포의 소모는 DC 백신/항-PD-1로 처리된 마우스에서 관찰된 생존 이익을 완전히 회복시켰다. 이식후 16일째(제2 처리 후 72시간)에 프로세싱을 위해 비장, 림프 및 뇌 반구를 수거했다. 종양 미세환경에서 이들 Ly6C+ PD-L1+ 세포의 부재가 확인되었고 CD3+ CD8+ CD25+ 활성화된 림프구의 유의미한 종양-침윤 집단이 관찰되었다. DC 백신/항-PD-1로 처리된 마우스에서 CD8+ 세포의 소모는 상기 처리와 관련된 모든 치료 이익을 없애버렸다(도 4c). 조직 수거에 의해 전신적으로 그리고 종양 부위에서 모두 활성화된 림프구의 부재를 확인했다.
실시예
4
PET 및 MR 이미지화 기법의 신규 사용은 DC 백신/항-PD-1 요법의 비-
침습성
평가를 가능하게 한다
DC 백신/항-PD-1 요법의 치료 진행은 MRI(자기 공명 영상) 및 PET(양전자 방출 단층촬영) 이미지화 기술을 사용하여 모니터링될 수 있음이 가정되었다. GL261로 두개내로 이식된 마우스를 4개의 처리 그룹(비처리, DC 백신, 항-PD-1 mAb 및 DC 백신/항-PD-1)으로 분리하고 종양에 트래피킹된 활성화된 림프구를 이미지화하도록 [18F]-L-FAC 또는 [18F]-D-FAC PET 프로브로 이미지화했다. 이식 후 21일째에, 마우스를 브루커 7T MR 스캐너(UCLA)를 사용하여 이미지화하여 대비전 및 대비후 T1-가중된 이미지, T2 맵 및 역동 대비-증강(dynamic contrast-enhancing: DCE) 및 역동 자화율 대조(dynamic susceptibility contrast: DSC) 관류 데이타를 얻었다. 이미지화 후, 마우스를 안락사시키고 절편법 및 IHC를 위해 뇌 조직을 수거했다. PET 및 대비후 T1-가중된 MR 데이타를 공동-기록(co-resister)하여 양성 PET 프로브 신호에 대한 양성 MR 종양 대비를 도표로 나타냈다. DC 백신-처리된 그룹 및 DC 백신/항-PD-1 처리된 그룹은 다른 처리 그룹과 비교하여 감소된 종양 부담(tumor burden) 및 증가된 면역 침윤을 나타냈다. 양성 PET 및 MR 신호는 각각 상응하는 해부 뇌 조직 단면에 대한 CD3+ 및 Ki-67+ IHC 염색과 관련되었다.
실시예
5
재료 및 방법
세포주. 뮤린 신경아교종 세포주, GL261 및 GL261-gp100을 완전 DMEM(Mediatech, Inc. Herndon, VA)(10% FBS(Gemini Bio-Products, West Sacramento, CA), 1%(v/v) 페니실린 및 스트렙토마이신(Mediatech Cellgro, Manassas, VA)으로 보충됨)에 유지시키고 37℃에서 5% CO2의 가습 대기에서 배양했다.
Pmel -1 T 세포의 시험관내 활성화. 비장 및 림프절을 Pmel-1 TCR 유전자 이식 마우스(n=2)로부터 수거하고, 2% FBS로 보충된 XVIVO-15(Lonza, Walkersville, MD) 중에서 사람 IL-2(100IU/mL, NCI 전임상 리포지토리, 개발 치료제 프로그램(Preclinical Repository, Developmental Therapeutics Program)) 및 hgp10025-33 펩타이드(1ug/mL, NH2-KVPRNQDWL-OH, Biosynthesis, Inc., Lewisville, TX)와 함께 배양했다. 72시간 후, 세포를 PBS 1x로 세척하고 1 x 106세포/mL의 농도로 IL-2 및 hgp10025-33 펩타이드에서 배양했다.
PD-1의 시험관내 억제. 세포를 1uM 항-PD-1 Ab(BioXCell, West Lebanon, NH)로 보충된 상기 기재된 적절한 배지에서 배양했다. 배양 동안, 배지를 24시간 마다 새롭게 제조된 항-PD-1 Ab를 갖는 배지로 대체했다.
사이토카인/ 케모카인 루미넥스 검정. Pmel T 세포 및 GL261-gp100 세포를 1uM 항-PD-1 Ab로 보충된 완전 DMEM 배지에서 10:1의 작동인자:표적(E:T) 비율로 공동배양했다. 24시간 후 상청액을 수집하고 액체 질소에서 급속 냉동시켰다. 마우스 32-plex 사이토카인/케모카인 루미넥스 검정에 의한 분석을 리드 일레인 박사(Dr. Elain Reed, UCLA)와 공동작업으로 수행했다.
xCELLigence 실시간 세포독성 검정. 종양 세포의 세포독성 사멸을 xCELLigence 실시간 세포 분석기 시스템(Acea Biotechnology, San Diego, CA)으로 평가했다. 표적 GL261-gp100 세포를 배지 150μL에서 플레이팅했다(105 세포/웰). 웰 바닥으로 종양 세포를 밤새 부착한 후, 작동인자 세포(Pmel T 세포)를 10:1의 E:T 비율로 첨가했다. 대조군의 경우, 최대 세포 방출은 종양만을 함유하는 추가의 웰에 1% 트리톤 X-100의 첨가에 의해 수득되었다. 세포 지수(cell index: CI) 값(상대적인 세포 임피던스)을 24시간에 걸쳐 수집했다. 작동인자 세포 플레이팅 직전 값들을 최대 CI 값으로 정규화했다. 임의의 시점에서의 정규화된 CI(nCI) 대 초기 작동인자 세포 플레이팅의 nCI의 비율을 계산하여 퍼센트 종양 용해를 도표로 나타냈다(23).
GL261 용해물 제조. GL261 신경아교종 세포를 완전 DMEM 배지에서 배양하고 확장시켰다. 이어서 세포를 수거하고 몇몇 동결-용융 사이클을 통과시킨 후 현탁액을 여과했다. 용해물 농도를 브래드포드 단백질 검정을 사용하여 정량했다.
골수-유래 DC 및 백신화 . 뮤린 골수 전구 세포로부터의 DC의 제조는 이전에 공개된 대로 제조되었다(참조: Prins et al., Cancer Research 63:8487 (2003)). 간략하게, 골수 세포를 완전 RPMI(Mediatech, Inc. Herndon, VA)(10% FBS, 1%(v/v) 페니실린 및 스트렙토마이신으로 보충됨) 중에서 37℃에서 5% CO2의 가습 대기에서 밤새 배양했다. 다음날, 비부착 세포를 수집하고 뮤린 인터류킨-4(IL-4, 400IU/mL, R&D Systems, Minneapolis, MN) 및 뮤린 과립구-대식세포 집락 자극 인자(GM-CSF, 100ng/ml, R&D Systems, Minneapolis, MN)와 함께 플레이팅했다. 4일째에, 부착 세포에 동일한 사이토카인을 갖는 신선한 배지를 재공급했다. 7일째에, DC를 수거하고 완전 RPMI 중에서 1 x 106 세포/ml로 재현탁시키고 GL261 용해물(250μg/mL)로 펄싱했다. 8일째에, DC를 수집하고 PBS 1x 중에서 2 x 106 세포/mL로 재현탁시키고 마우스당 세포 현탁액 0.2ml로 주사용으로 바로 제조했다. 주사는 등쪽 4 부위에서 피하로(s.c.) 주어졌다.
두개내 신경아교종 이식물 . 6 내지 10주령의 암컷 C57BL/6 마우스를 기관 사육 콜로니(institutional breeding colonies)로부터 입수했다. 모든 마우스를 UCLA의 실험 방사선 종양학 학부의 AALAC-승인된 동물 수용시설에서 한정된-플로라(defined-flora) 병원체가 없는 조건 하에 사육하고 유지시켰다. 마우스를 UCLA 동물 관리 방침 및 승인된 동물 프로토콜에 따라서 다루었다. 마우스를 케타민/자일라진의 복강내(i.p.) 주사로 마취시켰다. 제모하고 포비돈-도말된 두피를 절개한 후, 정위 장치(stereotactic apparatus)에 고정된 마우스의 머리를 치과 드릴을 사용하여 브레그마에서 2.5mm 측면 두개골에 천두공을 만들었다. GL261 신경아교종 세포(2μl PBS 중 2 x 104)를 26-게이지 바늘이 장착된 멸균 해밀턴 시린지로 정위적으로 주사했다. 두개내 주사는 경질막 아래 3.5mm의 깊이에 2분에 걸쳐 계속되었다. 세포의 완전한 주입 후에 시린지를 추가 몇 분 동안 뇌에서 유지시킨 후 서서히 빼내 연수막 공간 내로의 세포의 누출을 방지했다. 두개내 종양 이식 후, NSG 마우스를 치료 그룹(n은 6 내지 16임)으로 무작위로 배정했다.
생체내 항-PD-1 mAb 처리. 적절한 처리일에 항-PD-1 mAb를 250mg/kg(대략 250μg/마우스)로 i.p. 투여했다.
조직 수거, 면역조직화학 및 유세포측정 . 21일째에 마우스로부터 비장, 림프절 및 종양을 수거했다. 절편법 및 면역조직화학을 필요로 하는 경우에, 조직을 아연 고정액(1x, BD Biosciences, San Jose, CA)에 24시간 동안 두고 이후 파라핀 왁스에 포매되기 전에 70% 에탄올로 옮겼다. 비장 및 림프절을 70um 세포 스트레이너(strainer)를 통과시켜 단일-세포 현탁액을 생성했다. 저장성 용해(hypotonic lysis) 후 림프구를 수득하고 트리판 블루 배제(trypan blue exclusion)를 사용하여 계수했다. 종양 침윤 림프구(TIL)의 수를 측정하기 위해, 종양-보유 반구를 조심스럽게 칭량하고 이후 외과용 메스로 잘게 썰었다. 이어서 조직을 로테이터 상에서 DNase와 함께 콜라게나제에 24시간 동안 두고, 이후 30%:70% 퍼콜(Percoll) 구배를 사용하여 림프구를 단리했다. 종양 내의 작은 단핵 세포를 트리판 블루 배제를 사용하여 계수했다. 대략 1x106 림프구가 염색에 사용되었다. 종양-보유 반구당 CD8+ 세포의 총수를 측정함으로써 TIL을 계산했다. CD3, CD4, CD8, CD25, FoxP3, Ly6C, PD-1 및 PD-L1에 대한 형광색소 접합된 항체를 바이오레전드(Biolegend)로부터 입수했다. 모든 FACS 분석은 LSRII(BD Biosciences)를 사용하여 수행되었다. 동형 특이적 대조 항체를 토대로 관문을 설정했다(데이타는 도시되지 않음). FlowJo 소프트웨어를 사용하여 데이타를 분석했다.
생체내 PET 및 MR 이미지화. 마우스를 O2/N2 유동 하에 1 내지 3% 이소플루란으로 진정시키고 호흡을 모니터링했다. 마우스를 TP500 워터 펌프(Gaymar Solid State)를 사용하여 순환되는 37℃로 가열된 물로 따뜻하게 했다. PET 프로브의 꼬리-정맥 투어를 스캔 1시간 전 수행했다. PET 스캐닝. 스캔 동안 적절한 시점에 조영제(contrast agent)를 투여하도록 꼬리-정맥 카테터삽입을 수행했다. 모든 이미지는 주문 제작된 2.2-cm RF 버드케이지 코일(birdcage coil)을 갖춘 7T 부르커 바이오스펙 시스템(Bruker Biospec system)에서 입수되었다. 본 발명자들은 고속 저각 영상 획득(fast low-angle shot: FLASH)을 사용한 2차원 대비전 T1-가중된 이미지; 정량적 T2 맵(10ms의 간격으로 10 내지 160ms 범위의 TE로 16 에코), 78um2 평면내 해상도 및 1mm 절편 두께의 계산을 위한 다중절편 다중-에코(multislice multi-echo: MSME) 스핀-에코 T2-가중된 스캔; 2 내지 20°의 플립각(flip angle)을 사용하여 대비전 T1 맵의 계산을 위한 다중 플립각 3D FLASH T1-가중된 이미지; 및 고해상도 3D 대비후 T1-가중된 이미지를 수집했다.
본 발명이 상기 실시예를 참조하여 기재되더라도, 변형 및 변화가 본 발명의 진의 및 범위 내에 포함됨이 이해될 것이다. 따라서, 본 발명은 하기 청구범위로만 한정된다.
Claims (47)
- 암의 치료 또는 항종양 반응의 개시, 향상 또는 연장을 필요로 하는 피험자에게 치료제를 체크포인트 억제제와 함께 투여함을 포함하는, 상기 피험자에서 암을 치료하거나 항종양 반응을 개시, 향상 또는 연장하는 방법.
- 제1항에 있어서, 상기 체크포인트 억제제가 생물학적 치료제 또는 소분자인, 방법.
- 제1항에 있어서, 상기 체크포인트 억제제가 단클론 항체, 사람화된 항체, 전장 사람 항체 및 융합 단백질 또는 이들의 조합으로 이루어진 그룹으로부터 선택되는, 방법.
- 제1항에 있어서, 상기 체크포인트 억제제가 CTLA-4, PDL1, PDL2, PD1, B7-H3, B7-H4, BTLA, HVEM, TIM3, GAL9, LAG3, VISTA, KIR, 2B4, CD160, CGEN-15049, CHK 1, CHK2, A2aR 및 B-7 패밀리 리간드 또는 이들의 조합으로 이루어진 그룹으로부터 선택된 체크포인트 단백질을 억제하는, 방법.
- 제1항에 있어서, 상기 체크포인트 억제제가 CTLA-4, PDL1, PDL2, PD1, B7-H3, B7-H4, BTLA, HVEM, TIM3, GAL9, LAG3, VISTA, KIR, 2B4, CD160, CGEN-15049, CHK 1, CHK2, A2aR 및 B-7 패밀리 리간드 또는 이들의 조합으로 이루어진 그룹으로부터 선택된 체크포인트 단백질의 리간드와 상호작용하는, 방법.
- 제1항에 있어서, 상기 치료제가 면역자극제, T 세포 성장 인자, 인터류킨, 항체 및 백신 또는 이들의 조합으로 이루어진 그룹으로부터 선택되는, 방법.
- 제6항에 있어서, 상기 인터류킨이 IL-7 또는 IL-15인, 방법.
- 제7항에 있어서, 상기 인터류킨이 글리코실화된 IL-7인, 방법.
- 제6항에 있어서, 상기 백신이 수지상 세포 백신인, 방법.
- 제1항에 있어서, 상기 체크포인트 억제제 및 상기 치료제가 동시에 또는 어느 순서든 순차적으로 투여되는, 방법.
- 제10항에 있어서, 상기 치료제가 체크포인트 억제제의 투여 전에 투여되는, 방법.
- 제11항에 있어서, 상기 치료제가 백신이고 상기 체크포인트 억제제가 PD-1 억제제인, 방법.
- 제12항에 있어서, 상기 백신이 수지상 세포 백신인, 방법.
- 제1항에 있어서, 처리가 임상적 결과; T 세포에 의한 항종양 활성의 증가, 향상 또는 연장; 치료 전의 수와 비교하여 항종양 T 세포 또는 활성화된 T 세포의 수의 증가 또는 이들의 조합에 의해 결정되는, 방법.
- 제14항에 있어서, 임상적 결과가 종양 퇴행; 종양 수축; 종양 괴사; 면역계에 의한 항종양 반응; 종양 확대, 재발 또는 확산 또는 이들의 조합으로 이루어진 그룹으로부터 선택되는, 방법.
- 제1항에 있어서, 상기 처리 효과가 T 세포의 존재, 또는 T 세포 염증을 표시하는 유전자 서명(gene signature)의 존재, 또는 이들의 조합에 의해 예측되는, 방법.
- 제1항에 있어서, 상기 피험자가 암을 갖는, 방법.
- 제17항에 있어서, 상기 암이 비뇨생식기암, 부인과암, 폐암, 위장암, 두경부암, 악성 교모세포종, 악성 중피종, 비-전이성 또는 전이성 유방암, 악성 흑색종, 메르켈 세포 암종 또는 골 및 연조직 육종, 혈액 신생물, 다발성 골수종, 급성 골수성 백혈병, 만성 골수성 백혈병, 골수이형성 증후군 및 급성 림프모구 백혈병, 비-소(小)세포 폐암(NSCLC), 유방암, 전이성 결장직장암, 호르몬 민감성 또는 호르몬 무반응성 전립선암, 결장직장암, 난소암, 간세포암, 신장 세포암, 췌장암, 위암, 식도암, 간세포암, 담관세포암, 두경부 편평세포암 연조직 육종 및 소(小)세포 폐암으로 이루어진 그룹으로부터 선택되는, 방법.
- 제1항에 있어서, 병용 요법으로의 처리 전, 처리와 동시에 또는 처리 후 피험자에게 화학요법제, 표적화된 요법 또는 방사선을 투여함을 추가로 포함하는, 방법.
- 체크포인트 억제제의 효과를 향상시키거나 연장하거나, 피험자가 체크포인트 억제제에 반응하게 하거나, 체크포인트 억제제의 독성 또는 용량을 감소시키는 방법으로서, 치료제를 체크포인트 억제제와 함께 이를 필요로 하는 피험자에게 투여함을 포함하고, 상기 피험자는 암을 갖는, 방법.
- 제20항에 있어서, 상기 체크포인트 억제제가 생물학적 치료제 또는 소분자인, 방법.
- 제20항에 있어서, 상기 체크포인트 억제제가 단클론 항체, 사람화된 항체, 전장 사람 항체 및 융합 단백질 또는 이들의 조합으로 이루어진 그룹으로부터 선택되는, 방법.
- 제20항에 있어서, 상기 체크포인트 억제제가 CTLA-4, PDL1, PDL2, PD1, B7-H3, B7-H4, BTLA, HVEM, TIM3, GAL9, LAG3, VISTA, KIR, 2B4, CD160, CGEN-15049, CHK 1, CHK2, A2aR 및 B-7 패밀리 리간드 또는 이들의 조합으로 이루어진 그룹으로부터 선택된 체크포인트 단백질을 억제하는, 방법.
- 제20항에 있어서, 상기 체크포인트 억제제가 CTLA-4, PDL1, PDL2, PD1, B7-H3, B7-H4, BTLA, HVEM, TIM3, GAL9, LAG3, VISTA, KIR, 2B4, CD160, CGEN-15049, CHK 1, CHK2, A2aR 및 B-7 패밀리 리간드 또는 이들의 조합으로 이루어진 그룹으로부터 선택된 체크포인트 단백질의 리간드와 상호작용하는, 방법.
- 제20항에 있어서, 상기 치료제가 면역자극제, T 세포 성장 인자, 인터류킨, 항체 및 백신 또는 이들의 조합으로 이루어진 그룹으로부터 선택되는, 방법.
- 제25항에 있어서, 상기 인터류킨이 IL-7 또는 IL-15인, 방법.
- 제26항에 있어서, 상기 인터류킨이 글리코실화된 IL-7인, 방법.
- 제25항에 있어서, 상기 백신이 수지상 세포 백신인, 방법.
- 제20항에 있어서, 상기 체크포인트 억제제 및 상기 생물학적 치료제가 동시에 또는 어느 순서든 순차적으로 투여되는, 방법.
- 제29항에 있어서, 상기 치료제가 상기 체크포인트 억제제의 투여 전에 투여되는, 방법.
- 제30항에 있어서, 상기 치료제가 백신이고 상기 체크포인트 억제제가 PD-1 억제제인, 방법.
- 제29항에 있어서, 상기 백신이 수지상 세포 백신인, 방법.
- 제20항에 있어서, 상기 암이 비뇨생식기암, 부인과암, 폐암, 위장암 , 두경부암, 악성 교모세포종, 악성 중피종, 비-전이성 또는 전이성 유방암, 악성 흑색종, 메르켈 세포 암종 또는 골 및 연조직 육종, 혈액 신생물, 다발성 골수종, 급성 골수성 백혈병, 만성 골수성 백혈병, 골수이형성 증후군 및 급성 림프모구 백혈병, 비-소세포 폐암(NSCLC), 유방암, 전이성 결장직장암, 호르몬 민감성 또는 호르몬 무반응성 전립선암, 결장직장암, 난소암, 간세포암, 신장 세포암, 췌장암, 위암, 식도암, 간세포암, 담관세포암, 두경부 편평세포암 연조직 육종 및 소세포 폐암으로 이루어진 그룹으로부터 선택되는, 방법.
- 제20항에 있어서, 병용 요법으로의 처리 전, 처리와 동시에 또는 처리 후 피험자에게 화학요법제, 표적화된 요법 또는 방사선을 투여함을 추가로 포함하는, 방법.
- 체크포인트 억제제를 생물학적 치료제와 함께 포함하는 약제학적 조성물.
- 제35항에 있어서, 상기 생물학적 치료제가 백신인, 조성물.
- 수지상 세포 백신 및 PD-1 억제제를 포함하는 약제학적 조성물.
- 입양(adoptive) T 세포 요법 및 체크포인트 억제제를 포함하는, 암 치료용 병용 요법.
- 제38항에 있어서, 상기 입양 T 세포 요법이 자가 T-세포를 포함하는, 병용 요법.
- 제39항에 있어서, 상기 자가 T-세포가 종양 항원에 대해 표적화된, 병용 요법.
- 제38항에 있어서, 상기 입양 T 세포 요법이 동종이형 T-세포를 포함하는, 병용 요법.
- 제41항에 있어서, 상기 자가 T-세포가 종양 항원에 대해 표적화된, 병용 요법.
- 제38항에 있어서, 상기 체크포인트 억제제가 PD-1 또는 PDL-1 체크포인트 억제제인, 병용 요법.
- 입양 T 세포 요법 및 체크포인트 억제제를 피험자에게 투여함을 포함하는, 항종양 또는 항암 면역 반응을 향상시키는 방법.
- 제44항에 있어서, 상기 입양 T 세포 요법이 상기 체크포인트 억제제의 투여 전에 투여되는, 방법.
- 제45항에 있어서, 상기 입양 T 세포 요법이 체크포인트 억제제의 투여 1일 내지 30일 전에 투여되는, 방법.
- 제44항에 있어서, 상기 항종양 반응이 종양 성장 억제; 종양 세포사 유도; 종양 퇴행; 종양의 재발, 성장, 또는 확산의 예방 또는 지연; 및 종양 제거로부터 선택되는, 방법.
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201361900355P | 2013-11-05 | 2013-11-05 | |
| US201361900309P | 2013-11-05 | 2013-11-05 | |
| US61/900,309 | 2013-11-05 | ||
| US61/900,355 | 2013-11-05 | ||
| PCT/US2014/064133 WO2015069770A1 (en) | 2013-11-05 | 2014-11-05 | Combinations of checkpoint inhibitors and therapeutics to treat cancer |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20160093012A true KR20160093012A (ko) | 2016-08-05 |
Family
ID=53042035
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020167014867A KR20160093012A (ko) | 2013-11-05 | 2014-11-05 | 암 치료를 위한 체크포인트 억제제 및 치료제의 배합물 |
Country Status (14)
| Country | Link |
|---|---|
| US (2) | US20150273033A1 (ko) |
| EP (1) | EP3065772A4 (ko) |
| JP (1) | JP2016540042A (ko) |
| KR (1) | KR20160093012A (ko) |
| CN (1) | CN105828834A (ko) |
| AU (1) | AU2014346852A1 (ko) |
| BR (1) | BR112016010224A2 (ko) |
| CA (1) | CA2929407A1 (ko) |
| EA (1) | EA201690912A1 (ko) |
| HK (1) | HK1232119A1 (ko) |
| IL (2) | IL292510A (ko) |
| MX (2) | MX2016005925A (ko) |
| PH (1) | PH12016500841A1 (ko) |
| WO (1) | WO2015069770A1 (ko) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US11229668B2 (en) | 2017-02-07 | 2022-01-25 | Nantcell, Inc. | Maximizing T-cell memory and compositions and methods therefor |
Families Citing this family (162)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| SI2376535T1 (sl) | 2008-12-09 | 2017-07-31 | F. Hoffmann-La Roche Ag | Protitelesa anti-pd-l1 in njihova uporaba za izboljšanje funkcije celic t |
| RS59480B1 (sr) | 2013-12-12 | 2019-12-31 | Shanghai hengrui pharmaceutical co ltd | Pd-1 antitelo, njegov fragment koji se vezuje na antigen, i njegova medicinska primena |
| WO2015109391A1 (en) | 2014-01-24 | 2015-07-30 | Children's Hospital Of Eastern Ontario Research Institute Inc. | Smc combination therapy for the treatment of cancer |
| EP3137105A4 (en) * | 2014-04-30 | 2017-12-27 | President and Fellows of Harvard College | Combination vaccine devices and methods of killing cancer cells |
| JO3663B1 (ar) | 2014-08-19 | 2020-08-27 | Merck Sharp & Dohme | الأجسام المضادة لمضاد lag3 وأجزاء ربط الأنتيجين |
| CA2976072A1 (en) * | 2015-02-09 | 2016-08-18 | Synta Pharmaceuticals Corp. | Combination therapy of hsp90 inhibitors and pd-1 inhibitors for treating cancer |
| WO2016137985A1 (en) * | 2015-02-26 | 2016-09-01 | Merck Patent Gmbh | Pd-1 / pd-l1 inhibitors for the treatment of cancer |
| SG11201707127VA (en) | 2015-03-06 | 2017-09-28 | Beyondspring Pharmaceuticals Inc | Method of treating cancer associated with a ras mutation |
| WO2016145317A1 (en) * | 2015-03-12 | 2016-09-15 | Thomas Schwaab | Enrichment of cd16+ monocytes to improve dendritic cell vaccine quality |
| SG11201707383PA (en) | 2015-03-13 | 2017-10-30 | Cytomx Therapeutics Inc | Anti-pdl1 antibodies, activatable anti-pdl1 antibodies, and methods of use thereof |
| WO2016145578A1 (en) * | 2015-03-13 | 2016-09-22 | Syz Cell Therapy Co. | Methods of cancer treatment using activated t cells |
| SG11201708804WA (en) | 2015-05-07 | 2017-11-29 | Agenus Inc | Anti-ox40 antibodies and methods of use thereof |
| JP2018519262A (ja) * | 2015-05-07 | 2018-07-19 | ベイラー カレッジ オブ メディスンBaylor College Of Medicine | 樹状細胞免疫療法 |
| US10314854B2 (en) * | 2015-05-15 | 2019-06-11 | University Of Iowa Foundation | Methods for treating tumors in situ including intratumor injection of cytotoxic particles and immune checkpoint blockade therapy |
| IL305621A (en) | 2015-05-28 | 2023-11-01 | Us Health | Methods for training patients for T-cell therapy |
| KR20230148387A (ko) | 2015-05-28 | 2023-10-24 | 카이트 파마 인코포레이티드 | T 세포 요법을 위한 진단 방법 |
| RU2017145940A (ru) * | 2015-05-29 | 2019-07-02 | Дайнэвокс Текнолоджиз Корпорейшн | Внутрилегочное введение полинуклеотидных агонистов толл-подобного рецептора 9 для лечения рака легких |
| SG10201913500TA (en) | 2015-05-29 | 2020-03-30 | Agenus Inc | Anti-ctla-4 antibodies and methods of use thereof |
| CA2987129A1 (en) * | 2015-06-01 | 2016-12-08 | The University Of Chicago | Treatment of cancer by manipulation of commensal microflora |
| MX2017016324A (es) | 2015-06-16 | 2018-03-02 | Merck Patent Gmbh | Tratamientos de combinacion de antagonista de ligando 1 de muerte programada (pd-l1). |
| EP3316888A1 (en) * | 2015-07-02 | 2018-05-09 | Celgene Corporation | Combination therapy for treatment of hematological cancers and solid tumors |
| KR20180040138A (ko) | 2015-07-13 | 2018-04-19 | 싸이톰스 테라퓨틱스, 인크. | 항pd-1 항체, 활성화 가능한 항pd-1 항체, 및 이들의 사용 방법 |
| CN109516981B (zh) | 2015-07-13 | 2019-10-22 | 大连万春布林医药有限公司 | 普那布林组合物 |
| EP3322448A4 (en) * | 2015-07-16 | 2019-03-06 | Bioxcel Therapeutics, Inc. | NOVEL METHOD FOR THE TREATMENT OF CANCER WITH IMMUNOMODULATION |
| EP3322431A2 (en) | 2015-07-16 | 2018-05-23 | Biokine Therapeutics Ltd. | Compositions and methods for treating cancer |
| US10842763B2 (en) | 2015-07-31 | 2020-11-24 | The Johns Hopkins University | Methods for cancer and immunotherapy using prodrugs of glutamine analogs |
| SI3328827T1 (sl) | 2015-07-31 | 2023-11-30 | The Johns Hopkins University | Predzdravila glutamin analogov |
| CN108135875B (zh) | 2015-07-31 | 2021-12-31 | 约翰霍普金斯大学 | 用于治疗代谢重编程病症的方法和组合物 |
| DK3139170T3 (en) * | 2015-08-10 | 2019-01-28 | Univ Medical Hospital China | PROCEDURE FOR ASSESSING IF A PATIENT WITH GLIOBLASTOMA MULTIFORM IS SUITABLE FOR IMMUNTERY TREATMENT BASED ON DENDRITIC CELL TUMOR VACCINES |
| EA201890630A1 (ru) | 2015-09-01 | 2018-10-31 | Эйдженус Инк. | Антитела против pd-1 и способы их применения |
| EP3349731B1 (en) * | 2015-09-16 | 2023-11-01 | Board of Regents, The University of Texas System | Combination of topoisomerase-i inhibitors with immunotherapy in the treatment of cancer |
| US20180296561A1 (en) * | 2015-10-07 | 2018-10-18 | The University Of North Carolina At Chapel Hill | The Methods For Treatment Of Tumors |
| WO2017062619A2 (en) | 2015-10-08 | 2017-04-13 | Macrogenics, Inc. | Combination therapy for the treatment of cancer |
| US10744170B2 (en) | 2015-10-15 | 2020-08-18 | Duke University | Combination treatment |
| KR20180086195A (ko) * | 2015-10-21 | 2018-07-30 | 테크리슨 리미티드 | 면역 매개 암 치료를 위한 조성물 및 방법 |
| WO2017068349A1 (en) * | 2015-10-23 | 2017-04-27 | E-Therapeutics Plc | Cannabinoid for use in immunotherapy |
| CN108367070B (zh) * | 2015-11-04 | 2022-10-28 | 杜克大学 | 免疫毒素与检查点抑制剂的组合治疗 |
| EP3370755B1 (en) | 2015-11-06 | 2021-09-29 | Regents of the University of Minnesota | Activation of resident memory t cells for cancer immunotherapy |
| US20190038713A1 (en) * | 2015-11-07 | 2019-02-07 | Multivir Inc. | Compositions comprising tumor suppressor gene therapy and immune checkpoint blockade for the treatment of cancer |
| AU2016356708B2 (en) | 2015-11-20 | 2022-02-03 | Memorial Sloan Kettering Cancer Center | Methods and compositions for treating cancer |
| BR112018011228A2 (pt) * | 2015-12-01 | 2019-01-15 | Glaxosmithkline Ip Dev Ltd | tratamentos de combinação e seus usos e métodos |
| CN108883173B (zh) | 2015-12-02 | 2022-09-06 | 阿吉纳斯公司 | 抗体和其使用方法 |
| US20180353524A1 (en) * | 2015-12-04 | 2018-12-13 | Seattle Genetics, Inc. | Cancer treatment using 2-deoxy-2-fluoro-l-fucose in combination with a checkpoint inhibitor |
| CN109069486A (zh) | 2015-12-14 | 2018-12-21 | X4 制药有限公司 | 治疗癌症的方法 |
| EP3389634B1 (en) | 2015-12-14 | 2021-10-06 | X4 Pharmaceuticals, Inc. | Methods for treating cancer |
| WO2017106129A1 (en) | 2015-12-16 | 2017-06-22 | Merck Sharp & Dohme Corp. | Anti-lag3 antibodies and antigen-binding fragments |
| SI3393468T1 (sl) | 2015-12-22 | 2023-01-31 | X4 Pharmaceuticals, Inc. | Postopki za zdravljenje bolezni imunske pomanjkljivosti |
| US20190022129A1 (en) * | 2016-01-08 | 2019-01-24 | Biothera, Inc. | Beta-glucan immunotherapies affecting the immune microenvironment |
| US11484592B2 (en) | 2016-01-08 | 2022-11-01 | Momotaro-Gene Inc. | Combination therapy using REIC/Dkk-3 gene and a checkpoint inhibitor |
| WO2017120589A1 (en) * | 2016-01-08 | 2017-07-13 | Washington University | Compositions comprising chemerin and methods of use thereof |
| US20210000921A1 (en) * | 2016-01-11 | 2021-01-07 | Flagship Pioneering Innovations V. Inc. | Methods and compositions for modulating thymic function |
| CN108883132A (zh) * | 2016-01-22 | 2018-11-23 | X4 制药有限公司 | 用于治疗癌症的方法 |
| GB201601868D0 (en) * | 2016-02-02 | 2016-03-16 | Lytix Biopharma As | Methods |
| RU2753543C1 (ru) | 2016-02-08 | 2021-08-17 | Бейондспринг Фармасьютикалс, Инк. | Композиции, содержащие тукаресол или его аналоги |
| KR102518146B1 (ko) * | 2016-02-15 | 2023-04-06 | 에프케이디 테라피즈 리미티드, | 향상된 인터페론 치료 |
| AU2017222495B2 (en) | 2016-02-23 | 2019-08-08 | Biolinerx Ltd. | Methods of treating acute myeloid leukemia |
| EP3426299A4 (en) * | 2016-03-11 | 2019-10-16 | University of Louisville Research Foundation, Inc. | METHOD AND COMPOSITIONS FOR TREATMENT OF TUMORS |
| GB201604213D0 (en) * | 2016-03-11 | 2016-04-27 | Proximagen Ltd | Drug combination and its use in therapy |
| US10869923B2 (en) | 2016-03-30 | 2020-12-22 | Microbio Co. Ltd. | Combined cancer therapy with immune checkpoint modulators and fermentation products by symbiotic microbiota |
| JP2019510785A (ja) | 2016-04-08 | 2019-04-18 | エックス4 ファーマシューティカルズ, インコーポレイテッド | 癌を処置する方法 |
| WO2017203362A1 (en) * | 2016-05-25 | 2017-11-30 | The Council Of The Queensland Institute Of Medical Research | Immune checkpoint inhibitors and cytotoxic t cells for the treatment of cancer |
| MX2018014387A (es) | 2016-05-27 | 2019-03-14 | Agenus Inc | Anticuerpos anti proteina inmunoglobulina de linfocitos t y dominio de mucina 3 (tim-3) y métodos para usarlos. |
| SG11201810872UA (en) | 2016-06-06 | 2019-01-30 | Beyondspring Pharmaceuticals Inc | Composition and method for reducing neutropenia |
| WO2017212021A1 (en) * | 2016-06-10 | 2017-12-14 | INSERM (Institut National de la Santé et de la Recherche Médicale) | Methods and pharmaceutical compositions for the treatment of cancer |
| US10759796B2 (en) | 2016-06-21 | 2020-09-01 | X4 Pharmaceuticals, Inc. | CXCR4 inhibitors and uses thereof |
| WO2017223243A1 (en) | 2016-06-21 | 2017-12-28 | X4 Pharmaceuticals, Inc. | Cxcr4 inhibitors and uses thereof |
| EP3471726A4 (en) | 2016-06-21 | 2019-10-09 | X4 Pharmaceuticals, Inc. | CXCR4 INHIBITORS AND USES THEREOF |
| JP7027401B2 (ja) | 2016-07-14 | 2022-03-01 | ブリストル-マイヤーズ スクイブ カンパニー | Tim3に対する抗体およびその使用 |
| WO2018014260A1 (en) * | 2016-07-20 | 2018-01-25 | Nanjing Legend Biotech Co., Ltd. | Multispecific antigen binding proteins and methods of use thereof |
| KR20190038935A (ko) | 2016-08-25 | 2019-04-09 | 난토믹스, 엘엘씨 | 면역요법 마커들 및 그 용도들(immunotherapy markers and uses therefor) |
| CN109906088A (zh) * | 2016-08-26 | 2019-06-18 | 奥野哲治 | 微血管血流减少剂及其应用 |
| TWI771315B (zh) * | 2016-08-26 | 2022-07-21 | 奧野哲治 | 微小奈米化藥劑及其利用 |
| JP7200093B2 (ja) | 2016-09-15 | 2023-01-06 | アイデラ・ファーマシューティカルズ,インコーポレーテッド | がん治療用tlr9アゴニストを用いた免疫調節 |
| CA3037253A1 (en) * | 2016-09-26 | 2018-03-29 | Advantagene, Inc. | Methods of treating tim-3 elevation |
| EP3523416A4 (en) * | 2016-10-05 | 2020-04-15 | University of Central Florida Research Foundation, Inc. | METHODS AND COMPOSITIONS ASSOCIATED WITH ANTI-CANCER THERAPIES OF NK AND ANTI-PDL1 CELLS |
| AU2017339856A1 (en) | 2016-10-06 | 2019-05-23 | Merck Patent Gmbh | Dosing regimen of avelumab for the treatment of cancer |
| CA3039071A1 (en) * | 2016-10-07 | 2018-04-12 | Secarna Pharmaceuticals Gmbh & Co. Kg | Immunosuppression-reverting oligonucleotides inhibiting the expression of ido |
| WO2018068201A1 (en) | 2016-10-11 | 2018-04-19 | Nanjing Legend Biotech Co., Ltd. | Single-domain antibodies and variants thereof against ctla-4 |
| TW202246349A (zh) | 2016-10-11 | 2022-12-01 | 美商艾吉納斯公司 | 抗lag-3抗體及其使用方法 |
| US20200038509A1 (en) * | 2016-10-14 | 2020-02-06 | Baylor College Of Medicine | Radiofrequency field hyperthermia and solid tumor immunomodulation |
| WO2018075447A1 (en) * | 2016-10-19 | 2018-04-26 | The Trustees Of Columbia University In The City Of New York | Combination of braf inhibitor, talimogene laherparepvec, and immune checkpoint inhibitor for use in the treatment cancer (melanoma) |
| CA3041340A1 (en) | 2016-11-09 | 2018-05-17 | Agenus Inc. | Anti-ox40 antibodies, anti-gitr antibodies, and methods of use thereof |
| MX2019006340A (es) | 2016-12-07 | 2019-11-07 | Agenus Inc | Anticuerpos anti antígeno 4 del linfocito t citotóxico (ctla-4) y métodos de uso de los mismos. |
| CN110582292A (zh) * | 2016-12-09 | 2019-12-17 | 基因药物株式会社 | 含有表达细胞外基质的降解因子的重组腺病毒的抗癌组合物 |
| CN110475560B (zh) * | 2016-12-15 | 2023-06-20 | 普罗基Pg500系列私人有限公司 | 组合物及其用途 |
| EP3559209A4 (en) | 2016-12-23 | 2021-03-10 | Keio University | COMPOSITION AND METHOD OF INDUCTION OF CD8 + CELLS |
| US11633393B2 (en) | 2017-01-06 | 2023-04-25 | Beyondspring Pharmaceuticals, Inc. | Tubulin binding compounds and therapeutic use thereof |
| KR20230132603A (ko) | 2017-01-11 | 2023-09-15 | 브리스톨-마이어스 스큅 컴퍼니 | Psgl-1 길항제 및 그의 용도 |
| KR20190109479A (ko) | 2017-02-01 | 2019-09-25 | 비욘드스프링 파마수티컬스, 인코포레이티드. | 호중구감소증의 감소 방법 |
| EP3579846A1 (en) * | 2017-02-07 | 2019-12-18 | Memorial Sloan Kettering Cancer Center | Use of immune checkpoint modulators in combination with antigen-specific t cells in adoptive immunotherapy |
| WO2018156888A1 (en) | 2017-02-24 | 2018-08-30 | Biothera Pharmaceuticals, Inc. | Beta glucan immunopharmacodynamics |
| EP3366703B1 (en) * | 2017-02-28 | 2019-04-03 | Ralf Kleef | Immune checkpoint therapy with hyperthermia |
| KR102549625B1 (ko) * | 2017-03-03 | 2023-06-28 | 트레오스 바이오 리미티드 | 개인화된 면역원성 펩타이드 확인 플랫폼 |
| CA3055557A1 (en) * | 2017-03-08 | 2018-09-13 | Yale University | Compositions and methods for treating cancer with anti-renalase antibodies and anti-pd1 antibodies |
| EP3595720A4 (en) | 2017-03-14 | 2021-05-26 | Five Prime Therapeutics, Inc. | ANTIBODIES BINDING TO VISTA AT AN ACID PH |
| CN107082812B (zh) | 2017-03-29 | 2018-11-13 | 上海科医联创生物科技有限公司 | 一种恢复衰竭性免疫细胞功能的融合蛋白及其应用 |
| CN108728440A (zh) * | 2017-04-25 | 2018-11-02 | 上海吉倍生物技术有限公司 | Ctla-4基因的用途及相关药物 |
| UY37695A (es) * | 2017-04-28 | 2018-11-30 | Novartis Ag | Compuesto dinucleótido cíclico bis 2’-5’-rr-(3’f-a)(3’f-a) y usos del mismo |
| GB2562721A (en) * | 2017-05-16 | 2018-11-28 | Fastbase Solutions Ltd | Kits, methods and their uses for detecting cell-cell interactions in a sample |
| BR112019025188A2 (pt) | 2017-06-01 | 2020-06-23 | Cytomx Therapeutics, Inc. | Anticorpos anti-pdl1 ativáveis e métodos de uso dos mesmos |
| WO2019011879A1 (en) * | 2017-07-09 | 2019-01-17 | Rainer Henning | THERAPEUTIC AGENT FOR THE TREATMENT OF CAPILLARY LEAK SYNDROME |
| WO2019023624A1 (en) | 2017-07-28 | 2019-01-31 | Bristol-Myers Squibb Company | PREDICTIVE PERIPHERAL BLOOD BIOMARKER FOR INHIBITORS OF CONTROL POINTS |
| AU2018317390A1 (en) * | 2017-08-14 | 2020-04-02 | Cytodigm, Inc. | Microparticle formulations of adenosine receptor antagonists for treating cancer |
| WO2019040780A1 (en) | 2017-08-25 | 2019-02-28 | Five Prime Therapeutics Inc. | ANTI-B7-H4 ANTIBODIES AND METHODS OF USE |
| EP3689376A4 (en) * | 2017-09-26 | 2021-06-16 | Chugai Seiyaku Kabushiki Kaisha | PHARMACEUTICAL COMPOSITION |
| CN111278436A (zh) | 2017-10-03 | 2020-06-12 | 克里蒂泰克公司 | 局部递送抗肿瘤颗粒与全身递送免疫治疗剂相结合用于治疗癌症 |
| WO2019087087A1 (en) | 2017-11-03 | 2019-05-09 | Aurigene Discovery Technologies Limited | Dual inhibitors of tim-3 and pd-1 pathways |
| CN111386128A (zh) | 2017-11-06 | 2020-07-07 | 奥瑞基尼探索技术有限公司 | 用于免疫调节的联合疗法 |
| CN111971028A (zh) * | 2017-11-21 | 2020-11-20 | 西奈山伊坎医学院 | 用治疗性纳米生物组合物促进训练免疫 |
| WO2019122941A1 (en) * | 2017-12-21 | 2019-06-27 | Debiopharm International Sa | Combination anti cancer therapy with an iap antagonist and an anti pd-1 molecule |
| KR20200104333A (ko) | 2017-12-28 | 2020-09-03 | 난징 레전드 바이오테크 씨오., 엘티디. | Tigit에 대한 단일-도메인 항체 및 이의 변이체 |
| TWI817977B (zh) * | 2018-01-09 | 2023-10-11 | 中天生物科技股份有限公司 | 活化腫瘤浸潤淋巴細胞之方法 |
| US11713353B2 (en) | 2018-01-15 | 2023-08-01 | Nanjing Legend Biotech Co., Ltd. | Single-domain antibodies and variants thereof against PD-1 |
| CA3089226A1 (en) | 2018-01-24 | 2019-08-01 | Beyondspring Pharmaceuticals, Inc. | Composition and method for reducing thrombocytopenia via the administration of plinabulin |
| SG11202006945PA (en) | 2018-01-26 | 2020-08-28 | Exelixis Inc | Compounds for the treatment of kinase-dependent disorders |
| CA3088200A1 (en) | 2018-01-26 | 2019-08-01 | Exelixis, Inc. | Compounds for the treatment of kinase-dependent disorders |
| MA51679A (fr) | 2018-01-26 | 2020-12-02 | Exelixis Inc | Composés destinés au traitement de troubles dépendant de la kinase |
| WO2019152680A1 (en) * | 2018-01-31 | 2019-08-08 | Flagship Pioneering Innovations V, Inc. | Methods and compositions for treating cancer using chrna6 inhibitors |
| CA3089781A1 (en) * | 2018-02-02 | 2019-08-08 | Murray & Poole Enterprises, Ltd | Use of colchicine to inhibit tumor growth and metastases |
| US11723934B2 (en) | 2018-02-09 | 2023-08-15 | Keio University | Compositions and methods for the induction of CD8+ T-cells |
| CA3085467A1 (en) | 2018-02-28 | 2019-09-06 | Ap Biosciences, Inc. | Bifunctional proteins combining checkpoint blockade for targeted therapy |
| BR112020017925A2 (pt) | 2018-03-02 | 2020-12-22 | Five Prime Therapeutics, Inc. | Anticorpos contra b7-h4 e métodos de uso dos mesmos |
| WO2019183924A1 (en) | 2018-03-30 | 2019-10-03 | Syz Cell Therapy Co. | Improved multiple antigen specific cell therapy methods |
| MX2020010437A (es) | 2018-04-05 | 2021-01-29 | Sumitomo Pharma Oncology Inc | Inhibidores de axl cinasa y uso de los mismos. |
| US20210145830A1 (en) * | 2018-04-05 | 2021-05-20 | Mayo Foundation For Medical Education And Research | Materials and methods for treating cancer |
| US11564980B2 (en) | 2018-04-23 | 2023-01-31 | Nantcell, Inc. | Tumor treatment method with an individualized peptide vaccine |
| TWI816603B (zh) * | 2018-04-23 | 2023-09-21 | 美商南特細胞公司 | 新抗原表位疫苗及免疫刺激組合物及方法 |
| EP3566718A1 (en) | 2018-05-07 | 2019-11-13 | Universitätsmedizin der Johannes Gutenberg-Universität Mainz | A pharmazeutical combination (treg depleting agent, checkpoint inhibitor, tlr9 agonist) for use in the treatment of cancer |
| KR20210018253A (ko) * | 2018-05-31 | 2021-02-17 | 오노 야꾸힝 고교 가부시키가이샤 | 면역 체크포인트 저해약의 유효성 판정 바이오마커 |
| AU2019277656A1 (en) * | 2018-06-01 | 2021-01-07 | Tva (Abc), Llc | Combination therapy |
| EP3801523A2 (en) * | 2018-06-01 | 2021-04-14 | Eisai R&D Management Co., Ltd. | Methods of using splicing modulators |
| CA3102643A1 (en) * | 2018-06-08 | 2019-12-12 | Harrow Ip, Llc | Pyrimethamine-based pharmaceutical compositions and methods for fabricating thereof |
| US11266615B2 (en) | 2018-06-08 | 2022-03-08 | Harrow Ip, Llc | Pyrimethamine-based pharmaceutical compositions and methods for fabricating thereof |
| EP3843718A1 (en) * | 2018-06-15 | 2021-07-07 | The Board Of Regents Of The University Of Texas System | Methods of treating and preventing melanoma with s-equol |
| US20210170005A1 (en) * | 2018-08-15 | 2021-06-10 | University Of Florida Research Foundation, Inc. | Methods of sensitizing tumors to treatment with immune checkpoint inhibitors |
| WO2020047319A1 (en) * | 2018-08-29 | 2020-03-05 | Shattuck Labs, Inc. | Combination therapies comprising sirp alpha-based chimeric proteins |
| US10548889B1 (en) | 2018-08-31 | 2020-02-04 | X4 Pharmaceuticals, Inc. | Compositions of CXCR4 inhibitors and methods of preparation and use |
| BR112021005540A2 (pt) * | 2018-09-24 | 2021-06-29 | Biovaxys Llc | vacinas autólogas bi-haptenizadas e seus usos |
| WO2020091944A1 (en) * | 2018-10-31 | 2020-05-07 | Nantomics, Llc | Genomic and immune infiltration differences between msi and mss gi tumors |
| WO2020092589A1 (en) * | 2018-10-31 | 2020-05-07 | Nantomics, Llc | Immune checkpoint therapeutic methods |
| KR20210093946A (ko) * | 2018-11-16 | 2021-07-28 | 아르퀼 인코포레이티드 | 암의 치료를 위한 제약 조합물 |
| WO2020123912A1 (en) * | 2018-12-13 | 2020-06-18 | Rhode Island Hospital | Inhibition of asph expressing tumor growth and progression |
| CN113614109A (zh) * | 2018-12-21 | 2021-11-05 | Ose免疫疗法公司 | 双功能抗pd-1/il-7分子 |
| TW202043256A (zh) | 2019-01-10 | 2020-12-01 | 美商健生生物科技公司 | 前列腺新抗原及其用途 |
| WO2020163628A1 (en) | 2019-02-06 | 2020-08-13 | Cornell University | Darc expression as prognosticator of immunotherapy outcomes |
| CN109771445B (zh) * | 2019-03-20 | 2022-08-05 | 青岛东海药业有限公司 | 酪酸梭菌在制备诱导抗肿瘤免疫及免疫检查点抑制剂增敏制剂中的应用 |
| CN111751545A (zh) * | 2019-03-28 | 2020-10-09 | 中国科学院上海药物研究所 | 一种筛选pd-l1/pd-1检测点抑制剂的方法 |
| AU2020253955A1 (en) * | 2019-04-03 | 2021-09-09 | Targimmune Therapeutics Ag | Immunotherapy for the treatment of cancer |
| EP3721899A1 (en) * | 2019-04-08 | 2020-10-14 | China Medical University | Combination therapies comprising dendritic cells-based vaccine and immune checkpoint inhibitor |
| WO2020215037A1 (en) | 2019-04-18 | 2020-10-22 | The Regents Of The University Of Michigan | Combination with checkpoint inhibitors to treat cancer |
| WO2020246846A1 (ko) * | 2019-06-05 | 2020-12-10 | 연세대학교 산학협력단 | Tox에 기초한 면역 항암 요법에 대한 치료 반응 예측 방법 |
| WO2021003138A1 (en) * | 2019-06-30 | 2021-01-07 | Memorial Sloan Kettering Cancer Center | Methods and compositions for treatment of pancreatic cancer |
| US11364291B1 (en) * | 2019-07-18 | 2022-06-21 | Nantcell, Inc. | Bacillus Calmette-Guerin (BCG) and antigen presenting cells for treatment of bladder cancer |
| WO2021034774A1 (en) * | 2019-08-16 | 2021-02-25 | H. Lee Moffitt Cancer Center And Research Institute, Inc. | Fucosylation and immune modulation in cancer |
| JP2023510199A (ja) * | 2020-01-02 | 2023-03-13 | メルク・シャープ・アンド・ドーム・エルエルシー | Pd-1アンタゴニスト、ilt4アンタゴニストおよびレンバチニブまたはその塩を使用する組合せ癌治療 |
| WO2021178657A1 (en) * | 2020-03-05 | 2021-09-10 | Merck Sharp & Dohme Corp. | Methods for treating cancer using a combination of a pd-1 antagonist, a ctla4 antagonist, and lenvatinib or a pharmaceutically acceptable salt thereof |
| MX2022011154A (es) | 2020-03-18 | 2022-10-13 | Gi Innovation Inc | Composicion farmaceutica para el tratamiento de cancer que comprende proteina de fusion que se compone de proteina il-2 y proteina cd80 y farmaco anticancerigeno. |
| WO2022198101A1 (en) | 2021-03-19 | 2022-09-22 | Trained Therapeutix Discovery, Inc. | Compounds for regulating trained immunity, and their methods of use |
| JP7018531B1 (ja) | 2021-04-30 | 2022-02-10 | 潤 齋藤 | Axl阻害剤 |
| WO2023199927A1 (ja) * | 2022-04-13 | 2023-10-19 | アステラス製薬株式会社 | がん治療におけるpd-1シグナル阻害剤との組み合わせによる抗tspan8-抗cd3二重特異性抗体の使用 |
| WO2023203561A1 (en) * | 2022-04-19 | 2023-10-26 | Enlivex Therapeutics Rdo Ltd | Apoptotic cell - check point inhibitor combination therapy |
| CN117050177B (zh) * | 2023-08-25 | 2024-03-08 | 遵义北科融汇生命科技有限公司 | 血液分离的免疫细胞联合药物治疗癌症的用途 |
Family Cites Families (20)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5892019A (en) | 1987-07-15 | 1999-04-06 | The United States Of America, As Represented By The Department Of Health And Human Services | Production of a single-gene-encoded immunoglobulin |
| US5851795A (en) | 1991-06-27 | 1998-12-22 | Bristol-Myers Squibb Company | Soluble CTLA4 molecules and uses thereof |
| US5855887A (en) | 1995-07-25 | 1999-01-05 | The Regents Of The University Of California | Blockade of lymphocyte down-regulation associated with CTLA-4 signaling |
| US6051227A (en) | 1995-07-25 | 2000-04-18 | The Regents Of The University Of California, Office Of Technology Transfer | Blockade of T lymphocyte down-regulation associated with CTLA-4 signaling |
| US5811097A (en) | 1995-07-25 | 1998-09-22 | The Regents Of The University Of California | Blockade of T lymphocyte down-regulation associated with CTLA-4 signaling |
| JP2001523958A (ja) | 1997-03-21 | 2001-11-27 | ブライハム アンド ウィミンズ ホスピタル,インコーポレイテッド | 免疫療法のctla−4結合ペプチド |
| US6682736B1 (en) | 1998-12-23 | 2004-01-27 | Abgenix, Inc. | Human monoclonal antibodies to CTLA-4 |
| US7109003B2 (en) | 1998-12-23 | 2006-09-19 | Abgenix, Inc. | Methods for expressing and recovering human monoclonal antibodies to CTLA-4 |
| KR100856446B1 (ko) | 1998-12-23 | 2008-09-04 | 화이자 인크. | Ctla-4에 대한 인간 단일클론 항체 |
| EP2829609A1 (en) | 1999-08-24 | 2015-01-28 | E. R. Squibb & Sons, L.L.C. | Human CTLA-4 antibodies and their uses |
| US7605238B2 (en) | 1999-08-24 | 2009-10-20 | Medarex, Inc. | Human CTLA-4 antibodies and their uses |
| AU2001233027A1 (en) | 2000-01-27 | 2001-08-07 | Genetics Institute, Llc | Antibodies against ctla4 (cd152), conjugates comprising same, and uses thereof |
| WO2003086459A1 (en) * | 2002-04-12 | 2003-10-23 | Medarex, Inc. | Methods of treatement using ctla-4 antibodies |
| SI1558648T1 (sl) | 2002-10-17 | 2012-05-31 | Genmab As | Človeška monoklonalna protitelesa proti CD |
| ATE486125T1 (de) | 2002-12-06 | 2010-11-15 | Northwest Biotherapeutics Inc | Verabreichung teilgereifter dendritischer zellen in vitro zur behandlung von tumoren |
| GB0406598D0 (en) * | 2004-03-24 | 2004-04-28 | Univ Leicester | Vaccine |
| GB0920258D0 (en) * | 2009-11-19 | 2010-01-06 | Alligator Bioscience Ab | New medical agents and use thereof |
| CN103429264A (zh) * | 2011-03-31 | 2013-12-04 | 默沙东公司 | 针对人程序性死亡受体pd-1的抗体的稳定制剂和有关的治疗 |
| CA2840170A1 (en) * | 2011-06-21 | 2012-12-27 | The Johns Hopkins University | Focused radiation for augmenting immune-based therapies against neoplasms |
| US9856320B2 (en) * | 2012-05-15 | 2018-01-02 | Bristol-Myers Squibb Company | Cancer immunotherapy by disrupting PD-1/PD-L1 signaling |
-
2014
- 2014-11-05 US US14/533,879 patent/US20150273033A1/en not_active Abandoned
- 2014-11-05 WO PCT/US2014/064133 patent/WO2015069770A1/en active Application Filing
- 2014-11-05 CN CN201480070071.7A patent/CN105828834A/zh active Pending
- 2014-11-05 JP JP2016552469A patent/JP2016540042A/ja active Pending
- 2014-11-05 EP EP14859634.9A patent/EP3065772A4/en active Pending
- 2014-11-05 EA EA201690912A patent/EA201690912A1/ru unknown
- 2014-11-05 BR BR112016010224-0A patent/BR112016010224A2/pt not_active Application Discontinuation
- 2014-11-05 MX MX2016005925A patent/MX2016005925A/es unknown
- 2014-11-05 AU AU2014346852A patent/AU2014346852A1/en not_active Abandoned
- 2014-11-05 US US14/534,158 patent/US20150202291A1/en not_active Abandoned
- 2014-11-05 IL IL292510A patent/IL292510A/en unknown
- 2014-11-05 CA CA2929407A patent/CA2929407A1/en active Pending
- 2014-11-05 KR KR1020167014867A patent/KR20160093012A/ko not_active Application Discontinuation
-
2016
- 2016-05-01 IL IL245337A patent/IL245337B/en unknown
- 2016-05-04 MX MX2022006726A patent/MX2022006726A/es unknown
- 2016-05-05 PH PH12016500841A patent/PH12016500841A1/en unknown
-
2017
- 2017-03-08 HK HK17102406.5A patent/HK1232119A1/zh unknown
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US11229668B2 (en) | 2017-02-07 | 2022-01-25 | Nantcell, Inc. | Maximizing T-cell memory and compositions and methods therefor |
Also Published As
| Publication number | Publication date |
|---|---|
| MX2016005925A (es) | 2016-11-28 |
| CN105828834A (zh) | 2016-08-03 |
| IL245337A0 (en) | 2016-06-30 |
| EP3065772A1 (en) | 2016-09-14 |
| WO2015069770A1 (en) | 2015-05-14 |
| US20150273033A1 (en) | 2015-10-01 |
| IL245337B (en) | 2022-05-01 |
| JP2016540042A (ja) | 2016-12-22 |
| BR112016010224A2 (pt) | 2018-05-02 |
| IL292510A (en) | 2022-06-01 |
| AU2014346852A1 (en) | 2016-06-16 |
| EP3065772A4 (en) | 2017-09-13 |
| EA201690912A1 (ru) | 2016-10-31 |
| US20150202291A1 (en) | 2015-07-23 |
| CA2929407A1 (en) | 2015-05-14 |
| MX2022006726A (es) | 2022-06-09 |
| HK1232119A1 (zh) | 2018-01-05 |
| PH12016500841A1 (en) | 2016-07-04 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR20160093012A (ko) | 암 치료를 위한 체크포인트 억제제 및 치료제의 배합물 | |
| JP6936221B2 (ja) | Cd80細胞外ドメインポリペプチドと、がん治療でのそれらの使用 | |
| JP6879996B2 (ja) | 悪性腫瘍の治療方法 | |
| JP6858128B2 (ja) | 癌治療のための免疫療法とサイトカイン制御療法との組み合わせ | |
| EP2766035B1 (en) | Combination medicament comprising il-12 and an agent for blockade of t-cell inhibitory molecules for tumour therapy | |
| EP3057990B1 (en) | Compositions comprising a combination of a vegf antagonist and an anti-ctla-4 antibody | |
| JP6415437B2 (ja) | 癌の処置における特異的免疫療法を向上する方法 | |
| KR20170072928A (ko) | 조합물 | |
| CN107530419A (zh) | 治疗疾病的组合疗法 | |
| ES2808728T3 (es) | Agente terapéutico para cáncer sólido | |
| CA3128202A1 (en) | Anti-egfr/high affinity nk-cells compositions and methods for chordoma treatment | |
| US20220111069A1 (en) | Immunoswitch nanoparticles for reprogrammed t cell responses | |
| CN109937051A (zh) | 治疗tim-3升高的方法 | |
| US20210100896A1 (en) | Methods and compositions for stimulating the immune system | |
| JP2021523098A (ja) | T細胞による認識を強化するよう抗原性を調節する方法 | |
| JP7407452B2 (ja) | がんの治療及び/又は予防のための医薬 | |
| US20230255978A1 (en) | Methods for treating glioblastoma | |
| Brito | CANCER IMMUNOTHERAPY | |
| US20220047701A1 (en) | Combination of her2/neu antibody with heme for treating cancer | |
| WO2023203561A1 (en) | Apoptotic cell - check point inhibitor combination therapy | |
| JP2022028682A (ja) | 抗fugetactic特性を有する改変されたT細胞およびその使用 | |
| NZ750663A (en) | Compositions and methods for cancer immunotherapy | |
| NZ750663B2 (en) | Compositions and methods for cancer immunotherapy |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| WITN | Application deemed withdrawn, e.g. because no request for examination was filed or no examination fee was paid |