KR20160054582A - 유기 전계발광 디바이스 - Google Patents
유기 전계발광 디바이스 Download PDFInfo
- Publication number
- KR20160054582A KR20160054582A KR1020167009385A KR20167009385A KR20160054582A KR 20160054582 A KR20160054582 A KR 20160054582A KR 1020167009385 A KR1020167009385 A KR 1020167009385A KR 20167009385 A KR20167009385 A KR 20167009385A KR 20160054582 A KR20160054582 A KR 20160054582A
- Authority
- KR
- South Korea
- Prior art keywords
- compound
- group
- radicals
- aromatic
- atoms
- Prior art date
Links
- 150000001875 compounds Chemical class 0.000 claims abstract description 64
- 125000003118 aryl group Chemical group 0.000 claims description 72
- 125000004432 carbon atom Chemical group C* 0.000 claims description 31
- 238000000034 method Methods 0.000 claims description 31
- -1 quaterphenyl Chemical group 0.000 claims description 29
- 229910052799 carbon Inorganic materials 0.000 claims description 27
- JNGZXGGOCLZBFB-IVCQMTBJSA-N compound E Chemical compound N([C@@H](C)C(=O)N[C@@H]1C(N(C)C2=CC=CC=C2C(C=2C=CC=CC=2)=N1)=O)C(=O)CC1=CC(F)=CC(F)=C1 JNGZXGGOCLZBFB-IVCQMTBJSA-N 0.000 claims description 25
- 229910052760 oxygen Inorganic materials 0.000 claims description 22
- 229910052731 fluorine Inorganic materials 0.000 claims description 19
- 238000004770 highest occupied molecular orbital Methods 0.000 claims description 19
- 238000004768 lowest unoccupied molecular orbital Methods 0.000 claims description 19
- 229910052739 hydrogen Inorganic materials 0.000 claims description 14
- 125000000217 alkyl group Chemical group 0.000 claims description 13
- 125000001072 heteroaryl group Chemical group 0.000 claims description 13
- 239000011159 matrix material Substances 0.000 claims description 13
- 238000003077 quantum chemistry computational method Methods 0.000 claims description 12
- 125000001424 substituent group Chemical group 0.000 claims description 11
- 125000003545 alkoxy group Chemical group 0.000 claims description 10
- 229910052805 deuterium Inorganic materials 0.000 claims description 10
- 125000000714 pyrimidinyl group Chemical group 0.000 claims description 10
- 229910052717 sulfur Inorganic materials 0.000 claims description 10
- 230000005284 excitation Effects 0.000 claims description 9
- 229910052710 silicon Inorganic materials 0.000 claims description 9
- ZUOUZKKEUPVFJK-UHFFFAOYSA-N diphenyl Chemical compound C1=CC=CC=C1C1=CC=CC=C1 ZUOUZKKEUPVFJK-UHFFFAOYSA-N 0.000 claims description 8
- 238000004519 manufacturing process Methods 0.000 claims description 8
- 125000005842 heteroatom Chemical group 0.000 claims description 7
- 229910052757 nitrogen Inorganic materials 0.000 claims description 7
- 238000007639 printing Methods 0.000 claims description 7
- 125000003342 alkenyl group Chemical group 0.000 claims description 6
- 125000000304 alkynyl group Chemical group 0.000 claims description 6
- 239000004305 biphenyl Substances 0.000 claims description 5
- 125000004435 hydrogen atom Chemical group [H]* 0.000 claims description 5
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 claims description 5
- YJTKZCDBKVTVBY-UHFFFAOYSA-N 1,3-Diphenylbenzene Chemical group C1=CC=CC=C1C1=CC=CC(C=2C=CC=CC=2)=C1 YJTKZCDBKVTVBY-UHFFFAOYSA-N 0.000 claims description 4
- 235000010290 biphenyl Nutrition 0.000 claims description 4
- 125000004122 cyclic group Chemical group 0.000 claims description 4
- 125000003983 fluorenyl group Chemical group C1(=CC=CC=2C3=CC=CC=C3CC12)* 0.000 claims description 4
- 125000001792 phenanthrenyl group Chemical group C1(=CC=CC=2C3=CC=CC=C3C=CC12)* 0.000 claims description 4
- 238000005092 sublimation method Methods 0.000 claims description 4
- 150000001491 aromatic compounds Chemical class 0.000 claims description 3
- 125000000499 benzofuranyl group Chemical group O1C(=CC2=C1C=CC=C2)* 0.000 claims description 3
- 239000012159 carrier gas Substances 0.000 claims description 3
- 125000005509 dibenzothiophenyl group Chemical group 0.000 claims description 3
- 125000001624 naphthyl group Chemical group 0.000 claims description 3
- 125000004076 pyridyl group Chemical group 0.000 claims description 3
- 238000004528 spin coating Methods 0.000 claims description 3
- 238000000859 sublimation Methods 0.000 claims description 3
- 230000008022 sublimation Effects 0.000 claims description 3
- 125000001931 aliphatic group Chemical group 0.000 claims description 2
- 125000002178 anthracenyl group Chemical group C1(=CC=CC2=CC3=CC=CC=C3C=C12)* 0.000 claims description 2
- 125000000732 arylene group Chemical group 0.000 claims description 2
- 125000004196 benzothienyl group Chemical group S1C(=CC2=C1C=CC=C2)* 0.000 claims description 2
- 125000005549 heteroarylene group Chemical group 0.000 claims description 2
- 125000001041 indolyl group Chemical group 0.000 claims description 2
- 125000001977 isobenzofuranyl group Chemical group C=1(OC=C2C=CC=CC12)* 0.000 claims description 2
- 125000000904 isoindolyl group Chemical group C=1(NC=C2C=CC=CC12)* 0.000 claims description 2
- 125000001725 pyrenyl group Chemical group 0.000 claims description 2
- 125000000168 pyrrolyl group Chemical group 0.000 claims description 2
- 229910052711 selenium Inorganic materials 0.000 claims description 2
- 125000001544 thienyl group Chemical group 0.000 claims description 2
- 125000002541 furyl group Chemical group 0.000 claims 1
- 125000006413 ring segment Chemical group 0.000 claims 1
- 239000010410 layer Substances 0.000 description 68
- 150000003254 radicals Chemical class 0.000 description 45
- 239000000463 material Substances 0.000 description 21
- IOJUPLGTWVMSFF-UHFFFAOYSA-N benzothiazole Chemical compound C1=CC=C2SC=NC2=C1 IOJUPLGTWVMSFF-UHFFFAOYSA-N 0.000 description 14
- 229910052751 metal Inorganic materials 0.000 description 12
- 239000002184 metal Substances 0.000 description 12
- 238000003786 synthesis reaction Methods 0.000 description 11
- 230000015572 biosynthetic process Effects 0.000 description 10
- 150000003230 pyrimidines Chemical class 0.000 description 10
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 9
- FCEHBMOGCRZNNI-UHFFFAOYSA-N 1-benzothiophene Chemical compound C1=CC=C2SC=CC2=C1 FCEHBMOGCRZNNI-UHFFFAOYSA-N 0.000 description 8
- PXGOKWXKJXAPGV-UHFFFAOYSA-N Fluorine Chemical compound FF PXGOKWXKJXAPGV-UHFFFAOYSA-N 0.000 description 8
- 239000011737 fluorine Substances 0.000 description 8
- 239000000203 mixture Substances 0.000 description 8
- 239000000243 solution Substances 0.000 description 8
- GVEPBJHOBDJJJI-UHFFFAOYSA-N fluoranthrene Natural products C1=CC(C2=CC=CC=C22)=C3C2=CC=CC3=C1 GVEPBJHOBDJJJI-UHFFFAOYSA-N 0.000 description 7
- 238000005259 measurement Methods 0.000 description 7
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 7
- UJOBWOGCFQCDNV-UHFFFAOYSA-N 9H-carbazole Chemical compound C1=CC=C2C3=CC=CC=C3NC2=C1 UJOBWOGCFQCDNV-UHFFFAOYSA-N 0.000 description 6
- UHOVQNZJYSORNB-UHFFFAOYSA-N Benzene Chemical compound C1=CC=CC=C1 UHOVQNZJYSORNB-UHFFFAOYSA-N 0.000 description 6
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 6
- UFWIBTONFRDIAS-UHFFFAOYSA-N Naphthalene Chemical compound C1=CC=CC2=CC=CC=C21 UFWIBTONFRDIAS-UHFFFAOYSA-N 0.000 description 6
- SMWDFEZZVXVKRB-UHFFFAOYSA-N Quinoline Chemical compound N1=CC=CC2=CC=CC=C21 SMWDFEZZVXVKRB-UHFFFAOYSA-N 0.000 description 6
- MWPLVEDNUUSJAV-UHFFFAOYSA-N anthracene Chemical compound C1=CC=CC2=CC3=CC=CC=C3C=C21 MWPLVEDNUUSJAV-UHFFFAOYSA-N 0.000 description 6
- 239000002019 doping agent Substances 0.000 description 6
- RAXXELZNTBOGNW-UHFFFAOYSA-N imidazole Natural products C1=CNC=N1 RAXXELZNTBOGNW-UHFFFAOYSA-N 0.000 description 6
- YNPNZTXNASCQKK-UHFFFAOYSA-N phenanthrene Chemical compound C1=CC=C2C3=CC=CC=C3C=CC2=C1 YNPNZTXNASCQKK-UHFFFAOYSA-N 0.000 description 6
- BBEAQIROQSPTKN-UHFFFAOYSA-N pyrene Chemical compound C1=CC=C2C=CC3=CC=CC4=CC=C1C2=C43 BBEAQIROQSPTKN-UHFFFAOYSA-N 0.000 description 6
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 6
- 125000004414 alkyl thio group Chemical group 0.000 description 5
- ZADPBFCGQRWHPN-UHFFFAOYSA-N boronic acid Chemical compound OBO ZADPBFCGQRWHPN-UHFFFAOYSA-N 0.000 description 5
- 125000000609 carbazolyl group Chemical group C1(=CC=CC=2C3=CC=CC=C3NC12)* 0.000 description 5
- 125000006165 cyclic alkyl group Chemical group 0.000 description 5
- 125000000113 cyclohexyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 5
- 150000002739 metals Chemical class 0.000 description 5
- 239000011368 organic material Substances 0.000 description 5
- 229910052709 silver Inorganic materials 0.000 description 5
- SIKJAQJRHWYJAI-UHFFFAOYSA-N Indole Chemical compound C1=CC=C2NC=CC2=C1 SIKJAQJRHWYJAI-UHFFFAOYSA-N 0.000 description 4
- PCNDJXKNXGMECE-UHFFFAOYSA-N Phenazine Natural products C1=CC=CC2=NC3=CC=CC=C3N=C21 PCNDJXKNXGMECE-UHFFFAOYSA-N 0.000 description 4
- KYQCOXFCLRTKLS-UHFFFAOYSA-N Pyrazine Chemical compound C1=CN=CC=N1 KYQCOXFCLRTKLS-UHFFFAOYSA-N 0.000 description 4
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical compound C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 4
- KAESVJOAVNADME-UHFFFAOYSA-N Pyrrole Chemical compound C=1C=CNC=1 KAESVJOAVNADME-UHFFFAOYSA-N 0.000 description 4
- YTPLMLYBLZKORZ-UHFFFAOYSA-N Thiophene Chemical compound C=1C=CSC=1 YTPLMLYBLZKORZ-UHFFFAOYSA-N 0.000 description 4
- 230000000903 blocking effect Effects 0.000 description 4
- 238000004364 calculation method Methods 0.000 description 4
- WDECIBYCCFPHNR-UHFFFAOYSA-N chrysene Chemical compound C1=CC=CC2=CC=C3C4=CC=CC=C4C=CC3=C21 WDECIBYCCFPHNR-UHFFFAOYSA-N 0.000 description 4
- IYYZUPMFVPLQIF-UHFFFAOYSA-N dibenzothiophene Chemical compound C1=CC=C2C3=CC=CC=C3SC2=C1 IYYZUPMFVPLQIF-UHFFFAOYSA-N 0.000 description 4
- 238000002347 injection Methods 0.000 description 4
- 239000007924 injection Substances 0.000 description 4
- XSCHRSMBECNVNS-UHFFFAOYSA-N quinoxaline Chemical compound N1=CC=NC2=CC=CC=C21 XSCHRSMBECNVNS-UHFFFAOYSA-N 0.000 description 4
- 239000000758 substrate Substances 0.000 description 4
- WJFKNYWRSNBZNX-UHFFFAOYSA-N 10H-phenothiazine Chemical compound C1=CC=C2NC3=CC=CC=C3SC2=C1 WJFKNYWRSNBZNX-UHFFFAOYSA-N 0.000 description 3
- CZPWVGJYEJSRLH-UHFFFAOYSA-N Pyrimidine Chemical compound C1=CN=CN=C1 CZPWVGJYEJSRLH-UHFFFAOYSA-N 0.000 description 3
- 238000000862 absorption spectrum Methods 0.000 description 3
- 229910052782 aluminium Inorganic materials 0.000 description 3
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 3
- 239000002585 base Substances 0.000 description 3
- 239000011229 interlayer Substances 0.000 description 3
- 239000011777 magnesium Substances 0.000 description 3
- 150000002894 organic compounds Chemical class 0.000 description 3
- 239000001301 oxygen Substances 0.000 description 3
- 229950000688 phenothiazine Drugs 0.000 description 3
- BASFCYQUMIYNBI-UHFFFAOYSA-N platinum Chemical compound [Pt] BASFCYQUMIYNBI-UHFFFAOYSA-N 0.000 description 3
- PBMFSQRYOILNGV-UHFFFAOYSA-N pyridazine Chemical compound C1=CC=NN=C1 PBMFSQRYOILNGV-UHFFFAOYSA-N 0.000 description 3
- 239000007787 solid Substances 0.000 description 3
- 238000001228 spectrum Methods 0.000 description 3
- ZFXBERJDEUDDMX-UHFFFAOYSA-N 1,2,3,5-tetrazine Chemical compound C1=NC=NN=N1 ZFXBERJDEUDDMX-UHFFFAOYSA-N 0.000 description 2
- UGUHFDPGDQDVGX-UHFFFAOYSA-N 1,2,3-thiadiazole Chemical compound C1=CSN=N1 UGUHFDPGDQDVGX-UHFFFAOYSA-N 0.000 description 2
- JYEUMXHLPRZUAT-UHFFFAOYSA-N 1,2,3-triazine Chemical compound C1=CN=NN=C1 JYEUMXHLPRZUAT-UHFFFAOYSA-N 0.000 description 2
- HTJMXYRLEDBSLT-UHFFFAOYSA-N 1,2,4,5-tetrazine Chemical compound C1=NN=CN=N1 HTJMXYRLEDBSLT-UHFFFAOYSA-N 0.000 description 2
- BBVIDBNAYOIXOE-UHFFFAOYSA-N 1,2,4-oxadiazole Chemical compound C=1N=CON=1 BBVIDBNAYOIXOE-UHFFFAOYSA-N 0.000 description 2
- YGTAZGSLCXNBQL-UHFFFAOYSA-N 1,2,4-thiadiazole Chemical compound C=1N=CSN=1 YGTAZGSLCXNBQL-UHFFFAOYSA-N 0.000 description 2
- FYADHXFMURLYQI-UHFFFAOYSA-N 1,2,4-triazine Chemical compound C1=CN=NC=N1 FYADHXFMURLYQI-UHFFFAOYSA-N 0.000 description 2
- UDGKZGLPXCRRAM-UHFFFAOYSA-N 1,2,5-thiadiazole Chemical compound C=1C=NSN=1 UDGKZGLPXCRRAM-UHFFFAOYSA-N 0.000 description 2
- DXBHBZVCASKNBY-UHFFFAOYSA-N 1,2-Benz(a)anthracene Chemical compound C1=CC=C2C3=CC4=CC=CC=C4C=C3C=CC2=C1 DXBHBZVCASKNBY-UHFFFAOYSA-N 0.000 description 2
- FKASFBLJDCHBNZ-UHFFFAOYSA-N 1,3,4-oxadiazole Chemical compound C1=NN=CO1 FKASFBLJDCHBNZ-UHFFFAOYSA-N 0.000 description 2
- MBIZXFATKUQOOA-UHFFFAOYSA-N 1,3,4-thiadiazole Chemical compound C1=NN=CS1 MBIZXFATKUQOOA-UHFFFAOYSA-N 0.000 description 2
- JIHQDMXYYFUGFV-UHFFFAOYSA-N 1,3,5-triazine Chemical compound C1=NC=NC=N1 JIHQDMXYYFUGFV-UHFFFAOYSA-N 0.000 description 2
- FLBAYUMRQUHISI-UHFFFAOYSA-N 1,8-naphthyridine Chemical compound N1=CC=CC2=CC=CN=C21 FLBAYUMRQUHISI-UHFFFAOYSA-N 0.000 description 2
- TZMSYXZUNZXBOL-UHFFFAOYSA-N 10H-phenoxazine Chemical compound C1=CC=C2NC3=CC=CC=C3OC2=C1 TZMSYXZUNZXBOL-UHFFFAOYSA-N 0.000 description 2
- QWENRTYMTSOGBR-UHFFFAOYSA-N 1H-1,2,3-Triazole Chemical compound C=1C=NNN=1 QWENRTYMTSOGBR-UHFFFAOYSA-N 0.000 description 2
- HYZJCKYKOHLVJF-UHFFFAOYSA-N 1H-benzimidazole Chemical compound C1=CC=C2NC=NC2=C1 HYZJCKYKOHLVJF-UHFFFAOYSA-N 0.000 description 2
- BAXOFTOLAUCFNW-UHFFFAOYSA-N 1H-indazole Chemical compound C1=CC=C2C=NNC2=C1 BAXOFTOLAUCFNW-UHFFFAOYSA-N 0.000 description 2
- USYCQABRSUEURP-UHFFFAOYSA-N 1h-benzo[f]benzimidazole Chemical compound C1=CC=C2C=C(NC=N3)C3=CC2=C1 USYCQABRSUEURP-UHFFFAOYSA-N 0.000 description 2
- VEPOHXYIFQMVHW-XOZOLZJESA-N 2,3-dihydroxybutanedioic acid (2S,3S)-3,4-dimethyl-2-phenylmorpholine Chemical compound OC(C(O)C(O)=O)C(O)=O.C[C@H]1[C@@H](OCCN1C)c1ccccc1 VEPOHXYIFQMVHW-XOZOLZJESA-N 0.000 description 2
- LYTMVABTDYMBQK-UHFFFAOYSA-N 2-benzothiophene Chemical compound C1=CC=CC2=CSC=C21 LYTMVABTDYMBQK-UHFFFAOYSA-N 0.000 description 2
- VHMICKWLTGFITH-UHFFFAOYSA-N 2H-isoindole Chemical compound C1=CC=CC2=CNC=C21 VHMICKWLTGFITH-UHFFFAOYSA-N 0.000 description 2
- BPMFPOGUJAAYHL-UHFFFAOYSA-N 9H-Pyrido[2,3-b]indole Chemical compound C1=CC=C2C3=CC=CC=C3NC2=N1 BPMFPOGUJAAYHL-UHFFFAOYSA-N 0.000 description 2
- XKRFYHLGVUSROY-UHFFFAOYSA-N Argon Chemical compound [Ar] XKRFYHLGVUSROY-UHFFFAOYSA-N 0.000 description 2
- YLQBMQCUIZJEEH-UHFFFAOYSA-N Furan Chemical compound C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 2
- MZRVEZGGRBJDDB-UHFFFAOYSA-N N-Butyllithium Chemical compound [Li]CCCC MZRVEZGGRBJDDB-UHFFFAOYSA-N 0.000 description 2
- WTKZEGDFNFYCGP-UHFFFAOYSA-N Pyrazole Chemical compound C=1C=NNC=1 WTKZEGDFNFYCGP-UHFFFAOYSA-N 0.000 description 2
- DPOPAJRDYZGTIR-UHFFFAOYSA-N Tetrazine Chemical compound C1=CN=NN=N1 DPOPAJRDYZGTIR-UHFFFAOYSA-N 0.000 description 2
- DGEZNRSVGBDHLK-UHFFFAOYSA-N [1,10]phenanthroline Chemical compound C1=CN=C2C3=NC=CC=C3C=CC2=C1 DGEZNRSVGBDHLK-UHFFFAOYSA-N 0.000 description 2
- DZBUGLKDJFMEHC-UHFFFAOYSA-N acridine Chemical compound C1=CC=CC2=CC3=CC=CC=C3N=C21 DZBUGLKDJFMEHC-UHFFFAOYSA-N 0.000 description 2
- 150000001340 alkali metals Chemical class 0.000 description 2
- 150000001342 alkaline earth metals Chemical class 0.000 description 2
- 125000002947 alkylene group Chemical group 0.000 description 2
- 125000004429 atom Chemical group 0.000 description 2
- 229910052788 barium Inorganic materials 0.000 description 2
- QRUDEWIWKLJBPS-UHFFFAOYSA-N benzotriazole Chemical compound C1=CC=C2N[N][N]C2=C1 QRUDEWIWKLJBPS-UHFFFAOYSA-N 0.000 description 2
- 239000012964 benzotriazole Substances 0.000 description 2
- 125000006267 biphenyl group Chemical group 0.000 description 2
- 150000001716 carbazoles Chemical class 0.000 description 2
- 238000001816 cooling Methods 0.000 description 2
- 230000008878 coupling Effects 0.000 description 2
- 238000010168 coupling process Methods 0.000 description 2
- 238000005859 coupling reaction Methods 0.000 description 2
- 125000004093 cyano group Chemical group *C#N 0.000 description 2
- TXCDCPKCNAJMEE-UHFFFAOYSA-N dibenzofuran Chemical compound C1=CC=C2C3=CC=CC=C3OC2=C1 TXCDCPKCNAJMEE-UHFFFAOYSA-N 0.000 description 2
- JKFAIQOWCVVSKC-UHFFFAOYSA-N furazan Chemical compound C=1C=NON=1 JKFAIQOWCVVSKC-UHFFFAOYSA-N 0.000 description 2
- 230000005283 ground state Effects 0.000 description 2
- 230000005525 hole transport Effects 0.000 description 2
- 150000002430 hydrocarbons Chemical group 0.000 description 2
- AMGQUBHHOARCQH-UHFFFAOYSA-N indium;oxotin Chemical compound [In].[Sn]=O AMGQUBHHOARCQH-UHFFFAOYSA-N 0.000 description 2
- PZOUSPYUWWUPPK-UHFFFAOYSA-N indole Natural products CC1=CC=CC2=C1C=CN2 PZOUSPYUWWUPPK-UHFFFAOYSA-N 0.000 description 2
- RKJUIXBNRJVNHR-UHFFFAOYSA-N indolenine Natural products C1=CC=C2CC=NC2=C1 RKJUIXBNRJVNHR-UHFFFAOYSA-N 0.000 description 2
- AWJUIBRHMBBTKR-UHFFFAOYSA-N isoquinoline Chemical compound C1=NC=CC2=CC=CC=C21 AWJUIBRHMBBTKR-UHFFFAOYSA-N 0.000 description 2
- 229910052749 magnesium Inorganic materials 0.000 description 2
- 229910044991 metal oxide Inorganic materials 0.000 description 2
- 150000004706 metal oxides Chemical class 0.000 description 2
- 239000012074 organic phase Substances 0.000 description 2
- WCPAKWJPBJAGKN-UHFFFAOYSA-N oxadiazole Chemical compound C1=CON=N1 WCPAKWJPBJAGKN-UHFFFAOYSA-N 0.000 description 2
- SLIUAWYAILUBJU-UHFFFAOYSA-N pentacene Chemical compound C1=CC=CC2=CC3=CC4=CC5=CC=CC=C5C=C4C=C3C=C21 SLIUAWYAILUBJU-UHFFFAOYSA-N 0.000 description 2
- 125000002080 perylenyl group Chemical group C1(=CC=C2C=CC=C3C4=CC=CC5=CC=CC(C1=C23)=C45)* 0.000 description 2
- CSHWQDPOILHKBI-UHFFFAOYSA-N peryrene Natural products C1=CC(C2=CC=CC=3C2=C2C=CC=3)=C3C2=CC=CC3=C1 CSHWQDPOILHKBI-UHFFFAOYSA-N 0.000 description 2
- RDOWQLZANAYVLL-UHFFFAOYSA-N phenanthridine Chemical compound C1=CC=C2C3=CC=CC=C3C=NC2=C1 RDOWQLZANAYVLL-UHFFFAOYSA-N 0.000 description 2
- 229910052697 platinum Inorganic materials 0.000 description 2
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Natural products COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 description 2
- JWVCLYRUEFBMGU-UHFFFAOYSA-N quinazoline Chemical compound N1=CN=CC2=CC=CC=C21 JWVCLYRUEFBMGU-UHFFFAOYSA-N 0.000 description 2
- 125000002943 quinolinyl group Chemical group N1=C(C=CC2=CC=CC=C12)* 0.000 description 2
- 238000010992 reflux Methods 0.000 description 2
- 238000000926 separation method Methods 0.000 description 2
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N silicon dioxide Inorganic materials O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 2
- 238000003756 stirring Methods 0.000 description 2
- IFLREYGFSNHWGE-UHFFFAOYSA-N tetracene Chemical compound C1=CC=CC2=CC3=CC4=CC=CC=C4C=C3C=C21 IFLREYGFSNHWGE-UHFFFAOYSA-N 0.000 description 2
- 150000003536 tetrazoles Chemical class 0.000 description 2
- 229930192474 thiophene Natural products 0.000 description 2
- SLGBZMMZGDRARJ-UHFFFAOYSA-N triphenylene Chemical compound C1=CC=C2C3=CC=CC=C3C3=CC=CC=C3C2=C1 SLGBZMMZGDRARJ-UHFFFAOYSA-N 0.000 description 2
- 238000007740 vapor deposition Methods 0.000 description 2
- 238000001947 vapour-phase growth Methods 0.000 description 2
- FNQJDLTXOVEEFB-UHFFFAOYSA-N 1,2,3-benzothiadiazole Chemical class C1=CC=C2SN=NC2=C1 FNQJDLTXOVEEFB-UHFFFAOYSA-N 0.000 description 1
- WCSKHSJQFUUMDC-UHFFFAOYSA-N 1,3-benzothiazole quinoxaline Chemical compound N1=CC=NC2=CC=CC=C12.S1C=NC2=C1C=CC=C2 WCSKHSJQFUUMDC-UHFFFAOYSA-N 0.000 description 1
- BCMCBBGGLRIHSE-UHFFFAOYSA-N 1,3-benzoxazole Chemical compound C1=CC=C2OC=NC2=C1 BCMCBBGGLRIHSE-UHFFFAOYSA-N 0.000 description 1
- IGHOZKDBCCFNNC-UHFFFAOYSA-N 1h-imidazole;quinoxaline Chemical compound C1=CNC=N1.N1=CC=NC2=CC=CC=C21 IGHOZKDBCCFNNC-UHFFFAOYSA-N 0.000 description 1
- YMRIDJQAEZFTSC-UHFFFAOYSA-N 2,3-dihydro-1h-tetrazole Chemical compound N1NC=NN1 YMRIDJQAEZFTSC-UHFFFAOYSA-N 0.000 description 1
- WNEXSUAHKVAPFK-UHFFFAOYSA-N 2,8-dibromodibenzothiophene Chemical compound C1=C(Br)C=C2C3=CC(Br)=CC=C3SC2=C1 WNEXSUAHKVAPFK-UHFFFAOYSA-N 0.000 description 1
- VZXWIPIYAOGJID-UHFFFAOYSA-N 2-(9H-carbazol-1-yl)benzonitrile Chemical class C1(=CC=CC=2C3=CC=CC=C3NC1=2)C1=C(C=CC=C1)C#N VZXWIPIYAOGJID-UHFFFAOYSA-N 0.000 description 1
- UXGVMFHEKMGWMA-UHFFFAOYSA-N 2-benzofuran Chemical compound C1=CC=CC2=COC=C21 UXGVMFHEKMGWMA-UHFFFAOYSA-N 0.000 description 1
- HHVGZHHLRBNWAD-UHFFFAOYSA-N 4,6-diphenyltriazine Chemical compound C1=CC=CC=C1C1=CC(C=2C=CC=CC=2)=NN=N1 HHVGZHHLRBNWAD-UHFFFAOYSA-N 0.000 description 1
- NSPMIYGKQJPBQR-UHFFFAOYSA-N 4H-1,2,4-triazole Chemical compound C=1N=CNN=1 NSPMIYGKQJPBQR-UHFFFAOYSA-N 0.000 description 1
- SNFCXVRWFNAHQX-UHFFFAOYSA-N 9,9'-spirobi[fluorene] Chemical compound C12=CC=CC=C2C2=CC=CC=C2C21C1=CC=CC=C1C1=CC=CC=C21 SNFCXVRWFNAHQX-UHFFFAOYSA-N 0.000 description 1
- 229910001316 Ag alloy Inorganic materials 0.000 description 1
- 229910016036 BaF 2 Inorganic materials 0.000 description 1
- LZBNYQZCNUYJGK-UHFFFAOYSA-N Brc1ccc2[s]c(ccc(-c3cc(-c4ccccc4)cc(-c4ccccc4)c3)c3)c3c2c1 Chemical compound Brc1ccc2[s]c(ccc(-c3cc(-c4ccccc4)cc(-c4ccccc4)c3)c3)c3c2c1 LZBNYQZCNUYJGK-UHFFFAOYSA-N 0.000 description 1
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 1
- 229910018068 Li 2 O Inorganic materials 0.000 description 1
- FYYHWMGAXLPEAU-UHFFFAOYSA-N Magnesium Chemical compound [Mg] FYYHWMGAXLPEAU-UHFFFAOYSA-N 0.000 description 1
- 229910000861 Mg alloy Inorganic materials 0.000 description 1
- GLIQMRVGQAJTFB-UHFFFAOYSA-N Oc(cc1)cc(c2c3)c1[s]c2ccc3Br Chemical compound Oc(cc1)cc(c2c3)c1[s]c2ccc3Br GLIQMRVGQAJTFB-UHFFFAOYSA-N 0.000 description 1
- ZCQWOFVYLHDMMC-UHFFFAOYSA-N Oxazole Chemical compound C1=COC=N1 ZCQWOFVYLHDMMC-UHFFFAOYSA-N 0.000 description 1
- 229910052772 Samarium Inorganic materials 0.000 description 1
- BQCADISMDOOEFD-UHFFFAOYSA-N Silver Chemical compound [Ag] BQCADISMDOOEFD-UHFFFAOYSA-N 0.000 description 1
- PJANXHGTPQOBST-VAWYXSNFSA-N Stilbene Natural products C=1C=CC=CC=1/C=C/C1=CC=CC=C1 PJANXHGTPQOBST-VAWYXSNFSA-N 0.000 description 1
- 238000006069 Suzuki reaction reaction Methods 0.000 description 1
- XBDYBAVJXHJMNQ-UHFFFAOYSA-N Tetrahydroanthracene Natural products C1=CC=C2C=C(CCCC3)C3=CC2=C1 XBDYBAVJXHJMNQ-UHFFFAOYSA-N 0.000 description 1
- FZWLAAWBMGSTSO-UHFFFAOYSA-N Thiazole Chemical compound C1=CSC=N1 FZWLAAWBMGSTSO-UHFFFAOYSA-N 0.000 description 1
- WCQRWCFGZARAMR-UHFFFAOYSA-N [F].[F] Chemical compound [F].[F] WCQRWCFGZARAMR-UHFFFAOYSA-N 0.000 description 1
- XHCLAFWTIXFWPH-UHFFFAOYSA-N [O-2].[O-2].[O-2].[O-2].[O-2].[V+5].[V+5] Chemical compound [O-2].[O-2].[O-2].[O-2].[O-2].[V+5].[V+5] XHCLAFWTIXFWPH-UHFFFAOYSA-N 0.000 description 1
- 238000010521 absorption reaction Methods 0.000 description 1
- 229910052783 alkali metal Inorganic materials 0.000 description 1
- 229910000573 alkali metal alloy Inorganic materials 0.000 description 1
- 229910001515 alkali metal fluoride Inorganic materials 0.000 description 1
- 229910052784 alkaline earth metal Inorganic materials 0.000 description 1
- 229910000941 alkaline earth metal alloy Inorganic materials 0.000 description 1
- 229910001618 alkaline earth metal fluoride Inorganic materials 0.000 description 1
- HSFWRNGVRCDJHI-UHFFFAOYSA-N alpha-acetylene Natural products C#C HSFWRNGVRCDJHI-UHFFFAOYSA-N 0.000 description 1
- XAGFODPZIPBFFR-UHFFFAOYSA-N aluminium Chemical compound [Al] XAGFODPZIPBFFR-UHFFFAOYSA-N 0.000 description 1
- 239000010405 anode material Substances 0.000 description 1
- 229910052786 argon Inorganic materials 0.000 description 1
- 229910052785 arsenic Inorganic materials 0.000 description 1
- 125000005110 aryl thio group Chemical group 0.000 description 1
- 125000003785 benzimidazolyl group Chemical group N1=C(NC2=C1C=CC=C2)* 0.000 description 1
- WMUIZUWOEIQJEH-UHFFFAOYSA-N benzo[e][1,3]benzoxazole Chemical compound C1=CC=C2C(N=CO3)=C3C=CC2=C1 WMUIZUWOEIQJEH-UHFFFAOYSA-N 0.000 description 1
- WPYMKLBDIGXBTP-UHFFFAOYSA-N benzoic acid Chemical compound OC(=O)C1=CC=CC=C1 WPYMKLBDIGXBTP-UHFFFAOYSA-N 0.000 description 1
- 125000002529 biphenylenyl group Chemical group C1(=CC=CC=2C3=CC=CC=C3C12)* 0.000 description 1
- KGBXLFKZBHKPEV-UHFFFAOYSA-N boric acid Chemical compound OB(O)O KGBXLFKZBHKPEV-UHFFFAOYSA-N 0.000 description 1
- 239000004327 boric acid Substances 0.000 description 1
- 229910052796 boron Inorganic materials 0.000 description 1
- 230000031709 bromination Effects 0.000 description 1
- 238000005893 bromination reaction Methods 0.000 description 1
- 125000004369 butenyl group Chemical group C(=CCC)* 0.000 description 1
- 125000000480 butynyl group Chemical group [*]C#CC([H])([H])C([H])([H])[H] 0.000 description 1
- 229910052791 calcium Inorganic materials 0.000 description 1
- 229910052801 chlorine Inorganic materials 0.000 description 1
- WCZVZNOTHYJIEI-UHFFFAOYSA-N cinnoline Chemical compound N1=NC=CC2=CC=CC=C21 WCZVZNOTHYJIEI-UHFFFAOYSA-N 0.000 description 1
- 238000010549 co-Evaporation Methods 0.000 description 1
- 239000011248 coating agent Substances 0.000 description 1
- 238000000576 coating method Methods 0.000 description 1
- 230000000052 comparative effect Effects 0.000 description 1
- 238000002484 cyclic voltammetry Methods 0.000 description 1
- 125000001162 cycloheptenyl group Chemical group C1(=CCCCCC1)* 0.000 description 1
- 125000000582 cycloheptyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 1
- 125000000596 cyclohexenyl group Chemical group C1(=CCCCC1)* 0.000 description 1
- 125000000522 cyclooctenyl group Chemical group C1(=CCCCCCC1)* 0.000 description 1
- 125000002433 cyclopentenyl group Chemical group C1(=CCCC1)* 0.000 description 1
- 125000001511 cyclopentyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 1
- 230000000254 damaging effect Effects 0.000 description 1
- 230000002950 deficient Effects 0.000 description 1
- 239000003599 detergent Substances 0.000 description 1
- 238000011161 development Methods 0.000 description 1
- 125000004986 diarylamino group Chemical group 0.000 description 1
- 150000001987 diarylethers Chemical class 0.000 description 1
- 125000005240 diheteroarylamino group Chemical group 0.000 description 1
- XXPBFNVKTVJZKF-UHFFFAOYSA-N dihydrophenanthrene Natural products C1=CC=C2CCC3=CC=CC=C3C2=C1 XXPBFNVKTVJZKF-UHFFFAOYSA-N 0.000 description 1
- 238000006073 displacement reaction Methods 0.000 description 1
- 230000000694 effects Effects 0.000 description 1
- 238000000295 emission spectrum Methods 0.000 description 1
- 239000000839 emulsion Substances 0.000 description 1
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 1
- 125000002534 ethynyl group Chemical group [H]C#C* 0.000 description 1
- 238000011156 evaluation Methods 0.000 description 1
- 125000003914 fluoranthenyl group Chemical group C1(=CC=C2C=CC=C3C4=CC=CC=C4C1=C23)* 0.000 description 1
- 239000007789 gas Substances 0.000 description 1
- 239000011521 glass Substances 0.000 description 1
- 229910052737 gold Inorganic materials 0.000 description 1
- 125000005843 halogen group Chemical group 0.000 description 1
- 125000000623 heterocyclic group Chemical group 0.000 description 1
- 125000006038 hexenyl group Chemical group 0.000 description 1
- 125000005980 hexynyl group Chemical group 0.000 description 1
- 239000001257 hydrogen Substances 0.000 description 1
- 125000002883 imidazolyl group Chemical group 0.000 description 1
- WUNJCKOTXFSWBK-UHFFFAOYSA-N indeno[2,1-a]carbazole Chemical compound C1=CC=C2C=C3C4=NC5=CC=CC=C5C4=CC=C3C2=C1 WUNJCKOTXFSWBK-UHFFFAOYSA-N 0.000 description 1
- 229910052738 indium Inorganic materials 0.000 description 1
- 125000003406 indolizinyl group Chemical class C=1(C=CN2C=CC=CC12)* 0.000 description 1
- VVVPGLRKXQSQSZ-UHFFFAOYSA-N indolo[3,2-c]carbazole Chemical compound C1=CC=CC2=NC3=C4C5=CC=CC=C5N=C4C=CC3=C21 VVVPGLRKXQSQSZ-UHFFFAOYSA-N 0.000 description 1
- 229960005544 indolocarbazole Drugs 0.000 description 1
- 238000007641 inkjet printing Methods 0.000 description 1
- 229910052741 iridium Inorganic materials 0.000 description 1
- GKOZUEZYRPOHIO-UHFFFAOYSA-N iridium atom Chemical compound [Ir] GKOZUEZYRPOHIO-UHFFFAOYSA-N 0.000 description 1
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 1
- 125000002183 isoquinolinyl group Chemical group C1(=NC=CC2=CC=CC=C12)* 0.000 description 1
- 229910052747 lanthanoid Inorganic materials 0.000 description 1
- 150000002602 lanthanoids Chemical class 0.000 description 1
- 239000003446 ligand Substances 0.000 description 1
- IMKMFBIYHXBKRX-UHFFFAOYSA-M lithium;quinoline-2-carboxylate Chemical compound [Li+].C1=CC=CC2=NC(C(=O)[O-])=CC=C21 IMKMFBIYHXBKRX-UHFFFAOYSA-M 0.000 description 1
- 239000008204 material by function Substances 0.000 description 1
- 150000001247 metal acetylides Chemical class 0.000 description 1
- 229910001092 metal group alloy Inorganic materials 0.000 description 1
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 1
- 229910003455 mixed metal oxide Inorganic materials 0.000 description 1
- 229910000476 molybdenum oxide Inorganic materials 0.000 description 1
- 125000004108 n-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000003136 n-heptyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000001280 n-hexyl group Chemical group C(CCCCC)* 0.000 description 1
- 125000000740 n-pentyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000004123 n-propyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000005244 neohexyl group Chemical group [H]C([H])([H])C(C([H])([H])[H])(C([H])([H])[H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000001971 neopentyl group Chemical group [H]C([*])([H])C(C([H])([H])[H])(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 125000004433 nitrogen atom Chemical group N* 0.000 description 1
- QGLKJKCYBOYXKC-UHFFFAOYSA-N nonaoxidotritungsten Chemical compound O=[W]1(=O)O[W](=O)(=O)O[W](=O)(=O)O1 QGLKJKCYBOYXKC-UHFFFAOYSA-N 0.000 description 1
- TVMXDCGIABBOFY-UHFFFAOYSA-N octane Chemical compound CCCCCCCC TVMXDCGIABBOFY-UHFFFAOYSA-N 0.000 description 1
- 125000004365 octenyl group Chemical group C(=CCCCCCC)* 0.000 description 1
- 238000007645 offset printing Methods 0.000 description 1
- 230000003287 optical effect Effects 0.000 description 1
- 238000005457 optimization Methods 0.000 description 1
- 125000000962 organic group Chemical group 0.000 description 1
- 239000012044 organic layer Substances 0.000 description 1
- 230000003647 oxidation Effects 0.000 description 1
- 238000007254 oxidation reaction Methods 0.000 description 1
- 230000001590 oxidative effect Effects 0.000 description 1
- PQQKPALAQIIWST-UHFFFAOYSA-N oxomolybdenum Chemical compound [Mo]=O PQQKPALAQIIWST-UHFFFAOYSA-N 0.000 description 1
- 125000004430 oxygen atom Chemical group O* 0.000 description 1
- 125000002255 pentenyl group Chemical group C(=CCCC)* 0.000 description 1
- 125000005981 pentynyl group Chemical group 0.000 description 1
- 239000012071 phase Substances 0.000 description 1
- FIZIRKROSLGMPL-UHFFFAOYSA-N phenoxazin-1-one Chemical compound C1=CC=C2N=C3C(=O)C=CC=C3OC2=C1 FIZIRKROSLGMPL-UHFFFAOYSA-N 0.000 description 1
- UOMHBFAJZRZNQD-UHFFFAOYSA-N phenoxazone Natural products C1=CC=C2OC3=CC(=O)C=CC3=NC2=C1 UOMHBFAJZRZNQD-UHFFFAOYSA-N 0.000 description 1
- 229910052698 phosphorus Inorganic materials 0.000 description 1
- 229920000642 polymer Polymers 0.000 description 1
- 238000002360 preparation method Methods 0.000 description 1
- 125000002568 propynyl group Chemical group [*]C#CC([H])([H])[H] 0.000 description 1
- 125000001042 pteridinyl group Chemical class N1=C(N=CC2=NC=CN=C12)* 0.000 description 1
- 238000000746 purification Methods 0.000 description 1
- 125000000561 purinyl group Chemical class N1=C(N=C2N=CNC2=C1)* 0.000 description 1
- 125000003226 pyrazolyl group Chemical group 0.000 description 1
- 125000005495 pyridazyl group Chemical group 0.000 description 1
- 150000003222 pyridines Chemical class 0.000 description 1
- 239000010453 quartz Substances 0.000 description 1
- 230000005855 radiation Effects 0.000 description 1
- 239000011541 reaction mixture Substances 0.000 description 1
- 238000007650 screen-printing Methods 0.000 description 1
- 239000004065 semiconductor Substances 0.000 description 1
- 239000000741 silica gel Substances 0.000 description 1
- 229910002027 silica gel Inorganic materials 0.000 description 1
- 239000004332 silver Substances 0.000 description 1
- 125000003808 silyl group Chemical group [H][Si]([H])([H])[*] 0.000 description 1
- 238000010561 standard procedure Methods 0.000 description 1
- PJANXHGTPQOBST-UHFFFAOYSA-N stilbene Chemical compound C=1C=CC=CC=1C=CC1=CC=CC=C1 PJANXHGTPQOBST-UHFFFAOYSA-N 0.000 description 1
- 235000021286 stilbenes Nutrition 0.000 description 1
- 239000000126 substance Substances 0.000 description 1
- 239000000725 suspension Substances 0.000 description 1
- 125000006836 terphenylene group Chemical group 0.000 description 1
- 238000001931 thermography Methods 0.000 description 1
- 125000004001 thioalkyl group Chemical group 0.000 description 1
- 238000000411 transmission spectrum Methods 0.000 description 1
- 125000005259 triarylamine group Chemical group 0.000 description 1
- WRECIMRULFAWHA-UHFFFAOYSA-N trimethyl borate Chemical compound COB(OC)OC WRECIMRULFAWHA-UHFFFAOYSA-N 0.000 description 1
- 229910001930 tungsten oxide Inorganic materials 0.000 description 1
- 238000002061 vacuum sublimation Methods 0.000 description 1
- 229910001935 vanadium oxide Inorganic materials 0.000 description 1
- YVTHLONGBIQYBO-UHFFFAOYSA-N zinc indium(3+) oxygen(2-) Chemical compound [O--].[Zn++].[In+3] YVTHLONGBIQYBO-UHFFFAOYSA-N 0.000 description 1
Classifications
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/649—Aromatic compounds comprising a hetero atom
- H10K85/654—Aromatic compounds comprising a hetero atom comprising only nitrogen as heteroatom
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D307/00—Heterocyclic compounds containing five-membered rings having one oxygen atom as the only ring hetero atom
- C07D307/77—Heterocyclic compounds containing five-membered rings having one oxygen atom as the only ring hetero atom ortho- or peri-condensed with carbocyclic rings or ring systems
- C07D307/91—Dibenzofurans; Hydrogenated dibenzofurans
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D491/00—Heterocyclic compounds containing in the condensed ring system both one or more rings having oxygen atoms as the only ring hetero atoms and one or more rings having nitrogen atoms as the only ring hetero atoms, not provided for by groups C07D451/00 - C07D459/00, C07D463/00, C07D477/00 or C07D489/00
- C07D491/02—Heterocyclic compounds containing in the condensed ring system both one or more rings having oxygen atoms as the only ring hetero atoms and one or more rings having nitrogen atoms as the only ring hetero atoms, not provided for by groups C07D451/00 - C07D459/00, C07D463/00, C07D477/00 or C07D489/00 in which the condensed system contains two hetero rings
- C07D491/04—Ortho-condensed systems
- C07D491/044—Ortho-condensed systems with only one oxygen atom as ring hetero atom in the oxygen-containing ring
- C07D491/048—Ortho-condensed systems with only one oxygen atom as ring hetero atom in the oxygen-containing ring the oxygen-containing ring being five-membered
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D495/00—Heterocyclic compounds containing in the condensed system at least one hetero ring having sulfur atoms as the only ring hetero atoms
- C07D495/02—Heterocyclic compounds containing in the condensed system at least one hetero ring having sulfur atoms as the only ring hetero atoms in which the condensed system contains two hetero rings
- C07D495/04—Ortho-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K11/00—Luminescent, e.g. electroluminescent, chemiluminescent materials
- C09K11/02—Use of particular materials as binders, particle coatings or suspension media therefor
- C09K11/025—Use of particular materials as binders, particle coatings or suspension media therefor non-luminescent particle coatings or suspension media
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K11/00—Luminescent, e.g. electroluminescent, chemiluminescent materials
- C09K11/06—Luminescent, e.g. electroluminescent, chemiluminescent materials containing organic luminescent materials
-
- H01L51/0072—
-
- H01L51/0073—
-
- H01L51/5012—
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K50/00—Organic light-emitting devices
- H10K50/10—OLEDs or polymer light-emitting diodes [PLED]
- H10K50/11—OLEDs or polymer light-emitting diodes [PLED] characterised by the electroluminescent [EL] layers
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/649—Aromatic compounds comprising a hetero atom
- H10K85/657—Polycyclic condensed heteroaromatic hydrocarbons
- H10K85/6572—Polycyclic condensed heteroaromatic hydrocarbons comprising only nitrogen in the heteroaromatic polycondensed ring system, e.g. phenanthroline or carbazole
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/649—Aromatic compounds comprising a hetero atom
- H10K85/657—Polycyclic condensed heteroaromatic hydrocarbons
- H10K85/6574—Polycyclic condensed heteroaromatic hydrocarbons comprising only oxygen in the heteroaromatic polycondensed ring system, e.g. cumarine dyes
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1003—Carbocyclic compounds
- C09K2211/1007—Non-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1003—Carbocyclic compounds
- C09K2211/1011—Condensed systems
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1018—Heterocyclic compounds
- C09K2211/1025—Heterocyclic compounds characterised by ligands
- C09K2211/1029—Heterocyclic compounds characterised by ligands containing one nitrogen atom as the heteroatom
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1018—Heterocyclic compounds
- C09K2211/1025—Heterocyclic compounds characterised by ligands
- C09K2211/1029—Heterocyclic compounds characterised by ligands containing one nitrogen atom as the heteroatom
- C09K2211/1033—Heterocyclic compounds characterised by ligands containing one nitrogen atom as the heteroatom with oxygen
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1018—Heterocyclic compounds
- C09K2211/1025—Heterocyclic compounds characterised by ligands
- C09K2211/1029—Heterocyclic compounds characterised by ligands containing one nitrogen atom as the heteroatom
- C09K2211/1037—Heterocyclic compounds characterised by ligands containing one nitrogen atom as the heteroatom with sulfur
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1018—Heterocyclic compounds
- C09K2211/1025—Heterocyclic compounds characterised by ligands
- C09K2211/1044—Heterocyclic compounds characterised by ligands containing two nitrogen atoms as heteroatoms
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1018—Heterocyclic compounds
- C09K2211/1025—Heterocyclic compounds characterised by ligands
- C09K2211/1059—Heterocyclic compounds characterised by ligands containing three nitrogen atoms as heteroatoms
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1018—Heterocyclic compounds
- C09K2211/1025—Heterocyclic compounds characterised by ligands
- C09K2211/1088—Heterocyclic compounds characterised by ligands containing oxygen as the only heteroatom
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1018—Heterocyclic compounds
- C09K2211/1025—Heterocyclic compounds characterised by ligands
- C09K2211/1092—Heterocyclic compounds characterised by ligands containing sulfur as the only heteroatom
-
- H01L2251/552—
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K2101/00—Properties of the organic materials covered by group H10K85/00
- H10K2101/30—Highest occupied molecular orbital [HOMO], lowest unoccupied molecular orbital [LUMO] or Fermi energy values
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K2101/00—Properties of the organic materials covered by group H10K85/00
- H10K2101/40—Interrelation of parameters between multiple constituent active layers or sublayers, e.g. HOMO values in adjacent layers
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K71/00—Manufacture or treatment specially adapted for the organic devices covered by this subclass
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K71/00—Manufacture or treatment specially adapted for the organic devices covered by this subclass
- H10K71/40—Thermal treatment, e.g. annealing in the presence of a solvent vapour
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/649—Aromatic compounds comprising a hetero atom
- H10K85/657—Polycyclic condensed heteroaromatic hydrocarbons
- H10K85/6576—Polycyclic condensed heteroaromatic hydrocarbons comprising only sulfur in the heteroaromatic polycondensed ring system, e.g. benzothiophene
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Engineering & Computer Science (AREA)
- Materials Engineering (AREA)
- Physics & Mathematics (AREA)
- Spectroscopy & Molecular Physics (AREA)
- Optics & Photonics (AREA)
- Electroluminescent Light Sources (AREA)
Abstract
본 발명은 S1과 T1 에너지들 준위들 간의 차이가 작은 화합물 및 식 (I) 또는 (II) 의 또 다른 화합물을 포함하는 방출층을 포함하는 유기 전계발광 디바이스 (OLED) 에 관한 것이다.
Description
본 출원은 방출층 (emitting layer) 을 포함하는 유기 전계발광 디바이스 (OLED) 에 관한 것으로, 방출층은 S1 과 T1 상태들의 에너지들 간의 차이가 작은 화합물 및 부가하여 식 (I) 또는 (II) 의 추가 화합물을 포함한다.
일반적으로, 용어 OLED 는 전기 전압의 인가시 광을 방출하고 적어도 하나의 유기 재료를 포함하는 전자 디바이스를 의미하는 것으로 여겨진다. OLED들의 기본 구조는 당업자에게 알려져 있으며, 그 중에서도, US 4539507, US 5151629, EP 0676461 및 WO 98/27136 에 기재되어 있다.
화합물의 S1과 T1 상태의 에너지들은, 본 출원의 목적을 위해서, 양자 화학적 계산에 의해 화합물의 관련 상태에 대해 얻어지는 에너지들로서 정의된다. S1 상태는 여기서 에너지적으로 최저 여기 단일항 상태이며 T1 상태는 에너지적으로 최저 삼중항 상태이다. 양자 화학적 계산이 실행되는 정확한 방식은 작업예들에 기재된다.
신규한 OLED들의 개발에 있어서, 디바이스의 효율성과 동작 전압의 개선에 상당한 관심이 있다. 더욱이, 디바이스의 수명 개선에 관심이 있다. 더욱 더, 제조하기에 간단하고 저렴하며, 그리고 간단히 조제될 수 있는 저렴한 재료들로부터 특히 빌드업될 수 있는 OLED의 제공에 관심이 있다.
매우 양호한 효율성을 갖는 OLED들이 인광을 발하지 않고 대신 형광을 발하는 소정의 순수 유기 방출 화합물들에 의해 얻어질 수 있다는 것은 종래 기술로부터 알려져 있다. 예를 들어, H. Uoyama 등의, Nature 2012, 492, 234에는, 방출 화합물들로서의 카르바졸릴시아노벤젠 화합물들에 의해 획득될 수 있는 인광 에미터들에 의해 획득될 수 있는 외부 양자 효율성과 유사하거나 또는 보다 나은 외부 양자 효율성을 갖는 OLED들이 개시되어 있다.
이 공보에서 사용되는 방출 화합물들은 S1과 T1 상태들 간의 에너지 차이가 작다. 에너지 차이는 바람직하게 열적 에너지 이하의 영역에 있다. 상기 공보에는, 매트릭스 재료를 대표하는 추가 화합물과 조합한 방출층에서의 이들 방출 화합물들의 사용이 기재되어 있다. 개시된 매트릭스 재료는 그 중에서도 카르바졸 유도체 CBP 및 아릴포스핀 산화물 PPT이다.
더욱이, S1과 T1 상태들 간의 에너지 차이가 작은 상기 언급된 방출 화합물들이 또한 매트릭스 재료로서의 아릴실란 화합물 TBSi-F과 조합하여 채용되어 이로울 수 있다는 것이 종래 기술로부터 알려져 있다 (G. Mehes, Angew. Chem. Int. Ed. 2012, 51, 11311-11315).
이러한 진보에도 불구하고, OLED의 분야에서, 특히 이러한 디바이스들의 방출층을 위한 조성물들의 분야에서, 개선에 대한 필요성이 계속되고 있다. 또한, 종래 기술에서의 OLED들과 비교할만한 OLED들의 성능 데이터를 초래하는, OLED들의 방출층에 대한 대체 실시형태들의 제공에 상당한 관심이 있다.
이를 위해, 상기 언급된 방출 화합물들과 조합하여 사용하기 위한 매트릭스 재료로서 어떤 화합물들이 적합한지에 대한 연구가 본 출원의 일부로서 수행되어 왔다. 이를 위해, OLED들에서 기능성 재료들로 사용하기에 적합한 것으로 알려져 있는 구조 부류의 방대한 다양성이 당업자에게 이용가능하다.
이들 연구에서, 놀랍게도, 소정의 구조를 갖는 아릴디벤조푸란 화합물 및 아릴디벤조티오펜 화합물이, S1과 T1 상태들 간의 에너지 차이가 작은 상기 언급된 방출 화합물들과 조합하여 매트릭스 재료로서 사용하기에 매우 적합하다는 것이 밝혀졌다. 그 중에서도, 동작 전압 U1000, 외부 양자 효율성 EQE, 수명 및 롤 오프에 대한 매우 양호한 값들 (설명을 위해 작업예를 참조) 이 여기서 얻어진다. 이리듐 또는 백금 착물을 방출체로서 포함하는 전계발광 디바이스들과 비교하여, 본 발명에 따른 디바이스들의 경우 상승된 온도에서 보다 긴 수명이 얻어진다.
즉, 본 출원은 화합물 E 및 화합물 M을 포함하는 방출층을 포함하는 유기 전계발광 디바이스에 관한 것으로,
화합물 E는 S1과 T1 상태들의 에너지들 간의 값 차이가 최대 0.15 eV 이며, 그리고
화합물 M은 식 (I) 또는 (II) 에 따르며,
이 경우:
Y는 각각의 발생시, 동일하거나 또는 상이하게, O, S 또는 Se 이고;
Z는 각각의 발생시, 동일하거나 또는 상이하게, CR1, C 또는 N이고, 여기서 Z는 기 L1 또는 L2가 L1 또는 L2에 결합되는 기와 함께 Z에 결합된다면 정확하게 C와 동일하고;
L1, L2는 각각의 발생시, 동일하거나 또는 상이하게, 단일 결합 또는 이가기이고;
Ar1은 각각의 발생시, 동일하거나 또는 상이하게, 하나 이상의 라디칼들 R2에 의해 치환될 수도 있는, 5 ∼ 40개의 방향족 고리 원자들을 갖는 방향족 또는 헤테로방향족 고리계이고;
R1, R2는 각각의 발생시, 동일하거나 또는 상이하게, H, D, F, C(=O)R3, CN, Si(R3)3, N(R3)2, P(=O)(R3)2, OR3, S(=O)R3, S(=O)2R3, 1 ∼ 20 개의 C 원자들을 갖는 직쇄 알킬 또는 알콕시기 또는 3 ∼ 20 개의 C 원자들을 갖는 분지형 또는 환형 알킬 또는 알콕시기 또는 2 ∼ 20 개의 C 원자들을 갖는 알케닐 또는 알키닐기 (여기서 상기 언급된 기들은 각각 하나 이상의 라디칼들 R3에 의해 치환될 수 있으며, 상기 언급된 기들 내의 하나 이상의 CH2 기들은 -R3C=CR3-, -C≡C-, Si(R3)2, C=O, C=NR3, -C(=O)O-, -C(=O)NR3-, NR3, P(=O)(R3), -O-, -S-, SO 또는 SO2에 의해 대체될 수 있음), 또는 각각의 경우 하나 이상의 라디칼들 R3에 의해 치환될 수도 있는, 5 ∼ 30 개의 방향족 고리 원자들을 갖는 방향족 또는 헤테로방향족 고리계이고, 여기서 2개 이상의 라디칼들 R1 또는 R2는 서로 연결될 수도 있고 고리를 형성할 수도 있으며;
R3은 각각의 발생시, 동일하거나 또는 상이하게, H, D, F, C(=O)R4, CN, Si(R4)3, N(R4)2, P(=O)(R4)2, OR4, S(=O)R4, S(=O)2R4, 1 ∼ 20 개의 C 원자들을 갖는 직쇄 알킬 또는 알콕시기 또는 3 ∼ 20 개의 C 원자들을 갖는 분지형 또는 환형 알킬 또는 알콕시기 또는 2 ∼ 20 개의 C 원자들을 갖는 알케닐 또는 알키닐기 (여기서 상기 언급된 기들은 각각 하나 이상의 라디칼들 R4 에 의해 치환될 수 있으며, 상기 언급된 기들 내의 하나 이상의 CH2 기들은 -R4C=CR4-, -C≡C-, Si(R4)2, C=O, C=NR4, -C(=O)O-, -C(=O)NR4-, NR4, P(=O)(R4), -O-, -S-, SO 또는 SO2에 의해 대체될 수 있음), 또는 각각의 경우 하나 이상의 라디칼들 R4에 의해 치환될 수도 있는, 5 ∼ 30 개의 방향족 고리 원자들을 갖는 방향족 또는 헤테로방향족 고리계이고, 여기서 2개 이상의 라디칼들 R3은 서로 연결될 수도 있고 고리를 형성할 수도 있으며;
R4는 각각의 발생시, 동일하거나 또는 상이하게, H, D, F 또는 1 ∼ 20 개의 C 원자들을 갖는 지방족, 방향족 또는 헤테로방향족 유기 라디칼이고, 여기서 부가적으로 하나 이상의 H 원자들은 D 또는 F에 의해 대체될 수도 있으며; 2개 이상의 치환기들 R4는 여기서 서로 연결될 수도 있고 고리를 형성할 수도 있으며;
n은 0 또는 1과 동일하며;
여기서 상기 에너지들은 작업예들에 기재되는 바와 같이 양자 화학적 계산에 의해 결정된다.
본 출원의 의미에서 이가기는, 2개의 자유 결합들을 갖는 임의의 원하는 유기기를 의미하는 것으로 여겨진다. 이것은, 예를 들어, 헤테로원자, 탄화수소쇄, 탄화수소 고리, 또는 상기 언급된 복수 단위들의 함께 묶음 (stringing together) 또는 연결 (linking) 일 수 있다. 여기서 단위들은 치환되거나 비치환될 수도 있다.
본 발명의 의미에서 아릴기는 6 ∼ 60 개의 방향족 고리 원자들을 포함하고; 본 발명의 의미에서 헤테로아릴기는 5 ∼ 60 개의 방향족 고리 원자들을 포함하며, 그 적어도 하나는 헤테로원자이다. 헤테로원자들은 바람직하게 N, O 및 S 로부터 선택된다. 이것은 기본적인 정의를 나타낸다. 본 발명의 설명에서, 예를 들어, 방향족 고리 원자들의 수 또는 헤테로원자들의 존재와 관련하여, 다른 바람직함이 표시된다면, 이들이 적용된다.
아릴기 또는 헤테로아릴기는 여기서 단순 (simple) 방향족 고리, 즉, 벤젠, 또는 단순 헤테로방향족 고리, 예를 들어 피리딘, 피리미딘 또는 티오펜, 또는 축합된 (융합된) 방향족 또는 헤테로방향족 다환, 예를 들어 나프탈렌, 페난트렌, 퀴놀린 또는 카르바졸 중 어느 하나를 의미하는 것으로 여겨진다. 본 출원의 의미에서 축합된 (융합된) 방향족 또는 헤테로방향족 다환은 서로 축합된 2개 이상의 단순 방향족 또는 헤테로 방향족 고리들로 이루어진다.
각각의 경우 상기 언급된 라디칼들에 의해 치환될 수도 있고 임의의 원하는 위치들을 통해 방향족 또는 헤테로방향족 고리계에 연결될 수도 있는, 아릴 또는 헤테로아릴기는 특히 벤젠, 나프탈렌, 안트라센, 페난트렌, 피렌, 디히드로피렌, 크리센, 페릴렌, 플루오란텐, 벤즈안트라센, 벤조페난트렌, 테트라센, 펜타센, 벤조피렌, 푸란, 벤조푸란, 이소벤조푸란, 디벤조푸란, 티오펜, 벤조티오펜, 이소벤조티오펜, 디벤조푸란, 티오펜, 벤조티오펜, 이소벤조티오펜, 디벤조티오펜, 피롤, 인돌, 이소인돌, 카르바졸, 피리딘, 퀴놀린, 이소퀴놀린, 아크리딘, 페난트리딘, 벤조-5,6-퀴놀린, 벤조-6,7-퀴놀린, 벤조-7,8-퀴놀린, 페노티아진, 페녹사진, 피라졸, 인다졸, 이미다졸, 벤즈이미다졸, 나프트이미다졸, 페난트리미다졸, 피리디미다졸, 피라진이미다졸, 퀴녹살린이미다졸, 옥사졸, 벤조옥사졸, 나프토옥사졸, 안트로옥사졸, 페난트로옥사졸, 이소옥사졸, 1,2-티아졸, 1,3-티아졸, 벤조티아졸, 피리다진, 벤조피리다진, 피리미딘, 벤조피리미딘, 퀴녹살린, 피라진, 페나진, 나프티리딘, 아자카르바졸, 벤조카르볼린, 페난트롤린, 1,2,3-트리아졸, 1,2,4-트리아졸, 벤조트리아졸, 1,2,3-옥사디아졸, 1,2,4-옥사디아졸, 1,2,5-옥사디아졸, 1,3,4-옥사디아졸, 1,2,3-티아디아졸, 1,2,4-티아디아졸, 1,2,5-티아디아졸, 1,3,4-티아디아졸, 1,3,5-트리아진, 1,2,4-트리아진, 1,2,3-트리아진, 테트라졸, 1,2,4,5-테트라진, 1,2,3,4-테트라진, 1,2,3,5-테트라진, 푸린, 프테리딘, 인돌리진 및 벤조티아디아졸로부터 유도된 기들을 의미하는 것으로 여겨진다.
본 발명의 의미에서 방향족 고리계는 고리계 내에 6 ∼ 60개의 C 원자들을 함유한다. 본 발명의 의미에서의 헤테로방향족 고리계는 고리계 내에 5 ∼ 60개의 방향족 고리 원자들을 포함하고 그 중 적어도 하나는 헤테로원자이다. 헤테로원자들은 N, O 및/또는 S 로부터 선택되는 것이 바람직하다. 본 발명의 의미에서의 방향족 또는 헤테로방향족 고리계는, 반드시 아릴 또는 헤테로아릴기만을 포함할 필요는 없으며, 그 대신에 부가하여 복수의 아릴 또는 헤테로아릴기들이 비방향족 단위 (바람직하게는 H 이외의 원자들의 10% 미만), 예를 들어 sp3-혼성화된 C, Si, N 또는 O 원자, sp2-혼성화된 C 또는 N 또는 sp-혼성화된 C 원자에 의해 연결될 수도 있는 계를 의미하는 것으로 여겨진다. 이로써, 예를 들어, 9,9'-스피로비플루오렌, 9,9'-디아릴플루오렌, 트리아릴아민, 디아릴 에테르, 스틸벤 등과 같은 계들이 또한 본 발명의 의미에서의 방향족 고리계인 것으로 여겨지며, 이는 2개 이상의 아릴기들이 예를 들어 선형 또는 환형 알킬, 알케닐 또는 알키닐기에 의해 또는 실릴기에 의해 연결되는 계들이다. 더욱이, 2개 이상의 아릴 또는 헤테로아릴기들이 단일 결합들을 통해 서로 연결되는 계들이 또한 본 발명의 의미에서 방향족 또는 헤테로방향족 고리계들인 것으로 여겨지며, 예를 들어, 비페닐, 터페닐 또는 디페닐트리아진과 같은 계들이 있다.
각각의 경우 상기에 정의된 라디칼들에 의해 치환될 수도 있고 임의의 원하는 위치들을 통해 방향족 또는 헤테로방향족기에 연결될 수도 있는, 5 ∼ 60 개의 방향족 고리 원자들을 갖는 방향족 또는 헤테로방향족 고리계는, 특히 벤젠, 나프탈렌, 안트라센, 벤즈안트라센, 페난트렌, 벤조페난트렌, 피렌, 크리센, 페릴렌, 플루오란텐, 나프타센, 펜타센, 벤조피렌, 비페닐, 비페닐렌, 터페닐, 터페닐렌, 쿼터페닐, 플루오렌, 스피로비플루오렌, 디히드로페난트렌, 디히드로피렌, 테트라히드로피렌, cis- 또는 trans-인데노플루오렌, 트루센, 이소트루센, 스피로트루센, 스피로이소트루센, 푸란, 벤조푸란, 이소벤조푸란, 디벤조푸란, 티오펜, 벤조티오펜, 이소벤조티오펜, 디벤조티오펜, 피롤, 인돌, 이소인돌, 카르바졸, 인돌로카르바졸, 인데노카르바졸, 피리딘, 퀴놀린, 이소퀴놀린, 아크리딘, 페난트리딘, 벤조-5,6-퀴놀린, 벤조-6,7-퀴놀린, 벤조-7,8-퀴놀린, 페노티아진, 페녹사진, 피라졸, 인다졸, 이미다졸, 벤즈이미다졸, 나프트이미다졸, 페난트리미다졸, 피리디미다졸, 피라진이미다졸, 퀴녹살린이미다졸, 옥사졸, 벤즈옥사졸, 나프트옥사졸, 안트로옥사졸, 페난트로옥사졸, 이소옥사졸, 1,2-티아졸, 1,3-티아졸, 벤조티아졸, 피리다진, 벤조피리다진, 피리미딘, 벤조피리미딘, 퀴녹살린, 1,5-디아자안트라센, 2,7-디아자피렌, 2,3-디아자피렌, 1,6-디아자피렌, 1,8-디아자피렌, 4,5-디아자피렌, 4,5,9,10-테트라아자페릴렌, 피라진, 페나진, 페녹사진, 페노티아진, 플루오루빈, 나프티리딘, 아자카르바졸, 벤조카르볼린, 페난트롤린, 1,2,3-트리아졸, 1,2,4-트리아졸, 벤조트리아졸, 1,2,3-옥사디아졸, 1,2,4-옥사디아졸, 1,2,5-옥사디아졸, 1,3,4-옥사디아졸, 1,2,3-티아디아졸, 1,2,4-티아디아졸, 1,2,5-티아디아졸, 1,3,4-티아디아졸, 1,3,5-트리아진, 1,2,4-트리아진, 1,2,3-트리아진, 테트라졸, 1,2,4,5-테트라진, 1,2,3,4-테트라진, 1,2,3,5-테트라진, 푸린, 프테리딘, 인돌리진 및 벤조티아디아졸, 또는 이들 기들의 조합들로부터 유도된 기들을 의미하는 것으로 여겨진다.
본 발명의 목적을 위해서, 부가하여, 개별 H 원자들 또는 CH2 기들이 라디칼들의 정의하에서 상기에 언급된 기들에 의해 치환될 수도 있는, 1 ∼ 40 개의 C 원자들을 갖는 직사슬 알킬기 또는 3 ∼ 40 개의 C 원자들을 갖는 분지형 또는 환형 알킬기 또는 2 ∼ 40 개의 C 원자들을 갖는 알케닐 또는 알키닐기는, 바람직하게 라디칼들 메틸, 에틸, n-프로필, i-프로필, n-부틸, i-부틸, s-부틸, t-부틸, 2-메틸부틸, n-펜틸, s-펜틸, 시클로펜틸, 네오펜틸, n-헥실, 시클로헥실, 네오헥실, n-헵틸, 시클로헵틸, n-옥틸, 시클로옥틸, 2-에틸헥실, 트리플루오로메틸, 펜타플루오로에틸, 2,2,2-트리플루오로에틸, 에테닐, 프로페닐, 부테닐, 펜테닐, 시클로펜테닐, 헥세닐, 시클로헥세닐, 헵테닐, 시클로헵테닐, 옥테닐, 시클로옥테닐, 에티닐, 프로피닐, 부티닐, 펜티닐, 헥시닐 또는 옥티닐을 의미하는 것으로 여겨진다. 1 ∼ 40 개의 C 원자들을 갖는 알콕시 또는 티오알킬기는 바람직하게 메톡시, 트리플루오로메톡시, 에톡시, n-프로폭시, i-프로폭시, n-부톡시, i-부톡시, s-부톡시, t-부톡시, n-펜톡시, s-펜톡시, 2-메틸부톡시, n-헥속시, 시클로헥실옥시, n-헵톡시, 시클로헵틸옥시, n-옥틸옥시, 시클로옥틸옥시, 2-에틸헥실옥시, 펜타플루오로에톡시, 2,2,2-트리플루오로에톡시, 메틸티오, 에틸티오, n-프로필티오, i-프로필티오, n-부틸티오, i-부틸티오, s-부틸티오, t-부틸티오, n-펜틸티오, s-펜틸티오, n-헥실티오, 시클로헥실티오, n-헵틸티오, 시클로헵틸티오, n-옥틸티오, 시클로옥틸티오, 2-에틸헥실티오, 트리플루오로메틸티오, 펜타플루오로에틸티오, 2,2,2-트리플루오로에틸티오, 에테닐티오, 프로페닐티오, 부테닐티오, 펜테닐티오, 시클로펜테닐티오, 헥세닐티오, 시클로헥세닐티오, 헵테닐티오, 시클로헵테닐티오, 옥테닐티오, 시클로옥테닐티오, 에티닐티오, 프로피닐티오, 부티닐티오, 펜티닐티오, 헥시닐티오, 헵티닐티오 또는 옥티닐티오를 의미하는 것으로 여겨진다.
2개 이상의 라디칼들이 서로 고리를 형성할 수 있는 조성물은, 그 중에서도, 2개의 라디칼들이 화학 결합에 의해 서로 연결되는 것을 의미하는 것으로 여겨지는 것으로 본 출원의 목적을 위해서 의도된다. 하지만, 더욱이, 상기 언급된 조성물은 또한, 2개의 라디칼들 중 하나가 수소를 나타내는 경우, 두번째 라디칼이 수소 원자가 결합되어 고리를 형성하는 위치에 결합되는 것을 의미하는 것으로 여겨진다.
고리당 2개 이하의 Z가 N과 동일한 것이 바람직하고, 고리당 1개 이하의 Z가 N과 동일한 것이 특히 바람직하다.
바람직한 실시형태에 따르면, Z는 각각의 발생시, 동일하거나 또는 상이하게, CR1 또는 C이고, 여기서 Z는 기 L1 또는 L1가 기 L1 또는 L1에 결합되는 기와 함께 Z에 결합된다면 정확하게 C와 동일하다.
Y는 바람직하게 각각의 발생시, 동일하거나 또는 상이하게, O 또는 S 이다.
L1은 바람직하게 각각의 발생시, 동일하거나 또는 상이하게, 단일 결합, Si(R2)2, O, S 또는 1 ∼ 10 개의 C 원자들을 갖는 알킬렌기 (여기서 하나 이상의 CH2 기들은 Si(R2)2, O, S, C=O, C=NR2, C=O-O, C=O-NR2, NR2, P(=O)(R2), SO 또는 SO2에 의해 대체될 수도 있고 하나 이상의 라디칼들 R2에 의해 치환될 수 있음), 또는 각각의 경우 하나 이상의 라디칼들 R2에 의해 치환될 수도 있는, 5 ∼ 30 개의 방향족 고리 원자들을 갖는 방향족 또는 헤테로방향족 고리계로부터 선택된다.
L1은 특히 바람직하게 각각의 발생시, 동일하거나 또는 상이하게, 단일 결합, Si(R2)2, 또는 하나 이상의 라디칼들 R2에 의해 치환될 수도 있는, 5 ∼ 30 개의 방향족 고리 원자들을 갖는 방향족 또는 헤테로방향족 고리계로부터 선택되며; L1은 매우 특히 바람직하게 각각의 발생시, 동일하거나 또는 상이하게, 단일 결합 또는 하나 이상의 라디칼들 R2에 의해 치환될 수도 있는, 5 ∼ 30 개의 방향족 고리 원자들을 갖는 방향족 또는 헤테로방향족 고리계로부터 선택된다.
L2는 바람직하게 단일 결합, Si(R2)2, O, S 또는 1 ∼ 10 개의 C 원자들을 갖는 알킬렌기 (여기서 하나 이상의 CH2 기들은 Si(R2)2, O, S, C=O, C=NR2, C=O-O, C=O-NR2, NR2, P(=O)(R2), SO 또는 SO2에 의해 대체될 수도 있고 하나 이상의 라디칼들 R2에 의해 치환될 수 있음), 또는 각각의 경우 하나 이상의 라디칼들 R2에 의해 치환될 수도 있는, 5 ∼ 60 개의 방향족 고리 원자들을 갖는 방향족 또는 헤테로방향족 고리계로부터 선택된다.
L2는 특히 바람직하게 단일 결합 또는 하나 이상의 라디칼들 R2에 의해 치환될 수도 있는, 5 ∼ 60 개의 방향족 고리 원자들을 갖는 방향족 또는 헤테로방향족 고리계로부터 선택되며; L2는 매우 특히 바람직하게 하나 이상의 라디칼들 R2에 의해 치환될 수도 있는, 5 ∼ 60 개의 방향족 고리 원자들을 갖는 방향족 또는 헤테로방향족 고리계이다.
Ar1은 바람직하게 각각의 발생시, 동일하거나 또는 상이하게, 하나 이상의 라디칼들 R2에 의해 치환될 수도 있는, 5 ∼ 18개의 방향족 고리 원자들, 특히 바람직하게 5 ∼ 16개의 방향족 고리 원자들을 갖는 방향족 또는 헤테로방향족 고리계이다. Ar1은 특히 바람직하게 페닐, 비페닐, 터페닐, 쿼터페닐, 플루오레닐, 스피로비플루오레닐, 인데노플루오레닐, 나프틸, 안트라세닐, 페난트레닐, 피레닐, 플루오란테닐, 푸라닐, 벤조푸라닐, 이소벤조푸라닐, 디벤조푸라닐, 티오페닐, 벤조티오페닐, 이소벤조티오페닐, 디벤조티오페닐, 피롤릴, 인돌릴, 이소인돌릴, 카르바졸릴, 인돌로카르바졸릴, 인데노카르바졸릴, 피리딜, 퀴놀리닐, 이소퀴놀리닐, 아크리딜, 피라졸릴, 이미다졸릴, 벤즈이미다졸릴, 피리다질, 피리미딜, 피라지닐 및 페난트롤릴로부터 선택되고, 그 각각은 선택적으로 라디칼들 R2에 의해 치환된다.
R1 은 바람직하게 각각의 발생시, 동일하거나 또는 상이하게, H, D, F, CN, Si(R3)3, 1 ∼ 10 개의 C 원자들을 갖는 직쇄 알킬 또는 알콕시기 또는 3 ∼ 10 개의 C 원자들을 갖는 분지형 또는 환형 알킬 또는 알콕시기 (여기서 상기 언급된 기들은 각각 하나 이상의 라디칼들 R3에 의해 치환될 수 있으며, 상기 언급된 기들 내의 하나 이상의 CH2 기들은 -C≡C-, -R3C=CR3-, Si(R3)2, C=O, C=NR3, -NR3-, -O-, -S-, -C(=O)O- 또는 -C(=O)NR3- 에 의해 대체될 수 있음), 또는 각각의 경우 하나 이상의 라디칼들 R3에 의해 치환될 수도 있는, 5 ∼ 20 개의 방향족 고리 원자들을 갖는 방향족 또는 헤테로방향족 고리계이고, 여기서 2개 이상의 라디칼들 R1은 서로 연결될 수도 있고 고리를 형성할 수도 있다.
R1은 특히 바람직하게 각각의 발생시, 동일하거나 또는 상이하게, H, F, CN, 1 ∼ 10 개의 C 원자들을 갖는 직쇄 알킬기 또는 3 ∼ 10 개의 C 원자들을 갖는 분지형 또는 환형 알킬기 (여기서 알킬기들은 각각 하나 이상의 라디칼들 R3에 의해 치환될 수도 있음), 또는 각각의 경우 하나 이상의 라디칼들 R3에 의해 치환될 수도 있는, 5 ∼ 20 개의 방향족 고리 원자들을 갖는 방향족 또는 헤테로방향족 고리계로부터 선택된다.
R2는 바람직하게 각각의 발생시, 동일하거나 또는 상이하게, H, D, F, CN, Si(R3)3, 1 ∼ 10 개의 C 원자들을 갖는 직쇄 알킬 또는 알콕시기 또는 3 ∼ 10 개의 C 원자들을 갖는 분지형 또는 환형 알킬 또는 알콕시기 (여기서 상기 언급된 기들은 각각 하나 이상의 라디칼들 R3에 의해 치환될 수 있으며, 상기 언급된 기들 내의 하나 이상의 CH2 기들은 -C≡C-, -R3C=CR3-, Si(R3)2, C=O, C=NR3, -NR3-, -O-, -S-, -C(=O)O- 또는 -C(=O)NR3-에 의해 대체될 수 있음), 또는 각각의 경우 하나 이상의 라디칼들 R3에 의해 치환될 수도 있는, 5 ∼ 20 개의 방향족 고리 원자들을 갖는 방향족 또는 헤테로방향족 고리계로부터 선택되고, 여기서 2개 이상의 라디칼들 R2는 서로 연결될 수도 있고 고리를 형성할 수도 있다.
R2는 특히 바람직하게 각각의 발생시, 동일하거나 또는 상이하게, H, F, CN, 1 ∼ 10 개의 C 원자들을 갖는 직쇄 알킬기 또는 3 ∼ 10 개의 C 원자들을 갖는 분지형 또는 환형 알킬기 (여기서 알킬기들은 각각 하나 이상의 라디칼들 R3에 의해 치환될 수도 있음), 또는 각각의 경우 하나 이상의 라디칼들 R3에 의해 치환될 수도 있는, 5 ∼ 20 개의 방향족 고리 원자들을 갖는 방향족 또는 헤테로방향족 고리계로부터 선택된다.
R3은 바람직하게 각각의 발생시, 동일하거나 또는 상이하게, H, D, F, CN, Si(R4)3, 1 ∼ 10 개의 C 원자들을 갖는 직쇄 알킬 또는 알콕시기 또는 3 ∼ 10 개의 C 원자들을 갖는 분지형 또는 환형 알킬 또는 알콕시기 (여기서 상기 언급된 기들은 각각 하나 이상의 라디칼들 R4에 의해 치환될 수 있으며, 상기 언급된 기들 내의 하나 이상의 CH2 기들은 -C≡C-, -R4C=CR4-, Si(R4)2, C=O, C=NR4, -NR4-, -O-, -S-, -C(=O)O- 또는 -C(=O)NR4- 에 의해 대체될 수 있음), 또는 각각의 경우 하나 이상의 라디칼들 R4에 의해 치환될 수도 있는, 5 ∼ 20 개의 방향족 고리 원자들을 갖는 방향족 또는 헤테로방향족 고리계로부터 선택되고, 여기서 2개 이상의 라디칼들 R3은 서로 연결될 수도 있고 고리를 형성할 수도 있다.
R3은 특히 바람직하게 각각의 발생시, 동일하거나 또는 상이하게, H, F, CN, 1 ∼ 10 개의 C 원자들을 갖는 직쇄 알킬기 또는 3 ∼ 10 개의 C 원자들을 갖는 분지형 또는 환형 알킬기 (여기서 알킬기들은 각각 하나 이상의 라디칼들 R4에 의해 치환될 수도 있음), 또는 각각의 경우 하나 이상의 라디칼들 R4 에 의해 치환될 수도 있는, 5 ∼ 20 개의 방향족 고리 원자들을 갖는 방향족 또는 헤테로방향족 고리계로부터 선택된다.
일반적으로, 식 (I) 의 모든 바람직한 실시형태들에 대해, L1의 결합 위치는 아래에 나타낸 바와 같이 중심 골격의 위치들 1, 2, 3, 4, 6, 7, 8 및 9로부터 선택된 위치에 있을 수 있다.
일반적으로, 식 (II) 의 모든 바람직한 실시형태들에 대해, L2의 결합 위치는 아래에 나타낸 바와 같이 중심 골격의 위치들 1, 2, 3 및 4로부터 선택된 위치에 있을 수 있다.
식 (I) 의 바람직한 실시형태들은 하기 식들 (I-1) 내지 (I-4) 에 따른다.
식중 발생하는 기들은 상기와 같이 정의된다.
바람직하게 식들 (I-1) 내지 (I-4) 에서 발생하는 기들은 상기에 나타낸 그 바람직한 실시형태들에 상응한다.
식 (I-1) 및 (I-3)의 바람직한 실시형태들은 하기 식들 (I-1-1) 및 (I-1-2) 및 (I-3-1) 및 (I-3-2) 이다:
식중:
V는 각각의 발생시, 동일하거나 또는 상이하게, CR2, C 또는 N이고, 여기서 V는 기 L1이 거기에 결합되는 기라면 정확하게 C와 동일하고, 그리고 그 단서는 적어도 하나의 기 V가 N과 동일한 것에도 적용되며;
Z1은 각각의 발생시, 동일하거나 또는 상이하게, CR2, C 또는 N이고, 여기서 Z1은 기 L1이 기 L1에 결합된다면 정확하게 C와 동일하며;
Ar2는 하나 이상의 라디칼들 R2에 의해 치환될 수도 있는 10 ∼ 14개의 방향족 고리 원자들을 갖는 축합된 아릴기이며;
그리고 발생하는 다른 기들은 상기와 같이 정의된다.
식들 (I-1-1) 내지 (I-1-2) 및 (I-3-1) 내지 (I-3-2)에서 발생하는 기들은 바람직하게 상기에 나타낸 그 바람직한 실시형태들에 상응한다.
Z1이 CR2 또는 C와 동일한 것이 더욱 바람직하며, 여기서 Z1은 기 L1이 거기에 결합된다면 정확하게 C와 동일하다.
고리에서의 정확하게 1, 2 또는 3개의 기들 V가 N과 동일하고, 그리고 나머지 기들 V가 CR2 또는 C와 동일한 것이 더욱 바람직하다. 여기서는 고리중의 2개 이하의 인접하는 기들 V가 N과 동일한 것이 바람직하고, 고리에서의 인접하지 않는 기들 V가 N과 동일한 것이 특히 바람직하다.
식들 (I-1-1) 및 (I-1-2) 및 (I-3-1) 및 (I-3-2)에서의 L1이 단일 결합, 또는 라디칼들 R2에 의해 선택적으로 치환되는 페닐기 또는 비페닐기인 것이 더욱 바람직하다.
식 (I-2) 및 (I-4)의 바람직한 실시형태들은 하기 식들 (I-2-1) 내지 (I-2-4) 및 (I-4-1) 내지 (I-4-4):
식중:
V는 각각의 발생시, 동일하거나 또는 상이하게, CR2, C 또는 N이고, 여기서 V는 기 L1이 거기에 결합되는 기라면 정확하게 C와 동일하고, 그리고 그 단서는 적어도 하나의 기 V가 N과 동일한 것에도 적용되며;
Z1은 각각의 발생시, 동일하거나 또는 상이하게, CR2, C 또는 N이고, 여기서 Z1은 기 L1이 거기에 결합된다면 정확하게 C와 동일하며;
Ar2는 하나 이상의 라디칼들 R2에 의해 치환될 수도 있는 10 ∼ 14개의 방향족 고리 원자들을 갖는 축합된 아릴기이며;
그리고 발생하는 다른 기들은 상기와 같이 정의된다.
식들 (I-2-1) 내지 (I-2-4) 및 (I-4-1) 내지 (I-4-4)에서 발생하는 기들은 바람직하게 상기에 나타낸 그 바람직한 실시형태들에 상응한다.
Z1이 CR2 또는 C와 동일한 것이 더욱 바람직하며, 여기서 Z1은 기 L1이 거기에 결합된다면 정확하게 C와 동일하다.
고리에서의 정확하게 1, 2 또는 3개의 기들 V가 N과 동일하고, 그리고 나머지 기들 V가 CR2 또는 C와 동일한 것이 더욱 바람직하다. 여기서는 고리중의 2개 이하의 인접하는 기들 V가 N과 동일한 것이 바람직하고, 고리에서의 인접하지 않는 기들 V가 N과 동일한 것이 특히 바람직하다.
식들 (I-2-2), (I-2-3), (I-4-2) 및 (I-4-3)에 있어서 기 Z1의 치환기로서의 적어도 하나의 기 R2가, 라디칼들 R3에 의해 선택적으로 치환되는, 카르바졸기를 나타내는 것이 특히 바람직하다.
Ar2가, 하나 이상의 라디칼들 R2에 의해 치환될 수도 있는, 페난트레닐기인 것이 더욱 바람직하다.
식들 (I-2-1) 내지 (I-2-4) 및 (I-4-1) 내지 (I-4-4)에 있어서 L1이 단일 결합, 기 Si(R2)2, 또는 라디칼들 R2에 의해 선택적으로 치환되는 페닐기 또는 비페닐기인 것이 더욱 바람직하다.
식 (II) 의 바람직한 실시형태들은 하기 식들 (II-1) 내지 (II-3) 에 따른다.
식중 발생하는 기들은 상기와 같이 정의된다.
식들 (II-1) 내지 (II-3)에서 발생하는 기들은 바람직하게 상기에 나타낸 그 바람직한 실시형태들에 상응한다.
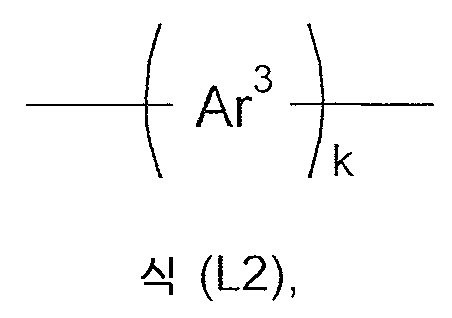
식들 (II-1) 내지 (II-3)에서의 기 L2는 바람직하게 단일 결합 또는 식 (L2)의 단위로부터 선택된다.
식중:
Ar3은 각각의 발생시, 동일하거나 또는 상이하게, 하나 이상의 라디칼들 R2에 의해 치환될 수도 있는, 6 ∼ 14 개의 방향족 고리 원자들을 갖는 아릴렌 또는 헤테로아릴렌기이고; 그리고
k는 1, 2, 3 또는 4과 동일하다.
여기서 Ar3은 바람직하게 페닐, 피리딜, 피리미딜, 나프틸, 페난트레닐, 퀴놀리닐, 카르바졸릴, 디벤조푸라닐 및 디벤조티오페닐로부터 선택된다.
여기서 k 는 바람직하게 1, 2 또는 3과 동일하다.
하기 화합물들은 식 (I) 또는 (II) 의 화합물들 M의 예들이다.
식들 (I) 및 (II) 의 화합물 M은 알려져 있는 유기 합성 프로세스들, 예를 들어, 브롬화, 부흐발트 (Buchwald) 커플링 및 스즈키 커플링에 의해 조제될 수 있다.
식 (I) 또는 (II)의 화합물 M의 조제를 위한 합성 프로세스들은, 예를 들어, WO 2012/145173, WO 2012/048266, WO 2011/137072, EP 2551932, US 2009/0030202 및 WO 2011/057706에 상세히 기재되어 있다.
본 발명에 따른 유기 전계발광 디바이스가 아래에 보다 상세히 기재된다.
본 발명의 바람직한 실시형태에서, 식 (I) 또는 (II)의 화합물 M은 방출층에서의 매트릭스 재료이고, 화합물 E는 방출 화합물이다. 방출 화합물은, 디바이스의 동작중 방출층으로부터의 에미션이 관찰되는 화합물을 의미하는 것으로 여겨진다. 본 발명에 따라서, 식 (I) 또는 (II)의 화합물 M은 방출층으로부터의 에미션에 기여하지 않거나 또는 상당히 기여하지 않는다.
본 발명의 바람직한 실시형태에서, 방출층은 필수적으로 식 (I) 또는 (II)의 화합물 M 및 화합물 E로 이루어진다. 방출층은 특히 바람직하게 전적으로 식 (I) 또는 (II)의 화합물 M 및 화합물 E로 이루어진다.
화합물 E는 바람직하게 화합물 M보다 상당히 높은 비율로 방출층에 존재한다. 화합물 M의 비율은 바람직하게 80% ∼ 99% 이고, 특히 바람직하게 90% ∼ 98% 이고, 매우 특히 바람직하게 93% ∼ 97% 이다. 화합물 E의 비율은 바람직하게 1% ∼ 20% 이고, 특히 바람직하게 2% ∼ 10% 이고, 매우 특히 바람직하게 3% ∼ 7% 이다.
여기서 % 단위 비율의 설명은, 기상으로부터 적용되는 화합물들의 경우 체적 퍼센트 비율을 의미하는 것으로 여겨지고, 그리고 용액으로부터 적용되는 화합물들의 경우 중량 퍼센트 비율을 의미하는 것으로 여겨진다.
식 (I) 또는 (II)의 화합물 M의 T1 상태의 에너지 (T1(M)) 가 화합물 E의 T1 상태의 에너지 (T1(E)) 보다 최대 0.1 eV 더 낮은 것이 더욱 바람직하다. T1(M)은 특히 바람직하게 ≥ T1(E) 이다. 매우 특히 바람직하게 T1(M) - T1(E) ≥ 0.1 eV, 가장 바람직하게 T1(M) - T1(E) ≥ 0.2 eV 이다. 여기서 T1 상태들의 에너지들은 작업예들에 기재되는 바와 같이 양자 화학적 계산에 의해 결정된다.
화합물 E는 바람직하게 유기 화합물이다. 본 발명의 의미에서 유기 화합물은 금속을 함유하지 않는 탄소 함유 화합물이다. 특히, 유기 화합물은 원소들 C, H, D, B, Si, N, P, O, S, F, Cl, Br 및 I로부터 빌드업된다.
더욱 바람직하게, 화합물 E는 발광성 화합물이다. 본 발명의 의미에서 발광성 화합물은, 유기 전계발광 디바이스에 존재하는 환경에서의 광학 여기시 실온에서 광을 방출할 수 있는 화합물이다. 화합물은 바람직하게 적어도 40%, 특히 바람직하게 적어도 50%, 매우 특히 바람직하게 적어도 60% 및 특히 바람직하게 적어도 70%의 발광 양자 효율성을 갖는다. 여기서 발광 양자 효율성은, 유기 전계발광 디바이스에 채용될, 매트릭스 재료와 혼합한 층에서 결정된다. 본 발명의 목적을 위해 발광 양자 효율성의 결정이 실행되는 방식은 실시예 파트에 기재된다.
화합물 E가 짧은 감쇠 시간을 갖는 것이 더욱 바람직하다. 여기서 감쇠 시간은 바람직하게 ≤ 50 μs 이다. 본 발명의 목적을 위해 감쇠 시간의 결정이 실행되는 방식은 실시예 파트에 기재된다.
최저 여기 단일항 상태 (S1) 및 최저 삼중항 상태 (T1) 의 에너지는 양자 화학적 계산에 의해 결정된다. 본 발명의 목적을 위해 이러한 결정이 실행되는 방식은 실시예 파트에 기재된다.
화합물 E의 S1과 T1 상태들의 에너지들 간의 값 차이는, 본 발명에 따라서, 최대 0.15 eV이다. 값의 차이는 바람직하게 ≤ 0.10 eV 이고, 특히 바람직하게 ≤ 0.08 eV 이고, 매우 특히 바람직하게 ≤ 0.05 eV 이다.
화합물 E는 바람직하게 적어도 하나의 공여체 치환기와 또한 적어도 하나의 수용체 치환기의 양자를 포함하는 방향족 화합물이고, 여기서 화합물의 LUMO 및 HOMO는 단지 공간상 약한 정도로 오버랩된다. 공여체 또는 수용체 치환기 하에서 이해되는 것은 원칙적으로 당업자에게 알려져 있다. 적합한 공여체 치환기들은 특히 디아릴아미노 및 디헤테로아릴아미노 기들은 물론 카르바졸기들 및 카르바졸 유도체들이며, 그 각각은 바람직하게 N을 통해 방향족 화합물에 결합된다. 또한 이들 기는 여기서 더욱 치환될 수도 있다. 적합한 수용체 치환기들은 특히 시아노기들 및 전자 결핍성 헤테로아릴기들이며, 이들은 또한 더욱 치환될 수도 있다.
화합물 E의 LUMO (LUMO(E)) 및 화합물 M의 HOMO (HOMO(M)) 에는 바람직하게 다음이 적용된다:
LUMO(E) - HOMO(M) > S1(E) - 0.4 eV;
특히 바람직하게:
LUMO(E) - HOMO(M) > S1(E) - 0.3 eV;
매우 특히 바람직하게:
LUMO(E) - HOMO(M) > S1(E) - 0.2 eV.
여기서 S1(E)는 화합물 E의 제 1 여기 단일항 상태 (S1) 이다. 상기 HOMO 및 LUMO 에너지들 LUMO(E) 및 HOMO(M)은 여기서, 작업예들에 기재되는 바와 같이 양자 화학적 계산에 의해 결정된다.
본 발명에 따른 디바이스에서 사용하기 위한 화합물들 (E) 의 예들은 하기 표에 도시된다.
유기 전계발광 디바이스는 캐소드, 애노드 및 방출층을 포함한다. 이 층들 이외에, 유기 전계발광 디바이스는 또한 추가층들을, 예를 들어, 정공 주입층들, 정공 수송층들, 정공 차단층들, 전자 수송층들, 전자 주입층들, 여기자 차단층들, 전자 차단층들 및/또는 전하 발생층들을 포함할 수도 있다. 유기 전계발광 디바이스는 바람직하게 애노드와 방출층 사이에 배치되는 1층 이상의 정공 수송층들, 및 캐소드와 방출층 사이에 배치되는 1층 이상의 전자 수송층들을 포함한다.
종래 기술로부터 이 용도로 알려져 있는 모든 재료들은 본 발명에 따른 유기 전계발광 디바이스의 추가층들에서, 특히 정공 주입 및 수송 층들에서 그리고 전자 주입 및 수송 층들에서 사용될 수 있다.
여기서 정공 수송층들은 또한 p-도핑될 수도 있고 전자 수송층들은 또한 n-도핑될 수도 있다. p-도핑된 층은, 자유 정공들이 p-도펀트에 의해 발생되고 이로써 그 도전성이 증가되는 층을 의미하는 것으로 여겨진다. OLED들에서의 도핑된 수송층들의 폭넓은 논의는 Chem. Rev. 2007, 107, 1233 에서 찾을 수 있다. p-도펀트는 특히 바람직하게 정공 수송층에서의 정공 수송 재료를 산화시킬 수 있고, 즉 충분히 높은 레독스 전위, 특히 정공 수송 재료보다 더 높은 레독스 전위를 가질 수 있다. 적합한 p-도펀트들은 원칙적으로, 전자 수용체 화합물들이고 정공 수송 재료의 산화에 의해 유기층의 전도성을 증가시킬 수 있는 모든 화합물들이다. 당업자는 그의 일반적인 전문 지식에 기초하여 큰 노력없이 적합한 화합물들을 식별할 수 있을 것이다. 특히 적합한 도펀트들은 WO 2011/073149, EP 1968131, EP 2276085, EP 2213662, EP 1722602, EP 2045848, DE 102007031220, US 8044390, US 8057712, WO 2009/003455, WO 2010/094378, WO 2011/120709 및 US 2010/0096600에 개시된 화합물들이다.
유기 전계발광 디바이스의 캐소드는 일 함수가 낮은 금속들, 금속 합금들 또는 상이한 금속들, 예를 들어, 알칼리 토금속들, 알칼리 금속들, 주족 금속들 또는 란타노이드들 (예를 들어, Ca, Ba, Mg, Al, In, Mg, Yb, Sm 등) 을 포함하는 적층 구조를 포함하는 것이 바람직하다. 또한, 알칼리 금속 또는 알칼리 토금속 및 은의 합금들, 예를 들어 마그네슘 및 은의 합금이 적합하다. 적층 구조들의 경우, 상기 금속들 이외에 추가로, 예를 들어, Ag 또는 Al 과 같이 일함수가 비교적 높은 다른 금속들이 또한 사용될 수 있으며, 이 금속들의 조합물들, 예를 들어, Ca/Ag, Mg/Ag 또는 Ba/Ag 가 일반적으로 사용된다. 또한, 금속 캐소드와 유기 반도체 사이에 높은 유전 상수를 갖는 재료의 얇은 층간층을 도입하는 것이 바람직할 수도 있다. 이 목적을 위해서는, 예를 들어, 알칼리 금속 또는 알칼리 토금속 불화물들이 적합하지만, 또한 상응하는 산화물들 또는 탄화물들 (예를 들어, LiF, Li2O, BaF2, MgO, NaF, CsF, Cs2CO3 등) 도 적합하다. 더욱이, 리튬 퀴놀리네이트 (LiQ) 가 이 목적을 위해서 사용될 수 있다. 이 층의 층 두께는 바람직하게 0.5 ∼ 5nm 이다.
애노드는 바람직하게 일 함수가 높은 재료들을 포함한다. 애노드는 바람직하게 일 함수가 진공 대비 4.5 eV 초과한다. 이 목적에 적합한 것은, 한편으로, 높은 레독스 전위를 갖는 금속들, 예를 들어, Ag, Pt 또는 Au 이다. 다른 한편, 금속/금속 산화물 전극들 (예를 들어, Al/Ni/NiOx, Al/PtOx) 이 또한 바람직할 수도 있다. 일부 응용들에 있어서, 전극들 중 적어도 하나는 유기 재료의 조사 (유기 태양 전지들) 또는 광의 커플링 아웃 (OLEDs, O-레이저들) 을 용이하게 하기 위해서 투명 또는 부분적으로 투명해야 한다. 바람직한 애노드 재료들은 여기서 전도성의 혼합 금속 산화물들이다. 특히 바람직한 것은 인듐 주석 산화물 (ITO) 또는 인듐 아연 산화물 (IZO) 이다. 전도성의 도핑된 유기 재료들이 더욱 바람직하고, 전도성의 도핑된 폴리머들이 특히 바람직하다. 더욱이, 애노드는 또한 복수의 층들, 예를 들어, ITO 의 내부층 및 금속 산화물, 바람직하게 산화 텅스텐, 산화 몰리브덴 또는 산화 바나듐의의 외부층으로 이루어질 수도 있다.
디바이스는 (응용에 의존하여) 상응하게 구조화되고, 컨택이 제공되고, 그리고 물 및 공기의 손상시키는 영향을 배제하기 위해서 최종적으로 밀봉된다.
바람직한 실시형태에서, 유기 전계발광 디바이스는, 재료들이 10-5 mbar 미만, 바람직하게는 10-6 mbar 미만의 초기 압력의 진공 승화 유닛에서 기상 증착에 의해 공급되는, 승화 공정에 의해 하나 이상의 층들이 공급되는 것을 특징으로 한다. 하지만, 여기서 초기 압력이 심지어 더 낮을 수도 있으며, 예를 들어, 10-7 mbar 미만일 수도 있다.
마찬가지로, 재료들이 10-5 mbar ∼ 1 bar 의 압력에서 공급되는 캐리어 가스 승화의 도움으로 또는 OVPD (Organic Vapour Phase Deposition) 공정에 의해 하나 이상의 층들이 공급되는 것을 특징으로 하는 유기 전계발광 디바이스가 바람직하다. 이러한 공정의 특별한 경우는 OVJP (Organic Vapour Jet Printing) 공정이며, 여기서 재료들은 노즐을 통해 직접 공급되어 구조화된다 (예를 들어, M. S. Arnold 등, Appl. Phys. Lett. 2008년, 92, 053301).
하나 이상의 층들이 용액으로부터, 예를 들어, 스핀 코팅에 의해 또는 임의의 원하는 인쇄 공정, 예컨대, 스크린 인쇄, 플렉소그래픽 인쇄, 노즐 인쇄 또는 오프셋 인쇄, 특히 바람직하게 LITI (Light Induced Thermal Imaging, 열 전달 인쇄) 또는 잉크젯 인쇄에 의해 제조되는 것을 특징으로 하는 유기 전계발광 디바이스가 더욱 바람직하다. 이 목적을 위해서 식 (I) 또는 (II) 의 수용성 화합물들이 필요하다. 화합물들의 적합한 치환에 의해 고용해도가 달성될 수 있다.
유기 전계발광 디바이스의 제조시, 하나 이상의 층들이 용액으로부터 공급되고 그리고 하나 이상의 층들이 승화 공정에 의해 공급되는 것이 더욱 바람직하다.
따라서, 본 발명은 더욱이, 적어도 하나의 층이 승화 공정에 의해 공급되고 및/또는 적어도 하나의 층이 OVPD (Organic Vapour Phase Deposition) 공정에 의해 또는 캐리어 가스 승화의 도움으로 공급되는 것을 특징으로 하고 및/또는 적어도 하나의 층이 용액으로부터 스핀 코팅에 의해 또는 인쇄 공정에 의해 공급되는 것을 특징으로 하는, 본 발명에 따른 유기 전계발광 디바이스의 제조 방법에 관한 것이다.
하기 작업예들은 본 발명의 보다 상세한 설명 및 그 기술적 효과를 위한 것이며 제한적으로 해석되어서는 안된다.
작업예들
A) HOMO, LUMO, 단일항 및 삼중항 준위의 결정
재료들의 최저 삼중항 상태 (T1) 및 최저 여기 단일항 상태 (S1) 의 HOMO 및 LUMO 에너지 준위들 및 에너지는 양자 화학적 계산들을 통해 결정된다. 이 목적을 위해, "Gaussian09W" (Gaussian Inc.) 프로그램 패키지가 사용된다. (표 1에서 "org." 방법으로 표기된) 금속들이 없는 유기 물질들을 계산하기 위해서, 먼저 지오메트리 최적화가 "그라운드 상태/반경험적/디폴트 스핀/AM1/전하 0/스핀 단일항" 방법을 이용하여 실행된다. 최적화된 지오메트리에 기초하여 에너지 계산이 후속하여 실행된다. "6-31G(d)" 베이스 세트에 의한 "TD-SFC/DFT/디폴트 스핀/B3PW91" 방법이 여기서 이용된다 (전하 0, 스핀 단일항). (표 1에서 "org.-m." 방법으로 표기된) 금속 함유의 화합물들에 대해, 지오메트리는 "그라운드 상태/하트리-포크 (Hartree-Fock)/디폴트 스핀/LanL2MB/전하 0/스핀 단일항" 방법을 통해 최적화된다. 에너지 계산은 상술된 바와 같이 유기 물질들과 유사하게 실행되며, 금속 원자에 대해 "LanL2DZ" 베이스 세트가 사용되고 리간드에 대해 "6-31G(d)" 베이스 세트가 사용되는 것이 상이하다. 에너지 계산은 하트리 (hartree) 단위로 HOMO 에너지 준위 HEh 또는 LUMO 에너지 준위 LEh 를 제공한다. 순환 전류전압법 (cyclic voltammetry) 측정들을 참조하여 교정된 HOMO 및 LUMO 에너지 준위들이 다음과 같이 전자 볼트 단위로 결정된다.
HOMO(eV) = ((HEh*27.212)-0.9899)/1.1206
LUMO(eV) = ((LEh*27.212)-2.0041)/1.385
본 출원의 목적상, 이 값들은 각각 재료들의 HOMO 및 LUMO 에너지 준위로서 간주될 수 있다.
최저 삼중항 상태 (T1) 는 기재된 양자 화학적 계산으로부터 야기되는 최저 에너지를 갖는 삼중항 상태의 에너지로서 정의된다.
최저 여기 단일항 상태 (S1) 는 기재된 양자 화학적 계산으로부터 야기되는 최저 에너지를 갖는 여기 단일항 상태의 에너지로서 정의된다.
표 1은 다양한 재료들의 HOMO 및 LUMO 에너지 준위들 및 S1 및 T1을 나타낸다.
B) PL 양자 효율성 (PLQE) 의 결정
여러 OLED들에서 사용되는 에미션층들의 50 nm 두께의 필름은 적합한 투명 기판, 바람직하게는 석영에 공급되며, 즉 그 층은 OLED과 동일 재료를 동일한 농도로 포함한다. 여기서 OLED들에 대한 방출층의 제조에서와 같이 동일한 제조 조건들이 이용된다. 이 필름의 파장 범위 350 ∼ 500 nm 에서의 흡수 스펙트럼이 측정된다. 이를 위해, 샘플의 반사 스펙트럼 R(λ) 및 투과 스펙트럼 T(λ) 는 6° 의 입사각 (즉, 사실상 직교하는 입사각) 에서 결정된다. 본 출원의 목적상, 흡수 스펙트럼은 A(λ)=1-R(λ)-T(λ)로 정의된다.
범위 350-500 nm에서 A(λ) ≤ 0.3 인 경우, 범위 350-500 nm에서 최대 흡수 스펙트럼에 속하는 파장은 λexc 로 정의된다. 임의의 파장에 대해 A(λ) > 0.3인 경우, A(λ) 이 0.3 미만의 값으로부터 0.3 초과의 값으로 또는 0.3 초과의 값으로부터 0.3 미만의 값으로 변하는 최대 파장은 λexc 로 정의된다.
PLQE는 Hamamatsu C9920-02 측정 시스템을 이용하여 결정된다. 원리는 정의된 파장의 광에 의한 샘플의 여기와 흡수 및 방출된 방사선의 측정에 기초한다. 샘플은 측정동안 울브리히트구 (Ulbricht sphere) ("적분구") 에 위치한다. 여기광의 스펙트럼은 대략적으로, 상기에 정의된 바와 같은 피크 파장 λexc 및 <10 nm의 반치폭을 갖는 가우시안이다.
PLQE는, 상기 측정 시스템을 위해 유용한 평가 방법에 의해 결정된다. 샘플이 언제라도 산소와 접촉하지 않게 되는 것이 엄격히 보장되어야 하며, 그 이유는 S1과 T1 간의 에너지 분리가 작은 재료들의 PLQE가 산소에 의해 매우 크게 감소되기 때문이다 (H. Uoyama 등, Nature 2012, Vol, 492, 234).
표 2는 사용된 여기 파장과 함께 상기에서 정의된 OLED들의 방출층들에 대한 PLQE를 나타낸다.
C) 감쇠 시간의 결정
감쇠 시간은 "PL 양자 효율성 (PLQE) 의 결정" 하에서 상술된 바와 같이 제조된 샘플을 이용하여 결정된다. 측정은 진공에서 실행된다. 샘플은 적합한 강도의 레이저 펄스 (파장 266 nm, 펄스 지속기간 약 1.5 ns) 에 의해 실온에서 여기된다. (t = 0 으로 정의된) 여기 이후, 방출된 광발광의 시간에 따른 변화가 측정된다. 시간 t = 250 ns로부터의 측정 데이터를 위해, 감쇠 시간 (ta = te - 250 ns) 이 결정된다. 여기서 te 는, 강도가 t = 250 ns에서의 그 값의 1/e로 처음 드롭된 때인 t = 250 ns 이후의 시간이다.
D) 화합물들의 합성
하기 예들에서 사용되는 대부분의 화합물들이 종래 기술로부터 알려져 있다. 예를 들어, 도펀트 D1의 합성이 Uoyama et al., Nature 2012, Vol. 492, 234 에 개시되어 있다. 호스트 재료들 H1, H2 및 H3의 합성은 WO 2011/057706에 개시되어 있고, H4의 합성은 WO 2012/048266에 개시되어 있다. H5의 합성은 WO 2012/12145173에 개시되어 있고, H6의 합성은 US 2009/0030202에 개시되어 있다.
H7의 합성은 아래에 기재된다:
단계 1: 2-브로모-8-[1,1';3',1'']터페닐-5'-일디벤조티오펜의 합성
2.47 g (8.1 mmol) 의 테트라키스트리페닐포스피노팔라듐(0) 을, 500 ml 의 DMF 중의 15 g (40 mmol) 의 2,8-디브로모디벤조티오펜, 11 g (40 mmol) 의 (3,5-디페닐)보론산 및 63.9 g (127 mmol) 의 Na2CO3의 거칠게 혼합된 현탁액에 첨가하고, 그 혼합물을 16 h 동안 환류하에서 후속 가열한다. 냉각 이후, 침전된 고체를 흡인 여과하고, 50 ml 톨루엔으로 3회, 50 ml 에탄올:물 (1:1, v:v) 로 3회, 100 ml 에탄올로 3회 세정한다. 이후 생성물을 DMF (약 15 ml/g) 로부터 3회 재결정화하여, 12.5 g (25 mmol) 의 생성물 (이론의 880.0%) 을 순도 99.9% (HLPC) 로 제공한다.
단계 2: 2-(8-[1,1';3',1'']터페닐-5'-일디벤조티오펜-2-일)보론산의 합성
52 ml (130 mmol) 의 n-부틸리튬 (n-헥산에서 2.5 M) 을 1000 ml 의 THF 중의 49 g (100 mmol) 의 2-브로모-8-[1,1';3',1'']터페닐-5'-일-디벤조티오펜의 현탁액에 -78℃ 에서 거칠게 교반하면서 적하 첨가하고, 그 혼합물을 추가 2 h 동안 교반한다. 16.7 ml (150 mmol) 의 트리메틸 보레이트를 거칠게 교반하면서 일 부분에서의 적색 용액에 첨가하고, 그 혼합물을 -78℃에서 추가 30 min동안 교반한 다음, 3 h 에 걸쳐서 실온으로 가온하고, 300 ml 의 물을 첨가하고, 그리고 그 혼합물을 30 min 동안 교반한다. 유기상을 분리하고 진공에서 증발 건조시킨다. 고체를 100 ml 의 n-헥산에서 취하고, 흡인 여과하고, 100 ml의 헥산으로 1회 세정하고 진공에서 건조한다. 수율: 37 g (81 mmol), 83%, 순도 약 90% (NMR) 의 보론산, 보론산 무수물 및 보론산의 양의 가변. 추가 정제없이 다음 단계에서 보론산이 채용될 수 있다.
단계 3: 8,8'-비스-[1,1';3',1'']터페닐-5'-일-[2,2']비[디벤조티오페닐]의 합성
66.7 g (136 mmol) 의 2-브로모-8-[1,1';3',1'']터페닐-5'-일디벤조티오펜, 65.6 g (144 mmol) 의 2-(8-[1,1';3',1'']터페닐-5'-일디벤조티오펜-2-일)보론산 및 78.9 ml (158 mmol) 의 Na2CO3 (2M 용액) 가 120 ml 의 톨루엔, 120 ml 의 에탄올 및 100 ml 의 물에서 현탁된다. 이 현탁액에 2.6 g (2.2 mmol) 의 Pd(PPh3)4 를 첨가하고, 반응 혼합물을 16h 동안 환류하에서 가열한다. 냉각 이후, 유기상을 분리하고, 실리카 겔을 통해 여과하고, 200 ml 의 물로 3회 세정하고 후속하여 증발 건조시킨다. 잔여물을 톨루엔으로부터 재결정화하며, 최종적으로 고진공 (p = 5 x 10-5 mbar) 에서 승화시킨다. 수율은 105 g (130 mmol) 이며, 이론의 96% 에 상응한다.
E) OLED들의 제조
다양한 OLED들의 데이터는 아래 실시예들 V1 및 E1 ∼ E7 에 제시된다 (표 1 및 2 참조).
두께 50 nm 의 구조화된 ITO (인듐 주석 산화물) 로 코팅된 유리판들이 OLED용 기판들을 형성한다. 기판들을 습식 세정하고 (식기 세척기, Merck Extran 세제), 후속하여 코팅 이전에 250℃ 에서 15 min 동안 가열하여 건조시키고 산소 플라즈마로 처음 처리한 다음 아르곤 플라즈마로 처리한다.
OLED들은 원칙적으로 다음의 층 구조를 갖는다: 기판 / 정공 주입층 (HIL) / 정공 수송층 (HTL) / 층간층 (IL) / 전자 차단층 (EBL) / 에미션층 (EML) / 정공 차단층 (HBL) / 전자 수송층 (ETL) 및 마지막으로 캐소드. 캐소드는 두께 100 nm 의 알루미늄층에 의해 형성된다. OLED들의 정확한 구조는 표 1에 나타낸다. OLED들의 제조에 필요한 재료는 표 3에 나타낸다.
모든 재료들은 진공 챔버에서 열 기상 증착에 의해 공급된다. 여기서 에미션층은 언제나 매트릭스 재료 (호스트 재료) 및 도펀트 형태의 방출 화합물로 이루어진다. 이것은 공증발 (co-evaporation) 에 의해 소정의 체적 비율로 매트릭스 재료와 혼합된다. 여기서 H1:D1(95%:5%) 와 같은 표현은, 재료 H1 이 95% 의 체적 비율로 층 내에 존재하고 D1 이 5% 의 체적 비율로 층 내에 존재한다는 것을 의미한다. 유사하게, 전자 수송층은 2개의 재료들의 혼합물로 이루어진다.
OLED들은 표준 방법들에 의해 특징화된다. 이 목적을 위해서, 전계발광 스펙트럼들, 전류 효율성 (cd/A 단위로 측정), 전력 효율성 (lm/W 단위로 측정) 및 람베르트 에미션 특징들을 상정하는 전류/전압/발광 밀도 특징선들 (IUL 특징선들) 로부터 계산된 발광 밀도의 함수로서의 외부 양자 효율성 (EQE, 퍼센트로 측정), 그리고 수명이 결정된다. 전계발광 스펙트럼들은 1000 cd/㎡ 의 발광 밀도에서 결정되고, 이로부터 CIE 1931 x 및 y 색 좌표들이 계산된다. 표 2에서 용어 U1000 은 1000 cd/㎡ 의 발광 밀도에 필요한 전압을 표기한다. CE1000 및 PE1000 은 각각 1000 cd/㎡ 에서 달성되는 전류 및 전력 효율성을 표기한다. 마지막으로, EQE1000은 1000 cd/㎡ 의 동작 발광 밀도에서의 외부 양자 효율성을 표기한다.
롤 오프는 500 cd/m²에서의 EQE 로 제산된 5000 cd/m²에서의 EQE 로 정의되며, 즉 높은 값은 높은 발광 밀도에서의 효율성 드롭이 작은 것에 상응하여 이롭다.
수명 (LT) 은, 발광 밀도가 일정한 전류에서의 동작시 초기 발광 밀도로부터 소정의 비율 (L1) 로 드롭된 이후의 시간으로 정의된다. 표 2에서의 명기 j0 = 10 mA/㎠, L1 = 80% 는, 발광 밀도가 10 mA/㎠ 에서의 동작시 시간 (LT) 이후 초기 값의 80%로 드롭되는 것을 의미한다.
에미션 층에 채용되는 방출 도펀트는 화합물 D1 이며, 이것은 S1과 T1 간의 에너지 분리가 0.09 eV 이다.
다양한 OLED들의 데이터는 표 2 에 요약된다. 실시예 V1은 종래 기술에 따른 화합물 CBP를 매트릭스 재료로 포함하는 비교예이다. 실시예 E1-E7은, 식 (I) 또는 (II)의 화합물들을 매트릭스 재료들로 포함하는 본 발명에 따른 OLED들의 데이터를 나타낸다.
OLED들의 측정된 성능 데이터는 예로써, OLED들의 전압, 효율성, 롤 오프 및 수명의 우수한 값들이 본 출원에 따른 방출층의 구조에 의해 획득된다는 것을 나타낸다. 성능 데이터는 통상적으로 종래 기술에 따른 방출층의 구조에 의해 획득된 것들보다 우수하며 (Uoyama et al., Nature 2012, Vol. 492, 234 참조), 여기서 CBP는 방출층의 매트릭스 재료로 사용된다.
특히, 동작 전압 U1000, 외부 양자 효율성 EQE, 수명 및 롤 오프에 대한 뛰어난 값들이 얻어진다 (표 2).
Claims (18)
- 유기 전계발광 디바이스로서,
화합물 E 및 화합물 M을 포함하는 방출층을 포함하고,
화합물 E는 S1과 T1 상태들의 에너지들 간의 값 차이가 최대 0.15 eV 이며, 그리고
화합물 M은 식 (I) 또는 (II) 에 따르며,
이 경우:
Y는 각각의 발생시, 동일하거나 또는 상이하게, O, S 또는 Se 이고;
Z는 각각의 발생시, 동일하거나 또는 상이하게, CR1, C 또는 N이고, 여기서 Z는 기 L1 또는 L2가 상기 기 L1 또는 L2에 결합되는 기와 함께 Z에 결합된다면 정확하게 C와 동일하고;
L1, L2는 각각의 발생시, 동일하거나 또는 상이하게, 단일 결합 또는 이가기이고;
Ar1은 각각의 발생시, 동일하거나 또는 상이하게, 하나 이상의 라디칼들 R2에 의해 치환될 수도 있는, 5 ∼ 40개의 방향족 고리 원자들을 갖는 방향족 또는 헤테로방향족 고리계이고;
R1, R2는 각각의 발생시, 동일하거나 또는 상이하게, H, D, F, C(=O)R3, CN, Si(R3)3, N(R3)2, P(=O)(R3)2, OR3, S(=O)R3, S(=O)2R3, 1 ∼ 20 개의 C 원자들을 갖는 직쇄 알킬 또는 알콕시기 또는 3 ∼ 20 개의 C 원자들을 갖는 분지형 또는 환형 알킬 또는 알콕시기 또는 2 ∼ 20 개의 C 원자들을 갖는 알케닐 또는 알키닐기 (여기서 상기 언급된 기들은 각각 하나 이상의 라디칼들 R3에 의해 치환될 수 있으며, 상기 언급된 기들 내의 하나 이상의 CH2 기들은 -R3C=CR3-, -C≡C-, Si(R3)2, C=O, C=NR3, -C(=O)O-, -C(=O)NR3-, NR3, P(=O)(R3), -O-, -S-, SO 또는 SO2에 의해 대체될 수 있음), 또는 각각의 경우 하나 이상의 라디칼들 R3에 의해 치환될 수도 있는, 5 ∼ 30 개의 방향족 고리 원자들을 갖는 방향족 또는 헤테로방향족 고리계이고, 여기서 2개 이상의 라디칼들 R1 또는 R2는 서로 연결될 수도 있고 고리를 형성할 수도 있으며;
R3은 각각의 발생시, 동일하거나 또는 상이하게, H, D, F, C(=O)R4, CN, Si(R4)3, N(R4)2, P(=O)(R4)2, OR4, S(=O)R4, S(=O)2R4, 1 ∼ 20 개의 C 원자들을 갖는 직쇄 알킬 또는 알콕시기 또는 3 ∼ 20 개의 C 원자들을 갖는 분지형 또는 환형 알킬 또는 알콕시기 또는 2 ∼ 20 개의 C 원자들을 갖는 알케닐 또는 알키닐기 (여기서 상기 언급된 기들은 각각 하나 이상의 라디칼들 R4 에 의해 치환될 수 있으며, 상기 언급된 기들 내의 하나 이상의 CH2 기들은 -R4C=CR4-, -C≡C-, Si(R4)2, C=O, C=NR4, -C(=O)O-, -C(=O)NR4-, NR4, P(=O)(R4), -O-, -S-, SO 또는 SO2에 의해 대체될 수 있음), 또는 각각의 경우 하나 이상의 라디칼들 R4에 의해 치환될 수도 있는, 5 ∼ 30 개의 방향족 고리 원자들을 갖는 방향족 또는 헤테로방향족 고리계이고, 여기서 2개 이상의 라디칼들 R3은 서로 연결될 수도 있고 고리를 형성할 수도 있으며;
R4는 각각의 발생시, 동일하거나 또는 상이하게, H, D, F 또는 1 ∼ 20 개의 C 원자들을 갖는 지방족, 방향족 또는 헤테로방향족 유기 라디칼이고, 여기서 부가적으로 하나 이상의 H 원자들은 D 또는 F에 의해 대체될 수도 있으며; 2개 이상의 치환기들 R4는 여기서 서로 연결될 수도 있고 고리를 형성할 수도 있으며;
n은 0 또는 1과 동일하며;
여기서 상기 에너지들은 작업예들에 기재되는 바와 같이 양자 화학적 계산에 의해 결정되는, 유기 전계발광 디바이스. - 제 1 항에 있어서,
식들 (I) 및 (II) 에서 고리당 1개 이하의 기 Z는 N과 동일한 것을 특징으로 하는 유기 전계발광 디바이스. - 제 1 항 또는 제 2 항에 있어서,
식들 (I) 및 (II) 에서 상기 기 Y는 각각의 발생시, 동일하거나 또는 상이하게, O 또는 S인 것을 특징으로 하는 유기 전계발광 디바이스. - 제 1 항 내지 제 3 항 중 어느 한 항에 있어서,
식 (I) 에서 상기 기 L1 은 각각의 발생시, 동일하거나 또는 상이하게, 단일 결합, Si(R2)2, 또는 하나 이상의 라디칼들 R2 에 의해 치환될 수도 있는, 5 ∼ 30 개의 방향족 고리 원자들을 갖는 방향족 또는 헤테로방향족 고리계로부터 선택되는 것을 특징으로 하는 유기 전계발광 디바이스. - 제 1 항 내지 제 4 항 중 어느 한 항에 있어서,
식 (II) 에서 상기 기 L2는 단일 결합, 또는 하나 이상의 라디칼들 R2 에 의해 치환될 수도 있는, 5 ∼ 60 개의 방향족 고리 원자들을 갖는 방향족 또는 헤테로방향족 고리계로부터 선택되는 것을 특징으로 하는 유기 전계발광 디바이스. - 제 1 항 내지 제 5 항 중 어느 한 항에 있어서,
식 (II) 에서 상기 기 Ar1은 페닐, 비페닐, 터페닐, 쿼터페닐, 플루오레닐, 스피로비플루오레닐, 인데노플루오레닐, 나프틸, 안트라세닐, 페난트레닐, 피레닐, 플루오란테닐, 푸라닐, 벤조푸라닐, 이소벤조푸라닐, 디벤조푸라닐, 티오페닐, 벤조티오페닐, 이소벤조티오페닐, 디벤조티오페닐, 피롤릴, 인돌릴, 이소인돌릴, 카르바졸릴, 인돌로카르바졸릴, 인데노카르바졸릴, 피리딜, 퀴놀리닐, 이소퀴놀리닐, 아크리딜, 피라졸릴, 이미다졸릴, 벤즈이미다졸릴, 피리다질, 피리미딜, 피라지닐 및 페난트롤릴로부터 선택되고, 그 각각은 선택적으로 라디칼들 R2에 의해 치환되는 것을 특징으로 하는 유기 전계발광 디바이스. - 제 1 항 내지 제 9 항 중 어느 한 항에 있어서,
상기 식 (I) 또는 (II)의 화합물 M은 상기 방출층에서의 매트릭스 재료이고, 화합물 E는 상기 방출층에서의 방출 화합물인 것을 특징으로 하는 유기 전계발광 디바이스. - 제 1 항 내지 제 10 항 중 어느 한 항에 있어서,
상기 방출층은 본질적으로 상기 식 (I) 또는 (II)의 화합물 M 및 화합물 E로 이루어지는 것을 특징으로 하는 유기 전계발광 디바이스. - 제 1 항 내지 제 11 항 중 어느 한 항에 있어서,
화합물 M의 비율은 80% ∼ 99% 이고, 화합물 E의 비율은 1% ∼ 20% 인 것을 특징으로 하는 유기 전계발광 디바이스. - 제 1 항 내지 제 12 항 중 어느 한 항에 있어서,
상기 식 (I) 또는 (II)의 화합물 M의 T1 상태의 에너지 (T1(M)) 와 화합물 E의 T1 상태의 에너지 (T1(E)) 에 하기가 적용되고:
T1(M) ≥ T1(E),
여기서 상기 T1 상태들의 에너지들은 작업예들에 기재되는 바와 같이 양자 화학적 계산에 의해 결정되는 것을 특징으로 하는 유기 전계발광 디바이스. - 제 1 항 내지 제 13 항 중 어느 한 항에 있어서,
화합물 E는 적어도 60%의 발광성 양자 효율성을 갖는 발광성 화합물인 것을 특징으로 하는 유기 전계발광 디바이스. - 제 1 항 내지 제 14 항 중 어느 한 항에 있어서,
화합물 E의 S1 및 T1 상태들의 에너지들 간의 값 차이는 0.10 eV 이하이고, 상기 에너지들은 작업예들에 기재되는 바와 같이 양자 화학적 계산에 의해 결정되는 것을 특징으로 하는 유기 전계발광 디바이스. - 제 1 항 내지 제 15 항 중 어느 한 항에 있어서,
상기 화합물 E는, 적어도 하나의 공여체 치환기와 또한 적어도 하나의 수용체 치환기 양자를 포함하는 방향족 화합물인 것을 특징으로 하는 유기 전계발광 디바이스. - 제 1 항 내지 제 16 항 중 어느 한 항에 있어서,
화합물 E의 LUMO (LUMO(E)) 및 화합물 M의 HOMO (HOMO(M)) 에 다음이 적용되며:
LUMO(E) - HOMO(M) > S1(E) - 0.4 eV,
식중 S1(E)는 화합물 E의 제 1 여기 단일항 상태 (S1) 이고, 에너지들 LUMO(E) 및 HOMO(M)은 작업예들에 기재되는 바와 같이 양자 화학적 계산에 의해 결정되는 것을 특징으로 하는 유기 전계발광 디바이스. - 제 1 항 내지 제 17 항 중 어느 한 항에 기재된 유기 전계발광 디바이스의 제조 방법으로서,
적어도 하나의 층이 승화 공정에 의해 공급되고 및/또는 적어도 하나의 층이 OVPD 공정에 의해 또는 캐리어 가스 승화의 도움으로 공급되고 및/또는 적어도 하나의 층이 용액으로부터 스핀 코팅에 의해 또는 인쇄 공정에 의해 공급되는 것을 특징으로 하는 유기 전계발광 디바이스.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| EP13004412.6 | 2013-09-11 | ||
| EP13004412 | 2013-09-11 | ||
| PCT/EP2014/002225 WO2015036080A1 (de) | 2013-09-11 | 2014-08-13 | Organische elektrolumineszenzvorrichtung |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| KR20160054582A true KR20160054582A (ko) | 2016-05-16 |
| KR102246399B1 KR102246399B1 (ko) | 2021-04-29 |
Family
ID=49165488
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020167009385A KR102246399B1 (ko) | 2013-09-11 | 2014-08-13 | 유기 전계발광 디바이스 |
Country Status (7)
| Country | Link |
|---|---|
| US (1) | US20160226001A1 (ko) |
| EP (1) | EP3044286B1 (ko) |
| JP (1) | JP6580571B2 (ko) |
| KR (1) | KR102246399B1 (ko) |
| CN (1) | CN105518103B (ko) |
| TW (1) | TWI637946B (ko) |
| WO (1) | WO2015036080A1 (ko) |
Cited By (13)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2018101691A1 (ko) * | 2016-11-29 | 2018-06-07 | 주식회사 엘지화학 | 유기 발광 소자 |
| WO2018084423A3 (ko) * | 2016-11-07 | 2018-08-09 | 주식회사 엘지화학 | 신규한 헤테로 고리 화합물 및 이를 이용한 유기발광소자 |
| KR20190013139A (ko) * | 2017-07-31 | 2019-02-11 | 엘티소재주식회사 | 헤테로고리 화합물 및 이를 포함하는 유기 발광 소자 |
| KR20190024780A (ko) * | 2017-08-28 | 2019-03-08 | 시노라 게엠베하 | 유기 분자, 특히 광전자 디바이스에 사용하기 위한 유기 분자 |
| KR20190027343A (ko) * | 2017-09-06 | 2019-03-14 | 주식회사 엘지화학 | 유기 발광 소자 |
| KR20190064009A (ko) * | 2017-11-30 | 2019-06-10 | 엘지디스플레이 주식회사 | 우수한 발광 특성을 가지는 유기 화합물, 이를 포함하는 유기발광다이오드 및 유기발광장치 |
| WO2019240532A1 (ko) * | 2018-06-14 | 2019-12-19 | 주식회사 엘지화학 | 헤테로고리 화합물 및 이를 포함하는 유기 발광 소자 |
| KR20200034626A (ko) * | 2018-09-21 | 2020-03-31 | 주식회사 엘지화학 | 신규한 헤테로 고리 화합물 및 이를 이용한 유기 발광 소자 |
| WO2020096350A1 (ko) * | 2018-11-06 | 2020-05-14 | 주식회사 엘지화학 | 신규한 화합물 및 이를 이용한 유기 발광 소자 |
| US10897015B2 (en) | 2017-02-27 | 2021-01-19 | Samsung Display Co., Ltd. | Organic light emitting device |
| US11208402B2 (en) | 2016-11-07 | 2021-12-28 | Lg Chem, Ltd. | Heterocyclic compound and organic light emitting device comprising the same |
| US11581494B2 (en) | 2017-12-27 | 2023-02-14 | Lg Chem, Ltd. | Organic light emitting device |
| US11851423B2 (en) | 2017-07-19 | 2023-12-26 | Lg Chem, Ltd. | Heterocyclic compound and organic light emitting device comprising the same |
Families Citing this family (11)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN105473569B (zh) | 2013-11-13 | 2021-01-01 | 出光兴产株式会社 | 化合物、有机电致发光元件用材料、有机电致发光元件和电子设备 |
| KR101885898B1 (ko) * | 2016-11-16 | 2018-08-06 | 주식회사 엘지화학 | 유기 발광 소자 |
| KR102078302B1 (ko) * | 2016-11-29 | 2020-02-18 | 주식회사 엘지화학 | 유기 발광 소자 |
| KR101982792B1 (ko) | 2017-07-20 | 2019-05-27 | 주식회사 엘지화학 | 신규한 헤테로 고리 화합물 및 이를 이용한 유기 발광 소자 |
| KR102206482B1 (ko) | 2018-04-24 | 2021-01-22 | 주식회사 엘지화학 | 신규한 헤테로 고리 화합물 및 이를 이용한 유기발광 소자 |
| KR102322698B1 (ko) | 2018-06-22 | 2021-11-09 | 엘티소재주식회사 | 헤테로고리 화합물, 이를 포함하는 유기 발광 소자, 유기 발광 소자의 유기물층용 조성물 및 유기 발광 소자의 제조 방법 |
| US12010912B2 (en) | 2018-07-24 | 2024-06-11 | Lg Chem, Ltd. | Heterocyclic compound and organic light emitting device comprising the same |
| EP3696167A4 (en) | 2018-07-27 | 2021-03-24 | Idemitsu Kosan Co.,Ltd. | COMPOUND, MATERIAL FOR AN ORGANIC ELECTROLUMINESC ELEMENT, ORGANIC ELECTROLUMINESC ELEMENT, AND ELECTRONIC DEVICE |
| KR102321311B1 (ko) * | 2018-11-06 | 2021-11-03 | 주식회사 엘지화학 | 신규한 화합물 및 이를 이용한 유기 발광 소자 |
| CN109679072B (zh) * | 2018-12-29 | 2021-03-12 | 武汉天马微电子有限公司 | 聚合物、显示面板以及显示装置 |
| WO2020235976A1 (ko) * | 2019-05-23 | 2020-11-26 | 주식회사 엘지화학 | 신규한 화합물 및 이를 이용한 유기발광 소자 |
Citations (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20090030202A1 (en) * | 2007-07-10 | 2009-01-29 | Idemitsu Kosan Co., Ltd. | Material for organic electroluminescent element and organic electroluminescent element employing the same |
| US20120256169A1 (en) * | 2011-04-08 | 2012-10-11 | Universal Display Corporation | Substituted oligoazacarbazoles for light emitting diodes |
| WO2013011955A1 (ja) * | 2011-07-15 | 2013-01-24 | 国立大学法人九州大学 | 遅延蛍光材料およびそれを用いた有機エレクトロルミネッセンス素子 |
| JP2013060411A (ja) * | 2010-10-15 | 2013-04-04 | Semiconductor Energy Lab Co Ltd | カルバゾール化合物、発光素子用材料、有機半導体材料、発光素子 |
| KR20130100236A (ko) * | 2010-04-26 | 2013-09-10 | 유니버셜 디스플레이 코포레이션 | Oled 용 바이카바졸 함유 화합물 |
| KR20150126381A (ko) * | 2013-04-05 | 2015-11-11 | 코니카 미놀타 가부시키가이샤 | 발광층 형성용 도포액, 유기 일렉트로루미네센스 소자와 그 제조 방법 및 조명·표시 장치 |
Family Cites Families (31)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4539507A (en) | 1983-03-25 | 1985-09-03 | Eastman Kodak Company | Organic electroluminescent devices having improved power conversion efficiencies |
| US5151629A (en) | 1991-08-01 | 1992-09-29 | Eastman Kodak Company | Blue emitting internal junction organic electroluminescent device (I) |
| DE59510315D1 (de) | 1994-04-07 | 2002-09-19 | Covion Organic Semiconductors | Spiroverbindungen und ihre Verwendung als Elektrolumineszenzmaterialien |
| DE19652261A1 (de) | 1996-12-16 | 1998-06-18 | Hoechst Ag | Arylsubstituierte Poly(p-arylenvinylene), Verfahren zur Herstellung und deren Verwendung in Elektroluminszenzbauelementen |
| EP1722602A1 (en) | 2004-03-05 | 2006-11-15 | Idemitsu Kosan Co., Ltd. | Organic electroluminescent device and organic electroluminescent display |
| JP4929186B2 (ja) | 2005-12-27 | 2012-05-09 | 出光興産株式会社 | 有機エレクトロルミネッセンス素子用材料及び有機エレクトロルミネッセンス素子 |
| USRE44831E1 (en) * | 2006-01-05 | 2014-04-08 | Konica Minolta Holdings, Inc. | Organic electroluminescent device, display, and illuminating device |
| US8044390B2 (en) | 2007-05-25 | 2011-10-25 | Idemitsu Kosan Co., Ltd. | Material for organic electroluminescent device, organic electroluminescent device, and organic electroluminescent display |
| DE102007031220B4 (de) | 2007-07-04 | 2022-04-28 | Novaled Gmbh | Chinoide Verbindungen und deren Verwendung in halbleitenden Matrixmaterialien, elektronischen und optoelektronischen Bauelementen |
| US8288013B2 (en) | 2007-07-18 | 2012-10-16 | Idemitsu Kosan Co., Ltd. | Material for organic electroluminescence device and organic electroluminescence device |
| WO2009069717A1 (ja) | 2007-11-30 | 2009-06-04 | Idemitsu Kosan Co., Ltd. | アザインデノフルオレンジオン誘導体、有機エレクトロルミネッセンス素子用材料及び有機エレクトロルミネッセンス素子 |
| TWI478624B (zh) | 2008-03-27 | 2015-03-21 | Nippon Steel & Sumikin Chem Co | Organic electroluminescent elements |
| US8057712B2 (en) | 2008-04-29 | 2011-11-15 | Novaled Ag | Radialene compounds and their use |
| US8119037B2 (en) | 2008-10-16 | 2012-02-21 | Novaled Ag | Square planar transition metal complexes and organic semiconductive materials using them as well as electronic or optoelectric components |
| DE102009009277B4 (de) | 2009-02-17 | 2023-12-07 | Merck Patent Gmbh | Organische elektronische Vorrichtung, Verfahren zu deren Herstellung und Verwendung von Verbindungen |
| DE102009053382A1 (de) * | 2009-11-14 | 2011-05-19 | Merck Patent Gmbh | Materialien für elektronische Vorrichtungen |
| JP5124785B2 (ja) * | 2009-12-07 | 2013-01-23 | 新日鉄住金化学株式会社 | 有機発光材料及び有機発光素子 |
| WO2011073149A1 (de) | 2009-12-14 | 2011-06-23 | Basf Se | Metallkomplexe, enthaltend diazabenzimidazolcarben-liganden und deren verwendung in oleds |
| DE102010013495A1 (de) | 2010-03-31 | 2011-10-06 | Siemens Aktiengesellschaft | Dotierstoff für eine Lochleiterschicht für organische Halbleiterbauelemente und Verwendung dazu |
| US9203037B2 (en) * | 2010-06-18 | 2015-12-01 | Basf Se | Organic electronic devices comprising a layer of a dibenzofurane compound and a 8-hydroxypquinolinolato earth alkaline metal, or alkali metal complex |
| WO2012000001A2 (de) | 2010-07-01 | 2012-01-05 | Psw Systems Ag | Speicher |
| US8932734B2 (en) | 2010-10-08 | 2015-01-13 | Universal Display Corporation | Organic electroluminescent materials and devices |
| TW201229052A (en) * | 2010-12-02 | 2012-07-16 | Nippon Steel Chemical Co | Heteroacene compound, organic semiconductor material, and organic electronic device |
| WO2012124412A1 (ja) * | 2011-03-16 | 2012-09-20 | 新日鐵化学株式会社 | 含窒素芳香族化合物及び有機電界発光素子 |
| JP5656228B2 (ja) * | 2011-06-24 | 2015-01-21 | 国立大学法人九州大学 | 有機エレクトロルミネッセンス素子 |
| US8409729B2 (en) | 2011-07-28 | 2013-04-02 | Universal Display Corporation | Host materials for phosphorescent OLEDs |
| CN103380508B (zh) * | 2011-11-22 | 2017-09-08 | 出光兴产株式会社 | 芳香族杂环衍生物、有机电致发光元件用材料以及有机电致发光元件 |
| US20140131665A1 (en) * | 2012-11-12 | 2014-05-15 | Universal Display Corporation | Organic Electroluminescent Device With Delayed Fluorescence |
| KR102190183B1 (ko) * | 2012-12-28 | 2020-12-11 | 이데미쓰 고산 가부시키가이샤 | 유기 일렉트로 루미네선스 소자 |
| KR102361072B1 (ko) | 2013-04-08 | 2022-02-09 | 메르크 파텐트 게엠베하 | 열 활성화 지연 형광 재료를 갖는 유기 전계발광 디바이스 |
| JP6567499B2 (ja) * | 2013-04-08 | 2019-08-28 | メルク パテント ゲーエムベーハー | 有機エレクトロルミネッセント素子 |
-
2014
- 2014-08-13 CN CN201480048894.XA patent/CN105518103B/zh active Active
- 2014-08-13 US US15/021,125 patent/US20160226001A1/en not_active Abandoned
- 2014-08-13 KR KR1020167009385A patent/KR102246399B1/ko active IP Right Grant
- 2014-08-13 EP EP14755593.2A patent/EP3044286B1/de active Active
- 2014-08-13 WO PCT/EP2014/002225 patent/WO2015036080A1/de active Application Filing
- 2014-08-13 JP JP2016541833A patent/JP6580571B2/ja active Active
- 2014-09-09 TW TW103131006A patent/TWI637946B/zh active
Patent Citations (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20090030202A1 (en) * | 2007-07-10 | 2009-01-29 | Idemitsu Kosan Co., Ltd. | Material for organic electroluminescent element and organic electroluminescent element employing the same |
| KR20130100236A (ko) * | 2010-04-26 | 2013-09-10 | 유니버셜 디스플레이 코포레이션 | Oled 용 바이카바졸 함유 화합물 |
| JP2013060411A (ja) * | 2010-10-15 | 2013-04-04 | Semiconductor Energy Lab Co Ltd | カルバゾール化合物、発光素子用材料、有機半導体材料、発光素子 |
| US20120256169A1 (en) * | 2011-04-08 | 2012-10-11 | Universal Display Corporation | Substituted oligoazacarbazoles for light emitting diodes |
| WO2013011955A1 (ja) * | 2011-07-15 | 2013-01-24 | 国立大学法人九州大学 | 遅延蛍光材料およびそれを用いた有機エレクトロルミネッセンス素子 |
| KR20150126381A (ko) * | 2013-04-05 | 2015-11-11 | 코니카 미놀타 가부시키가이샤 | 발광층 형성용 도포액, 유기 일렉트로루미네센스 소자와 그 제조 방법 및 조명·표시 장치 |
Cited By (16)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2018084423A3 (ko) * | 2016-11-07 | 2018-08-09 | 주식회사 엘지화학 | 신규한 헤테로 고리 화합물 및 이를 이용한 유기발광소자 |
| US11802123B2 (en) | 2016-11-07 | 2023-10-31 | Lg Chem, Ltd. | Heterocyclic compound and organic light emitting device comprising the same |
| US11208402B2 (en) | 2016-11-07 | 2021-12-28 | Lg Chem, Ltd. | Heterocyclic compound and organic light emitting device comprising the same |
| WO2018101691A1 (ko) * | 2016-11-29 | 2018-06-07 | 주식회사 엘지화학 | 유기 발광 소자 |
| US10897015B2 (en) | 2017-02-27 | 2021-01-19 | Samsung Display Co., Ltd. | Organic light emitting device |
| US11851423B2 (en) | 2017-07-19 | 2023-12-26 | Lg Chem, Ltd. | Heterocyclic compound and organic light emitting device comprising the same |
| KR20190013139A (ko) * | 2017-07-31 | 2019-02-11 | 엘티소재주식회사 | 헤테로고리 화합물 및 이를 포함하는 유기 발광 소자 |
| KR20190024780A (ko) * | 2017-08-28 | 2019-03-08 | 시노라 게엠베하 | 유기 분자, 특히 광전자 디바이스에 사용하기 위한 유기 분자 |
| KR20190027343A (ko) * | 2017-09-06 | 2019-03-14 | 주식회사 엘지화학 | 유기 발광 소자 |
| KR20190064009A (ko) * | 2017-11-30 | 2019-06-10 | 엘지디스플레이 주식회사 | 우수한 발광 특성을 가지는 유기 화합물, 이를 포함하는 유기발광다이오드 및 유기발광장치 |
| US11581494B2 (en) | 2017-12-27 | 2023-02-14 | Lg Chem, Ltd. | Organic light emitting device |
| US11767315B2 (en) | 2018-06-14 | 2023-09-26 | Lg Chem, Ltd. | Heterocyclic compound and organic light-emitting device including same |
| WO2019240532A1 (ko) * | 2018-06-14 | 2019-12-19 | 주식회사 엘지화학 | 헤테로고리 화합물 및 이를 포함하는 유기 발광 소자 |
| KR20200034626A (ko) * | 2018-09-21 | 2020-03-31 | 주식회사 엘지화학 | 신규한 헤테로 고리 화합물 및 이를 이용한 유기 발광 소자 |
| WO2020096350A1 (ko) * | 2018-11-06 | 2020-05-14 | 주식회사 엘지화학 | 신규한 화합물 및 이를 이용한 유기 발광 소자 |
| US11832517B2 (en) | 2018-11-06 | 2023-11-28 | Lg Chem, Ltd. | Heterocyclic compound and organic light emitting device comprising same |
Also Published As
| Publication number | Publication date |
|---|---|
| CN105518103A (zh) | 2016-04-20 |
| KR102246399B1 (ko) | 2021-04-29 |
| EP3044286B1 (de) | 2018-01-31 |
| EP3044286A1 (de) | 2016-07-20 |
| US20160226001A1 (en) | 2016-08-04 |
| TWI637946B (zh) | 2018-10-11 |
| CN105518103B (zh) | 2018-12-21 |
| JP6580571B2 (ja) | 2019-09-25 |
| JP2016536802A (ja) | 2016-11-24 |
| TW201527291A (zh) | 2015-07-16 |
| WO2015036080A1 (de) | 2015-03-19 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR102246399B1 (ko) | 유기 전계발광 디바이스 | |
| KR101925192B1 (ko) | 전자 소자용 물질 | |
| KR101963104B1 (ko) | 전자 디바이스 | |
| KR102088637B1 (ko) | 전자 소자용 화합물 | |
| JP6022478B2 (ja) | 有機エレクトロルミネッセンス素子のための材料 | |
| KR101959575B1 (ko) | 유기 전계발광 디바이스용 트리페닐렌계 재료 | |
| JP5851999B2 (ja) | 電子素子のための材料 | |
| TWI798167B (zh) | 用於電子裝置之材料 | |
| KR101948334B1 (ko) | 전자 디바이스용 재료 | |
| KR20180041744A (ko) | 6,9,15,18-테트라히드로-s-인다세노[1,2-b:5,6-b']디플루오렌 유도체 및 전자 소자에서의 이의 용도 | |
| KR20160149267A (ko) | 전자 소자용 재료 | |
| KR20160039657A (ko) | 전자 소자용 물질 | |
| JP6271417B2 (ja) | 電子素子のための材料 | |
| KR20150093836A (ko) | 전자 소자용 물질 | |
| KR101884034B1 (ko) | 전자 소자용 화합물 | |
| KR20170110641A (ko) | 전자 디바이스용 재료 | |
| KR20160103144A (ko) | 유기 전계발광 소자용 재료 | |
| KR102173856B1 (ko) | 전자 소자 | |
| KR20200090817A (ko) | 전자 디바이스용 재료 | |
| KR20190141220A (ko) | 전자 디바이스용 화합물 | |
| KR20180077216A (ko) | 유기 전계발광 소자용 재료 | |
| KR102013465B1 (ko) | 전자 소자용 화합물 | |
| TW201945514A (zh) | 有機電致發光裝置之材料 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A201 | Request for examination | ||
| E902 | Notification of reason for refusal | ||
| E701 | Decision to grant or registration of patent right | ||
| GRNT | Written decision to grant |