KR20140074997A - 신경병성 질환에서 마이크로rna - Google Patents
신경병성 질환에서 마이크로rna Download PDFInfo
- Publication number
- KR20140074997A KR20140074997A KR1020147012433A KR20147012433A KR20140074997A KR 20140074997 A KR20140074997 A KR 20140074997A KR 1020147012433 A KR1020147012433 A KR 1020147012433A KR 20147012433 A KR20147012433 A KR 20147012433A KR 20140074997 A KR20140074997 A KR 20140074997A
- Authority
- KR
- South Korea
- Prior art keywords
- mir
- hsa
- subject
- level
- micrornas
- Prior art date
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/68—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving nucleic acids
- C12Q1/6876—Nucleic acid products used in the analysis of nucleic acids, e.g. primers or probes
- C12Q1/6883—Nucleic acid products used in the analysis of nucleic acids, e.g. primers or probes for diseases caused by alterations of genetic material
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P21/00—Drugs for disorders of the muscular or neuromuscular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P21/00—Drugs for disorders of the muscular or neuromuscular system
- A61P21/02—Muscle relaxants, e.g. for tetanus or cramps
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/11—DNA or RNA fragments; Modified forms thereof; Non-coding nucleic acids having a biological activity
- C12N15/113—Non-coding nucleic acids modulating the expression of genes, e.g. antisense oligonucleotides; Antisense DNA or RNA; Triplex- forming oligonucleotides; Catalytic nucleic acids, e.g. ribozymes; Nucleic acids used in co-suppression or gene silencing
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/10—Type of nucleic acid
- C12N2310/11—Antisense
- C12N2310/113—Antisense targeting other non-coding nucleic acids, e.g. antagomirs
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/30—Chemical structure
- C12N2310/32—Chemical structure of the sugar
- C12N2310/323—Chemical structure of the sugar modified ring structure
- C12N2310/3231—Chemical structure of the sugar modified ring structure having an additional ring, e.g. LNA, ENA
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q2600/00—Oligonucleotides characterized by their use
- C12Q2600/158—Expression markers
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q2600/00—Oligonucleotides characterized by their use
- C12Q2600/178—Oligonucleotides characterized by their use miRNA, siRNA or ncRNA
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Engineering & Computer Science (AREA)
- Organic Chemistry (AREA)
- Genetics & Genomics (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Zoology (AREA)
- Wood Science & Technology (AREA)
- Biomedical Technology (AREA)
- General Health & Medical Sciences (AREA)
- Biotechnology (AREA)
- Molecular Biology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- General Engineering & Computer Science (AREA)
- Analytical Chemistry (AREA)
- Microbiology (AREA)
- Biophysics (AREA)
- Physics & Mathematics (AREA)
- Biochemistry (AREA)
- Medicinal Chemistry (AREA)
- Animal Behavior & Ethology (AREA)
- Neurology (AREA)
- Veterinary Medicine (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Public Health (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Pharmacology & Pharmacy (AREA)
- Pathology (AREA)
- Immunology (AREA)
- Plant Pathology (AREA)
- Orthopedic Medicine & Surgery (AREA)
- Physical Education & Sports Medicine (AREA)
- Neurosurgery (AREA)
- Pain & Pain Management (AREA)
- Measuring Or Testing Involving Enzymes Or Micro-Organisms (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Investigating Or Analysing Biological Materials (AREA)
Abstract
본 발명은 대상체에서 신경병성 질환(예, 근 위축성 측삭 경화증 및 다발성 경화증)을 진단하는 방법, 신경병성 질환이 발생될 위험에 있는 대상체를 확인하는 방법, 신경병성 질환이 있는 대상체에서 질환의 진행 속도를 예측하는 방법, 신경병성 질환의 치료를 위한 대상체를 선택하는 방법, 임상 연구 참여를 위한 대상체를 선택하는 방법, 및 신경병성 질환의 치료의 효능을 판단하는 방법을 제공한다. 이러한 방법들은 상기 대상체의 단핵구(예, CD14+CD16- 또는 CD14+CD16- 단핵구) 또는 뇌척수액(CSF) 내의 하나 이상의 마이크로RNA 및/또는 하나 이상의 염증 마커의 레벨을 결정하는 단계, 및 상기 하나 이상의 마이크로RNA의 레벨 및/또는 상기 하나 이상의 염증 마커의 레벨을 기준 레벨에 비교하는 단계를 포함한다. 또한, 본 발명은 신경병성 질환을 치료하는 방법으로서, 대상체의 단핵구(예, CD14+CD16- 또는 CD14+CD16- 단핵구) 또는 CSF 내의 하나 이상의 마이크로RNA 또는 하나 이상의 염증 마커의 상기 레벨 또는 활성을 감소시키거나 증가시기는 적어도 하나의 제제를 대상체에 투여하는 단계를 포함하는 방법을 제공한다.
Description
관련 출원의 상호-참조
본 출원은 2011년 10월 11일에 출원한 미국 가특허 출원 번호 제61/545,968호 및 2012년 2월 21일에 출원한 미국 가특허 출원 번호 제61/601,205호에 대하여 우선권을 주장하여, 상기 특허 출원의 개시 사항은 본 명세서에 참조로서 병합된다.
염증은 많은 신경병성 질환(neurodegenerative disorders)(예, 근 위축성 측삭 경화증 (amyotrophic lateral sclerosis, ALS) 및 다발성 경화증(multiple sclerosis))과 관련이 있다. 예를 들면, ALS 환자 및 ALS 동물 모델에서 염증 반응이 증가하는 것이 관찰되었다(McGreer et al., Muscle Nerve 26:459-470, 2002; Beers et al., Proc . Natl . Acad . Sci . U.S.A. 105:15558-15563, 2008; Banerjee et al., PLoS ONE 3:e2740, 2008; Chiu et al., Proc . Natl. Acad . Sci . U.S.A. 105:17913-17918, 2008; Chiu et al., Proc . Natl . Acad . Sci. U.S.A. 106:20960-20965, 2009; Beers et al., Proc . Natl . Acad . Sci . U.S.A. 103:16021-16026, 2006; Henkel et al., Ann . Neurol . 55:221-235, 2004; Meissner et al., Proc . Natl . Acad . Sci . U.S.A. 107:13046-13050, 2010). 가족유전성 ALS 마우스 모델에서 미세아교세포 및 성상세포가 중추 신경계에서 활성화되고(Alexianu et al., Neurology 57:1282-1289, 2001; Hall et al., Glia 23:249-256, 1998), ALS 마우스 모델의 경우 자연 살해 세포 및 말초 T-세포가 신경병성 질환의 진행 중에 척수에 침투한다(Chiu et al., Proc . Natl . Acad . Sci . U.S.A. 105:17913-17918, 2008)는 것이 보고되었다.
말초 신경계에서, 말초 운동 축삭(motor axon)의 변성은 ALS 환자와 ALS 동물 모델에서 초기의 중요한 병적 특징이며, 대식 세포의 점증 및 활성화로 이어진다(Chiu et al., Proc . Natl . Acad . Sci . U.S.A. 106:20960-20965, 2009). 마우스의 특정 단핵구 서브세트(subset)(Ly6CHi)는 다발성 경화증 마우스 모델에서 조직을 손상시키거나 질환을 일으키며(King et al., Blood 113:3190-3197, 2009), 이러한 단핵구들은 CCL2에 의하여 염증 조직으로 모여 점증한다(Kim et al., Immunity 34:769-780, 2011; Getts et al., J. Exp . Med . 205:2319-2337, 2008).
본 발명은 대상체에서 신경병성 질환(예, 근 위축성 측삭 경화증 및 다발성 경화증)을 진단하는 방법, 신경병성 질환이 발생될 위험에 있는 대상체를 확인하는 방법, 신경병성 질환이 있는 대상체에서 질환의 진행 속도를 예측하는 방법, 신경병성 질환의 치료를 위한 대상체를 선택하는 방법, 임상 연구 참여를 위한 대상체를 선택하는 방법, 및 신경병성 질환의 치료의 효능을 판단하는 방법을 제공하고자 한다.
본 발명은, 건강한 대상체(subjects)의 뇌척수액(cerebrospinal fluid, CSF) 및 CD14+CD16- 및 CD14+CD16+ 단핵구에서의 특정 마이크로RNA 및 염증 마커 유전자의 발현율에 비하여, 이러한 마이크로RNA 및 염증 마커 유전자가 신경병성 질환을 가지는 대상체의 뇌척수액(CSF) 및 CD14+CD16- 및 CD14+CD16+ 단핵구에서 증가하거나 감소한다는 사실에 적어도 부분적으로 기반한 것이다. 신경병성 질환을 가지는 대상체의 뇌척수액(CSF) 및 CD14+CD16- 및 CD14+CD16+ 단핵구에서 증가하거나 감소하는 것으로 확인된 특정 마이크로RNA 및 염증 마커 유전자가 표 1 내지 21에 열거되어 있다. 본원에 기재된 염증 마커는 표 20 및 21에 열거되어 있다.
본 발명은 대상체의 신경병성 질환(예, 근 위축성 측삭 경화증 또는 다발성 경화증)을 진단하는 방법으로서, 상기 대상체의 단핵구(예, CD14+CD16- 및 CD14+CD16+ 단핵구) 또는 CSF에서 표 1 내지 21 중 어느 하나 이상에 열거된 하나 이상의 마이크로RNA 및/또는 하나 이상의 염증 마커의 레벨을 결정하는 단계; 및 상기 하나 이상의 마이크로RNA 및/또는 하나 이상의 염증 마커의 상기 레벨을 상기 하나 이상의 마이크로RNA 및/또는 하나 이상의 염증 마커의 기준 레벨(예, 건강한 대상체의 CSF 또는 CD14+CD16- 혹은 CD14+CD16+ 단핵구에서의 임계 레벨(threshold level) 또는 레벨)과 비교하는 단계를 포함하는 방법을 제공한다. 상기 방법에서, 상기 기준 레벨 대비 상기 하나 이상의 마이크로RNA 및/또는 하나 이상의 염증 마커의 상기 레벨의 증가 또는 감소는 상기 대상체가 신경병성 질환이 있다는 것을 나타낸다.
또한, 본 발명은 대상체의 신경병성 질환(예, 근 위축성 측삭 경화증 또는 다발성 경화증)이 발생될 위험에 있는 대상체를 확인하는 방법으로서, 상기 대상체의 단핵구(예, CD14+CD16- 또는 CD14+CD16+ 단핵구(예, 말초 또는 혈액 유래 단핵구)) 또는 CSF에서 표 1 내지 21 중 어느 하나 이상에 열거된 하나 이상의 마이크로RNA 및/또는 하나 이상의 염증 마커의 레벨을 결정하는 단계; 및 상기 하나 이상의 마이크로RNA 및/또는 하나 이상의 염증 마커의 상기 레벨을 상기 하나 이상의 마이크로RNA 및/또는 하나 이상의 염증 마커의 기준 레벨(예, 건강한 대상체의 CSF 또는 CD14+CD16- 혹은 CD14+CD16+ 단핵구(예, 말초 또는 혈액 유래 단핵구)에서의 임계 레벨 또는 레벨)과 비교하는 단계를 포함하는 방법을 제공한다. 상기 방법에서, 상기 기준 레벨 대비 상기 하나 이상의 마이크로RNA 및/또는 하나 이상의 염증 마커의 상기 레벨의 증가 또는 감소는 상기 대상체에 신경병성 질환이 발생될 위험이 증가하거나 감소하는 것(예, 기준 레벨 대비 상기 하나 이상의 마이크로RNA 및/또는 하나 이상의 염증 마커의 레벨의 증가 또는 감소가 없는 사람을 기준으로 함)을 나타낸다.
또한, 본 발명은 신경병성 질환(예, 근 위축성 측삭 경화증 또는 다발성 경화증)이 있는 대상체에서 질환의 진행 속도를 예측하는 방법으로서, 상기 대상체의 단핵구(예, CD14+CD16- 또는 CD14+CD16+ 단핵구(예, 말초 또는 혈액 유래 단핵구)) 또는 CSF 내의 표 1 내지 21 중 어느 하나 이상에 열거된 하나 이상의 마이크로RNA 및/또는 하나 이상의 염증 마커의 레벨을 결정하는 단계; 및 상기 하나 이상의 마이크로RNA 및/또는 하나 이상의 염증 마커의 상기 레벨을 상기 하나 이상의 마이크로RNA 및/또는 하나 이상의 염증 마커의 기준 레벨(예, 건강한 대상체의 CSF 또는 CD14+CD16- 혹은 CD14+CD16+ 단핵구(예, 말초 또는 혈액 유래 단핵구)에서의 임계 레벨 또는 레벨)과 비교하는 단계를 포함하는 방법을 제공한다. 상기 방법에서, 상기 기준 레벨 대비 상기 하나 이상의 마이크로RNA 및/또는 하나 이상의 염증 마커의 상기 레벨의 증가 또는 감소는 상기 대상체에서 질환 진행 속도가 증가하거나 감소할 것(예, 기준 레벨 대비 상기 하나 이상의 마이크로RNA 및/또는 하나 이상의 염증 마커의 상기 레벨의 증가 또는 감소가 없는 사람을 기준으로 함)임을 나타낸다.
또한, 본 발명은 대상체의 신경병성 질환(예, 근 위축성 측삭 경화증 또는 다발성 경화증)의 치료를 위한 대상체를 선택하는 방법으로서, 상기 대상체의 단핵구(예, CD14+CD16- 또는 CD14+CD16+ 단핵구(예, 말초 또는 혈액 유래 단핵구)) 또는 CSF 내의 표 1 내지 21 중 어느 하나 이상에 열거된 하나 이상의 마이크로RNA 및/또는 하나 이상의 염증 마커의 레벨을 결정하는 단계; 상기 하나 이상의 마이크로RNA 및/또는 하나 이상의 염증 마커의 상기 레벨을 상기 하나 이상의 마이크로RNA 및/또는 하나 이상의 염증 마커의 기준 레벨(예, 건강한 대상체의 CSF 또는 CD14+CD16- 혹은 CD14+CD16+ 단핵구(예, 말초 또는 혈액 유래 단핵구)에서의 임계 레벨 또는 레벨)과 비교하는 단계; 및 상기 기준 레벨 대비 상기 하나 이상의 마이크로RNA 및/또는 하나 이상의 염증 마커의 상기 레벨의 증가 또는 감소가 있는 대상체를 신경병성 질환의 치료를 위하여 선택하는 단계를 포함하는 방법을 제공한다.
또한, 본 발명은 대상체에서 신경병성 질환(예, 근 위축성 측삭 경화증 또는 다발성 경화증)의 치료제의 효능을 판단하는 방법으로서, 제1 시점에서 상기 대상체의 단핵구(예, CD14+CD16- 또는 CD14+CD16+ 단핵구(예, 말초 또는 혈액 유래 단핵구)) 또는 CSF 내의 표 1 내지 21 중 어느 하나 이상에 열거된 하나 이상의 마이크로RNA 및/또는 하나 이상의 염증 마커의 레벨을 결정하는 단계; 적어도 1 회분의 치료제를 투여한 후의 제 2 시점에서 상기 대상체의 단핵구(예, CD14+CD16- 또는 CD14+CD16+ 단핵구(예, 말초 또는 혈액 유래 단핵구)) 또는 CSF 내의 상기 하나 이상의 마이크로RNA 및/또는 하나 이상의 염증 마커의 레벨을 결정하는 단계; 및 제1 시점에서의 상기 하나 이상의 마이크로RNA 및/또는 하나 이상의 염증 마커의 상기 레벨을 제2 시점에서의 상기 하나 이상의 마이크로RNA 및/또는 하나 이상의 염증 마커의 상기 레벨과 비교하는 단계를 포함하는 방법을 제공한다. 상기 방법에서, 상기 제2 시점에서 건강한 대상체에서의 레벨로 복귀하거나 접근하는 것(예, 상술한 바와 같은 상기 하나 이상의 마이크로RNA 및/또는 상기 하나 이상의 염증 마커의 상기 제1 시점에서의 레벨 대비 상기 제2 시점에서의 레벨의 증가 또는 감소)은 상기 치료제가 상기 대상체에서 효과적이었다(예를 들면, 상기 치료제가 동일한 신경병성 질환이 있고 동일한 치료제를 받은 대상체에 대하여 효과적이었지만, 상기 제2 시점에서 건강한 대상체의 레벨으로의 복귀 또는 접근을 보여 주지 않거나(예, 상술한 바와 같은 기준 값 대비 상기 하나 이상의 마이크로RNA 및/또는 상기 하나 이상의 염증 마커의 상기 레벨의 증가 또는 감소), 상술한 바와 같은 기준 값 대비 상기 하나 이상의 마이크로RNA 및/또는 상기 하나 이상의 염증 마커의 상기 레벨의 유의미한 증가 또는 감소를 보여주지 않음)는 것을 나타낸다.
또한, 본 발명은 임상 연구 참여를 위한 대상체를 선택하는 방법을 제공한다. 상기 방법은 상기 대상체의 단핵구(예, CD14+CD16- 또는 CD14+CD16+ 단핵구(예, 말초 또는 혈액 유래 단핵구)) 또는 CSF 내의 표 1 내지 21 중 어느 하나 이상에 열거된 하나 이상의 마이크로RNA 및/또는 하나 이상의 염증 마커의 레벨을 결정하는 단계; 상기 하나 이상의 마이크로RNA 및/또는 하나 이상의 염증 마커의 상기 레벨을 상기 하나 이상의 마이크로RNA 및/또는 하나 이상의 염증 마커의 기준 레벨(예, 건강한 대상체의 CSF 또는 CD14+CD16- 혹은 CD14+CD16+ 단핵구(예, 말초 또는 혈액 유래 단핵구)에서의 임계 레벨 또는 레벨)과 비교하는 단계; 및 상기 기준 레벨 대비 상기 하나 이상의 마이크로RNA 및/또는 하나 이상의 염증 마커의 상기 레벨의 증가 또는 감소가 있는 대상체를 임상 연구 참여를 위하여 선택하는 단계를 포함하는 방법을 제공한다.
또한, 본 발명은 대상체에서 신경병성 질환(예, 근 위축성 측삭 경화증 또는 다발성 경화증)을 치료하는 방법으로서, 표 1, 3, 5, 7, 9, 11, 12, 14, 16, 또는 18에 열거된 하나 이상의 마이크로RNA 또는 표 21에 열거된 임의의 염증 마커의 발현 또는 활성을 감소시키는 적어도 하나의 제제(예, 억제성 핵산, 예, 안타고미르(antagomir))를 대상체에 투여하는 단계를 포함하는 방법을 제공한다. 또한, 본 발명은 대상체에서 신경병성 질환(예, 근 위축성 측삭 경화증 또는 다발성 경화증)을 치료하는 방법으로서, 표 2, 4, 6, 8, 10, 13, 15, 17, 또는 19에 열거된 하나 이상의 마이크로RNA 또는 표 20에 열거된 임의의 염증 마커의 발현 또는 활성을 증가시키는 적어도 하나의 제제(예, 센스(단백질-암호화) 핵산을 함유한 핵산)를 대상체에 투여하는 단계를 포함하는 방법을 제공한다.
또한, 본 발명은 대상체에서 신경병성 질환(예, 산발성(sporadic) ALS 또는 가족성(familial) ALS, 또는 다발성 경화증)을 치료하는 방법으로, hsa-miR-155에 존재하는 연속 서열(예, 전구체(precursor) 또는 성숙한(mature) 형태의 hsa-miR-155에 존재하는 연속 서열)에 상보적인 서열을 포함하는 적어도 하나의 억제성 핵산(예, siRNA, 안티센스 올리고뉴클레오티드, 안타고미르, 및/또는 리보자임)을 신경병성 질환(예, 산발성(sporadic) ALS 또는 가족성(familial) ALS, 또는 다발성 경화증)이 있는 대상체에 투여하는 단계를 포함하는 방법을 제공한다.
또한, 본 발명은 연속 서열, 예를 들면 hsa-miR-155, hsa-miR-19b, hsa-miR-106b, hsa-miR-30b, hsa-miR-21, hsa-miR-142-5p, hsa-miR-27a, hsa-miR-16, hsa-miR-374a, hsa-miR-374b, hsa-miR-101, hsa-miR-340, hsa-miR-30e, hsa-miR-29c, hsa-miR-29a, hsa-miR-223, hsa-miR-26a, hsa-miR-26b, hsa-miR-24, hsa-miR-181a, hsa-miR-103, hsa-miR-532-3p, hsa-miR-27b, hsa-miR-99b, hsa-miR-146a, hsa-miR-150, hsa-miR-328, hsa-miR-15b, 또는 hsa-miR-19a에 존재하는, 적어도 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 또는 25개의 뉴클레오티드의 연속 서열에 상보적인 서열을 포함하는, 대상체에서 근 위축성 측삭 경화증(ALS)을 치료하는데 사용하기 위한 억제성 핵산을 제공한다. 바람직하게는 상기 서열은 hsa-miR-155에 존재하는 적어도 7개 또는 8개의 뉴클레오티드의 연속 서열에 상보적이다.
본 발명은 대상체에서 근 위축성 측삭 경화증(ALS)을 진단하는 방법으로서, 상기 대상체의 CD14+CD16- 단핵구에서 hsa-miR-19b, hsa-miR-106b, hsa-miR-30b, hsa-miR-21, hsa-miR-142-5p, hsa-miR-27a, hsa-miR-16, hsa-miR-374a, hsa-miR-374b, hsa-miR-101, hsa-miR-340, hsa-miR-30e, hsa-miR-29c, hsa-miR-29a, hsa-miR-223, hsa-miR-26a, hsa-miR-26b, hsa-miR-24, hsa-miR-181a, hsa-miR-103, hsa-miR-155, hsa-miR-532-3p, hsa-miR-518f, hsa-miR-206, hsa-miR-204, hsa-miR-137, hsa-miR-453, hsa-miR-146a, hsa-miR-603, hsa-miR-1297, hsa-miR-192, hsa-miR-526a, hsa-miR-615-5p, hsa-miR-655, hsa-miR-450b-5p, hsa-miR-548b-3p, hsa-miR-584, hsa-miR-548f, hsa-miR-300, hsa-miR-302c, hsa-miR-328, hsa-miR-421, 및 hsa-miR-580으로 구성되는 군에서 선택되는 하나 이상의 마이크로RNA의 레벨을 결정하는 단계; 및 상기 대상체의 CD14+CD16- 단핵구에서 상기 하나 이상의 마이크로RNA의 레벨을 상기 하나 이상의 마이크로RNA의 기준 레벨과 비교하는 단계를 포함하되, 상기 기준 레벨에 대한 상기 대상체의 CD14+CD16- 단핵구 내의 hsa-miR-19b, hsa-miR-106b, hsa-miR-30b, hsa-miR-21, hsa-miR-142-5p, hsa-miR-27a, hsa-miR-16, hsa-miR-374a, hsa-miR-374b, hsa-miR-101, hsa-miR-340, hsa-miR-30e, hsa-miR-29c, hsa-miR-29a, hsa-miR-223, hsa-miR-26a, hsa-miR-26b, hsa-miR-24, hsa-miR-181a, hsa-miR-103, hsa-miR-155, and hsa-miR-532-3p 중 하나 이상의 증가 및/또는 hsa-miR-518f, hsa-miR-206, hsa-miR-204, hsa-miR-137, hsa-miR-453, hsa-miR-146a, hsa-miR-603, hsa-miR-1297, hsa-miR-192, hsa-miR-526a, hsa-miR-615-5p, hsa-miR-655, hsa-miR-450b-5p, hsa-miR-548b-3p, hsa-miR-584, hsa-miR-548f, hsa-miR-300, hsa-miR-302c, hsa-miR-328, hsa-miR-421, 및 hsa-miR-580 중 하나 이상의 레벨의 감소는 상기 대상체가 ALS이 있음을 나타내는 것인 방법을 제공한다.
또한, 본 발명은 대상체에서, 근 위축성 측삭 경화증(ALS)을 진단하는 방법으로서, 상기 대상체의 뇌척수액(CSF)에서 hsa-miR-27b, hsa-miR-99b, hsa-miR-146a, hsa-miR-150, hsa-miR-328, 및 hsa-miR-532-3p 중 하나 이상의 레벨을 결정하고; 상기 대상체의 CSF에서 hsa-miR-27b, hsa-miR-99b, hsa-miR-146a, hsa-miR-150, hsa-miR-328, 및 hsa-miR-532-3p 중 하나 이상의 레벨을 hsa-miR-27b, hsa-miR-99b, hsa-miR-146a, hsa-miR-150, hsa-miR-328, 및 hsa-miR-532-3p 중 하나 이상의 기준 레벨과 비교하는 것을 포함하되, 상기 기준 레벨에 대한 상기 대상체의 CSF에서 hsa-miR-27b, hsa-miR-99b, hsa-miR-146a, hsa-miR-150, hsa-miR-328, 및 hsa-miR-532-3p 중 하나 이상의 레벨의 증가는 상기 대상체가 ALS이 있음을 나타내는 것인 방법을 제공한다.
또한, 본 발명은 대상체에서 가족성 근 위축성 측삭 경화증(familial ALS)을 진단하는 방법으로서, 상기 대상체의 뇌척수액(CSF) 내의 hsa-miR-27b의 레벨 및 hsa-miR-99b, hsa-miR-146a, hsa-miR-150, hsa-miR-328, 및 hsa-miR-532-3p 중 하나 이상의 레벨을 결정하는 단계; 및 상기 대상체의 CSF 내의 hsa-miR-27b의 레벨을 hsa-miR-27b의 기준 레벨에 비교하고 상기 대상체의 CSF 내의 hsa-miR-99b, hsa-miR-146a, hsa-miR-150, hsa-miR-328, 및 hsa-miR-532-3p 중 하나 이상의 레벨을 hsa-miR-99b, hsa-miR-146a, hsa-miR-150, hsa-miR-328, 및 hsa-miR-532-3p 중 하나 이상의 기준 레벨에 비교는 단계를 포함하되, 상기 hsa-miR-27b의 기준 레벨 대비 상기 대상체의 CSF 내의 hsa-miR-27b의 상기 레벨의 증가 및 hsa-miR-99b, hsa-miR-146a, hsa-miR-150, hsa-miR-328, 및 hsa-miR-532-3p 중 하나 이상의 상기 기준 레벨 대비 상기 대상체의 CSF 내의 hsa-miR-99b, hsa-miR-146a, hsa-miR-150, hsa-miR-328, 및 hsa-miR-532-3p 중 하나 이상의 상기 레벨의 감소 또는 유의하지 않은 변화는 상기 대상체가 가족성 ALS이 있음을 나타내는 것인 방법을 제공한다.
또한, 본 발명은 대상체에서 산발성 근 위축성 측삭 경화증(sporadic ALS)을 진단하기 위한 방법으로서, 상기 대상체의 뇌척수액(CSF) 내의 hsa-miR-27b, hsa-miR-99b, hsa-miR-146a, hsa-miR-150, hsa-miR-328, 및 hsa-miR-532-3p으로 구성되는 군에서 선택된 둘 이상의 마이크로RNA의 레벨을 결정하는 단계; 및 상기 대상체의 CSF 내의 상기 둘 이상의 마이크로RNA의 상기 레벨을 상기 둘 이상의 마이크로RNA의 기준 레벨에 비교하는 단계를 포함하되, 상기 기준 레벨 대비 상기 대상체의 CSF 내의 상기 둘 이상의 마이크로RNA의 상기 레벨의 증가는 상기 대상체가 산발성 ALS가 있음을 나타내는 것인 방법을 제공하다.
본 발명은 대상체에서 근 위축성 측삭 경화증(ALS)이 발병될 위험이 있는 대상체를 확인하는 방법으로서, 상기 대상체의 CD14+CD16- 단핵구 내의 hsa-miR-19b, hsa-miR-106b, hsa-miR-30b, hsa-miR-21, hsa-miR-142-5p, hsa-miR-27a, hsa-miR-16, hsa-miR-374a, hsa-miR-374b, hsa-miR-101, hsa-miR-340, hsa-miR-30e, hsa-miR-29c, hsa-miR-29a, hsa-miR-223, hsa-miR-26a, hsa-miR-26b, hsa-miR-24, hsa-miR-181a, hsa-miR-103, hsa-miR-155, hsa-miR-532-3p, hsa-miR-518f, hsa-miR-206, hsa-miR-204, hsa-miR-137, hsa-miR-453, hsa-miR-146a, hsa-miR-603, hsa-miR-1297, hsa-miR-192, hsa-miR-526a, hsa-miR-615-5p, hsa-miR-655, hsa-miR-450b-5p, hsa-miR-548b-3p, hsa-miR-584, hsa-miR-548f, hsa-miR-300, hsa-miR-302c, hsa-miR-328, hsa-miR-421, 및 hsa-miR-580으로 구성되는 군에서 선택되는 하나 이상의 마이크로RNA의 레벨을 결정하는 단계; 상기 대상체의 CD14+CD16- 단핵구 내의 상기 하나 이상의 마이크로RNA의 상기 레벨을 상기 하나 이상의 마이크로RNA의 기준 레벨과 비교하는 단계를 포함하되, 상기 기준 레벨 대비 상기 대상체의 CD14+CD16- 단핵구 내의 hsa-miR-19b, hsa-miR-106b, hsa-miR-30b, hsa-miR-21, hsa-miR-142-5p, hsa-miR-27a, hsa-miR-16, hsa-miR-374a, hsa-miR-374b, hsa-miR-101, hsa-miR-340, hsa-miR-30e, hsa-miR-29c, hsa-miR-29a, hsa-miR-223, hsa-miR-26a, hsa-miR-26b, hsa-miR-24, hsa-miR-181a, hsa-miR-103, hsa-miR-155, and hsa-miR-532-3p 중 하나 이상의 상기 레벨의 증가 및/또는 hsa-miR-518f, hsa-miR-206, hsa-miR-204, hsa-miR-137, hsa-miR-453, hsa-miR-146a, hsa-miR-603, hsa-miR-1297, hsa-miR-192, hsa-miR-526a, hsa-miR-615-5p, hsa-miR-655, hsa-miR-450b-5p, hsa-miR-548b-3p, hsa-miR-584, hsa-miR-548f, hsa-miR-300, hsa-miR-302c, hsa-miR-328, hsa-miR-421, 및 hsa-miR-580 중 하나 이상의 상기 레벨의 감소는 상기 대상체가 ALS가 발생될 위험이 증가하고 있음을 나타내는 것인 방법을 제공한다.
또한, 본 발명은 대상체에서 근 위축성 측삭 경화증(ALS)이 발생될 위험이 있는 대상체를 확인하는 방법으로서, 상기 대상체의 뇌척수액(CSF) 내의 hsa-miR-27b, hsa-miR-99b, hsa-miR-146a, hsa-miR-150, hsa-miR-328, 및 hsa-miR-532-3p 중 하나 이상의 레벨을 결정하는 단계; 및 상기 대상체의 CSF 내의 hsa-miR-27b, hsa-miR-99b, hsa-miR-146a, hsa-miR-150, hsa-miR-328, 및 hsa-miR-532-3p 중 하나 이상의 상기 레벨을 hsa-miR-27b, hsa-miR-99b, hsa-miR-146a, hsa-miR-150, hsa-miR-328, 및 hsa-miR-532-3p 중 하나 이상의 기준 레벨에 비교하는 단계를 포함하되, 상기 기준 레벨 대비 상기 대상체의 CSF 내의 hsa-miR-27b, hsa-miR-99b, hsa-miR-146a, hsa-miR-150, hsa-miR-328, 및 hsa-miR-532-3p 중 하나 이상의 상기 레벨의 증가는 상기 대상체가 ALS가 발생될 위험이 증가하고 있음을 나타내는 것인 방법을 제공한다.
또한, 본 발명은 대상체에서 가족성 근 위축성 측삭 경화증(ALS)이 발생될 위험이 있는 대상체를 확인하는 방법으로서, 상기 대상체의 뇌척수액(CSF) 내의 hsa-miR-27b의 레벨 및 hsa-miR-99b, hsa-miR-146a, hsa-miR-150, hsa-miR-328, 및 hsa-miR-532-3p 중 하나 이상의 레벨을 결정하는 단계; 및 상기 대상체의 CSF 내의 hsa-miR-27b의 상기 레벨을 hsa-miR-27b의 기준 레벨에 비교하고 상기 대상체의 CSF 내의 hsa-miR-99b, hsa-miR-146a, hsa-miR-150, hsa-miR-328, 및 hsa-miR-532-3p 중 하나 이상의 상기 레벨을 hsa-miR-99b, hsa-miR-146a, hsa-miR-150, hsa-miR-328, 및 hsa-miR-532-3p 중 하나 이상의 기준 레벨에 비교는 단계를 포함하되, hsa-miR-27b의 상기 기준 레벨에 대한 상기 대상체의 CSF 내의 hsa-miR-27b의 상기 레벨의 증가 및 hsa-miR-99b, hsa-miR-146a, hsa-miR-150, hsa-miR-328, 및 hsa-miR-532-3p 중 하나 이상의 상기 기준 레벨에 대한 상기 대상체의 CSF 내의 hsa-miR-99b, hsa-miR-146a, hsa-miR-150, hsa-miR-328, 및 hsa-miR-532-3p 중 하나 이상의 상기 레벨의 감소 또는 유의하지 않는 변화는 상기 대상체가 가족성 ALS가 발병될 위험이 증가하고 있음을 나타내는 것인 방법을 제공한다.
또한, 본 발명은 산발성 근 위축성 측삭 경화증(sporadic ALS)이 발생될 위험이 있는 대상체를 확인하는 방법으로서, 상기 대상체의 뇌척수액(CSF) 내의 hsa-miR-27b, hsa-miR-99b, hsa-miR-146a, hsa-miR-150, hsa-miR-328, 및 hsa-miR-532-3p으로 구성되는 군에서 선택된 둘 이상의 마이크로RNA의 레벨을 결정하는 단계; 상기 대상체의 CSF 내의 상기 둘 이상의 마이크로RNA의 상기 레벨을 상기 둘 이상의 마이크로RNA의 기준 레벨과 비교하는 단계를 포함하되, 상기 기준 레벨 대비 상기 대상체의 CSF 내의 상기 둘 이상의 마이크로RNA의 상기 레벨의 증가는 상기 대상체가 산발성 ALS가 발생될 위험이 증가하고 있음을 나타내는 것인 방법을 제공하다.
또한, 본 발명은 근 위축성 측삭 경화증(ALS)이 있는 대상체에서 질환의 진행속도를 예측하는 방법으로서, 상기 대상체의 CD14+CD16- 단핵구 내의 hsa-miR-19b, hsa-miR-106b, hsa-miR-30b, hsa-miR-21, hsa-miR-142-5p, hsa-miR-27a, hsa-miR-16, hsa-miR-374a, hsa-miR-374b, hsa-miR-101, hsa-miR-340, hsa-miR-30e, hsa-miR-29c, hsa-miR-29a, hsa-miR-223, hsa-miR-26a, hsa-miR-26b, hsa-miR-24, hsa-miR-181a, hsa-miR-103, hsa-miR-155, hsa-miR-532-3p, hsa-miR-518f, hsa-miR-206, hsa-miR-204, hsa-miR-137, hsa-miR-453, hsa-miR-146a, hsa-miR-603, hsa-miR-1297, hsa-miR-192, hsa-miR-526a, hsa-miR-615-5p, hsa-miR-655, hsa-miR-450b-5p, hsa-miR-548b-3p, hsa-miR-584, hsa-miR-548f, hsa-miR-300, hsa-miR-302c, hsa-miR-328, hsa-miR-421, hsa-miR-580, hsa-miR-15b, 및 hsa-miR19a으로 구성되는 군에서 선택되는 하나 이상의 마이크로RNA의 레벨을 결정하는 단계; 및 상기 대상체의 CD14+CD16- 단핵구 내의 상기 하나 이상의 마이크로RNA의 상기 레벨을 상기 하나 이상의 마이크로RNA의 기준 레벨에 비교하는 단계를 포함하되, 상기 기준 레벨 대비 상기 대상체의 CD14+CD16- 단핵구 내의 hsa-miR-19b, hsa-miR-106b, hsa-miR-30b, hsa-miR-21, hsa-miR-142-5p, hsa-miR-27a, hsa-miR-16, hsa-miR-374a, hsa-miR-374b, hsa-miR-101, hsa-miR-340, hsa-miR-30e, hsa-miR-29c, hsa-miR-29a, hsa-miR-223, hsa-miR-26a, hsa-miR-26b, hsa-miR-24, hsa-miR-181a, hsa-miR-103, hsa-miR-155, hsa-miR-532-3p, hsa-miR-15b, and miR-19a and/or a decrease in the level of one or more of hsa-miR-518f, hsa-miR-206, hsa-miR-204, hsa-miR-137, hsa-miR-453, hsa-miR-146a, hsa-miR-603, hsa-miR-1297, hsa-miR-192, hsa-miR-526a, hsa-miR-615-5p, hsa-miR-655, hsa-miR-450b-5p, hsa-miR-548b-3p, hsa-miR-584, hsa-miR-548f, hsa-miR-300, hsa-miR-302c, hsa-miR-328, hsa-miR-421, 및 hsa-miR-580 중 하나 이상의 상기 레벨의 증가는 상기 대상체에서 질환의 진행 속도가 증가할 것임을 나타내는 것인 방법을 제공한다.
또한, 본 발명은 근 위축성 측삭 경화증(ALS)이 있는 대상체에서 질환의 진행 속도를 예측하는 방법으로서, 대상체의 뇌척수액(CSF) 내의 hsa-miR-27b, hsa-miR-99b, hsa-miR-146a, hsa-miR-150, hsa-miR-328, 및 hsa-miR-532-3p 중 하나 이상의 레벨을 결정하는 단계; 및 상기 대상체의 CSF 내의 hsa-miR-27b, hsa-miR-99b, hsa-miR-146a, hsa-miR-150, hsa-miR-328, 및 hsa-miR-532-3p 중 하나 이상의 상기 레벨을 hsa-miR-27b, hsa-miR-99b, hsa-miR-146a, hsa-miR-150, hsa-miR-328, 및 hsa-miR-532-3p 중 하나 이상의 기준 레벨에 비교하는 단계를 포함하되, 상기 기준 레벨 대비 상기 대상체의 CSF 내의 hsa-miR-27b, hsa-miR-99b, hsa-miR-146a, hsa-miR-150, hsa-miR-328, 및 hsa-miR-532-3p 중 하나 이상의 상기 레벨의 증가는 상기 대상체에서 질환의 진행 속도가 증가할 것임을 나타내는 것인 방법을 제공한다. 일부 구체예에서, 상기 질환 진행 속도의 증가는 하나 이상의 ALS 증상의 발생률의 증가, 하나 이상의 ALS 증상의 악화의 증가, 하나 이상의 ALS 증상의 빈도의 증가, 하나 이상의 ALS 증상의 지속기간의 증가, 또는 대상체의 수명 감소이다.
또한, 본 발명은 근 위축성 측삭 경화증(ALS)의 치료를 위한 대상체를 선택하는 방법으로서, 상기 대상체의 CD14+CD16- 단핵구 내의 hsa-miR-19b, hsa-miR-106b, hsa-miR-30b, hsa-miR-21, hsa-miR-142-5p, hsa-miR-27a, hsa-miR-16, hsa-miR-374a, hsa-miR-374b, hsa-miR-101, hsa-miR-340, hsa-miR-30e, hsa-miR-29c, hsa-miR-29a, hsa-miR-223, hsa-miR-26a, hsa-miR-26b, hsa-miR-24, hsa-miR-181a, hsa-miR-103, hsa-miR-155, hsa-miR-532-3p, hsa-miR-518f, hsa-miR-206, hsa-miR-204, hsa-miR-137, hsa-miR-453, hsa-miR-146a, hsa-miR-603, hsa-miR-1297, hsa-miR-192, hsa-miR-526a, hsa-miR-615-5p, hsa-miR-655, hsa-miR-450b-5p, hsa-miR-548b-3p, hsa-miR-584, hsa-miR-548f, hsa-miR-300, hsa-miR-302c, hsa-miR-328, hsa-miR-421, hsa-miR-580, hsa-miR-15b, 및 hsa-miR-19a으로 구성되는 군에서 선택되는 하나 이상의 마이크로RNA의 레벨을 결정하는 단계; 상기 대상체의 CD14+CD16- 단핵구 내의 상기 하나 이상의 마이크로RNA의 상기 레벨을 상기 하나 이상의 마이크로RNA의 기준 레벨에 비교하는 단계; 상기 기준 레벨에 대한 CD14+CD16- 단핵구 내의 hsa-miR-19b, hsa-miR-106b, hsa-miR-30b, hsa-miR-21, hsa-miR-142-5p, hsa-miR-27a, hsa-miR-16, hsa-miR-374a, hsa-miR-374b, hsa-miR-101, hsa-miR-340, hsa-miR-30e, hsa-miR-29c, hsa-miR-29a, hsa-miR-223, hsa-miR-26a, hsa-miR-26b, hsa-miR-24, hsa-miR-181a, hsa-miR-103, hsa-miR-155, hsa-miR-532-3p, hsa-miR-15b, and hsa-miR-19a and/or a decrease in the level of one or more of hsa-miR-518f, hsa-miR-206, hsa-miR-204, hsa-miR-137, hsa-miR-453, hsa-miR-146a, hsa-miR-603, hsa-miR-1297, hsa-miR-192, hsa-miR-526a, hsa-miR-615-5p, hsa-miR-655, hsa-miR-450b-5p, hsa-miR-548b-3p, hsa-miR-584, hsa-miR-548f, hsa-miR-300, hsa-miR-302c, hsa-miR-328, hsa-miR-421, 및 hsa-miR-580 중 하나 이상의 상기 레벨의 증가가 있는 대상체를 ALS의 치료를 위하여 선택하는 단계를 포함하는 방법을 제공한다.
또한, 본 발명은 근 위축성 측삭 경화증(ALS)의 치료를 위한 대상체를 선택하는 방법으로서, 상기 대상체의 뇌척수액(CSF) 내의 hsa-miR-27b, hsa-miR-99b, hsa-miR-146a, hsa-miR-150, hsa-miR-328, 및 hsa-miR-532-3p 중 하나 이상의 레벨을 결정하는 단계; 상기 대상체의 CSF 내의 hsa-miR-27b, hsa-miR-99b, hsa-miR-146a, hsa-miR-150, hsa-miR-328, 및 hsa-miR-532-3p 중 하나 이상의 상기 레벨을 상기 hsa-miR-27b, hsa-miR-99b, hsa-miR-146a, hsa-miR-150, hsa-miR-328, 및 hsa-miR-532-3p 중 하나 이상의 기준 레벨에 비교하는 단계; 및 상기 기준 레벨 대비 CSF 내의 hsa-miR-27b, hsa-miR-99b, hsa-miR-146a, hsa-miR-150, hsa-miR-328, 및 hsa-miR-532-3p 중 하나 이상의 상기 레벨의 증가가 있는 대상체를 ALS의 치료를 위하여 선택하는 단계를 포함하는 방법을 제공한다.
또한, 본 발명은 대상체에서 가족성 근 위축성 측삭 경화증(familial ALS)의 치료를 위한 대상체를 선택하는 방법으로서, 상기 대상체의 뇌척수액(CSF) 내의 hsa-miR-27b의 레벨 및 hsa-miR-99b, hsa-miR-146a, hsa-miR-150, hsa-miR-328, 및 hsa-miR-532-3p 중 하나 이상의 레벨을 결정하는 단계; 상기 대상체의 CSF 내의 hsa-miR-27b의 상기 레벨을 hsa-miR-27b의 기준 레벨에 비교하고 상기 대상체의 CSF 내의 hsa-miR-99b, hsa-miR-146a, hsa-miR-150, hsa-miR-328, 및 hsa-miR-532-3p 중 하나 이상의 상기 레벨을 hsa-miR-99b, hsa-miR-146a, hsa-miR-150, hsa-miR-328, 및 hsa-miR-532-3p 중 하나 이상의 기준 레벨에 비교하는 단계; hsa-miR-27b의 상기 기준 레벨 대비 상기 CSF 내의 hsa-miR-27b의 상기 레벨의 증가 및 hsa-miR-99b, hsa-miR-146a, hsa-miR-150, hsa-miR-328, 및 hsa-miR-532-3p 중 하나 이상의 상기 기준 레벨 대비 상기 CSF 내의 hsa-miR-99b, hsa-miR-146a, hsa-miR-150, hsa-miR-328, 및 hsa-miR-532-3p 중 하나 이상의 상기 레벨의 감소 또는 유의하지 않은 변화가 있는 대상체를 가족성 ALS의 치료를 위하여 선택하는 단계를 포함하는 방법을 제공한다.
또한, 본 발명은 산발성 근 위축성 측삭 경화증(ALS)의 치료를 위한 대상체를 선택하는 방법으로서, 상기 대상체의 뇌척수액(CSF) 내의 hsa-miR-27b, hsa-miR-99b, hsa-miR-146a, hsa-miR-150, hsa-miR-328, 및 hsa-miR-532-3p으로 구성되는 군에서 선택된 둘 이상의 마이크로RNA의 레벨을 결정하는 단계; 상기 대상체의 CSF 내의 상기 둘 이상의 마이크로RNA의 상기 레벨을 상기 둘 이상의 마이크로RNA의 기준 레벨에 비교하는 단계; 상기 기준 레벨 대비 상기 CSF 내의 상기 둘 이상의 마이크로RNA의 상기 레벨의 증가가 있는 대상체를 산발성 ALS의 치료를 위하여 선택하는 단계를 포함하는 방법을 제공하다.
본원에 기재된 방법들의 일부 구체예에서, 상기 선택된 대상체는 ALS용 치료제를 추가적으로 투여받는다.
또한, 본 발명은 임상 연구 참여를 위한 대상체를 선택하는 방법으로서, 상기 대상체의 CD14+CD16- 단핵구 내의 hsa-miR-19b, hsa-miR-106b, hsa-miR-30b, hsa-miR-21, hsa-miR-142-5p, hsa-miR-27a, hsa-miR-16, hsa-miR-374a, hsa-miR-374b, hsa-miR-101, hsa-miR-340, hsa-miR-30e, hsa-miR-29c, hsa-miR-29a, hsa-miR-223, hsa-miR-26a, hsa-miR-26b, hsa-miR-24, hsa-miR-181a, hsa-miR-103, hsa-miR-155, hsa-miR-532-3p, hsa-miR-518f, hsa-miR-206, hsa-miR-204, hsa-miR-137, hsa-miR-453, hsa-miR-146a, hsa-miR-603, hsa-miR-1297, hsa-miR-192, hsa-miR-526a, hsa-miR-615-5p, hsa-miR-655, hsa-miR-450b-5p, hsa-miR-548b-3p, hsa-miR-584, hsa-miR-548f, hsa-miR-300, hsa-miR-302c, hsa-miR-328, hsa-miR-421, hsa-miR-580, hsa-miR-15b, 및 hsa-miR-19a으로 구성되는 군에서 선택되는 하나 이상의 마이크로RNA의 레벨을 결정하는 단계; 상기 대상체의 CD14+CD16- 단핵구 내의 상기 하나 이상의 마이크로RNA의 상기 레벨을 상기 하나 이상의 마이크로RNA의 기준 레벨에 비교하는 단계; 상기 기준 레벨 대비 상기 CD14+CD16- 단핵구 내의 hsa-miR-19b, hsa-miR-106b, hsa-miR-30b, hsa-miR-21, hsa-miR-142-5p, hsa-miR-27a, hsa-miR-16, hsa-miR-374a, hsa-miR-374b, hsa-miR-101, hsa-miR-340, hsa-miR-30e, hsa-miR-29c, hsa-miR-29a, hsa-miR-223, hsa-miR-26a, hsa-miR-26b, hsa-miR-24, hsa-miR-181a, hsa-miR-103, hsa-miR-155, hsa-miR-532-3p, hsa-miR-15b, 및 hsa-miR-19a 중 하나 이상의 상기 레벨의 증가 및/또는 hsa-miR-518f, hsa-miR-206, hsa-miR-204, hsa-miR-137, hsa-miR-453, hsa-miR-146a, hsa-miR-603, hsa-miR-1297, hsa-miR-192, hsa-miR-526a, hsa-miR-615-5p, hsa-miR-655, hsa-miR-450b-5p, hsa-miR-548b-3p, hsa-miR-584, hsa-miR-548f, hsa-miR-300, hsa-miR-302c, hsa-miR-328, hsa-miR-421, 및 hsa-miR-580 중 하나 이상의 상기 레벨의 감소가 있는 대상체를 임상 연구의 참여를 위하여 선택하는 것을 포함하는 방법을 제공한다.
또한, 본 발명은 임상 연구 참여를 위한 대상체를 선택하는 방법으로서, 상기 대상체의 뇌척수액(CSF) 내의 hsa-miR-27b, hsa-miR-99b, hsa-miR-146a, hsa-miR-150, hsa-miR-328, 및 hsa-miR-532-3p으로 구성되는 군에서 선택된 하나 이상의 마이크로RNA의 레벨을 결정하는 단계; 상기 대상체의 CSF 내의 상기 하나 이상의 마이크로RNA의 상기 레벨을 상기 하나 이상의 마이크로RNA의 기준 레벨에 비교하는 단계; 및 상기 기준 레벨 대비 상기 CSF 내의 상기 하나 이상의 마이크로RNA의 상기 레벨의 증가가 있는 대상체를 임상 연구 참여를 위하여 선택하는 단계를 포함하는 방법을 제공하다.
또한, 본 발명은 대상체에서 근 위축성 측삭 경화증의 치료의 효능을 판단하는 방법으로서, 제1 시점에서 상기 대상체의 CD14+CD16- 단핵구 내의 hsa-miR-19b, hsa-miR-106b, hsa-miR-30b, hsa-miR-21, hsa-miR-142-5p, hsa-miR-27a, hsa-miR-16, hsa-miR-374a, hsa-miR-374b, hsa-miR-101, hsa-miR-340, hsa-miR-30e, hsa-miR-29c, hsa-miR-29a, hsa-miR-223, hsa-miR-26a, hsa-miR-26b, hsa-miR-24, hsa-miR-181a, hsa-miR-103, hsa-miR-155, hsa-miR-532-3p, hsa-miR-518f, hsa-miR-206, hsa-miR-204, hsa-miR-137, hsa-miR-453, hsa-miR-146a, hsa-miR-603, hsa-miR-1297, hsa-miR-192, hsa-miR-526a, hsa-miR-615-5p, hsa-miR-655, hsa-miR-450b-5p, hsa-miR-548b-3p, hsa-miR-584, hsa-miR-548f, hsa-miR-300, hsa-miR-302c, hsa-miR-328, hsa-miR-421, hsa-miR-580, hsa-miR-15b, 및 hsa-miR-19a으로 구성되는 군에서 선택되는 하나 이상의 마이크로RNA의 레벨을 결정하는 단계; 적어도 1 회분의 치료제를 투여한 후의 제2 시점에서 상기 대상체의 CD14+CD16- 단핵구 내의 상기 하나 이상의 마이크로RNA의 레벨을 결정하는 단계; 및 상기 제1 시점에서의 상기 하나 이상의 마이크로RNA의 상기 레벨을 상기 제2시점에서의 상기 하나 이상의 마이크로RNA의 상기 레벨과 비교하는 단계를 포함하되, 상기 제2 시점에서의 hsa-miR-19b, hsa-miR-106b, hsa-miR-30b, hsa-miR-21, hsa-miR-142-5p, hsa-miR-27a, hsa-miR-16, hsa-miR-374a, hsa-miR-374b, hsa-miR-101, hsa-miR-340, hsa-miR-30e, hsa-miR-29c, hsa-miR-29a, hsa-miR-223, hsa-miR-26a, hsa-miR-26b, hsa-miR-24, hsa-miR-181a, hsa-miR-103, hsa-miR-155, hsa-miR-532-3p, hsa-miR-15b, and hsa-miR-19a 중 하나 이상의 레벨의 감소 및/또는 hsa-miR-518f, hsa-miR-206, hsa-miR-204, hsa-miR-137, hsa-miR-453, hsa-miR-146a, hsa-miR-603, hsa-miR-1297, hsa-miR-192, hsa-miR-526a, hsa-miR-615-5p, hsa-miR-655, hsa-miR-450b-5p, hsa-miR-548b-3p, hsa-miR-584, hsa-miR-548f, hsa-miR-300, hsa-miR-302c, hsa-miR-328, hsa-miR-421, 및 hsa-miR-580 중 하나 이상의 상기 레벨이 상기 제1 시점에서의 상기 레벨과 대비하여 증가하면 상기 치료제가 상기 대상체에서 효과적임을 나타내는 방법을 제공한다.
또한, 본 발명은 대상체에서 근 위축성 측삭 경화증(ALS)의 치료의 효능을 판단하는 방법으로서, 제1 시점에 상기 대상체의 뇌척수액 내의 hsa-miR-27b, hsa-miR-99b, hsa-miR-146a, hsa-miR-150, hsa-miR-328, 및 hsa-miR-532-3p 중 하나 이상의 레벨을 결정하는 단계; 적어도 1 회분의 치료제를 투여한 후의 제2 시점에서 상기 대상체의 CSF 내의 hsa-miR-27b, hsa-miR-99b, hsa-miR-146a, hsa-miR-150, hsa-miR-328, 및 hsa-miR-532-3p 중 하나 이상의 레벨을 결정하는 단계; 및 상기 제1 시점에서의 hsa-miR-27b, hsa-miR-99b, hsa-miR-146a, hsa-miR-150, hsa-miR-328, 및 hsa-miR-532-3p 중 하나 이상의 상기 레벨을 상기 제2시점에서의 hsa-miR-27b, hsa-miR-99b, hsa-miR-146a, hsa-miR-150, hsa-miR-328, 및 hsa-miR-532-3p 중 하나 이상의 상기 레벨에 비교하는 단계를 포함하되, 상기 제2 시점에서의 hsa-miR-27b, hsa-miR-99b, hsa-miR-146a, hsa-miR-150, hsa-miR-328, 및 hsa-miR-532-3p 중 하나 이상의 상기 레벨이 상기 제1 시점에서의 상기 레벨과 대비하여 감소하면 상기 치료제가 상기 대상체에서 효과적임을 나타내는 방법을 제공한다.
본원에 기재된 임의의 방법들의 일부 구체예에서, 상기 기준 레벨은 임계 레벨(threshold level)이다. 일부 구체예에서, 상기 기준 레벨은 대조군 대상체의 CD14+CD16- 단핵구(예, 말초 또는 혈액 유래 단핵구) 내에서 구하여지는 레벨이다. 일부 구체예에서, 상기 기준 레벨은 대조군 대상체의 CSF 내에서 구하여지는 레벨이다.
본원에 기재되는 방법들 중 일부 구체예는 상기 대상체의 CD14+CD16- 단핵구를 함유하는 생물학적 샘플(예, 혈액, 혈장, 혈청, 또는 뇌척수액)을 얻는 단계를 더 포함한다. 일부 구체예에서, 상기 방법은 상기 생물학적 샘플의 CD14+CD16- 단핵구를 정제하는 단계를 더 포함한다.
본원에 기재된 상기 방법들의 일부 구체예는 상기 대상체의 CSF를 함유하는 샘플을 얻는 단계를 더 포함한다.
본원에 기재된 임의의 방법의 일부 구체예에서, 상기 마이크로RNA 또는 상기 하나 이상의 마이크로RNA는 전구체 마이크로RNA이다. 본원에 기재된 임의의 방법의 일부 구체예에서, 상기 마이크로RNA 또는 상기 하나 이상의 마이크로RNA는 성숙 마이크로RNA이다.
또한, 본 발명은 대상체에서 근 위축성 측삭 경화증(ALS)을 치료하는 방법으로서, hsa-miR-19b, hsa-miR-106b, hsa-miR-30b, hsa-miR-21, hsa-miR-142-5p, hsa-miR-27a, hsa-miR-16, hsa-miR-374a, hsa-miR-374b, hsa-miR-101, hsa-miR-340, hsa-miR-30e, hsa-miR-29c, hsa-miR-29a, hsa-miR-223, hsa-miR-26a, hsa-miR-26b, hsa-miR-24, hsa-miR-181a, hsa-miR-103, hsa-miR-155, hsa-miR-532-3p, hsa-miR-27b, hsa-miR-99b, hsa-miR-146a, hsa-miR-150 hsa-miR-328, has-miR-19a, hsa-miR-15b, hsa-miR-15b, and hsa-miR-19a 중 임의의 하나에 존재하는 연속 서열(예를 들면, 적어도 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 또는 25개의 뉴클레오티드, 바람직하게는 적어도 7개 또는 8개의 뉴클레오티드의 연속 서열)에 상보적인 서열을 포함하는 적어도 하나의 안타고미르를 ALS가 있는 대상체에 투여하는 단계를 포함하는 방법을 제공한다.
또한, 본 발명은 대상체에 근 위축성 측삭 경화증(ALS)을 치료하는 방법으로서, hsa-miR-155에 존재하는 연속 서열에 상보적인 서열을 포함하는 적어도 하나의 억제성 핵산을 ALS가 있는 대상체에 투여하는 단계를 포함하는 방법을 제공한다. 일부 구체예에서, 상기 적어도 하나의 억제성 핵산은 안타고미르(예, 서열번호 262의 서열을 함유하거나 갖는 안타고미르)이다. 일부 구체예에서, 상기 적어도 하나의 억제성 핵산은 안티센스 올리고뉴클레오티드이다. 일부 구체예에서, 상기 적어도 하나의 억제성 핵산은 리보자임이다. 일부 구체예에서, 상기 적어도 하나의 억제성 핵산을 대상체의 뇌척수액에 주사(예, 두개내 주사 또는 척수강내 주사)한다. 일부 구체예에서, 상기 적어도 하나의 억제성 핵산은 하나 이상의 양이온성 고분자 및/또는 양이온성 지질과 착화된다(complexed). 일부 구체예에서, 상기 억제성 핵산은 렌티바이러스(lentivirus vector) 벡터를 이용하여 운반된다.
또한, 본 발명은 대상체의 근 위축성 측삭 경화증을 치료하기 위한 약제의 제조에 있어서, hsa-miR-155, hsa-miR-19b, hsa-miR-106b, hsa-miR-30b, hsa-miR-21, hsa-miR-142-5p, hsa-miR-27a, hsa-miR-16, hsa-miR-374a, hsa-miR-374b, hsa-miR-101, hsa-miR-340, hsa-miR-30e, hsa-miR-29c, hsa-miR-29a, hsa-miR-223, hsa-miR-26a, hsa-miR-26b, hsa-miR-24, hsa-miR-181a, hsa-miR-103, hsa-miR-532-3p, hsa-miR-27b, hsa-miR-99b, hsa-miR-146a, hsa-miR-150, hsa-miR-328, hsa-miR-15b, 및 hsa-miR-19a 중 어느 하나에 존재하는 연속 서열에 상보적인 서열을 포함하는 적어도 하나의 안타고미르를 이용하는 방법을 제공한다. 또한, 본 발명은 대상체의 근 위축성 측삭 경화증의 치료에 사용하기 위하여, hsa-miR-155, hsa-miR-19b, hsa-miR-106b, hsa-miR-30b, hsa-miR-21, hsa-miR-142-5p, hsa-miR-27a, hsa-miR-16, hsa-miR-374a, hsa-miR-374b, hsa-miR-101, hsa-miR-340, hsa-miR-30e, hsa-miR-29c, hsa-miR-29a, hsa-miR-223, hsa-miR-26a, hsa-miR-26b, hsa-miR-24, hsa-miR-181a, hsa-miR-103, hsa-miR-532-3p, hsa-miR-27b, hsa-miR-99b, hsa-miR-146a, hsa-miR-150, hsa-miR-328, hsa-miR-15b, 및 hsa-miR-19a 중 어느 하나에 존재하는 연속 서열에 상보적인 서열을 포함하는 안타고미르를 제공한다.
또한, 본 발명은 대상체의 근 위축성 측삭 경화증을 치료하기 위한 약제의 제조에 있어서, hsa-miR-155에 존재하는 연속 서열에 상보적인 서열을 포함하는 적어도 하나의 억제성 핵산(예, 안타고미르)를 이용하는 방법을 제공한다. 또한, 본 발명은 대상체의 근 위축성 측삭 경화증의 치료를 위하여 hsa-miR-155에 존재하는 연속 서열에 상보적인 서열을 함유하는 억제성 핵산(예, 안티고미르)을 제공한다.
본 발명에서, "RNA"는 적어도 하나의 리보뉴클레오티드 잔기를 포함하는 분자를 지칭한다. "리보뉴클레오티드"는 β-D-리보퓨라노스 부위의 2'-위치에 하이드록실기가 있는 뉴클레오티드이다. 본원에서, 용어 RNA는 이중 가닥 RNA, 단일 가닥 RNA, 단리된(isolated) RNA, 부분적으로 정제된 RNA, 본질적으로 순수한 RNA, 합성 RNA, 재조합적으로 생산된 RNA 뿐만 아니라, 하나 이상의 뉴클레오티드의 부가, 결실, 치환 및/또는 변경에 의하여 자연 발생적인 RNA와는 상이한 변형 RNA를 포함한다. 또한, RNA 분자의 뉴클레오티드는 비자연적으로 발생되는 뉴클레오티드, 화학적으로 합성되는 뉴클레오티드, 디옥시뉴클레오티드와 같은 비표준(non-standard) 뉴클레오티드를 포함할 수 있다,
"성숙한 마이크로RNA(성숙한 miRNA)"는 일반적으로 유전자 발현을 조절하는 약 21 내지 23개의 뉴클레오티드 길이의 단일 가닥 RNA 분자를 지칭한다. miRNA는 DNA가 전사되는 유전자에 의하여 암호화되나, miRNA는 단백질로 번역되지 않는다. 대신에 각 일차 전사체 (pri-miRNA)가 기능적인 성숙한 miRNA로 더 진행되기 전에 짧은 스템-루프 구조(stem-loop structure)로 진행된다. 성숙한 miRNA 분자는 하나 이상의 메신저 RNA(mRNA)에 부분적으로 상보적이며, 그 주요 기능은 유전자 발현을 하향조절하는 것(down-regulate)이다. 본 명세서 전체에서 사용되는 용어 "마이크로RNA" 또는 "miRNA"는 성숙한 마이크로RNA 및 전구체 마이크로RNA 둘 다를 포함한다.
본 발명에서 사용되는 용어 "염증 마커(inflammatory marker)"는 표 20 및 표 21에 열거된 임의의 단백질 또는 mRNA를 지칭한다. 표 20 및 표 21에 열거된 단백질 및 mRNA는 염증의 역할과 관련이 있다. 염증 마커의 레벨 또는 활성을 탐지하는 방법은 당해 기술 분야에서 공지되어 있다. 염증 마커의 레벨 또는 활성을 탐지하는 추가적인 방법이 본원에 기재되어 있다.
용어 "기준 레벨(reference level)"은 표 1 내지 표 19에 열거된 마이크로RNA 중 하나 또는 표 20 및 표 21에 열거된 염증 마커 중 하나의 대조군 레벨(control level)을 의미한다. 기준 레벨은 특정 마이크로RNA 또는 염증 마커의 임계 레벨을 나타낼 수 있다. 또한, 기준 레벨은 건강한 대상체(예, 둘 이상의 신경병성 질환의 증상이 없는 대상체, 신경병성 질환으로 진단되지 않은 대상체, 및/또는 신경병성 질환의 가족력이 없는 대상체)의 뇌척수액 또는 단핵구(예, CD14+CD16- 또는 CD14+CD16+ 단핵구 (예, 말초 또는 혈액-유래 단핵구))에 존재하는 특정 마이크로RNA 또는 염증 마커의 레벨일 수 있다.
용어 "증가"는 기준 레벨 또는 동일한 대상체에서 초기 시점 또는 나중 시점에 측정된 레벨에 대비하여 관찰가능한, 탐지가능한, 또는 유의미한 레벨 증가를 의미한다.
용어 "감소"는 기준 레벨 또는 동일한 대상체에서 초기 시점 또는 나중 시점에 측정된 레벨에 대비 관찰가능한, 탐지가능한, 또는 유의미한 레벨 감소를 의미한다.
용어 "신경병성 질환"은 신경 세포의 기능 및 구조의 점진적 상실 및 신경 세포 사멸을 특징으로 하는 신경 질환을 의미한다. 신경병성 질환의 비제한적 예는 파킨슨병(PD), 알츠하이머병(AD), 헌팅톤병(Huntington's disease, HD), 뇌졸중, 뇌종양, 심장 허혈, 노화 관련 황반 변성(AMD), 색소성 망막염(RP), 근 위축성 측삭 경화증(ALS, 예를 들면, 가족성 ALS 및 산발성 ALS), 및 다발성 경화증(MS)을 포함한다. 신경병성 질환을 진단하는 방법이 본원에 기재되어 있다. 신경병성 질환을 진단하는 추가의 방법은 당해 기술 분야에 공지되어 있다.
용어 "억제성 RNA"는 표적 핵산의 레벨 또는 활성(예, CD14+CD16- 또는 CD14+CD16+ 단핵구의 활성)의 감소를 도모하여, 표적 핵산(예, 표적 마이크로RNA 또는 표적 염증 마커, 예컨대 표 1, 3, 5, 7, 9, 11, 12, 14, 16, 또는 18에 열거된 임의의 마이크로RNA)에 상보적인 서열을 포함하는 핵산을 의미한다. 억제성 RNA의 비제한적 예는 간섭(interfering) RNA, shRNA, siRNA, 리보자임, 안타고미르, 및 안티센스 올리고뉴클레오티드를 포함한다. 억제성 RNA를 제조하는 방법이 본원에 기재되어 있다. 억제성 RNA를 제조하는 추가 방법은 당해 기술 분야에 공지되어 있다.
본원에서 사용되는 "간섭(interfering) RNA"는 RNA 간섭을 도모함으로써, 유전자 발현을 억제하거나 하향조절할 수 있는 (직접적으로 또는 간접적으로 (즉, 전환 시)) 임의의 이중 가닥 또는 단일 가닥 RNA 서열을 지칭한다. 간섭 RNA는 짧은 간섭 RNA (small interfering RNA, "siRNA") 및 짧은 헤어핀 RNA (small hairpin RNA, "shRNA")을 포함하나 이에 제한되지 않는다. "RNA 간섭(interference)"은 서열-상보적인 메신저 RNA 전사의 선택적 변성(selective degradation)을 지칭한다.
본원에서 사용되는 용어 "shRNA(small hairpin RNA)"는 안티센스 영역, 루프 부분, 및 센스 영역을 포함하는 RNA 분자를 지칭하는 것으로, 여기에서 센스 영역은, 안티센스 영역과 염기 쌍을 이루어 이중 스템(duplex stem)을 형성하는 상보적 뉴클레오티드를 가진다. 전사 후 프로세싱(post-transcriptional processing)에 이어서, 짧은 헤어핀 RNA는, RNase III 계열인 다이서(Dicer) 효소에 의한 절단에 의하여 짧은 간섭 RNA로 전환된다.
본원에서 사용되는 용어 "짧은 간섭 RNA"또는 "siRNA"는 RNA 간섭을 서열 특이적 방식으로 꾀함으로써 유전자 발현을 저해하거나 하향조절할 수 있는 임의의 짧은 RNA 분자를 지칭한다. 예를 들면, 짧은 RNA는 약 18 내지 21개 뉴클레오티드 길이를 가질 수 있다.
본원에 사용되는 "안타고미르(antagomir)"는, 특이 마이크로RNA 표적에 대하여 상보성을 가지고 있으며, 선택적으로는 절단 부위에서의 잘못 짝지음(misparing)이나 하나 이상의 염기 변형으로 인하여 절단을 저해하는 짧은 합성 RNA를 지칭한다.
본원에서 사용되는 구절 "전사 후 프로세싱(post-transcriptional processing)"은 전사 후에 일어나고, 예컨대 다이서(Dicer) 효소 및/또는 드로샤(Drosha) 효소에 의하여 매개되는 mRNA 프레세싱을 지칭한다.
구절 "질환이 발생될 위험(risk of developing disease)"은 대상체가 대조군 대상체 또는 집단(예, 건강한 대상체 또는 집단)에 비교하여 장래 신경병성 질환이 발생될 상대적 가능성을 의미한다. 본 발명은 대상체가 장래 신경병성 질환이 발생될 위험을 판단하는 방법으로서, 표 1 내지 표 19에 열거된 마이크로RNA 중 하나 이상 또는 표 20 및 표 21에 열거된 염증 마커 중 하나 이상의 레벨을 결정하는 단계를 포함하는 방법을 제공한다.
구절 "질환의 진행 속도(rate of disease progression)"는 대상체에서 신경병성 질환 증상의 발생율, 대상체에서 신경병성 질환 증상의 세기(악화)의 증가율, 대상체에서 신경병성 질환의 하나 이상의 증상의 빈도, 대상체에 신경병성 질환의 하나 이상의 증상의 지속기간, 또는 대상체의 수명 중 하나 이상을 의미한다. 예를 들면, 질환의 진행 속도의 증가는 대상체에서 신경병성 질환 증상의 발생률의 증가, 대상체에서 신경병성 질환의 하나 이상의 증상의 빈도 증가, 대상체에 신경병성 질환의 하나 이상의 증상의 지속기간 증가, 또는 대상체의 수명의 감소 중 하나 이상을 포함할 수 있다. 본원에는 신경병성 질환이 있는 대상체에 질환의 진행 속도를 예측하는 방법이 기재되어 있다.
용어 "정제(purifying)"는 물질을 그의 자연 환경으로부터 부분적으로 단리시키는 것(예, 오염성 생체 분자 또는 세포의 부분적 제거)을 의미한다. 예를 들면, 단핵구(예. CD14+CD16- 및 CD14+CD16+ 단핵구)는 말초 혈액 샘플에 존재하는 기타 세포 타입으로부터 정제될 수 있다.
용어 "치료(treating)"는 대상체에서 증상 개수의 감소 또는 질환(예, 신경병성 질환)의 하나 이상의 증상의 강도, 기간, 또는 빈도를 줄이는 것을 포함한다. 또한, 치료라는 용어는 대상체에서 신경병성 질환이 발생될 위험을 줄이는 것, 대상체에서 신경병성 질환의 증상의 발생을 지연시키는 것, 또는 신경병성 질환이 있는 대상체의 수명을 연장시키는 것을 포함한다.
용어 "양이온성 고분자"는 핵산을 나노입자로 압축시킬 수 있는, 생리적 pH(예, 대략 6.5 내지 8.0 의 pH)에서 양으로 하전되는 고분자 물질을 의미한다. 양이온성 고분자의 비제한적 예는 폴리-L-리신 및 폴리(에틸렌이민)을 포함한다. 양이온성 고분자의 추가적인 예들은 당해 기술분야에 공지되어 있다.
용어 "양이온성 지질"은 핵산과는 착물을 형성할 수 있는, 생리적 pH(예, 대략 6.5 내지 8.0 의 pH)에서 적어도 하나의 양전하를 가지는 지질을 의미한다. 양이온성 지질의 비제한적 예는 1,2-디올레오일-3-트리메틸암모늄 프로폰(DOTAP), N-메틸-4-(디올레일)메틸 피리디늄, 및 3β-[N-(N',N'-디메틸아미노에탄)-카바모일] 콜레스테롤을 포함한다. 양이온성 지질의 추가적인 예는 당해 기술분야에 공지되어 있으며, 상업적으로 입수 가능하다(예, LipofectamineTM 2000; Life Technologies사, Carlsbad, CA).
기타 용어의 정의는 명세서 전반에 걸쳐 문맥에 나타난다. 달리 정의되어 있지 않다면, 본원에 사용되는 모든 기술적 과학적 용어는 본 발명이 속하는 기술 분야에서 통상의 기술자가 공통으로 이해하는 의미와 동일하다. 방법과 재료는 본 발명의 이용을 위하여 본원에 기재되어 있고, 당해 기술분야에서 공지된 다른 적절한 방법과 재료도 사용된다. 상기 재료, 방법, 및 실시예는 단지 예시하기 위한 것이며 제한하고자 하는 것은 아니다. 모든 공개물, 특허 출원, 특허, 서열, 데이터베이스 엔트리, 및 본원에서 언급된 기타 문헌은 그 전체 내용이 참조로서 병합된다. 상충하는 경우, 정의를 포함하는 본 명세서는 조정할 것이다.
본 발명의 다른 특징 및 장점은 다음의 상세한 설명과 도면 및 청구 범위로부터 명백할 것이다.
본 발명에 의해 대상체에서 신경병성 질환(예, 근 위축성 측삭 경화증 및 다발성 경화증)을 진단하는 방법, 신경병성 질환이 발생될 위험에 있는 대상체를 확인하는 방법, 신경병성 질환이 있는 대상체에서 질환의 진행 속도를 예측하는 방법, 신경병성 질환의 치료를 위한 대상체를 선택하는 방법, 임상 연구 참여를 위한 대상체를 선택하는 방법, 및 신경병성 질환의 치료의 효능을 판단하는 방법이 제공된다.
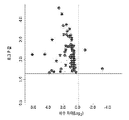
도 1A는 전증상(60 일) 시점(전증상), 증상 발생 시(발생), 및 질환의 말기 단계(말기 단계)에서, 비-형질전환 리터메이트(littermates)의 CD39+ 미세아교세포에서의 마이크로RNA의 발현에 비교하여 SODG93A 마우스의 CD39+ 미세아교세포에서의 상당히(significantly) 조절이상된 마이크로RNA의 볼케이노 플롯(volcano plot)을 보여준다. x-축은 발현 변화(ddCT 값을 기준으로하는 log2-배수 차이)를 나타내고, y-축은 로그-오즈(log-odds) 변화의 통계적 유의성을 보여준다.
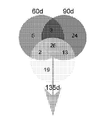
도 1B는 모든 질환 단계에 걸쳐, 비-형질전환 리터메이트(littermates)의 CD39+ 미세아교세포에서의 마이크로RNA의 발현에 비교하여 SODG93A 마우스의 CD39+ 미세아교세포에서의 상당히 조절이상된 마이크로RNA의 벤 다이아그램을 보여준다. 숫자는 각 질환 단계에서 상당히 조절이상된 마이크로RNA를 나타낸다.
도 1C는 비-형질전환 리터메이트(littermates)의 CD39+ 미세아교세포에서의 마이크로RNA의 발현에 비교하여 SODG93A 마우스의 CD39+ 미세아교세포에서의 상당히 조절이상된 마이크로RNA의 요약을 보여준다. 데이터는 싱글플렉스 TaqMan PCR으로 확인하였다.
도 2A는 전증상(60 일) 시점(전증상), 증상 발생 시(발생), 및 질환의 말기 단계(말기-단계), 비-형질전환 리터메이트(littermates)의 Ly6CHi 단핵구에서의 RNA의 발현에 비교하여 SODG93A 마우스의 Ly6CHi 단핵구에서의 상당히 조절이상된 마이크로RNA의 볼케이노 플롯을 나타낸다. x-축은 발현 변화(ddCT 값을 기준으로하는 log2-배수 차이)를 나타내고, y-축은 로그-오즈(log-odds) 변화의 통계적 유의성을 보여준다.
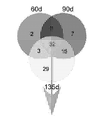
도 2B는 모든 질환 단계(전증상, 증상의 발생, 및 질환이 말기-단계)에 걸쳐, 비-형질전환 리터메이트(littermates)의 Ly6CHi 단핵구에서의 마이크로RNA의 발현에 비교하여 SODG93A 마우스의 Ly6CHi 단핵구에서의 상당히 조절이상된 마이크로RNA의 벤 다이아그램을 보여준다. 숫자는 각 질환 단계에서 상당히 조절이상된 마이크로RNA를 나타낸다.
도 2C는 비-형질전환 리터메이트(littermates)의 Ly6CHi 단핵구에서의 마이크로RNA의 발현에 비교하여 SODG93A 마우스의 Ly6CHi 단핵구에서의 상당히 조절이상된 마이크로RNA의 요약을 보여준다. 데이터는 싱글플렉스 TaqMan PCR으로 확인하였다.
도 3A는 전증상(60 일) 시점(전증상), 증상 발생 시(발생), 및 질환의 말기 단계(말기-단계), 비-형질전환 리터메이트(littermates)의 Ly6CLow 단핵구 내의 RNA의 발현에 비교하여 SODG93A 마우스의 Ly6CLow 단핵구에서의 상당히 조절이상된 마이크로RNA의 볼케이노 플롯을 보여준다. x-축은 발현 변화(ddCT 값을 기준으로 하는 log2-배수 차이)를 나타내고, y-축은 로그-오즈(log-odds) 변화의 통계적 유의성을 보여준다.
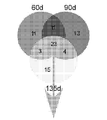
도 3B는 모든 질환 단계에 걸쳐, 비-형질전환 리터메이트(littermates)의 Ly6CLow 단핵구에서의 마이크로RNA의 발현 대비 SODG93A 마우스의 Ly6CLow 단핵구에서의 상당히 조절이상된 마이크로RNA의 벤 다이아그램을 보여준다. 숫자는 각 질환 단계에서 상당히 조절이상된 마이크로RNA를 나타낸다.
도 3C는 비-형질전환 리터메이트(littermates)의 Ly6CLow 단핵구에서의 마이크로RNA의 발현에 비교하여 SODG93A 마우스의 Ly6CLow 단핵구에서의 상당히 조절이상된 마이크로RNA의 요약을 보여준다. 데이터는 싱글플렉스 TaqMan PCR으로 확인하였다.
도 4A 및 4B는 SOD1 마우스의 모든 질환 단계에 걸쳐서, (비-형질전환 리터메이트(littermates 대비) Ly6CHi 단핵구에서의 32개의 조절이상된 마이크로RNA에 대한 Ingenuity pathway analysis의 결과를 나타내는 그래프와 표를 보여준다. 그래프는 골격 질환, 근육 질환, 및 근 질환에서 관찰되는 패턴을 보여준다.
도 5는 건강한 대조군(8개의 대상체)의 CD14+CD16- 단핵구 내의 마이크로RNA의 발현에 비교하여, 산발성 ALS (8개의 대상체) 및 재발성 감퇴 다발성 경화증(8개의 대상체)의 664개의 마이크로RNA에 관한, 혈액-유래 CD14+CD16- 단핵구의 엔카운터 발현 프로파일링(nCounter expression profiling)을 나타내는 히트맵을 보여준다. 히트맵은 Dunnett's post hoc test을 이용한 분산 분석(ANOVA) 결과를 보여준다(P < 0.01). ALS 대상체의 CD14+CD16- 단핵구에서 상향조절되거나 하향조절된 마이크로RNA(건강한 대조군의 CD14+CD16- 단핵구의 마이크로RNA의 발현 대비)가 나타나있다. 히트맵의 각 열은 개별 유전자을 나타내고 각 행은 개별 대상체를 나타낸다.
도 6는 건강한 대조군(8개의 대상체)의 CD14+CD16- 단핵구 내의 마이크로RNA의 발현에 비교하여, 산발성 ALS (8개의 대상체) 및 재발성 감퇴 다발성 경화증(8개의 대상체)의 664개의 마이크로RNA에 관한, 혈액-유래 CD14+CD16- 단핵구의 엔카운터 발현 프로파일링(nCounter expression profiling)을 나타내는 히트맵을 보여준다. 히트맵은 Dunnett's post hoc test (P < 0.01)을 이용한 ANOVA 결과를 보여준다. ALS 대상체의 CD14+CD16- 단핵구에서 상향조절되거나 하향조절된 마이크로RNA(건강한 대조군의 CD14+CD16- 단핵구에서의 마이크로RNA의 발현 대비)가 나타나있다. 히트맵의 각 열은 개별 유전자을 나타내고 각 행은 개별 대상체를 나타낸다.
도 7A는 건강한 대조군의 CD14+CD16- 단핵구에서의 마이크로RNA의 발현에 비교하여 ALS 및 MS 대상체의 CD14+CD16- 단핵구에서의 고유한 또는 유사한 조절이상된(상향조절되거나 하향조절된) 마이크로RNA의 밴 다이아그램을 보여준다.
도 7B는 건강한 대조군의 CD14+CD16- 단핵구에서의 마이크로RNA의 발현에 비교하여 ALS 대상체의 CD14+CD16- 단핵구에서 상당히 조절이상된 마이크로RNA를 보여주는 볼케이노 플롯(volcano plot)이다.
도 7C는 건강한 대조군의 CD14+CD16- 단핵구에서의 마이크로RNA의 발현에 비교하여 MS 대상체의 CD14+CD16- 단핵구에서 상당히 조절이상된 마이크로RNA를 보여주는 볼케이노 플롯(volcano plot)이다.
도 8은 건강한 대조군의 CD14+CD16- 단핵구에서의 마이크로RNA의 발현에 비교하여 ALS 및 MS 대상체의 CD14+CD16- 단핵구에서의 상당히 조절이상된 마이크로RNA의 요약을 나타낸다. 바는 건강한 대조군의 CD14+CD16- 단핵구에서의 마이크로RNA의 발현에 비하여 ALS 및 MS 대상체의 CD14+CD16- 단핵구에서의 조절이상된 마이크로RNA의 상대적 발현을 보여준다.
도 9는 건강한 대상체(8개의 대상체) 및 ALS가 있는 대상체(11개의 대상체)의 CD14+CD16- 단핵구에서 6개의 상이한 마이크로RNA의 발현을 보여주는 6개 그래프를 한 세트로 하여 보여 준다(실시간 PCR에 의하여 측정). 양측 검정(two-tailed Mann-Whitney t-test)을 이용하여 P 값을 계산하였다(*, P < 0.05; **, P < 0.01; ***, P < 0.001).
도 10A는 8명의 서로 다른 ALS 환자의 임상 점수(강제 폐활량 (FVC) 점수 및 기능 평가 척도 (FRS))를 보여주는 두 개의 그래프를 나타낸다. 건강한 대조군 및 MS 대상체의 CD14+CD16- 단핵구에서의 마이크로RNA 발현에 대한 이들 8명의 환자의 CD14+CD16- 단핵구에서의 마이크로RNA 발현의 비교가 도 10C에 나타나 있다.
도 10B는 도 10A 및 도 10C에 기재된 8명의 상이한 ALS 환자의 목록이다.
도 10C는 산발성 ALS 환자(8개의 대상체), 건강한 대상체, 및 MS가 있는 대상체의 CD14+CD16- 단핵구에서 20개의 상향조절된 마이크로RNA의 발현을 보여주는 20개의 그래프를 나타낸다. 양측 검정(two-tailed Mann-Whitney t-test)을 이용하여 P 값을 계산하였다.
도 11은 건강한 대상체(n=8) 및 MS가 있는 대상체(n=8)에 비교하여, 산발성 ALS 대상체(n=11)의 CD14+CD16- 단핵구에서 4개의 상향조절된 마이크로RNA의 발현에 대한 실시간 PCR 분석을 보여주는 4개의 그래프를 나타낸다. 데이터는 일원 분산분석(one-way ANOVA) 및 Dunett's multiple comparison test를 이용하여 생성하였다(***, p < 0.001).
도 12A는 8명이 서로 다른 ALS 환자의 임상 점수(강제 폐활량 (FVC) 점수 및 기능 평가 척도 (FRS))를 보여주는 두 개의 그래프를 나타낸다. 건강한 대조군 및 MS 대상체의 CD14+CD16- 단핵구에서의 마이크로RNA 발현에 대한 이들 8명의 환자의 CD14+CD16- 단핵구에서의 마이크로RNA 발현의 비교가 도 10C에 나타나 있다.
도 12B는 도 12A 및 도 12C에 기재된 8명의 상이한 ALS 환자의 목록이다.
도 12C는 건강한 대상체, 및 MS-재발성 감퇴(MS-RR)가 있는 대상체와 비교하여, 산발성 ALS 대상체의 CD14+CD16- 단핵구에서 20개의 하향조절된 마이크로RNA의 발현을 보여주는 20개의 그래프를 나타낸다(실시간 PCR을 이용하여 결정). 양측 검정(two-tailed Mann-Whitney t-test)을 이용하여 P 값을 계산하였다 (*, P < 0.05; **, P < 0.01; ***, P < 0.001).
도 13은 건강한 대상체, 및 MS-재발성 감퇴(MS-RR)가 있는 대상체와 비교하여(각 그룹에 8 대상체), 산발성 ALS 대상체의 CD14+CD16- 단핵구에서 8개의 하향조절된 마이크로RNA의 발현을 보여주는 8개의 그래프를 나타낸다(실시간 PCR을 이용하여 결정). 데이터는 일원 분산분석(one-way ANOVA) 및 Dunett's multiple comparison test를 이용하여 생성하였다(**, P < 0.01; ***, p < 0.001).
도 14는 건강한 대상체 및 ALS이 있는 대상체(8개의 대상체)에 비교하여 MS-RR 대상체의 CD14+CD16- 단핵구에서 5개의 상향조절된 마이크로RNA의 발현을 보여주는 5개의 상이한 그래프를 나타낸다(실시간 PCR을 이용하여 결정). 양측 검정(two-tailed Mann-Whitney t-test)을 이용하여 P 값을 계산하였다(*, P < 0.05; **, P < 0.01; ***, P < 0.001).
도 15는 건강한 대상체 및 산발성 ALS이 있는 대상체에 비교하여 MS-RR 대상체의 CD14+CD16- 단핵구에서 5개의 하향조절된 마이크로RNA의 발현을 보여주는 5개의 그래프를 나타낸다(실시간 PCR을 이용하여 결정). 양측 검정(two-tailed Mann-Whitney t-test)을 이용하여 P 값을 계산하였다 (*, P < 0.05).
도 16은 건강한 대상체, 가족성 ALS이 있는 대상체(n=5), 및 산발성 ALS이 있는 대상체(n=10)의 뇌척수에서 6개의 상향조절된 마이크로RNA의 발현을 보여주는6개의 그래프를 나타낸다 데이터는 ANOVA와 Bonfferoni's multiple comparison test를 이용하여 분석하였다. *, p < 0.05; **, p < 0.01; 및 ***, p < 0.001.
도 17은 건강한 대조군(n=10)의 CD14+CD16- 단핵구 내의 염증 마커 유전자의 레벨에 비교하여, ALS 대상체(n=8) 및 MS 대상체(n=11)의 CD14+CD16- 단핵구 내의 179개의 염증 관련 유전자("염증 마커 유전자")의 엔카운터 발현 프로파일을 보여주는 히트맵을 보여 준다. 데이터 분석은 AVONA 및 Dunnett's post hoc test을 이용하여 실시하였다(p < 0.01). 히트맵의 각 열은 개별 유전자을 나타내고 각 행은 개별 대상체를 나타낸다.
도 18A는 건강한 대조군의 CD14+CD16- 단핵구 내의 염증 마커 유전자의 레벨에 비교하여, ALS 대상체(좌측 그래프) 및 MS(우측 그래프)의 CD14+CD16- 단핵구에서의 상당히 조절이상된 염증 마커 유전자를 보여주는 2개의 볼케이노 플릇을 나타낸다.
도 18B는 건강한 대조군의 CD14+CD16- 단핵구에서의 염증 마커 유전자의 레벨에 비교하여 ALS 및 MS 대상체의 CD14+CD16- 단핵구에서 상당히 조절이상된 염증 마커 유전자의 요약을 나타낸다. 바는 건강한 대조군의 CD14+CD16- 단핵구에서의 염증 마커 유전자의 발현 대한 ALS 및 MS 대상체의 CD14+CD16- 단핵구에서의 조절이상된 염증 마커 유전자의 상대적 발현을 보여준다.
도 19는 건강한 대조군(n=8) 및 ALS 대상체(n=11)의 CD14+CD16+ 대상체에서의 8개의 상이한 마이크로RNA의 발현을 보여주는 8개의 그래프를 나타낸다(실시간 PCR을 이용하여 측정) 데이터는 양측 검정을 이용하여 분석하였다(*, P < 0.05).
도 20A는 건강한 대조군(n=8)의 CD14+CD16- 단핵구에서의 마이크로RNA의 발현에 비교하여, ALS 대상체(n=8) 및 MS 대상체(n=8)의 CD14+CD16- 단핵구에서의 마이크로RNA의 엔카운터 발현 프로파일을 보여주는 히트맵을 나타낸다. 데이터 분석은 AVONA 및 Dunnett's post hoc test를 이용하여 실시하였다(p < 0.01). 히트맵의 각 열은 개별 유전자를 나타내고 각 행은 개별 대상체를 나타낸다. 건강한 대상체의 CD14+CD16+ 단핵구에 비교하여 상대적으로 ALS 대상체의 CD14+CD16+ 단핵구에서 상향조절되거나 하향조절된 마이크로RNA가 나타나 있다.
도 20B는 건강한 대조군(n=8)의 CD14+CD16- 단핵구 내의 마이크로RNA의 발현에 비교하여, ALS 대상체(n=8) 및 MS 대상체(n=8)의 CD14+CD16- 단핵구 내의 마이크로RNA의 엔카운터 발현 프로파일을 보여주는 히트맵을 나타낸다. 데이터 분석은 AVONA 및 Dunnett's post hoc test를 이용하여 실시하였다(p < 0.01). 히트맵의 각 열은 개별 유전자을 나타내고 각 행은 개별 대상체를 나타낸다. 건강한 대상체의 CD14+CD16+ 단핵구에서의 마이크로RNA의 발현에 비교하여 MS 대상체의 CD14+CD16+ 단핵구에서 상향조절되거나 하향조절된 마이크로RNA가 나타나 있다.
도 20C는 건강한 대조군의 CD14+CD16- 단핵구 내의 마이크로RNA의 발현에 비교하여 ALS 및 MS 대상체의 CD14+CD16- 단핵구 내의 상당히 조절이상된 마이크로RNA의 개요를 나타낸다. 바는 건강한 대조군의 CD14+CD16- 단핵구 내의 마이크로RNA의 발현 대비 ALS 및 MS 대상체의 CD14+CD16- 단핵구 내의 조절이상된 마이크로RNA의 상대적 발현을 보여준다.
도 21A 및 21B는 질병의 전증상(60일), 발생(체중 손실로 정의함), 및 말기-단계에서, 비-형질전화(Tg) 리터메이트의 Ly6CHi 비장 유래 단핵구 서브세트에 비교하여, SOD1G93A 마우스의 Ly6CHi 비장 유래 단핵구 서브세트에서의 179개 염증 마커 유전자의 엔카운터(nCounter) 발현 프로파일을 보여준다. 적어도 2-배 변형 전사 레벨을 갖는 유전자를 보여 주는 ANOVA 및 Dunett's post hoc test(P < 0.01)의 결과를 보여주는 히트맵을 보여주고 있다. 생물학적 삼중 실험(biological triplicates, 각 시점에서 4-5마리의 마우스 풀의 각 그룹당 n=3 열)에서 히트맵의 각 열은 개별 유전자를 나타내고 각 행은 각 그룹을 나타낸다. 각 질환 단계에서 비-형질전환 복제는 붕괴되었고 유전자는 계층적으로 모였다(clustered). 유전자 발현 레벨을 6개의 하우스-키핑 유전자(CLTC, GAPDH, GUSB, HPRT1, PGK1, 및 TUBB5)의 기하 평균에 대하여 정규화하였다.
도 21C는 질환의 전증상(60일), 발생(체중 손실로 정의함), 및 말기-단계에서, 비-형질전화(Tg) 리터메이트의 Ly6CHi 비장 유래 단핵구 서브세트 대비 SOD1G93A 마우스의 Ly6CHi 비장 유래 단핵구 서브세트에서 상당히 하향조절된 염증 마커 유전자를 보여주는 엔카운터(nCounter) 발현 프로파일을 나타낸다.
도 21D는 SOD1G93A 마우스에서 질환 발생 한 달 전 Ly6CHi 비장 유래 단핵구에서 활성화된 주요 생물학적 네트워크의 목록을 나타낸다.
도 21E는 비-형질전환 리터메이트의 척수 유래 CD39+ 미세아교세포에 비교하여 SOD1G93A 마우스의 척수 유래 CD39+ 미세아교세포에서 상향조절된 유전자의 엔카운터 발현 프로파일 데이터를 보여준다.
도 21F 및 도 21G는 비-형질전환 리터메이트의 척수 유래 CD39+ 미세아교세포 대비 SOD1G93A 마우스의 척수 유래 CD39+ 미세아교세포에서 하향조절된 유전자의 엔카운터 발현 프로파일 데이터를 보여준다.
도 21H 질환이 발생 시에 SOD1 마우스의 척수의 CD39+ 미세아교세포에서 활성화된 주요 생물학적 경로의 목록을 나타낸다.
도 21I는 발병시 SOD1 마우스의 척수로부터의 CD39+ 미세아교세포에 비교하여 동일한 SOD1 마우스의 뇌에서 분리한 CD39+ 미세아교세포에서 상당히 상향조절된 유전자의 비교 분석을 보여준다.
도 22A는 건강한 대조군(n=10) 대비 산발성 ALS 대상체(n=11) 및 MS 대상체(n=8)의 CD14+CD16- 혈액 단핵구 내의 184개의 염증-관련 유전자의 엔카운터 발현 프로파일을 보여준다.
도 22B는 건강한 대조군에 비교하여 산발성 ALS 및 MS 대상체에서 상당히 조절이상된 유전자의 발현에 있어서의 배수 차이를 보여주는 그래프이다. 유전자 발현 레벨을 6개의 내부 기준 하우스-키핑 유전자(CLTC, GAPDH, GUSB, HPRT1, PGK1, 및 TUBB5)의 기하 평균에 대하여 정규화하였다.
도 22C는 공간 유전자 분포를 가지는 산발성 ALS 대상체와 MS 대상체 사이에서 확인된 조절이상 유전자의 주성분 분석(principal components analysis, PCA)을 보여주는 그래프이다.
도 23A는 건강한 대조군 (10개의 대상체) 대비 산발성 ALS(10개의 대상체) 및 가족성 SOD1 ALS(4개의 대상체)에서 511개 면역- 및 184개 염증-관련 유전자에 대한 혈액 선별 CD14+CD16- 단핵구의 엔카운터 발현 프로파일을 보여준다. 상기 프로파일(히트맵)은 상당히 조절이상된 유전자를 나타내는 무감독 계층적 클러스터링(unsupervised hierarchial clustering, Pearson 상관관계)을 나타낸다(Nonparametric Kruskal-Wallis test; Benjamini-Hochberg 방법에 의하여 결정되는 오류발견율(FDR)에 기초한 유의성; 선택된 FDR 제한: 0.05; P < 0.01). 히트맵의 각 열은 개별 유전자를 나타내고 각 행은 개별 대상체를 나타낸다.
도 23B는 건강한 대조군에 비교하여 산발성 ALS 및 가족성 ALS 대상체의 혈액 선별 CD14+CD16- 단핵구 내에서 상당히 조절이상된 유전자의 배수 차이(fold difference)를 보여주는 그래프이다. 유전자 발현 레벨은 15개의 내부 기준 하우스-키핑 유전자(ABCF1, ALAS1, EEF1G, G6PD, GAPDH, GUSB, HPRT1, OAZ1, POLR1B, POLR2A, PPIA, RPL19, DSHA, TBP, 및 TUBB)의 기하 평균에 대하여 정규화하였다.
도 23C는 공간 유전자 분포를 가지는 산발성 ALS 대상체와 가족성 ALS 대 건강한 대조군에서, 혈액 선별 CD14+CD16- 단핵구 내에서의 확인된 조절이상 유전자의 PCA 분석을 보여주는 그래프이다.
도 24는 건강한 대조군의 혈액 선정 CD14+CD16- 단핵구에 비하여 가족성 및/또는 산발성 ALS 대상체의 CD14+CD16- 단핵구에서 가장 상당히 조절이상된 8개의 유전자에 대하여 실시한 PCR 입증을 보여주는 8개의 그래프 세트이다. 건강한 대조군 대비 산발성 ALS 및 가족성 ALS에서 상대적 발현은 비교 Ct(2-ΔΔCt) 방법을 이용하여 계산하였다. 유전자 발현 레벨을 3개의 하우스-키핑 유전자(GAPDH, TUBB, 및 GRB2)의 기하 평균에 대하여 정규화하였다. 각 대상체에서 PCR을 중복 실행하였다. 그래프는 ALS 대상체에서 상당히 조절이상된 유전자의 일원 분산분석(ANOVA) 및 Dunett's multiple comparison test를 나타낸다.
도 25는 ALS 대상체의 CD14+CD16- 혈액 단핵구에서 확인된 상당히 조절이상된 miRNA 및 mRNA에 기반하여 ALS 대상체의 CD14+CD16- 혈액 단핵구에서 상위 10 순위의 마이크로 miRNA-mRNA 상호 작용을 보여주는 Ingenuity 표적 필터 분석의 그래프이다.
도 26A 및 26B는 ALS 대상체의 CD14+CD16- 혈액 단핵구에서 얻은 데이터에 대하여 행해진 마이크로RNA-mRNA 표적 분석의 결과를 보여주는 표이다 (IPA; Ingenuity). 결과는 27개의 mRNA를 표적화하는 32개의 miRNA를 보여준다.
도 27A 및 27B는 ALS의 혈액-분류(blood-sorted) CD14+CD16- 단핵구에서 마이크로RNA-mRNA 상호작용을 설명하는 그래프이다. 그래프는 ALS 대상체의 혈액 선정 CD14+CD16- 단핵구에서 상당히 조절이상된 miRNA와 면역-관련 유전자의 결과를 설명한다. 27개의 mRNA를 표적화하는 총 32개의 miRNA를 보여준다.
도 28은 SOD1 마우스의 비장 Lys6CHi 단핵구에서 관찰된 41개의 비-조절된 고도로 발현된 miRNA와 47개의 조절이상된 유전자(도 28A) 및 ALS 대상체의 CD14+CD16- 말초 혈액 단핵구에서 관찰된 64개의 비-조절된 고도로 발현된 miRNA와 59개의 조절이상된 유전자(도 28B)에서 관찰된 추정 miRNA-mRNA 쌍과 비교하여 1000개의 무작위 및 비-조절된 miRNA-mRNA 쌍 사이에서 가능한 무작위 상호작용의 분포를 보여주는 두 그래프이다(Targetscan 4.1).
도 29A 및 29B는 ALS 대상체의 혈액 선정 CD14+CD16- 단핵구에서 상위 20위 전사 인자 및 조절이상된 표적 유전자(GeneGo pathway analysis를 이용하여 측정)를 보여주는 표와, ALS 대상체에서 혈액 선정 CD14+CD16- 단핵구에서 SP1(specific protein-1) 전사 인자 및 그의 표적 유전자를 보여주는 그래프이다.
도 30은 SOD1/miR-155-/- 및 SOD1/miR-155+/- 마우스의 생존 가능성의 Kaplan-Meir analysis에 대한 그래프이다. SOD1/miR-155-/- 대 SOD1/miR-155+/- 마우스 그룹 간의 Mantel-Cox's F-test 비교 (P < 0.0001).
도 31은 신경학적 질환 시작(신경 심각도 점수 2)의 시간-대-발생 분석(time-to-event analysis)의 그래프이다. 질환 시작은 SOD1/miR-155+/- 마우스에 비교하여 SOD1/miR-155-/- 마우스에서 상당히 지연되었다(P < 0.0001).
도 32는 나이의 함수로서 SOD1/miR-155-/- 및 SOD1/miR-155+/- 마우스의 로타로드 성능의 그래프이다. **P < 0.01; ***P < 0.001; 계승식(factorial) ANOVA 및 Fisher's LSD post-hoc test.
도 33은 SOD1/miR-155-/- 및 SOD1/miR-155+/- 마우스에서 체중 손실의 그래프이다. 통계분석을 2-way ANOVA 및 Bonferri post-hoc test를 이용하여 행하였다. ***P < 0.001.
도 34는 SOD1/miR-155-/- 및 SOD1/miR-155+/- 마우스에서 초기 질환 상태(발생부터 체중손실 5%까지)의 지속기간(좌측 그래프) 및 후기 질환 상태(체중손실 5%부터 말기 단계)의 지속기간을 보여주는 두 그래프 세트이다.
도 35A는 야생형, SOD1/miR155+/+, SOD1/miR155-/+, 및 SOD1/miR155-/- 마우스에서, 4D4 (상주 미세아교세포) 및 CD11b (골수세포)로 염색된 척수 유래 단핵구의 FACS(fluorescence-activated cell sorting) 분석 데이터를 보여준다.
도 35B는 야생형, SOD1/miR155+/+, SOD1/miR155-/+, 및 SOD1/miR155-/- 마우스에서, 척수 당 미세아교세포(4D4 양성) 및 단핵구세포(CD11b 양성)의 절대 수(absolute number)를 보여준다.
도 36A 및 36B는 WT, SOD1/miR155-/+, 및 SOD1/miR155-/- 마우스에서, 척수 미세아교세포 및 Ly6CHi 비장 단핵구에서의 염증-관련 유전자의 발현을 보여주는 4개의 히트맵 세트를 보여준다. (a)로 표지된 히트맵은 말기 단계의 동물 것이다. (SOD1/miR155-/- 마우스는 연구가 끝날 무렵에 여전히 생존하고 번식하지만, SOD1/miR-/+ 마우스는 증상의 발생을 경험한다(말기 단계)는 것을 참고) 모든 마우스는 수컷 C57/BI6-SOD1이다. (b)로 표지된 히트맵은 SOD1 마우스에서 miR155에 의하여 상당히 영향을 받은 유전자를 나타낸다.
도 37은 야생형, SOD1/miR155-/+, SOD1/miR155-/- 마우스에서, Ly6CHi 비장 유래 단핵구 서브세트에서의 여러 마이크로RNA의 발현을 보여주는 엔카운터 발현 프로파일 데이터를 보여준다.
도 38A 및 38B는 건강한 대조군(8개의 대상체)의 CD14+CD16- 단핵구 내의 마이크로RNA의 발현에 비교하여, 산발성 ALS (8개의 대상체) 및 재발성 감퇴 다발성 경화증(8개의 대상체)의 마이크로RNA에 대한 혈액-유래 CD14+CD16- 단핵구의 엔카운터 발현 프로파일링을 보여주는 히트맵을 보여준다. 히트맵은 Dunnett's post hoc test(P < 0.01)를 이용한 분산 분석(ANOVA) 결과를 보여준다(P < 0.01). ALS 대상체의 CD14+CD16- 단핵구에서 상향조절되거나 하향조절된 마이크로RNA(건강한 대조군의 CD14+CD16- 단핵구의 마이크로RNA의 발현 대비)가 나타나 있다. 히트맵의 각 열은 개별 유전자을 나타내고 각 행은 개별 대상체를 나타낸다.
도 1B는 모든 질환 단계에 걸쳐, 비-형질전환 리터메이트(littermates)의 CD39+ 미세아교세포에서의 마이크로RNA의 발현에 비교하여 SODG93A 마우스의 CD39+ 미세아교세포에서의 상당히 조절이상된 마이크로RNA의 벤 다이아그램을 보여준다. 숫자는 각 질환 단계에서 상당히 조절이상된 마이크로RNA를 나타낸다.
도 1C는 비-형질전환 리터메이트(littermates)의 CD39+ 미세아교세포에서의 마이크로RNA의 발현에 비교하여 SODG93A 마우스의 CD39+ 미세아교세포에서의 상당히 조절이상된 마이크로RNA의 요약을 보여준다. 데이터는 싱글플렉스 TaqMan PCR으로 확인하였다.
도 2A는 전증상(60 일) 시점(전증상), 증상 발생 시(발생), 및 질환의 말기 단계(말기-단계), 비-형질전환 리터메이트(littermates)의 Ly6CHi 단핵구에서의 RNA의 발현에 비교하여 SODG93A 마우스의 Ly6CHi 단핵구에서의 상당히 조절이상된 마이크로RNA의 볼케이노 플롯을 나타낸다. x-축은 발현 변화(ddCT 값을 기준으로하는 log2-배수 차이)를 나타내고, y-축은 로그-오즈(log-odds) 변화의 통계적 유의성을 보여준다.
도 2B는 모든 질환 단계(전증상, 증상의 발생, 및 질환이 말기-단계)에 걸쳐, 비-형질전환 리터메이트(littermates)의 Ly6CHi 단핵구에서의 마이크로RNA의 발현에 비교하여 SODG93A 마우스의 Ly6CHi 단핵구에서의 상당히 조절이상된 마이크로RNA의 벤 다이아그램을 보여준다. 숫자는 각 질환 단계에서 상당히 조절이상된 마이크로RNA를 나타낸다.
도 2C는 비-형질전환 리터메이트(littermates)의 Ly6CHi 단핵구에서의 마이크로RNA의 발현에 비교하여 SODG93A 마우스의 Ly6CHi 단핵구에서의 상당히 조절이상된 마이크로RNA의 요약을 보여준다. 데이터는 싱글플렉스 TaqMan PCR으로 확인하였다.
도 3A는 전증상(60 일) 시점(전증상), 증상 발생 시(발생), 및 질환의 말기 단계(말기-단계), 비-형질전환 리터메이트(littermates)의 Ly6CLow 단핵구 내의 RNA의 발현에 비교하여 SODG93A 마우스의 Ly6CLow 단핵구에서의 상당히 조절이상된 마이크로RNA의 볼케이노 플롯을 보여준다. x-축은 발현 변화(ddCT 값을 기준으로 하는 log2-배수 차이)를 나타내고, y-축은 로그-오즈(log-odds) 변화의 통계적 유의성을 보여준다.
도 3B는 모든 질환 단계에 걸쳐, 비-형질전환 리터메이트(littermates)의 Ly6CLow 단핵구에서의 마이크로RNA의 발현 대비 SODG93A 마우스의 Ly6CLow 단핵구에서의 상당히 조절이상된 마이크로RNA의 벤 다이아그램을 보여준다. 숫자는 각 질환 단계에서 상당히 조절이상된 마이크로RNA를 나타낸다.
도 3C는 비-형질전환 리터메이트(littermates)의 Ly6CLow 단핵구에서의 마이크로RNA의 발현에 비교하여 SODG93A 마우스의 Ly6CLow 단핵구에서의 상당히 조절이상된 마이크로RNA의 요약을 보여준다. 데이터는 싱글플렉스 TaqMan PCR으로 확인하였다.
도 4A 및 4B는 SOD1 마우스의 모든 질환 단계에 걸쳐서, (비-형질전환 리터메이트(littermates 대비) Ly6CHi 단핵구에서의 32개의 조절이상된 마이크로RNA에 대한 Ingenuity pathway analysis의 결과를 나타내는 그래프와 표를 보여준다. 그래프는 골격 질환, 근육 질환, 및 근 질환에서 관찰되는 패턴을 보여준다.
도 5는 건강한 대조군(8개의 대상체)의 CD14+CD16- 단핵구 내의 마이크로RNA의 발현에 비교하여, 산발성 ALS (8개의 대상체) 및 재발성 감퇴 다발성 경화증(8개의 대상체)의 664개의 마이크로RNA에 관한, 혈액-유래 CD14+CD16- 단핵구의 엔카운터 발현 프로파일링(nCounter expression profiling)을 나타내는 히트맵을 보여준다. 히트맵은 Dunnett's post hoc test을 이용한 분산 분석(ANOVA) 결과를 보여준다(P < 0.01). ALS 대상체의 CD14+CD16- 단핵구에서 상향조절되거나 하향조절된 마이크로RNA(건강한 대조군의 CD14+CD16- 단핵구의 마이크로RNA의 발현 대비)가 나타나있다. 히트맵의 각 열은 개별 유전자을 나타내고 각 행은 개별 대상체를 나타낸다.
도 6는 건강한 대조군(8개의 대상체)의 CD14+CD16- 단핵구 내의 마이크로RNA의 발현에 비교하여, 산발성 ALS (8개의 대상체) 및 재발성 감퇴 다발성 경화증(8개의 대상체)의 664개의 마이크로RNA에 관한, 혈액-유래 CD14+CD16- 단핵구의 엔카운터 발현 프로파일링(nCounter expression profiling)을 나타내는 히트맵을 보여준다. 히트맵은 Dunnett's post hoc test (P < 0.01)을 이용한 ANOVA 결과를 보여준다. ALS 대상체의 CD14+CD16- 단핵구에서 상향조절되거나 하향조절된 마이크로RNA(건강한 대조군의 CD14+CD16- 단핵구에서의 마이크로RNA의 발현 대비)가 나타나있다. 히트맵의 각 열은 개별 유전자을 나타내고 각 행은 개별 대상체를 나타낸다.
도 7A는 건강한 대조군의 CD14+CD16- 단핵구에서의 마이크로RNA의 발현에 비교하여 ALS 및 MS 대상체의 CD14+CD16- 단핵구에서의 고유한 또는 유사한 조절이상된(상향조절되거나 하향조절된) 마이크로RNA의 밴 다이아그램을 보여준다.
도 7B는 건강한 대조군의 CD14+CD16- 단핵구에서의 마이크로RNA의 발현에 비교하여 ALS 대상체의 CD14+CD16- 단핵구에서 상당히 조절이상된 마이크로RNA를 보여주는 볼케이노 플롯(volcano plot)이다.
도 7C는 건강한 대조군의 CD14+CD16- 단핵구에서의 마이크로RNA의 발현에 비교하여 MS 대상체의 CD14+CD16- 단핵구에서 상당히 조절이상된 마이크로RNA를 보여주는 볼케이노 플롯(volcano plot)이다.
도 8은 건강한 대조군의 CD14+CD16- 단핵구에서의 마이크로RNA의 발현에 비교하여 ALS 및 MS 대상체의 CD14+CD16- 단핵구에서의 상당히 조절이상된 마이크로RNA의 요약을 나타낸다. 바는 건강한 대조군의 CD14+CD16- 단핵구에서의 마이크로RNA의 발현에 비하여 ALS 및 MS 대상체의 CD14+CD16- 단핵구에서의 조절이상된 마이크로RNA의 상대적 발현을 보여준다.
도 9는 건강한 대상체(8개의 대상체) 및 ALS가 있는 대상체(11개의 대상체)의 CD14+CD16- 단핵구에서 6개의 상이한 마이크로RNA의 발현을 보여주는 6개 그래프를 한 세트로 하여 보여 준다(실시간 PCR에 의하여 측정). 양측 검정(two-tailed Mann-Whitney t-test)을 이용하여 P 값을 계산하였다(*, P < 0.05; **, P < 0.01; ***, P < 0.001).
도 10A는 8명의 서로 다른 ALS 환자의 임상 점수(강제 폐활량 (FVC) 점수 및 기능 평가 척도 (FRS))를 보여주는 두 개의 그래프를 나타낸다. 건강한 대조군 및 MS 대상체의 CD14+CD16- 단핵구에서의 마이크로RNA 발현에 대한 이들 8명의 환자의 CD14+CD16- 단핵구에서의 마이크로RNA 발현의 비교가 도 10C에 나타나 있다.
도 10B는 도 10A 및 도 10C에 기재된 8명의 상이한 ALS 환자의 목록이다.
도 10C는 산발성 ALS 환자(8개의 대상체), 건강한 대상체, 및 MS가 있는 대상체의 CD14+CD16- 단핵구에서 20개의 상향조절된 마이크로RNA의 발현을 보여주는 20개의 그래프를 나타낸다. 양측 검정(two-tailed Mann-Whitney t-test)을 이용하여 P 값을 계산하였다.
도 11은 건강한 대상체(n=8) 및 MS가 있는 대상체(n=8)에 비교하여, 산발성 ALS 대상체(n=11)의 CD14+CD16- 단핵구에서 4개의 상향조절된 마이크로RNA의 발현에 대한 실시간 PCR 분석을 보여주는 4개의 그래프를 나타낸다. 데이터는 일원 분산분석(one-way ANOVA) 및 Dunett's multiple comparison test를 이용하여 생성하였다(***, p < 0.001).
도 12A는 8명이 서로 다른 ALS 환자의 임상 점수(강제 폐활량 (FVC) 점수 및 기능 평가 척도 (FRS))를 보여주는 두 개의 그래프를 나타낸다. 건강한 대조군 및 MS 대상체의 CD14+CD16- 단핵구에서의 마이크로RNA 발현에 대한 이들 8명의 환자의 CD14+CD16- 단핵구에서의 마이크로RNA 발현의 비교가 도 10C에 나타나 있다.
도 12B는 도 12A 및 도 12C에 기재된 8명의 상이한 ALS 환자의 목록이다.
도 12C는 건강한 대상체, 및 MS-재발성 감퇴(MS-RR)가 있는 대상체와 비교하여, 산발성 ALS 대상체의 CD14+CD16- 단핵구에서 20개의 하향조절된 마이크로RNA의 발현을 보여주는 20개의 그래프를 나타낸다(실시간 PCR을 이용하여 결정). 양측 검정(two-tailed Mann-Whitney t-test)을 이용하여 P 값을 계산하였다 (*, P < 0.05; **, P < 0.01; ***, P < 0.001).
도 13은 건강한 대상체, 및 MS-재발성 감퇴(MS-RR)가 있는 대상체와 비교하여(각 그룹에 8 대상체), 산발성 ALS 대상체의 CD14+CD16- 단핵구에서 8개의 하향조절된 마이크로RNA의 발현을 보여주는 8개의 그래프를 나타낸다(실시간 PCR을 이용하여 결정). 데이터는 일원 분산분석(one-way ANOVA) 및 Dunett's multiple comparison test를 이용하여 생성하였다(**, P < 0.01; ***, p < 0.001).
도 14는 건강한 대상체 및 ALS이 있는 대상체(8개의 대상체)에 비교하여 MS-RR 대상체의 CD14+CD16- 단핵구에서 5개의 상향조절된 마이크로RNA의 발현을 보여주는 5개의 상이한 그래프를 나타낸다(실시간 PCR을 이용하여 결정). 양측 검정(two-tailed Mann-Whitney t-test)을 이용하여 P 값을 계산하였다(*, P < 0.05; **, P < 0.01; ***, P < 0.001).
도 15는 건강한 대상체 및 산발성 ALS이 있는 대상체에 비교하여 MS-RR 대상체의 CD14+CD16- 단핵구에서 5개의 하향조절된 마이크로RNA의 발현을 보여주는 5개의 그래프를 나타낸다(실시간 PCR을 이용하여 결정). 양측 검정(two-tailed Mann-Whitney t-test)을 이용하여 P 값을 계산하였다 (*, P < 0.05).
도 16은 건강한 대상체, 가족성 ALS이 있는 대상체(n=5), 및 산발성 ALS이 있는 대상체(n=10)의 뇌척수에서 6개의 상향조절된 마이크로RNA의 발현을 보여주는6개의 그래프를 나타낸다 데이터는 ANOVA와 Bonfferoni's multiple comparison test를 이용하여 분석하였다. *, p < 0.05; **, p < 0.01; 및 ***, p < 0.001.
도 17은 건강한 대조군(n=10)의 CD14+CD16- 단핵구 내의 염증 마커 유전자의 레벨에 비교하여, ALS 대상체(n=8) 및 MS 대상체(n=11)의 CD14+CD16- 단핵구 내의 179개의 염증 관련 유전자("염증 마커 유전자")의 엔카운터 발현 프로파일을 보여주는 히트맵을 보여 준다. 데이터 분석은 AVONA 및 Dunnett's post hoc test을 이용하여 실시하였다(p < 0.01). 히트맵의 각 열은 개별 유전자을 나타내고 각 행은 개별 대상체를 나타낸다.
도 18A는 건강한 대조군의 CD14+CD16- 단핵구 내의 염증 마커 유전자의 레벨에 비교하여, ALS 대상체(좌측 그래프) 및 MS(우측 그래프)의 CD14+CD16- 단핵구에서의 상당히 조절이상된 염증 마커 유전자를 보여주는 2개의 볼케이노 플릇을 나타낸다.
도 18B는 건강한 대조군의 CD14+CD16- 단핵구에서의 염증 마커 유전자의 레벨에 비교하여 ALS 및 MS 대상체의 CD14+CD16- 단핵구에서 상당히 조절이상된 염증 마커 유전자의 요약을 나타낸다. 바는 건강한 대조군의 CD14+CD16- 단핵구에서의 염증 마커 유전자의 발현 대한 ALS 및 MS 대상체의 CD14+CD16- 단핵구에서의 조절이상된 염증 마커 유전자의 상대적 발현을 보여준다.
도 19는 건강한 대조군(n=8) 및 ALS 대상체(n=11)의 CD14+CD16+ 대상체에서의 8개의 상이한 마이크로RNA의 발현을 보여주는 8개의 그래프를 나타낸다(실시간 PCR을 이용하여 측정) 데이터는 양측 검정을 이용하여 분석하였다(*, P < 0.05).
도 20A는 건강한 대조군(n=8)의 CD14+CD16- 단핵구에서의 마이크로RNA의 발현에 비교하여, ALS 대상체(n=8) 및 MS 대상체(n=8)의 CD14+CD16- 단핵구에서의 마이크로RNA의 엔카운터 발현 프로파일을 보여주는 히트맵을 나타낸다. 데이터 분석은 AVONA 및 Dunnett's post hoc test를 이용하여 실시하였다(p < 0.01). 히트맵의 각 열은 개별 유전자를 나타내고 각 행은 개별 대상체를 나타낸다. 건강한 대상체의 CD14+CD16+ 단핵구에 비교하여 상대적으로 ALS 대상체의 CD14+CD16+ 단핵구에서 상향조절되거나 하향조절된 마이크로RNA가 나타나 있다.
도 20B는 건강한 대조군(n=8)의 CD14+CD16- 단핵구 내의 마이크로RNA의 발현에 비교하여, ALS 대상체(n=8) 및 MS 대상체(n=8)의 CD14+CD16- 단핵구 내의 마이크로RNA의 엔카운터 발현 프로파일을 보여주는 히트맵을 나타낸다. 데이터 분석은 AVONA 및 Dunnett's post hoc test를 이용하여 실시하였다(p < 0.01). 히트맵의 각 열은 개별 유전자을 나타내고 각 행은 개별 대상체를 나타낸다. 건강한 대상체의 CD14+CD16+ 단핵구에서의 마이크로RNA의 발현에 비교하여 MS 대상체의 CD14+CD16+ 단핵구에서 상향조절되거나 하향조절된 마이크로RNA가 나타나 있다.
도 20C는 건강한 대조군의 CD14+CD16- 단핵구 내의 마이크로RNA의 발현에 비교하여 ALS 및 MS 대상체의 CD14+CD16- 단핵구 내의 상당히 조절이상된 마이크로RNA의 개요를 나타낸다. 바는 건강한 대조군의 CD14+CD16- 단핵구 내의 마이크로RNA의 발현 대비 ALS 및 MS 대상체의 CD14+CD16- 단핵구 내의 조절이상된 마이크로RNA의 상대적 발현을 보여준다.
도 21A 및 21B는 질병의 전증상(60일), 발생(체중 손실로 정의함), 및 말기-단계에서, 비-형질전화(Tg) 리터메이트의 Ly6CHi 비장 유래 단핵구 서브세트에 비교하여, SOD1G93A 마우스의 Ly6CHi 비장 유래 단핵구 서브세트에서의 179개 염증 마커 유전자의 엔카운터(nCounter) 발현 프로파일을 보여준다. 적어도 2-배 변형 전사 레벨을 갖는 유전자를 보여 주는 ANOVA 및 Dunett's post hoc test(P < 0.01)의 결과를 보여주는 히트맵을 보여주고 있다. 생물학적 삼중 실험(biological triplicates, 각 시점에서 4-5마리의 마우스 풀의 각 그룹당 n=3 열)에서 히트맵의 각 열은 개별 유전자를 나타내고 각 행은 각 그룹을 나타낸다. 각 질환 단계에서 비-형질전환 복제는 붕괴되었고 유전자는 계층적으로 모였다(clustered). 유전자 발현 레벨을 6개의 하우스-키핑 유전자(CLTC, GAPDH, GUSB, HPRT1, PGK1, 및 TUBB5)의 기하 평균에 대하여 정규화하였다.
도 21C는 질환의 전증상(60일), 발생(체중 손실로 정의함), 및 말기-단계에서, 비-형질전화(Tg) 리터메이트의 Ly6CHi 비장 유래 단핵구 서브세트 대비 SOD1G93A 마우스의 Ly6CHi 비장 유래 단핵구 서브세트에서 상당히 하향조절된 염증 마커 유전자를 보여주는 엔카운터(nCounter) 발현 프로파일을 나타낸다.
도 21D는 SOD1G93A 마우스에서 질환 발생 한 달 전 Ly6CHi 비장 유래 단핵구에서 활성화된 주요 생물학적 네트워크의 목록을 나타낸다.
도 21E는 비-형질전환 리터메이트의 척수 유래 CD39+ 미세아교세포에 비교하여 SOD1G93A 마우스의 척수 유래 CD39+ 미세아교세포에서 상향조절된 유전자의 엔카운터 발현 프로파일 데이터를 보여준다.
도 21F 및 도 21G는 비-형질전환 리터메이트의 척수 유래 CD39+ 미세아교세포 대비 SOD1G93A 마우스의 척수 유래 CD39+ 미세아교세포에서 하향조절된 유전자의 엔카운터 발현 프로파일 데이터를 보여준다.
도 21H 질환이 발생 시에 SOD1 마우스의 척수의 CD39+ 미세아교세포에서 활성화된 주요 생물학적 경로의 목록을 나타낸다.
도 21I는 발병시 SOD1 마우스의 척수로부터의 CD39+ 미세아교세포에 비교하여 동일한 SOD1 마우스의 뇌에서 분리한 CD39+ 미세아교세포에서 상당히 상향조절된 유전자의 비교 분석을 보여준다.
도 22A는 건강한 대조군(n=10) 대비 산발성 ALS 대상체(n=11) 및 MS 대상체(n=8)의 CD14+CD16- 혈액 단핵구 내의 184개의 염증-관련 유전자의 엔카운터 발현 프로파일을 보여준다.
도 22B는 건강한 대조군에 비교하여 산발성 ALS 및 MS 대상체에서 상당히 조절이상된 유전자의 발현에 있어서의 배수 차이를 보여주는 그래프이다. 유전자 발현 레벨을 6개의 내부 기준 하우스-키핑 유전자(CLTC, GAPDH, GUSB, HPRT1, PGK1, 및 TUBB5)의 기하 평균에 대하여 정규화하였다.
도 22C는 공간 유전자 분포를 가지는 산발성 ALS 대상체와 MS 대상체 사이에서 확인된 조절이상 유전자의 주성분 분석(principal components analysis, PCA)을 보여주는 그래프이다.
도 23A는 건강한 대조군 (10개의 대상체) 대비 산발성 ALS(10개의 대상체) 및 가족성 SOD1 ALS(4개의 대상체)에서 511개 면역- 및 184개 염증-관련 유전자에 대한 혈액 선별 CD14+CD16- 단핵구의 엔카운터 발현 프로파일을 보여준다. 상기 프로파일(히트맵)은 상당히 조절이상된 유전자를 나타내는 무감독 계층적 클러스터링(unsupervised hierarchial clustering, Pearson 상관관계)을 나타낸다(Nonparametric Kruskal-Wallis test; Benjamini-Hochberg 방법에 의하여 결정되는 오류발견율(FDR)에 기초한 유의성; 선택된 FDR 제한: 0.05; P < 0.01). 히트맵의 각 열은 개별 유전자를 나타내고 각 행은 개별 대상체를 나타낸다.
도 23B는 건강한 대조군에 비교하여 산발성 ALS 및 가족성 ALS 대상체의 혈액 선별 CD14+CD16- 단핵구 내에서 상당히 조절이상된 유전자의 배수 차이(fold difference)를 보여주는 그래프이다. 유전자 발현 레벨은 15개의 내부 기준 하우스-키핑 유전자(ABCF1, ALAS1, EEF1G, G6PD, GAPDH, GUSB, HPRT1, OAZ1, POLR1B, POLR2A, PPIA, RPL19, DSHA, TBP, 및 TUBB)의 기하 평균에 대하여 정규화하였다.
도 23C는 공간 유전자 분포를 가지는 산발성 ALS 대상체와 가족성 ALS 대 건강한 대조군에서, 혈액 선별 CD14+CD16- 단핵구 내에서의 확인된 조절이상 유전자의 PCA 분석을 보여주는 그래프이다.
도 24는 건강한 대조군의 혈액 선정 CD14+CD16- 단핵구에 비하여 가족성 및/또는 산발성 ALS 대상체의 CD14+CD16- 단핵구에서 가장 상당히 조절이상된 8개의 유전자에 대하여 실시한 PCR 입증을 보여주는 8개의 그래프 세트이다. 건강한 대조군 대비 산발성 ALS 및 가족성 ALS에서 상대적 발현은 비교 Ct(2-ΔΔCt) 방법을 이용하여 계산하였다. 유전자 발현 레벨을 3개의 하우스-키핑 유전자(GAPDH, TUBB, 및 GRB2)의 기하 평균에 대하여 정규화하였다. 각 대상체에서 PCR을 중복 실행하였다. 그래프는 ALS 대상체에서 상당히 조절이상된 유전자의 일원 분산분석(ANOVA) 및 Dunett's multiple comparison test를 나타낸다.
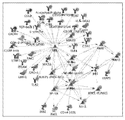
도 25는 ALS 대상체의 CD14+CD16- 혈액 단핵구에서 확인된 상당히 조절이상된 miRNA 및 mRNA에 기반하여 ALS 대상체의 CD14+CD16- 혈액 단핵구에서 상위 10 순위의 마이크로 miRNA-mRNA 상호 작용을 보여주는 Ingenuity 표적 필터 분석의 그래프이다.
도 26A 및 26B는 ALS 대상체의 CD14+CD16- 혈액 단핵구에서 얻은 데이터에 대하여 행해진 마이크로RNA-mRNA 표적 분석의 결과를 보여주는 표이다 (IPA; Ingenuity). 결과는 27개의 mRNA를 표적화하는 32개의 miRNA를 보여준다.
도 27A 및 27B는 ALS의 혈액-분류(blood-sorted) CD14+CD16- 단핵구에서 마이크로RNA-mRNA 상호작용을 설명하는 그래프이다. 그래프는 ALS 대상체의 혈액 선정 CD14+CD16- 단핵구에서 상당히 조절이상된 miRNA와 면역-관련 유전자의 결과를 설명한다. 27개의 mRNA를 표적화하는 총 32개의 miRNA를 보여준다.
도 28은 SOD1 마우스의 비장 Lys6CHi 단핵구에서 관찰된 41개의 비-조절된 고도로 발현된 miRNA와 47개의 조절이상된 유전자(도 28A) 및 ALS 대상체의 CD14+CD16- 말초 혈액 단핵구에서 관찰된 64개의 비-조절된 고도로 발현된 miRNA와 59개의 조절이상된 유전자(도 28B)에서 관찰된 추정 miRNA-mRNA 쌍과 비교하여 1000개의 무작위 및 비-조절된 miRNA-mRNA 쌍 사이에서 가능한 무작위 상호작용의 분포를 보여주는 두 그래프이다(Targetscan 4.1).
도 29A 및 29B는 ALS 대상체의 혈액 선정 CD14+CD16- 단핵구에서 상위 20위 전사 인자 및 조절이상된 표적 유전자(GeneGo pathway analysis를 이용하여 측정)를 보여주는 표와, ALS 대상체에서 혈액 선정 CD14+CD16- 단핵구에서 SP1(specific protein-1) 전사 인자 및 그의 표적 유전자를 보여주는 그래프이다.
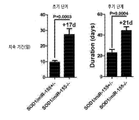
도 30은 SOD1/miR-155-/- 및 SOD1/miR-155+/- 마우스의 생존 가능성의 Kaplan-Meir analysis에 대한 그래프이다. SOD1/miR-155-/- 대 SOD1/miR-155+/- 마우스 그룹 간의 Mantel-Cox's F-test 비교 (P < 0.0001).
도 31은 신경학적 질환 시작(신경 심각도 점수 2)의 시간-대-발생 분석(time-to-event analysis)의 그래프이다. 질환 시작은 SOD1/miR-155+/- 마우스에 비교하여 SOD1/miR-155-/- 마우스에서 상당히 지연되었다(P < 0.0001).
도 32는 나이의 함수로서 SOD1/miR-155-/- 및 SOD1/miR-155+/- 마우스의 로타로드 성능의 그래프이다. **P < 0.01; ***P < 0.001; 계승식(factorial) ANOVA 및 Fisher's LSD post-hoc test.
도 33은 SOD1/miR-155-/- 및 SOD1/miR-155+/- 마우스에서 체중 손실의 그래프이다. 통계분석을 2-way ANOVA 및 Bonferri post-hoc test를 이용하여 행하였다. ***P < 0.001.
도 34는 SOD1/miR-155-/- 및 SOD1/miR-155+/- 마우스에서 초기 질환 상태(발생부터 체중손실 5%까지)의 지속기간(좌측 그래프) 및 후기 질환 상태(체중손실 5%부터 말기 단계)의 지속기간을 보여주는 두 그래프 세트이다.
도 35A는 야생형, SOD1/miR155+/+, SOD1/miR155-/+, 및 SOD1/miR155-/- 마우스에서, 4D4 (상주 미세아교세포) 및 CD11b (골수세포)로 염색된 척수 유래 단핵구의 FACS(fluorescence-activated cell sorting) 분석 데이터를 보여준다.
도 35B는 야생형, SOD1/miR155+/+, SOD1/miR155-/+, 및 SOD1/miR155-/- 마우스에서, 척수 당 미세아교세포(4D4 양성) 및 단핵구세포(CD11b 양성)의 절대 수(absolute number)를 보여준다.
도 36A 및 36B는 WT, SOD1/miR155-/+, 및 SOD1/miR155-/- 마우스에서, 척수 미세아교세포 및 Ly6CHi 비장 단핵구에서의 염증-관련 유전자의 발현을 보여주는 4개의 히트맵 세트를 보여준다. (a)로 표지된 히트맵은 말기 단계의 동물 것이다. (SOD1/miR155-/- 마우스는 연구가 끝날 무렵에 여전히 생존하고 번식하지만, SOD1/miR-/+ 마우스는 증상의 발생을 경험한다(말기 단계)는 것을 참고) 모든 마우스는 수컷 C57/BI6-SOD1이다. (b)로 표지된 히트맵은 SOD1 마우스에서 miR155에 의하여 상당히 영향을 받은 유전자를 나타낸다.
도 37은 야생형, SOD1/miR155-/+, SOD1/miR155-/- 마우스에서, Ly6CHi 비장 유래 단핵구 서브세트에서의 여러 마이크로RNA의 발현을 보여주는 엔카운터 발현 프로파일 데이터를 보여준다.
도 38A 및 38B는 건강한 대조군(8개의 대상체)의 CD14+CD16- 단핵구 내의 마이크로RNA의 발현에 비교하여, 산발성 ALS (8개의 대상체) 및 재발성 감퇴 다발성 경화증(8개의 대상체)의 마이크로RNA에 대한 혈액-유래 CD14+CD16- 단핵구의 엔카운터 발현 프로파일링을 보여주는 히트맵을 보여준다. 히트맵은 Dunnett's post hoc test(P < 0.01)를 이용한 분산 분석(ANOVA) 결과를 보여준다(P < 0.01). ALS 대상체의 CD14+CD16- 단핵구에서 상향조절되거나 하향조절된 마이크로RNA(건강한 대조군의 CD14+CD16- 단핵구의 마이크로RNA의 발현 대비)가 나타나 있다. 히트맵의 각 열은 개별 유전자을 나타내고 각 행은 개별 대상체를 나타낸다.
본 발명은, 특정 마이크로RNA 및 염증 마커는 신경병성 질환이 있는 환자의 CD14+CD16- 단핵구 및/또는 CD14+CD16+ 단핵구(예, 말초 또는 혈액 유래 단핵구)에서 조절이상이 되고(dysregulated), 특정 마아크로 RNA의 레벨이 건강한 대상체에 비교하여 신경병성 질환(예, ALS(예, 산발성 ALS 및 가족성 ALS))이 있는 환자의 뇌척수액에서 증가하거나 감소한다는 사실에 적어도 부분적으로 기반한 것이다. 또한, 본 발명은, hsa-miR-155가 ALS 마우스 모델에서 질환의 발생에 유의미한 역할을 한다는 사실에 기반한 것이다. 이러한 발견을 고려하여, 본 발명은 신경병성 질환을 진단하는 방법, 신경병성 질환이 발생될 위험(예, 위험이 감소하거나 증가함)에 있는 대상체를 확인하는 방법, 신경병성 질환이 있는 대상체에서 질병의 진행 속도를 예측하는 방법, 신경병성 질환의 치료를 위한 대상체를 선택하는 방법, 신경병성 질환이 있는 대상체를 위한 치료제를 선택하는 방법, 신경병성 질환의 치료의 효능을 판단하는 방법, 및 임상 연구 참여를 위한 대상체를 선택하는 방법을 제공한다. 이러한 방법들은 표 1 내지 표 19 중 하나 이상에 열거된 하나 이상(2, 3, 4, 5, 6, 7, 8, 9, 또는 10개)의 마이크로RNA 및/또는 표 20 및 표 21에 열거되는 하나 이상의 염증 마커의 레벨을 결정하는 단계를 포함한다.
또한, 본 발명은 신경병성 질환(예, ALS 또는 MS)를 치료하는 방법으로서, 표 1, 3, 5, 7, 9, 11, 12, 14, 16, 또는 18에 열거된 마이크로RNA(예, hsa-miR-155) 중 하나 이상의 레벨 또는 활성을 감소 및/또는 표 2, 4, 6, 8, 10, 13, 15, 17, 또는 19에 열거된 마이크로RNA 중 하나 이상의 레벨 또는 활성을 증가시키는 제제(예, 핵산)를 대상체에 투여하는 단계를 포함하는 방법을 제공한다. 또한, 본 발명은 신경병성 질환(예, ALS 또는 MS)를 치료하는 방법으로서, 표 21에 열거된 염증 마커 중 하나 이상의 발현(예, 단백질 또는 mRNA) 및/또는 활성을 감소시키고 및/또는 표 20에 열거된 유전자 중 하나 이상의 발현(예, 단백질 또는 mRNA) 및/또는 활성을 증가시키는 제제(예, 핵산)를 대상체에 투여하는 단계를 포함하는 방법을 제공한다
또한, 본 발명은 표 1 내지 표 19에 열거된 마이크로RNA 중 임의의 하나에 존재하는 서열 또는 표 20 및 21에 열거된 유전자 중 임의의 하나를 암호화하는 mRNA에 존재하는 서열에 상보적인 서열(예, 프라이머 또는 프로브)을 함유하는 핵산을 제공한다. 또한, 본 발명은 표 1, 3, 5, 7, 9, 11, 12, 14, 16, 또는 18에 열거된 마이크로RNA(표적 마이크로RNA) 중 임의의 하나에 존재하는 서열 또는 표 21에 열거된 유전자 중 임의의 하나에 의하여 암호화되는 mRNA(표적 mRNA)에 존재하는 서열에 상보적인 서열을 함유하고, 상기 표적 마이크로RNA 또는 표적 mRNA (예, 억제성 RNA, 예를 들면 본원에 기재된 억제성 핵산 중 하나)의 발현 또는 활성을 감소시키는 핵산을 제공한다. 또한, 본 발명은 표 2, 4, 6, 8, 10, 13, 15, 17, 및 19 에 열거된 마이크로RNA 중 임의의 하나(표적 마이크로RNA)의 서열 또는 표 20에 열거된 유전자 중 임의의 하나에 의하여 암호화되는 mRNA(표적 mRNA)에 존재하는 서열에 상보적인 서열을 포함하는 핵산을 함유하고, 상기 표적 마이크로RNA 또는 표적 mRNA의 발현 또는 활성을 증가시키는 조성물을 제공한다 또한, 본 발명은 표 20 및 표 21에 열거된 단백질 중 임의의 하나에 특이적으로 결합하는 적어도 하나의 항체를 함유하는 조성물을 포함한다. 또한, 본 발명은 표 20 및 도 21에 열거된 적어도 하나의 단백질을 함유하는 조성물을 포함한다. 또한, 본 발명은 상기 핵산, 단백질, 또는 항체 (임의의 조합으로) 중 하나 이상을 포함하는 키트를 제공한다.
신경병성
질환(
Neurodegenerative
Disorders
)
신경병성 질환은 신경 세포의 구조와 기능의 점진적 손실 및 신경 세포 사멸이 특징인 신경 질환의 종류이다. 염증은 몇몇 신경병성 질환에서의 기능과 관련이 있다. 운동 및 감각 뉴런, 그리고 감각 정보에 대하여 외부 객체를 참조하는 능력에 대한 점진적 손실은 상이한 종류의 신경병성 질환에서 영향을 받는다. 신경병성 질환의 비제한적 예는 파킨슨병, 알츠하이머병, 헌팅톤병, 근 위축성 측삭 경화증(ALS, 예를 들면, 가족성 ALS 및 산발성 ALS), 및 다발성 경화증(MS)을 포함한다.
건강 관리 전문가는 대상체의 신경병성 질환의 하나 이상의 증상을 평가하여 대상체가 신경병성 질환이 있는 것으로 진단할 수 있다. 대상체에서의 신경병성 질환의 비제한적 예는 발과 발가락의 앞 부분을 들어올리기가 어려움; 팔, 다리, 발 또는 발목에 힘이 없음; 손에 힘이 없거나 어색함; 말이 어눌함; 삼키기 어려움; 근육 경련; 팔, 어깨, 및 혀에 경련; 씹기 어려움; 호흡 곤란; 근육 마비; 시력의 부분적 또는 전체 손실; 복시; 신체 일부가 따끔거리거나 통증; 머리를 움직일 때 일어나는 전기 충격 느낌; 떨림; 불안정한 걸음걸이; 피로; 현기증; 기억 상실; 방향 감각 상실; 공간 관계를 잘못 이해함; 읽기나 쓰기가 어려움; 집중하거나 생각하기 어려움; 판단이나 결정을 내리기가 어려움; 익숙한 작업을 계획하거나 수행하기 어려움; 우울; 불안; 사회적 격리; 기분이 잘 변함; 과민함; 공격적임; 수면 습관이 바뀜; 방황; 치매; 자율 운동 손실; 자세와 균형에 장애가 있음; 근육 경직; 운동완서(bradykinesia); 안구 운동이 느리거나 비정상적임; 무의식적 저킹(jerking)이나 몸부림(무도병(chorea)); 무의식적, 지속적인 근 수축(긴장이상(dystonia)); 유연성 부족; 충동 조절의 부족; 및 식욕 변화를 포함한다. 건강 관리 전문가는 부분적으로는 대상체의 신경병성 질환의 가족력에 기반하여 진단할 수 있다. 건강 관리 전문가는 대상체가 의료시설(예, 전문 진료소나 병원)을 방문할 시에는 신경병성 질환이 있는 것으로 진단할 수 있다. 일부 구체예에서, 건강 관리 전문가는 대상체가 보조 치료 시설에 입원하는 동안은 대상체를 신경병성 질환이 있는 것으로 진단할 수 있다. 일반적으로, 의사는 하나 이상의 증상이 나타난 후에 대상체의 신경병성 질환을 진단한다.
본 발명은 대상체(예, 신경병성 질환의 하나 이상의 증상이 나타난 대상체 또는 신경병성 질환의 증상이 나타나지 않은 대상체(예, 미확진 및/또는 무증상 대상체))에서 신경병성 질환을 진단하는 추가의 방법을 제공한다. 또한, 본 발명은 예후 방법 및 대상체에 신경병성 질환을 치료하는 방법(예, 대상체에 신경병성 질환의 증상(예, 운동실조)의 발생 또는 진행의 속도를 감소시키는 방법)을 제공한다.
마커
(
Markers
)
본원에 기재된 마커 중 하나 이상의 임의의 조합은 본 원에 기재된 방법들 중 임의의 하나에서 사용될 수 있는데, 예를 들어, 대상체에 신경병성 질환을 진단하는 방법, 신경병성 질환이 발생될 위험(예, 위험 증가 또는 감소)이 있는 대상체를 확인하는 방법, 신경병성 질환이 있는 대상체에서 질환의 진행 속도를 예측하는 방법, 신경병성 질환의 치료를 위한 대상체를 선택하는 방법, 신경병성 질환이 있는 대상체에 대한 치료의 효능을 판단하는 방법, 또는 임상 연구 참여를 위한 대상체를 선택하는 방법에 사용될 수 있다.
건강한 대조군(건강한 대조군의 CD14+CD16- 또는 CD14+CD16+ 단핵구 또는 CSF)에 비하여 신경병성 질환이 있는 대상체의 단핵구(CD14+CD16- 또는 CD14+CD16+ 단핵구) 또는 CSF에서 증가된 마이크로RNA 마커가 표 1에 열거되어 있다.
| MiRNA | Mature miRNA sequence | Precursor miRNA sequence |
| hsa-miR-19b | gugcaaauccaugcaaaacuga (서열번호 1) ugugcaaauccaugcaaaacuga (서열번호 2) |
CACUGUUCUAUGGUUAGUUUUGCAGGUUUGCAUCCAGCUGUGUGAUAUUCUGCUGUGCAAAUCCAUGCAAAACUGACUGUGGUAGUG (서열번호 3) ACAUUGCUACUUACAAUUAGUUUUGCAGGUUUGCAUUUCAGCGUAUAUAUGUAUAUGUGGCUGUGCAAAUCCAUGCAAAACUGAUUGUGAUAAUGU (서열번호 4) |
| hsa-miR-106b | uaaagugcugacagugcagau (서열번호 5) | CCUGCCGGGGCUAAAGUGCUGACAGUGCAGAUAGUGGUCCUCUCCGUGCUACCGCACUGUGGGUACUUGCUGCUCCAGCAGG (EQ ID NO: 6) |
| hsa-miR-30b | uguaaacauccuacacucagcu (서열번호 7) | ACCAAGUUUCAGUUCAUGUAAACAUCCUACACUCAGCUGUAAUACAUGGAUUGGCUGGGAGGUGGAUGUUUACUUCAGCUGACUUGGA (서열번호 8) |
| hsa-miR-21 | uagcuuaucagacugauguuga (서열번호 9) | UGUCGGGUAGCUUAUCAGACUGAUGUUGACUGUUGAAUCUCAUGGCAACACCAGUCGAUGGGCUGUCUGACA (서열번호 10) |
| hsa-miR-142-5p | cauaaaguagaaagcacuacu (서열번호 11) | GACAGUGCAGUCACCCAUAAAGUAGAAAGCACUACUAACAGCACUGGAGGGUGUAGUGUUUCCUACUUUAUGGAUGAGUGUACUGUG (서열번호 12) |
| hsa-miR-27a | uucacaguggcuaaguuccgc (서열번호 12) | CUGAGGAGCAGGGCUUAGCUGCUUGUGAGCAGGGUCCACACCAAGUCGUGUUCACAGUGGCUAAGUUCCGCCCCCCAG (서열번호 13) |
| hsa-miR-16 | uagcagcacguaaauauuggcg (서열번호 14) uagcagcacguaaauauuggcg (서열번호 15) |
GUCAGCAGUGCCUUAGCAGCACGUAAAUAUUGGCGUUAAGAUUCUAAAAUUAUCUCCAGUAUUAACUGUGCUGCUGAAGUAAGGUUGAC (서열번호 16) GUUCCACUCUAGCAGCACGUAAAUAUUGGCGUAGUGAAAUAUAUAUUAAACACCAAUAUUACUGUGCUGCUUUAGUGUGAC (서열번호 17) |
| hsa-miR-374a | uuauaauacaaccugauaagug (서열번호 18) | UACAUCGGCCAUUAUAAUACAACCUGAUAAGUGUUAUAGCACUUAUCAGAUUGUAUUGUAAUUGUCUGUGUA (서열번호 19) |
| hsa-miR-374b | auauaauacaaccugcuaagug (서열번호 20) | ACUCGGAUGGAUAUAAUACAACCUGCUAAGUGUCCUAGCACUUAGCAGGUUGUAUUAUCAUUGUCCGUGUCU (서열번호 21) |
| hsa-miR-101 | uacaguacugugauaacugaa (서열번호 22) uacaguacugugauaacugaa (서열번호 23) |
UGCCCUGGCUCAGUUAUCACAGUGCUGAUGCUGUCUAUUCUAAAGGUACAGUACUGUGAUAACUGAAGGAUGGCA (서열번호 24) ACUGUCCUUUUUCGGUUAUCAUGGUACCGAUGCUGUAUAUCUGAAAGGUACAGUACUGUGAUAACUGAAGAAUGGUGGU (서열번호 25) |
| hsa-miR-340 | uuauaaagcaaugagacugauu (서열번호 26) | UUGUACCUGGUGUGAUUAUAAAGCAAUGAGACUGAUUGUCAUAUGUCGUUUGUGGGAUCCGUCUCAGUUACUUUAUAGCCAUACCUGGUAUCUUA (서열번호 27) |
| hsa-miR-30e | uguaaacauccuugacuggaag (서열번호 28) | GGGCAGUCUUUGCUACUGUAAACAUCCUUGACUGGAAGCUGUAAGGUGUUCAGAGGAGCUUUCAGUCGGAUGUUUACAGCGGCAGGCUGCCA (서열번호 29) |
| hsa-miR-29c | uagcaccauuugaaaucgguua (서열번호 30) | AUCUCUUACACAGGCUGACCGAUUUCUCCUGGUGUUCAGAGUCUGUUUUUGUCUAGCACCAUUUGAAAUCGGUUAUGAUGUAGGGGGA (SEQ ID NO: 31) |
| hsa-miR-29a | uagcaccaucugaaaucgguua (서열번호 32) | AUGACUGAUUUCUUUUGGUGUUCAGAGUCAAUAUAAUUUUCUAGCACCAUCUGAAAUCGGUUAU (서열번호 33) |
| hsa-miR-223 | ugucaguuugucaaauacccca (서열번호 34) | CCUGGCCUCCUGCAGUGCCACGCUCCGUGUAUUUGACAAGCUGAGUUGGACACUCCAUGUGGUAGAGUGUCAGUUUGUCAAAUACCCCAAGUGCGGCACAUGCUUACCAG (서열번호 35) |
| hsa-miR-26a | uucaaguaauccaggauaggcu (서열번호 36) uucaaguaauccaggauaggcu (서열번호 37) |
GUGGCCUCGUUCAAGUAAUCCAGGAUAGGCUGUGCAGGUCCCAAUGGGCCUAUUCUUGGUUACUUGCACGGGGACGC (서열번호 38) GGCUGUGGCUGGAUUCAAGUAAUCCAGGAUAGGCUGUUUCCAUCUGUGAGGCCUAUUCUUGAUUACUUGUUUCUGGAGGCAGCU (서열번호 39) |
| hsa-miR-26b | uucaaguaauucaggauaggu (서열번호 40) | CCGGGACCCAGUUCAAGUAAUUCAGGAUAGGUUGUGUGCUGUCCAGCCUGUUCUCCAUUACUUGGCUCGGGGACCGG (서열번호 41) |
| hsa-miR-24 | uggcucaguucagcaggaacag (서열번호 42) uggcucaguucagcaggaacag (서열번호 43) |
CUCCGGUGCCUACUGAGCUGAUAUCAGUUCUCAUUUUACACACUGGCUCAGUUCAGCAGGAACAGGAG (서열번호 44) CUCUGCCUCCCGUGCCUACUGAGCUGAAACACAGUUGGUUUGUGUACACUGGCUCAGUUCAGCAGGAACAGGG (서열번호 45) |
| hsa-miR-181a | aacauucaacgcugucggugagu (서열번호 46) aacauucaacgcugucggugagu (서열번호 47) |
UGAGUUUUGAGGUUGCUUCAGUGAACAUUCAACGCUGUCGGUGAGUUUGGAAUUAAAAUCAAAACCAUCGACCGUUGAUUGUACCCUAUGGCUAACCAUCAUCUACUCCA (서열번호 48) AGAAGGGCUAUCAGGCCAGCCUUCAGAGGACUCCAAGGAACAUUCAACGCUGUCGGUGAGUUUGGGAUUUGAAAAAACCACUGACCGUUGACUGUACCUUGGGGUCCUUA (서열번호 49) |
| hsa-miR-103 | agcagcauuguacagggcuauga (서열번호 50) agcagcauuguacagggcuauga (서열번호 51) ucauagcccuguacaaugcugcu (서열번호 52) ucauagcccuguacaaugcugcu (서열번호 53) |
UACUGCCCUCGGCUUCUUUACAGUGCUGCCUUGUUGCAUAUGGAUCAAGCAGCAUUGUACAGGGCUAUGAAGGCAUUG (서열번호 54) UUGUGCUUUCAGCUUCUUUACAGUGCUGCCUUGUAGCAUUCAGGUCAAGCAGCAUUGUACAGGGCUAUGAAAGAACCA (서열번호 55) UCAUAGCCCUGUACAAUGCUGCUUGAUCCAUAUGCAACAAGGCAGCACUGUAAAGAAGCCGA (서열번호 56) UCAUAGCCCUGUACAAUGCUGCUUGACCUGAAUGCUACAAGGCAGCACUGUAAAGAAGCUGA (서열번호 57) |
| hsa-miR-155 | uuaaugcuaaucgugauaggggu (서열번호 58) | CUGUUAAUGCUAAUCGUGAUAGGGGUUUUUGCCUCCAACUGACUCCUACAUAUUAGCAUUAACAG (서열번호 59) |
| hsa-miR-532-3p | caugccuugaguguaggaccgu (서열번호 60) | CGACUUGCUUUCUCUCCUCCAUGCCUUGAGUGUAGGACCGUUGGCAUCUUAAUUACCCUCCCACACCCAAGGCUUGCAAAAAAGCGAGCCU (서열번호 61) |
| hsa-miR-320c | aaaagcuggguugagagggu (서열번호 62) aaaagcuggguugagagggu (서열번호 63) |
UUUGCAUUAAAAAUGAGGCCUUCUCUUCCCAGUUCUUCCCAGAGUCAGGAAAAGCUGGGUUGAGAGGGUAGAAAAAAAAUGAUGUAGG (서열번호 64) CUUCUCUUUCCAGUUCUUCCCAGAAUUGGGAAAAGCUGGGUUGAGAGGGU (서열번호 65) |
| hsa-miR-27b | uucacaguggcuaaguucugc (서열번호 66) | ACCUCUCUAACAAGGUGCAGAGCUUAGCUGAUUGGUGAACAGUGAUUGGUUUCCGCUUUGUUCACAGUGGCUAAGUUCUGCACCUGAAGAGAAGGUG (서열번호 67) |
| hsa-miR-664 | uauucauuuauccccagccuaca (서열번호 68) | GAACAUUGAAACUGGCUAGGGAAAAUGAUUGGAUAGAAACUAUUAUUCUAUUCAUUUAUCCCCAGCCUACAAAAUGAAAAAA (서열번호 69) |
| hsa-miR-432-5p | ucuuggaguaggucauugggugg (서열번호 70) | UGACUCCUCCAGGUCUUGGAGUAGGUCAUUGGGUGGAUCCUCUAUUUCCUUACGUGGGCCACUGGAUGGCUCCUCCAUGUCUUGGAGUAGAUCA (서열번호 71) |
| hsa-miR-92a | uauugcacuugucccggccugu (서열번호 72) uauugcacuugucccggccugu (서열번호 73) |
CUUUCUACACAGGUUGGGAUCGGUUGCAAUGCUGUGUUUCUGUAUGGUAUUGCACUUGUCCCGGCCUGUUGAGUUUGG (서열번호 74) UCAUCCCUGGGUGGGGAUUUGUUGCAUUACUUGUGUUCUAUAUAAAGUAUUGCACUUGUCCCGGCCUGUGGAAGA (서열번호 75) |
| hsa-miR-99b | cacccguagaaccgaccuugcg (서열번호 76) | GGCACCCACCCGUAGAACCGACCUUGCGGGGCCUUCGCCGCACACAAGCUCGUGUCUGUGGGUCCGUGUC (서열번호 77) |
| hsa-miR-146a | ugagaacugaauuccauggguu (서열번호 78) | CCGAUGUGUAUCCUCAGCUUUGAGAACUGAAUUCCAUGGGUUGUGUCAGUGUCAGACCUCUGAAAUUCAGUUCUUCAGCUGGGAUAUCUCUGUCAUCGU (서열번호 79) |
| hsa-miR-150 | ucucccaacccuuguaccagug (서열번호 80) | CUCCCCAUGGCCCUGUCUCCCAACCCUUGUACCAGUGCUGGGCUCAGACCCUGGUACAGGCCUGGGGGACAGGGACCUGGGGAC (서열번호 81) |
| hsa-miR-328 | cuggcccucucugcccuuccgu (서열번호 82) | UGGAGUGGGGGGGCAGGAGGGGCUCAGGGAGAAAGUGCAUACAGCCCCUGGCCCUCUCUGCCCUUCCGUCCCCUG (서열번호 83) |
| hsa-miR-532-3p | ccucccacacccaaggcuugca (서열번호 84) | CGACUUGCUUUCUCUCCUCCAUGCCUUGAGUGUAGGACCGUUGGCAUCUUAAUUACCCUCCCACACCCAAGGCUUGCAAAAAAGCGAGCCU (서열번호 85) |
| hsa-miR-1260 | aucccaccucugccacca (서열번호 86) | ACCUUUCCAGCUCAUCCCACCUCUGCCACCAAAACACUCAUCGCGGGGUCAGAGGGAGUGCCAAAAAAGGUAA (서열번호 87) |
| hsa-miR-423 | ugaggggcagagagcgagacuuu (서열번호 88) | AUAAAGGAAGUUAGGCUGAGGGGCAGAGAGCGAGACUUUUCUAUUUUCCAAAAGCUCGGUCUGAGGCCCCUCAGUCUUGCUUCCUAACCCGCGC (서열번호 89) |
| hsa-miR-361-5p | uuaucagaaucuccagggguac (서열번호 90) | GGAGCUUAUCAGAAUCUCCAGGGGUACUUUAUAAUUUCAAAAAGUCCCCCAGGUGUGAUUCUGAUUUGCUUC (서열번호 91) |
| hsa-miR-93 | caaagugcuguucgugcagguag (서열번호 92) | CUGGGGGCUCCAAAGUGCUGUUCGUGCAGGUAGUGUGAUUACCCAACCUACUGCUGAGCUAGCACUUCCCGAGCCCCCGG (서열번호 93) |
| hsa-miR-221 | agcuacauugucugcuggguuuc (서열번호 94) | UGAACAUCCAGGUCUGGGGCAUGAACCUGGCAUACAAUGUAGAUUUCUGUGUUCGUUAGGCAACAGCUACAUUGUCUGCUGGGUUUCAGGCUACCUGGAAACAUGUUCUC (서열번호 95) |
| hsa-miR-20a | uaaagugcuuauagugcagguag (서열번호 96) | GUAGCACUAAAGUGCUUAUAGUGCAGGUAGUGUUUAGUUAUCUACUGCAUUAUGAGCACUUAAAGUACUGC (서열번호 97) |
| hsa-miR-30c | uguaaacauccuacacucucagc (서열번호 98) uguaaacauccuacacucucagc (서열번호 99) |
ACCAUGCUGUAGUGUGUGUAAACAUCCUACACUCUCAGCUGUGAGCUCAAGGUGGCUGGGAGAGGGUUGUUUACUCCUUCUGCCAUGGA (서열번호 100) AGAUACUGUAAACAUCCUACACUCUCAGCUGUGGAAAGUAAGAAAGCUGGGAGAAGGCUGUUUACUCUUUCU (서열번호 101) |
| hsa-miR-15b | uagcagcacaucaugguuuaca (서열번호 102) | UUGAGGCCUUAAAGUACUGUAGCAGCACAUCAUGGUUUACAUGCUACAGUCAAGAUGCGAAUCAUUAUUUGCUGCUCUAGAAAUUUAAGGAAAUUCAU (서열번호 103) |
| hsa-let-7g | ugagguaguaguuuguacaguu (서열번호 104) | AGGCUGAGGUAGUAGUUUGUACAGUUUGAGGGUCUAUGAUACCACCCGGUACAGGAGAUAACUGUACAGGCCACUGCCUUGCCA (서열번호 105) |
| hsa-let-7b | ugagguaguagguugugugguu (서열번호 106) | CGGGGUGAGGUAGUAGGUUGUGUGGUUUCAGGGCAGUGAUGUUGCCCCUCGGAAGAUAACUAUACAACCUACUGCCUUCCCUG (서열번호 107) |
| hsa-let-7a | ugagguaguagguuguauaguu (서열번호 108) ugagguaguagguuguauaguu (서열번호 109) ugagguaguagguuguauaguu (서열번호 110) |
UGGGAUGAGGUAGUAGGUUGUAUAGUUUUAGGGUCACACCCACCACUGGGAGAUAACUAUACAAUCUACUGUCUUUCCUA (서열번호 111) AGGUUGAGGUAGUAGGUUGUAUAGUUUAGAAUUACAUCAAGGGAGAUAACUGUACAGCCUCCUAGCUUUCCU (서열번호 112) GGGUGAGGUAGUAGGUUGUAUAGUUUGGGGCUCUGCCCUGCUAUGGGAUAACUAUACAAUCUACUGUCUUUCCU (서열번호 113) |
| hsa-miR-574-3p | ugagugugugugugugagugugu (서열번호 114) |
GGGACCUGCGUGGGUGCGGGCGUGUGAGUGUGUGUGUGUGAGUGUGUGUCGCUCCGGGUCCAC GCUCAUGCACACACCCACACGCCCACACUCAGG (서열번호 115) |
| hsa-miR-19a | ugugcaaaucuaugcaaaacuga (서열번호 116) | GCAGUCCUCUGUUAGUUUUGCAUAGUUGCACUACAAGAAGAAUGUAGUUGUGCAAAUCUAUGCAAAACUGAUGGUGGCCUGC (서열번호 117) |
| hsa-let-7f | ugagguaguagauuguauaguu (서열번호 118) ugagguaguagauuguauaguu (서열번호 119) |
UCAGAGUGAGGUAGUAGAUUGUAUAGUUGUGGGGUAGUGAUUUUACCCUGUUCAGGAGAUAACUAUACAAUCUAUUGCCUUCCCUGA (서열번호 120) UGUGGGAUGAGGUAGUAGAUUGUAUAGUUUUAGGGUCAUACCCCAUCUUGGAGAUAACUAUACAGUCUACUGUCUUUCCCACG (서열번호 121) |
| hsa-miR-140-5p | cagugguuuuacccuaugguag (서열번호 122) | UGUGUCUCUCUCUGUGUCCUGCCAGUGGUUUUACCCUAUGGUAGGUUACGUCAUGCUGUUCUACCACAGGGUAGAACCACGGACAGGAUACCGGGGCACC (서열번호 123) |
| hsa-miR-30a | uguaaacauccucgacuggaag (서열번호 124) | GCGACUGUAAACAUCCUCGACUGGAAGCUGUGAAGCCACAGAUGGGCUUUCAGUCGGAUGUUUGCAGCUGC (서열번호 125) |
| hsa-miR-190 | ugauauguuugauauauuaggu (서열번호 126) | UGCAGGCCUCUGUGUGAUAUGUUUGAUAUAUUAGGUUGUUAUUUAAUCCAACUAUAUAUCAAACAUAUUCCUACAGUGUCUUGCC (서열번호 127) |
| hsa-miR-500 | uaauccuugcuaccugggugaga (서열번호 128) aauccuugcuaccugggu (서열번호 129) |
GCUCCCCCUCUCUAAUCCUUGCUACCUGGGUGAGAGUGCUGUCUGAAUGCAAUGCACCUGGGCAAGGAUUCUGAGAGCGAGAGC (서열번호 130) CCCCCUCUCUAAUCCUUGCUACCUGGGUGAGAGUGCUUUCUGAAUGCAGUGCACCCAGGCAAGGAUUCUGCAAGGGGGA (서열번호 131) |
| hsa-let-7i | ugagguaguaguuugugcuguu (서열번호 132) | CUGGCUGAGGUAGUAGUUUGUGCUGUUGGUCGGGUUGUGACAUUGCCCGCUGUGGAGAUAACUGCGCAAGCUACUGCCUUGCUA (서열번호 133) |
| hsa-miR-23a | aucacauugccagggauuucc (서열번호 134) | GGCCGGCUGGGGUUCCUGGGGAUGGGAUUUGCUUCCUGUCACAAAUCACAUUGCCAGGGAUUUCCAACCGACC (서열번호 135) |
| hsa-miR-142-3p | cauaaaguagaaagcacuacu (서열번호 136) | GACAGUGCAGUCACCCAUAAAGUAGAAAGCACUACUAACAGCACUGGAGGGUGUAGUGUUUCC UACUUUAUGGAUGAGUGUACUGUG (서열번호 137) |
| hsa-miR-15a | uagcagcacauaaugguuugug (서열번호 138) | CCUUGGAGUAAAGUAGCAGCACAUAAUGGUUUGUGGAUUUUGAAAAGGUGCAGGCCAUAUUGUGCUGCCUCAAAAAUACAAGG (서열번호 139) |
| hsa-miR-191 | caacggaaucccaaaagcagcug (서열번호 140) | CGGCUGGACAGCGGGCAACGGAAUCCCAAAAGCAGCUGUUGUCUCCAGAGCAUUCCAGCUGCGCUUGGAUUUCGUCCCCUGCUCUCCUGCCU (서열번호 141) |
| hsa-miR-720 | ucucgcuggggccucca (서열번호 142) | CCGGAUCUCACACGGUGGUGUUAAUAUCUCGCUGGGGCCUCCAAAAUGUUGUGCCCAGGGGUGUUAGAGAAAACACCACACUUUGAGAUGAAUUAAGAGUCCUUUAUUAG (서열번호 143) |
| hsa-miR-320a | aaaagcuggguugagagggcga (서열번호 144) | GCUUCGCUCCCCUCCGCCUUCUCUUCCCGGUUCUUCCCGGAGUCGGGAAAAGCUGGGUUGAGAGGGCGAAAAAGGAUGAGGU (서열번호 145) |
| hsa-miR-520g | acaaagugcuucccuuuagagugu (서열번호 146) | UCCCAUGCUGUGACCCUCUAGAGGAAGCACUUUCUGUUUGUUGUCUGAGAAAAAACAAAGUGCUUCCCUUUAGAGUGUUACCGUUUGGGA (서열번호 147) |
| hsa-miR-204 | uucccuuugucauccuaugccu (서열번호 148) | GGCUACAGUCUUUCUUCAUGUGACUCGUGGACUUCCCUUUGUCAUCCUAUGCCUGAGAAUAUAUGAAGGAGGCUGGGAAGGCAAAGGGACGUUCAAUUGUCAUCACUGGC (서열번호 149) |
| hsa-miR-708 | aaggagcuuacaaucuagcuggg (서열번호 252) | AACUGCCCUCAAGGAGCUUACAAUCUAGCUGGGGGUAAAUGACUUGCACAUGAACACAACUAGACUGUGAGCUUCUAGAGGGCAGGGA (서열번호 253) |
| hsa-miR-197 | uucaccaccuucuccacccagc (서열번호 254) | GGCUGUGCCGGGUAGAGAGGGCAGUGGGAGGUAAGAGCUCUUCACCCUUCACCACCUUCUCCACCCAGCAUGGCC (서열번호 255) |
| hsa-miR-1274a | GUCCCUGUUCAGGCGCCA (서열번호 256) | |
| hsa-miR-1274b | UCCCUGUUCGGGCGCCA (서열번호 257) | |
건강한 대조군(건강한 대조군의 CD14+CD16- 또는 CD14+CD16+ 단핵구) 비하여 신경병성 질환이 있는 대상체의 단핵구 (CD14+CD16- 또는 CD14+CD16+ 단핵구) 에서 감소된 마이크로RNA 마커가 표 2에 열거되어 있다.
| miRNA | Mature miRNA sequence | Precursor miRNA sequence |
| hsa-miR-518f | gaaagcgcuucucuuuagagg (서열번호 150) | UCUCAUGCUGUGACCCUCUAGAGGGAAGCACUUUCUCUUGUCUAAAAGAAAAGAAAGCGCUUCUCUUUAGAGGAUUACUCUUUGAGA (서열번호 151) |
| hsa-miR-206 | uggaauguaaggaagugugugg (서열번호 152) | UGCUUCCCGAGGCCACAUGCUUCUUUAUAUCCCCAUAUGGAUUACUUUGCUAUGGAAUGUAAGGAAGUGUGUGGUUUCGGCAAGUG (서열번호 153) |
| hsa-miR-204 | uucccuuugucauccuaugccu (서열번호 154) | GGCUACAGUCUUUCUUCAUGUGACUCGUGGACUUCCCUUUGUCAUCCUAUGCCUGAGAAUAUAUGAAGGAGGCUGGGAAGGCAAAGGGACGUUCAAUUGUCAUCACUGGC (서열번호 155) |
| hsa-miR-137 | uuauugcuuaagaauacgcguag (서열번호 156) | GGUCCUCUGACUCUCUUCGGUGACGGGUAUUCUUGGGUGGAUAAUACGGAUUACGUUGUUAUUGCUUAAGAAUACGCGUAGUCGAGGAGAGUACCAGCGGCA (서열번호 157) |
| hsa-miR-453 | AGGUUGUCCGUGGUGAGUUCGCA (서열번호 257) | UGGUACUCGGAGGGAGGUUGUCCGUGGUGAGUUCGCAUUAUUUAAUGAUGCCCAAUACACGGUCGACCUCUUUUCGGUAUCA (서열번호 258) |
| hsa-miR-603 | cacacacugcaauuacuuuugc (서열번호 158) | GAUUGAUGCUGUUGGUUUGGUGCAAAAGUAAUUGCAGUGCUUCCCAUUUAAAAGUAAUGGCACACACUGCAAUUACUUUUGCUCCAACUUAAUACUU (서열번호 159) |
| hsa-miR-1297 | uucaaguaauucaggug (서열번호 160) | UGUUUAUCUCUAGGGUUGAUCUAUUAGAAUUACUUAUCUGAGCCAAAGUAAUUCAAGUAAUUCAGGUGUAGUGAAAC (서열번호 161) |
| hsa-miR-192 | cugaccuaugaauugacagcc (서열번호 162) | GCCGAGACCGAGUGCACAGGGCUCUGACCUAUGAAUUGACAGCCAGUGCUCUCGUCUCCCCUCUGGCUGCCAAUUCCAUAGGUCACAGGUAUGUUCGCCUCAAUGCCAGC (서열번호 163) |
| hsa-miR-526a | cucuagagggaagcacuuucug (서열번호 164) cucuagagggaagcacuuucug (서열번호 165) |
CUCAGGCUGUGACCCUCUAGAGGGAAGCACUUUCUGUUGCUUGAAAGAAGAGAAAGCGCUUCCUUUUAGAGGAUUACUCUUUGAG (서열번호 166) GUGACCCUCUAGAGGGAAGCACUUUCUGUUGAAAGAAAAGAACAUGCAUCCUUUCAGAGGGUUAC (서열번호 167) |
| hsa-miR-615-5p | ggggguccccggugcucggauc (서열번호 168) | CUCGGGAGGGGCGGGAGGGGGGUCCCCGGUGCUCGGAUCUCGAGGGUGCUUAUUGUUCGGUCCGAGCCUGGGUCUCCCUCUUCCCCCCAACCCCCC (서열번호 169) |
| hsa-miR-655 | auaauacaugguuaaccucuuu (서열번호 170) | AACUAUGCAAGGAUAUUUGAGGAGAGGUUAUCCGUGUUAUGUUCGCUUCAUUCAUCAUGAAUAAUACAUGGUUAACCUCUUUUUGAAUAUCAGACUC (서열번호 171) |
| hsa-miR-450b-5p | uuuugcaauauguuccugaaua (서열번호 172) | GCAGAAUUAUUUUUGCAAUAUGUUCCUGAAUAUGUAAUAUAAGUGUAUUGGGAUCAUUUUGCAUCCAUAGUUUUGUAU (서열번호 173) |
| hsa-miR-548b-3p | aaaaguaauugugguuuuggcc (서열번호 174) | CAGACUAUAUAUUUAGGUUGGCGCAAAAGUAAUUGUGGUUUUGGCCUUUAUUUUCAAUGGCAAGAACCUCAGUUGCUUUUGUGCCAACCUAAUACUU (서열번호 175) |
| hsa-miR-584 | uuaugguuugccugggacugag (서열번호 176) | UAGGGUGACCAGCCAUUAUGGUUUGCCUGGGACUGAGGAAUUUGCUGGGAUAUGUCAGUUCCAGGCCAACCAGGCUGGUUGGUCUCCCUGAAGCAAC (서열번호 177) |
| hsa-miR-548f | aaaaacuguaauuacuuuu (서열번호 178) aaaaacuguaauuacuuuu (서열번호 179) aaaaacuguaauuacuuuu (서열번호 180) aaaaacuguaauuacuuuu (서열번호 181) aaaaacuguaauuacuuuu (서열번호 182) |
AUUAGGUUGGUGCAAAAGUAAUCACAGUUUUUGACAUUACUUUCAAAGACAAAAACUGUAAUUACUUUUGGACCAACCUAAUAG (서열번호 183) UAAUAACUAUUAGGUUGGUGCGAACAUAAUUGCAGUUUUUAUCAUUACUUUUAAUGGCAAAAACUGUAAUUACUUUUGCACCAACCUAAUAUUUUAGU (서열번호 184) AUUAGGUUGGUGCAAACCUAAUUGCAAUUUUUGCAGUUUUUUUAAGUAAUUGCAAAAACUGUAAUUACUUUUGCACCAACCUAAUAC (서열번호 185) GAGUUCUAACGUAUUAGGUUGGUGCAAAAGUAAUAGUGGUUUUUGCCAUUAAAAGUAAUGACAAAAACUGUAAUUACUUUUGGAACAAUAUUAAUAGAAUUUCAG (서열번호 186) UAUUAGGUUGCUGCAAAAGUAAUCAUGUUUUUUUCCAUUGUAAGUAAUGGGAAAAACUGUAAUUACUUUUGUACCAACCUAAUAGC (서열번호 187) |
| hsa-miR-300 | uauacaagggcagacucucucu (서열번호 188) | UGCUACUUGAAGAGAGGUAAUCCUUCACGCAUUUGCUUUACUUGCAAUGAUUAUACAAGGGCAGACUCUCUCUGGGGAGCAAA (서열번호 189) |
| hsa-miR-302c |
uaagugcuuccauguuucagugg (서열번호 190) | CCUUUGCUUUAACAUGGGGGUACCUGCUGUGUGAAACAAAAGUAAGUGCUUCCAUGUUUCAGUGGAGG (서열번호 191) |
| hsa-miR-328 | cuggcccucucugcccuuccgu (서열번호 82) | UGGAGUGGGGGGGCAGGAGGGGCUCAGGGAGAAAGUGCAUACAGCCCCUGGCCCUCUCUGCCCUUCCGUCCCCUG (서열번호 83) |
| hsa-miR-421 | aucaacagacauuaauugggcgc (서열번호 192) | GCACAUUGUAGGCCUCAUUAAAUGUUUGUUGAAUGAAAAAAUGAAUCAUCAACAGACAUUAAUUGGGCGCCUGCUCUGUGAUCUC (서열번호 193) |
| hsa-miR-580 | uugagaaugaugaaucauuagg (서열번호 194) | AUAAAAUUUCCAAUUGGAACCUAAUGAUUCAUCAGACUCAGAUAUUUAAGUUAACAGUAUUUGAGAAUGAUGAAUCAUUAGGUUCCGGUCAGAAAUU (서열번호 195) |
| hsa-miR-651 | uuuaggauaagcuugacuuuug (서열번호 196) | AAUCUAUCACUGCUUUUUAGGAUAAGCUUGACUUUUGUUCAAAUAAAAAUGCAAAAGGAAAGUGUAUCCUAAAAGGCAAUGACAGUUUAAUGUGUUU (서열번호 197) |
| hsa-miR-379 | ugguagacuauggaacguagg (서열번호 198) | AGAGAUGGUAGACUAUGGAACGUAGGCGUUAUGAUUUCUGACCUAUGUAACAUGGUCCACUAACUCU (서열번호 199) |
| hsa-miR-193a-3p | ugggucuuugcgggcgagauga (서열번호 200) | CGAGGAUGGGAGCUGAGGGCUGGGUCUUUGCGGGCGAGAUGAGGGUGUCGGAUCAACUGGCCUACAAAGUCCCAGUUCUCGGCCCCCG (서열번호 201) |
| hsa-miR-515-3p | uucuccaaaagaaagcacuuucug (서열번호 202) uucuccaaaagaaagcacuuucug (서열번호 203) |
UCUCAUGCAGUCAUUCUCCAAAAGAAAGCACUUUCUGUUGUCUGAAAGCAGAGUGCCUUCUUUUGGAGCGUUACUGUUUGAGA (서열번호 204) UCUCAUGCAGUCAUUCUCCAAAAGAAAGCACUUUCUGUUGUCUGAAAGCAGAGUGCCUUCUUUUGGAGCGUUACUGUUUGAGA (서열번호 205) |
| hsa-miR-598 | uacgucaucguugucaucguca (서열번호 206) | GCUUGAUGAUGCUGCUGAUGCUGGCGGUGAUCCCGAUGGUGUGAGCUGGAAAUGGGGUGCUACGUCAUCGUUGUCAUCGUCAUCAUCAUCAUCCGAG (서열번호 207) |
| hsa-miR-513a-5p | uucacagggaggugucau (서열번호 208) uucacagggaggugucau (서열번호 209) |
GGGAUGCCACAUUCAGCCAUUCAGCGUACAGUGCCUUUCACAGGGAGGUGUCAUUUAUGUGAACUAAAAUAUAAAUUUCACCUUUCUGAGAAGGGUAAUGUACAGCAUGCACUGCAUAUGUGGUGUCCC (서열번호 210) GGAUGCCACAUUCAGCCAUUCAGUGUGCAGUGCCUUUCACAGGGAGGUGUCAUUUAUGUGAACUAAAAUAUAAAUUUCACCUUUCUGAGAAGGGUAAUGUACAGCAUGCACUGCAUAUGUGGUGUCC (서열번호 211) |
| hsa-miR-640 | augauccaggaaccugccucu (서열번호 212) | GUGACCCUGGGCAAGUUCCUGAAGAUCAGACACAUCAGAUCCCUUAUCUGUAAAAUGGGCAUGAUCCAGGAACCUGCCUCUACGGUUGCCUUGGGG (서열번호 213) |
| hsa-miR-548g | aaaacuguaauuacuuuuguac (서열번호 214) | AGUUAUUAGAUUAGUGCAAAAGUAAUUGCAGUUUUUGCAUUACGUUCUAUGGCAAAACUGUAAUUACUUUUGUACCAACAUAAUACUUC (서열번호 215) |
| hsa-miR-1206 | uguucauguagauguuuaagc (서열번호 216) | CAGUGUUCAUGUAGAUGUUUAAGCUCUUGCAGUAGGUUUUUGCAAGCUAGUGAACGCUG (서열번호 217) |
| hsa-miR-383 | agaucagaaggugauuguggcu (서열번호 218) | CUCCUCAGAUCAGAAGGUGAUUGUGGCUUUGGGUGGAUAUUAAUCAGCCACAGCACUGCCUGGUCAGAAAGAG (서열번호 219) |
| hsa-miR-649 | aaaccuguguuguucaagaguc (서열번호 220) | GGCCUAGCCAAAUACUGUAUUUUUGAUCGACAUUUGGUUGAAAAAUAUCUAUGUAUUAGUAAACCUGUGUUGUUCAAGAGUCCACUGUGUUUUGCUG (서열번호 221) |
| hsa-miR-592 | uugugucaauaugcgaugaugu (서열번호 222) | UAUUAUGCCAUGACAUUGUGUCAAUAUGCGAUGAUGUGUUGUGAUGGCACAGCGUCAUCACGUGGUGACGCAACAUCAUGACGUAAGACGUCACAAC (서열번호 223) |
| hsa-miR-2054 | cuguaauauaaauuuaauuuauu (서열번호 224) | CUGUAAUAUAAAUUUAAUUUAUUCUCUAUCAUUAAAAAAUGUAUUACAG (서열번호 225) |
| hsa-miR-450a | uuuugcgauguguuccuaauau (서열번호 226) uuuugcgauguguuccuaauau (서열번호 227) |
AAACGAUACUAAACUGUUUUUGCGAUGUGUUCCUAAUAUGCACUAUAAAUAUAUUGGGAACAUUUUGCAUGUAUAGUUUUGUAUCAAUAUA (서열번호 228) CCAAAGAAAGAUGCUAAACUAUUUUUGCGAUGUGUUCCUAAUAUGUAAUAUAAAUGUAUUGGGGACAUUUUGCAUUCAUAGUUUUGUAUCAAUAAUAUGG (서열번호 229) |
| hsa-miR-362-3p | aauccuuggaaccuaggugugagu (서열번호 230) | CUUGAAUCCUUGGAACCUAGGUGUGAGUGCUAUUUCAGUGCAACACACCUAUUCAAGGAUUCAAA (서열번호 231) |
| hsa-miR-193a-3p | ugggucuuugcgggcgagauga (서열번호 232) | CGAGGAUGGGAGCUGAGGGCUGGGUCUUUGCGGGCGAGAUGAGGGUGUCGGAUCAACUGGCCUACAAAGUCCCAGUUCUCGGCCCCCG (서열번호 233) |
| hsa-miR-566 |
gggcgccugugaucccaac (서열번호 234) | GCUAGGCGUGGUGGCGGGCGCCUGUGAUCCCAACUACUCAGGAGGCUGGGGCAGCAGAAUCGCUUGAACCCGGGAGGCGAAGGUUGCAGUGAGC (서열번호 235) |
| hsa-miR-142-3p | cauaaaguagaaagcacuacu (서열번호 236) | GACAGUGCAGUCACCCAUAAAGUAGAAAGCACUACUAACAGCACUGGAGGGUGUAGUGUUUCCUACUUUAUGGAUGAGUGUACUGUG (서열번호 237) |
| hsa-miR-15a | uagcagcacauaaugguuugug (서열번호 238) | CCUUGGAGUAAAGUAGCAGCACAUAAUGGUUUGUGGAUUUUGAAAAGGUGCAGGCCAUAUUGUGCUGCCUCAAAAAUACAAGG (서열번호 239) |
| hsa-miR-1537 | aaaaccgucuaguuacaguugu (서열번호 240) | ACAGCUGUAAUUAGUCAGUUUUCUGUCCUGUCCACACAGAAAACCGUCUAGUUACAGUUGU (서열번호 241) |
| hsa-miR-148b | ucagugcaucacagaacuuugu (서열번호 242) | CAAGCACGAUUAGCAUUUGAGGUGAAGUUCUGUUAUACACUCAGGCUGUGGCUCUCUGAAAGUCAGUGCAUCACAGAACUUUGUCUCGAAAGCUUUCUA (서열번호 243) |
| hsa-miR-494 | ugaaacauacacgggaaaccuc (서열번호 244) | GAUACUCGAAGGAGAGGUUGUCCGUGUUGUCUUCUCUUUAUUUAUGAUGAAACAUACACGGGAAACCUCUUUUUUAGUAUC (서열번호 245) |
| hsa-miR-369-3p | agaucgaccguguuauauucgc (서열번호 246) | UUGAAGGGAGAUCGACCGUGUUAUAUUCGCUUUAUUGACUUCGAAUAAUACAUGGUUGAUCUUUUCUCAG (서열번호 247) |
| hsa-miR-10a | uacccuguagauccgaauuugug (서열번호 248) | GAUCUGUCUGUCUUCUGUAUAUACCCUGUAGAUCCGAAUUUGUGUAAGGAAUUUUGUGGUCACAAAUUCGUAUCUAGGGGAAUAUGUAGUUGACAUAAACACUCCGCUCU (서열번호 249) |
| hsa-miR-30d | uguaaacauccccgacuggaag (서열번호 250) | GUUGUUGUAAACAUCCCCGACUGGAAGCUGUAAGACACAGCUAAGCUUUCAGUCAGAUGUUUGCUGCUAC (서열번호 251) |
| hsa-miR-660 | uacccauugcauaucggaguug (서열번호 260) accuccugugugcauggauua (서열번호 261) |
CUGCUCCUUCUCCCAUACCCAUUGCAUAUCGGAGUUGUGAAUUCUCAAAACACCUCCUGUGUGCAUGGAUUACAGGAGGGUGAGCCUUGUCAUCGUG (서열번호 259) |
건강한 대조군(건강한 대조군의 CD14+CD16- 또는 CD14+CD16+ 단핵구, 또는 CSF)에 비하여 ALS 질환이 있는 대상체의 단핵구(CD14+CD16- 또는 CD14+CD16+ 단핵구) 또는 CSF에서 증가된 마이크로RNA 마커가 표 3에 열거되어 있다.
| hsa-miR-19b | hsa-miR-26b | hsa-let-7a |
| hsa-miR-106b | hsa-miR-24 | hsa-miR-574-3p |
| hsa-miR-30b | hsa-miR-181a | hsa-miR-19a |
| hsa-miR-21 | hsa-miR-103 | hsa-let-7f |
| hsa-miR-142-5p | hsa-miR-155 | hsa-miR-140-5p |
| hsa-miR-27a | hsa-miR-532-3p | hsa-miR-30a |
| hsa-miR-16 | hsa-miR-1260 | hsa-miR-190 |
| hsa-miR-374a | hsa-miR-423 | hsa-miR-500 |
| hsa-miR-374b | hsa-miR-361-5p | hsa-let-7i |
| hsa-miR-101 | hsa-miR-93 | hsa-miR-23a |
| hsa-miR-340 | hsa-miR-221 | hsa-miR-142-3p |
| hsa-miR-30e | hsa-miR-20a | hsa-miR-15a |
| hsa-miR-29c | hsa-miR-30c | hsa-let-7b |
| hsa-miR-29a | hsa-miR-15b | hsa-miR-26a |
| hsa-miR-223 | hsa-let-7g | |
건강한 대조군(건강한 대조군의 CD14+CD16- 또는 CD14+CD16+ 단핵구) 비하여 ALS 질환이 있는 대상체의 단핵구(CD14+CD16- 또는 CD14+CD16+ 단핵구)에서 감소된 마이크로RNA 마커가 표 4에 열거되어 있다.
| hsa-miR-518f | hsa-miR-655 | hsa-miR-421 | hsa-miR-383 |
| hsa-miR-206 | hsa-miR-450b-5p | hsa-miR-651 | hsa-miR-649 |
| hsa-miR-204 | hsa-miR-548b-3p | hsa-miR-379 | hsa-miR-592 |
| hsa-miR-137 | hsa-miR-584 | hsa-miR-193a-3p | hsa-miR-2054 |
| hsa-miR-453 | hsa-miR-548f | hsa-miR-515-3p | hsa-miR-566 |
| hsa-miR-603 | hsa-miR-300 | hsa-miR-598 | hsa-miR-494 |
| hsa-miR-1297 | hsa-miR-302c | hsa-miR-513a-5p | hsa-miR-142-3p |
| hsa-miR-192 | hsa-miR-328 | hsa-miR-640 | hsa-miR-1206 |
| hsa-miR-526a | hsa-miR-421 | hsa-miR-548g | hsa-miR-580 |
| hsa-miR-615-5p | |||
| hsa-miR-660 |
건강한 대조군의 CD14+CD16- 단핵구에 비하여 ALS 환자의 CD14+CD16- 단핵구에서 증가된 마이크로RNA 마커가 표 5에 열거되어 있다.
| hsa-miR-1260 | hsa-let-7g | hsa-miR-26a | hsa-miR-500 |
| hsa-miR-30a | hsa-let-7b | hsa-miR-16 | hsa-miR-150 |
| hsa-miR-423 | hsa-let-7a | hsa-miR-374b | hsa-miR-30e |
| hsa-miR-361-5p | hsa-miR-574-3p | hsa-miR-140-5p | hsa-miR-29c |
| hsa-miR-93 | hsa-miR-26b | hsa-miR-101 | hsa-miR-29a |
| hsa-miR-103 | hsa-miR-532-3p | hsa-miR-142-5p | hsa-miR-223 |
| hsa-miR-24 | hsa-miR-19a | hsa-miR-374a | hsa-mIR-423 |
| hsa-miR-221 | hsa-let-7f | hsa-miR-340 | hsa-miR-1260 |
| hsa-miR-20a | hsa-miR-27a | hsa-miR-21 | hsa-miR-30a |
| hsa-miR-30c | hsa-miR-106b | hsa-miR-155 | hsa-miR-30b |
| hsa-miR-181a | hsa-miR-19b | hsa-miR-146a | hsa-miR-190 |
| hsa-miR-15b | |||
건강한 대조군의 CD14+CD16- 단핵구에 비하여 ALS 환자의 CD14+CD16- 단핵구에서 감소된 마이크로RNA가 표 6에 열거되어 있다.
| hsa-miR-328 | hsa-miR-513a-5p | hsa-miR-302c | hsa-miR-453 |
| hsa-miR-651 | hsa-miR-640 | hsa-miR-2054 | hsa-miR-204 |
| hsa-miR-379 | hsa-miR-548g | hsa-miR-584 | hsa-miR-518f |
| hsa-miR-300 | hsa-miR-1206 | hsa-miR-655 | hsa-miR-206 |
| hsa-miR-548f | hsa-miR-450b-5p | hsa-miR-421 | hsa-miR-192 |
| hsa-miR-193a-3p | hsa-miR-548b-3p | hsa-miR-615-5p | hsa-miR-566 |
| hsa-miR-137 | hsa-miR-383 | hsa-miR-526a | hsa-miR-598 |
| hsa-miR-580 | hsa-miR-649 | hsa-miR-603 | |
| hsa-miR-515-3p | hsa-miR-592 | hsa-miR-1297 | |
| hsa-miR-660 | |||
건강한 대조군과 MS 대상체의 CD14+CD16- 단핵구에 비하여 ALS 환자의 CD14+CD16- 단핵구에서 독특하게 증가된 마이크로RNA 마커가 표 7에 열거되어 있다.
| hsa-miR-19b | hsa-miR-16 | hsa-miR-29c | hsa-miR-181a |
| hsa-miR-106b | hsa-miR-374a | hsa-miR-29a | hsa-miR-103 |
| hsa-miR-30b | hsa-miR-374b | hsa-miR-223 | hsa-miR-155 |
| hsa-miR-21 | hsa-miR-101 | hsa-miR-26a | hsa-miR-532-3p |
| hsa-miR-142-5p | hsa-miR-340 | hsa-miR-26b | hsa-miR-24 |
| hsa-miR-27a | hsa-miR-30e | ||
건강한 대조군과 MS 대상체의 CD14+CD16- 단핵구에 비하여 ALS 환자의 CD14+CD16- 단핵구에서 독특하게 감소된 마이크로RNA 마커가 표 8에 열거되어 있다.
| hsa-miR-518f | hsa-miR-603 | hsa-miR-655 | hsa-miR-300 |
| hsa-miR-206 | hsa-miR-1297 | hsa-miR-450b-5p | hsa-miR-302c |
| hsa-miR-204 | hsa-miR-192 | hsa-miR-548b-3p | hsa-miR-328 |
| hsa-miR-137 | hsa-miR-526a | hsa-miR-584 | hsa-miR-421 |
| hsa-miR-453 | hsa-miR-615-5p | hsa-miR-548f | hsa-miR-580 |
건강한 대조군의 CD14+CD16+ 단핵구에 비하여 ALS 환자의 CD14+CD16+ 단핵구에서 증가된 마이크로RNA 마커가 표 9에 열거되어 있다.
| hsa-miR-708 | hsa-miR-24 | hsa-miR-26a | hsa-miR-21 |
| hsa-miR-142-5p | hsa-miR-103 | hsa-miR-30b | hsa-miR-142-3p |
| hsa-miR-15b | hsa-miR-23a | hsa-miR-16 | hsa-miR-340 |
| hsa-miR-223 | hsa-miR-29a | hsa-miR-15a | hsa-let-7i |
건강한 대조군의 CD14+CD16+ 단핵구에 비하여 ALS 환자의 CD14+CD16+ 단핵구에서 감소된 마이크로RNA 마커가 표 10에 열거되어 있다.
| hsa-miR-598 |
| hsa-miR-494 |
| hsa-miR-142-3p |
건강한 대조군의 CSF에 비하여 산발성 ALS 또는 가족성 ALS가 있는 질환의 CSF에서 독특하게 증가된 마이크로RNA 마커가 표 11에 열거되어 있다.
| miRNA | Form of ALS |
| hsa-miR-27b | Familial and sporadic ALS |
| hsa-miR-99b | Sporadic ALS |
| hsa-miR-146a | Sporadic ALS |
| hsa-miR-150 | Sporadic ALS |
| hsa-miR-328 | Familial and Sporadic ALS |
| hsa-miR-532-3p | Familial and Sporadic ALS |
건강한 대조군(건강한 대조군의 CD14+CD16- 또는 CD14+CD16+ 단핵구) 비하여 MS 질환이 있는 대상체의 단핵구 (CD14+CD16- 또는 CD14+CD16+ 단핵구) 에서 증가된 마이크로RNA 마커가 표 12에 열거되어 있다.
| hsa-miR-320c | hsa-miR-1260 | hsa-miR-19b | hsa-miR-340 | hsa-let-320a |
| hsa-miR-27b | hsa-miR-720 | hsa-miR-106b | hsa-miR-26b | hsa-miR-520g |
| hsa-miR-664 | hsa-miR-1274a | hsa-let-7g | hsa-miR-1260 | hsa-miR-204 |
| hsa-miR-432-5p | hsa-miR-423 | hsa-miR-181a | hsa-miR-361-5p | hsa-miR-29a |
| hsa-miR-92a | hsa-miR-197 | hsa-miR-140-5p | hsa-miR-374b | hsa-miR-23a |
| hsa-miR-24 | hsa-miR-30a | hsa-miR-142-5p | hsa-let-7a | hsa-miR-142-3p |
| hsa-miR-93 | hsa-miR-221 | hsa-miR-19a | hsa-miR-532-3p | hsa-miR-103 |
| hsa-miR-20a | hsa-miR-361-5p | hsa-let-7b | hsa-miR-155 | hsa-miR-15a |
| hsa-miR-let-7a | hsa-miR-103 | hsa-miR-221 | hsa-miR-27a | hsa-miR-21 |
| hsa-miR-30c | hsa-miR-16 | hsa-miR-15b | hsa-miR-146a | hsa-miR-223 |
| hsa-miR-181a | hsa-miR-30b | hsa-miR-574-3p | hsa-let-7i | hsa-miR-1274b |
| hsa-miR-423 | hsa-miR-26a | hsa-let-7f | hsa-let-191 | |
건강한 대조군(건강한 대조군의 CD14+CD16- 또는 CD14+CD16+ 단핵구) 비하여 MS 질환이 있는 대상체의 단핵구 (CD14+CD16- 또는 CD14+CD16+ 단핵구) 에서 감소된 마이크로RNA 마커가 표 13에 열거되어 있다.
| hsa-miR-649 | hsa-miR-362-3p | hsa-miR-603 | hsa-miR-15a |
| hsa-miR-383 | hsa-miR-450b-5p | hsa-miR-584 | hsa-miR-1537 |
| hsa-miR-1206 | hsa-miR-302c | hsa-miR-204 | hsa-miR-148b |
| hsa-miR-548g | hsa-miR-548f | hsa-miR-526a | hsa-miR-369-3p |
| hsa-miR-640 | hsa-miR-328 | hsa-miR-453 | hsa-miR-615-5p |
| hsa-miR-592 | hsa-miR-580 | hsa-miR-2054 | hsa-miR-10a |
| hsa-miR-598 | hsa-miR-421 | hsa-miR-655 | hsa-miR-30d |
| hsa-miR-515-3p | hsa-miR-1297 | hsa-miR-518f | hsa-miR-494 |
| hsa-miR-513a-5p | hsa-miR-548b-3p | hsa-miR-206 | hsa-miR-142-3p |
| hsa-miR-651 | hsa-miR-615-5p | hsa-miR-192 | hsa-miR-651 |
| hsa-miR-379 | hsa-miR-137 | hsa-miR-450a | |
| hsa-miR-193a-3p | hsa-miR-300 | hsa-miR-566 | |
MS 환자의 CD14+CD16- 단핵구에 비하여 MS 환자의 CD14+CD16- 단핵구에서 증가된 마이크로RNA 마커가 표 14에 열거되어 있다.
| hsa-miR-720 | hsa-miR-20a | hsa-let-7g | hsa-miR-26b |
| hsa-miR-1274a | hsa-miR-93 | hsa-miR-181a | hsa-miR-21 |
| hsa-miR-320c | hsa-miR-361-5p | hsa-140-5p | hsa-miR-374b |
| hsa-miR-27b | hsa-miR-423 | hsa-142-5p | hsa-let-7a |
| hsa-miR-664 | hsa-miR-24 | hsa-miR-19a | hsa-miR-532-3p |
| hsa-miR-1260 | hsa-miR-103 | hsa-let-7b | hsa-miR-155 |
| hsa-miR-423 | hsa-miR-16 | hsa-miR-15b | hsa-miR-27a |
| hsa-miR-197 | hsa-miR-30b | hsa-miR-574-3p | hsa-miR-146a |
| hsa-miR-30a | hsa-miR-26a | hsa-let-7f | hsa-miR-92a |
| hsa-miR-30c | hsa-miR-19b | hsa-miR-340 | hsa-miR-1274b |
| hsa-miR-221 | hsa-miR-106b | hsa-miR-101 | |
건강한 대상체의 CD14+CD16- 단핵구에 비하여 MS 환자의 CD14+CD16- 단핵구에서 감소된 마이크로RNA 마커가 표 15에 열거되어 있다.
| hsa-miR-649 | hsa-miR-193a-3p | hsa-miR-615-5p | hsa-miR-206 |
| hsa-miR-383 | hsa-miR-450a | hsa-miR-137 | hsa-miR-192 |
| hsa-miR-1206 | hsa-miR-362-3p | hsa-miR-300 | hsa-miR-566 |
| hsa-miR-548g | hsa-miR-450b-5p | hsa-miR-603 | hsa-miR-142-3p |
| hsa-miR-640 | hsa-miR-302c | hsa-miR-584 | hsa-miR-15a |
| hsa-miR-592 | hsa-miR-548f | hsa-miR-204 | hsa-miR-1537 |
| hsa-miR-598 | hsa-miR-328 | hsa-miR-526a | hsa-miR-148b |
| hsa-miR-515-3p | hsa-miR-580 | hsa-miR-453 | hsa-miR-379 |
| hsa-miR-513a-5p | hsa-miR-421 | hsa-miR-2054 | hsa-miR-548b-3p |
| hsa-miR-651 | hsa-miR-1297 | hsa-miR-655 | hsa-miR-518f |
건강한 대조군과 ALS 대상체의 CD14+CD16- 단핵구에 비하여 MS 환자의 CD14+CD16- 단핵구에서 독특하게 증가된 마이크로RNA 마커가 표 16에 열거되어 있다.
| hsa-miR-320c | hsa-miR-664 | hsa-miR-92a |
| hsa-miR-27b | hsa-miR-432-5p | |
건강한 대조군과 ALS 대상체의 CD14+CD16- 단핵구에 비하여 MS 환자의 CD14+CD16- 단핵구에서 독특하게 감소된 마이크로RNA 마커가 표 17에 열거되어 있다.
| hsa-miR-142-3p | hsa-miR-1537 | hsa-miR-148b |
| hsa-miR-15a | hsa-miR-362-3p | |
건강한 대조군의 CD14+CD16+ 단핵구에 비하여 MS 환자의 CD14+CD16+ 단핵구에서 증가된 마이크로RNA 마커가 표 18에 열거되어 있다.
| hsa-let-7i | hsa-miR-520g | hsa-miR-24 | hsa-miR-21 |
| hsa-miR-191 | hsa-miR-204 | hsa-miR-30b | hsa-miR-16 |
| hsa-miR-1260 | hsa-miR-340 | hsa-miR-142-3p | hsa-miR-142-5p |
| hsa-miR-720 | hsa-miR-15b | hsa-miR-103 | hsa-miR-223 |
| hsa-miR-1274a | hsa-miR-29a | hsa-miR-15a | |
| hsa-miR-320a | hsa-miR-23a | hsa-miR-26a | |
건강한 대조군의 CD14+CD16+ 단핵구에 비하여 MS 환자의 CD14+CD16+ 단핵구에서 감소된 마이크로RNA 마커가 표 19에 열거되어 있다.
| hsa-miR-369-3p | hsa-miR-10a | hsa-miR-598 |
| hsa-miR-615-5p | hsa-miR-30d | hsa-miR-494 |
건강한 대조군의 CD14+CD16- 단핵구에 비하여 신경병성 질환이 있는 환자의 CD14+CD16- 단핵구에서 감소된 염증 마커가 표 20에 열거되어 있다.
| Marker | Protein sequence (NCBI Accession No.; Version No.) | mRNA sequence (NCBI Accession No.; Version No.) |
| BCL6 | NP_001128210; NP_001128210.1 NP_001124317; NP_001124317.1 |
NM_001134738; NM_001134738.1 NM_001130845; NM_001130845.1 |
| IL1RAP | NP_001161401; NP_001161401.1 NP_001161402; NP_001161402.1 NP_001161403; NP_001161403.1 |
NM_001167929; NM_001167929.1 NM_001167930; NM_001167930.1 NM_001167931; NM_001167931.1 |
| PLCB1 | NP_056007; NP_056007.1 NP_877398; NP_877398.1 |
NM_015192; NM_015192.2 NM_182734; NM_182734.1 |
| MAFK | AAC14426; AAC14426.1 | AF059194; AF059194.1 |
| NFE2L2 | NP_006155; NP_006155.2 NP_001138884; NP_001138884.1 NP_001138885; NP_001138885.1 |
NM_006164; NM_006164.3 NM_001145412; NM_001145412.1 NM_001145413; NM_001145413.1 |
| DDIT3 | NP_001181982; NP_001181982.1 NP_001181983; NP_001181983.1 NP_001181984TN; NP_001181984.1 NP_001181985; NP_001181985.1 NP_004074; NP_004074.2 |
NM_001195053; NM_001195053.1 NM_001195054; NM_001195054.1 NM_001195055; NM_001195055.1 NM_001195056; NM_001195056.1 NM_004083; NM_004083.5 |
| GNAQ | NP_002063; NP_002063.2 | NM_002072; NM_002072.3 |
| RAPGEF2 | NP_055062; NP_055062.1 | NM_014247; NM_014247.2 |
| MAFG | NP_002350; NP_002350.1 NP_116100; NP_116100.2 |
NM_002359; NM_002359.3 NM_032711; NM_032711.3 |
| PTK2N | NP_722560; NP_722560.1 NP_005598; NP_005598.3 NP_001186578; NP_001186578.1 |
NM_153831; NM_153831.3 NM_005607; NM_005607.4 NM_001199649; NM_001199649.1 |
| MKNK1 | NP_003675; NP_003675.2 NP_945324; NP_945324.1 NP_001129025; NP_001129025.1 |
NM_003684; NM_003684.4 NM_198973; NM_198973.2 NM_001135553; NM_001135553.1 |
| RIPK1 | NP_003795; NP_003795.2 | NM_003804; NM_003804.3 |
| IL15 | NP_751915; NP_751915.1 NP_000576; NP_000576.1 |
NM_172175; NM_172175.2 NM_000585; NM_000585.4 |
| MAP3K1 | NP_005912; NP_005912.1 | NM_005921; NM_005921.1 |
| PPP1R12B | NP_001184060; NP_001184060.1 NP_001161330; NP_001161330.1 NP_001161329; NP_001161329.1 NP_115287; NP_115287.1 NP_115286; NP_115286.1 NP_002472; NP_002472.2 |
NM_001197131; NM_001197131.1 NM_001167858; NM_001167858.1 NM_001167857; NM_001167857.1 NM_032104; NM_032104.2 NM_032103; NM_032103.2 NM_002481; NM_002481.3 |
| MAPK14 | NP_620582; NP_620582.1 NP_001306; NP_001306.1 NP_620583; NP_620583.1 NP_620581; NP_620581.1 |
NM_139013; NM_139013.2 NM_001315; NM_001315.2 NM_139014; NM_139014.2 NM_139012; NM_139012.2 |
| CXCR4 | NP_001008540; NP_001008540.1 NP_003458; NP_003458.1 |
NM_001008540; NM_001008540.1 NM_003467; NM_003467.2 |
| MEF2A | NP_001165365; NP_001165365.1 NP_001124400; NP_001124400.1 NP_001124399; NP_001124399.1 NP_001124398; NP_001124398.1 NP_005578; NP_005578.2 |
NM_001171894; NM_001171894.1 NM_001130928; NM_001130928.1 NM_001130927; NM_001130927.1 NM_001130926; NM_001130926.1 NM_005587; NM_005587.2 |
| TGFB1 | NP_000651; NP_000651.3 | NM_000660; NM_000660.4 |
| NR3C1 | NP_001191194; NP_001191194.1 NP_001019265; NP_001019265.1 NP_001018661; NP_001018661.1 NP_001018087; NP_001018087.1 NP_001018086; NP_001018086.1 NP_001018085; NP_001018085.1 NP_001018084; NP_001018084.1 NP_000167; NP_000167.1 |
NM_001204265; NM_001204265.1 NM_001024094; NM_001024094.1 NM_001020825; NM_001020825.1 NM_001018077; NM_001018077.1 NM_001018076; NM_001018076.1 NM_001018075; NM_001018075.1 NM_001018074; NM_001018074.1 NM_000176; NM_000176.2 |
| MAP3K5 | NP_005914; NP_005914.1 | NM_005923; NM_005923.3 |
| CDC42 | NP_426359; NP_426359.1 NP_001782; NP_001782.1 NP_001034891; NP_001034891.1 |
NM_044472; NM_044472.2 NM_001791; NM_001791.3 NM_001039802; NM_001039802.1 |
| RAF1 | NP_002871; NP_002871.1 | NM_002880; NM_002880.3 |
| CFB | NP_001701; NP_001701.2 | NM_001710; NM_001710.5 |
| ITGB2 | NP_000202; NP_000202.2 NP_001120963; NP_001120963.1 |
NM_000211; NM_000211.3 NM_001127491; NM_001127491.1 |
| ATF2 | NP_001871; NP_001871.2 | NM_001880; NM_001880.2 |
| CREB1 | NP_004370; NP_004370.1 NP_604391; NP_604391.1 |
NM_004379; NM_004379.3 NM_134442; NM_134442.3 |
| MAP2K6 | NP_002749; NP_002749.2 | NM_002758; NM_002758.3 |
| MAP3K7 | NP_663306; NP_663306.1 NP_663305; NP_663305.1 NP_663304; NP_663304.1 NP_003179; NP_003179.1 |
NM_145333; NM_145333.1 NM_145332; NM_145332.1 NM_145331; NM_145331.1 NM_003188; NM_003188.2 |
| RPS6KA5 | NP_004746; NP_004746.2 NP_872198; NP_872198.1 |
NM_004755; NM_004755.2 NM_182398; NM_182398.1 |
| TRADD | NP_003780; NP_003780.1 | NM_003789; NM_003789.3 |
| C5 | NP_001726; NP_001726.2 | NM_001735; NM_001735.2 |
| NCR1 | NP_004820; NP_004820.1 NP_001138929; NP_001138929.1 NP_001138930; NP_001138930.1 NP_001229285; NP_001229285.1 NP_001229286; NP_001229286.1 | NM_004829; NM_004829.5 NM_001145457; NM_001145457.1 NM_001145458; NM_001145458.1 NM_001242356; NM_001242356.1 NM_001242357; NM_001242357.1 |
| SOCS1 | NP_003736; NP_003736.1 | NM_003745; NM_003745.1 |
| TAGAP | NP_687034; NP_687034.1 NP_473455; NP_473455.2 NP_620165; NP_620165.1 |
NM_152133; NM_152133.1 NM_054114; NM_054114.3 NM_138810; NM_138810.2 |
| PTGS2 | NP_000954; NP_000954.1 | NM_000963; NM_000963.2 |
| PRDM1 | NP_001189; NP_001189.2 NP_878911; NP_878911.1 |
NM_001198; NM_001198.3 NM_182907; NM_182907.2 |
| PLAUR | NP_002650; NP_002650.1 NP_001005376; NP_001005376.1 | NM_002659; NM_002659.3 NM_00100537; NM_001005376.2 |
| FOS | NP_005243; NP_005243.1 | NM_005252; NM_005252.3 |
| NFKBIZ | NP_113607; NP_113607.1 NP_001005474; NP_001005474.1 | NM_031419; NM_031419 .3 NM_001005474; NM_001005474.2 |
| LILRA5 | NP_067073; NP_067073.1 NP_871714; NP_871714.1 NP_870994; NP_870994.1 NP_871715; NP_871715.1 |
NM_021250; NM_021250.2 NM_181985; NM_181985.2 NM_181879; NM_181879.2 NM_181986; NM_181986.2 |
| RIPK2 | NP_003812; NP_003812.1 | NM_003821; NM_003821.5 |
| LCP2 | NP_005556; NP_005556.1 | NM_005565; NM_005565.3 |
| LITAF | NP_004853; NP_004853.2 NP_037531; NP_037531.2 NP_001129945; NP_001129945.1 |
NM_004862; NM_004862.3 NM_013399; NM_013399.2 NM_001136473; NM_001136473.1 NR_024320; NR_024320.1 |
| TNFRSF8 | NP_001234; NP_001234.2 NP_694421; NP_694421.1 |
NM_001243; NM_001243.3 NM_152942; NM_152942.2 |
| MEF2D | NP_005911; NP_005911.1 | NM_005920; NM_005920.2 |
| CDKN1A | NP_000380; NP_000380.1 NP_510867; NP_510867.1 NP_001207707; NP_001207707.1 NP_001207706; NP_001207706.1 |
NM_000389; NM_000389.2 NM_078467; NM_078467.2 NM_001220778; NM_001220778.1 NM_001220777; NM_001220777.1 |
| CD83 | NP_004224; NP_004224.1 NP_001035370; NP_001035370.1 NP_001238830; NP_001238830.1 | NM_004233; NM_004233.3 NM_001040280; NM_001040280.1 NM_001251901; NM_001251901.1 |
| CASP10 | NP_116759; NP_116759.2 NP_116756; NP_116756.2 NP_001221; NP_001221.2 NP_116758; NP_116758.1 NP_001193471; NP_001193471.1 NP_001193453; NP_001193453.1 |
NM_032977; NM_032977.3 NM_032974; NM_032974.4 NM_001230; NM_001230.4 NM_032976; NM_032976.3 NM_001206542; NM_001206542.1 NM_001206524; NM_001206524.1 |
| LTB4R | NP_858043; NP_858043.1 NP_001137391; NP_001137391.1 | NM_181657; NM_181657 .3 NM_001143919; NM_001143919.2 |
건강한 대조군의 CD14+CD16- 단핵구에 비하여 신경병성 질환이 있는 환자의 CD14+CD16- 단핵구에서 독특하게 증가된 염증 마커가 표 21에 열거되어 있다.
| Marker | Protein sequence (NCBI Accession No.; Version No.) | mRNA sequence (NCBI Accession No.; Version No.) |
| CSF1 | NP_000748; NP_000748.3 NP_757351; NP_757351.1 NP_757349; NP_757349.1 |
NM_000757; NM_000757.5 NM_172212; NM_172212.2 NM_172210; NM_172210.2 |
| IL10 | NP_000563; NP_000563.1 | NM_000572; NM_000572.2 |
| IL1A | NP_000566; NP_000566.3 | NM_000575; NM_000575.3 |
| HLA-DRA | NP_061984; NP_061984.2 | NM_019111; NM_019111.4 |
| RAC1 | NP_061485; NP_061485.1 NP_008839; NP_008839.2 |
NM_018890; NM_018890.3 NM_006908; NM_006908.4 |
| GRB2 | NP_987102; NP_987102.1 NP_002077; NP_002077.1 |
NM_203506; NM_203506.2 NM_002086; NM_002086.4 |
| PLA2G4A | NP_077734; NP_077734.1 | NM_024420; NM_024420.2 |
| GNAS | NP_001070956; NP_001070956.1 NP_001070957; NP_001070957.1 NP_001070958; NP_001070958.1 NP_057676; NP_057676.1 NP_536351; NP_536351.1 NP_536350; NP_536350.2 NP_000507; NP_000507.1 |
NM_001077488; NM_001077488.2 NM_001077489; NM_001077489.2 NM_001077490; NM_001077490.1 NM_016592; NM_016592.2 NM_080426; NM_080426.2 NM_080425; NM_080425.2 NM_000516; NM_000516.4 |
| GNB1 | NP_002065; NP_002065.1 | NM_002074; NM_002074.3 |
| TGFB3 | NP_003230; NP_003230.1 | NM_003239; NM_003239.2 |
| IL6R | NP_000556; NP_000556.1 NP_852004; NP_852004.1 NP_001193795; NP_001193795.1 |
NM_000565; NM_000565.3 NM_181359; NM_181359.2 NM_001206866; NM_001206866.1 |
| CXCL3 | NP_002081; NP_002081.2 | NM_002090; NM_002090.2 |
| IL18 | NP_001553; NP_001553.1 NP_001230140; NP_001230140.1 | NM_001562; NM_001562.3 NM_001243211; NM_001243211.1 |
| IL1RN | NP_776214; NP_776214.1 NP_000568; NP_000568.1 NP_776213; NP_776213.1 NP_776215; NP_776215.1 |
NM_173842; NM_173842.2 NM_000577; NM_000577.4 NM_173841; NM_173841.2 NM_173843; NM_173843.2 |
| KEAP1 | NP_036421; NP_036421.2 NP_987096; NP_987096.1 |
NM_012289; NM_012289.3 NM_203500; NM_203500.1 |
| LIMK1 | NP_002305; NP_002305.1 NP_001191355; NP_001191355.1 |
NM_002314; NM_002314.3 NM_001204426; NM_001204426.1 |
| MYC | NP_002458; NP_002458.2 | NM_002467; NM_002467.4 |
| NFKB1 | NP_003989; NP_003989.2 | NM_003998; NM_003998.2 |
| SHC1 | NP_892113; NP_892113.4 NP_001123512; NP_001123512.1 NP_001123513; NP_001123513.1 NP_001189788; NP_001189788.1 NP_003020; NP_003020.2 |
NM_183001; NM_183001.4 NM_001130040; NM_001130040.1 NM_001130041; NM_001130041.1 NM_001202859; NM_001202859.1 NM_003029; NM_003029.4 |
| TLR2 | NP_003255; NP_003255.2 | NM_003264; NM_003264.3 |
| TLR4 | NP_612564; NP_612564.1 | NM_138554; NM_138554.3 |
| TNFSF14 | NP_003798; NP_003798.2 NP_742011; NP_742011.2 |
NM_003807; NM_003807.3 NM_172014; NM_172014.2 |
| AHR | NP_001612; NP_001612.1 | NM_001621; NM_001621.4 |
| BCL3 | NP_005169; NP_005169.1 | NM_005178; NM_005178.4 |
| CD44 | NP_000601; NP_000601.3 NP_001001389; NP_001001389.1 NP_001001390; NP_001001390.1 NP_001001391; NP_001001391.1 NP_001001392; NP_001001392.1 NP_001189484; NP_001189484.1 NP_001189485; NP_001189485.1 NP_001189486; NP_001189486.1 |
NM_000610; NM_000610.3 NM_001001389; NM_001001389.1 NM_001001390; NM_001001390.1 NM_001001391; NM_001001391.1 NM_001001392; NM_001001392.1 NM_001202555; NM_001202555.1 NM_001202556; NM_001202556.1 NM_001202557; NM_001202557.1 |
| CD81 | NP_004347; NP_004347.1 | NM_004356; NM_004356.3 |
| CD82 | NP_002222; NP_002222.1 NP_001020015; NP_001020015.1 |
NM_002231; NM_002231.3 NM_001024844; NM_001024844.1 |
| FCER1A | NP_001992; NP_001992.1 | NM_002001; NM_002001.2 |
| FCER1G | NP_004097; NP_004097.1 | NM_004106; NM_004106.1 |
| IL4R | NP_000409; NP_000409.1 NP_001008699; NP_001008699.1 |
NM_000418; NM_000418.2 NM_001008699; NM_001008699.1 |
| IL7R | NP_002176; NP_002176.2 | NM_002185; NM_002185.2 |
| ITGAM | NP_000623; NP_000623.2 NP_001139280; NP_001139280.1 |
NM_000632; NM_000632.3 NM_001145808; NM_001145808.1 |
| JAK3 | NP_000206; NP_000206.2 | NM_000215; NM_000215.3 |
| KLRB1 | NP_002249; NP_002249.1 | NM_002258; NM_002258.2 |
| LILRB4 | NP_001074907; NP_001074907.1 NP_006838; NP_006838.3 |
NM_001081438; NM_001081438.1 NM_006847; NM_006847.3 |
| PTAFR | NP_000943; NP_000943.1 NP_001158193; NP_001158193.1 NP_001158194; NP_001158194.1 NP_001158195; NP_001158195.1 |
NM_000952; NM_000952.4 NM_001164721; NM_001164721.1 NM_001164722; NM_001164722.2 NM_001164723; NM_001164723.2 |
| RUNX1 | NP_001745; NP_001745.2 NP_001001890; NP_001001890.1 NP_001116079; NP_001116079.1 |
NM_001754; NM_001754.4 NM_001001890; NM_001001890.2 NM_001122607; NM_001122607.1 |
| SELL | NP_000646; NP_000646.2 | NM_000655; NM_000655.4 |
| TNFSF8 | NP_001235; NP_001235.1; NP_001239219; NP_001239219.1 | NM_001244; NM_001244.3 NM_001252290; NM_001252290.1 |
| TRAF3 | NP_663777; NP_663777.1 NP_001186356; NP_001186356.1 NP_003291; NP_003291.2 NP_663778; NP_663778.1 |
NM_145725; NM_145725.1 NM_001199427; NM_001199427.1 NM_003300; NM_003300.3 NM_145726; NM_145726.2 |
| CCL2 | NP_002973; NP_002973.1 | NM_002982; NM_002982.3 |
| CCL4 | NP_002975; NP_002975.1 | NM_002984; NM_002984.2 |
| CCR1 | NP_001286; NP_001286.1 | NM_001295; NM_001295.2 |
| TLR1 | NP_003254; NP_003254.2 AAC34137; AAC34137.1 AAI09094; AAI09094.1 AAI09095; AAI09095.1 AAH89403; AAH89403.1 AAY85642; AAY85642.1 AAY85640; AAY85640.1 AAY85638; AAY85638.1 AAY85636; AAY85636.1 AAY85634; AAY85634.1 AAY85643; AAY85643.1 AAY85641; AAY85641.1 AAY85639; AAY85639.1 AAY85637; AAY85637.1 AAY85635; AAY85635.1 AAY85633; AAY85633.1 |
NM_003263; NM_003263.3 U88540; U88540.1 BC109093; BC109093.1 BC109094; BC109094.1 BC089403; BC089403.1 DQ012263; DQ012263.1 DQ012261; DQ012261.1 DQ012259; DQ012259.1 DQ012257; DQ012257.1 DQ012255; DQ012255.1 DQ012264; DQ012264.1 DQ012262; DQ012262.1 DQ012260; DQ012260.1 DQ012258; DQ012258.1 DQ012256; DQ012256.1 DQ012254; DQ012254.1 |
| TLR5 | NP_003259; NP_003259.2 AAC34136; AAC34136.1 BAG55042; BAG55042.1 AAI09120; AAI09120.1 AAI09119; AAI09119.1 BAB43955; BAB43955.1 |
NM_003268; NM_003268.5 U88881; U88881.1 AB445645; AB445645.1 BC109119; BC109119.1 BC109118; BC109118.1 AB060695; AB060695.1 |
진단 방법(
Diagnostic
method
)
본 발명은 신경병성 질환을 진단하는 방법을 제공한다. 상기 방법은 대상체의 뇌척수액 또는 CD14+CD16- 또는 CD14+CD16+ 단핵구(예, 말초 또는 혈액 유래 단핵구) 내의 표 1 내지 표 19에 열거된 마이크로RNA 중 하나 이상(예, 적어도 1, 2, 3, 4, 5, 또는 6개) 및/또는 표 20 및 표 21에 열거된 염증 마커 중 하나 이상(예, 적어도 1, 2, 3, 4, 5, 또는 6개)의 레벨을 결정하는 단계; 및 상기 하나 이상의 마이크로RNA 및/또는 상기 하나 이상의 염증 마커의 상기 레벨을 상기 하나 이상의 마이크로RNA 및/또는 상기 하나 이상의 염증 마커의 기준 레벨과 비교하는 단계를 포함한다. 상기 기준 레벨 대비 상기 하나 이상의 마이크로RNA 및/또는 상기 하나 이상의 염증 마커의 상기 레벨의 증가 또는 감소는 대상체가 하기에 상세히 설명한 바와 같이 신경병성 질환이 있다는 것을 나타낸다.
일부 구체예에서, 대상체의 CSF, 혹은 CD14+CD16- 또는 CD14+CD16+ 단핵구(예, 말초 또는 혈액 유래 단핵구) 내의 표 1에 열거된 마이크로RNA 중 하나 이상(예, 적어도 2, 3, 4, 5, 또는 6개)의 레벨이 표 1에 열거된 마이크로RNA 중 하나 이상의 기준 레벨에 비하여 증가, 및/또는 대상체의 CSF 혹은 CD14+CD16- 또는 CD14+CD16+ 단핵구(예, 말초 또는 혈액 유래 단핵구) 내의 표 2에 열거된 마이크로RNA 중 하나 이상(예, 적어도 2, 3, 4, 5, 또는 6개)의 레벨이 표 2에 열거된 마이크로RNA 중 하나 이상의 기준 레벨에 비하여 감소한다면, 대상체는 신경병성 질환이 있는 것으로 진단될 수 있다.
일부 구체예에서, 대상체의 CD14+CD16- 또는 CD14+CD16+ 단핵구 내의 표 3 내지 표 12에 열거된 마이크로RNA 중 하나 이상(예, 적어도 2, 3, 4, 5, 또는 6개)의 레벨이 표 4 내지 표 13에 열거된 마이크로RNA 중 하나 이상(예, 적어도 2, 3, 4, 5, 또는 6개)의 기준 레벨에 비하여 증가, 및/또는 대상체의 CD14+CD16- 또는 CD14+CD16+ 단핵구 내의 표 4 내지 표 13에 열거된 마이크로RNA 중 하나 이상의 레벨이 표 4 내지 표 13에 열거된 마이크로RNA 중 하나 이상의 기준 레벨에 비하여 감소한다면, 상기 대상체는 신경병성 질환이 있는 것으로 진단될 수 있다.
일부 구체예에서, 대상체의 CD14+CD16- 단핵구 내의 표 5 및 표 14에 열거된 마이크로RNA 중 하나 이상(예, 적어도 2, 3, 4, 5, 또는 6개) 및/또는 표 21에 열거된 염증 마커 중 하나 이상(예, 적어도 2, 3, 4, 5, 또는 6개)의 레벨이 표 5 및 표 14에 열거된 마이크로RNA 중 하나 이상의 기준 레벨 및/또는 표 21에 열거된 염증 마커 중 하나 이상의 기준 레벨에 비하여 증가 및/또는 대상체의 CD14+CD16- 단핵구 내의 표 6 및 표 15에 열거된 마이크로RNA 중 하나 이상(예, 적어도 2, 3, 4, 5, 또는 6개) 및/또는 표 20에 열거된 염증 마커 중 하나 이상(예, 적어도 2, 3, 4, 5, 또는 6개)의 레벨이 표 6 및 표 15에 열거된 마이크로RNA 중 하나 이상의 기준 레벨 및/또는 표 20에 열거된 염증 마커 중 하나 이상의 기준 레벨에 비하여 감소한다면, 상기 대상체는 신경병성 질환이 있는 것으로 진단될 수 있다.
일부 구체예에서, 대상체의 CD14+CD16- 단핵구 내의 표 5 및 표 7에 열거된 마이크로RNA 중 하나 이상(예, 적어도 2, 3, 4, 5, 또는 6개) 및/또는 표 21에 열거된 염증 마커 중 하나 이상(예, 적어도 2, 3, 4, 5, 또는 6개)의 레벨이 표 5 및 표 7에 열거된 마이크로RNA 중 하나 이상의 기준 레벨 및/또는 표 21에 열거된 염증 마커 중 하나 이상의 기준 레벨에 비하여 증가 및/또는 대상체의 CD14+CD16- 단핵구 내의 표 6 및 표 8에 열거된 마이크로RNA 중 하나 이상(예, 적어도 2, 3, 4, 5, 또는 6개) 및/또는 표 20에 열거된 염증 마커 중 하나 이상(예, 적어도 2, 3, 4, 5, 또는 6개)의 레벨이 표 6 및 표 8에 열거된 마이크로RNA 중 하나 이상의 기준 레벨 및/또는 표 20에 열거된 염증 마커 중 하나 이상의 기준 레벨에 비하여 감소한다면, 상기 대상체는 근 위축성 측삭 경화증이 있는 것으로 진단될 수 있다.
일부 구체예에서, 대상체의 CD14+CD16+ 단핵구 내의 표 9에 열거된 마이크로RNA 중 하나 이상(예, 적어도 2, 3, 4, 5, 또는 6개)의 레벨이 표 9에 열거된 마이크로RNA 중 하나 이상의 기준 레벨에 비하여 증가, 및/또는 대상체의 CD14+CD16+ 단핵구 내의 표 10에 열거된 마이크로RNA 중 하나 이상(예, 적어도 1, 2, 또는 3개)의 레벨이 표 10에 열거된 마이크로RNA 중 하나 이상의 기준 레벨에 비하여 감소한다면, 상기 대상체는 근 위축성 측삭 경화증이 있는 것으로 진단될 수 있다.
일부 구체예에서, 상기 대상체의 뇌척수액 내에서 hsa-miR-27b, hsa-miR-99b, hsa-miR-146a, hsa-miR-150, hsa-miR-328, 및 hsa-miR-532-3p 중 하나 이상(예, 적어도 2, 3, 4, 5, 또는 6개)의 레벨이 hsa-miR-27b, hsa-miR-99b, hsa-miR-146a, hsa-miR-150, hsa-miR-328, 및 hsa-miR-532-3p 중 하나 이상의 기준 레벨에 비하여 증가한다면, 상기 대상체는 근 위축성 측삭 경화증이 있는 것으로 진단될 수 있다.
일부 구체예에서, 대상체의 뇌척수액에서 hsa-miR-27b의 레벨이 hsa-miR-27b의 기준 레벨에 비하여 증가하고 대상체의 뇌척수액에서 hsa-miR-99b, hsa-miR-146a, hsa-miR-150, hsa-miR-328, 및 hsa-miR-532-3p 중 하나 이상(예, 1, 2, 3, 4, 또는 5개)의 레벨이 hsa-miR-99b, hsa-miR-146a, hsa-miR-150, hsa-miR-328, 및 hsa-miR-532-3p 중 하나 이상의 기준 레벨에 비하여 감소하거나 유의미하게 변하지 않는다면, 상기 대상체는 가족성 ALS가 있는 것으로 진단될 수 있다.
일부 구체예에서, 대상체의 뇌척수액에서 hsa-27b, hsa-miR-99b, hsa-miR-146a, hsa-miR-150, hsa-miR-328, 및 hsa-miR-532-3p 중에서 선택되는 둘 이상(예, 2, 3, 4, 5, 또는 6개)의 마이크로RNA의 레벨이 상기 하나 이상의 마이크로RNA의 기준 레벨에 비하여 증가한다면, 상기 대상체는 산발성 ALS가 있는 것으로 진단될 수 있다. 일부 구체예에서, 대상체의 뇌척수액에서 hsa-miR-99b, hsa-miR-146a, hsa-miR-150, hsa-miR-328, 및 hsa-miR-532-3p 중에서 선택되는 하나 이상(예, 2, 3, 4, 또는 5개)의 마이크로RNA의 레벨이 상기 하나 이상의 마이크로RNA의 기준 레벨에 비하여 증가한다면, 상기 대상체는 산발성 ALS가 있는 것으로 진단될 수 있다.
일부 구체예에서, 대상체의 CD14+CD16- 단핵구 내에서 표 14 및 표 16에서의 하나 이상(예, 적어도 2, 3, 4, 5, 또는 6개)의 마이크로RNA 및/또는 표 21에서의 하나 이상(예, 적어도 2, 3, 4, 5, 또는 6개)의 염증 마커의 레벨이 표 14 및 표 16에 열거된 하나 이상의 마이크로RNA의 기준 레벨 및/또는 표 21에 열거된 하나 이상의 염증 마커의 기준 레벨에 비하여 증가; 및/또는 대상체의 CD14+CD16- 단핵구 내에서 표 15 및 표 17에서의 하나 이상(예, 적어도 2, 3, 4, 5, 또는 6개)의 마이크로RNA 및/또는 표 20에서의 하나 이상(예, 적어도 2, 3, 4, 5, 또는 6개)의 염증 마커의 레벨이 표 15 및 표 17에 열거된 하나 이상의 마이크로RNA의 기준 레벨 및/또는 표 20에 열거된 하나 이상의 염증 마커의 기준 레벨에 비하여 감소한다면, 상기 대상체는 다발성 경화증이 있는 것으로 진단받을 수 있다.
일부 구체예에서, 대상체의 CD14+CD16+ 단핵구에서 표 18에서의 하나 이상(예, 적어도 2, 3, 4, 5, 또는 6개)의 마이크로RNA의 레벨이 표 18에서의 상기 하나 이상의 마이크로RNA의 기준 레벨에 비하여 증가, 및/또는 대상체의 CD14+CD16+ 단핵구에서 표 19에서의 하나 이상(예, 적어도 2, 3, 4, 5, 또는 6개)의 마이크로RNA의 레벨이 표 19에 열거된 상기 하나 이상의 마이크로RNA의 기준 레벨에 비하여 감소한다면, 상기 대상체는 다발성 경화증이 있는 것으로 진단될 수 있다.
표 1 내지 표 19에 기재된 하나 이상의 마이크로RNA(성숙한 및 전구체 마이크로RNA 둘 다)의 레벨은 당해 기술 분야에서 공지된 분자 생물학 방법을 이용하여 결정될 수 있다. 예를 들면, 본원에 기재된 마이크로RNA 중 임의의 하나의 레벨은 중합효소 연쇄 반응 (PCR) 및 적절한 프라이머, 예컨대 정량적 실시간 PCR(qRT-PCR)의 이용을 포함하는 기술에 의하여 측정할 수 있다. 본원에 기재된 성숙한 및 전구체 마이크로RNA 각각의 프라이머는 당해 기술 분야에서 공지된 방법을 이용하여 설계될 수 있다. 마찬가지로, 표 20 및 표 21의 염증 마커 중 임의의 하나를 암호화하는 mRNA의 레벨은 PCR 및 적절한 프라이머의 사용을 포함하는 기술을 이용하여 결정할 수 있다. 예를 들면, 프라이머는 표적 마이크로RNA 또는 표적 염증 마커 mRNA에 존재하는 서열에 상보적인 적어도 7개 (예, 적어도 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 또는 20개)의 연속 뉴클레오티드를 함유할 수 있다. 프라이머는 본원에 기재된 변형 중 하나 이상(예, 백본(backbone)에서의 하나 이상의 변형, 뉴클레오염기에서 하나 이상의 변형, 및 당에서의 하나 이상의 변형)을 포함할 수 있다. 또한, 프라이머는 라벨(예, 방사성 동위 원소 또는 형광)을 포함할 수 있다. 또한, 프라이머는 (본원에 기재된) 프라이머의 안정성을 향상시키기 위하여 2차 분자 또는 제제에 접합(conjugate)될 수 있다.
표 20 및 표 21에 열거된 염증 마커 유전자에 의하여 암호화된 단백질의 레벨은 표 20 및 표 21에 열거된 단백질 중 하나에 특이적으로 결합하는 항체를 이용하는 당해 기술 분야에서 공지된 많은 기술을 이용하여 탐지할 수 있다.
본원에 기재된 방법 중 임의의 하나는 대상체 유래 샘플(예, 뇌척수액 또는 말초 혈액을 함유한 생물학적 샘플)을 얻거나 수집하는 단계를 더 포함할 수 있다. 일부 구체예에서, 상기 방법(예, 본원에 기재된 방법 중 하나)은 단핵구(예, 대상체의 생물학적 샘플에서의 CD14+CD16- 단핵구 또는 CD14+CD16+ 단핵구)를 정제하는 단계를 더 포함할 수 있다. CD14+CD16- 단핵구 또는 CD14+CD16+ 단핵구를 정제하는 방법은 당해 기술 분야에서 공지된 다양한 방법, 예를 들면, fluorescence-assisted cell sorting(FACS)와 같은 항체 기반 방법(antibody-based methods)을 이용하여 실시할 수 있다.
본원에 기재된 방법 중 임의의 하나는 의료 시설(예, 병원, 전문 진료소, 또는 보조 의료시설)에 방문한 환자를 대상으로 실시할 수 있다. 대상체는 신경병성 질환의 하나 이상의 증상(예, 본원에 기재된 신경병성 질환의 증상 중 임의의 하나)을 겪을 수 있다. 또한, 대상체는 신경병성 질환의 증상이 없거나(무증상 대상체), 단지 하나의 증상을 겪을 수 있다. 대상체는 신경병성 질환(예, 가족성 ALS)의 가족력을 가질 수 있다.
본원에 기재된 진단 방법은 임의의 의료 전문가(예, 의사, 실험실 기술자, 간호사, 의사의 조수, 및 간호사의 조수)에 의하여 실시할 수 있다. 본원에 기재된 진단 방법은 당해 기술 분야에서 공지된 임의의 추가 진단 테스트 방법(예, 대상체에서 신경병성 질환의 하나 이상의 증상에 대한 관찰 또는 평가)과 조합하여 이용할 수 있다.
치료를 위한
대상체을
선택하는 방법(
Methods
of
Selecting
a
Subject
for
Treatment
)
또한, 본 발명은 신경병성 질환의 치료를 위한 대상체을 선택하는 방법을 제공한다. 상기 방법은 대상체의 뇌척수액 또는 CD14+CD16- 또는 CD14+CD16+ 단핵구에서 표 1 내지 표 19에 열거된 마이크로RNA의 하나 이상(예, 적어도 2, 3, 4, 5, 또는 6개)의 레벨 및/또는 표 20 및 표 21에 열거된 하나 이상(예, 적어도 2, 3, 4, 5, 또는 6개)의 염증 마커의 레벨을 결정하는 단계; 상기 대상체의 뇌척수액 또는 CD14+CD16- 또는 CD14+CD16+ 단핵구에서 상기 하나 이상의 레벨을 상기 하나 이상의 마이크로RNA의 기준 레벨 및/또는 상기 하나 이상의 염증 마커의 기준 레벨과 비교하는 단계: 및 표 1, 3, 5, 7, 9, 11, 12, 14, 16, 또는 18에 열거된 상기 하나 이상의 마이크로RNA의 기준 레벨 및/또는 표 21에 열거된 상기 하나 이상의 염증 마커의 기준 레벨 대비 상기 대상체의 뇌척수액 또는 CD14+CD16- 또는 CD14+CD16+ 단핵구 내의 표 1, 3, 5, 7, 9, 11, 12, 14, 16, 또는 18에 열거된 하나 이상(예, 적어도 2, 3, 4, 5, 또는 6개)의 마이크로RNA 및/또는 표 21에 열거된 하나 이상(예, 적어도 2, 3, 4, 5, 또는 6개)의 염증 마커의 레벨 증가가 있고, 및/또는 표 2, 4, 6, 8, 10, 13, 15, 17, 및 19에 열거된 하나 이상의 마이크로RNA의 기준 레벨 및/또는 표 20에 열거된 하나 이상의 염증 마커의 기준 레벨 대비 상기 대상체의 뇌척수액 또는 CD14+CD16- 또는 CD14+CD16+ 단핵구 내의 2, 4, 6, 8, 10, 13, 15, 17, 및 19에 열거된 하나 이상(예, 적어도 2, 3, 4, 5, 또는 6개)의 마이크로RNA 및/또는 표 20에 열거된 하나 이상(예, 적어도 2, 3, 4, 5, 또는 6개)의 염증 마커의 레벨의 감소가 있는 대상체를 선택하는 단계를 포함한다.
진단 방법을 설명한 상기 섹션에 기재된 바와 같이, 표 1 내지 표 19에 열거된 하나 이상(예, 적어도 2, 3, 4, 5, 또는 6개)의 마이크로RNA 및/또는 표 20 및 표 21에 열거된 하나 이상(예, 적어도 2, 3, 4, 5, 또는 6개)의 염증 마커의 상대적인 발현에 기반하여, 치료를 위한 대상체를 선택할 수 있다. 예를 들면, 표 1, 3, 5, 7, 9, 11, 12, 14, 16, 또는 18에 열거된 하나 이상(예, 적어도 2, 3, 4, 5, 또는 6개)의 마이크로RNA 및/또는 표 21에 열거된 하나 이상(예, 적어도 2, 3, 4, 5, 또는 6개)의 염증 마커의 레벨의 증가(기준 레벨 대비)는, 대상체가 신경병성 질환이 있는 것으로 진단하는데 이용된 바와 같이, 신경병성 질환의 치료를 위한 대상체를 선택하는데 이용할 수 있다. 유사하게, 표 2, 4, 6, 8, 10, 13, 15, 17, 또는 19에 열거된 하나 이상(예, 적어도 2, 3, 4, 5, 또는 6개)의 마이크로RNA 및/또는 표 20에 열거된 하나 이상(예, 적어도 2, 3, 4, 5, 또는 6개)의 염증 마커의 레벨의 감소(기준 레벨 대비)는, 대상체가 신경병성 질환이 있는 것으로 진단하는데 이용된 바와 같이, 신경병성 질환의 치료를 위한 대상체를 선택하는데 이용할 수 있다.
표 1 내지 표 19에 기재된 하나 이상의 마이크로RNA(성숙한 및 전구체 마이크로RNA 둘 다)의 레벨은 당해 기술 분야에서 공지된 분자 생물학 방법을 이용하여 결정될 수 있다. 예를 들면, 본원에 기재된 마이크로RNA 중 임의의 하나의 레벨은 중합효소 연쇄 반응 (PCR) 및 적절한 프라이머, 예컨대 정량적 실시간 PCR(qRT-PCR)의 이용을 포함하는 기술을 이용하여 측정할 수 있다. 본원에 기재된 성숙한 및 전구체 마이크로RNA 각각의 프라이머는 당해 기술 분야에서 공지된 방법을 이용하여 설계될 수 있다. 마찬가지로, 표 20 및 표 21의 염증 마커 중 임의의 하나를 암호화하는 mRNA의 레벨은 PCR 및 적절한 프라이머의 사용을 포함하는 기술을 이용하여 측정할 수 있다. 예를 들면, 프라이머는 표적 마이크로RNA 또는 표적 염증 마커 mRNA에 존재하는 서열에 상보적인 적어도 7개(예, 적어도 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 또는 20개)의 연속 뉴클레오티드를 함유할 수 있다. 프라이머는 본원에 기재된 변형 중 하나 이상(예, 백본(backbone)에서의 하나 이상의 변형, 뉴클레오염기에서 하나 이상의 변형, 및 당에서의 하나 이상의 변형)을 포함할 수 있다. 또한, 프라이머는 라벨(예, 방사성 동위 원소 또는 형광)을 포함할 수 있다. 또한, 프라이머는 (본원에 기재된) 프라이머의 안정성을 향상시키기 위하여 2차 분자 또는 제제에 접합될 수 있다. 상기 방법은 임의의 의료 전문가(예, 의사, 간호사, 의사의 조수, 공장 기술자, 및 간호사의 조수)에 의하여 실시할 수 있다.
대상체는 신경병성 질환의 하나 이상(예, 적어도 2, 3, 또는 4개)의 증상(예, 본원에 기재된 신경병성 질환의 증상 중 임의의 하나)을 겪을 수 있다. 또한, 대상체는 신경병성 질환의 증상이 없거나 단지 하나의 증상을 겪을 수 있다. 대상체는 신경병성 질환(예, 가족성 ALS)의 가족력을 가질 수 있다. 대상체는 이전에 신경병성 질환이 있는 것으로 진단받을 수 있다.
대상체에 투여될 수 있는 신경병성 질환의 치료제는 릴루졸(riluzole), 코르티코스테로이드(corticosteroids), 베타-인터페론, 글라티라머(glatiramer), 핑골리모드(fingolimod), 나탈리쥬맙(natalizumab), 미톡산트론(mitoxantrone), 근육 이완제, 및 아만타딘(amantadine)을 포함할 수 있다. 신경병성 질환의 추가적인 치료제는 물리 치료 및 혈장사혈(plasmapheresis)을 포함한다.
신경병성
질환이
발생될
위험이 있는
대상체를
확인하는 방법(
Methods
of
Identifying a
Subject
at
Risk
of
Developing
a
Neurodegenerative
Disorder
)
또한, 본 발명은 신경병성 질환이 발생될 위험이 있는 대상체를 확인하는 방법을 제공한다. 상기 방법은 대상체의 뇌척수액 또는 CD14+CD16- 또는 CD14+CD16+ 단핵구에서 표 1 내지 표 19에 열거된 하나 이상(예, 적어도 1, 2, 3, 4, 5, 또는 6개) 마이크로RNA 및/또는 표 20 및 표 21에 열거된 하나 이상(예, 적어도 1, 2, 3, 4, 5, 또는 6개)의 염증 마커의 레벨을 결정하는 단계; 및 상기 대상체의 뇌척수액 또는 CD14+CD16- 또는 CD14+CD16+ 단핵구에서 상기 하나 이상의 마이크로RNA의 상기 레벨을 상기 하나 이상의 마이크로RNA의 기준 레벨 및 상기 하나 이상의 염증 마커의 기준 레벨과 비교하는 단계를 포함한다. 대상체의 뇌척수액 또는 CD14+CD16- 또는 CD14+CD16+ 단핵구에서 표 1, 3, 5, 7, 9, 11, 12, 14, 16, 또는 18에 열거된 하나 이상(예, 적어도 2, 3, 4, 5, 또는 6개)의 마이크로RNA 및/또는 표 21에 열거된 하나 이상(예, 적어도 2, 3, 4, 5, 또는 6개)의 염증 마커의 레벨이 표 1, 3, 5, 7, 9, 11, 12, 14, 16, 또는 18에 열거된 하나 이상의 마이크로RNA의 기준 레벨 및/또는 표 21에 열거된 하나 이상의 염증 마커의 기준 레벨에 비하여 증가 및/또는 대상체의 뇌척수액 또는 CD14+CD16- 또는 CD14+CD16+ 단핵구에서 표 2, 4, 6, 8, 10, 13, 15, 17, 및 19에 열거된 하나 이상(예, 적어도 2, 3, 4, 5, 또는 6개)의 마이크로RNA 및/또는 표 20에 열거된 하나 이상(예, 적어도 2, 3, 4, 5, 또는 6개)의 염증 마커의 레벨이 표 2, 4, 6, 8, 10, 13, 15, 17, 및 19에 열거된 하나 이상의 마이크로RNA의 기준 레벨 및/또는 표 20에 열거된 하나 이상의 염증 마커의 기준 레벨에 비하여 감소하면, 상기 대상체는 신경병성 질환이 발생될 위험이 증가하고 있는 것으로 확인된다.
일부 구체예에서, 대상체의 뇌척수액 또는 CD14+CD16- 또는 CD14+CD16+ 단핵구에서 표 1, 3, 5, 7, 9, 11, 12, 14, 16, 또는 18에 열거된 하나 이상(예, 적어도 2, 3, 4, 5, 또는 6개)의 마이크로RNA 및/또는 표 21에 열거된 하나 이상(예, 적어도 2, 3, 4, 5, 또는 6개)의 염증 마커의 레벨이 표 1, 3, 5, 7, 9, 11, 12, 14, 16, 또는 18에 열거된 하나 이상의 마이크로RNA의 기준 레벨 및/또는 표 21에 열거된 하나 이상의 염증 마커의 기준 레벨에 비하여 감소 및/또는 대상체의 뇌척수액 또는 CD14+CD16- 또는 CD14+CD16+ 단핵구에서 표 2, 4, 6, 8, 10, 13, 15, 17, 및 19에 열거된 하나 이상(예, 적어도 2, 3, 4, 5, 또는 6개)의 마이크로RNA 및/또는 표 20에 열거된 하나 이상(예, 적어도 2, 3, 4, 5, 또는 6개)의 염증 마커의 레벨이 표 2, 4, 6, 8, 10, 13, 15, 17, 및 19에 열거된 하나 이상의 마이크로RNA의 기준 레벨 및/또는 표 20에 열거된 하나 이상의 염증 마커의 기준 레벨에 비하여 증가하거나 유의미한 변화가 없으면, 상기 대상체는 신경병성 질환이 발생될 위험이 감소하고 있는 것으로 확인된다.
일부 구체예에서, 진단 방법을 설명한 상기 섹션에 기재된 바와 같이, 기준 레벨 대비 대상체의 뇌척수액 또는 CD14+CD16- 또는 CD14+CD16+ 단핵구에서 표 1 내지 표 19에 열거된 하나 이상(예, 적어도 2, 3, 4, 5, 또는 6개)의 마이크로RNA 및/또는 표 20 및 표 21에 열거된 하나 이상(예, 적어도 2, 3, 4, 5, 또는 6개)의 염증 마커의 상대적인 발현을 기반으로 하여, 대상체가 신경병성 질환이 발생될 위험이 증가하거나 감소한다는 것을 확인할 수 있다. 예를 들면, (기준 레벨 대비) 대상체의 뇌척수액 또는 CD14+CD16- 또는 CD14+CD16+ 단핵구에서 표 1, 3, 5, 7, 9, 11, 12, 14, 16, 또는 18에 열거된 하나 이상(예, 적어도 2, 3, 4, 5, 또는 6개)의 마이크로RNA 및/또는 표 21에 열거된 하나 이상(예, 적어도 2, 3, 4, 5, 또는 6개)의 염증 마커의 레벨 증가는, 대상체가 신경병성 질환이 있는 것으로 진단하는데 이용된 바와 같이, 신경병성 질환이 발생될 위험이 증가한 대상체를 확인하는데 이용될 수 있다. 유사하게, (기준 레벨 대비) 대상체의 뇌척수액 또는 CD14+CD16- 또는 CD14+CD16+ 단핵구에서 표 2, 4, 6, 8, 10, 13, 15, 17, 또는 19에 열거된 하나 이상(예, 적어도 2, 3, 4, 5, 또는 6개)의 마이크로RNA 및/또는 표 20에 열거된 하나 이상(예, 적어도 2, 3, 4, 5, 또는 6개)의 염증 마커의 레벨 감소는, 대상체가 신경병성 질환이 있는 것으로 진단하는데 이용된 바와 같이, 신경병성 질환이 생길 위험이 증가한 대상체을 확인하는데 이용될 수 있다.
일부 구체예에서, (기준 레벨 대비) 대상체의 뇌척수액 또는 CD14+CD16- 또는 CD14+CD16+ 단핵구에서 표 2, 4, 6, 8, 10, 13, 15, 17, 또는 19에 열거된 하나 이상(예, 적어도 2, 3, 4, 5, 또는 6개)의 마이크로RNA 및/또는 표 20에 열거된 하나 이상(예, 적어도 2, 3, 4, 5, 또는 6개)의 염증 마커의 레벨 증가는, (상기 진단 방법을 설명하는 섹션에 기재된 바와 같이) 상기 하나 이상의 마이크로RNA의 레벨의 감소 또는 상기 하나 이상의 염증 마커의 레벨의 감소가 신경병성 질환을 진단하는 경우, 대상체에서 신경병성 질환이 발생될 위험이 감소한다는 것을 나타낸다.
일부 구체예에서, (기준 레벨 대비) 대상체의 뇌척수액 또는 CD14+CD16- 또는 CD14+CD16+ 단핵구에서 표 1, 3, 5, 7, 9, 11, 12, 14, 또는 18에 열거된 하나 이상(예, 적어도 2, 3, 4, 5, 또는 6개)의 마이크로RNA 및/또는 표 21에 열거된 하나 이상(예, 적어도 2, 3, 4, 5, 또는 6개)의 염증 마커의 레벨의 감소는, (상기 진단 방법을 설명하는 섹션에 기재된 바와 같이) 상기 하나 이상의 마이크로RNA의 레벨의 증가 또는 상기 하나 이상의 염증 마커의 레벨의 증가가 신경병성 질환을 진단하는 경우, 대상체가 신경병성 질환이 발생될 위험이 감소한다는 것을 나타낸다.
본원에 기재된 방법 중 임의의 하나에 있어서, 위험성의 증가 또는 감소는, 표 1 내지 표 19에 열거된 하나 이상(예, 적어도 2, 3, 4, 5, 또는 6개)의 마이크로RNA의 레벨 및/또는 표 20 및 표 21에 열거된 하나 이상(예, 적어도 2, 3, 4, 5, 또는 6개)의 염증 마커의 레벨이 증가하거나 감소하지 않는 대상체(예, 본원에 기재된 방법 중 임의의 하나를 이용하여 신경병성 질환이 없는 것으로 진단되는 대상체)에 따라 상대적인 것이다.
표 1 내지 표 19의 임의의 마이크로RNA의 레벨 또는 표 20 및 표 21에 열거된 임의의 염증 마커의 레벨의 측정은 표준 분자 생물학 방법(예, 본원에 기재된 PCR-기반 방법 및 항체-기반 방법)을 이용하여 실시할 수 있다. 상기 방법은 임의의 의료 전문가(예, 의사, 간호사, 의사의 조수, 공장 기술자, 및 간호사의 조수)에 의하여 실시할 수 있다.
대상체는 신경병성 질환의 하나 이상의 증상(예, 본원에 기재된 신경병성 질환의 증상 중 임의의 하나)을 겪을 수 있다. 또한, 대상체는 신경병성 질환의 증상이 없거나 단지 하나의 증상을 겪을 수 있다. 대상체는 신경병성 질환(예, 가족성 ALS)의 가족력을 가질 수 있다.
신경병성 질환이 발생될 위험이 증가한다고 확인된 대상체에 신경병성 질환을 위한 치료제를 투여하거나 신경병성 질환을 위한 새로운 또는 대체 치료제를 투여할 수 있다. 신경병성 질환이 발생될 위험이 증가한다고 확인된 대상체는 보다 적극적인 치료를 받을 수 있다(예, 전문 진료소나 병원의 방문 회수를 증가시킴).
질환의 진행 속도를 예측하는 방법(
Methods
of
Predicting
the
Rate
of
Disease
Progression
)
또한, 본 발명은 신경병성 질환이 있는 대상체에서 질환의 진행 속도를 예측하는 방법을 제공한다. 상기 방법은 대상체의 뇌척수액 또는 CD14+CD16- 또는 CD14+CD16+ 단핵구에서 표 1 내지 표 19에 열거된 마이크로RNA 중 하나 이상(예, 적어도 1, 2, 3, 4, 5, 또는 6개) 및/또는 표 20 및 표 21에 열거된 염증 마커 중 하나 이상(예, 적어도 1, 2, 3, 4, 5, 또는 6개)의 레벨을 결정하는 단계; 및 상기 하나 이상의 마이크로RNA 및/또는 상기 하나 이상의 염증 마커의 상기 레벨을 상기 하나 이상의 마이크로RNA의 기준 레벨 및/또는 상기 하나 이상의 염증 마커의 기준 레벨과 비교하는 단계를 포함한다. 대상체의 뇌척수액 또는 CD14+CD16- 또는 CD14+CD16+ 단핵구에서 표 1, 3, 5, 7, 9, 11, 12, 14, 16, 또는 18에 열거된 하나 이상(예, 적어도 2, 3, 4, 5, 또는 6개)의 마이크로RNA 및/또는 표 21에 열거된 하나 이상(예, 적어도 2, 3, 4, 5, 또는 6개)의 염증 마커의 레벨이 표 1, 3, 5, 7, 9, 11, 12, 14, 16, 또는 18에 열거된 하나 이상의 마이크로RNA의 기준 레벨 및/또는 표 21에 열거된 하나 이상의 염증 마커의 기준 레벨에 비하여 증가, 및/또는 상기 대상체의 뇌척수액 또는 CD14+CD16- 또는 CD14+CD16+ 단핵구에서 표 2, 4, 6, 8, 10, 13, 15, 17, 및 19에 열거된 하나 이상(예, 적어도 2, 3, 4, 5, 또는 6개)의 마이크로RNA 및/또는 표 20에 열거된 하나 이상(예, 적어도 2, 3, 4, 5, 또는 6개)의 염증 마커의 레벨이 표 2, 4, 6, 8, 10, 13, 15, 17, 및 19에 열거된 하나 이상의 마이크로RNA의 기준 레벨 및/또는 표 20에 열거된 하나 이상의 염증 마커의 기준 레벨에 비하여 감소하면, 상기 대상체는 질환의 진행 속도가 증가하고 있다고 예측된다.
일부 구체예에서, 대상체의 뇌척수액 또는 CD14+CD16- 또는 CD14+CD16+ 단핵구에서 표 1, 3, 5, 7, 9, 11, 12, 14, 16, 또는 18에 열거된 하나 이상(예, 적어도 2, 3, 4, 5, 또는 6개)의 마이크로RNA 및/또는 표 21에 열거된 하나 이상(예, 적어도 2, 3, 4, 5, 또는 6개)의 염증 마커의 레벨이 표 1, 3, 5, 7, 9, 11, 12, 14, 16, 또는 18에 열거된 하나 이상의 마이크로RNA의 기준 레벨 및/또는 표 21에 열거된 하나 이상의 염증 마커의 기준 레벨에 비하여 감소하거나 유의미한 변화가 없고 및/또는 대상체의 뇌척수액 또는 CD14+CD16- 또는 CD14+CD16+ 단핵구에서 표 2, 4, 6, 8, 10, 13, 15, 17, 및 19에 열거된 하나 이상(예, 적어도 2, 3, 4, 5, 또는 6개)의 마이크로RNA 및/또는 표 20에 열거된 하나 이상(예, 적어도 2, 3, 4, 5, 또는 6개)의 염증 마커의 레벨이 표 2, 4, 6, 8, 10, 13, 15, 17, 및 19에 열거된 하나 이상의 마이크로RNA의 기준 레벨 및/또는 표 20에 열거된 하나 이상의 염증 마커의 기준 레벨에 비하여 증가하거나 유의미한 변화가 없으면, 상기 대상체에서 질환의 진행 속도가 느려졌거나 평균적일 것이라고 예측할 수 있다.
일부 구체예에서, 진단 방법을 설명한 상기 섹션에 기재된 바와 같이, 기준 레벨 대비 대상체의 뇌척수액 또는 CD14+CD16- 또는 CD14+CD16+ 단핵구 내의 표 1 내지 표 19에 열거된 하나 이상(예, 적어도 2, 3, 4, 5, 또는 6개)의 마이크로RNA 및/또는 표 20 및 표 21에 열거된 하나 이상(예, 적어도 2, 3, 4, 5, 또는 6개)의 염증 마커의 상대적인 발현에 기반하여, 대상체에서 질환의 진행 속도가 증가하거나 감소함을 예측할 수 있다. 예를 들면, (기준 레벨 대비) 대상체의 뇌척수액 또는 CD14+CD16- 또는 CD14+CD16+ 단핵구 내의 표 1, 3, 5, 7, 9, 11, 12, 14, 16, 또는 18에 열거된 하나 이상(예, 적어도 2, 3, 4, 5, 또는 6개)의 마이크로RNA 및/또는 표 21에 열거된 하나 이상(예, 적어도 2, 3, 4, 5, 또는 6개)의 염증 마커의 레벨의 증가는, 대상체가 신경병성 질환이 있는 것으로 진단하는데 이용된 바와 동일하게, 질환 진행 속도가 증가하고 있음을 예측하는데 이용될 수 있다. 유사하게, (기준 레벨 대비) 표 2, 4, 6, 8, 10, 13, 15, 17, 또는 19에 열거된 하나 이상(예, 적어도 2, 3, 4, 5, 또는 6개)의 마이크로RNA 및/또는 표 20에 열거된 하나 이상(예, 적어도 2, 3, 4, 5, 또는 6개)의 염증 마커의 레벨의 감소는, 대상체가 신경병성 질환이 있는 것으로 진단하는데 이용된 바와 동일하게, 질환 진행 속도가 증가하고 있음을 예측하는데 이용될 수 있다.
일부 구체예에서, (기준 레벨 대비) 대상체의 뇌척수액 또는 CD14+CD16- 또는 CD14+CD16+ 단핵구에서 표 2, 4, 6, 8, 10, 13, 15, 17, 또는 19에 열거된 하나 이상(예, 적어도 2, 3, 4, 5, 또는 6개)의 마이크로RNA 및/또는 표 20에 열거된 하나 이상(예, 적어도 2, 3, 4, 5, 또는 6개)의 염증 마커의 레벨의 증가는, (상기 진단 방법을 설명하는 섹션에 기재된 바와 같이) 상기 하나 이상의 마이크로RNA의 레벨의 감소 또는 상기 하나 이상의 염증 마커의 레벨의 감소가 신경병성 질환을 진단하는 경우, 대상체에서 질환의 진행 속도가 감소하거나 평균적임을 예측하는데 이용될 수 있다. 일부 구체예에서, (기준 레벨 대비) 대상체의 뇌척수액 또는 CD14+CD16- 또는 CD14+CD16+ 단핵구에서 표 1, 3, 5, 7, 9, 11, 12, 14, 16, 또는 18에 열거된 하나 이상(예, 적어도 2, 3, 4, 5, 또는 6개)의 마이크로RNA의 레벨 및/또는 표 21에 열거된 하나 이상(예, 적어도 2, 3, 4, 5, 또는 6개)의 염증 마커의 레벨의 감소는, (상기 진단 방법을 설명하는 섹션에 기재된 바와 같이) 상기 하나 이상의 마이크로RNA의 레벨의 증가 및/또는 상기 하나 이상의 염증 마커의 레벨의 증가가 신경병성 질환을 진단하는 경우, 대상체에서 질환의 진행 속도가 감소하거나 평균적임을 예측하는데 이용될 수 있다.
일부 구체예에서, 상기 질환의 진행 속도는 신경병성 질환의 하나 이상(예, 적어도 1, 2, 3, 또는 4개)의 증상(예, 운동실조(ataxia))의 발생률, 신경병성 질환의 증상 강도(악화)의 증가율, 신경병성 질환의 하나 이상의 증상의 빈도, 신경병성 질환의 하나 이상의 증상의 지속기간, 또는 대상체의 수명을 포함한다. 예를 들면, 상기 질환의 진행 속도의 증가는, 신경병성 질환의 하나 이상의 (새로운) 증상의 발생률의 증가, 신경병성 질환의 하나 이상의 증상의 강도(악화)의 증가율의 증가, 신경병성 질환의 하나 이상의 증상의 지속기간의 증가, 또는 대상체의 수명의 감소 중 하나 이상에 의하여 명백해질 수 있다.
본원에 기재된 방법을 이용하여 결정된 질환의 진행 속도는, 대상체의 CSF 또는 CD14+CD16- 또는 CD14+CD16+ 단핵구 내의 표 1 내지 표 19에 열거된 하나 이상(예, 적어도 2, 3, 4, 5, 또는 6개)의 마이크로RNA의 레벨의 증가 또는 감소가 없는 및/또는 표 20 및 표 21에 열거된 하나 이상(예, 적어도 2, 3, 4, 5, 또는 6개)의 염증 마커의 레벨의 증가 또는 감소가 없는 대상체에서의 질환의 진행 속도와 비교할 수 있다. 일부 구체예에서, 상기 질환의 진행 속도는 동일한 신경병성 질환이 있다고 진단되는 모든 대상체의 평균 질환 진행 속도와 비교할 수 있다.
표 1 내지 표 19의 임의의 마이크로RNA의 레벨 또는 표 20 및 표 21에 열거된 임의의 염증 마커의 레벨의 측정은 표준 분자 생물학 방법(예, 본원에 기재된 PCR-기반 방법 및 항체-기반 방법)을 이용하여 실시할 수 있다. 상기 방법은 임의의 의료 전문가(예, 의사, 간호사, 의사의 조수, 공장 기술자, 및 간호사의 조수)에 의하여 실시할 수 있다.
대상체는 신경병성 질환의 하나 이상(예, 1, 2, 3, 또는 4개)의 증상(예, 본원에 기재된 신경병성 질환의 임의의 증상)을 겪을 수 있다. 또한, 대상체는 신경병성 질환의 증상이 없거나 단지 하나의 증상을 겪을 수 있다. 대상체는 신경병성 질환(예, 가족성 ALS)의 가족력을 가질 수 있다. 일부 구체예에서, 대상체는 이미 신경병성 질환이 있다고 진단 받을 수 있다.
상기 방법의 일부 구체예는 질환의 진행 속도가 증가하고 있다고 예측되는 대상체에 치료제를 투여하는 단계를 포함한다. 일부 구체예에서, 질환 진행 속도가 증가하고 있다고 예측되는 대상체는 보다 적극적인 치료를 받는다(예, 전문 진료소나 병원의 방문 회수를 증가시킴).
임상 연구 참여를 위한
대상체를
선택하는 방법(
Methods
of
Selecting
a Subject
for
Participation
in
a
Clinical
Study
)
또한, 본 발명은 임상 연구에 참여할 대상체를 선택하는 방법을 제공한다. 상기 방법은 대상체의 뇌척수액 또는 CD14+CD16- 또는 CD14+CD16+ 단핵구 내의 표 1 내지 표 19에 열거된 하나 이상(예, 적어도 2, 3, 4, 5, 또는 6개)의 마이크로RNA 및/또는 표 20 및 표 21에 열거된 하나 이상(예, 적어도 2, 3, 4, 5, 또는 6개)의 염증 마커의 레벨을 결정하는 단계; 및 상기 하나 이상의 마이크로RNA의 상기 레벨 및/또는 상기 하나 이상의 염증 마커의 상기 레벨을 상기 하나 이상의 마이크로RNA의 기준 레벨 및/또는 상기 하나 이상의 염증 마커의 기준 레벨과 비교하는 단계; 및 상기 기준 레벨 대비 상기 대상체의 뇌척수액 또는 CD14+CD16- 또는 CD14+CD16+ 단핵구 내의 상기 하나 이상의 마이크로RNA의 상기 레벨 및/또는 상기 하나 이상의 염증 마커의 상기 레벨의 증가 또는 감소가 있는 대상체를 임상 연구 참여를 위하여 선택하는 단계를 포함한다. 일부 구체예에서, 대상체의 뇌척수액 또는 CD14+CD16- 또는 CD14+CD16+ 단핵구에서 표 1, 3, 5, 7, 9, 11, 12, 14, 16, 또는 18에 열거된 하나 이상(예, 적어도 2, 3, 4, 5, 또는 6개)의 마이크로RNA 및/또는 표 21에 열거된 하나 이상(예, 적어도 2, 3, 4, 5, 또는 6개)의 염증 마커의 레벨이 표 1, 3, 5, 7, 9, 11, 12, 14, 16, 또는 18에 열거된 상기 하나 이상의 마이크로RNA의 기준 레벨 및/또는 표 21에 열거된 상기 하나 이상의 염증 마커의 기준 레벨에 비하여 증가하며 및/또는 대상체의 뇌척수액 또는 CD14+CD16- 또는 CD14+CD16+ 단핵구에서 표 2, 4, 6, 8, 10, 13, 15, 17, 및 19에 열거된 하나 이상(예, 적어도 2, 3, 4, 5, 또는 6개)의 마이크로RNA 및/또는 표 20에 열거된 하나 이상(예, 적어도 2, 3, 4, 5, 또는 6개)의 염증 마커의 레벨이 표 2, 4, 6, 8, 10, 13, 15, 17, 및 19에 열거된 상기 하나 이상의 마이크로RNA의 기준 레벨 및/또는 표 20에 열거된 상기 하나 이상의 염증 마커의 기준 레벨에 비하여 감소하면, 상기 대상체는 임상 연구 참여를 위하여 선택될 수 있다.
일부 구체예에서, 대상체의 뇌척수액 또는 CD14+CD16- 또는 CD14+CD16+ 단핵구에서 표 1, 3, 5, 7, 9, 11, 12, 14, 16, 또는 18에 열거된 하나 이상(예, 적어도 2, 3, 4, 5, 또는 6개)의 마이크로RNA 및/또는 표 21에 열거된 하나 이상(예, 적어도 2, 3, 4, 5, 또는 6개)의 염증 마커의 레벨이 표 1, 3, 5, 7, 9, 11, 12, 14, 16, 또는 18에 열거된 상기 하나 이상의 마이크로RNA의 기준 레벨 및/또는 표 21에 열거된 상기 하나 이상의 염증 마커의 기준 레벨에 비하여 감소하며 및/또는 대상체의 뇌척수액 또는 CD14+CD16- 또는 CD14+CD16+ 단핵구 내의 표 2, 4, 6, 8, 10, 13, 15, 17, 및 19에 열거된 하나 이상(예, 적어도 2, 3, 4, 5, 또는 6개)의 마이크로RNA 및/또는 표 20에 열거된 하나 이상(예, 적어도 2, 3, 4, 5, 또는 6개)의 염증 마커의 레벨이 표 2, 4, 6, 8, 10, 13, 15, 17, 및 19에 열거된 상기 하나 이상의 마이크로RNA의 기준 레벨 및/또는 표 20에 열거된 상기 하나 이상의 염증 마커의 기준 레벨에 비하여 증가하거나 유의미한 변화가 없다면, 상기 대상체는 임상 연구 참여를 위하여 선택될 수 있다.
일부 구체예에서, 진단 방법을 설명한 상기 섹션에 기재된 바와 같이, 기준 레벨 대비 대상체의 뇌척수액 또는 CD14+CD16- 또는 CD14+CD16+ 단핵구 내의 표 1 내지 표 19에 열거된 하나 이상(예, 적어도 2, 3, 4, 5, 또는 6개)의 마이크로RNA 및/또는 표 20 및 표 21에 열거된 하나 이상(예, 적어도 2, 3, 4, 5, 또는 6개)의 염증 마커의 상대적인 발현에 기반하여, 임상 연구 참여를 위하여 대상체를 선택할 수 있다. 예를 들면, (기준 레벨 대비) 대상체의 뇌척수액 또는 CD14+CD16- 또는 CD14+CD16+ 단핵구에서 표 1, 3, 5, 7, 9, 11, 12, 14, 16, 또는 18에 열거된 하나 이상(예, 적어도 2, 3, 4, 5, 또는 6개)의 마이크로RNA 및/또는 표 21에 열거된 하나 이상(예, 적어도 2, 3, 4, 5, 또는 6개)의 염증 마커의 레벨의 증가는, 대상체가 신경병성 질환이 있는 것으로 진단하는데 이용된 바와 동일하게, 임상 연구 참여를 위한 대상체를 선택하는데 이용될 수 있다. 유사하게, (기준 레벨 대비) 표 2, 4, 6, 8, 10, 13, 15, 17, 또는 19에 열거된 하나 이상(예, 적어도 2, 3, 4, 5, 또는 6개)의 마이크로RNA 및/또는 표 20에 열거된 하나 이상(예, 적어도 2, 3, 4, 5, 또는 6개)의 염증 마커의 레벨의 감소는, 대상체가 신경병성 질환이 있는 것으로 진단하는데 이용된 바와 동일하게, 임상 연구 참여를 위한 대상체를 선택하는데 이용될 수 있다.
일부 구체예에서, (기준 레벨 대비) 대상체의 뇌척수액 또는 CD14+CD16- 또는 CD14+CD16+ 단핵구 내의 표 2, 4, 6, 8, 10, 13, 15, 17, 또는 19에 열거된 하나 이상(예, 적어도 2, 3, 4, 5, 또는 6개)의 마이크로RNA의 레벨 및/또는 표 20에 열거된 하나 이상(예, 적어도 2, 3, 4, 5, 또는 6개)의 염증 마커의 레벨의 증가 또는 유의미하지 않은 변화는, (상기 진단 방법을 설명하는 섹션에 기재된 바와 같이) 상기 하나 이상의 마이크로RNA의 레벨의 감소 및/또는 상기 하나 이상의 염증 마커의 레벨의 감소가 신경병성 질환을 진단하는 경우, 임상 연구 참여를 위한 대상체를 선택하는데 이용될 수 있다. 일부 구체예에서, (기준 레벨 대비) 대상체의 뇌척수액 또는 CD14+CD16- 또는 CD14+CD16+ 단핵구에서 표 1, 3, 5, 7, 9, 11, 12, 14, 16, 또는 18에 열거된 하나 이상(예, 적어도 2, 3, 4, 5, 또는 6개)의 마이크로RNA의 레벨 및/또는 표 21에 열거된 하나 이상(예, 적어도 2, 3, 4, 5, 또는 6개)의 염증 마커의 레벨의 감소 또는 유의미하지 않은 변화는, (상기 진단 방법을 설명하는 섹션에 기재된 바와 같이) 상기 하나 이상의 마이크로RNA의 레벨의 증가 및/또는 상기 하나 이상의 염증 마커의 레벨의 증가가 신경병성 질환을 진단하는 경우, 임상 연구 참여를 위한 대상체를 선택하는데 이용될 수 있다.
표 1 내지 표 19의 임의의 마이크로RNA의 레벨 또는 표 20 및 표 21에 열거된 임의의 염증 마커의 레벨의 측정은 표준 분자 생물학 방법(예, 본원에 기재된 PCR-기반 방법 및 항체-기반 방법)을 이용하여 실시할 수 있다. 상기 방법은 임의의 의료 전문가(예, 의사, 간호사, 의사의 조수, 공장 기술자, 및 간호사의 조수)에 의하여 실시할 수 있다.
일부 구체예에서, 대상체는 신경병성 질환의 하나 이상의 증상(예, 본원에 기재된 신경병성 질환의 임의의 증상)을 겪을 수 있다. 일부 구체예에서, 대상체는 또한 신경병성 질환의 증상이 없거나 단지 하나의 증상을 겪을 수 있다. 일부 구체예에서, 대상체는 신경병성 질환(예, 가족성 ALS)의 가족력을 가질 수 있다. 일부 구체예에서, 대상체는 신경병성 질환이 있다고 이미 진단받을 수 있다.
치료 방법(
Methods
of
Treatment
)
또한, 본 발명은 신경병성 질환을 치료하는 방법으로서, 표 1, 3, 5, 7, 9, 11, 12, 14, 16, 또는 18에 열거된 마이크로RNA 중 하나 이상(예, 적어도 2, 3, 4, 5, 또는 6개)의 레벨 또는 활성을 감소시키며(예, 억제성 핵산, 예, 안타고미르) 및/또는 표 2, 4, 6, 8, 10, 13, 15, 17, 또는 19에 열거된 마이크로RNA 중 하나 이상(예, 적어도 2, 3, 4, 5, 또는 6개)의 레벨 또는 활성을 증가시키는(예, 센스 핵산), 적어도 하나(예, 적어도 2, 3, 4, 5, 또는 6개)의 제제(예, 핵산)를 대상체에 투여하는 단계를 포함하는 방법을 제공한다. 또한, 본 발명은 신경병성 질환(예, ALS 또는 MS)을 치료하는 방법으로서, 표 21에 열거된 염증 마커 중 하나 이상(예, 적어도 2, 3, 4, 5, 또는 6개)의 발현(예, 단백질 또는 mRNA) 또는 활성을 감소시키며(예, 억제성 핵산 또는 항체), 및/또는 표 21에 열거된 염증 마커 중 하나 이상(예, 적어도 2, 3, 4, 5, 또는 6개)의 활성(예, 단백질 또는 mRNA) 및/또는 활성을 증가시키는(예, 센스 핵산), 적어도 하나(예, 적어도 2, 3, 4, 5, 또는 6개)의 제제(예, 핵산)를 대상체에 투여하는 단계를 포함하는 방법을 제공한다. 일부 구체예에서, 본원에 기재된 임의의 진단 방법 또는 본원에 기재된 신경병성 질환이 발생될 위험에 있는 대상체를 예측하는 임의의 방법을 이용하여, 대상체는 첫번째로 확인되거나 치료를 위하여 선택된다.
일부 구체예에서, hsa-miR-155에 존재하는 연속 서열(예, 성숙한 또는 전구체 hsa-miR-155에 존재하는 연속 서열)에 상보적인 서열을 포함하는 적어도 하나의 억제성 핵산을 대상체에 투여한다. 비제한적 구체예에서, 상기 억제성 핵산은 안티센스 올리고뉴클레오티드, 리보자임, siRNA, 또는 안타고미르일 수 있다. 일부 구체예에서, 상기 적어도 하나의 억제성 핵산을 대상체의 뇌척수에세 주사할 수 있다. 일부 구체예에서, 상기 주사는 두개내 주사 또는 척수강내 주사이다. 일부 구체예에서, 상기 적어도 하나의 억제성 핵산은 하나 이상의 양이온성 고분자 및/또는 양이온성 지질(예, 본원에 기재된 또는 당해 기술 분야에서 공지된 임의의 양이온성 고분자)과 착화된다(complexed). 특정 표적 miRNA(예, hsa-miR-155) 의 발현 및/또는 활성을 감소시키는 안타고미르는 당해 기술분야에서 공지된 방법을 이용하여 설계될 수 있다(예를 들어, Krutzfeld et al., Nature 438:685-689, 2005 참조). 안타고미르 및 다른 형태의 억제성 핵산을 설계하고 제조하는 추가적인 예시적 방법이 본원에 기재되어 있다.
일부 구체예에서, miR-155 레벨을 감소시키는 상기 억제성 핵산은 안타고미르-155 LNA 서열+TC+AC+A+A+TTA+G+C+AT+T+A (서열번호 262) (이때, +는 LNA 부위(moiety)의 존재를 나타냄)이다. 표적 마이크로RNA 분자에 대한 안타고미르를 설계하는 방법은 Obad et al., Nature Genetics 43:371-378, 2011에 기재되어 있다. hsa-miR-155의 레벨 또는 발현을 감소시키기 위한 추가의 억제성 핵산은 Worm et al., Nucleic Acids Res . 37:5784-5792, 2009, and Murugaiyan et al., J. Immunol . 187:2213-2221, 2011에 기재되어 있다.
적어도 1 회분(예, 적어도 2, 3, 4, 또는 5회분)의 제제(예, 하나 이상의 억제성 핵산)을 대상체에 투여할 수 있다. 상기 제제(예, 하나 이상의 억제성 핵산)는 하루에 적어도 1번(예, 하루에 2번, 하루에 3번, 및 하루에 4번), 한 주에 적어도 1번(예, 한 주에 2번, 한 주에 3번, 한 주에 4번), 및/또는 적어도 한 달에 1번 대상체에 투여할 수 있다. 대상체를 오랜 기간 동안(예, 적어도 1개월, 2개월, 6개월, 1년, 2년, 3년, 4년, 또는 5년) 치료할 수 있다(예, 주기적으로 제제를 투여함). 본원에 자세히 기재된 바와 같이, 대상체에 투여될 제제의 용량은, 대상체의 성별, 대상체의 체중, 대상체의 연령, 및 다른 의료 조건의 존재를 포함하나 이에 제한되지 않는 많은 생리적인 요인을 고려하여, 의사가 결정할 수 있다. 상기 제제는 경구로, 정맥내로, 동맥내로, 피하로, 근육내로, 두개내로, 또는 척수액으로의 주사를 통해 대상체에 투여할 수 있다. 마찬가지로, 상기 제제는 고체(예를 들면, 경구 투여용) 또는 생리학적으로 허용되는 액상 담체(예: 생리 식염수)(예, 정맥내, 동맥내, 피하, 근육내, 뇌척수(intrathecal), 또는 두개내 투여용)로 제형화할 수 있다. 일부 구체예에서, 상기 제제(예, 하나 이상의 억제성 핵산)은 일정 기간에 걸쳐 주사(injection)로 투여하거나 주입(infusion)하여 투여할 수 있다.
신경병성 질환의 치료를 위하여 대상체에 투여될 제제는 하기에 기재되어 있으며, 임의로 조합하여(e.g., 하기에 기술되는 제제 또는 제제 계열의 임의의 조합의 적어도 1, 2, 3, 4, 또는 5개) 사용할 수 있다.
억제성
핵산(
Inhibitory
Nucleic
Acids
)
본원에 기재된 치료 방법에 유용한 억제성 제제는 표 1, 3, 5, 7, 9, 11, 12, 14, 16, 또는 18 (예, hsa-miR-155)에 열거된 마이크로RNA(예, 성숙한 마이크로RNA 또는 전구체 마이크로RNA)의 발현 또는 활성을 감소시키거나, 표 21에 열거된 염증 마커를 암호화하는 mRNA(표적 mRNA)의 발현 또는 활성을 감소시키는 억제성 핵산 분자를 포함한다.
본 방법 및 조성물에 유용한 억제성 핵산 분자는 안티센스 올리고뉴클레오티드, 리보자임, 외부 가이드 서열(external guide sequence, EGS) 올리고뉴클레오티드, siRNA 화합물, siRNA 화합물과 같은 단일 또는 이중 가닥 RNA 간섭 (RNAi) 화합물, 변형 염기/록 핵산(locked nucleic acids, LNAs), 안타고미르, 펩티드 핵산(peptide nucleic acids, PNAs), 및 기타 올리고 화합물, 또는 표적 핵산의 적어도 일부에 혼합하고 그 기능을 조절하는 올리고뉴클레오티드 모방체(oligonucleotide mimetics)를 포함한다. 일부 구체예에서, 상기 억제성 핵산은 안티센스 RNA, 안티센스 DNA, 키메릭 안티센스 올리고뉴클레오티드, 변형 연결을 포함하는 안티센스 올리고뉴클레오티드, 간섭 RNA(RNAi), 짧은 간섭 RNA(siRNA); 마이크로 간섭 RNA(miRNA); stRNA(small, temporal RNA); 또는 shRNA (short, hairpin RNA); 짧은 RNA-유도 유전자 활성화(small RNA-induced gene activation, RNAa); 짧은 활성화 RNA(small activating RNAs, saRNAs); 또는 이들의 조합을 포함한다. 예를 들어, WO 2010/040112을 참조.
일부 구체예에서, 상기 억제성 핵산은 10개 내지 50개, 13개 내지 50개, 또는 13개 내지 30개 뉴클레오티드 길이를 가진다. 통상의 기술자는 이것이 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 또는 50개 뉴클레오티드 길이 또는 그 안의 임의의 범위의 안티센스 부분을 가지는 뉴클레오티드를 구체화하는 것임을 알 것이다. 일부 구체예에서, 상기 뉴클레오티드는 15개 뉴클레오티드 길이를 가진다. 일부 구체예에서, 본 발명의 안티센스 또는 올리고뉴클레오티드 화합물은 12개 또는 13개 내지 30개 뉴클레오티드 길이를 가진다. 통상의 기술자는 이것이 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 또는 30개의 뉴클레오티드 길이 또는 그 안의 임의의 범위의 안티센스 부분을 가지는 뉴클레오티드를 구체화하는 것임을 알 수 있을 것이다.
일부 구체예에서, 상기 억제성 핵산은 적어도 하나의 뉴클레오티드로 구성되는 키메릭 특정 영역을 둘 이상 함유하는 키메릭 올리고뉴클레어티드이다. 이러한 뉴클레오티드는 일반적으로 하나 이상의 유익한 성질(예를 들면, 뉴클레아제 저항 증가, 세포로의 섭취 증가, 표적에 대한 결합 친화성 증가)을 부여하는 변형 뉴클레오티드의 적어도 하나의 영역 및 RNA:DNA 또는 RNA:RNA 하이브리드를 절단할 수 있는 효소용 기질의 영역을 일반적으로 포함한다. 본 발명의 키메릭 억제성 핵산은 상술한 바와 같이 둘 이상의 올리고뉴클레오티드, 변형 올리고뉴클레오티드, 올리고뉴클레오티드, 및/또는 올리고뉴클레오티드 모방체로서 형성될 수 있다. 상기 화합물들은 당해 기술 분야에서 하이브리드 또는 갭머(gapmers)로도 지칭되어 왔다. 상기 하이브리드 구조의 제조를 설명한 대표적인 미국 특허는 USP 5,013,830; 5,149,797; 5,220,007; 5,256,775; 5,366,878; 5,403,711; 5,491,133; 5,565,350; 5,623,065; 5,652,355; 5,652,356; 및 5,700,922를 포함하나 이에 한정되지 않으며, 이들의 내용은 참조로서 본원에 병합된다.
일부 구체예에서, 상기 억제성 핵산은 당의 2'-위치에서 변형된 적어도 하나의 뉴클레오티드, 즉 2'-O-알킬, 2'-O-알킬-O-알킬 또는 2'-플루오로-변형 뉴클레오티드를 포함한다. 다른 바람직한 구체예에서, RNA 변형은 피리미딘의 리보오스, 무염기 잔기, 또는 RNA의 3'-말단에서의 반전 염기 상에서의 2'-플루오로, 2'-아미노, 및 2'-O-메틸 변형을 포함한다. 그러한 변형은 올리고뉴클레오티드에 통상적으로 결합되며, 이러한 뉴클레오티드는 주어진 표적에 대항하여 2'-디옥시올리고뉴클레오티드보다 높은 Tm(즉, 표적 결합 친화성보다 높은)을 가지는 것으로 밝혀졌다.
많은 뉴클레오티드 및 뉴클레오티드 변형체는 그들이 결합하고 있는 올리고뉴클레오티드를 천연 올리고뉴클레오티드보다 뉴클레아제 소화에 대한 저항성을 높인다-변형 올리고는 변형되지 않은 올리고뉴클레오티드보다 더 오랜 시간 동안 그대로 생존한다. 변형 올리고뉴클레오티드의 구체적인 예는 변형 백본, 예를 들면, 포스포로티오에이트, 포스포트리에스테르, 메틸 포스포네이트, 단쇄 알킬 또는 시클로알킬 당간 결합, 또는 단쇄 헤테로원자 또는 헤테로사이클 단간 결합을 포함하는 올리고뉴클레오티드를 포함한다. 가장 바람직한 것은 포스포로티오에이트 백본을 가지는 올리고뉴클레오티드 및 헤테로원자 백본을 가지는 올리고뉴클레오티드이며, 특히 CH2-NH-O-CH2, CH, ~N(CH3)~O~CH2 (메틸렌(메틸이미노) 또는 MMI 백본으로 알려짐), CH2--O--N(CH3)-CH2, CH2-N(CH3)-N (CH3)-CH2, 및 O-N(CH3)-CH2-CH2 백본, 상기 천연(native) 포스포다이에스테르 백본은 O-P-O-CH로 나타냄); 아미드 백본(De Mesmaeker et al., Ace . Chem . Res . 28:366-374, 1995을 참조); 모르폴리노 백본 구조(USP 5,034,506); 펩티드 핵산(PNA) 백본(여기서, 상기 올리고뉴클레오티드의 포스포다이에스테르 백본은 폴리아미드 백본으로 치환되고, 상기 뉴클레오티드는 폴리아미드 백본의 아자 질소 원자에 직접적으로 또는 간접적으로 결합한다. Nielsen et al., Science 254: 1497, 1991을 참조). 인-함유 결합은 포스포로티오에이트, 카이랄 포스포로티오에이트, 포스포로디티오에이트, 포스포트리에스테르, 아미노알킬포스포트리에스테르, 3'-알킬렌 포스포네이트 및 카이랄 포스포네이트를 포함하는 메틸 및 기타 알킬 포스포네이트, 포스피네이트, 3'-아미노 포스포르아미데이트 및 아미노알킬포스포르아미데이트를 포함하는 포스포르아미데이트, 티오노포스포르아미데이트, 티오노알킬포스포네이트, 티오노알킬포스포트리에스테르, 및 정상 3'-5' 결합, 이들의 2'-5' 결합 유사체, 및 뉴클레오사이드 단위의 이웃하는 쌍들이 3'-5' 에서 5'-3' 또는 2'-5' 에서 5'-2'로 연결되는 역극성을 가지는 것들을 가지는 브라노포스페이트를 포함하나 이에 제한되지 않는다. USP 3,687,808; 4,469,863; 4,476,301; 5,023,243; 5, 177,196; 5,188,897; 5,264,423; 5,276,019; 5,278,302; 5,286,717; 5,321,131; 5,399,676; 5,405,939; 5,453,496; 5,455, 233; 5,466,677; 5,476,925; 5,519,126; 5,536,821; 5,541,306; 5,550,111; 5,563, 253; 5,571,799; 5,587,361; 및 5,625,050 참조(이들은 참조로서 본원에 병합됨).
모르포리노계 올리고머 화합물은 Braasch et al., Biochemistry 41(14):4503-4510, 2002; Genesis, volume 30, issue 3, 2001; Heasman, J., Dev . Biol ., 243:209-214, 2002; Nasevicius et al., Nat . Genet . 26: 216-220, 2000; Lacerra et al., Proc . Natl . Acad . Sci . U.S.A. 97:9591-9596, 2000; 및 USP 5,034,506에 기재되어 있다. 사이클로헥세닐 핵산 올리고뉴클레오티드 모방체는 Wang et al., J. Am . Chem . Soc . 122, 8595-8602, 2000에 기재되어 있다.
인 원자를 포함하지 않은 변형 올리고뉴클레이티드 백본은 단쇄 알킬 또는 사이클로알킬 뉴클레오사이드간 결합, 혼합형 헤테로원자 및 알킬 또는 사이클로알킬 뉴클레오사이드간 결합, 또는 하나 이상의 단쇄 헤테로원자 또는 헤테로사이클 뉴클레오사이드간 결합에 의하여 형성되는 백본을 가진다. 이러한 화합물은 모르폴리노 결합(뉴클레오사이드의 당 부분의 일부에 형성됨); 실록산 백본; 설파이드, 설폭시드, 및 설폰 백본; 포름아세틸 및 티오포름아세틸 백본; 메틸렌 포름아세틸 및 티오포름아세틸 백본; 알켄 함유 백본; 설파메이트 백본; 메틸렌이미노 및 메틸렌하이드라지노 백본; 설포네이트 및 설폰아미드 백본; 아미드 백본; 및 혼합 N, O, S 및 CH2 성분 부분을 가지는 기타 백본을 가지는 것을 포함한다. USP 5,034,506; 5,166,315; 5,185,444; 5,214,134; 5,216,141; 5,235,033; 5,264, 562; 5, 264,564; 5,405,938; 5,434,257; 5,466,677; 5,470,967; 5,489,677; 5,541,307; 5,561,225; 5,596, 086; 5,602,240; 5,610,289; 5,602,240; 5,608,046; 5,610,289; 5,618,704; 5,623, 070; 5,663,312; 5,633,360; 5,677,437; 및 5,677,439을 참조(각각은 참조로서 본원에 병합됨).
또한 하나 이상의 치환된 당 부위는, 예컨대, 2'-위치에서 다음 중의 하나를 포함할 수 있다: OH, SH, SCH3, F, OCN, OCH3 OCH3, OCH3 O(CH2)n CH3, O(CH2)n NH2 또는 O(CH2)n CH3, 여기서 n은 1 내지 약 10; Ci 내지 C10은 저급 알킬, 알콕시알콕시, 치환된 저급 알킬, 알카릴 또는 아랄킬; Cl; Br; CN; CF3; OCF3; O-, S-, 또는 N-알킬; O-, S-, 또는 N-알케닐; SOCH3; SO2 CH3; ONO2; NO2; N3; NH2; 헤테로사이클로알킬; 헤테로사이클로알카릴; 아미노알킬아미노; 폴리알킬아미노; 치환된 실릴; RNA 절단기; 리포터기; 인터칼레이터(intercalator); 올리고뉴클레오티드의 약동학적 성질을 향상시키기 위한 기; 또는 올리고뉴클레오티드의 약력학적 성질을 향상시키기 위한 기 및 유사한 성질을 가지는 기타 치환체. 바람직한 변형은 2'-메톡시에톡시 [2'-0-CH2CH2OCH3, 2'-O-(2-메톡시에틸)이라고도 알려짐] (Martin et al., HeIv . Chim . Acta 78:486, 1995)를 포함한다. 다른 바람직한 변형은 2'-메톡시 (2'-0-CH3), 2'-프로폭시 (2'-OCH2 CH2CH3) 및 2'-플로우로 (2'-F)을 포함한다. 또한 유사한 변형은 올리고뉴클레오티드 상의 다른 위치, 특히 3'-말단 뉴클레오티드 상의 당의 3'-위치 및 5'-말단 뉴클레오티드의 5'-위치에 만들어질 수 있다. 또한, 올리고뉴클레오티드는 펜토퓨라노실기 대신에 사이클로부틸과 같은, 당 모방체를 가질 수 있다.
또한, 억제성 핵산은 핵산 염기(nucleobase )(당해 기술 분야에서는 종종 "염기"라고 지칭됨) 변형 또는 치환을 추가적으로 또는 대안적으로 포함할 수 있다. 본원에서 사용되는 "비변형된(unmodified)" 또는 "천연(natural)" 핵산 염기는 아데닌 (A), 구아닌(G), 티민(T), 시토신(C), 및 우라실(U)을 포함할 수 있다. 변형된 핵산 염기는 천연 핵산에서 단지 드물게 또는 일시적으로 발견되는 핵산 염기, 예를 들면, 하이포산틴, 6-메틸아데닌, 5-Me 피리미딘, 특히 5-메틸시토신 (5-메틸-2' 디옥시시토신이라고도 하며 당해 기술분야에서 종종 5-Me-C라고도 함), 5-하이드록시메틸시토신(HMC), 글리코실 HMC, 및 젠토바이오실(gentobiosyl) HMC 뿐만 아니라, 합성 핵산 염기, 예를 들어, 2-아미노아데닌, 2-(메틸아미노)아데닌, 2-(이미다졸릴알킬)아데닌, 2-(아미노알킬아미노)아데닌 또는 기타 헤테로치환 알킬아데닌, 2-티오우라실, 2-티오티민, 5-브로모우라실, 5-하이드록시메틸우라실, 8-아자구아닌, 7-데아자구아닌, N6 (6-아미노헥실)아데닌, 및 2,6-디아미노퓨린을 포함한다. Kornberg, A., DNA Replication, W. H. Freeman & Co., San Francisco, 1980, pp75-77; 및 Gebeyehu et al., Nucl . Acids Res . 15:4513, 1987을 참조. 또한, 당해 기술 분야에서 알려진 "범용(universal)" 염기로, 예컨대, 이노신이 포함될 수 있다. 5-Me-C 치환은 핵산 듀플렉스 안정성을 0.6-1.2<0>C 만큼 증가시키는 것으로 보여지며(Sanghvi, Y. S., in Crooke, S. T. and Lebleu, B., Eds., Antisense Research and Applications, CRC Press, Boca Raton, 1993, pp. 276-278), 현재 선호되는 염기 치환이다.
주어진 올리고뉴클레오티드의 모든 위치에서 균일하게 변형될 필요는 없으며, 실제로 상기 언급한 변형 중 하나 이상이 단일 올리고뉴클레오티드에 병합되거나 올리고뉴클레오티드 내에 단일 뉴크레오시드 내에서도 병합될 수 있다.
일부 구체예에서, 뉴클레오티드 단위의 당 및 뉴클레오티드간 결합 즉, 백본은 신규 기(novel groups)로 치환될 수 있다. 염기 단위들은 적절한 핵산 표적 화합물과의 혼성화를 위하여 유지된다. 그러한 올리고머 화합물, 즉 우수한 혼성화 성질을 가지는 것으로 보여지는 올리고뉴클레오티드 모방체는 펩티드 핵산(PNA)로 지칭된다. PNA 화합물에서, 올리고뉴클레오티드의 당-백본은 아미드를 함유하는 백본, 예를 들면, 아미노에틸글리신 백본으로 치환될 수 있다. 핵산 염기는 유지되며, 백본의 아미드 부분의 아자 질소 원자에 직접적으로 또는 간접적으로 결합된다. PNA 화합물의 제조를 설명한 대표적인 미국 특허는 USP 5,539,082; 5,714,331; 및 5,719,262를 포함하나 이에 한정되지 않으며, 이들의 내용은 참조로서 본원에 병합된다. PNA 화합물에 대한 추가적인 교시는 Nielsen et al, Science 254:1497-1500, 1991에 있을 수 있다.
또한, 억제성 핵산은 하나 이상의 핵산 염기(nucleobase)(당해 기술 분야에서는 간단히 "염기"라고 지칭됨) 변형 또는 치환을 추가적으로 또는 대안적으로 포함할 수 있다. 본원에서 사용되는 "비변형된(unmodified)" 또는 "천연(natural)" 핵산 염기는 퓨린염기 아데닌 (A) 및 구아닌(G)과, 피리미딘 티민(T), 시토신(C), 및 우라실(U)를 포함한다. 변형된 핵산 염기는 기타 합성 및 천연 핵산 염기, 예를 들면, 5-메틸시토신 (5-me-C), 5-하이드록시메틸 시토신, 크산틴, 하이포크산틴, 2-아미노아데닌, 6-메틸, 및 아데닌과 구아닌의 기타 알킬 유도체, 2-프로필 및 아데닌과 구아닌의 기타 알킬 유도체, 2-티오우라실, 2-티오티민, 및 2-티오시토신, 5-할로우라실 및 시토신, 5-프로피닐 우라실 및 시토신, 6-아조 우라실, 시토신 및 티민, 5-우라실 (의사-우라실), 4-티오우라실, 8-할로 , 8-아미노, 8-티올, 8-티오알킬, 8-하이드록실 및 기타 8-치환된 아데닌 및 구아닌, 5-할로, 특히 5-브로모, 5-트리플루오로메틸 및 기타 5-치환된 우라실 및 시토신, 7-메틸쿠아닌 및 7-메틸아데닌, 8-아자구아닌 및 8-아자아데닌, 7-데아자 구아닌, 및 7-데 아자아데닌, 및 3-데아자구아닌, 및 3-데아자아데닌을 포함한다.
또한, 핵산 염기는 USP 3,687,808에 공개된 것, 'The Concise Encyclopedia of Polymer Science And Engineering', pages 858-859, Kroschwitz, J.I., Ed. John Wiley & Sons, 1990에 공개된 것, Englisch et al., Angewandle Chemie, International Edition', 1991, 30, page 613에 공개된 것, 및 Sanghvi, Y. S., Chapter 15, Antisense Research and Applications', pages 289- 302, Crooke, S.T. and Lebleu, B. ea., CRC Press, 1993에 공개된 것을 포함한다. 이러한 핵산 염기 중 소정의 것은 본 발명의 올리고머 화합물의 결합 친화성을 증가시키는데 특히 유용하다. 이것은 2-아미노프로필아데닌, 5-프로피닐 우라실, 및 5-프로피닐시토신을 포함하는, 5-치환된 피리미딘, 6-아자피리미딘, 및 N-2, N-6 및 0-6 치환된 퓨린을 포함한다. 5-메틸시토신 치환은 핵산 듀플렉스 안정성을 0.6-1.2<0>C 만큼 증가시키는 것으로 보여지며(Sanghvi, Y. S., in Crooke, S. T. and Lebleu, B., Eds., Antisense Research and Applications, CRC Press, Boca Raton, 1993, pp. 276-278), 특히 2'-O-메톡시에틸 당 변환과 결합할 때에도, 현재 선호되는 염기 치환이다. 변형된 핵산 염기가 USP 3,687,808 뿐만 아니라 4,845,205; 5,130,302; 5,134,066; 5,175, 273; 5, 367,066; 5,432,272; 5,457,187; 5,459,255; 5,484,908; 5,502,177; 5,525,711; 5,552,540; 5,587,469; 5,596,091; 5,614,617; 5,750,692, 및 5,681,941에 기재되어 있다(이들 각각은 참조로서 본원에 병합되어 있음).
일부 구체예에서, 억제성 핵산은 올리고뉴클레오티드의 활성, 세포 분포, 또는 세포 흡수를 향상시키는 하나 이상의 부위 또는 접합체에 화학적으로 연결된다. 그러한 부위는 콜레스테롤 부위(Letsinger et al., Proc . Natl . Acad . Sci . U.S.A. 86:6553-6556, 1989), 콜산(Manoharan et al., Bioorg . Med . Chem . Lett . 4:1053-1060, 1994), 티오에테르, 예컨대, 헥실-S-트리틸티오(Manoharan et al, Ann . N. Y. Acad . Sci . 660:306-309, 1992; Manoharan et al., Bioorg. Med . Chem . Lett . 3:2765-2770, 1993), 티오콜레스테롤(Oberhauser et al., Nucl . Acids Res. 20, 533-538, 1992), 지방족 쇄, 예컨대, 도데칸디올 또는 운데실 잔기(Kabanov et al., FEBS Lett . 259:327-330, 1990; Svinarchuk et al., Biochimie 75:49- 54, 1993), 인지질, 예컨대, 디-헥사데실-락-글리세롤 또는 트리에틸암모늄 1,2-디-O-헥사데실-락-글리세로-3-H-포스포네이트(Manoharan et al., Tetrahedron Lett . 36:3651-3654, 1995; Shea et al., Nucl . Acids Res.18:3777-3783, 1990), 폴리아민 또는 폴리에틸렌 글리콜 쇄(Mancharan et al., Nucleosides & Nucleotides 14:969-973, 1995), 또는 아다만탄 아세트산(Manoharan et al., Tetrahedron Lett . 36:3651-3654, 1995), 팔미틸 부위(Mishra et al., Biochim . Biophys . Acta 1264: 229-237, 1995), 또는 옥타데실아민 또는 헥실아미노-카르보닐-톡시콜레스테롤 부위(Crooke et al., J. Pharmacol. Exp . Ther . 277:923-937, 1996)과 같은 지질 부위를 포함한다. USP 4,828,979; 4,948,882; 5,218,105; 5,525,465; 5,541,313; 5,545,730; 5,552, 538; 5,578,717, 5,580,731; 5,580,731; 5,591,584; 5,109,124; 5,118,802; 5,138,045; 5,414,077; 5,486, 603; 5,512,439; 5,578,718; 5,608,046; 4,587,044; 4,605,735; 4,667,025; 4,762, 779; 4,789,737; 4,824,941; 4,835,263; 4,876,335; 4,904,582; 4,958,013; 5,082, 830; 5,112,963; 5,214,136; 5,082,830; 5,112,963; 5,214,136; 5, 245,022; 5,254,469; 5,258,506; 5,262,536; 5,272,250; 5,292,873; 5,317,098; 5,371,241, 5,391, 723; 5,416,203, 5,451,463; 5,510,475; 5,512,667; 5,514,785; 5, 565,552; 5,567,810; 5,574,142; 5,585,481; 5,587,371; 5,595,726; 5,597,696; 5,599,923; 5,599, 928 및 5,688,941를 참조(각각은 참조로서 본원에 병합됨).
이러한 부위 또는 접합체는 1차 또는 2차 하이드록실기와 같은 기능기에 공유 결합하는 접합기를 포함할 수 있다. 본 발명의 접합기는 인터칼레이터, 리포터 분자, 폴리아민, 폴리아미드, 폴리에틸렌 글리콜, 폴리에테르, 올리고머의 약력학적 성질을 향상시키는 기, 및 올리고머의 약동학적 성질을 향상시키는 기를 포함한다. 전형적인 접합체기는 콜레스테롤, 지질, 인지질, 비오틴, 페나진, 폴레이트, 페난트리딘, 안트라퀴논, 아크리딘, 플루오르세인, 로다민, 쿠마린, 및 염료를 포함한다. 본 발명의 문맥에서, 약동학적 성질을 향상시키는 기는 흡수를 향상시키고, 열화에 대한 저항을 향상시키고, 및/또는 표적 핵산과의 서열-특이적 혼성화를 강화시키는 기를 포함한다. 본 발명의 문맥에서, 약동학적 성질을 향상시키는 기는 본 발명의 화합물을 흡수, 분배, 대사, 또는 배설을 향상시키는 기를 포함한다. 대표적인 접합체 기는 1992년 10월 23일에 출원된 PCT/US92/09196 및 USP 6,287,860에 공개되어 있으며, 이들은 참조로서 본원에 병합되어 있다.접합체 부위는 헥실-S-트리틸티오, 티오콜레스테롤, 지방족 쇄, 예컨대, 도데칸디올 또는 운데실 잔기, 인지질, 예컨대, 디-헥사데실-락-글리세롤 또는 트리에틸암모늄 1,2-디-O-헥사데실-락-글리세로-3-H-포스포네이트, 폴리아민 또는 폴리에틸렌 글리콜 쇄, 또는 아다만탄 아세트산, 팔미틸 부위, 또는 옥타데실아민 또는 헥실아미노-카르보닐-옥시콜레스테롤 부위과 같은 지질 부위를 포함한다. USP 4,828,979; 4,948,882; 5,218,105; 5,525,465; 5,541,313; 5,545,730; 5,552,538; 5,578,717, 5,580,731; 5,580,731; 5,591,584; 5,109,124; 5,118,802; 5,138,045; 5,414,077; 5,486,603; 5,512,439; 5,578,718; 5,608,046; 4,587,044; 4,605,735; 4,667,025; 4,762,779; 4,789,737; 4,824,941; 4,835,263; 4,876,335; 4,904,582; 4,958,013; 5,082,830; 5,112,963; 5,214,136; 5,082,830; 5,112,963; 5,214,136; 5,245,022; 5,254,469; 5,258,506; 5,262,536; 5,272,250; 5,292,873; 5,317,098; 5,371,241, 5,391,723; 5,416,203, 5,451,463; 5,510,475; 5,512,667; 5,514,785; 5,565,552; 5,567,810; 5,574,142; 5,585,481; 5,587,371; 5,595,726; 5,597,696; 5,599,923; 5,599,928 및 5,688,941을 참조(각각은 참조로서 본원에 병합됨).
본 방법에 유용한 억제성 핵산은 표적 miRNA에 충분히 상보적인, 즉, 충분히 잘 그리고 충분한 특이성으로 혼성화된다. 용어 "상보적인"은 자연적으로 또는 비자연적으로 일어나는 염기 또는 그의 유사체를 포함하는 두 서열 사이에 수소 결합을 통하여 쌍을 이루는 능력을 지칭한다. 예를 들어, 억제성 핵산의 한 위치에서의 염기는 miRNA의 해당 위치에서의 염기와 수소 결합할 수 있으면, 상기 염기들은 그 위치에서 서로 상보적이라고 할 수 있다. 일부 구체예에서, 100% 상보성은 요하지 않는다. 일부 구체예에서, 100% 상보성은 요하지 않는다. 통상적인 방법은 표적 서열에 충분한 특이성으로 결합하는 억제성 핵산을 설계하는데 이용될 수 있다.
소정의 예시적 표적 분절의 특이적 서열이 본원에 제시되어 있지만, 당업자는 이러한 것들이 본 발명의 범위 내에 특정 구체예를 설명하거나 기재하는 것이라고 알 수 있을 것이다. 추가적인 표적 분절은 본 공개물에 있어서 당업자에 의하여 쉽게 확인할 수 있다. 시드 서열(seed sequence) 내의 또는 여기에 바로 인접한 일련의 적어도 5개의 연속 뉴클레오티드를 포함하는 5, 6, 7, 8, 9, 10개, 또는 그 이상의 뉴클레오티드 길이의 표적 분절은 또한 표적화에 적절할 수 있다고 여겨진다. 일부 구체예에서, 표적 분절은 하나의 시드 서열의 5'-말단으로부터의 적어도 5개의 연속된는 뉴클레오티드를 포함하는 서열을 포함할 수 있다(잔여 뉴클레오티드는 시드 서열의 5'-말단의 업스트림에서 바로 시작하는 동일한 RNA의 연속적인 열이며, 억제성 핵산이 약 5개 내지 약 30개의 뉴클레오티드를 포함할때가지 계속됨). 일부 구체예에서, 표적 분절은 하나의 시드 서열의 3'-말단으로부터의 적어도 5개의 연속되는 뉴클레오티드를 포함하는 서열을 포함하는 RNA 서열로 나타낸다(잔여 뉴클레오티드는 표적 서열의 3'-말단의 다운 스트림에서 바로 시작하는 동일한 miRNA의 연속적인 열이며, 억제성 핵산이 약 5개 내지 약 30개의 뉴클레오티드를 포함할때가지 계속됨). 당업자는 과도한 실험 없이, 본원에 제공된 서열을 이용하여 표적에 더 선호되는 영역을 확인할 수 있다. 일부 구체예에서, 표적(예, 표적 miRNA, 예, 성숙한 또는 전구체 hsa-miR-155 또는 표적 mRNA)에 존재하는 적어도 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 또는 25개의 연속하는 뉴클레오티드에 상보적인 서열을 포함한다.
일단 하나 이상의 표적 영역, 분절, 또는 위치가 확인되면, 표적에 충분히 상보적인, 즉 충분한 특이성(즉, 다른 비-표적 RNA에 본질적으로 결합하지 않음)으로 충분히 혼성화되는 억제성 핵산 화합물이 선택되어, 원하는 효과를 준다.
본 발명의 문맥에서, 혼성화는, 상보적 뉴클레오티드 또는 뉴클레오티드 염기 사이에, Watson-Crick, Hoogsteen 또는 reversed Hoogsteen 수소 결합일 수 있는, 수소 결합을 의미한다. 예를 들면, 아데닌과 티민은 수소 결합의 형성을 통하여 쌍을 이루는 상보적인 핵산 염기이다. 본원에서 사용되는 용어 상보적은 뉴클레오티드 사이에 정밀한 쌍을 이루는 능력을 지칭한다. 예를 들면, 올리고뉴클레오티드의 소정 위치에서의 뉴클레오티드가 miRNA 분자 또는 mRNA 분자의 동일한 위치에서의 뉴클레오티드와 수소 결합을 할 수 있다면, 억제성 핵산 및 miRNA 또는 mRNA는 그 위치에서 서로 상보적이라 여겨진다. 각 분자에서 충분히 많은 해당 위치가 수소 결합으로 서로 결합되는 뉴클레오티드가 차지하고 있을 때, 억제성 핵산 및 miRNA 또는 mRNA는 서로 상보적이다 따라서, "특이적으로 혼성화할 수 있는" 및 "상보적인"은 안전하고 특이적인 결합이 억제성 핵산 및 miRNA 표적 사이에 일어나도록 하는 충분한 정도의 상보성 또는 정밀한 쌍합(pairing)을 가리킬 때 이용되는 단어이다. 예를 들면, 억제성 핵산의 한 위치에서의 염기가 miRNA 또는 mRNA의 해당 위치에서의 염기와 수소 결합할 수 있으면, 상기 염기들은 그 위치에서 서로 상보적이라고 할 수 있다. 100% 상보성을 요하지는 않는다.
상보적인 핵산 서열은 특이적으로 혼성화할 수 있기 위하여 그의 표적 핵산의 서열과 100% 상보적일 필요는 없다고 이해된다. 표적 miRNA 또는 mRNA 분자에 대한 서열이 결합이 표적 miRNA 또는 mRNA 분자의 정상 기능을 간섭하여 발현 또는 활성의 손실을 야기할 때, 본 방법의 목적을 위한 상보적 핵산 서열은 특이적으로 혼성화할 수 있는 것이고, 특이적 결합을 원하는 조건 하에서, 예를 들면, 생체내 분석 또는 치료적 처우의 경우에는 생리적 조건 하에서, 그리고 시험관내 분석의 경우에는 상기 분석이 적절히 엄격한 조건하에서 행해질 수 있는 조건 하에서, 비-표적 RNA 서열에 대한 서열의 비-특이적 결합을 피하기 위한 충분한 정도의 상보성이 있다. 예를 들면, 엄격한 염 농도는 보통 약 750 mM 이하의 NaCl의 트리소듐 시트레이트, 바람직하게는 약 500 mM 이하의 트리소듐 시트레이트, 더 바람직하게는 약 250 mM 이하의 트리소튬 시트레이트일 것이다. 낮은 엄격 혼성화는 유기 용제, 예를 들면 포름아미드의 부재하에서 얻을 수 있는데 반하여, 높은 엄격 혼성화는 적어도 약 35% 포름아미드, 더 바람직하게는 적어도 약 50% 포름아미드의 존재하에서 얻을 수 있다. 엄격 온도 조건은 보통은 적어도 약 30℃, 더 바람직하게는 적어도 약 37℃, 및 가장 바람직하게는 적어도 42℃의 온도일 것이다. 혼성화 시간, 도데실 황산나트륨(SDS)과 같은 세제의 농도, 및 캐리어 DNA의 포함 또는 배제와 같은 다양한 추가적인 파라미터가 당업자에게 잘 알려져 있다. 필요에 따라 이러한 다양한 조건들을 조합하여 다양한 레벨의 엄격함이 달성된다. 바람직한 구체예에서, 혼성화는 750 mM NaCl, 75 mM 트리소듐 시트레이트, 및 1% SDS에서 30℃에서 일어날 것이다. 더 바람직한 구체예에서, 500 mM NaCl, 50 mM 트리소듐 시트레이트, 1% SDS, 35% 포름아미드, 및 100 ㎍/㎖ 변성 연어 정자 DNA(salmon sperm DNA, ssDNA)에서 37℃에서 일어날 것이다 가장 바람직한 구체예에서, 250 mM NaCl, 25 mM 트리소듐 시트레이트, 1% SDS, 50% 포름아미드, 및 200 ㎍/㎖ ssDNA에서 42℃에서 일어날 것이다 이러한 조건들에 유용한 변이는 당업자에게는 명백할 것이다.
대부분의 적용에 있어서, 혼성화에 이은 세척 단계 또한 엄격함에 있어서 변화될 것이다. 세척 엄격 조건은 염 농도 및 온도에 의하여 정의될 수 있다. 상기와 같이, 세척 엄격성은 염 농도를 감소시키고 온도를 증가시킴으로써 증가될 수 있다. 예를 들면, 세척 단계를 위한 엄격한 염 농도는 바람직하게는 약 30 mM 미만의 NaCl 및 3 mM 트리소듐 시트레이트이며, 가장 바람직하게는 약 15 mM 미만의 NaCl 및 1.5 mM 트리소듐 시트레이트일 것이다. 세척 단계를 위한 엄격 온도 조건은 보통은 적어도 약 25℃, 더 바람직하게는 적어도 약 43℃, 및 가장 바람직하게는 적어도 68℃의 온도일 것이다. 바람직한 구체예에서, 세척 단계는 30 mM NaCl, 3 mM 트리소듐 시트레이트, 및 0.1% SDS에서 25℃에서 일어날 것이다. 더 바람직한 구체예에서, 세척 단계는 15 mM NaCl, 1.5 mM 트리소듐 시트레이트, 및 0.1% SDS에서 42℃에서 일어날 것이다. 더 바람직한 구체예에서, 세척 단계는 15 mM NaCl, 1.5 mM 트리소듐 시트레이트, 및 0.1% SDS에서 68℃에서 일어날 것이다. 이러한 조건들에 유용한 변이가 당업자에게는 명백할 것이다. 혼성화 기술은 당업자에게 잘 알려져 있으며, 예를 들면, Benton and Davis (Science 196:180, 1977); Grunstein and Hogness (Proc . Natl . Acad . Sci . U.S.A. 72:3961, 1975); Ausubel et al. (Current Protocols in Molecular Biology, Wiley Interscience, New York, 2001); Berger and Kimmel (Guide to Molecular Cloning Techniques, 1987, Academic Press, New York); and Sambrook et al., Molecular Cloning : A Laboratory Manual, Cold Spring Harbor Laboratory Press, New York에 기재되어 있다.
일반적으로, 본원에 기재된 방법에 유용한 억제성 핵산은 표적 핵산 내의 표적 영역에 적어도 80% 서열 상보성, 예를 들면, miRNA 내의 표적 영역에 90%, 95%, 또는 100% 서열 상보성이 있다. 예를 들면, 안티센스 올리고뉴클레오티드의 20개의 핵산 염기 중 18개가 상보성이어서 표적 영역에 특이적으로 혼성화하는 안티센스 화합물은 90% 상보성을 나타낸다. 표적 핵산의 영역에 대한 억제성 핵산의 퍼센트 상보성은 BLAST(basic local alignment search tools) 프로그램을 이용하여 통상적으로 결정할 수 있다(Altschul et al., J. Mol . Biol . 215:403-410, 1990; Zhang and Madden, Genome Res . 7:649-656, 1997). miRNA 또는 mRNA에 혼성화하는 본 발명의 안티센스 및 기타 화합물은 통상적인 실험을 통하여 확인한다. 일반적으로 억제성 핵산은 그의 표적에 특이성을 가지고 있어야 하는데, 즉 의도된 표적 이외의 전사체에 직접적으로 결합하거나 그 전사체의 발현 레벨에 직접적으로 유의미하게 영향을 주어서는 안 된다.
억제성 핵산에 대한 추가 내용은 US2010/0317718 (안티센스 올리고); US2010/0249052 (이중 가닥 리보핵산(dsRNA)); US2009/0181914 및 US2010/0234451 (LNAs); US2007/0191294 (siRNA 유사체); US2008/0249039 (변형 siRNA); 및 WO2010/129746 및 WO2010/040112 (억제성 핵산)을 참조.
안티센스
안티센스 올리고뉴클레오티드는 전형적으로, 표적에 결합하거나 전사, 번역, 또는 스플라이싱(splicing)의 정도에 발현을 중단시킴으로써, DNA 또는 RNA 표적의 발현을 블록킹하도록 설계된다. 본 발명의 안티센스 올리고뉴클레오티드는 엄격한 조건에서 표적 마이크로RNA 또는 표적 염증 마커 RNA에 혼성화하도록 설계된 상보적 핵산 서열이다. 따라서, 표적에 충분히 상보적인, 즉 충분한 특이성으로 충분히 잘 혼성화하여 원하는 효과를 주는 올리고 뉴클레오티드를 선택한다.
변형 염기/잠금 핵산(
Modified
Base
/
locked
nucleic
acids
,
LNAs
)
일부 구체예에서, 본원에 기재된 방법에 사용되는 억제성 핵산은 하나 이상의 변형 결합 또는 염기를 포함한다. 변형 염기는 포스포로티오에이트, 메틸포스포네이트, 펩티드 핵산, 또는 잠금 핵산(LNA) 분자를 포함한다. 바람직하게는, 변형 핵산은 [알파]-L-LNA를 포함하는 잠금 핵산 분자이다. LNA는 리보핵산 유사체를 포함하는데, 여기서 리보스 고리는 2'-산소와 4'-탄소 사이의 메틸렌 브릿지에 의해 "잠겨져" 있는, 즉 적어도 LNA 단량체를 포함하는 올리고뉴클레오티드, 즉 하나의 2'-O,4'-C-메틸렌-β-D-리보퓨라노실 뉴클레오티드이다. LNA 염기는 표준 Watson-Crick 염기쌍을 형성하나, 상기 잠금 구조(locked configuration)는 염기 쌍 반응(base pairing reaction)의 속도와 안정성을 증가시킨다(Jepsen et al., Oligonucleotides 14:130-146, 2004). 또한, LNA는 DNA에 비하여 RNA에 대하여 염기쌍 친화성을 증가시킨다. 이러한 성질은, miRNA용 녹다운 기구(knockdown tool)로서, 및 표적 mRNA 또는 기타 RNA, 예를 들면, 본원에 기재된 miRNA 및 mRNA에 대한 안티센스 올리고뉴클레오티드로서, 형광 제자리 혼성화(fluorescence in situ hybridization, FISH) 및 비교 게놈 혼성화(comparative genomic hybridization)를 위한 프로브로서, RNA를 특히 유용하게 한다.
LNA 분자는, 각 가닥(each strand)에서, 10-30 개, 예를 들면, 12-24개, 예를 들면, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 또는 30개의 뉴클레오티드를 포함하는데, 여기서 하나의 가닥은 본질적으로 miRNA 또는 mRNA의 표적 영역에, 예컨대 적어도 80% (또는 그 이상, 예컨대, 85%, 90%, 95%, 또는 100%) 동일하고, 예를 들면, 3, 2, 1, 또는 0개의 미스매칭된 뉴클레오티드를 포함한다. LNA 분자는 당해 기술 분야에서 알려진 방법을 이용하여 화학적으로 합성될 수 있다.
LNA 분자는 당해 분야에서 알려진 방법을 이용하여 설계될 수 있는데, 많은 알고리즘이 공지되어 있으며 상업적으로 입수가 가능하다(예, 인터넷 상으로, 예를 들면, exiqon.com) 예를 들면, You et al., Nuc . Acids . Res . 34:e60, 2006; McTigue et al., Biochemistry 43:5388-405, 2004; 및 Levin et al., Nucl . Acids . Res . 34:e142, 2006을 참조. 예를 들면, 안티센스 올리고를 설계하는데 사용되는 것과 유사한, "유전자 보행(gene walk)" 방법이 LNA의 억제 활성을 최적화하는데 이용될 수 있다; 예를 들면, 표적 miRNA 또는 mRNA의 길이를 포괄하는 10 내지 30개의 뉴클레오티드을 가지는 일련의 올리고뉴클레오티드가 제조되어 활성을 테스트할 수 있다. 선택적으로는, 예컨대 5개 내지 10개의 뉴클레오티드 또는 그 이상의 갭이 LNA들 사이에 남겨져 합성되어 테스트되는 올리고뉴클레오티드의 수를 줄일 수 있다. GC 함량은 바람직하게는 약 30-60% 사이이다. LNA를 설계하기 위한 일반적인 가이드라인은 당해 기술 분야에 공지되어 있는데, 예를 들면, LNA 서열은 다른 LNA 서열과 매우 긴밀하게 결합하는데, 따라서 LNA 내에서의 유의미한 상보성을 회피하는 것이 바람직하다. 셋 이상의 Gs 또는 Cs, 또는 4개가 넘는 LNA 잔기의 연속적인 실행은 가능하면 피해야 한다(예를 들면, 매우 짧은(예, 약 9-10 nt) 올리고뉴클레오티드로서는 불가능할 수 있음). 일부 구체예에서, LNA는 xylo-LNA이다.
일부 구체예에서, LNA 분자는 miRNA의 특정 영역을 표적화하도록 설계될 수 있다. 예를 들면, 특정 기능 영역, 예컨대, 시드 서열을 포함하는 영역이 표적화될 수 있다. 대안적으로 또는 추가적으로, 고도로 보존된 영역(highly conserved regions)이, 예컨대, 영장류(예, 인간) 및 설치류(예, 마우스)와 같은 이질적인 종들의 서열을 정렬가ㅗ 높은 동일성 정도를 가진 영역을 찾아서 확인된 영역을 표적화할 수 있다. 퍼센트 동일성은 BLAST(basic local alignment search tools) 프로그램, 예를 들면, 디폴트 파라미터를 이용하여 통상적으로 결정할 수 있다(Altschul et al., J. Mol . Biol . 215:403-410, 1990; Zhang and Madden, Genome Res . 7:649-656, 1997).
LNA에 관한 추가적인 정보는 USP 6,268,490; 6,734,291; 6,770,748; 6,794,499; 7,034,133; 7,053,207; 7,060,809; 7,084,125; 및 7,572,582; 및 US 공개번호 2010/0267018; 2010/0261175; 및 2010/0035968; Koshkin et al., Tetrahedron 54:3607-630, 1998; Obika et al., Tetrahedron Lett . 39:5401-404, 1998; Jepsen et al., Oligonucleotides 14:130-146 , 2004; Kauppinen et al., Drug Disc . Today 2(3):287-290, 2005; 및 Ponting et al., Cell 136(4):629-641, 2009, 및 본원에 인용된 문헌을 참조.
또한, USSN 61/412,862도 참조하며, 이의 내용은 그 전체가 본원에 참조로서 병합된다.
안타고미르(
Antagomirs
)
일부 구체예에서, 안티센스는 안타고미르이다. 안타고미르는 마이크로RNA(예, 표적 hsa-miR-155)을 표적화하는 화학적으로 변형된 안티센스 올리고뉴클레오티드이다. 예를 들면, 본원에 기재된 방법에 사용되는 안타고미르는, 약 12개 내지 25개의 뉴클레오티드, 바람직하게는 15개 내지 23개의 뉴클레오티드의 miRNA 표적 서열에 혼성화하도록 충분히 상보적인 뉴클레오티드 서열을 포함할 수 있다.
일반적으로, 안타고미르는, 예컨대, 3'-말단부의 콜레스테롤 부위를 포함할 수 있다. 일부 구체예에서, 안타고미르는 RNA 보호 및, 조직 및 세포 흡수 향상과 같은 약동학적 성질을 위하여 , 다양한 변형을 포함할 수 있다. 예를 들면, 안티센스 올리고와 관련하여 상기에서 검토된 변형에 더하여, 안타고미르는 당 및/또는 포스포로티오에이트 백본의 하나 이상의 완전한 또는 부분적인 2'-O-메틸화를 가질 수 있다. 포스포로티오에이트 변형은 RNA 활성을 막고, 그의 친유성은 조직 흡수를 향상시키는데 기여한다. 일부 구체예에서, 안타고미르는 6개의 포스포로티오에이트 백본 변형을 포함할 수 있다; 2개의 포스포로티오에이트는 5'-말단에 있고 4개의 포스포로티오에이트는 3'-말단에 위치함. 예를 들면, Krutzfeldt et al., Nature 438:685-689, 2005; Czech, N. Engl . J. Med . 354:1194-1195, 2006; Robertson et al., Silence 1:10, 2010; Marquez and McCaffrey, Human Gene Ther . 19(1):27-38, 2008; van Rooij et al., Circ. Res . 103(9):919-928, 2008; 및 Liu et al., Int . J. Mol . Sci . 9:978-999, 2008을 참조.
또한, 본 방법에 유용한 안타고미르는 그의 길이가, 혹은 안타고미르를 구성하는 뉴클레오티드의 수가 변할 수 있다. 일반적으로, 안타고미르는 최적의 기능을 위하여 20개 내지 21개의 뉴클레오티드 길이를 가지며, 이 크기는 대부분의 성숙한 마이크로RNA의 크기와 부합된다. 안타고미르는 그의 표적에 특이성을 가지고 있어야 하는데, 즉 의도된 표적 이외의 전사체에 직접적으로 결합하거나 그 전사체의 발현 레벨에 직접적으로 유의미하게 영향을 주어서는 안 된다.
일부 구체예에서, 억제성 핵산은 잠겨 있으며, 콜레스테롤 부위(예, 잠금 안타고미르)를 포함한다.
siRNA
일부 구체예에서, 표적 miRNA 또는 표적 mRNA에 상보적인 핵산 서열은 간섭 RNA일 수 있으며, 이는 짧은 간섭 RNA("siRNA") 또는 짧은 헤어핀 RNA("shRNA")를 포함하나 이에 제한되지 않는다. 간섭 RNA를 구축하기 위한 방법은 당해 기술분야에 잘 공지되어 있다. 예를 들면, 간섭 RNA는 두 개의 이질적인 올리고뉴클레오티드로부터 조립될 수 있는데, 하나의 가닥은 센스 가닥이고 다른 하나의 가닥은 안티센스 가닥이다. 이 때, 안티센스 및 센스 가닥은 자기-상보적이고(즉, 각 가닥은 다른 가닥의 뉴클레오티드 서열에 상보적인 뉴클레오티드 서열을 포함하고, 예를 들면 안티센스 가닥과 센스 가닥은 듀플렉스 또는 이중 가닥 구조를 형성함); 안티센스 가닥은 표적 핵산 분자 또는 이의 일부(즉, 원하지 않는 유전자)의 뉴클레오티드 서열에 상보적인 뉴클레오티드 서열을 포함하고 센스 가닥은 표적 핵산 분자 또는 이의 일부에 해당하는 뉴클레오티드 서열을 포함한다. 대안적으로, 간섭 RNA는 단일 올리고뉴클레오티드로부터 조립될 수 있는데, 자기-상보적 센스 및 안티센스 영역은 핵산계 또는 비핵산계 링커에 의하여 연결된다. 간섭 RNA는, 자기-상보적 센스 및 안티센스 영역을 가지는 듀플렉스, 비대칭 듀플렉스, 헤어핀, 또는 비대칭 헤어핀 2차 구조를 가지는데, 여기서 안티센스 영역은 별도의 표적 핵산 분자 또는 이의 일부의 뉴클레오티드 서열에 상보적인 뉴클레오티드 서열을 포함하고 센스 영역은 표적 핵산 분자 또는 이의 일부에 해당하는 뉴클레오티드 서열을 가진다. 간섭은 두개 이상의 루프 구조와 자기 상보적인 센스 및 안티센스 영역을 포함하는 줄기(stem)를 가지는 환형 단일 가닥 폴리뉴클레오티드일 수 있는데, 여기서 안티센스 영역은 표적 핵산 분자 또는 이의 일부의 뉴클레오티드 서열에 상보적인 뉴클레오티드 서열을 포함하고 센스 영역은 표적 핵산 분자 또는 이의 부분에 해당하는 뉴클레오티드 서열을 가지며, 또한, 상기 환형 폴리뉴클레오티드는 생체내 또는 시험관내에서 처리되어 RNA 간섭을 매개할 수 있는 활성 siRNA를 생성할 수 있다.
일부 구체예에서, 간섭 RNA 코딩 영역은 센스 영역, 안티센스 영역, 및 루프 영역을 가지는 자기-상보적 RNA 분자를 암호화한다. 바람직하게 표현한다면, 그러한 RNA 분자는 "헤어핀" 구조를 형성하며, 본원에서 "shRNA"로 지칭된다. 루프 영역은 일반적으로 약 2개와 약 10개 사이의 뉴클레오티드 길이를 가진다. 일부 구체예에서, 루프 영역은 약 6개 내지 약 9개 뉴클레오티드 길이를 가진다. 일부 구체예에서, 센스 영역 및 안티센스 영역은 약 15개와 약 20개 사이의 뉴클레오티드 길이를 가진다. 전사 후 처리(post-transcriptional processing)에 이어서, 짧은 헤어핀 RNA는, RNase III 계열인 다이서(Dicer) 효소에 매개되는 절단에 의하여 siRNA로 전환된다. 이 때, siRNA는 상동성을 공유하는 유전자의 발현을 저해할 수 있다. 상세한 것은 Brummelkamp et al., Science 296:550-553, 2002; Lee et al., Nature Biotechnol ., 20, 500-505, 2002; Miyagishi and Taira, Nature Biotechnol . 20:497-500, 2002; Paddison et al., Genes & Dev . 16:948-958, 2002; Paul, Nature Biotechnol. 20, 505-508, 2002; Sui, Proc . Natl . Acad . Sci . U.S.A., 99(6):5515-5520, 2002; Yu et al., Proc . Natl . Acad. Sci . U.S.A. 99:6047-6052, 2002을 참조.
siRNA에 의하여 가이드되는 표적 RNA 절단 반응은 고도로 서열 특이적이다. 일반적으로, 표적 핵산의 일부(즉, 표적 miRNA 또는 mRNA의 시드 서열을 포함하는 표적 영역)와 동일한 뉴클레오티드 서열을 포함하는 siRNA은 저해를 위하여 바람직하다. 그러나, siRNA와 표적 유전자 사이의 100% 서열 동일성은 본 발명을 실시하는데 요하지 않는다. 따라서, 본 발명은, 유전자 돌연변이, 변형 다형성(strain polymorphism), 또는 진화 분기(evolutionary divergence)로 인하여 예측될 수 있는 서열 변형을 허용할 수 있는 장점이 있다. 예를 들면, 표적 서열에 비하여 삽입, 결실, 및 단일점 돌연변이가 있는 siRNA 서열도 저해에 있어서 효과적이라도 밝혀졌다. 대안적으로, 뉴클레오티드 유사체 치환 또는 삽입이 있는 siRNA 서열은 저해에 있어서 효과적일 수 있다. 일반적으로, siRNA는 그의 표적에 특이성을 가지고 있어야 하는데, 즉 의도된 표적 이외의 전사체에 직접적으로 결합하거나 그 전사체의 발현 레벨에 직접적으로 유의미하게 영향을 주어서는 안된다.
리보자임(
Ribozymes
)
트랜스-절단 효소적 핵산 분자(Trans-cleaving enzymatic nucleic acid molecules)도 이용될 수 있는데, 인간 질환의 치료제로서 유망한 것으로 보인다(Usman & McSwiggen, Ann . Rep. Med . Chem . 30:285-294, 1995; Christoffersen and Marr, J. Med . Chem . 38:2023-2037, 1995). 효소적 핵산 분자는 세포 RNA의 배경에서 특이저인 miRNA 또는 mRNA 표적을 절단하도록 설계될 수 있다. 그러한 절단 이벤트는 miRNA 또는 mRNA를 비기능적이게 한다.
일반적으로, RNA 절단 활성이 있는 효소적 핵산은 표적 RNA에 첫 번째로 결합함으로써 작용한다. 그러한 결합은 표적 RNA를 절단하도록 작용하는 분자의 효소 부위에 아주 가까운 곳에서 지지되는 효소적 핵산의 표적 결합부를 통하여 일어난다. 따라서, 효소적 핵산은 우선 상보적 염기 페어링(pairing)을 통하여 표적 RNA를 인지한 후 결합하며, 일단 정확한 위치에 결합되면, 효소적으로 작용하여 표적 RNA를 절단한다. 그러한 표적 RNA의 전략적 절단은 그의 활성을 손상시키다. 효소적 핵산은 그의 RNA 표적에 결합하여 절단한 후에, 그 RNA로부터 이탈되어 또 다른 표적을 탐색하며, 새로운 표적에 결합하고 절단하는 것을 반복적으로 할 수 있다.
시험관 내 선택(진화) 전략(Orgel, Proc . R. Soc . London , B 205:435, 1979)과 같은 여러 접근법을 이용하여, 포스포디에스테르 링키지 및 아미드 링키지의 클리비지와 리게이션과 같은, 다양한 반응을 촉매화할 수 있는 새로운 핵산 효소를 진화시킨다(Joyce, Gene, 82, 83-87, 1989; Beaudry et al., Science 257, 635-641, 1992; Joyce, Scientific American 267, 90-97, 1992; Breaker et al., TIBTECH 12:268, 1994; Bartel et al., Science 261 :1411-1418, 1993; Szostak, TIBS 17, 89-93, 1993; Kumar et al., FASEB J., 9:1183, 1995; Breaker, Curr . Op . Biotech ., 1:442, 1996).촉매 활성에 최적인 리보자임의 개발은 유전자 발현을 조절하는 목적을 위하여 RNA-절단 리보자임을 이용하는 어떠한 전략에도 크게 기여할 것이다. 망치머리 리보자임(hammerhead ribozyme)은, 예를 들면, 포화 농도(10 mM)의 Mg2 + 보조인자(cofactor)의 존재하에 약 1 min-1의 효소 속도(kcat)로 기능한다. 인공적인 "RNA 리가제" 리보자임은 약 100 min-1의 속도로 해당하는 자기-변형 반응을 촉매화하는 것으로 보인다. 또한, DNA로 이루어진 기질 결합 팔(arms)을 가지는 소정의 변형된 망치머리 리보자임이 100 min-1에 가까운 중복 턴-오버 속도(multiple turn-over rates)로 RNA 절단을 촉매화하는 것으로 알려져 있다.
센스 핵산(
Sense
Nucleic
Acids
)
본원에 기재된 치료 방법에 유용한 제제는 표 2, 4, 6, 8, 10, 13, 15, 17, 또는 19에 열거된 마이크로RNA(예, 성숙한 마이크로RNA 또는 전구체 마이크로RNA) 중 임의의 하나의 발현 또는 활성을 증가시키거나, 표 21에 열거된 염증 마커를 암호화하는 mRNA(표적 mRNA) 중 임의의 하나의 발현 또는 활성을 증가시키는 센스 핵산 분자를 포함한다. 센스 핵산은 표 2, 4, 6, 8, 10, 13, 15, 17, 또는 19에 열거된 마이크로RNA(예, 성숙한 마이크로RNA 또는 전구체 마이크로RNA) 중 임의의 하나의 서열 또는 표 21에 열거된 mRNA 중 임의의 하나의 서열과 적어도 80% (예, 적어도 90%, 95%, 96%, 97%, 98%, 99%, 또는 100%) 동일한 서열을 포함할 수 있다. 센스 핵산은 본원에 기재된 변형(예, 백본 변형, 핵산 염기 변형, 당 변형, 또는 하나 이상의 접합 분자) 중 하나 이상을 제한 없이 포함할 수 있다. 센스 핵산을 제조하고 투여하는 방법은 당해 기술 분야에 공지되어 있다. 센스 핵산을 제조하고 이용하는 추가의 방법은 본원에 기재되어 있다.
억제성
핵산 및 센스 핵산의 제조 및 이용(
Making
and
Using
Inhibitory
Nucleic
Acids
and
Sense
Nucleic
Acids
)
본원에 기재된 방법을 실시하는데 이용되는 핵산 서열은, RNA, cDNA, 게놈 DNA, 벡터, 바이러스, 또는 이들의 하이브리드이거나, 다양한 소스로부터, 유전자 공학적으로, 증폭적으로, 및/또는 발현적으로/유전자 재조합적으로 분리할 수 있다. 재조합 핵산 서열은 희망하는 활성을 위하여 개별적으로 분리하거나 클로닝되거나 시험할 수 있다. 임의의 재조합 발현 시스템은, 예를 들면, 생체내, 박테리아, 곰팡이, 포유류, 효모, 곤충, 또는 식물 세포 발현 시스템을 포함하여 이용될 수 있다.
본 발명의 핵산 서열(예, 본원에 기재된 억제성 핵산 또는 센스 핵산 중 임의의 하나)은 운반 벡터에 삽입되어, 벡터 내에서 전사 단위로 발현될 수 있다. 재조합 벡터는 DNA 플라스미드 또는 바이러스 벡터일 수 있다. 예를 들어, Sambrook et al. (Molecular Cloning: A Laboratory Manual. (1989)), Coffin et al. (Retroviruses. (1997)) 및 "RNA Viruses: A Practical Approach" (Alan J. Cann, Ed., Oxford University Press, (2000))에 기재되어 있는 바와 같이, 벡터 구조체는 PCR, 올리고뉴클레오티드 합성, 제한 엔도뉴클레아제 분해, 결찰, 형질 전환, 플라스미드 정제, 및 DNA 시퀀싱의 표준 기술들을 제한없이 포함하여, 당해 기술분야에서 알려진 임의의 적절한 유전 공학 기술을 이용하여 생성할 수 있다.
당업자에게 명백하듯이, 본 발명의 핵산을 세포에 운반하기 위한 적절한 벡터를 다양하게 입수할 수 있다. 핵산을 운반하기 위한 적절한 벡터를 선택하고 선택된 발현 벡터를 세포에 삽입하기 위한 조건을 최적화하는 것은 과도한 실험이 없이도 당업자의 범위내에 있다. 바이러스 벡터는 패키징 세포에서 재조합 바이러스를 생산하기 위한 서열을 가지는 뉴클레오티드 서열을 포함한다. 본 발명의 핵산을 발현하는 바이러스 벡터는, 레트로바이러스, 렌티바이러스, 헤르페스 바이러스, 아데노바이러스, 아데노-관련 바이러스, 수두 바이러스, 또는 알파바이러스를 포함하나 이에 제한 되지 않는 것을 포함하는 바이러스 백본에 기반하여 구축할 수 있다. 본 발명의 핵산을 발현시킬 수 있는 재조합 벡터(예, 바이러스 벡터)는 본원에 기재된 바와 같이 운반될 수 있으며, 표적 세포에 지속할 수 있다(예, 안정한 형질전환체). 예를 들면, 그러한 재조합 벡터(예, hsa-miR-155에 상보적인 안티센스 올리고머를 발현하는 재조합 벡터)를 대상체의 뇌하수체에 투여(예, 주사 또는 침투)할 수 있다(예, 두개내 주사, 뇌실질 주사, 심실내 주사, 및 척수강내 주사, 예를 들어 Bergen et al., Pharmaceutical Res . 25:983-998, 2007을 참조). 본원에 기재된 핵산 중 임의의 하나를 발현하는데 사용되는 많은 예시적인 재조합 바이러스 벡터도 Bergen et al. (앞서 언급)에 기재되어 있다. 재조합 바이러스 벡터의 추가적인 예들은 당해 기술 분야에 공지되어 있다.
본원에서 제공된 핵산(예, 억제성 핵산)은, 대상체에 투여하기 전에(예, 대상체의 뇌척수액에 주사 또는 침투), 추가적으로 하나 이상의 양이온성 고분자(예, 폴리-L-라이신 및 폴리(에틸렌이민), 양이온성 지질 (예, 1,2-디올에오일-3-트리메틸암모늄 프로폰 (DOTAP), N-메틸-4-(디올레일)메틸피리디늄, 및 3β-[N-(N',N'-디메틸아미노에탄)-카바모일] 콜레스테롤), 및/또는 나노입자(예, 양이온성 폴리부틸 시아노아크릴레이트 나노입자, 실리카 나노입자, 또는 폴리에틸렌 글리콜계 나노입자)와 착화할 수 있다. 양이온성 고분자, 양이온성 지질, 및 핵산의 치료적 운반을 위한 나노입자의 추가 예들은 당해 기술 분야에 공지되어 있다. 또한, 핵산의 치료적 운반은 폴리에틸렌이민/DNA 복합체의 척수강내 주사에 의하여 달성할 수 있다(Wang et al., Mol . Ther . 12:314-320, 2005). 본원에 기재된 핵산의 운반 방법은 비제한적이다. 대상체로 핵산을 치료적으로 운반하는 추가적인 방법이 당해 기술 분야에 공지되어 있다.
일부 구체예에서, 억제성 핵산(예, hsa-miR-155을 표적화하는 하나 이상의 억제성 핵산)을 전신적으로(예, 정맥내, 동맥내, 근육내, 피하, 또는 복강내), 또는 경막내로(예, 경막외 투여) 투여 할 수 있다. 일부 구체예에서, 억제성 핵산은 예를 들어 하나 이상의 양이온성 지질과 착화하여 조성물 내에 포함되어 투여될 수 있다. 하나 이상의 억제성 핵산(예, 본원에 기재된 억제성 핵산 중 임의의 하나)을 투여하는데 사용될 수 있는 양이온성 지질의 비제한적 예는, Lipofectamine, WO 97/045069, 및 US 공개번호 2012/0021044, 2012/0015865, 2011/0305769, 2011/0262527, 2011/0229581, 2010/0305198, 2010/0203112, 및 2010/0104629 (각각은 본원에 참조로서 병합됨)에 기재된 양이온성 지질 분자를 포함한다. 본 발명을 실시하는데 사용되는 핵산 서열은 잘 알려진 화학 합성 기술에 의하여 시험관내에서 합성할 수 있으며, 이는 예를 들어 Adams, J. Am . Chem . Soc . 105:661, 1983; Belousov, Nucleic Acids Res . 25:3440-3444, 1997; Frenkel, Free Radic . Biol . Med . 19:373-380, 1995; Blommers, Biochemistry 33:7886-7896, 1994; Narang, Meth . Enzymol . 68:90, 1994; Brown, Meth . Enzymol . 68:109, 1979; Beaucage, Tetra . Lett . 22:1859, 1981; 및 U.S. Patent No. 4,458,066에 기재되어 있다.
본 발명이 핵산 서열은 변형, 예컨대, 뉴클레오티드 변형의 함입에 의하여, 핵산 분해에 대하여 안정화될 수 있다. 예를 들면, 본 발명의 핵산 서열은 뉴클레오티드 서열의 5'- 또는 3'- 말단에 적어도, 제1, 제2, 또는 제3 뉴클레오티드간 결합이 있는 포스포로티오에이트를 포함한다. 또 다른 예로서, 핵산 서열은 2'-변형된 뉴클레오티드, 예컨대, 2'-데옥시, 2'-데옥시-2'-플루오로, 2'-O-메틸, 2'-O-메톡시에틸(2'-O-MOE), 2'-O-아미노프로필(2'-O-AP), 2'-O-디메틸아미노에틸(2'-O-DMAOE), 2'-O-디메틸아미노프로필(2'-O-DMAP), 2'-O-디메틸아미노에틸옥시에틸(2'-O-DMAEOE), 또는 2'-O-N-메틸아세트아미도(2'-O-NMA)을 포함할 수 있다. 또 다른 예로서, 핵산 서열은 적어도 하나의 2'-O-메틸-변형된 뉴클레오티드를 포함할 수 있으며, 일부 구체예에서, 모든 뉴클레오티드는 2'-O-메틸-변형을 포함할 수 있다. 일부 구체예에서, 핵산은 "잠겨져"있으며, 즉, 리보스 고리가 2’-산소 원자와 4’-탄소 원자를 연결하는 메틸렌 브릿지에 의해 “잠겨져”있는 핵산 유사체를 포함한다(예를 들어, Kaupinnen et al., Drug Disc. Today 2(3):287-290, 2005; Koshkin et al., J. Am . Chem . Soc ., 120(50):13252-13253, 1998을 참조). 추가 변형에 대해서는 US 2010/0004320, US 2009/0298916, 및 US 2009/0143326을 참조, 이들 각각은 참조로서 본원에 병합됨).
본 발명을 실시하는데 이용되는 핵산의 조작에 대한 기술, 예를 들면, 서브클로닝, 라벨링 프로브 (예, Klenow 중합효소를 이용하는 무작위-프라이머 라벨링, 닉(nick), 번역, 증폭), 시퀀싱, 혼성화 등이 과학 및 특허 문헌에 잘 기재되어 있으머, 이를 위하여 Sambrook et al., Molecular Cloning ; A Laboratory Manual 3d ed. (2001); Current Protocols in Molecular Biology, Ausubel et al., Eds. (John Wiley & Sons, Inc., New York 2010); Kriegler, Gene Transfer and Expression : A Laboratory Manual (1990); Laboratory Techniques In Biochemistry And Molecular Biology : Hybridization With Nucleic Acid Probes, Part I. Theory and Nucleic Acid Preparation , Tijssen, Ed. Elsevier, N.Y. (1993)을 참조.
?항제 및 재조합 단백질( Antibodies and Recombinant Proteins )
표 21에 열거된 염증 마커 유전자들 중 임의의 하나에 의하여 암호화되는 단백질에 특이적으로 결합하는 하나 이상의 항체도 대상체에 투여하여 신경병성 질환을 치료할 수 있다. 표 21에 열거된 단백질에 특이적으로 결합되는 항체는 상업적으로 입수되거나 당해 기술 분야에서 알려진 표준 방법을 이용하여 생성할 수 있다. 예를 들면, 포유동물을 정제된 단백질로 면역화시키고 상기 정제된 단백질에 특이적으로 결합된 포유동물로부터 항체를 분리시킴으로써, 표 21에 열거된 단백질에 특이적으로 결합되는 다클론성 항체를 생성할 수 있다. 사용된 항체는 단일클론성 또는 다클론성 항체일 수 있다. 투여되는 항체는 면역글로불린 G 또는 면역글로불린 M일 수 있다. 투여된 항체는 키메릭(예, 인간화된 항체) 또는 인간 항체일 수 있다. 또한, 사용된 항체는 항체 절편(예, Fab, F(ab')2, Fv, 및 단쇄 Fv (scFv) 절편)일 수 있다.
또한, 표 20에 열거된 하나 이상의 염증 마커 단백질을 신경병성 질환을 치료를 위한 대상체에 투여할 수 있다. 분자 생물학 및 세포 배양 기술을 이용한 재조합 단백질을 생산하기 위한 여러 방법이 당해 기술 분야에 공지되어 있다. 예를 들어, 표 20에 열거된 mRNA 서열에 의하여 암호화된 염증 마커 단백질은 박테리아, 이스트, 또는 포유동물 세포(단백질 발현 플라스미드 또는 바이러스 벡터를 이용)를 형질감염시켜, 형질감염된 세포에 의하여 염증을 발현시킬 수 있다. 형질감염된 세포 또는 배양 배지를 획득하고, 당해 기술분야에서 알려진 방법을 이용하여 재조합 염증 마커 단백질을 정제시킬 수 있다. 대상체에 투여된 염증 마커 단백질은 표 20에 열거된 아미노산 서열 중 임의의 하나와 적어도 80% (예, 적어도 85%, 90%, 95%, 96%, 97%, 98%, 99%, 또는 100%) 동일성을 가지는 서열을 포함할 수 있다. 대상체에 투여되는 염증 마커 단백질은 추가적으로 변형체(예, 폴리에틸렌 글리콜 또는 HIV tat 단백질, 또는 염증 마커 단백질의 세포 투과성을 증가시키는 다른 부위)를 추가적으로 포함할 수 있다.
약학적 조성물(
Pharmaceutical
Compositions
)
본원에 기재된 방법은, 본원에 기재된 억제성 핵산(예, hsa-miR-155 표적화하는 하나 이상의 억제성 핵산), 센스 핵산, 염증 마커 단백질, 또는 항체 중 하나 이상(예, 2, 3, 4, 또는 5개)를 포함하는 약학적 조성물 및 제제를 투여하는 것을 포함한다.
일부 구체예에서, 상기 조성물은 약학적으로 허용가능한 담체를 가지고 제형화된다. 상기 약학적 조성물 및 제제는 비경구적으로, 국소적으로, 경구적으로 또는 에어로졸 투여 또는 경피투여와 같은 국소적 투여에 의하여 투여할 수 있다. 상기 약제학적 조성물은 임의의 방법에 의하여 제형화될 수 있으며, 환자의 상태 또는 질병, 질병의 정도, 일반적인 건강 상태, 그 결과로 선호되는 투여 방법, 등등에 따라 다양한 단위 용량 형태로 투여할 수 있다. 약제의 제제와 투여에 관한 상세한 기술은 과학 및 특허 문헌에 잘 기재되어 있으며, 예를 들어, Remington : The Science and Practice of Pharmacy, 21st ed., 2005을 참조.
억제성 핵산은 단독으로 또는 약학 제형(조성물)의 성분으로서 투여할 수 있다. 화합물은 인간 또는 수의학에서 사용하기 위한 임의의 편리한 방법으로 투여하기 위해 제형화될 수 있다. 또한 소듐 라우릴 설페이트 및 마그네슘 스테아레이트와 같은 습윤제, 유화제 및 윤활제, 뿐만 아니라 착색제, 이형제, 코팅제, 감미제, 향료, 방향제, 보존제, 및 항산화 제가 상기 조성물에 존재할 수 있다. 일부 구체예에서, 하나 이상의 양이온성 지질, 양이온성 고분자, 또는 나노입자가 하나 이상의 억제성 핵산을 함유하는 조성물(예, hsa-miR-155를 표적화하는 하나 이상의 억제성 핵산을 함유하는 조성물)에 포함될 수 있다.
본 발명의 조성물의 제제는 피내, 흡입, 경구/비강, 국소, 비경구, 직장, 및/또는 질내 투여에 적합한 것들을 포함한다. 상기 제제는 편리하게 단위 용량 형태로 제공될 수 있으며, 약학 분야에서 공지된 임의의 방법에 의해 제조될 수 있다. 단일 용량 형태를 생산하기 위해 담체 물질과 조합 될 수 있는 활성 성분(예, 본 발명의 핵산 서열)의 양은, 치료받을 숙주, 투여의 특정 모드, 예를 들어, 피내 또는 흡입 등에 따라 달라질 것이다. 단일 용량 형태를 생산하기 위해 담체 물질과 조합될 수 있는 활성 성분의 양은 일반적으로 치료 효과를 내는 화합물의 양일 것이다.
본 발명의 약제학적 제제는 약제의 제조를 위해 당해 분야에서 공지된 임의의 방법에 따라 제조할 수 있다. 그러한 약물은 감미제, 향미제, 착색제 및 보존제를 함유할 수 있다. 제제는 제조에 적합한 비독성의 약학적으로 허용가능한 부형제와 혼합할 수 있다. 제제는 하나 이상의 희석제, 유화제, 보존제, 완충제, 부형제 등을 포함할 수 있고, 액체, 분말, 유제, 동결 건조 분말, 스프레이, 크림, 로션, 방출 조절 제제, 정제, 환제, 젤, 패치 상에, 임플란트 내에 등의 형태로 제공될 수 있다.
경구 투여용 약제학적 제제는 적절하고 적합한 투여량으로 당해 분야에서 공지된 약학적으로 허용가능한 담체를 이용하여 제형화 될 수 있다. 그러한 담체는 환자가 섭취하기에 적합한 정제, 환제, 분말, 당의정, 캡슐, 액체, 로젠지(lozenges), 겔, 시럽, 슬러리, 현탁액 등의 단위 용량 형태로 제형화 될 약제를 가능하게 한다. 경구용 약학 제제는 적합한 추가적인 화합물을 첨가한 후에, 원한다면, 정제 또는 당의정 코어를 얻기 위해, 선택적으로 결과의 혼합물을 분쇄하고, 과립의 혼합물을 처리하여, 고체 부형제로서 제형 화 될 수 있다. 적합한 고체 부형제는 탄수화물 또는 단백질 충전제인데, 예를 들어, 락토스, 수 크로스, 만니톨, 또는 소르비톨을 포함한 당; 옥수수, 쌀, 감자, 또는 다른 식물로부터의 전분; 메틸 셀룰로오스, 히이드록시프로필메틸 셀룰로오스, 또는 소듐 카르복시-메틸셀룰로오스와 같은 셀룰로오스; 아라빅 및 트라가탄트를 포함한 검; 단백질, 예컨대 젤라틴 및 콜라겐을 포함한다. 예를 들어, 가교된 폴리비닐 피롤리돈, 한천, 알긴산, 또는 소듐 알기네이트와 같은 그의 염과 같은, 붕해제 또는 가용화제를 첨가할 수 있다. 푸시-핏 캡슐(push-fit capsules)은 충전체, 락토오스 또는 전분과 같은 결합제, 탈크 또는 마그네슘 스테아레이트와 같은 윤활제, 및 선택적으로는 안정화제와 혼합되는 활성제를 포함할 수 있다. 연질 캡슐에서, 상기 활성제는 지방 오일, 액체 파라핀, 또는 액상 폴리에틸렌 글리콜과 같은 적절한 액체에, 안정화제 없이 또는 함께, 용해되거나 현탁될 수 있다.
수성 현탁액은, 예를 들어, 수성 피내 주사를 위하여, 수성 현탁액의 제조에 적합한 부형제와 혼합되는 활성제(예를 들면, 본원에 기재된 억제성 핵산 또는 센스 핵산)를 포함할 수 있다. 상기 부형제는, 소듐 카르복시메틸셀룰로오스, 메틸셀룰로오스, 하이드록시프로필메틸셀룰로오스, 소듐 알기네이트, 폴리비닐피롤리돈, 트라가칸트 검 및 아카시아 검과 같은 현탁제, 천연 포스파티드(예: 레시틴), 알킬렌 옥사이드와 지방의 축합물(예: 폴리옥시에틸렌 스테아레이트), 에틸렌 옥사이드와 장쇄 지방족 알코올의 축합물(예, 헵타데카에틸렌 옥시세탄올), 에틸렌 옥사이드와 지방산 유래의 부분 에스테르 및 헥시톨의 축합물(예, 폴리옥시에틸렌 소르비톨 모노-올레이트), 또는 에틸렌 옥사이드와 지방산 유래의 부분 에스테르 및 헥시톨 무수물의 축합물(예, 폴리옥시에틸렌 소르비탄 모노-올레이트)과 같은 분산제 또는 습윤제를 포함할 수 있다, 또한, 수성 현탁액은 에틸 또는 n-프로필 p-하이드록시벤조에이트와 같은 하나 이상의 보존제, 하나 이상의 착색제, 하나 이상의 향미제, 및 수크로스, 아스파르탐, 또는 사카린과 같은 하나 이상의 감미제를 포함할 수 있다. 제제는 삼투압을 위해 조정될 수 있다.
일부 구체예에서, 오일계 약제는 본 발명의 핵산 서열의 투여를 위하여 이용된다. 오일계 현탁액은 아라키스유, 올리브유, 참기름 또는 코코넛유과 같은 야채유, 또는 액상 파라핀과 같은 광유, 또는 이들의 혼합물에 활성제를 현탁하여 제형화될 수 있다. 생체 이용률의 증가를 위하여 정유(essential oils) 또는 정유 성분을 이용하고 소수성 약학 화합물의 경구 투여의 인터- 및 인트라- 개별적인 가변성을 감소시키는 것을 설명하는 U.S. Patent No. 5,716,928을 참조하고 U.S. Patent No. 5,858,401도 참조. 상기 오일 현탁액은 밀랍, 하드 파라핀, 또는 세틸 알코올과 같은 증점제를 포함할 수 있다. 감미제는 글리세롤, 소르비톨, 또는 슈크로스와 같은 기호성 경구 제제를 제공하기 위하여 첨가될 수 있다. 이러한 제제들은 아스코르브산과 같은 산화방지제의 첨가에 의해 보존될 수 있다. 주사가능한 오일 비이클의 예로서, Minto, J. Pharmacol . Exp . Ther . 281:93-102, 1997을 참조.
또한, 약학 제제는 수중유 유화제의 형태 일 수 있다. 오일상은, 전술한 바와 같은 식물성 오일 또는 미네랄 오일, 또는 이들의 혼합물일 수 있다. 적합한 유화제는, 아카시아 검 및 트라가칸트 검과 같은 천연 검, 콩 레시틴, 에스테르 또는 지방산으로부터 유도된 부분 에스테르와 같은 천연 포스파티드, 소르비탄 모노-올레이트와 같은 헥시톨 무수물, 이러한 부분 에스테르와 에틸렌 옥사이드의 축합물, 예컨대, 폴리옥시에틸렌 소르비탄 모노-올레 에이트를 포함할 수 있다. 또한, 유화제는 시럽 및 엘릭시르(elixirs)의 제제으로서, 감미제 및 향미제를 포함 할 수 있다. 또한, 그러한 제제는 자극완화제, 방부제, 또는 착색제를 포함할 수 있다. 대안적인 구체예에서, 본 발명의 이러한 주사용 수중유 유화제는 파라핀유, 소르비탄 모노올레이트, 에톡실화 소르비탄 모노올레에이트, 및/또는 에톡실화 소르비탄 트리올레에이트를 포함한다.
또한, 제약 화합물은 비강, 안내, 및 좌약, 통기, 분말 및 에어로졸 제제를 포함 질내 경로에 의해 투여될 수 있다(스테로이드 흡입제의 예로서, Rohatagi, J. Clin . Pharmacol . 35:1187-1193, 1995; Tjwa, Ann . Allergy Asthma Immunol . 75:107-111, 1995을 참조). 좌약 제제는 체온에서 액체이고 통상 온도에서 고체이며, 따라서 약물을 방출하기 위해 신체에서 녹을 수 있는 적합한 비-자극성 부형제와 약물을 혼합함으로써 제조할 수 있다. 그러한 물질은 코코아 버터 및 폴리에틸렌 글리콜이다.
일부 구체예에서, 약학적 화합물은 어플리케이터 스틱(applicator sticks), 용액, 현탁액, 에멀젼, 겔, 크림, 연고, 페이스트, 젤리, 도료, 분말 및 에어로졸로서 제형되어, 국소 경로에 의해, 경피적으로 운반될 수 있다.
일부 구체예에서, 또한 약학적 화합물은 신체에서 서방용 미세구체로서 운반될 수 있다. 예를 들면, 미소구체는 피하로 서서히 방출하는 약물의 피내 주사를 통해(예를 들면 Rao, J. Biomater Sci . Polym . Ed . 7:623-645, 1995을 참조); 생분해성 및 주사용 겔 제제로서(예를 들면, Gao, Pharm . Res . 12:857-863, 1995을 참조); 또는 경구 투여용 미소구체로서(예컨대, Eyles, J. Pharm . Pharmacol . 49:669-674, 1997을 참조) 투여할 수 있다.
일부 구체예에서, 약학적 화합물은 정맥내(IV) 투여, 또는 체강, 기관의 내강, 또는 대상체의 두개골(예, 두개내 주사 또는 주입) 또는 뇌척수액으로의 투여와 같은 것에 의하여 비경구적으로 투여할 수 있다. 이러한 제제는 약학적으로 허용가능한 담체에 용해되는 활성제의 용액을 포함할 수 있다. 이용될 수 있는 허용가능한 비이클 및 용매는 물, 링거액, 및 등장성 염화나트륨이다. 또한, 멸균 고정 오일을 용매 또는 현탁 매질로서 이용될 수 있다. 이러한 목적을 위하여, 합성 모노- 또는 디-글리세리드를 포함하는 임의의 완하성 지방유(bland fixed oil)를 포함할 수 있다. 또한, 마찬가지로, 올레산과 같은 지방산을 주사제의 제조에 사용될 수 있다. 이러한 용액은 멸균적이며, 일반적으로 바람직하지 않은 물질을 가지고 있지 않다. 이러한 제제는 통상적이고 잘 알려진 멸균 기술에 의하여 멸균될 수 있다. 상기 제제는, 생리적 조건에 근접하는데 필요한 약학적으로 허용가능한 보조 물질, 예를 들면, pH 조정 및 완충 제제, 독성 조절제, 예컨대, 아세트산나트륨, 염화나트륨, 염화칼륨, 염화칼슘, 젖산나트륨 등을 들 수 있다. 이러한 제제 내의 활성제의 농도는 광범위하게 변할 수 있으며, 선택된 특별한 투여 형태 및 환자의 요구에 따라, 유체 부피, 점도, 체중 등을 주 기반으로 선택될 것이다. IV 투여의 경우, 제제는 멸균 주사제, 예컨대 멸균 주사용 수성 또는 유성 현택액일 수 있다. 이러한 현탁액은 적당한 분산제 또는 습윤제 및 현탁제를 이용하여 제형화될 수 있다. 멸균 주사제도 비독성 비경구적으로 허용가능한 희석제 또는 용매, 예컨대 1,3-부탄디올 내의 현탁액일 수 있다. 투여는 알약 또는 연속 주입(예, 일정 기간 동안 혈관에 실질적으로 중단없이 투입)에 의하여 행해질 수 있다.
일부 구체예에서, 약학적 화합물 및 제제는 동결건조될 수 있다. 억제성 핵산 또는 센스 핵산을 포함하는 안정한 동결건조된 제제는 본 발명의 약제 및 증량제, 예컨대 만니톨, 트레할로스, 라피노스, 수크로오스, 또는 이들의 혼합물을 포함하는 용액을 동결건조하여 제조할 수 있다. 안정된 동결건조 제제의 제조 공정은 약 2.5 ㎎/㎖의 단백질, 약 15 ㎎/㎖의 슈크로스, 약 19 ㎎/㎖의 NaCl, 및 5.5 보다 크지만 6.5보타 작은 pH를 갖는 시트르산 나트륨 완충액을 동결건조하여 포함할 수 있다. 예를 들면 US 2004/0028670을 참조.
조성물 및 제제는 리포좀을 이용하여 운반될 수 있다. 특히 리포좀 표면이 표적 세포에 특이적인 리간드를 보유하거나, 그렇지 않다면 특정 기관에 우선적으로 향하는 리포좀을 사용함으로써, 생체 내에서 활성제를 표적 세포로 집중 전달할 수 있다. 예를 들면, U.S. Patent Nos. 6,063,400; 6,007,839; Al-Muhammed, J. Microencapsul . 13:293-306, 1996; Chonn, Curr . Opin . Biotechnol . 6:698-708, 1995; Ostro, Am . J. Hosp . Pharm . 46:1576-1587, 1989을 참조.
본 발명의 제제는 예방 및/또는 치료적 처치를 위하여 투여될 수 있다. 일부 구체예에서, 치료를 위해, 조성물은 본원에 기재된 질환이 발생될 위험이 있거나 질환이 있는 대상체에, 질환 또는 그 합병증의 임상적 증상을 치료, 완화, 또는 부분적으로 저지할 수 있는 충분한 양으로, 투여될 수 있으며, 이를 치료적 유효량이라 한다. 예를 들면, 일부 구체예에서, 본 발명의 약학적 조성물은, 대상체의 신경병성 질환의 하나 이상의 증상의 심각도, 지속기간, 또는 빈도를 줄이거나 그 증상 개수를 줄이기에 충분한 양으로 투여될 수 있다.
이를 성취하기에 적합한 약학적 조성물의 양이 치료적 유효 용량이다. 투여 일정 및 이의 이용에 효과적인 투여양, 즉, 투약 처방은, 질환 또는 상태의 단계, 질환이나 상태의 심각도, 환자 건강의 일반적인 상태, 환자의 신체적 상태, 나이 등등을 포함하는 다양한 요인에 따라 달라질 것이다. 환자를 위한 용량 요법을 산정할 때, 투여의 모드도 고려된다.
또한, 투여 요법은 당해 기술 분야에서 잘 알려진 약동학적 파라미터, 즉 활성제의 흡수율, 생체 이용률, 물질 대사, 제거, 등등을 고려한다(예를 들어, Hidalgo-Aragones, J. Steroid Biochem . Mol . Biol . 58:611-617, 1996; Groning, Pharmazie 51:337-341, 1996; Fotherby, Contraception 54:59-69, 1996; Johnson, J. Pharm . Sci . 84:1144-1146, 1995; Rohatagi, Pharmazie 50:610-613, 1995; Brophy, Eur . J. Clin . Pharmacol . 24:103-108, 1983; Remington : The Science and Practice of Pharmacy, 21st ed., 2005을 참조). 당해 기술에서는, 임상의가 각 개별 환자, 활성제, 질환 또는 처리 조건에서 용량 요법을 결정할 수 있다. 약제로서 사용되는 유사한 조성물에 제공된 지침은, 용량 요법을 결정하는 안내자로서 이용될 수 있는데, 즉, 본 발명의 방법을 실시하기 위하여 투여되는 용량 스케쥴 및 용량 수준은 정확하고 적절하다.
제제의 단회 또는 다회 투여는 예를 들어, 환자에게 필요하고 허용될 수 있는 용량 및 빈도에 따라 주어질 수 있다. 제제는 상태, 질환, 또는 증상을 효과적으로 치료, 예방, 또는 완화시키기에 충분한 양의 활성제를 제공해야 한다.
대안적인 구체예에서, 경구 투여용 약제는 매일 체중 1kg 당 약 1 내지 100 이상 mg 사이의 양을 가진다. 경구 투여와는 대조적으로, 혈류내, 체강내, 또는 기관의 내강 내로 투여하는 경우에는 더 적은 용량을 사용할 수 있다. 국소 또는 경구 투여시, 또는 분말, 스프레이, 또는 흡입에 의한 투여의 경우에는 실질적으로 더 높은 용량을 사용할 수 있다. 비경구 또는 비-비경구적으로 투여 가능한 제제를 제조하는 실제 방법은 당업자에게 공지되거나 명백하며, 상세한 사항은, Remington : The Science and Practice of Pharmacy, 21st ed., 2005와 같은 출판물에 기재되어 있다.
상보적 핵산 서열을 이용하여 포유류에게 성공적으로 투여한 다양한 연구들이 보고되어 왔다. 예를 들어, Esau C., et al., Cell Metabolism, 3(2):87-98, 2006에서는 정상적인 마우스에게 miR-122 안티센스 올리고뉴클레오티드를 일주일에 두번 12.5 내지 75 mg/kg을 4주 동안 복강내 투여한 것이 보고되어 있다. 마우스는 처리 종료시에 체중 감소 또는 식이 섭취 감소 없이 건강하고 정상적으로 보였다. 플라즈마 트랜스아미나제(transaminase) 레벨은, miR-122 ASO에 75 mg/kg을 투여하여 매우 약한 ALT 및 AST 레벨 증가를 보인 경우를 제외하고는, 모든 투여량에서 정상범위(AST 3/4 45, ALT 3/4 35)에 있었다. 결론적으로 50mg/kg이 효과적이고 비독성적인 용량이었다. Krruzfelldt J., et al., Nature 438, 685-689, 2005에 의한 다른 연구에서는, 마우스 내의 침묵(silence) miR-122에 안타고미르를 체중 1kg 당 총 용량 80, 160, 또는 240으로 주사하였다. 최고 농도에서 miR-122 신호가 완전히 소실되었다. 또 다른 연구에서는, 잠금 핵산("LNAs")을 영장류의 침묵 miR-122에 성공적으로 적용하였다. Elmen et al., Nature 452, 896-899, 2008의 보고에 따르면, 영장류에 LAN-antimiR을 10 mg/kg을 3회 용량으로 투여함으로써, 효율적인 침묵화를 달성하였고, 연구 동물에서 LNA 관련 독성이나 조직병리학적 변화에 대한 증거없이, 총 혈장 콜레스테롤을 오래 지속되게 가역적으로 감소시켰다.
일부 구체예에서, 본원에 기재된 방법은 다른 약물이나 약제, 예컨대, 본원에 기재된 신경병성 질환에 대한 임의의 치료제와 공동으로 투여하는 것을 포함할 수 있다.
키트(
Kits
)
또한, 본 발명은 본원에 기재된 프로브, 억제성 핵산, 센스 핵산, 염증 마커 단백질, 및 항체 중의 하나 이상(예, 적어도 2, 3, 4, 5, 6, 7, 8, 9, 10, 12, 14, 16, 18, 또는 20개)을 포함하는 키트를 제공한다. 일부 구체예에서, 키트는 본원에 기재된 방법 중 임의의 하나를 실시하기 위한 설명서를 포함할 수 있다.
일부 구체예에서, 키트는 표 1 내지 표 19에 열거된 임의의 마이크로RNA(예, 성숙한 마이크로RNA 또는 전구체 마이크로RNA)에 존재하는 서열을 증폭시키기 위한 또는 표 20 및 표 21에 열거된 임의의 mRNA에 존재하는 서열을 증폭시키기 위한 적어도 두개의 프라이머(예, 적어도 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28, 30, 32, 36, 38, 또는 40개)을 포함할 수 있다.
일부 구체예에서, 표 1 내지 11 중 임의의 하나에 열거된 마이크로RNA(예, 표 1 및 표 2; 표 3 및 표 4; 표 5 및 표 6; 표 7 및 표 8; 표 9 및 표 10; 및 표 12의 마이크로RNA 중 하나 이상(예, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 또는 109 개)) 중 하나 이상(예, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 또는 109 쌍의 프라이머)에 존재하는 서열을 증폭하는, 및/또는 표 20 및/또는 표 21에 열거된 mRNA 중 하나 이상(예, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 또는 95 개)에 존재하는 서열을 증폭하는 둘 이상의 프라이머 세트(예, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 또는 109 쌍의 프라이머)를 포함할 수 있다(예, ALS 진단 키트).
일부 구체예에서, 표 1 내지 11 중 임의의 하나에 열거된 마이크로RNA 중 하나 이상(예, 표 1 및 표 2; 표 3 및 표 4; 표 5 및 표 6; 표 7 및 표 8; 표 9 및 표 10; 및 표 12의 마이크로RNA 중 하나 이상(예, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 또는 109개))에 존재하는 서열을 증폭하는 둘 이상의 프라이머 세트(예, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 또는 109 쌍의 프라이머) 및/또는 표 20 및/또는 표 21에 열거된 mRNA 중 하나 이상(예, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 또는 95 개)에 존재하는 서열을 증폭하는 둘 이상의 프라이머 세트(예, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 또는 109 쌍의 프라이머)를 포함할 수 있다(예, ALS 진단 키트).
일부 구체예에서, 표 1, 2, 및 12 내지 19 중 임의의 하나에 열거된 마이크로RNA(예, 표 1 및 표 2; 표 12 및 표 13; 표 14 및 표 15; 표 16 및 표 17; 및 표 18및 표 19의 마이크로RNA 중 하나 이상(예, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 또는 109 개)) 중 하나 이상(예, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 또는 109 개)에 집합적으로 혼성화할 수 있는, 및/또는 표 20 및/또는 표 21에 열거된 mRNA 중 하나 이상(예, 3, 13, 5, 15, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 또는 95 개)에 집합적으로 혼성화할 수 있는 둘 이상의 안티센스 올리고뉴클레오타이드(예, 3, 4, 5, 6, 7, 17, 9, 19, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 또는 109 쌍의 프라이머)를 포함할 수 있다(예, MS 진단 키트).
일부 구체예에서, 표 1, 2, 및 12 내지 19 중 임의의 하나에 열거된 마이크로RNA(예, 표 1 및 표 2; 표 12 및 표 13; 표 14 및 표 15; 표 16 및 표 17; 및 표 18 및 표 19으로부터의 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 또는 109 개의 마이크로RNA) 중 하나 이상(예, 3, 13, 5, 15, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 또는 95 개)에 집합적으로 혼성화할 수 있는, 및/또는 표 20 및/또는 표 21에 열거된 mRNA 중 하나 이상(예, 3, 13, 5, 15, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 또는 95 개)에 집합적으로 혼성화할 수 있는 둘 이상의 안티센스 올리고뉴클레오타이드(예, 3, 4, 5, 6, 7, 17, 9, 19, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 또는 109개의 안티센스 뉴클레오티드)를 포함할 수 있다(예, MS 진단 키트).
일부 구체예에서, 키트는 표 1 내지 19에 열거된 임의의 마이크로RNA(예, 성숙한 마이크로RNA 또는 전구체 마이크로RNA)에 존재하는 서열 또는 표 20 및 표 21에 열거된 임의의 mRNA에 존재하는 서열과 혼성화하기 위한 적어도 둘의 안티센스 분자(예, 4, 6, 8, 10, 12, 14, 16, 20, 22, 24, 26, 28, 30, 32, 34, 36, 38, 또는 40 개)를 포함할 수 있다.
일부 구체예에서, 키트는 적어도 하나의 억제성 핵산 및/또는 적어도 하나의 센스 핵산(예, 본원에 기재된 임의의 억제성 핵산 또는 센스 핵산)을 포함할 수 있다. 일부 구체예에서, 키트는 척수강 내 또는 두개내 주사 또는 주입용으로 제형되는 적어도 하나의 억제성 핵산(예, hsa-miR-155를 표적화하는 적어도 하나의 억제성 핵산)을 포함할 수 있다.
일부 구체예에서, 키트는 표 20 및 표 21에 열거된 임의의 염증 마커 유전자(예, 본원에 기재된 임의의 다양한 항체 또는 항제 분절)에 의하여 암호화되는 단백질 중 임의의 하나에 특이적으로 결합하는 적어도 하나(예, 적어도 둘, 셋, 넷, 다섯, 또는 여섯)의 항체를 포함할 수 있다. 일부 구체예에서, 항체는 표지될 수 있다(예, 형광단, 방사성동위원소, 효소, 비오틴, 또는 아비딘으로 표지됨).
일부 구체예에서, 키트는 적어도 하나의 추가적인 치료제(예, KNS760704, SB509, 세프트리악손(ceftriaxone), 미노사이클린(minocycline), 리루텍(rilutek), 및 릴루졸(riluzole)을 더 포함할 수 있다. 일부 구체예에서, 키트는 신경병성 질환(예, 산발성 ALS 및/또는 가족성 ALS, 또는 MS)이 있거나 있는 것으로 진단받은 대상체에 적어도 하나의 제제(예, 하나 이상의 억제성 핵산)을 투여하기 위한 설명서를 더 포함할 수 있다.
본 발명은 다음 실시예에서 추가로 설명되며, 이들은 청구범위에 기재된 본 발명의 범위를 제한하지 않는다.
실시예
실시예
1:
ALS
마우스 모델(
SOD1
G93A
마우스)에서
Ly6C
Hi
단핵구,
Ly6C
Low
단핵구, 및
CD39
+
미세아교세포에서의 마이크로
RNA
탈조절(
MicroRNA
Deregulation
in
Ly6C
Hi
Monocytes
,
Ly6C
Low
Monocytes
,
and
CD39
+
Microglia
in
a
Mouse
Model
of
ALS
(
SOD1
G93A
Mice
)
Lys6CHi/CCR2+ 단핵구는, MS 동물 모델을 포함하여 다양한 조건에서 조직 손상 및 질환 발생에 참여한다(King et al., Blood 113:3190-3197, 2009). 실험을 실시하여, ALS의 마우스 SOD1G93A 모델에 있어서, 비-형질전환 리터메이트 내의 동일한 세포에서의 발현에 관하여, 전증상 단계(60일), 증상 발생 단계, 및 질환의 말기 단계에서, CD39+ 미세아교세포(도 1A-1C), Ly6CHi 단핵구(도 2A-2C), 및 Ly6CLow 단핵구(도 3A-3C)에서의 마이크로RNA 발현 프로파일을 비교하였다.
데이터를 설치류 TaqMan Low Density Arrays(364개의 마우스 마이크로RNA 분석을 포함하는 TaqMan MicroRNA Assays(n=각 그룹당 2 어레이; 그룹당 5-6 마리 마우스 풀(pool)). 마이크로어레이 데이터를 변위치(R software)를 이용하여 정규화하여 샘플간 변이를 없앴다. U6 miRNA(내부 통제)에 대한 dCT 및 모든 샘플에 대한 기하 평균을 이용하여 마이크로RNA 발현 레벨을 정규화하였다. 정규화 단계 후에, 그룹간 변이체 분석(ANOVA)을 이용하여 SOD1 마우스에서 모든 질환 단계에 걸쳐 상당히 변형된 마이크로RNA를 정의하였다(오류발견률 ≤ 0.1).
질병의 모든 단계 동안 SOD1 마우스의 비장-유래 Ly6CHi 및 Ly6CLow 단핵구의 마이크로RNA 프로파일링은 Ly6CHi 비장 단핵구에서 32개의 크게 조절이상된(dysregulated) 마이크로RNA와 Ly6CLOW 비장 단핵구에서 23개의 조절이상된(dysregulated) 마이크로RNA를 나타냈다. 단핵구 서브세트에서 모든 조절 이상된 마이크로RNA는 임상 시작 한달 전 그리고 질환 진행의 동안에 관찰되었다. 이러한 마이크로RNA 대부분은 Lys6CHi 단핵구와 Ly6CLow 단핵구 사이에서 중첩되지 않는데, 이것은 이러한 상이한 단핵구 서브세트가 질환 진행 동안에서 상이한 기능을 한다는 것을 나타낸다. let-7a, miR-27a, miR-34a, miR-132, miR-146a, miR-451, 및 miR-155와 같은 염증 관련 마이크로RNA는 SOD1 마우스에서 질환의 진행 동안에 Ly6CHi 단핵구에서 크게 상향조절되었다(upregulated) (도 2). SOD1 마우스의 Ly6CHi 단핵구의 마이크로RNA 프로파일에 대한 Ingenuity pathway analysis 을 통하여 일차 근육 질환에서 마이크로RNA의 발현 패턴을 확인하였다(그림 4).
SOD1 마우스에서 CD39+ 미세아교세포의 마이크로RNA의 발현 프로파일 데이터는 비-형질전환 리터메이트의 동일한 세포에 비하여 24개의 마이크로RNA가 상향조절되었고 2개의 마이크로RNA가 하향조절되었음을 보여준다. 이들 마이크로RNA는, 6개의 마이크로RNA(let-7a, miR-27a, miR-34a, miR-132, miR-146a, 및 miR-155)을 제외하고는, Ly6CHi 단핵구에서 조절이상된 마이크로RNA와 상이하다. 이러한 데이터는 Ly6C 단핵구에 의하여 확인된 상주 미세아교세포와 침투한 CD39 단핵구간의 차이를 입증하며, SOD1 마우스의 미세아교세포에서 고유한(unique) 마이크로RNA 패턴을 확인해준다.
실시예
2:
ALS
및
MS
가 있는
대상체의
CD14
+
CD16
-
에서
조절이상된
마이크로RNA(MicroRNAs
dysregulated
in
CD14
+
CD16
-
monocytes
in
subjects
with
ALS
and
MS
)
마우스 단핵구에서 관찰된 고유한 마이크로RNA 프로파일을 고려하여, 마이크로RNA 프로파일링을 ALS 대상체 및 MS 대상체의 인간 혈액 유래 CD14+CD16- 단핵구(Ly6CHi 유사체)에 대하여 실시하였다. 이 실험에서, 산발성 ALS이 있는 대상체(n=8), 재발성 감퇴(relapsing-remitting) MS가 있는 대상체(n=8), 및 건강한 대조군(n=8)의 혈액 유래 CD14+CD16- 단핵구 내의 664개의 마이크로RNA에 대한 엔카운터 발현 프로파일링(nCounter expression profiling)을 실시하였다. 마이크로RNA 발현 레벨을 5개 하우스-키핑 유전자(ACTB, B2M, GAPDH, RPL19, 및 RPLP0)의 기하 평균에 대하여 정규화하였다. 건강한 대조군의 발현 대비 ALS 또는 MS 대상체의 단핵구 내의 마이크로RNA 발현을 비교하는 히트맵(heatmap)을 Dunnett's post hoc test(p < 0.01)를 이용한 ANOVA로 생성하였다(각각, 도 5, 6, 및 33) 도 7A는 ALS 및 MS 대상체의 CD14+CD16- 내에서 고유하게 상향조절된 마이크로RNA의 수와 ALS 및 MS 대상체 둘 다의 CD14+CD16- 내에서 고유하게 상향조절된 마이크로RNA의 수를 나타낸다. 또한, 도 7A는 ALS 및 MS 대상체의 CD14+CD16- 내에서 고유하게 하향조절된 마이크로RNA의 수와 ALS 및 MS 대상체 둘 다의 CD14+CD16- 내에서 고유하게 상향조절된 마이크로RNA의 수를 나타낸다. 도 7B는 건강한 대조군의 CD14+CD16- 단핵구에서의 마이크로RNA의 발현 대비 ALS 대상체의 CD14+CD16- 단핵구에서 상당히 탈조절된 마이크로RNA를 보여주는 볼케이노 플롯(volcano plot)이다. 도 7C는 건강한 대조군의 CD14+CD16- 단핵구에서의 마이크로RNA의 발현 대비 MS 대상체의 CD14+CD16- 단핵구에서 상당히 탈조절된 마이크로RNA를 보여주는 볼케이노 플롯(volcano plot)이다. 도 8은 건강한 대조군의 CD14+CD16- 단핵구에서의 마이크로RNA의 발현 대비 ALS 및 MS 대상체의 CD14+CD16- 단핵구에서 탈조절된 마이크로RNA의 요약을 제공한다.
ALS 및 MS 대상체의 CD14+CD16- 단핵구에서의 마이크로RNA의 조절이상(건강한 대조군 대비)은 실시간 PCR을 이용하여 확인하였다. 예를 들어, 실시간 PCR을 이용하여, 건강한 대조군(n=8)의 CD14+CD16- 단핵구에서의 마이크로RNA의 발현 대비 ALS 대상체(n=11)의 CD14+CD16- 단핵구에서 hsa-miR-27a, hsa-miR-190, hsa-miR-500, hsa-miR-155, 및 hsa-miR-532-3p의 상향조절을 확인하였다.(양측 검정(two-tailed Mann-Whitney t-test))(도 9). 추가의 실시한 PCR 실험을 실시하여 MS 대조군 및 건강한 대조군 둘 다에서의 CD14+CD16- 단핵구 내의 마이크로RNA의 발현 대비 ALS 대상체(n=8; 이러한 대상체의 임상 스코어링이 도 10A 및 도 10B에 보임)의 CD14+CD16- 단핵구 내의 마이크로RNA의 고유한 상향조절을 확인하였다 (도 10C). 도 10C의 데이터는, MS 대조군 및 건강한 대조군의 CD14+CD16- 단핵구 내의 마이크로RNA의 발현에 비교하여, CD14+CD16- 단핵구에서 20개의 상이한 마이크로RNA가 고유하게 상향조절되었다는 것을 보여준다:hsa-miR-19b, hsa-miR-106b, hsa-miR-30b, hsa-miR-21, hsa-miR-142-5p, hsa-miR-27a, hsa-miR-16, hsa-miR-374a, hsa-miR-374b, hsa-miR-101, hsa-miR-340, hsa-miR-30e, hsa-miR-29c, hsa-miR-29a, hsa-miR-223, hsa-miR-26a, hsa-miR-26b, hsa-miR-24, hsa-miR-181a, 및 hsa-miR-103. 또한, MS 대조군 및 건강한 대조군의 CD14+CD16- 단핵구 내의 마이크로RNA의 발현에 비교하여, ALS 대상체의 CD14+CD16- 단핵구 내의 hsa-miR-27a, hsa-miR-155, hsa-miR-146a, 및 hsa-miR-532-3p의 고유한 상향 조절은 실시간 PCR 실험의 두 번째 세트에서 확인하였다(도 11) (마이크로RNA 발현을 U6 miRNA를 이용하는 dCT에 대하여 정규화하였음). 추가의 실시간 PCR 실험을 실시하여, MS 대상체 및 건강한 대조군의 CD14+CD16- 단핵구 내의 마이크로RNA의 발현에 비교하여, ALS 대상체의 CD14+CD16- 단핵구 내의 hsa-miR-518f, hsa-miR-206, hsa-miR-204, hsa-miR-137, hsa-miR-453, hsa-miR-603, hsa-miR-1297, hsa-miR-192, hsa-miR-526a, hsa-miR-615-5p, hsa-miR-655, hsa-miR-450b-5p, hsa-miR-548b-3p, hsa-miR-584, hsa-miR-548f, hsa-miR-300, hsa-miR-302c, hsa-miR-328, hsa-miR-421, and hsa-miR-580의 고유한 하향조절을 확인하였다(도 12).
추가의 실시간 PCR 실험을 실시하여, 건강한 대조군의 CD14+CD16- 단핵구 내의 마이크로RNA의 발현에 비교하여, ALS 및 MS 대상체 둘 다의 CD14+CD16- 단핵구 내의 hsa-miR-24, hsa-miR-93, hsa-miR-20a, hsa-let-7a, hsa-miR-30c, hsa-miR-181a, hsa-miR-432-3p, 및 hsa-miR-1260의 상향조절을 확인하였다(도 13). 추가의 실시간 PCR 실험을 실시하여, 건강한 대조군 대비 MS 대상체의 CD14+CD16- 단핵구 내의 hsa-miR-320c, hsa-miR-27b, hsa-miR-664, hsa-miR-423-5p, 및 hsa-miR-92a의 상향조절을 확인하였다(도 14). 또한, 이러한 데이터는, ALS 대상체 및 건강한 대조군의 CD14+CD16- 단핵구 내의 마이크로RNA의 발현에 비교하여, MS 대상체의 CD14+CD16- 단핵구 내에서 hsa-miR-664가 고유하게 상향조절됨을 확인시켜 준다.
또한, ALS 대상체 및 건강한 대조군의 CD14+CD16- 단핵구 내의 마이크로RNA의 발현에 비교하여, MS 대상체의 CD14+CD16- 단핵구 내에서 hsa-miR-142-3p, hsa-miR-15a, hsa-miR-1537, hsa-miR-362-3p, 및 hsa-miR-148b의 고유한 하향 조절을 실시간 PCR을 이용하여 확인하였다 (도 15).
실시예
3: 산발성
ALS
및 가족성
ALS
이 있는
대상체의
뇌척수액에서의 비정상적인 마이크로RNA 레벨(
Abnormal
MicroRNA
Levels
in
Cerebrospinal
Fluid
from
Subjects
having
Sporadic
ALS
and
Familial
ALS
)
또한, 산발성 ALS 및 가족성 ALS가 있는 대상체의 뇌척수액(CSF)을 이용하여 마이크로RNA 발현 프로파일링을 실시하였다. 산발성 ALC 대상체(n=10) 및 가족성 ALS 대상체(n=5) 둘다의 CSF 내의 마이크로RNA 레벨을 건강한 대조군(n=10)의 뇌척수액에서의 마이크로RNA의 레벨과 비교하였다. 결과 데이터는 건강한 대조군의 CSF 내의 마이크로RNA의 레벨에 비교하여 hsa-miR-27b이 산발성 및 가족성 ALS 둘 다 있는 대상체의 CSF 내에서 증가하고, 건강한 대조군 또는 가족성 ALS가 있는 대상체의 CSF 내의 마이크로RNA의 레벨에 비교하여 hsa-miR-99b, hsa-miR-146a, hsa-miR-150, hsa-miR-328, 및 hsa-miR-532-3p이 산발성 ALS가 있는 대조군의 CSF내에서 고유하게 상향조절된다는 것을 보여준다(도 16).
실시예
4:
ALS
및
MS
가 있는
대상체의
CD14
+
CD16
-
단구체에서
염증 관련 유전자도 조절이상된다(
Inflammation
-
Related
Genes
are
also
dysregulated
in
CD14
+
CD16
-
monocytes
from
subjects
having
ALS
and
MS
)
179개 염증-관련 유전자("염증 마커 유전자")의 발현 프로파일링 분석을 ALS 대상체(n = 8), MS 대상체(n = 11), 및 건강한 대조군(n = 10)의 CD14+CD16- 단핵구를 이용하여 실시하였다. ALS 또는 MS 대상체의 CD14+CD16- 단핵구에서의 상이한 염증 마커 유전자의 발현 차이를, 건강한 대조군의 CD14+CD16- 단핵구에서의 이들 유전자의 발현에 비교하여, 보여주는 히트맵(heatmap)을 도 17이 보여준다. 건강한 대조군의 CD14+CD16- 단핵구의 염증 마커 유전자의 발현에 비교하여 ALS 및 MS 대상체의 CD14+CD16- 단핵구에서 조절이상된 염증 마커 유전자의 볼케이노 플롯(volcano plot)을 도 18A가 보여준다(각각, 좌측 그래프 및 우측 그래프). 건강한 대조군의 CD14+CD16- 단핵구에서의 염증 마커 유전자의 발현 대비 ALS 및 MS 대상체의 CD14+CD16- 단핵구에서 상향조절되거나 하향조절된 염증 마커 유전자의 목록를 도 18B가 보여준다.
실시예
5: 마이크로
RNA
도
ALS
대상체의
CD14
+
CD16
+
단핵구에서 조절이상된다(
MicroRNAs
are
also
Dysregulated
in
CD14
+
CD16
+
Monocytes
from
ALS
subjects
또한, 마이크로RNA 발현 프로파일링을 ALS 대상체(n = 11) 및 건강한 대조군(n = 8) 둘 다의 CD14+CD16- 단핵구를 이용하여 실시하였다 (도 9). 데이터는 건강한 대상체의 CD14+CD16- 단핵구 내의 마이크로RNA의 발현에 비교하여, hsa-miR-708가 ALS 대상체의 CD14+CD16- 단핵구에서 증가함을 보여준다.
엔카운터 발현 프로파일링(nCounter expression profiling)을 실시하여, 건강한 대조군(n=8)의 CD14+CD16+ 단핵구 내의 마이크로RNA의 발현에 비교하여, ALS가 있는 대상체(n=8) 및 MS 대상체(n=8)의 CD14+CD16+ 단핵구에서 조절이상된 추가의 마이크로RNA를 확인하였다. 이 실험에서의 데이터를 5개 하우스-키핑 유전자(ACTB, B2M, GAPDH, RPL19, 및 RPLP0)의 기하 평균에 대하여 정규화하였다. 이 실험에서, 664개의 마이크로RNA의 발현을 분석하였다(도 20A 내지 20C). 건강한 대조군의 CD14+CD16- 단핵구에서의 마이크로RNA의 발현 대비 ALS 대상체 및 MS 대상체의 CD14+CD16- 단핵구에서의 마이크로RNA의 상대적인 발현에 대한 히트맵(heatmap)을 도 21A 내지 도 21C가 각각 보여준다. 건강한 대조군의 CD14+CD16- 단핵구에서의 마이크로RNA의 발현 대비 ALS 및 MS 대상체의 CD14+CD16- 단핵구에서 상당히 탈조절된 마이크로RNA의 요약을 도 20C가 보여준다.
실시예
6:
SOD1
G93A
마우스의
Ly6C
Hi
단핵구 및
CD39
+
미세아교세포에서 발현되는 염증 마커(
Proinflammatory
Markers
Expressed
in
Ly6C
Hi
Monocytes
and
CD39
+
Microglia
from
SOD1
G93A
Mice
)
SOD1 마우스의 비장에서 분리된 Ly6CHi 단핵구의 유전자 발현 프로파일을 임상 질환 발생 한 달 전 그리고 질환의 진행 동안에 실시하였다. 전-염증(pro-inflammatory) 유전자는 두 시점 모두에서 발현하였다(도 21A 및 21B) 엔카운터 발현 프로파일링에 의하여 측정된 179개의 염증 마커 유전자 중에서, 97개가 변형된 발현(비-형질전환 리터메이트의 Ly6CHi 대비)이 있는 것으로 검출되었다. 적어도 하나의 질환 단계에서, 40개의 유전자가 SOD1 마우의 Ly6CHi 단핵구에서 상향조절되었다(비-형질전환 리터메이트 대비). TGFβ1 및 TGFβ1 수용체를 포함하는 7개의 유전자가, 비-형질전환 리터메이트의 Ly6CHi 단핵구에 비교하여 SOD1 마우스의 Ly6CHi 단핵구에서 하향조절되었다(도 21C). 생물학적 네트워크 분석(biological network analysis)은, 염증 반응과 관련된 이번 분석에서 가장 크게 영향을 받은 경로는 CREB1, NF-kB, PU.1, PPAR, 등등을 포함한다는 것을 입증하였다(도 21D). 이들 경로는 단핵구 활성화 및 분화 둘 다에 있어서 중요한 역할을 하는 것으로 보여진다. 유전자 발현 프로파일링은, SOD1 마우스의 말초 면역 구역(peripheral immune compartment)에서 활성화된 전-염증 Ly6CHi 단핵구 집단을 입증하였다.
SOD1 마우스의 척수와 뇌에서 분리한 CD11b+/CD39+ 미세아교세포의 발현 프로파일링을 질환의 상이한 단계에서 실시하였다. 179개 염증 마커 유전자에서, 120개를 검출하였다. SOD1 마우스의 CD11b+/CD39+ 미세아교세포에서 20개의 유전자가 상향조절되었고(비-형질전환 리터메이트의 CD11b+/CD39+ 미세아교세포 대비)(도 21E), SOD1 마우스의 CD11b+/CD39+ 미세아교세포에서 38개의 유전자가 하향조절되었다(비-형질전환 리터메이트의 CD11b+/CD39+ 미세아교세포 대비)(도 21F 및 21G). SOD1 마우스의 CD11b+/CD39+ 미세아교세포는, 비-형질전환 리터메이트의 동일한 세포에 비교할 때, 주화성과 관련된 유전자(예, CCL2, CCL3, CCL4, CCL5, CXCR4, 및 CXCR10)의 발현이 현저하였다. 흥미롭게도, TGFβ1 및 TGFβ1 수용체가 하향조절된 유전자들에 있었다. 생물학적 네트워크 분석은 염증 경로의 활성화가 가장 큰 것은 주화성임을 입증하였다(도 21H). 이러한 유전자의 발현은 증상 발생시 진행하였고, 척수에서는 관찰되나 뇌에서는 관찰되지 않았다(도 21I).
실시예
7:
ALS
대상체의
CD14
+
CD16
-
단핵구에서 발현된 전-염증 마커(
Proinflammatory
Markers
Expressed
in
CD14
+
CD16
-
Monocytes
in
ALS
Subjects
)
ALS 대상체의 CD14+CD16- 단핵구에서의 면역-관련 유전자 발현을 실시예 6에서와 같이 분석하였다. 여러 염증-관련 유전자가, 건강한 대조군 대비 ALS 대상체의 CD14+CD16- 단핵구에서 상향조절되었다. ALS 대상체와 MS 대상체의 CD14+CD16- 단핵구들 간 면역-관련 유전자 발현은 약간의 차이가 있었지만, ALS 대상체와 MS 대상체의 CD14+CD16- 단핵구들에서의 면역-관련 유전자 발현 패턴은 유사하였다(도 22A 내지 22C).
추가 실험에서, 511개의 면역-관련 유전자의 발현을 ALS(산발성 및 가족성 ALS)가 있는 대상체의 CD14+CD16- 단핵구에서 분석하였다. 이 실험은 정량적 나노스트링 엔카운터 기술(quantitative NanoString nCounter technology)을 이용하여 실시하였다. 이 실험에서 얻은 데이터와 실시예 6에 기재된 데이터를 GeneGo and Ingenuity® pathway analysis를 이용하여 추가로 분석하였다.
SOD1 마우스의 척수 CD39+ 미세아교세포 및 비장 Ly6CHi 단핵구에서, 그리고 산발성 ALS 대상체 대 건강한 대조군의 혈액-유도 CD14+CD16- 단핵구에서, 상이하게 상향조절된 유전자를 GeneGo Metacore pathway analysis(GeneGO, St. Joseph, MI)를 이용하여 분석하였다. 이 방법은 한정된 온톨로지(ontologies)에서 지나치게 부각된 전사체를 확인하다. 오류 발견률(false discovery rate, FDR) 필터를 q-값 산출을 이용하여 예비 P 값에 적용하였다. 농축 후, P 값은 주어진 온톨로지 내에서 모든 항에 대해 계산하고, 각 항은 별도의 가설로서 시험하였다. 결과의 q 값은, 주어진 온톨로지에서 전체 항의 설명 및 특정 항의 순위를 가지는 수정된 P 값을 나타낸다. 확인된 상당히 조절이상된 유전자를 추가로 분석하여 SOD1 마우스 및 인간 ALS에서 생물학적/질환 과정 및 연관된 경로/네트워크를 확인하였다. 척수의 CD39+ 미세아교세포 내의 58개의 조절이상된 유전자의 전체 데이터 세트 및 SOD1 마우스의 Ly6CHi 비장 단핵구 내의 47개의 조절이상된 유전자를 MetaCore로 불러와 GeneGo 과정, GeneGo 질환 과정, 표준 경로 맵(canonical pathway maps), 및 네트워크를 이용하여 기능적 온톨리지의 분석을 구축하였다. 맵, 네트워크, 및 프로세스용 MetaCore를 통한 통계적 유의성의 계산은 초기하 분포에 기초하여 산출 된 P 값을 기반으로 행하였다. 맵/네트워크/프로세스에 존재하는 모든 유전자의 세트 내의 유전자, 특정 맵/네트워크/프로세스 상의 유전자, 및 실험에서의 유전자의 수가 주어지면, P 값은 우연히 발생하는 특정 매핑의 확률을 나타낸다. 0.01의 P 값은 컷오프(cutoff)를 위하여 사용하였다. 업로드된 데이터 세트의 상이한 카테고리에 대한 관련성의 정도는 P 값으로 정의되며, 따라서, 더 낮은 P 값은 더 높은 우선 순위를 나타낸다. 실험 데이터는 네트워크를 구축하는데 투입하였다. 네트워크 구축 알고리즘에 의해 생성된 소형 서브네트워크의 순위 결정에 사용된 세개의 상이한 스코어링 함수는 zScore, gScore, 및 P 값이었다. 상기 zScore는 실험에서 유전자와의 포화와 관련하여 (분석된 네트워크 내에서) 서브네트워크의 순위를 결정한다. 높은 zScore는 네트워크가 실험에서 확인된 조절이상 유전자가 고도로 포화되어 있음을 의미한다. 즉, 특정 네트워크에서의 상대적으로 많은 유전자/분석물질이 수상 샘플에 존재하였다는 것을 의미한다. 각 네트워크는 네트워크를 구축하는데 사용되는 표준 경로로 구성되어 있다. 만약 네트워크가 높은 gScore를 갖는다면, (그 gScore로부터) 그것은 발현된 유전자와 포화되어 있으며 많은 표준 경로를 포함한다. 다중 테스트에서, 오류발견률을 추정함으로써 분석을 조절하였다. 측정된 664개의 마이크로RNA에서, 56개는 확실하게 검출하였고, 20개는 적어도 하나의 질환군에서 차등적으로 발현되었다.
Targetscan 14.1을 이용하여 miRNA-mRNA 상호작용의 통계적 유의성을 조사하였다. 보존의 척도인 비-제로 문맥 스코어(non-zeero context score)로 862044개의 보존된 miRNA 결합 부위를 예측하는데 Targetscan 14.1을 이용하였다. SOD1 마우스 데이터 세트에서, IPA(Ingenuity® pathway analysis)를 이용하는 miRNA 표적 필터링 분석으로 10797개의 mRNA를 표적화하는 것으로 예측되는 34개 miRNA 패밀리를 확인하였다. 이들 테이터를 필터링하여 세포 면역 반응, 체액성 면역 반응, 및 사이토카인 신호전달에 관련된 신호전달 경로를 나타내는 IPA Canonical Pathway 카테고리에 속한 유전자만을 포함하였다. 이는 34개의 마이크로RNA를 필터링하게 되어 면역 반응 신호전달에 가능하면 연관된 971개의 mRNA를 표적화하였다. mRNA 발현 연구는 나노스트링 플랫폼(Nanostring platform)을 이용하여 분석에 병합된다. 971개의 필터링된 표적은, miRNA-mRNA 조절의 상반되는 성질을 고려하면, SOD1 마우스에서 조절이상이 된 47개의 면역 관련 유전자를 포함한다. 이는 27개의 miRNA 패밀리 및 33개의 miRNA를 나타내는 최종 87쌍의 miRNA-mRNA 상호작용을 가지게 한다. ALS 대상체의 miRNA 발현 연구에 있어서, 56개의 miRNA가 ALS 대상체에서 상당히 조절이상되는 것으로 밝혀졌다. 862044 개의 예측 부위를 이러한 56개의 miRNA의 표적만을 포함하는 것으로 필터링함으로써 예측 부위의 수를 감소시킨다(34118 부위로 감소). 면역적 패널 나노스트링 어레(immunological panel nanostring arrays) mRNA 표적의 데이터를 단지 1.4 의 배수 차이(fold change)로 조절되는 것으로 알려진 유전자에 한정시킴으로써 상기 부위의 수를 더 감소시켰다. 최종 데이터는 mRNA 및 miRNA가 반대로 조절되는 68개의 고유한 miRNA-mRNA 상호작용 쌍을 나타낸다. 56개의 조절이상된 miRNA에 의하여 형성된 이러한 68개의 miRNA-mRNA 상호작용 쌍의 통계적 유의성을 다음과 같이 더 평가하였다: 1) 1000개의 랜덤 네트워크에서, 연구에서 랜덤하게 선택되고 비-조절된 56개의 miRNA를 이용하여 결합을 위하여 3'-UTR 모티프(motif)를 함유한 mRNA를 구하고; 2) miRNA-mRNA 쌍을 더 필터링하여 ALS 대상체에서 조절이상된 59개의 mRNA만을 포함시켰다. 평균 44.88개의 상호작용을 관찰하였다(SD = 9.99). 발현 연구에서 결정되는 진성 상호작용은 68개이고, 유의미한 P 값(< 1.1 x 10-15)에 해당한다. SOD1 마우스 내의 조절된 miRNA-mRNA 쌍에 대한 유사한 분석은 평균 15.26개(SD = 4.03)의 상호작용 분포를 보여주며, 이때 실험적으로 결정되는 진성 miRNA-mRNA 상호작용은 41개이며, 유의한 P 값은 < 5.7 x 10-9이다.
상기 데이터는 ALS 대상체의 CD14+CD16- 단핵구가 건강한 대조군의 CD14+CD16- 단핵구에 대비 면역-관련 유전자의 고유한 발현을 갖는다는 것을 보여준다. 또한, 적은 수의 면역-관련 유전자가 가족성 ALS 대상체의 CD14+CD16- 단핵구와 산발성 ALS 대상체의 CD14+CD16- 단핵구에서 다르게 발현된다(도 23A 내지 23C). 이러한 결과는 ALS 환자와 건강한 대조군의 독립적 코호트(independent cohort)에서의 단일 qPCR을 이용하여 검증하였다(CCL2, AHR, PTAFR, NF-RB, TRAF3, FCER1A, CXCR4, 및 SOCS1의 발현 차이를 검증하였다)(도 2). 이 데이터는, CCL2, AHR, PTAFR, NF-RB, 및 TRAF3이 건강한 대조군의 CD14+CD16- 단핵구에 비교하여 ALS 대상체의 CD14+CD16- 단핵구에서 상향조절되며, CXCR4 및 SOCS1는 건강한 대조군의 CD14+CD16- 단핵구에 비교하여 ALS 대상체의 CD14+CD16- 단핵구에서 하향조절된다는 것을 확인하였다.
Ingenuity 마이크로RNA-mRNA 표적 필터 분석은, SOD1 마우스의 Ly6CHi 세포에서 상위 10순위 마이크로RNA-miRNA 상호 작용이 ALS 대상체의 CD14+CD16- 단핵구에서 가장 상당히 조절이상된 것으로 밝혀진 유전자에 연관되어 있음을 추가로 밝혔다.
ALS 대상체의 CD14+CD16- 단핵구에서의 두 miRNA 및 mRNA 발현 프로파일의 추가적인 평가는, CD14+CD16- 단핵구에서의 miRNA 및 유전자 발현과 관련된 비정상적인 것이 염증- 및 면역-관련 유전자와 연관이 있음을 보여주었다(도 26A, 도 26B, 도 27A 및 도 27B). CD14+CD16- 단핵구에서의 이러한 miRNA-mRNA 상호작용을 분석할 때, 상기 상호작용은 SOD1 마우스 및 ALD 대상체 둘 다에서 Targetscan 4.1 prediction analysis를 이용하여 통계적으로 유의한 것으로 나타났다(도 28). 또한, GeneGo pathway analysis는 9개의 염증-관련 네트워크를 확인하였다(도 29A 및 도 29B). 이러한 염증 네트워크는 SOD1 마우스의 Ly6CHi 단핵구에서 조절이상되는 것으로 (본원에 기재된 연구에서) 관찰된 것과 동일하였다.
실시예
8:
SOD1
G93A
모델에서
miR
-55의
치료적
역할(
Therapeutic
role
of
miR-155
in
the
SOD1
G93A
model)
miR-55의 유의미한 상향조절은 비장-유래 Ly6CHi 단핵구와 척수 유래 미세아교세포에서 임상 개시 전에 발생하였으며, SOD1G93A 마우스에서 질환 진행의 모든 단계 동안 증가하였다(상기 데이터 참조). 추가 실험을 실시하여, miR-155가 ALS의 발전/발생에 있어서 중요한 역할을 하는지 여부를 조사하였다. 이 실험에서, SOD1 마우스(ALS의 모델)를 추가로 유전자 조작하여 miR-155의 발현을 녹다운(knockdown)시키거나 녹아웃(knockout)시켰다.
동물 거동 분석(
Animals
and
Behavioral
Analysis
)
B6/SJL-SOD1G93A Tg 및 SOD1-야생형(WT)을 Prize4Life에서 제공받거나 Jackson Laboratories에서 구입하였다. ALS 마우스를 30-60일(전-증상) 시점에서, 90-100일(초기 증상) 시점에서, 및 120-140일 (후반기 증상/말기) 시점에서 분석하였다. 증상의 발생을 체중 곡선의 피크와 근육 약화의 징후로 정의하였다. 말기 단계 질환은 증상의 진행과 동물 보호 지침에 의해 결정하였다(따라서, 135일 시점에서부터 ±5일로 변함). 질환 진행은 Prize4Life 및 The Jackson Laboratory에서 제공된 확립된 방법에 따라 기록하였다. 증상 분석을 80일째에 시작하여 매 3-4일마다 매일 모니터링하고 무게를 측정함으로써 실시하였다. 증상 발생은 동물 체중이 감소하기 시작하는 나이로 정의하였다. 양 뒷다리에 대한 신경학적 점수는 50일령부터 시작하여 각 마우스를 매일 평가하였다. 신경학적 점수는 ALSTDI(ALS Therapy Development Institute)에 의하여 개발된 0 내지 4 의 등급을 이용하였다. 각 점수 레벨에 대한 기준은 다음과 같다: 0 = 마우스가 꼬리에 매달리면서 뒷다리가 측면 중간선에서부터 충분히 뻗어 있음, 마우스는 이 상태를 2초간 유지하고 2-3 번 매달려 있음; 2 = 측면 중간선을 향하여 다리 뻗음이 무너지거나 부분적으로 무너짐(약함), 또는 꼬리에 매달려 있는 동안 뒷다리 떨림; 2 = 걷는 동안 발가락이 들어올려지거나 적어도 하나의 사지가 끌림; 3 = 강성 마비 또는 최소한의 관절 운동, 다리가 전진 운동에 사용되지 못함; 4 = 마우스는 양쪽에서 30초 내에 혼자서 서 있지 못하여, 안락사.
SOD1
G93A
/
miR
-155
-/-
생성(
Generation
of
SOD1
G93A
/
miR
-155
-/-)
수컷 SOD1G93A [B6.Cg-Tg(SOD1G93A)1Gur/J] 마우스를 non-Tg C57Bl/6 miR155-/- 암컷과 함께 키웠다. 비-형질전환 miR155-/-을 F1-SOD1G93A/miR155-/+와 교잡하여 miR155가 없는 F2-SOD1G93A/ miR155-/-을 생산하였다. 마우스를 신경해동 검사(로타로드 성능과 신경 학적 점수)에 의하여 임상적으로 평가하였고, miR-155가 상이하게 발현되는 세 SOD1 마우스 실험군의 생존을 평가하였다: 1) SOD1G93A/miR155+/+; 2) SOD1G93A/miR155-/+; 및 3) SOD1G93A/miR155-/-.
SOD1
마우스내의
miR
-155 표적화(
Targeting
of
miR
-155
in
SOD1
mice
)
miRNA과 그의 표적 간 직접적인 상호 작용을 증명하기 위해, 잠재적인 miRNA 결합 부위가 있는 3'UTR을 지닌 루시페라제 리포터가 이용된다. miRNA 결합 부위의 부위-특이적 돌연변이(site-directed mutagenesis)를 miRNA 조절에 대한 루시페라제 리포터의 응답을 제거하는데, 이는 직접 표적화의 증거를 제공할 것이다.
유세포
분석(
Flow
Cytometry
)
디스파제(dispase)가 여러 표면 분자를 절단하고 표면 분자의 표면 검출성을 감소시킬 수 있으므로 디스파제를 사용하지 않은 것을 제외하고는, Cardona et al. (Nat . Protoc . 1:1947-1951, 2006)에 기재된 바와 같이, 단핵 세포를 마우스의 척수에서 직접 분리하였다. 마우스에 경심관류로(transcardially) 차가운 얼음 인산염 완충 생리 식염수(PBS)를 관류시키고, 척수와 뇌는 따로 절개하였다. 단일 세포 현탁액을 제조하고, 37%/70 %의 불연속 퍼콜 구배(GE 헬스 케어) 위에서 원심 분리하고, 단핵 세포를 인터페이스로부터 분리하고, 총 세포 수를 측정하였다. 세포를 항-CD16/CD32 (Fc Block BD Biosciences)로 예비 블로킹하고, 얼음 위에서 항-Ly6C-FITC, CD11b-PE-CyTM7, 및 4D4-APC(고유한 미세아교세포 항체)의 조합으로 30분 동안 염색하였다. 7AAD-PerCP(BD Biosciences)을 이용하여 초기 사멸적 세포 및 죽은 세포를 검출하거나 제외시켰다. 적절한 항체 IgG 이소타입 대조군 (BD Biosciences)을 모든 염색에 이용하였다. FACS(Fluorescence-activated cell sorting) 분석을 LSR 장치(BD Biosciences) 상에서 실시하고, 연속해서 데이터를 FlowJo Software (TreeStar Software)로 분석하였다.
양적 나노스트링
엔카운더
miRNA
/유전자 발현 분석(
Quantitative
NanoString
nCounter
miRNA
/
gene
expression
analysis
)
Nanostring nCounter technology을 이용하여 800개까지의 염증-관련 유전자의 발현을 조사하였다. 또한, 염증 및 면역 반응 동안 다르게 발현되는 유전자로 구성되는 179개의 염증-관련 전사체의 다중화 표적 프로파일링을 상술한 바와 같이 실시하였다.
결과 데이터는 SOD1G93A/miR155-/- 동물이 SOD1G93A 동물에 비하여 질환 발생과 생존을 유의미하게 지연시켰다(표 22 및 23, 도면 30 내지 34)는 것을 보여 주었다. 마우스의 체중을 80일에 시작에서 매 3-4일에 측정하였고, 마우스의 임상적인 신경학적 점수는 매일 평가하였으며, 로타로드 성능을 일주일에 3번 평가하였다. 데이터는 miR-155의 유전적 제거가 수명을 51일 연장시켰고(P <0.0001; 도 30), 2의 신경학적 점수에 도달하는 시간을 49일 연장시켰고(P <0.0001; 도 31), 로타로드 성능을 향상시켰고(도 32), 체중 손실을 감소시켰고(도 33), 초기(P = 0.0003) 및 후기 (P = 0.0004) 질환 발생을 지연시켰다(도 34)는 것을 보여 주었다.
| SOD1 . miR155 +/+ | SOD1 / miR155 -/- |
| 말기 단계 145일 | 162일째, 여전히 번식함 |
| Kaplan-Meie 생존 적합성 | |||||
| 암컷 |
평균 시간(일) | P 값 | |||
| SOD1/miR-155+/- | SOD1/miR-155-/- | 차이 | Log-rank | Wilcoxon | |
| 신경학적 점수(2점) | 138 | 187 | 49 | <0.0001 | <0.0001 |
| 죽음에 이를때 피크 체중 | 32 | 80 | 48 | <0.0001 | <0.0001 |
| 50% 생존 | 156 | 207 | 51 | <0.0001 | <0.0001 |
| 수컷 |
평균 시간(일) | P 값 | |||
| SOD1/miR-155+/- | SOD1/miR-155-/- | 차이 | Log-rank | Wilcoxon | |
| 신경학적 점수(2점) | 144 | 168 | 24 | <0.0001 | 0.0003 |
| 죽음에 이를때 피크 체중 | 56 | 64 | 8 | 0.1397 | 0.0647 |
| 50% 생존 (사망시 나이) | 157 | 184 | 27 | <0.0001 | <0.0001 |
또한, SOD1G93A/miR155-/- 동물은 SOD1G93A 마우스에 비하여 척수의 미세아교세포 보호와 관련있는 말초 단핵구의 점증을 유의적으로 감소시켰고(도 35), SOD1G93A 마우스에 비하여 척수 미세아교세포 및 Ly6CHi 단핵구에서의 염증-관련 유전자 발현을 유의미하게 감소시켰다(도 36A 및 도 36B). 그러나, 염증-관련 유전자가 비장 T 세포에서 영향을 받지 않았으며, 염증-관련 유전자(IL4 및 IL10)의 발현이 비-형질전화 마우스의 레벨로 복원되었는데, 이는 miR-155가 SOD1G93A 마우스의 Ly6CHi 단핵구에서 MI-관련 신호의 활성에 주로 영향을 줄 수 있음을 나타낸다.
이들 데이터는 miR-155가 ALS의 발생(발병)에 중요한 역할을 한다는 것과, 신경병성 질환(예, ALS, 예컨대, 가족성 ALS 및/또는 산발성 ALS)이 있는 대상체에 대한 치료를 hsa-miR-155(예, 전구체는 성숙한 hsa-miR-155)를 표적화하는 적어도 하나의 억제성 핵산을 신경병성 질환(예, ALS, 예컨대, 가족성 ALS 및/또는 산발성 ALS)이 있는 대상체에 투여함으로써 달성할 수 있다. 신경병성 질환이 있는 대상체에 투여될 수 있는 hsa-miR-155 (예, 전구체 또는 성숙한 hsa-miR-155)을 표적화하는 예시적인 억제성 핵산은 기재되어 있다.
실시예
9:
SOD1
G93A
마우스 치료에 대한
miR
-155
안타고미르의
효능(
Efficacy
of
miR-155
antagomir
for
treating
SOD1
G93A
mice
)
제1 실험 세트를 가족성 ALS의 SOD1G93A 모델에서 실시하여 miR-155를 표적화하는 안타고미르가 척수-유래된 미세아교세포 및 비장 Ly6CHi 단핵구에서의 miRNA 발현 및/또는 염증 유전자 발현을 변경하는지를 조사하였다. 이 실험에서, 다음 5개의 실험군을 연구하였다.
그룹 I: 대조군 스크램블 miR-155(복강내 주사, 1회 주사당 2㎎, 3 일에 한 번씩) (n=3). 대조군 스크램블 miR-155: +TC+AA+C+A+TTA+G+A+CT+T+A (서열번호 263) ("+"는 LAN 부위의 존재를 나타냄).
그룹 II: 안타고미르 miR-155 저용량(정맥내 주사, 1회 주사당 0.2 ㎎, 3 일에 한 번씩) (n=3). 안타고미르 miR-155: +TC+AC+A+A+TTA+G+C+AT+T+A (서열번호 262) ("+"는 LAN 부위의 존재를 나타냄).
그룹 III: 안타고미르 miR-155 고용량(정맥내 주사, 1회 주사당 2 ㎎, 3 일에 한 번씩) (n=3).
그룹 IV: 안타고미르 miR-155 저용량(복강내 주사, 1회 주사당 0.2 ㎎, 3 일에 한 번씩) (n=3).
그룹 V: 안타고미르 miR-155 고용량(복강내 주사, 1회 주사당 2 ㎎, 3 일에 한 번씩) (n=3).
나노스트링 염증 유전자 및 miRNA 발현 분석을 상술한 바와 같은 척수 유래 미세아교세포 및 비장 Ly6CHi에서 실시하였다.
3일에 한 번씩 저용량(1회 주사당 0.2 mg/kg 체중) 대 고용량(1회 주사당 2 mg/kg 체중)으로 투여된 SOD1 마우스의 미세아교세포 및 비장 Ly6C 단핵구로부터의 데이터를 비교하면, 저용량 투여는 비장 Ly6CHi 단핵구 M1-표현형에 영향을 주지 않음(비처리된 SOD1 마우스와 비교하여 이들 마우스에서 동일한 miRNA 및 염증 유전자 발현이 관찰됨)을 알 수 있다. 그러나, 고용량 투여(i.p. 또는 i.v. 투여)는, 염증-관련 유전자에서 엔카운터 기술(quantitative nCounter technology)에 의하여 측정된 바와 같이, 전-염증 사이토카인의 발현을 저해하였다. 또한, 데이터는 척수 유래 미세아교세포가 전신성 안타고미르 miR-155 치료에 영향을 받지 않음을 보여준다.
제 2 실험 세트를 실시하여 SOD1 마우스의 거동과 생존에 대한 안타고미르 miR-155의 영향을 조사하였다. 이 실험에서, SOD1 마우스에 스크램블 miR-155 (n = 10) 또는 안타고미르 miR-155(n=10)를 복강내 주사에 의하여 1회 주사당 2 mg/kg 체중, 3 일에 한 번씩으로 투여하였다. 치료는 질병 발생(체중 손실 및 신경학적 점수에 의하여 정의됨)시에 시작하였다. 실험이 끝나거나 말기 단계가 될 때까지 마우스를 계속하여 치료하였다. 마우스 거동을, 예를 들면 로타로드 성능에 의하여 측정하고, 마우스의 체중 및 생존을 모니터하였다.
SOD1 마우스의 중추 신경계 내의 miR-155를 렌티노바이러스-매개 miR-155 저해를 이용하여 표적화할 수 있는지 여부를 조사하도록 제3 실험 세트를 설계한다. 이 실험에서, 안타고미르 miR-155는 렌티노바이러스 감염에 의하여 운반된다. miR-155 저해에 있어서, 돌연변이 miR-155 를 암호화하는 서열 또는 이의 특이적 저해제를 렌티바이러스 벡터에 클로닝한다. 바이러스는 사용자 매뉴얼에 따라 표적 세포를 감염시켜 생산한다. 거의 2 x 107 개의 재조합 렌티바이러스의 변환 단위들을 CSF 또는 측뇌실로의 정위 주사에 의하여 SOD1 마우스에 운반한다. 처리군은 다음과 같다:
그룹 I: 대조군 렌티바이러스-스크램블 miR-155-GFP-태그 고용량으로 투여된 마우스 (n=10). (대조군 스크램블 안타고미르 서열, 서열번호 263 참조)
그룹 II: 안타고미르 렌티바이러스-스크램블 miR-155-GFP-태그 고용량으로 투여된 마우스 (n=10). (안타고미르 miR-155 서열, 서열번호 262 참조)
마우스의 거동을, 예를 들면 로타로드 성능에 의하여 결정하고, 마우스의 체중 및 생존을 모니터하였다. 또한, 선천적인 면역계의 나노스트링 miRNA 및 면역-관련 유전자 프로파일링과 T-세포 염증-관련 유전자 프로파일링을 이러한 마우스(예, 말초 Lys6CHi 세포)에서 유래된 세포에 실시하였다.
또한, 엔카운터 발현 분석을 실시하여 야생형, SOD1/miR155-/+, SOD1/miR155-/- 마우스의 Ly6CHi 비장 유래 단핵구 서브세트 내의 여러 마이크로RNA의 발현을 조사하였다. 데이터는, 여러 마이크로RNA가 SOD1/miR155-/+ 마우스 대비 야생형 마우스에서, 그리고 SOD1/miR155-/+ 마우스와 SOD1/miR155-/- 마우스 사이에서 다르게 발현되었음을 나타낸다(도 37).
또한, 건강한 대조군(8개의 대상체)의 CD14+CD16- 단핵구 내의 마이크로RNA의 발현에 비교하여, 산발성 ALS (8개의 대상체) 및 재발성 감퇴 다발성 경화증(8개의 대상체)의 마이크로RNA를 위한 혈액-유래 CD14+CD16- 단핵구의 엔카운터 발현 프로파일링을 실시하였다. 도 38A 및 도 38B에서의 결과의 히트맵은 Dunnett's post hoc test (P < 0.01)을 이용한 분산 분석(analysis of variance, ANOVA) 결과를 보여준다. ALS 대상체의 CD14+CD16- 단핵구에서 상향조절되거나 하향조절된 마이크로RNA (건강한 대조군의 CD14+CD16- 단핵구의 마이크로RNA의 발현 대비)가 지시되어 있다.
기타
구체예
(
OTHER
EMBODIMENTS
)
본 발명은 상세한 설명과 함께 설명되었지만, 전술한 설명은 첨부된 청구범위에 의해 정의되는 본 발명의 범위를 예시할 뿐, 한정하지는 않는 것으로 이해되어야 한다 기타 다른 특징, 이점, 및 변형은 다음의 청구 범위 내에 있다.
SEQUENCE LISTING
<110> WEINER, HOWARD
BUTOVSKY, OLEG
<120> MICRORNAS IN NEURODEGENERATIVE DISORDERS
<130> 29618-0025US1
<140>
<141>
<150> PCT/US2012/059671
<151> 2012-10-11
<150> 61/601,205
<151> 2012-02-21
<150> 61/545,968
<151> 2011-10-11
<160> 265
<170> PatentIn version 3.5
<210> 1
<211> 22
<212> RNA
<213> Homo sapiens
<400> 1
gugcaaaucc augcaaaacu ga 22
<210> 2
<211> 23
<212> RNA
<213> Homo sapiens
<400> 2
ugugcaaauc caugcaaaac uga 23
<210> 3
<211> 87
<212> RNA
<213> Homo sapiens
<400> 3
cacuguucua ugguuaguuu ugcagguuug cauccagcug ugugauauuc ugcugugcaa 60
auccaugcaa aacugacugu gguagug 87
<210> 4
<211> 96
<212> RNA
<213> Homo sapiens
<400> 4
acauugcuac uuacaauuag uuuugcaggu uugcauuuca gcguauauau guauaugugg 60
cugugcaaau ccaugcaaaa cugauuguga uaaugu 96
<210> 5
<211> 21
<212> RNA
<213> Homo sapiens
<400> 5
uaaagugcug acagugcaga u 21
<210> 6
<211> 82
<212> RNA
<213> Homo sapiens
<400> 6
ccugccgggg cuaaagugcu gacagugcag auaguggucc ucuccgugcu accgcacugu 60
ggguacuugc ugcuccagca gg 82
<210> 7
<211> 22
<212> RNA
<213> Homo sapiens
<400> 7
uguaaacauc cuacacucag cu 22
<210> 8
<211> 88
<212> RNA
<213> Homo sapiens
<400> 8
accaaguuuc aguucaugua aacauccuac acucagcugu aauacaugga uuggcuggga 60
gguggauguu uacuucagcu gacuugga 88
<210> 9
<211> 22
<212> RNA
<213> Homo sapiens
<400> 9
uagcuuauca gacugauguu ga 22
<210> 10
<211> 72
<212> RNA
<213> Homo sapiens
<400> 10
ugucggguag cuuaucagac ugauguugac uguugaaucu cauggcaaca ccagucgaug 60
ggcugucuga ca 72
<210> 11
<211> 21
<212> RNA
<213> Homo sapiens
<400> 11
cauaaaguag aaagcacuac u 21
<210> 12
<211> 87
<212> RNA
<213> Homo sapiens
<400> 12
gacagugcag ucacccauaa aguagaaagc acuacuaaca gcacuggagg guguaguguu 60
uccuacuuua uggaugagug uacugug 87
<210> 13
<211> 78
<212> RNA
<213> Homo sapiens
<400> 13
cugaggagca gggcuuagcu gcuugugagc aggguccaca ccaagucgug uucacagugg 60
cuaaguuccg ccccccag 78
<210> 14
<211> 22
<212> RNA
<213> Homo sapiens
<400> 14
uagcagcacg uaaauauugg cg 22
<210> 15
<211> 22
<212> RNA
<213> Homo sapiens
<400> 15
uagcagcacg uaaauauugg cg 22
<210> 16
<211> 89
<212> RNA
<213> Homo sapiens
<400> 16
gucagcagug ccuuagcagc acguaaauau uggcguuaag auucuaaaau uaucuccagu 60
auuaacugug cugcugaagu aagguugac 89
<210> 17
<211> 81
<212> RNA
<213> Homo sapiens
<400> 17
guuccacucu agcagcacgu aaauauuggc guagugaaau auauauuaaa caccaauauu 60
acugugcugc uuuaguguga c 81
<210> 18
<211> 22
<212> RNA
<213> Homo sapiens
<400> 18
uuauaauaca accugauaag ug 22
<210> 19
<211> 72
<212> RNA
<213> Homo sapiens
<400> 19
uacaucggcc auuauaauac aaccugauaa guguuauagc acuuaucaga uuguauugua 60
auugucugug ua 72
<210> 20
<211> 22
<212> RNA
<213> Homo sapiens
<400> 20
auauaauaca accugcuaag ug 22
<210> 21
<211> 72
<212> RNA
<213> Homo sapiens
<400> 21
acucggaugg auauaauaca accugcuaag uguccuagca cuuagcaggu uguauuauca 60
uuguccgugu cu 72
<210> 22
<211> 21
<212> RNA
<213> Homo sapiens
<400> 22
uacaguacug ugauaacuga a 21
<210> 23
<211> 21
<212> RNA
<213> Homo sapiens
<400> 23
uacaguacug ugauaacuga a 21
<210> 24
<211> 75
<212> RNA
<213> Homo sapiens
<400> 24
ugcccuggcu caguuaucac agugcugaug cugucuauuc uaaagguaca guacugugau 60
aacugaagga uggca 75
<210> 25
<211> 79
<212> RNA
<213> Homo sapiens
<400> 25
acuguccuuu uucgguuauc augguaccga ugcuguauau cugaaaggua caguacugug 60
auaacugaag aaugguggu 79
<210> 26
<211> 22
<212> RNA
<213> Homo sapiens
<400> 26
uuauaaagca augagacuga uu 22
<210> 27
<211> 95
<212> RNA
<213> Homo sapiens
<400> 27
uuguaccugg ugugauuaua aagcaaugag acugauuguc auaugucguu ugugggaucc 60
gucucaguua cuuuauagcc auaccuggua ucuua 95
<210> 28
<211> 22
<212> RNA
<213> Homo sapiens
<400> 28
uguaaacauc cuugacugga ag 22
<210> 29
<211> 92
<212> RNA
<213> Homo sapiens
<400> 29
gggcagucuu ugcuacugua aacauccuug acuggaagcu guaagguguu cagaggagcu 60
uucagucgga uguuuacagc ggcaggcugc ca 92
<210> 30
<211> 22
<212> RNA
<213> Homo sapiens
<400> 30
uagcaccauu ugaaaucggu ua 22
<210> 31
<211> 88
<212> RNA
<213> Homo sapiens
<400> 31
aucucuuaca caggcugacc gauuucuccu gguguucaga gucuguuuuu gucuagcacc 60
auuugaaauc gguuaugaug uaggggga 88
<210> 32
<211> 22
<212> RNA
<213> Homo sapiens
<400> 32
uagcaccauc ugaaaucggu ua 22
<210> 33
<211> 64
<212> RNA
<213> Homo sapiens
<400> 33
augacugauu ucuuuuggug uucagaguca auauaauuuu cuagcaccau cugaaaucgg 60
uuau 64
<210> 34
<211> 22
<212> RNA
<213> Homo sapiens
<400> 34
ugucaguuug ucaaauaccc ca 22
<210> 35
<211> 110
<212> RNA
<213> Homo sapiens
<400> 35
ccuggccucc ugcagugcca cgcuccgugu auuugacaag cugaguugga cacuccaugu 60
gguagagugu caguuuguca aauaccccaa gugcggcaca ugcuuaccag 110
<210> 36
<211> 22
<212> RNA
<213> Homo sapiens
<400> 36
uucaaguaau ccaggauagg cu 22
<210> 37
<211> 22
<212> RNA
<213> Homo sapiens
<400> 37
uucaaguaau ccaggauagg cu 22
<210> 38
<211> 77
<212> RNA
<213> Homo sapiens
<400> 38
guggccucgu ucaaguaauc caggauaggc ugugcagguc ccaaugggcc uauucuuggu 60
uacuugcacg gggacgc 77
<210> 39
<211> 84
<212> RNA
<213> Homo sapiens
<400> 39
ggcuguggcu ggauucaagu aauccaggau aggcuguuuc caucugugag gccuauucuu 60
gauuacuugu uucuggaggc agcu 84
<210> 40
<211> 21
<212> RNA
<213> Homo sapiens
<400> 40
uucaaguaau ucaggauagg u 21
<210> 41
<211> 77
<212> RNA
<213> Homo sapiens
<400> 41
ccgggaccca guucaaguaa uucaggauag guugugugcu guccagccug uucuccauua 60
cuuggcucgg ggaccgg 77
<210> 42
<211> 22
<212> RNA
<213> Homo sapiens
<400> 42
uggcucaguu cagcaggaac ag 22
<210> 43
<211> 22
<212> RNA
<213> Homo sapiens
<400> 43
uggcucaguu cagcaggaac ag 22
<210> 44
<211> 68
<212> RNA
<213> Homo sapiens
<400> 44
cuccggugcc uacugagcug auaucaguuc ucauuuuaca cacuggcuca guucagcagg 60
aacaggag 68
<210> 45
<211> 73
<212> RNA
<213> Homo sapiens
<400> 45
cucugccucc cgugccuacu gagcugaaac acaguugguu uguguacacu ggcucaguuc 60
agcaggaaca ggg 73
<210> 46
<211> 23
<212> RNA
<213> Homo sapiens
<400> 46
aacauucaac gcugucggug agu 23
<210> 47
<211> 23
<212> RNA
<213> Homo sapiens
<400> 47
aacauucaac gcugucggug agu 23
<210> 48
<211> 110
<212> RNA
<213> Homo sapiens
<400> 48
ugaguuuuga gguugcuuca gugaacauuc aacgcugucg gugaguuugg aauuaaaauc 60
aaaaccaucg accguugauu guacccuaug gcuaaccauc aucuacucca 110
<210> 49
<211> 110
<212> RNA
<213> Homo sapiens
<400> 49
agaagggcua ucaggccagc cuucagagga cuccaaggaa cauucaacgc ugucggugag 60
uuugggauuu gaaaaaacca cugaccguug acuguaccuu gggguccuua 110
<210> 50
<211> 23
<212> RNA
<213> Homo sapiens
<400> 50
agcagcauug uacagggcua uga 23
<210> 51
<211> 23
<212> RNA
<213> Homo sapiens
<400> 51
agcagcauug uacagggcua uga 23
<210> 52
<211> 23
<212> RNA
<213> Homo sapiens
<400> 52
ucauagcccu guacaaugcu gcu 23
<210> 53
<211> 23
<212> RNA
<213> Homo sapiens
<400> 53
ucauagcccu guacaaugcu gcu 23
<210> 54
<211> 78
<212> RNA
<213> Homo sapiens
<400> 54
uacugcccuc ggcuucuuua cagugcugcc uuguugcaua uggaucaagc agcauuguac 60
agggcuauga aggcauug 78
<210> 55
<211> 78
<212> RNA
<213> Homo sapiens
<400> 55
uugugcuuuc agcuucuuua cagugcugcc uuguagcauu caggucaagc agcauuguac 60
agggcuauga aagaacca 78
<210> 56
<211> 62
<212> RNA
<213> Homo sapiens
<400> 56
ucauagcccu guacaaugcu gcuugaucca uaugcaacaa ggcagcacug uaaagaagcc 60
ga 62
<210> 57
<211> 62
<212> RNA
<213> Homo sapiens
<400> 57
ucauagcccu guacaaugcu gcuugaccug aaugcuacaa ggcagcacug uaaagaagcu 60
ga 62
<210> 58
<211> 23
<212> RNA
<213> Homo sapiens
<400> 58
uuaaugcuaa ucgugauagg ggu 23
<210> 59
<211> 65
<212> RNA
<213> Homo sapiens
<400> 59
cuguuaaugc uaaucgugau agggguuuuu gccuccaacu gacuccuaca uauuagcauu 60
aacag 65
<210> 60
<211> 22
<212> RNA
<213> Homo sapiens
<400> 60
caugccuuga guguaggacc gu 22
<210> 61
<211> 91
<212> RNA
<213> Homo sapiens
<400> 61
cgacuugcuu ucucuccucc augccuugag uguaggaccg uuggcaucuu aauuacccuc 60
ccacacccaa ggcuugcaaa aaagcgagcc u 91
<210> 62
<211> 20
<212> RNA
<213> Homo sapiens
<400> 62
aaaagcuggg uugagagggu 20
<210> 63
<211> 20
<212> RNA
<213> Homo sapiens
<400> 63
aaaagcuggg uugagagggu 20
<210> 64
<211> 88
<212> RNA
<213> Homo sapiens
<400> 64
uuugcauuaa aaaugaggcc uucucuuccc aguucuuccc agagucagga aaagcugggu 60
ugagagggua gaaaaaaaau gauguagg 88
<210> 65
<211> 50
<212> RNA
<213> Homo sapiens
<400> 65
cuucucuuuc caguucuucc cagaauuggg aaaagcuggg uugagagggu 50
<210> 66
<211> 21
<212> RNA
<213> Homo sapiens
<400> 66
uucacagugg cuaaguucug c 21
<210> 67
<211> 97
<212> RNA
<213> Homo sapiens
<400> 67
accucucuaa caaggugcag agcuuagcug auuggugaac agugauuggu uuccgcuuug 60
uucacagugg cuaaguucug caccugaaga gaaggug 97
<210> 68
<211> 23
<212> RNA
<213> Homo sapiens
<400> 68
uauucauuua uccccagccu aca 23
<210> 69
<211> 82
<212> RNA
<213> Homo sapiens
<400> 69
gaacauugaa acuggcuagg gaaaaugauu ggauagaaac uauuauucua uucauuuauc 60
cccagccuac aaaaugaaaa aa 82
<210> 70
<211> 23
<212> RNA
<213> Homo sapiens
<400> 70
ucuuggagua ggucauuggg ugg 23
<210> 71
<211> 94
<212> RNA
<213> Homo sapiens
<400> 71
ugacuccucc aggucuugga guaggucauu ggguggaucc ucuauuuccu uacgugggcc 60
acuggauggc uccuccaugu cuuggaguag auca 94
<210> 72
<211> 22
<212> RNA
<213> Homo sapiens
<400> 72
uauugcacuu gucccggccu gu 22
<210> 73
<211> 22
<212> RNA
<213> Homo sapiens
<400> 73
uauugcacuu gucccggccu gu 22
<210> 74
<211> 78
<212> RNA
<213> Homo sapiens
<400> 74
cuuucuacac agguugggau cgguugcaau gcuguguuuc uguaugguau ugcacuuguc 60
ccggccuguu gaguuugg 78
<210> 75
<211> 75
<212> RNA
<213> Homo sapiens
<400> 75
ucaucccugg guggggauuu guugcauuac uuguguucua uauaaaguau ugcacuuguc 60
ccggccugug gaaga 75
<210> 76
<211> 22
<212> RNA
<213> Homo sapiens
<400> 76
cacccguaga accgaccuug cg 22
<210> 77
<211> 70
<212> RNA
<213> Homo sapiens
<400> 77
ggcacccacc cguagaaccg accuugcggg gccuucgccg cacacaagcu cgugucugug 60
gguccguguc 70
<210> 78
<211> 22
<212> RNA
<213> Homo sapiens
<400> 78
ugagaacuga auuccauggg uu 22
<210> 79
<211> 99
<212> RNA
<213> Homo sapiens
<400> 79
ccgaugugua uccucagcuu ugagaacuga auuccauggg uugugucagu gucagaccuc 60
ugaaauucag uucuucagcu gggauaucuc ugucaucgu 99
<210> 80
<211> 22
<212> RNA
<213> Homo sapiens
<400> 80
ucucccaacc cuuguaccag ug 22
<210> 81
<211> 84
<212> RNA
<213> Homo sapiens
<400> 81
cuccccaugg cccugucucc caacccuugu accagugcug ggcucagacc cugguacagg 60
ccugggggac agggaccugg ggac 84
<210> 82
<211> 22
<212> RNA
<213> Homo sapiens
<400> 82
cuggcccucu cugcccuucc gu 22
<210> 83
<211> 75
<212> RNA
<213> Homo sapiens
<400> 83
uggagugggg gggcaggagg ggcucaggga gaaagugcau acagccccug gcccucucug 60
cccuuccguc cccug 75
<210> 84
<211> 22
<212> RNA
<213> Homo sapiens
<400> 84
ccucccacac ccaaggcuug ca 22
<210> 85
<211> 91
<212> RNA
<213> Homo sapiens
<400> 85
cgacuugcuu ucucuccucc augccuugag uguaggaccg uuggcaucuu aauuacccuc 60
ccacacccaa ggcuugcaaa aaagcgagcc u 91
<210> 86
<211> 18
<212> RNA
<213> Homo sapiens
<400> 86
aucccaccuc ugccacca 18
<210> 87
<211> 73
<212> RNA
<213> Homo sapiens
<400> 87
accuuuccag cucaucccac cucugccacc aaaacacuca ucgcgggguc agagggagug 60
ccaaaaaagg uaa 73
<210> 88
<211> 23
<212> RNA
<213> Homo sapiens
<400> 88
ugaggggcag agagcgagac uuu 23
<210> 89
<211> 94
<212> RNA
<213> Homo sapiens
<400> 89
auaaaggaag uuaggcugag gggcagagag cgagacuuuu cuauuuucca aaagcucggu 60
cugaggcccc ucagucuugc uuccuaaccc gcgc 94
<210> 90
<211> 22
<212> RNA
<213> Homo sapiens
<400> 90
uuaucagaau cuccaggggu ac 22
<210> 91
<211> 72
<212> RNA
<213> Homo sapiens
<400> 91
ggagcuuauc agaaucucca gggguacuuu auaauuucaa aaaguccccc aggugugauu 60
cugauuugcu uc 72
<210> 92
<211> 23
<212> RNA
<213> Homo sapiens
<400> 92
caaagugcug uucgugcagg uag 23
<210> 93
<211> 80
<212> RNA
<213> Homo sapiens
<400> 93
cugggggcuc caaagugcug uucgugcagg uagugugauu acccaaccua cugcugagcu 60
agcacuuccc gagcccccgg 80
<210> 94
<211> 23
<212> RNA
<213> Homo sapiens
<400> 94
agcuacauug ucugcugggu uuc 23
<210> 95
<211> 110
<212> RNA
<213> Homo sapiens
<400> 95
ugaacaucca ggucuggggc augaaccugg cauacaaugu agauuucugu guucguuagg 60
caacagcuac auugucugcu ggguuucagg cuaccuggaa acauguucuc 110
<210> 96
<211> 23
<212> RNA
<213> Homo sapiens
<400> 96
uaaagugcuu auagugcagg uag 23
<210> 97
<211> 71
<212> RNA
<213> Homo sapiens
<400> 97
guagcacuaa agugcuuaua gugcagguag uguuuaguua ucuacugcau uaugagcacu 60
uaaaguacug c 71
<210> 98
<211> 23
<212> RNA
<213> Homo sapiens
<400> 98
uguaaacauc cuacacucuc agc 23
<210> 99
<211> 23
<212> RNA
<213> Homo sapiens
<400> 99
uguaaacauc cuacacucuc agc 23
<210> 100
<211> 89
<212> RNA
<213> Homo sapiens
<400> 100
accaugcugu agugugugua aacauccuac acucucagcu gugagcucaa gguggcuggg 60
agaggguugu uuacuccuuc ugccaugga 89
<210> 101
<211> 72
<212> RNA
<213> Homo sapiens
<400> 101
agauacugua aacauccuac acucucagcu guggaaagua agaaagcugg gagaaggcug 60
uuuacucuuu cu 72
<210> 102
<211> 22
<212> RNA
<213> Homo sapiens
<400> 102
uagcagcaca ucaugguuua ca 22
<210> 103
<211> 98
<212> RNA
<213> Homo sapiens
<400> 103
uugaggccuu aaaguacugu agcagcacau caugguuuac augcuacagu caagaugcga 60
aucauuauuu gcugcucuag aaauuuaagg aaauucau 98
<210> 104
<211> 22
<212> RNA
<213> Homo sapiens
<400> 104
ugagguagua guuuguacag uu 22
<210> 105
<211> 84
<212> RNA
<213> Homo sapiens
<400> 105
aggcugaggu aguaguuugu acaguuugag ggucuaugau accacccggu acaggagaua 60
acuguacagg ccacugccuu gcca 84
<210> 106
<211> 22
<212> RNA
<213> Homo sapiens
<400> 106
ugagguagua gguugugugg uu 22
<210> 107
<211> 83
<212> RNA
<213> Homo sapiens
<400> 107
cggggugagg uaguagguug ugugguuuca gggcagugau guugccccuc ggaagauaac 60
uauacaaccu acugccuucc cug 83
<210> 108
<211> 22
<212> RNA
<213> Homo sapiens
<400> 108
ugagguagua gguuguauag uu 22
<210> 109
<211> 22
<212> RNA
<213> Homo sapiens
<400> 109
ugagguagua gguuguauag uu 22
<210> 110
<211> 22
<212> RNA
<213> Homo sapiens
<400> 110
ugagguagua gguuguauag uu 22
<210> 111
<211> 80
<212> RNA
<213> Homo sapiens
<400> 111
ugggaugagg uaguagguug uauaguuuua gggucacacc caccacuggg agauaacuau 60
acaaucuacu gucuuuccua 80
<210> 112
<211> 72
<212> RNA
<213> Homo sapiens
<400> 112
agguugaggu aguagguugu auaguuuaga auuacaucaa gggagauaac uguacagccu 60
ccuagcuuuc cu 72
<210> 113
<211> 74
<212> RNA
<213> Homo sapiens
<400> 113
gggugaggua guagguugua uaguuugggg cucugcccug cuaugggaua acuauacaau 60
cuacugucuu uccu 74
<210> 114
<211> 23
<212> RNA
<213> Homo sapiens
<400> 114
ugagugugug ugugugagug ugu 23
<210> 115
<211> 96
<212> RNA
<213> Homo sapiens
<400> 115
gggaccugcg ugggugcggg cgugugagug ugugugugug aguguguguc gcuccggguc 60
cacgcucaug cacacaccca cacgcccaca cucagg 96
<210> 116
<211> 23
<212> RNA
<213> Homo sapiens
<400> 116
ugugcaaauc uaugcaaaac uga 23
<210> 117
<211> 82
<212> RNA
<213> Homo sapiens
<400> 117
gcaguccucu guuaguuuug cauaguugca cuacaagaag aauguaguug ugcaaaucua 60
ugcaaaacug augguggccu gc 82
<210> 118
<211> 22
<212> RNA
<213> Homo sapiens
<400> 118
ugagguagua gauuguauag uu 22
<210> 119
<211> 22
<212> RNA
<213> Homo sapiens
<400> 119
ugagguagua gauuguauag uu 22
<210> 120
<211> 87
<212> RNA
<213> Homo sapiens
<400> 120
ucagagugag guaguagauu guauaguugu gggguaguga uuuuacccug uucaggagau 60
aacuauacaa ucuauugccu ucccuga 87
<210> 121
<211> 83
<212> RNA
<213> Homo sapiens
<400> 121
ugugggauga gguaguagau uguauaguuu uagggucaua ccccaucuug gagauaacua 60
uacagucuac ugucuuuccc acg 83
<210> 122
<211> 22
<212> RNA
<213> Homo sapiens
<400> 122
cagugguuuu acccuauggu ag 22
<210> 123
<211> 100
<212> RNA
<213> Homo sapiens
<400> 123
ugugucucuc ucuguguccu gccagugguu uuacccuaug guagguuacg ucaugcuguu 60
cuaccacagg guagaaccac ggacaggaua ccggggcacc 100
<210> 124
<211> 22
<212> RNA
<213> Homo sapiens
<400> 124
uguaaacauc cucgacugga ag 22
<210> 125
<211> 71
<212> RNA
<213> Homo sapiens
<400> 125
gcgacuguaa acauccucga cuggaagcug ugaagccaca gaugggcuuu cagucggaug 60
uuugcagcug c 71
<210> 126
<211> 22
<212> RNA
<213> Homo sapiens
<400> 126
ugauauguuu gauauauuag gu 22
<210> 127
<211> 85
<212> RNA
<213> Homo sapiens
<400> 127
ugcaggccuc ugugugauau guuugauaua uuagguuguu auuuaaucca acuauauauc 60
aaacauauuc cuacaguguc uugcc 85
<210> 128
<211> 23
<212> RNA
<213> Homo sapiens
<400> 128
uaauccuugc uaccugggug aga 23
<210> 129
<211> 18
<212> RNA
<213> Homo sapiens
<400> 129
aauccuugcu accugggu 18
<210> 130
<211> 84
<212> RNA
<213> Homo sapiens
<400> 130
gcucccccuc ucuaauccuu gcuaccuggg ugagagugcu gucugaaugc aaugcaccug 60
ggcaaggauu cugagagcga gagc 84
<210> 131
<211> 79
<212> RNA
<213> Homo sapiens
<400> 131
cccccucucu aauccuugcu accuggguga gagugcuuuc ugaaugcagu gcacccaggc 60
aaggauucug caaggggga 79
<210> 132
<211> 22
<212> RNA
<213> Homo sapiens
<400> 132
ugagguagua guuugugcug uu 22
<210> 133
<211> 84
<212> RNA
<213> Homo sapiens
<400> 133
cuggcugagg uaguaguuug ugcuguuggu cggguuguga cauugcccgc uguggagaua 60
acugcgcaag cuacugccuu gcua 84
<210> 134
<211> 21
<212> RNA
<213> Homo sapiens
<400> 134
aucacauugc cagggauuuc c 21
<210> 135
<211> 73
<212> RNA
<213> Homo sapiens
<400> 135
ggccggcugg gguuccuggg gaugggauuu gcuuccuguc acaaaucaca uugccaggga 60
uuuccaaccg acc 73
<210> 136
<211> 21
<212> RNA
<213> Homo sapiens
<400> 136
cauaaaguag aaagcacuac u 21
<210> 137
<211> 87
<212> RNA
<213> Homo sapiens
<400> 137
gacagugcag ucacccauaa aguagaaagc acuacuaaca gcacuggagg guguaguguu 60
uccuacuuua uggaugagug uacugug 87
<210> 138
<211> 22
<212> RNA
<213> Homo sapiens
<400> 138
uagcagcaca uaaugguuug ug 22
<210> 139
<211> 83
<212> RNA
<213> Homo sapiens
<400> 139
ccuuggagua aaguagcagc acauaauggu uuguggauuu ugaaaaggug caggccauau 60
ugugcugccu caaaaauaca agg 83
<210> 140
<211> 23
<212> RNA
<213> Homo sapiens
<400> 140
caacggaauc ccaaaagcag cug 23
<210> 141
<211> 92
<212> RNA
<213> Homo sapiens
<400> 141
cggcuggaca gcgggcaacg gaaucccaaa agcagcuguu gucuccagag cauuccagcu 60
gcgcuuggau uucguccccu gcucuccugc cu 92
<210> 142
<211> 17
<212> RNA
<213> Homo sapiens
<400> 142
ucucgcuggg gccucca 17
<210> 143
<211> 110
<212> RNA
<213> Homo sapiens
<400> 143
ccggaucuca cacgguggug uuaauaucuc gcuggggccu ccaaaauguu gugcccaggg 60
guguuagaga aaacaccaca cuuugagaug aauuaagagu ccuuuauuag 110
<210> 144
<211> 22
<212> RNA
<213> Homo sapiens
<400> 144
aaaagcuggg uugagagggc ga 22
<210> 145
<211> 82
<212> RNA
<213> Homo sapiens
<400> 145
gcuucgcucc ccuccgccuu cucuucccgg uucuucccgg agucgggaaa agcuggguug 60
agagggcgaa aaaggaugag gu 82
<210> 146
<211> 24
<212> RNA
<213> Homo sapiens
<400> 146
acaaagugcu ucccuuuaga gugu 24
<210> 147
<211> 90
<212> RNA
<213> Homo sapiens
<400> 147
ucccaugcug ugacccucua gaggaagcac uuucuguuug uugucugaga aaaaacaaag 60
ugcuucccuu uagaguguua ccguuuggga 90
<210> 148
<211> 22
<212> RNA
<213> Homo sapiens
<400> 148
uucccuuugu cauccuaugc cu 22
<210> 149
<211> 110
<212> RNA
<213> Homo sapiens
<400> 149
ggcuacaguc uuucuucaug ugacucgugg acuucccuuu gucauccuau gccugagaau 60
auaugaagga ggcugggaag gcaaagggac guucaauugu caucacuggc 110
<210> 150
<211> 21
<212> RNA
<213> Homo sapiens
<400> 150
gaaagcgcuu cucuuuagag g 21
<210> 151
<211> 87
<212> RNA
<213> Homo sapiens
<400> 151
ucucaugcug ugacccucua gagggaagca cuuucucuug ucuaaaagaa aagaaagcgc 60
uucucuuuag aggauuacuc uuugaga 87
<210> 152
<211> 22
<212> RNA
<213> Homo sapiens
<400> 152
uggaauguaa ggaagugugu gg 22
<210> 153
<211> 86
<212> RNA
<213> Homo sapiens
<400> 153
ugcuucccga ggccacaugc uucuuuauau ccccauaugg auuacuuugc uauggaaugu 60
aaggaagugu gugguuucgg caagug 86
<210> 154
<211> 22
<212> RNA
<213> Homo sapiens
<400> 154
uucccuuugu cauccuaugc cu 22
<210> 155
<211> 110
<212> RNA
<213> Homo sapiens
<400> 155
ggcuacaguc uuucuucaug ugacucgugg acuucccuuu gucauccuau gccugagaau 60
auaugaagga ggcugggaag gcaaagggac guucaauugu caucacuggc 110
<210> 156
<211> 23
<212> RNA
<213> Homo sapiens
<400> 156
uuauugcuua agaauacgcg uag 23
<210> 157
<211> 102
<212> RNA
<213> Homo sapiens
<400> 157
gguccucuga cucucuucgg ugacggguau ucuugggugg auaauacgga uuacguuguu 60
auugcuuaag aauacgcgua gucgaggaga guaccagcgg ca 102
<210> 158
<211> 22
<212> RNA
<213> Homo sapiens
<400> 158
cacacacugc aauuacuuuu gc 22
<210> 159
<211> 97
<212> RNA
<213> Homo sapiens
<400> 159
gauugaugcu guugguuugg ugcaaaagua auugcagugc uucccauuua aaaguaaugg 60
cacacacugc aauuacuuuu gcuccaacuu aauacuu 97
<210> 160
<211> 17
<212> RNA
<213> Homo sapiens
<400> 160
uucaaguaau ucaggug 17
<210> 161
<211> 77
<212> RNA
<213> Homo sapiens
<400> 161
uguuuaucuc uaggguugau cuauuagaau uacuuaucug agccaaagua auucaaguaa 60
uucaggugua gugaaac 77
<210> 162
<211> 21
<212> RNA
<213> Homo sapiens
<400> 162
cugaccuaug aauugacagc c 21
<210> 163
<211> 110
<212> RNA
<213> Homo sapiens
<400> 163
gccgagaccg agugcacagg gcucugaccu augaauugac agccagugcu cucgucuccc 60
cucuggcugc caauuccaua ggucacaggu auguucgccu caaugccagc 110
<210> 164
<211> 22
<212> RNA
<213> Homo sapiens
<400> 164
cucuagaggg aagcacuuuc ug 22
<210> 165
<211> 22
<212> RNA
<213> Homo sapiens
<400> 165
cucuagaggg aagcacuuuc ug 22
<210> 166
<211> 85
<212> RNA
<213> Homo sapiens
<400> 166
cucaggcugu gacccucuag agggaagcac uuucuguugc uugaaagaag agaaagcgcu 60
uccuuuuaga ggauuacucu uugag 85
<210> 167
<211> 65
<212> RNA
<213> Homo sapiens
<400> 167
gugacccucu agagggaagc acuuucuguu gaaagaaaag aacaugcauc cuuucagagg 60
guuac 65
<210> 168
<211> 22
<212> RNA
<213> Homo sapiens
<400> 168
gggggucccc ggugcucgga uc 22
<210> 169
<211> 96
<212> RNA
<213> Homo sapiens
<400> 169
cucgggaggg gcgggagggg gguccccggu gcucggaucu cgagggugcu uauuguucgg 60
uccgagccug ggucucccuc uuccccccaa cccccc 96
<210> 170
<211> 22
<212> RNA
<213> Homo sapiens
<400> 170
auaauacaug guuaaccucu uu 22
<210> 171
<211> 97
<212> RNA
<213> Homo sapiens
<400> 171
aacuaugcaa ggauauuuga ggagagguua uccguguuau guucgcuuca uucaucauga 60
auaauacaug guuaaccucu uuuugaauau cagacuc 97
<210> 172
<211> 22
<212> RNA
<213> Homo sapiens
<400> 172
uuuugcaaua uguuccugaa ua 22
<210> 173
<211> 78
<212> RNA
<213> Homo sapiens
<400> 173
gcagaauuau uuuugcaaua uguuccugaa uauguaauau aaguguauug ggaucauuuu 60
gcauccauag uuuuguau 78
<210> 174
<211> 22
<212> RNA
<213> Homo sapiens
<400> 174
aaaaguaauu gugguuuugg cc 22
<210> 175
<211> 97
<212> RNA
<213> Homo sapiens
<400> 175
cagacuauau auuuagguug gcgcaaaagu aauugugguu uuggccuuua uuuucaaugg 60
caagaaccuc aguugcuuuu gugccaaccu aauacuu 97
<210> 176
<211> 22
<212> RNA
<213> Homo sapiens
<400> 176
uuaugguuug ccugggacug ag 22
<210> 177
<211> 97
<212> RNA
<213> Homo sapiens
<400> 177
uagggugacc agccauuaug guuugccugg gacugaggaa uuugcuggga uaugucaguu 60
ccaggccaac caggcugguu ggucucccug aagcaac 97
<210> 178
<211> 19
<212> RNA
<213> Homo sapiens
<400> 178
aaaaacugua auuacuuuu 19
<210> 179
<211> 19
<212> RNA
<213> Homo sapiens
<400> 179
aaaaacugua auuacuuuu 19
<210> 180
<211> 19
<212> RNA
<213> Homo sapiens
<400> 180
aaaaacugua auuacuuuu 19
<210> 181
<211> 19
<212> RNA
<213> Homo sapiens
<400> 181
aaaaacugua auuacuuuu 19
<210> 182
<211> 19
<212> RNA
<213> Homo sapiens
<400> 182
aaaaacugua auuacuuuu 19
<210> 183
<211> 84
<212> RNA
<213> Homo sapiens
<400> 183
auuagguugg ugcaaaagua aucacaguuu uugacauuac uuucaaagac aaaaacugua 60
auuacuuuug gaccaaccua auag 84
<210> 184
<211> 98
<212> RNA
<213> Homo sapiens
<400> 184
uaauaacuau uagguuggug cgaacauaau ugcaguuuuu aucauuacuu uuaauggcaa 60
aaacuguaau uacuuuugca ccaaccuaau auuuuagu 98
<210> 185
<211> 87
<212> RNA
<213> Homo sapiens
<400> 185
auuagguugg ugcaaaccua auugcaauuu uugcaguuuu uuuaaguaau ugcaaaaacu 60
guaauuacuu uugcaccaac cuaauac 87
<210> 186
<211> 105
<212> RNA
<213> Homo sapiens
<400> 186
gaguucuaac guauuagguu ggugcaaaag uaauaguggu uuuugccauu aaaaguaaug 60
acaaaaacug uaauuacuuu uggaacaaua uuaauagaau uucag 105
<210> 187
<211> 86
<212> RNA
<213> Homo sapiens
<400> 187
uauuagguug cugcaaaagu aaucauguuu uuuuccauug uaaguaaugg gaaaaacugu 60
aauuacuuuu guaccaaccu aauagc 86
<210> 188
<211> 22
<212> RNA
<213> Homo sapiens
<400> 188
uauacaaggg cagacucucu cu 22
<210> 189
<211> 83
<212> RNA
<213> Homo sapiens
<400> 189
ugcuacuuga agagagguaa uccuucacgc auuugcuuua cuugcaauga uuauacaagg 60
gcagacucuc ucuggggagc aaa 83
<210> 190
<211> 23
<212> RNA
<213> Homo sapiens
<400> 190
uaagugcuuc cauguuucag ugg 23
<210> 191
<211> 68
<212> RNA
<213> Homo sapiens
<400> 191
ccuuugcuuu aacauggggg uaccugcugu gugaaacaaa aguaagugcu uccauguuuc 60
aguggagg 68
<210> 192
<211> 23
<212> RNA
<213> Homo sapiens
<400> 192
aucaacagac auuaauuggg cgc 23
<210> 193
<211> 85
<212> RNA
<213> Homo sapiens
<400> 193
gcacauugua ggccucauua aauguuuguu gaaugaaaaa augaaucauc aacagacauu 60
aauugggcgc cugcucugug aucuc 85
<210> 194
<211> 22
<212> RNA
<213> Homo sapiens
<400> 194
uugagaauga ugaaucauua gg 22
<210> 195
<211> 97
<212> RNA
<213> Homo sapiens
<400> 195
auaaaauuuc caauuggaac cuaaugauuc aucagacuca gauauuuaag uuaacaguau 60
uugagaauga ugaaucauua gguuccgguc agaaauu 97
<210> 196
<211> 22
<212> RNA
<213> Homo sapiens
<400> 196
uuuaggauaa gcuugacuuu ug 22
<210> 197
<211> 97
<212> RNA
<213> Homo sapiens
<400> 197
aaucuaucac ugcuuuuuag gauaagcuug acuuuuguuc aaauaaaaau gcaaaaggaa 60
aguguauccu aaaaggcaau gacaguuuaa uguguuu 97
<210> 198
<211> 21
<212> RNA
<213> Homo sapiens
<400> 198
ugguagacua uggaacguag g 21
<210> 199
<211> 67
<212> RNA
<213> Homo sapiens
<400> 199
agagauggua gacuauggaa cguaggcguu augauuucug accuauguaa caugguccac 60
uaacucu 67
<210> 200
<211> 22
<212> RNA
<213> Homo sapiens
<400> 200
ugggucuuug cgggcgagau ga 22
<210> 201
<211> 88
<212> RNA
<213> Homo sapiens
<400> 201
cgaggauggg agcugagggc ugggucuuug cgggcgagau gagggugucg gaucaacugg 60
ccuacaaagu cccaguucuc ggcccccg 88
<210> 202
<211> 24
<212> RNA
<213> Homo sapiens
<400> 202
uucuccaaaa gaaagcacuu ucug 24
<210> 203
<211> 24
<212> RNA
<213> Homo sapiens
<400> 203
uucuccaaaa gaaagcacuu ucug 24
<210> 204
<211> 83
<212> RNA
<213> Homo sapiens
<400> 204
ucucaugcag ucauucucca aaagaaagca cuuucuguug ucugaaagca gagugccuuc 60
uuuuggagcg uuacuguuug aga 83
<210> 205
<211> 83
<212> RNA
<213> Homo sapiens
<400> 205
ucucaugcag ucauucucca aaagaaagca cuuucuguug ucugaaagca gagugccuuc 60
uuuuggagcg uuacuguuug aga 83
<210> 206
<211> 22
<212> RNA
<213> Homo sapiens
<400> 206
uacgucaucg uugucaucgu ca 22
<210> 207
<211> 97
<212> RNA
<213> Homo sapiens
<400> 207
gcuugaugau gcugcugaug cuggcgguga ucccgauggu gugagcugga aauggggugc 60
uacgucaucg uugucaucgu caucaucauc auccgag 97
<210> 208
<211> 18
<212> RNA
<213> Homo sapiens
<400> 208
uucacaggga ggugucau 18
<210> 209
<211> 18
<212> RNA
<213> Homo sapiens
<400> 209
uucacaggga ggugucau 18
<210> 210
<211> 129
<212> RNA
<213> Homo sapiens
<400> 210
gggaugccac auucagccau ucagcguaca gugccuuuca cagggaggug ucauuuaugu 60
gaacuaaaau auaaauuuca ccuuucugag aaggguaaug uacagcaugc acugcauaug 120
ugguguccc 129
<210> 211
<211> 127
<212> RNA
<213> Homo sapiens
<400> 211
ggaugccaca uucagccauu cagugugcag ugccuuucac agggaggugu cauuuaugug 60
aacuaaaaua uaaauuucac cuuucugaga aggguaaugu acagcaugca cugcauaugu 120
ggugucc 127
<210> 212
<211> 21
<212> RNA
<213> Homo sapiens
<400> 212
augauccagg aaccugccuc u 21
<210> 213
<211> 96
<212> RNA
<213> Homo sapiens
<400> 213
gugacccugg gcaaguuccu gaagaucaga cacaucagau cccuuaucug uaaaaugggc 60
augauccagg aaccugccuc uacgguugcc uugggg 96
<210> 214
<211> 22
<212> RNA
<213> Homo sapiens
<400> 214
aaaacuguaa uuacuuuugu ac 22
<210> 215
<211> 89
<212> RNA
<213> Homo sapiens
<400> 215
aguuauuaga uuagugcaaa aguaauugca guuuuugcau uacguucuau ggcaaaacug 60
uaauuacuuu uguaccaaca uaauacuuc 89
<210> 216
<211> 21
<212> RNA
<213> Homo sapiens
<400> 216
uguucaugua gauguuuaag c 21
<210> 217
<211> 59
<212> RNA
<213> Homo sapiens
<400> 217
caguguucau guagauguuu aagcucuugc aguagguuuu ugcaagcuag ugaacgcug 59
<210> 218
<211> 22
<212> RNA
<213> Homo sapiens
<400> 218
agaucagaag gugauugugg cu 22
<210> 219
<211> 73
<212> RNA
<213> Homo sapiens
<400> 219
cuccucagau cagaagguga uuguggcuuu ggguggauau uaaucagcca cagcacugcc 60
uggucagaaa gag 73
<210> 220
<211> 22
<212> RNA
<213> Homo sapiens
<400> 220
aaaccugugu uguucaagag uc 22
<210> 221
<211> 97
<212> RNA
<213> Homo sapiens
<400> 221
ggccuagcca aauacuguau uuuugaucga cauuugguug aaaaauaucu auguauuagu 60
aaaccugugu uguucaagag uccacugugu uuugcug 97
<210> 222
<211> 22
<212> RNA
<213> Homo sapiens
<400> 222
uugugucaau augcgaugau gu 22
<210> 223
<211> 97
<212> RNA
<213> Homo sapiens
<400> 223
uauuaugcca ugacauugug ucaauaugcg augauguguu gugauggcac agcgucauca 60
cguggugacg caacaucaug acguaagacg ucacaac 97
<210> 224
<211> 23
<212> RNA
<213> Homo sapiens
<400> 224
cuguaauaua aauuuaauuu auu 23
<210> 225
<211> 49
<212> RNA
<213> Homo sapiens
<400> 225
cuguaauaua aauuuaauuu auucucuauc auuaaaaaau guauuacag 49
<210> 226
<211> 22
<212> RNA
<213> Homo sapiens
<400> 226
uuuugcgaug uguuccuaau au 22
<210> 227
<211> 22
<212> RNA
<213> Homo sapiens
<400> 227
uuuugcgaug uguuccuaau au 22
<210> 228
<211> 91
<212> RNA
<213> Homo sapiens
<400> 228
aaacgauacu aaacuguuuu ugcgaugugu uccuaauaug cacuauaaau auauugggaa 60
cauuuugcau guauaguuuu guaucaauau a 91
<210> 229
<211> 100
<212> RNA
<213> Homo sapiens
<400> 229
ccaaagaaag augcuaaacu auuuuugcga uguguuccua auauguaaua uaaauguauu 60
ggggacauuu ugcauucaua guuuuguauc aauaauaugg 100
<210> 230
<211> 24
<212> RNA
<213> Homo sapiens
<400> 230
aauccuugga accuaggugu gagu 24
<210> 231
<211> 65
<212> RNA
<213> Homo sapiens
<400> 231
cuugaauccu uggaaccuag gugugagugc uauuucagug caacacaccu auucaaggau 60
ucaaa 65
<210> 232
<211> 22
<212> RNA
<213> Homo sapiens
<400> 232
ugggucuuug cgggcgagau ga 22
<210> 233
<211> 88
<212> RNA
<213> Homo sapiens
<400> 233
cgaggauggg agcugagggc ugggucuuug cgggcgagau gagggugucg gaucaacugg 60
ccuacaaagu cccaguucuc ggcccccg 88
<210> 234
<211> 19
<212> RNA
<213> Homo sapiens
<400> 234
gggcgccugu gaucccaac 19
<210> 235
<211> 94
<212> RNA
<213> Homo sapiens
<400> 235
gcuaggcgug guggcgggcg ccugugaucc caacuacuca ggaggcuggg gcagcagaau 60
cgcuugaacc cgggaggcga agguugcagu gagc 94
<210> 236
<211> 21
<212> RNA
<213> Homo sapiens
<400> 236
cauaaaguag aaagcacuac u 21
<210> 237
<211> 87
<212> RNA
<213> Homo sapiens
<400> 237
gacagugcag ucacccauaa aguagaaagc acuacuaaca gcacuggagg guguaguguu 60
uccuacuuua uggaugagug uacugug 87
<210> 238
<211> 22
<212> RNA
<213> Homo sapiens
<400> 238
uagcagcaca uaaugguuug ug 22
<210> 239
<211> 83
<212> RNA
<213> Homo sapiens
<400> 239
ccuuggagua aaguagcagc acauaauggu uuguggauuu ugaaaaggug caggccauau 60
ugugcugccu caaaaauaca agg 83
<210> 240
<211> 22
<212> RNA
<213> Homo sapiens
<400> 240
aaaaccgucu aguuacaguu gu 22
<210> 241
<211> 61
<212> RNA
<213> Homo sapiens
<400> 241
acagcuguaa uuagucaguu uucuguccug uccacacaga aaaccgucua guuacaguug 60
u 61
<210> 242
<211> 22
<212> RNA
<213> Homo sapiens
<400> 242
ucagugcauc acagaacuuu gu 22
<210> 243
<211> 99
<212> RNA
<213> Homo sapiens
<400> 243
caagcacgau uagcauuuga ggugaaguuc uguuauacac ucaggcugug gcucucugaa 60
agucagugca ucacagaacu uugucucgaa agcuuucua 99
<210> 244
<211> 22
<212> RNA
<213> Homo sapiens
<400> 244
ugaaacauac acgggaaacc uc 22
<210> 245
<211> 81
<212> RNA
<213> Homo sapiens
<400> 245
gauacucgaa ggagagguug uccguguugu cuucucuuua uuuaugauga aacauacacg 60
ggaaaccucu uuuuuaguau c 81
<210> 246
<211> 22
<212> RNA
<213> Homo sapiens
<400> 246
agaucgaccg uguuauauuc gc 22
<210> 247
<211> 70
<212> RNA
<213> Homo sapiens
<400> 247
uugaagggag aucgaccgug uuauauucgc uuuauugacu ucgaauaaua caugguugau 60
cuuuucucag 70
<210> 248
<211> 23
<212> RNA
<213> Homo sapiens
<400> 248
uacccuguag auccgaauuu gug 23
<210> 249
<211> 110
<212> RNA
<213> Homo sapiens
<400> 249
gaucugucug ucuucuguau auacccugua gauccgaauu uguguaagga auuuuguggu 60
cacaaauucg uaucuagggg aauauguagu ugacauaaac acuccgcucu 110
<210> 250
<211> 22
<212> RNA
<213> Homo sapiens
<400> 250
uguaaacauc cccgacugga ag 22
<210> 251
<211> 70
<212> RNA
<213> Homo sapiens
<400> 251
guuguuguaa acauccccga cuggaagcug uaagacacag cuaagcuuuc agucagaugu 60
uugcugcuac 70
<210> 252
<211> 23
<212> RNA
<213> Homo sapiens
<400> 252
aaggagcuua caaucuagcu ggg 23
<210> 253
<211> 88
<212> RNA
<213> Homo sapiens
<400> 253
aacugcccuc aaggagcuua caaucuagcu ggggguaaau gacuugcaca ugaacacaac 60
uagacuguga gcuucuagag ggcaggga 88
<210> 254
<211> 22
<212> RNA
<213> Homo sapiens
<400> 254
uucaccaccu ucuccaccca gc 22
<210> 255
<211> 75
<212> RNA
<213> Homo sapiens
<400> 255
ggcugugccg gguagagagg gcagugggag guaagagcuc uucacccuuc accaccuucu 60
ccacccagca uggcc 75
<210> 256
<211> 18
<212> RNA
<213> Homo sapiens
<400> 256
gucccuguuc aggcgcca 18
<210> 257
<211> 23
<212> RNA
<213> Homo sapiens
<400> 257
agguuguccg uggugaguuc gca 23
<210> 258
<211> 82
<212> RNA
<213> Homo sapiens
<400> 258
ugguacucgg agggagguug uccgugguga guucgcauua uuuaaugaug cccaauacac 60
ggucgaccuc uuuucgguau ca 82
<210> 259
<211> 97
<212> RNA
<213> Homo sapiens
<400> 259
cugcuccuuc ucccauaccc auugcauauc ggaguuguga auucucaaaa caccuccugu 60
gugcauggau uacaggaggg ugagccuugu caucgug 97
<210> 260
<211> 22
<212> RNA
<213> Homo sapiens
<400> 260
uacccauugc auaucggagu ug 22
<210> 261
<211> 21
<212> RNA
<213> Homo sapiens
<400> 261
accuccugug ugcauggauu a 21
<210> 262
<211> 15
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<221> modified_base
<222> (1)..(1)
<223> LNA moiety
<220>
<221> modified_base
<222> (3)..(3)
<223> LNA moiety
<220>
<221> modified_base
<222> (5)..(7)
<223> LNA moiety
<220>
<221> modified_base
<222> (10)..(12)
<223> LNA moiety
<220>
<221> modified_base
<222> (14)..(15)
<223> LNA moiety
<400> 262
tcacaattag catta 15
<210> 263
<211> 15
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<221> modified_base
<222> (1)..(1)
<223> LNA moiety
<220>
<221> modified_base
<222> (3)..(3)
<223> LNA moiety
<220>
<221> modified_base
<222> (5)..(7)
<223> LNA moiety
<220>
<221> modified_base
<222> (10)..(12)
<223> LNA moiety
<220>
<221> modified_base
<222> (14)..(15)
<223> LNA moiety
<400> 263
tcaacattag actta 15
<210> 264
<211> 17
<212> RNA
<213> Homo sapiens
<400> 264
ucccuguucg ggcgcca 17
<210> 265
<211> 21
<212> RNA
<213> Homo sapiens
<400> 265
uucacagugg cuaaguuccg c 21
Claims (39)
- 대상체의 근 위축성 측삭 경화증(ALS)의 치료를 위하여, hsa-miR-155에 존재하는 연속 서열, 예컨대 적어도 5개의 뉴클레오티드의 연속 서열에 상보적인 서열을 포함하는 억제성 핵산.
- 대상체의 근 위축성 측삭 경화증(ALS)을 치료하는 방법으로서, hsa-miR-155, hsa-miR-19b, hsa-miR-106b, hsa-miR-30b, hsa-miR-21, hsa-miR-142-5p, hsa-miR-27a, hsa-miR-16, hsa-miR-374a, hsa-miR-374b, hsa-miR-101, hsa-miR-340, hsa-miR-30e, hsa-miR-29c, hsa-miR-29a, hsa-miR-223, hsa-miR-26a, hsa-miR-26b, hsa-miR-24, hsa-miR-181a, hsa-miR-103, hsa-miR-532-3p, hsa-miR-27b, hsa-miR-99b, hsa-miR-146a, hsa-miR-150, hsa-miR-328, hsa-miR-15b, 및 hsa-miR-19a 중 어느 하나에 존재하는 연속 서열, 예컨대 적어도 5개의 뉴클레오티드의 연속 서열에 상보적인 서열을 포함하는 적어도 하나의 안타고미르(antagomir)를 ALS가 있는 대상체에 투여하는 단계를 포함하는 방법.
- 대상체의 근 위축성 측삭 경화증(ALS)을 치료하는 방법으로서, hsa-miR-155에 존재하는 연속 서열, 예컨대 적어도 5개의 뉴클레오티드의 연속 서열에 상보적인 서열을 포함하는 적어도 하나의 억제성 핵산을 ALS가 있는 대상체에 투여하는 단계를 포함하는 방법.
- 제 3항에 있어서, 상기 적어도 하나의 억제성 핵산은 안타고미르인 방법.
- 제 4항에 있어서, 상기 안타고미르는 서열번호 262의 서열을 가지는 방법.
- 제 3항에 있어서, 상기 적어도 하나의 억제성 핵산은 안티센스 올리고뉴클레오티드인 방법.
- 제 3항에 있어서, 상기 적어도 하나의 억제성 핵산은 리보자임(ribozyme)인 방법.
- 제 3항에 있어서, 상기 적어도 하나의 억제성 핵산을 대상체의 뇌척수액에 주사하는 방법.
- 제 8항에 있어서, 상기 주사는 두개내 주사인 방법.
- 제 8항에 있어서, 상기 주사는 척수강내 주사인 방법.
- 제 3항에 있어서, 상기 적어도 하나의 억제성 핵산은 하나 이상의 양이온성 고분자 및/또는 음이온성 지질과 착화(complex)하는 방법.
- 대상체에서 근 위축성 측삭 경화증(ALS)을 진단하는 방법으로서,
상기 대상체의 CD14+CD16- 단핵구 내의 hsa-miR-19b, hsa-miR-106b, hsa-miR-30b, hsa-miR-21, hsa-miR-142-5p, hsa-miR-27a, hsa-miR-16, hsa-miR-374a, hsa-miR-374b, hsa-miR-101, hsa-miR-340, hsa-miR-30e, hsa-miR-29c, hsa-miR-29a, hsa-miR-223, hsa-miR-26a, hsa-miR-26b, hsa-miR-24, hsa-miR-181a, hsa-miR-103, hsa-miR-155, hsa-miR-532-3p, hsa-miR-518f, hsa-miR-206, hsa-miR-204, hsa-miR-137, hsa-miR-453, hsa-miR-146a, hsa-miR-603, hsa-miR-1297, hsa-miR-192, hsa-miR-526a, hsa-miR-615-5p, hsa-miR-655, hsa-miR-450b-5p, hsa-miR-548b-3p, hsa-miR-584, hsa-miR-548f, hsa-miR-300, hsa-miR-302c, hsa-miR-328, hsa-miR-421, hsa-miR-580, hsa-miR-15b, 및 hsa-miR-19a로 구성되는 군으로부터 선택되는 하나 이상의 마이크로RNA의 레벨을 결정하는 단계; 및
상기 대상체의 CD14+CD16- 단핵구 내의 상기 마이크로RNA 중 하나 이상의 상기 레벨을 상기 하나 이상의 마이크로RNA의 기준 레벨과 비교하는 단계를 포함하되,
상기 기준 레벨 대비 상기 대상체의 CD14+CD16- 단핵구 내의 hsa-miR-19b, hsa-miR-106b, hsa-miR-30b, hsa-miR-21, hsa-miR-142-5p, hsa-miR-27a, hsa-miR-16, hsa-miR-374a, hsa-miR-374b, hsa-miR-101, hsa-miR-340, hsa-miR-30e, hsa-miR-29c, hsa-miR-29a, hsa-miR-223, hsa-miR-26a, hsa-miR-26b, hsa-miR-24, hsa-miR-181a, hsa-miR-103, hsa-miR-155, hsa-miR-532-3p, hsa-miR-15b, 및 has-miR-19a 중 하나 이상의 상기 레벨의 증가 및/또는 hsa-miR-518f, hsa-miR-206, hsa-miR-204, hsa-miR-137, hsa-miR-453, hsa-miR-146a, hsa-miR-603, hsa-miR-1297, hsa-miR-192, hsa-miR-526a, hsa-miR-615-5p, hsa-miR-655, hsa-miR-450b-5p, hsa-miR-548b-3p, hsa-miR-584, hsa-miR-548f, hsa-miR-300, hsa-miR-302c, hsa-miR-328, hsa-miR-421, 및 hsa-miR-580 중 하나 이상의 상기 레벨의 감소는 상기 대상체가 ALS가 있음을 나타내는 방법.
- 대상체에서 근 위축성 측삭 경화증(ALS)을 진단하는 방법으로서,
대상체의 뇌척수액(CSF) 내의 hsa-miR-27b, hsa-miR-99b, hsa-miR-146a, hsa-miR-150, hsa-miR-328, 및 hsa-miR-532-3p 중 하나 이상의 레벨을 결정하는 단계; 및
상기 대상체의 CSF 내의 hsa-miR-27b, hsa-miR-99b, hsa-miR-146a, hsa-miR-150, hsa-miR-328, 및 hsa-miR-532-3p 중 하나 이상의 상기 레벨을 hsa-miR-27b, hsa-miR-99b, hsa-miR-146a, hsa-miR-150, hsa-miR-328, 및 hsa-miR-532-3p 중 하나 이상의 기준 레벨과 비교하는 단계를 포함하되,
상기 기준 레벨 대비 상기 대상체의 CSF 내의 hsa-miR-27b, hsa-miR-99b, hsa-miR-146a, hsa-miR-150, hsa-miR-328, 및 hsa-miR-532-3p 중 하나 이상의 상기 레벨의 증가는 상기 대상체가 ALS가 있음을 나타내는 방법.
- 대상체에서 가족성 근 위축성 측삭 경화증(familial ALS)을 진단하는 방법으로서,
대상체의 뇌척수액(CSF) 내의 hsa-miR-27b의 레벨과 hsa-miR-99b, hsa-miR-146a, hsa-miR-150, hsa-miR-328, 및 hsa-miR-532-3p 중 하나 이상의 레벨을 결정하는 단계; 및
상기 대상체의 CSF 내의 hsa-miR-27b의 상기 레벨을 hsa-miR-27b의 기준 레벨과 비교하고, 상기 대상체의 CSF 내의 hsa-miR-99b, hsa-miR-146a, hsa-miR-150, hsa-miR-328, 및 hsa-miR-532-3p 중 하나 이상의 상기 레벨을 hsa-miR-99b, hsa-miR-146a, hsa-miR-150, hsa-miR-328, 및 hsa-miR-532-3p 중 하나 이상의 기준 레벨과 비교하는 단계를 포함하되,
hsa-miR-27b의 상기 기준 레벨 대비 상기 대상체의 CSF 내의 hsa-miR-27b의 상기 레벨의 증가, 및 hsa-miR-99b, hsa-miR-146a, hsa-miR-150, hsa-miR-328, 및 hsa-miR-532-3p 중 하나 이상의 상기 기준 레벨 대비 상기 대상체의 CSF 내의 miR-99b, hsa-miR-146a, hsa-miR-150, hsa-miR-328, 및 hsa-miR-532-3p 중 하나 이상의 상기 레벨의 감소 또는 유의미하지 않은 변화(no significant change)는 상기 대상체가 가족성 ALS가 있음을 나타내는 방법.
- 대상체에서 산발성 근 위축성 측삭 경화증(sporadic ALS)을 진단하는 방법으로서,
대상체의 뇌척수액(CSF) 내의 hsa-miR-27b, hsa-miR-99b, hsa-miR-146a, hsa-miR-150, hsa-miR-328, 및 hsa-miR-532-3p으로 구성되는 군에서 선택되는 둘 이상의 마이크로RNA의 레벨을 결정하는 단계; 및
상기 대상체의 CSF 내의 상기 둘 이상의 마이크로RNA의 상기 레벨을 상기 둘 이상의 마이크로RNA의 기준 레벨과 비교하는 단계를 포함하되,
상기 기준 레벨 대비 상기 대상체의 CSF 내의 상기 둘 이상의 마이크로RNA의 상기 레벨의 증가는 상기 대상체가 산발성 ALS가 있음을 나타내는 방법.
- 근 위축성 측삭 경화증(ALS)이 발생될 위험이 있는 대상체를 확인(identifying)하는 방법으로서,
상기 대상체의 CD14+CD16- 단핵구 내의 hsa-miR-19b, hsa-miR-106b, hsa-miR-30b, hsa-miR-21, hsa-miR-142-5p, hsa-miR-27a, hsa-miR-16, hsa-miR-374a, hsa-miR-374b, hsa-miR-101, hsa-miR-340, hsa-miR-30e, hsa-miR-29c, hsa-miR-29a, hsa-miR-223, hsa-miR-26a, hsa-miR-26b, hsa-miR-24, hsa-miR-181a, hsa-miR-103, hsa-miR-155, hsa-miR-532-3p, hsa-miR-518f, hsa-miR-206, hsa-miR-204, hsa-miR-137, hsa-miR-453, hsa-miR-146a, hsa-miR-603, hsa-miR-1297, hsa-miR-192, hsa-miR-526a, hsa-miR-615-5p, hsa-miR-655, hsa-miR-450b-5p, hsa-miR-548b-3p, hsa-miR-584, hsa-miR-548f, hsa-miR-300, hsa-miR-302c, hsa-miR-328, hsa-miR-421, hsa-miR-580, hsa-miR-15b, 및 hsa-miR-19a로 구성되는 군으로부터 선택되는 하나 이상의 마이크로RNA의 레벨을 결정하는 단계와;
상기 대상체의 CD14+CD16- 단핵구 내의 상기 하나 이상의 마이크로RNA의 레벨을 상기 하나 이상의 마이크로RNA의 기준 레벨과 비교하는 단계를 포함하되,
상기 기준 레벨 대비 상기 대상체의 CD14+CD16- 단핵구 내의 hsa-miR-19b, hsa-miR-106b, hsa-miR-30b, hsa-miR-21, hsa-miR-142-5p, hsa-miR-27a, hsa-miR-16, hsa-miR-374a, hsa-miR-374b, hsa-miR-101, hsa-miR-340, hsa-miR-30e, hsa-miR-29c, hsa-miR-29a, hsa-miR-223, hsa-miR-26a, hsa-miR-26b, hsa-miR-24, hsa-miR-181a, hsa-miR-103, hsa-miR-155, hsa-miR-532-3p, hsa-miR-15b, 및 hsa-miR-19a 중 하나 이상의 상기 레벨의 증가 및/또는 hsa-miR-518f, hsa-miR-206, hsa-miR-204, hsa-miR-137, hsa-miR-453, hsa-miR-146a, hsa-miR-603, hsa-miR-1297, hsa-miR-192, hsa-miR-526a, hsa-miR-615-5p, hsa-miR-655, hsa-miR-450b-5p, hsa-miR-548b-3p, hsa-miR-584, hsa-miR-548f, hsa-miR-300, hsa-miR-302c, hsa-miR-328, hsa-miR-421, 및 hsa-miR-580 중 하나 이상의 상기 레벨의 감소는 상기 대상체가 ALS가 발생될 위험이 증가하고 있음을 나타내는 방법.
- 근 위축성 측삭 경화증(ALS)이 발생될 위험이 있는 대상체를 확인(identifying)하는 방법으로서,
대상체의 뇌척수액(CSF) 내의 hsa-miR-27b, hsa-miR-99b, hsa-miR-146a, hsa-miR-150, hsa-miR-328, 및 hsa-miR-532-3p 중 하나 이상의 레벨을 결정하는 단계; 및
대상체의 CSF 내의 hsa-miR-27b, hsa-miR-99b, hsa-miR-146a, hsa-miR-150, hsa-miR-328, 및 hsa-miR-532-3p 중 하나 이상의 상기 레벨을 hsa-miR-27b, hsa-miR-99b, hsa-miR-146a, hsa-miR-150, hsa-miR-328, 및 hsa-miR-532-3p 중 하나 이상의 기준 레벨과 비교하는 단계를 포함하되,
상기 기준 레벨 대비 상기 대상체의 CSF 내의 hsa-miR-27b, hsa-miR-99b, hsa-miR-146a, hsa-miR-150, hsa-miR-328, 및 hsa-miR-532-3p 중 하나 이상의 상기 레벨의 증가는 상기 대상체가 ALS가 발생될 위험이 증가하고 있음을 나타내는 방법.
- 가족성 근 위축성 측삭 경화증(familial ALS)이 발생될 위험이 있는 대상체를 확인(identifying)하는 방법으로서,
대상체의 뇌척수액(CSF) 내의 hsa-miR-27b의 레벨과 hsa-miR-99b, hsa-miR-146a, hsa-miR-150, hsa-miR-328, 및 hsa-miR-532-3p 중 하나 이상의 레벨을 측정하는 단계; 및
상기 대상체의 CSF 내의 hsa-miR-27b의 상기 레벨을 hsa-miR-27b의 기준 레벨과 비교하고, 상기 대상체의 CSF 내의 hsa-miR-99b, hsa-miR-146a, hsa-miR-150, hsa-miR-328, 및 hsa-miR-532-3p 중 하나 이상의 상기 레벨을 hsa-miR-99b, hsa-miR-146a, hsa-miR-150, hsa-miR-328, 및 hsa-miR-532-3p 중 하나 이상의 기준 레벨과 비교하는 단계를 포함하되,
상기 hsa-miR-27b의 상기 기준 레벨 대비 상기 대상체의 CSF 내의 hsa-miR-27b의 상기 레벨의 증가, 및 상기 hsa-miR-99b, hsa-miR-146a, hsa-miR-150, hsa-miR-328, 및 hsa-miR-532-3p 중 하나 이상의 상기 기준 레벨 대비 상기 대상체의 CSF 내의 miR-99b, hsa-miR-146a, hsa-miR-150, hsa-miR-328, 및 hsa-miR-532-3p 중 하나 이상의 상기 레벨의 감소 또는 유의미하지 않은 변화는 상기 대상체가 가족성 ALS가 발생될 위험이 증가하고 있음을 나타내는 방법.
- 산발성 근 위축성 측삭 경화증(sporadic ALS)이 발생될 위험이 있는 대상체를 확인(identifying)하는 방법으로서,
대상체의 뇌척수액(CSF) 내의 hsa-miR-27b, hsa-miR-99b, hsa-miR-146a, hsa-miR-150, hsa-miR-328, 및 hsa-miR-532-3p으로 구성되는 군에서 선택되는 둘 이상의 마이크로RNA의 레벨을 측정하는 단계; 및
상기 대상체의 CSF 내의 상기 둘 이상의 마이크로RNA의 상기 레벨을 상기 둘 이상의 마이크로RNA의 기준 레벨과 비교하는 단계를 포함하되,
상기 기준 레벨 대비 상기 대상체의 CSF 내의 상기 둘 이상의 마이크로RNA의 상기 레벨의 증가는 상기 대상체가 산발성 ALS가 발생될 위험이 증가하고 있음을 나타내는 방법.
- 근 위축성 측삭 경화증(ALS)가 있는 대상체에서 질환의 진행속도를 예측하는 방법으로서,
상기 대상체의 CD14+CD16- 단핵구 내의 hsa-miR-19b, hsa-miR-106b, hsa-miR-30b, hsa-miR-21, hsa-miR-142-5p, hsa-miR-27a, hsa-miR-16, hsa-miR-374a, hsa-miR-374b, hsa-miR-101, hsa-miR-340, hsa-miR-30e, hsa-miR-29c, hsa-miR-29a, hsa-miR-223, hsa-miR-26a, hsa-miR-26b, hsa-miR-24, hsa-miR-181a, hsa-miR-103, hsa-miR-155, hsa-miR-532-3p, hsa-miR-518f, hsa-miR-206, hsa-miR-204, hsa-miR-137, hsa-miR-453, hsa-miR-146a, hsa-miR-603, hsa-miR-1297, hsa-miR-192, hsa-miR-526a, hsa-miR-615-5p, hsa-miR-655, hsa-miR-450b-5p, hsa-miR-548b-3p, hsa-miR-584, hsa-miR-548f, hsa-miR-300, hsa-miR-302c, hsa-miR-328, hsa-miR-421, hsa-miR-580, hsa-miR-15b, 및 hsa-miR-19a로 구성되는 군으로부터 선택되는 하나 이상의 마이크로RNA의 레벨을 결정하는 단계; 및
상기 대상체의 CD14+CD16- 단핵구 내의 상기 하나 이상의 마이크로RNA의 상기 레벨을 상기 하나 이상의 마이크로RNA의 기준 레벨과 비교하는 단계를 포함하되,
상기 기준 레벨 대비 상기 대상체의 CD14+CD16- 단핵구 내의 hsa-miR-19b, hsa-miR-106b, hsa-miR-30b, hsa-miR-21, hsa-miR-142-5p, hsa-miR-27a, hsa-miR-16, hsa-miR-374a, hsa-miR-374b, hsa-miR-101, hsa-miR-340, hsa-miR-30e, hsa-miR-29c, hsa-miR-29a, hsa-miR-223, hsa-miR-26a, hsa-miR-26b, hsa-miR-24, hsa-miR-181a, hsa-miR-103, hsa-miR-155, hsa-miR-532-3p, hsa-miR-15b, 및 hsa-miR-19a 중 하나 이상의 상기 레벨의 증가 및/또는 hsa-miR-518f, hsa-miR-206, hsa-miR-204, hsa-miR-137, hsa-miR-453, hsa-miR-146a, hsa-miR-603, hsa-miR-1297, hsa-miR-192, hsa-miR-526a, hsa-miR-615-5p, hsa-miR-655, hsa-miR-450b-5p, hsa-miR-548b-3p, hsa-miR-584, hsa-miR-548f, hsa-miR-300, hsa-miR-302c, hsa-miR-328, hsa-miR-421, 및 hsa-miR-580 중 하나 이상의 상기 레벨의 감소는 상기 대상체에서 질환의 진행 속도가 증가할 것이라는 것을 있음을 나타내는 방법.
- 근 위축성 측삭 경화증(ALS)가 있는 대상체에서 질환의 진행속도를 예측하는 방법으로서,
대상체의 뇌척수액(CSF) 내의 hsa-miR-27b, hsa-miR-99b, hsa-miR-146a, hsa-miR-150, hsa-miR-328, 및 hsa-miR-532-3p 중 하나 이상의 레벨을 결정하는 단계; 및
대상체의 CSF 내의 hsa-miR-27b, hsa-miR-99b, hsa-miR-146a, hsa-miR-150, hsa-miR-328, 및 hsa-miR-532-3p 중 하나 이상의 상기 레벨을 hsa-miR-27b, hsa-miR-99b, hsa-miR-146a, hsa-miR-150, hsa-miR-328, 및 hsa-miR-532-3p 중 하나 이상의 기준 레벨과 비교하는 단계를 포함하되,
상기 기준 레벨 대비 상기 대상체의 CSF 내의 hsa-miR-27b, hsa-miR-99b, hsa-miR-146a, hsa-miR-150, hsa-miR-328, 및 hsa-miR-532-3p 중 하나 이상의 상기 레벨의 증가는 상기 대상체에서 질환의 진행 속도가 증가할 것이라는 것을 나타내는 방법.
- 제 20항 또는 제 21항에 있어서, 상기 질환의 진행 속도의 증가는 하나 이상의 ALS 증상의 발생률의 증가, 하나 이상의 ALS 증상의 악화의 증가, 하나 이상의 ALS 증상의 빈도의 증가, 하나 이상의 ALS 증상의 지속기간의 증가, 또는 상기 대상체의 수명 감소인 방법.
- 근 위축성 측삭 경화증(ALS)의 치료를 위한 대상체를 선택(selecting)하는 방법으로서,
상기 대상체의 CD14+CD16- 단핵구 내의 hsa-miR-19b, hsa-miR-106b, hsa-miR-30b, hsa-miR-21, hsa-miR-142-5p, hsa-miR-27a, hsa-miR-16, hsa-miR-374a, hsa-miR-374b, hsa-miR-101, hsa-miR-340, hsa-miR-30e, hsa-miR-29c, hsa-miR-29a, hsa-miR-223, hsa-miR-26a, hsa-miR-26b, hsa-miR-24, hsa-miR-181a, hsa-miR-103, hsa-miR-155, hsa-miR-532-3p, hsa-miR-518f, hsa-miR-206, hsa-miR-204, hsa-miR-137, hsa-miR-453, hsa-miR-146a, hsa-miR-603, hsa-miR-1297, hsa-miR-192, hsa-miR-526a, hsa-miR-615-5p, hsa-miR-655, hsa-miR-450b-5p, hsa-miR-548b-3p, hsa-miR-584, hsa-miR-548f, hsa-miR-300, hsa-miR-302c, hsa-miR-328, hsa-miR-421, hsa-miR-580, hsa-miR-15b, 및 hsa-miR-19a로 구성되는 군으로부터 선택되는 하나 이상의 마이크로RNA의 레벨을 결정하는 단계;
상기 대상체의 CD14+CD16- 단핵구 내의 상기 하나 이상의 마이크로RNA의 상기 레벨을 상기 하나 이상의 마이크로RNA의 기준 레벨과 비교하는 단계, 및
상기 기준 레벨 대비 상기 대상체의 CD14+CD16- 단핵구에서, hsa-miR-19b, hsa-miR-106b, hsa-miR-30b, hsa-miR-21, hsa-miR-142-5p, hsa-miR-27a, hsa-miR-16, hsa-miR-374a, hsa-miR-374b, hsa-miR-101, hsa-miR-340, hsa-miR-30e, hsa-miR-29c, hsa-miR-29a, hsa-miR-223, hsa-miR-26a, hsa-miR-26b, hsa-miR-24, hsa-miR-181a, hsa-miR-103, hsa-miR-155, hsa-miR-532-3p, hsa-miR-15b, 및 hsa-miR-19a 중 하나 이상의 상기 레벨의 증가 및/또는 hsa-miR-518f, hsa-miR-206, hsa-miR-204, hsa-miR-137, hsa-miR-453, hsa-miR-146a, hsa-miR-603, hsa-miR-1297, hsa-miR-192, hsa-miR-526a, hsa-miR-615-5p, hsa-miR-655, hsa-miR-450b-5p, hsa-miR-548b-3p, hsa-miR-584, hsa-miR-548f, hsa-miR-300, hsa-miR-302c, hsa-miR-328, hsa-miR-421, 및 hsa-miR-580 중 하나 이상의 상기 레벨의 감소가 있는 대상체를 ALS의 치료를 위하여 선택하는 단계를 포함하는 방법.
- 근 위축성 측삭 경화증(ALS)의 치료를 위한 대상체를 선택(selecting)하는 방법으로서,
대상체의 뇌척수액(CSF) 내의 hsa-miR-27b, hsa-miR-99b, hsa-miR-146a, hsa-miR-150, hsa-miR-328, 및 hsa-miR-532-3p 중 하나 이상의 레벨을 결정하는 단계;
대상체의 CSF 내의 hsa-miR-27b, hsa-miR-99b, hsa-miR-146a, hsa-miR-150, hsa-miR-328, 및 hsa-miR-532-3p 중 하나 이상의 상기 레벨을 hsa-miR-27b, hsa-miR-99b, hsa-miR-146a, hsa-miR-150, hsa-miR-328, 및 hsa-miR-532-3p 중 하나 이상의 기준 레벨과 비교하는 단계; 및
상기 기준 레벨 대비 상기 CSF 내의 hsa-miR-27b, hsa-miR-99b, hsa-miR-146a, hsa-miR-150, hsa-miR-328, 및 hsa-miR-532-3p 중 하나 이상의 상기 레벨의 증가가 있는 대상체를 ALS의 치료를 위하여 선택하는 단계를 포함하는 방법.
- 가족성 근 위축성 측삭 경화증(familial ALS)의 치료를 위한 대상체를 선택(selecting)하는 방법으로서,
대상체의 뇌척수액(CSF) 내의 hsa-miR-27b의 레벨과 hsa-miR-99b, hsa-miR-146a, hsa-miR-150, hsa-miR-328, 및 hsa-miR-532-3p 중 하나 이상의 레벨을 결정하는 단계;
상기 대상체의 CSF 내의 hsa-miR-27b의 상기 레벨을 hsa-miR-27b의 기준 레벨과 비교하고, 상기 대상체의 CSF 내의 hsa-miR-99b, hsa-miR-146a, hsa-miR-150, hsa-miR-328, 및 hsa-miR-532-3p 중 하나 이상의 상기 레벨을 hsa-miR-99b, hsa-miR-146a, hsa-miR-150, hsa-miR-328, 및 hsa-miR-532-3p 중 하나 이상의 기준 레벨과 비교하는 단계; 및
상기 hsa-miR-27b의 기준 레벨 대비 상기 CSF 내의 hsa-miR-27b의 상기 레벨의 증가, 및 hsa-miR-99b, hsa-miR-146a, hsa-miR-150, hsa-miR-328, 및 hsa-miR-532-3p의 하나 이상의 상기 기준 레벨 대비 상기 대상체의 CSF 내의 miR-99b, hsa-miR-146a, hsa-miR-150, hsa-miR-328, 및 hsa-miR-532-3p 중 하나 이상의 상기 레벨의 감소 또는 유의미하지 않은 변화가 있는 대상체를 가족성 ALS의 치료를 위하여 선택하는 단계를 포함하는 방법.
- 측발성 가족성 근 위축성 측삭 경화증(sporadic ALS)의 치료를 위한 대상체를 선택(selecting)하는 방법으로서,
대상체의 뇌척수액(CSF) 내의 hsa-miR-27b, hsa-miR-99b, hsa-miR-146a, hsa-miR-150, hsa-miR-328, 및 hsa-miR-532-3p으로 구성되는 군에서 선택되는 둘 이상의 마이크로RNA의 레벨을 측정하는 단계; 및
상기 대상체의 CSF 내의 상기 둘 이상의 마이크로RNA를 상기 둘 이상의 마이크로RNA의 기준 레벨과 비교하는 단계; 및
상기 기준 레벨 대비 상기 CSF 내의 상기 둘 이상의 마이크로RNA의 상기 레벨의 증가가 있는 대상체를 산발성 ALS의 치료를 위하여 선택하는 단계를 포함하는 방법.
- 제 23항 내지 제 26항 중 어느 한 항에 있어서, 상기 선택된 대상체에 ALS 치료제를 투여하는 방법.
- 임상 연구 참여를 위한 대상체를 선택하는 방법으로서,
상기 대상체의 CD14+CD16- 단핵구 내의 hsa-miR-19b, hsa-miR-106b, hsa-miR-30b, hsa-miR-21, hsa-miR-142-5p, hsa-miR-27a, hsa-miR-16, hsa-miR-374a, hsa-miR-374b, hsa-miR-101, hsa-miR-340, hsa-miR-30e, hsa-miR-29c, hsa-miR-29a, hsa-miR-223, hsa-miR-26a, hsa-miR-26b, hsa-miR-24, hsa-miR-181a, hsa-miR-103, hsa-miR-155, hsa-miR-532-3p, hsa-miR-518f, hsa-miR-206, hsa-miR-204, hsa-miR-137, hsa-miR-453, hsa-miR-146a, hsa-miR-603, hsa-miR-1297, hsa-miR-192, hsa-miR-526a, hsa-miR-615-5p, hsa-miR-655, hsa-miR-450b-5p, hsa-miR-548b-3p, hsa-miR-584, hsa-miR-548f, hsa-miR-300, hsa-miR-302c, hsa-miR-328, hsa-miR-421, hsa-miR-580, hsa-miR-15b, 및 hsa-miR-19a로 구성되는 군으로부터 선택되는 하나 이상의 마이크로RNA의 레벨을 결정하는 단계;
상기 대상체의 CD14+CD16- 단핵구 내의 상기 하나 이상의 마이크로RNA의 상기 레벨을 상기 하나 이상의 마이크로RNA의 기준 레벨과 비교하는 단계, 및
상기 기준 레벨 대비 상기 대상체의 CD14+CD16- 단핵구에서, hsa-miR-19b, hsa-miR-106b, hsa-miR-30b, hsa-miR-21, hsa-miR-142-5p, hsa-miR-27a, hsa-miR-16, hsa-miR-374a, hsa-miR-374b, hsa-miR-101, hsa-miR-340, hsa-miR-30e, hsa-miR-29c, hsa-miR-29a, hsa-miR-223, hsa-miR-26a, hsa-miR-26b, hsa-miR-24, hsa-miR-181a, hsa-miR-103, hsa-miR-155, hsa-miR-532-3p, hsa-miR-15b, 및 hsa-miR-19a 중 하나 이상의 상기 레벨의 증가 및/또는 hsa-miR-518f, hsa-miR-206, hsa-miR-204, hsa-miR-137, hsa-miR-453, hsa-miR-146a, hsa-miR-603, hsa-miR-1297, hsa-miR-192, hsa-miR-526a, hsa-miR-615-5p, hsa-miR-655, hsa-miR-450b-5p, hsa-miR-548b-3p, hsa-miR-584, hsa-miR-548f, hsa-miR-300, hsa-miR-302c, hsa-miR-328, hsa-miR-421, 및 hsa-miR-580 중 하나 이상의 상기 레벨의 감소가 있는 대상체를 임상 연구 참여를 위하여 선택하는 단계를 포함하는 방법.
- 임상 연구 참여를 위한 대상체를 선택하는 방법으로서,
대상체의 뇌척수액(CSF) 내의 hsa-miR-27b, hsa-miR-99b, hsa-miR-146a, hsa-miR-150, hsa-miR-328, 및 hsa-miR-532-3p으로 구성되는 군에서 선택되는 하나 이상의 마이크로RNA의 레벨을 측정하는 단계;
상기 대상체의 CSF 내의 상기 하나 이상의 마이크로RNA를 상기 하나 이상의 마이크로RNA의 기준 레벨과 비교하는 단계; 및
상기 기준 레벨 대비 상기 CSF 내의 상기 하나 이상의 마이크로RNA의 상기 레벨의 증가가 있는 대상체를 임상 연구 참여를 위하여 선택하는 단계를 포함하는 방법.
- 대상체에서 근 위축성 측삭 경화증의 치료의 효능을 판단하는 방법으로서,
제1 시점에서 상기 대상체의 CD14+CD16- 단핵구 내의 hsa-miR-19b, hsa-miR-106b, hsa-miR-30b, hsa-miR-21, hsa-miR-142-5p, hsa-miR-27a, hsa-miR-16, hsa-miR-374a, hsa-miR-374b, hsa-miR-101, hsa-miR-340, hsa-miR-30e, hsa-miR-29c, hsa-miR-29a, hsa-miR-223, hsa-miR-26a, hsa-miR-26b, hsa-miR-24, hsa-miR-181a, hsa-miR-103, hsa-miR-155, hsa-miR-532-3p, hsa-miR-518f, hsa-miR-206, hsa-miR-204, hsa-miR-137, hsa-miR-453, hsa-miR-146a, hsa-miR-603, hsa-miR-1297, hsa-miR-192, hsa-miR-526a, hsa-miR-615-5p, hsa-miR-655, hsa-miR-450b-5p, hsa-miR-548b-3p, hsa-miR-584, hsa-miR-548f, hsa-miR-300, hsa-miR-302c, hsa-miR-328, hsa-miR-421, hsa-miR-580, hsa-miR-15b, 및 hsa-miR-19a로 구성되는 군으로부터 선택되는 하나 이상의 마이크로RNA의 레벨을 결정하는 단계;
적어도 1회 용량의 치료제를 투여한 후 제2 시점에서 상기 대상체의 CD14+CD16- 단핵구 내의 상기 하나 이상의 마이크로RNA의 레벨을 결정하는 단계;
상기 제1 시점에서의 상기 하나 이상의 마이크로RNA의 상기 레벨과 상기 제2 시점에서의 상기 하나 이상의 마이크로RNA의 상기 레벨을 비교하는 단계를 포함하되,
상기 제1 시점에서의 상기 레벨 대비 상기 제2 시점에서의 hsa-miR-19b, hsa-miR-106b, hsa-miR-30b, hsa-miR-21, hsa-miR-142-5p, hsa-miR-27a, hsa-miR-16, hsa-miR-374a, hsa-miR-374b, hsa-miR-101, hsa-miR-340, hsa-miR-30e, hsa-miR-29c, hsa-miR-29a, hsa-miR-223, hsa-miR-26a, hsa-miR-26b, hsa-miR-24, hsa-miR-181a, hsa-miR-103, hsa-miR-155, hsa-miR-532-3p, hsa-miR-15b, 및 hsa-miR-19a 중 하나 이상의 상기 레벨의 감소 및/또는 hsa-miR-518f, hsa-miR-206, hsa-miR-204, hsa-miR-137, hsa-miR-453, hsa-miR-146a, hsa-miR-603, hsa-miR-1297, hsa-miR-192, hsa-miR-526a, hsa-miR-615-5p, hsa-miR-655, hsa-miR-450b-5p, hsa-miR-548b-3p, hsa-miR-584, hsa-miR-548f, hsa-miR-300, hsa-miR-302c, hsa-miR-328, hsa-miR-421, 및 hsa-miR-580 중 하나 이상의 상기 레벨의 증가는 상기 치료제가 상기 대상체에 효과적이었음을 나타내는 방법.
- 대상체에서 근 위축성 측삭 경화증(ALS)의 치료의 효능을 판단하는 방법으로서,
제1 시점에서 상기 대상체의 뇌척수액 내의 hsa-miR-27b, hsa-miR-99b, hsa-miR-146a, hsa-miR-150, hsa-miR-328, 및 hsa-miR-532-3p 중 하나 이상의 레벨을 결정하는 단계;
적어도 1회 용량의 치료제를 투여한 후 제2 시점에서 상기 대상체의 CSF 내의 hsa-miR-27b, hsa-miR-99b, hsa-miR-146a, hsa-miR-150, hsa-miR-328, 및 hsa-miR-532-3p 중 하나 이상의 레벨을 결정하는 단계; 및
상기 제1 시점에서의 hsa-miR-27b, hsa-miR-99b, hsa-miR-146a, hsa-miR-150, hsa-miR-328, 및 hsa-miR-532-3p 중 하나 이상의 상기 레벨을 제2 시점에서의 hsa-miR-27b, hsa-miR-99b, hsa-miR-146a, hsa-miR-150, hsa-miR-328, 및 hsa-miR-532-3p 중 하나 이상의 상기 레벨과 비교하는 단계를 포함하되,
상기 제1 시점에서의 상기 레벨 대비 상기 제2 시점에서의 hsa-miR-27b, hsa-miR-99b, hsa-miR-146a, hsa-miR-150, hsa-miR-328, 및 hsa-miR-532-3p 중 하나 이상의 상기 레벨의 감소는 상기 치료제가 상기 대상체에 효과적이었음을 나타내는 방법.
- 제12항 내지 제31항 중 어느 한 항에 있어서, 상기 기준 레벨은 임계 레벨(threshold level)인 방법.
- 제12항, 제16항, 제20항, 제23항, 제28항, 및 30항 중 어느 한 항에 있어서, 상기 기준 레벨은 대조군 대상체의 CD14+CD16- 대상체에서 알아낸 레벨인 방법.
- 제13항 내지 15항, 제17항 내지 19항, 제21항, 제24항 내지 26항, 제29항, 및 제31항 중 어느 한 항에 있어서, 상기 기준 레벨은 대조군 대상체의 CSF에서 알아낸 레벨인 방법.
- 제12항, 제16항, 제20항, 제23항, 제28항, 및 제30항 중 어느 한 항에 있어서, 상기 대상체의 CD14+CD16- 단핵구를 포함하는 생물학적 샘플을 얻는 단계를 더 포함하는 방법.
- 제35항에서 있어서, 상기 방법은 상기 생물학적 샘플의 CD14+CD16- 단핵구를 정제하는 단계를 더 포함하는 방법.
- 제13항 내지 15항, 제17항 내지 19항, 제21항, 제24항 내지 26항, 제29항, 및 제31항 중 어느 한 항에 있어서, 상기 대상체의 CSF를 포함하는 샘플을 얻는 단계를 더 포함하는 방법.
- 제12항 내지 제31항 중 어느 한 항에 있어서, 상기 마이크로 RNA 또는 상기 하나 이상의 마이크로 RNA는 전구체 마이크로 RNA인 방법.
- 제12항 내지 제31항 중 어느 한 항에 있어서, 상기 마이크로 RNA 또는 상기 하나 이상의 마이크로 RNA는 성숙한(mature) 마이크로 RNA인 방법.
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201161545968P | 2011-10-11 | 2011-10-11 | |
| US61/545,968 | 2011-10-11 | ||
| US201261601205P | 2012-02-21 | 2012-02-21 | |
| US61/601,205 | 2012-02-21 | ||
| PCT/US2012/059671 WO2013055865A1 (en) | 2011-10-11 | 2012-10-11 | Micrornas in neurodegenerative disorders |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20140074997A true KR20140074997A (ko) | 2014-06-18 |
Family
ID=48082415
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020147012433A KR20140074997A (ko) | 2011-10-11 | 2012-10-11 | 신경병성 질환에서 마이크로rna |
Country Status (11)
| Country | Link |
|---|---|
| US (3) | US10184151B2 (ko) |
| EP (2) | EP3170899B1 (ko) |
| JP (1) | JP6234370B2 (ko) |
| KR (1) | KR20140074997A (ko) |
| CN (1) | CN104011210B (ko) |
| AU (1) | AU2012322788B2 (ko) |
| BR (1) | BR112014008925A2 (ko) |
| CA (1) | CA2851280C (ko) |
| HK (1) | HK1201294A1 (ko) |
| MX (1) | MX2014004516A (ko) |
| WO (1) | WO2013055865A1 (ko) |
Cited By (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20170008491A (ko) * | 2015-07-14 | 2017-01-24 | 한국과학기술연구원 | 마약 중독 여부 진단용 바이오마커 및 마약 중독 여부 진단용 키트 |
| KR20190080227A (ko) * | 2017-12-28 | 2019-07-08 | 재단법인대구경북과학기술원 | 뇌전증과 관련된 miRNA 및 그의 용도 |
| KR20210052425A (ko) * | 2017-12-28 | 2021-05-10 | 재단법인대구경북과학기술원 | 뇌전증과 관련된 miRNA 및 그의 용도 |
Families Citing this family (60)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US9217155B2 (en) | 2008-05-28 | 2015-12-22 | University Of Massachusetts | Isolation of novel AAV'S and uses thereof |
| WO2010138263A2 (en) | 2009-05-28 | 2010-12-02 | University Of Massachusetts | Novel aav 's and uses thereof |
| CA3049237C (en) | 2010-04-23 | 2024-06-11 | University Of Massachusetts | Cns targeting aav vectors and methods of use thereof |
| CA3050894C (en) | 2010-04-23 | 2022-10-18 | University Of Massachusetts | Multicistronic expression constructs |
| US20140259192A1 (en) * | 2011-07-12 | 2014-09-11 | Sanofi | Transgenic animal comprising a deletion or functional deletion of the 3'utr of an endogenous gene |
| JP2014128249A (ja) * | 2012-12-28 | 2014-07-10 | Hokkaido Univ | 神経変性疾患の検査と治療に対するmiRNA又はその標的遺伝子の利用 |
| JP6541049B2 (ja) * | 2014-01-16 | 2019-07-10 | 国立大学法人北海道大学 | 筋萎縮性側索硬化症のバイオマーカー |
| US10072251B2 (en) | 2014-02-19 | 2018-09-11 | University Of Massachusetts | Recombinant AAVS having useful transcytosis properties |
| NZ724508A (en) | 2014-03-18 | 2024-05-31 | Univ Of Massachusetts | Raav-based compositions and methods for treating amyotrophic lateral sclerosis |
| WO2015164786A1 (en) | 2014-04-25 | 2015-10-29 | University Of Massachusetts | Recombinant aav vectors useful for reducing immunity against transgene products |
| WO2015187825A2 (en) | 2014-06-03 | 2015-12-10 | University Of Massachusetts | Compositions and methods for modulating dysferlin expression |
| US10627392B2 (en) | 2014-06-17 | 2020-04-21 | Stealth Biotherapeutics Corp | Methods of identifying and monitoring mitochondrial dysfunction using monocyte screening |
| US10370432B2 (en) | 2014-10-03 | 2019-08-06 | University Of Massachusetts | Heterologous targeting peptide grafted AAVS |
| US10711270B2 (en) | 2014-10-03 | 2020-07-14 | University Of Massachusetts | High efficiency library-identified AAV vectors |
| AU2015335923B2 (en) | 2014-10-21 | 2021-04-29 | University Of Massachusetts | Recombinant AAV variants and uses thereof |
| US10584321B2 (en) | 2015-02-13 | 2020-03-10 | University Of Massachusetts | Compositions and methods for transient delivery of nucleases |
| WO2016138287A1 (en) | 2015-02-25 | 2016-09-01 | Washington University | METHODS TO DETECT MOTOR NEURON DISEASE COMPRISING MICRO-RNAs |
| JP2016198021A (ja) * | 2015-04-08 | 2016-12-01 | 国立大学法人北海道大学 | 筋萎縮性側索硬化症の検出を補助する方法及び治療剤 |
| CN104826131B (zh) * | 2015-04-15 | 2018-12-18 | 涛康生物科技(上海)有限公司 | miR-17-92基因簇在制备治疗精神类疾病药物中的用途 |
| EP3285780A4 (en) | 2015-04-24 | 2018-12-19 | University of Massachusetts | Modified aav constructions and uses thereof |
| AU2016270434B2 (en) | 2015-06-05 | 2019-07-11 | MiRagen Therapeutics, Inc. | miR-155 inhibitors for treating cutaneous T cell lymphoma (CTCL) |
| CN107922947A (zh) * | 2015-06-05 | 2018-04-17 | 米拉根医疗股份有限公司 | 用于治疗肌萎缩性侧索硬化症(als)的mir‑155抑制剂 |
| US10441601B2 (en) | 2015-06-30 | 2019-10-15 | St. Jude Children's Research Hospital, Inc. | Method for treating schizophrenia |
| CA3002982A1 (en) | 2015-10-22 | 2017-04-27 | University Of Massachusetts | Methods and compositions for treating metabolic imbalance in neurodegenerative disease |
| WO2017070516A1 (en) | 2015-10-22 | 2017-04-27 | University Of Massachusetts | Prostate-targeting adeno-associated virus serotype vectors |
| WO2017136536A1 (en) | 2016-02-02 | 2017-08-10 | University Of Massachusetts | Method to enhance the efficiency of systemic aav gene delivery to the central nervous system |
| EP3413928B1 (en) | 2016-02-12 | 2022-04-20 | University of Massachusetts | Anti-angiogenic mirna therapeutics for inhibiting corneal neovascularization |
| EP3440210A4 (en) | 2016-04-05 | 2019-11-27 | University of Massachusetts | COMPOSITIONS AND METHODS FOR SELECTIVE INHIBITION OF EXPRESSION OF GRAINHEAD PROTEIN |
| US11661630B2 (en) | 2016-04-06 | 2023-05-30 | Duke University | Compositions and methods for blood storage |
| US11413356B2 (en) | 2016-04-15 | 2022-08-16 | University Of Massachusetts | Methods and compositions for treating metabolic imbalance |
| US20190131019A1 (en) * | 2016-05-09 | 2019-05-02 | Wayne State University | Orthogonal approach to integrate independent omic data |
| CA3026103A1 (en) | 2016-06-10 | 2017-12-14 | Saunders, Ann M. | Methods for detecting structural variants in neurodegenerative disease |
| CN105861728A (zh) * | 2016-06-12 | 2016-08-17 | 上海市第十人民医院 | 循环miRNA作为年龄相关黄斑变性诊断标志物中的应用 |
| US11882815B2 (en) | 2016-06-15 | 2024-01-30 | University Of Massachusetts | Recombinant adeno-associated viruses for delivering gene editing molecules to embryonic cells |
| CN106620718B (zh) * | 2016-08-30 | 2019-11-05 | 广东医科大学 | PF-127-miRNA-615 agomir复合物及其制备方法和应用 |
| US10457940B2 (en) | 2016-09-22 | 2019-10-29 | University Of Massachusetts | AAV treatment of Huntington's disease |
| WO2018071831A1 (en) | 2016-10-13 | 2018-04-19 | University Of Massachusetts | Aav capsid designs |
| US11957713B2 (en) | 2016-10-14 | 2024-04-16 | Children's Medical Center Corporation | Compositions and methods for treating diseases and disorders of the central nervous system |
| EP3571310A4 (en) | 2017-01-17 | 2020-12-16 | Children's Medical Center Corporation | COMPOSITIONS AND METHODS OF DIAGNOSIS AND TREATMENT OF PEROXISOMAL DISEASES |
| JP7225115B2 (ja) | 2017-01-17 | 2023-02-20 | ザ チルドレンズ メディカル センター コーポレーション | リソソーム蓄積症およびリソソーム蓄積障害を処置するための組成物および方法 |
| WO2018208972A1 (en) | 2017-05-09 | 2018-11-15 | University Of Massachusetts | Methods of treating amyotrophic lateral sclerosis (als) |
| ES2890949T3 (es) * | 2017-06-19 | 2022-01-25 | St Johns Univ | Biomarcadores de microARN séricos circulantes y métodos para determinar la velocidad de progresión de la enfermedad de Parkinson |
| US11078535B2 (en) | 2017-07-18 | 2021-08-03 | The Trustees Of Indiana University | Presymptomatic micro RNA targets for treatment of neurodegeneration pathology |
| KR101956315B1 (ko) | 2017-07-19 | 2019-03-08 | 국민대학교 산학협력단 | 파킨슨병 바이오마커로서의 miR494 및 이를 이용한 진단키트 |
| KR102177130B1 (ko) * | 2017-08-18 | 2020-11-10 | (주)큐라미스 | 근육 질환 및 신경근육 질환 예방, 치료 또는 진단을 위한 miR-18b의 용도 |
| CA3075643A1 (en) | 2017-09-22 | 2019-03-28 | University Of Massachusetts | Sod1 dual expression vectors and uses thereof |
| WO2019116412A1 (en) * | 2017-12-15 | 2019-06-20 | Istituto Superiore Di Sanita' | Method for in vitro diagnosis of amyotrophic lateral sclerosis |
| JP2021522212A (ja) * | 2018-04-20 | 2021-08-30 | フォンダッツィオーネ・テレソン | miR−181阻害剤及びその使用 |
| KR20210014109A (ko) * | 2018-05-10 | 2021-02-08 | 더 메서디스트 하스피틀 | 질환의 예후와 관리 방법 |
| WO2020171889A1 (en) | 2019-02-19 | 2020-08-27 | University Of Rochester | Blocking lipid accumulation or inflammation in thyroid eye disease |
| GB201909619D0 (en) * | 2019-07-04 | 2019-08-21 | Univ Oxford Innovation Ltd | Methods for diagnosing multiple sclerosis |
| EP3887546B1 (en) * | 2019-09-16 | 2024-02-21 | Genieus Genomics Pty Ltd | Biomarkers for neurodegenerative diseases |
| WO2021067613A1 (en) * | 2019-10-01 | 2021-04-08 | Children's Medical Center Corporation | Compositions and methods for treating amyotrophic lateral sclerosis |
| CN111727260A (zh) * | 2019-10-15 | 2020-09-29 | 湖南乾康科技有限公司 | 中间型单核细胞在制备诊断和预测ad药物中的应用 |
| CN110791560B (zh) * | 2019-11-06 | 2021-09-14 | 中国医学科学院医药生物技术研究所 | 一种用于阿尔茨海默病诊断和/或治疗的miRNA标志物 |
| JP2023510083A (ja) * | 2019-12-02 | 2023-03-13 | ジ・インスティテュート・フォー・エスノメディシン・ディビーエイ・ブレイン・ケミストリー・ラブズ | 神経由来エクソソーム中の核酸の検出方法および分析方法 |
| CN112458165A (zh) * | 2020-12-27 | 2021-03-09 | 中山大学孙逸仙纪念医院 | 一种阿尔茨海默病的预测标志物、检测试剂盒及应用 |
| KR20230113048A (ko) * | 2022-01-21 | 2023-07-28 | 재단법인 바이오나노헬스가드연구단 | 알츠하이머 조기진단용 바이오마커와 이의 용도 |
| KR102662899B1 (ko) * | 2022-01-21 | 2024-05-03 | 재단법인 바이오나노헬스가드연구단 | 알츠하이머병 진단용 바이오마커 및 이의 용도 |
| CN117427090A (zh) * | 2023-10-25 | 2024-01-23 | 暨南大学附属第一医院(广州华侨医院) | miR-137-3p在制备阿尔茨海默病神经炎症药物的用途 |
Family Cites Families (178)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3687808A (en) | 1969-08-14 | 1972-08-29 | Univ Leland Stanford Junior | Synthetic polynucleotides |
| US4458066A (en) | 1980-02-29 | 1984-07-03 | University Patents, Inc. | Process for preparing polynucleotides |
| US4469863A (en) | 1980-11-12 | 1984-09-04 | Ts O Paul O P | Nonionic nucleic acid alkyl and aryl phosphonates and processes for manufacture and use thereof |
| US5023243A (en) | 1981-10-23 | 1991-06-11 | Molecular Biosystems, Inc. | Oligonucleotide therapeutic agent and method of making same |
| US4476301A (en) | 1982-04-29 | 1984-10-09 | Centre National De La Recherche Scientifique | Oligonucleotides, a process for preparing the same and their application as mediators of the action of interferon |
| JPS5927900A (ja) | 1982-08-09 | 1984-02-14 | Wakunaga Seiyaku Kk | 固定化オリゴヌクレオチド |
| FR2540122B1 (fr) | 1983-01-27 | 1985-11-29 | Centre Nat Rech Scient | Nouveaux composes comportant une sequence d'oligonucleotide liee a un agent d'intercalation, leur procede de synthese et leur application |
| US4605735A (en) | 1983-02-14 | 1986-08-12 | Wakunaga Seiyaku Kabushiki Kaisha | Oligonucleotide derivatives |
| US4948882A (en) | 1983-02-22 | 1990-08-14 | Syngene, Inc. | Single-stranded labelled oligonucleotides, reactive monomers and methods of synthesis |
| US4824941A (en) | 1983-03-10 | 1989-04-25 | Julian Gordon | Specific antibody to the native form of 2'5'-oligonucleotides, the method of preparation and the use as reagents in immunoassays or for binding 2'5'-oligonucleotides in biological systems |
| US4587044A (en) | 1983-09-01 | 1986-05-06 | The Johns Hopkins University | Linkage of proteins to nucleic acids |
| US5118802A (en) | 1983-12-20 | 1992-06-02 | California Institute Of Technology | DNA-reporter conjugates linked via the 2' or 5'-primary amino group of the 5'-terminal nucleoside |
| US5550111A (en) | 1984-07-11 | 1996-08-27 | Temple University-Of The Commonwealth System Of Higher Education | Dual action 2',5'-oligoadenylate antiviral derivatives and uses thereof |
| US5367066A (en) | 1984-10-16 | 1994-11-22 | Chiron Corporation | Oligonucleotides with selectably cleavable and/or abasic sites |
| US5430136A (en) | 1984-10-16 | 1995-07-04 | Chiron Corporation | Oligonucleotides having selectably cleavable and/or abasic sites |
| US5258506A (en) | 1984-10-16 | 1993-11-02 | Chiron Corporation | Photolabile reagents for incorporation into oligonucleotide chains |
| US4828979A (en) | 1984-11-08 | 1989-05-09 | Life Technologies, Inc. | Nucleotide analogs for nucleic acid labeling and detection |
| FR2575751B1 (fr) | 1985-01-08 | 1987-04-03 | Pasteur Institut | Nouveaux nucleosides de derives de l'adenosine, leur preparation et leurs applications biologiques |
| US5034506A (en) | 1985-03-15 | 1991-07-23 | Anti-Gene Development Group | Uncharged morpholino-based polymers having achiral intersubunit linkages |
| US5166315A (en) | 1989-12-20 | 1992-11-24 | Anti-Gene Development Group | Sequence-specific binding polymers for duplex nucleic acids |
| US5405938A (en) | 1989-12-20 | 1995-04-11 | Anti-Gene Development Group | Sequence-specific binding polymers for duplex nucleic acids |
| US5235033A (en) | 1985-03-15 | 1993-08-10 | Anti-Gene Development Group | Alpha-morpholino ribonucleoside derivatives and polymers thereof |
| US5185444A (en) | 1985-03-15 | 1993-02-09 | Anti-Gene Deveopment Group | Uncharged morpolino-based polymers having phosphorous containing chiral intersubunit linkages |
| US4762779A (en) | 1985-06-13 | 1988-08-09 | Amgen Inc. | Compositions and methods for functionalizing nucleic acids |
| US5317098A (en) | 1986-03-17 | 1994-05-31 | Hiroaki Shizuya | Non-radioisotope tagging of fragments |
| JPS638396A (ja) | 1986-06-30 | 1988-01-14 | Wakunaga Pharmaceut Co Ltd | ポリ標識化オリゴヌクレオチド誘導体 |
| DE3788914T2 (de) | 1986-09-08 | 1994-08-25 | Ajinomoto Kk | Verbindungen zur Spaltung von RNS an eine spezifische Position, Oligomere, verwendet bei der Herstellung dieser Verbindungen und Ausgangsprodukte für die Synthese dieser Oligomere. |
| US5264423A (en) | 1987-03-25 | 1993-11-23 | The United States Of America As Represented By The Department Of Health And Human Services | Inhibitors for replication of retroviruses and for the expression of oncogene products |
| US5276019A (en) | 1987-03-25 | 1994-01-04 | The United States Of America As Represented By The Department Of Health And Human Services | Inhibitors for replication of retroviruses and for the expression of oncogene products |
| US4904582A (en) | 1987-06-11 | 1990-02-27 | Synthetic Genetics | Novel amphiphilic nucleic acid conjugates |
| WO1988010264A1 (en) | 1987-06-24 | 1988-12-29 | Howard Florey Institute Of Experimental Physiology | Nucleoside derivatives |
| US5585481A (en) | 1987-09-21 | 1996-12-17 | Gen-Probe Incorporated | Linking reagents for nucleotide probes |
| US5188897A (en) | 1987-10-22 | 1993-02-23 | Temple University Of The Commonwealth System Of Higher Education | Encapsulated 2',5'-phosphorothioate oligoadenylates |
| US4924624A (en) | 1987-10-22 | 1990-05-15 | Temple University-Of The Commonwealth System Of Higher Education | 2,',5'-phosphorothioate oligoadenylates and plant antiviral uses thereof |
| US5525465A (en) | 1987-10-28 | 1996-06-11 | Howard Florey Institute Of Experimental Physiology And Medicine | Oligonucleotide-polyamide conjugates and methods of production and applications of the same |
| DE3738460A1 (de) | 1987-11-12 | 1989-05-24 | Max Planck Gesellschaft | Modifizierte oligonukleotide |
| WO1989005358A1 (en) | 1987-11-30 | 1989-06-15 | University Of Iowa Research Foundation | Dna and rna molecules stabilized by modifications of the 3'-terminal phosphodiester linkage and their use as nucleic acid probes and as therapeutic agents to block the expression of specifically targeted genes |
| US5403711A (en) | 1987-11-30 | 1995-04-04 | University Of Iowa Research Foundation | Nucleic acid hybridization and amplification method for detection of specific sequences in which a complementary labeled nucleic acid probe is cleaved |
| US5082830A (en) | 1988-02-26 | 1992-01-21 | Enzo Biochem, Inc. | End labeled nucleotide probe |
| WO1989009221A1 (en) | 1988-03-25 | 1989-10-05 | University Of Virginia Alumni Patents Foundation | Oligonucleotide n-alkylphosphoramidates |
| US5278302A (en) | 1988-05-26 | 1994-01-11 | University Patents, Inc. | Polynucleotide phosphorodithioates |
| US5109124A (en) | 1988-06-01 | 1992-04-28 | Biogen, Inc. | Nucleic acid probe linked to a label having a terminal cysteine |
| US5216141A (en) | 1988-06-06 | 1993-06-01 | Benner Steven A | Oligonucleotide analogs containing sulfur linkages |
| US5175273A (en) | 1988-07-01 | 1992-12-29 | Genentech, Inc. | Nucleic acid intercalating agents |
| US5262536A (en) | 1988-09-15 | 1993-11-16 | E. I. Du Pont De Nemours And Company | Reagents for the preparation of 5'-tagged oligonucleotides |
| US5512439A (en) | 1988-11-21 | 1996-04-30 | Dynal As | Oligonucleotide-linked magnetic particles and uses thereof |
| US5599923A (en) | 1989-03-06 | 1997-02-04 | Board Of Regents, University Of Tx | Texaphyrin metal complexes having improved functionalization |
| US5457183A (en) | 1989-03-06 | 1995-10-10 | Board Of Regents, The University Of Texas System | Hydroxylated texaphyrins |
| US5391723A (en) | 1989-05-31 | 1995-02-21 | Neorx Corporation | Oligonucleotide conjugates |
| US5256775A (en) | 1989-06-05 | 1993-10-26 | Gilead Sciences, Inc. | Exonuclease-resistant oligonucleotides |
| US4958013A (en) | 1989-06-06 | 1990-09-18 | Northwestern University | Cholesteryl modified oligonucleotides |
| US5451463A (en) | 1989-08-28 | 1995-09-19 | Clontech Laboratories, Inc. | Non-nucleoside 1,3-diol reagents for labeling synthetic oligonucleotides |
| US5134066A (en) | 1989-08-29 | 1992-07-28 | Monsanto Company | Improved probes using nucleosides containing 3-dezauracil analogs |
| US5254469A (en) | 1989-09-12 | 1993-10-19 | Eastman Kodak Company | Oligonucleotide-enzyme conjugate that can be used as a probe in hybridization assays and polymerase chain reaction procedures |
| US5399676A (en) | 1989-10-23 | 1995-03-21 | Gilead Sciences | Oligonucleotides with inverted polarity |
| US5264564A (en) | 1989-10-24 | 1993-11-23 | Gilead Sciences | Oligonucleotide analogs with novel linkages |
| US5264562A (en) | 1989-10-24 | 1993-11-23 | Gilead Sciences, Inc. | Oligonucleotide analogs with novel linkages |
| US5292873A (en) | 1989-11-29 | 1994-03-08 | The Research Foundation Of State University Of New York | Nucleic acids labeled with naphthoquinone probe |
| US5177198A (en) | 1989-11-30 | 1993-01-05 | University Of N.C. At Chapel Hill | Process for preparing oligoribonucleoside and oligodeoxyribonucleoside boranophosphates |
| US5130302A (en) | 1989-12-20 | 1992-07-14 | Boron Bilogicals, Inc. | Boronated nucleoside, nucleotide and oligonucleotide compounds, compositions and methods for using same |
| US5486603A (en) | 1990-01-08 | 1996-01-23 | Gilead Sciences, Inc. | Oligonucleotide having enhanced binding affinity |
| US5578718A (en) | 1990-01-11 | 1996-11-26 | Isis Pharmaceuticals, Inc. | Thiol-derivatized nucleosides |
| US5459255A (en) | 1990-01-11 | 1995-10-17 | Isis Pharmaceuticals, Inc. | N-2 substituted purines |
| US5681941A (en) | 1990-01-11 | 1997-10-28 | Isis Pharmaceuticals, Inc. | Substituted purines and oligonucleotide cross-linking |
| US5587470A (en) | 1990-01-11 | 1996-12-24 | Isis Pharmaceuticals, Inc. | 3-deazapurines |
| US5587361A (en) | 1991-10-15 | 1996-12-24 | Isis Pharmaceuticals, Inc. | Oligonucleotides having phosphorothioate linkages of high chiral purity |
| US5623065A (en) | 1990-08-13 | 1997-04-22 | Isis Pharmaceuticals, Inc. | Gapped 2' modified oligonucleotides |
| US5220007A (en) | 1990-02-15 | 1993-06-15 | The Worcester Foundation For Experimental Biology | Method of site-specific alteration of RNA and production of encoded polypeptides |
| US5149797A (en) | 1990-02-15 | 1992-09-22 | The Worcester Foundation For Experimental Biology | Method of site-specific alteration of rna and production of encoded polypeptides |
| AU7579991A (en) | 1990-02-20 | 1991-09-18 | Gilead Sciences, Inc. | Pseudonucleosides and pseudonucleotides and their polymers |
| US5214136A (en) | 1990-02-20 | 1993-05-25 | Gilead Sciences, Inc. | Anthraquinone-derivatives oligonucleotides |
| US5321131A (en) | 1990-03-08 | 1994-06-14 | Hybridon, Inc. | Site-specific functionalization of oligodeoxynucleotides for non-radioactive labelling |
| US5470967A (en) | 1990-04-10 | 1995-11-28 | The Dupont Merck Pharmaceutical Company | Oligonucleotide analogs with sulfamate linkages |
| EP0745689A3 (en) | 1990-05-11 | 1996-12-11 | Microprobe Corporation | A dipstick for a nucleic acid hybridization assay |
| US5677437A (en) | 1990-07-27 | 1997-10-14 | Isis Pharmaceuticals, Inc. | Heteroatomic oligonucleoside linkages |
| US5489677A (en) | 1990-07-27 | 1996-02-06 | Isis Pharmaceuticals, Inc. | Oligonucleoside linkages containing adjacent oxygen and nitrogen atoms |
| US5623070A (en) | 1990-07-27 | 1997-04-22 | Isis Pharmaceuticals, Inc. | Heteroatomic oligonucleoside linkages |
| US5608046A (en) | 1990-07-27 | 1997-03-04 | Isis Pharmaceuticals, Inc. | Conjugated 4'-desmethyl nucleoside analog compounds |
| US5688941A (en) | 1990-07-27 | 1997-11-18 | Isis Pharmaceuticals, Inc. | Methods of making conjugated 4' desmethyl nucleoside analog compounds |
| US5618704A (en) | 1990-07-27 | 1997-04-08 | Isis Pharmacueticals, Inc. | Backbone-modified oligonucleotide analogs and preparation thereof through radical coupling |
| US5541307A (en) | 1990-07-27 | 1996-07-30 | Isis Pharmaceuticals, Inc. | Backbone modified oligonucleotide analogs and solid phase synthesis thereof |
| US5218105A (en) | 1990-07-27 | 1993-06-08 | Isis Pharmaceuticals | Polyamine conjugated oligonucleotides |
| DE69126530T2 (de) | 1990-07-27 | 1998-02-05 | Isis Pharmaceutical, Inc., Carlsbad, Calif. | Nuklease resistente, pyrimidin modifizierte oligonukleotide, die die gen-expression detektieren und modulieren |
| US5138045A (en) | 1990-07-27 | 1992-08-11 | Isis Pharmaceuticals | Polyamine conjugated oligonucleotides |
| US5602240A (en) | 1990-07-27 | 1997-02-11 | Ciba Geigy Ag. | Backbone modified oligonucleotide analogs |
| US5610289A (en) | 1990-07-27 | 1997-03-11 | Isis Pharmaceuticals, Inc. | Backbone modified oligonucleotide analogues |
| US5245022A (en) | 1990-08-03 | 1993-09-14 | Sterling Drug, Inc. | Exonuclease resistant terminally substituted oligonucleotides |
| BR9106729A (pt) | 1990-08-03 | 1993-07-20 | Sterling Winthrop Inc | Composto,processos para inibir a degradacao por nuclease de compostos e para estabilizar sequencias de nicleotideos ou oligonucleosideos,composicao utilizavel para inibir expressao de genes e processo para inibir expressao de genes em um mamifero necessitando de tal tratamento |
| US5177196A (en) | 1990-08-16 | 1993-01-05 | Microprobe Corporation | Oligo (α-arabinofuranosyl nucleotides) and α-arabinofuranosyl precursors thereof |
| US5512667A (en) | 1990-08-28 | 1996-04-30 | Reed; Michael W. | Trifunctional intermediates for preparing 3'-tailed oligonucleotides |
| US5214134A (en) | 1990-09-12 | 1993-05-25 | Sterling Winthrop Inc. | Process of linking nucleosides with a siloxane bridge |
| US5561225A (en) | 1990-09-19 | 1996-10-01 | Southern Research Institute | Polynucleotide analogs containing sulfonate and sulfonamide internucleoside linkages |
| CA2092002A1 (en) | 1990-09-20 | 1992-03-21 | Mark Matteucci | Modified internucleoside linkages |
| US5432272A (en) | 1990-10-09 | 1995-07-11 | Benner; Steven A. | Method for incorporating into a DNA or RNA oligonucleotide using nucleotides bearing heterocyclic bases |
| KR930702373A (ko) | 1990-11-08 | 1993-09-08 | 안토니 제이. 페이네 | 합성 올리고누클레오티드에 대한 다중 리포터(Reporter)그룹의 첨합 |
| US5714331A (en) | 1991-05-24 | 1998-02-03 | Buchardt, Deceased; Ole | Peptide nucleic acids having enhanced binding affinity, sequence specificity and solubility |
| US5719262A (en) | 1993-11-22 | 1998-02-17 | Buchardt, Deceased; Ole | Peptide nucleic acids having amino acid side chains |
| US5539082A (en) | 1993-04-26 | 1996-07-23 | Nielsen; Peter E. | Peptide nucleic acids |
| US5371241A (en) | 1991-07-19 | 1994-12-06 | Pharmacia P-L Biochemicals Inc. | Fluorescein labelled phosphoramidites |
| US5571799A (en) | 1991-08-12 | 1996-11-05 | Basco, Ltd. | (2'-5') oligoadenylate analogues useful as inhibitors of host-v5.-graft response |
| US5484908A (en) | 1991-11-26 | 1996-01-16 | Gilead Sciences, Inc. | Oligonucleotides containing 5-propynyl pyrimidines |
| US5700922A (en) | 1991-12-24 | 1997-12-23 | Isis Pharmaceuticals, Inc. | PNA-DNA-PNA chimeric macromolecules |
| US5595726A (en) | 1992-01-21 | 1997-01-21 | Pharmacyclics, Inc. | Chromophore probe for detection of nucleic acid |
| US5565552A (en) | 1992-01-21 | 1996-10-15 | Pharmacyclics, Inc. | Method of expanded porphyrin-oligonucleotide conjugate synthesis |
| US5633360A (en) | 1992-04-14 | 1997-05-27 | Gilead Sciences, Inc. | Oligonucleotide analogs capable of passive cell membrane permeation |
| US5434257A (en) | 1992-06-01 | 1995-07-18 | Gilead Sciences, Inc. | Binding compentent oligomers containing unsaturated 3',5' and 2',5' linkages |
| US5272250A (en) | 1992-07-10 | 1993-12-21 | Spielvogel Bernard F | Boronated phosphoramidate compounds |
| US5652355A (en) | 1992-07-23 | 1997-07-29 | Worcester Foundation For Experimental Biology | Hybrid oligonucleotide phosphorothioates |
| US5574142A (en) | 1992-12-15 | 1996-11-12 | Microprobe Corporation | Peptide linkers for improved oligonucleotide delivery |
| US5476925A (en) | 1993-02-01 | 1995-12-19 | Northwestern University | Oligodeoxyribonucleotides including 3'-aminonucleoside-phosphoramidate linkages and terminal 3'-amino groups |
| GB9304618D0 (en) | 1993-03-06 | 1993-04-21 | Ciba Geigy Ag | Chemical compounds |
| AU6412794A (en) | 1993-03-31 | 1994-10-24 | Sterling Winthrop Inc. | Oligonucleotides with amide linkages replacing phosphodiester linkages |
| US5502177A (en) | 1993-09-17 | 1996-03-26 | Gilead Sciences, Inc. | Pyrimidine derivatives for labeled binding partners |
| US5457187A (en) | 1993-12-08 | 1995-10-10 | Board Of Regents University Of Nebraska | Oligonucleotides containing 5-fluorouracil |
| AU691550B2 (en) | 1993-12-09 | 1998-05-21 | Thomas Jefferson University | Compounds and methods for site-directed mutations in eukaryotic cells |
| US5596091A (en) | 1994-03-18 | 1997-01-21 | The Regents Of The University Of California | Antisense oligonucleotides comprising 5-aminoalkyl pyrimidine nucleotides |
| US5625050A (en) | 1994-03-31 | 1997-04-29 | Amgen Inc. | Modified oligonucleotides and intermediates useful in nucleic acid therapeutics |
| US5525711A (en) | 1994-05-18 | 1996-06-11 | The United States Of America As Represented By The Secretary Of The Department Of Health And Human Services | Pteridine nucleotide analogs as fluorescent DNA probes |
| US5597696A (en) | 1994-07-18 | 1997-01-28 | Becton Dickinson And Company | Covalent cyanine dye oligonucleotide conjugates |
| US5580731A (en) | 1994-08-25 | 1996-12-03 | Chiron Corporation | N-4 modified pyrimidine deoxynucleotides and oligonucleotide probes synthesized therewith |
| US5716928A (en) | 1995-06-07 | 1998-02-10 | Avmax, Inc. | Use of essential oils to increase bioavailability of oral pharmaceutical compounds |
| US5652356A (en) | 1995-08-17 | 1997-07-29 | Hybridon, Inc. | Inverted chimeric and hybrid oligonucleotides |
| US5858401A (en) | 1996-01-22 | 1999-01-12 | Sidmak Laboratories, Inc. | Pharmaceutical composition for cyclosporines |
| US6007839A (en) | 1996-02-16 | 1999-12-28 | The Liposome Company, Inc. | Preparation of pharmaceutical compositions containing etherlipid-containing multiple lipid liposomes |
| EP0904031A4 (en) | 1996-05-29 | 2002-05-02 | Cell Genesys Inc | CATIONIC POLYMERS / LIPIDS AS VEHICLES FOR PROVIDING NUCLEIC ACID |
| WO1999029731A1 (de) | 1997-06-05 | 1999-06-17 | Walter Schubert | Verwendung von substanzen mit immunmodulatorischer wirkung für die behandlung der amyotrophen lateralsklerose |
| US6770748B2 (en) | 1997-03-07 | 2004-08-03 | Takeshi Imanishi | Bicyclonucleoside and oligonucleotide analogue |
| JP3756313B2 (ja) | 1997-03-07 | 2006-03-15 | 武 今西 | 新規ビシクロヌクレオシド及びオリゴヌクレオチド類縁体 |
| US6630137B1 (en) | 1997-04-28 | 2003-10-07 | Eli Lilly And Company | Activated protein C formulations |
| JP2000516641A (ja) | 1997-07-02 | 2000-12-12 | エスディージー インコーポレイテッド | 診断および治療用途の目標指向性リポソーム構成物 |
| US7572582B2 (en) | 1997-09-12 | 2009-08-11 | Exiqon A/S | Oligonucleotide analogues |
| US6794499B2 (en) | 1997-09-12 | 2004-09-21 | Exiqon A/S | Oligonucleotide analogues |
| US7087648B1 (en) | 1997-10-27 | 2006-08-08 | The Regents Of The University Of California | Methods for modulating macrophage proliferation using polyamine analogs |
| US7084125B2 (en) | 1999-03-18 | 2006-08-01 | Exiqon A/S | Xylo-LNA analogues |
| US6734291B2 (en) | 1999-03-24 | 2004-05-11 | Exiqon A/S | Synthesis of [2.2.1]bicyclo nucleosides |
| US7053207B2 (en) | 1999-05-04 | 2006-05-30 | Exiqon A/S | L-ribo-LNA analogues |
| ES2331644T3 (es) | 1999-06-09 | 2010-01-12 | Immunomedics, Inc. | Inmunoterapia de trastornos autoinmunes usando anticuerpos cuya diana son celulas b. |
| US6287860B1 (en) | 2000-01-20 | 2001-09-11 | Isis Pharmaceuticals, Inc. | Antisense inhibition of MEKK2 expression |
| EP1446412B1 (en) | 2001-09-04 | 2012-03-07 | Exiqon A/S | Novel lna compositions and uses thereof |
| JP2005510524A (ja) * | 2001-11-16 | 2005-04-21 | アルス・セラピー・デベロツプメント・フアンデーシヨン・インコーポレーテツド | ポリアミン経路の調節による神経変性障害の治療 |
| DK2284269T3 (en) | 2002-11-18 | 2017-10-23 | Roche Innovation Ct Copenhagen As | Antisense design |
| EP2141234B1 (en) | 2003-03-21 | 2016-04-27 | Roche Innovation Center Copenhagen A/S | Short Interfering RNA (siRNA) Analogues |
| US7683036B2 (en) | 2003-07-31 | 2010-03-23 | Regulus Therapeutics Inc. | Oligomeric compounds and compositions for use in modulation of small non-coding RNAs |
| ATE467679T1 (de) | 2003-12-23 | 2010-05-15 | Santaris Pharma As | Oligomere verbindungen zur modulation von bcl-2 |
| WO2005073378A1 (en) | 2004-01-30 | 2005-08-11 | Santaris Pharma A/S | MODIFIED SHORT INTERFERING RNA (MODIFIED siRNA) |
| AU2005214904B2 (en) * | 2004-02-13 | 2011-07-21 | Rockefeller University | Anti-microRNA oligonucleotide molecules |
| ATE537263T1 (de) | 2004-06-07 | 2011-12-15 | Protiva Biotherapeutics Inc | Kationische lipide und verwendungsverfahren |
| US7618947B2 (en) | 2004-08-25 | 2009-11-17 | Isis Pharmaceuticals, Inc. | Modulation of HIF-1 beta expression |
| JP5107047B2 (ja) | 2004-11-09 | 2012-12-26 | サンタリス ファーマ アー/エス | Lnaオリゴヌクレオチドおよび癌の処置 |
| EP1959012A3 (en) | 2004-12-29 | 2009-12-30 | Exiqon A/S | Novel oligonucleotide compositions and probe sequences useful for detection and analysis of microRNAs and their target mRNAs |
| US8163708B2 (en) * | 2006-04-03 | 2012-04-24 | Santaris Pharma A/S | Pharmaceutical composition comprising anti-mirna antisense oligonucleotide |
| CA3024953A1 (en) | 2006-04-03 | 2007-10-11 | Roche Innovation Center Copenhagen A/S | Pharmaceutical composition comprising anti-mirna antisense oligonucleotides |
| US8338376B2 (en) * | 2006-10-20 | 2012-12-25 | Biogen Idec Ma Inc. | Compositions comprising variant LT-B-R-IG fusion proteins |
| US8048998B2 (en) | 2007-01-19 | 2011-11-01 | Exiqon A/S | Mediated cellular delivery of LNA oligonucleotides |
| PE20090064A1 (es) | 2007-03-26 | 2009-03-02 | Novartis Ag | Acido ribonucleico de doble cadena para inhibir la expresion del gen e6ap humano y composicion farmaceutica que lo comprende |
| KR100794449B1 (ko) | 2007-03-29 | 2008-01-16 | 고려대학교 산학협력단 | 핵산 전달용 양이온성 인지질 나노입자 조성물 |
| US20100167948A1 (en) * | 2007-05-22 | 2010-07-01 | The Brigham And Women's Hospital, Inc. | MicroRNA Expression Profiling of Cerebrospinal Fluid |
| WO2008151631A2 (en) | 2007-06-15 | 2008-12-18 | Exiqon A/S | Use of short oligonucleotides for reagent redundancy experiments in rna functional analysis |
| US9328345B2 (en) * | 2007-08-27 | 2016-05-03 | 1 Globe Health Institute Llc | Compositions of asymmetric interfering RNA and uses thereof |
| KR100807060B1 (ko) | 2007-08-28 | 2008-02-25 | 고려대학교 산학협력단 | 신규한 양이온성 지질, 그의 제조 방법 및 그를 포함하는전달체 |
| EA019939B1 (ru) | 2007-10-04 | 2014-07-30 | Сантарис Фарма А/С | МОДИФИЦИРОВАННЫЙ ОЛИГОМЕР ДЛЯ УМЕНЬШЕНИЯ КОЛИЧЕСТВА микроРНК В КЛЕТКЕ |
| GB0720486D0 (en) | 2007-10-19 | 2007-11-28 | Univ Edinburgh | Cationic lipids |
| EP2225377B1 (en) | 2007-11-26 | 2014-01-08 | Santaris Pharma A/S | Lna antagonists targeting the androgen receptor |
| FR2925491B1 (fr) | 2007-12-19 | 2010-09-03 | Oz Biosciences Sas | Nouvelle classe de lipides cationiques pour le transport d'agents actifs dans les cellules |
| EP2268811A1 (en) | 2008-03-07 | 2011-01-05 | Santaris Pharma A/S | Pharmaceutical compositions for treatment of microrna related diseases |
| CN102036689B (zh) * | 2008-03-17 | 2014-08-06 | 得克萨斯系统大学董事会 | 神经肌肉突触维持和再生中涉及的微小rna的鉴定 |
| US20100104629A1 (en) | 2008-04-16 | 2010-04-29 | Abbott Laboratories | Cationic lipids and uses thereof |
| US8153606B2 (en) | 2008-10-03 | 2012-04-10 | Opko Curna, Llc | Treatment of apolipoprotein-A1 related diseases by inhibition of natural antisense transcript to apolipoprotein-A1 |
| TW201019969A (en) | 2008-11-17 | 2010-06-01 | Enzon Pharmaceuticals Inc | Branched cationic lipids for nucleic acids delivery system |
| TW201021853A (en) | 2008-11-17 | 2010-06-16 | Enzon Pharmaceuticals Inc | Releasable cationic lipids for nucleic acids delivery systems |
| JP6250930B2 (ja) | 2009-05-06 | 2017-12-20 | クルナ・インコーポレーテッド | トリステトラプロリン(ttp)に対する天然アンチセンス転写物の抑制によるttp関連疾患の治療 |
| EP2490699A1 (en) | 2009-10-20 | 2012-08-29 | Santaris Pharma A/S | Oral delivery of therapeutically effective lna oligonucleotides |
| US20110142789A1 (en) | 2009-12-10 | 2011-06-16 | The Trustees Of The University Of Pennsylvania | Compositions and Methods for the Diagnosis and Treatment of Amyotrophic Lateral Sclerosis |
| WO2012037043A2 (en) * | 2010-09-13 | 2012-03-22 | California Institute Of Technolgoy | Treatment of autoimmune inflammation using mir-155 |
| US9209196B2 (en) | 2011-11-30 | 2015-12-08 | Sharp Kabushiki Kaisha | Memory circuit, method of driving the same, nonvolatile storage device using the same, and liquid crystal display device |
| WO2013134403A1 (en) * | 2012-03-06 | 2013-09-12 | The Washington University | Method of treating neurodegenerative diseases with microrna regulators |
| US20150083872A1 (en) * | 2012-03-09 | 2015-03-26 | Ts Tech Co., Ltd. | Seat mounting structure |
| CN107922947A (zh) | 2015-06-05 | 2018-04-17 | 米拉根医疗股份有限公司 | 用于治疗肌萎缩性侧索硬化症(als)的mir‑155抑制剂 |
-
2012
- 2012-10-11 CN CN201280061082.XA patent/CN104011210B/zh not_active Expired - Fee Related
- 2012-10-11 BR BR112014008925-6A patent/BR112014008925A2/pt not_active Application Discontinuation
- 2012-10-11 KR KR1020147012433A patent/KR20140074997A/ko not_active Application Discontinuation
- 2012-10-11 EP EP16193582.0A patent/EP3170899B1/en active Active
- 2012-10-11 CA CA2851280A patent/CA2851280C/en active Active
- 2012-10-11 JP JP2014535856A patent/JP6234370B2/ja not_active Expired - Fee Related
- 2012-10-11 EP EP12839637.1A patent/EP2766482B1/en not_active Not-in-force
- 2012-10-11 WO PCT/US2012/059671 patent/WO2013055865A1/en active Application Filing
- 2012-10-11 AU AU2012322788A patent/AU2012322788B2/en not_active Ceased
- 2012-10-11 MX MX2014004516A patent/MX2014004516A/es active IP Right Grant
- 2012-10-11 US US14/350,977 patent/US10184151B2/en active Active
-
2015
- 2015-02-23 HK HK15101851.9A patent/HK1201294A1/xx not_active IP Right Cessation
-
2017
- 2017-09-08 US US15/699,546 patent/US20180023142A1/en not_active Abandoned
-
2019
- 2019-01-18 US US16/251,945 patent/US20190276892A1/en not_active Abandoned
Cited By (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20170008491A (ko) * | 2015-07-14 | 2017-01-24 | 한국과학기술연구원 | 마약 중독 여부 진단용 바이오마커 및 마약 중독 여부 진단용 키트 |
| KR20190080227A (ko) * | 2017-12-28 | 2019-07-08 | 재단법인대구경북과학기술원 | 뇌전증과 관련된 miRNA 및 그의 용도 |
| KR20210052425A (ko) * | 2017-12-28 | 2021-05-10 | 재단법인대구경북과학기술원 | 뇌전증과 관련된 miRNA 및 그의 용도 |
Also Published As
| Publication number | Publication date |
|---|---|
| US20190276892A1 (en) | 2019-09-12 |
| US10184151B2 (en) | 2019-01-22 |
| EP2766482A1 (en) | 2014-08-20 |
| CA2851280C (en) | 2021-05-18 |
| JP6234370B2 (ja) | 2017-11-22 |
| BR112014008925A2 (pt) | 2020-10-27 |
| WO2013055865A1 (en) | 2013-04-18 |
| AU2012322788B2 (en) | 2018-01-04 |
| US20140235697A1 (en) | 2014-08-21 |
| EP3170899A1 (en) | 2017-05-24 |
| CA2851280A1 (en) | 2013-04-18 |
| MX2014004516A (es) | 2015-01-16 |
| JP2014534810A (ja) | 2014-12-25 |
| HK1201294A1 (en) | 2015-08-28 |
| US20180023142A1 (en) | 2018-01-25 |
| EP3170899B1 (en) | 2020-06-24 |
| NZ623459A (en) | 2016-05-27 |
| CN104011210B (zh) | 2018-05-01 |
| EP2766482B1 (en) | 2016-12-07 |
| AU2012322788A1 (en) | 2014-04-24 |
| CN104011210A (zh) | 2014-08-27 |
| EP2766482A4 (en) | 2015-03-11 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US20190276892A1 (en) | Micrornas in neurodegenerative disorders | |
| US10253319B2 (en) | miRNA modulators of thermogenesis | |
| CN102439169B (zh) | 用于结肠直肠癌的微rna表达谱分析的组合物和方法 | |
| AU2011219029B2 (en) | Methods and compositions for the detection and treatment of cancer involving miRNAs and miRNA inhibitors and targets | |
| US20100202973A1 (en) | Microrna molecules associated with inflammatory skin disorders | |
| US20110107440A1 (en) | Skin cancer associated micrornas | |
| CN102892897A (zh) | 用于肺癌的微rna表达谱分析的组合物和方法 | |
| EP2298359A1 (en) | Nucleic acid capable of controlling degranulation of mast cell | |
| WO2014096418A2 (en) | Micrornas as therapeutics and biomarkers for epilepsy | |
| EP2683411B1 (en) | Methods of using microrna-26a to promote angiogenesis | |
| US8771937B2 (en) | Methods for diagnosing and treating a pathology associated with a synonymous mutation occuring within a gene of interest | |
| CA2802950A1 (en) | Monitoring of immune system using peripheral blood micro-rna expression profile analysis and uses thereof | |
| US20130079384A1 (en) | Means and Methods for Determining Risk of Cardiovascular Disease | |
| WO2022086935A1 (en) | Targeting xist and rna methylation for x reactivation therapy | |
| KR20210149107A (ko) | Angptl2 안티센스 올리고뉴클레오티드 및 그의 용도 | |
| NZ623459B2 (en) | Micrornas in neurodegenerative disorders |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A201 | Request for examination | ||
| E902 | Notification of reason for refusal | ||
| E601 | Decision to refuse application |