KR20120089643A - 헤테로시클릭 히드라존 화합물, 및 암 및 염증을 치료하기 위한 그의 용도 - Google Patents
헤테로시클릭 히드라존 화합물, 및 암 및 염증을 치료하기 위한 그의 용도 Download PDFInfo
- Publication number
- KR20120089643A KR20120089643A KR1020127006238A KR20127006238A KR20120089643A KR 20120089643 A KR20120089643 A KR 20120089643A KR 1020127006238 A KR1020127006238 A KR 1020127006238A KR 20127006238 A KR20127006238 A KR 20127006238A KR 20120089643 A KR20120089643 A KR 20120089643A
- Authority
- KR
- South Korea
- Prior art keywords
- mmol
- methyl
- compound
- alkyl
- compounds
- Prior art date
Links
- 0 Cc1ncc(*)[n]1C Chemical compound Cc1ncc(*)[n]1C 0.000 description 5
- RKAUSQFLQYFIDB-WYMPLXKRSA-N C/C(/c(cc1)n[n]2c1ncc2Cc(c(F)c1)cc2c1nccc2)=N\NC(C)=O Chemical compound C/C(/c(cc1)n[n]2c1ncc2Cc(c(F)c1)cc2c1nccc2)=N\NC(C)=O RKAUSQFLQYFIDB-WYMPLXKRSA-N 0.000 description 1
- LSFQRGFFWRDEDT-LQKURTRISA-N C/C(/c(cc1)n[n]2c1ncc2Cc1cc2cccnc2cc1F)=N\Nc1ccccc1 Chemical compound C/C(/c(cc1)n[n]2c1ncc2Cc1cc2cccnc2cc1F)=N\Nc1ccccc1 LSFQRGFFWRDEDT-LQKURTRISA-N 0.000 description 1
- NELCMGKUBGXWPM-LUOAPIJWSA-N C/C(/c(cc1)n[n]2c1nnc2C(c1ccc2ncccc2c1)(F)F)=N\N(CC(N1)=O)C1=O Chemical compound C/C(/c(cc1)n[n]2c1nnc2C(c1ccc2ncccc2c1)(F)F)=N\N(CC(N1)=O)C1=O NELCMGKUBGXWPM-LUOAPIJWSA-N 0.000 description 1
- VGZYIRGPXGPWOZ-FOKLQQMPSA-N C/C(/c(cn1)n[n]2c1ncc2Cc(cc1)cc2c1nccc2)=N\NC(N)=O Chemical compound C/C(/c(cn1)n[n]2c1ncc2Cc(cc1)cc2c1nccc2)=N\NC(N)=O VGZYIRGPXGPWOZ-FOKLQQMPSA-N 0.000 description 1
- IHDCXAAYKPVJBE-AUEPDCJTSA-N C/C(/c1cnc2nn[n](Cc(c(F)c3)cc4c3nccc4)c2n1)=N\NC(OC)=O Chemical compound C/C(/c1cnc2nn[n](Cc(c(F)c3)cc4c3nccc4)c2n1)=N\NC(OC)=O IHDCXAAYKPVJBE-AUEPDCJTSA-N 0.000 description 1
- FHGAJELRJIIFQY-UFFVCSGVSA-N C/C(/c1cnc2nn[n](Cc(cc3)cc4c3nccc4)c2n1)=N\N Chemical compound C/C(/c1cnc2nn[n](Cc(cc3)cc4c3nccc4)c2n1)=N\N FHGAJELRJIIFQY-UFFVCSGVSA-N 0.000 description 1
- GLIGCBNKAYTKJP-UHFFFAOYSA-N CC(c(cn1)n[n]2c1ncc2Cc(cc1)cc2c1nccc2)=O Chemical compound CC(c(cn1)n[n]2c1ncc2Cc(cc1)cc2c1nccc2)=O GLIGCBNKAYTKJP-UHFFFAOYSA-N 0.000 description 1
- PNQSACWHCHWEDT-BUVRLJJBSA-N CC/C(/c(cc1)n[n]2c1ncc2Cc(cc(cn[n]1C)c1c1)c1F)=N\NC(N)=O Chemical compound CC/C(/c(cc1)n[n]2c1ncc2Cc(cc(cn[n]1C)c1c1)c1F)=N\NC(N)=O PNQSACWHCHWEDT-BUVRLJJBSA-N 0.000 description 1
- QAIHPWWHZXZEOW-UHFFFAOYSA-N CC1(c(cn2)n[n]3c2ncc3Cc(cc2)cc3c2nccc3)OCCO1 Chemical compound CC1(c(cn2)n[n]3c2ncc3Cc(cc2)cc3c2nccc3)OCCO1 QAIHPWWHZXZEOW-UHFFFAOYSA-N 0.000 description 1
- APPGDQLWKOTAJL-UHFFFAOYSA-N CCC(c(cc1)n[n]2c1ncc2Cc(c(F)c1)cc2c1[n](C)nc2)=O Chemical compound CCC(c(cc1)n[n]2c1ncc2Cc(c(F)c1)cc2c1[n](C)nc2)=O APPGDQLWKOTAJL-UHFFFAOYSA-N 0.000 description 1
- QLOZRQXUWADQGD-UHFFFAOYSA-N CCC(c(cc1)n[n]2c1ncc2Cc(c(F)c1)cc2c1[n](C)nc2)O Chemical compound CCC(c(cc1)n[n]2c1ncc2Cc(c(F)c1)cc2c1[n](C)nc2)O QLOZRQXUWADQGD-UHFFFAOYSA-N 0.000 description 1
- KZXHPPKZGVDUFV-UHFFFAOYSA-N CCOC(c1cnc(N)nn1)=C Chemical compound CCOC(c1cnc(N)nn1)=C KZXHPPKZGVDUFV-UHFFFAOYSA-N 0.000 description 1
- YAZHJSBBZQZPMH-UHFFFAOYSA-N C[BrH]c1cnc(N)nn1 Chemical compound C[BrH]c1cnc(N)nn1 YAZHJSBBZQZPMH-UHFFFAOYSA-N 0.000 description 1
- OHASPPGCAMMHRE-UHFFFAOYSA-N C[n](c1c2)ncc1cc(Cc1cnc(cc3)[n]1nc3Cl)c2F Chemical compound C[n](c1c2)ncc1cc(Cc1cnc(cc3)[n]1nc3Cl)c2F OHASPPGCAMMHRE-UHFFFAOYSA-N 0.000 description 1
- QCJMSDNZVYBEQW-UHFFFAOYSA-N C[n](c1c2)ncc1cc(Cc1cnc3[n]1nc(C=C)cc3)c2F Chemical compound C[n](c1c2)ncc1cc(Cc1cnc3[n]1nc(C=C)cc3)c2F QCJMSDNZVYBEQW-UHFFFAOYSA-N 0.000 description 1
- RGRCKPUKTWSBSE-UHFFFAOYSA-N C[n]1ncc(cc2Cc3cnc4[n]3nc(C=O)cc4)c1cc2F Chemical compound C[n]1ncc(cc2Cc3cnc4[n]3nc(C=O)cc4)c1cc2F RGRCKPUKTWSBSE-UHFFFAOYSA-N 0.000 description 1
- MJIWQHRXSLOUJN-UHFFFAOYSA-N Nc1nccnn1 Chemical compound Nc1nccnn1 MJIWQHRXSLOUJN-UHFFFAOYSA-N 0.000 description 1
- KRKHRJAAILLRNE-UHFFFAOYSA-N O=CC(Cc1cc2cccnc2cc1)Cl Chemical compound O=CC(Cc1cc2cccnc2cc1)Cl KRKHRJAAILLRNE-UHFFFAOYSA-N 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D487/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00
- C07D487/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00 in which the condensed system contains two hetero rings
- C07D487/04—Ortho-condensed systems
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/50—Pyridazines; Hydrogenated pyridazines
- A61K31/5025—Pyridazines; Hydrogenated pyridazines ortho- or peri-condensed with heterocyclic ring systems
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/02—Drugs for skeletal disorders for joint disorders, e.g. arthritis, arthrosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings
- C07D401/04—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings directly linked by a ring-member-to-ring-member bond
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Life Sciences & Earth Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Rheumatology (AREA)
- Pain & Pain Management (AREA)
- Immunology (AREA)
- Orthopedic Medicine & Surgery (AREA)
- Physical Education & Sports Medicine (AREA)
- Epidemiology (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Nitrogen Condensed Heterocyclic Rings (AREA)
Abstract
Description
본 발명은 화학식 I의 비시클릭 화합물 및 그의 염, 특히 증식성 질환과 관련이 있는 인간 또는 동물 신체를 치료하기 위한 이러한 화합물의 용도, 이러한 화합물을 포함하는 제약 조성물, 화학식 I의 화합물을 포함하는 조합물, 및 이러한 화합물의 제조 방법에 관한 것이다.
본원에서 c-Met라고 지칭되는 간세포 성장 인자 수용체는 다양한 악성종양에서 과다발현되고/되거나 유전적으로 변경되는, 구체적으로는 유전자 증폭되는 것으로 나타난 바 있는 수용체 티로신 키나제이고, 수많은 c-Met 돌연변이가 다양한 고형 종양에서 확인되었으며, 예를 들어 WO 2007/126799를 참조한다. 추가로, 수용체 티로신 키나제 c-Met는 이동, 침윤 및 형태발생 (배아형성(embryogenesis) 및 조직 재생을 수반함)의 과정에도 관여한다. c-Met는 또한 전이의 과정에도 관여한다. 여러 증거가 c-Met가 종양 발병기전에서 소정의 역할을 한다는 것을 나타낸 바 있다. c-Met에서 기능적 배선(germ line) 돌연변이의 발생은 유전성 유두상 신세포 암종 (PRCC)의 발병과 관련이 있다. c-Met에서의 증폭 또는 돌연변이는 또한 산발성 형태의 PRCC, 두경부 편평 세포 암종, 위 암종, 췌장 암종 및 폐암에서도 보고된 바 있다. 이러한 변경은 c-Met에 대한 종양의 의존성 및/또는 다른 표적화 요법에 대한 내성을 부여하는 선택된 예에서 나타난 바 있다. c-Met 및 그의 고유 리간드 HGF/SF의 수준 증가는 여러가지 임상 관련 종양에서 높은 빈도로 관찰된다. 발현 증가 및 질환 진행, 전이 및 환자 사망률 사이의 상관관계가 여러 암, 예컨대 방광암, 유방암, 편평 세포 암종 및 위 암종 및 또한 평활근육종 및 교모세포종에서 보고된 바 있다.
WO 2008/008539는 HGF 매개 질환의 치료에 유용한 특정 융합된 헤테로시클릭 유도체를 개시한다. WO 2007/013673은 면역억제제로서 유용한 Lck 억제제로서의 융합된 헤테로시클릭 유도체를 개시한다. EP0490587은 안지오텐신 II 길항제로서 유용한 특정 피라졸로피리미딘을 개시한다. 본 명세서에 인용된 공보의 개시내용은 본원에 참조로 포함된다.
본 발명의 목적은 c-Met를 조정, 특히 억제하는 추가의 화합물을 제공하는 것이다. 본 발명에 이르러, 본원에 기재된 화학식 I의 화합물이 c-Met를 억제하며, 다수의 치료 용도를 갖는 것으로 밝혀졌다. 예를 들어, 화학식 I의 화합물은 c-Met 활성에 의존적인 질환, 특히 고형 종양 또는 그로부터 유래된 전이의 치료에 사용하기에 적합하다. c-Met의 억제를 통해, 본 발명의 화합물은 또한 예를 들어 감염으로 인한 염증성 상태를 치료하기 위한 항염증제로서 유용성을 갖는다.
바람직하게는, 본 발명의 화합물은 대사적으로 안정하고, 유리한 약동학 특성을 보유하고, 비독성이며, 부작용을 거의 나타내지 않는다. 또한, 본 발명의 바람직한 화합물은 안정하고 비흡습성이며 용이하게 제제화되는 물리적 형태로 존재한다. 본 발명의 바람직한 측면은 선행 기술의 화합물의 활성보다 월등한 활성을 갖는 화학식 I의 화합물에 관한 것이다. 본 발명의 또 다른 바람직한 측면은 우수한 키나제 선택성을 갖는 화학식 I의 화합물에 관한 것이다.
본 발명은 하기 화학식 I의 화합물 또는 그의 제약상 허용되는 염에 관한 것이다.
<화학식 I>
상기 식에서,
Y는 C 또는 N이고;
X는 CH 또는 N이고;
B는 CH 또는 N이고;
A는 고리이고;
여기서, X가 CH이고 B가 N인 경우에, 고리 A는 고리 Ai 또는 고리 Aii이고;
X가 N이고 B가 N인 경우에, 고리 A는 Aiii이고;
X가 N이고 B가 N이거나, 또는 X가 N이고 B가 CH인 경우에, 고리 A는 Ai이고;
R1은 i, ii 및 iii으로부터 선택된 기이고,
여기서, R5는 헤테로아릴1이고;
R6은 수소, 중수소, OH, 메틸 또는 할로이고;
R7은 수소, 중수소, 할로 또는 (C1-C3)알킬이고, 여기서 상기 (C1-C3)알킬은 OH 및 할로로부터 독립적으로 선택된 1개 이상의 치환기에 의해 임의로 치환되거나; 또는
R6 및 R7은 이들이 부착되어 있는 탄소와 함께 시클로프로필을 형성하고, 여기서 상기 시클로프로필은 메틸에 의해 임의로 치환되고;
n은 0, 1 또는 2이고;
R2는 수소, NH2 또는 (C1-C4)알킬이고, 여기서 상기 (C1-C4)알킬은 OH, NH2 및 할로로부터 독립적으로 선택된 1개 이상의 치환기에 의해 임의로 치환되고;
R3은 수소, -CONH2, -CONH(C1-C4)알킬, -CONH페닐이고, 여기서 상기 CONH페닐의 페닐은 1개 이상의 할로, -(C1-C4)알킬, -CO(C1-C4)알킬, -CO2(C1-C4)알킬, 페닐, 헤테로아릴2, -CO헤테로아릴2, -CSNH2, -CSNH(C1-C4)알킬, -CSNH벤질, -SO2(C1-C4)알킬 또는 -COCH2헤테로시클릴1에 의해 임의로 치환되고, 상기 헤테로시클릴1은 (C1-C3)알킬에 의해 임의로 치환되고;
R4는 수소 또는 (C1-C3)알킬이거나; 또는
R3 및 R4는 이들이 부착되어 있는 질소와 함께, R3 및 R4가 부착되어 있는 1개의 고리 N 원자 및 임의로 N, O 및 S로부터 독립적으로 선택된 1개의 추가 고리 헤테로원자를 포함하는 5 또는 6원 포화 또는 부분 불포화 모노시클릭 기를 형성하고, 여기서 상기 모노시클릭 기는 1 또는 2개의 =O 치환기에 의해 치환된다.
달리 명시되지 않는 한, 하기 일반적 정의가 본 명세서에서 적용될 것이다.
"본 발명의 화합물" 또는 "본 발명의 화합물들" 또는 "이 발명의 화합물"은 본원에 기재된 바와 같은 화학식 I의 화합물 또는 화합물들을 의미한다.
본원에 사용된 용어 "비롯한", "함유하는" 및 "포함하는"은 본원에서 이들의 개방적, 비제한적 의미로 사용된다.
복수형 (예를 들어, 화합물들, 염들)이 사용되는 경우, 이는 단수형 (예를 들어, 단일 화합물, 단일 염)을 포함한다. "화합물"은 (예를 들어, 제약 제제에서) 하나 초과의 화학식 I의 화합물 (또는 그의 염)이 존재하는 것을 배제하지 않는다.
"치료"는 예방적 (방지적) 및 치유적 치료, 뿐만 아니라 질환, 장애 또는 상태 진행의 지연을 포함한다.
1개 초과의 탄소 원자를 갖는 임의의 비-시클릭 탄소 함유 기 또는 잔기는 직쇄 또는 분지형이다. "알킬"은 직쇄 또는 분지쇄 알킬 기를 지칭한다. 예를 들어, (C1-C4)알킬은 메틸, 에틸, n- 또는 이소-프로필, 및 n-, 이소-, sec- 또는 tert-부틸을 포함한다.
"헤테로아릴1"은 N, O 및 S로부터 독립적으로 선택된 1, 2, 3 또는 4개의 고리 헤테로원자를 포함하는 9- 또는 10-원, 불포화 또는 부분 불포화 비시클릭 기를 의미하고, 여기서 고리 S 원자의 총 개수는 1을 초과하지 않고, 고리 O 원자의 총 개수는 1을 초과하지 않는다.
헤테로아릴1은 할로, OH 및 (C1-C3)알킬로부터 독립적으로 선택된 1개 이상의 치환기, 바람직하게는 1, 2 또는 3개의 치환기에 의해 임의로 치환되고, 여기서 상기 (C1-C3)알킬은 OH 및 할로로부터 독립적으로 선택된 1개 이상의 치환기에 의해 임의로 치환된다.
헤테로아릴1의 구체적인 예는 퀴놀리닐, 이소퀴놀리닐, 신놀리닐, 퀴나졸리닐, 퀴녹살리닐, 프탈라지닐, 1,5-나프티리디닐, 1,6-나프티리디닐, 1,7-나프티리디닐, 1,8-나프티리디닐, 2,6-나프티리디닐, 2,7-나프티리디닐, 피리도[3,2-d]피리미디닐, 피리도[4,3-d]피리미디닐, 피리도[3,4-d]피리미디닐, 피리도[2,3-d]피리미디닐, 피리도[2,3-b]피라지닐, 피리도[3,4-b]피라지닐, 피리미도[5,4-d]피리미디닐, 피라지노[2,3-b]피라지닐, 피리미도[4,5-d]피리미디닐, 벤조푸라닐, 벤조티오페닐, 인돌릴, 벤즈이미다졸릴, 벤족사졸릴, 인다조일, 벤조트리아졸릴, 피롤로[2,3-b]피리디닐, 피롤로[2,3-c]피리디닐, 피롤로[3,2-c]피리디닐, 피롤로[3,2-b]피리디닐, 이미다조[4,5-b]피리디닐, 이미다조[4,5-c]피리디닐, 피라졸로[4,3-d]피리디닐, 피라졸로[4,3-c]피리디닐, 피라졸로[3,4-c]피리디닐, 피라졸로[3,4-b]피리디닐, 이소인돌릴, 인다졸릴, 퓨리닐, 인돌리지닐, 이미다조[1,2-a]피리디닐, 이미다조[1,5-a]피리디닐, 피라졸로[1,5-a]피리디닐, 피롤로[1,2-b]피리다지닐 및 이미다조[1,2-c]피리미디닐, 및 이들의 부분 포화 등가물을 포함하나, 이에 제한되지는 않는다.
"헤테로아릴2"는 N, O 및 S로부터 독립적으로 선택된 1, 2, 3 또는 4개의 고리 헤테로원자를 포함하는 5- 내지 10-원 불포화 또는 부분 불포화 모노시클릭 또는 비시클릭 기를 의미하고, 여기서 고리 S 원자의 총 개수는 1을 초과하지 않고, 고리 O 원자의 총 개수는 1을 초과하지 않는다. 헤테로아릴2는 할로, OH 및 (C1-C3)알킬로부터 독립적으로 선택된 1개 이상의 치환기에 의해 임의로 치환되고, 여기서 상기 (C1-C3)알킬은 OH 및 할로로부터 독립적으로 선택된 1개 이상의 치환기에 의해 임의로 치환된다. 헤테로아릴2의 구체적인 예는 피롤릴, 푸라닐, 티오페닐, 피라졸릴, 이미다졸릴, 이속사졸릴, 옥사졸릴, 이소티아졸릴, 티아졸릴, 1,2,3-트리아졸릴, 1,3,4-트리아졸릴, 1-옥사-2,3-디아졸릴, 1-옥사-2,4-디아졸릴, 1-옥사-2,5-디아졸릴, 1-옥사-3,4-디아졸릴, 1-티아-2,3-디아졸릴, 1-티아-2,4-디아졸릴, 1-티아-2,5-디아졸릴, 1-티아-3,4-디아졸릴, 테트라졸릴, 피리디닐, 피리다지닐, 피리미디닐, 피라지닐, 퀴놀리닐, 이소퀴놀리닐, 신놀리닐, 퀴나졸리닐, 퀴녹살리닐, 아자퀴녹살리닐, 프탈라지닐, 1,5-나프티리디닐, 1,6-나프티리디닐, 1,7-나프티리디닐, 1,8-나프티리디닐, 2,6-나프티리디닐, 2,7-나프티리디닐, 피리도[3,2-d]피리미디닐, 피리도[4,3-d]피리미디닐, 피리도[3,4-d]피리미디닐, 피리도[2,3-d]피리미디닐, 피리도[2,3-b]피라지닐, 피리도[3,4-b]피라지닐, 피리미도[5,4-d]피리미디닐, 피라지노[2,3-b]피라지닐, 피리미도[4,5-d]피리미디닐, 벤조푸라닐, 벤조티오페닐, 인돌릴, 벤즈이미다졸릴, 벤족사졸릴, 인다조일, 벤조트리아졸릴, 피롤로[2,3-b]피리디닐, 피롤로[2,3-c]피리디닐, 피롤로[3,2-c]피리디닐, 피롤로[3,2-b]피리디닐, 이미다조[4,5-b]피리디닐, 이미다조[4,5-c]피리디닐, 피라졸로[4,3-d]피리디닐, 피라졸로[4,3-c]피리디닐, 피라졸로[3,4-c]피리디닐, 피라졸로[3,4-b]피리디닐, 이소인돌릴, 인다졸릴, 퓨리닐, 인돌리지닐, 이미다조[1,2-a]피리디닐, 이미다조[1,5-a]피리디닐, 피라졸로[1,5-a]피리디닐, 피롤로[1,2-b]피리다지닐 및 이미다조[1,2-c]피리미디닐, 및 부분 포화 시클릭 기, 예컨대 3,4-디히드로-2H-피라닐, 5,6-디히드로-2H-피라닐, 2H-피라닐, 1,2,3,4-테트라히드로피리디닐 및 1,2,5,6-테트라히드로피리디닐을 포함하나, 이에 제한되지는 않는다.
"헤테로시클릴1"은 N, O 및 S로부터 독립적으로 선택된 1 또는 2개의 고리 헤테로원자를 포함하는 5 또는 6원 포화 또는 부분 불포화 모노시클릭 기를 의미한다. 헤테로시클릴1의 구체적인 예는 3,4-디히드로-2H-피라닐, 5,6-디히드로-2H-피라닐, 2H-피라닐, 1,2,3,4-테트라히드로피리디닐 및 1,2,5,6-테트라히드로피리디닐, 테트라히드로푸라닐, 테트라히드로티오페닐, 피롤리디닐, 테트라히드로피라닐, 테트라히드로티오피라닐, 피페리디닐, 1,4-디옥사닐, 1,4-옥사티아닐, 모르폴리닐, 1,4-디티아닐, 피페라지닐 및 1,4-아자티아닐을 포함하나, 이에 제한되지는 않는다.
"헤테로아릴3"은 1 또는 2개의 고리 N 헤테로원자를 포함하는 9- 또는 10-원, 불포화 또는 부분 불포화 비시클릭 기를 의미한다. 헤테로아릴3은 할로, OH 및 (C1-C3)알킬로부터 독립적으로 선택된 1개 이상의 치환기에 의해 임의로 치환되고, 여기서 상기 (C1-C3)알킬은 OH 및 할로로부터 독립적으로 선택된 1개 이상의 치환기에 의해 임의로 치환된다. 헤테로아릴3의 구체적인 예는 퀴놀리닐, 이소퀴놀리닐, 신놀리닐, 아자퀴나졸리닐, 퀴녹살리닐, 프탈라지닐, 1,5-나프티리디닐, 1,6-나프티리디닐, 1,7-나프티리디닐, 1,8-나프티리디닐, 2,6-나프티리디닐, 2,7-나프티리디닐, 인돌릴, 벤즈이미다졸릴, 인다졸릴, 피롤로[2,3-b]피리디닐, 피롤로[2,3-c]피리디닐, 피롤로[3,2-c]피리디닐, 피롤로[3,2-b]피리디닐, 이소인돌릴, 인다졸릴, 인돌리니닐, 이미다조[1,2-a]피리디닐, 이미다조[1,5-a]피리디닐, 피라졸로[1,5-a]피리디닐 및 피롤로[1,2-b]피리다지닐을 포함하나, 이에 제한되지는 않는다.
헤테로아릴4는 N, O 및 S로부터 독립적으로 선택된 1, 2, 3 또는 4개의 고리 헤테로원자를 포함하는 5 또는 6원 불포화 또는 부분 불포화 모노시클릭 기를 의미하고, 여기서 고리 S 원자의 총 개수는 1을 초과하지 않고, 고리 O 원자의 총 개수는 1을 초과하지 않는다. 헤테로아릴4의 구체적인 예는 피롤릴, 푸라닐, 티오페닐, 피라졸릴, 이미다졸릴, 이속사졸릴, 옥사졸릴, 이소티아졸릴, 티아졸릴, 1,2,3-트리아졸릴, 1,3,4-트리아졸릴, 1-옥사-2,3-디아졸릴, 1-옥사-2,4-디아졸릴, 1-옥사-2,5-디아졸릴, 1-옥사-3,4-디아졸릴, 1-티아-2,3-디아졸릴, 1-티아-2,4-디아졸릴, 1-티아-2,5-디아졸릴, 1-티아-3,4-디아졸릴, 테트라졸릴, 피리디닐, 피리다지닐, 피리미디닐, 피라지닐, 3,4-디히드로-2H-피라닐, 5,6-디히드로-2H-피라닐, 2H-피라닐, 1,2,3,4-테트라히드로피리디닐 및 1,2,5,6-테트라히드로피리디닐을 포함하나, 이에 제한되지는 않는다.
바람직한 실시양태에서, 헤테로아릴4는 1 또는 2개의 고리 N 헤테로원자를 포함하는 5 또는 6원 불포화 모노시클릭 기를 의미한다. 상기 바람직한 실시양태의 구체적인 예는 피롤릴, 피라졸릴, 이미다졸릴, 피리디닐, 피리다지닐, 피리미디닐 및 피라지닐을 포함하나, 이에 제한되지는 않는다.
본원에 사용된 "질환"은 장애 또는 상태를 포함한다.
본원의 개시내용에 따르면, 화학식 I의 화합물은 하기 구조 Ia 내지 Ie 중 임의의 하나로부터 선택된다.
<화학식 Ia>
<화학식 Ib>
<화학식 Ic>
<화학식 Id>
<화학식 Ie>
본 발명의 한 실시양태에서,
B가 N이고;
Y가 C 또는 N이고;
X가 CH 또는 N이고;
여기서, X가 CH인 경우에, 고리 A가 고리 Ai 또는 고리 Aii이고;
X가 N인 경우에, 고리 A가 Aiii이고;
X가 N이고 B가 CH인 경우에, 고리 A가 Ai인
화학식 I의 화합물이 제공된다.
이러한 화합물은 본원에 개시된 바와 같은 구조 Ia, Ib, Ic 또는 Ie를 갖는다.
본 발명의 또 다른 실시양태에서,
B가 N이고;
Y가 C 또는 N이고;
X기 CH 또는 N이고;
여기서, X가 CH인 경우에, 고리 A가 고리 Ai 또는 고리 Aii이고;
X가 N인 경우에, 고리 A가 Aiii인
화학식 I의 화합물이 제공된다.
이러한 화합물은 본원에 개시된 바와 같은 구조 Ia, Ib 또는 Ic를 갖는다.
본 발명의 또 다른 실시양태에서, R1은 i 또는 ii이다.
본 발명의 바람직한 실시양태에서, R1은 i이다.
본 발명의 또 다른 실시양태에서, R1은 i, ii 및 iii으로부터 선택된 기이고,
R5는 헤테로아릴3이다.
본 발명의 또 다른 바람직한 실시양태에서, R1은 i이고,
R5는 헤테로아릴3이다.
본 발명의 또 다른 실시양태에서, 헤테로아릴1 및 헤테로아릴3은 각각 할로, OH 및 (C1-C3)알킬로부터 독립적으로 선택된 1개 이상의 치환기에 의해 임의로 치환된다. 특히, 헤테로아릴1 및 헤테로아릴3은 각각 할로 및 (C1-C2)알킬로부터 독립적으로 선택된 1, 2 또는 3개의 치환기에 의해 임의로 치환된다.
본 발명의 바람직한 실시양태에서, R5는 할로 및 (C1-C3)알킬로부터 독립적으로 선택된 1개 이상의 치환기에 의해 임의로 치환된 인다졸릴 또는 퀴놀리닐이다. 특히, R5는 할로 및 (C1-C3)알킬로부터 독립적으로 선택된 1, 2 또는 3개의 치환기에 의해 임의로 치환된 인다졸릴 또는 퀴놀리닐이다.
본 발명의 추가의 바람직한 실시양태에서, R5는 메틸 및 플루오로로부터 독립적으로 선택된 1, 2 또는 3개의 치환기에 의해 임의로 치환된 인다졸릴이거나, 또는 R5는 1 또는 2개의 플루오로 치환기에 의해 임의로 치환된 퀴놀리닐이다.
본 발명의 특정 실시양태에서, R5는 메틸 치환기에 의해 위치 1에서 치환되고 1 또는 2개의 플루오로 치환기로 임의로 추가 치환된 인다졸-5-일이거나, 또는 R5는 1 또는 2개의 플루오로 치환기에 의해 임의로 치환된 퀴놀린-6-일이다.
본 발명의 또 다른 실시양태에서, R6은 수소, 중수소, OH 또는 할로, 특히 수소, 중수소 또는 할로이고, 바람직한 실시양태에서, R6은 수소이다.
본 발명의 또 다른 실시양태에서, R7은 수소, 중수소, 할로 또는 메틸이고, 여기서 상기 메틸은 OH 및 할로로부터 독립적으로 선택된 1개 이상의 치환기에 의해 임의로 치환된다. 본 발명의 또 다른 실시양태에서, R7은 수소, 중수소, 할로 또는 메틸이다. 바람직한 실시양태에서, R7은 수소이다.
R1이 i이고 R6 및 R7이 둘 다 수소는 아닌 경우에, 화학식 I의 화합물은 R1에 비대칭 탄소 원자를 함유한다. 본 발명의 범주 내에는 R1i의 (R) 또는 (S) 거울상이성질체를 함유하는 화학식 I의 화합물 또는 그의 혼합물이 포함된다. 본 발명의 바람직한 실시양태에서, R1i의 (S) 거울상이성질체를 함유하는 화학식 I의 화합물, 또는 (S) 거울상이성질체를 주요 성분으로서 포함하는 혼합물이 제공된다.
본 발명의 또 다른 실시양태에서, R1은 플루오로퀴놀리닐메틸-, 플루오로퀴놀리닐메틸-d-, 플루오로퀴놀리닐메틸-d2-, 퀴놀리닐메틸-, 디플루오로퀴놀리닐메틸-, 플루오로퀴놀리닐히드록시메틸-, 퀴놀리닐히드록시메틸-, 디플루오로퀴놀리닐히드록시메틸-, 플루오로퀴놀리닐히드록시에틸-, 퀴놀리닐히드록시에틸-, 플루오로퀴놀리닐에틸-, 퀴놀리닐에틸-, 4,6-디플루오로-1-메틸인다졸릴에틸-, 4,6-디플루오로-1-메틸인다졸릴메틸-, 디플루오로(퀴놀리닐)메틸-, 퀴놀리닐프로파닐-, 디플루오로퀴놀리닐에틸-, 퀴놀리닐시클로프로필-, 6-플루오로-1-메틸-인다졸릴에틸-, 6-플루오로-1-메틸-인다졸릴메틸-,1-메틸인다졸릴메틸- 및 1-메틸인다졸릴에틸-로부터 선택된다.
본 발명의 바람직한 실시양태에서, n은 0이다.
본 발명의 또 다른 실시양태에서, R2는 수소 또는 메틸이다. 바람직하게는, R2는 메틸이다.
본 발명의 또 다른 실시양태에서, R3은 수소, -CONH2, -CONHCH3, -CONH페닐이고, 여기서 상기 CONH페닐의 페닐은 1개 이상의 할로, -(C1-C4)알킬, -COCH3, -CO2CH3, 페닐, 벤족사졸릴, 헤테로아릴4, -CO헤테로아릴4, -CSNH2, -CSNH(C1-C2)알킬, -CSNH벤질, -SO2Me, -COCH2모르폴리닐, COCH2피페리디닐 또는 -COCH2피페라지닐에 의해 임의로 치환되고, 상기 피페라지닐은 1개 이상의 (C1-C3)알킬에 의해 임의로 치환된다.
본 발명의 추가 실시양태에서, R3은 수소, -CONH2, -CONHCH3, -CONH페닐이고, 여기서 상기 CONH페닐의 페닐은 1개 이상의 할로, -(C1-C4)알킬, -COCH3, -CO2CH3, 페닐, 피리디닐, 벤족사졸릴, -CO피리디닐, -CSNH2, -CSNH(C1-C2)알킬, -CSNH벤질, -SO2Me, -COCH2모르폴린, 또는 -COCH2피페라진에 의해 임의로 치환되고, 여기서 상기 -COCH2피페라진의 피페라진은 메틸에 의해 위치 4에서 임의로 치환된다.
본 발명의 바람직한 실시양태에서, R3은 -CONH2이다.
본 발명의 또 다른 바람직한 실시양태에서, R4는 수소 또는 메틸, 보다 바람직하게는 수소이다.
본 발명의 대안적 실시양태에서, R3 및 R4는 이들이 부착되어 있는 질소와 함께 옥사졸리디논, 옥사졸리딘디온, 이미다졸리디논 또는 이미다졸리딘디온을 형성한다.
할로는 플루오로, 클로로, 브로모 또는 아이오도를 의미한다. 본 발명의 특정 실시양태에서, 할로는 플루오로 또는 클로로이다. 바람직하게는, 할로는 플루오로이다.
본 발명은 하기 화학식 I의 화합물에 관한 것이다.
<화학식 I>
상기 식에서,
Y는 C 또는 N이고;
X는 CH 또는 N이고;
B는 CH 또는 N이고;
A는 고리이고;
여기서, X가 CH이고 B가 N인 경우에, 고리 A는 고리 Ai 또는 고리 Aii이고;
X가 N이고 B가 N인 경우에, 고리 A는 Aiii이고;
X가 N이고 B가 N이거나, 또는 X가 N이고 B가 CH인 경우에, 고리 A는 Ai이고;
R1은 플루오로퀴놀리닐메틸-, 플루오로퀴놀리닐메틸-d-, 플루오로퀴놀리닐메틸-d2-, 퀴놀리닐메틸-, 디플루오로퀴놀리닐메틸-, 플루오로퀴놀리닐히드록시메틸-, 퀴놀리닐히드록시메틸-, 디플루오로퀴놀리닐히드록시메틸-, 플루오로퀴놀리닐히드록시에틸-, 퀴놀리닐히드록시에틸-, 플루오로퀴놀리닐에틸-, 퀴놀리닐에틸-, 4,6-디플루오로-1-메틸인다졸릴에틸-, 4,6-디플루오로-1-메틸인다졸릴메틸-, 디플루오로(퀴놀리닐)메틸-, 퀴놀리닐프로파닐-, 디플루오로퀴놀리닐에틸-, 퀴놀리닐시클로프로필-, 6-플루오로-1-메틸-인다졸릴에틸-, 6-플루오로-1-메틸-인다졸릴메틸-,1-메틸인다졸릴메틸- 또는 1-메틸인다졸릴에틸-이고;
R2는 수소, NH2, 에틸 또는 메틸이고;
R3은 -CONH2, 에틸, -CO(C1-C2)알킬, 페닐, 피리디닐, -CONH페닐, -CONH클로로페닐, CONHCH3, 벤족사졸릴, -SO2Me, CSNH(C1-C2)알킬, CSNH벤질-, -CSNH2, -COCH2모르폴린, -COCH2(4-메틸피페라진), 수소, -CO2CH3 또는 -CO피리디닐이고;
R4는 수소 또는 메틸이거나; 또는
R3 및 R4는 이들이 부착되어 있는 질소와 함께 옥사졸리디논, 옥사졸리딘디온, 이미다졸리디논 또는 이미다졸리딘디온을 형성한다.
본 발명의 보다 바람직한 실시양태에서,
B가 N이고;
Y가 C 또는 N이고;
X가 CH 또는 N이고;
여기서, X가 CH인 경우에, 고리 A가 고리 Ai 또는 고리 Aii이고;
X가 N인 경우에, 고리 A가 Aiii이고;
R1이 i이고;
R5가 1 또는 2개의 플루오로 치환기에 의해 임의로 치환된 퀴놀리닐이고;
R2가 메틸이고;
R3이 -CONH2이고;
R4가 수소이고;
R6 및 R7이 둘 다 수소이거나;
R6 및 R7이 둘 다 플루오로이거나;
R6 및 R7이 둘 다 중수소이거나; 또는
R6이 메틸이고 R7이 수소인 (S-거울상이성질체를 형성함)
화학식 I의 화합물이 제공된다.
본 발명의 다양한 실시양태가 본원에 기재된다. 각 실시양태에 명시된 특징을 다른 명시된 특징과 조합하여 추가 실시양태를 제공할 수 있음이 인지될 것이다.
특정 실시양태에서, 본 발명은 본원에 개시된 실시예 화합물로부터 선택된 하나 이상의 화합물, 또는 그의 제약상 허용되는 염을 제공한다.
본원에 사용된 용어 "이성질체"는 동일한 분자식을 갖지만 원자의 배열 및 배위가 다른, 상이한 화합물을 지칭한다. 또한 본원에 사용된 용어 "광학 이성질체" 또는 "입체이성질체"는 주어진 본 발명의 화합물에 대해 존재할 수 있는 다양한 입체이성질체 배위 중 임의의 것을 지칭하고, 기하 이성질체를 포함한다. 치환기는 탄소 원자의 키랄 중심에 부착될 수 있는 것으로 이해된다. 따라서, 본 발명은 화합물의 거울상이성질체, 부분입체이성질체 또는 라세미체를 포함한다. "거울상이성질체"란 서로 중첩되지 않는 거울 상인 한 쌍의 입체이성질체이다. 한 쌍의 거울상이성질체의 1:1 혼합물은 "라세미" 혼합물이다. 적절한 경우, 이 용어는 라세미 혼합물을 지칭하는 데 사용된다. "부분입체이성질체"는 2개 이상의 비대칭 원자를 가지나, 서로 거울 상이 아닌 입체이성질체이다. 절대 입체화학은 칸-잉골드-프렐로그(Cahn-Ingold-Prelog) R-S 시스템에 따라 특정된다. 화합물이 순수한 거울상이성질체인 경우, 각 키랄 탄소에서의 입체화학은 R 또는 S에 의해 규정될 수 있다. 절대 배열이 밝혀지지 않은 분할된 화합물들은 이들이 나트륨 D 선의 파장에서 평면 편광을 회전시키는 방향 (우회전 또는 좌회전)에 따라 (+) 또는 (-)로 지칭될 수 있다. 본원에 기재된 특정 화합물은 하나 이상의 비대칭 중심 또는 축을 함유하기 때문에, 거울상이성질체, 부분입체이성질체, 및 절대 입체화학의 관점에서 (R)- 또는 (S)-로 규정될 수 있는 다른 입체이성질체 형태를 생성할 수 있다. 본 발명은 라세미 혼합물, 광학적으로 순수한 형태 및 중간체 혼합물을 비롯한 모든 가능한 이성질체들을 포함하는 것으로 의도된다. 광학 활성 (R)- 및 (S)-이성질체는 키랄 합성단위체 또는 키랄 시약을 사용하여 제조하거나, 통상의 기술을 사용하여 분할할 수 있다. 화합물이 이중 결합을 함유하는 경우, 치환기는 E 또는 Z 배위일 수 있다. 화합물이 이치환 시클로알킬을 함유하는 경우, 시클로알킬 치환기는 시스- 또는 트랜스-배열을 가질 수 있다. 또한, 모든 호변이성질체 형태를 포함하는 것으로 의도된다.
본 발명의 화합물(들)의 임의의 비대칭 원자 (예를 들어, 탄소 등)는, 예컨대 본원에 정의된 R1 기 i 내에 존재할 수 있는 비대칭 탄소 원자에 대해, 라세미 또는 거울상이성질체적으로 풍부한, 예를 들어 (R)-, (S)- 또는 (R,S)-배위로 존재할 수 있다. 특정 실시양태에서, 각각의 비대칭 원자는 (R)- 또는 (S)-배위에서 적어도 50%의 거울상이성질체 과잉률, 적어도 60%의 거울상이성질체 과잉률, 적어도 70%의 거울상이성질체 과잉률, 적어도 80%의 거울상이성질체 과잉률, 적어도 90%의 거울상이성질체 과잉률, 적어도 95%의 거울상이성질체 과잉률, 또는 적어도 99%의 거울상이성질체 과잉률을 갖는다. 바람직하게는, 본원에 정의된 비대칭 R1 기 i에 대해, (S) 거울상이성질체는 상기 기재된 바와 같은 양으로 과잉 상태에 있다.
불포화 결합을 갖는 원자에서의 치환기는, 가능한 경우에 시스- (Z)- 또는 트랜스- (E)- 형태로 존재할 수 있다. 바람직하게는, 본 발명의 히드라존은 트랜스-(E)- 형태를 갖는다.
따라서, 본원에 사용된 바와 같이 본 발명의 화합물은 가능한 이성질체, 회전이성질체, 회전장애이성질체, 호변이성질체 또는 그의 혼합물 중 하나의 형태로, 예를 들어 실질적으로 순수한 기하 (시스 또는 트랜스) 이성질체, 부분입체이성질체, 광학 이성질체 (대장체), 라세미체 또는 그의 혼합물로 존재할 수 있다.
임의의 생성된 이성질체 혼합물은 구성성분의 물리화학적 차이에 기초하여, 예를 들어 크로마토그래피 및/또는 분별 결정화에 의해 순수한 또는 실질적으로 순수한 기하 또는 광학 이성질체, 부분입체이성질체, 라세미체로 분리될 수 있다.
최종 생성물 또는 중간체의 임의의 생성된 라세미체를 공지된 방법에 의해, 예를 들어 광학 활성 산 또는 염기에 의해 얻어진 그의 부분입체이성질체 염을 분리하고 광학 활성 산성 또는 염기성 화합물을 유리시킴으로써, 광학 대장체로 분할할 수 있다. 특히, 이에 따라 염기성 잔기를 사용하여, 예를 들어 광학 활성 산, 예를 들어 타르타르산, 디벤조일 타르타르산, 디아세틸 타르타르산, 디-O,O'-p-톨루오일 타르타르산, 만델산, 말산 또는 캄포르-10-술폰산을 사용하여 형성된 염의 분별 결정화에 의해 본 발명의 화합물을 그의 광학 대장체로 분할할 수 있다. 또한, 라세미 생성물은 키랄 흡착제를 사용하여 키랄 크로마토그래피, 예를 들어 고압 액체 크로마토그래피 (HPLC)에 의해 분할할 수 있다.
본원에 제시된 임의의 화학식은 또한 화합물의 표지되지 않은 형태 뿐만 아니라, 동위원소 표지된 형태를 나타내는 것으로 의도된다. 동위원소 표지된 화합물은, 1개 이상의 원자가 선택된 원자 질량 또는 질량 수를 갖는 원자로 대체된 것을 제외하고는, 본원에 기재된 화학식으로 도시되는 구조를 갖는다. 본 발명의 화합물 내로 혼입될 수 있는 동위원소의 예는 각각 수소, 탄소, 질소, 산소, 인, 플루오린 및 염소의 동위원소, 예컨대 2H, 3H, 11C, 13C, 14C, 15N, 18F, 31P, 32P, 35S, 36Cl, 125I를 포함한다. 본 발명의 다양한 동위원소 표지된 화합물은, 예를 들어 3H, 13C 및 14C와 같은 방사성 동위원소가 혼입된 것들이다. 이러한 동위원소 표지된 화합물은 대사 연구 (바람직하게는, 14C를 갖는 화합물), 반응 역학 연구 (예를 들어, 2H 또는 3H을 갖는 화합물), 검출 또는 영상화 기술 [예컨대, 양전자 방출 단층촬영술 (PET) 또는 단일-광자 방출 전산화 단층촬영술 (SPECT)], 예를 들어 약물 또는 기질 조직 분포 검정, 또는 환자의 방사능 치료에 유용하다. 특히, 18F 또는 표지된 화합물이 PET 또는 SPECT 연구에서 특히 바람직할 수 있다. 나아가, 보다 무거운 동위원소, 예컨대 중수소 (즉, 2H)로의 치환은 보다 큰 대사 안정성, 예를 들어 생체내 반감기 증가 또는 투여량 요건의 감소에 의한 특정의 치료 이점을 제공할 수 있다. 일반적으로, 본 발명의 동위원소 표지된 화합물 및 그의 전구약물은, 하기 기재한 반응식 또는 실시예 및 제조예에 개시된 절차를 동위원소 표지되지 않은 시약을 쉽게 이용가능한 동위원소 표지된 시약으로 대체하여 수행함으로써 제조될 수 있다.
추가로, 보다 무거운 동위원소, 특히 중수소 (즉, 2H 또는 D)로의 치환은 보다 큰 대사 안정성, 예를 들어, 생체내 반감기 증가 또는 투여량 요건의 감소 또는 치료 지수의 개선으로부터 특정의 치료 이점을 제공할 수 있다. 이와 관련하여, 중수소는 화학식 I의 화합물의 치환기로 간주된다는 것을 이해하여야 한다. 이러한 보다 무거운 동위원소, 특히 중수소의 농도는 동위원소 농축 계수에 의해 정의될 수 있다. 본원에 사용된 용어 "동위원소 농축 계수"는 동위원소 존재비 및 특정 동위원소의 천연 존재비 사이의 비율을 의미한다. 본 발명의 화합물 내의 치환기가 표시된 중수소인 경우, 이러한 화합물은 각 지정된 중수소 원자에 대하여 적어도 3500 (각각의 지정된 중수소 원자에서 52.5%의 중수소 혼입), 적어도 4000 (60%의 중수소 혼입), 적어도 4500 (67.5%의 중수소 혼입), 적어도 5000 (75%의 중수소 혼입), 적어도 5500 (82.5%의 중수소 혼입), 적어도 6000 (90%의 중수소 혼입), 적어도 6333.3 (95%의 중수소 혼입), 적어도 6466.7 (97%의 중수소 혼입), 적어도 6600 (99%의 중수소 혼입), 또는 적어도 6633.3 (99.5%의 중수소 혼입)의 동위원소 농축 계수를 갖는다. 본 발명의 화합물에서, 특정 동위원소로서 구체적으로 지정되지 않은 임의의 원자는 상기 원자의 임의의 안정한 동위원소를 나타내는 것을 의미한다. 달리 언급하지 않는 한, 위치가 "H" 또는 "수소"로서 구체적으로 지정된 경우, 상기 위치는 그의 자연 존재량 동위원소 조성으로 수소를 갖는 것으로 이해한다. 따라서, 본 발명의 화합물에서 중수소 (D)로서 구체적으로 지정된 임의의 원자는, 예를 들어 앞서 제시된 범위의 중수소를 나타내는 것을 의미한다.
일반적으로, 동위원소-표지된 화학식 I의 화합물은 기존에 사용되었던 비-표지된 시약 대신에 적절한 동위원소-표지된 시약을 사용하여 당업자에게 공지된 통상의 기술에 의해 또는 첨부하는 실시예 및 제조예에 기재된 것과 유사한 방법으로 제조될 수 있다.
본원에 사용된 용어 "제약상 허용되는 염"은 본 발명의 화합물의 생물학적 유효성 및 특성을 보유하는 염을 의미하며, 이는 전형적으로, 생물학적으로 또는 달리 바람직한 것이다. 염은 단독으로 또는 화학식 I의 유리 화합물과의 혼합물로 존재할 수 있다. 다수의 경우에서, 본 발명의 화합물은 아미노 기 또는 그와 유사한 기의 존재에 의해 산 염을 형성할 수 있다.
제약상 허용되는 산 부가염은 무기 산 및 유기 산으로 형성될 수 있으며, 예를 들어 아세테이트, 아스파르테이트, 벤조에이트, 베실레이트, 브로마이드/히드로브로마이드, 비카르보네이트/카르보네이트, 비술페이트/술페이트, 캄포르술포네이트, 클로라이드/히드로클로라이드, 클로르테오필로네이트, 시트레이트, 에탄디술포네이트, 푸마레이트, 글루셉테이트, 글루코네이트, 글루쿠로네이트, 히푸레이트, 히드로아이오다이드/아이오다이드, 이세티오네이트, 락테이트, 락토비오네이트, 라우릴술페이트, 말레이트, 말레에이트, 말로네이트, 만델레이트, 메실레이트, 메틸술페이트, 나프토에이트, 납실레이트, 니코티네이트, 니트레이트, 옥타데카노에이트, 올레에이트, 옥살레이트, 팔미테이트, 파모에이트, 포스페이트/수소 포스페이트/디히드로겐 포스페이트, 폴리갈락투로네이트, 프로피오네이트, 스테아레이트, 숙시네이트, 술포살리실레이트, 타르트레이트, 토실레이트 및 트리플루오로아세테이트 염이 있다. 염이 유도될 수 있는 무기 산은, 예를 들어 염산, 브로민화수소산, 황산, 질산, 인산 등을 포함한다. 염이 유도될 수 있는 유기 산은, 예를 들어 아세트산, 프로피온산, 글리콜산, 옥살산, 말레산, 말론산, 숙신산, 푸마르산, 타르타르산, 시트르산, 벤조산, 만델산, 메탄술폰산, 에탄술폰산, 톨루엔술폰산, 술포살리실산 등을 포함한다.
본 발명의 제약상 허용되는 염은 통상의 화학적 방법에 의해 모 화합물, 염기성 또는 산성 잔기로부터 합성될 수 있다. 일반적으로, 이러한 염은 이들 화합물의 유리 염기 형태를 화학량론적 양의 적절한 산과 반응시킴으로써 제조될 수 있다. 전형적으로, 이러한 반응은 물 또는 유기 용매, 또는 상기 둘의 혼합물 중에서 수행된다. 일반적으로, 실행 가능한 경우에 에테르, 에틸 아세테이트, 에탄올, 이소프로판올 또는 아세토니트릴과 같은 비-수성 매질의 사용이 바람직하다. 추가의 적합한 염의 목록은, 예를 들어 문헌 ["Remington's Pharmaceutical Sciences", 20th ed., Mack Publishing Company, Easton, Pa., (1985)]; 및 ["Handbook of Pharmaceutical Salts: Properties, Selection, and Use" by Stahl and Wermuth (Wiley-VCH, Weinheim, Germany, 2002)]에서 찾아볼 수 있다. "염", 또는 "그의 염들" 또는 "또는 그의 염"은 단독으로 또는 화학식 I의 유리 화합물과의 혼합물로 존재할 수 있다.
단리 또는 정제 목적상, 제약상 허용되지 않는 염, 예를 들어 피크레이트 또는 퍼클로레이트를 사용하는 것도 가능하다. 치료 용도를 위해서는, 제약상 허용되는 염 또는 유리 화합물만을 사용하므로 (제약 제제의 형태로 적용가능한 경우), 이들이 바람직하다. 유리 형태의 신규 화합물 및 그의 염 (예를 들어, 신규 화합물의 정제 또는 동정에서 중간체로서 사용될 수 있는 염 포함) 형태의 신규 화합물 사이의 밀접한 관계를 고려할 때, 상기 및 하기의 유리 화합물에 대한 임의의 언급은, 적절하게 편의상 상응하는 염도 지칭하는 것으로 이해해야 한다.
본 발명의 화합물은 비용매화 및 용매화 형태 둘 다로 존재할 수 있다. 용어 "용매화물"은 본원에서 본 발명의 화합물 및 하나 이상의 제약상 허용되는 용매 분자, 예를 들어 에탄올을 포함하는 분자 복합체를 기재하기 위해 사용된다. 용어 "수화물"은 상기 용매가 물인 경우에 사용된다. 제약상 허용되는 용매화물은 수화물 및 다른 용매화물을 포함하고, 여기서 결정화의 용매는 동위원소로 치환될 수 있다 (예를 들어, D2O, d6-아세톤, d6-DMSO). 본원에 제시된 임의의 화학식은 이러한 화합물의 수화물, 용매화물 및 다형체, 및 이들의 혼합물을 나타내는 것으로 의도된다.
수소 결합에 대한 공여자 및/또는 수용자로서 작용할 수 있는 기를 함유하는 본 발명의 화합물, 즉 화학식 I의 화합물은 적합한 공결정 형성제로 공결정을 형성할 수 있다. 상기 공결정은 공지된 공결정 형성 절차에 의해 화학식 I의 화합물로부터 제조할 수 있다. 이러한 절차는 분쇄, 가열, 동시-승화, 동시-용융, 또는 결정화 조건 하에 용액 중에서 화학식 I의 화합물을 공결정 형성제와 접촉시키고 이에 의해 형성된 공결정을 단리시키는 것을 포함한다. 적합한 공결정 형성제는 WO 2004/078163에 기재된 것들을 포함한다. 따라서, 본 발명은 추가적으로 화학식 I의 화합물을 포함하는 공결정을 제공한다.
본 발명의 화합물은 따라서 본원에 정의된 바와 같은 화학식 I의 화합물, 그의 다형체 및 이성질체 (광학, 기하 및 호변이성질체 포함) 및 동위원소-표지된 화학식 I의 화합물을 포함한다. 바람직한 실시양태 (독립적으로, 총괄적으로 또는 임의의 조합 또는 하위-조합으로 바람직함)에서, 본 발명은 유리 염기 형태 또는 산 부가염 형태의 화학식 I의 화합물 (여기서, 치환기는 본원에 정의된 바와 같음)에 관한 것이다.
본 발명의 화합물은 전구약물로서 투여될 수 있다. 따라서, 그 자체로는 약리 활성이 거의 또는 전혀 없을 수 있는 화학식 I의 화합물의 특정 유도체가, 신체 내로 또는 상에 투여시, 예를 들어 가수분해성 절단에 의해 목적 활성을 갖는 화학식 I의 화합물로 전환될 수 있다. 이러한 유도체는 '전구약물'로 지칭된다. [전구약물의 사용에 관한 추가적인 정보는 문헌 ['Pro-drugs as Novel Delivery Systems, Vol. 14, ACS Symposium Series (T Higuchi and W Stella)] 및 ['Bioreversible Carriers in Drug Design', Pergamon Press, 1987 (ed. E B Roche, American Pharmaceutical Association)]에서 찾아볼 수 있다.]
전구약물은, 예를 들어 화학식 I의 화합물에 존재하는 적절한 관능기를, 예를 들어 문헌 ["Design of Prodrugs" by H Bundgaard (Elsevier, 1985)]에 기재된 바와 같이 '전구-잔기(pro-moieties)'로 당업자에 공지된 특정 잔기로 대체함으로써 생성시킬 수 있다.
이러한 전구약물의 몇몇 예는
(i) 화학식 I의 화합물이 카르복실산 관능기 (-COOH)를 함유하는 경우에, 그의 에스테르, 예를 들어 수소의 (C1-C8)알킬로의 대체;
(ii) 화학식 I의 화합물이 알콜 관능기 (-OH)를 함유하는 경우에, 그의 에테르, 예를 들어 수소의 (C1-C6)알카노일옥시메틸로의 대체; 및
(iii) 화학식 I의 화합물이 1급 또는 2급 아미노 관능기 (-NH2 또는 -NHR (여기서, R ≠ H임))인 경우에, 그의 아미드, 예를 들어 1개 또는 양쪽 수소의 (C1-C10)알카노일로의 대체
를 포함한다.
화학식 I의 특정 화합물은 또한 그 자체로 화학식 I의 다른 화합물의 전구약물로서 작용할 수 있다.
본 발명은 또한 화학식 I의 화합물의 제약상 허용되는 전구약물에 관한 것이다. 본 발명은 또한 화학식 I의 화합물의 제약상 허용되는 대사물에 관한 것이다.
특히, "c-Met 티로신 키나제 매개 질환"은 유익한 방식 (예를 들어 하나 이상의 증상의 완화, 질환 발병의 지연, 질환의 적어도 일시적인 치유 또는 질환의 완전한 치유)으로 단백질 티로신 키나제의 억제, 특히 c-Met 키나제의 억제에 반응하는 장애이다. 이러한 장애는 증식성 질환, 예컨대 종양 질환, 특히 고형 종양 및 그로부터 유래된 전이물, 예를 들어 유전성 유두상 신세포 암종 (PRCC), 산발성 형태의 PRCC, 두경부암, 편평 세포 암종, 위 암종, 췌장 암종, 폐암, 방광암, 유방암, 평활근육종, 교모세포종, 흑색종 및 폐포 연부 육종을 포함한다. 이러한 장애는 염증성 상태, 예컨대 감염으로 인한 염증성 상태를 추가로 포함한다.
"조합물"은 1개의 투여량 단위 형태 중의 고정 조합물을 지칭하거나, 또는 화학식 I의 화합물 및 조합 파트너 (예를 들어, "치료제" 또는 "동시-작용제"라 지칭되기도 하는 하기 설명된 바와 같은 다른 약물)가 독립적으로 동일 시간에 또는 시간 간격을 두고 별개로 (특히, 이러한 시간 간격은 조합 파트너가 협력적인 효과, 예를 들어 상승작용 효과를 나타내게 함) 투여될 수 있는 조합 투여를 위한 부분들의 키트를 지칭한다. 본원에 사용된 용어 "동시-투여" 또는 "조합 투여" 등은 이를 필요로 하는 단일 대상체 (예를 들어, 환자)로의 선택된 조합 파트너의 투여를 포함하는 것을 의미하며, 작용제가 반드시 동일한 투여 경로를 통해 또는 동일한 시간에 투여될 필요는 없는 치료 투약법을 포함하는 것으로 의도된다. 본원에 사용된 용어 "제약 조합물"은 하나 초과의 활성 성분을 혼합 또는 조합하여 얻은 생성물을 의미하며, 활성 성분들의 고정 및 비-고정 조합물을 모두 포함한다. 용어 "고정 조합물"은 활성 성분, 예를 들어 화학식 I의 화합물 및 조합 파트너가 모두 단일 개체 또는 투여 형태로 환자에게 동시에 투여되는 것을 의미한다. 용어 "비-고정 조합물"은 활성 성분, 예를 들어 화학식 I의 화합물 및 조합 파트너가 둘 다 별도의 개체로서 동시에, 함께, 또는 구체적 시간 제한 없이 순차적으로 환자에게 투여되는 것을 의미한다 (여기서, 상기 투여는 환자 체내에서 두 화합물의 치료적 유효 수준을 제공함). 후자는 또한 칵테일 요법, 예를 들어 3종 이상의 활성 성분의 투여에 적용된다.
본 발명은 특히 실시예에 제공된 바와 같은 화학식 I의 화합물, 뿐만 아니라 그에 기재된 제조 방법에 관한 것이다.
상기 및 하기에 기재된 바와 같이, 화학식 I의 화합물은 유익한 약리 특성을 갖는다.
본 발명의 또 다른 실시양태에서, c-Met 관련 장애 또는 상태를 치료하는 방법이 제공된다. 치료할 장애 또는 상태는, 바람직하게는 증식성 질환, 예컨대 암 또는 염증성 상태이다. 화학식 I의 화합물은 추가로 c-Met-관련 상태와 관련된 질환을 치료하기에 유용하다.
A: 증식성 질환: 화학식 I의 화합물은 하나 이상의 하기 증식성 질환의 치료에 특히 유용하다:
화학식 I의 화합물은 뇌암, 위암, 생식기암, 비뇨기암, 전립선암, 방광암 (표재성 및 근침윤성), 유방암, 자궁경부암, 결장암, 결장직장암, 신경교종 (교모세포종, 역형성 성상세포종, 핍지교성상세포종, 핍지교종을 포함함), 식도암, 위암, 위장암, 간암, 간세포 암종 (HCC), 예를 들어 소아 HCC, 두경부암 (두경부 편평-세포 암종, 비인두 암종을 포함함), 휘르틀레(Hurthle) 세포 암종, 상피암, 피부암, 흑색종 (악성 흑색종을 포함함), 중피종, 림프종, 골수종 (다발성 골수종을 포함함), 백혈병, 폐암 (비소세포 폐암 (모든 조직학적 아형: 선암종, 편평 세포 암종, 기관지폐포 암종, 거대 세포 암종 및 선편평 혼합형 포함), 소세포 폐암을 포함함), 난소암, 췌장암, 전립선암, 신장암 (유두상 신세포 암종을 포함하나, 이에 제한되지 않음), 장암, 신세포암 (유전성 및 산발성 유두상 신세포암, 제I형 및 제II형 및 투명 세포 신세포암을 포함함), 육종, 특히 골육종, 투명 세포 육종 및 연조직 육종 (폐포성 및 배아성 횡문근육종, 폐포 연부 육종을 포함함), 갑상선 암종 (유두상 및 기타 아형)으로 이루어진 군으로부터 선택된 암의 치료에 유용하다.
화학식 I의 화합물은 위암, 결장암, 간암, 생식기암, 비뇨기암, 흑색종 또는 전립선암의 치료에 유용하다. 특정 실시양태에서, 상기 암은 간암 또는 식도암이다.
화학식 I의 화합물은, 예를 들어 간에서의 전이를 포함하는 결장암 및 비소세포 폐 암종의 치료에 유용하다.
화학식 I의 화합물은 또한 유전성 유두상 신장 암종 (문헌 [Schmidt, L. et al. Nat. Genet. 16, 68-73, 1997]) 및 c-Met가 과다발현되거나 돌연변이에 의해 (문헌 [Jeffers and Vande Woude. Oncogene 18, 5120-5125, 1999] 및 그에 인용된 참고문헌) 또는 염색체 재배열에 의해 (예를 들어, TPR-MET; 문헌 [Cooper et al. Nature 311, 29-33, 1984], [Park. et al. Cell 45, 895-904, 1986]) 구성적으로 활성화된 다른 증식성 질환의 치료에 사용될 수도 있다.
추가로, 화학식 I의 화합물은 본원에 제공된 바와 같거나 당업계에 공지된 추가의 암 및 상태의 치료에 유용하다.
B: 염증성 상태: 화학식 I의 화합물은 하나 이상의 염증성 상태의 치료에 특히 적합하다.
추가 실시양태에서, 염증성 상태는 감염으로 인한 것이다. 한 실시양태에서, 치료 방법은 병원체 감염의 차단이다. 특정 실시양태에서, 감염은 박테리아 감염, 예를 들어 리스테리아(Listeria) 감염이다. 예를 들어, 문헌 [Shen et al. Cell 103: 501-10, (2000)]을 참조하며, 그에 의하면 박테리아 표면 단백질이 수용체의 세포외 도메인에의 결합을 통해 c-Met 키나제를 활성화시키고, 그로 인해 동족 리간드 HGF/SF의 효과를 모방한다.
추가로, 화학식 I의 화합물은 본원에 제공된 바와 같거나 당업계에 공지된 추가의 염증성 장애 및 상태의 치료에 유용하다.
C: 조합 요법: 특정 실시양태에서, 임의의 상기 방법은 화학요법제의 투여를 추가로 포함한다.
관련된 실시양태에서, 화학요법제는 항암제이다. 특정 조합은 본 출원 전반에 걸쳐 제공된다.
추가의 관련된 실시양태에서, 임의의 상기 방법은 경로 특이적 억제제의 투여를 추가로 포함한다. 경로 특이적 억제제는 화학요법제일 수도 있고, 또는 생물학적 작용제, 예를 들어 항체일 수도 있다. 경로 특이적 억제제는 EGFR, Her-2, Her-3, VEGFR, Ron, IGF-IR, PI-3K, mTOR, Raf의 억제제를 포함하나, 이에 제한되지는 않는다.
상기한 여러 방법에 관한 추가의 관련된 실시양태에서, 이러한 방법은 대상체로의 투여 또는 세포와의 접촉 후에 암의 발생 또는 암의 전이의 완화 또는 지연을 관찰하는 것을 추가로 포함할 수 있다.
따라서, 한 실시양태에서, 본 발명은 c-Met 관련 장애 또는 상태의 치료를 필요로 하는 대상체에게 유효량의 임의의 화학식 I의 화합물을 투여하는 것을 포함하는, c-Met 관련 장애 또는 상태의 치료 방법에 관한 것이다.
추가 실시양태에서, 본 발명은 의약으로서, 특히 하나 이상의 c-Met 티로신 키나제 매개 질환 치료용 의약으로서 사용하기 위한 화학식 I의 화합물 또는 그의 제약상 허용되는 염에 관한 것이다.
추가 실시양태에서, 본 발명은 하나 이상의 c-Met 티로신 키나제 매개 질환 치료용 의약의 제조에서의, 화학식 I의 화합물 또는 그의 제약상 허용되는 염의 용도에 관한 것이다.
추가 실시양태에서, 본 발명은 c-Met 티로신 키나제의 억제에 반응하는 질환 또는 장애의 치료를 필요로 하는 온혈 동물에게 화학식 I의 화합물 또는 그의 제약상 허용되는 염을, 특히 상기 질환에 대한 유효량으로 투여하는 것을 포함하는, c-Met 티로신 키나제의 억제에 반응하는 질환 또는 장애의 치료 방법에 관한 것이다.
추가 실시양태에서, 본 발명은 활성 성분으로서의 화학식 I의 화합물을 하나 이상의 제약 담체 또는 희석제와 함께 포함하는 제약 조성물에 관한 것이다.
추가 실시양태에서, 본 발명은 (a) 유효량의 화학식 I의 화합물 및 그의 제약상 허용되는 염, 제약상 허용되는 전구약물 및/또는 제약 활성 대사물; 및 (b) 하나 이상의 제약상 허용되는 부형제 및/또는 희석제를 포함하는 제약 조성물에 관한 것이다.
추가 실시양태에서, 본 발명은 인간을 비롯한 온혈 동물에서의 질환, 예를 들어 고형 또는 액상 종양의 치료에 유효한 용량의 상기 기재된 바와 같은 화학식 I의 화합물 또는 이러한 화합물의 제약상 허용되는 염을 제약상 허용되는 담체 (= 담체 물질)와 함께 포함하는, 인간을 비롯한 온혈 동물에서의 질환, 예를 들어 고형 또는 액상 종양의 치료를 위한 제약 조성물에 관한 것이다.
본 발명의 또 다른 실시양태에서, 본원에 정의된 바와 같은 화학식 I의 화합물, 또는 이러한 화합물의 제약상 허용되는 염, 또는 그의 수화물 또는 용매화물, 및 하나 이상의 제약상 허용되는 담체 및/또는 희석제 및 임의로 하나 이상의 추가 치료제를 포함하는 제약 제제 (조성물)가 제공된다.
본원에 사용된 용어 "제약상 허용되는 담체"는 당업자에게 공지되어 있는 임의의 모든 용매, 분산 매질, 코팅제, 계면활성제, 항산화제, 보존제 (예를 들어, 항박테리아제, 항진균제), 등장화제, 흡수 지연제, 염, 보존제, 약물, 약물 안정화제, 결합제, 부형제, 붕해제, 윤활제, 감미제, 향미제, 염료 등, 및 이들의 조합물을 포함한다 (예를 들어, 문헌 [Remington's Pharmaceutical Sciences, 18th Ed. Mack Printing Company, 1990, pp. 1289-1329] 참조). 임의의 통상의 담체가 활성 성분과 상용적이지 않은 경우를 제외하고, 치료 또는 제약 조성물에서의 사용이 고려된다.
용어 본 발명의 화합물의 "치료 유효량"은 대상체의 생물학적 또는 의학적 반응, 예를 들어 효소 또는 단백질 활성의 감소 또는 억제, 또는 증상의 개선, 상태의 완화, 질환 진행의 감속 또는 지연, 또는 질환의 예방 등을 이끌어낼 본 발명의 화합물의 양을 나타낸다. 한 비제한적인 실시양태에서, 용어 "치료 유효량"은, 대상체에게 투여되는 경우에, (1) (i) c-Met에 의해 매개되거나, 또는 (ii) c-Met 활성과 관련되거나, 또는 (iii) c-Met의 활성 (정상적 또는 비정상적)을 특징으로 하는 상태 또는 장애 또는 질환을 적어도 부분적으로 개선, 억제, 예방 및/또는 완화시키는 데 효과적이거나; 또는 (2) c-Met의 활성을 감소시키거나 억제하는 데 효과적이거나; 또는 (3) c-Met의 발현을 감소시키거나 억제하는 데 효과적인 본 발명의 화합물의 양을 지칭한다. 또 다른 비제한적 실시양태에서, 용어 "치료 유효량"은, 세포, 조직, 비-세포 생물학적 물질, 또는 배지에 투여되는 경우에 c-Met의 활성을 적어도 부분적으로 감소시키거나 억제하는 데 효과적이거나; 또는 c-Met의 발현을 적어도 부분적으로 감소시키거나 억제하는데 효과적인 본 발명의 화합물의 양을 지칭한다.
본원에 사용된 용어 "대상체"는 동물을 지칭한다. 전형적으로, 동물은 포유동물이다. 대상체는 또한, 예를 들어 영장류 (예를 들어, 인간), 소, 양, 염소, 말, 개, 고양이, 토끼, 래트, 마우스, 어류, 조류 등을 지칭한다. 특정 실시양태에서, 대상체는 영장류이다. 또 다른 실시양태에서, 대상체는 인간이다.
본원에 사용된 용어 "억제하다", "억제" 또는 "억제하는"은 주어진 상태, 증상 또는 장애 또는 질환의 감소 또는 저해, 또는 생물학적 활성 또는 과정의 기저 활성의 유의한 감소를 지칭한다.
본원에 사용된 용어 임의의 질환 또는 장애를 "치료하다", "치료하는" 또는 임의의 질환 또는 장애의 "치료"는 한 실시양태에서 질환 또는 장애의 개선 (즉, 질환 또는 그의 하나 이상의 임상적 증상의 발병의 감속 또는 저지 또는 감소)을 지칭한다. 또 다른 실시양태에서, "치료하다", "치료하는" 또는 "치료"는 환자에 의해 인식가능하지 않을 수 있는 것을 포함하는 하나 이상의 물리적 파라미터의 완화 또는 개선을 지칭한다. 또 다른 실시양태에서, "치료하다", "치료하는" 또는 "치료"는 질환 또는 장애를 물리적으로 (예를 들어, 인식가능한 증상의 안정화), 생리적으로 (예를 들어, 물리적 파라미터의 안정화) 또는 둘 모두의 방식으로 조절하는 것을 지칭한다. 또 다른 실시양태에서, "치료하다", "치료하는" 또는 "치료"는 질환 또는 장애의 발병 또는 발달 또는 진행의 방지 또는 지연을 지칭한다.
본원에 사용된 바와 같이, 대상체가 치료로부터 생물학적으로, 의학적으로 또는 삶의 질에서 유익할 경우에, 상기 대상체는 치료"를 필요로 한다".
본원에 사용된 단수 용어 및 본 발명의 문맥에서 (특히, 특허청구범위의 문맥에서) 사용된 유사한 용어들은, 본원에서 달리 나타내거나 문맥상 명확하게 모순되지 않는 한, 단수형 및 복수형을 둘 다 포함하는 것으로 해석되어야 한다.
또 다른 측면에서, 본 발명은 본 발명의 화합물 및 제약상 허용되는 담체를 포함하는 제약 조성물을 제공한다. 제약 조성물은 특정 투여 경로, 예컨대 경구 투여, 비경구 투여 및 직장내 투여 등을 위해 제제화될 수 있다. 또한, 본 발명의 제약 조성물은 고체 형태 (비제한적으로, 캡슐, 정제, 환제, 과립, 분말 또는 좌제 포함), 또는 액체 형태 (비제한적으로, 용액, 현탁액 또는 에멀젼 포함)로 제조될 수 있다. 제약 조성물은 멸균과 같은 통상적인 제약학적 작업에 적용될 수 있고/거나, 통상적인 불활성 희석제, 윤활제, 완충제, 뿐만 아니라 보조제, 예컨대 보존제, 안정화제, 습윤제, 유화제 및 완충제 등을 함유할 수 있다.
전형적으로, 제약 조성물은 활성 성분을
a) 희석제, 예를 들어 락토스, 덱스트로스, 수크로스, 만니톨, 소르비톨, 셀룰로스 및/또는 글리신;
b) 윤활제, 예를 들어 실리카, 활석, 스테아르산, 그의 마그네슘 또는 칼슘 염 및/또는 폴리에틸렌글리콜; 정제의 경우에는 또한
c) 결합제, 예를 들어 규산알루미늄마그네슘, 전분 페이스트, 젤라틴, 트라가칸트, 메틸셀룰로스, 나트륨 카르복시메틸셀룰로스 및/또는 폴리비닐피롤리돈; 원하는 경우에는
d) 붕해제, 예를 들어 전분, 아가, 알긴산 또는 그의 나트륨 염, 또는 발포성 혼합물; 및/또는
e) 흡수제, 착색제, 향미제 및 감미제
와 함께 포함하는 정제 또는 젤라틴 캡슐이다.
정제는 당업계에 공지된 방법에 따라 필름 코팅되거나 장용성 코팅될 수 있다.
경구 투여에 적합한 조성물은 유효량의 본 발명의 화합물을 정제, 로젠지, 수성 또는 유성 현탁액, 분산가능한 분말 또는 과립, 에멀젼, 경질 또는 연질 캡슐, 시럽 또는 엘릭시르의 형태로 포함한다. 경구 사용을 위한 조성물은 제약 조성물의 제조에 대해 당업계에 공지된 임의의 방법에 따라 제조되고, 이러한 조성물은 우아하고 맛우수한 제제를 제공하기 위해 감미제, 향미제, 착색제 및 보존제로 이루어진 군으로부터 선택된 하나 이상의 작용제를 함유할 수 있다. 정제는 활성 성분을, 정제의 제조에 적합한 비독성의 제약상 허용되는 부형제와 혼합하여 함유할 수 있다. 이러한 부형제는, 예를 들어 불활성 희석제, 예컨대 탄산칼슘, 탄산나트륨, 락토스, 인산칼슘 또는 인산나트륨; 과립화제 및 붕해제, 예를 들어 옥수수 전분 또는 알긴산; 결합제, 예를 들어 전분, 젤라틴 또는 아카시아; 및 윤활제, 예를 들어 스테아르산마그네슘, 스테아르산 또는 활석이다. 정제는 코팅되지 않거나, 또는 공지된 기술에 의해 코팅되어 위장관에서의 붕해 및 흡수를 지연시킴으로써 보다 장기간에 걸쳐 지속적인 작용을 제공한다. 예를 들어, 글리세릴 모노스테아레이트 또는 글리세릴 디스테아레이트와 같은 시간 지연 물질이 사용될 수 있다. 경구용 제제는, 활성 성분이 불활성 고체 희석제, 예를 들어 탄산칼슘, 인산칼슘 또는 카올린과 혼합된 경질 젤라틴 캡슐, 또는 활성 성분이 물 또는 오일 매질, 예를 들어 땅콩 오일, 액상 파라핀 또는 올리브 오일과 혼합된 연질 젤라틴 캡슐로서 제공될 수 있다.
주사가능한 특정 조성물은 수성 등장성 용액 또는 현탁액이고, 좌제는 지방 에멀젼 또는 현탁액으로부터 유리하게 제조된다. 상기 조성물은 멸균될 수 있고/거나, 보존제, 안정화제, 습윤제 또는 유화제, 용해 촉진제, 삼투압 조절을 위한 염 및/또는 완충제와 같은 보조제를 함유할 수 있다. 추가로, 이들은 또한 다른 치료상 유익한 물질을 함유할 수 있다. 상기 조성물들은 각각 통상적인 혼합, 과립화 또는 코팅 방법에 따라 제조되며, 약 0.1 내지 75%, 또는 약 1 내지 50%의 활성 성분을 함유한다.
경피 적용에 적합한 조성물은 유효량의 본 발명의 화합물을 적합한 담체와 함께 포함한다. 경피 전달에 적합한 담체는 흡수가능한 약리학상 허용되는 용매를 포함하여 숙주의 피부를 통한 통과를 보조한다. 예를 들어, 경피 장치는 백킹 부재, 화합물을 임의로 담체와 함께 함유하는 저장소, 임의로 장기간에 걸쳐 제어된 예정 속도로 숙주의 피부에 화합물을 전달하기 위한 속도 제어 장벽, 및 장치가 피부에 부착되도록 하는 수단을 포함하는 붕대 형태이다.
예를 들어 피부 및 눈으로의 국소 적용에 적합한 조성물은 수용액, 현탁액, 연고, 크림, 겔 또는, 예를 들어 에어로졸 등에 의한 전달을 위한 분무가능한 제제를 포함한다. 이러한 국소 전달 시스템은 선 크림, 로션, 스프레이 등으로 특히 피부 도포, 예를 들어 피부암 치료, 예를 들어 예방적 용도에 적절할 것이다. 따라서, 이들은 당업계에 널리 공지된 국소 제제 (미용 제제 포함)로 사용하기에 특히 적합하다. 이들은 가용화제, 안정화제, 장성 증강제, 완충제 및 보존제를 함유할 수 있다.
본원에 사용된 국소 적용은 또한 흡입 또는 비내 적용에 관한 것일 수 있다. 이는 편리하게는 적합한 추진제를 사용하거나 사용하지 않고, 가압 용기, 펌프, 스프레이, 분무기 또는 연무기로부터의 건조 분말 흡입기 또는 에어로졸 스프레이 형태로부터 건조 분말의 형태로 (단독으로, 혼합물로서, 예를 들어 락토스와의 건조 블렌드로서, 또는 예를 들어 인지질과의 혼합 성분 입자로서) 전달될 수 있다.
본 발명은 또한 유효량, 특히 상기 언급된 질환, 장애 또는 상태 중 하나의 치료에 효과적인 양의 화학식 I의 화합물 또는 그의 제약상 허용되는 염을, 국소, 경장, 예를 들어 경구 또는 직장, 또는 비경구 투여에 적합하고 무기 또는 유기, 고체 또는 액체일 수 있는 하나 이상의 제약상 허용되는 담체와 함께 포함하는 제약 조성물에 관한 것이다.
온혈 동물에게 적용될 활성 성분의 투여량은 환자의 유형, 종, 연령, 체중, 성별 및 의학적 상태; 치료할 질환의 중증도; 투여 경로; 환자의 신장 및 간의 기능; 및 사용되는 특정 화합물을 비롯한 다양한 인자에 따라 달라진다. 당업계의 전문의, 임상의 또는 수의사는 해당 질환을 예방하거나 역전시키거나 그의 진행을 정지시키는 데 필요한 약물 유효량을 쉽게 결정하고 처방할 수 있다. 독성 없이 효능이 나타나도록 하는 범위 내에서 약물의 농도를 달성하는 데 있어 최적인 정확한 양에는, 표적 부위에 대한 해당 약물의 이용가능성의 동력학을 기초로 하는 요법이 필요하다. 그에는 약물의 분포, 평형 및 제거를 고려하는 것이 수반된다. 온혈 동물, 예를 들어 대략 70 kg 체중의 인간에게 투여될 화학식 I의 화합물 또는 그의 제약상 허용되는 염의 투여량은 하루에 1명에게 바람직하게는 대략 3 mg 내지 대략 5 g, 보다 바람직하게는 대략 10 mg 내지 대략 1.5 g이며, 이것을 예를 들어 동일한 양일 수 있는 1회 내지 3회의 단일 용량으로 나누는 것이 바람직하다. 통상적으로, 소아에게는 성인 용량의 절반을 사용한다.
본 발명의 제약 조성물 또는 조합물은 약 50 내지 70 kg의 대상체에 대해 활성 성분(들) 약 1 내지 1000 mg, 또는 활성 성분 약 1 내지 500 mg, 약 1 내지 250 mg, 약 1 내지 150 mg, 약 0.5 내지 100 mg 또는 약 1 내지 50 mg의 단위 투여량일 수 있다. 화합물, 제약 조성물 또는 그의 조합물의 치료 유효 투여량은 대상체의 종, 체중, 연령 및 개별 상태, 치료할 장애 또는 질환, 또는 그의 중증도에 따라 달라진다. 통상의 의사, 임상의 또는 수의사는 장애 또는 질환의 진행을 예방, 치료 또는 억제하는 데 필요한 각 활성 성분의 유효량을 용이하게 결정할 수 있다.
상기 언급된 투여량 특성은, 유리하게는 포유동물, 예를 들어 마우스, 래트, 개, 원숭이 또는 단리된 기관, 조직 및 그의 제제를 사용한 시험관내 및 생체내 시험에서 입증될 수 있다. 본 발명의 화합물은 용액, 예를 들어 수용액의 형태로 시험관내에서 적용될 수 있고, 경장, 비경구, 유리하게는 정맥내 경로를 통해, 예를 들어 현탁액 또는 수용액으로 생체내에서 적용될 수 있다. 시험관내 투여량은 약 10-3 몰 내지 10-9 몰 농도의 범위일 수 있다. 생체내 치료 유효량은 투여 경로에 따라 약 0.1 내지 500 mg/kg, 또는 약 1 내지 100 mg/kg의 범위일 수 있다.
본 발명의 또 다른 실시양태에서, 화학식 I의 화합물과 하나 이상의 다른 치료 활성제의 조합물이 제공된다. 따라서, 화학식 I의 화합물은 단독으로 투여될 수도 있고, 또는 하나 이상의 다른 치료제와 조합되어 투여될 수도 있으며, 가능한 조합 요법은 고정 조합물의 형태를 이용하거나, 또는 본 발명의 화합물 및 하나 이상의 다른 치료제를 교체적으로 또는 서로 독립적으로 투여하거나, 또는 고정 조합물 및 하나 이상의 다른 치료제를 조합 투여하는 것이다.
추가로, 화학식 I의 화합물은 특히 화학요법, 방사선요법, 면역요법, 수술적 개입, 또는 이들의 조합과 조합되어 종양 요법을 위해 투여될 수도 있다. 장기 요법은 상기한 바와 같은 다른 치료 전략과 관련하여 보조 요법으로서 동등하게 가능하다. 다른 가능한 치료법은, 예를 들어 위험 환자에서 종양 퇴행 또는 심지어는 화학예방 요법 후에 환자의 상태를 유지하기 위한 요법이다.
따라서, 화학식 I의 화합물은 다른 항증식성 화합물과 조합되어 사용될 수 있다. 이러한 항증식성 화합물은 아로마타제 억제제, 항에스트로겐, 토포이소머라제 I 억제제, 토포이소머라제 II 억제제, 미세소관 활성 화합물, 알킬화 화합물, 히스톤 데아세틸라제 억제제, 세포 분화 과정을 유도하는 화합물, 시클로옥시게나제 억제제, MMP 억제제, mTOR 억제제, 항신생물성 항대사물, 플라틴 화합물, 단백질 또는 지질 키나제 활성을 표적으로 하거나 감소시키는 화합물, 항혈관신생 화합물, 단백질 또는 지질 포스파타제의 활성을 표적으로 하거나, 감소시키거나 또는 억제하는 화합물, 고나도렐린 효능제, 항안드로겐, 메티오닌 아미노펩티다제 억제제, 비스포스포네이트, 생물학적 반응 조절제, 항증식성 항체, 헤파라나제 억제제, Ras 종양원성 이소형의 억제제, 텔로머라제 억제제, 프로테아솜 억제제, 혈액 악성종양의 치료에 사용되는 화합물, Flt-3의 활성을 표적으로 하거나, 감소시키거나 또는 억제하는 화합물, Hsp90 억제제, 키네신 스핀들 단백질 억제제, MEK 억제제, 류코보린, EDG 결합제, 항-백혈병 화합물, 리보뉴클레오티드 리덕타제 억제제, S-아데노실메티오닌 데카르복실라제 억제제, 혈관신생억제 스테로이드, 코르티코스테로이드, 다른 화학요법 화합물 (하기 정의된 바와 같음), 광증감 화합물을 포함하나, 이에 제한되지는 않는다.
또한, 대안적으로 또는 추가로, 이들은 다른 종양 치료 접근법, 예컨대 수술, 이온화 방사선, 광역학 요법, 이식물, 예를 들어 코르티코스테로이드, 호르몬과 조합되어 사용될 수 있거나, 또는 이들은 방사선증감제로서 사용될 수 있다.
본원에 사용된 용어 "아로마타제 억제제"는 에스트로겐 생성을 억제하는 화합물, 즉, 기질 안드로스텐디온 및 테스토스테론을 각각 에스트론 및 에스트라디올로 전환시키는 것을 억제하는 화합물에 관한 것이다. 상기 용어는 스테로이드, 특히 아타메스탄, 엑세메스탄 및 포르메스탄, 및 특히 비-스테로이드, 특히 아미노글루테티미드, 로글레티미드, 피리도글루테티미드, 트릴로스탄, 테스토락톤, 케토코나졸, 보로졸, 파드로졸, 아나스트로졸 및 레트로졸을 포함하나, 이에 제한되지는 않는다. 엑세메스탄은 예를 들어 시판 형태, 예컨대 상표명 아로마신(AROMASIN)의 시판 형태로 투여될 수 있다. 포르메스탄은 예를 들어 시판 형태, 예컨대 상표명 렌타론(LENTARON)의 시판 형태로 투여될 수 있다. 파드로졸은 예를 들어 시판 형태, 예컨대 상표명 아페마(AFEMA)의 시판 형태로 투여될 수 있다. 아나스트로졸은 예를 들어 시판 형태, 예컨대 상표명 아리미덱스(ARIMIDEX)의 시판 형태로 투여될 수 있다. 레트로졸은 예를 들어 시판 형태, 예컨대 상표명 페마라(FEMARA) 또는 페마르(FEMAR)의 시판 형태로 투여될 수 있다. 아미노글루테티미드는 예를 들어 시판 형태, 예컨대 상표명 오리메텐(ORIMETEN)의 시판 형태로 투여될 수 있다. 아로마타제 억제제인 화학요법제를 포함하는 본 발명의 조합물은 호르몬 수용체 양성 종양, 예를 들어 유방 종양의 치료에 특히 유용하다.
본원에 사용된 용어 "항에스트로겐"은 에스트로겐 수용체 수준에서 에스트로겐의 효과를 길항시키는 화합물에 관한 것이다. 상기 용어는 타목시펜, 풀베스트란트, 랄록시펜 및 랄록시펜 히드로클로라이드를 포함하나, 이에 제한되지는 않는다. 타목시펜은 예를 들어 시판 형태, 예컨대 상표명 놀바덱스(NOLVADEX)의 시판 형태로 투여될 수 있다. 랄록시펜 히드로클로라이드는 예를 들어 시판 형태, 예컨대 상표명 에비스타(EVISTA)의 시판 형태로 투여될 수 있다. 풀베스트란트는 US 4,659,516에 개시된 바와 같이 제제화될 수 있거나, 또는 예를 들어 시판 형태, 예컨대 상표명 파슬로덱스(FASLODEX)의 시판 형태로 투여될 수 있다. 항에스트로겐인 화학요법제를 포함하는 본 발명의 조합물은 에스트로겐 수용체 양성 종양, 예를 들어 유방 종양의 치료에 특히 유용하다.
본원에 사용된 용어 "항안드로겐"은 안드로겐 호르몬의 생물학적 효과를 억제할 수 있는 임의의 물질에 관한 것이며, 이는 예를 들어 US 4,636,505에 개시된 바와 같이 제제화될 수 있는 비칼루타미드 (카소덱스(CASODEX))를 포함하나, 이에 제한되지는 않는다.
본원에 사용된 용어 "고나도렐린 효능제"는 아바렐릭스, 고세렐린 및 고세렐린 아세테이트를 포함하나, 이에 제한되지는 않는다. 고세렐린은 US 4,100,274에 개시되어 있으며, 예를 들어 시판 형태, 예컨대 상표명 졸라덱스(ZOLADEX)의 시판 형태로 투여될 수 있다. 아바렐릭스는 예를 들어 US 5,843,901에 개시된 바와 같이 제제화될 수 있다.
본원에 사용된 용어 "토포이소머라제 I 억제제"는 토포테칸, 지마테칸, 이리노테칸, 캄프토테신 및 그의 유사체인 9-니트로캄프토테신 및 거대분자 캄프토테신 접합체 PNU-166148 (WO 99/17804의 화합물 A1)을 포함하나, 이에 제한되지는 않는다. 이리노테칸은 예를 들어 시판 형태, 예컨대 상표명 캄프토사르(CAMPTOSAR)의 시판 형태로 투여될 수 있다. 토포테칸은 예를 들어 시판 형태, 예컨대 상표명 하이캄틴(HYCAMTIN)의 시판 형태로 투여될 수 있다.
본원에 사용된 "토포이소머라제 II 억제제"는 안트라시클린, 예컨대 독소루비신 (예를 들어, 리포좀 제제, 예를 들어 케릭스), 다우노루비신, 에피루비신, 이다루비신 및 네모루비신, 안트라퀴논 미톡산트론 및 로속산트론, 및 포도필로톡신 에토포시드 및 테니포시드를 포함하나, 이에 제한되지는 않는다. 에토포시드는 예를 들어 시판 형태, 예컨대 상표명 에토포포스(ETOPOPHOS)의 시판 형태로 투여될 수 있다. 테니포시드는 예를 들어 시판 형태, 예컨대 상표명 VM 26-브리스톨(VM 26-BRISTOL)의 시판 형태로 투여될 수 있다. 독소루비신은 예를 들어 시판 형태, 예컨대 상표명 아드리블라스틴(ADRIBLASTIN) 또는 아드리아마이신(ADRIAMYCIN)의 시판 형태로 투여될 수 있다. 에피루비신은 예를 들어 시판 형태, 예컨대 상표명 파르모루비신(FARMORUBICIN)의 시판 형태로 투여될 수 있다. 이다루비신은 예를 들어 시판 형태, 예컨대 상표명 자베도스(ZAVEDOS)의 시판 형태로 투여될 수 있다. 미톡산트론은 예를 들어 시판 형태, 예컨대 상표명 노반트론(NOVANTRON)의 시판 형태로 투여될 수 있다.
용어 "미세소관 활성 화합물"은 탁산, 예를 들어 파클리탁셀 및 도세탁셀, 빈카 알칼로이드, 예를 들어 빈블라스틴, 특히 빈블라스틴 술페이트, 빈크리스틴, 특히 빈크리스틴 술페이트, 및 비노렐빈, 디스코데르몰리데스, 코키신 및 에포틸론 및 그의 유도체, 예를 들어 에포틸론 B 또는 D 또는 그의 유도체를 비롯한 (이에 제한되지는 않음), 미세소관 안정화, 미세소관 탈안정화 화합물 및 미세소관 중합 억제제에 관한 것이다. 파클리탁셀은 예를 들어 시판 형태, 예컨대 탁솔(TAXOL)의 시판 형태로 투여될 수 있다. 도세탁셀은 예를 들어 시판 형태, 예컨대 상표명 탁소테레(TAXOTERE)의 시판 형태로 투여될 수 있다. 빈블라스틴 술페이트는 예를 들어 시판 형태, 예컨대 상표명 빈블라스틴 R.P.(VINBLASTIN R.P.)의 시판 형태로 투여될 수 있다. 빈크리스틴 술페이트는 예를 들어 시판 형태, 예컨대 상표명 파르미스틴(FARMISTIN)의 시판 형태로 투여될 수 있다. 디스코데르몰리데스는 예를 들어 US 5,010,099에 개시된 바와 같이 수득할 수 있다. 또한, WO 98/10121, US 6,194,181, WO 98/25929, WO 98/08849, WO 99/43653, WO 98/22461 및 WO 00/31247에 개시된 에포틸론 유도체가 포함된다. 에포틸론 A 및/또는 B가 특히 바람직하다.
본원에 사용된 용어 "알킬화 화합물"은 시클로포스파미드, 이포스파미드, 멜팔란 또는 니트로소우레아 (BCNU 또는 글리아델)을 포함하나, 이에 제한되지는 않는다. 시클로포스파미드는 예를 들어 시판 형태, 예컨대 상표명 시클로스틴(CYCLOSTIN)의 시판 형태로 투여될 수 있다. 이포스파미드는 예를 들어 시판 형태, 예컨대 상표명 홀록산(HOLOXAN)의 시판 형태로 투여될 수 있다.
용어 "히스톤 데아세틸라제 억제제" 또는 "HDAC 억제제"는 히스톤 데아세틸라제를 억제하고 항증식 활성을 보유하는 화합물에 관한 것이다. 이는 WO 02/22577에 개시된 화합물, 특히 N-히드록시-3-[4-[[(2-히드록시에틸)[2-(1H-인돌-3-일)에틸]-아미노]메틸]페닐]-2E-2-프로펜아미드, N-히드록시-3-[4-[[[2-(2-메틸-1H-인돌-3-일)-에틸]-아미노]메틸]페닐]-2E-2-프로펜아미드 및 이들의 제약상 허용되는 염을 포함한다. 추가로, 특히 수베로일아닐리드 히드록삼산 (SAHA)이 포함된다. 히스톤 데아세틸라제 (HDAC)의 활성을 표적으로 하거나, 감소시키거나 또는 억제하는 화합물, 예컨대 부티르산나트륨 및 수베로일아닐리드 히드록삼산 (SAHA)은 히스톤 데아세틸라제라고 공지된 효소의 활성을 억제한다. 구체적인 HDAC 억제제는 MS275, SAHA, FK228 (종전 FR901228), 트리코스타틴 A, 및 US 6,552,065에 개시된 화합물, 특히, N-히드록시-3-[4-[[[2-(2-메틸-1H-인돌-3-일)-에틸]-아미노]메틸]페닐]-2E-2-프로펜아미드 또는 그의 제약상 허용되는 염, 및 N-히드록시-3-[4-[(2-히드록시에틸){2-(1H-인돌-3-일)에틸]-아미노]메틸]페닐]-2E-2-프로펜아미드 또는 그의 제약상 허용되는 염, 특히 락테이트 염을 포함한다.
용어 "항신생물성 항대사물"은 5-플루오로우라실 또는 5-FU, 카페시타빈, 겜시타빈, DNA 탈메틸화 화합물, 예컨대 5-아자시티딘 및 데시타빈, 메토트렉세이트 및 에다트렉세이트 및 폴산 길항제, 예컨대 페메트렉세드를 포함하나, 이에 제한되지는 않는다. 카페시타빈은 예를 들어 시판 형태, 예컨대 상표명 젤로다(XELODA)의 시판 형태로 투여될 수 있다. 겜시타빈은 예를 들어 시판 형태, 예컨대 상표명 겜자르(GEMZAR)의 시판 형태로 투여될 수 있다.
본원에 사용된 용어 "플라틴 화합물"은 카르보플라틴, 시스-플라틴, 시스플라티눔 및 옥살리플라틴을 포함하나, 이에 제한되지는 않는다. 카르보플라틴은 예를 들어 시판 형태, 예컨대 상표명 카르보플라트(CARBOPLAT)의 시판 형태로 투여될 수 있다. 옥살리플라틴은 예를 들어 시판 형태, 예컨대 상표명 엘록사틴(ELOXATIN)의 시판 형태로 투여될 수 있다.
본원에 사용된 용어 "단백질 또는 지질 키나제 활성을 표적으로 하거나 감소시키는 화합물" 또는 "단백질 또는 지질 포스파타제 활성" 또는 "추가의 항혈관신생 화합물"은 c-Met 티로신 키나제 및/또는 세린 및/또는 트레오닌 키나제 억제제 또는 지질 키나제 억제제, 예를 들어
a) 혈소판-유래의 성장 인자-수용체 (PDGFR)의 활성을 표적으로 하거나, 감소시키거나 또는 억제하는 화합물, 예컨대 PDGFR의 활성을 표적으로 하거나, 감소시키거나 또는 억제하는 화합물, 특히 PDGF 수용체를 억제하는 화합물, 예를 들어 N-페닐-2-피리미딘-아민 유도체, 예를 들어 이마티닙, SU101, SU6668 및 GFB-111;
b) 섬유모세포 성장 인자-수용체 (FGFR)의 활성을 표적으로 하거나, 감소시키거나 억제하는 화합물;
c) 인슐린-유사 성장 인자 수용체 I (IGF-IR)의 활성을 표적으로 하거나, 감소시키거나 또는 억제하는 화합물, 예컨대 IGF-IR의 활성을 표적으로 하거나, 감소시키거나 또는 억제하는 화합물, 특히 IGF-I 수용체의 키나제 활성을 억제하는 화합물, 예컨대 WO 02/092599에 개시된 화합물, 또는 IGF-I 수용체 또는 그의 성장 인자의 세포외 도메인을 표적으로 하는 항체;
d) Trk 수용체 티로신 키나제 패밀리의 활성을 표적으로 하거나, 감소시키거나 또는 억제하는 화합물, 또는 에프린 키나제 패밀리 억제제;
e) Axl 수용체 티로신 키나제 패밀리의 활성을 표적으로 하거나, 감소시키거나 억제하는 화합물;
f) Ret 수용체 티로신 키나제의 활성을 표적으로 하거나, 감소시키거나 억제하는 화합물;
g) Kit/SCFR 수용체 티로신 키나제의 활성을 표적으로 하거나, 감소시키거나 또는 억제하는 화합물, 예를 들어 이마티닙;
h) C-Kit 수용체 티로신 키나제 - (PDGFR 패밀리의 일부)의 활성을 표적으로 하거나, 감소시키거나 또는 억제하는 화합물, 예컨대 c-Kit 수용체 티로신 키나제 패밀리의 활성을 표적으로 하거나, 감소시키거나 또는 억제하는 화합물, 특히 c-Kit 수용체를 억제하는 화합물, 예를 들어 이마티닙;
i) c-Abl 패밀리의 구성원, 이들의 유전자-융합 생성물 (예를 들어, BCR-Abl 키나제) 및 돌연변이체의 활성을 표적으로 하거나, 감소시키거나 또는 억제하는 화합물, 예컨대 c-Abl 패밀리의 구성원 및 이들의 유전자-융합 생성물의 활성을 표적으로 하거나, 감소시키거나 또는 억제하는 화합물, 예를 들어 N-페닐-2-피리미딘-아민 유도체, 예를 들어 이마티닙 또는 닐로티닙 (AMN107); PD180970; AG957; NSC680410; PD173955 (파크데이비스(ParkeDavis)); 또는 다사티닙 (BMS-354825);
j) 단백질 키나제 C (PKC) 및 세린/트레오닌 키나제의 Raf 패밀리의 구성원, MEK, SRC, JAK, FAK, PDK1, PKB/Akt의 구성원, 및 Ras/MAPK 패밀리 구성원, 및/또는 시클린-의존성 키나제 패밀리 (CDK)의 구성원의 활성을 표적으로 하거나, 감소시키거나 또는 억제하는 화합물, 및 특히 US 5,093,330에 개시된 이들 스타우로스포린 유도체, 예를 들어 미도스타우린 (추가의 화합물의 예는, 예를 들어 UCN-01, 사핀골, BAY 43-9006, 브리오스타틴 1, 페리포신; 일모포신; RO 318220 및 RO 320432; GO 6976; 이시스 3521; LY333531/LY379196; 이소키놀린 화합물, 예컨대 WO 00/09495에 개시된 것; FTI; PD184352 또는 QAN697 (P13K 억제제) 또는 AT7519 (CDK 억제제)를 포함함);
k) 단백질-티로신 키나제 억제제의 활성을 표적으로 하거나, 감소시키거나 또는 억제하는 화합물, 예컨대 이마티닙 메실레이트 (글리벡(GLEEVEC)) 또는 티르포스틴(tyrphostin)을 포함하는 단백질-티로신 키나제 억제제의 활성을 표적으로 하거나, 감소시키거나 또는 억제하는 화합물 (티르포스틴은 바람직하게는 저분자량 (Mr < 1500)의 화합물 또는 그의 제약상 허용되는 염, 특히 화합물의 벤질리덴말로니트릴 클래스 또는 S-아릴벤젠말로니릴 또는 이중기질 퀴놀린 클래스로부터 선택된 화합물, 보다 특히 티르포스틴(Tyrphostin) A23/RG-50810; AG 99; 티르포스틴 AG 213; 티르포스틴 AG 1748; 티르포스틴 AG 490; 티르포스틴 B44; 티르포스틴 B44 (+) 거울상이성질체; 티르포스틴 AG 555; AG 494; 티르포스틴 AG 556, AG 957 및 아다포스틴 (4-{[(2,5-디히드록시페닐)메틸]아미노}-벤조산 아다만틸 에스테르; NSC 680410, 아다포스틴)으로 이루어진 군으로부터 선택된 임의의 화합물임); 및
l) 수용체 티로신 키나제의 표피 성장 인자 패밀리 (동종이량체 또는 이종이량체로서의 EGFR, ErbB2, ErbB3, ErbB4) 및 이들의 돌연변이체의 활성을 표적으로 하거나, 감소시키거나 또는 억제하는 화합물, 예컨대 표피 성장 인자 수용체 패밀리의 활성을 표적으로 하거나, 감소시키거나 또는 억제하는 화합물, 특히 EGF 수용체 티로신 키나제 패밀리의 구성원, 예를 들어 EGF 수용체, ErbB2, ErbB3 및 ErbB4를 억제하거나 또는 EGF 또는 EGF 관련 리간드에 결합하는 화합물, 단백질 또는 항체, 및 특히 WO 97/02266 (예를 들어, 실시예 39의 화합물) 또는 EP 0 564 409, WO 99/03854, EP 0520722, EP 0 566 226, EP 0 787 722, EP 0 837 063, US 5,747,498, WO 98/10767, WO 97/30034, WO 97/49688, WO 97/38983 및, 특히 WO 96/30347 (예를 들어, CP 358774로 공지된 화합물), WO 96/33980 (예를 들어, 화합물 ZD 1839) 및 WO 95/03283 (예를 들어, 화합물 ZM 105180)에 일반적으로 및 구체적으로 개시된 화합물, 단백질 또는 모노클로날 항체; 예를 들어 트라스투주맙 (헤르셉틴(Herceptin)™), 세툭시맙 (에르비툭스(Erbitux)™), 이레사(Iressa), 타르세바(Tarceva), OSI-774, CI-1033, EKB-569, GW-2016, E1.1, E2.4, E2.5, E6.2, E6.4, E2.11, E6.3 또는 E7.6.3, 및 7H-피롤로-[2,3-d]피리미딘 유도체 (WO 03/013541에 개시되어 있음); 및
m) c-Met 수용체의 활성을 표적으로 하거나, 감소시키거나 또는 억제하는 화합물, 예컨대 c-Met의 활성을 표적으로 하거나, 감소시키거나 또는 억제하는 화합물, 특히 c-Met 수용체의 키나제 활성을 억제하는 화합물, 또는 c-Met의 세포외 도메인을 표적으로 하거나 또는 HGF에 결합하는 항체;
n) Ron 수용체 티로신 키나제의 활성을 표적으로 하거나, 감소시키거나 억제하는 화합물
을 포함하나, 이에 제한되지는 않는다.
추가의 항혈관신생 화합물은 그의 활성에 대한 또 다른 메카니즘, 예를 들어 단백질 또는 지질 키나제 억제와 무관한 메카니즘을 갖는 화합물, 예를 들어 탈리도미드 (탈로미드) 및 TNP-470을 포함한다.
용어 "단백질 또는 지질 포스파타제의 활성을 표적으로 하거나, 감소시키거나 또는 억제하는 화합물"은 포스파타제 1, 포스파타제 2A 또는 CDC25의 억제제, 예를 들어 오카다산 또는 그의 유도체를 포함하나, 이에 제한되지는 않는다.
용어 "세포 분화 과정을 유도하는 화합물"은, 예를 들어 레티노산, α-, γ- 또는 δ-토코페롤, 또는 α-, γ- 또는 δ-토코트리에놀을 포함하나, 이에 제한되지는 않는다.
본원에 사용된 용어 "시클로옥시게나제 억제제"는 예를 들어 Cox-2 억제제, 5-알킬 치환된 2-아릴아미노페닐아세트산 및 유도체, 예컨대 셀레콕시브 (셀레브렉스(CELEBREX)), 로페콕시브 (비옥스(VIOXX)), 에토리콕시브, 발데콕시브 또는 5-알킬-2-아릴아미노페닐아세트산, 예를 들어 5-메틸-2-(2'-클로로-6'-플루오로아닐리노)페닐 아세트산, 루미라콕시브를 포함하나, 이에 제한되지는 않는다.
본원에 사용된 용어 "비스포스포네이트"는 에트리돈산, 클로드론산, 틸루드론산, 파미드론산, 알렌드론산, 이반드론산, 리세드론산 및 졸레드론산을 포함하나, 이에 제한되지는 않는다. "에트리돈산"은 예를 들어 시판 형태, 예컨대 상표명 디드로넬(DIDRONEL)의 시판 형태로 투여될 수 있다. "클로드론산"은 예를 들어 시판 형태, 예컨대 상표명 보네포스(BONEFOS)의 시판 형태로 투여될 수 있다. "틸루드론산"은 예를 들어 시판 형태, 예컨대 상표명 스켈리드(SKELID)의 시판 형태로 투여될 수 있다. "파미드론산"은 예를 들어 시판 형태, 예컨대 상표명 아레디아(AREDIA)™의 시판 형태로 투여될 수 있다. "알렌드론산"은 예를 들어 시판 형태, 예컨대 상표명 포사맥스(FOSAMAX)의 시판 형태로 투여될 수 있다. "이반드론산"은 예를 들어 시판 형태, 예컨대 상표명 본드라나트(BONDRANAT)의 시판 형태로 투여될 수 있다. "리세드론산"은 예를 들어 시판 형태, 예컨대 상표명 악토넬(ACTONEL)의 시판 형태로 투여될 수 있다. "졸레드론산"은 예를 들어 시판 형태, 예컨대 상표명 조메타(ZOMETA)의 시판 형태로 투여될 수 있다.
용어 "mTOR 억제제"는 라파마이신의 표유동물 표적 (mTOR)을 억제하며 항증식 활성을 갖는 화합물, 예컨대 시롤리무스 (라파뮨(Rapamune)®), 에베롤리무스 (세르티칸(Certican)™), CCI-779 및 ABT578에 관한 것이다.
본원에 사용된 용어 "헤파라나제 억제제"는 헤파린 술페이트 분해를 표적으로 하거나, 감소시키거나 또는 억제하는 화합물을 지칭한다. 상기 용어는 PI-88을 포함하나, 이에 제한되지는 않는다.
본원에 사용된 용어 "생물학적 반응 조절제"는 림포카인 또는 인터페론, 예를 들어 인터페론 γ를 지칭한다.
본원에 사용된 용어 "Ras 종양원성 이소형의 억제제", 예를 들어 H-Ras, K-Ras, 또는 N-Ras는 Ras의 종양원성 활성을 표적으로 하거나, 감소시키거나 또는 억제하는 화합물, 예를 들어 "파르네실 트랜스퍼라제 억제제", 예컨대 L-744832, DK8G557 또는 R115777 (자르네스트라)을 지칭한다.
본원에 사용된 용어 "텔로머라제 억제제"는 텔로머라제의 활성을 표적으로 하거나, 감소시키거나 또는 억제하는 화합물을 지칭한다. 텔로머라제의 활성을 표적으로 하거나, 감소시키거나 또는 억제하는 화합물은 특히 텔로머라제 수용체를 억제하는 화합물, 예를 들어 텔로메스타틴이다.
본원에 사용된 용어 "메티오닌 아미노펩티다제 억제제"는 메티오닌 아미노펩티다제의 활성을 표적으로 하거나, 감소시키거나 또는 억제하는 화합물을 지칭한다. 메티오닌 아미노펩티다제의 활성을 표적으로 하거나, 감소시키거나 또는 억제하는 화합물은, 예를 들어 벤가미드 또는 그의 유도체이다.
본원에 사용된 용어 "프로테아솜 억제제"는 프로테아좀의 활성을 표적으로 하거나, 감소시키거나 또는 억제하는 화합물을 지칭한다. 프로테아좀의 활성을 표적으로 하거나, 감소시키거나 또는 억제하는 화합물은, 예를 들어 보르테조미드(Bortezomid) (벨케이드(Velcade)™) 및 MLN 341을 포함한다.
본원에 사용된 용어 "매트릭스 메탈로프로테이나제 억제제" 또는 ("MMP" 억제제)는 콜라겐 펩티드모방체 및 비-펩티드모방체 억제제, 테트라시클린 유도체, 예를 들어 히드록사메이트 펩티드모방체 억제제 바티마스타트 및 그의 경구 생체이용가능한 유사체 마리마스타트 (BB-2516), 프리노마스타트 (AG3340), 메타스타트 (NSC 683551), BMS-279251, BAY 12-9566, TAA211, MMI270B 또는 AAJ996을 포함하나, 이에 제한되지는 않는다.
본원에 사용된 용어 "혈액 악성종양의 치료에 사용되는 화합물"은 FMS-유사 티로신 키나제 억제제, 예를 들어 FMS-유사 티로신 키나제 수용체 (Flt-3R)의 활성을 표적으로 하거나, 감소시키거나 또는 억제하는 화합물; 인터페론, 1-b-D-아라비노푸란실시토신 (ara-c) 및 비술판; 및 ALK 억제제, 예를 들어 역형성 림프종 키나제를 표적으로 하거나, 감소시키거나 또는 억제하는 화합물을 포함하나, 이에 제한되지는 않는다.
용어 "FMS-유사 티로신 키나제 수용체 (Flt-3R)의 활성을 표적으로 하거나, 감소시키거나 또는 억제하는 화합물"은 특히 Flt-3R 수용체 키나제 패밀리의 구성원을 억제하는 화합물, 단백질 또는 항체, 예를 들어 PKC412, 미도스타우린, 스타우로스포린 유도체, SU11248 및 MLN518이다.
본원에 사용된 용어 "HSP90 억제제"는 HSP90의 내인성 ATPase 활성을 표적으로 하거나, 감소시키거나 또는 억제하는 화합물; 유비퀴틴 프로테아좀 경로를 통해 HSP90 클라이언트 단백질을 분해하거나, 표적으로 하거나, 감소시키거나 또는 억제하는 화합물을 포함하나, 이에 제한되지는 않는다. HSP90의 내재적 ATPase 활성을 표적으로 하거나, 감소시키거나 또는 억제하는 화합물은 특히 HSP90의 ATPase 활성을 억제하는 화합물, 단백질 또는 항체, 예를 들어 17-알릴아미노, 17-데메톡시겔다나마이신 (17AAG, 17-DMAG), 겔다나마이신 유도체, 기타 겔다나마이신 관련 화합물, 라디시콜 및 HDAC 억제제, IPI-504, CNF1010, CNF2024, CNF1010 (컨포마 테라퓨틱스(Conforma Therapeutics)), 테모졸로미드 (테모달(TEMODAL)®), AUY922 (노파르티스(Novartis))이다.
본원에 사용된 용어 "항증식성 항체"는 트라스투주맙 (헤르셉틴™), 트라스투주맙-DM1, 에르비툭스, 베바시주맙 (아바스틴(Avastin)™)), 리툭시맙 (리툭산(Rituxan)®), PRO64553 (항-CD40) 및 2C4 항체를 포함하나 이들로 한정되지는 않는다. 항체는, 예를 들어 무손상 모노클로날 항체, 폴리클로날 항체, 2 가지 이상의 무손상 항체로부터 형성된 다중특이적 항체, 및 목적하는 생물학적 활성을 나타내는 항체 단편을 의미한다.
용어 "항백혈병 화합물"은 예를 들어 데옥시시티딘의 2'-알파-히드록시 리보스 (아라비노시드) 유도체인 Ara-C, 피리미딘 유사체를 포함한다. 또한, 하이포크산틴의 퓨린 유사체, 6-메르캅토퓨린 (6-MP) 및 플루다라빈 포스페이트가 포함된다. 급성 골수성 백혈병 (AML)의 치료를 위해, 화학식 I의 화합물은 표준 백혈병 요법과 함께, 특히 AML의 치료를 위해 사용되는 요법과 함께 사용될 수 있다. 특히, 화학식 I의 화합물은, 예를 들어 파르네실 트랜스퍼라제 억제제 및/또는 AML의 치료에 유용한 다른 약물, 예를 들어 다우노루비신, 아드리아마이신, Ara-C, VP-16, 테니포시드, 미톡산트론, 이다루비신, 카르보플라티눔 및 PKC412와 함께 투여될 수 있다.
본원에 사용된 "소마토스타틴 수용체 길항제"는 소마토스타틴 수용체를 표적으로 하거나, 치료하거나 또는 억제하는 화합물, 예를 들어 옥트레오티드 및 SOM230을 지칭한다.
"종양 세포에 손상을 입히는 접근법"은 이온화 방사선과 같은 접근법을 지칭한다. 상기 및 하기에서 언급되는 용어 "이온화 방사선"은 전자기선 (예컨대, X선 및 감마선) 또는 입자 (예컨대, 알파 및 베타 입자)로 나타나는 이온화 방사선을 의미한다. 이온화 방사선은 방사선 요법에서 제공되며 (이에 제한되지는 않음), 당업계에 공지되어 있다. 문헌 [Hellman, Principles of Radiation Therapy, Cancer, in Principles and Practice of Oncology, Devita et al., Eds., 4th Edition, Vol. 1, pp. 248-275 (1993)]을 참조한다.
본원에 사용된 용어 "EDG 결합제"는 림프구 재순환을 조정하는 면역억제제의 한 클래스, 예컨대 FTY720을 지칭한다.
용어 "키네신 스핀들 단백질 억제제"는 당업계에 공지되어 있고, SB715992 또는 SB743921 (글락소스미스클라인(GlaxoSmithKline)), 펜타미딘/클로르프로마진 (콤비네이토알엑스(CombinatoRx))을 포함한다.
용어 "MEK 억제제"는 당업계에 공지되어 있고, ARRY142886 (어레이 피오파마(Array PioPharma)), AZD6244 (아스트라제네카(AstraZeneca)), PD181461 (화이자(Pfizer)), 류코보린을 포함한다.
용어 "리보뉴클레오티드 리덕타제 억제제"는 피리미딘 또는 퓨린 뉴클레오시드 유사체, 예컨대 플루다라빈 및/또는 시토신 아라비노시드 (ara-C), 6-티오구아닌, 5-플루오로우라실, 클라드리빈, 6-메르캅토퓨린 (특히, ALL에 대한 ara-C와의 조합물) 및/또는 펜토스타틴 (이에 제한되지는 않음)을 포함하나, 이에 제한되지는 않는다. 리보뉴클레오티드 리덕타제 억제제는 특히 히드록시우레아 또는 2-히드록시-1H-이소인돌-1,3-디온 유도체, 예컨대 PL-1, PL-2, PL-3, PL-4, PL-5, PL-6, PL-7 또는 PL-8 (문헌 [Nandy et al., Acta Oncologica, Vol. 33, No. 8, pp. 953-961 (1994)]에 언급되어 있음)이다.
본원에 사용된 용어 "S-아데노실메티오닌 데카르복실라제 억제제"는 US 5,461,076에 개시된 화합물을 포함하나, 이에 제한되지는 않는다.
또한, 특히 WO 98/35958에 개시된 화합물, 단백질 또는 VEGF / VEGFR의 모노클로날 항체, 예를 들어 1-(4-클로로아닐리노)-4-(4-피리딜메틸)프탈라진 또는 그의 제약상 허용되는 염, 예를 들어 숙시네이트, 또는 WO 00/09495, WO 00/27820, WO 00/59509, WO 98/11223, WO 00/27819 및 EP 0 769 947에 개시된 것들; 문헌 [Prewett et al., Cancer Res, Vol. 59, pp. 5209-5218 (1999)]; [Yuan et al., Proc Natl Acad Sci U S A, Vol. 93, pp. 14765-14770 (1996)]; [Zhu et al., Cancer Res, Vol. 58, pp. 3209-3214 (1998)]; 및 [Mordenti et al., Toxicol Pathol, Vol. 27, No. 1, pp. 14-21 (1999)]; WO 00/37502 및 WO 94/10202에 기재된 것들; 안지오스타틴 (문헌 [O'Reilly et al., Cell, Vol. 79, pp. 315-328 (1994)]에 기재되어 있음); 엔도스타틴 (문헌 [O'Reilly et al., Cell, Vol. 88, pp. 277-285 (1997)]에 기재되어 있음); 안트라닐산 아미드; ZD4190; ZD6474; SU5416; SU6668; 베바시주맙; 또는 항-VEGF 항체 또는 항-VEGF 수용체 항체, 예를 들어 rhuMAb 및 RHUFab, VEGF 압타머, 예를 들어 마쿠곤; FLT-4 억제제, FLT-3 억제제, VEGFR-2 IgG1 항체, 안지오자임 (RPI 4610) 및 베바시주맙 (아바스틴™)이 포함된다.
본원에 사용된 "광역학 요법"은 암을 치료하거나 예방하기 위한 광증감 화합물로서 공지된 특정 화학물질을 사용하는 요법을 지칭한다. 광역학 요법의 예는, 예를 들어 비수딘 및 포르피머 나트륨과 같은 화합물을 사용한 치료를 포함한다.
본원에 사용된 "혈관신생억제 스테로이드"는 혈관신생을 차단하거나 억제하는 화합물, 예를 들어 아네코르타베, 트리암시놀론, 히드로코르티손, 11-α-에피히드로코티솔, 코르텍솔론, 17α-히드록시프로게스테론, 코르티코스테론, 데스옥시코르티코스테론, 테스토스테론, 에스트론 및 덱사메타손을 지칭한다.
본원에 사용된 용어 "코르티코스테로이드"는 예를 들어 특히 이식물 형태의 플루오시놀론 및 덱사메타손과 같은 화합물을 포함하나 이에 제한되지는 않는다.
"다른 화학요법 화합물"은 식물 알칼로이드, 호르몬 화합물 및 길항제; 생물학적 반응 조절제, 바람직하게는 림포카인 또는 인터페론; 안티센스 올리고뉴클레오티드 또는 올리고뉴클레오티드 유도체; shRNA 또는 siRNA; 또는 기타 다양한 화합물 또는 다른 또는 미지의 작용 메카니즘을 갖는 화합물을 포함하나, 이에 제한되지는 않는다.
화학식 I의 화합물은 또한 항염증성 약물 물질, 항히스타민 약물 물질, 기관지확장 약물 물질, NSAID, 케모카인 수용체의 길항제의 군으로부터 선택된 하나 이상의 추가의 약물 물질과 조합되어 사용될 수도 있다.
본 발명의 화합물은 또한 특히 염증성 질환, 예컨대 앞서 언급한 것들의 치료에 있어서 예를 들어 추가의 약물 물질의 치료 활성 증진제로서 또는 이러한 약물의 투여 요구량 또는 잠재적인 부작용을 감소시키는 수단으로서 추가의 약물 물질과 조합하여 사용하기 위한 공동-치료 화합물로서 유용하다. 본 발명의 화합물은 고정 제약 조성물 중에서 이러한 다른 약물 물질과 혼합될 수도 있고, 또는 이것이 별개로 투여 (즉, 다른 약물 물질의 투여 이전에 투여되거나 그와 동시에 투여되거나 그 후에 투여됨)될 수도 있다. 따라서, 본 발명은 화학식 I의 화합물 및 항염증성 약물 물질, 항히스타민 약물 물질, 기관지확장 약물 물질, 케모카인 수용체의 NSAID 길항제의 군으로부터 선택된 하나 이상의 추가의 약물 물질의 조합물을 포함하고, 화학식 I의 상기 화합물 및 상기 약물 물질은 동일하거나 상이한 제약 조성물 중에 존재한다.
적합한 항염증성 약물은 스테로이드, 특히 글루코코르티코스테로이드, 예컨대 부데소니드, 베클라메타손 디프로피오네이트, 플루티카손 프로피오네이트, 시클레소니드 또는 모메타손 푸로에이트, 또는 WO 02/88167, WO 02/12266, WO 02/100879, WO 02/00679 (특히, 실시예 3, 11, 14, 17, 19, 26, 34, 37, 39, 51, 60, 67, 72, 73, 90, 99 및 101), WO 03/035668, WO 03/048181, WO 03/062259, WO 03/064445, WO 03/072592에 기재되어 있는 스테로이드, WO 00/00531, WO 02/10143, WO 03/082280, WO 03/082787, WO 03/104195, WO 04/005229에 기재되어 있는 것과 같은 비-스테로이드성 글루코코르티코이드 수용체 효능제; LTB4 길항제, 예컨대 LY293111, CGS025019C, CP-195543, SC-53228, BIIL 284, ONO 4057, SB 209247 및 US 5451700에 기재된 것; LTD4 길항제, 예컨대 몬테루카스트 및 자피르루카스트; PDE4 억제제, 예컨대 실로밀라스트 (아리플로(Ariflo)® 글락소스미스클라인), 로플루밀라스트 (바이크 굴덴(Byk Gulden)), V-11294A (나프(Napp)), BAY19-8004 (바이엘(Bayer)), SCH-351591 (쉐링-플라우(Schering-Plough)), 아로필린 (알미랄 프로데스파르마(Almirall Prodesfarma)), PD189659 / PD168787 (파크-데이비스), AWD-12-281 (아스타 메디카(Asta Medica)), CDC-801 (셀진(Celgene)), SelCID(TM) CC-10004 (셀진), VM554/UM565 (베르날리스(Vernalis)), T-440 (다나베(Tanabe)), KW-4490 (교와 핫꼬 고교(Kyowa Hakko Kogyo)), 및 WO 92/19594, WO 93/19749, WO 93/19750, WO 93/19751, WO 98/18796, WO 99/16766, WO 01/13953, WO 03/104204, WO 03/104205, WO 03/39544, WO 04/000814, WO 04/000839, WO 04/005258, WO 04/018450, WO 04/018451, WO 04/018457, WO 04/018465, WO 04/018431, WO 04/018449, WO 04/018450, WO 04/018451, WO 04/018457, WO 04/018465, WO 04/019944, WO 04/019945, WO 04/045607 및 WO 04/037805에 개시된 것; A2a 효능제, 예컨대 EP 409595A2, EP 1052264, EP 1241176, WO 94/17090, WO 96/02543, WO 96/02553, WO 98/28319, WO 99/24449, WO 99/24450, WO 99/24451, WO 99/38877, WO 99/41267, WO 99/67263, WO 99/67264, WO 99/67265, WO 99/67266, WO 00/23457, WO 00/77018, WO 00/78774, WO 01/23399, WO 01/27130, WO 01/27131, WO 01/60835, WO 01/94368, WO 02/00676, WO 02/22630, WO 02/96462, WO 03/086408, WO 04/039762, WO 04/039766, WO 04/045618 및 WO 04/046083에 개시된 것; A2b 길항제, 예컨대 WO 02/42298에 기재된 것; 및 베타-2 아드레날린수용체 효능제, 예컨대 알부테롤 (살부타몰), 메타프로테레놀, 테르부탈린, 살메테롤, 페노테롤, 프로카테롤, 및 특히 포르모테롤 및 그의 제약상 허용되는 염, 및 WO 0075114 (상기 문헌은 본원에 포함됨)의 화학식 I의 화합물 (유리 형태, 염 형태 또는 용매화물 형태), 바람직하게는 상기 문헌의 실시예의 화합물, 특히 화학식의 화합물 및 그의 제약상 허용되는 염, 뿐만 아니라 WO 04/16601의 화학식 I의 화합물 (유리 형태, 염 형태 또는 용매화물 형태), 및 또한 WO 04/033412의 화합물을 포함한다.
적합한 기관지확장 약물은 항콜린성 또는 항무스카린성 화합물, 특히 이프라트로퓸 브로마이드, 옥시트로퓸 브로마이드, 티오트로퓸 염 및 CHF 4226 (키에시(Chiesi)), 및 글리코피롤레이트, 뿐만 아니라 WO 01/04118, WO 02/51841, WO 02/53564, WO 03/00840, WO 03/87094, WO 04/05285, WO 02/00652, WO 03/53966, EP 424021, US 5171744, US 3714357, WO 03/33495 및 WO 04/018422에 개시된 것들을 포함한다.
적합한 케모카인 수용체는, 예를 들어 CCR-1, CCR-2, CCR-3, CCR-4, CCR-5, CCR-6, CCR-7, CCR-8, CCR-9 및 CCR10, CXCR1, CXCR2, CXCR3, CXCR4, CXCR5, 특히 CCR-5 길항제, 예컨대 쉐링-플라우 길항제 SC-351125, SCH-55700 및 SCH-D, 다케다(Takeda) 길항제, 예컨대 N-[[4-[[[6,7-디히드로-2-(4-메틸페닐)-5H-벤조-시클로헵텐-8-일]카르보닐]아미노]페닐]-메틸]테트라히드로-N,N-디메틸-2H-피란-4-아미늄 클로라이드 (TAK-770), 및 US 6166037 (특히 청구항 18 및 19), WO 00/66558 (특히 청구항 8), WO 00/66559 (특히 청구항 9), WO 04/018425 및 WO 04/026873에 기재된 CCR-5 길항제를 포함한다.
적합한 항히스타민 약물 물질은 세티리진 히드로클로라이드, 아세트아미노펜, 클레마스틴 푸마레이트, 프로메타진, 로라티딘, 데슬로라티딘, 디펜히드라민 및 펙소페나딘 히드로클로라이드, 악티바스틴, 아스테미졸, 아젤라스틴, 에바스틴, 에피나스틴, 미졸라스틴 및 테페나딘, 뿐만 아니라 WO 03/099807, WO 04/026841 및 JP 2004107299에 개시된 것들을 포함한다.
가능한 조합을 위한 치료제는 특히 하나 이상의 항증식성, 세포증식억제 또는 세포독성 화합물, 예를 들어 폴리아민 생합성 억제제, 단백질 키나제 억제제, 특히 세린/트레오닌 단백질 키나제 억제제, 예컨대 단백질 키나제 C 억제제, 또는 티로신 단백질 키나제 억제제, 예컨대 EGF 수용체 티로신 키나제 억제제, 예를 들어 이레사®, VEGF 수용체 티로신 키나제 억제제, 예를 들어 PTK787 또는 아바스틴®, 리간드 VEGF에 대한 항체, 또는 PDGF 수용체 티로신 키나제 억제제, 예를 들어 STI571 (글리벡®), PI3K 억제제 (예컨대 BEZ235 (노파르티스)) 및 mToR 억제제, 예컨대 라파마이신, RAD001, 시토카인, 음성 성장 조절자, 예컨대 TGF-β 또는 IFN-β, 아로마타제 억제제, 예를 들어 레트로졸 (페마라(Femara)®) 또는 아나스트로졸, SH2 도메인과 인산화된 단백질의 상호작용 억제제, 항에스트로겐, 토포이소머라제 I 억제제, 예컨대 이리노테칸, 토포이소머라제 II 억제제, 미세소관 활성제, 예를 들어 파클리탁셀 또는 에포틸론, 알킬화제, 항증식성 항-대사물, 예컨대 겜시타빈 또는 카페시타빈, 플라틴 화합물, 예컨대 카르보플라틴 또는 시스-플라틴, 비스포스포네이트, 예를 들어 아레디아® 또는 조메타®, 및 예를 들어 HER2에 대한 모노클로날 항체, 예컨대 트라스투주맙을 포함하나 이에 제한되지 않는 군으로부터 선택된 하나의 또는 여러 작용제이다.
코드 번호, 일반명 또는 상표명으로 식별되는 활성제의 구조는 표준 일람인 "머크 인덱스(The Merck Index)"의 현행판, 또는 데이터베이스, 예를 들어 페이턴츠 인터내셔널(Patents International) (예컨대 IMS 월드 퍼블리케이션즈(IMS World Publications))로부터 알아낼 수 있다. 그의 상응하는 내용은 참고로 본원에 포함된다.
화학식 I의 화합물과 함께 사용될 수 있는 상기 언급된 화합물은 당업계, 예컨대 상기 인용된 문헌에 기재된 바와 같이 제조 및 투여될 수 있다.
본 발명의 조합 요법에서, 본 발명의 화합물 및 다른 치료제는 동일하거나 상이한 제조업체에 의해 제조되고/거나 제제화될 수 있다. 더욱이, 본 발명의 화합물 및 다른 치료제는 함께, (i) 의사로부터 조합 생성물로 배포되기 전에 (예를 들어, 본 발명의 화합물 및 다른 치료제를 포함하는 키트의 경우); (ii) 투여 직전에 의사에 의해 (또는 의사 지시 하에서); (iii) 예를 들어 본 발명의 화합물 및 다른 치료제의 순차 투여 동안에 환자 자신 내에서, 조합 요법으로 사용될 수 있다.
따라서, 본 발명은 c-Met에 의해 매개되는 질환 또는 상태를 치료하기 위한 화학식 I의 화합물의 용도를 제공하고, 여기서 의약은 또 다른 치료제와 함께 투여하기 위해 제조된다. 또한, 본 발명은 c-Met에 의해 매개된 질환 또는 상태를 치료하기 위한 또 다른 치료제의 용도를 제공하고, 여기서 의약은 화학식 I의 화합물과 함께 투여된다.
따라서, 추가 실시양태에서, 본 발명은 치료 유효량의 유리 형태 또는 제약상 허용되는 염 형태의 화학식 I의 화합물 및 제2 치료 활성제를 포함하는, 동시 또는 순차적 투여를 위한 조합물, 특히 제약 조성물에 관한 것이다. 추가의 치료제는 바람직하게는 항암제 및 항염증제로 이루어진 군으로부터 선택된다.
추가로, 본 발명은 c-Met 티로신 키나제에 반응하는 질환 또는 장애, 특히 증식성 장애 또는 질환, 특히 암의 치료를 필요로 하는 대상체, 특히 인간에게 (a) 화학식 I의 화합물, 및 (b) 하나 이상의 제약 활성제를 포함하는 유효량의 제약 작용제 조합물을 투여하는 것을 포함하는, c-Met 티로신 키나제에 반응하는 질환 또는 장애, 특히 증식성 장애 또는 질환, 특히 암의 치료 방법에 관한 것이다.
추가로, 본 발명은 c-Met 티로신 키나제에 반응하는 질환 또는 장애, 특히 증식성 장애 또는 질환, 특히 암의 치료를 위한, (a) 화학식 I의 화합물, 및 (b) 하나 이상의 제약 활성제를 포함하는 제약 작용제 조합물의 용도에 관한 것이다.
추가로, 본 발명은 c-Met 티로신 키나제에 반응하는 질환 또는 장애, 특히 증식성 장애 또는 질환, 특히 암 치료용 의약의 제조를 위한, (a) 화학식 I의 화합물, 및 (b) 하나 이상의 제약 활성제를 포함하는 제약 작용제 조합물의 용도에 관한 것이다.
추가로, 본 발명은 (a) 화학식 I의 화합물 및 (b) 제약 활성제 (여기서, 하나 이상의 제약 활성제가 항암 치료제임), 및 (c) 제약상 허용되는 담체를 포함하는 제약 조성물에 관한 것이다.
추가로, 본 발명은 (a) 화학식 I의 화합물, 및 (b) 동시, 공동, 개별 또는 순차적 사용을 위한 제약 활성제의 제약 제제 (여기서, 하나 이상의 제약 활성제가 항암 치료제임)를 포함하는 상업용 패키지 또는 제품에 관한 것이다.
또한, 바람직하게는 조합물 구성성분-약물이, 치료 효능에 대한 상호 효과가 발견될 수 없을 정도로 긴 시간 간격으로 조합물 구성성분-약물을 독립적으로 사용할 때 발견되는 효과를 능가하는 연합 치료 효과 (상승작용 효과가 특히 바람직함)를 나타내도록, 순차적, 개별 및 동시 투여 중 둘 이상의 조합이 가능하다.
또한, 본 발명은 c-Met에 의해 매개되는 질환 또는 상태의 치료를 위한 화학식 I의 화합물의 용도를 제공하고, 여기서 환자는 이전에 (예를 들어 24시간 내에) 또 다른 치료제로 치료되었다. 또한, 본 발명은 c-Met에 의해 매개되는 질환 또는 상태의 치료를 위한 또 다른 치료제의 용도를 제공하고, 여기서 환자는 이전에 (예를 들어 24시간 내에) 화학식 I의 화합물로 치료되었다.
본원에 사용된 용어 "진행의 지연"은 최초 징후발현의 전단계 또는 초기 단계의 환자, 또는 치료할 질환이 재발된 환자에게 조합물을 투여하는 것을 의미하며, 여기서의 환자는 예를 들어 상응하는 질환의 예비 형태가 진단된 환자이거나, 또는 예를 들어 의학적 처치를 받고 있는 상태의 환자이거나, 또는 상응하는 질환이 발병할 것으로 예상되는 상황으로 인한 상태의 환자이다.
용어 "연합 치료 활성" 또는 "연합 치료 효과"는 해당 화합물이 바람직하게는 치료할 온혈 동물, 특히 인간에서 여전히 (바람직하게는 상승작용) 상호작용 (연합 치료 효과)을 나타내도록 하는 시간 간격으로 별개로 (장기적인 교체적 방식, 특히 순서-특이적 방식으로) 제공될 수 있다는 것을 의미한다. 특히, 연합 치료 효과는 2가지 화합물 모두가 적어도 특정 시간 간격 동안에 치료할 인간의 혈액 중에 존재한다는 것을 보여주는 혈중 농도를 측정하여 결정될 수 있다.
용어 "제약상 유효한"은 바람직하게는 치료량에 관한 것이거나, 또는 보다 광범위한 의미에서는 본원에 개시된 바와 같은 질환 또는 장애의 진행에 대해 예방적으로도 유효한 양에 관한 것이다.
본원에 사용된 용어 "상업용 패키지" 또는 "제품"은 특히 상기 정의된 바와 같은 성분 (a)와 (b)가 독립적으로 투여될 수 있거나, 또는 상이한 양의 성분 (a)와 (b)를 수반하는 상이한 고정 조합물의 사용을 통해, 즉 동시에 또는 상이한 시점에서의 사용으로 투여될 수 있다는 점에서 "부분들의 키트"로 규정된다. 또한, 이러한 용어는 증식성 질환의 진행 지연 또는 치료에서 동시, 순차적 (만성적으로 시차를 둔, 시간-특이적 순서로, 우선적으로) 또는 (덜 바람직하게는) 개별 사용을 위한 설명서와 함께 활성 성분으로서의 구성성분 (a) 및 (b)를 포함하는 (특히, 조합하는) 상업용 패키지를 포함한다. 부분들의 키트의 부분들은, 예를 들어 동시에 또는 장기 교대로 (즉, 상이한 시점에), 부분들의 키트의 어느 한 부분에 대해서 동일하거나 상이한 시간 간격으로 투여될 수 있다. 매우 바람직하게는, (표준 방법에 따라 결정될 수 있듯이) 부품의 조합된 사용에서 치료되는 질환에 대한 효과가 조합 파트너 (a) 및 (b) 중 어느 하나만을 사용함으로써 수득되는 효과에 비해 크도록 시간 간격이 선택된다. 조합 제제로 투여되는 조합 상대 (a) 대 조합 상대 (b)의 총량의 비율은, 예를 들어 치료할 환자 소-집단의 요구 또는 환자의 특정 질환, 연령, 성별, 체중 등에 기인할 수 있는 단일 환자의 상이한 요구에 대처하기 위하여 달라질 수 있다. 바람직하게는, 하나 이상의 유리한 효과, 예를 들어 조합 파트너 (a) 및 (b)의 효과를 상호 증진시키는 효과, 특히 상가 효과 초과의 효과가 존재하며, 이는 조합하지 않고 개별 약물로 치료한 경우에 허용되는 것보다 낮은 투여량의 각각의 조합된 약물에 의해 달성될 수 있어서, 조합 파트너 (성분) (a) 및 (b)의 한쪽 또는 양쪽의 비-효과적인 투여량에서 추가의 유리한 효과, 예를 들어 적은 부작용 또는 조합된 치료 효과를 일으키며, 매우 바람직하게는 조합 파트너 (a) 및 (b)의 강한 상승작용을 일으킨다.
성분 (a) 및 (b)의 조합물 및 상업적 패키지를 사용하는 경우 둘다에서 동시, 순차적 및 별개 사용의 임의의 조합이 또한 가능하며, 이는 성분 (a) 및 (b)를 하나의 시점에서 동시 투여한 후에 이후의 시점에서는 더 낮은 숙주 독성을 갖는 1가지 성분만을 장기적으로, 예를 들어 3주 내지 4주 넘게 매일 투여한 후, 더 이후의 시점에는 다른 성분 또는 2가지 성분의 조합물을 투여하는 (이후에는 최적의 효과가 달성되도록 약물 조합물 처리 방침을 변경함) 것과 같은 방식임을 의미한다.
본 발명의 또 다른 실시양태에서, 화학식 I의 화합물 및 그의 중간체의 제조 방법이 제공된다. 화학식 I의 화합물은 공지의 방법 (본 발명의 신규 화합물에는 아직까지 적용된 바 없으므로, 신규 방법을 구성함)으로 제조될 수 있다. 하기 반응식은 화학식 I의 화합물을 수득하기 위한 합성 전략의 일반적인 개요를 제공한다. 본원에 기재된 모든 방법은 본원에서 달리 나타내지 않는 한 또는 문맥에 의해 명백히 모순되지 않는 한, 임의의 적합한 순서로 수행될 수 있다. 본원에 제공된 임의의 모든 예 또는 예시용 어휘 (예를 들어, "예컨대")의 사용은 본 발명을 보다 잘 설명하기 위한 의도일 뿐이며 청구되는 본 발명의 범주를 제한하지는 않는다.
따라서, 본 발명은 본원에 개시된 바와 같은 하나 이상의 반응 단계를 포함하는 화학식 I의 화합물 및 그의 중간체의 제조 방법 (제조를 위한 방법)에 대한 추가 측면에 관한 것이다.
<반응식 1>
Z1은 Cl, Br 및 I로부터 선택된다.
반응식 2는 IIA, IIB 및 IIC를 통해 화학식 IA, IB, IC의 바람직한 화합물을 수득하기 위한 합성 전략에 대한 세부사항을 제공한다.
<반응식 2>
Z1 및 Z2는 Cl, Br 및 I로부터 독립적으로 선택된다.
반응식 3은 IID를 통해 화학식 ID의 바람직한 화합물을 수득하기 위한 합성 전략에 대한 세부사항을 제공한다.
<반응식 3>
Z1은 Cl, Br 및 I로부터 선택된다.
반응식 4는 IIE를 통해 화학식 IE의 바람직한 화합물을 수득하기 위한 합성 전략에 대한 세부사항을 제공한다.
<반응식 4>
Z1은 Cl, Br 및 I로부터 선택된다.
반응식 5는 IIF를 통해 화학식 IF의 바람직한 화합물을 수득하기 위한 합성 전략에 대한 세부사항을 제공한다.
<반응식 5>
Z1 및 Z2는 Cl, Br 및 I로부터 독립적으로 선택된다.
당업자에게 널리 공지된 방법을 사용하여 산화시킴으로써, SO/SO2 링커를 생성한다.
반응식 6은 IIG를 통해 화학식 IG의 바람직한 화합물을 수득하기 위한 합성 전략에 대한 세부사항을 제공한다.
<반응식 6>
반응식 7은 IIH를 통해 화학식 IH의 바람직한 화합물을 수득하기 위한 합성 전략에 대한 대안적 세부사항을 제공한다.
<반응식 7>
반응식 8은 IIK를 통해 화학식 IK의 바람직한 화합물을 수득하기 위한 합성 전략에 대한 세부사항을 제공한다.
<반응식 8>
하기 실시예는 본 발명의 범위의 제한 없이 본 발명을 설명한다. 제공된 실시예에서, 온도는 ℃로 측정된다. 달리 나타내지 않는 한, 반응은 실온에서 수행된다. 추가로, 달리 나타내지 않는 한, 분석용 HPLC 조건은 하기와 같다:
방법 A:
유량은 메탄올 및 물 (0.5% 아세트산 함유)의 0.5 mL/분이다.
0 - 4.0분: 10% → 90%의 메탄올
4.0 - 6.0분: 90%의 메탄올
칼럼: GP C18 3 μm 4.6 x 30 mm (세팍스(Sepax)).
오븐 온도: 30℃
방법 B:
유량은 메탄올 및 물 (0.5% 아세트산 함유)의 1.2 mL/분이다.
0 - 2.0분: 10% → 90%의 메탄올
2.0 - 3.0분: 90%의 메탄올
칼럼: GP C18 3 μm 4.6 x 30 mm (세팍스).
오븐 온도: 30℃
방법 C:
유량은 메탄올 및 물 (0.5% 아세트산 함유)의 0.5 mL/분이다.
0 - 3.0분: 60% → 90%의 메탄올
3.0 - 5.0분: 90%의 메탄올
칼럼: GP C18 3 μm 4.6 x 30 mm (세팍스).
오븐 온도: 30℃
방법 D:
유량은 메탄올 및 물 (0.5% 아세트산 함유)의 0.5 mL/분이다.
0 - 3.0분: 10% → 50%의 메탄올
3.0 - 4.0분: 50%의 메탄올
칼럼: GP C18 3 μm 4.6 x 30 mm (세팍스).
오븐 온도: 30℃
방법 E:
유량은 메탄올 및 물 (0.5% 아세트산 함유)의 0.5 mL/분이다.
0 - 4.0분: 10% → 90%의 메탄올
4.0 - 8.0분: 90%의 메탄올
칼럼: GP C18 3 μm 4.6 x 30 mm (세팍스).
오븐 온도: 30℃
방법 F:
유량은 헥산/에탄올/디에틸아민 60/40/0.1 (v/v/v)의 1 mL/분이다.
칼럼: 키랄팩(CHIRALPAK) AD-H, 4.6 x 150 mm
오븐 온도: 35℃
방법 G:
유량은 헥산/이소프로판올/디에틸아민 70/30/0.1 (v/v/v)의 1 mL/분이다.
칼럼: 키랄팩 AD-H, 4.6 x 150 mm
오븐 온도: 35℃
하기 실시예에서, 하기 주어진 약어가 사용된다:
AcOH 아세트산
atm. 대기압
BINAP 2,2'-비스-디페닐포스파닐-[1,1']비나프탈레닐
Bn 벤질
Boc tert-부톡시카르보닐
DCM 디클로로메탄
DME 1,2-디메톡시에탄
Et2O 디에틸 에테르
EtOAc 또는 EA 에틸 아세테이트
EtOH 에탄올
DCC 디시클로헥실카르보디이미드
DME 디메틸 에틸렌 글리콜
DMF N,N-디메틸포름아미드
DMSO 디메틸 술폭시드
eq. 당량
h 시간
HATU 2-(1H-7-아자벤조트리아졸-1-일)-1,1,3,3-테트라메틸우로늄 헥사플루오로포스페이트
HPLC 고성능 액체 크로마토그래피
HV 고진공
IBX 2-아이오독시벤조산
이솔루트(Isolute) 이솔루트® HM-N (인터내셔널 솔벤트 테크놀로지 리미티드(International Solvent Technology Ltd.), 영국)
LAH 수소화알루미늄리튬
LCMS 질량 분광법과 커플링된 액체 크로마토그래피
LDA 리튬 디이소프로필아미드
mL 밀리리터
min 분
MPLC 중압 액체 크로마토그래피
MS-ES 전기분무 질량 분광측정법
MW 마이크로웨이브
NBS N-브로모숙신이미드
n-BuLi n-부틸리튬
NMP N-메틸피롤리디논
PdCl2(dppf) 1,1-비스(디페닐포스피노)페로센디클로로팔라듐 (II)
Pd2(dba)3 트리스(디벤질리덴아세톤)디팔라듐 (0)
PdCl2(Ph3)2 디클로로비스(트리페닐포스핀)팔라듐 (II)
PL 폴리머랩스(PolymerLabs) (카트리지 공급업체)
RM 반응 혼합물
Rf TLC의 전개율
SPE 고체 상 추출
rt 실온
TBAF 테트라부틸암모늄 플루오라이드
TBME 메틸 tert-부틸 에테르
TFA 트리플루오로아세트산
THF 테트라히드로푸란
TLC 박층 크로마토그래피
tR 체류 시간
UV 자외선
중간체의 합성:
중간체 A
3-브로모-6-클로로이미다조[1,2-b]피리다진
아세토니트릴 (300 ml) 중 6-클로로이미다조[1,2-b]피리다진 (5 g, 32.6 mmol)의 용액에 1-브로모피롤리딘-2,5-디온 (6.37 g, 35.8 mmol) 및 트리플루오로아세트산 (0.75 mL)을 첨가하였다. 생성된 용액을 실온에서 밤새 교반되도록 하였다. 용매를 감압 하에 제거하고, 잔류물을 EtOAc 중에 용해시키고, NaHCO3 용액, 물 및 염수로 세척하고, Na2SO4 상에서 건조시키고, 진공 하에 농축시켜 표제 화합물 7.2 g을 담황색 고체로서 92% 수율로 수득하였다.
중간체 B
1-(6-클로로-이미다조[1,2-b]피리다진-3-일)-에타논
N'-(6-클로로-피리다진-3-일)-N,N-디메틸-포름아미딘 (i)
3-아미노-6-클로로피리다진 (1.3 g, 10 mmol) 및 디메틸포름아미드 디메틸아세탈 (1.35 ml, 10.2 mmol)의 혼합물을 환류 하에 2시간 동안 가열하고, 진공 하에 농축시켜 갈색 고체를 수득하였다. EtOAc로 재결정화한 후, N'-(6-클로로-피리다진-3-일)-N,N-디메틸-포름아미딘 1.5 g을 81% 수율로 수득하였다.
1-(6-클로로-이미다조[1,2-b]피리다진-3-일)-에타논 (중간체 B)
DMF (60 mL) 중 N'-(6-클로로-피리다진-3-일)-N,N-디메틸-포름아미딘 (1.3 g, 7 mmol)의 용액에 NaI (1 g, 6.7 mmol) 및 클로로아세톤 (1 mL, 12.6 mmol)을 첨가하였다. 혼합물을 80℃에서 밤새 가열한 다음, 감압 하에 농축시켰다. 잔류물을 칼럼 크로마토그래피에 의해 정제하여 1-(6-클로로-이미다조[1,2-b]피리다진-3-일)-에타논 (0.7 g)을 51% 수율로 수득하였다.
중간체 C
6-클로로-이미다조[1,2-b]피리다진-3-카르브알데히드
(6-클로로-이미다조[1,2-b]피리다진-3-일)-메탄올 (i)
AcOH (50 mL) 중 6-클로로이미다조[1,2-b]피리다진 (1.5 g, 9.8 mmol)의 용액에 NaOAc (1.4 g, 17.1 mmol) 및 파라포름알데히드 (1.5 g)를 첨가하였다. 혼합물을 환류 하에 밤새 가열한 다음, 감압 하에 농축시켰다. 잔류물을 pH = 12로 염기성화시켰다. 이어서, 혼합물을 여과하고, 고체를 EtOH로 세척하여 (6-클로로-이미다조[1,2-b]피리다진-3-일)-메탄올 (1.3 g)을 72% 수율로 수득하였다.
6-클로로-이미다조[1,2-b]피리다진-3-카르브알데히드 (중간체 C)
DCM (50 mL) 중 (6-클로로-이미다조[1,2-b]피리다진-3-일)-메탄올 (1.3 g, 7.1 mmol)의 용액에 활성 MnO2 (3 g, 34.5 mmol)를 첨가하였다. 혼합물을 실온에서 밤새 교반한 다음, 여과하였다. 여과물을 진공 하에 농축시키고, 잔류물을 EtOAc로 세척하여 6-클로로-이미다조[1,2-b]피리다진-3-카르브알데히드 (0.7 g)를 54% 수율로 수득하였다.
중간체 D
퀴놀린-6-일메탄아민
퀴놀린-6-일메탄올 (i)
THF (80 mL) 중 메틸 퀴놀린-6-카르복실레이트 (14 g, 74.8 mmol)의 용액에 LiAlH4 (2.84 g, 74.8 mmol)를 조금씩 첨가하였다. 이어서, 물 (2.84 mL) 및 NaOH (10%, 4.26 mL)를 적가하여 과량의 환원제를 켄칭하였다. 추가로 20분 동안 교반한 후, 에테르를 첨가하고, 생성된 혼합물을 셀라이트를 통해 여과하였다. 여과물을 잔류물로 농축시키고, 이를 실리카 겔에 의해 헥산:EtOAc를 사용하여 정제함으로써 퀴놀린-6-일메탄올 (7.6 g)을 64% 수율로 수득하였다.
2-(퀴놀린-6-일메틸)이소인돌린-1,3-디온 (ii)
0℃에서 THF (70 mL) 중 이소인돌린-1,3-디온 (6.47 g, 44.0 mmol) 및 트리페닐포스핀 (11.53 g, 44.0 mmol)의 용액에 THF (30 mL) 중 퀴놀린-6-일메탄올 (7 g, 44.0 mmol)의 용액 및 (E)-디이소프로필 디아젠-1,2-디카르복실레이트 (8.89 g, 44.0 mmol)를 30분의 기간에 걸쳐 적가하였다. 이어서, 혼합물을 30℃로 20시간 동안 가열하였다. 반응물을 실온으로 냉각시키고, 진공 하에 농축시켰다. 생성된 잔류물을 아날로직스(Analogix) 실리카 겔에 의해 헥산:EtOAc 구배를 사용하여 정제함으로써 2-(퀴놀린-6-일메틸)이소인돌린-1,3-디온 (12.04 g)을 95% 수율로 수득하였다.
퀴놀린-6-일메탄아민 (중간체 D)
MeOH (100 mL) 중 2-(퀴놀린-6-일메틸)이소인돌린-1,3-디온 (20 g, 69.4 mmol)의 용액에 히드라진 수화물 (3.47 g, 69.4 mmol)을 첨가하였다. 용액을 3시간 동안 가열 환류시킨 다음, 실온으로 냉각시키고, 셀라이트를 통해 여과하였다. 여과물을 진공 하에 농축시키고, EtOAc를 첨가하여 잔류물을 희석하고, 여과하고, 진공 하에 농축시켜 6-브로모-N2-(퀴놀린-6-일메틸)피라진-2,3-디아민 (5 g)을 41% 수율로 수득하였다.
중간체 E 및 F
7-플루오로-퀴놀린-6-카르브알데히드 및 7-(7-플루오로-퀴놀린-6-일)-메틸아민
6-브로모-7-플루오로 퀴놀린 (i)
진한 황산 (290 mL) 중 4-브로모-3-플루오로-페닐아민 (100 g, 526 mmol)의 현탁액에 글리세롤 (220 g, 2.39 mol, 4.5 당량)에 이어서 황산제1철 (30 g, 0.2 당량)을 첨가하였다. 반응 혼합물을 130℃에서 14시간 동안 가열하고, 실온으로 냉각시키고, 빙수에 부었다. 용액을 포화 수성 수산화암모늄을 사용하여 pH 8로 중화시키고, DCM (2 L x 3)으로 추출하였다. 합한 유기 층을 염수 (1 L x 3)로 세척하고, 황산나트륨 상에서 건조시키고, 감압 하에 농축시켜 조 생성물을 갈색 고체로서 수득하였으며, 이를 칼럼 크로마토그래피 (석유:에틸 아세테이트=10:1)에 의해 정제하여 6-브로모-7-플루오로 퀴놀린을 백색 고체 (45 g, 39%)로서 수득하였다.
7-플루오로-퀴놀린-6-카르브알데히드 (중간체 E)
아세토니트릴 (30 mL) 중 Pd(PPh3)4 (1.27 g, 1.1 mmol) 및 포름산나트륨 (13.8 g, 132 mmol, 6 당량)의 현탁액에 DMSO (30 mL) 중 6-브로모-7-플루오로 퀴놀린 (5 g, 22 mmol)의 용액을 첨가하였다. 반응 혼합물을 CO 분위기 (1 MPa) 하에 120℃에서 4시간 동안 가열하고, 실온으로 냉각시키고, 감압 하에 농축시켰다. 잔류물을 물 (100 mL)과 에틸 아세테이트 (150 mL) 사이에 분배하였다. 유기 층을 분리하고, 염수 (100 mL)로 세척하고, Na2SO4 상에서 건조시키고, 감압 하에 농축시켰다. 잔류물을 칼럼 크로마토그래피에 의해 석유:에틸 아세테이트=10:1 → 3:1로 용리하여 정제함으로써 표제 화합물을 백색 고체 (400 mg, 10.4%)로서 수득하였다.
7-(7-플루오로-퀴놀린-6-일)-메틸아민 (중간체 F)
7-플루오로-퀴놀린-6-카르브알데히드 (500 mg, 2.85 mmol)를 암모니아 용액 (MeOH 중 2 M, 50 mL) 중에 용해시켰다. 실온에서 3시간 동안 교반한 후, NaBH4 (108.0 mg, 2.85 mmol)를 조금씩 첨가하였다. 반응 혼합물을 밤새 교반하고, 빙조에서 물로 켄칭하였다. 메탄올을 감압 하에 제거한 다음, 잔류물을 물로 희석하고, 용액의 pH 값을 1N HCl 용액을 사용하여 약 8로 조정한 다음, DCM으로 3회 추출하였다. 합한 유기 층을 물로 세척하고, Na2SO4 상에서 건조시키고, 여과하고, 진공 하에 농축시켰다. 조 생성물을 크로마토그래피 (DCM:MeOH = 50:1)에 의해 정제하여 표제 화합물을 황색 고체 (250.0 mg, 49%)로서 수득하였다.
중간체 G
1-(7-플루오로퀴놀린-6-일)에탄아민
1-(7-플루오로퀴놀린-6-일)에탄올 (i)
0℃에서 THF (30 ml) 중 7-플루오로퀴놀린-6-카르브알데히드 (4.0 g, 22.84 mmol)의 용액에 메틸마그네슘 브로마이드 (THF 중 2.85M, 8 mL, 22.84 mmol)를 적가하였다. 용액을 2시간 동안 교반하고, NH4Cl을 첨가하여 반응물을 켄칭하였다. 생성된 혼합물을 EtOAc로 추출하고, 유기 층을 포화 NaHCO3 및 NH4Cl로 세척하고, Na2SO4 상에서 건조시키고, 여과하고, 농축시켜 조 생성물을 수득하였으며, 이를 아날로직스 겔 실리카에 의해 헥산:EtOAc를 사용하여 정제함으로써 1-(7-플루오로퀴놀린-6-일)에탄올 (i)을 수득하였다.
2-(1-(7-플루오로퀴놀린-6-일)에틸)이소인돌린-1,3-디온 (ii)
표제 화합물을 1-(7-플루오로퀴놀린-6-일)에탄올로부터 중간체 D의 합성과 유사하게 백색 고체로서 제조하였다.
1-(7-플루오로퀴놀린-6-일)에탄아민 (중간체 G)
표제 화합물을 2-(1-(7-플루오로퀴놀린-6-일)에틸)이소인돌린-1,3-디온으로부터 중간체 D의 합성과 유사하게 제조하였다.
중간체 H
5,7-디플루오로-퀴놀린-6-카르브알데히드
5,7-디플루오로-페닐아민 (10.0 g, 77.5 mmol)을 DMF (100 mL) 중에 용해시켰다. 이어서, NBS (13.9 g, 78.0 mmol)를 실온에서 조금씩 첨가하였다. 실온에서 밤새 교반한 후, 반응 혼합물을 Et2O로 희석하고, 염수로 세척하였다. 분리된 유기 상을 건조 (Na2SO4)시키고, 농축시켜 오일을 수득하였으며, 이를 칼럼 크로마토그래피에 의해 정제하여 4-브로모-3,5-디플루오로-페닐아민 (i) (12.9 g, 80.2%)을 수득하였다.
4-브로모-3,5-디플루오로-페닐아민 (i) (6.0 g, 28.8 mmol), 황산제1철 1.82 g, 글리세롤 8.6 mL, 니트로벤젠 1.79 mL 및 진한 황산 5.0 mL의 혼합물을 서서히 가열하였다. 첫 번째 격렬한 반응 후, 혼합물은 5시간 동안 비등하였다. 니트로벤젠을 진공 하에 증류에 의해 제거하였다. 수용액을 빙초산을 사용하여 산성화시키고, 암갈색 침전물이 분리되었고, 이를 플래쉬 크로마토그래피 (실리카 겔, 석유/에틸 아세테이트= 12/1)에 의해 정제하여 6-브로모-5,7-디플루오로퀴놀린 (ii)을 백색 고체 (3.5 g, 49.8%)로서 수득하였다.
-78℃에서 무수 THF (2200 mL) 중 6-브로모-5,7-디플루오로퀴놀린 (ii) (250 g, 1.02 mol)의 용액에 헥산 중 n-BuLi의 용액 (2.5 M, 408 ml, 1.02 mol)을 적가하였다. 생성된 혼합물을 -78℃에서 추가로 30분 동안 교반하였다. 이어서, 무수 THF (200 mL) 중 DMF (79 mL, 1.02 mol)의 용액을 온도를 -70℃ 미만으로 유지하면서 첨가하고, 혼합물을 동일한 온도에서 30분 동안 교반하였다. 반응 혼합물을 실온으로 천천히 가온하고, NH4Cl의 포화 수용액 (1000 mL) 및 물 (800 mL)로 희석하였다. 혼합물을 에틸 아세테이트로 2회 추출하고, 합한 유기 층을 물 및 염수로 세척하고, 무수 황산나트륨 상에서 건조시키고, 농축시켜 갈색 오일을 수득하였으며, 이를 실리카 겔 상에서 칼럼 크로마토그래피에 의해 석유 및 에틸 아세테이트 (10:1)로 용리하여 정제함으로써 5,7-디플루오로-퀴놀린-6-카르브알데히드 (중간체 H)를 황색 고체 (100 g, 50%)로서 수득하였다.
중간체 I
1-메틸-1H-인다졸-5-카르브알데히드
5-브로모-1H-인다졸 (i)
DME 100 mL 중 5-브로모-2-플루오로벤즈알데히드 (10.15 g, 50 mmol), MeONH2-HCl (4.07 g, 50 mmol) 및 K2CO3 (7.59 g, 55.0 mmol)의 현탁액을 40℃에서 5시간 동안 교반하였다. 혼합물을 여과하였다. 옥심 중간체를 함유하는 여과물을 진공 하에 농축시켜 잔류물 대략 50 mL를 수득하였다. 상기 진한 옥심 잔류물에 N2H4-H2O (50 mL, 1.03 mol)를 첨가하고, 혼합물을 밤새 환류시켰다. 반응이 끝난 후, 반응 혼합물을 진공 하에 농축시켰다. 잔류물을 물로 희석하고, EtOAc로 2회 추출하였다. 유기 층을 합하고, Na2SO4 상에서 건조시키고, 잔류물로 농축시키고, 이를 플래쉬 크로마토그래피 (헥산:EtOAc = 10:1)에 의해 정제하여 표제 화합물을 백색 고체 (6.02 g, 61.2%)로서 수득하였다.
5-브로모-1-메틸-1H-인다졸 (ii) 및 5-브로모-2-메틸-2H-인다졸 (iii)
0℃에서 THF 3 mL 중 5-브로모-1H-인다졸 (0.19 g, 0.94 mmol)의 용액에 NaH (0.04 g, 1.03 mmol)를 첨가하였다. 반응 용액을 상기 온도에서 1시간 동안 교반한 후, 메틸 아이오다이드 (0.09 mL, 1.41 mmol)를 0℃에서 첨가하였다. 반응물을 실온으로 천천히 가온되도록 하고, 2시간 동안 교반하고, 물로 켄칭하고, 진공 하에 농축시켰다. 잔류물을 물로 희석하고, DCM으로 2회 추출하였다. 유기 층을 합하고, Na2SO4 상에서 건조시키고, 농축시켰다. 조 생성물을 플래쉬 크로마토그래피 (헥산:EtOAc = 10:1)에 의해 정제하여 표제 화합물 ii (88.7 mg, 42.5%) 및 iii (60.9 mg, 29%)를 2가지 백색 고체로서 수득하였다.
1-메틸-1H-인다졸-5-카르브알데히드 (중간체 I)
톨루엔 30 mL 중 n-BuLi (7.33 mL, 11.73 mmol) 및 에틸마그네슘 브로마이드 (5.76 mL, 5.76 mmol)의 현탁액을 -30℃에서 30분 동안 교반한 다음, THF 5 mL 중 5-브로모-1-메틸-1H-인다졸 (2.25 g, 10.66 mmol)을 첨가하였다. -10℃에서 1시간 동안 교반한 후, 무수 DMF (4.95 mL, 64.0 mmol)를 -10℃에서 첨가하였다. 반응물을 실온으로 가온되도록 하고, 2시간 동안 교반하였다. 반응물을 1N HCl로 켄칭하고, 진공 하에 농축시켰다. 잔류물을 물로 희석하고, DCM으로 2회 추출하였다. 유기 층을 합하고, Na2SO4 상에서 건조시키고, 농축시켰다. 조 생성물을 플래쉬 크로마토그래피 (헥산:EtOAc = 10:1)에 의해 정제하여 표제 화합물을 백색 고체 (1.37 g, 76%)로서 수득하였다.
중간체 J
5-브로모-6-플루오로-1-메틸-1H-인다졸
DMF (20 ml) 중 5-브로모-6-플루오로-1H-인다졸 (4 g, 18.60 mmol)의 용액에 칼륨 2-메틸프로판-2-올레이트 (2.087 g, 18.60 mmol)를 첨가하였다. 생성된 혼합물을 40분 동안 교반하였다. CH3I (3.17 g, 22.32 mmol)를 적가하였다. 밤새 교반한 후, 반응 혼합물을 NH4Cl(수성)로 켄칭하고, EtOAc로 추출하고, NH4Cl(수성)로 세척하고, Na2SO4 상에서 건조시키고, 여과하고, 진공 하에 농축시켜 조 생성물을 수득하였다. 조 생성물을 실리카 겔 칼럼 크로마토그래피에 의해 헥산:EA 구배를 사용하여 정제함으로써 담황색 고체 5-브로모-6-플루오로-1-메틸-1H-인다졸 (1.86 g, 42%)을 수득하였다.
중간체 K
4,6-디플루오로-1-메틸-1H-인다졸
N-메틸-N'-[1-(2,4,6-트리플루오로-페닐)-메트-(E)-일리덴]-히드라진 (i)
무수 에탄올 20 ml 중 2,4,6-트리플루오로-벤즈알데히드 (3 g, 18.74 mmol) 및 메틸 히드라진 (물 중 40%, 2.6 ml, 18.74 mmol)의 용액을 실온에서 1시간 동안 교반하였다. 용매를 증발시켜 표제 화합물을 백색 고체로서 수득하였으며, 이를 후속 단계에 정제 없이 사용하였다 (3.95 g, 100%).
4,6-디플루오로-1-메틸-1H-인다졸 (중간체 K)
N-메틸-N'-[1-(2,4,6-트리플루오로-페닐)-메트-(E)-일리덴]-히드라진 (3.85 g, 20.46 mmol)을 210℃에서 2시간 동안 밀봉 튜브에서 가열하였다. 실온으로 냉각시킨 후, 흑색 잔류물을 DCM 중에 용해시키고, 플래쉬 크로마토그래피 (EtOAc: 헥산 10:90) 상에서 정제하여 표제 화합물을 담황색 결정 (1.926 g, 56%)으로서 수득하였다.
중간체 L
6-((6-클로로-[1,2,4]트리아졸로[4,3-b]피리다진-3-일)메틸)퀴놀린
3-클로로-6-히드라지닐피리다진 (i)
3,6-디클로로피리다진 (3 g, 20.14 mmol) 및 히드라진 모노히드라이드(1 g, 20.14 mmol)의 혼합물을 밀봉된 튜브에서 80℃로 5시간 동안 가열하였다. 용매를 증발시키고, 조 물질을 후속 단계에 정제 없이 사용하였다 (3.56 g, 100%).
N'-(6-클로로피리다진-3-일)-2-(퀴놀린-6-일)아세토히드라지드 (ii)
DCM 200 ml 중 3-클로로-6-히드라지닐피리다진 (3 g, 20.75 mmol) 및 2-(퀴놀린-6-일)아세트산 (4.27 g, 22.83 mmol)의 현탁액에 DCC (5.14 g, 24.90 mmol)를 첨가하였다. 용액을 실온에서 주말 동안 교반하였다. 디시클로헥실 우레아를 함유하는 백색 고체로서의 표제 화합물을 여과하고, 후속 단계에 추가 정제 없이 사용하였다 (8 g, 100%).
6-((6-클로로-[1,2,4]트리아졸로[4,3-b]피리다진-3-일)메틸)퀴놀린 (중간체 L)
아세트산 250 mL 중 N'-(6-클로로피리다진-3-일)-2-(퀴놀린-6-일)아세토히드라지드 (8 g 조 물질, 25.5 mmol)의 용액을 50℃에서 5시간 동안 가열하였다. 반응이 완결된 후, 용매를 증발시키고, 조 물질을 EtOAc 중에 용해시키고, 여과하였다. 고체는 주로 불순물인 디시클로헥실 우레아였고, 생성물을 EtOAc 중에 용해시켰다. 용매를 증발시켜 표제 화합물을 황색 고체 (4 g, 53%)로서 수득하였다.
중간체 M
6-[(6-클로로-[1,2,4]트리아졸로[4,3-b]피리다진-3-일)-디플루오로-메틸]-퀴놀
디플루오로-퀴놀린-6-일-아세트산 에틸 에스테르 (i)
아이오딘화나트륨 (4.32 g, 28.8 mmol), 아이오딘화구리 (I) (137 mg, 0.72 mmol), 6-브로모-퀴놀린 (3 g, 14.4 mmol), N,N'-디메틸-시클로헥산 (0.227 ml, 1.44 mmol) 및 디옥산을 마이크로웨이브 튜브 (25 mL)에 충전하였다. 튜브를 질소로 10분 동안 플러싱하고, 테플론 격막으로 밀봉하였다. 반응 혼합물을 110℃에서 15시간 동안 교반하였다. 이어서, 현탁액을 실온으로 냉각되도록 하고, 빙수에 붓고, DCM으로 추출하였다. 조 물질을 실리카 겔 칼럼에 의해 정제하여 6-아이오도-퀴놀린을 약간 녹색의 고체 (3.5 g, 92%)로서 수득하였다.
건조 DMSO 중 6-아이오도-퀴놀린 (i) (1.0 g, 4 mmol) 및 Cu (0) (559 mg, 8.8 mmol)의 현탁액에 브로모-디플루오로-아세트산 에틸 에스테르 (893 mg, 4.4 mmol)를 첨가하였다. 반응 혼합물을 55℃에서 N2 하에 15시간 동안 교반하였다. 혼합물을 K2CO3의 용액에 붓고, EtOAc로 추출하였다. 유기 층을 수집하고, MgSO4로 건조시켰다. 조 물질을 실리카 겔 칼럼에 의해 정제하여 디플루오로-퀴놀린-6-일-아세트산 에틸 에스테르를 적색 오일 (310 mg, 30%)로서 수득하였다.
디플루오로-퀴놀린-6-일-아세트산 히드라지드 (ii)
디플루오로-퀴놀린-6-일-아세트산 에틸 에스테르 (836 mg, 3.33 mmol)를 MeOH (13 ml) 중에 용해시켰다. 수화물 히드라진 (1.5 ml, 16.8 mmol)을 반응 혼합물에 첨가하였다. 혼합물을 45℃로 30분 동안 가열하고, 실온으로 냉각시키고, 농축시키고, DCM에 녹였다. 유기 층을 MgSO4 상에서 건조시키고, 여과하고, 진공 하에 농축시켜 조 생성물을 수득하였으며, 이를 실리카 겔 칼럼에 의해 정제하여 디플루오로-퀴놀린-6-일-아세트산 히드라지드를 밝은 오렌지색 고체 (400 mg, 51%)로서 수득하였다.
6-[(6-클로로-[1,2,4]트리아졸로[4,3-b]피리다진-3-일)-디플루오로-메틸]-퀴놀린 (중간체 M)
3,6-디클로로피리다진 (160 mg, 1.07 mmol) 및 디플루오로-퀴놀린-6-일-아세트산 히드라지드 (254 mg, 1.07 mmol)를 n-BuOH (20 mL)에 첨가하였다. 반응 혼합물을 130℃로 12시간 동안 가열하였다. 용매를 진공 하에 제거하였다. 조 물질을 K2CO3 및 EtOAc의 용액으로 추출하였다. 유기 층을 수집하고, 농축시켜 고체를 수득하였으며, 이를 실리카 겔 칼럼에 의해 정제하여 6-[(6-클로로-[1,2,4]트리아졸로[4,3-b]피리다진-3-일)-디플루오로-메틸]-퀴놀린을 흑색 고체 (190 mg, 53%)로서 수득하였다.
중간체 N
1-메틸히드라진카르복스아미드
물 (70 mL) 중 시안산나트륨 (13 g, 200 mmol)의 용액에 0℃에서 40% 수성 메틸히드라진 (24 mL, 210 mmol)을 첨가하고, 이어서 0℃에서 진한 염산 (18 mL)을 적가하였다. 생성된 혼합물을 실온에서 밤새 교반한 다음, 여과하였다. 여과물을 농축시키고, 동결건조기 상에서 건조시켜 조 2-메틸 세미카르바지드 14 g을 백색 고체로서 수득하였다. 상기 조 생성물을 플래쉬 크로마토그래피 (MeOH:DCM = 1:4)에 의해 정제하여 표제 화합물을 백색 고체로서 수득하였다.
중간체 O
N-메틸히드라진카르복스아미드
1,3-디메틸-1-니트로소우레아 (i)
물 (100 mL) 중 황산 (진한 황산 6.0 mL, 113 mmol)의 용액을 물 (150 mL) 중 1,3-디메틸우레아 (10 g, 113 mmol) 및 아질산나트륨 (8.61 g, 125 mmol)의 냉각된 용액에 1시간에 걸쳐 적가하였다. 백색 고체를 침전시켰다. 여과한 후, 여과물 케이크를 건조시키고, 사염화탄소로부터 재결정화하여 표제 화합물 7.8 g을 연황색 침상물 결정 고체로서 수득하였다.
N-메틸히드라진카르복스아미드 (중간체 O)
물 (10 mL) 중 1,3-디메틸-1-니트로소우레아 (1.0 g, 8.54 mmol)의 용액에 0℃에서 히드라진 1수화물 (2 mL, 64.3 mmol)을 첨가하였다. 반응 혼합물을 실온에서 밤새 교반하고, 물을 제거하였다. 잔류물을 동결건조기 상에서 건조시켜 표제 화합물 810 mg을 백색 고체로서 수득하였다.
중간체 P
1-에틸히드라진카르복스아미드
상기 표제 화합물을 중간체 N의 합성에 기재된 것과 동일한 절차를 이용하여 에틸히드라진을 사용하여 제조하였다.
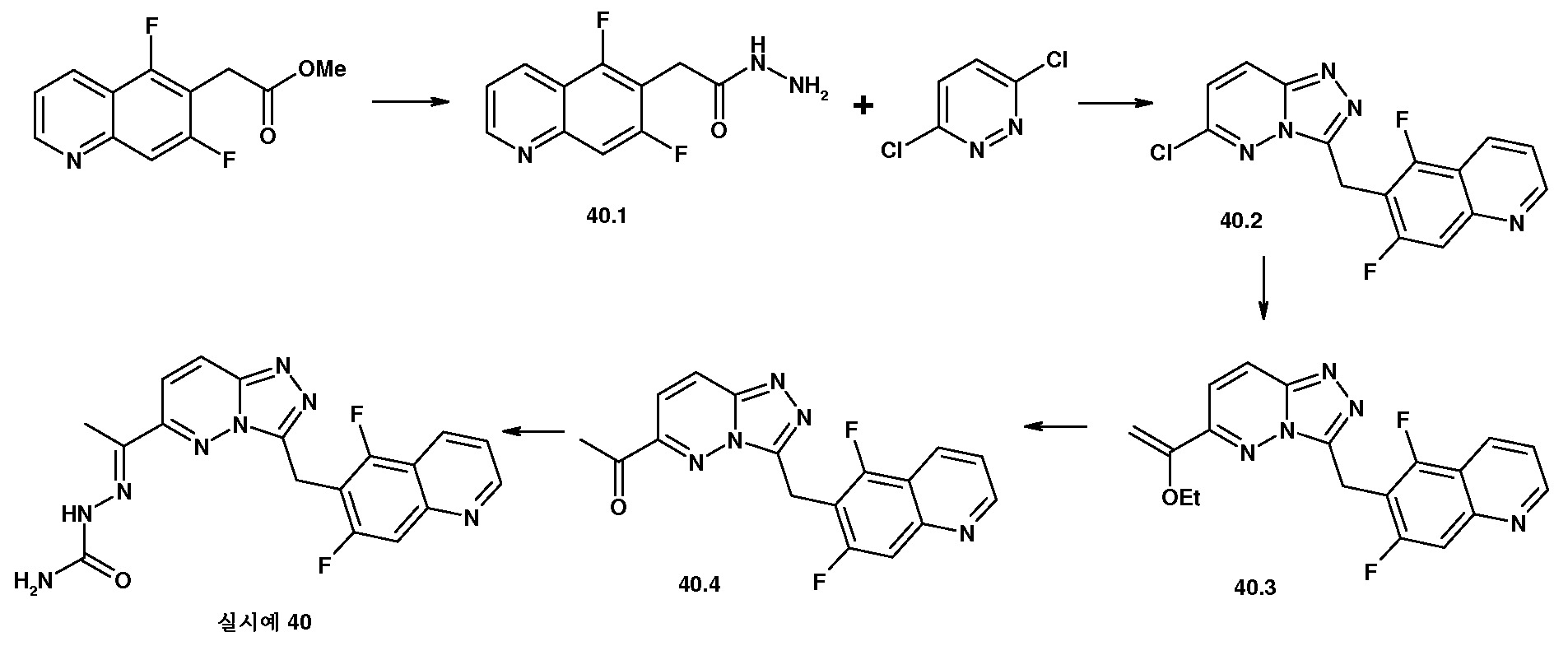
실시예 1
(E)-2-(1-(3-((7-플루오로퀴놀린-6-일)메틸)이미다조[1,2-b]피리다진-6-일)에틸리덴)-히드라진카르복스아미드
6-클로로-이미다조[1,2-b]피리다진-3-일)-(7-플루오로-퀴놀린-6-일)-메탄올 (1.1)
THF 160 ml 중 3-브로모-6-클로로-이미다조[1,2-b]피리다진 (13.27 g, 57.1 mmol)의 용액에 실온에서 EtMgBr (68.5 ml, 68.5 mmol) 용액을 첨가하였다. 반응 혼합물을 30분 동안 교반하고, THF 40 ml 중 7-플루오로-퀴놀린-6-카르브알데히드 (10 g, 57.1 mmol)의 현탁액을 첨가하였다. 생성된 혼합물을 실온에서 3시간 동안 교반하고, 물 400 ml로 켄칭하였다. 추가로 1시간 동안 교반한 후, 침전물을 여과에 의해 수집하고, EtOAc로 세척하고, 진공 오븐 상에서 밤새 건조시켜 표제 화합물 13 g (수율: 69%)을 수득하였다.
6-(6-클로로-이미다조[1,2-b]피리다진-3-일메틸)-7-플루오로-퀴놀린 (1.2)
아세트산 (80 mL) 중 6-클로로-이미다조[1,2-b]피리다진-3-일)-(7-플루오로-퀴놀린-6-일)-메탄올 (9.48 g, 28.8 mmol)의 용액에 포스핀산 (50% 수용액, 15.73 ml, 144 mmol) 및 아이오딘 (18.3 g, 72.1 mmol)을 첨가하였다. 생성된 용액을 110℃로 가열하고, 밤새 교반하였다. 용매를 감압 하에 제거하였다. 잔류물을 물로 희석하고, 그의 pH를 6N NaOH 용액을 사용하여 8 내지 10으로 조정하였다. 생성된 용액을 CH2Cl2로 추출하고, 합한 유기 층을 염수로 세척하고, 무수 Na2SO4 상에서 건조시키고, 진공 하에 농축시켰다. 잔류물을 칼럼 크로마토그래피 (CH2Cl2 중 5% → 10% MeOH)에 의해 정제하여 표제 화합물 5.8 g (수율: 64.3%)을 수득하였다.
1-[3-(7-플루오로-퀴놀린-6-일메틸)-이미다조[1,2-b]피리다진-6-일]-에타논 (1.3)
플라스크를 질소 하에 테트라키스-(트리페닐포스핀)-팔라듐 (1.7 g, 1.48 mmol)으로 충전하였다. DMF (150 mL) 중 6-(6-클로로-이미다조[1,2-b]피리다진-3-일메틸)-7-플루오로-퀴놀린 (5.8 g, 18.55 mmol)의 용액을 첨가하였다. 플라스크를 질소 기체로 3회 퍼징하고, 트리부틸-(1-에톡시-비닐)-스탄난 (6.59 ml, 19.47 mmol)을 첨가하였다. 온도를 100℃로 증가시키고, 밤새 교반하였다. 반응 혼합물을 실온으로 냉각시키고, 3N HCl 20 ml를 첨가하고, 혼합물을 추가로 2시간 동안 교반하였다. 물을 첨가한 다음, 생성물을 EtOAc로 추출하고, Na2SO4 상에서 건조시키고, 감압 하에 농축시켰다. 잔류물을 칼럼 크로마토그래피에 의해 정제하여 표제 화합물 4.8 g (수율: 79%)을 암황색 고체로서 수득하였다.
(E)-2-(1-(3-((7-플루오로퀴놀린-6-일)메틸)이미다조[1,2-b]피리다진-6-일)에틸리덴)-히드라진카르복스아미드 (실시예 1)
메탄올 (30 mL) 중 1-[3-(7-플루오로-퀴놀린-6-일메틸)-이미다조[1,2-b]피리다진-6-일]-에타논 (320 mg, 1 mmol)의 용액에 세미카르바지드 히드로클로라이드 (334 mg, 3.0 mmol)를 첨가하였다. 트리에틸 아민을 반응 혼합물에 적가하여 pH를 5 내지 6으로 조정하였다. 반응 혼합물을 실온에서 밤새 교반하였다. 침전물을 여과에 의해 수집하고, 진공 펌프 상에서 건조시켜 표제 화합물 250 mg (수율: 66%)을 백색 고체로서 수득하였다.
실시예 2
(E)-6-((6-(1-(2-에틸히드라조노)에틸)이미다조[1,2-b]피리다진-3-일)메틸)-7-플루오로퀴놀린
표제 화합물을 에틸 히드라진 및 1-[3-(7-플루오로-퀴놀린-6-일메틸)-이미다조[1,2-b]피리다진-6-일]-에타논으로부터 실시예 1의 합성과 유사하게 32% 수율로 제조하였다.
실시예 3
(E)-N'-(1-(3-((7-플루오로퀴놀린-6-일)메틸)이미다조[1,2-b]피리다진-6-일)에틸리덴)-아세토히드라지드
표제 화합물을 아세트산 히드라지드 및 1-[3-(7-플루오로-퀴놀린-6-일메틸)-이미다조[1,2-b]피리다진-6-일]-에타논으로부터 실시예 1의 합성과 유사하게 백색 고체로서 75% 수율로 제조하였다.
실시예 4
(E)-7-플루오로-6-((6-(1-(2-페닐히드라조노)에틸)이미다조[1,2-b]피리다진-3-일)메틸)-퀴놀린
표제 화합물을 페닐 히드라진 및 1-[3-(7-플루오로-퀴놀린-6-일메틸)-이미다조[1,2-b]피리다진-6-일]-에타논으로부터 실시예 1의 합성과 유사하게 황색 고체로서 32% 수율로 제조하였다.
실시예 5
(E)-7-플루오로-6-((6-(1-(2-(피리딘-2-일)히드라조노)에틸)이미다조[1,2-b]피리다진-3-일)메틸)퀴놀린
표제 화합물을 피리딘-2-일-히드라진 및 1-[3-(7-플루오로-퀴놀린-6-일메틸)-이미다조[1,2-b]피리다진-6-일]-에타논으로부터 실시예 1의 합성과 유사하게 백색 고체로서 48% 수율로 제조하였다.
실시예 6
(E)-2-(1-(3-((7-플루오로퀴놀린-6-일)메틸)이미다조[1,2-b]피리다진-6-일)에틸리덴)-N-페닐히드라진카르복스아미드
표제 화합물을 N-페닐히드라진 카르복스아미드 및 1-[3-(7-플루오로-퀴놀린-6-일메틸)-이미다조[1,2-b]피리다진-6-일]-에타논으로부터 실시예 1의 합성과 유사하게 36% 수율로 제조하였다.
실시예 7
(E)-N-(4-클로로페닐)-2-(1-(3-((7-플루오로퀴놀린-6-일)메틸)이미다조[1,2-b]피리다진-6-일)에틸리덴)히드라진카르복스아미드
표제 화합물을 N-p-클로로페닐히드라진 카르복스아미드 및 1-[3-(7-플루오로-퀴놀린-6-일메틸)-이미다조[1,2-b]피리다진-6-일]-에타논으로부터 실시예 1의 합성과 유사하게 제조하였다.
실시예 8
(E)-2-(1-(3-((7-플루오로퀴놀린-6-일)메틸)이미다조[1,2-b]피리다진-6-일)에틸리덴)-1-메틸히드라진카르복스아미드
표제 화합물을 1-메틸히드라진 카르복스아미드 및 1-[3-(7-플루오로-퀴놀린-6-일메틸)-이미다조[1,2-b]피리다진-6-일]-에타논으로부터 실시예 1의 합성과 유사하게 21% 수율로 제조하였다.
실시예 9
(E)-2-(1-(3-((7-플루오로퀴놀린-6-일)메틸)이미다조[1,2-b]피리다진-6-일)에틸리덴)-N,1-디메틸히드라진카르복스아미드
표제 화합물을 N,1-디메틸히드라진 카르복스아미드 및 1-[3-(7-플루오로-퀴놀린-6-일메틸)-이미다조[1,2-b]피리다진-6-일]-에타논으로부터 실시예 1의 합성과 유사하게 21% 수율로 제조하였다.
실시예 10
(E)-3-(1-(3-((7-플루오로퀴놀린-6-일)메틸)이미다조[1,2-b]피리다진-6-일)에틸리덴-아미노)옥사졸리딘-2-온
표제 화합물을 3-아미노옥사졸리딘-2-온 및 1-[3-(7-플루오로-퀴놀린-6-일메틸)-이미다조[1,2-b]피리다진-6-일]-에타논으로부터 실시예 1의 합성과 유사하게 24% 수율로 제조하였다.
실시예 11
(E)-1-(1-(3-((7-플루오로퀴놀린-6-일)메틸)이미다조[1,2-b]피리다진-6-일)에틸리덴-아미노)이미다졸리딘-2,4-디온
표제 화합물을 1-아미노이미다졸리딘-2,4-디온 히드로클로라이드 및 1-[3-(7-플루오로-퀴놀린-6-일메틸)-이미다조[1,2-b]피리다진-6-일]-에타논으로부터 실시예 1의 합성과 유사하게 39% 수율로 제조하였다.
실시예 12
(E)-2-(2-(1-(3-((7-플루오로퀴놀린-6-일)메틸)이미다조[1,2-b]피리다진-6-일)에틸리덴)-히드라지닐)벤조[d]옥사졸
표제 화합물을 2-히드라지닐벤조[d]옥사졸 및 1-[3-(7-플루오로-퀴놀린-6-일메틸)-이미다조[1,2-b]피리다진-6-일]-에타논으로부터 실시예 1의 합성과 유사하게 74% 수율로 제조하였다.
실시예 13
(E)-N'-(1-(3-((7-플루오로퀴놀린-6-일)메틸)이미다조[1,2-b]피리다진-6-일)에틸리덴)-메탄술포노히드라지드
표제 화합물을 메탄술포노히드라지드 및 1-[3-(7-플루오로-퀴놀린-6-일메틸)-이미다조[1,2-b]피리다진-6-일]-에타논으로부터 실시예 1의 합성과 유사하게 60% 수율로 제조하였다.
실시예 14
(E)-N-에틸-2-(1-(3-((7-플루오로퀴놀린-6-일)메틸)이미다조[1,2-b]피리다진-6-일)에틸리덴)히드라진카르보티오아미드
표제 화합물을 N-에틸히드라진 카르보티오아미드 및 1-[3-(7-플루오로-퀴놀린-6-일메틸)-이미다조[1,2-b]피리다진-6-일]-에타논으로부터 실시예 1의 합성과 유사하게 53% 수율로 제조하였다.
실시예 15
(E)-N-벤질-2-(1-(3-((7-플루오로퀴놀린-6-일)메틸)이미다조[1,2-b]피리다진-6-일)에틸리덴)히드라진카르보티오아미드
표제 화합물을 N-벤질히드라진 카르보티오아미드 및 1-[3-(7-플루오로-퀴놀린-6-일메틸)-이미다조[1,2-b]피리다진-6-일]-에타논으로부터 실시예 1의 합성과 유사하게 80% 수율로 제조하였다.
실시예 16
(E)-2-(1-(3-((7-플루오로퀴놀린-6-일)메틸)이미다조[1,2-b]피리다진-6-일)에틸리덴)-히드라진카르보티오아미드
표제 화합물을 히드라진 카르보티오아미드 히드로클로라이드 및 1-[3-(7-플루오로-퀴놀린-6-일메틸)-이미다조[1,2-b]피리다진-6-일]-에타논으로부터 실시예 1의 합성과 유사하게 백색 고체로서 60% 수율로 제조하였다.
실시예 17
(E)-2-(1-(3-((7-플루오로퀴놀린-6-일)메틸-d)이미다조[1,2-b]피리다진-6-일)에틸리덴)-히드라진카르복스아미드
6-(6-클로로-이미다조[1,2-b]피리다진-3-일메틸-d)-7-플루오로-퀴놀린 (17.1)
밀봉된 튜브에 (6-클로로-이미다조[1,2-b]피리다진-3-일)-(7-플루오로-퀴놀린-6-일)-메탄올 (150 mg, 0.46 mmol), 트리에틸 실란-d (0.5 mL), 트리플루오로아세트산-d (0.5 mL) 및 디클로로메탄 1.5 ml를 첨가하였다. 반응 혼합물을 40℃에서 5 일 동안 교반하였다. 이어서, 반응 혼합물을 물로 켄칭하고, NaHCO3 용액으로 중화시켰다. 생성물을 CH2Cl2로 추출하고, 합한 유기 층을 염수로 세척하고, Na2SO4 상에서 건조시키고, 감압 하에 농축시켰다. 잔류물을 칼럼 크로마토그래피에 의해 정제하여 표제 화합물을 수득하였다.
1-[3-(7-플루오로-퀴놀린-6-일메틸-d)-이미다조[1,2-b]피리다진-6-일]-에타논 (17.2)
플라스크에 질소 하에 테트라키스-(트리페닐포스핀)-팔라듐 (21 mg, 0.018 mmol)을 충전하였다. CH2Cl2 (5 mL) 중 6-(6-클로로-이미다조[1,2-b]피리다진-3-일메틸-d)-7-플루오로-퀴놀린의 용액을 첨가하였다. 계를 질소 기체로 3회 퍼징하고, 트리부틸-(1-에톡시-비닐)-스탄난 (0.063 mL, 0.19 mmol)을 첨가하였다. 온도를 100℃로 증가시키고, 밤새 교반하였다. 반응 혼합물을 실온으로 냉각시키고, 3N HCl 5 mL를 첨가하고, 혼합물을 추가로 2시간 동안 교반하였다. 물을 첨가하고, 생성물을 EtOAc로 추출하고, Na2SO4 상에서 건조시키고, 감압 하에 농축시켰다. 잔류물을 칼럼 크로마토그래피 (CH2Cl2 중 3% → 10% MeOH)에 의해 정제하여 표제 화합물을 황색 고체로서 수득하였다.
(E)-2-(1-(3-((7-플루오로퀴놀린-6-일)메틸-d)이미다조[1,2-b]피리다진-6-일)에틸리덴)-히드라진카르복스아미드 (실시예 17)
메탄올 (15 mL) 중 1-[3-(7-플루오로-퀴놀린-6-일메틸-d)-이미다조[1,2-b]피리다진-6-일]-에타논의 용액에 세미카르바지드 히드로클로라이드 (27 mg, 0.25 mmol)를 첨가하였다. 트리에틸 아민을 적가하여 pH를 5 내지 6으로 조정하였다. 반응 혼합물을 실온에서 밤새 교반하였다. 침전물을 여과에 의해 수집하고, 진공 펌프 상에서 건조시켜 표제 화합물을 백색 고체로서 수득하였다.
실시예 18
(E)-2-(1-(3-((7-플루오로퀴놀린-6-일)메틸-d2)이미다조[1,2-b]피리다진-6-일)에틸리덴)-히드라진카르복스아미드
(6-클로로이미다조[1,2-b]피리다진-3-일)(7-플루오로퀴놀린-6-일)메타논 (18.1)
아세톤 (200 mL) 중 (6-클로로-이미다조[1,2-b]피리다진-3-일)-(7-플루오로-퀴놀린-6-일)-메탄올 (1.8 g, 5.48 mmol)의 현탁액에 2-아이오독시벤조산 산 (8.52 g, 45%, 13.69 mmol)을 첨가하고, 반응 혼합물을 환류 하에 1일 동안 교반하였다. 용매를 감압 하에 제거하고, 잔류물을 물 200 mL 중에 용해시켰다. 용액을 3N NaOH 용액에 의해 염기성화시키고, 침전물을 수집하고, 물로 세척하고, 진공 오븐 상에서 건조시켜 표제 화합물 1.7 g (수율: 95%)을 회색 고체로서 수득하였다.
6-(6-클로로-이미다조[1,2-b]피리다진-3-일메틸-d2)-7-플루오로-퀴놀린 (18.2)
마이크로웨이브 튜브에 (6-클로로이미다조[1,2-b]피리다진-3-일)(7-플루오로퀴놀린-6-일)메타논 (90 mg, 0.28 mmol), 트리에틸 실란-d (0.7 mL), 트리플루오로아세트산-d (0.7 ml) 및 1,2-디클로로에탄 2 ml를 첨가하였다. 반응 혼합물을 120℃에서 5시간 동안 마이크로웨이브 반응기에서 교반하였다. 반응 혼합물을 물로 켄칭하고, NaHCO3 용액으로 중화시켰다. 생성된 혼합물을 CH2Cl2로 추출하고, 합한 유기 층을 염수로 세척하고, Na2SO4 상에서 건조시키고, 감압 하에 농축시켰다. 잔류물을 칼럼 크로마토그래피 (CH2Cl2 중 5% → 10% MeOH)에 의해 정제하여 표제 화합물 30 mg (수율: 20%)을 황색 고체로서 수득하였다.
1-[3-(7-플루오로-퀴놀린-6-일메틸-d2)-이미다조[1,2-b]피리다진-6-일]-에타논 (18.3)
플라스크에 질소 하에 테트라키스-(트리페닐포스핀)-팔라듐 (21 mg, 0.018 mmol)을 충전하였다. CH2Cl2 (10 mL) 중 6-(6-클로로-이미다조[1,2-b]피리다진-3-일메틸-d2)-7-플루오로-퀴놀린의 용액을 첨가하였다. 계를 질소 기체로 3회 퍼징한 다음, 트리부틸-(1-에톡시-비닐)-스탄난 (0.063 ml, 0.19 mmol)을 첨가하였다. 온도를 100℃로 증가시키고, 밤새 교반하였다. 이어서, 반응 혼합물을 실온으로 냉각시키고, 3N HCl 5 mL를 첨가하고, 혼합물을 추가로 2시간 동안 교반하였다. 물을 첨가한 다음, 혼합물을 EtOAc로 추출하고, Na2SO4 상에서 건조시키고, 감압 하에 농축시켰다. 잔류물을 칼럼 크로마토그래피 (CH2Cl2 중 3% → 10% MeOH)에 의해 정제하여 표제 화합물을 암황색 고체로서 수득하였다.
(E)-2-(1-(3-((7-플루오로퀴놀린-6-일)메틸-d2)이미다조[1,2-b]피리다진-6-일)에틸리덴)-히드라진카르복스아미드 (실시예 18)
메탄올 (10 mL) 중 1-[3-(7-플루오로-퀴놀린-6-일메틸-d2)-이미다조[1,2-b]피리다진-6-일]-에타논의 용액에 세미카르바지드 히드로클로라이드 (29 mg, 0.25 mmol)를 첨가하였다. 이어서, 트리에틸 아민을 적가하여 pH를 5 내지 6으로 조정하였다. 반응 혼합물을 실온에서 밤새 교반하였다. 침전물을 여과에 의해 수집하고, 진공 펌프 상에서 건조시켜 표제 화합물을 담황색 고체로서 수득하였다.
실시예 19
(E)-2-(1-(3-(퀴놀린-6-일메틸)이미다조[1,2-b]피리다진-6-일)에틸리덴)-히드라진-카르복스아미드
표제 화합물을 실시예 1의 합성과 유사하게 백색 고체로서 제조하였다.
실시예 20
(E)-2-(1-(3-((5,7-디플루오로퀴놀린-6-일)메틸)이미다조[1,2-b]피리다진-6-일)에틸리덴)-히드라진카르복스아미드
표제 화합물을 실시예 1의 합성과 유사하게 백색 고체로서 제조하였다.
실시예 21
(E)-2-(1-(3-((5,7-디플루오로퀴놀린-6-일)메틸)이미다조[1,2-b]피리다진-6-일)에틸리덴)-1-메틸히드라진카르복스아미드
표제 화합물을 실시예 8의 합성과 유사하게 제조하였다.
실시예 22
(E)-2-(1-(3-((7-플루오로퀴놀린-6-일)(히드록시)메틸)이미다조[1,2-b]피리다진-6-일)에틸리덴)히드라진카르복스아미드
1-(3-((7-플루오로퀴놀린-6-일)(히드록시)메틸)이미다조[1,2-b]피리다진-6-일)에타논 (22.1)
플라스크를 질소 하에 테트라키스-(트리페닐포스핀)-팔라듐 (176 mg, 0.15 mmol)으로 충전하였다. CH2Cl2 (20 mL) 중 (6-클로로이미다조[1,2-b]피리다진-3-일)(7-플루오로퀴놀린-6-일)메탄올 (500 mg, 1.52 mmol)의 용액을 첨가하였다. 계를 질소 기체로 3회 퍼징하고, 트리부틸-(1-에톡시-비닐)-스탄난 (0.54 ml, 1.59 mmol)을 첨가하였다. 온도를 100℃로 증가시키고, 밤새 교반하였다. 반응 혼합물을 실온으로 냉각시키고, 3N HCl을 첨가하고, 혼합물을 추가로 4시간 동안 교반하였다. 물을 첨가한 다음, 혼합물을 EtOAc로 추출하고, Na2SO4 상에서 건조시키고, 감압 하에 농축시켰다. 잔류물을 칼럼 크로마토그래피 (CH2Cl2 중 3% → 10% MeOH)에 의해 정제하여 표제 화합물 500 mg (수율: 88%)을 수득하였다.
(E)-2-(1-(3-((7-플루오로퀴놀린-6-일)(히드록시)메틸)이미다조[1,2-b]피리다진-6-일)에틸리덴)히드라진카르복스아미드 (실시예 22)
메탄올 (15 mL) 중 1-(3-((7-플루오로퀴놀린-6-일)(히드록시)메틸)이미다조[1,2-b]피리다진-6-일)에타논 (100 mg, 0.27 mmol)의 용액에 세미카르바지드 히드로클로라이드 (45 mg, 0.41 mmol)를 첨가하였다. 트리에틸 아민을 적가하여 pH를 5 내지 6으로 조정하였다. 반응 혼합물을 실온에서 밤새 교반하였다. 침전물을 여과에 의해 수집하고, 진공 펌프 상에서 건조시켜 표제 화합물 50 mg (수율: 47%)을 백색 고체로서 수득하였다.
실시예 23
(E)-2-(1-(3-(히드록시(퀴놀린-6-일)메틸)이미다조[1,2-b]피리다진-6-일)에틸리덴)-히드라진카르복스아미드
표제 화합물을 실시예 22의 합성과 유사하게 백색 고체로서 제조하였다.
실시예 24
(E)-2-(1-(3-((7-플루오로퀴놀린-6-일)(히드록시)메틸)이미다조[1,2-b]피리다진-6-일)에틸리덴)-1-메틸히드라진카르복스아미드
표제 화합물을 실시예 22의 합성과 유사하게 제조하였다.
실시예 25
(E)-2-(1-(3-((5,7-디플루오로퀴놀린-6-일)(히드록시)메틸)이미다조[1,2-b]피리다진-6-일)에틸리덴)히드라진카르복스아미드
표제 화합물을 실시예 22의 합성과 유사하게 백색 고체로서 제조하였다.
실시예 26
(E)-2-(1-(3-((5,7-디플루오로퀴놀린-6-일)(히드록시)메틸)이미다조[1,2-b]피리다진-6-일)에틸리덴)-1-메틸히드라진카르복스아미드
표제 화합물을 실시예 22의 합성과 유사하게 제조하였다.
실시예 27
(E)-2-(1-(3-(1-(7-플루오로퀴놀린-6-일)-1-히드록시에틸)이미다조[1,2-b]피리다진-6-일)에틸리덴)히드라진카르복스아미드
1-(6-클로로이미다조[1,2-b]피리다진-3-일)-1-(7-플루오로퀴놀린-6-일)에탄올 (27.1)
THF (80 mL) 중 (6-클로로이미다조[1,2-b]피리다진-3-일)(7-플루오로퀴놀린-6-일)메타논 (2.93 g, 6.73 mmol)의 용액에 MeMgI 용액 (4.48 mL, 13.45 mmol)을 첨가하였다. 생성된 용액을 환류 하에 5시간 동안 교반되도록 하였다. 이어서, 반응 혼합물을 실온으로 냉각시키고, 물로 켄칭하고, NH4Cl 용액으로 세척하고, CH2Cl2로 추출하였다. 합한 유기 층을 Na2SO4 상에서 건조시키고, 감압 하에 농축시켜 표제 화합물 2.2 g (수율: 95%)을 수득하였으며, 이를 후속 단계에 추가 정제 없이 사용하였다.
1-(3-(1-(7-플루오로퀴놀린-6-일)-1-히드록시에틸)이미다조[1,2-b]피리다진-6-일)에타논 (27.2)
플라스크에 질소 하에 테트라키스-(트리페닐포스핀)-팔라듐 (51 mg, 0.044 mmol)을 충전하였다. DMF (10 mL) 중 1-(6-클로로이미다조[1,2-b]피리다진-3-일)-1-(7-플루오로퀴놀린-6-일)에탄올 (150 mg, 0.44 mmol)의 용액을 첨가하였다. 계를 질소 기체로 3회 퍼징하고, 트리부틸-(1-에톡시-비닐)-스탄난 (0.16 ml, 0.46 mmol)을 첨가하였다. 온도를 100℃로 증가시키고, 밤새 교반하였다. 반응 혼합물을 실온으로 냉각시키고, 3N HCl을 첨가하고, 혼합물을 추가로 4시간 동안 교반하였다. 물을 첨가한 다음, 혼합물을 EtOAc로 추출하고, Na2SO4 상에서 건조시키고, 감압 하에 농축시켰다. 잔류물을 칼럼 크로마토그래피 (CH2Cl2 중 3% → 10% MeOH)에 의해 정제하여 표제 화합물 70 mg (수율: 41%)을 수득하였다.
(E)-2-(1-(3-(1-(7-플루오로퀴놀린-6-일)-1-히드록시에틸)이미다조[1,2-b]피리다진-6-일)에틸리덴)히드라진카르복스아미드 (실시예 27)
메탄올 (20 mL) 중 1-(3-(1-(7-플루오로퀴놀린-6-일)-1-히드록시에틸)이미다조[1,2-b]피리다진-6-일)에타논 (35 mg, 0.09 mmol)의 용액에 세미카르바지드 히드로클로라이드 (20 mg, 0.18 mmol)를 첨가하였다. 트리에틸 아민을 적가하여 pH를 5 내지 6으로 조정하였다. 반응 혼합물을 실온에서 밤새 교반하였다. 용액을 감압 하에 농축시키고, 잔류물을 칼럼 크로마토그래피 (CH2Cl2 중 3% → 50% MeOH)에 의해 정제하여 표제 화합물 23 mg (수율: 62%)을 수득하였다.
실시예 28
(E)-2-(1-(3-(1-히드록시-1-(퀴놀린-6-일)에틸)이미다조[1,2-b]피리다진-6-일)에틸리덴)히드라진카르복스아미드
표제 화합물을 실시예 27의 합성과 유사하게 황색 고체로서 제조하였다.
실시예 29
(E)-2-(1-(3-(1-(7-플루오로퀴놀린-6-일)에틸)이미다조[1,2-b]피리다진-6-일)에틸리덴)-히드라진카르복스아미드
6-(1-(6-클로로이미다조[1,2-b]피리다진-3-일)에틸)-7-플루오로퀴놀린 (29.1)
아세트산 (20 mL) 중 1-(6-클로로이미다조[1,2-b]피리다진-3-일)-1-(7-플루오로퀴놀린-6-일)에탄올 (420 mg, 1.10 mmol)의 용액에 포스핀산 (50% 수용액, 0.60 ml, 5.51 mmol) 및 아이오딘 (700 mg, 2.76 mmol)을 첨가하였다. 생성된 용액을 110℃에서 밤새 가열하고, 용매를 제거하였다. 잔류물을 물로 희석하고, pH를 6N NaOH 용액을 사용하여 8 내지 10으로 조정하였다. 이어서, 혼합물을 CH2Cl2로 추출하고, 염수로 세척하고, 무수 Na2SO4 상에서 건조시키고, 진공 하에 농축시켰다. 잔류물을 칼럼 크로마토그래피 (CH2Cl2 중 3% → 10% MeOH)에 의해 정제하여 표제 화합물 260 mg (수율: 72%)을 수득하였다.
1-(3-(1-(7-플루오로퀴놀린-6-일)에틸)이미다조[1,2-b]피리다진-6-일)에타논 (29.2)
플라스크에 질소 하에 테트라키스-(트리페닐포스핀)-팔라듐 (46 mg, 0.040 mmol)을 충전하였다. DMF (5 mL) 중 6-(1-(6-클로로이미다조[1,2-b]피리다진-3-일)에틸)-7-플루오로퀴놀린 (130 mg, 0.40 mmol)의 용액을 첨가하였다. 계를 질소 기체로 3회 퍼징하고, 트리부틸-(1-에톡시-비닐)-스탄난 (0.14 mL, 0.42 mmol)을 첨가하였다. 온도를 100℃로 증가시키고, 2시간 동안 교반하였다. 이어서, 반응 혼합물을 실온으로 냉각시키고, 3N HCl을 첨가하고, 혼합물을 추가로 4시간 동안 교반하였다. 물을 첨가한 다음, 혼합물을 EtOAc로 추출하고, Na2SO4 상에서 건조시키고, 감압 하에 농축시켰다. 잔류물을 칼럼 크로마토그래피 (CH2Cl2 중 3% → 10% MeOH)에 의해 정제하여 표제 화합물 120 mg (수율: 90)을 수득하였다.
(E)-2-(1-(3-(1-(7-플루오로퀴놀린-6-일)에틸)이미다조[1,2-b]피리다진-6-일)에틸리덴)-히드라진카르복스아미드 (실시예 29)
메탄올 (10 ml) 중 1-(3-(1-(7-플루오로퀴놀린-6-일)에틸)이미다조[1,2-b]피리다진-6-일)에타논 (60 mg, 0.18 mmol)의 용액에 세미카르바지드 히드로클로라이드 (40 mg, 0.36 mmol)를 첨가하였다. 트리에틸 아민을 적가하여 pH를 5 내지 6으로 조정하였다. 반응 혼합물을 실온에서 밤새 교반하였다. 침전물을 여과에 의해 수집하고, 진공 펌프 상에서 건조시켜 표제 화합물 38 mg (수율: 54%)을 백색 고체로서 수득하였다.
실시예 30 및 30*
(E)-2-(1-(3-(1-(퀴놀린-6-일)에틸)이미다조[1,2-b]피리다진-6-일)에틸리덴)히드라진-카르복스아미드
라세미 혼합물로서의 표제 화합물을 실시예 29의 합성과 유사하게 백색 고체로서 제조하였다.
키랄 분리하여 (방법 F) 거울상이성질체적으로 순수한 화합물 실시예 30 및 30*를 수득하였다.
실시예 31
(E)-2-(1-(3-(1-(4,6-디플루오로-1-메틸-1H-인다졸-5-일)에틸)이미다조[1,2-b]피리다진-6-일)에틸리덴)히드라진카르복스아미드
1-(6-클로로-이미다조[1,2-b]피리다진-3-일)-1-(4,6-디플루오로-1-메틸-1H-인다졸-5-일)-에탄올 (31.1)
-78℃에서 무수 THF 20 mL 중 4,6-디플루오로-1-메틸-1H-인다졸 (600 mg, 3.57 mmol)의 용액에 n-BuLi (헥산 중 1.6M 용액, 2.56 mL, 4.1 mmol)를 첨가하였다. 용액을 상기 온도에서 1시간 동안 교반한 다음, 무수 THF 10 mL 중 1-(6-클로로-이미다조[1,2-b]피리다진-3-일)-에타논 (698 mg, 3.57 mmol)의 용액을 -78℃에서 적가하였다. 생성된 용액을 상기 온도에서 3시간 동안 교반하고, 실온으로 천천히 가온하고, 밤새 교반하였다. 반응 혼합물을 물로 켄칭하고, EtOAc로 3회 추출하였다. 유기 층을 합하고, 염수로 세척하고, Na2SO4 상에서 건조시켰다. 조 생성물을 플래쉬 크로마토그래피 (CH2Cl2:MeOH 95:5)에 의해 정제하여 표제 화합물을 황색 오일 (530 mg, 41%)로서 수득하였다.
6-클로로-3-[1-(4,6-디플루오로-1-메틸-1H-인다졸-5-일)-에틸]-이미다조[1,2-b]피리다진 (31.2)
아세트산 20 mL 중 1-(6-클로로-이미다조[1,2-b]피리다진-3-일)-1-(4,6-디플루오로-1-메틸-1H-인다졸-5-일)-에탄올 (530 mg, 1.457 mmol), 아이오딘 (925 mg, 3.64 mmol) 및 포스핀산 (50%, 0.556 mL)의 용액을 110℃에서 2시간 동안 가열하였다. 용매를 증발시키고, 잔류물을 물 중에 용해시키고, 포화 NaHCO3 용액으로 중화시키고, CH2Cl2로 3회 추출하였다. 유기 층을 합하고, 염수로 세척하고, Na2SO4 상에서 건조시켰다. 이어서, 용매를 증발시키고, 조 물질을 플래쉬 크로마토그래피 (헥산:EtOAc 1:2) 상에서 정제하여 표제 화합물을 담황색 고체 (320 mg, 63.2%)로서 수득하였다.
3-[1-(4,6-디플루오로-1-메틸-1H-인다졸-5-일)-에틸]-6-(1-에톡시-비닐)-이미다조[1,2-b]피리다진 (31.3)
DMF 15 mL 중 6-클로로-3-[1-(4,6-디플루오로-1-메틸-1H-인다졸-5-일)-에틸]-이미다조[1,2-b]피리다진 (80 mg, 0.23 mmol) 및 트리부틸(1-에톡시비닐)스탄난 (0.234 mL, 0.69 mmol)의 용액을 N2로 30분 동안 퍼징한 다음, 테트라키스-(트리페닐포스핀)-팔라듐 (80 mg, 0.069 mmol)을 첨가하고, 용액을 95℃에서 밤새 가열하였다. 이어서, 반응물을 물로 켄칭하고, EtOAc로 3회 추출하였다. 유기 층을 합하고, KF 용액 및 염수로 세척하고, Na2SO4 상에서 건조시켰다. 용매를 증발시키고, 조 생성물 (80 mg, 90%)을 후속 단계에 추가 정제 없이 사용하였다.
1-(3-(1-(4,6-디플루오로-1-메틸-1H-인다졸-5-일)에틸)이미다조[1,2-b]피리다진-6-일)에타논 (31.4)
3N HCl 용액 2 mL를 MeOH 10 ml 중 3-[1-(4,6-디플루오로-1-메틸-1H-인다졸-5-일)-에틸]-6-(1-에톡시-비닐)-이미다조[1,2-b]피리다진의 용액에 첨가하였다. 반응 용액을 실온에서 3시간 동안 교반한 다음, 포화 NaHCO3 용액으로 중화시켰다. 용매를 증발시키고, 잔류물을 크로마토그래피 (CH2Cl2:MeOH 10:1) 상에서 정제하여 표제 화합물을 황색 고체 (30 mg, 41%)로서 수득하였다.
(E)-2-(1-(3-(1-(4,6-디플루오로-1-메틸-1H-인다졸-5-일)에틸)이미다조[1,2-b]피리다진-6-일)에틸리덴)히드라진카르복스아미드 (실시예 31)
MeOH 8 mL 중 1-(3-(1-(4,6-디플루오로-1-메틸-1H-인다졸-5-일)에틸)이미다조[1,2-b]피리다진-6-일)에타논 (22 mg, 0.062 mmol) 및 히드라진카르복스아미드 히드로클로라이드 (16 mg, 0.14 mmol)의 용액을 실온에서 밤새 교반하였다. 이어서, 용액을 포화 NaHCO3 용액으로 중화시키고, EtOAc로 추출하였다. 유기 층을 합하고, 염수로 세척하고, Na2SO4 상에서 건조시켰다. 용매를 증발시키고, 조 생성물을 HPLC (염기성, 0.05% NH4OH를 사용함) 상에서 정제하여 표제 화합물을 백색 고체 (10 mg, 35%)로서 수득하였다.
실시예 32
(E)-2-(1-(3-((4,6-디플루오로-1-메틸-1H-인다졸-5-일)메틸)이미다조[1,2-b]피리다진-6-일)에틸리덴)히드라진카르복스아미드
(6-클로로이미다조[1,2-b]피리다진-3-일)(4,6-디플루오로-1-메틸-1H-인다졸-5-일)메탄올 (32.1)
황색 고체로서의 표제 화합물 (60 mg, 0.172 mmol, 41%)을 화합물 31.1의 합성에 기재된 것과 동일한 절차를 이용하여 중간체 4,6-디플루오로-1-메틸-1H-인다졸 (70 mg, 0.416 mmol) 및 6-클로로이미다조[1,2-b]피리다진-3-카르브알데히드 (76 mg, 0.416 mmol)로부터 합성하였다.
6-클로로-3-((4,6-디플루오로-1-메틸-1H-인다졸-5-일)메틸)이미다조[1,2-b]피리다진 (32.2)
담황색 고체로서의 표제 화합물 (370 mg, 1.109 mmol, 78%)을 화합물 31.2의 합성에 기재된 것과 동일한 절차를 이용하여 (6-클로로이미다조[1,2-b]피리다진-3-일)(4,6-디플루오로-1-메틸-1H-인다졸-5-일)메탄올 (500 mg, 1.43 mmol), 아이오딘 (907 mg, 3.57 mmol) 및 포스핀산 (50%, 0.55 mL)으로부터 합성하였다.
1-(3-((4,6-디플루오로-1-메틸-1H-인다졸-5-일)메틸)이미다조[1,2-b]피리다진-6-일)에타논 (32.3)
담황색 고체로서의 표제 화합물 (350 mg, 0.769 mmol, 71.3%)을 화합물 31.4의 합성에 기재된 것과 동일한 절차를 이용하여 6-클로로-3-((4,6-디플루오로-1-메틸-1H-인다졸-5-일)메틸)이미다조[1,2-b]피리다진 (360 mg, 1.079 mmol), 트리부틸(1-에톡시비닐)스탄난 (1.095 ml, 3.24 mmol) 및 테트라키스-(트리페닐포스핀)-팔라듐 (374 mg, 0.324 mmol)으로부터 합성하였다.
(E)-2-(1-(3-((4,6-디플루오로-1-메틸-1H-인다졸-5-일)메틸)이미다조[1,2-b]피리다진-6-일)에틸리덴)히드라진카르복스아미드 (실시예 32)
MeOH 10 mL 중 1-(3-((4,6-디플루오로-1-메틸-1H-인다졸-5-일)메틸)이미다조[1,2-b]피리다진-6-일)에타논 (45 mg, 0.099 mmol, 75% 순도) 및 히드라진카르복스아미드 히드로클로라이드 (22 mg, 0.198 mmol)의 용액을 실온에서 밤새 교반하였다. 용매를 증발시키고, 잔류물을 소량의 MeOH 중에 용해시켰다. 침전물을 형성하고, 여과하여 표제 화합물을 백색 고체 (25 mg, 0.062 mmol)로서 수득하였다.
실시예 33
(E)-2-(1-(3-(디플루오로(퀴놀린-6-일)메틸)-[1,2,4]트리아졸로[4,3-b]피리다진-6-일)에틸리덴)-히드라진카르복스아미드
1-(3-(디플루오로(퀴놀린-6-일)메틸)-[1,2,4]트리아졸로[4,3-b]피리다진-6-일)에타논 (33.1)
담황색 오일로서의 표제 화합물 (180 mg, 30%, 80% 순도)을 화합물 31.4의 합성에 기재된 것과 동일한 절차를 이용하여 1,4-디옥산 중 6-((6-클로로-[1,2,4]트리아졸로[4,3-b]피리다진-3-일)디플루오로메틸)퀴놀린 (500 mg, 1.507 mmol), 트리부틸(1-에톡시비닐)스탄난 (2.55 ml, 7.54 mmol) 및 PdCl2(PPh3)2 (106 mg, 0.151 mmol)로부터 합성하였다.
(E)-2-(1-(3-(디플루오로(퀴놀린-6-일)메틸)-[1,2,4]트리아졸로[4,3-b]피리다진-6-일)에틸리덴)-히드라진카르복스아미드 (실시예 33)
MeOH 중 1-(3-(디플루오로(퀴놀린-6-일)메틸)-[1,2,4]트리아졸로[4,3-b]피리다진-6-일)에타논 (100 mg, 0.295 mmol) 및 히드라진카르복스아미드 히드로클로라이드 (44.3 mg, 0.589 mmol)의 용액을 실온에서 밤새 교반하였다. 용매를 증발시키고, 잔류물을 소량의 MeOH 중에 용해시켰다. 고체를 여과하고, 건조시켜 표제 화합물을 백색 고체 (90 mg, 75%)로서 수득하였다.
실시예 34
(E)-1-(1-(3-(디플루오로(퀴놀린-6-일)메틸)-[1,2,4]트리아졸로[4,3-b]피리다진-6-일)에틸리덴아미노)이미다졸리딘-2,4-디온
1-(3-(디플루오로(퀴놀린-6-일)메틸)-[1,2,4]트리아졸로[4,3-b]피리다진-6-일)에타논 (20 mg, 0.059 mmol) 및 1-아미노이미다졸리딘-2,4-디온 (13.6 mg, 0.12 mmol)의 용액을 MeOH 중에서 실온에서 주말에 걸쳐 교반하였다. 담황색 고체를 여과하여 표제 화합물 (6 mg, 0.014 mmol)을 수득하였다. 여과물을 HPLC (산성, 0.05% TFA를 사용함) 상에서 정제하여 표제 화합물을 TFA 염 (8 mg, 0.0145 mmol)으로서 수득하였다. 합한 수율은 48%였다.
실시예 35
(E)-1-(1-(3-(디플루오로(퀴놀린-6-일)메틸)-[1,2,4]트리아졸로[4,3-b]피리다진-6-일)에틸리덴아미노)이미다졸리딘-2-온
MeOH 중 1-(3-(디플루오로(퀴놀린-6-일)메틸)-[1,2,4]트리아졸로[4,3-b]피리다진-6-일)에타논 (20 mg, 0.059 mmol) 및 1-아미노이미다졸리딘-2-온 (12 mg, 0.12 mmol)의 용액을 실온에서 밤새 교반하였다. 용매를 증발시키고, 조 생성물을 플래쉬 크로마토그래피 (CH2Cl2:MeOH 9:1) 상에서 정제하여 표제 화합물을 백색 고체 (8 mg, 32%)로서 수득하였다.
실시예 36
(E)-N'-(1-(3-(디플루오로(퀴놀린-6-일)메틸)-[1,2,4]트리아졸로[4,3-b]피리다진-6-일)에틸리덴)-2-모르폴리노아세토히드라지드
1-(3-(디플루오로(퀴놀린-6-일)메틸)-[1,2,4]트리아졸로[4,3-b]피리다진-6-일)에타논 (25 mg, 0.074 mmol) 및 2-모르폴리노아세토히드라지드 (12 mg, 0.075 mmol)를 MeOH 중에 용해시키고, 반응 용액의 pH를 5로 조정하였다. 이어서, 용액을 45℃에서 3시간 동안 교반하였다. 용매를 증발시키고, 조 생성물을 HPLC (유리 염기로 중화됨) 상에서 정제하여 표제 화합물을 백색 고체 (18 mg, 50%)로서 수득하였다.
실시예 37
(E)-2-(1-(3-(퀴놀린-6-일메틸)-[1,2,4]트리아졸로[4,3-b]피리다진-6-일)에틸리덴)-히드라진카르복스아미드 (37)
1-(3-(퀴놀린-6-일메틸)-[1,2,4]트리아졸로[4,3-b]피리다진-6-일)에타논 (37.1)
담황색 고체로서의 표제 화합물 (500 mg, 51%)을 화합물 31.4의 합성에 기재된 것과 동일한 절차를 이용하여 DMF 중 6-((6-클로로-[1,2,4]트리아졸로[4,3-b]피리다진-3-일)메틸)퀴놀린 (950 mg, 3.21 mmol), 트리부틸(1-에톡시-비닐)스탄난 (1.142 ml, 3.37 mmol) 및 테트라키스-(트리페닐포스핀)-팔라듐 (186 mg, 0.161 mmol)으로부터 합성하였다.
(E)-2-(1-(3-(퀴놀린-6-일메틸)-[1,2,4]트리아졸로[4,3-b]피리다진-6-일)에틸리덴)-히드라진카르복스아미드 (실시예 37)
MeOH 중 1-(3-(퀴놀린-6-일메틸)-[1,2,4]트리아졸로[4,3-b]피리다진-6-일)에타논 (35 mg, 0.115 mmol) 및 히드라진카르복스아미드 히드로클로라이드 (17.32 mg, 0.231 mmol)의 용액을 실온에서 밤새 교반하였다. 고체를 여과하고, 건조시켜 표제 화합물을 담황색 고체 (35 mg, 84%)로서 수득하였다.
실시예 38
(E)-1-(1-(3-(퀴놀린-6-일메틸)-[1,2,4]트리아졸로[4,3-b]피리다진-6-일)에틸리덴아미노)-이미다졸리딘-2,4-디온
표제 화합물 (20 mg, 51%)을 실시예 37의 합성에 기재된 것과 동일한 절차를 이용하여 1-(3-(퀴놀린-6-일메틸)-[1,2,4]트리아졸로[4,3-b]피리다진-6-일)에타논 (30 mg, 0.1 mmol) 및 1-아미노이미다졸리딘-2,4-디온 (22.77 mg, 0.198 mmol)으로부터 합성하였다.
실시예 39
(E)-1-메틸-2-(1-(3-(퀴놀린-6-일메틸)-[1,2,4]트리아졸로[4,3-b]피리다진-6-일)에틸리덴)히드라진카르복스아미드
표제 화합물 (27 mg, 55%)을 37의 합성에 기재된 것과 동일한 절차를 이용하여 1-(3-(퀴놀린-6-일메틸)-[1,2,4]트리아졸로[4,3-b]피리다진-6-일)에타논 (40 mg, 0.132 mmol) 및 1-메틸히드라진-카르복스아미드 (23.5 mg, 0.264 mmol)로부터 합성하였다.
실시예 40
(E)-2-(1-(3-((5,7-디플루오로퀴놀린-6-일)메틸)-[1,2,4]트리아졸로[4,3-b]피리다진-6-일)에틸리덴)히드라진카르복스아미드
(5,7-디플루오로-퀴놀린-6-일)-아세트산 히드라지드 (40.1)
에탄올 (15 mL) 중 (5,7-디플루오로-퀴놀린-6-일)-아세트산 메틸 에스테르 (1.023 g, 4.32 mmol)의 용액에 히드라진 1수화물 (2 mL)을 첨가하고, 혼합물을 30℃에서 24시간 동안 교반하였다. 용매를 진공 하에 제거하여 표제 화합물 1.024 g을 백색 고체로서 수득하였으며, 이를 추가 정제 없이 사용하였다.
(5,7-디플루오로퀴놀린-6-일)-아세트산 메틸 에스테르를, WO2008/144767 p108 (중간체 2)에 기재된 방법을 이용한 후에 중간체 12, 단계 1에 대해 기재된 방법 (WO2008/144767 p114)에 의해 합성하였다.
6-(6-클로로-[1,2,4]트리아졸로[4,3-b]피리다진-3-일메틸)-5,7-디플루오로-퀴놀린 (40.2)
부탄-1-올 60 mL 중 (5,7-디플루오로-퀴놀린-6-일)-아세트산 히드라지드 (1.024 g, 4.32 mmol) 및 3,6-디클로로피리다진 (0.772 g, 5.18 mmol)의 용액을 밀봉된 튜브 중에서 135℃에서 16시간 동안 가열하였다. 용매를 진공 하에 제거하고, 잔류물을 플래쉬 크로마토그래피에 의해 정제하여 표제 화합물 842 mg을 회색 고체로서 수득하였다.
6-[6-(1-에톡시-비닐)-[1,2,4]트리아졸로[4,3-b]피리다진-3-일메틸]-5,7-디플루오로-퀴놀린 (40.3)
디옥산 (5 mL) 중 6-(6-클로로-[1,2,4]트리아졸로[4,3-b]피리다진-3-일메틸)-5,7-디플루오로-퀴놀린 (58 mg, 0.175 mmol)의 용액을 아르곤으로 1분 동안 퍼징하였다. 이어서, 트리부틸-(1-에톡시-비닐)스탄난 (0.2 mL, 0.53 mmol)을 첨가하고, 이어서 PdCl2(PPh3)2 (14.4 mg, 0.021 mmol)를 첨가하였다. 반응 혼합물을 아르곤으로 또 다른 0.5분 동안 퍼징하였다. 반응 혼합물을 80-85℃에서 4 h 동안 교반하였고; LC/MS는 반응이 완결되었음을 나타내었다. 반응 혼합물을 EtOAc로 희석하고, 수성 KF 용액 15 mL를 첨가하였다. 혼합물을 EtOAc로 추출하고, 무수 Na2SO4 상에서 건조시키고, 농축시켜 조 표제 화합물을 수득하였으며, 이를 추가 정제 없이 사용하였다.
1-[3-(5,7-디플루오로-퀴놀린-6-일메틸)-[1,2,4]트리아졸로[4,3-b]피리다진-6-일]에타논 (40.4)
수성 3N HCl (0.2 mL, 0.6 mmol)을 HOAc (2 mL) 중 6-[6-(1-에톡시-비닐)-[1,2,4]트리아졸로[4,3-b]피리다진-3-일메틸]-5,7-디플루오로-퀴놀린 (87 mg, 0.237 mmol)의 용액에 첨가하였다. 반응 혼합물을 40℃에서 6시간 동안 교반하였다. LC/MS는 반응이 완결되었음을 나타내었다. 용매를 진공 하에 제거하고, EtOAc 중에 용해시킨 잔류물을 중화시키고, EtOAc로 추출하였다. 유기 층을 건조시키고 농축시키고, 플래쉬 크로마토그래피로 정제하여 표제 화합물 40 mg을 연황색 고체로서 수득하였다.
(E)-2-(1-(3-((5,7-디플루오로퀴놀린-6-일)메틸)-[1,2,4]트리아졸로[4,3-b]피리다진-6-일)에틸리덴)히드라진카르복스아미드 (실시예 40)
메탄올 (3 mL) 중 1-[3-(5,7-디플루오로-퀴놀린-6-일메틸)-[1,2,4]트리아졸로[4,3-b]피리다진-6-일]-에타논 (38 mg, 0.112 mmol), 세미카르바지드 (37.5 mg, 0.336 mmol) 및 중탄산나트륨 (40 mg, 0.67 mmol)의 혼합물을 40℃에서 20시간 동안 교반하였다. LC/MS가 반응이 완결되었음을 나타내었고, 현탁액을 여과하였다. 여과물 케이크를 냉수 및 메탄올로 연속적으로 세척한 다음, 건조시켜 표제 화합물 36.3 mg (82% 수율)을 백색 고체로서 수득하였다.
실시예 41
(E)-2-(1-(3-((5,7-디플루오로퀴놀린-6-일)메틸)-[1,2,4]트리아졸로[4,3-b]피리다진-6-일)에틸리덴)-N,1-디메틸히드라진카르복스아미드
표제 화합물을 실시예 40의 합성에 기재된 것과 동일한 절차를 이용하여 제조하였다.
실시예 42
(E)-2-(1-(3-((5,7-디플루오로퀴놀린-6-일)메틸)-[1,2,4]트리아졸로[4,3-b]피리다진-6-일)에틸리덴)-1-메틸히드라진카르복스아미드
표제 화합물을 실시예 40의 합성에 기재된 것과 동일한 절차를 이용하여 제조하였다.
실시예 43
(E)-2-(1-(3-((5,7-디플루오로퀴놀린-6-일)메틸)-[1,2,4]트리아졸로[4,3-b]피리다진-6-일)에틸리덴)-1-에틸히드라진카르복스아미드
표제 화합물을 실시예 40의 합성에 기재된 것과 동일한 절차를 이용하여 제조하였다.
실시예 44
(E)-3-(1-(3-((5,7-디플루오로퀴놀린-6-일)메틸)-[1,2,4]트리아졸로[4,3-b]피리다진-6-일)에틸리덴아미노)옥사졸리딘-2-온
표제 화합물을 실시예 40의 합성에 기재된 것과 동일한 절차를 이용하여 3-아미노옥사졸리딘-2-온 및 1-(3-((5,7-디플루오로퀴놀린-6-일)메틸)-[1,2,4]트리아졸로[4,3-b]피리다진-6-일)에타논으로부터 백색 고체로서 86% 수율로 제조하였다.
실시예 45
(E)-2-(1-(3-((7-플루오로퀴놀린-6-일)메틸)-[1,2,4]트리아졸로[4,3-b]피리다진-6-일)에틸리덴)히드라진카르복스아미드
6-(6-클로로-[1,2,4]트리아졸로[4,3-b]피리다진-3-일메틸)-7-플루오로-퀴놀린 (45.1)
표제 화합물을 40.2의 합성에 기재된 것과 동일한 절차를 이용하여 제조하였다.
6-[6-(1-에톡시-비닐)-[1,2,4]트리아졸로[4,3-b]피리다진-3-일메틸]-7-플루오로-퀴놀린 (45.2)
표제 화합물을 40.3의 합성에 기재된 것과 동일한 절차를 이용하여 제조하였다.
1-[3-(7-플루오로-퀴놀린-6-일메틸)-[1,2,4]트리아졸로[4,3-b]피리다진-6-일]-에타논 (45.3)
표제 화합물을 40.4의 합성에 기재된 것과 동일한 절차를 이용하여 제조하였다.
(E)-2-(1-(3-((7-플루오로퀴놀린-6-일)메틸)-[1,2,4]트리아졸로[4,3-b]피리다진-6-일)에틸리덴)히드라진카르복스아미드 (실시예 45)
표제 화합물을 실시예 40의 합성에 기재된 것과 동일한 절차를 이용하여 제조하였다.
실시예 46 및 46*
(E)-2-(1-(3-(1-(퀴놀린-6-일)에틸)-[1,2,4]트리아졸로[4,3-b]피리다진-6-일)에틸리덴)-히드라진카르복스아미드
6-{1-[6-(1-에톡시-비닐)-[1,2,4]트리아졸로[4,3-b]피리다진-3-일]-에틸}-퀴놀린 (46.1)
표제 화합물을 40.3의 합성에 기재된 것과 동일한 절차를 이용하여 제조하였다.
1-[3-(1-퀴놀린-6-일-에틸)-[1,2,4]트리아졸로[4,3-b]피리다진-6-일]-에타논 (46.2)
표제 화합물을 40.4의 합성에 기재된 것과 동일한 절차를 이용하여 제조하였다.
(E)-2-(1-(3-(1-(퀴놀린-6-일)에틸)-[1,2,4]트리아졸로[4,3-b]피리다진-6-일)에틸리덴)-히드라진카르복스아미드 (실시예 46 및 46*)
라세미 혼합물로서의 표제 화합물을 실시예 40의 합성에 기재된 것과 동일한 절차를 이용하여 제조하였다.
키랄 분리하여 (방법 G) 거울상이성질체적으로 순수한 화합물 실시예 46 및 46*를 수득하였다.
실시예 47
(E)-2-(1-(3-(2-(퀴놀린-6-일)프로판-2-일)-[1,2,4]트리아졸로[4,3-b]피리다진-6-일)에틸리덴)히드라진카르복스아미드
2-메틸-2-퀴놀린-6-일-프로피온산 히드라지드 (47.1)
표제 화합물을 40.1의 합성에 기재된 것과 동일한 절차를 이용하여 제조하였다.
6-[1-(6-클로로-[1,2,4]트리아졸로[4,3-b]피리다진-3-일)-1-메틸-에틸]-퀴놀린 (47.2)
표제 화합물을 40.2의 합성에 기재된 것과 동일한 절차를 이용하여 제조하였다.
1-[3-(1-메틸-1-퀴놀린-6-일-에틸)-[1,2,4]트리아졸로[4,3-b]피리다진-6-일]-에타논 (47.3)
표제 화합물을 40.4의 합성에 기재된 것과 동일한 절차를 이용하여 제조하였다.
(E)-2-(1-(3-(2-(퀴놀린-6-일)프로판-2-일)-[1,2,4]트리아졸로[4,3-b]피리다진-6-일)에틸리덴)히드라진카르복스아미드 (실시예 47)
표제 화합물을 실시예 40의 합성에 기재된 것과 동일한 절차를 이용하여 제조하였다.
실시예 48
(E)-1-메틸-2-(1-(3-(2-(퀴놀린-6-일)프로판-2-일)-[1,2,4]트리아졸로[4,3-b]피리다진-6-일)에틸리덴)히드라진카르복스아미드
표제 화합물을 실시예 47의 합성에 기재된 것과 동일한 절차를 이용하여 제조하였다.
실시예 49
(E)-2-(1-(3-(1-(5,7-디플루오로퀴놀린-6-일)에틸)-[1,2,4]트리아졸로[4,3-b]피리다진-6-일)에틸리덴)히드라진카르복스아미드
2-(5,7-디플루오로-퀴놀린-6-일)-프로피온산 메틸 에스테르 (49.1)
-78℃에서 건조 THF (30 mL) 중 LDA (THF 중 1.2 M, 9.5 mL, 11.40 mmol)의 용액에 THF (20 mL) 중 (5,7-디플루오로퀴놀린-6-일)-아세트산 메틸 에스테르 (2.12 g, 9.50 mmol)의 용액을 적가하였다. 30분 후, MeI (0.9 mL, 14.25 mmol)를 적가하고, 반응 혼합물을 0℃로 천천히 상승하도록 하였다. 1시간 후, 반응물을 포화 수성 NaHCO3 용액에 의해 켄칭하고, EtOAc로 추출하였다. 유기 층을 염수로 세척하고, 무수 Na2SO4 상에서 건조시키고, 여과하고, 농축시키고, 플래쉬 크로마토그래피로 정제하여 표제 화합물 2.272 g을 연황색 고체로서 수득하였다.
2-(5,7-디플루오로-퀴놀린-6-일)-프로피온산 히드라지드 (49.2)
표제 화합물을 40.1의 합성에 기재된 것과 동일한 절차를 이용하여 제조하였다.
6-[1-(6-클로로-[1,2,4]트리아졸로[4,3-b]피리다진-3-일)-에틸]-5,7-디플루오로-퀴놀린 (49.3)
표제 화합물을 40.2의 합성에 기재된 것과 동일한 절차를 이용하여 제조하였다.
6-{1-[6-(1-에톡시-비닐)-[1,2,4]트리아졸로[4,3-b]피리다진-3-일]-에틸}-5,7-디플루오로-퀴놀린 (49.4)
표제 화합물을 40.3의 합성에 기재된 것과 동일한 절차를 이용하여 제조하였다.
1-{3-[1-(5,7-디플루오로-퀴놀린-6-일)-에틸]-[1,2,4]트리아졸로[4,3-b]피리다진-6-일}-에타논 (49.5)
표제 화합물을 40.4의 합성에 기재된 것과 동일한 절차를 이용하여 제조하였다.
(E)-2-(1-(3-(1-(5,7-디플루오로퀴놀린-6-일)에틸)-[1,2,4]트리아졸로[4,3-b]피리다진-6-일)에틸리덴)히드라진카르복스아미드 (실시예 49)
표제 화합물을 실시예 40의 합성에 기재된 것과 동일한 절차를 이용하여 제조하였다.
실시예 50
(E)-1-메틸-2-(1-(3-(1-(퀴놀린-6-일)시클로프로필)-[1,2,4]트리아졸로[4,3-b]피리다진-6-일)에틸리덴)히드라진카르복스아미드
1-퀴놀린-6-일-시클로프로판카르복실산 메틸 에스테르 (50.1)
LDA의 용액 (톨루엔 중 1.8 M 용액, 14.8 ml, 26.6 mmol)을 건조 THF (40 mL) 중 퀴놀린-6-일-아세트산 메틸 에스테르 (2.14 g, 10.64 mmol)의 용액에 질소 분위기 하에 -78℃에서 적가하였다. 30분 후, 1,2-디브로모에탄 (2.40 g, 12.76 mmol)을 3분에 걸쳐 적가하였다. 생성된 혼합물을 실온에서 1시간 동안 교반한 다음, 포화 수성 NH4Cl로 켄칭하였다. 혼합물을 DCM으로 추출하고, 염수로 세척하고, Na2SO4 상에서 건조시키고, 용매를 스트리핑하였다. 잔류물을 실리카 겔 중 플래쉬 크로마토그래피에 의해 EtOAC/헥산 구배로 용리하여 정제함으로써 표제 화합물 463 mg (20%)을 황색 고체로서 수득하였다.
1-퀴놀린-6-일-시클로프로판카르복실산 히드라지드 (50.2)
메탄올 (5 mL) 중 1-퀴놀린-6-일-시클로프로판카르복실산 메틸 에스테르 (513 mg, 2.26 mmol) 및 히드라진 1수화물 (3.39 g, 67.7 mmol)의 용액을 환류 하에 밤새 가열하였다. 냉각시킨 후, 용매를 진공 하에 제거하여 표제 화합물 513 mg (100%)을 수득하고, 추가 정제 없이 사용하였다.
6-[1-(6-클로로-[1,2,4]트리아졸로[4,3-b]피리다진-3-일)-시클로프로필]-퀴놀린 (50.3)
마이크로웨이브 튜브를 1-퀴놀린-6-일-시클로프로판카르복실산 히드라지드 (513 mg, 2.26 mmol), 3,6-디클로로피리다진 (437 mg, 2.93 mmol) 및 n-부탄올 (5 mL)로 충전하였다. 혼합물을 140℃에서 12시간 동안 가열하였다. 용매를 진공 하에 제거하고, 잔류물을 실리카 겔 중 플래쉬 크로마토그래피에 의해 ETOAC/메탄올 구배로 용리하여 정제함으로써 표제 화합물 196 mg (41%)을 수득하였다.
1-[3-(1-퀴놀린-6-일-시클로프로필)-[1,2,4]트리아졸로[4,3-b]피리다진-6-일]-에타논 (50.4)
1,4-디옥산 (3 mL) 중 6-[1-(6-클로로-[1,2,4]트리아졸로[4,3-b]피리다진-3-일)-시클로프로필]-퀴놀린 (30 mg, 0.093 mmol), PdCl2(PPh3)2 (6.5 mg, 0.0093 mmol) 및 트리부틸(1-에톡시비닐)스탄난 (67 mg, 0.186 mmol)의 용액을 90℃에서 N2 하에 3시간 동안 가열하였다. 반응 혼합물을 EtOAc로 희석하고, 수성 KF로 세척하였다. 유기 층을 Na2SO4 상에서 건조시키고, 여과하고, 진공 하에 농축시켰다. 잔류물을 HOAc 및 3N HCl 중에 용해시키고, 실온에서 3시간 동안 교반하였다. 용매를 진공 하에 제거하고, 잔류물을 DCM 중에 용해시키고, 포화 수성 NaHCO3 및 염수로 세척하였다. 유기 층을 Na2SO4 상에서 건조시키고, 여과하고, 진공 하에 농축시켰다. 잔류물을 실리카 겔 중 플래쉬 크로마토그래피에 의해 EtOAC/MeOH 구배로 용리하여 정제함으로써 표제 화합물을 황색 고체로서 수득하였다.
(E)-1-메틸-2-(1-(3-(1-(퀴놀린-6-일)시클로프로필)-[1,2,4]트리아졸로[4,3-b]피리다진-6-일)에틸리덴)히드라진카르복스아미드 (실시예 50)
메탄올 (5 mL) 중 1-[3-(1-퀴놀린-6-일-시클로프로필)-[1,2,4]트리아졸로[4,3-b]피리다진-6-일]-에타논 (30 mg, 0.091 mmol), 아세트산 (0.1 mL) 및 1-메틸히드라진카르복스아미드 (16.2 mg, 0.18 mmol)의 용액을 실온에서 밤새 교반하였다. 용매를 진공 하에 제거하고, 잔류물을 DCM으로 희석하고, 포화 수성 NaHCO3으로 세척하였다. 유기 층을 Na2SO4 상에서 건조시키고, 여과하고, 진공 하에 농축시켰다. 잔류물을 실리카 겔 중 플래쉬 크로마토그래피에 의해 CH2Cl2/MeOH 구배로 용리하여 정제함으로써 표제 화합물 (14.9 mg, 41%)을 황색 고체로서 수득하였다.
실시예 51
(E)-2-(1-(3-(퀴놀린-6-일메틸)이미다조[1,2-a]피리미딘-6-일)에틸리덴)히드라진카르복스아미드
6-((6-브로모이미다조[1,2-a]피리미딘-3-일)메틸)퀴놀린 (51.1)
2-메틸-부탄-2-올 (10 mL) 중 2-클로로-3-(퀴놀린-6-일)프로판알 (1.0 g, 2.54 mmol) 및 5-브로모피리미딘-2-아민 (0.53 g, 3.05 mmol)의 용액을 135℃에서 12시간 동안 교반하였다. 냉각시킨 후, 용매를 진공 하에 제거하고, 잔류물을 실리카 겔 중 플래쉬 크로마토그래피에 의해 CH2Cl2/MeOH 구배로 용리하여 정제함으로써 표제 화합물 및 6-(6-브로모-이미다조[1,2-a]피리미딘-2-일메틸)퀴놀린 (250 mg, 29%)의 혼합물을 갈색 고체로서 수득하였다.
1-(3-(퀴놀린-6-일메틸)이미다조[1,2-a]피리미딘-6-일)에타논 (51.2)
1,4-디옥산 5 mL 중 6-((6-브로모이미다조[1,2-a]피리미딘-3-일)메틸)퀴놀린 및 6-(6-브로모-이미다조[1,2-a]피리미딘-2-일메틸)퀴놀린 (혼합물, 250 mg, 0.737 mmol), PdCl2(PPh3)2 (51.7 mg, 0.074 mmol) 및 트리부틸(1-에톡시비닐)스탄난 (399 mg, 1.106 mmol)의 용액을 80℃에서 N2 하에 12시간 동안 가열하였다. 반응 혼합물을 EtOAc로 희석하고, 물로 세척하였다. 유기 층을 Na2SO4 상에서 건조시키고, 여과하고, 진공 하에 농축시켰다. 잔류물을 HOAc 및 3N HCl 중에 용해시키고, 실온에서 3시간 동안 교반하였다. 용매를 감압 하에 제거하고, 잔류물을 CH2Cl2 중에 용해시키고, 포화 수성 NaHCO3 및 염수로 세척하였다. 유기 층을 Na2SO4 상에서 건조시키고, 여과하고, 진공 하에 농축시켰다. 잔류물을 실리카 겔 중 플래쉬 크로마토그래피에 의해 EtOAc/MeOH 구배로 용리하여 정제함으로써 표제 화합물을 황색 고체로서 수득하였다.
(E)-2-(1-(3-(퀴놀린-6-일메틸)이미다조[1,2-a]피리미딘-6-일)에틸리덴)-히드라진카르복스아미드 (실시예 51)
메탄올 (3 mL) 중 1-(3-(퀴놀린-6-일메틸)이미다조[1,2-a]피리미딘-6-일)에타논 (40 mg, 0.132 mmol) 및 히드라진카르복스아미드 히드로클로라이드 (14.9 mg, 0.198 mmol)의 용액을 40℃에서 2시간 동안 교반하였다. 용매를 진공 하에 제거하고, 잔류물을 HPLC에 의해 정제하여 표제 화합물 4.2 mg (8.8%)을 백색 고체로서 수득하였다.
실시예 52
(E)-2-(1-(1-(퀴놀린-6-일메틸)-1H-[1,2,3]트리아졸로[4,5-b]피라진-6-일)에틸리덴)히드라진카르복스아미드
6-브로모-N2-(퀴놀린-6-일메틸)피라진-2,3-디아민 (52.1)
퀴놀린-6-일메탄아민 (3.6 g, 22.76 mmol), 3,5-디브로모피라진-2-아민 (5.75 g, 22.76 mmol) 및 트리에틸 아민 (4.61 g, 45.5 mmol)의 혼합물을 마이크로웨이브에서 130℃로 5시간 동안 가열하였다. 반응 혼합물을 CH2Cl2 및 물로 희석하고, 유기 층을 분리하고, 수성 NH4Cl로 세척하고, Na2SO4 상에서 건조시키고, 여과하고, 진공 하에 농축시켰다. 잔류물을 실리카 겔 크로마토그래피에 의해 EA:헥산을 사용하여 정제함으로써 6-브로모-N2-(퀴놀린-6-일메틸)피라진-2,3-디아민 (6.93 g, 92%)을 수득하였다.
6-((6-브로모-1H-[1,2,3]트리아졸로[4,5-b]피라진-1-일)메틸)퀴놀린 (52.2)
아세트산 (15 mL) 중 6-브로모-N2-(퀴놀린-6-일메틸)피라진-2,3-디아민 (6.55 g, 19.84 mmol)의 용액에 물 (3 mL) 중 아질산나트륨 (2.74 g, 39.7 mmol)의 용액을 첨가하였다. 실온에서 3시간 동안 교반한 후, 용액을 진공 하에 농축시켰다. 잔류물을 NaHCO3(수성)에 녹이고, DCM으로 추출하였다. 유기 층을 NH4Cl(수성)로 세척하고, Na2SO4 상에서 건조시키고, 여과하고, 진공 하에 농축시키고, 실리카 겔 크로마토그래피에 의해 EA:헥산을 사용하여 정제함으로써 6-((6-브로모-1H-[1,2,3]트리아졸로[4,5-b]피라진-1-일)메틸)퀴놀린 (3.35 g, 47%)을 수득하였다.
6-((6-(1-에톡시비닐)-1H-[1,2,3]트리아졸로[4,5-b]피라진-1-일)메틸)퀴놀린 (52.3)
DMF (20 mL) 중 6-((6-브로모-1H-[1,2,3]트리아졸로[4,5-b]피라진-1-일)메틸)퀴놀린 (2.50 g, 5.86 mmol)의 탈기된 용액에 Pd(Ph3P)4 (0.542 g, 0.469 mmol)를 첨가하고, 용액을 실온에서 20분 동안 교반하였다. 이어서, 트리부틸(1-에톡시비닐)스탄난 (2.117 g, 5.86 mmol)을 첨가하였다. LC-MS가 반응이 완결되었음을 나타낼 때까지 반응물을 100℃로 가열하였다. 반응 혼합물을 셀라이트를 통해 여과하고, 여과물을 물로 세척하고, Na2SO4 상에서 건조시키고, 농축시켰다. 생성된 조 생성물을 실리카 겔 칼럼 크로마토그래피에 의해 헥스:EA 구배를 사용하여 정제함으로써 6-((6-(1-에톡시비닐)-1H-[1,2,3]트리아졸로[4,5-b]피라진-1-일)메틸)퀴놀린 (1.2 g, 62%)을 수득하였다.
1-(1-(퀴놀린-6-일메틸)-1H-[1,2,3]트리아졸로[4,5-b]피라진-6-일)에타논 (52.4)
아세트산 중 6-((6-(1-에톡시비닐)-1H-[1,2,3]트리아졸로[4,5-b]피라진-1-일)메틸)퀴놀린 (150 mg, 0.451 mmol)의 용액에 3N HCl (0.1 mL)을 첨가하였다. 용액을 실온에서 2시간 동안 교반한 후, 용매를 감압 하에 제거하였다. 잔류물을 물로 희석하고, 그의 pH를 수성 NaHCO3을 사용하여 염기성으로 조정하고, DCM으로 추출하였다. 합한 유기 층을 NaHCO3(수성) 및 염수로 세척하고, Na2SO4 상에서 건조시키고, 여과하고, 진공 하에 농축시켰다. 잔류물을 실리카 겔 칼럼 크로마토그래피에 의해 정제하여 1-(1-(퀴놀린-6-일메틸)-1H-[1,2,3]트리아졸로[4,5-b]피라진-6-일)에타논 (131 mg, 91%)의 황색 고체를 수득하였다.
(E)-2-(1-(1-(퀴놀린-6-일메틸)-1H-[1,2,3]트리아졸로[4,5-b]피라진-6-일)에틸리덴)히드라진카르복스아미드 (실시예 52)
MeOH (3 mL) 중 1-(1-(퀴놀린-6-일메틸)-1H-[1,2,3]트리아졸로[4,5-b]피라진-6-일)에타논 (35 mg, 0.115 mmol)의 용액에 히드라진카르복스아미드 히드로클로라이드 (115 mg, 1.035 mmol)를 첨가하였다. 용액을 37℃로 밤새 가열하였다. 트리에틸 아민 (1 mL)을 첨가하고, 용액을 실온에서 20분 동안 교반하였다. 용매를 진공 하에 제거하고, 잔류물을 DCM으로 희석하고, 염수로 세척하고, Na2SO4 상에서 건조시키고, 여과하고, 진공 하에 농축시켜 표제 화합물 25 mg을 백색 고체로서 57% 수율로 수득하였다.
실시예 53
(E)-2-모르폴리노-N'-(1-(1-(퀴놀린-6-일메틸)-1H-[1,2,3]트리아졸로[4,5-b]피라진-6-일)에틸리덴)아세토히드라지드
표제 화합물을 실시예 52의 합성과 유사하게 1-(1-(퀴놀린-6-일메틸)-1H-[1,2,3]트리아졸로[4,5-b]피라진-6-일)에타논 및 2-모르폴리노아세토-히드라지드로부터 제조하였다. 표제 화합물을 담황색 고체로서 수득하였다.
실시예 54
(E)-2-(4-메틸피페라진-1-일)-N'-(1-(1-(퀴놀린-6-일메틸)-1H-[1,2,3]트리아졸로[4,5-b]피라진-6-일)에틸리덴)아세토히드라지드
표제 화합물을 실시예 52의 합성과 유사하게 1-(1-(퀴놀린-6-일메틸)-1H-[1,2,3]트리아졸로[4,5-b]피라진-6-일)로부터 담황색 고체로서 제조하였다.
실시예 55
(E)-3-(1-(1-(퀴놀린-6-일메틸)-1H-[1,2,3]트리아졸로[4,5-b]피라진-6-일)에틸리덴아미노)옥사졸리딘-2-온
표제 화합물을 실시예 52의 합성과 유사하게 1-(1-(퀴놀린-6-일메틸)-1H-[1,2,3]트리아졸로[4,5-b]피라진-6-일)에타논 및 3-아미노옥사졸리딘-2-온으로부터 제조하였다.
실시예 56
(E)-1-(1-(1-(퀴놀린-6-일메틸)-1H-[1,2,3]트리아졸로[4,5-b]피라진-6-일)에틸리덴아미노)-이미다졸리딘-2,4-디온
표제 화합물을 실시예 52의 합성과 유사하게 1-아미노이미다졸리딘-2,4-디온 히드로클로라이드 및 1-(1-(퀴놀린-6-일메틸)-1H-[1,2,3]트리아졸로[4,5-b]피라진-6-일)에타논으로부터 담황색 고체로서 58% 수율로 제조하였다.
실시예 57
(E)-1-(1-(1-(퀴놀린-6-일메틸)-1H-[1,2,3]트리아졸로[4,5-b]피라진-6-일)에틸리덴아미노)-이미다졸리딘-2-온
표제 화합물을 실시예 52의 합성과 유사하게 1-(1-(퀴놀린-6-일메틸)-1H-[1,2,3]트리아졸로[4,5-b]피라진-6-일)에타논 및 1-아미노이미다졸리딘-2-온으로부터 담황색 고체로서 26% 수율로 제조하였다.
실시예 58
(E)-N'-(1-(1-(퀴놀린-6-일메틸)-1H-[1,2,3]트리아졸로[4,5-b]피라진-6-일)에틸리덴)-메탄술포노히드라지드
표제 화합물을 실시예 52의 합성과 유사하게 1-(1-(퀴놀린-6-일메틸)-1H-[1,2,3]트리아졸로[4,5-b]피라진-6-일)에타논 및 메탄술포노-히드라지드로부터 제조하였다.
실시예 59
[1-(3-퀴놀린-6-일메틸-3H-[1,2,3]트리아졸로[4,5-b]피라진-5-일)-에트-(E)-일리덴]-히드라진
표제 화합물을 실시예 52의 합성과 유사하게 1-(1-(퀴놀린-6-일메틸)-1H-[1,2,3]트리아졸로[4,5-b]피라진-6-일)에타논으로부터 36% 수율로 제조하였다.
실시예 60
(E)-1-메틸-2-(1-(1-(퀴놀린-6-일메틸)-1H-[1,2,3]트리아졸로[4,5-b]피라진-6-일)에틸리덴)히드라진카르복스아미드
표제 화합물을 실시예 52의 합성과 유사하게 1-(1-(퀴놀린-6-일메틸)-1H-[1,2,3]트리아졸로[4,5-b]피라진-6-일)에타논 및 1-메틸히드라진-카르복스아미드로부터 백색 고체로서 제조하였다.
실시예 61
(E)-N-메틸-2-(1-(1-(퀴놀린-6-일메틸)-1H-[1,2,3]트리아졸로[4,5-b]피라진-6-일)에틸리덴)히드라진카르복스아미드
표제 화합물을 실시예 52의 합성과 유사하게 1-(1-(퀴놀린-6-일메틸)-1H-[1,2,3]트리아졸로[4,5-b]피라진-6-일)에타논 및 N-메틸히드라진-카르복스아미드로부터 제조하였다.
실시예 62
(E)-N,1-디메틸-2-(1-(1-(퀴놀린-6-일메틸)-1H-[1,2,3]트리아졸로[4,5-b]피라진-6-일)에틸리덴)히드라진카르복스아미드
표제 화합물을 실시예 52의 합성과 유사하게 1-(1-(퀴놀린-6-일메틸)-1H-[1,2,3]트리아졸로[4,5-b]피라진-6-일)에타논 및 N,1-디메틸-히드라진카르복스아미드로부터 제조하였다.
실시예 63
(E)-1-에틸-2-(1-(1-(퀴놀린-6-일메틸)-1H-[1,2,3]트리아졸로[4,5-b]피라진-6-일)에틸리덴)히드라진카르복스아미드
표제 화합물을 실시예 52의 합성과 유사하게 1-(1-(퀴놀린-6-일메틸)-1H-[1,2,3]트리아졸로[4,5-b]피라진-6-일)에타논 및 1-에틸히드라진-카르복스아미드로부터 백색 고체로서 57% 수율로 제조하였다.
실시예 64
(E)-N'-아세틸-1-(퀴놀린-6-일메틸)-1H-[1,2,3]트리아졸로[4,5-b]피라진-6-카르보히드라존아미드
1-(퀴놀린-6-일메틸)-1H-[1,2,3]트리아졸로[4,5-b]피라진-6-카르보니트릴 (64.1)
DMF (8 mL) 중 6-((6-브로모-1H-[1,2,3]트리아졸로[4,5-b]피라진-1-일)메틸)퀴놀린 (1.6 g, 4.69 mmol)의 탈기된 용액에 Pd(PPh3)4 (0.434 g, 0.375 mmol) 및 디시아노아연 (0.441 g, 3.75 mmol)을 첨가하였다. 반응 혼합물을 127℃로 4시간 동안 가열하였다. NH4Cl(수성)을 첨가하여 반응을 켄칭한 후, EtOAc를 첨가하였다. 반응 혼합물을 셀라이트를 통해 여과하고, 포화 NaHCO3 및 NH4Cl로 세척하였다. 유기 층을 분리하고, Na2SO4 상에서 건조시키고, 여과하고, 농축시켜 조 생성물을 수득하였으며, 이를 아날로직스 겔 실리카 (헥산:EtOAc)에 의해 정제하여 표제 화합물을 담황색 고체로서 수득하였다.
1-(퀴놀린-6-일메틸)-1H-[1,2,3]트리아졸로[4,5-b]피라진-6-카르보히드라존아미드 (64.2)
EtOH (3 mL) 중 1-(퀴놀린-6-일메틸)-1H-[1,2,3]트리아졸로[4,5-b]피라진-6-카르보니트릴 (80 mg, 0.278 mmol)의 용액에 히드라진 수화물 (18.12 mg, 0.362 mmol)을 첨가하였다. 반응을 60℃로 밤새 가열하였다. 혼합물을 여과하고, EtOH, H2O 및 EtOH로 세척하여 황색 고체를 수득하였다.
((E)-N'-아세틸-1-(퀴놀린-6-일메틸)-1H-[1,2,3]트리아졸로[4,5-b]피라진-6-카르보히드라존아미드 (실시예 64)
DMSO (1 mL) 및 DCM (2.0 mL) 중 1-(퀴놀린-6-일메틸)-1H-[1,2,3]트리아졸로[4,5-b]피라진-6-카르보히드라존아미드 (25 mg, 0.078 mmol)의 용액에 피리딘 (6.19 mg, 0.078 mmol) 및 아세트산 무수물 (10.39 mg, 0.102 mmol)을 첨가하였다. 밤새 교반한 후, 반응 혼합물을 여과하였다. 고체를 EtOH, H2O 및 EtOH로 세척하여 표제 화합물 19.9 mg을 67% 수율로 수득하였다.
실시예 65
(E)-2-(아미노(1-(퀴놀린-6-일메틸)-1H-[1,2,3]트리아졸로[4,5-b]피라진-6-일)메틸렌)히드라진카르복스아미드
표제 화합물을 1-(퀴놀린-6-일메틸)-1H-[1,2,3]트리아졸로[4,5-b]피라진-6-카르보니트릴 및 히드라진카르복스-아미드 히드로클로라이드로부터 화합물 64.2의 합성과 유사하게 제조하였다.
실시예 66
(E)-2-((1-(퀴놀린-6-일메틸)-1H-[1,2,3]트리아졸로[4,5-b]피라진-6-일)메틸렌)-히드라진카르복스아미드
6-((6-비닐-1H-[1,2,3]트리아졸로[4,5-b]피라진-1-일)메틸)퀴놀린 (66.1)
DMF (10 mL) 중 6-((6-브로모-1H-[1,2,3]트리아졸로[4,5-b]피라진-1-일)메틸)퀴놀린 (1200 mg, 3.52 mmol)의 탈기된 용액에 Pd(PPh3)4 (610 mg, 0.528 mmol)를 첨가하였다. 용액을 20분 동안 교반한 다음, 트리부틸(비닐)스탄난 (1227 mg, 3.87 mmol)을 첨가하였다. 반응 혼합물을 120℃로 5시간 동안 가열하였다. NH4Cl(수성)을 첨가하여 반응물을 켄칭한 후, EtOAc를 첨가하였다. 반응 혼합물을 셀라이트를 통해 여과하고, 여과물을 포화 NaHCO3, 포화 NH4Cl로 세척하였다. 유기 층을 분리하고, Na2SO4 상에서 건조시키고, 농축시켜 조 생성물을 수득하였으며, 이를 아날로직스 겔 실리카 (헥산:EA)에 의해 정제하여 표제 화합물 210 mg을 20% 수율로 수득하였다.
1-(퀴놀린-6-일메틸)-1H-[1,2,3]트리아졸로[4,5-b]피라진-6-카르브알데히드 (66.2)
6-((6-비닐-1H-[1,2,3]트리아졸로[4,5-b]피라진-1-일)메틸)퀴놀린 (100 mg, 0.347 mmol) 및 2,6-디메틸피리딘 (74.3 mg, 0.694 mmol)의 혼합물에 H2O (1.333 mL) 중 산화오스뮴(VIII) (297 mg, 1.387 mmol)의 용액에 이어서 1,4-디옥산 (4 ml) 중 과아이오딘산나트륨 (88 mg, 6.94 μmol)의 용액을 첨가하였다. 반응 혼합물을 실온에서 10시간 동안 교반하였다. 용매를 진공 하에 제거하고, DCM을 묽은 잔류물에 첨가하였다. 생성된 용액을 포화 NaHCO3, NH4Cl 및 염수로 세척하였다. 유기 층을 분리하고, Na2SO4 상에서 건조시키고, 농축시켜 조 생성물을 수득하였으며, 이를 아날로직스 겔 실리카 (헥산:EA)에 의해 정제하여 표제 화합물 45 mg을 43% 수율로 수득하였다.
(E)-2-((1-(퀴놀린-6-일메틸)-1H-[1,2,3]트리아졸로[4,5-b]피라진-6-일)메틸렌) 히드라진카르복스아미드 (실시예 66)
표제 화합물을 1-(퀴놀린-6-일메틸)-1H-[1,2,3]트리아졸로[4,5-b]피라진-6-카르브알데히드로부터 52의 화합물의 합성과 유사하게 65% 수율로 제조하였다.
실시예 67
(E)-2-(1-(1-(1-(7-플루오로퀴놀린-6-일)에틸)-1H-[1,2,3]트리아졸로[4,5-b]피라진-6-일)에틸리덴)히드라진카르복스아미드
6-브로모-N2-(1-(7-플루오로퀴놀린-6-일)에틸)피라진-2,3-디아민 (67.1)
표제 화합물을 1-(7-플루오로퀴놀린-6-일)에탄아민으로부터 화합물 52.1의 합성과 유사하게 백색 고체로서 제조하였다.
6-(1-(6-브로모-1H-[1,2,3]트리아졸로[4,5-b]피라진-1-일)에틸)-7-플루오로퀴놀린 (67.1)
표제 화합물을 6-브로모-N2-(1-(7-플루오로퀴놀린-6-일)에틸)피라진-2,3-디아민으로부터 화합물 52.2의 합성과 유사하게 제조하였다.
6-(1-(6-(1-에톡시비닐)-1H-[1,2,3]트리아졸로[4,5-b]피라진-1-일)에틸)-7-플루오로퀴놀린 (67.3)
표제 화합물을 6-(1-(6-브로모-1H-[1,2,3]트리아졸로[4,5-b]피라진-1-일)에틸)-7-플루오로퀴놀린으로부터 화합물 52.3의 합성과 유사하게 제조하였다.
1-(1-(1-(7-플루오로퀴놀린-6-일)에틸)-1H-[1,2,3]트리아졸로[4,5-b]피라진-6-일)에타논 (67.4)
표제 화합물을 6-(1-(6-(1-에톡시비닐)-1H-[1,2,3]트리아졸로[4,5-b]피라진-1-일)에틸)-7-플루오로퀴놀린으로부터 52.4의 화합물의 합성과 유사하게 제조하였다.
(E)-2-(1-(1-(1-(7-플루오로퀴놀린-6-일)에틸)-1H-[1,2,3]트리아졸로[4,5-b]피라진-6-일)에틸리덴)히드라진카르복스아미드 (실시예 67)
표제 화합물을 1-(1-(1-(7-플루오로퀴놀린-6-일)에틸)-1H-[1,2,3]트리아졸로[4,5-b]피라진-6-일)에타논으로부터 실시예 52의 합성과 유사하게 제조하였다.
실시예 68
(E)-2-(1-(3-((6-플루오로-1-메틸-1H-인다졸-5-일)에틸)이미다조[1,2-b]피리다진-6-일)에틸리덴)히드라진카르복스아미드
1-(6-클로로이미다조[1,2-b]피리다진-3-일)-1-(6-플루오로-1-메틸-1H-인다졸-5-일)에탄올 (68.1)
-100℃에서 THF (79 ml) 중 5-브로모-6-플루오로-1-메틸-1H-인다졸 (1.800 g, 7.86 mmol)의 용액에 n-BuLi (5.40 ml, 8.64 mmol)를 적가하였다. -100℃에서 1시간 동안 교반한 후, THF (20 mL) 중 1-(6-클로로이미다조[1,2-b]피리다진-3-일)에타논 (1.691 g, 8.64 mmol)을 적가하였다. 반응 용액을 추가로 2시간 동안 교반하고, NH4Cl (수성)로 켄칭하였다. 생성된 혼합물을 EtOAc로 추출하였다. 합한 유기 층을 NH4Cl(수성)로 세척하고, Na2SO4 상에서 건조시키고, 진공 하에 농축시켜 조 생성물을 수득하였으며, 이를 실리카 겔 칼럼 크로마토그래피 (헥산:EtOAc) 상에서 정제하여 표제 화합물을 34% 수율로 수득하였다.
6-클로로-3-(1-(6-플루오로-1-메틸-1H-인다졸-5-일)에틸)이미다조[1,2-b]피리다진 (68.2)
HOAc (10 ml) 중 1-(6-클로로이미다조[1,2-b]피리다진-3-일)-1-(6-플루오로-1-메틸-1H-인다졸-5-일)에탄올 (1.1 g, 3.18 mmol), 디아이오딘 (2.019 g, 7.95 mmol), 및 포스핀산 (0.840 g, 12.73 mmol)의 혼합물을 120℃로 5시간 동안 가열하였다. 실온으로 냉각시킨 후, 반응 혼합물을 진공 하에 농축시켰다. 잔류물을 물로 녹이고, 수성 NaOH를 사용하여 그의 pH를 8로 조정하였다. 혼합물을 DCM으로 추출하고, Na2SO4 상에서 건조시키고, 농축시켜 잔류물을 수득하였으며, 이를 실리카 겔 칼럼 크로마토그래피 (MeOH:EA)에 의해 정제하여 6-클로로-3-(1-(6-플루오로-1-메틸-1H-인다졸-5-일)에틸)이미다조[1,2-b]피리다진 (900 mg, 60%)을 수득하였다.
6-(1-에톡시비닐)-3-(1-(6-플루오로-1-메틸-1H-인다졸-5-일)에틸)이미다조[1,2-b]피리다진 (68.3)
DMF (8 mL) 중 6-클로로-3-(1-(6-플루오로-1-메틸-1H-인다졸-5-일)에틸)이미다조[1,2-b]피리다진 (900 mg, 1.910 mmol)의 용액에 Pd(Ph3P)4 (221 mg, 0.191 mmol)를 첨가하였다. 혼합물을 20분 동안 교반하고, 트리부틸(1-에톡시비닐)스탄난 (784 mg, 2.102 mmol)을 첨가하였다. LC-MS가 반응이 완결되었음을 나타낼 때까지, 생성된 혼합물을 100℃로 가열하였다. 반응 혼합물을 셀라이트를 통해 여과하고, 고체를 에테르로 세척하였다. 이어서, 여과물을 물로 세척하고, Na2SO4 상에서 건조시키고, 잔류물로 농축시키고, 이를 실리카 겔 칼럼 크로마토그래피에 의해 헥스:EA 구배를 사용하여 정제함으로써 6-(1-에톡시비닐)-3-(1-(6-플루오로-1-메틸-1H-인다졸-5-일)에틸)이미다조[1,2-b]피리다진 (450 mg, 52%)을 수득하였다.
1-(3-(1-(6-플루오로-1-메틸-1H-인다졸-5-일)에틸)이미다조[1,2-b]피리다진-6-일)에타논 (68.4)
아세트산 (8 mL) 중 6-(1-에톡시비닐)-3-(1-(6-플루오로-1-메틸-1H-인다졸-5-일)에틸)-이미다조[1,2-b]피리다진 (450 mg, 0.985 mmol)의 용액에 3N HCl (0.5 mL)을 첨가하였다. 용액을 실온에서 2시간 동안 교반하고, 용매를 감압 하에 제거하였다. 잔류물을 물로 희석하고, 그의 pH를 수성 NaHCO3을 사용하여 염기성으로 조정하고, DCM으로 추출하였다. 유기 층을 NaHCO3(수성) 및 염수로 세척하고, Na2SO4 상에서 건조시키고, 진공 하에 농축시켰다. 잔류물을 실리카 겔 칼럼 크로마토그래피에 의해 정제하여 황색 고체 1-(3-(1-(6-플루오로-1-메틸-1H-인다졸-5-일)에틸)이미다조[1,2-b]피리다진-6-일)에타논 (300 mg, 81%)을 수득하였다.
(E)-2-(1-(3-(1-(6-플루오로-1-메틸-1H-인다졸-5-일)에틸)이미다조[1,2-b]피리다진-6-일)에틸리덴)히드라진카르복스아미드 (실시예 68)
MeOH (4 mL) 중 1-(3-(1-(6-플루오로-1-메틸-1H-인다졸-5-일)에틸)이미다조[1,2-b]피리다진-6-일)에타논 (35 mg, 0.104 mmol)의 용액에 히드라진카르복스아미드 히드로클로라이드 (28.9 mg, 0.259 mmol)를 첨가하였다. 반응 혼합물을 35℃로 가열하였다. 5시간 동안 교반한 후, 용매를 제거하고, DCM을 묽은 잔류물에 첨가하였다. 이어서, 생성된 혼합물을 염수로 세척하고, Na2SO4 상에서 건조시키고, 진공 하에 농축시켜 (E)-2-(1-(3-(1-(6-플루오로-1-메틸-1H-인다졸-5-일)에틸)이미다조[1,2-b]피리다진-6-일)에틸리덴)히드라진카르복스아미드 (14 mg, 33%)를 백색 고체로서 수득하였다.
실시예 69
(E)-2-(1-(3-((6-플루오로-1-메틸-1H-인다졸-5-일)메틸)이미다조[1,2-b]피리다진-6-일)에틸리덴)히드라진카르복스아미드
6-클로로이미다조[1,2-b]피리다진-3-일)(6-플루오로-1-메틸-1H-인다졸-5-일)메탄올 (69.1)
표제 화합물을 6-클로로이미다조[1,2-b]피리다진-3-카르브알데히드로부터 화합물 68.1의 합성과 유사하게 황색 고체로서 제조하였다.
6-클로로-3-((6-플루오로-1-메틸-1H-인다졸-5-일)메틸)이미다조[1,2-b]피리다진 (69.2)
표제 화합물을 (6-클로로이미다조[1,2-b]피리다진-3-일)(6-플루오로-1-메틸-1H-인다졸-5-일)메탄올로부터 화합물 68.2의 합성과 유사하게 황색 고체로서 제조하였다.
6-(1-에톡시비닐)-3-((6-플루오로-1-메틸-1H-인다졸-5-일)메틸)이미다조[1,2-b]피리다진 (67.3)
표제 화합물을 6-클로로-3-((6-플루오로-1-메틸-1H-인다졸-5-일)메틸)이미다조[1,2-b]피리다진으로부터 화합물 68.3의 합성과 유사하게 제조하였다.
1-(3-((6-플루오로-1-메틸-1H-인다졸-5-일)메틸)이미다조[1,2-b]피리다진-6-일)에타논 (67.4)
표제 화합물을 6-(1-에톡시비닐)-3-((6-플루오로-1-메틸-1H-인다졸-5-일)메틸)이미다조[1,2-b]피리다진으로부터 화합물 68.4의 합성과 유사하게 백색 고체로서 제조하였다.
(E)-2-(1-(3-((6-플루오로-1-메틸-1H-인다졸-5-일)메틸)이미다조[1,2-b]피리다진-6-일)에틸리덴)히드라진카르복스아미드 (실시예 67)
표제 화합물을 1-(3-((6-플루오로-1-메틸-1H-인다졸-5-일)메틸)이미다조[1,2-b]피리다진-6-일)에타논으로부터 실시예 68의 합성과 유사하게 백색 고체로서 제조하였다.
실시예 70
(E)-2-(1-(3-((1-메틸-1H-인다졸-5-일)메틸)이미다조[1,2-b]피리다진-6-일)에틸리덴) 히드라진카르복스아미드
(6-클로로이미다조[1,2-b]피리다진-3-일)(1-메틸-1H-인다졸-5-일)메탄올 (70.1)
THF 5 mL 중 3-브로모-6-클로로이미다조[1,2-b]피리다진 (232.0 mg, 1.00 mmol)의 용액에 -10℃에서 에틸마그네슘 브로마이드 (1.50 mL, 1.50 mmol)를 첨가하였다. -10℃에서 1시간 동안 교반한 후, 1-메틸-1H-인다졸-5-카르브알데히드 (240.0 mg, 1.50 mmol)를 첨가하였다. 혼합물을 실온으로 천천히 가온되도록 하고, 추가로 2시간 동안 교반하였다. 반응물을 포화 NH4Cl 용액으로 켄칭하고, 감압 하에 농축시켰다. 잔류물을 물로 희석하고, EtOAc로 2회 추출하였다. 유기 층을 합하고, Na2SO4 상에서 건조시키고, 농축시켰다. 조 생성물을 DCM으로 세척하여 표제 화합물을 백색 고체 (230 mg, 70%)로서 수득하였다.
6-클로로-3-((1-메틸-1H-인다졸-5-일)메틸)이미다조[1,2-b]피리다진 (70.2):
AcOH 4 mL 중 (6-클로로이미다조[1,2-b]피리다진-3-일)(1-메틸-1H-인다졸-5-일)메탄올 (156.8 mg, 0.50 mmol), I2 (381 mg, 1.50 mmol) 및 H3PO2 (0.273 mL, 2.50 mmol)의 용액을 110℃에서 7시간 동안 가열하였다. 용매를 감압 하에 제거하였다. 잔류물을 물로 희석하고, DCM으로 2회 추출하였다. 유기 층을 합하고, Na2SO4 상에서 건조시키고, 농축시켰다. 조 생성물을 플래쉬 크로마토그래피 (DCM:MeOH=20:1)에 의해 정제하여 일부 아이오딘을 함유하는 표제 화합물을 수득하고, 후속 단계에 추가 정제 없이 사용하였다 (180.0 mg, 44%, 36% 순도).
6-(1-에톡시-비닐)-3-(1-메틸-1H-인다졸-5-일메틸)-이미다조[1,2-b]피리다진 (70.3):
DMF 10 mL 중 6-클로로-3-((1-메틸-1H-인다졸-5-일)메틸)이미다조[1,2-b]피리다진 (180.0 mg, 36% 순도, 0.22 mmol), 트리부틸(1-에톡시비닐)스탄난 (94 mg, 0.26 mmol) 및 Pd(PPh3)4 (25.1 mg, 0.02 mmol)의 현탁액을 질소로 플러싱한 다음, 110℃에서 가열하고, 밤새 교반하였다. 용매를 감압 하에 제거하고, 잔류물을 DCM으로 희석하고, KF 용액 및 물로 순차적으로 세척하였다. 유기 층을 Na2SO4 상에서 건조시키고, 여과하고, 진공 하에 농축시켰다. 조 생성물을 플래쉬 크로마토그래피 (DCM:MeOH=20:1)에 의해 정제하여 일부 트리페닐포스핀 옥시드 불순물을 함유하는 표제 화합물을 수득하고, 후속 단계에 추가 정제 없이 사용하였다 (49 mg, 47%, 70% 순도).
1-(3-((1-메틸-1H-인다졸-5-일)메틸)이미다조[1,2-b]피리다진-6-일)에타논 (70.4):
AcOH 10 mL 중 6-(1-에톡시-비닐)-3-(1-메틸-1H-인다졸-5-일메틸)-이미다조[1,2-b]피리다진 (50 mg, 0.15 mmol) 및 HCl (0.15 mL, 0.15 mmol)의 용액을 50℃에서 3시간 동안 가열하였다. 용매를 감압 하에 제거하였다. 잔류물을 물로 희석하고, 수성 NaHCO3을 사용하여 용액의 pH 값을 약 8로 조정하고, DCM으로 3회 추출하였다. 유기 층을 합하고, Na2SO4 상에서 건조시키고, 농축시켰다. 조 생성물을 후속 단계에 정제 없이 사용하였다 (45 mg, 75%, 76% 순도).
(E)-2-(1-(3-((1-메틸-1H-인다졸-5-일)메틸)이미다조[1,2-b]피리다진-6-일)에틸리덴) 히드라진카르복스아미드 (실시예 70):
THF 10 mL 중 1-(3-((1-메틸-1H-인다졸-5-일)메틸)이미다조[1,2-b]피리다진-6-일)에타논 (40.0 mg, 0.09 mmol) 및 히드라진카르복스아미드(19.47 mg, 0.26 mmol)의 용액을 40℃에서 밤새 교반하였다. 용매를 진공 하에 제거하였다. 조 생성물을 플래쉬 크로마토그래피 (DCM:MeOH = 20:1)상에서 정제하여 표제 화합물을 백색 고체 (29.0 mg, 88%)로서 수득하였다.
실시예 71
(E)-2-(1-(3-(1-(1-메틸-1H-인다졸-5-일)에틸)이미다조[1,2-b]피리다진-6-일)에틸리덴) 히드라진카르복스아미드
(6-클로로이미다조[1,2-b]피리다진-3-일)(1-메틸-1H-인다졸-5-일)메타논 (71.1):
아세톤 10 mL 중 (6-클로로이미다조[1,2-b]피리다진-3-일)(1-메틸-1H-인다졸-5-일)메탄올 (500.0 mg, 1.60 mmol) 및 2-아이오독시벤조산 (45% 순도, 1488.0 mg, 2.39 mmol)의 현탁액을 환류 하에 가열하고, 3시간 동안 교반하였다. 용매를 감압 하에 제거하였다. 잔류물을 물로 희석하고, 용액의 pH 값을 10% 수성 NaOH를 사용하여 약 10으로 조정하였다. 침전물을 여과에 의해 수집하고, 물로 3회 세척하였다. 고체를 DCM 중에 용해시키고, Na2SO4 상에서 건조시키고, 여과하고, 농축시켜 표제 화합물을 백색 고체 (410.0 mg, 78%)로서 수득하였다.
1-(6-클로로-이미다조[1,2-b]피리다진-3-일)-1-(1-메틸-1H-인다졸-5-일)-에탄올 (71.2):
THF 10 mL 중 (6-클로로이미다조[1,2-b]피리다진-3-일)(1-메틸-1H-인다졸-5-일)메타논 (410 mg, 1.32 mmol)의 용액에 0℃에서 메틸마그네슘 아이오다이드 (0.88 mL, 2.63 mmol)를 첨가하였다. 0℃에서 3시간 동안 교반한 후, 반응물을 포화 NH4Cl로 켄칭하고, 감압 하에 농축시켰다. 잔류물을 DCM으로 3회 추출하였다. 유기 층을 합하고, Na2SO4 상에서 건조시키고, 농축시켜 표제 화합물을 백색 고체 (430.0 mg, 95%)로서 수득하였다.
6-클로로-3-[1-(1-메틸-1H-인다졸-5-일)-에틸]-이미다조[1,2-b]피리다진 (71.3):
표제 화합물 (390.0 mg, 91%)을 화합물 69.2의 합성에 기재된 것과 동일한 절차를 이용하여 1-(6-클로로-이미다조[1,2-b]피리다진-3-일)-1-(1-메틸-1H-인다졸-5-일)-에탄올 (430.0 mg, 1.31 mmol), I2 (832.0 mg, 3.28 mmol) 및 H3PO2 (0.72 mL, 6.56 mmol)로부터 합성하였다.
6-(1-에톡시-비닐)-3-[1-(1-메틸-1H-인다졸-5-일)-에틸]-이미다조[1,2-b]피리다진 (71.4):
표제 화합물 (415.0 mg, 86%, 90% 순도)을 화합물 69.3의 합성에 기재된 것과 동일한 절차를 이용하여 6-클로로-3-[1-(1-메틸-1H-인다졸-5-일)-에틸]-이미다조[1,2-b]피리다진 (390.0 mg, 1.25 mmol), 트리부틸(1-에톡시비닐)스탄난 (497.0 mg, 1.38 mmol) 및 Pd(PPh3)4 (145 mg, 0.13 mmol)로부터 합성하였다.
1-(3-(1-(1-메틸-1H-인다졸-5-일)에틸)이미다조[1,2-b]피리다진-6-일)에타논 (71.5)
표제 화합물 (325.0 mg, 75%, 88% 순도)을 화합물 69.4의 합성에 기재된 것과 동일한 절차를 이용하여 6-(1-에톡시-비닐)-3-[1-(1-메틸-1H-인다졸-5-일)-에틸]-이미다조[1,2-b]피리다진 (415.0 mg, 1.20 mmol) 및 HCl (1.20 mL, 1.20 mmol)로부터 합성하였다.
(E)-2-(1-(3-(1-(1-메틸-1H-인다졸-5-일)에틸)이미다조[1,2-b]피리다진-6-일)에틸리덴) 히드라진카르복스아미드 (실시예 71):
표제 화합물 (14.0 mg, 59%)을 실시예 69의 합성에 기재된 것과 동일한 절차를 이용하여 1-(3-(1-(1-메틸-1H-인다졸-5-일)에틸)이미다조[1,2-b]피리다진-6-일)에타논 (20.0 mg, 0.06 mmol) 및 히드라진카르복스아미드 (13.97 mg, 0.13 mmol)로부터 합성하였다.
실시예 72
(E)-2-(1-(1-((7-플루오로퀴놀린-6-일)메틸)-1H-[1,2,3]트리아졸로[4,5-b]피라진-6-일)에틸리덴)히드라진카르복스아미드
5-브로모-N*3*-(7-플루오로-퀴놀린-6-일메틸)-피라진-2,3-디아민 (72.1):
N-(7-플루오로-퀴놀린-6-일)-메틸아민 (1.69 g, 9.63 mmol), 3,5-디브로모피라진-2-아민 (2.43 g, 9.63 mmol) 및 DIPEA (2.96 g, 22.90 mmol)의 혼합물을 마이크로웨이브에서 120℃로 10시간 동안 가열하였다. 반응물을 DCM 및 물로 희석하였다. 유기 층을 NH4Cl (수성)로 세척하고, Na2SO4 상에서 건조시키고, 여과하고, 진공 하에 농축시켰다. 조 생성물을 실리카 겔 크로마토그래피 (DCM:MeOH)에 의해 정제하여 표제 화합물을 황색 고체 (2.60 g, 69%)로서 수득하였다.
6-(6-브로모-[1,2,3]트리아졸로[4,5-b]피라진-1-일메틸)-7-플루오로-퀴놀린 (72.2):
아세트산 (4 mL) 중 5-브로모-N*3*-(7-플루오로-퀴놀린-6-일메틸)-피라진-2,3-디아민 (90 mg, 0.26 mmol)의 용액에 물 (1 mL) 중 아질산나트륨 (11.4 mg, 0.26 mmol)의 용액을 한번에 첨가하였다. 실온에서 3시간 동안 교반한 후, 용매를 진공 하에 제거하고, 잔류물을 NaHCO3(수성)으로 희석하고, DCM으로 추출하였다. 유기 층을 물로 세척하고, Na2SO4 상에서 건조시키고, 여과하고, 진공 하에 농축시켰다. 조 생성물을 실리카 겔 크로마토그래피에 의해 (DCM:MeOH = 50:1)을 사용하여 정제함으로써 표제 화합물을 황색 고체 (57.0 mg, 61%)로서 수득하였다.
6-[6-(1-에톡시-비닐)-[1,2,3]트리아졸로[4,5-b]피라진-1-일메틸]-7-플루오로-퀴놀린 (72.3):
DMF (50 mL) 중 6-(6-브로모-[1,2,3]트리아졸로[4,5-b]피라진-1-일메틸)-7-플루오로-퀴놀린 (2.0 g, 5.57 mmol), Pd(Ph3P)4 (0.64 g, 0.56 mmol) 및 트리부틸(1-에톡시비닐)스탄난 (4.02 g, 11.14 mmol)의 혼합물을 질소로 플러싱한 다음, 100℃에서 가열하고, 7시간 동안 교반하였다. 용매를 감압 하에 제거하고, 잔류물을 DCM으로 희석하고, KF (수성) 및 물로 순차적으로 세척하고, Na2SO4 상에서 건조시키고, 진공 하에 농축시켰다. 조 생성물을 실리카 겔 칼럼 크로마토그래피에 의해 구배 (DCM:MeOH = 50:1)을 사용하여 정제함으로써 표제 화합물을 백색 고체로서 수득하였다.
1-[3-(7-플루오로-퀴놀린-6-일메틸)-3H-[1,2,3]트리아졸로[4,5-b]피라진-5-일]-에타논 (72.4):
아세트산 중 6-[6-(1-에톡시-비닐)-[1,2,3]트리아졸로[4,5-b]피라진-1-일메틸]-7-플루오로-퀴놀린 (600.0 mg, 0.89 mmol) 및 3N HCl (0.1 mL)의 용액을 50℃에서 2시간 동안 교반하였다. 용매를 감압 하에 제거하였다. 잔류물을 물로 희석하고, 수성 NaHCO3을 사용하여 용액의 pH 값을 약 8로 조정하고, DCM으로 2회 추출하였다. 합한 유기 층을 물 및 염수로 순차적으로 세척하고, Na2SO4 상에서 건조시키고, 여과하고, 진공 하에 농축시켜 표제 화합물을 백색 고체 (630 mg, 96%)로서 수득하였다.
(E)-2-(1-(1-((7-플루오로퀴놀린-6-일)메틸)-1H-[1,2,3]트리아졸로[4,5-b]피라진-6-일)에틸리덴)히드라진카르복스아미드 (실시예 72)
MeOH (10 mL) 중 1-[3-(7-플루오로-퀴놀린-6-일메틸)-3H-[1,2,3]트리아졸로[4,5-b]피라진-5-일]-에타논 (30.0 mg, 0.09 mmol)의 용액에 히드라진카르복스아미드 히드로클로라이드 (31.0 mg, 0.28 mmol)를 첨가하였다. 혼합물을 45℃에서 가열하고, 밤새 교반하였다. 용매를 감압 하에 제거하였다. 잔류물을 실리카 겔 칼럼 크로마토그래피에 의해 구배 (DCM:MeOH =10:1)을 사용하여 정제함으로써 표제 화합물을 백색 고체 (25.0 mg, 67%)로서 수득하였다.
실시예 73
아세트산 [1-[3-(7-플루오로-퀴놀린-6-일메틸)-3H-[1,2,3]트리아졸로[4,5-b]피라진-5-일]-에트-(E)-일리덴]-히드라지드
표제 화합물 (30.5 mg, 82%)을 실시예 72의 합성에 기재된 것과 동일한 절차를 이용하여 1-[3-(7-플루오로-퀴놀린-6-일메틸)-3H-[1,2,3]트리아졸로[4,5-b]피라진-5-일]-에타논 (30.0 mg, 0.09 mmol) 및 아세트산 히드라지드 (23.0 mg, 0.28 mmol)로부터 합성하였다.
실시예 74
1N'-[1-[3-(7-플루오로-퀴놀린-6-일메틸)-3H-[1,2,3]트리아졸로[4,5-b]피라진-5-일]-에트-(E)-일리덴]-히드라진카르복실산 메틸 에스테르
표제 화합물 (29.9 mg, 77%)을 실시예 72의 합성에 기재된 것과 동일한 절차를 이용하여 1-[3-(7-플루오로-퀴놀린-6-일메틸)-3H-[1,2,3]트리아졸로[4,5-b]피라진-5-일]-에타논 (30.0 mg, 0.09 mmol) 및 히드라진카르복실산 메틸 에스테르 (25.2 mg, 0.28 mmol)로부터 합성하였다.
실시예 75
이소니코틴산 [1-[3-(7-플루오로-퀴놀린-6-일메틸)-3H-[1,2,3]트리아졸로[4,5-b]피라진-5-일]-에트-(E)-일리덴]-히드라지드
표제 화합물 (27.9 mg, 64%)을 실시예 72의 합성에 기재된 것과 동일한 절차를 이용하여 1-[3-(7-플루오로-퀴놀린-6-일메틸)-3H-[1,2,3]트리아졸로[4,5-b]피라진-5-일]-에타논 (30.0 mg, 0.09 mmol) 및 이소니코틴산 히드라지드 (38.3 mg, 0.28 mmol)로부터 합성하였다.
실시예 76
1-[1-[3-(7-플루오로-퀴놀린-6-일메틸)-3H-[1,2,3]트리아졸로[4,5-b]피라진-5-일]-에트-(E)-일리덴아미노]-이미다졸리딘-2,4-디온
표제 화합물 (18.0 mg, 66%)을 실시예 72의 합성에 기재된 것과 동일한 절차를 이용하여 1-[3-(7-플루오로-퀴놀린-6-일메틸)-3H-[1,2,3]트리아졸로[4,5-b]피라진-5-일]-에타논 (20.0 mg, 0.06 mmol) 및 1-아미노-이미다졸리딘-2,4-디온 (28.2 mg, 0.19 mmol)으로부터 합성하였다.
실시예 77
프로피온산 [1-[3-(7-플루오로-퀴놀린-6-일메틸)-3H-[1,2,3]트리아졸로[4,5-b]피라진-5-일]-에트-(E)-일리덴]-히드라지드
표제 화합물 (28.5 mg, 74%)을 실시예 72의 합성에 기재된 것과 동일한 절차를 이용하여 1-[3-(7-플루오로-퀴놀린-6-일메틸)-3H-[1,2,3]트리아졸로[4,5-b]피라진-5-일]-에타논 (30.0 mg, 0.09 mmol) 및 프로피온산 히드라지드 (24.6 mg, 0.28 mmol)로부터 합성하였다.
실시예 78
니코틴산 [1-[3-(7-플루오로-퀴놀린-6-일메틸)-3H-[1,2,3]트리아졸로[4,5-b]피라진-5-일]-에트-(E)-일리덴]-히드라지드
표제 화합물 (17.0 mg, 59%)을 실시예 72의 합성에 기재된 것과 동일한 절차를 이용하여 1-[3-(7-플루오로-퀴놀린-6-일메틸)-3H-[1,2,3]트리아졸로[4,5-b]피라진-5-일]-에타논 (20.0 mg, 0.06 mmol) 및 니코틴산 히드라지드 (17.0 mg, 0.12 mmol)로부터 합성하였다.
실시예 79
1-[1-[3-(7-플루오로-퀴놀린-6-일메틸)-3H-[1,2,3]트리아졸로[4,5-b]피라진-5-일]-에트-(E)-일리덴아미노]-이미다졸리딘-2-온
표제 화합물 (18.0 mg, 66%)을 실시예 72의 합성에 기재된 것과 동일한 절차를 이용하여 1-[3-(7-플루오로-퀴놀린-6-일메틸)-3H-[1,2,3]트리아졸로[4,5-b]피라진-5-일]-에타논 (20.0 mg, 0.06 mmol) 및 1-아미노-이미다졸리딘-2-온 (28.2 mg, 0.19 mmol)으로부터 합성하였다.
실시예 80
(E)-2-(1-(3-((6-플루오로-1-메틸-1H-인다졸-5-일)메틸)이미다조[1,2-b]피리다진-6-일)프로필리덴)히드라진카르복스아미드
3-((6-플루오로-1-메틸-1H-인다졸-5-일)메틸)-6-비닐이미다조[1,2-b]피리다진 (80.1)
6-클로로-3-((6-플루오로-1-메틸-1H-인다졸-5-일)메틸)이미다조[1,2-b]피리다진 (400 mg, 1.267 mmol)의 탈기된 용액에 Pd(Ph3P)4 (220 mg, 0.190 mmol) 및 트리부틸(비닐)스탄난 (422 mg, 1.330 mmol)을 첨가하였다. 반응 혼합물을 120℃로 밤새 가열하였다. 이어서, 반응물을 NH4Cl(수성)로 켄칭하고, DCM으로 추출하고, Na2SO4 상에서 건조시키고, 진공 하에 농축시켜 잔류물을 수득하였으며, 이를 실리카 겔 칼럼 크로마토그래피에 의해 헥스:EA 구배를 사용하여 정제함으로써 3-((6-플루오로-1-메틸-1H-인다졸-5-일)메틸)-6-비닐이미다조[1,2-b]피리다진 (168 mg, 43%)을 수득하였다.
3-((6-플루오로-1-메틸-1H-인다졸-5-일)메틸)이미다조[1,2-b]피리다진-6-카르브알데히드 (80.2)
3-((6-플루오로-1-메틸-1H-인다졸-5-일)메틸)-6-비닐이미다조[1,2-b]피리다진 (50 mg, 0.163 mmol), 산화오스뮴(VIII) (103 mg, 8.13 μmol)의 혼합물에 아세톤 (2 ml) 및 H2O (0.16 ml) 중 NMO (29.5 mg, 0.252 mmol)의 용액을 첨가하였다. 반응 혼합물을 46℃로 가열하였다. 4시간 동안 교반한 후, 용매를 제거하고, THF (6 ml) 및 H2O (1.5 ml)의 혼합물을 첨가하여 잔류물을 용해시킨 다음, 과아이오딘산나트륨 (69.6 mg, 0.325 mmol)을 첨가하고, 생성된 혼합물을 46℃에서 12h 동안 교반하였다. 이어서, 반응 혼합물을 Na2SO3(수성)으로 켄칭하고, DCM으로 추출하고, Na2SO4 상에서 건조시키고, 셀라이트를 통해 여과하고, 진공 하에 농축시켜 잔류물을 수득하였으며, 이를 실리카 겔 칼럼 크로마토그래피에 의해 헥스:EA 구배를 사용하여 정제함으로써 3-((6-플루오로-1-메틸-1H-인다졸-5-일)메틸)이미다조[1,2-b]피리다진-6-카르브알데히드 (20 mg)를 수율 38%로 수득하였다.
1-(3-((6-플루오로-1-메틸-1H-인다졸-5-일)메틸)이미다조[1,2-b]피리다진-6-일)프로판-1-올 (80.3)
0℃에서 THF (4 mL) 중 3-((6-플루오로-1-메틸-1H-인다졸-5-일)메틸)이미다조[1,2-b]피리다진-6-카르브알데히드 (52 mg, 0.168 mmol)의 용액에 THF 중 에틸마그네슘 브로마이드의 용액 (1M, 0.336 mL)을 적가하였다. 16시간 동안 교반한 후, 반응 혼합물을 NH4Cl(수성)로 켄칭하고, EtOAc로 추출하고, Na2SO4 상에서 건조시켰다. 셀라이트를 통해 여과하고, 진공 하에 농축시켜 조 생성물 (14 mg, 10%)을 수득하였다.
1-(3-((6-플루오로-1-메틸-1H-인다졸-5-일)메틸)이미다조[1,2-b]피리다진-6-일)프로판-1-온 (80.4)
DCM (3 mL) 중 1-(3-((6-플루오로-1-메틸-1H-인다졸-5-일)메틸)이미다조[1,2-b]피리다진-6-일)프로판-1-올 (13 mg, 0.015 mmol)의 용액에 TEA (0.011 ml, 0.079 mmol) 및 데스-마르틴 퍼아이오디난 (40 mg, 0.094 mmol)을 첨가하였다. 실온에서 10분 동안 교반한 후, 반응물을 Na2SO3(수성)으로 켄칭하고, DCM으로 추출하였다. 유기 층을 분리하고, Na2SO4 상에서 건조시키고, 진공 하에 농축시켜 잔류물을 수득하였으며, 이를 실리카 겔 칼럼 크로마토그래피에 의해 헥스:EA 구배를 사용하여 정제함으로써 1-(3-((6-플루오로-1-메틸-1H-인다졸-5-일)메틸)이미다조[1,2-b]피리다진-6-일)프로판-1-온 (4 mg, 74%)을 수득하였다.
(E)-2-(1-(3-((6-플루오로-1-메틸-1H-인다졸-5-일)메틸)이미다조[1,2-b]피리다진-6-일)프로필리덴)히드라진카르복스아미드 (실시예 80)
표제 화합물을 1-(3-((6-플루오로-1-메틸-1H-인다졸-5-일)메틸)이미다조[1,2-b]피리다진-6-일)프로판-1-온으로부터 실시예 1의 합성과 유사하게 백색 고체로서 제조하였다.
실시예 81
(E)-2-(1-(7-(퀴놀린-6-일메틸)이미다조[1,2-b][1,2,4]트리아진-2-일)에틸리덴)히드라진카르복스아미드
6-브로모-1,2,4-트리아진-3-아민 (81.1)
물 (6000 mL) 중 3-아미노-1,2,4-트리아진 (50.0 g, 521 mmol)의 혼합물을 0-5℃로 냉각시켰다. 브로민 (70 mL, 1.30 mmol)을 반응 혼합물에 1시간 동안 적가하였다. 이어서, 혼합물을 0-10℃에서 밤새 교반하였다. 포화 수성 Na2SO3 용액을 반응물에 첨가하고, 혼합물을 6N 수성 NaOH 용액을 사용하여 pH = 12로 중화시켰다. 혼합물을 디클로로메탄으로 추출하고, Na2SO4 상에서 건조시켰다. 용매를 진공하에 제거하여 표제 화합물 50.0 g (54%)을 황색 고체로서 수득하였다.
6-(1-에톡시비닐)-1,2,4-트리아진-3-아민 (81.2)
N,N-디메틸포름아미드 (50 mL) 중 6-브로모-1,2,4-트리아진-3-아민 (780 mg, 4.46 mmol)의 용액을 테트라키스 (트리페닐포스핀) 팔라듐 (0) (258 mg, 0.22 mmol), N,N-디이소프로필에틸 아민 (2284 mg, 11.14 mmol), 염화리튬 (661 mg, 15.6 mmol) 및 비닐트리-n-부틸주석 (2093 mg, 5.79 mmol)으로 처리하고, 반응물을 120℃에서 2시간 동안 가열하였다. 반응 혼합물을 실온으로 냉각시키고, 용매를 진공 하에 농축시켰다. 잔류물을 디클로로메탄으로 희석하고, 수성 KF 용액으로 세척하였다. 조 생성물을 실리카 겔 중 플래쉬 크로마토그래피에 의해 에틸 아세테이트/헥산 구배로 용리하여 정제함으로써 표제 화합물 380 mg (51%)을 황색 고체로서 수득하였다.
6-((2-(2-메틸-1,3-디옥솔란-2-일)이미다조[1,2-b][1,2,4]트리아진-7-일)메틸)퀴놀린 (81.3)
에틸렌 글리콜 (8 mL) 중 6-(1-에톡시비닐)-1,2,4-트리아진-3-아민 (120 mg, 0.72 mmol), 2-클로로-3-(퀴놀린-3-일)프로판알 (317 mg, 1.44 mmol)의 용액을 140℃에서 2시간 동안 교반하였다. 반응 혼합물을 실온으로 냉각시키고, 포화 수성 Na2CO3 용액으로 중화시키고, 물로 희석하고, 에틸 아세테이트로 추출하고, Na2SO4 상에서 건조시켰다. 용매를 진공 하에 제거하고, 잔류물을 실리카 겔 중 플래쉬 크로마토그래피에 의해 에틸 아세테이트/헥산 구배로 용리하여 정제함으로써 표제 화합물 135 mg (54%)을 황색 고체로서 수득하였다.
1-(7-(퀴놀린-6-일메틸)이미다조[1,2-b][1,2,4]트리아진-2-일)에타논 (81.4)
3N HCl (5 mL) 중 6-((2-(2-메틸-1,3-디옥솔란-2-일)이미다조[1,2-b][1,2,4]트리아진-7-일)메틸)퀴놀린 (130 mg, 0.37 mmol)의 용액을 90℃에서 0.5시간 동안 교반하였다. 반응 혼합물을 실온으로 냉각시키고, 포화 수성 Na2CO3 용액으로 중화시키고, 에틸 아세테이트로 추출하고, Na2SO4 상에서 건조시켰다. 용매를 진공 하에 제거하여 표제 화합물 85 mg (75%)을 황색 고체로서 수득하였다.
c-Met 효소 검정
본 발명의 수많은 화합물을 하기와 같이 항체 기반 키나제 인산화 검정을 통해 검정하였다.
EPK c-Met 프로파일링 검정:
정제된 재조합 GST-융합 단백질 (효소의 세포질 도메인 함유)을 사용하여 c-Met 수용체 티로신 키나제에 대한 EPK 키나제 검정을 개발하였다. GST-c-Met(969-1390)를 친화도 크로마토그래피로 정제하였다.
본 키나제 검정은 란타스크린(LanthaScreen)™ 기술을 기초로 한다. 란타스크린™은 란타나이드 킬레이트를 사용하여 다양한 결합 파트너들 사이의 상호작용을 측정하는 시간-분해 형광 공명 에너지 전달(Time-Resolved Fluorescence Resonance Energy Transfer) (TR-FRET)의 검출이다. TR-FRET 키나제 검정에서, 수명이 긴 란타나이드 공여자 종을 적합한 수용자 형광단으로 표지된 키나제 반응의 인산화된 생성물에 특이적으로 결합하는 항체에 접합시켰다. 이러한 항체-매개 상호작용은 란타나이드 공여자 및 수용자를 근접하게 하여 공명 에너지 전달이 일어날 수 있게 하여, FRET 신호를 검출가능하게 증가시킨다.
키나제 반응은 384 웰 마이크로타이터 플레이트에서 10.05 μL의 전체 반응 부피로 수행하였다. 검정 플레이트는 하기 "화합물 희석액의 제조"에 기재된 바와 같이, 적절한 실험 농도의 시험 화합물을 웰 당 0.05 μL씩 사용하여 제조하였다. 반응은 5 μL의 ATP 용액을 5 μL의 효소-기질 믹스 (키나제 및 기질로 구성됨)와 합함으로써 개시하였다. 키나제 반응물 중 최종 농도는 25 mM 트리스/HCl, 1 mM DTT, 0.025% 트윈20(Tween20), 10 μM 나트륨 오르토바나데이트, 0.25% BSA, 0.5% DMSO, 10 mM MgCl2, 3 mM MnCl2, 2 μM ATP, 50 nM 플루오레세인-폴리EAY(Fluorescein-PolyEAY) 및 0.3 nM 효소였다.
상기 반응물을 60분 동안 실온에서 인큐베이션하고, 정지 완충제 (50 mM EDTA, 0.04% NP40, 20 mM 트리스/HCl) 5 μL를 첨가하여 정지시켰다.
후속적으로, 검출 믹스 (50 mM 트리스/HCl, 2 mM DTT, 0.05% 트윈20, 20 μM 나트륨 오르토바나데이트, 1% BSA, 1 nM Tb-PY20 항체) 5 μL를 정지된 반응물에 첨가하였다. 암실에서 45분 동안 실온에서 인큐베이션한 후, 플레이트를 퍼킨엘머(Perkinelmer) 엔비전(Envision) 형광 판독기에서 측정하였다. 모든 검정에서 효소 활성에 대한 화합물의 효과는 선형 진전 곡선(progress curve)으로부터 구하였고, 1개의 판독치로부터 결정하였다 (종점 결정).
결과는 하기 표에 요약되어 있다. "활성"인 본 발명의 화합물은 본 효소 검정에서 5000 nM 미만, 특히 3500 nM 미만, 바람직하게는 1000 nM 미만, 보다 바람직하게는 500 nM, 가장 바람직하게는 10 nM 미만의 IC50을 갖는다.
GTL16 세포 생존율 검정:
GTL16 세포주를 위암 환자로부터 얻었다. 유전자 증폭에 의해 GTL16이 높은 수준의 c-Met 수용체 티로신 키나제를 나타내도록 하였다. GTL16의 성장은 c-Met 키나제 활성에 고도로 의존적이기 때문에, 이것을 c-Met 키나제 억제제의 세포 활성을 모니터링하기 위한 세포 기반 검정으로서 이용하였다.
GTL16 세포를 96 웰 플레이트에서 10% FBS 및 1% 페니실린 & 스트렙토마이신을 함유하는 DMEM 배지 중에 5000개 세포/웰/90 μL로 시딩하고, 5% CO2 인큐베이터에서 부착을 위해 37℃에서 밤새 인큐베이션하였다. 화합물의 10배 연속 희석물을 세포에 10 μL/웰로 첨가하였다. 최종 검정 부피는 100 μl/웰이었다. 검정 플레이트를 37℃에서 24시간 동안 5% CO2 인큐베이터에서 인큐베이션하였다. 세포의 생존율을 셀타이터 글로(CellTiter Glo) (Cat# G7573 프로메가(Promega))를 이용하여 판매자에 의해 제안된 프로토콜에 따라 측정하였다. 간략하게, 플레이트를 실온에서 10분 동안 냉각시키고, 100 μl의 셀타이터 글로 시약을 각 웰에 첨가하였다. 플레이트를 10분 동안 진탕시켰다. 화학발광 광 단위를 엔비전 (퍼킨 엘머)에서 판독하였다. 모든 시험은 3중으로 실행하였다. IC50을 스폿파이어(Spotfire) 소프트웨어를 이용하여 계산하였다.
Claims (19)
- 하기 화학식 I의 화합물 또는 그의 제약상 허용되는 염.
<화학식 I>
상기 식에서,
Y는 C 또는 N이고;
X는 CH 또는 N이고;
B는 CH 또는 N이고;
A는 고리이고;
여기서, X가 CH이고 B가 N인 경우에, 고리 A는 하기 고리 Ai 또는 고리 Aii이고;
X가 N이고 B가 N인 경우에, 고리 A는 하기 Aiii이고;
X가 N이고 B가 N이거나, 또는 X가 N이고 B가 CH인 경우에, 고리 A는 하기 Ai이고;
R1은 하기 기 i이고,
여기서, R5는 헤테로아릴1이고;
헤테로아릴1은 N, O 및 S로부터 독립적으로 선택된 1, 2, 3 또는 4개의 고리 헤테로원자를 포함하는 9- 또는 10-원, 불포화 또는 부분 불포화 비시클릭 기이고, 여기서 고리 S 원자의 총 개수는 1을 초과하지 않고, 고리 O 원자의 총 개수는 1을 초과하지 않고, 헤테로아릴1은 할로, OH 및 (C1-C3)알킬로부터 독립적으로 선택된 1개 이상의 치환기에 의해 임의로 치환되고, 상기 (C1-C3)알킬은 OH 및 할로로부터 독립적으로 선택된 1개 이상의 치환기에 의해 임의로 치환되고;
R6은 수소, 중수소, OH, 메틸 또는 할로이고;
R7은 수소, 중수소, 할로 또는 (C1-C3)알킬이고, 여기서 상기 (C1-C3)알킬은 OH 및 할로로부터 독립적으로 선택된 1개 이상의 치환기에 의해 임의로 치환되거나; 또는
R6 및 R7은 이들이 부착되어 있는 탄소와 함께 시클로프로필을 형성하고, 여기서 상기 시클로프로필은 메틸에 의해 임의로 치환되고;
R2는 수소, NH2 또는 (C1-C4)알킬이고, 여기서 상기 (C1-C4)알킬은 OH, NH2 및 할로로부터 독립적으로 선택된 1개 이상의 치환기에 의해 임의로 치환되고;
R3은 수소, -CONH2, -CONH(C1-C4)알킬, -CONH페닐이고, 여기서 상기 CONH페닐의 페닐은 1개 이상의 할로, -(C1-C4)알킬, -CO(C1-C4)알킬, -CO2(C1-C4)알킬, 페닐, 헤테로아릴2, -CO헤테로아릴2, -CSNH2, -CSNH(C1-C4)알킬, -CSNH벤질, -SO2(C1-C4)알킬 또는 -COCH2헤테로시클릴1에 의해 임의로 치환되고, 상기 헤테로시클릴1은 (C1-C3)알킬에 의해 임의로 치환되고;
헤테로아릴2는 N, O 및 S로부터 독립적으로 선택된 1, 2, 3 또는 4개의 고리 헤테로원자를 포함하는 5- 내지 10-원 불포화 또는 부분 불포화 모노시클릭 또는 비시클릭 기이고, 여기서 고리 S 원자의 총 개수는 1을 초과하지 않고, 고리 O 원자의 총 개수는 1을 초과하지 않고, 헤테로아릴2는 할로, OH 및 (C1-C3)알킬로부터 독립적으로 선택된 1개 이상의 치환기에 의해 임의로 치환되고, 상기 (C1-C3)알킬은 OH 및 할로로부터 독립적으로 선택된 1개 이상의 치환기에 의해 임의로 치환되고;
헤테로시클릴1은 N, O 및 S로부터 독립적으로 선택된 1 또는 2개의 고리 헤테로원자를 포함하는 5 또는 6원 포화 또는 부분 불포화 모노시클릭 기를 의미하고;
R4는 수소 또는 (C1-C3)알킬이거나; 또는
R3 및 R4는 이들이 부착되어 있는 질소와 함께, R3 및 R4가 부착되어 있는 1개의 고리 N 원자 및 임의로 N, O 및 S로부터 독립적으로 선택된 1개의 추가 고리 헤테로원자를 포함하는 5 또는 6원 포화 또는 부분 불포화 모노시클릭 기를 형성하고, 여기서 상기 모노시클릭 기는 1 또는 2개의 =O 치환기에 의해 치환된다. - 제1항 또는 제2항에 있어서, R5가 헤테로아릴3이고, 여기서 헤테로아릴3이 1 또는 2개의 고리 N 헤테로원자를 포함하는 9- 또는 10-원, 불포화 또는 부분 불포화 비시클릭 기이고, 헤테로아릴3이 할로, OH 및 (C1-C3)알킬로부터 독립적으로 선택된 1개 이상의 치환기에 의해 임의로 치환되고, 상기 (C1-C3)알킬이 OH 및 할로로부터 독립적으로 선택된 1개 이상의 치환기에 의해 임의로 치환되는 것인 화합물 또는 그의 제약상 허용되는 염.
- 제3항에 있어서, R5가 할로 및 (C1-C3)알킬로부터 독립적으로 선택된 1개 이상의 치환기에 의해 임의로 치환된 인다졸릴 또는 퀴놀리닐인 화합물 또는 그의 제약상 허용되는 염.
- 제4항에 있어서, R5가 메틸 치환기에 의해 위치 1에서 치환되고 1 또는 2개의 플루오로 치환기에 의해 임의로 추가 치환된 인다졸-5-일이거나, 또는 R5가 1 또는 2개의 플루오로 치환기에 의해 임의로 치환된 퀴놀린-6-일인 화합물 또는 그의 제약상 허용되는 염.
- 제1항 내지 제5항 중 어느 한 항에 있어서, R6이 수소, 중수소 또는 할로인 화합물 또는 그의 제약상 허용되는 염.
- 제1항 내지 제6항 중 어느 한 항에 있어서, R7이 수소, 중수소, 할로 또는 메틸인 화합물 또는 그의 제약상 허용되는 염.
- 제1항 내지 제7항 중 어느 한 항에 있어서, R6 및 R7이 둘 다 수소는 아닌 경우에, 화학식 I의 화합물이 (S) 거울상이성질체인 화합물 또는 그의 제약상 허용되는 염.
- 제1항 내지 제8항 중 어느 한 항에 있어서, R2가 수소 또는 메틸인 화합물 또는 그의 제약상 허용되는 염.
- 제1항 내지 제9항 중 어느 한 항에 있어서, R3이 수소, -CONH2, -CONHCH3, -CONH페닐이고, 여기서 상기 CONH페닐의 페닐이 1개 이상의 할로, -(C1-C4)알킬, -COCH3, -CO2CH3, 페닐, 벤족사졸릴, 헤테로아릴4, -CO헤테로아릴4, -CSNH2, -CSNH(C1-C2)알킬, -CSNH벤질, -SO2Me, -COCH2모르폴리닐, COCH2피페리디닐 또는 -COCH2피페라지닐에 의해 임의로 치환되고, 상기 피페라지닐이 1개 이상의 (C1-C3)알킬에 의해 임의로 치환되고, 헤테로아릴4가 N, O 및 S로부터 독립적으로 선택된 1, 2, 3 또는 4개의 고리 헤테로원자를 포함하는 5 또는 6원 불포화 또는 부분 불포화 모노시클릭 기이고, 여기서 고리 S 원자의 총 개수가 1을 초과하지 않고, 고리 O 원자의 총 개수가 1을 초과하지 않는 것인 화합물 또는 그의 제약상 허용되는 염.
- 제10항에 있어서, R3이 -CONH2인 화합물 또는 그의 제약상 허용되는 염.
- 제1항 내지 제9항 중 어느 한 항에 있어서, R3 및 R4가 이들이 부착되어 있는 질소와 함께 옥사졸리디논, 옥사졸리딘디온, 이미다졸리디논 또는 이미다졸리딘디온을 형성하는 것인 화합물 또는 그의 제약상 허용되는 염.
- 제1항 내지 제12항 중 어느 한 항에 있어서, 의약에 사용하기 위한 화합물 또는 그의 제약상 허용되는 염.
- 제1항 내지 제12항 중 어느 한 항에 있어서, 하나 이상의 c-Met 티로신 키나제 매개 질환의 치료에 사용하기 위한 화합물 또는 그의 제약상 허용되는 염.
- 제1항 내지 제12항 중 어느 한 항에 있어서, 증식성 질환 또는 염증성 상태의 치료에 사용하기 위한 화합물 또는 그의 제약상 허용되는 염.
- 하나 이상의 c-Met 티로신 키나제 매개 질환 치료용 의약의 제조에서의, 제1항 내지 제12항 중 어느 한 항에 청구된 바와 같은 화합물 또는 그의 제약상 허용되는 염의 용도.
- c-Met 관련 장애 또는 상태의 치료를 필요로 하는 대상체에게 유효량의 화학식 I의 화합물 또는 그의 제약상 허용되는 염을 투여하는 것을 포함하는, c-Met 관련 장애 또는 상태의 치료 방법.
- 제1항 내지 제12항 중 어느 한 항에 청구된 바와 같은 화학식 I의 화합물 또는 그의 제약상 허용되는 염, 및 하나 이상의 제약상 허용되는 담체 및/또는 희석제, 및 임의로 하나 이상의 추가 치료제를 포함하는 제약 조성물.
- 제1항 내지 제12항 중 어느 한 항에 있어서, 하나 이상의 추가 치료 활성제와 조합된 화학식 I의 화합물 또는 그의 제약상 허용되는 염.
Applications Claiming Priority (7)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US23332809P | 2009-08-12 | 2009-08-12 | |
| US61/233,328 | 2009-08-12 | ||
| CNPCT/CN2010/071981 | 2010-04-21 | ||
| CN2010071981 | 2010-04-21 | ||
| CNPCT/CN2010/074078 | 2010-06-18 | ||
| CN2010074078 | 2010-06-18 | ||
| PCT/EP2010/061609 WO2011018454A1 (en) | 2009-08-12 | 2010-08-10 | Heterocyclic hydrazone compounds and their uses to treat cancer and inflammation |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20120089643A true KR20120089643A (ko) | 2012-08-13 |
Family
ID=43385579
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020127006238A KR20120089643A (ko) | 2009-08-12 | 2010-08-10 | 헤테로시클릭 히드라존 화합물, 및 암 및 염증을 치료하기 위한 그의 용도 |
Country Status (10)
| Country | Link |
|---|---|
| US (1) | US8497368B2 (ko) |
| EP (1) | EP2464649A1 (ko) |
| JP (1) | JP5781510B2 (ko) |
| KR (1) | KR20120089643A (ko) |
| AU (1) | AU2010283806A1 (ko) |
| BR (1) | BR112012003262A8 (ko) |
| CA (1) | CA2770873A1 (ko) |
| EA (1) | EA201200260A1 (ko) |
| MX (1) | MX2012001838A (ko) |
| WO (1) | WO2011018454A1 (ko) |
Families Citing this family (20)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CA2771432A1 (en) | 2009-08-20 | 2011-02-24 | Novartis Ag | Heterocyclic oxime compounds |
| PL2719699T3 (pl) * | 2009-12-31 | 2016-01-29 | Hutchison Medipharma Ltd | Pewne triazolopirazyny, ich kompozycje i sposoby ich stosowania |
| WO2011145035A1 (en) | 2010-05-17 | 2011-11-24 | Indian Incozen Therapeutics Pvt. Ltd. | Novel 3,5-disubstitued-3h-imidazo[4,5-b]pyridine and 3,5- disubstitued -3h-[1,2,3]triazolo[4,5-b] pyridine compounds as modulators of protein kinases |
| CN103459396B (zh) * | 2011-02-10 | 2015-08-19 | 诺瓦提斯公司 | 作为c-Met酪氨酸激酶抑制剂的[1,2,4]三唑并[4,3-b]哒嗪化合物 |
| JP2014505088A (ja) * | 2011-02-10 | 2014-02-27 | ノバルティス アーゲー | C−METチロシンキナーゼ阻害剤としての[1,2,4]トリアゾロ[4,3−b]ピリダジン化合物 |
| UY34329A (es) | 2011-09-15 | 2013-04-30 | Novartis Ag | Compuestos de triazolopiridina |
| WO2013151913A1 (en) | 2012-04-03 | 2013-10-10 | Novartis Ag | Tyrosine kinase inhibitor combinations and their use |
| CN104245701A (zh) | 2012-04-03 | 2014-12-24 | 诺华有限公司 | 有酪氨酸激酶抑制剂的组合产品和其应用 |
| CN102977014B (zh) | 2012-11-05 | 2015-01-07 | 沈阳药科大学 | 新的喹啉类化合物及其用途 |
| EP2917210B1 (en) | 2012-11-06 | 2019-02-27 | Shanghai Fochon Pharmaceutical Co. Ltd | Alk kinase inhibitors |
| WO2014174478A1 (en) | 2013-04-26 | 2014-10-30 | Novartis Ag | Pharmaceutical combinations of a pkc inhibitor and a c-met receptor tyrosine kinase inhibitor |
| GB201321732D0 (en) * | 2013-12-09 | 2014-01-22 | Ucb Pharma Sa | Therapeutic agents |
| GB201321745D0 (en) * | 2013-12-09 | 2014-01-22 | Ucb Pharma Sa | Therapeutic agents |
| HUE053654T2 (hu) | 2014-03-26 | 2021-07-28 | Astex Therapeutics Ltd | FGFR- és CMET-inhibitorok kombinációi a rák kezelésére |
| HUE049523T2 (hu) * | 2015-01-23 | 2020-09-28 | Syngenta Participations Ag | Peszticidként hatásos szemikarbazon- és tioszemikarbazon-származékok |
| WO2017100644A1 (en) * | 2015-12-09 | 2017-06-15 | Case Western Reserve University | Method of modulating ribonucleotide reductase |
| CN106632069A (zh) * | 2016-11-18 | 2017-05-10 | 山东友帮生化科技有限公司 | 3‑氯‑6‑肼基哒嗪的合成方法 |
| TWI774755B (zh) * | 2017-04-28 | 2022-08-21 | 日商佐藤製藥股份有限公司 | 二氟甲烯化合物之製造法 |
| JP2022515198A (ja) | 2018-12-19 | 2022-02-17 | アレイ バイオファーマ インコーポレイテッド | FGFRチロシンキナーゼの阻害剤としての置換ピラゾロ[1,5-a]ピリジン化合物 |
| CN110483526B (zh) * | 2019-09-09 | 2021-10-01 | 辽宁大学 | 含芳基腙结构的吡唑并[1,5-a]嘧啶类衍生物及其应用 |
Family Cites Families (166)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| FR901228A (fr) | 1943-01-16 | 1945-07-20 | Deutsche Edelstahlwerke Ag | Système d'aimant à entrefer annulaire |
| GB1219606A (en) | 1968-07-15 | 1971-01-20 | Rech S Et D Applic Scient Soge | Quinuclidinol derivatives and preparation thereof |
| GB1524747A (en) | 1976-05-11 | 1978-09-13 | Ici Ltd | Polypeptide |
| ATE28864T1 (de) | 1982-07-23 | 1987-08-15 | Ici Plc | Amide-derivate. |
| GB8327256D0 (en) | 1983-10-12 | 1983-11-16 | Ici Plc | Steroid derivatives |
| US5093330A (en) | 1987-06-15 | 1992-03-03 | Ciba-Geigy Corporation | Staurosporine derivatives substituted at methylamino nitrogen |
| GB8916480D0 (en) | 1989-07-19 | 1989-09-06 | Glaxo Group Ltd | Chemical process |
| US5010099A (en) | 1989-08-11 | 1991-04-23 | Harbor Branch Oceanographic Institution, Inc. | Discodermolide compounds, compositions containing same and method of preparation and use |
| GB8923590D0 (en) | 1989-10-19 | 1989-12-06 | Pfizer Ltd | Antimuscarinic bronchodilators |
| US5395855A (en) | 1990-05-07 | 1995-03-07 | Ciba-Geigy Corporation | Hydrazones |
| CA2057089A1 (en) | 1990-12-07 | 1992-06-08 | Eric E. Allen | Substituted pyrazolopyrimidines and imidazopyridazines as angiotensin ii antagonists |
| PT100441A (pt) | 1991-05-02 | 1993-09-30 | Smithkline Beecham Corp | Pirrolidinonas, seu processo de preparacao, composicoes farmaceuticas que as contem e uso |
| US5451700A (en) | 1991-06-11 | 1995-09-19 | Ciba-Geigy Corporation | Amidino compounds, their manufacture and methods of treatment |
| NZ243082A (en) | 1991-06-28 | 1995-02-24 | Ici Plc | 4-anilino-quinazoline derivatives; pharmaceutical compositions, preparatory processes, and use thereof |
| GB9300059D0 (en) | 1992-01-20 | 1993-03-03 | Zeneca Ltd | Quinazoline derivatives |
| WO1993019750A1 (en) | 1992-04-02 | 1993-10-14 | Smithkline Beecham Corporation | Compounds useful for treating allergic or inflammatory diseases |
| EP0633776B1 (en) | 1992-04-02 | 2001-05-09 | Smithkline Beecham Corporation | Compounds useful for treating allergic and inflammatory diseases |
| WO1993019751A1 (en) | 1992-04-02 | 1993-10-14 | Smithkline Beecham Corporation | Compounds useful for treating inflammatory diseases and inhibiting production of tumor necrosis factor |
| TW225528B (ko) | 1992-04-03 | 1994-06-21 | Ciba Geigy Ag | |
| DK0666868T4 (da) | 1992-10-28 | 2006-09-18 | Genentech Inc | Anvendelse af anti-VEGF-antistoffer til behandling af cancer |
| GB9301000D0 (en) | 1993-01-20 | 1993-03-10 | Glaxo Group Ltd | Chemical compounds |
| GB9314893D0 (en) | 1993-07-19 | 1993-09-01 | Zeneca Ltd | Quinazoline derivatives |
| GB9414193D0 (en) | 1994-07-14 | 1994-08-31 | Glaxo Group Ltd | Compounds |
| GB9414208D0 (en) | 1994-07-14 | 1994-08-31 | Glaxo Group Ltd | Compounds |
| EP1110953B1 (en) | 1995-03-30 | 2009-10-28 | Pfizer Products Inc. | Quinazoline derivatives |
| GB9508538D0 (en) | 1995-04-27 | 1995-06-14 | Zeneca Ltd | Quinazoline derivatives |
| US5747498A (en) | 1996-05-28 | 1998-05-05 | Pfizer Inc. | Alkynyl and azido-substituted 4-anilinoquinazolines |
| US5880141A (en) | 1995-06-07 | 1999-03-09 | Sugen, Inc. | Benzylidene-Z-indoline compounds for the treatment of disease |
| US5843901A (en) | 1995-06-07 | 1998-12-01 | Advanced Research & Technology Institute | LHRH antagonist peptides |
| DK0836605T3 (da) | 1995-07-06 | 2002-05-13 | Novartis Ag | Pyrrolopyrimidiner og fremgangsmåder til deres fremstilling |
| US5760041A (en) | 1996-02-05 | 1998-06-02 | American Cyanamid Company | 4-aminoquinazoline EGFR Inhibitors |
| GB9603095D0 (en) | 1996-02-14 | 1996-04-10 | Zeneca Ltd | Quinazoline derivatives |
| NZ332119A (en) | 1996-04-12 | 2001-08-31 | Warner Lambert Co | Quinazoline compounds which are irreversible inhibitors of tyrosine kinases |
| DE69734513T2 (de) | 1996-06-24 | 2006-07-27 | Pfizer Inc. | Phenylamino-substituierte tricyclische derivate zur behandlung hyperproliferativer krankheiten |
| JP2001500851A (ja) | 1996-08-30 | 2001-01-23 | ノバルティス アクチエンゲゼルシャフト | エポシロンの製造法および製造過程中に得られる中間生産物 |
| CA2264908C (en) | 1996-09-06 | 2006-04-25 | Obducat Ab | Method for anisotropic etching of structures in conducting materials |
| DE19638745C2 (de) | 1996-09-11 | 2001-05-10 | Schering Ag | Monoklonale Antikörper gegen die extrazelluläre Domäne des menschlichen VEGF - Rezeptorproteins (KDR) |
| AU4342997A (en) | 1996-09-13 | 1998-04-02 | Sugen, Inc. | Use of quinazoline derivatives for the manufacture of a medicament in the reatment of hyperproliferative skin disorders |
| EP0837063A1 (en) | 1996-10-17 | 1998-04-22 | Pfizer Inc. | 4-Aminoquinazoline derivatives |
| GB9622386D0 (en) | 1996-10-28 | 1997-01-08 | Sandoz Ltd | Organic compounds |
| HU229833B1 (en) | 1996-11-18 | 2014-09-29 | Biotechnolog Forschung Gmbh | Epothilone d production process, and its use as cytostatic as well as phytosanitary agents |
| US6441186B1 (en) | 1996-12-13 | 2002-08-27 | The Scripps Research Institute | Epothilone analogs |
| TW528755B (en) | 1996-12-24 | 2003-04-21 | Glaxo Group Ltd | 2-(purin-9-yl)-tetrahydrofuran-3,4-diol derivatives |
| AU6031898A (en) | 1997-01-22 | 1998-08-07 | Eli Lilly And Company | Anti-viral compounds |
| CO4950519A1 (es) | 1997-02-13 | 2000-09-01 | Novartis Ag | Ftalazinas, preparaciones farmaceuticas que las comprenden y proceso para su preparacion |
| CO4940418A1 (es) | 1997-07-18 | 2000-07-24 | Novartis Ag | Modificacion de cristal de un derivado de n-fenil-2- pirimidinamina, procesos para su fabricacion y su uso |
| US6166037A (en) | 1997-08-28 | 2000-12-26 | Merck & Co., Inc. | Pyrrolidine and piperidine modulators of chemokine receptor activity |
| WO1999016766A1 (fr) | 1997-10-01 | 1999-04-08 | Kyowa Hakko Kogyo Co., Ltd. | Derives de benzodioxole |
| GB9721069D0 (en) | 1997-10-03 | 1997-12-03 | Pharmacia & Upjohn Spa | Polymeric derivatives of camptothecin |
| GB9723589D0 (en) | 1997-11-08 | 1998-01-07 | Glaxo Group Ltd | Chemical compounds |
| GB9723566D0 (en) | 1997-11-08 | 1998-01-07 | Glaxo Group Ltd | Chemical compounds |
| GB9723590D0 (en) | 1997-11-08 | 1998-01-07 | Glaxo Group Ltd | Chemical compounds |
| YU44900A (sh) | 1998-01-31 | 2003-01-31 | Glaxo Group Limited | Derivati 2-(purin-9-il)tetrahidrofuran-3,4-diola |
| CO4990969A1 (es) | 1998-02-14 | 2000-12-26 | Glaxo Group Ltd | Derivados de 2-(purin-9-il)-tetrahidrofuran-3,4-diol |
| US6194181B1 (en) | 1998-02-19 | 2001-02-27 | Novartis Ag | Fermentative preparation process for and crystal forms of cytostatics |
| NZ506742A (en) | 1998-02-25 | 2003-09-26 | Sloan Kettering Inst Cancer | Synthesis of desoxyepothilones and hydroxy acid derivative intermediates |
| DE69910213T2 (de) | 1998-06-23 | 2004-07-01 | Glaxo Group Ltd., Greenford | 2-(purin-9-yl)-tetrahydrofuran-3,4-diol derivate |
| GB9813565D0 (en) | 1998-06-23 | 1998-08-19 | Glaxo Group Ltd | Chemical compounds |
| GB9813535D0 (en) | 1998-06-23 | 1998-08-19 | Glaxo Group Ltd | Chemical compounds |
| GB9813540D0 (en) | 1998-06-23 | 1998-08-19 | Glaxo Group Ltd | Chemical compounds |
| BR9815931A (pt) | 1998-06-30 | 2001-02-20 | Dow Chemical Co | Polióis poliméricos, um processo para sua produção, e espuma de poliuretanoobtida |
| ATE459616T1 (de) | 1998-08-11 | 2010-03-15 | Novartis Ag | Isochinoline derivate mit angiogenesis-hemmender wirkung |
| US6346534B1 (en) | 1998-09-23 | 2002-02-12 | Neurocrine Biosciences, Inc. | Gonadotropin-releasing hormone receptor antagonists and methods relating thereto |
| BR9914526A (pt) | 1998-10-16 | 2001-07-03 | Pfizer | Derivados de adenina |
| UA71587C2 (uk) | 1998-11-10 | 2004-12-15 | Шерінг Акцієнгезелльшафт | Аміди антранілової кислоти та їхнє застосування як лікарських засобів |
| GB9824579D0 (en) | 1998-11-10 | 1999-01-06 | Novartis Ag | Organic compounds |
| NZ511722A (en) | 1998-11-20 | 2004-05-28 | Kosan Biosciences Inc | Recombinant methods and materials for producing epothilone and epothilone derivatives |
| IL143596A0 (en) | 1998-12-22 | 2002-04-21 | Genentech Inc | Vascular endothelial cell growth factor antagonists and uses thereof |
| BR0009507A (pt) | 1999-03-30 | 2002-01-15 | Novartis Ag | Derivados de ftalazina para o tratamento de doenças inflamatórias |
| GB9913083D0 (en) | 1999-06-04 | 1999-08-04 | Novartis Ag | Organic compounds |
| IL145742A0 (en) | 1999-05-04 | 2002-07-25 | Schering Corp | Piperidine derivatives useful as ccr5 antagonists |
| EP1632479B1 (en) | 1999-05-04 | 2011-01-12 | Schering Corporation | Pharmaceutical compositions comprising CCR5 antagonizing piperazine derivatives |
| YU25500A (sh) | 1999-05-11 | 2003-08-29 | Pfizer Products Inc. | Postupak za sintezu analoga nukleozida |
| GB9913932D0 (en) | 1999-06-15 | 1999-08-18 | Pfizer Ltd | Purine derivatives |
| US6322771B1 (en) | 1999-06-18 | 2001-11-27 | University Of Virginia Patent Foundation | Induction of pharmacological stress with adenosine receptor agonists |
| ES2165768B1 (es) | 1999-07-14 | 2003-04-01 | Almirall Prodesfarma Sa | Nuevos derivados de quinuclidina y composiciones farmaceuticas que los contienen. |
| PT1212089E (pt) | 1999-08-21 | 2006-08-31 | Altana Pharma Ag | Combinacao sinergica de roflumilast e salmeterol |
| CO5180581A1 (es) | 1999-09-30 | 2002-07-30 | Pfizer Prod Inc | Compuestos para el tratamiento de la isquemia ciones farmaceuticas que los contienen para el tratamiento de la isquemia |
| GB9924363D0 (en) | 1999-10-14 | 1999-12-15 | Pfizer Central Res | Purine derivatives |
| GB9924361D0 (en) | 1999-10-14 | 1999-12-15 | Pfizer Ltd | Purine derivatives |
| GB0003960D0 (en) | 2000-02-18 | 2000-04-12 | Pfizer Ltd | Purine derivatives |
| AU2001252609A1 (en) | 2000-04-27 | 2001-11-12 | Imperial Cancer Research Technology Ltd. | Imidazopyridine derivatives |
| TWI227240B (en) | 2000-06-06 | 2005-02-01 | Pfizer | 2-aminocarbonyl-9H-purine derivatives |
| PT1300407E (pt) | 2000-06-27 | 2004-05-31 | S A L V A T Lab Sa | Compostos carbamatos derivados de arilalquilaminas |
| GB0015727D0 (en) | 2000-06-27 | 2000-08-16 | Pfizer Ltd | Purine derivatives |
| GB0015876D0 (en) | 2000-06-28 | 2000-08-23 | Novartis Ag | Organic compounds |
| DE10038639A1 (de) | 2000-07-28 | 2002-02-21 | Schering Ag | Nichtsteroidale Entzündungshemmer |
| BRPI0113042B8 (pt) | 2000-08-05 | 2021-05-25 | Glaxo Group Ltd | composto da fórmula ou um seu solvato fisiologicamente aceitável, uso do mesmo, composição farmacêutica, formulação farmacêutica, método para o tratamento de um indivíduo humano ou animal com uma condição inflamatória e/ou alérgica, e, processo para preparar um composto ou um seu solvato |
| PE20020354A1 (es) | 2000-09-01 | 2002-06-12 | Novartis Ag | Compuestos de hidroxamato como inhibidores de histona-desacetilasa (hda) |
| GB0022695D0 (en) | 2000-09-15 | 2000-11-01 | Pfizer Ltd | Purine Derivatives |
| GB0028383D0 (en) | 2000-11-21 | 2001-01-03 | Novartis Ag | Organic compounds |
| DK1345937T3 (da) | 2000-12-22 | 2006-01-16 | Almirall Prodesfarma Ag | Quinuclidincarbamatderivater og deres anvendelse som M3-antagonister |
| EE05404B1 (et) | 2000-12-28 | 2011-04-15 | Almirall Prodesfarma Ag | Kinuklidiini derivaat, selle saamine ja kasutamine ravimi valmistamiseks, mis on ette nhtud respiratoorsete, kuseelundite v?i mao-soolte haiguste ravimiseks, ning seda sisaldav ravimkompositsioon |
| EP1241176A1 (en) | 2001-03-16 | 2002-09-18 | Pfizer Products Inc. | Purine derivatives for the treatment of ischemia |
| BR0209271A (pt) | 2001-04-30 | 2004-06-15 | Glaxo Group Ltd | Composto, uso de um composto composição farmacêutica, formulação em aerossol farmacêutica, método para o tratamento de um paciente humano ou animal com uma condição inflamatória e/ou alérgica, e, processo para a preparação de um composto |
| AR035885A1 (es) | 2001-05-14 | 2004-07-21 | Novartis Ag | Derivados de 4-amino-5-fenil-7-ciclobutilpirrolo (2,3-d)pirimidina, un proceso para su preparacion, una composicion farmaceutica y el uso de dichos derivados para la preparacion de una composicion farmaceutica |
| EP1395287A1 (en) | 2001-05-25 | 2004-03-10 | Pfizer Inc. | An adenosine a2a receptor agonist and an anticholinergic agent in combination for treating obstructive airways diseases |
| US20040248867A1 (en) | 2001-06-12 | 2004-12-09 | Keith Biggadike | Novel anti-inflammatory 17.alpha.-heterocyclic-esters of 17.beta.carbothioate androstane derivatives |
| DK2327767T3 (en) | 2001-06-21 | 2015-07-27 | Basf Enzymes Llc | nitrilases |
| GB0119249D0 (en) | 2001-08-07 | 2001-10-03 | Novartis Ag | Organic compounds |
| RU2004110717A (ru) | 2001-10-17 | 2005-10-20 | Юсиби, С.А. (Be) | Производные хинуклидина, способы их получения и их применение в качестве и нгибиторов м2- и/или м3- мускариновых рецепторов |
| GB0125259D0 (en) | 2001-10-20 | 2001-12-12 | Glaxo Group Ltd | Novel compounds |
| AR037517A1 (es) | 2001-11-05 | 2004-11-17 | Novartis Ag | Derivados de naftiridinas, un proceso para su preparacion, composicion farmaceutica y el uso de los mismos para la preparacion de un medicamento para el tratamiento de una enfermedad inflamatoria |
| AU2002356759A1 (en) | 2001-12-01 | 2003-06-17 | Glaxo Group Limited | 17.alpha. -cyclic esters of 16-methylpregnan-3,20-dione as anti-inflammatory agents |
| US7452904B2 (en) | 2001-12-20 | 2008-11-18 | Chiesi Farmaceutici S.P.A. | 1-alkyl-1-azoniabicyclo' 2.2.2 octane carbamate derivatives and their use as muscarinic receptor antagonists |
| AU2003202044A1 (en) | 2002-01-15 | 2003-09-09 | Glaxo Group Limited | 17.alpha-cycloalkyl/cycloylkenyl esters of alkyl-or haloalkyl-androst-4-en-3-on-11.beta.,17.alpha.-diol 17.beta.-carboxylates as anti-inflammatory agents |
| AU2003201693A1 (en) | 2002-01-21 | 2003-09-02 | Glaxo Group Limited | Non-aromatic 17.alpha.-esters of androstane-17.beta.-carboxylate esters as anti-inflammatory agents |
| GB0202216D0 (en) | 2002-01-31 | 2002-03-20 | Glaxo Group Ltd | Novel compounds |
| CN1633296A (zh) | 2002-03-26 | 2005-06-29 | 贝林格尔·英格海姆药物公司 | 糖皮质素模拟物、其制备方法、药物组合物及其用途 |
| ATE381336T1 (de) | 2002-04-10 | 2008-01-15 | Univ Virginia | Verwendung von a2a adenosin rezeptor agonisten und anti-pathogene mittel enthaltenden kombinationen zur behandlung von entzündungskrankheiten |
| ES2206021B1 (es) | 2002-04-16 | 2005-08-01 | Almirall Prodesfarma, S.A. | Nuevos derivados de pirrolidinio. |
| ES2201907B1 (es) | 2002-05-29 | 2005-06-01 | Almirall Prodesfarma, S.A. | Nuevos derivados de indolilpiperidina como potentes agentes antihistaminicos y antialergicos. |
| DE10224888A1 (de) | 2002-06-05 | 2003-12-24 | Merck Patent Gmbh | Pyridazinderivate |
| US7074806B2 (en) | 2002-06-06 | 2006-07-11 | Boehringer Ingelheim Pharmaceuticals, Inc. | Glucocorticoid mimetics, methods of making them, pharmaceutical compositions, and uses thereof |
| DE10225574A1 (de) | 2002-06-10 | 2003-12-18 | Merck Patent Gmbh | Aryloxime |
| DE10227269A1 (de) | 2002-06-19 | 2004-01-08 | Merck Patent Gmbh | Thiazolderivate |
| AU2003243870B2 (en) | 2002-06-25 | 2008-11-20 | Merck Frosst Canada Ltd | 8-(biaryl) quinoline PDE4 inhibitors |
| EP1519922A1 (en) | 2002-07-02 | 2005-04-06 | Merck Frosst Canada & Co. | Di-aryl-substituted ethane pyridone pde4 inhibitors |
| ES2204295B1 (es) | 2002-07-02 | 2005-08-01 | Almirall Prodesfarma, S.A. | Nuevos derivados de quinuclidina-amida. |
| EP1521733B1 (en) | 2002-07-08 | 2014-08-20 | Pfizer Products Inc. | Modulators of the glucocorticoid receptor |
| AR040962A1 (es) | 2002-08-09 | 2005-04-27 | Novartis Ag | Compuestos derivados de tiazol 1,3-2-ona, composicion farmaceutica y proceso de preparacion del compuesto |
| WO2004018450A1 (en) | 2002-08-10 | 2004-03-04 | Altana Pharma Ag | Piperidine-n-oxide-derivatives |
| WO2004018457A1 (en) | 2002-08-10 | 2004-03-04 | Altana Pharma Ag | Pyrrolidinedione substituted piperidine-phthalazones as pde4 inhibitors |
| US20060167001A1 (en) | 2002-08-10 | 2006-07-27 | Sterk Jan G | Pyridazinone-derivatives as pde4 inhibitors |
| WO2004018449A1 (en) | 2002-08-10 | 2004-03-04 | Altana Pharma Ag | Piperidine-derivatives as pde4 inhibitors |
| RS20050117A (en) | 2002-08-17 | 2007-06-04 | Altana Pharma Ag., | Novel benzonaphthyridines |
| EP1537086A2 (en) | 2002-08-17 | 2005-06-08 | ALTANA Pharma AG | Novel phenanthridines |
| SE0202483D0 (sv) | 2002-08-21 | 2002-08-21 | Astrazeneca Ab | Chemical compounds |
| US7288562B2 (en) | 2002-08-23 | 2007-10-30 | Ranbaxy Laboratories Limited | Fluoro and sulphonylamino containing 3,6-disubstituted azabicyclo (3.1.0) hexane derivatives as muscarinic receptor antagonists |
| ATE353217T1 (de) | 2002-08-29 | 2007-02-15 | Altana Pharma Ag | 3-hydroxy-6-phenylphenanthridine als pde-4 inhibitoren |
| JP4587294B2 (ja) | 2002-08-29 | 2010-11-24 | ニコメッド ゲゼルシャフト ミット ベシュレンクテル ハフツング | Pde4インヒビターとしての2−ヒドロキシ−6−フェニルフェナントリジン |
| JP2006096662A (ja) | 2002-09-18 | 2006-04-13 | Sumitomo Pharmaceut Co Ltd | 新規6−置換ウラシル誘導体及びアレルギー性疾患の治療剤 |
| CN1688577A (zh) | 2002-09-18 | 2005-10-26 | 小野药品工业株式会社 | 三氮杂螺[5.5]十一烷衍生物及以它为活性成分的药物 |
| JP2004107299A (ja) | 2002-09-20 | 2004-04-08 | Japan Energy Corp | 新規1−置換ウラシル誘導体及びアレルギー性疾患の治療剤 |
| DE10246374A1 (de) | 2002-10-04 | 2004-04-15 | Boehringer Ingelheim Pharma Gmbh & Co. Kg | Neue Betamimetika mit verlängerter Wirkungsdauer, Verfahren zu deren Herstellung und deren Verwendung als Arzneimittel |
| JP2006506379A (ja) | 2002-10-23 | 2006-02-23 | グレンマーク・ファーマシューティカルズ・リミテッド | 炎症性およびアレルギー性疾患の治療に有用な新規三環式化合物:その調製方法およびそれらを含む医薬組成物 |
| GB0225540D0 (en) | 2002-11-01 | 2002-12-11 | Glaxo Group Ltd | Medicinal compounds |
| GB0225535D0 (en) | 2002-11-01 | 2002-12-11 | Glaxo Group Ltd | Medicinal compounds |
| DE10253282A1 (de) | 2002-11-15 | 2004-05-27 | Boehringer Ingelheim Pharma Gmbh & Co. Kg | Neue Arzneimittel zur Behandlung von chronisch obstruktiver Lungenerkrankung |
| DE10253426B4 (de) | 2002-11-15 | 2005-09-22 | Elbion Ag | Neue Hydroxyindole, deren Verwendung als Inhibitoren der Phosphodiesterase 4 und Verfahren zu deren Herstellung |
| DE10253220A1 (de) | 2002-11-15 | 2004-05-27 | Boehringer Ingelheim Pharma Gmbh & Co. Kg | Neue Dihydroxy-Methyl-Phenyl-Derivate, Verfahren zu deren Herstellung und deren Verwendung als Arzneimittel |
| CA2514733A1 (en) | 2003-02-28 | 2004-09-16 | Transform Pharmaceuticals, Inc. | Pharmaceutical co-crystal compositions of drugs such as carbamazepine, celecoxib, olanzapine, itraconazole, topiramate, modafinil, 5-fluorouracil, hydrochlorothiazide, acetaminophen, aspirin, flurbiprofen, phenytoin and ibuprofen |
| BRPI0412003A (pt) | 2003-07-02 | 2006-08-15 | Sugen Inc | arilmetil triazol e imidazopirazinas como inibidores de c-met |
| US7122548B2 (en) | 2003-07-02 | 2006-10-17 | Sugen, Inc. | Triazolotriazine compounds and uses thereof |
| JP2007504243A (ja) | 2003-09-03 | 2007-03-01 | ニューロジェン・コーポレーション | 5−アリール−ピラゾロ[4,3−d]ピリミジン類、ピリジン類、ピラジン類及び関連化合物 |
| WO2006101456A1 (en) | 2005-03-21 | 2006-09-28 | S*Bio Pte Ltd | Bicyclic heterocycles hydroxamate compounds useful as histone deacetylase (hdac) inhibitors |
| US7572807B2 (en) | 2005-06-09 | 2009-08-11 | Bristol-Myers Squibb Company | Heteroaryl 11-beta-hydroxysteroid dehydrogenase type I inhibitors |
| WO2007013673A1 (en) | 2005-07-29 | 2007-02-01 | Astellas Pharma Inc. | Fused heterocycles as lck inhibitors |
| AU2006320580B2 (en) | 2005-11-30 | 2011-06-23 | Vertex Pharmaceuticals Incorporated | Inhibitors of c-Met and uses thereof |
| ME02736B (me) | 2005-12-21 | 2017-10-20 | Janssen Pharmaceutica Nv | Triazolopiridazini kao modulatori tirozin kinaze |
| EP2004693B1 (en) | 2006-03-30 | 2012-06-06 | Novartis AG | Compositions and methods of use for antibodies of c-met |
| NL2000613C2 (nl) * | 2006-05-11 | 2007-11-20 | Pfizer Prod Inc | Triazoolpyrazinederivaten. |
| JP2009538899A (ja) | 2006-05-30 | 2009-11-12 | ファイザー・プロダクツ・インク | トリアゾロピリダジン誘導体 |
| US7783272B2 (en) | 2006-06-29 | 2010-08-24 | Microtune (Texas), L.P. | Dynamic performance control of broadband tuner |
| WO2008003753A1 (en) | 2006-07-07 | 2008-01-10 | Biovitrum Ab (Publ) | Pyrazolo [1,5-a] pyrimidine analogs for use as inhibitors of stearoyl-coa desaturase (scd) activity |
| US8217177B2 (en) | 2006-07-14 | 2012-07-10 | Amgen Inc. | Fused heterocyclic derivatives and methods of use |
| PE20121506A1 (es) * | 2006-07-14 | 2012-11-26 | Amgen Inc | Compuestos triazolopiridinas como inhibidores de c-met |
| EP2084162B1 (en) | 2006-10-23 | 2012-09-12 | SGX Pharmaceuticals, Inc. | Bicyclic triazoles as protein kinase modulators |
| ES2393132T3 (es) | 2006-10-23 | 2012-12-18 | Sgx Pharmaceuticals, Inc. | Moduoladores de proteína quinasa de triazolopiridazina |
| EA026126B1 (ru) | 2006-11-22 | 2017-03-31 | Инсайт Холдингс Корпорейшн | Имидазотриазины и имидазопиримидины в качестве ингибиторов киназы |
| JP2010522716A (ja) | 2007-03-28 | 2010-07-08 | イノバシア・アクチボラゲット | ステアロイル−CoAデサチュラーゼのインヒビターとしてのピラゾロ[1,5−A]ピリミジン |
| MX2009012623A (es) | 2007-05-21 | 2009-12-11 | Sgx Pharmaceuticals Inc | Moduladores de cinasa heterociclicos. |
| JP5488778B2 (ja) | 2007-07-02 | 2014-05-14 | 日産化学工業株式会社 | 放出制御される粒状物および該粒状物を含む固型農薬製剤 |
| MX2010009414A (es) | 2008-02-28 | 2010-09-24 | Novartis Ag | Derivados de imidazo-[1,2-b]-piridazina para el tratamiento de enfermedad mediada por cinasa de tirosina c-met. |
| US8389526B2 (en) | 2009-08-07 | 2013-03-05 | Novartis Ag | 3-heteroarylmethyl-imidazo[1,2-b]pyridazin-6-yl derivatives |
| CA2771432A1 (en) | 2009-08-20 | 2011-02-24 | Novartis Ag | Heterocyclic oxime compounds |
-
2010
- 2010-08-10 EP EP10744553A patent/EP2464649A1/en not_active Withdrawn
- 2010-08-10 KR KR1020127006238A patent/KR20120089643A/ko not_active Application Discontinuation
- 2010-08-10 MX MX2012001838A patent/MX2012001838A/es not_active Application Discontinuation
- 2010-08-10 EA EA201200260A patent/EA201200260A1/ru unknown
- 2010-08-10 BR BR112012003262A patent/BR112012003262A8/pt not_active Application Discontinuation
- 2010-08-10 CA CA2770873A patent/CA2770873A1/en not_active Abandoned
- 2010-08-10 US US13/389,912 patent/US8497368B2/en not_active Expired - Fee Related
- 2010-08-10 JP JP2012524218A patent/JP5781510B2/ja not_active Expired - Fee Related
- 2010-08-10 AU AU2010283806A patent/AU2010283806A1/en not_active Abandoned
- 2010-08-10 WO PCT/EP2010/061609 patent/WO2011018454A1/en active Application Filing
Also Published As
| Publication number | Publication date |
|---|---|
| JP2013501749A (ja) | 2013-01-17 |
| BR112012003262A2 (pt) | 2016-03-01 |
| BR112012003262A8 (pt) | 2016-05-17 |
| EP2464649A1 (en) | 2012-06-20 |
| AU2010283806A1 (en) | 2012-03-01 |
| WO2011018454A1 (en) | 2011-02-17 |
| US20120142681A1 (en) | 2012-06-07 |
| US8497368B2 (en) | 2013-07-30 |
| CA2770873A1 (en) | 2011-02-17 |
| EA201200260A1 (ru) | 2012-09-28 |
| JP5781510B2 (ja) | 2015-09-24 |
| MX2012001838A (es) | 2012-02-29 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP5781510B2 (ja) | ヘテロ環式ヒドラゾン化合物および癌および炎症の処置のためのそれらの使用 | |
| JP5775871B2 (ja) | ヘテロ環式オキシム化合物 | |
| US8822468B2 (en) | 3-Methyl-imidazo[1,2-b]pyridazine derivatives | |
| TWI383982B (zh) | 作為脂激酶抑制劑之咪唑喹啉 | |
| US9474762B2 (en) | Triazolopyridine compounds | |
| KR20100019489A (ko) | Pi3k 지질 키나제 억제제로서의 치환된 이미다조피리다진 | |
| EP2462143B1 (en) | 3-heteroarylmethyl-imidazo[1,2-b]pyridazin-6-yl derivatives as c-met tyrosine kinase modulators | |
| CN102548995B (zh) | 杂环腙化合物以及它们治疗癌症和炎症的用途 | |
| US20130324526A1 (en) | [1,2,4] triazolo [4,3-b] pyridazine compounds as inhibitors of the c-met tyrosine kinase |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| WITN | Application deemed withdrawn, e.g. because no request for examination was filed or no examination fee was paid |