KR101843201B1 - 인광성 에미터 - Google Patents
인광성 에미터 Download PDFInfo
- Publication number
- KR101843201B1 KR101843201B1 KR1020117012696A KR20117012696A KR101843201B1 KR 101843201 B1 KR101843201 B1 KR 101843201B1 KR 1020117012696 A KR1020117012696 A KR 1020117012696A KR 20117012696 A KR20117012696 A KR 20117012696A KR 101843201 B1 KR101843201 B1 KR 101843201B1
- Authority
- KR
- South Korea
- Prior art keywords
- group
- compound
- aryl
- heteroaryl
- substituted
- Prior art date
Links
- 150000001875 compounds Chemical class 0.000 claims abstract description 128
- 239000003446 ligand Substances 0.000 claims abstract description 76
- 239000002019 doping agent Substances 0.000 claims abstract description 22
- 239000010410 layer Substances 0.000 claims description 72
- 125000001072 heteroaryl group Chemical group 0.000 claims description 28
- 125000003118 aryl group Chemical group 0.000 claims description 26
- 239000012044 organic layer Substances 0.000 claims description 26
- 229910052739 hydrogen Inorganic materials 0.000 claims description 24
- 239000001257 hydrogen Substances 0.000 claims description 24
- 125000000217 alkyl group Chemical group 0.000 claims description 17
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 claims description 15
- 125000001424 substituent group Chemical group 0.000 claims description 15
- 125000003107 substituted aryl group Chemical group 0.000 claims description 11
- 150000002431 hydrogen Chemical class 0.000 claims description 9
- 238000000034 method Methods 0.000 claims description 9
- 125000004404 heteroalkyl group Chemical group 0.000 claims description 8
- 125000003342 alkenyl group Chemical group 0.000 claims description 3
- 125000000304 alkynyl group Chemical group 0.000 claims description 3
- 125000003710 aryl alkyl group Chemical group 0.000 claims description 3
- 125000003545 alkoxy group Chemical group 0.000 claims description 2
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 claims description 2
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 claims description 2
- 230000011664 signaling Effects 0.000 claims description 2
- 125000005580 triphenylene group Chemical group 0.000 claims description 2
- 150000002504 iridium compounds Chemical class 0.000 claims 3
- VQGHOUODWALEFC-UHFFFAOYSA-N 2-phenylpyridine Chemical compound C1=CC=CC=C1C1=CC=CC=N1 VQGHOUODWALEFC-UHFFFAOYSA-N 0.000 abstract description 37
- DWYHDSLIWMUSOO-UHFFFAOYSA-N 2-phenyl-1h-benzimidazole Chemical compound C1=CC=CC=C1C1=NC2=CC=CC=C2N1 DWYHDSLIWMUSOO-UHFFFAOYSA-N 0.000 abstract description 17
- JVZRCNQLWOELDU-UHFFFAOYSA-N gamma-Phenylpyridine Natural products C1=CC=CC=C1C1=CC=NC=C1 JVZRCNQLWOELDU-UHFFFAOYSA-N 0.000 abstract description 17
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 69
- 239000000463 material Substances 0.000 description 53
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 33
- 239000000047 product Substances 0.000 description 33
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 30
- 239000000203 mixture Substances 0.000 description 24
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 21
- 230000015572 biosynthetic process Effects 0.000 description 21
- 229910052757 nitrogen Inorganic materials 0.000 description 21
- 238000003786 synthesis reaction Methods 0.000 description 21
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 20
- 238000010992 reflux Methods 0.000 description 17
- 239000000243 solution Substances 0.000 description 17
- 238000004440 column chromatography Methods 0.000 description 13
- 238000000859 sublimation Methods 0.000 description 12
- 230000008022 sublimation Effects 0.000 description 12
- 238000001816 cooling Methods 0.000 description 11
- 238000004770 highest occupied molecular orbital Methods 0.000 description 11
- 238000004768 lowest unoccupied molecular orbital Methods 0.000 description 11
- 150000003384 small molecules Chemical class 0.000 description 11
- 229920006395 saturated elastomer Polymers 0.000 description 10
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 9
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 9
- 238000001914 filtration Methods 0.000 description 9
- 239000002244 precipitate Substances 0.000 description 9
- 238000000746 purification Methods 0.000 description 9
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 8
- HUMNYLRZRPPJDN-UHFFFAOYSA-N benzaldehyde Chemical compound O=CC1=CC=CC=C1 HUMNYLRZRPPJDN-UHFFFAOYSA-N 0.000 description 8
- 235000019646 color tone Nutrition 0.000 description 8
- 239000003480 eluent Substances 0.000 description 8
- 239000002904 solvent Substances 0.000 description 8
- HYZJCKYKOHLVJF-UHFFFAOYSA-N 1H-benzimidazole Chemical compound C1=CC=C2NC=NC2=C1 HYZJCKYKOHLVJF-UHFFFAOYSA-N 0.000 description 7
- 238000000295 emission spectrum Methods 0.000 description 7
- 239000000758 substrate Substances 0.000 description 7
- KDLHZDBZIXYQEI-UHFFFAOYSA-N Palladium Chemical compound [Pd] KDLHZDBZIXYQEI-UHFFFAOYSA-N 0.000 description 6
- 229940126214 compound 3 Drugs 0.000 description 6
- 238000000151 deposition Methods 0.000 description 6
- 238000002347 injection Methods 0.000 description 6
- 239000007924 injection Substances 0.000 description 6
- 239000011368 organic material Substances 0.000 description 6
- NROKBHXJSPEDAR-UHFFFAOYSA-M potassium fluoride Chemical compound [F-].[K+] NROKBHXJSPEDAR-UHFFFAOYSA-M 0.000 description 6
- LVTJOONKWUXEFR-FZRMHRINSA-N protoneodioscin Natural products O(C[C@@H](CC[C@]1(O)[C@H](C)[C@@H]2[C@]3(C)[C@H]([C@H]4[C@@H]([C@]5(C)C(=CC4)C[C@@H](O[C@@H]4[C@H](O[C@H]6[C@@H](O)[C@@H](O)[C@@H](O)[C@H](C)O6)[C@@H](O)[C@H](O[C@H]6[C@@H](O)[C@@H](O)[C@@H](O)[C@H](C)O6)[C@H](CO)O4)CC5)CC3)C[C@@H]2O1)C)[C@H]1[C@H](O)[C@H](O)[C@H](O)[C@@H](CO)O1 LVTJOONKWUXEFR-FZRMHRINSA-N 0.000 description 6
- 0 CC**1C(C2=CC=C*(*CC)C=C2CC2(*)CC)=*2c2c1cccc2 Chemical compound CC**1C(C2=CC=C*(*CC)C=C2CC2(*)CC)=*2c2c1cccc2 0.000 description 5
- 230000000052 comparative effect Effects 0.000 description 5
- 239000000412 dendrimer Substances 0.000 description 5
- 229920000736 dendritic polymer Polymers 0.000 description 5
- 230000005525 hole transport Effects 0.000 description 5
- 238000004519 manufacturing process Methods 0.000 description 5
- 230000005693 optoelectronics Effects 0.000 description 5
- 239000011541 reaction mixture Substances 0.000 description 5
- 230000000903 blocking effect Effects 0.000 description 4
- 229910052799 carbon Inorganic materials 0.000 description 4
- RBTARNINKXHZNM-UHFFFAOYSA-K iron trichloride Chemical compound Cl[Fe](Cl)Cl RBTARNINKXHZNM-UHFFFAOYSA-K 0.000 description 4
- QNGNSVIICDLXHT-UHFFFAOYSA-N para-ethylbenzaldehyde Natural products CCC1=CC=C(C=O)C=C1 QNGNSVIICDLXHT-UHFFFAOYSA-N 0.000 description 4
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 4
- ZLGVZKQXZYQJSM-UHFFFAOYSA-N 1,2-diphenylbenzimidazole Chemical compound C1=CC=CC=C1C1=NC2=CC=CC=C2N1C1=CC=CC=C1 ZLGVZKQXZYQJSM-UHFFFAOYSA-N 0.000 description 3
- PWKNBLFSJAVFAB-UHFFFAOYSA-N 1-fluoro-2-nitrobenzene Chemical compound [O-][N+](=O)C1=CC=CC=C1F PWKNBLFSJAVFAB-UHFFFAOYSA-N 0.000 description 3
- 229910021578 Iron(III) chloride Inorganic materials 0.000 description 3
- 230000004888 barrier function Effects 0.000 description 3
- 239000003054 catalyst Substances 0.000 description 3
- 230000007246 mechanism Effects 0.000 description 3
- 229910052751 metal Inorganic materials 0.000 description 3
- 239000002184 metal Substances 0.000 description 3
- 229920000642 polymer Polymers 0.000 description 3
- 235000003270 potassium fluoride Nutrition 0.000 description 3
- 239000011698 potassium fluoride Substances 0.000 description 3
- 239000000741 silica gel Substances 0.000 description 3
- 229910002027 silica gel Inorganic materials 0.000 description 3
- 239000007787 solid Substances 0.000 description 3
- 238000002207 thermal evaporation Methods 0.000 description 3
- GEYOCULIXLDCMW-UHFFFAOYSA-N 1,2-phenylenediamine Chemical compound NC1=CC=CC=C1N GEYOCULIXLDCMW-UHFFFAOYSA-N 0.000 description 2
- SQPHXIODKFYQNR-UHFFFAOYSA-N 2-n-[2,6-di(propan-2-yl)phenyl]benzene-1,2-diamine Chemical compound CC(C)C1=CC=CC(C(C)C)=C1NC1=CC=CC=C1N SQPHXIODKFYQNR-UHFFFAOYSA-N 0.000 description 2
- QGQCJZWACCDMTC-UHFFFAOYSA-N 2-phenyl-1-(2-phenylphenyl)benzimidazole Chemical compound C1=CC=CC=C1C1=NC2=CC=CC=C2N1C1=CC=CC=C1C1=CC=CC=C1 QGQCJZWACCDMTC-UHFFFAOYSA-N 0.000 description 2
- BWGRDBSNKQABCB-UHFFFAOYSA-N 4,4-difluoro-N-[3-[3-(3-methyl-5-propan-2-yl-1,2,4-triazol-4-yl)-8-azabicyclo[3.2.1]octan-8-yl]-1-thiophen-2-ylpropyl]cyclohexane-1-carboxamide Chemical compound CC(C)C1=NN=C(C)N1C1CC2CCC(C1)N2CCC(NC(=O)C1CCC(F)(F)CC1)C1=CC=CS1 BWGRDBSNKQABCB-UHFFFAOYSA-N 0.000 description 2
- 229940126062 Compound A Drugs 0.000 description 2
- NLDMNSXOCDLTTB-UHFFFAOYSA-N Heterophylliin A Natural products O1C2COC(=O)C3=CC(O)=C(O)C(O)=C3C3=C(O)C(O)=C(O)C=C3C(=O)OC2C(OC(=O)C=2C=C(O)C(O)=C(O)C=2)C(O)C1OC(=O)C1=CC(O)=C(O)C(O)=C1 NLDMNSXOCDLTTB-UHFFFAOYSA-N 0.000 description 2
- CSNNHWWHGAXBCP-UHFFFAOYSA-L Magnesium sulfate Chemical compound [Mg+2].[O-][S+2]([O-])([O-])[O-] CSNNHWWHGAXBCP-UHFFFAOYSA-L 0.000 description 2
- LFZAGIJXANFPFN-UHFFFAOYSA-N N-[3-[4-(3-methyl-5-propan-2-yl-1,2,4-triazol-4-yl)piperidin-1-yl]-1-thiophen-2-ylpropyl]acetamide Chemical compound C(C)(C)C1=NN=C(N1C1CCN(CC1)CCC(C=1SC=CC=1)NC(C)=O)C LFZAGIJXANFPFN-UHFFFAOYSA-N 0.000 description 2
- 230000008901 benefit Effects 0.000 description 2
- 238000006243 chemical reaction Methods 0.000 description 2
- 230000021615 conjugation Effects 0.000 description 2
- 239000012043 crude product Substances 0.000 description 2
- -1 electrodes Substances 0.000 description 2
- 230000002349 favourable effect Effects 0.000 description 2
- 239000000706 filtrate Substances 0.000 description 2
- 239000011521 glass Substances 0.000 description 2
- 238000005984 hydrogenation reaction Methods 0.000 description 2
- KKVCQQVPYMSIRI-UHFFFAOYSA-N n-(2-nitrophenyl)-2-propan-2-ylaniline Chemical compound CC(C)C1=CC=CC=C1NC1=CC=CC=C1[N+]([O-])=O KKVCQQVPYMSIRI-UHFFFAOYSA-N 0.000 description 2
- 229910052760 oxygen Inorganic materials 0.000 description 2
- 238000000059 patterning Methods 0.000 description 2
- 238000005424 photoluminescence Methods 0.000 description 2
- 239000004033 plastic Substances 0.000 description 2
- 239000011241 protective layer Substances 0.000 description 2
- 238000001953 recrystallisation Methods 0.000 description 2
- 239000000126 substance Substances 0.000 description 2
- YDVALELYYSENFN-UHFFFAOYSA-N 1-(2,2-dimethylpropyl)-2-phenylbenzimidazole Chemical compound N=1C2=CC=CC=C2N(CC(C)(C)C)C=1C1=CC=CC=C1 YDVALELYYSENFN-UHFFFAOYSA-N 0.000 description 1
- MISCLPZYFYRLOZ-UHFFFAOYSA-N 1-(2-propan-2-ylphenyl)cyclohexa-3,5-diene-1,2-diamine Chemical compound C(C)(C)C1=C(C=CC=C1)C1(C(C=CC=C1)N)N MISCLPZYFYRLOZ-UHFFFAOYSA-N 0.000 description 1
- HDGKECNHQTVLTQ-UHFFFAOYSA-N 1-(2-propan-2-ylphenyl)ethanol Chemical compound CC(C)C1=CC=CC=C1C(C)O HDGKECNHQTVLTQ-UHFFFAOYSA-N 0.000 description 1
- ZXBAOQTZRMQRGD-UHFFFAOYSA-N 1-[2,6-di(propan-2-yl)phenyl]-2-phenylbenzimidazole Chemical compound CC(C)C1=CC=CC(C(C)C)=C1N1C2=CC=CC=C2N=C1C1=CC=CC=C1 ZXBAOQTZRMQRGD-UHFFFAOYSA-N 0.000 description 1
- GEGLCBTXYBXOJA-UHFFFAOYSA-N 1-methoxyethanol Chemical compound COC(C)O GEGLCBTXYBXOJA-UHFFFAOYSA-N 0.000 description 1
- MOSQXYPUMBJMRR-UHFFFAOYSA-N 2,5-diphenylpyridine Chemical compound C1=CC=CC=C1C1=CC=C(C=2C=CC=CC=2)N=C1 MOSQXYPUMBJMRR-UHFFFAOYSA-N 0.000 description 1
- WKBALTUBRZPIPZ-UHFFFAOYSA-N 2,6-di(propan-2-yl)aniline Chemical compound CC(C)C1=CC=CC(C(C)C)=C1N WKBALTUBRZPIPZ-UHFFFAOYSA-N 0.000 description 1
- QWVOHJGKYCTVIR-UHFFFAOYSA-N 2-(3-phenylphenyl)pyridine Chemical compound C1=CC=CC=C1C1=CC=CC(C=2N=CC=CC=2)=C1 QWVOHJGKYCTVIR-UHFFFAOYSA-N 0.000 description 1
- YKOLZVXSPGIIBJ-UHFFFAOYSA-N 2-Isopropylaniline Chemical compound CC(C)C1=CC=CC=C1N YKOLZVXSPGIIBJ-UHFFFAOYSA-N 0.000 description 1
- ZNQVEEAIQZEUHB-UHFFFAOYSA-N 2-ethoxyethanol Chemical compound CCOCCO ZNQVEEAIQZEUHB-UHFFFAOYSA-N 0.000 description 1
- 229940093475 2-ethoxyethanol Drugs 0.000 description 1
- XVOKRPINHSZVMW-UHFFFAOYSA-N 2-n-(2-phenylphenyl)benzene-1,2-diamine Chemical compound NC1=CC=CC=C1NC1=CC=CC=C1C1=CC=CC=C1 XVOKRPINHSZVMW-UHFFFAOYSA-N 0.000 description 1
- NFCPRRWCTNLGSN-UHFFFAOYSA-N 2-n-phenylbenzene-1,2-diamine Chemical compound NC1=CC=CC=C1NC1=CC=CC=C1 NFCPRRWCTNLGSN-UHFFFAOYSA-N 0.000 description 1
- YLOGPYFDJZZZTB-UHFFFAOYSA-N 2-phenyl-1-(2-propan-2-ylphenyl)benzimidazole Chemical compound CC(C)C1=CC=CC=C1N1C2=CC=CC=C2N=C1C1=CC=CC=C1 YLOGPYFDJZZZTB-UHFFFAOYSA-N 0.000 description 1
- TWBPWBPGNQWFSJ-UHFFFAOYSA-N 2-phenylaniline Chemical group NC1=CC=CC=C1C1=CC=CC=C1 TWBPWBPGNQWFSJ-UHFFFAOYSA-N 0.000 description 1
- WDBQJSCPCGTAFG-QHCPKHFHSA-N 4,4-difluoro-N-[(1S)-3-[4-(3-methyl-5-propan-2-yl-1,2,4-triazol-4-yl)piperidin-1-yl]-1-pyridin-3-ylpropyl]cyclohexane-1-carboxamide Chemical compound FC1(CCC(CC1)C(=O)N[C@@H](CCN1CCC(CC1)N1C(=NN=C1C)C(C)C)C=1C=NC=CC=1)F WDBQJSCPCGTAFG-QHCPKHFHSA-N 0.000 description 1
- DHDHJYNTEFLIHY-UHFFFAOYSA-N 4,7-diphenyl-1,10-phenanthroline Chemical group C1=CC=CC=C1C1=CC=NC2=C1C=CC1=C(C=3C=CC=CC=3)C=CN=C21 DHDHJYNTEFLIHY-UHFFFAOYSA-N 0.000 description 1
- RGWJAQMYOVSKIE-XFQLMFQHSA-N C/C=C\c1c(C)nc(-c2ccccc2)[n]1-c(c(-c1ccccc1)cc(-c1ccccc1)c1)c1-c1ccccc1 Chemical compound C/C=C\c1c(C)nc(-c2ccccc2)[n]1-c(c(-c1ccccc1)cc(-c1ccccc1)c1)c1-c1ccccc1 RGWJAQMYOVSKIE-XFQLMFQHSA-N 0.000 description 1
- NHQOWIMGZJPZJR-UHFFFAOYSA-N CC(C)(C)Cc(cccc1)c1-[n]1c(-c2ccccc2)nc2ccccc12 Chemical compound CC(C)(C)Cc(cccc1)c1-[n]1c(-c2ccccc2)nc2ccccc12 NHQOWIMGZJPZJR-UHFFFAOYSA-N 0.000 description 1
- BALAFHCQDIRRBH-UHFFFAOYSA-N CC(C)(C)Cc(cccc1CC(C)(C)C)c1-[n]1c(-c2ccccc2)nc2c1cccc2 Chemical compound CC(C)(C)Cc(cccc1CC(C)(C)C)c1-[n]1c(-c2ccccc2)nc2c1cccc2 BALAFHCQDIRRBH-UHFFFAOYSA-N 0.000 description 1
- BAYXHADSPCFXHC-UHFFFAOYSA-N CC(C)CC(CCC=C1)=C1[n]1c(-c2ccccc2)nc2ccccc12 Chemical compound CC(C)CC(CCC=C1)=C1[n]1c(-c2ccccc2)nc2ccccc12 BAYXHADSPCFXHC-UHFFFAOYSA-N 0.000 description 1
- SNPPEWCENGPTNW-UHFFFAOYSA-N CC(C)Cc(cccc1CC(C)C)c1-[n]1c(-c2ccccc2)nc2c1cccc2 Chemical compound CC(C)Cc(cccc1CC(C)C)c1-[n]1c(-c2ccccc2)nc2c1cccc2 SNPPEWCENGPTNW-UHFFFAOYSA-N 0.000 description 1
- NOLWRNVTPFQMIG-UHFFFAOYSA-N CC(C)c(cc(cc1C2C)-c3ccccc3)c1-[n]1c(-c3ccccc3)nc3cccc2c13 Chemical compound CC(C)c(cc(cc1C2C)-c3ccccc3)c1-[n]1c(-c3ccccc3)nc3cccc2c13 NOLWRNVTPFQMIG-UHFFFAOYSA-N 0.000 description 1
- BLNCEANQTPSOTO-UHFFFAOYSA-N CC(C)c(cc1C2C)cc(C(C)C)c1-[n]1c(-c3ccccc3)nc3cccc2c13 Chemical compound CC(C)c(cc1C2C)cc(C(C)C)c1-[n]1c(-c3ccccc3)nc3cccc2c13 BLNCEANQTPSOTO-UHFFFAOYSA-N 0.000 description 1
- DGRCTYITVZVHST-UHFFFAOYSA-N CC(C)c(cccc1C2C)c1-[n]1c(-c3ccccc3)nc3cccc2c13 Chemical compound CC(C)c(cccc1C2C)c1-[n]1c(-c3ccccc3)nc3cccc2c13 DGRCTYITVZVHST-UHFFFAOYSA-N 0.000 description 1
- BFYODLQSPUFALU-UHFFFAOYSA-N CC(C=CCC1)=C1[n]1c(-c2ccccc2)nc2ccccc12 Chemical compound CC(C=CCC1)=C1[n]1c(-c2ccccc2)nc2ccccc12 BFYODLQSPUFALU-UHFFFAOYSA-N 0.000 description 1
- HCVKIUJAEWSQLH-UHFFFAOYSA-N CC(CCC=C1C)=C1[n]1c(-c2ccccc2)nc2c1ccc(Cc1cccc(-c3cccc(-c4ccccc4)c3-[n]3c(-c4ccccc4)nc4c3cccc4)c1)c2 Chemical compound CC(CCC=C1C)=C1[n]1c(-c2ccccc2)nc2c1ccc(Cc1cccc(-c3cccc(-c4ccccc4)c3-[n]3c(-c4ccccc4)nc4c3cccc4)c1)c2 HCVKIUJAEWSQLH-UHFFFAOYSA-N 0.000 description 1
- IQDRTWZZGQBNLU-CQSZACIVSA-N C[C@@H]1c(cccc2)c2-[n]2c(-c3ccccc3)nc3cccc1c23 Chemical compound C[C@@H]1c(cccc2)c2-[n]2c(-c3ccccc3)nc3cccc1c23 IQDRTWZZGQBNLU-CQSZACIVSA-N 0.000 description 1
- FCVCNSKCWFLGBO-UHFFFAOYSA-N Cc(cc1)cc(nc2c(cccc3)c3c3c4)c1[n]2c3c(C)cc4-c1ccccc1 Chemical compound Cc(cc1)cc(nc2c(cccc3)c3c3c4)c1[n]2c3c(C)cc4-c1ccccc1 FCVCNSKCWFLGBO-UHFFFAOYSA-N 0.000 description 1
- PZXTWVMIRRITGH-UHFFFAOYSA-N Cc(cc1C)cc(C)c1-[n]1c(-c2ccccc2)nc2c1cccc2 Chemical compound Cc(cc1C)cc(C)c1-[n]1c(-c2ccccc2)nc2c1cccc2 PZXTWVMIRRITGH-UHFFFAOYSA-N 0.000 description 1
- XASVOMJLVKRWGZ-UHFFFAOYSA-N Cc(cc1nc2-c3ccccc3)ccc1[n]2-c1c(C)cccc1 Chemical compound Cc(cc1nc2-c3ccccc3)ccc1[n]2-c1c(C)cccc1 XASVOMJLVKRWGZ-UHFFFAOYSA-N 0.000 description 1
- SZFKYLYARHXUSE-UHFFFAOYSA-N Cc(cccc1C)c1-[n]1c(-c2ccccc2)nc2c1cccc2 Chemical compound Cc(cccc1C)c1-[n]1c(-c2ccccc2)nc2c1cccc2 SZFKYLYARHXUSE-UHFFFAOYSA-N 0.000 description 1
- IFBMHOADCFAVKO-UHFFFAOYSA-N Cc1cc(-c2ccccc2)cc(C)c1-[n]1c(-c2ccccc2)nc2ccccc12 Chemical compound Cc1cc(-c2ccccc2)cc(C)c1-[n]1c(-c2ccccc2)nc2ccccc12 IFBMHOADCFAVKO-UHFFFAOYSA-N 0.000 description 1
- AHFXDBOYINBTJK-UHFFFAOYSA-N Cc1ccc2[n]3c(c(C)cc(C)c4)c4c(cccc4)c4c3nc2c1 Chemical compound Cc1ccc2[n]3c(c(C)cc(C)c4)c4c(cccc4)c4c3nc2c1 AHFXDBOYINBTJK-UHFFFAOYSA-N 0.000 description 1
- NUGPIZCTELGDOS-QHCPKHFHSA-N N-[(1S)-3-[4-(3-methyl-5-propan-2-yl-1,2,4-triazol-4-yl)piperidin-1-yl]-1-pyridin-3-ylpropyl]cyclopentanecarboxamide Chemical compound C(C)(C)C1=NN=C(N1C1CCN(CC1)CC[C@@H](C=1C=NC=CC=1)NC(=O)C1CCCC1)C NUGPIZCTELGDOS-QHCPKHFHSA-N 0.000 description 1
- MKNMGYWHEJCQQL-UHFFFAOYSA-N N-[6,6-di(propan-2-yl)cyclohexa-2,4-dien-1-yl]-2-nitroaniline Chemical compound C(C)(C)C1(C(NC2=C(C=CC=C2)[N+](=O)[O-])C=CC=C1)C(C)C MKNMGYWHEJCQQL-UHFFFAOYSA-N 0.000 description 1
- 239000004693 Polybenzimidazole Substances 0.000 description 1
- 230000009286 beneficial effect Effects 0.000 description 1
- 125000003785 benzimidazolyl group Chemical group N1=C(NC2=C1C=CC=C2)* 0.000 description 1
- 125000006269 biphenyl-2-yl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C1=C(*)C([H])=C([H])C([H])=C1[H] 0.000 description 1
- 238000004364 calculation method Methods 0.000 description 1
- 230000008859 change Effects 0.000 description 1
- 125000003636 chemical group Chemical group 0.000 description 1
- 229940125904 compound 1 Drugs 0.000 description 1
- 238000010168 coupling process Methods 0.000 description 1
- 238000005859 coupling reaction Methods 0.000 description 1
- 125000000753 cycloalkyl group Chemical group 0.000 description 1
- 230000008021 deposition Effects 0.000 description 1
- 230000000694 effects Effects 0.000 description 1
- 230000002708 enhancing effect Effects 0.000 description 1
- 239000003822 epoxy resin Substances 0.000 description 1
- 229910052736 halogen Inorganic materials 0.000 description 1
- 125000005843 halogen group Chemical group 0.000 description 1
- 150000002367 halogens Chemical class 0.000 description 1
- 125000005842 heteroatom Chemical group 0.000 description 1
- 125000000623 heterocyclic group Chemical group 0.000 description 1
- 239000007943 implant Substances 0.000 description 1
- PSCMQHVBLHHWTO-UHFFFAOYSA-K indium(iii) chloride Chemical compound Cl[In](Cl)Cl PSCMQHVBLHHWTO-UHFFFAOYSA-K 0.000 description 1
- AMGQUBHHOARCQH-UHFFFAOYSA-N indium;oxotin Chemical compound [In].[Sn]=O AMGQUBHHOARCQH-UHFFFAOYSA-N 0.000 description 1
- 230000003993 interaction Effects 0.000 description 1
- UEEXRMUCXBPYOV-UHFFFAOYSA-N iridium;2-phenylpyridine Chemical group [Ir].C1=CC=CC=C1C1=CC=CC=N1.C1=CC=CC=C1C1=CC=CC=N1.C1=CC=CC=C1C1=CC=CC=N1 UEEXRMUCXBPYOV-UHFFFAOYSA-N 0.000 description 1
- 125000000959 isobutyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])* 0.000 description 1
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 1
- 239000007788 liquid Substances 0.000 description 1
- 239000011777 magnesium Substances 0.000 description 1
- 229910052943 magnesium sulfate Inorganic materials 0.000 description 1
- 235000019341 magnesium sulphate Nutrition 0.000 description 1
- PPPCBPFYSCMIMV-UHFFFAOYSA-N n-(2-nitrophenyl)-2,6-di(propan-2-yl)aniline Chemical compound CC(C)C1=CC=CC(C(C)C)=C1NC1=CC=CC=C1[N+]([O-])=O PPPCBPFYSCMIMV-UHFFFAOYSA-N 0.000 description 1
- MQBSMSNMCXDRLS-UHFFFAOYSA-N n-(2-nitrophenyl)-2-phenylaniline Chemical compound [O-][N+](=O)C1=CC=CC=C1NC1=CC=CC=C1C1=CC=CC=C1 MQBSMSNMCXDRLS-UHFFFAOYSA-N 0.000 description 1
- IBHBKWKFFTZAHE-UHFFFAOYSA-N n-[4-[4-(n-naphthalen-1-ylanilino)phenyl]phenyl]-n-phenylnaphthalen-1-amine Chemical group C1=CC=CC=C1N(C=1C2=CC=CC=C2C=CC=1)C1=CC=C(C=2C=CC(=CC=2)N(C=2C=CC=CC=2)C=2C3=CC=CC=C3C=CC=2)C=C1 IBHBKWKFFTZAHE-UHFFFAOYSA-N 0.000 description 1
- QJGQUHMNIGDVPM-UHFFFAOYSA-N nitrogen group Chemical group [N] QJGQUHMNIGDVPM-UHFFFAOYSA-N 0.000 description 1
- 238000013086 organic photovoltaic Methods 0.000 description 1
- 230000010355 oscillation Effects 0.000 description 1
- AICOOMRHRUFYCM-ZRRPKQBOSA-N oxazine, 1 Chemical compound C([C@@H]1[C@H](C(C[C@]2(C)[C@@H]([C@H](C)N(C)C)[C@H](O)C[C@]21C)=O)CC1=CC2)C[C@H]1[C@@]1(C)[C@H]2N=C(C(C)C)OC1 AICOOMRHRUFYCM-ZRRPKQBOSA-N 0.000 description 1
- 238000012856 packing Methods 0.000 description 1
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 description 1
- 238000000103 photoluminescence spectrum Methods 0.000 description 1
- 229920002480 polybenzimidazole Polymers 0.000 description 1
- 229920000647 polyepoxide Polymers 0.000 description 1
- 230000009467 reduction Effects 0.000 description 1
- 229910052594 sapphire Inorganic materials 0.000 description 1
- 239000010980 sapphire Substances 0.000 description 1
- QRUBYZBWAOOHSV-UHFFFAOYSA-M silver trifluoromethanesulfonate Chemical compound [Ag+].[O-]S(=O)(=O)C(F)(F)F QRUBYZBWAOOHSV-UHFFFAOYSA-M 0.000 description 1
- 239000002356 single layer Substances 0.000 description 1
- 238000001228 spectrum Methods 0.000 description 1
- 238000004528 spin coating Methods 0.000 description 1
- 238000006467 substitution reaction Methods 0.000 description 1
- 239000000725 suspension Substances 0.000 description 1
- 239000003981 vehicle Substances 0.000 description 1
- 238000003466 welding Methods 0.000 description 1
- 229910052727 yttrium Inorganic materials 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07F—ACYCLIC, CARBOCYCLIC OR HETEROCYCLIC COMPOUNDS CONTAINING ELEMENTS OTHER THAN CARBON, HYDROGEN, HALOGEN, OXYGEN, NITROGEN, SULFUR, SELENIUM OR TELLURIUM
- C07F15/00—Compounds containing elements of Groups 8, 9, 10 or 18 of the Periodic Table
- C07F15/0006—Compounds containing elements of Groups 8, 9, 10 or 18 of the Periodic Table compounds of the platinum group
- C07F15/0033—Iridium compounds
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07F—ACYCLIC, CARBOCYCLIC OR HETEROCYCLIC COMPOUNDS CONTAINING ELEMENTS OTHER THAN CARBON, HYDROGEN, HALOGEN, OXYGEN, NITROGEN, SULFUR, SELENIUM OR TELLURIUM
- C07F15/00—Compounds containing elements of Groups 8, 9, 10 or 18 of the Periodic Table
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K11/00—Luminescent, e.g. electroluminescent, chemiluminescent materials
- C09K11/06—Luminescent, e.g. electroluminescent, chemiluminescent materials containing organic luminescent materials
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/30—Coordination compounds
- H10K85/341—Transition metal complexes, e.g. Ru(II)polypyridine complexes
- H10K85/342—Transition metal complexes, e.g. Ru(II)polypyridine complexes comprising iridium
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1003—Carbocyclic compounds
- C09K2211/1007—Non-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1018—Heterocyclic compounds
- C09K2211/1025—Heterocyclic compounds characterised by ligands
- C09K2211/1044—Heterocyclic compounds characterised by ligands containing two nitrogen atoms as heteroatoms
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K2101/00—Properties of the organic materials covered by group H10K85/00
- H10K2101/30—Highest occupied molecular orbital [HOMO], lowest unoccupied molecular orbital [LUMO] or Fermi energy values
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Engineering & Computer Science (AREA)
- Materials Engineering (AREA)
- Crystallography & Structural Chemistry (AREA)
- Inorganic Chemistry (AREA)
- Electroluminescent Light Sources (AREA)
- Plural Heterocyclic Compounds (AREA)
Abstract
본 발명은 페닐피리딘 및 페닐벤즈이미다졸을 함유하는 이종리간드 화합물을 제공한다. 화합물은 특히 각 소자의 방출 층에서 방출 도펀트로서 유기 발광 소자에 사용될 수 있다.
Description
본 출원은 미국 가출원 번호 제61/113,257호(2008년 11월 11일 출원)를 우선권 주장의 기초 출원으로 하여 특허 청구하고, 이의 내용은 그 전문이 본원에 명백하게 참고 인용된다.
특허 청구된 본 발명은 공동 산학 연구 협약에 따라 하기 당사자 중 하나 이상에 의해, 하기 당사자 중 하나 이상을 위해, 및/또는 하기 당사자 중 하나 이상과 연계에 의해 이루어졌다: 리젠츠 오브 더 유니버시티 오브 미시간, 프린스턴 유니버시티, 더 유니버시티 오브 서던 캘리포니아 및 유니버셜 디스플레이 코포레이션. 이 협약은 특허 청구한 발명이 만들어진 당일 및 그 전일부터 유효하고, 특허 청구된 발명은 상기 협약의 범주에서 수행된 활동 결과로서 이루어진 것이다.
발명의 분야
본 발명은 신규한 이종리간드(heteroleptic) 착체에 관한 것이다. 특히, 이종리간드 화합물은 페닐피리딘 및 페닐벤즈이미다졸을 함유한다. 화합물은 유기 발광 소자(OLED)에 유용할 수 있다.
유기 물질을 사용한 광전자 소자는 다수의 이유로 점점 더 바람직해지고 있다. 이러한 소자를 제조하는데 사용되는 물질 중 다수는 비교적 저렴한 편인데, 그 이유는 유기 광전자 소자가 무기 소자보다 비용 우위에 대한 잠재성을 갖고 있기 때문이다. 또한, 유기 물질의 내재적 특성, 예컨대 이의 가요성은 특정한 분야, 예를 들어 가요성 기판 상에서의 제작에 잘 맞도록 할 수 있다. 유기 광전자 소자의 예는 유기 발광 소자(OLED), 유기 광트랜지스터, 유기 광전지 및 유기 광검출기가 포함된다. OLED의 경우, 유기 물질은 통상의 물질보다 성능 이점을 가질 수 있다. 예를 들면, 유기 방출 층이 광을 방출하는 파장은 일반적으로 적당한 도펀트로 용이하게 조정될 수 있다.
OLED는 소자에 전압이 가해지는 경우 광을 방출하는 얇은 유기 필름을 사용한다. OLED는 평면 디스플레이, 조명 및 역광조명과 같은 분야에 사용하는 데 점점 더 흥미로운 기법이 되고 있다. 몇몇 OLED 물질 및 배치는 미국 특허 번호 제5,844,363호, 제6,303,238호 및 제5,707,745호에 기술되며, 이의 전문은 본원에 참고 인용된다.
인광성 방출 분자에 대한 한 분야는 풀 컬러 디스플레이이다. 이러한 디스플레이에 대한 산업 표준은 "포화된" 색조로 지칭되는 특정 색조를 방출하기에 적합한 픽셀을 요구한다. 특히, 이러한 표준은 포화된 적색, 녹색 및 청색 픽셀을 요구한다. 색조는 당업계에 잘 공지된 CIE 좌표를 사용하여 측정할 수 있다.
녹색 방출 분자의 일례는 트리스(2-페닐피리딘) 이리듐이며, 이는 하기 화학식 1의 구조를 갖는 Ir(ppy)3을 나타낸다:
본원에서, 그리고 본원의 도면에서는, 직선으로서 질소로부터 금속(여기서는, Ir)까지의 배위 결합(dative bond)을 나타내고 있다.
본원에 사용된 바와 같이, 용어 "유기"는 유기 광전자 소자를 제조하는 데 사용될 수 있는 중합체 물질 뿐만 아니라 작은 분자 유기 물질을 포함한다. "작은 분자"는 중합체가 아닌 임의의 유기 물질을 나타내고, "작은 분자"는 실제로 상당히 클 수 있다. 작은 분자는 일부 환경에서 반복 단위를 포함할 수 있다. 예를 들면, 치환기로서 장쇄 알킬 기를 사용하는 것은 "작은 분자" 부류로부터 분자를 제거하지 않는다. 작은 분자는 또한 예를 들어 중합체 골격 상의 펜던트 기로서 또는 골격의 일부로서 중합체 내에 혼입될 수도 있다. 작은 분자는 또한 코어 부분 상에 형성된 일련의 화학적 쉘로 이루어진 덴드리머의 코어 부분으로서 작용할 수도 있다. 덴드리머의 코어 부분은 형광성 또는 인광성 작은 분자 에미터일 수 있다. 덴드리머는 "작은 분자"일 수 있고, OLED 분야에 최근 사용된 모든 덴드리머는 작은 분자인 것으로 여겨진다.
본원에 사용된 바와 같이, "탑"은 기판으로부터 가장 멀리 떨어진 것을 의미하고, 반면 "버텀"은 기판에 가장 가까운 것을 의미한다. 제1 층이 제2 층 "상에 배치되는" 것으로 기술되는 경우, 제1 층은 기판으로부터 보다 멀리 떨어져서 배치된다. 제1 층이 제2 층과 "접촉하여" 있는 것으로 구체화하지 않는 한, 제1 층과 제2 층 사이에 다른 층이 존재할 수 있다. 예를 들면, 캐소드는 각종 유기 층이 중간에 존재하더라도 애노드 "상에 배치되는" 것으로 기술될 수 있다.
본원에 사용된 바와 같이, "용액 가공성"은 용액 또는 현탁액 형태로 액체 매질 중에 용해, 분산 또는 수송될 수 있고/있거나 이로부터 증착될 수 있는 것을 의미한다.
리간드는 리간드가 방출성 물질의 광활성에 직접 기여하는 것으로 여겨지는 경우 "광활성"으로 지칭될 수 있다. 리간드는 리간드가 방출성 물질의 광활성에 기여하지 않는 것으로 여겨지는 경우 비록 보조 리간드가 광활성 리간드의 성질을 변화시킬 수 있지만 "보조"로서 지칭될 수 있다. "광활성" 리간드 중 하나 이상의 유형은 착체로 존재할 수 있다. 상이한 광활성 리간드는 각각 방출성 물질의 성질에 기여할 수 있다.
본원에 사용된 바와 같이 그리고 일반적으로 당업자에 의해 이해되고 있는 바와 같이, 제1 에너지 준위가 진공 에너지 준위에 보다 가까운 경우, 제1 "최고 점유 분자 오비탈(HOMO)" 또는 "최저 비점유 분자 오비탈(LUMO)" 에너지 준위가 제2 HOMO 또는 LUMO 에너지 준위보다 "더 크거나" 또는 "더 높다". 이온화 전위(IP)가 진공 준위에 비하여 음의 에너지로서 측정되기 때문에, 보다 높은 HOMO 에너지 준위는 보다 작은 절대 값을 갖는 IP(보다 작은 음인 IP)에 상응한다. 유사하게, 보다 높은 LUMO 에너지 준위는 보다 작은 절대 값을 갖는 전자 친화도(EA)(보다 작은 음인 EA)에 상응한다. 탑에서 진공 준위를 지닌 통상적인 에너지 준위 도식 상에서, 물질의 LUMO 에너지 준위가 동일 물질의 HOMO 에너지 준위보다 더 높다. "보다 높은" HOMO 또는 LUMO 에너지 준위는 "보다 낮은" HOMO 또는 LUMO 에너지 준위보다 그러한 도식의 탑에 더 가깝게 나타나게 된다.
본원에 사용된 바와 같이 그리고 일반적으로 당업자에 의해 이해되고 있는 바와 같이, 제1 일함수는 제1 일함수가 높은 절대값을 갖는 경우 제2 일함수보다 "더 크거나" 또는 "더 높다". 일함수가 일반적으로 진공 준위에 비해 음수로서 측정되기 때문에, 이는 "보다 높은" 일함수가 더욱 음인 것을 의미한다. 탑에서 진공 준위를 지닌 통상적인 에너지 준위 도식 상에서, "보다 높은" 일함수는 하향 방향으로 진공 준위로부터 더욱 멀어지는 것으로 예시된다. 따라서, HOMO 및 LUMO 에너지 준위의 정의는 일함수와 상이한 규정을 따른다.
OLED에 대한 더욱 상세한 사항 및 상기 기술된 정의는 미국 특허 번호 제7,279,704호에서 찾을 수 있으며, 이는 그 전문이 본원에 참고 인용된다.
발명의 개요
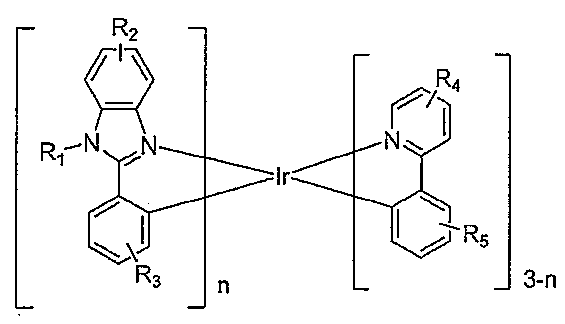
이종리간드 화합물 Ir(L1)n(L2)3-n이 제공된다. 이종리간드 화합물은 하기 화학식을 갖는다:
R1, R2, R3, R4 및 R5는 1치환, 2치환, 3치환 또는 4치환을 나타낼 수 있고, R1, R2, R3, R4 및 R5는 각각 수소, 알킬, 헤테로알킬, 아릴, 치환된 아릴, 헤테로아릴 및 치환된 헤테로아릴로 이루어진 군에서 독립적으로 선택된다. 바람직하게는, n은 1이다. 일 측면에서, R1은 알킬, 헤테로알킬, 치환된 아릴 및 치환된 헤테로아릴로 이루어진 군에서 선택되고, 여기서 R1은 L1과 공액계를 형성하지 않는다. 바람직하게는, R1은 이고, 여기서 X1 및 X2는 C 및 N에서 독립적으로 선택된다. Y1은 수소가 아니다. Y1은 아릴 고리 상의 다른 치환기에 결합될 수 있다. 이종리간드 화합물은 상응한 동종리간드(homoleptic) 화합물보다 더 좁은 방출 반치전폭(FWHM) 및/또는 더 낮은 승화 온도를 가질 수 있다.
특정 L1 및 L2 리간드를 갖는 이종리간드 화합물의 특정예가 제공된다. 이종리간드 화합물은 하기 화합물로 이루어진 군에서 선택되는 것이 바람직하다:
다른 측면에서, 이종리간드 화합물은 하기 화학물로 이루어진 군에서 선택되는 것이 바람직하다:
유기 발광 소자가 또한 제공된다. 이 소자는 애노드, 캐소드, 및 애노드와 캐소드 사이에 배치된 유기 층을 갖는다. 유기 층은 상기 기술된 바와 같은 이종리간드 화합물 Ir(L1)n(L2)3-n을 추가로 포함한다. 바람직하게는, 유기 층은 호스트 및 방출 도펀트를 갖는 방출 층이고, 이종리간드 화합물은 방출 도펀트이다.
소비자 제품이 또한 제공된다. 이 제품은 애노드, 캐소드 및 애노드와 캐소드 사이에 배치된 방출 층을 갖는 소자를 함유하고, 여기서 유기 층은 상기 기술된 바와 같은 이종리간드 화합물 Ir(L1)n(L2)3-n을 추가로 포함한다.
도면의 간단한 설명
도 1에는 유기 발광 소자가 도시된다.
도 2에는 별개의 전자 수송 층을 갖지 않는 역위 유기 발광 소자가 도시된다.
도 3에는 동종리간드 및 이종리간드 화합물의 용액 광발광 스펙트럼이 도시된다.
도 4에는 인광성 유기 발광 소자 구조가 도시된다.
도 5에는 본 발명의 화합물을 함유하는 인광성 유기 발광 소자가 도시된다.
도 6에는 이종리간드 화합물이 도시된다.
발명의 상세한 설명
일반적으로, OLED는 애노드와 캐소드 사이에 배치되고 이에 전기 접속된 하나 이상의 유기 층을 포함한다. 전류가 인가되는 경우, 애노드는 정공을 주입하고 캐소드는 유기 층(들) 내에 전자를 주입한다. 주입된 정공 및 전자는 각각 반대로 하전된 전극을 향해서 이동한다. 전자 및 정공이 동일한 분자에 국소화되는 경우, 여기 에너지 상태를 갖는 국소화된 전자-정공 쌍인 "엑시톤"을 형성한다. 엑시톤이 광전자방출성 메카니즘을 통해 이완되는 경우 광이 방출된다. 일부 경우에, 엑시톤은 엑시머 또는 엑시플렉스에 국소화될 수 있다. 비방사성 메카니즘, 예컨대 열적 이완이 또한 발생할 수 있지만, 일반적으로는 바람직하지 못한 것으로 간주된다.
초기 OLED는, 예를 들어 전문이 본원에 참고 인용된 미국 특허 번호 제4,769,292호에 개시된 바와 같이, 일중항 상태로부터 광을 방출하는 방출 분자("형광성")를 사용하였다. 형광성 방출은 일반적으로 10 나노초보다 적은 시간 프레임 내에 발생한다.
보다 최근에는, 삼중항 상태로부터 광을 방출하는 방출성 물질("인광")을 갖는 OLED가 입증된 바 있다. 문헌[Baldo et al., "Highly Efficient Phosphorescent Emission from Organic Electroluminescent Devices," Nature, vol. 395, 151-154, 1998; ("Baldo-I")] 및 문헌[Baldo et al., "Very high-efficiency green organic light-emitting devices based on electrophosphorescence," Appl. Phys. Lett., vol. 75, No. 3, 4-6 (1999) ("Baldo-II")]는 본원에 그 전문이 참고 인용된다. 인광은 본원에 참고 인용된 미국 특허 번호 제7,279,704호, 컬럼 5∼6에 더욱 상세하게 기술된다.
도 1에는 유기 발광 소자(100)가 도시된다. 이 도면은 꼭 비율에 따른 것은 아니다. 소자(100)는 기판(110), 애노드(115), 정공 주입 층(120), 정공 수송 층(125), 전자 차단 층(130), 방출 층(135), 정공 차단 층(140), 전자 수송 층(145), 전자 주입 층(150), 보호 층(155) 및 캐소드(160)를 포함할 수 있다. 캐소드(160)는 제1 전도성 층(162) 및 제2 전도성 층(164)을 갖는 화합물 캐소드이다. 소자(100)는 기술된 층들은 순서대로 증착됨으로써 제조될 수 있다. 이러한 각종 층들 뿐만 아니라 예시 물질의 특성 및 기능은 본원에 참고 인용된 US 7,279,704, 컬럼 6∼10에 더욱 상세하게 기술된다.
이러한 층들 각각에 대한 추가 예가 이용 가능하다. 예를 들면, 가요성 및 투명성 기판-애노드 조합이 본원에 전문이 참고 인용된 미국 특허 번호 제5,844,363호에 개시된다. p-도핑된 정공 수송 층의 예로는, 전문이 본원에 참고 인용된 미국 특허 출원 공개 번호 제2003/0230980호에 개시된 바와 같이, 50:1의 몰비에서 F.sub.4-TCNQ로 도핑된 m-MTDATA가 있다. 방출성 및 호스트 물질의 예는 전문이 본원에 참고 인용된 Thompson 등에 의한 미국 특허 번호 제6,303,238호에 개시된 바와 같다. n-도핑된 전자 수송 층의 예로는, 전문이 본원에 참고 인용된 미국 특허 출원 공개 번호 제2003/0230980호에 개시된 바와 같이, 1:1의 몰비에서 Li로 도핑된 BPhen이 있다. 전문이 본원에 참고 인용된 미국 특허 번호 제5,703,436호 및 제5,707,745호는 상부면 투명성의 전기 전도성 스퍼터-증착된 ITO 층으로 Mg:Ag와 같은 금속의 얇은 층을 갖는 화합물 캐소드를 포함하는 캐소드의 예가 개시된다. 차단 층의 이론 및 용도는 전문이 본원에 참고 인용되는 미국 특허 번호 제6,097,147호 및 미국 특허 출원 공개 번호 제2003/0230980호에 더욱 상세하게 기술된다. 주입 층의 예는 전문이 본원에 참고 인용되는 미국 특허 출원 공개 번호 제2004/0174116호에 제공된다. 보호 층의 설명은 전문이 본원에 참고 인용되는 미국 특허 출원 공개 번호 제2004/0174116호에서 찾을 수 있다.
도 2는 역위 OLED(200)가 도시된다. 소자는 기판(210), 캐소드(215), 방출 층(220), 정공 수송 층(225) 및 애노드(230)를 포함한다. 소자(200)는 기술된 층들을 순서대로 증착시킴으로써 제조될 수 있다. 가장 일반적인 OLED 배치가 애노드 위에 배치된 캐소드를 갖고, 소자(200)가 애노드(230) 아래에 배치된 캐소드(215)를 갖기 때문에, 소자(200)는 "역위" OLED로서 지칭될 수 있다. 소자(100)와 관련하여 기술된 것과 유사한 물질은 소자(200)의 해당 층들에 사용될 수 있다. 도 2는 일부 층들이 소자(100)의 구조로부터 생략될 수 있는 방법의 일례를 제공한다.
도 1 및 도 2에 도시된 간단한 층을 이룬 구조는 비제한적 예에 의해 제공되고, 본 발명의 구체예는 광범위하게 다양한 다른 구조와 관련하여 사용될 수 있다는 것을 이해할 것이다. 기술된 특정 물질 및 구조는 사실상 예시일 뿐이며, 다른 물질 및 구조도 사용될 수 있다. 기능성 OLED는 상이한 방식으로 기술된 각종 층들을 조합함으로써 실현될 수 있거나, 층들은 디자인, 성능 및 비용 요소를 기초로 완전하게 생략될 수 있다. 구체적으로 기술되지 않은 다른 층들이 또한 포함될 수도 있다. 구체적으로 기술된 것 이외의 물질이 사용될 수 있다. 본원에 제공된 다수의 예들이 단일 물질을 포함하는 것으로서 각종 층들을 기술하지만, 물질의 조합, 예컨대 호스트와 도펀트의 혼합물 또는 더욱 일반적으로는 혼합물이 사용될 수 있다는 것을 이해할 것이다. 또한, 이 층들은 다양한 서브층(sublayer)을 가질 수 있다. 본원에서 각종 층들에게 제공된 명칭은 엄격하게 제한하고자 하려는 것이 아니다. 예를 들면, 소자(200)에서, 정공 수송 층(225)은 정공을 수송하고 방출 층(220) 내로 정공을 주입하며, 정공 수송 층 또는 정공 주입 층으로서 기술될 수 있다. 일 구체예에서, OLED는 캐소드와 애노드 사이에 배치된 "유기 층"을 갖는 것으로서 기술될 수 있다. 이러한 유기 층은 단일 층을 포함할 수 있거나, 예를 들어 도 1 및 도 2와 관련하여 기술된 바와 같이 상이한 유기 물질의 다중 층을 추가로 포함할 수 있다.
구체적으로 기술되지 않은 구조 및 물질은 또한 전문이 본원에 참고 인용된 Friend 등에 의한 미국 특허 번호 제5,247,190호에 개시된 것과 같은 중합체 물질을 포함하는 OLED(PLED)와 같이 사용될 수도 있다. 추가 예로서, 단일 유기 층을 갖는 OLED가 사용될 수 있다. OLED는, 예를 들어 전문이 본원에 참고 인용되는 Forrest 등에 의한 미국 특허 번호 제5,707,745호에 기술된 바와 같이 적층될 수 있다. OLED 구조는 도 1 및 도 2에 도시된 간단한 층을 이룬 구조로부터 벗어날 수 있다. 예를 들면, 기판은 아웃 커플링(out-coupling)을 향상시키기 위한 각이 있는 반사 표면, 예를 들어 전문이 본원에 참고 인용되는 Forrest 등에 의한 미국 특허 번호 제6,091,195호에 기술된 메사(mesa) 구조, 및/또는 Bulovic 등에 의한 미국 특허 번호 제5,834,893호에 기술된 피트(pit) 구조를 포함할 수 있다.
달리 구체화하지 않는 한, 다양한 구체예의 임의의 층들은 임의의 적당한 방법에 의해 증착될 수 있다. 유기 층의 경우, 바람직한 방법은 전문이 본원에 참고 인용된 미국 특허 번호 제6,013,982호 및 제6,087,196호에 기술된 바와 같은 열적 증발, 잉크젯, 전문이 본원에 참고 인용되는 Forrest 등에 의한 미국 특허 번호 제6,337,102호에 기술된 바와 같은 유기 기상 증착(OVPD), 및 전문이 본원에 참고 인용되는 미국 특허 출원 제10/233,470호에 기술된 바와 같은 유기 증기 젯 프린팅(OVJP)에 의한 증착을 포함한다. 다른 적당한 증착 방법은 회전 코팅 및 다른 용액을 기초로 하는 방법을 포함한다. 용액을 기초로 하는 방법은 바람직하게는 질소 또는 불활성 분위기에서 수행된다. 다른 층의 경우, 바람직한 방법은 열적 증발을 포함한다. 바람직한 패턴화 방법은 전문이 본원에 참고 인용되는 미국 특허 번호 제6,294,398호 및 제6,468,819호에 기술된 바와 같은 마스크, 냉간 용접을 통한 증착, 및 잉크젯 및 OVJD와 같은 증착 방법 중 일부와 관련된 패턴화를 포함한다. 다른 방법이 또한 사용될 수 있다. 증착시키고자 하는 물질은 특정한 증착 방법에 적합하도록 변형될 수 있다. 예를 들면, 바람직하게는 3개 이상의 탄소를 함유하는 분지 또는 비분지된 치환기, 예컨대 알킬 및 아릴 기는 작은 분자에 사용되어 용액 처리를 실시하는 능력을 향상시킬 수 있다. 20개 이상의 탄소를 갖는 치환기가 사용될 수 있고, 3∼20개의 탄소가 바람직한 범위이다. 비대칭 구조를 갖는 물질은 대칭 구조를 갖는 것보다 더 나은 용액 가공성을 가질 수 있는데, 그 이유는 비대칭 물질은 더욱 낮은 재결정화 경향을 가질 수 있기 때문이다. 덴드리머 치환기는 용액 처리를 실시하기 위한 작은 분자의 능력을 향상시키는데 사용될 수 있다.
본 발명의 구체예에 따라 제조된 소자는 평면 디스플레이, 컴퓨터 모니터, 텔레비젼, 광고게시판, 실내 또는 실외용 조명 및/또는 신호기를 위한 라이트, 헤드업 디스플레이, 완전 투명성 디스플레이, 가요성 디스플레이, 레이저 프린터, 전화기, 휴대전화기, 개인 휴대 정보 단말기(PDA), 노트북 컴퓨터, 디지털 카메라, 캠코더, 뷰파인더, 마이크로디스플레이, 운송수단, 대형 구역 벽, 극장 또는 스타디움 스크린, 또는 사인(sign)을 포함하는 광범위하게 다양한 소비자 제품 내에 혼입될 수 있다. 패시브 매트릭스 및 엑티브 매트릭스를 비롯한 다양한 제어 메카니즘은 본 발명에 따라 제조된 소자를 제어하는 데 사용될 수 있다. 다수의 소자들은 인간에게 편안한 온도 범위 내, 예를 들어 18℃∼30℃, 더욱 바람직하게는 실온(20∼25℃)에서 사용하게 된다.
본원에 기술된 물질 및 구조는 OLED 이외의 소자에서 용도를 가질 수 있다. 예를 들면, 유기 태양 전지 및 유기 광검출기와 같은 다른 광전자 소자는 물질 및 구조를 사용할 수 있다. 더욱 일반적으로는, 유기 소자, 예컨대 유기 트랜지스터는 물질 및 구조를 사용할 수 있다.
용어 할로, 할로겐, 알킬, 시클로알킬, 알케닐, 알키닐, 아릴킬, 복소환 기, 아릴, 방향족 기 및 헤테로아릴은 당업계에 공지되어 있고, 본원에 참고 인용되는 US 7,279,704, 컬럼 31∼32에 정의되어 있다.
고 효율, 고 안정성, 장기간의 작동 수명 및 향상된 색조를 형성하는 인광성 유기 발광 소자에 사용될 수 있는 2-페닐벤즈이미다졸(본원에서, "페닐벤즈이미다졸"로 지침됨) 및 페닐피리딘- 함유 물질이 제공된다. 이 물질은 녹색 소자에서 인광성 방출 도펀트로서 사용될 수 있다
페닐피리딘 및 페닐벤즈이미다졸-함유 이종리간드 화합물이 제공된다. 이종리간드 화합물은 고도로 조정가능한 인광성 방출 물질을 제공하고 따라서 이러한 화합물은 광범위한 범위의 색조 및 상당히 포화된 색조를 실현하는 데 유리하다. 금속 착체의 방출은 상이한 리간드의 삼중항 에너지 및 HOMO/LUMO 준위에 따라 상이한 리간드를 신중하게 선택함으로써 조정될 수 있다. 페닐벤즈이미다졸이 수명 성능이 우수한 소자를 제공하는 반면, 이는 일반적으로 더 높은 승화 온도를 갖고 전자진동의 방출 스펙트럼(도3 참조)을 가질 수 있다. 페닐벤즈이미다졸 리간드 및 페닐피리딘 리간드 둘다를 함유하는 이종리간드 착체는 페닐벤즈이미다졸의 유리한 성질(즉, 장기간의 수명 및 고 안정성)을 유지하면서 더 낮은 승화 온도를 제공할 수 있다.
일반적으로, 착체의 승화 온도는 착체의 분자 구조로부터 측정될 수 있는 것으로 용인된다. 고 분자량은 통상 더 높은 승화 온도를 유도한다. 그렇다면, 이종리간드 화합물은, 이종리간드 화합물의 분자량이 각 상응한 동종리간드 화합물의 분자량 사이에 존재하기 때문에 상응한 동종리간드 화합물의 승화 온도 사이의 승화 온도를 가질 것으로 예상할 수 있다. 하지만, 본원에 개시된 페닐피리딘 및 페닐벤즈이미다졸을 함유하는 이종리간드 화합물 중 일부는 모든 상응한 동종리간드 화합물(즉, 페닐피리딘 동종리간드 화합물 및 페닐벤즈이미다졸 동종리간드 화합물)보다 더 낮은 승화 온도를 갖는다. 이종리간드 착체의 승화 온도에서의 감소는 향상된 소자 제조를 제공할 수 있다.
추가적으로, 이러한 이종리간드 화합물은 또한 더욱 좁은 방출 스펙트럼을 제공할 수 있다. 이론에 결부시키고자 하는 것은 아니지만, 모든 리간드(즉, 페닐피리딘 및 페닐벤즈이미다졸)은 에너지 준위에 근접한 녹색 에미터이며, 따라서 모든 리간드는 화합물의 방출에 직접 기여할 수 있다는 것이 주목된다. 관찰되는 본원에 개시된 이종리간드 화합물의 방출 스펙트럼은 예상 외로 좁다(도 3 참조). 화합물의 방출 스펙트럼은 벤즈이미다졸의 전기화학적 갭이 페닐피리딘보다 좁기 때문에(즉, 벤즈이미다졸은 페닐피리딘보다 더 얕은 HOMO 및 더 깊은 LUMO를 가짐) 페닐벤즈이미다졸의 방출에 유사할 것으로 예상된다. 하지만, 관찰된 이종리간드 화합물의 방출은 벤즈이미다졸(예, 전자진동 구조 아님)보다 페닐피리딘의 방출 프로파일에 더 근접하다. 관찰된 화합물의 방출 스펙트럼은 모든 리간드가 동일한 착체에 포함되는 경우 페닐피리딘과 페닐벤즈이미다졸 리간드 간의 예상 외의 상호작용의 결과일 수 있는 것으로 여겨진다. 따라서, 페닐피리딘 및 페닐벤즈이미다졸 리간드를 함유하는 착체는 장기간의 수명, 고 안정성 및 향상된 제조 뿐만 아니라 향상된 색조를 갖는 PHOLED용 방출성 물질로서 유리하게 사용될 수 있다.
OLED에 유리하게 사용될 수 있고, 하기 화학식을 갖는 이종리간드 화합물 Ir(L1)n(L2)3-n이 제공된다:
R1, R2, R3, R4 및 R5는 1치환, 2치환, 3치환 또는 4치환을 나타낼 수 있고, R1, R2, R3, R4 및 R5는 각각 수소, 알킬, 헤테로알킬, 아릴, 치환된 아릴, 헤테로아릴 및 치환된 헤테로아릴로 이루어진 군에서 독립적으로 선택된다. 바람직하게는, n은 1이다.
일 측면에서, 화합물은 하기 화학식을 갖는다:
상기 식에서, R4는 수소 또는 메틸이다.
다른 측면에서, R1은 알킬, 헤테로알킬, 아릴, 헤테로아릴, 치환된 아릴 및 치환된 헤테로아릴로 이루어진 군에서 선택되고, 여기서 R1은 L1과 공액계를 형성하지 않는다. 페닐벤즈이미다졸 부분은 이러한 이종리간드 화합물의 유리한 성질을 실현하는 데 중요하다. 따라서, 유리한 특징을 유지하기 위해, R1 치환기는 최소 공액을 갖는 화학적 기이다. 추가로, L1의 페닐과 벤즈이미다졸 부위 사이의 공액은 감소된 LUMO 준위 및 포화된 녹색 방출의 손실을 초래할 것 같다. 따라서, 치환기(예, R1 및 R2)는 연장된 공액계를 형성하도록 융합되지 않는다.
바람직하게는, R1 치환기는 분지형 알킬 또는 트위스트형 아릴(예, 이소프로필 및 이소부틸)이다. 본원에 사용된 "트위스트형 아릴"은 하기 화학식을 갖는 구조로 언급된다:
상기 식에서, X1 및 X2는 C 및 N에서 독립적으로 선택되고, Y1은 수소가 아니고, Y1은 아릴 고리 상의 다른 치환기에 결합될 수 있다. 분지형 알킬 및 트위스트화된 아릴 치환기는 감소된 고체 상태 팩킹 및 더 낮은 승화 온도를 제공할 수 있다.
더욱 바람직하게는, R1 은 이고, 상기 식에서 X1 및 X2는 C 및 N에서 독립적으로 선택된다. Y1은 수소가 아니다. Y1은 아릴 고리 상의 다른 치환기에 결합될 수 있다. 비평면 배좌는 화합물의 유리한 성질에 기여하는 것으로 여겨진다. 예를 들면, 이러한 R1 치환기를 갖는 이종리간드 화합물은 보다 우수한 색조와 더 낮은 승화 온도를 가질 수 있다. 추가적으로, 이러한 R1 치환기는 화합물의 삼중항 에너지를 더 낮아지게 하지 않을 수 있다.
다른 측면에서, 각 R2, R3 및 R5는 수소이다.
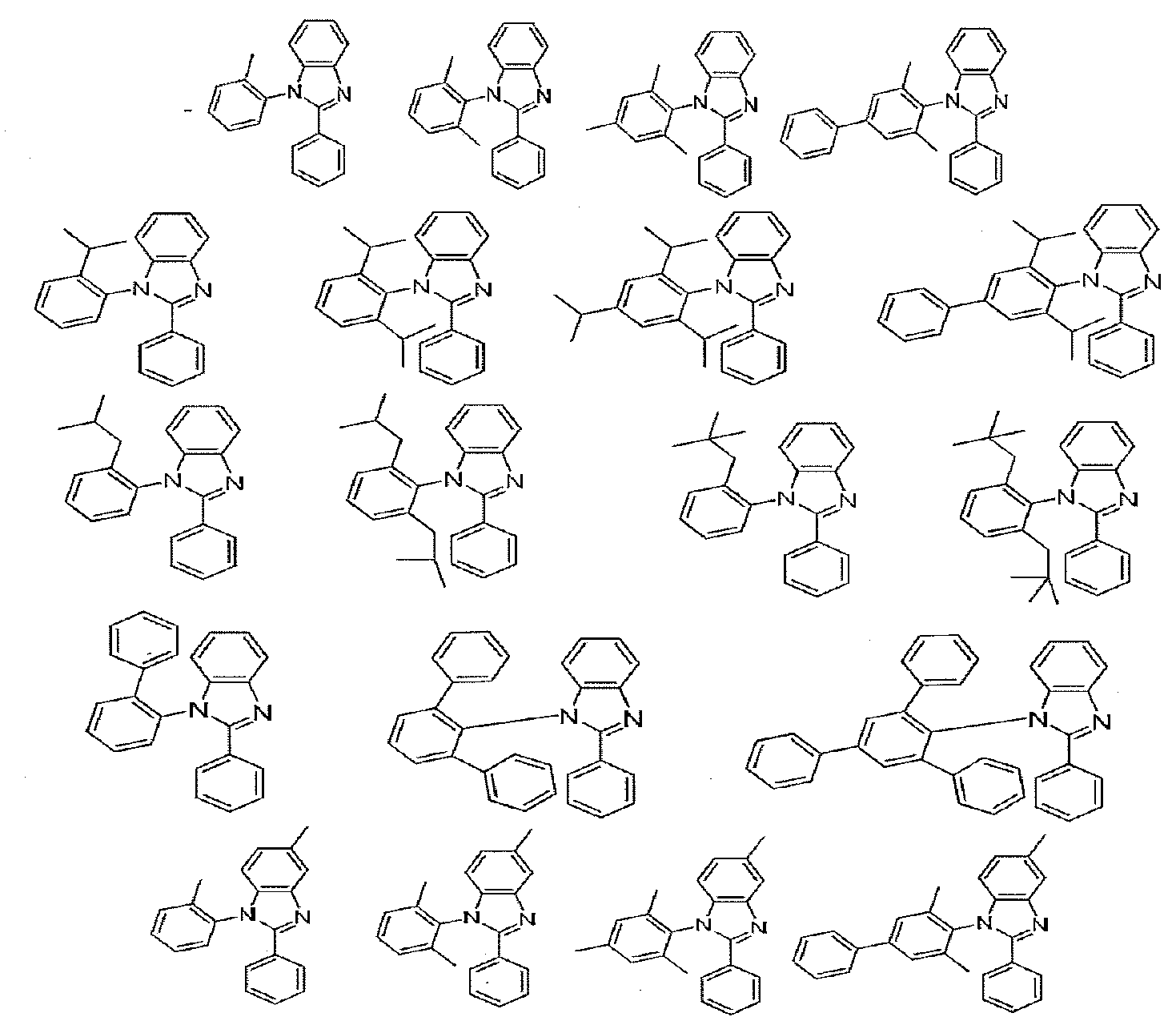
이종리간드 화합물의 특정예는 하기 화학식으로 이루어진 군에서 선택된 L1을 함유하는 화합물을 포함한다:
이종리간드 화합물의 추가 특정예는 하기 화학식으로 이루어진 군에서 선택된 L2를 함유하는 화합물을 포함한다:
일 측면에서, 이종리간드 화합물은 상기 제공된 기에서 선택된 L1 및 L2 모두를 포함한다.
특정한 이종리간드 화합물의 추가예는 하기 식으로 이루어진 군에서 선택된 L1을 함유하는 화합물을 포함한다:
이종리간드 화합물의 추가 특정예는 하기 식으로 이루어진 군에서 선택된 L2를 함유하는 화합물을 포함한다:
다른 측면에서, 이종리간드 화합물은 즉시 진행되는 2개의 기로부터 L1 및 L2 모두를 포함한다.
바람직하게는, 이종리간드 화합물은 하기 화합물로 이루어진 군에서 선택된다:
더욱 바람직하게는, 이종리간드 화합물은 화합물 1, 3, 5∼8에서 선택된다.
다른 측면에서, 이종리간드 화합물은 하기 화합물로 이루어진 군에서 선택되는 것이 바람직하다:
일 측면에서, 이종리간드 화합물은
다른 측면에서, 이종리간드 화합물은
추가적으로, 또한 유기 발광 소자가 제공된다. 이 소자는 애노드, 캐소드 및 애노드와 캐소드 사이에 배치된 유기 층을 포함한다. 유기 층은 상기 기술된 바와 같은 이종리간드 화합물 Ir(L1)n(L2)3-n을 추가로 포함한다. 바람직하게는, 유기 층은 화합물 1∼화합물 8로 이루어진 군에서 선택된 이종리간드 화합물을 함유한다. 더욱 바람직하게는, 유기 층은 화합물 1, 3 및 5∼8로 이루어진 군에서 선택된 이종리간드 화합물을 함유한다.
추가로, 애노드, 캐소드 및 애노드와 캐소드 사이에 배치된 유기 층을 포함하고, 그 자체로 화합물 1∼화합물 9로 이루어진 군에서 선택된 이종리간드 화합물을 추가로 포함하는 유기 발광 소자가 또한 제공된다.
소자의 유기 층은 이종리간드 화합물을 포함할 수 있고, 여기서 R1은 알킬, 헤테로알킬, 아릴, 헤테로아릴, 치환된 아릴 및 치환된 헤테로아릴로 이루어진 군에서 선택되고, R1은 L1과 공액계를 형성하지 않는다.
일 측면에서, 방출 층은 호스트를 추가로 포함한다. 바람직하게는, 호스트는 하기 화학식을 갖는다:
상기 식에서, R1 및 R2는 독립적으로 알킬, 알콕시, 아미노, 알케닐, 알키닐, 아릴킬, 아릴 및 헤테로아릴에서 선택되는 1치환, 2치환, 3치환 또는 4치환을 나타내거나, 또는 비치환을 나타내고; R1 및 R2 중 하나 이상은 트리페닐렌 기를 포함한다.
다른 측면에서, 호스트는 하기 화학식을 갖는다:
상기 식에서, 각 R1, R2 및 R3은 독립적으로 수소, 하나 이상의 메타-치환기를 갖는 비융합된 아릴 기 또는 비융합된 헤테로아릴 기이고, 여기서 R1, R2 및 R3 중 하나 이상은 수소가 아니다. 각 메타-치환기는 비융합된 아릴 기, 비융합된 헤테로아릴 기 및 알킬 기로 이루어진 군에서 선택된 추가의 치환기로 임의 치환된 비융합된 아릴 또는 헤테로아릴 기이다.
유기 발광 소자에서 특정한 층에 유용한 것으로서 본원에 기술된 물질은 소자에 존재하는 광범위하게 다양한 다른 물질과 조합하여 사용될 수 있다. 예를 들면, 본원에 개시된 방출 도펀트는 존재할 수 있는 광범위하게 다양한 호스트, 수송 층, 차단 층, 주입 층, 전극 및 다른 층과 함께 사용될 수 있다. 하기 기술되거나 지칭된 물질은 하기 개시된 화합물과 병용되어 유용할 수 있는 물질의 비제한적 예이고, 당업자는 병용하여 유용할 수 있는 다른 물질을 확인하기 위해 문헌을 용이하게 참조할 수 있다.
소자를 포함하는 소비자 제품이 또한 제공되는데, 여기서 소자는 애노드, 캐소드 및 유기 층을 추가로 포함한다. 유기 층은 기술된 바와 같은 페닐피리딘 및 페닐벤즈이미다졸-함유 착체를 추가로 포함할 수 있다.
특히, 소자의 유기 층이 화합물 1∼9로 이루어진 군에서 선택된 이종리간드 화합물을 함유하는, 그러한 소자를 함유한 소비자 제품이 제공된다.
본원에 개시된 물질 이외에, 및/또는 이러한 물질과 함께, 수많은 정공 주입 물질, 정공 수송 물질, 호스트 물질, 도펀트 물질, 엑시톤/정공 차단 층 물질, 전자 수송 및 전자 주입 물질은 OLED에 사용될 수 있다. 본원에 개시된 물질과 함께 OLED에 사용될 수 있는 물질의 비제한적 예는 하기 표 1에 나열된다. 표 1에는 물질의 비제한적 부류, 각 부류에 대한 화합물의 비제한적 예시 및 물질을 개시하는 문헌이 나열된다.
화합물의 예
화합물 1의 합성
화합물 1의 합성. 중간체 1(1.4 g, 1.96 mmol) 및 1-네오펜틸-2-페닐-1H-벤조[d]이미다졸(1.6 g, 5.9 mmol)을 질소 하에 3구 플라스크 내에서 30 ㎖의 에탄올과 혼합시켰다. 이 혼합물을 24시간 동안 환류까지 가열하였다. 실온으로 냉각시킨 후, 침전물을 여과 수집하였다. 용리액으로서 1:2 디클로로메탄 및 헥산을 사용하여 생성물을 컬럼 크로마토그래피에 의해 정제하였다. 정제 후 0.3 g의 원하는 생성물을 얻었다.
화합물 2의 합성
1,2-디페닐-1H-벤조[d]이미다졸의 합성. N1-페닐벤젠-1,2-디아민(4.15 g, 22 mmol) 및 벤즈알데히드(2.1 g, 20 mmol)를 3구 플라스크 내에서 메톡실에탄올(60 ㎖)과 혼합시켰다. 이 혼합물을 48시간 동안 환류까지 가열하였다. 실온으로 냉각시킨 후, 용매를 증발시켰다. 용리액으로서 디클로로메탄 중의 5% 에틸 아세테이트로 디클로로메탄을 사용하여 잔류물을 컬럼 크로마토그래피에 의해 정제하였다. 2 g의 원하는 생성물을 얻었다.
화합물 2의 합성. 중간체 1(1.32 g, 1.86 mmol) 및 1,2-디페닐-1H-벤조[d]이미다졸(1.5 g, 5.5 mmol)을 질소 하에 3구 플라스크 내에서 40 ㎖의 에탄올과 혼합시켰다. 이 혼합물을 24시간 동안 환류까지 가열하였다. 실온으로 냉각시킨 후, 침전물을 여과 수집하였다. 용리액으로서 1:2 디클로로메탄 및 헥산을 사용하여 생성물을 컬럼 크로마토그래피에 의해 정제하였다. 정제 후에 0.3 g의 원하는 생성물을 얻었다.
화합물 3의 합성
2-이소프로필-N-(2-니트로페닐)아닐린의 합성. 2-이소프로필 아닐린(27 g, 200 mmol), 2-플루오로니트로벤젠(14 g, 100 mmol) 및 플루오르화칼륨(8.6 g, 150 mmol)을 1구 플라스크 내에서 혼합시켰다. 이 혼합물을 48시간 동안 질소 하에서 180℃까지 가열하였다. 실온으로 냉각시킨 후, 물(200 ㎖)을 첨가하였다. 그리고나서 혼합물을 디클로로메탄(200 ㎖)으로 3회 추출하였다. 용매를 증발시키고 헥산 중의 20% 디클로로메탄을 사용하여 잔류물을 컬럼 크로마토그래피에 의해 정제하였다. 22.5 g의 원하는 생성물을 얻었다.
N1-2-이소프로필페닐)벤젠-1,2-디아민의 합성. 2-이소프로필-N-(2-니트로페닐)아닐린(22.7 g, 89 mmol) 및 10% 탄소 상 팔라듐(0.6 g)을 플라스틱 코팅 수소화 용기 내에서 질소 하에 150 ㎖의 에탄올과 혼합시켰다. 이 혼합물을 Parr 수소생산기(hydrogenator) 상에 넣고 압력 강하가 없을 때까지 40 psi의 수소 하에서 반응시켰다. 셀라이트 상을 통해 촉매를 여과하였다. 용매를 증발시켰다. 추가 정제없이 다음 단계에 생성물을 사용하였다. 20 g의 원하는 생성물을 얻었다.
1-(2-이소프로필페닐)-2-페닐-1H-벤조[d]이미다졸의 합성. N1-(2-이소프로필페닐)벤젠-1,2-디아민(20 g, 88 mmol) 및 벤즈알데히드(8.5 g, 80 mmol)를 3시간 동안 환류 하에 아세토니트릴(100 ㎖)에서 반응시켰다. 반응 혼합물을 실온으로 냉각시켰다. 염화제2철(0.13 g, 0.8 mmol)을 첨가하였다. 반응 혼합물을 밤새 다시 환류까지 가열하였다. 환류 동안 반응을 통해 공기를 폭기시켰다. 용매를 증발시켰다. 잔류물을 디클로로메탄(200 ㎖) 중에 용해시키고 짧은 실리카겔 플러그를 관류시켰다. 디클로로메탄 중의 3%의 에틸 아세테이트로 디클로로메탄을 사용하여 미정제 생성물을 컬럼 크로마토그래피에 의해 정제하였다. 메탄올로 재결정화시킴으로써 생성물을 추가 정제하였다. 8 g의 원하는 생성물을 얻었다.
화합물 3의 합성. 중간체 1(1.5 g, 2.1 mmol) 및 1-(2-이소프로필페닐)-2-페닐-1H-벤조[d]이미다졸(2 g, 6.4 mmol)을 질소 하에 3구 플라스크 내에서 30 ㎖의 에탄올과 혼합시켰다. 이 혼합물을 24시간 동안 환류까지 가열하였다. 실온으로 냉각시킨 후, 침전물을 여과 수집하였다. 용리액으로서 1:2 디클로로메탄 및 헥산을 사용하여 생성물을 컬럼 크로마토그래피에 의해 정제하였다. 정제 후에 0.7 g의 원하는 생성물을 얻었다.
화합물 4의 합성
화합물 4의 합성. 중간체 2(7.4 g, 10 mmol) 및 1,2-디페닐-1H-벤조[d]이미다졸(8.11 g, 30 mmol)을 질소 하에 3구 플라스크 내에서 200 ㎖의 에탄올과 혼합시켰다. 이 혼합물을 24시간 동안 환류까지 가열하였다. 실온으로 냉각시킨 후, 침전물을 여과 수집하였다. 용리액으로서 1:2 디클로로메탄 및 헥산을 사용하여 생성물을 컬럼 크로마토그래피에 의해 정제하였다. 정제 후에 1.4 g의 원하는 생성물을 얻었다.
화합물 5의 합성
2,6-디이소프로필-N-(2-니트로페닐)아닐린의 합성. 2,6-디이소프로필아닐린(25 g, 141 mmol), 2-플루오로니트로벤젠(10 g, 70 mmol) 및 플루오르화칼륨(6.2 g, 106 mmol)을 1구 플라스크 내에서 혼합시켰다. 48시간 동안 질소 하에 180℃까지 혼합물을 가열하였다. 실온으로 냉각시킨 후, 물(200 ㎖)을 첨가하였다. 그리고나서 혼합물을 디클로로메탄(200 ㎖)으로 3회 추출하였다. 용매를 증발시키고 헥산 중의 20%의 디클로로메탄을 사용하여 잔류물을 컬럼 크로마토그래피에 의해 정제하였다. 1O g의 원하는 생성물을 얻었다.
N1-(2,6-디이소프로필페닐)벤젠-1,2-디아민의 합성. 2,6-디이소프로필-N-(2-니트로페닐)아닐린(9.5 g, 32 mmol) 및 10% 탄소 상 팔라듐(0.4 g)을 플라스틱 코팅 수소화 용기 내에서 질소 하에 150 ㎖의 에탄올과 혼합시켰다. 혼합물을 Parr 수소생산기 상에 넣고 압력 강하가 없을 때까지 40 psi의 수소 하에 반응시켰다. 셀라이트 상을 통해 촉매를 여과하였다. 용매를 증발시켰다. 추가 정제없이 다음 단계에 생성물을 사용하였다. 8.5 g의 원하는 생성물을 얻었다.
1-(2,6-디이소프로필페닐)-2-페닐-1H-벤조[d]이미다졸의 합성. N1-(2,6-디이소프로필페닐)벤젠-1,2-디아민(8.5 g, 32 mmol) 및 벤즈알데히드(3 g, 28.8 mmol)를 3시간 동안 환류 하에 아세토니트릴(100 ㎖)에서 반응시켰다. 반응 혼합물을 실온으로 냉각시켰다. 염화제2철(0.05 g, 0.28 mmol)을 첨가하였다. 반응 혼합물을 밤새 다시 환류까지 가열하였다. 환류 동안 반응을 통해 공기를 폭기시켰다. 용매를 증발시켰다. 잔류물을 디클로로메탄(200 ㎖) 중에 용해시키고 짧은 실리카겔 플러그를 관류하였다. 디클로로메탄 중의 3%의 에틸 아세테이트로 디클로로메탄을 사용하여 미정제 생성물을 컬럼 크로마토그래피에 의해 정제하였다. 3.4 g의 원하는 생성물을 얻었다.
화합물 5의 합성. 중간체 1(2.1 g, 2.9 mmol) 및 1-(2,6-디이소프로필페닐)-2-페닐-1H-벤조[d] 이미다졸(3.1 g, 8.7 mmol)을 질소 하에 3구 플라스크 내에서 60 ㎖의 에탄올과 혼합시켰다. 이 혼합물을 24시간 동안 환류까지 가열하였다. 실온으로 냉각시킨 후, 침전물을 여과 수집하였다. 용리액으로서 1:2 디클로로메탄 및 헥산을 사용하여 생성물을 컬럼 크로마토그래피에 의해 정제하였다. 정제 후에 1.1 g의 원하는 생성물을 얻었다.
화합물 6의 합성
중간체 3의 합성. 1-(2-이소프로필페닐)-2-페닐-1H-벤조[d]이미다졸(3 g, 9.6 mmol) 및 염화인듐(1.5 g, 4.36 mmol)을 질소 하에 3구 플라스크 내에서 60 ㎖의 2-에톡시에탄올 및 20 ㎖의 물로 혼합시켰다. 이 혼합물을 24시간 동안 환류까지 가열하였다. 실온으로 냉각시킨 후, 침전물을 여과 수집하였다. 메탄올 및 헥산으로 고체를 완전히 세척한 후 진공 건조하였다. 3.5 g의 생성물을 얻었다.
중간체 4의 합성. 중간체 3(3.5 g, 2.06 mmol) 및 은 트리플레이트(1.06 g, 4.12 mmol)를 300 ㎖의 디클로로메탄 및 30 ㎖의 메탄올과 혼합시켰다. 혼합물을 24시간 동안 실온에서 교반하였다. 고체를 여과하였다. 여과물을 증발 건조하였다. 4.2 g의 생성물을 얻었다.
화합물 6의 합성. 중간체 4(2.0 g, 1.95 mmol) 및 2,5-디페닐피리딘(1.4 g, 5.83 mmol)을 질소 하에 3구 플라스크 내에서 50 ㎖의 에탄올과 혼합시켰다. 이 혼합물을 24시간 동안 환류까지 가열하였다. 실온으로 냉각시킨 후, 침전물을 여과 수집하였다. 용리액으로서 1:1 디클로로메탄 및 헥산을 사용하여 생성물을 컬럼 크로마토그래피에 의해 정제하였다. 정제 후에 0.5 g의 원하는 생성물을 얻었다.
화합물 7 및 화합물 8의 합성
화합물 7 및 화합물 8의 합성. 중간체 4(2.0 g, 1.95 mmol) 및 2-(비페닐-3-일)피리딘(1.5 g, 5.8 mmol)을 질소 하에 3구 플라스크 내에서 60 ㎖의 에탄올과 혼합시켰다. 이 혼합물을 24시간 동안 환류까지 가열하였다. 실온으로 냉각시킨 후, 침전물을 여과 수집하였다. 용리액으로서 1:1 디클로로메탄 및 헥산을 사용하여 생성물을 컬럼 크로마토그래피에 의해 정제하였다. 1.4 g의 화합물 7 및 0.4 g의 화합물 8을 수집하였다.
화합물 9의 합성
N-(2-니트로페닐)비페닐-2-아민의 합성. 1-플루오로-2-니트로벤젠(13.06 g, 92.6 mmol), 2-아미노비페닐(31.3 g, 185.2 mmol) 및 플루오르화칼륨(8.1 g, 138.9 mmol)의 혼합물을 100 ㎖ 둥근 바닥 플라스크 내에서 제조하였다. 플라스크를 비우고 질소로 대체하였다. 혼합물을 밤새 200℃로 가열하였다. 반응 혼합물을 냉각시키고 에틸 아세테이트 및 물을 첨가하였다. 층을 분리시키고 수성층을 에틸 아세테이트로 추출하였다. 유기 층을 황산마그네슘 상에서 건조하고, 여과하고, 증발시켰다. 잔류물을 셀라이트 상에 미리 흡수시키고, O%, 2% 및 5% 에틸 아세테이트/헥산으로 용리시키는 컬럼 크로마토그래피에 의해 정제하였다. 24.5 g(91%)의 생성물을 얻었다.
N1-(비페닐-2-일)벤젠-1,2-디아민의 합성. N-(2-니트로페닐)비페닐-2-아민(19.69 g, 67.8 mmol), 10% 탄소 상 팔라듐(0.29 g, 0.27 mmol) 및 150 ㎖의 에탄올을 Parr 수소생산기 병에 첨가하였다. 더이상 용액에 의해 수소가 흡수되지 않을 때까지 Parr 수소생산기 상에서 혼합물을 수소화시켰다. 셀라이트를 통해 용액을 여과하여 촉매를 제거하고, 셀라이트를 디클로로메탄으로 세척하고, 여과물을 증발시켜 갈색 오일 14.8 g(84%)을 형성하였다. 추가 정제없이 생성물을 다음 단계에 사용하였다.
1-(비페닐-2-일)-2-페닐-1H-벤조[d]이미다졸의 합성. N1-(비페닐-2-일)벤젠-1,2-디아민(14.8 g, 56.85 mmol), 벤즈알데히드(5.2 ㎖, 51.68 mmol) 및 200 ㎖의 아세토니트릴을 500 ㎖ 3구 둥근 바닥 플라스크에 첨가하였다. 혼합물을 질소 하에 밤새 환류로 가열하였다. 80 mg(0.49 mmol)의 염화철(III)을 첨가하고 혼합물을 냉각된 용액에 직접 공기로 폭기시켰다. 3시간 후, 용매를 증발시키고 잔류물을 디클로로메탄 중에 용해시키고 이 용액을 0 내지 10% 에틸 아세테이트/디클로로메탄으로 용리하는 실리카겔 플러그를 통해 통과시켰다. 6.56 g(37%)의 생성물을 얻었다.
화합물 9의 합성. 트리플레이트 착체(2.06 g, 2.89 mmol), 1-(비페닐-2-일)-2-페닐-1H-벤조[d]이미다졸(4 g, 11.55 mmol) 및 100 ㎖의 에탄올을 250 ㎖ 둥근 바닥 플라스크에 첨가하였다. 혼합물을 질소 하에 밤새 환류로 가열하였다. 침전물을 여과 수집한 후 컬럼에 의해 정제하였다. 0.75 g의 생성물을 얻었다.
소자예
모든 예시적 소자는 고 진공 (< 10-7 Torr) 열적 증발에 의해 제작되었다. 애노드 전극은 유리 상의 ∼800 Å, 1200 Å 또는 2000 Å의 인듐 주석 산화물(ITO), 또는 800 Å 사파이어/IZO이다. 캐소드는 10 Å의 LiF 다음에 1000 Å의 Al로 이루어진다. 모든 소자는 제작 직후 질소 글러브 박스(< 1 ppm의 H2O 및 O2)에서 에폭시 수지에 의해 밀봉된 유리 뚜껑으로 캡슐화되고, 수분 게터(getter)를 패키지 내부에 혼입시켰다.
소자예 1∼10의 유기 스택은 ITO 표면(1200 Å), 정공 주입 층(HIL)로서 화합물 C 100 Å, 정공 수송 층(HTL)으로서 4,4'-비스[N-(1-나프틸)-N-페닐아미노]비페닐(α-NPD) 300 Å, 방출 층(EML)으로서 7∼10%의 도펀트 에미터(본 발명의 화합물 1∼3)로 도핑된 호스트-1 또는 호스트-2 300 Å, 차단 층(BL)으로서 호스트 1 또는 호스트 2 50 Å 또는 100 Å, 및 ETL로서 트리스-8-히드록시퀴놀린 알루미늄 (Alq3) 400 Å 또는 450 Å로부터 순차적으로 이루어졌다.
비교예 1∼4는 화합물 B 또는 화합물 C가 방출 도펀트로서 사용되는 것을 제외하고는 소자예와 유사하게 제작되었다.
본원에 사용된 바와 같이, 하기 화합물은 다음의 구조를 갖는다:
특별히 우수한 성질을 갖는 소자가 유도될 수 있는 OLED의 방출 층을 위한 특정 방출 도펀트가 제공된다. 소자예 1∼10의 방출 층을 위한 물질, 및 BL 및 ETL을 위한 물질 및 두께가 하기 표 2에 제시된다. 소자는 테스트되고, 측정된 결과가 하기 표 3에 제공된다. 방출 도펀트로서 화합물 1∼3을 사용하는 방출 층을 갖는 소자는 향상된 소자 효율 및 수명 뿐만 아니라 더욱 포화된 색조를 나타내고 이는 이러한 이종리간드 화합물이 유리할 수 있음을 나타낸다.
소자예 1∼10으로부터, 녹색 인광성 OLED에서 방출 도펀트로서의 본 발명의 화합물은 높은 소자 효율, 장기간의 작동 수명 및 더욱 포화된 색조를 형성한다는 것을 확인할 수 있다. 화합물 1 및 2는, 소자예 1∼4 및 비교예 3으로부터 확인될 수 있는 바와 같이, 화합물 C보다 더욱 우수한 효율, 더욱 포화된 색조 및 장기간의 수명을 제시하였다. 화합물 3은, 소자예 5 및 6, 및 비교예 1 및 2로부터 확인될 수 있는 바와 같이, 화합물 B보다 장기간의 수명 및 더 높은 효율을 갖는다. 특히, 방출 도펀트로서 화합물 3을 함유하는 소자는 또한 비교예 4에서 확인된 바와 같이 화합물 C보다 더욱 포화된 색조 및 더 좁은 방출 스펙트럼을 제시하였다.
이러한 데이타는 이종리간드 화합물을 함유하는 페닐피리딘 및 페닐벤즈이미다졸이 더 우수한 색조, 장기간의 수명 및 더 높은 효율을 제공하는 인광성 OLED를 위한 탁월한 방출 도펀트임을 제시한다.
OLED의 방출 층에 사용하기 위한 특정한 방출 도펀트가 제공된다. 이러한 도펀트는 특히 우수한 성질을 갖는 소자를 제공할 수 있다. 소자예 1∼16의 방출 층을 위한 물질, 및 BL 및 ETL을 위한 물질 및 두께가 하기 표 4에 제시된다. 소자는 테스트되고, 측정된 결과가 하기 표 5에 제공된다. 방출 도펀트로서 화합물 1∼6, 8 및 9를 사용하는 방출 층을 갖는 소자는 향상된 소자 효율 및 수명 뿐만 아니라 더욱 포화된 색조를 나타내고 이는 이러한 이종리간드 화합물이 유리할 수 있음을 나타낸다.
소자예 1∼16으로부터, 방출 도펀트로서 본 발명의 화합물을 포함하는 녹색 OLED는 탁월한 성질을 제공한다는 것을 확인할 수 있다. 화합물 6, 8 및 9는, 소자예 11∼14 및 비교예 1∼4로부터 확인될 수 있는 바와 같이, 화합물 B 및 C보다 더욱 포화된 색조 더욱 우수한 효율 및 장기간의 수명을 제시하였다. 화합물 6을 함유하는 소자는 화합물 B 또는 화합물 C를 사용하는 소자와 비교하여 향상된 수명을 제시하였다. 화합물 8 또는 화합물 9를 사용하는 소자는 화합물 B 또는 화합물 C를 사용하는 소자보다 더욱 포화된 색조, 향상된 효율 및 장기간의 수명을 제시하였다.
이러한 데이타는 페닐피리딘 및 페닐벤즈이미다졸을 함유하는 이종리간드 화합물이 인광성 OLED를 위한 우수한 방출 도펀트인 것을 제시한다. 이러한 화합물은 향상된 효율, 향상된 색조 및 장기간의 수명을 갖는 소자를 제공한다.
도 3에는 화합물 3, 화합물 A, 및 화합물 B의 용액 광발광(PL) 스펙트럼이 도시된다. 동종리간드 착체 화합물 A는 전자진동 구조를 제시하였다. 이종리간드 착체 화합물 3은 화합물 B와 유사한 형상을 갖는다. 하지만, 화합물 3의 방출은 화합물 B보다 더 좁으며, 이는 모든 리간드가 방출에 기여할 수 있다는 것을 나타낸다. 추가적으로, 화합물 3은 화합물 B보다 약 20° 낮고 화합물 A보다 약 60° 낮은 고 진공 하에 220℃ 미만에서 증발시킬 수 있다.
도 4에는 일반적인 인광성 유기 발광 소자가 도시된다.
도 5에는 방출 도펀트로서 본 발명의 화합물을 함유하는 방출 층을 갖는 인광성 유기 발광 소자가 도시된다. 도 5의 소자는 화합물 C의 100 Å 두께의 정공 주입 층, NPD의 300 Å 두께의 정공 수송 층, 본 발명의 화합물의 X%로 도핑된 호스트 물질의 300 Å 두께의 방출 층, 호스트-1 또는 호스트-2의 50 Å 또는 100 Å 두께의 차단 층, 및 Alq3의 400 Å 또는 450 Å 두께의 전자 수송 층, 및 LiF/Al 캐소드를 포함한다. X는 7% 또는 10%이다.
도 6에는 페닐피리딘 및 페닐벤즈이미다졸을 함유하는 이종리간드 화합물이 도시된다.
본원에 기술된 각종 구체예는 오직 예로서만 언급되고, 본 발명의 범위를 한정하고자 하는 것이 아님을 이해한다. 예를 들면, 본원에 기술된 물질 및 구조의 다수는 본 발명의 취지로부터 벗어나는 일 없이 다른 물질 및 구조로 대체될 수 있다. 특허 청구된 본 발명은 이에 따라 당업자에게 확인되는 바와 같이 본원에 기술된 특정 실시예 및 바람직한 구체예로부터 변경예를 포함할 수 있다. 본 발명이 작용하는 이유로 다양한 이론들은 이를 한정하고자 하는 것이 아님을 이해할 것이다.
Claims (28)
- 하기 화학식을 갖는 이종리간드(heteroleptic) 이리듐 화합물 Ir(L1)n(L2)3-n:
상기 식에서,
n = 1 또는 2이고;
은 L1이고;
는 L2이고;
R2, R3, R4 및 R5는 화합물 상에 1치환, 2치환, 3치환, 4치환을 나타내거나 또는 비치환을 나타내고;
R2, R3, R4 및 R5는 각각 수소, 알킬, 헤테로알킬, 아릴, 치환된 아릴, 헤테로아릴 및 치환된 헤테로아릴로 이루어지는 군에서 독립적으로 선택되며,
R1은 치환된 아릴 및 치환된 헤테로아릴로 이루어진 군에서 선택되고; R1은 L1과 공액계를 형성하지 않는다. - 제1항에 있어서, n = 1인 화합물.
- 제1항에 있어서, 각 R2, R3 및 R5는 수소인 화합물.
- 제1항에 있어서, 녹색 방출 도펀트일 수 있는 화합물.
- 애노드;
캐소드; 및
애노드와 캐소드 사이에 배치된 유기 층
을 포함하는 유기 발광 소자로서, 상기 유기 층은 하기 화학식을 갖는 이종리간드 이리듐 화합물 Ir(L1)n(L2)3-n을 포함하는 유기 발광 소자:
상기 식에서,
n = 1 또는 2이고;
은 L1이고;
는 L2이고;
R2, R3, R4 및 R5는 화합물 상에 1치환, 2치환, 3치환 또는 4치환을 나타내거나 또는 비치환을 나타내고;
R2, R3, R4 및 R5는 각각 수소, 알킬, 헤테로알킬, 아릴, 치환된 아릴, 헤테로아릴 및 치환된 헤테로아릴로 이루어지는 군에서 독립적으로 선택되고,
R1은 치환된 아릴 및 치환된 헤테로아릴로 이루어진 군에서 선택되고; R1은 L1과 공액계를 형성하지 않는다. - 제11항에 있어서, 유기 층은 호스트를 추가로 포함하는 것인 유기 발광 소자.
- 애노드;
캐소드; 및
애노드와 캐소드 사이에 배치되고 하기 화학식을 갖는 이종리간드 이리듐 화합물 Ir(L1)n(L2)3-n을 포함하는 유기 층
을 포함하는 소자를 포함하는 소비자 제품으로서, 소비자 제품은 평면 디스플레이, 컴퓨터 모니터, 텔레비젼, 광고게시판, 실내 또는 실외용 조명 및 신호기를 위한 라이트, 헤드업 디스플레이, 완전 투명성 디스플레이, 가요성 디스플레이, 레이저 프린터, 전화기, 휴대전화기, 개인 휴대 정보 단말기(PDA), 노트북 컴퓨터, 디지털 카메라, 캠코더, 뷰파인더, 마이크로디스플레이, 운송수단, 대형 구역 벽, 극장 또는 스타디움 스크린 및 사인(sign)으로 이루어진 군에서 선택되는 것인 소비자 제품:
상기 식에서,
n = 1 또는 2이고;
은 L1이고;
는 L2이고;
R2, R3, R4 및 R5는 화합물 상에 1치환, 2치환, 3치환, 4치환을 나타내거나 또는 비치환을 나타내고;
R2, R3, R4 및 R5는 각각 수소, 알킬, 헤테로알킬, 아릴, 치환된 아릴, 헤테로아릴 및 치환된 헤테로아릴로 이루어지는 군에서 독립적으로 선택되고;
R1은 치환된 아릴 및 치환된 헤테로아릴로 이루어진 군에서 선택되고; R1은 L1과 공액계를 형성하지 않는다. - 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US11325708P | 2008-11-11 | 2008-11-11 | |
| US61/113,257 | 2008-11-11 | ||
| US12/615,660 US8367223B2 (en) | 2008-11-11 | 2009-11-10 | Heteroleptic phosphorescent emitters |
| US12/615,660 | 2009-11-10 | ||
| PCT/US2009/063873 WO2010056669A1 (en) | 2008-11-11 | 2009-11-10 | Phosphorescent emitters |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020167011603A Division KR101919207B1 (ko) | 2008-11-11 | 2009-11-10 | 인광성 에미터 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| KR20110094027A KR20110094027A (ko) | 2011-08-19 |
| KR101843201B1 true KR101843201B1 (ko) | 2018-03-28 |
Family
ID=41569895
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020117012696A KR101843201B1 (ko) | 2008-11-11 | 2009-11-10 | 인광성 에미터 |
| KR1020167011603A KR101919207B1 (ko) | 2008-11-11 | 2009-11-10 | 인광성 에미터 |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020167011603A KR101919207B1 (ko) | 2008-11-11 | 2009-11-10 | 인광성 에미터 |
Country Status (6)
| Country | Link |
|---|---|
| US (2) | US8367223B2 (ko) |
| EP (1) | EP2362889B1 (ko) |
| JP (2) | JP5854839B2 (ko) |
| KR (2) | KR101843201B1 (ko) |
| CN (2) | CN103396455B (ko) |
| WO (1) | WO2010056669A1 (ko) |
Families Citing this family (103)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US9051344B2 (en) * | 2005-05-06 | 2015-06-09 | Universal Display Corporation | Stability OLED materials and devices |
| CN103396455B (zh) * | 2008-11-11 | 2017-03-01 | 通用显示公司 | 磷光发射体 |
| KR101212670B1 (ko) * | 2009-11-03 | 2012-12-14 | 제일모직주식회사 | 유기광전소자용 조성물, 이를 이용한 유기광전소자 및 이를 포함하는 표시장치 |
| KR20130067276A (ko) | 2010-04-30 | 2013-06-21 | 아리조나 보드 오브 리젠츠 퍼 앤 온 비하프 오브 아리조나 스테이트 유니버시티 | 4개의 배위된 팔라듐 착물의 합성 및 그것에 관한 발광 디바이스에서의 그의 적용 |
| WO2011157779A1 (en) | 2010-06-18 | 2011-12-22 | Basf Se | Organic electronic devices comprising a layer of a pyridine compound and a 8-hydroxyquinolinolato earth alkaline metal, or alkali metal complex |
| JP5990515B2 (ja) | 2010-06-18 | 2016-09-14 | ビーエーエスエフ ソシエタス・ヨーロピアBasf Se | ジベンゾフラン化合物と8−ヒドロキシキノリノラトアルカリ土類金属錯体または8−ヒドロキシキノリノラトアルカリ金属錯体との層を含む、有機電子デバイス |
| KR102001685B1 (ko) | 2010-10-07 | 2019-07-18 | 유디씨 아일랜드 리미티드 | 전자 응용을 위한 페난트로[9,10-b]푸란 |
| US9079872B2 (en) | 2010-10-07 | 2015-07-14 | Basf Se | Phenanthro[9, 10-B]furans for electronic applications |
| JP6012024B2 (ja) | 2010-12-13 | 2016-10-25 | ユー・ディー・シー アイルランド リミテッド | 電子装置用途のためのビスピリミジン |
| US8362246B2 (en) | 2010-12-13 | 2013-01-29 | Basf Se | Bispyrimidines for electronic applications |
| CN103221508B (zh) * | 2010-12-30 | 2015-07-01 | 海洋王照明科技股份有限公司 | 含铱有机电致发光材料及其制备方法和有机电致发光器件 |
| KR102116313B1 (ko) | 2011-03-25 | 2020-06-01 | 유디씨 아일랜드 리미티드 | 전자장치 응용을 위한 4h-이미다조[1,2-a]이미다졸 |
| US9806270B2 (en) | 2011-03-25 | 2017-10-31 | Udc Ireland Limited | 4H-imidazo[1,2-a]imidazoles for electronic applications |
| US8580399B2 (en) | 2011-04-08 | 2013-11-12 | Universal Display Corporation | Substituted oligoazacarbazoles for light emitting diodes |
| US9221857B2 (en) | 2011-04-14 | 2015-12-29 | Arizona Board Of Regents Acting For And On Behalf Of Arizona State University | Pyridine-oxyphenyl coordinated iridium (III) complexes and methods of making and using |
| US9212197B2 (en) | 2011-05-19 | 2015-12-15 | Universal Display Corporation | Phosphorescent heteroleptic phenylbenzimidazole dopants |
| US8795850B2 (en) | 2011-05-19 | 2014-08-05 | Universal Display Corporation | Phosphorescent heteroleptic phenylbenzimidazole dopants and new synthetic methodology |
| US9238668B2 (en) | 2011-05-26 | 2016-01-19 | Arizona Board Of Regents, Acting For And On Behalf Of Arizona State University | Synthesis of platinum and palladium complexes as narrow-band phosphorescent emitters for full color displays |
| JP5742586B2 (ja) * | 2011-08-25 | 2015-07-01 | コニカミノルタ株式会社 | 有機エレクトロルミネッセンス素子、照明装置及び表示装置 |
| US9502664B2 (en) | 2011-11-10 | 2016-11-22 | Udc Ireland Limited | 4H-imidazo[1,2-a]imidazoles for electronic applications |
| EP2676964A1 (en) | 2012-06-18 | 2013-12-25 | Solvay Sa | Preparation of heteroleptic metal complexes |
| EP2674468A1 (en) | 2012-06-15 | 2013-12-18 | Solvay Sa | Heteroleptic light emitting complexes |
| KR20140119043A (ko) | 2011-12-28 | 2014-10-08 | 솔베이(소시에떼아노님) | 이종 리간드 발광 착물 |
| US20140378685A1 (en) | 2011-12-28 | 2014-12-25 | Solvay Sa | Preparation of heteroleptic metal complexes |
| US10211413B2 (en) * | 2012-01-17 | 2019-02-19 | Universal Display Corporation | Organic electroluminescent materials and devices |
| CN108191870A (zh) | 2012-07-10 | 2018-06-22 | Udc 爱尔兰有限责任公司 | 用于电子应用的苯并咪唑并[1,2-a]苯并咪唑衍生物 |
| WO2014031977A1 (en) | 2012-08-24 | 2014-02-27 | Arizona Board Of Regents For And On Behalf Of Arizona State University | Metal compounds and methods and uses thereof |
| US20150221877A1 (en) | 2012-08-31 | 2015-08-06 | Solvay Sa | Transition metal complexes comprising symmetric tetradentate ligands |
| TWI623539B (zh) | 2012-09-20 | 2018-05-11 | Udc愛爾蘭責任有限公司 | 供電子應用之氮雜二苯并呋喃 |
| WO2014047616A1 (en) | 2012-09-24 | 2014-03-27 | Arizona Board Of Regents For And On Behalf Of Arizona State University | Metal compounds, methods, and uses thereof |
| EP2712909A1 (en) | 2012-09-28 | 2014-04-02 | Solvay SA | Light emitting transition metal complexes based on hexadentate ligands |
| US20150274762A1 (en) | 2012-10-26 | 2015-10-01 | Arizona Board Of Regents Acting For And On Behalf Of Arizona State University | Metal complexes, methods, and uses thereof |
| JP5984689B2 (ja) | 2013-01-21 | 2016-09-06 | キヤノン株式会社 | 有機金属錯体及びこれを用いた有機発光素子 |
| US10400163B2 (en) * | 2013-02-08 | 2019-09-03 | Universal Display Corporation | Organic electroluminescent materials and devices |
| JP6804823B2 (ja) | 2013-10-14 | 2020-12-23 | アリゾナ・ボード・オブ・リージェンツ・オン・ビハーフ・オブ・アリゾナ・ステイト・ユニバーシティーArizona Board of Regents on behalf of Arizona State University | 白金錯体およびデバイス |
| WO2015063046A1 (en) | 2013-10-31 | 2015-05-07 | Basf Se | Azadibenzothiophenes for electronic applications |
| US10020455B2 (en) | 2014-01-07 | 2018-07-10 | Arizona Board Of Regents On Behalf Of Arizona State University | Tetradentate platinum and palladium complex emitters containing phenyl-pyrazole and its analogues |
| WO2015131158A1 (en) | 2014-02-28 | 2015-09-03 | Arizona Board Of Regents On Behalf Of Arizona State University | Chiral metal complexes as emitters for organic polarized electroluminescent devices |
| US9941479B2 (en) | 2014-06-02 | 2018-04-10 | Arizona Board Of Regents On Behalf Of Arizona State University | Tetradentate cyclometalated platinum complexes containing 9,10-dihydroacridine and its analogues |
| US9923155B2 (en) | 2014-07-24 | 2018-03-20 | Arizona Board Of Regents On Behalf Of Arizona State University | Tetradentate platinum (II) complexes cyclometalated with functionalized phenyl carbene ligands and their analogues |
| WO2016016791A1 (en) | 2014-07-28 | 2016-02-04 | Idemitsu Kosan Co., Ltd (Ikc) | 2,9-functionalized benzimidazolo[1,2-a]benzimidazoles as hosts for organic light emitting diodes (oleds) |
| US9502671B2 (en) | 2014-07-28 | 2016-11-22 | Arizona Board Of Regents On Behalf Of Arizona State University | Tridentate cyclometalated metal complexes with six-membered coordination rings |
| US9818959B2 (en) | 2014-07-29 | 2017-11-14 | Arizona Board of Regents on behlaf of Arizona State University | Metal-assisted delayed fluorescent emitters containing tridentate ligands |
| KR102241847B1 (ko) | 2014-07-29 | 2021-04-20 | 삼성디스플레이 주식회사 | 유기 발광 소자 |
| EP2982676B1 (en) | 2014-08-07 | 2018-04-11 | Idemitsu Kosan Co., Ltd. | Benzimidazo[2,1-B]benzoxazoles for electronic applications |
| TWI690534B (zh) | 2014-08-08 | 2020-04-11 | 愛爾蘭商Udc愛爾蘭責任有限公司 | 電致發光咪唑并喹噁啉碳烯金屬錯合物 |
| US11329244B2 (en) | 2014-08-22 | 2022-05-10 | Arizona Board Of Regents On Behalf Of Arizona State University | Organic light-emitting diodes with fluorescent and phosphorescent emitters |
| EP2993215B1 (en) | 2014-09-04 | 2019-06-19 | Idemitsu Kosan Co., Ltd. | Azabenzimidazo[2,1-a]benzimidazoles for electronic applications |
| EP3015469B1 (en) | 2014-10-30 | 2018-12-19 | Idemitsu Kosan Co., Ltd. | 5-(benzimidazol-2-yl)benzimidazo[1,2-a]benzimidazoles for electronic applications |
| US10033003B2 (en) | 2014-11-10 | 2018-07-24 | Arizona Board Of Regents On Behalf Of Arizona State University | Tetradentate metal complexes with carbon group bridging ligands |
| US9865825B2 (en) | 2014-11-10 | 2018-01-09 | Arizona Board Of Regents On Behalf Of Arizona State University | Emitters based on octahedral metal complexes |
| WO2016079667A1 (en) | 2014-11-17 | 2016-05-26 | Idemitsu Kosan Co., Ltd. | Indole derivatives for electronic applications |
| KR102512938B1 (ko) | 2014-11-18 | 2023-03-23 | 유디씨 아일랜드 리미티드 | 유기 발광 다이오드에 사용하기 위한 Pt- 또는 Pd-카르벤 착체 |
| EP3034507A1 (en) | 2014-12-15 | 2016-06-22 | Idemitsu Kosan Co., Ltd | 1-functionalized dibenzofurans and dibenzothiophenes for organic light emitting diodes (OLEDs) |
| EP3034506A1 (en) | 2014-12-15 | 2016-06-22 | Idemitsu Kosan Co., Ltd | 4-functionalized carbazole derivatives for electronic applications |
| KR102343146B1 (ko) | 2014-12-16 | 2021-12-27 | 삼성디스플레이 주식회사 | 유기금속 화합물 및 이를 포함한 유기 발광 소자 |
| EP3053918B1 (en) | 2015-02-06 | 2018-04-11 | Idemitsu Kosan Co., Ltd. | 2-carbazole substituted benzimidazoles for electronic applications |
| EP3054498B1 (en) | 2015-02-06 | 2017-09-20 | Idemitsu Kosan Co., Ltd. | Bisimidazodiazocines |
| EP3061759B1 (en) | 2015-02-24 | 2019-12-25 | Idemitsu Kosan Co., Ltd | Nitrile substituted dibenzofurans |
| WO2016143770A1 (ja) | 2015-03-10 | 2016-09-15 | 国立研究開発法人産業技術総合研究所 | ヘテロレプティックイリジウム錯体、ならびに該化合物を用いた発光材料および有機発光素子 |
| EP3070144B1 (en) | 2015-03-17 | 2018-02-28 | Idemitsu Kosan Co., Ltd. | Seven-membered ring compounds |
| EP3072943B1 (en) | 2015-03-26 | 2018-05-02 | Idemitsu Kosan Co., Ltd. | Dibenzofuran/carbazole-substituted benzonitriles |
| EP3075737B1 (en) | 2015-03-31 | 2019-12-04 | Idemitsu Kosan Co., Ltd | Benzimidazolo[1,2-a]benzimidazole carrying aryl- or heteroarylnitril groups for organic light emitting diodes |
| KR102424977B1 (ko) | 2015-04-14 | 2022-07-26 | 삼성디스플레이 주식회사 | 축합환 화합물 및 이를 포함한 유기 발광 소자 |
| US9879039B2 (en) | 2015-06-03 | 2018-01-30 | Arizona Board Of Regents On Behalf Of Arizona State University | Tetradentate and octahedral metal complexes containing naphthyridinocarbazole and its analogues |
| US10158091B2 (en) | 2015-08-04 | 2018-12-18 | Arizona Board Of Regents On Behalf Of Arizona State University | Tetradentate platinum (II) and palladium (II) complexes, devices, and uses thereof |
| EP3150606B1 (en) | 2015-10-01 | 2019-08-14 | Idemitsu Kosan Co., Ltd. | Benzimidazolo[1,2-a]benzimidazoles carrying benzofurane or benzothiophene groups for organic light emitting diodes |
| WO2017056053A1 (en) | 2015-10-01 | 2017-04-06 | Idemitsu Kosan Co., Ltd. | Benzimidazolo[1,2-a]benzimidazole carrying benzimidazolo[1,2-a]benzimidazolyl groups, carbazolyl groups, benzofurane groups or benzothiophene groups for organic light emitting diodes |
| US20180269407A1 (en) | 2015-10-01 | 2018-09-20 | Idemitsu Kosan Co., Ltd. | Benzimidazolo[1,2-a]benzimidazole carrying triazine groups for organic light emitting diodes |
| EP3150604B1 (en) | 2015-10-01 | 2021-07-14 | Idemitsu Kosan Co., Ltd. | Benzimidazolo[1,2-a]benzimidazole carrying benzimidazolo[1,2-a]benzimidazolylyl groups, carbazolyl groups, benzofurane groups or benzothiophene groups for organic light emitting diodes |
| US20180319813A1 (en) | 2015-11-04 | 2018-11-08 | Idemitsu Kosan Co., Ltd | Benzimidazole fused heteroaryls |
| US11174258B2 (en) | 2015-12-04 | 2021-11-16 | Idemitsu Kosan Co., Ltd. | Benzimidazolo[1,2-a]benzimidazole derivatives for organic light emitting diodes |
| KR102630644B1 (ko) | 2015-12-17 | 2024-01-30 | 삼성디스플레이 주식회사 | 유기 발광 소자 |
| WO2017109722A1 (en) | 2015-12-21 | 2017-06-29 | Idemitsu Kosan Co., Ltd. | Nitrogen-containing heterocyclic compounds and organic electroluminescence devices containing them |
| KR20170074170A (ko) | 2015-12-21 | 2017-06-29 | 유디씨 아일랜드 리미티드 | 삼각형 리간드를 갖는 전이 금속 착체 및 oled에서의 이의 용도 |
| US10457864B2 (en) | 2016-02-09 | 2019-10-29 | Universal Display Corporation | Organic electroluminescent materials and devices |
| US10968229B2 (en) | 2016-04-12 | 2021-04-06 | Idemitsu Kosan Co., Ltd. | Seven-membered ring compounds |
| US11335865B2 (en) | 2016-04-15 | 2022-05-17 | Arizona Board Of Regents On Behalf Of Arizona State University | OLED with multi-emissive material layer |
| US20170324049A1 (en) * | 2016-05-05 | 2017-11-09 | Universal Display Corporation | Organic Electroluminescent Materials and Devices |
| KR102447668B1 (ko) | 2016-06-22 | 2022-09-26 | 이데미쓰 고산 가부시키가이샤 | 유기 발광 다이오드를 위한 특이적으로 치환된 벤조푸로- 및 벤조티에노퀴놀린 |
| US10177323B2 (en) | 2016-08-22 | 2019-01-08 | Arizona Board Of Regents On Behalf Of Arizona State University | Tetradentate platinum (II) and palladium (II) complexes and octahedral iridium complexes employing azepine functional groups and their analogues |
| KR20210083134A (ko) | 2016-10-12 | 2021-07-06 | 아리조나 보드 오브 리젠츠 온 비하프 오브 아리조나 스테이트 유니버시티 | 협대역 적색 인광성 4좌 백금(ii) 착물 |
| KR102555608B1 (ko) * | 2016-12-16 | 2023-07-13 | 가부시키가이샤 한도오따이 에네루기 켄큐쇼 | 유기 금속 착체, 발광 소자, 발광 장치, 전자 기기, 및 조명 장치 |
| US11183670B2 (en) | 2016-12-16 | 2021-11-23 | Arizona Board Of Regents On Behalf Of Arizona State University | Organic light emitting diode with split emissive layer |
| CN106753340A (zh) * | 2016-12-20 | 2017-05-31 | 中节能万润股份有限公司 | 一种苯并咪唑类有机电致发光材料及其制备方法和应用 |
| WO2018140765A1 (en) | 2017-01-27 | 2018-08-02 | Jian Li | Metal-assisted delayed fluorescent emitters employing pyrido-pyrrolo-acridine and analogues |
| US10516117B2 (en) | 2017-05-19 | 2019-12-24 | Arizona Board Of Regents On Behalf Of Arizona State University | Metal-assisted delayed fluorescent emttters employing benzo-imidazo-phenanthridine and analogues |
| US11101435B2 (en) | 2017-05-19 | 2021-08-24 | Arizona Board Of Regents On Behalf Of Arizona State University | Tetradentate platinum and palladium complexes based on biscarbazole and analogues |
| EP3466954A1 (en) | 2017-10-04 | 2019-04-10 | Idemitsu Kosan Co., Ltd. | Fused phenylquinazolines bridged with a heteroatom |
| KR20200065064A (ko) | 2017-10-17 | 2020-06-08 | 지안 리 | 표시 및 조명 분야용 단색성 이미터로서의, 바람직한 분자 배향을 갖는 인광성 엑시머 |
| US11647643B2 (en) | 2017-10-17 | 2023-05-09 | Arizona Board Of Regents On Behalf Of Arizona State University | Hole-blocking materials for organic light emitting diodes |
| EP3604477A1 (en) | 2018-07-30 | 2020-02-05 | Idemitsu Kosan Co., Ltd. | Polycyclic compound, organic electroluminescence device, and electronic device |
| DE112019003873B4 (de) * | 2018-07-31 | 2024-05-16 | Semiconductor Energy Laboratory Co., Ltd. | Organische Verbindung, Licht emittierendes Element, Licht emittierende Vorrichtung, elektronisches Gerät und Beleuchtungsvorrichtung |
| EP3608319A1 (en) | 2018-08-07 | 2020-02-12 | Idemitsu Kosan Co., Ltd. | Condensed aza cycles as organic light emitting device and materials for use in same |
| EP3674295A1 (en) | 2018-12-28 | 2020-07-01 | Samsung Electronics Co., Ltd. | Heterocyclic compound, composition including heterocyclic compound, and organic light-emitting device including heterocyclic compound |
| JP7311265B2 (ja) * | 2018-12-28 | 2023-07-19 | 三星電子株式会社 | 化合物、組成物、液状組成物および有機エレクトロルミネッセンス素子 |
| US11878988B2 (en) | 2019-01-24 | 2024-01-23 | Arizona Board Of Regents On Behalf Of Arizona State University | Blue phosphorescent emitters employing functionalized imidazophenthridine and analogues |
| US11594691B2 (en) | 2019-01-25 | 2023-02-28 | Arizona Board Of Regents On Behalf Of Arizona State University | Light outcoupling efficiency of phosphorescent OLEDs by mixing horizontally aligned fluorescent emitters |
| US11785838B2 (en) | 2019-10-02 | 2023-10-10 | Arizona Board Of Regents On Behalf Of Arizona State University | Green and red organic light-emitting diodes employing excimer emitters |
| US11945985B2 (en) | 2020-05-19 | 2024-04-02 | Arizona Board Of Regents On Behalf Of Arizona State University | Metal assisted delayed fluorescent emitters for organic light-emitting diodes |
| CN114409708B (zh) * | 2020-10-28 | 2023-06-16 | 广东阿格蕾雅光电材料有限公司 | 一种有机金属化合物及其应用 |
| CN115368416A (zh) * | 2021-05-18 | 2022-11-22 | 广东阿格蕾雅光电材料有限公司 | 一种有机金属铱化合物及其应用 |
| KR20220164129A (ko) * | 2021-06-03 | 2022-12-13 | 삼성전자주식회사 | 조성물, 상기 조성물을 포함한 층, 상기 조성물을 포함한 발광 소자 및 상기 발광 소자를 포함한 전자 장치 |
Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2003192691A (ja) * | 2001-12-26 | 2003-07-09 | Mitsubishi Chemicals Corp | 有機イリジウム錯体及び有機電界発光素子 |
| JP2004131464A (ja) * | 2002-08-14 | 2004-04-30 | Mitsubishi Chemicals Corp | 有機金属錯体、発光色素、有機電界発光素子材料、および有機電界発光素子 |
| JP2005163036A (ja) * | 2003-11-18 | 2005-06-23 | Chi Mei Electronics Corp | 発光材料としてのイリジウム錯体および有機発光ダイオードデバイス |
| JP2006505956A (ja) * | 2002-11-08 | 2006-02-16 | ユニバーサル ディスプレイ コーポレイション | 有機発光物質及びデバイス |
Family Cites Families (106)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4769292A (en) * | 1987-03-02 | 1988-09-06 | Eastman Kodak Company | Electroluminescent device with modified thin film luminescent zone |
| GB8909011D0 (en) * | 1989-04-20 | 1989-06-07 | Friend Richard H | Electroluminescent devices |
| US5061569A (en) * | 1990-07-26 | 1991-10-29 | Eastman Kodak Company | Electroluminescent device with organic electroluminescent medium |
| DE69412567T2 (de) | 1993-11-01 | 1999-02-04 | Hodogaya Chemical Co Ltd | Aminverbindung und sie enthaltende Elektrolumineszenzvorrichtung |
| US5707745A (en) * | 1994-12-13 | 1998-01-13 | The Trustees Of Princeton University | Multicolor organic light emitting devices |
| US5703436A (en) * | 1994-12-13 | 1997-12-30 | The Trustees Of Princeton University | Transparent contacts for organic devices |
| US6939625B2 (en) * | 1996-06-25 | 2005-09-06 | Nôrthwestern University | Organic light-emitting diodes and methods for assembly and enhanced charge injection |
| US5844363A (en) * | 1997-01-23 | 1998-12-01 | The Trustees Of Princeton Univ. | Vacuum deposited, non-polymeric flexible organic light emitting devices |
| US5834893A (en) * | 1996-12-23 | 1998-11-10 | The Trustees Of Princeton University | High efficiency organic light emitting devices with light directing structures |
| US6091195A (en) * | 1997-02-03 | 2000-07-18 | The Trustees Of Princeton University | Displays having mesa pixel configuration |
| US6013982A (en) * | 1996-12-23 | 2000-01-11 | The Trustees Of Princeton University | Multicolor display devices |
| US6303238B1 (en) * | 1997-12-01 | 2001-10-16 | The Trustees Of Princeton University | OLEDs doped with phosphorescent compounds |
| US6337102B1 (en) * | 1997-11-17 | 2002-01-08 | The Trustees Of Princeton University | Low pressure vapor phase deposition of organic thin films |
| US6087196A (en) * | 1998-01-30 | 2000-07-11 | The Trustees Of Princeton University | Fabrication of organic semiconductor devices using ink jet printing |
| US6528187B1 (en) * | 1998-09-08 | 2003-03-04 | Fuji Photo Film Co., Ltd. | Material for luminescence element and luminescence element using the same |
| US6830828B2 (en) * | 1998-09-14 | 2004-12-14 | The Trustees Of Princeton University | Organometallic complexes as phosphorescent emitters in organic LEDs |
| US6097147A (en) * | 1998-09-14 | 2000-08-01 | The Trustees Of Princeton University | Structure for high efficiency electroluminescent device |
| US6294398B1 (en) * | 1999-11-23 | 2001-09-25 | The Trustees Of Princeton University | Method for patterning devices |
| US6458475B1 (en) | 1999-11-24 | 2002-10-01 | The Trustee Of Princeton University | Organic light emitting diode having a blue phosphorescent molecule as an emitter |
| US6821645B2 (en) * | 1999-12-27 | 2004-11-23 | Fuji Photo Film Co., Ltd. | Light-emitting material comprising orthometalated iridium complex, light-emitting device, high efficiency red light-emitting device, and novel iridium complex |
| KR100377321B1 (ko) * | 1999-12-31 | 2003-03-26 | 주식회사 엘지화학 | 피-형 반도체 성질을 갖는 유기 화합물을 포함하는 전기소자 |
| US20020121638A1 (en) | 2000-06-30 | 2002-09-05 | Vladimir Grushin | Electroluminescent iridium compounds with fluorinated phenylpyridines, phenylpyrimidines, and phenylquinolines and devices made with such compounds |
| CN101924190B (zh) | 2000-08-11 | 2012-07-04 | 普林斯顿大学理事会 | 有机金属化合物和发射转换有机电致磷光 |
| US6579630B2 (en) * | 2000-12-07 | 2003-06-17 | Canon Kabushiki Kaisha | Deuterated semiconducting organic compounds used for opto-electronic devices |
| JP3812730B2 (ja) * | 2001-02-01 | 2006-08-23 | 富士写真フイルム株式会社 | 遷移金属錯体及び発光素子 |
| JP4307000B2 (ja) * | 2001-03-08 | 2009-08-05 | キヤノン株式会社 | 金属配位化合物、電界発光素子及び表示装置 |
| JP4310077B2 (ja) * | 2001-06-19 | 2009-08-05 | キヤノン株式会社 | 金属配位化合物及び有機発光素子 |
| ATE431970T1 (de) * | 2001-06-20 | 2009-06-15 | Showa Denko Kk | Licht emittierendes material und organische leuchtdiode |
| US7071615B2 (en) * | 2001-08-20 | 2006-07-04 | Universal Display Corporation | Transparent electrodes |
| US7250226B2 (en) * | 2001-08-31 | 2007-07-31 | Nippon Hoso Kyokai | Phosphorescent compound, a phosphorescent composition and an organic light-emitting device |
| US7431968B1 (en) * | 2001-09-04 | 2008-10-07 | The Trustees Of Princeton University | Process and apparatus for organic vapor jet deposition |
| US6835469B2 (en) * | 2001-10-17 | 2004-12-28 | The University Of Southern California | Phosphorescent compounds and devices comprising the same |
| US7166368B2 (en) | 2001-11-07 | 2007-01-23 | E. I. Du Pont De Nemours And Company | Electroluminescent platinum compounds and devices made with such compounds |
| US6863997B2 (en) * | 2001-12-28 | 2005-03-08 | The Trustees Of Princeton University | White light emitting OLEDs from combined monomer and aggregate emission |
| KR100691543B1 (ko) | 2002-01-18 | 2007-03-09 | 주식회사 엘지화학 | 새로운 전자 수송용 물질 및 이를 이용한 유기 발광 소자 |
| US6939578B2 (en) * | 2002-01-18 | 2005-09-06 | E. I. Du Pont De Nemours And Company | Volatile copper(II) complexes for deposition of copper films by atomic layer deposition |
| US20030230980A1 (en) * | 2002-06-18 | 2003-12-18 | Forrest Stephen R | Very low voltage, high efficiency phosphorescent oled in a p-i-n structure |
| US7189989B2 (en) * | 2002-08-22 | 2007-03-13 | Fuji Photo Film Co., Ltd. | Light emitting element |
| EP2264122A3 (en) * | 2002-08-27 | 2011-05-11 | Fujifilm Corporation | Organometallic complexes, organic electroluminescent devices and organic electroluminescent displays |
| JP4365199B2 (ja) * | 2002-12-27 | 2009-11-18 | 富士フイルム株式会社 | 有機電界発光素子 |
| JP4365196B2 (ja) * | 2002-12-27 | 2009-11-18 | 富士フイルム株式会社 | 有機電界発光素子 |
| CN100387607C (zh) * | 2003-03-24 | 2008-05-14 | 南加利福尼亚大学 | Ir的苯基-吡唑配合物 |
| US7090928B2 (en) * | 2003-04-01 | 2006-08-15 | The University Of Southern California | Binuclear compounds |
| JP5318347B2 (ja) | 2003-04-15 | 2013-10-16 | メルク パテント ゲーエムベーハー | 発光可能な、マトリックス材料と有機半導体との混合物、その使用、ならびに前記混合物を含む電子部品 |
| US7029765B2 (en) * | 2003-04-22 | 2006-04-18 | Universal Display Corporation | Organic light emitting devices having reduced pixel shrinkage |
| KR101032355B1 (ko) | 2003-05-29 | 2011-05-03 | 신닛테츠가가쿠 가부시키가이샤 | 유기 전계 발광 소자 |
| JP2005011610A (ja) | 2003-06-18 | 2005-01-13 | Nippon Steel Chem Co Ltd | 有機電界発光素子 |
| US20050025993A1 (en) * | 2003-07-25 | 2005-02-03 | Thompson Mark E. | Materials and structures for enhancing the performance of organic light emitting devices |
| TWI390006B (zh) | 2003-08-07 | 2013-03-21 | Nippon Steel Chemical Co | Organic EL materials with aluminum clamps |
| DE10338550A1 (de) | 2003-08-19 | 2005-03-31 | Basf Ag | Übergangsmetallkomplexe mit Carbenliganden als Emitter für organische Licht-emittierende Dioden (OLEDs) |
| JP4337475B2 (ja) * | 2003-08-27 | 2009-09-30 | 三菱化学株式会社 | 有機金属錯体、発光材料、および有機電界発光素子 |
| US20060269780A1 (en) | 2003-09-25 | 2006-11-30 | Takayuki Fukumatsu | Organic electroluminescent device |
| DE10350606A1 (de) * | 2003-10-30 | 2005-06-09 | Covion Organic Semiconductors Gmbh | Verfahren zur Herstellung heteroleptischer, ortho-metallierter Organometall-Verbindungen |
| JP4822687B2 (ja) * | 2003-11-21 | 2011-11-24 | 富士フイルム株式会社 | 有機電界発光素子 |
| US7332232B2 (en) * | 2004-02-03 | 2008-02-19 | Universal Display Corporation | OLEDs utilizing multidentate ligand systems |
| KR100834327B1 (ko) | 2004-03-11 | 2008-06-02 | 미쓰비시 가가꾸 가부시키가이샤 | 전하 수송막용 조성물 및 이온 화합물, 이를 이용한 전하수송막 및 유기 전계 발광 장치, 및 유기 전계 발광 장치의제조 방법 및 전하 수송막의 제조 방법 |
| TW200531592A (en) | 2004-03-15 | 2005-09-16 | Nippon Steel Chemical Co | Organic electroluminescent device |
| JP4869565B2 (ja) * | 2004-04-23 | 2012-02-08 | 富士フイルム株式会社 | 有機電界発光素子 |
| US7393599B2 (en) * | 2004-05-18 | 2008-07-01 | The University Of Southern California | Luminescent compounds with carbene ligands |
| US7491823B2 (en) * | 2004-05-18 | 2009-02-17 | The University Of Southern California | Luminescent compounds with carbene ligands |
| US7154114B2 (en) * | 2004-05-18 | 2006-12-26 | Universal Display Corporation | Cyclometallated iridium carbene complexes for use as hosts |
| US7445855B2 (en) * | 2004-05-18 | 2008-11-04 | The University Of Southern California | Cationic metal-carbene complexes |
| US7534505B2 (en) * | 2004-05-18 | 2009-05-19 | The University Of Southern California | Organometallic compounds for use in electroluminescent devices |
| US7279704B2 (en) * | 2004-05-18 | 2007-10-09 | The University Of Southern California | Complexes with tridentate ligands |
| WO2005123873A1 (ja) | 2004-06-17 | 2005-12-29 | Konica Minolta Holdings, Inc. | 有機エレクトロルミネッセンス素子材料、有機エレクトロルミネッセンス素子、表示装置及び照明装置 |
| BRPI0512641A (pt) * | 2004-06-28 | 2008-03-25 | Ciba Sc Holding Ag | complexos metálicos eletroluminescentes com triazóis e benzotriazóis |
| US20060008670A1 (en) * | 2004-07-06 | 2006-01-12 | Chun Lin | Organic light emitting materials and devices |
| US7251561B2 (en) * | 2004-07-28 | 2007-07-31 | Telmap Ltd. | Selective download of corridor map data |
| DE102004057072A1 (de) * | 2004-11-25 | 2006-06-01 | Basf Ag | Verwendung von Übergangsmetall-Carbenkomplexen in organischen Licht-emittierenden Dioden (OLEDs) |
| KR100803125B1 (ko) * | 2005-03-08 | 2008-02-14 | 엘지전자 주식회사 | 적색 인광 화합물 및 이를 사용한 유기전계발광소자 |
| US7807275B2 (en) * | 2005-04-21 | 2010-10-05 | Universal Display Corporation | Non-blocked phosphorescent OLEDs |
| JP4533796B2 (ja) * | 2005-05-06 | 2010-09-01 | 富士フイルム株式会社 | 有機電界発光素子 |
| US9051344B2 (en) | 2005-05-06 | 2015-06-09 | Universal Display Corporation | Stability OLED materials and devices |
| KR101634423B1 (ko) * | 2005-05-31 | 2016-06-28 | 유니버셜 디스플레이 코포레이션 | 인광 발광 다이오드에서의 트리페닐렌 호스트 |
| JP5130913B2 (ja) * | 2005-08-25 | 2013-01-30 | コニカミノルタホールディングス株式会社 | 有機エレクトロルミネッセンス素子材料、有機エレクトロルミネッセンス素子、表示装置及び照明装置 |
| WO2007028417A1 (en) * | 2005-09-07 | 2007-03-15 | Technische Universität Braunschweig | Triplett emitter having condensed five-membered rings |
| JP4887731B2 (ja) | 2005-10-26 | 2012-02-29 | コニカミノルタホールディングス株式会社 | 有機エレクトロルミネッセンス素子、表示装置及び照明装置 |
| EP3569606B1 (en) * | 2006-02-10 | 2022-01-05 | Universal Display Corporation | Metal complexes of cyclometallated imidazo (1,2-f)phenanthridine and diimidazo (1,2-a; 1', 2'-c)quinazoline ligands and isoelectronic and benzannulated analogs thereof |
| JP4823730B2 (ja) | 2006-03-20 | 2011-11-24 | 新日鐵化学株式会社 | 発光層化合物及び有機電界発光素子 |
| KR101453109B1 (ko) * | 2006-04-26 | 2014-10-27 | 이데미쓰 고산 가부시키가이샤 | 방향족 아민 유도체 및 그들을 이용한 유기 전기 발광 소자 |
| JP5432523B2 (ja) * | 2006-05-11 | 2014-03-05 | 出光興産株式会社 | 有機エレクトロルミネッセンス素子 |
| CN101461074B (zh) | 2006-06-02 | 2011-06-15 | 出光兴产株式会社 | 有机电致发光元件用材料及使用了它的有机电致发光元件 |
| JP5203207B2 (ja) * | 2006-08-23 | 2013-06-05 | 出光興産株式会社 | 芳香族アミン誘導体及びそれらを用いた有機エレクトロルミネッセンス素子 |
| JP5556014B2 (ja) * | 2006-09-20 | 2014-07-23 | コニカミノルタ株式会社 | 有機エレクトロルミネッセンス素子 |
| JP5589251B2 (ja) | 2006-09-21 | 2014-09-17 | コニカミノルタ株式会社 | 有機エレクトロルミネッセンス素子材料 |
| KR101347519B1 (ko) * | 2006-11-24 | 2014-01-03 | 이데미쓰 고산 가부시키가이샤 | 방향족 아민 유도체 및 그것을 이용한 유기 전기발광 소자 |
| US8119255B2 (en) * | 2006-12-08 | 2012-02-21 | Universal Display Corporation | Cross-linkable iridium complexes and organic light-emitting devices using the same |
| KR101118808B1 (ko) * | 2006-12-28 | 2012-03-22 | 유니버셜 디스플레이 코포레이션 | 긴 수명의 인광 유기 발광 소자(oled) 구조체 |
| US8062767B2 (en) * | 2007-03-06 | 2011-11-22 | Chien-Hong Cheng | Organic light emitting diode containing a Ir complex having a novel ligand as a phosphorescent emitter |
| WO2008156879A1 (en) * | 2007-06-20 | 2008-12-24 | Universal Display Corporation | Blue phosphorescent imidazophenanthridine materials |
| WO2009008198A1 (ja) * | 2007-07-07 | 2009-01-15 | Idemitsu Kosan Co., Ltd. | ナフタレン誘導体、有機el素子用材料及びそれを用いた有機el素子 |
| US8330350B2 (en) * | 2007-07-07 | 2012-12-11 | Idemitsu Kosan Co., Ltd. | Organic electroluminescence device and material for organic electroluminescence device |
| US20090045731A1 (en) * | 2007-07-07 | 2009-02-19 | Idemitsu Kosan Co., Ltd. | Organic electroluminescence device and material for organic electroluminescence device |
| US8779655B2 (en) * | 2007-07-07 | 2014-07-15 | Idemitsu Kosan Co., Ltd. | Organic electroluminescence device and material for organic electroluminescence device |
| WO2009008100A1 (ja) * | 2007-07-10 | 2009-01-15 | Idemitsu Kosan Co., Ltd. | 有機エレクトロルミネッセンス素子用材料及びそれを用いた有機エレクトロルミネッセンス素子 |
| US8080658B2 (en) * | 2007-07-10 | 2011-12-20 | Idemitsu Kosan Co., Ltd. | Material for organic electroluminescent element and organic electroluminescent element employing the same |
| WO2009021126A2 (en) * | 2007-08-08 | 2009-02-12 | Universal Display Corporation | Benzo-fused thiophene or benzo-fused furan compounds comprising a triphenylene group |
| JP2009040728A (ja) * | 2007-08-09 | 2009-02-26 | Canon Inc | 有機金属錯体及びこれを用いた有機発光素子 |
| US20090101870A1 (en) * | 2007-10-22 | 2009-04-23 | E. I. Du Pont De Nemours And Company | Electron transport bi-layers and devices made with such bi-layers |
| US7914908B2 (en) * | 2007-11-02 | 2011-03-29 | Global Oled Technology Llc | Organic electroluminescent device having an azatriphenylene derivative |
| KR100933226B1 (ko) * | 2007-11-20 | 2009-12-22 | 다우어드밴스드디스플레이머티리얼 유한회사 | 신규한 적색 인광 화합물 및 이를 발광재료로서 채용하고있는 유기발광소자 |
| KR100933225B1 (ko) * | 2007-11-27 | 2009-12-22 | 다우어드밴스드디스플레이머티리얼 유한회사 | 신규한 인광 화합물 및 이를 발광재료로서 채용하고 있는유기발광소자 |
| WO2009073245A1 (en) * | 2007-12-06 | 2009-06-11 | Universal Display Corporation | Light-emitting organometallic complexes |
| WO2009085344A2 (en) * | 2007-12-28 | 2009-07-09 | Universal Display Corporation | Dibenzothiophene-containing materials in phosphorescent light emitting diodes |
| KR100966886B1 (ko) * | 2008-01-29 | 2010-06-30 | 다우어드밴스드디스플레이머티리얼 유한회사 | 신규한 유기 발광 화합물 및 이를 발광재료로서 채용하고있는 유기발광소자 |
| CN103396455B (zh) * | 2008-11-11 | 2017-03-01 | 通用显示公司 | 磷光发射体 |
-
2009
- 2009-11-10 CN CN201310350037.2A patent/CN103396455B/zh active Active
- 2009-11-10 JP JP2011535762A patent/JP5854839B2/ja active Active
- 2009-11-10 WO PCT/US2009/063873 patent/WO2010056669A1/en active Application Filing
- 2009-11-10 EP EP09753295.6A patent/EP2362889B1/en active Active
- 2009-11-10 KR KR1020117012696A patent/KR101843201B1/ko active IP Right Grant
- 2009-11-10 US US12/615,660 patent/US8367223B2/en active Active
- 2009-11-10 CN CN200980152287.7A patent/CN102272261B/zh active Active
- 2009-11-10 KR KR1020167011603A patent/KR101919207B1/ko active IP Right Grant
-
2012
- 2012-11-30 US US13/691,276 patent/US20130341599A1/en not_active Abandoned
-
2015
- 2015-06-22 JP JP2015124526A patent/JP2016026140A/ja active Pending
Patent Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2003192691A (ja) * | 2001-12-26 | 2003-07-09 | Mitsubishi Chemicals Corp | 有機イリジウム錯体及び有機電界発光素子 |
| JP2004131464A (ja) * | 2002-08-14 | 2004-04-30 | Mitsubishi Chemicals Corp | 有機金属錯体、発光色素、有機電界発光素子材料、および有機電界発光素子 |
| JP2006505956A (ja) * | 2002-11-08 | 2006-02-16 | ユニバーサル ディスプレイ コーポレイション | 有機発光物質及びデバイス |
| JP2005163036A (ja) * | 2003-11-18 | 2005-06-23 | Chi Mei Electronics Corp | 発光材料としてのイリジウム錯体および有機発光ダイオードデバイス |
Also Published As
| Publication number | Publication date |
|---|---|
| US20100141127A1 (en) | 2010-06-10 |
| JP5854839B2 (ja) | 2016-02-09 |
| US8367223B2 (en) | 2013-02-05 |
| KR20110094027A (ko) | 2011-08-19 |
| EP2362889A1 (en) | 2011-09-07 |
| KR101919207B1 (ko) | 2018-11-15 |
| JP2016026140A (ja) | 2016-02-12 |
| CN102272261B (zh) | 2014-02-26 |
| JP2012508258A (ja) | 2012-04-05 |
| US20130341599A1 (en) | 2013-12-26 |
| EP2362889B1 (en) | 2018-12-26 |
| CN102272261A (zh) | 2011-12-07 |
| KR20160057488A (ko) | 2016-05-23 |
| CN103396455B (zh) | 2017-03-01 |
| CN103396455A (zh) | 2013-11-20 |
| WO2010056669A1 (en) | 2010-05-20 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR101843201B1 (ko) | 인광성 에미터 | |
| KR102076934B1 (ko) | 시클로금속화 4좌 배위자 Pt(II) 착물 | |
| KR102133124B1 (ko) | 신규한 헤테로렙틱 이리듐 착물 | |
| JP6843196B2 (ja) | Oledデバイス用高効率黄色光発光体 | |
| KR102118826B1 (ko) | N-1에 결합된 트위스트 아릴 기를 갖는 1 또는 2개 이미다졸 고리를 포함하는 시클로금속화 4좌 배위자 Pt(II) 착물 | |
| JP6581169B2 (ja) | 燐光性物質 | |
| JP6219466B2 (ja) | リン光物質 | |
| JP2021185226A (ja) | ドーパントとしてのヘテロレプティックイリジウム錯体 | |
| JP6332904B2 (ja) | 新規有機発光材料 | |
| JP5872491B2 (ja) | リン光物質 | |
| EP2313362A1 (en) | Hole transport materials containing triphenylene | |
| KR20190143457A (ko) | 헤테로렙틱 이리듐 카르벤 착물 및 이를 사용한 발광 디바이스 | |
| KR102012047B1 (ko) | 효율이 큰 인광 물질 | |
| TWI487696B (zh) | 磷光發射體 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A201 | Request for examination | ||
| E902 | Notification of reason for refusal | ||
| E601 | Decision to refuse application | ||
| A107 | Divisional application of patent | ||
| J201 | Request for trial against refusal decision | ||
| J301 | Trial decision |
Free format text: TRIAL NUMBER: 2016101002606; TRIAL DECISION FOR APPEAL AGAINST DECISION TO DECLINE REFUSAL REQUESTED 20160502 Effective date: 20171130 |
|
| S901 | Examination by remand of revocation | ||
| GRNO | Decision to grant (after opposition) | ||
| GRNT | Written decision to grant |