KR0145295B1 - 살균제 - Google Patents
살균제Info
- Publication number
- KR0145295B1 KR0145295B1 KR1019900001264A KR900001264A KR0145295B1 KR 0145295 B1 KR0145295 B1 KR 0145295B1 KR 1019900001264 A KR1019900001264 A KR 1019900001264A KR 900001264 A KR900001264 A KR 900001264A KR 0145295 B1 KR0145295 B1 KR 0145295B1
- Authority
- KR
- South Korea
- Prior art keywords
- compound
- formula
- oxygen
- chloro
- general formula
- Prior art date
Links
- 0 C*c1cc(NC(CC(C)(C)*)=O)cc(*)c1C(C*)=O Chemical compound C*c1cc(NC(CC(C)(C)*)=O)cc(*)c1C(C*)=O 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D295/00—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms
- C07D295/16—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms acylated on ring nitrogen atoms
- C07D295/18—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms acylated on ring nitrogen atoms by radicals derived from carboxylic acids, or sulfur or nitrogen analogues thereof
- C07D295/182—Radicals derived from carboxylic acids
- C07D295/192—Radicals derived from carboxylic acids from aromatic carboxylic acids
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01N—PRESERVATION OF BODIES OF HUMANS OR ANIMALS OR PLANTS OR PARTS THEREOF; BIOCIDES, e.g. AS DISINFECTANTS, AS PESTICIDES OR AS HERBICIDES; PEST REPELLANTS OR ATTRACTANTS; PLANT GROWTH REGULATORS
- A01N37/00—Biocides, pest repellants or attractants, or plant growth regulators containing organic compounds containing a carbon atom having three bonds to hetero atoms with at the most two bonds to halogen, e.g. carboxylic acids
- A01N37/44—Biocides, pest repellants or attractants, or plant growth regulators containing organic compounds containing a carbon atom having three bonds to hetero atoms with at the most two bonds to halogen, e.g. carboxylic acids containing at least one carboxylic group or a thio analogue, or a derivative thereof, and a nitrogen atom attached to the same carbon skeleton by a single or double bond, this nitrogen atom not being a member of a derivative or of a thio analogue of a carboxylic group, e.g. amino-carboxylic acids
- A01N37/46—N-acyl derivatives
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01N—PRESERVATION OF BODIES OF HUMANS OR ANIMALS OR PLANTS OR PARTS THEREOF; BIOCIDES, e.g. AS DISINFECTANTS, AS PESTICIDES OR AS HERBICIDES; PEST REPELLANTS OR ATTRACTANTS; PLANT GROWTH REGULATORS
- A01N43/00—Biocides, pest repellants or attractants, or plant growth regulators containing heterocyclic compounds
- A01N43/34—Biocides, pest repellants or attractants, or plant growth regulators containing heterocyclic compounds having rings with one nitrogen atom as the only ring hetero atom
- A01N43/44—Biocides, pest repellants or attractants, or plant growth regulators containing heterocyclic compounds having rings with one nitrogen atom as the only ring hetero atom three- or four-membered rings
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01N—PRESERVATION OF BODIES OF HUMANS OR ANIMALS OR PLANTS OR PARTS THEREOF; BIOCIDES, e.g. AS DISINFECTANTS, AS PESTICIDES OR AS HERBICIDES; PEST REPELLANTS OR ATTRACTANTS; PLANT GROWTH REGULATORS
- A01N47/00—Biocides, pest repellants or attractants, or plant growth regulators containing organic compounds containing a carbon atom not being member of a ring and having no bond to a carbon or hydrogen atom, e.g. derivatives of carbonic acid
- A01N47/08—Biocides, pest repellants or attractants, or plant growth regulators containing organic compounds containing a carbon atom not being member of a ring and having no bond to a carbon or hydrogen atom, e.g. derivatives of carbonic acid the carbon atom having one or more single bonds to nitrogen atoms
- A01N47/10—Carbamic acid derivatives, i.e. containing the group —O—CO—N<; Thio analogues thereof
- A01N47/20—N-Aryl derivatives thereof
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01N—PRESERVATION OF BODIES OF HUMANS OR ANIMALS OR PLANTS OR PARTS THEREOF; BIOCIDES, e.g. AS DISINFECTANTS, AS PESTICIDES OR AS HERBICIDES; PEST REPELLANTS OR ATTRACTANTS; PLANT GROWTH REGULATORS
- A01N47/00—Biocides, pest repellants or attractants, or plant growth regulators containing organic compounds containing a carbon atom not being member of a ring and having no bond to a carbon or hydrogen atom, e.g. derivatives of carbonic acid
- A01N47/08—Biocides, pest repellants or attractants, or plant growth regulators containing organic compounds containing a carbon atom not being member of a ring and having no bond to a carbon or hydrogen atom, e.g. derivatives of carbonic acid the carbon atom having one or more single bonds to nitrogen atoms
- A01N47/28—Ureas or thioureas containing the groups >N—CO—N< or >N—CS—N<
- A01N47/30—Derivatives containing the group >N—CO—N aryl or >N—CS—N—aryl
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01N—PRESERVATION OF BODIES OF HUMANS OR ANIMALS OR PLANTS OR PARTS THEREOF; BIOCIDES, e.g. AS DISINFECTANTS, AS PESTICIDES OR AS HERBICIDES; PEST REPELLANTS OR ATTRACTANTS; PLANT GROWTH REGULATORS
- A01N53/00—Biocides, pest repellants or attractants, or plant growth regulators containing cyclopropane carboxylic acids or derivatives thereof
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C237/00—Carboxylic acid amides, the carbon skeleton of the acid part being further substituted by amino groups
- C07C237/28—Carboxylic acid amides, the carbon skeleton of the acid part being further substituted by amino groups having the carbon atom of at least one of the carboxamide groups bound to a carbon atom of a non-condensed six-membered aromatic ring of the carbon skeleton
- C07C237/42—Carboxylic acid amides, the carbon skeleton of the acid part being further substituted by amino groups having the carbon atom of at least one of the carboxamide groups bound to a carbon atom of a non-condensed six-membered aromatic ring of the carbon skeleton having nitrogen atoms of amino groups bound to the carbon skeleton of the acid part, further acylated
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C259/00—Compounds containing carboxyl groups, an oxygen atom of a carboxyl group being replaced by a nitrogen atom, this nitrogen atom being further bound to an oxygen atom and not being part of nitro or nitroso groups
- C07C259/04—Compounds containing carboxyl groups, an oxygen atom of a carboxyl group being replaced by a nitrogen atom, this nitrogen atom being further bound to an oxygen atom and not being part of nitro or nitroso groups without replacement of the other oxygen atom of the carboxyl group, e.g. hydroxamic acids
- C07C259/10—Compounds containing carboxyl groups, an oxygen atom of a carboxyl group being replaced by a nitrogen atom, this nitrogen atom being further bound to an oxygen atom and not being part of nitro or nitroso groups without replacement of the other oxygen atom of the carboxyl group, e.g. hydroxamic acids having carbon atoms of hydroxamic groups bound to carbon atoms of six-membered aromatic rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C271/00—Derivatives of carbamic acids, i.e. compounds containing any of the groups, the nitrogen atom not being part of nitro or nitroso groups
- C07C271/06—Esters of carbamic acids
- C07C271/08—Esters of carbamic acids having oxygen atoms of carbamate groups bound to acyclic carbon atoms
- C07C271/26—Esters of carbamic acids having oxygen atoms of carbamate groups bound to acyclic carbon atoms with the nitrogen atom of at least one of the carbamate groups bound to a carbon atom of a six-membered aromatic ring
- C07C271/28—Esters of carbamic acids having oxygen atoms of carbamate groups bound to acyclic carbon atoms with the nitrogen atom of at least one of the carbamate groups bound to a carbon atom of a six-membered aromatic ring to a carbon atom of a non-condensed six-membered aromatic ring
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C275/00—Derivatives of urea, i.e. compounds containing any of the groups, the nitrogen atoms not being part of nitro or nitroso groups
- C07C275/28—Derivatives of urea, i.e. compounds containing any of the groups, the nitrogen atoms not being part of nitro or nitroso groups having nitrogen atoms of urea groups bound to carbon atoms of six-membered aromatic rings of a carbon skeleton
- C07C275/42—Derivatives of urea, i.e. compounds containing any of the groups, the nitrogen atoms not being part of nitro or nitroso groups having nitrogen atoms of urea groups bound to carbon atoms of six-membered aromatic rings of a carbon skeleton being further substituted by carboxyl groups
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C317/00—Sulfones; Sulfoxides
- C07C317/44—Sulfones; Sulfoxides having sulfone or sulfoxide groups and carboxyl groups bound to the same carbon skeleton
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C323/00—Thiols, sulfides, hydropolysulfides or polysulfides substituted by halogen, oxygen or nitrogen atoms, or by sulfur atoms not being part of thio groups
- C07C323/50—Thiols, sulfides, hydropolysulfides or polysulfides substituted by halogen, oxygen or nitrogen atoms, or by sulfur atoms not being part of thio groups containing thio groups and carboxyl groups bound to the same carbon skeleton
- C07C323/51—Thiols, sulfides, hydropolysulfides or polysulfides substituted by halogen, oxygen or nitrogen atoms, or by sulfur atoms not being part of thio groups containing thio groups and carboxyl groups bound to the same carbon skeleton having the sulfur atoms of the thio groups bound to acyclic carbon atoms of the carbon skeleton
- C07C323/52—Thiols, sulfides, hydropolysulfides or polysulfides substituted by halogen, oxygen or nitrogen atoms, or by sulfur atoms not being part of thio groups containing thio groups and carboxyl groups bound to the same carbon skeleton having the sulfur atoms of the thio groups bound to acyclic carbon atoms of the carbon skeleton the carbon skeleton being acyclic and saturated
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D205/00—Heterocyclic compounds containing four-membered rings with one nitrogen atom as the only ring hetero atom
- C07D205/02—Heterocyclic compounds containing four-membered rings with one nitrogen atom as the only ring hetero atom not condensed with other rings
- C07D205/06—Heterocyclic compounds containing four-membered rings with one nitrogen atom as the only ring hetero atom not condensed with other rings having one double bond between ring members or between a ring member and a non-ring member
- C07D205/08—Heterocyclic compounds containing four-membered rings with one nitrogen atom as the only ring hetero atom not condensed with other rings having one double bond between ring members or between a ring member and a non-ring member with one oxygen atom directly attached in position 2, e.g. beta-lactams
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C2601/00—Systems containing only non-condensed rings
- C07C2601/02—Systems containing only non-condensed rings with a three-membered ring
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Life Sciences & Earth Sciences (AREA)
- Agronomy & Crop Science (AREA)
- Pest Control & Pesticides (AREA)
- Plant Pathology (AREA)
- Health & Medical Sciences (AREA)
- Engineering & Computer Science (AREA)
- Dentistry (AREA)
- General Health & Medical Sciences (AREA)
- Wood Science & Technology (AREA)
- Zoology (AREA)
- Environmental Sciences (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
- Agricultural Chemicals And Associated Chemicals (AREA)
- Plural Heterocyclic Compounds (AREA)
- Heterocyclic Carbon Compounds Containing A Hetero Ring Having Nitrogen And Oxygen As The Only Ring Hetero Atoms (AREA)
Abstract
내용 없음
Description
본 발명은 신규의 살균성 아실아미노벤즈아미드 및 이의 제조방법에 관하고, 또 이를 함유한 살균조성물, 및 이를 사용하여 균류, 특히 식물을 감염시키는 균을 퇴치시키는 방법에 관한다.
선행기술들은 예를들면 미합중국 특허 제 482218호를 우선권으로 하는 영국출원 제42454/77호와 유렵 출원 제 0127990 호에 기재되어 있다.
전자에는 항안드로겐특성을 갖는 아실아닐리드에 관해 기술되어 있고 후자에는 살균특성을 지닌 아닐린 유도체들에 관해 기술되어 있다.
본 발명은 다음 일반식(Ⅰ)화합물을 제공한다.
알킬 그룹들 및 알킬이 포함된 다른 그룹의 알킬 부분은 직쇄 또는 분지쇄 형태일 수 있다.
예로서 메틸, 에틸, 프로필(n-및 이소-프로필), 부틸(n-, sec, 이소- 및 t-부틸), 1,1-디메틸프로필 및 1,1-디메틸부틸이 있다.
알케닐 및 알키닐 그룹들 또한 직쇄 또는 분지쇄 형태일 수 있다.
예로서 1,1-디메틸부트-3-에닐과 1,1-디메틸프로프-2-이닐이 있다.
할로겐으로는 불소, 염소 및 브롬이 포함된다.
페닐의 임의 치환체들로는 할로겐, C1-4알킬(보기:메틸), C1-4알콕시(보기:메톡시), C1-4알킬티오(보기:메틸티오), 트리플루오로메틸, 트리플루오로메톡시, 니트로, 시아노, C1-4알콕시카보닐, 아미노 및 모노- 및 디(C1-4)-알킬아미노가 포함된다.
본 발명의 제1양상으로서 본 발명은 듈이 동시에 H가 아닐 것을 조건으로하여 A 및 B 가 독립적으로 H, 플루오로, 클로로 또는 브로모 ; D와 E모두 H이고 ; R1이 수소 또는 C1-4알킬; R2가 C1-4알킬, C1-4알콕시 또는 페닐이거나 또는 R1과 R2가자신들이 결합되어 있는 질소와 함께 뭉쳐져서 모폴린, 피페리딘, 피롤리딘 또는 아제티딘 고리를 만들고 ; R3가 수소 ; R4가 C3-6알킬(할로겐, 메톡시, 메틸티오 또는 메틸 설포닐로 임의 치환된), 시클로프로필(메틸로 임의 치환된),C3-6알케닐, C3-6알키닐, C1-4알콕시 또는 CH3ON=C(CN) 그룹이며 ; X와 Y둘다 산소인 일반식 (Ⅰ)화합물을 제공한다.
본 발명의 제2의 양상으로서 본 발명은 A 가 클로로 ; B, D 및 E가 모두 H이고 ; R1이 수소, 메틸 또는 에틸이며 ; R2가 메틸, 에틸 또는 페닐이거나 또는 R1과 R2가 자신들이 결합되어 있는 질소원자와 함께 뭉쳐져서 모폴린 또는 피페리딘 고리를 만들고 ; R3가 수소 ; R4가 C3-4알킬(예컨대, 이소-프로필 또는 t-부틸) 또는 시클로프로필이며 ; X와 Y 둘다 산소인 일반식(Ⅰ)화합물을 제공한다.
본 발명의 제3의 양상으로서 본 발명은 A가 클로로 ; B, D 및 E가 모두 H이고 ; R1과 R2가 독립적으로 메틸 또는 에틸(그러나 둘이 시에 메틸 또는 에틸인 것이 적당함) 또는 이들 둘이 자신들이 결합되어 있는 질소원자와 함께 뭉쳐져서 모폴린 또는 피페리딘 고리를 형성하고 ; R4가 이소-프로필, t-부틸 또는 시클로프로필 ; X와 Y둘다 산소인 일반식(Ⅰ)화합물을 제공한다.
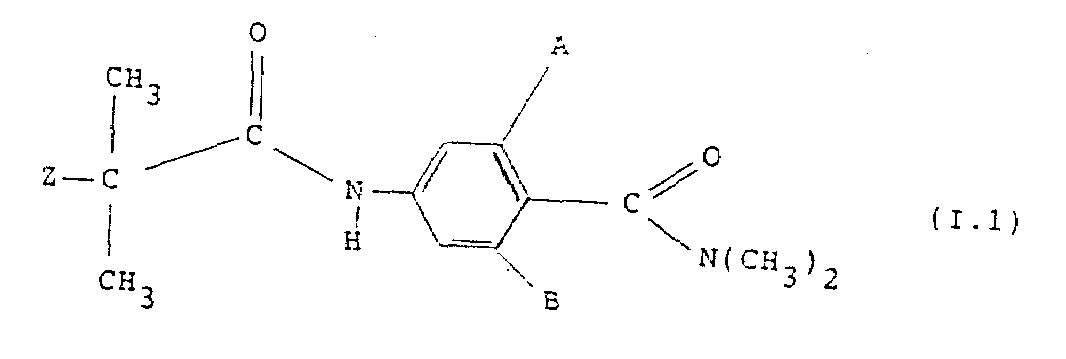
본 발명의 제4의 양상으로서 본 발명은 다음 일반식(Ⅰ.1)의 화합물을 제공한다.
이들 중에서도 B가 H인 화합물과 A와 B둘다 클로로 또는 둘다 메틸인 화합물이 주목되는 화합물이다. 특히 중요한 화합물은 A가 클로로 ; B 가 H이고 ; Z가 앞서 주어진 것들중 어느 하나인 화합물이며 ; 또는 A가 클로로 또는 브로모이고 ; B가 H이거나 또는 A와 B둘다 클로로이고 Z가 메킬인 화합물이다.
다음의 표1,2 및 3에 나타낸 화합물들은 본 발명을 예시해주고 있다.
[표 1 계속]
[표 1 계속]
[표 1 계속]
[표 1 계속]
[표 1 계속]
[표 2 계속]
[표 2 계속]
[표 2 계속]
[표 2 계속]
본 발명의 화합물들은 예컨대 도식 1-11에 예시된 방법으로 제조할 수 있다. 이러한 도식들에서 R , R , R , A, B, D 및 E는 상기한 바와같다.
도식1 에서, 3차아민(예컨대, 트리에틸아민)과 같은 염기 또는 알카리금속탄산염 또는 수산화물(예컨대, 중탄산나트륨 또는 수산화나트륨)의 존재하에서 염화메틸렌 또는 톨루엔 같은 적당한 유기 용매내에서 일반식 (Ⅵ) 화합물과 산 염화물(RCOC1)을 반응시켜 일반식(Ⅱ)의 화합물들을 제조할 수 있다.
수성 에탄올내의 철 분말 같이 문헌에 공지된 표준방법을 사용하여 일반식(Ⅴ)의 니트로 화합물들을 환원시켜 일반식(Ⅵ)의 화합물을 제조할 수 있다.
일반식(Ⅴ) 의 아미드는 먼저 화합물(Ⅲ)을 염화티오닐 또는 염화 옥살릴 같은 표준 시약으로 처리하여 일반식(Ⅳ)의 산 염화물로 전환시킨뒤, 이를 염기(트리에틸아민 또는 중타산 나트륨 또는 과량의 아민(RRNH) 과 같은)의 존재하에 물또는 적당한 유기 용매(염화메틸렌 또는 톨루엔)내에서 아민(RRNH)과 반응시켜 제조한다.
도식 2에서, 일반식(Ⅱ)의 화합물은 트리에틸아민, 중탄산 나트륨 또는 과량의 아민(R R NH)과 같은 존재하에 염화메틸렌 또는 테트라하이드로퓨란(THF)같은 적당한 유기용매내에서 일반식(Ⅸ)화합물을 아민(RRNH)과 반응시켜 제조할 수 있다.
[도식 1]
[도식 2]
[도식 3]
일반식(Ⅸ) 산 염화물은 필요하다면 촉매유효량의 DMF 를 부가하여 THF또는 염화메틸렌 같은 적당한 순수 용매 내에서 염화 옥살릴 같은 표준시약을 일반식(Ⅷ) 카복실산과 반응시켜 제조할 수 있다.
일반식(Ⅷ) 카복실산은 알카리금속 탄산염 또는 수산화물(예컨대, 중탄산나트륨)같은 최소한 2 당량의 염기 존재하에 물 내의 산 염화물 (R4COC1)을 적당히 치환된 4-아미노벤조산과 반응시켜 제조할 수 있다. 상기 치환된 4-아미노벤조산(Ⅷ)은 일반적으로 문헌에 기재된 방법으로 제조할 수 있다.
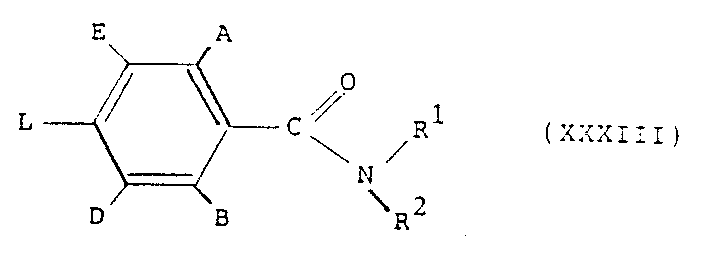
도식3에서, 일반식(Ⅱ) 화합물(식중 : R5와 R6가 수소, C1-4알킬 또는 할로겐임)은 상-전환 촉매(예컨대, 테트라부틸아모늄 브로마이드)존재하에 염화메틸렌 같은 유기용매와 물로 이루어진 2-상 시스템내에서 알카리금속 수산화물(예컨대 수산화나트륨)같은 염기로 일반식(Ⅹ) 화합물(식중 : X'가 염소, 브롬 또는 요오드임)을 처리하여 제조할 수 있다.
도식4에서, 수성 무기산(예를들면, 수성 황산)으로 처리하거나 또는 수성알카리(예를들면, 에탄올같은 공용매가 있거나 또는 없는 수성 수산화나트륨)로 처리 하는 것과같은 문헌에 공지된 표준 방법으로 일반식(ⅩⅣ)화합물을 가수분해 하거나, 또는 일반식(ⅩⅣ)화합물을 수성 디아조화 (예를들면, 수성 황산내의 질산나트륨을 사용하여) 시켜 일반식 (Ⅷ)의 중간생성물을 만들 수 있다. 일반식(ⅩⅣ)화합물은 일반식(ⅩⅢ)화합물을 수성 무기산 (예를들어 수성 황산) 또는 수성 알카리(예를드면, 에탄올 같은 공용매가 있거나 또는 없는 수성 수산화나트륨) 로 처리하는 것과 같은 문헌에 공지된 표준방법으로 가수분해시키거나, 또는 수산화나트륨( 에탄올과 같은 공용매가있거나 또는 없는) 을 함유하는 수성 알카리 과산화물 (예를들어, 수성 과산화수소) 로 처리하여 제조할 수 있다.
일반식(ⅩⅢ) 화합물은 3 차아민 (예를들어 트리에틸아민) 또는 알카리금속 탄산염 또는 수산화물(예를들면, 중탄산나트륨 또는 수산화나트륨)같은 염기의 존재하에서 적당한 유기용매 (예를들어, 염화메틸렌 또는 톨루엔) 내의 산 염화물(R4COC1) 과 일반식(ⅩⅡ) 화합물을 반응시켜 제조할 수 있다.
[도식 4]
도식5에서, 물 또는 에탄올 또는 이들의 혼합물과 같은 적당한 용매내에서 R7이 C1-4알킬인 에스테르(ⅩⅥ)를 알카리금속 수산화물(예를들어 수산화나트륨) 로 가수분해시켜 일반식(Ⅷ)의 중간생성물을 만들 수 있다. 일반식 (ⅩⅤ)의 아미노벤조산 에스테르로 부터 만들 수 있다. 그 첫 번째로, 3차아민 (예를들어, 트리에틸아민) 또는 알카리금속 탄산염 또는 수산화물(예컨대, 중탄산나트륨 또는 수산화나트륨) 과 같은 염기의 존재하에 적당한 유기용매 (예를들어, 염화메틸렌 또는 톨루엔) 내의 산 염화물(R4COC1) 과 반응시키는 방법이 있다. 한편, 치환체 A, B, D 및 E중 어떤 것이 전자를 강력하게 잡아당길 경우, 아미노 에스테르(ⅩⅤ) 는 강 염기 (예를들어 수소화나트륨 또는 리튬 디이소프로필아미드) 에 의해 양자를 잃어버리게 되는데 이때산 염화물(R4COC1) 로 처리하여 일반식 (ⅩⅤ) 화합물을 만들 수 있다. 일반식(ⅩⅤ) 화합물은 일반식(Ⅶ) 화합물을 산 촉매 (예를들면, 농축 황산 또는 염화수소 가스) 존재하에 R7이 C1-4알킬인 알칸을 R7OH와 반응시켜 제조한다.
[도식 5]
도식6에서, 일반식(ⅩⅦ) 화합물을 적당한 용매(예를들어, 아세토나이트릴) 내에서 플루오라이드 전환시약 (예를들어 실버 테트라플루오로보레이트) 으로 처리하여 일반식(ⅩⅧ)의 화합물 (식중, R6과 R9는 독립적으로 H, C1-4알킬 또는 C1-4할로알킬임) 을 제조할 수 있다.
[도식 6]
도식7에서, 적당한 용매 (예를들어, 염화메틸렌) 내에서 일반식(ⅩⅨ)의 하이드록시 화합물을 불화제 (예를들어 디어틸아미노설퍼 트리플루오라이드) 로 처리하면 일반식 (XX)화합물(식중, R8과 R9는 도식 6에서의 정의와 동일함)을 제조할 수 있다. 일반식(ⅩⅩ) 화합물은 또한 염기(트리에틸아민 또는 탄산칼륨과 같은) 존재하에 적당한 용매(염화메틸렌 또는 에틸아세테이트와 같은) 내에서 일반식 (XXXV)의 산염화물과 일반식 (VI) 화합물을 반응시켜 제조할 수 있다.
[도식 7]
도식8에서, 일반식(XXI) 화합물은 적당한 용매(예를들어 톨루엔 또는 아세토나이트릴) 내에서 일반식 (II) 화합물을 가황처리 시약 (예컨대, 포스포러스 펜파설파이드 또는 Lawesson 시약)으로 처리하여 제조할 수 있다. 일반식 (XXI) 및 (XXII) 화합물들은 혼합물 형태로 함께 만들어 크로마토그래피 또는 결정화법으로 분리시키거나 또는 일반식 (XXI) 화합물만을 만든후에 일반식 (XXII) 화합물로 전환시킬 수 있다.
[도식 8]
[도식 9]
도식9에서의 일반식 (XXIV) 화합물들은 -78°-+28℃온도의 적당한 용매(테트라하이드로퓨란과 같은) 내에서 R4Li 또는 R4Mghal (식중, Hal 은 염소 또는 불소와 같은 할로겐임) 형태의유기 금속성 시약을 일반식 (XXIII)의 이소티오시아네이트와 반응시켜 제조한다.
일반식 (XXIII)의 이소티오시아네이트는 예를들면 일반식 (VI) 의 화합물을 티오포스겐으로 처리하는 것과같은 표준방법에 의해 일반식 (VI)의 화합물로 부터 제조할수 있다.
일반식 (XXIV)의 화합물 또한 아미드를 제조하는 표준 방법에 의해 일반식(XXV) 로 부터 만들 수 있다.
예를들면 염소화 시약 (예컨대, 염화옥살릴 또는 염화티오닐) 으로 일반식(XXV)화합물을 처리하여 일반식 (XXVI)의 산 염화물로 전환시킨뒤 이를 염기 (예컨대, 트리에틸아민 또는 탄산칼륨) 의 존재하에서 아민 (R1R2NH) 과 반응시킬 수 있다.
일반식 (XXVII)의 에스테르를 가수분해시켜 만들 수 있다.
에스테르 (XXVII)는 적당한 용매 (예를들어 톨루엔 또는 아세토나이트릴) 내에서가황처리 시약(예를들면 포스포러스펜타설파이드 또는 Laweesson 시약) 과 일반식(XXVIII) 화합물을 만등시켜 제조한다.
도식10에서, 알카리 금속 탄산염 또는 산화물 또는 수산화물 (예를들어, 산화바륨) 과 같은 염기 존재하에 적당한 용매 (예를들어, 메탄올) 내에서 할라이드 [R-hal (식중, hal 이 염소, 브롬 또는 요오드임)] 를 일반식 (XIX) 화합물과 반응시켜 R이 C1-4알킬인 일반식 (XXXII)의 화합물을 제조할 수 있다.
일반식 (XIX) 화합물은 일반식 (XXXI) 화합물을 적당한 용매 (예를들어 수성 메탄올) 내에서 알카리 금속 수산화물 (예를들어, 수산화 나트륨)로 가수분해 제조할 수 있다.
일반식 (XXXI)의 화합물은 염기 (예를들어, 트리에틸아민) 가 존재하는 적당한 용매 (예컨대, 염화메틸렌) 내에서 일반식 (VI)의 화합물을 일반식 (XXX)의 산 염화물과 반응시켜 제조할 수 있다.
일반식 (XXX)의 산 염화물은 일반식 (XXIX)의 하이드록시산을 일반식 (R10CO)2O 의 산 무수물로 처리한뒤 산 염화물 생성 시약 (예를들어, 염화티오닐 또는 염화옥살릴) 으로 처리하여 제조할 수 있다.
[도식 10]
[도식 11]
도식11에서, 일반식 (XXXIII)의 화합물 (식중, L은 예를들면 불소, 염소, 브롬, 요오드, 메탄설포닐옥시, p-톨루엔설포닐옥시 또는 트리플루오로메탄설포닐옥시와 같은 이탈그룹임) 을 일반식 R4- CO - NH2화합물 및 염기 (예를들어, 수소화 나트륨, 리듐 디이소프로필아미드, 알카리금속 알콕사이드 또는 알카리금속 탄산염) 와 반응시켜 일반식 (II) 화합물을 제조할 수 있다. 일반식 (II)화합물은 또한 도식1에서 기술한 바와같이 일반식(VI)의 아닐린으로부터 제조할 수도 있다. 일반식 (VI)의 아닐린은 일반식 (XXXIIII) 화합물을 적당한 용매 (예를들어, 에탄올 또는 피리딘) 내에서 암모니아와 반응시켜 제조할 수 있다. 일반식 (VI)의 화합물은 또한 M이 아지도 또는 하이드라지노인 일반식 (XXXIV) 화합물을 환원제 (예를들어, 촉매 존재하의 수소) 로 처리하여 제조할 수 있다. 일반식 (XXXIV)의 화합물은 적당한 용매 (예를들어, 디메틸 포름아미드 또는 에탄올) 내에서 일반식 (XXXIII)의 화합물을 알카리금속 아지드 (예를들어, 소듐 아지드) 와 반응시키면 제조할 수 있다.
본 발명의 제5의 양상으로서 본 발명은 본 발명의 화합물들을 제조하는데 기술하였던 바와같은 제조방법을 제공한다.
본 발명의 화합물들은 효과적인 살균제이며 다음과 같은 하나 이상의 병원균들을 억제하는데 사용할 수 있다 :
밀의 Puccinia recondita,
보리의 Erysiphe graminis (가루 곰팡이),
사과의 Venturia inaequalis (반점병),
땅콩의 Cercospora arachidicola,
포도의 Plasmopara viticola,
감자의 Phytophthora infestans
특히, 이들은 침투성 치료제로서 Plasmopara viticola 와 Phytophthora infestans 에 특별한 활성을 나타낸다.
따라서, 본 발명은 앞서 정의한 살균 효과를 낼 수 있을 만큼의 화합물 또는 이를 함유한 조성물을 식물에, 식물의 종자에, 또는 식물의 재배지 또는 식물종자의 보관장소에 살포하는 것으로 구성되는 균의 퇴치방법을 제공한다.
이 화합물들은 농업용으로 직접 사용할 수도 있으나 보다 일반적으로 담체또는 희석제를 사용한 조성물로 배합하여 사용한다.
따라서, 본 발명은 앞서 정의한 바와같은 화합물 및 이에 적당한 담체 또는 희석제로 이루어진 살균 조성물을 제공한다.
이 화합물들은 여러가지 방법으로 사용될 수 있다. 예를들면 이들은 제제화 되거나 비제제화된 형태로 식물의 잎에, 종자에 또는 식물이 자라고 있거나 심어질 기타 배지에 직접 사용될 수 있고 분무 또는 살포될 수 있으며, 또는 크림 또는 호상물 형태로 도포되거나 또는 증기상, 서방형 과립으로 사용가능하다.
잎, 줄기, 가지, 또는 뿌리를 포함하여 식물의 혹종의 부분에, 또는 뿌리를 둘러싼 토양에, 또는 심기전의 종자에 ; 또는 일반적으로 토양에 ; 논의 물 또는 수경 (hydroponic) 배양계에 사용가능하다.
본 발명의 화합물은 또한 식물에 주입가능하고 전기역학적 분무 기술 또는 기타 소량을 취급하는 방법으로 채소에 분무할 수 있다.
본원에서 식물은 묘목, 수풀 및 나무를 포함한다. 더구나, 본 발명의 살균 방법은 예방, 보호, 방지 및 근절 처리를 포함된다.
화합물은 조성물 형태로 농업 및 원예의 목적에 바람직하게 사용된다. 당면한 구체적인 목적에 따라 사용되는 조성물의 형태는 달라지게 될 것이다.
조성물은 활성 성분, 및 예를들어, 고령토, 벤토나이트, 규조토, 백운석, 탄산칼슘, 활석, 마그네시아 분말, 퓰러토 (Fuller's earth), 석고, 규조가 들어있는 흙 및 도토와 같은 충전재인 고체희석제 또는 담체로 구성되는 분무 가능한 분말 또는 과립형태일 수 있다. 이러한 과립은 또다른 처리없이 토양에 사용하기에 적당한 과립으로 미리 제조할 수 있다. 이 과립은 활성 성분으로 충전재의 펠릿(pellet)를 함침시키거나, 또는 활성 성분 및 분체시킨 충전재 혼합물을 펠릿화시킴으로써 제조가능하다. 종자 도포용 조성물은종자에 조성물이 점착되는 것을 돕는 시약(예를들어 광유)을 포함할 수 있고;이와는 다르게 활성 성분은 유기용매(예를들어 N-메틸피롤리돈, 프로필렌 글리콜 또는 디메틸포름아미드)를 사용하여 종자 도포용으로 제제화할 수 있다. 조성물은 또한 분말의 액체내 분산을 촉진 시키는 습윤제 및 분산제로 구성되는 물에 분산가능한 과립 또는 습윤 가능한 분말형태일 수 있다. 분말 및 과립은 또한 충전재 및 현탁제를 포함할 수 있다.
유화가능한 농축물 또는 유액은 습윤제 또는 유화제를 임의로 포함한 용매에 활성 성분을 용해시킨 다음, 혼합물을 습윤제, 또는 유화제를 포함할 수도 있는 물에 가하여 제조될 수 있다. 적당한 유기 용매는 알킬 벤젠 및 알킬나프탈렌 같은 방향족 용매, 사이클로헥사논 및 메틸사이클로헷사논같은 케톤, 클로로벤젠 및 트리클로르에탄같은 염화 탄화수소 및 벤질 알콜, 푸르푸릴 알콜, 부탄올 및 글리콜 에테르같은 알콜이다.
거의 불용성 고체의 현탁 농축물은 고체의 침전을 막기 위한 현탁제와 분산제를 함께 볼 또는 비드 밀링(ball or bead milling)하여 제조한다.
분무용 조성물은 연무질(aerosol)형태일 수 있는데, 제제는 예를들어 플루오로트리클로로메탄 또는 디클로로디플루오로메탄과 같은 추진제(propellent)가압하에 용기내에 놓인다.
본 화합물은 건조 상태로 발연(pyrotechnic)혼합물과 혼합되어 밀페공간에서 상기 혼합물을 함유하는 연기를 발생시키는데 적당한 조성물로 형성될 수 있다.
이와는 다르게, 화합물은 마이크로 캡슐 형태로 사용될 수 있다. 이는 또한 활성 물질이 서서히 방출될 수 있도록 조절하기 위하여 생체 분해 가능한 중합체 제제로 제제화될 수 있다.
예를들어 분산력, 점착력 및 처리된 표면이 강우에 견디는 성질을 향상시키는 첨가제와 같은 적당한 첨가제를 포함함으로써 상이한 조성물들이 여러 용도에서 보다더 적합하게 사용될 수 있다.
여러 조성물들의 생물학적 효과를 향상시키기 위한 기타 첨가제들을 포함시킬 수 있다. 이러한 첨가제들은 습윤성, 제제로 처리한 표면 위에서의 보존성, 활성물질의 흡수성 및 이동성을 향상시키는 계면활성제일수 있으며 이에 더하여오일을 기본으로 하는 분무 첨가제를 포함할 수 있다. 예를들어 혹종의 광유 및 천연 식물성 오일(예를들면 간장콩 기름 및 평지씨유)첨가제들이 예를들면 Plasmopara viticola에 대한 겹잎 식물(several-fold foliar)의 보호력을 증대시킨다는 것을 발견하였다.
본 화합물은 비료(예를들어 질소-, 칼슘-또는 인-을 함유하는 비료)와의 혼합물로 사용할 수 있다. 예를들면 본 화합물로 피복시키는 것과 같이 본화합물을 첨합시킨 과립형 비료로만 구성된 조성물이 바람직하다. 이러한 과립은 적당하게는 최대 25중량%의 화합물을 포함한다. 따라서 본 발명은 또한 구조식(I)화합물, 또는 이것의 염 또는 금속착물 및 비료로 구성되는 비료 조성물을 제공한다.
습윤 가능한 분말, 유화 농축물 및 현탁 농축물은 통상 예를들면 습윤제, 분산제, 유화제 또는 현탁제 같은 계면활성제를 함유할 것이다. 이들 계면활성제는 양이온성, 음이온성 또는 비이온성일 수 있다. 적당한 양이온성 시약은 세틸트리메틸암모늄 브로마이드 같은 4차 암모늄 화합물이다. 적당한 음이온성 시약은 비누, 황산의 지방족 화합물의 염(소듐라우릴 설페이트 같은) 및 설폰화된 방향족 화합물의 염(소듐 도데실벤젠설포네이트, 나트륨, 칼슘 또는 암모늄 리그노설포네이트, 부틸나프탈렌 설포네이트 및 소듐 디이소프로필- 및 트리이소프로필-나프탈렌 설포네이트의 혼합물과 같은)이다. 적당한 비이온성 시약은 올레일 또는 세틸 알콜과 같은 지방성 알콜, 또는 옥틸-또는 노닐-페닐 및 옥틸크레졸 같은 알킬 페놀과 산화에틸렌의 축합 생성물이다. 기타 비이온성 시약은 장쇄 지방산 및 헥시톨 무수물에서 유도된 부분 에스테르이고, 산화 에틸렌과 상기의 부분 에스테르와의 축합 생성물 및 레시틴이다. 적당한 현탁제는 친수성 콜로이드(폴리비닐피롤리돈 및 소듐 카복시 메틸셀룰로스와 같은) 및 벤토나이트 또는 애터펄자이트 같은 팽창토이다.
수성 분산액 또는 유액으로 사용되는 조성물은 일반적으로 고비율의 활성 성분을 포함한 농축물 형태로 사용되고 그 농축물은 사용하기 전에 물로 희석시킨다. 이 농축물은 장기간의 저장에 견뎌야 하고 그러한 저장후에 통상적인 분무 장치로 시용할 수 있도록 충분한 시간동안 균질하게 유지되는 수성 제제를 형성하기 위해 물로 희석가능해야 한다. 농축물은 편리하게 최대 95중량%, 적당하게 10-85중량%, 예를들면 25-60중량%의 활성 성분을 포함할 수 있다. 수성 제제를 만들기 위해 희석시킨 후 , 의도하는 목적에 따라 이러한 제제에 포함되는 활성 성분의 양은 달라질 수 있지만, 0.0005중량%-10중량% 또는 0.01중량%-10중량%의 활성 성분을 포함하는 수성 제제가 사용될 수 있다.
본 발명의 조성물에는 예를들어 유사한 살균 활성 또는 보충적인 살균 활성, 또는 실물 생장 조절, 제초 또는 살충 활성을 가지는 화합물과 같은 생물학적 활성을 가지는 기타 화합물이 포함될 수 있다.
본 발명의 조성물에 존재가능한 살균 화합물은 Septoria, Gibberella 및 Helminthosporium spp. 와 같은 곡류(예를들어 밀)의 이삭병해, 종자 및 토양의 병해 및 포도의 솜털 곰팡이 및 가루곰팡이 및 사과의가루 곰팡이 및 반점병을 퇴치할 수 있는 것이다. 기타 살균제를 포함하므로써 이 살균 조성물은 구조식(I)의 화합물 만으로 이루어진 경우 보다 더 넓은 활성 범위를 가진다. 더구나 기타 살균제는 구조식(I)의 화합물의 살균 화성에 상승효과를 나타낸다.
본 발명의 조성물에 포함시킬 수 있는 살균 화합물의 예로는 테트라코나졸, (RS)-1-아미노프로필포스폰산,(RS)-4-(4-클로로페닐)-2-페닐-2-(1H-1,2,4-만코재브, 마네브, 메프로닐, 메타락실, 메트퍼옥삼, 메트설포박스, 마이클로부탄일, N-(4-메틸-6-프로피-1-닐피리미딘-2-일)-아닐린, 네오아소진, 니켈디메틸디티오카바메이트, 니트로탈-이소프로필, 누아티몰, 오퓨레이트, 유기수은화합물, 옥사딕실, 옥시카복신, 펜코나졸, 펜시큐론, 펜퓨라조에이드, 페나진 옥사이드, 프탈라이드, 폴리옥신D,폴리람, 프로베나졸, 프로클로라즈, 프로사이미돈, 프로파모카브, 프로피코나졸, 프로피네브, 프로티오카브, 피라조포스, 피리페녹스, 피로퀴론, 피록시퍼, 피롤리니트린, 피라조포스, 피리페녹스, 피로퀴론, 피록시퍼, 피롤리니트린, 퀴노메티오네이트, 퀸토젠, 스트렙토마이신, 황, 레클로프탈람, 테크나젠, 테부코나졸, 티아벤다졸, 티오파네이트-메릴,, 타람, 톨클로포스-메릴, 1,1'-이미노 디(옥타메틸렌)디구아니딘의 트리아세테이트 염, 트리아디메폰, 트리아디메놀, 트리아즈부틸, 트리시클라졸, 트리디모프, 트리포린, 발리다마이신A, 빈클로졸린 및 지네브가 있다.
일반식(I)의 화합물은식물을 종자, 토양, 또는 잎의 균류 병해에서 보호하기 위해 토양, 토반 또는 기타 뿌리매체와 혼합시킬 수 있다.
본 발명의 조성물에 첨합시킬 수 있는 적당한 살충제는 부프로페진, 카바릴, 카보퓨란, 카보설폰, 클로르피리포스, 시클로프로트린, 디메톤-S-메틸, 디아지논, 디메토에이트, 에토펜프록스, 페니트로티온, 페노부캅, 펜티온, 포르모티온, 이소프로캅, 이속사티온, 모노크로토파스, 펜토에이트, 피리미캅, 프로파노스및 XMC가 있다.
식물 생장 조절 화합물은 잡초 또는 종자의 머리 형성을 조절하거나 선택적으로 목적하지않는 식물(예를들어 풀)의 생장을 조절하는 화합물이다.
본 발명의 화합물과 함께 사용되는 적당한 식물생장 조절 화합물의 예로는 3,6-디클로로피콜린산, 1-(4-클로로페닐)-4,6-디메틸-2-옥소-1,2-디하이드로피리딘-3-카복실산, 메틸-3,6-디클로로아니세이트, 아브씨스산, 아설람, 벤조일프로프-에틸, 카벳아미드, 다미노지드, 디펜조쿠아트, 에테폰, 펜펜테졸, 플로라이드아미드,글리포세이트, 글리포신, 하이드록시 벤조나이트릴(예컨대,브로옥신일), 이나벤파이드, 이소피리몰, 장쇄 지방산알콜 및 지방산, 말레인산 하이드라지드, 메플루이다이드, 모프악틴(예컨대, 클로로플루오로콜), 파크롤부트라졸, 페녹시아세트산(예컨대, 2,4-D 또는 MCPA), 치환된 벤조산(예컨대, 트리아이오도벤조산), 치환된 4차 암모늄 및 포스포늄 화합물(예컨대, 클로토메쿠아트, 클로로포늄 또는 메피쿠아트클로라이드), 테크나젠, 옥신(예컨대, 인돌-아세트산, 인돌부티르산, 나프릴아세트산 또는 나프틸옥시아세트산), 사이토키닌(예컨대, 벤즈이미다졸, 벤질아데닌, 벤질아미노퓨린, 디페닐우레아 또는 키네틴), 기베렐린(예컨대, GA3, GA4또는 GA7) 및 트리아펜텐올이 있다.
다음 실시예들은 본 발명을 예시하고 있다. 실시예에서, 에테르는 디에릴 에테르이고, 황산 마그네슘은 용액을 건조시키기 위해 사용하며 강압하에서 용액을 농축시켰다. 공기 또는 물에 민감한 중간 생성물의 방응은 질소 대기하에서 실시하였고, 적절하다면,용매는 사용하기 전에 건조시켰다. IR 및 NMR 데이터는 선택적이며 모든 경우의 흡수를 기록하지는 않았다. CDC13용액을 사용하여1H NMR 스펙트럼을 기록하였다. 실시예 전체를 통하여 다음의 약자가 사용되었다.
THF=테트라하이드로퓨란
DMF=N,N-디메틸포름아미드
NMR=핵 자기 공명
IR=적외선
m.p.=융점
s=단일선
d=이중선
t=삼중선
m=다중선
br=광폭
[실시예1]
본 실시예는 2-클로로-4-(2',2'-디메틸프로피온아미드)-N,N-디메틸벤즈아미드(표1의 5번화합물)의제조방법을 예시한다.
[단계1]
2-클로로-4-니트로-N,N-디메틸벤즈아미드의 제조
2-클로로-4-니트로벤조산(25.0g)을 DMF가 몇방울 함유된 티오닐 클로라이드(80g)내에서 3시간동안 환류시켰다. 과량의 티오닐 클로라이드를 증발시키고 크루드한 2-클로로-4-니트로벤조일 클로라이드를 0-5℃의 40% 수성 디메틸아민(70ml)에 적가 하였다. 30분간 교반한 후에 황색의 결정형 침전물을 여과한 뒤 물로 세척하고 건조시켜 m.p.가 116-117℃이고 엷은 황색 결정형 고체인 2-클로로-4-니트로-N,N-디메틸벤즈아미드(24.97g) 를 얻었다. NMR(CDC13, 90MHZ)δ:2.90(3H,s), 3.20(3H,s), 7.49(1H,d), 8.12((1H,d), 8.27(1H,m), IR(nujol mull):3100, 1640cm-1
[단계2]
4-아미노-2-클로로-N,N-디메틸벤즈아미드의 제조
철 분말(수소로 미리 환원시킨 철, 10.0g)을 에탄올(80ml)에 현탁시키고 이를 크게 교반하면서 물(10ml)각 진한 염산(4ml)을 부가하였다. 2-클로로-4-니트로-N,N-디메틸벤즈아미드(7.50g) 를 15분에 걸쳐 소량씩 부가한 뒤 이 혼합물을 50-60℃로 가열하고 5시간 동안 교반하였다. Celite를 통해 이 혼합물을 여과한뒤 에탄올을 증발시켰다. 물(200ml)과 진한 염산(20ml)을 부가하고 반응물을 에틸아세테이트로 세척한 뒤 중탄산나트륨을 사용하여 pH 8까지 알카리화 시킨뒤 염화메틸렌으로 추출하였다. 이 유기 추출물을 건조시키고 증발시켜 회색의 결정형 고체인 4-아미노-2-클로로-N,N-디메틸벤즈아미드(5.21g)를 얻었다. 이를 클로로포름/에틸아세테이트를 재결정하여 회색결정을 얻었다(3.46g, m.p. 170-173℃). NMR(CDC13, 270MHZ)δ:2.89(3H,s), 3.11(3H,s),3.87(2H,bs), 6.57(1H,dd), 6.67(1H,s), 7.07(1H,d). IR(액체 필름):3440-3340, 1640cm-1
[단계3]
2-클로로-4-(2,2'-디메틸프로피온아미드)-N,N-디메틸벤즈아미드의 제조
4-아미노-2-클로로-N,N-디메틸벤즈아미드(1.0g)와 트리에틸아민(1.21g)을 염화메틸렌(20ml)에 용해시키고 이 용액을 0-5℃까지 냉각시켰다. 온도를 10℃ 미만으로 유지시키면서 2,2-디메틸프로피온일크로라이드(1.21g)를 적가하고 결과의 오렌지색 용액을 30분간 0-10℃에서 교반하였다. 용액을 수성 중탄산나트륨과 물로 차례로 세척한 뒤 건조 시키고 증발시켜 오렌지색 고체를 얻었다. 이것을 3:1 에틸아세테이트:클로로포름으로 재결정하여 m.p. 가 202-203℃이고 회색 결정형 고체인 2-클로로-(2',2'-디메틸프로피온아미드)-N,N-디메틸벤즈아미드를 얻었다.
NMR(CDC13, 270MHZ)δ: 1.32(9H,s), 2.86(3H,s), 3.13(3H,s), 7.16(1H,d), 7.34(1H,d), 7.68(1H,s), 7.72(1H,bs). IR(Nujol mull):3340,1690,1630cm-1
[실시예2]
본 실시예는 2-클로로-4-(2'-메틸프로피온아미드)-N,N-디에틸벤즈아미드(표1의1번 화합물)의 제조 방법을 예시한다.
[단계1]
2-클로로-4-(2'-메틸프로피온아미드)벤조산의 제조
4-아미드-2-클로로벤조산을 중탄산나트륨(5.04g)이 들어있는 1,2-디메톡시에탄(25ml)과 물(60ml)에 넣고 교반하여 만든 갈색 현탄액을 0-5℃까지 냉각시켰다. 이것을 크게 교반하면서 2-메틸프로피온일 클로라이드(4.26g)을 10분에 걸쳐 적가한뒤 혼합물을 0-10℃온도로 2시간 동안 교반하였다. 이 혼합물을 2M 염산에 붓고 이렇게 하여 생긴 엷은 갈색 침전물을 물로 세척, 여과, 건조시켜 엷은 갈색 고체인 m.p. 206-209℃의 2-클로로-4-(2'-메틸프로피온 아미드)벤조산을 얻었다.
NMR(d6- DMSO, 270MHZ) δ:1.05(6H,d), 2.53(1H,septet), 7.51(1H,dd), 7.78(1H,d), 7.86(1H,ε), 10.19(1H,s), 14-12(1H,very bs).
IR(Nujo1):3320,1705,1670cm-1
[단계2]
2-클로로-4-(2'-메틸프로피온아미드)-벤조일클로라이드의 제조
순수한 THF(5ml)내의 옥살릴 클로라이드(0.63g)을 실온에서 순수한 THF(5ml)내의 2-클로로-4-(2'-메틸프로피온 아미드)벤조산(1.0g)용액에 5분에 걸쳐 적가하였다. 완전히 부가한 후에 순수한 DMF(1방울)을 부었더니 크게 거품이 일어나면서 온도가 약간 올라갔다. 4시간 동안 교반한 후에 DMF를 더 부가하고 THF를 증발시켜 점성을 갖는 갈색 검인 2-클로로-4-(2'-메틸프로피온 아미드)벤조일 클로라이드를 얻었다. 이를 정제하지 않고 사용하였다.
IR(액체필름):3320,3260,3160,3070,1780,1710,1680cm-1
[단계3]
2-클로로-4-(2'-메틸프로피온 아미드)-N,N-디에틸벤조아미드의 제조
상기한 2-클로로-4-(2'-메틸프로피온아미드)벤조일클로라이드를 순수한 THF(10ml)에 넣은 것을 0-5℃에서 교반하면서 순수한 THF(10ml)내의 디에틸아밀(1.46g)용액에 10-15분 동안에 결쳐 부가 하였다. 0-10℃에서 교반한 후에 반응 혼합물을 실온에서 밤새 방치한뒤 냉수에 붓고 에틸아세테이트로 추출하였다. 이 추출물을 건조, 증발하여 천천히 결정화하여 점성을 갖는 검을 얻어 이를 에틸아세테이트로 재결정하여 2-클로로-4-(2'-메틸프로피온 아미드)-N,N-디에틸벤조아미드 백색 결정을 (0.507g)얻었다.
NMR(CDC13, 270MHZ)δ:1.04(3H,t), 1.21(6H,d), 1.26(3H,t), 2.58(H,septet), 3.15(2H,q), 3.39(1H,bm), 3.74(1H,bm), 7.04(1H,d),7.30(1H,dd), 7.51(1H,s), 8.58(1H,bs), IR(Nujo1 mull):3300,3250,3165,1685cm-1
[실시예3]
1-[3'-클로로-4'-N,N-디메틸카바모일)페닐]-3,3-디메틸아제티딘-2-온(표I의 11번 화합물)의 제조방법
[단계1]
2-클로로-4-(3'-클로로-2',2'-디메틸프로피온아미드)-N,N-디메틸벤즈아미드의 제조
순수한 염화메틸렌(40ml)과 순수한 트리에틸아민(1.21g)에 현탁된 4-아미노-2-클로로-N,N-디메틸벤즈 아미드(2.00g)를 10℃미만의 온도로 유지시키고 교반하면서 3-클로로-2,2-디메틸프로피오닐 클로라이드(1.86g)을 5분에 걸쳐 적가하였다. 1시간 동안 교반한 후에 실온까지 가온한뒤 염화메틸렌(40ml)을 부가한뒤 용액을 2M염산, 포화된 수성 중탄산나트륨, 포화 염수로 세척하였다. 이 용액을 건조, 증발시켜 끈끈한 황색 고체를 얻고 이를 에틸아세테이드/클로로포름으로 재결정하여 백색고체인 2-N,N-디메틸벤즈아미드(m.p. 179-181℃)를 얻었다.
NMR(CDC13, 270MHZ)δ:1.42(6H,S), 2.86(3H,s), 3.14(3H,s), 3.73(2H,s), 7.06(1H,d), 7.26(1H,dd),7.50(1H,s), 8.48(1H,bs).
IR(Nujol mull):3310,1670,1620cm-1
[단계2]
1-[3'-클로로-4'-(n,n-디메틸카바모일)페닐]-3,3-디메틸아제티딘-2-온
물에(10ml)수산화나트륨(4.00g)과 테트라부틸암모늄 브로마이드(0.10g)를 넣은 용액을 염화메틸렌(10ml)내의 2-클로로-4-(3'-클로로-2'-2'-디메틸프로피온아미드)-N,N-디메틸벤즈아미드(1.00g)현탁액을 부가하고 2-상 시스템을 실온에서 1시간 동안 교반하였다. 물(100ml)과 염화메틸렌(10ml)을 부가하고 염화메틸렌층 전체를 염수로 세척한 뒤 건조, 증발시켜 연노랑색 고체를 얻었다. 이것을 에틸아세테이드/헥산으로 재결정하여 백색의 결정형 고체인 1-[3'-클로로-4-(N,N-디메틸카바모일)페닐]-3,3-디메틸아제티딘-2-온(0.516g, m.p.122-123℃)을 얻었다.
NMR(CDC13, 270MHZ)δ:1.42(4H,s), 2.87(3H,s), 3.13(3H,s), 3.42(2H,s), 7.27(2H,t), 7.39(1H,s), IR(Nujol mull):3600-3100,1740,1625ml-1
[실시예4]
2-메톡시-4-(2',2'-디메틸프로피온아미드)-N,N-디메틸벤즈 아미드(표II의 1번 화합물)의 제조 방법.
[단계1]
2-메톡시-4-(2'.2'-디메틸프로피온아미드)-벤조에이트의 제조
메틸2-메톡시-4-아미노벤조에이트(3.03g)와 트리에틸아민(1.83g)을 순수한 염화메틸렌(50ml)내에서 0-5℃온도에서 교반하였다. 이 용액에 순수한 염화메틸렌(10ml)내의 2,2-디메틸프로피온일클로라이드(6.07g)를 적가하였다. 완전히 부가한 후에 이 혼합물을 실온에서 밤새 교반한 뒤 묽은 염산에 부었다. 유기층을 분리해낸 뒤 묽은 수성 중탄산나트륨 및 물로 차례로 세척하고 건조, 증발시켜 오일을 얻었다. 이를 헥산과 함께 가열하여 얻어진 생성물을 여과하여 백색 고체(3.61g)를 얻었다.
NMR(CDC13, 270MHZ)δ:1.36(9H,s), 4.10(3H,s), 6.78(1H,dd), 8.10(2H,m), 10.61(1H,s).
[단계2]
2-메톡시-4-(2',2'-디메틸프로피온아미드)-벤조산 제조
메틸 2-메톡시-4-(2', 2'-디메틸프로피온아미드)-벤조에이드(2.98g)를 메탄올(50㎖)내의 수산화칼륨(0.725g)과 함께 실온에서 3시간 동안 고반한 뒤 8시간 동안 환류시키고 물에 부었다. 이 혼합물을 에틸 아세티이드로 추출한 뒤 염산으로 산성화시켰다.
이 산성화된 부분을 에틸 아세테이드로 추출하고 이 추출물을 건조·증발시켜 고체인 생성물(1.24g)을 얻었다.
MMR(CDC13, 270MHz)δ:1.36(0H, s), 4,10(3H, s), 6.78(1H, dd), 8.10(2H, m), 10.61(1H, s).
[단계3]
2-메톡시-4-(2',2'-디메틸프로피온아미드)-벤조일 클로라이드의 제조
순수한 에테르(25ml)내의 2-메톡시-4-(2',2'-디메틸프로피온아미드)-벤조산(1.04g)에 실온의 순수한 에테르(5ml)내의 옥살릴 클로라이드(1.4g)와 소량의 DMF를 교반하면서 부가하였다. 완전히 부가한 후에 이 혼합물을 4시간 동안 교반한 뒤 밤새 방치하였다. 염화 메틸렌을 약간 부가한뒤 혼합물을 증발시켜 황색 고체인 산 염화물(1.12g)을 부가하였다.
[단계4]
2-메톡시-4-(2',2'-디메틸프로피온아미드)-N,N-디메틸벤즈아미드의 제조
0-5℃ 에서 THF(15ml)내의 디메틸아민(40% 수성용액 1.17g)용액을 교반하면서 여기에 순수한 THF(10ml)내의 2-메톡시-4-(2',2'-디메틸프로피온아미드)-벤조일클로라이드(1.12g)을 30분에 결쳐 적가하였다. 완전히 부가한 후에 이용액을 5-10℃에서 1시간 동안 교반하고 실온에서 밤새 방치해둔 뒤 물에 붓고 이를 에틸 아세테이트로 추출하였다. 추출물을 건조, 중발시켜 황색 고체인 생성물을 얻었다(0.889g, m.p. 143-144℃).
NMR(CDC13, 270MHZ)δ:1.33(9H,s), 2.85(3H,s), 3.11(3H,s), 6.75(1H,dd), 7.15(1H,d), (1H,s), 7.65(1H,d).
[실시예5]
2-트리플루오로메틸-4-(2'.2'-디메틸프로피온아미드)-N,N-디메틸벤즈아미드(표II의 7번 화합물)의제조방법
[단계1]
2-트리플루오로메틸-4-(2',2'-디메틸프로피온아미드)-벤조나이트릴의제조 순수한 염화메틸렌(5ml)내의 2,2-디메틸프로피오일클로라이드(3.79g)를 0-5℃의 순수한 염화메틸렌(50ml)내의 4-시아노-3-트리플루오로메틸아닐린(3.02g)과 트리에틸아민(3.34g)에 천천히 적가하였다. 완전히 부가한 후에 혼합물을 1.5시간 동안 실온에서 교반한 뒤 묽은 염산에 부었다. 유기물 부분을 묽은 수성 중탄산 나트륨과 물로 차례로 추출한 뒤 건조 증발시켜 오렌지색 고체를 얻었다. 이것을 재결정 하여 황색분말을 얻었다.
NMR(CDC13, 270MHZ)δ:1.35(9H,s), 7.61(1H,s), 7.78(1H,d), 7.93(1H,dd), 8.03(1H,d).
[단계2]
2-트리플루오로메틸-4-(2',2'-디메틸프로피온아미드)-벤조아미드의 제조
과산화수소(30% 수성 용액 8.5ml)를 에탄올(140ml)내의 2-트리플루오로메틸-4-(2'.2'-디메틸프로피온아미드)-벤조나이트릴(5.03g)에 놓고 반응 혼합물을 실온에서 5시간 교반하면서 그동안 에탄올(100ml)을 더 부가하였다. 반응 혼합물을 24시간 동안 50℃로 가온하고 물에 부은 뒤 에틸 아세테이트로 추출하였다. 유기층을 건조시킨뒤 증발시켜 오일을 얻고 이를 실리카로 플래쉬 크로마토그래피하여 원하던 생성물을 (2.89g)얻었다.
NMR(CDC13, 270MHZ)δ:1.35(9H,s), 5.80(2H,bs), 7.54(1H,s), 7.59(1H,d), 7.82(1H,dd), 7.82(1H,dd), 7.90(1H,d).
[단계3]
2-트리플루오로메틸-4-(2',2'-디메틸프로피온아미드)-벤조산의 제조
-5-0℃의 빙초산(36ml)내의 2-트리플루오로메틸-4-(2',2'-디메틸프로피온아미드)-벤조아미드(2.35g)에 진한 염산(15ml_을 부가하였다. 이 혼합물에 물(10ml)내의 질산나트륨(1.807g)용액을 넣고-5-0℃에서 1시간 동안 교반하였다. 실온까지 가온한 뒤 반응물을 24시간 동안 교반하고 이것을 물에 부은 뒤 염화메틸렌으로 추출하였다. 염화메틸렌 분급물을 묽은 수성 수산화나트륨으로 세척한후 알카리층을 묽은 염산으로 산성화시켰다. 이 산성화된 층을 염화메틸렌으로 추출한뒤 유기층을 건조, 증발시켜 백색고체인 원하던 산을 얻었다(0.926g).
NMR(CDC13, 270MHZ)δ:1.20(9H,s), 7.79(1H,b), 8.02(1H,dd), 8.19(1H,d), 9.69(1H,s).
[단계4]
2-트리플루오로메틸-4-(2',2'-디메틸프로피온아미드)-N,N-디메틸벤즈아미드의 제조
순수한 에테르(7ml)내의 옥살릴 클로라이드 (0.64g)을 교반하면서 실온의 순수한 에테르(40ml)내의 2-트리플루오로메틸-4-(2',2'-디메틸프로피온아미드)-벤조산(0.926g)에 부가하였다. 부가하는 동안에 DMF방울을 떨어뜨렸다. 2시간이 지난후에 옥살릴 클로라이드를 더(0.257g) 부가하고 반응물을 2시간동안 더 교반하였다. 이 유기용액을 침전물로 부터 따라내고 증발시켜 액체인 2-트리플루오로메틸-4-(2'.2'-디메틸프로피온아미드)-벤조일클로라이드(1.136g)를 얻었다. 이를 정제하지 않도 사용하였다. 순수한 TMF(10ml)내의 산 염화물(1.136g)을 교반하면서0-5℃의 TMF(15ml)내의 디메틸아민(40% 수성용액 1.0g)에 30분 동안에 결쳐 적가하였다. 이 반응물을 실온이 될 때까지 방치하고 24일동안 놓아둔 뒤 물에 붓고 이를 에틸 아세테이트로 추출하였다. 에틸 아세테이트 분급물을 수성 중탄산나트륨으로 세척하고 이어서 묽은 염산으로 세척한 뒤 물로다시세척하였다. 이를 건조시킨뒤 유기용액을 증발시켜 백색고체인 2-트리플루오로메틸-4-(2',2'-디메틸프로피온아미드)-N,N-디메틸벤즈아미드(0.576g)를 얻었다. m.p.198.7-199.6℃.
NMR(CDC13, 270MHZ)δ:1.35(9H,s), 2.89(3H,s), 3.12(3H,s), 7.22(1H,d), 7.72(1H,s),7.75(1H,dd), 7.85(1H,d).
[실시예6]
2,3,5,6-테트라플루오로-4-(2',2'-디메틸프로피온아미드)-N,N-디메틸벤즈아미드(표II의 6번 화합물)의 제조방법.
[단계1]
메틸2,3,5,6-테트라플루오로-4-(2',2'-디메틸프로피온아미드)-벤조에이트의 제조
순수한 THF(5ml)내의 메틸 2, 3, 5, 6-테트라 플로오로-4-아미노벤조에이트(1.887g)를 실온에서 고반하는 순수한 THF(70ml)내의 수소화 나트륨(55% 오일내 분산물 0.764g) 현탁액에 부가하였다. 완전히 비등하고난 후에 냉각시키면서 순수한 TMF(5ml)내의 2,2-디메틸프로피온일 클로라이드(1.127g)를 천천히 부가하였다. 이반응물을 10℃에서 1시간동안 교반한뒤물에 붓고 에틸 아세테이트로 추출하였다. 이 에틸 아세테이트 분급물을 묽은 염산각 묽은 수성 중탄산나트륨으로 세척하고 건조, 증발시켜 백색고체인 생성물(2.44g)을 얻었다.
NMR(CDC13, 270MHZ)δ:1.36(9H,s), 3.97(3H,s), 7.05(1H,s).
[단계2]
2,3,5,6-테트라플루오로-4-(2',2'-디메틸프로피온아미드)-벤조산제조
메톡시에탄(DME, 60ml)내의 수산화칼륨(최소량의물에 용해된 0.669g)과 메틸 2,3,5,6-테트라플루오로-4-(2',2'-디메틸프로피온아미드)-벤조에이트(1.83g)를 밤새 교반하고 이를 물에 부었다. 이 혼합물을 에틸아세테이트로 추출하였다.
수성상을 산성화시키고 에틸아세테이트로 추출한 뒤 이 에틸아세테이트 추출물을 건조, 증발시켜 연노랑색 교체인 산(1.538g)을 얻었다.
NMR(CDC13, 270MHz)δ:1.19(9H,s), 9.65(1H,s).
[단계3]
2,3,5,6-테트라플루오로-4-(2',2'-디메틸프로피온아미드)-N,N-디메틸벤즈아미드의 제조
순수한 에테르(5ml)내의 옥살릴클로라이드(1.00g)를 교반하면서 DMF가 한방울 들어간 순수한 에테르(35ml)내의 2,3,5,6-테트라플루오로-4-(2',2'-디메틸프로피온아미드)-벤조산(1.47g)에 부가하였다. 실온에서 2시간동안 교반한 뒤 에테르 용액을 불용성 물질로부터 따라낸 뒤 증발시켜 오일인 산 염화물 (1.494g)을 얻었다. 이를 정제하지 않고 사용하였다.
순수한 TMF(10ml)내의 산 염화물(1.494g)을 30분에 걸쳐 0-5℃ TMF(10ml)내의 디메틸아민 (1.363g)에 천천히 적가하였다. 10℃에서 1.5시간동안 교반한 후에 이 반응 혼합물을 물에 붓고 에틸아세테이트로 추출하였다. 이 추출물을 수성 중탄산나트륨, 묽은 염산으로 차례대로 세척한 뒤 건조, 증발시켜 백색 분말 고체인 생성물(1.279g)을 얻었다. m.p. 187-189℃
NMR(CDC13, 270MHZ)δ:1.35(9H,s), 2.97(3H,s), 3.17(3H,s), 7.82(1H,d).
[실시예7]
2-클로로-4-(2'-플루오로-2'-메틸프로피온아미드)-N,N-디메틸벤즈아미드(표I의 38번 화합물)의 제조방법.
아세토나이트릴(5ml)내의 실버테트라플루오로보레이트(0.60g)를 아세토나이트릴 (150ml)내의 2-클로로-4-(2'-브로모-2'-메틸프로피온아미드)-N,N-디메틸벤즈아미드(1.065g)에 부가하여 이 반응 혼합물을 빛을 차단한상태의 질소대기하에서 6.5시간 동안 교반하였다. 에틸 아세테이트를 부가하고 이 용액을 Celite로 여과한뒤 증발시켰다. 잔사를 다시 에틸아세테이트에 용해시키고 Celite 로 여과하여 증발시켰다. 이 잔사를 HPLC(용출제 염화메틸렌:아세토나이트릴, 2:1)로 정제하여 백색 결정형 고체인 생성물(0.319g)을 얻었다. m.p. 125-128℃
NMR(CDC13, 270MHZ)δ:1.67(6H,d), 2.87(3H,s) 3.13(3H,s), 7.27(1H,d), 7.45(1H,dd), 7.80(1H,s) 8.18(1H,d).
[실시예8]
2-클로로-4-(3'-플루오로-2',2'-메틸프로피온아미드)-N,N-디메틸벤즈아미드(표I의 42번 화합물)의 제조방법
[단계1]
2-클로로-4-(3'-마세톡시-2',2'-메틸프로피온아미드)-N,N-디메틸벤즈아미드의 제조.
0-5℃의 순수한 염화메틸렌(15ml)내의 4-아미노-2-클로로-N,N-디메틸젠즈아미드(5.88g)과 트리에틸아민(5.99G)의 교반 용액에 3-아세톡시-2,2-디메틸프로피온일 클로라이드(7.84g)를 부가하였다. 30분간 교반한뒤반응 혼합물을 묽은 수성 중탄산나트륨, 묽은 수산화나트륨, 묽은 염산, 물로 차례로 세척하였다. 유기층을 건조, 증발시킨 뒤 오렌지색 교체를 얻어 이를 헥산으로 분쇄하여 원하던 생성물(9.08g)을 얻었다. m.p. 117-120℃.
NMR(CDC13, 270MHZ)δ:1.33(6H,s), 2.10(3H,s), 2.86(3H,s), 3.13(3H,s), 4.20(2H,s),7.11(1H,d), 7.29(1H,dd),7.60(1H,d), 8.21(1H,s).
IR(nujol mull):1740,1680,1630cm-1
[단계2]
2-클로로-4-(3'-하이드록시-2',2'-디메틸프로피온아미드)-N,N-디메틸벤즈아미드의 제조.
수산화칼륨(2.68g)이 함유된 메탄올(100ml)에 2-클로로-4-(3'-아세톡시-2',2'-메틸프로피온아미드)-N,N-디메틸벤즈아미드(8.14g)를 넣고 2시간동안 실온에서 교반하였다. 메탄올을 증발시키고 잔사를 에틸아세테이트로 추출하였다. 에틸아세테이트를 건조, 증발시켜 원하던 생성물(5.03g)을 얻었다. m.p. 137-139℃.
NMR(CDC13, 270MHZ)δ:1.17(6H,s), 2.89(3H,s), 3.15(3H,s), 3.56(3H,s), 5.12(1H,t), 7.17(1H,d), 7.30(1H,dd),7.60(1H,d), 9.49(1H,s).
[단계3]
2-클로로-4-(3'-플루오로-2',2'-디메틸프로피온아미드)-N,N-디메틸벤즈아미드의 제조
순수한 염화메틸렌(40ml)내의 2-클로로-4-(3'-하이드록시-2',2'-메틸프로피온아미드)-N,N-디메틸벤즈아미드(1.008g)를 -70℃의 순수한 염화메틸렌(20ml)내의 디에틸아미노설퍼 트리플로라이드(DAST)(0.68g)용액에 3시간에 걸쳐 부가하였다. 30분후에 DAST(0.128g)를 더 부가하고 이용액을 30분간-70℃에서 교반한 뒤 밤새 실온까지 가온하였다. 반응 혼합물을 물로 세척한 뒤 건조, 증발시켜 거품을 얻었다. 이것을 헥산으로 분쇄하여 연한 오렌지색 분말인 원하던 생성물(0.269g)를 얻었다. m.p. 152-4℃.
NMR(CDC13, 270MHZ)δ:1.32(6H,s), 2.86(3H,s), 3.12(3H,s), 4.48(2H,d), 7.23(1H,d), 7.39(1H,dd), 7.75(1H,d), 7.77(1H,s).
[실시예9]
2-클로로-4-(3'-메톡시-2',2'-디메틸프로피온아미드)-N,N-디메틸벤즈아미드(표I의 40번 화합물)의 제조방법.
0℃ DMF(20ml)내의 2-클로로-4-(3'-하이드록시-2',2'-디메틸프로피온아미드)-N,N-디메틸벤즈아미드(0.510g)용액에 산화바륨(2.608g)과 수산화바륨(0.540g)을 부가하였다. 0℃에서 15분간 교반한 후에 요오드화메틸(3.64g)을 적가하였다. 2시간에 걸쳐 실온까지 더워지도록 방치한 뒤 반응물에 염화메틸렌을 부가하고 혼합물을 celite로 여과하였다. 유기 분급물을 건조, 증발시켜 유동하는 액체를 얻고 이를 HPLC(용출제:에틸아세테이트)로 정제하여 고체인 원하던 생성물(0.101g)을 얻었다. m.p. 101-103℃.
NMR(CDC13, 270MHZ)δ:1.24(1H,s), 2.86(3H,s), 3.12(3H,s), 3.43(2H,s), 3.51(3H,s), 7.21(1H,d), 7.39(1H,dd), 7.75(1H,d), 9.05(1H,s).
[실시예10]
2-클로로-4-(2',2'-디메틸-티오프로피온아미드)-N,N-디메틸-티오벤즈아미드와 2-클로로-4-(2',2'-디메틸프로피온아미드)-N,N-디메틸티오벤즈아미드(표III의 화합물 3과1)의 제조방법.
2-클로로-4-(2',2'-디메틸프로피온아미드)-N,N-디메틸벤즈아미드(1.00g)를 순수한 톨루엔(10ml)에 현탁시키고 Lawesson시약 (0.73G)을 실온에서 소량씩 5분에 걸쳐 부가하였다. 이 현탁액을 1시간동안 환류시켜 맑은 용액을 얻고 톨루엔을 증발시켜 점성을띤 검을 얻었다. 이를 실리카겔로 크로마토그래피(용출제 : 염화메틸렌)하여 두 생성물을 얻었다.
1. 2-클로로-4-(2',2'-디메틸-티오프로피온아미드)-N,N-디메틸-티오벤즈아미드(0.104g),m.p. 154-156℃.
NMR(CDC13, 270MHZ)δ:1.47(9H,s), 3.14(3H,s), 3.60(3H,s), 7.29(1H,d), 7.52(1H,dd), 7.82(1H,s), 8.85(1H,bs).
2. 2-클로로-4-(2',2'-디메틸프로피온아미드)-N,N-디메틸벤즈아미드(0.475g),m.p. 164-167℃.
NMR(CDC13, 270MHZ)δ:1.47(9H,s), 1.31(9H,s), 3.11(3H,s), 3.58(3H,s), 7.25(1H,d), 7.33(1H,dd), 7.38(1H,bs), 7.74(1H,s).
[실시예11]
2-클로로-4-(2',2'-디메틸-티오프로피온아미드)-N,N-디메틸벤즈아미드(표III의 2번 화합물)의 제조방법
[단계1]
3-클로로-4-N,N,-디메틸카바모일-페닐이소티오시아네이트의 제조
물에 중탄산나트륨(1.68g)을 현탁시키고 교반한 뒤 실온에서 3시간에 걸쳐 티오포스겐(1.15g)을 적가 하였다. 온도를 20-25℃로 유지시키면서 20분에 걸쳐 4-아미노-2-클로로-N,N-디메틸벤즈아미드(1.00g)를 일부분씩 부가하였다. 15분간 더 교반한 뒤 염화메틸렌으로 갈색 현탁액을 추출하고 유기층을 건조, 증발시켜 오렌지-황색 고체인원하던 생성물(1.18g)을 얻었다. 이를 정제하지 않고 사용하였다.
NMR(CDC13, 270MHZ)δ:2.86(3H,s), 3.13(3H,s), 7.17(1H,dd), 7.26(1H,dd), 7.26(1H,d), 7.28(1H,d), IR(nujol mull):2014-2080(bs), 1630cm-1
[단계2]
2-클로로-4-(2',2'-디메틸-티오프로피온아미드)-N,N-디메틸벤즈아미드의 제조.
-70℃ 질소 대기하에서 THF내의 3-클로로-4-N,N,-디메틸카바모일페닐 이소티오시아네이트 교반용액에 3차 부틸리튬(펜탄내의 1.7M 용액3.2ml)을 20분동안 부가하였다. 동일한 온도에서 20분간 교반한 후에 물을 조심스럽게 부가하고 이어서 진한 염산을 부가하였다. 혼합물을 염화메틸렌으로 추출하고 건조, 증발시켜 끈끈한 갈색고체(1.23g)를 얻었다. 이를 HPLC(용출제:에틸아세테이트)로 정제하여 황색검(0.099g)을 얻었다. 이를 에테르/톨루엔으로 분쇄하여 황색 고체인 원하던 생성물을 얻었다. m.p. 120℃(분해)
NMR(CDC13, 270MHZ)δ:1.66(9H,s), 2.88(3H,s), 3.14(3H,s), 7.25(1H,d), 7.45(1H,dd), 7.64(1H,d), 8.82(1H,bs).
[실시예12]
2-클로로-4-(2',2'-디메틸-4'-아미드)-N,N-디메틸벤즈아미드의(표I의 66번 화합물)의 제조방법
[단계1]
에틸 2,2-디메틸펜티-4-노에이트의 제조
-60℃ 미만의 온도를 유지하는 질소대기하에서 순수한 THF(10ml)내의 에틸 이소부티레이트(2.38g)교반 용액에 20분에 걸쳐 리튬 디이소프로필아미드(시클로헥산내의 모노-THF 착물의 1.5M 용액 13.7ml)를 적가하였다. 1시간 후에 온도를 -60℃미만으로 유지시키면서 순수한 THF(5ml)내의 브롬화프로파길(2.45g)을 적가하였다. 이 반응물을 아세테이트로 추출하였다. 에틸 아세테이트 분급물을 건조, 증발시켜 오렌지-갈색 액체를 얻고 이를 증류시켜(Kugelrohr, 115℃/60mm)원하던 생성물(1.39g)을 얻었다.
NMR(CDC13, 270MHZ)δ:1.19(3H,t), 1.21(6H,s), 1.93(1H,t), 2.38(2H,d), 4.08(2H,q).
[단계2]
2,2,-디메틸펜티-4-노인산의 제조
40℃에서 7시간 30분간 메탄올(20ml)내의 수산화칼륨(1.07g)을 에틸 2,2-디메틸펜티-4-노에이트(1.39g)와 함께 교반한 뒤 밤새 방치해 두었다. 이 반응물을 물에 붓고 에틸아세테이트로 세척하였다. 수성상을 산성화시킨 뒤 에틸아세테이트로 추출하였다. 이 층을 건조, 증발시켜 액체인 원하던 산(1.05g)을 얻었다.
NMR(CDC13, 270MHZ)δ:1.32(6H,s), 2.04(1H,t), 2.47(2H,d)
IR(액체필름):3300,3000-2500,1720cm-1
[단계3]
2-클로로-4-(2',2'-디메틸펜틴-4-아미드)-N,N-디메틸벤즈아미드의 제조
순수한 에테르(5ml)내의 염화옥살릴(1.53g)을 교반하면서 실온의 순수한 에테르(15ml)내의 2,2-디메틸펜티-4-논산에 적가하였다. 완전히 부가한 후에 혼합물을 30분간 교반하였다. 혼합물을 따라내고 에테르를 증발하여 엷은 액체인 산 염화물(0.417g)을 얻었다. 이를 더 정제하지않고 사용하였다. 염화메텔렌 내의 4-아미노-2-클로로-N,N,-디메틸벤즈아미드(0.524)와 트리에틸아민(0.534g) 교반용액에 0-5℃의 2,2-디메틸펜티-4-논 카복실산염화물(0.417g)을 부가하였다. 30분간 교반하고 난 뒤 반응 혼합물을 묽은 염산으로 세척하고 수성 중탄산나트륨, 물로 세척하였다.
염화 메틸렌 용액을 건조시킨 뒤 증발시켜 거품을 얻어 이를 결정화하여 엷은 오렌지색 고체인 원하던 생성물(0.606g)을 얻었다. m.p.154-5℃.
NMR(CDC13, 270MHZ)δ:1.40(6H,s), 2.17(1H,t), 2.52(2H,d), 2.87(3H,s), 3.13(3H,s), 7.05(1H,d), 7.33(1H,dd),7.64(1H,d)
다음은 본 발명의 화합물로 만들 수 있는 농업 및 원예용으로 적당한 조성물의 예이다. 이런한 조성물들은 본 발명의 또 다른 일면이다. 백분율은 중량 단위이다.
[실시예13]
다음의 구성성분들을 완전히 용해될 때까지 혼합, 교반하여 유화가능한 농축액을 만들었다.
표I의 1번 화합물 10%
벤질 알콜 30%
칼슘 도데실벤젠설포네이트 5%
노닐페놀에톡실레이트(산화에틸렌13몰) 10%
알킬 벤젠 45%
[실시예14]
활성 성분을 이염화메틸렌에 용해시킨 결과의액체를 애터풀 가이드 토의 과립위에 분무시켰다. 그런뒤 용매를 증발시켜 과립 조성물을 만들었다.
표I의 2번 화합물 5%
애터풀가이드 과립 95%
[실시예15]
다음 세가지 성분을 분쇄, 혼합하여 씨 도포용으로 적당한 조성물을 만들었다.
표 I의 3번 화합물 50%
광유 2%
도토 48%
[실시예16]
활성 성분을 활성과 분쇄, 혼합하여 살포용 분말을 만들었다.
표I 의 4번 화합물 5%
활석 95%
[실시예17]
분쇄된 혼합물과 물의 수성 현탁액을 만들기 위해 성분들을 볼 밀링하여 현탁 농축물을 만들었다.
표I의 5번 화합물 40%
소듐 리그노설포네이트 10%
벤토나이트 토 1%
물 49%
이 제제는 물로 희석시켜 분무하거나 또는 씨에 직접 사용할 수 있다.
[실시예18]
구성 성분들을 혼합하고 완전히 혼합될 때까지 함께 분쇄하여 습윤가능한 분말 제제를 만들었다.
표I 의 6번 화합물 25%
소듐 라우릴 설페이트 2%
소듐 리그노설포네이트 25%
실리카 25%
도토 43%
[실시예19]
본 발명의 화합물을 식물의 잎에 생기는 균에 의한 병해에 대해 시험했다.
식물을 4cm 직경 미니포트내의 존 인네스포팅 컴포스트(John Innes Potting Compost)(1또는 2번)내에서 키웠다. 시험 화합물을 수성디스퍼솔 T 로 비드 밀링하거나 또는 아세톤 또는 아세톤/에탄올내의 용액으로 제제화하는데, 사용전에 물로 필요한 농도까지 희석하였다. 잎에 생기는 병해에 대해 제제(100ppm활성 성분)를 잎에 분무하고 토양안에 있는 식물 뿌리에 살포하였다. 제제가 최대로 보유되도록 분무하고 뿌리를 대략 40ppm a.i./건조 토양에 상당하는 최종 농도까지 적신다. 곡물에 분무할 때 0.05%의 최종 농도를 만들기 위해 투원(Tween) 20을 부가했다.
대부분의 시험의 경우 식물에 병원균을 접종하기 하루 또는 이틀 전에 화합물을 토양(뿌리) 및 잎(분무에 의해)에 사용했다. 예외적으로 에리시퍼 그라미니스(Erysiphe graminis)는 처리하기 24시간 전에 접종시켰다. 잎 병원균을 시험 식물의 잎에 포자 현탁액으로서 분무했다. 접종 후, 식물을 적당한 환경에 놓아 감염되도록 하고 병해가 평가될 때까지 배양하였다. 접촉과 평가 사이의 기간은 병해 및 환경에 따라 4일에서 14일까지 변화시켰다.
병해 억제를 다음 등급으로 기록하였다.
4=병해 없음
3=비처리된 식물에 약간-5% 병해
2=비처리된 식물에 6-25% 병해
1=비처리된 식물에 26-59% 병해
0=비처리된 식물에 60-100% 병해
결과를 표 Ⅳ, Ⅴ 및 Ⅵ에 나타냈다.
[표 4 계속]
[표 4 계속]
[표 4 계속]
Claims (8)
- 제1항에 있어서, 둘이 동시에 H가 아닐 것을 조건으로하여 A 및 B가 독립적으로 H, 플루으로, 클로드 또는 브로모이고;D 및 E 둘다 H이며;R1은 C1-4알킬;R2는 C1-4알킬 또는 C1-4알콕시이거나, 또는 R1과 R2가 자신들이 결합되어 있는 질소원자와 함께 뭉쳐져서 모플린, 피페리딘, 피롤리딘 또는 아제티딘 고리를 형성하며;R3이 수소이고;R4가 C3-6알킬(할로겐, 매톡시, 메틸티오 또는 메틸설포닐로 임의 치환된), 시클로프로필(메틸로 임의 치환된), C3-6알케닐, C3-6알키닐, C1-4알콜시 또는 그룹 CH3ON=C(CN)이고;X와 Y 둘다 산소인 화합물.
- 제1항에 있어서, A가 클로로;B, D 및 E 모두가 H이며;R1이 메틸 또는 에틸;R2가 메틸 또는 에틸 이거나, 또는 R1및 R2가 자신들이 결합되어 있는 질소원자와 뭉쳐져서 모폴린 또는 피페리딘 고리를 형성하며;R3이 수소;R4가 C3-4알킬 또는 시클로프로필이며;X와 Y둘다 산소인 화합물.
- 제1항에 있어서, A가 클로드;B, D 및 E 모두가 H;R1과 R2가 독립적으로 메틸 또는 에틸이거나, 또는 이둘이 자신들이 결합되어 있는 질소환자와 뭉쳐져서 모폴린 또는 피페리딘 고리를 형성하고, R3이 수소;R4가 이소-프로필, t-부틸 또는 시클로프로필이며;X와 Y 둘다 산소인 화합물.
- 제5항에 있어서, B가 수소이거나, 또는 A와 B 둘다 클로로 또는 둘다 메틸인 화합물.
- 제5항에 있어서, A가 클로로 또는 브로모이고 B가 H이거나, 또는 A와 B 둘다 클로로이고 Z가 메틸인 화합물.
- a) X와 Y 둘다 산소이고 R3이 H일 경우ⅰ) 염기 존재하에 적당한 유기 용매내에서 하기 일반식(Ⅵ)화합물을 산 염화물(R4COC1)과 반응시키거나;ⅱ) 염기 또는 과량의 아민(R1R2NH) 존재하에 적당한 유기용매내에서 하기 일반식(Ⅸ) 화합물을 아민과 반응시키거나;또는ⅲ) 하기 일반식(XXXIII) 화합물을 일반식 R4-CO-NH2화합물 및 염기와 반응시키거나;b) X와 Y 둘다 산소이고 R3과 R4가 그룹 C(O)N과 뭉쳐져서 하기식의 고리를 형성한 경우ⅰ) 하기 일반식(X) 화합물을 상-전환 촉매의 존재하에 유기용매와 물로 이루어진 2-상 시스템내의 염기로 처리하거나;c) X와 Y 둘다 산소이고 R3이 H, R4가 그룹ⅰ) 일반식(XⅦ) 화합물을 적당한 용매내의 플루오라이드 전환시약으로 처리하거나;d) X와 Y 둘다 산소이고 R3이 H, R4가 그룹ⅰ) 하기 일반식(ⅩⅨ) 화합물을 적당한 용매내에서 불화제로 처리하거나;;또는ⅱ) 하기 일반식(Ⅵ) 화합물을염기존재하에 적당한 유기용매내에서 일반식(ⅩⅩⅩⅤ)의 산 염화물을 처리하거나;e) X가 산소 또는 황이고 Y가 황, R3이 H일 경우ⅰ) 하기 일반식(Ⅱ) 화합물을 적당한 용매내에서 가황처리(thionation) 시약으로 처리하여 X가 산소, Y가 황이고 R3이 수소인 일반식(Ⅰ) 화합물을 만들거나;또는 X가 산소, Y가 황, R3이 수소인 일반식(Ⅰ) 화합물과, X와 Y 둘다 황이고 R3이 수소인 일반식 (Ⅰ) 화합물의 혼합물을 만들거나;f) X가 황, Y가 산소이고 R3이 H일 경우ⅰ) -78℃-+25℃ 온도에서 하기 일반식(ⅩⅩⅢ)의 이소티오시아네이트를 적당한 용매내에서 유기금속 시약 R4Li 또는 R4Mghal과 반응시키거나;;또는ⅱ) 하기 일반식(ⅩⅩⅥ)의 산 염화물을 염기 존재하에 아민(R1R2NH)과 반응시키거나;;또는g) X와 Y 둘다 산소이고 R3이 H, R4가 그룹ⅰ) 일반식(ⅩⅨ) 화합물을 염기 존재하에 적당한 용매내에서 할라이드(R″-hal)와 반응시켜제1항의 화합물을 제조하는 방법9. 살균 유효량의 제1항의 화합물과 이의 살균적으로 허용가능한 담체 또는 희석제로 구성되는 살균 조성물.10. 제1항의 화합물 또는 제9항의 조성물을 식물에, 식물의 종자에 또는 식물의 재배지 또는 식물의 종자 보관 장소에 살포되는 것으로 구성되는 균 퇴치 방법.11. 제1항에 있어서, X와 Y 둘다 산소이고;A가 클로로;R3, B, D 및 E 모두가 H이고;R1및 R2둘다 메틸이며;R4가 F(CH3)2C인 화합물.
Applications Claiming Priority (4)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| GB8902323.8 | 1989-02-02 | ||
| GB898902323A GB8902323D0 (en) | 1989-02-02 | 1989-02-02 | Fungicides |
| GB898923366A GB8923366D0 (en) | 1989-10-17 | 1989-10-17 | Fungicides |
| GB8923366.2 | 1989-10-17 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| KR900012535A KR900012535A (ko) | 1990-09-01 |
| KR0145295B1 true KR0145295B1 (ko) | 1998-07-15 |
Family
ID=26294905
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1019900001264A KR0145295B1 (ko) | 1989-02-02 | 1990-02-02 | 살균제 |
Country Status (23)
| Country | Link |
|---|---|
| US (2) | US4999381A (ko) |
| EP (1) | EP0381330B1 (ko) |
| JP (1) | JP2688530B2 (ko) |
| KR (1) | KR0145295B1 (ko) |
| CN (1) | CN1024004C (ko) |
| AP (1) | AP123A (ko) |
| AR (1) | AR246734A1 (ko) |
| AU (1) | AU617238B2 (ko) |
| BR (1) | BR9000477A (ko) |
| CA (1) | CA2008291A1 (ko) |
| DE (1) | DE69005466T2 (ko) |
| EG (1) | EG19119A (ko) |
| ES (1) | ES2062320T3 (ko) |
| GB (1) | GB9002370D0 (ko) |
| HU (1) | HU206191B (ko) |
| IE (1) | IE62559B1 (ko) |
| IL (1) | IL93076A (ko) |
| LV (1) | LV10084B (ko) |
| MY (1) | MY106000A (ko) |
| NZ (1) | NZ232127A (ko) |
| PL (2) | PL163362B1 (ko) |
| PT (1) | PT93030B (ko) |
| SK (1) | SK23690A3 (ko) |
Families Citing this family (32)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| IE62559B1 (en) * | 1989-02-02 | 1995-02-08 | Ici Plc | Fungicides |
| GB9016582D0 (en) * | 1990-07-27 | 1990-09-12 | Ici Plc | Fungicides |
| GB9016581D0 (en) * | 1990-07-27 | 1990-09-12 | Ici Plc | Fungicides |
| GB9016580D0 (en) * | 1990-07-27 | 1990-09-12 | Ici Plc | Fungicides |
| EP0468681B1 (en) * | 1990-07-27 | 1995-05-24 | Zeneca Limited | Alfa-fluorocarboxylic acid derivatives as intermediates for the preparation of fungicides |
| GB9016578D0 (en) * | 1990-07-27 | 1990-09-12 | Ici Plc | Fungicides |
| US5639949A (en) * | 1990-08-20 | 1997-06-17 | Ciba-Geigy Corporation | Genes for the synthesis of antipathogenic substances |
| US5662898A (en) * | 1990-08-20 | 1997-09-02 | Ciba-Geigy Corporation | Genes for the synthesis of antipathogenic substances |
| CA2119155C (en) * | 1991-10-18 | 1999-06-15 | Dennis Paul Phillion | Fungicides for the control of take-all disease of plants |
| AU1160492A (en) * | 1992-01-13 | 1993-08-03 | Imperial Chemical Industries Plc | Fungicides |
| TR27569A (tr) * | 1992-01-24 | 1995-06-13 | Ici Plc | Yeni fungisidal asilaminobenzamidler, bunlarin hazirlanis islemleri ve bitkilerdeki mantar enfeksiyonlariyla mücadelede kullanimlari. |
| DE69314952T2 (de) * | 1992-06-26 | 1998-03-05 | Zeneca Ltd | 4-acylamino-benzamide und deren verwendung als fungizide |
| GB9213568D0 (en) * | 1992-06-26 | 1992-08-12 | Ici Plc | Fungicides |
| TR28604A (tr) * | 1992-06-26 | 1996-11-04 | Zeneca Ltd | Fungusid acilaminobenzenler. |
| HRP921338B1 (en) * | 1992-10-02 | 2002-04-30 | Monsanto Co | Fungicides for the control of take-all disease of plants |
| DE4342026A1 (de) * | 1993-12-09 | 1995-06-14 | Basf Ag | Acylamino-benzamide und sie enthaltende fungizide Mittel |
| US5482974A (en) * | 1994-03-08 | 1996-01-09 | Monsanto Company | Selected fungicides for the control of take-all disease of plants |
| US6117670A (en) * | 1994-06-08 | 2000-09-12 | Novartis Finance Corporation | Pyrrolnitrin biosynthesis genes and uses thereof |
| US5486621A (en) * | 1994-12-15 | 1996-01-23 | Monsanto Company | Fungicides for the control of take-all disease of plants |
| US5658953A (en) * | 1995-04-03 | 1997-08-19 | Centaur Pharmaceuticals, Inc. | Pharmaceutical compositions of acetamidobenzamide compounds for neurodegenerative disorders |
| US5643965A (en) * | 1995-04-03 | 1997-07-01 | Centaur Pharmaceuticals, Inc. | Aminobenzamide compounds for the treatment of neurodegenerative disorders |
| US5955506A (en) * | 1996-04-03 | 1999-09-21 | Centaur Pharmaceuticals, Inc. | Benzamides for neurodegenerative disorder treatment |
| GB9622926D0 (en) * | 1996-11-04 | 1997-01-08 | Zeneca Ltd | Chemical process |
| US6444849B1 (en) | 1997-06-25 | 2002-09-03 | Mitsubishi Chemical Corporation | Amide derivatives |
| UA70327C2 (uk) | 1998-06-08 | 2004-10-15 | Баєр Акціенгезельшафт | Спосіб боротьби з фітопатогенними хворобами сільськогосподарських рослин та фунгіцидна композиція |
| US6333432B1 (en) * | 1999-05-04 | 2001-12-25 | Gina M. Fitzpatrick | Fungicidal compositions and methods, and compounds and methods for the preparation thereof |
| CA2381703A1 (en) | 1999-08-13 | 2001-02-22 | Monsanto Technology Llc | Oxyme amides and hydrazone amides having fungicidal activity |
| FR2812633A1 (fr) * | 2000-08-04 | 2002-02-08 | Aventis Cropscience Sa | Derives de phenyl(thio)urees et phenyl(thio)carbamates fongicides |
| JP2010505811A (ja) * | 2006-10-04 | 2010-02-25 | ファイザー・プロダクツ・インク | カルシウム受容体アンタゴニストとしてのピリド[4,3−d]ピリミジン−4(3H)−オン誘導体 |
| CA2886973C (en) * | 2012-10-15 | 2017-08-15 | Albemarle Corporation | Processes for the synthesis of 2-amino-4,6-dimethoxybenzamide and other benzamide compounds |
| CN109206335B (zh) * | 2017-06-29 | 2020-10-30 | 沈阳中化农药化工研发有限公司 | 制备邻三氟甲基苯胺类化合物的方法及其中间体 |
| BR112020004926A2 (pt) * | 2017-09-13 | 2020-09-15 | Syngenta Participations Ag | derivados de quinolino(tio)carboxamida microbiocidas |
Family Cites Families (18)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE1168918B (de) * | 1961-08-16 | 1964-04-30 | Cassella Farbwerke Mainkur Ag | Verfahren zur Herstellung von Acylanthranilsaeureaniliden |
| BE621404A (fr) * | 1961-08-16 | 1962-12-03 | Cassella Farbwerke Mainkur Ag | Nouveaux anilides d'acides acylanthraniliques substitués et leur préparation |
| US3455987A (en) * | 1966-06-17 | 1969-07-15 | Abbott Lab | P-hydroxylaminobenzoylaminoacetonitriles and preparation thereof |
| CH507652A (de) * | 1968-03-29 | 1971-05-31 | Agripat Sa | Herbizides Mittel |
| BE758433A (fr) * | 1969-10-13 | 1971-05-04 | Ciba Geigy | N-o-fluorophenylurees, leur preparation et leur utilisation comme pesticides. |
| US4060638A (en) * | 1975-05-27 | 1977-11-29 | Sandoz, Inc. | Anthranilic acid amides |
| EP0002309B1 (en) * | 1977-10-12 | 1982-12-01 | Imperial Chemical Industries Plc | Acylanilides, process for their manufacture and pharmaceutical and veterinary compositions containing them |
| US4485105A (en) * | 1978-10-12 | 1984-11-27 | American Cyanamid Company | Method of treating hyperlipidemia with 4-(monoalkylamino)benzoic acid amides |
| JPS5780351A (en) * | 1980-11-06 | 1982-05-19 | Hodogaya Chem Co Ltd | Benzamide derivative and herbicide containing the same |
| JPS5867657A (ja) * | 1981-10-15 | 1983-04-22 | Chugai Pharmaceut Co Ltd | ペンズアミド誘導体 |
| US4623662A (en) * | 1985-05-23 | 1986-11-18 | American Cyanamid Company | Antiatherosclerotic ureas and thioureas |
| EP0100615B1 (en) * | 1982-07-27 | 1987-09-23 | Sumitomo Chemical Company, Limited | Fungicidal anilides |
| GB8315495D0 (en) * | 1983-06-06 | 1983-07-13 | Sumitomo Chemical Co | Fungicidal aniline derivatives |
| US4555525A (en) * | 1984-08-31 | 1985-11-26 | Administrators Of The Tulane Educational Fund | Use of desethyl-N-acetylprocainamide (NAPADE) as an inotropic agent |
| IL78394A (en) * | 1985-04-05 | 1989-12-15 | Lilly Co Eli | Fluoroalkanoyl anilides,process for their preparation,insecticidal,arachnicidal,fungicidal and herbicidal compositions comprising them |
| US4826841A (en) * | 1985-04-05 | 1989-05-02 | Eli Lilly And Company | Alkanoyl anilides as pesticides |
| DE3822448A1 (de) * | 1988-07-02 | 1990-03-01 | Bayer Ag | Ureido-benzoesaeure-derivate |
| IE62559B1 (en) * | 1989-02-02 | 1995-02-08 | Ici Plc | Fungicides |
-
1990
- 1990-01-12 IE IE14590A patent/IE62559B1/en not_active IP Right Cessation
- 1990-01-16 NZ NZ232127A patent/NZ232127A/en unknown
- 1990-01-17 EP EP90300457A patent/EP0381330B1/en not_active Expired - Lifetime
- 1990-01-17 IL IL9307690A patent/IL93076A/en not_active IP Right Cessation
- 1990-01-17 ES ES90300457T patent/ES2062320T3/es not_active Expired - Lifetime
- 1990-01-17 SK SK236-90A patent/SK23690A3/sk unknown
- 1990-01-17 DE DE90300457T patent/DE69005466T2/de not_active Expired - Fee Related
- 1990-01-22 CA CA002008291A patent/CA2008291A1/en not_active Abandoned
- 1990-01-22 HU HU90221A patent/HU206191B/hu not_active IP Right Cessation
- 1990-01-22 AP APAP/P/1990/000159A patent/AP123A/en active
- 1990-01-23 MY MYPI90000119A patent/MY106000A/en unknown
- 1990-01-24 AR AR90316000A patent/AR246734A1/es active
- 1990-01-26 AU AU48871/90A patent/AU617238B2/en not_active Ceased
- 1990-01-30 PL PL90285553A patent/PL163362B1/pl unknown
- 1990-01-30 EG EG4590A patent/EG19119A/xx active
- 1990-01-30 PL PL90283525A patent/PL163155B1/pl unknown
- 1990-02-01 PT PT93030A patent/PT93030B/pt not_active IP Right Cessation
- 1990-02-02 US US07/473,677 patent/US4999381A/en not_active Expired - Fee Related
- 1990-02-02 KR KR1019900001264A patent/KR0145295B1/ko not_active IP Right Cessation
- 1990-02-02 BR BR909000477A patent/BR9000477A/pt not_active Application Discontinuation
- 1990-02-02 CN CN90100999A patent/CN1024004C/zh not_active Expired - Fee Related
- 1990-02-02 GB GB909002370A patent/GB9002370D0/en active Pending
- 1990-02-02 JP JP2022308A patent/JP2688530B2/ja not_active Expired - Lifetime
- 1990-12-31 US US07/635,993 patent/US5280044A/en not_active Expired - Fee Related
-
1992
- 1992-12-24 LV LVP-92-487A patent/LV10084B/en unknown
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR0145295B1 (ko) | 살균제 | |
| RU2043990C1 (ru) | Производные пиримидина | |
| JP2559119B2 (ja) | アクリル酸誘導体、その製造方法およびこれを含有する殺菌剤組成物 | |
| JP2740306B2 (ja) | プロペン酸誘導体、その製造法及びそれを含有する殺菌剤、殺虫剤又は殺ダニ剤組成物 | |
| JP2858756B2 (ja) | プロペン酸誘導体、それらの製造法及びそれらを含有する殺菌剤組成物 | |
| CA1280417C (en) | Fungicidal acrylates and preparation thereof | |
| JP3371139B2 (ja) | 殺菌剤 | |
| JPH07121906B2 (ja) | アクリル酸誘導体、その製造方法及びこれを有効成分とする農薬組成物 | |
| KR20010034505A (ko) | 살균제로서 유용한 2-피리딜메틸아민 유도체 | |
| JPH0717615B2 (ja) | アクリル酸誘導体、その製造方法及びこれを有効成分とする殺菌剤組成物 | |
| JP2866704B2 (ja) | プロペン酸誘導体、その製造方法、殺菌剤組成物及び殺菌方法 | |
| JPH0424350B2 (ko) | ||
| JP2835073B2 (ja) | 殺菌性化合物及びそれを含有する殺菌剤組成物 | |
| JPH0770073A (ja) | ピリジルシクロプロパン誘導体、その製造方法及びこれを含有する殺菌剤組成物 | |
| EP0149324B1 (en) | Biologically active amide derivatives | |
| JP2619916B2 (ja) | プロペン酸化合物、その製造法及びそれを含有する殺菌組成物 | |
| US5122529A (en) | Pyridyl cyclopropane carboxamidine fungicides | |
| JPH05155837A (ja) | アシルアミノベンズアミド化合物、その製造法、それを含有する殺カビ剤組成物 | |
| JPH0776202B2 (ja) | アシルアミノブテニルニトリル誘導体、その製造法およびそれらを含有する除草剤および農園芸用殺菌剤 | |
| DD291750A5 (de) | Verfahren zur herstellung von acylaminobenzamiden mit fungizider wirkung | |
| JPS61212556A (ja) | 置換プロパルギルオキシアセトチオアミド誘導体、その製造法およびそれらを含有する除草剤および農園芸用殺菌剤 | |
| JPH0623155B2 (ja) | 置換プロパルギルオキシアセトニトリル誘導体、その製造法およびそれらを含有する除草剤および農園芸用殺菌剤 | |
| JPS61212553A (ja) | アシルアミノ誘導体、その製造法およびそれらを含有する除草剤および農園芸用殺菌剤 | |
| JPS60169405A (ja) | 農園芸用殺菌剤 | |
| JPH0759559B2 (ja) | 新規ピラゾ−ル誘導体、その製造法および農園芸用殺菌剤 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A201 | Request for examination | ||
| N231 | Notification of change of applicant | ||
| E701 | Decision to grant or registration of patent right | ||
| GRNT | Written decision to grant | ||
| LAPS | Lapse due to unpaid annual fee |