CN1024004C - 杀菌剂 - Google Patents
杀菌剂 Download PDFInfo
- Publication number
- CN1024004C CN1024004C CN90100999A CN90100999A CN1024004C CN 1024004 C CN1024004 C CN 1024004C CN 90100999 A CN90100999 A CN 90100999A CN 90100999 A CN90100999 A CN 90100999A CN 1024004 C CN1024004 C CN 1024004C
- Authority
- CN
- China
- Prior art keywords
- compound
- alkyl
- general formula
- formula
- hydrogen
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D295/00—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms
- C07D295/16—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms acylated on ring nitrogen atoms
- C07D295/18—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms acylated on ring nitrogen atoms by radicals derived from carboxylic acids, or sulfur or nitrogen analogues thereof
- C07D295/182—Radicals derived from carboxylic acids
- C07D295/192—Radicals derived from carboxylic acids from aromatic carboxylic acids
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01N—PRESERVATION OF BODIES OF HUMANS OR ANIMALS OR PLANTS OR PARTS THEREOF; BIOCIDES, e.g. AS DISINFECTANTS, AS PESTICIDES OR AS HERBICIDES; PEST REPELLANTS OR ATTRACTANTS; PLANT GROWTH REGULATORS
- A01N37/00—Biocides, pest repellants or attractants, or plant growth regulators containing organic compounds containing a carbon atom having three bonds to hetero atoms with at the most two bonds to halogen, e.g. carboxylic acids
- A01N37/44—Biocides, pest repellants or attractants, or plant growth regulators containing organic compounds containing a carbon atom having three bonds to hetero atoms with at the most two bonds to halogen, e.g. carboxylic acids containing at least one carboxylic group or a thio analogue, or a derivative thereof, and a nitrogen atom attached to the same carbon skeleton by a single or double bond, this nitrogen atom not being a member of a derivative or of a thio analogue of a carboxylic group, e.g. amino-carboxylic acids
- A01N37/46—N-acyl derivatives
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01N—PRESERVATION OF BODIES OF HUMANS OR ANIMALS OR PLANTS OR PARTS THEREOF; BIOCIDES, e.g. AS DISINFECTANTS, AS PESTICIDES OR AS HERBICIDES; PEST REPELLANTS OR ATTRACTANTS; PLANT GROWTH REGULATORS
- A01N43/00—Biocides, pest repellants or attractants, or plant growth regulators containing heterocyclic compounds
- A01N43/34—Biocides, pest repellants or attractants, or plant growth regulators containing heterocyclic compounds having rings with one nitrogen atom as the only ring hetero atom
- A01N43/44—Biocides, pest repellants or attractants, or plant growth regulators containing heterocyclic compounds having rings with one nitrogen atom as the only ring hetero atom three- or four-membered rings
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01N—PRESERVATION OF BODIES OF HUMANS OR ANIMALS OR PLANTS OR PARTS THEREOF; BIOCIDES, e.g. AS DISINFECTANTS, AS PESTICIDES OR AS HERBICIDES; PEST REPELLANTS OR ATTRACTANTS; PLANT GROWTH REGULATORS
- A01N47/00—Biocides, pest repellants or attractants, or plant growth regulators containing organic compounds containing a carbon atom not being member of a ring and having no bond to a carbon or hydrogen atom, e.g. derivatives of carbonic acid
- A01N47/08—Biocides, pest repellants or attractants, or plant growth regulators containing organic compounds containing a carbon atom not being member of a ring and having no bond to a carbon or hydrogen atom, e.g. derivatives of carbonic acid the carbon atom having one or more single bonds to nitrogen atoms
- A01N47/10—Carbamic acid derivatives, i.e. containing the group —O—CO—N<; Thio analogues thereof
- A01N47/20—N-Aryl derivatives thereof
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01N—PRESERVATION OF BODIES OF HUMANS OR ANIMALS OR PLANTS OR PARTS THEREOF; BIOCIDES, e.g. AS DISINFECTANTS, AS PESTICIDES OR AS HERBICIDES; PEST REPELLANTS OR ATTRACTANTS; PLANT GROWTH REGULATORS
- A01N47/00—Biocides, pest repellants or attractants, or plant growth regulators containing organic compounds containing a carbon atom not being member of a ring and having no bond to a carbon or hydrogen atom, e.g. derivatives of carbonic acid
- A01N47/08—Biocides, pest repellants or attractants, or plant growth regulators containing organic compounds containing a carbon atom not being member of a ring and having no bond to a carbon or hydrogen atom, e.g. derivatives of carbonic acid the carbon atom having one or more single bonds to nitrogen atoms
- A01N47/28—Ureas or thioureas containing the groups >N—CO—N< or >N—CS—N<
- A01N47/30—Derivatives containing the group >N—CO—N aryl or >N—CS—N—aryl
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01N—PRESERVATION OF BODIES OF HUMANS OR ANIMALS OR PLANTS OR PARTS THEREOF; BIOCIDES, e.g. AS DISINFECTANTS, AS PESTICIDES OR AS HERBICIDES; PEST REPELLANTS OR ATTRACTANTS; PLANT GROWTH REGULATORS
- A01N53/00—Biocides, pest repellants or attractants, or plant growth regulators containing cyclopropane carboxylic acids or derivatives thereof
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C237/00—Carboxylic acid amides, the carbon skeleton of the acid part being further substituted by amino groups
- C07C237/28—Carboxylic acid amides, the carbon skeleton of the acid part being further substituted by amino groups having the carbon atom of at least one of the carboxamide groups bound to a carbon atom of a non-condensed six-membered aromatic ring of the carbon skeleton
- C07C237/42—Carboxylic acid amides, the carbon skeleton of the acid part being further substituted by amino groups having the carbon atom of at least one of the carboxamide groups bound to a carbon atom of a non-condensed six-membered aromatic ring of the carbon skeleton having nitrogen atoms of amino groups bound to the carbon skeleton of the acid part, further acylated
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C259/00—Compounds containing carboxyl groups, an oxygen atom of a carboxyl group being replaced by a nitrogen atom, this nitrogen atom being further bound to an oxygen atom and not being part of nitro or nitroso groups
- C07C259/04—Compounds containing carboxyl groups, an oxygen atom of a carboxyl group being replaced by a nitrogen atom, this nitrogen atom being further bound to an oxygen atom and not being part of nitro or nitroso groups without replacement of the other oxygen atom of the carboxyl group, e.g. hydroxamic acids
- C07C259/10—Compounds containing carboxyl groups, an oxygen atom of a carboxyl group being replaced by a nitrogen atom, this nitrogen atom being further bound to an oxygen atom and not being part of nitro or nitroso groups without replacement of the other oxygen atom of the carboxyl group, e.g. hydroxamic acids having carbon atoms of hydroxamic groups bound to carbon atoms of six-membered aromatic rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C271/00—Derivatives of carbamic acids, i.e. compounds containing any of the groups, the nitrogen atom not being part of nitro or nitroso groups
- C07C271/06—Esters of carbamic acids
- C07C271/08—Esters of carbamic acids having oxygen atoms of carbamate groups bound to acyclic carbon atoms
- C07C271/26—Esters of carbamic acids having oxygen atoms of carbamate groups bound to acyclic carbon atoms with the nitrogen atom of at least one of the carbamate groups bound to a carbon atom of a six-membered aromatic ring
- C07C271/28—Esters of carbamic acids having oxygen atoms of carbamate groups bound to acyclic carbon atoms with the nitrogen atom of at least one of the carbamate groups bound to a carbon atom of a six-membered aromatic ring to a carbon atom of a non-condensed six-membered aromatic ring
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C275/00—Derivatives of urea, i.e. compounds containing any of the groups, the nitrogen atoms not being part of nitro or nitroso groups
- C07C275/28—Derivatives of urea, i.e. compounds containing any of the groups, the nitrogen atoms not being part of nitro or nitroso groups having nitrogen atoms of urea groups bound to carbon atoms of six-membered aromatic rings of a carbon skeleton
- C07C275/42—Derivatives of urea, i.e. compounds containing any of the groups, the nitrogen atoms not being part of nitro or nitroso groups having nitrogen atoms of urea groups bound to carbon atoms of six-membered aromatic rings of a carbon skeleton being further substituted by carboxyl groups
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C317/00—Sulfones; Sulfoxides
- C07C317/44—Sulfones; Sulfoxides having sulfone or sulfoxide groups and carboxyl groups bound to the same carbon skeleton
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C323/00—Thiols, sulfides, hydropolysulfides or polysulfides substituted by halogen, oxygen or nitrogen atoms, or by sulfur atoms not being part of thio groups
- C07C323/50—Thiols, sulfides, hydropolysulfides or polysulfides substituted by halogen, oxygen or nitrogen atoms, or by sulfur atoms not being part of thio groups containing thio groups and carboxyl groups bound to the same carbon skeleton
- C07C323/51—Thiols, sulfides, hydropolysulfides or polysulfides substituted by halogen, oxygen or nitrogen atoms, or by sulfur atoms not being part of thio groups containing thio groups and carboxyl groups bound to the same carbon skeleton having the sulfur atoms of the thio groups bound to acyclic carbon atoms of the carbon skeleton
- C07C323/52—Thiols, sulfides, hydropolysulfides or polysulfides substituted by halogen, oxygen or nitrogen atoms, or by sulfur atoms not being part of thio groups containing thio groups and carboxyl groups bound to the same carbon skeleton having the sulfur atoms of the thio groups bound to acyclic carbon atoms of the carbon skeleton the carbon skeleton being acyclic and saturated
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D205/00—Heterocyclic compounds containing four-membered rings with one nitrogen atom as the only ring hetero atom
- C07D205/02—Heterocyclic compounds containing four-membered rings with one nitrogen atom as the only ring hetero atom not condensed with other rings
- C07D205/06—Heterocyclic compounds containing four-membered rings with one nitrogen atom as the only ring hetero atom not condensed with other rings having one double bond between ring members or between a ring member and a non-ring member
- C07D205/08—Heterocyclic compounds containing four-membered rings with one nitrogen atom as the only ring hetero atom not condensed with other rings having one double bond between ring members or between a ring member and a non-ring member with one oxygen atom directly attached in position 2, e.g. beta-lactams
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C2601/00—Systems containing only non-condensed rings
- C07C2601/02—Systems containing only non-condensed rings with a three-membered ring
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Life Sciences & Earth Sciences (AREA)
- Agronomy & Crop Science (AREA)
- Pest Control & Pesticides (AREA)
- Plant Pathology (AREA)
- Health & Medical Sciences (AREA)
- Engineering & Computer Science (AREA)
- Dentistry (AREA)
- General Health & Medical Sciences (AREA)
- Wood Science & Technology (AREA)
- Zoology (AREA)
- Environmental Sciences (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
- Agricultural Chemicals And Associated Chemicals (AREA)
- Plural Heterocyclic Compounds (AREA)
- Heterocyclic Carbon Compounds Containing A Hetero Ring Having Nitrogen And Oxygen As The Only Ring Hetero Atoms (AREA)
Abstract
本发明涉及新的杀菌剂酰氨基苯甲酰胺及其制备方法,及含有这些化合物的杀菌剂组合物,还涉及使用这些化合物杀真菌,尤其是杀植物感染的真菌之方法。所说的有效化合物具有如下结构:式中,所述的基团A,B,D,E,R1,R2,R3,R4,X及Y与说明书及权利要求书中的定义相同。
Description
本发明涉及新的杀菌剂酰氨基苯甲酰胺及其制备方法,及含有这些化合物的杀菌剂组合物,和使用这些化合物杀死真菌,尤其是植物感染的真菌之方法。
公知技术包括英国专利申请NO42454/77(例如,由此获得的要求优先权的美国专利NO.4282218)和EP-A-0127990,前者描述了具有抗雄激素物质性能的酰基苯胺,后者描述了具有杀菌性能的苯胺衍生物。
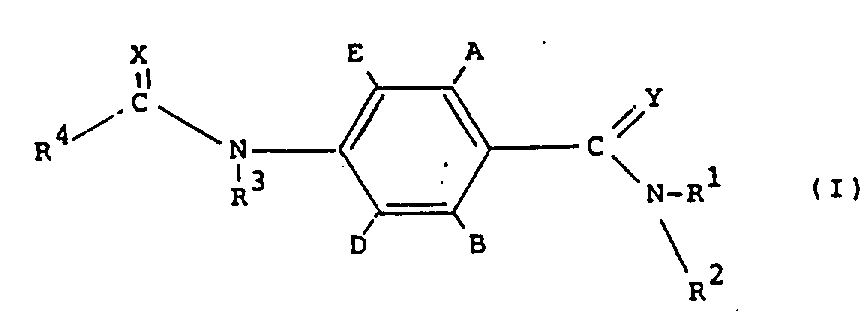
本发明提供了具有如下结构式(Ⅰ)的化合物:
其中,在A和B不同时为氢的条件下,A和B独立地为氢、氟、氯、溴、C1-4烷基、C1-4烷氧基或卤代(C1-4)烷基;D和E独立地为氢或氟;R1为氢、C1-4烷基或C1-4烷氧基;R2为C1-4烷基、C1-4烷氧基或任意取代的苯基,或R1和R2与氮原子连接在一起被C1-4烷基任意取代的吗啉、哌啶、吡咯烷或氮杂环丁烷环;R3为氢;R4为三氯甲基、C2-8烷基(可任意地被卤素、C1-8烷氧基或R′S(O)n取代,其中R′为C1-4烷基、C2-4烯基或C2-4炔基,n为0、1或2)、环丙基(可任意地被卤素或C1-4烷基取代)、C2-8烯基、C2-8炔基、C2-8烷氧基、单或二(C1-4)烷氨基或基团R″ON=C(CN),其中R″是C1-4烷基,或R3和R4与基团C(O)N连接在一起形成被卤素或C1-4烷基任意取代的氮杂环丁-2-酮环;和X和Y独立地为氧或硫。
烷基和其他含烷基基团的烷基部分可以是直链或支链形式。烷基的实例包括甲基、乙基、丙基(正和异丙基)、丁基(正、仲、异和叔丁基)、1,1-二甲基丙基和1,1-二甲基丁基。烯基和炔基也可以是直链或支链形式,其例子为1,1-二甲基丁-3-烯基和1,1-二甲基丙-2-炔基。
卤素包括氟、氯和溴。
苯基的任意取代基包括:卤素、C1-4烷基(例如,甲基)、C1-4烷氧基(例如,甲氧基)、C1-4烷硫基(例如,甲硫基)、三氟甲基、三氟甲氧基、硝基、氰基、C1-4烷氧基羰基、氨基和单和二(C1-4)烷氨基。
另一方面,本发明提供了结构式(Ⅰ)的化合物,其中在A和B不同时为氢的条件下,A和B独立地为氢、氟、氯或溴;D和E均是氢;R1是氢或C1-4烷基;R2是C1-4烷基、C1-4烷氧基或苯基,或R1和R2一起与氮原子连接形成吗啉、哌啶、吡咯烷或氮杂环丁烷环;R3是氢;R4是C3-6烷基(可任意地被卤素、甲氧基、甲硫基或甲磺酰基取代)、环丙基(可任意地被甲基取代)、C3-6烯基、C3-6炔基、C1-4烷氧基或基团CH3ON=C(CN);X和Y均是氧。
另一方面,本发明提供了结构式(Ⅰ)的化合物,其中A是氯;B、D和E均是氢;R1是氢、甲基或乙基;R2是甲基、乙基或苯基、或R1和R2一起与氮原子连接形成吗啉或哌啶环;R3是氢;R4是C3-4烷基(例如,异丙基或叔丁基)或环丙基;X和Y均为氧。
另一方面,本发明提供了结构式(Ⅰ.1)的化合物,其中A是氯;B、D和E均为氢;R1和R2独立地是甲基或乙基(但相应地均是甲基或均是乙基)或与氮原子连接在一起形成吗啉或哌啶环;R3是氢;R4是异丙基、叔丁基或环丙基;X和Y均为氧。
另一方面,本发明还提供了如下结构式(Ⅰ.1)的化合物:
其中A和B独立地是氯、溴或甲基或B是氢;Z是氟、氯、溴、甲基、乙基或甲氧基。在这些化合物中应注意其中B是氢以及其中A和B均是氯或均是甲基的化合物。尤其感兴趣的化合物为其中A是氯;B是氢;和Z是上述给出的任何基团的化合物;和其中A是氯或溴;B是氢,或A和B均是氯;Z是甲基的化合物。
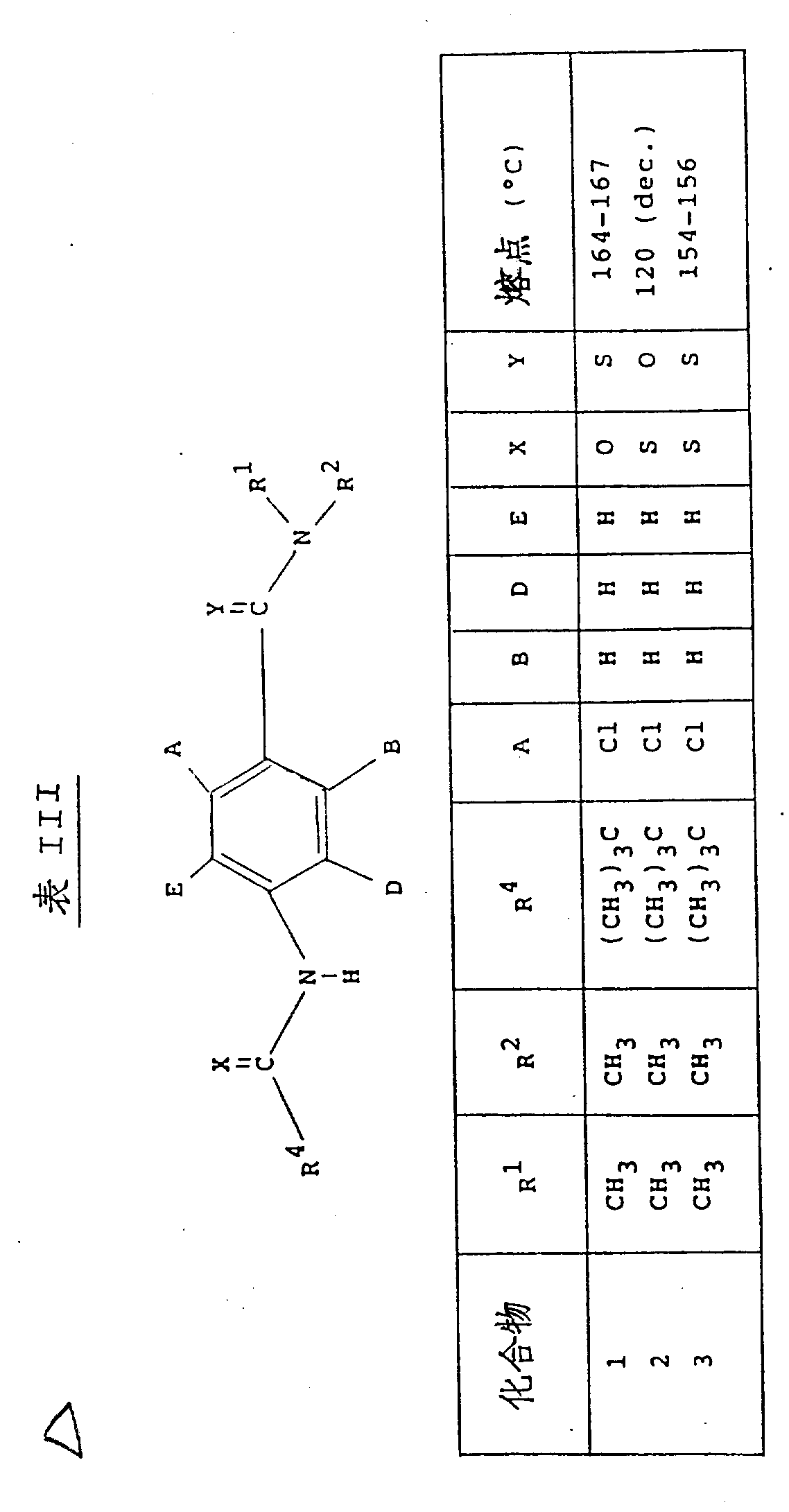
本发明用以下表Ⅰ、Ⅱ和Ⅲ中列出的化合物举例说明。(表见文后)
本发明的化合物可以通过,例如方案1至11举例的方法来制备,在所有方案中,R1、R2、R4、A、B、D和E均如上文定义。
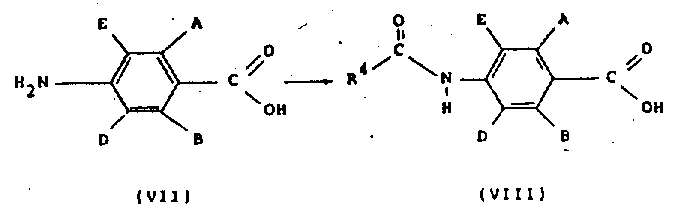
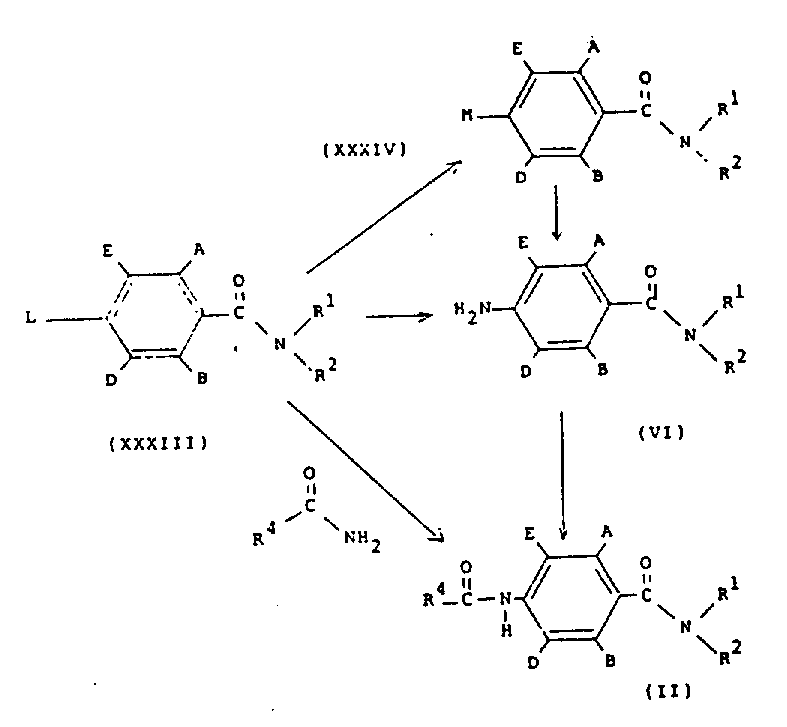
在方案1中,结构式(Ⅱ)的化合物可以通过将结构式(Ⅵ)的化合物与酰基氯R4COCl在适当的有机溶剂,例如,二氯甲烷或甲苯中,在碱,例如,叔胺(如,三乙胺)或碱金属碳酸盐或氢氧化物(如,碳酸氢钠或氢氧化钠)存在下反应来制备。
结构式(Ⅵ)的化合物可以通过采用文献中公
知的标准方法,如在含水乙醇中的铁粉,还原结构式(Ⅴ)的硝基化合物来制备。
结构式(Ⅴ)的酰胺可以由结构式(Ⅲ)的化合物制备,首先用标准试剂,例如亚硫酰氯或草酰氯处理结构式(Ⅲ)的化合物,将其转化为结构式(Ⅳ)的酰基氯,随后将酰基氯(Ⅳ)与胺(R1R2NH)在适当的有机溶剂(如二氯甲烷或甲苯)或水中,在碱(如三乙胺或碳酸氢钠或过量胺R1R2NH)的存在下反应。
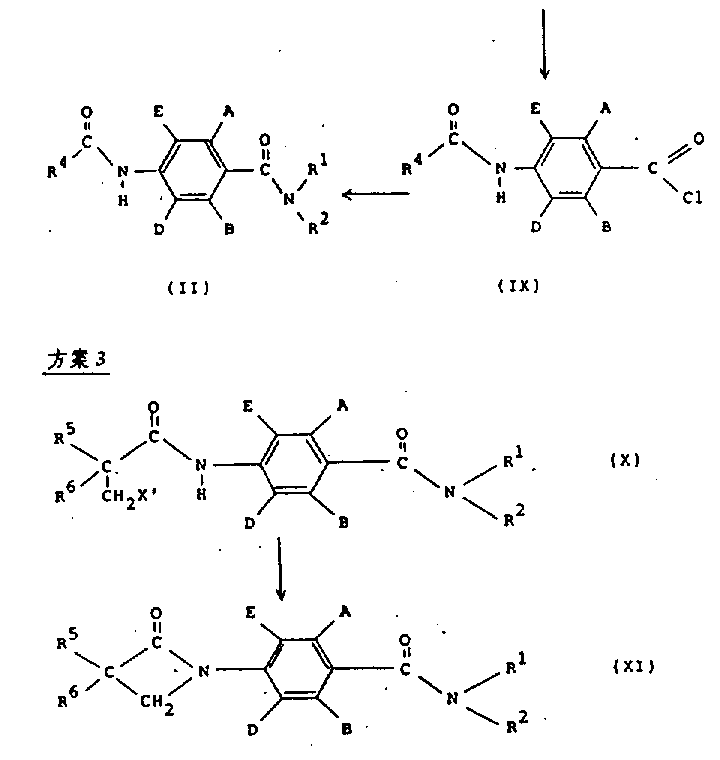
在方案2中,结构式(Ⅱ)的化合物可以通过将结构式(Ⅸ)的化合物与胺R1R2NH在适当的有机溶剂,如二氯甲烷或四氢呋喃(THF)中,在碱,如三乙胺、碳酸氢钠或过量R1R2NH存在下反应来制备。
方案1
方案2
结构式(Ⅸ)的酰基氯可以通过在适当的无水溶剂,如THF或二氯甲烷中将结构式(Ⅷ)的羧酸与一种标准试剂,如草酰氯和根据需要加入一定的催化量的DMF反应来制备。
结构式(Ⅷ)的羧酸可以将适当取代的4-氨基苯甲酸(Ⅶ)与酰基氯R4CoCl在水中,在至少两当量的碱,例如碱金属碳酸盐或氢氧化物(如碳酸氢钠)存在下反应来制备。取代的4-氨基苯甲酸(Ⅶ)通常由文献中描述的方法来制备。
在方案3中,结构式(Ⅺ)中R5和R6是氢、C1-4烷基或卤素的化合物通过在含有机溶剂,例如二氯甲烷,和水构成的两相系统中,在相转移催化剂(例如四丁基溴化铵)存在下,用碱,例如碱金属氢氧化物(如,氢氧化钠)处理结构式(Ⅹ)中(Ⅹ′是氯、溴或碘)的化合物来制备。
在方案4中,结构式(Ⅷ)中的中间体可以采用文献中的标准方法,例如,用含水无机酸(如含水硫酸)或用含水强碱(例如含或不含共溶剂,(如乙醇)的含水氢氧化钠)处理,使结构式(ⅩⅣ)的化合物水解来制备,或通过含水重氮化反应(例如用在含水硫酸中的亚硝酸钠)来制备。结构式(ⅩⅣ)的化合物可以采用文献中的标准方法,如用含水无机酸(例如含水硫酸)或含水强碱(例如含或不含共溶剂,(如乙醇)的含水氢氧化钠)处理,使结构式(ⅩⅢ)的化合物水解来制备,或用含水碱性过氧化物(如含水过氧化氢)处理,上述碱性过氧化物含有氢氧化钠及含或不含共
溶剂,如乙醇。结构式(ⅩⅢ)的化合物可以通过在适当有机溶剂(如二氯甲烷或甲苯)中,在碱,例如叔胺(如三乙胺)或碱金属碳酸盐或氢氧化物(如碳酸氢钠或氢氧化钠)存在下,将结构式(Ⅻ)的化合物与酰基氯R4COCl反应来制备。
方案4
在方案5中,通式(Ⅷ)的中间体可以通过在适当的溶剂,如水或乙醇或它们的混合物中用碱金属氢氧化物(如氢氧化钠)水解酯(ⅩⅥ)(其中R7是C1-4烷基)来制备。通式(ⅩⅥ)的酯可以采用若干途径由通式(ⅩⅤ)的氨基苯甲酸酯来制备。第一步,在适当的有机溶剂中(如二氯甲烷或甲苯),在碱,诸如叔胺(如三乙胺)或碱金属碳酸盐或氢氧化物(如碳酸氢钠或氢氧化钠)存在下与酰基氯R4COCl反应。另一方面,如果取代基A、B、C、D和E中的任何一个是强吸电子基,则可以首先用强碱(例如氢化钠或二异丙基酰胺锂),在惰性有机溶剂(如四氢呋喃或二甲氧基乙烷)中,使氨基酯(ⅩⅤ)去质子化,随后,用酰基氯R4COCl处理。为了得到满意的产率,需要两当量的强碱。通式(ⅩⅤ)的化合物可以在酸性催化剂(如浓硫酸或氯化氢气体)存在下,将通式(Ⅶ)化合物与烷基醇R7OH(其中R7是C1-4烷基)反应来制备。
方案5
在方案6中,通式(ⅩⅧ)的化合物(其中R8和R9独立地是氢、C1-4烷基或C1-4卤代烷基),在适当的溶剂(例如乙腈)中,用氟化物转换试剂(如四氟硼酸银)处理结构式(ⅩⅦ)的化合物来制备。
方案6
在方案7中,通式(ⅩⅩ)的化合物(其中R8和R9如方案6所定义)可以在适当的溶剂(例如二氯甲烷)中,用氟化剂(如二乙氨基硫三氟化物)处理通式(ⅩⅨ)的羟基化合物来制备。通式(ⅩⅩ)的化合物也可以在适当的溶剂(如二氯甲烷或乙酸乙酯)中,在碱(如三乙胺或碳酸钾)存在下,将通式(Ⅵ)的化合物与通式(ⅩⅩⅩⅤ)的酰基氯反应来制备。
方案7
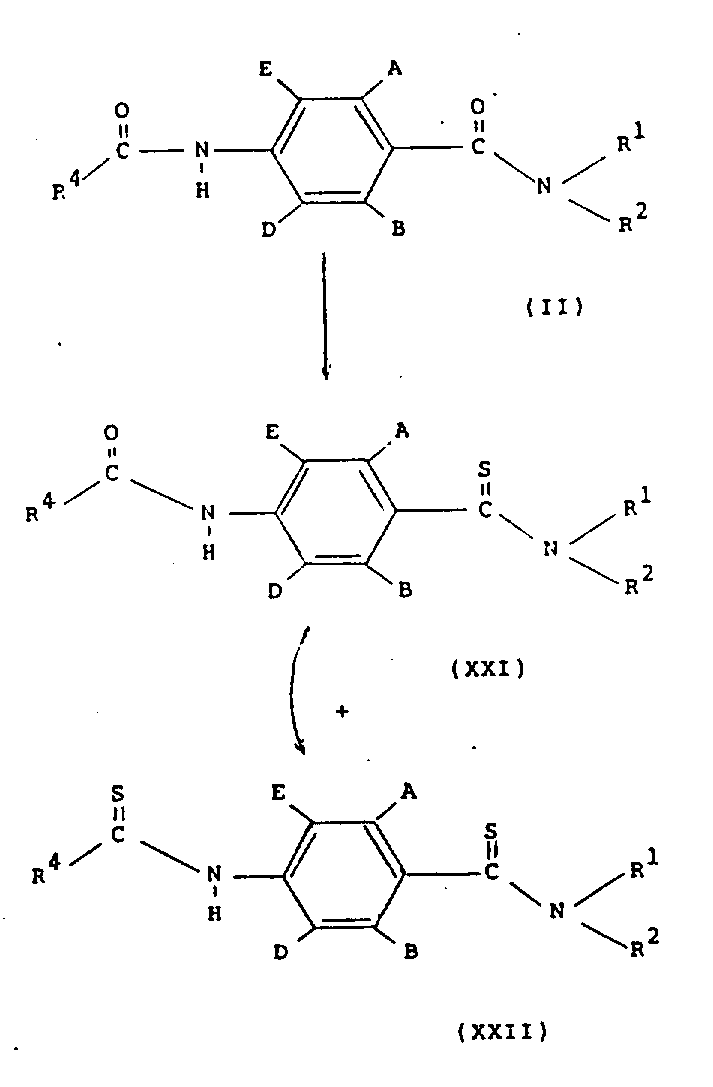
在方案8中,通式(ⅩⅪ)和(ⅩⅫ)的化合物可以在适当的溶剂(例如甲苯或乙腈)中,通过用硫化剂(如五硫化磷或Lawesson试剂)处理通式(Ⅱ)的化合物来制备。化合物(ⅩⅪ)和(ⅩⅫ)可以以混合物形式一起生成(该混合物可以用色谱法和结晶法分离)也可以单独生成化合物(ⅩⅪ),随后转化为(ⅩⅫ)。
方案8
方案9
在方案9中,通式(ⅩⅩⅣ)的化合物可以通过在适当溶剂(如四氢呋喃)中,在-78℃至°+25℃的温度间,将通式(ⅩⅩⅢ)的异硫氰酸酯与R4Li或R4Mghal(其中hal是卤素,如氯或溴)型有机金属试剂反应来制备。
通式(ⅩⅩⅢ)的异硫氰酸酯可以采用标准方法,由通式(Ⅵ)的化合物制备,例如用硫光气处理通式(Ⅵ)的化合物。
通式(ⅩⅩⅣ)的化合物也可以采用制备酰胺的标准方法,由通式(ⅩⅩⅤ)的化合物制备。例如,通过用氯化试剂(如草酰氯或亚硫酰氯)处理,将(ⅩⅩⅤ)化合物转化为通式(ⅩⅩⅥ)的酰基氯。随后,在碱的存在下(如三乙胺或碳酸钾),酰基氯(ⅩⅩⅥ)与胺R1R2NH反应。通式(ⅩⅩⅤ)的羧酸可以采用标准方法水解通式(ⅩⅩⅦ)的酯来制备(如在氢氧化钠甲醇液中)。酯(ⅩⅩⅦ)可以通过在适当溶剂(例如甲苯或乙腈)中,将通式(ⅩⅩⅧ)化合物与硫化试剂(如
五硫化磷或Lawesson试剂)反应来制备。
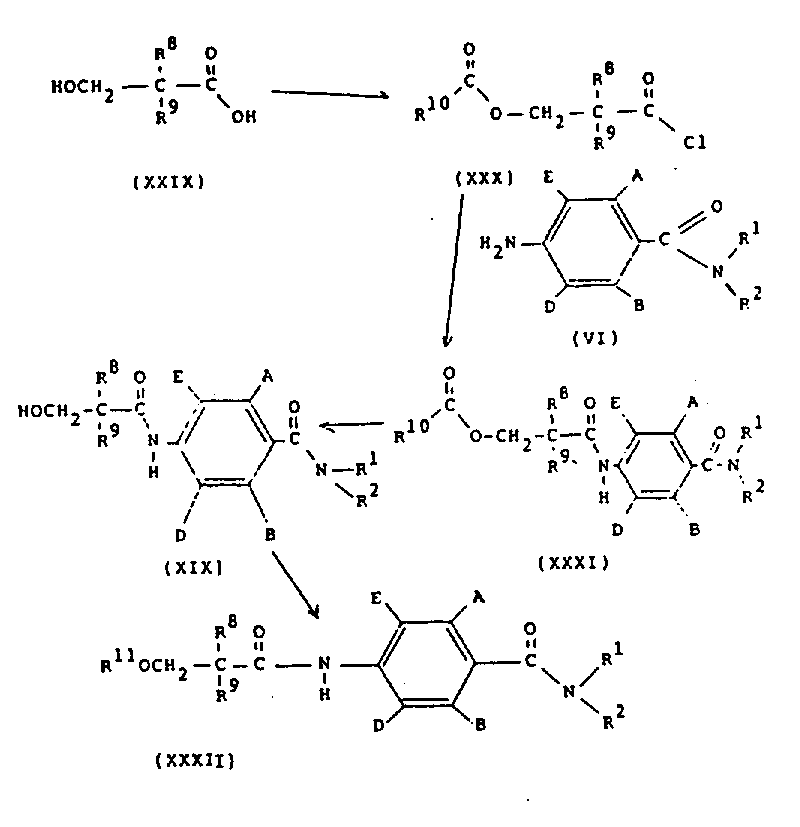
在方案10中,通式(ⅩⅩⅫ)的化合物(其中R11是C1-4烷基)可以通过在碱,例如碱金属碳酸盐或氧化物或氢氧化物(如氧化钡)存在下,在适当的溶剂(如甲醇)中,将通式(ⅩⅨ)的化合物与卤化物R11-hal(其中hal是氯、溴或碘)反应来制备。通式(ⅩⅨ)的化合物可以在适当的溶剂(如含水甲醇)中用碱金属氢氧化物(如氢氧化钠)水解通式(ⅩⅩⅪ)的化合物来制备。通式(ⅩⅩⅪ)的化合物可以通过在适当的溶剂(如二氯甲烷)中,在碱(如三乙胺)的存在下,将通式(Ⅵ)的化合物与通式(ⅩⅩⅩ)的酰基氯反应来制备。通式(ⅩⅩⅩ)的酰基氯可以通过用结构式(R10CO)2O的酸酐处理通式(ⅩⅩⅨ)的羟基酸,随后用酰基氯生成试剂(例如,亚硫酰氯或草酰氯)处理来制备。
方案10
方案11
在方案11中,结构式(Ⅱ)的化合物可以通过将结构式(ⅩⅩⅩⅢ)的化合物(其中L是离去基团,例如,氟、氯、溴、碘、甲烷磺酰氧基、对甲苯磺酰基氧基、或三氟甲烷磺酰基氧基)与通式R4-CO-NH2的化合物和碱(例如,氢化钠、二异丙基酰胺锂、碱金属醇盐或碱金属碳酸盐)反应而制备。结构式(Ⅱ)的化合物也可以如方案1所描述的由通式(Ⅵ)的苯胺制备。通式(Ⅵ)的苯胺可以通过在适当的溶剂(例如,乙醇或吡啶)中,将通式(ⅩⅩⅩⅢ)的化合物与氨反应而制备。结构式(Ⅵ)的化合物也可以通过用还原剂(例如,在催化剂存在下的氢气)处理通式(ⅩⅩⅩⅣ)的化合物(其中M是叠氮基或肼基)而制备。通式(ⅩⅩⅩⅣ)的化合物可以通过在适当的
溶剂(例如二甲基甲酰胺或乙醇)中,将通式(ⅩⅩⅩⅢ)的化合物与碱金属叠氮化物(如叠氮化钠)或肼反应而制备。
另一方面,本发明提供了本文描述的用于制备本发明化合物的方法。
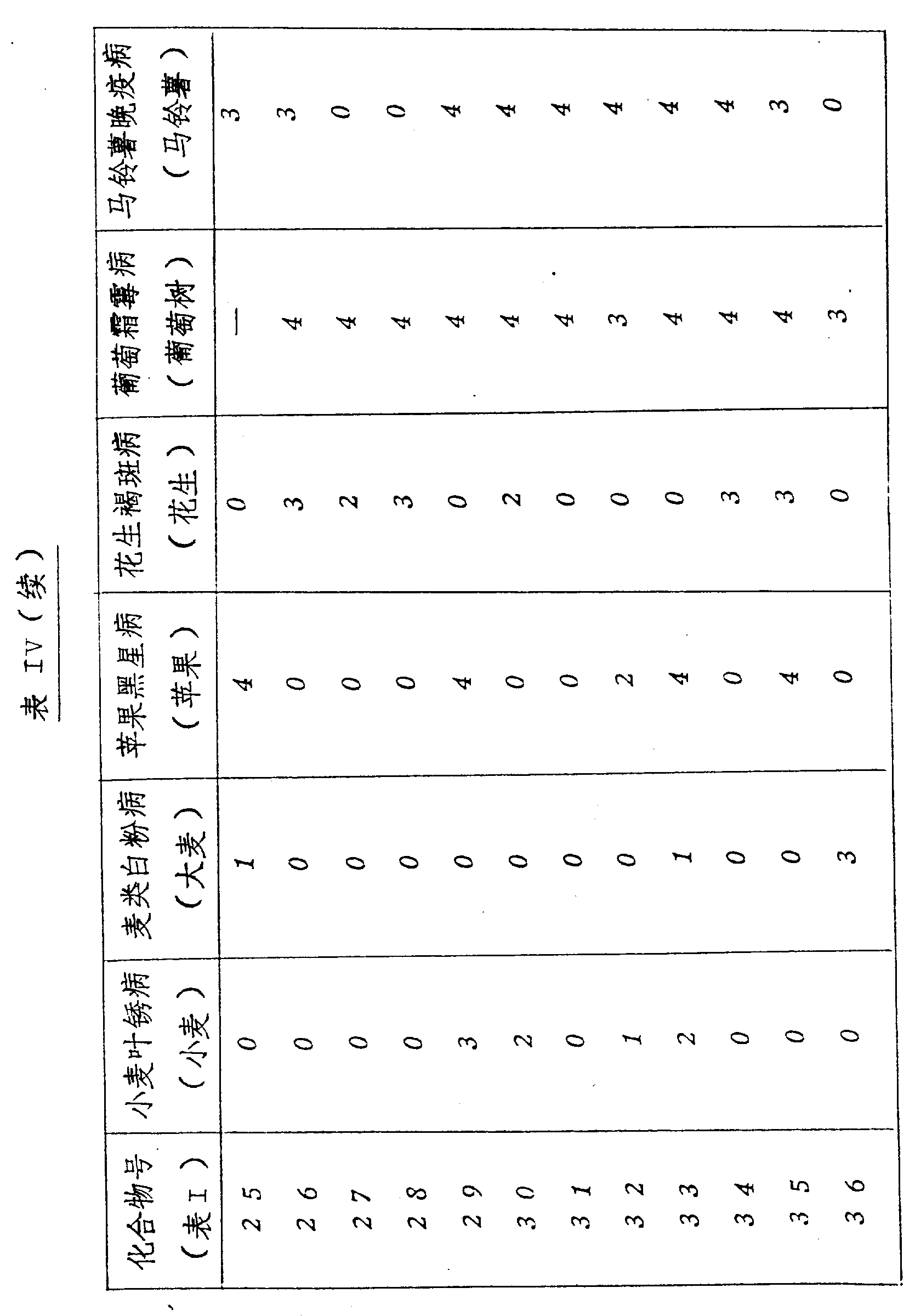
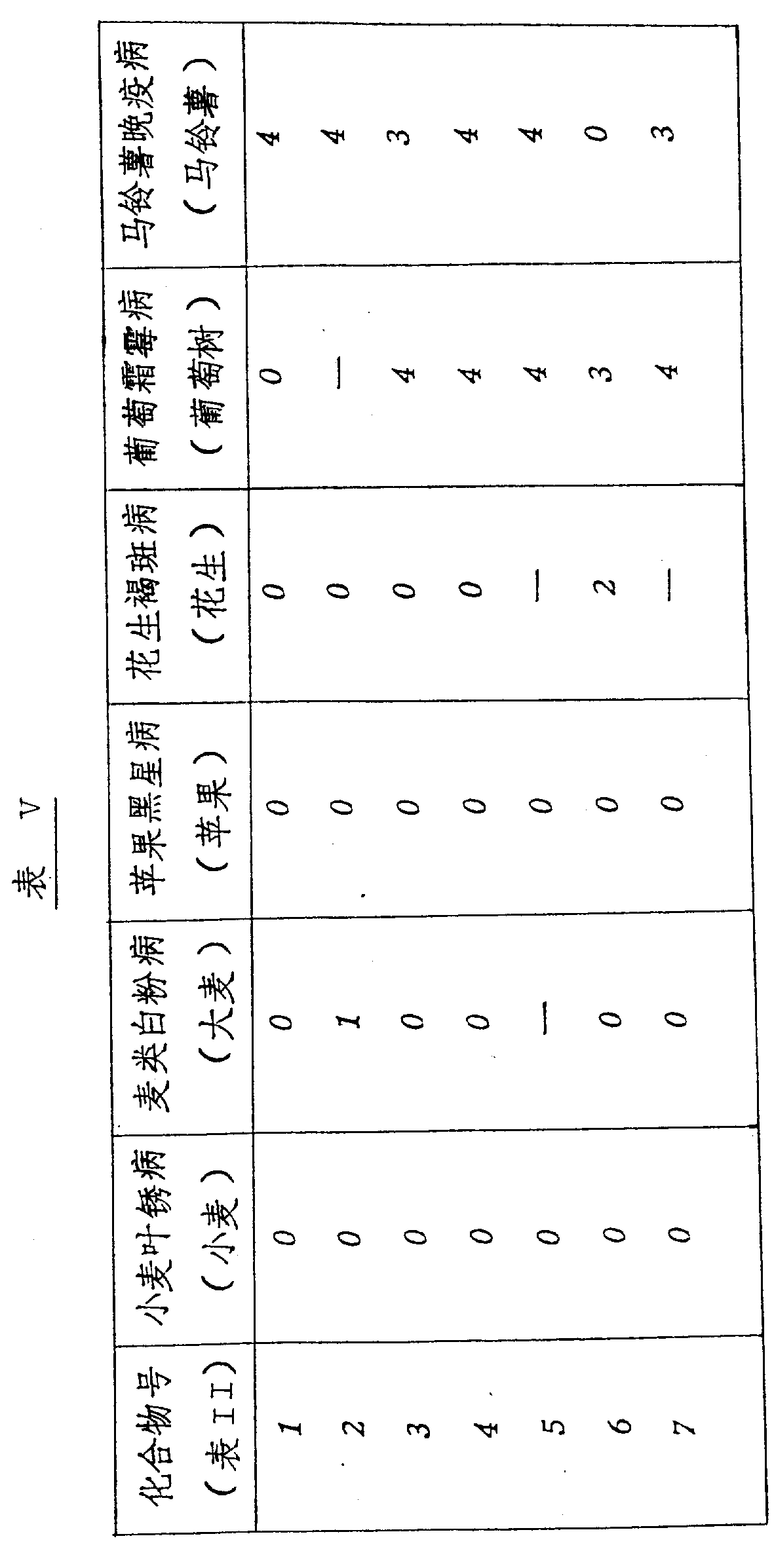
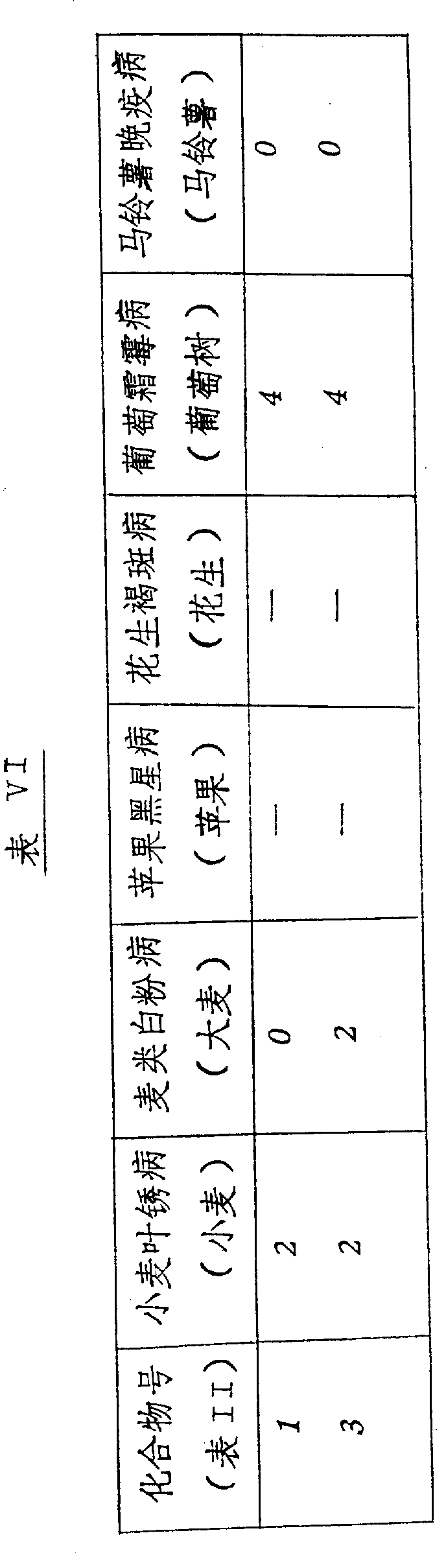
本发明的化合物是活性杀菌剂,可以抑制一种或多种如下病菌:小麦的叶锈病、大麦的白粉病、苹果的黑星病、花生的褐斑病、葡萄树的霜霉病和土豆的晚疫病,尤其,在作为系统处理时,化合物显示出对于葡萄霜霉病和马铃薯晚疫病具有明显的活性。
因而,本发明提供了杀死真菌的方法,其包括,将杀菌有效量的上文定义的化合物或含化合物的组合物施用于植物、植物的种子或植物、种子的场所。
化合物可以直接应用于农业上,但更常见的是用载体或稀释剂配制成组合物。本发明提供了含有如上定义的化合物和其可接受的载体或稀释剂的杀菌剂组合物。
化合物可以以许多方式施用,例如,以配制的或未配制的形式直接施用于植物的叶子、种子或其他植物正在生长或将要生长的介质,它们可以喷洒、撒粉或作为乳剂或糊剂施用,或者以蒸汽状态或以缓慢释放的颗粒状态施用。
可以施用在植物的任何部分,包括叶、杆、枝或根,或根附近的土壤,或使用于种植前的种子或一般土壤,施用于谷水或营养液栽培系统。本发明的化合物可以注射入植物或用电动喷洒工艺喷洒在蔬菜上或其他低容量方法。
本文所用的“术语”“植物”包括籽苗、灌木和树木,此外,本发明的杀菌方法,包括了预防性的防护剂、预防剂和根除处理方法。
化合物优选地是以组合物形式用于农业和园艺,在任何情况下所用组合物的类型取决于特定的预计用途。
组合物是以含有活性成分(本发明化合物)和固体稀释剂或载体的可粉化的粉末或颗粒形式,载体包括,填充物如高岭土、膨润土、硅藻土、白云石、碳酸钙、滑石、粉末镁土、填充土、石膏、硅藻土(diatomceousearth)和陶土。这些颗粒是无需进一步处理的适合于施用于土壤的预成型颗粒。这些颗粒可以通过用活性成分浸渍填充物颗粒或将活性成分和粉末填充物的混合物挤压造粒来制备。用于处理种子的组合物可以包括用于促使组合物粘附于种子的试剂(如矿物油);此外,活性组分可以用有机溶剂(如,N-甲基吡咯烷酮、丙二醇或二甲基甲酰胺)配制成适用于种子处理物。组合物也可以是含有有助于在液体中分散的增湿粉末和易于在水分散颗粒,该颗粒含有增湿或分散剂。粉末和颗粒也可以含有填充物和悬浮剂。
可乳化的浓缩液可以通过将活性组分溶解于任意地含有增湿或乳化剂的有机溶剂中,随后将混合物加入也含有增湿或乳化剂的水中来制备。适当的有机溶剂是芳烃溶剂,如烷基苯和烷基萘、酮,如环己酮和甲基环己酮,氯化烃,如氯苯和三氯乙烷,和醇,如苯甲酮、糠醇、丁醇和乙二醇醚。
大部分不溶固体的悬浮浓缩液可以由与分散剂和含有阻止固体沉积的悬浮剂进行球磨或珠研来制备。
用于喷洒的组合物可以是烟雾剂的形式,其中,制剂存贮在用推进剂,如氟代三氯甲烷或二氯二氟甲烷,的加压容器中。
本发明化合物可以以干燥状态与烟火混合物混合形成适合于在密闭空间中产生含有化合物烟的组合物。
另一方面,化合物可以以微胶囊形式使用。它们可以配制在生物降解的聚合物配方中以得到缓慢的、控制释放的活性物质。
通过包含适当的添加剂,例如,用于改善分布、粘附能力和处理表面的防雨性能的添加剂,的不同组合物能更好地适用于不同的应用。可以包含其他添加剂以改善各种配方的生物效果,这类添加剂可以是表面活性物质,其用于改善增湿和保持在表面用制剂处理以及活性物质的吸收和流动性,或另外地可以含有油基质喷洒添加剂,例如,已经发现,某些矿物油和天然植物油(如豆油和菜油)添加剂对于如葡萄霜霉病,其叶子的防护活性可以提高几倍。
本发明的化合物可以用作与肥料(例如,含氮、钾或磷的肥料)的混合物,仅把化合物被覆在肥料颗粒上的组合物是优选的。这些颗粒通常含有按重量计高达25%的化合物。从而,本发明还提供了含有肥料和通式(Ⅰ)化合物或其盐或金属配位体的肥料组合物。
可增湿粉末、可乳化浓缩液和悬浮浓缩液通常含有表面活性剂,例如,增湿剂、分散剂、乳化剂或悬浮剂,这些试剂可以是阳离子、阴离子或非离子试剂。
适当的阳离子试剂是季铵化合物,例如,十六烷基三甲基溴化铵。适当的阴离子试剂是皂剂、硫酸的脂肪单酯的盐(例如,十二烷基硫酸钠),和磺化的芳烃化合物的盐(例如,十二烷基苯磺酸钠、木素磺酸钠、钙或铵,丁基萘磺酸酯、和二异丙基和三异丙基萘磺酸钠的混合物)。
适当的非离子试剂是环氧乙烷与脂肪醇,如油醇或十六烷醇,或烷基苯酚,如辛基或壬基苯酚和辛基甲酚的缩合产物。其它非离子试剂是由长链脂肪酸和己糠醇酐衍生的部分酯、上述部分酸酯与环氧乙烷的缩合产物,和卵磷脂。适当的悬浮剂是亲水胶体(例如,聚乙烯吡咯烷酮和羧甲基纤维素钠)和膨胀粘土,例如膨润土或美国活性粘土。
用作含水分散液或乳化液的组合物通常以含有高比率活性组分的浓缩液形式提供,该浓缩液在使用前用水稀释。这些浓缩液最好能经受长期贮存,在贮存后能用水稀释以得到保持均相的含水制备物,使其能用普通喷洒设备施用。浓缩液通常可以含有按重量计高达95%,普通为10~85%,例如25~60%的活性组分。经稀释形成含水制备物后,该制备物根据所需用途可以含有变化量的活性组分,可以使用按重量计含有0.0005%或0.01%至10%活性组分的含水制备物。
本发明的组合物可以含有其它具有生物活性的化合物,例如,具有类似的或辅助的杀菌活性或具有控制植物生长、除草或杀虫活性的化合物。
可以存在于本发明组合物的杀菌化合物可以是能够对抗谷物穗(如小麦)的感染病菌,例如,壳针孢属、赤霉属和长蠕孢属SPP以及种子和土壤传播的病和葡萄的绒毛的和粉状霉和苹果粉状霉和疥藓等病菌。通过含有另一种杀菌剂,组合物可以具有比单独的通式(Ⅰ)化合物更宽的活性范围。此外,其它杀菌剂能够得到通式(Ⅰ)的化合物的杀菌活性的复合效果。可以包含在本发明组合物中的杀菌化合物的例子为四十烷基吡咯、(RS)-1-氨基丙基磷酸、(RS)-4-(4-氯代苯基)-2-苯基-2-(1H-1,2,4-三唑-1-基甲基)丁腈、(RS)-4-氯-N-(氰基(乙氧基)甲基)苯甲酰胺、(Z)-N-丁-2-烯氧甲基-2-氯-2′,6′-二乙基乙酰苯胺、1-(2-氰基-2-甲氧基亚氨基乙酰基)-3-乙基脲、1-[(2RS,4RS;2RS,4RS)-4-溴-2-(2,4-二氯苯基)四氢呋喃基]-1H-1,2,4-三唑、3-(2,4-二氯苯基)-2-(1H-1,2,4-三唑-1-基)喹唑啉-4(3H)-酮、3-氯-4-[4-甲基-2-(1H-1,2,4-三唑-1-甲基)-1,3-二氧戊环-2-基]苯基-4-氯苯基醚、4-溴-2-氰基-N,N-二甲基-6-三氟甲基苯并咪唑-1-磺酰胺、N-(2,4-二氯苯基)-2-(1H-1,2,4-三唑-1-基)硫代乙酰胺4-氯苄酯、5-乙基-5,8-二氢-8-氧(1,3)-二氧戊环并(4,5-g)喹啉-7-羧酸、α-[N-(3-氯-2,6-二甲苯基)-2-甲氧基乙酰氨基]-r-丁内酯、敌菌灵、BAS454、benalaxyl、苯菌灵、双苯三唑醇(biloxazol)、乐杀螨、双苯三唑醇(bitertanol)、灭瘟素S、磺酸丁嘧啶、丁赛特、敌菌丹、克菌丹、多菌灵、萎锈灵、氯苯硫腙、地茂散、百菌清、氯咔吡唑盐、含铜化合物,如氯氧化铜、硫酸铜和波尔多液、放线菌酮、CYmoxanil、环草胺、环呋喃联-2-吡啶二硫化物、1,1′-二氧化物、抑菌灵、二氢萘醌、苄氯三唑醇、二氯甲锌、氯硝胺、二甲吗啡、甲嘧醇、diniconazole、消螨普、灭菌灵、二噻农、环烷吗啡、十二烷胍、克瘟散、乙环唑、乙嘧醇、(Z)-N-苄基-N-([甲基(甲硫基亚乙基氨基-氧基羰基)氨基]硫代)-β-丙氨酸乙酯、氯唑灵、咪菌腈、双氯苯嘧醇、一甲肤萎灵、fenpiclonil、苯丙哌啶、丁苯吗啉、稻瘟净、异稻瘟净、氟化二苯炔、flutriatol、fluzilazole、灭菌丹、fosetyl-双平胍胺、麦穗宁、呋霜灵、顺式-四十吡咯烷、双辛胍胺、六十吡咯烷、甲羟异恶唑、抑霉唑、iprobenfos、异菌脲、稻瘟灵、春日霉素、代森锰锌、代森锰、灭锈胺、甲霜灵、methfuroxam、三甲基苯基呋喃羧酰胺、metsulfovax、丁霉菌、N-(4-甲基-6-丙-1-炔基嘧啶-2-基)-苯胺、甲胂酸铁铵、二甲基二硫代氨基甲酸镍、nitrothal-异丙基、氟苯嘧啶醇、ofurace、有机汞化合物、氧杂二酰、氧化萎锈灵、五十吡咯烷、pencycuron、pefurazoate、叶枯净、四氯苯酞、多氧霉素D、代森联、噻菌烯、米鲜安、二甲菌核利、丙酰胺、丙环唑、甲基代森锌、丙威硫、定菌磷、pyrifenox、
pyroquilon、甲氧氟吡啶、吡咯叠氮、甲基克杀螨、五氯硝基苯、链霉素、硫黄粉、叶枯酞、四氯硝基苯、tebuconazole、噻菌灵、甲基托布津、福美双、甲基立枯磷、1,1′-亚氨基=(1,8-亚辛基)缩二胍三乙酸盐、三唑二甲酮、三唑醇、丁基三唑、三唑苯噻、环吗啉、嗪胺灵、有效霉素A、vinclozolin和双代森锌。通式(Ⅰ)的化合物可以与土壤、泥土或其它生根介质混合以保护植物,以防种子传播的、土壤传播的或叶片真菌疾病。
可以包含在本发明组合物中的适当杀虫剂包括buprofezin、西维因、呋喃丹、丁硫克百威、甲氯蜱硫磷、环丙扑拉磷、异吸硫磷Ⅱ、地亚农、乐果、ethofenprox、杀螟松、fenobucarb、倍硫磷、安果、异丙威、异恶唑硫磷、久效磷、稻丰散、灭定威、丙虫磷和二甲威。
植物生长调节化合物是抑制杂草或种头生长,或选择性抑制少数不需要的植物(例如,草)生长的化合物。
与本发明化合物一起使用的合适的植物生长调节化合物的实例是3,6-二氯吡啶甲酸、1-(4-氯苯基)-4,6-二甲基-2-氧代-1,2-二氢吡啶-3-羧酸、3,6-二氯茴香酸甲酯、脱落酸、黄草灵、新燕灵、草威安、二甲基琥珀酰肼、草吡唑、dikegulac、乙烯利、fenpentezol、氟磺安、草甘膦、催热膦、羟基苄腈(例如,溴草腈)、inabenfide、isopyrimol、长链脂肪醇和酸、抑芽丹、mefeuidide、整形素(例如,氯甲丹)、paclobutrazol、苯甲基乙酸(例如,2,4-D或MCPA)、取代的苯甲酸(例如,三碘代苯甲酸)、取代的季铵和磷化合物(例如,chloromequat、氯丁苄磷、助壮素)、四氯硝基苯、植物生长激素(例如,吲哚乙酸、吲哚丁酸、萘基乙酸或萘氧基乙酸)、胞质分裂素(例如,苯并咪唑、苄基腺嘌呤、苄氨基嘌呤、二苯基脲或动力精)、赤霉素(例如,GA3、GA4或GA7)和三附体肉桂醇(triapenthenol)。
用以下实施例说明本发明。
整个实施例中,术语“醚”指的是乙醚,硫酸镁用于干燥溶液,溶液在减压下浓缩。涉及到对水敏感的中间体反应,应在氮气氛下和使用前对溶剂进行干燥。选择红外和核磁共振数据;不打算列出所有情况下的每个吸收峰。1HNMR光谱除非另有说明,用CDCl3溶液记录,全部使用如下缩写:
THF=四氢呋喃 S=单峰
DMF=N,N-二甲基甲酰胺 d=双重峰
NMR=核磁共振 t=三重峰
IR=红外 m=多重峰
m.P=熔点 b=宽峰
实施例1
本实施例说明了2-氯-4-(2′,2′-二甲基丙酰胺基)-N,N-二甲基苯甲酰胺(表1化合物NO.5)的制备。
步骤1
2-氯-4-硝基-N,N-二甲基苯甲酰胺的制备。
将2-氯-4-硝基苯甲酸(25.0g)在含有数滴DMF的亚硫酰氯(80g)中回流加热3小时,然后蒸发掉过量的亚硫酰氯,将粗的2-氯-4-硝基苯甲酰氯在0~5℃下逐滴加入到40%含水二甲胺(70ml)中。在搅拌0.5小时后,过滤出黄色结晶沉淀物,用水洗涤,经干燥得到2-氯-4-硝基-N,N-二甲基苯甲酰胺浅黄色结晶固体(24,97g,m.p.116~117℃NMR(CDCl3,90MHZ)δ:2.90(3H,s),3.20(3H,s),7.49(1H,d)8.12(1H,d),8.27(1H,m)IR(石蜡糊):3100,1640cm-1。
步骤2
4-氨基-2-氯-N,N-二甲基苯甲酰胺的制备。
将铁粉(用氢气予还原,10.0g)悬浮在乙醇(80ml)中,在强有力的搅拌下加入水(10ml)和浓盐酸(4ml)。在15分钟内,小量地加入2-氯-4-硝基-N,N-二甲基-苯甲酰胺(7.50g),随后,将混合物加热到50~60℃,搅拌5小时。用硅藻土过滤混合物,蒸发出乙醇。加入水(200ml)和浓盐酸(20ml),反应物用乙酸乙酯洗涤,用碳酸氢钠碱化至pH8,用二氯甲烷萃取。将有机萃取液干燥和蒸发,得到4-氨基-2-氯-N,N-二甲基苯甲酰胺灰色结晶固体(5.21g),经氯仿/乙酸乙酯重结晶得到灰白色结晶体(3.46g),m.p170~173℃。
NMR(CDCl3,270MHZ)δ:2.89(3H,s),3.11(3H,s),3.87(2H,bs),6.57(1H,
dd),6.67(1H,s),7.07(1H,d)。IR(液体薄膜):3440-3340,1640cm-1。
步骤3
2-氯-4-(2′,2′-二甲基-丙酰胺基)-N,N-二甲基苯甲酰胺的制备
将4-氨基-2-氯-N,N-二甲基苯甲酰胺(1.0g)和三乙胺(1.21g)溶解在二氯甲烷(20ml)中,溶液冷却至0~5℃。在保持温度低于10℃的条件下,逐滴加入2,2-二甲基丙酰氯(1.21g),生成的橙色溶液在0~10℃搅拌0.5小时。随后用含水碳酸氢钠洗涤有机溶液,随后用水洗涤,经干燥和蒸发得到橙色固体。由3∶1的乙酸乙酯∶氯仿中重结晶得到2-氯-(2′,2′-二甲基丙酰胺基)-N,N-二甲基苯甲酰胺灰白色结晶固体(1.027g),m.p.202~203℃。
NMR(CDCl3,270MHZ)δ:1.32(9H,s),2.86(3H,s),3.13(3H,s),7.16(1H,d),7.34(1H,d),7.68(1H,s),7.72(1H,bs)。IR(石蜡糊):3340,1690,1630cm-1。
实施例2
本实施例说明2-氯-4-(2′-甲基丙酰胺基)-N,N-二乙基苯甲酰胺(表1化合物NO.1)的制备。
步骤1
2-氯-4-(2′-甲基丙酰胺基)苯甲酸的制备。
将4-氨基-2-氯苯甲酸在水(60ml)和1,2-二甲氧基乙烷(25ml)中与碳酸氢钠(5.04g)一起搅拌,将棕色悬浮液冷至0~5℃。在10分钟内,在强力的搅拌下逐滴加入2-甲基丙酰氯(4.26g),然后将混合物在0~10℃下搅拌2小时。将混合物倒入2M盐酸中,浅棕色沉淀物用水洗涤经过滤和干燥得到的2-氯-4-(2′-甲基丙酰胺基)苯甲酸浅棕色经晶固体(6.30g),m.p:206~209℃。
NMR(d6-DMSO,270MHZ)δ:1.05(6H,d),2.53(1H,七重峰),7.51(1H,dd),7.78(1H,d),7.86(1H,s),10.19(1H,s),14-12(1H,很宽单峰)。IR(石蜡糊):3320,1705,1670cm-1。
步骤2
2-氯-4-(2′-甲基丙酰胺基)-苯甲酰氯的制备。
将在无水THF(5ml)中的草酰氯(0.63g)在室温下,在5分钟内逐滴加入在无水THF(5ml)中的2-氯-4-(2′-甲基丙酰胺基)苯甲酸(1.0g)中。滴加完成后,加入无水DMF(1滴),引起强烈的沸腾和略微的温度上升。搅拌4小时后,再加入1滴DMF,蒸发出THF得到2-氯-4-(2′-甲基丙酰胺基)苯甲酰氯粘稠的标色胶体,它无需进一步提纯即可使用。IR(液体薄膜):3320,3260,3160,3070,1780,1710,1680,cm-1。
步骤3
2-氯-4-(2′-甲基丙酰胺基)-N,N-二乙基苯甲酰胺的制备。
将上述反应得到的在无水THF(10ml)中的粗的2-氯-4-(2′-甲基丙酰胺基)苯甲酰氯在0~5℃下,在搅拌下于10~15分钟内滴加在无水THF(10ml)的二乙胺(1.46g)溶液中。在0~10℃下搅拌后,反应混合物在室温下静置过夜,随后倒入凉水中,用乙酸乙酯萃取。将萃取液干燥和蒸发后得到粘稠胶体,胶体经缓慢结晶,随后在乙酸乙酯中重结晶得到2-氯-4-(2′-甲基丙酰胺基)-N,N-二乙基苯甲酰胺的白色结晶体(0.507g)
NMR(CDCl3,270MHZ)δ:1.04(3H,t),1.21(6H,d),1.26(3H,t),2.58(1H,七重峰),3.15(2H,q),3.39(1H,bm),3.74(1H,bm),7.04(1H,d),7.30(1H,dd),7.51(1H,s),8.58(1H,bs),IR石蜡糊):3300,3250,3165,1685cm-1。
实施例3
本实施例说明1-[3′-氯-4′-(N,N-二甲基氨基甲酰基)苯基]-3,3-二甲基氮杂环丁-2-酮(表1化合物NO.11)的制备。
步骤1
2-氯-4-(3′-氯-2′,2′-二甲基丙酰胺基)N,N-二甲基苯甲酰胺的制备。
在保持温度低于10℃的条件下,将3-氯-2,2-二甲基丙酰氯(1.86g),于5分钟内,搅拌下,逐滴加入悬浮在无水二氯甲烷(40ml)和无水三乙胺(1.21g)中的4-氨基-2-氯-N,N-二甲基苯甲酰胺(2.00g)中。搅拌1小时后,升
至室温,加入二氯甲烷(40ml),溶液依次用2M盐酸、饱和含水碳酸氢钠和饱和盐水洗涤。随后将溶液干燥和蒸发,得到粘性黄色固体,该固体在乙酸乙酯/氯仿中重结晶后,得到2-氯-4-(3′-氯-2′,2′-二甲基丙酰胺基)-N,N-二甲基苯甲酰胺白色结晶固体(2.349g),m.p.179-181℃NMR(CDCl3,270MHZ)δ:1.42(6H,s),2.86(3H,s),3.14(3H,s),3.73(2H,s),7.06(1H,d)7.26(1H,dd),7.50(1H,s),8.48(1H,bs),IR(石蜡糊):3310,1670,1620cm-1。
步骤2
1-[3′-氯-4′-(N,N-二甲基氨甲酰基)苯基]-3,3-二甲基氮杂环丁-2-酮。
将氢氧化钠(4.00g)和溴化四丁铵(0.10g)的水溶液(10ml)添加到2-氯-4-(3′-氯-2′,2′-二甲基丙酰胺基)-N,N-二甲基苯甲酰胺(1g)在二氯甲烷(10ml)中的悬浮液中,然后,在室温下搅拌两相系统一小时。再加入水(10ml)和二氯甲烷(10ml),并用盐水洗涤全部二氯甲烷层,经干燥、蒸发后,得到浅黄色固体。将其从乙酸乙酯/己烷中重结晶后,得到1-[3′-氯-4′-(N,N-二甲基氨甲酰基)苯基]-3,3-二甲基氮杂环丁-2-酮白色结晶固体(0.516g),m.p.122~123℃。
NMR(CDCl3,270MHZ)δ:1.42(6H,s),2.87(3H,s),3.13(3H,s),3.46(2H,s),7.27(2H,t),7.39(1H,s)。
IR(石蜡糊):3600~3100,1740,1625cm-1。
实施例4
本实施例说明了2-甲氧基-4-(2′,2′-二甲基丙酰胺基)-N,N-二甲基苯甲酰胺的制备(表Ⅱ中的NO.1化合物)。
步骤1
2-甲氧基-4-(2′,2′-二甲基丙酰胺基)-苯甲酸甲酯的制备。
将2-甲氧基-4-氨基苯甲酸甲酯(3.03g)和三乙胺(1.83g),在0~5℃下,于无水二氯甲烷(50ml)中搅拌。向此溶液中滴加2,2-二甲基丙酰氯(6.07g)在无水二氯甲烷(10ml)中的溶液。添加完成后,搅拌混合物,并在室温下过夜,而后,倾入稀盐酸中。分离出有机层,用稀碳酸氢钠水溶液洗涤,再用水洗涤,经干燥和蒸发后得到结晶的油。与己烷一起加热后,过滤产物,得到白色固体(3.61g)。
NMR(CDCl3,270MHz)δ:1.33(9H,s),3.86(3H,s),3.94(3H,s),6.79(1H,dd),7.45(1H,s),7.79(1H,d),7.82(1H,d。
步骤2
2-甲氧基-4-(2′,2′-二甲基丙酰胺基)-苯甲酸的制备。
将2-甲氧基-4-(2′,2′-二甲基丙酰胺基)-苯甲酸甲酯(2.98g)与在甲醇(50ml)中的氢氧化钾(0.725g)在室温下一起搅拌3小时,然后,回流8小时,再倾入水中,混合物用乙酸乙酯萃取,而后用盐酸酸化,酸化部分用乙酸乙酯萃取,萃取物经干燥、蒸发后得到固体产物(1.24g)。
NMR(CDCl3,270MHz)δ:1.36(9H,s),4.10(3H,s),6.78(1H,dd),8.10(2H,m),10.61(1H,s)
步骤3
2-甲氧基-4-(2′,2′-二甲基丙酰胺基)-苯甲酰氯的制备。
向在无水乙醚(25ml)中不断搅拌着的2-甲氧基-4-(2′,2′-二甲基丙酰胺基)-苯甲酸(1.04g)中,在室温下,滴加带有微量DMF的乙二酰氯(1.4g)无水乙醚溶液(5ml)。添加完成后,将混合物搅拌4小时,并放置过夜。加入一些二氯甲烷,蒸发混合物得到酰基氯黄色固体(1.12g)。
步骤4
2-甲氧基-4-(2′,2′-二甲基丙酰胺基)-N,N-二甲基苯甲酰胺的制备。
将无水THF(10ml)中的2-甲氧基-4-(2′,2′-二甲基丙酰胺基)-苯甲酰氯(1.12g)溶液在30分钟内,0~5℃下,滴加到二甲胺(1.17g的40%含水溶液)在THF(15ml)的搅拌液中。添加完后,该溶液在5~10℃下搅拌一小时,在室温下放置过夜,倾入水中,并用乙酸乙酯萃取。萃取物经干燥、蒸发后,得到黄色固体产物(0.889g)m.p.143~144℃。
NMR(CDCl3,270MHz)δ:1.33(9H,
s),2.85(3H,s),3.11(3H,s),6.75(1H,dd)7.15(1H,d),7.48(1H,s),7.65(1H,d)。
实施例5
本实施例说明了2-三氟甲基-4-(2′,2′-二甲基丙酰胺基)-N,N-二甲基苯甲酰胺的制备(表Ⅱ中的NO.7化合物)。
步骤1
2-三氟甲基-4-(2′,2′-二甲基丙酰胺基)-苯基氰的制备。
在0~5℃下,将2,2-二甲基丙酰氯(3.79g)的无水二氯甲烷(5ml)中的溶液,缓慢地滴加到4-氰基-3-三氟甲基苯胺(3.02g)和三乙胺(3.34g)在无水二氯甲烷(50ml)中的溶液中。添加完后,在室温下搅拌混合物1.5小时,然后,例入稀盐酸中。用稀的碳酸氢钠水溶液洗涤有机馏分,继而用水洗涤,最后经干燥和蒸发,得到橙色固体。将该固体重结晶后,得到黄色粉末产物。
NMR(CDCl3,270MHz)δ:1.35(9H,s),7.61(1H,s),7.78(1H,d),7.93(1H,dd),8.03(1H,d)。
步骤2
2-三氟甲基-4-(2′,2′-二甲基丙酰胺基)苯甲酰胺的制备。
将过氧化氢(85ml的30%水溶液)和氢氧化钠(8.5ml的20%水溶液)加到2-三氟甲基-4-(2′,2′-二甲基丙酰胺基)苯基氰(5.03g)的乙醇(140ml)溶液中,并且在室温下搅拌反应混合物5天,在此期间另加入乙醇(100ml)。随后,反应物在50℃下加热24小时后,倒入水中,并用乙酸乙酯萃取。有机层经干燥、蒸发,得到油状物,将其在硅胶上进行闪蒸色谱分离,得到所需产物(2.89g)。
NMR(CDCl3,270MHz)δ:1.35(9H,s),5.80(2H,bs),7.54(1H,s),7.59(1H,d,7.82(1H,dd),7.90(1H,d)。
步骤3
2-三氟甲基-4-(2′,2′-二甲基丙酰胺基)苯甲酸的制备。
在-5~0℃下,将浓盐酸(15ml)加到2-三氟甲基-4-(2′,2′-二甲基丙酰胺基)苯甲酰胺(2.35g)的冰醋酸(35ml)液体中。然后,将亚硝酸钠(1.807g)在水(10ml)中的溶液滴加到混合物中,并在-5~0℃下搅拌1小时。加热到室温后,搅拌反应物24小时,倒入水中并用二氯甲烷萃取。用稀的氢氧化钠水溶液洗涤二氯甲烷部分,再用稀盐酸酸化碱层。用二氯甲烷萃取酸化层,有机层经干燥、蒸发得到需要的酸(白色固体(0.926g)。
NMR(CDCl3,270MHz)δ:1.0(9H,s),7.79(1H,d),8.0(1H,dd),8.19(1H,d),9.69(1H,s)。
步骤4
2-三氟甲基-4-(2′,2′-二甲基丙酰胺基)-N,N-二甲基苯甲酰胺的制备。
在室温下,将草酰氯(0.64g)的无水乙醚溶液(7ml)在不断搅拌下,滴加到2-三氟甲基-4-(2′,2′-二甲基丙酰胺基)-苯甲酸(0.926g)的无水乙醚液(40ml)中。在添加中滴入一滴DMF溶液。2小时后,再加入草酰氯(0.257g),进一步搅拌反应物2小时。然后,从沉淀物中倾析出有机溶液,经蒸发,得到2-三氟甲基-4-(2′,2′-二甲基丙酰胺基)-苯甲酰氯(液体)(1.136g),该产物不用提纯即可使用。
将酰基氯(1.136g)的无水THF(10ml)溶液在不断搅拌下,于30分钟内,0~5℃下滴加到二甲胺(1.0g的40%水溶液)的THF(15ml)溶液中。使反应升至室温并静置2 1/2 天,然后倾入水中,并用乙酸乙酯萃取。用碳酸氢钠水溶液洗涤乙酸乙酯部分,接着用稀盐酸,再用水洗涤。干燥后,蒸发有机溶液,得到2-三氟甲基-4-(2′,2′-二甲基丙酰胺基)-N,N-二甲基苯甲酰胺白色固体(0.576g),m.p.198.7~199.6℃。
NMR(CDCl3,270MHz)δ:1.35(9H,s),2.80(3H,s),3.12(3H,s),7.22(1H,d),7.72(1H,s),7.75(1H,dd),7.85(1H,d。
实施例6
本实施例说明了2,3,5,6-四氟-4-(2′,2′-二甲基丙酰胺基)-N,N-二甲基苯甲酰胺的制备(表Ⅱ中的NO.6化合物)。
步骤1
2,3,5,6-四氟-4-(2′,2′-二甲基丙酰胺
基)-苯甲酸甲酯的制备。
在室温下,将2,3,5,6-四氟-4-氨基苯甲酸甲酯(1.887g)的无水THF(5ml)溶液加入氢氧化钠(0.764g的55%油中分散液)在无水THF(70ml)中的搅拌的悬浮液中。在泡腾完全后,在冷却条件下,缓慢地滴加2,2-二甲基丙酰氯(1.127g)的无水THF(5ml)溶液。反应物在10℃下搅拌1小时,然后,倒入水中,并用乙酸乙酯萃取。乙酸乙酯部分用稀盐酸和稀碳酸氢钠水溶液洗涤,干燥和蒸发后,得到白色固体产物(2.44g)。
NMR(CDCl3,270MHz)δ:1.36(9H,s),3.97(3H,s),7.05(1H,s)。
步骤2
2,3,5,6-四氟-4-(2′,2′-二甲基丙酰胺基)-苯甲酸的制备。
2,3,5,6-四氟-4-(2′,2′-二甲基丙酰胺基)-苯甲酸甲酯(1.83g)与氢氧化钾(0.669g),溶解在微量水中)在二甲氧基乙烷(DME)(60ml)中一起搅拌,过夜,然后倒入水中。混合物用乙酸乙酯萃取。将水相酸化,并用乙酸乙酯萃取,将乙酸乙酯萃取物干燥、蒸发后,得到酸,它是浅黄色固体(1.538g)。
NMR(CDCl3,270MHz)δ:1.19(9H,s),9.65(1H,s)。
步骤3
2,3,5,6-四氟-4-(2′,2′-二甲基丙酰胺基)-N,N-二甲基苯甲酰胺的制备。
在不断搅拌下,将乙二酰氯(1.00g)的无水乙醚(5ml)溶液滴加入2,3,5,6-四氟-4-(2′,2′-二甲基丙酰胺基)-苯甲酸(1.47g)的无水乙醚(35ml)溶液中,并向其中加入1滴DMF。在室温下,搅拌2小时后,醚溶液从不溶物质倾析出来,并且蒸发得到酰基氯油状物(1.494g),该产物不用提纯即可使用。
在0~5℃下,将酰基氯(1.494g)的无水THF(10ml)溶液于30分钟内,缓慢地滴加到二甲胺(1.363g)的THF(10ml)溶液中。在10℃下,搅拌1.5小时后,反应混合物倾入到水中,并用乙酸乙醇萃取。用碳酸氢钠水溶液洗涤萃取物,然后用稀盐酸洗涤,经干燥和蒸发,得到白色粉末状固体产物(1.279g),m.p.187~189℃。
NMR(CDCl3,270MHz)δ:1.35(9H,s),2.97(3H,s),3.17(3H,s),7.82(1H,s)。
实施例7
本实施例说明了2-氯-4-(2′-氯-2′-甲基丙酰胺基)-N,N-二甲基苯甲酰胺的制备(表Ⅰ的化合物NO.38)。
将在乙腈(5ml)中的四氟硼酸银(0.60g)加到2-氯-4-(2′-溴-2′-甲基丙酰胺基)-N,N-二甲基苯甲酰胺(1.065g)的乙腈(150ml)溶液中,反应混合物在氮气中,避光条件下,搅拌6.5小时。加入乙酸乙酯,并用硅藻土过滤溶液,而后蒸发。将残余物再次溶解在乙酸乙酯中,并用硅藻土过滤。蒸发。残余物用HPLC(洗脱液二氯甲烷∶乙腈,2∶1)提纯,得到白色结晶状固体产物(0.319g),m.p.125~128℃。
NMR(CDCl3,270MHz)δ:1.67(6H,d),2.87(3H,s),3.13(3H,s),7.27(1H,d),7.45(1H,dd),7.80(1H,d),8.18(1H,d)。
实施例8
本实施例说明了2-氯-4-(3′-氟-2′,2′-二甲基丙酰胺基)-N,N-二甲基苯甲酰胺的制备(表Ⅰ的化合物42)。
步骤1
2-氯-4-(3′-乙酸基-2′,2-二甲基丙酰胺基)-N,N-二甲基苯甲酰胺的制备。
在0~5℃下,将3-乙酸基-2,2-二甲基丙酰氯(7.84g)加到4-氨基-2-氯-N,N-二甲基苯甲酰胺(5.88g)和三乙胺(5.99g)在无水二氯甲烷(15ml)中的搅拌溶液中。在搅拌30分钟后,反应混合物用稀的碳酸氢钠水溶液、稀氢氧化钠、稀盐酸洗涤,而后用水洗涤。有机层经干燥、蒸发后得到橙色固体,它用己烷研制后得到需要的产物(9.08g),m.p.117~120℃。
NMR(CDCl3,270MHz)δ:1.33(6H,s),2.10(3H,s),2.86(3H,s),3.13(3H,s),4.20(2H,s),7.11(1H,d),7.29(1H,dd),7.60(1H,d),8.21(1H,s)。
IR(石蜡糊):1740,1680,1630cm-1
步骤2
2-氯-4-(3′-羟基-2′,2′-二甲基丙酰胺
基)-N,N-二甲基苯甲酰胺的制备。
在室温下,将2-氯-4-(3′-乙酸基-2′,2′-二甲基丙酰胺基)-N,N-二甲基苯甲酰胺(8.14g)在含有氢氧化钾(2.68g)的甲醇(100ml)中搅拌2小时。蒸发出甲醇,残余物用乙酸乙酯萃取。干燥乙酸乙酯,并蒸发得到所需的产物(5.03g),m.p.137~139℃。
NMR(CDCl3,270MHz)δ:1.17(6H,s),2.89(3H,s)3.15(3H,s),3.56(3H,d),5.12(1H,t),7.17(1H,d),7.30(1H,dd,7.69(1H,d),9.49(1H,s)
步骤3
2-氯-4-(3′-氟-2′,2′-二甲基丙酰胺基)-N,N-二甲基苯甲酰胺的制备。
在-70℃下,将2-氯-4-(3′-羟基-2′,2′-二甲基丙酰胺基-N,N-二甲基苯甲酰胺(1.008g)的无水二氯甲烷(40ml)的溶液,在3小时内滴加到二乙氨基硫三氟化物(DAST)(0.68g)的无水二氯甲烷(20ml)的溶液中。在半小时后,再加入一定量的DAST(0.128g),并在-70℃下,将溶液搅拌1/2小时,而后,加热到室温过夜。用水洗涤反应混合物,干燥和蒸发得到泡沫产物。再用乙烷研制后得到所需的产物(浅橙色粉末)(0.269g),m.p.152-4℃。
NMR(CDCl3,270MHz)δ:1.32(6H,d),2.86(3H,s),3.12(3H,s),4.48(2H,d),7.23(1H,d),7.39(1H,dd),7.75(1H,d),7.77(1H,s)。
实施例9
本实施例说明了2-氯-4-(3′-甲氧基-2′,2′-二甲基丙酰胺基)-N,N-二甲基苯甲酰胺的制备(表Ⅰ的化合物40)。
在0℃下,将氧化钡(2.608g)和氢氧化钡(0.540g)加到2-氯-4-(3′-羟基-2′,2′-二甲基丙酰胺基)-N,N-二甲基苯甲酰胺(0.510g)的DMF(20ml)的溶液中。在0℃下,搅拌15分钟后,滴加甲基碘(3.64g)。在2小时内使之升到室温后,将二氯甲烷加入到反应物中,然后,用硅藻土过滤混合物,有机部分经干燥、蒸发,得到流动的液体,将其用HPLC提纯(洗脱液∶乙酸乙酯)后,得到所需的固体产物(0.101g),m.p.101~103℃。
NMR(CDCl3,270MHz)δ:1.24(6H,s),2.86(3H,s),3.12(3H,s),3.43(2H,s)3.51(3H,s)7.21(1H,d),7.39(1H,dd),7.75(1H,d),9.05(1H,s)。
实施例10
本实施例说明了2-氯-4-(2′,2′-二甲基-硫代丙酰胺基)-N,N-二甲基-硫代-苯甲酰胺和2-氯-4-(2′,2′-二甲基丙酰胺)-N,N-二甲基-硫代苯甲酰胺的制备(分别为表Ⅲ中的化合物3和1)。
在室温下,将2-氯-4-(2′,2′-二甲基丙酰胺基-N,N-二甲基苯甲酰胺(1.00g)悬浮在无水甲苯(10ml)中,并且在5分钟内,分小批加入Lawesson试剂(0.73g)。将悬浮液回流1小时后,得到清沏的溶液,然后,蒸发出甲苯,得到粘性胶体,将其在硅胶上进行色谱分离(洗脱液:二氯甲烷),最后得到二种产物:
1.2-氯-4-(2′.2′-二甲基硫代丙酰胺基)-N,N-二甲基-硫代苯甲酰胺(0.104g),m.p.154~156℃。
NMR(CDCl3,270MHz)δ:1.47(9H,s),3.14(3H,s),3.60(3H,s),7.29(1H,d),7.52(1H,dd),7.82(1H,s),8.85(1H,bs)。
2.2-氯-4-(2′,2′-二甲基丙酰胺基)-N,N-二甲基-硫代苯甲酰胺(0.475g),m.p.164~167℃。
NMR(CDCl3,270MHz)δ:1.31(9H,s),3.11(3H,s),3.58(3H,s),7.25(1H,d),7.33(1H,dd),7.38(1H,bs),7.47(1H,s)。
实施例11
本实施例说明了2-氯-4-(2′,2′-二甲基-硫代丙酰胺基)-N,N-二甲基苯甲酰胺的制备(表3的化合物2)。
步骤11
2-氯-4-N,N-二甲基氨甲酰基苯基异硫氰酸酯的制备。
在室温下,将二氯硫化碳(1.15g)在3分钟内滴加到悬浮在水中的搅拌的碳酸氢钠(1.68g)溶液中。然后,在20分钟内,将4-氨基-2-氯-N,N-二甲基苯甲酰胺(1.00g)分批加入上述
溶液中,温度保持在20~25℃。在15分钟后,用二氯甲烷萃取褐色的悬浮液,有机层经干燥、蒸发,得到橙-黄色固体的所需产物(1.18g),它不用进一步提纯即可使用。
NMR(CDCl3,270MHz)δ:2.86(3H,s),3.13(3H,s),7.17(1H,dd),7.26(1H,s),7.28(1H,d)。
IR(石蜡糊):2140-2080(bs),1630cm-1。
步骤2
2-氯-4-(2′,2′-二甲基-硫代丙酰胺基)-N,N-二甲基苯甲酰胺的制备。
在氮气中,-70℃条件下,将叔丁基锂(3.2ml的1.7M的戊烷溶液)在20分钟内,加入3-氯-4-N,N-二甲基氨甲酰基苯基异硫氰酸酯(1.17g)的THF搅拌溶液中。在同一温度下搅拌20分钟后,小心地加入水,接着加入浓盐酸。混合物用二氯甲烷萃取,然后,干燥、蒸发,得到粘性褐色固体(1.23g)。用HPLC(洗脱液:乙酸乙酯)提纯,得到黄色胶体(0.099g)。用乙醚/甲苯研制后得到所需黄色固体产物,m.p.120℃(分解)。
NMR(CDCl3,270MHz)δ:1.66(9H,s),2.88(3H,s),3.14(3H,s),7.25(1H,d),7.45(1H,dd),7.64(1H,d),8.82(1H,bs)。
实施例12
本实施例说明了2-氯-4-(2′,2′-二甲基戊-4′-炔酰氨基)-N,N-二甲基-苯甲酰胺(表Ⅰ化合物66)的制备。
步骤1
2,2-二甲基戊-4-炔酸乙酯的制备。
在氮气中并将温度保持在-60℃以下的条件下,将二异丙基氨基化锂(13.7ml在环己烷中的单一THF配合物的1.5M溶液)在20分钟内,滴加到异丁酸乙酯(2.38g)的无水THF(10ml)溶液中。1小时后,向其中滴加炔丙基溴(2.45g)的无水THF(5ml)溶液,同时保持温度低于-60℃。在2小时之内,使反应物升至室温。然后,倾入水中并用乙酸乙酯萃取,乙酸乙酯部分经干燥、蒸发,得到橙褐色液体,将其蒸馏后(Kugelrohr,115℃/60mm)得到所需产物(1.39g)。
NMR(CDCl3,270MHz)δ:1.19(3H,t),1.21(6H,s),1.93(1H,t),2.38(2H,d),4.08(2H,q)。
步骤2
2,2-二甲基戊-4-炔酸的制备
在40℃下,将2,2-二甲基戊-4-炔酸乙酯(1.39g)与氢氧化钾(1.07g)在甲醇(20ml)中一起搅拌7 1/2 小时。而后,放置过夜。将反应物倒入水中,并用乙酸乙酯洗涤。将水层酸化后,用乙酸乙酯萃取。然后干燥、蒸发,得到所需的酸(液体)(1.05g)。
NMR(CDCl3,270MHz)δ:1.32(6H,s),2.04(1H,t),2.47(2H,d)。
IR(液膜):3300,3000~2500,1720cm-1。
步骤3
2-氯-4-(2′,2′-二甲基-戊-4-炔酰氨基)-N,N-二甲基苯甲酰胺的制备。
在室温下,不断搅拌2,2-二甲基戊-4-炔酸在乙醚(15ml)中的溶液,同时加入草酰氯(1.53g)的无水乙醚(5ml)溶液,并不断地加以搅拌。添加完毕后,将混合物搅拌1/2小时。
倾析混合物并蒸发掉醚后,得到浅色液体的酰基氯(0.417g),它不用进一步提纯即可使用。
在0-5℃下,向4-氨基-2-氯-N,N-二甲基苯甲酰胺(0.524g)和三乙胺(0.534g)的二氯甲烷搅拌液中加入2,2-二甲基戊-4-炔羧酸氯化物(0.417g)。在搅拌1 1/2 小时后,反应混合物用稀盐酸、碳酸氢钠水溶液和水洗涤。二氯甲烷溶液经干燥和蒸发后,得到泡沫产物,将其结晶,得到浅橙色固体产物(0.606g),m.p.154~5℃。
NMR(CDCl3,270MHz)δ:1.40(6H,s),2.17(1H,t),2.52(2H,d),2.87(3H,s),3.13(3H,s),7.05(1H,d),7.33(1H,dd,7.64(1H,d)。
以下是用于农业和园艺方面的用本发明化合物进行配制而得到的组合物的实施例。这些组合物构成本发明的另一方面。百分数均为按重量计。
实施例13
通过混合和搅拌以下组分使之全部溶解来制备可乳化的浓缩物。
表1化合物NO.1 10%
苄醇 30%
十二烷基苯磺酸钙 5%
壬基酚乙氧基化物(13mole环氧乙烷) 10%
烷基苯 45%
实施例14
将活性组分溶解在二氯甲烷中,并把得到的液体喷洒在硅镁白土上,然后,蒸发出溶剂得到粒状组合物。
表1化合物NO.2 5%
硅镁白土颗粒 95%
实施例15
通过研磨和混合以下三种组分来制备用于种子包层的组合物。
表1化合物NO.3 50%
矿物油 2%
陶土 48%
实施例16
通过将以下活性组分与滑石研磨和混合来制备可粉化的组合物。
表1化合物NO.4 5%
滑石 95%
实施例17
通过球磨以下组分,与水形成研碎的混合物的含水悬浮液来制备悬浮浓缩液。
表1化合物NO.5 40%
木素磺酸钠 10%
膨润土 1%
水 49%
该配制物可以稀释到水中后喷洒,或直接施用于种子。
实施例18
通过混合和研磨以下组分,直到它们完全混合来制备可湿粉配制物。
表1化合物NO.6 25%
十二烷基硫酸钠 2%
木素磺酸钠 5%
二氧化硅 25%
陶土 43%
实施例19
化合物用于试验抵抗植物的各种叶片霉菌病,其实验的技术如下。
将植物生长在装有John Innes的混料(NO.1或2)的直径4cm的小钵中。试验化合物可通过与含水Dispersol T研磨进行配制,或作为丙酮或丙酮/乙醇溶液配制,它们在使用前直接稀释至所需浓度。对于叶片病可将配制物(100ppm活性组分)喷洒在叶子上,和施用于土壤中的植物根部。喷洒至使之含有最大的保持量,并且,在干燥土壤中,根部浸透的最终浓度约为40ppma.i。若对谷类进行喷洒,施用Tween20的最终浓度为0.05%。
对于大多数试验,植物在与病菌接种前1或2天将化合物施用于土壤(根部)和叶子上。而对麦类白粉病的试验是个例外,它在处理前24小时进行作物的接种。通过喷洒把叶片病菌以孢子悬浮在试验植物的叶子上。为了评价效果,在接种后,把植物置于适当环境中,使其感染,直到发展成病菌。根据病菌和环境,接种和评价之间的周期可以在4到14天之间。
由以下分级记录病菌的对照值:
4=无病菌
3=痕量-5%的病菌在未处理的植物上
2=6~25%的病菌在未处理的植物上
1=26~59%的病菌在未处理的植物上
0=60~100%的病菌在未处理的植物上
其结果示于表Ⅳ、Ⅴ和Ⅵ上。(表见文后)
Claims (3)
1、一种杀菌组合物,它含有杀菌有效量的活性成分和杀菌可接受的载体或稀释剂,其中所述的活性成分是下述式(Ⅰ)的化合物:
其中A和B独立地表示H、氟、氯、溴、C1-4烷基、C1-4烷氧基或卤代(C1-4)烷基,其前提是它们两者不同时是H;D和E独立地表示H或氟;R1是C1-4烷基;R2是C1-4烷基,或C1-4烷氧基、或R1和R2与氮原子一起相接形成吗啉、哌啶、吡咯烷或氮杂环丁烷环,并且环上可以任意被C1-4烷基取代;R3是H;R4是三氯甲基、C2-8烷基(可以任意地用卤素、C1-8烷氧基或R′S(O)n取代,其中R′是C1-4烷基,并且n是0、1或2)、环丙基(可任意地用卤素或C1-4烷基取代)、C2-8链烯基、C2-8炔基、C2-8烷氧基、单或双(C1-4)烷氨基或基团R″ON=C(CN),其中R″是C1-4烷基,或R3和R4与基团C(O)N一起相连形成氮杂环丁-2-酮环,它可任意地用卤素或C1-4烷基取代;而X和Y独立地表示氧或硫。
2、制备权利要求1的组合物的方法,包括将杀菌有效量的式(Ⅰ)化合物与一种杀菌可接受的载体或稀释剂混合。
3、根据权利要求2的方法,其中制备作为活性成分的式(Ⅰ)化合物的方法包括:
a)当X和Y均是氧而R3是氢时
ⅰ)将如下通式(Ⅵ)化合物与酰基氯R4COCl在合适的有机溶剂中,在碱存在下进行反应;
ⅱ)将如下通式(Ⅸ)的化合物与胺R1R2NH,在合适的有机溶剂中,在碱或过量的R1R2NH存在下进行反应;或
b)当X和Y均是氧,而R3和R4与基团C(O)N一起形成下式环时
ⅰ)在由有机溶剂和水组成的两相系统中,在相转移催化剂存在下,用碱处理如下通式(Ⅹ)的化合物:
C)当X和Y均是氧,R3是H和R4是如下基团时
ⅰ)通过在合适的溶剂中,用氟转移试剂处理如下通式(ⅩⅦ)的化合物;
d)当X和Y均是氧,R3是氢和R4是如下基团时
ⅰ)通过在合适的溶剂中用氟化剂处理通式(ⅩⅨ)的化合物;或
ⅱ)用如下通式(Ⅵ)的化合物与通式(ⅩⅩⅩⅤ)的酰基氯,在合适的溶剂中,在碱存在下进行反应;
e)当X是氧或硫,Y是硫而R3是氢时,
ⅰ)在合适的溶剂中,用硫化剂处理如下通式(Ⅱ)的化合物,可生成通式(Ⅰ)的化合物(其中X是氧。Y是硫而R3是氢),也可生成通式(Ⅰ)的化合物(其中X是氧,Y是硫而R3是氢)和通式(Ⅰ)化合物(其中X和Y均是硫,而R3是氢)的混合物;
f)当X是硫,Y是氧,R3是H时,
ⅰ)用如下通式(ⅩⅩⅢ)的异硫氰酸酯与有机金属试剂R4Li或R4Mghal,在合适的溶剂中,在-78℃和+25℃之间进行反应;
g)当X和Y均是氧,R3是氢和R4是如下基团时,
ⅰ)用如下通式(ⅩⅨ)的化合物与卤化物R11-hal,在碱的存在下,在合适的溶剂中反应;
以上各式其中A、B、D、E、R1、R2和R4如权利要求1中所定义(除非另有说明),R5和R6是H、C1-4烷基或卤素、R8和R9是氢、C1-4烷基或C1-4卤代烷基、R11是C1-4烷基,X′是氯、溴或碘、hal是卤素,而L是离去基团。
Applications Claiming Priority (4)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| GB898902323A GB8902323D0 (en) | 1989-02-02 | 1989-02-02 | Fungicides |
| GB8902323.8 | 1989-02-02 | ||
| GB8923366.2 | 1989-10-17 | ||
| GB898923366A GB8923366D0 (en) | 1989-10-17 | 1989-10-17 | Fungicides |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| CN1046523A CN1046523A (zh) | 1990-10-31 |
| CN1024004C true CN1024004C (zh) | 1994-03-16 |
Family
ID=26294905
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN90100999A Expired - Fee Related CN1024004C (zh) | 1989-02-02 | 1990-02-02 | 杀菌剂 |
Country Status (23)
| Country | Link |
|---|---|
| US (2) | US4999381A (zh) |
| EP (1) | EP0381330B1 (zh) |
| JP (1) | JP2688530B2 (zh) |
| KR (1) | KR0145295B1 (zh) |
| CN (1) | CN1024004C (zh) |
| AP (1) | AP123A (zh) |
| AR (1) | AR246734A1 (zh) |
| AU (1) | AU617238B2 (zh) |
| BR (1) | BR9000477A (zh) |
| CA (1) | CA2008291A1 (zh) |
| DE (1) | DE69005466T2 (zh) |
| EG (1) | EG19119A (zh) |
| ES (1) | ES2062320T3 (zh) |
| GB (1) | GB9002370D0 (zh) |
| HU (1) | HU206191B (zh) |
| IE (1) | IE62559B1 (zh) |
| IL (1) | IL93076A (zh) |
| LV (1) | LV10084B (zh) |
| MY (1) | MY106000A (zh) |
| NZ (1) | NZ232127A (zh) |
| PL (2) | PL163155B1 (zh) |
| PT (1) | PT93030B (zh) |
| SK (1) | SK278842B6 (zh) |
Families Citing this family (32)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| IE62559B1 (en) * | 1989-02-02 | 1995-02-08 | Ici Plc | Fungicides |
| GB9016580D0 (en) * | 1990-07-27 | 1990-09-12 | Ici Plc | Fungicides |
| GB9016582D0 (en) * | 1990-07-27 | 1990-09-12 | Ici Plc | Fungicides |
| GB9016581D0 (en) * | 1990-07-27 | 1990-09-12 | Ici Plc | Fungicides |
| GB9016578D0 (en) * | 1990-07-27 | 1990-09-12 | Ici Plc | Fungicides |
| DE69109953T2 (de) * | 1990-07-27 | 1995-09-21 | Zeneca Ltd | Alfa-fluorocarbonsäurederivate als Zwischenprodukte zur Herstellung von Fungiziden. |
| US5662898A (en) * | 1990-08-20 | 1997-09-02 | Ciba-Geigy Corporation | Genes for the synthesis of antipathogenic substances |
| US5639949A (en) * | 1990-08-20 | 1997-06-17 | Ciba-Geigy Corporation | Genes for the synthesis of antipathogenic substances |
| CA2119155C (en) | 1991-10-18 | 1999-06-15 | Dennis Paul Phillion | Fungicides for the control of take-all disease of plants |
| WO1993014063A1 (en) * | 1992-01-13 | 1993-07-22 | Imperial Chemical Industries Plc | Fungicides |
| TR27569A (tr) * | 1992-01-24 | 1995-06-13 | Ici Plc | Yeni fungisidal asilaminobenzamidler, bunlarin hazirlanis islemleri ve bitkilerdeki mantar enfeksiyonlariyla mücadelede kullanimlari. |
| GB9213568D0 (en) * | 1992-06-26 | 1992-08-12 | Ici Plc | Fungicides |
| JPH07508272A (ja) * | 1992-06-26 | 1995-09-14 | ゼネカ・リミテッド | 4−アシルアミノベンズアミド類及びこれらの殺菌剤としての使用 |
| TR28604A (tr) * | 1992-06-26 | 1996-11-04 | Zeneca Ltd | Fungusid acilaminobenzenler. |
| HRP921338B1 (en) * | 1992-10-02 | 2002-04-30 | Monsanto Co | Fungicides for the control of take-all disease of plants |
| DE4342026A1 (de) * | 1993-12-09 | 1995-06-14 | Basf Ag | Acylamino-benzamide und sie enthaltende fungizide Mittel |
| US5482974A (en) * | 1994-03-08 | 1996-01-09 | Monsanto Company | Selected fungicides for the control of take-all disease of plants |
| US6117670A (en) * | 1994-06-08 | 2000-09-12 | Novartis Finance Corporation | Pyrrolnitrin biosynthesis genes and uses thereof |
| US5486621A (en) * | 1994-12-15 | 1996-01-23 | Monsanto Company | Fungicides for the control of take-all disease of plants |
| US5658953A (en) * | 1995-04-03 | 1997-08-19 | Centaur Pharmaceuticals, Inc. | Pharmaceutical compositions of acetamidobenzamide compounds for neurodegenerative disorders |
| US5643965A (en) * | 1995-04-03 | 1997-07-01 | Centaur Pharmaceuticals, Inc. | Aminobenzamide compounds for the treatment of neurodegenerative disorders |
| US5955506A (en) * | 1996-04-03 | 1999-09-21 | Centaur Pharmaceuticals, Inc. | Benzamides for neurodegenerative disorder treatment |
| GB9622926D0 (en) * | 1996-11-04 | 1997-01-08 | Zeneca Ltd | Chemical process |
| US6444849B1 (en) | 1997-06-25 | 2002-09-03 | Mitsubishi Chemical Corporation | Amide derivatives |
| UA70327C2 (uk) | 1998-06-08 | 2004-10-15 | Баєр Акціенгезельшафт | Спосіб боротьби з фітопатогенними хворобами сільськогосподарських рослин та фунгіцидна композиція |
| US6333432B1 (en) * | 1999-05-04 | 2001-12-25 | Gina M. Fitzpatrick | Fungicidal compositions and methods, and compounds and methods for the preparation thereof |
| ES2211577T3 (es) | 1999-08-13 | 2004-07-16 | Monsanto Technology Llc | Amidas oxima y amidas hidrazona con actividad fungicida. |
| FR2812633A1 (fr) * | 2000-08-04 | 2002-02-08 | Aventis Cropscience Sa | Derives de phenyl(thio)urees et phenyl(thio)carbamates fongicides |
| EP2079739A2 (en) * | 2006-10-04 | 2009-07-22 | Pfizer Products Inc. | Pyrido[4,3-d]pyrimidin-4(3h)-one derivatives as calcium receptor antagonists |
| CA2886973C (en) * | 2012-10-15 | 2017-08-15 | Albemarle Corporation | Processes for the synthesis of 2-amino-4,6-dimethoxybenzamide and other benzamide compounds |
| CN109206335B (zh) * | 2017-06-29 | 2020-10-30 | 沈阳中化农药化工研发有限公司 | 制备邻三氟甲基苯胺类化合物的方法及其中间体 |
| EP3681869B1 (en) * | 2017-09-13 | 2021-12-08 | Syngenta Participations AG | Microbiocidal quinoline (thio)carboxamide derivatives |
Family Cites Families (18)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE1168918B (de) * | 1961-08-16 | 1964-04-30 | Cassella Farbwerke Mainkur Ag | Verfahren zur Herstellung von Acylanthranilsaeureaniliden |
| BE621404A (fr) * | 1961-08-16 | 1962-12-03 | Cassella Farbwerke Mainkur Ag | Nouveaux anilides d'acides acylanthraniliques substitués et leur préparation |
| US3455987A (en) * | 1966-06-17 | 1969-07-15 | Abbott Lab | P-hydroxylaminobenzoylaminoacetonitriles and preparation thereof |
| CH507205A (de) * | 1968-03-29 | 1971-05-15 | Agripat Sa | Verfahren zur Herstellung von neuen 2-Ureido-benzamiden und deren Verwendung zur Unkrautbekämpfung |
| BE758433A (fr) * | 1969-10-13 | 1971-05-04 | Ciba Geigy | N-o-fluorophenylurees, leur preparation et leur utilisation comme pesticides. |
| US4060638A (en) * | 1975-05-27 | 1977-11-29 | Sandoz, Inc. | Anthranilic acid amides |
| DE2862100D1 (en) * | 1977-10-12 | 1983-01-05 | Ici Plc | Acylanilides, process for their manufacture and pharmaceutical and veterinary compositions containing them |
| US4485105A (en) * | 1978-10-12 | 1984-11-27 | American Cyanamid Company | Method of treating hyperlipidemia with 4-(monoalkylamino)benzoic acid amides |
| JPS5780351A (en) * | 1980-11-06 | 1982-05-19 | Hodogaya Chem Co Ltd | Benzamide derivative and herbicide containing the same |
| JPS5867657A (ja) * | 1981-10-15 | 1983-04-22 | Chugai Pharmaceut Co Ltd | ペンズアミド誘導体 |
| US4623662A (en) * | 1985-05-23 | 1986-11-18 | American Cyanamid Company | Antiatherosclerotic ureas and thioureas |
| DE3373810D1 (de) * | 1982-07-27 | 1987-10-29 | Sumitomo Chemical Co | Fungicidal anilides |
| GB8315495D0 (en) * | 1983-06-06 | 1983-07-13 | Sumitomo Chemical Co | Fungicidal aniline derivatives |
| US4555525A (en) * | 1984-08-31 | 1985-11-26 | Administrators Of The Tulane Educational Fund | Use of desethyl-N-acetylprocainamide (NAPADE) as an inotropic agent |
| IL78394A (en) * | 1985-04-05 | 1989-12-15 | Lilly Co Eli | Fluoroalkanoyl anilides,process for their preparation,insecticidal,arachnicidal,fungicidal and herbicidal compositions comprising them |
| US4826841A (en) * | 1985-04-05 | 1989-05-02 | Eli Lilly And Company | Alkanoyl anilides as pesticides |
| DE3822448A1 (de) * | 1988-07-02 | 1990-03-01 | Bayer Ag | Ureido-benzoesaeure-derivate |
| IE62559B1 (en) * | 1989-02-02 | 1995-02-08 | Ici Plc | Fungicides |
-
1990
- 1990-01-12 IE IE14590A patent/IE62559B1/en not_active IP Right Cessation
- 1990-01-16 NZ NZ232127A patent/NZ232127A/en unknown
- 1990-01-17 SK SK236-90A patent/SK278842B6/sk unknown
- 1990-01-17 IL IL9307690A patent/IL93076A/en not_active IP Right Cessation
- 1990-01-17 EP EP90300457A patent/EP0381330B1/en not_active Expired - Lifetime
- 1990-01-17 ES ES90300457T patent/ES2062320T3/es not_active Expired - Lifetime
- 1990-01-17 DE DE90300457T patent/DE69005466T2/de not_active Expired - Fee Related
- 1990-01-22 CA CA002008291A patent/CA2008291A1/en not_active Abandoned
- 1990-01-22 AP APAP/P/1990/000159A patent/AP123A/en active
- 1990-01-22 HU HU90221A patent/HU206191B/hu not_active IP Right Cessation
- 1990-01-23 MY MYPI90000119A patent/MY106000A/en unknown
- 1990-01-24 AR AR90316000A patent/AR246734A1/es active
- 1990-01-26 AU AU48871/90A patent/AU617238B2/en not_active Ceased
- 1990-01-30 PL PL90283525A patent/PL163155B1/pl unknown
- 1990-01-30 PL PL90285553A patent/PL163362B1/pl unknown
- 1990-01-30 EG EG4590A patent/EG19119A/xx active
- 1990-02-01 PT PT93030A patent/PT93030B/pt not_active IP Right Cessation
- 1990-02-02 BR BR909000477A patent/BR9000477A/pt not_active Application Discontinuation
- 1990-02-02 GB GB909002370A patent/GB9002370D0/en active Pending
- 1990-02-02 KR KR1019900001264A patent/KR0145295B1/ko not_active Expired - Fee Related
- 1990-02-02 CN CN90100999A patent/CN1024004C/zh not_active Expired - Fee Related
- 1990-02-02 US US07/473,677 patent/US4999381A/en not_active Expired - Fee Related
- 1990-02-02 JP JP2022308A patent/JP2688530B2/ja not_active Expired - Lifetime
- 1990-12-31 US US07/635,993 patent/US5280044A/en not_active Expired - Fee Related
-
1992
- 1992-12-24 LV LVP-92-487A patent/LV10084B/en unknown
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN1024004C (zh) | 杀菌剂 | |
| CN1024005C (zh) | 杀真菌剂 | |
| CN1185216C (zh) | 杀真菌剂 | |
| CN1020901C (zh) | 杀真菌剂组合物其制备方法及用途 | |
| CN1023600C (zh) | 杀菌剂组合物及其制法 | |
| CN1083688C (zh) | 新除草剂 | |
| CN1022885C (zh) | 含有丙烯酸衍生物作为活性成分的农用组合物,其应用制备方法 | |
| CN87105481A (zh) | 杀真菌剂及其制备方法和用途 | |
| CN1054974A (zh) | 除草用的甲酰胺衍生物 | |
| CN1057646A (zh) | 肼甲酰胺衍生物及其生产方法和应用 | |
| CN1068567A (zh) | 新型除草剂 | |
| CN87103543A (zh) | 杀真菌剂 | |
| CN1100262A (zh) | 新型除草剂 | |
| CN1049654A (zh) | N-(取代的苄氧基)亚胺衍生物、它们的制备方法、它们的应用以及应用的方法 | |
| CN1104636A (zh) | 新的除草剂 | |
| CN1045439C (zh) | 杂芳酰基异噁唑衍生物、其制备应用及含该衍生物的组合物 | |
| CN1030749A (zh) | 制备杀菌化合物的方法 | |
| CN86102450A (zh) | 制备杂环化合物的方法 | |
| CN87102877A (zh) | 杀菌剂 | |
| CN1032184C (zh) | 杀真菌剂及其制备方法 | |
| CN86100254A (zh) | 制备叔胺类化合物的方法 | |
| CN1505612A (zh) | 邻苯二酰胺衍生物、农用与园艺用杀虫剂及其施用方法 | |
| CN1053232A (zh) | 杀真菌剂 | |
| CN1294574A (zh) | 杀真菌酰胺 | |
| CN1134698A (zh) | 新颖的三唑化合物,其制备方法和作病虫害防治剂 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| C06 | Publication | ||
| PB01 | Publication | ||
| C10 | Entry into substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| C14 | Grant of patent or utility model | ||
| GR01 | Patent grant | ||
| C53 | Correction of patent of invention or patent application | ||
| COR | Change of bibliographic data |
Free format text: CORRECT: PATENTEE; FROM: IMPERIAL CHEMICAL CORPORATION TO: ZENECA LTD |
|
| CP01 | Change in the name or title of a patent holder |
Patentee after: Zeneca Limited Patentee before: Imperial Chemical Industries PLC |
|
| C19 | Lapse of patent right due to non-payment of the annual fee | ||
| CF01 | Termination of patent right due to non-payment of annual fee |