JP6530409B2 - 骨髄性白血病の治療におけるエピジェネティック因子ならびにcd33およびcd3を標的化する二重特異性化合物の組み合わせ - Google Patents
骨髄性白血病の治療におけるエピジェネティック因子ならびにcd33およびcd3を標的化する二重特異性化合物の組み合わせ Download PDFInfo
- Publication number
- JP6530409B2 JP6530409B2 JP2016542329A JP2016542329A JP6530409B2 JP 6530409 B2 JP6530409 B2 JP 6530409B2 JP 2016542329 A JP2016542329 A JP 2016542329A JP 2016542329 A JP2016542329 A JP 2016542329A JP 6530409 B2 JP6530409 B2 JP 6530409B2
- Authority
- JP
- Japan
- Prior art keywords
- leukemia
- seq
- epigenetic
- cells
- targeting compound
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
- A61K39/39533—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals
- A61K39/39558—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals against tumor tissues, cells, antigens
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/40—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with one nitrogen as the only ring hetero atom, e.g. sulpiride, succinimide, tolmetin, buflomedil
- A61K31/403—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with one nitrogen as the only ring hetero atom, e.g. sulpiride, succinimide, tolmetin, buflomedil condensed with carbocyclic rings, e.g. carbazole
- A61K31/404—Indoles, e.g. pindolol
- A61K31/4045—Indole-alkylamines; Amides thereof, e.g. serotonin, melatonin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/02—Antineoplastic agents specific for leukemia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2803—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2803—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily
- C07K16/2809—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily against the T-cell receptor (TcR)-CD3 complex
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K2300/00—Mixtures or combinations of active ingredients, wherein at least one active ingredient is fully defined in groups A61K31/00 - A61K41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/30—Immunoglobulins specific features characterized by aspects of specificity or valency
- C07K2317/31—Immunoglobulins specific features characterized by aspects of specificity or valency multispecific
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/30—Immunoglobulins specific features characterized by aspects of specificity or valency
- C07K2317/33—Crossreactivity, e.g. for species or epitope, or lack of said crossreactivity
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/60—Immunoglobulins specific features characterized by non-natural combinations of immunoglobulin fragments
- C07K2317/62—Immunoglobulins specific features characterized by non-natural combinations of immunoglobulin fragments comprising only variable region components
- C07K2317/622—Single chain antibody (scFv)
Description
本発明は、骨髄性白血病の治療における、エピジェネティック因子ならびにCD33およびCD3を標的化する二重特異性化合物の組み合わせであって、エピジェネティック因子が、ヒストンデアセチラーゼ(HDAC)阻害剤、DNAメチルトランスフェラーゼ(DNMT)I阻害剤、ヒドロキシ尿素、顆粒球コロニー刺激因子(G-CSF)、ヒストンデメチラーゼ阻害剤、およびATRA(全トランス型レチノイン酸)からなる群より選択される、組み合わせを提供する。したがって、本発明は、CD33標的化化合物および少なくとも1種のエピジェネティック因子を含む薬学的組成物、ならびに骨髄性白血病の寛解および/または治療に使用するための、CD33標的化化合物に対する患者の応答性を増加させるエピジェネティック因子を提供する。さらに、本発明は、CD33標的化化合物による処置に対する骨髄性白血病患者の応答性を増加させるための少なくとも1種のエピジェネティック因子の使用、CD33標的化化合物および少なくとも1種のエピジェネティック因子を、それを必要とする患者に投与することを含む、骨髄性白血病の治療のための方法、ならびに本発明の薬学的組成物、または本発明のエピジェネティック因子および二重特異性CD33標的化化合物を含む、キットを提供する。
多剤従来型化学療法および同種幹細胞移植(SCT)を含む集中的な治療法の使用による、この数十年を通しての段階的な改善にもかかわらず、急性骨髄性白血病(AML)に罹患する患者の生存は低いままであり、患者は、治療に関連した病的状態および死亡を経験する高いリスクがある。例えば、SCTは、化学療法抵抗性の白血病細胞の除去を導き得る強力な抗白血病効果を提供することが証明されているが、多数の患者が、多くにおいて最終的には致命的になる著しい移植片対宿主(GvH)病を発症する。多くの患者に対して、特にそのような集中的な治療戦略に適していない患者に対して、免疫治療アプローチを含む新規の治療選択肢が早急に求められている。GvH反応のない有望な免疫治療戦略は、患者の自身のT細胞をインビボで増員すること、およびそれらを白血病細胞に直接的に再標的化することである。
(a)該CD33標的化化合物が、CD33に特異的に結合する第一の結合ドメインおよびCD3に特異的に結合する第二の結合ドメインを含む、二重特異性構築物であり;かつ
(b)該少なくとも1種のエピジェネティック因子が、ヒストンデアセチラーゼ(HDAC)阻害剤、DNAメチルトランスフェラーゼ(DNMT)I阻害剤、ヒドロキシ尿素、顆粒球コロニー刺激因子(G-CSF)、ヒストンメチルトランスフェラーゼ(HMT)阻害剤、およびATRA(全トランス型レチノイン酸)からなる群より選択される、
薬学的組成物を提供する。
(a)パノビノスタット、ボリノスタット、ロミデプシン、N-アセチルジナリン、ベリノスタット、ギビノスタット(givinostat)、エンチノスタット、モセチノスタット、EVP-0334、SRT501、CUDC-101、キシノスタット(Quisinostat)、アベキシノスタット(abexinostat)、LAQ824、およびバルプロ酸からなる群より選択される、ヒストンデアセチラーゼ(HDAC)阻害剤;
(b)5-アザシチジン、デシタビン、ヒドララジン、ゼブラリン、プロカインアミド、(-)-エピガロカテキン-3-ガレート、MG98、RG108、およびSGI-110からなる群より選択される、DNAメチルトランスフェラーゼ(DNMT)I阻害剤;ならびに
(c)LSD1(KDM1A)デメチラーゼ阻害剤およびケトシン(chaetocin)からなる群より選択される、ヒストンメチルトランスフェラーゼ(HMT)阻害剤
を含む群から選択されるように、特徴づけられる。
(a)CD33標的化化合物の投与前にエピジェネティック因子が投与されるか;
(b)CD33標的化化合物の投与後にエピジェネティック因子が投与されるか;または
(c)エピジェネティック因子とCD33標的化化合物が同時に投与される、
薬学的組成物を提供する。
・SEQ ID NO:6、24、42、60、78、96、114および132に示されるアミノ酸配列を有するVL鎖と、SEQ ID NO:1、19、37、55、73、91、109および127に示されるアミノ酸配列を有するVH鎖を含み、かつCD33に特異的に結合する第一の結合ドメイン;ならびに
・SEQ ID NO:154、157、160、163、166、169および172に示されるアミノ酸配列を有するVL鎖と、SEQ ID NO:155、158、161、164、167、170および173に示されるアミノ酸配列を有するVH鎖を含み、かつCD3に特異的に結合する第二の結合ドメイン
を含む。
(a)該CD33標的化化合物が、CD33に特異的に結合する第一の結合ドメインおよびCD3に特異的に結合する第二の結合ドメインを含む、二重特異性構築物であり;かつ
(b)該少なくとも1種のエピジェネティック因子が、ヒストンデアセチラーゼ(HDAC)阻害剤、DNAメチルトランスフェラーゼ(DNMT)I阻害剤、ヒドロキシ尿素、顆粒球コロニー刺激因子(G-CSF)、ヒストンメチルトランスフェラーゼ(HMT)阻害剤、およびATRA(全トランス型レチノイン酸)からなる群より選択される、
エピジェネティック因子を提供する。
(a)パノビノスタット、ボリノスタット、ロミデプシン、N-アセチルジナリン、ベリノスタット、ギビノスタット、エンチノスタット、モセチノスタット、EVP-0334、SRT501、CUDC-101、キシノスタット、アベキシノスタット、LAQ824、およびバルプロ酸からなる群より選択される、ヒストンデアセチラーゼ(HDAC)阻害剤;
(b)5-アザシチジン、デシタビン、ヒドララジン、ゼブラリン、プロカインアミド、(-)-エピガロカテキン-3-ガレート、MG98、RG108、およびSGI-110からなる群より選択される、DNAメチルトランスフェラーゼ(DNMT)I阻害剤;ならびに
(c)LSD1(KDM1A)デメチラーゼ阻害剤およびケトシンからなる群より選択される、ヒストンメチルトランスフェラーゼ(HMT)阻害剤
を含む群から選択される。
(a)CD33標的化化合物の投与前にエピジェネティック因子が投与されるか;
(b)CD33標的化化合物の投与後にエピジェネティック因子が投与されるか;または
(c)エピジェネティック因子とCD33標的化化合物が同時に投与される。
・SEQ ID NO:6、24、42、60、78、96、114および132に示されるアミノ酸配列を有するVL鎖と、SEQ ID NO:1、19、37、55、73、91、109および127に示されるアミノ酸配列を有するVH鎖を含み、かつCD33に特異的に結合する第一の結合ドメイン;ならびに
・SEQ ID NO:154、157、160、163、166、169および172に示されるアミノ酸配列を有するVL鎖と、SEQ ID NO:155、158、161、164、167、170および173に示されるアミノ酸配列を有するVH鎖を含み、かつCD3に特異的に結合する第二の結合ドメイン
を含むことである。
(a)該CD33標的化化合物が、CD33に特異的に結合する第一の結合ドメインおよびCD3に特異的に結合する第二の結合ドメインを含む、二重特異性構築物であり;かつ
(b)該少なくとも1種のエピジェネティック因子が、ヒストンデアセチラーゼ(HDAC)阻害剤、DNAメチルトランスフェラーゼ(DNMT)I阻害剤、ヒドロキシ尿素、顆粒球コロニー刺激因子(G-CSF)、ヒストンデメチラーゼ阻害剤、およびATRA(全トランス型レチノイン酸)からなる群より選択される、
使用を提供する。
(a)パノビノスタット、ボリノスタット、ロミデプシン、N-アセチルジナリン、ベリノスタット、ギビノスタット、エンチノスタット、モセチノスタット、EVP-0334、SRT501、CUDC-101、キシノスタット、アベキシノスタット、LAQ824、およびバルプロ酸からなる群より選択される、ヒストンデアセチラーゼ(HDAC)阻害剤;
(b)5-アザシチジン、デシタビン、ヒドララジン、ゼブラリン、プロカインアミド、(-)-エピガロカテキン-3-ガレート、MG98、RG108、およびSGI-110からなる群より選択される、DNAメチルトランスフェラーゼ(DNMT)I阻害剤;ならびに
(c)LSD1(KDM1A)デメチラーゼ阻害剤およびケトシンからなる群より選択される、ヒストンメチルトランスフェラーゼ(HMT)阻害剤
を含む群から選択される。
(a)CD33標的化化合物の投与前にエピジェネティック因子が投与されるか;
(b)CD33標的化化合物の投与後にエピジェネティック因子が投与されるか;または
(c)エピジェネティック因子とCD33標的化化合物が同時に投与される。
・SEQ ID NO:6、24、42、60、78、96、114および132に示されるアミノ酸配列を有するVL鎖と、SEQ ID NO:1、19、37、55、73、91、109および127に示されるアミノ酸配列を有するVH鎖を含み、かつCD33に特異的に結合する第一の結合ドメイン;ならびに
・SEQ ID NO:154、157、160、163、166、169および172に示されるアミノ酸配列を有するVL鎖と、SEQ ID NO:155、158、161、164、167、170および173に示されるアミノ酸配列を有するVH鎖を含み、かつCD3に特異的に結合する第二の結合ドメイン
を含む。
(a)該CD33標的化化合物が、CD33に特異的に結合する第一の結合ドメインおよびCD3に特異的に結合する第二の結合ドメインを含む、二重特異性構築物であり;かつ
(b)該少なくとも1種のエピジェネティック因子が、ヒストンデアセチラーゼ(HDAC)阻害剤、DNAメチルトランスフェラーゼ(DNMT)I阻害剤、ヒドロキシ尿素、顆粒球コロニー刺激因子(G-CSF)、ヒストンメチルトランスフェラーゼ(HMT)阻害剤、およびATRA(全トランス型レチノイン酸)からなる群より選択される、
方法を提供する。
(a)パノビノスタット、ボリノスタット、ロミデプシン、N-アセチルジナリン、ベリノスタット、ギビノスタット、エンチノスタット、モセチノスタット、EVP-0334、SRT501、CUDC-101、キシノスタット、アベキシノスタット、LAQ824、およびバルプロ酸からなる群より選択される、ヒストンデアセチラーゼ(HDAC)阻害剤;
(b)5-アザシチジン、デシタビン、ヒドララジン、ゼブラリン、プロカインアミド、(-)-エピガロカテキン-3-ガレート、MG98、RG108、およびSGI-110からなる群より選択される、DNAメチルトランスフェラーゼ(DNMT)I阻害剤;ならびに
(c)LSD1(KDM1A)デメチラーゼ阻害剤およびケトシンからなる群より選択される、ヒストンメチルトランスフェラーゼ(HMT)阻害剤
を含む群から選択される。
(a)CD33標的化化合物の投与前にエピジェネティック因子が投与されるか;
(b)CD33標的化化合物の投与後にエピジェネティック因子が投与されるか;または
(c)エピジェネティック因子とCD33標的化化合物が同時に投与される。
・SEQ ID NO:6、24、42、60、78、96、114および132に示されるアミノ酸配列を有するVL鎖と、SEQ ID NO:1、19、37、55、73、91、109および127に示されるアミノ酸配列を有するVH鎖を含み、かつCD33に特異的に結合する第一の結合ドメイン;ならびに
・SEQ ID NO:154、157、160、163、166、169および172に示されるアミノ酸配列を有するVL鎖と、SEQ ID NO:155、158、161、164、167、170および173に示されるアミノ酸配列を有するVH鎖を含み、かつCD3に特異的に結合する第二の結合ドメイン
を含む。
[本発明1001]
CD33標的化化合物および少なくとも1種のエピジェネティック因子を含む、薬学的組成物であって、
(a)該CD33標的化化合物が、CD33に特異的に結合する第一の結合ドメインおよびCD3に特異的に結合する第二の結合ドメインを含む、二重特異性構築物であり;かつ
(b)該少なくとも1種のエピジェネティック因子が、ヒストンデアセチラーゼ(HDAC)阻害剤、DNAメチルトランスフェラーゼ(DNMT)I阻害剤、ヒドロキシ尿素、顆粒球コロニー刺激因子(G-CSF)、ヒストンメチルトランスフェラーゼ(HMT)阻害剤、およびATRA(全トランス型レチノイン酸)からなる群より選択される、
薬学的組成物。
[本発明1002]
少なくとも1種のエピジェネティック因子が、
(a)パノビノスタット、ボリノスタット、ロミデプシン、N-アセチルジナリン、ベリノスタット、ギビノスタット(givinostat)、エンチノスタット、モセチノスタット、EVP-0334、SRT501、CUDC-101、キシノスタット(Quisinostat)、アベキシノスタット(abexinostat)、LAQ824、およびバルプロ酸からなる群より選択される、ヒストンデアセチラーゼ(HDAC)阻害剤;
(b)5-アザシチジン、デシタビン、ヒドララジン、ゼブラリン、プロカインアミド、(-)-エピガロカテキン-3-ガレート、MG98、RG108、およびSGI-110からなる群より選択される、DNAメチルトランスフェラーゼ(DNMT)I阻害剤;ならびに
(c)LSD1(KDM1A)デメチラーゼ阻害剤およびケトシン(chaetocin)からなる群より選択される、ヒストンメチルトランスフェラーゼ(HMT)阻害剤
を含む群から選択される、本発明1001の薬学的組成物。
[本発明1003]
(a)CD33標的化化合物の投与前にエピジェネティック因子が投与されるか;
(b)CD33標的化化合物の投与後にエピジェネティック因子が投与されるか;または
(c)エピジェネティック因子とCD33標的化化合物が同時に投与される、
本発明1001または1002の薬学的組成物。
[本発明1004]
エピジェネティック因子の第一の用量が、CD33標的化化合物の投与の開始前に投与される、本発明1001〜1003のいずれかの薬学的組成物。
[本発明1005]
エピジェネティック因子の投与が、CD33標的化化合物の投与の間中継続される、本発明1004の薬学的組成物。
[本発明1006]
二重特異性構築物が、二重特異性抗体構築物である、本発明1001〜1005のいずれかの薬学的組成物。
[本発明1007]
二重特異性抗体構築物が、二重特異性単鎖抗体構築物である、本発明1006の薬学的組成物。
[本発明1008]
二重特異性抗体構築物が、ヒトおよびカニクイザルのCD3ならびにヒトおよびカニクイザルのCD33に結合する、本発明1006または1007の薬学的組成物。
[本発明1009]
二重特異性抗体構築物が、
・SEQ ID NO:6、24、42、60、78、96、114および132に示されるアミノ酸配列を有するVL鎖と、SEQ ID NO:1、19、37、55、73、91、109および127に示されるアミノ酸配列を有するVH鎖を含み、かつCD33に特異的に結合する第一の結合ドメイン;ならびに
・SEQ ID NO:154、157、160、163、166、169および172に示されるアミノ酸配列を有するVL鎖と、SEQ ID NO:155、158、161、164、167、170および173に示されるアミノ酸配列を有するVH鎖を含み、かつCD3に特異的に結合する第二の結合ドメイン
を含む、本発明1006〜1008のいずれかの薬学的組成物。
[本発明1010]
二重特異性抗体構築物が、SEQ ID NO:13、15、17、31、33、35、49、51、53、67、69、71、85、87、89、103、105、107、121、123、125、139、141、143、148、150、152、215、217、219、221、223、225および227のいずれかに示されるアミノ酸配列を含む、本発明1009の薬学的組成物。
[本発明1011]
骨髄性白血病を治療するための本発明1001〜1010のいずれかの薬学的組成物。
[本発明1012]
骨髄性白血病が、急性骨髄芽球性白血病、慢性好中球性白血病、骨髄樹状細胞白血病、慢性骨髄性白血病移行期、急性骨髄単球性白血病、若年性骨髄単球性白血病、慢性骨髄単球性白血病、急性好塩基球性白血病、急性好酸球性白血病、慢性好酸球性白血病、急性巨核芽球性白血病、本態性血小板増加症、急性赤白血病、真性赤血球増加症、骨髄異形成症候群、急性汎骨髄症、骨髄肉腫、および急性混合性白血病からなる群より選択される、本発明1011の薬学的組成物。
[本発明1013]
骨髄性白血病の寛解および/または治療に使用するための、CD33標的化化合物に対する患者の応答性を増加させるエピジェネティック因子であって、
(a)該CD33標的化化合物が、CD33に特異的に結合する第一の結合ドメインおよびCD3に特異的に結合する第二の結合ドメインを含む、二重特異性構築物であり;かつ
(b)少なくとも1種のエピジェネティック因子が、ヒストンデアセチラーゼ(HDAC)阻害剤、DNAメチルトランスフェラーゼ(DNMT)I阻害剤、ヒドロキシ尿素、顆粒球コロニー刺激因子(G-CSF)、ヒストンメチルトランスフェラーゼ(HMT)阻害剤、およびATRA(全トランス型レチノイン酸)からなる群より選択される、
エピジェネティック因子。
[本発明1014]
(a)パノビノスタット、ボリノスタット、ロミデプシン、N-アセチルジナリン、ベリノスタット、ギビノスタット、エンチノスタット、モセチノスタット、EVP-0334、SRT501、CUDC-101、キシノスタット、アベキシノスタット、LAQ824、およびバルプロ酸からなる群より選択される、ヒストンデアセチラーゼ(HDAC)阻害剤;
(b)5-アザシチジン、デシタビン、ヒドララジン、ゼブラリン、プロカインアミド、(-)-エピガロカテキン-3-ガレート、MG98、RG108、およびSGI-110からなる群より選択される、DNAメチルトランスフェラーゼ(DNMT)I阻害剤;ならびに
(c)LSD1(KDM1A)デメチラーゼ阻害剤およびケトシンからなる群より選択される、ヒストンメチルトランスフェラーゼ(HMT)阻害剤
を含む群から選択される、本発明1013のエピジェネティック因子。
[本発明1015]
(a)CD33標的化化合物の投与前にエピジェネティック因子が投与されるか;
(b)CD33標的化化合物の投与後にエピジェネティック因子が投与されるか;または
(c)エピジェネティック因子とCD33標的化化合物が同時に投与される、
本発明1013または1014のエピジェネティック因子。
[本発明1016]
エピジェネティック因子の第一の用量が、CD33標的化化合物の投与の開始前に投与される、本発明1013〜1015のいずれかのエピジェネティック因子。
[本発明1017]
エピジェネティック因子の投与が、CD33標的化化合物の投与の間中継続される、本発明1016のエピジェネティック因子。
[本発明1018]
二重特異性構築物が、二重特異性抗体構築物である、本発明1013〜1017のいずれかのエピジェネティック因子。
[本発明1019]
二重特異性抗体構築物が、二重特異性単鎖抗体構築物である、本発明1018のエピジェネティック因子。
[本発明1020]
二重特異性抗体構築物が、ヒトおよびカニクイザルのCD3およびCD33に結合する、本発明1018または1019のエピジェネティック因子。
[本発明1021]
二重特異性抗体構築物が、
・SEQ ID NO:6、24、42、60、78、96、114および132に示されるアミノ酸配列を有するVL鎖と、SEQ ID NO:1、19、37、55、73、91、109および127に示されるアミノ酸配列を有するVH鎖を含み、かつCD33に特異的に結合する第一の結合ドメイン;ならびに
・SEQ ID NO:154、157、160、163、166、169および172に示されるアミノ酸配列を有するVL鎖と、SEQ ID NO:155、158、161、164、167、170および173に示されるアミノ酸配列を有するVH鎖を含み、かつCD3に特異的に結合する第二の結合ドメイン
を含む、本発明1018〜1020のいずれかのエピジェネティック因子。
[本発明1022]
二重特異性抗体構築物が、SEQ ID NO:13、15、17、31、33、35、49、51、53、67、69、71、85、87、89、103、105、107、121、123、125、139、141、143、148、150、152、215、217、219、221、223、225および227のいずれかに示されるアミノ酸配列を含む、本発明1021のエピジェネティック因子。
[本発明1023]
骨髄性白血病が、急性骨髄芽球性白血病、慢性好中球性白血病、骨髄樹状細胞白血病、慢性骨髄性白血病移行期、急性骨髄単球性白血病、若年性骨髄単球性白血病、慢性骨髄単球性白血病、急性好塩基球性白血病、急性好酸球性白血病、慢性好酸球性白血病、急性巨核芽球性白血病、本態性血小板増加症、急性赤白血病、真性赤血球増加症、骨髄異形成症候群、急性汎骨髄症、骨髄肉腫、および急性混合性白血病からなる群より選択される、本発明1013〜1022のいずれかのエピジェネティック因子。
[本発明1024]
CD33標的化化合物による処置に対する骨髄性白血病患者の応答性を増加させるための少なくとも1種のエピジェネティック因子の使用であって、
(a)該CD33標的化化合物が、CD33に特異的に結合する第一の結合ドメインおよびCD3に特異的に結合する第二の結合ドメインを含む、二重特異性構築物であり;かつ
(b)該少なくとも1種のエピジェネティック因子が、ヒストンデアセチラーゼ(HDAC)阻害剤、DNAメチルトランスフェラーゼ(DNMT)I阻害剤、ヒドロキシ尿素、顆粒球コロニー刺激因子(G-CSF)、ヒストンメチルトランスフェラーゼ(HMT)阻害剤、およびATRA(全トランス型レチノイン酸)からなる群より選択される、
使用。
[本発明1025]
少なくとも1種のエピジェネティック因子が、
(a)パノビノスタット、ボリノスタット、ロミデプシン、N-アセチルジナリン、ベリノスタット、ギビノスタット、エンチノスタット、モセチノスタット、EVP-0334、SRT501、CUDC-101、キシノスタット、アベキシノスタット、LAQ824、およびバルプロ酸からなる群より選択される、ヒストンデアセチラーゼ(HDAC)阻害剤;
(b)5-アザシチジン、デシタビン、ヒドララジン、ゼブラリン、プロカインアミド、(-)-エピガロカテキン-3-ガレート、MG98、RG108、およびSGI-110からなる群より選択される、DNAメチルトランスフェラーゼ(DNMT)I阻害剤;ならびに
(c)LSD1(KDM1A)デメチラーゼ阻害剤およびケトシンからなる群より選択される、ヒストンメチルトランスフェラーゼ(HMT)阻害剤
を含む群から選択される、本発明1024の使用。
[本発明1026]
(a)CD33標的化化合物の投与前にエピジェネティック因子が投与されるか;
(b)CD33標的化化合物の投与後にエピジェネティック因子が投与されるか;または
(c)エピジェネティック因子とCD33標的化化合物が同時に投与される、
本発明1024または1025の使用。
[本発明1027]
エピジェネティック因子の第一の用量が、CD33標的化化合物の投与の開始前に投与される、本発明1024〜1026のいずれかの使用。
[本発明1028]
エピジェネティック因子の投与が、CD33標的化化合物の投与の間中継続される、本発明1027の使用。
[本発明1029]
二重特異性構築物が、二重特異性抗体構築物である、本発明1024〜1028のいずれかの使用。
[本発明1030]
二重特異性抗体構築物が、二重特異性単鎖抗体構築物である、本発明1029の使用。
[本発明1031]
二重特異性抗体構築物が、ヒトおよびカニクイザルのCD3およびCD33に結合する、本発明1029または1030の使用。
[本発明1032]
二重特異性抗体構築物が、
・SEQ ID NO:6、24、42、60、78、96、114および132に示されるアミノ酸配列を有するVL鎖と、SEQ ID NO:1、19、37、55、73、91、109および127に示されるアミノ酸配列を有するVH鎖を含み、かつCD33に特異的に結合する第一の結合ドメイン;ならびに
・SEQ ID NO:154、157、160、163、166、169および172に示されるアミノ酸配列を有するVL鎖と、SEQ ID NO:155、158、161、164、167、170および173に示されるアミノ酸配列を有するVH鎖を含み、かつCD3に特異的に結合する第二の結合ドメイン
を含む、本発明1029〜1031のいずれかの使用。
[本発明1033]
二重特異性抗体構築物が、SEQ ID NO:13、15、17、31、33、35、49、51、53、67、69、71、85、87、89、103、105、107、121、123、125、139、141、143、148、150、152、215、217、219、221、223、225および227のいずれかに示されるアミノ酸配列を含む、本発明1032の使用。
[本発明1034]
骨髄性白血病が、急性骨髄芽球性白血病、慢性好中球性白血病、骨髄樹状細胞白血病、慢性骨髄性白血病移行期、急性骨髄単球性白血病、若年性骨髄単球性白血病、慢性骨髄単球性白血病、急性好塩基球性白血病、急性好酸球性白血病、慢性好酸球性白血病、急性巨核芽球性白血病、本態性血小板増加症、急性赤白血病、真性赤血球増加症、骨髄異形成症候群、急性汎骨髄症、骨髄肉腫、および急性混合性白血病からなる群より選択される、本発明1024〜1033のいずれかの使用。
[本発明1035]
CD33標的化化合物および少なくとも1種のエピジェネティック因子を、それを必要とする患者に投与することを含む、骨髄性白血病の治療のための方法であって、
(a)該CD33標的化化合物が、CD33に特異的に結合する第一の結合ドメインおよびCD3に特異的に結合する第二の結合ドメインを含む、二重特異性構築物であり;かつ
(b)該少なくとも1種のエピジェネティック因子が、ヒストンデアセチラーゼ(HDAC)阻害剤、DNAメチルトランスフェラーゼ(DNMT)I阻害剤、ヒドロキシ尿素、顆粒球コロニー刺激因子(G-CSF)、ヒストンメチルトランスフェラーゼ(HMT)阻害剤、およびATRA(全トランス型レチノイン酸)からなる群より選択される、
方法。
[本発明1036]
少なくとも1種のエピジェネティック因子が、
(a)パノビノスタット、ボリノスタット、ロミデプシン、N-アセチルジナリン、ベリノスタット、ギビノスタット、エンチノスタット、モセチノスタット、EVP-0334、SRT501、CUDC-101、キシノスタット、アベキシノスタット、LAQ824、およびバルプロ酸からなる群より選択される、ヒストンデアセチラーゼ(HDAC)阻害剤;
(b)5-アザシチジン、デシタビン、ヒドララジン、ゼブラリン、プロカインアミド、(-)-エピガロカテキン-3-ガレート、MG98、RG108、およびSGI-110からなる群より選択される、DNAメチルトランスフェラーゼ(DNMT)I阻害剤;ならびに
(c)LSD1(KDM1A)デメチラーゼ阻害剤およびケトシンからなる群より選択される、ヒストンメチルトランスフェラーゼ(HMT)阻害剤
を含む群から選択される、本発明1035の方法。
[本発明1037]
(a)CD33標的化化合物の投与前にエピジェネティック因子が投与されるか;
(b)CD33標的化化合物の投与後にエピジェネティック因子が投与されるか;または
(c)エピジェネティック因子とCD33標的化化合物が同時に投与される、
本発明1035または1036の方法。
[本発明1038]
エピジェネティック因子の第一の用量が、CD33標的化化合物の投与の開始前に投与される、本発明1035〜1037のいずれかの方法。
[本発明1039]
エピジェネティック因子の投与が、CD33標的化化合物の投与の間中継続される、本発明1038の方法。
[本発明1040]
二重特異性構築物が、二重特異性抗体構築物である、本発明1035〜1039のいずれかの方法。
[本発明1041]
二重特異性抗体構築物が、二重特異性単鎖抗体構築物である、本発明1040の方法。
[本発明1042]
二重特異性抗体構築物が、ヒトおよびカニクイザルのCD3およびCD33に結合する、本発明1040または1041の方法。
[本発明1043]
二重特異性抗体構築物が、
・SEQ ID NO:6、24、42、60、78、96、114および132に示されるアミノ酸配列を有するVL鎖と、SEQ ID NO:1、19、37、55、73、91、109および127に示されるアミノ酸配列を有するVH鎖を含み、かつCD33に特異的に結合する第一の結合ドメイン;ならびに
・SEQ ID NO:154、157、160、163、166、169および172に示されるアミノ酸配列を有するVL鎖と、SEQ ID NO:155、158、161、164、167、170および173に示されるアミノ酸配列を有するVH鎖を含み、かつCD3に特異的に結合する第二の結合ドメイン
を含む、本発明1040〜1042のいずれかの方法。
[本発明1044]
二重特異性抗体構築物が、SEQ ID NO:13、15、17、31、33、35、49、51、53、67、69、71、85、87、89、103、105、107、121、123、125、139、141、143、148、150、152、215、217、219、221、223、225および227のいずれかに示されるアミノ酸配列を含む、本発明1043の方法。
[本発明1045]
骨髄性白血病が、急性骨髄芽球性白血病、慢性好中球性白血病、骨髄樹状細胞白血病、慢性骨髄性白血病移行期、急性骨髄単球性白血病、若年性骨髄単球性白血病、慢性骨髄単球性白血病、急性好塩基球性白血病、急性好酸球性白血病、慢性好酸球性白血病、急性巨核芽球性白血病、本態性血小板増加症、急性赤白血病、真性赤血球増加症、骨髄異形成症候群、急性汎骨髄症、骨髄肉腫、および急性混合性白血病からなる群より選択される、本発明1035〜1044のいずれかの方法。
[本発明1046]
本発明1001〜1012のいずれかの薬学的組成物、または本発明1013〜1023のいずれかのエピジェネティック因子および二重特異性CD33標的化化合物を含む、骨髄性白血病の寛解および/または治療に使用するためのキットであって、該二重特異性CD33標的化化合物が、CD33に特異的に結合する第一の結合ドメインおよびCD3に特異的に結合する第二の結合ドメインを含む、キット。
定義:
本明細書で使用される場合、単数形(「1つの」、「ある」および「その」)は、文脈が明らかにそうでないことを示していない限り、複数の参照を含むことに留意されなければならない。したがって、例えば、「1つの試薬」は、1つまたは複数のそのような異なる試薬を含み、「その方法」に対する言及は、本明細書に記載される方法を修正または置換することができる当業者に公知の等価な工程および方法に対する言及を含む。
(a)WO 2008/119567のSEQ ID NO: 27に示されるCDR-L1、WO 2008/119567のSEQ ID NO: 28に示されるCDR-L2およびWO 2008/119567のSEQ ID NO: 29に示されるCDR-L3;
(b)WO 2008/119567のSEQ ID NO: 117に示されるCDR-L1、WO 2008/119567のSEQ ID NO: 118に示されるCDR-L2およびWO 2008/119567のSEQ ID NO: 119に示されるCDR-L3;ならびに
(c)WO 2008/119567のSEQ ID NO: 153に示されるCDR-L1、WO 2008/119567のSEQ ID NO: 154に示されるCDR-L2およびWO 2008/119567のSEQ ID NO: 155に示されるCDR-L3
から選択されるCDR-L1、CDR-L2およびCDR-L3を含むVL領域を含む本明細書に記載されるCD33標的化化合物が、特に好ましい。
(a)WO 2008/119567のSEQ ID NO: 12に示されるCDR-H1、WO 2008/119567のSEQ ID NO: 13に示されるCDR-H2およびWO 2008/119567のSEQ ID NO: 14に示されるCDR-H3;
(b)WO 2008/119567のSEQ ID NO: 30に示されるCDR-H1、WO 2008/119567のSEQ ID NO: 31に示されるCDR-H2およびWO 2008/119567のSEQ ID NO: 32に示されるCDR-H3;
(c)WO 2008/119567のSEQ ID NO: 48に示されるCDR-H1、WO 2008/119567のSEQ ID NO: 49に示されるCDR-H2およびWO 2008/119567のSEQ ID NO: 50に示されるCDR-H3;
(d)WO 2008/119567のSEQ ID NO: 66に示されるCDR-H1、WO 2008/119567のSEQ ID NO: 67に示されるCDR-H2およびWO 2008/119567のSEQ ID NO: 68に示されるCDR-H3;
(e)WO 2008/119567のSEQ ID NO: 84に示されるCDR-H1、WO 2008/119567のSEQ ID NO: 85に示されるCDR-H2およびWO 2008/119567のSEQ ID NO: 86に示されるCDR-H3;
(f)WO 2008/119567のSEQ ID NO: 102に示されるCDR-H1、WO 2008/119567のSEQ ID NO: 103に示されるCDR-H2およびWO 2008/119567のSEQ ID NO: 104に示されるCDR-H3;
(g)WO 2008/119567のSEQ ID NO: 120に示されるCDR-H1、WO 2008/119567のSEQ ID NO: 121に示されるCDR-H2およびWO 2008/119567のSEQ ID NO: 122に示されるCDR-H3;
(h)WO 2008/119567のSEQ ID NO: 138に示されるCDR-H1、WO 2008/119567のSEQ ID NO: 139に示されるCDR-H2およびWO 2008/119567のSEQ ID NO: 140に示されるCDR-H3;
(i)WO 2008/119567のSEQ ID NO: 156に示されるCDR-H1、WO 2008/119567のSEQ ID NO: 157に示されるCDR-H2およびWO 2008/119567のSEQ ID NO: 158に示されるCDR-H3;ならびに
(j)WO 2008/119567のSEQ ID NO: 174に示されるCDR-H1、WO 2008/119567のSEQ ID NO: 175に示されるCDR-H2およびWO 2008/119567のSEQ ID NO: 176に示されるCDR-H3
から選択されるCDR-H1、CDR-H2およびCDR-H3を含むVH領域を含む。
(a)WO 2008/119567のSEQ ID NO: 17または21に示されるVL領域およびWO 2008/119567のSEQ ID NO: 15または19に示されるVH領域;
(b)WO 2008/119567のSEQ ID NO: 35または39に示されるVL領域およびWO 2008/119567のSEQ ID NO: 33または37に示されるVH領域;
(c)WO 2008/119567のSEQ ID NO: 53または57に示されるVL領域およびWO 2008/119567のSEQ ID NO: 51または55に示されるVH領域;
(d)WO 2008/119567のSEQ ID NO: 71または75に示されるVL領域およびWO 2008/119567のSEQ ID NO: 69または73に示されるVH領域;
(e)WO 2008/119567のSEQ ID NO: 89または93に示されるVL領域およびWO 2008/119567のSEQ ID NO: 87または91に示されるVH領域;
(f)WO 2008/119567のSEQ ID NO: 107または111に示されるVL領域およびWO 2008/119567のSEQ ID NO: 105または109に示されるVH領域;
(g)WO 2008/119567のSEQ ID NO: 125または129に示されるVL領域およびWO 2008/119567のSEQ ID NO: 123または127に示されるVH領域;
(h)WO 2008/119567のSEQ ID NO: 143または147に示されるVL領域およびWO 2008/119567のSEQ ID NO: 141または145に示されるVH領域;
(i)WO 2008/119567のSEQ ID NO: 161または165に示されるVL領域およびWO 2008/119567のSEQ ID NO: 159または163に示されるVH領域;ならびに
(j)WO 2008/119567のSEQ ID NO: 179または183に示されるVL領域およびWO 2008/119567のSEQ ID NO: 177または181に示されるVH領域;
からなる群より選択されるVL領域およびVH領域を含むT細胞CD3受容体複合体に結合できる第2の結合ドメインによって特徴づけられる。
CD33の発現レベルは、ヒトAML細胞に対するAMG330等の本明細書に記載されるCD33標的化化合物の活性範囲に対する重要な変数として同定された。したがって、AMG 330誘導性細胞毒性に対する感作物質としての、ヒストンデアセチラーゼ(HDAC)阻害剤またはDNAメチルトランスフェラーゼ(DNMT)I阻害剤等のエピジェネティック修飾薬物の可能性の観察は、驚くべきことだった。
ヒドロキシ尿素
AML細胞系におけるCD33の上方調節:
AML細胞系であるHL-60、PL21、OCI-AML3、KG1a、およびMV4-11を、0日目に1×106細胞/mlで24ウェルプレートに播種した。細胞を、未処理(UT)で放置、または10 μMのヒドロキシ尿素(H1)もしくは100 μMのヒドロキシ尿素(H2)(Sigma)で、連続3日間(0日目、1日目、および2日目)処理した。3日目に細胞を回収し、計数し、フローサイトメトリーによりCD33の表面発現レベルにおける変化を解析した。
3種類の初代AML試料を、以前に記載されたように、1×106細胞/mlで12ウェルプレートに播種した(Krupka, Subklewe et.al, Blood 2014)。細胞を、未処理(UT)で放置、または10 μMのヒドロキシ尿素(H1)もしくは100 μMのヒドロキシ尿素(H2)(Sigma)で、連続3日間(0日目、1日目、および2日目)処理した。1〜3日目に細胞を回収し、計数し、フローサイトメトリーによりCD33の表面発現レベルにおける変化を解析した。
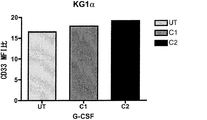
AML細胞系におけるCD33の上方調節:
AML細胞系であるOCI-AML3およびKG1αを、0日目に5×105細胞/mlで24ウェルプレートに播種した。細胞を、未処理(UT)で放置、または200 ng/mlのG-CSF(C1)もしくは2000 ng/mlのG-CSF(C2)(Peprotech)で、10日間処理した。G-CSFをバイウイークリーで(biweekly)培養物に新たに添加した。10日目に細胞を回収し、フローサイトメトリーによりCD33の表面発現レベルにおける変化を解析した。
Claims (11)
- CD33標的化化合物および少なくとも1種のエピジェネティック因子を含む、薬学的組成物であって、
(a)該CD33標的化化合物が、CD33に特異的に結合する第一の結合ドメインおよびCD3に特異的に結合する第二の結合ドメインを含む、二重特異性単鎖抗体構築物であり;かつ
(b)該少なくとも1種のエピジェネティック因子が、ヒストンデアセチラーゼ(HDAC)阻害剤パノビノスタット、DNAメチルトランスフェラーゼ(DNMT)I阻害剤5-アザシチジン、ヒドロキシ尿素、および顆粒球コロニー刺激因子(G-CSF)からなる群より選択される、
薬学的組成物。 - (a)CD33標的化化合物の投与前にエピジェネティック因子が投与されるか;
(b)CD33標的化化合物の投与後にエピジェネティック因子が投与されるか;または
(c)エピジェネティック因子とCD33標的化化合物が同時に投与される、
請求項1記載の薬学的組成物。 - エピジェネティック因子の第一の用量が、CD33標的化化合物の投与の開始前に投与される、請求項1または2記載の薬学的組成物。
- エピジェネティック因子の投与が、CD33標的化化合物の投与の間中継続される、請求項3記載の薬学的組成物。
- 二重特異性単鎖抗体構築物が、ヒトおよびカニクイザルのCD3ならびにヒトおよびカニクイザルのCD33に結合する、請求項1記載の薬学的組成物。
- 二重特異性単鎖抗体構築物が、
・SEQ ID NO:6、24、42、60、78、96、114および132からなる群より選択されるアミノ酸配列を有するVL鎖と、SEQ ID NO:1、19、37、55、73、91、109および127からなる群より選択されるアミノ酸配列を有するVH鎖を含み、かつCD33に特異的に結合する第一の結合ドメイン;ならびに
・SEQ ID NO:154、157、160、163、166、169および172からなる群より選択されるアミノ酸配列を有するVL鎖と、SEQ ID NO:155、158、161、164、167、170および173からなる群より選択されるアミノ酸配列を有するVH鎖を含み、かつCD3に特異的に結合する第二の結合ドメイン
を含む、請求項5記載の薬学的組成物。 - 二重特異性単鎖抗体構築物が、SEQ ID NO:13、15、17、31、33、35、49、51、53、67、69、71、85、87、89、103、105、107、121、123、125、139、141、143、148、150、152、215、217、219、221、223、225および227のいずれかに示されるアミノ酸配列を含む、請求項6記載の薬学的組成物。
- 骨髄性白血病を治療するための請求項1〜7のいずれか一項記載の薬学的組成物。
- 骨髄性白血病が、急性骨髄芽球性白血病、慢性好中球性白血病、骨髄樹状細胞白血病、慢性骨髄性白血病移行期、急性骨髄単球性白血病、若年性骨髄単球性白血病、慢性骨髄単球性白血病、急性好塩基球性白血病、急性好酸球性白血病、慢性好酸球性白血病、急性巨核芽球性白血病、本態性血小板増加症、急性赤白血病、真性赤血球増加症、骨髄異形成症候群、急性汎骨髄症、骨髄肉腫、および急性混合性白血病からなる群より選択される、請求項8記載の薬学的組成物。
- 骨髄性白血病の寛解および/または治療剤の製造における、CD33標的化化合物に対する患者の応答性を増加させるエピジェネティック因子の使用であって、
(a)該CD33標的化化合物が、CD33に特異的に結合する第一の結合ドメインおよびCD3に特異的に結合する第二の結合ドメインを含む、二重特異性単鎖抗体構築物であり;かつ
(b)少なくとも1種のエピジェネティック因子が、ヒストンデアセチラーゼ(HDAC)阻害剤パノビノスタット、DNAメチルトランスフェラーゼ(DNMT)I阻害剤5-アザシチジン、ヒドロキシ尿素、および顆粒球コロニー刺激因子(G-CSF)からなる群より選択される、
使用。 - 請求項1〜9のいずれか一項記載の薬学的組成物、または請求項10に規定のエピジェネティック因子および二重特異性CD33標的化化合物を含む、骨髄性白血病の寛解および/または治療に使用するためのキットであって、該二重特異性CD33標的化化合物が、CD33に特異的に結合する第一の結合ドメインおよびCD3に特異的に結合する第二の結合ドメインを含む、キット。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201361877714P | 2013-09-13 | 2013-09-13 | |
| US61/877,714 | 2013-09-13 | ||
| PCT/EP2014/069575 WO2015036583A2 (en) | 2013-09-13 | 2014-09-15 | Combination of epigenetic factors and bispecific compounds targeting cd33 and cd3 in the treatment of myeloid leukemia |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2016536341A JP2016536341A (ja) | 2016-11-24 |
| JP2016536341A5 JP2016536341A5 (ja) | 2017-10-12 |
| JP6530409B2 true JP6530409B2 (ja) | 2019-06-12 |
Family
ID=51690351
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2016542329A Active JP6530409B2 (ja) | 2013-09-13 | 2014-09-15 | 骨髄性白血病の治療におけるエピジェネティック因子ならびにcd33およびcd3を標的化する二重特異性化合物の組み合わせ |
Country Status (28)
| Country | Link |
|---|---|
| US (1) | US10933132B2 (ja) |
| EP (1) | EP3043794B1 (ja) |
| JP (1) | JP6530409B2 (ja) |
| KR (1) | KR102366470B1 (ja) |
| CN (2) | CN111888474A (ja) |
| AP (1) | AP2016009132A0 (ja) |
| AR (1) | AR097648A1 (ja) |
| AU (2) | AU2014320246B2 (ja) |
| CA (1) | CA2923354C (ja) |
| CL (1) | CL2016000564A1 (ja) |
| DK (1) | DK3043794T3 (ja) |
| EA (1) | EA036476B1 (ja) |
| HK (1) | HK1225975A1 (ja) |
| HU (1) | HUE056867T2 (ja) |
| IL (1) | IL278527B (ja) |
| JO (1) | JO3597B1 (ja) |
| LT (1) | LT3043794T (ja) |
| MA (2) | MA46164B1 (ja) |
| MX (1) | MX2016003197A (ja) |
| MY (1) | MY185611A (ja) |
| NZ (1) | NZ716448A (ja) |
| PH (1) | PH12016500434B1 (ja) |
| SG (2) | SG10201801777YA (ja) |
| SI (1) | SI3043794T1 (ja) |
| TW (1) | TWI688401B (ja) |
| UA (1) | UA123199C2 (ja) |
| WO (1) | WO2015036583A2 (ja) |
| ZA (1) | ZA201600528B (ja) |
Families Citing this family (32)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US9212225B1 (en) * | 2014-07-01 | 2015-12-15 | Amphivena Therapeutics, Inc. | Bispecific CD33 and CD3 binding proteins |
| CN114652827A (zh) | 2015-05-29 | 2022-06-24 | 安普希韦纳治疗公司 | 双特异性cd33和cd3结合蛋白质的使用方法 |
| TWI829617B (zh) | 2015-07-31 | 2024-01-21 | 德商安美基研究(慕尼黑)公司 | Flt3及cd3抗體構築體 |
| TWI796283B (zh) | 2015-07-31 | 2023-03-21 | 德商安美基研究(慕尼黑)公司 | Msln及cd3抗體構築體 |
| JO3620B1 (ar) | 2015-08-05 | 2020-08-27 | Amgen Res Munich Gmbh | مثبطات نقطة فحص مناعية للاستخدام في علاج سرطانات محمولة عبر الدم |
| WO2017102908A1 (en) * | 2015-12-16 | 2017-06-22 | F. Hoffmann-La Roche Ag | Improved recombinant production method |
| TWI797073B (zh) * | 2016-01-25 | 2023-04-01 | 德商安美基研究(慕尼黑)公司 | 包含雙特異性抗體建構物之醫藥組合物 |
| EA039859B1 (ru) * | 2016-02-03 | 2022-03-21 | Эмджен Рисерч (Мюник) Гмбх | Биспецифические конструкты антител, связывающие egfrviii и cd3 |
| JOP20170091B1 (ar) * | 2016-04-19 | 2021-08-17 | Amgen Res Munich Gmbh | إعطاء تركيبة ثنائية النوعية ترتبط بـ cd33 وcd3 للاستخدام في طريقة لعلاج اللوكيميا النخاعية |
| BR112019019597A2 (pt) * | 2017-03-20 | 2020-04-14 | Vaccinex Inc | tratamento de câncer com um anticorpo anti-semaforina- 4d em combinação com um agente de modulação epigenética |
| WO2019103531A1 (ko) * | 2017-11-24 | 2019-05-31 | 충북대학교 산학협력단 | 항-icam4 항체 및 icam4 발현 세포와 관련된 질병의 진단 및 치료용 조성물 |
| KR102090407B1 (ko) * | 2017-11-24 | 2020-03-17 | 충북대학교 산학협력단 | 항-icam4 항체 및 icam4 발현 세포와 관련된 질병의 진단 및 치료용 조성물 |
| US11597933B2 (en) | 2017-11-29 | 2023-03-07 | The Trustees Of Columbia University In The City Of New York | Combination therapy of lymphoma |
| JOP20190116A1 (ar) | 2018-05-24 | 2019-11-24 | Janssen Biotech Inc | الأجسام المضادة لتكتل التمايز 33 (cd33)، والأجسام المضادة ثنائية النوعية لتكتل التمايز 33 (cd33)/تكتل التمايز 3 (cd3) واستخداماتها |
| WO2020025532A1 (en) * | 2018-07-30 | 2020-02-06 | Amgen Research (Munich) Gmbh | Prolonged administration of a bispecific antibody construct binding to cd33 and cd3 |
| US20220098613A1 (en) | 2018-09-12 | 2022-03-31 | Fred Hutchinson Cancer Research Center | Reducing cd33 expression to selectively protect therapeutic cells |
| CN113045664B (zh) | 2019-11-28 | 2023-05-12 | 尚健单抗(北京)生物技术有限公司 | 一种分离的结合抗原axl的蛋白及其用途 |
| JP2023506458A (ja) | 2019-12-09 | 2023-02-16 | 北京中因科技有限公司 | 医薬の製造におけるCYP4V2およびRdCVFの使用 |
| CN112079934B (zh) | 2019-12-17 | 2021-01-29 | 合源生物科技(天津)有限公司 | 一种靶向cd19的嵌合抗原受体及其用途 |
| CN115003802A (zh) | 2020-01-02 | 2022-09-02 | 宁波茂行生物医药科技有限公司 | 一种经修饰的免疫效应细胞及其制备方法 |
| CN113481165B (zh) * | 2020-07-16 | 2022-06-03 | 山东博安生物技术股份有限公司 | 分泌双特异性t细胞衔接子的car-t及治疗实体肿瘤的应用 |
| CN111733174B (zh) | 2020-08-07 | 2021-02-09 | 北京大学第三医院(北京大学第三临床医学院) | 一种分离的核酸分子及其用途 |
| TW202222840A (zh) | 2020-12-11 | 2022-06-16 | 大陸商上海華奧泰生物藥業股份有限公司 | Cd73的抗原結合蛋白及其應用 |
| KR20230147616A (ko) | 2021-01-11 | 2023-10-23 | 스타맵 바이오로직스 (쑤저우) 씨오., 엘티디 | 황색포도상구균 α-독소를 표적으로 하는 항원 결합단백질 및 이의 응용 |
| KR20230132511A (ko) | 2021-01-13 | 2023-09-15 | 상하이 후아오타 바이오파마슈티컬 컴퍼니 리미티드 | Cd73에 결합하는 단백질 및 이의 용도 |
| CN112630438B (zh) * | 2021-03-08 | 2021-06-22 | 信纳克(北京)生化标志物检测医学研究有限责任公司 | 抗体组合物及其筛查髓系疾病及检测免疫检查点的应用 |
| JP2024513746A (ja) | 2021-03-22 | 2024-03-27 | 星濟生物(蘇州)有限公司 | ニューモリシンを標的とした抗原結合たんぱく質およびその応用 |
| KR20230166096A (ko) | 2021-04-02 | 2023-12-06 | 오리셀 테라퓨틱스 컴퍼니 리미티드 | Cldn18.2 항원 결합 단백질 및 이의 적용 |
| CN113533729A (zh) * | 2021-06-15 | 2021-10-22 | 北京大学人民医院 | 一种鉴定aml患者骨髓中nk细胞耗竭的研究方法及其应用 |
| CN115612674A (zh) | 2021-07-14 | 2023-01-17 | 上海荣瑞医药科技有限公司 | 一种溶瘤病毒及其用途 |
| CN113461821B (zh) * | 2021-09-03 | 2021-12-28 | 苏州近岸蛋白质科技股份有限公司 | 抗cd3人源化抗体 |
| CN114908087B (zh) * | 2022-05-07 | 2024-01-23 | 四川大学华西医院 | 一种长循环肾靶向细胞外囊泡的构建及其应用 |
Family Cites Families (68)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3773919A (en) | 1969-10-23 | 1973-11-20 | Du Pont | Polylactide-drug mixtures |
| US3691016A (en) | 1970-04-17 | 1972-09-12 | Monsanto Co | Process for the preparation of insoluble enzymes |
| CA1023287A (en) | 1972-12-08 | 1977-12-27 | Boehringer Mannheim G.M.B.H. | Process for the preparation of carrier-bound proteins |
| US4179337A (en) | 1973-07-20 | 1979-12-18 | Davis Frank F | Non-immunogenic polypeptides |
| US4195128A (en) | 1976-05-03 | 1980-03-25 | Bayer Aktiengesellschaft | Polymeric carrier bound ligands |
| US4330440A (en) | 1977-02-08 | 1982-05-18 | Development Finance Corporation Of New Zealand | Activated matrix and method of activation |
| CA1093991A (en) | 1977-02-17 | 1981-01-20 | Hideo Hirohara | Enzyme immobilization with pullulan gel |
| US4229537A (en) | 1978-02-09 | 1980-10-21 | New York University | Preparation of trichloro-s-triazine activated supports for coupling ligands |
| US4263428A (en) | 1978-03-24 | 1981-04-21 | The Regents Of The University Of California | Bis-anthracycline nucleic acid function inhibitors and improved method for administering the same |
| JPS6023084B2 (ja) | 1979-07-11 | 1985-06-05 | 味の素株式会社 | 代用血液 |
| IE52535B1 (en) | 1981-02-16 | 1987-12-09 | Ici Plc | Continuous release pharmaceutical compositions |
| US4475196A (en) | 1981-03-06 | 1984-10-02 | Zor Clair G | Instrument for locating faults in aircraft passenger reading light and attendant call control system |
| US4447233A (en) | 1981-04-10 | 1984-05-08 | Parker-Hannifin Corporation | Medication infusion pump |
| US4485045A (en) | 1981-07-06 | 1984-11-27 | Research Corporation | Synthetic phosphatidyl cholines useful in forming liposomes |
| US4640835A (en) | 1981-10-30 | 1987-02-03 | Nippon Chemiphar Company, Ltd. | Plasminogen activator derivatives |
| EP0088046B1 (de) | 1982-02-17 | 1987-12-09 | Ciba-Geigy Ag | Lipide in wässriger Phase |
| US4439196A (en) | 1982-03-18 | 1984-03-27 | Merck & Co., Inc. | Osmotic drug delivery system |
| US4447224A (en) | 1982-09-20 | 1984-05-08 | Infusaid Corporation | Variable flow implantable infusion apparatus |
| US4487603A (en) | 1982-11-26 | 1984-12-11 | Cordis Corporation | Implantable microinfusion pump system |
| US4816567A (en) | 1983-04-08 | 1989-03-28 | Genentech, Inc. | Recombinant immunoglobin preparations |
| US4486194A (en) | 1983-06-08 | 1984-12-04 | James Ferrara | Therapeutic device for administering medicaments through the skin |
| US4544545A (en) | 1983-06-20 | 1985-10-01 | Trustees University Of Massachusetts | Liposomes containing modified cholesterol for organ targeting |
| HUT35524A (en) | 1983-08-02 | 1985-07-29 | Hoechst Ag | Process for preparing pharmaceutical compositions containing regulatory /regulative/ peptides providing for the retarded release of the active substance |
| EP0143949B1 (en) | 1983-11-01 | 1988-10-12 | TERUMO KABUSHIKI KAISHA trading as TERUMO CORPORATION | Pharmaceutical composition containing urokinase |
| US4496689A (en) | 1983-12-27 | 1985-01-29 | Miles Laboratories, Inc. | Covalently attached complex of alpha-1-proteinase inhibitor with a water soluble polymer |
| US4879231A (en) | 1984-10-30 | 1989-11-07 | Phillips Petroleum Company | Transformation of yeasts of the genus pichia |
| US4596556A (en) | 1985-03-25 | 1986-06-24 | Bioject, Inc. | Hypodermic injection apparatus |
| US4751180A (en) | 1985-03-28 | 1988-06-14 | Chiron Corporation | Expression using fused genes providing for protein product |
| DE3675588D1 (de) | 1985-06-19 | 1990-12-20 | Ajinomoto Kk | Haemoglobin, das an ein poly(alkenylenoxid) gebunden ist. |
| US4935233A (en) | 1985-12-02 | 1990-06-19 | G. D. Searle And Company | Covalently linked polypeptide cell modulators |
| JPS63502716A (ja) | 1986-03-07 | 1988-10-13 | マサチューセッツ・インステチュート・オブ・テクノロジー | 糖タンパク安定性の強化方法 |
| GB8610600D0 (en) | 1986-04-30 | 1986-06-04 | Novo Industri As | Transformation of trichoderma |
| US4791192A (en) | 1986-06-26 | 1988-12-13 | Takeda Chemical Industries, Ltd. | Chemically modified protein with polyethyleneglycol |
| US4946778A (en) | 1987-09-21 | 1990-08-07 | Genex Corporation | Single polypeptide chain binding molecules |
| EP0307434B2 (en) | 1987-03-18 | 1998-07-29 | Scotgen Biopharmaceuticals, Inc. | Altered antibodies |
| DE3856559T2 (de) | 1987-05-21 | 2004-04-29 | Micromet Ag | Multifunktionelle Proteine mit vorbestimmter Zielsetzung |
| US4790824A (en) | 1987-06-19 | 1988-12-13 | Bioject, Inc. | Non-invasive hypodermic injection device |
| US4941880A (en) | 1987-06-19 | 1990-07-17 | Bioject, Inc. | Pre-filled ampule and non-invasive hypodermic injection device assembly |
| EP0402226A1 (en) | 1989-06-06 | 1990-12-12 | Institut National De La Recherche Agronomique | Transformation vectors for yeast yarrowia |
| US5683888A (en) | 1989-07-22 | 1997-11-04 | University Of Wales College Of Medicine | Modified bioluminescent proteins and their use |
| US5013556A (en) | 1989-10-20 | 1991-05-07 | Liposome Technology, Inc. | Liposomes with enhanced circulation time |
| US5312335A (en) | 1989-11-09 | 1994-05-17 | Bioject Inc. | Needleless hypodermic injection device |
| US5064413A (en) | 1989-11-09 | 1991-11-12 | Bioject, Inc. | Needleless hypodermic injection device |
| US5292658A (en) | 1989-12-29 | 1994-03-08 | University Of Georgia Research Foundation, Inc. Boyd Graduate Studies Research Center | Cloning and expressions of Renilla luciferase |
| DE69131780T2 (de) | 1991-03-11 | 2000-11-16 | Univ Georgia Res Foundation At | Klonierung und expression der luziferase aus renilla |
| US5565332A (en) | 1991-09-23 | 1996-10-15 | Medical Research Council | Production of chimeric antibodies - a combinatorial approach |
| WO1993015722A1 (en) | 1992-02-07 | 1993-08-19 | Syntex (Usa) Inc. | Controlled delivery of pharmaceuticals from preformed porous microparticles |
| US5383851A (en) | 1992-07-24 | 1995-01-24 | Bioject Inc. | Needleless hypodermic injection device |
| WO1994010308A1 (en) | 1992-10-23 | 1994-05-11 | Immunex Corporation | Methods of preparing soluble, oligomeric proteins |
| US6146826A (en) | 1993-09-10 | 2000-11-14 | The Trustees Of Columbia University In The City Of New York | Green fluorescent protein |
| WO1995021191A1 (en) | 1994-02-04 | 1995-08-10 | William Ward | Bioluminescent indicator based upon the expression of a gene for a modified green-fluorescent protein |
| US6214388B1 (en) | 1994-11-09 | 2001-04-10 | The Regents Of The University Of California | Immunoliposomes that optimize internalization into target cells |
| US5777079A (en) | 1994-11-10 | 1998-07-07 | The Regents Of The University Of California | Modified green fluorescent proteins |
| US5874304A (en) | 1996-01-18 | 1999-02-23 | University Of Florida Research Foundation, Inc. | Humanized green fluorescent protein genes and methods |
| US5804387A (en) | 1996-02-01 | 1998-09-08 | The Board Of Trustees Of The Leland Stanford Junior University | FACS-optimized mutants of the green fluorescent protein (GFP) |
| US5876995A (en) | 1996-02-06 | 1999-03-02 | Bryan; Bruce | Bioluminescent novelty items |
| US5925558A (en) | 1996-07-16 | 1999-07-20 | The Regents Of The University Of California | Assays for protein kinases using fluorescent protein substrates |
| US5976796A (en) | 1996-10-04 | 1999-11-02 | Loma Linda University | Construction and expression of renilla luciferase and green fluorescent protein fusion genes |
| ATE290205T1 (de) | 1996-12-12 | 2005-03-15 | Prolume Ltd | Vorrichtung und verfahren zum nachweis und identifizieren von infektiösen wirkstoffen |
| JP2002507410A (ja) | 1998-03-27 | 2002-03-12 | プロルーム・リミテッド | ルシフェラーゼ、蛍光タンパク質、ルシフェラーゼおよび蛍光タンパク質をコードする核酸および、診断、高処理スクリーニングおよび新規アイテムにおけるその使用 |
| ATE244758T1 (de) | 1998-04-21 | 2003-07-15 | Micromet Ag | Cd19xcd3 spezifische polypeptide und deren verwendung |
| US20050025823A1 (en) * | 2003-07-29 | 2005-02-03 | Fong Andy A.T. | Methods of use of herbal compositions |
| JP2008543839A (ja) | 2005-06-14 | 2008-12-04 | アムジェン インコーポレーテッド | 自己緩衝タンパク質製剤 |
| DK1940881T3 (en) | 2005-10-11 | 2017-02-20 | Amgen Res (Munich) Gmbh | COMPOSITIONS WITH ARTICLE CROSS-SPECIFIC ANTIBODIES AND APPLICATIONS THEREOF |
| JP2010509234A (ja) * | 2006-11-02 | 2010-03-25 | シアトル ジェネティックス, インコーポレイテッド | 新生物疾患、自己免疫疾患および炎症性疾患を処置する方法 |
| RU2561457C2 (ru) | 2007-04-03 | 2015-08-27 | Эмджен Рисерч (Мьюник) Гмбх | Cd3-эпсилон-связывающий домен с межвидовой специфичностью |
| UA112062C2 (uk) * | 2010-10-04 | 2016-07-25 | Бьорінгер Інгельхайм Інтернаціональ Гмбх | Cd33-зв'язувальний агент |
| US9300829B2 (en) | 2014-04-04 | 2016-03-29 | Canon Kabushiki Kaisha | Image reading apparatus and correction method thereof |
-
2014
- 2014-09-12 AR ARP140103413A patent/AR097648A1/es unknown
- 2014-09-12 TW TW103131571A patent/TWI688401B/zh active
- 2014-09-14 JO JOP/2014/0268A patent/JO3597B1/ar active
- 2014-09-15 US US14/916,201 patent/US10933132B2/en active Active
- 2014-09-15 MY MYPI2016700856A patent/MY185611A/en unknown
- 2014-09-15 EA EA201690485A patent/EA036476B1/ru not_active IP Right Cessation
- 2014-09-15 IL IL278527A patent/IL278527B/en unknown
- 2014-09-15 SI SI201431891T patent/SI3043794T1/sl unknown
- 2014-09-15 WO PCT/EP2014/069575 patent/WO2015036583A2/en active Application Filing
- 2014-09-15 UA UAA201600619A patent/UA123199C2/uk unknown
- 2014-09-15 AU AU2014320246A patent/AU2014320246B2/en active Active
- 2014-09-15 SG SG10201801777YA patent/SG10201801777YA/en unknown
- 2014-09-15 NZ NZ716448A patent/NZ716448A/en unknown
- 2014-09-15 KR KR1020167008346A patent/KR102366470B1/ko active IP Right Grant
- 2014-09-15 MA MA46164A patent/MA46164B1/fr unknown
- 2014-09-15 DK DK14783554.0T patent/DK3043794T3/da active
- 2014-09-15 EP EP14783554.0A patent/EP3043794B1/en active Active
- 2014-09-15 HU HUE14783554A patent/HUE056867T2/hu unknown
- 2014-09-15 CA CA2923354A patent/CA2923354C/en active Active
- 2014-09-15 MX MX2016003197A patent/MX2016003197A/es unknown
- 2014-09-15 LT LTEPPCT/EP2014/069575T patent/LT3043794T/lt unknown
- 2014-09-15 CN CN202010532460.4A patent/CN111888474A/zh active Pending
- 2014-09-15 JP JP2016542329A patent/JP6530409B2/ja active Active
- 2014-09-15 SG SG11201600671QA patent/SG11201600671QA/en unknown
- 2014-09-15 CN CN201480061643.5A patent/CN105764505A/zh active Pending
- 2014-09-15 AP AP2016009132A patent/AP2016009132A0/en unknown
-
2016
- 2016-01-25 ZA ZA2016/00528A patent/ZA201600528B/en unknown
- 2016-03-07 PH PH12016500434A patent/PH12016500434B1/en unknown
- 2016-03-09 MA MA38898A patent/MA38898A1/fr unknown
- 2016-03-10 CL CL2016000564A patent/CL2016000564A1/es unknown
- 2016-12-16 HK HK16114358A patent/HK1225975A1/zh unknown
-
2020
- 2020-04-20 AU AU2020202641A patent/AU2020202641A1/en not_active Abandoned
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6530409B2 (ja) | 骨髄性白血病の治療におけるエピジェネティック因子ならびにcd33およびcd3を標的化する二重特異性化合物の組み合わせ | |
| JP6880100B2 (ja) | Cdh19およびcd3に対する抗体構築物 | |
| US20200040099A1 (en) | Single chain binding molecules comprising N-terminal ABP | |
| JP7170532B2 (ja) | 血液由来のがんの治療における使用を目的とする免疫チェックポイント阻害物質 | |
| JP6879998B2 (ja) | Cd70及びcd3に対する抗体構築物 | |
| JP7011574B2 (ja) | Flt3及びcd3に対する抗体構築物 | |
| JP6726168B2 (ja) | Cdh19およびcd3に対する抗体コンストラクト | |
| JP6907124B2 (ja) | Cdh3及びcd3に対する二重特異性抗体構築物 | |
| JP2018531215A6 (ja) | 血液由来のがんの治療における使用を目的とする免疫チェックポイント阻害物質 | |
| JP2018524997A (ja) | Egfrviii及びcd3に結合する二重特異性抗体構築物 | |
| CN111630067B (zh) | 针对muc17和cd3的双特异性抗体构建体 | |
| US9505849B2 (en) | Antibody constructs for influenza M2 and CD3 | |
| JP2022512636A (ja) | 二重特異性抗体コンストラクトの下流プロセシング |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20170831 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20170831 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20181004 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20181221 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20190403 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20190417 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20190516 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 6530409 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |