JP3894795B2 - ヒト細胞株における組換え血液凝固因子の製造 - Google Patents
ヒト細胞株における組換え血液凝固因子の製造 Download PDFInfo
- Publication number
- JP3894795B2 JP3894795B2 JP2001569351A JP2001569351A JP3894795B2 JP 3894795 B2 JP3894795 B2 JP 3894795B2 JP 2001569351 A JP2001569351 A JP 2001569351A JP 2001569351 A JP2001569351 A JP 2001569351A JP 3894795 B2 JP3894795 B2 JP 3894795B2
- Authority
- JP
- Japan
- Prior art keywords
- factor viii
- factor
- vector
- mutein
- viii mutein
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Lifetime
Links
- 239000003114 blood coagulation factor Substances 0.000 title claims abstract description 39
- 210000005260 human cell Anatomy 0.000 title claims abstract description 26
- 238000004519 manufacturing process Methods 0.000 title claims abstract description 22
- 108010054218 Factor VIII Proteins 0.000 claims abstract description 110
- 102000001690 Factor VIII Human genes 0.000 claims abstract description 110
- 229960000301 factor viii Drugs 0.000 claims abstract description 109
- 239000013598 vector Substances 0.000 claims abstract description 80
- 108091028043 Nucleic acid sequence Proteins 0.000 claims abstract description 34
- 238000000034 method Methods 0.000 claims abstract description 31
- 208000009292 Hemophilia A Diseases 0.000 claims abstract description 20
- 208000031220 Hemophilia Diseases 0.000 claims abstract description 18
- 239000008194 pharmaceutical composition Substances 0.000 claims abstract description 11
- 239000003814 drug Substances 0.000 claims abstract description 10
- 230000006490 viral transcription Effects 0.000 claims abstract description 9
- 108091006088 activator proteins Proteins 0.000 claims abstract description 8
- 210000004027 cell Anatomy 0.000 claims description 55
- 108090000623 proteins and genes Proteins 0.000 claims description 44
- 230000035772 mutation Effects 0.000 claims description 23
- 125000000539 amino acid group Chemical group 0.000 claims description 16
- 108010047303 von Willebrand Factor Proteins 0.000 claims description 16
- 102100036537 von Willebrand factor Human genes 0.000 claims description 16
- 229960001134 von willebrand factor Drugs 0.000 claims description 16
- 108090000765 processed proteins & peptides Proteins 0.000 claims description 15
- 241000700605 Viruses Species 0.000 claims description 13
- 238000012546 transfer Methods 0.000 claims description 13
- 230000002779 inactivation Effects 0.000 claims description 12
- 101000911390 Homo sapiens Coagulation factor VIII Proteins 0.000 claims description 11
- 150000001413 amino acids Chemical class 0.000 claims description 11
- 102100026735 Coagulation factor VIII Human genes 0.000 claims description 7
- 108020004414 DNA Proteins 0.000 claims description 6
- 238000012258 culturing Methods 0.000 claims description 6
- 239000001963 growth medium Substances 0.000 claims description 6
- 239000000427 antigen Substances 0.000 claims description 5
- 108091007433 antigens Proteins 0.000 claims description 5
- 102000036639 antigens Human genes 0.000 claims description 5
- 210000004185 liver Anatomy 0.000 claims description 5
- FWMNVWWHGCHHJJ-SKKKGAJSSA-N 4-amino-1-[(2r)-6-amino-2-[[(2r)-2-[[(2r)-2-[[(2r)-2-amino-3-phenylpropanoyl]amino]-3-phenylpropanoyl]amino]-4-methylpentanoyl]amino]hexanoyl]piperidine-4-carboxylic acid Chemical compound C([C@H](C(=O)N[C@H](CC(C)C)C(=O)N[C@H](CCCCN)C(=O)N1CCC(N)(CC1)C(O)=O)NC(=O)[C@H](N)CC=1C=CC=CC=1)C1=CC=CC=C1 FWMNVWWHGCHHJJ-SKKKGAJSSA-N 0.000 claims description 4
- 230000002378 acidificating effect Effects 0.000 claims description 4
- 230000007935 neutral effect Effects 0.000 claims description 4
- 230000001105 regulatory effect Effects 0.000 claims description 4
- 210000003292 kidney cell Anatomy 0.000 claims description 3
- 201000003542 Factor VIII deficiency Diseases 0.000 claims description 2
- 230000002496 gastric effect Effects 0.000 claims description 2
- 210000003734 kidney Anatomy 0.000 claims description 2
- 210000004072 lung Anatomy 0.000 claims description 2
- 210000004165 myocardium Anatomy 0.000 claims description 2
- 210000001672 ovary Anatomy 0.000 claims description 2
- 210000002460 smooth muscle Anatomy 0.000 claims description 2
- 210000003932 urinary bladder Anatomy 0.000 claims description 2
- 125000003275 alpha amino acid group Chemical group 0.000 claims 2
- 239000003550 marker Substances 0.000 claims 1
- 102100022641 Coagulation factor IX Human genes 0.000 abstract description 38
- 108010076282 Factor IX Proteins 0.000 abstract description 37
- 229960004222 factor ix Drugs 0.000 abstract description 34
- 230000003612 virological effect Effects 0.000 abstract description 18
- 102000015081 Blood Coagulation Factors Human genes 0.000 description 21
- 108010039209 Blood Coagulation Factors Proteins 0.000 description 21
- 230000014509 gene expression Effects 0.000 description 21
- 102000004169 proteins and genes Human genes 0.000 description 21
- 239000012634 fragment Substances 0.000 description 19
- 235000018102 proteins Nutrition 0.000 description 19
- 101710195626 Transcriptional activator protein Proteins 0.000 description 12
- 229940019700 blood coagulation factors Drugs 0.000 description 11
- 238000002965 ELISA Methods 0.000 description 9
- 102000004190 Enzymes Human genes 0.000 description 9
- 108090000790 Enzymes Proteins 0.000 description 9
- 229930003448 Vitamin K Natural products 0.000 description 9
- 230000000694 effects Effects 0.000 description 9
- 229940088598 enzyme Drugs 0.000 description 9
- 239000002609 medium Substances 0.000 description 9
- SHUZOJHMOBOZST-UHFFFAOYSA-N phylloquinone Natural products CC(C)CCCCC(C)CCC(C)CCCC(=CCC1=C(C)C(=O)c2ccccc2C1=O)C SHUZOJHMOBOZST-UHFFFAOYSA-N 0.000 description 9
- 238000002360 preparation method Methods 0.000 description 9
- 102000004196 processed proteins & peptides Human genes 0.000 description 9
- 235000019168 vitamin K Nutrition 0.000 description 9
- 239000011712 vitamin K Substances 0.000 description 9
- 150000003721 vitamin K derivatives Chemical class 0.000 description 9
- 229940046010 vitamin k Drugs 0.000 description 9
- 230000035602 clotting Effects 0.000 description 8
- 229920001184 polypeptide Polymers 0.000 description 8
- 238000000746 purification Methods 0.000 description 8
- 238000001890 transfection Methods 0.000 description 7
- 238000003556 assay Methods 0.000 description 6
- 239000000872 buffer Substances 0.000 description 6
- 238000006243 chemical reaction Methods 0.000 description 6
- 239000000706 filtrate Substances 0.000 description 6
- PEDCQBHIVMGVHV-UHFFFAOYSA-N glycerol group Chemical group OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 6
- 238000011534 incubation Methods 0.000 description 6
- 239000006228 supernatant Substances 0.000 description 6
- 102000002260 Alkaline Phosphatase Human genes 0.000 description 5
- 108020004774 Alkaline Phosphatase Proteins 0.000 description 5
- 206010053567 Coagulopathies Diseases 0.000 description 5
- 238000010367 cloning Methods 0.000 description 5
- 239000002299 complementary DNA Substances 0.000 description 5
- 238000001514 detection method Methods 0.000 description 5
- 230000029087 digestion Effects 0.000 description 5
- 208000015181 infectious disease Diseases 0.000 description 5
- 210000004962 mammalian cell Anatomy 0.000 description 5
- 239000013612 plasmid Substances 0.000 description 5
- 229920000136 polysorbate Polymers 0.000 description 5
- 230000002797 proteolythic effect Effects 0.000 description 5
- 239000000243 solution Substances 0.000 description 5
- 238000013518 transcription Methods 0.000 description 5
- 230000035897 transcription Effects 0.000 description 5
- 108020004638 Circular DNA Proteins 0.000 description 4
- 239000006144 Dulbecco’s modified Eagle's medium Substances 0.000 description 4
- 230000004913 activation Effects 0.000 description 4
- 239000001506 calcium phosphate Substances 0.000 description 4
- 229910000389 calcium phosphate Inorganic materials 0.000 description 4
- 230000002950 deficient Effects 0.000 description 4
- 238000012217 deletion Methods 0.000 description 4
- 230000037430 deletion Effects 0.000 description 4
- 102000057593 human F8 Human genes 0.000 description 4
- 239000012678 infectious agent Substances 0.000 description 4
- 230000002458 infectious effect Effects 0.000 description 4
- 238000012986 modification Methods 0.000 description 4
- 238000005406 washing Methods 0.000 description 4
- XMTQQYYKAHVGBJ-UHFFFAOYSA-N 3-(3,4-DICHLOROPHENYL)-1,1-DIMETHYLUREA Chemical compound CN(C)C(=O)NC1=CC=C(Cl)C(Cl)=C1 XMTQQYYKAHVGBJ-UHFFFAOYSA-N 0.000 description 3
- 108010024878 Adenovirus E1A Proteins Proteins 0.000 description 3
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 3
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 3
- 102000003886 Glycoproteins Human genes 0.000 description 3
- 108090000288 Glycoproteins Proteins 0.000 description 3
- 101000823435 Homo sapiens Coagulation factor IX Proteins 0.000 description 3
- 108700026244 Open Reading Frames Proteins 0.000 description 3
- 230000023555 blood coagulation Effects 0.000 description 3
- 235000011010 calcium phosphates Nutrition 0.000 description 3
- 238000004113 cell culture Methods 0.000 description 3
- 239000013024 dilution buffer Substances 0.000 description 3
- 230000013595 glycosylation Effects 0.000 description 3
- 238000006206 glycosylation reaction Methods 0.000 description 3
- 230000003993 interaction Effects 0.000 description 3
- 230000004048 modification Effects 0.000 description 3
- 239000000047 product Substances 0.000 description 3
- 238000003259 recombinant expression Methods 0.000 description 3
- 238000011160 research Methods 0.000 description 3
- 238000006467 substitution reaction Methods 0.000 description 3
- 239000000758 substrate Substances 0.000 description 3
- 230000001225 therapeutic effect Effects 0.000 description 3
- 230000014616 translation Effects 0.000 description 3
- QORWJWZARLRLPR-UHFFFAOYSA-H tricalcium bis(phosphate) Chemical compound [Ca+2].[Ca+2].[Ca+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O QORWJWZARLRLPR-UHFFFAOYSA-H 0.000 description 3
- 102000002110 C2 domains Human genes 0.000 description 2
- 108050009459 C2 domains Proteins 0.000 description 2
- 241000283707 Capra Species 0.000 description 2
- 101001091269 Escherichia coli Hygromycin-B 4-O-kinase Proteins 0.000 description 2
- HTTJABKRGRZYRN-UHFFFAOYSA-N Heparin Chemical compound OC1C(NC(=O)C)C(O)OC(COS(O)(=O)=O)C1OC1C(OS(O)(=O)=O)C(O)C(OC2C(C(OS(O)(=O)=O)C(OC3C(C(O)C(O)C(O3)C(O)=O)OS(O)(=O)=O)C(CO)O2)NS(O)(=O)=O)C(C(O)=O)O1 HTTJABKRGRZYRN-UHFFFAOYSA-N 0.000 description 2
- GRRNUXAQVGOGFE-UHFFFAOYSA-N Hygromycin-B Natural products OC1C(NC)CC(N)C(O)C1OC1C2OC3(C(C(O)C(O)C(C(N)CO)O3)O)OC2C(O)C(CO)O1 GRRNUXAQVGOGFE-UHFFFAOYSA-N 0.000 description 2
- RJKFOVLPORLFTN-LEKSSAKUSA-N Progesterone Chemical compound C1CC2=CC(=O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@H](C(=O)C)[C@@]1(C)CC2 RJKFOVLPORLFTN-LEKSSAKUSA-N 0.000 description 2
- 108010076504 Protein Sorting Signals Proteins 0.000 description 2
- 102000007056 Recombinant Fusion Proteins Human genes 0.000 description 2
- 108010008281 Recombinant Fusion Proteins Proteins 0.000 description 2
- CDBYLPFSWZWCQE-UHFFFAOYSA-L Sodium Carbonate Chemical compound [Na+].[Na+].[O-]C([O-])=O CDBYLPFSWZWCQE-UHFFFAOYSA-L 0.000 description 2
- 101001091268 Streptomyces hygroscopicus Hygromycin-B 7''-O-kinase Proteins 0.000 description 2
- 108090000190 Thrombin Proteins 0.000 description 2
- 102000006601 Thymidine Kinase Human genes 0.000 description 2
- 108020004440 Thymidine kinase Proteins 0.000 description 2
- 238000010521 absorption reaction Methods 0.000 description 2
- 238000005571 anion exchange chromatography Methods 0.000 description 2
- 230000000890 antigenic effect Effects 0.000 description 2
- 230000004071 biological effect Effects 0.000 description 2
- 230000015572 biosynthetic process Effects 0.000 description 2
- 239000008280 blood Substances 0.000 description 2
- 210000004369 blood Anatomy 0.000 description 2
- 210000004899 c-terminal region Anatomy 0.000 description 2
- 108010015046 cell aggregation factors Proteins 0.000 description 2
- 238000004587 chromatography analysis Methods 0.000 description 2
- 238000003776 cleavage reaction Methods 0.000 description 2
- 239000011248 coating agent Substances 0.000 description 2
- 238000000576 coating method Methods 0.000 description 2
- 239000000356 contaminant Substances 0.000 description 2
- 239000012228 culture supernatant Substances 0.000 description 2
- 238000010790 dilution Methods 0.000 description 2
- 239000012895 dilution Substances 0.000 description 2
- 229940082150 encore Drugs 0.000 description 2
- 210000003527 eukaryotic cell Anatomy 0.000 description 2
- 238000002474 experimental method Methods 0.000 description 2
- 239000013604 expression vector Substances 0.000 description 2
- 230000006870 function Effects 0.000 description 2
- 238000010438 heat treatment Methods 0.000 description 2
- 208000031169 hemorrhagic disease Diseases 0.000 description 2
- 229960002897 heparin Drugs 0.000 description 2
- 229920000669 heparin Polymers 0.000 description 2
- 239000005556 hormone Substances 0.000 description 2
- 229940088597 hormone Drugs 0.000 description 2
- 229940052349 human coagulation factor ix Drugs 0.000 description 2
- 229960000027 human factor ix Drugs 0.000 description 2
- 229960000900 human factor viii Drugs 0.000 description 2
- 230000002209 hydrophobic effect Effects 0.000 description 2
- GRRNUXAQVGOGFE-NZSRVPFOSA-N hygromycin B Chemical compound O[C@@H]1[C@@H](NC)C[C@@H](N)[C@H](O)[C@H]1O[C@H]1[C@H]2O[C@@]3([C@@H]([C@@H](O)[C@@H](O)[C@@H](C(N)CO)O3)O)O[C@H]2[C@@H](O)[C@@H](CO)O1 GRRNUXAQVGOGFE-NZSRVPFOSA-N 0.000 description 2
- 229940097277 hygromycin b Drugs 0.000 description 2
- 238000010166 immunofluorescence Methods 0.000 description 2
- 230000000415 inactivating effect Effects 0.000 description 2
- 230000003834 intracellular effect Effects 0.000 description 2
- 238000012417 linear regression Methods 0.000 description 2
- 150000002632 lipids Chemical class 0.000 description 2
- 239000007788 liquid Substances 0.000 description 2
- 238000005259 measurement Methods 0.000 description 2
- 108020004999 messenger RNA Proteins 0.000 description 2
- 239000000203 mixture Substances 0.000 description 2
- 150000002772 monosaccharides Chemical group 0.000 description 2
- 239000013642 negative control Substances 0.000 description 2
- 150000002482 oligosaccharides Chemical class 0.000 description 2
- 102000013415 peroxidase activity proteins Human genes 0.000 description 2
- 108040007629 peroxidase activity proteins Proteins 0.000 description 2
- YBYRMVIVWMBXKQ-UHFFFAOYSA-N phenylmethanesulfonyl fluoride Chemical compound FS(=O)(=O)CC1=CC=CC=C1 YBYRMVIVWMBXKQ-UHFFFAOYSA-N 0.000 description 2
- 150000003904 phospholipids Chemical class 0.000 description 2
- 238000001556 precipitation Methods 0.000 description 2
- 230000004044 response Effects 0.000 description 2
- 230000007017 scission Effects 0.000 description 2
- 230000028327 secretion Effects 0.000 description 2
- 238000012163 sequencing technique Methods 0.000 description 2
- 125000006850 spacer group Chemical group 0.000 description 2
- 239000000126 substance Substances 0.000 description 2
- 229960004072 thrombin Drugs 0.000 description 2
- 230000001052 transient effect Effects 0.000 description 2
- 238000003146 transient transfection Methods 0.000 description 2
- 238000013519 translation Methods 0.000 description 2
- 230000032258 transport Effects 0.000 description 2
- 238000011144 upstream manufacturing Methods 0.000 description 2
- HDTRYLNUVZCQOY-UHFFFAOYSA-N α-D-glucopyranosyl-α-D-glucopyranoside Natural products OC1C(O)C(O)C(CO)OC1OC1C(O)C(O)C(O)C(CO)O1 HDTRYLNUVZCQOY-UHFFFAOYSA-N 0.000 description 1
- PGOHTUIFYSHAQG-LJSDBVFPSA-N (2S)-6-amino-2-[[(2S)-5-amino-2-[[(2S)-2-[[(2S)-2-[[(2S)-2-[[(2S)-4-amino-2-[[(2S)-2-[[(2S)-2-[[(2S)-2-[[(2S)-2-[[(2S)-5-amino-2-[[(2S)-5-amino-2-[[(2S)-2-[[(2S)-2-[[(2S)-2-[[(2S,3R)-2-[[(2S)-5-amino-2-[[(2S)-2-[[(2S)-2-[[(2S,3R)-2-[[(2S)-2-[[(2S)-2-[[(2S)-2-[[(2S)-2-[[(2S)-5-amino-2-[[(2S)-1-[(2S,3R)-2-[[(2S)-2-[[(2S)-2-[[(2R)-2-[[(2S)-2-[[(2S)-2-[[2-[[(2S)-2-[[(2S)-2-[[(2S)-2-[[(2S)-1-[(2S)-2-[[(2S)-2-[[(2S)-2-[[(2S)-2-amino-4-methylsulfanylbutanoyl]amino]-3-(1H-indol-3-yl)propanoyl]amino]-5-carbamimidamidopentanoyl]amino]propanoyl]pyrrolidine-2-carbonyl]amino]-3-methylbutanoyl]amino]-4-methylpentanoyl]amino]-4-methylpentanoyl]amino]acetyl]amino]-3-hydroxypropanoyl]amino]-4-methylpentanoyl]amino]-3-sulfanylpropanoyl]amino]-4-methylsulfanylbutanoyl]amino]-5-carbamimidamidopentanoyl]amino]-3-hydroxybutanoyl]pyrrolidine-2-carbonyl]amino]-5-oxopentanoyl]amino]-3-hydroxypropanoyl]amino]-3-hydroxypropanoyl]amino]-3-(1H-imidazol-5-yl)propanoyl]amino]-4-methylpentanoyl]amino]-3-hydroxybutanoyl]amino]-3-(1H-indol-3-yl)propanoyl]amino]-5-carbamimidamidopentanoyl]amino]-5-oxopentanoyl]amino]-3-hydroxybutanoyl]amino]-3-hydroxypropanoyl]amino]-3-carboxypropanoyl]amino]-3-hydroxypropanoyl]amino]-5-oxopentanoyl]amino]-5-oxopentanoyl]amino]-3-phenylpropanoyl]amino]-5-carbamimidamidopentanoyl]amino]-3-methylbutanoyl]amino]-4-methylpentanoyl]amino]-4-oxobutanoyl]amino]-5-carbamimidamidopentanoyl]amino]-3-(1H-indol-3-yl)propanoyl]amino]-4-carboxybutanoyl]amino]-5-oxopentanoyl]amino]hexanoic acid Chemical compound CSCC[C@H](N)C(=O)N[C@@H](Cc1c[nH]c2ccccc12)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](C)C(=O)N1CCC[C@H]1C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(C)C)C(=O)NCC(=O)N[C@@H](CO)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CS)C(=O)N[C@@H](CCSC)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H]([C@@H](C)O)C(=O)N1CCC[C@H]1C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CO)C(=O)N[C@@H](CO)C(=O)N[C@@H](Cc1cnc[nH]1)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](Cc1c[nH]c2ccccc12)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CO)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CO)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](Cc1ccccc1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](Cc1c[nH]c2ccccc12)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCCCN)C(O)=O PGOHTUIFYSHAQG-LJSDBVFPSA-N 0.000 description 1
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 1
- GEYOCULIXLDCMW-UHFFFAOYSA-N 1,2-phenylenediamine Chemical compound NC1=CC=CC=C1N GEYOCULIXLDCMW-UHFFFAOYSA-N 0.000 description 1
- QKNYBSVHEMOAJP-UHFFFAOYSA-N 2-amino-2-(hydroxymethyl)propane-1,3-diol;hydron;chloride Chemical compound Cl.OCC(N)(CO)CO QKNYBSVHEMOAJP-UHFFFAOYSA-N 0.000 description 1
- CFWRDBDJAOHXSH-SECBINFHSA-N 2-azaniumylethyl [(2r)-2,3-diacetyloxypropyl] phosphate Chemical compound CC(=O)OC[C@@H](OC(C)=O)COP(O)(=O)OCCN CFWRDBDJAOHXSH-SECBINFHSA-N 0.000 description 1
- BFSVOASYOCHEOV-UHFFFAOYSA-N 2-diethylaminoethanol Chemical compound CCN(CC)CCO BFSVOASYOCHEOV-UHFFFAOYSA-N 0.000 description 1
- 208000030507 AIDS Diseases 0.000 description 1
- 108010087905 Adenovirus E1B Proteins Proteins 0.000 description 1
- 102000009027 Albumins Human genes 0.000 description 1
- 108010088751 Albumins Proteins 0.000 description 1
- 241000701822 Bovine papillomavirus Species 0.000 description 1
- 102000014914 Carrier Proteins Human genes 0.000 description 1
- 108010078791 Carrier Proteins Proteins 0.000 description 1
- 102100023804 Coagulation factor VII Human genes 0.000 description 1
- 108091026890 Coding region Proteins 0.000 description 1
- 108020004705 Codon Proteins 0.000 description 1
- 108020004635 Complementary DNA Proteins 0.000 description 1
- 229920000858 Cyclodextrin Polymers 0.000 description 1
- 241000701022 Cytomegalovirus Species 0.000 description 1
- 108010014303 DNA-directed DNA polymerase Proteins 0.000 description 1
- 102000016928 DNA-directed DNA polymerase Human genes 0.000 description 1
- 102000004163 DNA-directed RNA polymerases Human genes 0.000 description 1
- 108090000626 DNA-directed RNA polymerases Proteins 0.000 description 1
- YQYJSBFKSSDGFO-UHFFFAOYSA-N Epihygromycin Natural products OC1C(O)C(C(=O)C)OC1OC(C(=C1)O)=CC=C1C=C(C)C(=O)NC1C(O)C(O)C2OCOC2C1O YQYJSBFKSSDGFO-UHFFFAOYSA-N 0.000 description 1
- 241000620209 Escherichia coli DH5[alpha] Species 0.000 description 1
- 108700024394 Exon Proteins 0.000 description 1
- 108010048049 Factor IXa Proteins 0.000 description 1
- 108010014172 Factor V Proteins 0.000 description 1
- 108010023321 Factor VII Proteins 0.000 description 1
- 108010014173 Factor X Proteins 0.000 description 1
- 102000009123 Fibrin Human genes 0.000 description 1
- 108010073385 Fibrin Proteins 0.000 description 1
- BWGVNKXGVNDBDI-UHFFFAOYSA-N Fibrin monomer Chemical compound CNC(=O)CNC(=O)CN BWGVNKXGVNDBDI-UHFFFAOYSA-N 0.000 description 1
- 108010049003 Fibrinogen Proteins 0.000 description 1
- 102000008946 Fibrinogen Human genes 0.000 description 1
- 101150066002 GFP gene Proteins 0.000 description 1
- JZNWSCPGTDBMEW-UHFFFAOYSA-N Glycerophosphorylethanolamin Natural products NCCOP(O)(=O)OCC(O)CO JZNWSCPGTDBMEW-UHFFFAOYSA-N 0.000 description 1
- 239000004471 Glycine Substances 0.000 description 1
- 208000028782 Hereditary disease Diseases 0.000 description 1
- 241000282412 Homo Species 0.000 description 1
- 102000008100 Human Serum Albumin Human genes 0.000 description 1
- 108091006905 Human Serum Albumin Proteins 0.000 description 1
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 1
- 108091092195 Intron Proteins 0.000 description 1
- HNDVDQJCIGZPNO-YFKPBYRVSA-N L-histidine Chemical compound OC(=O)[C@@H](N)CC1=CN=CN1 HNDVDQJCIGZPNO-YFKPBYRVSA-N 0.000 description 1
- KDXKERNSBIXSRK-YFKPBYRVSA-N L-lysine Chemical compound NCCCC[C@H](N)C(O)=O KDXKERNSBIXSRK-YFKPBYRVSA-N 0.000 description 1
- 102000004895 Lipoproteins Human genes 0.000 description 1
- 108090001030 Lipoproteins Proteins 0.000 description 1
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 1
- 239000004472 Lysine Substances 0.000 description 1
- 241000699670 Mus sp. Species 0.000 description 1
- 230000004988 N-glycosylation Effects 0.000 description 1
- 206010028980 Neoplasm Diseases 0.000 description 1
- 108091034117 Oligonucleotide Proteins 0.000 description 1
- 229910019142 PO4 Inorganic materials 0.000 description 1
- 241001494479 Pecora Species 0.000 description 1
- 108091000080 Phosphotransferase Proteins 0.000 description 1
- 229920002556 Polyethylene Glycol 300 Polymers 0.000 description 1
- 239000002202 Polyethylene glycol Substances 0.000 description 1
- WDVSHHCDHLJJJR-UHFFFAOYSA-N Proflavine Chemical compound C1=CC(N)=CC2=NC3=CC(N)=CC=C3C=C21 WDVSHHCDHLJJJR-UHFFFAOYSA-N 0.000 description 1
- 101800004937 Protein C Proteins 0.000 description 1
- 102000017975 Protein C Human genes 0.000 description 1
- 108010019653 Pwo polymerase Proteins 0.000 description 1
- 108020004511 Recombinant DNA Proteins 0.000 description 1
- 241000714474 Rous sarcoma virus Species 0.000 description 1
- 101800001700 Saposin-D Proteins 0.000 description 1
- 108010022999 Serine Proteases Proteins 0.000 description 1
- 102000012479 Serine Proteases Human genes 0.000 description 1
- 229930006000 Sucrose Natural products 0.000 description 1
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 1
- 108010000499 Thromboplastin Proteins 0.000 description 1
- 102000002262 Thromboplastin Human genes 0.000 description 1
- HDTRYLNUVZCQOY-WSWWMNSNSA-N Trehalose Natural products O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@H](O)[C@@H](O)[C@@H](O)[C@@H](CO)O1 HDTRYLNUVZCQOY-WSWWMNSNSA-N 0.000 description 1
- 229920004890 Triton X-100 Polymers 0.000 description 1
- 108090000631 Trypsin Proteins 0.000 description 1
- 102000004142 Trypsin Human genes 0.000 description 1
- 210000001766 X chromosome Anatomy 0.000 description 1
- 239000002253 acid Substances 0.000 description 1
- 239000000654 additive Substances 0.000 description 1
- 238000004115 adherent culture Methods 0.000 description 1
- 239000002671 adjuvant Substances 0.000 description 1
- 238000001042 affinity chromatography Methods 0.000 description 1
- 238000001261 affinity purification Methods 0.000 description 1
- HDTRYLNUVZCQOY-LIZSDCNHSA-N alpha,alpha-trehalose Chemical compound O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 HDTRYLNUVZCQOY-LIZSDCNHSA-N 0.000 description 1
- 238000012870 ammonium sulfate precipitation Methods 0.000 description 1
- 238000004458 analytical method Methods 0.000 description 1
- 239000012223 aqueous fraction Substances 0.000 description 1
- OHDRQQURAXLVGJ-HLVWOLMTSA-N azane;(2e)-3-ethyl-2-[(e)-(3-ethyl-6-sulfo-1,3-benzothiazol-2-ylidene)hydrazinylidene]-1,3-benzothiazole-6-sulfonic acid Chemical compound [NH4+].[NH4+].S/1C2=CC(S([O-])(=O)=O)=CC=C2N(CC)C\1=N/N=C1/SC2=CC(S([O-])(=O)=O)=CC=C2N1CC OHDRQQURAXLVGJ-HLVWOLMTSA-N 0.000 description 1
- 230000008901 benefit Effects 0.000 description 1
- SQVRNKJHWKZAKO-UHFFFAOYSA-N beta-N-Acetyl-D-neuraminic acid Natural products CC(=O)NC1C(O)CC(O)(C(O)=O)OC1C(O)C(O)CO SQVRNKJHWKZAKO-UHFFFAOYSA-N 0.000 description 1
- 230000003115 biocidal effect Effects 0.000 description 1
- 229960000074 biopharmaceutical Drugs 0.000 description 1
- 230000000903 blocking effect Effects 0.000 description 1
- 238000011088 calibration curve Methods 0.000 description 1
- 201000011510 cancer Diseases 0.000 description 1
- 230000021523 carboxylation Effects 0.000 description 1
- 238000006473 carboxylation reaction Methods 0.000 description 1
- 239000004359 castor oil Substances 0.000 description 1
- 235000019438 castor oil Nutrition 0.000 description 1
- 230000015556 catabolic process Effects 0.000 description 1
- 239000006143 cell culture medium Substances 0.000 description 1
- 239000006285 cell suspension Substances 0.000 description 1
- 238000005119 centrifugation Methods 0.000 description 1
- 238000012512 characterization method Methods 0.000 description 1
- 239000007795 chemical reaction product Substances 0.000 description 1
- 230000015271 coagulation Effects 0.000 description 1
- 238000005345 coagulation Methods 0.000 description 1
- 150000001875 compounds Chemical class 0.000 description 1
- 239000012141 concentrate Substances 0.000 description 1
- 238000010276 construction Methods 0.000 description 1
- 238000011109 contamination Methods 0.000 description 1
- 239000006059 cover glass Substances 0.000 description 1
- 229940097362 cyclodextrins Drugs 0.000 description 1
- 230000007812 deficiency Effects 0.000 description 1
- 238000006731 degradation reaction Methods 0.000 description 1
- 230000001419 dependent effect Effects 0.000 description 1
- 239000003599 detergent Substances 0.000 description 1
- 229940042399 direct acting antivirals protease inhibitors Drugs 0.000 description 1
- 150000002016 disaccharides Chemical class 0.000 description 1
- 239000006185 dispersion Substances 0.000 description 1
- 230000009977 dual effect Effects 0.000 description 1
- 230000004064 dysfunction Effects 0.000 description 1
- 108010030074 endodeoxyribonuclease MluI Proteins 0.000 description 1
- 238000005516 engineering process Methods 0.000 description 1
- 230000001747 exhibiting effect Effects 0.000 description 1
- 229940012413 factor vii Drugs 0.000 description 1
- 229950003499 fibrin Drugs 0.000 description 1
- 229940012952 fibrinogen Drugs 0.000 description 1
- 238000009472 formulation Methods 0.000 description 1
- 239000012737 fresh medium Substances 0.000 description 1
- 238000001415 gene therapy Methods 0.000 description 1
- 238000007429 general method Methods 0.000 description 1
- 239000011521 glass Substances 0.000 description 1
- ZDXPYRJPNDTMRX-UHFFFAOYSA-N glutamine Natural products OC(=O)C(N)CCC(N)=O ZDXPYRJPNDTMRX-UHFFFAOYSA-N 0.000 description 1
- ZEMPKEQAKRGZGQ-XOQCFJPHSA-N glycerol triricinoleate Natural products CCCCCC[C@@H](O)CC=CCCCCCCCC(=O)OC[C@@H](COC(=O)CCCCCCCC=CC[C@@H](O)CCCCCC)OC(=O)CCCCCCCC=CC[C@H](O)CCCCCC ZEMPKEQAKRGZGQ-XOQCFJPHSA-N 0.000 description 1
- 230000036541 health Effects 0.000 description 1
- 208000009429 hemophilia B Diseases 0.000 description 1
- 208000006454 hepatitis Diseases 0.000 description 1
- 231100000283 hepatitis Toxicity 0.000 description 1
- 210000003494 hepatocyte Anatomy 0.000 description 1
- HNDVDQJCIGZPNO-UHFFFAOYSA-N histidine Natural products OC(=O)C(N)CC1=CN=CN1 HNDVDQJCIGZPNO-UHFFFAOYSA-N 0.000 description 1
- 230000005847 immunogenicity Effects 0.000 description 1
- 238000000338 in vitro Methods 0.000 description 1
- 238000001727 in vivo Methods 0.000 description 1
- 238000011065 in-situ storage Methods 0.000 description 1
- 238000010348 incorporation Methods 0.000 description 1
- 230000002401 inhibitory effect Effects 0.000 description 1
- 229910017053 inorganic salt Inorganic materials 0.000 description 1
- 230000010354 integration Effects 0.000 description 1
- 230000006662 intracellular pathway Effects 0.000 description 1
- 239000011159 matrix material Substances 0.000 description 1
- 239000012528 membrane Substances 0.000 description 1
- 229910052751 metal Inorganic materials 0.000 description 1
- 239000002184 metal Substances 0.000 description 1
- 150000002739 metals Chemical class 0.000 description 1
- 210000004897 n-terminal region Anatomy 0.000 description 1
- 239000007922 nasal spray Substances 0.000 description 1
- 229940097496 nasal spray Drugs 0.000 description 1
- 239000002736 nonionic surfactant Substances 0.000 description 1
- 150000007523 nucleic acids Chemical group 0.000 description 1
- 229920001542 oligosaccharide Polymers 0.000 description 1
- 230000036961 partial effect Effects 0.000 description 1
- 239000000137 peptide hydrolase inhibitor Substances 0.000 description 1
- 230000002093 peripheral effect Effects 0.000 description 1
- 238000005191 phase separation Methods 0.000 description 1
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 description 1
- 239000010452 phosphate Substances 0.000 description 1
- 150000008104 phosphatidylethanolamines Chemical class 0.000 description 1
- 102000020233 phosphotransferase Human genes 0.000 description 1
- 229920001223 polyethylene glycol Polymers 0.000 description 1
- 229920000151 polyglycol Polymers 0.000 description 1
- 239000010695 polyglycol Substances 0.000 description 1
- 230000001323 posttranslational effect Effects 0.000 description 1
- 239000002243 precursor Substances 0.000 description 1
- 230000002265 prevention Effects 0.000 description 1
- 230000002947 procoagulating effect Effects 0.000 description 1
- 239000000186 progesterone Substances 0.000 description 1
- 229960003387 progesterone Drugs 0.000 description 1
- 229960000856 protein c Drugs 0.000 description 1
- 235000004252 protein component Nutrition 0.000 description 1
- 230000009145 protein modification Effects 0.000 description 1
- 238000001742 protein purification Methods 0.000 description 1
- 239000012460 protein solution Substances 0.000 description 1
- 230000006337 proteolytic cleavage Effects 0.000 description 1
- 239000001397 quillaja saponaria molina bark Substances 0.000 description 1
- 230000005855 radiation Effects 0.000 description 1
- 102000005962 receptors Human genes 0.000 description 1
- 238000010188 recombinant method Methods 0.000 description 1
- 229940047431 recombinate Drugs 0.000 description 1
- 230000009467 reduction Effects 0.000 description 1
- 230000000717 retained effect Effects 0.000 description 1
- 238000010839 reverse transcription Methods 0.000 description 1
- 229930182490 saponin Natural products 0.000 description 1
- 150000007949 saponins Chemical class 0.000 description 1
- 238000012216 screening Methods 0.000 description 1
- SQVRNKJHWKZAKO-OQPLDHBCSA-N sialic acid Chemical compound CC(=O)N[C@@H]1[C@@H](O)C[C@@](O)(C(O)=O)OC1[C@H](O)[C@H](O)CO SQVRNKJHWKZAKO-OQPLDHBCSA-N 0.000 description 1
- 125000005629 sialic acid group Chemical group 0.000 description 1
- 230000037432 silent mutation Effects 0.000 description 1
- 238000001542 size-exclusion chromatography Methods 0.000 description 1
- 229910052708 sodium Inorganic materials 0.000 description 1
- 239000011734 sodium Substances 0.000 description 1
- 229910000029 sodium carbonate Inorganic materials 0.000 description 1
- 239000001509 sodium citrate Substances 0.000 description 1
- NLJMYIDDQXHKNR-UHFFFAOYSA-K sodium citrate Chemical compound O.O.[Na+].[Na+].[Na+].[O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O NLJMYIDDQXHKNR-UHFFFAOYSA-K 0.000 description 1
- 239000002904 solvent Substances 0.000 description 1
- 238000011895 specific detection Methods 0.000 description 1
- 238000013112 stability test Methods 0.000 description 1
- 230000000087 stabilizing effect Effects 0.000 description 1
- 230000010473 stable expression Effects 0.000 description 1
- 238000003756 stirring Methods 0.000 description 1
- 239000005720 sucrose Substances 0.000 description 1
- 239000013589 supplement Substances 0.000 description 1
- 239000004094 surface-active agent Substances 0.000 description 1
- 208000024891 symptom Diseases 0.000 description 1
- 238000003786 synthesis reaction Methods 0.000 description 1
- 230000009424 thromboembolic effect Effects 0.000 description 1
- 210000001519 tissue Anatomy 0.000 description 1
- 230000010474 transient expression Effects 0.000 description 1
- 239000012588 trypsin Substances 0.000 description 1
- 239000002753 trypsin inhibitor Substances 0.000 description 1
- 241000701161 unidentified adenovirus Species 0.000 description 1
- 241001529453 unidentified herpesvirus Species 0.000 description 1
- 239000003981 vehicle Substances 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/11—DNA or RNA fragments; Modified forms thereof; Non-coding nucleic acids having a biological activity
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N9/00—Enzymes; Proenzymes; Compositions thereof; Processes for preparing, activating, inhibiting, separating or purifying enzymes
- C12N9/14—Hydrolases (3)
- C12N9/48—Hydrolases (3) acting on peptide bonds (3.4)
- C12N9/50—Proteinases, e.g. Endopeptidases (3.4.21-3.4.25)
- C12N9/64—Proteinases, e.g. Endopeptidases (3.4.21-3.4.25) derived from animal tissue
- C12N9/6421—Proteinases, e.g. Endopeptidases (3.4.21-3.4.25) derived from animal tissue from mammals
- C12N9/6424—Serine endopeptidases (3.4.21)
- C12N9/6437—Coagulation factor VIIa (3.4.21.21)
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
- A61P7/04—Antihaemorrhagics; Procoagulants; Haemostatic agents; Antifibrinolytic agents
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/745—Blood coagulation or fibrinolysis factors
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/745—Blood coagulation or fibrinolysis factors
- C07K14/755—Factors VIII, e.g. factor VIII C (AHF), factor VIII Ag (VWF)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N9/00—Enzymes; Proenzymes; Compositions thereof; Processes for preparing, activating, inhibiting, separating or purifying enzymes
- C12N9/14—Hydrolases (3)
- C12N9/48—Hydrolases (3) acting on peptide bonds (3.4)
- C12N9/50—Proteinases, e.g. Endopeptidases (3.4.21-3.4.25)
- C12N9/64—Proteinases, e.g. Endopeptidases (3.4.21-3.4.25) derived from animal tissue
- C12N9/6421—Proteinases, e.g. Endopeptidases (3.4.21-3.4.25) derived from animal tissue from mammals
- C12N9/6424—Serine endopeptidases (3.4.21)
- C12N9/644—Coagulation factor IXa (3.4.21.22)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N9/00—Enzymes; Proenzymes; Compositions thereof; Processes for preparing, activating, inhibiting, separating or purifying enzymes
- C12N9/14—Hydrolases (3)
- C12N9/48—Hydrolases (3) acting on peptide bonds (3.4)
- C12N9/50—Proteinases, e.g. Endopeptidases (3.4.21-3.4.25)
- C12N9/64—Proteinases, e.g. Endopeptidases (3.4.21-3.4.25) derived from animal tissue
- C12N9/6421—Proteinases, e.g. Endopeptidases (3.4.21-3.4.25) derived from animal tissue from mammals
- C12N9/6424—Serine endopeptidases (3.4.21)
- C12N9/647—Blood coagulation factors not provided for in a preceding group or according to more than one of the proceeding groups
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Y—ENZYMES
- C12Y304/00—Hydrolases acting on peptide bonds, i.e. peptidases (3.4)
- C12Y304/21—Serine endopeptidases (3.4.21)
- C12Y304/21021—Coagulation factor VIIa (3.4.21.21)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Y—ENZYMES
- C12Y304/00—Hydrolases acting on peptide bonds, i.e. peptidases (3.4)
- C12Y304/21—Serine endopeptidases (3.4.21)
- C12Y304/21022—Coagulation factor IXa (3.4.21.22)
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K48/00—Medicinal preparations containing genetic material which is inserted into cells of the living body to treat genetic diseases; Gene therapy
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Organic Chemistry (AREA)
- Engineering & Computer Science (AREA)
- Genetics & Genomics (AREA)
- Zoology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Wood Science & Technology (AREA)
- General Health & Medical Sciences (AREA)
- Biochemistry (AREA)
- Biomedical Technology (AREA)
- General Engineering & Computer Science (AREA)
- Molecular Biology (AREA)
- Medicinal Chemistry (AREA)
- Biotechnology (AREA)
- Microbiology (AREA)
- Hematology (AREA)
- Biophysics (AREA)
- Gastroenterology & Hepatology (AREA)
- Toxicology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Diabetes (AREA)
- Public Health (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Veterinary Medicine (AREA)
- Pharmacology & Pharmacy (AREA)
- Physics & Mathematics (AREA)
- Plant Pathology (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
- Peptides Or Proteins (AREA)
- Preparation Of Compounds By Using Micro-Organisms (AREA)
- Medicines Containing Material From Animals Or Micro-Organisms (AREA)
- Enzymes And Modification Thereof (AREA)
Description
序論
本発明はウイルス転写アクチベータータンパク質を安定的に発現し、血液凝固因子をコードするDNA配列に機能的に連結したプロモーター(ただし該プロモーターは該ウイルス転写アクチベータータンパク質により刺激されるウイルスプロモーターではない)を有するベクターを保持する不死化ヒト細胞株を利用する、組換えヒト血液凝固因子、特に第VIIIおよび第IX因子を製造するための改良された方法;該ベクターを保持する不死化ヒト細胞株;特に前記の製造方法に適した第VIII因子突然変異タンパク質;かかる第VIII因子突然変異タンパク質を含む医薬用組成物および血友病を治療するための医薬を調製するためのかかる第VIII因子突然変異タンパク質の使用に関する。
【0002】
関連技術についての要旨
血友病は血液凝固カスケードのタンパク質成分の機能障害により引き起こされる出血性の疾患である。影響される凝固因子により、血友病は2つの型に分類される。両者とも共通して可溶性フィブリノーゲンの不溶性フィブリンクロットへの変換が阻害される。これらは主に男性が羅患する、劣性X染色体に関連する遺伝性疾患である。
【0003】
男性10000人あたり1から2人の個体が血友病Aを羅患する。これは非常に大きな糖タンパク質(分子量約330kDa(フリエB.、フリエB.C.、Cell(1988)53:505〜518))であり、血液凝固カスケードの重要な要素である第VIII因子の不足あるいは欠失により引き起こされる。ポリペプチド配列は3領域、すなわち、いわゆるA1およびA2ドメインからなるN末端領域、中央のBドメイン領域、およびA3、C1およびC2ドメインからなるC末端領域に再分類できる。血液凝固において第VIII因子は不活性前駆体として存在する。これは安定化キャリヤタンパク質として作用するフォンビルブラント因子(vWF)に強固にかつ非共有結合的に結合する。トロンビンによる第VIII因子の3つの特定の位置(740、372、1689)におけるタンパク質分解的切断により、第VIII因子がvWFから解離し、カスケード内での凝固促進作用を発揮する。その活性形態では第VIII因子は第IXaのコファクターとして機能し、それによりいくつかのオーダーで第X因子のタンパク質分解による活性化が促進される。
【0004】
男性25000人あたり約1人に血友病Bが発生する。これはセリンプロテアーゼである第IX因子(クリスマス因子)の欠損によって特徴づけられる。この415個のアミノ酸ポリペプチドは肝臓で56kDaの糖タンパク質として合成される。その適切な機能を果たすため、ビタミンKの存在下でのみ生じる翻訳後カルボキシル化のステップが必要である。
両方の型の出血性障害の治療として伝統的に第VIII因子または第IX因子のヒト血漿由来タンパク質濃縮物の投与が行われてきた。この方法は血友病患者の有効な治療法であるが、種々の感染性因子、例えば肝炎またはAIDSを引き起こすウイルス、あるいは血栓塞栓性因子の感染の危険性を伴う。また、凝固因子の製造のためのいくつかの組換え体DNA技術が記載されている。このために、野生型第VIII因子および第IX因子の対応するcDNAが単離され、適当な発現ベクターにクローン化されている(欧州特許第−A−160457号;国際公開公報第A−86/01961号、米国特許第4770999号、第5521070号および第5521070号)。
【0005】
第VIII因子の場合、凝固活性を示す複合体を製造するためのサブユニットの組換え体発現が当該分野で既知である(例えば欧州特許第A−150735号、欧州特許第A−232112号、欧州特許第A−0500734号、国際公開公報第91/07490号、国際公開公報第95/13300号、米国特許第5045455号および第5789203号)。さらに、高度にグリコシル化されたBドメインをコードする配列を部分的または全体的に欠く、トランケートされたcDNA体の発現について記載されている(例えば国際公開公報第86/06101号、国際公開公報第87/04187号、国際公開公報第87/07144号、国際公開公報第88/00381号、欧州特許第A−251843号、欧州特許第A−253455号、欧州特許第A−254076号、米国特許第4868112号および第4980456号、欧州特許第A−294910号、欧州特許第A−265778号、欧州特許第A−303540号並びに国際公開公報第91/09122号)。ごく最近、活性化タンパク質Cによる第VIII因子のタンパク質分解性不活性化作用を阻害するか、または治療された患者による阻害抗体の形成をもたらす免疫原性を低減するために、種々の選択された点変異が導入されている(例えば米国特許第5859204号、第5422269号および第5451521号、国際公開公報第97/49725号並びに国際公開公報第99/29848号)。
【0006】
組換え凝固因子は通常、安定的にトランスフェクトされた真核細胞、および好ましくは哺乳動物細胞株の培地から単離された。しかしながら、これはヒト細胞が保持し、発現され得るいくつかの感染性因子を同時に精製する危険性を排除するために、本明細書以前に記載された参考文献にて開示された生産方法において非ヒト細胞株で用いられる一般的な方法であった。
しかしながら、特に第VIII因子に関しては、非ヒト細胞株の使用によりある種の不利益に遭遇する。例えば培地に発現されたタンパク質の分泌レベルが満足できるものではないことが報告されている。これはタンパク質翻訳および修飾の細胞内経路に関する、発現されたポリペプチドの生物学的活性にも影響する異なる型の哺乳動物細胞内でのわずかな差異によるものである。これとは別に、非ヒト発現系から精製された治療用タンパク質が患者での抗原性反応を生じ得る細胞内成分と夾雑するという懸念があった。
【0007】
さらに、非ヒト発現系により発現されたタンパク質は、患者において抗原性反応を生じる非ヒトグリコシル化パターンを有するかもしれない。しかしながら、凝固因子の生物学的安定性および有効性は実質的にN−グリコシル化のパターンにより影響を受ける。特に、末梢かつ末端の単糖類が重要である。それは、分解に関与する細胞の特異的レセプターにより検出されるからである。凝固因子は末端単糖類としてシアル酸残基を保持する。例えば凝固因子としての糖タンパク質のアンテナにおけるシアル酸組成の修飾により不均質のグリコシル化パターンとなり得る。それゆえ生物学的安定性および有効性は修飾を生じた場合に重大な影響を受ける。従って、組換え凝集因子の製造においてヒト細胞株に対する非ヒト生産細胞株のグリコシル化の影響を評価することは重要な考察となる。一般的に、ヒト細胞株は非ヒト細胞株よりも組換え凝固因子の製造に関してより適切であることは妥当であると思われる。この仮説の理由は、組換え因子の合成中に恐らく外来のオリゴ糖がオリゴ糖部分に組み込まれないということである。
【0008】
一方、ウイルス転写アクチベータータンパク質を発現する、不死化され、安定的にトランスフェクトされた哺乳動物細胞株を含有する望みの遺伝子を高レベルでタンパク質発現させるための一般的方法がここしばらくの間利用可能となっている(例えば米国特許第5712119号)。さらにこれらの細胞株は、適当なウイルス転写プロモーターが目的の遺伝子を定義しているDNA配列に作用するように結合しているベクター構築物で形質転換され、転写アクチベータータンパク質はウイルス転写プロモーターを活性化し、その結果目的の遺伝子発現が開始される。その上これらの細胞株により発現された転写アクチベータータンパク質は標的の治療用タンパク質において夾雑物を生じるという懸念がある。
前記に鑑み、ヒト血液凝固因子に関する有効な製造方法が依然必要である。
驚くべきことに、夾雑物を含まない血液凝固因子が前記した不死化ヒト細胞株で得られることが発見された。特に、不死化細胞株は、血液凝固因子をコードするDNA配列に機能的に連結したプロモーターを有するベクターを保持する場合、プロモーターが該ウイルスアクチベータータンパク質により刺激されるウイルスプロモーターではないという事実にかかわらず、血液凝固因子を発現できる。適切なタンパク質精製およびウイルス不活性化プロトコールを組み合わせて、この方法はヒトに対して治療的な応用をするための安全で高活性な組換え血液凝固因子を製造する有効な方法を提供する。さらに、タンパク質分解性不活性化に対して例外的に安定であり、従って積極的なウイルス不活性化プロトコールに適用できる特定の第VIII因子ムテインを発見した。
【0009】
発明の要旨
本発明は:
(1)(a)少なくとも一つのウイルス転写アクチベータータンパク質を安定的に発現し、ヒト血液凝固因子をコードするDNA配列に機能的に連結したプロモーターを有するベクターを保持するヒト細胞株を培養すること、(ただし該プロモーターは少なくとも一つの該ウイルス転写アクチベータータンパク質により刺激されるウイルスプロモーターではない);および
(b)培養液から血液凝固因子を単離すること;
を特徴とする組換えヒト血液凝固因子の生産方法;
(2)前記の(1)に記載される方法の好ましい実施形態であって、ここでヒト血液凝固因子は第VIII因子またはそのムテインである;
(3)前記の(2)に記載される方法の好ましい実施形態であって、ここで第VIII因子は少なくとも一つの以下の変異を有するムテインである:
(a)162番目のValが他の中性アミノ酸残基により置換されている;
(b)2011番目のSerが他の親水性アミノ酸残基により置換されている;
(c)2223番目のValが酸性アミノ酸残基により置換されている;および
(d)Arg740とGlu1649の間のBドメインが10から25個、好ましくは14から20個のアミノ酸残基を含むArgリッチのリンカーペプチドにより置換され、ここで該第VIII因子の位置の数字は配列番号:2に示される成熟野生型第VIII因子に相当する;
(4)前記の(1)に記載される方法の好ましい実施形態であって、ここでヒト血液凝固因子は第IX因子またはそのムテインである;
(5)前記の(1)から(4)に記載されるヒト血液凝固因子をコードするベクターを保持する不死化ヒト細胞株;
(6)前記の(3)に記載される第VIII因子ムテイン;
(7)前記の(6)に記載される第VIII因子ムテインをコードするDNA配列;
(8)前記の(7)に記載されるDNAを含有するベクター;
(9)遺伝子トランスファーベクターである前記の(8)に記載されるベクター;
(10)前記の(8)に記載されるベクターで形質転換され、および/または前記の(7)に記載されるDNA配列を含有する宿主細胞;
(11)前記の(6)に記載される第VIII因子ムテインまたは前記の(9)に記載される遺伝子トランスファーベクターを含有する医薬組成物;
(12)血友病の治療用医薬品を製造するための前記の(6)に記載される第VIII因子ムテインまたは前記の(9)に記載される遺伝子トランスファーベクターの使用;および
(13)前記の(6)に記載される第VIII因子ムテインまたは前記の(9)に記載される遺伝子トランスファーベクターをヒト血友病患者に投与することを特徴とする血友病の治療方法;
を提供する。
【0010】
発明の詳細な説明
「機能的に連結された」とは、プロモーターがヒト血液凝固因子をコードするDNA配列の転写を刺激できるような様式でベクター内に配置されるベクターの配置を意味する。「非機能的に連結された」とは、プロモーターが血液凝固因子の発現された遺伝子配列から非常に遠くに位置するのでその転写を刺激できない配置を意味する。
「遺伝子」とは、リーダーおよび付随する配列並びにイントロンおよびエクソンを任意に含むポリペプチドをコードするDNA配列を意味する。
「ベクター」とは、プラスミド、ファージ、コスミド等の遺伝子構築物のいずれかを意味し、適当な調節エレメントと結合した場合、複製可能である。この用語にはクローニングおよび発現ベヒクルが含まれる。「ベクターを保持する」とは、宿主細胞への機能的DNAセグメントの安定的および一過性の両方の組み込みを意味する。しかしながら安定的な組み込みが好ましい。
「遺伝子トランスファーベクター」とは、本発明によれば、遺伝子治療に適したベクターを意味する。かかるベクターは当業者には既知の、望ましい目的のための機能的配列を含む。
「成熟」なる用語は、その細胞内分泌の直後の規定のタンパク質の分子構造(すなわちそのN末端輸送シグナルポリペプチドを欠如すること)を意味する。
「プロモーター」とはRNAポリメラーゼが結合する遺伝子の転写を制御するための調節DNA配列の領域を意味する。
本発明の医薬組成物の「治療上有効な用量」とは治療または予防に有効な用量、例えば血友病の症状の有効な治療または低減をもたらす用量を意味する。治療上有効な用量の決定は当業者の範囲内である。
「コード(暗号化)する」または「コード(暗号)化」とは適当な制御配列の調節下に置かれた場合、インビトロまたはインビボでポリペプチドに転写(DNAの場合)または翻訳(mRNAの場合)される核酸配列の特性を意味する。
本願の目的のために、「発現する」、「発現すること」または「発現」とはタンパク質をコードする遺伝子の転写および翻訳を意味する。
【0011】
前記の(1)から(13)に記載される本発明を以後より詳細に記載する。本願発明の実施態様(1)によれば、ヒト血液凝固因子をコードするDNA配列に機能的に連結されるプロモーターは不死化ヒト細胞株により発現される少なくとも一つのウイルス転写アクチベータータンパク質により刺激されるウイルスプロモーターではない。
不死化ヒト細胞株は、好ましくは不死化された腎臓、膀胱、肝臓、肺、心筋、平滑筋、卵巣または胃腸細胞である。さらに好ましくは、不死化ヒト細胞株はヒト胎児腎臓細胞に由来し、最も好ましくは293T細胞株である(ECACC:tsa201、ref.96121229;DSM ACC2494)。
不死化細胞株により発現される少なくとも一つの転写アクチベータータンパク質にはシミアンウイルスT抗原、アデノウイルスE1AまたはE1Bタンパク質、ウシパピローマウイルス初期領域DNA配列によりコードされるタンパク質およびヘルペスウイルスIEタンパク質などがある。好ましくは、不死化細胞は少なくとも二つのウイルス転写アクチベータータンパク質、例えば温度感受性SV40T抗原およびアデノウイルスE1Aタンパク質(例えば前記の293T細胞株)を発現する。
【0012】
ヒト血液凝固因子をコードするDNA配列に機能的に連結したプロモーターには、好ましくは
(i)前記で定義した不死化細胞(例えばSV40およびCMV)により発現されるアクチベータータンパク質により刺激されないウイルスプロモーター;
(ii)ハウスキーピング宿主プロモーター(アルブミン);および
(iii)組織特異的プロモーター(例えば肝臓のα抗トリプシン)、
を含む。本発明によれば、最も好ましいプロモーターはCMVプロモーターである(一方、不死化細胞により発現された転写アクチベータータンパク質は該プロモーターを刺激しない)。
本発明によれば、ベクターは該ウイルス転写アクチベータータンパク質により刺激されるが、血液凝固因子には機能的に連結していない別のウイルスプロモーターを保持することができる。かかるウイルスプロモーターはアデノウイルス、ラウス肉腫ウイルスおよびサイトメガロウイルスに由来するプロモーターから選択される。ベクターはさらに一つまたはそれ以上の、下記の機能的配列:選択マーカー、調節配列(例えばPRE)等を含むことができる。
【0013】
本発明の実施態様(1)記載のヒト血液凝固因子には、これに限定されないが、第IX因子、第VIII因子、第VII因子、第V因子、フォンビルブラント因子(vWF)を含む。
本発明の好ましい実施態様(2)において、ベクターは第VIII因子またはそのムテインをコードするDNA配列を含有する。組換え第IX因子は一般に構造的に血漿から単離された野生型タンパク質と同一であるが、いくつかの修飾第VIII因子発現構築物が組換え体発現用に設計されている。機能的な第VIII因子ポリペプチドのドメイン構造を考慮すると、vWFとの重要な相互作用部位がA3ドメイン(アミノ酸1680から1689)およびC2ドメインに位置する(カウフマンおよびパイプ、Haemophilia(1998)4、370〜379)。vWFから第VIII因子を遊離させ、第VIII因子を荷電リン脂質と相互作用させるために1689番以降の切断が計画された。vWF結合部位を欠如する組換え第VIII因子構築物は、第VIII因子欠損マウスに注射された場合、タンパク質分解性消化を非常に受けやすくなることが示された。哺乳動物細胞培養物中のトランケートされた第VIII因子構築物の組換え体発現により、Bドメインの完全な欠失が対応する第VIII因子様タンパク質の生物学的活性を変化させないことが示された(イートンら、Biochemistry(1986)25、8343〜8347)。加えて観察されたBドメイン欠失構築物の発現速度は、細胞におけるmRNAのレベル上昇のために野生型第VIII因子に比較して顕著に高い(ピットマンら、Blood(1993)81、2925〜2935)。4つの組換え第VIII因子製品(リコンビネート(登録商標)、バクスター・ヘルス・ケア;コグネート(登録商標)およびコグネートFS(登録商標)、バイエル・コーポレーション;およびレファクト(登録商標)ワイス、ジェネティックス・インスティテュート)が現在市場に出ている。
【0014】
本発明の好ましい実施態様(3)では第VIII因子ムテインが以下の変異(a)から(d)の少なくとも一つを有する:
(a)162番目のValが他の中性アミノ酸残基により置換されている;
(b)2011番目のSerが他の親水性アミノ酸残基により置換されている;
(c)2223番目のValが酸性アミノ酸残基により置換されている;および
(d)Arg740とGlu1649の間のBドメインが10から25個、好ましくは14から20個のアミノ酸残基を含むArgリッチのリンカーペプチドにより置換され、ここで該第VIII因子のナンバリングは配列番号:2に示される成熟野生型第VIII因子に相当する(19個のアミノ酸シグナルペプチドを含有しないが全Bドメインを含有する成熟ペプチドのアミノ酸配列である(国際公開公報第99/29848号))。
【0015】
本発明による「他の中性アミノ酸残基」にはGly、Ala、Leu、Ile、MetおよびProを、好ましくはAlaを含む。「他の親水性アミノ酸」にはAsn、Thr、およびGlnを、好ましくはAsnを含む。酸性アミノ酸残基はGluおよびAspから選択され、好ましくはGluである。
実施態様(3)の第VIII因子のうち、第VIII因子ムテインは変異(a)、(b)、および(c)の少なくとも一つを有するのが好ましく、変異(a)および(b)の少なくとも一つを有するのがより好ましく、前記で定義した(a)から(c)の3つ全ての変異を有するのが最も好ましい。ムテインが変異体V162A、S2011NおよびV2223Eの3つ全てを含むのが特に好ましい。
【0016】
同様に本発明の実施態様(4)のベクターに含有されるDNA配列は、配列番号:1に示される成熟野生型第VIII因子のDNA配列に相対して変異体T485C、G6032AおよびT6668Aを有する。好ましい実施態様では、DNA配列は沈黙(すなわちサイレント)変異T6816Cをも含有する(さらに該番号は成熟野生型第VIII因子のDNA配列に相当する)。
また別に、実施態様(3)の第VIII因子ムテインの中で、第VIII因子ムテインは前記で定義した変異(d)を有するのが好ましい。
本発明の好ましい発現系は、ここ以前に記載した点突然変異(a)から(c)に加え、部分的または全体的にそのBドメインを欠如する独特な第VIII因子ムテイン、好ましくはR740とE1649の間のBドメインが前記(d)に記載の、Argリッチの特徴的なアミノ酸スペーサーによって置換されるムテインを利用する。本発明によれば「Argリッチ」とは該スペーサーが少なくとも3個、好ましくは少なくとも4個のArg残基を含有することを意味する。最も好ましい実施態様では、該スペーサーは可変ドメインの8個のアミノ酸に続く野生型Bドメインの8個のアミノ酸からなる(図5A、配列番号:9参照)。ここ以前で論じたBドメイン修飾を有するかかる構築物では、提示されたvWF結合部位は未変化のままで、細胞培養培地中、または後に治療した患者の血液中に分泌された第VIII因子の即座のタンパク質分解性消化を防御する。トロンビン切断による特異的活性化の後のみ、第VIII因子がvWFから放出される。好ましい第VIII因子のcDNAは、例えば実施例1に記載される4個のDNA断片を集合させることにより構築した。
【0017】
本発明の実施態様(3)のタンパク質は、これに限定されないが、天然輸送シグナルペプチド(配列番号:4、13および15に示すタンパク質の−19から−1のアミノ酸残基に相当する)またはその断片もしくは類似体、人工ペプチド(例えば高度なアフィニティー精製のためのオリゴ−His−タグ)を含む別のNまたはC末端配列を含んでよい。
第VIII因子の発現のための最も好ましいベクターは図2に示すベクターpTGF8−1である。該ベクターのDNA配列を配列番号:3に示し、これ以前に扱った5個の変異(変異T485C、G6032AおよびT6816C(ここで;T1217C、G4088A、T4724AおよびT4872C)および配列番号:9のBドメインリンカーをコードするDNA配列)全てを包含し、配列番号:4に表される第VIII因子ムテインをコードする。
さらに最も好ましいベクターは、その共通する分子構造を図6に示したpTGF8−2hyg−sおよびpTGF8−3である。
【0018】
配列番号:12に示すpTGF8−2hyg−sはサイレント変異T6816Cのみを含み、配列番号:9のリンカーペプチドによるBドメインの置換を有するが、配列番号:2の野生型配列と比較して1次タンパク質構造にさらなる変化はない第VIII因子ムテインを生ずる。
配列番号:14に示すpTGF8−3は変異T485C、T668AおよびT6816Cを含み、前記のBドメインの置換に加えて、配列番号:2と比較してアミノ酸置換V162AおよびV2223Eを示す第VIII因子ムテインである。
【0019】
第VIII因子の製造の場合、フォンビルブラント因子の存在下で培養を実施する。フォンビルブラント因子は第VIII因子のモルあたり好ましくは10から100、より好ましくは50から60モルのvWFの量で用いられる(精製手順の間の培養液中および/または第VIII因子溶液中(以下を参照))。
本発明の好ましい実施態様(4)では、ヒト血液凝固因子は第IX因子またはそのムテインであり、好ましくは配列番号:5に示す野生型第IX因子である。第IX因子の適当なムテインには第IX因子の点突然変異および不完全形態などがある。最も好ましい第IX因子の発現のためのベクターは各々図3および図4に示すベクターpTGFG36およびpTG36hygである。
第IX因子の製造の場合、ビタミンKの存在下で培養を実施するのが好ましく、ビタミンKは好ましくは培養液1mlあたり0.1から100μg、より好ましくは培養液1mlあたり1から20μgの量で存在できる。
【0020】
本発明の実施態様(1)記載の方法は、
(c)ステップ(b)で単離された血液凝固因子を精製するステップ;および/または
(d)ステップ(b)で単離された、またはステップ(c)で精製された血液凝固因子をウイルス不活性化処置に当てるステップ;
をさらに含む。
適当な精製ステップは純粋で、安定的かつ高活性の産物の収量を最大にする当業界で既知の方法を含み、免疫アフィニティークロマトグラフィー、陰イオン交換クロマトグラフィー、サイズ排除クロマトグラフィー等およびその組み合わせから選択される。特にヒト血漿からの凝固因子の詳細な精製プロトコールは例えば国際公開公報第93/15105号、欧州特許第0813597号、国際公開公報第96/40883号および国際公開公報第96/15140/50号に開示されている。組換え第VIII因子および第IX因子を単離するのに必要な特異的な要件にこれらを容易に適合させることができる。第IX因子については、硫酸アンモニウム沈殿ステップ、続いてDEAEおよびHICテンタクルクロマトグラフィーおよびヘパリンアフィニティークロマトグラフィーを含む有効なプロトコールが紹介されている(米国特許第5919909号)。精製手順の間および後の精製されたタンパク質量および活性をELISAおよび凝固アッセイによりモニターできる。
【0021】
精製されたタンパク質試料中または選択した分泌組換えタンパク質を含む細胞培養上清から直接得られる産物中の可能な感染性夾雑物の問題を打破するために、試料および/または培養上清を熱処理(乾燥または液体状態で、プロテアーゼインヒビターなどの化学物質を添加して、または添加せずに)などのウイルス不活性化の手順で処理できる。ウイルス不活性化の後、化学物質を除去するためのさらなる精製ステップが必要である。特に血漿から単離された第VIII因子の場合、例えば陰イオン交換クロマトグラフィーによる高純度のウイルス不活性化タンパク質の収集が記載されている(国際公開公報第93/15105号)。加えて、血漿または他の生物学的資源から高純度の非感染性凝固因子を製造するためのいくつかの方法が報告されている。潜在的な感染性物質を2相系を形成する疎水性相で処理し、続いてそこから水不溶性部分を除去することにより、脂質コーティングされたウイルスは効果的に不活性化される。さらなる利点は非イオン性生体適合性界面活性剤およびジアルキルまたはトリアルキルホスフェートでの処置と同時にまたは引き続いて疎水相処置を補足することであることが解明された(国際公開公報第9636369号、欧州特許第0131740号、米国特許第6007979号)。非脂質コーティングウイルスには非イオン性界面活性剤で処理し、続いて数時間の加熱ステップ(60から65℃)からなる不活性化プロトコールが必要である(国際公開公報第94/17834号)。
【0022】
前記の結果に鑑み、ヒト細胞株に基づく有効なタンパク質発現系と潜在する危険性を有する感染性因子を不活性化するための改善された方法との組み合わせが、組換え凝集因子の製造のために安全で容易に使用される方法として提供される。
さらに、本発明の実施態様(6)によれば、優れた第VIII因子変異体が提供される。該第VIII因子変異体を医薬組成物の一部にでき、血友病を治療するための医薬品の調製のために使用でき、血友病の治療のための方法に応用できる(本発明の実施態様(11)から(13))。前記の医薬組成物および上記医薬品は治療上有効量、例えば50から500μg(国際単位(IU)に対応する第VIII因子200ngを含む)の第VIII因子を含有する。血友病の型により、患者は第VIII因子を年間用量200000IUまで投与され、通常週1回または週2回投与される。
【0023】
実施態様(11)から(13)の血友病を治療する方法に適用される医薬組成物、医薬品または調製物は治療上有効量の実施態様(6)の第VIII因子ムテインまたは実施態様(9)の遺伝子トランスファーベクターを含有する。前者の場合、ヒト血清アルブミン(HSA;好ましくは約1mg/ml溶液);無機塩例えばCaCl2(好ましくは2から5mM);アミノ酸例えばグリシン、リジン、およびヒスチジン(好ましくはアミノ酸あたり0.1から1M);二糖類例えばスクロースおよび/またはトレハロース(好ましくは0.4から1M);有機塩例えばクエン酸ナトリウム(好ましくは50mMまで);等の医薬上許容し得る添加剤を含有してよい。調製物は水性または非水性でよい。後者の場合、主要成分はグリセロールおよび/またはポリエチレングリコール(例えばPEG−300)である。調製物は乾燥形態でもよい(投与前に望ましい溶媒に溶解すべきである)。
前記したように、本発明の実施態様(9)記載の遺伝子トランスファーベクターを医薬組成物の一部にでき、血友病を治療するための医薬品の調製のために使用でき、血友病の治療のための方法に適用できる(本発明の実施態様(11)から(13))。該医薬組成物および医薬品はさらに適当なマトリックス処方、例えば国際公開公報第00/49147号(その開示は参考文献として本明細書に組み込まれる)で論じられる脂質またはホルモンを含有してよい。遺伝子トランスファーベクターまたは本発明の遺伝子トランスファーベクターを含む医薬組成物または医薬品を経口、静脈内、筋肉内、皮下、局所、経粘膜(バッカル、鼻腔用スプレイなど)により、または遺伝子ガンにより投与できる。経口投与(例えば微粉化ホルモン分散物にて)が好ましい。
【0024】
本発明の実施態様(6)の第VIII因子ムテインは前記の実施態様(3)に記載されるとおりであるのが好ましい。該第FVIII因子ムテインをさらに標準的な組換え技術、例えば:
(a)実施態様(8)のベクターで形質転換された、および/または実施態様(7)のDNAを含有する宿主細胞を培養すること(これはまた少なくとも一つのウイルス転写アクチベータータンパク質を安定的に発現し、ヒト血液凝固因子をコードするDNA配列に機能的に連結したウイルス転写プロモーターを有するベクターを保持する不死化ヒト細胞株を培養することも含む);および
(b)培養液から血液凝固因子を単離すること;
を特徴とする方法により調製することができる。適当な不死化ヒト細胞株、転写アクチベータータンパク質およびウイルスプロモーターはこれ以前に記載されたものである。該方法において利用される不死化ヒト細胞株は好ましくは二つのウイルス転写アクチベータータンパク質、最も好ましくは温度感受性SV40T抗原およびアデノウイルスE1Aタンパク質を発現する。この方法はさらに前記した精製およびウイルス不活性化ステップ(c)および(d)を含有してよい。
市販の細胞株293T(ECACC:tsa201、ref.96121229)は2001年2月20日、寄託番号DSM ACC2494でDMSZ(ドイッツェ・サムルング・フォン・ミクロオルガニズメン・ウント・ゼルクルツレン・GmbH、マッシェルオーダー・ウェグ 1b、38124 ブラウンシュバイッヒ、ドイツ)に寄託された。
以下の実施例により本発明をさらに説明する。
【0025】
【実施例】
実施例1−第VIII因子のクローニング:
組換え第VIII因子の配列は完全なヒト肝細胞RNAプールを逆転写することにより得られた。その後、制限部位を含むように設計されたプライマーを用いて標準的なPCRにより4つの断片(1/2、3/4、5/6、7/8)を増幅した。断片3/4および5/6組み合わせるために、プラスミドpBSFVIII3/4のSmaI/SalI断片をpBSFVII5/6のSalI部位にブラント挿入し、pBSFVIII3/6を得た。次にpBSFVIII3/6をXhoI/BspHI、および部分的にAlw44Iで消化して断片3/6を得た。pBSFVIII1/6を得るこの手段により、この断片およびpBSFVIII1/2のPstI/Alw44I断片をPstIおよびXhoIで消化したpBSFVIII1/2のベクターバックボーンに1ステップで連結した。pBSFVIII7/8をSmaIおよび部分的にMva1269Iで消化することにより断片7/8が得られ、XhoIおよびMva1269Iで切断したpBSFVIII1/6に連結し、pBSFVIII1/8を生じた。最終的にpBSFVIII1/8のSmaI/XhoI断片をオクタジーンベクターpTGFG67(該ベクターの製造はPCT/欧州特許第00/01368号に開示されている)のSalI部位にブラント挿入し、ヒト第VIII因子の真核細胞発現ベクターであるpTGF8−1が得られた(図1および図2参照)。得られたベクターは変異V162A、S2011NおよびV2223Eを有する第VIII因子ムテインをコードする。
【0026】
実施例2−第IX因子のクローニング:
ベクターpUC19(MBIファーメンタス)をXbaIで消化し、クレノウ酵素で処置し、再連結した。このXbaI欠失ベクターをEcoRI部位を欠失させるために、次いでEcoRIで消化し、クレノウ酵素で処置し、再連結した。このベクターのSacI部位にXbaI部位を挿入するために、SacIで消化し、T4DNAポリメラーゼで処置し、アルカリホスファターゼで脱リン酸化し、XbaIリンカーCTCTAGAG(バイオラブズ#1032)と連結した。新規に作製したベクターをHindIIIで消化することにより別のXbaI部位を挿入し、それをクレノウで処置し、アルカリホスファターゼで脱リン酸化し、XbaIリンカーCTCTAGAG(バイオラブズ#1032)と連結した。このベクターをpUC19/Xと命名した。
ベクターphGFP−S65T(クロンテック)に存在するXbaI部位を破壊するために、このベクターをXbaIで消化し、クレノウ酵素で処置し、再連結し、ベクターpGFP/0を得た。pGFP/0をMluIで消化し、それをクレノウ酵素で処置し、それをBamHIで消化した後、GFP遺伝子を含む2.3kbの断片を単離した。この断片をSalIで消化し、クレノウ酵素で処置し、BamHIで消化したベクターpUC19/Xのマルチプルクローニング部位に挿入した。得られたベクターをpTGFG1と命名した。
オリゴヌクレオチド(メタビオン)PRE−S(5‘−GGG GTA CCA GCT TCG TAG CTA GAA CAT CAT GTT CTG GGA TAT CAG CTT CGT AGC TAG AAC ATC ATG TTC TGG TAC CCC−3’;配列番号:10)およびPRE−AS(5‘−GGG GTA CCA GAA CAT GAT GTT CTA GCT ACG AAG CTG ATA TCC CAG AAC ATG ATG TTC TAG CTA CGA AGC TGG TAC CCC−3’;配列番号:11)
をハイブリダイズし、キナーゼ反応によりリン酸化し、インサートPRE(ds)を得た。
ベクターpTGFG1をEcoO109Iで消化し、クレノウ酵素で処置し、アルカリホスファターゼで脱リン酸化した。これを次いでPRE(ds)インサートに連結し、ベクターpTGFG5を得た。
ベクターpUC19(MBIファーメンタス)をSalIで消化し、クレノウ酵素で処置し、アルカリホスファターゼで脱リン酸化した。これをNotI−リンカーGCGGCCGC(バイオラブズ#1045)に連結し、ベクターpUC19/Nを得た。
第IX因子オープン・リーディング・フレームの開始および終止コドンに重なる2個のプライマーを用いてヒト肝臓cDNA(クロンテック)から第IX因子cDNAを増幅し、完全なオープン・リーディング・フレームを含む1387bpの断片を得た。クローニングを容易にするために、EcoRI(上流)およびBamHI(下流)の制限部位を各プライマーの末端に含む。反応容量50μl[10mM トリスHCl(pH8.85)、25mM KCl、5mM (NH4)2SO4、2mM MgSO4]でPwo DNAポリメラーゼ(ベーリンガー・マンハイム)を用いて、96℃で1分間、60℃で1分間、72℃で2分間のインキュベーションを30サイクル、続いて72℃で10分間の最終伸長ステップで増幅を実施した。
反応生成物をPUC19のEcoRIおよびBamHI部位にライゲートし、大腸菌DH5−αに形質転換した。陽性のクローンを選別した。標識プライマー(IR−700)を用いる両方の末端からのサイクルシークエンシング(アマシャム)およびLiCorシークエンシングシステムの自動分析(MWG、バイオテック)により配列を確認した。
以下のプライマーを使用した:
GGAATTCCGCAAAGGTTATGCAGCGCGTGAACATGATCATGGC(上流;配列番号:16)
CGCGGATCCATTAAGTGAGCTTTGTTTTTTCCTTAATCC(下流;配列番号:17)。
PstIで消化し、T4−ポリメラーゼで処置し、アルカリホスファターゼで脱リン酸化した、前記で調製されたベクターpUC19/NのPstI部位に、ヒトcDNAライブラリーから単離したヒト凝固第IX因子のオープン・リーディング・フレームを含む1.4kbの断片を挿入した。得られたベクターpUC19/N−FIXからヒト凝固第IX因子のオープン・リーディング・フレームを含む1.4kbの断片をHindIIIおよびNotIの二重消化により切り出した。この断片をHindIIIおよびNotI二重消化したベクターpTGFG5の4.3kbの断片に連結し、図3に示すベクターpTGFG36を得た。このベクターは第IX因子をコードする発現カセットを細胞に分配するために好ましいベクターで、そのDNA配列を配列番号:6に示す。
【0027】
実施例3−タンパク質発現のためのヒト細胞株
好ましい細胞株は、SV40温度感受性T抗原を安定的に発現する、形質転換されたヒト胚性腎臓細胞株(293、ECACC番号85120602)であるtsA201(ECACC Ref.:96121229)である(J.Membrane Biol.152:39(1996);Gene 156:235(1995);PNAS USA 91:12785(1994);Pflugers Arch.427:136(1994);J.Gen.Physiol.104:57(1994);Biotechniques 15:906(1993))。この細胞株の他の名称には293tsA1609neo(Mol.Cell.Biol.7:379(1987))および293Tなどがある。この上皮性様細胞株は種々の機能発現アッセイにおいて用いられており、高レベルの組換えタンパク質を生産することが報告されている。これらは2mM グルタミンおよび10% FCSを添加したDMEM中で培養できる。第IX因子を効果的に製造するために、ビタミンKを100μg/mlまで添加することにより培地を改変することができる(米国特許第4770999号)。
発現されたポリペプチドの精製を簡単にするために、適当な補助剤を含む血清不含またはタンパク質不含培地で細胞を培養することができる。安定性の理由から、分泌された第VIII因子は培地中にvWFの存在が必要である(米国特許第5198349号)。リポタンパク質、リン脂質、ポリグリコール、微量金属、ヘパリン、非イオン性界面活性剤またはシクロデキストリンの添加もまた報告されている(欧州特許第0254076号、米国特許第5679549号、米国特許第5198349号、米国特許第5250421号、米国特許第5576194号、欧州特許第0872487号、国際公開公報第94/11525号、米国特許第5378612号)。
【0028】
実施例4−第VIII因子および第IX因子の一過性生産のための293T細胞のリン酸カルシウムトランスフェクション:
トランスフェクションの前日に、密集成長させた293T細胞を10cmディッシュでDMEM/10% FCS(FIX用には10μg/ml ビタミンK)6ml中に低密度でプレートする。チェンおよびオカヤマ(Mol.Cell.Biol.7:2745(1987))におおよそ従って、トランスフェクションを実施した。第VIII因子の製造用にはプラスミドpTGF8−1 12μgを、第IX因子の製造用にはpTGFG36をトランスフェクトした。トランスフェクションの6時間後に培地を新鮮なものと交換し、トランスフェクションの3日後に上清を回収し、さらに精製するかあるいはさらに精製することなくELISAまたはコアグロメトリーにより分析した(実施例5および6を参照)。
【0029】
実施例5−ELISAによるFIXおよびFVIII濃度の決定:
第IX因子:
捕獲抗体としてヤギポリクローナル抗ヒトFIX(エンザイム・リサーチ・ラボラトリーズ)を用いるELISAにより、トランスフェクトした293T細胞の上清中のヒト組換え第IX因子のレベルを決定した。全インキュベーションは加湿チャンバー中22℃で2時間実施した。プレート(ダイネックス、イムロン−4)を抗体8.8μg/mlのコーティングバッファー100μlでコーティングした。記載した条件下ではブロッキングは必要ない。非特異的相互作用をブロックするためにはPBS・トゥイーン(登録商標)(0.1容量/容量%)でプレートを4回(エンコア2000、メルク)洗浄するので十分である。
各々別の工程の後、未結合のタンパク質を除去するために洗浄が必要とされた。10mM PMSF10μlで処置した上清100μlおよび0.11M クエン酸ナトリウム10μlを各ウェルに加えた。希釈バッファー(HBS−BSA−EDTA−トゥイーン(登録商標))で試料および標準品(ヒト第IX因子、ハウス標準、オクタファルマ)の希釈を行い、100μl/ウェルでインキュベートした。検出抗体は1μg抗体/ml希釈バッファー濃度のペルオキシダーゼ標識ヤギポリクローナル抗FIX(エンザイム・リサーチ・ラボラトリーズ)であり、100μl/ウェルでインキュベートした。各ウェルに基質としてABTS(ロッシュ)150μlを加え、1から2時間後405nmで比色反応を検出した。標準濃度対標準吸収の直線回帰により結果を算出し、以下の表にまとめる:
【0030】
【表1】
細胞数[/ml] 第IX因子濃度[ng/ml] 凝固時間[秒]
___________________________________
2.1×105 36 45
8.7×105 20 79
正常血漿:37から39秒
第IX欠損血漿:137から140秒
【0031】
第VIII因子:
捕獲抗体としてアフィニティー精製ポリクローナルヒツジ抗FVIII:C調製物(F8C−EIA−C、アフィニティー・バイオロジカルズ)を用いてELISAによりトランスフェクトされた293T細胞の培養濾液中のヒト組換え第VIII因子のレベルを決定した。加湿チャンバー中22℃で2時間コーティングを実施した。コーティングバッファー(50mM炭酸ナトリウム、pH9.6)中100倍希釈の抗体100μlでプレート(ダイネックス、イムロン−4)をコーティングした。非特異的相互作用をブロックするためにPBS・トゥイーン(登録商標)(0.1容量/容量%)でプレートを4回洗浄(エンコア2000、メルク)で十分であった。
各々別の工程の後、未結合のタンパク質を除去するために洗浄が必要とされた。48時間のインキュベーションの後pTGF8−3で安定的にトランスフェクトされた異なる293Tクローンから回収された培養濾液試料の各々100μlを各ウェルに加えた。希釈バッファー(HBS−BSA−EDTA−トゥイーン(登録商標))でFVIII標準品(ハウススタンダード、オクタファルマ)の希釈を行い、100μl/ウェルでインキュベートした。検出用にペルオキシダーゼ標識抗FVIII(F8C−EIA−D、アフィニティー・バイオロジカルズ)の既製の希釈物をウェルあたり100μlで60分間インキュベートした。比色反応用に使用の直前にO−フェニレンジアミン(P−6912、シグマ)5mg錠剤を基質バッファー12mlに溶解し、30% H2O2 12μlで充当した。この基質溶液150μlを各ウェルに加え、暗闇、室温で10分間インキュベートし、各ウェルに2.5M H2SO4 50μlを添加して反応を停止させた後、MRXリーダー(ダイネックス)で490nmでの比色記録を行った。標準濃度対標準吸収の直線回帰により結果を算出し(図7A)、図7Bにまとめる。
【0032】
実施例6: ヒト凝固第VIII因子および第IX因子活性の検出:
細胞培養293T細胞(実施例4に記載されるようにpTGF8−1を用いてリン酸カルシウム沈殿によりトランスフェクトされた)の上清中のヒト組換え第VIII因子の凝固活性を以下のとおり決定した:
手動凝固装置(ML−2、インストラメンテーション・ラボラトリーズ)でセファリン(ホスファチジルエタノールアミン)活性化を用いる部分的トロンボプラスチン時間アッセイに基づいて凝固活性を検定した。実験のために、トランスフェクトした293T細胞の無希釈上清100μl、欠損血漿(プロゲン)100μlおよびセファリン(インストラメンテーション・ラボラトリーズ)100μlを37℃で5分間インキュベートした。CaCl2 100μlを添加することにより凝固を開始した。試料の凝固時間を正常血漿と比較した。結果を図5Bにまとめる。図5Bから示され得るように、pTGF8−1でトランスフェクトされた細胞からの細胞上清は正常血漿と比較して凝固活性を示すが、トランスフェクトされていない細胞では第VIII因子を欠損する血漿と同等の値を呈する。
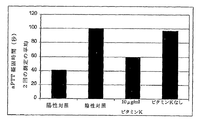
第IX因子に関して類似のアッセイを実施した。結果を実施例5の表に示す。ビタミンKの存在に対する発現の依存性については図10を参照されたい。
【0033】
実施例7− ウイルス不活性化:
米国特許第6007979号の方法に従って、ウイルス不活性化を実施した。すなわち、潜在的感染性タンパク質溶液に以下の化合物を添加し、続いて攪拌した:
1.トゥイーン(登録商標)80、0.2mlおよびTNBP、0.06mlを溶液19.74mlに添加した;または
2.トリトン(登録商標)X−100、0.2mlおよびTNBP、0.2mlを溶液19.6mlに添加した。
ヒマシ油1mlを調製物1および2に添加し、次いでこれを室温で1時間、激しく抽出した。
各々の場合で相分離のために遠心を行った。感染性対照に関しては、各1mlの試料を水性分画から繰り返し採取した。
【0034】
実施例8−第VIII因子および第IX因子を安定的に発現する細胞株の確立:
好ましいベクターpTGF8−1およびpTGFG36は各々哺乳動物細胞における第VIII因子および第IX因子の一過性発現のための構築物を含有する。安定的にトランスフェクトされた細胞クローンの選別方法を可能にするために、ハイグロマイシン−B−ホスフォトランスフェラーゼのカセット(TK−HygからのHindIII−Mva1260I断片、クロンテック)を両方のベクターに存在するSmaI部位にサブクローニングした。その結果得られた構築物(pTGF8−1−hygおよびpTG36hyg)は、CMV−プロモーターおよびSV40−ポリアデニル化シグナルを有するヒト第VIII因子または第IX因子の発現カセット、並びにHSVチミジンキナーゼプロモーターおよびHSVチミジンキナーゼポリアデニル化シグナルを有するハイグロマイシン−B−ホスフォトランスフェラーゼ発現カセットをシスで含む(図4参照)。
ベクターpTGF8−2hyg−sおよびpTGF8−3(図6、配列番号:12および14)はpTGF8−1hygの誘導体であり、そこでは点突然変異V162A、S2011NおよびV2223E(pTGF8−2hyg−s)およびS2011N(pTGF8−3)がクイックチェンジ(登録商標)プロトコール(ストラタジーン)を用いるPCR依存性の方法により野生型配列に復帰した。
凝固因子のコーディング配列を選択した他のいずれかの遺伝子配列と置換することができる。これらの構築物は、リン酸カルシウムトランスフェクションおよび続くハイグロマイシン抵抗性に関する選別による安定的な発現をする細胞株の確立を可能にする。さらに、プラスミドはプロゲステロン応答性因子(PRE)を含む。pTG36hygを用いた一過性トランスフェクション実験では、ELISAおよびコアグロメトリックアッセイにより培地1mlあたり約40ngの活性第IX因子が製造されたことを示すことができた(実施例5および6参照)。
第IX因子の製造に関しては、10%FCSおよび10μg/mlビタミンKを添加したDMEM中で293T細胞を培養した(米国特許第4770999号、図10をも参照)。まず、安定的にトランスフェクトされた293T細胞を有効に選別するための抗生物質の臨界濃度を確立しなければならなかった。このために、細胞を低希釈でプレートに播き、10から800μg/mlのハイグロマイシンBの存在下で成育した。200μg/mlまたはそれ以上の濃度で2週間後、細胞は成長していなかったので、この濃度を安定的にトランスフェクトした細胞の選別のために選択した。
標準的なトランスフェクションを10cmディッシュで293T細胞を用いて分配前日に1:15の比率で実施した。リン酸カルシウム沈殿法(Biotechniques(1988)6(7):632−638)を用いて、ディッシュあたりプラスミド12μgをトランスフェクトし、2日後、培地を200μg/mlハイグロマイシンBを含有する新鮮な培地と交換した。選別の2から3週後、ELISA(実施例5を参照)により第VIII因子または第IX因子の存在に関して培地を試験した。陽性クローンを単離し、24ウェルプレートに移した。ELISAおよび活性決定によるスクリーニングの後、陽性クローンをさらに2回のサブクローニングのラウンドに当て、次いで展開した後、そのアリコートをさらなる使用および特徴づけのために凍結した。
【0035】
実施例9: 第VIII因子発現のインサイチュー免疫蛍光検出による安定的にトランスフェクトされた細胞の表現型均一性の証明:
DMEM+9.1% FBSを用いた付着培養から、pTGF8−3で安定的にトランスフェクトした5x107個の293T細胞(クローン49/19)およびトランスフェクトしていない293T細胞(陰性対照)の各々をトリプシン消化により培養ディッシュから剥離し、数回洗浄し、PBSバッファー5mlに再懸濁した。
これらの細胞懸濁液2μlを滅菌顕微鏡用ガラススライドに移し、全液体が蒸発するまで室温でインキュベートした。細胞を70%エタノール中10分間固定し、室温で5分間乾燥した。PBSバッファー中10%希釈のFBS中でインキュベートすることにより、スライドを非特異的検出に対してブロックした。1次抗体(sh抗FVIII:C F8C−EIA−C、アフィニティー・バイオロジカルズ)を10%FBSおよび0.1%サポニンを含むPBSバッファーで100倍希釈し、加湿インキュベーションチャンバー中室温で60分間インキュベートした。PBSでしっかり洗浄した後、100倍希釈の2次抗体(rb抗sh CY3コンジュゲート313−165−003、ジャクソン・イムノ・リサーチ)を調製し、前記の方法でインキュベートした。続いて顕微鏡用プレパラートをしっかり洗浄し、50%グリセロール層およびカバーガラスにより被覆した。白色光、および蛍光顕微鏡(570nmで放射)により可視化した。
結果を図8に表す。
【0036】
実施例10: 培養濾液中の組換え第IX因子における熱安定性試験:
100μg/mlビタミンKの存在下、pTGFG36での一過性のトランスフェクションの48時間後に293T細胞から回収し、−80℃で7日間保存した培養濾液を迅速に解凍し、500μlのアリコート7個に分配し、次に続いてこれを以下の温度のインキュベーションに当てた:
【0037】
【表2】
試料 温度(℃) 時間(分)
_______________________
1 0 240
2 20 30
3 20 60
4 20 240
5 37 30
6 37 60
7 37 240
【0038】
サンプルを氷上で冷却し、実施例6で示す概要のとおりFIX活性を決定した(二重測定)。結果を図9に示す。37℃で240分までのインキュベーション条件内で活性はほぼ安定した。
【図面の簡単な説明】
【図1】 図1は欠失したBドメイン有する第VIII因子の構築に利用される断片を示す(実施例1)。
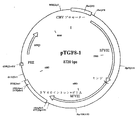
【図2】 図2は8720bpの環状DNAであるベクターpTGF8−1を示し、その正確なDNA配列は配列番号:3に示す(該DNA配列によりコードされる第VIII因子タンパク質に関しては配列番号:4を参照)。
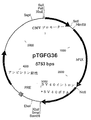
【図3】 図3は5753bpの環状DNAであるベクターpTGFG36を示し、その正確なDNA配列は配列番号:6に示す(配列番号:6内の塩基689から2071は第IX因子タンパク質をコードする)。
【図4】 図4は8124bpの環状DNAであるベクターpTG36hygを示す。
【図5】 図5Aは本発明の好ましいリンカー配列(配列番号:9)を表す、図5Bは実施例6で決定される組換えhFVIIIの凝固時間を示す。
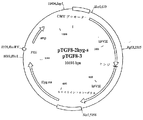
【図6】 図6は10698bpの環状DNAであるpTFG8−2hyg−5およびpTGF8−3の共通する分子構造を示し、その正確なDNA配列は配列番号:12および14に示す(該DNA配列によりコードされる第VIII因子に関しては配列番号:13および15を参照)。
【図7】 図7Aは実施例5に記載されるFVIII ELISAの検量線を示し、図7Bは実施例5に記載される、異なる培養濾液における組換えFVIII濃度の測定結果を表す。
【図8】 図8は実施例9に記載される第VIII因子特異的免疫蛍光アッセイの結果を示す。上列:pTGF8−3、クローン49/19で安定的にトランスフェクトされた293T細胞。下列:陰性対照:トランスフェクトされていない293T細胞。AおよびC:白色光、フィルターなし;BおよびD:フィルター550nmでの蛍光による第VIII因子検出。
【図9】 図9は実施例10に記載される培養濾液におけるFIX活性に及ぼす熱処理の影響を示す。
【図10】 図10は、培地へのビタミンKの添加に対する活性組換え第IX因子の発現の依存性を示す。
【配列表】
Claims (27)
- Arg740とGlu1649の間のBドメインが、少なくとも3個のArg残基を有し、10から25個のアミノ酸残基を含有してなるArgリッチのリンカーペプチドにより置換される第VIII因子ムテインであって、前記第VIII因子のナンバリングは配列番号:2で示される成熟野生型第VIII因子の配列に対応する、前記ムテイン。
- 第VIII因子ムテインが以下の突然変異(a)162番目のValがGly、Ala、Leu、Ile、MetおよびProから選択される中性アミノ酸残基により置換される;
(b)2011番目のSerがAsn、ThrおよびGlnから選択される親水性アミノ酸残基により置換される;
(c)2223番目のValがGluおよびAspから選択される酸性アミノ酸残基により置換される;
の少なくとも一つを有する、請求項1に記載の第VIII因子ムテイン。 - 第VIII因子ムテインが突然変異(a)および(b)の少なくとも一つを有する、請求項2に記載の第VIII因子ムテイン。
- 第VIII因子ムテインが突然変異(a)、(b)および(c)の3種全てを有する、請求項2に記載の第VIII因子ムテイン。
- 突然変異(a)において、162番目のValがAlaに置換され、突然変異(b)において、2011番目のSerがAsnに置換され、および/または突然変異(c)において、2223番目のValがGluに置換される、請求項2から4のいずれか一つに記載の第VIII因子ムテイン。
- Argリッチのリンカーペプチドが14から20アミノ酸残基を有する、請求項1から5のいずれか一つに記載の第VIII因子ムテイン。
- リンカーがアミノ酸配列SFSQNSRH、および/または
アミノ酸配列QAYRYRRGを含有する、請求項1から6のいずれか一つに記載の第VIII因子ムテイン。 - リンカーが配列SFSQNSRHQAYRYRRG、を有する、請求項7に記載の第VIII因子ムテイン。
- 配列番号:4、13または15のアミノ酸1から1440番目を含有する、請求項1に記載の第VIII因子ムテイン。
- 請求項1から9のいずれか一つに記載の第VIII因子ムテインをコードするDNA配列。
- 配列番号:1に示される成熟野生型第VIII因子のDNA配列に関する、突然変異T485C、G6032AおよびT6668Aの少なくとも一つを有する、請求項10に記載のDNA配列。
- 配列番号:1に示される成熟野生型第VIII因子のDNA配列に関する、突然変異T485C、G6032AおよびT6668Aの3種全てを含有する、請求項10に記載のDNA配列。
- 請求項10から12のいずれか一つに記載のDNAを含有するベクター。
- ベクターがそれぞれ配列番号:3、12および14で示されるpTGF8−1、pTGT8−2hyg−sまたはpTGF8−3である、請求項13に記載のベクター。
- 遺伝子トランスファーベクターである、請求項13に記載のベクター。
- 請求項13に記載のベクターで形質転換された、および/または、請求項10に記載のDNA配列を含有する宿主細胞。
- 請求項1から9のいずれか一つに記載の第VIII因子ムテインまたは請求項15に記載の遺伝子トランスファーベクターを含有してなる医薬組成物。
- 血友病を治療するための医薬を製造するための、請求項1から9のいずれか一つに記載の第VIII因子ムテインまたは請求項15に記載の遺伝子トランスファーベクターの使用。
- 前記血友病が血友病Aである、請求項18に記載の遺伝子トランスファーベクターの使用。
- (a)請求項16に記載の形質転換宿主細胞を培養し、
(b)培養液から第VIII因子ムテインを単離することを含む、請求項1から9のいずれか一つに記載の第VIII因子ムテインの生産方法。 - (a)シミアンウイルスT抗原を安定に発現し、第VIII因子ムテインをコードするDNA配列に機能的に連結するCMVプロモーターを含有するベクターを有する不死化ヒト細胞株を培養することを含む、請求項20に記載の方法。
- 不死化ヒト細胞株が不死化された腎臓、膀胱、肝臓、肺、心筋、平滑筋、卵巣または胃腸細胞である、請求項21に記載の方法。
- 不死化ヒト細胞株がヒト胎児腎臓細胞に由来し、好ましくは293T細胞株(DSM ACC2494)である、請求項22に記載の方法。
- ベクターがさらに選択マーカーおよび/または調節配列を含有する、請求項21から23のいずれか一つに記載の方法。
- 培養が、フォンビルブラント因子(vWF)の存在下で行われる、請求項21から24のいずれか一つに記載の方法。
- さらに、
(c)ステップ(b)で単離された血液凝固因子を精製すること;および/または、
(d)ステップ(b)で単離された、またはステップ(c)で精製された血液凝固因子をウイルス不活性化処理に供すること、を特徴とする、請求項20から25のいずれか一つに記載の方法。 - 少なくとも一つのウイルス転写アクチベータータンパク質を安定に発現し、請求項21から23の方法のいずれか一つに記載の第VIII因子ムテインをコードするベクターを有する不死化ヒト細胞株。
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| EP00106225.6 | 2000-03-22 | ||
| EP00106225A EP1136553A1 (en) | 2000-03-22 | 2000-03-22 | Production of recombinant blood clotting factors in human cell lines |
| US20324900P | 2000-05-08 | 2000-05-08 | |
| US60/203,249 | 2000-05-08 | ||
| PCT/EP2001/003220 WO2001070968A2 (en) | 2000-03-22 | 2001-03-21 | Production of recombinant blood clotting factors in human cell lines |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2003530093A JP2003530093A (ja) | 2003-10-14 |
| JP2003530093A5 JP2003530093A5 (ja) | 2005-08-18 |
| JP3894795B2 true JP3894795B2 (ja) | 2007-03-22 |
Family
ID=26070708
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2001569351A Expired - Lifetime JP3894795B2 (ja) | 2000-03-22 | 2001-03-21 | ヒト細胞株における組換え血液凝固因子の製造 |
Country Status (28)
| Country | Link |
|---|---|
| US (1) | US7572619B2 (ja) |
| EP (2) | EP1460131A3 (ja) |
| JP (1) | JP3894795B2 (ja) |
| KR (1) | KR100581574B1 (ja) |
| CN (1) | CN1454257B (ja) |
| AT (1) | ATE312176T1 (ja) |
| AU (3) | AU2001254715B2 (ja) |
| BE (1) | BE2014C077I2 (ja) |
| BG (1) | BG65930B1 (ja) |
| BR (1) | BRPI0109494B8 (ja) |
| CA (1) | CA2404163C (ja) |
| CZ (1) | CZ303929B6 (ja) |
| DE (1) | DE60115613T2 (ja) |
| DK (1) | DK1266006T3 (ja) |
| EA (1) | EA004317B1 (ja) |
| EE (1) | EE200200538A (ja) |
| ES (1) | ES2254403T3 (ja) |
| FR (1) | FR15C0003I2 (ja) |
| HR (1) | HRP20020767B1 (ja) |
| HU (1) | HU228091B1 (ja) |
| IL (2) | IL151857A0 (ja) |
| MX (1) | MXPA02009221A (ja) |
| NO (1) | NO330910B1 (ja) |
| NZ (1) | NZ521732A (ja) |
| RS (1) | RS50743B (ja) |
| SI (1) | SI1266006T1 (ja) |
| SK (1) | SK287706B6 (ja) |
| WO (1) | WO2001070968A2 (ja) |
Families Citing this family (52)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DK1266006T3 (da) * | 2000-03-22 | 2006-01-16 | Octagene Gmbh | Fremstilling af rekombinante muteiner af blodkoagulationsfaktor VIII i humane cellelinier |
| JP2004525608A (ja) * | 2000-09-19 | 2004-08-26 | エモリー ユニバーシテイ | 修飾された因子viii |
| EP1469064A1 (en) | 2003-04-15 | 2004-10-20 | DRK-Blutspendedienst Baden-Württemberg-Hessen gGmbH | Expression of proteins in endothelial cells derived from precursor cells from cord blood |
| ES2357132T3 (es) | 2004-03-19 | 2011-04-19 | Baxter International Inc. | Factor ixa para el tratamiento de trastornos hemorrágicos. |
| KR100624013B1 (ko) * | 2004-06-25 | 2006-09-19 | 주식회사 녹십자홀딩스 | 동결건조된 알부민 비함유 재조합 사람 혈액응고 제 8인자 제제 |
| DK1804839T3 (da) | 2004-09-22 | 2012-04-10 | St Jude Childrens Res Hospital | Forbedret ekspression af faktor ix i genterapivektorer |
| US20060094104A1 (en) | 2004-10-29 | 2006-05-04 | Leopold Grillberger | Animal protein-free media for cultivation of cells |
| ES2380485T3 (es) * | 2005-02-11 | 2012-05-14 | Novo Nordisk Health Care Ag | Producción de un polipéptido en un lÃquido de cultivo sin suero con hidrolizado de proteÃnas vegetales |
| EP1707634A1 (en) | 2005-03-29 | 2006-10-04 | Octapharma AG | Method for isolation of recombinantly produced proteins |
| EP1739179A1 (en) | 2005-06-30 | 2007-01-03 | Octapharma AG | Serum-free stable transfection and production of recombinant human proteins in human cell lines |
| DK2495307T5 (en) | 2006-07-13 | 2018-07-16 | Wyeth Llc | Preparation of coagulation factor IX with improved glycosylation pattern |
| JP6050927B2 (ja) * | 2007-04-26 | 2016-12-21 | シーエヌジェイ ホールディングス,インコーポレイテッド | 高シアル酸含量を有する組換えビタミンk依存性タンパク質およびその調製方法 |
| WO2009028575A1 (ja) * | 2007-08-27 | 2009-03-05 | National University Corporation Nagoya University | 血液凝固第vii因子プロモーターの活性化剤及びその利用 |
| BRPI0917656A2 (pt) | 2008-08-21 | 2017-07-11 | Octapharma Ag | Fatores viii e ix humanos produzidos de forma recombinante |
| SG2014012918A (en) | 2009-02-11 | 2014-04-28 | Novozymes Biopharma Dk As | Albumin variants and conjugates |
| EP2482841B2 (en) | 2009-10-02 | 2022-09-28 | The Children's Hospital Of Philadelphia | Compositions and methods for enhancing coagulation factor viii function |
| CN105567699A (zh) | 2009-10-30 | 2016-05-11 | 诺维信生物制药丹麦公司 | 白蛋白变体 |
| WO2011124718A1 (en) | 2010-04-09 | 2011-10-13 | Novozymes A/S | Albumin derivatives and variants |
| BRPI1105317A2 (pt) * | 2011-01-24 | 2013-04-30 | Fundacco Hemoct De Ribeirco Preto | produÇço estÁvel e em larga escala de fviii humano em linhagem celular humana sk-hep-1 |
| KR20200103845A (ko) | 2011-02-25 | 2020-09-02 | 추가이 세이야쿠 가부시키가이샤 | FcγRIIb 특이적 Fc 항체 |
| CN102199607B (zh) * | 2011-03-30 | 2012-11-14 | 山西大学 | 重组人凝血因子ix小基因及其ptc突变体稳定细胞株 |
| US9115381B2 (en) | 2011-05-13 | 2015-08-25 | Octapharma Ag | Method of increasing the productivity of eucaryotic cells in the production of recombinant FVIII |
| TW201307563A (zh) * | 2011-05-19 | 2013-02-16 | Shire Human Genetic Therapies | 純化乙醯肝素-n-硫酸酯酶之方法 |
| CN102321668A (zh) * | 2011-07-06 | 2012-01-18 | 中国人民解放军军事医学科学院野战输血研究所 | 一种表达重组人凝血因子ⅶ的方法及其专用载体 |
| EP3939996A1 (en) | 2011-09-30 | 2022-01-19 | Chugai Seiyaku Kabushiki Kaisha | Antigen-binding molecule promoting disappearance of antigens having plurality of biological activities |
| WO2013057219A1 (en) | 2011-10-18 | 2013-04-25 | Csl Behring Gmbh | Method for improving the stability of purified factor viii after reconstitution |
| US20140315817A1 (en) | 2011-11-18 | 2014-10-23 | Eleven Biotherapeutics, Inc. | Variant serum albumin with improved half-life and other properties |
| CN104080909A (zh) | 2011-11-30 | 2014-10-01 | 中外制药株式会社 | 包含进入细胞内以形成免疫复合体的搬运体(载体)的药物 |
| EP3330283A3 (en) | 2012-03-16 | 2018-07-11 | Albumedix A/S | Albumin variants |
| US9550819B2 (en) | 2012-03-27 | 2017-01-24 | Ngm Biopharmaceuticals, Inc. | Compositions and methods of use for treating metabolic disorders |
| GB201210357D0 (en) | 2012-06-12 | 2012-07-25 | Ucl Business Plc | Factor VIII sequences |
| US8986991B2 (en) * | 2012-07-03 | 2015-03-24 | Expression Therapeutics, Llc | High yield suspension cell line, system and method for making same |
| US10023628B2 (en) | 2012-07-06 | 2018-07-17 | Bioverativ Therapeutics Inc. | Cell line expressing single chain factor VIII polypeptides and uses thereof |
| US20140128326A1 (en) | 2012-11-08 | 2014-05-08 | Novozymes Biopharma Dk A/S | Albumin variants |
| US20150352194A1 (en) * | 2013-01-24 | 2015-12-10 | Portola Pharmaceuticals, Inc. | Inhibition of tissue factor pathway inhibitor with factor xa derivatives |
| KR102318483B1 (ko) | 2013-04-02 | 2021-10-27 | 추가이 세이야쿠 가부시키가이샤 | Fc영역 개변체 |
| EP2853538A1 (en) | 2013-09-27 | 2015-04-01 | Université Pierre et Marie Curie (Paris 6) | Analogues of temporin-SHa and uses thereof |
| TN2016000578A1 (en) | 2014-07-30 | 2018-04-04 | Ngm Biopharmaceuticals Inc | Compositions and methods of use for treating metabolic disorders |
| MD20170035A2 (ro) | 2014-10-31 | 2017-09-30 | Ngm Biopharmaceuticals Inc | Compoziţii şi metode de utilizare pentru tratamentul tulburărilor metabolice |
| GB201420139D0 (en) | 2014-11-12 | 2014-12-24 | Ucl Business Plc | Factor IX gene therapy |
| CA2963760A1 (en) | 2014-12-19 | 2016-06-23 | Yoshinao Ruike | Anti-myostatin antibodies, polypeptides containing variant fc regions, and methods of use |
| BR102015012334A2 (pt) | 2015-05-27 | 2016-11-29 | Fundação Hemoct De Ribeirão Preto Fundherp | processo de produção do fator vii de coagulação sanguínea e fator vii de coagulação sanguínea |
| WO2016198499A1 (en) | 2015-06-09 | 2016-12-15 | Glycotope Gmbh | IMPROVED METHOD FOR PRODUCTION OF γ-CARBOXYLATED POLYPEPTIDES |
| CA2989966C (en) | 2015-08-20 | 2024-04-30 | Albumedix A/S | Albumin variants and conjugates |
| CN105219739A (zh) * | 2015-09-21 | 2016-01-06 | 北京神源德生物科技有限公司 | 重组单纯疱疹病毒及它感染和制备它的宿主细胞以及它们的应用 |
| RU2762257C2 (ru) | 2016-04-15 | 2021-12-17 | Зе Трастис Оф Зе Юниверсити Оф Пенсильвания | Генная терапия для лечения гемофилии a |
| CA3026050A1 (en) | 2016-08-05 | 2018-02-08 | Chugai Seiyaku Kabushiki Kaisha | Composition for prophylaxis or treatment of il-8 related diseases |
| EP3625329A1 (en) | 2017-05-17 | 2020-03-25 | Octapharma AG | Method for the production of a recombinant target protein |
| JP2021502967A (ja) | 2017-11-14 | 2021-02-04 | 中外製薬株式会社 | 抗C1s抗体および使用方法 |
| WO2020020364A1 (zh) * | 2018-07-26 | 2020-01-30 | 正大天晴药业集团南京顺欣制药有限公司 | 一种制备重组人凝血因子ⅷ的方法 |
| US10842885B2 (en) | 2018-08-20 | 2020-11-24 | Ucl Business Ltd | Factor IX encoding nucleotides |
| EP4352083A1 (en) | 2021-06-11 | 2024-04-17 | Sorbonne Universite | Short antimicrobial peptides |
Family Cites Families (21)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| FI86885C (fi) * | 1984-04-20 | 1992-10-26 | Genentech Inc | Foerfarande foer framstaellning av human rekombinantfaktor viii och nukleinsyrasekvenser och vektorer anvaend daertill |
| JPS6171774A (ja) * | 1984-09-14 | 1986-04-12 | Sony Corp | テレビジヨンカメラ装置のビ−ム電流制御装置 |
| AU5864086A (en) * | 1985-04-22 | 1986-11-18 | Genetics Institute Inc. | High yield production of active factor ix |
| ATE87663T1 (de) | 1986-01-03 | 1993-04-15 | Genetics Inst | Verfahren zur herstellung von faktor-viii:c-typ- proteinen. |
| US5451521A (en) * | 1986-05-29 | 1995-09-19 | Genetics Institute, Inc. | Procoagulant proteins |
| US5422260A (en) * | 1986-05-29 | 1995-06-06 | Genetics Institute, Inc. -Legal Affairs | Human factor VIII:c muteins |
| US5024939A (en) * | 1987-07-09 | 1991-06-18 | Genentech, Inc. | Transient expression system for producing recombinant protein |
| FR2638643B1 (fr) * | 1988-11-09 | 1991-04-12 | Transgene Sa | Sequence d'adn codant pour le facteur ix humain ou une proteine analogue, vecteur d'expression, cellules transformees, procede de preparation du facteur ix et produits obtenus correspondants |
| NZ236094A (en) * | 1989-11-17 | 1993-04-28 | Chiron Corp | Recombinant protein complex having human factor viii:c activity |
| SE465222C5 (sv) * | 1989-12-15 | 1998-02-10 | Pharmacia & Upjohn Ab | Ett rekombinant, humant faktor VIII-derivat och förfarande för dess framställning |
| HUT63459A (en) * | 1990-01-26 | 1993-08-30 | Immuno Ag | Blood factors produced by recommbinant process, process for expressing them, as well as recombinant vaccine viruses used in the process |
| US5445953A (en) * | 1991-08-26 | 1995-08-29 | Immuno Aktiengesellschaft | Direct molecular cloning of a modified poxvirus genome |
| EP0710288B1 (en) * | 1993-06-10 | 2006-04-05 | Genetic Therapy, Inc. | Adenoviral vectors for treatment of hemophilia |
| EP0951544A2 (en) * | 1996-07-03 | 1999-10-27 | Chiron Corporation | Methods for administration of recombinant gene delivery vehicles for treatment of human disease |
| US6114148C1 (en) * | 1996-09-20 | 2012-05-01 | Gen Hospital Corp | High level expression of proteins |
| AU735763B2 (en) * | 1997-12-05 | 2001-07-12 | Immune Response Corporation, The | Novel vectors and genes exhibiting increased expression |
| US6358703B1 (en) * | 1998-12-10 | 2002-03-19 | Bayer Corporation | Expression system for factor VIII |
| NZ513595A (en) * | 1999-02-19 | 2001-09-28 | Octagene Gmbh | Hormone-hormone receptor complexes and nucleic acid constructs and their use in gene therapy |
| AU6770200A (en) * | 1999-08-13 | 2001-03-13 | Fred Hutchinson Cancer Research Center | Crystal of a truncated protein construct containing a coagulation factor viii c2domain in the presence or absence of a bound ligand and methods of use thereof |
| DK1266006T3 (da) * | 2000-03-22 | 2006-01-16 | Octagene Gmbh | Fremstilling af rekombinante muteiner af blodkoagulationsfaktor VIII i humane cellelinier |
| WO2003009237A1 (en) * | 2001-07-18 | 2003-01-30 | Skaginn Hf. | A method and apparatus for relating information of a processed object to an operator |
-
2001
- 2001-03-21 DK DK01927769T patent/DK1266006T3/da active
- 2001-03-21 AT AT01927769T patent/ATE312176T1/de active
- 2001-03-21 RS YUP-710/02A patent/RS50743B/sr unknown
- 2001-03-21 ES ES01927769T patent/ES2254403T3/es not_active Expired - Lifetime
- 2001-03-21 BR BRPI0109494A patent/BRPI0109494B8/pt not_active IP Right Cessation
- 2001-03-21 EA EA200201008A patent/EA004317B1/ru active Protection Beyond IP Right Term
- 2001-03-21 AU AU2001254715A patent/AU2001254715B2/en not_active Expired
- 2001-03-21 CN CN018097456A patent/CN1454257B/zh not_active Expired - Lifetime
- 2001-03-21 IL IL15185701A patent/IL151857A0/xx unknown
- 2001-03-21 SK SK1504-2002A patent/SK287706B6/sk not_active IP Right Cessation
- 2001-03-21 HU HU0300588A patent/HU228091B1/hu unknown
- 2001-03-21 US US10/239,498 patent/US7572619B2/en active Active
- 2001-03-21 JP JP2001569351A patent/JP3894795B2/ja not_active Expired - Lifetime
- 2001-03-21 CZ CZ20023166A patent/CZ303929B6/cs not_active IP Right Cessation
- 2001-03-21 SI SI200130501T patent/SI1266006T1/sl unknown
- 2001-03-21 EP EP04009279A patent/EP1460131A3/en not_active Withdrawn
- 2001-03-21 NZ NZ521732A patent/NZ521732A/en not_active IP Right Cessation
- 2001-03-21 DE DE60115613T patent/DE60115613T2/de not_active Expired - Lifetime
- 2001-03-21 EE EEP200200538A patent/EE200200538A/xx unknown
- 2001-03-21 KR KR1020027012443A patent/KR100581574B1/ko active IP Right Grant
- 2001-03-21 WO PCT/EP2001/003220 patent/WO2001070968A2/en active IP Right Grant
- 2001-03-21 MX MXPA02009221A patent/MXPA02009221A/es active IP Right Grant
- 2001-03-21 AU AU5471501A patent/AU5471501A/xx active Pending
- 2001-03-21 EP EP01927769A patent/EP1266006B1/en not_active Expired - Lifetime
- 2001-03-21 CA CA002404163A patent/CA2404163C/en not_active Expired - Lifetime
-
2002
- 2002-09-19 NO NO20024475A patent/NO330910B1/no not_active IP Right Cessation
- 2002-09-19 IL IL151857A patent/IL151857A/en active IP Right Grant
- 2002-09-20 HR HR20020767A patent/HRP20020767B1/xx not_active IP Right Cessation
- 2002-09-26 BG BG107152A patent/BG65930B1/bg unknown
-
2006
- 2006-05-02 AU AU2006201848A patent/AU2006201848A1/en not_active Abandoned
-
2014
- 2014-12-29 BE BE2014C077C patent/BE2014C077I2/fr unknown
-
2015
- 2015-01-20 FR FR15C0003C patent/FR15C0003I2/fr active Active
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP3894795B2 (ja) | ヒト細胞株における組換え血液凝固因子の製造 | |
| AU2001254715A1 (en) | Production of recombinant blood clotting factors in human cell lines | |
| JP4361786B2 (ja) | 操作されたジスルフィド結合を有する安定化蛋白質 | |
| US7125841B2 (en) | Mutant human factor IX with an increased resistance to inhibition by heparin | |
| KR101439817B1 (ko) | 연장된 반감기를 갖는 변형된 응고 인자 VIIa | |
| JP2022000471A (ja) | XTENおよびvon Willebrand因子タンパク質を有する第VIII因子の複合体、および、その使用 | |
| US7122634B2 (en) | Modified factor VIII | |
| US7560107B2 (en) | Modified factor VIII | |
| JP2003508019A (ja) | 修飾されたviii因子 | |
| KR20110114587A (ko) | 세린 프로테아제 유도체 및 혈액응고 장애의 치료 또는 예방의 용도 | |
| CA2850579A1 (en) | Method for improving the stability of purified factor viii after reconstitution | |
| KR20010082521A (ko) | 변형된 인자 ⅷ | |
| AU2002364509A1 (en) | Factor viii c2 domain variants | |
| Kaufman | Insight into the structure, function, and biosynthesis of factor VIII through recombinant DNA technology | |
| CZ140298A3 (cs) | Hybridní faktor VIII s modifikovanou aktivitou | |
| EP1136553A1 (en) | Production of recombinant blood clotting factors in human cell lines |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20060711 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20061010 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20061128 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20061212 |
|
| R150 | Certificate of patent or registration of utility model |
Free format text: JAPANESE INTERMEDIATE CODE: R150 Ref document number: 3894795 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20101222 Year of fee payment: 4 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20111222 Year of fee payment: 5 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20111222 Year of fee payment: 5 |
|
| S531 | Written request for registration of change of domicile |
Free format text: JAPANESE INTERMEDIATE CODE: R313531 |
|
| S533 | Written request for registration of change of name |
Free format text: JAPANESE INTERMEDIATE CODE: R313533 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20111222 Year of fee payment: 5 |
|
| R350 | Written notification of registration of transfer |
Free format text: JAPANESE INTERMEDIATE CODE: R350 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20121222 Year of fee payment: 6 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20131222 Year of fee payment: 7 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| S111 | Request for change of ownership or part of ownership |
Free format text: JAPANESE INTERMEDIATE CODE: R313113 |
|
| R350 | Written notification of registration of transfer |
Free format text: JAPANESE INTERMEDIATE CODE: R350 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| EXPY | Cancellation because of completion of term |