JP2016500251A - 免疫調節Fc融合タンパク質の抗癌活性の増強 - Google Patents
免疫調節Fc融合タンパク質の抗癌活性の増強 Download PDFInfo
- Publication number
- JP2016500251A JP2016500251A JP2015545522A JP2015545522A JP2016500251A JP 2016500251 A JP2016500251 A JP 2016500251A JP 2015545522 A JP2015545522 A JP 2015545522A JP 2015545522 A JP2015545522 A JP 2015545522A JP 2016500251 A JP2016500251 A JP 2016500251A
- Authority
- JP
- Japan
- Prior art keywords
- antibody
- tumor
- ctla
- cells
- cancer
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2803—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily
- C07K16/2818—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily against CD28 or CD152
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2875—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the NGF/TNF superfamily, e.g. CD70, CD95L, CD153, CD154
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2878—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the NGF-receptor/TNF-receptor superfamily, e.g. CD27, CD30, CD40, CD95
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/40—Immunoglobulins specific features characterized by post-translational modification
- C07K2317/41—Glycosylation, sialylation, or fucosylation
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/52—Constant or Fc region; Isotype
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/71—Decreased effector function due to an Fc-modification
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/72—Increased effector function due to an Fc-modification
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/73—Inducing cell death, e.g. apoptosis, necrosis or inhibition of cell proliferation
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/75—Agonist effect on antigen
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/76—Antagonist effect on antigen, e.g. neutralization or inhibition of binding
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/30—Non-immunoglobulin-derived peptide or protein having an immunoglobulin constant or Fc region, or a fragment thereof, attached thereto
Abstract
Description
本開示は、癌または感染性物質により生じた疾患に罹患した対象のT細胞上の標的(例えば免疫調節標的)と特異的に結合し、該標的の活性を変化させることにより癌細胞または感染性物質に対する内因性免疫応答を増強するFc融合タンパク質の抗腫瘍効果を増強、最適化、または最大化するための方法であって、該Fc領域の活性化Fcレセプターに対する結合を増強するためにFc融合タンパク質のFc領域を選択、設計、または修飾することを含む方法を提供する。ある好ましい態様において、該Fc融合タンパク質は、抗体、例えば、抗CTLA-4、抗GITR、抗OX40、抗ICOS、または抗CD137抗体である。他の好ましい態様において、該標的は、腫瘍部位のTregsに腫瘍部位のTeffsより高レベルで発現する。
本開示のある局面は、癌または感染性疾患に罹患した患者におけるT細胞上の標的(例えば免疫調節標的、例えばCTLA-4、GITR、またはICOS)と結合するFc融合タンパク質(例えば抗体)の抗腫瘍効果を増強、最適化、または最大化する方法に関する。しかしながら、該標的は、免疫応答の調節に関与する免疫調節標的である必要はなく、より重要なことは、該標的は、腫瘍部位のTeffsにおける発現レベルに比べて腫瘍部位のTregsで高レベルに発現する標的である。さらに、該標的は、好ましくは、末梢のTregsおよびTeffsにおける発現レベルに比べて腫瘍部位のTregsで高レベルに発現する。ある態様において、該標的は、免疫調節レセプターまたはリガンドであり、Fc融合タンパク質の結合が標的の活性を変化させ癌細胞に対する内因性免疫応答を増強する。
本開示をより容易に理解することができるように、いくつかの用語を最初に定義する。特記しないかぎり、本明細書で用いている以下の各用語は、下記の意味を有する。さらなる定義は本願全体に記載する。
すなわち、IgGの約アミノ酸341から約アミノ酸447に延長する。本明細書で用いているFc領域は、天然配列Fcまたは変異体Fcでありうる。Fcは、分離して、またはFcを含むタンパク質ポリペプチド、例えば「Fc領域を含む結合タンパク質」(「Fc融合タンパク質」ともいう)(例えば、抗体またはイムノアドヘシン)の文脈でもこの領域を表しうる。
市販のほとんどの治療的抗体は、他のヒト抗体アイソタイプに比べて強いADCCおよびCDCを誘導することができるヒトIgG1アイソタイプである。さらに、治療的IgG1抗体は、新生児Fcレセプター(FcRn)との結合を介して血液中で長期間安定性を有する。抗CD20 リツキシマブ(RITUXAN(登録商標))(Dall’Ozzo et al.、2004))、抗Her2 トラスツズマブ(HERCEPTIN(登録商標))(Gennari et al.、2004)、抗腫瘍壊死因子-α(抗TNF-α) インフリキシマブ(REMICADE(登録商標))(Louis et al.、2004)、および抗RhD(Miescher et al.、2004)を含む種々の治療的抗体の活性は、少なくとも一部がADCCにより仲介される。CDCもリツキシマブ(Idusogie et al.、2000)およびアレムツズマブ(CAMPATH(登録商標))(Crowe et al.、1992)の抗腫瘍メカニズムの可能性が考えられる。したがって、治療的抗体の有効性を改善する努力が、最近、エフェクター機能、特にADCCおよびCDCの増強に集中していることは驚くべきことではない(Natsume et al.、2009)。Fc領域にアミノ酸突然変異を導入するかまたはFc結合オリゴ糖の修飾により抗体のFc領域のFcγRIIIaまたはC1qに対する結合活性を改善することを含む有効なアプローチが報告されている。
Fc領域の活性化FcγRsとの結合能に一致し、抗腫瘍効果に関連する、ある種の抗CTLA-4アイソタイプ、特にマウスIgG2aアイソタイプ、および程度が低いがマウスIgG2bが、腫瘍部位からのTregsの排除または枯渇を仲介するという証拠に従って(実施例1〜7)、抗腫瘍活性に対するさらなる抗体および他のFc融合タンパク質のアイソタイプの影響を検討した。
本明細書に記載のデータは、抗CTLA-4抗体、ならびに限定されるものではないが、癌患者の治療における共刺激および共阻害レセプターおよびレセプターリガンドを含むT細胞上の免疫調節標的と結合する他のFc融合タンパク質の活性と関連がある。これらのデータは、より効力の高い抗免疫調節抗体を設計する可能性も示唆する。
本開示のFc融合タンパク質は、T細胞上の標的と特異的かつ高親和性に結合するFc領域を含む結合タンパク質である。好ましい態様において、該Fc融合タンパク質は、末梢のTregsおよびTeffsでの発現レベルと比べて腫瘍環境のTregsで高レベルに発現する免疫調節標的と結合する。ある態様において、抗免疫調節物質のFc融合タンパク質はCTLA-4と特異的に結合する抗CTLA-4結合タンパク質である。好ましい態様において、抗CTLA-4結合タンパク質は遮断抗体である。他のある態様において、免疫調節物質のFc融合タンパク質は、GITR、OX40、またはICOSと特異的に結合する抗GITR、抗OX40、または抗ICOS結合タンパク質である。好ましい態様において、抗GITR、抗OX40、またはICOS結合タンパク質はアゴニスト抗体である。
本開示の別の局面は、T細胞上の標的、例えば、免疫調節レセプターまたはリガンドと結合する本開示のFc融合タンパク質のいずれかをコードする単離された核酸分子に関する。好ましい態様において、これらの単離された核酸分子は、阻害性免疫調節レセプターを標的とし遮断する抗体をコードする。該核酸は、全細胞、細胞溶解物、または部分精製されるかもしくは実質的に純粋な形中に存在しうる。該核酸は、例えばDNAまたはRNAであり得、イントロン配列を含んでいてもいなくてもよい。ある態様において、該DNAは、ゲノムDNA、cDNA、または合成DNA、すなわち、研究室で、例えばポリメラーゼ連鎖反応または化学合成により合成されたDNAである。好ましい態様において、該核酸はcDNAである。
本発明のFc融合タンパク質は、結合タンパク質(例えば抗体またはその断片)と医薬的に許容される担体を含む組成物(例えば医薬組成物)に構成することができる。本明細書で用いている「医薬的に許容される担体」には、生物学的に互換性のあらゆるすべての溶媒、分散媒質、コーティング、抗菌剤および抗真菌剤、等張化剤および吸収遅延剤などが含まれる。好ましくは、該担体は、静脈内、皮下、筋肉内、非経口的、脊髄、または表皮投与(例えば、注射または注入による)に適している。本発明の医薬組成物は、1またはそれ以上の医薬的に許容される塩、抗酸化剤、水性および非水性担体、および/またはアジュバント、例えば保存料、湿潤剤、乳化剤、および分散剤を含みうる。
本開示のFc融合タンパク質、組成物、および方法は、癌および感染性疾患の治療を含む多くの治療的有用性を有する。
本開示は、治療的有効量の本明細書に記載のFc融合タンパク質のいずれかを対象に投与することを含む、癌に罹患した対象の内因性免疫応答を増強して該対象を治療する方法であって、Fc融合タンパク質のFc領域が該Fc領域と活性化Fcレセプターとの結合を増強するように選択、設計、または修飾されている方法を提供する。本明細書に記載の方法において、該Fc領域は必ずしも修飾されておらず、例えば、適切なFc領域は活性化FcRsと結合するよう選択または設計することができる。同様に、FcRに対する結合は、必ずしも増加しておらず、高いように選択または設計することができる。ある態様において、該Fc融合タンパク質は抗体である。好ましい態様において、該抗体はIgGアイソタイプである。ある他の態様において、該抗体はモノクローナル抗体である。さらなる態様において、該モノクローナル抗体はキメラ、ヒト化、またはヒト抗体である。さらに他の態様において、該モノクローナル抗体はヒトIgG抗体である。本発明の方法のある好ましい局面において、FcγI、FcγIIa、またはFcγIIIaレセプターに対するヒトIgG抗体の結合が増強される。好ましくは、ヒトIgG抗体のFcγI、FcγIIa、またはFcγIIIaレセプターとの結合の増強はADCCの増加をもたらす。ある態様において、該抗体はT細胞上の共阻害免疫調節標的の活性を遮断するアンタゴニスト抗体である。好ましい態様において、該共阻害免疫調節標的はCTLAまたはTIGITである。
本発明の他の方法を用い、特定の毒素または病原体に暴露した患者を治療する。したがって、本発明の別の局面は、例えば感染性疾患に罹患した対象の内因性免疫応答を増強することによる対象の感染性疾患の治療方法であって、治療的有効量の本開示のFc融合タンパク質を対象に投与することを含む、Fc融合タンパク質のFc領域が該Fc領域と活性化Fcレセプターとの結合を増強するように選択、設計、または修飾されている方法を提供する。
本明細書に記載のデータは、抗CTLA-4抗体による免疫療法の候補患者の適切さを予測し、および/またはそのような抗体の抗腫瘍効果を予測するための可能なバイオマーカーも示唆する。例えば、抗CTLA-4のIgG1アイソタイプがTregの枯渇を仲介する知見は、FCRG3A(CD16)多形性が、リツキシマブ(WengおよびLevy、2003;Cartron et al.、2004)およびトラスツズマブ(HERCEPTIN(登録商標)) Musolino et al.、2008;Tamura et al.、2011)の活性で観察されたようにイピリムマブの活性と関連しうることを示唆する。FcγRIIIaとの結合がイピリムマブの活性に必要であれば、F158変異体より高い親和性でIgG1と結合するホモ接合FcγRIIIa V158変異体を有する個体は、よりよい生存および/または反応を示すと予期される(Cartron et al.、2004)。さらに、FcγRIIaとの結合がイピリムマブの活性に必要であれば、R131変異体より高い親和性でIgG1と結合するFcγRIIa H131変異体を有する個体はよりよい生存および/または反応を示すと予期される(WengおよびLevy、2003)。
本開示のあらゆるFc融合タンパク質またはその組成物と使用説明書を含むキットも本開示の範囲内である。したがって、本開示は、対象の癌または感染性物質で生じた疾患を治療するためのキットであって、(a) 1またはそれ以上の用量の、対象の癌細胞または感染性物質に対する内因性免疫応答を増強する能力が増強している本開示のあらゆるFc融合タンパク質、および(b)本明細書に記載のいずれかの治療方法に該Fc融合タンパク質を用いるための使用説明書を含むキットを提供する。例えば、ある態様において、キット中のFc融合タンパク質は、T細胞上の共阻害免疫調節標的の活性を遮断するアンタゴニストFc融合タンパク質である。さらなる態様において、共阻害免疫調節標的はCTLAまたはTIGITである。他の態様において、アンタゴニストFc融合タンパク質は抗体である。さらなる態様において、抗体は抗CTLA-4または抗TIGIT抗体である。さらなる態様において、抗CTLA-4抗体はイピリムマブまたはトレメリムマブの増強変異体である。
抗腫瘍活性における抗CTLA-4の種々のアイソタイプの相対的効力を決定するため、マウス抗マウスCTLA-4抗体、9D9の4つのアイソタイプ変異体を作製し、CHO形質移入体または親ハイブリドーマから精製した。これら抗CTLA-4変異体には、非FcγR結合突然変異体であるD265A突然変異(IgG1-D265A) を含むIgG1アイソタイプ(Clynes et al.、2000)、IgG1、IgG2b(ハイブリドーマ由来の9D9の元のアイソタイプ)、およびIgG2aが含まれた。9D9 ハイブリドーマ(J. Allison、University of Texas、MD Anderson、Houston、Texasから好意により提供された)は、ヒトCTLA-4トランスジェニックマウスをマウスCTLA-4で免疫して誘導したマウス抗マウスCTLA-4抗体である(Peggs et al.、2009)。9D9は、ネズミCTLA-4-IgのB7-1陽性細胞への結合を遮断する(データ示さず)。
抗CTLA-4抗体の薬物動態を特徴付けるため、9匹の雌C57BL/6マウスに10mg/kgの各抗CTLA-4アイソタイプ(IgG1、IgG1-D265A、IgG2a、またはIgG2b)を腹腔内注射した。血液試料を、1、6、24、48、72、120、168、336、および504hに採取し、血清をELISAで分析した。化学発光ELISAを用いて抗CTLA-4モノクローナル抗体の血清レベルを測定した。組換えマウスCTLA-4-Igをヤギ抗マウスIgG(軽鎖特異的)ポリクローナル抗体のHRPコンジュゲートと組み合わせて捕捉物として用いた。標準品、コントロール、および試料を1%BSA/PBS/0.05%Tween 20で100倍に希釈した。マウス血清試料中の抗CTLA-4抗体濃度を、対応する抗CTLA-4抗体較正装置から作成した5-パラメーターロジスティック(5-PL)較正曲線を用いてM5プレートリーダー(Molecular Devices、Sunnyvale、CA)で測定した発光強度から計算した。
IgG2aでは最終減衰の促進が336h〜504hでみられ、これはおそらく抗薬剤抗体の形成による(下記参照)。IgG2aアロタイプはBALB/cマウス由来であることに留意のこと。504hのタイムポイントはT1/2の評価から除外した。
各抗CTLA-4アイソタイプを、表面プラズモン共鳴による可溶型のFcγRI、FcγRIIB、FcγRIIIおよびFcγRIV、およびFcRnに対する結合で特徴づけた。種々の抗CTLA-4アイソタイプのFcγRsに対する親和性を先に記載のごとく測定した(NimmerjahnおよびRavetch、2005)。FcγRsはFcγRIを除いてR&D Systemsから入手した。FcγRIの発現については、細胞外ドメインをPCRで増幅し、UCOE発現ベクター(EMD Millipore、USA)中にオステオネクチンシグナル配列およびC末端6xHis-タグおよび終止コドンとインフレームにクローニングした。CHO-S細胞(Invitrogen)をAmaxa Nucleofector II(Lonza Group、AG)を用いて形質移入し、安定なプールおよびクローンを選択して増殖させ、次いで上清を精製用に回収した。可溶性組換えタンパク質を、固定化金属ニッケルアフィニティクロマトグラフィ(IMAC Life Technologies Corporation)ニッケル荷電樹脂カラムを用いる標準的技術を用いて精製した。
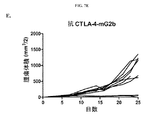
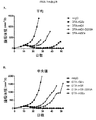
多くの異なる抗体を用いて、抗CTLA-4抗体(ハムスター抗CTLA-4抗体、9H10(KrummelおよびAllison、1995)および4F10(Walunas et al.、1994)、およびマウス抗マウスCTLA-4抗体、9D9(Peggs et al.、2009)を含む)の活性を証明した。抗腫瘍活性における抗CTLA-4の種々のアイソタイプの相対的有効性を決定するため、作製した抗CTLA-4抗体9D9の4つのアイソタイプ変異体のうちの3つ(実施例1に記載のごとくCTLA-4+細胞と等しく良好に結合する抗CTLA-4-γ1D265A、抗CTLA-4-γ2b、および抗CTLA-4-γ2a)の同系CT26結腸腺癌モデルにおける抗腫瘍活性をマウスIgG1アイソタイプコントロールと共に試験した。試験に用いたコントロール抗体は、マウスIgG1アイソタイプの組換えヒト抗ジフテリア毒素抗体である。10匹のBALB/cマウスに1 x 106個のCT26腫瘍細胞を第0日に皮下注射した。移植後第7日に処置を開始した。腫瘍を測定し、同等な平均腫瘍体積(45〜50mm3/2)となるよう処置群に無作為化し、次いで、示した抗体(200μg/用量)を再度第10、14、および17日に腹腔内(IP)投与した。腫瘍体積を週に2回測定した。図3に示すように、抗CTLA-4 9D9-IgG2aは処置したマウス10匹中9匹に腫瘍拒絶を生じたが、9D9-IgG2bは中等度の腫瘍増殖阻害を示し、50日後まで処置マウス10匹のうち腫瘍がなくなったものは0匹であった。驚くべきことに、抗CTLA-4 IgG1D265Aアイソタイプはほとんど活性を示さず、コントロールIgGと同等であった(図3)。
リンパ球染色分析
種々の抗CTLA-4アイソタイプのT細胞ポピュレーションに対する効果を測定するため、種々の抗体で処置したマウスから単離したT細胞のCD8、CD4、CD45、およびFoxp3マーカーの存在について染色した。腫瘍移植後第15日にすべてのマウスを屠殺し、腫瘍と流入領域リンパ節を分析用に回収した。単細胞浮遊液を腫瘍とリンパ節を24ウェルプレート中でシリンジの後ろで解離させて調製した。細胞浮遊液を70μmフィルターに通し、ペレットにし、再浮遊させ、次いで算定した。次に、細胞を染色用に1 x 106細胞/ウェルで96ウェルプレートに播いた。細胞を24G.2(BioXcell)で処理して、FcγRIIBおよびFcγRIIIに対するFcの結合を遮断し、次いでCD8に対する抗体(クローン53-6.7;Biolegend)、CD4に対する抗体(クローンGK1.5;Biolegend)、およびCD45に対する抗体(クローン30-F11;Biolegend)、またはCD11cに対する抗体(クローンN418;eBioscience)、CD45、CD8、CD11bに対する抗体(クローンM1/70 Biolegend)、およびGr-1に対する抗体(クローンRb6-8C5;eBioscience)で染色した。細胞内染色用に試料を固定し、透過化し、次いでFoxp3に対する抗体(クローンFJK-16s;eBioscience)、Ki67に対する抗体(クローンSolA15;eBioscience)、およびCTLA-4に対する抗体(クローン4F10;BD Pharmingen)で染色した。次に、試料をFACS Cantoフローサイトメーター(BD)で分析した。この一般的フローサイトメトリー法を用いて下記実施例に記載のごとく種々のT細胞のポピュレーションに対する種々のFc融合タンパク質の効果を測定した。
CTLA-4は、活性化Teff/T記憶細胞およびTregサブセットの両方に発現し、機能的役割を有するので、種々の位置からの多様な細胞ポピュレーションをモニターした。以前のデータは、抗CTLA-4抗体遮断は、処置マウスのリンパ節(LN)におけるTregsの増殖をもたらすことを示した(Quezada et al.、2006)。CTLA-4抗体アイソタイプの末梢Treg増殖に対する効果を、CT26結腸腺癌腫瘍保有マウスを用い、該マウスの抗体処置後第16日の腫瘍および腫瘍流入領域リンパ節中のT細胞サブセットを分析することにより評価した。統計分析はGraphPad Prismを用いて行った。誤差バーはPrismを用いて計算した平均の標準誤差を示す。用いた具体的統計的検定は、対象のないt検定と一元配置分散分析であった。<0.05、0.01、および0.001のP値は、各図中にそれぞれ*、**、および***で示す。
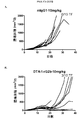
実施例3に記載のCT26腫瘍モデルに加え、種々の抗CTLA-4アイソタイプの抗腫瘍活性をMC38結腸腺癌腫瘍モデルで評価した。C57BL/6マウスにそれぞれ2 x 106個のMC38腫瘍細胞を皮下注射した。7日後に腫瘍体積を測定し、マウスを平均腫瘍体積(44.7〜49.2mm3/2)が同等になるように処置群に無作為化した。PBS中で処方した4つの異なるアイソタイプ(IgG1、IgG1D265A、IgG2a、およびIgG2b)の抗CTLA-4抗体を、第7、10、および14日に容量200μl中200μg/用量でIP投与した。腫瘍体積を1週間に3回記録した。
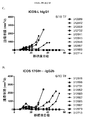
種々の抗CTLA-4アイソタイプで処置したマウスから得たMC38腫瘍浸潤リンパ球(TIL)のT細胞サブセットを分析した。IgG2aおよび突然変異IgG1D265Aアイソタイプは、マウスIgG1アイソタイプコントロールと比べてCD4+細胞の割合のわずかな増加をもたらした(図9A)。しかしながら、CD8+細胞のレベルを分析すると、IgG2a 抗CTLA-4抗体による処置は、マウスIgG1アイソタイプおよび突然変異IgG1 抗CTLA-4の両方と比べてCD8+細胞のパーセンテージの顕著(約2.5倍)増加をもたらした(図9B)。IgG2a 抗CTLA-4抗体は、IgG1アイソタイプおよび突然変異IgG1 抗CTLA-4と比べてTregsレベルの約5倍の低下ももたらした(図9C)。
抗CTLA-4の抗腫瘍活性を免疫原性Sa1N繊維肉腫腫瘍モデルでも評価した。A/Jマウスに2x 106個のSa1N腫瘍細胞を皮下注射した。7日間後、腫瘍体積を測定し、平均腫瘍体積が同等になるように(132.4〜146.5mm3/2)マウスを処置群に無作為化した。IgG1、突然変異IgG1D265A、およびIgG2aアイソタイプを有する抗CTLA-4(9D9)抗体をPBSで処方し、容量200μl中200μg/用量を第7、11、および14日にIP投与した。腫瘍体積を1週間に2回記録した。
IgG1アイソタイプコントロールと共にIgG2aおよび突然変異IgG1抗CTLA-4アイソタイプで処置したマウスから得たSa1N腫瘍TILsのT細胞サブセットを分析した。試験した抗体はいずれも、CD4+細胞の割合にいかなる有意な変化ももたらさなかった(図13A)。反対に、2aアイソタイプを有する抗CTLA-4による処置は、CD8+細胞(図13B)の割合の顕著な増加と、同時にTregsレベルの顕著な低下をもたらした(図13C)。IgG2a 抗CTLA-4アイソタイプにより介在されるCD8+Teffsの増加とTregsの低下をTeff/Treg比に変換すると(図14A)、IgG1アイソタイプまたはIgG1D265A 抗CTLA-4抗体による処置で得られたTeff/Treg比より顕著に高かった(少なくとも約6倍高かった)(図14A)。CT26およびMC38腫瘍モデルと一致して、この高いTeff/Treg比は強い抗腫瘍活性を示す。IgG2a抗体による処置で得られたCD4+ Teff/Treg比も、アイソタイプコントロールまたはIgG1D265A 抗CTLA-4抗体で得られたTeff/Treg比より高かった(図14B)。しかしながら、IgG2a抗体は、IgG1コントロールまたはIgG1D265Aと比べてCD4+細胞の増加をもたらさなかったので、Teff/Treg比の増加は、CD8+ Teff/Treg比のように断言されなかった。
T細胞に加えて、表面マーカーCD11bおよびGr-1の発現により定義される骨髄由来サプレッサー細胞(MDSC)を、抗CTLA-4抗体処置MC38腫瘍保有マウスの腫瘍および脾臓において分析した。MC38結腸腫瘍細胞(2x 106)をC57BL/6マウスの皮下に移植した。移植後第7日に、腫瘍保有マウスを無作為化し、3日毎に3用量の抗体を腹腔内注射(10 mg/kg)した。移植後第15日に、腫瘍を回収し、手作業で解離して単細胞浮遊液とし、腫瘍内サイトカインレベルをビーズベースのサイトカインアレイで評価した(FlowCytomix;Ebioscience、San Diego、CA)。図15は、CD45+細胞中のMDSCs(CD11b+Gr-1+)数(図15A)およびインターロイキン1α(IL-1α)レベル(図15B)の評価を示す。データは、(A)>3マウス/群の2つの独立した実験、または(B)>5マウス/群/実験の3つの独立した実験の典型である。抗CTLA-4アイソタイプのいずれについても脾臓MDSCの変化はみられなかった(データ示さず)。しかしながら、これに対してMDSC数は、IgG2aアイソタイプ処置マウスの腫瘍で実質的に増加した(図15A)。
腫瘍浸潤Tregsの減少と付随するエフェクターCD8数の増加がT細胞機能の変化と関連があるか否かを検討するため、MC38腫瘍保有マウスにおける各処置群の腫瘍微小環境内に存在するサイトカインレベルを測定した。腫瘍を24ウェルプレート中の1mlの完全T細胞培地(10%加熱不活化ウシ胎児血清(FBS)、ペニシリン/ストレプトマイシン、およびβ-メルカプトエタノール添加RPMI-1640(Life Technologies、Grand Island、NY))中の回収し、手動で解離させて単細胞浮遊液とした。細胞およびデブリを遠心沈殿させて上清を回収し、試料をバッチ処理するために凍結した。解凍し、各試料の上清25μlについて腫瘍内IL-1α、IL-2、IL-4、IL-5、IL-6、IL-10、IL-13、IL-17A、IL-21、IL-22、IL-27、IP-10、GM-CSF、TNF-α、およびIFN-γ濃度をビーズベースのサイトカインアレイを使用説明書に従って用い(FlowCytomix;eBioscience、San Diego、CA)、デュプリケートで評価した。
GITR(グルココルチコイド誘導性腫瘍壊死因子(TNF)レセプター)、他のTNFレセプターファミリーメンバー(例えば、OX40、CD27、および4-1BB)との相同性を有するI型貫膜タンパク質(NocentiniおよびRiccardi、2005)。ヒトではGITRは、通常、静止CD4+Foxp3-およびCD8+ T細胞に低レベルで発現するが、CD4+CD25+Foxp3+ Tregsに高レベルで構成的に発現する。発現は、3サブポピュレーションすべてでT細胞活性化後に増加する(Cohen et al.、2010)。本発明者らのデータは、マウスではGITRがすべてのT細胞サブセットで高レベルに構成的に発現することを示す(実施例18参照)。
実験MC38#1
種々の抗GITR(DTA-1)アイソタイプの抗腫瘍活性を、実施例4に記載のごとく段階的MC38結腸腺癌腫瘍モデルで評価した。C57BL/6マウスにそれぞれ2x 106 MC38腫瘍細胞を皮下注射した。7日後、該マウスを5処置群に無作為化し、容量200μl中200μg/用量の試験抗体を以下のごとく第7、10および14日にIP投与した:再操作:グループ1:マウスIgG1コントロール(IgG);グループ2:抗CTLA-4マウスIgG2a Ab(9D9-m2a);グループ3:抗GITRラットIgG2b Ab(DTA-r2b);グループ4:抗GITRマウスIgG1 Ab(DTA-mg1);およびグループ5:抗GITRマウスIgG2a Ab(DTA-m2a)。腫瘍および脾臓を第15日に回収した。(生物物理学的分析(SECによる)は、DTA-r2b抗体を除くすべての再設計DTA-1モノクローナル抗体の凝集性が高いことを示し、後で、下記実験MC38#2のごとくこの実験を反復することを促した。)
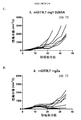
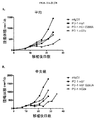
種々の抗GITRアイソタイプで処置したマウスのMC38 TILsおよび脾臓中のT細胞サブセットのポピュレーションを比較した。脾臓ではDTA-m2aおよびDTA-r2bがCD8+細胞レベルのわずかな低下をもたらし、9D9-m2aおよびDTA-m1はCD8+ T細胞レベルを変化させなかった(図19A)。試験したアイソタイプ変異体はいずれも、脾臓中のCD4+またはCD4+Foxp3+細胞のパーセンテージに顕著な効果がなかった(図19BおよびC)。
DTA-1変異体(市販のオリジナル型のDTA-r2bを除く)で凝集がみられたため、新たな一連のアイソタイプ変異体を再操作して、凝集しないDTA-1抗体を得た。観察された凝集は、操作されたアイソタイプ変異体の軽鎖に不注意に組み込まれた余分なアミノ酸によることが突き止められ、この無関係なアミノ酸を除去することによりこの問題は軽減された。該再操作された抗体を本実験#2に用いた。再操作された抗GITR(DTA-1;GITR.7シリーズ)アイソタイプの抗腫瘍活性を段階的MC38モデルを用いて評価した。C57BL/6マウスに2x 106個のMC38細胞を皮下移植した。7日後に、平均腫瘍体積が同等(約148mm3/2)となるようにマウスを7処置群に無作為化し、試験抗体の200μg/用量を以下のごとく第7、10、および14日にIP投与した(用量200μgを投与したmIgG コントロールを除く):グループ1:マウスIgG1 コントロール(mIgG、または「アイソタイプ」);グループ2:抗GITRマウスIgG1Ab(mGITR.7.mg1);グループ3:抗GITRマウスIgG1D265Aアイソタイプ(mGITR.7.mg1-D265A);グループ4:抗GITRマウスIgG2a Ab(mGITR.7.mg2a);グループ5:抗GITRマウスIgG2b Ab(mGITR.7.mg2b);グループ6:抗GITRラットIgG2b Ab(mGITR.7.r2b、またはDTA-1-rG2b);およびグループ7:抗CTLA-4マウスIgG2a Ab(9D9-mg2a)。腫瘍および脾臓を第15日に採取した。
処置したマウスのTILsおよび脾臓におけるTregsのポピュレーションに対する種々の抗GITRアイソタイプの効果を図22に示す。実験#1に示すように、試験したアイソタイプ変異体のいずれも脾臓中のCD4+Foxp3+ Tregsのパーセンテージに対する大きな効果を示さず、最も強い効果は、ラット抗GITR IgG2bアイソタイプによる処置で生じた40%増加より少なく、マウス抗GITR IgG2bアイソタイプはCD4+Foxp3+ Tregsのパーセンテージをわずかに低下させた。試験したその他の抗GITRアイソタイプおよび抗CTLA-4はTregsのパーセンテージをわずかに増加させた(図22A)。
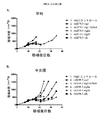
また、抗GITRの抗腫瘍活性をA/JマウスのSa1N肉腫モデルで評価した。該マウスに2x 106 Sa1N細胞/移植を皮下注射した。7日後、腫瘍体積を測定し、マウスを平均腫瘍体積(約75mm3/2)が同等になるように処置群に無作為化した。実施例11、実験MC38#1に記載のごとく種々のアイソタイプを持つように操作した抗GITR(DTA-1)抗体を第7、10、および12日に200μg/用量でIP投与した。
処置マウスのSa1NTILsおよび脾臓のTregポピュレーションに対する種々の抗GITRアイソタイプの効果を図25に示す。試験したすべての抗GITRアイソタイプ変異体は、脾臓におけるCD4+Foxp3+ Tregsレベルの約20〜40%の比較的小さな増加をもたらした。最も高い増加は、マウス抗GITR IgG2aアイソタイプによる処置で得られ、これは抗CTLA-4 IgG2bおよびIgG1-D265A抗体による処置と同じ増加をもたらした(図25A)。Treg枯渇がIgG2bアイソタイプで先にみられたので、このGITR試験では後者の抗CTLA-4アイソタイプを陽性コントロールとして用いた。
非フコシル化(NF)抗CTLA-4(9D9)アイソタイプの抗腫瘍活性をMC38腫瘍モデルで評価した。これらの非フコシル化変異体を、フコシルトランスフェラーゼ欠損CHO細胞株を用いて形質移入のために作製した。C57BL/6マウスに2x 106 MC38腫瘍細胞/移植を皮下注射し、11日後にマウスを平均腫瘍体積約230mm3/2を有する処置群に無作為化した。抗CTLA-4抗体の4つの種々のアイソタイプ(IgG1D265A、IgG2a、IgG2a-NF、IgG2bおよびIgG2b-NF)を、容量200μl中200μg/用量で第11、13、および15日にIP投与した。
アゴニスト性抗OX40抗体の種々のアイソタイプの相対的抗腫瘍効果を決定するため、抗OX40抗体OX86の以下の3つのアイソタイプ変異体(Al-Shamkhani et al.、1996)を操作した:抗OX40ラットIgG1(OX40-rg1)、抗OX40-マウスIgG1(OX40-mg1)、および抗OX40マウスIgG2a(OX40-mg2a)。これらのアイソタイプ変異体とマウスIgG1アイソタイプコントロール(マウスIgG1アイソタイプの組換えヒト抗ジフテリア毒素抗体)の同系CT26結腸癌マウスモデルにおける抗腫瘍活性を試験した。BALB/cマウスに1 x 106 CT26腫瘍細胞を皮下注射した。マウスを、容量200μl中200μg/用量のPBSで処方した該抗体を第3、7、および10日にIP処置した。腫瘍耐性を1週間に2回測定した。
抗マウスICOS抗体17G9は、ICOSとB7hの結合を遮断するラットIgG2bアゴニストモノクローナル抗体であり、T細胞増殖およびサイトカイン産生を含むT細胞反応を増強することが知られている(McAdam et al.、2000)。ICOSリガンド(ICOSL)は、ICOSと特異的に結合し、T細胞増殖およびサイトカイン分泌の共刺激シグナルとして作用する。ネズミIgG1 Fc(ICOSL-muIgG1)またはヒトIgG1 Fc(ICOSL-hIgG1)と融合したネズミICOSLの細胞外ドメインを含むICOSL-融合タンパク質を作製した。ICOSL-hIgG1および抗体17G9はマウス活性化FcRsと優先的に相互作用するが、ICOSL-mIgG1はマウス阻害FcRと相互作用する。
MC38結腸腫瘍細胞(2 x 106細胞/移植)をC57BL/6マウスに皮下注射した。移植後第7日に、腫瘍保有マウスを無作為化し、10mg/kgのラットIgG2b抗体17G9またはマウスIgG1コントロール抗体をIP注射Q3D x 3により投与した。移植後第15日に、腫瘍を摘出し、分離して単細胞浮遊液とし、フローサイトメトリーのために染色した(実施例3参照)。図31AおよびBに示すように、17G9による処置は、CD4+細胞のパーセンテージまたはCD45+総リンパ球のパーセンテージで表したMC38腫瘍の腫瘍部位のFoxp3+制御性細胞の減少をもたらす。
実験#1
抗マウスPD-1抗体 4H2の種々のアイソタイプの抗腫瘍活性を先(実施例4)に記載のごとく段階的MC38結腸腫瘍モデルで評価した。4H2は、Fc部分をマウスIgG1アイソタイプのFc部分で置換したラットIgG2a 抗マウスPD-1抗体から構築したキメララット-マウス抗mPD-1抗体である(WO 2006/121168)。4H2は、mPD-L1およびmPD-L2のmPD-1との結合を遮断し、T細胞反応を刺激し、抗腫瘍活性を示す。C57BL/6マウスに2 x 106 MC38腫瘍細胞をそれぞれ皮下注射した。7日後にマウスを4処置群に無作為化し、被験抗体を以下のごとく容量200μlで200μg/用量でIP投与した:グループ1:マウスIgG1 コントロール(IgG);グループ2:抗PD-1 IgG1;グループ3:抗PD-1 IgG1D265A;グループ4:抗PD-1 IgG2a。
種々の抗PD-1アイソタイプで処置したマウスのMC38腫瘍に浸潤するT細胞サブセットのパーセンテージを比較した。図34Aは、4H2-G1およびG1D265Aアイソタイプは両マウスIgG1コントロールと比べてCD8+細胞のパーセンテージをそれぞれ約20%および50%の小さな増加をもたらしたが、IgG2aアイソタイプはCD8+細胞のパーセンテージの約50%の低下をもたらすことを示す。これら3つの4H2アイソタイプは、実質的にマウスIgG1アイソタイプコントロールと比べてCD4+細胞のパーセンテージの変化をもたらさず(図34B)、CD4+Foxp3+ Tregsのパーセンテージの小さな増加をもたらし、IgG2aアイソタイプが最も顕著な増加をもたらした(図34C)。これらの結果は、対応するアイソタイプ抗CTLA-4、GITR、OX40、およびICOS抗体で得られたものと異なる。
免疫モニタリング実験を除く、MC38腫瘍モデルにおける種々の抗PD-1アイソタイプの抗腫瘍活性の上記試験を反復した。図34および35に示す結果の傾向は、実験#1と同様であったが顕著であり、腫瘍増殖阻害における種々のアイソタイプ間の差をより明確に示す。抗PD-1 IgG1(図34B)およびIgG1D265A(図34C)処置は、それぞれ10匹中5および6匹のTFマウスをもたらしたが、10匹中TFマウスが0匹であったマウスIgG1 コントロール(図32A)に比べて、IgG2aアイソタイプによる処置は10匹中2匹のTFマウスをもたらした(図34D)。実験#1と実験#2の結果の相違を表6にまとめる。
腫瘍の微小環境におけるTregsおよび通常のT(Tconv)細胞は、多様な共刺激および共阻害レセプターを発現する。しかしながら、Tregsに対するレセプターのエンゲージメントは、Tconvsに対する同じ標的のエンゲージメントに比べて細胞機能に対する著しく異なる効果があるかもしれない。例えば、OX40に対するアゴニスト抗体は、Treg機能を阻害しながらTconv活性化を増強する。さらに、各レセプターの発現レベルは、種々のT細胞サブセット間、および腫瘍微小環境または末梢中の同タイプのT細胞で実質的に異なり得る。
Claims (15)
- 癌または感染性物質により生じた疾患に罹患した対象のT細胞上の免疫調節標的と特異的に結合して該標的の活性を変化させ、癌細胞または感染性物質に対する内因性免疫応答を増強するFc融合タンパク質の抗腫瘍効果を増強、最適化、または最大にする方法であって、該Fc領域の活性化Fcレセプター(FcR)に対する結合を増強するようにFc融合タンパク質のFc領域を選択、設計、または修飾することを含む方法。
- 該Fc融合タンパク質が抗体である請求項1記載の方法。
- 該抗体がヒトIgG抗体である請求項2記載の方法。
- FcγI、FcγIIa、またはFcγIIIaレセプターに対するヒトIgG抗体の結合を増強する請求項3記載の方法。
- FcgγI、FcγIIa、またはFcγIIIaレセプターに対するヒトIgG抗体の結合の増強が、腫瘍部位における調節性T細胞(Tregs)の減少を仲介する請求項4記載の方法。
- FcγI、FcγIIa、またはFcγIIIaレセプターに対するヒトIgG抗体の結合の増強が腫瘍部位のエフェクターT細胞(Teffs)の(a)減少を仲介しないかまたは(b)増加を仲介する請求項4記載の方法。
- 該標的が、腫瘍部位のTregsに腫瘍部位のTeffsより高レベルに発現する請求項1記載の方法。
- 該抗体が、T細胞上の共阻害免疫調節標的の活性を遮断するアンタゴニスト抗体である請求項2記載の方法。
- 該共阻害免疫調節標的がCTLAまたはTIGITである請求項8記載の方法。
- 該抗体が、T細胞の共刺激免疫調節標的の活性化を増強するアゴニスト抗体である請求項2記載の方法。
- 該共刺激免疫調節標的がGITR、OX40、ICOS、またはCD137である請求項10記載の方法。
- 癌または感染性物質により生じた疾患に罹患した対象のT細胞上の免疫調節標的と特異的に結合し、該標的の活性を遮断することにより、癌細胞または感染性物質に対する内因性免疫応答を増強するFc融合タンパク質であって、内因性免疫応答を増強する抗体の能力がFc領域の活性化FcRに対する結合を増強するようにFc融合タンパク質のFc領域を選択、設計、または修飾することを含む方法により増強(最適化または最大化)されているFc融合タンパク質。
- 癌または感染性物質により生じた疾患に罹患した対象の内因性免疫応答を増強することにより該対象を治療する方法であって、治療的有効量の請求項12記載のFc融合タンパク質を対象に投与することを含む、Fc融合タンパク質のFc領域が該Fc領域の活性化FcRに対する結合を増強するように選択、設計、または修飾されている方法。
- 癌に罹患した対象の免疫療法のための方法であって、
(a)免疫療法に適した候補である対象を選択し、
ここで、該選択は、(i)被験組織試料中の骨髄由来サプレッサー細胞(MDSCs)の存在を評価し、(ii)被験組織試料中のMDSCの存在に基づいて適切な候補として該対象を選択することを含む;
(b)治療的有効量の免疫調節Fc融合タンパク質を選択した対象に投与する、ことを含む方法。 - 対象の癌または感染性物質により生じる疾患を治療するためのキットであって、
(a)対象の癌細胞または感染性物質に対する内因性免疫応答を増強する能力の増大をもたらす用量の請求項12記載のFc融合タンパク質、および
(b)請求項13に記載の方法に該Fc融合タンパク質を用いるための取扱説明書を含むキット。
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201261732760P | 2012-12-03 | 2012-12-03 | |
| US61/732,760 | 2012-12-03 | ||
| US201361801187P | 2013-03-15 | 2013-03-15 | |
| US61/801,187 | 2013-03-15 | ||
| PCT/US2013/072918 WO2014089113A1 (en) | 2012-12-03 | 2013-12-03 | Enhancing anti-cancer activity of immunomodulatory fc fusion proteins |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2019002712A Division JP7132858B2 (ja) | 2012-12-03 | 2019-01-10 | 免疫調節Fc融合タンパク質の抗癌活性の増強 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2016500251A true JP2016500251A (ja) | 2016-01-12 |
| JP2016500251A5 JP2016500251A5 (ja) | 2017-01-19 |
Family
ID=49877017
Family Applications (4)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2015545522A Pending JP2016500251A (ja) | 2012-12-03 | 2013-12-03 | 免疫調節Fc融合タンパク質の抗癌活性の増強 |
| JP2019002712A Active JP7132858B2 (ja) | 2012-12-03 | 2019-01-10 | 免疫調節Fc融合タンパク質の抗癌活性の増強 |
| JP2021065226A Pending JP2021113197A (ja) | 2012-12-03 | 2021-04-07 | 免疫調節Fc融合タンパク質の抗癌活性の増強 |
| JP2023045137A Pending JP2023078356A (ja) | 2012-12-03 | 2023-03-22 | 免疫調節Fc融合タンパク質の抗癌活性の増強 |
Family Applications After (3)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2019002712A Active JP7132858B2 (ja) | 2012-12-03 | 2019-01-10 | 免疫調節Fc融合タンパク質の抗癌活性の増強 |
| JP2021065226A Pending JP2021113197A (ja) | 2012-12-03 | 2021-04-07 | 免疫調節Fc融合タンパク質の抗癌活性の増強 |
| JP2023045137A Pending JP2023078356A (ja) | 2012-12-03 | 2023-03-22 | 免疫調節Fc融合タンパク質の抗癌活性の増強 |
Country Status (15)
| Country | Link |
|---|---|
| US (4) | US20150322119A1 (ja) |
| EP (2) | EP2925350B1 (ja) |
| JP (4) | JP2016500251A (ja) |
| CN (2) | CN116637183A (ja) |
| CY (1) | CY1121557T1 (ja) |
| DK (1) | DK2925350T3 (ja) |
| ES (1) | ES2715673T3 (ja) |
| HR (1) | HRP20190574T1 (ja) |
| HU (1) | HUE043903T2 (ja) |
| LT (1) | LT2925350T (ja) |
| PL (1) | PL2925350T3 (ja) |
| PT (1) | PT2925350T (ja) |
| RS (1) | RS58528B1 (ja) |
| SI (1) | SI2925350T1 (ja) |
| WO (1) | WO2014089113A1 (ja) |
Cited By (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2020509037A (ja) * | 2017-02-28 | 2020-03-26 | ブリストル−マイヤーズ スクイブ カンパニーBristol−Myers Squibb Company | ワクチンに対する免疫応答を増強するための、adccが増強された抗ctla−4抗体の使用 |
| JP2021508676A (ja) * | 2017-12-30 | 2021-03-11 | ベイジーン リミテッド | 抗tigit抗体並びに治療剤及び診断剤としてのその使用 |
| JP2021512884A (ja) * | 2018-02-02 | 2021-05-20 | オンコイミューン, インコーポレイテッド | 免疫療法効果が向上し副作用が軽減した変異抗ctla−4抗体 |
Families Citing this family (90)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2004024068A2 (en) | 2002-09-11 | 2004-03-25 | Genentech, Inc. | Novel composition and methods for the treatment of immune related diseases |
| HUE036780T2 (hu) | 2008-04-09 | 2018-07-30 | Genentech Inc | Új kompozíciók és eljárások immunológiai vonatkozású betegségek kezelésére |
| US11066483B2 (en) | 2010-11-30 | 2021-07-20 | Chugai Seiyaku Kabushiki Kaisha | Cytotoxicity-inducing therapeutic agent |
| CN116637183A (zh) | 2012-12-03 | 2023-08-25 | 百时美施贵宝公司 | 强化免疫调变性Fc融合蛋白的抗癌活性 |
| BR112016000853A2 (pt) | 2013-07-16 | 2017-12-12 | Genentech Inc | métodos para tratar ou retardar, reduzir ou inibir a recidiva ou a progressão do câncer e a progressão de uma doença imune-relacionada em um indivíduo, para aumentar, melhorar ou estimular uma resposta ou função imune em um indivíduo e kit |
| TW201605896A (zh) | 2013-08-30 | 2016-02-16 | 安美基股份有限公司 | Gitr抗原結合蛋白 |
| GB201403775D0 (en) | 2014-03-04 | 2014-04-16 | Kymab Ltd | Antibodies, uses & methods |
| JP6588461B2 (ja) | 2014-03-31 | 2019-10-09 | ジェネンテック, インコーポレイテッド | 抗血管新生剤及びox40結合アゴニストを含む併用療法 |
| CA2943943C (en) | 2014-04-07 | 2023-01-10 | Chugai Seiyaku Kabushiki Kaisha | Immunoactivating antigen-binding molecule |
| MX2016014434A (es) * | 2014-05-13 | 2017-02-23 | Chugai Pharmaceutical Co Ltd | Molecula de union a antigeno redirigida a celulas t para celulas que tienen funcion de inmunosupresion. |
| MA47849A (fr) | 2014-05-28 | 2020-01-29 | Agenus Inc | Anticorps anti-gitr et leurs procédés d'utilisation |
| WO2015187835A2 (en) | 2014-06-06 | 2015-12-10 | Bristol-Myers Squibb Company | Antibodies against glucocorticoid-induced tumor necrosis factor receptor (gitr) and uses thereof |
| JP2017522311A (ja) * | 2014-07-16 | 2017-08-10 | ジェネンテック, インコーポレイテッド | Tigit阻害剤及び抗癌剤を使用する癌の治療方法 |
| AP2017009765A0 (en) | 2014-08-19 | 2017-02-28 | Merck Sharp & Dohme | Anti-tigit antibodies |
| MA41044A (fr) | 2014-10-08 | 2017-08-15 | Novartis Ag | Compositions et procédés d'utilisation pour une réponse immunitaire accrue et traitement contre le cancer |
| JP2017534633A (ja) * | 2014-11-06 | 2017-11-24 | ジェネンテック, インコーポレイテッド | Ox40結合アゴニスト及びtigit阻害剤を含む組み合わせ療法 |
| KR102644115B1 (ko) * | 2014-12-23 | 2024-03-05 | 브리스톨-마이어스 스큅 컴퍼니 | Tigit에 대한 항체 |
| MA41414A (fr) | 2015-01-28 | 2017-12-05 | Centre Nat Rech Scient | Protéines de liaison agonistes d' icos |
| MA41460A (fr) | 2015-02-03 | 2017-12-12 | Oncomed Pharm Inc | Agents de liaison à la tnfrsf et leurs utilisations |
| RU2714157C2 (ru) * | 2015-02-06 | 2020-02-12 | Хит Байолоджикс, Инк. | Вектор, коэкспрессирующий молекулы для вакцинации и костимулирующие молекулы |
| US10196445B1 (en) | 2015-03-17 | 2019-02-05 | Bristol-Myers Squibb Company | Ipilimumab variant with enhanced ADCC |
| TWI715587B (zh) | 2015-05-28 | 2021-01-11 | 美商安可美德藥物股份有限公司 | Tigit結合劑和彼之用途 |
| JP6797137B2 (ja) | 2015-05-29 | 2020-12-09 | ブリストル−マイヤーズ スクイブ カンパニーBristol−Myers Squibb Company | Ox40に対する抗体およびその使用 |
| BR112017025297A2 (pt) | 2015-06-03 | 2018-08-14 | Bristol-Myers Squibb Company | anticorpos anti-gitr para diagnóstico do câncer |
| EP3303397A1 (en) * | 2015-06-08 | 2018-04-11 | H. Hoffnabb-La Roche Ag | Methods of treating cancer using anti-ox40 antibodies and pd-1 axis binding antagonists |
| MX2017015811A (es) | 2015-06-12 | 2018-04-10 | Squibb Bristol Myers Co | Tratamiento de cancer por bloqueo combinado de las trayectorias de señalizacion de muerte programada 1 (pd)-1 y receptor 4 de quimiocina c-x-c(cxcr4). |
| WO2017011580A2 (en) | 2015-07-13 | 2017-01-19 | Cytomx Therapeutics, Inc. | Anti-pd-1 antibodies, activatable anti-pd-1 antibodies, and methods of use thereof |
| WO2017009842A2 (en) | 2015-07-16 | 2017-01-19 | Biokine Therapeutics Ltd. | Compositions and methods for treating cancer |
| CA2992298A1 (en) | 2015-07-23 | 2017-01-26 | Inhibrx Lp | Multivalent and multispecific gitr-binding fusion proteins |
| EP3331917A1 (en) * | 2015-08-04 | 2018-06-13 | GlaxoSmithKline Intellectual Property Development Limited | Combination treatments and uses and methods thereof |
| CN115925931A (zh) | 2015-08-14 | 2023-04-07 | 默沙东公司 | 抗tigit抗体 |
| CR20180225A (es) | 2015-09-25 | 2018-07-09 | Genentech Inc | Anticuerpo anti-tigit y métodos de uso |
| AR109625A1 (es) | 2015-10-01 | 2019-01-09 | Potenza Therapeutics Inc | Proteínas de unión a antígenos (abp) que se unen selectivamente a tigit y métodos para el uso de las mismas |
| BR112018002570A2 (pt) | 2015-10-02 | 2018-10-16 | Hoffmann La Roche | molécula de ligação ao antígeno biespecífica, anticorpo biespecífico, polinucleotídeos, anticorpo que se liga especificamente ao ox40, composição farmacêutica e método para inibir o crescimento de células tumorais em um indivíduo |
| WO2017066561A2 (en) | 2015-10-16 | 2017-04-20 | President And Fellows Of Harvard College | Regulatory t cell pd-1 modulation for regulating t cell effector immune responses |
| EP3378488A4 (en) | 2015-11-18 | 2019-10-30 | Chugai Seiyaku Kabushiki Kaisha | METHOD FOR ENHANCING THE HUMORAL IMMUNE RESPONSE |
| WO2017086367A1 (ja) | 2015-11-18 | 2017-05-26 | 中外製薬株式会社 | 免疫抑制機能を有する細胞に対するt細胞リダイレクト抗原結合分子を用いた併用療法 |
| EA201891121A1 (ru) | 2015-11-19 | 2018-12-28 | Бристол-Майерс Сквибб Компани | Антитела к глюкокортикоид-индуцированному рецептору фактора некроза опухоли (gitr) и их применения |
| US11447557B2 (en) | 2015-12-02 | 2022-09-20 | Agenus Inc. | Antibodies and methods of use thereof |
| BR112018012113A2 (pt) * | 2015-12-15 | 2018-12-04 | Oncoimmune Inc | anticorpos monoclonais de ctla4 anti-humana quiméricos e humanizados e usos dos mesmo |
| KR102355950B1 (ko) | 2016-03-04 | 2022-01-26 | 제이엔 바이오사이언시즈 엘엘씨 | Tigit에 대한 항체 |
| US20210309965A1 (en) | 2016-03-21 | 2021-10-07 | Dana-Farber Cancer Institute, Inc. | T-cell exhaustion state-specific gene expression regulators and uses thereof |
| KR20230051601A (ko) * | 2016-04-15 | 2023-04-18 | 알파인 이뮨 사이언시즈, 인코포레이티드 | Icos 리간드 변이체 면역조절 단백질 및 그의 용도 |
| MX2018012468A (es) * | 2016-04-15 | 2019-06-06 | Zymeworks Inc | Construcciones de union a antigeno multiespecificas dirigidas a agentes inmunoterapeuticos. |
| CA3024508A1 (en) | 2016-05-27 | 2017-11-30 | Agenus Inc. | Anti-tim-3 antibodies and methods of use thereof |
| FR3051794A1 (fr) * | 2016-05-31 | 2017-12-01 | Lab Francais Du Fractionnement | Anticorps pour le traitement de cancers |
| US9567399B1 (en) | 2016-06-20 | 2017-02-14 | Kymab Limited | Antibodies and immunocytokines |
| WO2018029474A2 (en) | 2016-08-09 | 2018-02-15 | Kymab Limited | Anti-icos antibodies |
| JP2019530434A (ja) | 2016-08-05 | 2019-10-24 | ジェネンテック, インコーポレイテッド | アゴニスト活性を有する多価及び多重エピトープ抗体ならびに使用方法 |
| KR20230044038A (ko) | 2016-08-09 | 2023-03-31 | 키맵 리미티드 | 항-icos 항체 |
| MA46529A (fr) | 2016-10-11 | 2019-08-21 | Agenus Inc | Anticorps anti-lag-3 et leurs procédés d'utilisation |
| US11779604B2 (en) | 2016-11-03 | 2023-10-10 | Kymab Limited | Antibodies, combinations comprising antibodies, biomarkers, uses and methods |
| JP7126269B2 (ja) | 2016-11-30 | 2022-08-26 | メレオ バイオファーマ 5 インコーポレイテッド | Tigit結合物質を含む、がんの処置のための方法 |
| JP6992068B2 (ja) | 2016-12-07 | 2022-02-03 | アジェナス インコーポレイテッド | 抗ctla-4抗体およびそれらの使用方法 |
| EP3939993A1 (en) | 2017-01-05 | 2022-01-19 | KAHR Medical Ltd. | A sirp1-alpha-4-1bbl fusion protein and methods of use thereof |
| EP3565579B9 (en) * | 2017-01-05 | 2023-10-04 | KAHR Medical Ltd. | A pd1-41bbl fusion protein and methods of use thereof |
| MX2019009117A (es) | 2017-02-17 | 2019-09-13 | Bristol Myers Squibb Co | Anticuerpos anti alfa-sinucleina y usos de los mismos. |
| JOP20190203A1 (ar) | 2017-03-30 | 2019-09-03 | Potenza Therapeutics Inc | بروتينات رابطة لمولد ضد مضادة لـ tigit وطرق استخدامها |
| TWI788340B (zh) | 2017-04-07 | 2023-01-01 | 美商必治妥美雅史谷比公司 | 抗icos促效劑抗體及其用途 |
| CA3058477A1 (en) | 2017-04-11 | 2018-10-18 | Inhibrx, Inc. | Multispecific polypeptide constructs having constrained cd3 binding and methods of using the same |
| EP3625260A1 (en) | 2017-05-16 | 2020-03-25 | Bristol-Myers Squibb Company | Treatment of cancer with anti-gitr agonist antibodies |
| GB201709808D0 (en) | 2017-06-20 | 2017-08-02 | Kymab Ltd | Antibodies |
| WO2019008375A1 (en) * | 2017-07-06 | 2019-01-10 | Ucl Business Plc | METHOD FOR IDENTIFYING RESPONDERS TO THE TREATMENT OF CANCER |
| CA3070791A1 (en) | 2017-07-27 | 2019-01-31 | Iteos Therapeutics Sa | Anti-tigit antibodies |
| CN111051347B (zh) | 2017-09-29 | 2021-12-21 | 江苏恒瑞医药股份有限公司 | Tigit抗体、其抗原结合片段及医药用途 |
| AU2018351000B2 (en) | 2017-10-18 | 2023-11-30 | Alpine Immune Sciences, Inc. | Variant ICOS Ligand immunomodulatory proteins and related compositions and methods |
| GB201721338D0 (en) | 2017-12-19 | 2018-01-31 | Kymab Ltd | Anti-icos Antibodies |
| WO2019122882A1 (en) | 2017-12-19 | 2019-06-27 | Kymab Limited | Bispecific antibody for icos and pd-l1 |
| IT201800001315A1 (it) * | 2018-01-18 | 2019-07-18 | Univ Degli Studi Del Piemonte Orientale Amedeo Avogadro | Nuovi agenti terapeutici antitumorali |
| SG11202007018QA (en) * | 2018-02-02 | 2020-08-28 | Oncoimmune Inc | Methods of selecting and designing safer and more effective anti-ctla-4 antibodies for cancer therapy |
| GB201811408D0 (en) * | 2018-07-12 | 2018-08-29 | F Star Beta Ltd | CD137 Binding Molecules |
| CN112638944A (zh) | 2018-08-23 | 2021-04-09 | 西进公司 | 抗tigit抗体 |
| WO2020047048A1 (en) * | 2018-08-29 | 2020-03-05 | Academia Sinica | Combination of natural killer cells with cyclophosphamide compounds for the treatment of cancer |
| CN112839962A (zh) | 2018-10-09 | 2021-05-25 | 百时美施贵宝公司 | 用于治疗癌症的抗mertk抗体 |
| JP2022516071A (ja) * | 2018-12-27 | 2022-02-24 | ギガジェン,インコーポレイティッド | 抗ctla-4結合タンパク質およびその使用方法 |
| US20230192860A1 (en) * | 2019-09-19 | 2023-06-22 | Bristol-Myers Squibb Company | Antibodies Binding to Vista at Acidic pH |
| WO2021127554A1 (en) | 2019-12-19 | 2021-06-24 | Bristol-Myers Squibb Company | Combinations of dgk inhibitors and checkpoint antagonists |
| KR20220154140A (ko) | 2020-03-13 | 2022-11-21 | 지앙수 헨그루이 파마슈티컬스 컴퍼니 리미티드 | Pvrig 결합 단백질 및 이의 의학적 용도 |
| PE20230682A1 (es) * | 2020-04-17 | 2023-04-21 | Hutchison Medipharma Ltd | Anticuerpo anti-ox40 y usos del mismo |
| IL298111A (en) | 2020-06-02 | 2023-01-01 | Arcus Biosciences Inc | Antibodies to tigit |
| WO2022073515A1 (zh) | 2020-10-11 | 2022-04-14 | 百奥泰生物制药股份有限公司 | 抗pd-1抗体在联合用药中的应用 |
| EP4240769A1 (en) | 2020-11-06 | 2023-09-13 | Bristol-Myers Squibb Company | Dosing and administration of non-fucosylated anti-ctla-4 antibody as monotherapy |
| CA3219336A1 (en) | 2021-05-18 | 2022-11-24 | Kymab Limited | Uses of anti-icos antibodies |
| GB202107994D0 (en) | 2021-06-04 | 2021-07-21 | Kymab Ltd | Treatment of cancer |
| CA3231553A1 (en) | 2021-09-15 | 2023-03-23 | Jiangsu Hengrui Pharmaceuticals Co., Ltd. | Pharmaceutical composition comprising anti-pvrig/tigit bispecific antibody |
| TW202328195A (zh) | 2021-09-15 | 2023-07-16 | 大陸商江蘇恆瑞醫藥股份有限公司 | 特異性結合pd-1的蛋白及其醫藥用途 |
| WO2023168404A1 (en) | 2022-03-04 | 2023-09-07 | Bristol-Myers Squibb Company | Methods of treating a tumor |
| WO2023196987A1 (en) | 2022-04-07 | 2023-10-12 | Bristol-Myers Squibb Company | Methods of treating tumor |
| WO2023222854A1 (en) | 2022-05-18 | 2023-11-23 | Kymab Limited | Uses of anti-icos antibodies |
| WO2024031032A1 (en) | 2022-08-05 | 2024-02-08 | Bristol-Myers Squibb Company | Anti-ctla-4 antibodies for treatment of kras mutant cancers |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2009512694A (ja) * | 2005-10-21 | 2009-03-26 | ジーティーシー バイオセラピューティックス インコーポレイテッド | 抗体依存性細胞障害活性を増強させた抗体、その調製法および使用法 |
| WO2012123586A1 (en) * | 2011-03-16 | 2012-09-20 | arGEN-X BV | Antibodies to cd70 |
Family Cites Families (42)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5851795A (en) | 1991-06-27 | 1998-12-22 | Bristol-Myers Squibb Company | Soluble CTLA4 molecules and uses thereof |
| US5821332A (en) | 1993-11-03 | 1998-10-13 | The Board Of Trustees Of The Leland Stanford Junior University | Receptor on the surface of activated CD4+ T-cells: ACT-4 |
| US20060034844A1 (en) * | 1996-12-04 | 2006-02-16 | The Regents Of The University Of California | Stimulation of T cells against self antigens using CTLA-4 blocking agents |
| JP3521382B2 (ja) | 1997-02-27 | 2004-04-19 | 日本たばこ産業株式会社 | 細胞間接着及びシグナル伝達を媒介する細胞表面分子 |
| DE19821060A1 (de) | 1997-09-23 | 1999-04-15 | Bundesrepublik Deutschland Let | Ko-stimulierendes Polypeptid von T-Zellen, monoklonale Antikörper sowie die Herstellung und deren Verwendung |
| AU2873999A (en) | 1998-02-24 | 1999-09-06 | Sisters Of Providence In Oregon | Compositions containing an OX-40 receptor binding agent or nucleic acid encoding the same and methods for enhancing antigen-specific immune response |
| EP2261229A3 (en) | 1998-04-20 | 2011-03-23 | GlycArt Biotechnology AG | Glycosylation engineering of antibodies for improving antibody-dependent cellular cytotoxicity |
| US6682736B1 (en) | 1998-12-23 | 2004-01-27 | Abgenix, Inc. | Human monoclonal antibodies to CTLA-4 |
| EP2270148A3 (en) | 1999-04-09 | 2011-06-08 | Kyowa Hakko Kirin Co., Ltd. | Method for controlling the activity of immunologically functional molecule |
| KR100942863B1 (ko) | 1999-08-24 | 2010-02-17 | 메다렉스, 인코포레이티드 | 인간 씨티엘에이-4 항체 및 그의 용도 |
| US7605238B2 (en) | 1999-08-24 | 2009-10-20 | Medarex, Inc. | Human CTLA-4 antibodies and their uses |
| JP3597140B2 (ja) | 2000-05-18 | 2004-12-02 | 日本たばこ産業株式会社 | 副刺激伝達分子ailimに対するヒトモノクローナル抗体及びその医薬用途 |
| ES2295228T3 (es) | 2000-11-30 | 2008-04-16 | Medarex, Inc. | Roedores transcromosomicos transgenicos para la preparacion de anticuerpos humanos. |
| IL149701A0 (en) * | 2001-05-23 | 2002-11-10 | Pfizer Prod Inc | Use of anti-ctla-4 antibodies |
| US7045605B2 (en) * | 2001-06-01 | 2006-05-16 | Cornell Research Foundation, Inc. | Modified antibodies to prostate-specific membrane antigen and uses thereof |
| HUP0600342A3 (en) | 2001-10-25 | 2011-03-28 | Genentech Inc | Glycoprotein compositions |
| PL373256A1 (en) | 2002-04-09 | 2005-08-22 | Kyowa Hakko Kogyo Co, Ltd. | Cells with modified genome |
| CA2489004C (en) | 2002-06-13 | 2013-01-08 | Crucell Holland B.V. | Agonistic binding molecules to the human ox40 receptor |
| AU2004204494B2 (en) | 2003-01-09 | 2011-09-29 | Macrogenics, Inc. | Identification and engineering of antibodies with variant Fc regions and methods of using same |
| WO2004076621A2 (en) * | 2003-02-27 | 2004-09-10 | Yeda Research And Development Co. Ltd. | Compositions of nucleic acids for treating and detecting influenza virus |
| JP4762156B2 (ja) | 2004-01-12 | 2011-08-31 | アプライド モレキュラー エボリューション,インコーポレイテッド | Fc領域変異体 |
| KR101291640B1 (ko) | 2005-02-18 | 2013-08-05 | 메다렉스, 엘.엘.시. | 푸코실 잔기가 결핍된 전립선 특이적 막 항원(psma)에대한 단클론성 항체 |
| PT2343320T (pt) | 2005-03-25 | 2018-01-23 | Gitr Inc | Anticorpos anti-gitr e as suas utilizações |
| AU2006244885B2 (en) | 2005-05-09 | 2011-03-31 | E. R. Squibb & Sons, L.L.C. | Human monoclonal antibodies to programmed death 1(PD-1) and methods for treating cancer using anti-PD-1 antibodies alone or in combination with other immunotherapeutics |
| CA2626859A1 (en) | 2005-11-08 | 2007-05-18 | Medarex, Inc. | Tnf-alpha blocker treatment for enterocolitis associated with immunostimulatory therapeutic antibody therapy |
| TWI461436B (zh) | 2005-11-25 | 2014-11-21 | Kyowa Hakko Kirin Co Ltd | 人類cd134(ox40)之人類單株抗體及其製造及使用方法 |
| US20090175886A1 (en) | 2006-01-17 | 2009-07-09 | Medarex, Inc. | Monoclonal antibodies against cd30 lacking in fucosyl and xylosyl residues |
| EP1981969A4 (en) | 2006-01-19 | 2009-06-03 | Genzyme Corp | ANTI-GITRANT ANTIBODIES FOR THE TREATMENT OF CANCER |
| KR20100017514A (ko) * | 2007-05-07 | 2010-02-16 | 메디뮨 엘엘씨 | 항 icos 항체, 및 종양, 이식 및 자가면역성 질환 치료에서의 이의 용도 |
| JP2008278814A (ja) | 2007-05-11 | 2008-11-20 | Igaku Seibutsugaku Kenkyusho:Kk | アゴニスティック抗ヒトgitr抗体による免疫制御の解除とその応用 |
| AU2008338591B8 (en) | 2007-12-14 | 2014-02-20 | Bristol-Myers Squibb Company | Binding molecules to the human OX40 receptor |
| US8747847B2 (en) | 2008-02-11 | 2014-06-10 | Curetech Ltd. | Monoclonal antibodies for tumor treatment |
| LT2398498T (lt) | 2009-02-17 | 2019-01-10 | Ucb Biopharma Sprl | Antikūno molekulės, pasižyminčios specifiškumu žmogaus ox40 |
| ES2788869T3 (es) | 2009-09-03 | 2020-10-23 | Merck Sharp & Dohme | Anticuerpos anti-GITR |
| PE20131403A1 (es) | 2010-08-23 | 2014-01-10 | Univ Texas | Anticuerpos anti-ox40 y metodos de uso de los mismos |
| CN103597073B (zh) | 2011-03-06 | 2019-06-07 | 默克雪兰诺有限公司 | 低岩藻糖细胞系及其应用 |
| CN103608028A (zh) * | 2011-04-28 | 2014-02-26 | 南加利福尼亚大学 | 人类髓源抑制性细胞癌症标记 |
| CA3158257A1 (en) | 2011-07-11 | 2013-01-17 | Ichnos Sciences SA | Antibodies that bind to ox40 and their uses |
| KR101685262B1 (ko) | 2011-08-23 | 2016-12-21 | 보드 오브 리전츠, 더 유니버시티 오브 텍사스 시스템 | 항-ox40 항체 및 이의 사용 방법 |
| GB201116092D0 (en) | 2011-09-16 | 2011-11-02 | Bioceros B V | Antibodies and uses thereof |
| CA2865153C (en) * | 2012-02-23 | 2022-11-22 | Sloan-Kettering Institute For Cancer Research | Prediction of responsiveness to treatment with immunomodulatory therapeutics and method of monitoring abscopal effects during such treatment |
| CN116637183A (zh) | 2012-12-03 | 2023-08-25 | 百时美施贵宝公司 | 强化免疫调变性Fc融合蛋白的抗癌活性 |
-
2013
- 2013-12-03 CN CN202310218856.5A patent/CN116637183A/zh active Pending
- 2013-12-03 PL PL13811698T patent/PL2925350T3/pl unknown
- 2013-12-03 DK DK13811698.3T patent/DK2925350T3/da active
- 2013-12-03 PT PT13811698T patent/PT2925350T/pt unknown
- 2013-12-03 EP EP13811698.3A patent/EP2925350B1/en active Active
- 2013-12-03 ES ES13811698T patent/ES2715673T3/es active Active
- 2013-12-03 LT LTEP13811698.3T patent/LT2925350T/lt unknown
- 2013-12-03 EP EP18209431.8A patent/EP3508215A3/en not_active Withdrawn
- 2013-12-03 SI SI201331367T patent/SI2925350T1/sl unknown
- 2013-12-03 WO PCT/US2013/072918 patent/WO2014089113A1/en active Application Filing
- 2013-12-03 RS RS20190387A patent/RS58528B1/sr unknown
- 2013-12-03 HU HUE13811698A patent/HUE043903T2/hu unknown
- 2013-12-03 JP JP2015545522A patent/JP2016500251A/ja active Pending
- 2013-12-03 US US14/648,941 patent/US20150322119A1/en not_active Abandoned
- 2013-12-03 CN CN201380072031.1A patent/CN104968364A/zh active Pending
-
2018
- 2018-02-13 US US15/895,655 patent/US20180312553A1/en not_active Abandoned
-
2019
- 2019-01-10 JP JP2019002712A patent/JP7132858B2/ja active Active
- 2019-03-25 HR HRP20190574TT patent/HRP20190574T1/hr unknown
- 2019-04-16 CY CY20191100422T patent/CY1121557T1/el unknown
-
2020
- 2020-01-08 US US16/737,745 patent/US20200207816A1/en not_active Abandoned
-
2021
- 2021-04-07 JP JP2021065226A patent/JP2021113197A/ja active Pending
-
2023
- 2023-02-27 US US18/174,892 patent/US20230287064A1/en active Pending
- 2023-03-22 JP JP2023045137A patent/JP2023078356A/ja active Pending
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2009512694A (ja) * | 2005-10-21 | 2009-03-26 | ジーティーシー バイオセラピューティックス インコーポレイテッド | 抗体依存性細胞障害活性を増強させた抗体、その調製法および使用法 |
| WO2012123586A1 (en) * | 2011-03-16 | 2012-09-20 | arGEN-X BV | Antibodies to cd70 |
Non-Patent Citations (2)
| Title |
|---|
| CLIN. CANCER RES., vol. 13, no. 3, JPN6017038451, 2007, pages 958 - 964, ISSN: 0003877326 * |
| YAKUGAKU ZASSHI, vol. 129, no. 1, JPN6018035664, 2009, pages 3 - 9, ISSN: 0003877327 * |
Cited By (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2020509037A (ja) * | 2017-02-28 | 2020-03-26 | ブリストル−マイヤーズ スクイブ カンパニーBristol−Myers Squibb Company | ワクチンに対する免疫応答を増強するための、adccが増強された抗ctla−4抗体の使用 |
| JP2021508676A (ja) * | 2017-12-30 | 2021-03-11 | ベイジーン リミテッド | 抗tigit抗体並びに治療剤及び診断剤としてのその使用 |
| JP7287963B2 (ja) | 2017-12-30 | 2023-06-06 | ベイジーン リミテッド | 抗tigit抗体並びに治療剤及び診断剤としてのその使用 |
| JP2021512884A (ja) * | 2018-02-02 | 2021-05-20 | オンコイミューン, インコーポレイテッド | 免疫療法効果が向上し副作用が軽減した変異抗ctla−4抗体 |
Also Published As
| Publication number | Publication date |
|---|---|
| JP7132858B2 (ja) | 2022-09-07 |
| ES2715673T3 (es) | 2019-06-05 |
| CY1121557T1 (el) | 2020-05-29 |
| JP2023078356A (ja) | 2023-06-06 |
| SI2925350T1 (sl) | 2019-04-30 |
| HRP20190574T1 (hr) | 2019-05-17 |
| LT2925350T (lt) | 2019-04-10 |
| EP3508215A2 (en) | 2019-07-10 |
| JP2021113197A (ja) | 2021-08-05 |
| EP2925350A1 (en) | 2015-10-07 |
| DK2925350T3 (da) | 2019-05-13 |
| PT2925350T (pt) | 2019-03-25 |
| PL2925350T3 (pl) | 2019-07-31 |
| US20180312553A1 (en) | 2018-11-01 |
| JP2019073534A (ja) | 2019-05-16 |
| HUE043903T2 (hu) | 2019-09-30 |
| US20230287064A1 (en) | 2023-09-14 |
| EP2925350B1 (en) | 2019-01-30 |
| EP3508215A3 (en) | 2019-10-02 |
| RS58528B1 (sr) | 2019-04-30 |
| CN104968364A (zh) | 2015-10-07 |
| US20150322119A1 (en) | 2015-11-12 |
| WO2014089113A1 (en) | 2014-06-12 |
| CN116637183A (zh) | 2023-08-25 |
| US20200207816A1 (en) | 2020-07-02 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP7132858B2 (ja) | 免疫調節Fc融合タンパク質の抗癌活性の増強 | |
| US11421027B2 (en) | CD3 binding antibodies | |
| AU2017281034B2 (en) | CD3 binding antibodies | |
| US20220127363A1 (en) | Use of anti-ctla-4 antibodies with enhanced adcc to enhance immune response to a vaccine | |
| IL296673A (en) | Anti-ccr8 antibodies for cancer treatment | |
| US20220193237A1 (en) | Ipilimumab variants with enhanced specificity for binding at low ph | |
| US10196445B1 (en) | Ipilimumab variant with enhanced ADCC | |
| TW202305005A (zh) | 抗siglec組合物及其用途 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20161128 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20161128 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20170914 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20171017 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20180105 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20180416 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20180911 |