JP2012167127A - 2,4,6−トリメルカプト−1,3,5−トリアジンの製造方法 - Google Patents
2,4,6−トリメルカプト−1,3,5−トリアジンの製造方法 Download PDFInfo
- Publication number
- JP2012167127A JP2012167127A JP2012132118A JP2012132118A JP2012167127A JP 2012167127 A JP2012167127 A JP 2012167127A JP 2012132118 A JP2012132118 A JP 2012132118A JP 2012132118 A JP2012132118 A JP 2012132118A JP 2012167127 A JP2012167127 A JP 2012167127A
- Authority
- JP
- Japan
- Prior art keywords
- triazine
- solution
- tmt
- trimercapto
- mercapto
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Withdrawn
Links
- 238000000034 method Methods 0.000 title claims abstract description 30
- WZRRRFSJFQTGGB-UHFFFAOYSA-N 1,3,5-triazinane-2,4,6-trithione Chemical compound S=C1NC(=S)NC(=S)N1 WZRRRFSJFQTGGB-UHFFFAOYSA-N 0.000 title claims abstract description 19
- 239000000243 solution Substances 0.000 claims abstract description 19
- 239000007864 aqueous solution Substances 0.000 claims abstract description 12
- 150000003839 salts Chemical class 0.000 claims abstract description 12
- 230000020477 pH reduction Effects 0.000 claims description 11
- 238000004519 manufacturing process Methods 0.000 claims description 8
- 229920002401 polyacrylamide Polymers 0.000 claims description 3
- 230000007547 defect Effects 0.000 abstract 1
- 230000007613 environmental effect Effects 0.000 abstract 1
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 10
- 239000002253 acid Substances 0.000 description 9
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 9
- QAOWNCQODCNURD-UHFFFAOYSA-N Sulfuric acid Chemical compound OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 8
- 238000006243 chemical reaction Methods 0.000 description 8
- 230000015572 biosynthetic process Effects 0.000 description 7
- 239000002244 precipitate Substances 0.000 description 6
- 238000007792 addition Methods 0.000 description 5
- 238000001914 filtration Methods 0.000 description 5
- 239000000047 product Substances 0.000 description 5
- 239000011734 sodium Substances 0.000 description 5
- HRXKRNGNAMMEHJ-UHFFFAOYSA-K trisodium citrate Chemical compound [Na+].[Na+].[Na+].[O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O HRXKRNGNAMMEHJ-UHFFFAOYSA-K 0.000 description 5
- MGNCLNQXLYJVJD-UHFFFAOYSA-N cyanuric chloride Chemical compound ClC1=NC(Cl)=NC(Cl)=N1 MGNCLNQXLYJVJD-UHFFFAOYSA-N 0.000 description 4
- 239000012153 distilled water Substances 0.000 description 4
- 238000003756 stirring Methods 0.000 description 4
- CDMIYIVDILNBIJ-UHFFFAOYSA-N triazinane-4,5,6-trithione Chemical compound SC1=NN=NC(S)=C1S CDMIYIVDILNBIJ-UHFFFAOYSA-N 0.000 description 4
- PDQAZBWRQCGBEV-UHFFFAOYSA-N Ethylenethiourea Chemical compound S=C1NCCN1 PDQAZBWRQCGBEV-UHFFFAOYSA-N 0.000 description 3
- 239000008367 deionised water Substances 0.000 description 3
- 229910021641 deionized water Inorganic materials 0.000 description 3
- 229920001971 elastomer Polymers 0.000 description 3
- 150000007522 mineralic acids Chemical class 0.000 description 3
- 239000000725 suspension Substances 0.000 description 3
- 238000003786 synthesis reaction Methods 0.000 description 3
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 2
- QXNVGIXVLWOKEQ-UHFFFAOYSA-N Disodium Chemical compound [Na][Na] QXNVGIXVLWOKEQ-UHFFFAOYSA-N 0.000 description 2
- NBIIXXVUZAFLBC-UHFFFAOYSA-N Phosphoric acid Chemical compound OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 description 2
- KEAYESYHFKHZAL-UHFFFAOYSA-N Sodium Chemical class [Na] KEAYESYHFKHZAL-UHFFFAOYSA-N 0.000 description 2
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 2
- DTQVDTLACAAQTR-UHFFFAOYSA-N Trifluoroacetic acid Chemical compound OC(=O)C(F)(F)F DTQVDTLACAAQTR-UHFFFAOYSA-N 0.000 description 2
- 230000002378 acidificating effect Effects 0.000 description 2
- 239000012670 alkaline solution Substances 0.000 description 2
- 230000000052 comparative effect Effects 0.000 description 2
- 238000004132 cross linking Methods 0.000 description 2
- 229920005558 epichlorohydrin rubber Polymers 0.000 description 2
- 239000000543 intermediate Substances 0.000 description 2
- 238000002156 mixing Methods 0.000 description 2
- 239000000203 mixture Substances 0.000 description 2
- 150000007524 organic acids Chemical class 0.000 description 2
- 235000005985 organic acids Nutrition 0.000 description 2
- 239000012266 salt solution Substances 0.000 description 2
- ZMZDMBWJUHKJPS-UHFFFAOYSA-N thiocyanic acid Chemical class SC#N ZMZDMBWJUHKJPS-UHFFFAOYSA-N 0.000 description 2
- JOXIMZWYDAKGHI-UHFFFAOYSA-N toluene-4-sulfonic acid Chemical compound CC1=CC=C(S(O)(=O)=O)C=C1 JOXIMZWYDAKGHI-UHFFFAOYSA-N 0.000 description 2
- 238000005406 washing Methods 0.000 description 2
- JYEUMXHLPRZUAT-UHFFFAOYSA-N 1,2,3-triazine Chemical compound C1=CN=NN=C1 JYEUMXHLPRZUAT-UHFFFAOYSA-N 0.000 description 1
- JIHQDMXYYFUGFV-UHFFFAOYSA-N 1,3,5-triazine Chemical compound C1=NC=NC=N1 JIHQDMXYYFUGFV-UHFFFAOYSA-N 0.000 description 1
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 1
- 239000004971 Cross linker Substances 0.000 description 1
- RWSOTUBLDIXVET-UHFFFAOYSA-N Dihydrogen sulfide Chemical class S RWSOTUBLDIXVET-UHFFFAOYSA-N 0.000 description 1
- BRLQWZUYTZBJKN-UHFFFAOYSA-N Epichlorohydrin Chemical compound ClCC1CO1 BRLQWZUYTZBJKN-UHFFFAOYSA-N 0.000 description 1
- IAYPIBMASNFSPL-UHFFFAOYSA-N Ethylene oxide Chemical compound C1CO1 IAYPIBMASNFSPL-UHFFFAOYSA-N 0.000 description 1
- 238000003916 acid precipitation Methods 0.000 description 1
- 239000003929 acidic solution Substances 0.000 description 1
- 239000013543 active substance Substances 0.000 description 1
- PNEYBMLMFCGWSK-UHFFFAOYSA-N aluminium oxide Inorganic materials [O-2].[O-2].[O-2].[Al+3].[Al+3] PNEYBMLMFCGWSK-UHFFFAOYSA-N 0.000 description 1
- 229910000147 aluminium phosphate Inorganic materials 0.000 description 1
- SOIFLUNRINLCBN-UHFFFAOYSA-N ammonium thiocyanate Chemical compound [NH4+].[S-]C#N SOIFLUNRINLCBN-UHFFFAOYSA-N 0.000 description 1
- HUTDDBSSHVOYJR-UHFFFAOYSA-H bis[(2-oxo-1,3,2$l^{5},4$l^{2}-dioxaphosphaplumbetan-2-yl)oxy]lead Chemical compound [Pb+2].[Pb+2].[Pb+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O HUTDDBSSHVOYJR-UHFFFAOYSA-H 0.000 description 1
- 229910052791 calcium Inorganic materials 0.000 description 1
- 239000011575 calcium Substances 0.000 description 1
- 229940043430 calcium compound Drugs 0.000 description 1
- 238000004140 cleaning Methods 0.000 description 1
- 238000011109 contamination Methods 0.000 description 1
- 229920001577 copolymer Polymers 0.000 description 1
- 239000006071 cream Substances 0.000 description 1
- 125000004122 cyclic group Chemical group 0.000 description 1
- 238000011033 desalting Methods 0.000 description 1
- 238000001035 drying Methods 0.000 description 1
- 238000003912 environmental pollution Methods 0.000 description 1
- 239000012527 feed solution Substances 0.000 description 1
- 239000012065 filter cake Substances 0.000 description 1
- 239000012530 fluid Substances 0.000 description 1
- 229910001385 heavy metal Inorganic materials 0.000 description 1
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 1
- 239000012535 impurity Substances 0.000 description 1
- 150000002611 lead compounds Chemical class 0.000 description 1
- 150000002681 magnesium compounds Chemical class 0.000 description 1
- 239000000463 material Substances 0.000 description 1
- 239000002184 metal Substances 0.000 description 1
- 229910052751 metal Inorganic materials 0.000 description 1
- 231100000252 nontoxic Toxicity 0.000 description 1
- 230000003000 nontoxic effect Effects 0.000 description 1
- 239000000843 powder Substances 0.000 description 1
- 238000002360 preparation method Methods 0.000 description 1
- OVARTBFNCCXQKS-UHFFFAOYSA-N propan-2-one;hydrate Chemical compound O.CC(C)=O OVARTBFNCCXQKS-UHFFFAOYSA-N 0.000 description 1
- 238000007086 side reaction Methods 0.000 description 1
- 239000011780 sodium chloride Substances 0.000 description 1
- 159000000000 sodium salts Chemical class 0.000 description 1
- RPACBEVZENYWOL-XFULWGLBSA-M sodium;(2r)-2-[6-(4-chlorophenoxy)hexyl]oxirane-2-carboxylate Chemical compound [Na+].C=1C=C(Cl)C=CC=1OCCCCCC[C@]1(C(=O)[O-])CO1 RPACBEVZENYWOL-XFULWGLBSA-M 0.000 description 1
- 239000007787 solid Substances 0.000 description 1
- 238000003746 solid phase reaction Methods 0.000 description 1
- 239000007858 starting material Substances 0.000 description 1
- 239000000126 substance Substances 0.000 description 1
- 238000000967 suction filtration Methods 0.000 description 1
- 231100000419 toxicity Toxicity 0.000 description 1
- 230000001988 toxicity Effects 0.000 description 1
- 238000005829 trimerization reaction Methods 0.000 description 1
- SOBHUZYZLFQYFK-UHFFFAOYSA-K trisodium;hydroxy-[[phosphonatomethyl(phosphonomethyl)amino]methyl]phosphinate Chemical class [Na+].[Na+].[Na+].OP(O)(=O)CN(CP(O)([O-])=O)CP([O-])([O-])=O SOBHUZYZLFQYFK-UHFFFAOYSA-K 0.000 description 1
- 238000004073 vulcanization Methods 0.000 description 1
- 239000002351 wastewater Substances 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D251/00—Heterocyclic compounds containing 1,3,5-triazine rings
- C07D251/02—Heterocyclic compounds containing 1,3,5-triazine rings not condensed with other rings
- C07D251/12—Heterocyclic compounds containing 1,3,5-triazine rings not condensed with other rings having three double bonds between ring members or between ring members and non-ring members
- C07D251/26—Heterocyclic compounds containing 1,3,5-triazine rings not condensed with other rings having three double bonds between ring members or between ring members and non-ring members with only hetero atoms directly attached to ring carbon atoms
- C07D251/38—Sulfur atoms
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
- Low-Molecular Organic Synthesis Reactions Using Catalysts (AREA)
Abstract
【課題】経済面及び環境面において先行技術の方法に勝っていて、かつ前記の公知の方法の欠点を克服するさらなる方法を特定することである。
【解決手段】特許請求の範囲によって解決される。
【選択図】なし
【解決手段】特許請求の範囲によって解決される。
【選択図】なし
Description
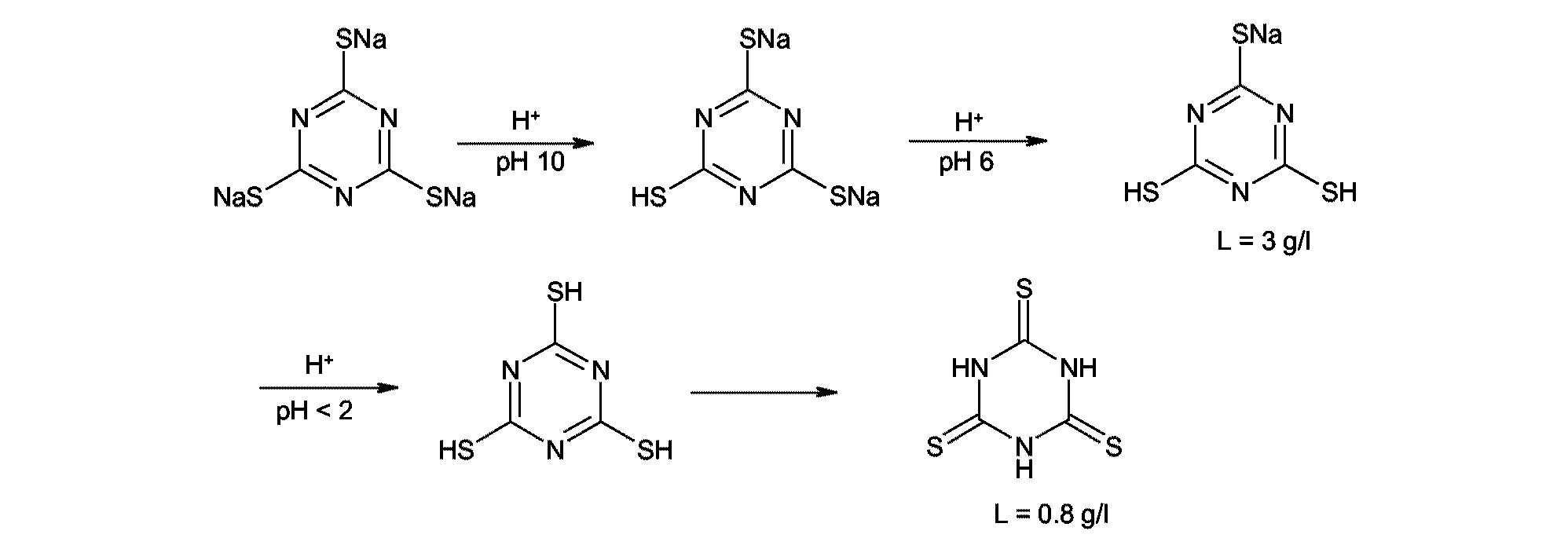
本発明は、2,4,6−トリメルカプト−1,3,5−トリアジン(TMT−H3)の製造方法に関する。特に、発明主題の方法は、水溶液中での、かつ定義されたpHの範囲内での2,4,6−トリメルカプト−1,3,5−トリアジン(TMT)の塩の酸性化の実施に関する。
易水溶性の三ナトリウム塩[CAS番号17766−26−6]が、比較的長期間、重金属含有廃水及び排気ガス流を清浄するために既に産業使用されている2,4,6−トリメルカプト−1,3,5−トリアジン[CAS番号638−16−4]は、ゴム産業部門における様々な方法において遊離酸の形で使用されうる。特に、物理的及び化学的性質を改良するためにエチレンチオ尿素によって架橋された、エピクロロヒドリンゴム及び、エピクロロヒドリンと、例えば酸化エチレンとのコポリマー(ECOゴムと呼ばれる)は、使用の重要な分野を形成するまで成熟しうる。それは、この架橋が、今までは、加硫において形成された塩酸を結合する鉛化合物、例えば鉛丹又はリン酸鉛を必要としていたからである。
鉛に因る環境汚染と、エチレンチオ尿素(ETU)の毒性に対する基礎的な配慮もまた、鉛が少なくとも自動車製造部門ではもはや使用されていないという事実をもたらした。ETU/Pb系のための効果的な代替物は、TMT−H3であると判明しており、それと共に、適宜、活性剤に加えて、毒性のないカルシウム又はマグネシウム化合物を使用することができる。
TMT−H3の製造方法は、複数の文献において記述されている。
出発材料としてチオシアン酸アンモニウム又はチオシアン酸の他の塩を使用して、TMT−H3を強酸性の系において環状三量体化によって得る方法に加えて、ほとんどの方法は、塩化シアヌルから出発し、それと、適宜、アルカリ液の存在下で、ヒドロ硫酸の塩とが反応される。
例えば、CS 230344号によれば、塩化シアヌルは、80℃で4時間、濃Na2S溶液を使用してアセトン水中で加水分解され、次いで酸性化される。収率は、80%であると言われている。
CS 265150号は、塩化シアヌル懸濁液とNaSH/Na2S/Na2CO3混合物との反応、及び硫酸を用いた酸性化(収率90%、純度95%)を記載している。
US 5563267において、TMT−H3のトリアルカリ金属塩及びトリアンモニウム塩が製造され、その際、遊離酸は、アセトン中の塩化シアヌル水溶液へNaSHを添加することによって沈殿される。加えて、生成物を、塩酸で酸性化する。
我々の研究は、実際に、図2:
に従って行われうるトリメルカプトトリアジン合成が、TMT−H3架橋剤のためのゴム産業の要求を満たさない生成物を導くことを見出した。純度は95%未満であり、アルカリ溶液は混濁しており、かつ臭気は強く、典型的ではない。明らかに、この直接合成において、副反応は、例えばヒドロキシル誘導体及び架橋系を生じる。不純物の性質は、未だ詳細に知られていない。純粋なTMT−H3の成功した合成は、TMTの水溶性の塩の形成を介して進行し、そこから次に、純粋なTMT−H3が、酸性化によって沈殿される。
有利には、二ナトリウム塩又は三ナトリウム塩が使用される。その三塩の製造方法は、DE3729029号に記載されている。
通常、TMT−Na3溶液(pH約12)を、撹拌しながら、pH<2まで強酸と混合し、そして結果として酸の析出が生じる。前記特許において同様に時折報告されるこの方法において、実際には、実行することを工業的に事実上不可能にする基本的困難が生じる。
従って、pH6からモノナトリウム塩が沈殿し、それは、pH2未満でおそらく固相反応で転化されて遊離酸が生ずる。
この従来通りの手法において、沈殿物を撹拌域中に引き込むことができず、かつ従って均質混合を達成できないために、反応バッチは、固体沈殿が増加すればするほど、ますます混合することが難しくなることとなる。混合不足の結果として、Na塩を、従って、遊離酸に完全に転化することができない。この方法に従った濾過によって得られたTMT−H3がまだ高い灰分を有するという結果を招く。加えて、沈殿生成物は、極めて微粉であることが分かっているため、非常に長い濾過時間、及び特に洗浄時間もまた、溶解されたナトリウム塩(例えば、NaCl又はNa2SO4)を除去するために要求される。このことは、非常に低い空時収量、及び従って高い製造費用の結果となる。
従って、本発明の課題は、経済面及び環境面において先行技術の方法に勝っていて、かつ前記の公知の方法の欠点を克服するさらなる方法を特定することである。
前記課題は、特許請求の範囲によって解決される。
2,4,6−トリメルカプト−1,3,5−トリアジンの製造方法であって、水溶液における2,4,6−トリメルカプト−1,3,5−トリアジンの相応する塩の溶液の酸性化による方法において、酸性化の操作の間に、pH1.5〜2.5の範囲内を保つという事実の結果として、極めて驚いたことに、しかし確かに有利に、当該目的の溶液が得られる。この方法によって得られた2,4,6−トリメルカプト−1,3,5−トリアジン沈殿物の品質は、該方法における実質的により短い濾過時間、並びに洗浄及び乾燥時間を確立するため、かつ従って、経済的により適切な方法に達するためには十分である。
好ましい一実施態様において、本発明の方法において、引き続き、pH約2に調整された水溶液を装入し、そしてこの溶液に、pHを制御しながら(例えば酸の添加によって)、水溶液における2,4,6−トリメルカプト−1,3,5−トリアジンの相応する塩の溶液を添加するという手順がとられる。この場合において、当業者は、どのようにpHを制御しうるかを随時選択する。有利には、このことは、2,4,6−トリメルカプト−1,3,5−トリアジンの相応する塩の水溶液の添加と同時に、有利には、無機酸及び水(下記参照)から製造される酸性水溶液を、前記のpH範囲を保ちうるように添加することにより達成できる。その制御は、当業者に公知の手段、例えばpH電極を用いて行うことができる。
特に有利であるのは、2,4,6−トリメルカプト−1,3,5−トリアジンの相応する塩の酸性化を、1.75〜2.25、有利には1.75〜2.1の範囲のpHにおいて行うことである。
さらに有利であるのは、2,4,6−トリメルカプト−1,3,5−トリアジンの塩の酸性化の間、少量の有機高分子量ポリアクリルアミドが存在する発明の方法である。かかる高分子量物質は、当業者に十分に知られており、かつ市販されている(Praestol及びPraestol2500)。
本発明の方法は、有利には40〜70℃、より有利には50〜65℃、非常に特に有利には55〜62℃の温度で行われる。使用される2,4,6−トリメルカプト−1,3,5−トリアジンの塩の濃度は、供給溶液において、0.80〜1.45mol/l、有利には0.90〜1.25mol/l、及び非常に特に有利には0.95〜1.20mol/lの濃度が存在するものである。
本発明の方法は、TMTの易水溶性三ナトリウム塩(〜300g/l)又は二ナトリウム塩(〜750g/l)から、ほとんど水不溶性の酸(〜0.8g/l)を製造するための工業的方法を記載している。驚くべきことに、本発明に従って沈殿させたTMT−H3懸濁液は、低粘度のままである。その方法の全期間にわたりpHの変化が全く生じないため、粘度の大きな増大も、添加の終わり近くで測定されない。遊離酸は、純粋な形で、及び一定のpH状態のため、モノナトリウム塩による汚濁なしに製造される。加えて、濾過性が、大きく改良されることが判明している。さらに、その濾過性は、有機高分子量ポリアクリルアミドを、反応溶液0.01〜1g/l(反応溶液)、有利には0.1〜0.4g/l(反応溶液)の量で、(0.1〜0.5%の濃度の水溶液として)添加した場合に、向上させることができる。
本発明の方法は、特に単純な手法において、最初から予期されていない99%より多い含有率及び0.1%未満の灰分を有する純粋な2,4,6−トリメルカプト−1,3,5−トリアジンを生成する。
酸性化又は酸性水溶液の製造は、有利には強有機酸又は強無機酸を使用して行われる。塩酸、硫酸、リン酸からなる群から選択される強無機酸を使用することが有利であるが、しかし強有機酸、例えばトリフルオロ酢酸、p−トルエンスルホン酸などもまた使用できる。
下記の実施例は、本発明をより詳細に説明することを意図している。比較例は、先行技術からの限界決定を表している。
比較例
蒸留水412.5g中の、分子量243.2のトリメルカプトトリアジン三ナトリウム塩137.5g=0.565molからなる予備装入された溶液(〜25%の濃度の溶液に等しい)に、30分間、室温で撹拌しながら、分子量98.07の40%硫酸207.6g=0.847molを添加し、反応温度を40〜45℃まであげる。
蒸留水412.5g中の、分子量243.2のトリメルカプトトリアジン三ナトリウム塩137.5g=0.565molからなる予備装入された溶液(〜25%の濃度の溶液に等しい)に、30分間、室温で撹拌しながら、分子量98.07の40%硫酸207.6g=0.847molを添加し、反応温度を40〜45℃まであげる。
形成されたTMT−H3は、極めて微粉の形で沈殿し、そのバッチは、最後の三回の添加で、極めて濃く、アルミナ性[クリームチーズ様]になり、かつこれ以上撹拌することができない。1時間半、後反応させる。懸濁液の最終pHは、1.9である。
生成物を、濾過時間3時間で、直径16cmの真空濾過器を通して吸引濾過し、ペースト状の流動性の濾過ケークが得られる。
続く蒸留水での除塩洗浄は、6〜8時間を要した。
湿った生成物を、105℃で、真空キャビネット中で乾燥した。
収率:理論値の92.50%に相当する92.6gの分子量177.2のTMT−H3
灰分:1.7%
灰分:1.7%
実施例1
少量の塩酸の添加によってpH2.0に調節された、予備装入された蒸留水130gに、60分間で、0.43%の濃度のPraestol 2500水溶液21gが添加されている40〜50℃の温度の水中の25%の濃度のトリメルカプトトリアジン三ナトリウム塩溶液550g、及び37%の濃度の塩酸170gを、その系において常にpH1.8〜2.0が存在するように、同時に添加する。反応温度は、前記過程中に約50〜60℃まで上昇し、かつTMT−H3形成は、綿状で、絶えず非常に急速に撹拌できる形で直ちに沈殿する。60℃及びpH1.9〜2.0で1時間、後反応させる。直径16cmの磁製真空濾過器を通して吸引濾過をし、その際濾過時間は20秒であった。
少量の塩酸の添加によってpH2.0に調節された、予備装入された蒸留水130gに、60分間で、0.43%の濃度のPraestol 2500水溶液21gが添加されている40〜50℃の温度の水中の25%の濃度のトリメルカプトトリアジン三ナトリウム塩溶液550g、及び37%の濃度の塩酸170gを、その系において常にpH1.8〜2.0が存在するように、同時に添加する。反応温度は、前記過程中に約50〜60℃まで上昇し、かつTMT−H3形成は、綿状で、絶えず非常に急速に撹拌できる形で直ちに沈殿する。60℃及びpH1.9〜2.0で1時間、後反応させる。直径16cmの磁製真空濾過器を通して吸引濾過をし、その際濾過時間は20秒であった。
30分間、蒸留水を使用して、除塩洗浄をし、そして105℃で真空乾燥した。
収率:理論値の98.4%に相当する98.5gの分子量177.2のTMT−H3
灰分:<<0.1%
TMT−H3含有率:99.4%
灰分:<<0.1%
TMT−H3含有率:99.4%
実施例2
25%の濃度の溶液を、TMT−55(トリメルカプトトリアジン三ナトリウム塩)250kgとT=60℃の脱イオン水300kgとから製造し、この溶液に、Praestol 2500溶液[〜0.4%の濃度]25kgを添加し、そして混合物を均質化する。次いで好適な反応器において、脱イオン水(H2SO4を使用してpH2.0に調整された)150gを装入し、そして撹拌しながら、かつpHを測定しながら、40%の濃度の硫酸210kgとそのTMT溶液とを、常にpH約2であるように、60〜90分の間同時に圧入する。約60℃、pH1.7〜1.9で2時間、後反応させる。濾過し、そして脱イオン水で除塩洗浄をし、乾燥させる。
25%の濃度の溶液を、TMT−55(トリメルカプトトリアジン三ナトリウム塩)250kgとT=60℃の脱イオン水300kgとから製造し、この溶液に、Praestol 2500溶液[〜0.4%の濃度]25kgを添加し、そして混合物を均質化する。次いで好適な反応器において、脱イオン水(H2SO4を使用してpH2.0に調整された)150gを装入し、そして撹拌しながら、かつpHを測定しながら、40%の濃度の硫酸210kgとそのTMT溶液とを、常にpH約2であるように、60〜90分の間同時に圧入する。約60℃、pH1.7〜1.9で2時間、後反応させる。濾過し、そして脱イオン水で除塩洗浄をし、乾燥させる。
収率:理論値の99.8%に相当する100kgの分子量177.2のTMT−H3
TMT−H3含有率:99.6%
灰分:<<0.1%
TMT−H3含有率:99.6%
灰分:<<0.1%
Claims (4)
- 2,4,6−トリメルカプト−1,3,5−トリアジンを水溶液中での2,4,6−トリメルカプト−1,3,5−トリアジンの相応する塩の溶液の酸性化によって製造する方法において、酸性化の操作の間、pH1.5〜2.5までの範囲を保つことを特徴とする方法。
- pH約2に調整された水溶液を装入し、かつこの水溶液に、pHを調整しながら、水溶液中の2,4,6−トリメルカプト−1,3,5−トリアジンの相応する塩の溶液を添加することを特徴とする、請求項1に記載の方法。
- 酸性化を、1.75〜2.25、有利には1.75〜2.1の範囲のpHで行うことを特徴とする、請求項1又は2に記載の方法。
- 2,4,6−トリメルカプト−1,3,5−トリアジンの塩を、少量の有機高分子量ポリアクリルアミドの存在下で酸性化させることを特徴とする、請求項1から3までのいずれか1項に記載の方法。
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| DE102005036693A DE102005036693A1 (de) | 2005-08-04 | 2005-08-04 | Verfahren zur Herstellung von 2,4,6-Trimercapto-1,3,5-triazin |
| DE102005036693.7 | 2005-08-04 |
Related Parent Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2008524461A Division JP2009503012A (ja) | 2005-08-04 | 2006-07-03 | 2,4,6−トリメルカプト−1,3,5−トリアジンの製造方法 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| JP2012167127A true JP2012167127A (ja) | 2012-09-06 |
Family
ID=36933519
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2008524461A Pending JP2009503012A (ja) | 2005-08-04 | 2006-07-03 | 2,4,6−トリメルカプト−1,3,5−トリアジンの製造方法 |
| JP2012132118A Withdrawn JP2012167127A (ja) | 2005-08-04 | 2012-06-11 | 2,4,6−トリメルカプト−1,3,5−トリアジンの製造方法 |
Family Applications Before (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2008524461A Pending JP2009503012A (ja) | 2005-08-04 | 2006-07-03 | 2,4,6−トリメルカプト−1,3,5−トリアジンの製造方法 |
Country Status (15)
| Country | Link |
|---|---|
| US (1) | US8114992B2 (ja) |
| EP (1) | EP1910318B1 (ja) |
| JP (2) | JP2009503012A (ja) |
| KR (1) | KR101035168B1 (ja) |
| CN (1) | CN101233118B (ja) |
| BR (1) | BRPI0614260A2 (ja) |
| CA (1) | CA2617477C (ja) |
| DE (1) | DE102005036693A1 (ja) |
| DK (1) | DK1910318T3 (ja) |
| ES (1) | ES2399913T3 (ja) |
| IL (1) | IL188784A0 (ja) |
| MX (1) | MX2008001293A (ja) |
| PL (1) | PL1910318T3 (ja) |
| WO (1) | WO2007017314A1 (ja) |
| ZA (1) | ZA200801104B (ja) |
Families Citing this family (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE102008002073A1 (de) | 2008-05-29 | 2009-12-03 | Evonik Degussa Gmbh | Verfahren zur Herstellung des Trinatriumsalzes des 2,4,6-Trimercapto-s-triazins |
| CN102675235A (zh) * | 2012-04-21 | 2012-09-19 | 安徽金邦医药化工有限公司 | 6-二丁胺基-2,4-二硫醇-1,3,5-三嗪的制备方法 |
| CN109232454A (zh) * | 2018-11-01 | 2019-01-18 | 山东汇海医药化工有限公司 | 基于三聚硫氰酸钠的1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐废水处理方法 |
| CN111057089B (zh) * | 2019-12-19 | 2023-06-02 | 湖北新蓝天新材料股份有限公司 | 一种粘接剂及其制备方法 |
Family Cites Families (23)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US2528515A (en) * | 1946-01-04 | 1950-11-07 | Specialties Dev Corp | Siren |
| JPS4932868B2 (ja) * | 1972-05-04 | 1974-09-03 | ||
| US3849319A (en) * | 1973-11-19 | 1974-11-19 | Texaco Inc | Di and tri(hydrocarbylammonium)trithiocyanurate and lubricating oil compositions containing same |
| CS230344B1 (cs) | 1983-02-25 | 1984-08-13 | Josef Arient | Způsob přípravy 2,4,8-trimerkapto-l,3,5-triazinu |
| JPS62148466A (ja) * | 1985-12-23 | 1987-07-02 | Nippon Shokubai Kagaku Kogyo Co Ltd | 2,3,5,6−テトラフルオロ−4−メルカプト安息香酸の製造法 |
| JPS62185066A (ja) * | 1986-02-12 | 1987-08-13 | Nippon Shokubai Kagaku Kogyo Co Ltd | 3,5,6−トリフルオロ−4−メルカプトフタル酸 |
| JPS62212339A (ja) * | 1986-03-14 | 1987-09-18 | Mitsubishi Chem Ind Ltd | テレフタル酸の回収法 |
| DE3729029A1 (de) * | 1987-08-31 | 1989-03-09 | Degussa | Trinatriumsalz des 2,4,6-trinatriummercapto-s-triazin-nonahydrats und verfahren zur herstellung |
| CS265150B1 (cs) | 1988-02-10 | 1989-10-13 | Kroupa Jaroslav | Způsob přípravy 2,4,6-trimerl<apto-1,3,5-triazinu |
| US4822496A (en) * | 1988-08-18 | 1989-04-18 | Degussa Aktiengesellschaft | Process for the treatment of effluent containing cyanide and toxic metals, using hydrogen peroxide and trimercaptotriazine |
| DE3927469A1 (de) * | 1989-08-19 | 1991-02-21 | Degussa | Dinatriumsalz des trimercapto-s-triazin-hexahydrats, verfahren zu seiner herstellung und verwendung |
| DE3927470A1 (de) * | 1989-08-19 | 1991-02-21 | Degussa | Waessrige loesungen von natriumsalzen des trimercapto-s-triazins, deren herstellung und verwendung |
| US5258515A (en) * | 1989-08-19 | 1993-11-02 | Degussa Aktiengesellschaft | Aqueous solutions of sodium salts of trimercapto-s-triazine, their preparation and use |
| JP2888083B2 (ja) * | 1993-03-23 | 1999-05-10 | 王子製紙株式会社 | 粘着シート |
| US5563267A (en) | 1995-04-12 | 1996-10-08 | Eastman Kodak Company | Method of making trialkali and triammonium salts of tmt |
| JPH11255754A (ja) * | 1998-03-11 | 1999-09-21 | Sanshin Chem Ind Co Ltd | 2,4,6−トリメルカプト−s−トリアジンの製造方法 |
| JP3942326B2 (ja) * | 1999-04-22 | 2007-07-11 | 株式会社クレハ | 熱可塑性樹脂組成物 |
| DE10010125A1 (de) * | 2000-03-03 | 2001-09-06 | Degussa | Verfahren zur Holzkonservierung und verfahrensgemäß erhältliches konserviertes Holz |
| JP3789749B2 (ja) * | 2000-12-19 | 2006-06-28 | エア・ウォーター・ケミカル株式会社 | チオサリチル酸の製造方法 |
| JP2003137923A (ja) * | 2001-11-01 | 2003-05-14 | Gantsu Kasei Kk | ポリマー粉末の乾燥法 |
| JP2004123625A (ja) * | 2002-10-03 | 2004-04-22 | Nippon Kayaku Co Ltd | 高純度のエチニル基含有芳香族カルボン酸の精製方法と新規結晶 |
| JP4804710B2 (ja) * | 2003-09-02 | 2011-11-02 | ジャパンコンポジット株式会社 | 熱硬化性樹脂浴槽成形品およびその製造方法 |
| EP1787989A1 (de) * | 2005-11-17 | 2007-05-23 | Degussa GmbH | Triazinverbindungen mit Aminogruppen- und Carboxygruppen-haltigen Substituenten |
-
2005
- 2005-08-04 DE DE102005036693A patent/DE102005036693A1/de not_active Withdrawn
-
2006
- 2006-07-03 CA CA2617477A patent/CA2617477C/en not_active Expired - Fee Related
- 2006-07-03 WO PCT/EP2006/063795 patent/WO2007017314A1/en not_active Ceased
- 2006-07-03 KR KR1020087002786A patent/KR101035168B1/ko not_active Expired - Fee Related
- 2006-07-03 JP JP2008524461A patent/JP2009503012A/ja active Pending
- 2006-07-03 MX MX2008001293A patent/MX2008001293A/es active IP Right Grant
- 2006-07-03 PL PL06777550T patent/PL1910318T3/pl unknown
- 2006-07-03 CN CN2006800279437A patent/CN101233118B/zh not_active Expired - Fee Related
- 2006-07-03 EP EP06777550A patent/EP1910318B1/en not_active Not-in-force
- 2006-07-03 US US11/996,173 patent/US8114992B2/en not_active Expired - Fee Related
- 2006-07-03 BR BRPI0614260-5A patent/BRPI0614260A2/pt not_active IP Right Cessation
- 2006-07-03 ES ES06777550T patent/ES2399913T3/es active Active
- 2006-07-03 DK DK06777550.2T patent/DK1910318T3/da active
-
2008
- 2008-01-15 IL IL188784A patent/IL188784A0/en unknown
- 2008-02-01 ZA ZA200801104A patent/ZA200801104B/xx unknown
-
2012
- 2012-06-11 JP JP2012132118A patent/JP2012167127A/ja not_active Withdrawn
Also Published As
| Publication number | Publication date |
|---|---|
| WO2007017314A1 (en) | 2007-02-15 |
| US8114992B2 (en) | 2012-02-14 |
| DE102005036693A1 (de) | 2007-02-08 |
| JP2009503012A (ja) | 2009-01-29 |
| PL1910318T3 (pl) | 2013-04-30 |
| MX2008001293A (es) | 2008-03-18 |
| EP1910318B1 (en) | 2012-12-12 |
| IL188784A0 (en) | 2008-08-07 |
| EP1910318A1 (en) | 2008-04-16 |
| ES2399913T3 (es) | 2013-04-04 |
| US20080293935A1 (en) | 2008-11-27 |
| KR20080027915A (ko) | 2008-03-28 |
| KR101035168B1 (ko) | 2011-05-17 |
| CA2617477C (en) | 2010-10-19 |
| BRPI0614260A2 (pt) | 2011-03-15 |
| ZA200801104B (en) | 2008-11-26 |
| CA2617477A1 (en) | 2007-02-15 |
| CN101233118B (zh) | 2012-09-19 |
| DK1910318T3 (da) | 2013-03-04 |
| CN101233118A (zh) | 2008-07-30 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP2012167127A (ja) | 2,4,6−トリメルカプト−1,3,5−トリアジンの製造方法 | |
| AU633200B2 (en) | Chelate compositions and their production | |
| US2945061A (en) | Process for the production of biguanide derivatives containing active chlorine | |
| JPH0338306B2 (ja) | ||
| WO2023119286A1 (en) | Phthalimide-based fungicide and method of preparation thereof | |
| CN105541699B (zh) | 一种3,5‑二氯‑2‑吡啶醇的制备方法 | |
| JPS6133018B2 (ja) | ||
| HK1121145A (en) | Method for the production of 2, 4, 6-trimercapto-1, 3, 5-triazine | |
| SU468430A3 (ru) | Способ выделени цефалоспорина с | |
| US4550200A (en) | Process for obtaining D,L-homocystine (II) | |
| RU2548573C1 (ru) | Способ получения иминодиуксусной кислоты | |
| JPH054952A (ja) | N−長鎖アシル酸性アミノ酸モノアルカリ塩の製造方法 | |
| RU1825783C (ru) | Способ получени @ -цианкоричной кислоты | |
| Zolnikova et al. | Improved method for the cyclization of ortho-alkynylbenzenediazonium salts | |
| SU448716A1 (ru) | Способ получени производных симм-триазина | |
| SU1657495A1 (ru) | Способ получени 3-циан-4-метил-5-хлор-6-гидроксипиридона-2 | |
| SU565507A1 (ru) | Способ получени модифицированного лигнина | |
| SU526157A1 (ru) | Способ получени оротовой кислоты или ее солей | |
| SU70496A1 (ru) | Способ очистки N'-2' (4', 6'-дитетилпиритидил)-N4-ацилсульфанилатидов | |
| RU2589715C1 (ru) | Способ получения 1, 3-диамино-2-гидроксипропан-n, n'-диметилфосфоновой-n, n'-диуксусной кислоты | |
| SU278705A1 (ru) | Способ получения s-метилметионинсульфоний-хлорида | |
| CN101163686A (zh) | 二羟基氯三嗪的盐的制备方法 | |
| CS211874B1 (cs) | Způsob přípravy technické monosodné soli kyseliny 4-chlorftalové | |
| KR20040015025A (ko) | 페닐렌-비스-벤즈이미다졸-테트라설폰산 이나트륨 염의제조 방법 | |
| CS267458B1 (cs) | Způsob výroby m-aminofenylmočoviny |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20120710 |
|
| A761 | Written withdrawal of application |
Free format text: JAPANESE INTERMEDIATE CODE: A761 Effective date: 20120925 |