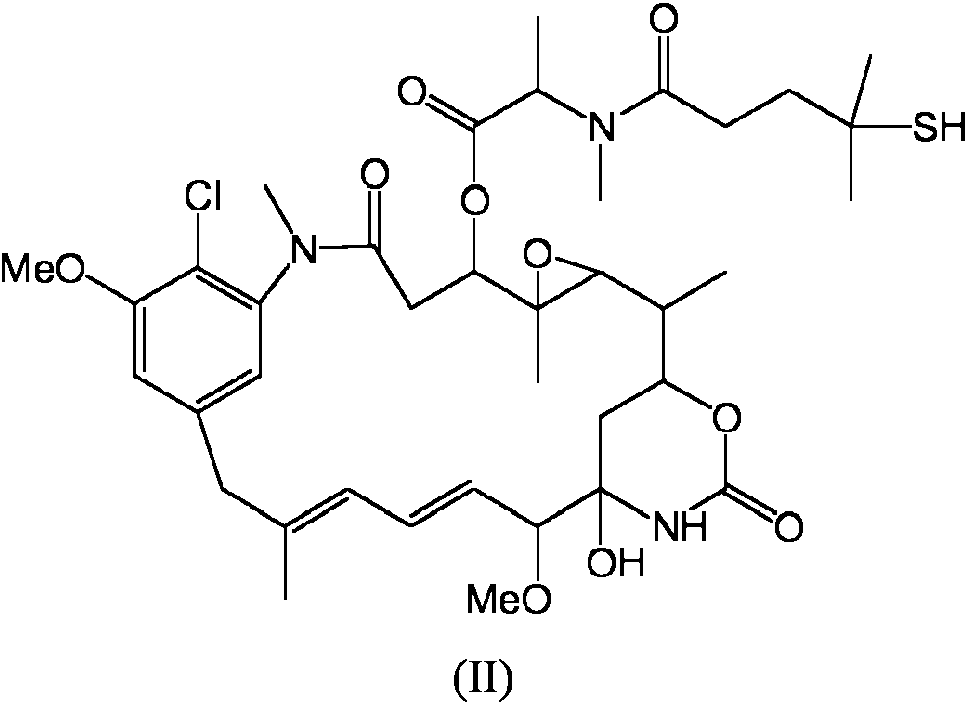
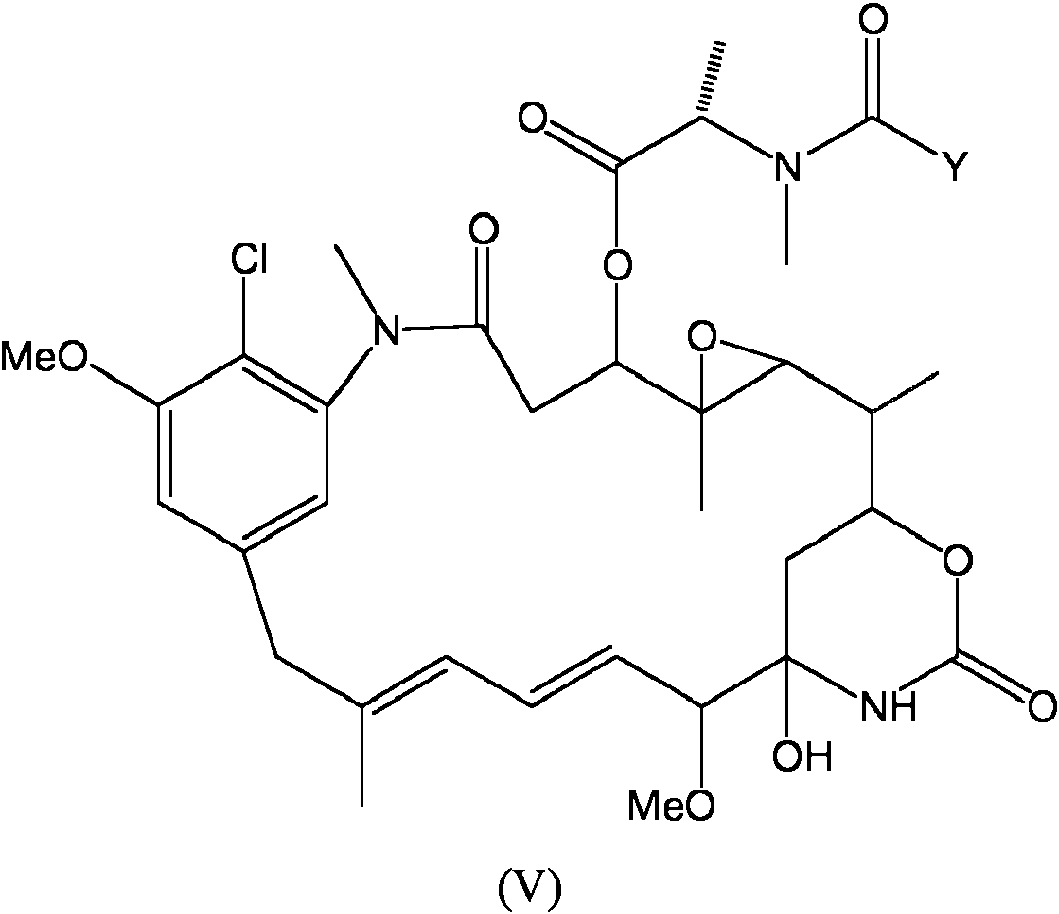
ES2709577T3 - Preparación de conjugados de maitansinoides y anticuerpos mediante un proceso de una sola etapa - Google Patents
Preparación de conjugados de maitansinoides y anticuerpos mediante un proceso de una sola etapa Download PDFInfo
- Publication number
- ES2709577T3 ES2709577T3 ES12714160T ES12714160T ES2709577T3 ES 2709577 T3 ES2709577 T3 ES 2709577T3 ES 12714160 T ES12714160 T ES 12714160T ES 12714160 T ES12714160 T ES 12714160T ES 2709577 T3 ES2709577 T3 ES 2709577T3
- Authority
- ES
- Spain
- Prior art keywords
- antibody
- mixture
- maytansinoid
- hours
- cytotoxic agent
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 238000000034 method Methods 0.000 title claims description 105
- 230000008569 process Effects 0.000 title claims description 83
- 238000002360 preparation method Methods 0.000 title description 6
- 239000000203 mixture Substances 0.000 claims abstract description 87
- 230000001588 bifunctional effect Effects 0.000 claims abstract description 64
- 238000006243 chemical reaction Methods 0.000 claims abstract description 50
- 239000003153 chemical reaction reagent Substances 0.000 claims abstract description 16
- 238000004519 manufacturing process Methods 0.000 claims abstract description 13
- 239000006227 byproduct Substances 0.000 claims abstract description 11
- 239000011230 binding agent Substances 0.000 claims description 140
- 239000003431 cross linking reagent Substances 0.000 claims description 66
- 239000000243 solution Substances 0.000 claims description 31
- -1 3-mercapto-1-oxopropyl Chemical group 0.000 claims description 20
- OWXMKDGYPWMGEB-UHFFFAOYSA-N HEPPS Chemical compound OCCN1CCN(CCCS(O)(=O)=O)CC1 OWXMKDGYPWMGEB-UHFFFAOYSA-N 0.000 claims description 16
- 230000002779 inactivation Effects 0.000 claims description 16
- 238000009295 crossflow filtration Methods 0.000 claims description 15
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 claims description 14
- 239000002253 acid Substances 0.000 claims description 13
- 238000005377 adsorption chromatography Methods 0.000 claims description 10
- 150000002148 esters Chemical group 0.000 claims description 9
- FUHCFUVCWLZEDQ-UHFFFAOYSA-N 1-(2,5-dioxopyrrolidin-1-yl)oxy-1-oxo-4-(pyridin-2-yldisulfanyl)butane-2-sulfonic acid Chemical compound O=C1CCC(=O)N1OC(=O)C(S(=O)(=O)O)CCSSC1=CC=CC=N1 FUHCFUVCWLZEDQ-UHFFFAOYSA-N 0.000 claims description 7
- 229940127121 immunoconjugate Drugs 0.000 claims description 7
- 230000003432 anti-folate effect Effects 0.000 claims description 6
- 229940127074 antifolate Drugs 0.000 claims description 6
- 239000004052 folic acid antagonist Substances 0.000 claims description 6
- 239000006172 buffering agent Substances 0.000 claims description 5
- 239000000126 substance Substances 0.000 claims description 5
- JKMHFZQWWAIEOD-UHFFFAOYSA-N 2-[4-(2-hydroxyethyl)piperazin-1-yl]ethanesulfonic acid Chemical compound OCC[NH+]1CCN(CCS([O-])(=O)=O)CC1 JKMHFZQWWAIEOD-UHFFFAOYSA-N 0.000 claims description 4
- 229930006000 Sucrose Natural products 0.000 claims description 4
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 claims description 4
- 238000001914 filtration Methods 0.000 claims description 4
- 229950001474 maitansine Drugs 0.000 claims description 4
- 239000005720 sucrose Substances 0.000 claims description 4
- 229960000575 trastuzumab Drugs 0.000 claims description 4
- JWDFQMWEFLOOED-UHFFFAOYSA-N (2,5-dioxopyrrolidin-1-yl) 3-(pyridin-2-yldisulfanyl)propanoate Chemical compound O=C1CCC(=O)N1OC(=O)CCSSC1=CC=CC=N1 JWDFQMWEFLOOED-UHFFFAOYSA-N 0.000 claims description 3
- LVQFQZZGTZFUNF-UHFFFAOYSA-N 2-hydroxy-3-[4-(2-hydroxy-3-sulfonatopropyl)piperazine-1,4-diium-1-yl]propane-1-sulfonate Chemical compound OS(=O)(=O)CC(O)CN1CCN(CC(O)CS(O)(=O)=O)CC1 LVQFQZZGTZFUNF-UHFFFAOYSA-N 0.000 claims description 3
- IUTPJBLLJJNPAJ-UHFFFAOYSA-N 3-(2,5-dioxopyrrol-1-yl)propanoic acid Chemical compound OC(=O)CCN1C(=O)C=CC1=O IUTPJBLLJJNPAJ-UHFFFAOYSA-N 0.000 claims description 3
- NCPQROHLJFARLL-UHFFFAOYSA-N 4-(2,5-dioxopyrrol-1-yl)butanoic acid Chemical compound OC(=O)CCCN1C(=O)C=CC1=O NCPQROHLJFARLL-UHFFFAOYSA-N 0.000 claims description 3
- 229950002903 bivatuzumab Drugs 0.000 claims description 3
- 125000004029 hydroxymethyl group Chemical group [H]OC([H])([H])* 0.000 claims description 3
- 230000000415 inactivating effect Effects 0.000 claims description 3
- 239000008363 phosphate buffer Substances 0.000 claims description 3
- 238000001556 precipitation Methods 0.000 claims description 3
- 229960004641 rituximab Drugs 0.000 claims description 3
- 229950008684 sibrotuzumab Drugs 0.000 claims description 3
- 238000001179 sorption measurement Methods 0.000 claims description 3
- QPPUSXURIGJCFQ-UHFFFAOYSA-N 2-[(2-iodoacetyl)amino]propanoic acid Chemical compound OC(=O)C(C)NC(=O)CI QPPUSXURIGJCFQ-UHFFFAOYSA-N 0.000 claims description 2
- 239000007995 HEPES buffer Substances 0.000 claims description 2
- 239000007996 HEPPS buffer Substances 0.000 claims description 2
- GIZQLVPDAOBAFN-UHFFFAOYSA-N HEPPSO Chemical compound OCCN1CCN(CC(O)CS(O)(=O)=O)CC1 GIZQLVPDAOBAFN-UHFFFAOYSA-N 0.000 claims description 2
- GHAZCVNUKKZTLG-UHFFFAOYSA-N N-ethyl-succinimide Natural products CCN1C(=O)CCC1=O GHAZCVNUKKZTLG-UHFFFAOYSA-N 0.000 claims description 2
- HDFGOPSGAURCEO-UHFFFAOYSA-N N-ethylmaleimide Chemical compound CCN1C(=O)C=CC1=O HDFGOPSGAURCEO-UHFFFAOYSA-N 0.000 claims description 2
- 239000008351 acetate buffer Substances 0.000 claims description 2
- 239000007979 citrate buffer Substances 0.000 claims description 2
- 125000005179 haloacetyl group Chemical group 0.000 claims description 2
- PGLTVOMIXTUURA-UHFFFAOYSA-N iodoacetamide Chemical compound NC(=O)CI PGLTVOMIXTUURA-UHFFFAOYSA-N 0.000 claims description 2
- 230000000717 retained effect Effects 0.000 claims description 2
- YCLWMUYXEGEIGD-UHFFFAOYSA-M sodium;2-hydroxy-3-[4-(2-hydroxyethyl)piperazin-1-yl]propane-1-sulfonate Chemical compound [Na+].OCCN1CCN(CC(O)CS([O-])(=O)=O)CC1 YCLWMUYXEGEIGD-UHFFFAOYSA-M 0.000 claims description 2
- 239000008362 succinate buffer Substances 0.000 claims description 2
- 101000945318 Homo sapiens Calponin-1 Proteins 0.000 claims 1
- 101000652736 Homo sapiens Transgelin Proteins 0.000 claims 1
- 101100369076 Mus musculus Tdgf1 gene Proteins 0.000 claims 1
- 102100031013 Transgelin Human genes 0.000 claims 1
- 239000007983 Tris buffer Substances 0.000 claims 1
- JJAHTWIKCUJRDK-UHFFFAOYSA-N succinimidyl 4-(N-maleimidomethyl)cyclohexane-1-carboxylate Chemical compound C1CC(CN2C(C=CC2=O)=O)CCC1C(=O)ON1C(=O)CCC1=O JJAHTWIKCUJRDK-UHFFFAOYSA-N 0.000 claims 1
- 238000004132 cross linking Methods 0.000 abstract description 2
- 210000004027 cell Anatomy 0.000 description 175
- 229940127089 cytotoxic agent Drugs 0.000 description 161
- 239000002254 cytotoxic agent Substances 0.000 description 161
- 231100000599 cytotoxic agent Toxicity 0.000 description 161
- 125000005647 linker group Chemical group 0.000 description 41
- 125000004432 carbon atom Chemical group C* 0.000 description 39
- 239000000427 antigen Substances 0.000 description 36
- 108091007433 antigens Proteins 0.000 description 36
- 102000036639 antigens Human genes 0.000 description 36
- 239000011347 resin Substances 0.000 description 34
- 229920005989 resin Polymers 0.000 description 34
- 125000003342 alkenyl group Chemical group 0.000 description 30
- 230000014759 maintenance of location Effects 0.000 description 24
- 125000000217 alkyl group Chemical group 0.000 description 23
- 238000000746 purification Methods 0.000 description 23
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 description 22
- FXHOOIRPVKKKFG-UHFFFAOYSA-N N,N-Dimethylacetamide Chemical compound CN(C)C(C)=O FXHOOIRPVKKKFG-UHFFFAOYSA-N 0.000 description 19
- 230000027455 binding Effects 0.000 description 19
- 125000006615 aromatic heterocyclic group Chemical group 0.000 description 18
- 239000012634 fragment Substances 0.000 description 17
- 241000894007 species Species 0.000 description 16
- 206010028980 Neoplasm Diseases 0.000 description 15
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 12
- 229920005654 Sephadex Polymers 0.000 description 11
- 239000012507 Sephadex™ Substances 0.000 description 11
- 239000000178 monomer Substances 0.000 description 11
- 150000001875 compounds Chemical class 0.000 description 10
- QWPXBEHQFHACTK-KZVYIGENSA-N (10e,12e)-86-chloro-12,14,4-trihydroxy-85,14-dimethoxy-33,2,7,10-tetramethyl-15,16-dihydro-14h-7-aza-1(6,4)-oxazina-3(2,3)-oxirana-8(1,3)-benzenacyclotetradecaphane-10,12-dien-6-one Chemical compound CN1C(=O)CC(O)C2(C)OC2C(C)C(OC(=O)N2)CC2(O)C(OC)\C=C\C=C(C)\CC2=CC(OC)=C(Cl)C1=C2 QWPXBEHQFHACTK-KZVYIGENSA-N 0.000 description 9
- 201000011510 cancer Diseases 0.000 description 9
- ANZJBCHSOXCCRQ-FKUXLPTCSA-N mertansine Chemical compound CO[C@@H]([C@@]1(O)C[C@H](OC(=O)N1)[C@@H](C)[C@@H]1O[C@@]1(C)[C@@H](OC(=O)[C@H](C)N(C)C(=O)CCS)CC(=O)N1C)\C=C\C=C(C)\CC2=CC(OC)=C(Cl)C1=C2 ANZJBCHSOXCCRQ-FKUXLPTCSA-N 0.000 description 9
- 229960005558 mertansine Drugs 0.000 description 9
- 108010021625 Immunoglobulin Fragments Proteins 0.000 description 8
- 102000008394 Immunoglobulin Fragments Human genes 0.000 description 8
- 239000003795 chemical substances by application Substances 0.000 description 8
- 210000004408 hybridoma Anatomy 0.000 description 8
- 239000011541 reaction mixture Substances 0.000 description 8
- 230000002829 reductive effect Effects 0.000 description 8
- 150000003573 thiols Chemical class 0.000 description 8
- 229920002684 Sepharose Polymers 0.000 description 7
- 229940074404 sodium succinate Drugs 0.000 description 7
- ZDQYSKICYIVCPN-UHFFFAOYSA-L sodium succinate (anhydrous) Chemical compound [Na+].[Na+].[O-]C(=O)CCC([O-])=O ZDQYSKICYIVCPN-UHFFFAOYSA-L 0.000 description 7
- 125000003107 substituted aryl group Chemical group 0.000 description 7
- 108010047041 Complementarity Determining Regions Proteins 0.000 description 6
- 108060003951 Immunoglobulin Proteins 0.000 description 6
- 210000003719 b-lymphocyte Anatomy 0.000 description 6
- 239000000872 buffer Substances 0.000 description 6
- 229910052799 carbon Inorganic materials 0.000 description 6
- 238000005516 engineering process Methods 0.000 description 6
- 102000018358 immunoglobulin Human genes 0.000 description 6
- NOESYZHRGYRDHS-UHFFFAOYSA-N insulin Chemical compound N1C(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(NC(=O)CN)C(C)CC)CSSCC(C(NC(CO)C(=O)NC(CC(C)C)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CCC(N)=O)C(=O)NC(CC(C)C)C(=O)NC(CCC(O)=O)C(=O)NC(CC(N)=O)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CSSCC(NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2C=CC(O)=CC=2)NC(=O)C(CC(C)C)NC(=O)C(C)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2NC=NC=2)NC(=O)C(CO)NC(=O)CNC2=O)C(=O)NCC(=O)NC(CCC(O)=O)C(=O)NC(CCCNC(N)=N)C(=O)NCC(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC(O)=CC=3)C(=O)NC(C(C)O)C(=O)N3C(CCC3)C(=O)NC(CCCCN)C(=O)NC(C)C(O)=O)C(=O)NC(CC(N)=O)C(O)=O)=O)NC(=O)C(C(C)CC)NC(=O)C(CO)NC(=O)C(C(C)O)NC(=O)C1CSSCC2NC(=O)C(CC(C)C)NC(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CC(N)=O)NC(=O)C(NC(=O)C(N)CC=1C=CC=CC=1)C(C)C)CC1=CN=CN1 NOESYZHRGYRDHS-UHFFFAOYSA-N 0.000 description 6
- 102000004169 proteins and genes Human genes 0.000 description 6
- 108090000623 proteins and genes Proteins 0.000 description 6
- QWPXBEHQFHACTK-UHFFFAOYSA-N Maytansinol Natural products CN1C(=O)CC(O)C2(C)OC2C(C)C(OC(=O)N2)CC2(O)C(OC)C=CC=C(C)CC2=CC(OC)=C(Cl)C1=C2 QWPXBEHQFHACTK-UHFFFAOYSA-N 0.000 description 5
- 241001529936 Murinae Species 0.000 description 5
- 238000003776 cleavage reaction Methods 0.000 description 5
- 230000021615 conjugation Effects 0.000 description 5
- 230000004048 modification Effects 0.000 description 5
- 238000012986 modification Methods 0.000 description 5
- 229940126619 mouse monoclonal antibody Drugs 0.000 description 5
- 108090000765 processed proteins & peptides Proteins 0.000 description 5
- 102000005962 receptors Human genes 0.000 description 5
- 108020003175 receptors Proteins 0.000 description 5
- 230000007017 scission Effects 0.000 description 5
- 238000003860 storage Methods 0.000 description 5
- 229910052717 sulfur Inorganic materials 0.000 description 5
- 102100031585 ADP-ribosyl cyclase/cyclic ADP-ribose hydrolase 1 Human genes 0.000 description 4
- 102400001368 Epidermal growth factor Human genes 0.000 description 4
- 101800003838 Epidermal growth factor Proteins 0.000 description 4
- 101000777636 Homo sapiens ADP-ribosyl cyclase/cyclic ADP-ribose hydrolase 1 Proteins 0.000 description 4
- 102100036981 Interferon regulatory factor 1 Human genes 0.000 description 4
- 241001465754 Metazoa Species 0.000 description 4
- 241000699670 Mus sp. Species 0.000 description 4
- 102100029268 Neurotrophin-3 Human genes 0.000 description 4
- 102000035195 Peptidases Human genes 0.000 description 4
- 108091005804 Peptidases Proteins 0.000 description 4
- 125000003118 aryl group Chemical group 0.000 description 4
- 125000002228 disulfide group Chemical group 0.000 description 4
- 229940116977 epidermal growth factor Drugs 0.000 description 4
- 229910052739 hydrogen Inorganic materials 0.000 description 4
- 229910052588 hydroxylapatite Inorganic materials 0.000 description 4
- 230000006872 improvement Effects 0.000 description 4
- SVVGCFZPFZGWRG-OTKBOCOUSA-N maytansinoid dm4 Chemical compound CO[C@@H]([C@@]1(O)C[C@H](OC(=O)N1)C(C)(C)[C@@H]1O[C@@]1(C)[C@@H](OC(=O)[C@H](C)N(C)C(=O)CCC(C)(C)S)CC(=O)N1C)\C=C\C=C(C)\CC2=CC(OC)=C(Cl)C1=C2 SVVGCFZPFZGWRG-OTKBOCOUSA-N 0.000 description 4
- 238000006011 modification reaction Methods 0.000 description 4
- XYJRXVWERLGGKC-UHFFFAOYSA-D pentacalcium;hydroxide;triphosphate Chemical compound [OH-].[Ca+2].[Ca+2].[Ca+2].[Ca+2].[Ca+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O XYJRXVWERLGGKC-UHFFFAOYSA-D 0.000 description 4
- 235000019833 protease Nutrition 0.000 description 4
- VBEQCZHXXJYVRD-GACYYNSASA-N uroanthelone Chemical compound C([C@@H](C(=O)N[C@H](C(=O)N[C@@H](CS)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CS)C(=O)N[C@H](C(=O)N[C@@H]([C@@H](C)CC)C(=O)NCC(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)N[C@@H](CO)C(=O)NCC(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CS)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(O)=O)C(C)C)[C@@H](C)O)NC(=O)[C@H](CO)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CO)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@@H](NC(=O)[C@H](CC=1NC=NC=1)NC(=O)[C@H](CCSC)NC(=O)[C@H](CS)NC(=O)[C@@H](NC(=O)CNC(=O)CNC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CS)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)CNC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CO)NC(=O)[C@H](CO)NC(=O)[C@H]1N(CCC1)C(=O)[C@H](CS)NC(=O)CNC(=O)[C@H]1N(CCC1)C(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CO)NC(=O)[C@@H](N)CC(N)=O)C(C)C)[C@@H](C)CC)C1=CC=C(O)C=C1 VBEQCZHXXJYVRD-GACYYNSASA-N 0.000 description 4
- JSHOVKSMJRQOGY-UHFFFAOYSA-N (2,5-dioxopyrrolidin-1-yl) 4-(pyridin-2-yldisulfanyl)butanoate Chemical compound O=C1CCC(=O)N1OC(=O)CCCSSC1=CC=CC=N1 JSHOVKSMJRQOGY-UHFFFAOYSA-N 0.000 description 3
- 208000031261 Acute myeloid leukaemia Diseases 0.000 description 3
- 102100024222 B-lymphocyte antigen CD19 Human genes 0.000 description 3
- 102100021935 C-C motif chemokine 26 Human genes 0.000 description 3
- 102100035361 Cerebellar degeneration-related protein 2 Human genes 0.000 description 3
- BWGNESOTFCXPMA-UHFFFAOYSA-N Dihydrogen disulfide Chemical compound SS BWGNESOTFCXPMA-UHFFFAOYSA-N 0.000 description 3
- 238000002965 ELISA Methods 0.000 description 3
- 102100037241 Endoglin Human genes 0.000 description 3
- 101000980825 Homo sapiens B-lymphocyte antigen CD19 Proteins 0.000 description 3
- 101000897493 Homo sapiens C-C motif chemokine 26 Proteins 0.000 description 3
- 101000737796 Homo sapiens Cerebellar degeneration-related protein 2 Proteins 0.000 description 3
- 101001023230 Homo sapiens Folate receptor alpha Proteins 0.000 description 3
- 101000934338 Homo sapiens Myeloid cell surface antigen CD33 Proteins 0.000 description 3
- 101001136592 Homo sapiens Prostate stem cell antigen Proteins 0.000 description 3
- 101000834948 Homo sapiens Tomoregulin-2 Proteins 0.000 description 3
- 102000004877 Insulin Human genes 0.000 description 3
- 108090001061 Insulin Proteins 0.000 description 3
- 108090000723 Insulin-Like Growth Factor I Proteins 0.000 description 3
- 241000699666 Mus <mouse, genus> Species 0.000 description 3
- 208000033776 Myeloid Acute Leukemia Diseases 0.000 description 3
- 102100025243 Myeloid cell surface antigen CD33 Human genes 0.000 description 3
- 108010025020 Nerve Growth Factor Proteins 0.000 description 3
- 108090000099 Neurotrophin-4 Proteins 0.000 description 3
- 102100033857 Neurotrophin-4 Human genes 0.000 description 3
- 239000002202 Polyethylene glycol Substances 0.000 description 3
- 102100036735 Prostate stem cell antigen Human genes 0.000 description 3
- 208000000236 Prostatic Neoplasms Diseases 0.000 description 3
- 108020004511 Recombinant DNA Proteins 0.000 description 3
- 241000187747 Streptomyces Species 0.000 description 3
- 239000012505 Superdex™ Substances 0.000 description 3
- 102100026160 Tomoregulin-2 Human genes 0.000 description 3
- 108010073929 Vascular Endothelial Growth Factor A Proteins 0.000 description 3
- 102000005789 Vascular Endothelial Growth Factors Human genes 0.000 description 3
- 108010019530 Vascular Endothelial Growth Factors Proteins 0.000 description 3
- 238000002835 absorbance Methods 0.000 description 3
- 125000002252 acyl group Chemical group 0.000 description 3
- DGBBXVWXOHSLTG-UMDRASRXSA-N ansamitocin p 2 Chemical compound C([C@@H]([C@@]1(O[C@H]1[C@@H]1C)C)OC(=O)CC)C(=O)N(C)C(C(=C(OC)C=2)Cl)=CC=2C\C(C)=C\C=C\[C@@H](OC)[C@]2(O)NC(=O)O[C@H]1C2 DGBBXVWXOHSLTG-UMDRASRXSA-N 0.000 description 3
- 125000003636 chemical group Chemical group 0.000 description 3
- 238000004587 chromatography analysis Methods 0.000 description 3
- 239000011248 coating agent Substances 0.000 description 3
- 238000000576 coating method Methods 0.000 description 3
- 125000000392 cycloalkenyl group Chemical group 0.000 description 3
- 125000000753 cycloalkyl group Chemical group 0.000 description 3
- 201000010099 disease Diseases 0.000 description 3
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 3
- 239000003814 drug Substances 0.000 description 3
- 238000001962 electrophoresis Methods 0.000 description 3
- 102000006815 folate receptor Human genes 0.000 description 3
- 108020005243 folate receptor Proteins 0.000 description 3
- OVBPIULPVIDEAO-LBPRGKRZSA-N folic acid Chemical compound C=1N=C2NC(N)=NC(=O)C2=NC=1CNC1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 OVBPIULPVIDEAO-LBPRGKRZSA-N 0.000 description 3
- 230000014509 gene expression Effects 0.000 description 3
- 238000004191 hydrophobic interaction chromatography Methods 0.000 description 3
- 125000004356 hydroxy functional group Chemical group O* 0.000 description 3
- 229940125396 insulin Drugs 0.000 description 3
- 102000006495 integrins Human genes 0.000 description 3
- 108010044426 integrins Proteins 0.000 description 3
- 239000003446 ligand Substances 0.000 description 3
- 208000020816 lung neoplasm Diseases 0.000 description 3
- 238000004949 mass spectrometry Methods 0.000 description 3
- 239000012038 nucleophile Substances 0.000 description 3
- 102000004196 processed proteins & peptides Human genes 0.000 description 3
- 238000003127 radioimmunoassay Methods 0.000 description 3
- 230000009467 reduction Effects 0.000 description 3
- 238000002415 sodium dodecyl sulfate polyacrylamide gel electrophoresis Methods 0.000 description 3
- 125000001424 substituent group Chemical group 0.000 description 3
- 125000004434 sulfur atom Chemical group 0.000 description 3
- NKUZQMZWTZAPSN-UHFFFAOYSA-N (2,5-dioxopyrrolidin-1-yl) 2-bromoacetate Chemical compound BrCC(=O)ON1C(=O)CCC1=O NKUZQMZWTZAPSN-UHFFFAOYSA-N 0.000 description 2
- VRDGQQTWSGDXCU-UHFFFAOYSA-N (2,5-dioxopyrrolidin-1-yl) 2-iodoacetate Chemical compound ICC(=O)ON1C(=O)CCC1=O VRDGQQTWSGDXCU-UHFFFAOYSA-N 0.000 description 2
- LLXVXPPXELIDGQ-UHFFFAOYSA-N (2,5-dioxopyrrolidin-1-yl) 3-(2,5-dioxopyrrol-1-yl)benzoate Chemical compound C=1C=CC(N2C(C=CC2=O)=O)=CC=1C(=O)ON1C(=O)CCC1=O LLXVXPPXELIDGQ-UHFFFAOYSA-N 0.000 description 2
- RVRLFABOQXZUJX-UHFFFAOYSA-N 1-[1-(2,5-dioxopyrrol-1-yl)ethyl]pyrrole-2,5-dione Chemical compound O=C1C=CC(=O)N1C(C)N1C(=O)C=CC1=O RVRLFABOQXZUJX-UHFFFAOYSA-N 0.000 description 2
- AASYSXRGODIQGY-UHFFFAOYSA-N 1-[1-(2,5-dioxopyrrol-1-yl)hexyl]pyrrole-2,5-dione Chemical compound O=C1C=CC(=O)N1C(CCCCC)N1C(=O)C=CC1=O AASYSXRGODIQGY-UHFFFAOYSA-N 0.000 description 2
- SGVWDRVQIYUSRA-UHFFFAOYSA-N 1-[2-[2-(2,5-dioxopyrrol-1-yl)ethyldisulfanyl]ethyl]pyrrole-2,5-dione Chemical compound O=C1C=CC(=O)N1CCSSCCN1C(=O)C=CC1=O SGVWDRVQIYUSRA-UHFFFAOYSA-N 0.000 description 2
- VHYRLCJMMJQUBY-UHFFFAOYSA-N 1-[4-[4-(2,5-dioxopyrrol-1-yl)phenyl]butanoyloxy]-2,5-dioxopyrrolidine-3-sulfonic acid Chemical compound O=C1C(S(=O)(=O)O)CC(=O)N1OC(=O)CCCC1=CC=C(N2C(C=CC2=O)=O)C=C1 VHYRLCJMMJQUBY-UHFFFAOYSA-N 0.000 description 2
- ZMRMMAOBSFSXLN-UHFFFAOYSA-N 4-[4-(2,5-dioxopyrrol-1-yl)phenyl]butanehydrazide Chemical compound C1=CC(CCCC(=O)NN)=CC=C1N1C(=O)C=CC1=O ZMRMMAOBSFSXLN-UHFFFAOYSA-N 0.000 description 2
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 description 2
- 208000024893 Acute lymphoblastic leukemia Diseases 0.000 description 2
- 208000014697 Acute lymphocytic leukaemia Diseases 0.000 description 2
- 108010088751 Albumins Proteins 0.000 description 2
- 102000009027 Albumins Human genes 0.000 description 2
- 102100036526 Anoctamin-7 Human genes 0.000 description 2
- 102100022005 B-lymphocyte antigen CD20 Human genes 0.000 description 2
- 102000007350 Bone Morphogenetic Proteins Human genes 0.000 description 2
- 108010007726 Bone Morphogenetic Proteins Proteins 0.000 description 2
- 102100025221 CD70 antigen Human genes 0.000 description 2
- 102100039498 Cytotoxic T-lymphocyte protein 4 Human genes 0.000 description 2
- 108010036395 Endoglin Proteins 0.000 description 2
- 108010055196 EphA2 Receptor Proteins 0.000 description 2
- 102100030340 Ephrin type-A receptor 2 Human genes 0.000 description 2
- 108090000371 Esterases Proteins 0.000 description 2
- 102100041003 Glutamate carboxypeptidase 2 Human genes 0.000 description 2
- 108010017213 Granulocyte-Macrophage Colony-Stimulating Factor Proteins 0.000 description 2
- 102100039620 Granulocyte-macrophage colony-stimulating factor Human genes 0.000 description 2
- 108010051696 Growth Hormone Proteins 0.000 description 2
- 241000282412 Homo Species 0.000 description 2
- 101000928370 Homo sapiens Anoctamin-7 Proteins 0.000 description 2
- 101000897405 Homo sapiens B-lymphocyte antigen CD20 Proteins 0.000 description 2
- 101000892862 Homo sapiens Glutamate carboxypeptidase 2 Proteins 0.000 description 2
- 101000628547 Homo sapiens Metalloreductase STEAP1 Proteins 0.000 description 2
- 101000581981 Homo sapiens Neural cell adhesion molecule 1 Proteins 0.000 description 2
- 101000721757 Homo sapiens Olfactory receptor 51E2 Proteins 0.000 description 2
- 101000874179 Homo sapiens Syndecan-1 Proteins 0.000 description 2
- 108010054477 Immunoglobulin Fab Fragments Proteins 0.000 description 2
- 102000001706 Immunoglobulin Fab Fragments Human genes 0.000 description 2
- 102000004218 Insulin-Like Growth Factor I Human genes 0.000 description 2
- 108010063738 Interleukins Proteins 0.000 description 2
- 102000015696 Interleukins Human genes 0.000 description 2
- 108090001090 Lectins Proteins 0.000 description 2
- 102000004856 Lectins Human genes 0.000 description 2
- 206010058467 Lung neoplasm malignant Diseases 0.000 description 2
- OFOBLEOULBTSOW-UHFFFAOYSA-N Malonic acid Chemical compound OC(=O)CC(O)=O OFOBLEOULBTSOW-UHFFFAOYSA-N 0.000 description 2
- 102100026712 Metalloreductase STEAP1 Human genes 0.000 description 2
- JOCBASBOOFNAJA-UHFFFAOYSA-N N-tris(hydroxymethyl)methyl-2-aminoethanesulfonic acid Chemical compound OCC(CO)(CO)NCCS(O)(=O)=O JOCBASBOOFNAJA-UHFFFAOYSA-N 0.000 description 2
- 102100027347 Neural cell adhesion molecule 1 Human genes 0.000 description 2
- 108090000742 Neurotrophin 3 Proteins 0.000 description 2
- 102100025128 Olfactory receptor 51E2 Human genes 0.000 description 2
- 206010061535 Ovarian neoplasm Diseases 0.000 description 2
- 206010035226 Plasma cell myeloma Diseases 0.000 description 2
- 108010038512 Platelet-Derived Growth Factor Proteins 0.000 description 2
- 102000010780 Platelet-Derived Growth Factor Human genes 0.000 description 2
- 208000006664 Precursor Cell Lymphoblastic Leukemia-Lymphoma Diseases 0.000 description 2
- 206010060862 Prostate cancer Diseases 0.000 description 2
- 102000003743 Relaxin Human genes 0.000 description 2
- 108090000103 Relaxin Proteins 0.000 description 2
- 102100038803 Somatotropin Human genes 0.000 description 2
- 102100035721 Syndecan-1 Human genes 0.000 description 2
- 210000001744 T-lymphocyte Anatomy 0.000 description 2
- 108010000499 Thromboplastin Proteins 0.000 description 2
- 102100030859 Tissue factor Human genes 0.000 description 2
- 102100033571 Tissue-type plasminogen activator Human genes 0.000 description 2
- 108010009583 Transforming Growth Factors Proteins 0.000 description 2
- 102000009618 Transforming Growth Factors Human genes 0.000 description 2
- 230000002378 acidificating effect Effects 0.000 description 2
- 238000001042 affinity chromatography Methods 0.000 description 2
- 150000001413 amino acids Chemical group 0.000 description 2
- 230000008901 benefit Effects 0.000 description 2
- 229940112869 bone morphogenetic protein Drugs 0.000 description 2
- 239000000919 ceramic Substances 0.000 description 2
- 125000004122 cyclic group Chemical group 0.000 description 2
- 231100000433 cytotoxic Toxicity 0.000 description 2
- 230000001472 cytotoxic effect Effects 0.000 description 2
- 238000011026 diafiltration Methods 0.000 description 2
- 238000009826 distribution Methods 0.000 description 2
- 229940079593 drug Drugs 0.000 description 2
- 230000008030 elimination Effects 0.000 description 2
- 238000003379 elimination reaction Methods 0.000 description 2
- 238000002474 experimental method Methods 0.000 description 2
- 235000019152 folic acid Nutrition 0.000 description 2
- 239000011724 folic acid Substances 0.000 description 2
- 238000013467 fragmentation Methods 0.000 description 2
- 238000006062 fragmentation reaction Methods 0.000 description 2
- 239000003102 growth factor Substances 0.000 description 2
- 239000000122 growth hormone Substances 0.000 description 2
- 238000004128 high performance liquid chromatography Methods 0.000 description 2
- 229940088597 hormone Drugs 0.000 description 2
- 239000005556 hormone Substances 0.000 description 2
- 102000053180 human FOLR1 Human genes 0.000 description 2
- 229940072221 immunoglobulins Drugs 0.000 description 2
- 238000000338 in vitro Methods 0.000 description 2
- 229940047122 interleukins Drugs 0.000 description 2
- 238000004255 ion exchange chromatography Methods 0.000 description 2
- 239000002523 lectin Substances 0.000 description 2
- 201000005202 lung cancer Diseases 0.000 description 2
- 201000001441 melanoma Diseases 0.000 description 2
- 239000012528 membrane Substances 0.000 description 2
- 201000000050 myeloid neoplasm Diseases 0.000 description 2
- 230000000955 neuroendocrine Effects 0.000 description 2
- 239000003900 neurotrophic factor Substances 0.000 description 2
- 238000005580 one pot reaction Methods 0.000 description 2
- 238000002823 phage display Methods 0.000 description 2
- 239000000049 pigment Substances 0.000 description 2
- 229920001481 poly(stearyl methacrylate) Polymers 0.000 description 2
- 229920001223 polyethylene glycol Polymers 0.000 description 2
- 229920001184 polypeptide Polymers 0.000 description 2
- 230000002265 prevention Effects 0.000 description 2
- 238000012545 processing Methods 0.000 description 2
- 239000000047 product Substances 0.000 description 2
- 230000001105 regulatory effect Effects 0.000 description 2
- 210000002966 serum Anatomy 0.000 description 2
- 238000003998 size exclusion chromatography high performance liquid chromatography Methods 0.000 description 2
- 239000002904 solvent Substances 0.000 description 2
- 229960002317 succinimide Drugs 0.000 description 2
- XOAAWQZATWQOTB-UHFFFAOYSA-N taurine Chemical compound NCCS(O)(=O)=O XOAAWQZATWQOTB-UHFFFAOYSA-N 0.000 description 2
- 230000001225 therapeutic effect Effects 0.000 description 2
- 125000003396 thiol group Chemical group [H]S* 0.000 description 2
- 210000004881 tumor cell Anatomy 0.000 description 2
- 238000000870 ultraviolet spectroscopy Methods 0.000 description 2
- 238000001262 western blot Methods 0.000 description 2
- TYKASZBHFXBROF-UHFFFAOYSA-N (2,5-dioxopyrrolidin-1-yl) 2-(2,5-dioxopyrrol-1-yl)acetate Chemical compound O=C1CCC(=O)N1OC(=O)CN1C(=O)C=CC1=O TYKASZBHFXBROF-UHFFFAOYSA-N 0.000 description 1
- JKHVDAUOODACDU-UHFFFAOYSA-N (2,5-dioxopyrrolidin-1-yl) 3-(2,5-dioxopyrrol-1-yl)propanoate Chemical compound O=C1CCC(=O)N1OC(=O)CCN1C(=O)C=CC1=O JKHVDAUOODACDU-UHFFFAOYSA-N 0.000 description 1
- PVGATNRYUYNBHO-UHFFFAOYSA-N (2,5-dioxopyrrolidin-1-yl) 4-(2,5-dioxopyrrol-1-yl)butanoate Chemical compound O=C1CCC(=O)N1OC(=O)CCCN1C(=O)C=CC1=O PVGATNRYUYNBHO-UHFFFAOYSA-N 0.000 description 1
- PMJWDPGOWBRILU-UHFFFAOYSA-N (2,5-dioxopyrrolidin-1-yl) 4-[4-(2,5-dioxopyrrol-1-yl)phenyl]butanoate Chemical compound O=C1CCC(=O)N1OC(=O)CCCC(C=C1)=CC=C1N1C(=O)C=CC1=O PMJWDPGOWBRILU-UHFFFAOYSA-N 0.000 description 1
- ULZJAHZPCLFGHQ-UHFFFAOYSA-N (2,5-dioxopyrrolidin-1-yl) 5-(2,5-dioxopyrrol-1-yl)pentanoate Chemical compound O=C1CCC(=O)N1OC(=O)CCCCN1C(=O)C=CC1=O ULZJAHZPCLFGHQ-UHFFFAOYSA-N 0.000 description 1
- VLARLSIGSPVYHX-UHFFFAOYSA-N (2,5-dioxopyrrolidin-1-yl) 6-(2,5-dioxopyrrol-1-yl)hexanoate Chemical compound O=C1CCC(=O)N1OC(=O)CCCCCN1C(=O)C=CC1=O VLARLSIGSPVYHX-UHFFFAOYSA-N 0.000 description 1
- AASBXERNXVFUEJ-UHFFFAOYSA-N (2,5-dioxopyrrolidin-1-yl) propanoate Chemical compound CCC(=O)ON1C(=O)CCC1=O AASBXERNXVFUEJ-UHFFFAOYSA-N 0.000 description 1
- OJQSISYVGFJJBY-UHFFFAOYSA-N 1-(4-isocyanatophenyl)pyrrole-2,5-dione Chemical compound C1=CC(N=C=O)=CC=C1N1C(=O)C=CC1=O OJQSISYVGFJJBY-UHFFFAOYSA-N 0.000 description 1
- VNJBTKQBKFMEHH-UHFFFAOYSA-N 1-[4-(2,5-dioxopyrrol-1-yl)-2,3-dihydroxybutyl]pyrrole-2,5-dione Chemical compound O=C1C=CC(=O)N1CC(O)C(O)CN1C(=O)C=CC1=O VNJBTKQBKFMEHH-UHFFFAOYSA-N 0.000 description 1
- WXXSHAKLDCERGU-UHFFFAOYSA-N 1-[4-(2,5-dioxopyrrol-1-yl)butyl]pyrrole-2,5-dione Chemical compound O=C1C=CC(=O)N1CCCCN1C(=O)C=CC1=O WXXSHAKLDCERGU-UHFFFAOYSA-N 0.000 description 1
- BLSAPDZWVFWUTL-UHFFFAOYSA-N 2,5-dioxopyrrolidine-3-sulfonic acid Chemical compound OS(=O)(=O)C1CC(=O)NC1=O BLSAPDZWVFWUTL-UHFFFAOYSA-N 0.000 description 1
- OWDQCSBZQVISPN-UHFFFAOYSA-N 2-[(2,5-dioxopyrrolidin-1-yl)amino]-4-(2-iodoacetyl)benzoic acid Chemical compound OC(=O)C1=CC=C(C(=O)CI)C=C1NN1C(=O)CCC1=O OWDQCSBZQVISPN-UHFFFAOYSA-N 0.000 description 1
- GUPXYSSGJWIURR-UHFFFAOYSA-N 3-octoxypropane-1,2-diol Chemical compound CCCCCCCCOCC(O)CO GUPXYSSGJWIURR-UHFFFAOYSA-N 0.000 description 1
- QXZBMSIDSOZZHK-DOPDSADYSA-N 31362-50-2 Chemical compound C([C@@H](C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCSC)C(N)=O)NC(=O)CNC(=O)[C@@H](NC(=O)[C@H](C)NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@H](CC(N)=O)NC(=O)CNC(=O)[C@H](CC(C)C)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@H]1NC(=O)CC1)C(C)C)C1=CNC=N1 QXZBMSIDSOZZHK-DOPDSADYSA-N 0.000 description 1
- ALYNCZNDIQEVRV-UHFFFAOYSA-N 4-aminobenzoic acid Chemical compound NC1=CC=C(C(O)=O)C=C1 ALYNCZNDIQEVRV-UHFFFAOYSA-N 0.000 description 1
- 241000186046 Actinomyces Species 0.000 description 1
- 108010059616 Activins Proteins 0.000 description 1
- 102000005606 Activins Human genes 0.000 description 1
- DGBBXVWXOHSLTG-UHFFFAOYSA-N Ansamitocin P2 Natural products CC1C2OC2(C)C(OC(=O)CC)CC(=O)N(C)C(C(=C(OC)C=2)Cl)=CC=2CC(C)=CC=CC(OC)C2(O)NC(=O)OC1C2 DGBBXVWXOHSLTG-UHFFFAOYSA-N 0.000 description 1
- 108010083359 Antigen Receptors Proteins 0.000 description 1
- 102000006306 Antigen Receptors Human genes 0.000 description 1
- 101800001288 Atrial natriuretic factor Proteins 0.000 description 1
- 102400001282 Atrial natriuretic peptide Human genes 0.000 description 1
- 101800001890 Atrial natriuretic peptide Proteins 0.000 description 1
- 208000010839 B-cell chronic lymphocytic leukemia Diseases 0.000 description 1
- 102100038080 B-cell receptor CD22 Human genes 0.000 description 1
- 102000015081 Blood Coagulation Factors Human genes 0.000 description 1
- 108010039209 Blood Coagulation Factors Proteins 0.000 description 1
- 102000013585 Bombesin Human genes 0.000 description 1
- 108010051479 Bombesin Proteins 0.000 description 1
- 108090000715 Brain-derived neurotrophic factor Proteins 0.000 description 1
- 102000004219 Brain-derived neurotrophic factor Human genes 0.000 description 1
- 206010006187 Breast cancer Diseases 0.000 description 1
- 208000026310 Breast neoplasm Diseases 0.000 description 1
- 239000012619 Butyl Sepharose® Substances 0.000 description 1
- 102100031092 C-C motif chemokine 3 Human genes 0.000 description 1
- 101710155856 C-C motif chemokine 3 Proteins 0.000 description 1
- 102100024217 CAMPATH-1 antigen Human genes 0.000 description 1
- 108010046080 CD27 Ligand Proteins 0.000 description 1
- 102000049320 CD36 Human genes 0.000 description 1
- 108010045374 CD36 Antigens Proteins 0.000 description 1
- 101150013553 CD40 gene Proteins 0.000 description 1
- 102100032912 CD44 antigen Human genes 0.000 description 1
- 108010065524 CD52 Antigen Proteins 0.000 description 1
- 102100022002 CD59 glycoprotein Human genes 0.000 description 1
- 102100027221 CD81 antigen Human genes 0.000 description 1
- 108010021064 CTLA-4 Antigen Proteins 0.000 description 1
- 229940045513 CTLA4 antagonist Drugs 0.000 description 1
- 102000055006 Calcitonin Human genes 0.000 description 1
- 108060001064 Calcitonin Proteins 0.000 description 1
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 1
- 102000000844 Cell Surface Receptors Human genes 0.000 description 1
- 108010001857 Cell Surface Receptors Proteins 0.000 description 1
- 241000251730 Chondrichthyes Species 0.000 description 1
- 102100022641 Coagulation factor IX Human genes 0.000 description 1
- 206010009944 Colon cancer Diseases 0.000 description 1
- 208000001333 Colorectal Neoplasms Diseases 0.000 description 1
- 102100025680 Complement decay-accelerating factor Human genes 0.000 description 1
- 102100032768 Complement receptor type 2 Human genes 0.000 description 1
- 108020004414 DNA Proteins 0.000 description 1
- 108010053770 Deoxyribonucleases Proteins 0.000 description 1
- 102000016911 Deoxyribonucleases Human genes 0.000 description 1
- 108090000204 Dipeptidase 1 Proteins 0.000 description 1
- 102100025012 Dipeptidyl peptidase 4 Human genes 0.000 description 1
- 101100421450 Drosophila melanogaster Shark gene Proteins 0.000 description 1
- 101150029707 ERBB2 gene Proteins 0.000 description 1
- 102000050554 Eph Family Receptors Human genes 0.000 description 1
- 108091008815 Eph receptors Proteins 0.000 description 1
- 102000018651 Epithelial Cell Adhesion Molecule Human genes 0.000 description 1
- 108010066687 Epithelial Cell Adhesion Molecule Proteins 0.000 description 1
- 102000003951 Erythropoietin Human genes 0.000 description 1
- 108090000394 Erythropoietin Proteins 0.000 description 1
- 108010076282 Factor IX Proteins 0.000 description 1
- 102100031517 Fc receptor-like protein 1 Human genes 0.000 description 1
- 102100031511 Fc receptor-like protein 2 Human genes 0.000 description 1
- 102100031512 Fc receptor-like protein 3 Human genes 0.000 description 1
- 102100031513 Fc receptor-like protein 4 Human genes 0.000 description 1
- 102100031507 Fc receptor-like protein 5 Human genes 0.000 description 1
- 102000018233 Fibroblast Growth Factor Human genes 0.000 description 1
- 108050007372 Fibroblast Growth Factor Proteins 0.000 description 1
- 108090000386 Fibroblast Growth Factor 1 Proteins 0.000 description 1
- 102100031706 Fibroblast growth factor 1 Human genes 0.000 description 1
- 102100024785 Fibroblast growth factor 2 Human genes 0.000 description 1
- 108090000379 Fibroblast growth factor 2 Proteins 0.000 description 1
- 102100035139 Folate receptor alpha Human genes 0.000 description 1
- 102400000321 Glucagon Human genes 0.000 description 1
- 108060003199 Glucagon Proteins 0.000 description 1
- 102000006771 Gonadotropins Human genes 0.000 description 1
- 108010086677 Gonadotropins Proteins 0.000 description 1
- 108010017080 Granulocyte Colony-Stimulating Factor Proteins 0.000 description 1
- 102000004269 Granulocyte Colony-Stimulating Factor Human genes 0.000 description 1
- 241001622557 Hesperia Species 0.000 description 1
- 101000884305 Homo sapiens B-cell receptor CD22 Proteins 0.000 description 1
- 101000868273 Homo sapiens CD44 antigen Proteins 0.000 description 1
- 101000897400 Homo sapiens CD59 glycoprotein Proteins 0.000 description 1
- 101000934356 Homo sapiens CD70 antigen Proteins 0.000 description 1
- 101000914479 Homo sapiens CD81 antigen Proteins 0.000 description 1
- 101000856022 Homo sapiens Complement decay-accelerating factor Proteins 0.000 description 1
- 101000941929 Homo sapiens Complement receptor type 2 Proteins 0.000 description 1
- 101000908391 Homo sapiens Dipeptidyl peptidase 4 Proteins 0.000 description 1
- 101000846913 Homo sapiens Fc receptor-like protein 1 Proteins 0.000 description 1
- 101000846911 Homo sapiens Fc receptor-like protein 2 Proteins 0.000 description 1
- 101000846910 Homo sapiens Fc receptor-like protein 3 Proteins 0.000 description 1
- 101000846909 Homo sapiens Fc receptor-like protein 4 Proteins 0.000 description 1
- 101000846908 Homo sapiens Fc receptor-like protein 5 Proteins 0.000 description 1
- 101001034652 Homo sapiens Insulin-like growth factor 1 receptor Proteins 0.000 description 1
- 101001046686 Homo sapiens Integrin alpha-M Proteins 0.000 description 1
- 101000935040 Homo sapiens Integrin beta-2 Proteins 0.000 description 1
- 101001057504 Homo sapiens Interferon-stimulated gene 20 kDa protein Proteins 0.000 description 1
- 101001055144 Homo sapiens Interleukin-2 receptor subunit alpha Proteins 0.000 description 1
- 101001063456 Homo sapiens Leucine-rich repeat-containing G-protein coupled receptor 5 Proteins 0.000 description 1
- 101000777628 Homo sapiens Leukocyte antigen CD37 Proteins 0.000 description 1
- 101000946889 Homo sapiens Monocyte differentiation antigen CD14 Proteins 0.000 description 1
- 101001099381 Homo sapiens Peroxisomal biogenesis factor 19 Proteins 0.000 description 1
- 101001012157 Homo sapiens Receptor tyrosine-protein kinase erbB-2 Proteins 0.000 description 1
- 101000914514 Homo sapiens T-cell-specific surface glycoprotein CD28 Proteins 0.000 description 1
- 101000914484 Homo sapiens T-lymphocyte activation antigen CD80 Proteins 0.000 description 1
- 101000955999 Homo sapiens V-set domain-containing T-cell activation inhibitor 1 Proteins 0.000 description 1
- 108010000521 Human Growth Hormone Proteins 0.000 description 1
- 102000002265 Human Growth Hormone Human genes 0.000 description 1
- 239000000854 Human Growth Hormone Substances 0.000 description 1
- AVXURJPOCDRRFD-UHFFFAOYSA-N Hydroxylamine Chemical compound ON AVXURJPOCDRRFD-UHFFFAOYSA-N 0.000 description 1
- 108700005091 Immunoglobulin Genes Proteins 0.000 description 1
- 108090001117 Insulin-Like Growth Factor II Proteins 0.000 description 1
- 102000048143 Insulin-Like Growth Factor II Human genes 0.000 description 1
- 102000014429 Insulin-like growth factor Human genes 0.000 description 1
- 102100039688 Insulin-like growth factor 1 receptor Human genes 0.000 description 1
- 102100022341 Integrin alpha-E Human genes 0.000 description 1
- 102100022338 Integrin alpha-M Human genes 0.000 description 1
- 102100022297 Integrin alpha-X Human genes 0.000 description 1
- 108010008212 Integrin alpha4beta1 Proteins 0.000 description 1
- 102100025390 Integrin beta-2 Human genes 0.000 description 1
- 102000006992 Interferon-alpha Human genes 0.000 description 1
- 108010047761 Interferon-alpha Proteins 0.000 description 1
- 102000003996 Interferon-beta Human genes 0.000 description 1
- 108090000467 Interferon-beta Proteins 0.000 description 1
- 102000008070 Interferon-gamma Human genes 0.000 description 1
- 108010074328 Interferon-gamma Proteins 0.000 description 1
- 102000014150 Interferons Human genes 0.000 description 1
- 108010050904 Interferons Proteins 0.000 description 1
- 108010002352 Interleukin-1 Proteins 0.000 description 1
- 108010002350 Interleukin-2 Proteins 0.000 description 1
- 102100026878 Interleukin-2 receptor subunit alpha Human genes 0.000 description 1
- 102100039064 Interleukin-3 Human genes 0.000 description 1
- 108010002386 Interleukin-3 Proteins 0.000 description 1
- KDXKERNSBIXSRK-YFKPBYRVSA-N L-lysine Chemical compound NCCCC[C@H](N)C(O)=O KDXKERNSBIXSRK-YFKPBYRVSA-N 0.000 description 1
- 102100031036 Leucine-rich repeat-containing G-protein coupled receptor 5 Human genes 0.000 description 1
- 102100031586 Leukocyte antigen CD37 Human genes 0.000 description 1
- 108090001030 Lipoproteins Proteins 0.000 description 1
- 102000004895 Lipoproteins Human genes 0.000 description 1
- 102000009151 Luteinizing Hormone Human genes 0.000 description 1
- 108010073521 Luteinizing Hormone Proteins 0.000 description 1
- 208000031422 Lymphocytic Chronic B-Cell Leukemia Diseases 0.000 description 1
- 108090000542 Lymphotoxin-alpha Proteins 0.000 description 1
- 102000004083 Lymphotoxin-alpha Human genes 0.000 description 1
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 1
- 239000004472 Lysine Substances 0.000 description 1
- 108010046938 Macrophage Colony-Stimulating Factor Proteins 0.000 description 1
- 102100028123 Macrophage colony-stimulating factor 1 Human genes 0.000 description 1
- PEEHTFAAVSWFBL-UHFFFAOYSA-N Maleimide Chemical compound O=C1NC(=O)C=C1 PEEHTFAAVSWFBL-UHFFFAOYSA-N 0.000 description 1
- 240000001427 Mallotus nudiflorus Species 0.000 description 1
- 241000124008 Mammalia Species 0.000 description 1
- 108010052285 Membrane Proteins Proteins 0.000 description 1
- 102000003735 Mesothelin Human genes 0.000 description 1
- 108090000015 Mesothelin Proteins 0.000 description 1
- 102000029749 Microtubule Human genes 0.000 description 1
- 108091022875 Microtubule Proteins 0.000 description 1
- 102100035877 Monocyte differentiation antigen CD14 Human genes 0.000 description 1
- 101100335081 Mus musculus Flt3 gene Proteins 0.000 description 1
- OVBPIULPVIDEAO-UHFFFAOYSA-N N-Pteroyl-L-glutaminsaeure Natural products C=1N=C2NC(N)=NC(=O)C2=NC=1CNC1=CC=C(C(=O)NC(CCC(O)=O)C(O)=O)C=C1 OVBPIULPVIDEAO-UHFFFAOYSA-N 0.000 description 1
- 108090000028 Neprilysin Proteins 0.000 description 1
- 102000003729 Neprilysin Human genes 0.000 description 1
- 102000015336 Nerve Growth Factor Human genes 0.000 description 1
- 108010069196 Neural Cell Adhesion Molecules Proteins 0.000 description 1
- 102100023616 Neural cell adhesion molecule L1-like protein Human genes 0.000 description 1
- 206010029260 Neuroblastoma Diseases 0.000 description 1
- 108090000095 Neurotrophin-6 Proteins 0.000 description 1
- 241000187654 Nocardia Species 0.000 description 1
- 208000015914 Non-Hodgkin lymphomas Diseases 0.000 description 1
- 206010033128 Ovarian cancer Diseases 0.000 description 1
- 108091033411 PCA3 Proteins 0.000 description 1
- 239000002033 PVDF binder Substances 0.000 description 1
- 206010061902 Pancreatic neoplasm Diseases 0.000 description 1
- 108090000526 Papain Proteins 0.000 description 1
- 102000003982 Parathyroid hormone Human genes 0.000 description 1
- 108090000445 Parathyroid hormone Proteins 0.000 description 1
- 108090000284 Pepsin A Proteins 0.000 description 1
- 102000057297 Pepsin A Human genes 0.000 description 1
- 102100038883 Peroxisomal biogenesis factor 19 Human genes 0.000 description 1
- 102100021768 Phosphoserine aminotransferase Human genes 0.000 description 1
- 102000001938 Plasminogen Activators Human genes 0.000 description 1
- 108010001014 Plasminogen Activators Proteins 0.000 description 1
- 241000276498 Pollachius virens Species 0.000 description 1
- 208000009052 Precursor T-Cell Lymphoblastic Leukemia-Lymphoma Diseases 0.000 description 1
- 108010076181 Proinsulin Proteins 0.000 description 1
- 108010072866 Prostate-Specific Antigen Proteins 0.000 description 1
- 239000012614 Q-Sepharose Substances 0.000 description 1
- JQYMGXZJTCOARG-UHFFFAOYSA-N Reactive blue 2 Chemical compound C1=2C(=O)C3=CC=CC=C3C(=O)C=2C(N)=C(S(O)(=O)=O)C=C1NC(C=C1S(O)(=O)=O)=CC=C1NC(N=1)=NC(Cl)=NC=1NC1=CC=CC(S(O)(=O)=O)=C1 JQYMGXZJTCOARG-UHFFFAOYSA-N 0.000 description 1
- 102100030086 Receptor tyrosine-protein kinase erbB-2 Human genes 0.000 description 1
- 101710100969 Receptor tyrosine-protein kinase erbB-3 Proteins 0.000 description 1
- 102100029986 Receptor tyrosine-protein kinase erbB-3 Human genes 0.000 description 1
- 102100029981 Receptor tyrosine-protein kinase erbB-4 Human genes 0.000 description 1
- 101710100963 Receptor tyrosine-protein kinase erbB-4 Proteins 0.000 description 1
- 108090000783 Renin Proteins 0.000 description 1
- 102100028255 Renin Human genes 0.000 description 1
- 239000012506 Sephacryl® Substances 0.000 description 1
- MTCFGRXMJLQNBG-UHFFFAOYSA-N Serine Natural products OCC(N)C(O)=O MTCFGRXMJLQNBG-UHFFFAOYSA-N 0.000 description 1
- 108010029180 Sialic Acid Binding Ig-like Lectin 3 Proteins 0.000 description 1
- 102000001555 Sialic Acid Binding Ig-like Lectin 3 Human genes 0.000 description 1
- VMHLLURERBWHNL-UHFFFAOYSA-M Sodium acetate Chemical compound [Na+].CC([O-])=O VMHLLURERBWHNL-UHFFFAOYSA-M 0.000 description 1
- 108010017622 Somatomedin Receptors Proteins 0.000 description 1
- 102000004584 Somatomedin Receptors Human genes 0.000 description 1
- 102000005157 Somatostatin Human genes 0.000 description 1
- 108010056088 Somatostatin Proteins 0.000 description 1
- 208000005718 Stomach Neoplasms Diseases 0.000 description 1
- 102000019197 Superoxide Dismutase Human genes 0.000 description 1
- 108010012715 Superoxide dismutase Proteins 0.000 description 1
- 108091008874 T cell receptors Proteins 0.000 description 1
- 102000016266 T-Cell Antigen Receptors Human genes 0.000 description 1
- 208000029052 T-cell acute lymphoblastic leukemia Diseases 0.000 description 1
- 102100027213 T-cell-specific surface glycoprotein CD28 Human genes 0.000 description 1
- 102100027222 T-lymphocyte activation antigen CD80 Human genes 0.000 description 1
- 229940123237 Taxane Drugs 0.000 description 1
- 108090000190 Thrombin Proteins 0.000 description 1
- 102000011923 Thyrotropin Human genes 0.000 description 1
- 108010061174 Thyrotropin Proteins 0.000 description 1
- 108090000373 Tissue Plasminogen Activator Proteins 0.000 description 1
- 108050006955 Tissue-type plasminogen activator Proteins 0.000 description 1
- 102000004887 Transforming Growth Factor beta Human genes 0.000 description 1
- 108090001012 Transforming Growth Factor beta Proteins 0.000 description 1
- 102400001320 Transforming growth factor alpha Human genes 0.000 description 1
- 101800004564 Transforming growth factor alpha Proteins 0.000 description 1
- 206010052779 Transplant rejections Diseases 0.000 description 1
- 108060008682 Tumor Necrosis Factor Proteins 0.000 description 1
- 102000000852 Tumor Necrosis Factor-alpha Human genes 0.000 description 1
- 102100022153 Tumor necrosis factor receptor superfamily member 4 Human genes 0.000 description 1
- 102100040245 Tumor necrosis factor receptor superfamily member 5 Human genes 0.000 description 1
- 102100036856 Tumor necrosis factor receptor superfamily member 9 Human genes 0.000 description 1
- 241000545760 Unio Species 0.000 description 1
- 102000003990 Urokinase-type plasminogen activator Human genes 0.000 description 1
- 108090000435 Urokinase-type plasminogen activator Proteins 0.000 description 1
- 102100038929 V-set domain-containing T-cell activation inhibitor 1 Human genes 0.000 description 1
- 108091008605 VEGF receptors Proteins 0.000 description 1
- 102100033177 Vascular endothelial growth factor receptor 2 Human genes 0.000 description 1
- 102220589754 YjeF N-terminal domain-containing protein 3_G25F_mutation Human genes 0.000 description 1
- 230000001133 acceleration Effects 0.000 description 1
- 230000004308 accommodation Effects 0.000 description 1
- 150000007513 acids Chemical class 0.000 description 1
- 230000004913 activation Effects 0.000 description 1
- 239000000488 activin Substances 0.000 description 1
- 201000011186 acute T cell leukemia Diseases 0.000 description 1
- 150000001263 acyl chlorides Chemical class 0.000 description 1
- 230000010933 acylation Effects 0.000 description 1
- 238000005917 acylation reaction Methods 0.000 description 1
- 125000004423 acyloxy group Chemical group 0.000 description 1
- 125000005042 acyloxymethyl group Chemical group 0.000 description 1
- 125000000304 alkynyl group Chemical group 0.000 description 1
- 102000015395 alpha 1-Antitrypsin Human genes 0.000 description 1
- 108010050122 alpha 1-Antitrypsin Proteins 0.000 description 1
- 229940024142 alpha 1-antitrypsin Drugs 0.000 description 1
- 125000003277 amino group Chemical group 0.000 description 1
- 229940064734 aminobenzoate Drugs 0.000 description 1
- 238000004458 analytical method Methods 0.000 description 1
- 238000011091 antibody purification Methods 0.000 description 1
- 238000003556 assay Methods 0.000 description 1
- 125000004429 atom Chemical group 0.000 description 1
- WPYMKLBDIGXBTP-UHFFFAOYSA-N benzoic acid Chemical compound OC(=O)C1=CC=CC=C1 WPYMKLBDIGXBTP-UHFFFAOYSA-N 0.000 description 1
- 102000006635 beta-lactamase Human genes 0.000 description 1
- 230000008033 biological extinction Effects 0.000 description 1
- 230000015572 biosynthetic process Effects 0.000 description 1
- 210000004369 blood Anatomy 0.000 description 1
- 239000008280 blood Substances 0.000 description 1
- 239000003114 blood coagulation factor Substances 0.000 description 1
- 239000003130 blood coagulation factor inhibitor Substances 0.000 description 1
- 238000010504 bond cleavage reaction Methods 0.000 description 1
- 210000000988 bone and bone Anatomy 0.000 description 1
- 108010006025 bovine growth hormone Proteins 0.000 description 1
- 210000000481 breast Anatomy 0.000 description 1
- 229960004015 calcitonin Drugs 0.000 description 1
- BBBFJLBPOGFECG-VJVYQDLKSA-N calcitonin Chemical compound N([C@H](C(=O)N[C@@H](CC(C)C)C(=O)NCC(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CO)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC=1NC=NC=1)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H]([C@@H](C)O)C(=O)NCC(=O)N[C@@H](CO)C(=O)NCC(=O)N[C@@H]([C@@H](C)O)C(=O)N1[C@@H](CCC1)C(N)=O)C(C)C)C(=O)[C@@H]1CSSC[C@H](N)C(=O)N[C@@H](CO)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CO)C(=O)N[C@@H]([C@@H](C)O)C(=O)N1 BBBFJLBPOGFECG-VJVYQDLKSA-N 0.000 description 1
- 125000002915 carbonyl group Chemical group [*:2]C([*:1])=O 0.000 description 1
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 1
- NSQLIUXCMFBZME-MPVJKSABSA-N carperitide Chemical compound C([C@H]1C(=O)NCC(=O)NCC(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCSC)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@H](C(NCC(=O)N[C@@H](C)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CO)C(=O)NCC(=O)N[C@@H](CC(C)C)C(=O)NCC(=O)N[C@@H](CSSC[C@@H](C(=O)N1)NC(=O)[C@H](CO)NC(=O)[C@H](CO)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](N)CO)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CO)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(O)=O)=O)[C@@H](C)CC)C1=CC=CC=C1 NSQLIUXCMFBZME-MPVJKSABSA-N 0.000 description 1
- 230000001413 cellular effect Effects 0.000 description 1
- 230000002490 cerebral effect Effects 0.000 description 1
- 239000012539 chromatography resin Substances 0.000 description 1
- 208000032852 chronic lymphocytic leukemia Diseases 0.000 description 1
- 230000006957 competitive inhibition Effects 0.000 description 1
- 230000001268 conjugating effect Effects 0.000 description 1
- 238000007796 conventional method Methods 0.000 description 1
- NZNMSOFKMUBTKW-UHFFFAOYSA-N cyclohexanecarboxylic acid Chemical compound OC(=O)C1CCCCC1 NZNMSOFKMUBTKW-UHFFFAOYSA-N 0.000 description 1
- UFULAYFCSOUIOV-UHFFFAOYSA-N cysteamine Chemical compound NCCS UFULAYFCSOUIOV-UHFFFAOYSA-N 0.000 description 1
- 210000001151 cytotoxic T lymphocyte Anatomy 0.000 description 1
- 230000003013 cytotoxicity Effects 0.000 description 1
- 231100000135 cytotoxicity Toxicity 0.000 description 1
- 238000006298 dechlorination reaction Methods 0.000 description 1
- 238000012217 deletion Methods 0.000 description 1
- 230000037430 deletion Effects 0.000 description 1
- 230000017858 demethylation Effects 0.000 description 1
- 238000010520 demethylation reaction Methods 0.000 description 1
- 108700001680 des-(1-3)- insulin-like growth factor 1 Proteins 0.000 description 1
- 230000006866 deterioration Effects 0.000 description 1
- 230000029087 digestion Effects 0.000 description 1
- KZNICNPSHKQLFF-UHFFFAOYSA-N dihydromaleimide Natural products O=C1CCC(=O)N1 KZNICNPSHKQLFF-UHFFFAOYSA-N 0.000 description 1
- 239000000539 dimer Substances 0.000 description 1
- 238000006471 dimerization reaction Methods 0.000 description 1
- 125000005414 dithiopyridyl group Chemical group 0.000 description 1
- 230000000694 effects Effects 0.000 description 1
- 210000001163 endosome Anatomy 0.000 description 1
- 108010087914 epidermal growth factor receptor VIII Proteins 0.000 description 1
- 229940105423 erythropoietin Drugs 0.000 description 1
- 230000007717 exclusion Effects 0.000 description 1
- 239000013604 expression vector Substances 0.000 description 1
- 229960004222 factor ix Drugs 0.000 description 1
- 229940126864 fibroblast growth factor Drugs 0.000 description 1
- 229910052587 fluorapatite Inorganic materials 0.000 description 1
- 229940077441 fluorapatite Drugs 0.000 description 1
- 229940014144 folate Drugs 0.000 description 1
- 229960000304 folic acid Drugs 0.000 description 1
- 238000009472 formulation Methods 0.000 description 1
- 230000008014 freezing Effects 0.000 description 1
- 238000007710 freezing Methods 0.000 description 1
- 230000004927 fusion Effects 0.000 description 1
- 206010017758 gastric cancer Diseases 0.000 description 1
- 230000002496 gastric effect Effects 0.000 description 1
- 238000001502 gel electrophoresis Methods 0.000 description 1
- MASNOZXLGMXCHN-ZLPAWPGGSA-N glucagon Chemical compound C([C@@H](C(=O)N[C@H](C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCSC)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H]([C@@H](C)O)C(O)=O)C(C)C)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@H](C)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CO)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CCCCN)NC(=O)[C@H](CO)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CO)NC(=O)[C@@H](NC(=O)[C@H](CC=1C=CC=CC=1)NC(=O)[C@@H](NC(=O)CNC(=O)[C@H](CCC(N)=O)NC(=O)[C@H](CO)NC(=O)[C@@H](N)CC=1NC=NC=1)[C@@H](C)O)[C@@H](C)O)C1=CC=CC=C1 MASNOZXLGMXCHN-ZLPAWPGGSA-N 0.000 description 1
- 229960004666 glucagon Drugs 0.000 description 1
- 239000002622 gonadotropin Substances 0.000 description 1
- 201000010536 head and neck cancer Diseases 0.000 description 1
- 208000014829 head and neck neoplasm Diseases 0.000 description 1
- 125000005842 heteroatom Chemical group 0.000 description 1
- 125000000623 heterocyclic group Chemical group 0.000 description 1
- FUZZWVXGSFPDMH-UHFFFAOYSA-N hexanoic acid Chemical compound CCCCCC(O)=O FUZZWVXGSFPDMH-UHFFFAOYSA-N 0.000 description 1
- 210000004754 hybrid cell Anatomy 0.000 description 1
- 230000002209 hydrophobic effect Effects 0.000 description 1
- 210000000987 immune system Anatomy 0.000 description 1
- 230000002163 immunogen Effects 0.000 description 1
- 238000001114 immunoprecipitation Methods 0.000 description 1
- 229940051026 immunotoxin Drugs 0.000 description 1
- 230000002637 immunotoxin Effects 0.000 description 1
- 239000002596 immunotoxin Substances 0.000 description 1
- 231100000608 immunotoxin Toxicity 0.000 description 1
- 230000002757 inflammatory effect Effects 0.000 description 1
- 239000000893 inhibin Substances 0.000 description 1
- 230000002401 inhibitory effect Effects 0.000 description 1
- ZPNFWUPYTFPOJU-LPYSRVMUSA-N iniprol Chemical compound C([C@H]1C(=O)NCC(=O)NCC(=O)N[C@H]2CSSC[C@H]3C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@H](C(N[C@H](C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC=4C=CC(O)=CC=4)C(=O)N[C@@H](CC=4C=CC=CC=4)C(=O)N[C@@H](CC=4C=CC(O)=CC=4)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](C)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](C)C(=O)NCC(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CSSC[C@H](NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](C)NC(=O)[C@H](CO)NC(=O)[C@H](CCCCN)NC(=O)[C@H](CC=4C=CC=CC=4)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CCCCN)NC(=O)[C@H](C)NC(=O)[C@H](CCCNC(N)=N)NC2=O)C(=O)N[C@@H](CCSC)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CSSC[C@H](NC(=O)[C@H](CC=2C=CC=CC=2)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H]2N(CCC2)C(=O)[C@@H](N)CCCNC(N)=N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(O)=O)C(=O)N2[C@@H](CCC2)C(=O)N2[C@@H](CCC2)C(=O)N[C@@H](CC=2C=CC(O)=CC=2)C(=O)N[C@@H]([C@@H](C)O)C(=O)NCC(=O)N2[C@@H](CCC2)C(=O)N3)C(=O)NCC(=O)NCC(=O)N[C@@H](C)C(O)=O)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@H](C(=O)N[C@@H](CC=2C=CC=CC=2)C(=O)N[C@H](C(=O)N1)C(C)C)[C@@H](C)O)[C@@H](C)CC)=O)[C@@H](C)CC)C1=CC=C(O)C=C1 ZPNFWUPYTFPOJU-LPYSRVMUSA-N 0.000 description 1
- 229940079322 interferon Drugs 0.000 description 1
- 230000003834 intracellular effect Effects 0.000 description 1
- 239000003456 ion exchange resin Substances 0.000 description 1
- 229920003303 ion-exchange polymer Polymers 0.000 description 1
- 150000002500 ions Chemical class 0.000 description 1
- 108010034897 lentil lectin Proteins 0.000 description 1
- 208000032839 leukemia Diseases 0.000 description 1
- 230000000670 limiting effect Effects 0.000 description 1
- 238000011068 loading method Methods 0.000 description 1
- 210000004072 lung Anatomy 0.000 description 1
- 239000003580 lung surfactant Substances 0.000 description 1
- 208000037841 lung tumor Diseases 0.000 description 1
- 229940040129 luteinizing hormone Drugs 0.000 description 1
- 210000003712 lysosome Anatomy 0.000 description 1
- 230000001868 lysosomic effect Effects 0.000 description 1
- 239000012516 mab select resin Substances 0.000 description 1
- 210000002540 macrophage Anatomy 0.000 description 1
- 208000015486 malignant pancreatic neoplasm Diseases 0.000 description 1
- 210000004962 mammalian cell Anatomy 0.000 description 1
- 210000002752 melanocyte Anatomy 0.000 description 1
- 229960003151 mercaptamine Drugs 0.000 description 1
- 229910021645 metal ion Inorganic materials 0.000 description 1
- 230000000813 microbial effect Effects 0.000 description 1
- 210000004688 microtubule Anatomy 0.000 description 1
- 238000010369 molecular cloning Methods 0.000 description 1
- 210000000066 myeloid cell Anatomy 0.000 description 1
- 229940053128 nerve growth factor Drugs 0.000 description 1
- 229940032018 neurotrophin 3 Drugs 0.000 description 1
- 230000007935 neutral effect Effects 0.000 description 1
- 229910052757 nitrogen Inorganic materials 0.000 description 1
- 150000007523 nucleic acids Chemical group 0.000 description 1
- 239000003960 organic solvent Substances 0.000 description 1
- 230000002138 osteoinductive effect Effects 0.000 description 1
- 230000002611 ovarian Effects 0.000 description 1
- 229910052760 oxygen Inorganic materials 0.000 description 1
- 201000002528 pancreatic cancer Diseases 0.000 description 1
- 208000008443 pancreatic carcinoma Diseases 0.000 description 1
- 239000000199 parathyroid hormone Substances 0.000 description 1
- 229960001319 parathyroid hormone Drugs 0.000 description 1
- VSIIXMUUUJUKCM-UHFFFAOYSA-D pentacalcium;fluoride;triphosphate Chemical compound [F-].[Ca+2].[Ca+2].[Ca+2].[Ca+2].[Ca+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O VSIIXMUUUJUKCM-UHFFFAOYSA-D 0.000 description 1
- NMHMNPHRMNGLLB-UHFFFAOYSA-N phloretic acid Chemical compound OC(=O)CCC1=CC=C(O)C=C1 NMHMNPHRMNGLLB-UHFFFAOYSA-N 0.000 description 1
- 230000004962 physiological condition Effects 0.000 description 1
- 239000013612 plasmid Substances 0.000 description 1
- 229940127126 plasminogen activator Drugs 0.000 description 1
- 229920000889 poly(m-phenylene isophthalamide) Polymers 0.000 description 1
- 229920002981 polyvinylidene fluoride Polymers 0.000 description 1
- OXCMYAYHXIHQOA-UHFFFAOYSA-N potassium;[2-butyl-5-chloro-3-[[4-[2-(1,2,4-triaza-3-azanidacyclopenta-1,4-dien-5-yl)phenyl]phenyl]methyl]imidazol-4-yl]methanol Chemical compound [K+].CCCCC1=NC(Cl)=C(CO)N1CC1=CC=C(C=2C(=CC=CC=2)C2=N[N-]N=N2)C=C1 OXCMYAYHXIHQOA-UHFFFAOYSA-N 0.000 description 1
- 210000002307 prostate Anatomy 0.000 description 1
- 230000006337 proteolytic cleavage Effects 0.000 description 1
- 238000011084 recovery Methods 0.000 description 1
- 230000004044 response Effects 0.000 description 1
- 238000004366 reverse phase liquid chromatography Methods 0.000 description 1
- 238000004007 reversed phase HPLC Methods 0.000 description 1
- 239000001632 sodium acetate Substances 0.000 description 1
- 235000017281 sodium acetate Nutrition 0.000 description 1
- 239000007974 sodium acetate buffer Substances 0.000 description 1
- 239000012064 sodium phosphate buffer Substances 0.000 description 1
- ULARYIUTHAWJMU-UHFFFAOYSA-M sodium;1-[4-(2,5-dioxopyrrol-1-yl)butanoyloxy]-2,5-dioxopyrrolidine-3-sulfonate Chemical compound [Na+].O=C1C(S(=O)(=O)[O-])CC(=O)N1OC(=O)CCCN1C(=O)C=CC1=O ULARYIUTHAWJMU-UHFFFAOYSA-M 0.000 description 1
- VUFNRPJNRFOTGK-UHFFFAOYSA-M sodium;1-[4-[(2,5-dioxopyrrol-1-yl)methyl]cyclohexanecarbonyl]oxy-2,5-dioxopyrrolidine-3-sulfonate Chemical compound [Na+].O=C1C(S(=O)(=O)[O-])CC(=O)N1OC(=O)C1CCC(CN2C(C=CC2=O)=O)CC1 VUFNRPJNRFOTGK-UHFFFAOYSA-M 0.000 description 1
- NHXLMOGPVYXJNR-ATOGVRKGSA-N somatostatin Chemical compound C([C@H]1C(=O)N[C@H](C(N[C@@H](CO)C(=O)N[C@@H](CSSC[C@@H](C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CC=2C=CC=CC=2)C(=O)N[C@@H](CC=2C=CC=CC=2)C(=O)N[C@@H](CC=2C3=CC=CC=C3NC=2)C(=O)N[C@@H](CCCCN)C(=O)N[C@H](C(=O)N1)[C@@H](C)O)NC(=O)CNC(=O)[C@H](C)N)C(O)=O)=O)[C@H](O)C)C1=CC=CC=C1 NHXLMOGPVYXJNR-ATOGVRKGSA-N 0.000 description 1
- 229960000553 somatostatin Drugs 0.000 description 1
- 230000009870 specific binding Effects 0.000 description 1
- 210000000952 spleen Anatomy 0.000 description 1
- 230000000638 stimulation Effects 0.000 description 1
- 201000011549 stomach cancer Diseases 0.000 description 1
- 238000006467 substitution reaction Methods 0.000 description 1
- 229960003080 taurine Drugs 0.000 description 1
- DKPFODGZWDEEBT-QFIAKTPHSA-N taxane Chemical class C([C@]1(C)CCC[C@@H](C)[C@H]1C1)C[C@H]2[C@H](C)CC[C@@H]1C2(C)C DKPFODGZWDEEBT-QFIAKTPHSA-N 0.000 description 1
- ZRKFYGHZFMAOKI-QMGMOQQFSA-N tgfbeta Chemical compound C([C@H](NC(=O)[C@H](C(C)C)NC(=O)CNC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CC(C)C)NC(=O)CNC(=O)[C@H](C)NC(=O)[C@H](CO)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@@H](NC(=O)[C@H](C)NC(=O)[C@H](C)NC(=O)[C@@H](NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](N)CCSC)C(C)C)[C@@H](C)CC)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](C)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](C)C(=O)N[C@@H](CC(C)C)C(=O)N1[C@@H](CCC1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CO)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(C)C)C(O)=O)C1=CC=C(O)C=C1 ZRKFYGHZFMAOKI-QMGMOQQFSA-N 0.000 description 1
- 229940124597 therapeutic agent Drugs 0.000 description 1
- 238000002560 therapeutic procedure Methods 0.000 description 1
- 230000034005 thiol-disulfide exchange Effects 0.000 description 1
- 229960004072 thrombin Drugs 0.000 description 1
- 210000001519 tissue Anatomy 0.000 description 1
- YONPGGFAJWQGJC-UHFFFAOYSA-K titanium(iii) chloride Chemical compound Cl[Ti](Cl)Cl YONPGGFAJWQGJC-UHFFFAOYSA-K 0.000 description 1
- 231100000331 toxic Toxicity 0.000 description 1
- 230000002588 toxic effect Effects 0.000 description 1
- 230000001988 toxicity Effects 0.000 description 1
- 231100000419 toxicity Toxicity 0.000 description 1
- 230000009261 transgenic effect Effects 0.000 description 1
- 241001515965 unidentified phage Species 0.000 description 1
- 210000002700 urine Anatomy 0.000 description 1
- 229960005356 urokinase Drugs 0.000 description 1
- 230000003612 virological effect Effects 0.000 description 1
- 108010047303 von Willebrand Factor Proteins 0.000 description 1
- 102100036537 von Willebrand factor Human genes 0.000 description 1
- 229960001134 von willebrand factor Drugs 0.000 description 1
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/535—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with at least one nitrogen and one oxygen as the ring hetero atoms, e.g. 1,2-oxazines
- A61K31/5365—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with at least one nitrogen and one oxygen as the ring hetero atoms, e.g. 1,2-oxazines ortho- or peri-condensed with heterocyclic ring systems
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
- A61K47/6801—Drug-antibody or immunoglobulin conjugates defined by the pharmacologically or therapeutically active agent
- A61K47/6803—Drugs conjugated to an antibody or immunoglobulin, e.g. cisplatin-antibody conjugates
- A61K47/68033—Drugs conjugated to an antibody or immunoglobulin, e.g. cisplatin-antibody conjugates the drug being a maytansine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
- A61K47/6801—Drug-antibody or immunoglobulin conjugates defined by the pharmacologically or therapeutically active agent
- A61K47/6803—Drugs conjugated to an antibody or immunoglobulin, e.g. cisplatin-antibody conjugates
- A61K47/6807—Drugs conjugated to an antibody or immunoglobulin, e.g. cisplatin-antibody conjugates the drug or compound being a sugar, nucleoside, nucleotide, nucleic acid, e.g. RNA antisense
- A61K47/6809—Antibiotics, e.g. antitumor antibiotics anthracyclins, adriamycin, doxorubicin or daunomycin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
- A61K47/6801—Drug-antibody or immunoglobulin conjugates defined by the pharmacologically or therapeutically active agent
- A61K47/6803—Drugs conjugated to an antibody or immunoglobulin, e.g. cisplatin-antibody conjugates
- A61K47/6811—Drugs conjugated to an antibody or immunoglobulin, e.g. cisplatin-antibody conjugates the drug being a protein or peptide, e.g. transferrin or bleomycin
- A61K47/6817—Toxins
- A61K47/6819—Plant toxins
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
- A61K47/6835—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site
- A61K47/6849—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site the antibody targeting a receptor, a cell surface antigen or a cell surface determinant
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
- A61K47/6835—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site
- A61K47/6851—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site the antibody targeting a determinant of a tumour cell
- A61K47/6867—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site the antibody targeting a determinant of a tumour cell the tumour determinant being from a cell of a blood cancer
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/02—Antineoplastic agents specific for leukemia
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K1/00—General methods for the preparation of peptides, i.e. processes for the organic chemical preparation of peptides or proteins of any length
- C07K1/107—General methods for the preparation of peptides, i.e. processes for the organic chemical preparation of peptides or proteins of any length by chemical modification of precursor peptides
- C07K1/113—General methods for the preparation of peptides, i.e. processes for the organic chemical preparation of peptides or proteins of any length by chemical modification of precursor peptides without change of the primary structure
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2896—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against molecules with a "CD"-designation, not provided for elsewhere
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/32—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against translation products of oncogenes
Landscapes
- Health & Medical Sciences (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Medicinal Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Immunology (AREA)
- Epidemiology (AREA)
- Cell Biology (AREA)
- Organic Chemistry (AREA)
- Molecular Biology (AREA)
- Biochemistry (AREA)
- Oncology (AREA)
- Hematology (AREA)
- Toxicology (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Biophysics (AREA)
- Genetics & Genomics (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Botany (AREA)
- Analytical Chemistry (AREA)
- Medicinal Preparation (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Peptides Or Proteins (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Preparation Of Compounds By Using Micro-Organisms (AREA)
- Nitrogen And Oxygen Or Sulfur-Condensed Heterocyclic Ring Systems (AREA)
Abstract
Un proceso para preparar un conjugado de anticuerpo y maitansinoide que comprende la etapa de: (a) poner en contacto un anticuerpo con un maitansinoide para formar una primera mezcla que comprende el anticuerpo y el maitansinoide, después poner en contacto la primera mezcla con un reactivo de reticulación bifuncional que comprende un conector, en una solución que tiene un pH de 4 a 9 para proporcionar una segunda mezcla que comprende (i) el conjugado de anticuerpo y maitansinoide, donde el anticuerpo está acoplado químicamente a través del conector al maitansinoide, (ii) maitansinoide libre, y (iii) subproductos de reacción.
Description
DESCRIPCION
Preparacion de conjugados de maitansinoides y anticuerpos mediante un proceso de una sola etapa
Referenda cruzada a solicitudes relacionadas
La presente solicitud de patente reivindica el beneficio de la solicitud provisional de EE.UU. N.° 61/468.997, presentada el 29 de marzo de 2011 y la solicitud provisional de EE.UU. N.° 61/468.981, presentada el 29 de marzo de 2011.
Antecedentes de la invencion
Los conjugados de anticuerpos y farmacos (ADC, por sus siglas en ingles) que resultan utiles en el tratamiento de cancer y otras enfermedades estan compuestos comunmente por tres elementos distintos: un agente de union celular, un conector y un agente citotoxico. El metodo convencional para conjugar un agente de union celular, tales como un anticuerpo, con un agente citotoxico, emplea dos etapas de reaccion distintas con el anticuerpo. En la primera etapa de reaccion (la etapa de modificacion), el anticuerpo se hace reaccionar con un conector heterobifuncional para producir un anticuerpo modificado por conector. El producto de anticuerpo modificado despues se purifica opcionalmente del exceso de conector o de reactivo de conector hidrolizado. En la segunda etapa de reaccion (la etapa de conjugacion), el anticuerpo modificado con conector se hace reaccionar con el agente citotoxico que contiene un grupo reactivo, tales como tiol, para generar el conjugado de anticuerpo y agente citotoxico, el cual nuevamente se purifica en una etapa de purificacion adicional.
Los procesos que se han descrito previamente para la fabricacion de los conjugados de anticuerpo y agente citotoxico son complejos porque estan cargados de etapas que son engorrosas de realizar o producen inmunoconjugados que son menos puros o menos estables que los optimos deseados. Por lo tanto, serla conveniente modificar o eliminar una o mas etapas de fabricacion a la vez que se mejora la calidad del producto, tales como la pureza y/o la estabilidad.
En vista de lo anterior, existe la necesidad en la tecnica de desarrollar procesos mejorados para preparar conjugados de agente de union celular y agente citotoxico que tengan una pureza sustancialmente alta, y que puedan prepararse evitando etapas engorrosas, y mediante la reduction del tiempo y del costo para el usuario. La invencion proporciona un proceso del mismo tipo. Estas y otras ventajas de la invencion, as! como otras caracterlsticas de la invencion, seran evidentes a partir de la description de la invencion que se proporciona en el presente documento.
Breve sumario de la invencion
La invencion proporciona un proceso para preparar un conjugado de agente de union celular y agente citotoxico es decir, un conjugado de maitansinoide y anticuerpo que comprende la etapa de poner en contacto un agente de union celular es decir, un maitansinoide con un agente citotoxico es decir, un anticuerpo para formar una primera mezcla que comprende el agente de union celular y el agente citotoxico, y despues poner en contacto la primera mezcla que comprende el agente de union celular y el agente citotoxico con un reactivo de reticulation bifuncional que comprende un conector, en una solution que tiene un pH de 4 a 9, para proporcionar una mezcla que comprende (i) el conjugado de agente de union celular y agente citotoxico, donde el agente de union celular se acopla qulmicamente a traves del conector al agente citotoxico, (ii) agente citotoxico libre y (iii) subproductos de reaccion. El proceso puede comprender adicionalmente la etapa de purificar la mezcla para proporcionar un conjugado de agente de union celular y agente citotoxico purificado.
Los procesos de la presente invencion proporcionan un conjugado de agente de union celular y agente citotoxico con alta pureza y/o estabilidad. Para lograr la alta pureza y/o estabilidad del conjugado, es esencial que el agente citotoxico se ponga en contacto con el agente de union celular primero para formar una mezcla que comprenda el agente de union celular y el agente citotoxico, antes de que la mezcla se ponga en contacto con un reactivo de reticulacion bifuncional.
La presente invencion incluye tambien un conjugado que comprende un agente de union celular que se acopla qulmicamente a un agente citotoxico preparado de acuerdo con los procesos descritos en el presente documento.
Basandose en la divulgation que se contiene en el presente documento, la presente invencion proporciona un proceso para preparar un conjugado de maitansinoide y anticuerpo que comprende la etapa de: (a) poner en contacto un anticuerpo con un maitansinoide para formar una primera mezcla que comprende el anticuerpo y el maitansinoide, despues poner en contacto la primera mezcla con un reactivo de reticulacion bifuncional que comprende un conector, en una solucion que tiene un pH de 4 a 9 para proporcionar una segunda mezcla que comprende (i) el conjugado de maitansinoide y anticuerpo, donde el anticuerpo se acopla qulmicamente a traves del conector al maitansinoide, (ii) maitansinoide libre y (iii) subproductos de la reaccion.
La presente invencion y las realizaciones de la misma se exponen en las reivindicaciones adjuntas.
Descripcion detallada de la invencion
La invencion proporciona un proceso de una etapa para preparar un conjugado de agente de union celular y agente citotoxico es decir, un conjugado de maitansinoide y anticuerpo. El proceso comprende poner en contacto un agente de union celular (es decir, un anticuerpo) con un agente citotoxico es decir, un maitansinoide para formar una primera mezcla que comprende el agente de union celular y el agente citotoxico, y despues poner en contacto la primera mezcla que comprende el agente de union celular y el agente citotoxico con un reactivo de reticulacion bifuncional que comprende un conector, en una solucion que tiene un pH de 4 a 9, para proporcionar una segunda mezcla que comprende el conjugado de agente de union celular y agente citotoxico, agente citotoxico libre y subproductos de reaccion, donde el agente de union celular se acopla qulmicamente al agente citotoxico a traves del conector. La segunda mezcla despues se somete a purification para proporcionar un conjugado de agente de union celular y agente citotoxico purificado.
En una realization, la puesta en contacto se efectua proporcionando el agente de union celular, despues poniendo en contacto el agente de union celular con el agente citotoxico para formar una primera mezcla que comprende el agente de union celular y el agente citotoxico, y despues poniendo en contacto la primera mezcla que comprende el agente de union celular y el agente citotoxico con el reactivo de reticulacion bifuncional. Por ejemplo, en una realizacion, el agente de union celular se proporciona en un recipiente de reaccion, el agente citotoxico se anade al recipiente de reaccion (que entra de la misma manera en contacto con el agente de union celular), y despues se anade el reactivo de reticulacion bifuncional a la mezcla que comprende el agente de union celular y el agente citotoxico (que entra de la misma manera en contacto con la mezcla que comprende el agente de union celular y el agente citotoxico). En una realizacion, se proporciona el agente de union celular en un recipiente de reaccion, y se anade el agente citotoxico al recipiente de reaccion inmediatamente despues de colocar el agente de union celular al recipiente. En otra realizacion, se proporciona el agente de union celular en un recipiente de reaccion, y el agente citotoxico se anade al recipiente de reaccion despues de un intervalo de tiempo despues de proporcionar el agente de union celular en el recipiente (por ejemplo, aproximadamente 5 minutos, aproximadamente 10 minutos, aproximadamente 20 minutos, aproximadamente 30 minutos, aproximadamente 40 minutos, aproximadamente 50 minutos, aproximadamente 1 hora, aproximadamente 1 dla o mas despues de proporcionar el agente de union celular en el receptaculo). El agente citotoxico pude anadirse rapidamente (es decir, dentro de un intervalo de tiempo corto, tales como aproximadamente 5 minutos, aproximadamente 10 minutos) o lentamente (tales como mediante el uso de una bomba).
La mezcla que comprende un agente de union celular y un agente citotoxico puede despues ponerse en contacto con el reactivo de reticulacion bifuncional, ya sea inmediatamente despues de poner en contacto el agente de union celular con el agente citotoxico o en un momento posterior (por ejemplo, aproximadamente 5 minutos a aproximadamente 8 horas o mas) despues de poner en contacto el agente de union celular con el agente citotoxico. Por ejemplo, en una realizacion, el reactivo de reticulacion bifuncional se anade a la mezcla que comprende el agente de union celular y el agente citotoxico inmediatamente despues de la adicion del agente citotoxico al recipiente de reaccion que comprende el agente de union celular. De manera alternativa, la mezcla que comprende el agente de union celular y el agente citotoxico puede ponerse en contacto con el reactivo de reticulacion bifuncional aproximadamente 5 minutos, aproximadamente 10 minutos, aproximadamente 20 minutos, aproximadamente 30 minutos, aproximadamente 1 hora, aproximadamente 2 horas, aproximadamente 3 horas, aproximadamente 4 horas, aproximadamente 5 horas, aproximadamente 6 horas, aproximadamente 7 horas, aproximadamente 8 horas o mas despues de poner en contacto el agente de union celular con el agente citotoxico.
En otra realizacion, el agente citotoxico y el agente bifuncional se anaden a traves de multiples ciclos (por ejemplo, 1, 2, 3, 4, 5 o mas ciclos). Por ejemplo, la invencion proporciona un proceso que comprende las etapas de: a) poner en contacto un agente de union celular es decir, un anticuerpo con el agente citotoxico es decir, un maitansinoide para formar una primera mezcla que comprende el agente de union celular y el agente citotoxico; y despues poner en contacto la primera mezcla con un reactivo de reticulacion bifuncional que comprende un conector, en una solucion que tiene un pH de 4 a 9 para proporcionar una segunda mezcla que comprende el conjugado de agente de union celular y agente citotoxico, agente citotoxico libre, y subproductos de reaccion, donde el agente de union celular esta acoplado qulmicamente a traves del conector al agente citotoxico; b) poner en contacto la segunda mezcla con el agente citotoxico para formar una tercera mezcla; y despues poner en contacto la tercera mezcla con el reactivo de reticulacion bifuncional a un pH de 4 a 9 para proporcionar una cuarta mezcla; y c) purificar la cuarta mezcla para proporcionar el conjugado de agente de union celular y agente citotoxico purificado. En una realizacion, la etapa b) se lleva a cabo despues de un intervalo de tiempo (por ejemplo, aproximadamente 1 hora, aproximadamente 2 horas, aproximadamente 3 horas o mas) despues de la etapa a). En otra realizacion, la etapa b) puede repetirse varias veces (por ejemplo, 1, 2, 3, 4 o mas veces) antes de llevar a cabo la etapa c). La etapa b) adicional puede llevarse a cabo despues de un intervalo de tiempo (por ejemplo, aproximadamente 1 hora, aproximadamente 2 horas, aproximadamente 3 horas o mas) despues de la etapa b) inicial.
En otra realizacion, el reactivo de reticulacion bifuncional se anade antes de que se completa la adicion del agente citotoxico. Por ejemplo, en una realizacion, el agente citotoxico se anade al agente de union celular de manera continua durante un intervalo de tiempo (por ejemplo, durante aproximadamente 5 minutos, aproximadamente 10 minutos, aproximadamente 30 minutos, aproximadamente 1 hora, aproximadamente 2 horas, aproximadamente 3 horas o mas) para formar una mezcla que comprende el agente de union celular y el agente citotoxico. Antes de que la adicion del
agente citotoxico este completa, se anade el reactivo de reticulacion bifuncional a la mezcla que comprende el agente de union celular y el agente citotoxico, con la condicion de que el agente citotoxico este en todo momento en exceso molar respecto al reactivo de reticulacion bifuncional. En una realizacion, el reactivo de reticulacion bifuncional se anade de manera continua durante un intervalo de tiempo (por ejemplo, durante aproximadamente 5 minutos, aproximadamente 10 minutos, aproximadamente 30 minutos, aproximadamente 1 hora, aproximadamente 2 horas, aproximadamente 3 horas, o mas).
Despues de que la mezcla que comprende el agente de union celular y el agente citotoxico se pone en contacto con el reactivo de reticulacion bifuncional, la reaccion se deja continuar durante aproximadamente 1 hora, aproximadamente 2 horas, aproximadamente 3 horas, aproximadamente 4 horas, aproximadamente 5 horas, aproximadamente 6 horas, aproximadamente 7 horas, aproximadamente 8 horas, aproximadamente 9 horas, aproximadamente 10 horas, aproximadamente 11 horas, aproximadamente 12 horas, aproximadamente 13 horas, aproximadamente 14 horas, aproximadamente 15 horas, aproximadamente 16 horas, aproximadamente 17 horas, aproximadamente 18 horas, aproximadamente 19 horas, aproximadamente 20 horas, aproximadamente 21 horas, aproximadamente 22 horas, aproximadamente 23 horas, aproximadamente 24 horas o mas (por ejemplo, aproximadamente 30 horas, aproximadamente 35 horas, aproximadamente 40 horas, aproximadamente 45 horas o aproximadamente 48 horas).
La puesta en contacto el agente de union celular con el agente citotoxico y despues el reactivo de reticulacion bifuncional (es decir, la etapa de reaccion) se produce en una solucion que tiene un pH de 4 a 9 (por ejemplo, 4, aproximadamente 4,5, aproximadamente 5, aproximadamente 5,5, aproximadamente 6, aproximadamente 6,5, aproximadamente 7, aproximadamente 7,5, aproximadamente 8, aproximadamente 8,5 o 9). En una realizacion, la etapa de reaccion se produce en una solucion que tiene un pH de aproximadamente 6 o menos (por ejemplo, 4 a aproximadamente 6, 4 a aproximadamente 5,5, o aproximadamente 4,5 a aproximadamente 5,5).
En otra realizacion, el proceso de la invencion comprende poner en contacto un agente de union celular es decir, un anticuerpo con un agente citotoxico es decir, un maitansinoide y despues un reactivo de reticulacion bifuncional en una solucion que tiene un pH de aproximadamente 6 o mas (por ejemplo, aproximadamente 6 a 9, aproximadamente 6 a aproximadamente 7, aproximadamente 7 a 9, aproximadamente 7 a aproximadamente 8,5, aproximadamente 7,5 a aproximadamente 8,5, aproximadamente 7,5 a aproximadamente 8,0, aproximadamente 8,0 a 9,0, o aproximadamente 8,5 a 9,0). Por ejemplo, el proceso de la invencion comprende poner en contacto un agente de union celular es decir, un anticuerpo con un agente citotoxico es decir, un maitansinoide y un reactivo de reticulacion bifuncional en una solucion que tiene un pH de aproximadamente 6,0, aproximadamente 6,1, aproximadamente 6,2, aproximadamente 6,3, aproximadamente 6,4, aproximadamente 6,5, aproximadamente 6,6, aproximadamente 6,7, aproximadamente 6,8, aproximadamente 6,9, aproximadamente 7,0, aproximadamente 7,1, aproximadamente 7,2, aproximadamente 7,3, aproximadamente 7,4, aproximadamente 7,5, aproximadamente 7,6, aproximadamente 7,7, aproximadamente 7,8, aproximadamente 7,9, aproximadamente 8,0, aproximadamente 8,1, aproximadamente 8,2, aproximadamente 8,3, aproximadamente 8,4, aproximadamente 8,5, aproximadamente 8,6, aproximadamente 8,7, aproximadamente 8,8, aproximadamente 8,9 o 9,0. En una realizacion especlfica, el proceso de la invencion comprende poner un agente de union celular es decir, un anticuerpo en contacto con un agente citotoxico es decir, un maitansinoide y un reactivo de reticulacion bifuncional en una solucion con un pH de aproximadamente 7,8 (por ejemplo, un pH de 7,6 a 8,0 o un pH de 7,7 a 7,9).
El proceso de la invencion comprende llevar a cabo la reaccion en una sola etapa (es decir, poner en contacto un agente de union celular es decir, un anticuerpo con un agente citotoxico es decir, un maitansinoide y despues un reactivo de reticulacion bifuncional) a cualquier temperatura adecuada conocida en la tecnica. Por ejemplo, la reaccion en una sola etapa puede ocurrir a aproximadamente 20 °C o menos (por ejemplo, aproximadamente -10 °C (con la condicion de que se evite que la solucion se congele, por ejemplo, mediante la presencia de un disolvente organico usado para disolver el agente citotoxico y el reactivo de reticulacion bifuncional) a aproximadamente 20 °C, aproximadamente 0 °C a aproximadamente 18 °C, aproximadamente 4 °C a aproximadamente 16 °C), a temperatura ambiente (por ejemplo, aproximadamente 20 °C a aproximadamente 30 °C, o aproximadamente 20 °C a aproximadamente 25 °C), o a una temperatura elevada (por ejemplo, aproximadamente 30 °C a aproximadamente 37 °C). En una realizacion, la puesta en contacto de un agente de union celular es decir, un anticuerpo con un agente citotoxico es decir, un maitansinoide y un reactivo de reticulacion bifuncional se produce a una temperatura de aproximadamente 16 °C a aproximadamente 24 °C (por ejemplo, aproximadamente 16 °C, aproximadamente 17 °C, aproximadamente 18 °C, aproximadamente 19 °C, aproximadamente 20 °C, aproximadamente 21 °C, aproximadamente 22 °C, aproximadamente 23 °C, aproximadamente 24 °C o aproximadamente 25 °C).
En otra realizacion, la puesta en contacto de un agente de union celular es decir, un anticuerpo con un agente citotoxico es decir, un maitansinoide y despues con un reactivo de reticulacion bifuncional se produce a una temperatura de aproximadamente 15 °C o menos (por ejemplo, aproximadamente -10 °C a aproximadamente 15 °C, o de aproximadamente 0 °C a aproximadamente 15 °C). En este sentido, el proceso de la invencion comprende poner un agente de union celular es decir, un anticuerpo en contacto con un agente citotoxico es decir, un maitansinoide y despues con un reactivo de reticulacion bifuncional a una temperatura de 15 °C, aproximadamente 14 °C, aproximadamente 13 °C, aproximadamente 12 °C, aproximadamente 11 °C, aproximadamente 10 °C, aproximadamente 9 °C, aproximadamente 8 °C, aproximadamente 7 °C, aproximadamente 6 °C, aproximadamente 5
°C, aproximadamente 4 °C, aproximadamente 3 °C, aproximadamente 2 °C, aproximadamente 1 °C, aproximadamente 0 °C, aproximadamente -1 °C, aproximadamente -2 °C, aproximadamente -3 °C, aproximadamente -4 °C, aproximadamente -5 °C, aproximadamente -6 °C, aproximadamente -7 °C, aproximadamente -8 °C, aproximadamente -9 °C, o aproximadamente -10 °C, con la condicion de que se evite que la solucion se congele, por ejemplo, mediante la presencia de disolvente o disolventes organicos usados para disolver el reactivo de reticulacion bifuncional. En una realization, el proceso de la invention comprende poner un agente de union celular es decir, un anticuerpo en contacto con un agente citotoxico es decir, un maitansinoide y despues con un reactivo de reticulacion bifuncional a una temperatura de aproximadamente -10 °C a aproximadamente 15 °C, aproximadamente 0 °C a aproximadamente 15 °C, aproximadamente 0 °C a aproximadamente 10 °C, aproximadamente 0 °C a aproximadamente 5 °C, aproximadamente 5 °C a aproximadamente 15 °C, aproximadamente 10 °C a aproximadamente 15 °C, o aproximadamente 5 °C a aproximadamente 10 °C. En otra realizacion, el proceso de la invencion comprende poner un agente de union celular es decir, un anticuerpo en contacto con un agente citotoxico es decir, un maitansinoide y despues con un reactivo de reticulacion bifuncional a una temperatura de aproximadamente 10 °C (por ejemplo, una temperatura de 8 °C a 12 °C o una temperatura de 9 °C a 11 °C).
En una realizacion, el proceso de la invencion comprende poner un agente de union celular es decir, un anticuerpo en contacto con un agente citotoxico: es decir, un maitansinoide y despues con un reactivo de reticulacion bifuncional en una solucion con un pH alto (por ejemplo, aproximadamente 7 o mayor) a una baja temperatura (por ejemplo aproximadamente 15 °C o menor). Por ejemplo, en una realizacion, el proceso de la invencion comprende poner un agente de union celular es decir, un anticuerpo en contacto con un agente citotoxico es decir, un maitansinoide y despues con un reactivo de reticulacion bifuncional en una solucion con un pH de aproximadamente 7,5 a una temperatura de aproximadamente 15 °C, en una solucion con un pH de aproximadamente 7,8 a una temperatura de aproximadamente 10 °C, en una solucion con un pH de 8,2 a una temperatura de aproximadamente 0 °C o en una solucion con un pH de 8,5 a una temperatura de aproximadamente 0 °C. En otra realizacion, el proceso de la invencion comprende poner un agente de union celular en contacto con un agente citotoxico y despues con un reactivo de reticulacion bifuncional en una solucion con un pH de 7,0 a 8,5 (por ejemplo, un pH de 7,5 a 8,0) a una temperatura de 5 °C a 15 °C.
En una realizacion, el proceso de la invencion comprende adicionalmente una etapa de inactivation para inactivar cualquier agente citotoxico sin reaccionar y/o reactivo de reticulacion bifuncional sin reaccionar. La etapa de inactivacion se lleva a cabo antes de la purification del agente de union celular y el agente citotoxico. Por ejemplo, el proceso de la invencion comprende (a) poner en contacto a un agente de union celular es decir, un anticuerpo con un agente citotoxico es decir, un maitansinoide para formar una mezcla que comprende el agente de union celular y el agente citotoxico, y despues poner en contacto la mezcla que comprende el agente de union celular y el agente citotoxico con un reactivo de reticulacion bifuncional, que comprende un conector, en una solucion con un pH de 4 a 9 para proporcionar una mezcla que comprende (i) el congujado de agente de union celular y agente citotoxico, donde el agente de union celular esta acoplado qulmicamente al agente citotoxico mediante el conector, (ii) agente citotoxico libre y (iii) subproductos de la reaction, (b) inactivar la mezcla preparada en la etapa (a) para inactivar cualquier agente citotoxico sin reaccionar y/o cualquier reactivo de reticulacion bifuncional sin reaccionar, y (c) purificar la mezcla para proporcionar un conjugado de agente de union celular y agente citotoxico.
En una realizacion, la mezcla se inactiva mediante la puesta en contacto de la mezcla con un reactivo de inactivacion. Tales como se usa en el presente documento, el "reactivo de inactivacion" se refiere a un reactivo que reacciona con el reactivo de reticulacion bifuncional y/o el agente citotoxico libre.
En una realizacion, los reactivos de inactivacion de maleimida o haloacetamida, tales como acido 4-maleimidobutlrico, acido 3-maleimidopropionico, N-etilmaleimida, yodoacetamida o acido yodoacetamidopropionico, pueden usarse para asegurarse de que se inactive cualquier grupo sin reaccionar (tales como tiol) en el agente citotoxico. La etapa de inactivacion puede ayudar a prevenir la dimerization del agente citotoxico, en particular del agente citotoxico que tiene un grupo tiol sin reaccionar (tales como DM1). El agente citotoxico dimerizado puede ser diflcil de retirar. La etapa de inactivacion tambien puede minimizar cualquier reaccion de intercambio tiol-disulfuro no deseada con los grupos disulfuro de anticuerpos naturales. Despues de la inactivacion con reactivos de inactivacion de tiol cargados y polares (tales como acido 4-maleimidobutlrico o acido 3-maleimidopropionico), el exceso de agente citotoxico sin reaccionar se convierte en un aducto soluble en agua cargado y polar, que puede separarse facilmente del conjugado unido covalentemente durante la etapa de purificacion. Tambien puede emplearse la inactivacion con reactivos de inactivacion de tiol neutros y no polares.
En una realizacion, la mezcla se inactiva poniendo en contacto la mezcla con un reactivo de inactivacion que reacciona con el reactivo de reticulacion bifuncional sin reaccionar. Por ejemplo, pueden anadirse nucleofilos a la mezcla para inactivar cualquier reactivo de reticulacion bifuncional sin reaccionar. El nucleofilo es preferentemente un grupo amino que contiene nucleofilos, tales como lisina, taurina o hidroxilamina.
En una realizacion preferida, la reaccion (es decir, poner en contacto un agente de union celular es decir, un anticuerpo con un agente citotoxico es decir, un maitansinoide y despues un reactivo de reticulacion bifuncional) se deja avanzar hasta completar antes de poner en contacto la mezcla con un reactivo de inactivacion. En este aspecto, el agente de inactivacion se anade a la mezcla entre aproximadamente 1 hora y aproximadamente 48 horas (por ejemplo,
aproximadamente 1 hora, aproximadamente 2 horas, aproximadamente 3 horas, aproximadamente 4 horas, aproximadamente 5 horas, aproximadamente 6 horas, aproximadamente 7 horas, aproximadamente 8 horas, aproximadamente 9 horas, aproximadamente 10 horas, aproximadamente 11 horas, aproximadamente 12 horas, aproximadamente 13 horas, aproximadamente 14 horas, aproximadamente 15 horas, aproximadamente 16 horas, aproximadamente 17 horas, aproximadamente 18 horas, aproximadamente 19 horas, aproximadamente 20 horas, aproximadamente 21 horas, aproximadamente 22 horas, aproximadamente 23 horas, aproximadamente 24 horas, o aproximadamente 25 horas a aproximadamente 48 horas) despues de que se ponga en contacto a la mezcla que comprende el agente de union celular y el agente citotoxico con el reactivo de reticulacion bifuncional.
El proceso de la invencion puede incluir opcionalmente la adicion de sacarosa a la etapa de reaccion (es decir, poner en contacto a un agente de union celular es decir, un anticuerpo con un agente citotoxico es decir, un maitansinoide y un reactivo de reticulacion bifuncional) para aumentar la solubilidad y recuperacion de los conjugados de agente de union celular y agentes citotoxicos. De forma deseable, la sacarosa se anade en una concentracion de aproximadamente el 0,1 % (p/v) a aproximadamente el 20 % (p/v) (por ejemplo, aproximadamente el 0,1 % (p/v), el 1 % (p/v), el 5 % (p/v), el 10 % (p/v), el 15 % (p/v), o el 20 % (p/v)). Preferentemente, la sacarosa se anade en una concentracion de aproximadamente el 1 % (p/v) a aproximadamente el 10 % (p/v) (por ejemplo, aproximadamente el 0,5 % (p/v), aproximadamente el 1 % (p/v), aproximadamente el 1,5 % (p/v), aproximadamente el 2 % (p/v), aproximadamente el 3 % (p/v), aproximadamente el 4 % (p/v), aproximadamente el 5 % (p/v), aproximadamente el 6 % (p/v), aproximadamente el 7 % (p/v), aproximadamente el 8 % (p/v), aproximadamente el 9 % (p/v), aproximadamente el 10 % (p/v), o aproximadamente el 11 % (p/v)). A su vez, la etapa de reaccion tambien puede comprender la adicion de un agente tamponante. Puede utilizarse cualquier agente tamponante adecuado conocido en la tecnica. Los agentes tamponantes adecuados incluyen, por ejemplo, un tampon de citrato, un tampon de acetato, un tampon de succinato y un tampon de fosfato. En una realizacion, el agente tamponante se selecciona del grupo que consiste en HEPPSO (acido N-(2-hidroxietil)piperazina-N'-(2-hidroxipropanosulfonico)), POPSO (deshidrato de piperazina-1,4-bis-(acido 2-hidroxi-propano-sulfonico)), HEPES (acido 4-(2-hidroxietil)piperazina-1-etanosulfonico), HEPPS (EPPS) (acido 4-(2-hidroxietil)piperazina-1-propanosulfonico), TES (acido N-[tris(hidroximetil)metil]-2-aminoetanosulfonico) y combinaciones de los mismos.
Despues de la etapa de reaccion, el conjugado de agente de union celular y agente citotoxico se somete a una etapa de purificacion. En este sentido, el conjugado de agente de union celular y agente citotoxico puede purificarse a partir de los otros componentes de la mezcla (por ejemplo, agente citotoxico libre y subproductos de reaccion) usando filtracion de flujo tangencial (TFF, por sus siglas en ingles), el cual es un proceso de filtracion de flujo tangencial en base a membranas, cromatografla de no adsorcion, cromatografla de adsorcion, filtracion de adsorcion, precipitacion selectiva, o cualquier otro proceso de purificacion adecuada, as! como combinaciones de los mismos. En una realizacion de la invencion, el conjugado de agente de union celular y agente citotoxico se purifica usando una unica etapa de purificacion (por ejemplo, TFF). Preferentemente, el conjugado se purifica e intercambia en la formulacion adecuada usando una unica etapa de purificacion (por ejemplo, TFF). En otra realizacion de la invencion, el conjugado de agente de union celular y agente citotoxico se purifica usando dos etapas de purificacion secuenciales. Por ejemplo, el conjugado puede primero purificarse mediante precipitacion selectiva, filtracion de adsorcion, cromatografla de adsorcion o cromatografla de no adsorcion, seguida de purificacion con TFF. Un experto en la materia entendera que la purificacion del conjugado de agente citotoxico y agente de union celular permite que se aisle un conjugado estable que comprende el agente de union celular acoplado quimicamente al agente citotoxico.
Puede utilizarse cualquier sistema adecuado de TFF para la purificacion, incluyendo un sistema tipo Pellicon (Milipore, Billerica, MA), un sistema de casete Sartocon (Sartorius AG, Edgewood, NY), y un sistema de tipo Centrasette (Pall Corp., East Hills, NY).
Puede utilizarse cualquier resina adecuada para cromatografla de adsorcion para la purificacion. Las resinas para cromatografla por adsorcion que se prefieren incluyen cromatografla con hidroxiapatita, cromatografla hidrofobica inducida por carga (HCIC), cromatografla de interaccion hidrofobica (HIC), cromatografla de intercambio ionico, cromatografla de intercambio ionico de modo mixto, cromatografla de afinidad por iones metalicos inmovilizados (IMAC), cromatografla usando pigmentos como ligandos, cromatografla de afinidad, cromatografla de fase inversa, y combinaciones de las mismas. Los ejemplos de resinas adecuadas para hidroxiapatita incluyen ceramicas de hidroxiapatita (CHT Tipo I y Tipo II, Bio-Rad Laboratories, Hercules, CA), hidroxiapatita HA Ultrogel (Pall Corp., East Hills, NY) y ceramicas de fluorapatito (CFT Tipo I y Tipo II, Bio-Rad Laboratories, Hercules, CA). Un ejemplo de una resina adecuada para HCIC es la resina MEP Hypercel (Pall Corp., East Hills, NY). Los ejemplos de resinas adecuadas para HIC incluyen resinas de Butyl-Sepharose, Hexyl-Sepaharose, Phenyl-Sepaharose, y Octyl Sepharose (todas de GE Healthcare, Piscataway, NJ), asi como resinas de metilo Macro-prep y t-butilo Macro-Prep (Biorad Laboratories, Hercules, CA). Los ejemplos de resinas de intercambio ionico adecuadas incluyen SP-Sepharose, CM-Sepharose, y Q-Sepharose (todas de Ge Healthcare, Piscataway, NJ) y resinas S Unosphere (Bio-Rad Laboratories, Hercules, CA).
Los ejemplos de intercambiadores ionicos mixtos adecuados incluyen resinas Bakerbond ABx (JT Baker, Phillipsburg NJ). Los ejemplos de resinas para IMAC adecuadas incluyen resinas Sepharose de quelacion (GE Healthcare, Piscataway, NJ), y resinas Profinity para IMAC (Bio-Rad Laboratories, Hercules, CA). Los ejemplos de resinas para ligandos de pigmentos incluyen resinas Blue Sepharose (GE Healthcare, Piscataway, NJ) y resinas Affi-gel Blue (Bio Rad Laboratories, Hercules, CA). Los ejemplos de resinas de afinidad adecuadas incluyen resinas Protein A Sepharose (por ejemplo, MabSelect, GE Healthcare, Piscataway, NJ), donde el agente de union celular es un
anticuerpo, y resinas de afinidad a la lectina, por ejemplo resinas Lentil Lectin Sepharose (GE Healthcare, Piscataway,
NJ), donde el agente de union celular presenta sitios de union de union de lectina adecuados. De manera alternativa,
se puede utilizar un anticuerpo especlfico para el agente de union celular. Dicho anticuerpo se puede inmovilizar a,
por ejemplo, una resina Sepharose 4 Fast Flow (GE, Healthcare, Piscataway, NJ). Los ejemplos de resinas adecuadas
para fase invertida incluyen resinas C4, C8 y C18 (Grace Vydac, Hesperia, CA).
Puede utilizarse cualquier resina adecuada para cromatografla de no adsorcion para la purificacion. Los ejemplos de
resinas adecuadas para cromatografla de no adsorcion incluyen, pero no se limitan a, SEPHADEX™ G-25, G-50, G-100, resinas SEPHACRYL™ (por ejemplo, S-200 y S-300), resinas SUPERDEX™ (por ejemplo, SUPERDEX™ 75 y
SUPERDEX™ 200), resinas BIO-GEL® (por ejemplo, P-6, P-10, P-30, P-60, y P-100) y otras conocidas para los
expertos en la tecnica.
En una realizacion, el proceso de la invencion comprende tambien una etapa de retencion para liberar los conectores
acoplados de manera inestable del agente de union celular. La etapa de retencion comprende retener la mezcla antes
de la purificacion del conjugado de agente de union celular y agente citotoxico (por ejemplo, despues de la etapa de
reaccion, entre la etapa de reaccion y la etapa de inactivacion, o despues de la etapa de inactivacion). Por ejemplo, el
proceso de la invencion comprende (a) poner en contacto a un agente de union celular es decir, un anticuerpo con un
agente citotoxico es decir, un maitansinoide para formar una mezcla que comprende el agente de union celular y el
agente citotoxico; y despues poner en contacto la mezcla que comprende el agente de union celular y el agente
citotoxico con un reactivo de reticulacion bifuncional, el cual proporciona un conector, en una solucion con un pH de 4
a 9 para proporcionar una mezcla que comprende (i) el congujado de agente de union celular y agente citotoxico,
donde el agente de union celular esta acoplado qulmicamente al agente citotoxico mediante el conector, (ii) agente
citotoxico libre y (iii) subproductos de la reaccion, (b) retener la mezcla tales como se preparo en la etapa (a) para
liberar los conectores unidos de forma inestable del agente de union celular, y (c) purificar la mezcla para proporcionar
un conjugado de agente de union celular y agente citotoxico purificado.
En otra realizacion, el proceso de la invencion comprende (a) poner en contacto a un agente de union celular es decir,
un anticuerpo con un agente citotoxico es decir, un maitansinoide para formar una mezcla que comprende el agente
de union celular y el agente citotoxico, y despues poner en contacto la mezcla que comprende el agente de union
celular y el agente citotoxico con un reactivo de reticulacion bifuncional, el cual proporciona un conector, en una
solucion con un pH de 4 a 9 para proporcionar una mezcla que comprende (i) el congujado de agente de union celular
y agente citotoxico, donde el agente de union celular esta acoplado qulmicamente al agente citotoxico mediante el
conector, (ii) agente citotoxico libre y (iii) subproductos de la reaccion, (b) inactivar la mezcla preparada en la etapa (a)
para inactivar todo agente citotoxico sin reaccionar y/o reactivo de reticulacion bifuncional sin reaccionar, (c) retener
la mezcla tales como se preparo en la etapa (b) para liberar los conectores unidos de forma inestable del agente de
union celular, y (d) purificar la mezcla para proporcionar un conjugado de agente de union celular y agente citotoxico
purificado.
De manera alternativa, la etapa de retencion puede tener lugar despues de la purificacion del conjugado de agente de
union celular y agente citotoxico, y ser seguida de una etapa de purificacion adicional.
En una realizacion preferida, la reaccion (es decir, poner en contacto un agente de union celular es decir, un anticuerpo
con un agente citotoxico es decir, un maitansinoide y despues un reactivo de reticulacion bifuncional) se puede
completar antes de la etapa de retencion. En este aspecto, la etapa de retencion se puede llevar a cabo
aproximadamente 1 hora a aproximadamente 48 horas (por ejemplo, aproximadamente 1 hora, aproximadamente 2
horas, aproximadamente 3 horas, aproximadamente 4 horas, aproximadamente 5 horas, aproximadamente 6 horas,
aproximadamente 7 horas, aproximadamente 8 horas, aproximadamente 9 horas, aproximadamente 10 horas,
aproximadamente 11 horas, aproximadamente 12 horas, aproximadamente 13 horas, aproximadamente 14 ho aproximadamente 15 horas, aproximadamente 16 horas, aproximadamente 17 horas, aproximadamente 18 ho aproximadamente 19 horas, aproximadamente 20 horas, aproximadamente 21 horas, aproximadamente 22 ho aproximadamente 23 horas, aproximadamente 24 horas, o aproximadamente 24 horas a aproximadamente 48 horas)
despues de que se ponga en contacto a la mezcla que comprende el agente de union celular y el agente citotoxico
con el reactivo de reticulacion bifuncional.
La etapa de retencion comprende mantener la solucion a una temperatura adecuada (por ejemplo, entre
aproximadamente 0 °C y aproximadamente 37 °C) durante un perlodo adecuado de tiempo (por ejemplo de
aproximadamente 1 hora a aproximadamente 1 semana, aproximadamente 1 hora a aproximadamente 24 horas,
aproximadamente 1 hora a aproximadamente 8 horas o de aproximadamente 1 hora a aproximadamente 4 horas)
para liberar los conectores acoplados de manera inestable del agente de union celular sin liberar cantidades
considerables de los conectores acoplados de manera estable al agente de union celular. En una realizacion, la etapa
de retencion comprende mantener la solucion a aproximadamente 20 °C o menos (por ejemplo, de aproximadamente
0 °C a aproximadamente 18 °C, de aproximadamente 4 °C a aproximadamente 16 °C), a temperatura ambiente (por
ejemplo de aproximadamente 20 °C a aproximadamente 30 °C o de aproximadamente 20 °C a aproximadamente
25 °C), o a temperaturas elevadas (por ejemplo de aproximadamente 30 °C a aproximadamente 37 °C). En una
realizacion, la etapa de retencion comprende mantener la solucion a una temperatura de aproximadamente 16 °C a
aproximadamente 24 °C (por ejemplo, aproximadamente 15 °C, aproximadamente 16 °C, aproximadamente 17 °C,
aproximadamente 18 °C, aproximadamente 19 °C, aproximadamente 20 °C, aproximadamente 21 °C, aproximadamente 22 °C, aproximadamente 23 °C, aproximadamente 24 °C, o aproximadamente 25 °C). En otra realizacion, la etapa de retencion comprende mantener la solucion a una temperatura de aproximadamente 2 °C a aproximadamente 8 °C (por ejemplo, aproximadamente 0 °C, aproximadamente 1 °C, aproximadamente 2 °C, aproximadamente 3 °C, aproximadamente 4 °C, aproximadamente 5 °C, aproximadamente 6 °C, aproximadamente 7 °C, aproximadamente 8 °C, aproximadamente 9 °C, o aproximadamente 10 °C). En otra realizacion, la etapa de retencion comprende mantener la solucion a una temperatura de alrededor 37 °C (por ejemplo, aproximadamente 34 °C, aproximadamente 35 °C, aproximadamente 36 °C, aproximadamente 37 °C, aproximadamente 38 °C, aproximadamente 39 °C, o aproximadamente 40 °C).
La duracion de la etapa de retencion depende de la temperatura y del pH a los cuales se lleve a cabo la etapa de retencion. Por ejemplo, la duracion de la etapa de retencion puede reducirse considerablemente si la etapa de retencion se lleva a cabo a temperaturas elevadas, donde la temperatura maxima esta limitada por la estabilidad del conjugado de agente de union celular y agente citotoxico. La etapa de retencion puede comprender mantener la solucion por alrededor 1 hora a aproximadamente 1 dla (por ejemplo, aproximadamente 1 hora, aproximadamente 2 horas, aproximadamente 3 horas, aproximadamente 4 horas, aproximadamente 5 horas, aproximadamente 6 horas, aproximadamente 7 horas, aproximadamente 8 horas, aproximadamente 9 horas, aproximadamente 10 horas, aproximadamente 12 horas, aproximadamente 14 horas, aproximadamente 16 horas, aproximadamente 18 horas, aproximadamente 20 horas, aproximadamente 22 horas, o aproximadamente 24 horas), de aproximadamente 10 horas a aproximadamente 24 horas, de aproximadamente 12 horas a aproximadamente 24 horas, de aproximadamente 14 horas a aproximadamente 24 horas, de aproximadamente 16 horas a aproximadamente 24 horas, de aproximadamente 18 horas a aproximadamente 24 horas, de aproximadamente 20 horas a aproximadamente 24 horas, de aproximadamente 5 horas a aproximadamente 1 semana, de aproximadamente 20 horas a aproximadamente 1 semana, de aproximadamente 12 horas a aproximadamente 1 semana (por ejemplo, aproximadamente 12 horas, aproximadamente 16 horas, aproximadamente 20 horas, aproximadamente 24 horas, aproximadamente 2 dlas, aproximadamente 3 dlas, aproximadamente 4 dlas, aproximadamente 5 dlas, aproximadamente 6 dlas, o aproximadamente 7 dlas), o de aproximadamente 1 dla a aproximadamente 1 semana.
En una realizacion, la etapa de retencion comprende mantener la solucion a una temperatura de aproximadamente 2 °C a aproximadamente 8 °C por un perlodo de al menos aproximadamente 12 horas hasta una semana. En otra realizacion, la etapa de retencion comprende mantener la solucion a una temperatura de aproximadamente 2 °C a aproximadamente 8 °C durante la noche (por ejemplo, aproximadamente 12 a aproximadamente 24 horas, preferentemente aproximadamente 20 horas).
El valor de pH para la etapa de retencion es preferentemente de aproximadamente 4 a aproximadamente 10. En una realizacion, el valor de pH para la etapa de retencion es de aproximadamente 4 o mas, pero menor que aproximadamente 6 (por ejemplo 4 a 5.9) o aproximadamente 5 o mas, pero menor que aproximadamente 6 (por ejemplo, 5 a 5.9). En otra realizacion, los valores de pH para la etapa de retencion varlan de entre aproximadamente 6 a aproximadamente 10 (por ejemplo, de aproximadamente 6.5 a aproximadamente 9, de aproximadamente 6 a aproximadamente 8). Por ejemplo, los valores de pH para la etapa de retencion pueden ser aproximadamente 6, aproximadamente 6.5, aproximadamente 7, aproximadamente 7.5, aproximadamente 8, aproximadamente 8.5, aproximadamente 9, aproximadamente 9.5, o aproximadamente 10.
En realizaciones especlficas, la etapa de retencion puede comprender incubar la mezcla a 25 °C a un pH de aproximadamente 6-7,5 por aproximadamente 12 horas a aproximadamente 1 semana, incubar la mezcla a 4 °C a un pH de aproximadamente 4,5-5,9 por aproximadamente 5 horas a aproximadamente 5 dlas, o incubar la mezcla a 25 °C a un pH de aproximadamente 4,5-5,9 por aproximadamente 5 horas a aproximadamente 1 dla.
La invencion proporciona un proceso para la preparacion de composiciones de conjugados estables que comprenden un agente de union celular es decir, un anticuerpo acoplado qulmicamente a un agente citotoxico es decir, un maitansinoide, donde las composiciones se encuentran sustancialmente libres de conjugados inestables. En este sentido, la invencion proporciona un proceso para preparar un conjugado de agente de union celular y agente citotoxico de pureza y estabilidad considerablemente altas. Dichas composiciones pueden usarse para tratar enfermedades dada la elevada pureza y estabilidad de los conjugados. Se describen composiciones que comprenden un agente de union celular, como un anticuerpo, acoplado qulmicamente a un agente citotoxico, como un maitansinoide, en, por ejemplo, la patente de EE.UU. 7.374.762. En un aspecto de la invencion, un conjugado de agente de union celular y agente citotoxico de pureza considerablemente alta tiene una o mas de las siguientes caracterlsticas: (a) mas que aproximadamente 90 % (por ejemplo, mas que o aproximadamente 91 %, 92 %, 93 %, 94 %, 95 %, 96 %, 97 %, 98 %, 99 %, o 100 %), preferentemente mas que aproximadamente 95 %, de las especies del conjugado son monomericas, (b) el nivel de conectores sin conjugar en la preparacion del conjugado es menos que aproximadamente 10 % (por ejemplo, menos que o igual a aproximadamente 9 %, 8 %, 7 %, 6 %, 5 %, 4 %, 3 %, 2 %, 1 %, o 0 %) (con relacion al total de conectores), (c) menos que 10 % de las especies del conjugado presentan reticulacion (por ejemplo, menos que o igual a aproximadamente 9 %, 8 %, 7 %, 6 %, 5 %, 4 %, 3 %, 2 %, 1 %, o 0 %), (d) el nivel de agente citotoxico libre en la preparacion del conjugado es menos que aproximadamente 2 % (por ejemplo, menos que o igual a aproximadamente 1,5 %, 1,4 %, 1,3 %, 1,2 %, 1,1 %, 1,0 %, 0,9 %, 0,8 %, 0,7 %, 0,6 %, 0,5 %, 0,4 %, 0,3 %, 0,2 %, 0,1 %, o 0 %) (mol/mol con relacion al total de agente citotoxico), y/o (e) no presenta un aumento considerable en el
nivel de agente citotoxico libre cuando se almacena (por ejemplo, despues de aproximadamente 1 semana, aproximadamente 2 semanas, aproximadamente 3 semanas, aproximadamente 1 mes, aproximadamente 2 meses, aproximadamente 3 meses, aproximadamente 4 meses, aproximadamente 5 meses, aproximadamente 6 meses, aproximadamente 1 ano, aproximadamente 2 anos, aproximadamente 3 anos, alrededor 4 anos o aproximadamente 5 anos). Un "aumento considerable" en los niveles de agente citotoxico libre significa que, despues de cierto tiempo de almacenamiento (por ejemplo, aproximadamente 1 semana, aproximadamente 2 semanas, aproximadamente 3 semanas, aproximadamente 1 mes, aproximadamente 2 meses, aproximadamente 3 meses, aproximadamente 4 meses, aproximadamente 5 meses, aproximadamente 6 meses, aproximadamente 1 ano, aproximadamente 2 anos, aproximadamente 3 anos, aproximadamente 4 anos o aproximadamente 5 anos), el aumento en el nivel de agente citotoxico es menor que aproximadamente 0,1 %, aproximadamente 0,2 %, aproximadamente 0,3 %, aproximadamente 0,4 %, aproximadamente 0,5 %, aproximadamente 0,6 %, aproximadamente 0,7 %, aproximadamente 0,8 %, aproximadamente 0,9 %, aproximadamente 1,0 %, aproximadamente 1,1 %, aproximadamente 1,2 %, aproximadamente 1,3 %, aproximadamente 1,4 %, aproximadamente 1,5 %, aproximadamente 1,6 %, aproximadamente 1,7 %, aproximadamente 1,8 %, aproximadamente 1,9 %, aproximadamente 2,0 %, aproximadamente 2,2 %, aproximadamente 2,5 %, aproximadamente 2,7 %, aproximadamente 3,0 %, aproximadamente 3,2 %, aproximadamente 3,5 %, aproximadamente 3,7 %, o aproximadamente 4,0 %.
Como se utiliza en el presente documento, la frase "conector sin conjugar" se refiere al agente de union celular que se enlaza, mediante enlaces covalentes, al reactivo de reticulacion bifuncional, donde el agente de union celular no se encuentra enlazado mediante enlaces covalentes al agente citotoxico por medio del conector del reactivo de reticulacion bifuncional (es decir, el "conector sin conjugar" puede representarse como CBA-L, donde CBA representa el agente de union celular y L representa el reactivo de reticulacion bifuncional. Por el contrario, el conjugado de agente de union celular y agente citotoxico se puede representar como CBA-L-D, donde D representa al agente citotoxico).
En una realizacion, la razon molar promedio del agente citotoxico al agente de union celular en el conjugado de agente de union celular y agente citotoxico es de aproximadamente 1 a aproximadamente 10, de aproximadamente 2 a aproximadamente 7, de aproximadamente 3 a aproximadamente 5, de aproximadamente 2,5 a aproximadamente 4,5 (por ejemplo, de aproximadamente 2,5, de aproximadamente 2,6, de aproximadamente 2,7, de aproximadamente 2,8, de aproximadamente 2,9, de aproximadamente 3,0, de aproximadamente 3,1, de aproximadamente 3,3, de aproximadamente 3,4, de aproximadamente 3,5, de aproximadamente 3,6, de aproximadamente 3,7, de aproximadamente 3,8, de aproximadamente 3,9, de aproximadamente 4,0, de aproximadamente 4,1, de aproximadamente 4,2, de aproximadamente 4,3, de aproximadamente 4,4, de aproximadamente 4,5), de aproximadamente 3,0 a aproximadamente 4,0, de aproximadamente 3,2 a aproximadamente 4,2 o de aproximadamente 4,5 a 5,5 (por ejemplo, de aproximadamente 4,5, de aproximadamente 4,6, de aproximadamente 4,7, de aproximadamente 4,8, de aproximadamente 4,9, de aproximadamente 5,0, de aproximadamente 5,1, de aproximadamente 5,2, de aproximadamente 5,3, de aproximadamente 5,4 o de aproximadamente 5,5).
La presente invencion proporciona un proceso mas eficaz para preparar composiciones de conjugados estables que comprenden un agente de union celular es decir, un anticuerpo que se acopla qulmicamente a un agente citotoxico es decir, un maitansinoide. En una realizacion, en comparacion con los procesos tradicionales para la preparacion de conjugados de un agente de union celular y un agente citotoxico, se necesita menor cantidad de agente citotoxico para alcanzar la misma razon molar promedio de agente citotoxico a agente de union celular para los conjugados.
Los agentes de union celular adecuados incluyen anticuerpos (por ejemplo anticuerpos monoclonales y fragmentos de los mismos).
Cuando el agente de union celular es un anticuerpo, se une a un antlgeno que es un polipeptido o un glicotopo y puede ser una molecula transmembrana (por ejemplo, receptor) o un ligando como un factor de crecimiento. Los antlgenos ejemplares incluyen moleculas tales como renina; una hormona de crecimiento, incluyendo hormona de crecimiento humana y hormona de crecimiento bovina; factor de liberacion de la hormona de crecimiento; hormona paratiroidea; hormona de estimulacion de la tiroides; lipoprotelnas; alfa-1-antitripsina; cadena A de insulina; cadena B de insulina; proinsulina; hormona follculo-estimulante; calcitonina; hormona luteinizante; glucagon; factores de coagulacion como el factor vmc, factor IX, factor tisular (TF) y factor de von Willebrand; factores anticoagulantes como la Protelna C; factor natriuretico auricular; tensioactivo pulmonar; un activador de plasminogeno, como uroquinasa u orina humana o activador de plasminogeno de tipo tisular (t-PA); bombesina; trombina; factor de crecimiento hematopoyetico; factor de necrosis tumoral alfa y beta; encefalinasa; RANTES (regulada al momento de la activacion normalmente expresada y secretada por celulas T); protelna inflamatoria de macrofago humana (MIP-1-alfa); una albumina serica, como albumina serica humana; sustancia inhibidora Muelleriana; cadena A de relaxina; cadena B de relaxina; prorrelaxina; peptido asociado con la gonadotropina de ratones; una protelna microbiana, como beta-lactamasa; DNasa; IgE; un antlgeno asociado con el linfocito T citotoxico (CTLA), como CTLA-4; inhibina; activina; factor de crecimiento endotelial vascular (VEGF); receptores para hormonas o factores de crecimiento; protelna A o D; factores reumatoides; un factor neurotrofico, como un factor neurotrofico derivado del hueso (BDNF), neurotrofina-3, -4, -5 o -6 (NT-3, NT4, NT-5 o NT-6) o un factor de crecimiento de nervios como NGF-p; factor de crecimiento derivado de plaquetas (PDGF); factor de crecimiento de fibroblastos como aFGF y bFGF; factor de crecimiento epidermico (EGF); factor de crecimiento de transformacion (TGF) como TGF-alfa y TGF-beta, incluyendo TGF-p1, TGF-p2, TGF-p3, TGF-pb4 o TGF-p5; factor
de crecimiento de tipo insulina I y II (IGF-I y IGF-II); des(1-3)-IGF-I (IGF-I cerebral); protelnas de union al factor de crecimiento tipo insulina; EpCAM; GD3; FLt 3; PSmA; PSCA; Mu C1; Mu C16; STEa P; CEA; TENB2; receptores EphA; receptores EphB; receptor de folato; FOLR1; mesotelina; cripto; alfavbeta6; integrinas; VEGF; VEGFR; receptor EGFR de tarnsferrina; IRTA1; IRTA2; IRTA3; IRTA4; IRTA5; protelnas CD como CD2, CD3, CD4, CD5, CD6, CD8, CD11, CD14, CD19, CD20, CD21, CD22, CD25, CD26, CD28, CD30, CD33, CD36, CD37, CD38, CD40, CD44, CD52, CD55, CD56, CD59, CD70, CD79, CD80. CD81, CD103, CD105, CD134, CD137, CD138, CD152 o un anticuerpo que se une a uno o mas antlgenos asociados con tumores o receptores de la superficie celular descritos en la Publication de EE.UU. N.° 2008/0171040 o la Publicacion de EE.UU. N.° 2008/0305044; eritropoyetina; factores osteoinductivos; immunotoxinas; una protelna morfogenetica osea (BMP); un interferon, como interferon alfa, beta y gamma; factores de estimulacion de colonias (CSF), por ejemplo, M-CSF, GM-CSF y G-CSF; interleucinas (IL), por ejemplo, IL-1 a IL-10; superoxido dismutasa; receptores de celulas T; protelnas de membrana superficial; factor de aceleracion del deterioro; antlgenos virales como, por ejemplo, una parte de la envoltura del VIH; protelnas de transporte; receptores de alojamiento; adresinas; protelnas reguladoras; integrinas, como CD11a, CD11b, CD11c, CD18, un ICAM, VLA-4 y VCAM; un antlgeno asociado con tumores como el receptor de HER2, HER3 o HER4; endoglina; c-Met; IGF1R; antlgenos prostaticos como PCA3, PSA, PSGR, NGEP, PSMA, PSCA, TMEFF2 y STEAP1; LGR5; B7H4; y fragmentos de cualquiera de los polipeptidos listados anteriormente.
Adicionalmente puede usarse GM-CSF, que se une a celulas mieloides, como agente de union celular para celulas enfermas de leucemia mielogena aguda. La IL-2 que se une a celulas T activadas se puede usar para la prevention del rechazo de injertos en trasplantes, para la terapia y la prevencion de la enfermedad de injerto contra el huesped y para el tratamiento de leucemia aguda de celulas T. Se pueden usar MSH que se unen a melanocitos, se puede usar para el tratamiento del melanoma, as! como anticuerpos dirigidos hacia melanomas. El acido folico se puede usar para dirigirse al receptor de folato expresado en tumores de ovarios y de otro tipo. El factor de crecimiento epidermico se puede usar para dirigirse a canceres escamosos como el de pulmon y el de cabeza y cuello. La somatostatina se puede usar para dirigirse a neuroblastomas y otros tipos tumorales.
El termino "anticuerpo" como se utiliza en el presente documento, se refiere a cualquier inmunoglobulina, cualquier fragmento de inmunoglobulina, como Fab, Fab', F(ab')2, dsFv, sFv, minicuerpos, diacuerpos, tricuerpos, tetracuerpos (Parham, J. Immunol. 131: 2895-2902 (1983); Spring et al. J. Immunol. 113: 470-478 (1974); Nisonoff et al. Arch. Biochem. Biophys. 89: 230-244 (1960), Kim et al., Mol, Cancer Ther., 7: 2486-2497 (2008), Carter, Nature Revs., 6: 343-357 (2006)), o inmunoglobulina quimerica, que se pueden unir a un antlgeno en la superficie de una celula (por ejemplo, que contiene una region determinante de complementariedad (CDR)). Se puede utilizar cualquier anticuerpo adecuado como el agente de union celular. Un experto en la materia entendera que la selection de un anticuerpo apropiado dependera de la poblacion celular diana. En este sentido, el tipo y numero de moleculas de la superficie celular (es decir, antlgenos) que se expresan selectivamente en una poblacion celular particular (tlpica y preferiblemente una poblacion celular enferma) regira la seleccion de un anticuerpo apropiado para ser utilizado en la composition inventiva. Se conocen los perfiles de expresion de la superficie celular para varios tipos celulares, incluyendo tipos de celulas tumorales, o, en caso de desconocerse, estos se pueden determinar utilizando tecnicas de rutina de biologla molecular e histoqulmica.
El anticuerpo puede ser policlonal o monoclonal, pero preferentemente es un anticuerpo monoclonal. Como se utiliza en el presente documento, anticuerpo "policlonal" hace referencia a poblaciones heterogeneas de moleculas de anticuerpos, tlpicamente encontradas en suero de animales inmunizados. Anticuerpo "monoclonal" se refiere a poblaciones homogeneas de moleculas de anticuerpos que son especlficas para un antlgeno particular. Tlpicamente, los anticuerpos monoclonales son producidos por un clon simple de linfocitos B ("celulas B"). Se pueden obtener anticuerpos monoclonales utilizando varias tecnicas conocidas por los expertos en la tecnica, incluyendo tecnologla estandar de hibridoma (vease, por ejemplo, Kohler and Milstein, Eur. J. Immunol., 5: 511-519 (1976), Harlow y Lane (eds.), Antibodies: A Laboratory Manual, CSH Press (1988), y C.A. Janeway et al. (eds.), Immunobiology, 5a Ed., Garland Publishing, Nueva York, NY (2001)). En resumen, el metodo de hibridoma para producir anticuerpos monoclonales suele implicar inyectar a cualquier animal adecuado, tlpica y preferentemente un raton, un antlgeno (es decir, un "inmunogeno"). Despues el animal es sacrificado, y los linfocitos B que se alslan de su bazo se fusionan con las celulas de mieloma humano. Se produce una celula hlbrida (es decir, un "hibridoma"), la cual prolifera indefinidamente y secreta, de forma continua, titulaciones elevadas de anticuerpos con la especificidad deseada in vitro. Se puede utilizar cualquier metodo apropiado conocido en la tecnica para identificar celulas hibridoma que producen un anticuerpo con la especificidad deseada. Dichos metodos incluyen, por ejemplo, el ensayo por inmunoabsorcion ligado a enzimas (ELISA), analisis de transferencia Western y radioinmunoensayo. La poblacion de hibridomas se analiza para aislar clones individuales, cada uno de los cuales secreta una unica especie de anticuerpo para el antlgeno. Dado que cada hibridoma es un clon derivado de la fusion con un unico linfocito B, todas las moleculas de anticuerpo que produce son identicas en cuanto a su estructura, incluyendo sus sitios de union al antlgeno y su isotipo. Tambien se pueden generar anticuerpos monoclonales utilizando otras tecnicas adecuadas incluyendo tecnologla de hibridoma-EBV (vease, por ejemplo Haskard y Archer, J. Immunol. Methods, 74(2): 361-67 (1984), y Roder et al., Methods Enzymol., 121: 140-67 (1986)), sistemas de vectores de expresion bacteriofagos (vease, por ejemplo, Huse et al., Science, 246: 1275-81 (1989)), o bibliotecas de expresion en fagos que comprenden fragmentos de anticuerpos, como Fab y scFv (region variable de cadena simple) (vease, por ejemplo las patentes de EE.UU. 5.885.793 y 5.969.108, y las publicaciones de solicitudes de patentes internacionales WO 92/01047 y WO 99/06587).
El anticuerpo monoclonal puede aislarse de o producirse en cualquier animal adecuado, pero preferentemente se produce en un mamifero, mas preferentemente un raton o un humano, y mas preferentemente un humano. Se conocen en la tecnica y se describen en el presente documento metodos para producir un anticuerpo en ratones. En lo que respecta a anticuerpos humanos, el experto en la tecnica entendera que se pueden aislar anticuerpos policlonales del suero de sujetos humanos vacunados o inmunizados con el antigeno adecuado. De manera alternativa, se pueden generar anticuerpos humanos adaptando tecnicas conocidas para producir anticuerpos humanos en animales que no son humanos, como ratones (vease, por ejemplo, las patentes de EE.UU. 5.545.806, 5.569.825 y 5.714.352, y la publicacion de solicitud de patente de EE.u U. N.° 2002/0197266 A1).
Mientras que son la opcion ideal para aplicaciones terapeuticas en humanos, los anticuerpos humanos, en especial los anticuerpos monoclonales humanos, son tipicamente mas dificiles de generar que los anticuerpos monoclonales de raton. Los anticuerpos monoclonales de raton, sin embargo, inducen una rapida respuesta de anticuerpos del huesped cuando se administran a humanos, lo que puede reducir el potencial diagnostico o terapeutico del conjugado de anticuerpo y agente citotoxico. Para evitar estas complicaciones, preferentemente un anticuerpo monoclonal no es considerado "extrano" por el sistema inmunitario humano.
Con este fin, puede utilizarse la expresion en fagos para generar el anticuerpo. En este sentido, las bibliotecas de fagos que codifican dominios variables (V) de union a antigenos para anticuerpos pueden generarse utilizando tecnicas de rutina de la biologia molecular y el ADN recombinante (vease, por ejemplo, Sambrook et al. (eds.), Molecular Cloning, A Laboratory Manual, 3a Edicion, Cold Spring Harbor Laboratory Press, Nueva York (2001)). Se seleccionan regiones variables de codificacion de fagos con la especificidad deseada para la union especifica al antigeno deseado, y se reconstituyen anticuerpos humanos completos que comprenden el dominio variable seleccionado. Se introducen secuencias de acido nucleico que codifican el anticuerpo reconstituido a una linea celular adecuada, como una celula de mieloma utilizada para la produccion de hibridomas, de manera tal que la celula secrete anticuerpos humanos con las caracteristicas de anticuerpos monoclonales (vease, por ejemplo, Janeway et al., supra, Huse et al., supra, y la patente de EE.UU. 6,265,150). De manera alternativa, se pueden generar anticuerpos monoclonales con ratones que sean transgenicos para genes de inmunoglobulina de cadena ligera y pesada especificos para humanos. Dichos metodos son conocidos en la tecnica y se describen, por ejemplo, en las patentes de EE.UU. 5.545.806 y 5.569.825 y en Janeway et al., supra.
Mas preferentemente, el anticuerpo es un anticuerpo humanizado. Como se utiliza en el presente documento, un anticuerpo "humanizado" es uno en que las regiones determinantes de complementariedad (CDR) de un anticuerpo monoclonal de raton, que forman los lazos de union del anticuerpo, se injertan al marco de una molecula de anticuerpo humano. Dadas las similitudes en los marcos de los anticuerpos de raton y de humano, se acepta mayoritariamente en la tecnica que este metodo produce un anticuerpo monoclonal que es antigenicamente identico al anticuerpo humano, pero se une al mismo antigeno que el anticuerpo monoclonal de raton del que se derivaron las secuencias de CDR. Se describen detalladamente metodos conocidos en la tecnica para generar anticuerpos humanizados, por ejemplo, en Janeway et al., supra, las patentes de EE.UU. 5.225.539, 5.585.089 y 5.693.761, la patente europea n.° 0239400 B1, y la patente del Reino Unido n.° 2188638. Tambien se pueden generar anticuerpos humanizados utilizando la tecnologia de revestimiento de anticuerpos que se describe en la patente de EE.UU. 5.639.641 y Pedersen et al., J. Mol. Biol., 235: 959-973 (1994). Mientras que el anticuerpo utilizado en el conjugado de la composicion inventiva es, mas preferentemente, un anticuerpo monoclonal humanizado, un anticuerpo monoclonal humano y un anticuerpo monoclonal de raton, como se describe anteriormente, tambien se encuentran dentro del alcance de la invencion.
Tambien se incluyen dentro del alcance de la invencion fragmentos de anticuerpos que tienen al menos un sitios de union de antigeno y que por lo tanto reconocen y se unen a al menos un antigeno o receptor que se encuentra en la superficie de la celula diana. En este sentido, la escision proteolitica de una molecula de anticuerpo intacta puede producir multiples fragmentos de anticuerpos que mantienen la capacidad de reconocer y unirse a antigenos. Por ejemplo, la digestion limitada de una molecula de anticuerpo con la papaina de proteasa tipicamente produce tres fragmentos, dos de los cuales son identicos y se los llama fragmentos Fab, ya que pueden mantener la actividad de union a antigenos de la molecula madre de anticuerpo. La escision de una molecula de anticuerpo con la enzima pepsina suele producir dos fragmentos de anticuerpo, uno de los cuales mantiene ambos brazos de union a antigenos de la molecula de anticuerpo, y por lo tanto se lo llama fragmento F(ab')2. La reduction de un fragmento F(ab')2 con ditiotereitol o mercaptoetilamina produce el fragmento que se llama fragmento Fab'. Se puede generar un fragmento de anticuerpo de region variable de cadena sencilla (sFv), que consiste en un fragmento Fab truncado que comprende el dominio variable (V) de una cadena pesada de anticuerpo unido a un domino V de una cadena ligera de anticuerpo mediante un peptido sintetico, utilizando tecnicas de rutina de tecnologia de ADN recombinante (vease, por ejemplo Janeway et al., supra). De manera similar, se pueden preparar fragmentos de region variable estabilizados con disulfuro (dsFv) usando tecnologia de ADN recombinante (vease, por ejemplo, Reiter et al., Protein Engineering, 7: 697-704 (1994)). Sin embargo, en el contexto de la invencion los fragmentos de anticuerpo no se ven limitados a estos ejemplos de tipos de fragmentos de anticuerpos. Se puede utilizar todo fragmento de anticuerpo adecuado que reconozca y se una a un receptor o antigeno deseado de la superficie de una celula. Los fragmentos de anticuerpos se describen adicionalmente, por ejemplo, en Parham, J. Immunol., 131: 2895-2902 (1983), Spring et al., J. Immunol., 113: 470-478 (1974), y Nisonoff et al., Arch. Biochem. Biophys., 89: 230-244 (1960). La union entre anticuerpos y antigenos se puede analizar utilizando cualquier metodo adecuado conocido en la tecnica como, por ejemplo,
radioinmunoensayos (RIA), ELISA, transferencia Western, inmunoprecipitacion y ensayos de inhibicion competitiva (vease, por ejemplo, Janeway et al., supra, y la publicacion de solicitud de patente de e E.UU. n.° 2002/0197266 A1).
A su vez, el anticuerpo puede ser un anticuerpo quimerico o un fragmento de union al antlgeno del mismo. Con "quimerico" quiere decirse que el anticuerpo comprende al menos dos inmunoglobulinas, o fragmentos de las mismas, obtenidas o derivadas de al menos dos especies diferentes (por ejemplo, dos inmunoglobulinas diferentes, como una region constante de inmunoglobulina humana combinada con una region variable de inmunoglobulina murina). El anticuerpo tambien puede ser un anticuerpo de domino (dAb) o un fragmento de union al antlgeno del mismo como, por ejemplo, un anticuerpo camelido (vease, por ejemplo, Desmyter et al., Nature Struct. Biol., 3: 752, (1996)), o un anticuerpo de tiburon, como, por ejemplo, un nuevo receptor de antlgenos (IgNAR) (vease, por ejemplo, Greenberg et al., Nature, 374: 168 (1995), y Stanfield et al., Science, 305: 1770-1773 (2004)).
Puede usarse cualquier anticuerpo adecuado en el contexto de la invencion. Por ejemplo, el anticuerpo monoclonal J5 es un anticuerpo IgG2a murino que es especlfico para el antlgeno de leucemia linfoblastica aguda comun (CALLA) (Ritz et al., Nature, 283: 583-585 (1980)), y se puede utilizar para dirigirse a las celulas que expresan CALLA (por ejemplo, celulas de leucemia linfoblastica aguda). El anticuerpo monoclonal MY9 es un anticuerpo IgG1 murino que se une especlficamente a el antlgeno CD33 (Griffin et al., Leukemia Res., 8: 521 (1984)), y se puede utilizar para combatir celulas que expresan CD33 (por ejemplo celulas de leucemia mielogena aguda (AML)).
De manera similar, el anticuerpo monoclonal anti-B4 (tambien llamado B4) es un anticuerpo IgG1 murino que se une al antlgeno CD19 en linfocitos B (Nadler et al., J. Immunol., 131: 244-250 (1983)), y se puede utilizar para combatir linfocitos B o celulas enfermas que expresen CD19 (por ejemplo, celulas de linfoma no-Hodgkin y celulas de leucemia linfocltica cronica). el N901 es un anticuerpo monoclonal murino que se une al antlgeno CD56 (molecula de adhesion celular neural) presente en celulas de origen neuroendocrino, incluyendo tumores de pulmon de celulas pequenas, que pueden ser usadas en el conjugado para dirigir farmacos a celulas de origen neuroendocrino. Los anticuerpos J5, MY9 y B4 preferentemente se revisten o humanizan antes de ser utilizados como parte del conjugado. El revestimiento o la humanizacion de anticuerpos se describe, por ejemplo, en Roguska et al., Proc. Natl. Acad. Sci. USA, 91: 969-73 (1994).
Ademas, el anticuerpo monoclonal C242 se une al antlgeno CanAg (vease, por ejemplo, la patente de EE.UU.
5.552.293), y se puede utilizar para dirigir el conjugado a tumores que expresan CanAg, como pueden ser el cancer colorrectal, cancer pancreatico, cancer de pulmon de celulas no pequenas, y cancer gastrico. El HuC242 es una forma humanizada del anticuerpo monoclonal C242 (vease, por ejemplo, la patente de EE.UU. 5.552.293). El hibridoma a partir del cual se forma el HuC242 se encuentra registrado con el numero de identification ECACC 90012601. El HuC242 se puede preparar utilizando metodos de injerto de CDR (vease, por ejemplo, las patentes de EE.UU.
5.585.089, 5.693.761 y 5.693.762) o tecnologla de revestimiento (vease, por ejemplo, la patente de EE.UU. 5.639.641). El HuC242 se puede utilizar para dirigir al conjugado hacia celulas tumorales que expresan el antlgeno CanAg como, por ejemplo, celulas de cancer colorrectal, pancreatico, de pulmon de celulas no microclticas y gastrico.
Para combatir celulas de cancer de ovario y cancer de prostata, puede utilizarse un anticuerpo anti-MUC1 como el agente de union celular en el conjugado. Los anticuerpos anti-MUC1 incluyen, por ejemplo, anti-HMFG-2 (vease, por ejemplo, Taylor-Papadimitriou et al., Int. J. Cancer, 28: 17-21 (1981)), hCTM01 (vease, por ejemplo, van Hof et al., Cancer Res., 56: 5179-5185 (1996)), y DS6. Las celulas de cancer de prostata tambien pueden combatirse con el conjugado utilizando un antlgeno prostatico especlfico de membrana (PSMA) como el agente de union celular, como un J591 (vease, por ejemplo, Liu et al., Cancer Res., 57: 3629-3634 (1997)). Ademas, las celulas cancerosas que expresan el antlgeno Her2, tales como los canceres de seno, de prostata y de ovario, se pueden combatir con el conjugado usando anticuerpos anti-Her2, por ejemplo, trastuzumab, como el agente de union celular. Las celulas que expresan el factor de crecimiento epidermico (EGFR) y sus variantes, como un mutante por deletion tipo III, EGFRvIII, pueden combatirse con el conjugado usando anticuerpos anti-EGFR. Los anticuerpos anti-EGFR se describen en las solicitudes internacionales de patente n.° PCT/US11/058385 y PCT/US11/058378. Se describen anticuerpos anti-EGFRvIII en las patentes de EE.UU. 7.736.644 y 7.628.986, y en las publicaciones de solicitud de EE.UU.
2010/0111979, 2009/0240038, 2009/0175887, 2009/0156790, y 2009/0155282. Los anticuerpos anti-IGF-IR que se unen al receptor de factor de crecimiento similar a la insulina, como los que se describen en la patente de EE.UU.
7.982.024, tambien se pueden usar en el conjugado. Tambien pueden usarse en el conjugado los anticuerpos que se unen a CD27L, Cripto, CD138, CD38, EphA2, integrinas, CD37, folato, CD20, PSGR, NGEP, PSCA, TMEFF2, STEAP1, endoglina, y Her3.
En una realization, el anticuerpo se selecciona del grupo que consiste en huN901, huMy9-6, huB4, huC242, un anticuerpo anti-HER2 (por ejemplo, trastuzumab), bivatuzumab, sibrotuzumab, rituximab, huDS6, anticuerpos antimesotelina descritos en la publicacion de solicitud de patente internacional WO 2010/124797 (como MF-T), anticuerpos anti-cripto descritos en la publicacion de solicitud de patente de EE.UU. 2010/0093980 (como huB3F6), anticuerpos anti-CD138 descritos en la publicacion de solicitud de patente de EE.UU. 2007/0183971 (como huB-B4), anticuerpos anti-EGFR descritos en las solicitudes de patente internacional n.° PCT/US11/058385 y PCT/US11/058378 (como EGFR-7), anticuerpos anti-EGFRvIII descritos en las patentes de EE.UU. 7.736.644 y 7.628.986 y las publicaciones de solicitudes de patentes de EE.UU. 2010/0111979, 2009/0240038, 2009/0175887, 2009/0156790 y 2009/0155282, los anticuerpos humanizados EphA2 descritos en las publicaciones de solicitudes
internacionales de patentes WO 2011/039721 y WO 2011/039724 (como 2H11R35R74); anticuerpos anti CD38 descritos en la publication de solicitud de patente internacional WO 2008/047242 (como hu38SB19), anticuerpos antifolato descritos en la publicacion de solicitud de patente internacional WO 2011/106528 y la publicacion de solicitud de patente de EE.UU. 2012/0009181 (por ejemplo, huMov19), anticuerpos anti-IGF1R descritos en las patentes de EE.UU. 5.958.872, 6.596.743, y 7.982.024; anticuerpos anti-CD37 descritos en la publicacion de solicitud de patente de EE.UU. 2011/0256153 (por ejemplo, huCD37-3); anticuerpos anti-integrina av06 descritos en la publicacion de solicitud de EE.UU. 2006/0127407 (por ejemplo, CNTO95); y anticuerpos anti-Her3 descritos en la publicacion de solicitud de patente internacional w O 2012/019024.
Los anticuerpos particularmente preferidos son los anticuerpos monoclonales humanizados que se describen en el presente documento. Los ejemplos incluyen, pero no se limitan a, huN901, huMy9-6, huB4, huC242, un anticuerpo monoclonal humanizado anti-Her2 (por ejemplo, trastuzumab), bivatuzumab, sibrotuzumab, CNTO95, huDS6, y rituximab (vease, por ejemplo, las patentes de EE.UU. 5.639.641 y 5.665.357, la solicitud de patente de EE.UU. provisional n.° 60/424.332 (que esta conectada con la patente de EE.UU. 7.557.189), la publicacion de solicitud de patente internacional (PCT) WO 02/16401, Pedersen et al., supra, Roguska et al., supra, Liu et al., supra, Nadler et al., supra, Colomer et al., Cancer Invest., 19: 49-56 (2001), Heider et al., Eur. J. Cancer, 31A: 2385-2391 (1995), Welt et al., J. Clin. Oncol., 12: 1193-1203 (1994), y Maloney et al., Blood, 90: 2188-2195 (1997)). Se conocen en la tecnica otros anticuerpos monoclonales humanizados y pueden utilizarse en relation con la invention.
En una realization, el agente de union celular es un anticuerpo anti-folato humanizado o un fragmento de antfgeno del mismo que se une especfficamente a un receptor de folato humano 1, donde el anticuerpo comprende: (a) un CDR1 de cadena pesada que comprende GYFMN; un CDR2 de cadena pesada que comprende RIHPYDGDTFYNQXaa1FXaa2Xaa3; y un CDR3 de cadena pesada que comprende YDg SrAMDY; y (b) un c Dr 1 de cadena ligera que comprende KASQSVSFAGTSLMH; un CDR2 de cadena ligera que comprende RASNLEA; y un CDR3 de cadena ligera que comprende QQSREYPYT; donde Xaa1 se selecciona de K, Q, H, y R; Xaa2 se selecciona de Q, H, N y R; y Xaa3 se selecciona de G, E, T, S, A y V. Preferentemente, la secuencia de CDR2 de cadena pesada comprende RIHPYDGDTFYNQKFQG.
En otra realizacion, el anticuerpo anti-folato es un anticuerpo humanizado o un fragmento de union al antfgeno del mismo que se une especfficamente al receptor de folato humano 1, que comprende la cadena pesada que tiene la secuencia de aminoacidos de
En otra realizacion, el anticuerpo anti-folato es un anticuerpo humanizado o un fragmento de union a antfgeno del mismo codificado por el ADN del plasmido registrado en el ATCC el 7 de abril de 2010, y que tiene como n.° de deposito en el ATCC PTA-10772 y PTA-10773 o 10774.
En otra realizacion, el anticuerpo anti-folato es un anticuerpo humanizado o fragmento de union al antfgeno del mismo que comprende un dominio variable de cadena pesada al menos aproximadamente un 90 %, un 95 %, un 99 % o un 100 % identica a
y un dominio variable de cadena ligera al menos aproximadamente un 90 %, un 95 %, un 99 % o un 100 % identico a
El agente citotoxico es un maitansinoide, incluyendo maitansinol y analogos de maitansinol. Los maitansinoides son compuestos que inhiben la formation de microtubulos y son altamente toxicos para las celulas mamfferas. Los ejemplos de analogos de maitansinol adecuados incluyen aquellos que tienen un anillo aromatico modificado y aquellos que tienen modificaciones en otras posiciones. Dichos maitansinoides se describen, por ejemplo, en las patentes de EE.UU. 4.256.746, 4.294.757, 4.307.016, 4.313.946, 4.315.929, 4.322.348, 4.331.598, 4.361.650, 4.362.663, 4.364.866, 4.424.219, 4.371.533, 4.450.254, 5.475.092, 5.585.499, 5.846.545 y 6.333.410.
Los ejemplos de analogos de maitansinol con un anillo aromatico modificado incluyen: (1) C-19-decloro (patente de EE.u U. 4.256.746) (preparado por reduction LAH de ansamitocina P2), (2) C-20-hidroxi (o C-20-demetilo) /-C-19-decloro (patentes de EE.UU. 4.361.650 y 4.307.016) (preparadas mediante desmetilacion utilizando Streptomyces o Actinomyces o decloracion utilizando LAH), y (3) C-20-demetoxi, C-20-aciloxi (-OCOR), /-decloro (patente de EE.UU.
4.294.757) (preparada mediante acilacion utilizando cloruros de acilo).
Los ejemplos de analogos de maitansinol con modificaciones de las posiciones que no son anillos aromaticos incluyen: (1) C-9-SH (patente de EE.UU. 4.424.219) (preparada mediante la reaction de maitansinol con H2S o P2S5), (2) C-14-alcoximetil (demetoxi/CH2OR) (patente de EE.UU. 4.331.598), (3) C-14-hidroximetilo o aciloximetilo (CH2OH o CH2OAc) (patente de EE.UU. 4.450.254) (preparada a partir de Nocardia), (4) C-15-hidroxi/aciloxi (patente de EE.UU.
4.364.866) (preparada mediante la conversion de maitansinol por Streptomyces), (5) C-15-metoxi (patentes de EE.UU.
4.313.946 y 4.315.929) (aislado de Trewia nudiflora), (6) C-18-N-demetilo (patentes de EE.UU. 4.362.663 y 4.322.348) (preparada mediante la desmetilacion de maitansinol por medio de Streptomyces), y (7) 4,5-deoxi (patente de EE.UU.
4.371.533) (preparada mediante reduccion de tricloruro de titanio/LAH de maitansinol).
En una realization preferida de la invention, el conjugado utiliza el maitansinoide DM1 que contiene tiol, tambien conocido como N2 ’-desacetil-N2 ’-(3-mercapto-1-oxopropyl)-maitansina, como agente citotoxico. La estructura de DM1 esta representada por la formula (I):
En otra realizacion preferida de la invencion, el conjugado utiliza el maitansinoide DM4 que contiene tiol, tambien conocido como N2’-desacetil-N2’-(4-metil-4-mercapto-1-oxopentil)-maitansina, como agente citotoxico. La estructura de DM4 esta representada por la formula (II):
Pueden usarse otros maitansinoides en el contexto de la invencion, incluyendo, por ejemplo, maitansinoides que contienen tiol o disulfuro que tienen una sustitucion mono o dialquilo en el atomo de carbono que porta el atomo de azufre. Se prefiere particularmente un maitansinoide que tiene en la posicion C-3 (a) funcionalidad de hidroximetilo C-14, hidroxi C-15 o desmetilo C-20 y (b) una cadena lateral de aminoacido acilada con un grupo acilo que tiene un grupo sulfhidrilo impedido, donde el atomo de carbono del grupo acilo que tiene la funcionalidad de tiol tiene uno o dos sustituyentes, dichos sustituyentes son CH3 , C2 H5 , alquilo o alquenilo lineal o ramificado que tiene de 1 a 10 atomos de carbono, alquilo o alquenilo cfclico que tiene de 3 a 10 atomos de carbono, fenilo, fenilo sustituido o un aromatico heterocfclico o un radical de heterocicloalquilo, y adicionalmente donde uno de los sustituyentes puede ser H, y donde el grupo acilo tiene una longitud de cadena lineal de al menos tres atomos de carbono entre la funcionalidad de carbonilo y el atomo de azufre.
Los maitansinoides adicionales que pueden usarse en el contexto de la invencion incluyen los compuestos representados por la formula (III):
donde Y' representa (CR7R8) l(CR9=CR10)p(C=C)qAo(CR5R6)mDu(CR11=CR12)r(C=C)s Bt(CR3R4)nCR1R2SZ,
donde R1 y R2 son cada uno independientemente CH3 , C2 H5 , alquilo o alquenilo lineal de 1 a 10 atomos de carbono, alquilo o alquenilo ramificado o cfclico con 3 a 10 atomos de carbono, fenilo, fenilo sustituido o un aromatico heterocfclico o un radical de heterocicloalquilo, y donde R2 tambien puede ser H,
donde A, B, D son cicloalquilo o cicloalquenilo que tiene de 3-10 atomos de carbono, arilo simple o sustituido, o un aromatico heterocfclico, o un radical de heterocicloalquilo,
donde R3 , R4 , R5 , R6 , R7 , R8 , R9 , R10 , R11 y R12 son cada uno independientemente H, CH3 , C2 H5 , alquilo o alquenilo lineal de 1 a 10 atomos de carbono, alquilo o alquenilo ramificado o cfclico con 3 a 10 atomos de carbono, fenilo, fenilo sustituido o un aromatico heterocfclico o un radical de heterocicloalquilo,
donde l, m, n, o, p, q, r, s y t son cada uno independientemente cero o un entero de 1 a 5, con la condition de que al menos dos de l, m, n, o, p, q, r, s y t no sean cero en ningun momento, y donde Z es H, SR o COR, donde R es un alquilo o alquenilo lineal de 1 a 10 atomos de carbono, alquilo o alquenilo ramificado o cfclico con 3 a 10 atomos de
carbono, o un arilo simple o sustituido o un aromatico heterocfclico, o un radical de heterocicloalquilo.
Las realizaciones preferidas de la formula (III) incluyen compuestos de la formula (III) donde (a) Ri es H, R2 es metilo y Z es H, (b) R i y R2 son metilo y Z es H, (c) Ri es H, R2 es metilo, y Z es -SCH 3 , y (d) Ri y R2 son metilo, y Z es -SCH3.
Dichos maitansinoides adicionales tambien incluyen compuestos representados por la formula (IV-L), (IV-D) o (IV-D, L):
donde Y representa (CR7 R8)l(CR5R6)m(CR3 R4)nCR i R2SZ, donde R i y R2 son cada uno independientemente CH3 , C2 H5 , alquilo o alquenilo lineal que tiene de i a i0 atomos de carbono, alquilo o alquenilo ramificado o cfclico que tiene de 3 a i0 atomos de carbono, fenilo, fenilo sustituido o un aromatico heterocfclico o un radical de heterocicloalquilo, y donde R2 tambien puede ser H,
donde R3 , R4 , R5 , R6 , R7 y R8 son cada uno independientemente H, CH3 , C2 H5 , alquilo o alquenilo lineal que tiene de i a i0 atomos de carbono, alquilo o alquenilo ramificado o cfclico que tiene de 3 a i0 atomos de carbono, fenilo, fenilo sustituido, o un aromatico heterocfclico o un radical de heterocicloalquilo,
donde l, m y n son cada uno independientemente un entero de i a 5, y ademas n puede ser cero, donde Z es H, SR, o COR donde R es alquilo o alquenilo lineal o ramificado que tiene de i a i0 atomos de carbono, alquilo o alquenilo cfclico que tiene de 3 a i0 atomos de carbono, o arilo simple o sustituido o un aromatico heterocfclico o un radical de heterocicloalquilo, y
donde May representa un maitansinoide que porta una cadena lateral en C-3, hidroximetilo C-i4, hidroxi C -i5 o desmetilo C-20.
Las realizaciones preferidas de las formulas (IV-L), (IV-D) y (IV-D,L) incluyen compuestos de las formulas (IV-L), (IV-D) y (IV-D,L) donde (a) Ri es H, R2 es metilo, R5 , R6 , R7 y R8 son cada uno H, l y m son cada uno i , n es 0, y Z es H, (b) R i y R2 son metilo, R5 , R6 , R7 , R8 son cada uno H, l y m son i , n es 0, y Z es H, (c) R i es H, R2 es metilo, R5 , R6 , R7 y R8 son cada uno H, l y m son cada uno i , n es 0, y Z es -SCH3 , o (d) R i y R2 son metilo, R5 , R6 , R7 , R8 son cada uno H, l y m son i , n es 0, y Z es -SCH 3.
Preferentemente el agente citotoxico esta representado por la formula (IV-L).
Los maitansinoides adicionales preferidos tambien incluyen compuestos representados por la formula (V):
i6
donde Y represents (CR7R8)i(CR5R6)m(CR3 R4)nCR i R2SZ,
donde Ri y R2 son cada una independientemente CH3 , C2 H5 , alquilo o alquenilo lineal que tiene de 1 a 10 atomos de carbono, alquilo o alquenilo ramificado o cfclico que tiene de 3 a 10 atomos de carbono, fenilo, fenilo sustituido o un aromatico heterocfclico o un radical de heterocicloalquilo, y donde R2 tambien puede ser H,
donde R3 , R4, R5 , R6 , R7 y R8 son cada uno independientemente H, CH3 , C2 H5 , alquilo o alquenilo lineal que tiene de 1 a 10 atomos de carbono, alquilo o alquenilo ramificado o cfclico que tiene de 3 a 10 atomos de carbono, fenilo, fenilo sustituido, o un aromatico heterocfclico o un radical de heterocicloalquilo,
donde l, m y n son cada uno independientemente un entero de 1 a 5, y ademas n puede ser cero,
y
donde Z es H, SR, o COR, donde R es alquilo o alquenilo lineal que tiene de 1 a 10 atomos de carbono, alquilo o alquenilo ramificado o cfclico que tiene de 3 a 10 atomos de carbono, o arilo simple o sustituido o un aromatico heterocfclico o un radical de heterocicloalquilo.
Las realizaciones preferidas de la formula (V) incluyen compuestos de la formula (V) donde (a) R1 es H, R2 es metilo, R5 , R6 , R7 y R8 son cada uno H, l y m son cada uno 1, n es 0, y Z es H, (b) R1 y R2 son metilo, R5 , R6 , R7 , R8 son cada uno H; l y m son 1; n es 0; y Z es H; (c) R1 es H, R2 es metilo; R5 , R6 , R7 y R8 son cada uno H, l y m son cada uno 1, n es 0, y Z es -SCH 3 , o (d) R1 y R2 son metilo, R5 , R6 , R7 , R8 son cada uno H, l y m son 1, n es 0, y Z es -SCH 3.
Los maitansinoides preferidos incluyen compuestos representados por la formula (VI-L), (VI-D), o (VI-D,L):
donde Y2 representa (CR7R8)l(CR5 R6)m(CR3R4)nCR1R2SZ2 ,
donde R1 y R2 son cada uno independientemente CH3 , C2 H5 , alquilo o alquenilo lineal que tiene de 1 a 10 atomos de carbono, alquilo o alquenilo ramificado o cfclico que tiene de 3 a 10 atomos de carbono, fenilo, fenilo sustituido o un aromatico heterocfclico o un radical de heterocicloalquilo, y donde R2 tambien puede ser H,
donde R3 , R4 , R5 , R6 , R7 y R8 son cada uno independientemente H, CH3 , C2 H5 , alquilo o alquenilo lineal o cfclico que tiene de 1 a 10 atomos de carbono, alquilo o alquenilo ramificado o cfclico que tiene de 3 a 10 atomos de carbono, fenilo, fenilo sustituido, o un aromatico heterocfclico o un radical de heterocicloalquilo, donde l, m y n son cada uno independientemente un entero de 1 a 5, y ademas n puede ser cero,
donde Z2 es SR, o COR, donde R es alquilo o alquenilo lineal que tiene de 1 a 10 atomos de carbono, alquilo o alquenilo ramificado o cfclico que tiene de 3 a 10 atomos de carbono, o arilo simple o sustituido o un aromatico heterocfclico o un radical de heterocicloalquilo, y donde May es la estructura macrocfclica de anillo del maitansinoide.
Los maitansinoides adicionales preferidos incluyen compuestos representados por la formula (VII):
donde Y2’ represents (CR7R8)i(CR9=CRi 0)p(C=C)qAo(CR5R6)mDu(CRi i =CRi 2)r(C=C)s Bt(CR3R4)nCRi R2SZ2 , donde Ri y R2 son cada uno independientemente CH3 , C2 H5 , alquilo o alquenilo lineal o ramificado de 1 a 10 atomos de carbono, alquilo o alquenilo clclico con 3 a 10 atomos de carbono, fenilo, fenilo sustituido o un aromatico heteroclclico o un radical de heterocicloalquilo, y R2 tambien puede ser H,
donde A, B, D son cada uno independientemente cicloalquilo o cicloalquenilo que tiene de 3 a 10 atomos de carbono, arilo simpe o sustituido, o un aromatico heteroclclico, o un radical de heterocicloalquilo, donde R3 , R4, R5 , R6, R7 , R8 , R9, R10 , R11 y R12 son cada uno independientemente H, CH3 , C2 H5 , alquilo o alquenilo lineal de 1 a 10 atomos de carbono, alquilo o alquenilo ramificado o clclico con 3 a 10 atomos de carbono, fenilo, fenilo sustituido o un aromatico heteroclclico o un radical de heterocicloalquilo,
donde l, m, n, o, p, q, r, s y t son cada uno independientemente cero o un entero de 1 a 5, siempre que al menos dos de l, m, n, o, p, q, r, s y t no sean cero en ningun momento, y
donde Z2 es SR o -COR, donde R es un alquilo o alquenilo lineal de 1 a 10 atomos de carbono, alquilo o alquenilo ramificado o clclico con 3 a 10 atomos de carbono, o un arilo simple o sustituido o un aromatico heteroclclico, o un radical de heterocicloalquilo.
Las realizaciones preferidas de la formula (VII) incluyen compuestos de la formula (VII), donde Ri es H y R2 es metilo.
Los conjugados de agente de union celular y agente citotoxico pueden prepararse mediante metodos in vitro. Para poder unir un agente citotoxico al anticuerpo se usa un grupo de enlace. Los grupos de enlace adecuados son conocidos en la tecnica e incluyen grupos disulfuro, grupos de acidos labiles, grupos fotolabiles, grupos de peptidasa labiles, y grupos de esterasa labiles, as! como grupos de enlace no escindibles. Por ejemplo, el agente de union celular puede estar acoplado qulmicamente al agente citotoxico por medio de enlaces qulmicos seleccionados del grupo que consiste en enlaces disulfuro, enlaces acidos labiles, enlaces fotolabiles, enlaces peptidasa labiles, enlaces tioeter y enlaces esterasa labiles.
De acuerdo con la invention, el agente de union celular se enlaza a un agente citotoxico por medio de un reactivo de reticulation bifuncional. Tales como se usa en el presente documento, un "reactivo de reticulation bifuncional" se refiere a un reactivo que posee dos grupos reactivos, uno de los cuales es capaz de reaccionar con un agente de union celular mientras que el otro es capaz de reaccionar con el agente citotoxico para unir el agente de union celular con el agente citotoxico, formando as! un conjugado.
Puede usarse cualquier reactivo de reticulacion bifuncional adecuado en conexion con la invencion, mientras el reactivo conector proporcione la retention del agente terapeutico, por ejemplo, citotoxicidad, y las caracterlsticas objetivo del agente citotoxico y del agente de union celular, respectivamente, sin toxicidad indebida. Preferentemente, la molecula conectora une al agente citotoxico con el agente de union celular a traves de enlaces qulmicos (tales como se describio anteriormente), de manera que el agente citotoxico y el agente de union celular se acoplen qulmicamente, (por ejemplo, unidos covalentemente) entre ellos.
En una realization, el reactivo de reticulacion bifuncional comprende conectores no escindibles. Un conector no escindible es cualquier resto qulmico que sea capaz de unir un agente citotoxico, tales como un maitansinoide, un taxano o un analogo de CC-1065, con un agente de union celular de forma estable y covalente. Por lo tanto, los conectores no escindibles son esencialmente resistentes a la escision inducida por acido, escision inducida por luz, escision inducida por peptidasa, escision inducida por esterasa y escision de enlace de disulfuro, en condiciones en las que el agente citotoxico o el agente de union a la celula permanece activo.
Los reactivos de reticulacion adecuados que forman conectores no escindibles entre un agente citotoxico y el agente de union celular son conocidos en la tecnica. En una realizacion, el agente citotoxico esta unido a un agente de union celular a traves de un enlace tioeter. Los ejemplos de conectores no escindibles incluyen conectores que tienen un resto basado en haloacetilo o maleimido para la reaction con el agente citotoxico. Dichos agentes de reticulacion bifuncionales son conocidos en la tecnica (veanse las publicaciones de patente de EE.UU. N° 2010/0129314, 2009/0274713, 2008/0050310, 20050169933, 2009/0274713, 2010/0129314 y aquellas disponibles de Pierce Biotechnology Inc. P.O. Box 117, Rockland, IL 61105, USA) e incluyen, pero no se limitan a, 4-(maleimidometil)ciclohexanocarboxilato de N-succinimidilo (SMCC), N-succinimidil-4-(N-maleimidometil)-ciclohexano-1-carboxi-(6-amidocaproato), que es un analogo de “cadena larga” de SMCC (LC-SMCC), ester de N-succinimidilo del acido K-maleimidoundecanoico (KMUA), ester de N'succinimidilo del acido Y-maleimidobutlrico (GMBS), ester de N-hidroxisuccinimida del acido £-maleimidocaproico (EMCS), ester de m-maleimidobenzoil-N-hidroxisuccinimida (MBS), ester de N-(a-maleimidoacetoxi)-succinimida (AMAS), succinimidil-6-(p-maleimidopropionamido)hexanoato (SMPH), 4-(p-maleimidofenil)-butirato de N-succinimidilo (SMPB) y N-(p-maleimidofenil)isocianato (PMPI). Los reactivos de reticulacion que comprenden un resto basado en halocetilo incluyen N-succinimidil-4-(yodoacetil)-aminobenzoato (SIAB), yodoacetato de N-succinimidilo (SIA), bromoacetato de N-succinimidilo (SBA), y 3-(bromoacetamido)propionato de N-succinimidilo (SBAP), bis-maleimidopolietilenglicol (BMPEO), BM(PEO)2 , BM(PEO)3 , ester de N-(b-maleimidopropiloxi)succinimida (BMPS), acido 5-maleimidovalerico NHS, HBVS, acido 4-(4-N-maleimidofenil)-butlrico hidrazida^HCl (MPBH), Succinimidil-(4-vinilsulfonil)benzoato (SVSB), ditiobismaleimidoetano (DTME), 1,4-bis-maleimidobutano (BMB), 1,4-bismaleimidil-2,3-dihodroxibutano (BMDB), bismaleimidohexano (BMH), bis-maleimidoetano (BMOE), 4-(N-maleimido-metil)ciclohexan-1-carboxilato de sulfosuccinimidilo (sulfo-SMCC), sulfosuccinimidil(4-yodo-acetil)aminobenzoato (sulfo-SIAB), ester de m
Maleimidobenzoil-N-hidroxisulfosuccinimida (sulfo-MBS), ester de N-(Y-maleimidobutriloxi)sulfosuccinimida (sulfo-GMBS), ester de N-(e-maleimidocaproiloxi)sulfosuccimido (sulfo-EMCS), ester de N-(kmaleimidoundecanoiloxi)sulfosuccinimida (sulfo-KMUS), 4-(p-maleimidofenil)butirato de sulfosuccinimidilo (sulfo-SMPB), CX1-1, sulfo-Mal y PEGn-Mal. Preferentemente, el reactivo de reticulacion bifuncional es SMCC.
En una realizacion, el reactivo conector es un conector escindible. Los ejemplos de conectores escindibles adecuados incluyen conectores de disulfuro, conectores labiles de acido, conectores fotolabiles, conectores labiles de peptidasa y conectores labiles de estearasa. Los conectores que contienen disulfuro son conectores escindibles a traves del intercambio de disulfuro, que puede ocurrir en condiciones fisiologicas. Los conectores labiles de acido son conectores escindibles a pH acido. Por ejemplo, determinados compartimentos intracelulares, tales como endosomas y lisosomas, tienen un pH acido (pH 4-5), y proporcionan condiciones adecuadas para escindir conectores labiles de acido. Los conectores fotolabiles son utiles en la superfine corporal y en muchas cavidades corporales que son accesibles a la luz. Asimismo, la luz infrarroja puede penetrar el tejido. Los conectores labiles de peptidasa pueden usarse para escindir determinados peptidos dentro o fuera de las celulas (vease por ejemplo, Trouet et al., Proc. Natl. Acad. Sci. USA, 79: 626-629 (1982), y Umemoto et al., Int. J. Cancer, 43: 677-684 (1989)). En una realizacion, el conector escindible se escinde bajo condiciones moderadas, es decir, condiciones dentro de una celula en la que la actividad del agente citotoxico no se ve afectada.
En otra realizacion, el agente citotoxico esta enlazado a un agente de union celular es decir, un anticuerpo a traves de un enlace de disulfuro. La molecula conectora comprende un grupo qulmico reactivo que puede reaccionar con el agente de union celular. Los grupos qulmicos reactivos preferidos para su reaccion con el agente de union celular son esteres de N-succinimidilo y esteres de N-sulfosuccinimidilo. Adicionalmente la molecula conectora comprende un grupo qulmico reactivo, preferentemente un grupo ditiopiridilo, que puede reaccionar con el agente citotoxico para formar un enlace disulfuro. Los reactivos de reticulacion bifuncionales que permiten el enlace del agente de union celular con el agente citotoxico a traves de los enlaces disulfuro son conocidos en la tecnica e incluyen, por ejemplo, 3- (2-piridilditio)propionato de N-succinimidilo (SPDP) (vease, por ejemplo, Carlsson et al., Biochem. J., 173: 723-737 (1978)), 4-(2-piridilditio)butanoato de N-succinimidilo (SPDB) (vease, por ejemplo, la patente de EE.UU. 4.563.304), 4- (2-piridilditio)pentanoato de N-succinimidilo (SPP) (vease, por ejemplo, numero de Registro CAS 341498-08-6), y N-succinimidil-4-(2-piridilditio)2-sulfo butanoato (sulfo-SPDB) (vease, por ejemplo, la publicacion de solicitud de EE.UU. N.° 2009/0274713). En la tecnica se conocen otros reactivos de reticulacion bifuncionales que pueden usarse para introducir grupos disulfuro y se describen en las patentes de EE.UU. 6.913.748, 6.716.821 y en las publicaciones de solicitud de patente de EE.UU. 2009/0274713 y 2010/0129314.
Otros reactivos de reticulacion que carecen de un atomo de azufre que forman conectores no escindibles pueden usarse tambien en el metodo de la invencion. Dichos conectores pueden derivar de restos a base de acido dicarboxllico. Los restos a base de acido dicarboxllico adecuados incluyen, pero no se limitan a, acidos a,wdicarboxllicos de la formula general (IX):
HOOC-Xi-Yn-Zm-COOH
(IX),
donde X es un grupo alquilo, alquenilo o alquinilo lineal o ramificado que tiene de 2 a 20 atomos de carbono, Y es un grupo cicloalquilo o cicloalquenilo con 3 a 10 atomos de carbono, Z es un grupo aromatico sustituido o no sustituido con 6 a 10 atomos de carbono, o un grupo heteroclclico sustituido o no sustituido donde el heteroatomo se selecciona de N, O o S, y donde l, m y n son cada uno 0 o 1, siempre que l, m y n no sean todos cero al mismo tiempo.
Muchos de los conectores no escindibles divulgados en el presente documento se describen en detalle en la publicacion de solicitud de patente de EE.UU. 2005/0169933 A1.
Los siguientes ejemplos ilustran adicionalmente la invencion pero, por supuesto, no deberlan entenderse como que limitan de manera alguna su alcance.
Ejemplo 1
Se hizo reaccionar el anticuerpo CD37-3 humanizado con el reactivo de reticulacion heterobifuncional SMCC y el maitansinoide DM1 usando un proceso descrito previamente (por ejemplo La patente de EE.UU. 5-208-020), as! como el proceso de una etapa que es el objeto de la presente solicitud.
Para el proceso descrito previamente, huCD37-3 (15 mg/ml) se hizo reaccionar primero con SMCC (exceso molar de 6,5 veces en relacion a la cantidad de anticuerpo) para formar el anticuerpo modificado. La reaccion de modificacion se llevo a cabo a 16 °C en tampon de fosfato de sodio 50 mM (pH 6,9) que contenla EDTA 2 mM y DMA al 10 % durante 90 minutos. La reaccion se inactivo con acetato 1 M para ajustar el pH a 4,5 y el anticuerpo modificado se purifico usando una columna de resina Sephadex G-25F equilibrada y eluida con acetato de sodio 20 mM (pH 4,5) que contenla EDTA 2 mM. Despues de la purificacion, el anticuerpo modificado (5 mg/ml) se hizo reaccionar con el maitansinoide DM1 (exceso molar de 6,8 veces en relacion con la cantidad de anticuerpo; exceso de 1,3 veces en relacion con la cantidad medida de conector en el anticuerpo) para formar el anticuerpo conjugado. La reaccion de conjugacion se llevo a cabo a 20 °C en tampon de acetato de sodio 20 mM (pH 5,0) que contenla EDTA 2 mM y DMA al 5 % durante aproximadamente 20 horas. La mezcla de reaccion se purifico usando una columna de resina Sephadex G-25F equilibrada y eluida en succinato de sodio 10 mM (pH 5,0).
Para el proceso de la invencion, huCD37-3 (2,5 mg/ml) se mezclo con DM1 (exceso molar de 6,2 veces en relacion con la cantidad de anticuerpo) y despues con SMCC (exceso de 5,2 veces en relacion a la cantidad de anticuerpo). La reaccion se llevo a cabo a 20 °C en tampon EPPS [acido 4-(2-Hidroxietil)-1-piperazinpropanosulfonico] 50 mM (pH 8,1) que contenla EDTA 2 mM y DMA al 10 % durante aproximadamente 2 horas. La reaccion se inactivo mediante la adicion de acetato 1 M para ajustar el pH a 5,0, Despues la mezcla de reaccion se retuvo a 2 - 8 °C durante aproximadamente 20 horas. Despues de la retencion, la mezcla de reaccion se filtro a traves de un filtro de PVDF de 0,2 |jm y se purifico y sometio a diafiltracion en succinato de sodio 10 mM (pH 5,0) usando filtracion de flujo tangencial (TFF).
El conjugado derivado de los dos procesos se analizo mediante: espectroscopla UV para verificar la concentracion y la carga de agente citotoxico (relacion de maitansinoide respecto al anticuerpo, MAR); espectrometrla de masas para determinar el nivel de conector no conjugado; electroforesis SDS PAGE reducida para determinar el nivel de la especie no reducible; y SEC-HPLC para determinar el monomero conjugado; y estabilidad durante el almacenamiento respecto a la liberacion de maitansinoide libre y monomero del conjugado.
La concentracion y la relacion de maitansinoide respecto al anticuerpo (MAR) se determinaron mediante la medicion de la absorbancia del conjugado a 252 y 280 nm en un espectrofotometro UV-VIS y usando los coeficientes de extincion molar de DM1 y del anticuerpo a las dos longitudes de onda, para calcular las concentraciones molares del anticuerpo y de DM1.
El nivel de conector no conjugado de los conjugados se analizo mediante espectrometrla de masas: se midieron las areas de pico de la especie conjugada individual (incluyendo conjugados con o sin conectores no conjugados); se calculo el nivel de conector no conjugado mediante la proporcion de la suma de areas que contenlan conectores no conjugados (pesada mediante el numero de conectores) respecto a la suma de areas de todas las especies conjugadas (tambien pesada mediante el numero de conectores).
El nivel de especies no reducibles de los conjugados se analizo mediante electroforesis en gel SDS reducida: se midieron las areas pico de las especies de conjugados individuales reducidas (incluyendo cadena ligera reducida, cadena pesada reducida, cadena ligera-ligera reticulada, cadena ligera-pesada reticulada, etc.); en nivel de especies no reducibles se calculo mediante la proporcion de la suma de areas de especies no reducibles respecto a la suma de las areas de todas las especies.
El nivel de monomeros de los conjugados se analizo mediante HPLC de exclusion por tamano: las areas pico de especies de bajo peso molecular, monomeros, dlmeros y anadidos se midieron usando un detector de absorbancia a
una longitud de onda de 252 nm o 280 nm; el nivel de monomero se calculo mediante la proportion de area de monomero respecto al area total.
La cantidad de maitansinoide libre presente en el conjugado se analizo mediante HPLC en doble columna (columnas HiSep y C18): las areas pico del total de especies de maitansinoide libre (eluido en el gradiente e identificado en comparacion con el tiempo de elusion con estandares conocidos) se midieron usando un detector de absorbancia a una longitud de onda de 252 nm; la cantidad de maitansinoide libre se calculo usando una curva estandar generada por las areas pico de la cantidad conocida de estandares.
Como se muestra en la Tabla 1 a continuation, el conjugado elaborado usando el proceso de la invention fue superior al elaborado usando el proceso previamente descrito, con respecto al conector no conjugado, especie no reducible y monomero del conjugado. A su vez, la estabilidad del conjugado elaborado mediante el proceso de la invencion resulto considerablemente superior con respecto a la liberation de maitansinoide libre despues de su almacenamiento durante cinco meses a 4 °C. Los niveles de monomeros de los conjugados elaborados mediante ambos procesos resultaron estables.
Tabla 1. Comparacion de propiedades clave del conjugado CD37-3 elaborado mediante el proceso de la invencion en
Los resultados de los experimentos reflejados en este ejemplo demuestran un proceso mejorado para preparar conjugados de agente de union celular y agente citotoxico que tienen una pureza considerablemente alta. Ademas de las mejoras a la pureza y estabilidad del conjugado utilizando el proceso de la invencion, tambien se presentan mejoras en los tiempos de procesamiento y conveniencia, como resultado de la elimination de dos etapas del proceso (la reaction de modification y la purification del anticuerpo modificado).
Ejemplo 2
El anticuerpo huMov19 receptor de folato humanizado (vease la publication de solicitud de EE.UU. 2012/0009181) se hizo reaccionar con el reactivo de reticulation bifuncional sulfo-SPDB y el maitansinoide DM4 usando dos procesos descritos previamente, as! como el proceso mejorado que es el sujeto de la presente solicitud.
Para el Proceso A descrito anteriormente (proceso de dos etapas, por ejemplo Chari et al., US 5.208.020), se hizo reaccionar el anticuerpo huMov19 (20 mg/ml) en primer lugar con sulfo-SPDB (exceso molar de 5,7 veces en relation a la cantidad de anticuerpo, disuelto en DMA, dimetilacetamida) para formar el anticuerpo modificado. La reaccion de modificacion se llevo a cabo a 20 °C en un tampon de EPPS (4-(acido 2-hidroxietil)piperazin-1-propansulfonico) 50 mM (pH 8,1) con 5 % DMA durante 180 minutos. El anticuerpo modificado se purifico usando una columna de resina Sephadex G-25F equilibrada y eluida en EPPS 50 mM (pH 8,1) con EDTA (acido etilendiaminotetraacetico) 2 mM. Despues de la purificacion, el anticuerpo modificado (5,0 mg/ml) se hizo reaccionar con el maitansinoide DM4 (Disuelto en DMA; exceso molar de 9,7 veces en relacion a la cantidad del anticuerpo; exceso de 1,7 veces en relacion con la cantidad medida de conector en el anticuerpo) para formar el anticuerpo conjugado. La reaccion de conjugation se llevo a cabo a temperatura ambiente en EPPS 50 mM (pH 8,1) que contenla EDTA 2mM y DMA al 5 % durante aproximadamente 18 horas. Despues, la mezcla de reaccion se purifico usando una columna de resina G-25F Sephadex equilibrada y eluida en succinato de sodio 10 mM (pH 5,0).
Para el Proceso B descrito anteriormente (proceso en un solo recipiente, Dai et al., patente de EE.UU. 7.811.572), se hizo reaccionar el anticuerpo huMov19 (10 mg/ml) en primer lugar con sulfo-SPDB (exceso molar de 4,9 veces en relacion a la cantidad de anticuerpo, disuelto en DMA) para formar el anticuerpo modificado. La reaccion de modificacion se llevo a cabo a 20 °C en tampon de EPPS 50 mM (pH 7,5) que contenla EDTA 2 mM y DMA al 10 % durante 60 minutos. El anticuerpo modificado no se purifico previo a la reaccion de conjugacion. En su lugar, el anticuerpo modificado sin purificar se hizo reaccionar a 10 mg/ml con el maitansinoide DM4 (exceso molar de 8,3 veces en relacion a la cantidad de anticuerpo, disuelto en DMA) para formar el anticuerpo conjugado. La reaccion de conjugacion se llevo a cabo a temperatura ambiente en tampon EPPS 50 mM (pH 7,5) que contenla EDTA 2mM y DMA al 10 % durante aproximadamente 18 horas. La mezcla de reaccion se purifico usando una columna de resina
G-25F Sephadex equilibrada y eluida en succinato de sodio 10 mM (pH 5,0).
Para el proceso de la invencion en que se utilizo Sephadex G-25 (Proceso C, proceso en una sola etapa) para purificar el conjugado, se mezclo anticuerpo huMov19 (6,0 mg/ml) con DM4 (exceso molar de 9,7 veces en relacion a la cantidad de anticuerpo, disuelto en DMA) y despues se anadio sulfo-SPDB (exceso molar de 5,7 veces en relacion a la cantidad de anticuerpo, disuelto en DMA). La reaccion se llevo a cabo a 20 °C en tampon de EPPS 50 mM (pH 8,1) que contenla EDTA 2 mM y DMA al 10 % durante aproximadamente 20 horas. La mezcla de reaccion se purifico usando una columna de resina G-25F Sephadex equilibrada y eluida en succinato de sodio 10 mM (pH 5,0).
Para el proceso de la invencion en que se utilizo filtracion de flujo tangencial (TFF) (Proceso D, proceso en una sola etapa) para purificar el conjugado, se mezclo anticuerpo huMov19 (5,0 mg/ml) con DM4 (exceso molar de 10,2 veces en relacion a la cantidad de anticuerpo, disuelto en DMA) y despues con sulfo-SPDB (exceso molar de 6,0 veces en relacion a la cantidad de anticuerpo, disuelto en DMA). La reaccion se llevo a cabo a 20 °C en tampon de EPPS 50 mM (pH 8,5) que contenla EDTA 2 mM y DMA al 10 % durante aproximadamente 20 horas. Despues, la mezcla de reaccion se purifico y se lo sometio a diafiltracion utilizando una TFF en succinato de sodio 10 mM (pH 5,0).
El conjugado derivado de los diferentes procesos se analizo mediante: Espectroscopla UV (para concentration y la relacion de maitansinoide respecto a anticuerpo, MAR); HPLC de fase inversa para determinar los maitansinoides libres; Espectrometrla de masas para la determination de niveles de conectores sin conjugar perfil de distribution de masa; electroforesis SDS PAGE reducida para determinar el nivel de especies no reducibles; electroforesis SDS PAGE no reducida para la determinacion del nivel de fragmentation; SEC-HPLC para determinar los monomeros del conjugado. La estabilidad durante el almacenamiento se evaluo en lo que refiere al monomero del conjugado y la liberation de maitansinoide libre. Se suministra information adicional sobre las metodologlas anallticas en el Ejemplo 1,
Como se muestra en la Tabla 2, a continuation, el conjugado elaborado usando el proceso de la invencion fue superior al elaborado usando los procesos previamente descritos con respecto al monomero. El conjugado elaborado utilizando los procesos de un recipiente y una etapa en que la purification final del conjugado se realizo utilizando Sephadex G-25, Procesos B y C, respectivamente, presentaron un nivel mas alto de maitansinoide libre que el conjugado elaborado utilizando el proceso de dos etapas, Proceso A. Sin embargo, cuando se utilizo un proceso de purificacion final diferente, TFF (Proceso D), el nivel de maitansinoide libre fue muy bajo y comparable con el encontrado en los procesos de dos etapas, ambos despues de la purificacion inicial y despues del almacenamiento a 4 °C durante seis semanas. En lo que respecta a los otros atributos importantes del conjugado (por ejemplo fragmentacion, especies no reducibles, perfil de distribucion de masa y conector sin conjugar), el conjugado elaborado utilizando el proceso de la invencion fue equivalente al elaborado mediante los procesos descritos anteriormente.
Tabla 2. Comparacion de propiedades clave del conjugado huMov19 elaborado mediante el proceso de la invencion n m r i n n r n ri r .
* Purificado con Sephadex G-25
** Purificado utilizando TFF
Los resultados de los experimented reflejados en este ejemplo demuestran un proceso mejorado para preparar conjugados de agente de union celular y agente citotoxico que tienen una pureza considerablemente alta. Ademas de las mejoras a la pureza y estabilidad del conjugado utilizando el proceso de la invencion, tambien se presentan mejoras en los tiempos de procesamiento y conveniencia, como resultado de la eliminacion de dos etapas del proceso (la reaccion de modificacion y la purificacion del anticuerpo modificado).
Ejemplo 3
Este ejemplo demuestra que el proceso en una sola etapa que se describe en el presente documento puede utilizarse para elaborar conjugados a partir de diversos conectores y agentes citotoxicos de maitansinoide.
El anticuerpo humanizado huN901 se mezclo con maitansinoide (DM1 o DM4) y despues con un conector (Sulfo-SMCC, SMCC, SPDB, o SPP). La reaccion se realizo a 20 °C en tampon de fosfato 50 mM (pH 7,5) que contenla EDTA 2 mM y 10 % DMA durante aproximadamente 20-24 horas. La mezcla de reaccion despues se purifico usando una columna de resina G25F Sephadex, equilibrada y eluida en succinato de sodio 10 mM (pH 5,0).
Como se muestra en la Tabla 3 a continuation, la reaccion en una sola etapa puede realizarse con diferentes combinaciones de conector y maitansinoide y producir un conjugado con buenos niveles de MAR y de monomeros.
T l . El r i n n iliz n if r n m in i n n r m i n in i
El uso de los terminos “un”, “una” y “el” y referentes similares utilizados en el contexto de la description de la invencion (especialmente en el contexto de las siguientes reivindicaciones) se deben interpretar como abarcativos tanto del singular como del plural, salvo que se indique lo contrario en el presente documento o que el contexto lo contradiga claramente. Los terminos "que comprende", "que tiene", "que incluye" y "que contiene" deben interpretarse como terminos abiertos (esto es, como que significan "que incluye, pero no se limitan a"), a menos que se indique lo contrario. La mention de intervalos de valores en el presente documento meramente pretende servir como un metodo taquigrafico para referirse individualmente a cada valor separado que esta dentro del intervalo, a menos que se indique lo contrario en el presente documento, y cada valor separado se incorpora a la memoria descriptiva como si se mencionara individualmente en el presente documento. Todos los metodos descritos en el presente documento se pueden realizar en cualquier orden adecuado, salvo que se indique lo contrario en el presente documento o que el contexto lo contradiga claramente. El uso de todos y cualquiera de los ejemplos o las expresiones de ejemplo (por ejemplo, "tales como") que se proporcionan en el presente documento, pretende meramente esclarecer la invencion y no representa una limitation al alcance de la invencion, a menos que se reivindique lo contrario. No se debe interpretar ninguna expresion en la memoria descriptiva como una indication de que algun elemento no reivindicado es esencial para la puesta en practica de la invencion.
Las realizaciones preferidas de la misma invencion se describen en el presente documento, incluyendo el mejor modo conocido por los inventores para desarrollar la invencion. Las variaciones de esas realizaciones preferidas seran evidentes para los expertos en la tecnica tras la lectura de la descripcion que antecede. Los inventores esperan que los expertos utilicen tales variaciones segun sea apropiado y pretenden que la invencion se practique de una forma diferente a la que se describe especlficamente en el presente documento. Por lo tanto, la presente invencion incluye todas las modificaciones y los equivalentes de la materia mencionada en las reivindicaciones adjuntas al presente documento segun permita la legislation pertinente. Adicionalmente, toda combination de los elementos listados anteriormente en todas las variaciones posibles de los mismos se encuentra incluida en la invencion, salvo que se indique lo contrario en el presente documento o que lo contradiga claramente el contexto.
Claims (16)
1. Un proceso para preparar un conjugado de anticuerpo y maitansinoide que comprende la etapa de:
(a) poner en contacto un anticuerpo con un maitansinoide para formar una primera mezcla que comprende el anticuerpo y el maitansinoide, despues poner en contacto la primera mezcla con un reactivo de reticulacion bifuncional que comprende un conector, en una solucion que tiene un pH de 4 a 9 para proporcionar una segunda mezcla que comprende (i) el conjugado de anticuerpo y maitansinoide, donde el anticuerpo esta acoplado qulmicamente a traves del conector al maitansinoide, (ii) maitansinoide libre, y (iii) subproductos de reaccion.
2. El proceso de la reivindicacion 1, donde el proceso comprende adicionalmente la etapa de:
(b) purificar la segunda mezcla que comprende el conjugado de anticuerpo y maitansinoide para proporcionar un conjugado de anticuerpo y maitansinoide purificado.
3. El proceso de la reivindicacion 2, done la segunda mezcla se purifica al someter la mezcla a filtracion de flujo tangencial, precipitacion selectiva, filtracion de adsorcion, cromatografla de adsorcion, cromatografla de no adsorcion o una combinacion de las mismas, para purificar el conjugado de anticuerpo y maitansinoide del maitansinoide libre y de los subproductos de reaccion, preferentemente la segunda mezcla se purifica al someter la mezcla a filtracion de flujo tangencia.
4. El proceso de una cualquiera de las reivindicaciones 1-3, donde la puesta en contacto en la etapa (a) se efectua proporcionando el agente de union celular en un recipiente de reaccion, anadiendo el maitansinoide al recipiente de reaccion para formar la primera mezcla que comprende el anticuerpo y el maitansinoide, y despues anadiendo el reactivo de reticulacion bifuncional a la primera mezcla.
5. El proceso de una cualquiera de las reivindicaciones 2-4, que comprende adicionalmente retener la segunda mezcla entre las etapas (a) - (b) para liberar los conectores unidos de manera inestable del anticuerpo y/o inactivar la segunda mezcla entre las etapas (a) - (b) para inactivar cualquier maitansinoide sin reaccionar y/o reactivo de reticulacion bifuncional sin reaccionar.
6. El proceso de la reivindicacion 5, donde la segunda mezcla se retiene durante aproximadamente 20 horas a una temperatura de 2° C a 8° C.
7. El proceso de la reivindicacion 5, donde la mezcla se inactiva poniendo en contacto de la segunda mezcla con un reactivo de inactivacion que reacciona con el maitansinoide libre.
8. El proceso de la reivindicacion 7, donde el reactivo de inactivacion se selecciona del grupo que consiste en acido 4-maleimidobutlrico, acido 3-maleimidopropionico, N-etilmaleimida, yodoacetamida y acido yodoacetamidopropionico.
9. El proceso de una cualquiera de las reivindicaciones 1-8, donde el contacto en la etapa (a) se produce en una solucion que tiene un pH de 7 a 9.
10. El proceso de cualquiera de las reivindicaciones 1-9, donde el contacto en la etapa (a) se produce a una temperatura de 16 °C a 24 °C o de 0 °C a 15 °C.
11. El proceso de cualquiera de las reivindicaciones 1-10, donde el anticuerpo es un anticuerpo monoclonal, preferentemente un anticuerpo monoclonal humanizado.
12. El proceso de una cualquiera de las reivindicaciones 1-11, donde el anticuerpo se selecciona del grupo que consiste en huN901, huMy9-6, huB4, huC242, trastuzumab, bivatuzumab, sibrotuzumab, CNTO95, huDS6, rituximab, anti-Her2, anti-EGFR, anti-CD27L, anti-EGFRvlll, Cripto, anti-CD138, anti-CD38, anti-EphA2, anticuerpo dirigido a integrina, anti-CD37, anti-folato, anti-Her3 y anti-IGFIR.
13. El proceso de una cualquiera de las reivindicaciones 1-12, donde el maitansinoide es N2’-desacetil-N2’-(3-mercapto-1-oxopropil)-maitansina (DM1) o N2’-desacetil-N2’-(4-metil-4-mercapto-1-oxopentil)-maitansina (DM4).
14. El proceso de cualquiera de las reivindicaciones 1-13, donde el anticuerpo esta acoplado qulmicamente al maitansinoide por medio de enlaces qulmicos seleccionados del grupo que consiste en enlaces disulfuro, enlaces acidos labiles, enlaces fotolabiles, enlaces peptidasa labiles, enlaces tioeter y enlaces estearasa labiles.
15. El proceso de una cualquiera de las reivindicaciones 1-14, donde el reactivo de reticulacion bifuncional comprende un resto de ester de N-succinimidilo, un resto de ester de N-sulfosuccinimidilo, un resto a base de maleimido o un resto a base de haloacetilo, preferentemente el reactivo de reticulacion bifuncional se selecciona del grupo que consiste en SPDP, SPP, SPd B, sulfo-SPDB, SMCC, PEG-mal, sulfo-Mal y CX1-1; donde
PEG-Mal es:
sulfo-Mal es
y CX1-1 es:
16. El proceso de una cualquiera de las reivindicaciones 1-15, donde la solucion en la etapa (a) comprende sacarosa y/o un agente tamponante seleccionado del grupo que consiste en un tampon citrato, un tampon acetato, un tampon succinato, un tampon fosfato, HEPPSO (acido N-(2-hidroxietil)piperazina-N'-(2-hidroxipropanosulfonico)), POPSO (deshidrato de piperazina-1,4-bis-(acido 2-hidroxi-propano-sulfonico)), HEPES (acido 4-(2-hidroxietil)piperazina-1-etanosulfonico), HEPPS (EPPS) (acido 4-(2-hidroxietil)piperazina-1-propanosulfonico), TES (acido N-[tris(hidroximetil)metil]-2-aminoetanosulfonico) y una combination de los mismos.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201161468997P | 2011-03-29 | 2011-03-29 | |
| PCT/US2012/031243 WO2012135517A2 (en) | 2011-03-29 | 2012-03-29 | Preparation of maytansinoid antibody conjugates by a one-step process |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| ES2709577T3 true ES2709577T3 (es) | 2019-04-16 |
Family
ID=46928080
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| ES12714160T Active ES2709577T3 (es) | 2011-03-29 | 2012-03-29 | Preparación de conjugados de maitansinoides y anticuerpos mediante un proceso de una sola etapa |
Country Status (26)
| Country | Link |
|---|---|
| US (7) | US8795673B2 (es) |
| EP (2) | EP3545977A1 (es) |
| JP (5) | JP6000329B2 (es) |
| KR (6) | KR20230128583A (es) |
| CN (2) | CN107537040A (es) |
| AU (5) | AU2012236398B2 (es) |
| CA (1) | CA2831467C (es) |
| CY (1) | CY1121321T1 (es) |
| DK (1) | DK2691155T3 (es) |
| EA (2) | EA201991268A3 (es) |
| ES (1) | ES2709577T3 (es) |
| HR (1) | HRP20190243T1 (es) |
| HU (1) | HUE041384T2 (es) |
| IL (3) | IL228559A (es) |
| LT (1) | LT2691155T (es) |
| ME (1) | ME03353B (es) |
| MX (2) | MX339927B (es) |
| NZ (1) | NZ726386A (es) |
| PL (1) | PL2691155T3 (es) |
| PT (1) | PT2691155T (es) |
| RS (1) | RS58367B1 (es) |
| SI (1) | SI2691155T1 (es) |
| SM (1) | SMT201900114T1 (es) |
| TR (1) | TR201902180T4 (es) |
| UA (1) | UA116524C2 (es) |
| ZA (1) | ZA201605918B (es) |
Families Citing this family (54)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN101098854B (zh) | 2004-07-23 | 2012-12-05 | 恩多塞特公司 | 二价连接体及其轭合物 |
| US20110166319A1 (en) * | 2005-02-11 | 2011-07-07 | Immunogen, Inc. | Process for preparing purified drug conjugates |
| NZ595430A (en) | 2005-08-24 | 2013-05-31 | Immunogen Inc | Process for preparing maytansinoid antibody conjugates |
| NZ599239A (en) | 2007-03-14 | 2013-10-25 | Endocyte Inc | Binding ligand linked drug delivery conjugates of tubulysins |
| US9138484B2 (en) | 2007-06-25 | 2015-09-22 | Endocyte, Inc. | Conjugates containing hydrophilic spacer linkers |
| US9877965B2 (en) | 2007-06-25 | 2018-01-30 | Endocyte, Inc. | Vitamin receptor drug delivery conjugates for treating inflammation |
| KR101947176B1 (ko) | 2009-06-03 | 2019-02-12 | 이뮤노젠 아이엔씨 | 접합 방법 |
| SMT201700139T1 (it) | 2010-02-24 | 2017-05-08 | Immunogen Inc | Immunoconiugati contro il recettore 1 del folato e relativi usi |
| MY177062A (en) | 2010-03-12 | 2020-09-03 | Debiopharm Int Sa | Cd37-binding molecules and immunoconjugates thereof |
| EA201991268A3 (ru) | 2011-03-29 | 2020-01-31 | Иммуноджен, Инк. | Получение конъюгатов "майтансиноид-антитело" одностадийным способом |
| CN114441757A (zh) * | 2011-04-01 | 2022-05-06 | 伊缪诺金公司 | 用于增加folr1癌症治疗的功效的方法 |
| WO2013126797A1 (en) | 2012-02-24 | 2013-08-29 | Purdue Research Foundation | Cholecystokinin b receptor targeting for imaging and therapy |
| US20140080175A1 (en) | 2012-03-29 | 2014-03-20 | Endocyte, Inc. | Processes for preparing tubulysin derivatives and conjugates thereof |
| MX362514B (es) | 2012-08-31 | 2019-01-22 | Immunogen Inc | Kits y ensayos de diagnostico para la deteccion del receptor 1 de folato. |
| WO2014055842A1 (en) * | 2012-10-04 | 2014-04-10 | Immunogen, Inc. | Process for preparing stable antibody maytansinoid conjugates |
| AU2013326897A1 (en) * | 2012-10-04 | 2015-05-07 | Immunogen, Inc. | Use of an ion exchange membrane to remove impurities from cell-binding agent cytotoxic agent conjugates |
| HK1213288A1 (zh) | 2012-10-04 | 2016-06-30 | Immunogen, Inc. | 使用pvdf膜純化細胞結合劑細胞毒性劑綴合物 |
| US9662402B2 (en) | 2012-10-16 | 2017-05-30 | Endocyte, Inc. | Drug delivery conjugates containing unnatural amino acids and methods for using |
| US8769557B1 (en) | 2012-12-27 | 2014-07-01 | The Nielsen Company (Us), Llc | Methods and apparatus to determine engagement levels of audience members |
| EP2961434A2 (en) | 2013-02-28 | 2016-01-06 | ImmunoGen, Inc. | Conjugates comprising cell-binding agents and cytotoxic agents |
| JP6423804B2 (ja) | 2013-02-28 | 2018-11-14 | イミュノジェン・インコーポレーテッド | 細胞結合剤及び細胞毒性剤を含む複合体 |
| US9498532B2 (en) | 2013-03-13 | 2016-11-22 | Novartis Ag | Antibody drug conjugates |
| KR20150131173A (ko) | 2013-03-15 | 2015-11-24 | 노파르티스 아게 | 항체 약물 접합체 |
| WO2014194030A2 (en) | 2013-05-31 | 2014-12-04 | Immunogen, Inc. | Conjugates comprising cell-binding agents and cytotoxic agents |
| SG11201601037YA (en) | 2013-08-30 | 2016-03-30 | Immunogen Inc | Antibodies and assays for detection of folate receptor 1 |
| TWI541022B (zh) | 2013-12-18 | 2016-07-11 | 應克隆公司 | 針對纖維母細胞生長因子受體-3(fgfr3)之化合物及治療方法 |
| HRP20191335T1 (hr) | 2014-03-11 | 2019-10-18 | Regeneron Pharmaceuticals, Inc. | Anti-egfrviii antitijela i njihove primjene |
| WO2016001485A1 (en) | 2014-06-30 | 2016-01-07 | Glykos Finland Oy | Saccharide derivative of a toxic payload and antibody conjugates thereof |
| US9982045B2 (en) | 2014-08-12 | 2018-05-29 | Novartis Ag | Anti-CDH6 antibody drug conjugates |
| EP3223857A4 (en) * | 2014-10-31 | 2018-06-27 | Formation Biologics Inc. | Egfr antibody-based combination therapy |
| CN106267225B (zh) * | 2015-05-29 | 2020-03-06 | 上海新理念生物医药科技有限公司 | 三马来酰亚胺型连接子及其应用 |
| TW201711702A (zh) | 2015-06-04 | 2017-04-01 | 應克隆公司 | 使用針對纖維母細胞生長因子受體3(fgfr3)之化合物的療法 |
| EA201792300A1 (ru) | 2015-06-08 | 2018-09-28 | Дебиофарм Интернэшнл, С.А. | Комбинации иммуноконъюгата к cd37 и антитела к cd20 |
| WO2016203432A1 (en) | 2015-06-17 | 2016-12-22 | Novartis Ag | Antibody drug conjugates |
| KR102766022B1 (ko) | 2015-08-28 | 2025-02-10 | 데비오팜 인터네셔날 에스 에이 | Cd37 의 검출을 위한 항체 및 검정 |
| JP6880006B2 (ja) | 2015-09-17 | 2021-06-02 | イミュノジェン, インコーポレイテッド | 抗folr1免疫複合体を含む治療組み合わせ |
| JP2019501139A (ja) | 2015-11-25 | 2019-01-17 | イミュノジェン・インコーポレーテッド | 医薬製剤及びその使用 |
| KR20180105233A (ko) * | 2016-02-05 | 2018-09-27 | 이뮤노젠 아이엔씨 | 세포 결합제-세포독성제 접합체를 제조하기 위한 효율적인 방법 |
| CN108421048B (zh) * | 2016-09-28 | 2021-04-20 | 首都医科大学附属北京世纪坛医院 | 纳米活性碳靶向药物递送系统、制备方法及其用途 |
| EP3535297B1 (en) | 2016-11-02 | 2022-08-10 | Debiopharm International, S.A. | Methods for improving anti-cd37 immunoconjugate therapy |
| US10864279B2 (en) | 2016-12-16 | 2020-12-15 | Industrial Technology Research Institute | Linker-drug and antibody-drug conjugate (ADC) employing the same |
| JOP20190187A1 (ar) | 2017-02-03 | 2019-08-01 | Novartis Ag | مترافقات عقار جسم مضاد لـ ccr7 |
| SG11201907693VA (en) | 2017-02-28 | 2019-09-27 | Immunogen Inc | Maytansinoid derivatives with self-immolative peptide linkers and conjugates thereof |
| WO2018185618A1 (en) | 2017-04-03 | 2018-10-11 | Novartis Ag | Anti-cdh6 antibody drug conjugates and anti-gitr antibody combinations and methods of treatment |
| EP3740233A4 (en) * | 2018-01-18 | 2021-11-24 | Magenta Therapeutics, Inc. | COMPOSITIONS AND METHODS FOR DEPLOYING CD134 + CELLS |
| EP3552631A1 (en) | 2018-04-10 | 2019-10-16 | Inatherys | Antibody-drug conjugates and their uses for the treatment of cancer |
| JP2021525735A (ja) | 2018-05-30 | 2021-09-27 | デビオファーム インターナショナル, エス. アー. | 抗cd37免疫コンジュゲート投薬レジメン |
| CN111620927B (zh) * | 2019-05-20 | 2022-11-11 | 烟台迈百瑞国际生物医药股份有限公司 | 一种抗体药物偶联物中间体的一锅法制备工艺 |
| WO2020263906A1 (en) * | 2019-06-25 | 2020-12-30 | Tarveda Therapeutics, Inc. | Sstr-targeted conjugates and formulations thereof |
| PH12022550039A1 (en) | 2019-07-10 | 2023-06-26 | Cybrexa 3 Inc | Peptide conjugates of cytotoxins as therapeutics |
| MX2022000450A (es) | 2019-07-10 | 2022-04-25 | Cybrexa 3 Inc | Conjugados peptídicos de agentes dirigidos a microtúbulos como terapéuticos. |
| US20230181756A1 (en) | 2020-04-30 | 2023-06-15 | Novartis Ag | Ccr7 antibody drug conjugates for treating cancer |
| JP2025508737A (ja) | 2022-02-17 | 2025-04-10 | ノベルティー、ノビリティー、インコーポレイテッド | 抗体薬物複合体 |
| WO2025019790A1 (en) | 2023-07-19 | 2025-01-23 | Iovance Biotherapeutics, Inc. | Treatment of cancer patients with tumor infiltrating lymphocyte therapies in combination with trop-2 targeting adc |
Family Cites Families (166)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US1043543A (en) | 1912-02-15 | 1912-11-05 | Robert H Shaw | Poultry-house door. |
| SE430062B (sv) | 1977-03-04 | 1983-10-17 | Pharmacia Fine Chemicals Ab | Kopplings- eller tioleringsreagens |
| US4137230A (en) * | 1977-11-14 | 1979-01-30 | Takeda Chemical Industries, Ltd. | Method for the production of maytansinoids |
| US4307016A (en) | 1978-03-24 | 1981-12-22 | Takeda Chemical Industries, Ltd. | Demethyl maytansinoids |
| US4256746A (en) | 1978-11-14 | 1981-03-17 | Takeda Chemical Industries | Dechloromaytansinoids, their pharmaceutical compositions and method of use |
| JPS55102583A (en) | 1979-01-31 | 1980-08-05 | Takeda Chem Ind Ltd | 20-acyloxy-20-demethylmaytansinoid compound |
| JPS55162791A (en) | 1979-06-05 | 1980-12-18 | Takeda Chem Ind Ltd | Antibiotic c-15003pnd and its preparation |
| JPS5645483A (en) | 1979-09-19 | 1981-04-25 | Takeda Chem Ind Ltd | C-15003phm and its preparation |
| JPS5645485A (en) | 1979-09-21 | 1981-04-25 | Takeda Chem Ind Ltd | Production of c-15003pnd |
| EP0028683A1 (en) | 1979-09-21 | 1981-05-20 | Takeda Chemical Industries, Ltd. | Antibiotic C-15003 PHO and production thereof |
| WO1982001188A1 (en) | 1980-10-08 | 1982-04-15 | Takeda Chemical Industries Ltd | 4,5-deoxymaytansinoide compounds and process for preparing same |
| US4450254A (en) | 1980-11-03 | 1984-05-22 | Standard Oil Company | Impact improvement of high nitrile resins |
| US4313946A (en) | 1981-01-27 | 1982-02-02 | The United States Of America As Represented By The Secretary Of Agriculture | Chemotherapeutically active maytansinoids from Trewia nudiflora |
| US4315929A (en) | 1981-01-27 | 1982-02-16 | The United States Of America As Represented By The Secretary Of Agriculture | Method of controlling the European corn borer with trewiasine |
| US4563304A (en) | 1981-02-27 | 1986-01-07 | Pharmacia Fine Chemicals Ab | Pyridine compounds modifying proteins, polypeptides or polysaccharides |
| JPS57192389A (en) | 1981-05-20 | 1982-11-26 | Takeda Chem Ind Ltd | Novel maytansinoid |
| US4664911A (en) | 1983-06-21 | 1987-05-12 | Board Of Regents, University Of Texas System | Immunotoxin conjugates employing toxin B chain moieties |
| DE3584012D1 (de) | 1985-01-22 | 1991-10-10 | Saint Gobain Vitrage | Verfahren zur herstellung eines pulvers auf basis von indium-formiat zur herstellung einer duennen beschichtung auf einem substrat, insbesondere auf glas. |
| GB8600582D0 (en) | 1986-01-10 | 1986-02-19 | Ca Minister Nat Defence | Purifying biological materials |
| US5225539A (en) | 1986-03-27 | 1993-07-06 | Medical Research Council | Recombinant altered antibodies and methods of making altered antibodies |
| GB8607679D0 (en) | 1986-03-27 | 1986-04-30 | Winter G P | Recombinant dna product |
| US4859449A (en) | 1987-09-14 | 1989-08-22 | Center For Molecular Medicine And Immunology | Modified antibodies for enhanced hepatocyte clearance |
| US5241078A (en) | 1988-06-14 | 1993-08-31 | Cetus Oncology | Coupling agents and sterically hindered disulfide linked conjugates prepared therefrom |
| US5024834A (en) | 1988-07-12 | 1991-06-18 | Cetus Corporation | Thioether linked immunotoxin conjugates |
| CA2006408A1 (en) | 1988-12-27 | 1990-06-27 | Susumu Iwasa | Bispecific monoclonal antibody, its production and use |
| US5530101A (en) | 1988-12-28 | 1996-06-25 | Protein Design Labs, Inc. | Humanized immunoglobulins |
| US5714149A (en) | 1989-02-10 | 1998-02-03 | Celltech Therapeutics Limited | Crosslinked antibodies and processes for their preparation |
| CA2026147C (en) * | 1989-10-25 | 2006-02-07 | Ravi J. Chari | Cytotoxic agents comprising maytansinoids and their therapeutic use |
| US5208020A (en) | 1989-10-25 | 1993-05-04 | Immunogen Inc. | Cytotoxic agents comprising maytansinoids and their therapeutic use |
| US6316003B1 (en) | 1989-12-21 | 2001-11-13 | Whitehead Institute For Biomedical Research | Tat-derived transport polypeptides |
| US5137877B1 (en) | 1990-05-14 | 1996-01-30 | Bristol Myers Squibb Co | Bifunctional linking compounds conjugates and methods for their production |
| GB9015198D0 (en) | 1990-07-10 | 1990-08-29 | Brien Caroline J O | Binding substance |
| US5545806A (en) | 1990-08-29 | 1996-08-13 | Genpharm International, Inc. | Ransgenic non-human animals for producing heterologous antibodies |
| JP2938569B2 (ja) | 1990-08-29 | 1999-08-23 | ジェンファーム インターナショナル,インコーポレイティド | 異種免疫グロブリンを作る方法及びトランスジェニックマウス |
| CA2048078A1 (en) | 1990-11-15 | 1992-05-16 | Wolfgang A. Wrasidlo | Chemical modification of antibodies for creation of immunoconjugates |
| US5252714A (en) * | 1990-11-28 | 1993-10-12 | The University Of Alabama In Huntsville | Preparation and use of polyethylene glycol propionaldehyde |
| SE9102074D0 (sv) | 1991-07-03 | 1991-07-03 | Kabi Pharmacia Ab | Tomour antigen specific antibody |
| SE470006B (sv) * | 1991-09-26 | 1993-10-25 | Corline Systems Ab | Nytt konjugat, dess framställning och användning samt substrat preparerat med konjugatet |
| WO1993011236A1 (en) | 1991-12-02 | 1993-06-10 | Medical Research Council | Production of anti-self antibodies from antibody segment repertoires and displayed on phage |
| DE69231123T2 (de) | 1992-03-25 | 2001-02-15 | Immunogen Inc | Konjugaten von Zell-bindender Mittel und Derivaten von CC-1065 |
| US5639641A (en) | 1992-09-09 | 1997-06-17 | Immunogen Inc. | Resurfacing of rodent antibodies |
| US5556623A (en) * | 1993-03-30 | 1996-09-17 | Eli Lilly And Company | Antibody-drug conjugates |
| IL111748A0 (en) | 1993-12-03 | 1995-01-24 | Zeneca Ltd | Proteins |
| US5747446A (en) | 1994-03-22 | 1998-05-05 | Beth Israel Deaconess Medical Center | Modified polypeptides with increased biological activity |
| US5919758A (en) | 1994-03-22 | 1999-07-06 | Beth Israel Deaconess Medical Center | Modified polypeptides with altered biological activity |
| US5580853A (en) | 1994-03-22 | 1996-12-03 | New England Deaconess Hospital | Modified polypeptides with increased biological activity |
| US5612474A (en) | 1994-06-30 | 1997-03-18 | Eli Lilly And Company | Acid labile immunoconjugate intermediates |
| AU5908296A (en) * | 1995-05-31 | 1996-12-24 | Fred Hutchinson Cancer Research Center | Compositions and methods for targeted delivery of effector m olecules |
| US6265150B1 (en) | 1995-06-07 | 2001-07-24 | Becton Dickinson & Company | Phage antibodies |
| US5714352A (en) | 1996-03-20 | 1998-02-03 | Xenotech Incorporated | Directed switch-mediated DNA recombination |
| US5958872A (en) | 1996-04-01 | 1999-09-28 | Apoptosis Technology, Inc. | Active survival domains of IGF-IR and methods of use |
| WO1998026747A2 (en) | 1996-12-17 | 1998-06-25 | Terman David S | Superantigen based methods and compositions for treatment of diseases |
| US6462070B1 (en) * | 1997-03-06 | 2002-10-08 | The General Hospital Corporation | Photosensitizer conjugates for pathogen targeting |
| US6371975B2 (en) * | 1998-11-06 | 2002-04-16 | Neomend, Inc. | Compositions, systems, and methods for creating in situ, chemically cross-linked, mechanical barriers |
| DE69827507T2 (de) * | 1997-06-11 | 2006-03-09 | Borean Pharma A/S | Trimerisierendes modul |
| US6171586B1 (en) | 1997-06-13 | 2001-01-09 | Genentech, Inc. | Antibody formulation |
| US5958677A (en) | 1997-07-28 | 1999-09-28 | The New York Blood Center, Inc. | Method for purifying viral nucleic acids |
| JP2002501721A (ja) | 1997-08-01 | 2002-01-22 | モルフォシス・アクチェンゲゼルシャフト | 多量体(ポリ)ペプチドコンプレックスのメンバーをコードする核酸配列を同定するための新規方法およびファージ |
| US5965714A (en) | 1997-10-02 | 1999-10-12 | Connaught Laboratories, Inc. | Method for the covalent attachment of polysaccharides to protein molecules |
| IL135148A0 (en) * | 1997-10-03 | 2001-05-20 | Galenica Pharmaceuticals Inc | A polysaccharide conjugate and pharmaceutical compositions containing the same |
| US6121236A (en) * | 1998-03-24 | 2000-09-19 | The Children's Medical Center Corporation | Multivalent ligands which modulate angiogenesis |
| US6573245B1 (en) * | 1998-04-28 | 2003-06-03 | Galenica Pharmaceuticals, Inc. | Modified polysaccharide adjuvant-protein antigen conjugates, the preparation thereof and the use thereof |
| US5981564A (en) * | 1998-07-01 | 1999-11-09 | Universite Laval | Water-soluble derivatives of paclitaxel, method for producing same and uses thereof |
| US7067109B1 (en) | 1998-07-13 | 2006-06-27 | Board Of Regents, The University Of Texas System | Cancer treatment kits comprising therapeutic conjugates that bind to aminophospholipids |
| TW593241B (en) | 1999-04-20 | 2004-06-21 | Hoffmann La Roche | Carbamic acid derivatives |
| AUPQ014799A0 (en) * | 1999-05-04 | 1999-05-27 | Access Pharmaceuticals Australia Pty Limited | Amplification of folate-mediated targeting to tumor cells using polymers |
| WO2001024763A2 (en) | 1999-10-01 | 2001-04-12 | Immunogen, Inc. | Compositions and methods for treating cancer using immunoconjugates and chemotherapeutic agents |
| JP2003514903A (ja) | 1999-11-24 | 2003-04-22 | イムノージェン インコーポレーテッド | タキサンを含有する細胞傷害薬とその治療への利用 |
| DK1242438T3 (da) | 1999-12-29 | 2007-02-12 | Immunogen Inc | Cytotoksiske midler omfattende modificerede doxorubiciner og daunorubiciner og deres terapeutiske anvendelse |
| EP1257289A1 (en) | 2000-02-08 | 2002-11-20 | The Penn State Research Foundation | Immunotherapy using interleukin 13 receptor subunit alpha 2 |
| US7097840B2 (en) * | 2000-03-16 | 2006-08-29 | Genentech, Inc. | Methods of treatment using anti-ErbB antibody-maytansinoid conjugates |
| US6632979B2 (en) | 2000-03-16 | 2003-10-14 | Genentech, Inc. | Rodent HER2 tumor model |
| US6333410B1 (en) | 2000-08-18 | 2001-12-25 | Immunogen, Inc. | Process for the preparation and purification of thiol-containing maytansinoids |
| US6596503B1 (en) | 2000-08-18 | 2003-07-22 | East Carolina University | Monoclonal antibody DS6, tumor-associated antigen CA6, and methods of use thereof |
| US20060062786A1 (en) | 2000-11-08 | 2006-03-23 | Human Genome Sciences, Inc. | Antibodies that immunospecifically bind to TRAIL receptors |
| MA26040A1 (fr) | 2001-01-05 | 2004-04-01 | Pfizer | Des anticorps pour recepteur i de facteur de croissance insulinique |
| KR20030091978A (ko) | 2001-01-29 | 2003-12-03 | 아이덱 파마슈티칼즈 코포레이션 | 변형된 항체 및 사용 방법 |
| DE60214134T2 (de) * | 2001-02-07 | 2007-07-19 | Beth Israel Deaconess Medical Center, Boston | Modifizierte psma-liganden und deren verwendung |
| US20020197261A1 (en) | 2001-04-26 | 2002-12-26 | Chun Li | Therapeutic agent/ligand conjugate compositions, their methods of synthesis and use |
| CN101172158A (zh) | 2001-05-11 | 2008-05-07 | 得克萨斯州立大学董事会 | 抗cd26单克隆抗体作为对与表达cd26的细胞相关疾病的治疗 |
| EP1258255A1 (en) | 2001-05-18 | 2002-11-20 | Boehringer Ingelheim International GmbH | Conjugates of an antibody to CD44 and a maytansinoid |
| US6441163B1 (en) | 2001-05-31 | 2002-08-27 | Immunogen, Inc. | Methods for preparation of cytotoxic conjugates of maytansinoids and cell binding agents |
| IL158969A0 (en) | 2001-06-01 | 2004-05-12 | Cornell Res Foundation Inc | Modified antibodies to prostate-specific membrane antigen and uses thereof |
| TW593239B (en) | 2001-06-04 | 2004-06-21 | Kevin Dale Allen | One-step production of 1,3-propanediol from ethylene oxide and syngas with a catalyst with a phospholanoalkane ligand |
| US7157443B2 (en) | 2001-12-11 | 2007-01-02 | Merck & Co., Inc. | Staphylococcus aureus exopolysaccharide and process |
| US6716821B2 (en) | 2001-12-21 | 2004-04-06 | Immunogen Inc. | Cytotoxic agents bearing a reactive polyethylene glycol moiety, cytotoxic conjugates comprising polyethylene glycol linking groups, and methods of making and using the same |
| WO2003057163A2 (en) | 2002-01-03 | 2003-07-17 | Smithkline Beecham Corporation | Methods for preparing immunoconjugates |
| US7591994B2 (en) * | 2002-12-13 | 2009-09-22 | Immunomedics, Inc. | Camptothecin-binding moiety conjugates |
| US8877901B2 (en) | 2002-12-13 | 2014-11-04 | Immunomedics, Inc. | Camptothecin-binding moiety conjugates |
| US6534660B1 (en) | 2002-04-05 | 2003-03-18 | Immunogen, Inc. | CC-1065 analog synthesis |
| US6756397B2 (en) | 2002-04-05 | 2004-06-29 | Immunogen, Inc. | Prodrugs of CC-1065 analogs |
| JP4319979B2 (ja) | 2002-04-26 | 2009-08-26 | ジェネンテック・インコーポレーテッド | タンパク質の非アフィニティ精製 |
| PL224001B1 (pl) | 2002-05-02 | 2016-11-30 | Wyeth Corp | Sposób wytwarzania stabilnej liofilizowanej kompozycji obejmującej monomeryczne koniugaty pochodna kalicheamycyny/przeciwciało anty-CD22, kompozycja otrzymana tym sposobem oraz jej zastosowanie |
| US20090068178A1 (en) | 2002-05-08 | 2009-03-12 | Genentech, Inc. | Compositions and Methods for the Treatment of Tumor of Hematopoietic Origin |
| US6596757B1 (en) | 2002-05-14 | 2003-07-22 | Immunogen Inc. | Cytotoxic agents comprising polyethylene glycol-containing taxanes and their therapeutic use |
| EP1551875A4 (en) | 2002-06-21 | 2006-06-28 | Biogen Idec Inc | TAMPON PREPARATIONS FOR CONCENTRATING ANTIBODIES AND METHODS FOR USE THEREOF |
| US7390898B2 (en) | 2002-08-02 | 2008-06-24 | Immunogen Inc. | Cytotoxic agents containing novel potent taxanes and their therapeutic use |
| ATE499116T1 (de) | 2002-08-16 | 2011-03-15 | Immunogen Inc | Vernetzer mit hoher reaktivität und löslichkeit und ihre verwendung bei der herstellung von konjugaten für die gezielte abgabe von kleinmolekularen arzneimitteln |
| AU2003273413A1 (en) * | 2002-10-08 | 2004-05-04 | Fresenius Kabi Deutschland Gmbh | Pharmaceutically active oligosaccharide conjugates |
| CN106337046B (zh) * | 2002-10-30 | 2021-03-23 | 纽韦卢森公司 | 合成双功能复合物的方法 |
| KR20050059332A (ko) | 2002-11-07 | 2005-06-17 | 이뮤노젠 아이엔씨 | 항-씨디33 항체와 이를 이용한 급성 골수성 백혈병의치료방법 |
| MX342007B (es) | 2003-05-14 | 2016-09-09 | Immunogen Inc | Composicion de farmaco conjugado. |
| US8088387B2 (en) | 2003-10-10 | 2012-01-03 | Immunogen Inc. | Method of targeting specific cell populations using cell-binding agent maytansinoid conjugates linked via a non-cleavable linker, said conjugates, and methods of making said conjugates |
| US7276497B2 (en) | 2003-05-20 | 2007-10-02 | Immunogen Inc. | Cytotoxic agents comprising new maytansinoids |
| EP3524611B1 (en) | 2003-05-20 | 2020-12-30 | ImmunoGen, Inc. | Improved cytotoxic agents comprising new maytansinoids |
| EP3037105B1 (en) | 2003-06-27 | 2021-03-17 | Amgen Fremont Inc. | Antibodies directed to the deletion mutants of epidermal growth factor receptor and uses thereof |
| US20050074425A1 (en) * | 2003-07-02 | 2005-04-07 | Polycord, Inc. | Method for delivering polymerized therapeutic agent compositions and compositions thereof |
| CN1878568A (zh) * | 2003-11-05 | 2006-12-13 | 盘林京有限公司 | Cdim结合抗体的增强的b细胞细胞毒性 |
| US20050175619A1 (en) | 2004-02-05 | 2005-08-11 | Robert Duffy | Methods of producing antibody conjugates |
| US20110064754A1 (en) | 2005-03-03 | 2011-03-17 | Center For Molecular Medicine And Immunology | Immunoconjugates Comprising Poxvirus-Derived Peptides and Antibodies Against Antigen-Presenting Cells for Subunit-Based Poxvirus Vaccines |
| WO2005094882A1 (en) | 2004-03-03 | 2005-10-13 | Millennium Pharmaceuticals, Inc. | Modified antibodies to prostate-specific membrane antigen and uses thereof |
| JP2008505853A (ja) | 2004-04-13 | 2008-02-28 | クインテセンス バイオサイエンシーズ インコーポレーティッド | 細胞傷害性薬剤としての非天然のリボヌクレアーゼ複合体 |
| US20060073528A1 (en) * | 2004-05-14 | 2006-04-06 | Jean-Michel Lecerf | Measurement methods |
| US7691962B2 (en) | 2004-05-19 | 2010-04-06 | Medarex, Inc. | Chemical linkers and conjugates thereof |
| WO2005112919A2 (en) | 2004-05-19 | 2005-12-01 | Medarex, Inc. | Self-immolative linkers and drug conjugates |
| CA2567520A1 (en) | 2004-06-01 | 2005-12-15 | Genentech, Inc. | Maytansinoid-antibody conjugates |
| AU2004224925C1 (en) | 2004-08-30 | 2011-07-21 | Biotest Ag | Immunoconjugates targeting syndecan-1 expressing cells and use thereof |
| TW200630106A (en) | 2004-10-08 | 2006-09-01 | Wyeth Corp | Immunotherapy of autoimmune disorders |
| CA2587589A1 (en) | 2004-11-29 | 2006-06-22 | Seattle Genetics, Inc. | Engineered antibodies and immunoconjugates |
| KR101281501B1 (ko) | 2004-12-09 | 2013-07-15 | 얀센 바이오테크 인코포레이티드 | 항인테그린 면역 컨쥬게이트, 방법 및 용도 |
| US7408030B2 (en) | 2005-01-13 | 2008-08-05 | North Carolina State University | Purification of immunoglobulins using affinity chromatography and peptide ligands |
| US20110166319A1 (en) * | 2005-02-11 | 2011-07-07 | Immunogen, Inc. | Process for preparing purified drug conjugates |
| WO2006086733A2 (en) | 2005-02-11 | 2006-08-17 | Immunogen, Inc. | Process for preparing maytansinoid antibody conjugates |
| US7678371B2 (en) | 2005-03-04 | 2010-03-16 | Biogen Idec Ma Inc. | Methods of humanizing immunoglobulin variable regions through rational modification of complementarity determining residues |
| EP1868649A4 (en) | 2005-04-15 | 2011-06-29 | Immunogen Inc | ELIMINATION OF A POPULATION OF HETEROGENEOUS OR MIXED CELLS IN TUMORS |
| GB2427360A (en) * | 2005-06-22 | 2006-12-27 | Complex Biosystems Gmbh | Aliphatic prodrug linker |
| RU2422143C2 (ru) | 2005-07-15 | 2011-06-27 | Анджиокем Инк. | Усиление действия противораковых агентов |
| EA014513B1 (ru) * | 2005-08-03 | 2010-12-30 | Иммьюноджен, Инк. | Композиция иммуноконъюгата |
| JP2009506302A (ja) * | 2005-08-04 | 2009-02-12 | イェシバ・ユニバーシティ | Ablによるタウのリン酸化 |
| NZ595430A (en) | 2005-08-24 | 2013-05-31 | Immunogen Inc | Process for preparing maytansinoid antibody conjugates |
| JP2009508938A (ja) * | 2005-09-22 | 2009-03-05 | ハダシット メディカル リサーチ サーヴィスィズ アンド ディベロップメント リミテッド | 治療上活性な化合物の結合体 |
| CN101312748A (zh) | 2005-09-26 | 2008-11-26 | 梅达莱克斯公司 | 抗体-药物轭合物和使用方法 |
| US7928113B2 (en) | 2005-11-14 | 2011-04-19 | University Of Southern California | Integrin-binding small molecules |
| US7964415B2 (en) * | 2006-04-26 | 2011-06-21 | Cardiogenics Inc. | Stable water-soluble polyethylenimine conjugates and methods of use thereof |
| US8524865B2 (en) | 2006-05-30 | 2013-09-03 | Genentech, Inc. | Antibodies and immunoconjugates and uses therefor |
| EA020324B1 (ru) | 2006-07-18 | 2014-10-30 | Санофи-Авентис | АНТИТЕЛА К РЕЦЕПТОРУ ЭФРИНА EphA2 И ИХ ПРИМЕНЕНИЕ |
| US20080213349A1 (en) * | 2006-09-11 | 2008-09-04 | Deepak Ramesh Thakker | Liposome Complexes Containing Pharmaceutical Agents and Methods |
| JP2010505874A (ja) | 2006-10-03 | 2010-02-25 | ノヴォ ノルディスク アー/エス | ポリペプチドコンジュゲートの精製方法 |
| EP1914242A1 (en) | 2006-10-19 | 2008-04-23 | Sanofi-Aventis | Novel anti-CD38 antibodies for the treatment of cancer |
| DK2019104T3 (da) | 2007-07-19 | 2013-12-16 | Sanofi Sa | Cytotoksiske midler, der omfatter nye tomaymycinderivater, og terapeutisk anvendelse deraf |
| CN102083461B (zh) | 2008-04-30 | 2014-09-17 | 伊缪诺金公司 | 有效的偶联物和亲水性连接体 |
| CN104524592B (zh) * | 2008-04-30 | 2018-06-05 | 伊缪诺金公司 | 交联剂和它们的用途 |
| GB0811743D0 (en) * | 2008-06-26 | 2008-07-30 | Hemosol Biopharma Inc | Composition |
| WO2010057160A1 (en) * | 2008-11-17 | 2010-05-20 | Enzon Pharmaceuticals, Inc. | Releasable fusogenic lipids for nucleic acids delivery systems |
| CN102365021B (zh) | 2009-02-05 | 2015-07-15 | 伊缪诺金公司 | 新型苯并二氮杂*衍生物 |
| AR076284A1 (es) | 2009-04-29 | 2011-06-01 | Bayer Schering Pharma Ag | Inmunoconjugados de antimesotelina y usos de los mismos |
| KR101947176B1 (ko) | 2009-06-03 | 2019-02-12 | 이뮤노젠 아이엔씨 | 접합 방법 |
| FR2947269B1 (fr) | 2009-06-29 | 2013-01-18 | Sanofi Aventis | Nouveaux composes anticancereux |
| UY32914A (es) | 2009-10-02 | 2011-04-29 | Sanofi Aventis | Anticuerpos que se usan específicamente al receptor epha2 |
| TW201117814A (en) | 2009-10-02 | 2011-06-01 | Sanofi Aventis | New maytansinoids and the use of said maytansinoids to prepare conjugates with an antibody |
| SMT201700139T1 (it) | 2010-02-24 | 2017-05-08 | Immunogen Inc | Immunoconiugati contro il recettore 1 del folato e relativi usi |
| MY177062A (en) | 2010-03-12 | 2020-09-03 | Debiopharm Int Sa | Cd37-binding molecules and immunoconjugates thereof |
| KR20110103182A (ko) | 2010-03-12 | 2011-09-20 | 삼성전자주식회사 | 입체 영상 표시 장치 |
| WO2012019024A2 (en) | 2010-08-04 | 2012-02-09 | Immunogen, Inc. | Her3-binding molecules and immunoconjugates thereof |
| US20120149732A1 (en) * | 2010-12-14 | 2012-06-14 | Alexander Chucholowski | Multifunctional linkers and methods for the use thereof |
| SMT201900181T1 (it) * | 2011-02-15 | 2019-05-10 | Immunogen Inc | Metodi di preparazione di coniugati |
| CA2831562A1 (en) | 2011-03-29 | 2012-10-04 | Immunogen, Inc. | Process for manufacturing conjugates of improved homogeneity |
| EA201991268A3 (ru) * | 2011-03-29 | 2020-01-31 | Иммуноджен, Инк. | Получение конъюгатов "майтансиноид-антитело" одностадийным способом |
| WO2012135517A2 (en) | 2011-03-29 | 2012-10-04 | Immunogen, Inc. | Preparation of maytansinoid antibody conjugates by a one-step process |
| CN114441757A (zh) | 2011-04-01 | 2022-05-06 | 伊缪诺金公司 | 用于增加folr1癌症治疗的功效的方法 |
| US20130071482A1 (en) * | 2011-09-20 | 2013-03-21 | The University Of Kentucky Research Foundation | Block copolymer cross-linked nanoassemblies as modular delivery vehicles |
| KR20140107418A (ko) | 2011-12-13 | 2014-09-04 | 이뮤노젠 아이엔씨 | 접합체 안정성을 개선하기 위한 n-하이드록시숙신이미드의 용도 |
| HK1213288A1 (zh) | 2012-10-04 | 2016-06-30 | Immunogen, Inc. | 使用pvdf膜純化細胞結合劑細胞毒性劑綴合物 |
| AU2013326897A1 (en) | 2012-10-04 | 2015-05-07 | Immunogen, Inc. | Use of an ion exchange membrane to remove impurities from cell-binding agent cytotoxic agent conjugates |
| WO2014055842A1 (en) | 2012-10-04 | 2014-04-10 | Immunogen, Inc. | Process for preparing stable antibody maytansinoid conjugates |
| WO2014086835A1 (en) * | 2012-12-05 | 2014-06-12 | Ruprecht-Karls-Universität Heidelberg | Conjugates of proteins and multivalent cell-penetrating peptides and their uses |
-
2012
- 2012-03-29 EA EA201991268A patent/EA201991268A3/ru unknown
- 2012-03-29 MX MX2013011215A patent/MX339927B/es active IP Right Grant
- 2012-03-29 KR KR1020237029015A patent/KR20230128583A/ko not_active Ceased
- 2012-03-29 JP JP2014502803A patent/JP6000329B2/ja not_active Expired - Fee Related
- 2012-03-29 KR KR1020207010853A patent/KR102272828B1/ko active Active
- 2012-03-29 KR KR1020227000970A patent/KR20220009505A/ko not_active Ceased
- 2012-03-29 SI SI201231538T patent/SI2691155T1/sl unknown
- 2012-03-29 SM SM20190114T patent/SMT201900114T1/it unknown
- 2012-03-29 LT LTEP12714160.4T patent/LT2691155T/lt unknown
- 2012-03-29 CN CN201710705089.5A patent/CN107537040A/zh active Pending
- 2012-03-29 EP EP18199729.7A patent/EP3545977A1/en not_active Withdrawn
- 2012-03-29 UA UAA201312640A patent/UA116524C2/uk unknown
- 2012-03-29 AU AU2012236398A patent/AU2012236398B2/en not_active Ceased
- 2012-03-29 ES ES12714160T patent/ES2709577T3/es active Active
- 2012-03-29 RS RS20190189A patent/RS58367B1/sr unknown
- 2012-03-29 MX MX2016007829A patent/MX369659B/es unknown
- 2012-03-29 HR HRP20190243TT patent/HRP20190243T1/hr unknown
- 2012-03-29 CA CA2831467A patent/CA2831467C/en active Active
- 2012-03-29 DK DK12714160.4T patent/DK2691155T3/en active
- 2012-03-29 KR KR1020137028135A patent/KR102103302B1/ko active Active
- 2012-03-29 PL PL12714160T patent/PL2691155T3/pl unknown
- 2012-03-29 US US13/434,451 patent/US8795673B2/en active Active
- 2012-03-29 TR TR2019/02180T patent/TR201902180T4/tr unknown
- 2012-03-29 KR KR1020227028603A patent/KR20220123130A/ko not_active Ceased
- 2012-03-29 HU HUE12714160A patent/HUE041384T2/hu unknown
- 2012-03-29 NZ NZ726386A patent/NZ726386A/en not_active IP Right Cessation
- 2012-03-29 CN CN201280016107.4A patent/CN103717262B/zh active Active
- 2012-03-29 EA EA201391398A patent/EA033468B1/ru unknown
- 2012-03-29 ME MEP-2019-34A patent/ME03353B/me unknown
- 2012-03-29 EP EP12714160.4A patent/EP2691155B1/en active Active
- 2012-03-29 PT PT12714160T patent/PT2691155T/pt unknown
- 2012-03-29 KR KR1020217019701A patent/KR102351886B1/ko not_active Expired - Fee Related
-
2013
- 2013-09-29 IL IL228559A patent/IL228559A/en active IP Right Grant
-
2014
- 2014-06-24 US US14/313,868 patent/US9428543B2/en active Active
-
2016
- 2016-05-03 AU AU2016202832A patent/AU2016202832B2/en not_active Ceased
- 2016-07-21 US US15/215,857 patent/US9914748B2/en active Active
- 2016-08-25 ZA ZA2016/05918A patent/ZA201605918B/en unknown
- 2016-08-30 JP JP2016167618A patent/JP6456885B2/ja not_active Expired - Fee Related
-
2017
- 2017-02-22 IL IL250723A patent/IL250723B/en active IP Right Grant
-
2018
- 2018-02-01 US US15/886,495 patent/US10435432B2/en active Active
- 2018-04-25 IL IL258929A patent/IL258929B/en active IP Right Grant
- 2018-08-03 AU AU2018211331A patent/AU2018211331B2/en not_active Ceased
- 2018-12-19 JP JP2018236944A patent/JP6797885B2/ja not_active Expired - Fee Related
-
2019
- 2019-02-07 CY CY20191100166T patent/CY1121321T1/el unknown
-
2020
- 2020-02-11 US US16/787,942 patent/US11090390B2/en not_active Expired - Fee Related
- 2020-08-10 AU AU2020217301A patent/AU2020217301B2/en not_active Ceased
- 2020-11-18 JP JP2020191507A patent/JP7269210B2/ja active Active
-
2021
- 2021-07-09 US US17/371,151 patent/US11744900B2/en active Active
-
2023
- 2023-04-21 JP JP2023070124A patent/JP2023083504A/ja active Pending
- 2023-07-14 US US18/352,362 patent/US20240156976A1/en not_active Abandoned
-
2024
- 2024-01-09 AU AU2024200123A patent/AU2024200123A1/en not_active Abandoned
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| ES2709577T3 (es) | Preparación de conjugados de maitansinoides y anticuerpos mediante un proceso de una sola etapa | |
| ES2390826T3 (es) | Procedimiento para preparar conjugados de fármaco purificados | |
| WO2012135517A2 (en) | Preparation of maytansinoid antibody conjugates by a one-step process | |
| HK40014867A (en) | Preparation of maytansinoid antibody conjugates by a one-step process | |
| HK1194700A (en) | Preparation of maytansinoid antibody conjugates by a one-step process | |
| HK1194700B (en) | Preparation of maytansinoid antibody conjugates by a one-step process | |
| NZ712414B2 (en) | Preparation of antibody maytansinoid conjugates | |
| BR112013025225B1 (pt) | Preparação de conjugados de anticorpo de maitansinoide por processo de uma etapa | |
| NZ616509B2 (en) | Preparation of maytansinoid antibody conjugates by a one-step process |