-
GEBIET DER
ERFINDUNG
-
Diese
Erfindung betrifft allgemein die Synthese von Paclitaxel und Paclitaxelanaloga
aus Vorläuferverbindungen.
In nochmals genaueren Worten betrifft diese Erfindung die Synthese
von Paclitaxel und Analoga davon durch den Schritt einer Veresterung
von C7, C-10-di-CBZ-10-Deacetylbaccatin III mit einer geeignet geschützten 3-Phenylisoserinseitenkette,
gefolgt von anschließenden
Schutzentfernungen und Acylierungen. Die vorliegende Erfindung betrifft
auch Verfahren zum selektiven Acylieren von C-2'-O-geschütztem 10-Hydroxy-Paclitaxel
an der C-10-Hydroxyposition
gegenüber
der C-7-Hydroxyposition. Die vorliegende Erfindung betrifft weiterhin
C-10-Metallalkoxid-Zwischenproduktverbindungen, welche für die Herstellung
von Paclitaxel und Paclitaxelanaloga nützlich sind.
-
HINTERGRUND
DER ERFINDUNG
-
Die
in der Literatur als Taxol und seit kürzerem als "Paclitaxel" bezeichnete chemische Verbindung hat in
der wissenschaftlichen und medizinischen Gemeinschaft ein zunehmendes
Interesse erfahren, aufgrund dessen, dass es eine anti-Tumoraktivität zeigt.
Paclitaxel ist für
die chemotherapeutische Behandlung von verschiedenen unterschiedlichen
Tumorvarietäten
zugelassen worden, und die klinischen Versuche deuten darauf hin,
dass Paclitaxel einen breiten Bereich wirkungsvoller anti-leukämischer
und Tumor-inhibierender Aktivität
verspricht. Bekanntermaßen
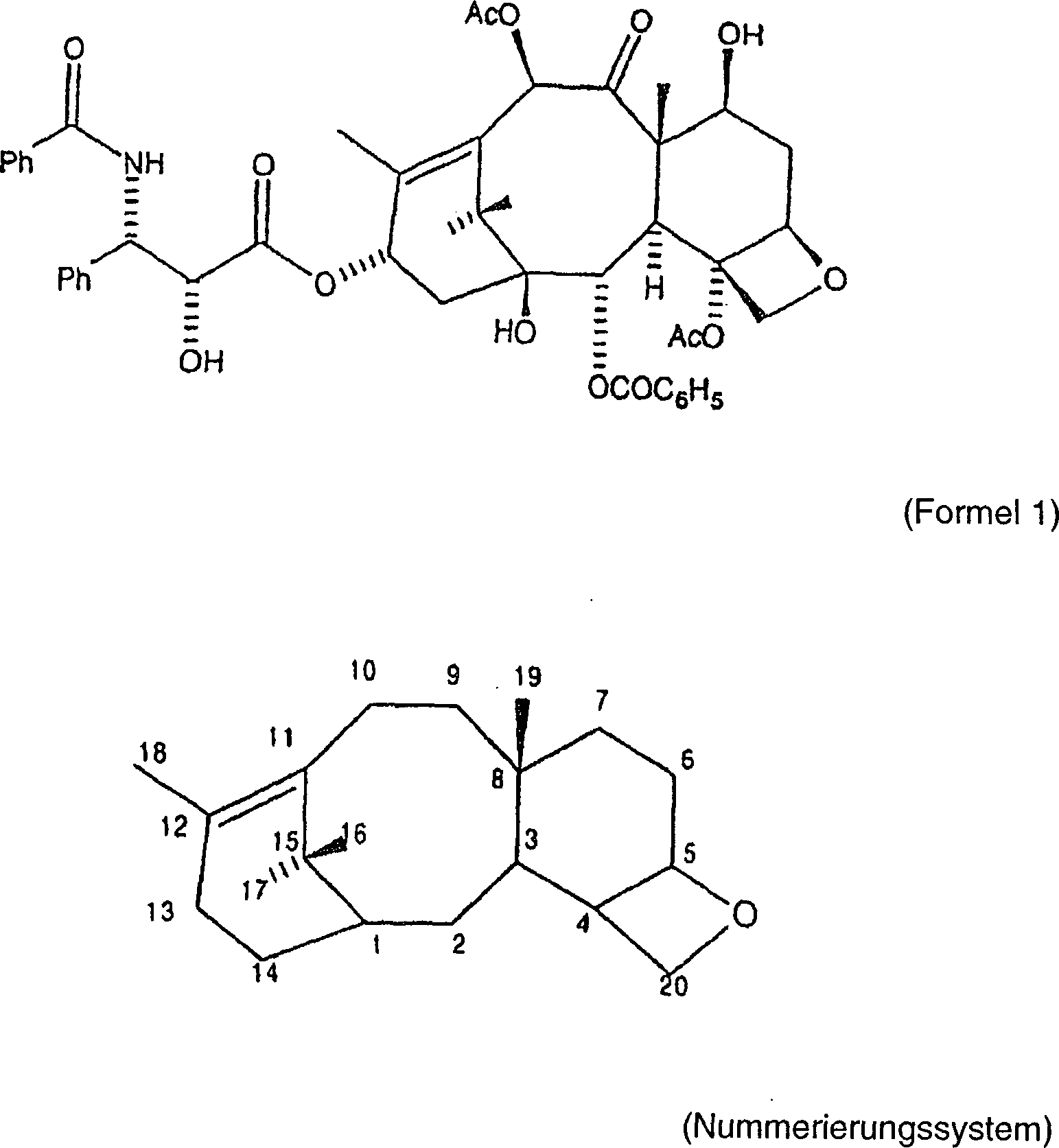
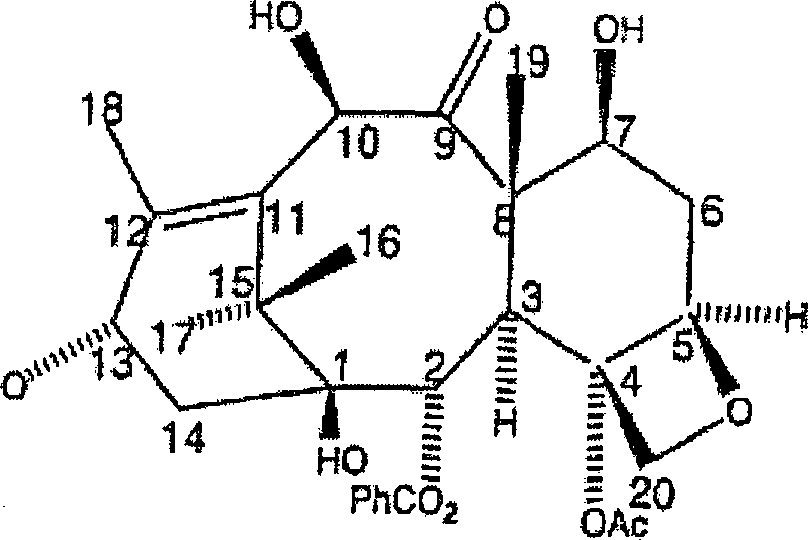
ist Paclitaxel ein natürlich
vorkommendes Taxanditerpenoid mit der Formel und dem Nummerierungssystem
wie folgt:
-
Obwohl
das Paclitaxel-Molekül
in verschiedenen Eibenspezies (Genus Taxus, Familie Taxaceae) gefunden
wird, ist die Konzentration dieser Verbindung sehr niedrig. Darüber hinaus
wachsen diese immergrünen Pflanzen
sehr langsam. Somit besteht eine Gefahr, dass die zunehmende Verwendung
von Paclitaxel als ein wirksames anti-Krebsmittel die natürlichen
Ressourcen in der Form der Eibenbäume erschöpfen wird. Obwohl die Rinde
der Eibenbäume
typischerweise die höchste
Konzentration an Paclitaxel aufweist, erfordert die Herstellung
von 1 Kilogramm Paclitaxel in der Tat annähernd 16.000 Pfund Rinde. Somit
sind die Langzeitperspektiven hinsichtlich der Verfügbarkeit
von Paclitaxel über
Isolierung entmutigend.
-
Die
Paclitaxel-Verbindung baut natürlich
auf dem Baccatin III-Grundgerüst
auf, und es gibt eine Reihe von anderen Taxan-Verbindungen, wie
etwa Baccatin III, Cephalomannin, 10-Deacetylbaccatin III, etc.,
von denen manche in höheren
Ausbeuten leichter aus den Eibenbäumen extrahiert werden. In
der Tat kann eine relativ hohe Konzentration an 10-Deacetylbaccatin
III aus den Blättern
der Eibe als eine erneuerbare Quelle extrahiert werden. Typischerweise
weisen diese anderen, in dem Eibenbaum vorhandenen Taxan-Verbindungen jedoch
nicht den Grad an anti-Tumoraktivität auf wie
die Paclitaxel-Verbindung.
-
Da
die Paclitaxel-Verbindung als ein chemotherapeutisches Mittel derart
viel versprechend erscheint, haben organische Chemiker erhebliche
Zeit und Ressourcen bei dem Versuch verbraucht, das Paclitaxel-Molekül zu synthetisieren.
Eine viel versprechendere Route für die Erzeugung von signifikanten
Mengen der Paclitaxel-Verbindung wurde für die Semisynthese von Paclitaxel
vorgeschlagen, mittels Bindung der A-Ring-Seitenkette an die C-13-Position
des natürlich
vorkommenden Baccatin III-Grundgerüsts, abgeleitet von den verschiedenen,
in der Eibe vorhandenen Taxanen. Siehe Denis et al., ein "Highly Efficient,
Practical Approach to Natural Taxol", Journal of the American Chemical Society,
Seite 5917 (1988). In diesem Artikel ist die partielle Synthese
von Paclitaxel aus 10-Deacetylbaccatin
III beschrieben.
-
Die
unkomplizierteste Ausführung
einer partiellen Synthese von Paclitaxel erfordert einen günstigen Zugang
zu einer chiralen, nicht-racemischen Seitenkette und Derivaten,
eine natürliche
Quelle für
ausreichend Baccatin III oder eng verwandte Diterpenoidsubstanzen,
und ein wirksames Mittel zum Verbinden der zwei. Von besonderem
Interesse ist demnach die Kondensation von Baccatin III oder 10-Deacetylbaccatin
III mit der A-Ring-Seitenkette von Paclitaxel. Die Veresterung dieser
zwei Einheiten ist jedoch schwierig, aufgrund des gehinderten C-13-Hydroxyls
von Baccatin III, welches innerhalb der konkaven Region des hemisphärischen Taxan-Skeletts
lokalisiert ist. Beispielsweise berichteten Greene und Gueritte-Voegelein eine lediglich
50-prozentige Umsetzung nach 100 Stunden in einer partiellen Synthese
von Paclitaxel. J. Am. Chem. Soc., 1988, 110, 5917.
-
In
US Patent Nr. 4,929,011, erteilt am 8. Mai 1990 an Denis et al.,
mit dem Titel "Process
for Preparing Taxol",
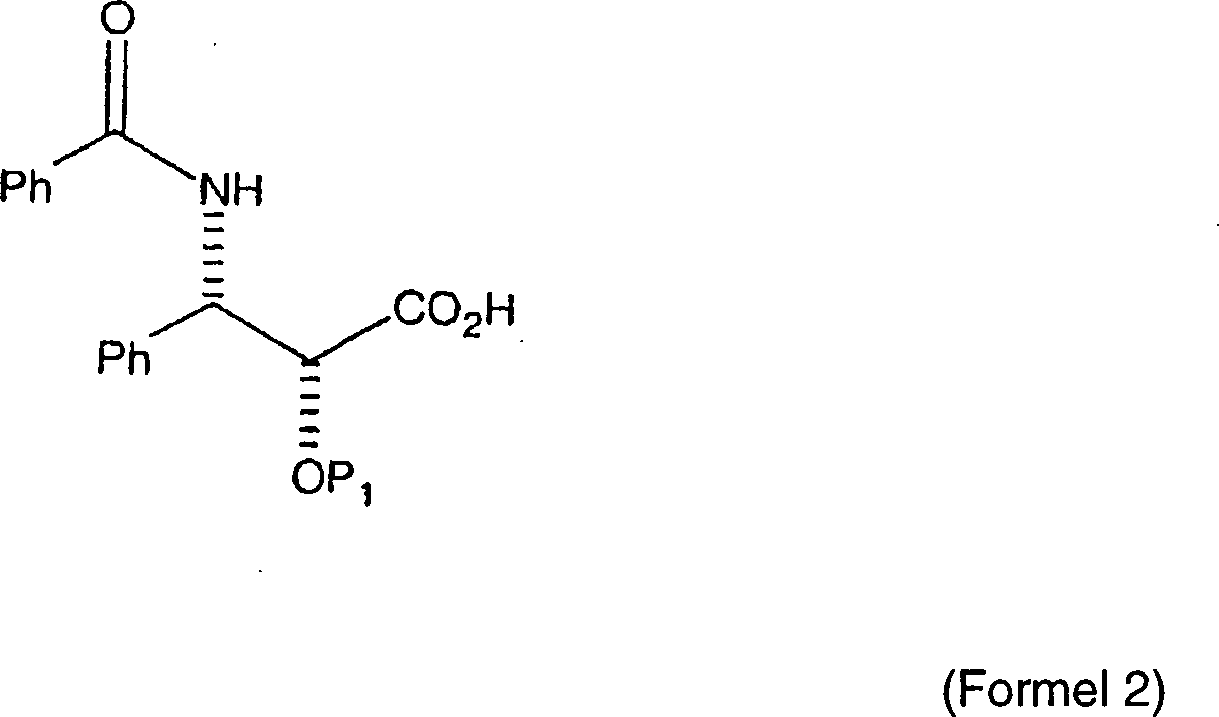
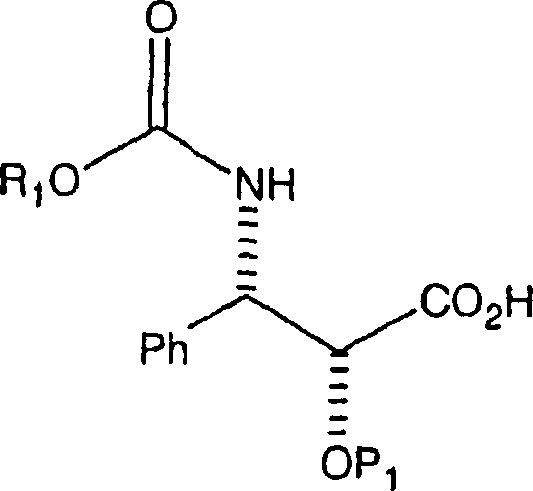
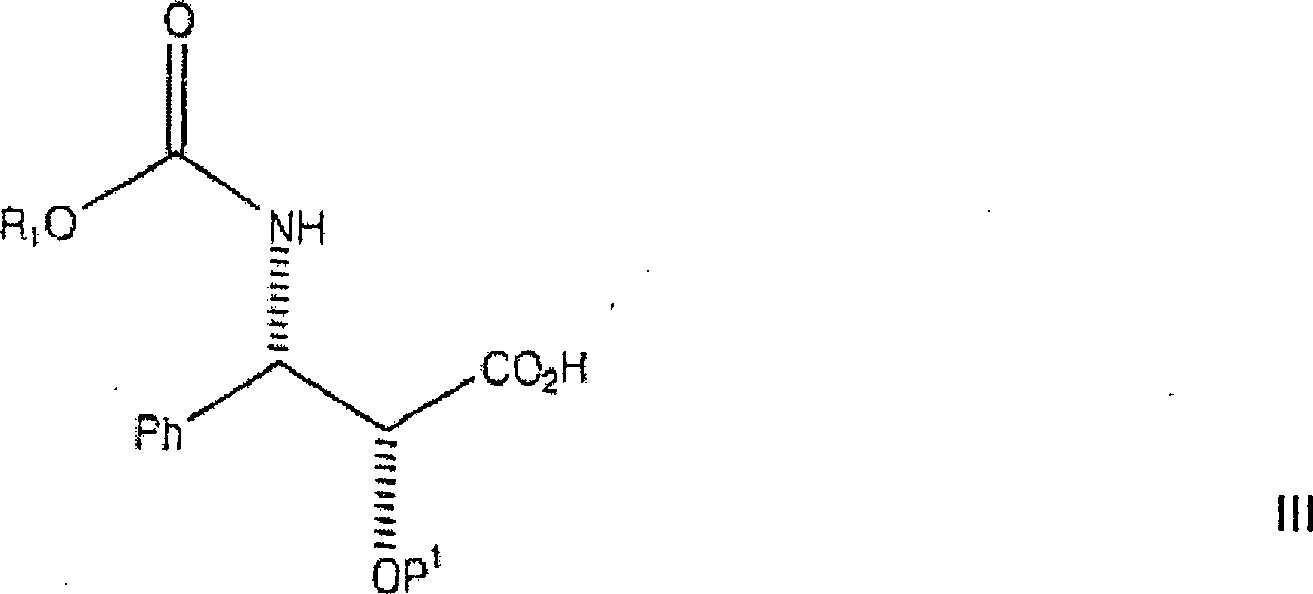
ist die Semisynthese von Paclitaxel aus der Kondensation einer (2R,3S)-Seitenkettensäure der
allgemeinen Formel:
wobei
P
1 eine Hydroxyschutzgruppe ist, mit einem
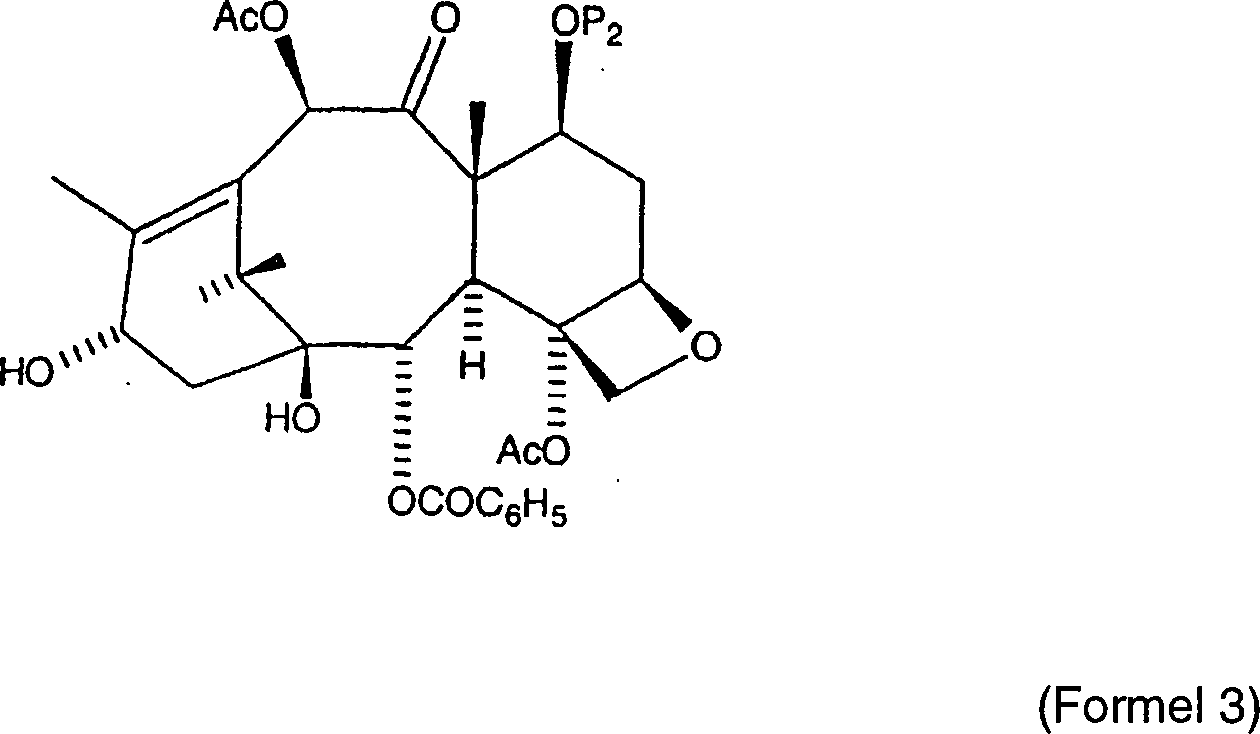
Taxan-Derivat der allgemeinen Formel,
wobei
P
2 eine Hydroxyschutzgruppe ist, beschrieben,
wobei das Kondensationsprodukt anschließend weiter bearbeitet wird
um die Schutzgruppen P
1 und P
2 zu
entfernen. In Denis et al. ist das (2R,3S)-3-Phenylisoserin-Derivat,
mit Ausnahme der P
1-Schutzgruppe, die A-Ring-Seitenkette
für das
Paclitaxel-Molekül.
Die P
2-Schutzgruppe auf dem Baccatin III-Grundgerüst ist durch
beispielsweise einen Trimethylsilyl- oder einen Trialkylsilylrest
geschützt.
-
Eine
alternative Semisynthese von Paclitaxel ist in US Patent Nr. 5,770,745
von Swindell et al. beschrieben. Dieses Patent offenbart die Semisynthese
von Paclitaxel aus einem Baccatin III-Grundgerüst durch die Kondensation mit
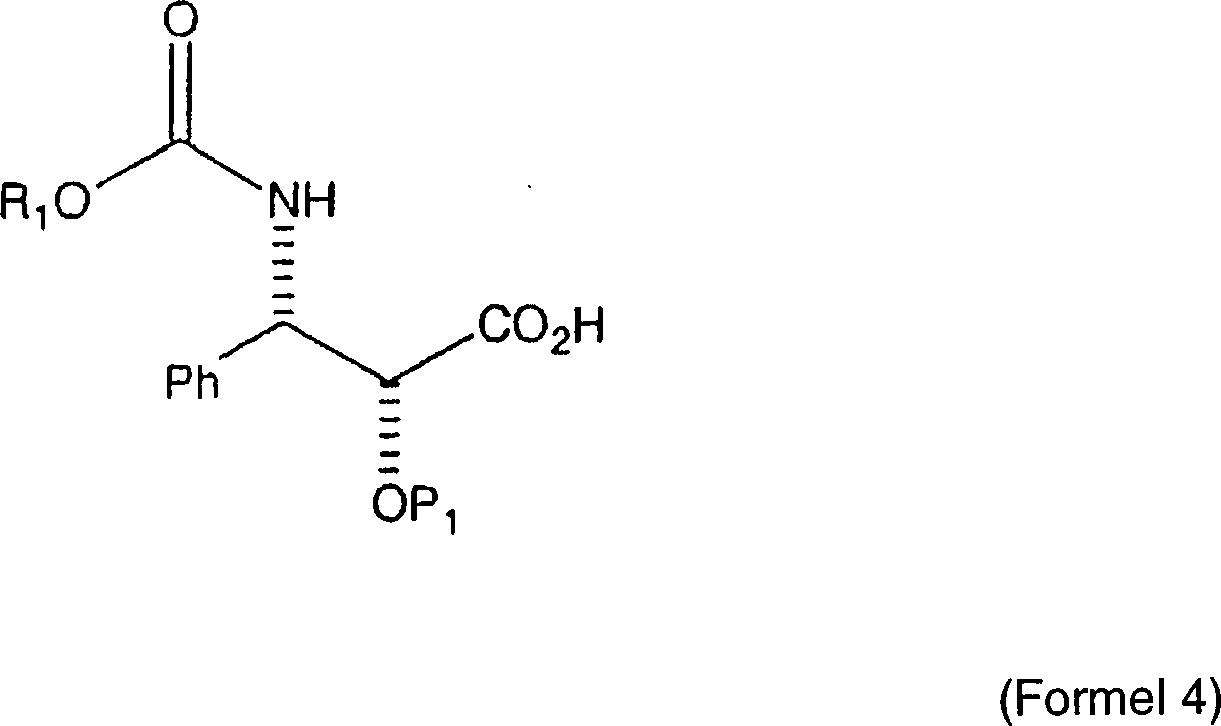
einer Seitenkette mit der allgemeinen Formel:
wobei
R
1 gleich Alkyl, olefinisch oder aromatisch
oder PhCl
2 ist, und P
1 eine
Hydroxylschutzgruppe ist.
-
Die
Seitenkette in Swindell et al. unterscheidet sich von der in Denis
et al., vorstehend, verwendeten Seitenkettenbindung dadurch, dass
der Stickstoff als ein Carbamat geschützt ist. Die A-Ring-Seitenkette
ist bevorzugt mittels Benzyloxycarbonyl (CBZ) geschützt. Nach
der Veresterung wird die CBZ-Schutzgruppe
entfernt und durch PhCO ersetzt, was zu Paclitaxel führt. Dieses
Verfahren erzeugte höhere
Ausbeuten als das in Denis et al. beschriebene. In Swindell et al.
wurden die bevorzugten Maskierungsgruppen derart ausgewählt, so
dass sie Trichlorethoxymethyl oder Trichlorethoxycarbonyl waren.
Benzyloxymethyl (BOM) wurde zwar als eine mögliche Seitenketten-Schutzgruppe
offenbart, gemäß den hierin
beschriebenen Verfahren konnte die BOM-Schutzgruppe jedoch nicht
von dem stärker überladenen
C-2'-Hydroxyl in
der angebundenen 3-Phenylisoserinseitenkette
entfernt werden. Die Verwendung der BOM-geschützten Seitenkette wurde aus diesem.
Grund nicht eingehend untersucht.
-
US
Patent Nr. 5,675,025, erteilt am 7. Oktober 1997 an Sisti et al.,
beschreibt eine Methodik um die C-2'-O-BOM-Seitenkette erfolgreich in der
Synthese von Paclitaxel zu verwenden. In genaueren Worten lehrt das '025 Patent ein Verfahren
um die C-2'- O-BOM-Gruppe in C-2'-O-BOM-Paclitaxel
zu entfernen, wobei Paclitaxel erzeugt wird.
-
US
Patent Nr. 5,684,175 von Sisti et al. und WO 96/40666 beschreiben
jeweils die Herstellung von Paclitaxel, welche eine Veresterung
einer geeignet geschützten
Seitenkette mit einem C-7-TES-geschützten Baccatin 111 umfasst.
Es ist zu bemerken, dass das C-10-Acetat vor der Anbindung der C-13-Seitenkette
vorhanden ist.
-
US
Patent Nr. 4,924,012, erteilt am 8. Mai 1990 an Collins et al.,
offenbart ein Verfahren zur Herstellung von Derivaten von Baccatin
III und von 10-Deacetylbaccatin
III, durch Kondensation einer Säure
mit einem Derivat von Baccatin III oder von 10-Deacetylbaccatin
III, mit der nachfolgenden Entfernung von Schutzgruppen durch Wasserstoff.
Verschiedene Synthesen von TAXOTERE® (eingetragene
Marke von Rhone-Poulenc Sante) und verwandten Verbindungen wurden
veröffentlicht
im Journal of Organic Chemistry: 1986, 51, 46; 1990, 55, 1957; 1991,
56, 1681; 1991, 56, 6939; 1992, 57, 4320; 1992, 57, 6387; und 1993,
58, 255; auch US Patent Nr. 5,015,744, erteilt am 14. Mai 1991 an
Holton, beschreibt eine derartige Synthese.
-
Das
europäische
Patent Nr. 0 522 958 A1 scheint die Herstellung von verschiedenen
Derivaten von Baccatin III und 10-Deacetylbaccatin III zu betreffen,
und insbesondere von solchen mit C-7- und/oder C-10-Schutzgruppen.
Insbesondere scheint dieses Dokument die Veresterung einer geeigneten
Seitenkette von Paclitaxel oder Docetaxel mit einem geeignet geschützten Baccatin
III- oder 10-Deacetylbaccatin III-Grundgerüst zu lehren.
-
WO
98/13360 lehrt ein Verfahren zur Synthese von Paclitaxel, welches
das Verestern von C-7-CBZ-Baccatin III mit C-3'-N-CBZ-C-2'-O-geschütztem (2R,3S)-3-Phenylisoserin, und
danach das Durchführen
von verschiedenen Schutzentfernungen und Acylierungen umfasst, wobei
Paclitaxel erhalten wird.
-
WO
98/02427 lehrt ein Verfahren zum Überführen von 10-Deacetylbaccatin
III zu Baccatin III, durch Acylieren von 10-Deacetylbaccatin III
selektiv an der C-10- Position
gegenüber
der C-7-Hydroxyposition davon. Die selektive Acylierung wird bewirkt
durch Zugabe eines Acylierungsmittels, wie etwa Acetylchlorid, in
der Gegenwart einer Lithiumbase, bevorzugt n-Butyllithium. Das resultierende
Baccatin III kann in Verfahren zur Bildung von Paclitaxel verwendet
werden.
-
US
Patent Nr. 5,688,977, erteilt am 18. November 1997 an Sisti et al.,
WO 97/31911 und WO 97/34866 beschreiben eine effiziente Methodik
zur Synthese von Docetaxel (TAXOTERE®).
Diese Dokumente lehren ein Verfahren für die Synthese von Docetaxel,
umfassend die Veresterung von C7, C-10-di-CBZ-10-Deacetylbaccatin
III und einer N-CBZ-C-2-hydrierbarer Benzyl-Typ-geschützten 3-Phenylisoserinseitenkette.
In diesem Verfahren war jedoch weder eine Acylierung des C-10-Hydroxyls
oder eine Benzolierung des C-3'-Stickstoffs notwendig.
-
Trotz
der in den vorstehend beschriebenen Verfahren erzielten Fortschritte
bei der Semisynthese des Paclitaxel-Moleküls verbleibt ein Bedarf für effizientere
Protokolle für
die Synthese von Paclitaxel, um Effizienzen bezüglich Ausbeuten und Produktionsraten
zu erhöhen.
Es bleibt ein Bedarf für
Semisynthesen, die in kommerziellen Verfahren implementiert werden
können.
Es besteht weiterhin ein Bedarf für effiziente Protokolle für die Synthese
von Paclitaxelanaloga, Zwischenprodukten und verschiedenen A-Ring-Seitenketten-Strukturen.
-
ZUSAMMENFASSUNG
DER ERFINDUNG
-
Es
ist ein Gegenstand der vorliegenden Erfindung, ein neues und nützliches
Verfahren zur Herstellung von Paclitaxel oder Paclitaxelanaloga
bereitzustellen.
-
Ein
weiterer Gegenstand der vorliegenden Erfindung ist es, ein neues,
nützliches
und effizientes Protokoll bereitzustellen für die Anbindung einer geschützten A-Ring-Seitenkette an ein
geschütztes
Baccatin III-Skelett, welches danach zu Paclitaxel oder einem Paclitaxelanalogon überführt werden
kann.
-
Es
ist ein weiterer Gegenstand der vorliegenden Erfindung, ein neues
und nützliches
Protokoll für
die Semisynthese von Paclitaxel und Analoga davon bereitzustellen,
um Paclitaxel und Paclitaxelanaloga in hoher Ausbeute in einer kosteneffizienten
Weise bereitzustellen.
-
Ein
nochmals anderer Gegenstand der vorliegenden Erfindung ist es, ein
Verfahren zur Herstellung von Paclitaxel und Analoga davon bereitzustellen,
weiches potentiell auf eine Ausführung
im kommerziellen Maßstab
gebracht werden kann.
-
Gemäß der vorliegenden
Erfindung wird somit ein neues und nützliches Verfahren zur Herstellung
von Paclitaxel oder einem Paclitaxelanalogon bereitgestellt. Gemäß dem allgemeinen
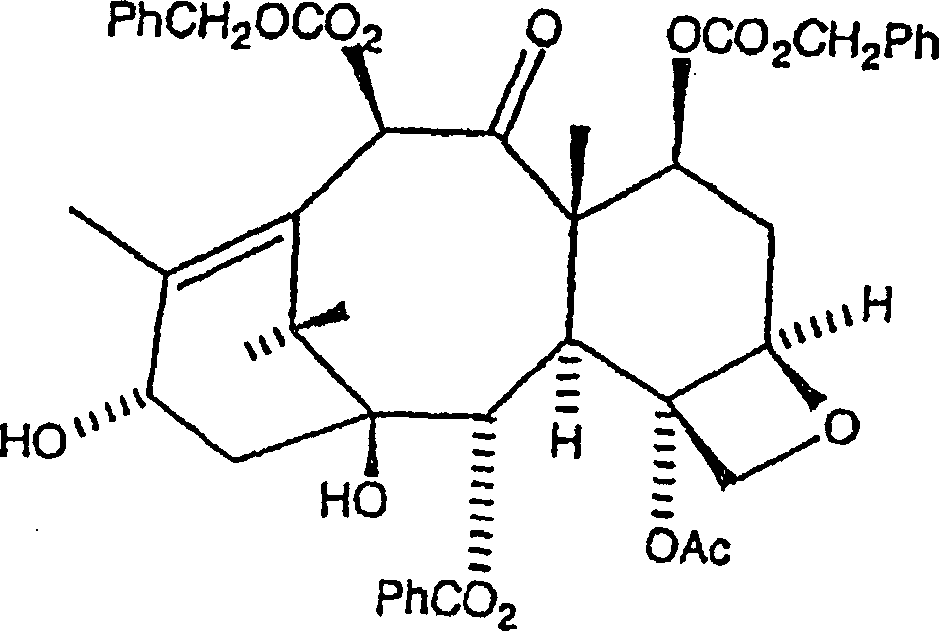
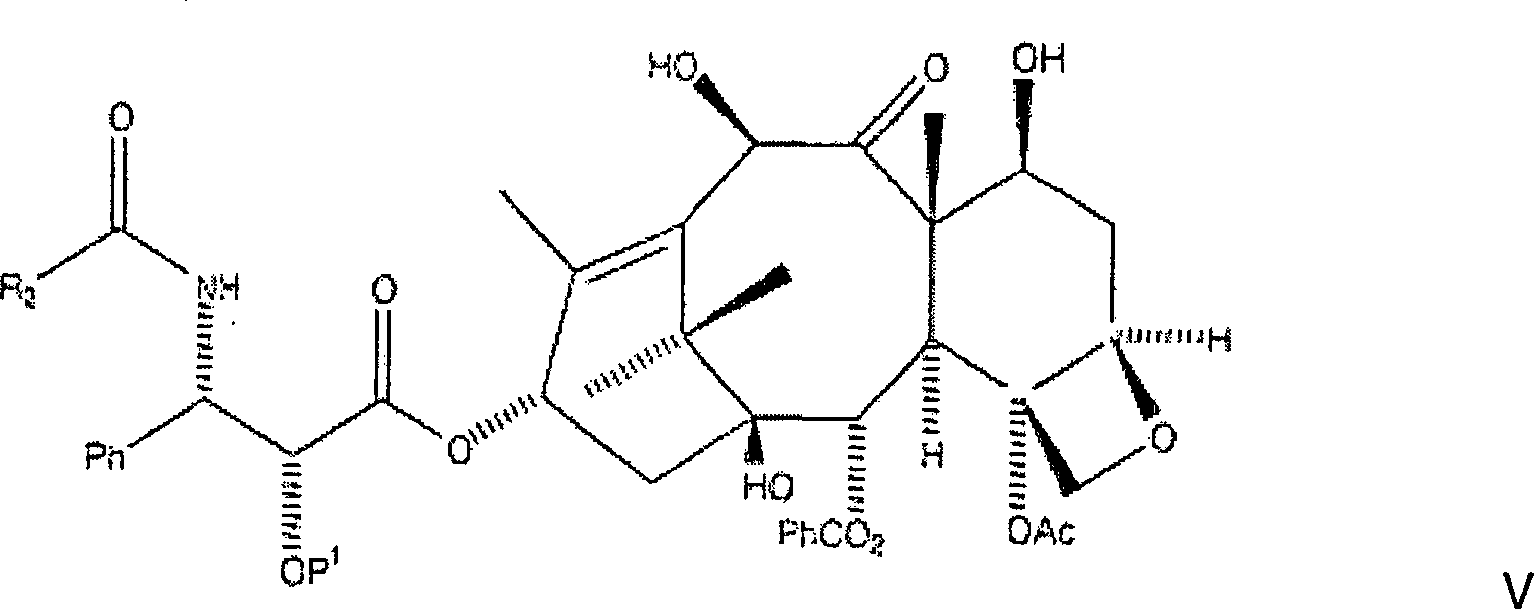
Verfahren wird C7, C-10-di-CBZ-10-Deacetylbaccatin III der Formel
mit einer N-Carbamat-geschützten, C-2-geschützten 3-Phenylisoserinseitenkette
der Formel
verestert, wobei eine erste
Zwischenproduktverbindung der Formel
gebildet
wird, worin P
1 eine Hydroxylschutzgruppe
ist und R
1 aus der Gruppe, bestehend aus
Ph, PhCH
2, einer aromatischen Gruppe, einer
Alkylgruppe, und einer olefinischen Gruppe ausgewählt ist.
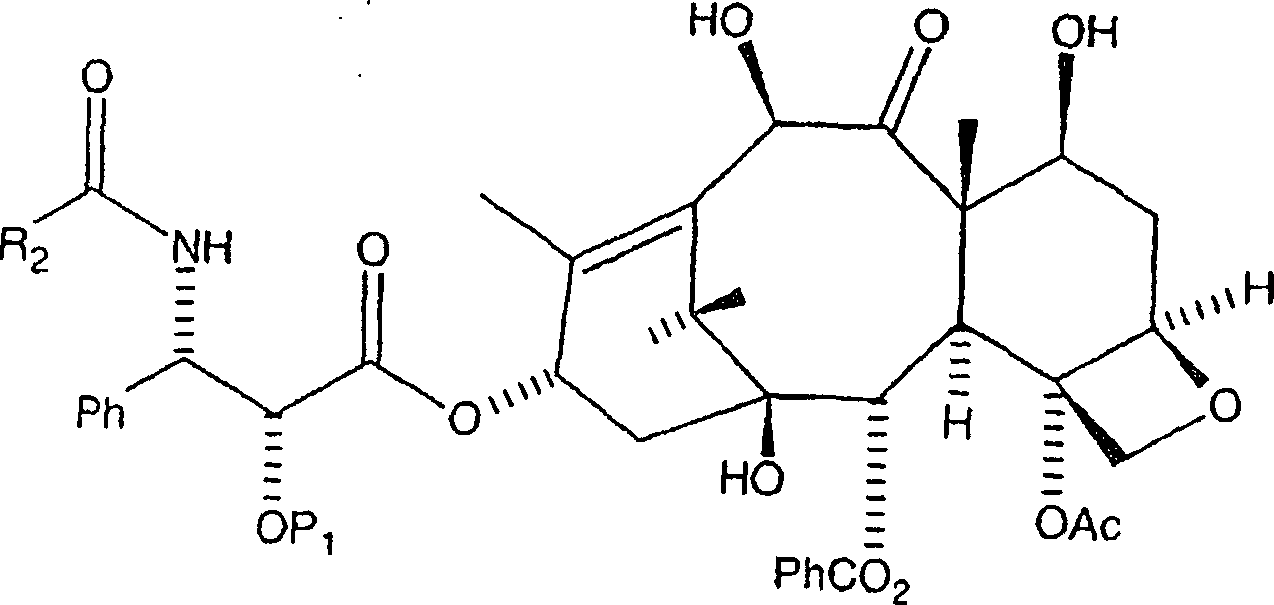
Danach werden die C-7, C-10-Carbobenzyloxygruppen
in der ersten Zwischenproduktverbindung durch Wasserstoff ersetzt,
und die R
1OCO-Gruppe an der C-3'-Stickstoffposition
wird durch R
2CO ersetzt, wobei eine zweite
Zwischenproduktverbindung der Formel
gebildet
wird, worin P
1 eine Hydroxylschutzgruppe
ist und R
2 aus der Gruppe, bestehend aus
Ph, PhCH
2, PhO-, PhCH
2O-,
einer aromatischen Gruppe, einer Alkylgruppe, einer olefinischen
Gruppe, einer O-aromatischen Gruppe, einer O-Alkylgruppe, und einer O-olefinischen
Gruppe ausgewählt
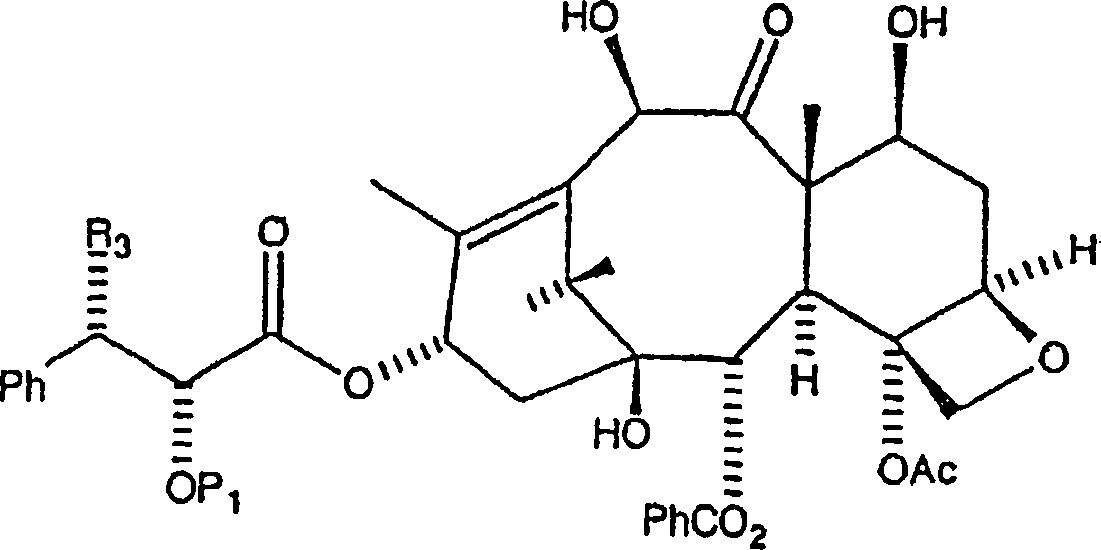
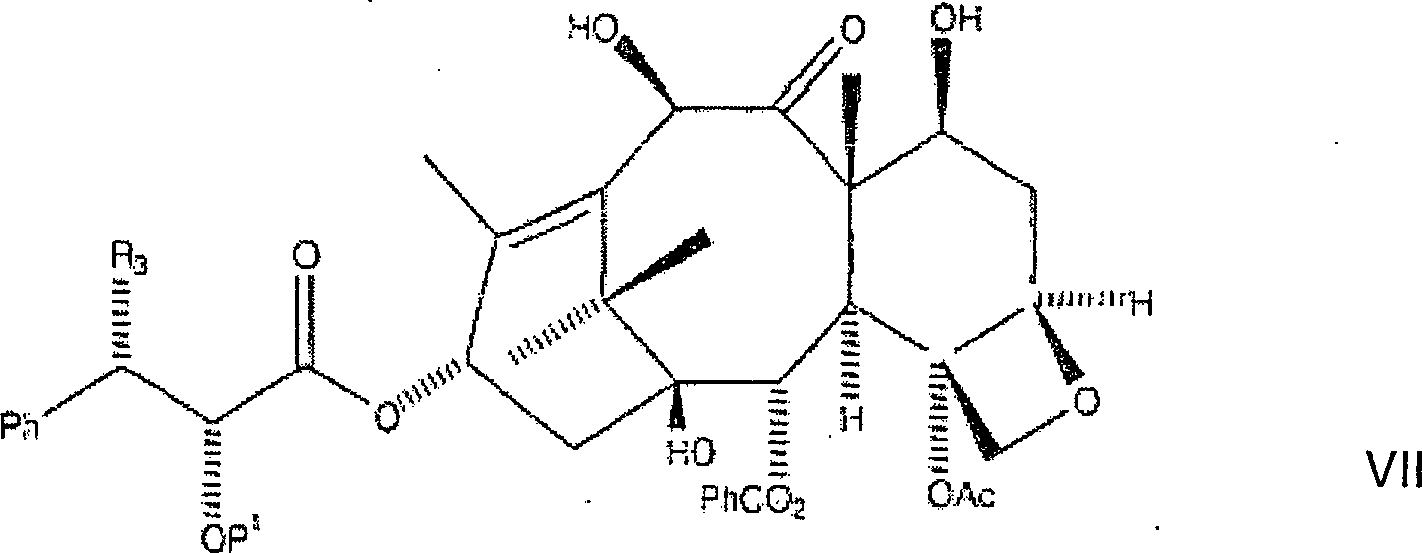
ist. Danach wird die zweite Zwischenproduktverbindung an der C-10-Hydroxylposition
acyliert, wobei eine dritte Zwischenproduktverbindung der Formel
gebildet wird, wobei P
1 und R
2 wie vorstehend
sind. Schließlich
wird der Schutz der dritten Zwischenproduktverbindung entfernt,
indem P
1 durch Wasserstoff ersetzt wird,
wobei Paclitaxel oder ein Paclitaxelanalogon hergestellt wird. Es
ist bevorzugt, dass P
1 eine hydrierbare
Schutzgruppe vom Benzyl-Typ ist, insbesondere Benzyloxymethyl oder
Benzyl, wobei Benzyloxymethyl die bevorzugte Schutzgruppe ist. Es
ist auch bevorzugt, dass R
1 gleich PhCH
2 ist und R
2 gleich
Ph ist, wodurch Paclitaxel hergestellt wird.
-
Die
Veresterungsreaktion wird bevorzugt durchgeführt durch Auflösen der
Isoserinseitenkette und des C7, C-10-di-CBZ-10-Deacetylbaccatin
III in Toluol, wobei eine erste Lösung gebildet wird, wonach
Dimethylaminopyridin (DMAP) und ein Dialkylcarbodiimid zu der ersten
Lösung
zugegeben werden, wobei eine zweite Lösung gebildet wird, welche
die erste Zwischenproduktverbindung enthält. Der Schritt, die C-7- und
C-10-Carbobenzyloxygruppen durch Wasserstoff zu ersetzen und die
R
1OCO-Gruppe an der C-3'-Stickstoffposition durch R
2CO
zu ersetzen kann derart durchgeführt
werden, so dass zunächst
ein Amin oder ein Aminsalz der Formel
erzeugt wird, worin P
1 eine Hydroxylschutzgruppe ist und worin
R
3 aus der Gruppe, bestehend aus NH
2 und NH
3 +X
– ausgewählt ist,
wobei X eine deprotonierte organische Säure, bevorzugt deprotonierte
Trifluoressigsäure
ist, wonach R
2CO an die C-3'-Stickstoffposition
gebunden wird, wobei die zweite Zwischenproduktverbindung erzeugt
wird. Der Schritt, den Schutz der dritten Zwischenproduktverbindung
zu entfernen, kann bewirkt werden durch Auflösen der dritten Zwischenproduktverbindung
in Isopropanol und Hydrierung in der Gegenwart von Pearlmans Katalysator.
-
Die
vorliegende Erfindung ist auch auf ein Verfahren zur Acylierung
eines 10-Hydroxy-Paxlitaxelanalogons,
zur Verwendung bei der Herstellung von Paclitaxel und Paclitaxelanaloga,
gerichtet. Das Verfahren liefert eine selektive Acylierung der C-10-Hydroxylposition
gegenüber
der C-7-Hydroxylposition. Gemäß dem allgemeinen
Verfahren wird eine ausgewählte
Menge eines 10-Hydroxy-Paclitaxelanalogons
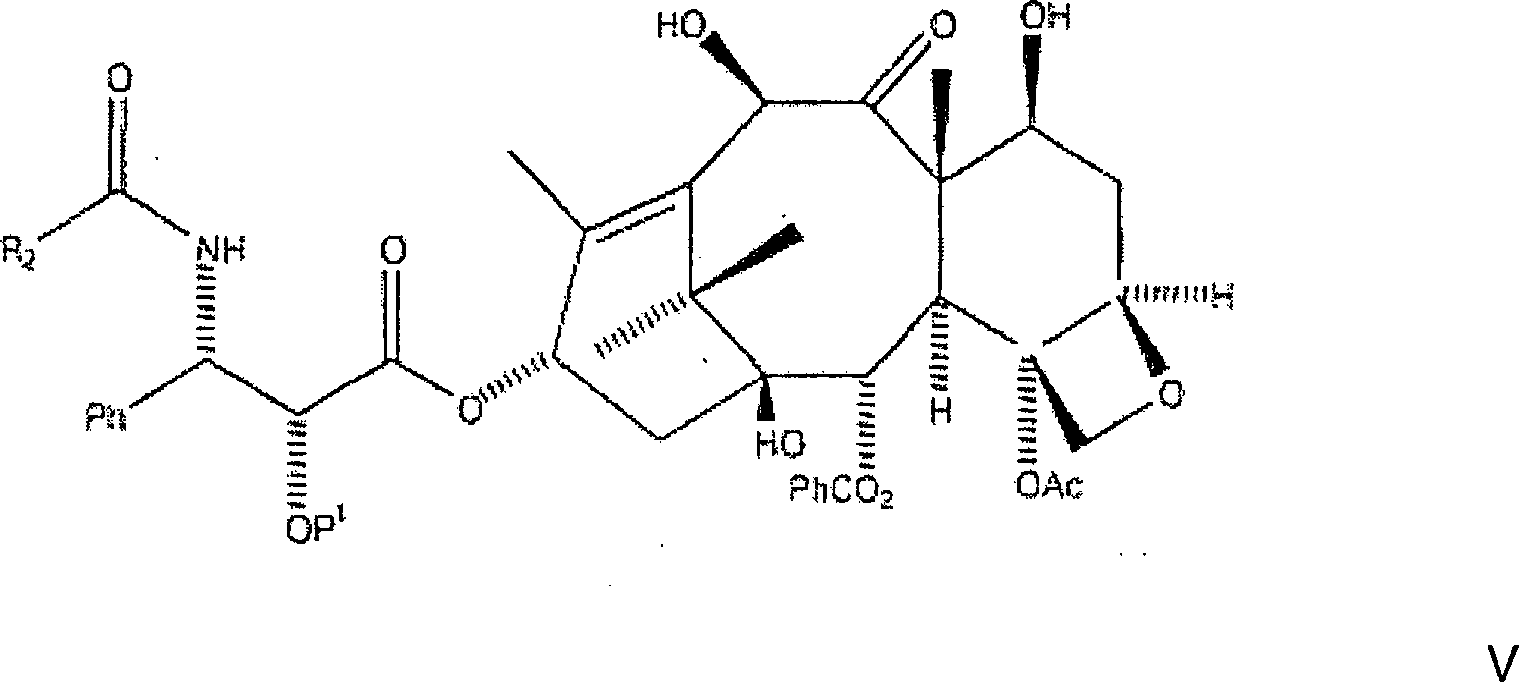
der Formel:
worin
P
1 eine Hydroxylschutzgruppe ist und R
2 aus der Gruppe, bestehend aus Ph, PhCH
2, PhO-, PhCH
2O-, einer
aromatischen Gruppe, einer Alkylgruppe, einer olefinischen Gruppe,
einer O-aromatischen Gruppe, einer O-Alkylgruppe, und einer O-olefinischen
Gruppe ausgewählt
ist, in einem akzeptablen Etherlösungsmittel
dafür aufgelöst, wobei
eine erste Lösung
bei einer ersten Temperatur gebildet wird. Die erste Lösung wird
danach auf eine zweite Temperatur abgekühlt, und mindestens ein Äquivalent
einer Alkalibase wird zu der ersten Lösung bei der zweiten Temperatur
zugegeben, wobei ein erstes Zwischenprodukt in einer zweiten Lösung gebildet
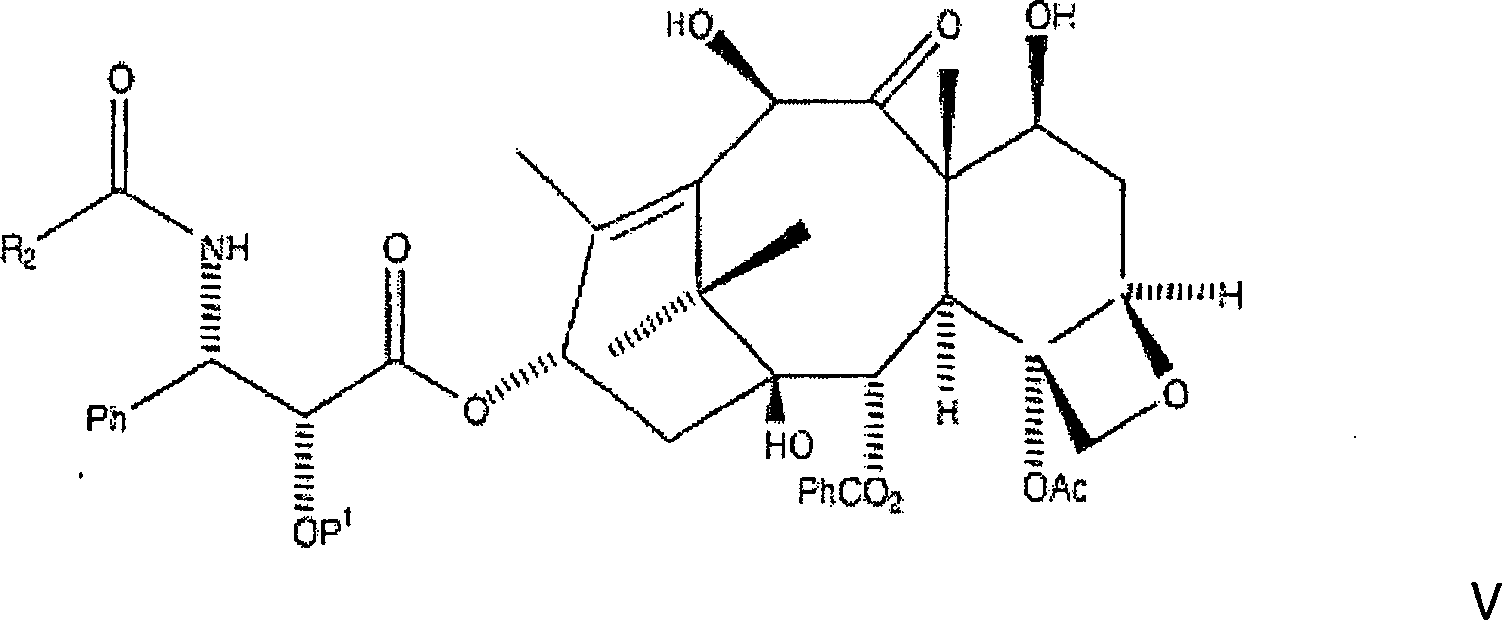
wird, wobei das erste Zwischenprodukt die Formel:
hat, worin
M ein Alkalimetall ist und P
1 und R
2 wie vorstehend sind. Zu dem ersten Zwischenprodukt
in der zweiten Lösung
bei der zweiten Temperatur wird danach mindestens ein Äquivalent
eines Acylierungsmittels zugegeben, wobei eine dritte Lösung gebildet
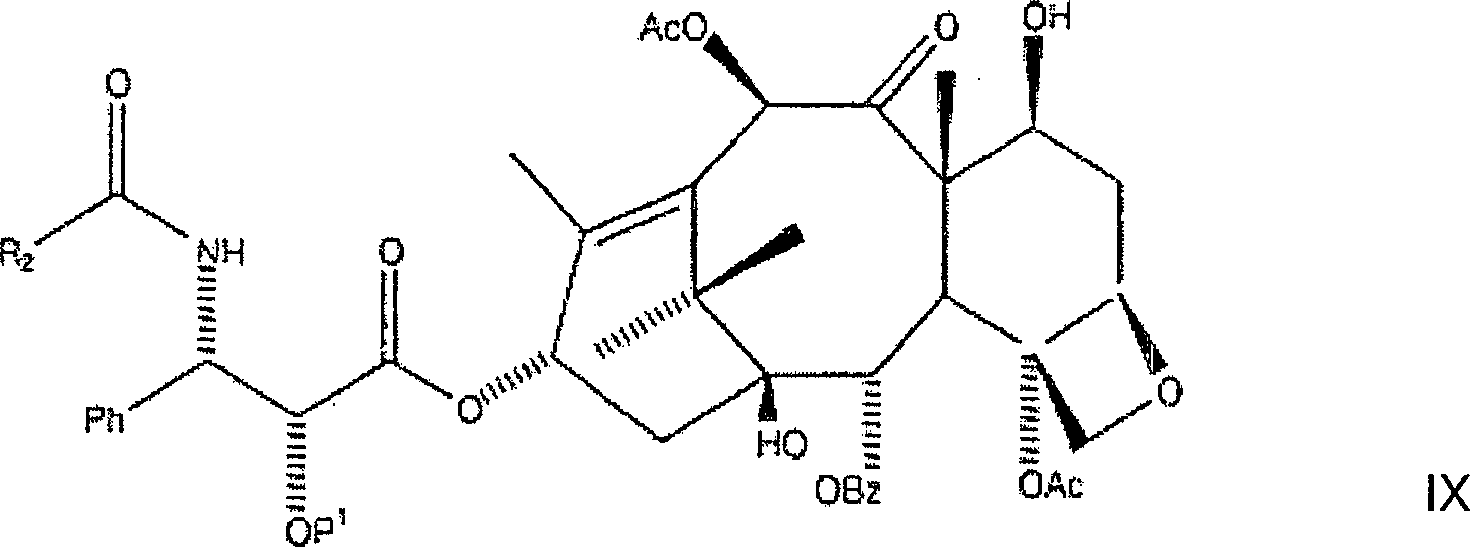
wird, so dass eine Verbindung der Formel:
wobei P
1 und
R
2 wie vorstehend sind, in der dritten Lösung gebildet
wird. Bevorzugt ist M aus der Gruppe, bestehend aus Lithium, Kalium
und Natrium ausgewählt,
ist R
2 gleich Ph und ist P
1 eine
hydrierbare Schutzgruppe vom Benzyl-Typ, insbesondere Benzyloxymethyl
oder Benzyl. Weiterhin bevorzugt ist, wenn M gleich Lithium ist
und P
1 gleich Benzyloxymethyl ist.
-
Die
vorliegende Erfindung ist auch auf ein alternatives Verfahren zur
Acylierung eines 10-Hydroxy-Paclitaxelanalogons zur Verwendung bei
der Herstellung von Paclitaxel und Paclitaxelanaloga gerichtet.
Gemäß dem allgemeinen
Verfahren wird eine ausgewählte
Menge eines 10-Hydroxy-Paclitaxelanalogons der Formel:
worin
P
1 eine Hydroxylschutzgruppe ist und R
2 aus der Gruppe, bestehend aus Ph, PhCH
2, PhO-, PhCH
2O-, einer
aromatischen Gruppe, einer Alkylgruppe, einer olefinischen Gruppe,
einer O-aromatischen Gruppe, einer O-Alkylgruppe, und einer O-olefinischen
Gruppe ausgewählt
ist, in einem akzeptablen Etherlösungsmittel
dafür aufgelöst, wobei
eine erste Lösung
gebildet wird. Danach wird eine ein Alkalisalz enthaltende Lösung in
die erste Lösung
eingemischt, wobei eine zweite Lösung
gebildet wird. Danach wird eine Base, ausgewählt aus der Gruppe, bestehend
aus Trialkylaminbasen und Pyridin zu der zweiten Lösung zugegeben,
wodurch eine dritte Lösung
gebildet wird. Die dritte Lösung
wird danach mit einem Acylierungsmittel, bevorzugt Acetylchlorid, kombiniert,
wobei eine vierte Lösung
gebildet wird, so dass eine Verbindung der Formel
worin
P
1 und R
2 wie vorstehend
sind, in der vierten Lösung
gebildet wird.
-
Bei
diesem Verfahren ist es bevorzugt, dass R2 gleich
Ph ist und P1 eine hydrierbare Schutzgruppe vom
Benzyl-Typ, insbesondere Benzyloxymethyl oder Benzyl ist. Das Alkalisalz
kann aus der Gruppe, bestehend aus einem Lithiumsalz, einem Kaliumsalz
und einem Natriumsalz ausgewählt
werden. Das Alkalisalz ist bevorzugt ein Lithiumsalz, wie etwa Lithiumchlorid
oder Lithiumjodid.
-
Die
vorliegende Erfindung ist auch auf ein chemisches Zwischenprodukt
zur Verwendung bei der Herstellung von Paclitaxel oder Paclitaxelanaloga
gerichtet, wobei das Zwischenprodukt die Formel
hat, worin
M ein Alkalimetall ist, P
1 eine Hydroxylschutzgruppe
ist und R
2 aus der Gruppe, bestehend aus
Ph, PhCH
2, PhO-, PhCH
2O-,
einer aromatischen Gruppe, einer Alkylgruppe, einer olefinischen
Gruppe, einer O-aromatischen Gruppe, einer O-Alkylgruppe, und einer O-olefinischen
Gruppe ausgewählt
ist. Bevorzugt ist P
1 eine hydrierbare Schutzgruppe
vom Benzyl-Typ, insbesondere Benzyloxymethyl oder Benzyl, wobei
Benzyloxymethyl bevorzugt ist. M kann aus der Gruppe, bestehend
aus Lithium, Kalium und Natrium ausgewählt werden. Bevorzugt ist M
gleich Lithium und ist R
2 gleich Ph.
-
Diese
und andere Gegenstände
der vorliegenden Erfindung werden leichter erkannt und verstanden werden,
wenn die nachfolgende ausführliche
Beschreibung der beispielhaften Ausführungsformen in Erwägung gezogen
wird.
-
AUSFÜHRLICHE
BESCHREIBUNG DER BEISPIELHAFTEN AUSFÜHRUNGSFORMEN
-
Die
vorliegende Offenbarung ist breit auf ein chemisches Verfahren für die effiziente
Herstellung von Paclitaxel und Paclitaxelanaloga, sowie von Zwischenprodukten
und Vorläufern
dafür gerichtet.
In genaueren Worten ist die vorliegende Erfindung auf ein Verfahren
zur Herstellung von Paclitaxel und Paclitaxelanaloga unter Verwendung
eines Taxan-Grundgerüsts,
welches an den Positionen C-7 und C-10 mit der Carbobenzyloxy (CBZ)-Schutzgruppe
geschützt
ist, gerichtet.
-
Das
allgemeine hierin beschriebene Verfahren umfasst die Herstellung
des C7, C-10-di-CBZ-10-Deacetylbaccatin
III-Grundgerüsts,
die Herstellung der geeignet geschützten 3-Phenylisoserinsäure mit
einer Hydroxylschutzgruppe an C-2, die Kondensation der zwei Verbindungen,
und die nachfolgende Entfernung des Schutzes an C-7 und C-10, sowie
an der C-3'-Stickstoffposition,
wie in US Patent Nr. 5,688,977 beschrieben. Es wird eine Acylierung
an der C-3'-Stickstoffposition
durchgeführt,
gefolgt von selektiver Acylierung an der C-10-Hydroxylposition gegenüber der
C-7-Hydroxylposition, um die Acetylgruppe hinzuzufügen, gefolgt
von weiterer Entfernung des Schutzes, um Paclitaxel oder ein Paclitaxelanalogon
zu ergeben.
-
Die
nachfolgenden, nicht einschränkenden
Beispiele veranschaulichen die vorliegende Erfindung weiter.
-
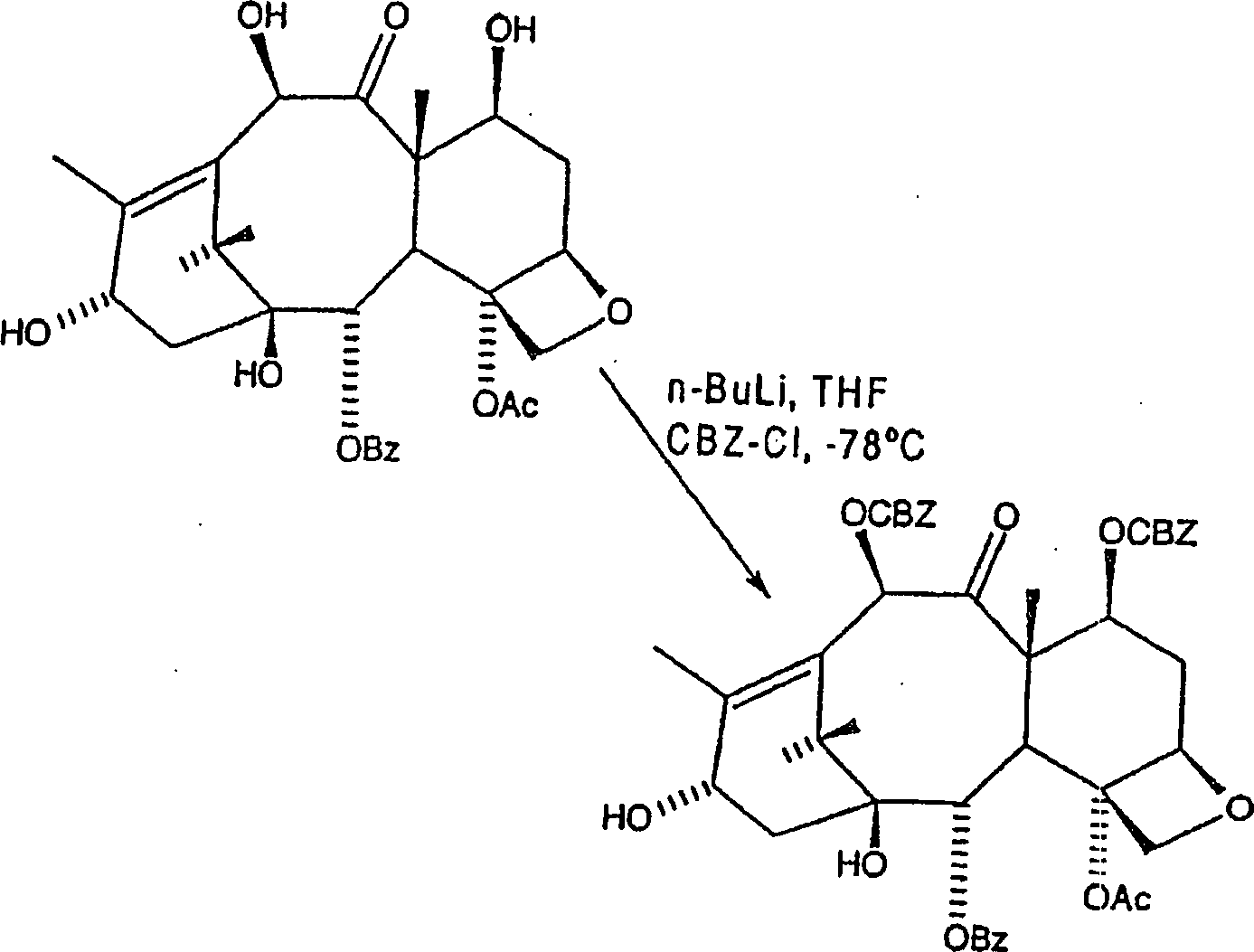
A. Herstellung von C7,
C-10-di-Carbobenzyloxy (CBZ)-10-Deacetylbaccatin III
-
C7,
C-10-di-CBZ-Baccatin III kann gemäß der nachfolgenden Reaktion
hergestellt werden:
Reaktion
I
-
Hier
wird 10-Deacetylbaccatin III in wasserfreiem THF (Tetrahydrofuran)
aufgelöst
und unter einer Stickstoffatmosphäre auf eine Temperatur von
weniger als –20°C, aber bevorzugt –78°C gekühlt. n-Butyllithium (1,6
M in Hexan) wird zugetropft, und die Lösung wird annähernd fünf Minuten
bei der erniedrigten Temperatur gerührt. Mindestens 1,5 Äquivalente
n-Butyllithium sind erforderlich, um eine signifikante Ausbeute
an Produkt zu erhalten, 2 Äquivalente
sind jedoch bevorzugt. Danach wird Benzylchlorformiat (wiederum
sind mindestens 1,5 Äquivalente
des Benzylchlorformiats erforderlich, um eine signifikante Ausbeute
zu erhalten, 2 Äquivalente sind
jedoch bevorzugt) zugetropft, und das Gemisch wird während eines
Zeitraums von einer Stunde erwärmt, während dessen
es auf eine Temperatur von nicht mehr als 0°C erwärmen gelassen wird. Das Gemisch
wird danach mit kaltem gesättigtem
Ammoniumchlorid abgelöscht,
um alles überschüssige n-Butyllithium
und Acetylchlorid zu beseitigen, und das Gemisch wird unter Vakuum
eingeengt. Der Rückstand
wird in Ethylacetat aufgenommen und einmal mit Wasser und danach
mit Salzlösung
gewaschen um unerwünschte
Salze zu entfernen. Die organische Schicht kann danach getrocknet
und unter Vakuum eingeengt werden, und der Rückstand rekristallisiert oder
säulenchromatographiert
werden, mit Ethylacetat/Hexan, wobei C7, C-10-di-CBZ-10-Deacetylbaccatin
III als ein weißer
Feststoff in einer Ausbeute von mehr als 80% insgesamt erhalten
wird.
-
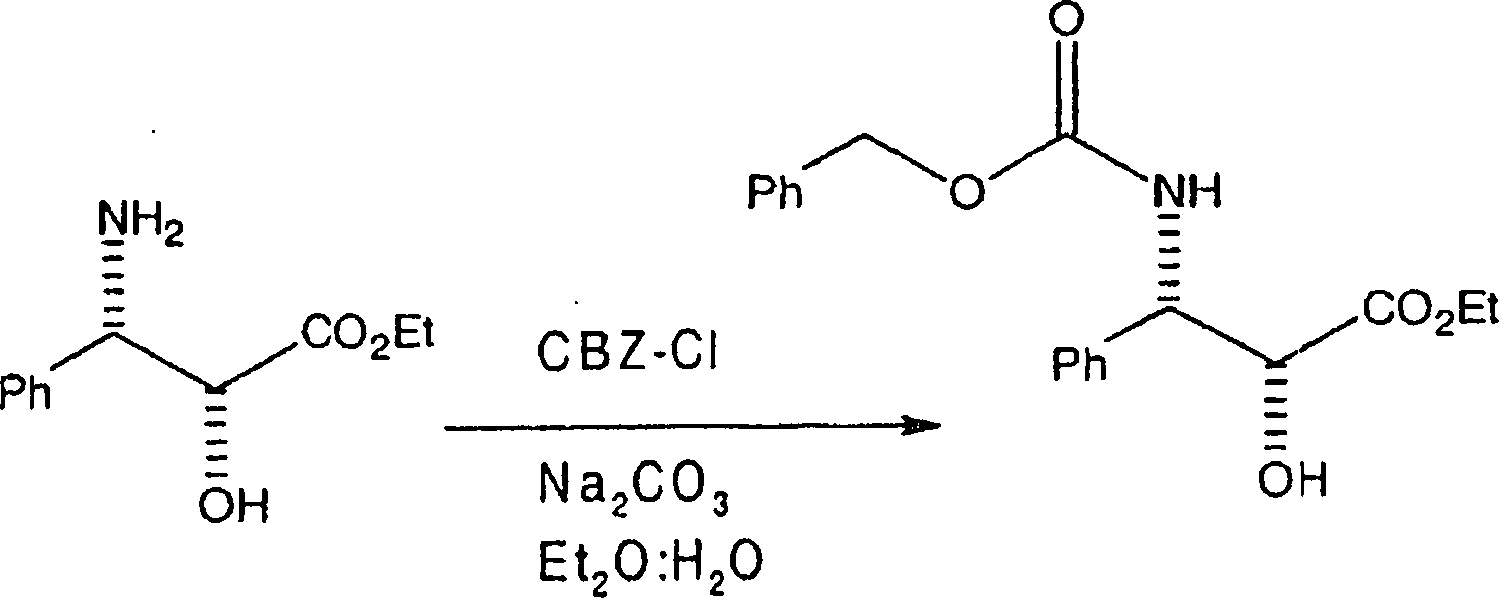
B. Herstellung der 3-Phenylisoserinseitenkette
-
Die
Herstellung der (2R,3S)-N-CBZ-C-2-O-geschützten 3-Phenylisoserinethylester-Seitenkette, bei der
die C-2-Hydroxygruppe durch eine hydrierbare Schutzgruppe vom Benzyl-Typ
geschützt
ist, kann aus der Ausgangsverbindung (2R,3S)-3-Phenylisoserinethylester gemäß den nachfolgenden
Reaktionen bewirkt werden. Die erste Reaktion ist
Reaktion
II
-
Hier
wurde (2R,3S)-3-Phenylisoserinethylester alternativ entweder in
gleichen Teilen Diethylether:Wasser oder gleichen Teilen Methyl-t-butylether:Wasser
aufgelöst,
und die Lösung
wurde auf 0°C
gekühlt. Danach
wurde das Natriumcarbonat zu der Lösung zugegeben und das Benzylchlorformiat
wurde über
einen Zeitraum von etwa fünf
Minuten zugetropft, und das resultierende Gemisch annähernd eine
Stunde bei 0°C gerührt. Nach
einstündigem
Rühren
wurde die Lösung
danach in Wasser gegossen und mit Methylenchlorid oder Ethylacetat,
je nach Wunsch, extrahiert. Die organische Schicht wird abgetrennt,
getrocknet und unter Vakuum zu einem Rückstand eingeengt. Der Rückstand
wurde danach aus Ethylether:Hexan rekristallisiert, wobei der N-CBZ-3-Phenylisoserinethylester
erhalten wurde. Es sollte bemerkt werden, dass die PhCH2OCO-Gruppe
durch alternative Gruppen substituiert sein kann, in dem vom Durchschnittsfachmann
verstandenen Ausmaß.
-
Insbesondere
ist vorgesehen, dass R1OCO anstelle von
PhCH2OCO substituiert sein kann, wobei R1 zusätzlich
gleich Ph, eine aromatische Gruppe, eine Alkylgruppe oder eine olefinische
Gruppe sein kann.
-
Dieses
Zwischenprodukt wurde danach auf mehrere Weisen durch die hydrierbare
Schutzgruppe vom Benzyl-Typ geschützt. Beispielsweise ist ein
Weg zu der gewünschten,
mit der hydrierbaren Schutzgruppe vom Benzyl-Typ geschützten Seitenkette
wie folgt:
Reaktion
III
-
Hier
ist die hydrierbare Schutzgruppe vom Benzyl-Typ Benzyloxymethyl
(BOM). Um diese Verbindung herzustellen, wird der N-CBZ-3-Phenylisoserinethylester
unter einer Stickstoffatmosphäre
in wasserfreiem THF aufgelöst
und auf eine erniedrigte Temperatur wie etwa –20°C oder –78°C abgekühlt, beispielsweise in einem
Trockeneis/Aceton-Bad, gefolgt von Zutropfen eines Alkyllithiummittels,
wie etwa n-Butyllithium,
obwohl es wünschenswert
ist, dass das Alkyllithiummittel ein geradkettiges Alkyl ist. In
jedem Fall wird die Reaktion am besten bei einer Temperatur von
nicht mehr als 0°C
ausgeführt.
Das resultierende Gemisch wird etwa zehn Minuten gerührt. Benzyloxymethylchlorid
(BOM-Cl) wird danach über
einen Zeitraum von etwa fünf
Minuten zugetropft, und das Gemisch wird annähernd zwei bis fünf Stunden
bei der erniedrigten Temperatur gerührt. Danach wird die Lösung auf
0°C erwärmt und
mit Wasser abgelöscht
um überschüssiges n-Butyllithium
zu beseitigen. Das resultierende Gemisch wird unter Vakuum auf einen
Rückstand
eingeengt, und dieser Rückstand wird
danach in Ethylacetat aufgenommen, und mit Wasser und Salzlösung gewaschen
um unerwünschte
Salze zu entfernen. Die organische Schicht kann danach getrocknet
und unter Vakuum eingeengt werden, und der Rückstand aus Ethylacetat/Hexan
rekristallisiert oder mit Ethylacetat/Hexan chromatographiert werden, wobei
der N-CBZ-C-2-O-BOM-3-Phenylisoserinethylester erhalten wird.
-
Ein
anderer Weg für
die Herstellung von N-CSZ-C-2-O-BOM-3-Phenylisoserinethylester wird bewirkt durch
Auflösen
der Verbindung N-CBZ-(2R,3S)-3-Phenylisoserinethylester
in wasserfreiem Methylenchlorid. Danach wird eine tertiäre Aminbase
wie etwa Diisopropylethylamin zusammen mit BOM-Cl zugegeben, und das
Gemisch wird vierundzwanzig Stunden unter Rückfluss erwärmt. Obwohl dieser Reaktionsweg N-CBZ-C-2-O-BOM-3-Phenylisoserinethylester
ergibt, verläuft
die Reaktion viel langsamer als der vorstehend diskutierte Weg.
Er kann jedoch aufgrund einer höheren
Ausbeute bevorzugt sein. Hier wird die Verbindung nicht gereinigt,
sondern vielmehr in roher Form nachfolgenden Bearbeitungsschritten
zugeführt.
-
In
jedem Fall kann der resultierende N-CBZ-C-2-O-BOM-(2R,3S)-3-Phenylisoserinethylester,
entweder in der gereinigten Form des ersten Wegs oder in der Rohform
des zweiten Wegs, einfach in die entsprechende Säure überführt werden durch die Reaktion:
Reaktion
IV
-
Hier
wird der geschützte
Ethylester in Ethanol/Wasser (Verhältnis 8:1) aufgelöst. Lithiumhydroxid
(oder ein anderes geeignetes Alkalihydroxid) wird zu der Lösung zugegeben,
und das resultierende Gemisch wird annähernd drei Stunden gerührt um die
Verbindung zu verseifen. Das Gemisch wird danach angesäuert (1
N Salzsäure) und
mit Ethylacetat extrahiert. Die resultierende organische Schicht
wird abgetrennt, getrocknet und unter Vakuum eingeengt. Die Rückstandsäure wird
danach ohne weitere Reinigung zur Verwendung isoliert. Dies erzeugt
das gewünschte
N-CBZ-C-2-O-BOM-(2R,3S)-3-Phenylisoserin.
-
Wenn
der N-CBZ-C-2-O-BOM-3-Phenylisoserinethylester in roher Form eingebracht
wurde und zu N-CBZ-C-2-O-BOM-(2R,3S)-3-Phenylisoserin überführt wird,
ist es notwendig, das Endprodukt weiter zu reinigen. Diese Reinigung
wird bewirkt durch Auflösen
des Produkts in Toluol, gefolgt von Zutropfen eines Äquivalents
Dicyclohexylamin, und Rühren
der resultierenden Lösung
während
einer halben Stunde. Das Gemisch wird danach in vacuo aufkonzentriert,
und der resultierende Rückstand
wird aus Ethylacetat:Hexan rekristallisiert, wobei das Dicyclohexylaminsalz
von N-CBZ-C-2-O-BOM-(2R,3S)-3-Phenylisoserin erhalten wird, welches
danach freigesetzt werden kann durch Auflösen dieses Dicyclohexylaminsalzes
in Methylenchlorid oder einem anderen halogenierten Lösungsmittel,
gefolgt von Waschen des Methylenchlorids mit mehreren Teilmengen
1 N HCl. Die organische Phase wird danach mit mehreren Teilmengen
Wasser gewaschen, um Dicyclohexylamin-Hydrochlorid zu entfernen.
Danach wird sie mit einer Teilmenge gesättigter Salzlösung gewaschen
und in vacuo eingeengt, wobei die gewünschte Säure erhalten wird.
-
Benzyl
selbst ist ein anderes Beispiel einer hydrierbaren Schutzgruppe
vom Benzyl-Typ,
welche anstelle von BOM verwendet werden kann. N-CBZ-C-2-Benzyl-3-Phenylisoserinethylester
wurde wie vorstehend hergestellt, wobei BOM-Cl durch Benzylbromid
ersetzt wurde, gemäß der Reaktion:
Reaktion
V
-
Hier
wird der CBZ-geschützte
(2R,3S)-3-Phenylisoserinethylester unter einer Stickstoffatmosphäre in wasserfreiem
THF aufgelöst
und auf eine erniedrigte Temperatur wie etwa –20°C oder –78°C abgekühlt, beispielsweise in einem
Trockeneis/Aceton-Bad, gefolgt von Zutropfen eines Alkyllithiummittels,
wie etwa n-Butyllithium,
obwohl es wünschenswert
ist, dass das Alkyllithiummittel ein geradkettiges Alkyl ist. Das
resultierende Gemisch wird etwa 10 Minuten gerührt. Danach wird Benzylbromid
(BnBr) über
einen Zeitraum von etwa fünf
Minuten zugetropft, und das Gemisch wird annähernd zwei bis fünf Stunden
bei der erniedrigten Temperatur gerührt. Danach wird die Lösung auf
0°C erwärmt und
mit Wasser abgelöscht
um überschüssiges n-Butyllithium
zu zerstören.
Das resultierende Gemisch wird unter Vakuum zu einem Rückstand
eingeengt, und dieser Rückstand
wird danach in Ethylacetat aufgenommen und mit Wasser gewaschen
um alles Lithiumbromidsalz zu entfernen; danach wird er weiter mit
Salzlösung
gewaschen. Die organische Schicht kann danach getrocknet und unter
Vakuum eingeengt werden, und der Rückstand aus Ethylacetat/Hexan
rekristallisiert oder mit Ethylacetat/Hexan chromatographiert werden,
wobei der N-CBZ-C-2-Benzyl-3-Phenylisoserinethylester erhalten
wird.
-
Alternativ
kann der N-CBZ-C-2-Benzyl-3-Phenylisoserinethylester erhalten werden
gemäß der Reaktion:
Reaktion
VI
-
Hier
wird zu einer gerührten
Lösung
von NaH in wasserfreiem DMF unter Stickstoff über fünf Minuten N-CBZ-3-Phenylisoserinethylester,
aufgelöst
in DMF, zugegeben. Das Gemisch wird danach eine halbe Stunde bei
0°C gerührt. Danach
wird über
fünf Minuten
Benzylbromid (1,1 Äquivalente)
zugetropft, und die Reaktion wird zwei Stunden gerührt. Das
Gemisch wird danach mit Wasser abgelöscht um überschüssiges Natriumhydrid zu zerstören. Danach
wird entweder Diethylether oder Methyl-t-butylether zugegeben. Die
organische Schicht wird danach mit vier Teilmengen Wasser gewaschen
um DMF und Natriumbromid zu entfernen. Danach wird sie mit Salzlösung gewaschen
und danach getrocknet und unter Vakuum eingeengt, wobei N-CBZ-C-2-Benzyl-3-Phenylisoserinethylester
erzeugt wird, der danach leicht zu N-CBZ-C-2-Benzyl-3-Phenylisoserin überführt werden
kann, durch das Verfahren von Reaktion IV, vorstehend, wobei verstanden
wird, dass in diesem Fall Benzyl anstelle von Benzyloxymethyl (BOM)
die C-2-Schutzgruppe ist.
-
Es
ist bevorzugt, dass die C-2-Schutzgruppe eine hydrierbare Schutzgruppe
vom Benzyl-Typ ist, insbesondere Benzyloxymethyl oder Benzyl. Aus
dem Vorhergehenden sollte jedoch klar sein, dass die vorliegende
Erfindung die Verwendung von anderen Hydroxylschutzgruppen an der
C-2 Position der 3-Phenylisoserinseitenkette
vorsieht.
-
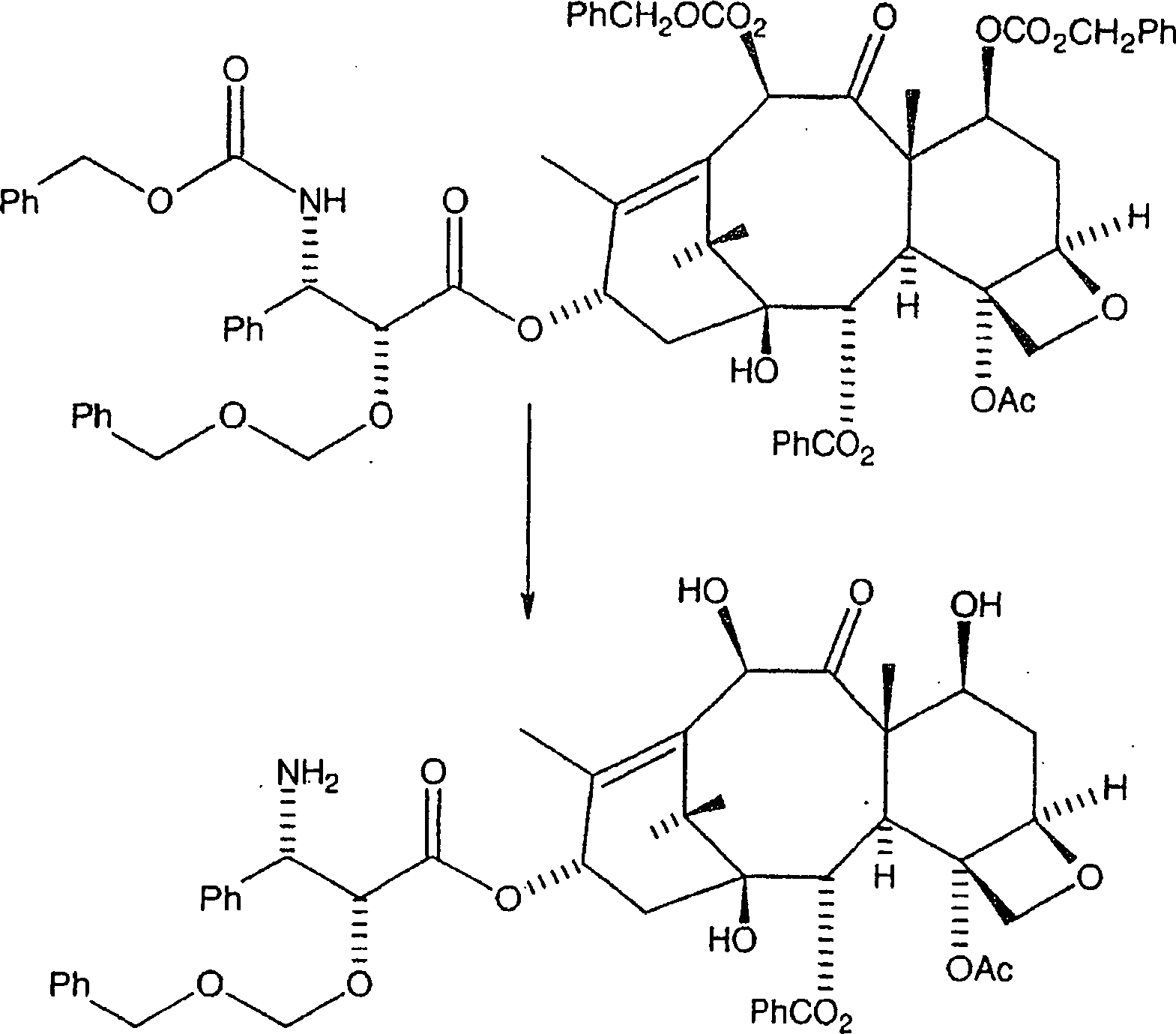
C. Veresterung des geschützten Baccatin
III mit der Seitenkette
-
Die
Veresterung des C7, C-10-di-CBZ-10-Deacetylbaccatin III mit der
N-CBZ an C-2 geschützten 3-Phenylisoserinseitenkette,
mit einer hydrierbaren Schutzgruppe vom Benzyl-Typ, wird wie folgt
bewerkstelligt. Die nachstehend gezeigte, bevorzugte hydrierbare
Benzylgruppe ist BOM (Benzyloxymethyl).
Reaktion
VII
-
Hier
werden das C7, C-10-di-CBZ-10-Deacetylbaccatin III (1 Äquivalent)
und ein Überschuss
der Seitenkette (bevorzugt 6 Äquivalente)
in Toluol aufgelöst.
Zu diesem Gemisch werden 4-Dimethylaminopyridin (DMAP) (1 Äquivalent)
und Dicyclohexylcarbodiimid (bevorzugt 6 Äquivalente, oder im gleichen
Verhältnis
wie die Seitenketteverbindung) zugegeben, und das resultierende
Gemisch wird zunächst
während
eines ersten Zeitraums, annähernd
eine bis fünf
Stunden, bei einer ersten Temperatur von etwa 60°C bis 80°C erwärmt. Es sollte jedoch auch
bemerkt werden, dass das Dicyclohexylcarbodiimid durch andere Dialkylcarbodiimide
ersetzt werden kann, wobei Diisopropylcarbodiimid ein Beispiel dafür ist.
-
Die
Lösung
wird danach auf Raumtemperatur abkühlen gelassen, und danach wird
ein gleiches Volumen Diethylether oder Ethylacetat zugegeben. Die
resultierende Lösung
wird auf eine erniedrigte Temperatur abgekühlt, welche ausreichend ist
um Harnstoff daraus zu kristallisieren. Bevorzugt wird die Lösung unter
Rühren
auf 0°C gekühlt und
vierundzwanzig Stunden bei dieser Temperatur gehalten. Dieser Schritt
kristallisiert den Großteil
der Harnstoffverunreinigung aus. Nachdem der Zeitraum von vierundzwanzig
Stunden vergangen ist, wird die Lösung filtriert und der Rückstand
entweder mit Ethylether der Methyl-t-butylether oder Ethylacetat gewaschen.
Die vereinten organischen Phasen werden danach mit Salzsäure (5%),
Wasser und schließlich mit
Satzlösung
gewaschen. Die organische Phase wird abgetrennt, getrocknet und
unter Vakuum eingeengt. Es ist bevorzugt, den resultierenden Rückstand
danach durch Auflösen
in Ethylacetat:Hexan und Eluieren über einen Stopfen aus Silikagel
zu reinigen. Der Eluent wird danach unter Vakuum zu einem Rückstand
eingeengt. Der Rückstand
wird danach aus Diethylether rekristallisiert, wobei das gewünschte Kopplungsprodukt
erhalten wird, nämlich
C-3'-N-CBZ-C-2'-O-BOM-C7, C-10-di-CBZ-10-Deacetylbaccatin
III der Formel:
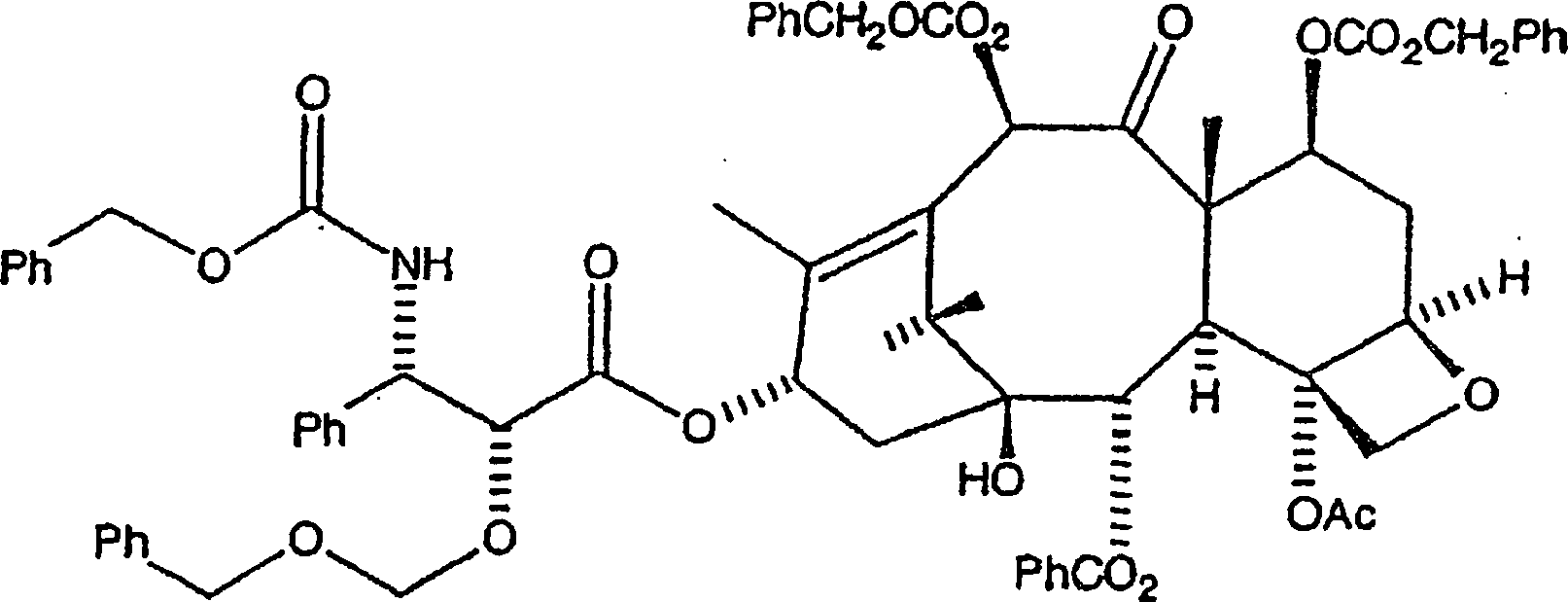
-
D. Entfernung des Schutzes
und Behandlung mit Benzoylchlorid
-
Die
nachfolgende Reaktion entfernt die CBZ-Schutzgruppen an C-7 und
C-10 und an der C-3'-Stickstoffposition
der Seitenkette, wobei das gewünschte
Amin erzeugt wird (aus Gründen
der Klarheit wird hier wiederum BOM als ein Beispiel einer hydrierbaren
C-2'-Schutzgruppe
vom Benzyl-Typ verwendet):
Reaktion
VIII
-
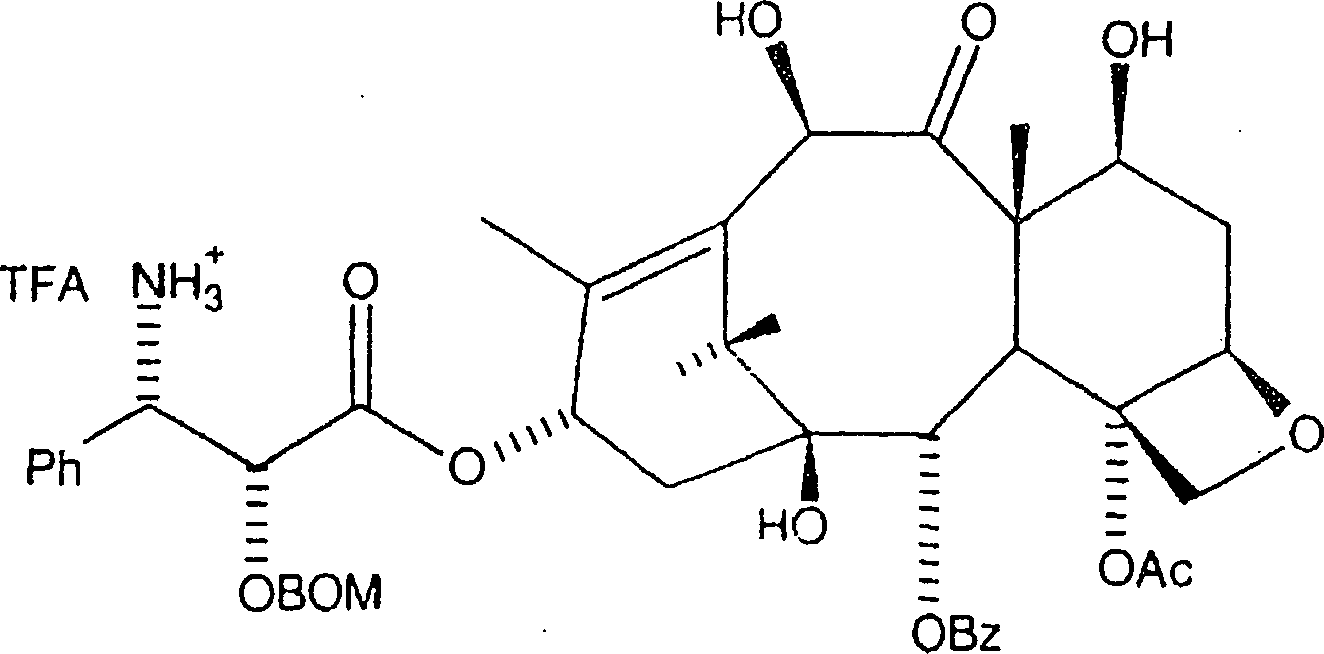
Das
gekoppelte Produkt wird in Isopropanol/Ethylacetat aufgelöst, wozu
Pearlmans Katalysator zugegeben wird. Das resultierende Gemisch
wird mindestens vierundzwanzig Stunden bei 40 psi Wasserstoff hydriert.
Dies führt
zu dem in Reaktion VIII gezeigten Amin. Alternativ kann das gekoppelte
Produkt in Isopropanol/Ethylacetat aufgelöst und bei 1 atm Wasserstoff
in der Gegenwart von Pearlmans Katalysator und einem Äquivalent
Trifluoressigsäure
hydriert werden. Dieses Verfahren erzeugt das TFA-Salz des durch
die nachstehende Formel gezeigten Amins:
-
In
jedem Fall wird das Gemisch durch Diatomeenerde filtriert und unter
Vakuum eingeengt, wobei das Amin oder dessen TFA-Salz erhalten wird,
welches ohne weitere Reinigung verwendet wird. Es sollte erkannt werden,
dass das TFA-Anion durch andere deprotonierte organische Säuren ersetzt
werden kann, in dem vom Durchschnittsfachmann verstandenen Ausmaß, wodurch
ein Aminsalz mit dem Anion der deprotonierten organischen Säure erzeugt
wird.
-
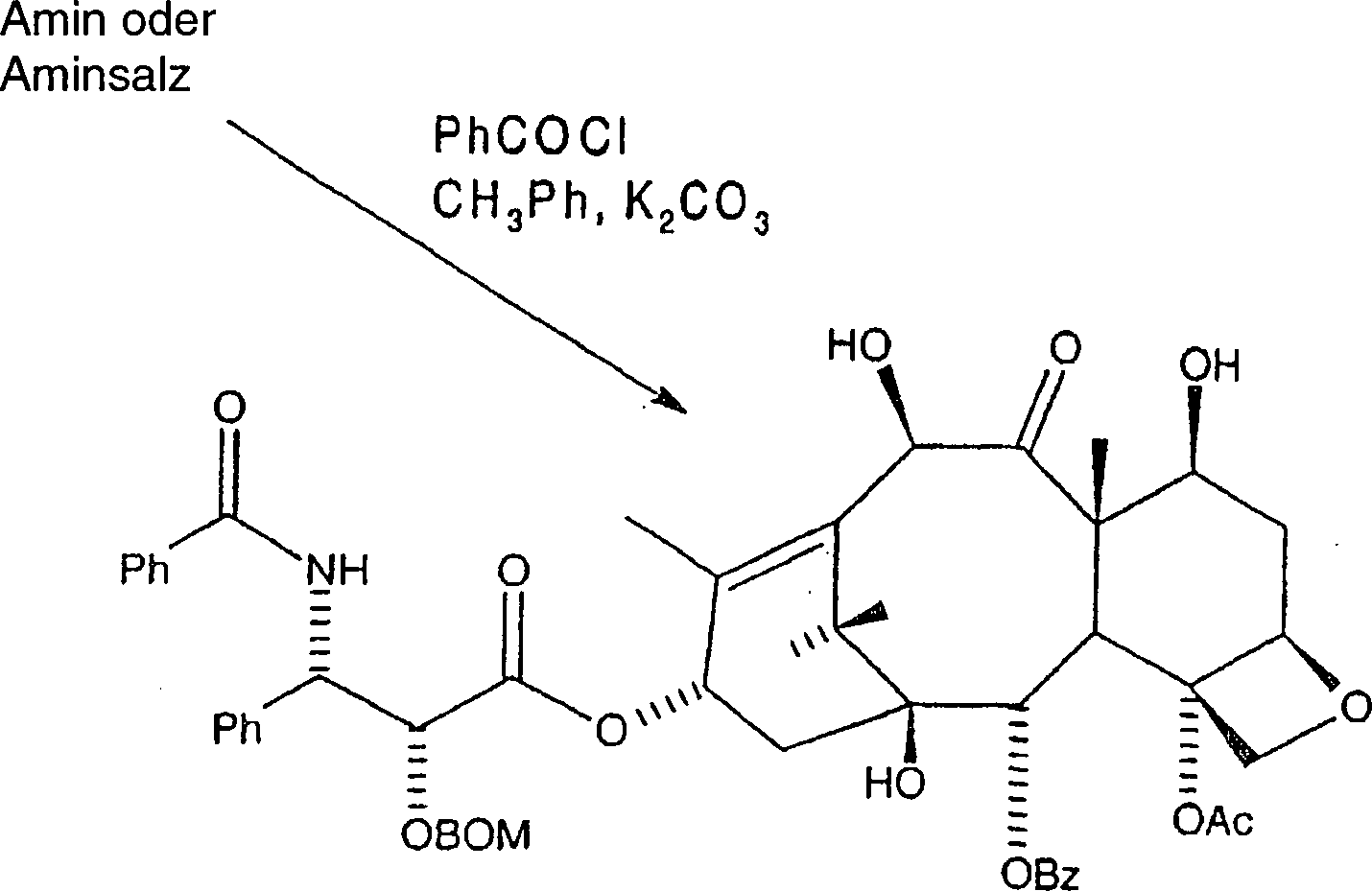
Danach
wird das Amin oder Aminsalz gemäß der nachfolgenden
Reaktion am C-3'-Stickstoff acyliert.
Reaktion
IX
-
Hier
wird das Amin oder alternativ das Aminsalz in wasserfreiem Toluol
aufgenommen, und Kaliumcarbonat wird zugegeben, gefolgt von der
Zugabe des entsprechenden Acylierungsmittels, wie etwa Benzoylchlorid.
Das Gemisch wird danach mindestens dreißig Minuten gerührt, mit
Ethylacetat verdünnt,
mit Wasser und Salzlösung
gewaschen. Die resultierende organische Phase wird danach abgetrennt, über Magnesiumsulfat
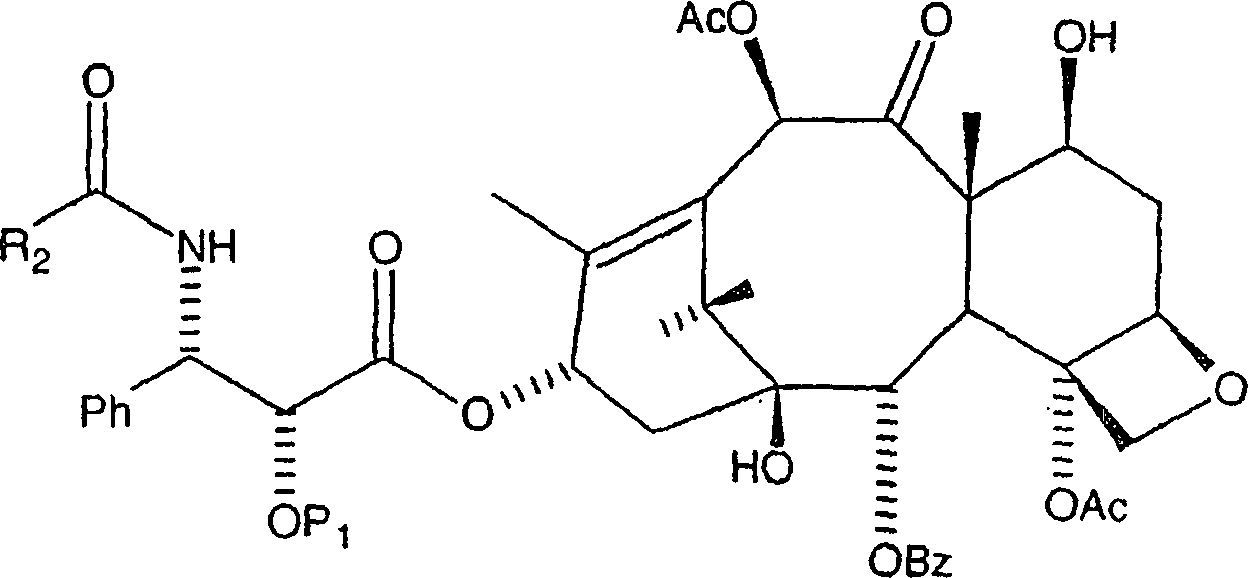
getrocknet und unter Vakuum eingeengt, wobei rohes C-2'-O-BOM-10-Hydroxytaxol
erhalten wird. Alternativ kann das Amin oder Aminsalz in wasserfreiem
Tetrahydrofuran aufgenommen werden und mindestens ein Äquivalent
einer tertiären
Aminbase wie etwa Diisopropylethylamin zugegeben werden, gefolgt
von Benzoylchlorid. Das Gemisch wird danach mindestens dreißig Minuten
gerührt,
mit Ethylacetat verdünnt,
mit Wasser und Salzlösung
gewaschen. Die resultierende organische Phase wurde danach abgetrennt, über Magnesiumsulfat
getrocknet und unter Vakuum eingeengt, wobei rohes C-2'-O-BOM-10-Hydroxytaxol
erhalten wurde.
-
Auf
diesem Bearbeitungsstadium ist es notwendig, das rohe C-2'-O-BOM-10-Hydroxytaxol zu reinigen.
Dies kann mittels Säulenchromatographie
und/oder Rekristallisation aus Ethylacetat:Hexan erreicht werden.
Bevorzugt wird sowohl Säulenchromatographie
mit Ethylacetat:Hexan angewandt, wobei ein Eluent erzeugt wird,
der in vacuo eingeengt wird um einen Rückstand zu erzeugen, gefolgt
von Rekristallisation des Rückstands
aus Ethylacetat:Hexan, wobei C-2'-O-BOM-10-Hydroxytaxol in im
Wesentlichen reiner Form erhalten wird.
-
Es
sollte erkannt werden, dass die vorliegende Erfindung den Ersatz
der PhCO-Gruppe
am C-3'-Stickstoff
durch zusätzliche
Gruppen vorsieht. Insbesondere kann die PhCO-Gruppe durch R2CO ersetzt werden in dem vom Durchschnittsfachmann
verstandenen Ausmaß,
wobei R2 zusätzlich aus PhCH2,
PhO-, PhCH2O-, einer aromatischen Gruppe,
einer Alkylgruppe, einer olefinischen Gruppe, einer O-aromatischen Gruppe,
einer O-Alkylgruppe, und einer O-olefinischen Gruppe ausgewählt sein
kann.
-
E. Selektive C-10-Acylierung
und Entfernung des Schutzes, wobei Paclitaxel gebildet wird
-
Die
nachfolgende Reaktion acyliert die C-10-Hydroxygruppe selektiv in
der Gegenwart der C-7-Hydroxygruppe. Obwohl jede Schutzgruppe an
C-2' ein ähnliches
Verhalten zeigen sollte, wird aus Gründen der Klarheit hier BOM
als ein Beispiel einer hydrierbaren C-2'-Schutzgruppe vom Benzyl-Typ verwendet.
Reaktion
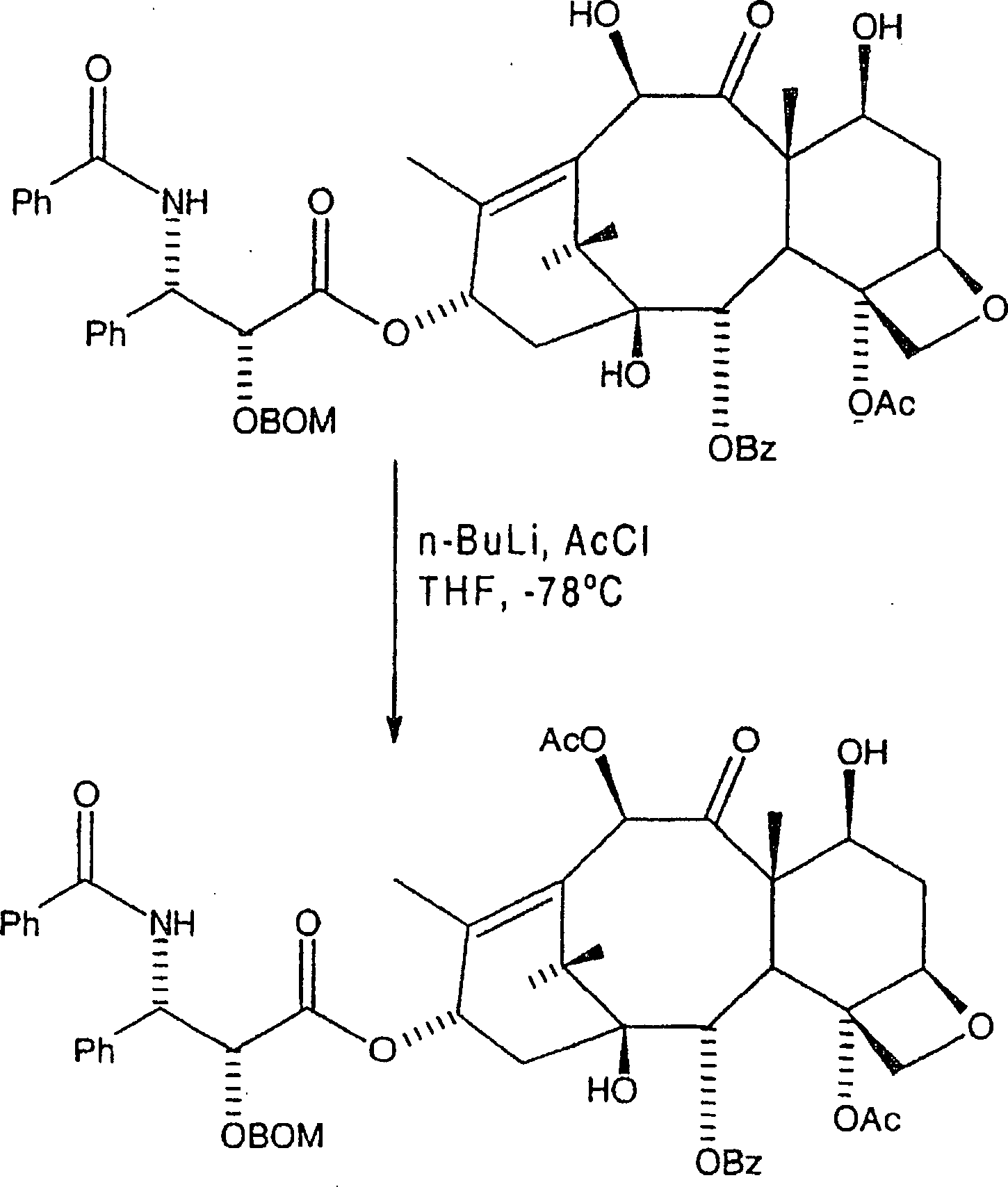
X(a)
-
Hier
wird C-2'-O-BOM-10-Hydroxytaxol
bei etwa 20°–30°C, bevorzugt
etwa bei Raumtemperatur in einem akzeptablen Etherlösungsmittel
aufgenommen, als eine erste Lösung.
Das Etherlösungsmittel
kann aus Tetrahydrofuran und Polyethern ausgewählt werden, wobei wasserfreies
Tetrahydrofuran bevorzugt ist. Die Temperatur der ersten Lösung wird
danach auf nicht mehr als etwa –20°C, aber bevorzugt
etwa –78°C erniedrigt.
Zu dieser ersten Lösung
bei der erniedrigten Temperatur werden danach mindestens 1,0 Äquivalente
Alkalibase, bevorzugt n-Butyllithium
zugegeben, wobei ein erstes Zwischenprodukt in einer zweiten Lösung gebildet
wird. Die gewünschte
Menge an n-Butyllithium liegt bevorzugt in einem Bereich von 1,0
bis 1,25 Äquivalenten,
und es wurde festgestellt, dass die Verwendung von 1,1 Äquivalenten
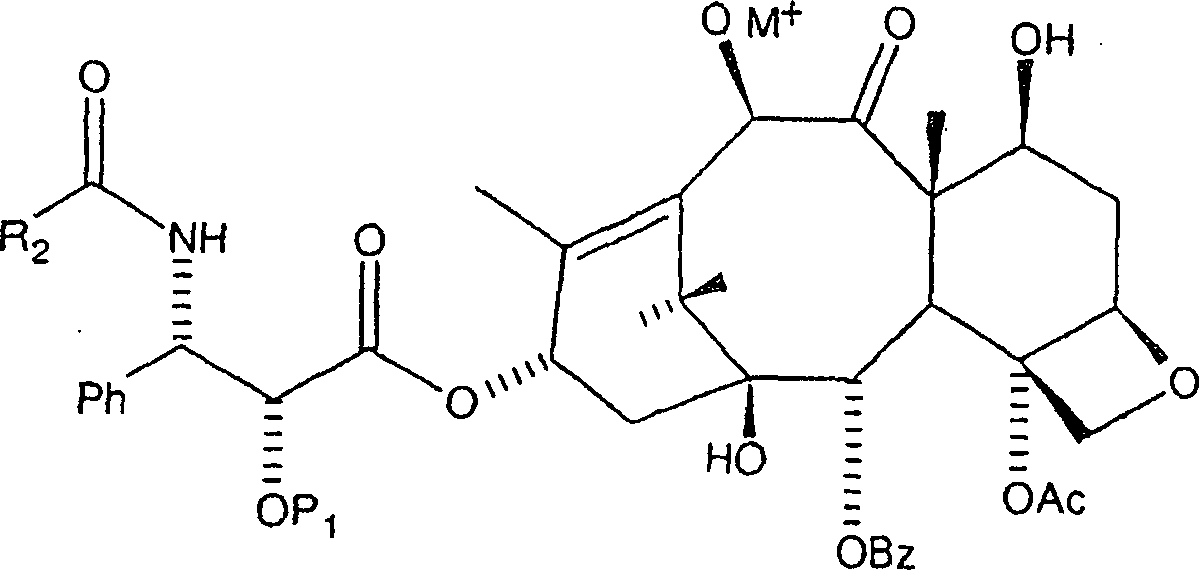
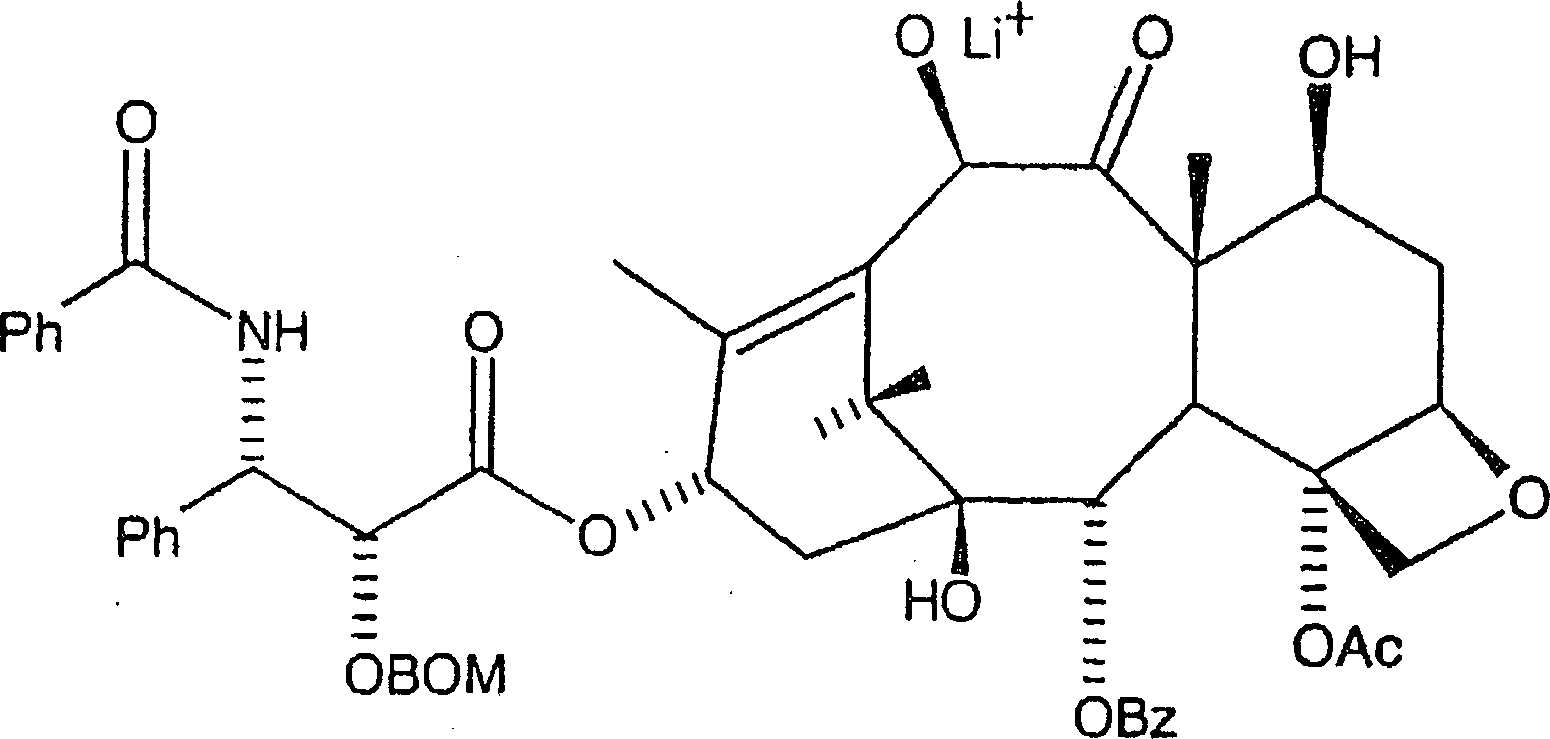
besonders geeignet ist. Das erste Zwischenprodukt hat hier die Formel:
-
Das
erste Zwischenprodukt wird danach acyliert, durch die Zugabe von
mindestens 1,0 aber bevorzugt etwa 1,1 Äquivalenten an Acylierungsmittel,
bevorzugt Acetylchlorid, wobei eine dritte Lösung gebildet wird, gefolgt
von Erwärmen
der dritten Lösung
auf eine Temperatur von nicht mehr als 0°C über eine Stunde. Die erwärmte dritte
Lösung
kann danach mit einer geeigneten Ablöschverbindung, bevorzugt kalter
gesättigter Ammoniumchloridlösung, abgelöscht werden,
wobei eine vierte Lösung
gebildet wird. Die Ablöschverbindung beseitigt überschüssige Mengen
der Alkalibase und des Acylierungsmittels. Die vierte Lösung kann
danach mit einem etwa zweifachen Volumenüberschuss von Ethylacetat verdünnt werden,
wobei eine fünfte
Lösung gebildet
wird. Die fünfte
Lösung
wird danach mit Wasser und Salzlösung
gewaschen, um unerwünschte
Salzverbindungen zu entfernen. Die resultierende organische Phase
wurde danach abgetrennt, getrocknet und unter Vakuum eingeengt,
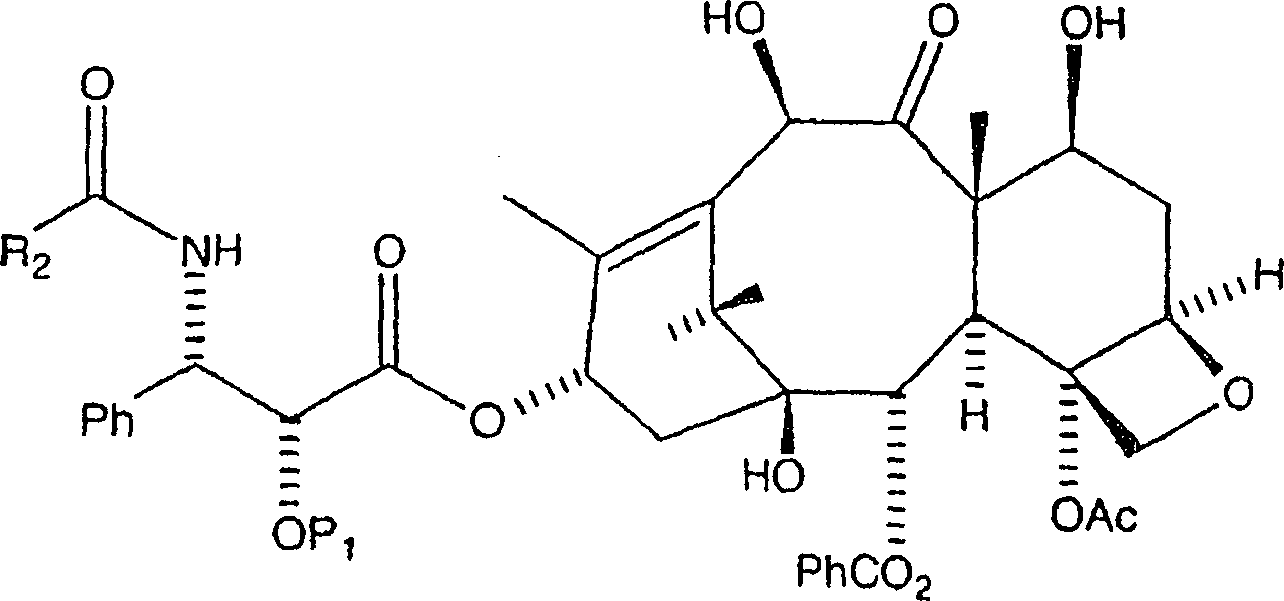
wobei rohes C-2'-O-BOM-Paclitaxel
als ein erster Rückstand
erhalten wurde.
-
Auf
diesem Bearbeitungsstadium ist es notwendig, das rohe C-2'-O-BOM-Taxol zu reinigen.
Dies kann erreicht werden durch Säulenchromatographie und/oder
Rekristallisation aus Ethylacetat:Hexan, wobei ein Eluent erzeugt
wird, der in vacuo eingeengt wird, wobei ein zweiter Rückstand
erzeugt wird, gefolgt von Verwendung einer Rekristallisation des
Rückstands
aus Ethylacetat:Hexan, wobei C-2'-O-BOM-Taxol in einer im Wesentlichen
reinen Form erhalten wird.
-
Es
sollte erkannt werden, dass die vorliegende Erfindung zusätzlich zu
n-Butyllithium die Verwendung von anderen Alkalibasen vorsieht,
wie etwa von Lithiumhexamethyldisilizan, Natriumhydroxid, Kaliumhydroxid, sowie
von Metallalkoxidbasen. Insbesondere sind Metallalkoxidbasen vorgesehen,
wie etwa Lithiumisopropoxid, Lithiummethoxid, Lithium-t-butyloxid
und andere Basen mit der Formel MOR4, worin
M ein Alkalimetall, insbesondere Lithium, Kalium oder Natrium ist,
und worin R4 ein organischer Rest wie etwa
Methyl, Isopropyl und t-Butyl ist. Es sollte erkannt werden, dass
die Verwendung der vorstehenden Basen, ähnlich zu n-Butyllithium wie gezeigt, zu der Metallalkoxid-Zwischenproduktformel
wie vorstehend führt,
mit O–M+ an C-10, wobei M ein Alkalimetall, in genaueren
Worten, Lithium, Kalium oder Natrium ist.
-
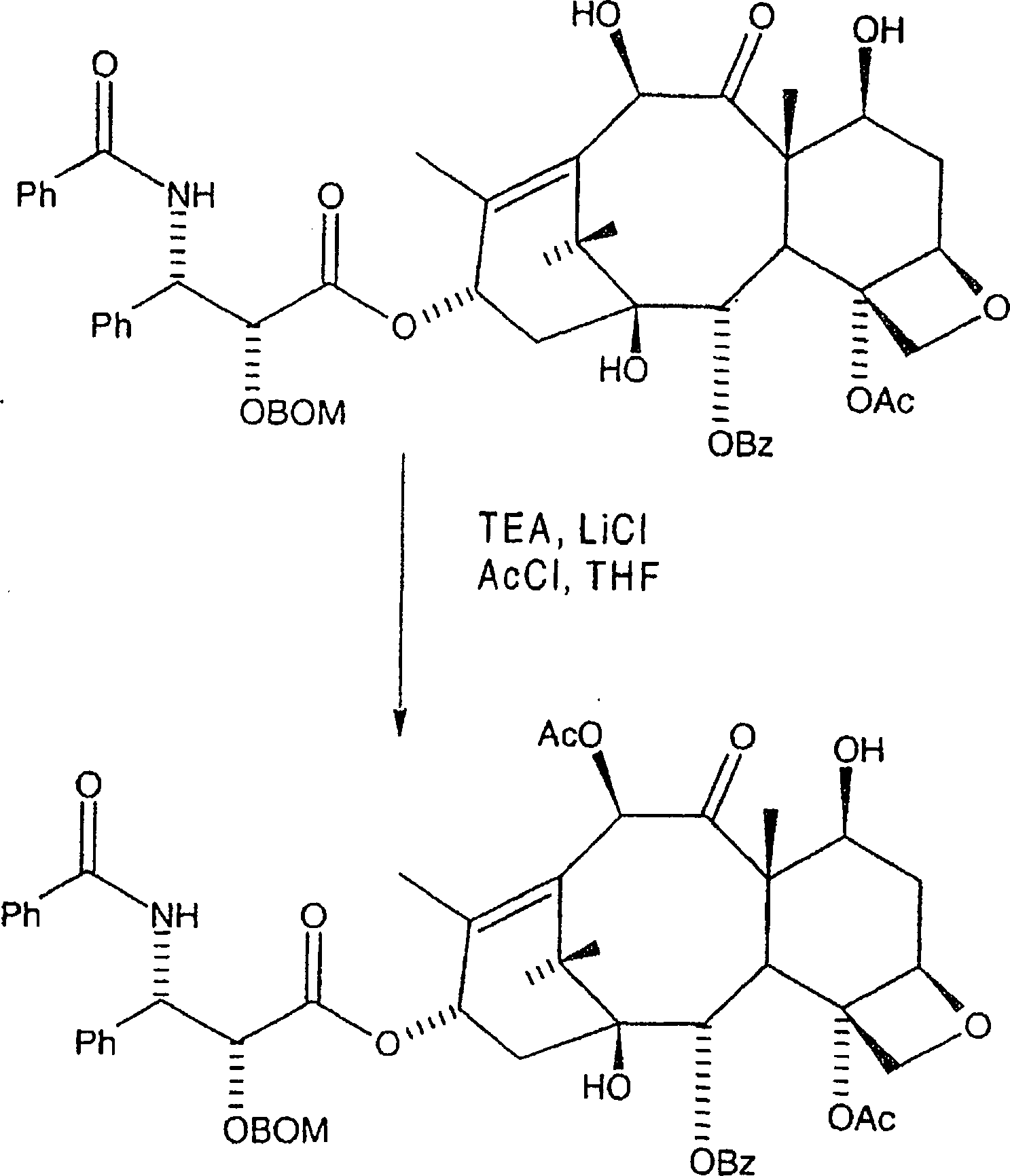
Alternativ
kann die nachfolgende Reaktion angewandt werden um die C-10-Hydroxygruppe selektiv
in der Gegenwart der C-7-Hydroxygruppe zu acylieren.
Reaktion
X(b)
-
Hier
wird C-2'-O-BOM-10-Hydroxytaxol
bei einer Temperatur zwischen etwa –10° und 30°C aber bevorzugt von etwa 25°C in einem
akzeptablen Etherlösungsmittel
aufgenommen, wobei eine erste Lösung
gebildet wird. Bevorzugt wird das Etherlösungsmittel aus Tetrahydrofuran
und Polyethern ausgewählt,
wobei wasserfreies Tetrahydrofuran bevorzugt ist. Danach wird eine
Lösung
von ein bis fünf Äquivalenten,
wobei fünf Äquivalente
bevorzugt sind, eines Lithiumsalzes, bevorzugt von Lithiumchlorid,
in einem akzeptablen Etherlösungsmittel,
bevorzugt wasserfreiem Tetrahydrofuran, in die erste Lösung eingemischt,
wobei eine zweite Lösung
gebildet wird. Danach werden zwei bis zehn Äquivalente, aber bevorzugt
fünf Äquivalente
Trialkylaminbase oder Pyridin, aber bevorzugt Triethylamin, zu der
zweiten Lösung
zugegeben, wobei eine dritte Lösung gebildet
wird.
-
Danach
werden zwei bis zehn Äquivalente,
aber bevorzugt fünf Äquivalente
Acylierungsmittel, bevorzugt Acetylchlorid, zu der dritten Lösung zugegeben,
wobei eine vierte Lösung
gebildet wird. Die dritte Lösung kann
zu einer Lösung
zugegeben werden, welche zwischen zwei und zehn Äquivalente des Acylierungsmittels enthält, um die
vierte Lösung
zu bilden. Bevorzugt werden annähernd
fünf Äquivalente
des Acylierungsmittels in Tetrahydrofuran aufgelöst, wozu die dritte Lösung zugegeben
wird um die vierte Lösung
zu bilden. Die vierte Lösung
wird danach während
eines Zeitraums von mindestens einer halben Stunde, aber bevorzugt
vierundzwanzig Stunden gerührt,
und mit einer geeigneten Ablöschverbindung,
bevorzugt Ammoniumchloridlösung, welche
wirksam ist um einen Überschuss
an Acylierungsmittel daraus zu beseitigen, abgelöscht, wobei eine fünfte Lösung erzeugt
wird. Die fünfte
Lösung
wird mit Ethylacetat verdünnt,
wobei sich eine wässrige
Phase und eine organische Phase bildet; die wässrige Phase wird verworfen
und die organische Phase wird mit ein-normaler HCl, Salzlösung gewaschen,
zu einem ersten Rückstand
eingeengt und gereinigt, wie etwa mittels Säulenchromatographie mit Ethylacetat:Heptan
oder mittels Rekristallisation, wobei C-2'-O-BOM-Taxol in im Wesentlichen reiner
Forme erhalten wird.
-
Es
sollte erkannt werden, dass die vorliegende Erfindung die Verwendung
von anderen Alkalisalzen zusätzlich
zu Lithiumchlorid vorsieht. Insbesondere sieht die vorliegende Erfindung
die Verwendung von Kaliumsalzen und Natriumsalzen sowie von Lithiumsalzen,
wie etwa von Lithiumchlorid und Lithiumjodid vor. Wie mit dem vorstehenden
Verfahren führt
die Verwendung von anderen Alkalimetallen zu einem Metallalkoxid-Zwischenprodukt
mit dem Alkalimetallgegenion an C-10.
-
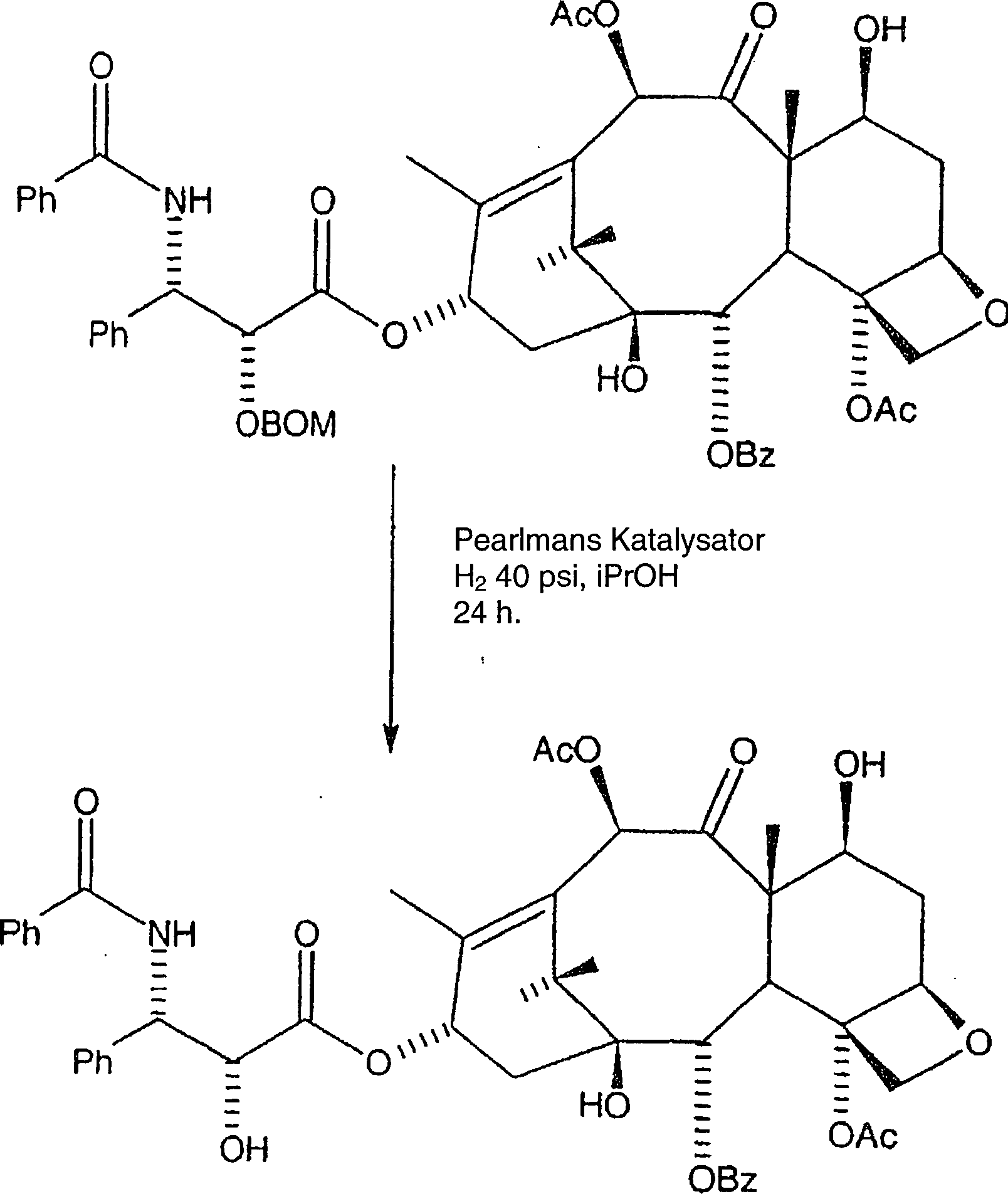
Wie
früher
in US Patent Nr. 5,675,025 gezeigt, wird die Benzyloxymethyl-Schutzgruppe wie
folgt entfernt:
Reaktion
XI
-
Hier
wird das gereinigte C-2'-O-BOM-Taxol
in Isopropanol aufgelöst
und Pearlmans Katalysator wird zugegeben. Das Gemisch wird danach
hydriert, entweder bei 1 atm Wasserstoff unter Zugabe von katalytischer
Trifluoressigsäure,
oder bei 40 psi Wasserstoff ohne Zugabe von Trifluoressigsäure während mindestens vierundzwanzig
Stunden. In jedem Fall wird das Gemisch danach durch Diatomeenerde
filtriert und unter Vakuum eingeengt, wobei rohes Paclitaxel erhalten
wird.
-
Die
vorliegende Erfindung wurde dementsprechend mit einem gewissen Ausmaß an Einzelheiten
im Hinblick auf die beispielhaften Ausführungsformen der vorliegenden
Erfindung beschrieben. Es sollte jedoch erkannt werden, dass die
vorliegende Erfindung durch die nachfolgenden, in Kenntnis des bekannten
Standes der Technik konstruierten Ansprüche definiert ist, so dass
Modifikationen oder Veränderungen
an den beispielhaften Ausführungsformen
der vorliegenden Erfindung vorgenommen werden können, ohne von den darin enthaltenen
erfindungsgemäßen Konzepten
abzuweichen.