-
Hintergrund der Erfindung
-
Es
ist bekannt, dass bestimmte Proteine eine größere biologische Aktivität aufweisen,
wenn sie an andere Reste gebunden sind, und zwar entweder durch
Bildung von multimeren Komplexen, bei denen die Proteine eine Gelegenheit
zum Zusammenwirken haben, oder über
andere Veränderungen
in den physikochemischen Eigenschaften des Proteins, z. B. der Absorption,
Bioverteilung und Halbwertszeit des Proteins. Somit beinhaltet ein
derzeitiges Forschungsgebiet der Biotechnologie die Entwicklung
von Verfahren zur Modifizierung der physikochemischen Eigenschaften
von Proteinen, so dass sie in geringeren Mengen, mit geringeren Nebenwirkungen,
auf neuen Verabreichungswegen und kostengünstiger verabreicht werden
können.
-
Beispielsweise
kann die Bindungsaffinität
eines beliebigen einzelnen Proteins (z. B. als Ligand für seinen
verwandten Rezeptor) gering sein. Jedoch exprimieren Zellen normalerweise
Hunderte bis Tausende Kopien eines bestimmten Oberflächenrezeptors
und es können
zahlreiche Rezeptor-Ligand-Wechselwirkungen gleichzeitig
stattfinden. Wenn zahlreiche Oberflächenmoleküle an der Bindung beteiligt
sind, ist die gesamte wirksame Affinität größer als die Summe der Bindungsaffinitäten der
einzelnen Moleküle.
Wenn im Gegensatz dazu Ligandenproteine von der Zelloberfläche entfernt
und gereinigt werden oder durch rekombinante DNA-Techniken für die Verwendung, z. B. als
Therapeutika, isoliert werden, wirken sie als Monomere und verlieren
den Vorteil, dass sie mit zahlreichen anderen Kopien des gleichen
Proteins, die eng an der Oberfläche einer
Zelle miteinander assoziiert sind, zusammenwirken. Somit kann in
isoliertem Zustand die geringe Affinität eines Proteins für seinen
Rezeptor einen schweren Nachteil bezüglich seiner Wirksamkeit als
Therapeutikum zur Blockierung eines speziellen Bindungsweges darstellen,
da es gegen die Zell- Zell-Wechselwirkungen
von hoher Avidität
konkurrieren muss. Eine wirksame Behandlung könnte eine konstante Verabreichung
und/oder höhere
Dosen erforderlich machen. Derartige Nachteile ließen sich
jedoch vermeiden, wenn sich Mittel zur Bereitstellung multimerer
Formen eines isolierten Proteins auffinden ließen.
-
Gleichermaßen wäre es wertvoll,
weitere physikochemische Eigenschaften von biologisch aktiven Proteinen
zu modifizieren, so dass beispielsweise ein Protein zur Assoziation
mit einer Membran angeregt wird, wobei es an der Verabreichungsstelle
lokalisiert wird und seine Fähigkeit
zur Bindung an ein bestimmtes Ziel oder zu einer anderweitigen Wechselwirkung
mit diesem Ziel verstärkt
wird. Derartige Veränderungen
können
auch die pharmakologische Verteilung des Proteins beeinflussen.
-
Es
wurden verschiedene Verfahren zur Entwicklung von gekuppelten Proteinen
konzipiert. Viele dieser Verfahren sind nicht hochgradig spezifisch,
d. h. sie sind nicht auf den Punkt der Kupplung an eine bestimmte Stelle
am Protein ausgerichtet. Infolgedessen können herkömmliche Kupplungsmittel funktionelle
Stellen angreifen oder sterisch aktive Zentren blockieren, wodurch
die gekuppelten Proteine inaktiv werden. Ferner orientieren sich
die gekuppelten Produkte möglicherweise
so, dass die aktiven Zentren nicht synergistisch zusammenwirken
können,
so dass die Produkte nicht wirksamer als das monomere Protein allein
sind.
-
Weitere
Motivationen zum Auffinden neuer Verfahren zur Proteinmodifikation
ergeben sich daraus, dass Proteine mit einem N-terminalen Cysteinrest
gegenüber
einer Oxidation oder anderen chemischen Modifikationen, die die
Aktivität
oder die Halbwertszeit beeinträchtigen
können,
empfindlich sind. Ferner weisen bestimmte Puffer, die üblicherweise
bei der Proteinreinigung eingesetzt werden, Bestandteile oder Verunreinigungen
auf, die das N-terminale Cystein modifizieren können. Selbst wenn diese Puffer
vermieden werden, wird das N-terminale Cystein im Laufe der Zeit
modifiziert, möglicherweise
aufgrund von Chemikalien in den Lagerungsfläschchen oder in der Luft. Infolgedessen
müssen
Zubereitungspuffer ein Schutzmittel, wie Dithiothreit, enthalten,
um eine Modifikation und/oder Oxidation von Cystein zu verhindern.
Jedoch weisen die Schutzmittel selbst eine erhebliche biologische
Aktivität
auf und können
daher Experimente kompliziert gestalten und die therapeutische Eignung
einer Zubereitung nachteilig beeinflussen.
-
WO-A-97/40852
betrifft ein Verfahren zum Modifizieren eines antigenen Peptids,
um die Bindungsaffinität
eines MHC-Komplexes zu erhöhen..
Jedoch finden sich in WO-A-97/40852
keine Ausführungen über die Modifikation
eines Peptids oder Proteins mit dem Ziel, seine Aktivität zu erhöhen.
-
PNAS,
Bd. 94 (Juni 1997), S. 6116–6120,
beschreibt die Palmitoylierung von G-Protein-Untereinheiten am Cys
in der Nähe
des N-Terminus, beschreibt aber nicht die Modifikation eines Peptids
oder Proteins mit dem Ziel, die Aktivität der Peptide oder Proteine
zu erhöhen.
-
Biochem.
J., Bd. 328(1) (November 1997), S. 23–31 beschreibt die Bindung
von Liposomen an G-Protein-Untereinheiten,
beschreibt aber nicht die Modifikation eines Peptids oder Proteins
zur Erhöhung
von dessen Aktivität.
-
Biochemistry,
Bd. 33(51) (1994), S. 15469–15482
beschreibt modifizierte Proteine, wie BPTI, beschreibt aber nicht
die Modifizierung von Peptiden oder Proteinen zur Verstärkung ihrer
Aktivität.
-
WO-A-96/16668
beschreibt Hedgehog-Proteine, beschreibt aber ebenfalls nicht die
Modifikation von Peptiden oder Proteinen zur Erhöhung ihrer Aktivität.
-
WO-A-98/30576
beschreibt die Verknüpfung
von Hedgehog-Sequenzen
mit Cholesterol über
N-terminales Cys, beschreibt aber nicht die Modifikation von Peptiden
zur Erhöhung
ihrer Aktivität.
-
Demzufolge
besteht auf dem einschlägigen
Gebiet ein Bedürfnis
zur Entwicklung spezifischerer Mittel zur Bereitstellung derivatisierter
Produkte oder multimerer Formen davon, um die Eigenschaften des
Proteins mit dem Ziel zu verändern,
seine Stabilität,
Wirkungsstärke,
Pharmakokinetik und Pharmakodynamik zu beeinflussen.
-
Zusammenfassende Darstellung
der Erfindung
-
Gemäß einem
Aspekt der Erfindung haben wir das Problem zum Auffinden eines Weges,
in zweckmäßiger Weise
modifizierte Formen von biologisch aktiven Proteinen herzustellen,
gelöst.
Die erfindungsgemäßen Verfahren
können
zur Derivatisierung multimerer Formen der Proteine und/oder zur
Veränderung
ihrer physikochemischen Eigenschaften herangezogen werden. Wir haben
festgestellt, dass eine Modifikation eines Hedgehog-Proteins (d.
h. das Addieren oder Anheften eines hydrophoben Restes an eine vorhandene
Aminosäure
oder das Ersetzen einer Aminosäure
durch einen hydrophoben Rest) in der Weise, dass der hydrophobe Rest
in das Protein eingeführt
wird, die biologische Aktivität
und/oder Stabilität
des Proteins erhöhen
kann. Beispielsweise kann ein N-terminales Cystein als zweckmäßiges "Ziel" verwendet werden,
um einen hydrophoben Rest (z. B. ein Lipid) anzuheften und dadurch
die biologisch aktiven Proteine zu modifizieren.
-
Alternativ
kann ein hydrophober Rest an einen C-terminalen Rest eines biologisch aktiven
Hedgehog-Proteins angeheftet werden, um die Aktivität des Proteins
zu modifizieren. Ein hydrophober Rest kann auch an einen internen
Aminosäurerest
angeheftet werden, um die Aktivität des Proteins zu verstärken, vorausgesetzt,
dass die Modifikation nicht die Aktivität des Proteins beeinträchtigt,
z. B. die Fähigkeit
des Proteins zur Bindung an einen Rezeptor oder Corezeptor, oder
die dreidimensionale Struktur des Proteins nicht beeinträchtigt.
Vorzugsweise wird der hydrophobe Rest an einen internen Aminosäurerest
angeheftet, d. h. an die Oberfläche
des Proteins, wenn das Protein in seiner nativen Form vorliegt.
Die erfindungsgemäße hydrophobe Modifikation
bietet ein allgemein geeignetes Verfahren zur Erzeugung von Proteinen,
deren physikochemische Eigenschaften im Vergleich zu nicht-modifizierten
Formen verändert
sind.
-
Die
Erfindung beruht auf dem Befund, dass wir bei der Expression von
Sonic-Hedgehog-Protein von voller Länge in Insekten- oder Säugetierzellen
feststellten, dass die reife Form des Proteins (Reste 1–174 in der
reifen Sequenz) zusätzlich
zum Vorliegen von Cholesterol am C-Terminus auch an seinem N-terminalen Ende
mit einer Fettsäure
derivatisiert ist. In signifikanter Weise zeigte diese Form von
Hedgehog bei einem in vitro-Test eine etwa 30-fach erhöhte Wirkungsstärke, verglichen
mit löslichem,
nicht-modifiziertem
Hedgehog.
-
Ein
Aspekt der Erfindung betrifft daher ein isoliertes Hedgehog-Protein,
das eine N-terminale Aminosäure
und eine C-terminale Aminosäure
umfasst, wobei das Protein aus der Gruppe ausgewählt ist, die besteht aus: einem
Protein mit einem N-terminalen Cystein, an das mindestens ein hydrophober
Rest angeheftet ist; einem Protein mit einer N-terminalen Aminosäure, bei der es sich nicht
um ein Cystein, an das mindestens ein hydrophober Rest angehängt ist,
handelt; und einem Protein mit einem hydrophoben Rest, der die N-terminale Aminosäure ersetzt.
Beim hydrophoben Rest kann es sich um ein hydrophobes Peptid oder
um ein beliebiges Lipid oder um einen beliebigen anderen chemischen
Rest, der hydrophob ist, handeln.
-
Das
Protein kann an seiner N-terminalen Aminosäure modifiziert sein und vorzugsweise
handelt es sich bei der N-terminalen Aminosäure um ein Cystein oder um
ein funktionelles Derivat davon. Das Protein kann an der C-terminalen Aminosäure oder
sowohl an der N-terminalen als auch an der C-terminalen Aminosäure oder
an mindestens einer internen Aminosäure, die zwischen der N-terminalen
und der C-terminalen Aminosäure
liegt, modifiziert sein oder es kann sich auch um verschiedene Kombinationen
dieser Konfigurationen handeln. Beim Protein kann es sich um ein
extrazelluläres
signalgebendes Protein handeln und in bevorzugten Ausführungsformen
handelt es sich beim Protein um ein Hedgehog-Protein, das aus einer
Wirbeltierquelle erhältlich
ist, vorzugsweise aus einer humanen Quelle, und Sonic-, Indian-
und Desert-Hedgehog umfasst.
-
Bei
einer weiteren Ausführungsform
handelt es sich um ein isoliertes Hedgehog-Protein der Form A-Cys-[Sp]-B-X,
wobei A einen hydrophoben Rest bedeutet;
Cys ein Cystein oder
ein funktionelles Äquivalent
davon bedeutet;
[Sp] eine fakultative Abstandshalter-Peptidsequenz
bedeutet;
B ein Hedgehog-Protein bedeutet, das eine Mehrzahl
von Aminosäuren
umfasst, einschließlich
mindestens einer fakultativen Abstandshalter-Peptidsequenz; und
X
einen fakultativen weiteren hydrophoben Rest, der mit dem Protein
verknüpft
ist, bedeutet.
-
Das
Hedgehog-Protein kann an mindestens einer weiteren Aminosäure mit
mindestens einem hydrophoben Rest modifiziert sein. In weiteren
Ausführungsformen
steht das Protein in Kontakt mit einer Vesikel, die aus der aus
einer Zellmembran, einer Mizelle und einem Liposom ausgewählten Gruppe
ausgewählt
ist.
-
Ein
weiterer Aspekt der Erfindung betrifft ein isoliertes Hedgehog-Protein
mit einer C-terminalen Aminosäure
und einer N-terminalen Thiaprolingruppe, wobei die Thiaprolingruppe
durch Umsetzung eines Aldehyds mit einem N-terminalen Cystein des
Proteins gebildet worden ist. Ein weiterer Aspekt der Erfindung
betrifft ein isoliertes Hedgehog-Protein mit einer C-terminalen
Aminosäure
und einer N-terminalen Amidgruppe, wobei die Amidgruppe durch Umsetzung
eines Fettsäurethioesters
mit einem N-terminalen Cystein des Proteins gebildet worden ist.
Ein weiterer Aspekt der Erfindung betrifft ein isoliertes Hedgehog-Protein
mit einer C-terminalen Aminosäure
und einer N-terminalen Maleinimidgruppe, wobei die N-terminale Maleinimidgruppe durch
Umsetzung einer Maleinimidgruppe mit dem N-terminalen Cystein des
Proteins gebildet worden ist. Ein weiterer Aspekt der Erfindung
betrifft ein isoliertes Hedgehog-Protein mit einer C-terminalen Aminosäure und einer
N-terminalen Acetamidgruppe. Ein weiterer Aspekt der Erfindung betrifft ein
isoliertes Hedgehog-Protein mit einer C-terminalen Aminosäure und
einer N-terminalen Thiomorpholingruppe.
-
Bei
diesen Ausführungsformen
kann die C-terminale Aminosäure
des Proteins mit einem hydrophoben Rest modifiziert sein.
-
Die
erfindungsgemäßen Verfahren
umfassen ein Verfahren zur Erzeugung eines mehrwertigen Proteinkomplexes,
wobei das Verfahren die Stufe der Verknüpfung – in Gegenwart einer Vesikel – eines
hydrophoben Restes mit einem N-terminalen
Cystein eines Proteins oder einem funktionellen Äquivalent des N-terminalen
Cysteins umfasst. Die Verknüpfungsstufe
kann die Verknüpfung
eines Lipidrestes umfassen, der aus gesättigten und ungesättigten
Fettsäuren
mit 2 bis 24 Kohlenstoffatomen ausgewählt ist. Beim Protein kann
es sich um ein Hedgehog-Protein handeln, das aus der aus Sonic-,
Indian- und Desert-Hedgehog bestehenden Gruppe ausgewählt ist.
-
Bei
einem weiteren erfindungsgemäßen Verfahren
handelt es sich um ein Verfahren zum Modifizieren einer physikochemischen
Eigenschaft eines Hedgehog-Proteins, wobei das Verfahren die Einführung mindestens
eines hydrophoben Restes in ein N-terminales Cystein des Proteins
oder in ein funktionelles Äquivalent des
N-terminalen Cysteins umfasst. Beim hydrophoben Rest kann es sich
um einen Lipidrest handeln, der aus gesättigten und ungesättigten
Fettsäuren
mit 2 bis 24 Kohlenstoffatomen ausgewählt ist. Es kann sich auch um
ein hydrophobes Protein handeln. Bei dem unter Anwendung dieses
Verfahrens modifizierten Protein kann es sich um ein Hedgehog-Protein
handeln, das aus der aus Sonic-, Indian- und Desert-Hedgehog bestehenden
Gruppe ausgewählt
ist. Ein Proteinkomplex, der durch diese Verfahren erzeugt worden
ist, fällt
ebenfalls unter die vorliegende Erfindung.
-
Bei
einem weiteren Verfahren handelt es sich um ein Verfahren zum Modifizieren
eines Hedgehog-Proteins (z. B. eines extrazellulären signalgebenden Proteins),
das ein N-terminales
Cystein aufweist. Dieses Verfahren umfasst die Umsetzung des N-terminalen
Cysteins mit einem Fettsäurethioester
unter Bildung eines Amids, wobei die Modifikation die biologische
Aktivität
des Proteins verstärkt.
-
Bei
einem weiteren Verfahren handelt es sich um ein Verfahren zum Modifizieren
eines Hedgehog-Proteins mit einem N-terminalen Cystein, wobei das
Verfahren die Umsetzung des N-terminalen Cysteins mit einer Maleinimidgruppe
umfasst, wobei eine derartige Modifikation die biologische Aktivität des Proteins verstärkt. Weitere
Ausführungsformen
dieses Verfahrens beinhalten die Umsetzung des N-terminalen Cysteins
mit einer Aldehydgruppe, einer Acetamidgruppe oder einer Thiomorpholingruppe.
-
Ein
weiteres Verfahren besteht in einem Verfahren zum Modifizieren eines
Hedgehog-Proteins, das das Anheften eines hydrophoben Peptids an
das Protein umfasst. Der hydrophobe Rest kann an eine Aminosäure des
Proteins angeheftet werden, die aus der Gruppe ausgewählt ist,
die aus der N-terminalen Aminosäure,
der C-terminalen Aminosäure,
einer zwischen der N-terminalen Aminosäure und der C-terminalen Aminosäure liegenden
Aminosäure
und Kombinationen davon ausgewählt
ist. In einer Ausführungsform
stellt die vorliegende Erfindung Hedgehog-Polypeptide bereit, die mit lipophilen
Resten modifiziert ist. In bestimmten Ausführungsformen sind die erfindungsgemäßen Hedgehog-Proteine
durch einen oder mehrere lipophile Reste an einer oder mehreren
internen Stellen der reifen, prozessierten, extrazellulären Domäne modifiziert
und können
gegebenenfalls auch mit lipophilen Resten an den N- oder C-terminalen
Resten des reifen Polypeptids derivatisiert sein. Bei weiteren Ausführungsformen
ist das Polypeptid am C-terminalen Rest mit einem hydrophoben Rest,
der von einem Sterol abweicht, modifiziert. Bei weiteren Ausführungsformen
ist das Polypeptid am N-terminalen Rest mit einer cyclischen (vorzugsweise
polycyclischen) lipophilen Gruppe modifiziert. Ferner kommen verschiedene
Kombinationen der vorstehenden Ausführungsformen in Betracht. Bei
einer erfindungsgemäßen Verwendung
handelt es sich um eine Verwendung eines erfindungsgemäßen, hydrophob
modifizierten Hedgehog-Proteins zur Herstellung eines Arzneimittels
zur Behandlung einer neurologischen Störung.
-
Kurze Beschreibung der
Figuren
-
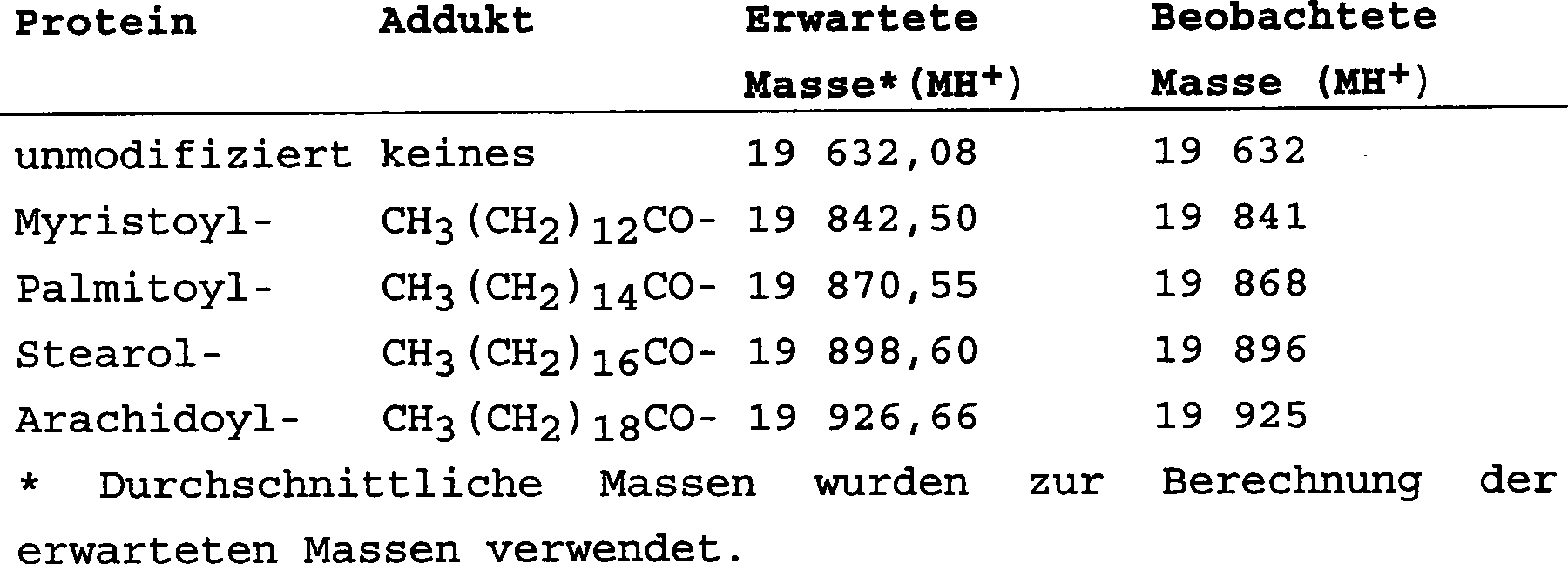
1.
Charakterisierung einer palmitoylierten Form von Shh. Eine gebundene
Form von humanem Shh wurde aus High FiveR-Insektenzellen
einer Immunoaffinitätsreinigung
unterzogen und durch SDS-Page analysiert. Das Protein wurde mit
Coomassie-Blau gefärbt
(Bahn a, Life Technologies, Inc., vorgefärbt mit hochmolekularen Markern;
Bahn b, lösliches
Shh (0,6 μg);
Bahn c, gebundenes Shh (0,6 μg);
Bahn d, Gemisch von löslichem
plus gebundenem Shh (jeweils 0,6 μg)).
Die Fähigkeit
von Shh und Ihh (vergl. Bahn h) zur Modifikation mit Palmitinsäure wurde
unter Verwendung eines in Beispiel 2 beschriebenen zellfreien Systems
getestet. Lösliche
Formen von Hedgehog-Protein (3 μg/Probe)
wurden 1 Stunde mit Rattenleber-Mikrosomen, ATP, Coenzym A und 3H-Palmitinsäure inkubiert
und sodann durch SDS-PAGE auf die Palmitoylierung analysiert. Die
in den Bahnen e–i
dargestellten Proben wurden durch Fluorographie sichtbar gemacht
(Bahn e, Shh; Bahn f, des-1-10-Shh; Bahn g, Cys-1 bis Ser-Shh; Bahn
h, Ihh; Bahn i, mit His markiertes Shh) und in den Bahnen j–k, Coomassie-Färbung (Bahn
j, Shh; Bahn k, des-1-10-Shh).
-
2.
Analyse von gereinigtem Shh durch ESI-MS. Lösliches, humanes Shh (A) und
gebundenes, humanes Shh (B) wurden durch ESI-MS an einem Micromass
Quattro II-Dreifachquadrupol-Massenspektrometer,
der mit einer Elektrospray-Ionenquelle ausgerüstet war, analysiert. Sämtliche
Elektrospray-Massenspektrumdaten wurden gewonnen, im Profilmodus
gespeichert und unter Verwendung des Micromass MassLynx-Datensystems
verarbeitet. Molekül-Massenspektren sind
dargestellt (die Massenzuordnungen wurden vom Datensystem erzeugt).
-
3.
Analyse von gebundenem Shh durch Umkehrphasen-HPLC. Lösliches, humanes Shh (A), gebundenes,
humanes Shh aus High FiveR-Insektenzellen
(B), gebundenes, humanes Shh aus EBNA-293-Zellen (C) und zellassoziiertes
Ratten-Shh (D) wurden der Umkehrphasen-HPLC an einer Vydac C4-Säule
mit enger Bohrung (2,1 mm Innendurchmesser × 250 mm) unterworfen. Die
Säule wurde
mit einem 30 Minuten-0-80 %-Acetonitril-Gradienten
in 0,1 % Trifluoressigsäure
mit 0,25 ml/min entwickelt. Das ausströmende Produkt wurde unter Verwendung
eines Photodioden-Felddetektors von 200–300 nm überwacht (Daten bei 214 nm dargestellt).
Peakfraktioen wurden gesammelt und ferner durch SDS-PAGE und MS
charakterisiert (Daten in den Tabellen 3, 4 und 5 zusammengestellt).
-
4.
Charakterisierung von Shh durch LC-MS. Gebundenes, humanes Shh (A)
und lösliches,
humanes Shh (B) wurden mit 4-Vinylpyridin alkyliert (1 μl/100 μl Probe in
6 M Guanidin-HCl, 1 mM EDTA, 100 mM Tris-HCl, pH-Wert 8,0), mit
Ethanol gefällt
und mit Endoproteinase-Lys-C in 50 mM Tris-HCl, pH-Wert 7,0, 2 M Harnstoff
bei einem Enzym:Protein-Verhältnis
1:5 gemäß Literaturangaben
(27) verdaut. Die Verdauungsprodukte wurden "in line" durch Umkehrphasen-HPLC mit einem Elektrospray-Micromass
Quattro II-Dreifachquadrupol-Massenspektrometer analysiert. Eine
Abtastung wurde während
des gesamten Ansatzes durchgeführt. Eine
Bearbeitung wurde unter Verwendung des Micromass MassLynx-Datensystems
vorgenommen (die gesamten Ionenchromatogramme aus den Ansätzen sind
dargestellt). Sterne geben die Positionen des N-terminalen Peptids
an, die entweder durch MALDI-PSD oder durch N-terminale Edman-Sequenzierung bestätigt wurden.
-
5.
Sequenzierung des N-terminalen Shh-Peptids durch MALDI-PSD-Messung.
Das N-terminale Endoproteinase-Lys-C-Peptid
von gebundenem, humanem Shh wurde der MALDI-PSD-Messung an einem Voyager-DER-STR-Flugzeit-Massenspektrometer unterworfen. Das
vorhergesagte Fragmentierungsmuster und die Nomenklatur für die erfassten
Fragmentionen sind oben am Feld angegeben (PA, Palmitoylsäure; 4vp, 4-Pyridylethylgruppe).
Der Rest der Figur zeigt das im Ansatz erzeugte molekulare Massenspektrum.
Relevante Ionen sind unter Anwendung der im Schema definierten Nomenklatur
bezeichnet. Die berechneten Massen (Da) für b1-b8 betragen 447,3, 504,3, 601,4, 658,4, 814,5,
871,5, 1018,6 bzw. 1075,6. Für
y1-y8 betragen die Massen
(Da) 147,1, 204,1, 351,2, 408,2, 564,3, 621,3, 718,4 bzw. 775,4.
Die berechnete Masse für
z8 beträgt 758,4
Da. Die beobachtete Masse für
b8 enthält
zusätzlich
18 Da aufgrund von addiertem Wasser.
-
6.
Verstärkte
Aktivität
von gebundenem Shh beim C3H10T1/2-Test. Die relativen Wirkungsstärken von
löslichem
und gebundenem, humanem Shh allein (A) oder in Gegenwart des neutralisierenden
anti-Hedgehog-Mab 5E1 (B) wurden an C3H10T1/2-Zellen zur Messung
der Induktion von alkalischer Phosphatase bestimmt. Die aufgeführten Zahlen
geben die Mittelwerte von Zweifachbestimmungen an. (A) Zweifach-Reihenverdünnungen
von löslichem
(6) und gebundenem (8) Shh wurden mit den Zellen 5 Tage inkubiert. Die
sich ergebenden Werte für
die Aktivität
von alkalischer Phosphatase wurden bei 405 nm unter Verwendung des
chromogenen Substrats für
alkalische Phosphatase, nämlich
p-Nitrophenylphosphat, gemessen. (B) Reihenverdünnungen von Mab5E1 wurden mit
löslichem
Shh (5 μg/ml:
schwarze Balken) oder gebundenem Shh (0,25 μg/ml: graue Balken) oder mit
Trägerkontrolle
ohne Zusatz von Shh (weißer
Balken) 30 Minuten inkubiert und sodann dem C3H10T1/2-Test unterworfen.
-
7.
Analyse von Shh in einem Rezeptor-Bindungstest. Die relative Wirkungsstärke von
löslichem (6)
und gebundenem (8) Shh zur "patched"-Bindung wurde an "patched"-transfizierten EBNA-293-Zellen
durch FACS-Analyse bestimmt. Reihenverdünnungen der Testproben wurden
mit den EBNA-293-Zellen inkubiert, gewaschen und anschließend einer
Messung der prozentualen Bindung aufgrund der Fähigkeit der Proben zur Konkurrenz
mit Shh-Ig in Bezug auf die Bindung an die Zellen unterworfen. Gebundenes
Shh-Ig wurde quantitativ durch die mittlere Fluoreszenz unter Verwendung
einer FITC-markierten anti-Ig-Antikörpersonde als Ablesung bestimmt.
Die Daten wurden durch nicht-lineare Regression an eine hyperbolische
Kurve angepasst.
-
8.
Ausrichtung des N-terminalen Fragments von humanen Hedgehog-Proteinen.
Die humanen 20 kDa-Hedgehog-Proteine
(Sonic "Shh", Desert "Dhh" und Indian "Ihh") werden bezüglich ihres
N-terminalen Cysteins ausgerichtet (Cys-1 in der reifen Sequenz).
Bei diesem Cystein handelt es sich normalerweise um Cys-24 im Shh-Vorläuferprotein
von voller Länge,
und zwar aufgrund der Anwesenheit der natürlichen Signalsequenz, die
während
der Sekretion entfernt wird. Die tatsächliche Position des Cysteins
kann aufgrund von Speziesunterschieden geringfügig variieren.
-
9.
Konsensus-Sequenz des N-terminalen Fragments von humanen Hedgehog-Proteinen.
-
10. Einfluss der Lipid-Kettenlänge auf die Aktivität von humanem
Sonic-Hedgehog. Eine Reihe von Fettsäure-modifizierten Hedgehog-Proteinen
wurde erfindungsgemäß synthetisiert.
Der Einfluss der Fettsäure-Kettenlänge auf
die Hedgehog-Aktivität
wurde unter Verwendung des hier beschriebenen C3H10T1/2-alkalische
Phosphatase-Induktionstests getestet. Die Ergebnisse sind als Balkendiagramm
dargestellt.
-
11. C3H10T1/2-Test von palmitoyliertem, myristyliertem,
lauroyliertem, decanoyliertem und octanoyliertem, humanem Sonic-Hedgehog.
Palmitoyliertes, lauroyliertes, decanoyliertes und octanoyliertes,
humanes Sonic-Hedgehog, das in 5 mM Na
2HPO
4, pH-Wert 5,5, 150 mM NaCl, 1 % Octylglucosid,
0,5 mM DTT zubereitet war, und myristoyliertes, humanes Sonic-Hedgehog,
das in 150 mM NaCl, 0,5 mM DTT zubereitet war, wurden an C3H10T1/2-Zellen
zur Messung der Induktion von alkalischer Phosphatase getestet.
Die Zahlenwerte geben den Mittelwert von Zweifachbestimmungen an.
Dreifach-Reihenverdünnungen
von palmitoyliertem (o), myristoyliertem (⦁), lauroyliertem
(☐), decanoyliertem (∎), octanoyliertem (Δ) und unmodifiziertem
und
x), humanem Sonic-Hedgehog wurden mit den Zellen 5 Tage inkubiert.
Die erhaltenen Werte für
die alkalische Phosphatase wurden bei 405 nm unter Verwendung des
chromogenen Substrats p-Nitrophenylphosphat gemessen. Die palmitoylierten,
myristoylierten, lauroylierten und decanoylierten Proteine wurden
in einem Experiment mit dem unmodifizierten Protein, das als
dargestellt
ist, getestet, während
das octanoylierte Protein in einem weiteren Experiment mit dem als
(x) dargestellten unmodifizierten Protein getestet wurde. Der Pfeil
auf der y-Achse bezeichnet den Hintergrundwert für alkalische Phosphatase in
Abwesenheit von zugesetztem Hedgehog-Protein.
-
12. Allgemeine Strukturen verschiedener, hydrophob
modifizierter Formen von Hedgehog. (A) Fettsäureamidderivat, wobei R eine
Kohlenwasserstoffkette einer Fettsäure bedeutet; (B) Thiazolidinderivat, wobei
R einen Kohlenwasserstoff bedeutet; (C) Aminosäuresubstitution, wobei R eine
hydrophobe Aminosäure-Seitenkette bedeutet;
(D) Maleinimidderivat, wobei R einen Kohlenwasserstoff bedeutet;
(E) SH = freies Thiol am N-terminalen
Cystein von Wildtyp-Hedgehog; (F) ein Iodacetamidderivat, wobei
R1 einen Kohlenwasserstoff bedeutet und
R2 entweder H oder einen Kohlenwasserstoff
bedeutet; und (G) Thiomorpholinylderivat, wobei R einen Kohlenwasserstoff
bedeutet. Für
sämtliche
Strukturen gilt: HH = Hedgehog.
-
13. Relative Wirkungsstärke verschiedener hydrophob
modifizierter Formen von Hedgehog beim C3H10T1/2-Test. Der EC50-Wert
(2 μg/ml)
von unmodifiziertem humanem Wildtyp-Sonic-Hedgehog wird als 1 x
bezeichnet. Die Wirkungsstärke
der übrigen
Proteine wird als das Verhältnis
des EC50-Werts von Wildtypprotein dividiert
durch den EC50-Wert des modifizierten Proteins angegeben.
Die Modifikationen liegen am N-Terminus des Proteins vor, sofern
nichts anderes angegeben ist.
-
14. Relative Wirkungsstärke der unmodifizierten, myristoylierten
und C1II-Mutante von humanem Sonic-Hedgehog in einem durch Malonat
induzierten Ratten-Striatum-Läsionstest.
Die Figur zeigt die Verringerung des durch Malonat induzierten Läsionsvolumens,
die sich aus der Verabreichung der unmodifizierten, der myristoylierten
oder der C1II-Mutante von humanem Sonic-Hedgehog in das Ratten-Striatum ergibt.
-
15. zeigt die spezifischen Aktivitäten von
mit Maleinimid modifizierten und unmodifizierten Hedgehog-Polypeptiden.
-
Ausführliche Beschreibung der Erfindung
-
Die
Erfindung beruht teilweise auf dem Befund, dass humanes Sonic-Hedgehog,
das als Konstrukt von voller Länge
entweder in Insekten oder in Säugetierzellen
exprimiert wird, eine hydrophobe Palmitoylgruppe aufweist, die an
das α-Amin
des N-terminalen Cysteins angeheftet ist. Dies ist nach Kenntnis
der Erfinder das erste Beispiel für ein extrazelluläres signalgebendes
Protein, das auf derartige Weise modifiziert ist. Im Gegensatz zu
thiolverknüpften
Palmitinsäure-Modifikationen,
deren Bindung leicht reversibel ist, ist es wahrscheinlich, dass
dieser neue, N-verknüpfte Palmitoylrest
in Analogie zur Myristinsäure-Modifikation sehr
stabil ist.
-
Als
direkte Folge dieser anfänglichen
Entdeckung haben die Erfinder festgestellt, dass mit zunehmender
hydrophober Natur eines Hedgehog-Proteins die biologische Aktivität des Proteins
zunehmen kann. Insbesondere haben die Erfinder festgestellt, dass
durch Anheften eines hydrophoben Restes an ein Hegedhog-Protein
die Aktivität
des Proteins verstärkt
werden kann. Die Erfinder haben festgestellt, dass das N-terminale
Cystein von biologisch aktiven Hedgehog-Proteinen nicht nur eine
zweckmäßige Stelle
zum Anheften eines hydrophoben Restes und dadurch zum Modifizieren
der physikochemischen Eigenschaften des Proteins bietet, sondern
dass Modifikationen des N-terminalen
Cysteins auch die Stabilität
des Proteins erhöhen
können.
Ferner verstärkt
die Addition eines hydrophoben Restes an einen internen Aminosäurerest
an der Oberfläche
der Proteinstruktur die Aktivität
des Proteins.
-
Ein
Aspekt der vorliegenden Erfindung befasst sich mit der Entdeckung,
dass zusätzlich
zu den Wirkungen, die bei einer Cholesterol-Addition an den C-Terminus
von extrazellulären
Fragmenten des Proteins zu erkennen sind, mindestens bestimmte der
biologischen Aktivitäten
der Hedgehog-Genprodukte in unerwarteter Weise durch Derivatisierung
des Proteins mit lipophilen Resten an anderen Stellen des Proteins
und/oder durch Reste, die von Cholesterol abweichen, verstärkt werden.
Bestimmte Aspekte der Erfindung befassen sich mit Präparaten
von Hedgehog-Polypeptiden,
die an Stellen modifiziert sind, die von den N-terminalen oder C-terminalen
Resten der natürlichen,
prozessierten Form des Proteins abweichen und/oder die an derartigen terminalen
Resten mit lipophilen Resten, bei denen es sich nicht um ein Sterol
am C-Terminus oder um eine Fettsäure
am N-Terminus handelt, modifiziert sind.
-
Wie
in den PCT-Veröffentlichungen
WO-95/18856 und WO-96/17924
beschrieben wird, eignen sich Hedgehog-Polypeptide im allgemeinen
für die
in vitro- und in vivo-Reparatur und/oder Regulation des funktionellen
Verhaltens einer Vielzahl von Zellen, Geweben und Organen und weisen
therapeutische Anwendungsmöglichkeiten
auf, die in den Bereichen der Neuroprotektion, Neuroregeneration,
Verstärkung
der neuralen Funktion, Regulierung von Knochen- und Knorpelbildung und -reparatur,
Regulation der Spermatogenese, Regulation von Lunge, Leber und anderen
Organen, die aus dem Primaten-Darm entstehen, Regulation der hämatopoetischen
Funktion und dergl. liegen. Demzufolge umfassen die Verfahren und
Zusammensetzungen der vorliegenden Erfindung die Verwendung der
derivatisierten Hedgehog-Polypeptide für alle derartigen Anwendungsmöglichkeiten
sofern Hedgehog-Proteine beteiligt sind. Außerdem können die vorliegenden Verfahren
an Zellen durchgeführt
werden, die in Kultur (in vitro) bereitgestellt werden, oder an
Zellen in einem vollständigen
Tier (in vivo).
-
Gemäß einem
Aspekt werden erfindungsgemäß pharmazeutische
Präparate
bereitgestellt, die als Wirkstoff ein Hedgehog-Polypeptid umfassen,
das durch einen oder mehrere lipophile Reste, wie sie hier beschrieben
werden, derivatisiert ist.
-
Die
vorliegenden Hedgehog-Behandlungen eignen sich sowohl bei humanen
als auch bei tierischen Subjekten. Tierische Subjekte, auf die die
Erfindung anwendbar ist, umfassen sowohl Haustiere als auch Viehbestände, die
entweder als Hausgenossen oder für
gewerbliche Zwecke gehalten werden. Zu Beispielen gehören Hunde,
Katzen, Rinder, Pferde, Schafe, Schweine und Ziegen.
-
Bei
den Hedgehog-Proteinen handelt es sich um eine Familie von extrazellulären signalgebenden
Proteinen, die verschiedene Aspekte der embryonalen Entwicklung
sowohl bei Wirbeltieren als auch bei wirbellosen Tieren regulieren
(bezüglich
einer Übersicht
wird auf 1, 2 verwiesen). Bei dem am besten charakterisierten Hedgehog-Protein
handelt es sich um Sonic-Hegedhog (Shh). Es ist beteiligt an der
Anterior-Posterior-Musterbildung, der Bildung einer apikalen, ektodermalen
Kante, des Hinterdarm-Mesoderms, der Wirbelsäule, der distalen Gliedmaßen, der
Rippenentwicklung und der Lungenentwicklung und an der Induktion
von ventralen Zelltypen im Rückenmark,
Hinterhirn und Vorderhirn (3–8).
Während
der Mechanismus der Wirkung von Hedgehog-Proteinen nicht vollständig aufgeklärt ist,
lassen die neuesten biochemischen und genetischen Daten darauf schließen, dass
der Rezeptor für
Shh das Produkt des Tumor-Suppressorgens, "patched" (9, 10), ist und
dass andere Proteine, "smoothened" (10, 11), Cubitus
interruptus (12, 13) und "fused" (14) am Hedgehog-Signalgebungsweg
beteiligt sind.
-
Humanes
Shh wird als ein 45 kDa-Vorläuferprotein
synthetisiert, das autokatalytisch unter Bildung folgender Bestandteile
gespalten wird: (2) ein N-terminales 20 kDa-Fragment, das für sämtliche bekannten Hedgehog-Signalgebungsaktivitäten verantwortlich
ist (SEQ ID NOS. 1–4);
und (II) ein C-terminales 25 kDa-Fragment, das die Autoprozessierungsaktivität enthält (15–17). Das
N-terminale Fragment
besteht aus den Aminosäureresten
24–197
der Vorläufersequenz
von voller Länge.
-
Das
N-terminale Fragment bleibt durch die Addition eines Cholesterols
an seinem C-Terminus membranassoziiert (18, 19). Dieses Cholesterol
ist kritisch für
die Beschränkung
der Gewebelokalisierung des Hedgehog-Signals. Die Addition des Cholesterols
wird während
der Prozessierungsstufe durch die C-terminale Domäne katalysiert.
-
I. Definitionen
-
Nachstehend
wird die Erfindung unter Bezugnahme auf die folgende ausführliche
Beschreibung erläutert,
wobei die folgenden Definitionen gelten:
"Aminosäure": eine monomere Einheit eines Peptids,
Polypeptids oder Proteins. Es gibt 20 Aminosäuren, die in natürlich vorkommenden
Peptiden, Polypeptiden und Proteinen auftreten und bei denen es
sich durchweg um L-Isomere handelt. Der Ausdruck umfasst auch Analoge
der Aminosäuren
und D-Isomere der Protein-Aminosäuren
und ihrer Analogen.
"Protein": beliebige Polymere,
die im wesentlichen aus beliebigen der 20 Aminosäuren bestehen. Obgleich der Ausdruck "Polypeptid" häufig in
Bezug auf relativ große
Polypeptide verwendet wird und der Ausdruck "Peptid" häufig
in Bezug auf kleine Polypeptide verwendet wird, ist die Verwendung
dieser Ausdrücke
im Stand der Technik überlappend
und variabel. Sofern nichts anderes angegeben ist, bezieht sich
der hier verwendete Ausdruck "Protein" auf Peptide, Proteine
und Polypeptide.
"N-terminales
Ende": dieser Ausdruck
bezieht sich auf die erste Aminosäure (Aminosäure Nr. 1) der reifen Form
eines Proteins.
"N-terminales
Cystein": dieser
Ausdruck bezieht sich auf den Aminosäurerest (Nr. 1) gemäß der Darstellung
in SEQ ID NOS. 1–4.
Er bezieht sich ferner auf ein beliebiges Cystein in Position 1
eines beliebigen anderen Proteins oder auf funktionelle Äquivalente
dieses Cysteins (vergl. Abschnitt IV).
-
Der
Ausdruck "Abstandshalter"-Sequenz bezieht
sich auf eine kurze Sequenz, die so klein wie eine einzelne Aminosäure sein
kann, die zwischen einer hydrophob zu modifizierenden Aminosäure (z.
B. das N-terminale Cystein oder ein funktionelles Äquivalent
davon) und den Rest des Proteins eingeführt werden kann. Ein Abstandshalter
dient dazu, eine Trennung zwischen der hydrophoben Modifikation
(z. B. dem modifizierten, N-terminalen Cystein) und dem Rest des
Proteins zu gewährleisten,
um zu verhindern, dass die Modifikation die Proteinfunktion beeinträchtigt,
und/oder um es der Modifikation (z. B. dem N-terminalen Cystein zu
erleichtern, eine Bindung mit einem Lipid, einer Vesikel oder einem
anderen hydrophoben Rest einzugehen. Wenn somit ein Protein an seinem
N-terminalen Cystein und an einer Aminosäure an einer anderen Stelle
modifiziert ist, so können
zwei oder mehr Spacer-Sequenzen vorliegen.
-
Der
Ausdruck "gebundenes" ("tethered") Protein bezieht
sich auf ein erfindungsgemäßes, hydrophob modifiziertes
Protein.
-
Der
Ausdruck "mehrwertiger
Proteinkomplex" bezieht
sich auf eine Mehrzahl von Proteinen (d. h. eines oder mehrere).
Ein Lipid oder ein anderer hydrophober Rest ist an mindestens eines
der Mehrzahl von Proteinen gebunden. Das Lipid oder der andere hydrophobe
Rest kann gegebenenfalls in Kontakt mit einer Vesikel stehen. Wenn
einem Protein ein Lipid oder ein anderer hydrophober Rest fehlt,
so kann das Protein mit einem Protein, das ein Lipid oder einen
anderen hydrophoben Rest aufweist, vernetzt oder an dieses gebunden
sein. Die einzelnen Proteine können
gleich oder verschieden sein und die einzelnen Lipide oder anderen
hydrophoben Reste können
gleich oder verschieden sein.
-
Der
Ausdruck "Vesikel" bezieht sich auf
ein beliebiges Aggregat von lipophilen Molekülen. Die Vesikel kann aus einer
biologischen Quelle (z. B. einer Lipid-Doppelschicht, wie eine Zellmembran
oder ein von Cholinsäure
abgeleitetes Detergenspräparat)
oder von einer nicht-biologischen Quelle (z. B. eine nicht-biologische Detergens-Vesikel
gemäß der Beschreibung
im Abschnitt VI) erhalten werden. Die Gestalt, der Typ und die Konfiguration
der Vesikel beschränken
den Schutzumfang der Erfindung nicht.
-
Der
Ausdruck "funktionelles Äquivalent" eines Aminosäurerestes
(z. B. eines N-terminalen Cysteins) bedeutet folgendes: (i) eine
Aminosäure
mit ähnlichen
reaktiven Eigenschaften, wie sie der Aminosäurerest hat, der durch das
funktionelle Äquivalent
ersetzt worden ist; (ii) eine Aminosäure eines Liganden eines erfindungsgemäßen Polypeptids,
wobei die Aminosäure ähnliche
Bindungseigenschaften an einen hydrophoben Rest (z. B. ein Lipid)
wie der Aminosäurerest
aufweist, der durch das funktionelle Äquivalent ersetzt worden ist;
(iii) ein Nichtaminosäure-Molekül mit ähnlichen
Bindungseigenschaften an einen hydrophoben Rest (z. B. ein Lipid)
wie der Aminosäurerest,
der durch das funktionelle Äquivalent
ersetzt worden ist.
-
Der
Ausdruck "genetische
Fusion" bezieht
sich auf eine kolineare, kovalente Verknüpfung von zwei oder mehr Proteinen
oder Fragmenten davon über
ihre individuellen Peptidgerüste
durch eine genetische Expression eines Polynucleotidmoleküls, das
für diese
Proteine kodiert.
-
Bei
den Ausdrücken "chimäres Protein" oder "Fusionsprotein" handelt es sich
um eine Fusion einer ersten Aminosäuresequenz, die für ein Hedgehog-Polypeptid
kodiert, mit einer zweiten Aminosäuresequenz, die eine Domäne definiert,
die in bezug zu einer beliebigen Domäne des hh-Proteins fremd und
nicht im wesentlichen homolog dazu ist. Ein chimäres Protein kann eine fremde
Domäne
aufweisen, die (obgleich in einem unterschiedlichen Protein) in
einem Organismus gefunden wird, der ebenfalls das erste Protein
exprimiert, oder es kann sich um eine "Interspezies-", "intergenetische" und eine ähnliche
Fusion von Proteinstrukturen handeln, die durch unterschiedliche
Arten von Organismen exprimiert werden. Im allgemeinen lässt sich
ein Fusionsprotein durch die allgemeine Formel (X)n-(hh)m-(Y)n wiedergeben,
wobei hh die Gesamtheit oder einen Teil des Hedgehog-Proteins repräsentiert,
X und Y jeweils unabhängig
voneinander Aminosäuresequenzen
repräsentieren,
die nicht natürlicherweise
als Polypeptidkette, die an die Hedgehog-Sequenz angrenzt, auftreten,
m eine ganze Zahl mit einem Wert von 1 oder mehr ist und n bei jedem
Auftreten unabhängig
voneinander 0 oder eine ganze Zahl mit einem Wert von 1 oder mehr
bedeutet (n und m haben vorzugsweise einen Wert von nicht mehr als
5 oder 10).
-
Der
Ausdruck "Mutante" bedeutet eine beliebige
Veränderung
im genetischen Material eines Organismus, insbesondere eine beliebige
Veränderung
(z. B. Deletion, Substitution, Addition oder Alteration) in einer Wildtyp-Polynucleotidsequenz
oder eine beliebige Veränderung
in einem Wildtyp-Protein.
-
Der
Ausdruck "Wildtyp" bedeutet die natürlich auftretende
Polynucleotidsequenz eines Exons eines Proteins oder eines Teils
davon bzw. eine Proteinsequenz oder einen Teil davon, die normalerweise
in vivo existieren.
-
Der
Ausdruck "Standardhybridisierungsbedingungen" bedeutet Salz- und
Temperaturbedingungen, die im wesentlichen 0,5 × SSC bis etwa 5 × SSC und
65 °C sowohl
für die
Hybridisierung als auch für
den Waschvorgang entsprechen. Der hier verwendete Ausdruck "Standardhybridisierungsbedingungen" stellt eine Arbeitsdefinition
dar und umfasst einen Bereich von Hybridisierungsbedingungen; vergl.
auch Current Protocols in Molecular Biology, John Wiley & Sons, Inc., New
York, Abschnitte 6.3.1–6.3.6
(1989).
-
Der
Ausdruck "Expressionskontrollsequenz" bedeutet eine Sequenz
von Polynucleotiden, die die Expression von Genen steuert und reguliert,
wenn sie mit diesen Genen funktionell verknüpft ist.
-
Der
Ausdruck "funktionell
verknüpft" bedeutet eine Polynucleotidsequenz
(DNA, RNA), die funktionell mit einer Expressionskontrollsequenz
verknüpft
ist, wenn die Expressionskontrollsequenz die Transkription und Translation
dieser Polynucleotidsequenz steuert und reguliert. Der Ausdruck "operativ verknüpft" beinhaltet, dass
ein geeignetes Startsignal (z. B. ATG) vor der zu exprimierenden
Polynucleotidsequenz vorliegt und der korrekte Leseraster aufrechterhalten
wird, um eine Expression der Polynucleotidsequenz unter der Steuerung
der Expressionskontrollsequenz sowie die Bildung des erwünschten
Polypeptids, das durch die Polynucleotidsequenz kodiert wird, aufrechtzuerhalten.
-
Der
Ausdruck "Expressionsvektor" bedeutet ein Polynucleotid,
z. B. ein DNA-Plasmid oder einen Phagen (unter anderen üblichen
Beispielen), das eine Expression mindestens eines Gens ermöglicht,
wenn der Expressionsvektor in eine Wirtszelle eingeführt wird.
Der Vektor kann zur Replikation in einer Zelle befähigt sein
oder nicht.
-
Der
Ausdruck "isoliert" (der austauschbar
mit "im wesentlichen
rein" verwendet
wird) bedeutet bei Anwendung auf eine Nucleinsäure, d. h. Polynucleotidsequenzen,
die für
Polypeptide kodieren, ein RNA- oder DNA-Polynucleotid, einen Teil
eines genomischen Polynucleotids, cDNR oder ein synthetisches Polynucleotid, die
aufgrund ihrer Herkunft oder aufgrund von Manipulation folgende
Eigenschaften aufweisen: (i) keine Assoziation mit der Gesamtheit
eines Polynucleotids, mit dem es in der Natur assoziiert ist (z.
B. Vorliegen in einer Wirtszelle als ein Expressionsvektor oder
als ein Teil davon); oder (ii) Verknüpfung mit einer Nucleinsäure oder einem
anderen chemischen Rest, die von der Nucleinsäure oder dem Rest, mit dem
sie in der Natur verknüpft sind,
abweichen; oder (iii) kein Vorkommen in der Natur. Unter dem Ausdruck "isoliert" ist ferner eine
Polynucleotidsequenz zu verstehen, die folgende Eigenschaften aufweist:
(i) in vitro amplifiziert, beispielsweise durch die Polymerase-Kettenreaktion
(PCR); (ii) chemisch synthetisiert; (iii) rekombinant durch Klonierung
hergestellt; oder (iv) gereinigt, z. B. durch Spaltung und Geltrennung.
-
Der
Ausdruck "im wesentlichen
reine Nucleinsäure" bedeutet eine Nucleinsäure, die
nicht unmittelbar an eine oder beide der Kodierungssequenzen angrenzt,
an die sie normalerweise im natürlich
auftretenden Genom des Organismus, aus dem die Nucleinsäure abgeleitet
ist, angrenzt. Eine im wesentlichen reine DNA umfasst auch eine
rekombinante DNA, die Bestandteil eines Hybridgens ist, das für zusätzliche
Hedgehog-Sequenzen kodiert.
-
Der
Ausdruck "isoliert" (mit "im wesentlichen rein" in austauschbarer
Weise verwendet) bedeutet bei Anwendung auf Polypeptide ein Polypeptid
oder einen Teil davon, die aufgrund ihrer Herkunft oder einer Manipulation
folgende Eigenschaften aufweisen: (i) Anwesenheit in einer Wirtszelle
als Expressionsprodukt eines Teils eines Expressionsvektors; oder
(ii) Verknüpfung
mit einem Protein oder einem anderen chemischen Rest, die sich von
dem Protein oder dem chemischen Rest, an die sie in der Natur gebunden
sind, unterscheiden; oder (iii) fehlendes Auftreten in der Natur,
beispielsweise ein Protein, das chemisch manipuliert ist, in dem
mindestens ein hydrophober Rest an das Protein angeheftet oder addiert
ist, so dass das Protein sich in einer Form befindet, die in der
Natur nicht auftritt. Unter "isoliert" ist ferner ein Protein
zu verstehen, das folgende Eigenschaften aufweist: (i) chemisch
synthetisiert; oder (ii) in einer Wirtszelle exprimiert und von
assoziierten und kontaminierenden Proteinen gereinigt. Der Ausdruck
bedeutet im allgemeinen ein Polypeptid, das von anderen Proteinen
und Nucleinsäuren,
mit denen es natürlicherweise
vorkommt, getrennt worden ist. Vorzugsweise ist das Polypeptid auch
von Substanzen, wie Antikörpern
oder Gelmatrices (Polyacrylamid), die zu seiner Reinigung verwendet
werden, getrennt.
-
Der
hier verwendete Ausdruck "heterologer
Promotor" bedeutet
einen Promotor, der nicht von Natur aus mit einem Gen oder einer
gereinigten Nucleinsäure
assoziiert ist.
-
Der
hier verwendete Ausdruck "homolog" ist synonym mit
dem Ausdruck "Identität" und bezieht sich auf
die Sequenzähnlichkeit
zwischen zwei Polypeptiden, Molekülen oder Nucleinsäuren. Wenn
eine Position in jeder der zwei verglichenen Sequenzen durch die
gleiche Basen- oder Aminosäure-Monomeruntereinheit besetzt
ist (wenn beispielsweise eine Position in jeder der beiden DNA-Moleküle durch
Adenin besetzt ist oder eine Position in jedem der beiden Polypeptide
durch einen Lysinrest besetzt ist), so sind die jeweiligen Moleküle in dieser
Position homolog. Die prozentuale Homologie zwischen zwei Sequenzen
ist eine Funktion der Anzahl von übereinstimmenden oder homologen
Positionen, die den beiden Sequenzen gemeinsam sind, dividiert durch
die Anzahl der verglichenen Positionen × 100. Wenn beispielsweise
6 von 10 Positionen in zwei Sequenzen übereinstimmen oder homolog
sind, so weisen die beiden Sequenzen eine Homologie von 60 % auf.
Beispielsweise haben die DNA-Sequenzen CTGACT und CAGGTT eine Homologie
von 50 % (3 der insgesamt 6 Positionen stimmen überein). Im allgemeinen wird
ein Vergleich vorgenommen, wenn zwei Sequenzen so zueinander ausgerichtet
sind, dass sich eine maximale Homologie ergibt. Eine derartige Ausrichtung kann
beispielsweise unter Anwendung des Verfahrens von Needleman et al.,
J. Mol. Biol., Bd. 48 (1970), S. 443–453, erreicht werden, das
zweckmäßigerweise
durch Computerprogramme, wie das Align-Programm (DNAstar, Inc.)
ausgeführt
wird. Homologe Sequenzen haben identische oder ähnliche Aminosäurereste
gemeinsam, wobei es sich bei ähnlichen
Resten um konservative Substitutionen für entsprechende Aminosäurereste
in einer ausgerichteten Referenzsequenz oder um "zulässige
Punktmutationen" handelt.
Diesbezüglich handelt
es sich bei einer "konservativen
Substitution" eines
Restes in einer Referenzsequenz um solche Substitutionen, die physikalisch
oder funktionell ähnlich
mit den entsprechenden Referenzresten sind, die beispielsweise in
Bezug auf Größe, Gestalt,
elektrische Ladung, chemische Eigenschaften, einschließlich der
Fähigkeit
zur Bildung von kovalenten Bindungen oder Wasserstoffbrückenbindungen,
oder dergl. ähnlich
sind. Besonders bevorzugte konservative Substitutionen sind solche,
die die Kriterien für
eine "akzeptierte
Punktmutation" gemäß Dayhoff
et al., Atlas of Protein Sequence and Structure, Bd. 5, Suppl. 3,
Kapitel 22, (1978), S. 354–352,
Nat. Biomed. Res. Foundation, Washington, D.C., definiert sind.
-
Bei
den hier in austauschbarer Weise verwendeten Ausdrücken "Hedgehog-Protein" oder "Hedgehog-Polypeptid" handelt es sich
um mindestens einen Bereich, der aus der Konsensus-Aminosäuresequenz von
SEQ ID NO: 4 besteht. Der Ausdruck bedeutet auch ein Hedgehog-Polypeptid
oder eine funktionelle Variante eines Hedgehog-Polypeptids oder
ein Homologes eines Hedgehog-Polypeptids oder eine funktionelle Variante
davon mit biologischer Aktivität.
Insbesondere umfassen diese Ausdrücke "Präparate
von Hedgehog-Proteinen und Peptidylfragmente davon", und zwar sowohl
agonistische als auch antagonistische Formen, wie aus dem speziellen
Zusammenhang hervorgeht. Der hier verwendete Ausdruck "bioaktives Fragment eines
Hedgehog-Proteins" bezieht
sich auf ein Fragment des Hedgehog-Polypeptids von voller Länge, wobei das
Fragment spezifisch agonistisch oder antagonistisch gegen induktive
Ereignisse wirkt, die durch Wildtyp-Hedgehog-Proteine vermittelt
werden. Beim bioaktiven Hedgehog-Fragment handelt es sich vorzugsweise um
einen löslichen,
extrazellulären
Bereich eines Hedgehog-Proteins,
wobei die Löslichkeit
sich auf physiologisch verträgliche
Lösungen
bezieht. Beispielhafte bioaktive Fragmente sind in den PCT-Veröffentlichungen WO-95/18856
und WO-96/17924 beschrieben. In bevorzugten Ausführungsformen binden die erfindungsgemäßen Hedgehog-Polypeptide an das
Patched-Protein.
-
Der
Ausdruck "entspricht" bedeutet in Bezug
auf ein spezielles Polypeptid oder auf eine spezielle Nucleinsäuresequenz,
dass die Sequenz von Interesse mit der Referenzsequenz, der das
Produkt entspricht, identisch oder homolog dazu ist.
-
Die
Ausdrücke "Peptid(e)", "Protein(e)" und "Polypeptid(e)" werden hier in austauschbarer
Weise verwendet. Die Ausdrücke "Polynucleotidsequenz" und "Nucleotidsequenz" werden hier ebenfalls
in austauschbarer Weise verwendet. Die Ausdrücke "Hedgehog-Fragment" und "N-terminales
Hedgehog-Fragment" werden
in austauschbarer Weise mit dem Ausdruck "Hedgehog" verwendet.
-
Ein
Hedgehog-Molekül
weist eine "biologische
Aktivität" auf, wenn es mindestens
eine der folgenden Eigenschaften besitzt: (i) das Molekül erfüllt die
Hedgehog-Konsensus-Kriterien gemäß der Definition
in (SEQ ID NO: 4) und weist die Fähigkeit zur Bindung an seinen
Rezeptor "Patched" auf oder kodiert
bei der Expression für
ein Polypeptid, das diese Eigenschaft besitzt; (ii) das Molekül erfüllt die
Hedgehog-Konsensus-Kriterien gemäß der hier
gegebenen Definition oder kodiert bei Expression für ein Polypeptid,
das diese Eigenschaft aufweist; und (iii) es kann in C3H10T1/2-Zellen
eine alkalische Phosphatase-Aktivität induzieren.
Im allgemeinen besitzt jedes Protein "biologische Aktivität", wenn das Protein in vitro Wirkungen,
Eigenschaften oder Charakteristiken aufweist, von denen der Fachmann
erkennt, dass sie repräsentativ
oder angemessen für
eine vernünftige
Vorhersage der in vivo-Effekte
des Proteins sind.
-
Der
Ausdruck "hydrophob" bezieht sich auf
die Tendenz von chemischen Resten, die nicht-polare Atome aufweisen,
zu Wechselwirkungen miteinander anstelle einer Wechselwirkung mit
Wasser oder anderen polaren Atomen. Materialien die "hydrophob" sind, sind meistens
in Wasser unlöslich.
Natürliche
Produkte mit hydrophoben Eigenschaften umfassen Lipide, Fettsäuren, Phospholipide,
Sphingolipide, Acylglycerine, Wachse, Sterole, Steroide, Terpene,
Prostaglandine, Thromboxane, Leukotriene, Isoprenoide, Retenoide,
Biotin und hydrophobe Aminosäuren,
wie Tryptophan, Phenylalanin, Isoleucin, Leucin, Valin, Methionin,
Alanin, Prolin und Tyrosin. Ein chemischer Rest ist ferner hydrophob
oder weist hydrophobe Eigenschaften auf, wenn seine physikalischen
Eigenschaften durch die Anwesenheit von nicht-polaren Atomen festgelegt
werden. Der Ausdruck umfasst lipophile Gruppen.
-
Der
Ausdruck "lipophile
Gruppe" bedeutet
im Zusammenhang mit der Bindung an ein Polypeptid eine Gruppe mit
einem hohen Kohlenwasserstoffanteil, was der Gruppe eine hohe Affinität für Lipidphasen
verleiht. Bei einer lipophilen Gruppe kann es sich beispielsweise
um eine relativ langkettige Alkyl- oder Cycloalkylgruppe (vorzugsweise
n-Alkylgruppe) mit etwa 7 bis 30 Kohlenstoffatomen handeln. Die
Alkylgruppe kann in einem "Schwanz" mit einer Hydroxygruppe
oder einer primären Amingruppe
enden. Zur weiteren Erläuterung
umfassen lipophile Moleküle
natürlich
auftretende und synthetische aromatische und nicht-aromatische Reste,
wie Fettsäuren,
Ester und Alkohole, weitere Lipidmoleküle, Käfigstrukturen, wie Adamantan
und Buckminsterfullerene, sowie aromatische Kohlenwasserstoffe,
wie Benzol, Perylen, Phenanthren, Anthracen, Naphthalin, Pyren,
Chrysen und Naphthacen.
-
Der
Ausdruck "interne
Aminosäure" bedeutet beliebige
Aminosäuren
in einer Peptidsequenz, bei denen es sich weder um die N-terminale
Aminosäure
noch um die C-terminale Aminosäure
handelt.
-
Der
Ausdruck "Oberflächen-Aminosäure" bedeutet beliebige
Aminosäuren,
die bei Faltung des Proteins in seiner nativen Form einem Lösungsmittel
ausgesetzt sind.
-
Eine "wirksame Menge" eines Hedgehog-Polypeptids
bedeutet im Zusammenhang mit den vorliegenden Behandlungsverfahren
eine Menge eines Polypeptids in einem Präparat, das bei Anwendung als
Teil eines erwünschten
Dosierungsschemas beispielsweise eine Veränderung der Geschwindigkeit
der Zellproliferation und/oder des Differenzierungszustands einer
Zelle und/oder der Überlebensrate
einer Zelle gemäß klinisch
akzeptablen Standards für
die zu behandelnde Störung
oder den kosmetischen Zweck herbeiführt.
-
Bei
einem "Patienten" oder "Subjekt", die mit dem vorliegenden
Verfahren zu behandeln sind, handelt es sich entweder um einen Menschen
oder um ein Tier.
-
Der
Ausdruck "Wachstumszustand" einer Zelle bezieht
sich auf die Proliferationsrate der Zelle und den Differenzierungszustand
der Zelle.
-
Sofern
nichts anderes angegeben ist, bedient sich die erfindungsgemäße Praxis
herkömmlicher
Techniken der Zellbiologie, der Zellkultur, der Molekularbiologie,
der Mikrobiologie, der rekombinanten DNA-Chemie, der Proteinchemie
und der Immunologie, die alle dem Wissen des Fachmanns entsprechen.
Derartige Techniken sind in der Literatur beschrieben.
-
II. Allgemeine Eigenschaften
von isolierten Hedgehog-Proteinen
-
Der
Polypeptidteil der Hedgehog-Zusammensetzungen des vorliegenden Verfahrens
lässt sich
durch eine Vielzahl von Techniken erzeugen, einschließlich Reinigung
von natürlich
auftretenden Proteinen, auf rekombinante Weise erzeugte Proteine
und synthetische chemische Verfahren. Polypeptidformen der Hedgehog-Therapeutika
leiten sich vorzugsweise von Wirbeltier-Hedgehog-Proteinen ab und
weisen beispielsweise Sequenzen auf, die natürlich auftretenden Hedgehog-Proteinen
oder Fragmenten davon aus Wirbeltierorganismen entsprechen. Es ist
jedoch darauf hinzuweisen, dass das Hedgehog-Polypeptid einem Hedgehog-Protein (oder einem
Fragment davon) entsprechen kann, das in einem beliebigen metazoischen
Organismus auftritt.
-
Bei
den in den erfindungsgemäßen Verfahren
verwendeten isolierten Hedgehog-Proteinen handelt es sich um natürlich auftretende
oder rekombinante Proteine der Hedgehog-Familie, die entweder aus Nichtwirbeltier-
oder Wirbeltierquellen erhältlich
sind (vergl. die nachstehenden Literaturstellen). Mitglieder der
Wirbeltier-Hedgehog-Proteinfamilie
haben eine Homologie mit Proteinen gemeinsam, die durch das Drosophila-Hedgehog
(hh)-Gen kodiert werden (33). Bisher wurden durch kombiniertes Screening
von Mäusegenom- und
cDNA-Bibliotheken drei Säugetier-hh-Gegenstücke mit
den Bezeichnungen Sonic-Hedgehog
(Shh), Indian-Hedgehog (Ihh) und Desert-Hedgehog (Dhh) identifiziert,
die auch in anderen Säugern,
einschließlich
des Menschen, sowie in Fischen und Vögeln vorkommen. Zu weiteren
Mitgliedern gehören
Moonrat-Hedgehog (Mhh) sowie Hühner-Sonic-hh
und Zebrafisch-Sonic-hh.
-
Mäuse- und
Hühner-Shh-
und Mäuse-Ihh-Gene
kodieren für
Glycoproteine, die einer Spaltung unterliegen, wodurch sich ein
aminoterminales Fragment von etwa 20 kDa (vergl. 8)
und ein carboxyterminales Fragment von etwa 25 kDa ergeben. Das
besonders bevorzugte 20 kDa-Fragment weist die Konsensus-Sequenz
SEQ ID NO: 4 auf und umfasst die Aminosäuresequenzen von SEQ ID NOS:
1–3. Verschiedene andere Fragmente,
die den 20 kDa-Rest umfassen, fallen unter den Umfang der derzeit
beanspruchten Erfindung. Zu Veröffentlichungen,
die diese Sequenzen sowie ihre chemischen und physikalischen Eigenschaften
beschreiben, gehören
(34–38);
PCT-Patentanmeldungen WO-95/23223 (Jessell, Dodd, Roelink und Edlund), WO-95/18856
(Ingham, McMahon und Tabin) und WO-96/17924 (Beachy et al.).
-
Zu
Familienmitgliedern, die sich in den erfindungsgemäßen Verfahren
eignen, gehören
beliebige der natürlich
vorkommenden, nativen Hedgehog-Proteine, einschließlich allele,
phylogenetische Gegenstücke oder
andere Varianten davon, unabhängig
davon, ob es sich um Produkte aus natürlichen Quellen oder chemisch
hergestellte Produkte unter Einschluss von Muteinen oder mutanten
Proteinen sowie um rekombinante Formen und neue, aktive Mitglieder
der Hedgehog-Familie handelt. Zu besonders geeigneten Hedgehog-Polypeptiden
gehören
SEQ ID NOS: 1–4.
-
Im
erfindungsgemäßen Verfahren
verwendete, isolierte Hedgehog-Polypeptide sind biologisch aktiv. Die
Polypeptide umfassen eine Aminosäuresequenz
mit einer Homologie von mindestens 60 %, 80 %, 90 %, 95 %, 98 %
oder 99 % zu einer Aminosäuresequenz
von SEQ ID NOS: 1–4.
Das Polypeptid kann auch eine Aminosäuresequenz umfassen, die im
wesentlichen gleich mit einer Aminosäuresequenz in SEQ ID NOS: 1–4 ist.
Das Polypeptid weist eine Länge
von mindestens 5, 10, 20, 50, 100 oder 150 Aminosäuren auf
und umfasst mindestens 5, vorzugsweise mindestens 10, insbesondere
mindestens 20 und ganz besonders mindestens 50, 100 oder 150 zusammenhängende Aminosäuren aus
SEQ ID NOS: 1–4.
-
Die
bevorzugten erfindungsgemäßen Polypeptide
umfassen eine Hedgehog-Polypeptidsequenz sowie eine weitere N-terminale und/oder
C-terminale Aminosäuresequenz
oder sie können
die Gesamtheit oder ein Fragment der Hedgehog-Aminosäuresequenz umfassen. Beim isolierten
Hedgehog-Polypeptid
kann es sich auch um ein rekombinantes Fusionsprotein handeln, das
einen ersten Hedgehog-Bereich und einen zweiten Polypeptid-Bereich
umfasst, z. B. einen zweiten Polypeptid-Bereich mit einer Aminosäuresequenz,
die mit Hedgehog nicht verwandt ist. Beim zweiten Polypeptid-Bereich kann es sich
beispielsweise um eine Histidin-Markierung,
ein Maltose-Bindungsprotein, Glutathion-S-transferase, eine DNA-Bindungsdomäne oder eine
Polymerase-Aktivierungsdomäne handeln.
-
Die
erfindungsgemäßen Polypeptide
umfassen solche Peptide, die als Folge des Vorliegens von Mehrfachgenen,
alternativen Transkriptionsereignissen, alternativen RNA-Spleißereignissen
und alternativen translationalen und posttranslationalen Ereignissen
entstehen. Das Polypeptid kann vollständig durch synthetische Maßnahmen
hergestellt werden oder es kann in Systemen, z. B. gezüchteten
Zellen, exprimiert werden, wobei im wesentlichen die gleichen posttranslationalen
Modifikationen entstehen, die vorliegen, wenn das Protein in einer
nativen Zelle exprimiert wird, oder es kann eine Expression in Systemen
erfolgen, die zum Weglassen der posttranslationalen Modifikationen,
die bei Expression in einer nativen Zelle vorliegen, führen.
-
In
einer bevorzugten Ausführungsform
handelt es sich beim isolierten Hedgehog um ein Hedgehog-Polypeptid
mit einer oder mehreren der folgenden Eigenschaften:
- (i) es weist eine Sequenzidentität von mindestens 30, 40, 42,
50, 60, 70, 80, 90 oder 95 % mit den Aminosäuresequenzen von SEQ ID NOS:
1–4 auf;
- (ii) es weist ein Cystein oder ein funktionelles Äquivalent
davon am N-terminalen Ende auf;
- (iii) es kann in C3H10T1/2-Zellen die Aktivität von alkalischer
Phosphatase induzieren;
- (iv) es weist eine gesamte Sequenzidentität von mindestens 50 %, vorzugsweise
mindestens 60 % und insbesondere mindestens 70, 80, 90 oder 95 %
mit einem Polypeptid von SEQ ID NO: 1–4 auf;
- (v) es kann aus natürlichen
Quellen, wie Säugetierzellen,
isoliert werden;
- (vi) es kann mit "Patched" binden oder in Wechselwirkung
treten; und
- (vii) es ist hydrophob modifiziert (d. h. mindestens ein hydrophober
Rest ist an das Polypeptid gebunden), aber an der C-terminalen Aminosäure nicht
mit einem Sterol modifiziert.
-
III. Herstellung von rekombinanten
Polypeptiden
-
Die
hier beschriebenen isolierten Polypeptide lassen sich durch beliebige
geeignete, aus dem Stand der Technik bekannte Verfahren herstellen.
Derartige Verfahren reichen von direkten Protein-Syntheseverfahren
bis zur Konstruktion einer DNA-Sequenz, die für isolierte Polypeptidsequenzen
kodiert, und Expression derartiger Sequenzen in einem geeigneten,
transformierten Wirt.
-
In
einer Ausführungsform
eines rekombinanten Verfahrens wird eine DNA-Sequenz konstruiert,
indem man eine DNA-Sequenz, die für ein Wildtyp-Protein von Interesse
kodiert, isoliert oder synthetisiert. Gegebenenfalls kann die Sequenz
einer Mutagenese durch ortspezifische Mutagenese unterzogen werden,
um funktionelle Analoge davon bereitzustellen; vergl. beispielsweise
(40) und das US-Patent
4 588585. Ein weiteres Verfahren zur Konstruktion einer DNA-Sequenz,
die für
ein Polypeptid von Interesse kodiert, besteht in der chemischen
Synthese unter Verwendung eines Oligonucleotid-Synthesegeräts. Derartige
Oligonucleotide können
vorzugsweise auf der Basis der Aminosäuresequenz des angestrebten
Polypeptids konstruiert werden, wobei vorzugsweise solche Codons
ausgewählt
werden, die in der Wirtszelle, in der das rekombinante Polypeptid
von Interesse erzeugt werden soll, begünstigt sind.
-
Zur
Synthese einer isolierten Polynucleotidsequenz, die für ein isoliertes
Polypeptid von Interesse kodiert, können übliche Verfahren herangezogen
werden. Beispielsweise kann eine vollständige Aminosäuresequenz
zur Konstruktion eines rücktranslatierten
Gens verwendet werden; vergl. Maniatis et al., a.a.O. Ferner kann
ein DNA-Oligomeres,
das eine Nucleotidsequenz enthält,
die für
das spezielle isolierte Polypeptid kodiert, synthetisiert werden.
Beispielsweise können
mehrere kleine Oligonucleotide, die für Bereiche des angestrebten Polypeptids
kodieren, synthetisiert und anschließend verknüpft werden. Die einzelnen Oligonucleotide
enthalten typischerweise 5'-
oder 3'-Überhänge für einen
komplementären
Zusammenbau.
-
Nach
dem Zusammenbau (durch Synthese, ortsgerichtete Mutagenese oder
ein anderes Verfahren) werden die mutanten DNA-Sequenzen, die für ein spezielles
isoliertes Polypeptid von Interesse kodieren, in einen Expressionsvektor
inseriert und funktionell mit einer Expressionskontrollsequenz,
die sich für
die Expression des Proteins in einem gewünschten Wirt eignet, verknüpft. Ein
einwandfreier Zusammenbau kann durch Nucleotidsequenzierung, Restriktionskartierung
und Expression eines biologisch aktiven Polypeptids in einem geeigneten
Wirt bestätigt
werden. Wie es aus dem Stand der Technik bekannt ist, muss zur Erzielung
hochgradiger Expressionsniveaus eines transfizierten Gens in einem
Wirt das Gen operativ mit transkriptionalen und translationalen
Expressionskontrollsequenzen verknüpft werden, die im gewählten Expressionswirt
funktionell sind.
-
Die
Wahl der Expressionskontrollsequenz und des Expressionsvektors hängt von
der Wahl des Wirts ab. Eine Vielzahl von Expressionswirt/Vektor-Kombinationen
kann herangezogen werden. Zu geeigneten Expressionsvektoren für eukaryontische
Wirte gehören
beispielsweise Vektoren, die für
Expressionskontrollsequenzen aus SV40, Rinder-Papillomavirus, Adenovirus und Cytomegalovirus
umfassen. Zu geeigneten Expressionsvektoren für bakterielle Wirte gehören bekannte
bakterielle Plasmide, wie Plasmide aus Escherichia coli, einschließlich pCR1,
pBR322, pMB9 und deren Derivate, Plasmide mit einem breiteren Wirtsbereich,
wie M13, und filamentöse,
einzelsträngige
DNA-Phagen. Zu bevorzugten E. coli-Vektoren gehören pL-Vektoren, die den lambda-Phagen-pL-Promotor
(US-Patent 4 874 702), pET-Vektoren,
die den T7-Polymerase-Promotor enthalten (Studier et al., Methods
in Enzymology, Bd. 185 (1990), S. 60–89), und der pSP72-Vektor
(Kaelin et al., a.a.O.). Zu geeigneten Expressionsvektoren für Hefezellen
gehören
beispielsweise 2T und zentromere Plasmide.
-
Ferner
können
beliebige Sequenzen einer breiten Vielzahl von Expressionskontrollsequenzen
in diesen Vektoren verwendet werden. Zu geeigneten Expressionskontrollsequenzen
gehören
die Expressionskontrollsequenzen, die mit Strukturgenen der vorstehenden
Expressionsvektoren assoziiert sind. Zu Beispielen für geeignete
Expressionskontrollsequenzen gehören
der frühe
und der späte
Promotor von SV40 oder Adenovirus, das lac-System, das trp-System,
das TAC- oder TRC-System, der Hauptoperator und die Promotorregionen
des lambda-Phagen, beispielsweise pL, die Kontrollregionen des fd-Überzugsproteins,
der Promotor für 3-Phosphoglyceratkinase
oder andere glycolytische Enzyme, die Promotoren von saurer Phosphatase,
z. B. Pho5, die Promotoren des Hefe-α-Paarungssystems und andere Sequenzen,
von denen bekannt ist, dass sie die Expression von Genen von prokaryontischen
oder eukaryontischen Zellen und deren Viren steuern, sowie verschiedene
Kombinationen davon.
-
Beliebige
geeignete Wirte können
zur Herstellung der hier beschriebenen isolierten Hedgehog-Polypeptide
in großen
Mengen verwendet werden, einschließlich Bakterien, Pilze (einschließlich Hefen),
Pflanzen, Insekten, Säugetiere
oder andere geeignete Tierzellen oder Zelllinien sowie transgene
Tiere oder Pflanzen. Insbesondere umfassen diese Wirte bekannte
eukaryontische und prokaryontische Wirte, wie Stämme von E. coli, Pseudomonas,
Bacillus, Streptomyces, Pilze, Hefen (z. B. Hansenula), Insektenzellen,
wie Spodoptera frugiperda (SF9) und High FiveR (vergl.
Beispiel 1), Tierzellen, wie Ovarialzellen des chinesischen Hamsters (CHO),
Mäusezellen
wie NS/O-Zellen,
Zellen des afrikanischen grünen
Affen, COS 1, COS 7, BSC 1, BSC 40 und BMT 10 und humane Zellen
sowie Pflanzenzellen.
-
Es
ist darauf hinzuweisen, dass nicht alle Vektoren und Expressionskontrollsequenzen
gleichermaßen zur
Expression eines gegebenen, isolierten Polypeptids funktionieren.
Ferner funktionieren auch nicht alle Wirte gleichermaßen mit
dem gleichen Expressionssystem. Jedoch kann ein Fachmann unter diesen
Vektoren, Expressionskontrollsystemen und Wirten ohne übermäßiges Experimentieren
eine Auswahl treffen. Beispielsweise muss zur Herstellung eines
isolierten Polypeptids von Interesse in einer Tierkultur im Großmaßstab die Kopienzahl
des Expressionsvektors gesteuert werden. Amplifizierbare Vektoren
sind aus dem Stand der Technik bekannt; vergl. beispielsweise (41)
und die US-Patente 4 470 461 und 5 122 464.
-
Eine
derartige funktionelle Verknüpfung
einer DNA-Sequenz
mit einer Expressionskontrollsequenz umfasst die Bereitstellung
eines Translationsstartsignals im korrekten Leseraster strangaufwärts von
der DNA-Sequenz. Wenn die zu exprimierende spezielle DNA-Sequenz
nicht mit einem Methionin beginnt, endet das Startsignal mit einer
zusätzlichen
Aminosäure
(Methionin), die sich am N-Terminus des Produkts befindet. Wenn
ein hydrophober Rest mit dem N-terminalen,
methionylhaltigen Protein zu verknüpfen ist, kann das Protein
direkt in den erfindungsgemäßen Zusammensetzungen
verwendet werden. Da aber dennoch das bevorzugte N-terminale Ende
des Proteins aus Cystein bestehen soll (oder einem funktionellen Äquivalent
davon), muss das Methionin vor der Verwendung entfernt werden. Aus
dem Stand der Technik sind Verfahren zur Entfernung von derartigen
N-terminalen Methioninen aus Polypeptiden, die damit exprimiert
worden sind, bekannt. Beispielsweise ermöglichen bestimmte Wirte und
Fermentationsbedingungen eine in vivo-Entfernung von im wesentlichen
dem gesamten N-terminalen
Methionin. Andere Wirte erfordern die in vitro-Entfernung des N-terminalen Methionins.
Derartige in vitro- und
in vivo-Verfahren sind aus dem Stand der Technik bekannt.
-
Die
durch einen transformierten Wirt erzeugten Proteine können nach
einem beliebigen geeigneten Verfahren gereinigt werden. Zu derartigen üblichen
Verfahren gehören
die Chromatographie (z. B. Ionenaustausch-, Affinitäts- und Größen-Säulenchromatographie),
die Zentrifugation, die differentielle Löslichkeit oder beliebige andere übliche Techniken
zur Proteinreinigung. Für
die Immunoaffinitätschromatographie
(vergl. Beispiel 1) kann ein Protein, z. B. Sonic-Hedgehog, durch
Bindung an eine Affinitätssäule isoliert
werden, die Antikörper
gegen Sonic-Hedgehog oder ein verwandtes Protein, die an einen stationären Träger angeheftet
worden sind, umfasst. Alternativ können Affinitätsmarkierungen,
wie Hexahistidin, die Maltose-Bindungsdomäne, die Influenza-Überzugsequenz
und Glutathion-S-transferase, am Protein angebracht werden, um eine
einfache Reinigung durch Passage über eine geeignete Affinitätssäule zu ermöglichen.
Isolierte Proteine können auch
physikalisch charakterisiert werden, wobei man Techniken, wie Proteolyse,
kernmagnetische Resonanz und Röntgenkristallographie,
heranzieht.
-
A. Herstellung von Fragmenten
und Analogen
-
Fragmente
eines isolierten Proteins (z. B. Fragmente von SEQ ID NOS: 1–4) können ferner
in wirksamer Weise durch rekombinante Verfahren, durch proteolytischen
Verdau oder durch chemische Synthese hergestellt werden, wobei man
sich bekannter, dem Fachmann geläufiger
Verfahren bedient. Bei rekombinanten Verfahren können interne oder terminale
Fragmente eines Polypeptids erzeugt werden, indem man ein oder mehr
Nucleotide von einem Ende (für
ein terminales Fragment) oder von beiden Enden (für ein internes
Fragment) einer DNA-Sequenz, die für das isolierte Hedgehog-Polypeptid kodiert,
entfernt. Die Expression der mutagenisierten DNA liefert Polypeptidfragmente.
Ein Verdau mit "am
Ende knabbernden" Endonucleasen
kann ebenfalls DNAs erzeugen, die für eine Reihe von Fragmenten
kodieren. DNAs, die für
Fragmente eines Proteins kodieren, können auch durch willkürliches
Abscheren, Restriktionsverdau oder eine Kombination beider Wege
erzeugt werden. Proteinfragmente können direkt aus intakten Proteinen
erzeugt werden. Peptide können
speziell durch proteolytische Enzyme gespalten werden, wozu (ohne
Beschränkung
hierauf) Plasmin, Thrombin, Trypsin, Chymotrypsin oder Pepsin gehören. Jedes dieser
Enzyme ist für
den Typ der Peptidbindung, den es angreift, spezifisch. Trypsin
katalysiert die Hydrolyse von Peptidbindungen, bei denen die Carbonylgruppe
von einer basischen Aminosäure, üblicherweise
Arginin oder Lysin, stammt. Pepsin und Chymotrypsin katalysieren
die Hydrolyse von Peptidbindungen aus aromatischen Aminosäuren, wie
Tryptophan, Tyrosin und Phenylalanin. Alternative Sätze von
gespaltenen Proteinfragmenten werden durch Verhinderung der Spaltung
an einer Stelle, die für
ein proteolytisches Enzym empfindlich ist, erzeugt. Beispielsweise
ergibt die Umsetzung der ε-Aminosäuregruppe
von Lysin mit Ethyltrifluorthioacetat in einer schwach basischen
Lösung blockierte
Aminosäurereste,
deren benachbarte Peptidbindung nicht mehr gegenüber einer Hydrolyse durch Trypsin
empfindlich ist. Proteine lassen sich modifizieren, um Peptidverknüpfungen
zu schaffen, die gegenüber proteolytischen
Enzymen empfindlich sind. Beispielsweise führt eine Alkylierung von Cysteinresten
mit β-Halogenethylaminen
zu Peptidverknüpfungen,
die durch Trypsin hydrolysiert werden (51). Ferner können chemische
Reagenzien, die Peptidketten an speziellen Resten spalten, verwendet
werden. Beispielsweise spaltet Cyanogenbromid Peptide an Methioninresten
(52). Somit können
Proteine mit verschiedenen Kombinationen von Modifikatoren, proteolytischen
Enzymen und/oder chemischen Reagenzien in Fragmente von gewünschter
Länge ohne Überlappung
der Fragmente aufgeteilt oder in überlappende Fragmente einer
gewünschten Länge aufgeteilt
werden.
-
Fragmente
lassen sich ferner chemisch unter Anwendung von aus dem Stand der
Technik bekannten Verfahren synthetisieren, z. B. mit der Merrifield-Festphasen-Fmoc- oder t-Boc-Chemie
(vergl. Merrifield, Recent Progress in Hormone Research, Bd. 23
(1967), S. 451.
-
Beispiele
für herkömmliche
Verfahren, die die Herstellung und das Testen von Fragmenten und
Analogen ermöglichen,
sind nachstehend erläutert.
Diese oder analoge Verfahren können
zur Herstellung und zum Screening von Fragmenten und Analogen eines
isolierten Polypeptids (z. B. Hedgehog) verwendet werden, von dem
gezeigt werden kann, dass es biologisch aktiv ist. Ein beispielhaftes
Verfahren zum Testen darauf, ob Fragmente und Analoge von Hedgehog
biologisch aktiv sind, findet sich in Beispiel 3.
-
B. Herstellung von veränderten
DNA- und Peptidsequenzen: Statistische Verfahren
-
Aminosäuresequenz-Varianten
eines Proteins (z. B. die Varianten SEQ ID NOS: 1–4) lassen
sich durch statistische Mutagenese von DNA herstellen, die für das Protein
oder einen speziellen Bereich davon kodiert. Zu geeigneten Verfahren
gehören
die PCR-Mutagenese und die Sättigungsmutagenese.
Eine Bibliothek von willkürlichen
Aminosäuresequenz-Varianten
lässt sich
auch durch Synthese eines Satzes von degenerierten Oligonucleotidsequenzen
erzeugen. Verfahren zur Erzeugung von Aminosäuresequenz-Varianten eines vorgegebenen Proteins
unter Verwendung von veränderten
DNAs und Peptiden sind aus dem Stand der Technik bekannt. Die nachstehenden
Beispiele für
derartige Verfahren sollen den Schutzumfang der vorliegenden Erfindung
nicht einschränken,
sondern dienen lediglich der Erläuterung
repräsentativer
Techniken. Fachleute erkennen, dass auch andere Verfahren diesbezüglich geeignet
sind.
-
PCR-Mutagenese:
Kurz zusammengefasst, Taq-Polymerase (oder eine andere Polymerase)
wird zur Einführung
von willkürlichen
Mutationen in ein kloniertes DNA-Fragment verwendet (42). Die PCR-Bedingungen
werden so gewählt,
dass die Zuverlässigkeit
der DNA-Synthese durch Taq-DNA-Polymere verringert wird, wobei man
beispielsweise ein dGTP/dATP-Verhältnis von
5 verwendet und der PCR-Reaktion Mn2+ zusetzt. Der
Pool von amplifizierten DNA-Fragmenten wird in geeignete Klonierungsvektoren
inseriert, um willkürliche mutante
Bibliotheken bereitzustellen.
-
Sättigungsmutagenese:
Ein Verfahren ist allgemein in (43) beschrieben. Kurz zusammengefasst,
die Technik umfasst die Erzeugung von Mutationen durch chemische
Behandlung oder Bestrahlung von einzelsträngiger DNA in vitro und die
Synthese eines cDNA-Strangs. Die Mutationsfrequenz wird durch die
Schwere der Behandlung moduliert und es lassen sich im wesentlichen
sämtliche
möglichen
Basensubstitutionen erhalten.
-
Degenerierte
Oligonucleotid-Mutagenese: Eine Bibliothek von homologen Peptiden
lässt sich
aus einem Satz von degenerierten Oligonucleotidsequenzen erhalten.
Eine chemische Synthese von degenerierten Sequenzen lässt sich
in einem automatischen DNA-Synthesegerät bewerkstelligen. Die synthetischen
Gene werden sodann in einen geeigneten Expressionsvektor ligiert;
vergl. beispielsweise (44, 45) und Itakura et al., Recombinant DNA,
Proc. 3rd Cleveland Symposium on Macromolecules, Hrsg. A. G. Walton,
Elsevier, Amsterdam (1981), S. 273–289.
-
C. Herstellung von veränderten
DNA- und Peptidsequenzen: Direkte Verfahren
-
Eine
nicht-willkürliche
oder gerichtete Mutagenese ergibt spezifische Sequenzen oder Mutationen
in spezifischen Bereichen einer Polynucleotidsequenz, die für ein isoliertes
Polypeptid kodiert, um Varianten bereitzustellen, die Deletionen,
Insertionen oder Substitutionen von Resten der bekannten Aminosäuresequenz des
isolierten Polypeptids umfassen. Die Mutationsstellen können individuell
oder in Serie modifiziert werden, beispielsweise durch: (1) zunächst Substituieren
mit konservierten Aminosäuren
und anschließend
mit einer radikaleren Auswahl, je nach den erzielten Ergebnissen;
(2) Deletion des Zielrestes; oder (3) Insertion von Resten der gleichen
oder einer unterschiedlichen Klasse neben der entsprechenden Stelle
oder Kombinationen der Optionen 1–3.
-
Klar
ausgedrückt,
handelt es sich bei derartigen ortsgerichteten Verfahren um einen
Weg, bei dem ein N-terminales
Cystein (oder ein funktionelles Äquivalent)
in eine vorgegebene Polypeptidsequenz eingeführt werden kann, um die Haftungsstelle
für einen
hydrophoben Rest bereitzustellen.
-
Alanin-Scanning-Mutagenese:
Dieses Verfahren lokalisiert solche Reste oder Bereiche eines erwünschten
Proteins, bei denen es sich um bevorzugte Stellen für die Mutagenese
handelt (46). Beim Alanin-Screening werden ein Rest oder eine Gruppe
von Zielresten ausgewählt
und durch Alanin ersetzt. Dieses Ersetzen kann die Wechselwirkung
der Aminosäure
mit benachbarten Aminosäuren
und/oder mit der wässrigen
oder Membranumgebung beeinflussen. Produkte, die eine funktionelle
Empfindlichkeit gegenüber
den Substitutionen aufweisen, werden sodann durch Einführung weiterer
oder anderer Varianten an den Substitutionsstellen verfeinert.
-
Oligonucleotidvermittelte
Mutagenese: Eine Version dieses Verfahrens zur Herstellung von Substitutions-,
Deletions- und Insertionsvarianten von DNA kann herangezogen werden
(47). Kurz zusammengefasst, die gewünschte DNA wird verändert, indem
man einen Oligonucleotid-Primer, der für eine DNA-Mutation kodiert,
mit einer DNA-Matrize hybridisiert, bei der es sich typischerweise
um die einzelsträngige
Form eines Plasmids oder eines Phagen handelt, die die unveränderte oder
Wildtyp-DNA-Sequenzmatrize des angestrebten Proteins (z. B. des
Hedgehog-Proteins) enthalten. Nach der Hybridisierung wird eine
DNA-Polymerase zur Herstellung des zweiten und komplementären Strangs
von DNA der Matrize verwendet, die den Oligonucleotid-Primer enthält und für eine gewählte Veränderung
in der gewünschten
DNA-Sequenz kodiert. Im allgemeinen werden Oligonucleotide mit einer
Länge von
mindestens 25 Nucleotiden verwendet. Ein optimales Oligonucleotid
weist 12 bis 15 Nucleotide auf, die vollständig komplementär zur Matrize
an beiden Seiten der Mutation sind. Dies gewährleistet, dass das Oligonucleotid
einwandfrei mit dem einzelsträngigen
DNA-Matrizenmolekül
hybridisiert.
-
Kassettenmutagenese:
Dieses Verfahren (48) erfordert ein Plasmid oder einen anderen Vektor,
der die zu mutierende Proteinuntereinheit-DNA enthält. Das
oder die Codons in der Proteinuntereinheit-DNA werden identifiziert
und eine einzige Restriktionsendonuclease-Stelle wird auf jeder
Seite der identifizierten Mutationsstelle(n) inseriert, wobei man
sich des vorstehend beschriebenen Oligonucleotid-gerichteten Mutageneseverfahrens
bedient. Das Plasmid wird sodann an diesen Stellen geschnitten,
um es zu linearisieren. Ein doppelsträngiges Oligonucleotid, das
für die
Sequenz der DNA zwischen den Restriktionsstellen kodiert, das aber
die angestrebte(n) Mutation(en) enthält, wird unter Anwendung üblicher
Verfahren synthetisiert. Die beiden Stränge werden getrennt synthetisiert
und sodann miteinander unter Anwendung üblicher Verfahren hybridisiert.
Bei diesem doppelsträngigem
Oligonucleotid handelt es sich um die "Kassette". Sie weist 3'- und 5'-Enden auf, die mit den Enden des linearisierten
Plasmids verträglich
sind, so dass es direkt darin ligiert werden kann. Das Plasmid enthält nunmehr
die mutierte, angestrebte Proteinuntereinheit-DNA-Sequenz.
-
Kombinationsmutagenese:
In einer Version dieses Verfahrens (Ladner et al., WO-88/06630)
werden die Aminosäuresequenzen
für eine
Gruppe von Homologen oder anderen verwandten Proteinen ausgerichtet, vorzugsweise
um die höchstmögliche Homologie
zu fördern.
Sämtliche
Aminosäuren,
die an einer gegebenen Position der ausgerichteten Sequenzen auftreten,
können
zur Schaffung eines degenerierten Satzes von Kombinationssequenzen
ausgewählt
werden. Die vielgestaltige Bibliothek wird durch Kombinationsmutagenese auf
dem Nucleinsäureniveau
erzeugt und von einer vielgestaltigen Genbibliothek kodiert. Beispielsweise
kann ein Gemisch von synthetischen Oligonucleotiden enzymatisch
in die Gensequenz ligiert werden, so dass der degenerierte Satz
von möglichen
Sequenzen in Form von individuellen Peptiden oder alternativ als
ein Satz von Proteinen, die den gesamten Satz von degenerierten
Sequenzen enthalten, exprimierbar ist.
-
D. Andere Varianten von
isolierten Polypeptiden
-
Unter
die Erfindung fallen isolierte Moleküle, wozu folgende Produkte
gehören:
allele Varianten, natürliche
Mutanten, induzierte Mutanten und Proteine, die durch DNA kodiert
werden, die unter Bedingungen hoher oder geringer Stringenz mit
einer Nucleinsäure
hybridisiert, die für
ein Polypeptid kodiert, z. B. das N-terminale Fragment von Sonic-Hedgehog
(SEQ ID NO: 1), und Polypeptide, die spezifisch durch Antiseren
gegen Hedgehog-Peptide gebunden werden, insbesondere durch Antiseren
gegen ein aktives Zentrum oder die Bindungsstelle von Hedgehog.
von sämtlichen
hier beschriebenen Varianten wird erwartet, dass sie (i) die biologische
Funktion des ursprünglichen
Proteins behalten und (ii) die Fähigkeit
zur Verknüpfung
mit einem hydrophoben Rest (z. B. einem Lipid) behalten.
-
Die
erfindungsgemäßen Verfahren
beinhalten auch die Verwendung von Fragmenten, vorzugsweise biologisch
aktiven Fragmenten, oder Analogen eines isolierten Peptids, wie
Hedgehog. Speziell handelt es sich bei einem biologisch aktiven
Fragment oder Analogen um ein Produkt, das eine beliebige in vivo-
oder in vitro-Aktivität
aufweist, die charakteristisch für
das in SEQ ID NOS: 1–4
dargestellte Peptid oder für
ein anderes, natürlich
auftretendes, isoliertes Hedgehog ist. Insbesondere weist das hydrophob
modifizierte Fragment oder Analoge eine Aktivität von mindestens 10 %, vorzugsweise
40 % oder mehr oder insbesondere mindestens 90 % der Aktivität von Sonic-Hedgehog (vergl.
Beispiel 3) bei einem beliebigen in vivo- oder in vitro-Test auf.
-
Analoge
können
sich von einem natürlich
auftretenden, isolierten Protein in der Aminosäuresequenz und/oder auf eine
Art und Weise, an der die Sequenz nicht beteiligt ist, unterscheiden.
Die besonders bevorzugten erfindungsgemäßen Polypeptide weisen bevorzugte
Nichtsequenz-Modifikationen auf, die eine chemische in vivo- oder
in vitro-Derivatisierung
(z. B. des N-terminalen Endes) sowie mögliche Veränderungen in Bezug auf Acetylierung,
Methylierung, Phosphorylierung, Amidierung, Carboxylierung oder
Glycosylierung umfassen.
-
Weitere
Analoge umfassen ein Protein, wie Sonic-Hedgehog oder biologisch aktive Fragmente,
deren Sequenzen sich von der Wildtyp-Konsensussequenz (z. B. SEQ
ID NO: 4) durch eine oder mehrere konservative Aminosäuresubstitutionen
oder durch eine oder mehrere nicht-konservative Aminosäuresubstitutionen oder
durch Deletionen oder Insertionen unterscheiden, die die biologische
Aktivität
des isolierten Proteins nicht beseitigen. Konservative Substitutionen
umfassen typischerweise die Substitution einer Aminosäure durch eine
andere Aminosäure
mit ähnlichen
Eigenschaften, z. B. Substitutionen innerhalb der folgenden Gruppen: Valin,
Alanin und Glycin; Leucin und Isoleucin; Asparaginsäure und
Glutaminsäure;
Asparagin und Glutamin; Serin und Threonin; Lysin und Arginin; und
Phenylalanin und Tyrosin. Die nicht-polaren hydrophoben Aminosäuren umfassen
Alanin, Leucin, Isoleucin, Valin, Prolin, Phenylalanin, Tryptophan
und Methionin. Die polaren, neutralen Aminosäuren umfassen Glycin, Serin,
Threonin, Cystein, Tyrosin, Asparagin und Glutamin. Die positiv
geladenen (basischen) Aminosäuren
umfassen Arginin, Lysin und Histidin. Die negativ geladenen (sauren)
Aminosäuren
umfassen Asparaginsäure
und Glutaminsäure.
Weitere konservative Substitutionen sind für den Fachmann leicht ersichtlich.
Beispielsweise kann für
die Aminosäure
Alanin eine konservative Substitution durch einen der Bestandteile
D-Alanin, Glycin, beta-Alanin, L-Cystein
und D-Cystein vorgenommen werden. Für Lysin kann ein Ersatz durch
einen der Bestandteile D-Lysin, Arginin, D-Arginin, Homoarginin,
Methionin, D-Methionin, Ornithin oder D-Ornithin vorgenommen werden.
-
Im
allgemeinen handelt es sich bei Substitutionen, von denen erwartet
werden kann, dass sie Veränderungen
in den funktionellen Eigenschaften von isolierten Polypeptiden herbeiführen, um
solche, bei denen (i) ein polarer Rest, z. B. Serin oder Threonin,
durch einen hydrophoben Rest ersetzt ist oder an dessen Stelle tritt,
z. B. Leucin, Isoleucin, Phenylalanin oder Alanin; (ii) ein Cysteinrest
durch einen anderen Rest ersetzt ist (oder an dessen Stelle tritt)
(vergl. Beispiel 10); (iii) ein Rest mit einer elektropositiven
Seitenkette, z. B. Lysin, Arginin oder Histidin, durch einen Rest
mit einer elektronegativen Seitenkette, wie Glutaminsäure oder
Asparaginsäure,
ersetzt ist oder an dessen Stelle tritt; oder (iv) ein Rest mit einer
voluminösen
Seitenkette, z. B. Phenylalanin, durch einen Rest ohne eine derartige
Seitenkette, z. B. Glycin, ersetzt ist oder an dessen Stelle tritt.
-
Bei
weiteren Analogen, die im Rahmen der erfindungsgemäßen Verfahren
verwendet werden, handelt es sich um solche mit Modifikationen,
die die Peptidstabilität
erhöhen.
Derartige Analoge können
beispielsweise eine oder mehrere Nichtpeptidbindungen (die die Peptidbindung
ersetzen) in der Peptidsequenz enthalten. Ferner gehören dazu
Analoge, die Reste umfassen, die von natürlich auftretenden L-Aminosäuren abweichen, z.
B. D-Aminosäure
oder nicht-natürlich
auftretende oder synthetische Aminosäuren, wie beta- oder gamma-Aminosäuren und
cyclische Analoge. Der Einbau von D-Aminosäuren anstelle von L-Aminosäuren in
das isolierte Hedgehog-Polypeptid kann dessen Beständigkeit
gegen Proteasen erhöhen
(vergl. US-Patent
5 219 990, a.a.O.).
-
Der
Ausdruck "Fragment", der auf ein isoliertes
Hedgehog-Analoges angewandt wird, kann einen kleinen Bestandteil,
wie eine einzelne Aminosäure
bedeuten, vorausgesetzt, dass die biologische Aktivität erhalten
bleibt. Es kann sich um ein Produkt mit mindestens etwa 20 Resten,
typischerweise mindestens etwa 40 Resten und vorzugsweise mindestens
etwa 60 Resten handeln. Fragmente lassen sich durch dem Fachmann geläufige Verfahren
erzeugen. Die Fähigkeit
eines als Kandidat in Frage kommenden Fragments, die biologische
Aktivität
von isoliertem Hedgehog aufzuweisen, kann nach dem Fachmann geläufigen Verfahren,
die hier beschrieben werden, bestimmt werden.
-
V. Herstellung von hydrophoben
Derivaten
-
Die
Erfinder haben festgestellt, dass durch Steigerung der gesamten
hydrophoben Natur eines Hedgehog-Proteins die biologische Aktivität des Proteins
erhöht
wird. Die Wirkungsstärke
eines signalgebenden Proteins, wie Hedgehog, kann erhöht werden:
(a) durch chemische Modifikation, z. B. Addition eines hydrophoben Restes
an die Sulfhydrylgruppe und/oder das α-Amin des N-terminalen Cysteins
(Beispiele 8 und 9); (b) durch Ersetzen des N-terminalen Cysteins
durch eine hydrophobe Aminosäure
(Beispiel 10); oder (c) durch Ersetzen des N-terminalen Cysteins
durch eine unterschiedliche Aminosäure und durch anschließende chemische
Modifikation des substituierten Restes, so dass ein hydrophober
Rest an die Substitutionsstelle addiert wird.
-
Ferner
bleibt die biologische Aktivität
des Proteins erhalten oder wird verstärkt, indem man eine Modifikation
eines Hedgehog-Proteins an einem internen Rest an der Oberfläche des
Proteins mit einem hydrophoben Rest vornimmt: (a) durch Ersetzen
des internen Restes durch eine hydrophobe Aminosäure; oder (b) durch Ersetzen
des internen Restes durch eine unterschiedliche Aminosäure und
anschließend
durch chemische Modifikation des substituierten Restes, so dass
ein hydrophober Rest an der Stelle der Substitution addiert wird
(vergl. Beispiel 10).
-
Ferner
bleibt die biologische Aktivität
des Proteins erhalten oder wird verstärkt, indem man eine Modifikation
eines Hedgehog-Proteins am C-Terminus mit einem hydrophoben Rest
vornimmt: (a) durch Ersetzen des C-terminalen Restes durch eine
hydrophobe Aminosäure;
oder (b) durch Ersetzen des C-terminalen Restes durch eine unterschiedliche
Aminosäure
und anschließende
chemische Modifikation des substituierten Restes, so dass ein hydrophober
Rest an der Substitutionsstelle addiert wird.
-
Es
gibt eine Vielzahl von lipophilen Resten, mit denen Hedgehog-Polypeptide
derivatisiert werden können.
Bei einer lipophilen Gruppe kann es sich beispielsweise um eine
relativ langkettige Alkyl- oder Cycloalkylgruppe (vorzugsweise n-Alkylgruppe)
mit etwa 7 bis 30 Kohlenstoffatomen handeln. Die Alkylgruppe kann am
Schwanz mit einer Hydroxylgruppe oder einem primären Amin enden. Beispielsweise
umfassen lipophile Moleküle
natürlich
auftretende und synthetische aromatische und nicht-aromatische Reste,
wie Fettsäuren, Ester
und Alkohole, weitere Lipidmoleküle,
Käfigstrukturen,
wie Adamantan und Buckminsterfullerene, sowie aromatische Kohlenwasserstoffe, wie
Benzol, Perylen, Phenanthren, Anthracen, Naphthalin, Pyren, Chrysen und
Naphthacen.
-
Besonders
geeignet als lipophile Moleküle
sind alicyclische Kohlenwasserstoffe, gesättigte und ungesättigte Fettsäuren und
andere Lipid- und Phospolipidreste, Wachse, Cholesterol, Isoprenoide,
Terpene und polyalicyclische Kohlenwasserstoffe, einschließlich Adamantan
und Buckminsterfullerene, Vitamine, Polyethylenglykol oder Oligoethylenglykol,
(C1-C18)-Alkylphosphatdiester,
-O-CH2-CH(OH)-O-(C12-C18)-Alkyl und insbesondere Konjugate mit
Pyrenderivaten. Beim lipophilen Rest kann es sich um einen lipophilen
Farbstoff, der zur erfindungsgemäßen Verwendung
geeignet ist, handeln, beispielsweise (ohne Beschränkung hierauf)
Diphenylhexatrien, Nil-Rot, N-Phenyl-1-naphthylamin, Prodan, Laurodan,
Pyren, Perylen, Rhodamin, Rhodamin B, Tetramethylrhodamin, Texas-Rot,
Sulforhodamin, 1,1'-Didodecyl-3,3,3',3'-tetramethylindocarbocyanin-perchlorat,
Octadecylrhodamin B und die von der Fa. Molecular Probes Inc, erhältlichen
BODIPY-Farbstoffe.
-
Zu
weiteren Beispielen für
lipophile Reste gehören
aliphatische Gruppen mit Carbonylresten, wie 1- oder 2-Adamantylacetyl,
3-Methyladamant-1-ylacetyl, 3-Methyl-3-brom-1-adamantylacetyl, 1-Decalinacetyl, Campheracetyl,
Camphanacetyl, Noradamantylacetyl, Norbornanacetyl, Bicyclo[2.2.2]oct-5-enacetyl,
1-Methoxybicyclo[2.2.2]oct-5-en-2-carbonyl,
cis-5-Norbornen-endo-2,3-dicarbonyl, 5-Norbornen-2-ylacetyl,(1R)-(-)-Myrtentanacetyl,
2-Norbornanacetyl,
Anti-3-oxo-tricyclo[2.2.1.0<2,6>]heptan-7-carbonyl, Decanoyl,
Dodecanoyl, Dodecenoyl, Tetradecadienoyl, Decinoyl oder Dodecinoyl.
-
Strukturen
für beispielhafte
hydrophobe Modifikationen sind in 12 dargestellt.
Wenn eine geeignete Aminosäure
an einer speziellen Position nicht verfügbar ist, kann eine ortsgerichtete
Mutagenese dazu herangezogen werden, eine reaktive Aminosäure an diese
Stelle zu bringen. Zu reaktiven Aminosäuren gehören Cystein, Lysin, Histidin,
Asparaginsäure,
Glutaminsäure,
Serin, Threonin, Tyrosin, Arginin, Methionin und Tryptophan. Eine
Mutagenese kann dazu herangezogen werden, eine reaktive Aminosäure an den
N- oder C-Terminus oder an eine interne Position zu bringen.
-
Wir
haben beispielsweise festgestellt, dass es möglich ist, ein N-terminales
Cystein eines biologisch aktiven Hedgehog-Proteins chemisch zu modifizieren
oder das N-terminale
Cystein insgesamt zu beseitigen und doch die biologische Aktivität des Proteins
zu erhalten, vorausgesetzt, dass der modifizierte oder substituierte
chemische Rest hydrophob ist. Die Erfinder haben festgestellt, dass
eine Verstärkung
der biologischen Hedgehog-Aktivität grob mit der Hydrophobizität der Modifikation
korreliert. Zusätzlich
zur Verstärkung
der Aktivität
des Proteins beseitigt eine Modifikation oder ein Ersatz des N-terminalen
Cysteins unerwünschte
Vernetzungsreaktionen und/oder Modifikationen des Cysteins, die
während
der Herstellung, Reinigung, Zubereitung und Lagerung des Proteins
erfolgen können.
Das Thiol eines N-terminalen
Cysteins ist aufgrund seiner Nähe
zum α-Amin,
das den pKa-Wert des Cysteins verringert und die Protonendissoziation
erhöht,
und aufgrund der Bildung des reaktiven Thiolations bei neutralem
oder saurem pH-Wert sehr reaktiv.
-
Wir
haben nachgewiesen, dass bei einem Signalgebungstest auf Zellbasis
ein Ersatz des N-terminalen Cysteins von Hedgehog durch eine hydrophobe
Aminosäure
zu einem Protein mit einer erhöhten
Wirkungsstärke
führt.
Durch Ersatz des Cysteins beseitigt dieser Weg die Schwierigkeit
der Unterdrückung
von anderen unerwünschten
Modifikationen des Cysteins, die während der Herstellung, Reinigung,
Zubereitung und Lagerung des Proteins auftreten können. Die
Allgemeingültigkeit
dieses Weges wird durch unsere Feststellung gestützt, dass drei verschiedene
hydrophobe Aminosäuren,
nämlich
Phenylalanin, Isoleucin und Methionin, jeweils eine aktivere Form
von Hedgehog ergeben. Daher sollte ein Ersatz des Cysteins durch
eine beliebige andere hydrophobe Aminosäure zu einem aktiven Protein führen. Da
wir ferner eine Korrelation zwischen der Hydrophobizität einer
Aminosäure
oder der chemischen Modifikation und der Wirkungsstärke des entsprechenden
modifizierten Proteins beim C3H10T1/2-Test festgestellt haben (z.
B. Phe > Met, langkettige Fettsäuren > kurze Kettenlänge), könnte die
Addition von mehr als einer hydrophoben Aminosäure an die Hedgehog-Sequenz
in Betracht gezogen werden, was die Wirkungsstärke des Proteins über den
Wert hinaus, der mit einer einzelnen Aminosäureaddition erzielt wird, erhöhen könnte. Tatsächlich führt die
Addition von zwei aufeinanderfolgenden Isoleucinresten an den N-Terminus
von humanem Sonic-Hedgehog zu einer Erhöhung der Wirkungsstärke beim
C3H10T1/2-Test, verglichen mit der Mutante, bei der nur ein einziges
Isoleucin addiert ist (vergl. Beispiel 10). Somit ist zu erwarten,
dass die Addition von hydrophoben Aminosäuren am N- oder C-Terminus
eines Hedgehog-Proteins in einer Oberflächenschleife oder in einer
gewissen Kombination von Positionen zu einer aktiveren Form des
Proteins führt.
Bei der Substitutionsaminosäure
muss es sich nicht um eine der 20 üblichen Aminosäuren handeln.
Es wurde über
die Substitution mit nicht-natürlichen
Aminosäuren
an speziellen Stellen in Proteinen berichtet (78, 79). Dies würde einen
Vorteil darstellen, wenn die Aminosäure einen stärker hydrophoben
Charakter aufwiese, gegenüber
einem proteolytischen Angriff beständiger wäre oder dazu verwendet werden
könnte,
das Hedgehog-Protein in vivo an einen bestimmten Ort zu dirigieren,
der seine Aktivität
stärker
oder spezifischer machen würde.
Nicht-natürliche
Aminosäuren
können
an speziellen Stellen im Protein während der in vitro-Translation
eingebaut werden. Es wird über
Fortschritte bei der Schaffung von in vivo-Systemen berichtet, die
die Herstellung von derartigen modifizierten Proteinen in größerem Maßstab erlauben.
-
Es
ist überraschend,
dass ein erfindungsgemäß modifiziertes
Hedgehog-Protein seine biologische Aktivität behält. Erstens ist das N-terminale
Cystein in sämtlichen
bekannten Hedgehog-Proteinsequenzen, einschließlich Fische, Frösche, Insekten,
Vögel und
Säugetiere,
konserviert. Daher lässt
sich vernünftigerweise erwarten,
dass die freie Sulfhydrylgruppe des N-terminalen Cysteins für die Struktur
oder Aktivität
des Proteins von Bedeutung ist. Zweitens sind Hedgehog-Proteine,
denen ein N-terminales Cystein fehlt, aufgrund einer proteolytischen
Spaltung oder einer Mutation zu hydrophilen Aminosäuren (z.
B. Asparaginsäure
oder Histidin) in einem C3H10T1/2-Test auf Zellbasis, wie er in
Beispiel 3 beschrieben ist, inaktiv.
-
Es
gibt zahlreiche Modifikationen des N-terminalen Cysteins, die das
Thiol schützen
und einen hydrophoben Rest anhängen.
Diese Modifikationen werden nachstehend ausführlich erörtert. Der Fachmann kann feststellen,
welche Modifikation sich für
eine spezielle therapeutische Anwendung am besten eignet. Zu Faktoren,
die eine derartige Bestimmung beeinflussen, gehören die Kosten und die Einfachheit
der Herstellung, der Reinigung und der Zubereitung, Löslichkeit,
Stabilität,
Wirkungsstärke,
Pharmakodynamik und -kinetik, Sicherheit, Immunogenizität und Gewebezielrichtung.
-
A. Chemische Modifikationen
der primären
Aminosäuresequenz
-
Die
chemische Modifikation des N-terminalen Cysteins zum Schutz des
Thiols unter gleichzeitiger Aktivierung durch einen hydrophoben
Rest kann vom Fachmann auf zahlreichen Wegen vorgenommen werden. Der
Sulfhydrylrest mit dem Thiolation als aktiver Spezies stellt die
reaktivste funktionelle Gruppe in einem Protein dar. Es gibt zahlreiche
Reagenzien, die mit Thiol rascher als mit anderen Gruppen reagieren;
vergl. Chemistry of Protein Conjugation and Cross-Linking (S. S.
Wong, CRC Press, Boca Raton, FL, 1991). Vom Thiol am N-terminalen
Cystein, wie es bei allen Hedgehog-Proteinen gefunden wird, ist
zu erwarten, dass es reaktiver ist als interne Cysteine innerhalb
der Sequenz. Dies ist auf die enge Nachbarschaft zum α-Amin zurückzuführen, was
den pKa-Wert des Thiols senkt, woraus sich ein höheres Maß der Protonendissoziation
zum reaktiven Thiolation bei neutralem oder saurem pH-Wert ergibt.
Ferner ist eine Exposition des Cysteins am N-Terminus der Struktur wahrscheinlicher
als bei den übrigen
beiden Cysteinen in der Hedgehog-Sequenz, die in die Proteinstruktur
eingebettet sind. Wir haben festgestellt, dass das N-terminale Cystein
die einzige Aminosäure
darstellt, die nach 1-stündiger
Umsetzung mit N-Ethylmaleinimid
beim pH-Wert 5,5 (vergl. Beispiel 9) und nach einer 18-stündigen Umsetzung
mit N-Isopropyliodacetamid
beim pH-Wert 7,0 (vergl. Beispiel 9) modifiziert ist. Zu weiteren
Beispielen für
derartige Verfahren gehören
die Umsetzung mit anderen α-Halogenacetylverbindungen,
Organoquecksilberverbindungen, Disulfidreagenzien und anderen N-substituierten
Maleinimiden. Zahlreiche hydrophobe Derivate dieser aktiven Spezies
sind handelsüblich
(z. B. Ethyliodacetat (Aldrich, Milwaukee, WI), Phenyldisulfid (Aldrich)
und N-Pyrenmaleinimid
(Molecular Probes, Eugene, OR)) oder lassen sich leicht synthetisieren
(z. B. N-Alkyliodacetamide (84), N-Alkylmaleinimide (85) und Organoquecksilberverbindungen
(86)). Wir haben gezeigt, dass das N-terminale Cystein an humanem
Sonic-Hedgehog spezifisch mit N-Isopropyliodacetamid
modifiziert werden kann und dass das hydrophob modifizierte Protein
beim C3H10T1/2-Test 2-fach stärker
wirkt als das unmodifizierte Protein (vergl. Beispiel 9). Es ist
zu erwarten, dass eine Modifikation von Shh mit einem langkettigen
Alkyliodacetamidderivat zu einem modifizierten Protein mit einer
noch höheren
Verstärkung
der Wirkung führt.
Derartige N-Alkyliodacetamide lassen sich vom Fachmann leicht unter
Verwendung handelsüblicher
Ausgangsmaterialien synthetisieren.
-
Ein
weiterer Aspekt bezüglich
der Reaktivität
eines N-terminalen
Cysteins besteht darin, dass es an chemischen Reaktionen teilnehmen
kann, die aufgrund seiner 1,2-Aminothiolkonfiguration
einzigartig sind. Ein Beispiel ist die Umsetzung mit Thioestergruppen
unter Bildung einer N-terminalen
Amidgruppe über
eine rasche S- nach N-Verschiebung
des Thioesters. Diese chemische Reaktion kann synthetische Peptide
aneinander kuppeln und kann zur Addition einer oder mehrerer, natürlicher
oder nicht-natürlicher
Aminosäuren
oder anderer hydrophober Gruppen über das in entsprechender Weise
aktivierte Peptid herangezogen werden. Ein weiteres Beispiel, das
hier dargelegt wird, besteht in der Umsetzung mit Aldehyden unter
Bildung des Thiazolidin-Addukts. Zahlreiche hydrophobe Derivate
von Thiolestern (z. B. C2-C24-gesättigte und
ungesättigte
Fettacyl-Coenzym A-ester (Sigma Chemical Co., St. Louis, MO)), Aldehyde
(z. B. Butyraldehyd, n-Decylaldehyd und n-Myristylaldehyd (Aldrich))
und Ketone (z. B. 2-, 3- und 4-Decanon (Aldrich)) sind im Handel
erhältlich oder
lassen sich leicht synthetisieren (87, 88). Auf ähnliche Weise können Thiomorpholinderivate,
die durch in Beispiel 9 beschriebene 1-Brom-2-Butanon-Chemie beispielhaft
erläutert
sind, aus verschiedenen α-Halogenketon-Ausgangsmaterialien
hergestellt werden (88). Da es leicht ist, alternative Wege zur
Modifikation des Thiols des N-terminalen Cysteins oder eines beliebigen
Cysteins in einem Protein aufzufinden, möchten wir nicht auf die speziellen,
hier dargelegten Beispiele festgelegt werden.
-
Das α-Amin eines
Proteins kann im Vergleich zu anderen Aminen in einem Protein bevorzugt
modifiziert werden, da sein geringerer pKa-Wert zu größeren Mengen
der reaktiven, unprotonierten Form bei neutralem oder saurem pH-Wert
führt.
Wir haben gezeigt, dass eine Modifikation des N-terminalen Amins mit einer langkettigen
Fettsäureamidgruppe
unter Aufrechterhaltung einer freien Cystein-Thiolgruppe das Hedgehog-Protein
stark um zwei Größenordnungen
aktiviert (vergl. Beispiel 8). Daher ist zu erwarten, dass chemische
Reaktionen, die bevorzugt auf eine Umsetzung mit dem N-terminalen
Amin abgestellt sind, für
eine Erhöhung
der Wirkungsstärke
der Hedgehog-Proteine wertvoll sind. Arylhalogenide, Aldehyde und
Ketone, Säureanhydride,
Isocyanate, Isothiocyanate, Imidoester, Säurehalogenide, N-Hydroxysuccinimidyl
(z. B. Sulfo-NHS-acetat), Nitrophenylester, Acylimidazole und andere
aktivierte Ester gehören
zu Produkten, von denen bekannt ist, dass sie mit Aminfunktionen
reagieren.
-
Durch
Ersatz des N-terminalen Cysteins von Hedgehog mit bestimmten anderen
Aminosäuren
können andere
chemische Verfahren dazu herangezogen werden, einen hydrophoben
Rest an den N-Terminus zu addieren. Ein Beispiel besteht darin,
ein Serin oder Threonin an den N-Terminus zu bringen, diese Aminosäure unter
Bildung eines Aldehyds zu oxidieren und anschließend das Protein mit einem
chemischen Rest, der eine 1,2-Aminothiolstruktur aufweist (z. B.
einem Cystein), zu konjugieren. Ein zweites Beispiel besteht darin,
ein Histidin an den N-Terminus zu bringen, um es mit einer C-terminalen Thiocarbonsäure zu kuppeln.
-
Chemische Modifikation
von anderen Aminosäuren
-
Es
gibt spezielle chemische Verfahren zur Modifikation zahlreicher
weiterer Aminosäuren.
Daher besteht ein weiterer Weg zur Synthese einer aktiveren Form
von Hedgehog darin, einen hydrophoben Rest chemisch an eine Aminosäure im Hedgehog,
die sich vom N-terminalen Cystein unterscheidet, zu binden, Wenn eine
geeignete Aminosäure
nicht an der gewünschten
Position verfügbar
ist, kann eine ortsgerichtete Mutagenese dazu herangezogen werden,
die reaktive Aminosäure
an diese Stelle in der Hedgehog-Struktur
zu bringen, unabhängig
davon, ob es sich um den N- oder
C-Terminus oder um eine andere Position handelt. Zu reaktiven Aminosäuren gehören Cystein,
Lysin, Histidin, Asparaginsäure,
Glutaminsäure,
Serin, Threonin, Tyrosin, Arginin, Methionin und Tryptophan. Somit
lässt sich
das Ziel zur Schaffung einer stärker
hydrophoben Form von Hedgehog durch zahlreiche chemische Maßnahmen
erreichen. Wir möchten
nicht durch eine spezielle chemische Reaktion oder eine Modifikationsstelle
festgelegt werden, da unsere Ergebnisse die Allgemeingültigkeit
dieser Vorgehensweise stützen.
-
Das
Hedgehog-Polypeptid kann auf zahlreichen Wegen mit dem hydrophoben
Rest verknüpft
werden, wozu chemische Kupplungsverfahren oder gentechnische Manipulationen
gehören.
-
Beispielsweise
gibt es eine große
Anzahl von chemischen Vernetzungsmitteln, die dem Fachmann geläufig sind.
Erfindungsgemäß handelt
es sich bei den bevorzugten Vernetzungsmitteln um heterobifunktionelle Vernetzungsmittel,
die zur Verknüpfung
des Hedgehog-Polypeptids
und des hydrophoben Restes in einer stufenartigen Vorgehensweise
verwendet werden können.
Heterobifunktionelle Vernetzungsmittel eröffnen die Möglichkeit, spezifischere Kupplungsverfahren
zur Konjugation an Proteine zu konzipieren, wodurch das Auftreten
von unerwünschten
Nebenreaktionen, wie die Bildung von Protein-Homopolymeren verringert
wird. Aus dem Stand der Technik ist eine große Vielzahl von heterobifunktionellen
Vernetzungsmitteln bekannt. Hierzu gehören: Succinimidyl-4-(N-maleinimidomethyl)-cyclohexan-1-carboxylat (SMCC),
m-Maleinimidobenzoyl-N-hydroxysuccinimidester
(MBS); N-Succinimidyl-(4-iodacetyl)-aminobenzoat (SIAB), Succinimidyl-4-(p-maleinimidophenyl)-butyrat (SMPB), 1-Ethyl-3-(3-dimethylaminopropyl)-carbodiimid-hydrochlorid (EDC);
4-Succinimidyloxycarbonyl-α-methyl-α-(2-pyridyldithio)-toluol
(SMPT), N-Succinimidyl-3-(2-pyridyldithio)-propionat
(SPDP), Succinimidyl-6-[3-(2-pyridyldithio)-propionat]-hexanoat
(LC-SPDP). Vernetzungsmittel mit N-Hydroxysuccinimidresten lassen
sich als N-Hydroxysulfosuccinimid-Analoge erhalten, die im allgemeinen
eine größere Wasserlöslichkeit
aufweisen. Ferner lassen sich Vernetzungsmittel mit Disulfidbrücken innerhalb
der verknüpfenden
Kette anstelle der Alkylderivate herstellen, so dass der Anteil
der Linker-Spaltung in vivo verringert wird.
-
Zusätzlich zu
den heterobifunktionellen Vernetzungsmitteln gibt es eine Anzahl
von weiteren Vernetzungsmitteln, einschließlich homobifunktionelle und
photoreaktive Vernetzungsmittel. Disuccinimidylsuberat (DSS), Bismaleinimidohexan
(BMH) und Dimethylpimellinimidat·2 HCl (DMP) sind Beispiele
für geeignete
homobifunktionelle Vernetzungsmittel, Bis-[β-(4-azidosalicylamido)-ethyl]-disulfid (BASED)
und N- Succinimidyl-6-(4'-azido-2'-nitrophenylamino)-hexanoat
(SANPAH) sind Beispiele für
geeignete photoreaktive Vernetzungsmittel zur erfindungsgemäßen Verwendung.
Bezüglich
eines neueren Übersichtsartikels über Protein-Kupplungstechniken
wird auf Means et al., Bioconjugate Chemistry, Bd. 1 (1990), S.
2–12 (durch
Verweis aufgenommen) Bezug genommen.
-
Eine
besonders geeignete Klasse der vorstehend erwähnten heterobifunktionellen
Vernetzungsmittel enthält
die primäre
reaktive Aminogruppe N-Hydroxysuccinimid (NHS) oder das wasserlösliche Analoge
davon, nämlich
N-Hydroxysulfosuccinimid
(Sulfo-NHS). Primäre
Amine (Lysin-ε-gruppen) bei alkalischen pH-Werten
sind unprotoniert und reagieren durch nucleophilen Angriff auf NHS
oder Sulfo-NHS-ester.
Diese Umsetzung führt
zur Bildung einer Amidbindung und zur Freisetzung von NHS oder Sulfo-NHS
als Nebenprodukt.
-
Eine
weitere reaktive Gruppe, die als Teil eines heterobifunktionellen
Vernetzungsmittels geeignet ist, ist eine reaktive Thiolgruppe.
Zu üblichen
reaktiven Thiolgruppen gehören
Maleinimide, Halogene und Pyridyldisulfide. Maleinimide reagieren
spezifisch mit freien Sulfhydrylgruppen (Cysteinresten) innerhalb
von Minuten unter leicht sauren bis neutralen Bedingungen (pH-Wert 6,5–7,5). Halogene
(Iodacetylfunktionen) reagieren mit -SH-Gruppen bei physiologischen
pH-Werten. Diese beiden reaktiven Gruppen führen zur Bildung von stabilen
Thioetherbindungen.
-
Bei
der dritten Komponente des heterobifunktionellen Vernetzungsmittels
handelt es sich um einen Abstandshalterarm oder eine Brücke. Die
Brücke
stellt die Struktur dar, die die beiden reaktiven Enden verbindet.
Das offensichtlichste Merkmal der Brücke besteht in der Herbeiführung einer
sterischen Hinderung. In einigen Fällen kann eine längere Brücke leichter
den zur Verknüpfung
von zwei komplizierten Biomolekülen
erforderlichen Abstand überbrücken. Beispielsweise
weist SMPB eine Spanne von 14,5 Å auf.
-
Bei
der Herstellung von Protein-Protein-Konjugaten unter Verwendung
von heterobifunktionellen Reagenzien handelt es sich um ein zweistufiges
Verfahren unter Beteiligung einer Aminreaktion und einer Sulfhydrylreaktion.
Bei der ersten Stufe, nämlich
der Aminreaktion, soll das gewählte
Protein ein primäres
Amin enthalten. Dabei kann es sich um Lysin-ε-amine oder ein primäres -α-Amin handeln,
das am N-Terminus der meisten Proteine auftritt. Dieses Protein
soll keine freien Sulfhydrylgruppen enthalten. Sofern beide, miteinander
zu konjugierende Proteine freie Sulfhydrylgruppen enthalten, kann
ein Protein so modifiziert werden, dass sämtliche Sulfhydrylgruppen blockiert
sind, wozu man beispielsweise N-Ethylmaleinimid verwendet (vergl. Partis
et al., J. Pro. Chem., Bd. 2 (1983), S. 263, durch Verweis aufgenommen).
Das Ellman-Reagenz kann zur Berechnung der Menge der Sulfhydrylgruppen
in einem bestimmten Protein verwendet werden (vergl. z. B. Ellman
et al., Arch. Biochem. Biophys., Bd. 74 (1958), S. 443, und Riddles
et al., Anal. Biochem., Bd. 94 (1979), S. 75, durch Verweis aufgenommen).
-
Der
Reaktionspuffer soll frei von fremden Aminen und Sulfhydrylen sein.
Der pH-Wert des Reaktionspuffers soll 7,0–7,5 betragen. Dieser pH-Bereich
verhindert die Umsetzung von Maleinimidgruppen mit Aminen, so dass
die Maleinimidgruppe für
die zweite Umsetzung mit Sulfhydrylen bewahrt wird. Die NHS-Ester enthaltenden
Vernetzungsmittel weisen eine begrenzte Wasserlöslichkeit auf. Sie sind in
einer möglichst
geringen Menge eines organischen Lösungsmittels (DMF oder DMSO)
vor Einführung
des Vernetzungsmittels in das Reaktionsgemisch zu lösen. Das
Vernetzungsmittel/Lösungsmittel
bildet eine Emulsion, die den Ablauf der Umsetzung ermöglicht.
-
Die
Sulfo-NHS-esteranalogen sind stärker
wasserlöslich
und können
direkt dem Reaktionspuffer zugesetzt werden. Puffer von hoher Ionenstärke sind
zu vermeiden, da sie tendenziell zu einem "Aussalzen" der Sulfo-NHS-ester führen. Um
einen Verlust an Reaktivität
aufgrund von Hydrolyse zu vermeiden, wird das Vernetzungsmittel
dem Reaktionsgemisch unmittelbar nach Bildung der Proteinlösung zugesetzt.
-
Die
Umsetzungen können
in konzentrierten Proteinlösungen
wirksamer vorgenommen werden. Je stärker alkalisch der pH-Wert
des Reaktionsgemisches ist, desto rascher läuft die Reaktion ab. Die Geschwindigkeit
der Hydrolyse der NHS- und Sulfo-NHS-ester nimmt auch mit steigendem
pH-Wert zu. Höhere
Temperaturen erhöhen
die Reaktionsgeschwindigkeiten sowohl der Hydrolyse als auch der
Acylierung.
-
Nachdem
die Umsetzung beendet ist, wird das erste Protein mit einem reaktiven
Sulfhydrylrest aktiviert. Das aktivierte Protein kann aus dem Reaktionsgemisch
durch einfache Gelfiltration oder Dialyse isoliert werden. Zur Durchführung der
zweiten Stufe der Vernetzung, der Sulfhydrylreaktion, muss die für die Umsetzung
mit Maleinimiden, aktivierten Halogenen oder Pyridyldisulfiden gewählte lipophile
Gruppe eine freie Sulfhydrylgruppe aufweisen. Alternativ kann ein
primäres
Amin unter Addition einer Sulfhydrylgruppe modifiziert werden.
-
In
sämtlichen
Fällen
ist der Puffer zu entgasen, um eine Oxidation von Sulfhydrylgruppen
zu vermeiden. EDTA kann zur Chelatbildung etwaiger oxidierender
Metalle, die im Puffer enthalten sein können, zugesetzt werden. Puffer
sollen frei von jeglichen sulfhydrylhaltigen Verbindungen sein.
-
Maleinimide
reagieren spezifisch mit -SH-Gruppen im leicht sauren bis neutralen
pH-Bereich (6,5–7,5).
Ein neutraler pH-Wert reicht für
Umsetzungen unter Beteiligung von Halogenen und Pyridyldisulfiden aus.
Unter diesen Bedingungen reagieren Maleinimide im allgemeinen mit
-SH-Gruppen innerhalb
von Minuten. Längere
Reaktionszeiten sind für
Halogene und Pyridyldisulfide erforderlich.
-
Das
bei der Aminreaktionsstufe hergestellte erste sulfhydrylreaktive
Protein wird unter geeigneten Pufferbedingungen mit der sulfhydrylhaltigen
lipophilen Gruppe vermischt. Die Konjugate können aus dem Reaktionsgemisch
durch Verfahren, wie Gelfiltration, oder durch Dialyse isoliert
werden.
-
Nachstehend
sind Beispiele für
aktivierte lipophile Reste für
die Konjugation aufgeführt:
N-(1-Pyren)-maleinimid;
2,5-Dimethoxystilben-4'-maleinimid;
Eosin-5-maleinimid;
Fluorescein-5-maleinimid; N-(4-(6-Dimethylamino-2-benzofuranyl)-phenyl)-maleinimid;
Benzophenon-4-maleinimid; 4-Dimethylaminophenylazophenyl-4'-maleinimid (DABMI), Tetramethylrhodamin-5-maleinimid,
Tetramethylrhodamin-6-maleinimid, RhodaminrotR-C2-maleinimid, N-(5-Aminopentyl)-maleinimid,
Trifluoressigsäuresalz,
N-(2-Aminoethyl)-maleinimid, Trifluoressigsäuresalz, OregongrünR-488-maleinimid, N-(2-((2-(((4-Azido-2,3,5,6-tetrafluor)-benzoyl)-amino)-ethyl)-dithio)-ethyl)-maleinimid
(TFPAM-SS1), 2-(1-(3-Dimethylaminopropyl)-indol-3-yl)-3-(indol-3-yl)-maleinimid-(bisindolylmaleinimid;
GF 109203X), BODIPYR FL-N-(2-Aminoethyl)-maleinimid,
N-(7-Dimethylamino-4-methylcumarin-3-yl)-maleinimid (DACM), AlexaR 488 C5-maleinimid, AlexaR 594C5-maleinimid,
Natriumsalz-N-(1-pyren)-maleinimid, 2,5-Dimethoxystilben-4'-maleinimid, Eosin-5-maleinimid, Fluorescein-5-maleinimid,
N-(4-(6-Dimethylamino-2-benzofuranyl)-phenyl)-maleinimid,
Benzophenon-4-maleinimid, 4-Dimethylaminophenylazophenyl-4'-maleinimid, 1-(2-Maleinimidylethyl)-4-(5-(4-methoxyphenyl)-oxazol-2-yl)-pyridiniummethansulfonat,
Tetramethylrhodamin-5-maleinimid, Tetramethylrhodamin-6-maleinimid,
RhodaminrotR-C2-maleinimid, N-(5-Aminopentyl)-maleinimid,
N-(2-Aminoethyl)-maleinimid, N-(2-((2-(((4-Azido-2,3,5,6-tetrafluor)-benzoyl)-amino)-ethyl)-dithio)-ethyl)-maleinimid,
2-(1-(3-Dimethylaminopropyl)-indol-3-yl)-3-(indol-3-yl)-maleinimid,
N-(7-Dimethylamino-4-methylcumarin-3-yl)-maleinimid (DACM), 11H-Benzo[a]fluoren,
Benzo[a]pyren.
-
In
einer Ausführungsform
kann das Hedgehog-Polypeptid unter Verwendung von Pyrenmaleinimid
derivatisiert werden, das von der Fa. Molecular Probes (Eugene,
Oreg.) erhältlich
ist, z. B. N-(1-Pyren)-maleinimid oder 1-Pyrenmethyliodacetat (PMIA-Ester). Wie
in 1 dargestellt, wies das von Pyren abgeleitete Hedgehog-Protein ein Aktivitätsprofil
auf, das zeigte, dass es nahezu um zwei Größenordnungen aktiver als die
unmodifizierte Form des Proteins war.
-
B. Herstellung von hydrophoben
Peptidderivaten
-
Erfindungsgemäß kann das
Protein auch unter Verwendung eines hydrophoben Peptids modifiziert werden.
Der hier verwendete Ausdruck "Peptid" umfasst eine Sequenz
von mindestens einem Aminosäurerest.
Vorzugsweise weist das Peptid eine Länge zwischen 1 Aminosäure und
18–26
Aminosäuren
auf, wobei der letztgenannte Bereich die typische Länge eines
membranüberspannenden
Segments eines Proteins darstellt. Um ein Peptid mit hydrophobem
Charakter zu erzeugen, werden die Aminosäuren vorwiegend unter den folgenden
hydrophoben Aminosäuren
ausgewählt:
Phenylalanin, Isoleucin, Leucin, Valin, Methionin, Tryptophan, Alanin,
Prolin und Tyrosin. Das hydrophobe Peptid kann auch nicht-natürliche Aminosäureanaloge
mit hydrophobem Charakter oder D-Aminosäuren, Peptoidbindungen, eine
N-terminale Acetylierung oder andere Merkmale aufweisen, die die
Empfindlichkeit des Peptids gegenüber einer Proteolyse verringern.
Verfahren zur Substitution mit nicht-natürlichen
Aminosäuren
an speziellen Stellen in Proteinen sind bekannt (78, 79).
-
Im
allgemeinen wird ein hydrophobes Peptid an verschiedene Stellen
eines Proteins angeheftet. Bei einer Stelle kann es sich um den
N-terminalen Rest handeln. Alternativ wird das hydrophobe Peptid
an die Stelle des N-terminalen
Restes gesetzt. Bei einer weiteren Ausführungsform wird ein hydrophobes
Peptid an den C-Terminus
des Proteins angeheftet. Alternativ kann das hydrophobe Peptid an
die Stelle des C-terminalen Restes gesetzt werden. Beim C-Terminus
kann es sich um die native C-terminale Aminosäure handeln, es kann sich aber
auch um den C-Terminus eines gekürzten
Proteins handeln, so dass das hydrophobe Peptid an die endgültige, C-terminale
Aminosäure
der gekürzten
Form, die immer noch als "C-Terminus" bezeichnet wird,
angeheftet wird. Ein gekürztes Hedgehog-Protein
behält
seine Aktivität,
wenn bis zu 11 Aminosäuren
von der nativen C-terminalen Sequenz deletiert werden. Das hydrophobe
Peptid kann auch zwischen dem N-terminalen
Rest und dem internen Rest unmittelbar neben dem N-terminalen Rest
oder zwischen dem C-terminalen Rest und dem unmittelbar neben dem
C-terminalen Rest liegenden Rest oder auch zwischen zwei interne
Reste eingeführt
werden.
-
In
bestimmten Ausführungsformen
handelt es sich beim lipophilen Rest um ein amphipathisches Polypeptid,
wie Magainin, Cecropin, Attacin, Melittin, Gramicidin S, alpha-Toxin von Staph.
aureus, Alamethicin oder ein synthetisches amphipathisches Polypeptid.
Fusogene Überzugsproteine
aus viralen Teilchen können ebenfalls
eine zweckmäßige Quelle
für amphipathische
Sequenzen für
die vorliegenden Hedgehog-Proteine darstellen.
-
C. Herstellung von Lipidderivaten
-
Eine
weitere Form eines von der Erfindung umfassten Hedgehog-Proteins
ist ein Protein, das mit einer Vielzahl von Lipidresten derivatisiert
ist. Im allgemeinen handelt es sich bei einem "Lipid" um ein Mitglied einer heterogenen Klasse
von hydrophoben Substanzen, die durch eine variable Löslichkeit
in organischen Lösungsmitteln
und großenteils
durch ihre Unlöslichkeit
in Wasser charakterisiert sind. Die Hauptklasse von Lipiden, die
unter die vorliegende Erfindung fallen, sind Fettsäuren und
Sterole (z. B. Cholesterol). Erfindungsgemäße derivatisierte Proteine
enthalten Fettsäuren,
bei denen es sich um cyclische, acyclische (d. h. geradkettige,
gesättigte
oder ungesättigte)
Monocarbonsäuren
handelt. Beispielsweise weisen gesättigte Fettsäuren die
folgende allgemeine Formel auf: CH
3(CH
2)
nCOOH. In der nachstehenden
Tabelle sind Beispiele für
einige Fettsäuren
aufgeführt,
die in zweckmäßiger Weise
unter Anwendung herkömmlicher
chemischer Verfahren derivatisiert werden können. Tabelle
2 Beispiele
für gesättigte und
ungesättigte
Fettsäuren Gesättigte Säuren: CH
3(CH
2)
nCOOH
| Wert
von n | Bezeichnung |
| 2 | Buttersäure |
| 4 | Capronsäure |
| 6 | Caprylsäure |
| 8 | Caprinsäure |
| 10 | Laurinsäure |
| 12 | Myristinsäure* |
| 14 | Palmitinsäure* |
| 16 | Stearinsäure* |
| 18 | Arachidinsäure* |
| 20 | Behensäure |
| 22 | Lignocerinsäure |
ungesättigte Säuren
| CH3CH=CHCOOH | Crotonsäure |
| CH3(CH2)3CH=CH(CH2)7COOH | Myristolsäure |
| CH3(CH2)5CH=CH(CH2)7COOH | Palmitolsäure |
| CH3(CH2)7CH=CH(CH2)7COOH | Ölsäure |
| CH3(CH2)3(CH2CH=CH)2(CH2)7COOH | Linolsäure |
| CH3(CH2CH=CH)3(CH2)7COOH | Linolensäure |
| CH3(CH2)3(CH2CH=CH)4(CH2)3COOH | Arachidonsäure |
-
Der
Stern (*) bezeichnet die Fettsäuren,
von denen wir feststellten, dass sie in rekombinantem Hedgehog-Protein
aus einem löslichen
Konstrukt sezerniert wurden.
-
Zu
weiteren Lipiden, die an das Protein angeheftet werden können, gehören verzweigtkettige
Fettsäuren
und solche der Phospholipidgruppe, wie Phosphatidylinosite (d. h.
Phosphatidylinosit-4-monophosphat und Phosphatidylinosit-4,5-biphosphat),
Phosphatidylcholin, Phosphatidylethanolamin, Phosphatidylserin und Isoprenoide,
wie Farnesyl oder Geranylgruppen.
-
Wir
haben nachgewiesen, dass lipidmodifizierte Hedgehog-Proteine entweder
aus einer natürlichen Quelle
gereinigt werden können
oder durch chemische Modifikation des löslichen, nicht-modifizierten
Proteins erhalten werden können.
Für ein
aus einer natürlichen
Quelle gereinigtes Protein haben wir gezeigt, dass dann, wenn humanes
Sonic-Hedgehog (Shh)
von voller Länge
in Insektenzellen exprimiert wurde und membrangebundenes Shh, das
aus den mit Detergens behandelten Zellen unter Kombination einer
SP-Sepharose-Chromatographie
und einer Immunoaffinitätschromatographie
gereinigt wurde, das gereinigte Protein an reduzierenden SDS-PAGE-Gelen
als eine einzige scharfe Bande mit einer scheinbaren Masse von 20
kDa wanderte (vergl. Beispiel 1). Die löslichen und membrangebundenen
Shh-Proteine waren durch Umkehrphasen-HPLC leicht unterscheidbar, wo die gebundenen
Formen im Acetonitrilgradienten später eluiert wurden (vergl.
Beispiel 1 und 3). Wir zeigten anschließend, dass
humanes Sonic-Hedgehog an Zellmembranen in zwei Formen gebunden
ist, nämlich
eine Form, die ein Cholesterol enthält und daher analog zu den
früher für Drosophila-Hedgehog berichteten
Daten ist (18), und eine zweite neue Form, die sowohl eine Cholesterol- als
auch eine Palmitinsäure-Modifikation
enthält.
Lösliche
und gebundene Formen von Shh wurden durch Elektrospray-Massenspektrometrie
unter Verwendung eines Dreifachquadrupol-Massenspektrometers, der mit
einer Elektrospray-Ionenquelle ausgerüstet war (Beispiel 1), wie
auch durch Flüssigchromatographie-Massenspektrometrie
(vergl. Beispiel 1) analysiert. Die Identität des N-terminalen Peptids aus mit Endoproteinase-Lys-C
verdautem, gebundenem Shh wurde durch MALDI-PSD-massenspektrometrische
Messung an einem MALDI-Flugzeit-Massenspektrometer bestätigt. Die
Palmitoylierungsstelle wurde durch eine Kombination von Peptidkartierung
und Sequenzanalyse identifiziert. Sie befindet sich am N-Terminus
des Proteins (Rest 1 der Sequenz des reifen Proteins in SEQ ID NOS:
1–4).
Beide gebundenen Formen waren beim C3H10T1/2-alkalischen Phosphatasetest gleichermaßen aktiv,
waren aber interessanterweise beide etwa 30-fach stärker wirksam
als lösliches
humanes Shh, bei dem keine Bindung vorliegt. Die Lipidmodofikationen
beeinflussten nicht in signifikanter weise die scheinbare Bindungsaffinität von Shh
für seinen
Rezeptor, "Patched" (7).
-
Wir
testeten anschließend
die Eignung der derivatisierten Formen zum Testen der relativen
Wirkungsstärken
von löslichem
und gebundenem Shh allein oder in Gegenwart des anti-Hedgehog-neutralisierenden Mab5E1
an C3H10T1/2-Zellen zur Messung der Induktion von alkalischer Phosphatase.
Außerdem
wurde die relative Wirkungsstärke
von löslichem
und gebundenem Shh zur Bindung an "Patched" unter Verwendung von "Patched"-transfizierten EBNA-293-Zellen
durch FACS-Analyse bestimmt (Beispiel 3).
-
Für lipidmodifiziertes
Hedgehog, das durch chemische Modifikation des löslichen, nicht-modifizierten Proteins
erhalten wurde, zeigten wir, dass Palmitinsäure und andere Lipide an lösliches
Shh unter Erzeugung von lipidmodifizierten Formen mit einer erhöhten Wirkungsstärke beim
C3H10T1/2-Test addiert werden können
(Beispiel 8). Wir zeigten (Beispiele 1, 2 und 8), dass das Thiol
und α-Amin
am N-terminalen Cystein zur Lipid-Derivatisierungsreaktion beiträgt. Ohne
Festlegung auf eine bestimmte Theorie wird angenommen, dass die
Lipid-Modifikation an Proteinen mit der Bildung eines Thioester-Zwischenprodukts
beginnt und der Lipidrest anschließend auf das α-Amin des
N-Terminus unter Bildung eines cyclischen Zwischenprodukts übertragen
wird. Im allgemeinen kann daher der reaktive Lipidrest in Form von
Thioestern von gesättigten
oder ungesättigten
Carbonsäuren,
wie Coenzym A-thioestern vorliegen. Derartige Materialien und ihre
Derivate umfassen beispielsweise handelsübliche Coenzym A-Derivate,
wie Palmitoleoyl-coenzym A, Arachidoyl-coenzym A, Arachidonoyl-coenzym
A, Lauroyl-coenzym
A und dergl. Diese Materialien können
leicht von der Fa. Sigma Chemical Company (St. Louis, MO, 1998-Katalog, S. 303–306) bezogen
werden.
-
Der
Einfluss von verschiedenen Lipidresten auf die funktionelle Aktivität von Hedgehog-Protein
wurde getestet (vergl. Beispiel 8 und 10 und 11).
Gleichermaßen
lässt sich
der Einfluss verschiedener Lipidreste auf die funktionelle Aktivität anderer
Proteine, wie sie beispielsweise im vorstehenden Abschnitt III beschrieben
wurden, in zweckmäßiger Weise
unter Anwendung von dem Fachmann geläufigen Verfahren testen. Beispielsweise
lassen sich funktionelle Tests von Gelsolin (50), verschiedener
Interferone (Interferon-α,
Interferon-β und
Interferon-γ),
verschiedener Interleukine (z. B. IL-1, -2, -3, -4 und dergl.),
der Tumornekrosefaktoren α und β und anderer
Wachstumsfaktoren, die erfindungsgemäß lipidmodifiziert sind, unter
Anwendung von bekannten Verfahren durchführen.
-
Obgleich
wir chemische Mittel bereitgestellt haben, mit denen eine Fettsäure an das
N-terminale Cystein von Hedgehog-Proteinen angeheftet werden kann,
ist zu erwarten, dass Lipide an die gleichen oder andere Stellen
unter Anwendung enzymatisch katalysierter Reaktionen angeheftet
werden können.
Die Palmitoylierung von Proteinen wird in vivo durch eine Klasse
von Enzymen katalysiert, die als Palmitoyl-CoA:Protein-S-palmitoyltransferasen
bekannt sind. Unter Verwendung von gereinigten Enzymen wurde eine
in vitro-Acylierung von Proteinsubstraten dargelegt (80, 81). Die
Substratspezifitäten
der Palmitoyltransferase-Enzyme sind nicht gut definiert; eine Analyse
von Palmitoylierungsstellen von zellulären und viralen Proteinen hat
nur wenig Bedeutung bezüglich
der Konsensus-Sequenz,
die den modifizierten Cysteinrest umgibt, lässt aber auf die gemeinsame
Anwesenheit eines Lysin- oder Argininrestes innerhalb von zwei Aminosäuren, nämlich Cystein
und großen,
hydrophoben Aminosäuren
in der Nähe
des Cysteins schließen.
Die aminoterminale Sequenz von Shh CGPGRGFG passt möglicherweise
zu dieser Konsensus-Sequenz und kann als Erkennungsstelle für die Palmitoylierung
dienen.
-
Als
Alternative kann eine Myristoylierung des Aminoterminus von Hedgehog-Proteinen
durchgeführt werden,
indem man eine N-Myristoyl-transferase (NMT) verwendet, von denen
eine Anzahl sowohl in Säugetieren
(82) als auch in Hefe (83) gut charakterisiert worden ist. Eine
Erkennungsstelle für
N-Myristoyl-transferase kann gentechnisch in die N-terminale Hedgehog-Sequenz
eingeführt werden,
um die Erkennung durch das Enzym zu erleichtern. Beide Strategien
erfordern die Verwendung von Fettsäureacyl-coenzym A-derivaten als
Substraten, wie sie für
die nicht-enzymatische Fettsäureacylierung
von humanem Sonic-Hedgehog gemäß Beispiel
8 verwendet werden. Alternativ kann ein Protein mit einer gentechnisch
konstruierten Erkennungssequenz während der Expression in einer
geeigneten Zelllinie myristoyliert werden. Ein weiteres Verfahren
zum Modifizieren eines Proteins, wie Hedgehog, mit einem hydrophoben
Rest besteht in der Erzeugung einer Erkennungsstelle für die Addition
einer Isoprenoid-Gruppe am C-Terminus des Proteins. Die Erkennungsstelle für die Addition
von Farnesyl und Geranyl-geranyl
ist bekannt und das Protein kann während der Expression in einer
eukaryontischen Zelle modifiziert werden (Gelb et al., Cur. Opin.
Chem. Biol., Bd. 2 (1998), S. 40–48).
-
VI. Multimere Proteinkomplexe
-
Die
hier beschriebenen modifizierten Hedgehog-Proteine eignen sich besonders
zur Bildung von multimeren Proteinkomplexen. Zu erfindungsgemäßen multimeren
Proteinkomplexen gehören
Proteine, die gegebenenfalls über
ihren hydrophoben Rest (z. B. ein Lipid) an eine Vesikel gebunden
sind. Bei der Vesikel kann es sich um eine natürlich vorkommende biologische
Membran, die von natürlichem
Material gereinigt worden ist, handeln, oder die Vesikel kann auf
synthetischem Wege konstruiert werden. Bei bevorzugten Vesikeln
handelt es sich im wesentlichen um sphärische Strukturen, die aus
amphiphilen Produkten, z. B. Tensiden oder Phospholipiden, hergestellt
worden sind. Die Lipide dieser sphärischen Vesikel sind im allgemeinen
in Form von Lipiden mit einer oder mehreren Strukturschichten organisiert,
z. B. in Form von multilamellaren Vesikeln (mehrfache, zwiebelartige
Schalen von Lipid-Doppelschichten,
die zwischen den Doppelschichten ein wässriges Volumen einschließen) oder
Mizellen.
-
Insbesondere
handelt es sich bei Liposomen um kleine, sphärische Vesikel, die primär aus verschiedenen
Lipiden und Phospholipiden und sekundär aus lipophilen Komponenten
zusammengesetzt sind. Diese Komponenten sind normalerweise in einer
Doppelschichtformation angeordnet, ähnlich der Lipidanordnung von
biologischen Membranen.
-
Typischerweise
steht das polare Ende eines Lipidbestandteils oder eines lipidartigen
Moleküls
in Kontakt mit der umgebenden Lösung, üblicherweise
einer wässrigen
Lösung,
während
das nicht-polare, hydrophobe Ende des Lipids oder lipidartigen Moleküls in Kontakt
mit dem nicht-polaren, hydrophoben Ende eines weiteren Lipids oder
lipidartigen Moleküls
steht. Die sich ergebende Doppelschichtmembran (d. h. Vesikel) ist
selektiv für
Moleküle
einer bestimmten Größe, hydrophoben
Beschaffenheit, Gestalt und Nettoladung durchlässig. Die meisten Vesikel sind
von Lipidnatur oder lipidartiger Natur, obgleich auch alternative
Liposomen-Doppelschichtzubereitungen,
die ein Tensid mit einem Lipid oder einem Cholesterol umfassen,
existieren.
-
Liposomen-Vesikel
können
insofern besonders bevorzugt sein, als sie zahlreiche therapeutische,
diagnostische, industrielle und gewerbliche Anwendungen finden.
Sie werden zur Abgabe von Molekülen
verwendet, die nicht leicht in Wasser löslich sind, oder wenn eine
zeitlich abgestimmte Freisetzung angestrebt wird. Aufgrund ihrer
selektiven Permeabilität
gegenüber
zahlreichen chemischen Verbindungen eignen sich Liposomen als Abgabeträger für Arzneistoffe
und biologische Materialien. Somit lassen sich lipidderivatisierte
Proteine, wie Hedgehog, als Multimere gestalten, indem man sie der
Lipiddoppelschicht von Liposomen-Vesikeln einverleibt. Beim Erreichen
der Zielstelle können
die Liposomen abgebaut werden (beispielsweise durch Enzyme im Magendarmtrakt)
oder sie können
mit Membranen von Zellen fusionieren.
-
Es
sind verschiedene Verfahren zur Herstellung von Vesikeln, z. B.
Liposomen, bekannt. Die Herstellung von Phospholipid-Vesikeln ist
bekannt (53). Bezüglich
einer allgemeinen Übersicht über herkömmlicherweise
verwendete Verfahren wird auf (54) verwiesen. Darunter sind folgende Verfahren
besonders gebräuchlich:
(1) Ultraschallbehandlung einer Lösung mit einem Gehalt an Lipiden,
wonach sich gelegentlich eine Verdampfung/Lyophilisation und Rehydratisierung
anschließen
(vergl. z. B. Stryer, Biochemistry, Freeman & Co., New York, (1988), S. 290–291; und
(55)); (2) Homogenisierung einer Lipidlösung, gelegentlich bei hohem Druck
oder unter hoher Scherkraft (vergl. z. B. US-Patent 4 743 449, Ausgabetag
10. Mai 1988, und US-Patent 4 753 788, Ausgabetag 28. Juni 1988);
(3) Hydratisierung und gelegentlich Ultraschallbehandlung eines
getrockneten Films von vesikelbildenden Lipiden, wobei der Lipidfilm
durch Eindampfen einer Lösung
von Lipiden in einem organischen Lösungsmittel hergestellt wird
(vergl. z. B. US-Patent 4 452 747, Ausgabetag 5. Juni 1984, US-Patent
4 895 719, Ausgabetag 23. Januar 1990, und US-Patent 4 946 787,
Ausgabetag 7. August 1990); (4) Lyophilisierung unter Eindampfung
und Rehydratisierung (vergl. z. B. US-Patent 4 897 355, Ausgabetag 30. Januar
1990, EP-267 050, veröffentlicht
am 5. November 1988, US-Patent 4 776 991, Ausgabetag 11. Oktober
1988, EP-172 007, veröffentlicht
am 19. Februar 1986, und australische Patentanmeldung AU-A-48713/85, veröffentlicht
am 24. April 1986); (5) Lösungsmittelinjektion
oder -infusion einer Lipidlösung
in ein wässriges
Medium oder umgekehrt (vergl. z. B. (56); US-Patent 4 921 757, Ausgabetag 1. Mai
1990, US-Patent 4 781871, Ausgabetag 1. November 1988, WO-87/02396,
veröffentlicht
am 24. März
1988, und US-Patent 4 895 452, Ausgabetag 23. Januar 1990); (6)
Sprühtrocknung
(vergl. z. B. australische Patentanmeldung AU-A-48713/85, veröffentlicht
am 24. April 1986, und US-Patent 4 830 858, Ausgabetag 16. Mai 1989);
(7) Filtration (vergl. z. B. WO-85/01161),
(8) Umkehrphaseneindampfung (vergl. z. B. (57)); und (9) Kombinationen
der vorstehenden Verfahren (vergl. z. B. (58) und (59)).
-
Zu
bevorzugten Lipiden und lipidartigen Bestandteilen, die sich zur
Herstellung von Vesikeln eignen, gehören Phospholipide, ein Gemisch
von Phospholipiden, polaren Lipiden, neutralen Lipiden, Fettsäuren und ihren
Derivaten.
-
Ein
bevorzugtes Lipid ist so beschaffen, dass es bei alleiniger Dispersion
in Wasser bei einer Temperatur über
der Lipid-Übergangstemperatur
in einer Lipid-Emulsionsphase vorliegt. Bei bestimmten Ausführungsformen
handelt es sich beim Lipid um eine einzelne aliphatische Kette mit
mehr als etwa 12 Kohlenstoffatomen, die entweder gesättigt oder
ungesättigt
sein kann oder auf andere Weise substituiert sein kann. Zu geeigneten
Lipiden gehören
die Ester-, Alkohol- und Säureformen
der folgenden Fettsäuren:
Stearat, Ölsäure, Linolsäure, Arachidat,
Arachidonsäure
und andere einzelkettige aliphatische Säuren. Zu weiteren Kandidaten gehören die
Ester-, Alkohol- und Säureformen
der Retinole, insbesondere Retinol und Retinoesäure. Zu weiteren bevorzugten
Lipiden gehören
Phosphatidylcholin (PC), Phosphatidylglycerin (PG) und deren Derivate, die
synthetisch erzeugt oder aus einer Vielzahl natürlicher Quellen abgeleitet
werden.
-
Bei
bestimmen Ausführungsformen
kann die Vesikel sterisch durch Einverleibung von Polyethylenglykol
(PEG) oder durch PEG-Kopfgruppen eines synthetischen Phospholipids
(PEG konjugiert an Distearoyl-Phosphatidylethanolamin
(DSPE) stabilisiert sein; vergl. z. B. (61)). Bevorzugte Tenside
sind solche mit guter Mischbarkeit, z. B. TweenR,
TritonR, Natriumdodecylsulfat (SDS), Natriumlaurylsulfat
oder Natriumoctylglycosid.
-
Bevorzugte
Tenside bilden bei Zugabe zu wässrigen
Lösungen
oberhalb der Phasenübergangstemperatur
des Tensids Mizellen. Die Tenside können aus einer oder mehreren
aliphatischen Ketten zusammengesetzt sein. Diese aliphatischen Ketten
können
gesättigt,
ungesättigt
oder anderweitig substituiert sein, z. B. durch Ethoxylierung. Typischerweise
enthält
die aliphatische Kette mehr als etwa 12 Kohlenstoffatome. Nachstehend
sind weitere geeignete Tenside aufgeführt: Lauryl-, Myristyl-, Linoleyl-
oder Stearylsulfobetain; Lauryl-, Myristyl-, Linoleyl- oder Stearylsarcosin;
Linoleyl-, Myristyl- oder Cetylbetain; Lauroamidopropyl-, Cocamidopropyl-,
Linolamidopropyl-, Myristamidopropyl-, Palmidopropyl- oder Isostearamidopropylbetain
(z. B. Lauroamidopropyl); Myristamidopropyl-, Palmidopropyl- oder
Isostearamidopropyldimethylamin; Natriummethylcocoyl- oder Dinatriummethyloleyltaurat;
und die MONAQUAT-Reihe (Mona Industries, Inc., Paterson, N.J.);
vergl. auch Beispiel 4.
-
Zu
bevorzugten Sterolen und Sterolestern, die sich zur Verwendung bei
der Herstellung von multimeren Proteinkomplexen eignen, gehören Cholesterol,
Cholestanol, Cholesterolsulfat und andere Cholesterol-Analoge und
Derivate. Die Tatsache, dass eine Vesikel zahlreiche unterschiedliche
Lipide und Tenside umfassen kann, ermöglicht eine hohe Flexibilität bei der
Konstruktion eines gebundenen Protein-Vesikel-Komplexes mit erwünschten
Eigenschaften. Beispielsweise kann man Vesikel herstellen, die eine
unterschiedliche Anzahl von Proteinen binden, indem man die Lipidzusammensetzung
der Ausgangsmaterialien variiert, um größere Vesikel zu schaffen, oder
indem man den prozentualen Anteil der Phosphatidylinosit-lipide
in der Vesikel erhöht.
-
VII: Anwendungsmöglichkeiten
-
Im
allgemeinen eignen sich die hier beschriebenen modifizierten Proteine
zur Behandlung der gleichen medizinischen Zustände, die mit den nicht-modifizierten
Formen der Hedgehog-Proteine behandelt werden können. Jedoch bieten die hier
beschriebenen, hydrophob modifizierten Proteine mehrere erhebliche
Verbesserungen gegenüber
den nicht-modifizierten Formen. Erstens ermöglicht die erhöhte Wirkungsstärke eine Behandlung
mit geringeren Proteinmengen und über kürzere Zeiträume. Dies ist sowohl bei systemischen
als auch bei ZNS-Anwendungen von Bedeutung. Zweitens ermöglicht der
Ersatz des N-terminalen
Cysteins durch eine chemisch weniger reaktive Aminosäure eine
leichtere Herstellung, Zubereitung und Lagerung eines Proteins für die klinische
Verwendung. Drittens werden die pharmakodynamischen Eigenschaften
eines Proteins durch eine hydrophobe Modifikation verändert, was
es ermöglicht,
die Proteine in der Nähe
der Verabreichungsstelle zu lokalisieren, wodurch ihre Sicherheit
unter Minimierung der systemischen Belastung erhöht wird und ihre Wirksamkeit
durch Erhöhung
der lokalen Konzentration gesteigert wird. Die erfindungsgemäßen Proteine
eignen sich auch in diagnostischen Zusammensetzungen und Verfahren
zum Nachweis ihrer entsprechenden Rezeptoren.
-
Als
ein Beispiel für
den ersten Sachverhalt wurde festgestellt, dass die Halbwertszeit
von Hedgehog nach systemischer Anwendung sehr gering ist und dass
mehrfache Injektionen erforderlich sind, um eine robuste Reaktion
auf das Protein zu erreichen. Die höhere Wirkungsstärke der
modifizierten Formen und die Möglichkeit
der Zubereitung in Liposomen bietet ein Mittel, eine Reaktion mit
weniger Behandlungen zu erreichen. Für ZNS-Anwendungen bietet die
höhere
Wirkungsstärke
ein Mittel, eine angemessene Proteinmenge in den kleinen Volumina,
die für
eine direkte Injektion für
das ZNS erforderlich sind, zuzuführen.
-
Die
Bedeutung des zweiten Sachverhalts wird durch die Tatsache erläutert, dass
wir festgestellt haben, dass das N-terminale Cystein von Hedgehog
hochgradig gegenüber
einem chemischen Angriff empfindlich ist, entweder unter Bildung
von anderen chemischen Addukten oder unter oxidativer Dimerisierung
mit einem anderen Hedgehog-Protein. Um dies zu verhindern, werden
während
der Reinigung spezielle Puffer und Verfahren angewendet und Dithiothreit
wird in der endgültigen
Zubereitung eingesetzt. Diese Vorsichtsmaßnahmen erfordern eine sorgfältige Bewertung
der Einflüsse
des Zubereitungspuffers in Tiermodellen.
-
Ein
Beispiel für
den dritten Sachverhalt besteht darin, dass der Bereich, in dem
das Protein von der Verabreichungsstelle weg diffundiert, um so
begrenzter ist, je höher
die lokale Konzentration ist. Diese höhere lokale Konzentration kann
daher spezifischere klinische Reaktionen während der Behandlung von neurologischen
Störungen
nach einer direkten Injektion in den erwünschten Bereich des Gehirns
oder des Rückenmarks
ermöglichen.
-
Gleichermaßen können die
modifizierten Proteine lokal verabreicht werden, und zwar an den
Ort von Knochenbrüchen, um
die Heilung der Frakturen zu unterstützen, in die Gonaden, um Fertilitätsstörungen zu behandeln,
intraokular, um Augenstörungen
zu behandeln, und unter die Haut, um dermatologische Zustände zu behandeln
und um das lokale Haarwachstum zu stimulieren. Eine Lokalisierung
der hydrophob modifizierten Proteine an der verabreichungsstelle
verringert daher eine mögliche
unerwünschte
systemische Belastung anderer Gewebe und Organe.
-
Für die therapeutische
Anwendung werden die erfindungsgemäßen, hydrophob modifizierten
Proteine in die Form von pharmazeutisch verträglichen, sterilen, isotonen
Zubereitungen gebracht und gegebenenfalls durch auf dem einschlägigen Gebiet
bekannte, übliche
Mittel verabreicht. Die Zubereitung ist vorzugsweise flüssig oder
kann als lyophilisiertes Pulver vorliegen. Es kommt in Betracht,
dass beispielsweise eine therapeutische Verabreichung eines multimeren
Proteinkomplexes Liposomen umfasst, denen die hier beschriebenen derivatisierten
Proteine einverleibt sind.
-
Für den Fachmann
ist es ersichtlich, dass die speziellen Bedingungen in Bezug auf
Verabreichung, Dosierung und klinische Anwendungen eines erfindungsgemäßen, hydrophob
modifizierten Proteins je nach dem speziellen Protein und dessen
biologischer Aktivität
variieren.
-
Als
ein Beispiel für
die therapeutische Anwendung der erfindungsgemäßen Proteine lassen sich Hedgehog-Proteine,
die in therapeutischer Weise hydrophob modifiziert sind, an Patienten
verabreichen, die an einer Vielzahl von neurologischen Zuständen leiden.
Die Fähigkeit
von Hedgehog-Protein zur Regulierung der neuronalen Differenzierung
während
der Entwicklung des Nervensystems und vermutlich auch im erwachsenen
Zustand zeigt, dass von hydrophob modifiziertem Hedgehog in vernünftiger
Weise erwartet werden kann, dass es die Kontrolle von erwachsenen
Neuronen in Bezug auf Aufrechterhaltung, funktionelles Verhalten
und Alterung von normalen Zellen; Reparatur- und Regenerationsvorgänge in läsionierten
Zellen; und Verhinderung des Abbaus und des vorzeitigen Todes, der
sich aus einem Differenzierungsverlust bei bestimmten pathologischen
Zuständen
ergibt, erleichtert. In Anbetracht dieser Tatsache können die
vorliegenden, hydrophob modifizierten Hedgehog-Zusammensetzungen
bei Behandlung durch lokale Infusion die Schwere von neurologischen
Zuständen,
die sich aufgrund folgender Tatsachen ergeben, verhindern und/oder
verringern: (i) akute, subakute oder chronische Schädigung des
Nervensystems, einschließlich
einer traumatischen Schädigung,
chemischen Schädigung,
Gefäßschädigung und
Defiziten (z. B. Ischämie
nach Schlaganfall), zusammen mit infektiösen und tumorinduzierten Schädigungen;
(ii) Alterung des Nervensystems, einschließlich Alzheimer-Krankheit;
(iii) chronische neurodegenerative Krankheiten des Nervensystems,
einschließlich
Morbus Parkinson, Chorea Huntington, amyotrophe Lateralsklerose
und dergl.; und (iv) chronische immunologische Krankheiten des Nervensystems,
einschließlich
multipler Sklerose. Das hydrophob modifizierte Protein kann auch
in die zerebrospinale Flüssigkeit
injiziert werden, um auf Mangelzustände von Hirnzellen einzuwirken, oder
je nach Bedarf in das Lymphsystem oder in den Blutkreislauf, um
auf spezielle Störungen
von Geweben oder des Organsystems einzuwirken.
-
Erfindungsgemäße Hedgehog-Zusammensetzungen
können
beispielsweise zur Rettung verschiedener Neuronen vor einem läsionsinduzierten
Tod sowie zur Reprojektionsführung
dieser Neuronen nach einer derartigen Schädigung verwendet werden. Eine
derartige Schädigung
kann Zuständen
zugeschrieben werden, die (ohne Einschränkung hierauf) ZNS-Traumainfarkte, Infektionen,
Stoffwechselkrankheiten, Ernährungsmangelzustände und
toxische Mittel (z. B. Behandlung mit Cisplatin) einschließen. Bestimmte
Hedgehog-Proteine
bewirken, dass neoplastische oder hyperplastische, transformierte
Zellen entweder postmitotisch oder apoptotisch werden. Derartige
Zusammensetzungen können
daher beispielsweise bei der Behandlung von malignen Gliomen, Medulloblastomen
und neuroektodermalen Tumoren verwendet werden.
-
Die
Proteine können
auch mit nachweisbaren Markern, wie fluoroskopisch oder radiographisch
undurchsichtigen Substanzen verknüpft werden und einem Subjekt
verabreicht werden, um eine Abbildung von Geweben, die Hedgehog-Rezeptoren exprimieren,
zu ermöglichen.
Die Proteine können
auch an Substanzen, wie Meerrettich-peroxidase, gebunden werden,
die als immunozytochemische Färbemittel
verwendet werden, um Bereiche von Hedgehog-Liganden-positiven Zellen
an histologischen Schnitten sichtbar zu machen. Erfindungsgemäße, hydrophob
modifizierte Proteine können
entweder allein oder in Form von mehrwertigen Proteinkomplexen dazu
herangezogen werden, eine spezifische Zielrichtung von medizinischen
Therapien gegen Krebs und Tumoren, die den Rezeptor für das Protein
exprimieren, zu bewirken. Derartige Materialien können als
Krebstherapeutika wirksamer gemacht werden, indem man sie als Abgabeträger für antineoplastische
Arzneistoffe, Toxine und zytozide Radionuclide, wie Yttrium 90,
verwendet.
-
Ein
Toxin kann auch mit einem hydrophob modifizierten Hedgehog (oder
vesikelhaltigen mehrwertigen Komplexen davon) konjugiert werden,
um eine selektive Zielrichtung auf Hedgehog-reaktive Zellen und
deren Abtötung
zu bewirken, z. B. eines oder mehrerer tumorexprimierender Hedgehog-Rezeptoren.
Weitere Toxine sind gleichermaßen
geeignet, wie es dem Fachmann geläufig ist. Derartige Toxine
umfassen (ohne Beschränkung
hierauf) Pseudomonas-Exotoxin,
Diphtheria-Toxin und Saporin. Dieser Weg sollte sich als erfolgreich
erweisen, da Hedgehog-Rezeptoren in einer sehr begrenzten Anzahl
von Geweben exprimiert werden. Ein weiterer Weg für derartige
medizinische Therapien ist die Verwendung eines mit Radioisotopen
markierten, hydrophob modifizierten Proteins (oder von mehrwertigen
Komplexen davon). Derartige radioaktiv markierte Verbindungen lenken
die Radioaktivität
zielgerichtet vorzugsweise an Stellen in Zellen, die Proteinrezeptoren
exprimieren, wobei normale Gewebe ausgespart werden. Je nach dem
verwendeten Radioisotop kann die von einem radioaktiv markierten
Protein, das an eine Tumorzelle gebunden ist, emittierte Strahlung
auch in der Nähe
davon befindliche maligne Tumorzellen, die nicht den Proteinrezeptor
exprimieren, abtöten.
Es kann eine Vielzahl von Radionucliden verwendet werden. Radioiod
(beispielsweise 131I) hat sich als erfolgreich
bei Verwendung mit monoklonalen Antikörpern gegen CD20, die an B-Zelllymphomen
vorhanden sind, erwiesen (63).
-
Die
therapeutisch zu verwendenden Proteinzusammensetzungen werden in
einer Art und Weise zubereitet und zu Dosierungen verarbeitet, wie
es der medizinischen Praxis unter Berücksichtigung der zu behandelnden
Störung,
des Zustands des einzelnen Patienten, der Abgabestelle des isolierten
Polypeptids, dem Verabreichungsverfahren und anderen Faktoren, die
dem Arzt bekannt sind, entspricht. Das Therapeutikum kann zur Verabreichung
zubereitet werden, indem man ein Protein, eine proteinhaltige Vesikel
oder einen derivatisierten Komplex im gewünschten Reinheitsgrad mit physiologisch
verträglichen
Trägern
(d. h. Trägern, die
für die
Empfänger
in den verwendeten Dosierungen und Konzentrationen nicht toxisch
sind) vermischt.
-
Es
kommt in Betracht; dass die lokale Abgabe an die Behandlungsstelle
den primären
Weg für
die therapeutische Verabreichung der erfindungsgemäßen Proteine
darstellt. Es kann auch eine intravenöse Abgabe oder eine Abgabe
durch einen Katheter oder einen anderen chirurgischen Schlauch in
Betracht gezogen werden. Zu alternativen Verabreichungswegen gehören Tabletten
und dergl., handelsübliche
Zerstäubungsgeräte für flüssige Zubereitungen
und eine Inhalation von lyophilisierten oder aerosolisierten Zubereitungen.
Flüssige Zubereitungen
können
nach Rekonstitution von Pulverzubereitungen eingesetzt werden.
-
Die
verabreichte Dosis hängt
von den Eigenschaften der verwendeten Vesikel und des verwendeten Proteins,
d. h. von dessen Bindungsaktivität
und in vivo-Plasmahalbwertszeit, der Konzentration von Vesikel und
Protein in der Zubereitung, dem Verabreichungsweg, der Dosierungsstelle
und -rate, der klinischen Verträglichkeit
durch den betroffenen Patienten, dem pathologischen Zustand, von
dem der Patienten betroffen ist, und dergl. ab, wie es dem Arzt
geläufig
ist. Im allgemeinen werden Dosen von 5 × 10–7 bis
5 × 10–9 M
Protein pro Patient pro Verabreichung bevorzugt, obgleich die Dosierung
von der Art des Proteins abhängt.
Unterschiedliche Dosierungen können
während
einer Reihe von aufeinanderfolgenden Verabreichungen eingesetzt werden.
-
Die
Erfindung ist auch auf eine pharmazeutische Zubereitung abgestellt,
die ein erfindungsgemäß modifiziertes
Hedgehog-Protein in Kombination mit einem pharmazeutisch verträglichen
Träger
umfasst. Gemäß einer
Ausführungsform
umfasst die Zubereitung auch Vesikel.
-
Die
erfindungsgemäßen, hydrophob
modifizierten Hedgehog-Proteine eignen sich auch für gentherapeutische
Verfahren.
-
Für neurodegenerative
Störungen
stehen verschiedene Tiermodelle zur Verfügung, von denen angenommen
wird, dass sie von gewissem Wert für klinische Vorhersagen sind.
Bei der Parkinson-Krankheit beinhalten die Modelle den Schutz oder
die Erholung von Nagetieren oder Primaten, bei denen der nigral-striatale, dopaminerge
Stoffwechselweg entweder durch systemische Verabreichung von MPTP
oder durch lokale (intrakraniale) Verabreichung von 6-Hydroxydopamin
(6-OHDA), d. h.
zwei selektive, dopaminerge Toxine, geschädigt ist. Spezielle Modelle
sind das Mäusemodell
mit MPTP-Behandlung
(64); das Primatenmodell (Krallenaffe oder Rhesusaffe) mit MPTP-Behandlung
(65); oder das Rattenmodell mit unilateraler 6-OHDA-Läsion (66).
Bei ALS (amyotrophe Lateralsklerose) beinhalten die Modelle eine
Behandlung von verschiedenen Mäusestämmen, die
eine spontane, motorische Neuronendegeneration zeigen, einschließlich Wobbler-Mäuse (67) und
pmn-Mäuse
(68) und von transgenen Mäusen,
die das humane, mutierte Superoxidase-dismutase (hSOD)-Gen, das
mit familiärer
ALS verknüpft
ist, exprimieren (69). Bei Schädigungen
des Rückenmarks
beinhalten die gebräuchlichsten
Modelle eine Kontusionsschädigung
von Ratten entweder durch einen kalibrierten Gewichtsverlust oder
durch Fluidschädigung
(hydrodynamische Schädigung)
(70). Bei Morbus Huntington beinhalten Modelle den Schutz gegen
eine Excitotoxin-Schädigung
(NMDA, Chinolinsäure,
Kaininsäure,
3-Nitropropionsäure,
APMA) des Striatums bei Ratten (71, 72). Kürzlich wurde ein Modell von
transgenen Mäusen, die
die humane, expandierte Trinucleotid-Wiederholungssequenz im Huntington-Gen überexprimieren,
ebenfalls beschrieben (73). Bei multipler Sklerose wird in Mäusen und
Ratten EAE durch Immunisierung mit MBP (basisches Myelinprotein)
oder durch passive Übertragung
von mit MBP aktivierten T-Zellen induziert (74). Bei Alzheimer besteht
ein einschlägiges
Mäusemodell
in der Bestimmung des Schutzes gegen Läsionen der Fimbria-Fornix in
Ratten (septale Läsion),
des Hauptnervenbündels,
das die cholinerge Innervation des Hippocampus (75) bewirkt, sowie
in der Verwendung von transgenen Mäusen, die das humane beta-Amyloid-Gen überexprimieren.
Bei peripheren Neuropathien besteht ein einschlägiges Modell im Schutz gegen
einen Verlust der peripheren Nervenleitung, die durch chemotherapeutische
Mittel, wie Taxol, Vincristin und Cisplatin, bei Mäusen und
Ratten hervorgerufen wird (76).
-
Nachstehend
wird die Erfindung unter Bezugnahme auf die folgenden nicht-beschränkenden
Beispiele näher
beschrieben.
-
Beispiel 1
-
Humanes Sonic-Hedgehog
ist bei Expression in Insektenzellen lipidmodifiziert.
-
A. Expression von humanem
Sonic-Hedgehog
-
Die
cDNA von humanem Sonic-Hedgehog (Shh) von voller Länge wurde
als ein 1,6 kb-EcoRI-Fragment, das in pBluescript SK– subkloniert
war (20), bereitgestellt (von David Bumcrot von der Fa. Ontogeny,
Inc., Cambridge, MA, zur Verfügung
gestellt). Die 5'-
und 3'-NotI-Stellen,
die unmittelbar den offenen Shh-Leseraster flankieren, wurden durch
Einzelstellen-Eliminationsmutagenese unter Verwendung eines Pharmacia-Kits gemäß dem vom
Hersteller empfohlenen Verfahren addiert. Das 1,4 kb NotI-Fragment,
das die Shh-cDNA
von voller Länge
trug, wurde sodann in den Insekten-Expressionsvektor pFastBac (Life Technologies,
Inc.) subkloniert. Rekombinantes Baculovirus wurde unter Anwendung
der von Life Technologies, Inc., bereitgestellten Verfahren erzeugt.
Das erhaltene Virus wurde zur Erzeugung eines Virus-Vorrats mit
hohem Titer verwendet. Die Verfahren zur Erzeugung und Reinigung
von Shh sind nachstehend beschrieben. Die Anwesenheit von membranassoziiertem
Shh wurde durch FACS und Western-Blot-Analyse geprüft. Die maximale Expression erfolgte
48 Stunden nach der Infektion. Für
die Western-Blot-Analyse wurden Überstände und
Zelllysate von Shh-infizierten oder nicht-infizierten Zellen der
SDS-PAGE an einem 10–20
%-Gradientengel
unter reduzierenden Bedingungen unterworfen, und elektrophoretisch
auf Nitrocellulose übertragen,
wonach das Shh mit einem polyklonalen Kaninchen-Antiserum, das gegen
ein N-terminales Shh-15-meres-Peptid-Schlüsselloch-Napfschnecken-Hämocyanin-Konjugat erzeugt worden
war, nachgewiesen. Die Zelllysate wurden hergestellt, indem man
den Zellen 5 Minuten bei 25 °C
in 20 mM Na2HPO4,
pH-Wert 6,5, 1 % Nonidet P-40 und 150 mM NaCl oder 20 mM Tris-HCl,
pH-Wert 8,0, 50 mM NaCl, 0,5 % Nonidet P-40 und 0,5 % Natriumdesoxycholat inkubierte
und anschließend
Teilchen bei 13 000 U/min 10 Minuten bei 4 °C in einer Eppendorf-Zentrifuge pelletisierte.
-
B. Reinigung von membrangebundenem,
humanem Sonic-Hedgehog
-
Die
membrangebundene Form von Shh wurde in High FiveR-Insektenzellen (Invitrogen)
hergestellt, wobei das vorstehend erörterte rekombinante Baculovirus,
das für
Shh von voller Länge
kodiert, verwendet wurde. High FiveR-Zellen wurden bei
28 °C in
serumfreiem sf900 II-Medium (Life Technologies, Inc.) in einem 10
Liter fassenden Bioreaktor, der in Bezug auf Sauerstoff kontrolliert
war, gezüchtet.
Die Zellen wurden in der späten
logarithmischen Phase bei etwa 2 × 106-Zellen/ml
mit Virus mit einem MOI-Wert
von 3 infiziert und 48 Stunden nach der Infektion geerntet (die
Lebensfähigkeit
der Zellen betrug zum Erntezeitpunkt >50 %). Die Zellen wurden durch Zentrifugation
gewonnen und in 10 mM Na2HPO4,
pH-Wert 6,5, 150 mM NaCl plus 0,5 mM PMSF, gewaschen. Das erhaltene
Zellpellet (150 g Feuchtgewicht) wurde in 1,2 Liter 10 mM Na2HPO4, pH-Wert 6,5,
150 mM NaCl, 0,5 mM PMSF suspendiert. 5 μM Pepstatin A, 10 μg/ml Leupeptin
und 2 μg/ml
E64 sowie 120 ml einer 10%igen Lösung
von Triton X-100 wurden sodann zugegeben.
-
Nach
30-minütiger
Inkubation auf Eis wurden teilchenförmige Produkte durch Zentrifugation
(1 500 × g,
10 min) entfernt. Sämtliche
folgenden Stufen wurden bei 4–6 °C durchgeführt. Der
pH-Wert des Überstands wurde
mit einer Vorratslösung
von 0,5 M MES, pH-Wert 5,0 (Endkonzentration 50 mM) auf 5,0 eingestellt
und das Produkt wurde auf eine 150 ml-SP-Sepharose Fast Flow-Säule (Pharmacia)
aufgesetzt. Die Säule
wurde mit 300 ml 5 mM Na2HPO4,
pH-Wert 5,5, 150 mM NaCl, 0,5 mM PMSF, 0,1 % Nonidet P-40 und sodann
mit 200 ml 5 mM Na2HPO4,
pH-Wert 5,5, 300 mM NaCl, 0,1 % Nonidet P-40 gewaschen. Gebundenes
Hedgehog wurde mit 5 mM Na2HPO4,
pH-Wert 5,5, 800 mM NaCl, 0,1 % Nonidet P-40 eluiert.
-
Anschließend wurde
das Shh einer Immunoaffinitätschromatographie
an einem 5E1-Sepharose-Harz, das
durch Konjugation von 4 mg Antikörper
pro ml CNBr-aktiviertem Sepharose-4B-Harz hergestellt worden war,
unterworfen. Der SP-Sepharose-Elutionspool wurde mit zwei Volumina
50 mM HEPES, pH-Wert 7,5, verdünnt
und absatzweise auf das 5E1-Harz aufgesetzt (1 h). Das Harz wurde
in einer Säule
gesammelt, mit 10 Säulenvolumina
PBS mit einem Gehalt an 0,1 % hydriertem Triton X-100 (Calbiochem)
gewaschen und mit 25 mM NaH2PO4,
pH-Wert 3,0, 200 mM NaCl, 0,1 % hydriertem Triton X-100 eluiert.
Die Elutionsfraktionen wurden mit 0,1 Volumen 1 M HEPES, pH-Wert
7,5, neutralisiert und in Bezug auf den Gehalt an Gesamtprotein durch
Absorptionsmessungen bei 240–340
nm und in Bezug auf die Reinheit durch SDS-PAGE analysiert. Die Fraktionen
wurden bei –70 °C aufbewahrt.
-
Peakfraktionen
von drei Affinitätsstufen
wurden vereinigt, mit 1,3 Volumina 50 mM HEPES, pH-Wert 7,5, 0,2
% hydriertem Triton X-100 verdünnt
und erneut absatzweise auf das 5E1-Harz aufgesetzt. Das Harz wurde
in einer Säule
gewonnen, mit drei Säulenvolumina
PBS, pH-Wert 7,2, 1 % Octylglucosid (US Biochemical Corp.) gewaschen
und mit 25 mM NaH2PO4,
pH-Wert 3,0, 200 mM NaCl, 1 % Octylglucosid gewaschen. Die Elutionsfraktionen
wurden auf die vorstehend angegebene Weise neutralisiert und analysiert,
vereinigt, durch ein 0,2 μm-Filter
filtriert, in Aliquotanteile aufgeteilt und bei –70 °C gelagert.
-
Wenn
humanes Sonic-Hedgehog (Shh) von voller Länge in High FiveR-Insektenzellen
exprimiert wurde, wurden mehr als 95 % des N-terminalen Fragments
durch Western-Blotting in einer zellassoziierten Form nachgewiesen.
Bei SDS-PAGE wanderte das gereinigte Protein als eine einzige scharfe
Bande mit einer scheinbaren Masse von 20 kDa (1,
Bahn c). Das Protein wanderte um etwa 0,5 kDa rascher als eine lösliche Version
des Proteins, die in E. coli erzeugt worden war (1,
Bahnen b–d),
was mit früher
veröffentlichten
Daten übereinstimmt
(19). Gleichermaßen
waren, wie früher
beschrieben (19), die löslichen
und membrangebundenen Shh-Proteine leicht durch Umkehrphasen-HPLC unterscheidbar,
wo die gebundene Form später im
Acetonitril-Gradienten eluiert wurde. Die für die Elution der membrangebundenen
Form erforderliche Acetonitril-Konzentration
betrug 60 %, gegenüber
nur 45 % für
die lösliche
Form, was auf eine signifikante Zunahme der Hydrophobizität des Proteins
hinweist.
-
C. Massenspektrometrische
Analyse von membrangebundenem humanem Sonic-Hedgehog
-
Aliquotanteile
von Shh wurden einer Umkehrphasen-HPLC an einer C4-Säule (Vydac,
Kat. Nr. 214TP104, Säulenabmessungen
4,6 mm Innendurchmesser × 250
mm) bei Umgebungstemperatur unterworfen. Gebundene Komponenten wurden
mit einem 30-minütigen
0–80 %
Gradienten von Acetonitril in 0,1 % Trifluoressigsäure bei
einer Strömungsgeschwindigkeit
von 1,4 ml/min eluiert. Das aus der Säule ausströmende Produkt wurde bei 280
nm überwacht
und Fraktionen von 0,5 min wurden gesammelt. 25 μl-Aliquotanteile von proteinhaltigen Fraktionen
wurden in einem Speed Vac-Konzentrator getrocknet, in Elektrophorese-Probenpuffer gelöst und durch
SDS-PAGE analysiert. Hedgehog enthaltende Fraktionen wurden vereinigt,
4-fach in einem Speed Vac-Konzentrator eingeengt und einer Bestimmung
des Proteingehalts aufgrund der Absorption bei 280 nm unter Ansetzen
eines Extinktionskoeffizienten von 1,33 für eine 1 mg/ml-Lösung von
Shh unterzogen. Proben wurden einer ESI-MS-Analyse an einem Micromass Quattro
II-Dreifachquadrupol-Massenspektrometer,
der mit einer Elektronenspray-Ionenquelle
ausgestattet war, unterworfen. Ein Volumen von 6 μl HPLC-gereinigtem
Hedgehog wurde direkt in die Ionenquelle mit einer Geschwindigkeit
von 10 μl/min
unter Verwendung von 50 % Wasser, 50 % Acetonitril, 0,1 % Ameisensäure als
Lösungsmittel
in der Spritzenpumpe infundiert. Während der gesamten Probeninfusion
wurde ein Scanningvorgang durchgeführt. Sämtliche Elektrospray-Massenspektrumsdaten
wurden gewonnen, im Profilmodus gespeichert und unter Verwendung
des Micromass MassLynx-Datensystems
verarbeitet.
-
Peptide
eines Endoproteinase-Lys-C-Verdaus von pyridylethyliertem Shh wurden
durch Umkehrphasen-HPLC im Anschluss an den Micromass Quattro II-Dreifachquadrupol-Massenspektrometer
analysiert. Das Verdauungsprodukt wurde an einer Reliasil C18-Säule
unter Verwendung eines MichromR-Ultrafast-Microprotein-Analyzer-Systems
mit einer Strömungsgeschwindigkeit
von 50 μl/min
unter Verwendung eines 5–85 %-Acetonitril-Gradienten
in 0,05 % Trifluoressigsäure
getrennt. Während
des gesamten Ansatzes wurde ein Scanning von m/z 400–2000 durchgeführt. Die
Verarbeitung erfolgte auf die vorstehend angegebene Weise.
-
Eine
Sequenzierung des N-terminalen Peptids von gebundenem Shh wurde
durch Post Source Decay (PSD)-Messung an einem Voyager DER-STR (PerSeptive Biosystems, Framingham,
MA)-Flugzeit (TOF)-Massenspektrometer unter Verwendung von α-Cyano-4-hydroxyzimtsäure als
Matrix (22, 23) durchgeführt.
Genau 0,5 μl
HPLC-gereinigtes Endoproteinase-Lys-C-Peptid wurden mit 0,5 μl Matrix
auf der Targetplatte vermischt. Um das gesamte Spektrum von Fragmentionen
abzudecken, wurden die Spiegelspannungen in 11 Stufen von 20 auf
1,2 kv verringert.
-
Elektrosprayionisation-Massenspektrometriedaten
für die
lösliche
und membrangebundene Form von Shh zeigten primäre Spezies mit Massen von 19
560 bzw. 20 167 Da (2). Die gemessene Masse von
19 560 Da stimmt mit der vorhergesagten Masse für Shh, beginnend mit Cys-1
und endend mit Gly-174, überein (berechnete
Masse 19 560,02 Da). Im Gegensatz dazu stimmte die Masse von 20
167 Da weder mit einer verfügbaren
Vorhersage überein,
noch konnte der Unterschied zwischen den Massen der gebundenen und
der löslichen
Form von 607 Da durch irgendeine bekannte Modifikation oder durch
eine abweichende proteolytische Prozessierung erklärt werden.
Früher
zeigten Porter et al. (18), dass Drosophila-Hedgehog einen Cholesterolrest
enthält
und dass die Massendifferenz im humanen System möglicherweise zumindest teilweise
auf Cholesterol zurückzuführen war
(die berechnete Masse für
verestertes Cholesterol beträgt
368,65 Da). Die Anwesenheit einer untergeordneten Komponente im
Massenspektrum von gebundenem Shh mit 19 796 Da, was sich vom primären Peak
um 371 Da unterscheidet, unterstützte
diese Auffassung.
-
Ein
weiterer Beweis für
Cholesterol wurde erhalten, indem man das gebundene Shh mit mildem
Alkali unter Bedingungen, die die Cholesterol-Bindung ohne Lösung von
Peptidbindungen aufbrechen kann (18), behandelte und anschließend eine
erneute Analyse der Reaktionsprodukte durch Massenspektrometrie
(MS) durchführte.
Kurz zusammengefasst, von Insektenzellen abgeleitetes Shh wurde
mit 50 mM KOH, 95 % Methanol 1 h bei Umgebungstemperatur behandelt
und sodann durch ESI-MS analysiert oder mit Endoproteinase-Lys-C
verdaut und einer Flüssigchromatographie-MS-Analyse
am Micromass Quattro II-Dreifachquadrupol-Massenspektrometer
unterworfen. Bei Proben, die der LC-MS unterworfen wurden, wurden
die Proteine zunächst
mit 4-Vinylpyridin behandelt. Die Basenbehandlung verschob die Masse
um 387 Da, was mit einem Verlust von Cholesterol plus Wasser übereinstimmt
(vergl. Tabelle 3). Die Masse von löslichem Shh wurde durch Basenbehandlung
nicht beeinflusst. Insgesamt lassen diese Beobachtungen darauf schließen, dass membrangebundenes,
humanes Shh zwei Modifikationen enthält, einen Cholesterolrest und
einen zweiten Rest mit einer Masse von 236 Da. Die Ähnlichkeit
der Masse zwischen diesem Wert und der Masse einer addierten Palmitoylgruppe
(238 Da) lässt
darauf schließen,
dass das Protein palmitoyliert ist. Genauere Massenbestimmungen,
die nachstehend erörtert
werden, ergaben eine Korrelation innerhalb von 0,1 Da mit der vorhergesagten
Masse eines Palmitoylrestes.
-
Tabelle
3 Charakterisierung
von gebundenem Shh durch MS. Die berechneten Massenwerte wurden
unter Verwendung von durchschnittlichen Restmassen in Teil a und
von protonierten Monoisotopen-Massen in Teil b bestimmt.
-
Anschließend stellten
wir fest, dass gebundenes Shh durch HPLC mit einem modifizierten
Elutionsgradienten in Subspezies fraktioniert werden konnte. Wir
entwickelten einen einfachen HPLC-Test für die quantitative Bestimmung der
verschiedenen Formen. Die Ergebnisse dieser Analysen sind in 3 aufgeführt. Bei
diesem Test wurde zunächst
unmodifiziertes Shh eluiert (Peak 1), anschließend mit Cholesterol modifiziertes
Shh (Peak 2) und schließlich
Produkt, das sowohl mit Cholesterol als auch mit Palmitinsäure modifiziertes Shh
enthält
(Peak 3). Die komplizierte Gestalt von Peak 3 spiegelt die Anwesenheit
einer modifizierten Form der Palmitoylgruppe wieder, die durch Sequenzierung
unter MALDI-PSD-Messung identifiziert wurde. Die Variante war um
2 Da kleiner als vorausgesagt und kann daher eine ungesättigte Bindung
enthalten (Daten nicht aufgeführt).
-
D. Lokalisierung der Palmitinsäure-Modifikation
innerhalb der humanen Sonic-Hedgehog-Sequenz
-
Die
Palmitoylierungsstelle innerhalb der humanen Sequenz wurde unter
Anwendung einer Kombination der Peptidkartierung und der Sequenzanalyse
identifiziert. 4B zeigt die Ergebnisse
einer Peptid-Kartierungsanalyse des löslichen Proteins mit einer
LC-MS-Ablesung. Massendaten für über 98 %
der löslichen Shh-Sequenz
konnten durch die Analyse erklärt
werden. Der mit einem Peak versehene Stern entspricht dem N-terminalen
Peptid (Reste 1–9
plus 4-Vinylpyridin,
beobachtete Masse 983,50 Da, berechnete Masse 983,49 Da; Tabelle
3). Bei der entsprechenden Analyse des gebundenen Produkts (4A) fehlte dieses Peptid, statt dessen
wurde ein hydrophoberes Peptid mit einer Masse von 1221,79 Da festgestellt
(mit einem Stern bezeichnet).
-
Der
1221,79 Da-Rest stimmt mit dem Vorliegen einer modifizierten Form
des N-terminalen Peptids überein,
d. h. 983,49 Da für
die Peptidkomponente plus 238,23 Da. Das 1221,79 Da-Peptid wurde
anschließend
der Sequenzanalyse durch MALDI-PSD-Messung unterworfen. Das erhaltene
PSD-Spektrum ist
in 5 dargestellt. Ionen, die den Fragmenten b1, b2,
b4, b5, b8 + H2O, y8, y7, y5, y4, y3, y2
und y1 entsprechen, wurden nachgewiesen, was die Sequenz bestätigte. Ferner
zeigten die b1- und b2-Ionen, dass das pyridylethylierte Cys-1-Addukt
palmitoyliert war. Nur Cys-1 enthaltende Ionen enthielten die zusätzliche
238,23 Da-Masse.
-
Da
Cystein in vivo eine normale Palmitoylierungsstelle für Proteine
darstellt, war die Feststellung nicht überraschend, dass das neue
Addukt an das N-terminale Cystein gebunden war. Jedoch ließen zwei
Beweise darauf schließen,
dass das Lipid an die Aminogruppe des Cysteins und nicht an das
Thiol gebunden war. Erstens setzten wir bei der Peptid-Kartierungsstudie
4-Vinylpyridin als spektroskopische Markierung zur Überwachung
von freien Thiolgruppen ein (27). Die Pyridylethylierung ist hochgradig
spezifisch für
Cystein-Thiole und addiert ein 105 Da-Addukt, das durch MS nachgewiesen
werden kann. Die beobachteten Cys-1 enthaltenden Fragmente im PSD-Spektrum
enthielten sowohl Palmitoyl- als auch Pyridylethyl-Modifikationen, was
auf die Anwesenheit einer freien Thiolgruppe schließen lässt. Zweitens
wurde das gebundene Shh einer automatisierten N-terminalen Edman-Sequenzierung
unterworfen und es wurde keine Sequenz erhalten, die auf eine Blockierung
des N-terminalen α-Amins
schließen
ließ.
Im Gegensatz dazu lässt
sich die entsprechende lösliche Form
von Shh leicht sequenzieren.
-
Beispiel 2
-
Humanes Sonic-Hedgehog
kann in einem zellfreien System mit Palmitinsäure modifiziert werden.
-
Lösliches
Shh wurde mit 3H-Palmitinsäure in einem
zellfreien System unter Anwendung einer modifizierten Version eines
veröffentlichten
Verfahrens (24) markiert. Eine rohe mikrosomale Fraktion aus Rattenleber
wurde hergestellt, indem ein Leberhomogenisat einer sequenziellen
Zentrifugation mit 3 000 g für
10 min, 9 000 g für
20 min und 100 000 g für
30 min unterworfen wurde. Das 100 000 g-Pellet wurde in 10 mM HEPES, pH-Wert
7,4, 10 % Saccharose, suspendiert und erneut 20 Minuten mit 100
000 g zentrifugiert. Das endgültige Pellet
(von 10 g Leber abgeleitet) wurde in 3 ml 20 mM Tris-HCl, pH-Wert
7,4, 150 mM NaCl, 1 mM EDTA, 10 μg/ml
Leupeptin, 0,15 % Triton X-100 suspendiert, einer Aliquotbildung
unterworfen und bei –70 °C aufbewahrt.
Reaktionen mit 3 μg
Shh, 1 μl
Rattenmikrosomen, 50 ng/ml Coenzym A (Sigma), 0,3 mM ATP, 20 mM Tris-HCl,
pH-Wert 7,4, 150 mM NaCl, 1 mM EDTA, 10 μg/ml Leupeptin und 0,5 μCi-[9,10-3H]-Palmitinsäure (50 Ci/mmol, New England
Nuclear) wurden 1 Stunde bei Raumtemperatur durchgeführt. Die
Reaktionen wurden mit reduzierendem Elektrophorese-Probenpuffer
gestoppt. SDS-PAGE
wurde an einem 10–20
% Gradientengel durchgeführt.
Die Visualisierung erfolgte durch Fluorographie.
-
Wie
in 1 dargestellt (Bahn e) lässt sich Shh leicht mit dem
radioaktiven Tracer markieren. Keines der ungefähr 100 übrigen Proteine im Reaktionsgemisch
wurde markiert (vergl. das entsprechende, mit Coomassie-Blau gefärbte Gelprofil
in Bahn j), was eine hochgradige Spezifität der Palmitoylierungsreaktion
zeigt. Als weiteren Beweis für
die Spezifität
der Palmitoylierungsreaktion testeten wir zwei Shh-Varianten, bei
denen die Palmitoylierungsstelle beseitigt worden war. 1 (Bahn
f) zeigt die Ergebnisse der Analyse einer geschnittenen Form von
löslichem
Shh, dem die ersten 10 Aminosäurereste
der reifen Sequenz fehlten. Bahn g zeigt eine mutante Form von Shh,
das an seinem N-terminalen Ende eine einzige Punktmutation von Cys-
zu Ser zeigt. Keine der Varianten war markiert.
-
Die
Bedeutung des N-terminalen Cysteins als Stelle der Lipid-Derivatbildung
wird durch die Tatsache betont, dass lösliches Wildtyp-Shh leicht
markiert wird, während
das bei der Mutante mit Serin anstelle von terminalem Cystein nicht
der Fall war. Die Unfähigkeit,
die Mutante mit N-terminalem Serin zu markieren, spricht gegen einen
einfachen Reaktionsmechanismus, gemäß dem der Palmitylrest direkt
an das N-terminale α-Amin
gebunden ist, da unter den Testbedingungen das Cystein durch Serin
substituiert worden sein sollte.
-
Wir
testeten ferner die Rolle des freien N-Terminus unter Verwendung
einer löslichen
Form von Shh mit einer N-terminalen
Histidin (His)-Markierungserweiterung. Das bei dieser Untersuchung
verwendete lösliche,
humane Shh war zunächst
als ein His-markiertes Fusionsprotein mit einer Enterokinase-Spaltungsstelle an
der Verbindung mit der reifen Sequenz hergestellt und sodann mit
Enterokinase zur Entfernung der His-Markierung prozessiert worden.
Das His-markierte
Shh wurde trotz des Vorliegens der freien Thiolgruppe des Cysteins
nicht palmitoyliert (vergl. 1, Bahn
i). Obgleich wir die Möglichkeit
nicht ausschließen
können, dass
die N-terminale Erweiterung sterisch das Auftreten der Palmitoylierung
hemmt, befindet sich Cys-1 an der P1-Position der Enterokinase-Spaltungsstelle
und ist für
die enzymatische Prozessierung leicht zugänglich. Somit hat es den Anschein,
dass sowohl das Thiol als auch das α-Amin von Cys-1 einen Beitrag zur Palmitoylierungsreaktion
leisten. Da sämtliche
bekannten Palmitoylierungsreaktionen auf die Seitenketten von Cys-, Ser-
oder Thr-Resten abzielen, nehmen wir an, dass die Modifikation von
Hedgehog mit der Bildung eines Thioester-Zwischenprodukts beginnt
und dass anschließend
der Palmitoylrest durch Bildung eines cyclischen Zwischenprodukts
auf den N-Terminus übertragen
wird. Diese Hypothese wurde bei Untersuchungen der Modifikation
von humanem Sonic-Hedgehog unter Verwendung von Palmitoyl-Coenzym
A bestätigt
(vergl. Beispiel 8).
-
Beispiel 3: Nachweis einer
erhöhten
Wirkungsstärke
von natürlich
auftretendem, mit Fettsäure
acyliertem, humanem Sonic-Hedgehog in einem Test auf Zellbasis (C3H10T1/2)
-
Shh
wurde auf seine Funktion in einem Test auf Zellbasis unter Messung
der Induktion von alkalischer Phosphatase in C3H10T1/2-Zellen (25)
bei einer Ablesung von 5 Tagen getestet. Der Test wurde in einem
Format mit 96 Vertiefungen durchgeführt. Die Proben wurden im Doppelversuch
angesetzt. Für
gebundenes Shh (100 μg/ml)
wurden die Proben zunächst
200-fach mit normalem Wachstumsmedium verdünnt und anschließend 2-fachen
Reihenverdünnungen
auf den Platten unterworfen. Die Vertiefungen wurden auf potentielle
Einflüsse
des zugesetzten Octylglucosids normiert, indem 0,005 % Octylglucosid
dem Kulturmedium zugesetzt wurden. Blockierungsuntersuchungen unter
Verwendung von neutralisierendem Mäuse-mAb 5E1 (26) wurden durch
30-minütiges Vermischen
von Shh mit Reihenverdünnungen
des Antikörpers
bei Umgebungstemperatur in Kulturmedium durchgeführt, bevor die Testproben auf
die Platten gegeben wurden.
-
Bei
diesem Test erzeugt lösliches,
humanes Shh eine dosisabhängige
Reaktion mit einem IC50-Wert von 1 μg/ml und
einem maximalen Signal bei 3 μg/ml
(6A). Gebundenes humanes Shh mit am
C-Terminus gebundenem Cholesterol und einer Palmitoylgruppe am N-Terminus
erzeugte gleichermaßen
eine dosisabhängige
Reaktion bei diesem Test, jedoch mit einem IC50-Wert
von 0,03 μg/ml
und einem maximalen Signal bei 0,1 μg/ml, was zeigt, dass es etwa
30-fach stärker
wirksam als lösliches
Shh war. Um zu bestätigen,
dass die beobachtete Aktivität
für Hedgehog
spezifisch war, testeten wir, ob die Aktivität mit dem neutralisierenden anti-Hedgehog-mAb 5E1
gehemmt werden konnte. Sowohl lösliches
als auch gebundenes Shh wurden durch 5E1-Behandlung gehemmt (6B). Die Hemmung von gebundenem Shh erforderte
die 10-fache 5E1-Menge, was mit der erhöhten Aktivität beim Test übereinstimmt.
-
Gebundenes
Shh wurde in einem Rezeptor-Bindungstest getestet, wobei dessen
Fähigkeit
zur Bindung von "Patched" getestet wurde.
Dabei wurde eine modifizierte Version eines kürzlich veröffentlichten Tests (10) herangezogen.
Das gebundene Shh zeigte eine dosisabhängige Bindung an Zellen, die "Patched" exprimierten, mit
einem scheinbaren IC50-Wert von 400 ng/ml
(7). Beim gleichen Test erfolgte eine Bindung von löslichem
Shh an "Patched" mit einem scheinbaren
IC50-Wert von 150 ng/ml, was darauf hinweist,
dass die gebundene Form nur geringfügig weniger stark an ihren
Rezeptor bindet.
-
Beispiel 4
-
Analyse von
gebundenem humanem Sonic-Hedgehog nach Rekonstitution in Liposomen
-
Dieses
Beispiel erläutert,
dass Rekonstitutionsexperimente zu positiv und negativ geladenen
Liposomen durch Detergensverdünnung über einen
breiten Bereich von Lipid:Protein-Verhältnissen (Gew./Gew.) von 1:1
bis 100:1 keinen Einfluss auf die Aktivität von gebundenem Shh beim C3H10T1/2-Test
hatten.
-
Die
Rekonstitution zu phospholipidhaltigen Liposomen ergibt eine wertvolle
Zubereitung für
lipidhaltige Proteine, da sie es ermöglicht, dass ein lipidhaltiges
Protein in einer nahezu normalen Einstellung vorliegt. Um zu testen,
ob eine derartige Zubereitung für
gebundenes Shh geeignet war, bedienten wir uns eines Detergens-Verdünnungsverfahrens,
um das Protein in ein Liposom einzuverleiben (60). Dabei werden
Liposomen mit Octylglucosid und dem Protein von Interesse vermischt
und anschließend
wird das Detergens unterhalb seiner kritischen Mizellenkonzentration
zugegeben, um die Rekonstitution zu betreiben. Obgleich eine große Anzahl
von reinen Lipiden und Lipidgemischen verwendet werden kann, wählten wir
zwei handelsübliche
Gemische als Modelle: ein negativ geladenes Liposomenkit mit einem
Gehalt an L-α-Phosphatidylcholin
aus Ei, Dicetylphosphat und Cholesterol (Kat. Nr. L-4262, Sigma,
St. Louis, MO) und ein positiv geladenes Liposomenkit aus Phosphatidylcholin
aus Ei, Stearylamin und Cholesterol (Kat. Nr. L-4137, Sigma).
-
Kurz
zusammengefasst, wir übertrugen
die Lipide in ein Pyrex-Röhrchen,
führten
eine Trocknung unter einem Stickstoffstrom durch und entfernten
restliches Lösungsmittel
durch Lyophilisation. Sodann wurde das Lipid in 10 mM HEPES, pH-Wert
7,5, 100 mM NaCl, 2,0 % Octylglucosid suspendiert, aufgewirbelt
und einer Ultraschallbehandlung unterworfen, bis die Suspension
ein opaleszierendes Erscheinungsbild annahm. Sodann wurde das Lipid
durch ein 0,2 μm-Filter
filtriert. Aliquotanteile von gebundenem Shh aus mit Baculovirus
infizierten High FiveR-Insektenzellen wurden in Octylglucosid
mit einem 400-, 1 000-, 5 000- und 20 000-fachen Überschuss
an Lipid (Gew./Gew.) behandelt. Nach 15-minütiger Vorinkubation wurden
die Proben verdünnt
und im C3H10T1/2-Test auf ihre Aktivität getestet.
-
Weder
die positive noch die negative Liposomenbehandlung hatte einen Einfluss
auf die Aktivität
des Hedgehog, was zeigt, dass ein Lipidträger eine geeignete Zubereitung
darstellt. Um zu bestätigen,
dass das Hedgehog tatsächlich
rekonstituiert wurde, wurden parallele Proben einer Zentrifugation
unter Bedingungen unterworfen, bei denen das gebundene Shh normalerweise
ein Pellet bilden würde
und die Liposomen an der Oberfläche
der Probe schwimmen würden.
Unter diesen Bedingungen schwamm gebundenes Shh an der Oberfläche, was
zeigt, dass die Rekonstitution erfolgt war.
-
Beispiel 5
-
Charakterisierung von
membrangebundenem, humanem Sonic-Hedgehog aus Säugetier-Zellen (EBNA-293)
-
Um
festzustellen, ob eine Palmitoylierung einen allgemeinen Modifizierungsweg
für Sonic-Hedgehog darstellt
oder ob sie spezifisch für
Insektenzellen ist, wurde das Protein auch in einem Säugetiersystem
in EBNA-293-Zellen erzeugt. Zur Expression von Shh von voller Länge in Säugetierzellen
wurden das 1,4 kb-NotI-Fragment, das das Shh von voller Länge enthielt
(vergl. Beispiel 1), in ein Derivat des Vektors CH269 pCEP4 (Invitrogen,
San Diego, CA (21)) kloniert. Das Konstrukt wurde unter Verwendung
von Lipofectamin (Life Technologies, Inc.) in EBNA-293-Zellen transfiziert.
Die Zellen wurden 48 Stunden nach der Transfektion geerntet. Die
Expression von Oberflächen-Shh
wurde durch FACS und durch Western-Blot-Analyse bestätigt.
-
Gebundenes
Shh aus EBNA-293-Zellen wurde durch Umkehrphasen-HPLC an einer C4-Säule mit
enger Bohrung fraktioniert (vergl. 3). Die
Peaks wurden durch ESI-MS (Teile a und b von Tabelle 4) oder durch
MALDI-TOF-MS an einem Finnigan LaserMat-Massenspektrometer unter
Verwendung von α-Cyano-4-hydroxyzimtsäure als
Matrix (Teil c von Tabelle 4) analysiert. Bei SDS PAGE wanderte
das Protein geringfügig
rascher als lösliches
Shh, wurde an der C4-Säule
bei der Umkehrphasen-HPLC-Analyse verzögert und enthielt gemäß Massenspektrometrie
ein Ion, das der Palmitinsäure-plus
Cholesterol-Modifikation entsprach. Im Gegensatz zu dem von Insektenzellen
abgeleiteten Produkten, bei dem mehr als 80 % des Produkts sowohl
die Palmitinsäure-
als auch die Cholesterol-Modifikation enthielt, ergaben jedoch das
HPLC-Elutionsprofil und die Daten der Massenspektrometrie, dass
dem Großteil
des von Säugetierzellen
abgeleiteten Proteins der Palmitoylrest fehlte (vergl. Tabelle 4
und 3C). Beim Peak 2 aus EBNA-293-Zellen
betrug nämlich
das Verhältnis
von geschnittenem (des-1-10) zum intakten Protein gemäß dem MS-Signal 50 %, während für den Peak
1 nur etwa 10 % des Shh geschnitten waren. Interessanterweise zeigten
sowohl das Produkt der Insektenzellen als auch das von Säugetierzellen
abgeleitete Produkt eine vergleichbare Aktivität beim C3H10T1/2-Test, was
darauf schließen
lässt,
dass sowohl die Cholesterol-Modifikation als auch die Cholesterol-plus-Palmitinsäure-Modifikation
funktionell waren. Ob die zweite Lipid-Bindungsstelle nur zur weiteren
Stabilisierung der Assoziation des Proteins an die Membran dient
oder ob sie eine aktivere Rolle spielt und die Konformation oder
Protein-Protein-Kontakte beeinflusst, bleibt noch zu klären.
-
Eine
Fettsäure-Derivatisierung
von Proteinen stellt eine übliche
posttranslationale Modifikation dar, die bei Reifungsvorgängen spät erfolgt
(28, 29). Für
Cystein-Derivate
ist der Prozess dynamisch, wobei separate Enzyme beteiligt sind,
die die Modifikation an der Sulfhydrylgruppe hinzufügen und
entfernen. Die häufigsten Funktionen
einer derartigen Derivatisierung (z. B. Palmitoylierung) bestehen
in einer Veränderung
der physikochemischen Eigenschaften des Proteins, d. h. um ein Protein
zielgerichtet an eine Funktionsstelle zu bringen, Protein-Protein-Wechselwirkungen
zu fördern
und Protein-Membran-Wechselwirkungen
zu vermitteln (30). Obgleich bei Hedgehog die Differenz im Ausmaß der Palmitoylierung
in von Insektenzellen abgeleiteten Präparaten und in von Säugetierzellen
abgeleiteten Präparaten überraschend
war (80 % bei Insektenzellen gegenüber 30 % bei Säugetierzellen),
wissen wir nicht, ob diese Differenz biologisch von Bedeutung ist
oder ob sie lediglich Unterschiede in der zellulären Maschinerie der beiden
Testsysteme in Bezug auf die Addition und Entfernung von Palmitinsäure wiederspiegelt.
Es ist unwahrscheinlich, dass der Unterschied im Ausmaß der Modifikation
in Insekten- und Säugetierzellen
speziesbezogen ist, da gebundenem Drosophila-Hedgehog, das in Insektenzellen
erzeugt worden ist, trotz der identischen N-terminalen Sequenz Palmitinsäure fehlt
(19).
-
Tabelle
4 Massenspektrometrische
Analyse von von EBNA-293 abgeleitetem, gebundenem humanem Sonic-Hedgehog
-
Beispiel 6
-
Lipidmodifikationen von
Ratten-Sonic-Hedgehog
-
Dieses
Beispiel erläutert,
dass eine Vielzahl von Lipiden an eine lösliche Version von Ratten-Sonic-Hedgehog
gebunden wird, wenn das Ratten-Shh-Gen, das für die Reste 1–174 kodiert,
in High FiveR Insektenzellen exprimiert wird,
im wesentlichen wie für
humanes Shh in voller Länge
gemäß Beispiel
1. Die Lipidmodifikation bewirkt eine Membranassoziierung dieser
Fraktion. Das N-terminale Fragment (Reste 1–174 von unprozessiertem Ratten-Sonic-Hedgehog) unterscheidet
sich nur um zwei Aminosäurereste
vom N-terminalen Fragment des humanen Sonic-Hedgehog. Im N-terminalen Fragment
von Ratten-Sonic-Hedgehog sind Serin in Position 44 durch Threonin
und Glycin in Position 173 durch Asparaginsäure ersetzt. wenn Ratten-Sonic-Hedgehog,
dem die Autoprozessierungsdomäne
fehlt, im High-FiveR-Insektenzellen/Baculovirus-Expressionssystem
exprimiert wird, wird der Großteil
des Proteins in das Kulturmedium sezerniert, da ihm die Fähigkeit zur
Bindung eines Cholesterolrestes am C-Terminus fehlt. Diese lösliche Form
weist eine spezifische biologische Aktivität (gemessen durch den C3H10T1/2-alkalische
Phosphatase-Induktionstest von Beispiel 3) auf, die ähnlich wie
die des löslichen,
N-terminalen Fragments
von humanem Sonic-Hedgehog ist, das von E. coli exprimiert und gereinigt
worden ist.
-
Jedoch
bleibt eine kleine Fraktion des gesamten Proteins mit den Insektenzellen
assoziiert. Das zellassoziierte Ratten-Sonic-Hedgehog-Protein wurde
im wesentlichen gemäß den Angaben
in Beispiel 1 gereinigt. Es wurde festgestellt, dass es beim alkalischen
Phosphatase-Test
wesentlich aktiver ist (Daten nicht aufgeführt) als die löslichen,
N-terminalen Fragmente von humanem oder Ratten-Sonic-Hedgehog, das
aus dem E. coli- bzw. dem High-FiveR-Insektenzellen/Baculovirus-Expressionssystem
gereinigt worden war. Anschließende Analysen von N-terminalen Ratten-Sonic-Hedgehog-Fragmenten
durch HPLC und Elektrospray-Massenspektrometrie (in Beispiel 1 beschrieben)
lassen darauf schließen,
dass das Protein lipidmodifiziert ist und dass mehr als ein Typ
der Lipidmodifikation vorliegt. Zu Beweisen hierfür gehören die
folgenden Beobachtungen:
- 1. Die zellassoziierten
Formen werden später
als die löslichen,
N-terminalen Fragmente von humanem und Ratten-Sonic-Hedgehog aus einer C4-Umkehrphasen-HPLC-Säule (Vydac Katalog
Nr. 214TP104), die mit einem linearen, 30-minütigen 0–70 %-Acetonitril-Gradient
in 0,1 % Triofluoressigsäure
entwickelt wird, eluiert.
- 2. Die Massen der zellassoziierten Formen stimmen mit den für die lipidmodifizierten
Proteine erwarteten Massen überein,
wie in Tabelle 5 dargelegt ist.
-
Tabelle
5 Massen
verschiedener, lipidmodifizierter Formen von Ratten-Sonic-Hedgehog
-
Die
Position des Lipidrestes wurde unter Verwendung einer Kombination
von Sequenzanalyse und Peptidkartierung bestimmt. Eine automatisierte,
N-terminale Edman-Sequenzierung
der lipidmodifizierten Formen zeigte, dass der N-Terminus blockiert
war, was darauf schließen
lässt,
dass das Lipid am α-Amin
des N-terminalen Cysteins gebunden war. Eine endo-Lys-C-Peptidkartierung,
eine MALDI-TOF-Massenspektrometrie
und eine MALDI-PSD-Analyse (gemäß den Angaben
von Beispiel 1) der mit 4-Vinylpyridin alkylierten, lipidmodifizierten
Formen wurden zur Bestätigung
der Position der Lipidmodifikationen und zur Bestimmung ihrer exakten
Massen herangezogen. Die Massen der N-terminalen Peptide (Reste
1–9 plus
4-Vinylpyridin, gebunden an die Thiolseitenkette des N-terminalen
Cysteins) mit den Lipidmodifikationen stimmten innerhalb von 0,1
Da mit der für
die lipidmodifizierten Peptide erwarteten Masse überein, wie in Tabelle 6 dargelegt
ist.
-
Tabelle
6 Massen
der N-terminalen Peptide die aus verschiedenen lipidmodifizierten
Formen von Ratten-Sonic-Hedgehog isoliert worden sind
-
Zusätzlich zu
den in Tabelle 6 aufgeführten
lipidmodifizierten Peptiden wurden ferner Peptide mit den Massen
1191,74, 1219,84 und 1247,82 nachgewiesen. Diese Massen stimmen
mit ungesättigten
Formen von Myristat, Palmitat bzw. Stearat überein, obgleich die Position
der Doppelbindung in der Alkylkette nicht bestimmt wurde. Diese
Beobachtungen zeigen, dass sowohl gesättigte als auch ungesättigte Fettsäuren kovalent an
das N-terminale Cystein gebunden werden können. Die in Beispiel 1 beschriebene
MALDI-PSD-Analyse bestätigte
sowohl für
die mit gesättigten
als auch mit ungesättigten
Lipiden modifizierten Peptide, dass die Lipide kovalent an den N-terminalen
Cysteinrest gebunden waren.
-
Beispiel 7
-
Lipidmodifikation von
Indian-Hedgehog
-
Um
festzustellen, ob die Palmitoylierungsreaktion für humanes Shh einzigartig ist
oder ob sie auch bei anderen Hedgehog-Proteinen auftreten kann,
testeten wir, ob humanes Indian-Hedgehog (exprimiert in E. coli als
ein His-markiertes
Fusionsprotein mit einer Enterokinase-Spaltungsstelle unmittelbar neben dem
Beginn der reifen Sequenz und genauso wie rekombinantes humanes
Sonic-Hedgehog gereinigt
(vergl. Beispiel 9)) unter Anwendung des in Beispiel 2 beschriebenen
Tests palmitoyliert werden kann. Humanes Indian-Hedgehog wurde modifiziert
(vergl. 1, Bahn h), was darauf hinweist,
dass die Palmitoylierung vermutlich ein gemeinsames Merkmal von Hedgehog-Proteinen
ist. Die Fähigkeit
zur direkten Markierung von Shh und Ihh mit radioaktiver Palmitinsäure in einem
zellfreien System ergab ein einfaches Screening auf Aminosäuren, die
bei der Modifikationsreaktion beteiligt sind. Außerdem war Indian-Hedgehog,
das gemäß dem Verfahren
von Beispiel 8 palmitoyliert war, beim C3H10T1/2-Test erheblich wirkungsstärker als
unmodifiziertes Ihh.
-
Beispiel 8
-
Lipidmodifikationen von
Sonic-Hedgehog unter Verwendung von Acyl-coenzym A
-
Die
in vitro-Acylierung eines Proteins mit einem Gehalt an einem N-terminalen
Cystein kann über
ein 2-stufiges Verfahren
durch chemische Reaktion mit einem Fettsäurethioester-Donator erfolgen.
Bei der ersten Stufe wird die Acylgruppe des Thioester-Donators
auf die Sulfhydrylgruppe des N-terminalen Cysteins am Protein durch
eine spontane Umesterungsreaktion übertragen. Anschließend unterliegt
der Acylrest einer Verschiebung von S nach N auf das α-Amin des
N-terminalen Cysteins unter Bildung einer stabilen Amidbindung. Eine
direkte Acylierung einer Aminfunktion an einem Protein kann auch
bei einer verlängerten
Inkubation mit einem Thioester erfolgen, jedoch beschleunigt das
Vorliegen eines Cysteins am Protein die Umsetzung und ermöglicht eine
Kontrolle der Acylierungsstelle. In den vorliegenden Beispielen
wurden handelsübliche
Coenzym A-Derivate (Sigma Chemical Company, St, Louis, MO) verwendet,
wobei aber auch andere Thioestergruppen zum gleichen Ergebnis führen würden. Tatsächlich ist
zu erwarten, dass bestimmte austretende Thioestergruppen, wie Thiobenzylester,
rascher reagieren. Interne Cysteinreste können ebenfalls die Acylierung
auf benachbarte Lysine (d. h. wie in einem internen Cystein-Lysin-Paar) fördern. Dies
kann zweckmäßigerweise unter
Verwendung von synthetischen Peptiden getestet werden. Sekundäre Acylierungen,
die am Protein während
der Umsetzung mit Thioestern erfolgen, können durch Steuerung der Pufferzusammensetzung,
des pH-Werts oder durch ortsgerichtete Mutagenese der benachbarten
Lysine verhindert werden.
-
Bei
vorausgehenden Analysen über
den Einfluss der Acylierung auf die Fähigkeit von humanem Sonic-Hedgehog
zur Induktion von alkalischer Phosphatase in C3H10T1/2-Zellen enthielten
die Reaktionsgemische 1 mg/ml humanes Sonic-Hedgehog (51 μM), 500 μM des speziellen handelsüblichen
Acyl-coenzyms A (zu den getesteten Verbindungen gehörten Acetyl-CoA
(C2:0), Butyryl-CoA (C4:0), Hexanoyl-CoA (C6:0), Octanoyl-CoA (C8:0),
Decanoyl CoA (C10:0), Lauroyl-CoA (C12:0), Myristoyl-CoA (C14:0),
Palmitoyl-CoA (C16:0), Palmitoleoyl-CoA (C16:1), Stearoyl-CoA (C18:0),
Arachidoyl-CoA (C20:0),
Behenoyl-CoA (C22:0), Lignoceroyl-CoA (C24:0), Succinyl-CoA und
Benzoyl-CoA), 25 mM DTT und 50 mM Na2HPO4, pH-Wert 7,0. Die Reaktionsgemische wurden
3 Stunden bei Raumtemperatur inkubiert und sodann sofort (ohne Reinigung)
einem Test ihrer biologischen Aktivität beim C3H10T1/2-Test gemäß der Beschreibung
in Beispiel 3 unterzogen. Proben für die Analyse durch Umkehrphasen-HPLC
und andere physikalische Methoden wurden üblicherweise bei –70 °C aufbewahrt.
Die HPLC-Analyse wurde an einer Vydac C4-Umkehrphasensäule (Innendurchmesser
4,6 mm × 250
mm, Teilchengröße 5 μm) mit einem
40 min-Gradienten von 5 % Acetonitril bis 85 % Acetonitril in wässriger
0,1 % TFA bei einer Fließgeschwindigkeit
von 1 ml/min durchgeführt.
Das ausströmende
Produkt wurde bei 280 nm überwacht.
Fraktionen wurden in einigen Experimenten gesammelt und durch SDS-PAGE
auf Hedgehog-Protein unter Nachweis mit Coomassie-Färbung und
durch Western-Blotting analysiert.
-
Ein
Vergleich der Aktivität
der verschiedenen Reaktionsgemische (10)
zeigt, dass eine Kettenlänge
von 12 bis 18 Kohlenstoffatomen optimal in Bezug auf eine Induktion
einer starken Aktivität
von alkalischer Phosphatase ist, verglichen mit dem unmodifizierten
Protein. Eine weitere Steigerung der Kettenlänge führte zu einer offensichtlichen
Verringerung der Aktivität.
Die Anwesenheit einer Doppelbindung im ungesättigten Palmitoleoyl-CoA (C16:1)
ergab die gleiche Aktivität
wie bei vollständig
gesättigtem
Palmitoyl-CoA (C16:0). Bei Umkehrphasen-HPLC-Analyse der Reaktionsgemische
stellten wir fest, dass zahlreiche kürzerkettige Acyl-CoA-Derivate
nicht mit dem Hedgehog-Protein reagiert hatten. Daher stellte die
Abhängigkeit
der in 10 dargestellten biologischen
Aktivität
kein echtes Abbild der Acylkettenlänge dar.
-
Um
Daten über
die echte Aktivität
der modifizierten Proteine und über
die Abhängigkeit
der Aktivität von
der Acylkettenlänge
zu erhalten, entwickelten wir Verfahren für die Synthese und Reinigung
der einzelnen, N-terminalen, acylierten Formen. Palmitoylierte,
myristoylierte, lauroylierte, decanoylierte und octanoylierte, humane
Sonic-Hedgehog-Proteine, bei denen eine einzige Acylkette am α-Amin des
N-terminalen Cysteins gebunden war, wurden in Reaktionsgemischen
mit einem Gehalt an 0,80 mg/ml (41 μM) humanem Sonic-Hedgehog 410 μM (10-facher
molarer Überschuss)
an Palmitoyl-CoA, Myristoyl-CoA oder Lauroyl-CoA oder 4,1 mM (100-facher molarer Überschuss)
an Decanoyl-CoA oder Octanoyl-CoA, 25 mM DTT (für Reaktionsgemische mit einem
Gehalt an Palmitoyl-CoA, Myristoyl-CoA oder Lauroyl-CoA) oder 0,5
mM DTT (für Reaktionsgemische
mit einem Gehalt an Decanoyl-CoA oder Octanoyl-CoA)und 40 mM Na2HPO4, pH-Wert 7,0,
hergestellt. Die Reaktionsgemische wurden 24 Stunden bei 28 °C inkubiert.
Eine Umsetzung des N-terminalen Cysteins mit Acylthioestern führt zu einer Übertragung
der Acylgruppe auf die Sulfhydrylgruppe durch eine spontane Umesterungsreaktion,
wonach eine Verschiebung von S zu N auf das α-Amin unter Bildung einer stabilen
Amidbindung erfolgt. Die freie Sulfhydrylgruppe unterliegt sodann
einer zweiten Umesterungsreaktion, woraus sich ein Protein mit einer
Fettsäureacylgruppe,
die über
eine Thioesterbindung an die Sulfhydrylgruppe gebunden ist, ergibt.
Die thioesterverknüpfte
Acylgruppe wurde durch aufeinanderfolgende Zugabe von 0,11 Volumenteilen
1 M Na2HPO4, pH-Wert
9,0, und 0,11 Volumenteilen 1 M Hydroxylamin (endgültige Konzentration
0,1 M) unter anschließender
18-stündiger
Inkubation bei 28 °C
entfernt, wodurch nur das an das Protein gebundene Acylamid verblieb
(62). 0,25 Volumenteile 5 % Octylglucosid wurden sodann zugegeben (Endkonzentration
1 %) und das Gemisch wurde 1 Stunde bei Raumtemperatur inkubiert.
Sodann wurden die Proteine in Gegenwart von 1 % Octylglucosid unter
Anwendung einer SP-Sepharose Fast Flow (Pharmacia)-Chromatographie
und einer Bio Scale S (Biorad)-Kationenaustauscher-Chromatographie gereinigt.
Die gereinigten Proteine wurden gegen 5 mM Na2HPO4, pH-Wert 5,5, 150 mM NaCl, 1 % Octylglucosid
und 0,5 mM DTT dialysiert und bei –70 °C aufbewahrt. Die Anwesenheit
von Octylglucosid war zur Aufrechterhaltung der vollständigen Löslichkeit
erforderlich. Nach Entfernung des Detergens durch Verdünnung und
Dialyse ergab sich ein Verlust von 75 %, 41 % bzw. 15 % des palmitoylierten,
myristoylierten bzw. lauroylierten Proteins. Eine ESI-MS-Analyse
der HPLC-gereinigten
Proteine bestätigte
deren Integrität:
palmitoyliertes Sonic-Hedgehog, gemessene Masse = 19 798, berechnete
Masse = 19 798,43; myristoyliertes Sonic-Hedgehog, gemessene Masse = 19 770,
berechnete Masse = 19 770,33; lauroyliertes Sonic-Hedgehog, gemessene
Masse = 19 742, berechnete Masse = 19 742,33; decanoyliertes Sonic-Hedgehog, gemessene
Masse = 19 715, berechnete Masse = 19 714,28; octanoyliertes Sonic-Hedgehog,
gemessene Masse = 19 686, berechnete Masse = 19 686,23.
-
Eine
Analyse der verschiedenen acylierten Formen von humanem Sonic-Hedgehog
beim C3H10T1/2-Test (11) zeigte, dass die Aktivität der Proteine
von der Kettenlänge
abhängig
war. Die palmitoylierten, myristoylierten und lauroylierten Proteine
zeigten eine annähernd
gleiche Aktivität
mit EC50-Werten von 5–10 ng/ml (100- bis 200-fache Steigerung
der Wirkungsstärke
im Vergleich zum unmodifizierten Protein). Decanoyliertes, humanes
Sonic-Hedgehog mit
einem EC50-Wert von 60–70 ng/ml (15- bis 30-fache Zunahme der
Wirkungsstärke
im Vergleich zum unmodifizierten Protein) war weniger aktiv als
die palmitoylierten, myristoylierten und lauroylierten Formen, während die
octanoylierte Form mit einem EC50-Wert von
100–200
ng/ml die geringste Aktivität
aufwies (10-fache Zunahme der Wirkungsstärke im Vergleich zum unmodifizierten
Protein). Sämtliche
acylierten Formen waren wirkungsstärker als das unmodifizierte
Protein, das einen EC50-Wert von 1000–2000 ng/ml
aufwies. Zusätzlich
zur Abnahme des EC50-Werts induzierten die palmitoylierten,
myristoylierten und lauroylierten Proteine die Aktivität von alkalischer
Phosphatase etwa 2-fach stärker
als das unmodifizierte Protein, während die decanoylierten und
octanoylierten Proteine eine etwa 1,5-fach stärkere Induktion bewirkten.
-
Zusätzlich zur
Zunahme der Wirkungsstärke
der myristoylierten Form von humanem Sonic-Hedgehog, die beim C3H10T1/2-Test
beobachtet wurde, ist diese Form bezüglich der Induktion von ventralen
Vorhirn-Neuronen in Explantaten von Ratten-Endhirn im embryonalen
Stadium El1 signifikant stärker
wirksam als das unmodifizierte Protein. Eine Inkubation von E11-Endhirn-Explantaten
mit verschiedenen Konzentrationen von unmodifiziertem oder myristoyliertem
Sonic-Hedgehog und eine anschließende Färbung der Explantate für die Produkte
der dlx- und islet-1/2-Gene (Marker für ventrale Vorhirn-Neuronen)
zeigt, dass eine Induktion durch das unmodifizierte Protein erstmals
bei 48 nM beobachtet wird, während
eine Induktion durch die myristoylierte Form erstmals bei 3 nM beobachtet
wird. Außerdem
induziert das unmodifizierte Protein eine eingeschränkte Expression
bei 3070 nM, während
das myristoylierte Protein eine ausgedehnte Expression bei nur 48
nM induziert. Eine ähnliche
Zunahme der Wirkungsstärke
wurde beobachtet, wenn Explantate von mutmaßlichem Endhirn im embryonalen
Zustand E9 entweder mit dem unmodifizierten oder dem myristoylierten Protein
inkubiert wurden. Eine Färbung
der Explantate für
das Produkt des Nkx2.1-Gens (ein früher Marker der ventralen Vorhirn-Neuronen)
zeigte, dass das unmodifizierte Protein Nkx2.1 erstmals bei 384
nM induzierte, während
für das
myristoylierte Protein eine Expression von Nkx2.1 erstmals bei 12
nM festgestellt wurde. Außerdem
war bei einer Konzentration des myristoylierten Sonic-Hedgehog von
48 nM die Expression von Nkx2.1 ausgedehnt, während sie bei dieser Konzentration
unter Verwendung der unmodifizierten Form nicht nachweisbar war.
-
Ferner
wurde gezeigt, dass myristoyliertes, humanes Sonic-Hedgehog signifikant
wirkungsstärker
als das unmodifizierte Protein in Bezug auf eine Verringerung des
Läsionsvolumens,
die sich bei einer Verabreichung von Malonat in das Striatum des
Rattenhirns ergibt (vergl. Beispiel 16), war.
-
Beispiel 9
-
Chemische Derivate des
N-terminalen Cysteins von humanem Sonic-Hedgehog
-
A. Allgemeine Verfahren
-
Alkylierung
von Proteinen: Proben mit einem Gehalt an etwa 20 μg des Proteins
in 50 μ1
6 M Guanidin-hydrochlorid, 50 mM Na2HPO4 pH-Wert 7,0, wurden 2 Stunden bei Raumtemperatur
mit 0,5 μl
4-Vinylpyridin behandelt. Das S-pyridylethylierte
Protein wurde durch Zugabe von 40 Volumenteilen gekühltem Ethanol ausgefällt. Die
Lösung
wurde 1 Stunde bei –20 °C aufbewahrt
und sodann 8 Minuten bei 4 °C
mit 14 000 g zentrifugiert. Die Überstände wurden
verworfen. Der Niederschlag wurde mit gekühltem Ethanol gewaschen. Das
Protein wurde bei –20 °C aufbewahrt.
-
Peptid-Kartierung:
Alkyliertes Protein (0,4 mg/ml in 1 M Guanidin-hydrochlorid, 20
mM Na2HPO4, pH-Wert
6,0) wurde mit endo-Lys-C (Wako Pure Chemical Industries, Ltd.)
in einem Verhältnis
von 1:20 verdaut. Die Verdauung wurde 30 Stunden bei Raumtemperatur
durchgeführt.
Sodann wurde die Umsetzung durch Ansäuerung mit 5 μl 25 % Triofluoressigsäure gestoppt.
Das Verdauungsprodukt wurde an einem Waters 2690 Separation Module-Gerät mit einem
Modell 996-Photodioden-Reihendetektor analysiert. Vor der Injektion
wurde das Verdauungsprodukt mit Guanidin-hydrochlorid in einer Konzentration
von 6 M versetzt, um unlösliches
Material aufzulösen.
Eine Umkehrphasen-Vydac-C18-Säule
(2,1 mm Innendurchmesser × 250
mm) wurde für
die Trennung verwendet, wobei ein 90 Minuten-Gradient von 0,1 % Trifluoressigsäure/Acetonitril
und 0,1 % Trifluoressigsäure/Acetonitril
mit einer Fließgeschwindigkeit
von 0,2 ml/min eingesetzt wurde. Einzelne Peaks wurden manuell für die Massenanalyse
gesammelt.
-
Massenbestimmung:
Die Molekülmassen
von intakten Proteinen wurden durch Elektrospray-Ionisationsmassenspektroskopie (ESI-MS)
an einem Micromass Quattro II-Dreifachquadrupol-Massenspektrometer bestimmt.
Proben wurden unter Verwendung eines Online-Michrom Ultrafast MicroProtein
Analyzer-Systems mit einer Reliasil-C4-Säule (1 mm
Innendurchmesser × 50
mm) entsalzt. Die Fließgeschwindigkeit
betrug 20 μL/min.
Sämtliche
Elektrospray-Massenspektrumsdaten wurden unter Verwendung des Micromass
MassLynx-Datensystems verarbeitet. Die Molekülmassen der Peptide wurden
durch matrixgestützte
Laser-Desorptionsionisation-Flugzeit-Massenspektrometrie (MALDI-TOF-MS)
an einem Voyager-DER-STR-Gerät (PerSeptive
Biosystems, Framingham, MA) bestimmt. Die Sequenzierung des modifizierten
Peptids wurde durch Post-source-Zerfall (PSD)-Messung am gleichen
Instrument durchgeführt. α-Cyano-4-hydroxyzimtsäure wurde
als Matrix verwendet.
-
N-terminale
Sequenzierung: Proteine wurden durch Edman-Abbau an einem Perkin-Elmer
Applied Biosystems Modell 477A Pulsed-Liquid Protein Sequencer-Gerät sequenziert.
PTH-Thiaprolin wurde on-line durch direktes Beladen der Probenbeladungskartusche
des Sequenziergeräts
mit Thiaprolin (Thiazolidin-4-carbonsäure) hergestellt.
-
Bakterielle
Expression und Reinigung des für
die chemische Modifikation verwendeten terminalen Fragments von
löslichem,
humanem Wildtyp-Sonic-Hedgehog: Bakterielle Pellets von Zellen,
die Shh in einer Menge von 4–5
% des gesamten Proteins exprimierten, wurden aufgetaut, in Lysispuffer
(25 mM Na2HPO4, pH-Wert
8, 150 mM NaCl, 1 mM EDTA, 1 mM PMSF, 0,5 mM DTT) in einem Verhältnis von
1:4 (Gew./Vol.) resuspendiert und durch zwei Durchgänge durch
eine Gaulin-Presse (Produkt der Fa. APV Rannie, Kopenhagen, Dänemark)
bei 12 000 psi lysiert. Sämtliche
anschließenden Reinigungsstufen
wurden bei 2–8 °C durchgeführt, sofern
nichts anderes angegeben ist. Das Homogenisat wurde 60 Minuten mit
19 000 g zentrifugiert. 0,5 M MES, pH-Wert 5, wurde zum erhaltenen
Lysat in einem Verhältnis
von 1:10 (Vol./Vol.) gegeben. Das Lysat (vom pH-Wert 5,5) wurde
auf eine SP-Sepharose-Fast Flow-Säule (Pharmacia, Piscataway,
NJ) (4 g E. coli-Feuchtgewicht/ml Harz), die mit 25 mM Na2HPO4, pH-Wert 5,5,
150 mM NaCl äquilibriert
worden war, aufgesetzt. Die Säule
wurde mit 4 Säulenvolumina
(CV) Äquilibrationspuffer
und anschließend
mit 3 CV 25 mM Na2HPO4,
pH-Wert 5,5, 200 mM NaCl, 0,5 mM DTT gewaschen. Histag-Shh wurde
mit 800 mM NaCl im gleichen Puffer eluiert. Die Elutionsfraktionen
wurden auf ihre Absorption bei 280 nm und durch SDS-PAGE analysiert.
Imidazol (1 M Vorratslösung
vom pH-Wert 7 und NaCl (5 M Vorratslösung) wurden zu einem Pool
der Shh enthaltenden Peakfraktionen aus dem SP-Sepharose-Eluat gegeben,
wobei Endkonzentrationen von 20 mM bzw. 1 M erzielt wurden. Dieses
Material wurde auf eine NTA-Ni-Agarose-Säule (Qiagen, Santa Clara, CA) (20
mg/ml Harz), die mit 25 mM Na2HPO4, pH-Wert 8, 1 M NaCl, 20 mM Imidazol, 0,5
mM DTT äquilibriert
worden war, aufgesetzt. Die Säule
wurde mit 5 CV des gleichen Puffers gewaschen und Histag-Shh wurde
mit 3 CV 25 mM Na2HPO4,
pH-Wert 8, 1 M NaCl, 200 mM Imidazol, 0,5 mM DDT eluiert. Der Proteingehalt
im Eluatpool aus der NTA-Ni-Säule
wurde durch Absorption bei 280 nm bestimmt. Der Pool wurde auf Raumtemperatur
erwärmt
und sodann mit einem gleichen Volumen an 2,5 M Natriumsulfat versetzt.
Die Phenyl-Sepharose-Stufe wurde bei Raumtemperatur durchgeführt. Das
Material wurde auf eine Phenyl-Sepharose Fast Flow-Säule (Pharmacia,
Piscataway, NJ) (20 mg/ml Harz), die mit 25 mM Na2HPO4, pH-Wert 8, 400 mM NaCl, 1,25 M Natriumsulfat,
0,5 mM DTT äquilibriert
worden war, aufgesetzt. Histag-Shh wurde mit 25 mM Na2HPO4, pH-Wert 8, 400 mM NaCl, 0,5 mM DTT eluiert.
Typischerweise gewannen wir 2–3
g His-markiertes Shh aus 0,5 kg Bakterienpaste (Feuchtgewicht).
Das Produkt wurde durch ein 0,2 μm-Filter
filtriert, in Aliquotanteile aufgeteilt und bei –70 °C aufbewahrt. Das His-markierte
Shh war gemäß Bestimmung
durch SDS-PAGE zu etwa 95 % rein. Als weitere Bestimmung der Eigenschaften
des gereinigten Produkts wurden Proben einer Bewertung durch Elektrospray-Ionisationsmassenspektrometrie
(ESI-MS) unterworfen. Bei etwa 50 % des Proteins fehlte das N-terminale
Methionin.
-
Zur
Abspaltung der Hexahistidin-Markierung wurde Enterokinase (Biozyme,
San Diego, CA) mit dem Histag-Shh bei einem Verhältnis von Enzym zu Shh von
1:1000 (Gew./Gew.) 2 Stunden bei 28 °C inkubiert. Nicht-gespaltenes Histag-Shh
und freies Histag wurden durch Passage des Verdauungsprodukts durch
eine zweite NTA-Ni-Agarose-Säule (20
mg Shh/ml Harz) entfernt. Vor dem Aufsetzen wurde das Verdauungsprodukt
mit Imidazol (1 M Vorratslösung
vom pH-Wert 7) und NaCl (5 M Vorratslösung) versetzt, wobei Endkonzentrationen
von 20 mM bzw. 600 mM erzielt wurden. Dieses Material wurde auf
eine NTA-Ni-Säule, die
in 25 mM Na2HPO4,
pH-Wert 8, 600 mM NaCl, 20 mM Imidazol, 0,5 mM DTT äquilibriert
worden war, aufgesetzt. Das durchfließende Material wurde gesammelt.
Die Säule
wurde mit 1 CV des gleichen Puffers gewaschen. Die Waschflüssigkeit
wurde mit dem durchfließenden
Material vereinigt. MES (0,5 M Vorratslösung vom pH-Wert 5) wurde zu
der ungebundenen NTA-Ni-Agarose-Fraktion in einer Endkonzentration
von 50 mM gegeben. 2 Volumenteile Wasser wurden zugegeben. Dieses
Material wurde auf eine zweite SP-Sepharose Fast Flow-Säule (20
mg/ml Harz), die mit 5 mM Na2HPO4, pH-Wert 5,5, 150 mM NaCl, 0,5 mM DTT äquilibriert
worden war, aufgesetzt. Die Säule
wurde mit 3 CV Äquilibrationspuffer
und 1 CV des gleichen Puffers mit einem Gehalt an 300 mM NaCl gewaschen.
Shh wurde mit 5 mM Na2HPO4,
pH-Wert 5,5, 800 mM NaCl, 0,5 mM DTT eluiert. Die Atomabsorptionsdaten
ergaben, dass Shh in diesem Stadium 0,5 Moläquivalent Zn2+ enthielt.
Eine äquimolare
Konzentration von ZnCl2 wurde zum Shh-Elutionsprodukt
gegeben. Das Protein wurde gegen 5 mM Na2HPO4, pH-Wert 5,5, 150 mM NaCl, 0,5 mM DTT dialysiert.
Das erhaltene Shh wies eine Reinheit von >98 % auf, wie durch SDS-PAGE, Größenausschlusschromatographie
(SEC) und ESI-MS bestimmt wurde. Gemäß Atomabsorption enthielt es
0,9 bis 1,1 Zn2+/Shh.
-
Die
ESI-MS-Daten für
Histag-Shh und die Produkte nach Entfernung des Histags sind in
Tabelle 7 zusammengestellt.
-
Tabelle
7 Charakterisierung
von Shh durch ESI-MS
-
B. Spezifische chemische
Modifikationen
-
Modifikation
von humanem Sonic-Hedgehog mit N-Ethylmaleinimid:
Gereinigtes Shh wurde in 5 mM Na2HPO4, pH-Wert
5,5, 150 mM NaCl, 0,5 mM DTT mit 10 mM N-Ethylmaleinimid 1 Stunde auf Eis behandelt und
sodann gegen 5 mM Na2HPO4,
pH-Wert 5,5, 150 mM NaCl dialysiert. Die MALDI-TOF-MS-Daten zeigten, dass
das mit N-Ethylmaleinimid (NEM) modifizierte Protein eine Massenzunahme
von 126 Da aufwies, was zeigt, dass nur ein Cysteinrest in Shh durch
das Reagenz modifiziert worden war. Die Daten der N-terminalen Sequenzierung
zeigten, dass das Protein sequenzierbar ist und dass ein ungewöhnlicher
Peak, vermutlich durch PTH-NEM-Cys bedingt, im ersten Zyklus nachgewiesen
wurde (Daten nicht aufgeführt).
Eine massenspektrometrische Analyse des pyridylethylierten NEM-Shh unter Denaturierungsbedingungen
ergab, dass nur zwei Cysteinreste im Protein alkyliert waren, was
bestätigt,
dass nur die Thiolgruppe des N-terminalen Cysteinrestes durch NEM
unter nativen Bedingungen modifiziert wurde (Tabelle 8). Die beiden übrigen Cysteinreste, die
offensichtlich im hydrophoben Kern des Proteins eingeschlossen sind,
können
ohne vorherige Denaturierung nicht modifiziert werden.
-
Tabelle
8 Charakterisierung
von NEM-modifiziertem Shh durch MS
-
Beim
Test mit dem C3H10T1/2-Test (vergl. Beispiel 3) zeigte das modifizierte
N-Ethylmaleinimid-Hedgehog-Protein eine gleiche Aktivität wie das
unmodifizierte Protein. Dies belegt, dass ein freies Sulfhydryl
am N-Terminus von Hedgehog für
die Aktivität
nicht erforderlich war und dass der N-Ethylmaleinimidrest ausreichend
hydrophob ist, um dem Hedgehog eine gewisse Aktivität zu verleihen,
verglichen mit anderen, stärker
hydrophilen Modifikationen, wie eine Umwandlung von Cys-1 in His
oder Asp, was zu einer Aktivitätsverringerung
führt.
-
Modifikation
von humanem Sonic-Hedgehog mit Formaldehyd unter Bildung eines N-terminalen
Thiaprolins sowie mit Acetaldehyd und Butyraldehyd unter Bildung
von N-terminalen
Thiaprolia-Derivaten: Für
die Formaldehyd-Modifikation
wurde gereinigtes Shh in einer Konzentration von 3 mg/ml in 5 mM
Na2HPO4, pH-Wert
5,5, 150 mM NaCl, 0,5 mM DTT mit 0,1 % Formaldehyd mit oder ohne
10 % Methanol 1 bis 6 Stunden bei Raumtemperatur behandelt. Das
Protein wurde entweder gegen 5 mM Na2HPO4, pH-Wert 5,5, 150 mM NaCl dialysiert oder
an einer CM-Poros-Säule
(Perseptive Biosystems) gemäß den nachstehenden
Angaben gereinigt und anschließend
gegen 5 mM Na2HPO4,
pH-Wert 5,5, 150 mM NaCl dialysiert. Zur Modifikation mit Acetaldehyd
oder Butyraldehyd wurde gereinigtes Shh in einer Konzentration von
3 mg/ml in 5 mM Na2HPO4, pH-Wert
5,5, 150 mM NaCl, 0,5 mM DTT mit 0,1 % Acetaldehyd oder Butyraldehyd
1 Stunde bei Raumtemperatur behandelt und sodann wurde das Protein
an einer CM-Poros-Säule
gereinigt. ESI-MS-Daten für
die mit Formaldehyd, Acetaldehyd und Butyraldehyd behandelten Formen
des Proteins ergaben, dass ihre Massen 13 Da, 27 Da und 54 Da höher waren
als beim unmodifizierten Protein (Tabelle 9).
-
Tabelle
9 Erwartete
und beobachtete Massen von humanem Sonic-Hedgehog nach Behandlung
mit Formaldehyd Acetaldehyd und Butyraldehyd
-
Für das mit
Formaldehyd behandelte Protein zeigte eine Peptidkartierung gemäß den vorstehenden Angaben,
dass die Modifikation im Peptid an einer Stelle erfolgte, die die
ersten 9 N-terminalen Reste überspannte
und dass die genaue Massenzunahme 12 Da betrug. Die Ergebnisse von
MALDI-PSD-MS-Untersuchungen
dieses Peptids ergaben, dass die Modifikation an Cys-1 erfolgte
und durch eine Modifikation des N-terminalen α-Amins und der Thiol-Seitenkette
von Cys-1 unter Bildung eines Thiaprolins erklärt werden konnte (vergl. 12). Die Struktur des Thiaprolins wurde durch
automatisierte, N-terminale Edman-Sequenzierung unter Verwendung
von "on-line" hergestelltem PTH-Thiaprolin
als Standard bestätigt.
Für die
mit Acetaldehyd und Butyraldehyd behandelten Proteine stimmten die
ESI-MS-Daten mit den Modifikationen überein, die mit Hilfe der gleichen
Chemie wie bei der Umsetzung mit Formaldehyd auftraten, obgleich
die genaue Modifikationsstelle nicht festgestellt wurde. Beim Test
auf der Basis von C3H10T1/2-Zellen waren die mit Formaldehyd, Acetaldehyd
und Butyraldehyd modifizierten Proteine etwa 8-fach, 2-fach bzw.
3-fach stärker
wirksam als das unmodifizierte Shh.
-
Modifikation
von humanem Sonic-Hedgehog mit N-
-
Isopropyliodacetamid:
Dieses Beispiel zeigt, dass eine Modifikation von humanem Shh mit
einem hydrophoben Derivat von Iodacetamid die Wirkungsstärke des
Proteins im Vergleich zum unmodifizierten Shh verstärken kann.
Gereinigtes Shh (1 mg/ml in 5 mM Na2HPO4, pH-Wert 7,0, 150 mM NaCl, 0,1 mM DTT)
wurde 18 Stunden bei 4 °C
mit 1 mM N-Isopropyliodacetamid
(NIPIA) inkubiert. Sodann wurde DTT in einer Endkonzentration von
10 mM zugegeben und die Probe wurde gründlich gegen 5 mM Na2HPO4, pH-Wert 5,5,
150 mM NaCl, 0,5 mM DTT dialysiert. Die Probe wurde an SP-Sepharose Fast-Flow-Harz
gereinigt und weiter gegen 5 mM Na2HPO4, pH-Wert 5,5, 150 mM NaCl, 0,5 mM DTT dialysiert.
Die ESI-MS-Daten ergaben eine vollständige Umwandlung in eine Spezies
mit einer Masse von 19 660, was dem vorhergesagten Massewert (19
659) für
das einfach modifizierte Protein entsprach. Eine spezifische Modifikation
am N-terminalen Cystein wurde durch Peptidkartierung von proteolytischen
Fragmenten bestätigt.
Beim Testen mit dem Test auf der Basis von C3H10T1/2-Zellen war
das mit NIPIA modifizierte, humane Shh etwa 2-fach stärker wirksam
als das unmodifizierte Protein. Während die Modifikation des
Proteins nur eine mäßige Steigerung
der Wirkungsstärke
ergab, ist zu erwarten, dass eine Modifikation des Proteins mit
langkettigen Alkyliodacetamid-Derivaten zu hydrophob modifizierten
Formen des Proteins mit einer größeren Steigerung
der Wirkungsstärke
führt,
möglicherweise
zu einer nahezu 100- bis
200-fachen Steigerung, die für
die palmitoylierten, myristoylierten und lauroylierten Shh-Proteine
festgestellt wurde (vergl. Beispiel 8).
-
Modifikation
von humanem Sonic-Hedgehog mit 1-Brom-2-butanon unter Bildung eines 6-gliedrigen hydrophoben
Rings am N-Terminus: Ein Thiomorpholinyl-(tetrahydrothiazinyl)-Derivat von Shh wurde
hergestellt, indem man humanes Shh-N (3 mg/ml in 5 mM Na2HPO4, pH-Wert 5,5,
150 mM NaCl, 0,15 mM DTT) mit 11 mM 1-Brom-2-butanon 60 Minuten
bei Raumtemperatur inkubierte und anschließend 60 Minuten bei Raumtemperatur
mit 5 mM NaCNBH3 reduzierte. Das Reaktionsprodukt
wurde an einer CM-Poros-Säule
(Perseptive Biosystems) gemäß den nachstehenden
Angaben gereinigt und gegen 5 mM Na2HPO4, pH-Wert 5,5, 150 mM NaCl, 0,5 mM DTT dialysiert.
ESI-MS und die Daten einer proteolytischen Peptidkartierung ergaben,
dass es sich bei dem Produkt um ein Gemisch des erwarteten Thiomorpholinyl-Derivats
(berechnete Masse = 19 615, beobachtete Masse = 19 615) und zwei
Formen des Proteins jeweils mit 16 zusätzlichen Masseeinheiten handelte.
Bei einer dieser Formen handelt es sich vermutlich um das nicht-cyclisierte
Ketothioether-Zwischenprodukt.
Das Gemisch wurde im C3H10T1/2-Test getestet, wobei sich ergab,
dass es etwa 5-fach stärker
wirksam als das nicht-modifizierte Protein war.
-
Beispiel 10
-
Gentechnisch hergestellte
Mutationen von humanem Sonic-Hedgehog
-
A. Gentechnisch hergestellte
Mutationen des N-terminalen
Cysteins
-
In
diesem Beispiel zeigen wir, dass ein spezifisches Ersetzen des N-terminalen
Cysteins von humanem Sonic-Hedgehog
(Cys-1) durch einzelne oder mehrere hydrophobe Aminosäurereste
zu einer erhöhten Wirkungsstärke im Vergleich
zum Wildtypprotein bei dem in Beispiel 3 beschriebenen Test auf
der Basis von C3H10T1/2-Zellen führt.
-
Konstruktion
von Shh-Cys-1-Mutanten: Das 584 bp-NcoI-XhoI-Restriktionsfragment mit dem His-markierten
N-terminalen Wildtyp-Shh-Fragment
aus p6H-SHH wurde in den von pUC abgeleiteten Klonierungsvektor
pNN05 subkloniert, um das Plasmid pEAG649 zu konstruieren. Cys-1-Mutanten
von löslichem,
humanem Shh wurden durch Eliminationsmutagenese an einer einzigen
Stelle der pEAG649-Plasmidmatrize unter Verwendung eines Pharmacia-Kits
gemäß dem vom
Hersteller empfohlenen Verfahren hergestellt. Bei der Konstruktion
der Mutageneseprimer wurde dann, wenn eine angestrebte Mutation keine
Restriktionsstellenänderung
hervorrief, eine stumme Mutation, die eine Restriktionsstellenänderung
hervorruft, in ein benachbartes Codon eingeführt, um die Identifizierung
von mutanten Klonen nach der Mutagenese zu erleichtern. Um eine fehlerhafte
Codonanwendung zu vermeiden, wurden substituierte Codons unter den
Codons ausgewählt,
die mindestens 1-mal an einer anderen Stelle in der humanen Shh-cDNA-Sequenz
auftreten. Die folgenden Mutageneseprimer wurden eingesetzt: (1)
für C1F:
5' GGC GAT GAC GAT
GAC AAA TTC GGA CCG GGC AGG GGG TTC 3' (SEQ ID NO: ), die eine ApoI-Stelle
einführt,
zur Herstellung von pEAG837; (2) für C1I: 5' GGC GAT GAC GAT GAC AAA ATA GGA CCG
GGC AGG GGG TTC 3' (SEQ
ID NO: ), die eine RsrII-Stelle
beseitigt, zur Herstellung von pEAG838; und (3) für C1M: 5' GGC GAT GAC GAT
GAC AAA ATG GGC CCG GGC AGG GGG TTC GGG 3' (SEQ ID NO: ), die sowohl die RsrII-
als auch AvaII-Stellen beseitigt, um pEAG839 herzustellen. Die Mutationen
wurden durch DNA-Sequenzierung über
ein 180 bp-NcoI-BglII-Restriktionsfragment
mit den mutanten N-Termini des Shh-Proteins in den Plasmiden pEAG837-839
bestätigt.
Expressionsvektoren wurden konstruiert, indem von den einzelnen
Plasmiden das 180 bp-NcoI-BglII-Fragment und das 404 bp BglII-XhoI-Fragment
aus pEAG649 in das mit Phosphatase behandelte 5,64 kb-Xho-NcoI-pET11d-Vektorgerüst von p6H-SHH
subkloniert wurden. Die Anwesenheit der eingeführten Restriktionsstellenänderung wurde
im Expressionsvektor für
jede Cys-1-Mutante bestätigt
(C1F in pEAG840, C1I in pEAG841 und C1M in pEAG842). Expressionsvektoren
wurden in kompetentes E. coli-BL21 (DE3) pLysS (Stratagene) gemäß dem vom
Hersteller empfohlenen Verfahren transformiert und auf LB-Agarplatten
mit einem Gehalt an 100 μg/ml Ampicillin
und 30 μg/ml
Chloramphenicol selektiert. Individuelle Kolonien wurden selektiert
und transformierte Bakterien wurden bis zu einem A600-Wert
von 0,4–0,6
gezüchtet
und 3 Stunden mit 0,5 mM IPTG induziert. Bakterielle Pellets wurden
in Bezug auf die Expression der mutanten Proteine durch reduzierende
SDS-PAGE und durch
Western-Blotting analysiert.
-
Eine
lösliche,
humane Shh-Mutante mit mehrfachen N-terminalen, hydrophoben Substitutionen
(ClII) wurde durch Einzelstellen-Eliminationsmutagenese unter Verwendung
eines Pharmacia-Kits gemäß dem vom Hersteller
empfohlenen Verfahren hergestellt. Bei der Konstruktion der Mutageneseprimer
wurde dann, wenn eine angestrebte Mutation keine Restriktionsstellenänderung
hervorrief, eine stumme Mutation, die eine Restriktionsstellenänderung
hervorruft, in ein benachbartes Codon eingeführt, um die Identifizierung
von mutanten Klonen nach der Mutagenese zu erleichtern. Um eine
fehlerhafte Codonanwendung zu vermeiden, wurden substituierte Codons
unter den Codons ausgewählt,
die mindestens 1-mal an einer anderen Stelle in der humanen Shh-cDNA-Sequenz
auftreten. Die folgenden Mutageneseprimer wurden am C1F-Matrizenplasmid pEAG837
für C1II
verwendet: 5' GCG
GCG ATG ACG ATG ACA AAA TCA TCG GAC CGG GCA GGG GGT TCG GG 3' (SEQ ID NO: ), die
eine ApoI-Stelle
entfernt, um pEAG872 herzustellen. Mutationen wurden durch DNA-Sequenzierung über ein
0,59 kb-NcoI-XhoI-Restriktionsfragment
mit dem mutanten C1II-Shh bestätigt. Ein
Expressionsvektor wurde durch Subklonieren des NcoI-XhoI-Fragments des
mutanten Plasmids in das mit Phosphatase behandelte 5,64 kb-XhoI-NcoI-pET11d-Vektorgerüst von p6H-SHH konstruiert.
Die Anwesenheit der eingeführten
Restriktionsstellenänderung
wurde im Expressionsvektor für
die C1II-Mutante pEAG875 erneut bestätigt. Der Expressionsvektor
wurde in kompetentes E. coli-BL21 (DE3) pLysS (Stratagene) gemäß dem von
Hersteller empfohlenen Verfahren transformiert und auf LB-Agarplatten
mit einem Gehalt an 100 μg/ml
Ampicillin und 30 μg/ml
Chloramphenicol selektiert. Individuelle Kolonien wurden selektiert
und transformierte Bakterien wurden bis zu einem A600-Wert
von 0,4–0,6
gezüchtet
und 3 Stunden mit 0,5 mM IPTG induziert. Bakterielle Pellets wurden
gemäß den vorstehenden
Angaben analysiert, um die Expression von mutantem Shh-Protein zu
bestätigen.
-
Reinigung
von Cys-1-Mutanten von humanem Sonic- Hedgehog: Die mit His markierten, mutanten Hedgehog- Proteine wurden aus
bakteriellen Pellets gemäß den vorstehenden
Angaben für
das Wildtyp-Protein mit Ausnahme der folgenden beiden Modifikationen
gereinigt. (1) Die Phenyl-Sepharose-Stufe wurde weggelassen und
statt dessen wurde der Proteinpool aus der ersten NTA-Ni-Agarose-Säule in 25
mM Na2HPO4, pH-Wert
8, 400 mM NaCl, 0,5 mM DTT bei der Vorbereitung für die Enterokinase-Spaltungsstufe
dialysiert. (2) Die Ionenaustauschstufe am Schluss wurde von einer
Stufenelution an SP-Sepharose-Fast Flow in eine Gradientenelution
aus einer CM-Poros-Säule
(Perseptive Biosystems) abgeändert.
Dies wurde in 50 mM Na2HPO4,
pH-Wert 6,0, mit
einem 0–800
mM NaCl-Gradienten über
30 Säulenvolumina
hinweg durchgeführt. Die
vereinigten Peakfraktionen aus dieser Stufe wurden in 5 mM Na2HPO4, pH-Wert 5,5, 150 mM
NaCl dialysiert und bei –80 °C aufbewahrt.
Eine massenspektrometrische Analyse der gereinigten Proteine ergab
die vorhergesagten Masseionen für
jede gereinigte Form.
-
Aktivität der Cys-1-Mutanten
von humanem Sonic-Hedgehog:
Wie in Tabelle 10 dargelegt, weist eine Mutation des N-terminalen
Cysteins eine signifikante Wirkung auf die Wirkungsstärke des
erhaltenen Hedgehog-Proteins beim C3H10T1/2-Test auf. Für einzelne Änderungen
korreliert im allgemeinen die Wirkungsstärke mit der Hydrophobizität der substituierten
Aminosäure,
d. h. Phenylalanin und Isoleucin ergeben die stärkste Aktivierung und Methionin
erweist sich als weniger aktivierend, während Histidin und Asparaginsäure die Aktivität im Vergleich
zum Wildtyp-Cystein
verringern. Ersetzt man das Cystein durch 2 Isoleucinreste, so ergibt
sich eine zusätzliche
Steigerung der Aktivität
gegenüber
der einzelnen Isoleucin-Substitution.
Aufgrund der Tatsache, dass 9 Aminosäuren im Vergleich zu Cystein
als stärker
hydrophob eingestuft werden (Proteins: Structures and Molecular
Properties, 2. Auflg., 1993, T. E. Creighton, W. H. Freeman Co.,
S. 154), stellen die vorstehend getesteten Substitutionen in klarer
Weise keinen erschöpfenden Überblick über die
möglichen
Mutationen am N-Terminus, die zur Entstehung von aktiveren Formen
von Hedgehog führen
können,
dar. Jedoch belegen die Ergebnisse, dass eine Aktivierung nicht
auf eine einzelne Aminosäurestruktur
beschränkt
ist und dass eine Substitution von mehr als einer Aminosäure zu einer
weiteren Steigerung der Wirkungsstärke führen kann. Daher kann ein Fachmann
Formen von Hedgehog mit anderen Aminosäuresubstitutionen am N-Terminus
erzeugen, von denen zu erwarten ist, dass sie im Vergleich zum Wildtyp-Protein
eine höhere
Wirkunsstärke
aufweisen.
-
Tabelle
10 Relative
Wirkungsstärke
von Aminosäure-Modifikationen
von humanem Sonic-Hedgehog beim C3H10T1/2-Test
-
B. Gentechnisch hergestellte
Mutationen von internen Resten
-
Konstruktion
der C1II/A169C-Mutante: Die lösliche,
humane Shh-Mutante C1II/A169C (mit einer Cystein-Substitution anstelle des entbehrlichen
C-terminalen Restes A169, für
den eine hohe, fraktionelle Lösungsmittelzugänglichkeit
vorhergesagt wird) wurde durch Einzelstellen-Eliminationsmutagenese
unter Verwendung eines Pharmacia-Kits gemäß dem von Hersteller empfohlenen
Verfahren und unter Verwendung der vorstehend beschriebenen Mutagenese-Oligo-Konstruktionsprinzipien
hergestellt. Der folgende Mutageneseprimer 5' GAG TCA TCA GCC TCC CGA TTT TGC GCA
CAC CGA GTT CTC TGC TTT CAC C 3' (SEQ
ID NO: ) wurde an der C1II-Shh-Matrize pEAG872 verwendet, um eine
FspI-Stelle zur Herstellung von pSYS049 zu addieren. Die C1II/A169C-Mutationen
wurden durch DNA-Sequenzierung über
ein 0,59 kb-NcoI-XhoI-Restriktionsfragment bestätigt. Der Expressionsvektor
pSYS050 wurde durch Subklonierung des NcoI-XhoI-Fragments in das
mit Phosphatase behandelte 5,64 kb-XhoI-NcoI-pET11d-Vektorgerüst von p6H-SHH
konstruiert. Die Anwesenheit der eingeführten Restriktionsstellenänderung
wurde im Expressionsvektor erneut bestätigt. Der Expressionsvektor
wurde in kompetentes E. coli BL21(DE3)pLysS transformiert. Kolonien
wurden auf die vorstehend angegebene Weise selektiert, induziert
und auf Shh-Expression abgesucht.
-
Reinigung
der C1II/A169C-Mutante: Die C1II/A169C-Mutante wurde gemäß den Angaben in Beispiel 9
für Wildtyp-Shh gereinigt, mit
Ausnahme der folgenden Modifikationen: (1) EDTA wurde im Lysis-Puffer
weggelassen; (2) die Reihenfolge der NTA-Ni- und SP-Sepharose-Stufen
wurde vertauscht und die Phenyl-Sepharose-Stufe wurde weggelassen;
(3) nach Klärung
der lysierten Bakterien durch Zentrifugation wurde der Überstand
mit zusätzlichem
NaCl bis zu einer Endkonzentration von 300 mM versetzt; (4) der
Elutionspuffer aus der NTA-Ni-Säule
enthielt 25 mM Na2HPO4,
pH-Wert 8,0, 200 mM Imidazol, 400 mM NaCl; (5) der Elutionspool aus
der NTA-Ni-Säule
wurde mit 3 Volumenteilen 100 mM MES, pH-Wert 5,0, verdünnt, bevor
er auf die SP-Sepharose-Säule aufgesetzt
wurde; (6) vor der Zugabe von Enterokinase wurde der SP-Sepharose-Elutionspool
mit einem halben Volumenteil 50 mM Na2HPO4, pH-Wert 8,0, verdünnt; und (7) der Elutionspuffer
der endgültigen
SP-Sepharose-Säule enthielt
0,2 mM DTT und der Elutionspool aus dieser Stufe wurde in Aliquotanteile
aufgeteilt und bei –70 °C aufbewahrt.
-
Hydrophobe
Modifikation und Aktivität
der C1II/A169C-Mutante:
Zur Modifikation mit N-(1-Pyren)-maleinimid (Sigma) wurde gereinigtes
C1II/A169C in einer Konzentration von 4,6 mg/ml in 5 mM Na2HPO4, pH-Wert 5,5,
800 mM NaCl, 0,2 mM DTT mit einem gleichen Volumen an 50 mM MES,
pH-Wert 6,5, verdünnt. Sodann
wurde Pyren-maleinimid aus einer 2,5 mg/ml-Vorratslösung in
DMSO in einer Menge von 1/20 des Volumens zugegeben. Die Probe wurde
1 Stunde bei Raumtemperatur im Dunkeln inkubiert. Zu diesem Zeitpunkt wurde
weiteres DTT bis zu 0,5 mM zugegeben und die Probe wurde eine weitere
Stunde bei Raumtemperatur inkubiert. Das modifizierte Protein wurde
direkt im C3H10T1/2-Test gemäß den Angaben
in Beispiel 3 auf seine Aktivität
getestet. Vor der Modifikation betrug die spezifische Aktivität des Proteins
EC50 = 0,22 μg/ml, während nach der Behandlung mit
Pyren-maleinimid die spezifische Aktivität auf EC50 =
0,08 μg/ml
gestiegen war. Erhöhungen
der spezifischen Aktivität
des modifizierten Produkts bis zum 3-fachen wurden häufig beobachtet, was
zeigt, dass die Zugabe der hydrophoben Gruppe nahe am C-Terminus
von Shh zu einer weiteren Zunahme der Aktivität im Vergleich zum C1II-Ausgangsmaterial
führte.
Beim Vergleich mit unmodifiziertem Wildtyp-Sonic-Hedgehog-Protein
war das mit N-(1-Pyren)-maleinimid
modifizierte C1II-Protein etwa 30-fach stärker wirksam. Während Pyren-maleinimid
ein einfaches Testsystem zur Bewertung der Modifikation an dieser Stelle
darstellt, können
auch andere hydrophobe Maleinimide oder andere auf Cystein abgestellte
chemische Verfahren herangezogen werden.
-
Beispiel 11
-
Vergleich der Wirkungsstärke von
verschiedenen, hydrophob modifizierten Formen von humanem Sonic-Hedgehog
im C3H10T1/2-Test
-
Die
Aktivität
von verschiedenen, hydrophob modifizierten Formen von humanem Sonic-Hedgehog (hergestellt
unter Anwendung der im Abschnitt V beschriebenen chemischen Verfahren
und gentechnischen Verfahren) wurde gemäß Beispiel 3 im C3H10T1/2-Test
getestet.
-
Die
Derivate wurden über
einen Konzentrationsbereich gemäß den Angaben
in Beispiel 3 getestet. Die Konzentration eines Hedgehog-Derivats,
die zu 50 % der maximalen Reaktion beim Test führte, wurde mit der Wildtyp-Konzentration
verglichen. Die relativen Aktivitäten sind nachstehend in Tabelle
11 und in 13 angegeben.
-
Tabelle
11 Relative
Wirkungsstärke
von Hedgehog-Derivaten beim C3H10T1/2-Test
-
Der
C3H10T1/2-Test belegt, dass eine große Vielzahl von hydrophoben
Modifikationen an Hedgehog die Aktivität des Proteins im Vergleich
zum unmodifizierten Wildtyp-Protein
erhöht.
Hydrophile Modifikationen (Asparaginsäure und Histidin) weisen nicht
diese Wirkung auf.
-
Beispiel 12
-
Bewertung der Wirksamkeit
von hydrophob modifiziertem, humanem Sonic-Hedgehog in einem durch
Malonat induzierten Ratten-Striatum-Läsionstest
-
Eine
Injektion von Malonat, einem Inhibitor des mitochondriellen Enzyms
Succinat-dehydrogenase, in das Ratten-Striatum (Nagetier-Äquivalent
von Primaten-Nucleus caudatus und Putamen) verursacht eine Degeneration
von mittelgroßen
bedornten Neuronen des Striatums. Beim Menschen stellt eine Degeneration
der mittelgroßen
gedornten Neuronen im Nucleus caudatus und Putamen das primäre pathologische
Merkmal der Huntington-Krankheit dar. Somit kann die durch Malonat
induzierte striatale Läsion
bei Ratten als Modell für den
Test herangezogen werden, ob hydrophob modifizierte Hedgehog-Proteine
den Tod der Neuronen, die bei der Huntington-Krankheit degenerieren,
verhindern kann.
-
Sprague-Dawley-Ratten
erhielten eine Injektion verschiedener Konzentrationen von hydrophob
modifiziertem, humanem Sonic-Hedgehog in das Striatum unter Anwendung
stereotaktischer Techniken. Stereotaktische Injektionen (2 μl) wurden
unter Betäubung
mit Natrium-Pentobarbital (40 mg/kg) durchgeführt und an den folgenden Koordinaten
platziert: 0,7 mm vor dem Scheitel, 2,8 mm lateral zur Mittellinie
und 5,5 mm ventral zur Oberfläche
des Schädels
am Scheitel. Zu verschiedenen Zeitpunkten (üblicherweise 48 Stunden) nach
Injektion des hydrophob modifizierten Proteins wurden die Ratten
mit Isofluran betäubt
und erhielten eine stereotaktische Injektion von Malonat (2 μmol in 2 μl) an den
gleichen Koordinaten des Striatums. 4 Tage nach der Injektion von
Malonat wurden die Ratten getötet.
Ihre Gehirne wurden für
eine histologische Analyse entnommen. Coronale Schnitte wurden durch
das Striatum in einer Dicke von 25 μm vorgenommen und einer Färbung auf
Cytochrom-oxidase-Aktivität
unterzogen, um geschädigtes
Gewebe von ungeschädigtem
Gewebe zu unterscheiden. Das Volumen der Läsion im Striatum wurde unter
Verwendung eines Bildanalysensystems gemessen.
-
Der
Einfluss von hydrophob modifiziertem, humanem Sonic-Hedgehog-Protein
bei dem durch Malonat induzierten Ratten-Striatum-Läsionsmodell
ist in 14 dargestellt. Unmodifiziertes
Sonic-Hedgehog (hergestellt gemäß Beispiel
9), myristoyliertes Shh (hergestellt gemäß Beispiel 8) und die C1II-Mutante
von Shh (hergestellt in Beispiel 10) verringerten in diesem Modell
alle das Läsionsvolumen
in einem ähnlichen
Ausmaß.
Jedoch zeigten die hydrophob modifizierten Proteine (myristoyliertes
Shh und C1II-Shh) eine Steigerung der Wirkungsstärke im Vergleich zu unmodifiziertem
Sonic-Hedgehog.
-
Beispiel 13
-
N-Octylmaleinimid-Derivatisierung
von Shh-N
-
Für eine Endkonzentration von
1 mg/ml
-
- 1) Eine 20 mM-Lösung von Octylmaleinimid (MG
= 209) in DMSO wird hergestellt (~4,2 mg/ml).
- 2) Eine Vorratslösung
von 10 mg/ml Shh-N (in 5 mM NaPO4, pH-Wert
5,5, 150 mM NaCl, 0,5 mM DTT) wird 10-fach mit PBS (Gibco Produkt-Nr.
20012-027, pH-Wert 7,2) verdünnt,
wodurch eine Shh-N-Lösung
mit 1 mg/ml (oder 50 μM)
entsteht. (Anmerkung: DTT, das mit Shh-N um Maleinimid bei der anschließenden Reaktion
konkurriert, befindet sich ebenfalls in einer Konzentration von
50 μM in
dieser Lösung.)
- 3) Die Shh-N-Lösung
mit 1 mg/ml wird sofort mit 1/200 Volumenteilen Octylmaleinimid
(d. h. 5 μl/ml)
versetzt. Es ergibt sich ein 2:1-Molverhältnis (100 μM:50 μM) von Octylmaleinimid zu Shh-N.
- 4) Diese Lösung
wird durch vorsichtiges Umkippen des Röhrchens vermischt und 1 Stunde
bei Raumtemperatur inkubiert.
- 5) Schließlich
wird jedes Röhrchen
mit 1/1000 Volumenteilen 0,35 M DTT als Abfangmittel für etwaiges
restliches Octylmaleinimid und als Reduktionsmittel versetzt.
- 6) Für
eine Träger-Kontrolle
wird eine Lösung
des Trägers
(5 mM NaPO4, pH-Wert 5,5, 150 mM NaCl, 0,5 mM
DTT) mit PBS (Gibco Produkt-Nr. 20012-027, pH-Wert 7,2) in einem
Verhältnis
von 1:10 versetzt. 1/400 Volumenteile 20 mM Octylmaleinimid in DMSO
und 1/400 Volumenteile DMSO werden zugegeben, wodurch sich eine
Endkonzentration von 50 μM
N-Octylmaleinimid
und 0,5 % DMSO ergibt. Schließlich
werden 1:1000 Volumenteile 0,35 M DTT, zugegeben.
-
Annähernde Zusammensetzung
der Shh-N-Lösung
mit 1 mg/ml N-Octylmaleinimid
-
- PBS (~pH-Wert 7,2)
- 50 μM
an N-Octylmaleinimid konjugiertes Shh-N
- 50 μM
an N-Octylmaleinimid konjugiertes DTT
- 350 μM
DTT
- 0,5 % DMSO
-
Annähernde Zusammensetzung der
N-Octylmaleinimid-Trägerlösung
-
- PBS (~pH-Wert 7,2)
- 50 μM
an N-Octylmaleinimid konjugiertes DTT
- 350 μM
DTT
- 0,5 % DMSO
-
Für eine Endkonzentration von
3 mg/ml
-
- 1) Eine 60 mM-Lösung von Octylmaleinimid (MG
= 209) in DMSO (~12,6 mg/ml) wird hergestellt.
- 2) Eine Vorratslösung
von 10 mg/ml Shh-N (in 5 mM NaPO4, pH-Wert
5, 5, 150 mM NaCl, 0, 5 mM DTT) wird 10-fach mit PBS (Gibco Produkt-Nr.
20012-027, pH-Wert 7,2) verdünnt,
wodurch eine Shh-N-Lösung mit
3 mg/ml (oder 150 μM)
entsteht. (Anmerkung: DTT, das mit Shh-N um Maleinimid bei der anschließenden Reaktion
konkurriert, befindet sich ebenfalls in einer Konzentration von
150 μM in
dieser Lösung.)
- 3) Die Shh-N-Lösung
mit 3 mg/ml wird sofort mit 1/200 Volumenteilen Octylmaleinimid
(d. h. 5 μl/ml)
versetzt. Es ergibt sich ein 2:1-Molverhältnis (300 μM:150 μM) von Octylmaleinimid zu Shh-N.
- 4) Diese Lösung
wird durch vorsichtiges Umkippen des Röhrchens vermischt und 1 Stunde
bei Raumtemperatur inkubiert.
- 5) Schließlich
wird jedes Röhrchen
mit 1/1000 Volumenteilen 0,35 M DTT als Abfangmittel für etwaiges
restliches Octylmaleinimid und als Reduktionsmittel versetzt.
- 6) Für
eine Träger-Kontrolle
wird eine Lösung
des Trägers
(5 mM NaPO4, pH-Wert 5,5, 150 mM NaCl, 0,5 mM
DTT) mit PBS (Gibco Produkt-Nr. 20012-027, pH-Wert 7,2) in einem
Verhältnis
von 3:7 versetzt. 1/400 Volumenteile 60 mM Octylmaleinimid in DMSO
und 1/400 Volumenteile DMSO werden zugegeben, wodurch sich eine
Endkonzentration von 150 μM
N- Octylmaleinimid
und 0,5 % DMSO ergibt. Schließlich
werden 1:1000 Volumenteile 0,5 M DTT, zugegeben.
-
Annähernde Zusammensetzung
der Shh-N-Lösung
mit 3 mg/ml N-Octylmaleinimid
-
- PBS (~pH-Wert 7,2)
- 150 μM
an N-Octylmaleinimid konjugiertes Shh-N
- 150 μM
an N-Octylmaleinimid konjugiertes DTT
- 500 μM
DTT
- 0,5 % DMSO
-
Annähernde Zusammensetzung der
N-Octylmaleinimid-Trägerlösung
-
- PBS (~pH-Wert 7,2)
- 150 μM
an N-Octylmaleinimid konjugiertes DTT
- 500 μM
DTT
- 0,5 % DMSO
- 0,5 % DMSO
-
Literatur
-
- 1. Perrimon, N. (1995) Cell 80, 517–520
- 2. Johnson, R.L., and Tabin, C. (1995) Cell 81, 313–316
- 3. Riddle, R.D. et al. (1993) Cell 75, 1401–1416
- 4. Niswander, L., et al. (1994) Nuture 371, 609–612
- 5. Laufter, E., et al. (1994) Cell 79. 993–1003
- 6. Roberts, D.J., et al. (1995) Development 121, 3163–3174
- 7. Chiang, C., et al. (1996) Nature 382, 407–413
- 8. Bellusci, S., et al. (1997) Develupment 124, 53–63
- 9. Marigo, V., et al. (1996) Nature 384, 176–179
- 10. Stone, D.M., et al., (1996) Nature 384, 129–134
- 11. Alcedo, J., et al. (1996) Cell 86, 221–232.
- 12. Dominguez, M., et al. (1996) Science 272, 1621–1625
- 13. Alexandre, C., et al. (1996) Genes & Dev. 10, 2003–2013
- 14. Therond, P.P., et al. (1996) Proc. Natl. Acad. Sci. USA
93, 4224–4228
- 15. Lee. J.J., et al. (1994) Science 266, 1528–1536
- 16. Bumcrot, D.A., et al. (1995). Mol. Cell Biol. 15, 2294–2303
- 17. Porter. J.A., et al. (1995) Nature 374, 363–366
- 18. Porter. J.A., et al. (1996) Science 274, 255–258
- 19. Porter, J.A., et al. (1995) Cell 86, 21–34
- 20. Marigo. V., et al. (1995) Genomics 28. 44–51
- 21. Sanicola, M., et al. (1997) Proc. Natl. Acad. Sci. USA 94,
6238–6243.
- 22. Spengler, B., et al. (1992) Rapid. Commun. Mass Spectrom.
6, 105–108.
- 23. Spengler, B., et al. (1992) J. Phys. Chem. 96, 9678–9684
- 24. Caron, J.M. (1997) Mol. Biol. Cell 8, 621–636
- 25. Kinto, N., et al. (1997) FEBS Letts. 404, 319–323
- 26. Ericson, J., et al. (1996) Cell 87, 661–673
- 27. Wen, D., et al. (1996) Biochemistry 30, 9700–9709
- 28. Bizzozero, O.A. (1996) Meth. Enzymol. 250, 361–382
- 29. Wedegaertner, P.B., et al. (1995) J. Biol. Chem. 270, 503–506
- 30. Grosenbach. D.W., et al. (1997) J. Biol. Chem. 272, 1956–1964
- 31. Pepinsky, R.B., et al. (1991) J. Biol. Chem. 266, 18244–18249
- 32. Tanaka Hall. T.M., et al. (1995) Nature 378, 212–216
- 33. Mohler and Vani, (1992) Development 115, 957–971
- 34. Hall et al., (1995) Nuture 378, 212–216
- 35. Ekker et al., (1995) Current Biology 5, 944–955
- 36. Fan et al., (1995) Cell 81, 457–465
- 37. Chang et al., (1994) Development 130, 3339–3353
- 38. Echelard et al., (1993) Cell 75, 1414–1430
- 39. Ericson et al., (1995) Cell 81, 747–756
- 40. Zoeller et al., (1984) Proc. Natl. Acad. Sci. USA, 81, 5662–66
- 41. Kaufman and Sharp, (1982) Mol. Cell. Biol., 2. 1304–1319
- 42. Leung et al., (1989) Technique 1, 11–15
- 43. Mayers et al., (1989) Science 229, 242
- 44. Harang, S.A., (1983) Tetrahedron 39, 3
- 45. Itakura et al., (1984) Ann. Rev. Biochem. 53, 323
- 46. Cunningham and Wells, (1989) Science 244, 1081–1085
- 47. Adelman et al., (1983) DNA 2, 183
- 48. Wells et al., (1985) Gene 34, 315
- 49. W.D. Huse et al., (1989) Science 246, 1275–1281
- 50. H.L. Yin and T.P. Stossel, (1979) Nature 281, 583–586
- 51. Lindley, (1956) Nature 178, 647
- 52. Gross and Witkip, (1961) J. Am. Chem. Soc. 83, 1510
- 53. D.M. Haverstick and M. Glaser, (1987) Proc. Nutl. Acad.
Sci. USA 64, 4475–4478
- 54. Szoka et al., (1980) Ann. Rev. Biophys. Bioeng. 9, 467–508
- 55. Ohsawa et al., (1984) Chem. Pharm. Bull. 32, 2442
- 56. Batzri et al., (1973) Biochim. Biophys. Acta 298, 1015–1019
- 57. Szoka et al., (1978) Proc. Natl. Acad. Sci. USA 75, 4191–4199
- 58. Pick, (1981) Arch. Biochem. Biophys. 212, 186–194
- 59. Kasahara et al., (1977) J. Biol. Chem. 251, 7384–7390
- 60. Racker et al., (1979) Arch. Biochem. Biophys. 198, 470–477
- 61. Papahadjopoulos et al., (1991) Proc. Natl. Acad. Sci. USA
88, 11460–11464
- 62. Chou. T.C. and Lipmann, F. (1952) J. Biol. Chem. 196, 89
- 63. Kaminski et al., (1993) New Engl. J. Med. 329, 459
- 64. Tomac et al., (1995) Nuture 373, 335–339
- 65. Gash et al., (1996) Nature 380, 252–255
- 66. Hoffer et al., (1994) Neuroscience Lett. 182, 107–111
- 67. Duchen, L.W. and Strich. S.J., (1968), J. Neurol. Neurosurg.
Psychiatry 31, 535–542
- 68. Kennel et al., (1996) Neurobiology of Disease 3, 137–147
- 69. Ripps et al., (1995) Proc. Natl. Acad. Sci, USA, 92: 689–693
- 71. Nicholson. L. et al., (1945) Neuroscience 66, 507–521
- 72. Beat, M.F. et al., (1993) J. Neuroscience 13, 4181–4192
- 73. Davies, S. et al., (1997) Cell 90, 537–548
- 74. Hebr-Katz, R. (1993) Int. Rev. Immunol. 9, 237–285
- 75. Borg et al., (1990) Brain Res., 518, 295–298
- 76. Apfel et al., (1991) Ann. Neurol., 29, 87–90
- 77. Noren, C.J. et al., (1989) Science 244, 182–188
- 78. Thorson, J.S. et al., (1998) Methods Mol. Biol. 77, 43–73
- 79. Das, A.K. et al., (1997) J. Biol. Chem. 272, 11021–11025
- 84. Berthiaume, L. & Resh,
M. D. (1995) J. Biol. Chem. 270, 22399–22405
- 81. Raju, R.V. et al., (1995) Mol. Cell. Biochem. 149–150, pp.
191–202
- 82. Duronio, R.J. et al., (1993) in Lipid Modification of Proteins,
M.J. Schlesinger, ed.
- 83. Krutsch, H.C. & Inman,
J.K. (1993) Anal. Biochem. 209, 109–116
- 84. Heitz, J.R. et al., (1968) Arch. Biochem. Biophys. 12, 627–636
- 85. Stefanini, S. et al., (1972) Arch. Biochem. Biophys 151,
28–34
- 86. Kawaguchi, A.J. (1981) Biochem. (Tokyo) 89, 337–339
- 87. House, H.O. (1972) in Modern Synthetic Reactions, W.A. Benjamin,
ed.
-
Alle
oben genannten Druckschriften und Veröffentlichungen werden hiermit
durch Inbezugnahme mit eingeschlossen.
-
-
-
-
-
-
-
-