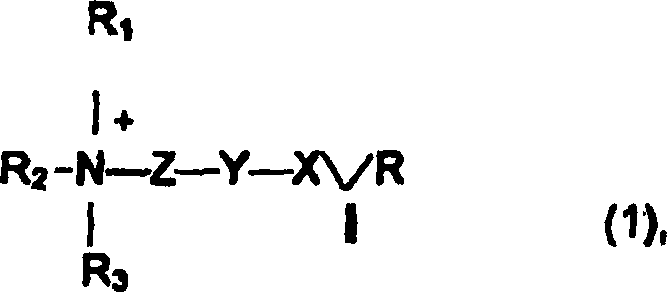-
In
jüngster
Zeit wurde eine Anzahl von kurzen (ca. 50 Aminosäurereste oder weniger) linearen
oder zyklischen cytotoxischen Peptiden aus einer Vielzahl von Quellen
isoliert. Diese umfassen Mellitin, aus Bienengift, die Magainine,
aus Froschhaut, und Cecropine, aus Insekten (Maloy, et al., Biopolymers
(Peptide Science) 37: 105-122 (1995)). Obwohl es breit variierende
Peptidsequenzen und -strukturen gibt, enthalten diese Peptide alle
mehrere Lysin- und
Argininreste und tragen bei physiologischem pH-Wert eine positive
Nettoladung. Sie bilden ebenfalls amphiphatische Strukturen, wobei
ein Abschnitt der Struktur hydrophil, während der andere Abschnitt
hydrophob ist.
-
Die
Peptide scheinen ausschließlich
durch direkte Lyse der Zellmembran zu wirken (Maloy et al., vorstehend
aufgeführt
(1995)). Nach dem gegenwärtigen
Modell wird eine Zelllyse durch die elektrostatische Anziehung der
positiven Ladung auf dem Peptid an die negativen Phosphatkopfgruppen
an der äußeren Oberfläche der
Membranphospholipid-Doppelschicht
initiiert. Diese Wechselwirkung führt zur Insertion des hydrophoben
Abschnitts des Proteins in die Membran, wodurch die Membranstruktur
unterbrochen wird. Die lytischen Peptide sind im Allgemeinen aktiver
gegen prokaryotische Zellen, wie Bakterien und Pilze, als gegen eukaryotische
Zellen. Dies hat zu Interesse an diesen Peptiden als potentielle
Agenzien für
die Behandlung von Infektionen in Menschen geführt (Maloy et al., vorstehend
aufgeführt
(1995); Arrowood et al., J. Protozool. 38: 161S-163S (1991); Haynie
et al., Antimicrob. Agents Chemotherapy 39: 301-307 (1995).
-
Jedoch
besitzen die natürlichen,
cytotoxischen Peptide mehrere Nachteile in Bezug auf deren Verwendung
als therapeutische Agenzien für
Menschen. Erstens scheint es, dass sich diese Peptide entwickelt
haben, um mit einer hohen Konzentration an spezifisch lokalisierten
Stellen zu wirken. Somit kann, bei Verabreichung als ein Arzneimittel,
die notwendige Dosierung bzw. Dosis zum Erzielen einer wirksamen
Konzentration an einer Infektionsstelle verhindernd bzw. unerschwinglich
hoch sein. Ein zweiter Nachteil ist die Schwierigkeit verwendbare
Mengen von diesen Peptiden aus den natürlichen Quellen zu isolieren,
zusammen mit den hohen Kosten zum Synthetisieren verwendbarer Mengen
an Peptiden in diesem Größenbereich.
Schließlich
werden diese Verbindungen, wie andere Peptide, im Magen-Darmtrakt
abgebaut und können
somit nicht oral verabreicht werden.
-
Die
WO 83/01 002 beschreibt Poly-(vinylbenzylammonium)-Polymere und
deren Verwendung als antimikrobielle Agenzien. Die Polymere können Copolymere
sein, die eine monomere Einheit mit einer Amino- oder Ammoniumgruppe
umfassen und über
eine aromatische Abstandshaltergruppe, wie Benzyl, an das Polymerrückgrat verbunden
sind. Die WO 83/01 002 offenbart die Verwendung dieser Polymere
in Lösungen
zum Desinfizieren von Kontaktlinsen. Die
EP 0 042 075 offenbart Copolymere,
in denen eine monomore Einheit beispielsweise ein Oligosaccharid
ist und die zweite monomere Einheit eine quaternäre Ammoniumgruppe umfasst,
die eine hohe bakterizide Aktivität aufweisen können. Die
EP 0 042 075 offenbart,
dass die darin offenbarten Copolymere beispielsweise in der Herstellung
von pharmazeutischen Zusammensetzungen zur topischen Verwendung,
wie Cremes, Salben, Lotionen, etc., nützlich sein können.
-
Es
besteht ein Bedarf für
antimikrobielle Agenzien, die das breite Aktivitätsspektrum der natürlichen cytotoxischen
Peptide besitzen, jedoch kostengünstig
herzustellen sind, oral verabreicht werden können und geringere Konzentrationserfordernisse
für eine
therapeutische Aktivität
aufweisen.
-
In
einer ersten Ausführungsform
betrifft die vorliegende Erfindung die Verwendung eines Homopolymers,
welches durch ein polymerisiertes Monomer mit einer über eine
aliphatische Abstandshalter-Gruppe an das Polymerrückgrat angebrachten
Animogruppe oder Ammoniumgruppe gekennzeichnet ist, zur Herstellung eines
Medikaments zur Behandlung einer Magen-Darminfektion in einem Menschen.
-
In
einer weiteren Ausführungsform
betrifft die vorliegende Erfindung die Verwendung eines Copolymers,
das gekennzeichnet ist durch ein polymerisiertes Monomer mit einer über eine
aliphatische Abstandshaltergruppe an das Polymerrückgrat angebrachten
Aminogruppe oder Ammoniumgruppe und einem polymerisierten neutralen
hydrophoben Monomer, zur Herstellung eines Medikaments zur Behandlung
einer Magen-Darminfektion in einem Menschen.
-
Das
zu verabreichende Polymer kann ein Homopolymer oder ein Copolymer
sein. In einer Ausführungsform
umfasst das Polymer ferner ein Monomer, das eine hydrophobe Gruppe
umfasst, wie eine Arylgruppe oder eine geradkettige oder verzweigte
C3-C18-Alkylgruppe.
-
Das
zu verabreichende Polymer kann ferner wahlweise ein Monomer umfassen,
das eine neutrale hydrophile Gruppe umfasst, wie eine Hydroxylgruppe
oder eine Amidgruppe.
-
Die
vorliegende Verwendung weist mehrere Vorteile auf. So werden die
eingesetzten Polymere beispielsweise einfach unter Verwendung von
Standardtechniken zur Polymersynthese und von kostengünstigen Ausgangsmaterialien
hergestellt. Die Polymere werden in dem Verdauungstrakt nicht wesentlich
abgebaut und können
deshalb oral verabreicht werden. Polymerzusammensetzungen können ebenfalls
leicht variiert werden, um Eigenschaften, wie Löslichkeit oder Quellvermögen in Wasser
und antimikrobielle Aktivität,
zu optimieren. Schließlich
umfassen die zu verabreichenden Polymere funktionelle Amin- oder
Ammoniumgruppen, die an das Polymerrückgrat über aliphatische Abstandshalter-Gruppen
angefügt
sind. Die strukturelle Flexibilität derartiger Abstandhalter-Gruppen
minimiert Rückgratbeschränkungen
auf die Wechselwirkung der Ammoniumgruppen mit anionischen Zielen.
-
Die
vorliegende Erfindung betrifft eine Verwendung zum Verhindern bzw.
Vorbeugen oder Behandeln einer mikrobiellen Infektion in einem Säuger, wie
einem Menschen, durch Verabreichen einer therapeutisch wirksamen
Menge eines Polymers an den Säuger,
welches mehrere Amino- oder Ammoniumgruppen umfasst, die an das
Polymerrückgrat über aliphatische
Abstandshalter-Gruppen angefügt
sind.
-
Wie
hier verwendet, ist eine "therapeutisch
wirksame Menge" eine
Menge, die ausreichend ist, um eine mikrobielle Infektion, teilweise
oder vollständig,
zu inhibieren oder eine Entwicklung einer mikrobiellen Infektion
umzukehren oder ihr weiteres Fortschreiten zu verhindern oder zu
verringern. Der Begriff "Polymer" betrifft ein Makromolekül, das mehrere
sich wiederholende Einheiten oder Monomere umfasst. Der Begriff
umfasst Homopolymere, die aus einem einzigen Monomertyp gebildet
sind, und Copolymere bzw. Mischpolymere, die aus zwei oder mehr
unterschiedlichen Monomeren gebildet sind. Ein "Terpolymer" ist ein Copolymer, das aus drei unterschiedlichen
Monomeren gebildet ist. Der Begriff Polymer, wie hier verwendet,
soll Proteine, Peptide, Polypeptide und proteinöse Materialien ausschließen.
-
Wie
hier verwendet, bezieht sich der Begriff "Polymerrückgrat" oder "Rückgrat" auf den Abschnitt
des Polymers, der eine kontinuierliche Kette ist, umfassend die
zwischen Monomeren durch Polymerisation gebildeten Bindungen. Die
Zusammensetzung des Polymerrückgrats
kann in Begriffen der Identität
der Monomere beschrieben werden, aus denen es gebildet ist, ohne
Bezugnahme auf die Zusammensetzung von Abzweigungen oder Seitenketten
weg von dem Polymerrückgrat.
Somit soll ein Poly-(akrylamid)-Polymer ein Poly-(akrylamid)-Rückgrat aufweisen,
wobei die Substituenten an dem Akrylamid-Stickstoffatom nicht betrachtet werden, die
Komponenten der Polymerseitenketten darstellen. Ein Poly-(akrylamid-co-styrol)-Copolymer
soll beispielsweise ein gemischtes Akrylamid/Styrol-Rückgrat aufweisen.
-
Der
Begriff "Polymerseitenkette" oder "Seitenkette" bezieht sich auf
den Abschnitt eines Monomers, der, nach Polymerisation, eine Abzweigung
weg von dem Polymerrückgrat
bildet. In einem Homopolymer sind alle Polymerseitenketten identisch.
Ein Copolymer kann zwei oder mehr verschiedene Seitenketten umfassen. Umfasst
eine Seitenkette beispielsweise eine ionische Einheit, hängt die
ionische Einheit von dem Polymerrückgrat ab, oder ist ein Substituent
davon, und wird als eine "Seitenstück- bzw.
Gegenstück-ionische-Einheit" ("pendant ionic unit") bezeichnet. Der
Begriff "Abstandshalter-Gruppe", wie hier verwendet,
betrifft ein polyvalentes molekulares Fragment, das eine Komponente
einer Polymerseitenkette ist und einen Seitenstückrest an das Polymerrückgrat verbindet.
Der Begriff "aliphatische
Abstandshalter-Gruppe" betrifft
eine Abstandshalter-Gruppe, die keine aromatische Einheit, wie eine
Phenyleneinheit umfasst.
-
Der
Begriff "Additionspolymer", wie hier verwendet,
ist ein Polymer, das durch die Addition von Monomeren ohne die nachfolgende
Freisetzung von einem kleinen Molekül gebildet wird. Ein üblicher
Typ eines Additionspolymers wird durch Polymerisation von olefinischen
Monomeren gebildet, wobei Monomere durch die Bildung von Kohlenstoff-Kohlenstoff-Bindungen
zwischen Monomeren verbunden werden, ohne dass irgendwelche Atome
verloren werden, die die nicht reagierten Monomere ausmachen.
-
Der
Begriff "Monomer", wie hier verwendet,
betrifft sowohl (a) ein einzelnes Molekül, das vor oder nach Polymerisation
eine oder mehrere polymerisierbare funktionelle Gruppen umfasst,
als auch (b) eine sich wiederholende Einheit eines Polymers. So
kann beispielsweise ein nicht polymerisiertes Monomer, das zur Additionspolymerisation
in der Lage ist, eine olefinische Bindung umfassen, die nach Polymerisation
verloren wird.
-
Die
Menge eines gegebenen zu verabreichenden Polymers wird auf einer
individuellen Basis bestimmt und wird, zumindest teilweise, durch
Betrachtung der Größe des Individuums,
der Ernsthaftigkeit der zu behandelnden Symptome und des erstrebten
Ergebnisses bestimmt. Das Polymer kann alleine oder in einer pharmazeutischen
Zusammensetzung verabreicht werden, die das Polymer umfasst, einen
annehmbaren Träger
oder Verdünnungsmittel
bzw. Streckmittel und wahlweise ein oder mehrere zusätzliche
Arzneimittel.
-
Die
Polymere können
beispielsweise topisch, oral, intranasal oder rektal verabreicht
werden. Die Form, in welcher das Agens verabreicht wird, beispielsweise
Pulver, Tablette, Kapsel, Lösung
oder Emulsion, hängt
teilweise von der Route ab, durch die es verabreicht wird. Die therapeutische
wirksame Menge kann in einer Reihe von Dosierungen bzw. Gaben verabreicht
werden, die durch geeignete Zeitintervalle getrennt sind, wie Stunden.
-
Mikrobielle
Infektionen, die durch das erfindungsgemäße Verfahren behandelt oder
verhindert werden können,
umfassen bakterielle Infektionen, wie Infektionen durch Streptococcus,
umfassend Streptococcous mutans, Streptococcus salivarius und Streptococcus
sanguis, Salmonella, Campylobacter, umfassend Campylobacter sputum,
Actinomyces, umfassend Actinomyces naeslundii und Actinomyces viscosus,
Escherichia coli, Clostridium difficile, Staphylococcus, umfassend
S. aureus, Shigella, Pseudomonas, umfassend P. aeruginosa, Eikenella
corrodens, Actinobacillus actinomycetemcomitans, Bacteriodes gingivalis,
Capnocytophaga, umfassend Capnocytophaga gingivalis, Wolinell recta,
Bacteriodes intermedius, Mycoplasma, umfassend Mycoplasma salivarium,
Treponema, umfassend Treponema denticola, Peptostreptococcus micros,
Bacteriodes forsythus, Fusobakterien, umfassend Fusobacterium nucleatum,
Selenomonas sputigena, Bacteriodes fragilis, Enterobacter cloacae
und Pneumocystis. Ebenfalls umfasst sind protozoische Infektionen,
wie Infektionen durch Cryptosporidium parvum und Giardia lamblia;
amöbische
Infektionen, wie Infektion durch Entameoba histolytica oder Acanthameoba;
Infektionen durch Pilze, wie Infektionen durch Candida albicans
und Aspergillus fumigatus und parasitische Infektionen, wie Infektionen
durch A. castellani und Trichinella spiralis. Das Verfahren ist
ebenfalls nützlich
zur Behandlung von Infektionen verschiedener Organe des Körpers, jedoch
ist es insbesondere nützlich
für Infektionen
der Haut und des Magen-Darmtrakts.
-
Polymere,
die für
das vorliegende Verfahren insbesondere geeignet sind, umfassen Polymere,
die Schlüsselmerkmale
natürlich
vorkommender cytotoxischer Peptide besitzen, insbesondere die Fähigkeit
amphipatische Strukturen zu bilden. Der Begriff „amphipatisch", wie hier verwendet,
beschreibt eine dreidimensionale Struktur, die diskrete hydrophobe
und hydrophile Bereiche aufweist. Somit interagiert ein Abschnitt
der Struktur vorzugsweise mit wässrigem
oder anderem polaren Medium, während
ein anderer Abschnitt der Struktur vorzugsweise mit nicht-polaren
Medien interagiert bzw. wechselwirkt. Ein amphipatisches Polymer
resultiert aus dem Vorliegen von sowohl hydrophilen als auch hydrophoben
Strukturelementen entlang des Polymerrückgrats.
-
In
einer Ausführungsform
umfasst das zu verabreichende Polymer ein Monomer der Formel I,
worin X eine kovalente Bindung
ist, eine Carbonylgruppe oder eine CH
2-Gruppe,
Y ein Sauerstoffatom, eine NH-Gruppe oder eine CH
2-Gruppe
ist, Z eine Abstandshalter-Gruppe ist, R ein Wasserstoffatom oder
eine Methyl- oder Ethylgruppe ist, R
1, R
2 und R
3 jeweils
unabhängig
ein Wasserstoffatom, eine geradkettige oder verzweigte, substituierte
oder nichtsubstituierte C
1-C
18-Alkylgruppe,
eine Arylgruppe oder eine Arylalkylgruppe sind. Geeignete Alkylsubstituenten
umfassen Halogenatome, wie Fluor- oder Chloratome.
-
In
dem Fall, in der mindestens eines von R1 – R3 ein Wasserstoffatom ist, kann das Monomer
ebenfalls in der freien Basen- oder Aminoform vorliegen, das heisst
als die neutrale konjugierte Base des Ammonium-Kations. Das ein
derartiges Monomer umfassende Polymer kann in der protonierten,
kationischen Form verabreicht werden, wie als ein Salz einer pharmazeutisch
annehmbaren Säure,
oder in der freien Basenform. Geeignete Säuren umfassen Salzsäure, Bromwasserstoffsäure, Zitronensäure, Milchsäure, Weinsäure, Phosphorsäure, Methansulfonsäure, Essigsäure, Ameisensäure, Maleinsäure, Fumarsäure, Äpfelsäure, Bernsteinsäure, Malonsäure, Schwefelsäure, L-Glutaminsäure, L-Asparaginsäure, Brenztraubensäure, Mucinsäure, Benzoesäure, Gluconsäure (glucoronic
acid), Oxalsäure,
Ascorbinsäure
und Acetylglycin. In jedem Fall werden nach Verabreichung bei physiologischem
pH-Wert mehrere Aminogruppen protoniert, um Ammoniumgruppen zu werden,
und das Polymer wird eine insgesamt positive Ladung tragen.
-
Die
Abstandshalter-Gruppe ist eine Komponente der Polymerseitenkette
und verbindet die Amino- oder Ammoniumgruppe an das Polymerrückgrat.
Die Amino- oder Ammoniumgruppe ist somit eine Seitenstückgruppe.
Die Abstandshalter-Gruppe kann eine geradkettige oder verzweigte,
gesättigte
oder nicht-gesättigte,
substituierte oder nichtsubstituierte Alkylengruppe sein, wie eine
Polymethylengruppe -(CH2)n-,
wobei n eine ganze Zahl von ungefähr 2 bis ungefähr 15 ist.
Geeignete Beispiele umfassen die Propylen-, Hexylen- und Octylengruppen.
Die Alkylengruppe kann ebenfalls wahlweise an einer oder mehreren
Stellen durch ein Heteroatom, wie ein Sauerstoff-, Stickstoff- (beispielsweise
NH) oder Schwefelatom unterbrochen werden. Beispiele umfassen die
Oxaalkylengruppen -(CH2)2O[(CH2)2O]n(CH2)2-, wobei n eine
ganze Zahl ist, die von 0 bis ungefähr 3 reicht.
-
Beispiele
von Monomeren der Formel I mit quarternären Ammoniumgruppen umfassen
2-Trimethyl-ammonium-ethylmethacrylat, 2-Trimethylammoniumethylacrylat,
N-(3-Trimethylammonium-propyl)methacrylamid,
N-(6-Trimethylammoniumhexyl)acrylamid, N-(3-Trimetyhlammoniumpropyl)acrylamid,
und N-(4-Trimethylammoniumbutyl)allylamin, wobei jedes davon ebenfalls
ein Gegenanion umfasst. Beispiele von Monomeren nach Formel I mit
einer Aminogruppe umfassen Allylamin und N-(3-Dimethylaminopropyl)acrylamid.
-
Zu
verabreichende Polymere mit quarternären Ammoniumgruppen oder protonierten
Aminogruppen umfassen ferner ein pharmazeutisch annehmbares Gegenion,
wie Anionen die konjugierten Basen der pharmazeutisch annehmbaren
Säuren,
die vorstehend erläutert
wurden, beispielsweise Chlorid, Bromid, Acetat, Format, Citrat,
Ascorbat, Sulfat oder Phosphat. Die Anzahl an Gegenionen, die mit
dem Polymer vor Verabreichung assoziiert sind, ist die notwendige
Anzahl, um die elektrische Ladung auf dem Polymer auszugleichen.
-
Das
Polymer kann ebenfalls ein Copolymer sein, das ferner ein hydrophobes
Monomer umfasst. Das hydrophobe Monomer kann eine Seitenkette umfassen,
die eine hydrophobe Gruppe trägt,
wie eine gerade Kette oder eine verzeigte, substituierte oder nicht
substituierte C3-C18-Alkylgruppe
oder eine substituierte oder nicht-substituierte Arylgruppe. Beispiele
geeigneter hydrophober Monomere umfassen Styrol, N-Isopropylacrylamid,
N-t-Butylacrylamid,
N-n-Butylacrylamid, Heptafluorbutylacrylat, N-n-Decylallylamin,
N-n-Decylacrylamid,
Pentafluorstyrol, n-Butylacrylat, t-Butylacrylat, n-Decylacrylat,
N-t-Butyl methacrylamid, n-Decylmethacrylat und n-Butylmethacrylat.
-
Beispiele
von Copolymeren bzw. Mischpolymeren, die ein Monomer nach Formel
I und ein hydrophobes Monomer umfassen, umfassen Poly(N-(3-dimethylaminopropyl)acrylamid-co-N-(n-butyl)acrylamid)
oder Salze davon mit pharmazeutisch annehmbaren Säuren. Andere
Beispiele geeigneter Copolymere umfassen Poly(2-trimethylammoniumethylmethacrylat-co-styrol)-chlorid,
Poly(2-trimethylammoniumethylmethacrylat-co-N-isopropylacrylamid)-chlorid,
Poly(2-trimethylammoniumethylmethacrylat-co-heptafluorbutylacryl)-chlorid, Poly(3-trimethylammoniumpropylmethacrylat-co-styrol)-chlorid,
Poly(3-trimethylammoniumpropylmethacrylat-co-N-t-butylacrylamid)-chlorid,
Poly(3-trimethylammoniumpropylmethacrylat-co-N-n-butylacrylamid)-chlorid
und Poly(N-(3-trimethylammoniumpropyl)allylamin-co-N-n-decylallylamin).
Jedes dieser ionischen Copolymere kann ebenfalls mit anderen Gegenionen
als Chlorid eingesetzt werden, beispielsweise mit einer konjugierten
Base einer pharmazeutisch annehmbaren Säure.
-
In
einer weiteren Ausführungsform
umfasst das zu verabreichende Polymer ein Monomer nach Formel I,
ein hydrophobes Monomer und ein neutrales hydrophiles Monomer, wie
Acrylamid, Methacrylamid, N-(2-Hydroxyethyl)acrylamid oder 2-Hydroxyethylmethacrylat.
Beispiele von Polymeren dieses Typs umfassen Terpolymere von N-(3-trimethylammoniumpropyl)methacrylamid/N-Isopropylacrylamid/2-Hydroxyethylmethacrylat, N-(3-Trimethylammoniumpropyl)methacrylamid/N-n-Decylacrylamid/2-Hydroxyethylmethacrylat,
N-(3-Trimethylammoniumpropyl)methacrylamid/N-t-Butylmethacrylamid/Methacrylamid, N-(3-Trimethylammonium-propyl)methacrylamid/n-Decylacrylat/Methacrylamid,
2-Trimethylammoniumethylmethacrylat/n-Butylacrylat/Acrylamid, 2-Trimethylammoniumethylmethacrylat/t-Butylacrylat/Acrylamid,
2-Trimethylammoniumethylmethacrylat/n-Decylacrylat/Acrylamid, 2-Trimethylammonium-ethylmethacrylat/n-Decylmethacrylat/Methacrylamid,
2-Trimethylammoniumethylmethacrylat/N-t-Butyl-methacrylamid/Methacrylamid
und 2-Trimethylammoniumethylmethacrylat/N-n-Butylmethacrylamid/Methacrylamid.
-
Das
zu verabreichende Polymer kann ein Additionspolymer sein mit einem
Polymerrückgrat
wie ein Polyacrylat-, Polyacrylamid-, Poly(allylalkohol)-, Poly(vinylalkohol)-,
Poly(vinylamin)-, Poly(allylamin)- oder ein Polyalkyleneimin-Rückgrat.
Das Polymer kann ein einheitliches Rückgrat aufweisen, wenn es aus
Monomeren zusammengesetzt ist, die von einer üblichen polymerisierbaren Einheit,
wie Acrylamid, abgeleitet sind. Falls das Polymer ein Copolymer
ist, kann es ebenfalls ein gemischtes Rückgrat umfassen, so kann beispielsweise das
Monomer nach Formel I ein Acrylamid-Derivat sein, während das
hydrophobe Monomer ein Styrol-Derivat sein kann. Die hier offenbarten
Polymere umfassen Beispiele von sowohl einheitlichen als auch gemischten Rückgraten.
-
Die
in dem vorliegenden Verfahren verwendeten Polymere können ebenfalls
Kondensationspolymere umfassen, wobei eine Polymerisation von Monomeren
von der Freisetzung eines kleinen Moleküls, wie einem Wassermolekül, begleitet
wird. Derartige Polymere umfassen, beispielsweise Polyester und
Polyurethane.
-
Die
Polymere zur Verwendung in dem vorliegenden Verfahren sind vorzugsweise
im Wesentlichen nicht biologisch abbaubar und nicht absorbierbar.
Das heißt,
die Polymere werden unter physiologischen Bedingungen im Wesentlichen
nicht in Fragmente abgebaut, die durch Körpergewebe absorbiert werden
können. Die
Polymere weisen vorzugsweise ein nicht hydrolysierbares Rückgrat auf,
das unter Bedingungen, die es in der Zielregion des Körpers, beispielsweise
dem Magen-Darm-Trakt, vorfindet, im Wesentlichen innert ist.
-
Die
Zusammensetzung des zu verabreichenden Copolymere kann wesentlich
variieren. So kann das Copolymer von ungefähr 95 Molprozent bis ungefähr 5 Molprozent,
vorzugsweise von ungefähr
20 Molprozent bis ungefähr
80 Molprozent, eines Monomers nach Formel I umfassen. Das Copolymer
kann ebenfalls von ungefähr
95 Molprozent bis ungefähr
5 Molprozent, vorzugsweise von ungefähr 20 Molprozent bis ungefähr 80 Molprozent,
eines hydrophoben Monomers umfassen.
-
Andere
Beispiele von Polymeren, die in dem vorliegenden Verfahren von Nutzen
sind, sind in den U.S.-Patenten Nr. 5,703,188; 5,624,963; 5,679,717;
5,618,530 und 5,607,669 offenbart.
-
Das
zu verabreichende Polymer weist, vorzugsweise, ein Molekulargewicht
auf, das für
den beabsichtigten Verabreichungsmodus geeignet ist und es dem Polymer
ermöglicht
die Zielregion des Körpers
zu erreichen und für
einen Zeitraum dort zu verbleiben, der ausreichend ist, um mit dem
infizierenden Organismus in Wechselwirkung zu treten. So sollte
beispielsweise ein Verfahren zum Behandeln einer Darminfektion ein
Polymer mit ausreichend großem
Molekulargewicht verwenden, um einer Absorption durch den Magen-Darm-Trakt in andere
Körperteile,
teilweise oder vollständig,
zu widerstehen. Die Polymere können
Molekulargewichte aufweisen, die in dem Bereich von ungefähr 500 Dalton
bis ungefähr
500.000 Dalton liegen, vorzugsweise von ungefähr 2.000 Dalton bis ungefähr 150.000
Dalton.
-
Die
Polymere, die in dem vorliegenden Verfahren nützlich sind, können durch
bekannte Verfahren hergestellt werden. Ein erstes Verfahren umfasst
die direkte Polymerisation eines Monomers, wie Trimethylammoniumethylacrylat-chlorid,
oder einem Satz aus zwei oder mehr Monomeren, wie Trimethylammoniumethylacrylat-chlorid,
N-n-Butylacrylamid und Acrylamid. Dies kann durch Standardverfahren
einer Polymerisation mit freiem Radikal, einer kationischen oder
anionischen Polymerisation erreicht werden, die im Stand der Technik
wohl bekannt sind. Aufgrund von Reaktivitätsunterschieden zwischen zwei
Monomeren, kann sich die Zusammensetzung eines auf diesem Weg erzeugten
Copolymer von der Zusammensetzung des Ausgangs- bzw. Startgemisches
unterscheiden. Diese Reaktivitätsunterschiede
können
ebenfalls zu einer nicht-zufälligen
Verteilung von Monomeren entlang der Polymerkette führen.
-
Ein
zweites Verfahren verfährt über das
Intermediär
bzw. den Vermittler (intermediacy) eines aktivierten Polymers, das
labile Seitenketten umfasst, die leicht durch eine gewünschte Seitenkette
substituiert werden. Ein Beispiel eines geeigneten aktivierten Polymers
ist der Succinimidester von Polyacrylsäure, Poly(N-acryloyloxysuccinimid)
(hier ebenfalls bezeichnet als "pNAS"), der mit Nucleophilen,
wie einem primären Amin,
reagiert, um ein N-substituiertes Polyacrylamid zu bilden. Ein anderes
geeignetes aktiviertes Polymer ist Poly(para-nitrophenylacrylat),
das in einer gleichartigen Weise mit Amin-Nucleophilen reagiert.
-
Polymere,
die zur Verwendung in dem vorliegenden Verfahren geeignet sind,
können
ebenfalls durch Addition einer Seitenkette an ein vorgebildetes
Polymer hergestellt werden. So kann beispielsweise Poly(allylamin)
an dem Amino-Stickstoff durch ein oder mehrere alkylierende Agenzien
alkyliert werden. So kann beispielsweise ein Anteil von Aminogruppen
unter Verwendung eines geradkettigen bzw. normalen oder verzweigten
C3-C18-Alkylhalogenid, wie n-Decylbromid, alkyliert
werden, während
ein anderer Anteil durch ein quaternäres Ammonium umfassendes Alkylhalogenid,
wie 1-Trimethyammonium-4-bromobutan,
alkyliert wird.
-
Ein
Copolymer mit einem Polyacrylamid-Rückgrat, das Amid-Stickstoffe
umfasst, die zwei unterschiedliche Substituenten tragen, kann durch
eine Behandlung von p(NAS) mit weniger als einem Äquivalent (relativ
zu N-Acryloyloxysuccinimid-Monomer) mit einem ersten primären Amin
hergestellt werden, wobei ein Poly(N-substituiertes Acrylamide-co-N-acryoyloxysuccinimid)-Copolymer
hergestellt wird. Verbleibendes N-Acryoyloxysuccinimid-Monomer kann
dann beispielsweise mit einem Überschuss
an einem zweiten primären
Amin in Reaktion gebracht werden, um ein Polyacrylamid-Copolymer
mit zwei unterschiedlichen N-Substituenten zu erzeugen. Somit kann
durch Behandlung des aktivierten Polymers mit verschiedenen Verhältnissen an
zwei oder mehr Aminen eine Vielzahl an Copolymer-Zusammensetzungen
erhalten werden.
-
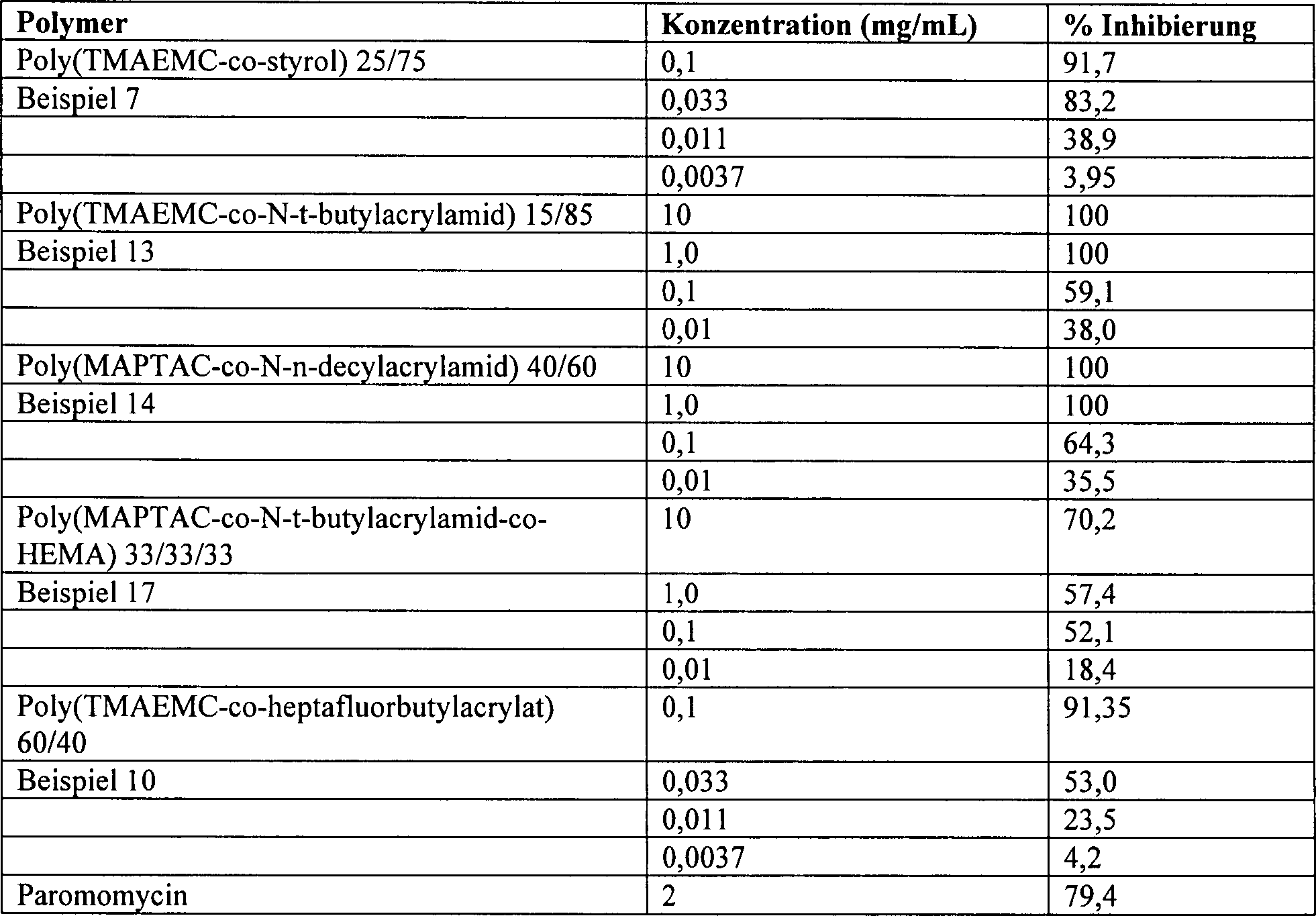
Wie
nachstehend in Beispiel 35 erläutert,
wurden mehrere hier beschriebene Polymere hinsichtlich in vitro-Aktivität gegen
eine Infektiosität
von Cryptosporidium parvum in einer Säugerzellkultur getestet. Von
diesen war das in Beispiel 7 beschriebene Poly(TMAEMC-co-styrol), am meisten
aktiv, wobei es angewendet als eine 0,1 mg/mL Lösung in Dimethylsulfoxid eine
Inhibierung der Infektiosität
von C. parvum von mehr als 90 % relativ zu der Kontrolle zeigte.
Die verbleibenden, getesteten Polymere zeigten ebenfalls eine signifikante anti-Cryptosporidium-Aktivität.
-
Die
Erfindung wird jetzt weiter und besonders durch die folgenden Beispiele
erläutert.
-
Beispiele
-
Die
folgenden Abkürzungen
werden während
der ganzen Beispiele verwendet, um die folgenden Monomere anzudeuten:
MAPTAC, N-(3-Trimethylammoniumpropyl)methacrylamid-chlorid; TMAEMC,
2-Trimethylammoniumethylmethacrylat-chlorid; HEMA, 2-Hydroxyethylmethacrylat;
TMAEAC, 2-Trimethylammoniumethylacrylat-chlorid.
-
Die
Copolymere und Terpolymere der folgenden Beispiele sind als nominale
Zusammensetzungen angegeben, die den molaren Verhältnissen
der Ausgangs- bzw. Startmonomere in dem Copolymerisationsgemisch
entsprechen.
-
Beispiel 1: Synthese von
Poly(N-acryloyloxysuccinimid) (pNAS)
-
Eine
Lösung
aus N-Acryloyloxysuccinimid (25,0 g, 148 mmol) in 100 mL trockenen
DMF wurde durch Spülen
mit Stickstoff entgast und gleichzeitig auf 60 °C erhitzt. Zu dem Reaktionsgemisch
wurde Azobisisobutyronitril (AIBN) (120 mg; 0,005 Äquivalente
in Bezug auf das Monomer) zugesetzt. Es wurde der Reaktion ermöglicht für 24 Stunden
bei 60 °C
fortzuschreiten. Die Polymerlösung
wurde auf Raumtemperatur abgekühlt und
in schnell gerührtes
THF gegossen. Das so erhaltene weiße Präzipitat bzw. Niederschlag bzw.
Ausfällung wurde
filtriert, mit TMF gewaschen und unter Vakuum getrocknet.
-
Beispiel 2: Synthese von
Poly(N-(3-dimethylaminopropyl)acrylamid-co-N-n-butylacrylamid
-
Zu
einer Lösung
aus 3,0 g (17,75 mmol) pNAS in 20 mL trockenem DMF wurde 0,6 g (3,55
mmol) n-Butylamin zugesetzt. Die so erhaltene Lösung wurde bei Raumtemperatur
für 14
Stunden gerührt
und dann für
4 Stunden auf 60 °C
erhitzt. Nachdem die Lösung
auf Raumtemperatur abgekühlt
war, wurden 9,05 g (89 mmol) 3-Dimethylaminopropylamin zugesetzt,
und die so erhaltene Lösung
wurde für
2 Stunden bei Raumtemperatur gerührt
und dann für
20 Stunden auf 60 °C
erhitzt. Nach Abkühlen
auf Raumtemperatur, wurde die Lösung
mit 25 mL Wasser verdünnt
und für
24 Stunden gegen Wasser dialysiert. Die Lösung wurde dann gefriergetrocknet,
um Poly(N-(3-dimethylaminopropylacrylamid)-co-N-n-butylacrylamid)
als einen klebrigen, weißen Feststoff
zu liefern.
-
Beispiel 3: Synthese von
Poly(N-(3-trimethylammoniumpropyl)acrylamid-co-N-n-butylacrylamid)-iodid
-
Zu
einer Suspension aus Poly(3-dimethylaminopropyl-acrylamid-co-N-n-butylacrylamid
in Methanol wurde 0,5 g Methyliodid zugesetzt. Das so erhaltene
Gemisch wurde für
3 Stunden gerührt
und wurde schrittweise homogen. Nach einem Rühren für weitere 12 Stunden, wurde
das Lösungsmittel
unter vermindertem Druck entfernt und das Polymer wurde mit trockenem
Hexan gewaschen.
-
Beispiel 4: Synthese von
Poly(N-(2-hydroxyethyl)acrylamid-co-N-(6-trimethylammoniumhexyl)acrylamid)-bromid
-
Zu
einer Lösung
aus 2,48 g (15 mmol) pNAS in 5 mL DMF wurde 1,00 g (3 mmol) 1-Trimethylammonium-6-hexanamin-bromid
zugesetzt. Die Lösung
wurde bei Raumtemperatur für
4 Stunden gerührt
und dann für
20 Stunden auf 60 °C
erhitzt. Die Lösung
wurde auf Raumtemperatur gekühlt,
wobei dann 8,95 g (150 mmol) 2-Ethanolamin zugesetzt wurde. Das
so erhaltene Gemisch wurde für
20 Stunden auf 80 °C
erhitzt, auf Raumtemperatur abgekühlt und mit 10 mL Wasser verdünnt. Die
Lösung
wurde für
24 Stunden gegen Wasser dialysiert, dann gefriergetrocknet, um das
Polymer als einen spröden
weißen
Feststoff hervorzubringen.
-
Beispiel 5: Synthese von
Poly(TMAEAC)
-
Eine
Lösung
aus 48,25 g (0,25 mol) 2-Trimethylammoniumethylacrylat-chlorid in
400 mL Isopropanol wurde durch Spülen mit Stickstoff entgast
und auf 35 °C
erhitzt. Zu dieser gerührten
Lösung
wurde eine Lösung aus
0,8 g Kaliumpersulfat in 10 mL destilliertem Wasser zugesetzt. Es
wurde eine leicht exotherme Reaktion beobachtet. Die Lösung wurde
für 6 Stunden
bei 35 °C
gerührt
und dann auf Raumtemperatur abgekühlt. Die Lösung wurde zu Hexan zugesetzt
und das so erhaltene Präzipitat
wurde durch Filtration isoliert.
-
Beispiel 6: Synthese von
Poly(decamethylendimethylammonium-co-ethylen-dimethylammonium)-bromid
-
In
einem dreihalsigen 250 mL Rundkolben wurden N,N,N'N'-Tetramethylethylendiamin
(10,0 g, Aldrich), 1,10-Dibromdecan (25,8 g, Aldrich) und Methanol
(100 mL) platziert. Das Gemisch wurde unter leichtem Rühren für 6 Tage
auf 65 °C
erhitzt, wobei an dem Punkt Methanol (40 mL) zugesetzt und das Gemisch
für zwei
weitere Tage refluxiert wurde. Das Gemisch wurde dann in Aceton
getröpfelt,
wobei sich ein Feststoff bildete, der durch Filtration gesammelt,
mit Aceton gespült
und in einem Vakuumofen getrocknet wurde, um 30,9 g an Produkt hervorzubringen.
-
Beispiel 7: Synthese von
Poly(TMAEMC-co-styrol) 75/25
-
Ein
500 mL Rundkolben wurde mit Trimethylammoniumethylmethacrylat-chlorid
(26,0 g einer 70 Gew.-% wässrigen
Lösung,
18,2 g), Styrol (6,0 g) und Isopropanol (150 mL) beladen. Die Lösung wurde
durch die Zugabe eines schnellen Stickstoffstroms für 10 Minuten
entgast, gefolgt von der Zugabe von AIBN (0,5 g). Die Lösung wurde
für weitere
dreißig
Minuten entgast, wobei während
einer Fortdauer der Stickstoffzugabe die Lösung auf 70 °C erhitzt
und die Temperatur für
17 Stunden beibehalten wurde. Das Polymer begann innerhalb von 2
Stunden zu präzipitieren,
wobei sich am Ende der Reaktion ein klebriges weißes Präzipitat
gebildet hat. Das Reaktionsgemisch wurde gekühlt, das Isopropanol wurde
von dem Polymer dekantiert, und das Polymer wurde in Methanol gelöst. Eine
tropfenweise Zugabe der Methanollösung zu Ethylacetat (1200 mL) bewirkte,
dass das Polymer als ein feines, weißes Pulver präzipitierte,
das durch Filtration gewonnen wurde.
-
Beispiel 8: Synthese von
Poly(TMAEMC-co-N-isopropylacrylamid) (67/33)
-
Ein
500 mL Rundkolben wurde mit Trimethylammoniumethylmethacrylat-chlorid
(14,5 g einer 70 Gew.-%igen wässrigen
Lösung,
10,0 g), N-Isopropylacrylamid (5,0 g) und Isopropanol (150mL) beladen.
Die Lösung
wurde durch die Zugabe eines schnellen Stickstoffstroms für 10 Minuten
entgast, gefolgt von der Zugabe von AIBN (0,5 g). Die Lösung wurde
für weitere
60 Minuten entgast. Das Reaktionsgemisch wurde auf 70 °C erhitzt
und die Temperatur wurde für
16 Stunden beibehalten. Das Polymer präzipitierte teilweise über den
Reaktionsverlauf. Nach Abkühlen
bzw. Kühlen
wurde das Propanol von dem Polymer dekantiert und das Polymer wurde
in Methanol gelöst.
Eine tropfenweise Präzipitation
der Methanollösung
in Ethylacetat (1200 mL) bewirkte, dass das Polymer als weißer, käsiger Niederschlag
abgelagert wurde, der durch Filtration gewonnen, mit Ethylacetat
gewaschen und unter Vakuum getrocknet wurde.
-
Zusätzlich wurden
TMAEMC/N-Isopropylacrylamid-Copolymere durch ein gleichartiges Verfahren
mit den Ausgangsmonomeren in den folgenden Verhältnissen hergestellt: TMAEMC/N-Isopropylacrylamid
= 40/60, 25/75 und 15/85.
-
Beispiel 9: Synthese von
Poly(MAPTAC-co-Styrol) 75/25
-
Zu
Isopropanol (150 mL) wurde eine Lösung aus N-(3-Trimethylammoniumpropyl)methacrylamid-chlorid
in Wasser (50 Gew.-%ige Lösung,
24,0 g, 12,0 g des Monomers) zugesetzt. Zu dieser Lösung wurde
Styrol (6,0 g) zugesetzt, gefolgt von der Zugabe von AIBN (0,5 g).
Die homogene Lösung
wurde durch Durchblasen eines Stickstoffstroms für 30 Minuten entgast. Die Lösung wurde
für 15
Stunden auf 70 °C
erhitzt. Das Polymer präzipitierte
teilweise mit Fortschritt der Reaktion. Die Lösung wurde abgekühlt, das
Isopropanol wurde abdekantiert und der weiße Feststoff wurde mit Propanol
(50 mL) gewaschen. Das Propanol wurde ein zweites Mal dekantiert,
und der Feststoff wurde in Methanol (150 mL) gelöst. Die klare Lösung wurde
tropfenweise zu Ethylacetat zugesetzt, was bewirkte, dass das Polymer
als ein weißes
Pulver präzipitierte.
Das Polymer wurde durch Filtration gewonnen, mit 50 mL Ethylacetat
gewaschen und luftgetrocknet.
-
Ein
zusätzliches
MAPTAC/Styrol-Copolymer wurde durch ein gleichartiges Verfahren
hergestellt, das ein 50/50-Gemisch an Ausgangsmonomeren einsetzte.
-
Beispiel 10: Synthese
von Poly(TMAEMC-co-heptafluorbutylacrylat) 75/25
-
Ein
500 mL Rundkolben wurde mit 2-Trimethylammoniumethylmethacrylat-chlorid
(26,0 g einer 70 Gew.-%igen wässrigen
Lösung,
18,2 g), Heptafluorbutylacrylat (6,0 g) und Isopropanol (150mL)
beladen. Die Lösung
wurde durch die Zugabe eines schnellen Stickstoffstroms für 10 Minuten
entgast, gefolgt von der Zugabe von AIBN (0,5 g). Die Lösung wurde
für weitere
dreißig
Minuten entgast, wobei während
der Fortdauer der Stickstoff zugabe, die Lösung auf 70 °C erhitzt
wurde. Die Temperatur wurde für
17 Stunden beibehalten. Das Polymer begann innerhalb einer Stunde
zu präzipitieren,
wobei sich am Ende der Reaktion ein klebriges, weißes Präzipitat
gebildet hatte. Das Reaktionsgemisch wurde gekühlt, das Propanol wurde von
dem Polymer dekantiert und das Polymer wurde in Methanol (100 mL)
gelöst.
Eine tropfenweise Präzipitation
der Methanollösung
in Ethylacetat (1200 mL) bewirkte, dass das Polymer als weißer Feststoff
abgelagert wurde, der durch Filtration gewonnen wurde.
-
Beispiel 11: Synthese
von Poly(MAPTAC-co-N-t-butylacrylamid) 75125
-
Zu
einem dreihalsigen 500 mL Rundkolben, der mit einem Thermoelement,
einem Rückflusskühler und
einem Septum ausgerüstet
war, wurden 36,4 g einer 50 %igen wässrigen Lösung von N-(3-Trimethylammoniumpropyl)methacrylamid-chlorid
und 6 g N-t-Butylacrylamid,
gefolgt von 150 mL Isopropanol zugesetzt. Die Lösung wurde für eine Stunde
mit Stickstoff gespült
und es wurde 0,5 g AIBN zugesetzt. Das Gemisch wurde für ~15 Minuten
gespült,
bis sich alles AIBN gelöst
hatte. Die Lösung
wurde unter Stickstoff für
16 Stunden auf 75 °C
erhitzt.
-
Das
so erhaltene Reaktionsgemisch bestand aus zwei Phasen. Die trübe, flüssige Phase
wurde von der Hauptmenge der Reaktion dekantiert, die eine weiße, klebrige,
feste Phase war. Die Flüssigkeit
wurde in 1200 mL Ethylacetat präzipitiert
und durch Vakuumfiltration durch einen Büchner-Trichter filtriert. Das
weiße, hygroskopische
Präzipitat
wurde unter Vakuum getrocknet. Die feste Phase wurde in Methanol
gelöst
und in 1200 mL Ethylacetat präzipitiert
und durch Vakuumfiltration filtriert, um ein weißes Pulver hervorzubringen,
das unter Vakuum gelagert wurde.
-
Zusätzlich wurden
MAPTAC/N-t-Butylacrylamid-Copolymere durch ein gleichartiges Verfahren
beginnend mit den Ausgangsmonomeren in den folgenden Verhältnissen
hergestellt: N-(3-trimethylammoniumpropyl)methacrylamid/N-t-Butylacrylamid
= 60/40, 50/50, 40/60 und 25/75.
-
Beispiel 12: Synthese
von Poly(N-decylallylamin-co-N-(4-trimethylammoniumbutyl)allylamin)
-
Zu
einer Lösung
aus Poly(allylamin)·HCl
(20,15 g einer 50 Gew.-%igen wässrigen
Lösung)
wurde Natriumhydroxid (5,64 g) als ein Feststoff zugesetzt. Die
Lösung
wurde für
40 Minuten gerührt,
filtriert und der Filterkuchen wurde mit Methanol (15 mL) gewaschen.
-
Die
Lösung
wurde weiter mit Methanol (25 mL) verdünnt und es wurde 1-Bromdecan
(7,73 g, 35 mmol) und (1-Trimethylamino-4-brombutan)-chlorid (9,13
g, 35mmol) zu der Lösung
zugesetzt. Es wurde eine Lösung aus
Natriumhydroxid (2,8 g, 70 mmol) in Wasser (5 mL) hergestellt. Diese
Lösung
wurde in vier Anteilen in dreißigminütigen Intervallen
zu dem Reaktionsgemisch zugesetzt. Die Lösung wurde dann für 24 Stunden
bei Raumtemperatur gerührt,
gefolgt von einer Dialyse gegen deionisiertes Wasser und gefriergetrocknet.
Insgesamt wurden 23,2 g eines glasigen, hygroskopischen Feststoffs
gewonnen.
-
Beispiel 13: Synthese
von Poly(TMAEMC-co-N-t-butyl-acrylamid) 57/43
-
In
einen dreihalsigen 500 mL Rundkolben, der mit einem Thermoelement,
einem Rückflusskühler und einem
Septum ausgerüstet
war, wurden 18,20 g einer 70 %igen wässrigen Lösung von 2-Trimethylammoniumethylmethacryl-chlorid
und 9,7 g N-t-Butylacrylamid, gefolgt von 150 mL Isopropanol zugesetzt.
Die Lösung wurde
für eine
Stunde mit Stickstoff gespült
und es wurde 0,5 g AIBN zugesetzt. Das Gemisch wurde für ~15 Minuten
gespült,
bis sich alles AIBN gelöst
hatte. Die Lösung
wurde unter Stickstoff für
16 Stunden auf 75 °C erhitzt.
-
Das
so erhaltene Reaktionsgemisch bestand aus zwei, leicht trennbaren
Phasen. Die flüssige
Phase wurde von der Hauptmenge der Reaktion dekantiert, die ein
weißer
Feststoff war. Die Flüssigkeit
wurde in 1200 mL Ethylacetat präzipitiert
und durch Vakuumfiltration durch einen Büchner-Trichter filtriert. Das
weiße
Präzipitat
wurde unter Vakuum getrocknet und gewogen: Fraktion A, 10,1 g (45,1
% Ausbeute basierend auf 22,4 g zugesetzten Monomeren). Die feste
Phase wurde in Methanol gelöst
und in 600 mL Ethylacetat präzipitiert
und durch Vakuumfiltration filtriert, um Fraktion B hervorzubringen,
5,81 g eines weißen
Pulvers (25,9 % Ausbeute), das unter Vakuum getrocknet wurde.
-
Ebenfalls
wurden durch ein gleichartiges Verfahren TMAEMC/N-t-Butylacrylamid-Copolymere mit den Ausgangsmonomeren
in den folgenden Verhältnissen
hergestellt: TMAEMC/N-t-Butylacrylamid = 63/37, 50/50, 40/60, 25/75,
15/85 und 5/95.
-
Beispiel 14: Synthese
von Poly(MAPTAC-co-N-n-decylacrylamid) 75/25
-
In
einen dreihalsigen 500 mL Rundkolben, der mit einem Thermoelement,
einem Rückflusskühler und einem
Septum ausgerüstet
war, wurden 36,4 g einer 50 %igen wässrigen Lösung von N-(3-Trimethylammoniumpropyl)methacrylamid-chlorid
und 6 g N-n-Decylacrylamid,
gefolgt von 150 mL Isopropanol zugesetzt. Die Lösung wurde für eine Stunde
mit Stickstoff gespült
und es wurde 0,5 g AIBN zugesetzt. Das Gemisch wurde für ~15 Minuten
gespült,
bis sich alles AIBN gelöst
hatte. Die Lösung
wurde unter Stickstoff für
16 Stunden auf 75 °C
erhitzt.
-
Das
Reaktionsgemisch bestand aus zwei, leicht trennbaren Phasen. Die
klare, gelbe, flüssige
Phase wurde in 1200 mL Ethylacetat präzipitiert. Das Präzipitat
wurde durch Filtration isoliert und unter Vakuum getrocknet, um
2,14 g eines gelben Pulvers, Fraktion A (8,84 % Ausbeute) hervorzubringen.
Zu dem sahneartigen, gelben Reaktionspräzipitat wurde Methanol zugesetzt
und die so erhaltene trübe,
gelbe Lösung
wurde in 1200 mL Ethylacetat präzipitiert.
Das weiße
Präzipitat
wurde durch Filtration isoliert und unter Vakuum getrocknet, um
Fraktion B, 27,22 g, als ein leicht gelbes Pulver (71,2 % Ausbeute),
hervorzubringen.
-
Zusätzlich wurden
durch ein gleichartiges Verfahren MAPTAC/N-n-Decylacrylamid-Copolymere mit den
Ausgangsmonomeren in den folgenden Verhältnissen hergestellt: MAPTAC/N-n-Decylacrylamid
= 60/40, 50/50, und 40/60.
-
Beispiel 15: Synthese
von Poly(TMAEMC-co-pentafluorstyrol) 75/25
-
In
einen dreihalsigen 500 mL Rundkolben, der mit einem Thermoelement,
einem Rückflusskühler und einem
Septum ausgerüstet
war, wurden 26,0 g einer 70 %igen wässrigen Lösung von 2-Trimethylammoniumethylmethacrylat-chlorid
und 6 g Pentafluorstyrol, gefolgt von 150 mL Isopropanol zugesetzt.
Die Lösung
wurde für
eine Stunde mit Stickstoff gespült
und es wurde 0,5 g AIBN zugesetzt. Das Gemisch wurde für ~15 Minuten gespült, bis
sich alles AIBN gelöst
hatte. Die Lösung
wurde unter Stickstoff für
16 Stunden auf 75 °C
erhitzt.
-
Das
Reaktionsgemisch bestand aus zwei Phasen. Die trübe Lösung wurde verworfen. Die Hauptmenge
der Reaktion, die aus einer weißen,
festen Masse am Boden des Kolbens bestand, wurde in Methanol gelöst. Die
so erhaltene klare Lösung
wurde in 1200 mL Ethylacetat präzipitiert.
Das weiße
Präzipitat
wurde durch Vakuumfiltration isoliert, um 20,39 g eines feinen,
weißen
Pulvers (84,3 % Ausbeute) hervorzubringen.
-
Zusätzlich wurden
durch ein gleichartiges Verfahren TMAEMC/Pentafluorstyrol-Copolymere
mit den Ausgangsmonomeren in den folgenden Verhältnissen hergestellt: TMAEMC/Pentafluorstyrol
= 60/40 und 50/50.
-
Beispiel 16: Synthese
von Poly(MAPTAC-co-Pentafluorstyrol) 75/25
-
In
einen dreihalsigen 500 mL Rundkolben, der mit einem Thermoelement,
einem Rückflusskühler und einem
Septum ausgerüstet
war, wurden 36,3 g einer 50 %igen wässrigen Lösung von N-(3-Trimethylammoniumpropyl)methacrylamid-chlorid
und 6 g Pentafluorstyrol, gefolgt von 150 mL Isopropanol zugesetzt.
Die Lösung
wurde für
eine Stunde mit Stickstoff gespült
und es wurde 0,5 g AIBN zugesetzt. Das Gemisch wurde für ~15 Minuten
gespült,
bis sich alles AIBN gelöst
hatte. Die Lösung
wurde unter Stickstoff für
16 Stunden auf 75 °C
erhitzt.
-
Das
Reaktionsgemisch bestand aus einer trüben Lösung mit einem weißen Präzipitat.
Der Überstand wurde
verworfen. Das weiße
Reaktionspräzipitat
wurde in Methanol gelöst,
und die so erhaltene klare Lösung wurde
in 1200 mL Ethylacetat präzipitiert.
Das weiße
Präzipitat
wurde durch Filtration isoliert und unter Vakuum getrocknet, um
12,81 g eines feinen, weißen
Pulvers (52,9 % Ausbeute) hervorzubringen.
-
Zusätzlich wurden
durch ein gleichartiges Verfahren MAPTAC/Pentafluorstyrol-Copolymere mit den Ausgangsmonomeren
in den folgenden Verhältnissen
hergestellt: MAPTAC/Pentafluorstyrol = 60/40 und 50/50.
-
Beispiel 17: Synthese
von MAPTAC/N-t-Butylacrylamid/HEMA-Terpolymer 33/33/33
-
In
einen dreihalsigen 500 mL Rundkolben, der mit einem Thermoelement,
einem Rückflusskühler und einem
Septum ausgerüstet
war, wurden 150 mL Isopropanol zugesetzt, gefolgt von 16,1 g einer
50 %igen wässrigen
Lösung
von N-(3-Trimethylammoniumpropyl)methacrylamid-chlorid, 8 g N-t-Butylacrylamid
und 8 g 2-Hydroxyethylmethacrylat. Die Lösung wurde für eine Stunde
mit Stickstoff gespült
und es wurde 0,5 g AIBN zugesetzt. Das Gemisch wurde für ~15 Minuten
gespült,
bis sich alles AIBN gelöst
hatte. Die Lösung
wurde unter Stickstoff für
16 Stunden auf 75 °C
erhitzt.
-
Das
Reaktionsgemisch bestand aus einer trüben Lösung mit einem weißen Latex
bzw. Milchsaft am Boden des Kolbens. Die Lösung wurde in 1200 mL Ethylacetat
präzipitiert.
Das weiße
Präzipitat
wurde durch Filtration isoliert, um ein klebriges, weißes Pulver
hervorzubringen, das unter Vakuum getrocknet wurde, um 10,43 g eines
klumpigen bzw. grobstückigen,
weißen
Feststoffs (Fraktion A) (43,1 % Ausbeute) hervorzubringen. Das weiße Reaktionspräzipitat
wurde in Methanol gelöst
und in 1200 mL Ethylacetat präzipitiert.
Das Präzipitat
wurde durch Filtration isoliert und unter Vakuum getrocknet, um
8,89 g eines feinen, weißen
Pulvers (Fraktion B) (36,7 % Ausbeute) hervorzubringen.
-
Zusätzlich wurden
durch ein gleichartiges Verfahren MAPTAC/N-t-Butylacrylamid/HEMA-Terpolymere beginnend
mit den folgenden Verhältnissen
der Ausgangsmonomere hergestellt: MAPTAC/N-t-Butylacrylamid/HEMA
= 28/43/28, 23/53/23 und 18/63/18.
-
Beispiel 18: Synthese
von MAPTAC/N-Isopropylacrylamid/EMA-Terpolymer 18/63/18
-
In
einen dreihalsigen 500 mL Rundkolben, der mit einem Thermoelement,
einem Rückflusskühler und einem
Septum ausgerüstet
war, wurden 150 mL Isopropanol zugesetzt, gefolgt von 8,9 g einer
50 %igen wässrigen
Lösung
von N-(3-trimethylammoniumpropyl)methacrylamid-chlorid, 15,3 g N-Isopropylacrylamid
und 4,4 g 2-Hydroxyethylmethacrylat. Die Lösung wurde für eine Stunde
mit Stickstoff gespült
und es wurde 0,5 g AIBN zugesetzt. Das Gemisch wurde für ~15 Minuten
gespült,
bis sich alles AIBN gelöst
hatte. Die Lösung
wurde unter Stickstoff für
16 Stunden auf 75 °C
erhitzt.
-
Die
klare, leicht rosafarbene Reaktionslösung wurde in 1200 mL Ethylacetat
präzipitiert.
Das Präzipitat wurde
durch Filtration isoliert, um einen klebrigen, weißen Feststoff
hervorzubringen, der unter Vakuum getrocknet wurde, um 14,42 g eines
harten klaren/weißen
körnigen
bzw. granulären
Feststoffs (59,6 % Ausbeute) hervorzubringen.
-
Beispiel 19: Synthese
von MAPTAC/N-Decylacrylamid/HEMA-Terpolymer 33/33/33
-
In
einen dreihalsigen 500 mL Rundkolben, der mit einem Thermoelement,
einem Rückflusskühler und einem
Septum ausgerüstet
war, wurden 150 mL Isopropanol zugesetzt, gefolgt von 16,1 g einer
50 %igen wässrigen
Lösung
von N-(3-Trimethylammoniumpropyl)methacrylamid-chlorid, 8 g N-Decylacrylamid
und 8 g 2-Hydroxyethylmethacrylat. Die Lösung wurde für eine Stunde
mit Stickstoff gespült
und es wurde 0,5 g AIBN zugesetzt. Das Gemisch wurde für ~15 Minuten
gespült,
bis sich alles AIBN gelöst
hatte. Die Lösung
wurde unter Stickstoff für
16 Stunden auf 75 °C
erhitzt.
-
Das
Reaktionsgemisch bestand aus zwei Phasen. Die klare, gelbe Lösung wurde
in 1200 mL Ethylacetat präzipitiert.
Das Präzipitat
wurde durch Filtration isoliert. Das klebrige, gelbe Präzipitat
wurde unter Vakuum getrocknet, und der so erhaltene brüchige bzw.
spröde,
klare, gelbe Schaum wurde zerrieben bzw. zerstoßen, um 4,98 g eines feinen,
gelben, granulären
Pulvers (Fraktion A) (20,6 % Ausbeute) hervorzubringen. Der weiße Reaktionslatex
wurde in Methanol gelöst
und in 1200 mL Ethylacetat präzipitiert.
Das Präzipitat
wurde durch Filtration isoliert und unter Vakuum getrocknet, um
10,24 g eines leicht gelben, granulären Feststoff (Fraktion B)
(42,3 % Ausbeute) hervorzubringen.
-
Zusätzlich wurden
durch ein gleichartiges Verfahren MAPTAC/N-Decylacrylamid/HEMA-Terpolymere beginnend
mit den folgenden Verhältnissen
der Ausgangsmonomere hergestellt: MAPTAC/N-Decylacrylamid/HEMA =
28/43/28, 23/53/23 und 18/63/18. Beispiel 20: Synthese von TMAEAC/n-Butylacrylat/Acrylamid-Terpolymer
10/30/60 In einen dreihalsigen 500 mL Rundkolben, der mit einem
Thermoelement, einem Rückflusskühler und
einem Septum ausgerüstet
war, wurden 150 mL Isopropanol zugesetzt gefolgt von 4,84 g einer
50 %igen wässrigen
Lösung
von 2-Trimethylammoniumethylacrylatchlorid, 7,26 g n-Butylacrylat
und 14,52 g Acrylamid. Die Lösung
wurde für
eine Stunde mit Stickstoff gespült
und es wurde 0,5 g AIBN zugesetzt. Das Gemisch wurde für ~15 Minuten
gespült,
bis sich alles AIBN gelöst
hatte. Die Lösung
wurde unter Stickstoff für
16 Stunden auf 75 °C
erhitzt.
-
Das
so erhaltene weiße
Reaktionsgemisch wurde durch Vakuumfiltration durch einen Büchner-Trichter filtriert,
um ein weißes
Pulver hervorzubringen. Das Pulver wurde mit Isopropanol gewaschen
und unter Vakuum getrocknet, um 21,57 g eines feinen, weißen Pulvers
hervorzubringen (89,1 % Ausbeute, basierend auf 24,2 g Monomere).
-
Zusätzlich wurden
durch ein gleichartiges Verfahren TMAEAC/n-Butylacrylat/Acrylamid-Terpolymere beginnend
mit den folgenden Verhältnissen
der Ausgangsmonomere hergestellt: TMAEMC/n-Butylacrylat/Acrylamid
= 20/20/60 und 30/10/60.
-
Beispiel 21: Synthese
of TMAEAC/t-Butylacrylat/Acrylamid-Terpolymer 10/30/60
-
In
einen dreihalsigen 500 mL Rundkolben, der mit einem Thermoelement,
einem Rückflusskühler und einem
Septum ausgerüstet
war, wurden 150 mL Isopropanol zugesetzt, gefolgt von 4,84 g einer
50 %igen wässrigen
Lösung
von 2-Trimethylammoniumethylacrylat-chlorid, 7,26 g t-Butylacrylat
und 14,52 g Acrylamid. Die Lösung
wurde für
eine Stunde mit Stickstoff gespült
und es wurde 0,5 g AIBN zugesetzt. Das Gemisch wurde für ~15 Minuten
gespült,
bis sich alles AIBN gelöst
hatte. Die Lösung
wurde unter Stickstoff für
16 Stunden auf 75 °C
erhitzt.
-
Das
so erhaltene weiße
Reaktionsgemisch wurde durch Vakuumfiltration durch einen Büchner-Trichter filtriert,
um ein weißes
Pulver hervorzubringen. Das Pulver wurde mit Isopropanol gewaschen
und unter Vakuum getrocknet, um 21,13 g eines weißen Pulvers
hervorzubringen (87,3 % Ausbeute).
-
Zusätzlich wurden
durch ein gleichartiges Verfahren TMAEAC/t-Butylacrylat/Acrylamid-Terpolymere beginnend
mit den folgenden Verhältnissen
der/an Ausgangsmonomere(n) hergestellt: TMAEAC/t-Butylacrylat/Acrylamid
= 20/20/60 und 30/10/60.
-
Beispiel 22: Synthese
von TMAEAC/n-Decylacrylat/Acrylamid-Terpolymer 10/30/60
-
In
einen dreihalsigen 500 mL Rundkolben, der mit einem Thermoelement,
einem Rückflusskühler und einem
Septum ausgerüstet
war, wurden 150 mL Isopropanol zugesetzt, gefolgt von 4,84 g einer
50 %igen wässrigen
Lösung
von 2-Trimethylammoniumethylacrylat-chlorid, 7,26 g n-Decylacrylat
und 14,52 g Acrylamid. Die Lösung
wurde für
eine Stunde mit Stickstoff gespült
und es wurde 0,5 g AIBN zugesetzt. Das Gemisch wurde für ~15 Minuten
gespült,
bis sich alles AIBN gelöst
hatte. Die Lösung
wurde unter Stickstoff für
16 Stunden auf 75 °C
erhitzt.
-
Das
so erhaltene weiße
Reaktionsgemisch wurde durch Vakuumfiltration durch einen Büchner-Trichter filtriert,
um ein weißes
Pulver hervorzubringen. Das Pulver wurde mit Isopropanol gewaschen
und unter Vakuum getrocknet, um 21,52 g eines feinen, weißen Pulvers
hervorzubringen (89 % Ausbeute).
-
Zusätzlich wurden
durch ein gleichartiges Verfahren TMAEAC/n-Decylacrylat/Acrylamid-Terpolymere beginnend
mit den folgenden Verhältnissen
der Ausgangsmonomere hergestellt: TMAEAC/n-Decylacrylat/Acrylamid
= 20/20/60 und 30/10/60.
-
Beispiel 23: Synthese
von MAPTAC/N-t-Butylmethacrylamid/Methacrylamid-Terpolymer 10/30/60
-
In
einen dreihalsigen 500 mL Rundkolben, der mit einem Thermoelement,
einem Rückflusskühler und einem
Septum ausgerüstet
war, wurden 150 mL Isopropanol zugesetzt, gefolgt von 4,84 g einer
50 %igen wässrigen
Lösung
von N-(3-Trimethylammoniumpropyl)methacrylamid-chlorid, 7,26 g of
N-t-Butylmethacrylamid und 14,52 g Methacrylamid. Die Lösung wurde
für eine
Stunde mit Stickstoff gespült
und es wurde 0,5 g AIBN zugesetzt. Das Gemisch wurde für ~15 Minuten
gespült,
bis sich alles AIBN gelöst
hatte. Die Lösung wurde
unter Stickstoff für
16 Stunden auf 75 °C
erhitzt.
-
Es
war zu schwierig, das weiße
Reaktionsgemisch durch Vakuumfiltration zu filtrieren, so dass anstelle Zentrifugationstechniken
eingesetzt wurden. Das Reaktions gemisch wurde in 50 mL Zentrifugenröhrchen gegossen
und zentrifugiert. Der Überstand
wurde verworfen. Zu dem Polymer wurde Isopropanol zugesetzt und das
Gemisch wurde gerührt
und zentrifugiert. Der Überstand
wurde verworfen und die weißen
Feststoffe wurden vereinigt und unter Vakuum getrocknet, um 14,99
g eines leicht gelbbraunes (buff) Pulver hervorzubringen (61,9%
Ausbeute).
-
Zusätzlich wurden
durch ein gleichartiges Verfahren MAPTAC/N-t-Butylmethacrylamid/Methacrylamid-Terpolymere
beginnend mit den folgenden Verhältnissen
der Ausgangsmonomere hergestellt: MAPTAC/N-t-Butylmethacrylamid/Methacrylamid
= 20/20/60, 33/33/33 und 30/10/60.
-
Beispiel 24: Synthese
von MAPTAC/n-Decylmethacrylat/Methacrylamid-Terpolymer 10/30/60
-
In
einen dreihalsigen 500 mL Rundkolben, der mit einem Thermoelement,
einem Rückflusskühler und einem
Septum ausgerüstet
war, wurden 150 mL Isopropanol zugesetzt, gefolgt von 4,84 g einer
50 %igen wässrigen
Lösung
von N-(3-Trimethylammoniumpropyl)methacrylamid-chlorid, 7,26 g of
n-Decylmethacrylat und 14,52 g Methacrylamid. Die Lösung wurde
für eine
Stunde mit Stickstoff gespült
und es wurde 0,5 g AIBN zugesetzt. Das Gemisch wurde für ~15 Minuten
gespült,
bis sich alles AIBN gelöst
hatte. Die Lösung
wurde unter Stickstoff für
16 Stunden auf 75 °C
erhitzt.
-
Das
Isopropanol wurde dekantiert, um ein weißes, grobes (chunky) Pulver
zurückzulassen.
Es wurde Isopropanol zugesetzt und das Gemisch wurde in 50 mL Zentrifugenröhrchen gegossen
und zentrifugiert. Der Überstand
wurde verworfen. Zu dem Polymer wurde Isopropanol zugesetzt und
das Gemisch wurde gerührt und
zentrifugiert. Der Überstand
wurde verworfen und die weißen
Feststoffe wurden vereinigt und unter Vakuum getrocknet, um 18,50
g eines granulären,
weißen
Feststoffs hervorzubringen (76,4% Ausbeute).
-
Zusätzlich wurden
durch ein gleichartiges Verfahren MAPTAC/N-Decylmethacrylamid/Methacrylamid-Terpolymere
beginnend mit den folgenden Verhältnissen
der Ausgangsmonomere hergestellt: MAPTAC/N-Decylmethacrylamid/Methacrylamid
= 20/20/60, 33/33/33 und 30/10/60.
-
Beispiel 25: Synthese
von TMAEMC/n-Decylmethacrylat/Methacrylamid-Terpolymer 10/30/60
-
In
einen dreihalsigen 500 mL Rundkolben, der mit einem Thermoelement,
einem Rückflusskühler und einem
Septum ausgerüstet
war, wurden 150 mL Isopropanol zugesetzt, gefolgt von 3,46 g einer
70 %igen wässrigen
Lösung
von 2-Trimethylammoniumethylmethacrylat-chlorid, 7,26 g n-Decylmethacrylat
und 14,52 g Methacrylamid. Die Lösung
wurde für
eine Stunde mit Stickstoff gespült
und es wurde 0,5 g AIBN zugesetzt. Das Gemisch wurde für ~15 Minuten
gespült,
bis sich alles AIBN gelöst
hatte. Die Lösung
wurde unter Stickstoff für
16 Stunden auf 75 °C
erhitzt.
-
Das
weiße
Reaktionsgemisch wurde in 50 mL Zentrifugenröhrchen gegossen und zentrifugiert.
Der Überstand
wurde verworfen. Zu dem Polymer wurde Isopropanol zugesetzt und
das Gemisch wurde gerührt und
zentrifugiert. Der Überstand
wurde verworfen und die weißen
Feststoffe wurden vereinigt und unter Vakuum getrocknet, um 10,29
g eines harten, weißen
Feststoffs hervorzubringen (42,5 % Ausbeute).
-
Zusätzlich wurden
durch ein gleichartiges Verfahren TMAEMC/N-n-Decylmethacrylamid/Methacrylamid-Terpolymere
beginnend mit den folgenden Verhältnissen
der Ausgangsmonomere hergestellt: TMAEMC/N-n-Decylmethacrylamid/Methacrylamid
= 20/20/60, 33/33/33 und 30/10/60.
-
Beispiel 26: Synthese
von TMAEMC/N-t-Butylmethacrylamid/Methacrylamid-Terpolymer 10/30/60
-
In
einen dreihalsigen 500 mL Rundkolben, der mit einem Thermoelement,
einem Rückflusskühler und einem
Septum ausgerüstet
war, wurden 150 mL Isopropanol zugesetzt, gefolgt von 3,46 g einer
70 %igen wässrigen
Lösung
von 2-Trimethylammoniumethylmethacrylat-chlorid, 7,26 g N-t-Butylmethacrylamid
und 14,52 g Methacrylamid. Die Lösung
wurde für
eine Stunde mit Stickstoff gespült
und es wurde 0,5 g AIBN zugesetzt. Das Gemisch wurde für ~15 Minuten
gespült,
bis sich alles AIBN gelöst
hatte. Die Lösung
wurde unter Stickstoff für
16 Stunden auf 75 °C
erhitzt.
-
Das
weiße
Reaktionsgemisch wurde in 50 mL Zentrifugenröhrchen gegossen und zentrifugiert.
Der Überstand
wurde verworfen. Zu dem Polymer wurde Isopropanol zugesetzt und
das Gemisch wurde gerührt und
zentrifugiert. Der Überstand
wurde verworfen und die weißen
Feststoffe wurden vereinigt und unter Vakuum getrocknet, um 18,35
g eines feinen, weißen
Pulvers hervorzubringen (75,8 % Ausbeute).
-
Zusätzlich wurden
durch ein gleichartiges Verfahren TMAEMC/N-t-Butylmethacrylamid/Methacrylamid-Terpolymere
beginnend mit den folgenden Verhältnissen
der Aus gangsmonomere hergestellt: TMAEMC/N-t-Butylmethacrylamid/Methacrylamid
= 20/20/60, 33/33/33 und 30/10/60.
-
Beispiel 27: Synthese
von TMAEMC/n-Butylmethacrylat/Methacrylamid-Terpolymer 10/30/60
-
In
einen dreihalsigen 500 mL Rundkolben, der mit einem Thermoelement,
einem Rückflusskühler und einem
Septum ausgerüstet
war, wurden 150 mL Isopropanol zugesetzt, gefolgt von 3,46 g einer
70 %igen wässrigen
Lösung
von 2-Trimethylammoniumethylmethacrylat-chlorid, 7,26 g n-Butylmethacrylat
und 14,52 g Methacrylamid. Die Lösung
wurde für
eine Stunde mit Stickstoff gespült
und es wurde 0,5 g AIBN zugesetzt. Das Gemisch wurde für ~15 Minuten
gespült,
bis sich alles AIBN gelöst
hatte. Die Lösung
wurde unter Stickstoff für
16 Stunden auf 75 °C
erhitzt.
-
Das
weiße
Reaktionsgemisch wurde in 50 mL Zentrifugenröhrchen gegossen und zentrifugiert.
Der Überstand
wurde verworfen. Zu dem Polymer wurde Isopropanol zugesetzt und
das Gemisch wurde gerührt und
zentrifugiert. Der Überstand
wurde verworfen und die weißen
Feststoffe wurden vereinigt und unter Vakuum getrocknet, um 20,99
g eines klumpigen, weißen
Pulvers hervorzubringen (86,7 % Ausbeute).
-
Zusätzlich wurden
durch ein gleichartiges Verfahren TMAEMC/N-n-Butylmethacrylamid/Methacrylamid-Terpolymere
beginnend mit den folgenden Verhältnissen
der Ausgangsmonomere hergestellt: TMAEMC/N-n-Butylmethacrylamid/Methacrylamid
= 20/20/60 und 30/10/60.
-
Beispiel 28: Synthese
von MAPTAC/n-Butylmethacrylat/Methacrylamid-Terpolymer 10/30/60
-
In
einen dreihalsigen 500 mL Rundkolben, der mit einem Thermoelement,
einem Rückflusskühler und einem
Septum ausgerüstet
war, wurden 150 mL Isopropanol zugesetzt, gefolgt von 4,84 g einer
50 %igen wässrigen
Lösung
von N-(3-Trimethylammoniumpropyl)methacrylamid-chlorid, 7,26 g n-Butylmethacrylat
und 14,52 g Methacrylamid. Die Lösung
wurde für
eine Stunde mit Stickstoff gespült
und es wurde 0,5 g AIBN zugesetzt. Das Gemisch wurde für ~15 Minuten
gespült,
bis sich alles AIBN gelöst
hatte. Die Lösung
wurde unter Stickstoff für
16 Stunden auf 75 °C
erhitzt.
-
Das
weiße
Reaktionsgemisch wurde durch Vakuumfiltration filtriert, um ein
weißes
Pulver hervorzubringen. Das Pulver wurde mit Isopropanol gewaschen
und unter Vakuum getrocknet, um 22,20 g eines weißen Pulvers
hervorzubringen (91,7 % Ausbeute).
-
Zusätzlich wurden
durch ein gleichartiges Verfahren MAPTAC/n-Butylmethacrylat/Methacrylamid-Terpolymere
beginnend mit den folgenden Verhältnissen
der Ausgangsmonomere hergestellt: MAPTAC/n-Butylmethacrylat/Methacrylamid
= 20/20/60 und 30/10/60.
-
Beispiel 29: Synthese
von TMAEAC/n-Decylacrylamide/Acrylamid-Terpolymer 33/33/33
-
In
einen dreihalsigen 500 mL Rundkolben, der mit einem Thermoelement,
einem Rückflusskühler und einem
Septum ausgerüstet
war, wurden 150 mL Isopropanol zugesetzt, gefolgt von 16,13 g einer
50%igen wässrigen
Lösung
von 2-Trimethylammoniumethylacrylat-chlorid, 8,06 g n-Decylacrylamid
und 8,06 g Acrylamid. Die Lösung
wurde für
eine Stunde mit Stickstoff gespült
und es wurde 0,5 g AIBN zugesetzt. Das Gemisch wurde für ~15 Minuten
gespült,
bis sich alles AIBN gelöst
hatte. Die Lösung
wurde unter Stickstoff für
16 Stunden auf 75 °C
erhitzt.
-
Das
Reaktionsgemisch wurde in 1200 mL Ethylacetat präzipitiert. Das feine Präzipitat
wurde durch Vakuumfiltration filtriert, um ein klebriges, gelbes
Material hervorzubringen. Der leicht gelbe Feststoff wurde in Methanol
gelöst
und in 1200 mL Ethylacetat präzipitiert.
Das Präzipitat
wurde durch Vakuumfiltration filtriert, um 10,85 g eines klebrigen,
leicht gelben Pulvers (44,8 % Ausbeute) hervorzubringen.
-
Beispiel
30: Synthese von TMAEAC/N-t-Butylacrylamid/Acrylamid-Terpolymer
33/33/33 In einen dreihalsigen 500 mL Rundkolben, der mit einem
Thermoelement, einem Rückflusskühler und
einem Septum ausgerüstet
war, wurden 150 mL Isopropanol zugesetzt, gefolgt von 16,13 g einer
50%igen wässrigen
Lösung
von 2-Trimethylammoniumethylacrylat-chlorid, 8,06 g N-t-Butylacrylamid
und 8,06 g Acrylamid. Die Lösung
wurde für
eine Stunde mit Stickstoff gespült
und es wurde 0,5 g AIBN zugesetzt. Das Gemisch wurde für ~15 Minuten gespült, bis
sich alles AIBN gelöst
hatte. Die Lösung
wurde unter Stickstoff für
16 Stunden auf 75 °C
erhitzt.
-
Das
Reaktionsgemisch bestand aus einer klaren, farblosen Lösung mit
einer geringen Menge eines weißen,
klebrigen Feststoffs. Die klare Lösung wurde in 1200 mL Ethylacetat
präzipitiert.
Das weiße
Präzipitat wurde
filtriert, in Wasser gelöst
und gefriergetrocknet, um 6,65 eines weißen Pulvers hervorzubringen
(27,5 % Ausbeute).
-
Beispiel 31: Synthese
von TMAEAC/Styrol/Acrylamid-Terpolymer 33/33/33
-
In
einen dreihalsigen 500 mL Rundkolben, der mit einem Thermoelement,
einem Rückflusskühler und einem
Septum ausgerüstet
war, wurden 150 mL Isopropanol zugesetzt, gefolgt von 16,13 g einer
50%igen wässrigen
Lösung
von 2-Trimethylammoniumethylacrylat-chlorid, 8,06 g Styrol und 8,06
g Acrylamid. Die Lösung
wurde für
eine Stunde mit Stickstoff gespült
und es wurde 0,5 g AIBN zugesetzt. Das Gemisch wurde für ~15 Minuten
gespült,
bis sich alles AIBN gelöst
hatte. Die Lösung
wurde unter Stickstoff für
16 Stunden auf 75 °C
erhitzt.
-
Das
Reaktionsgemisch bestand aus einer klaren, farblosen Lösung und
einem weißen
Feststoff. Die klare Lösung
wurde verworfen. Der Feststoff wurde in Methanol gelöst und in
Ethylacetat (1200 mL) präzipitiert.
Es bildete sich ein weißes
Präzipitat,
das sich aus der Lösung
als ein klebriger, weißer
Feststoff absetzte. Das Ethylacetat wurde dekantiert und der Feststoff
durch einen Durchtritt von Stickstoff durch den Kolben getrocknet.
Der Feststoff wurde in Wasser gelöst und gefriergetrocknet, um
18,14 g eines feinen, weißen
Pulvers (75 % Ausbeute) hervorzubringen.
-
Beispiel 32: Synthese
von TMAEAC/n-Butylacrylat/Acrylamid-Terpolymer 33/33/33
-
In
einen dreihalsigen 500 mL Rundkolben, der mit einem Thermoelement,
einem Rückflusskühler und einem
Septum ausgerüstet
war, wurden 150 mL Isopropanol zugesetzt, gefolgt von 16,13 g einer
50%igen wässrigen
Lösung
von 2-Trimethylammoniumethylacrylat-chlorid, 8,06 g n-Butylacrylat
und 8,06 g Acrylamid. Die Lösung
wurde für
eine Stunde mit Stickstoff gespült
und es wurde 0,5 g AIBN zugesetzt. Das Gemisch wurde für ~15 Minuten
gespült,
bis sich alles AIBN gelöst
hatte. Die Lösung
wurde unter Stickstoff für
16 Stunden auf 75 °C
erhitzt.
-
Das
Reaktionsgemisch bestand aus einer klaren, farblosen Lösung und
einem weißen,
groben Feststoff. Die Lösungsphase
wurde verworfen und der weiße
Feststoff wurde in Wasser gelöst,
filtriert und gefriergetrocknet, um 12,84 g eines feinen, weißen Pulvers
(53,1 % Ausbeute) hervorzubringen.
-
Beispiel
33: Synthese von TMAEAC/n-Decylacrylat/Acrylamid-Terpolymer 33/33/33
In einen dreihalsigen 500 mL Rundkolben, der mit einem Thermoelement,
einem Rückflusskühler und
einem Septum ausgerüstet
war, wurden 150 mL Isopropanol zugesetzt, gefolgt von 16,13 g einer
50%igen wässrigen
Lösung
von 2-Trimethylammoniumethylacrylat-chlorid, 8,06 g n-Decylacrylat
und 8,06 g Acrylamid. Die Lösung
wurde für
eine Stunde mit Stickstoff gespült
und es wurde 0,5 g AIBN zugesetzt. Das Gemisch wurde für ~15 Minuten
gespült, bis
sich alles AIBN gelöst
hatte. Die Lösung
wurde unter Stickstoff für
16 Stunden auf 75 °C
erhitzt.
-
Das
weiße
Reaktionsgemisch wurde in 1200 mL Ethylacetat präzipitiert. Die trübe Lösung wurde
dekantiert und das Polymer wurde mit Stickstoff getrocknet, in Wasser
gelöst
und gefriergetrocknet, um 8,79 g eines feinen, weißen Pulvers
(36,3 % Ausbeute) hervorzubringen.
-
Beispiel 34: Synthese
von TMAEAC/t-Butylacrylat/Acrylamid-Terpolymer 33/33/33
-
In
einen dreihalsigen 500 mL Rundkolben, der mit einem Thermoelement,
einem Rückflusskühler und einem
Septum ausgerüstet
war, wurden 150 mL Isopropanol zugesetzt, gefolgt von 16,13 g einer
50%igen wässrigen
Lösung
von 2-Trimethylammoniumethylacrylat-chlorid, 8,06 g t-Butylacrylat
und 8,06 g Acrylamid. Die Lösung
wurde für
eine Stunde mit Stickstoff gespült
und es wurde 0,5 g AIBN zugesetzt. Das Gemisch wurde für ~15 Minuten
gespült,
bis sich alles AIBN gelöst
hatte. Die Lösung
wurde unter Stickstoff für
16 Stunden auf 75 °C
erhitzt.
-
Das
weiße
Reaktionsgemisch wurde in 1200 mL Ethylacetat präzipitiert. Die trübe Lösung wurde
dekantiert und das Polymer wurde mit Stickstoff getrocknet, in Wasser
gelöst
und gefriergetrocknet, um 6,51 g eines feinen, weißen Pulvers
(26,9 % Ausbeute) hervorzubringen.
-
Beispiel 35: In vitro-Aktivität ausgewählter Polymere
gegen eine Infektiosität
von C. parvum
-
In
Objektträgern
mit 16 Vertiefungen bzw. Wells wurden zusammenfließende MDBK-Zellmonoschichten
wachsen gelassen und mit 5 × 105 C. parvum-Oocysten pro Vertiefung infiziert.
Zu den Monoschichten wurden verschiedene Verdünnungen der Testreagenzien
in Dimethylsulfoxid (DMSO) zugesetzt, und die Kulturen wurden für 48 Stunden
bei 37 °C
(8 % CO2) inkubiert. Die Höhe an Infektionen
mit C. parvum wurde bestimmt und nach 48 Stunden durch einen indirekten
Immunofluorezenz (IF)-Assay bzw. -Test analysiert. Es wurde anti-C.
parvum-Sporozoit-Kanninchenserum (1:1000) als der primäre Antikörper verwendet,
und ein Fluorescein-konjugiertes anit-Kanninchen-Ziegenserum (1:100)
wurde als der sekundäre
Antikörper
verwendet. Jede Verdünnung
wurde vierfach getestet und jeder Assay wurde mindestens zweimal
durchgeführt.
Die Mono schichten wurden mit Methanol fixiert und, nach IF-Markierung,
wurde die Anzahl an in 10 Gesichtsfeldern bei starker Vergrößerung bzw.
10 High Power Fields (HPF) pro Vertiefung in jeder der vier Bohrungen
pro Verdünnung
beobachteten Parasiten gezählt,
statistisch analysiert und mit infizierten Vertiefungen verglichen,
die lediglich DMSO enthielten. Paromomycin wurde als das positive
Kontroll-Arzneimittel verwendet. Die Ergebnisse sind in der folgenden
Tabelle dargestellt.
-