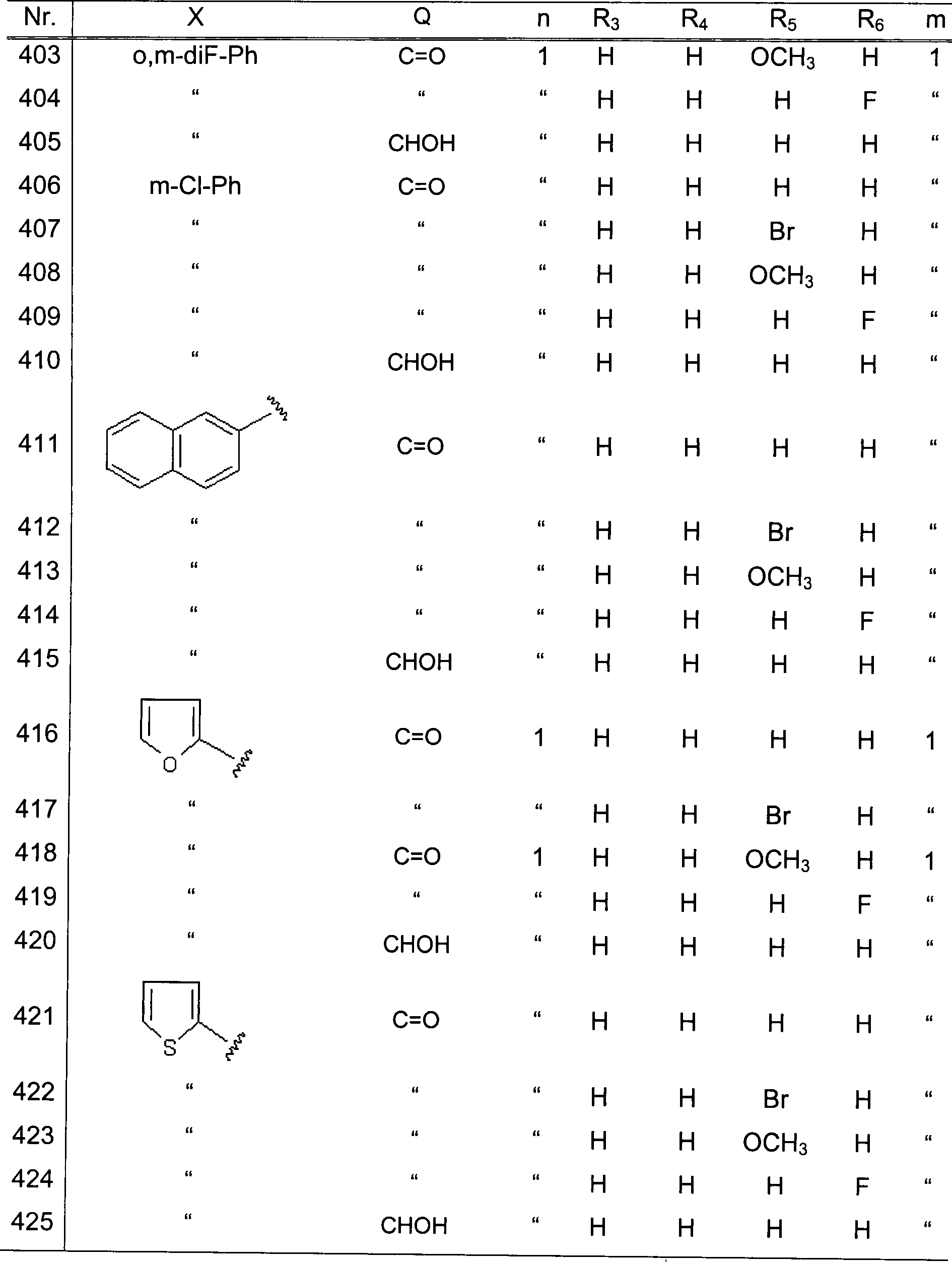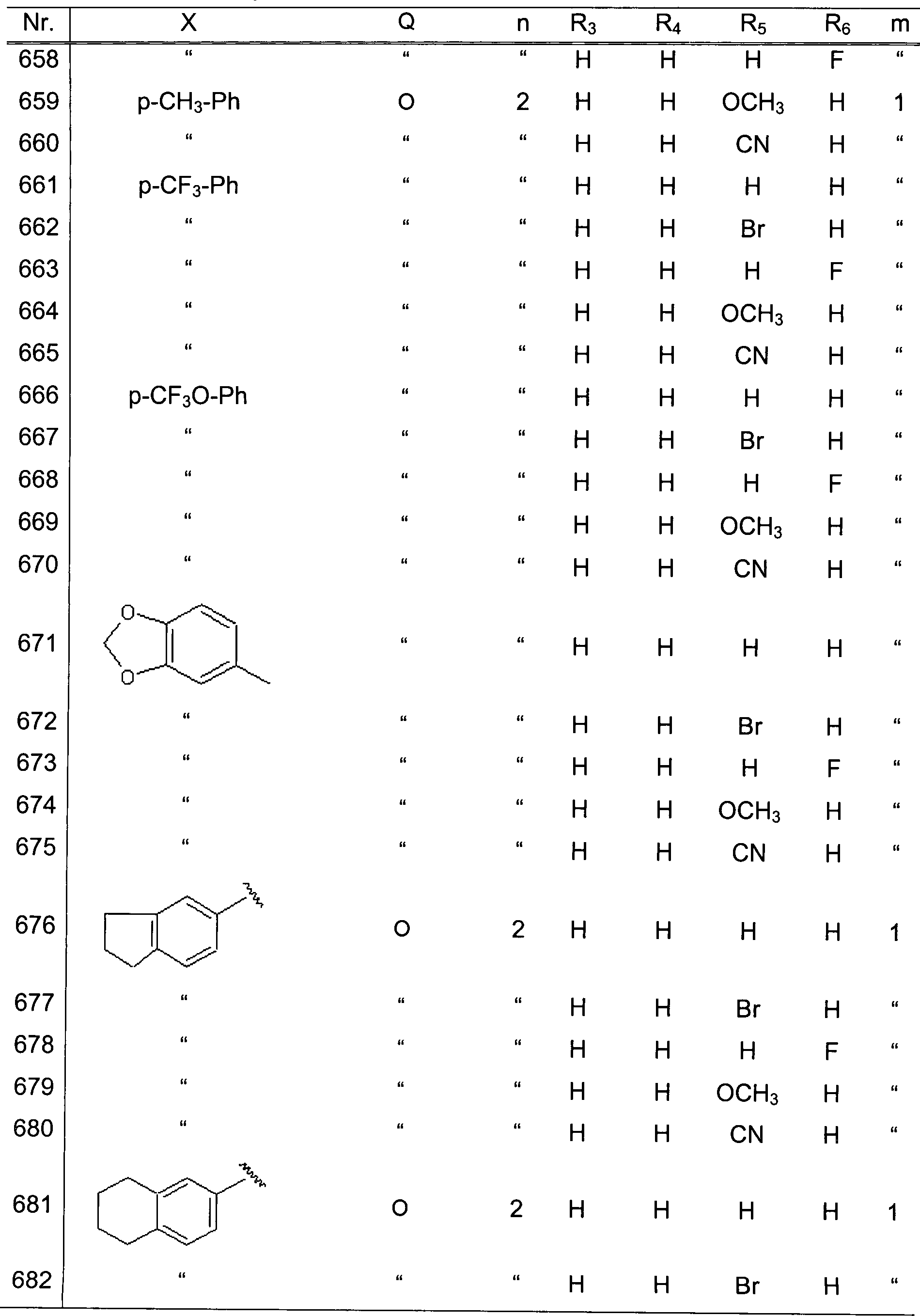-
Gebiet der Erfindung
-
Die
vorliegende Erfindung betrifft neuartige Verbindungen, welche als
Ligand für
die Bindestelle des Sigma-Rezeptors wirken, sowie Medikamente, welche
diese Verbindungen als einen Wirkstoff umfassen.
-
Hintergrund der Erfindung
-
Die
kürzlich
identifizierte Bindestelle des Sigma-Rezeptors im Gehirn ist ein
wichtiges Ziel für
die Entwicklung antipsychotischer Arzneien, welche frei von den
Nebenwirkungen aktuell erhältlicher
antipsychotischer Arzneien sind, die eine antagonistische Aktivität am Dopamin-D2-Rezeptor
zeigen (J.M. Walker und W.D. Bowen, F.O. Walker und R.R. Masumoto,
B. de Costa und K.C. Rice, Pharmacological Reviews, 42, S. 355–402, 1990;
G. Debonnel, J. Psychiatr. Neurosci., 18, 4, S. 157–172, 1993;
G. Debonnel und C. de Montigny, Life Sciences, 58, 9, S. 721–734, 1996).
Ferner wurden Daten veröffentlicht,
welche die Regulation der Signalweiterleitung durch einen Sigma-Liganden
(auch als „Sigma-Rezeptor-Ligand" bezeichnet) und
dessen Rezeptor mittels Kontrolle des Calcium-Spiegels in Synaptosomen
vorschlagen (P.J. Brent, H. Saunders und P.R. Dunkley, Neurosci.
Lett., 211, S. 138–142,
1996).
-
Der
hier verwendete Begriff „Rezeptor" bezeichnet einen
membranständigen
Rezeptor und andere Bindestellen. Die Existenz von mindestens zwei
Arten von Untertypen des Sigma-Rezeptors, d.h. Sigma 1 und Sigma
2, wurde entdeckt, und die Klassifizierung der Sigma-Bindestellen
wurde vorgeschlagen (R. Quirion, W.D. Bowen, Y. Itzhak, J.L. Junien,
J.M. Musacchio, R.B. Rothman, T.P. Su, W. Tam und D.P. Taylor, TIPS,
13, S. 85–86,
1992). Die Sigma-1-Bindestelle ist charakterisiert durch ihre hohe
Affinität
zu Haloperidol, Di-o-Tolylguanidin (DTG) und (+)-Benzomorphan, wie
beispielsweise (+)-Pentazocin, während
die Sigma-2-Bindestelle
charakterisiert ist durch eine hohe Affinität zu Haloperidol und DTG, jedoch
nur geringer Affinität
zu (+)-Benzomorphan aufweist.
-
Der
Sigma-1-Ligand zeigt eine Wirkung auf den Gastrointestinaltrakt,
und es scheint, dass die Sigma-1-Bindestelle die Unterdrückung der
Muscarin-ähnlichen
Acetylcholinrezeptor-/Phosphoinositid-Antwort vermittelt. Die Sigma-1-Bindestelle
kommt nicht nur im Gehirn vor, sondern auch auf Milzzellen (Y. Lin,
B.B. Whitlock, J.A. Pultz und S.A. Wolfe Jr, J. Neuroimmunol., 58,
S. 143–154,
1995), und derartige Sigma-Liganden können das Immunsystem unterdrücken (H.H.
Garza, S. Mayo, W.D. Bowen, B.R. DeCosta und D.J.J. Carr, J. of
Immunology, 151, 9, S. 4672–4680,
1993).
-
Die
Sigma-2-Bindestelle kommt in großer Zahl in der Leber vor (A.E.
Bruce, S.B. Hellewell und W.D. Bowen, Neurosci. Abstr., 16, 370,
1990; A.S. Basile, I.A. Paul und B. DeCosta, Eur. J. Pharmacol.
Mol. Pharm. Sect., 227, S: 95–98,
1992; C. Torrence-Campbell und W.D. Bowen, Eur. J. Pharmacol., 304,
S. 201–210, 1996),
in den Nieren (W.D. Bowen, G. Feinstein und J.S. Orringer, Soc.
Neurosci. Abstr., 18, 456, Abstract 195.8, 1992) und im Herzen (M.
Dumont und S. Lemaire, Eur. J. Pharmacol., 209, S. 245–248, 1991).
-
Die
Sigma-2-Bindestelle im Gehirn kommt vor im Hypothalamus, im Cerebellum,
der Pons Medulla und der Medulla oblongata. Im Hippocampus, Lobus
frontalis und Lobus occipitalis des Rattenhirns kommt diese häufiger vor
als die Sigma-1-Bindestelle
(D.J. McCann, A.D. Weissmann und T.P. Su, Soc. Neurosci. Abstr. 18,
22, Abstract 16.5, 1992). In den Synaptosomen im Hippocampus von
Meerschweinchen gibt es ebenso Sigma-2-Bindestellen, welche selektiv
mit (3H)-BIMU
markiert wurden (D.W. Bonhaus, D.N. Loury, L.B. Jakeman, Z. To,
A. De-Souza, R.M.
Eglen und E.H.F. Wong, J. Pharmacol. Exp. Ther., 267, 2, S. 961–970, 1993). Die
Beziehung zwischen der Sigma-2-Bindestelle und dem Cortex sowie
dem Iimbischen System ist ein Beleg für den Wert von Verbindungen,
welche zur Behandlung mentaler Erkrankungen verwendet werden (D.C.
Marsh und C.P. Zabetian, Synapse, 12, S. 195–205, 1992).
-
Es
wurde vermutet, dass die Sigma-2-Bindestelle an Funktionen des Bewegungsapparats
beteiligt ist, insbesondere bei Dystonie (R.R. Matsumoto, M.K. Hemstreet,
N.L. Lai und A. Thurkauf, B.R. DeCosta, K.C. Rice, S.B. Hellewell,
W.D. Bowen und J.M. Walker, Pharmacol. Biochem., Behav. 36, S. 151–155, 1990).
Jedoch wurde in Primatenmodellen zu funktionalen Störungen des
extrapyramidalen Systems kein Anhaltspunkt gefunden, der eine derartige
Wirkung nachweist (L.T. Meltzer, C.L. Christoffersen, K.A. Serpa,
T.A. Pugsley, A. Razmpour und T.G. Heffner, Neuropharmacology, 31,
9, S. 961–967,
1992).
-
Haloperidol,
welches ein klinisch wirksames dopaminerges antipsychotisches Mittel
ist, zeigt eine hohe Affinität
zu diesen zwei Sigma-Untertypen. Jedoch zeigt ein reduzierter Metabolit
des Haloperidols, welcher auf das zentrale Nervensystem wirkt, im
Vergleich zu Haloperidol eine deutlich bessere Affinität und Selektivität zum Sigma-2-Rezeptor
als Dopamin D2 (J.C. Jaen, B.W. Caprathe, T.A. Pugsley, L.D. Wise
und H. Akunne, J. Med. Chem., 36, S. 3929–3936, 1993). Da ein selektives
Mittel nicht verfügbar
gewesen ist, sind pharmakologische Bedeutung, Verteilung und Funktionen
der Sigma-2-Bindestelle bisher nicht aufgeklärt worden. Andererseits zeigten
neuere Studien, dass die Sigma-2-Stelle eine Rolle spielt bei der
Kontrolle der Funktionen des Ileums (G.G. Kinney, E.W. Hans, R.
Ray und T.J. Hudzik, Europ. J. Pharmacol., 294, S. 547–553, 1995).
Diese Daten weisen darauf hin, dass der selektive Sigma-2-Ligand
anwendbar ist zur Behandlung des Reizdarmsyndroms.
-
Derartige
Sigma-Liganden werden in
EP 1043319 und
EP 777660 und ähnlichen
offenbart. Jedoch ist bisher kein cyclisches Aminderivat, wie Isoindolin-1-on
als typisches Beispiel, beschrieben worden.
-
Als
Verbindungen, welche eine Struktur aufweisen, die ähnlich der
allgemeinen Formel (I) der vorliegenden Erfindung ist, offenbart
EP 637306 4-Imidomethyl-1-(2'-phenyl-2'-oxoethyl)-piperidine,
wie beispielsweise:
und Hydrochloride
davon usw. Jedoch werden diese Verbindungen als Serotonin-2-Antagonisten
beschrieben, und ob sie als Sigma-Liganden wirken können oder
nicht, ist bisher noch nicht bekannt. Des Weiteren können diese
Verbindungen, welche eine Phtalimidgruppe besitzen, möglicherweise
ein Problem aufgrund unzureichender Sicherheit darstellen.
-
Sowohl
WO 91/06297 als auch
WO 93/22310 beschreiben
bestimmte (N-Phthalimidoalkyl)-piperidin-Verbindungen, welche einen
selektiven Sigma-Rezeptor-Antagonismus
zeigen und welche verwendet werden können bei der Behandlung physiologischer
oder medikamentös
induzierter Psychose und Dyskinesie bei einem Säugetier. Allerdings unterscheiden
sich die (N-Phthalimidoalkyl)-piperidine aus
WO 91/06297 und
WO 93/22310 bezüglich ihrer Substituenten in
einigen Aspekten von den Verbindungen der allgemeinen Formel (I) der
vorliegenden Erfindung.
-
Offenbarung der Erfindung
-
Eine
Aufgabe der vorliegenden Erfindung ist es, eine neuartige Verbindung
bereitzustellen, welche eine hervorragende Affinität zur Sigma-Bindestelle
besitzt. Eine andere Aufgabe der vorliegenden Erfindung ist es,
ein Medikament bereitzustellen, welches eine Verbindung mit den
zuvor genannten Eigenschaften als Wirkstoff umfasst, welcher für Erkrankungen
anwendbar ist, die therapeutisch und/oder präventiv behandelt werden können durch
die Wirkung des Sigma-Liganden
auf die Nervensteuerung.
-
Die
Erfinder der vorliegenden Erfindung haben Untersuchungen durchgeführt, um
die oben genannten Aufgaben zu erfüllen. Als Ergebnis wurde gefunden,
dass durch Formel (I) repräsentierte
Verbindungen eine hohe Affinität
zur Sigma-1-Bindestelle und eine kleine Inhibitionskonstante Ki
für Sigma
1 und/oder Sigma 2 aufweisen. Außerdem wurde gefunden, dass
diese Verbindungen ein selektives Bindungsprofil aufwiesen, welches
sich vollständig
von denen der herkömmlichen
bekannten Verbindungen unterschied, und dass diese anwendbar waren
zur Behandlung von Erkrankungen, welche therapeutisch und/oder präventiv durch
die Wirkung des Sigma-Liganden auf die Nervensteuerung behandelt
werden können.
Die vorliegende Erfindung wurde auf der Basis dieser Erkenntnisse
erzielt.
-
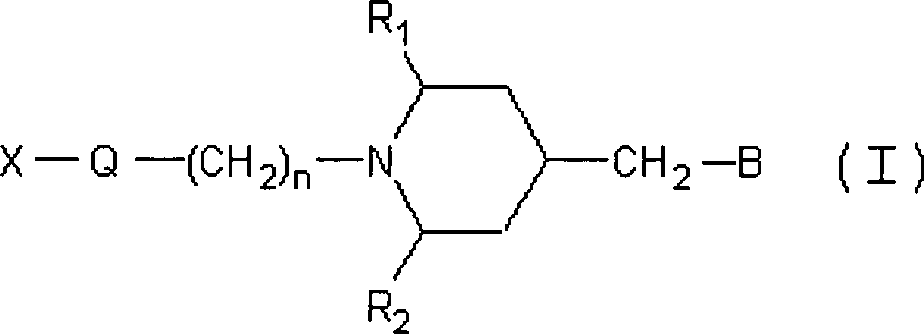
Die
vorliegende Erfindung stellt somit Verbindungen, repräsentiert
durch die folgende Formel (I), bereit, oder Salze davon oder Hydrate
davon oder Solvate davon:
wobei:
X eine Alkylgruppe,
eine cycloalkylsubstituierte Alkylgruppe, eine Arylsubstituierte
Alkylgruppe, eine Aryl-substituierte Alkenylgruppe, eine Aryl-substituierte
Alkinylgruppe, eine monocyclische oder polycyclische Cycloalkylgruppe
repräsentiert,
welche substituiert sein können
mit einer Alkylgruppe, einer Arylgruppe, einer heterocyclischen
Gruppe oder einer substituierten oder unsubstituierten Aminogruppe;
Q
eine Gruppe repräsentiert,
dargestellt durch -CO-, -O-, -S-, -CH(OR
7)-,
-C(=CH
2)- oder -C(=NR
8)-
(wobei R
7 ein Wasserstoffatom, eine Alkylgruppe,
eine Hydroxyalkylgruppe oder eine Acylgruppe repräsentiert,
und R
8 eine Hydroxylgruppe, eine Alkoxygruppe,
eine Aralkoxygruppe, eine Acyloxygruppe, eine Acylaminogruppe oder
eine Alkoxycarbonylaminogruppe repräsentiert);
n eine Ganzzahl
von 0 bis 5 repräsentiert;
R
1 und R
2 jeweils
unabhängig
ein Wasserstoffatom oder eine Alkylgruppe repräsentiern, oder R
1 und
R
2 verknüpft
werden, um eine Alkylengruppe zu bilden;
B die beiden folgenden
Gruppen repräsentiert:
(wobei R
3,
R
4, R
5 und R
6 jeweils unabhängig einen Substituenten repräsentieren,
ausgewählt
aus der Gruppe, bestehend aus einem Wasserstoffatom, einem Halogenatom,
einer Nitrogruppe, einer Alkylgruppe, einer halogenierten Alkylgruppe,
einer Hydroxylgruppe, einer Alkoxygruppe, einer halogenierten Alkoxygruppe
und einer Cyanogruppe);
m 1 oder 2 repräsentiert; und
der Ring:
einen 5- oder 6-gliedrigen
aromatischen heterocyclischen Ring repräsentiert, enthaltend ein oder
zwei Heteroatome, welcher substituiert sein kann.
-
Nach
einem anderen Aspekt der vorliegenden Erfindung, werden Medikamente
bereitgestellt, welche als Wirkstoff eine Substanz umfassen, ausgewählt aus
der Gruppe, bestehend aus den zuvor genannten Verbindungen und deren
Salze, sowie deren Hydrate und deren Solvate. Als eine bevorzugte
Ausführungsform derselben
werden die zuvor genannten Medikamente bereitgestellt, welche für Erkrankungen
angewendet werden, die therapeutisch und/oder präventiv behandelt werden durch
die Nervensteuerungsfunktion eines Sigma-Liganden (beispielsweise
Erkrankungen des zentralen Nervensystems, Erkrankungen des Gastrointestinaltraktes,
Herzdefekte und dergleichen). Die vorliegende Erfindung stellt außerdem einen
Sigma-Liganden bereit, welcher eine Substanz umfasst, ausgewählt aus
der Gruppe, welche aus den zuvor genannten Verbindungen und deren
Salze, deren Hydrate und deren Solvate besteht.
-
Nach
weiteren Aspekten der vorliegenden Erfindung wird eine Anwendung
einer Substanz, ausgewählt
aus der Gruppe, bestehend aus den zuvor genannten Verbindungen und
deren Salze, deren Hydrate und deren Solvate, bereitgestellt für die Herstellung
der zuvor genannten Medikamente, vorzugsweise in Form einer pharmazeutischen
Zusammensetzung, sowie Verfahren für eine therapeutische und/oder
präventive
Behandlung von Erkrankungen durch die Nervensteuerungsfunktion von
Sigma-Liganden, welche einen Schritt des Verabreichens einer wirksamen
Menge einer Substanz an ein Säugetier,
einschließlich
Menschen, umfassen, ausgewählt
aus der Gruppe, bestehend aus den zuvor genannten Verbindungen und
deren Salze, deren Hydrate und deren Solvate.
-
Bester Weg zur Ausführung der
Erfindung
-
In
der oben beschrieben Formel (I) repräsentiert X eine Alkylgruppe,
eine Cycloalkyl-substituierte Alkylgruppe, eine Aryl-substituierte
Alkylgruppe, eine Aryl-substituierte Alkenylgruppe, eine Aryl-substituierte
Alkinylgruppe, eine monocyclische oder polycyclische Cycloalkylgruppe,
welche substituiert sein kann mit einer Alkylgruppe, einer Arylgruppe,
einer heterocyclischen Gruppe oder einer substituierten oder unsubstituierten Aminogruppe.
-
Der
hier verwendete Begriff „Alkylgruppe" und der Begriff „Alkyl" für eine Gruppe,
welche eine Alkylgruppe als Rest enthält, umfasst beispielsweise
lineare oder verzweigte Alkylgruppen mit 1 bis 6 Kohlenstoffatomen,
vorzugsweise 1 bis 4 Kohlenstoffatome. Insbesondere können als
Alkylgruppe verwendet werden: Methylgruppen, Ethylgruppen, n-Propylgruppen,
Isopropylgruppen, n-Butylgruppen, Isobutylgruppen, sec-Butylgruppen,
tert-Butylgruppen, n-Pentylgruppen, Isopentylgruppen, Neopentylgruppen,
tert-Pentylgruppen, n-Hexylgruppen und dergleichen.
-
Wenn
sich auf „Alkylgruppe" bezogen wird, umfasst
dieser Begriff in der Beschreibung jene, welche eine oder mehrere
Substituenten besitzen, falls nicht anders angegeben. Zu den Beispielen
für diese
Substituenten gehören:
ein Halogenatom, eine Nitrogruppe, eine Cycloalkylgruppe, eine Arylgruppe,
eine Aryloxygruppe, eine Heteroarylgruppe, eine Hydroxylgruppe,
eine Alkoxygruppe, eine halogenierte Alkoxygruppe, eine Carboxylgruppe,
eine Alkoxycarboxylgruppe, eine substituierte oder unsubstituierte
Aminogruppe, eine Acylgruppe oder eine Cyanogruppe. Als diese Substituenten
können
vorzugsweise die unten beschriebenen verwendet werden.
-
Der
hier verwendete Begriff „Cycloalkylgruppe" und der Begriff „Cycloalkyl" für eine Gruppe,
welche eine Cycloalkylgruppe als Rest enthält, umfassen beispielsweise
eine 3- bis 8-gliedrige Cycloalkylgruppe, vorzugsweise eine etwa
3- bis 6-gliedrige
Cycloalkylgruppe (eine monocyclische Cycloalkylgruppe, falls nicht
anderweitig besonders erwähnt).
Diese Cycloalkylgruppen können
eine oder zwei Alkylgruppen an ihrem Ring aufweisen. Insbesondere
können,
beispielsweise, Cyclopropylgruppen, Methylcyclopropylgruppen, Cyclobutylgruppen,
Cyclopentylgruppen, Cyclohexylgruppen, Methylcyclohexylgruppen,
Dimethylcyclohexylgruppen und dergleichen als Cycloalkylgruppe verwendet
werden. Als polycyclische Cycloalkylgruppe kann eine 5- bis 12-gliedrige
Polycycloalkylgruppe, wie beispielsweise eine Norbonylgruppe oder
eine Adamantylgruppe verwendet werden, und die Adamantylgruppe kann
vorzugsweise verwendet werden.
-
Zu
den Beispielen für
die Cycloalkyl-substituierten Alkylgruppen gehören beispielsweise: Cyclopropylmethylgruppen,
Methylcyclopropylmethylgruppen, Cyclopropylethylgruppen, Cyclopropylpropylgruppen,
Cyclobutylmethylgruppen, Cyclobutylethylgruppen, Cyclopentylmethylgruppen,
Cyclohexylmethylgruppen, Dimethylcyclohexylmethylgruppen und dergleichen.
-
Der
hier verwendete Begriff „Arylgruppe" und der Begriff „Aryl" für eine Gruppe, welche
eine Arylgruppe als Rest enthält,
umfassen beispielsweise eine monocyclische, bicyclische oder tricyclische
Arylgruppe, welche etwa 6 bis 14 Atome enthalten. Beispielsweise
können
Phenylgruppen, 1-Naphthylgruppen und 2-Naphthylgruppen, ebenso wie Phenanthrylgruppen,
Anthracenylgruppen und dergleichen verwendet werden. Ferner umfasst „Arylgruppe" bicyclische oder
tricyclische Arylgruppen, deren Ring oder Ringe teilweise hydriert
sind, einschließlich
einer 5,6,7,8-Tetrahydronaphthylgruppe.
-
Der
hier verwendete Begriff „Alkenylgruppe" umfasst lineare
oder verzweigte Alkenylgruppen mit 2 bis 6 Kohlenstoffatomen, vorzugsweise
3 bis 6 Kohlenstoffatome, und welche eine oder mehrere Doppelbindungen
enthalten, vorzugsweise eine Doppelbindung. Beispielsweise können 1-Propenylgruppen,
Allylgruppen, Isopropenylgruppen, 1-Butenylgruppen, 3-Butenylgruppen,
1-Pentenylgruppen, 2-Pentenylgruppen, 3-Pentenylgruppen, 4-Pentenylgruppen,
1-Hexenylgruppen, 2-Hexenylgruppen und dergleichen als Alkenylgruppe verwendet
werden. Die in der Alkenylgruppe enthaltene Doppelbindung kann entweder
in cis- oder in trans-Konfiguration
vorliegen.
-
Der
Begriff „Alkinylgruppe" umfasst eine lineare
oder verzweigte Alkinylgruppe mit 2 bis 6 Kohlenstoffatomen, vorzugsweise
3 bis 6 Kohlenstoffatome, beispielsweise 2-Propinylgruppen, 3-Butinylgruppen,
4-Pentinylgruppen, 5-Hexinylgruppen und dergleichen
-
Als
heterocyclische Gruppe wird eine 5- bis 10-gliedrige monocyclische
bis tricyclische heterocyclische Gruppe verwendet, welche 1 bis
4 Heteroatome enthält,
ausgewählt
aus Sauerstoffatomen, Schwefelatomen und Stickstoffatomen als ringbildende
Atome. Beispielsweise schließen
verwendbare Gruppen ein: Furylgruppe (Furanring), Benzofuranylgruppe
(Benzofuranring), Isobenzofuranylgruppe (Isobenzofuranring), Thienylgruppe
(Thiophenring), Benzothiophenylgruppe (Benzothiophenring), Pyrrolylgruppe
(Pyrrolring), Imidazolylgruppe (Imidazolring), Pyrazolylgruppe (Pyrazolring),
Thiazolylgruppe (Thiazolring), Benzothiazolylgruppe (Benzothiazolring),
Isothiazolylgruppe (Isothiazolring), Benzisothiazo lylgruppe (Benzisothiazolring), Triazolylgruppe
(Triazolring), Tetrazolylgruppe (Tetrazolring), Pyridylgruppe (Pyridinring),
Pyrazinylgruppe (Pyrazinring), Pyrimidinylgruppe (Pyrimidinring),
Pyridazinyigruppe (Pyridazinring), Indolylgruppe (Indolring), Isoindolylgruppe
(Isoindolring), Benzimidazolylgruppe (Benzimidazolring), Purinylgruppe
(Purinring), Chinolylgruppe (Chinolinring), Isochinolylgruppe (Isochinolinring),
Dihydroisochinolylgruppe (Dihydroisochinolinring), Phthalazinylgruppe
(Phthalazinring), Naphthyridinylgruppe (Naphthyridinring), Chinoxalinylgruppe
(Chinoxalinring), Cinnolinylgruppe (Cinnolinring), Pteridinylgruppe
(Pteridinring), Oxazolylgruppe (Oxazolring), Isoxazolylgruppe (Isoxazolring),
Benzoxazolylgruppe (Benzoxazolring), Benzisoxazolylgruppe (Benzisoxazolring),
Furazanylgruppe (Furazanring), Oxazinylgruppe (Oxazinring) und dergleichen.
Zusätzlich
können
außerdem jene
heterocyclischen Gruppen, deren Ring oder Ringe teilweise hydriert
sind, verwendet werden, einschließlich der Pyrrolidingruppe
(Pyrrolidinring), Imidazolidinylgruppe (Imidazolidinring), Piperidinylgruppe
(Piperidinring), Piperazinylgruppe (Piperazinring), Morpholinyigruppe
(Morpholinring) und dergleichen. Unter diesen kann eine 5- bis 7-gliedrige
monocyclische heterocyclische Gruppe, die 1 oder 2 Heteroatome enthält, oder eine
8- bis 10-gliedrige
bicyclische Heteroarylgruppe, die 1 oder 2 Heteroatome enthält, vorzugsweise
als die erfindungsgemäße heterocyclische
Gruppe verwendet werden.
-
Wenn
sich in der Beschreibung auf „Cycloalkylgruppe", „Arylgruppe", „Heterocyclische
Gruppe" oder „Heteroarylgruppe" bezogen wird, umfasst
der Begriff eine Cycloalkylgruppe, eine Arylgruppe, eine heterocyclische
Gruppe oder eine Heteroarylgruppe mit einem oder mehreren Substituenten
am Ring, falls nicht anders angegeben. Zu den Beispielen für Substituenten
gehören:
ein Halogenatom, eine Nitrogruppe, eine Alkylgruppe, eine Cycloalkylgruppe,
eine Alkenylgruppe, eine Alkinylgruppe, eine halogenierte Alkylgruppe,
eine Hydroxylgruppe, eine Alkoxygruppe, eine halogenierte Alkoxygruppe,
eine Carboxylgruppe, eine Alkoxycarboxylgruppe, eine Phenylgruppe,
eine Phenoxygruppe, eine substituierte oder unsubstituierte Aminogruppe,
eine Acylgruppe, eine Cyanogruppe und dergleichen. Als diese Substituenten
können
die oben erläuterten
oder die unten beschriebenen vorzugsweise verwendet werden.
-
Beispiele
der substituierten oder unsubstituierten Aminogruppe schließen beispielsweise
ein: eine Aminogruppe, eine Alkylaminogruppe, wie beispielsweise
eine Monoalkylaminogruppe und eine Dialkylaminogruppe, eine Acylaminogruppe,
wie beispielsweise eine Alkanoylaminogruppe und eine Arylcarbonylaminogruppe,
eine Aralkylaminogruppe, eine Alkylsulfonylaminogruppe und dergleichen.
Insbesondere sind in den Beispielen eingeschlossen: eine Alkylaminogruppe,
wie beispielsweise eine Monomethylaminogruppe, Dimethylaminogruppe,
Ethylaminogruppe, Diethylaminogruppe, Methylethylaminogruppe, Propylaminogruppe,
Dipropylaminogruppe, Butylaminogruppe, Pentylaminogruppe und Hexylaminogruppe;
eine Acylaminogruppe, wie beispielsweise eine Acetylaminogruppe,
Trifluoracetylaminogruppe, Propionylaminogruppe, Benzoylaminogruppe
und p-Methoxybenzoylaminogruppe; eine Aralkylaminogruppe, wie beispielsweise
eine Benzylaminogruppe und eine p-Methoxybenzylaminogruppe; und
eine Alkylsulfonylaminogruppe, wie beispielsweise eine Methylsulfonylaminogruppe,
Ethylsulfonylaminogruppe, n-Propylsulfonylaminogruppe und eine n-Hexylsulfonylaminogruppe.
-
Wenn
sich in der Beschreibung auf den Begriff „Halogenatom" oder „halogeniert" bezogen wird, kann jeweils
ein Fluoratom, Chloratom, Bromatom und Jodatom als das Halogenatom
verwendet werden. Der in der Beschreibung verwendete Begriff „halogenierte
Alkylgruppe" umfasst
beispielsweise eine Monofluormethylgruppe, Difluormethylgruppe,
Trifluormethylgruppe, Trifluorethylgruppe, Pentafluorethylgruppe,
Monochlormethylgruppe, Dichlormethylgruppe, Trichlormethylgruppe
und dergleichen, und bevorzugte Beispiele derselben schließen eine
Trifluormethylgruppe ein.
-
Der
hier verwendete Begriff „Alkoxygruppe" und der Begriff „Alkoxy" für eine Gruppe,
welche eine Alkoxygruppe als Rest enthält, umfasst beispielsweise
lineare oder verzweigte Alkoxygruppen mit 1 bis 6 Kohlenstoffatomen,
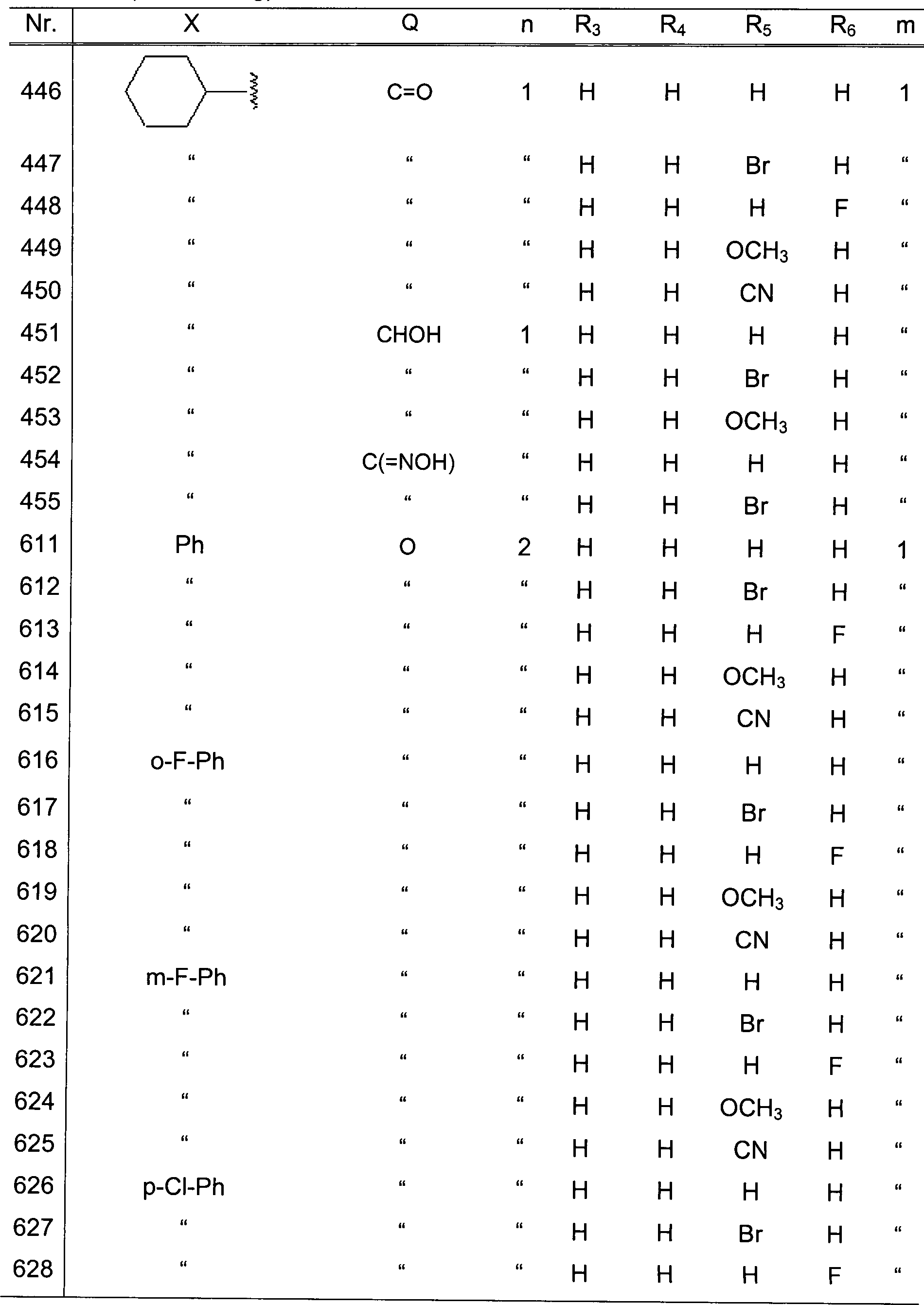
vorzugsweise 1 bis 4 Kohlenstoffatome. Insbesondere kann eine Methoxygruppe,
Eth oxygruppe, n-Propoxygruppe, Isopropoxygruppe, n-Butoxygruppe,
Isobutoxygruppe, tert-Butoxygruppe, n-Pentyloxygruppe, n-Hexyloxygruppe
und dergleichen als die Alkoxygruppe verwendet werden. Beispielsweise
können
eine Trifluormethoxygruppe, Trifluorethoxygruppe, Monochlormethoxygruppe,
Trichlormethoxygruppe und dergleichen als die halogenierte Alkoxygruppe
verwendet werden.
-
Als
die Alkoxycarboxylgruppe können
beispielsweise Alkoxycarboxylgruppen, gebildet durch die zuvor genannten
Alkoxygruppen, verwendet werden, und insbesondere kann eine Methoxycarbonylgruppe,
Ethoxycarbonylgruppe, n-Propoxycarbonylgruppe, Isopropoxycarbonylgruppe
und dergleichen verwendet werden.
-
Beispiele
der Acylgruppe schließen
ein eine Alkanoylgruppe (z. B. eine Alkylcarbonylgruppe, eine halogenierte
Alkylcarbonylgruppe und dergleichen), eine Arylcarbonylgruppe, eine
Heteroarylcarbonylgruppe und dergleichen. Insbesondere können eine
Formylgruppe, Acetylgruppe, Propionylgruppe, Trifluormethylcarbonylgruppe,
Pentafluorethylcarbonylgruppe, Benzoylgruppe, p-Methoxybenzoylgruppe,
3-Pyridylcarbonylgruppe und dergleichen verwendet werden.
-
Als
X kann eine Alkylgruppe, eine Aryl-substituierte Alkylgruppe, eine
Ar–yl-substituierte
Alkenylgruppe, eine Aryl-substituierte Alkinylgruppe, eine Arylgruppe,
eine monocyclische Cycloalkylgruppe, eine monocyclische heterocyclische
Gruppe, eine 8- bis 10-gliedrige bicyclische Heteroarylgruppe, welche,
1 oder 2 Heteroatome enthält,
oder eine Aminogruppe, welche substituiert ist mit einer Alkyl-
oder Arylgruppe, in der vorliegenden Erfindung vorzugsweise verwendet
werden. Besonders bevorzugt kann eine substituierte oder unsubstituierte
Phenylgruppe (Beispiele des Substituenten schließen einen oder mehrere Substituenten
ein, ausgewählt
aus der Gruppe, welche beispielsweise besteht aus: einem Halogenatom,
einer Alkylgruppe, einer halogenierten Alkylgruppe, einer Alkoxygruppe,
einer halogenierten Alkoxygruppe, einer Aralkylgruppe, einer Aralkoxygruppe,
einer Phenylgruppe, einer Phenoxygruppe, einer Furylgruppe, ei ner
Acylgruppe, einer Aminogruppe, einer Alkylaminogruppe, einer Acylaminogruppe,
einer Nitrogruppe und einer Cyanogruppe), eine 5- oder 6-gliedrige
monocyclische heterocyclische Gruppe oder eine 8- bis 10-gliedrige
bicyclische Heteroarylgruppe, welche ein oder zwei Heteroatome enthält, verwendet
werden.
-
Besonders
bevorzugte Beispiele von X in der vorliegenden Erfindung schließen ein:
eine substituierte oder unsubstituierte Phenylgruppe (der Substituent
ist vorzugsweise einer oder mehrere Substituenten, ausgewählt aus
der Gruppe, bestehend aus einem Halogenatom, einer Alkylgruppe,
einer halogenierten Alkylgruppe, einer Alkoxygruppe, einer halogenierten
Alkoxygruppe und einer Cyanogruppe, und besonders bevorzugt einer
oder mehrere Substituenten, ausgewählt aus der Gruppe, bestehend
aus einem Halogenatom und einer Alkoxygruppe). Die p-Fluorphenylgruppe
ist am meisten bevorzugt. In der oben beschriebenen Formel (I) steht
Q für eine
Gruppe, repräsentiert
durch -CO-, -O-, -S-, -CH(OR7), -C(=CH2)- oder -C(=NR8).
R7 repräsentiert
ein Wasserstoffatom, eine Alkylgruppe, eine Hydroxyalkylgruppe oder
eine Acylgruppe, besonders bevorzugt für ein Wasserstoffatom, eine
niedere Alkylgruppe oder eine Acetylgruppe, und am meisten bevorzugt für ein Wasserstoffatom
oder eine Acetylgruppe. R8 repräsentiert
eine Hydroxylgruppe, eine Alkoxygruppe, eine Aralkoxygruppe, eine
Acyloxygruppe, eine Acylaminogruppe oder eine Alkoxycarbonylaminogruppe,
und besonders bevorzugt für
eine Hydroxylgruppe, eine Alkoxygruppe oder eine Acylaminogruppe.
Am meisten bevorzugt ist es, wenn R8 eine
Hydroxylgruppe oder eine Acetylaminogruppe ist.
-
Als
Q kann eine Gruppe, repräsentiert
durch -CO-, -O-, -C(=NOH)- oder -CH(=NR)-, in der vorliegenden Erfindung
bevorzugt sein, und eine Gruppe, repräsentiert durch -CH2-,
-CO-, -O- oder -CH(OH)- ist besonders bevorzugt. Am meisten bevorzugt
ist -CO-.
-
In
der oben beschrieben Formel (I) repräsentiert n eine Ganzzahl von
0 bis 5, vorzugsweise von 0 bis 4, besonders bevorzugt von 1 bis
3 und am meisten bevorzugt 1.
-
In
der oben beschriebenen Formel (I) stehen R1 und
R2 jeweils unabhängig für ein Wasserstoffatom oder
eine Alkylgruppe, oder R1 und R2 werden
kombiniert, um eine Alkylengruppe zu bilden. Vorzugsweise repräsentieren
unter diesen R1 und R2 unabhängig ein
Wasserstoffatom oder eine Alkylgruppe, und am meisten bevorzugt
ist es, wenn sowohl R1 als auch R2 Wasserstoffatome sind.
-
In
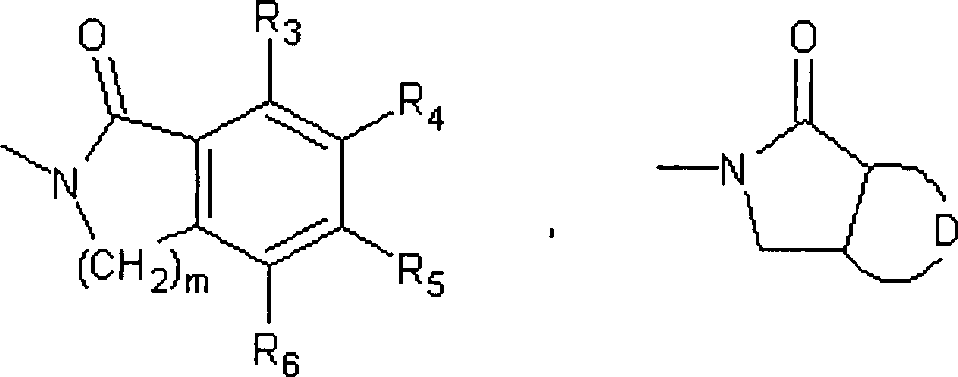
B der oben beschrieben Formel (I) stehen R3,
R4, R5 und R6 jeweils unabhängig für einen Substituenten, ausgewählt aus
der Gruppe, bestehend aus einem Wasserstoffatom, einem Halogenatom,
einer Nitrogruppe, einer Alkylgruppe, einer halogenierten Alkylgruppe,
einer Hydroxylgruppe, einer Alkoxygruppe, einer halogenierten Alkoxygruppe
und einer Cyanogruppe. Vorzugsweise repräsentieren unter diesen R3, R4, R5 und R6 jeweils unabhängig einen Substituenten, ausgewählt aus
der Gruppe, bestehend aus einem Wasserstoffatom, einem Halogenatom,
einer Nitrogruppe, einer Alkylgruppe, einer Hydroxylgruppe, einer
Alkoxygruppe und einer Cyanogruppe. Besonders bevorzugt ist es,
wenn drei von R3, R4,
R5 und R6 Wasserstoffatome
sind, und das verbliebene einen Substituenten repräsentiert,
ausgewählt
aus der Gruppe, bestehend aus einem Wasserstoffatom, einem Halogenatom,
einer Alkoxygruppe und einer Cyanogruppe. Am meisten bevorzugt ist
es, wenn drei von R3, R4,
R5 und R6 Wasserstoffatome
sind und das verbliebene ein Wasserstoffatom, Fluoratom, Chloratom,
Bromatom, Methoxygruppe oder Cyanogruppe repräsentiert. m repräsentiert
eine Ganzzahl von 1 oder 2, vorzugsweise 1.
-
In
einer Gruppe, repräsentiert
durch B, repräsentiert
der Ring:
einen 5- oder 6-gliedrigen
aromatischen heterocyclischen Ring, enthaltend ein oder zwei Heteroatome,
welcher substituiert sein kann. Unter diesen ist ein aromatischer
heterocyclischer Ring, ausgewählt
aus der Gruppe, bestehend aus Furanring, Thiophenring und Pyridinring
bevorzugt, und ein unsubstituierter Thio phenring oder Furanring
ist besonders bevorzugt.
-
Beispiele
bevorzugter Klassen von Verbindungen, welche der oben genannten
Formel (I) entsprechen, schließen
ein:
- (1) jene, bei welchen X eine Alkylgruppe,
eine Aryl-substituierte Alkylgruppe, eine Aryl-substituierte Alkenylgruppe,
eine Aryl-substituierte Alkinylgruppe, eine Arylgruppe, eine monocyclische
Cycloalkylgruppe, eine monocyclische heterocyclische Gruppe, eine
8- bis 10-gliedrige bicyclische Heteroarylgruppe, welche 1 oder
2 Heteroatome enthält,
oder eine substituierte oder unsubstituierte Aminogruppe repräsentiert;
Q eine Gruppe darstellt, repräsentiert
durch -CO-, -O-, -S-, -CH(OR7)- oder -C(=NR8)- (wobei R7 ein
Wasserstoffatom, eine Alkylgruppe oder eine Acylgruppe repräsentiert,
und R8 eine Hydroxylgruppe, eine Alkoxygruppe
oder eine Acylaminogruppe repräsentiert);
n eine Ganzzahl von 0 bis 4 repräsentiert;
R1 und R2 jeweils
unabhängig
ein Wasserstoffatom oder eine Alkylgruppe repräsentieren; R3,
R4, R5 und R6 jeweils unabhängig einen Substituenten repräsentieren,
ausgewählt
aus der Gruppe, bestehend aus einem Wasserstoffatom, einem Halogenatom,
einer Nitrogruppe, einer Alkylgruppe, einer halogenierten Alkylgruppe,
einer Hydroxylgruppe, einer Alkoxygruppe, einer halogenierten Alkoxygruppe
und einer Cyanogruppe; m 1 oder 2 repräsentiert; und der Ring: ein heterocyclischer Ring
ist, ausgewählt
aus der Gruppe, bestehend aus einem Furanring, einem Thiophenring
und einem Pyridinring, welche substituiert sein können.
-
Beispiele
von besonders bevorzugten Klassen von Verbindungen schließen ein:
- (2) die Verbindungen nach (1), wobei X eine
Alkylgruppe repräsentiert,
eine Arylsubstituierte Alkylgruppe, eine Aryl-substituierte Alkenylgruppe,
eine Aryl-substituierte Alkinylgruppe, eine Arylgruppe, eine monocyclische
Cycloalkylgruppe, ei ne monocyclische heterocyclische Gruppe, eine
8- bis 10-gliedrige bicyclische Heteroalkylgruppe, welche 1 oder
2 Heteroatome enthält,
oder eine Aminogruppe, welche substituiert ist mit einer Alkyl-
oder Arylgruppe, und sowohl R1 als auch
R2 Wasserstoffatome sind, R3,
R4, R5 und R6 jeweils unabhängig einen Substituenten repräsentieren,
ausgewählt
aus der Gruppe, bestehend aus einem Wasserstoffatom, einem Halogenatom,
einer Nitrogruppe, einer Alkylgruppe, einer Hydroxylgruppe, einer
Alkoxygruppe und einer Cyanogruppe, m 1 oder 2 repräsentiert,
und der Ring: ein Furanring, ein Thiophenring
oder ein Pyridinring ist, welche substituiert sein können;
- (3) Verbindungen nach (1), wobei X eine substituierte oder unsubstituierte
Phenylgruppe repräsentiert
(der Substituent ist ein oder mehrere Substituenten, ausgewählt aus
der Gruppe, bestehend aus einem Wasserstoffatom, einer Alkylgruppe,
einer halogenierten Alkylgruppe, einer Alkoxygruppe, einer halogenierten
Alkoxygruppe und einer Cyanogruppe), eine 5- oder 6-gliedrige monocyclische
heterocyclische Gruppe, oder einer 8- bis 10-gliedrigen bicyclischen
Heteroarylgruppe, welche ein oder zwei Heteroatome enthält, sowohl R1 als auch R2 Wasserstoffatome
sind, drei von R3, R4,
R5, R6 Wasserstoffatome
sind und das verbliebene einen Substituenten repräsentiert,
ausgewählt
aus der Gruppe, bestehend aus einem Wasserstoffatom, einem Halogenatom,
einer Nitrogruppe, einer Alkoxygruppe, einer halogenierten Alkoxygruppe
und einer Cyanogruppe, m 1 oder 2 repräsentiert, und der Ring: ein heterocyclischer Ring
ist aus der Gruppe, bestehend aus einem Furanring, einem Thiophenring
und einem Pyridinring, wobei diese jeweils substituiert sein können;
- (4) die Verbindungen nach (2) oder (3) oben, wobei Q -CO-, -O-,
-C(=NOH)- oder -CH(OR7)- repräsentiert (wobei
R7 ein Wasserstoffatom, eine Alkylgruppe
oder eine Acylgruppe repräsentiert),
B durch folgende Formel repräsentiert
wird: (wobei drei von R3, R4, R5 und
R5 Wasserstoffatome sind und das verbliebene
einen Substituenten repräsentiert,
ausgewählt
aus der Gruppe, bestehend aus einem Wasserstoffatom, einem Halogenatom,
einer Nitrogruppe, einer Alkylgruppe, einer Hydroxylgruppe, einer
Alkoxygruppe und einer Cyanogruppe), und n 1 ist; und
- (5) Verbindungen, in welchen X eine substituierte oder unsubstituierte
Phenylgruppe repräsentiert
(der Substituent ist ein oder mehrere Substituenten, ausgewählt aus
der Gruppe, bestehend aus einem Halogenatom und einer Alkoxygruppe),
Q -CO-, -O- oder -CH(OH)- repräsentiert,
n eine Ganzzahl von 1 bis 3 repräsentiert,
sowohl R1 und R2 Wasserstoffatome
sind, drei von R3, R4,
R5 und R6 Wasserstoffatome
sind, und das verbliebene ein Wasserstoffatom, ein Halogenatom oder
eine Alkoxygruppe repräsentiert,
m 1 oder 2 repräsentiert,
und der folgende Ring: ein Thiophen- oder Furanring
ist.
-
Zu
den Beispielen besonders bevorzugter Verbindungsklassen gehören:
- (6) die Verbindungen, bei welchen X eine substituierte
oder unsubstituierte Phenylgruppe repräsentiert, eine Naphthylgruppe,
tert-Butylgruppe, Cyclohexylgrup pe, eine substituierte oder unsubstituierte
Pyrrolylgruppe, Piperidinylgruppe, Benzisoxazolylgruppe, Benzodioxolygruppe,
Tetrahydrochinolylgruppe, Indolinylgruppe oder eine substituierte
oder unsubstituierte Phenylaminogruppe, Q -CO-, -O-, -S-, -CH(OH)-
oder -C(=NHO)- repräsentiert,
n eine Ganzzahl von 1 oder 2 repräsentiert, R1 und
R2 jeweils ein Wasserstoffatom ist, drei
von R3, R4, R5 und R6 Wasserstoffatome
sind, und das verbliebene einen Substituenten repräsentiert,
ausgewählt
aus der Gruppe, bestehend aus einem Wasserstoffatom, einem Fluoratom,
einem Chloratom, einem Bromatom und einer Methoxygruppe, m 1 oder
2 repräsentiert,
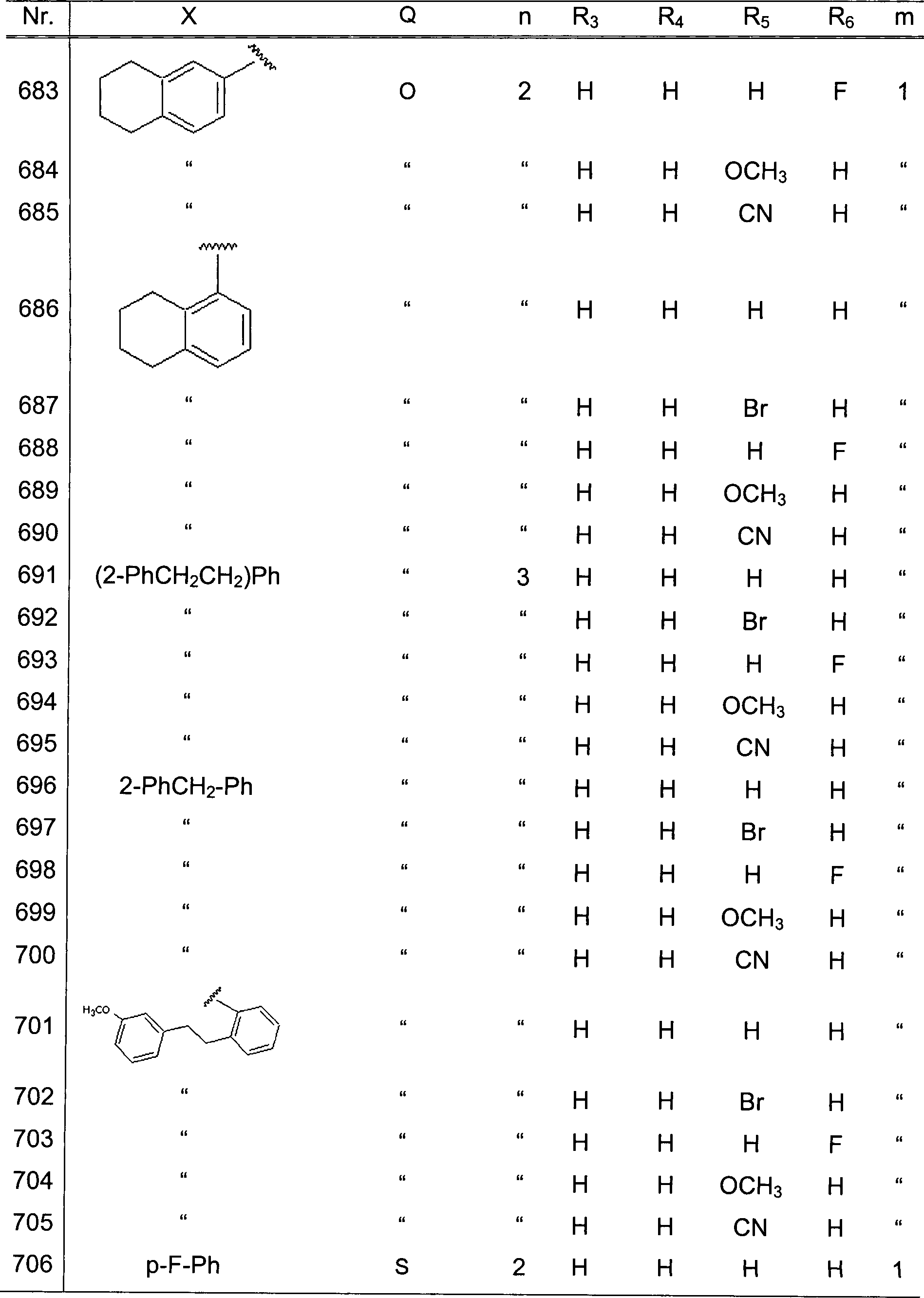
und der Ring: ein Furan- oder Thiophenring
ist;
- (7) die Verbindungen, bei welchen X eine p-Fluorphenylgruppe
repräsentiert,
Q -CO-, -O- oder -CH(OH)- repräsentiert,
n 1 repräsentiert,
sowohl R1 als auch R2 Wasserstoffatome
sind, drei von R3, R4,
R5 und R6 sind Wasserstoffatome,
und der verbliebene ein Wasserstoffatom, ein Halogenatom oder eine
Methoxygruppe repräsentiert,
und m 1 repräsentiert;
- (8) die Verbindungen nach (7), wobei Q -CO- repräsentiert;
- (9) die Verbindungen nach (8), wobei alle von R3,
R4, R5 und R6 Wasserstoffatome sind;
- (10) die Verbindungen nach (8), wobei drei von R3,
R4, R5 und R6 Wasserstoffatome sind, und das verbliebene
ein Halogenatom repräsentiert;
und
- (11) die Verbindungen nach (6), wobei X eine p-Fluorphenylgruppe
repräsentiert,
Q -CO- repräsentiert,
n 1 repräsentiert
und der Ring: einen Furan- oder Thiophenring
repräsentiert.
-
Spezielle
Beispiele von besonders bevorzugten Verbindungen der vorliegenden
Erfindung sind in den folgenden Tabellen aufgelistet. Jedoch sind
die Verbindungen der vorliegenden Erfindung nicht auf diese Beispiele
beschränkt.
In den unten genannten Verbindungen sind sowohl R1 als
auch R2 Wasserstoffatome. In den Tabellen
bedeutet beispielsweise die Spezifizierung von „p-F-Ph" für
X, dass X eine p-Fluorphenylgruppe ist. Andere Spezifizierungen
sind auf ähnliche
Weise angegeben. Ferner steht „Bu" für eine Butyl-
oder Butylengruppe, „Pr" steht für eine Propyl-
oder Propylengruppe, „Et" steht für eine Ethyl-
oder Ethylengruppe, „Ac" steht für eine Acetylgruppe,
und „"" steht für die gleiche Gruppe wie die
in einer oberen Zeile abgebildete Gruppe.
-
Tabelle
1 zeigt die Verbindungen, wobei B eine Gruppe ist, die durch folgende
Formel repräsentiert wird:
und Tabelle 2 zeigt jene,
bei welchen B eine Gruppe ist, die durch die folgende Formel repräsentiert
wird:
-
Die
speziell offenbarten Verbindungen in den Beispielen der Beschreibung
sind auch erfindungsgemäß bevorzugt,
ebenso die unten beschriebenen. Tabelle 1
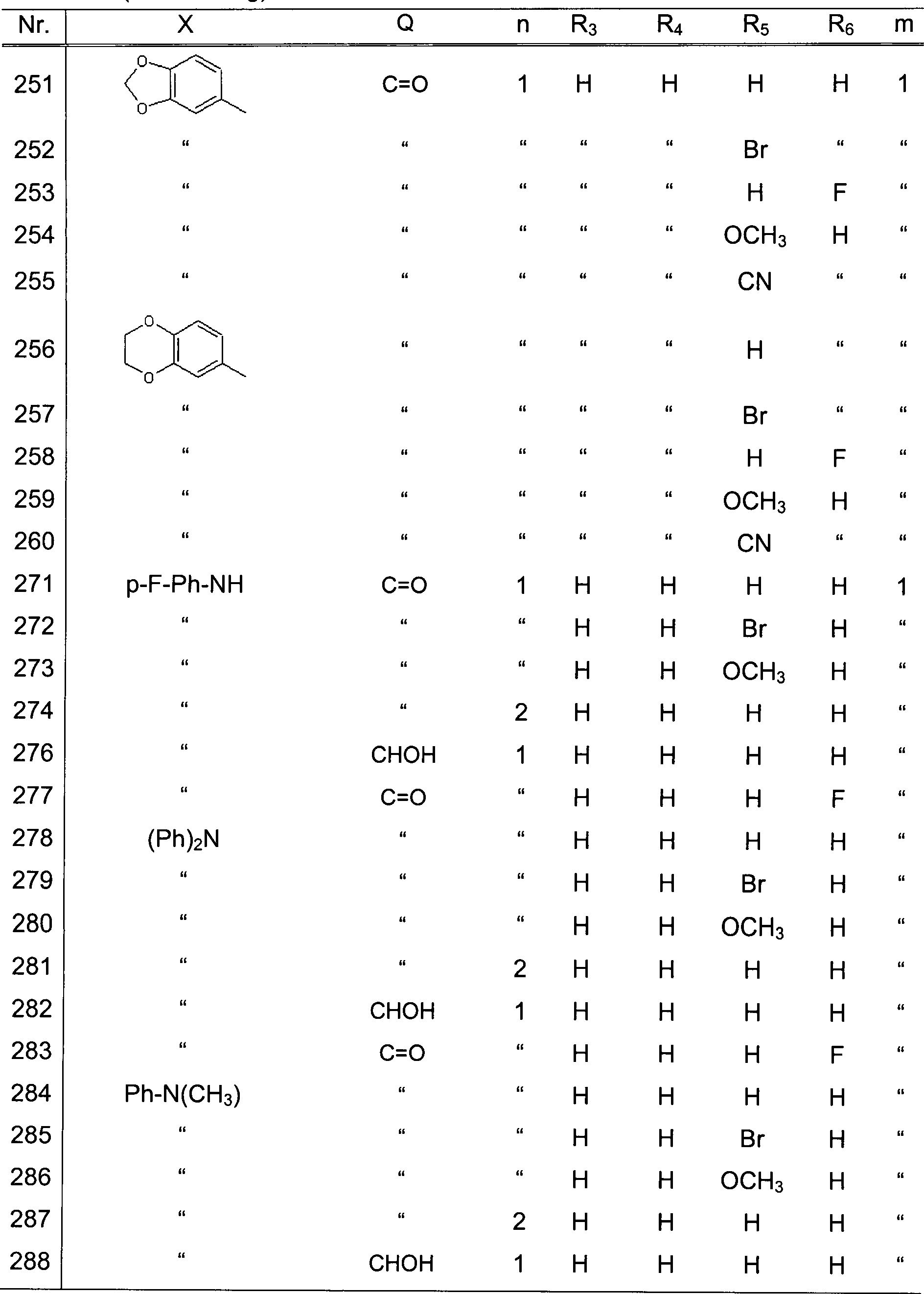
| Nr. | X | Q | n | R3 | R4 | R5 | R6 | m |
| 1 | p-F-Ph | C=O | 1 | H | H | H | H | 1 |
| 2 | " | " | " | Br | " | " | " | " |
| 3 | " | " | " | H | Br | " | " | " |
| 4 | " | " | " | " | H | Br | " | " |
| 5 | " | " | " | " | " | H | Br | " |
| 6 | " | " | " | Br | " | " | " | " |
| 7 | " | " | " | F | H | " | H | " |
| 8 | " | " | " | H | F | " | " | " |
| 9 | " | " | " | " | H | F | " | " |
| 10 | " | " | " | " | " | H | F | " |
| 11 | " | " | " | Cl | " | " | H | " |
| 12 | " | " | " | H | Cl | " | " | " |
| 13 | " | " | " | " | H | Cl | " | " |
| 14 | " | " | " | " | " | H | Cl | " |
| 15 | " | " | " | OCH3 | " | " | H | " |
| 16 | " | " | " | H | OCH3 | " | " | " |
| 17 | " | " | " | " | H | OCH3 | " | " |
| 18 | " | " | " | " | " | H | OCH3 | " |
| 19 | " | " | " | CN | " | " | H | " |
| 20 | " | " | " | H | CN | " | " | " |
| 21 | " | " | " | " | H | CN | " | " |
| 22 | " | " | " | " | " | H | CN | " |
| 23 | " | " | " | " | NO2 | " | H | " |
| 24 | " | " | " | " | H | NO2 | " | " |
| 25 | " | " | " | " | " | H | NO2 | " |
| 26 | Ph | " | " | " | " | " | H | " |
| 27 | " | " | " | Br | " | " | " | " |
| 28 | " | " | " | H | Br | " | " | " |
| 29 | " | " | " | " | H | Br | " | " |
| 30 | " | " | " | " | " | H | Br | " |
| 31 | " | " | " | " | Br | " | " | " |
| 32 | " | " | " | F | H | " | H | " |
| 33 | " | " | " | H | F | " | " | " |
| 34 | " | " | " | " | H | F | " | " |
| 35 | " | " | " | " | " | H | F | " |
Tabelle 1 (Fortsetzung)
| Nr. | X | Q | n | R3 | R4 | R5 | R6 | m |
| 36 | Ph | C=O | 1 | Cl | H | H | H | " |
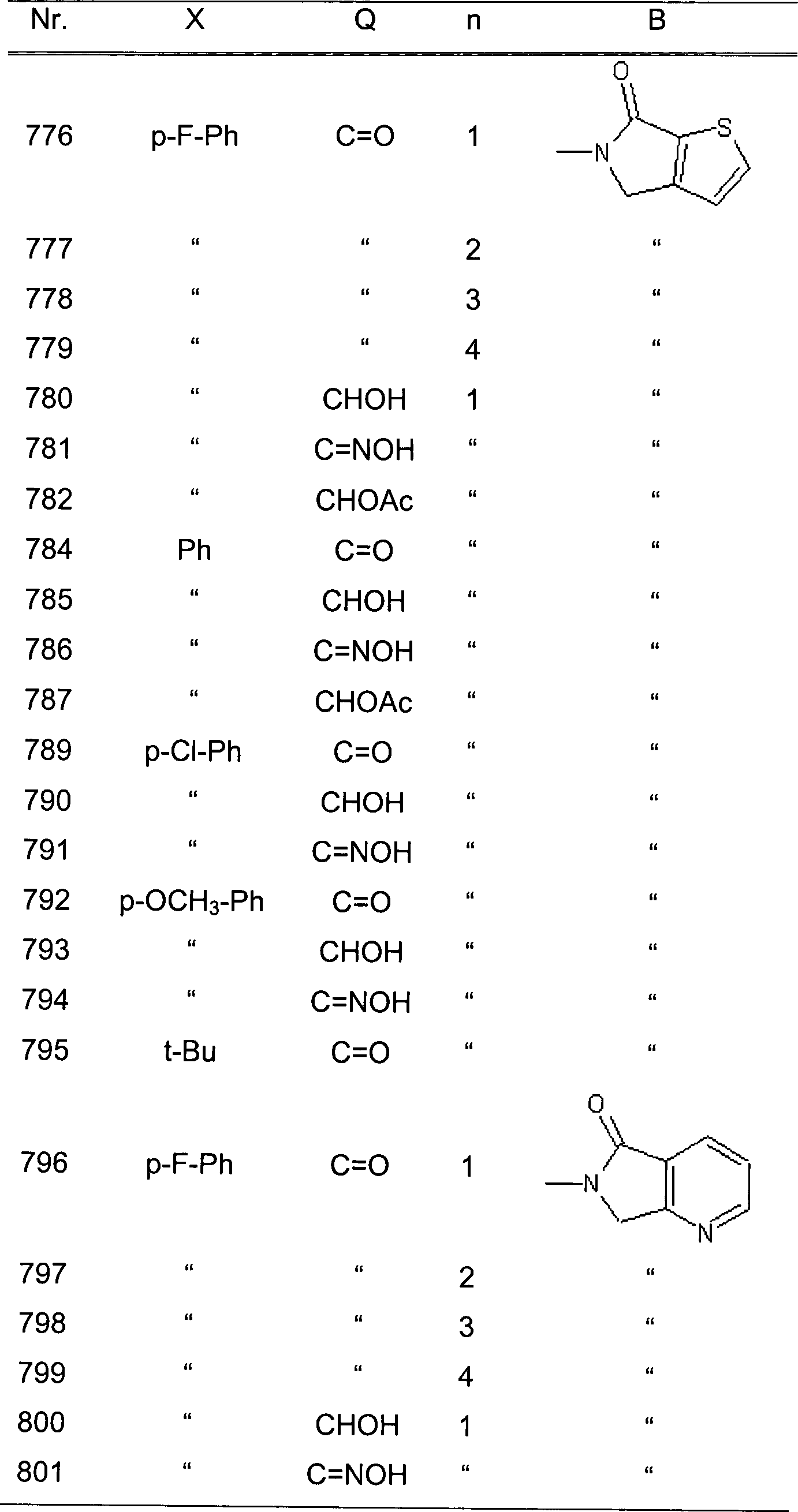
| 37 | " | " | " | H | Cl | " | " | " |
| 38 | " | " | " | " | H | Cl | " | " |
| 39 | " | " | " | " | " | H | Cl | " |
| 40 | " | " | " | OCH3 | " | " | H | " |
| 41 | " | " | " | H | OCH3 | " | " | " |
| 42 | " | " | " | " | H | OCH3 | " | " |
| 43 | " | " | " | " | " | H | OCH3 | " |
| 44 | " | " | " | C N | " | " | H | " |
| 45 | " | " | " | H | CN | " | " | " |
| 46 | " | " | " | " | H | CN | " | " |
| 47 | " | " | " | " | " | H | CN | " |
| 48 | " | " | " | " | NO2 | " | H | " |
| 49 | " | " | " | " | H | NO2 | " | " |
| 50 | " | " | " | " | " | H | NO2 | " |
| 51 | p-Cl-Ph | " | " | " | " | " | H | " |
| 52 | " | " | " | " | Br | " | " | " |
| 53 | " | " | " | " | H | Br | " | " |
| 54 | " | " | " | " | " | H | Br | " |
| 55 | " | " | " | " | Br | " | " | " |
| 56 | " | " | " | " | F | " | H | " |
| 57 | " | " | " | " | H | " | F | " |
| 58 | " | " | " | " | " | Cl | H | " |
| 59 | " | " | " | " | Cl | H | " | " |
| 60 | " | " | " | " | H | OCH3 | " | " |
| 61 | " | " | " | " | " | CN | " | " |
| 62 | " | " | " | " | NO2 | H | " | " |
| 63 | " | " | " | " | H | " | NO2 | " |
| 64 | p-H3CO-Ph | " | " | " | " | " | H | " |
| 65 | " | " | " | " | Br | " | " | " |
Tabelle 1 (Fortsetzung)
| Nr. | X | Q | n | R3 | R4 | R5 | R6 | m |
| 66 | " | " | " | " | H | Br | " | " |
| 67 | p-H3CO-Ph | C=O | 1 | H | H | H | Br | 1 |
| 68 | " | " | " | " | Br | " | " | " |
| 69 | " | " | " | " | F | " | H | " |
| 70 | " | " | " | " | H | " | F | " |
| 71 | p-H3CO-Ph | C=O | 1 | H | H | Cl | H | 1 |
| 72 | " | " | " | " | Cl | H | " | " |
| 73 | " | " | " | " | H | OCH3 | " | " |
| 74 | " | " | " | " | " | CN | " | " |
| 75 | " | " | " | " | NO2 | H | " | " |
| 76 | " | " | " | " | H | " | NO2 | " |
| 77 | p-F-Ph | CHOH | " | " | " | " | H | " |
| 78 | " | " | " | " | Br | " | " | " |
| 79 | " | " | " | " | H | Br | " | " |
| 80 | " | " | " | " | " | H | Br | " |
| 81 | p-F-Ph | CHOH | 1 | H | Br | H | Br | 1 |
| 82 | " | " | " | " | F | " | H | " |
| 83 | " | " | " | " | H | " | F | " |
| 84 | " | " | " | " | " | Cl | H | " |
| 85 | " | " | " | " | Cl | H | " | " |
| 86 | " | " | " | " | H | OCH3 | " | " |
| 87 | " | " | " | " | " | CN | " | " |
| 88 | " | " | " | " | NO2 | H | " | " |
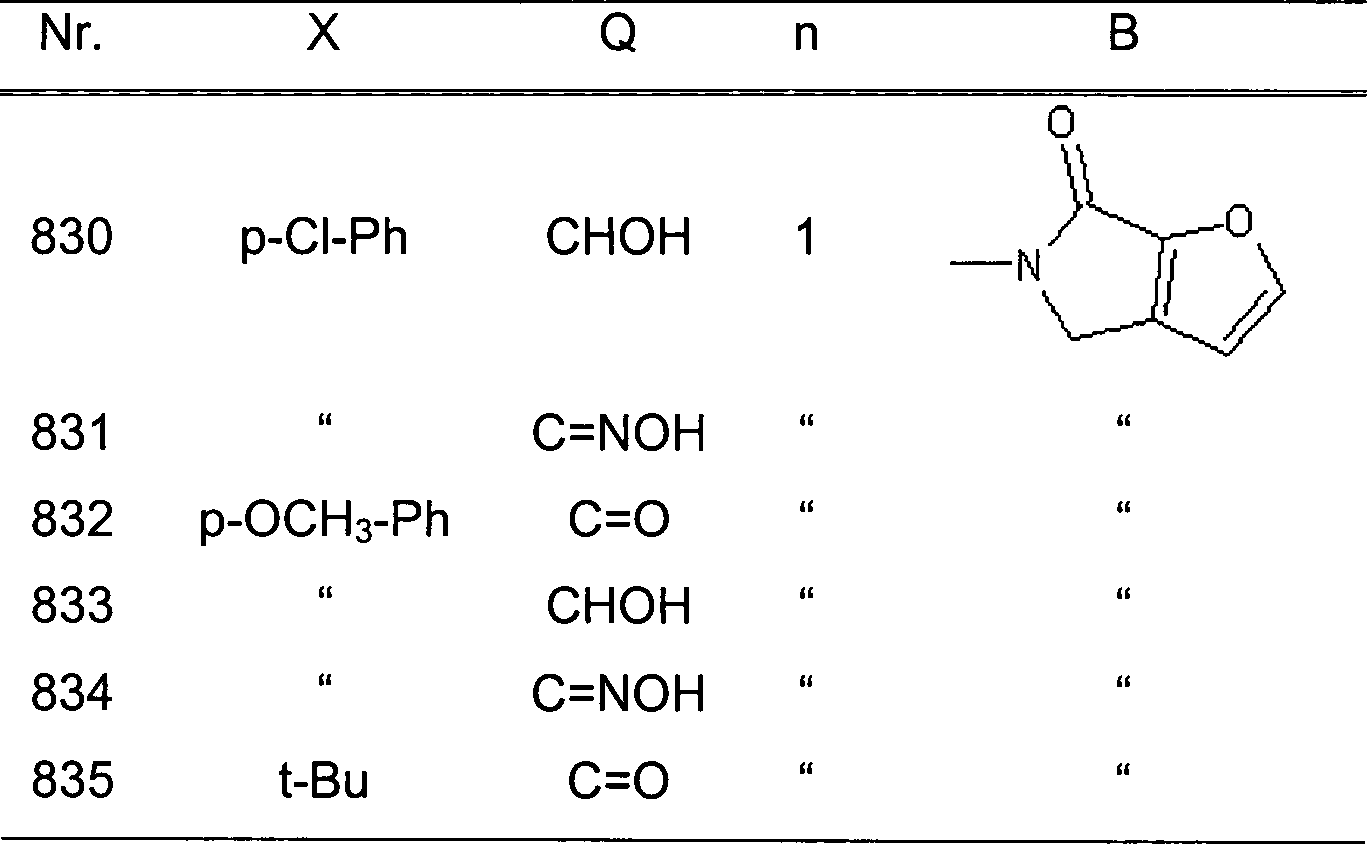
| 89 | " | " | " | " | H | " | NO2 | " |
| 90 | " | C=NOH | " | " | " | " | H | " |
| 91 | " | " | " | " | Br | " | " | " |
| 92 | " | " | " | " | H | Br | " | " |
| 93 | " | " | " | " | " | H | Br | " |
| 94 | " | " | " | " | Br | " | " | " |
| 95 | " | " | " | H | F | " | H | " |
Tabelle 1 (Fortsetzung)
| Nr. | X | Q | n | R3 | R4 | R5 | R6 | m |
| 96 | " | " | " | " | H | " | F | " |
| 97 | " | " | " | " | " | Cl | H | " |
| 98 | p-F-Ph | C=NOH | 1 | H | Cl | H | H | 1 |
| 99 | " | " | " | " | H | OCH3 | " | " |
| 100 | " | " | " | " | " | CN | " | " |
| 101 | " | " | " | " | NO2 | H | " | " |
| 102 | " | " | " | " | H | " | NO2 | " |
| 103 | p-F-Ph | CHOAc | " | " | " | " | H | " |
| 104 | " | " | " | " | Br | " | " | " |
| 105 | " | " | " | " | H | Br | " | " |
| 106 | p-F-ph | CHOAc | 1 | H | H | H | Br | 1 |
| 107 | " | " | " | " | Br | " | " | " |
| 108 | " | " | " | " | F | " | " | " |
| 109 | " | " | " | " | H | " | F | " |
| 110 | " | " | " | " | " | Cl | H | " |
| 111 | " | " | " | " | Cl | H | " | " |
| 112 | " | " | " | " | H | OCH3 | " | " |
| 113 | " | " | " | " | " | CN | " | " |
| 114 | " | " | " | " | NO2 | H | " | " |
| 115 | " | " | " | " | H | " | NO2 | " |
| 116 | o,p-diF-Ph | C=NOH | " | " | " | " | H | " |
| 117 | " | " | " | " | Br | " | " | " |
| 118 | " | " | " | " | H | Br | " | " |
| 119 | " | " | " | " | " | H | Br | " |
| 120 | " | " | " | " | Br | " | " | " |
| 121 | o,p-diF-Ph | C=NOH | 1 | H | F | H | H | 1 |
| 122 | " | " | " | " | H | " | F | " |
| 123 | " | " | " | " | " | Cl | H | " |
| 124 | " | " | " | " | " | OCH3 | " | " |
| 125 | " | " | " | " | " | CN | " | " |
Tabelle 1 (Fortsetzung)
| Nr. | X | Q | n | R3 | R4 | R5 | R6 | m |
| 126 | t-Bu | C=O | " | " | " | H | " | " |
| 127 | " | " | " | " | Br | " | " | " |
| 128 | " | " | " | " | H | Br | " | " |
| 129 | t-Bu | C=O | 1 | H | H | H | Br | 1 |
| 130 | " | " | " | " | Br | " | " | " |
| 131 | " | " | " | " | F | " | H | " |
| 132 | " | " | " | " | H | " | F | " |
| 133 | " | " | " | " | " | Cl | H | " |
| 134 | " | " | " | " | " | OCH3 | " | " |
| 135 | " | " | " | " | " | CN | " | " |
| 156 | Ph | C=O | 2 | H | H | H | H | 1 |
| 157 | " | " | " | " | Br | " | " | " |
| 158 | " | " | " | " | H | Br | " | " |
| 159 | " | " | " | " | " | H | Br | |
| 160 | " | " | " | " | Br | " | " | " |
| 161 | Ph | C=O | 2 | H | F | H | H | 1 |
| 162 | " | " | " | " | H | " | F | " |
| 163 | " | " | " | " | " | Cl | H | |
| 164 | " | " | " | " | " | OCH3 | " | " |
| 165 | " | " | " | " | " | CN | " | " |
| 166 | p-F-Ph | " | 3 | " | " | H | " | " |
| 167 | " | " | " | " | Br | " | " | " |
| 168 | " | " | " | " | H | Br | " | " |
| 169 | " | " | " | " | " | H | Br | " |
| 170 | " | " | " | " | Br | " | " | " |
| 171 | " | " | " | " | F | " | H | " |
| 172 | " | " | " | " | H | " | F | " |
| 173 | " | " | " | " | " | Cl | H | " |
| 174 | " | " | " | " | " | OCH3 | " | " |
| 175 | " | " | " | " | " | CN | " | " |
Tabelle 1 (Fortsetzung)
| Nr. | X | Q | n | R3 | R4 | R5 | R6 | m |
| 206 | p-F-Ph | O | 2 | H | H | H | H | 1 |
| 207 | " | " | " | " | Br | " | " | " |
| 208 | " | " | " | " | H | Br | " | " |
| 209 | " | " | " | " | " | H | Br | " |
| 210 | p-F-Ph | O | 2 | H | Br | H | Br | 1 |
| 211 | p-F-Ph | O | 2 | H | F | H | H | 1 |
| 212 | " | " | " | " | H | " | F | " |
| 213 | " | " | " | " | " | Cl | H | " |
| 214 | " | " | " | " | " | OCH3 | " | " |
| 215 | " | " | " | " | " | CN | " | " |
| 216 | " | " | 3 | " | " | H | " | " |
| 217 | " | " | " | " | Br | " | " | " |
| 218 | " | " | " | " | H | Br | " | " |
| 219 | " | " | " | " | " | H | Br | " |
| 220 | " | " | " | " | Br | " | " | " |
| 221 | " | " | " | " | F | " | H | " |
| 222 | " | " | " | " | H | " | F | " |
| 223 | " | " | " | " | " | Cl | H | " |
| 224 | " | " | " | " | " | OCH3 | " | " |
| 225 | " | " | " | " | " | CN | " | " |
| 226 | " | " | 4 | " | " | H | " | " |
| 227 | " | " | " | " | Br | " | " | " |
| 228 | " | " | " | " | H | Br | " | " |
| 229 | " | " | " | " | " | H | Br | " |
| 230 | " | " | " | " | Br | " | " | " |
| 231 | " | " | " | " | F | " | H | " |
| 232 | " | " | " | " | H | " | F | " |
| 233 | " | " | " | " | " | Cl | H | " |
| 234 | " | " | " | " | OCH3 | " | " | " |
| 235 | " | " | " | " | " | CN | " | " |
Tabelle
1 (Fortsetzung)
Tabelle
1 (Fortsetzung)
Tabelle
1 (Fortsetzung)
Tabelle
1 (Fortsetzung)
Tabelle
1 (Fortsetzung)
Tabelle
1 (Fortsetzung)
Tabelle
1 (Fortsetzung)
Tabelle
1 (Fortsetzung)
Tabelle 1 (Fortsetzung)
| Nr. | X | Q | n | R3 | R4 | R5 | R6 | m |
| 629 | p-Cl-Ph | O | 2 | H | H | OCH3 | H | 1 |
| 630 | " | " | " | H | H | CN | H | " |
| 631 | o-CH3O-Ph | " | " | H | H | H | H | " |
| 632 | " | " | " | H | H | Br | H | " |
| 633 | " | " | " | H | H | H | F | " |
| 634 | " | " | " | H | H | OCH3 | H | " |
| 635 | " | " | " | H | H | CN | H | " |
| 636 | m-CH3O-Ph | " | " | H | H | H | H | " |
| 637 | " | " | " | H | H | Br | H | " |
| 638 | " | " | " | H | H | H | F | " |
| 639 | " | " | " | H | H | OCH3 | H | " |
| 640 | " | " | " | H | H | CN | H | " |
| 641 | p-CH3O-Ph | O | 2 | H | H | H | H | 1 |
| 642 | " | " | " | H | H | Br | H | " |
| 643 | " | " | " | H | H | H | F | " |
| 644 | " | " | " | H | H | OCH3 | H | " |
| 645 | " | " | " | H | H | CN | H | " |
| 646 | o-CH3-Ph | O | 2 | H | H | H | H | 1 |
| 647 | " | " | " | H | H | Br | H | " |
| 648 | " | " | " | H | H | H | F | " |
| 649 | " | " | " | H | H | OCH3 | H | " |
| 650 | " | " | " | H | H | CN | H | " |
| 651 | m-CH3-Ph | " | " | H | H | H | H | " |
| 652 | " | " | " | H | H | Br | H | " |
| 653 | " | " | " | H | H | H | F | 1 |
| 654 | " | " | " | H | H | OCH3 | H | " |
| 655 | " | " | " | H | H | CN | H | " |
| 656 | p-CH3-Ph | " | " | H | H | H | H | " |
| 657 | " | " | " | H | H | Br | H | " |
Tabelle
1 (Fortsetzung)
Tabelle
1 (Fortsetzung)
Tabelle 1 (Fortsetzung)
| Nr. | X | Q | n | R3 | R4 | R5 | R6 | m |
| 707 | p-F-Ph | S | 2 | H | H | Br | H | 1 |
| 708 | " | " | " | H | H | H | F | " |
| 709 | " | " | " | H | H | OCH3 | H | " |
| 710 | " | " | " | H | H | CN | H | " |
| 711 | " | " | 3 | H | H | H | H | " |
| 712 | " | " | " | H | H | Br | H | " |
| 713 | " | " | " | H | H | H | F | " |
| 714 | " | " | " | H | H | OCH3 | H | " |
| 715 | " | " | " | H | H | CN | H | " |
| 716 | o-F-Ph | " | 2 | H | H | H | H | " |
| 717 | " | " | " | H | H | Br | H | " |
| 718 | " | " | " | H | H | H | F | " |
| 719 | " | " | " | H | H | OCH3 | H | " |
| 720 | " | " | " | H | H | CN | H | " |
| 721 | m-F-Ph | " | " | H | H | H | H | " |
| 722 | " | " | " | H | H | Br | H | " |
| 723 | " | " | " | H | H | H | F | " |
| 724 | " | " | " | H | H | OCH3 | H | " |
| 725 | " | " | " | H | H | CN | H | " |
| 726 | Ph | " | " | H | H | H | H | " |
| 727 | " | " | " | H | H | Br | H | " |
| 728 | " | " | " | H | H | H | F | " |
| 729 | " | " | " | H | H | OCH3 | H | " |
| 730 | " | " | " | H | H | CN | H | " |
| 731 | o-CH3-O-Ph | S | 2 | H | H | H | H | 1 |
| 732 | " | " | " | H | H | Br | N | " |
| 733 | " | " | " | H | H | H | F | " |
| 734 | " | " | " | H | H | OCH3 | H | " |
| 735 | " | " | " | H | H | CN | H | " |
| 736 | m-CH3O-Ph | " | " | H | H | H | H | " |
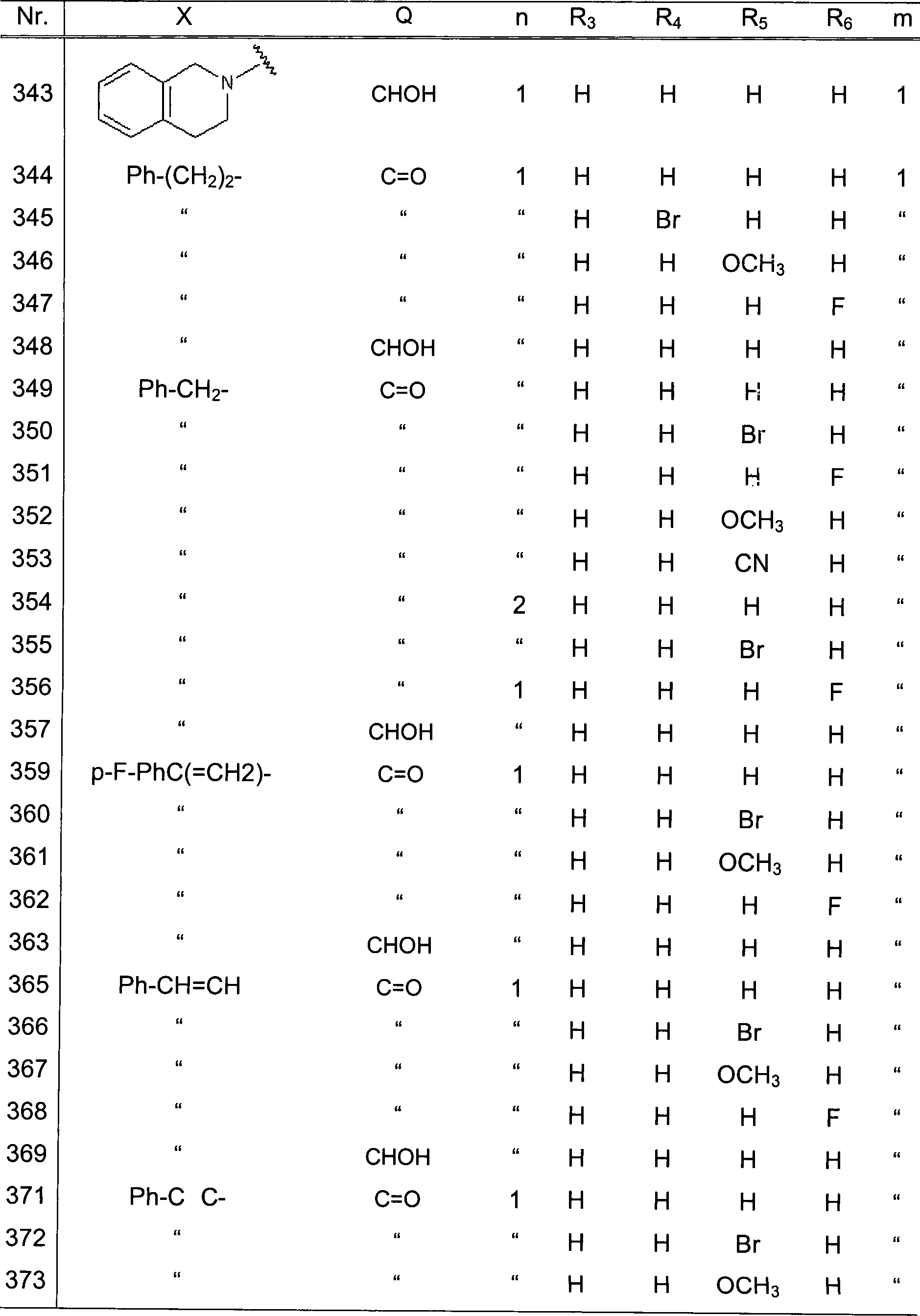
Tabelle 1 (Fortsetzung)
| Nr. | X | Q | n | R3 | R4 | R5 | R6 | m |
| 737 | m-CH3O-Ph | S | 2 | H | H | Br | H | 1 |
| 738 | " | " | " | H | H | H | F | " |
| 739 | " | " | " | H | H | OCH3 | H | " |
| 740 | " | " | " | H | H | CN | H | " |
| 741 | 4-F-Ph | C=NOCH3 | 1 | H | H | H | H | 1 |
| 742 | " | " | " | H | H | Br | H | " |
| 743 | " | " | " | H | H | H | F | " |
| 744 | " | " | " | H | H | OCH3 | H | " |
| 745 | " | " | " | H | H | CN | H | " |
| 746 | 4-F-Ph | C=NNH(COOCH3) | 1 | H | H | H | H | 1 |
| 747 | " | " | " | H | H | Br | H | " |
| 748 | " | " | " | H | H | H | F | " |
| 749 | " | " | " | H | H | OCH3 | H | " |
| 750 | " | " | " | H | H | CN | H | " |
| 751 | " | C=NNH(COCH3) | " | H | H | H | H | 1 |
| 752 | " | " | " | H | H | Br | H | " |
| 753 | " | " | " | H | H | H | F | " |
| 754 | " | " | " | H | H | OCH3 | H | " |
| 755 | " | " | " | H | H | CN | H | " |
| 756 | " | C=NOCH2Ph | " | H | H | H | H | " |
| 757 | " | " | " | H | H | Br | H | " |
| 758 | " | " | " | H | H | H | F | " |
| 759 | " | " | " | H | H | OCH3 | H | " |
| 760 | " | " | " | H | H | CN | H | " |
| 761 | " | C=O | " | H | H | H | H | 2 |
| 762 | " | " | " | Br | H | H | H | " |
| 763 | " | " | " | H | Br | H | H | " |
| 764 | " | " | " | H | H | Br | H | " |
| 765 | " | " | " | H | H | H | Br | " |
| 766 | " | " | " | H | Br | H | Br | " |
Tabelle 1 (Fortsetzung)
| Nr. | X | Q | n | R3 | R4 | R5 | R6 | m |
| 767 | 4-F-Ph | C=O | 1 | H | F | H | H | 2 |
| 768 | " | " | " | H | H | F | H | " |
| 769 | " | " | " | H | H | H | F | " |
| 770 | " | " | " | H | H | Cl | H | " |
| 771 | " | " | " | H | Cl | H | H | " |
| 772 | " | " | " | H | H | OCH3 | H | " |
| 773 | " | " | " | H | H | CN | H | " |
| 774 | " | " | " | H | NO2 | H | H | " |
| 775 | " | " | " | H | H | H | NO2 | " |
Tabelle
2
Tabelle
2 (Fortsetzung)
Tabelle
2 (Fortsetzung)
-
Verfahren
zur Herstellung der Verbindungen der vorliegenden Erfindung, repräsentiert
durch Formel (I), sind nicht speziell beschränkt. Beispielsweise können die
Verbindungen hergestellt werden durch eines der unten beschriebenen
Verfahren. Die Herstellung bevorzugter Verbindungen, welche zu den
Verbindungen der vorliegenden Erfindung gehören, wird in den Beispielen
der Beschreibung genauer erläutert.
Dementsprechend können
Fachleute eine Verbindung der vorliegenden Erfindung, welche der
Formel (I) entspricht, durch Bezug auf die folgenden allgemeinen
Erläuterungen
und auf spezielle Erläuterungen,
herstellen, und die Ausgangsstoffe, die Reaktionsbedingungen, Reagenzien
und so weiter, falls erforderlich, entsprechend abändern oder
abwandeln.
-
Verfahren zur Herstellung
-
-
Eine
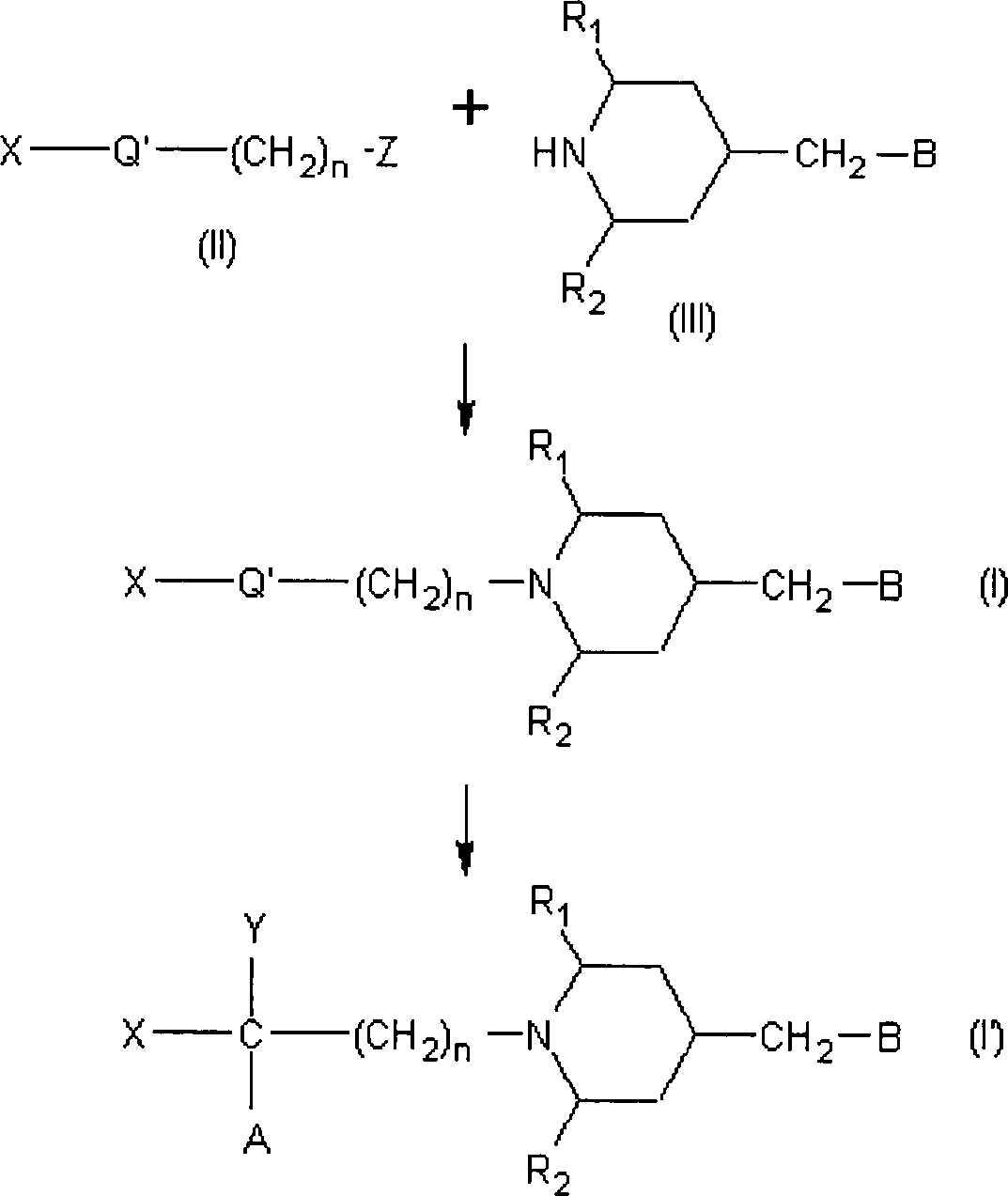
Verbindung nach der Formel (II) (in der Formel repräsentiert
Z ein Halogenatom, wie beispielsweise ein Chloratom, Bromatom oder
Jodatom, oder für
Tosylat oder Mesylat oder dergleichen, Q' steht für -CO-, -O- oder -S-, und X
ist wie oben beschrieben) kann mit einem nukleophilen Aminoderivat,
repräsentiert durch
die Formel (III) (R1, R2 und
B besitzen die gleichen Bedeutungen wie oben definiert), zur Reaktion
gebracht werden, um eine entsprechende Verbindung nach der Formel
(I) zu erhalten. Diese Reaktion kann gewöhnlich in einem polaren Lösemittel
wie Dimethylformamid, N-Methylpyrrolidon, Ethanol oder Acetonitril
in Gegenwart einer Base wie Triethylamin, Natriumhydrogencarbonat
oder Kaliumcarbonat durchgeführt
werden.
-
Wenn
Q' -CO- ist, kann
das Amino-Keto-Derivat nach Formel (I) reduziert werden, um ein
Hydroxyderivat nach Formel (I')
zu erhalten, wobei A eine Hydroxylgruppe ist und Y ein Wasserstoffatom.
Allgemein kann die Reduktion bei Raumtemperatur in einem organischen
Lösemittel
wie Ethanol, Methanol oder Tetrahydrofuran unter Verwendung von
Borhydrid durchgeführt
werden. Das Amino-Keto-Derivat nach Formel (I) kann außerdem mit
einem organometallischen Reagenz wie Y-MgBr umgesetzt werden, um
eine Verbindung nach Formel (I')
zu erhalten, wobei A eine Hydroxylgruppe ist.
-
Die
Acyloxy- und Alkoxyverbindungen können durch die üblichen
Verfahren dargestellt werden, ausgehend von einem freien Hydroxyderivat.
Ein O-Alkyl-Derivat kann durch Solvolyse eines Sulfonylesterintermediats
dargestellt werden (Advanced Organic Chemistry, J. March, John Wiley & Sons, New York,
S. 264–317,
1985). Ein chiraler Ether kann ebenfalls durch Solvolyse eines chiralen
Sulfonylesterderivats wie beispielsweise Camphersulfonsäure erhalten
werden. Ein Oxim des Ketoderivats nach Formel (I), wobei Q' -CO- ist, kann dargestellt
werden durch eine Oxim-Darstellung, wie jene, welche beschrieben
wurden in Organic Functional Group Preparation Vol. 111, S.R. Sandler
und W. Karo, Academic Press, London, S. 430–481, 1989.
-
Als
Verbindung nach Formel (II), gezeigt in Schema A, wobei Q' -CO- ist, kön nen kommerziell
erhältliche
Verbindungen verwendet werden, oder die Verbindungen können erhalten
werden durch Halogenisierung unter Verwendung einer mit einer Alkylgruppe
oder einer Alkylketongruppe substituierten Verbindung als Ausgangsstoff
oder durch ein anderes, ähnliches
Verfahren. Dort, wo Q' -O- oder -S- ist, können kommerziell
erhältliche
Verbindungen verwendet werden, oder die Verbindungen können erhalten
werden durch Reaktion einer Verbindung, welche mit einer Hydroxylgruppe
oder Thiolgruppe substituiert ist, als Ausgangssubstanz mit Z(CH2)nZ' (wobei Z und Z' für ein Halogenatom,
Tosylat, Mesylat oder dergleichen stehen), oder durch ein ähnliches
Verfahren.
-
Bezüglich der
Synthesen von Benzisoxazolidin-Derivaten und Benzisothioxazolin-Derivaten
schließen die
Beispiele die in bekannten Referenzen beschriebenen Verfahren ein
(H. Uno, M. Kurokawa, K. Natsuka, Y. Yamato und H. Nishimura, Chem.
Pharm. Bull., 24 (4), S. 632–643,
1976; H. Uno und M. Kurokawa, Chem. Pharm. Bull., 26 (12), S. 3888–3891, 1978)).
-
-
Eine
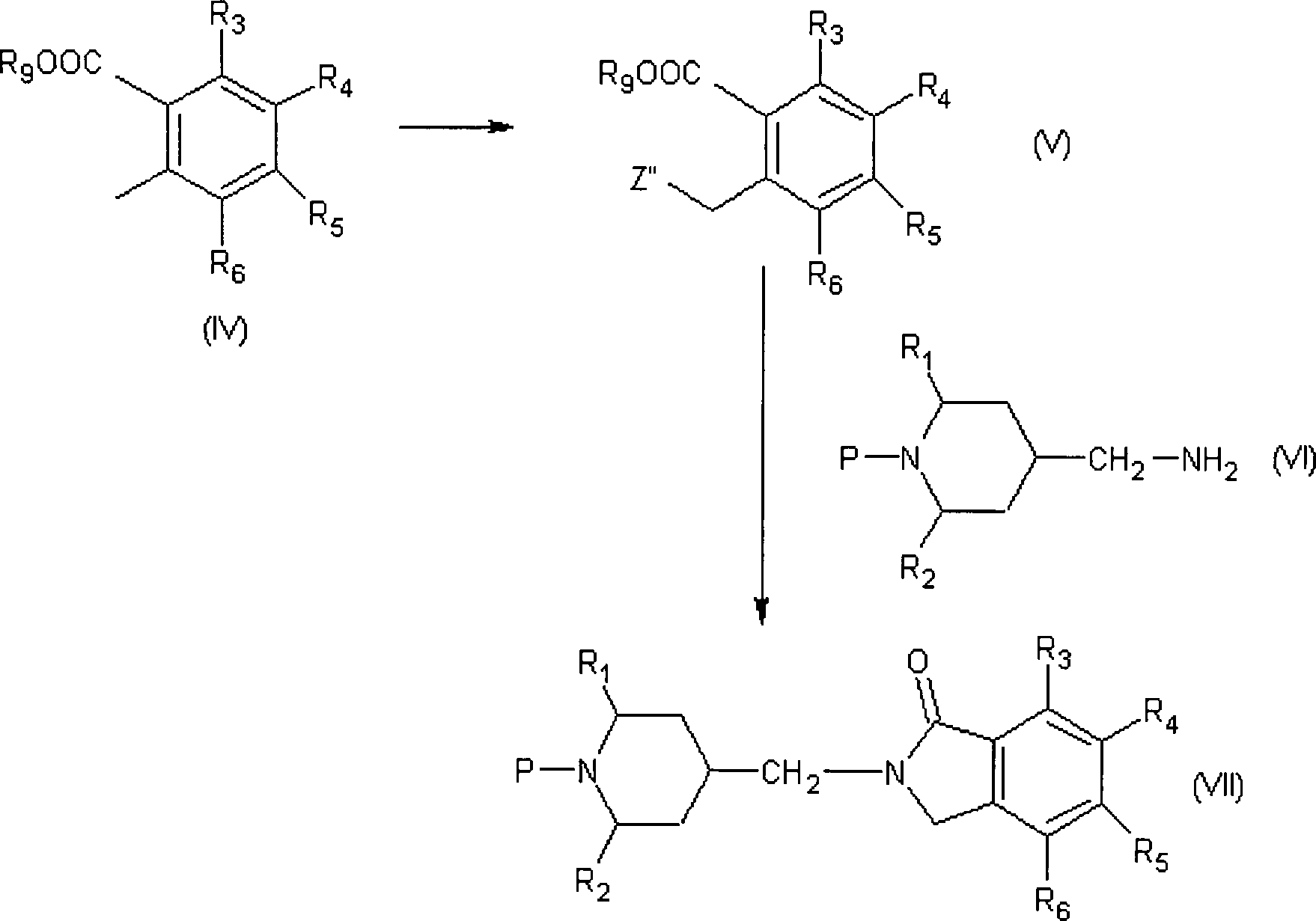
Verbindung der Formel (III) als Ausgangssubstanz im Schema A oben,
wobei m für
1 repräsentiert,
kann, wie in dem oben beschriebenen Schema B gezeigt, hergestellt
werden nach dem Verfahren von P. D. Leeson et al., (J. Med. Chem.,
35, 1954–1968,
1992). Eine Verbindung der Formel (IV) (wobei R9 eine
Alkylgruppe repräsentiert
und R3, R4, R5 und R6 definiert
sind wie oben) wird halogeniert in einem Lösemittel wie beispielsweise
Kohlenstofftetrachlorid unter Verwendung von beispielsweise N-Bromsuccinimid,
um eine Verbindung der Formel (V) zu erhalten (wobei Z' ein Halogenatom
repräsentiert),
welcher anschließend
ermöglicht wird,
mit einer Verbindung der Formel (VI) zu reagieren.
-
Der
Substituent P der im Schema abgebildeten Verbindungen repräsentiert
eine Schutzgruppe für
die Aminogruppe, wie beispielsweise jene, welche in Protective Groups
in Organic Synthesis (T.W. Greene und P.G.M. Wuts, John Wiley & Sons, New York,
1991) beschrieben wurden, und die Schutzgruppe lässt sich bereitwillig abtrennen,
um eine Piperidinverbindung der Formel (III) zu ergeben.
-
Alternativ
können
Verbindungen der Formel (VII) außerdem synthetisiert werden
nach den in der Literatur beschriebenen Verfahren (I. Takahashi,
T. Kawakami, E. Hirano, H. Yokota und H. Kitajima, Synlett, 4, 353–355, 1996;
S. M. Allin, C. C. Hodkinson und N. Taj, Synlett, 8, 781–782, 1996).
-
Die
als Ausgangssubstanzen verwendeten Verbindungen können in
den zuvor genannten Verfahren ein Racemat oder eine erwünschte optisch
aktive Substanz sein, und es kann ein entsprechendes Racemat oder
eine optisch aktive Substanz hergestellt werden. Es ist außerdem möglich, eine
erwünschte
optisch aktive Substanz durch Racematspaltung nach bekannten herkömmlichen
Verfahren herzustellen. Basische Substanzen der Formel (I) können mit
verschiedenen anorganischen oder organischen Säuren Säureadditionssalze bilden, vorzugsweise
pharmakologisch zulässige
Salze. Diese Salze können
leicht dargestellt werden durch Behandlung einer basischen Verbindung
der Formel (I) mit einer Mineralsäure oder einer organischen
Säure in
einem geeigneten organischen Lösemittel
wie beispielsweise Methanol, Ethanol, Isopropanol oder Ethylacetat.
-
Die
Verbindungen der vorliegenden Erfindung, repräsentiert durch die allgemeine
Formel (I), können ein
oder mehrere asymmetrische Kohlenstoffatome besitzen, und daher
können
die Verbindungen als optische Isomere existieren. Jede Art von Racemat
oder optischen Isomeren in einer optisch reinen Form, und jede Mischung
von optischen Isomeren gehören
zum Umfang der vorliegenden Erfindung. Racemate können durch ein
Fachleuten wohlbekanntes Verfahren in optisch reine Enantiomere
getrennt. Ferner gehören
Diastereomere, basierend auf zwei oder mehr asymmetrischen Kohlenstoffatomen,
und jede Mischung derselben, ebenso zum Umfang der vorliegenden
Erfindung. Säureadditionssalze,
vorzugsweise pharmazeutisch zulässige
Säureadditionssalze,
Hydrate und jede Art von Solvat der Verbindungen der vorliegenden
Erfindung, repräsentiert durch
zuvor genannte allgemeine Formel (I), gehören ebenfalls um Umfang der
vorlie genden Erfindung.
-
Beispiele
von Salzen, welche mit den Verbindungen der vorliegenden Erfindung
gebildet werden können,
schließen
beispielsweise ein: anorganische Salze wie Hydrochloride, Hydrobromide,
Hydroiodide, Sulfate, Nitrate und Phosphate, Salze organischer Säuren, wie
Succinate, Acetate, Glycolate, Methansulfonate und Toluolsulfonate,
Alkalimetallsalze wie Natriumsalze und Kaliumsalze, Erdalkalimetallsalze
wioe Magnesiumsalze und Calciumsalze, Ammoniumsalze wie Ammoniumsalze
und Alkylammoniumsalze und dergleichen. Beispiele von mit den Solvaten
assoziierten Lösemitteln,
die mit den Verbindungen der vorliegenden Erfindung gebildet werden
können,
schließen
ein: Methanol, Ethanol, Isopropanol, Aceton, Ethylacetat und dergleichen. Jedoch
sind die Formen der Salze und Solvate nicht auf die oben beispielhaft
genannten beschränkt.
-
Die
Verbindungen der vorliegenden Erfindung besitzen eine hohe Affinität zur Sigma-Bindestelle (wenn
sich in der Beschreibung auf eine bestimmte Verbindung als „Sigma-Ligand" bezogen wird, dann
heißt dies,
dass die Verbindung das zuvor genannte Merkmal besitzt). Daher sind
die Verbindungen der vorliegenden Erfindung als Medikamente anwendbar
für verschiedene
Erkrankungen und Symptome, welche therapeutisch und/oder präventiv durch
die Wirkung des Sigma-Liganden auf die Nervensteuerung in Säugetieren,
einschließlich
des Menschen, vorzugsweise in Menschen, behandelt werden können. Zu
den derartigen Erkrankungen zählen
beispielsweise Erkrankungen der zentralen Nervensystems, des Gastrointestinaltraktes
und des kardiovaskulären
Systems.
-
Zu
den Erkrankungen des zentralen Nervensystems zählen beispielsweise Angststörungen,
Depressionen oder emotionale Störungen,
Schizophrenie, Betäubungsmittelvergiftung
oder Betäubungsmittelabhängigkeit,
starke Schmerzen, Dyskinesie, zerebrovaskuläre Erkrankungen, Epilepsie,
Demenz, einschließlich
der Alzheimer-Krankheit, Parkinson-Krankheit, Gehirntumor, Aufmerksamkeitsdefizitstörung und
dergleichen. Zu den gastrointestinalen Erkrankungen zählen beispielsweise
das Reizdarmsyndrom, Reizdarm, spastischer Colon, Colitis mu cosa,
Enterocolitis, Divertikulitis, Dysenterie. Zu den Erkrankungen des
kardiovaskulären Systems
gehören
beispielsweise Hypertonie, Arrhythmie, Angina pectoris. Jedoch sind
die durch die Medikamente der vorliegenden Erfindung behandelten
Erkrankungen nicht auf diese speziellen Erkrankungen und/oder Symptome
beschränkt,
und die Medikamente können
für die
therapeutische und/oder präventive
Behandlung einer Vielzahl von Erkrankungen und/oder Symptomen angewendet
werden, bei welchen Sigma-Liganden in vivo involviert sind.
-
Die
Verbindungen nach der vorliegenden Erfindung zeigen eine ausgezeichnete
Anti-Methamphetaminaktivität
und sind als Medikamente anwendbar, insbesondere zur therapeutischen
und/oder präventiven Behandlung
von Schizophrenie, Betäubungsmittelvergiftung
oder Betäubungsmittelabhängigkeit
unter den oben beispielhaft angeführten Erkrankungen und Symptomen.
-
Als
Wirkstoff der Medikamente der vorliegenden Erfindung können eine
oder mehrere Substanzen, ausgewählt
aus der Gruppe, bestehend aus den zuvor genannten Verbindungen und
deren Salze, und deren Hydrate und deren Solvate verwendet werden.
Die Art der Verabreichung der Medikamente der vorliegenden Erfindung
ist nicht speziell beschränkt,
und sie können
oral oder parenteral verabreicht werden. Als die Medikamente der
vorliegenden Erfindung können
die zuvor genannten Substanzen in Reinform an Patienten verabreicht
werden. Vorzugsweise sollten die Medikamente als Zubereitungen in
Form pharmazeutischer Zusammensetzungen verabreicht werden, welche
den Wirkstoff und ein oder zwei pharmakologisch und pharmazeutisch
zulässige
Additive enthalten. Zu den Beispielen pharmakologisch und pharmazeutisch
zulässiger
Additive gehören
beispielsweise Arzneistoffträger,
Tablettensprengmittel oder Tabletten sprengende Hilfsstoffe, Bindemittel,
Gleitmittel, Überzugmittel,
Farbstoffe, Verdünnungsmittel,
Grundstoffe, Lösemittel
und Lösehilfen, isotonische
Substanzen, pH-Regulatoren, Stabilisierungsmittel, Treibmittel,
Klebemittel und dergleichen. Zu den Beispielen pharmazeutischer
Zubereitungen, geeignet zur oralen Verabreichung, gehören beispielsweise Tabletten,
Kapseln, Pulver, Feingranu lat, Granulat, Flüssigkeiten, Sirups und dergleichen.
Zu den Beispielen pharmazeutischer Zubereitungen, geeignet zur parenteralen
Verabreichung, gehören
beispielsweise Injektionen, Tropfinfusionen, Salben, Cremes, transmukosale
Zubereitungen, Augentropfen, Ohrentropfen, Inhalationsmittel, Suppositorien
und dergleichen. Jedoch sind die Formen der Zubereitungen nicht
auf diese Beispiele beschränkt.
-
Als
Additive für
die zur oralen Verabreichung geeigneten Zubereitungen können beispielsweise
verwendet werden: Arzneistoffträger
wie Glucose, Lactose, D-Mannit,
Stärke
und kristalline Cellulose; Tablettensprengmittel oder Tabletten
sprengende Hilfsstoffe wie Carboxymethylcellulose, Stärke und
Calciumcarboxymethylcellulose; Bindemittel wie Hydroxypropylcellulose,
Hydroxypropylmethylcellulose, Polyvinylpyrrolidon und Gelatine;
Gleitmittel wie Magnesiumstearat und Talkum; Überzugmittel wie Hydroxypropylmethylcellulose, Saccharose,
Polyethylenglykol und Titandioxid; und Grundstoffe wie Vaseline,
flüssiges
Paraffin, Polyethylenglykol, Gelatine, Kaolin, Glycerin, gereinigtes
Wasser und harte Fette. Für
die zur Injektion oder Tropfinfusion geeigneten Zubereitungen können beispielsweise
als Additive für
pharmazeutische Zubereitungen verwendet werden: Lösemittel
oder Lösehilfen,
welche wässrige
Injektionen bilden können
oder Injektionen, die zur Anwendung gelöst werden, wie beispielsweise
destilliertes Wasser für
Injektionen, physiologische Kochsalzlösung und Propylenglykol; Isotonische
Mittel wie Glucose, Natriumchlorid, D-Mannit und Glycerin; pH-Regulatoren wie anorganische
Säuren,
organische Säuren,
anorganische Basen und organische Basen und dergleichen.
-
Die
Dosen der Medikamente der vorliegenden Erfindung sollten geeignet
festgelegt werden in Abhängigkeit
von der Art der zu behandelnden Erkrankung, dem Zweck der Prävention
oder der therapeutischen Behandlung, dem Alter, Körpergewicht
und der Verfassung des Patienten und dergleichen. Eine Tagesdosis
für einen
erwachsenen Patienten kann allgemein innerhalb eines Bereichs von
etwa 0,05 bis 500 mg bei oraler Verabreichung liegen. Allgemein
kann die zuvor genannte Dosis einmal oder in zwei oder mehr aufgeteilten Portionen
pro Tag ver abreicht werden, oder diese kann jeweils im Abstand von
wenigen Tagen verabreicht werden.
-
Beispiele
-
Die
vorliegende Erfindung wird mit Bezug auf die folgenden Beispiele
genauer erläutert
werden. Jedoch ist der Umfang der vorliegenden Erfindung nicht auf
diese Beispiele beschränkt.
-
Bei
den physikochemischem Eigenschaften bedeutet NMR Nuklearmagnetisches
Resonanzspektrum, und die Werte sind angegeben als δ-Werte, welche
allgemein verwendet werden, um chemische Verschiebungen anzugeben,
und die „Einheit" ist ppm. TMS (Tetramethylsilan)
wurde als interner Standard verwendet. In den Klammern, die auf
die δ-Werte
folgen, zeigt „s" eine einzelne Linie
an, „d" zeigt eine doppelte
Linie an, „t" zeigt eine dreifache
Linie an, „q" zeigt eine vierfache
Linie an, „m" zeigt eine Vielfachlinie
an, „br" zeigt einen breiten
Absorptionspeak an, und Zahlen, die den Buchstaben folgen, stellen
die Anzahl der Wasserstoffatome dar.
-
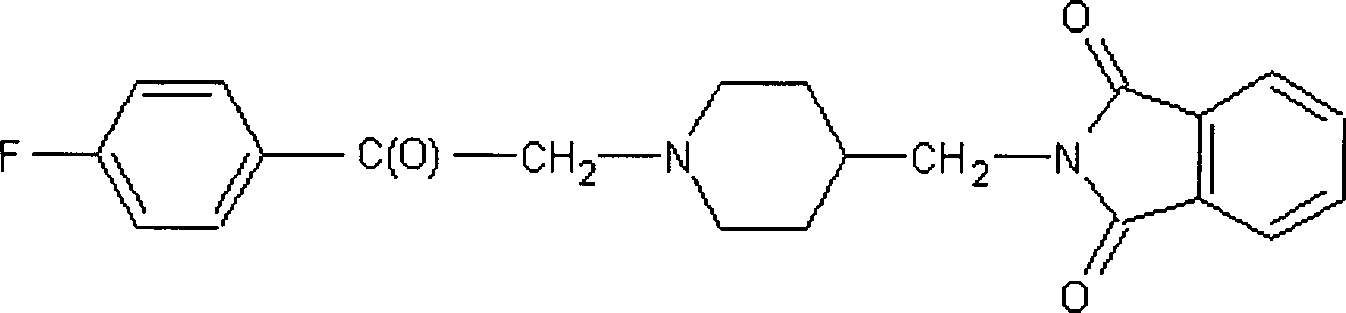
Beispiel 1: 2-((1-(2-(4-Fluorphenyl)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-hydrochlorid
(Verbindung 1 in Tabelle 1)
-
a) 4-Aminomethyl-piperidin-1-tert-butylcarboxylat-hydrochlorid
-
Unter
Verwendung von 5,71 g 4-Aminomethylpiperidin als Ausgangssubstanz
wurde 4-Aminomethyl-piperidin-1-tert-butylcarboxylat dargestellt
nach dem Verfahren, welches beschrieben wurde in Synthetic Commun.,
22 (16), 2357–2360
(1992). Die resultierende Verbindung wurde in 80 ml Ethylacetat
gelöst
und der Lösung
wurde 4N Chlorwasserstoff in-Ethylacetat zugesetzt und gerührt. Der
Niederschlag wurde mittels Filtration gesammelt, um die Titelverbindung
zu erhalten (10,27 g, Ausbeute: 82%).
Schmelzpunkt: 236–240°C
1H-NMR (DMSO-d6): δ 8,00 (3H,
s), 3,92 (2H, br d, J = 12,6 Hz), 2,68 (4H, m), 1,77-1,65 (3H, m),
1,39 (9H, s), 1,02 (2H, m)
-
b) 2-Brommethylbenzoesäureethylester
-
2-Methylbenzoesäureethylester
(2,00 g, 11,9 mmol) wurde in Kohlenstofftetrachlorid (60 ml) gelöst und der
Lösung
wurden N-Bromsuccinimid (2,56 g, 14,4 mmol) und eine katalytische
Menge Benzoylperoxid zugegeben und anschließend unter Rückfluss
erhitzt. Nach einer Stunde wurde die Reaktionsmischung auf Raumtemperatur
abgekühlt
und mit Hexan (40 ml) versetzt, um unlösliche Feststoffe mittels Filtration
zu entfernen. Das Filtrat wurde unter vermindertem Druck eingedampft,
um die Titelverbindung als gelbes Öl (3,16 g) zu erhalten. Das
Produkt wurde ohne Aufreinigung in die nächste Reaktion eingesetzt.
-
c) 4-(1-Oxoisoindolin-2-yl-methyl)-piperidin-1-tert-butylcarboxylat
-
Die
in Beispiel 1b erhaltene Verbindung (3,15 g) und die in Beispiel
1a (3,00 g, 12,0 mmol) erhaltene Verbindung wurden in Dimethylformamid
(30 ml) vereinigt. Die Mischung wurde unter Rühren bei Raumtemperatur mit
Triethylamin (3,5 ml, 25 mmol) versetzt, anschließend wurde
das Rühren
für 17
Stunden bei gleicher Temperatur fortgesetzt. Der Reaktionsmischung
wurde Wasser zugesetzt und extrahiert mit einem Lösemittelgemisch
aus Ethylacetat und Hexan. Die organische Phase wurde mit 10% wässriger
Citronensäurelösung, Wasser,
wässriger
Natriumhydrogencarbonat-Lösung
und anschließend
mit gesättigter
Kochsalzlösung gewaschen.
Anschließend
wurde über
Magnesiumsulfat getrocknet. Unlösliche
Feststoffe wurden durch Filtration abgetrennt und das Filtrat wurde
unter vermindertem Druck eingedampft. Das resultierende Öl wurde mittels
Silicagel-Säulenchromatographie
(Ethylacetat/Hexan) gereinigt, um die Titelverbindung als gelbes Öl zu erhalten
(Ausbeute: 41%).
1H-NMR (CDCl3): δ 7,85
(1H, d, J = 7,5), 7,4-7,6 (3H, m), 4,41 (2H, s), 4,0-4,2 (2H, m),
3,4-3,6 (2H, m), 2,6-2,8 (2H, m), 1,8-2,0 (1H, m), 1,5-1,7 (4H,
m), 1,45 (9H, s)
-
d) 2-(Piperidin-4-yl-methyl)-isoindolin-1-on-hydrochlorid
-
Die
in Beispiel 1c erhaltene Verbindung (1,61 g, 4,87 mmol) wurde gelöst in ei nem
Lösemittelgemisch aus
Methylenchlorid (5 ml) und Ethanol (1 ml), und die Lösung wurde
mit 4N Chlorwasserstoff in Ethylacetat (5 ml, 20 mmol) bei Raumtemperatur
versetzt. Die Mischung wurde bei gleicher Temperatur für 1 Stunde
gerührt,
und der Niederschlag wurde durch Filtration gesammelt. Der resultierende
Feststoff wurden mit Ethylacetat gewaschen und anschließend unter
vermindertem Druck getrocknet, um die Titelverbindung als farblosen Feststoff
zu erhalten (726 mg, Ausbeute: 56%).
1H-NMR
(DMSO-d6): δ 8,83 (1H, brs), 8,53 (1H, brs),
7,4-7,7 (4H, m), 4,50 (2H, s), 3,44 (2H, d, J = 7,2), 3,2-3,3 (2H,
m), 2,7-2,9 (2H, m), 1,9-2,1 (1H, m), 1,6-1,8 (2H, m), 1,3-1,5 (2H,
m)
-
e) 2-((1-(2-(4-Fluorphenyl)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on
-
Die
in Beispiel 1d erhaltene Verbindung (518 mg, 1,94 mmol) und 2-Chlor-4'-fluoracetophenon (358 mg, 2,07 mmol)
wurden zu Dimethylformamid gegeben (12 ml), und der Lösung wurde
unter Rühren
bei Raumtemperatur Triethylamin (575 μl, 4,13 mmol) zugesetzt. Das
Rühren
wurde für
4 Stunden bei gleicher Temperatur fortgesetzt, und anschließend wurde
Wasser zu der Reaktionsmischung gegeben und mit Ethylacetat extrahiert.
Die organische Phase wurde mit Wasser und dann mit gesättigter
Kochsalzlösung
gewaschen, anschließend
wurde über
Natriumsulfat getrocknet. Unlösliche
Feststoffe wurden durch Filtration abgetrennt und das Filtrat wurde
unter vermindertem Druck eingedampft, um ein oranges Öl zu erhalten.
Das resultierende Öl wurde
durch Zusatz von Hexan kristallisiert und der Feststoff wurde durch
Filtration gesammelt und unter vermindertem Druck getrocknet, um
die Titelverbindung als blassgelben Feststoff zu erhalten (551 mg,
Ausbeute: 77%).
1H-NMR (CDCl3): δ 8,0-8,1
(2H, m), 7,85 (1H, d, J = 7,2), 7,4-7,55 (3H, m), 7,12 (2H, t),
4,41 (2H, s), 3,73 (2H, s), 3,51 (2H, d, J = 7,5), 2,9-3,0 (2H,
m), 2,1-2,2 (2H, m), 1,4-1,9 (5H, m)
-
f) 2-((1-(2-(4-Fluorphenyl)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-hydrochlorid
-
Die
in Beispiel 1e erhaltene Verbindung (550 mg, 1,50 mmol) wurde gelöst in Ethanol
(2 ml) und der Lösung
wurde bei Raumtemperatur 4N HCl in Ethylacetat (2 ml, 8 mmol) zugegeben
und das Rühren
wurde bei gleicher Temperatur für
15 Minuten fortgesetzt. Zur Reaktionsmischung wurde Ethylacetat
(10 ml) gegeben und der Niederschlag wurde durch Filtration gesammelt.
Der resultierende Feststoff wurde mit Ethylacetat gewaschen und
unter vermindertem Druck getrocknet, um ein weißes Pulver zu erhalten (364
mg). Das Produkt wurde in Ethanol/Ethylacetat umkristallisiert,
um die Titelverbindung als farblosen Feststoff zu erhalten (246 mg,
Ausbeute: 41%).
Schmelzpunkt: 182–188°C
1H-NMR
(DMSO-d6): δ 9,93 (br s, 1H), 8,0-8,2 (m,
2H), 7,4-7,7 (m, 6H), 4,9-5,1 (m, 2H), 4,53 (s, 2H), 2,9-3,6 (m,
6H), 1,6-2,2 (m, 5).
-
Beispiel 2: 4-Brom-2-((1-(2-(4-fluorphenyl)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-hydrochlorid (Verbindung
5 in Tabelle 1)
-
a) 3-Brom-2-methylbenzoesäureethylester
-
2-Methylbenzoesäureethylester
(18,3 mmol) wurde tropfenweise zu Aluminiumtrichlorid (45,7 mmol) gegeben,
anschließend
wurde Br2 (22,0 mmol) tropfenweise zugegeben.
Das Rühren
wurde für
1 Stunde bei Raumtemperatur fortgesetzt, anschließend wurden
Eis und Ethylacetat zugefügt,
um die organische Phase abzutrennen. Die organische Phase wurde
mit Wasser, einer wässrigen
Natriumhydrogencarbonat-Lösung
und anschließend
mit gesättigter
Kochsalzlösung
gewaschen und über
Natriumsulfat getrocknet. Das Trockenmittel wurde durch Filtration
abgetrennt, die Phase wurde eingeengt und drei Produkte wurden durch
Silicagel-Säulenchromatographie
aufgetrennt (Hexan/Ether), d.h. 3-Brom-2-methylbenzoesäureethylester (Ausbeute: 14%),
5-Brom-2-methyl-benzoesäureethylester
(Ausbeute: 13%), 3,5-Dibrom-2-methylbenzoesäureethylester (Ausbeute: 10%).
3-Brom-2-methylbenzoesäureethylester:
1H-NMR (CDCl3): δ 7,71 (dd,
J = 7,9, 1,0 Hz, 1H), 7,69 (dd, J = 7,9, 1,0 Hz, 1H), 7,10 (t, J
= 7,9 Hz, 1H), 4,37 (q, J = 7,0 Hz, 2H), 2,63 (s, 3H), 1,40 (t,
J = 7,0 Hz, 3H).
5-Brom-2-methylbenzoesäureethylester:
1H-NMR (CDCl3): δ 8,03 (d,
J = 2,1 Hz, 1H), 7,50 (dd, J = 8,4, 2,1 Hz, 1H), 7,12 (d, J = 8,4
Hz, 1H), 4,36 (q, J = 6,9 Hz, 2H), 2,54 (s, 3H), 1,40 (t, J = 6,9
Hz, 3H).
3,5-Dibrom-2-methyl-benzoesäureethylester:
1H-NMR (CDCl3): δ 7,85 (d,
J = 2 Hz, 1H), 7,84 (d, J = 2 Hz, 1H), 4,37 (q, J = 7,0 Hz, 2H),
2,57 (s, 3H), 1,40 (t, J = 7,0 Hz, 3H).
-
b) 4-(4-Brom-1-oxoisoindolin-2-yl-methyl)-piperidin-1-tert-butylcarboxylat
-
Unter
Verwendung von 3-Brom-2-methylbenzoesäureethylester, erhalten in
Beispiel 2a, wurde die Titelverbindung durch ähnliche Verfahren wie in den
Beispielen 1b und 1c erhalten.
1H-NMR
(CDCl3): δ 7,80
(d, J = 9 Hz, 1H), 7,66 (d, J = 6 Hz, 1H), 7,37 (dd, J = 9,6 Hz,
1H), 4,33 (s, 2H), 4,12 (m, 2H), 3,54 (br d, J = 7 Hz, 2H), 2,70
(br t, J = 12 Hz, 2H), 1,95 (m, 1H), 1,66 (br d, J = 12 Hz, 2H),
1,45 (s, 9H), 1,24 (dq, J = 12 Hz, 4 Hz, 2H).
-
c) 4-Brom-2-(piperidin-4-yl-methyl)-isoindolin-1-on-hydrochlorid
-
Unter
Verwendung der in Beispiel 2b erhaltenen Verbindung wurde die Titelverbindung
auf die gleiche Weise erhalten wie in Beispiel 1d (Ausbeute: 62%).
1H-NMR (DMSO-d6): δ 8,92 (br
s, 1H), 8,64 (br s, 1H), 7,83 (d, J = 9 Hz, 1H), 7,71 (d, J = 6
Hz, 1H), 7,48 (dd, J = 9 Hz, 6 Hz, 1H), 4,45 (s, 2H), 3,45 (d, J
= 12 Hz, 2H), 3,24 (br d, J = 12 Hz, 2H), 2,79 (br q, J = 12 Hz,
2H), 2,06 (m, 1H), 1,74 (br d, J = 12 Hz, 2H), 1,37 (br q, J = 12
Hz, 2H).
-
d) 4-Brom-2-((1-(2-(4-fluorphenyl)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on
-
Unter
Verwendung der in Beispiel 2c erhaltenen Verbindung wurde die Titelverbindung
durch ähnliche Verfahren
wie in Beispiel 1e erhalten (Ausbeute: 57%).
1H-NMR
(CDCl3): δ 8,07
(m, 2H), 7,79 (d, J = 7,8 Hz, 1H), 7,65 (d, J = 7,8 Hz, 1H), 7,37
(t, J = 7,8 Hz, 1H), 7,11 (t, J = 8,6 Hz, 2H), 4,32 (s, 2H), 3,72
(s, 2H), 3,53 (d, J = 7,2 Hz, 2H), 2,96 (br d, J = 11,4 Hz, 2H),
2,16 (dt, J = 11,4 Hz, 2,7 Hz, 2H), 1,84 (m, 1H), 1,69 (br d, J
= 12 Hz, 2H), 1,48 (dq, J = 12 Hz, 4 Hz, 2H).
-
e) 4-Brom-2-((1-(2-(4-fluorphenyl)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-hydrochlorid
-
Unter
Verwendung der in Beispiel 2d erhaltenen Verbindung wurde die Titelverbindung
durch ähnliche Verfahren
wie in Beispiel 1f erhalten (Ausbeute: 66%).
Schmelzpunkt:
152–154°C
1H-NMR (DMSO-d6): δ 9,98 (br
s, 1H), 8,06-8,16 (m, 2H), 7,84 (d, J = 8,1 Hz, 1H), 7,72 (d, J
= 7,5 Hz, 1H), 7,45-7,48 (m, 3H), 5,04-5,10 (m, 2H), 4,48 (s, 2H),
3,00-3,56 (m, 6H),
2,09 (m, 1H), 1,58-1,83 (m, 4H).
-
Beispiel 3: 5-Brom-2-((1-(2-(4-fluorphenyl)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-hydrochlorid (Verbindung
4 in Tabelle 1)
-
a) 4-Brom-2-methyl-benzoesäuremethylester
-
4-Brom-2-methyl-benzoesäure (4,06
g, 18,5 mmol) wurde in Methanol gelöst (60 ml). Zur Lösung wurde
konzentrierte Schwefelsäure
(1 ml) gegeben und anschließend
unter Rückfluss
9 Stunden erhitzt. Das Lösemittel
wurde unter vermindertem Druck verdampft und der Rückstand
mit Ethylether (100 ml) verdünnt.
Die resultierende Lösung
wurde mit Wasser, einer wässrigen
Natriumhydrogencarbonat-Lösung
und anschließend mit
gesättigter
Kochsalzlösung
gewaschen und über
Magnesiumsulfat getrocknet. Unlösliche
Feststoffe wurden durch Filtration abgetrennt und das Filtrat wurde
unter vermindertem Druck eingeengt, um die Titelverbindung als gelbes Öl zu erhalten
(3,87 g, Ausbeute: 91%).
1H-NMR (CDCl3): δ 7,78
(d, J = 8,3 Hz, 1H), 7,42 (d, J = 1,9 Hz, 1H), 7,38 (dd, J = 1,9
Hz, 8,3 Hz, 1H) 3,88 (s, 3H), 2,58 (s, 3H)
-
b) 4-Brom-2-brommethyl-benzoesäuremethylester
-
Unter
Verwendung der in Beispiel 3a (3,83 g, 16,7 mmol) erhaltenen Verbindung wurde
die Titelverbindung durch ähnliche
Verfahren wie in Beispiel 1b erhalten (5,70 g). Das Produkt wurde
ohne jede Behandlung in die nächste
Reaktion eingesetzt.
-
c) 4-(5-Brom-1-oxoisoindolin-2-yl-methyl)-piperidin-1-tert-butylcarboxylat
-
Unter
Verwendung der in Beispiel 3b erhaltenen Verbindung (5,70 g) wurde
die Titelverbindung als weißer
Feststoff durch ähnliche
Verfahren wie in Beispiel 1c erhalten (3,04 g, Ausbeute: 44%).
1H-NMR (CDCl3): δ 7,69-7,73
(m, 1H), 7,59-7,62 (m, 2H), 4,39 (s, 2H), 4,0-4,2 (m, 2H), 3,4-3,6
(m, 2H), 2,5-2,7 (m, 2H), 1,8-2,0 (m, 1H), 1,5-1,7 (m, 2H), 1,45
(s, 9H), 1,1-1,3 (m, 2H)
-
d) 5-Brom-2-(piperidin-4-yl-methyl)-isoindolin-1-on-hydrochlorid
-
Unter
Verwendung der in Beispiel 3c erhaltenen Verbindung (3,03 g, 7,40
mmol) wurde die Titelverbindung durch ähnliche Verfahren wie in Beispiel
1d als weißer
Feststoff erhalten (1,86 g, Ausbeute: 73%).
1H-NMR
(DMSO-d6): δ 8,96 (br s, 1H), 8,68 (br s,
1H), 7,89 (s, 1H), 7,69 (d, J = 8,2 Hz, 1H), 7,61 (d, J = 8,2 Hz,
1H), 4,50 (s, 2H), 3,42 (d, J = 7,2 Hz, 2H), 3,1-3,3 (m, 2H), 2,6-2,9 (m, 2H), 1,9-2,1
(m, 1H), 1,6-1,8 (m, 2H), 1,2-1,4 (m, 2H)
-
e) 5-Brom-2-((1-(2-(4-fluorphenyl)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on
-
Unter
Verwendung der in Beispiel 3d erhaltenen Verbindung (834 mg, 2,41
mmol) wurde die Titelverbindung durch ähnliche Verfahren wie in Beispiel
1e als blassgelber Feststoff erhalten (727 mg, Ausbeute: 68%).
1H-NMR (CDCl3): δ 8,0-8,1
(m, 2H), 7,68-7,72 (m, 1H), 7,58-7,62 (m, 2H), 7,08-7,15 (m, 2H), 4,38
(s, 2H), 3,73 (s, 2H), 3,49 (d, J = 7,2 Hz, 2H), 2,8-3,0 (m, 2H),
2,0-2,2 (m, 2H), 1,6-1,9 (m, 3H), 1,35-1,5 (m, 2H)
-
f) 5-Brom-2-((1-(2-(4-fluorphenyl)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-hydrochlorid
-
Unter
Verwendung der in Beispiel 3e erhaltenen Verbindung (727 mg, 1,63
mmol) wurde die Titelverbindung durch ähnliche Verfahren wie in Beispiel
1f als farbloser Feststoff erhalten (704 mg, Ausbeute: 89%)
Schmelzpunkt:
205–222°C
1H-NMR (DMSO-d6): δ 9,91 (br
s, 1H), 8,0-8,2 (m, 2H), 7,90 (s, 1H), 7,70 (d, J = 8,2 Hz, 1H),
7,62 (d, J = 8,2 Hz, 1H), 7,4-7,5 (m, 2H), 5,0-5,2 (m, 2H), 4,53
(s, 2H), 3,3-3,6 (4H, m), 2,9-3,1 (m, 2H), 2,0-2,2 (m, 1H), 1,5-1,9 (m,
4H).
-
Beispiel 4: 6-Brom-2-((1-(2-(4-fluorphenyl)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-hydrochlorid (Verbindung
3 in Tabelle 1)
-
a) 4-(6-Brom-1-oxoisoindolin-2-yl-methyl)-piperidin-1-tert-butylcarboxylat
-
Unter
Verwendung von 5-Brom-2-methylbenzoesäureethylester, erhalten in
Beispiel 2a, wurde die Titelverbindung durch ähnliche Verfahren wie in den
Beispielen 1b und 1c erhalten (Ausbeute: 52%).
1H-NMR
(CDCl3): δ 7,98
(d, J = 1,8 Hz, 1H), 7,65 (dd, J = 8,0 Hz, 1,8 Hz, 1H), 7,32 (d,
J = 8,0 Hz, 1H), 4,36 (s, 2H), 4,10 (m, 2H), 3,48 (m, 2H), 2,69
(br t, J = 12 Hz, 2H), 1,93 (m, 1H), 1,64 (br d, J = 12 Hz, 2H),
1,45 (s, 9H), 1,24 (dq, J = 12,3 Hz, 4,4 Hz, 2H).
-
b) 6-Brom-2-(piperidin-4-yl-methyl)-isoindolin-1-on-hydrochlorid
-
Unter
Verwendung der in Beispiel 4a erhaltenen Verbindung wurde die Titelverbindung
durch ähnlich Verfahren
wie in Beispiel 1d erhalten (Ausbeute: 96%).
1H-NMR
(DMSO-d6): δ 8,90 (br s, 1H), 8,61 (br s,
1H), 7,78-7,81 (m, 2H), 7,6 (d, J = 8,8 Hz, 1H), 4,48 (s, 2H), 3,43
(d, J = 7,4 Hz, 2H), 3,24 (br d, J = 12 Hz, 2H), 2,80 (br q, J =
12 Hz, 2H), 2,01 (m, 1H), 1,73 (br d, J = 12 Hz, 2H), 1,37 (br q,
J = 12 Hz, 2H).
-
c) 6-Brom-2-((1-(2-(4-fluorphenyl)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on
-
Unter
Verwendung der in Beispiel 4b erhaltenen Verbindung wurde die Titelverbindung
durch ähnliche Verfahren
wie in Beispiel 1e erhalten (Ausbeute: 93%).
1H-NMR
(CDCl3): δ 8,07
(m, 2H), 7,97 (d, J = 1,8 Hz, 1H), 7,65 (dd, J = 8,1 Hz, 1,8 Hz,
1H), 7,32 (d, J = 8,1 Hz, 1H), 7,12 (t, J = 8,7 Hz, 2H), 4,36 (s,
2H), 3,72 (s, 2H), 3,50 (d, J = 6,9 Hz, 2H), 2,96 (br d, J = 12
Hz, 2H), 2,14 (dt, J = 11,6 Hz, 2,4 Hz, 2H), 1,82 (m, 1H), 1,67
(br d, J = 12 Hz, 2H), 1,46 (dq, J = 11,7 Hz, 3,6 Hz, 2H).
-
d) 6-Brom-2-((1-(2-(4-fluorphenyl)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-hydrochlorid
-
Unter
Verwendung der in Beispiel 4c erhaltenen Verbindung wurde die Titelverbindung
durch ähnliche Verfahren
erhalten wie in Beispiel 1f (Ausbeute: 72%).
Schmelzpunkt:
187–193°C
1H-NMR (DMSO-d6): δ 9,99 (br
s, 1H), 8,05-8,16 (m, 2H), 7,62-7,78 (m, 2H), 7,60 (d, J = 8,6 Hz,
1H), 7,47 (t, J = 8,6 Hz, 2H), 5,03-5,09 (m, 2H), 4,51 (s, 2H),
3,01-3,55 (m, 6H), 2,03 (m, 1H), 1,62-1,86 (m, 4H).
-
Beispiel 5: 4,6-Dibrom-2-((1-(2-(4-fluorphenyl)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-hydrochlorid (Verbindung
6 in Tabelle 1)
-
a) 4-(4,6-Dibrom-1-oxoisoindolin-2-yl-methyl)-piperidin-1-tert-butylcarboxylat
-
Unter
Verwendung von 3,5-Dibrom-2-methylbenzoesäureethylester, erhalten in
Beispiel 2a, wurde die Titelverbindung durch ähnliche Verfahren erhalten
wie in den Beispielen 1b und 1c (Ausbeute: 64%).
1H-NMR
(CDCl3): δ 7,93
(d, J = 1,5 Hz, 1H), 7,82 (d, J = 1,5 Hz, 1H), 4,27 (s, 2H), 4,12
(m, 2H), 3,51 (d, J = 6,7 Hz, 2H), 2,70 (br t, J = 12 Hz, 2H), 1,94
(m, 1H), 1,64 (br d, J = 12 Hz, 2H), 1,45 (s, 9H), 1,25 (dq, J =
12 Hz, 4 Hz, 2H).
-
b) 4,6-Dibrom-2-(piperidin-4-yl-methyl)-isoindolin-1-on-hydrochlorid
-
Unter
Verwendung der in Beispiel 5a erhaltenen Verbindung wurde die Titelverbindung
durch ähnliche Verfahren
wie in Beispiel 1a erhalten (Ausbeute: 100%).
1H-NMR
(DMSO-d6): δ 8,87 (br s, 1H), 8,60 (br s,
1H), 4,43 (s, 2H), 3,44 (d, J = 7,5 Hz, 2H), 3,24 (br d, J = 12 Hz,
2H), 2,79 (br q, J = 12 Hz, 2H), 2,06 (m, 1H), 1,74 (br d, J = 12
Hz, 2H), 1,36 (br q, J = 12 Hz, 2H).
-
c) 4,6-Dibrom-2-((1-(2-(4-fluorphenyl)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on
-
Unter
Verwendung der in Beispiel 5b erhaltenen Verbindung wurde die Titelverbindung
durch ähnliche Verfahren
wie in Beispiel 1e erhalten (Ausbeute: 83%).
1H-NMR
(CDCl3): δ 8,07
(m, 2H), 7,92 (d, J = 1,4 Hz, 1H), 7,81 (d, J = 1,4 Hz, 1H), 7,60
(t, J = 8,6 Hz, 2H), 4,28 (s, 2H), 3,73 (s, 2H), 3,51 (d, J = 7,3
Hz, 2H), 2,97 (br d, J = 12 Hz, 2H), 2,16 (br t, J = 12 Hz, 2H),
1,83 (m, 1H), 1,68 (br d, J = 12 Hz, 2H), 1,47 (dq, J = 12 Hz, 3
Hz, 2H).
-
d) 4,6-Dibrom-2-((1-(2-(4-fluorphenyl-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-hydrochlorid
-
Unter
Verwendung der in Beispiel 5c erhaltenen Verbindung wurde die Titelverbindung
durch ähnliche Verfahren
wie in Beispiel 1f erhalten (Ausbeute: 77%).
Schmelzpunkt:
186–190°C
1H-NMR (DMSO-d5): δ 10,03 (br
s, 1H), 8,06-8,16 (m, 3H), 7,86 (s, 1H), 7,47 (t, J = 8,7 Hz, 2H),
5,04-5,10 (m, 2H), 4,46 (s, 2H), 3,30-3,56 (m, 6H), 2,08 (m, 1H),
1,58-1,91 (m, 4H).
-
Beispiel 6: 4-Fluor-2-((1-(2-(4-fluorphenyl)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-hydrochlorid (Verbindung
10 in Tabelle 1)
-
a) 3-Fluor-2-methyl-benzoesäureethylester
-
Unter
Verwendung von 3-Fluor-2-methyl-benzoesäure (2,0 g, 12,98 mmol) wurde
die Titelverbindung durch ähnliche
Verfahren wie in Beispiel 3a als farbloses Öl erhalten (1,31 g). Das Produkt
wurde ohne Aufreinigung in die nächste
Reaktion eingesetzt.
-
b) 2-Brommethyl-3-fluor-benzoesäureethylester
-
Unter
Verwendung der in Beispiel 6a erhaltenen Verbindung (1,31 g) wurde
die Titelverbindung durch ähnliche
Verfahren wie in Beispiel 1b als blassgelbes Öl erhalten (2,01 g). Das Produkt
wurde ohne Aufreinigung in die nächste
Reaktion eingesetzt.
-
c) 4-((4-Fluorisoindolin-1-on)-2-yl-methyl)-piperidin-1-tert-butylcarboxylat
-
Unter
Verwendung der in Beispiel 6b erhaltenen Verbindung (1,57 g) wurde
die Titelverbindung durch ähnliche
Verfahren wie in Beispiel 1c als farbloser Feststoff erhalten (1,68
g, Ausbeute: 63%).
1H-NMR (CDCl3): δ 7,65
(d, J = 7,5 Hz, 1H), 7,49-7,43 (ddd, J = 7,8 Hz, 7,8 Hz, 4,8 Hz,
1H), 7,22 (dd, J = 8,6 Hz, 8,5 Hz, 1H), 4,45 (s, 2H), 4,11 (br d,
J = 11,7 Hz, 2H), 3,50 (br d, J = 6,3 Hz, 2H), 2,70 (br dd, J =
12,6 Hz, 6,3 Hz, 2H), 1,98-1,91 (m, 1H), 1,67-1,62 (m, 2H), 1,45
(s, 9H), 1,35-1,19 (m, 2H).
-
d) 4-Fluor-2-(piperidin-4-yl-methyl)-isoindolin-1-on-hydrochlorid
-
Unter
Verwendung der in Beispiel 6c erhaltenen Verbindung (1,68 g, 4,82
mmol) wurde die Titelverbindung durch ähnliche Verfahren wie in Beispiel
1d als farbloser Feststoff erhalten (1,27 g, Ausbeute: 93%).
1H-NMR (DMSO-d6): δ 8,91 (br
s, 1H), 8,65 (br s, 1H), 7,60-7,42 (m, 3H), 4,60 (s, 2H), 3,44 (d,
J = 7,5 Hz, 2H), 3,24 (br d, J = 12,6 Hz, 2H), 2,79 (br dd, J =
23,3 Hz, 12,2 Hz, 2H), 2,08-1,99 (m, 1H), 1,74 (br d, J = 12,3 Hz, 2H),
1,45-1,31 (m, 2H).
-
e) 4-Fluor-2-((1-(2-(4-fluorphenyl)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on
-
Unter
Verwendung der in Beispiel 6d erhaltenen Verbindung (1,27 g, 4,46
mmol) wurde die Titelverbindung durch ähnliche Verfahren wie in Beispiel
1e als blassbrauner Feststoff erhalten (1,52 g, Ausbeute: 89%).
1H-NMR (CDCl3): δ 8,10-8,05
(m, 2H), 7,65 (d, J = 7,3 Hz, 1H), 7,46-7,44 (m, 1H), 7,21 (dd,
J = 8,8 Hz, 8,8 Hz, 2H), 7,11 (dd, J = 7,6 Hz, 7,6 Hz, 2H), 4,45
(s, 2H), 3,71 (s, 2H), 3,52 (d, J = 7,2 Hz, 2H), 2,96 (br d, J =
11,6 Hz, 2H), 2,19-2,08 (m, 2H), 1,71-1,67 (m, 2H), 1,54-1,46 (m,
2H).
-
f) 4-Fluor-2-((1-(2-(4-fluorphenyl)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-hydrochlorid
-
Unter
Verwendung der in Beispiel 6e erhaltenen Verbindung (500 mg, 1,30
mmol) wurde die Titelverbindung durch ähnliche Verfahren wie in Beispiel
1f als farbloser Feststoff erhalten (484 mg, Ausbeute: 89%).
Schmelzpunkt:
177–196°C
1H-NMR (DMSO-d5): δ 9,92 (br
s, 1H), 8,16-8,06 (m, 2H), 7,59-7,44 (m, 5H), 5,04-5,01 (m, 2H),
4,63 (s, 2H), 3,56-3,46 (m, 4H), 3,02 (br d, J = 10,8 Hz, 2H), 2,09-2,06
(m, 1H), 1,91-1,62 (m, 4H).
-
Beispiel 7: 6-Fluor-2-((1-(2-(4-fluorphenyl)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-hydrochlorid (Verbindung
8 in Tabelle 1)
-
a) 5-Fluor-2-methyl-benzoesäuremethylester
-
Unter
Verwendung von 5-Fluor-2-methyl-benzoesäure (900 mg, 5,78 mmol) wurde
die Titelverbindung durch ähnliche
Verfahren wie in Beispiel 3a als farbloses Öl erhalten (1,01 g). Das Produkt
wurde ohne Aufreinigung in die nächste
Reaktion eingesetzt.
-
b) 2-Brommethyl-5-fluor-benzoesäuremethylester
-
Unter
Verwendung der in Beispiel 7a erhaltenen Verbindung (957 mg) wurde
die Titelverbindung durch ähnliche
Verfahren wie in Beispiel 1b erhalten (1,57 g). Das Produkt wurde
ohne Aufreinigung in die nächste Reaktion
eingesetzt.
-
c) 4-(6-Fluor-1-oxoisoindolin-2-yl-methyl)-piperidin-1-tert-butylcarboxylat
-
Unter
Verwendung der in Beispiel 7b erhaltenen Verbindung (1,57 g) wurde
die Titelverbindung durch ähnliche
Verfahren wie in Beispiel 1c als farbloser Feststoff erhalten (1,13
g, Ausbeute: 57%).
1H-NMR (CDCl3): δ 7,50-7,54
(m, 1H), 7,38-7,43 (m, 1H), 7,20-7,28 (m, 1H), 4,38 (s, 2H), 4,0-4,2
(m, 2H), 3,4-3,6 (m, 2H), 2,6-2,8 (m, 2H), 1,8-2,0 (m, 1H), 1,5-1,7
(m, 2H), 1,45 (s, 9H), 1,1-1,3 (m, 2H).
-
d) 6-Fluor-2-(piperidin-4-yl-methyl)-isoindolin-1-on-hydrochlorid
-
Unter
Verwendung der in Beispiel 7c erhaltenen Verbindung (1,09 g, 3,13
mmol) wurde die Titelverbindung durch ähnlich Verfahren wie in Beispiel
1d als farblo ser Feststoff erhalten (722 mg, Ausbeute: 81 %).
1H-NMR (DMSO-d6): δ 8,73 (br
s, 1H), 8,46 (br s, 1H), 7,63-7,69 (m, 1H), 7,43-7,49 (m, 2H), 4,48 (s, 2H), 3,44 (d,
J = 7,3 Hz, 2H), 3,1-3,3 (m, 2H), 2,7-2,9 (m, 2H), 1,9-2,1 (m, 1H),
1,6-1,8 (m, 2H), 1,2-1,4 (m, 2H).
-
e) 6-Fluor-2-((1-(2-(4-fluorphenyl)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on
-
Unter
Verwendung der in Beispiel 7d erhaltenen Verbindung (721 mg, 2,53
mmol) wurde die Titelverbindung durch ähnliche Verfahren wie in Beispiel
18 als blassgelber Feststoff erhalten (762 mg, Ausbeute: 78%).
1H-NMR (CDCl3): δ 8,04-8,10
(m, 2H), 7,49-7,53 (m, 1H), 7,37-7,41 (m, 1H), 7,22-7,26 (m, 1H),
7,08-7,15 (m, 2H), 4,38 (s, 2H), 3,73 (s, 2H), 3,50 (d, J = 7,3
Hz, 2H), 2,9-3,0 (m, 2H), 2,0-2,2 (m, 2H), 1,7-1,9 (m, 1H), 1,5-1,7 (m,
2H), 1,3-1,5 (m, 2H)
-
f) 6-Fluor-2-((1-(2-(4-fluorphenyl)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-hydrochlorid
-
Unter
Verwendung der in Beispiel 7e erhaltenen Verbindung (762 mg, 1,98
mmol) wurde die Titelverbindung durch ähnliche Verfahren wie in Beispiel
1f als farbloser Feststoff erhalten (762 mg, 91%).
Schmelzpunkt:
193–205°C
1H-NMR (DMSO-d6): δ 9,96 (br
s, 1H), 8,0-8,2 (m, 2H), 7,64-7,70 (m, 1H), 7,3-7,5 (m, 4H), 5,0-5,2 (m, 2H), 4,52 (s,
2H), 3,4-3,6 (m, 4H), 3,9-4,1 (m, 2H), 1,9-2,1 (m, 1H), 1,5-1,9 (m, 4H).
-
Beispiel 8: 5-Chlor-2-((1-(2-(4-fluorphenyl)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-hydrochlorid (Verbindung
13 in Tabelle 1)
-
a) 4-Chlor-2-methyl-benzoesäureethylester
-
Unter
Verwendung von 4-Chlor-2-methyl-benzoesäure (300 mg, 1,76 mmol) wurde
die Titelverbindung durch ähnliche
Verfahren wie in Beispiel 3a als farbloser Feststoff erhalten (347
mg). Das Produkt wurde ohne Aufreinigung in die nächste Reaktion
eingesetzt.
-
b) 2-Brommethyl-4-chlor-benzoesäureethylester
-
Unter
Verwendung der in Beispiel 8a erhaltenen Verbindung wurde die Titelverbindung
durch ähnliche Verfahren
wie in Beispiel 1b als blassbraunes Öl erhalten (494 mg). Das Produkt
wurde ohne Aufreinigung in die nächste
Reaktion eingesetzt.
-
c) 4-((5-Chlor-isoindolin-1-on)-2-yl-methyl)-piperidin-1-tert-butylcarboxylat
-
Unter
Verwendung der in Beispiel 8b erhaltenen Verbindung (490 mg) wurde
die Titelverbindung durch ähnliche
Verfahren wie in Beispiel 1c als blassbrauner Feststoff erhalten
(375 mg, Ausbeute: 58%).
1H-NMR (CDCl3): δ 7,77
(d, J = 8,7 Hz, 1H), 7,48-7,44 (m, 2H), 4,39 (s, 2H), 4,11 (br s,
2H), 3,49 (br s, 2H), 2,69 (br dd, J = 12,2 Hz, 12,2 Hz, 2H), 1,97-1,89
(m, 1H), 1,66-1,62 (m, 2H), 1,45 (s, 9H), 1,31-1,18 (m, 2H).
-
d) 5-Chlor-2-(piperidin-4-yl-methyl)-isoindolin-1-on-hydrochlorid
-
Unter
Verwendung der in Beispiel 8c erhaltenen Verbindung (370 mg, 1,01
mmol) wurde die Titelverbindung durch ähnliche Verfahren wie in Beispiel
1d als farbloser Feststoff erhalten (221 mg, Ausbeute: quantitativ).
1H-NMR (DMSO-d6): δ 9,08 (br
s, 1H), 8,81 (br s, 1H), 7,80 (s, 1H), 7,74 (d, J = 8,0 Hz, 1H),
7,60 (dd, J = 8,1 Hz, 1,6 Hz, 1H), 4,56 (s, 2H), 3,48 (d, J = 7,4
Hz, 2H), 3,29 (br d, J = 12,6 Hz, 2H), 2,85 (br dd, J = 23,0 Hz, 12,0
Hz, 2H), 2,10-2,02 (m, 1H), 1,78 (br d, J = 12,8 Hz, 2H), 1,51-1,37
(m, 2H).
-
e) 5-Chlor-2-((1-(2-(4-fluorphenyl)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on
-
Unter
Verwendung der in Beispiel 8d erhaltenen Verbindung (205 mg, 0,68
mmol) wurde die Titelverbindung durch ähnliche Verfahren wie in Beispiel
1e erhalten als weißer
Feststoff (213 mg, Ausbeute: 78%).
1H-NMR
(CDCl3): δ 8,07
(dd, J = 8,9 Hz, 5,6 Hz, 2H), 7,76 (d, J = 9,0 Hz, 1H), 7,44 (d,
J = 8,1 Hz, 2H), 7,12 (dd, J = 8,7 Hz, 8,7 Hz, 2H), 4,39 (s, 2H),
3,73 (s, 2H), 3,49 (d, J = 7,2 Hz, 2H), 2,96 (br d, J = 11,4 Hz,
2H), 2,19-2,11 (m, 2H), 1,84-1,77 (m, 1H), 1,68 (br d, J = 12,6
Hz, 2H), 1,54-1,45 (m, 2H).
-
f) 5-Chlor-2-((1-(2-(4-fluorphenyl)-2-oxoethyl)-piperidin-4-yl)-methyl-isoindolin-1-on-hydrochlorid
-
Unter
Verwendung der in Beispiel 8e erhaltenen Verbindung (213 mg, 0,53
mmol) wurde die Titelverbindung durch ähnliche Verfahren wie in Beispiel
1f erhalten als farbloser Feststoff (155 mg, Ausbeute: 48%).
Schmelzpunkt:
209–221°C
1H-NMR (DMSO-d6): δ 9,94 (br
s, 1H), 8,19-8,06 (m, 2H), 7,76 (s, 1H), 7,69 (d, J = 8,1 Hz, 1H),
7,65 (d, J = 9,3 Hz, 1H), 7,48 (dd, J = 8,7 Hz, 8,7 Hz, 2H), 5,10-5,03
(m, 2H), 4,54 (s, 2H), 3,55-3,40 (m, 4H), 3,08-3,00 (m, 2H), 2,09-1,99
(m, 1H), 1,88-1,61 (m, 4H).
-
Beispiel 9: 5-Methoxy-2-((1-(2-(4-fluorphenyl)-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-hydrochlorid (Verbindung
17 in Tabelle 1)
-
a) 4-Methoxy-2-methyl-benzoesäuremethylester
-
4-Brom-2-methyl-benzoesäuremethylester
(19,0 mmol) wurde in Dimethylformamid (2,7 ml) und Methanol (1,1
ml) gelöst.
Die Lösung
wurde auf 80°C
erhitzt und mit CuBr (1,09 mmol) versetzt. Nachdem 2 Stunden unter
Erhitzen weiter gerührt
worden war, wurde die Mischung auf Raumtemperatur abgekühlt. Der
Mischung wurde Diethylether zugesetzt (25 ml) und dann filtriert.
Das Filtrat wurde viermal gewaschen mit Wasser, einer wässrigen
Natriumhydrogencarbonat-Lösung
und anschließend
mit gesättigter
Kochsalzlösung
und über
Natriumsulfat getrocknet. Das Trockenmittel wurde durch Filtration
abgetrennt und das Filtrat eingeengt, um die Titelverbindung zu
ergeben.
1H-NMR (CDCl3): δ 7,93 (d,
J = 9,3 Hz, 1H), 6,72-6,76 (m, 2H), 3,86 (s, 3H), 3,84 (s, 3H),
2,60 (s, 3H).
-
b) 4-(5-Methoxy-1-oxoisoindolin-2-yl-methyl)-piperidin-1-tert-butylcarboxylat
-
Unter
Verwendung der in Beispiel 9a erhaltenen Verbindung wurde die Titelver bindung
durch ähnliche Verfahren
erhalten wie in den Beispielen 1b und 1c (Ausbeute: 40%).
1H-NMR (CDCl3): δ 7,75 (d,
J = 8,4 Hz, 1H), 6,99 (dd, J = 8,4 Hz, 2,1 Hz, 1H), 6,93 (d, J =
2,1 Hz, 1H), 4,35 (s, 2H), 4,11 (m, 2H), 3,87 (s, 3H), 3,47 (m,
2H), 2,69 (br t, J = 12 Hz, 2H), 1,93 (m, 1H), 1,65 (br d, J = 12
hz, 2H), 1,45 (s, 9H), 1,24 (dq, J = 12,4 Hz, 2H).
-
c) 5-Methoxy-2-(piperidin-4-yl-methyl)-isoindolin-1-on-hydrochlorid
-
Unter
Verwendung der in Beispiel 9b erhaltenen Verbindung wurde die Titelverbindung
durch ähnliche Verfahren
wie in Beispiel 1d erhalten (Ausbeute: 100%).
1H-NMR
(DMSO-d6): δ 9,13 (br s, 1H), 8,86 (br s,
1H), 7,57 (d, J = 8,4 Hz, 1H), 7,15 (d, J = 2,2 Hz, 1H), 7,02 (dd,
J = 8,6 Hz, 2,2 Hz, 1H), 4,43 (s, 2H), 3,83 (s, 3H), 3,39 (d, J
= 7,4 Hz, 2H), 3,22 (br d, J = 12 Hz, 2H), 2,78 (br q, J = 12 Hz,
2H), 1,98 (m, 1H), 1,71 (br d, J = 12 Hz, 2H), 1,43 (br q, J = 12
Hz, 2H).
-
d) 5-Methoxy-2-((1-(2-(4-fluorphenyl)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on
-
Unter
Verwendung der in Beispiel 9c erhaltenen Verbindung wurde die Titelverbindung
durch ähnliche Verfahren
wie in Beispiel 1e erhalten (Ausbeute: 84%).
1H-NMR
(CDCl3): δ 8,08
(m, 2H), 7,75 (d, J = 7,8 Hz, 1H), 7,11 (t, J = 8,4 Hz, 2H), 6,98
(dd, J = 8,4 Hz, 2,4 Hz, 1H), 6,77 (d, J = 2,4 Hz, 1H), 4,34 (s,
2H), 3,87 (s, 3H), 3,71 (s, 2H), 3,47 (d, J = 7,2 Hz, 2H), 2,95
(br d, J = 12 Hz, 2H), 2,15 (dt, J = 11,7 Hz, 2,4 Hz, 2H), 1,80
(m, 1H), 1,67 (br d, J = 12 Hz, 2H), 1,46 (dq, J = 12,4 Hz, 2H).
-
e) 5-Methoxy-2-((1-(2-(4-fluorphenyl)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-hydrochlorid
-
Unter
Verwendung der in Beispiel 9d erhaltenen Verbindung wurde die Titelverbindung
durch ähnliche Verfahren
erhalten wie in Beispiel 1f (Ausbeute: 65%).
Schmelzpunkt:
205–214°C
1H-NMR (DMSO-d6): δ 10,07 (br
s, 1H), 8,06-8,16 (m, 2H), 7,59 (d, J = 8,4 Hz, 1H), 7,47 (t, J
= 8,4 Hz, 2H), 7,17 (s, 1H), 7,03 (d, J = 8,4 Hz, 1H), 5,06-5,12
(m, 2H), 4,47 (s, 2H), 3,84 (s, 3H), 3,02-3,52 (m, 6H), 2,01 (m, 1H),
1,63-1,84 (m, 4H).
-
Beispiel 10: 5-Cyano-2-((1-(2-(4-fluorphenyl)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-hydrochlorid (Verbindung
21 in Tabelle 1)
-
a) 4-Cyano-2-methylbenzoesäuremethylester
-
4-Brom-2-methylbenzoesäuremethylester
(17,5 mmol) wurde gelöst
in N-Methyl-2-pyrrolidon
(24 ml). Der Lösung
wurde CuCN (21,0 mmol) zugesetzt und anschließend auf 180°C erhitzt.
Nach 5 Stunden wurde die Reaktionsmischung auf Raumtemperatur abgekühlt, mit
40 ml Wasser versetzt und filtriert. Der im Filter zurückbleibende
Feststoff wurde mit Aceton extrahiert, und der Extrakt wurde eingeengt,
um die Titelverbindung zu erhalten (Ausbeute: 45%).
1H-NMR (CDCl3): δ 7,97 (d,
J = 8,6 Hz, 1H), 7,55 (s, 1H), 7,54 (d, J = 8,6 Hz, 1H), 3,93 (s,
3H), 2,62 (s, 3H).
-
b) 4-(5-Cyano-1-oxoisoindolin-2-yl-methyl)-piperidin-1-tert-butylcarboxylat
-
Unter
Verwendung der in Beispiel 10a erhaltenen Verbindung wurde die Titelverbindung
durch ähnliche
Verfahren erhalten wie in den Beispielen 1b und 1c (Ausbeute: 40%).
1H-NMR (CDCl3): δ 7,96 (d,
J = 7,5 Hz, 1H), 7,78 (d, J = 7,5 Hz, 1H), 7,76 (s, 1H), 4,48 (s,
2H), 4,11 (m, 2H), 3,53 (m, 2H), 2,69 (br t, J = 12 Hz, 2H), 1,95
(m, 1H), 1,64 (br d, J = 12 Hz, 2H), 1,45 (s, 9H), 1,26 (dq, J =
12 Hz, 4 Hz, 2H).
-
c) 5-Cyano-2-(piperidin-4-yl-methyl)-isoindolin-1-on-hydrochlorid
-
Unter
Verwendung der in Beispiel 10b erhaltenen Verbindung wurde die Titelverbindung
durch ähnliche
Verfahren wie in Beispiel 1d erhalten (Ausbeute: 100%).
1H-NMR (DMSO-d6): δ 9,06 (br
s, 1H), 8,80 (br s, 1H), 8,16 (s, 1H), 7,95 (d, J = 7,4 Hz, 1H),
7,84 (d, J = 7,4 Hz, 1H), 4,57 (s, 2H), 3,45 (d, J = 7,3 Hz, 2H),
3,22 (br d, J = 12 Hz, 2H), 2,78 (br q, J = 12 Hz, 2H), 2,02 (m, 1H),
1,73 (br d, J = 12 Hz, 2H), 1,39 (br q, J = 12 Hz, 2H).
-
d) 5-Cyano-2-((1-(2-(4-fluorphenyl)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on
-
Unter
Verwendung der in Beispiel 10c erhaltenen Verbindung wurde die Titelverbindung
durch ähnliche
Verfahren erhalten wie in Beispiel 1e (Ausbeute: 79%).
1H-NMR (CDCl3): δ 8,07 (m,
2H), 7,95 (d, J = 7,8 Hz, 1H), 7,77 (d, J = 7,8 Hz, 1H), 7,76 (s,
1H), 7,12 (t, J = 8,4 Hz, 2H), 4,48 (s, 2H), 3,74 (s, 2H), 3,54
(d, J = 7,2 Hz, 2H), 2,97 (br d, J = 12 Hz, 2H), 2,15 (dt, J = 11,4
Hz, 2,1 Hz, 2H) 1,84 (m, 1H), 1,66 (br d, J = 12 Hz, 2H), 1,48 (dq,
J = 12,4 Hz, 2H).
-
e) 5-Cyano-2-((1-(2-(4-fluorphenyl)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-hydrochlorid
-
Unter
Verwendung der in Beispiel 10d erhaltenen Verbindung wurde die Titelverbindung
durch ähnliche
Verfahren erhalten wie in Beispiel 1f (Ausbeute: 85%).
Schmelzpunkt:
212–217°C
1H-NMR (DMSO-d6): δ 10,00 (br
s, 1H), 8,18 (s, 1H), 8,06-8,14 (m, 2H), 7,97 (d, J = 8 Hz, 1H),
7,86 (d, J = 8 Hz, 1H), 7,48 (t, J = 8,8 Hz, 2H), 5,06-5,12 (m,
2H), 4,61 (s, 2H), 3,01-3,61 (m, 6H), 2,06 (m, 1H), 1,59-1,87 (m,
4H).
-
Beispiel 11: 4-Nitro-2-((1-(2-(4-fluorphenyl)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-hydrochlorid (Verbindung
25 in Tabelle 1)
-
a) 2-Methyl-3-nitro-benzoesäuremethylester
-
Unter
Verwendung von 2-Methyl-3-nitro-benzoesäure (3,0 g, 16,56 mmol) wurde
die Titelverbindung durch ähnliche
Verfahren wie in Beispiel 3a als farbloser Feststoff erhalten (1,74
g). Das Produkt wurde ohne Aufreinigung in die nächste Reaktion eingesetzt.
-
b) 2-Brommethyl-3-nitro-benzoesäuremethylester
-
Unter
Verwendung der in Beispiel 11a erhaltenen Verbindung (1,00 g) wurde
die Titelverbindung durch ähnliche
Verfahren wie in Beispiel 1b erhalten als blassgelbes Öl (1,43
g). Das Produkt wurde ohne Aufreinigung in die nächste Reaktion eingesetzt.
-
c) 4-((4-Nitroisoindolin-1-on)-2-yl-methyl)-piperidin-1-tert-butylcarboxylat
-
Unter
Verwendung der in Beispiel 11b erhaltenen Verbindung (783 mg) wurde
die Titelverbindung durch ähnliche
Verfahren wie in Beispiel 1c erhalten als blassbrauner Feststoff
(590 mg, Ausbeute: 56%).
1H-NMR (CDCl3): δ 8,40
(dd, J = 8,2 Hz, 0,9 Hz, 1H), 8,19 (d, J = 7,6 Hz, 1H), 7,71 (dd,
J = 7,9 Hz, 7,9 Hz, 1H), 4,88 (s, 2H), 4,11 (br s, 2H), 3,57 (br
d, J = 7,2 Hz, 2H), 2,71 (br dd, J = 12,9 Hz, 12,9 Hz, 2H), 2,04-1,96
(m, 1H), 1,69-1,58 (m, 2H), 1,45 (s, 9H), 1,35-1,21 (m, 2H).
-
d) 4-Nitro-2-(piperidin-4-yl-methyl)-isoindolin-1-on-hydrochlorid
-
Unter
Verwendung der in Beispiel 11c erhaltenen Verbindung (590 mg, 1,57
mmol) wurde die Titelverbindung durch ähnliche Verfahren wie in Beispiel
1d erhalten als farbloser Feststoff (454 mg, Ausbeute: 93%).
1H-NMR (DMSO-d6): δ 8,96 (br
s, 1H), 8,71 (br s, 1H), 8,45 (d, J = 8,4 Hz, 1H), 8,13 (d, J =
7,5 Hz, 1H), 7,82 (dd, J = 7,8 Hz, 7,8 Hz, 1H), 4,94 (s, 2H), 3,50
(d, J = 7,5 Hz, 2H), 3,25 (br d, J = 12,3 Hz, 2H), 2,77 (br dd,
J = 23,1 Hz, 11,7 Hz, 2H), 2,13-2,06 (m, 1H), 1,76 (br d, J = 12,6
Hz, 2H), 1,47-1,33 (m, 2H).
-
e) 4-Nitro-2-((1-(2-(4-fluorphenyl)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on
-
Unter
Verwendung der in Beispiel 11d erhaltenen Verbindung (454 mg, 1,46
mmol) wurde die Titelverbindung durch ähnliche Verfahren wie in Beispiel
1e erhalten als blassgelber Feststoff (344 mg, Ausbeute: 57%).
1H-NMR (CDCl3): δ 8,40 (d,
J = 8,2 Hz, 1H), 8,18 (d, J = 7,4 Hz, 1H), 8,10-8,05 (m, 2H), 7,70
(dd, J = 7,8 Hz, 7,8 Hz, 1H), 7,09 (dd, J = 8,6 Hz, 8,6 Hz, 2H),
4,88 (s, 2H), 3,72 (s, 2H), 3,57 (d, J = 7,2 Hz, 2H), 2,97 (br d, 2H),
2,21-2,12 (m, 2H), 1,88-1,83 (m, 1H), 1,71 (br s, 2H), 1,56-1,47
(m, 2H).
-
f) 2-((1-(2-(4-Fluorphenyl)-2-oxoethyl)-piperidin-4-yl)-methyl)-4-nitroisoindolin-1-on-hydrochlorid
-
Unter
Verwendung der in Beispiel 11e erhaltenen Verbindung (320 mg, 0,78
mmol) wurde die Titelverbindung durch ähnliche Verfahren wie in Beispiel
1f erhalten als farbloser Feststoff (262 mg, Ausbeute: 75%).
Schmelzpunkt:
177–181°C
1H-NMR (DMSO-d6): δ 9,90 (br
s, 1H), 8,46 (d, J = 8,4 Hz, 1H), 8,16-8,09 (m, 3H), 7,83 (dd, J
= 7,8 Hz, 7,8 Hz, 1H), 7,48 (dd, J = 8,7 Hz, 8,7 Hz, 2H), 4,97 (s,
4H), 3,53 (br s, 4H), 3,02 (br s, 2H), 2,12 (br s, 1H), 1,83-1,61 (m,
4H).
-
Beispiel 12: 6-Nitro-2-((1-(2-(4-fluorphenyl)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-fumarat
(Verbindung 23 in Tabelle 1)
-
a) 2-Methyl-5-nitro-benzoesäuremethylester
-
Unter
Verwendung von 2-Methyl-5-nitro-benzoesäure (2,0 g, 11,04 mmol) wurde
die Titelverbindung durch ähnliche
Verfahren wie in Beispiel 3a erhalten als farbloser Feststoff (2,14
g). Das Produkt wurde ohne Aufreinigung in die nächste Reaktion eingesetzt.
-
b) 2-Brommethyl-5-nitro-benzoesäuremethylester
-
Unter
Verwendung der in Beispiel 12a erhaltenen Verbindung (2,14 g) wurde
die Titelverbindung durch ähnliche
Verfahren wie in Beispiel 1b erhalten als blassbraunes Öl (3,22
g). Das Produkt wurde ohne Aufreinigung in die nächste Reaktion eingesetzt.
-
c) 4-((6-Nitroisoindolin-1-on)-2-yl-methyl)-piperidin-1-tert-butylcarboxylat
-
Unter
Verwendung der in Beispiel 12b erhaltenen Verbindung (3,22 g) wurde
die Titelverbindung durch ähnliche
Verfahren wie in Beispiel 1c erhalten als blassbrauner Feststoff
(864 mg, Ausbeute: 21%).
1H-NMR (CDCl3): δ 8,68
(d, J = 2,1 Hz, 1H), 8,43 (dd, J = 8,4 Hz, 1,8 Hz, 1H), 7,62 (d,
J = 8,1 Hz, 1H), 4,53 (s, 2H), 4,11 (br s, 2H), 3,53 (br s, 2H),
2,70 (br dd, J = 12,0 Hz, 12,0 Hz, 2H), 2,00-1,92 (m, 1H), 1,68-1,64
(m, 2H), 1,45 (s, 9H), 1,33-1,20 (m, 2H).
-
d) 6-Nitro-2-(piperidin-4-yl-methyl)-isoindolin-1-on-hydrochlorid
-
Unter
Verwendung der in Beispiel 12c erhaltenen Verbindung (860 mg, 2,29
mmol) wurde die Titelverbindung durch ähnliche Verfahren wie in Beispiel
1d erhalten als farbloser Feststoff (732 mg, Ausbeute: quantitativ).
1H-NMR (DMSO-d6): δ 8,93 (br
s, 1H), 8,67 (br s, 1H), 8,47 (dd, J = 8,3 Hz, 2,3 Hz, 1H), 8,35
(d, J = 2,1 Hz, 1H), 7,92 (d, J = 8,4 Hz, 1H), 4,67 (s, 2H), 3,46
(br s, 2H), 3,25 (br d, J = 13,3 Hz, 2H), 2,80 (br dd, J = 23,1 Hz,
12,0 Hz, 2H), 2,07-2,00
(m, 1H), 1,75 (br d, J = 12,3 Hz, 2H), 1,46-1,34 (m, 2H).
-
e) 6-Nitro-2-((1-(2-(4-fluorphenyl)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on
-
Unter
Verwendung der in Beispiel 12d erhaltenen Verbindung (725 mg, 2,33
mmol) wurde die Titelverbindung durch ähnliche Verfahren wie in Beispiel
1e erhalten als blassgelber Feststoff (637 mg, Ausbeute: 67%).
1H-NMR (CDCl3): δ 8,68 (d,
J = 2,1 Hz, 1H), 8,43 (dd, J = 8,4 Hz, 2,1 Hz, 1H), 8,09-8,02 (m, 2H), 7,63
(d, J = 8,4 Hz, 1H), 7,16-7,08 (m, 2H), 4,54 (s, 2H), 3,74 (s, 2H),
3,55 (d, J = 7,2 Hz, 2H), 2,98 (br d, J = 9,9 Hz, 2H), 2,20-2,19
(m, 2H), 1,87-1,81
(m, 1H), 1,70 (br d, J = 12,9 Hz, 2H), 1,56-1,47 (m, 2H).
-
f) 6-Nitro-2-((1-(2-(4-fluorphenyl)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-fumarat
-
Die
in Beispiel 12e erhaltene Verbindung (287 mg, 0,70 mmol) wurde gelöst in Dichlormethan
(3 ml) und Aceton (3 ml), und der Lösung wurde bei Raumtemperatur
Fumarsäure
zugefügt
(41 mg, 0,35 mmol) und für
3 Stunden gerührt.
Der Niederschlag wurde durch Filtration gesammelt, um die Titelverbindung
als farblosen Feststoff zu erhalten (148 mg, Ausbeute: 40%).
Schmelzpunkt:
195–206°C
1H-NMR (DMSO-d6): δ 8,46 (dd,
J = 8,3 Hz, 2,3 Hz, 1H), 8,34 (d, J = 2,4 Hz, 1H), 8,11-8,07 (m,
2H), 7,88 (d, J = 8,4 Hz, 1H), 7,38-7,32 (m, 2H), 6,61 (s, 2H),
4,66 (s, 2H), 3,86 (s, 2H), 3,44 (d, J = 7,5 Hz, 2H), 2,90 (br d,
J = 11,4 Hz, 2H), 2,16 (br t, J = 10,8 Hz, 2H), 1,79-1,74 (m, 1H),
1,59 (br d, J = 11,7 Hz, 2H), 1,30-1,19 (m, 2H).
-
Beispiel 13: 2-((1-(2-Phenyl-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-hydrochlorid (Verbindung
26 in Tabelle 1)
-
a) 2-((1-(2-Phenyl-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on
-
Eine
Lösung
von der in Beispiel 1d erhaltenen Verbindung (400 mg, 1,50 mmol),
2-Bromacetophenon (299 mg, 1,50 mmol) und Triethylamin (0,46 ml,
3,30 mmol) in Dimethylformamid (3 ml) wurde bei Raumtemperatur für 3 Stunden
gerührt.
Die Reaktionsmischung wurde mit Wasser (10 ml) versetzt und bei
Raumtemperatur gerührt,
und anschließend
wurden die niedergeschlagenen Kristalle durch Filtration gesammelt
und mit Wasser gewaschen, um die Titelverbindung zu erhalten (319
mg, Ausbeute: 61%).
1H-NMR (CDCl3): δ 8,01
(d, 2H), 7,84 (d, 1H), 7,56-7,42 (m, 6H), 4,41 (s, 2H), 3,79 (s,
1H), 3,51 (d, 2H), 3,00 (br d, 2H), 2,16 (dt, 2H), 1,82 (m, 1H),
1,70 (m, 2H), 1,52 (dt, 2H).
-
b) 2-((1-(2-Phenyl-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-hydrochlorid
-
Die
in Beispiel 13a erhaltene Verbindung (319 mg) wurde in Ethanol-Ethylacetat
gelöst.
Zur Lösung wurde
4N HCl in Ethylacetat gegeben. Die niedergeschlagenen Kristalle
wurden durch Filtration gesammelt, um die Titelverbindung als weißen Feststoff
zu erhalten (299 mg, Ausbeute: 85%).
Schmelzpunkt: 190–197°C
1H-NMR (DMSO-d6): δ 9,91 (br
s, 1H), 8,03 (m, 2H), 7,77 (m, 1H), 7,65 (m, 1H), 7,49 (m, 1H),
5,06 (m, 2H), 4,54 (s, 2H), 3,48 (m, 2H), 3,03 (m, 2H), 2,04 (m,
1H), 1,99–1,61
(m, 4H).
-
Beispiel 14: 2-((1-(2-(4-Chlorphenyl)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-hydrochlorid
(Verbindung 51 in Tabelle 1)
-
a) 2-((1-(2-(4-Chlorphenyl)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on
-
Eine
Lösung
von der in Beispiel 1d erhaltenen Verbindung (400 mg, 1,50 mmol),
2-Brom-4'-chloracetophenon
(350 mg, 1,50 mmol) und Triethylamin (0,46 ml, 3,30 mmol) in Dimethylformamid
(3 ml) wurde bei Raumtemperatur für 3 Stunden gerührt. Zur
Reaktionsmischung wurde Wasser gegeben und anschließend mit Ethylacetat
extrahiert. Der Extrakt wurde viermal mit Wasser gewaschen und über Natriumsulfat
getrocknet. Das Lösemittel
wurde verdampft und der Rückstand
aus Ethylacetat-Hexan auskristallisiert, um die Titelverbindung
zu erhalten (318 mg, Ausbeute: 55%).
1H-NMR
(CDCl3): δ 7,99
(d, 2H), 7,84 (d, 2H), 7,56-7,40 (m, 5H), 4,41 (s, 2H), 3,73 (s,
2H), 3,51 (d, 1H), 2,95 (br d, 2H), 2,15 (dt, 2H), 1,82 (m, 1H),
1,70 (m, 2H), 1,50 (dt, 2H).
-
b) 2-((1-(2-(4-Chlorphenyl)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-hydrochlorid
-
Die
in Beispiel 14a erhaltene Verbindung (318 mg) wurde in Ethanol-Ethylacetat
gelöst
und zu der Lösung
wurde 4N Chlorwasserstoff in Ethylacetat gegeben. Die niedergeschlagenen
Kristalle wurden durch Filtration gesammelt, um die Titelverbindung
als weißen
Feststoff zu erhalten (268 mg, Ausbeute: 77%).
Schmelzpunkt:
188–196°C.
1H-NMR (DMSO-d6): δ 9,97 (br
s, 1H), 8,00 (m, 2H), 7,68 (m, 3H), 7,57 (m, 2H), 7,47 (m, 1H),
5,03 (m, 2H), 4,51 (s, 2H), 3,54-2,95 (m, 6H), 1,97 (m, 1H), 1,80-1,60 (m, 4H).
-
Beispiel 15: 2-((1-(2-(4-Methoxyphenyl)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-hydrochlorid
(Verbindung 64 in Tabelle 1)
-
a) 2-((1-(2-(4-Methoxyphenyl)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on
-
Eine
Lösung
von der in Beispiel 1d erhaltenen Verbindung (400 mg, 1,50 mmol),
2-Brom-4'-methoxyacetophenon
(344 mg, 1,50 mmol) und Triethylamin (0,46 ml, 3,30 mmol) in Dimethylformamid
(3 ml) wurde bei Raumtemperatur für 3 Stunden gerührt. Zur
Reaktionsmischung wurde Wasser (10 ml) gegeben und bei Raumtemperatur
gerührt.
Anschließend
wurden die niedergeschlagenen Kristalle durch Filtration gesammelt und
mit Wasser gewaschen, um die Titelverbindung zu erhalten (537 mg,
Ausbeute: 95%).
1H-NMR (CDCl3): δ 8,02
(d, 2H), 7,85 (d, 1H), 7,53-7,42 (m, 3H), 6,91 (d, 2H), 4,41 (s,
2H), 3,87 (s, 3H), 3,73 (s, 2H), 3,51 (d, 2H), 2,98 (br d, 2H),
2,15 (dt, 2H), 1,81 (m, 1H), 1,70 (m, 2H), 1,51 (dt, 2H).
-
b) 2-((1-(2-(4-Methoxyphenyl)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin)-1-on-hydrochlorid
-
Die
in Beispiel 15a erhaltene Verbindung (537 mg) wurde in Ethanol-Ethylacetat
gelöst
und mit 4N Chlorwasserstoff in Ethylacetat versetzt. Die niedergeschlagenen
Kristalle wurden durch Filtration gesammelt, um die Titelverbindung
als weißen
Feststoff zu erhalten (444 mg, Ausbeute: 75%).
Schmelzpunkt:
163–168°C
1H-NMR (DMSO-d6): δ 9,85 (br
s, 1H), 7,95 (m, 2H), 7,67 (d, 1H), 7,59 (d, 2H), 7,47 (m, 1H),
7,12 (d, 2H), 4,95 (m, 2H), 4,51 (s, 2H), 3,86 (s, 3H), 3,45 (m,
4H), 2,99 (m, 2H), 2,01 (m, 1H), 1,65 (m, 4H).
-
Beispiel 16: (R,S)-2-((1-(2-(4-Fluorphenyl)-2-hydroxyethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-hydrochlorid (Verbindung
77 in Tabelle 1)
-
a) (R,S)-2-((1-(2-(4-Fluorphenyl)-2-hydroxyethyl)-piperidin)-methyl)-isoindolin)-1-on
-
Die
in Beispiel 1f erhaltene Verbindung (403 mg, 1,0 mmol) wurde mit
Methylenchlorid und 1N Natriumhydroxid-Lösung behandelt. Die Methylenchlorid-Phase
wurde über
Natriumsulfat getrocknet und das Lösemittel anschließend verdampft.
Der resultierende Rückstand
wurde zu 15 ml ethanolischer Lösung
gelöst und
der Lösung
wurde anschließend
Natriumborhydrid (30 mg, 0,79 mmol) zugegeben und bei Raumtemperatur
für 2 Stunden
gerührt.
Das Lösemittel
wurde verdampft und der Rückstand
zur Bildung einer Suspension mit Wasser versetzt. Die resultierenden
Kristalle wurden durch Filtration gesammelt, um die Titelverbindung als
weißen
Feststoff zu erhalten (331 mg, Ausbeute: 90%).
1H-NMR
(CDCl3): δ 7,86
(d, 1H), 7,55-7,43 (m, 3H), 7,32 (m, 2H), 7,02 (m, 2H), 4,69 (m,
1H), 4,42 (s, 2H), 3,53 (d, 2H), 3,15 (m, 1H), 2,82 (m, 1H), 2,49-2,00
(m, 4H), 1,84 (m, 1H), 1,70 (m, 2H), 1,40 (m, 2H).
-
b) (R,S)-2-((1-(2-(4-Fluorphenyl)-2-hydroxyethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-hydrochlorid
-
Die
in Beispiel 16a erhaltene Verbindung (331 mg) wurde gelöst in Ethanol-Ethylacetat und versetzt mit
4N Chlorwasserstoff in Ethylacetat. Die niedergeschlagenen Kristalle
wurden durch Filtration gesammelt, um die Titelverbindung als weißen Feststoff
zu erhalten (347 mg, Ausbeute: 95%).
Schmelzpunkt: 223–228°C
1H-NMR (DMSO-d6): δ 9,82 (br
s, 1H), 7,68 (d, 1H), 7,61 (d, 2H), 7,48 (m, 3H), 7,22 (m, 2H),
6,26 (m, 1H), 5,15 (m, 1H), 4,52 (s, 2H), 3,63 (m, 2H), 3,45 (d,
2H), 3,18 (m, 2H), 2,95 (m, 2H), 1,99 (m, 1H), 1,86-1,57 (m, 4H).
-
Beispiel 17: (R,S)-5-Brom-2-((1-(2-(4-fluorphenyl)-2-hydroxyethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-hydrochlorid
(Verbindung 79 in Tabelle 1)
-
a) (R,S)-5-Brom-2-((1-(2-(4-fluorphenyl)-2-hydroxyethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on
-
Unter
Verwendung der in Beispiel 3e erhaltenen Verbindung (678 mg, 1,52
mmol) wurde die Titelverbindung durch ähnliche Verfahren wie in Beispiel
16a erhalten als farbloser Feststoff (677 mg, Ausbeute: 99%).
1H-NMR (CDCl3): δ 7,70-7,74
(m, 1H), 7,60-7,63 (m, 2H), 7,31-7,36 (m, 2H), 6,99-7,06 (m, 2H),
4,69 (dd, J = 3,6 Hz, 10,2 Hz, 1H), 4,40 (s, 2H), 3,51 (d, J = 6,9
Hz, 2H), 3,1-3,2 (m, 1H), 2,7-2,8 (m, 1H), 2,30-2,51 (m, 2H), 2,2-2,3
(m, 1H), 2,0-2,1 (m, 1H), 1,3-1,9 (m, 5H).
-
b) (R,S)-5-Brom-2-((1-(2-(4-fluorphenyl)-2-hydroxyethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-hydrochlorid
-
Unter
Verwendung der in Beispiel 17a erhaltenen Verbindung (313 mg, 0,700
mmol) wurde die Titelverbindung durch ähnliche Verfahren wie in Beispiel
1f als farbloser Feststoff erhalten (317 mg, Ausbeute: 94%).
Schmelzpunkt:
230–240°C
1H-NMR (DMSO-d6): δ 9,81 (br
s, 1H), 7,90 (d, J = 0,9 Hz, 1H), 7,70 (dd, J = 0,9 Hz, 8,0 Hz,
1H), 7,62 (d, J = 8,0 Hz, 1H), 7,43-7,53 (m, 2H), 7,20-7,26 (m,
2H), 6,29-6,31 (m, 1H), 5,0-5,2 (m, 1H), 4,52 (s, 2H), 3,5-3,7 (m, 2H),
2,8-3,5 (m, 4H), 1,5-2,2 (m, 5H).
-
Beispiel 18: 2-((1-(2-(4-Fluorphenyl)-2-(Z)-hydroxyiminoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-fumarat (Z-Isomer
von Verbindung 90 in Tabelle 1)
-
a) 2-((1-(2-(4-Fluorphenyl)-2-(Z)-hydroxyiminoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on
-
Die
in Beispiel 1e erhaltene Verbindung (496 mg, 1,35 mmol) wurde in
einer Lösemittelmischung
aus Ethanol (10 ml) und Pyridin (10 ml) gelöst. Der Lösung wurde bei Raumtemperatur
Hydroxylaminhydrochlorid (255 mg, 3,67 mmol) zugefügt und für 5 Tage
bei gleicher Temperatur weiter gerührt. Die Reaktionsmischung wurde
mit Ethylacetat verdünnt
und mit wässriger
Natriumhydrogencarbonat-Lösung
und anschließend
mit gesättigter
Kochsalzlösung
gewaschen und über
Natriumsulfat getrocknet. Unlöslicher
Niederschlag wurde durch Filtration abgetrennt und das Lösemittel
unter vermindertem Druck verdampft. Der resultierende Feststoff
wurde über
Silicagel-Säulenchromatographie
(Methanol/Dichlormethan) gereinigt, um die Titelverbindung (295 mg,
Ausbeute: 57%) und das E-Isomer (216 mg, Ausbeute: 42%) als farblose
Feststoffe zu erhalten.
(Z-Isomer)
1H-NMR
(CDCl3): δ 7,85
(d, J = 7,4 Hz, 1H), 7,42-7,64 (m, 5H), 7,01-7,07 (m, 2H), 4,41
(s, 2H), 3,74 (s, 2H), 3,52 (d, J = 7,4 Hz, 2H), 3,0-3,1 (m, 2H),
2,13-2,22 (m, 2H), 1,8-2,0 (m, 1H), 1,7-1,8 (m, 2H), 1,3-1,5 (m,
2H)
(E-Isomer)
1H-NMR (CDCl3): δ 7,84
(d, J = 6,9 Hz, 1H), 7,61-7,67 (m, 2H), 7,41-7,54 (m, 3H), 7,05-7,12
(m, 2H), 4,38 (s, 2H), 3,48 (d, J = 7,2 Hz, 2H), 3,31 (s, 2H), 2,8-3,0
(m, 2H), 1,9-2,05 (m, 2H), 1,5-1,8 (m, 3H), 1,3-1,4 (m, 2H).
-
b) 2-((1-(2-(4-Fluorphenyl)-2-(Z)-hydroxyiminoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-fumarat
-
Unter
Verwendung des in Beispiel 18a erhaltenen Z-Isomers (289 mg, 0,756
mmol) wurde die Titelverbindung durch ähnliche Verfahren wie in Beispiel
36c als farbloser Feststoff erhalten (320 mg, Ausbeute: 85%).
Schmelzpunkt:
178–180°C
1H-NMR (DMSO-d6): δ 7,76-7,81
(m, 2H), 7,4-7,7 (m, 4H), 7,16-7,23 (m, 2H), 6,62 (s, 2H, Fumarsäure), 4,45 (s,
2H), 3,61 (s, 2H), 3,2-3,4 (m, 2H), 2,7-2,8 (m, 2H), 1,9-2,1 (m,
2H), 1,6-1,8 (m, 1H), 1,4-1,6 (m, 2H), 1,0-1,2 (m, 2H).
-
Beispiel 19: 2-((1-(2-(4-Fluorphenyl)-2-(E)-hydroxyiminoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-fumarat (E-Isomer
der Verbindung 90 in Tabelle 1)
-
Unter
Verwendung des in Beispiel 18a erhaltenen E-Isomers (214 mg, 0,560
mmol) wurde die Titelverbindung durch ähnliche Verfahren wie in Beispiel
36c als farbloser Feststoff erhalten (225 mg, Ausbeute: 81 %).
Schmelzpunkt:
186–188°C
1H-NMR (DMSO-d6): δ 11,03 (br
s, 1H, OH), 7,4-7,7 (m, 6H), 7,19-7,25 (m, 2H), 6,62 (s, 2H, Fumarsäure), 4,46 (s,
2H), 3,2-3,4 (m, 2H), 2,8-2,9 (m, 2H), 1,9-2,05 (m, 2H), 1,6-1,8
(m, 1H), 1,4-1,6 (m, 2H), 1,0-1,2 (m, 2H).
-
Beispiel 20: 2-((1-(2-(2,4-Difluorphenyl)-2-hydroxyiminoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-hydrochlorid
(Verbindung 116 in Tabelle 1)
-
a) 2-Chlor-2',4'-difluoracetophenonoxim
-
2-Chlor-2',4'-difluoracetophenon
(3,09 g, 16,2 mmol) wurde in Ethanol (30 ml) gelöst. Zu der Lösung wurde
unter Eiskühlung
schrittweise Hydroxylaminhydrochlorid (1,23 g, 17,7 mmol) und Natriumacetat
(1,45 g, 17,7 mmol) gegeben, und der Mischung wurde erlaubt, sich
auf Raumtemperatur zu erwärmen,
und es wurde für
20 Stunden gerührt.
Das Lösemittel
der Reaktion wurde unter vermindertem Druck verdampft und der Rückstand
mit Ethylacetat verdünnt
und mit einer wässrigen
Natriumhydrogencarbonat-Lösung
sowie anschließend
mit gesättigter
Kochsalzlösung
gewaschen und über
Magnesiumsulfat getrocknet. Unlösliche
Feststoffe wurden durch Filtration abgetrennt und das Lösemittel
wurde unter vermindertem Druck verdampft. Der Rückstand wurde in Hexan suspendiert
und getrocknet, um die Titelverbindung als farblosen Feststoff zu
erhalten (2,29 g, Ausbeute: 69%).
1H-NMR
(CDCl3): δ 8,74
(s, 1H), 7,48-7,56 (m, 1H), 6,85-6,99 (m, 2H), 4,63 (s, 2H).
-
b) 2-((1-(2-(2,4-Difluorphenyl)-2-hydroxyiminoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on
-
Unter
Verwendung der in Beispiel 20a erhaltenen Verbindung (710 mg, 3,45
mmol) und der in Beispiel 1d erhaltenen Verbindung (880 mg, 3,30
mmol) wurde die Titelverbindung durch ähnliche Verfahren wie in Beispiel
1e erhalten als farbloser Feststoff (1,38 g, Ausbeute: 100%).
1H-NMR (CDCl3): δ 8,3 (br
s, 1H), 7,84 (d, J = 7,5 Hz, 1H), 7,41-7,53 (m, 3H), 7,25-7,31 (m,
1H), 6,81-6,92 (m, 2H), 4,38 (s, 2H), 3,46 (d, J = 7,2 Hz, 2H),
3,33 (s, 2H), 2,87-2,91 (m, 2H), 1,96-2,05 (m, 2H), 1,5-1,9 (m,
3H), 1,2-1,4 (m, 2H).
-
c) 2-((1-(2-(2,4-Difluorphenyl)-hydroxyiminoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-hydrochlorid
-
Unter
Verwendung der in Beispiel 20b erhaltenen Verbindung (213 mg, 0,533
mmol) wurde die Titelverbindung durch ähnliche Verfahren wie in Beispiel
1f erhalten als farbloser Feststoff (168 mg, Ausbeute: 72%).
Schmelzpunkt:
152–157°C
1H-NMR (DMSO-d6): δ 12,1 (s,
1H), 9,92 (br s, 1H), 7,65 (d, J = 7,5 Hz, 1H), 7,45-7,59 (m, 4H), 7,32-7,39
(m, 1H), 7,17-7,23 (m, 1H), 4,48 (s, 2H), 4,20-4,38 (m, 2H), 3,3-3,6
(m, 4H), 2,8-3,0 (m, 2H), 1,4-2,2 (m, 5H).
-
Beispiel 21: (R,S)-5-Brom-2-((1-(2-(4-fluorphenyl)-2-acetoxyethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-hydrochlorid
(Verbindung 105 in Tabelle 1)
-
a) (R,S)-5-Brom-2-((1-(2-(4-fluorphenyl)-2-acetoxyethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on
-
Die
in Beispiel 17a erhaltene Verbindung (360 mg, 0,805 mmol) und Dimethylaminopyridin
(139 mg, 1,14 mmol) wurden gelöst
in Dichlormethan (6 ml). Der Lösung
wurde Essigsäureanhydrid
(100 μl,
1,06 mmol) unter Eiskühlung
zugesetzt, und das Rühren
wurde bei gleicher Temperatur für
2 Stunden fortgesetzt. Die Reaktionsmischung wurde mit Ethylacetat
verdünnt,
mit Eiswasser, einer wässrigen
Natriumhydrogencarbonat-Lösung
sowie anschließend
mit gesättigter
Kochsalzlösung
gewaschen und über
Natriumsulfat getrocknet. Unlösliche
Feststoffe wurden durch Filtration abgetrennt und das Lösemittel
unter vermindertem Druck verdampft, um die Titelverbindung als farblosen
Feststoff zu erhalten (391 mg, Ausbeute: 99%).
1H-NMR
(CDCl3): δ 7,71
(d, J = 8,5 Hz, 1H), 7,58-7,62 (m, 2H), 7,27-7,33 (m, 2H), 6,98-7,05
(m, 2H), 5,89 (dd, J = 4,6 Hz, 8,4 Hz, 1H), 4,37 (s, 2H), 3,4-3,5
(m, 2H), 2,84-3,0 (m, 2H), 2,80 (dd, J = 8,4 Hz, 13,5 Hz, 1H), 2,52 (dd,
J = 4,6 Hz, 13,5 Hz, 1H), 2,11 (s, 3H), 1,9-2,2 (m, 2H), 1,7-1,8
(m, 1H), 1,5-1,7 (m, 2H), 1,2-1,4 (m, 2H).
-
b) (R,S)-5-Brom-2-((1-(2-(4-fluorphenyl)-2-acetoxyethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-hydrochlorid
-
Unter
Verwendung der in Beispiel 21a erhaltenen Verbindung (387 mg, 0,791
mmol) wurde die Titelverbindung durch ähnliche Verfahren wie in Beispiel
1f erhalten als farbloser Feststoff (285 mg, Ausbeute: 69%).
Schmelzpunkt:
193–200°C
1H-NMR (DMSO-d6): δ 11,0 (br
s, 1H), 7,90 (s, 1H), 7,69 (d, J = 8,1 Hz, 1H), 7,62 (d, J = 8,1
Hz, 1H), 7,44-7,53 (m, 2H), 7,22-7,31 (m, 2H), 6,0-6,2 (m, 1H),
4,49-4,52 (m, 2H),
3,2-3,7 (m, 6H), 2,8-3,0 (m, 2H), 2,12 (s, 3H), 1,4-2,0 (m, 5H).
-
Beispiel 22: 5-((1-(2-(4-Fluorphenyl)-2-oxoethyl)-piperidin-4-yl)-methyl)-4,5-dihydro-6H-thieno[2,3-c]-pyrrol-6-on-hydrochlorid
(Verbindung 776 in Tabelle 2)
-
a) 3-Methylthiophen-2-ethylcarboxylat
-
Unter
Verwendung von 3-Methyl-2-thiophencarbonsäure (1,5 g, 10,55 mmol), wurde
die Titelverbindung unter Anwendung ähnlicher Verfahren wie in Beispiel
1b erhalten als blassgelbes Öl
(1,20 g). Das Produkt wurde ohne Aufreinigung in die nächste Reaktion
eingesetzt.
-
b) 3-Brommethylthiophen-2-ethylcarboxylat
-
Unter
Verwendung der in Beispiel 22a erhaltenen Verbindung (1,20 g) wurde
die Titelverbindung unter Anwendung ähnlicher Verfahren wie in Beispiel
1b erhalten als blassbraunes Öl
(1,88 g). Das Produkt wurde ohne Aufreinigung in die nächste Reaktion
eingesetzt.
-
c) 3-((1-(tert-Butoxycarbonyl)-piperidin-4-yl)-methylaminomethyl)-thiophen-2-ethylcarboxylat
-
Unter
Verwendung der in Beispiel 22b erhaltenen Verbindung (1,88 g) wurde
die Titelverbindung unter Anwendung ähnlicher Verfahren wie in Beispiel
1c erhalten als blassbrauner Feststoff (2,02 g). Das Produkt wurde
ohne Aufreinigung in die nächste
Reaktion eingesetzt.
-
d) 3-((1-(tert-Butoxycarbonyl)-piperidin-4-yl)-methylaminomethyl)-thiophen-2-carbonsäure
-
Die
in Beispiel 22c erhaltene Verbindung 22c (1,0 g) wurde gelöst in Ethanol
(15 ml). Der Lösung
wurde Wasser (5 ml) zugefügt
und anschließend
unter Eiskühlung
Natriumhydroxid (400 mg, 10,0 mmol), anschließend wurde die Mischung auf
Raumtemperatur erwärmt
und gerührt.
Nach 6 Stunden wurde der Mischung unter Eiskühlung konzentrierte Salzsäure zugegeben,
um den pH-Wert auf
7,0 einzustellen. Anschließend
wurde mit Dichlormethan extrahiert. Die organische Phase wurde mit
Wasser gewaschen und über
Magnesiumsulfat getrocknet. Unlösliche
Feststoffe wurden durch Filtration abgetrennt und das Filtrat wurde
unter vermindertem Druck eingedampft. Der resultierende Feststoff
wurde in Dichlormethan (3 ml) gelöst. Der Lösung wurde Diethylether (20
ml) zugegeben und der Niederschlag wurde durch Filtration gesammelt,
um die Titelverbindung zu erhalten (416 mg, 35%, 3 Stufen).
1H-NMR (CDCl3): δ 11,4 (s,
2H), 7,32 (d, J = 5,1 Hz, 1H), 6,91 (d, J = 4,5 Hz, 1H), 4,21 (s,
2H), 4,04 (s, 2H), 2,71-2,61 (m, 4H), 1,96 (br s, 1H), 1,79 (br
d, J = 12,6 Hz, 2H), 1,41 (s, 9H), 1,16-1,03 (m, 2H).
-
e) 4-((4,5-Dihydro-6H-thieno[2,3-c]-pyrrol-6-on)-2-yl-methyl)-piperidin-1-tert-butylcarboxylat
-
Die
in Beispiel 22d erhaltene Verbindung (500 mg) wurde gelöst in Dichlormethan
(14 ml) und unter Eiskühlung
wurde Methansulfonylchlorid (0,11 ml, 1,41 mmol) zugegeben. Die
Mischung wurde bei gleicher Temperatur 1 Stunde gerührt, dann
auf Raumtemperatur erwärmt
und für
17 Stunden gerührt.
Der Reaktionsmischung wurde Wasser (5 ml) bei gleicher Temperatur
zugesetzt und mit Dichlormethan extrahiert. Die organische Phase
wurde mit Wasser gewaschen und über
Magnesiumsulfat getrocknet. Unlösliche
Feststoffe wurden durch Filtration abgetrennt und das Filtrat wurde
unter vermindertem Druck eingedampft. Das resultierende Öl wurde
mittels Silicagel-Säulenchromatographie
(Methanol/Dichlormethan) gereinigt, um die Titelverbindung als blassgrünen Feststoff
zu erhalten (247 mg, Ausbeute: 52%).
1H-NMR
(CDCl3): δ 7,63
(d, J = 4,5 Hz, 1H), 7,04 (d, J = 4,8 Hz, 1H), 4,33 (s, 2H), 4,11
(br s, 2H), 3,45 (br s, 2H), 2,69 (br dd, J = 12,3 Hz, 12,3 Hz,
2H), 1,93-1,87 (m, 1H), 1,67 (br d, J = 9,3 Hz, 2H), 1,45 (s, 9H),
1,30-1,16 (m, 2H).
-
f) 5-(piperidin-4-yl-methyl)-4,5-dihydro-6H-thieno[2,3-c]pyrrol-6-on-hydrochlorid
-
Unter
Verwendung der in Beispiel 22e erhaltenen Verbindung (310 mg, 0,90
mmol) wurde die Titelverbindung durch ähnliche Verfahren wie in Beispiel
1d erhalten als blassgrüner
Feststoff (200 mg, Ausbeute: 80%).
1H-NMR
(DMSO-d5): δ 8,90 (br s, 1H), 8,62 (br s,
1H), 7,98 (d, J = 4,7 Hz, 1H), 7,24 (d, J = 4,7 Hz, 1H), 4,44 (s,
2H), 3,38 (d, J = 7,4 Hz, 2H), 3,24 (br d, J = 12,6 Hz, 2H), 2,80
(br dd, J = 23,1 Hz, 12,1 Hz, 2H), 2,02-1,19 (m, 1H), 1,74 (br d,
J = 13,2 Hz, 2H), 1,43-1,29 (m, 2H).
-
g) 5-((1-(2-(4-Fluorphenyl)-2-oxoethyl)-piperidin-4-yl)-methyl)-4,5-dihydro-6H-thieno[2,3-c]-pyrrol-6-on
-
Unter
Verwendung der in Beispiel 22f erhaltenen Verbindung (193 mg, 0,71
mmol) wurde die Titelverbindung durch ähnliche Verfahren wie in Beispiel
1e erhalten als blassbrauner Feststoff (209 mg, Ausbeute: 79%).
1H-NMR (CDCl3): δ 8,10-8,04
(m, 2H), 7,62 (d, 1H), 7,15-7,07 (m, 2H), 7,02 (m, 1H), 4,32 (s,
2H), 3,72 (s, 2H), 3,45 (d, J = 7,1 Hz, 2H), 2,96 (br d, J = 11,5
Hz, 2H), 2,20-2,11 (m, 2H), 1,83-1,76 (m, 1H), 1,70 (br d, J = 13,9 Hz,
2H), 1,51-1,43 (m, 2H).
-
h) 5-((1-(2-(4-Fluorphenyl)-2-oxoethyl)-piperidin-4-yl)-methyl)-4,5-dihydro-6H-thieno[2,3-c]-pyrrol-6-on-hydrochlorid
-
Unter
Verwendung der in Beispiel 22g erhaltenen Verbindung (209 mg, 0,56
mmol) wurde die Titelverbindung durch ähnliche Verfahren wie in Beispiel
1f erhalten als farbloser Feststoff (178 mg, Ausbeute: 78%).
Schmelzpunkt:
167–171°C
1H-NMR (DMSO-d6): δ 9,94 (br
s, 1H), 8,19-8,06 (m, 2H), 7,99 (d, J = 4,8 Hz, 1H), 7,58 (dd, J
= 8,9 Hz, 8,9 Hz, 2H), 7,26 (d, J = 4,5 Hz, 1H), 5,11-5,04 (m, 2H),
4,47 (s, 2H), 3,54 (br d, J = 10,5 Hz, 2H), 3,31 (br s, 2H), 3,08-3,01
(m, 2H), 2,09-1,57 (m, 5H).
-
Beispiel 23: 6-((1-(2-(4-Fluorphenyl)-2-oxoethyl)-piperidin-4-yl)-methyl)-6,7-dihydro-5H-pyrrol[3,4-b]pyridin-5-on-dihydrochlorid
(Verbindung 796 in Tabelle 2)
-
a) 2-Brommethylpyridin-3-ethylcarboxylat
-
Unter
Verwendung von 2-Brommethylpyridin-3-carbonsäure (2,0 g, 12,11 mmol) wurde
die Titelverbindung durch ähnliche
Verfahren wie in Beispiel 1b erhalten als braunes Öl (1,02
g). Das Produkt wurde ohne Aufreinigung in die nächste Reaktion eingesetzt.
-
b) 4-((6,7-Dihydro-5H-pyrrol[3,4-b]pyridin-5-on)-2-yl-methyl)-piperidin-1-tert-butylcarboxylat
-
Unter
Verwendung der in Beispiel 23a erhaltenen Verbindung (1,01 g) wurde
die Titelverbindung durch ähnliche
Verfahren wie in Beispiel 1c erhalten als braunes Öl (945 mg).
Das Produkt wurde ohne Aufreinigung in die nächste Reaktion eingesetzt.
-
c) 6-Piperidin-4-yl-methyl)-6,7-dihydro-5H-pyrrol[3,4-b]pyridin-5-on-dihydrochlorid
-
Unter
Verwendung der in Beispiel 23b erhaltenen Verbindung (811 mg, 1,01
mmol) wurde die Titelverbindung durch ähnliche Verfahren wie in Beispiel
1d erhalten als farbloser Feststoff (416 mg, Ausbeute: 33%).
1H-NMR (DMSO-d6): δ 9,21 (s,
2H), 8,99 (s, 2H), 8,10 (dd, J = 8,6 Hz, 1,2 Hz, 1H), 7,54 (dd,
J = 7,7 Hz, 5,0 Hz, 1H), 4,57 (s, 2H), 3,47 (d, J = 7,4 Hz, 2H),
3,24 (br d, J = 12,3 Hz, 2H), 2,79 (br dd, J = 23,5 Hz, 12,3 Hz, 2H),
2,09-1,99 (m, 1H), 1,75 (br d, J = 12,9 Hz, 2H), 1,46-1,32 (m, 2H).
-
d) 2-((1-(2-(4-Fluorphenyl)-2-oxoethyl)-piperidin-4-yl)-methyl)-6,7-dihydro-5H-pyrrol[3,4-b]pyridin-5-on
-
Unter
Verwendung der in Beispiel 23c erhaltenen Verbindung (416 mg, 1,37
mmol) wurde die Titelverbindung durch ähnliche Verfahren wie in Beispiel
1e als blassbrauner Feststoff erhalten (377 mg, Ausbeute: 75%).
1H-NMR (CDCl3): δ 8,72 (dd,
J = 4,7 Hz, 1,4 Hz, 1H), 8,13-8,71 (m, 3H), 7,40 (dd, J = 7,6 Hz,
5,1 Hz, 1H), 7,12 (dd, J = 8,6 Hz, 8,6 Hz, 2H), 4,47 (s, 2H), 3,73
(s, 2H), 3,55 (d, J = 7,1 Hz, 2H), 2,97 (br d, J = 11,5 Hz, 2H), 2,15
(ddd, J = 2,1 Hz, 11,5 Hz, 11,5 Hz, 2H), 1,86-1,80 (m, 1H), 1,70
(br d, J = 13,0 Hz, 2H), 1,56-1,46 (m, 2H).
-
e) 2-((1-(2-(4-Fluorphenyl)-2-oxoethyl)-piperidin-4-yl)-methyl)-6,7-dihydro-5H-pyrrol[3,4-b]pyridin-5-on-dihydrochlorid
-
Unter
Verwendung der in Beispiel 23d erhaltenen Verbindung (377 mg, 1,03
mmol) wurde die Titelverbindung durch ähnliche Verfahren wie in Beispiel
1f als farbloser Feststoff erhalten (384 mg, Ausbeute: 85%).
Schmelzpunkt:
138–144°C
1H-NMR (DMSO-d6): δ 10,1 (br
s, 1H), 8,78 (dd, J = 4,7 Hz, 1,1 Hz, 1H), 8,19 (m, 3H), 7,57-7,45
(m, 3H), 5,13-5,05 (m, 2H), 4,61 (s, 2H), 3,62 (m, 3H), 3,32 (br
s, 1H), 3,04 (br dd, J = 21,8 Hz, 10,1 Hz, 2H), 2,07 (br s, 1H),
1,89-1,60 (m, 4H).
-
Beispiel 24: 2-((1-(3,3-Dimethyl-2-oxobutyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-hydrochlorid (Verbindung 126
in Tabelle 1)
-
a) 2-((1-(3,3-Dimethyl-2-oxobutyl)-piperidin-4-yl)-methyl)-isoindolin-1-on
-
Die
in Beispiel 1d erhaltene Verbindung (500 mg, 1,87 mmol) wurde gelöst in DMF
(6 ml). Der Lösung wurde
Triethylamin (0,57 ml, 4,11 mmol) und 1-Chlorpinacolon (0,24 ml, 1,87 mmol)
zugefügt
und 30 Stunden bei Raumtemperatur gerührt, anschließend für 7 Stunden
bei 50°C
erhitzt. Nachdem die Mischung zur Abkühlung stehen gelassen wurde,
wurde der Mischung Wasser (10 ml) zugefügt und mit Ethylacetat extrahiert.
Die organische Phase wurde dreimal mit Wasser gewaschen und über Magnesiumsulfat
getrocknet. Unlösliche Feststoffe
wurden durch Filtration abgetrennt und das Filtrat wurde eingedampft.
Das resultierende Öl
wurde durch Silicagel-Säulenchromatographie
gereinigt (Methanol/Dichlormethan), um die Titelverbindung als blassbraunen
Feststoff zu erhaltenen (369 mg, Ausbeute: 60%).
1H-NMR:
(CDCl3): δ 7,84
(d, J = 7,2 Hz, 1H), 7,56-7,42 (m, 3H), 4,41 (s, 2H), 3,50 (d, J
= 7,3 Hz, 2H), 3,36 (s, 2H), 2,88 (br d, J = 11,3 Hz, 2H), 2,05
(ddd, J = 2,2 Hz, 11,3 Hz, 11,3 Hz, 2H), 1,87-1,80 (m, 1H), 1,69
(br d, J = 12,9 Hz, 2H), 1,54-1,46 (m, 2H), 1,15 (s, 9H).
-
b) 2-((1-(3,3-Dimethyl-2-oxobutyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-hydrochlorid
-
Unter
Verwendung der in Beispiel 24a erhaltenen Verbindung (369 mg, 1,12
mmol) wurde die Titelverbindung durch ähnliche Verfahren wie in Beispiel
1f erhalten als farbloser Feststoff (323 mg, Ausbeute: 79%).
Schmelzpunkt:
239–243°C
1H-NMR (DMSO-d6): δ 9,73 (br
s, 1H), 7,68 (d, J = 7,5 Hz, 1H), 7,61 (d, 2H), 7,53-7,45 (m, 1H), 4,64-4,52
(m, 4H), 3,60-3,21 (m, 4H), 2,95 (br d, J = 10,5 Hz, 2H), 1,97 (br
s, 1H), 1,79 (br d, J = 13,5 Hz, 2H), 1,65-1,52 (m, 2H), 1,13 (s,
9H).
-
Beispiel 30: 2-((1-(3-Phenyl-3-oxopropyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-hydrochlorid (Verbindung
156 in Tabelle 1)
-
a) 2-((1-(3-Phenyl-3-oxopropyl)-piperidin-4-yl)-methyl)-isoindolin-1-on
-
Die
Titelverbindung wurde durch ähnliche
Verfahren erhalten wie in Beispiel 26b (Ausbeute: 61%).
1H-NMR (CDCl3): δ 7,96 (d,
J = 6,9 Hz, 2H), 7,85 (d, J = 7,2 Hz, 1H), 7,42-7,59 (m, 6H), 4,41
(s, 2H), 3,51 (d, J = 6,9 Hz, 2H), 3,19 (t, J = 7,4 Hz, 2H), 2,96
(br t, J = 12 Hz, 2H), 2,82 (t, J = 7,4 Hz, 2H), 2,04 (dt, J = 11,7 Hz,
1,8 Hz, 2H), 1,81 (m, 1H), 1,71 (br d, J = 12 Hz, 2H), 1,40 (dq,
J = 12 Hz, 4 Hz, 2H).
-
b) 2-((1-(3-Phenyl-3-oxopropyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-hydrochlorid
-
Unter
Verwendung der in Beispiel 30a erhaltenen Verbindung wurde die Titelverbindung
durch ähnliche
Verfahren wie in Beispiel 1f erhalten (Ausbeute: 66%).
Schmelzpunkt:
245–261°C
1H-NMR (DMSO-d6): δ 10,38 (br
s, 1H), 8,01 (d, J = 7,5 Hz, 2H), 7,69 (m, 2H), 7,54-7,62 (m, 4H),
7,49 (m, 1H), 4,52 (s, 2H), 2,88-3,70 (m, 10H), 2,01 (m, 1H), 1,58
(br d, J = 12 Hz, 2H), 1,51 (br q, J = 12 Hz, 2H).
-
Beispiel 31: 2-((1-(4-(4-Fluorphenyl)-4-oxobutyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-hydrochlorid
(Verbindung 166 in Tabelle 1)
-
a) 2-((1-(4-(4-Fluorphenyl)-4-oxobutyl)-piperidin-4-yl)-methyl)-isoindolin-1-on
-
Die
Titelverbindung wurde durch ähnliche
Verfahren erhalten wie in Beispiel 26b.
1H-NMR
(CDCl3): δ 8,00
(m, 2H), 7,85 (d, J = 7,5 Hz, 1H), 7,42-7,54 (m, 3H), 7,12 (t, J
= 8,4 Hz, 2H), 4,40 (s, 2H), 3,48 (d, J = 7,2 Hz, 2H), 2,96 (t,
J = 7,2 Hz, 2H), 2,90 (br d, J = 12 Hz, 2H), 2,39 (t, J = 7,2 Hz,
2H), 1,90-1,97 (m, 4H), 1,78 (m, 1H), 1,66 (br d, J = 12 Hz, 2H),
1,32 (dq, J = 12 Hz, 4 Hz, 2H).
-
b) 2-((1-(4-(4-Fluorphenyl)-4-oxobutyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-hydrochlorid
-
Unter
Verwendung der in Beispiel 31a erhaltenen Verbindung wurde die Titelverbindung
durch ähnliche
Verfahren wie in Beispiel 1f erhalten (Ausbeute: 20%).
Schmelzpunkt:
195–199°C
1H-NMR (DMSO-d6): δ 9,87 (br
s, 1H), 8,06 (m, 2H), 7,69 (d, J = 7,4 Hz, 1H), 7,60-7,63 (m, 2H),
7,51 (m, 1H), 7,38 (t, J = 8,8 Hz, 2H), 4,51 (s, 2H), 2,85-3,63
(m, 10H), 1,99-2,04 (m, 3H), 1,80 (br d, J = 12 Hz, 2H), 1,55 (br
q, J = 12 Hz, 2H).
-
Beispiel 32: 2-((1-(2-(4-Fluorphenoxy)-ethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-hydrochlorid (Verbindung 20
in Tabelle 1)
-
a) 1-(2-Chlorethoxy)-4-fluorbenzol
-
4-Fluorphenol
(8,92 mmol) und 1-Chor-2-Bromethan (13,4 mmol) wurden gelöst in Aceton
(18 ml). Der Lösung
wurde Kaliumcarbonat (12,5 mmol) zugesetzt und unter Rückfluss
für 10
Stunden erhitzt. Der Mischung wurde erlaubt, auf Raumtemperatur
abzukühlen
und wurde anschließend
filtriert. Das Filtrat wurde eingeengt und der Rückstand durch Silicagel-Säulenchromatographie
(Hexan/Ethylacetat) gereinigt, um die Titelverbindung zu erhalten
(Ausbeute: 31 %).
1H-NMR (CDCl3): δ 7,02
(t, J = 8,6 Hz, 1H), 6,87 (m, 2H), 4,19 (t, J = 5,8 Hz, 2H), 3,80
(t, J = 5,8 Hz, 2H).
-
b) 2-((1-(2-(4-Fluorphenoxy)-ethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on
-
Unter
Verwendung der in Beispiel 32a erhaltenen Verbindung wurde die Titelverbindung
durch ähnliche
Verfahren wie in Beispiel 26b erhalten (Ausbeute: 61%).
1H-NMR (CDCl3): δ 7,85 (d,
J = 7,2 Hz, 1H), 7,42-7,54 (m, 3H), 6,93 (t, J = 9 Hz, 2H), 6,83
(m, 2H), 4,41 (s, 2H), 4,05 (t, J = 6,0 Hz, 2H), 3,51 (d, J = 7,2
Hz, 2H), 3,00 (br d, J = 12 Hz, 2H), 2,78 (t, J = 6,0 Hz, 2H), 2,11 (dt,
J = 11,7 Hz, 2,1 Hz, 2H), 1,81 (m, 1H), 1,69 (m, 2H), 1,43 (dq,
J = 12,0 Hz, 3,6 Hz, 2H).
-
c) 2-((1-(2-(4-Fluorphenoxy)-ethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-hydrochlorid
-
Unter
Verwendung der in Beispiel 32b erhaltenen Verbindung wurde die Titelverbindung
durch ähnliche
Verfahren wie in Beispiel 1f erhalten (Ausbeute: 56%).
Schmelzpunkt:
198–204°C
1H-NMR (DMSO-d6): δ 10,28 (br
s, 1H), 7,68 (d, J = 7,5 Hz, 1H), 7,60-7,62 (m, 2H), 7,50 (m, 1H),
7,16 (m, 2H), 7,02 (m, 2H), 4,51 (s, 2H), 4,36 (s, 2H), 2,96-3,61 (m, 8H), 1,99
(m, 1H), 1,80 (m, 2H), 1,59 (m, 2H).
-
Beispiel 33: 2-((1-(3-(4-Fluorphenoxy)-propyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-hydrochlorid
(Verbindung 216 in Tabelle 1)
-
a) 1-(3-Chlorpropoxy)-4-fluorbenzol
-
Die
Titelverbindung wurde erhalten durch ähnliche Verfahren wie in Beispiel
32a (Ausbeute: 94%).
1H-NMR (CDCl3): δ 6,97
(t, J = 8,4 Hz, 2H), 6,84 (m, 2H), 4,07 (t, J = 6,0 Hz, 2H), 3,74
(t, J = 6,3 Hz, 2H), 2,22 (m, 2H).
-
b) 2-((1-(3-(4-Fluorphenoxy)-propyl)-piperidin-4-yl)-isoindolin-1-on
-
Unter
Verwendung der in Beispiel 33a erhaltenen Verbindung wurde die Titelverbindung
durch ähnliche
Verfahren wie in Beispiel 26b erhalten (Ausbeute: 72%).
1H-NMR (CDCl3): δ 7,85 (d,
J = 6,9 Hz, 1H), 7,42-7,55 (m, 3H), 6,96 (t, J = 8,4 Hz, 2H), 6,82
(m, 2H), 4,41 (s, 2H), 3,96 (t, J = 6,3 Hz, 2H), 3,51 (d, J = 7,2
Hz, 2H), 2,94 (br d, J = 12 Hz, 2H), 2,49 (t, J = 7,4 Hz, 2H), 1,90-1,99
(m, 4H), 1,81 (m, 1H), 1,70 (m, 2H), 1,41 (dq, J = 12,3 Hz, 3,3
Hz, 2H).
-
c) 2-((1-(3-(4-Fluorphenoxy)-propyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-hydrochlorid
-
Unter
Verwendung der in Beispiel 33b erhaltenen Verbindung wurde die Titelverbindung
durch ähnliche
Verfahren erhalten wie in Beispiel 1f (Ausbeute:43%).
Schmelzpunkt:
164°C
1H-NMR (DMSO-d6): δ 10,14 (br
s, 1H), 7,69 (d, J = 7,5 Hz, 1H), 7,61-7,62 (m, 2H), 7,51 (m, 1H),
7,13 (t, J = 8,7 Hz, 2H), 6,95 (m, 2H), 4,51 (s, 2H), 4,02 (t, J
= 6 Hz, 2H), 2,85-3,64 (m, 6H), 2,16 (m, 2H), 1,99 (m, 1H), 1,80
(br d, J = 12 Hz, 2H), 1,56 (br q, J = 12 Hz, 2H).
-
Beispiel 34: 2-((1-(4-(4-Fluorphenoxy)-butyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-hydrochlorid (Verbindung 226
in Tabelle 1)
-
a) 1-(4-Chlorbutoxy)-4-fluorbenzol
-
Die
Titelverbindung wurde durch ähnliche
Verfahren erhalten wie in Beispiel 32a (Ausbeute: 97%).
1H-NMR (CDCl3): δ 6,96 (t,
J = 8,7 Hz, 2H), 6,82 (m, 2H), 3,96 (t, J = 5,8 Hz, 2H), 3,61 (t,
J = 6,2 Hz, 2H), 1,89-1,99 (m, 4H).
-
b) 2-((1-(4-(4-Fluorphenoxy)-butyl)-piperidin-4-yl)-methyl)-isoindolin-1-on
-
Unter
Verwendung der in Beispiel 34a erhaltenen Verbindung wurde die Titelverbindung
durch ähnliche
Verfahren wie in Beispiel 26b erhalten (Ausbeute: 78%).
1H-NMR (CDCl3): δ 7,85 (d,
J = 7,5 Hz, 1H), 7,42-7,53 (m, 3H), 6,96 (t, J = 8,5 Hz, 2H), 6,1
(m, 2H), 4,41 (s, 2H), 3,92 (t, J = 6,3 Hz, 2H), 3,50 (d, J = 7,2
Hz, 2H), 2,93 (br d, J = 12 Hz, 2H), 2,38 (t, J = 7,5 Hz, 2H), 1,93 (br
t, J = 12 Hz, 2H), 1,62-1,82
(m, 7H), 1,40 (dq, J = 12 Hz, 3 Hz, 2H).
-
c) 2-((1-(4-(4-Fluorphenoxy)-butyl)-piperidin-4-yl)-methyl-isoindolin-1-on-hydrochlorid
-
Unter
Verwendung der in Beispiel 34b erhaltenen Verbindung wurde die Titelverbindung
durch ähnliche
Verfahren wie in Beispiel 1f erhalten (Ausbeute: 82%).
Schmelzpunkt:
145–146°C
1H-NMR (DMSO-d6): δ 10,08 (br
s, 1H), 7,69 (d, J = 7,5 Hz, 1H), 7,60-7,62 (m, 2H), 7,51 (m, 1H),
7,12 (t, J = 9 Hz, 2H), 6,94 (m, 2H), 4,51 (s, 2H), 3,96 (t, J =
6 Hz, 2H), 2,81-3,62 (m, 8H), 1,99 (m, 1H), 1,70-1,81 (m, 6H), 1,55
(m, 2H).
-
Beispiel 38: 2-((1-(2-(1,3-Benzodioxol-5-yl)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-hydrochlorid (Verbindung
251 in Tabelle 1)
-
a) 1-(1,3-Benzodioxol-5-yl)-bromethan-1-on
-
1-(1,3-Benzodioxol-5-yl)-ethan-1-on
(1,05 g, 6,40 mmol) wurde gelöst
in einer Lösemittelmischung
aus Dichlormethan (50 ml) und Methanol (20 ml). Zur Lösung wurde
Pyridin-hydrobromid-perbromid (2,24 g, 7,00 mmol) bei Raumtemperatur
gegeben und anschließend
unter Rückfluss
erhitzt. Nach einer Stunde wurde das Lösemittel unter vermindertem
Druck verdampft und der Rückstand
mit einem Lösemittelgemisch
aus Ethylacetat und Hexan verdünnt.
Die Mischung wurde mit Wasser, einer wässrigen Natriumhydrogencarbonat-Lösung und
anschließend
mit gesättigter
Kochsalzlösung
gewaschen und über
Natriumsulfat getrocknet. Unlösliche
Feststoffe wurden durch Filtration abgetrennt und das Lösemittel
unter vermindertem Druck verdampft. Der resultierende Feststoff
wurde in Hexan suspendiert und mit Hexan gewaschen und anschließend getrocknet,
um die Titelverbindung als blassgelben Feststoff zu erhalten (1,46
g, Ausbeute: 94%).
1H-NMR (CDCl3): δ 7,61
(dd, J = 2,2 Hz, 8,2 Hz, 1H), 7,46 (d, J = 2,2 Hz, 1H), 6,88 (d,
J = 8,2 Hz, 1H), 6,08 (s, 2H), 4,38 (s, 2H).
-
b) 2-((1-(2-(1,3-Benzodioxol-5-yl)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on
-
Unter
Verwendung der in Beispiel 38a erhaltenen Verbindung (491 mg, 2,02
mmol) und der in Beispiel 1d erhaltenen Verbindung (507 mg, 1,90
mmol) wurde durch ähnliche
Verfahren wie in Beispiel 1e die Titelverbindung als blassgelber
Feststoff erhalten (703 mg, Ausbeute: 94%).
1H-NMR
(CDCl3): δ 7,84
(d, J = 7,5 Hz, 1H), 7,67 (dd, J = 1,8 Hz, 8,1 Hz, 1H), 7,42-7,56 (m, 4H), 6,84
(d, J = 8,1 Hz, 1H), 6,04 (s, 2H), 4,41 (s, 2H), 3,70 (s, 2H), 3,51
(d, J = 7,5 Hz, 2H), 2,95-3,00 (m, 2H), 2,1-2,2 (m, 2H), 1,6-2,0
(m, 3H), 1,4-1,6 (m, 2H).
-
c) 2-((1-(2-(1,3-Benzodioxol-5-yl)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-hydrochlorid
-
Unter
Verwendung der in Beispiel 38b erhaltenen Verbindung (690 mg, 1,76
mmol) wurde die Titelverbindung durch ähnliche Verfahren wie in Beispiel
1f erhalten als farbloser Feststoff (549 mg, Ausbeute: 73%).
Schmelzpunkt:
162–166°C
1H-NMR (DMSO-d6): δ 9,85 (br
s, 1H), 7,47-7,74 (m, 6H), 7,13-7,19 (m, 1H), 6,19-6,22 (m, 2H),
4,95-5,03 (m, 2H), 4,51-4,54 (m, 2H), 3,3-3,6 (m, 4H), 2,9-3,1 (m,
2H), 2,0-2,2 (m, 1H), 1,5-1,9 (m, 4H).
-
Beispiel 39: 2-((1-(2-(2,3-Dihydro-1,4-benzodioxin-6-yl)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-hydrochlorid
(Verbindung 256 in Tabelle 1)
-
a) 2-Brom-1-(2,3-dihydro-1,4-benzodioxin-6-yl)-ethan-1-on
-
Unter
Verwendung von 1-(2,3-Dihydro-1,4-benzodioxin-6-yl)-ethan-1-on (1,42
g, 7,97 mmol) wurde die Titelverbindung durch ähnliche Verfahren wie in Beispiel
38a erhalten als blassgelber Feststoff (2,05 g, Ausbeute: 100%).
1H-NMR (CDCl3): δ 7,50-7,54
(m, 2H), 6,93 (m, 1H), 4,37 (s, 2H), 4,32-4,35 (m, 2H), 4,27-4,31
(m, 2H).
-
b) 2-((1-(2-(2,3-Dihydro-1,4-benzodioxin-6-yl)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on
-
Unter
Verwendung der in Beispiel 39a (571 mg, 2,22 mmol) und der in Beispiel
1d (576 mg, 2,16 mmol) erhaltenen Verbindungen wurde die Titelverbindung
durch ähnliche
Verfahren wie in Beispiel 1e erhalten als blassgelber Feststoff
(627 mg, Ausbeute: 71%).
1H-NMR (CDCl3): δ 7,84
(d, J = 7,5 Hz, 1H), 7,42-7,60 (m, 5H), 6,89 (d, J = 8,4 Hz, 1H),
4,41 (s, 2H), 4,26-4,34 (m, 4H), 3,69 (s, 2H), 3,51 (d, J = 7,2
Hz, 2H), 2,9-3,0 (m, 2H), 2,08-2,17 (m, 2H), 1,6-1,9 (m, 3H), 1,4-1,6
(m, 2H).
-
c) 2-((1-(2-(2,3-Dihydro-1,4-benzodioxin-6-yl)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-hydrochlorid
-
Unter
Verwendung der in Beispiel 39b erhaltenen Verbindung (306 mg, 0,753
mmol) wurde die Titelverbindung durch ähnliche Verfahren wie in Beispiel
1f erhalten als blassgelber Feststoff (263 mg, Ausbeute: 79%).
Schmelzpunkt:
142–150°C
1H-NMR (DMSO-d6): δ 10,01 (br
s, 1H), 7,69 (d, J = 7,5 Hz, 1H), 7,48-7,62 (m, 5H), 7,06 (d, J
= 8,1 Hz, 1H), 4,97-5,05 (m, 2H), 4,53 (s, 2H), 4,2-4,4 (m, 4H),
3,4-3,7 (m, 4H),
2,9-3,1 (m, 2H), 1,5-2,2 (m, 5H).
-
Beispiel 42: 2-((1-(2-(4-Fluoranilino)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-hydrochlorid
(Verbindung 271 in Tabelle 1)
-
a) 2-Chlor-N-(4-fluorphenyl)-acetamid
-
Chloracetylchlorid
(0,60 ml, 7,54 mmol) wurde gelöst
in Toluol (6 ml) und zur Lösung
wurde 4-Fluoranilin (0,72 ml, 7,52 mmol) bei Raumtemperatur gegeben
und bei gleicher Temperatur für
eine Stunde gerührt. Zur
Reaktionsmischung wurde Wasser gegeben und mit Ethylacetat extrahiert.
Der Extrakt wurde gewaschen mit gesättigter Kochsalzlösung und
getrocknet über
Magnesiumsulfat. Unlösliche
Feststoffe wurden durch Filtration abgetrennt und das Filtrat wurde
unter vermindertem Druck eingedampft, um die Titelverbindung als blassgelben
Feststoff zu erhalten (1,07 g, Ausbeute: 76%).
1H-NMR
(CDCl3): δ 8,23
(br s, 1H, NH), 7,47-7,55 (m, 2H), 7,02-7,11 (m, 2H) 4,20 (s, 2H).
-
b) 2-((1-(2-(4-Fluoranilino)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on
-
Die
in Beispiel 42a erhaltene Verbindung (354 mg, 1,89 mmol), die in
Beispiel 1d erhaltene Verbindung (501 mg, 1,88 mmol) und Triethylamin
(0,65 ml, 4,66 mmol) wurden zu Dimethylformamid (6 ml) gegeben und die
Mischung bei 60° für 3 Stunden
gerührt.
Der Reaktionsmischung wurde erlaubt, auf Raumtemperatur abzukühlen und
wurde anschließend
mit Wasser versetzt. Der niedergeschlagene Feststoff wurde durch
Filtration gesammelt und unter vermindertem Druck getrocknet, um
die Titelverbindung als blassgelben Feststoff zu erhalten (577 mg,
Ausbeute: 81%).
1H-NMR (CDCl3): δ 9,14
(br s, 1H, NH), 7,86 (d, J = 7,5 Hz, 1H), 7,43-7,57 (m, 5H), 6,99-7,07
(m, 2H), 4,42 (s, 2H), 3,57 (d, J = 7,2 Hz, 2H), 3,10 (s, 2H), 2,86-2,97 (m, 2H), 2,19-2,30
(m, 2H), 1,7-1,9 (m, 3H), 1,3-1,5 (m, 2H).
-
c) 2-((1-(2-(4-Fluoranilino)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-hydrochlorid
-
Unter
Verwendung der in Beispiel 42b erhaltenen Verbindung wurde die Titelverbindung
durch ähnliche
Verfahren wie in Beispiel 1f als farbloser Feststoff erhalten (Ausbeute:
70%).
Schmelzpunkt: 201–219°C
1H-NMR (DMSO-d6): δ 10,9 (br
s, 1H, NH), 9,9 (br s, 1H, HCl), 7,58-7,71 (m, 5H), 7,46-7,54 (m,
1H), 7,21 (t, J = 8,7 Hz, 2H), 4,52 (s, 2H), 4,25 (s, 0,4H), 4,14
(s, 1,6H), 3,3-3,7 (m, 4H), 2,9-3,1 (m, 2H), 1,9-2,1 (m, 1H), 1,7-1,9
(m, 2H), 1,4-1,6
(m, 2H).
-
Beispiel 43: 2-((1-(2-(Diphenylamino)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-hydrochlorid
(Verbindung 278 in Tabelle 1)
-
a) 2-Chlor-N,N-diphenylacetamid
-
Chloracetylchlorid
(0,32 ml, 4,02 mmol) wurde in einer Lösemittelmischung aus Toluol
(6 ml) und Tetrahydrofuran (2 ml) gelöst. Zur Lösung wurde bei Raumtemperatur
Diphenylamin (690 mg, 4,08 mmol) gegeben und anschließend bei
100°C für 80 Minuten
erhitzt. Das Lösemittel
wurde unter vermindertem Druck verdampft und der niedergeschlagene
Feststoff wurde suspendiert in und gewaschen mit Ethylether. Der
Feststoff wurde durch Filtration gesammelt und unter vermindertem
Druck getrocknet, um die Titelverbindung als farblosen Feststoff
zu erhalten (746 mg, Ausbeute: 75%).
1H-NMR
(CDCl3): δ 7,0-7,5
(m, 10H), 4,03 (s, 2H)
-
b) 2-((1-(2-(Diphenylamino)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on
-
Unter
Verwendung der in Beispiel 43a erhaltenen Verbindung wurde die Titelverbindung
durch ähnliche
Verfahren wie in Beispiel 42b erhalten als blassgelber Feststoff
(Ausbeute: 67%).
1H-NMR (CDCl3): δ 7,84
(d, J = 7,2 Hz, 1H), 7,1-7,6 (m, 13H), 4,38 (s, 2H), 3,48 (d, J
= 7,2 Hz, 2H), 3,10 (s, 2H), 2,82-2,90 (m, 2H), 2,04-2,18 (m, 2H),
1,5-1,8 (m, 3H), 1,2-1,4 (m, 2H).
-
c) 2-((1-(2-(Diphenylamino)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-hydrochlorid
-
Unter
Verwendung der in Beispiel 43b erhaltenen Verbindung wurde die Titelverbindung
durch ähnliche
Verfahren wie in Beispiel 1f erhalten als farbloser Feststoff (Ausbeute:
84%).
Schmelzpunkt: 197–209°C
1H-NMR (DMSO-d6): δ 9,7 (br
s, 1H, HCl), 7,68 (d, J = 7,4 Hz, 1H), 7,2-7,6 (m, 13H), 4,49 (s,
2H), 4,10 (s, 0,4H), 4,02 (s, 1,6H), 3,3-3,6 (m, 4H), 2,8-3,0 (m,
2H), 1,7-1,9 (m, 1H), 1,6-1,7 (m, 2H), 1,4-1,6 (m, 2H).
-
Beispiel 44: 2-((1-(2-(N-Methylanilino)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-hydrochlorid
(Verbindung 284 in Tabelle 1)
-
a) 2-((1-(2-(N-Methylanilino)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on
-
Unter
Verwendung von N-Methylanilin wurde 2-Chlor-N-methyl-N-phenylacetamid
durch ähnliche
Verfahren wie in Beispiel 43a als Rohprodukt erhalten. Unter Verwendung
des resultierenden Produkts wurde die Titelverbindung durch ähnliche
Verfahren wie in Beispiel 42b als farbloses Öl erhalten (Ausbeute: 69%).
1H-NMR (CDCl3): δ 7,83 (d,
J = 7,3 Hz, 1H), 7,16-7,54 (m, 8H), 4,38 (s, 2H), 3,46 (d, J = 7,2
Hz, 2H), 3,26 (s, 3H), 2,92 (s, 2H), 2,75-2,85 (m, 2H), 1,9-2,1
(m, 2H), 1,5-1,8 (m, 3H), 1,2-1,4 (m, 2H).
-
b) 2-((1-(2-(N-Methylanilino)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-hydrochlorid
-
Unter
Verwendung der in Beispiel 44a erhaltenen Verbindung wurde die Titelverbindung
durch ähnliche
Verfahren wie in Beispiel 1f erhalten als farbloser Feststoff (Ausbeute:
92%).
Schmelzpunkt: 199–213°C
1H-NMR (DMSO-d6): δ 9,6 (br
s, 1H, Hcl), 7,68 (d, J = 7,2 Hz, 1H), 7,56-7,62 (m, 2H), 7,2-7,55
(m, 6H), 4,49 (s, 2H), 3,9-4,0 (m, 2H), 3,37 (s, 3H), 3,1-3,7 (m,
4H), 2,8-3,0 (m, 2H), 1,6-1,9 (m, 3H), 1,3-16 (m, 2H).
-
Beispiel 45: 2-((1-(3-(4-Fluoranilino)-3-oxopropyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-hydrochlorid
(Verbindung 274 in Tabelle 1)
-
a) 3-Chlor-N-(4-fluorphenyl)-propanamid
-
Unter
Verwendung von 4-Fluoranilin und 3-Chlorpropionylchlorid wurde die
Titelverbindung durch ähnliche
Verfahren erhalten wie in Beispiel 42a (Ausbeute: 57%).
1H-NMR (CDCl3): δ 7,3-7,5
(m, 3H), 6,98-7,05 (m, 2H), 3,88 (t, J = 6,2 Hz, 2H), 2,81 (t, J
= 6,2 Hz, 2H).
-
b) 2-((1-(3-(4-Fluoranilino)-3-oxopropyl)-piperidin-4-yl)-methyl)-isoindolin-1-on
-
Unter
Verwendung der in Beispiel 45a erhaltenen Verbindung wurde die Titelverbindung
durch ähnliche
Verfahren wie in Beispiel 26b erhalten als blassgelber Feststoff
(Ausbeute: 86%).
1H-NMR (CDCl3): δ 11,04
(s, 1H, NH), 7,87 (d, J = 7,2 Hz, 1H), 7,44-7,60 (m, 5H), 6,96-7,03
(m, 2H), 4,43 (s, 2H), 3,58 (d, J = 6,9 Hz, 2H), 3,06-3,12 (m, 2H),
2,69 (t, J = 6,0 Hz, 2H), 2,51 (t, J = 6,0 Hz, 2H), 2,03-2,14 (m, 2H),
1,7-2,0 (m, 3H), 1,3-1,5
(2H, m).
-
c) 2-((1-(3-(4-Fluoranilino)-3-oxopropyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-hydrochlorid
-
Unter
Verwendung der in Beispiel 45b erhaltenen Verbindung wurde die Titelverbindung
durch ähnliche
Verfahren wie in Beispiel 1f erhalten als farbloser Feststoff (Ausbeute:
91 %).
Schmelzpunkt: 211–223°C
1H-NMR (DMSO-d6): δ 10,4 (s,
1H, NH), 10,2 (br s, 1H, HCl), 7,59-7,71 (m, 5H), 7,45-7,53 (m,
1H), 7,12-7,20 (m, 2H), 4,51 (s, 2H), 3,1-3,6 (m, 6H), 2,8-3,0 (m,
4H), 1,9-2,1 (m, 1H), 1,6-1,8 (m, 2H), 1,4-1,6 (m, 2H).
-
Beispiel 46: 2-((1-(3-(Diphenylamino)-3-oxopropyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-hydrochlorid
(Verbindung 281 in Tabelle 1)
-
a) 2-((1-(3-(Diphenylamino)-3-oxopropyl)-piperidin-4-yl)-methyl)-isoindolin-1-on
-
Unter
Verwendung von Diphenylamin wurde 3-Chlor-N,N-diphenylpropanamid
durch ähnliche
Verfahren wie in Beispiel 43a als Rohprodukt erhalten. Unter Verwendung
des resultierenden Produkts wurde die Titelverbindung durch ähnliche
Verfahren wie in Beispiel 26b erhalten als farbloser Feststoff (Ausbeute:
89%).
1H-NMR (CDCl3): δ 7,84 (d,
J = 7,4 Hz, 1H), 7,0-7,6 (m, 13H), 4,38 (s, 2H), 3,48 (d, J = 7,1
Hz, 2H), 2,74-2,84 (m, 2H), 2,73 (t, J = 7,5 Hz, 2H), 2,45 (t, J
= 7,5 Hz, 2H), 1,86-1,96 (m, 2H), 1,5-1,8 (m, 3H), 1,2-1,4 (m, 2H).
-
b) 2-((1-(3-(Diphenylamino)-3-oxopropyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-hydrochlorid
-
Unter
Verwendung der in Beispiel 46a erhaltenen Verbindung wurde die Titelverbindung
durch ähnliche
Verfahren wie in Beispiel 1f erhalten als farbloser Feststoff (Ausbeute:
82%).
Schmelzpunkt: 200–205°C
1H-NMR (DMSO-d6): δ 9,6-10,2
(breit, 1H, HCl), 7,68 (d, J = 7,5 Hz, 1H), 7,1-7,65 (m, 13H), 4,49
(s, 2H), 3,0-3,6 (m, 6H), 3,6-3,9 (m, 4H), 1,8-2,0 (m, 1H), 1,6-1,8
(m, 2H), 1,3-1,6 (m, 2H).
-
Beispiel 47: 2-((1-(3-(N-Methylanilino)-3-oxopropyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-hydrochlorid
(Verbindung 287 in Tabelle 1)
-
a) 2-((1-(3-(N-Methylanilino)-3-oxopropyl)-piperidin-4-yl)-methyl)-isoindolin-1-on
-
Unter
Verwendung von N-Methylanilin wurde 3-Chlor-N-methyl-N-phenylpropanamid
durch ähnliche Verfahren
wie in Beispiel 43a als Rohprodukt erhalten. Unter Verwendung des
resultierenden Produkts wurde die Titelverbindung durch ähnliche
Verfahren wie in Beispiel 26b erhalten als farbloser Feststoff (Ausbeute: 57%).
1H-NMR (CDCl3): δ 7,83 (d,
J = 7,2 Hz, 1H), 7,3-7,5 (m, 6H), 7,18 (dd, J = 1,4 Hz, 7,2 Hz,
2H), 4,37 (s, 2H), 3,46 (d, J = 7,2 Hz, 2H), 3,26 (s, 3H), 2,70-2,78
(m, 2H), 2,65 (t, J = 7,5 Hz, 2H), 2,26 (t, J = 7,5 Hz, 2H), 1,8-2,0 (m,
2H), 1,5-1,8 (m, 3H), 1,2-1,4 (m, 2H).
-
b) 2-((1-(3-(N-Methylanilino)-3-oxopropyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-hydrochlorid
-
Unter
Verwendung der in Beispiel 47a erhaltenen Verbindung wurde die Titelverbindung
durch ähnliche
Verfahren wie in Beispiel 1f als farbloser Feststoff erhalten (Ausbeute:
91%).
Schmelzpunkt: 206–214°C
1H-NMR (DMSO-d6): δ 9,5-10,1
(breit, 1H, HCl), 7,67 (d, J = 7,5 Hz, 1H), 7,55-7,62 (m, 2H), 7,1-7,5 (m, 6H), 4,48
(s, 2H), 3,0-3,6 (m, 9H), 2,7-2,9 (m, 2H), 2,5-2,6 (m, 2H), 1,8-2,0 (m, 1H), 1,6-1,8
(m, 2H), 1,3-1,6 (m, 2H).
-
Beispiel 48: 2-((1-(2-(1,2,3,4-Tetrahydrochinolin-1-yl)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-hydrochlorid
(Verbindung 320 in Tabelle 1)
-
a) 2-((1-(2-(1,2,3,4-Tetrahydrochinolin-1-yl)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on
-
Unter
Verwendung von 1,2,3,4-Tetrahydrochinolin wurde 2-Chlor-1-(1,2,3,4-tetrahydrochinolin-1-yl)-ethan-1-on
durch ähnliche
Verfahren wie in Beispiel 43a als Rohprodukt erhalten. Unter Verwendung des
resultierenden Produkts wurde die Titelverbindung durch ähnliche
Verfahren wie in Beispiel 42b erhalten als blassgelbes Öl (Ausbeute:
82%).
1H-NMR (CDCl3): δ 7,84 (d,
J = 7,2 Hz, 1H), 7,40-7,54 (m, 4H), 7,06-7,17 (m, 3H), 4,38 (s,
2H), 3,80 (t, J = 6,6 Hz, 2H), 3,48 (d, J = 7,2 Hz, 2H), 3,27 (s,
2H), 2,86-2,94 (m,
2H), 2,72 (t, J = 6,6 Hz, 2H), 2,04-2,14 (m, 2H), 1,92-2,02 (m,
2H), 1,5-1,8 (m,
3H), 1,2-1,4 (m, 2H).
-
b) 2-((1-(2-(1,2,3,4-Tetrahydrochinolin-1-yl)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-hydrochlorid
-
Unter
Verwendung der in Beispiel 48a erhaltenen Verbindung wurde die Titel verbindung
durch ähnliche
Verfahren wie in Beispiel 1f erhalten als farbloser Feststoff (Ausbeute:
94%).
Schmelzpunkt: 208–221°C
1H-NMR (DMSO-d6): δ 9,6 (br
s, 1H, HCl), 7,68 (d, J = 7,4 Hz, 1H), 7,55-7,62 (m, 2H), 7,45-7,54
(m, 1H), 7,0-7,4 (breit, 4H), 4,51 (s, 2H), 4,1-4,6 (breit, 2H),
3,2-3,8 (m, 8H),
2,8-3,0 (m, 2H), 2,6-2,8 (m, 2H), 1,5-2,0 (m, 7H).
-
Beispiel 49: 2-((1-(3-(1,2,q3,4-Tetrahydrochinolin-1-yl)-3-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-hydrochlorid
(Verbindung 324 in Tabelle 1)
-
a) 2-((1-(3-(1,2,3,4-Tetrahydrochinolin-1-yl)-3-oxopropyl)-piperidin-4-yl)-methyl)-isoindolin-1-on
-
Unter
Verwendung von 1,2,3,4-Tetrahydrochinolin wurde 3-Chlor-1-(1,2,3,4-tetrahydrochinolin-1-yl)-propan-1-on
durch ähnliche
Verfahren wie in Beispiel 43a als Rohprodukt erhalten. Unter Verwendung des
resultierenden Produkts wurde durch ähnliche Verfahren wie in Beispiel
26b die Titelverbindung erhalten als farbloser Feststoff (Ausbeute:
79%).
1H-NMR (CDCl3): δ 7,84 (d,
J = 7,2 Hz, 1H), 7,40-7,55 (m, 3H), 7,07-7,25 (m, 4H), 4,38 (s,
2H), 3,78 (t, J = 6,6 Hz, 2H), 3,47 (d, J = 7,2 Hz, 2H), 2,6-2,9
(m, 8H), 1,8-2,0
(m, 4H), 1,5-1,8 (m, 3H), 1,2-1,4 (m, 2H).
-
b) 2-((1-(3-(1,2,3,4-Tetrahydrochinolin-1-yl)-3-oxopropyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-hydrochlorid
-
Unter
Verwendung der in Beispiel 49a erhaltenen Verbindung wurde durch ähnliche
Verfahren wie in Beispiel 1f die Titelverbindung erhalten als farbloser
Feststoff (Ausbeute: 97%).
Schmelzpunkt: 227–232°C
1H-NMR (DMSO-d6): δ 9,6 (br
s, 1H, HCl), 7,4-7,7 (m, 5H), 7,0-7,3 (m, 3H), 4,50 (s, 2H), 3,6-3,7
(m, 2H), 3,2-3,6 (m, 8H), 3,0-3,2 (m, 2H), 2,8-3,0 (m, 2H), 2,6-2,8
(m, 2H), 1,7-2,0 (m, 5H), 1,3-1,6 (m, 2H).
-
Beispiel 50: 2-((1-(2-Oxo-2-(piperidin-1-yl)-ethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-fumarat
(Verbindung 328 in Tabelle 1)
-
a) 2-((1-(2-Oxo-2-(piperidin-1-yl)-ethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on
-
Unter
Verwendung von Piperidin wurde 2-Chlor-1-(piperidin-1-yl)-ethan-1-on
durch Verwendung ähnlicher
Verfahren wie in Beispiel 42a als Rohprodukt erhalten. Unter Verwendung
des resultierenden Produkts wurde die Titelverbindung durch ähnliche
Verfahren wie in Beispiel 42b als blassgelbes Öl erhalten (Ausbeute: 73%).
1H-NMR (CDCl3): δ 7,85 (d,
J = 7,5 Hz, 1H), 7,42-7,54 (m, 3H), 4,39 (s, 2H), 3,48-3,55 (m, 6H), 3,13
(s, 2H), 2,84-2,91 (m, 2H), 1,97-2,08 (m, 2H), 1,4-1,8 (m, 9H),
1,2-1,4 (m, 2H).
-
b) 2-((1-(2-Oxo-2-(piperidin-1-yl)-ethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-fumarat
-
Unter
Verwendung der in Beispiel 50a erhaltenen Verbindung wurde die Titelverbindung
durch ähnliche
Verfahren wie in Beispiel 36c als farbloser Feststoff erhalten (Ausbeute:
83%).
Schmelzpunkt: 201–204°C
1H-NMR (DMSO-d6): δ 7,67 (d,
J = 7,5 Hz, 1H), 7,56-7,61 (m, 2H), 7,45-7,52 (m, 1H), 6,59 (s,
2H, Fumarsäure), 4,48
(s, 2H), 3,3-3,5 (m, 6H), 3,23 (s, 2H), 2,83-3,00 (m, 2H), 2,03-2,14 (m, 2H), 1,6-1,8
(m, 1H), 1,3-1,6 (m, 8H), 1,1-1,3 (m, 2H).
-
Beispiel 51: 2-((1-(2-(Indolin-1-yl)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-fumarat (Verbindung
333 in Tabelle 1)
-
a) 2-((1-(2-(Indolin-1-yl)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on
-
Unter
Verwendung von Indolin wurde 2-Chlor-1-(indolin-1-yl)-ethan-1-on
durch ähnliche
Verfahren wie in Beispiel 43a als Rohprodukt erhalten. Unter Verwendung
des resultierenden Produkts wurde durch ähnliche Verfahren wie in Beispiel
42b die Titelverbindung erhalten als blassgelber Feststoff (Ausbeute:
84%).
1H-NMR (CDCl3): δ 8,22 (d,
J = 8,4 Hz, 1H), 7,84 (d, J = 7,2 Hz, 1H), 7,42-7,56 (m, 3H), 7,14-7,23
(m, 2H), 7,14 (t, J = 7,7 Hz, 1H), 4,40 (s, 2H), 4,19 (t, J = 8,4
Hz, 2H), 3,51 (d, J = 7,2 Hz, 2H), 3,24 (s, 2H), 3,18 (t, J = 8,4 Hz,
2H), 2,94-3,01 (m, 2H), 2,12-2,22 (m, 2H), 1,7-1,9 (m, 1H), 1,5-1,7
(m, 3H), 1,3-1,5 (m, 2H).
-
b) 2-((1-(2-(Indolin-1-yl)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-fumarat
-
Unter
Verwendung der in Beispiel 51a erhaltenen Verbindung wurde die Titelverbindung
durch ähnliche
Verfahren wie in Beispiel 36c erhalten als farbloser Feststoff (Ausbeute:
54%).
Schmelzpunkt: 168–171°C
1H-NMR (DMSO-d6): δ 8,05 (d,
J = 7,9 Hz, 1H), 7,67 (d, J = 7,4 Hz, 1H), 7,55-7,62 (m, 2H), 7,45-7,52
(m, 1H), 7,24 (d, J = 7,3 Hz, 1H), 7,12-7,18 (m, 1H), 6,97-7,03
(m, 1H), 6,61 (s, 2H, Fumarsäure),
4,49 (s, 2H), 4,17 (t, J = 8,4 Hz, 2H), 3,42 (d, J = 7,2 Hz, 2H),
3,35 (s, 2H), 3,13 (t, 8,4 Hz, 2H), 2,91-2,98 (m, 2H), 2,15-2,26
(m, 2H), 1,6-1,8 (m, 1H), 1,5-1,6 (m, 2H), 1,1-1,3 (m, 2H).
-
Beispiel 52: 2-((1-(2-(1,2,3,4-Tetrahydroisochinolin-2-yl)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-fumarat
(Verbindung 229 in Tabelle 1)
-
Unter
Verwendung von 1,2,3,4-Tetrahydroisochinolin wurde 2-Chlor-1-(1,2,3,4-tetrahydroisochinolin-2-yl)-ethan-1-on
durch ähnliche
Verfahren wie in Beispiel 42a als Rohprodukt erhalten. Unter Verwendung des
resultierenden Produkts wurde durch ähnliche Verfahren wie in Beispiel
42b 2-((1-(2-(1,2,3,4-Tetrahydroisochinolin-2-yl)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on
als Rohprodukt erhalten. Unter Verwendung des resultierenden Produkts
wurde die Titelverbindung durch ähnliche
Verfahren wie in Beispiel 36c erhalten als farbloser Feststoff (Ausbeute:
38%).
Schmelzpunkt: 171–173°C
1H-NMR (DMSO-d6): δ 7,67 (d,
J = 7,5 Hz, 1H), 7,55-7,61 (m, 2H), 7,45-7,52 (m, 1H), 7,0-7,2 (m,
4H), 6,60 (s, 2H, Fumarsäure),
4,73 (s, 0,8H), 4,59 (s, 1,2H), 4,48 (s, 1,2H), 4,46 (s, 0,8H),
3,74 (t, J = 5,7 Hz, 1,2H), 3,66 (t, J = 6,0 Hz, 0,8H), 3,32-3,43
(m, 4H), 2,6-3,0 (m, 4H), 2,0-2-2 (m, 2H), 1,6-1,8 (m, 1H), 1,4-1,6
(m, 2H), 1,1-1,3 (m, 2H).
-
Beispiel 54: 2-((1-(2-(1,2,3,4-Tetrahydrochinolin-1-yl)-ethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-fumarat (Verbindung
325 in Tabelle 1)
-
Unter
Verwendung von 1,2,3,4-Tetrahydrochinolin wurde 2-(1,2,3,4-Tetrahydrochinolin-1-yl)-ethylacetat
als Rohprodukt durch ähnliche
Verfahren erhalten wie in Beispiel 53a. Unter Verwendung des resultierenden
Produkts wurde 2-(1,2,3,4-Tetrahydrochinolin-1-yl)-ethan-1-ol
durch ähnliche
Verfahren wie in Beispiel 53b als Rohprodukt erhalten. Unter Verwendung
des resultierenden Produkts wurde 2-(1,2,3,4-Tetrahydrochinolin-1-yl)-ethyl-1-methansulfonat
durch ähnliche
Verfahren wie in Beispiel 26a als Rohprodukt erhalten. Unter Verwendung
des resultierenden Produkts wurde 2-((1-(2-(1,2,3,4-Tetrahydrochinolin-1-yl)-ethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on
durch ähnliche
Verfahren wie in Beispiel 26b als Rohprodukt erhalten. Unter Verwendung
des resultierenden Produkts wurde die Titelverbindung durch ähnliche
Verfahren wie in Beispiel 36c erhalten (Ausbeute: 46%).
Schmelzpunkt:
196–200°C
1H-NMR (DMSO-d6): δ 7,67 (d,
J = 7,5 Hz, 1H), 7,55-7,61 (m, 2H), 7,45-7,52 (m, 1H), 6,90-6,97
(m, 1H), 6,84 (d, J = 6,4 Hz, 1H), 6,59 (s, 2H, Fumarsäure), 6,56
(d, J = 8,3 Hz, 1H), 6,41-6,48 (m, 1H), 4,48 (s, 2H), 3,37-3,44 (m,
4H), 3,26 (t, J = 5,5 Hz, 2H), 3,00-3,07 (m, 2H), 2,56-2,68 (m,
4H), 2,1-2,3 (m, 2H), 1,7-1,9 (m, 3H), 1,5-1,7 (m, 2H), 1,1-1,4
(m, 2H).
-
Beispiel 55: 5-Methoxy-2-((1-(2-(4-fluorphenyl)-2-(Z)-hydroxyiminoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-hydrochlorid
(Z-Isomer von Verbindung 99 in Tabelle 1)
-
a) 5-Methoxy-2-((1-(2-(4-fluorphenyl)-2-(E,Z)-hyd
roxyiminoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on
-
Unter
Verwendung der in Beispiel 3e erhaltenen Verbindung (443 mg, 1,12
mmol) wurden das Z-Isomer (239 mg, Ausbeute: 52%) und das E-Isomer (187
mg, Ausbeute: 41%) der Titelverbindung als farblose Feststoffe durch ähnliche
Verfahren wie in Beispiel 18a erhalten.
(Z-Isomer)
1H-NMR (CDCl3): δ 12-13 (br,
1H, OH), 7,75 (d, J = 8,4 Hz, 1H), 7,56-7,65 (m, 2H), 6,96-7,08
(m, 3H), 6,92 (d, J = 2,1 Hz, 1H), 4,35 (s, 2H), 3,87 (s, 3H), 3,74
(s, 2H), 3,48 (d, J = 7,2, 2H), 3,00-3,07 (m, 2H), 2,12-2,23 (m, 2H),
1,8-2,0 (m, 1H), 1,6-1,8 (m, 2H), 1,3-1,5 (m, 2H).
(E-Isomer)
1H-NMR (CDCl3): δ 7,74 (d,
J = 8,4 Hz, 1H), 7,60-7,68 (m, 2H), 7,05-7,12 (m, 2H), 6,98 (dd,
J = 2,1 Hz, 8,4 Hz, 1H), 6,91 (d, J = 2,1 Hz, 1H), 4,32 (s, 2H),
3,86 (s, 3H), 3,44 (d, J = 7,5 Hz, 2H), 3,31 (s, 2H), 2,88-2,95
(m, 2H), 1,95-2,05 (m, 2H), 1,5-1,9 (m, 3H), 1,2-1,4 (m, 2H).
-
b) 5-Methoxy-2-((1-(2-(4-fluorphenyl)-2-(Z)-hydroxyiminoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-hydrochlorid
-
Unter
Verwendung des in Beispiel 55a erhaltenen Z-Isomers (232 mg, 0,564mmol)
wurde die Titelverbindung durch ähnliche
Verfahren wie in Beispiel 1f als farbloser Feststoff erhalten (208
mg, Ausbeute: 82%).
Schmelzpunkt: 173–178°C
1H-NMR
(DMSO-d6): δ 12,61 (s, 1H, OH), 10,6 (br
s, 1H, HCl), 7,81-7,87 (m, 2H), 7,56 (d, J = 8,4 Hz, 1H), 7,27-7,34
(m, 2H), 7,15 (d, J = 1,8 Hz, 1H), 7,02 (dd, J = 1,8 Hz, 8,4 Hz,
1H), 4,53 (s, 0,4H), 4,42 (s, 2H), 4,39 (s, 1,6H), 3,83 (s, 3H),
2,9-3,6 (m, 6H), 1,4-2,0 (m, 5H).
-
Beispiel 56: 5-Methoxy-2-((1-(2-(4-fluorphenyl)-2-(E)-hydroxyiminoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-hydrochlorid
(E-Isomer von Verbindung 99 in Tabelle 1)
-
Unter
Verwendung des in Beispiel 55a erhaltenen E-Isomers (180 mg, 0,438
mmol), wurde die Titelverbindung durch ähnliche Verfahren wie in Beispiel 1f
erhalten als farbloser Feststoff (140 mg, Ausbeute: 71%).
Schmelzpunkt:
192–195°C
1H-NMR (DMSO-d6): δ 11,86 (s,
1H, OH), 10,7 (br s, 1H, HCl), 7,68-7,74 (m, 2H), 7,57 (d, J = 8,4
Hz, 1H), 7,29-7,37 (m, 2H), 7,15 (d, J = 1,8 Hz, 1H), 7,03 (dd,
J = 1,8 Hz, 8,4 Hz, 1H), 4,43 (s, 2H+0,4H), 4,30 (s, 1,6H), 3,83
(s, 3H), 3,48-3,55 (m, 2H), 3,37 (d, J = 6,9 Hz, 2H), 2,90-3,01
(m, 2H), 1,8-2,0 (m, 2H), 1,3-1,8 (m, 4H).
-
Beispiel 57: 5-Brom-2-((1-(2-(4-fluorphenyl)-2-(Z)-hydroxyiminoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-fumarat
(Z-Isomer von Verbindung 92 in Tabelle 1)
-
a) 5-Brom-2-((1-(2-(4-fluorphenyl)-2-(E,Z)-hydroxyiminoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on
-
Unter
Verwendung der in Beispiel 3e erhaltenen Verbindung (481 mg, 1,08
mmol) wurden das Z-Isomer (217 mg, Ausbeute: 44%) und das E-Isomer
(112 mg, Ausbeute: 23%) der Titelverbindung durch ähnliche Verfahren
wie in Beispiel 18a als farblose Feststoffe erhalten.
(Z-Isomer)
1H-NMR (CDCl3): δ 7,71 (d,
J = 8,5 Hz, 1H), 7,56-7,65 (m, 4H), 7,00-7,08 (m, 2H), 4,38 (s,
2H), 3,74 (s, 2H), 3,49 (d, J = 7,3 Hz, 2H), 3,00-3,07 (m, 2H),
2,12-2,22 (m, 2H), 1,8-2,0 (m, 1H), 1,6-1,8 (m, 2H), 1,3-1,5 (m,
2H).
(E-Isomer)
1H-NMR (CDCl3): δ 7,70
(d, J = 8,4 Hz, 1H), 7,56-7,66 (m, 4H), 7,04-7,12 (m, 2H), 4,36
(s, 2H), 3,46 (d, J = 7,5 Hz, 2H), 3,32 (s, 2H), 2,90-2,96 (m, 2H),
1,96-2,07 (m, 2H), 1,5-1,9 (m, 3H), 1,2-1,4 (m, 2H).
-
b) 5-Brom-2-((1-(2-(4-fluorphenyl)-2-(Z)-hydroxyiminoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-fumarat
-
Unter
Verwendung des in Beispiel 57a erhaltenen Z-Isomers (212 mg, 0,461
mmol) wurde die Titelverbindung durch ähnliche Verfahren wie in Beispiel 36c
als farbloser Feststoff erhalten (114 mg, Ausbeute: 43%).
Schmelzpunkt:
171–174°C
1H-NMR (DMSO-d6): δ 7,83 (s,
1H), 7,75-7,82 (m, 2H), 7,66 (d, J = 8,1 Hz, 1H), 7,58 (d, J = 8,1
Hz, 1H), 7,15-7,22 (m, 2H), 6,62 (s, 2H, Fumarsäure), 4,45 (s, 2H), 3,60 (s,
2H), 3,34 (d, J = 7,2 Hz, 2H), 2,75-2,80 (m, 2H), 1,96-2,05 (m,
2H), 1,6-1,8 (m, 1H), 1,4-1,6 (m, 2H), 1,0-1,2 (m, 2H).
-
Beispiel 58: 5-Brom-2-((1-(2-(4-Fluorphenyl)-2-(E)-hydroxyiminoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-fumarat
(E-Isomer der Verbindung 92 in Tabelle 1)
-
Unter
Verwendung des in Beispiel 57a erhaltenen E-Isomers (109 mg, 0,237
mmol) wurde die Titelverbindung durch ähnliche Verfahren wie in Beispiel
36c als farbloser Feststoff erhalten (36 mg, Ausbeute: 26%).
Schmelzpunkt:
186–188°C
1H-NMR (DMSO-d6): δ 10,98 (br
s, 1H, OH), 7,83 (s, 1H), 7,61-7,70 (m, 3H), 7,59 (d, J = 8,1 Hz,
1H), 7,15-7,25 (m, 2H), 6,62 (s, 2H, Fumarsäure), 4,45 (s, 2H), 3,35 (d,
J = 7,2 Hz, 2H), 3,30 (s, 2H), 2,77-2,85 (m, 2H), 1,86-1,97 (m,
2H), 1,6-1,8 (m, 1H), 1,4-1,6 (m, 2H), 1,0-1,2 (m, 2H).
-
Beispiel 59: 2-((1-(2-Phenylbenzyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-fumarat
(Verbindung 456 in Tabelle 1)
-
a) 2-((1-(2-Phenylbenzyl)-piperidin-4-yl)-methyl)-isoindolin-1-on
-
2-Phenylbenzylbromid
(462 mg, 1,87 mmol) und die in Beispiel 1 d erhaltene Verbindung
wurden in Dimethylformamid (6 ml) gelöst. Der Lösung wurde Kaliumcarbonat (517
mg, 1,87 mmol) zugefügt
und auf 80°C
unter Rühren
erhitzt. Der Reaktionsmischung wurde Wasser (10 ml) zugesetzt und
der Niederschlag wurde durch Filtration gesammelt, um die Titelverbindung
als farblosen Feststoff zu erhalten (633 mg, Ausbeute: 85%).
1H-NMR (CDCl3): δ 7,84 (d,
J = 7,5 Hz, 1H), 7,53-7,24 (m, 12H), 4,36 (s, 2H), 3,47 (d, J =
7,2 Hz, 2H), 3,37 (s, 2H), 2,78 (br d, J = 11,4 Hz, 2H), 1,83 (br
dd, J = 11,6 Hz, 11,6 Hz, 2H), 1,74-1,68 (m, 1H), 1,63-1,57 (m,
2H) 1,39-1,30 (m, 2H).
-
b) 2-((1-(2-Phenylbenzyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-fumarat
-
Unter
Verwendung der in Beispiel 59a erhaltenen Verbindung (620 mg, 1,56
mmol) wurde die Titelverbindung durch ähnliche Verfahren wie in Beispiel
36c erhalten als farbloser Feststoff (331 mg, Ausbeute: 41%).
Schmelzpunkt:
188–193°C
1H-NMR (DMSO-d6): δ 7,67-7,23
(m, 13H), 6,62 (s, 2H), 4,45 (s, 2H), 3,42 (s, 2H), 3,37 (d, J =
6,9 Hz, 2H), 2,74 (br d, J = 11,4 Hz, 2H), 1,86 (br dd, J = 10,8
Hz, 10,8 Hz, 2H), 1,69-1,65 (m, 1H), 1,52 (br d, J = 12,6 Hz, 2H),
1,17 (br dd, J = 22,4 Hz, 10,4 Hz, 2H).
-
Beispiel 66: 2-((1-(3-(2-Phenetylphenoxy)-propyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-fumarat
(Verbindung 691 in Tabelle 1)
-
a) 2-(3-(Tetrahydro-2H-pyran-2-yl-oxy)-propoxy)-benzaldehyd
-
Unter
Verwendung von 2-(3-Brompropoxy)-tetrahydro-2H-pyran und Salicylaldehyd
wurde die Titelverbindung durch ähnliche
Verfahren wie in Beispiel 60b als farbloses Öl erhalten (Ausbeute: quantitativ).
1H-NMR (CDCl3): δ 10,52 (s,
1H, OH), 7,83 (dd, J = 1,8 Hz, 7,8 Hz, 1H), 7,50-7,57 (m, 1H), 6,98-7,05
(m, 2H), 4,56-4,61 (m, 1H), 4,22 (t, J = 6,3 Hz, 2H), 3,91-4,00
(m, 1H), 3,75-3,85 (m, 1H), 3,56-3,66 (m, 1H), 3,38-3,50 (m, 1H),
2,05-2,22 (m, 2H), 1,4-1,9 (m, 8H).
-
b) 3-(2-Phenethylphenoxy)-propanol
-
Benzyltriphenylphosphoniumbromid
(2,25 g, 5,19 mmol) wurde in Tetrahydrofuran (20 ml) suspendiert und
die Suspension wurde unter Eiskühlung
gerührt.
Der Suspension wurde Kalium-tert-butoxid (596 mg, 5,31 mol) zugefügt und die
Mischung bei gleicher Temperatur weiter gerührt. Der Reaktionsmischung
wurde die in Beispiel 66a erhaltene Verbindung zugesetzt (1,09 g,
4,12 mmol), welche in Tetrahydrofuran (4 ml) gelöst war, anschließend wurde
die Mischung für
1 Stunde gerührt.
Die Reaktionsmischung wurde mit 10% wässriger Citronensäu relösung verdünnt und
mit Ethylacetat extrahiert. Der Extrakt wurde mit Wasser, gesättigter
wässriger
Natriumhydrogencarbonat-Lösung
und anschließend
mit gesättigter
Kochsalzlösung
gewaschen und über Magnesiumsulfat
getrocknet. Unlösliche
Feststoffe wurden durch Filtration abgetrennt und das Filtrat wurde unter
vermindertem Druck eingedampft, um 2-(3-(2-((E,Z)-2-Phenylethenyl)-phenoxy)-propoxy)-tetrahydro-2H-pyran
als Rohprodukt zu erhalten. Das Produkt wurde in Methanol (50 ml)
gelöst
und der Lösung
wurde eine katalytische Menge an p-Toluolsulfonsäure zugesetzt und anschließend unter
Rückfluss
für 4 Stunden
erhitzt. Die Reaktionsmischung wurde unter vermindertem Druck eingeengt
und das resultierende Cl wurde mittels Silicagel-Säulenchromatographie
(Ethylacetat/Hexan) gereinigt, um 3-(2-((E,Z)-2-Phenylethenyl)-phenoxy)-propanol
zu erhalten. Das Produkt wurde in Ethanol (12 ml) gelöst und der
Lösung
wurde eine katalytische Menge an 10% Palladiumkohlenstoff zugegeben
und die Mischung wurde unter Wasserstoffatmosphäre gerührt, um die Titelverbindung
als farbloses Öl
zu erhalten (464 mg, Ausbeute: 45%).
1H-NMR
(CDCl3): δ 7,10-7,32
(m, 7H), 6,85-6,92 (m, 2H), 4,12 (t, J = 5,9 Hz, 2H), 3,90 (t, J
= 5,9 Hz, 2H), 2,8-3,0 (m, 4H), 2,0-2,2 (m, 2H).
-
c) 2-((1-(3-(2-Phenethylphenoxy)-propyl)-piperidin-4-yl)-methyl)-isoindolin-1-on
-
Unter
Verwendung der in Beispiel 66b erhaltenen Verbindung wurde 3-(2-Phenethylphenoxy)-propyl-methansulfonat
als Rohprodukt durch ähnliche
Verfahren wie in Beispiel 26a erhalten. Unter Verwendung des resultierenden
Produkts wurde die Titelverbindung durch ähnliche Verfahren wie in Beispiel
26b erhalten als gelbes Öl
(Ausbeute: 86%).
1H-NMR (CDCl3): δ 7,85
(d, J = 7,5 Hz, 1H), 7,40-7,55 (m, 3H), 7,07-7,29 (m, 7H), 6,83-6,89
(m, 2H), 4,41 (s, 2H), 4,01 (t, J = 6,2 Hz, 2H), 3,51 (d, J = 7,2
Hz, 2H), 2,82-3,00 (m, 6H), 2,51-2,59 (m, 2H), 1,9-2,1 (m, 4H), 1,6-1,9
(m, 3H), 1,3-1,5 (m, 2H)
-
d) 2-((1-(3-(2-Phenethylphenoxy)-propyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-fumarat
-
Unter
Verwendung der in Beispiel 66c erhaltenen Verbindung wurde die Titel verbindung
durch ähnliche
Verfahren wie in Beispiel 36c erhalten als farbloser Feststoff (Ausbeute:
60%).
Schmelzpunkt: 166–169°C
1H-NMR (DMSO-d6): δ 7,68 (d,
J = 7,3 Hz, 1H), 7,57-7,61 (m, 2H), 7,4-7,5 (m, 1H), 7,11-7,27 (m,
7H), 6,93 (d, J = 8,0 Hz, 1H), 6,8-6,9 (m, 1H), 6,57 (s, 2H, Fumarsäure), 4,48
(s, 2H), 4,00 (t, J = 5,9 Hz, 2H), 3,42 (d, J = 7,3 Hz, 2H), 3,00-3,07
(m, 2H), 2,81 (s, 4H), 2,6-2,7 (m, 2H), 2,1-2,3 (m, 2H), 1,9-2,0
(m, 2H), 1,7-1,9 (m, 1H), 1,5-1,7 (m, 2H), 1,2-1,4 (m, 2H).
-
Beispiel 67: 2-((1-(3-(2-Benzylphenoxy)-propyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-fumarat
(Verbindung 696 in Tabelle 1)
-
a) 3-(2-Benzylphenoxy)-propanol
-
Unter
Verwendung von 2-Hydroxydiphenylmethan und 3-Brompropanol wurde
die Titelverbindung durch ähnliche
Verfahren wie in Beispiel 60b erhalten als farbloses Öl (Ausbeute:
28%).
1H-NMR (CDCl3): δ 7,08-7,28
(m, 7H), 6,86-6,94 (m, 2H), 4,08 (t, J = 5,7 Hz, 2H), 3,98 (s, 2H),
3,71 (t, J = 6,0 Hz, 2H), 1,93-2,03 (m, 2H), 1,49 (br s, 1H, OH).
-
b) 2-((1-(3-(2-Benzylphenoxy)-propyl)-piperidin-4-yl)-methyl)-isoindolin-1-on
-
Unter
Verwendung der in Beispiel 67a erhaltenen Verbindung wurde 3-(2-Benzylphenoxy)-propanol als
Rohprodukt durch ähnliche
Verfahren wie in Beispiel 26a erhalten. Unter Verwendung des resultierenden Produkts
wurde die Titelverbindung durch ähnliche
Verfahren wie in Beispiel 26b erhalten als blassgelber Feststoff
(Ausbeute: 87%).
1H-NMR (CDCl3): δ 7,85
(d, J = 7,3 Hz, 1H), 7,41-7,55 (m, 3H), 7,0-7,3 (m, 7H), 6,81-6,90
(m, 2H), 4,40 (s, 2H), 3,97 (t, J = 6,1 Hz, 2H), 3,96 (s, 2H), 3,50
(d, J = 7,1 Hz, 2H), 2,84-3,92 (m, 2H), 2,36-2,44 (m, 2H), 1,8-2,0
(m, 4H), 1,5-1,8 (m, 3H), 1,2-1,4 (m, 2H).
-
c) 2-((1-(3-(2-(2-(3-Methoxyphenyl)-ethyl)-phenoxy)-propyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-fumarat
-
Unter
Verwendung der in Beispiel 67b erhaltenen Verbindung wurde die Titelverbindung
durch ähnliche
Verfahren wie in Beispiel 36c erhalten als farbloser Feststoff (Ausbeute:
80%).
Schmelzpunkt: 185–191°C
1H-NMR (DMSO-d6): δ 7,67 (d,
J = 7,2 Hz, 1H), 7,56-7,60 (m, 2H), 7,46-7,52 (m, 1H), 7,13-7,27
(m, 7H), 6,93 (d, J = 7,8 Hz, 1H), 6,83-6,89 (m, 1H), 6,57 (s, 2H,
Fumarsäure),
4,48 (s, 2H), 3,97 (t, J = 6,0 Hz, 2H), 3,88 (s, 2H), 3,41 (d, J
= 7,2 Hz, 2H), 2,90-2,97 (m, 2H), 2,48-2,52 (m, 2H), 2,0-2,15 (m,
2H), 1,6-1,9 (m, 3H), 1,5-1,6 (m, 2H), 1,2-1,3 (m, 2H).
-
Beispiel 68: 2-((1-(3-(2-(2-(3-Methoxyphenyl)-ethyl)-phenoxy)-propyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-fumarat
(Verbindung 701 in Tabelle 1)
-
a) 3-Methoxybenzyltriphenylphosphoniumchlorid
-
3-Methoxybenzylchlorid
(1,05 g, 6,69 mmol) und Triphenylphosphin (1,75 g, 6,67 mmol) wurden
in Dimethylformamid (10 ml) gelöst
und für
40 Minuten bei 150°C
erhitzt. Die Reaktionsmischung wurde auf Raumtemperatur abgekühlt und
der Niederschlag wurde durch Filtration gesammelt und mit Ethylether
gewaschen und anschließend
unter vermindertem Druck getrocknet, um die Titelverbindung als
farblosen Feststoff zu erhalten (1,70 g, Ausbeute: 61 %).
1H-NMR (DMSO-d6): δ 7,87-7,95
(m, 3H), 7,64-7,79 (m, 12H), 7,16 (t, J = 7,9 Hz, 1H), 6,86 (d,
J = 8,3 Hz, 1H), 6,61 (d, J = 7,4 Hz, 1H), 6,49 (s, 1H), 5,1-5,3
(m, 2H), 3,50 (s, 3H).
-
b) 3-(2-(2-(3-Methoxyphenyl)-ethyl)-phenoxy)-propanol
-
Unter
Verwendung der in Beispiel 68a erhaltenen Verbindung und der in
Beispiel 66a erhaltenen Verbindung wurde die Titelverbindung durch ähnliche
Verfahren wie in Beispiel 66b erhalten als farbloses Öl (Ausbeute:
50%).
1H-NMR (CDCl3): δ 7,10-7,24
(m, 3H), 6,70-6,93 (m, 5H), 4,12 (t, J = 5,9 Hz, 2H), 3,90 (t, J
= 5,9 Hz, 2H), 3,78 (s, 3H), 2,8-3,0 (m, 4H), 2,0-2,2 (m, 2H), 1,72
(br s, 1H, OH).
-
c) 2-((1-(3-(2-(2-(3-Methoxyphenyl)-ethyl)-phenoxy)-piperidin-4-yl)-methyl)-isoindolin-1-on
-
Unter
Verwendung der in Beispiel 68b erhaltenen Verbindung wurde 3-(2-(2-(3-Methoxyphenyl)-ethyl)-phenoxy)-propyl-methansulfonat
als Rohprodukt durch ähnliche
Verfahren wie in Beispiel 26a erhalten. Unter Verwendung des resultierenden
Produkts wurde die Titelverbindung durch ähnliche Verfahren wie in Beispiel
26b als gelbes Öl
erhalten (Ausbeute: 84%).
1H-NMR (CDCl3): δ 7,85
(d, J = 7,5 Hz, 1H), 7,42-7,55 (m, 3H), 7,07-7,22 (m, 3H), 6,70-6,89
(m, 5H), 4,41 (s, 2H), 4,01 (t, J = 6,1 Hz, 2H), 3,77 (s, 3H), 3,50
(d, J = 7,2 Hz, 2H), 2,80-3,00 (m, 6H), 2,51-2,59 (m, 2H), 1,9-2,1 (m,
4H), 1,6-1,9 (m, 3H), 1,3-1,5 (m, 2H).
-
d) 2-((1-(3-(2-(2-(3-Methoxyphenyl)-ethyl)-phenoxy)-propyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-fumarat
-
Unter
Verwendung der in Beispiel 68c erhaltenen Verbindung wurde die Titelverbindung
durch ähnliche
Verfahren wie in Beispiel 36c erhalten als farbloser Feststoff (Ausbeute:
73%).
Schmelzpunkt: 181–184°C
1H-NMR (DMSO-d6): δ 7,67 (d,
J = 7,4 Hz, 1H), 7,58-7,60 (m, 2H), 7,47-7,51 (m, 1H), 7,12-7,20
(m, 3H), 6,93 (d, J = 8,0 Hz, 1H), 6,70-6,87 (m, 4H), 6,57 (s, 2H,
Fumarsäure),
4,48 (s, 2H), 4,00 (t, J = 5,8 Hz, 2H), 3,70 (s, 3H), 3,41 (d, J
= 7,2 Hz, 2H), 2,98-3,05 (m, 2H), 2,7-2,9 (m, 4H), 2,6-2,7 (m, 2H),
2,0-2,2 (m, 2H), 1,9-2,0 (m, 2H), 1,7-1,8 (m, 1H), 1,5-1,7 (m, 2H),
1,2-1,4 (m, 2H).
-
Beispiel 69: 2-((1-(4-Phenyl-2-oxobutyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-hydrochlorid (Verbindung
344 in Tabelle 1)
-
2M
LDA-Lösung
in Heptan/THF/EtPh (3,07 ml, 6,14 mmol) wurden bei –78°C zu DME
(3 ml) gegeben und anschließend
wurde der Mischung tropfenweise 0,700 g Benzylaceton (4,72 mmol
in 5 ml DME) zugegeben. Nachdem eine Stunde gerührt worden war, wurde der Mischung
tropfenweise Chlortrimethylsilan (0,779 ml, 6,14 mmol) zugesetzt
und anschließend
auf Raumtemperatur er wärmt.
Die Reaktionsmischung wurde mit Hexan verdünnt und zweimal mit Wasser,
zweimal mit gesättigter
NH4Cl-Lösung
und anschließend
mit Kochsalzlösung
gewaschen und dann über
Na2SO4 getrocknet.
-
Das
Lösemittel
wurde verdampft und das zurückbleibende Öl wurde
gelöst
in THF (18 ml), auf 0°C
gekühlt
und mit NBS (0,924 g, 5,19 mmol) versetzt. Die Reaktionsmischung
wurde auf Raumtemperatur erwärmt und
1 Stunde lang gerührt,
dann wurde die Reaktionsmischung in wässrige Na2S2O3-Lösung geschüttet und dreimal
mit Ether extrahiert. Die vereinigten organischen Phasen wurden über Na2SO4 getrocknet.
-
Nachdem
das Lösemittel
verdampft worden war, wurde das zurückbleibende Öl in DMF
(10 ml) gelöst und
zu der Lösung
wurden die in Beispiel 1d erhaltene Verbindung (1,26 g, 4,72 mmol)
und Triethylamin (1,64 ml, 11,8 mmol) gegeben. Nachdem bei Raumtemperatur
gerührt
worden war, wurde die Reaktionsmischung verdünnt mit Ethylacetat und viermal
mit Wasser und anschließend
mit Kochsalzlösung
gewaschen und über Na2SO4 getrocknet.
-
Das
Trockenmittel wurde durch Filtration abgetrennt und das Filtrat
wurde gelöst
in einer Mischung aus Ethanol (1,5 ml) und Ethylacetat (3 ml). Zur
Lösung
wurde 4N HCl in Ethylacetat (1,08 ml, 4,31 mmol) gegeben. Nach Rühren wurde
der Mischung Ethylacetat (10 ml) zugegeben und niedergeschlagene
Kristalle wurden durch Filtration gesammelt und getrocknet, um die
Titelverbindung zu erhalten (Ausbeute: 39%).
Schmelzpunkt:
183–187°C
1H-NMR (DMSO-d6): δ 9,93 (br
s, 1H), 7,68 (d, J = 7,4 Hz, 1H), 7,61 (m, 2H), 7,49 (m, 1H), 7,16-7,31
(m, 5H), 4,51 (s, 2H), 4,33-4,50 (m, 2H), 2,84-3,57 (m, 10H), 1,99
(m, 1H), 1,78 (br d, J = 13 Hz, 2H), 1,58 (m, 2H).
-
Beispiel 70: 2-((1-(3-Phenyl-2-oxopropyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-hydrochlorid (Verbindung
349 in Tabelle 1)
-
a) 2-((1-(3-Phenyl-2-hydroxypropyl)-piperidin-4-yl)-methyl)-isoindolin-1-on
-
Die
in Beispiel 1d erhaltene Verbindung (994 mg, 3,73 mmol) und (2,3-Epoxypropyl)-benzol
(0,500 g, 3,73 mmol) und Triethylamin (0,78 ml, 5,60 mmol) wurden
in Ethanol (8 ml) gelöst
und die Mischung auf 50°C erwärmt. Nach
Ende der Reaktion wurde die Reaktionsmischung mit Ethylacetat verdünnt und
viermal mit Wasser und anschließend
mit Kochsalzlösung
gewaschen und über
Na2SO4 getrocknet.
Nachdem das Trockenmittel durch Filtration abgetrennt worden war,
wurde das Filtrat eingeengt und der Rückstand mittels Silicagel-Säulenchromatographie
(Aceton) gereinigt, um die Titelverbindung zu erhalten (Ausbeute:
44%).
1H-NMR (CDCl3): δ 7,85 (d,
J = 7,2 Hz, 1H), 7,42-7,56 (m, 3H), 7,21-7,32 (m, 5H), 4,39 (s,
2H), 3,90 (m, 1H), 3,49 (d, J = 9,6 Hz, 2H), 2,96 (br d, J = 9 Hz,
1H), 2,76-2,86 (m,
2H), 2,65 (m, 1H), 2,20-2,31 (m, 3H), 1,87 (dt, J = 12 Hz, 2 Hz,
1H), 1,79 (m, 1H), 1,67 (br d, J = 13 Hz, 2H), 1,36 (dq, J = 12
Hz, 4 Hz, 2H).
-
b) 2-((1-(3-Phenyl-2-oxopropyl)-piperidin-4-yl)-methyl)-isoindolin-1-on
-
(COCl)2 (0,125 g, 0,998 mmol) in CH2Cl2 (3 ml) wurde abgekühlt auf –78°C und der Lösung wurde tropfenweise DMSO
(0,121 g, 1,55 mmol) zugegeben und nach 10 Minuten des Rührens wurde
der Mischung tropfenweise die in Beispiel 70a erhaltene Verbindung
(180 mg, 0,494 mmol) in CH2Cl2 (1
ml) zugesetzt. Nach 30 Minuten Rühren
wurde der Reaktionsmischung tropfenweise Triethylamin (0,491 ml,
3,52 mmol) zugefügt
und nach 4 Stunden Rühren
wurde die Reaktionsmischung auf Raumtemperatur erwärmt. Die
Reaktionsmischung wurde verdünnt
mit Ethylacetat (40 ml) und viermal mit Wasser und anschließend mit
Kochsalzlösung
gewaschen und über
Na2SO4 getrocknet.
Nach Abtrennen des Trockenmittels durch Filtration und Einengen
des Filtrats wurde der Rückstand
gereinigt mittels Silicagel-Säulenchromatographie
(Aceton/Hexan), um die Titelverbindung zu erhalten (Ausbeute: 50%).
1H-NMR (CDCl3): δ 7,85 (d,
J = 7,5 Hz, 1H), 7,42-7,54 (m, 3H), 7,22-7,35 (m, 5H), 4,40 (s,
2H), 3,75 (s, 2H), 3,51 (d, J = 7,2 Hz, 2H), 3,16 (s, 2H), 2,79
(br d, J = 12 Hz, 2H), 2,03 (dt, J = 11,4 Hz, 2,1 Hz, 2H), 1,78
(m, 1H), 1,67 (br d, J = 10 Hz, 2H), 1,47 (dq, J = 12 Hz, 4 Hz,
2H).
-
c) 2-((1-(3-Phenyl-2-oxopropyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-hydrochlorid
-
Unser
Verwendung der in Beispiel 70b erhaltenen Verbindung wurde die Titelverbindung
durch ähnliche
Verfahren wie in Beispiel 1f erhalten (Ausbeute: 59%).
Schmelzpunkt:
198–204°C
1H-NMR (DMSO-d6): δ 9,84 (br
s, 1H), 7,68 (d, J = 7,5 Hz, 1H), 7,61 (m, 2H), 7,50 (m, 1H), 7,22-7,37
(m, 5H), 4,40-4,54 (m, 4H), 3,88 (s, 2H), 2,94-3,56 (m, 6H), 1,99
(m, 1H), 1,78 (br d, J = 14 Hz, 2H), 1,56 (m, 2H).
-
Beispiel 71: 2-((1-(4-Phenyl-3-oxobutyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-hydrochlorid (Verbindung
354 in Tabelle 1)
-
a) 1-Tosyloxy-3-hydroxy-4-phenylpropan
-
Eine
Lösung
von Methyl-(phenylacetyl)-essigsäure
(0,700 g, 3,64 mmol), dargestellt nach dem in der Literatur beschriebenen
Verfahren (Yonemitsu, O et al., Org. Synth., 1984, 63, 198), in
24 ml Ethanol wurde auf 0°C
gekühlt
und der Lösung
wurde NaBH4 (1,10 g, 29,1 mmol) zugefügt und bei
Raumtemperatur gerührt. Der
Reaktionsmischung wurde zur Ansäuerung
konzentrierte Salzsäure
zugesetzt und anschließend
mit Kochsalzlösung
verdünnt
und viermal mit Dichlormethan extrahiert. Die vereinigten organischen
Phasen wurden über
Na2SO4 getrocknet.
-
Nachdem
das Trockenmittel durch Filtration abgetrennt und das Filtrat eingeengt
worden war, wurde das resultierende Öl in Dichlormethan (8 ml) gelöst. Der
Lösung
wurde Pyridin (0,61 ml, 7,54 mmol) zugefügt und auf 0°C gekühlt. Unser
Rühren
wurde Tosylchlorid (0,694 g, 3,64 mmol) zu der Lösung gegeben und für 2 Stunden
gerührt.
Anschließend
wurde die Reaktionsmischung mit Ether verdünnt und zweimal mit Wasser
gewaschen und über
Na2SO4 getrocknet.
Nach Entfernen des Trockenmittels durch Filtration und Einengen
des Filtrats wurde der Rückstand
mittels Silicagel-Säulenchromatographie
(Ethylacetat/Hexan) gereinigt, um die Titelverbindung zu erhalten
(Ausbeute: 32%).
1H-NMR (CDCl3): δ 7,78
(d, J = 8,1 Hz, 2H), 7,15-7,34 (m, 7H), 4,26 (m, 1H), 4,17 (m, 1H),
3,94 (m, 1H), 2,78 (m, 1H), 2,64 (m, 1H), 2,44 (s, 3H), 1,93 (m,
1H), 1,75 (m, 1H).
-
b) 2-((1-(4-Phenyl-3-oxobutyl)-piperidin-4-yl)-methyl)-isoindolin-1-on
-
Unter
Verwendung der in Beispiel 71a erhaltenen Verbindung wurde ein Produkt
durch ähnliche
Verfahren wie in Beispiel 26b erhalten, welches ohne Aufreinigung ähnlichen
Verfahren wie in Beispiel 70b unterworfen wurde, um die Titelverbindung
zu erhalten (Ausbeute: 27%).
1H-NMR
(CDCl3): δ 7,84
(d, J = 7,2 Hz, 1H), 7,44-7,53 (m, 3H), 7,18-7,32 (m, 5H), 4,39
(s, 2H), 3,70 (s, 2H), 3,48 (d, J = 7,2 Hz, 2H), 2,82 (br d, J =
12 Hz, 2H), 2,05-2,65
(m, 4H), 1,91 (dt, J = 11,7 Hz, 2,1 Hz, 2H), 1,75 (m, 1H), 1,66
(m, 2H), 1,33 (dq, J = 12 Hz, 3 Hz, 2H).
-
c) 2-((1-(4-Phenyl-3-oxobutyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-hydrochlorid
-
Unter
Verwendung der in Beispiel 71b erhaltenen Verbindung wurde die Titelverbindung
durch ähnliche
Verfahren wie in Beispiel 1f erhalten (Ausbeute: 61%).
Schmelzpunkt:
163–166°C
1H-NMR (DMSO-d5): δ 9,89 (br
s, 1H), 7,68 (d, J = 7,5 Hz, 1H), 7,61 (m, 2H), 7,49 (m, 1H), 7,19-7,35
(m, 5H), 4,50 (s, 2H), 3,84 (s, 2H), 2,81-3,62 (m, 10H), 1,97 (m,
1H), 1,78 (br d, J = 13 Hz, 2H), 1,49 (m, 2H).
-
Beispiel 72: 2-((1-(2-(2-Methoxyphenyl)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-fumarat
(Verbindung 376 in Tabelle 1)
-
a) 2-((1-(2-(2-Methoxyphenyl)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on
-
2'-Methoxyacetophenon
(1,11 g, 7,39 mmol) und Pyridin-hydrobromid-perbromid (2,61 g, 8,16
mmol) wurden gelöst
in einem Lösemittelgemisch
aus Dichlormethan (50 ml) und Methanol (20 ml) und die Mischung wurde
unter Rückfluss
für 1 Stunde
erhitzt. Das Lösemittel
der Reaktion wurde unter vermindertem Druck verdampft und der Rückstand
mit Ethylacetat verdünnt.
Die Mischung wurde mit Wasser und gesättigter Kochsalzlösung gewaschen
und über
Magnesiumsulfat getrocknet. Unlösliche
Feststoffe wurden durch Filtration abgetrennt und das Filtrat wurde
unter vermindertem Druck eingedampft, um 2-Brom-1-(2-methoxyphenyl)-ethan-1-on
als Rohprodukt zu erhalten. Unter Verwendung des Produkts wurde
die Titelverbindung durch ähnliche
Verfahren wie in Beispiel 1e erhalten als gelbes Öl (Ausbeute:
63%).
1H-NMR (CDCl3): δ 7,84 (d,
J = 7,5 Hz, 1H), 7,70 (dd, J = 2,0 Hz, 7,7 Hz, 1H), 7,42-7,55 (m, 4H), 6,93-7,03
(m, 2H), 4,41 (s, 2H), 3,89 (s, 3H), 3,80 (s, 2H), 3,50 (d, J =
7,2 Hz, 2H), 2,92-3,00 (m, 2H), 2,14-2,26 (m, 2H), 1,6-1,9 (m, 3H),
1,4-1,55 (m, 2H).
-
b) 2-((1-(2-(2-Methoxyphenyl)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-fumarat
-
Unter
Verwendung der in Beispiel 72 erhaltenen Verbindung wurde die Titelverbindung
durch ähnliche Verfahren
wie in Beispiel 36c erhalten als farbloser Feststoff (Ausbeute:
50%).
Schmelzpunkt: 180–190°C
1H-NMR (DMSO-d6): δ 7,67 (d,
J = 7,5 Hz, 1H), 7,44-7,61 (m, 5H), 7,17 (d, J = 8,2 Hz, 1H), 7,03
(t, J = 7,4 Hz, 1H), 6,60 (s, 2H, Fumarsäure), 4,48 (s, 2H), 3,88 (s,
3H), 3,84 (s, 2H), 3,40 (d, J = 7,3 Hz, 2H), 2,88-2,95 (m, 2H),
2,21-2,31 (m, 2H), 1,6-1,8 (m, 1H), 1,4-1,6 (m, 2H), 1,1-1,3 (m,
2H).
-
Beispiel 73: 2-((1-(2-(4-Tolyl)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-hydrochlorid (Verbindung
396 in Tabelle 1)
-
a) 2-((1-(2-(4-Tolyl)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on
-
Unter
Verwendung von 2-Brom-1-(4-methylphenyl)-ethan-1-on wurde die Titelverbindung
durch ähnliche
Verfahren wie in Beispiel 1e erhalten als blassgelber Feststoff
(Ausbeute: 83%).
1H-NMR (CDCl3): δ 7,91
(d, J = 8,2 Hz, 2H), 7,84 (d, J = 7,5 Hz, 1H), 7,41-7,59 (m, 3H),
7,24 (d, J = 8,2 Hz, 2H), 4,41 (s, 2H), 3,76 (s, 2H), 3,51 (d, J
= 7,1 Hz, 2H), 2,95-3,03 (m, 2H), 2,41 (s, 3H), 2,09-2,21 (m, 2H), 1,6-1,9
(m, 3H), 1,4-1,6 (m, 2H).
-
b) 2-((1-(2-(4-Tolyl)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-hydrochlorid
-
Unter
Verwendung der in Beispiel 73a erhaltenen Verbindung wurde die Titelverbindung
durch ähnliche
Verfahren wie in Beispiel 1f erhalten als farbloser Feststoff (Ausbeute:
90%).
Schmelzpunkt: 169–185°C
1H-NMR (DMSO-d6): δ 9,8-10,0
(br s, 1H, HCl), 7,80 (d, J = 7,9 Hz, 0,5H), 7,89 (d, J = 7,9 Hz,
1,5H), 7,69 (d, J = 7,4 Hz, 1H), 7,57-7,36 (m, 2H), 7,40-7,52 (m,
3H), 5,09 (s, 0,5H), 5,02 (s, 1,5H), 4,53 (s, 2H), 3,51-3,58 (m, 2H),
3,47 (d, J = 7,0 Hz, 2H), 2,9-3,1 (m, 2H), 2,41 (s, 3H), 1,9-2,1
(m, 1H), 1,4-1,9 (m, 4H).
-
Beispiel 74: 2-((1-(2-(3,4-Difluorphenyl)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-fumarat
(Verbindung 401 in Tabelle 1)
-
a) 2-((1-(2-(3,4-Difluorphenyl)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on
-
Unter
Verwendung von 3',4'-Difluoracetophenon
wurde die Titelverbindung durch ähnliche
Verfahren wie in Beispiel 72a und Beispiel 1e erhalten als gelber
Feststoff (Ausbeute: 84%).
1H-NMR (CDCl3): δ 7,8-8,0
(m, 3H), 7,40-7,57 (m, 3H), 7,10-7,26 (m, 1H), 4,40 (s, 2H), 3,67
(s, 2H), 3,51 (d, J = 7,2 Hz, 2H), 2,86-2,97 (m, 2H), 2,08-2,20
(m, 2H), 1,6-1,9 (m, 3H), 1,3-1,5 (m, 2H).
-
b) 2-((1-(2-(3,4-Difluorphenyl)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-fumarat
-
Unter
Verwendung der in Beispiel 74a erhaltenen Verbindung wurde die Titelverbindung
durch ähnliche
Verfahren wie in Beispiel 36c erhalten als farbloser Feststoff (Ausbeute:
79%).
Schmelzpunkt: 186–193°C
1H-NMR (DMSO-d6): δ 8,00-8,09
(m, 1H), 7,85-7,95 (m, 1H), 7,54-7,69 (m, 4H), 7,4-7,5 (m, 1H),
6,62 (s, 2H, Fumarsäure),
4,48 (s, 2H), 3,83 (s, 2H), 3,40 (d, J = 7,2 Hz, 2H), 2,84-2,90
(m, 2H), 2,08-2,18 (m, 2H), 1,6-1,8 (m, 1H), 1,4-1,6 (m, 2H), 1,1-1,3
(m, 2H).
-
Beispiel 75: 2-((1-(2-(2-Naphthyl)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-hydrochlorid
(Verbindung 411 in Tabelle 1)
-
a) 2-((1-(2-(2-Naphthyl)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on
-
Unter
Verwendung von 2-Brom-1-(2-naphthyl)-ethan-1-on wurde die Titelverbindung
durch ähnliche Verfahren
wie in Beispiel 1e erhalten als blassgelber Feststoff (Ausbeute:
83%).
1H-NMR (CDCl3): δ 8,57 (s,
1H), 7,83-8,05 (m, 4H), 7,41-7,66 (m, 6H), 4,42 (s, 2H), 3,96 (s,
2H), 3,53 (d, J = 7,2 Hz, 2H), 3,04-3,13 (m, 2H), 2,20-2,31 (m,
2H), 1,6-1,9 (m, 3H), 1,4-1,6 (m, 2H).
-
b) 2-((1-(2-(2-Naphthyl)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-hydrochlorid
-
Unter
Verwendung der in Beispiel 75a erhaltenen Verbindung wurde die Titelverbindung
durch ähnliche
Verfahren wie in Beispiel 1f erhalten als blassgelber Feststoff
(Ausbeute: 61%).
Schmelzpunkt: 192–201°C
1H-NMR
(DMSO-d6): δ 9,8-10,2 (br s, 1H, HCl), 8,81
(s, 0,2H), 8,72 (s, 0,8H), 7,97-8,19 (m, 4H), 7,4-7,8 (m, 6H), 5,26
(s, 0,4H), 5,19 (s, 1,6H), 4,55 (s, 2H), 3,57-3,64 (m, 2H), 3,49
(d, J = 6,9 Hz, 2H), 3,0-3,2 (m, 2H), 2,0-2,2 (m, 1H), 1,5-1,9 (m, 4H).
-
Beispiel 76: 2-((1-(2-(3-Chlorphenyl)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-fumarat
(Verbindung 406 in Tabelle 1)
-
a) 2-((1-(2-(3-Chlorphenyl)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on
-
Unter
Verwendung von 3'-Chloracetophenon
wurde die Titelverbindung durch ähnliche
Verfahren wie in Beispiel 72a und Beispiel 1e erhalten als oranges Öl (Ausbeute:
79%).
1H-NMR (CDCl3): δ 7,98-8,00
(m, 1H), 7,90 (d, J = 8,1 Hz, 1H), 7,85 (d, J = 7,5 Hz, 1H), 7,3-7,6
(m, 5H), 4,41 (s, 2H), 3,74 (s, 2H), 3,52 (d, J = 7,4 Hz, 2H), 2,94-3,02
(m, 2H), 2,08-2,20 (m, 2H), 1,6-1,9 (m, 3H), 1,3-1,5 (m, 2H).
-
b) 2-((1-(2-(3-Chlorphenyl)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-fumarat
-
Unter
Verwendung der in Beispiel 76a erhaltenen Verbindung wurde die Titelverbindung
durch ähnliche
Verfahren wie in Beispiel 36c erhalten als farbloser Feststoff (Ausbeute:
64%).
Schmelzpunkt: 187–193°C
1H-NMR (DMSO-d6): δ 8,00 (d,
J = 1,5 Hz, 1H), 7,97 (d, J = 8,4 Hz, 1H), 7,64-7,74 (m, 2H), 7,4-7,6
(m, 4H), 6,61 (s, 2H, Fumarsäure),
4,48 (s, 2H), 3,88 (s, 2H), 3,40 (d, J = 7,2 Hz, 2H), 2,86-2,92
(m, 2H), 2,10-2,21 (m, 2H), 1,6-1,8 (m, 1H), 1,5-1,6 (m, 2H), 1,1-1,3
(m, 2H).
-
Beispiel 77: 2-((1-(2-(2-Tolyl)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-fumarat (Verbindung
386 in Tabelle 1)
-
a) 2-((1-(2-(2-Tolyl)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on
-
Unter
Verwendung von 2'-Methylacetophenon
wurde die Titelverbindung durch ähnliche
Verfahren wie in Beispiel 72a und Beispiel 1e erhalten als oranges Öl (Ausbeute:
78%).
1H-NMR (CDCl3): δ 7,84 (d,
J = 7,5 Hz, 1H), 7,33-7,66 (m, 5H), 7,20-7,27 (m, 2H), 4,41 (s,
2H), 3,75 (s, 2H), 3,52 (d, J = 7,2 Hz, 2H), 2,99-3,07 (m, 2H),
2,48 (s, 3H), 2,1-2,3 (m, 2H), 1,8-2,0 (m, 1H), 1,6-1,8 (m, 2H), 1,4-1,6
(m, 2H).
-
b) 2-((1-(2-(2-Tolyl)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-fumarat
-
Unter
Verwendung der in Beispiel 77a erhaltenen Verbindung wurde die Titelverbindung
durch ähnliche
Verfahren wie in Beispiel 36c erhalten als farbloser Feststoff (Ausbeute:
56%).
Schmelzpunkt: 186–194°C
1H-NMR (DMSO-d6): δ 7,75 (d,
J = 7,2 Hz, 1H), 7,66 (d, J = 7,5 Hz, 1H), 7,55-7,60 (m, 2H), 7,39-7,51
(m, 2H), 7,30 (t, J = 7,1 Hz, 2H), 6,61 (s, 2H, Fumarsäure), 4,47
(s, 2H), 3,79 (s, 2H), 3,39 (d, J = 7,2 Hz, 2H), 2,86-2,93 (m, 2H),
2,38 (s, 3H), 2,12-2,23 (m, 2H), 1,6-1,8 (m, 1H), 1,5-1,6 (m, 2H),
1,1-1,3 (m, 2H).
-
Beispiel 78: 2-((1-(2-(3-Tolyl)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-fumarat (Verbindung
391 in Tabelle 1)
-
a) 2-((1-(2-(3-Tolyl)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on
-
Unter
Verwendung von 3'-Methylacetophenon
wurde die Titelverbindung durch ähnliche
Verfahren wie in den Beispielen 72a und 1e erhalten als gelbes Öl (Ausbeute:
58%).
1H-NMR (CDCl3): δ 7,84 (d,
J = 7,5 Hz, 1H), 7,77-7,82 (m, 2H), 7,26-7,56 (m, 5H), 4,41 (s,
2H), 3,82 (s, 2H), 5,52 (d, J = 7,2 Hz, 2H), 2,99-3,06 (m, 2H),
2,40 (s, 3H), 2,18-2,30 (m, 2H), 1,8-2,0 (m, 1H), 1,6-1,8 (m, 2H), 1,4-1,6
(m, 2H).
-
b) 2-((1-(2-(3-Tolyl)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-fumarat
-
Unter
Verwendung der in Beispiel 78a erhaltenen Verbindung wurde die Titelverbindung
durch ähnliche
Verfahren wie in Beispiel 36c erhalten als farbloser Feststoff (Ausbeute:
55%).
Schmelzpunkt: 185–193°C
1H-NMR (DMSO-d6): δ 7,77-7,82
(m, 2H), 7,67 (d, J = 7,5 Hz, 1H), 7,55-7,60 (m, 2H), 7,35-7,52
(m, 3H), 6,61 (s, 2H, Fumarsäure),
4,48 (s, 2H), 3,88 (s, 2H), 3,41 (d, J = 7,3 Hz, 2H), 2,8-3,0 (m,
2H), 2,37 (s, 3H), 2,0-2,2 (m, 2H), 1,6-1,8 (m, 1H), 1,5-1,6 (m,
2H), 1,1-1,3 (m, 2H).
-
Beispiel 79: 2-((1-(2-(3-Methoxyphenyl)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-fumarat
(Verbindung 381 in Tabelle 1)
-
a) 2-((1-(2-(3-Methoxyphenyl)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on
-
Unter
Verwendung von 2-Brom-1-(3-methoxyphenyl)-ethan-1-on wurde die Titelverbindung
durch ähnliche
Verfahren wie in Beispiel 1e erhalten als gelbes Öl (Ausbeute:
90%).
1H-NMR (CDCl3): δ 7,84 (d,
J = 7,2 Hz, 1H), 7,40-7,65 (m, 5H), 7,35 (t, J = 8,0 Hz, 1H), 7,08-7,19
(m, 1H), 4,41 (s, 2H), 3,85 (s, 3H), 3,80 (s, 2H), 3,52 (d, J =
7,2 Hz, 2H), 2,97-3,06 (m, 2H), 2,15-2,29 (m, 2H), 1,6-1,9 (m, 3H),
1,4-1,6 (m, 2H).
-
b) 2-((1-(2-(3-Methoxyphenyl)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-fumarat
-
Unter
Verwendung der in Beispiel 79a erhaltenen Verbindung wurde die Titelverbindung
durch ähnliche
Verfahren wie in Beispiel 36c erhalten als farbloser Feststoff (Ausbeute:
71 %).
Schmelzpunkt: 178–188°C
1H-NMR (DMSO-d6): δ 7,67 (d,
J = 7,5 Hz, 1H), 7,55-7,61 (m, 3H), 7,40-7,52 (m, 3H), 7,21 (dd,
J = 2,3 Hz, 8,1 Hz, 1H), 6,61 (s, 2H, Fumarsäure), 4,48 (s, 2H), 3,87 (s,
2H), 3,81 (s, 3H), 3,41 (d, J = 7,2 Hz, 2H), 2,8-3,0 (m, 2H), 2,0-2,2
(m, 2H), 1,6-1,8 (m, 1H), 1,5-1,6 (m, 2H), 1,1-1,3 (m, 2H).
-
Beispiel 80: 5-Methoxy-2-((1-(2-phenyl-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-fumarat
(Verbindung 42 in Tabelle 1)
-
a) 5-Methoxy-2-((1-(2-phenyl-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on
-
Unter
Verwendung der in Beispiel 9c erhaltenen Verbindung sowie Phenacylbromid
wurde die Titelverbindung durch ähnliche
Verfahren wie in Beispiel 1e erhalten als blassgelbes Öl (Ausbeute:
55%).
1H-NMR (CDCl3): δ 8,01 (d,
J = 7,2 Hz, 2H), 7,75 (dd, J = 2,6 Hz, 8,7 Hz, 1H), 7,53-7,61 (m, 1H), 7,45
(t, J = 7,5 Hz, 2H), 6,96-7,00 (m, 1H), 6,92 (s, 1H), 4,63 (s, 2H),
3,88 (s, 3H), 3,82 (s, 2H), 3,48 (d, J = 7,2 Hz, 2H), 2,97-3,05
(m, 2H), 2,15-2,27
(m, 2H), 1,6-1,9 (m, 3H), 1,4-1,6 (m, 2H).
-
b) 5-Methoxy-2-((1-(2-phenyl-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-fumarat
-
Unter
Verwendung der in Beispiel 80a erhaltenen Verbindung wurde die Titelverbindung
durch ähnliche
Verfahren wie in Beispiel 36c erhalten als farbloser Feststoff (Ausbeute:
74%).
Schmelzpunkt: 186–193°C
1H-NMR (DMSO-d6): δ 7,99 (d,
J = 7,5 Hz, 2H), 7,66 (t, J = 7,5 Hz, 1H), 7,49-7,62 (m, 3H), 7,13
(d, J = 1,5 Hz, 1H), 7,02 (dd, J = 2,1 Hz, 8,4 Hz, 1H), 6,61 (s,
2H, Fumarsäure),
4,41 (s, 2H), 3,89 (s, 2H), 3,83 (s, 3H), 3,36 (d, J = 7,2 Hz, 2H),
2,88-2,95 (m, 2H), 2,12-2,23 (m, 2H), 1,6-1,8 (m, 1H), 1,5-1,6 (m,
2H), 1,1-1,3 (m, 2H).
-
Beispiel 81: 2-((1-(2-(2-Furyl)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-hydrochlorid (Verbindung
416 in Tabelle 1)
-
a) 2-Brom-1-(2-furyl)-ethan-1-on
-
Unter
Verwendung von 2-Acetylfuran (500 mg, 4,54 mmol) wurde die Titelverbindung
durch ähnliche Verfahren
wie in Beispiel 72a erhalten als farblose halbfeste Substanz (119
mg, Ausbeute: 14%).
1H-NMR (CDCl3): δ 7,65
(s, 1H), 7,35 (d, J = 3,9 Hz, 1H), 4,33 (s, 2H).
-
b) 2-((1-(2-(2-Furyl)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on
-
Unter
Verwendung der in Beispiel 81a erhaltenen Verbindung (119 mg, 0,63
mmol) und der in Beispiel 1d erhaltenen Verbindung (160 mg, 0,60
mmol) wurde die Titelverbindung durch ähnliche Verfahren wie in Beispiel
1e als Rohprodukt erhalten (131 mg). Das Rohprodukt wurde in die
nächste
Reaktion ohne Aufreinigung eingesetzt.
-
c) 2-((1-(2-(2-Furyl)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-hydrochlorid
-
Unter
Verwendung des in Beispiel 81b erhaltenen Rohprodukts (131 mg) wurde
die Titelverbindung durch ähnliche
Verfahren wie in Beispiel 1f erhalten als farbloser Feststoff (Ausbeute:
18%, 2 Stufen).
Schmelzpunkt (Zersetzung): 209–216°C
1H-NMR (DMSO-d6): δ 9,98 (br
s, 1H), 8,17 (s, 1H), 7,74-7,58 (m, 4H), 7,53-7,47 (m, 1H), 6,85
(d, J = 3,5 Hz, 1H), 4,87-4,78 (m, 2H), 4,52 (s, 2H), 3,60-3,44
(m, 4H), 3,05-2,98 (m, 2H), 2,01 (br s, 1H), 1,83 (br d, J = 13,9 Hz,
2H), 1,64 (br dd, J = 11,1 Hz, 11,1 Hz, 2H).
-
Beispiel 82: 2-((1-(2-(2-Thienyl)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-hydrochlorid (Verbindung 421
in Tabelle 1)
-
a) 2-Brom-1-(2-thienyl)-ethan-1-on und
2-Brom-1-(5-brom-2-thienyl)-ethan-1-on
-
Unter
Verwendung von 2-Acetylthiophen (500 mg, 3,96 mmol) wurde eine ähnliche
Reaktion wie in Beispiel 72a durchgeführt. Das Produkt wurde mittels
Silicagel-Säulenchromatographie
gereinigt, um 2-Brom-1-(2-thienyl)-ethan-1-on als blassgelbes Öl (618 mg,
Ausbeute: 76%) und 2-Brom-1-(5-brom-2-thienyl)-ethan-1-on als blassgelbes Öl (171 mg,
Ausbeute: 15%) zu erhalten.
2-Brom-1-(2-thienyl)-ethan-1-on
1H-NMR (CDCl3): δ 7,82 (d,
J = 3,6 Hz, 1H), 7,73 (d, J = 4,0 Hz, 1H), 7,18 (dd, J = 5,2 Hz,
3,8 Hz, 1H), 4,37 (s, 2H).
2-Brom-1-(5-brom-2-thienyl)-ethan-1-on
1H-NMR (CDCl3): δ 7,55 (d,
J = 3,8 Hz, 1H), 7,14 (d, J = 3,8 Hz, 1H), 4,28 (s, 2H).
-
b) 2-((1-(2-(2-Thienyl)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on
-
Unter
Verwendung von 2-Brom-1-(2-thienyl)-ethan-1-on, erhalten in Beispiel
82a (300 mg, 1,46 mmol), und der in Beispiel 1d erhaltenen Verbindung
(389 mg, 1,46 mmol), wurde eine ähnliche
Reaktion wie in Beispiel 1e durchgeführt, um die Titelverbindung
als farblosen Feststoff zu erhalten (441 mg, Ausbeute: 85%).
1H-NMR (CDCl3): δ 7,98 (dd,
J = 3,8 Hz, 1,1 Hz, 1H), 7,85 (d, J = 7,5 Hz, 1H), 7,62-7,61 (m, 1H), 7,56-7,43
(m, 3H), 7,13-7,10 (m, 1H), 4,41 (s, 2H), 3,58 (s, 2H), 3,53 (d,
J = 7,3 Hz, 2H), 2,96 (br d, J = 11,5 Hz, 2H), 2,17 (ddd, J = 2,4
Hz, 11,5 Hz, 11,5 Hz, 2H), 1,84-1,78 (m, 1H), 1,70-1,67 (m, 2H),
1,53 (ddd, J = 3,6 Hz, J = 12,0 Hz, 12,0 Hz, 2H).
-
c) 2-((1-(2-(2-Thienyl)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-hydrochlorid
-
Unter
Verwendung der in Beispiel 82b erhaltenen Verbindung (435 mg, 1,23
mmol) wurde eine ähnliche
Reaktion wie in Beispiel 1f durchgeführt, um die Titelverbindung
als farblosen Feststoff zu erhalten (418 mg, Ausbeute: 87%).
Schmelzpunkt:
182–186°C
1H-NMR (DMSO-d6): δ 10,1 (br
s, 1H), 8,18 (d, J = 1,8 Hz, 1H), 8,05 (d, J = 3,3 Hz, 1H), 7,69
(d, J = 7,2 Hz, 1H), 7,62-7,58 (m, 2H), 7,53-7,47 (m, 1H), 7,36-7,34
(m, 1H), 5,04-4,95 (m, 2H), 4,53 (s, 2H), 3,55 (br d, J = 11,7 Hz,
2H), 3,46 (br d, J = 6,9 Hz, 2H), 3,05 (br s, 2H), 2,03 (br s, 1H),
1,86-1,63 (m, 4H).
-
Beispiel 83: 2-((1-(2-(5-Brom-2-thienyl)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-hydrochlorid
(Verbindung 426 in Tabelle 1)
-
a) 2-((1-(2-(5-Brom-2-thienyl)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on
-
Unter
Verwendung von 2-Brom-1-(5-brom-2-thienyl)-ethan-1-on, erhalten
in Beispiel 82a (171 mg, 0,602 mmol), wurde eine ähnliche
Reaktion wie in Beispiel 82a durchgeführt, um das Rohprodukt der
Titelverbindung als blassbraunen Feststoff zu erhalten (210 mg).
Das erhaltene Rohprodukt wurde ohne Aufreinigung in die nächste Reaktion
eingesetzt.
-
b) 2-((1-(2-(5-Brom-2-thienyl)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-hydrochlorid
-
Unter
Verwendung des in Beispiel 83a erhaltenen Rohprodukts (171 mg) wurde
eine ähnliche
Reaktion wie in Beispiel 1f durchgeführt, um die Titelverbindung
als blassbraunen Feststoff zu erhalten (99 mg, Ausbeute: 38%, 2
Stufen).
Schmelzpunkt (Zersetzung): 195–208°C
1H-NMR
(DMSO-d6): δ 10,1 (br s, 1H), 8,03-7,89
(m, 1H), 7,70-7,47 (m, 5H), 5,01-4,90 (m, 2H), 4,52 (s, 2H), 3,58-3,44
(m, 4H), 3,04-2,97 (m, 2H), 2,03-1,60 (m, 5H).
-
Beispiel 84: 2-((1-(2-Cyclohexyl-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-fumarat (Verbindung
446 in Tabelle 1)
-
a) 2-Chlor-1-(1-cyclohexyl)-ethan-1-on
-
Unter
Verwendung von Methylcyclohexancarbonsäure wurde die Titelverbindung
erhalten nach dem Verfahren zur Darstellung von Halogenketonen,
beschrieben in der internationalen Veröffentlichung Nr.
WO/23756 (Ausbeute: 79%).
1H-NMR (CDCl
3): δ 4,16 (s,
2H), 2,58-2,69 (m, 1H), 1,6-1,9 (m, 4H), 1,1-1,5 (m, 6H).
-
b) 2-((1-(2-Cyclohexyl-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on
-
Unter
Verwendung der in Beispiel 84a erhaltenen Verbindung wurde die Titelverbindung
durch ähnliche
Verfahren wie in Beispiel 1e erhalten als farbloses Öl (Ausbeute:
51%).
1H-NMR (CDCl3): δ 7,84 (d,
J = 7,2 Hz, 1H), 7,41-7,56 (m, 3H), 4,40 (s, 2H), 3,50 (d, J = 7,2
Hz, 2H), 3,20 (s, 2H), 2,81-2,88 (m, 2H), 2,41-2,50 (m, 1H), 1,98-2,09
(m, 2H), 1,6-1,9 (m, 7H), 1,1-1,5 (m, 8H).
-
c) 2-((1-(2-Cyclohexyl-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-fumarat
-
Unter
Verwendung der in Beispiel 84b erhaltenen Verbindung wurde die Titelverbindung
durch ähnliche
Verfahren wie in Beispiel 36c erhalten als farbloser Feststoff (Ausbeute:
89%).
Schmelzpunkt: 186–196°C
1H-NMR (DMSO-d6): δ 7,67 (d,
J = 7,5 Hz, 1H), 7,55-7,60 (m, 2H), 7,45-7,52 (m, 1H), 6,61 (s,
2H, Fumarsäure), 4,48
(s, 2H), 3,41 (d, J = 7,4 Hz, 2H), 3,29 (s, 2H), 2,75-2,81 (m, 2H),
2,4-2,6 (m, 1H), 2,0-2,2 (m, 2H), 1,53-1,76 (m, 8H), 1,0-1,3 (m,
7H).
-
Beispiel 85: 2-((1-(2-Cyclohexyl-2-hydroxyethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-fumarat
(Verbindung 451 in Tabelle 1)
-
a) 2-((1-(2-Cyclohexyl-2-hydroxyethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on
-
Unter
Verwendung der in Beispiel 84b erhaltenen Verbindung wurde die Titelverbindung
durch ähnliche
Verfahren wie in Beispiel 16a erhalten als farbloser Feststoff (Ausbeute:
77%).
1H-NMR (CDCl3): δ 7,85 (d,
J = 7,5 Hz, 1H), 7,42-7,57 (m, 3H), 4,40 (s, 2H), 3,48-3,53 (m, 2H), 3,35-3,45
(m, 1H), 3,0-3,1 (m, 1H), 2,7-2,8 (m, 1H), 2,2-2,4 (m, 3H), 1,5-2,0
(m, 9H), 0,9-1,5 (m, 8H).
-
b) 2-((1-(2-Cyclohexyl-2-hydroxyethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-fumarat
-
Unter
Verwendung der in Beispiel 85a erhaltenen Verbindung wurde die Titelverbindung
durch ähnliche
Verfahren wie in Beispiel 36c erhalten als farbloser Feststoff (Ausbeute:
85%).
Schmelzpunkt: 180–183°C
1H-NMR (DMSO-d6): δ 7,67 (d,
J = 7,2 Hz, 1H), 7,55-7,62 (m, 2H), 7,44-7,52 (m, 1H), 6,53 (s,
2H, Fumarsäure), 4,49
(s, 2H), 3,45-3,60 (m, 1H), 3,42 (d, J = 7,2 Hz, 2H), 3,0-3,2 (m,
2H), 2,5-2,7 (m, 2H), 2,2-2,4 (m, 2H), 0,90-2,0 (m, 17H).
-
Beispiel 93: 2-((1-(2-(2-(1-Benzyl)-pyrrolyl)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-hydrochlorid (Verbindung
431 in Tabelle 1)
-
Unter
Verwendung von 2-Acetylpyrrol wurde 1-Benzyl-2-acetylpyrrol durch ähnliche
Verfahren wie in Beispiel 89a synthetisiert, und anschließend wurde
das Produkt ohne Aufreinigung ähnlichen
Verfahren wie in Beispiel 69 unterworfen, um die Titelverbindung
zu erhalten (Ausbeute: 8%)
Schmelzpunkt: 196–200°C
1H-NMR (DMSO-d6): δ 9,71 (br
s, 1H), 7,68 (d, J = 7,8 Hz, 1H), 7,61 (m, 2H), 7,57 (m, 1H), 7,49
(m, 1H), 7,23-7,33 (m, 4H), 7,08 (m, 2H), 6,35 (m, 1H), 5,59 (s,
2H), 4,69-4,78 (m, 2H), 4,51 (s, 2H), 2,89-3,56 (m, 6H), 1,97 (m,
1H), 1,79 (m, 2H), 1,58 (m, 2H).
-
Beispiel 94: 2-((1-(2-(2-(1-Butyl)-pyrrolyl)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-hydrochlorid
(Verbindung 436 in Tabelle 1)
-
Unter
Verwendung von 2-Acetylpyrrol wurde 1-Butyl-2-acetylpyrrol durch ähnliche
Verfahren wie in Beispiel 90a synthetisiert, und anschließend wurde
das Produkt ohne Aufreinigung ähnlichen
Verfahren wie in Beispiel 69 unterworfen, um die Titelverbindung
zu erhalten (Ausbeute: 67%).
Schmelzpunkt: 200–207°C
1H-NMR (DMSO-d6): δ 9,78 (br
s, 1H), 7,69 (d, J = 7,5 Hz, 1H), 7,61 (m, 2H), 7,51 (m, 1H), 7,40
(m, 1H), 7,20 (m, 1H), 6,25 (m, 1H), 4,70-4,78 (m, 2H), 4,53 (s,
2H), 4,30 (t, J = 7,2 Hz, 2H), 2,52-3,51 (m, 6H), 1,94 (m, 1H), 1,82
(br d, J = 12 Hz, 2H), 1,25 (m, 2H), 0,88 (t, J = 7,5 Hz, 3H).
-
Beispiel 95: 2-((1-(2-(2-(1-Phenyl)-pyrrolyl)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-hydrochlorid (Verbindung
441 in Tabelle 1)
-
a) 2-((1-(2-(2-(1-Phenyl)-pyrrolyl)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on
-
Unter
Verwendung von 1-Phenyl-2-chloracetylpyrrol, dargestellt nach dem
in der Literatur beschriebenen Verfahren (P.D. Croce, C.L. Rosa,
A. Ritieni, Synthesis, 1989, 783), wurde die Titelverbindung durch ähnliche
Verfahren wie in Beispiel 1e erhalten (Ausbeute: 52%).
1H-NMR (CDCl3): δ 7,84 (d,
J = 7,2 Hz, 1H), 7,34-7,57 (m, 6H), 7,21-7,25 (m, 3H), 6,95 (m,
1H), 6,29 (m, 1H), 4,38 (s, 2H), 3,61 (s, 2H), 3,48 (d, J = 7,2
Hz, 2H), 2,94 (br d, J = 11 Hz, 2H), 2,12 (dt, J = 11,4 Hz, 2,4
Hz, 2H), 1,80 (m, 1H), 1,65 (br d, J = 12 Hz, 2H), 1,45 (dq, J =
12 Hz, 3 Hz, 2H).
-
b) 2-((1-(2-(2-(1-Phenyl)-pyrrolyl)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-hydrochlorid
-
Unter
Verwendung der in Beispiel 95a erhaltenen Verbindung wurde die Titelverbindung
durch ähnliche
Verfahren wie in Beispiel 1f erhalten (Ausbeute: 89%).
Schmelzpunkt:
(193–197°C)
1H-NMR (DMSO-d6): δ 9,75 (br
s, 1H), 7,65 (d, J = 7,5 Hz, 1H), 7,33-7,50 (m, 8H), 6,46 (m, 1H),
4,76-4,86 (m, 2H), 4,51 (s, 2H), 2,98-3,61 (m, 6H), 1,99 (m, 1H), 1,78
(m, 2H), 1,56 (m, 2H).
-
Beispiel 107: 2-((1-(2-(4-Fluorphenylthio)-ethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-hydrochlorid
(Verbindung 706 in Tabelle 1)
-
a) 2-((1-(2-(4-Fluorphenylthio)-ethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on
-
4-Fluorbenzolthiol
(0,50 ml, 4,69 mmol) und 2-Bromethanol (0,345 ml, 4,87 mmol) wurden
gelöst
in Tetrahydrofuran (12 ml). Zur Lösung wurde 1N wässrige Natriumhydroxidlösung (4,8
ml, 4,8 mmol) gegeben und bei 80°C
für eine
Stunde unter Rühren
erhitzt. Die Reaktionsmischung wurde mit einem Lösemittelgemisch aus Ethylacetat
und Hexan verdünnt
und mit verdünnter
wässriger
Natriumhydroxidlösung,
Wasser und anschließend
mit gesättigter
Kochsalzlösung
gewaschen und über
Magnesiumsulfat getrocknet. Unlösliche Feststoffe
wurden durch Filtration abgetrennt und das Filtrat wurde unter vermindertem
Druck eingeengt, um 2-(4-Fluorphenylthio)-ethanol als Rohprodukt
zu erhalten. Unter Verwendung des resultierenden Produkts wurde
2-(4-Fluorphenylthio)-ethyl-ethansulfonat als Rohprodukt durch ähnliche
Verfahren wie in Beispiel 26a erhalten. Unter Verwendung des resultierenden
Produkts wurde die Titelverbindung durch ähnliche Verfahren wie in Beispiel
26b erhalten als farbloser Feststoff (Ausbeute: 64%).
1H-NMR (CDCl3): δ 7,84 (d,
J = 7,5 Hz, 1H), 7,40-7,55 (m, 3H), 7,31-7,39 (m, 2H), 6,98 (t,
J = 8,9 Hz, 2H), 4,39 (s, 2H), 3,49 (d, J = 7,2 Hz, 2H), 2,95-3,02
(m, 2H), 2,85-2,94 (m, 2H), 2,54-2,61 (m, 2H), 1,94-2,04 (m, 2H), 1,5-1,8
(m, 3H), 1,2-1,4 (m, 2H).
-
b) 2-((1-(2-(4-Fluorphenylthio)-ethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-hydrochlorid
-
Unter
Verwendung der in Beispiel 107a erhaltenen Verbindung wurde die
Titelverbindung durch ähnliche
Verfahren wie in Beispiel 1f erhalten (Ausbeute: 86%).
Schmelzpunkt:
185–192°C
1H-NMR (DMSO-d6): δ 10,55 (br
s, 1H, HCl), 7,68 (d, J = 7,5 Hz, 1H), 7,59-7,62 (m, 2H), 7,46-7,52
(m, 3H), 7,18-7,25 (m, 2H), 4,50 (s, 2H), 3,1-3,7 (m, 8H), 2,7-2,9 (m, 2H), 1,7-2,0
(m, 3H), 1,4-1,6 (m, 2H).
-
Beispiel 108: 2-((1-(3-(4-Fluorphenylthio)-propyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-hydrochlorid
(Verbindung 711 in Tabelle 1)
-
a) 3-(4-Fluorphenylthio)-propanol
-
4-Fluorbenzolthiol
(788 mg, 6,15 mmol) und 3-Brompropanol (0,535 ml, 6,16 mmol) wurden
gelöst
in Tetrahydrofuran (20 ml). Der Lösung wurde 1N wässrige Natriumhydroxidlösung (6,2
ml, 6,2 mmol) zugefügt und
bei 80°C
unter Rühren
für 3 Stunden
erhitzt. Die Reaktionsmischung wurde verdünnt mit einem Lösemittelgemisch
aus Ethylacetat und Hexan und mit verdünnter wässriger Natriumhydroxidlösung, Wasser
und anschließend
mit gesättigter
Kochsalzlösung
gewaschen und über
Magnesiumsulfat getrocknet. Unlösliche
Feststoffe wurden durch Filtration abgetrennt und das Filtrat unter
vermindertem Druck eingeengt. Das resultierende Öl wurde gereinigt mittels Silicagel-Säulenchromatographie
(Ethylacetat/Hexan), um die Titelverbindung als farbloses Öl zu erhalten
(592 mg, Ausbeute: 52%).
1H-NMR (CDCl3): δ 7,33-7,39
(m, 2H), 6,97-7,03 (m, 2H), 3,77 (t, J = 6,0 Hz, 2H), 2,99 (t, J
= 7,3 Hz, 2H), 1,80-1,91 (m, 2H), 1,49 (br s, 1H, OH).
-
b) 2-((1-(3-(4-Fluorphenylthio)-propyl)-piperidin-4-yl)-methyl)-isoindolin-1-on
-
Unter
Verwendung der in Beispiel 108a erhaltenen Verbindung wurde 3-(4-Fluorphenylthio)-propyl-methansulfonat
durch ähnliche
Verfahren wie in Beispiel 26a als Rohprodukt erhalten. Unter Verwendung des
resultierenden Produkts wurde die Titelverbindung durch ähnliche
Verfahren wie in Beispiel 26b erhalten als blassgelber Feststoff
(Ausbeute: 86%).
1H-NMR (CDCl3): δ 7,85
(d, J = 7,5 Hz, 1H), 7,41-7,55 (m, 3H), 7,30-7,37 (m, 2H), 6,98
(t, J = 8,6 Hz, 2H), 4,40 (s, 2H), 3,40 (d, J = 7,3 Hz, 2H), 2,83-2,92
(m, 4H), 2,41 (t, J = 7,5 Hz, 2H), 1,86-1,96 (m, 2H), 1,5-1,8 (m,
5H), 1,2-1,4 (m, 2H).
-
c) 2-((1-(3-(4-Fluorphenylthio)-propyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-hydrochlorid
-
Unter
Verwendung der in Beispiel 108b erhaltenen Verbindung wurde die
Titelverbindung durch ähnliche
Verfahren wie in Beispiel 1f erhalten als farbloser Feststoff (Ausbeute:
52%).
Schmelzpunkt: 162–164°C
1H-NMR (DMSO-d6): δ 9,8-10,6
(br s, 1H, HCl), 7,68 (d, J = 7,5 Hz, 1H), 7,60-7,62 (m, 2H), 7,42-7,52
(m, 3H), 7,17-7,24 (m, 2H), 4,50 (s, 2H), 2,9-3,7 (m, 8H), 2,6-2,8 (m, 2H), 1,8-2,0
(m, 3H), 1,6-1,8 (m, 2H), 1,4-1,6 (m, 2H).
-
Beispiel 109: 2-((1-(2-(Phenylthio)-ethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-fumarat (Verbindung
726 in Tabelle 1)
-
Unter
Verwendung von Thiophenol wurde 2-((1-(2-(Phenylthio)-ethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on
durch ähnliche
Verfahren wie in Beispiel 107a als Rohprodukt erhalten. Unter Verwendung
des resultierenden Produkts wurde die Titelverbindung durch ähnliche
Verfahren wie in Beispiel 36c erhalten als farbloser Feststoff (Ausbeute:
62%).
Schmelzpunkt: 188–192°C
1H-NMR (DMSO-d6): δ 7,67 (d,
J = 7,5 Hz, 1H), 7,55-7,60 (m, 2H), 7,45-7,52 (m, 1H), 7,27-7,35
(m, 4H), 7,14-7,20 (m, 1H), 6,60 (s, 2H, Fumarsäure), 4,47 (s, 2H), 3,40 (d,
J = 7,2 Hz, 2H), 3,06-3,18 (m, 2H), 2,88-2,95 (m, 2H), 2,5-2,6 (m,
2H), 1,9-2,1 (m, 2H), 1,6-1,8 (m, 1H), 1,5-1,6 (m, 2H), 1,1-1,3
(m, 2H).
-
Beispiel 110: 2-((1-(2-(2-Methoxyphenylthio)-ethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-fumarat
(Verbindung 731 in Tabelle 1)
-
Unter
Verwendung von 2-Methoxybenzolthiol wurde 2-((1-(2-(2-Methoxyphenylthio)-ethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on
durch ähnliche
Verfahren wie in Beispiel 107a als Rohprodukt erhalten. Unter Verwendung
des resultierenden Produkts wurde die Titelverbindung durch ähnliche
Verfahren wie in Beispiel 36c erhalten als farbloser Feststoff (Ausbeute:
53%).
Schmelzpunkt: 166–169°C
1H-NMR (DMSO-d6): δ 7,67 (d,
J = 7,5 Hz, 1H), 7,55-7,60 (m, 2H), 7,45-7,52 (m, 1H), 7,14-7,25
(m, 2H), 6,90-6,99 (m, 2H), 6,60 (s, 2H, Fumarsäure), 4,48 (s, 2H), 3,80 (s,
3H), 3,41 (d, J = 7,3 Hz, 2H), 2,99-3,06 (m, 2H), 2,91-2,98 (m,
2H), 2,55-2,64 (m, 2H), 2,0-2,11 (m, 2H), 1,6-1,8 (m, 1H), 1,5-1,6
(m, 2H), 1,1-1,3 (m, 2H).
-
Beispiel 111: 2-((1-(2-(3-Methoxyphenylthio)-ethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-fumarat
(Verbindung 736 in Tabelle 1)
-
Unter
Verwendung von 3-Methoxybenzolthiol wurde 2-((1-(2-(3-Methoxyphenylthio)-ethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on
durch ähnliche
Verfahren wie in Beispiel 107a als Rohprodukt erhalten. Unter Verwendung
des resultierenden Produkts wurde die Titelverbindung durch ähnliche
Verfahren wie in Beispiel 36c erhalten als farbloser Feststoff (Ausbeute:
40%).
Schmelzpunkt: 156–159°C
1H-NMR (DMSO-d6): δ 7,67 (d,
J = 7,4 Hz, 1H), 7,56-7,61 (m, 2H), 7,45-7,52 (m, 1H), 7,21 (t,
J = 7,9 Hz, 1H), 6,84-6,91 (m, 2H), 6,71-6,77 (m, 1H), 6,61 (s,
2H, Fumarsäure),
4,48 (s, 2H), 3,74 (s, 3H), 3,40 (d, J = 7,3 Hz, 2H), 3,07-3,15
(m, 2H), 2,90-2,97 (m, 2H), 2,56-2,63 (m, 2H), 2,02-2,09 (m, 2H),
1,6-1,8 (m, 1H), 1,5-1,6 (m, 2H), 1,1-1,3 (m, 2H).
-
Beispiel 112: 2-((1-(2-(2-Fluorphenylthio)-ethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-fumarat
(Verbindung 716 in Tabelle 1)
-
Unter
Verwendung von 2-Fluorbenzolthiol wurde 2-((1-(2-(2-Fluorphenylthio)ethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on
durch ähnliche
Verfahren wie in Beispiel 107a als Rohprodukt erhalten. Unter Verwendung des
resultierenden Produkts wurde die Titelverbindung durch ähnliche
Verfahren wie in Beispiel 36c erhalten als farbloser Feststoff (Ausbeute:
46%).
Schmelzpunkt: 187–189°C
1H-NMR (DMSO-d6): δ 7,67 (d,
J = 7,2 Hz, 1H), 7,55-7,60 (m, 2H), 7,41-7,52 (m, 2H), 7,14-7,28
(m, 3H), 6,16 (s, 2H, Fumarsäure),
4,47 (s, 2H), 3,39 (d, J = 7,2 Hz, 2H), 3,05-3,13 (m, 2H), 2,86-2,92
(m, 2H), 2,54-2,63 (m, 2H), 1,9-2,1 (m, 2H), 1,6-1,8 (m, 1H), 1,5-1,6
(m, 2H), 1,1-1,3 (m, 2H).
-
Beispiel 113: 2-((1-(2-(3-Fluorphenylthio)-ethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-fumarat
(Verbindung 721 in Tabelle 1)
-
Unter
Verwendung von 3-Fluorbenzolthiol wurde 2-((1-(2-(3-Fluorphenylthio)q-ethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on
durch ähnliche
Verfahren wie in Beispiel 107a als Rohprodukt erhalten. Unter Verwendung
des resultierenden Produkts wurde die Titelverbindung durch ähnliche
Verfahren wie in Beispiel 36c erhalten als farbloser Feststoff (Ausbeute:
48%).
Schmelzpunkt: 194–198°C
1H-NMR (DMSO-d5): δ 7,67 (d,
J = 7,4 Hz, 1H), 7,55-7,61 (m, 2H), 7,45-7,52 (m, 1H), 7,28-7,36
(m, 1H), 7,11-7,22 (m, 2H), 6,94-7,02 (m, 1H), 6,60 (s, 2H, Fumarsäure), 4,48
(s, 2H), 3,40 (d, J = 7,2 Hz, 2H), 3,12-3,19 (m, 2H), 2,90-2,96
(m, 2H), 2,56-2,64 (m, 2H), 1,97-2,08 (m, 2H), 1,6-1,8 (m, 1H),
1,5-1,6 (m, 2H), 1,1-1,3
(m, 2H).
-
Beispiel 114: 2-((1-(2-Phenoxyethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-fumarat
(Verbindung 611 in Tabelle 1)
-
a) 1-(4-Methylbenzol)-sulfonyloxy-2-phenoxyethan
-
2-Phenoxyethanol
(500 mg, 3,62 mmol) wurde gelöst
in Dichlormethan (7 ml) und der Lösung wurden p-Toluolsulfonylchlorid
(690 mg, 3,62 mmol) und Triethylamin (0,51 ml, 3,62 mmol) zugesetzt
und bei Raumtemperatur für
15 Stunden gerührt.
Die Reaktionsmischung wurde mit Dichlormethan verdünnt, mit
Wasser gewaschen und über
Magnesiumsulfat getrocknet. Unlösliche
Feststoffe wurden durch Filtration abgetrennt und das Filtrat wurde
unter vermindertem Druck eingedampft, um die Titelverbindung zu
erhalten (1,08 g, Ausbeute: quantitativ).
1H-NMR
(CDCl3): δ 7,83
(d, J = 1,8 Hz, 2H), 7,34 (d, J = 8,4 Hz, 2H), 7,28-7,23 (m, 2H),
6,98-6,93 (m, 1H), 6,78 (d, J = 7,8 Hz, 2H), 4,37 (t, J = 4,8 Hz,
2H), 4,14 (t, J = 5,0 Hz, 2H), 2,44 (s, 3H).
-
b) 2-((1-(2-Phenoxyethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on
-
Die
in Beispiel 114a erhaltene Verbindung (547 mg, 1,87 mmol) wurde
gelöst
in Dimethylformamid (3 ml), und der Lösung wurden die in Beispiel
1d erhaltene Verbindung (500 mg, 1,87 mmol) und Kaliumcarbonat (517
mg, 3,74 mmol) zugefügt
und anschließend
bei 60°C
für 7 Stunden
unter Rühren
erhitzt. Die Reaktionsmischung wurde zur Abkühlung stehen gelassen und anschließend wurde
Wasser (10 ml) zugegeben und mit Ethylacetat extrahiert. Der Extrakt
wurde mit Wasser und gesättigter
Kochsalzlösung
gewaschen und über
Natriumsulfat getrocknet. Unlösliche
Feststoffe wurden durch Filtration abgetrennt und das Filtrat unter
vermindertem Druck eingedampft. Der resultierende Feststoff wurde
suspendiert und gewaschen in Diethylether/Hexan und durch Filtration
gesammelt, um die Titelverbindung als Rohprodukt zu erhalten (171
mg). Das Produkt wurde ohne Aufreinigung in die nächste Reaktion
eingesetzt.
-
c) 2-((1-(2-Phenoxyethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-fumarat
-
Unter
Verwendung der in Beispiel 114b erhaltenen Verbindung (170 mg) wurde
die Titelverbindung durch ähnliche
Verfahren wie in Beispiel 36c erhalten als farbloser Feststoff (170
mg, Ausbeute: 19%, 2 Stufen).
Schmelzpunkt: 178–181°C
1H-NMR (DMSO-d6): δ 7,67 (d,
J = 7,5 Hz, 1H), 7,59 (d, J = 4,2 Hz, 2H), 7,51-7,47 (m, 1H), 6,95-6,90
(m, 3H), 6,59 (s, 2H), 4,48 (s, 2H), 4,11 (br t, J = 5,7 Hz, 2H),
3,42 (br d, J = 10,2 Hz, 2H), 2,85 (br t, J = 5,4 Hz, 2H), 2,23
(br dd, J = 11,3 Hz, 11,3 Hz, 2H), 1,80-1,75 (m, 1H), 1,61 (br d,
J = 12,9 Hz, 2H) 1,28 (br dd, J = 23,0 Hz, 10,2 Hz, 2H).
-
Beispiel 115: 2-((1-(2-(4-Chlorphenoxy)-ethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-fumarat (Verbindung
626 in Tabelle 1)
-
a) 1-Brom-2-(4-chlorphenoxy)-ethan
-
4-Chlorphenol
(500 mg, 3,89 mmol), 2-Bromethanol (0,28 ml, 3,89 mmol) und Triphenylphosphin
(1,02 g, 3,89 mmol) wurden gelöst
in Tetrahydrofuran (8 ml). Der Lösung
wurde tropfenweise Diisopropylazodicarboxylat (0,84 ml, 3,89 mmol)
zugegeben und bei Raumtemperatur für 3 Stunden gerührt. Das
Lösemittel
der Reaktionsmischung wurde verdampft und Feststoffe wurden unter
Verwendung von Diethylether/Hexan ausgefällt und durch Filtration abgetrennt.
Das Filtrat wurde unter vermindertem Druck eingedampft, um die Titelverbindung
als Rohprodukt zu erhalten (1,18 g). Das Rohprodukt wurde ohne Aufreinigung
in die nächste
Reaktion eingesetzt.
-
b) 2-((1-(2-(4-Chlorphenoxy)-ethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on
-
Die
in Beispiel 115a erhaltene Verbindung (500 mg) wurde gelöst in Dimethylformamid
(2 ml). Zur Lösung
wurden die in Beispiel 1d erhaltene Verbindung (440 mg, 1,65 mmol),
Kaliumcarbonat (456 mg, 3,30 mmol) und Natriumiodid (247 mg, 1,65
mmol) gegeben, und die Mischung wurde bei 60°C für 17 Stunden unter Rühren erhitzt.
Die Reaktionsmischung wurde zum Abkühlen stehen gelassen und anschließend mit
Ethylacetat verdünnt.
Die Mischung wurde mit Wasser und gesättigter Kochsalzlösung gewaschen
und über
Natriumsulfat getrocknet. Unlösliche
Feststoffe wurden durch Filtration abgetrennt und das Filtrat unter
vermindertem Druck eingedampft. Das resultierende Rohprodukt wurde
gereinigt mittels Silicagel-Säulenchromatographie (Methanol/Dichlormethan),
um die Titelverbindung als blassbraunen Feststoff zu erhalten (273
mg, Ausbeute: 18%, 2 Stufen).
1H-NMR
(CDCl3): δ 7,85
(d, J = 7,4 Hz, 1H), 7,56-7,42 (m, 3H), 7,23-7,19 (m, 2H), 6,84-6,80
(m, 2H), 4,40 (s, 2H), 4,05 (t, J = 5,8 Hz, 2H), 3,51 (d, J = 7,3
Hz, 2H), 2,98 (br d, J = 11,8 Hz, 2H), 2,77 (t, J = 5,9 Hz, 2H),
2,10 (ddd, J = 2,3 Hz, 11,6 Hz, 11,6 Hz, 2H), 1,84-1,68 (m, 3H),
1,45-1,40 (m, 2H).
-
c) 2-((1-(2-(4-Chlorphenoxy)-ethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-fumarat
-
Unter
Verwendung der in Beispiel 115b erhaltenen Verbindung (270 mg, 0,70
mmol) wurde die Titelverbindung durch ähnliche Verfahren wie in Beispiel
36c erhalten als farbloser Feststoff (272 mg, Ausbeute: 78%).
Schmelzpunkt:
189–192°C
1H-NMR (DMSO-d6): δ 7,67 (d,
J = 7,4 Hz, 1H), 7,59 (d, J = 1,4 Hz, 2H), 7,58-7,46 (m, 1H), 7,31
(dd, J = 7,5 Hz, 2,1 Hz, 1H), 6,97 (dd, J = 6,7 Hz, 2,1 Hz, 2H),
6,59 (s, 2H), 4,48 (s, 2H), 4,10 (t, J = 5,7 Hz, 2H), 3,41 (d, J
= 7,3 Hz, 2H), 3,00 (br d, J = 11,7 Hz, 2H), 2,80 (t, J = 5,8 Hz,
2H), 2,17 (dd, J = 10,7 Hz, 10,7 Hz, 2H), 1,79 (m, 1H), 1,60 (br
d, J = 12,4 Hz, 2H), 1,33-1,21 (m, 2H).
-
Beispiel 116: 2-((1-(2-(2-Methoxyphenoxy)-ethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-fumarat
(Verbindung 631 in Tabelle 1)
-
a) 1-Brom-2-(2-methoxyphenoxy)-ethan
-
Unter
Verwendung von 2-Methoxyphenol (186 mg, 1,5 mmol) wurde die Titelverbindung
durch ähnliche
Verfahren wie in Beispiel 115a erhalten (551 mg). Das resultierende
Rohprodukt wurde ohne Aufreinigung in die nächste Reaktion eingesetzt.
-
b) 2-((1-(2-(2-Methoxyphenoxy)-ethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on
-
Unter
Verwendung der in Beispiel 116a erhaltenen Verbindung (551 mg) wurde
die Titelverbindung durch ähnliche
Verfahren wie in Beispiel 115b erhalten als braunes Öl (119 mg,
Ausbeute: 21%, 2 Stufen).
1H-NMR (CDCl3): δ 7,85
(d, J = 7,5 Hz, 1H), 7,56-7,42 (m, 3H), 6,92-6,87 (m, 4H), 4,41
(s, 2H), 4,14 (t, J = 6,2 Hz, 2H), 3,85 (s, 3H), 3,51 (d, J = 7,2
Hz, 2H), 3,02 (br d, J = 11,7 Hz, 2H), 2,83 (t, J = 6,2 Hz, 2H),
2,15-2,07 (m, 2H), 1,87-1,69 (m, 3H), 1,51-1,37 (m, 2H).
-
c) 2-((1-(2-(2-Methoxyphenoxy)-ethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-fumarat
-
Unter
Verwendung der in Beispiel 116b erhaltenen Verbindung (119 mg, 0,32
mmol) wurde die Titelverbindung durch ähnliche Verfahren wie in Beispiel
36c erhalten als farbloser Feststoff (108 mg, Ausbeute: 69%).
Schmelzpunkt:
188–191°C
1H-NMR (DMSO-d6): δ 7,67 (d,
J = 7,5 Hz, 1H), 7,59-7,50 (m, 3H), 7,00-6,84 (m, 4H), 6,59 (s,
2H), 4,48 (s, 2H), 4,09 (t, J = 5,7 Hz, 2H), 3,74 (s, 3H), 3,41
(d, J = 7,2 Hz, 2H), 3,05 (br d, J = 11,1 Hz, 2H), 2,83 (br s, 2H),
2,22 (br dd, J = 11,0 Hz, 11,0 Hz, 2H), 1,78-1,77 (m, 1H), 1,62
(br d, J = 12,0 Hz, 2H), 1,28 (br dd, J = 21,8 Hz, 11,4 Hz, 2H).
-
Beispiel 117: 2-((1-(2-(2-Fluorphenoxy)-ethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-fumarat (Verbindung
616 in Tabelle 1)
-
a) 1-Brom-2-(2-fluorphenoxy)-ethan
-
Unter
Verwendung von 2-Fluorphenol (168 mg, 1,5 mmol) wurde die Titelverbindung
mittels Durchführung
einer ähnlichen
Reaktion wie in Beispiel 115a als Rohprodukt erhalten (418 mg).
Das resultierende Rohprodukt wurde ohne Aufreinigung in die nächste Reaktion
eingesetzt.
-
b) 2-((1-(2-(2-Fluorphenoxy)-ethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on
-
Unter
Verwendung der in Beispiel 117a erhaltenen Verbindung (418 mg) wurde
die Titelverbindung mittels Durchführung ähnlicher Reaktionen wie in
Beispiel 115b als braunes Öl
erhalten (240 mg, Ausbeute: 43%, 2 Stufen).
1H-NMR
(CDCl3): δ 7,85
(d, J = 7,2 Hz, 1H), 7,53-7,42 (m, 3H), 7,07-6,96 (m, 4H), 4,41
(s, 2H), 4,16 (t, J = 6,0 Hz, 2H), 3,51 (d, J = 7,2 Hz, 2H), 3,01
(br d, J = 11,7 Hz, 2H), 2,82 (t, J = 6,0 Hz, 2H), 2,13 (ddd, J
= 23,3 Hz, 11,6 Hz, 11,6 Hz, 2H), 1,84-1,68 (m, 3H), 1,49-1,40 (m,
2H).
-
c) 2-((1-(2-(2-Fluorphenoxy)-ethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-fumarat
-
Unter
Verwendung der in Beispiel 117b erhaltenen Verbindung (240 mg) wurde
die Titelverbindung mittels Ausführung
einer ähnlichen
Reaktion wie in Beispiel 36c als farbloser Feststoff erhalten (108
mg, Ausbeute: 78%).
Schmelzpunkt: 168–171°C
1H-NMR
(DMSO-d6): δ 7,67 (d, J = 7,5 Hz, 1H), 7,58
(br s, 2H), 7,50-7,47 (m, 1H), 7,22-7,11 (m, 3H), 6,94-6,92 (m,
1H), 6,60 (s, 2H), 4,48 (s, 2H), 4,17 (t, J = 5,6 Hz, 2H), 3,40
(d, J = 7,2 Hz, 2H), 3,00 (br d, J = 11,1 Hz, 2H), 2,81 (br dd,
J = 5,6 Hz, 5,6 Hz, 2H), 2,17 (br dd, J = 10,7 Hz, 10,7 Hz, 2H),
1,76-1,73 (m, 1H), 1,62 (br d, J = 12,0 Hz, 2H), 1,25 (br dd, J
= 22,4 Hz, 10,6 Hz, 2H).
-
Beispiel 118: 2-((1-(2-(3-Fluorphenoxy)-ethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-fumarat (Verbindung
621 in Tabelle 1)
-
a) 1-Brom-2-(3-fluorphenoxy)-ethan
-
Unter
Verwendung von 3-Fluorphenol (500 mg, 4,46 mmol) wurde die Titelverbindung
mittels Durchführung
einer ähnlichen
Reaktion wie in Beispiel 115a als Rohprodukt erhalten (1,26 g).
Das resultierende Rohprodukt wurde ohne Aufreinigung in die nächste Reaktion
eingesetzt.
-
b) 2-((1-(2-(3-Fluorphenoxy)-ethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on
-
Unter
Verwendung der in Beispiel 118a erhaltenen Verbindung (1,26 g) wurde
die Titelverbindung mittels Durchführung einer ähnlichen
Reaktion wie in Beispiel 115b als braunes Öl erhalten (823 mg, Ausbeute: 50%,
2 Stufen).
1H-NMR (CDCl3): δ 7,85 (d,
J = 7,2 Hz, 1H), 7,53-7,42 (m, 3H), 7,21-7,16 (m, 1H), 6,69-6,59
(m, 3H), 4,41 (s, 2H), 4,07 (t, J = 5,9 Hz, 2H), 3,51 (d, J = 7,2
Hz, 2H), 2,99 (br d, J = 12,0 Hz, 2H), 2,78 (t, J = 6,0 Hz, 2H),
2,11 (ddd, J = 2,5 Hz, 11,6 Hz, 11,6 Hz, 2H), 1,82-1,68 (m, 3H),
1,49-1,40 (m, 2H).
-
c) 2-((1-(2-(3-Fluorphenoxy)-ethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-fumarat
-
Unter
Verwendung der in Beispiel 118b erhaltenen Verbindung (823 mg) wurde
die Titelverbindung mittels Durchführung einer ähnlichen
Reaktion wie in Beispiel 36c als farbloser Feststoff erhalten (720
mg, Ausbeute: 67%)
Schmelzpunkt: 193–194°C
1H-NMR
(DMSO-d6): δ 7,67 (d, J = 7,4 Hz, 1H), 7,60-7,58
(m, 2H), 7,51-7,48 (m, 1H), 7,34-7,31 (m, 1H), 6,84-6,75 (m, 3H),
6,59 (s, 2H), 4,48 (s, 2H), 4,12 (t, J = 5,7 Hz, 2H), 3,41 (d, J
= 7,3 Hz, 2H), 3,02 (br d, J = 11,7 Hz, 2H), 2,81 (br dd, J = 5,7
Hz, 5,7 Hz, 2H), 2,19 (br dd, J = 10,5 Hz, 10,5 Hz, 2H), 1,79-1,74
(m, 1H), 1,61 (br d, J = 12,0 Hz, 2H), 1,32-1,20 (m, 2H).
-
Beispiel 119: 2-((1-(2-(4-Methylphenoxy)-ethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-fumarat
(Verbindung 656 in Tabelle 1)
-
a) 1-Brom-2-(4-methylphenoxy)-ethan
-
Unter
Verwendung von 4-Methylphenol (162 mg, 1,5 mmol) wurde die Titelverbindung
mittels Durchführung
einer ähnlichen
Reaktion wie in Beispiel 115a als Rohprodukt erhalten (458 mg).
Das Rohprodukt wurde ohne Aufreinigung in die nächste Reaktion eingesetzt.
-
b) 2-((1-(2-(4-Methylphenoxy)-ethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on
-
Unter
Verwendung der in Beispiel 119a erhaltenen Verbindung (458 mg) wurde
die Titelverbindung mittels Durchführung von ähnlichen Reaktionen wie in
Beispiel 115b als braunes Öl
erhalten (210 mg, Ausbeute: 38%, 2 Stufen).
1H-NMR
(CDCl3): δ 7,84
(d, J = 6,9 Hz, 1H), 7,55-7,42 (m, 3H), 7,06 (d, J = 8,4 Hz, 2H),
6,81-6,77 (m, 2H), 4,40 (s, 2H), 4,06 (t, J = 6,0 Hz, 2H), 3,50
(d, J = 7,2 Hz, 2H), 3,00 (br d, J = 11,7 Hz, 2H), 2,77 (t, J =
6,0 Hz, 2H), 2,27 (s, 3H), 2,10 (ddd, J = 2,3 Hz, 11,6 Hz, 11,6
Hz, 2H), 1,84-1,70 (m, 3H), 1,49-1,40 (m, 2H).
-
c) 2-((1-(2-(4-Methylphenoxy)-ethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-fumarat
-
Unter
Verwendung der in Beispiel 119b erhaltenen Verbindung (210 mg) wurde
die Titelverbindung mittels Durchführung einer ähnlichen
Reaktion wie in Beispiel 36c als farbloser Feststoff erhalten (220
mg, Ausbeute: 79%).
Schmelzpunkt: 183–185°C
1H-NMR
(DMSO-d6): δ 7,67 (d, J = 7,6 Hz, 1H), 7,62-7,58
(m, 2H), 7,52-7,45 (m, 1H), 7,07 (d, J = 8,3 Hz, 2H), 6,82 (d, J
= 8,4 Hz, 2H), 6,59 (s, 2H), 4,48 (s, 2H), 4,05 (t, J = 5,7 Hz,
2H), 3,41 (d, J = 7,2 Hz, 2H), 3,00 (br d, J = 11,6 Hz, 2H), 2,78
(t, J = 5,7 Hz, 2H), 2,22-2,09 (m, 5H), 1,79-1,73 (m, 1H), 1,61
(br d, J = 13,3 Hz, 2H), 1,26 (br dd, J = 21,4 Hz, 11,4 Hz, 2H).
-
Beispiel 120: 2-((1-(2-(3-Methoxyphenoxy)-ethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-fumarat
(Verbindung 636 in Tabelle 1)
-
a) 1-Brom-2-(3-methoxyphenoxy)-ethan
-
Unter
Verwendung von 4-Methoxyphenol (186 mg, 1,5 mmol) wurde die Titelverbindung
mittels Durchführung
einer ähnlichen
Reaktion wie in Beispiel 115a als Rohprodukt erhalten (953 mg).
Das resultierende Rohprodukt wurde ohne Aufreinigung in die nächste Reaktion
eingesetzt.
-
b) 2-((1-(2-(3-Methoxyphenoxy)-ethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on
-
Unter
Verwendung der in Beispiel 120a erhaltenen Verbindung (953 mg) wurde
die Titelverbindung mittels Durchführung von ähnlich Reaktionen wie in Beispiel
115b als braunes Öl
erhalten (192 mg, Ausbeute: 34%, 2 Stufen).
1H-NMR
(CDCl3): δ 7,85
(d, J = 7,2 Hz, 1H), 7,55-7,42 (m, 3H), 7,16 (dd, J = 8,0 Hz, 8,0
Hz, 1H), 6,51-6,46 (m, 3H), 4,41 (s, 2H), 4,08 (t, J = 6,0 Hz, 2H),
3,78 (s, 3H), 3,51 (d, J = 7,2 Hz, 2H), 3,00 (br d, J = 11,7 Hz,
2H), 2,79 (t, J = 6,0 Hz, 2H), 2,16-2,08 (m, 2H), 1,83-1,68 (m,
3H), 1,50-1,41 (m, 2H).
-
c) 2-((1-(2-(3-Methoxyphenoxy)-ethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-fumarat
-
Unter
Verwendung der in Beispiel 120b erhaltenen Verbindung (190 mg) wurde
die Titelverbindung mittels Durchführung einer ähnlichen
Reaktion wie in Beispiel 36c als farbloser Feststoff erhalten (200
mg, Ausbeute: 81%).
Schmelzpunkt: 173–174°C
1H-NMR
(DMSO-d6): δ 7,67 (d, J = 7,5 Hz, 1H), 7,62-7,58
(m, 2H), 7,52-7,45 (m, 1H), 7,17 (dd, J = 8,3 Hz, 8,0 Hz, 1H), 6,59
(s, 2H), 6,53-6,49 (m, 3H), 4,48 (s, 2H), 4,09 (t, J = 5,4 Hz, 2H),
3,72 (s, 3H), 3,41 (d, J = 7,2 Hz, 2H), 3,03 (br d, J = 11,2 Hz,
2H), 2,82 (br s, 2H), 2,21 (br dd, J = 11,4 Hz, 11,4 Hz, 2H) 1,78-1,77
(m, 1H), 1,62 (br d, J = 12,5 Hz, 2H), 1,28 (br dd, J = 22,0 Hz,
11,0 Hz, 2H).
-
Beispiel 121: 2-((1-(2-(3-Methylphenoxy)-ethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-fumarat
(Verbindung 651 in Tabelle 1)
-
a) 1-Brom-2-(3-methylphenoxy)-ethan
-
Unter
Verwendung von 3-Methylphenol (162 mg, 1,5 mmol) wurde die Titelverbindung
mittels Durchführung
einer ähnlichen
Reaktion wie in Beispiel 115a als Rohprodukt erhalten (410 mg).
Das resultierende Rohprodukt wurde ohne Aufreinigung in die nächste Reaktion
eingesetzt.
-
b) 2-((1-(2-(3-Methylphenoxy)-ethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on
-
Unter
Verwendung der in Beispiel 121a erhaltenen Verbindung (410 mg) wurde
die Titelverbindung mittels Durchführung von ähnlichen Reaktionen wie in
Beispiel 115b als braunes Cl erhalten (213 mg, Ausbeute: 39%, 2
Stufen).
1H-NMR (CDCl3): δ 7,85 (d,
J = 7,5 Hz, 1H), 7,55-7,42 (m, 3H), 7,14 (dd, J = 7,7 Hz, 7,7 Hz,
1H), 6,76-6,69 (m, 3H), 4,40 (s, 2H), 4,08 (t, J = 5,9 Hz, 2H),
3,51 (d, J = 6,9 Hz, 2H), 3,00 (br d, J = 11,7 Hz, 2H), 2,79 (t,
J = 5,9 Hz, 2H), 2,31 (s, 3H), 2,12 (br dd, J = 10,5 Hz, 10,5 Hz,
2H), 1,82-1,69 (m, 3H), 1,49-1,26 (m, 2H).
-
c) 2-((1-(2-(3-Methylphenoxy)-ethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-fumarat
-
Unter
Verwendung der in Beispiel 121b erhaltenen Verbindung (210 mg) wurde
die Titelverbindung mittels Durchführung einer ähnlichen
Reaktion wie in Beispiel 36c als farbloser Feststoff erhalten (252
mg, Ausbeute: 91%).
Schmelzpunkt: 202–203°C
1H-NMR
(DMSO-d6): δ 7,67 (d, J = 7,4 Hz, 1H), 7,59-7,58
(m, 2H), 7,50-7,45 (m, 1H), 7,15 (dd, J = 7,8 Hz, 7,8 Hz, 1H), 6,75-6,71
(m, 3H), 6,59 (s, 2H), 4,48 (s, 2H), 4,09 (t, J = 5,5 Hz, 2H), 3,41
(d, J = 7,3 Hz, 2H), 3,04 (br d, J = 11,3 Hz, 2H), 2,83 (t, J =
5,0 Hz, 2H), 2,26-2,19 (m, 5H), 1,78 (br s, 1H), 1,62 (br d, J =
12,7 Hz, 2H), 1,28 (br dd, J = 21,9 Hz, 10,7 Hz, 2H).
-
Beispiel 122: 2-((1-(2-(4-Methoxyphenoxy)-ethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-fumarat
(Verbindung 641 in Tabelle 1)
-
a) 1-Brom-2-(4-methoxyphenoxy)-ethan
-
Unter
Verwendung von 4-Methoxyphenol (186 g, 1,5 mmol) wurde die Titelver bindung
mittels Durchführung
einer ähnlichen
Reaktion wie in Beispiel 115a als Rohprodukt erhalten (347 mg).
Das resultierende Rohprodukt wurde ohne Aufreinigung in die nächste Reaktion
eingesetzt.
-
b) 2-((1-(2-(4-Methoxyphenoxy)-ethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on
-
Unter
Verwendung der in Beispiel 122a erhaltenen Verbindung (347 mg) wurde
die Titelverbindung mittels Durchführung von ähnlichen Reaktionen wie in
Beispiel 115b als braunes Öl
erhalten (274 mg, Ausbeute: 48%, 2 Stufen).
1H-NMR
(CDCl3): δ 7,85
(d, J = 7,2 Hz, 1H), 7,56-7,42 (m, 3H), 6,82-6,78 (m, 4H), 4,41
(s, 2H), 4,05 (t, J = 5,9 Hz, 2H), 3,76 (s, 3H), 3,51 (d, J = 7,2
Hz, 2H), 3,00 (br d, J = 12,0 Hz, 2H), 2,77 (t, J = 6,0 Hz, 2H),
2,11 (ddd, J = 2,3 Hz, 11,6 Hz, 11,6 Hz, 2H), 1,82-1,68 (m, 3H),
1,51-1,41 (m, 2H).
-
c) 2-((1-(2-(4-Methoxyphenoxy)-ethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-fumarat
-
Unter
Verwendung der in Beispiel 122b erhaltenen Verbindung (270 mg) wurde
die Titelverbindung mittels Durchführung einer ähnlichen
Reaktion wie in Beispiel 36c als farbloser Feststoff erhalten (232
mg, Ausbeute: 82%).
Schmelzpunkt: 165–168°C
1H-NMR
(DMSO-d6): δ 7,67 (d, J = 7,3 Hz, 1H), 7,59-7,58
(m, 2H), 7,52-7,45 (m, 1H), 6,89-6,82 (m, 4H), 6,59 (s, 2H), 4,48
(s, 2H), 4,04 (t, J = 5,7 Hz, 2H), 3,41 (d, J = 7,3 Hz, 2H), 3,03
(br d, J = 11,6 Hz, 2H), 2,80 (t, J = 5,7 Hz, 2H), 2,21 (br dd,
J = 10,7 Hz, 10,7 Hz, 2H), 1,80-1,79 (m, 1H), 1,61 (br d, J = 11,6
Hz, 2H), 1,33-1,18 (m,
2H).
-
Beispiel 123: 2-((1-(2-(2-Methylphenoxy)-ethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-fumarat
(Verbindung 646 in Tabelle 1)
-
a) 1-Brom-2-(2-methylphenoxy)-ethan
-
Unter
Verwendung von 2-Methylphenol (162 mg, 1,5 mmol) wurde die Titelverbindung
mittels Durchführung
einer ähnlichen
Reaktion wie in Beispiel 115a als Rohprodukt erhalten (334 mg).
Das resultierende Rohprodukt wurde ohne Auf reinigung in die nächste Reaktion
eingesetzt.
-
b) 2-((1-(2-(2-Methylphenoxy)-ethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on
-
Unter
Verwendung der in Beispiel 123a erhaltenen Verbindung (334 mg) wurde
die Titelverbindung mittels Durchführung einer ähnlichen
Reaktion wie in Beispiel 115b als braunes Öl erhalten (485 mg). Das resultierende
Rohprodukt wurde ohne Aufreinigung in die nächste Reaktion eingesetzt.
-
c) 2-((1-(2-(2-Methylphenoxy)-ethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-fumarat
-
Unter
Verwendung der in Beispiel 123b erhaltenen Verbindung (485 mg) wurde
die Titelverbindung mittels Durchführung von ähnlichen Reaktionen wie in
Beispiel 36c als farbloser Feststoff erhalten (89 mg, Ausbeute:
14%, 3 Stufen).
Schmelzpunkt: 214–218°C
1H-NMR
(DMSO-d6): δ 7,67 (d, J = 7,2 Hz, 1H), 7,59-7,58
(m, 2H), 7,52-7,45 (m, 1H), 7,16-7,11 (m, 2H), 6,92 (d, J = 8,1
Hz, 1H), 6,82 (dd, J = 7,5 Hz, 7,5 Hz, 1H), 6,59 (s, 2H), 4,48 (s,
2H), 4,10 (t, J = 5,6 Hz, 2H), 3,41 (d, J = 7,2 Hz, 2H), 3,03 (br
d, J = 12,0 Hz, 2H), 2,85 (br s, 2H), 2,23 (br dd, J = 11,0 Hz,
11,0 Hz, 2H), 2,13 (s, 3H), 1,77 (br s, 1H), 1,61 (br d, J = 12,3
Hz, 2H), 1,32-1,24 (m, 2H).
-
Beispiel 124: 2-((1-(2-(4-Trifluormethylphenoxy)-ethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-fumarat
(Verbindung 661 in Tabelle 1)
-
a) 1-Brom-2-(4-trifluormethylphenoxy)-ethan
-
Unter
Verwendung von 4-Trifluormethylphenol (243 mg, 1,5 mmol) wurde die
Titelverbindung mittels Durchführung
einer ähnlichen
Reaktion wie in Beispiel 115a als Rohprodukt erhalten (519 mg).
Das resultierende Rohprodukt wurde ohne Aufreinigung in die nächste Reaktion
eingesetzt.
-
b) 2-((1-(2-(4-Trifluormethylphenoxy)-ethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on
-
Unter
Verwendung der in Beispiel 124a erhaltenen Verbindung (519 mg) wurde die
Titelverbindung mittels Durchführung
von ähnlichen
Reaktionen wie in Beispiel 115b erhalten (150 mg, Ausbeute: 19%,
2 Stufen).
1H-NMR (CDCl3): δ 7,85 (d,
J = 7,2 Hz, 1H), 7,56-7,42 (m, 5H), 6,95 (d, J = 8,7 Hz, 2H), 4,41
(s, 2H), 4,13 (t, J = 5,9 Hz, 2H), 3,51 (d, J = 6,9 Hz, 2H), 3,00
(br d, J = 11,4 Hz, 2H), 2,81 (t, J = 5,9 Hz, 2H), 2,17-2,09 (m, 2H),
1,85-1,63 (m, 3H), 1,50-1,38 (m, 2H).
-
c) 2-((1-(2-(4-Trifluormethylphenoxy)-ethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-fumarat
-
Unter
Verwendung der in Beispiel 124b erhaltenen Verbindung (150 mg) wurde
die Titelverbindung mittels Durchführung einer ähnlichen
Reaktion wie in Beispiel 36c als farbloser Feststoff erhalten (171
mg, Ausbeute: 89%).
Schmelzpunkt: 198–199°C
1H-NMR
(DMSO-d6): δ 7,68-7,56 (m, 5H), 7,52-7,45
(m, 1H), 7,12 (d, J = 8,6 Hz, 2H), 6,60 (s, 2H), 4,48 (s, 2H), 4,18
(t, J = 5,7 Hz, 2H), 3,41 (d, J = 7,2 Hz, 2H), 2,98 (br d, J = 11,6
Hz, 2H), 2,79 (t, J = 5,7 Hz, 2H), 2,13 (br dd, J = 11,7 Hz, 11,7
Hz, 2H), 1,79-1,72 (m, 1H), 1,60 (br d, J = 12,3 Hz, 2H), 1,38-1,18
(m, 2H).
-
Beispiel 125: 2-((1-(2-(4-Trifluormethoxyphenoxy)-ethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-fumarat
(Verbindung 666 in Tabelle 1)
-
a) 1-Brom-2-(4-trifluormethoxyphenoxy)-ethan
-
Unter
Verwendung von 4-Trifluormethoxyphenol (267 mg, 1,5 mmol) wurde
die Titelverbindung mittels Durchführung einer ähnlichen
Reaktion wie in Beispiel 115a als Rohprodukt erhalten (598 mg).
Das resultierende Rohprodukt wurde ohne Aufreinigung in die nächste Reaktion
eingesetzt.
-
b) 2-((1-(2-(4-Trifluormethoxyphenoxy)-ethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on
-
Unter
Verwendung der in Beispiel 125a erhaltenen Verbindung (598 mg) wurde
die Titelverbindung mittels Durchführung einer ähnlichen
Reaktion wie in Beispiel 115b als Rohprodukt erhalten (589 mg).
Das resultierende Rohprodukt wurde ohne Aufreinigung in die nächste Reaktion
eingesetzt.
-
c) 2-((1-(2-(4-Trifluormethoxyphenoxy)-ethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-fumarat
-
Unter
Verwendung der in Beispiel 125b erhaltenen Verbindung (589 mg) wurde
die Titelverbindung mittels Durchführung ähnlicher Reaktionen wie in
Beispiel 36c als farbloser Feststoff erhalten (304 mg, Ausbeute:
55%, 3 Stufen).
Schmelzpunkt: 181–183°C
1H-NMR
(DMSO-d6): δ 7,67 (d, J = 7,3 Hz, 1H), 7,59-7,58
(m, 2H), 7,50-7,45 (m, 1H), 7,28 (d, J = 8,9 Hz, 2H), 7,06-7,00
(m, 2H), 6,60 (s, 2H), 4,48 (s, 2H), 4,11 (t, J = 5,7 Hz, 2H), 3,41
(d, J = 7,2 Hz, 2H), 2,98 (br d, J = 11,7 Hz, 2H), 2,78 (t, J =
5,7 Hz, 2H), 2,18-2,09 (m, 2H), 1,80-1,72 (m, 1H), 1,60 (m, 2H),
1,30-1,19 (m, 2H).
-
Beispiel 126: 2-((1-(2-(1,3-Benzodioxol-5-yl-oxy)-ethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-fumarat
(Verbindung 671 in Tabelle 1)
-
Unter
Verwendung von 3,4-Methylendioxyphenol wurde die Titelverbindung
durch ähnliche
Verfahren wie in Beispiel 115a und Beispiel 36c als farbloser Feststoff
erhalten (Ausbeute: 52%).
Schmelzpunkt: 220–232°C
1H-NMR
(DMSO-d6): δ 7,67 (d, J = 7,5 Hz, 1H), 7,55-7,60
(m, 2H), 7,45-7,52 (m, 1H), 6,79 (d, J = 8,4 Hz, 1H), 6,62 (d, J
= 2,4 Hz, 1H), 6,59 (s, 2H, Fumarsäure), 6,36 (dd, J = 2,4 Hz,
8,4 Hz, 1H), 5,94 (s, 2H), 4,48 (s, 2H), 3,98-4,04 (m, 2H), 3,41
(d, J = 7,2 Hz, 2H), 2,94-3,01 (m, 2H), 2,71-2,77 (m, 2H), 2,08-2,19
(m, 2H), 1,6-1,8 (m, 1H), 1,5-1,6 (m, 2H), 1,1-1,3 (m, 2H).
-
Beispiel 127: 2-((1-(2-(2,3-Dihydro-1H-inden-5-yl-oxy)-ethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-fumarat (Verbindung
676 in Tabelle 1)
-
Unter
Verwendung von 5-Indanol wurde die Titelverbindung durch ähnliche
Verfahren wie in Beispiel 115a und Beispiel 36 als farbloser Feststoff
erhalten (Aus beute: 22%).
Schmelzpunkt: 181–185°C
1H-NMR
(DMSO-d6): δ 7,67 (d, J = 7,2 Hz, 1H), 7,55-7,60
(m, 2H), 7,45-7,52 (m, 1H), 7,08 (d, J = 8,4 Hz, 1H), 6,80 (d, J
= 2,1 Hz, 1H), 6,67 (dd, J = 2,1 Hz, 8,4 Hz, 1H), 6,59 (s, 2H, Fumarsäure), 4,49
(s, 2H), 4,02-4,08 (m, 2H), 3,41 (d, J = 7,2 Hz, 2H), 2,96-3,03
(m, 2H), 2,72-2,84 (m, 6H), 2,12-2,22 (m, 2H), 1,93-2,04 (m, 2H), 1,6-1,8
(m, 1H), 1,5-1,6 (m, 2H), 1,1-1,3 (m, 2H).
-
Beispiel 128: 2-((1-(2-(5,6,7,8-Tetrahydronaphthalin-2-yl-oxy)-ethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-fumarat
(Verbindung 681 in Tabelle 1)
-
Unter
Verwendung von 5,6,7,8-Tetrahydro-2-naphthol wurde die Titelverbindung
durch ähnliche
Verfahren wie in Beispiel 115a und Beispiel 36c als farbloser Feststoff
erhalten (Ausbeute: 19%).
Schmelzpunkt: 186–190°C
1H-NMR
(DMSO-d6): δ 7,67 (d, J = 7,2 Hz, 1H), 7,55-7,60
(m, 2H), 7,45-7,52 (m, 1H), 6,92 (d, J = 8,1 Hz, 1H), 6,60-6,67
(m, 2H), 6,59 (s, 2H, Fumarsäure),
4,48 (s, 2H), 3,99-4,06 (m, 2H), 3,41 (d, J = 7,2 Hz, 2H), 2,95-3,02 (m,
2H), 2,72-2,79 (m, 2H), 2,60-2,69 (m, 4H), 2,10-2,20 (m, 2H), 1,55-1,80
(m, 7H), 1,1-1,3 (m, 2H).
-
Beispiel 129: 2-((1-(2-(5,6,7,8-Tetrahydronaphthalin-1-yl-oxy)-ethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-fumarat
(Verbindung 686 in Tabelle 1)
-
Unter
Verwendung von 5,6,7,8-Tetrahydro-1-naphthol wurde die Titelverbindung
durch ähnliche
Verfahren wie in Beispiel 115a und Beispiel 36c als farbloser Feststoff
erhalten (Ausbeute: 13%).
Schmelzpunkt: 196–203°C
1H-NMR
(DMSO-d6): δ 7,67 (d, J = 7,5 Hz, 1H), 7,55-7,60
(m, 2H), 7,45-7,52 (m, 1H), 6,97-7,05 (m, 1H), 6,70 (d, J = 8,1
Hz, 1H), 6,64 (d, J = 7,5 Hz, 1H), 6,59 (s, 2H, Fumarsäure), 4,48
(s, 2H), 4,03-4,09 (m, 2H), 3,41 (d, J = 7,2 Hz, 2H), 2,98-3,05 (m, 2H), 2,80-2,85
(m, 2H), 2,62-2,70 (m, 2H), 2,50-2,55 (m, 2H), 2,1-2,3 (m, 2H), 1,5-1,8
(m, 7H), 1,1-1,3 (m, 2H).
-
Beispiel 137: 2-((1-(2-(4-Fluorphenyl)-2-oxoethyl)-piperidin-4-yl)-methyl)-3,4-dihydroisochinolin-1-(2H)-on-hydrochlorid
(Verbindung 761 in Tabelle 1)
-
a) 4-(4-Methylbenzolsulfonyloxymethyl)-piperidin-1-tert-butylcarboxylat
-
4-Hydroxymethylpiperidin-1-tert-butylcarboxylat
(12,12 g, 56,30 mmol, dargestellt unter Bezug auf
Japanische Ungeprüfte Patentveröffentlichung
Nr. 11-217377 ,)
wurde gelöst
in Dichlormethan (26 ml), und der Lösung wurden p-Toluolsulfonylchlorid
(10,73 g, 56,30 mmol) und Triethylamin (8,63 ml, 61,9 mmol) bei
Raumtemperatur zugegeben und anschließend bei gleicher Temperatur
für 5 Stunden
gerührt.
Die Reaktionsmischung wurde mit Dichlormethan (100 ml) verdünnt und
mit Wasser und gesättigter
Kochsalzlösung
gewaschen und über
Natriumsulfat getrocknet. Unlösliche
Feststoffe wurden durch Filtration abgetrennt und das Filtrat wurde
unter vermindertem Druck eingedampft. Der Rückstand wurde aus Hexan (100
ml) umkristallisiert, um die Titelverbindung als farblosen Feststoff
zu erhalten (14,13 g, Ausbeute: 85%).
1H-NMR
(CDCl
3): δ 7,78
(d, J = 8,1 Hz, 2H), 7,35 (d, J = 8,4 Hz, 2H), 4,09 (br s, 2H),
3,85 (d, J = 6,9 Hz, 2H), 2,65 (br dd, J = 12,5 Hz, 12,5 Hz, 2H),
2,46 (s, 3H), 1,87-1,79 (m, 1H), 1,65-1,62 (m, 2H), 1,44 (s, 9H), 1,17-1,03
(m, 2H).
-
b) 4-(3,4-Dihydroisochinolin-2-(1H)-yl-methyl)-piperidin-1-tert-butylcarboxylat
-
Die
in Beispiel 137a erhaltene Verbindung (1,0 g, 2,71 mmol), Kaliumcarbonat
(375 mg, 2,71 mmol) und 3,4-Dihydroisochinolin (399 mg, 2,71 mmol)
wurden gelöst
in Dimethylformamid (9 ml) und die Mischung bei 80°C für 13 Stunden
gerührt.
Die Reaktionsmischung wurde zum Abkühlen stehen gelassen und anschließend mit
Ethylacetat verdünnt
und mit Wasser gewaschen, und anschließend über Natriumsulfat getrocknet. Unlösliche Feststoffe
wurden durch Filtration abgetrennt und das Filtrat unter vermindertem
Druck eingedampft. Das resultierende Rohprodukt wurde mittels Silicagel-Säulenchromatographie
gereinigt (Methanol/Dichlormethan), die Titelverbindung als farbloses Öl zu erhalten
(948 mg, Ausbeute: quantitativ).
1H-NMR
(CDCl3): δ 7,20-7,07
(m, 3H), 7,02-7,00 (m, 1H), 4,11 (br s, 2H), 3,60 (s, 2H), 2,91-2,87
(m, 2H), 2,76-2,68 (m, 4H), 2,35 (d, J = 6,6 Hz, 2H), 1,80-1,68
(m, 3H), 1,46 (s, 9H), 1,18-1,09 (m, 2H).
-
c) 4-((1-Oxo-3,4-dihydroisochinolin-2-(1H)-yl)-methyl)-piperidin-1-tert-butylcarboxylat
-
Die
in Beispiel 137b erhaltene Verbindung (488 mg, 1,48 mmol) wurde
gelöst
in Dichlormethan (15 ml), und der Lösung wurde Kaliumpermanganat
(702 mg, 4,44 mmol) und Triethylbenzylammoniumchlorid (337 g, 1,48
mmol) zugegeben und unter Rückfluss
für 5,5
Stunden erhitzt. Die Reaktionsmischung wurde zum Abkühlen stehen
gelassen und anschließend
mit gesättigter
wässriger
Natriumdithionit-Lösung
(15 ml) versetzt und für
20 Minuten gerührt.
Die Reaktionsmischung wurde mit Dichlormethan extrahiert, mit Wasser
gewaschen und über
Natriumsulfat getrocknet. Unlösliche
Feststoffe wurden durch Filtration abgetrennt, das Filtrat unter
vermindertem Druck eingedampft und der Rückstand gereinigt mittels Silicagel-Säulenchromatographie (Methanol/Dichlormethan),
um die Titelverbindung als farbloses Öl zu erhalten (281 mg, Ausbeute:
55%).
1H-NMR (CDCl3): δ 8,07 (dd,
J = 7,5 Hz, 1,2 Hz, 1H), 7,45-7,32 (m, 2H), 7,19-7,17 (m, 1H), 4,10
(br s, 2H), 3,57 (dd, J = 6,6 Hz, 6,6 Hz, 2H), 3,00 (dd, J = 6,6
Hz, 6,6 Hz, 2H), 3,02 (br s, 2H), 2,69 (br dd, J = 12,1 Hz, 12,1 Hz,
2H), 1,96-1,90 (m, 1H), 1,72-1,62 (m, 2H), 1,46 (s, 9H), 1,31-1,18
(m, 2H).
-
d) 2-(Piperidin-4-yl-methyl)-3,4-dihydroisochinolin-1-(2H)-on-hydrochlorid
-
Unter
Verwendung des in Beispiel 137c erhaltenen Rohprodukts (281 mg)
wurde die Titelverbindung durch ähnliche
Verfahren wie in Beispiel 1d erhalten als farbloser Feststoff (232
mg, Ausbeute: quantitativ).
-
e) 2-((1-(2-(4-Fluorphenyl)-2-oxoethyl)-piperidin-4-yl)-methyl)-3,4-dihydroisochinolin-1-(2H)-on
-
Unter
Verwendung der in Beispiel 137d erhaltenen Verbindung 230 mg, 0,82
mmol) wurde die Titelverbindung durch ähnliche Verfahren wie in Beispiel
1 e erhalten als braunes Öl
(110 mg, Ausbeute: 35%).
1H-NMR (CDCl3): δ 8,10-8,05
(m, 3H), 7,43-7,33 (m, 2H), 7,19-7,09 (m, 3H), 3,73 (s, 2H), 3,57
(dd, J = 6,8 Hz, 6,8 Hz, 2H), 3,45 (d, J = 7,2 Hz, 2H), 3,01-2,95
(m, 4H), 2,15 (ddd, J = 1,1 Hz, 11,5 Hz, 11,5 Hz, 2H), 1,83-1,44 (m,
5H).
-
f) 2-((1-(2-(4-Fluorphenyl)-2-oxoethyl)-piperidin-4-yl)-methyl)-3,4-dihydroisochinolin-1-(2H)-on-hydrochlorid
-
Unter
Verwendung der in Beispiel 137e erhaltenen Verbindung (110 mg, 0,29
mmol) wurde die Titelverbindung durch ähnliche Verfahren wie in Beispiel
1f erhalten als blassbrauner Feststoff (80 mg, Ausbeute: 66%).
Schmelzpunkt:
151–156°C
1H-NMR (DMSO-d6): δ 10,02 (br
s, 1H), 8,19-8,06 (m, 2H), 7,87 (d, J = 7,8 Hz, 1H), 7,51-7,45 (m,
3H), 7,38-7,29 (m, 2H), 5,11-5,04 (m, 2H), 3,60-3,53 (m, 4H), 3,44-3,37
(m, 2H), 3,07-2,98 (m, 4H), 1,99-1,07 (m, 5H).
-
Beispiel 138: 2-((1-((E)-2-(4-Fluorphenyl)-2-methoxyiminoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-fumarat
(E-Isomer von Verbindung 741 in Tabelle 1)
-
a) 2-((1-((E)-2-(4-Fluorphenyl)-2-methoxyiminoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on
und 2-((1-((2)-2-(4-Fluorphenyl)-2-methoxyiminoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on
-
Unter
Verwendung der in Beispiel 1e erhaltenen Verbindung und Methylhydroxylamin-hydrochlorid wurden
die Titelverbindungen durch ähnliche
Verfahren wie in Beispiel 18a erhalten.
2-((1-((E)-2-(4-Fluorphenyl)-2-methoxyiminoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on
(Ausbeute: 30%)
1H-NMR (CDCl3): δ 7,84
(d, J = 7,5 Hz, 1H), 7,78 (m, 2H), 7,41-7,52 (m, 3H), 7,01 (t, J
= 9 Hz, 2H), 4,37 (s, 2H), 3,94 (s, 3H), 3,57 (s, 2H), 3,46 (d,
J = 7,4 Hz, 2H), 2,82 (br d, J = 11,6 Hz, 2H), 2,04 (t, J = 10 Hz,
2H), 1,74 (m, 1H) 1,59 (m, 2H), 1,30 (m, 2H).
2-((1-((Z)-2-(4-Fluorphenyl)-2-methoxyiminoethyl)-piperidin-4-yl)-methyl)-isoindo lin-1-on
(Ausbeute: 6%)
1H-NMR (CDCl3): δ 7,84
(d, J = 7,5 Hz, 1H), 7,59 (m, 2H), 7,42-7,53 (m, 3H), 7,05 (t, J
= 8,9 Hz, 2H), 4,38 (s, 2H), 3,86 (s, 3H), 3,48 (d, J = 7,3 Hz,
2H), 3,30 (s, 2H), 2,91 (br d, J = 11,6 Hz, 2H), 2,01 (br t, J =
11 Hz, 2H), 1,76 (m, 1H), 1,62 (m, 2H), 1,33 (m, 2H).
-
b) 2-((1-((E)-2-(4-Fluorphenyl)-2-methoxyiminoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-fumarat
-
Unter
Verwendung der in Beispiel 138a erhaltenen Verbindung wurde die
Titelverbindung durch ähnliche
Verfahren wie in Beispiel 40f erhalten (Ausbeute: 66%).
Schmelzpunkt:
176°C
1H-NMR (DMSO-d6): δ 7,79 (m,
2H), 7,65 (d, J = 7,5 Hz, 1H), 7,58 (m, 2H), 7,49 (m, 1H), 7,21
(m, 2H), 6,63 (s, 2H), 4,45 (s, 2H), 3,88 (s, 3H), 3,59 (s, 2H),
3,35 (d, J = 7,3 Hz, 2H), 2,76 (br d, J = 11,5 Hz, 2H), 1,99 (br t,
J = 10 Hz, 2H), 1,69 (m, 1H), 1,51 (br d, J = 11,4 Hz, 2H), 1,08
(m, 2H).
-
Beispiel 139: 2-((1-((2)-2-(4-Fluorphenyl)-2-methoxyiminoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-fumarat
(Z-Isomer von Verbindung 741 in Tabelle 1)
-
Unter
Verwendung der in Beispiel 138a erhaltenen Verbindung wurde die
Titelverbindung durch ähnliche
Verfahren wie in Beispiel 40f erhalten (Ausbeute: 91%).
Schmelzpunkt:
164°C
1H-NMR (DMSO-d6): δ 7,65 (d,
J = 7,5 Hz, 1H), 7,55-7,62 (m, 4H), 7,47 (m, 1H), 7,23 (t, J = 8,9
Hz, 2H), 6,61 (s, 2H), 4,49 (s, 2H), 3,75 (s, 3H), 3,35 (d, J =
7,4 Hz, 2H), 3,30 (s, 2H), 2,80 (br d, J = 11,5 Hz, 2H), 1,93 (br t,
J = 11 Hz, 2H), 1,68 (m, 1H), 1,52 (br d, J = 11,8 Hz, 2H), 1,07
(m, 2H).
-
Beispiel 140: 2-((1-((E)-2-(4-Fluorphenyl)-2-methoxycarbonylhydrazonoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on ¼ fumarat
(E-Isomer von Verbindung 746 in Tabelle 1)
-
a) 2-((1-((E)-2-(4-Fluorphenyl)-2-methoxycarbonylhydrazonoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on
-
Unter
Verwendung der in Beispiel 1e erhaltenen Verbindung und Hydrazinmethylcarboxylat
wurde die Titelverbindung durch ähnliche
Verfahren wie in Beispiel 18a erhalten (Ausbeute: 46%).
1H-NMR (CDCl3): δ 11,95 (s,
1H), 7,85 (d, J = 6,9 Hz, 1H), 7,68 (m, 2H), 7,43-7,55 (m, 3H),
7,03 (t, J = 9 Hz, 2H), 4,41 (s, 2H), 3,85 (s, 3H), 3,64 (s, 2H),
3,54 (d, J = 7,2 Hz, 2H), 2,95 (br d, J = 11 Hz, 2H), 2,08 (br t,
J = 11 Hz, 2H), 1,87 (m, 1H), 1,76 (br d, J = 12 Hz, 2H), 1,44 (m,
2H).
2-((1-((Z)-2-(4-Fluorphenyl)-2-methoxycarbonylhydrazonoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on
(Ausbeute: 15%)
1H-NMR (CDCl3): δ 7,84
(d, J = 7,2 Hz, 1H), 7,45-7,53 (m, 3H), 7,28 (m, 2H), 7,18 (t, J
= 9 Hz, 2H), 4,38 (s, 2H), 3,78 (br s, 3H), 3,47 (d, J = 7,5 Hz,
2H), 3,36 (s, 2H), 2,85 (br d, J = 11 Hz, 2H), 2,06 (br t, J = 10
Hz, 2H), 1,72 (m, 1H), 1,61 (m, 2H), 1,28 (m, 2H).
-
b) 2-((1-((E)-2-(4-Fluorphenyl)-2-methoxycarbonylhydrazonoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on ¼ fumarat
-
Unter
Verwendung der in Beispiel 140a erhaltenen Verbindung wurde die
Titelverbindung durch ähnliche
Verfahren wie in Beispiel 40f erhalten (Ausbeute: 76%).
Schmelzpunkt:
154°C
1H-NMR (DMSO-d6): δ 12,08 (br
s, 1H), 7,75 (m, 2H), 7,67 (d, J = 7,5 Hz, 1H), 7,59 (m, 2H), 7,50
(m, 1H), 7,22 (t, J = 9 Hz, 2H), 6,63 (s, 0,5H), 4,48 (s, 2H), 3,73
(s, 2H), 3,71 (s, 3H), 3,42 (d, J = 7,2 Hz, 2H), 2,83 (br d, J =
12 Hz, 2H), 2,08 (br t, J = 11 Hz, 2H), 1,77 (m, 1H), 1,64 (br d,
J = 12 Hz, 2H), 1,18 (m, 2H).
-
Beispiel 141: 2-((1-((2)-2-(4-Fluorphenyl)-2-methoxycarbonylhydrazonoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-fumarat
(Z-Isomer von Verbindung 746 in Tabelle 1)
-
Unter
Verwendung der in Beispiel 140a erhaltenen Verbindung wurde die
Titelverbindung durch ähnliche
Verfahren wie in Beispiel 40 erhalten (Ausbeute: 73%).
Schmelzpunkt:
153°C
1H-NMR (DMSO-d6): δ 9,39 (s,
1H), 7,65 (d, J = 7,5 Hz, 1H), 7,58 (m, 2H), 7,48 (m, 1H), 7,38
(m, 2H), 7,27 (t, J = 9 Hz, 2H), 6,62 (s, 2H), 4,45 (s, 2H), 3,60
(s, 3H), 3,35 (d, J = 7,5 Hz, 2H), 3,32 (s, 2H), 2,80 (br d, J =
11 Hz, 2H), 1,98 (m, 2H), 1,70 (m, 1H), 1,52 (m, 2H), 1,07 (m, 2H).
-
Beispiel 142: 2-((1-((E)-2-(4-Fluorphenyl)-2-acetylhydrazonoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-fumarat
(E-Isomer von Verbindung 751 in Tabelle 1)
-
a) 2-((1-((E)-2-(4-Fluorphenyl)-2-acetylhydrazonoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on
-
Unter
Verwendung der in Beispiel 1e erhaltenen Verbindung und Essigsäurehydrazid
wurde die Titelverbindung durch ähnliche
Verfahren wie in Beispiel 18a erhalten (Ausbeute: 64%).
1H-NMR (CDCl3): δ 11,98 (s,
1H), 7,84 (d, J = 7,2 Hz, 1H), 7,67 (m, 2H), 7,24-7,54 (m, 3H),
7,06 (t, J = 8,7 Hz, 2H), 4,41 (s, 2H), 3,63 (s, 2H), 3,51 (d, J
= 7,5, Hz, 2H), 2,91 (br d, J = 11,4 Hz, 2H), 2,32 (s, 3H), 2,09
(br t, J = 10 Hz, 2H), 1,83 (m, 1H), 1,76 (br d, J = 12 Hz, 2H),
1,47 (m, 2H).
-
b) 2-((1-((E)-2-(4-Fluorphenyl)-2-acetylhydrazonoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-fumarat
-
Unter
Verwendung der in Beispiel 142a erhaltenen Verbindung wurde die
Titelverbindung durch ähnliche
Verfahren wie in Beispiel 40f erhalten (Ausbeute: 75%).
Schmelzpunkt:
168–170°C
1H-NMR (DMSO-d6): δ 12,06 (s,
1H), 7,80 (m 2H), 7,67 (d, J = 7,5 Hz, 1H), 7,59 (m, 2H), 7,48 (m,
1H), 7,23 (t, J = 9 Hz, 2H), 4,48 (s, 2H), 3,75 (s, 2H), 3,42 (d, J
= 7,2 Hz, 2H), 2,83 (br d, J = 11 Hz, 2H), 2,20 (s, 3H), 2,08 (br
t, J = 11 Hz, 2H), 1,76 (m, 1H), 1,64 (br d, J = 12 Hz, 2H), 1,19
(m, 2H).
-
Beispiel 143: 2-((1-((Z)-2-(4-Fluorphenyl)-2-acetylhydrazonoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-fumarat
(Z-Isomer von Verbindung 751 in Tabelle 1)
-
a) N'-(2-Chlor-1-(4-fluorphenyl)-ethyliden)-essigsäurehydrazid
-
2-Chlor-4'-fluoracetophenon
(1,00 g, 5,79 mmol) und Essigsäurehydrazid
(0,472 g, 6,37 mmol) wurden gelöst
in Ethanol und die Mischung wurde bei Raumtemperatur für 8 Stunden
gerührt.
Die Reaktionsmischung wurde eingeengt und anschließend wurde
der zurückbleibende
Feststoff in Hexan suspendiert und gewaschen. Der resultierende
Feststoff wurde gereinigt mittels Silicagel-Säulenchromatographie (Dichlormethan/Ethylacetat),
um die Titelverbindung zu erhalten (Ausbeute: 94%).
1H-NMR (CDCl3): δ 9,19 (br
s, 1H), 7,75 (m, 2H), 7,12 (m, 2H), 4,44 (s, 2H), 2,41 (s, 3H).
-
b) 2-((1-((2)-2-(4-Fluorphenyl)-2-acetylhydrazonoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on
-
Unter
Verwendung der in Beispiel 143a erhaltenen Verbindung wurde die
Titelverbindung durch ähnliche
Verfahren wie in Beispiel 1f und anschließender Reinigung mittels Silicagel-Säulenchromatographie
(Dichlormethan/Methanol) erhalten (Ausbeute: 53%).
1H-NMR (CDCl3): δ 8,29 (s,
1H), 7,85 (d, J = 7,2 Hz, 1H), 7,42-7,54 (m, 3H), 7,24 (m, 2H),
7,16 (t, J = 8,7 Hz, 2H), 4,39 (s, 2H), 3,49 (d, J = 7,2 Hz, 2H),
3,30 (s, 2H), 2,90 (br d, J = 11,7 Hz, 2H), 2,30 (s, 3H), 2,06 (m,
2H), 1,78 (m, 1H), 1,65 (m, 2H), 1,34 (m, 2H).
-
c) 2-((1-((Z)-2-(4-Fluorphenyl)-2-acetylhydrazonoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-fumarat
-
Unter
Verwendung der in Beispiel 143b erhaltenen Verbindung wurde die
Titelverbindung durch ähnliche
Verfahren wie in Beispiel 40f erhalten (Ausbeute: 63%).
Schmelzpunkt:
157°C
1H-NMR (DMSO-d6): δ 9,34-9,92
(m, 1H), 7,66 (d, J = 7,2 Hz, 1H), 7,58 (m, 2H), 7,40-7,57 (m, 3H),
7,31 (t, J = 9,0 Hz, 2H), 6,62 (s, 2H), 4,45 (s, 2H), 3,35-3,40
(m, 4H), 2,83 (m, 2H), 1,82-2,15 (m, 5H), 1,71 (m, 1H), 1,53 (m,
2H), 1,08 (m, 2H).
-
Beispiel 144: (E,Z)-2-((1-(2-(4-Fluorphenyl)-2-(benzyloxy)-iminoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-fumarat
(Verbindung 756 in Tabelle 1)
-
Die
in Beispiel 1e erhaltene Verbindung (581 mg, 1,59 mmol) und Benzyloxyaminhydrochlorid
(581 mg, 1,59 mmol) wurden gelöst
in einem Lösemittelgemisch
aus Pyridin (12 ml) und Ethanol (12 ml), und die wurde bei Raumtemperatur
für 3 Tage
gerührt.
Die Reaktionsmischung wurde mit Ethylacetat verdünnt und mit gesättigter
wässriger
Natriumhydrogencarbonat-Lösung
und anschließend
mit gesättigter
Kochsalzlösung
gewaschen und über
Natriumsulfat getrocknet. Unlösliche
Feststoffe wurden durch Filtration abgetrennt und das Filtrat wurde
unter vermindertem Druck eingeengt, um (E,Z)-2-((1-(2-(4-Fluorphenyl)-2-(benzyloxy)-iminoethyl-)piperidin-4-yl)-methyl)-isoindolin-1-on
als Rohprodukt zu erhalten. Unter Verwendung des resultierenden Produkts
wurde die Titelverbindung durch ähnliche
Verfahren wie in Beispiel 36c als farbloser Feststoff erhalten (255
mg, Ausbeute: 27%).
Schmelzpunkt: 151–155°C
1H-NMR
(DMSO-d6): δ 7,18-7,78 (m, 13H), 6,63 (s,
2H, Fumarsäure),
5,17 (s, 0,8H), 5,07 (s, 1,2H), 4,45 (s, 2H), 3,63 (s, 0,8H), 3,2-3,4
(m, 3,2H), 2,70-2,80 (m, 2H), 1,86-2,03 (m, 2H), 1,6-1,8 (m, 1H),
1,4-1,5 (m, 2H), 0,9-1,1 (m, 2H).
-
Beispiel 145: 2-((1-((E)-3-Phenylprop-2-enyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-hydrochlorid
(E-Isomer von Verbindung 364 in Tabelle 1)
-
a) 2-((1-((E)-3-Phenylprop-2-enyl)-piperidin-4-yl)-methyl)-isoindolin-1-on
-
Die
in Beispiel 1e erhaltene Verbindung (500 mg, 1,87 mmol) und 3-Brom-1- phenyl-1-propen (369
mg, 1,87 mmol) wurden gelöst
in Dimethylformamid (6 ml) und Kaliumcarbonat (516 mg, 3,74 mmol)
wurde zu der Lösung
gegeben und bei Raumtemperatur für
20 Stunden gerührt.
Der Reaktionsmischung wurde Wasser zugefügt (20 ml) und der Niederschlag
durch Filtration gesammelt, um die Titelverbindung als farblosen
Feststoff zu erhalten (402 mg, Ausbeute: 62%).
1H-NMR
(CDCl3): δ 7,85
(d, J = 7,0 Hz, 1H), 7,83-7,22 (m, 8H), 6,50 (d, J = 16,0 Hz, 1H),
6,28 (d t, J = 15,8 Hz, 6,7 Hz, 1H), 4,41 (s, 2H), 3,51 (d, J =
7,1 Hz, 2H), 3,14 (d, J = 6,7 Hz, 2H), 2,98 (br d, J = 11,0 Hz,
2H), 1,97 (dd, J = 11,4 Hz, 2H), 1,86-1,69 (m, 3H), 1,42 (ddd, J
= 24,5 Hz, 12,5 Hz, 2,9 Hz, 2H).
-
b) 2-((1-((E)-3-Phenylprop-2-enyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-hydrochlorid
-
Unter
Verwendung der in Beispiel 145a erhaltenen Verbindung wurde die
Titelverbindung durch ähnliche
Verfahren wie in Beispiel 1f erhalten als farbloser Feststoff (197
mg, Ausbeute: 45%).
Schmelzpunkt: 212–215°C
1H-NMR
(DMSO-d6): δ 10,8 (m, 1H), 7,68 (d, J =
4,8 Hz, 1H), 7,61 (d, J = 3,9 Hz, 2H), 7,53-7,46 (m, 3H), 7,41-7,30
(m, 3H), 6,81 (d, J = 15,9 Hz, 1H), 6,43 (dt, J = 15,9 Hz, 7,6 Hz,
1H), 4,51 (s, 2H), 3,84 (s, 2H), 3,44 (d, J = 6,9 Hz, 2H), 3,35
(s, 2H), 2,90-2,87 (m, 2H), 1,99 (br s, 1H), 1,81 (br d, J = 13,5
Hz, 2H), 1,57 (br dd, J = 15,2 Hz, 11,6 Hz, 2H).
-
Beispiel 154: 5-Fluor-2-((1-(2-(4-fluorphenyl)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-hydrochlorid (Verbindung
9 in Tabelle 1)
-
a) 4-Fluor-2-methyl-benzoesäureethylester
-
Magnesium
(0,644 g, 26,5 mmol) wurde mit THF (4 ml) versetzt sowie einer kleinen
Menge an Iod. Nach Rühren
der Mischung wurde der Mischung tropfenweise 1-Brom-4-fluor-2-methylbenzol
(5,00 g, 26,5 mmol) in THF (50 ml) zugegeben. Die Mischung wurde
bei Raumtemperatur für
30 Minuten gerührt
und anschließend
auf –78°C gekühlt und
tropfenweise mit einer Lösung
von Chlorameisensäureethylester
(3,80 ml, 39,8 mmol) in THF (40 ml) versetzt. Die Mischung wurde
langsam auf Raumtemperatur erwärmt
und 2 weitere Stunden bei Raumtemperatur gerührt. Die Reaktionsmischung
wurde mit Ether verdünnt
und mit Wasser, gesättigter
wässriger
Natriumhydrogencarbonat-Lösung
und anschließend
mit gesättigter
Kochsalzlösung
gewaschen und über
Natriumsulfat getrocknet. Das Trockenmittel wurde durch Filtration
abgetrennt und das Filtrat eingeengt, und die resultierende ölige Substanz
wurde mittels Silicagel-Säulenchromatographie
(Hexan/Ether) gereinigt, um die Titelverbindung zu erhalten (3,65
g, Ausbeute: 76%).
1H-NMR (CDCl3): δ 1,39
(t, J = 7,0 Hz, 3H), 2,61 (s, 3H), 4,35 (q, J = 7,0 Hz, 2H), 6,89-6,95
(m, 2H), 7,95 (m, 1H).
-
b) 4-(5-Fluor-1-oxoisoindolin-2-yl-methyl)-piperidin-1-tert-butylcarboxylat
-
Unter
Verwendung der in Beispiel 154a erhaltenen Verbindung wurde die
Titelverbindung durch ähnliche
Verfahren wie in den Beispielen 1b und 1c erhalten (Ausbeute: 57%).
1H-NMR (CDCl3): δ 1,25 (m,
2H), 1,45 (s, 9H), 1,64 (m, 2H), 1,93 (m, 1H), 2,69 (m, 2H), 3,47
(m, 2H), 4,11 (m, 2H), 4,39 (s, 2H), 7,12-7,20 (m, 2H), 7,82 (dd,
J = 5,0 Hz, 8,3 Hz, 1H).
-
c) 5-Fluor-2-(piperidin-4-yl-methyl)-isoindolin-1-on-hydrochlorid
-
Unter
Verwendung der in Beispiel 154b erhaltenen Verbindung wurde die
Titelverbindung durch ähnliche
Verfahren wie in Beispiel 1d erhalten (Ausbeute: 91%).
1H-NMR (DMSO-d6): δ 1,36 (m,
2H), 1,73 (m, 2H), 2,00 (m, 1H), 2,80 (m, 2H), 3,24 (m, 2H), 3,42
(d, J = 7,5 Hz, 2H), 4,49 (s, 2H), 7,32 (m, 1H), 7,49 (d, J = 8,6
Hz, 1H), 7,71 (dd, J = 5,1 Hz, 8,4 Hz, 1H), 8,49 (br s, 1H), 8,78
(br s, 1H).
-
d) 5-Fluor-2-((1-(2-(4-fluorphenyl)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on
-
Unter
Verwendung der in Beispiel 154c erhaltenen Verbindung wurde die
Titelverbindung durch ähnliche
Verfahren wie in Beispiel 1e erhalten (Ausbeute: 85%).
1H-NMR (CDCl3): δ 1,47 (m,
2H), 1,68 (m, 2H), 1,81 (m, 1H), 2,15 (m, 2H), 2,96 (m, 2H), 3,49
(d, J = 7,2 Hz, 2H), 3,72 (s, 2H), 4,38 (s, 2H), 7,08-7,18 (m, 4H),
7,81 (dd, J = 5,0 Hz, 8,3 Hz, 1H), 8,07 (m, 2H).
-
e) 5-Fluor-2-((1-(2-(4-fluorphenyl)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-hydrochlorid
-
Unter
Verwendung der in Beispiel 154d erhaltenen Verbindung wurde die
Titelverbindung durch ähnliche
Verfahren wie in Beispiel 1f erhalten (Ausbeute: 90%).
Schmelzpunkt:
209–216°C
1H-NMR (DMSO-d6): δ 1,58-1,86
(m, 4H), 2,03 (m, 1H), 3,04 (m, 2H), 3,45 (d, J = 8,8 Hz, 2H), 3,54
(m, 2H), 4,53 (s, 2H), 5,04-5,10 (m, 2H), 7,33 (m, 1H), 7,45-7,53 (m, 3H), 7,73
(dd, J = 5,2 Hz, 8,3 Hz, 1H), 8,06-8,15 (m, 2H), 9,96 (br s, 1H).
-
Beispiel 155: 6-Methoxy-2-((1-(2-(4-fluorphenyl)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-hydrochlorid
(Verbindung 18 in Tabelle 1)
-
a) 3-Hydroxy-2-methyl-benzoesäuremethylester
-
Unter
Verwendung von 3-Hydroxy-2-methylbenzoesäure wurde die Titelverbindung
durch ähnliche Verfahren
wie in Beispiel 3a erhalten (Ausbeute: 97%).
1H-NMR
(CDCl3): δ 2,46
(s, 3H), 3,89 (s, 3H), 6,94 (d, J = 8,3 Hz, 1H), 7,11 (t, J = 8,3
Hz, 1H), 7,42 (d, J = 8,3 Hz, 1H).
-
b) 3-(tert-Butyl-dimethyl-silanyloxy)-2-methyl-benzoesäuremethylester
-
Die
in Beispiel 155a erhaltene Verbindung (4,99 g, 30,0 mmol) wurde
in DMF (26 ml) gelöst
und anschließend
wurden der Lösung
tert-Butyldimethylchlorsilan (5,43 g, 36,0 mmol) und Imidazol (5,11
g, 75 mmol) zugefügt
und bei Raumtemperatur gerührt.
Die Reaktionsmischung wurde mit gesättigter wässriger Natriumhydrogencarbonat-Lösung versetzt
und viermal mit Hexan extrahiert, und anschließend wurden die vereinigten organischen
Phasen über
Natriumsulfat getrocknet. Das Trockenmittel wurde durch Filtration
abgetrennt und das Filtrat eingeengt, die resultierende ölige Substanz
wurde gereinigt mittels Silicagel-Säulenchromatographie
(Hexan/Ethylacetat), um die Titelverbindung zur erhal ten (8,24 g,
Ausbeute: 93%).
1H-NMR (CDCl3): δ 0,21
(s, 6H), 1,02 (s, 9H), 2,41 (s, 3H), 3,88 (s, 3H), 6,93 (d, J =
8,4 Hz, 1H), 7,09 (t, J = 8,4 Hz, 1H), 7,42 (d, J = 8,4 Hz, 1H).
-
c) 4-(6-(tert-Butyl-dimethyl-silanyloxy)-1-oxoisoindolin-2-yl-methyl)-piperidin-1-tert-butylcarboxylat
-
Unter
Verwendung der in Beispiel 155b erhaltenen Verbindung wurde die
Titelverbindung durch ähnliche
Verfahren wie in den Beispielen 1b und 1c erhalten (Ausbeute: 71%).
1H-NMR (CDCl3): δ 0,25 (s,
6H), 1,02 (s, 9H), 1,26 (m, 2H), 1,45 (s, 9H), 1,66 (m, 2H), 1,95
(m, 1H), 2,70 (m, 2H), 3,49 (m, 2H), 4,10 (m, 2H), 4,30 (s, 2H),
6,93 (d, J = 7,7 Hz, 1H), 7,33 (t, J = 7,7 Hz, 1H), 7,45 (d, J =
7,7 Hz, 1H).
-
d) 4-(6-Hydroxy-1-oxoisoindolin-2-yl-methyl)-piperidin-1-tert-butylcarboxylat
-
Die
in Beispiel 155c erhaltene Verbindung (9,20 g, 20,0 mmol) und Essigsäure (9,44
ml) wurden in THF (100 ml) gelöst
und die Lösung
auf 0°C
gekühlt
und tropfenweise mit 1M Tetrabutylammoniumfluorid-Lösung in
THF (20 ml, 20 mmol) versetzt. Nach 30 Minuten wurde die Reaktionsmischung
mit Ethylacetat verdünnt
und dreimal mit 0,5N wässriger
Salzsäure
und anschließend
mit gesättigter
Kochsalzlösung
gewaschen und über
Natriumsulfat getrocknet. Das Trockenmittel wurde durch Filtration
abgetrennt und das Filtrat eingeengt. Die resultierende ölige Substanz
wurde kristallisiert aus Dichlormethan/Ether/Hexen, um die Titelverbindung
zu erhalten (5,70 g, Ausbeute: 82%).
1H-NMR
(CDCl3): δ 1,23
(m, 2H), 1,46 (s, 9H), 1,65 (m, 2H), 1,95 (m, 1H), 2,69 (m, 2H),
3,50 (m, 2H), 4,12 (m, 2H), 4,41 (s, 2H), 7,03 (d, J = 7,5 Hz, 1H),
7,29 (t, J = 7,5 Hz, 1H), 7,39 (d, J = 7,5 Hz, 1H).
-
e) 6-Methoxy-2-(piperidin-4-yl-methyl)-isoindolin-1-on-hydrochlorid
-
Eine
Lösung
der in Beispiel 155d erhaltenen Verbindung (0,600 g, 1,74 mmol)
in Acetonitril (6 ml) wurde mit Methyliodid (0,216 ml, 3,46 mmol)
und Kaliumcarbonat (478 mg, 3,46 mmol) versetzt und auf 60°C erhitzt.
Nach 2,5 Stunden wurde die Mischung auf Raumtemperatur abgekühlt und
mit Ethylacetat verdünnt
und zweimal mit gesättigter
wässriger
Natriumhydrogencarbonat-Lösung
und gesättigter
Kochsalzlösung
gewaschen und anschließend über Natriumsulfat
getrocknet. Das Trockenmittel wurde durch Filtration abgetrennt und
das Filtrat eingeengt, das resultierende Rohprodukt wurde ähnlichen
Verfahren wie in Beispiel 1d ohne Aufreinigung unterworfen, um die
Titelverbindung zu erhalten (Ausbeute: 94%).
1H-NMR
(DMSO-d6): δ 1,36 (m, 2H), 1,71 (m, 2H),
2,04 (m, 1H), 2,79 (m, 2H), 3,24 (m, 2H), 3,42 (d, J = 7,4 Hz, 2H),
3,89 (s, 3H), 4,41 (s, 2H), 7,21 (d, J = 8,1 Hz, 1H), 7,26 (d, J
= 7,4 Hz, 1H), 7,47, (dd, J = 4,7 Hz, 8,1 Hz, 1H), 8,55 (br s, 1H),
8,84 (br s, 1H).
-
f) 6-Methoxy-2-((1-(2-(4-fluorphenyl)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-hydrochlorid
-
Unter
Verwendung der in Beispiel 155e erhaltenen Verbindung wurde die
Titelverbindung durch ähnliche
Verfahren wie in den Beispielen 1e und 1f erhalten (Ausbeute: 67%).
Schmelzpunkt:
213–229°C
1H-NMR (DMSO-d6): δ 1,57-1,84
(m, 4H), 2,05 (m, 1H), 3,02 (m, 2H), 3,45 (d, J = 6,9 Hz, 2H), 3,53
(m, 2H), 3,89 (s, 3H), 4,45 (s, 2H), 5,03-5,09 (m, 2H), 7,22 (d,
J = 8,1 Hz, 1H), 7,27 (d, J = 7,4 Hz, 1H), 7,45-7,50 (m, 3H), 8,05-8,15
(m, 2H), 9,95 (br s, 1H).
-
Beispiel 156: 6-Ethoxy-2-((1-(2-(4-fluorphenyl)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-hydrochlorid
-
a) 6-Ethoxy-2-(piperidin-4-yl-methyl)-isoindolin-1-on-hydrochlorid
-
Unter
Verwendung der in Beispiel 155d erhaltenen Verbindung wurde die
Titelverbindung durch ähnliche
Verfahren wie in Beispiel 155e erhalten (Ausbeute: 97%).
1H-NMR (DMSO-d6): δ 1,36 (m,
2H), 1,37 (t, J = 6,9 Hz, 3H), 1,71 (m, 2H), 2,05 (m, 1H), 2,79
(m, 2H), 3,23 (m, 2H), 3,42 (d, J = 7,1 Hz, 2H), 4,16 (q, J = 6,9
Hz, 2H), 4,41 (s, 2H), 7,19 (d, J = 8,1 Hz, 1H), 7,25 (d, J = 7,4 Hz,
1H), 7,45 (dd, J = 7,4 Hz, 8,1 Hz, 1H), 8,74 (br s, 1H), 9,02 (br
s, 1H).
-
b) 6-Ethoxy-2-((1-(2-(4-fluorphenyl)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-hydrochlorid
-
Unter
Verwendung der in Beispiel 156a erhaltenen Verbindung wurde die
Titelverbindung durch ähnliche
Verfahren wie in den Beispielen 1e und 1f erhalten (Ausbeute: 43%).
Schmelzpunkt:
200–209°C
1H-NMR (DMSO-d6): δ 1,37 (t,
J = 6,9 Hz, 3H), 1,57-1,84 (m, 4H), 2,08 (m, 1H), 3,01 (m, 2H),
3,45 (d, J = 6,8 Hz, 2H), 3,53 (m, 2H), 4,17 (q, J = 6,9 Hz, 2H),
4,44 (s, 2H), 5,03-5,09 (m, 2H), 7,20 (d, J = 8,0 Hz, 1H), 7,26 (d,
J = 7,4 Hz, 1H), 7,42-7,50
(m, 3H), 8,06-8,16 (m, 2H), 9,93 (br s, 1H).
-
Beispiel 157: 6-Isopropoxy-2-((1-(2-(4-fluorphenyl)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-hydrochlorid
-
a) Isopropoxy-2-(piperidin-4-yl-methyl)-isoindolin-1-on-hydrochlorid
-
Unter
Verwendung der in Beispiel 155d erhaltenen Verbindung wurde die
Titelverbindung durch ähnliche
Verfahren wie in Beispiel 155e erhalten (Ausbeute: 99%).
1H-NMR (DMSO-d6): δ 1,30 (d,
J = 5,5 Hz, 6H), 1,34 (m, 2H), 1,71 (m, 2H), 2,04 (m, 1H), 2,79
(m, 2H), 3,23 (m, 2H), 3,41 (d, J = 6,6 Hz, 2H), 4,37 (s, 2H), 4,74
(m, 1H), 7,21-7,23 (m, 2H), 7,43 (m, 1H), 8,60 (br s, 1H), 8,88
(br s, 1H).
-
b) 6-Isopropoxy-2-((1-(2-(4-fluorphenyl)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-fumarat
-
Unter
Verwendung der in Beispiel 157a erhaltenen Verbindung wurde die
Titelverbindung durch ähnliche
Verfahren wie in den Beispielen 1e und 36c erhalten (Ausbeute: 53%).
Schmelzpunkt:
132°C
1H-NMR (DMSO-d6): δ 1,21 (m,
2H), 1,30 (d, J = 6,0 Hz, 6H), 1,55 (m, 2H), 1,76 (m, 1H), 2,13
(m, 2H), 2,87 (m, 2H), 3,38 (d, J = 7,2 Hz, 2H), 3,81 (s, 2H), 4,35
(s, 2H), 4,74 (m, 1H), 6,61 (s, 2H), 7,19-7,23 (m, 2H), 7,35 (t,
J = 8,7 Hz, 2H), 7,42 (t, J = 7,8 Hz, 1H), 8,09 (dd, J = 5,7 Hz,
8,7 Hz, 2H).
-
Beispiel 158: 5-((1-(2-(4-Fluorphenyl)-2-oxoethyl)-piperidin-4-yl)-methyl)-4,5-dihydro-6H-furo[2,3-c]pyrrol-6-on-fumarat
(Verbindung 817 in Tabelle 2)
-
a) 3-Brommethylfuran-2-methylcarboxylat
-
Unter
Verwendung von 3-Methylfuranmethylcarboxylat (2,00 g, 14,27 mmol)
wurde die Titelverbindung als Rohprodukt mittels Durchführung einer ähnlichen
Reaktion wie in Beispiel 1c als gelbes Öl erhalten (3,51 g). Das Rohprodukt
wurde ohne Aufreinigung in die nächste
Reaktion eingesetzt.
-
b) 3-((1-(tert-Butoxycarbonyl)-piperidin-4-yl)-methylaminomethyl)-2-furanmethylcarboxylat
-
Unter
Verwendung der in Beispiel 158a erhaltenen Verbindung (3,51 g) wurde
die Titelverbindung mittels Durchführung von ähnlichen Reaktionen wie in
Beispiel 1c als gelbes Öl
erhalten (1,80 g, Ausbeute: 36%, 2 Stufen).
1H-NMR
(CDCl3): δ 7,48
(d, J = 1,5 Hz, 1H), 6,55 (d, J = 1,8 Hz, 1H), 4,09 (br d, J = 11,7
Hz, 2H), 3,94-3,91 (m, 5H), 2,69 (br t, J = 12,5 Hz, 2H), 2,51 (d,
J = 6,6 Hz, 2H), 1,73-1,58 (m, 3H), 1,45 (s, 9H), 1,18-1,06 (m,
2H).
-
c) 3-((1-(tert-Butoxycarbonyl)-piperidin-4-yl)-methylaminomethyl)-2-furancarbonsäure
-
Unter
Verwendung der in Beispiel 158b erhaltenen Verbindung (1,80 g) wurde
die Titelverbindung mittels Durchführung einer ähnlichen
Reaktion wie in Beispiel 22d, als gelbe, halbfeste Substanz erhalten
(1,35 g, Ausbeute: 78%).
1H-NMR (CDCl3): δ 10,36
(br s, 2H), 7,48 (d, J = 1,5 Hz, 1H), 6,58 (d, J = 1,2 Hz, 1H),
4,23 (br s, 2H), 4,09 (br d, J = 7,4 Hz, 2H), 2,97-2,70 (m, 4H),
2,08 (br s, 1H), 1,85 (br d, J = 12,0 Hz, 2H), 1,42 (s, 9H), 1,25-1,11
(m, 2H).
-
d) 4-((4,5-Dihydro-6H-furo[2,3-c]pyrrol-6-on)-2-yl-methyl)-piperidin-1-tert-butylcarboxylat
-
Die
in Beispiel 158c erhaltene Verbindung (658 mg, 1,94 mmol), 2,2'-Dipyridyldisulfid
(513 mg, 2,33 mmol) und Triphenylphosphin (611 mg, 2,33 mmol) wurden
in Acetonitril (6 ml) gelöst
und die Mischung unter Rückfluss
für 4 Stunden
erhitzt. Die Reaktionsmischung wurde zum Abkühlen stehen gelassen und das
Lösemittel
wurde verdampft. Der Rückstand
wurde mit Wasser versetzt und mit Ethylacetat extrahiert. Die organische
Phase wurde mit gesättigter
wässriger
Natriumhydrogencarbonat-Lösung,
Wasser und anschließend
gesättigter
Kochsalzlösung
gewaschen und über
wasserfreiem Natriumsulfat getrocknet. Unlösliche Feststoffe wurden durch
Filtration abgetrennt und das Lösemittel
unter vermindertem Druck verdampft. Das resultierende Rohprodukt
wurde mittels Silicagel-Chromatographie
(Ethylacetat/Hexan = 1/1) gereinigt, um die Titelverbindung als
gelbes Öl
zu erhalten (694 mg, eine Mischung mit dem Reagenz).
-
e) 5-(Piperidin-4-yl-methyl)-4,5-dihydro-6H-furo[2,3-c]pyrrol-6-on-hydrochlorid
-
Unter
Verwendung der in Beispiel 158d erhaltenen Verbindung (658 mg) wurde
die Titelverbindung mittels Durchführung ähnlicher Reaktionen wie in
Beispiel 1d als farbloser Feststoff erhalten (161 mg, Ausbeute:
12%, 3 Stufen).
1H-NMR (DMSO-d6): δ 8,92
(br s, 1H), 8,65 (br s, 1H), 7,99 (s, 1H), 6,77 (s, 1H), 4,30 (s,
2H), 3,33 (d, J = 7,4 Hz, 1H), 3,24 (br d, J = 12,7 Hz, 1H), 2,79
(br dd, J = 23,2 Hz, 12,0 Hz, 2H), 1,99-1,91 (m, 1H), 1,72 (d, J
= 13,2 Hz, 2H), 1,42-1,29 (m, 2H).
-
f) 5-((1-(2-(4-Fluorphenyl)-2-oxoethyl)-piperidin-4-yl)-methyl)-4,5-dihydro-6H-furo[2,3-c]pyrrol-6-on
-
Unter
Verwendung der in Beispiel 158e erhaltenen Verbindung (80 mg, 0,312
mmol) wurde dir Titelverbindung mittels Durchführung einer ähnlichen
Reaktion wie in Beispiel 1e als farbloser Feststoff erhalten (90
mg, Ausbeute: 81%).
1H-NMR (CDCl3): δ 8,10-8,05
(m, 2H), 7,61 (d, J = 1,7 Hz, 1H), 7,12 (t, J = 8,7 Hz, 2H), 6,50
(d, J = 1,6 Hz, 1H), 4,18 (s, 2H), 3,72 (s, 2H), 3,41 (d, J = 7,2
Hz, 2H), 2,96 (br d, J = 11,4 Hz, 2H), 2,18-2,10 (m, 2H), 1,78-1,62 (m,
3H), 1,50-1,41 (m, 2H).
-
g) 4-Fluor-2-(1-(2-(4-fluorphenyl)-ethyl)-piperidin-4-yl-methyl)-isoindolin-1-on-fumarat
-
Unter
Verwendung der in Beispiel 158f erhaltenen Verbindung (90 mg, 0,253
mmol) wurde die Titelverbindung mittels Durchführung einer ähnlichen
Reaktion wie in Beispiel 36c als farbloser Feststoff erhalten (109
mg, Ausbeute: 91%).
Schmelzpunkt: 230–232°C
1H-NMR
(DMSO-d6): δ 8,11-8,07 (m, 2H), 7,97 (d,
J = 1,7 Hz, 1H), 7,38-7,32 (m, 2H), 6,75 (d, J = 1,6 Hz, 1H), 6,61
(s, 2H), 4,27 (s, 2H), 3,84 (s, 2H), 3,29 (d, J = 7,2 Hz, 2H), 2,88
(br d, J = 11,4 Hz, 2H), 2,14 (t, J = 10,8 Hz, 2H), 1,70-1,67 (m,
1H), 1,56 (d, J = 12,3 Hz, 2H), 1,26-1,16 (m, 2H).
-
Beispiel 171: (R,S)-2-(1-(2-(4-Fluorphenyl)-2-hydroxyethyl)-piperidin-4-yl-methyl)-4-fluorisoindolin-1-on-hydrochlorid
(Verbindung 83 in Tabelle 1)
-
a) (R,S)-2-(1-(2-(4-Fluorphenyl)-2-hydroxyethyl)-piperidin-4-yl-methyl)-4-fluorisoindolin-1-on
-
Unter
Verwendung der in Beispiel 6 erhaltenen Verbindung wurde die Titelverbindung
durch ähnliche Verfahren
wie in Beispiel 16a erhalten (Ausbeute: 85%).
1H-NMR
(CDCl3): δ 7,66
(d, J = 7,8 Hz, 1H), 7,46 (m, 1H), 7,35-7,30 (m, 2H), 7,22 (t, J
= 8,1 Hz, 1H), 7,04-6,99 (m, 2H), 4,71-4,66 (m, 1H), 4,46 (s, 2H),
3,53 (d, J = 7,2 Hz, 2H), 3,15 (br d, J = 11,7 Hz, 1H), 2,83 (br
d, J = 10,2 Hz, 1H), 2,51-2,31 (m, 3H), 2,04 (m, 1H), 1,85 (m, 1H),
1,80-1,65 (m, 2H), 1,49-1,22 (m, 2H).
-
b) (R,S)-2-(1-(2-(4-Fluorphenyl)-2-hydroxyethyl)-piperidin-4-yl-methyl)-4-fluorisoindolin-1-on-hydrochlorid
-
Unter
Verwendung der in Beispiel 171a erhaltenen Verbindung wurde die
Titelverbindung durch ähnliche
Verfahren wie in Beispiel 1f erhalten (Ausbeute: 78%).
Schmelzpunkt:
221–224°C
1H-NMR (DMSO-d6): δ 9,63 (br
s, 1H), 7,56-7,42 (m, 5H), 7,20 (t, J = 8,7 Hz, 2H), 6,24 (br s,
1H), 5,11 (br s, 1H), 4,59 (s, 2H), 3,55-2,90 (m, 8H), 2,00 (m,
1H), 1,86-1,56 (m, 2H).
-
Beispiel 172: (R,S)-2-(1-(2-(4-Fluorphenyl)-2-hydroxyethyl)-piperidin-4-yl-methyl)-5-chlorisoindolin-1-on-hydrochlorid
(Verbindung 84 in Tabelle 1)
-
a) (R,S)-2-(1-(2-(4-Fluorphenyl)-2-hydroxyethyl)-piperidin-4-yl-methyl)-5-chlorisoindolin-1-on
-
Unter
Verwendung der in Beispiel 8 erhaltenen Verbindung wurde die Titelverbindung
durch ähnliche Verfahren
wie in Beispiel 16a erhalten (Ausbeute: 82%).
1H-NMR
(CDCl3): δ 7,78
(d, J = 8,7 Hz, 1H), 7,44 (m, 2H), 7,35-7,30 (m, 2H), 7,02 (m, 2H),
4,69 (m, 1H), 4,44 (s, 2H), 4,09 (br s, 1H), 3,51 (d, J = 7,2 Hz,
2H), 3,15 (br d, J = 11,4 Hz, 1H), 8,81 (br d, J = 11,1 Hz, 1H), 2,49-2,30
(m, 3H), 2,02 (m, 1H), 1,80 (m, 1H), 1,80-1,20 (m, 4H).
-
b) (R,S)-2-(1-(2-(4-Fluorphenyl)-2-hydroxyethyl)-piperidin-4-yl-methyl)-5-chlorisoindolin-1-on-hydrochlorid
-
Unter
Verwendung der in Beispiel 172a erhaltenen Verbindung wurde die
Titelverbindung durch ähnliche
Verfahren wie in Beispiel 1f erhalten (Ausbeute: 90%).
Schmelzpunkt:
254–256°C
1H-NMR (DMSO-d6): δ 9,59 (br
s, 1H), 7,74-7,67 (m, 2H), 7,56-7,43 (m, 3H), 7,25-7,20 (m, 2H),
6,27 (br s, 1H), 5,13 (br s, 1H), 4,52 (s, 2H), 3,64-2,95 (m, 8H),
1,99-1,57 (m, 5H).
-
Beispiel 173: (R,S)-2-(1-(2-(4-Fluorphenyl)-2-hydroxyethyl)-piperidin-4-yl-methyl)-5-fluorisoindolin-1-on-hydrochlorid
-
a) (R,S)-2-(1-(2-(4-Fluorphenyl)-2-hydroxyethyl)-piperidin-4-yl-methyl)-5-fluorisoindolin-1-on
-
Unter
Verwendung der in Beispiel 154 erhaltenen Verbindung wurde die Titelverbindung
durch ähnliche
Verfahren wie in Beispiel 16a erhalten (Ausbeute: 61%).
1H-NMR (CDCl3): δ 7,83 (m,
1H), 7,35-7,25 (m, 2H), 7,17-7,12 (m, 2H), 7,05-6,99 (m, 2H), 4,67 (m, 1H), 4,44 (s,
2H), 4,08 (br s, 1H), 3,51 (d, J = 7,2 Hz, 2H), 3,15 (br d, J =
11,1 Hz, 1H), 2,82 (br s, J = 11,1 Hz, 1H), 2,49-2,28 (m, 3H), 2,02
(m, 1H), 1,80 (m, 1H), 1,77-1,25 (m, 4H).
-
b) (R,S)-2-(1-(2-(4-Fluorphenyl)-2-hydroxyethyl)-piperidin-4-yl-methyl)-5-fluorisoindolin-1-on-hydrochlorid
-
Unter
Verwendung der in Beispiel 173a erhaltenen Verbindung wurde die
Titelverbindung durch ähnliche
Verfahren wie in Beispiel 1f erhalten (Ausbeute: 70%).
Schmelzpunkt:
243–245°C
1H-NMR (DMSO-d6): δ 9,66 (br
s, 1H), 7,71 (m, 1H), 7,43 (m, 3H), 7,34-7,17 (m, 3H), 6,24 (d,
J = 3,9 Hz, 1H), 5,11 (br s, 1H), 4,49 (s, 2H), 3,66-2,91 (m, 8H),
1,97-1,52 (m, 5H).
-
Beispiel 174: (R,S)-2-(1-(2-(4-Fluorphenyl)-2-hydroxyethyl)-piperidin-4-yl-methyl)-5-cyanoisoindolin-1-on-hydrochlorid
(Verbindung 87 in Tabelle 1)
-
a) (R,S)-2-(1-(2-(4-Fluorphenyl)-2-hydroxyethyl)-piperidin-4-yl-methyl)-5-cyanoisoindolin-1-on
-
Unter
Verwendung der in Beispiel 10 erhaltenen Verbindung wurde die Titelverbindung
durch ähnliche Verfahren
wie in Beispiel 16a erhalten (Ausbeute: 37%).
1H-NMR
(CDCl3): δ 7,95
(d, J = 7,8 Hz, 1H), 7,76 (m, 2H), 7,32 (m, 2H), 7,01 (m, 2H), 4,69
(m, 1H), 4,47 (s, 2H), 3,55 (d, J = 7,2 Hz, 2H), 3,14 (br d, J =
10,5 Hz, 1H), 2,81 (br d, J = 10,5 Hz, 1H), 2,79-2,29 (m, 3H), 2,03 (m,
1H), 1,95-1,35 (m, 5H).
-
b) (R,S)-2-(1-(2-(4-Fluorphenyl)-2-hydroxyethyl)-piperidin-4-yl-methyl)-5-cyanoisoindolin-1-on-hydrochlorid
-
Unter
Verwendung der in Beispiel 174a erhaltenen Verbindung wurde die
Titelverbindung durch ähnliche
Verfahren wie in Beispiel 1f erhalten (Ausbeute: 74%).
Schmelzpunkt:
255–262°C
1H-NMR (DMSO-d6): δ 9,66 (br
s, 1H), 8,16 (s, 1H), 7,96 (d, J = 7,5 Hz, 1H), 7,86 (d, J = 7,8
Hz, 1H), 7,45 (m, 2H), 7,22 (m, 2H), 6,27 (br s, 1H), 5,13 (br s,
1H), 4,59 (s, 2H), 3,60-2,92 (m, 8H), 1,98-1,54 (m, 5H).
-
Beispiel 175: (R,S)-5-(1-(2-(Fluorphenyl)-2-hydroxyethyl)-piperidin-4-yl-methyl)-4,5-dihydro-6H-thieno[2,3-c]pyrrol-6-on-fumarat
(Verbindung 780 in Tabelle 2)
-
a) (R,S)-5-(1-(2-(Fluorphenyl)-2-hydroxyethyl)-piperidin-4-yl-methyl)-4,5-dihydro-6H-thieno[2,3-c]pyrrol-6-on
-
Unter
Verwendung der in Beispiel 22 erhaltenen Verbindung wurde die Titelverbindung
durch ähnliche Verfahren
wie in Beispiel 16 erhalten (Ausbeute: 87%).
1H-NMR
(CDCl3): δ 7,63
(d, J = 4,8 Hz, 1H), 7,32 (m, 3H), 7,01 (m, 3H), 4,67 (m, 1H), 4,34
(s, 2H), 4,11 (br s, 1H), 3,47 (d, J = 6,9 Hz, 2H), 3,15 (br d,
J = 11,1 Hz, 1H), 2,83 (br d, J = 10,8 Hz, 1H), 2,50-2,30 (m, 3H),
2,03 (m, 1H), 1,87-1,71 (m, 3H), 1,47-1,37 (m, 1H).
-
b) (R,S)-5-(1-(2-(Fluorphenyl)-2-hydroxyethyl)-piperidin-4-yl-methyl)-4,5-dihydro-6H-thieno[2,3-c]pyrrol-6-on-fumarat
-
Die
in Beispiel 176a erhaltene Verbindung (70 mg) wurde in Ethanol (1
ml) und Ethylacetat (3 ml) gelöst
und zu der Lösung
wurde Fumarsäure
(26 mg) gegeben. Die niedergeschlagenen Kristalle, welche nach vollständiger Auflösung auftraten,
wurden durch Filtration gesammelt, um die Titelverbindung zu erhalten
(Ausbeute: 87%).
Schmelzpunkt: 174–176°C
1H-NMR
(DMSO-d6): δ 7,95 (d, J = 5,1 Hz, 1H), 7,41-7,35
(m, 2H), 7,23-7,11 (m, 3H), 6,57 (s, 2H), 4,76 (br s, 1H), 4,42
(s, 2H), 3,33-2,15 (m, 8H), 1,72-1,57 (m, 3H), 1,25-1,15 (m, 2H).
-
Beispiel 176: 2-(1-(2-(4-Fluorphenoxy)-ethyl)-piperidin-4-yl-methyl)-5-methoxyisoindolin-1-on-hydrochlorid (Verbindung
214 in Tabelle 1)
-
a) 2-(1-(2-(4-Fluorphenoxy)-ethyl-)-piperidin-4-yl-methyl)-5-methoxyisoindolin-1-on
-
Unter
Verwendung der in Beispiel 9c erhaltenen Verbindung und 1-Fluor-4-(2-bromethoxy)-benzol wurde
die Titelverbindung durch ähnliche
Verfahren wie in Beispiel 165a erhalten (Ausbeute: 78%).
1H-NMR (CDCl3): δ 7,75 (d,
J = 8,4 Hz), 7,0-6,91 (m, 4H), 6,85-6,80 (m, 2H), 4,34 (s, 2H),
4,04 (t, J = 6,0 Hz, 2H), 3,87 (s, 3H), 3,47 (d, J = 7,2 Hz, 2H),
2,98 (br d, J = 11,7 Hz, 2H), 2,76 (t, J = 6,0 Hz, 2H), 2,09 (t,
J = 9,3 Hz, 2H), 1,77 (m, 1H), 1,72 (m, 2H), 1,48-1,39 (m, 2H).
-
b) 2-(1-(2-(4-Fluorphenoxy)-ethyl)-piperidin-4-yl-methyl)-5-methoxyisoindolin-1-on-hydrochlorid
-
Unter
Verwendung der in Beispiel 176a erhaltenen Verbindung wurde die
Titelverbindung durch ähnliche
Verfahren wie in Beispiel 1f erhalten (Ausbeute: 47%).
Schmelzpunkt:
216–219°C
1H-NMR (DMSO-d6): δ 10,44 (br
s, 1H), 7,58 (d, J = 8,4 Hz), 7,19-7,13 (m, 3H), 7,06-6,99 (m, 3H),
4,44 (s, 2H), 4,37 (t, J = 4,5 Hz, 2H), 3,84 (s, 3H), 3,59-3,45
(m, 2H), 3,45-3,30 (m, 4H), 3,05-2,94 (m, 2H), 1,97 (m, 1H), 1,81-1,76
(m, 2H), 1,64-1,52 (m, 2H).
-
Beispiel 177: 2-(1-(2-(4-Fluorphenoxy)-ethyl)-piperidin-4-yl-methyl)-5-bromisoindolin-1-on-hydrochlorid
(Verbindung 208 in Tabelle 1)
-
a) 2-(1-(2-(4-Fluorphenoxy)-ethyl)-piperidin-4-yl-methyl)-5-bromisoindolin-1-on
-
Unter
Verwendung der in Beispiel 3d erhaltenen Verbindung sowie 1-Fluor-4-(2-bromethoxy)-benzol wurde
die Titelverbindung durch ähnliche
Verfahren wie in Beispiel 165a erhalten (Ausbeute: 66%).
1H-NMR (CDCl3): δ 7,71 (d,
J = 8,4 Hz, 1H), 7,62-7,59 (m, 2H), 6,99-6,93 (m, 2H), 6,85-6,80
(m, 2H), 4,38 (s, 2H), 4,04 (t, J = 6,0 Hz, 2H), 3,48 (d, J = 4,9
Hz), 2,99 (br d, J = 11,7 Hz), 2,77 (t, J = 6,0 Hz), 2,10 (t, J
= 11,7 Hz), 1,80 (m, 1H), 1,78-1,70 (m, 2H), 1,48-1,39 (m, 2H).
-
b) 2-(1-(2-(4-Fluorphenoxy)-ethyl)-piperidin-4-yl-methyl)-5-bromisoindolin-1-on-hydrochlorid
-
Unter
Verwendung der in Beispiel 177a erhaltenen Verbindung wurde die
Titelverbindung durch ähnliche
Verfahren wie in Beispiel 1f erhalten (Ausbeute: 86%).
Schmelzpunkt:
222–225°C
-
Beispiel 178: 5-Chlor-2-(1-(2-(4-fluorphenoxy)-ethyl)-piperidin-4-yl-methyl)-isoindolin-1-on-fumarat
(Verbindung 213 in Tabelle 1)
-
a) 5-Chlor-2-(1-(2-(4-fluorphenoxy)-ethyl)-piperidin-4-yl-methyl)-isoindolin-1-on
-
Unter
Verwendung der in Beispiel 8e erhaltenen Verbindung (250 mg, 0.83
mmol) sowie der in Beispiel 32a erhaltenen Verbindung (182 mg, 0.83
mmol) wurde die Titelverbindung als Rohprodukt durch ähnliche
Verfahren wie in Beispiel 26b als blassbrauner Feststoff erhalten
(321 mg). Das resultierende Rohprodukt wurde ohne Aufreinigung in
die nächste
Reaktion eingesetzt.
-
b) 5-Chlor-2-(1-(2-(4-fluorphenoxy)-ethyl)-piperidin-4-yl-methyl)-isoindolin-1-on-fumarat
-
Unter
Verwendung der in Beispiel 178a erhaltenen Verbindung (321 mg) wurde
die Titelverbindung mittels Durchführung ähnlicher Reaktionen wie in
Beispiel 36c als farbloser Feststoff erhalten (320 mg, Ausbeute:
74%, 2 Stufen).
Schmelzpunkt: 172–176°C
1H-NMR
(DMSO-d6): δ 7,68 (t, J = 7,6 Hz, 2H), 7,55
(d, J = 2,7 Hz, 1H), 7,11 (t, J = 8,8 Hz, 2H), 6,93-6,79 (m, 2H),
6,59 (s, 2H), 4,49 (s, 2H), 4,08 (t, J = 5,6 Hz, 2H), 3,40 (d, J
= 7,2 Hz, 2H), 3,01 (br d, J = 11,5 Hz, 2H), 2,80 (t, J = 5,6 Hz,
2H), 2,21-2,14 (m, 2H), 1,76-1,72 (m, 1H), 1,60 (br d, J = 12,1
Hz, 2H), 1,26 (br dd, J = 21,4 Hz, 11,3 Hz, 2H).
-
Beispiel 179: 5-Cyano-2-(1-(2-(4-fluorphenoxy)-ethyl)-piperidin-4-yl-methyl)-isoindolin-1-on-fumarat
(Verbindung 215 in Tabelle 1)
-
a) 5-Cyano-2-(1-(2-(4-fluorphenoxy)-ethyl)-piperidin-4-yl-methyl)-isoindolin-1-on
-
Unter
Verwendung der in Beispiel 8e erhaltenen Verbindung (300 mg, 1,03
mmol) sowie der in Beispiel 10c erhaltenen Verbindung (226 mg, 1,03
mmol) wurde die Titelverbindung als Rohprodukt mittels Durchführung einer ähnlichen
Reaktion wie in Beispiel 26b als blassbrauner Feststoff erhalten
(314 mg). Das resultierende Rohprodukt wurde ohne Aufreinigung in
die nächste
Reaktion eingesetzt.
-
b) 5-Cyano-2-(1-(2-(4-fluorphenoxy)-ethyl)-piperidin-4-yl-methyl)-isoindolin-1-on-fumarat
-
Unter
Verwendung der in Beispiel 179a erhaltenen Verbindung (314 mg) wurde
die Titelverbindung mittels Durchführung ähnlicher Reaktionen wie in
Beispiel 36c als farbloser Feststoff erhalten (331 mg, Ausbeute:
63%, 2 Stufen).
Schmelzpunkt: 194–198°C
1H-NMR
(DMSO-d6). δ 8,13 (s, 1H), 7,95 (d, J =
7,9 Hz, 1H), 7,84 (d, J = 7,7 Hz, 1H), 7,14-7,07 (t, J = 5,6 Hz, 2H),
6,99 (m, 2H), 6,59 (s, 2H), 4,57 (s, 2H), 4,11 (t, J = 5,6 Hz, 2H),
3,44 (d, J = 7,2 Hz, 2H), 3,06 (br d, J = 11,6 Hz, 2H), 2,87 (t,
J = 5,5 Hz, 2H), 2,27 (br t, J = 11,0 Hz, 2H), 1,83-1,77 (m, 1H),
1,63 (br d, J = 11,7 Hz, 2H), 1,36-1,23 (m, 2H).
-
Beispiel 180: 5-Fluor-2-((1-(2-(4-Fluorphenoxy)-ethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-fumarat
-
Unter
Verwendung der in Beispiel 154c erhaltenen Verbindung wurde die
Titelverbindung durch ähnliche
Verfahren wie in den Beispielen 26b und 36c erhalten (Ausbeute:
88%).
Schmelzpunkt: 174–176°C
1H-NMR (DMSO-d6): δ 1,25 (m,
2H), 1,60 (m, 2H), 1,76 (m, 1H), 2,17 (m, 2H), 2,79 (t, J = 5,6
Hz, 2H), 3,50 (m, 2H), 3,39 (d, J = 7,2 Hz, 2H), 4,07 (t, J = 5,6
Hz, 2H), 4,47 (s, 2H), 6,60 (s, 2H), 6,95 (m, 2H), 7,10 (t, J =
8,9 Hz, 2H), 7,31 (m, 1H), 7,46 (dd, J = 1,9 Hz, 8,7 Hz, 1H), 7,70
(dd, J = 5,2 Hz, 8,3 Hz, 1H).
-
Beispiel 181: 4-Fluor-2-(1-(2-(4-fluorphenoxy)-ethyl)-piperidin-4-yl-methyl)-isoindolin-1-on-fumarat
(Verbindung 212 in Tabelle 1)
-
a) 4-Fluor-2-(1-(2-(4-fluorphenoxy)-ethyl)-piperidin-4-yl-methyl)-isoindolin-1-on
-
Unter
Verwendung der in Beispiel 6d erhaltenen Verbindung (300 mg, 1,05
mmol) sowie der in Beispiel 32a erhaltenen Verbindung (230 mg, 1,05
mmol) wurde die Titelverbindung als Rohprodukt mittels Durchführung einer ähnlichen
Reaktion wie in Beispiel 26b als blassbrauner Feststoff erhalten
(356 mg). Das resultierende Rohprodukt wurde ohne Aufreinigung in
die nächste
Reaktion eingesetzt.
-
b) 4-Fluor-2-(1-(2-(4-fluorphenoxy)-ethyl)-piperidin-4-yl-methyl)-isoindolin-1-on-fumarat
-
Unter
Verwendung der in Beispiel 181a erhaltenen Verbindung (356 mg) wurde
die Titelverbindung mittels Durchführung von ähnlichen Reaktionen wie in
Beispiel 36c als farbloser Feststoff erhalten (412 mg, Ausbeute:
89%, 2 Stufen).
Schmelzpunkt: 196–198°C
1H-NMR
(DMSO-d6): δ 7,56-7,53 (m, 2H), 7,46 (m,
1H), 7,13-7,07 (m, 2H), 6,97-6,92
(m, 2H), 6,60 (s, 2H), 4,57 (s, 2H), 4,07 (t, J = 5,7 Hz, 2H), 3,41
(d, J = 7,4 Hz, 2H), 2,99 (br d, J = 11,7 Hz, 2H), 2,78 (t, J =
5,7 Hz, 2H), 2,16 (br t, J = 10,9 Hz, 2H), 1,80-1,75 (m, 1H), 1,61
(br d, J = 11,6 Hz, 2H), 1,32-1,23 (m, 2H).
-
Beispiel 182: 2-((1-(2-(4-Fluorphenyl)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-hydrochlorid-dihydrat
-
2-((1-(2-(4-Fluorphenyl)-2-oxoethyl)-piperidin-4-yl)-methyl)-isoindolin-1-on-hydrochlorid
(die Verbindung aus Beispiel 1, 39,4 mmol) wurde Wasser (30 ml)
und Aceton (210 ml) zugefügt
und die Mischung zur Auflösung
auf 60°C
erhitzt. Der Mischung wurde tropfenweise Ethylacetat (100 ml) zugegeben
und zum Abkühlen
auf Raumtemperatur stehen gelassen. Die ausgefällten Kristalle wurden durch
Filtration abgetrennt und die resultierenden Kristalle wurden mit
Ethylacetat gewaschen und unter vermindertem Druck getrocknet, um die
Titelverbin dung zu erhalten (Ausbeute: 79%).
Analyse (berechnet):
C: 60,20; H: 6,43; N: 6,38; Cl: 8,08; (gefunden): C: 60,02; H: 6,24;
N: 5,97; Cl: 7,74.
Analyse des Wassergehalts (nach Karl Fischer)
(berechnet): 8,2%, (gefunden): 8,3%.
-
Testbeispiel: Test zur Bindungshemmung
der Sigma-Bindestelle
-
Ein
Sigma-2-selektiver Inhibitionstest zur Rezeptorbindung wurde durchgeführt unter
Verwendung von [
3H]-di-o-Tolylguanidin (DTG,
Endkonzentration: 1 nM, 37 Ci/mmol, New England Nuclear, Dupont
de Nemours) als radioaktiven Liganden. Eine P2-Membran-Rohfraktion
wurde aus den Lebern männlicher
Ratten zubereitet (Sprague-Dawley-Ratten), nach einem in der Literatur
beschriebenen Verfahren (X. He et al., J. Med. Chem., 36, S. 566–571, 1993).
In Gegenwart von 500 nM Pentazocin und einer Kontrollverbindung
bei verschiedenen Konzentrationen (Haloperidol, 10
–10 bis
10
–6 M)
oder eines Testliganden bei verschiedenen Konzentrationen (10
–10 bis
10
–5 M),
zusammen mit einem radioaktiven Liganden, wurde die P2-Fraktion
(0,4 ml) in 50 mM Tris-HCl (pH 7,4, Endvolumen: 0,5 ml) bei 25°C für 2 Stunden
inkubiert. Die Reaktionsmischung wurde auf einem Brandell-Zellernter
unter Verwendung von Whatman-GF/B-Filterpapier, welches zuvor in
0,5% Polyethylenimin 1 Stunde lang getränkt wurde, schnell filtriert,
um die Reaktion zu stoppen. Das Filterpapier wurde viermal mit dem
eisgekühltem
Inkubationspuffer gewaschen. Die unspezifischen Resultate wurden
evaluiert unter Verwendung von 1 μM
Haloperidol, und die Szintillationsanalyse und die Kurvenanalyse
wurden wie oben beschrieben durchgeführt. Der Kd-Wert für [
3H]-DTG betrug 6,9 nM. Die Ergebnisse sind
unten in den Tabellen 3 und 4 angegeben. Tabelle 3
| Testverbindung | Sigma-2
Ki (nM) |
| Beispiel
1 | 13 |
| Beispiel
2 | 2,8 |
| Beispiel
3 | 7 |
| Beispiel
4 | 7,6 |
| Beispiel
6 | 8,7 |
| Beispiel
7 | 16 |
| Beispiel
8 | 3,1 |
| Beispiel
9 | 4,9 |
| Beispiel
13 | 6,6 |
| Beispiel
17 | 24 |
| Beispiel
22 | 22 |
| Beispiel
24 | 13 |
| Beispiel
30 | 22 |
| Beispiel
31 | 22 |
| Beispiel
32 | 2,8 |
| Beispiel
50 | 14 |
| Beispiel
84 | 3,4 |
| Beispiel
137 | 7,8 |
| Beispiel
154 | 16 |
Tabelle 4
| Testverbindung | Inhibitionsrate
gegen Sigma-2 (%, 10 nM) |
| Beispiel
48 | 59 |
| Beispiel
50 | 52 |
| Beispiel
51 | 74 |
| Beispiel
72 | 55 |
| Beispiel
76 | 84 |
| Beispiel
77 | 80 |
| Beispiel
78 | 86 |
| Beispiel
84 | 58 |
| Beispiel
85 | 59 |
| Beispiel
94 | 83 |
| Beispiel
95 | 69 |
| Beispiel
109 | 68 |
| Beispiel
110 | 68 |
| Beispiel
111 | 51 |
| Beispiel
112 | 60 |
| Beispiel
113 | 64 |
| Beispiel
114 | 51 |
| Beispiel
117 | 52 |
| Beispiel
118 | 50 |
| Beispiel
158 | 57 |
| Beispiel
177 | 55 |
| Beispiel
178 | 50 |
| Beispiel
181 | 70 |
-
Rezepturbeispiele
-
Die
pharmazeutischen Zusammensetzungen der vorliegenden Erfindung können hergestellt
werden durch Anwendung von Verfahren und Verwendung pharmazeutischer
Additive, welche in diesem Fachgebiet in herkömmlicher Weise verwendet werden.
Typische Rezepturbeispiele sind unten angegeben. Jedoch sind die
pharmazeutischen Zusammensetzungen der vorliegenden Erfindung nicht
auf diese Beispiele beschränkt. 1)
Tablette
| Verbindung
aus Beispiel 2 | 0,1
bis 50 mg |
| Calciumphosphat | 20
mg |
| Lactose | 30
mg |
| Talkum | 10
mg |
| Magnesiumstearat | 5
mg |
| Kartoffelstärke | ad
200 mg |
-
2) Suspension
-
Wasser
wird zur Verbindung aus Beispiel 2 (1 bis 5 mg) gegeben, Carboxymethylcellulose-Natrium
(50 mg), Natriumbenzoat (1 mg) und Sorbit (500 mg), um eine wässrige Suspension
zur oralen Verabreichung mit einem Gesamtvolumen von 1 ml herzustellen.
-
3) Injektion
-
Die
Verbindung aus Beispiel 2 wird in einer Menge von 1,5%, bezogen
auf Gewicht, als Wirkstoff mit einer Mischung aus Propylenglykol
(10%, bezogen auf Volumen) und destilliertem Wasser für Injektionen durch
Rühren
vermischt, und die resultierende Lösung wird mittels Filtration
durch einen Membranfilter sterilisiert, um eine Zusammensetzung
zur Injektion herzustellen. 4)
Salbe
| Verbindung
aus Beispiel 2 | 1
bis 1.000 mg |
| Stearylalkohol | 3
g |
| Lanolin | 5g |
| Weiße Vaseline | 15
g |
| Wasser | ad
100 g |
-
Industrielle Anwendbarkeit
-
Die
Verbindungen der vorliegenden Erfindung weisen eine hohe Affinität zur Sigma-Bindestelle
auf. Zusätzlich
besitzen die Verbindungen der vorliegenden Erfindung ausgezeichnete
pharmakokinetische Profile, wie beispielsweise eine hohe Fähigkeit
zur oralen Absorption und eine geringe Verstoffwechselungsrate,
und des Weiteren sind sie in hohem Maße sicher und zeigen hohe Wirksamkeit
in pharmakologischen Studien unter Verwendung von Tiermodellen.
Daher sind die Verbindungen der vorliegenden Erfindung anwendbar
als Sigma-Liganden für
die therapeutische oder präventive
Behandlung von verschiedenen Erkrankungen und Symptomen, bei denen
der Sigma-Ligand involviert ist.