DE60128912T2 - Pyridoxin- und pyridoxalanaloga als cardiovasculäre therapeutika - Google Patents
Pyridoxin- und pyridoxalanaloga als cardiovasculäre therapeutika Download PDFInfo
- Publication number
- DE60128912T2 DE60128912T2 DE60128912T DE60128912T DE60128912T2 DE 60128912 T2 DE60128912 T2 DE 60128912T2 DE 60128912 T DE60128912 T DE 60128912T DE 60128912 T DE60128912 T DE 60128912T DE 60128912 T2 DE60128912 T2 DE 60128912T2
- Authority
- DE
- Germany
- Prior art keywords
- compound
- cardiovascular
- use according
- straight
- saturated
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Lifetime
Links
- 230000002526 effect on cardiovascular system Effects 0.000 title claims abstract description 42
- 239000003814 drug Substances 0.000 title claims description 30
- LXNHXLLTXMVWPM-UHFFFAOYSA-N pyridoxine Chemical compound CC1=NC=C(CO)C(CO)=C1O LXNHXLLTXMVWPM-UHFFFAOYSA-N 0.000 title abstract description 50
- 229940011671 vitamin b6 Drugs 0.000 title abstract description 25
- RADKZDMFGJYCBB-UHFFFAOYSA-N Pyridoxal Chemical class CC1=NC=C(CO)C(C=O)=C1O RADKZDMFGJYCBB-UHFFFAOYSA-N 0.000 title abstract description 24
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 claims abstract description 39
- 238000000034 method Methods 0.000 claims abstract description 34
- 201000010099 disease Diseases 0.000 claims abstract description 33
- 239000008194 pharmaceutical composition Substances 0.000 claims abstract description 17
- 150000001875 compounds Chemical class 0.000 claims description 121
- 239000000203 mixture Substances 0.000 claims description 58
- -1 amino, hydroxyl Chemical group 0.000 claims description 45
- 150000003839 salts Chemical class 0.000 claims description 31
- 239000002253 acid Substances 0.000 claims description 26
- RAXXELZNTBOGNW-UHFFFAOYSA-N imidazole Natural products C1=CNC=N1 RAXXELZNTBOGNW-UHFFFAOYSA-N 0.000 claims description 20
- 230000001225 therapeutic effect Effects 0.000 claims description 20
- 125000000217 alkyl group Chemical group 0.000 claims description 19
- 229920006395 saturated elastomer Polymers 0.000 claims description 19
- 239000005557 antagonist Substances 0.000 claims description 18
- 229940127291 Calcium channel antagonist Drugs 0.000 claims description 15
- 206010019280 Heart failures Diseases 0.000 claims description 15
- 239000000480 calcium channel blocker Substances 0.000 claims description 15
- ZRALSGWEFCBTJO-UHFFFAOYSA-N Guanidine Chemical compound NC(N)=N ZRALSGWEFCBTJO-UHFFFAOYSA-N 0.000 claims description 14
- 239000003112 inhibitor Substances 0.000 claims description 14
- UUUHXMGGBIUAPW-UHFFFAOYSA-N 1-[1-[2-[[5-amino-2-[[1-[5-(diaminomethylideneamino)-2-[[1-[3-(1h-indol-3-yl)-2-[(5-oxopyrrolidine-2-carbonyl)amino]propanoyl]pyrrolidine-2-carbonyl]amino]pentanoyl]pyrrolidine-2-carbonyl]amino]-5-oxopentanoyl]amino]-3-methylpentanoyl]pyrrolidine-2-carbon Chemical compound C1CCC(C(=O)N2C(CCC2)C(O)=O)N1C(=O)C(C(C)CC)NC(=O)C(CCC(N)=O)NC(=O)C1CCCN1C(=O)C(CCCN=C(N)N)NC(=O)C1CCCN1C(=O)C(CC=1C2=CC=CC=C2NC=1)NC(=O)C1CCC(=O)N1 UUUHXMGGBIUAPW-UHFFFAOYSA-N 0.000 claims description 13
- 102000004270 Peptidyl-Dipeptidase A Human genes 0.000 claims description 13
- 108090000882 Peptidyl-Dipeptidase A Proteins 0.000 claims description 13
- 239000002333 angiotensin II receptor antagonist Substances 0.000 claims description 13
- 238000002360 preparation method Methods 0.000 claims description 13
- 239000001257 hydrogen Substances 0.000 claims description 12
- 229910052739 hydrogen Inorganic materials 0.000 claims description 12
- 125000000449 nitro group Chemical group [O-][N+](*)=O 0.000 claims description 12
- 125000004423 acyloxy group Chemical group 0.000 claims description 11
- 125000003118 aryl group Chemical group 0.000 claims description 11
- 239000002934 diuretic Substances 0.000 claims description 11
- 239000002243 precursor Substances 0.000 claims description 11
- 230000008569 process Effects 0.000 claims description 11
- 206010063837 Reperfusion injury Diseases 0.000 claims description 10
- 150000001412 amines Chemical class 0.000 claims description 10
- 229940126317 angiotensin II receptor antagonist Drugs 0.000 claims description 10
- 102000012740 beta Adrenergic Receptors Human genes 0.000 claims description 10
- 108010079452 beta Adrenergic Receptors Proteins 0.000 claims description 10
- 230000001882 diuretic effect Effects 0.000 claims description 10
- 208000031225 myocardial ischemia Diseases 0.000 claims description 10
- 150000003852 triazoles Chemical class 0.000 claims description 10
- 102000004305 alpha Adrenergic Receptors Human genes 0.000 claims description 9
- 108090000861 alpha Adrenergic Receptors Proteins 0.000 claims description 9
- 125000004093 cyano group Chemical group *C#N 0.000 claims description 9
- 208000010125 myocardial infarction Diseases 0.000 claims description 9
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 claims description 9
- 206010020772 Hypertension Diseases 0.000 claims description 8
- CHJJGSNFBQVOTG-UHFFFAOYSA-N N-methyl-guanidine Natural products CNC(N)=N CHJJGSNFBQVOTG-UHFFFAOYSA-N 0.000 claims description 8
- 239000003146 anticoagulant agent Substances 0.000 claims description 8
- 229960004676 antithrombotic agent Drugs 0.000 claims description 8
- 230000006793 arrhythmia Effects 0.000 claims description 8
- SWSQBOPZIKWTGO-UHFFFAOYSA-N dimethylaminoamidine Natural products CN(C)C(N)=N SWSQBOPZIKWTGO-UHFFFAOYSA-N 0.000 claims description 8
- 239000002552 dosage form Substances 0.000 claims description 8
- 150000002431 hydrogen Chemical class 0.000 claims description 8
- 241000124008 Mammalia Species 0.000 claims description 7
- 206010003119 arrhythmia Diseases 0.000 claims description 7
- 125000000654 isopropylidene group Chemical group C(C)(C)=* 0.000 claims description 7
- PAYRUJLWNCNPSJ-UHFFFAOYSA-N N-phenyl amine Natural products NC1=CC=CC=C1 PAYRUJLWNCNPSJ-UHFFFAOYSA-N 0.000 claims description 6
- 125000002490 anilino group Chemical group [H]N(*)C1=C([H])C([H])=C([H])C([H])=C1[H] 0.000 claims description 6
- 208000035475 disorder Diseases 0.000 claims description 6
- 229940124549 vasodilator Drugs 0.000 claims description 6
- 239000003071 vasodilator agent Substances 0.000 claims description 6
- 208000015294 blood coagulation disease Diseases 0.000 claims description 5
- 230000037396 body weight Effects 0.000 claims description 5
- 229940079593 drug Drugs 0.000 claims description 5
- 150000002357 guanidines Chemical class 0.000 claims description 5
- 208000010110 spontaneous platelet aggregation Diseases 0.000 claims description 5
- 150000003536 tetrazoles Chemical class 0.000 claims description 5
- 206010053567 Coagulopathies Diseases 0.000 claims description 4
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 claims description 4
- 230000015271 coagulation Effects 0.000 claims description 4
- 238000005345 coagulation Methods 0.000 claims description 4
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 claims description 4
- 201000006474 Brain Ischemia Diseases 0.000 claims description 3
- 206010007572 Cardiac hypertrophy Diseases 0.000 claims description 3
- 208000006029 Cardiomegaly Diseases 0.000 claims description 3
- 206010008120 Cerebral ischaemia Diseases 0.000 claims description 3
- 206010051055 Deep vein thrombosis Diseases 0.000 claims description 3
- 208000010378 Pulmonary Embolism Diseases 0.000 claims description 3
- 206010047249 Venous thrombosis Diseases 0.000 claims description 3
- IVRMZWNICZWHMI-UHFFFAOYSA-N azide group Chemical group [N-]=[N+]=[N-] IVRMZWNICZWHMI-UHFFFAOYSA-N 0.000 claims description 3
- 206010008118 cerebral infarction Diseases 0.000 claims description 3
- 239000003937 drug carrier Substances 0.000 claims description 3
- 125000002883 imidazolyl group Chemical group 0.000 claims description 3
- 239000012948 isocyanate Substances 0.000 claims description 3
- NONOKGVFTBWRLD-UHFFFAOYSA-N isocyanatosulfanylimino(oxo)methane Chemical compound O=C=NSN=C=O NONOKGVFTBWRLD-UHFFFAOYSA-N 0.000 claims description 3
- 230000003331 prothrombotic effect Effects 0.000 claims description 3
- 230000001732 thrombotic effect Effects 0.000 claims description 3
- 206010008111 Cerebral haemorrhage Diseases 0.000 claims description 2
- 208000016988 Hemorrhagic Stroke Diseases 0.000 claims description 2
- 208000032382 Ischaemic stroke Diseases 0.000 claims description 2
- 125000001931 aliphatic group Chemical group 0.000 claims description 2
- 229910052736 halogen Inorganic materials 0.000 claims 4
- 150000002367 halogens Chemical class 0.000 claims 4
- 230000003301 hydrolyzing effect Effects 0.000 claims 4
- 125000001424 substituent group Chemical group 0.000 claims 3
- 239000005541 ACE inhibitor Substances 0.000 claims 2
- 101710129690 Angiotensin-converting enzyme inhibitor Proteins 0.000 claims 2
- 101710086378 Bradykinin-potentiating and C-type natriuretic peptides Proteins 0.000 claims 2
- 239000000674 adrenergic antagonist Substances 0.000 claims 2
- 229940044094 angiotensin-converting-enzyme inhibitor Drugs 0.000 claims 2
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 claims 1
- 108090000312 Calcium Channels Proteins 0.000 claims 1
- 102000003922 Calcium Channels Human genes 0.000 claims 1
- 229910052791 calcium Inorganic materials 0.000 claims 1
- 239000011575 calcium Substances 0.000 claims 1
- 125000002795 guanidino group Chemical group C(N)(=N)N* 0.000 claims 1
- 208000020658 intracerebral hemorrhage Diseases 0.000 claims 1
- 208000012947 ischemia reperfusion injury Diseases 0.000 claims 1
- HZVOZRGWRWCICA-UHFFFAOYSA-N methanediyl Chemical compound [CH2] HZVOZRGWRWCICA-UHFFFAOYSA-N 0.000 claims 1
- 238000007911 parenteral administration Methods 0.000 claims 1
- HKOOXMFOFWEVGF-UHFFFAOYSA-N phenylhydrazine Chemical group NNC1=CC=CC=C1 HKOOXMFOFWEVGF-UHFFFAOYSA-N 0.000 claims 1
- 239000011677 pyridoxine Substances 0.000 abstract description 24
- 235000008160 pyridoxine Nutrition 0.000 abstract description 24
- 150000003227 pyridoxines Chemical class 0.000 abstract description 16
- 208000024891 symptom Diseases 0.000 abstract description 16
- 150000003223 pyridoxals Chemical class 0.000 abstract description 15
- 229960003581 pyridoxal Drugs 0.000 abstract description 12
- 235000008164 pyridoxal Nutrition 0.000 abstract description 11
- 239000011674 pyridoxal Substances 0.000 abstract description 11
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 60
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 50
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 41
- 239000000741 silica gel Substances 0.000 description 39
- 229910002027 silica gel Inorganic materials 0.000 description 39
- 238000004587 chromatography analysis Methods 0.000 description 37
- 238000000746 purification Methods 0.000 description 28
- 230000015572 biosynthetic process Effects 0.000 description 25
- 239000011541 reaction mixture Substances 0.000 description 22
- 238000003786 synthesis reaction Methods 0.000 description 22
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 21
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 21
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 20
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 20
- BWHMMNNQKKPAPP-UHFFFAOYSA-L potassium carbonate Chemical compound [K+].[K+].[O-]C([O-])=O BWHMMNNQKKPAPP-UHFFFAOYSA-L 0.000 description 20
- 239000000243 solution Substances 0.000 description 20
- 239000012043 crude product Substances 0.000 description 18
- 239000000047 product Substances 0.000 description 17
- 239000007787 solid Substances 0.000 description 17
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 16
- CPELXLSAUQHCOX-UHFFFAOYSA-M Bromide Chemical compound [Br-] CPELXLSAUQHCOX-UHFFFAOYSA-M 0.000 description 15
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 15
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 14
- 238000010626 work up procedure Methods 0.000 description 14
- NGVDGCNFYWLIFO-UHFFFAOYSA-N pyridoxal 5'-phosphate Chemical compound CC1=NC=C(COP(O)(O)=O)C(C=O)=C1O NGVDGCNFYWLIFO-UHFFFAOYSA-N 0.000 description 13
- 239000002904 solvent Substances 0.000 description 13
- OKKJLVBELUTLKV-VMNATFBRSA-N methanol-d1 Chemical compound [2H]OC OKKJLVBELUTLKV-VMNATFBRSA-N 0.000 description 12
- 235000007682 pyridoxal 5'-phosphate Nutrition 0.000 description 12
- 239000011589 pyridoxal 5'-phosphate Substances 0.000 description 12
- 238000006243 chemical reaction Methods 0.000 description 11
- HEDRZPFGACZZDS-MICDWDOJSA-N Trichloro(2H)methane Chemical compound [2H]C(Cl)(Cl)Cl HEDRZPFGACZZDS-MICDWDOJSA-N 0.000 description 10
- 229910000027 potassium carbonate Inorganic materials 0.000 description 10
- 208000028867 ischemia Diseases 0.000 description 9
- RBCOYOYDYNXAFA-UHFFFAOYSA-L (5-hydroxy-4,6-dimethylpyridin-3-yl)methyl phosphate Chemical compound CC1=NC=C(COP([O-])([O-])=O)C(C)=C1O RBCOYOYDYNXAFA-UHFFFAOYSA-L 0.000 description 8
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 8
- 150000001299 aldehydes Chemical class 0.000 description 8
- 125000003545 alkoxy group Chemical group 0.000 description 8
- 239000003480 eluent Substances 0.000 description 8
- 239000011780 sodium chloride Substances 0.000 description 8
- 0 *CC1=NCCN1 Chemical compound *CC1=NCCN1 0.000 description 7
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 6
- 206010020880 Hypertrophy Diseases 0.000 description 6
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 6
- 150000001540 azides Chemical class 0.000 description 6
- 238000001704 evaporation Methods 0.000 description 6
- 230000008020 evaporation Effects 0.000 description 6
- 210000004165 myocardium Anatomy 0.000 description 6
- 210000000056 organ Anatomy 0.000 description 6
- 229940124597 therapeutic agent Drugs 0.000 description 6
- 150000005347 biaryls Chemical group 0.000 description 5
- 210000004369 blood Anatomy 0.000 description 5
- 239000008280 blood Substances 0.000 description 5
- 239000003054 catalyst Substances 0.000 description 5
- 210000002216 heart Anatomy 0.000 description 5
- DSVGFKBFFICWLZ-UHFFFAOYSA-N 1-fluoro-4-isocyanatobenzene Chemical compound FC1=CC=C(N=C=O)C=C1 DSVGFKBFFICWLZ-UHFFFAOYSA-N 0.000 description 4
- DEPDDPLQZYCHOH-UHFFFAOYSA-N 1h-imidazol-2-amine Chemical compound NC1=NC=CN1 DEPDDPLQZYCHOH-UHFFFAOYSA-N 0.000 description 4
- 102000008186 Collagen Human genes 0.000 description 4
- 108010035532 Collagen Proteins 0.000 description 4
- DTQVDTLACAAQTR-UHFFFAOYSA-N Trifluoroacetic acid Chemical compound OC(=O)C(F)(F)F DTQVDTLACAAQTR-UHFFFAOYSA-N 0.000 description 4
- 230000002776 aggregation Effects 0.000 description 4
- 238000004220 aggregation Methods 0.000 description 4
- 229920001436 collagen Polymers 0.000 description 4
- 239000012458 free base Substances 0.000 description 4
- 125000001475 halogen functional group Chemical group 0.000 description 4
- 230000000302 ischemic effect Effects 0.000 description 4
- NUJOXMJBOLGQSY-UHFFFAOYSA-N manganese dioxide Chemical compound O=[Mn]=O NUJOXMJBOLGQSY-UHFFFAOYSA-N 0.000 description 4
- 239000000546 pharmaceutical excipient Substances 0.000 description 4
- 210000004623 platelet-rich plasma Anatomy 0.000 description 4
- NHZMQXZHNVQTQA-UHFFFAOYSA-N pyridoxamine Chemical compound CC1=NC=C(CO)C(CN)=C1O NHZMQXZHNVQTQA-UHFFFAOYSA-N 0.000 description 4
- 230000010410 reperfusion Effects 0.000 description 4
- FHZSIZRTNHGLSX-FLMSMKGQSA-N (2s)-1-[(2s)-4-amino-2-[[(2s)-2-[[(2s)-2-[[(2s)-2-[[(2s)-2-[[(2s)-2-amino-3-hydroxypropanoyl]amino]-3-phenylpropanoyl]amino]-4-methylpentanoyl]amino]-4-methylpentanoyl]amino]-5-(diaminomethylideneamino)pentanoyl]amino]-4-oxobutanoyl]pyrrolidine-2-carboxyl Chemical compound C([C@@H](C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCN=C(N)N)C(=O)N[C@@H](CC(N)=O)C(=O)N1[C@@H](CCC1)C(O)=O)NC(=O)[C@@H](N)CO)C1=CC=CC=C1 FHZSIZRTNHGLSX-FLMSMKGQSA-N 0.000 description 3
- YBAZINRZQSAIAY-UHFFFAOYSA-N 4-aminobenzonitrile Chemical compound NC1=CC=C(C#N)C=C1 YBAZINRZQSAIAY-UHFFFAOYSA-N 0.000 description 3
- PNFZSRRRZNXSMF-UHFFFAOYSA-N 5'-phosphopyridoxal-6-azobenzene-2,4-disulfonic acid Chemical compound O=CC1=C(O)C(C)=NC(N=NC=2C(=CC(=CC=2)S(O)(=O)=O)S(O)(=O)=O)=C1COP(O)(O)=O PNFZSRRRZNXSMF-UHFFFAOYSA-N 0.000 description 3
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 3
- UHOVQNZJYSORNB-UHFFFAOYSA-N Benzene Chemical compound C1=CC=CC=C1 UHOVQNZJYSORNB-UHFFFAOYSA-N 0.000 description 3
- WVDDGKGOMKODPV-UHFFFAOYSA-N Benzyl alcohol Chemical compound OCC1=CC=CC=C1 WVDDGKGOMKODPV-UHFFFAOYSA-N 0.000 description 3
- 208000024172 Cardiovascular disease Diseases 0.000 description 3
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 3
- 239000002262 Schiff base Substances 0.000 description 3
- 150000004753 Schiff bases Chemical class 0.000 description 3
- 102000003790 Thrombin receptors Human genes 0.000 description 3
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 3
- 150000007513 acids Chemical class 0.000 description 3
- 239000000654 additive Substances 0.000 description 3
- 239000003963 antioxidant agent Substances 0.000 description 3
- 235000006708 antioxidants Nutrition 0.000 description 3
- 239000012267 brine Substances 0.000 description 3
- 239000002775 capsule Substances 0.000 description 3
- 239000003085 diluting agent Substances 0.000 description 3
- 230000000694 effects Effects 0.000 description 3
- 239000003623 enhancer Substances 0.000 description 3
- 235000019439 ethyl acetate Nutrition 0.000 description 3
- 238000001914 filtration Methods 0.000 description 3
- 239000007789 gas Substances 0.000 description 3
- 125000005843 halogen group Chemical group 0.000 description 3
- IXCSERBJSXMMFS-UHFFFAOYSA-N hydrogen chloride Substances Cl.Cl IXCSERBJSXMMFS-UHFFFAOYSA-N 0.000 description 3
- 229910000041 hydrogen chloride Inorganic materials 0.000 description 3
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 3
- 150000002462 imidazolines Chemical class 0.000 description 3
- 238000011534 incubation Methods 0.000 description 3
- 230000007774 longterm Effects 0.000 description 3
- 238000004519 manufacturing process Methods 0.000 description 3
- 230000004060 metabolic process Effects 0.000 description 3
- 238000002156 mixing Methods 0.000 description 3
- 231100000252 nontoxic Toxicity 0.000 description 3
- 230000003000 nontoxic effect Effects 0.000 description 3
- 239000012044 organic layer Substances 0.000 description 3
- 230000003647 oxidation Effects 0.000 description 3
- 238000007254 oxidation reaction Methods 0.000 description 3
- 230000035699 permeability Effects 0.000 description 3
- HPALAKNZSZLMCH-UHFFFAOYSA-M sodium;chloride;hydrate Chemical compound O.[Na+].[Cl-] HPALAKNZSZLMCH-UHFFFAOYSA-M 0.000 description 3
- 239000011550 stock solution Substances 0.000 description 3
- 108010093640 thrombin receptor peptide SFLLRNP Proteins 0.000 description 3
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 description 3
- LYRSYURVUAAPCC-UHFFFAOYSA-N 1-fluoro-4-isocyanatosulfanylbenzene Chemical compound FC1=CC=C(SN=C=O)C=C1 LYRSYURVUAAPCC-UHFFFAOYSA-N 0.000 description 2
- KJUGUADJHNHALS-UHFFFAOYSA-N 1H-tetrazole Chemical compound C=1N=NNN=1 KJUGUADJHNHALS-UHFFFAOYSA-N 0.000 description 2
- LXBGSDVWAMZHDD-UHFFFAOYSA-N 2-methyl-1h-imidazole Chemical compound CC1=NC=CN1 LXBGSDVWAMZHDD-UHFFFAOYSA-N 0.000 description 2
- MXBCQCILOZMQJW-UHFFFAOYSA-N 4,5-bis(hydroxymethyl)-2-methylpyridin-3-ol;triazol-1-amine Chemical compound NN1C=CN=N1.CC1=NC=C(CO)C(CO)=C1O MXBCQCILOZMQJW-UHFFFAOYSA-N 0.000 description 2
- XLSZMDLNRCVEIJ-UHFFFAOYSA-N 4-methylimidazole Chemical compound CC1=CNC=N1 XLSZMDLNRCVEIJ-UHFFFAOYSA-N 0.000 description 2
- 206010001052 Acute respiratory distress syndrome Diseases 0.000 description 2
- KLSJWNVTNUYHDU-UHFFFAOYSA-N Amitrole Chemical compound NC1=NC=NN1 KLSJWNVTNUYHDU-UHFFFAOYSA-N 0.000 description 2
- CIWBSHSKHKDKBQ-JLAZNSOCSA-N Ascorbic acid Chemical compound OC[C@H](O)[C@H]1OC(=O)C(O)=C1O CIWBSHSKHKDKBQ-JLAZNSOCSA-N 0.000 description 2
- 201000001320 Atherosclerosis Diseases 0.000 description 2
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 2
- 229910004373 HOAc Inorganic materials 0.000 description 2
- RPTUSVTUFVMDQK-UHFFFAOYSA-N Hidralazin Chemical compound C1=CC=C2C(NN)=NN=CC2=C1 RPTUSVTUFVMDQK-UHFFFAOYSA-N 0.000 description 2
- 206010021143 Hypoxia Diseases 0.000 description 2
- 229920000168 Microcrystalline cellulose Polymers 0.000 description 2
- PCLIMKBDDGJMGD-UHFFFAOYSA-N N-bromosuccinimide Chemical compound BrN1C(=O)CCC1=O PCLIMKBDDGJMGD-UHFFFAOYSA-N 0.000 description 2
- 206010058156 Reperfusion arrhythmia Diseases 0.000 description 2
- 208000013616 Respiratory Distress Syndrome Diseases 0.000 description 2
- PXIPVTKHYLBLMZ-UHFFFAOYSA-N Sodium azide Chemical compound [Na+].[N-]=[N+]=[N-] PXIPVTKHYLBLMZ-UHFFFAOYSA-N 0.000 description 2
- UIIMBOGNXHQVGW-UHFFFAOYSA-M Sodium bicarbonate Chemical compound [Na+].OC([O-])=O UIIMBOGNXHQVGW-UHFFFAOYSA-M 0.000 description 2
- GOPYZMJAIPBUGX-UHFFFAOYSA-N [O-2].[O-2].[Mn+4] Chemical class [O-2].[O-2].[Mn+4] GOPYZMJAIPBUGX-UHFFFAOYSA-N 0.000 description 2
- 238000010521 absorption reaction Methods 0.000 description 2
- 230000009471 action Effects 0.000 description 2
- 125000004442 acylamino group Chemical group 0.000 description 2
- 208000011341 adult acute respiratory distress syndrome Diseases 0.000 description 2
- 201000000028 adult respiratory distress syndrome Diseases 0.000 description 2
- 239000000556 agonist Substances 0.000 description 2
- 210000001367 artery Anatomy 0.000 description 2
- 239000002585 base Substances 0.000 description 2
- 230000017531 blood circulation Effects 0.000 description 2
- 230000005587 bubbling Effects 0.000 description 2
- 125000004432 carbon atom Chemical group C* 0.000 description 2
- 239000000969 carrier Substances 0.000 description 2
- 210000004027 cell Anatomy 0.000 description 2
- 239000003153 chemical reaction reagent Substances 0.000 description 2
- 238000007796 conventional method Methods 0.000 description 2
- 125000004122 cyclic group Chemical group 0.000 description 2
- 239000002270 dispersing agent Substances 0.000 description 2
- 238000004821 distillation Methods 0.000 description 2
- 230000004116 glycogenolysis Effects 0.000 description 2
- 125000005842 heteroatom Chemical group 0.000 description 2
- XMBWDFGMSWQBCA-UHFFFAOYSA-N hydrogen iodide Chemical compound I XMBWDFGMSWQBCA-UHFFFAOYSA-N 0.000 description 2
- 238000006460 hydrolysis reaction Methods 0.000 description 2
- 230000001146 hypoxic effect Effects 0.000 description 2
- 150000002460 imidazoles Chemical class 0.000 description 2
- MTNDZQHUAFNZQY-UHFFFAOYSA-N imidazoline Chemical compound C1CN=CN1 MTNDZQHUAFNZQY-UHFFFAOYSA-N 0.000 description 2
- 230000005764 inhibitory process Effects 0.000 description 2
- 239000011981 lindlar catalyst Substances 0.000 description 2
- 239000007788 liquid Substances 0.000 description 2
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Chemical compound [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 description 2
- VZCYOOQTPOCHFL-UPHRSURJSA-N maleic acid Chemical compound OC(=O)\C=C/C(O)=O VZCYOOQTPOCHFL-UPHRSURJSA-N 0.000 description 2
- QPJVMBTYPHYUOC-UHFFFAOYSA-N methyl benzoate Chemical compound COC(=O)C1=CC=CC=C1 QPJVMBTYPHYUOC-UHFFFAOYSA-N 0.000 description 2
- 229940016286 microcrystalline cellulose Drugs 0.000 description 2
- 235000019813 microcrystalline cellulose Nutrition 0.000 description 2
- 239000008108 microcrystalline cellulose Substances 0.000 description 2
- 210000000440 neutrophil Anatomy 0.000 description 2
- 239000003921 oil Substances 0.000 description 2
- 125000004430 oxygen atom Chemical group O* 0.000 description 2
- 239000003186 pharmaceutical solution Substances 0.000 description 2
- 210000002381 plasma Anatomy 0.000 description 2
- 239000003755 preservative agent Substances 0.000 description 2
- 125000006239 protecting group Chemical group 0.000 description 2
- 235000008151 pyridoxamine Nutrition 0.000 description 2
- 239000011699 pyridoxamine Substances 0.000 description 2
- 239000011734 sodium Substances 0.000 description 2
- 239000012279 sodium borohydride Substances 0.000 description 2
- 229910000033 sodium borohydride Inorganic materials 0.000 description 2
- 238000003756 stirring Methods 0.000 description 2
- 239000000375 suspending agent Substances 0.000 description 2
- 239000000725 suspension Substances 0.000 description 2
- 239000003826 tablet Substances 0.000 description 2
- JOXIMZWYDAKGHI-UHFFFAOYSA-N toluene-4-sulfonic acid Chemical compound CC1=CC=C(S(O)(=O)=O)C=C1 JOXIMZWYDAKGHI-UHFFFAOYSA-N 0.000 description 2
- RIOQSEWOXXDEQQ-UHFFFAOYSA-N triphenylphosphine Chemical compound C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1 RIOQSEWOXXDEQQ-UHFFFAOYSA-N 0.000 description 2
- 239000003981 vehicle Substances 0.000 description 2
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 2
- BIDNLKIUORFRQP-XYGFDPSESA-N (2s,4s)-4-cyclohexyl-1-[2-[[(1s)-2-methyl-1-propanoyloxypropoxy]-(4-phenylbutyl)phosphoryl]acetyl]pyrrolidine-2-carboxylic acid Chemical compound C([P@@](=O)(O[C@H](OC(=O)CC)C(C)C)CC(=O)N1[C@@H](C[C@H](C1)C1CCCCC1)C(O)=O)CCCC1=CC=CC=C1 BIDNLKIUORFRQP-XYGFDPSESA-N 0.000 description 1
- CEBAHYWORUOILU-UHFFFAOYSA-N (4-cyanophenyl)boronic acid Chemical compound OB(O)C1=CC=C(C#N)C=C1 CEBAHYWORUOILU-UHFFFAOYSA-N 0.000 description 1
- WRIDQFICGBMAFQ-UHFFFAOYSA-N (E)-8-Octadecenoic acid Natural products CCCCCCCCCC=CCCCCCCC(O)=O WRIDQFICGBMAFQ-UHFFFAOYSA-N 0.000 description 1
- METKIMKYRPQLGS-GFCCVEGCSA-N (R)-atenolol Chemical compound CC(C)NC[C@@H](O)COC1=CC=C(CC(N)=O)C=C1 METKIMKYRPQLGS-GFCCVEGCSA-N 0.000 description 1
- TWBNMYSKRDRHAT-RCWTXCDDSA-N (S)-timolol hemihydrate Chemical compound O.CC(C)(C)NC[C@H](O)COC1=NSN=C1N1CCOCC1.CC(C)(C)NC[C@H](O)COC1=NSN=C1N1CCOCC1 TWBNMYSKRDRHAT-RCWTXCDDSA-N 0.000 description 1
- IXPNQXFRVYWDDI-UHFFFAOYSA-N 1-methyl-2,4-dioxo-1,3-diazinane-5-carboximidamide Chemical compound CN1CC(C(N)=N)C(=O)NC1=O IXPNQXFRVYWDDI-UHFFFAOYSA-N 0.000 description 1
- YMRIDJQAEZFTSC-UHFFFAOYSA-N 2,3-dihydro-1h-tetrazole Chemical compound N1NC=NN1 YMRIDJQAEZFTSC-UHFFFAOYSA-N 0.000 description 1
- HCSBTDBGTNZOAB-UHFFFAOYSA-N 2,3-dinitrobenzoic acid Chemical compound OC(=O)C1=CC=CC([N+]([O-])=O)=C1[N+]([O-])=O HCSBTDBGTNZOAB-UHFFFAOYSA-N 0.000 description 1
- SGTNSNPWRIOYBX-UHFFFAOYSA-N 2-(3,4-dimethoxyphenyl)-5-{[2-(3,4-dimethoxyphenyl)ethyl](methyl)amino}-2-(propan-2-yl)pentanenitrile Chemical compound C1=C(OC)C(OC)=CC=C1CCN(C)CCCC(C#N)(C(C)C)C1=CC=C(OC)C(OC)=C1 SGTNSNPWRIOYBX-UHFFFAOYSA-N 0.000 description 1
- SGUAFYQXFOLMHL-UHFFFAOYSA-N 2-hydroxy-5-{1-hydroxy-2-[(4-phenylbutan-2-yl)amino]ethyl}benzamide Chemical compound C=1C=C(O)C(C(N)=O)=CC=1C(O)CNC(C)CCC1=CC=CC=C1 SGUAFYQXFOLMHL-UHFFFAOYSA-N 0.000 description 1
- VWSLLSXLURJCDF-UHFFFAOYSA-N 2-methyl-4,5-dihydro-1h-imidazole Chemical compound CC1=NCCN1 VWSLLSXLURJCDF-UHFFFAOYSA-N 0.000 description 1
- LBLYYCQCTBFVLH-UHFFFAOYSA-M 2-methylbenzenesulfonate Chemical compound CC1=CC=CC=C1S([O-])(=O)=O LBLYYCQCTBFVLH-UHFFFAOYSA-M 0.000 description 1
- LQJBNNIYVWPHFW-UHFFFAOYSA-N 20:1omega9c fatty acid Natural products CCCCCCCCCCC=CCCCCCCCC(O)=O LQJBNNIYVWPHFW-UHFFFAOYSA-N 0.000 description 1
- ULRPISSMEBPJLN-UHFFFAOYSA-N 2h-tetrazol-5-amine Chemical compound NC1=NN=NN1 ULRPISSMEBPJLN-UHFFFAOYSA-N 0.000 description 1
- JSIAIROWMJGMQZ-UHFFFAOYSA-N 2h-triazol-4-amine Chemical compound NC1=CNN=N1 JSIAIROWMJGMQZ-UHFFFAOYSA-N 0.000 description 1
- UIAGMCDKSXEBJQ-IBGZPJMESA-N 3-o-(2-methoxyethyl) 5-o-propan-2-yl (4s)-2,6-dimethyl-4-(3-nitrophenyl)-1,4-dihydropyridine-3,5-dicarboxylate Chemical compound COCCOC(=O)C1=C(C)NC(C)=C(C(=O)OC(C)C)[C@H]1C1=CC=CC([N+]([O-])=O)=C1 UIAGMCDKSXEBJQ-IBGZPJMESA-N 0.000 description 1
- ZBGUGUZHFFUFBU-UHFFFAOYSA-N 4,5-bis(hydroxymethyl)-2-methylpyridin-3-ol;1h-imidazol-2-amine Chemical compound NC1=NC=CN1.CC1=NC=C(CO)C(CO)=C1O ZBGUGUZHFFUFBU-UHFFFAOYSA-N 0.000 description 1
- NQRIZAMUVSWWEZ-UHFFFAOYSA-N 4,5-bis(hydroxymethyl)-2-methylpyridin-3-ol;2-methyl-1h-imidazole Chemical compound CC1=NC=CN1.CC1=NC=C(CO)C(CO)=C1O NQRIZAMUVSWWEZ-UHFFFAOYSA-N 0.000 description 1
- LVDJAVCAVVDFBK-UHFFFAOYSA-N 4,5-bis(hydroxymethyl)-2-methylpyridin-3-ol;5-methyl-1h-imidazole Chemical compound CC1=CN=CN1.CC1=NC=C(CO)C(CO)=C1O LVDJAVCAVVDFBK-UHFFFAOYSA-N 0.000 description 1
- FQTDEWBAIPBZJH-UHFFFAOYSA-N 4,5-bis(hydroxymethyl)-2-methylpyridin-3-ol;5-nitro-1h-imidazole Chemical compound [O-][N+](=O)C1=CN=CN1.CC1=NC=C(CO)C(CO)=C1O FQTDEWBAIPBZJH-UHFFFAOYSA-N 0.000 description 1
- QCQCHGYLTSGIGX-GHXANHINSA-N 4-[[(3ar,5ar,5br,7ar,9s,11ar,11br,13as)-5a,5b,8,8,11a-pentamethyl-3a-[(5-methylpyridine-3-carbonyl)amino]-2-oxo-1-propan-2-yl-4,5,6,7,7a,9,10,11,11b,12,13,13a-dodecahydro-3h-cyclopenta[a]chrysen-9-yl]oxy]-2,2-dimethyl-4-oxobutanoic acid Chemical compound N([C@@]12CC[C@@]3(C)[C@]4(C)CC[C@H]5C(C)(C)[C@@H](OC(=O)CC(C)(C)C(O)=O)CC[C@]5(C)[C@H]4CC[C@@H]3C1=C(C(C2)=O)C(C)C)C(=O)C1=CN=CC(C)=C1 QCQCHGYLTSGIGX-GHXANHINSA-N 0.000 description 1
- QTUJZOPWBSOIDL-UHFFFAOYSA-N 5-amino-4,5-bis(hydroxymethyl)-2-methyl-4H-pyridin-3-ol Chemical class NC1(C(C(=C(N=C1)C)O)CO)CO QTUJZOPWBSOIDL-UHFFFAOYSA-N 0.000 description 1
- VYDWQPKRHOGLPA-UHFFFAOYSA-N 5-nitroimidazole Chemical compound [O-][N+](=O)C1=CN=CN1 VYDWQPKRHOGLPA-UHFFFAOYSA-N 0.000 description 1
- RZTAMFZIAATZDJ-HNNXBMFYSA-N 5-o-ethyl 3-o-methyl (4s)-4-(2,3-dichlorophenyl)-2,6-dimethyl-1,4-dihydropyridine-3,5-dicarboxylate Chemical compound CCOC(=O)C1=C(C)NC(C)=C(C(=O)OC)[C@@H]1C1=CC=CC(Cl)=C1Cl RZTAMFZIAATZDJ-HNNXBMFYSA-N 0.000 description 1
- QSBYPNXLFMSGKH-UHFFFAOYSA-N 9-Heptadecensaeure Natural products CCCCCCCC=CCCCCCCCC(O)=O QSBYPNXLFMSGKH-UHFFFAOYSA-N 0.000 description 1
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 description 1
- JBMKAUGHUNFTOL-UHFFFAOYSA-N Aldoclor Chemical compound C1=C(Cl)C(S(=O)(=O)N)=CC2=C1NC=NS2(=O)=O JBMKAUGHUNFTOL-UHFFFAOYSA-N 0.000 description 1
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 1
- 101800000734 Angiotensin-1 Proteins 0.000 description 1
- 102400000344 Angiotensin-1 Human genes 0.000 description 1
- 208000031104 Arterial Occlusive disease Diseases 0.000 description 1
- BSYNRYMUTXBXSQ-UHFFFAOYSA-N Aspirin Chemical compound CC(=O)OC1=CC=CC=C1C(O)=O BSYNRYMUTXBXSQ-UHFFFAOYSA-N 0.000 description 1
- XPCFTKFZXHTYIP-PMACEKPBSA-N Benazepril Chemical compound C([C@@H](C(=O)OCC)N[C@@H]1C(N(CC(O)=O)C2=CC=CC=C2CC1)=O)CC1=CC=CC=C1 XPCFTKFZXHTYIP-PMACEKPBSA-N 0.000 description 1
- LSNNMFCWUKXFEE-UHFFFAOYSA-M Bisulfite Chemical compound OS([O-])=O LSNNMFCWUKXFEE-UHFFFAOYSA-M 0.000 description 1
- 239000002083 C09CA01 - Losartan Substances 0.000 description 1
- 239000004072 C09CA03 - Valsartan Substances 0.000 description 1
- SKRMIYFJJDFKPJ-UFFVCSGVSA-N CC(C)(OC1)Oc2c1c(/C=N/c(cc1)ccc1C#N)cnc2C Chemical compound CC(C)(OC1)Oc2c1c(/C=N/c(cc1)ccc1C#N)cnc2C SKRMIYFJJDFKPJ-UFFVCSGVSA-N 0.000 description 1
- PECKJUIKFHWAGE-UHFFFAOYSA-N CC(C)(OC1)Oc2c1c(C=O)cnc2C Chemical compound CC(C)(OC1)Oc2c1c(C=O)cnc2C PECKJUIKFHWAGE-UHFFFAOYSA-N 0.000 description 1
- CFMGOCLHLCMUEM-SNAWJCMRSA-N CC1(C)Oc2c(C)ncc(/C=C/C3=NCCN3)c2CO1 Chemical compound CC1(C)Oc2c(C)ncc(/C=C/C3=NCCN3)c2CO1 CFMGOCLHLCMUEM-SNAWJCMRSA-N 0.000 description 1
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical group [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 1
- 206010007559 Cardiac failure congestive Diseases 0.000 description 1
- VYFFWJGOLCNSEY-NSCUHMNNSA-N Cc(ncc(/C=C/C1=NCCN1)c1CO)c1O Chemical compound Cc(ncc(/C=C/C1=NCCN1)c1CO)c1O VYFFWJGOLCNSEY-NSCUHMNNSA-N 0.000 description 1
- DHBITNCTOUJBPN-UHFFFAOYSA-N Cc(ncc(CNc(cc1)ccc1C(N)=N)c1CO)c1O Chemical compound Cc(ncc(CNc(cc1)ccc1C(N)=N)c1CO)c1O DHBITNCTOUJBPN-UHFFFAOYSA-N 0.000 description 1
- VEXZGXHMUGYJMC-UHFFFAOYSA-M Chloride anion Chemical compound [Cl-] VEXZGXHMUGYJMC-UHFFFAOYSA-M 0.000 description 1
- JZUFKLXOESDKRF-UHFFFAOYSA-N Chlorothiazide Chemical compound C1=C(Cl)C(S(=O)(=O)N)=CC2=C1NCNS2(=O)=O JZUFKLXOESDKRF-UHFFFAOYSA-N 0.000 description 1
- KRKNYBCHXYNGOX-UHFFFAOYSA-K Citrate Chemical compound [O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O KRKNYBCHXYNGOX-UHFFFAOYSA-K 0.000 description 1
- 208000001778 Coronary Occlusion Diseases 0.000 description 1
- 206010011086 Coronary artery occlusion Diseases 0.000 description 1
- ZZZCUOFIHGPKAK-UHFFFAOYSA-N D-erythro-ascorbic acid Natural products OCC1OC(=O)C(O)=C1O ZZZCUOFIHGPKAK-UHFFFAOYSA-N 0.000 description 1
- RGHNJXZEOKUKBD-SQOUGZDYSA-M D-gluconate Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@@H](O)C([O-])=O RGHNJXZEOKUKBD-SQOUGZDYSA-M 0.000 description 1
- FEWJPZIEWOKRBE-JCYAYHJZSA-N Dextrotartaric acid Chemical compound OC(=O)[C@H](O)[C@@H](O)C(O)=O FEWJPZIEWOKRBE-JCYAYHJZSA-N 0.000 description 1
- 108010061435 Enalapril Proteins 0.000 description 1
- 239000004606 Fillers/Extenders Substances 0.000 description 1
- KRHYYFGTRYWZRS-UHFFFAOYSA-N Fluorane Chemical compound F KRHYYFGTRYWZRS-UHFFFAOYSA-N 0.000 description 1
- PXGOKWXKJXAPGV-UHFFFAOYSA-N Fluorine Chemical compound FF PXGOKWXKJXAPGV-UHFFFAOYSA-N 0.000 description 1
- VZCYOOQTPOCHFL-OWOJBTEDSA-N Fumaric acid Chemical compound OC(=O)\C=C\C(O)=O VZCYOOQTPOCHFL-OWOJBTEDSA-N 0.000 description 1
- 102000007390 Glycogen Phosphorylase Human genes 0.000 description 1
- 108010046163 Glycogen Phosphorylase Proteins 0.000 description 1
- 206010058423 Haemangioma-thrombocytopenia syndrome Diseases 0.000 description 1
- HTTJABKRGRZYRN-UHFFFAOYSA-N Heparin Chemical compound OC1C(NC(=O)C)C(O)OC(COS(O)(=O)=O)C1OC1C(OS(O)(=O)=O)C(O)C(OC2C(C(OS(O)(=O)=O)C(OC3C(C(O)C(O)C(O3)C(O)=O)OS(O)(=O)=O)C(CO)O2)NS(O)(=O)=O)C(C(O)=O)O1 HTTJABKRGRZYRN-UHFFFAOYSA-N 0.000 description 1
- 206010061218 Inflammation Diseases 0.000 description 1
- 208000010299 Kasabach-Merritt syndrome Diseases 0.000 description 1
- FFFHZYDWPBMWHY-VKHMYHEASA-N L-homocysteine Chemical compound OC(=O)[C@@H](N)CCS FFFHZYDWPBMWHY-VKHMYHEASA-N 0.000 description 1
- JVTAAEKCZFNVCJ-UHFFFAOYSA-M Lactate Chemical compound CC(O)C([O-])=O JVTAAEKCZFNVCJ-UHFFFAOYSA-M 0.000 description 1
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 1
- 108010007859 Lisinopril Proteins 0.000 description 1
- OFOBLEOULBTSOW-UHFFFAOYSA-L Malonate Chemical compound [O-]C(=O)CC([O-])=O OFOBLEOULBTSOW-UHFFFAOYSA-L 0.000 description 1
- AFVFQIVMOAPDHO-UHFFFAOYSA-N Methanesulfonic acid Chemical compound CS(O)(=O)=O AFVFQIVMOAPDHO-UHFFFAOYSA-N 0.000 description 1
- UWWDHYUMIORJTA-HSQYWUDLSA-N Moexipril Chemical compound C([C@@H](C(=O)OCC)N[C@@H](C)C(=O)N1[C@@H](CC2=CC(OC)=C(OC)C=C2C1)C(O)=O)CC1=CC=CC=C1 UWWDHYUMIORJTA-HSQYWUDLSA-N 0.000 description 1
- ONXPDKGXOOORHB-BYPYZUCNSA-N N(5)-methyl-L-glutamine Chemical compound CNC(=O)CC[C@H](N)C(O)=O ONXPDKGXOOORHB-BYPYZUCNSA-N 0.000 description 1
- 229910002651 NO3 Inorganic materials 0.000 description 1
- 206010028851 Necrosis Diseases 0.000 description 1
- ZBBHBTPTTSWHBA-UHFFFAOYSA-N Nicardipine Chemical compound COC(=O)C1=C(C)NC(C)=C(C(=O)OCCN(C)CC=2C=CC=CC=2)C1C1=CC=CC([N+]([O-])=O)=C1 ZBBHBTPTTSWHBA-UHFFFAOYSA-N 0.000 description 1
- NHNBFGGVMKEFGY-UHFFFAOYSA-N Nitrate Chemical compound [O-][N+]([O-])=O NHNBFGGVMKEFGY-UHFFFAOYSA-N 0.000 description 1
- SNIOPGDIGTZGOP-UHFFFAOYSA-N Nitroglycerin Chemical compound [O-][N+](=O)OCC(O[N+]([O-])=O)CO[N+]([O-])=O SNIOPGDIGTZGOP-UHFFFAOYSA-N 0.000 description 1
- 239000000006 Nitroglycerin Substances 0.000 description 1
- 206010030113 Oedema Diseases 0.000 description 1
- 206010030124 Oedema peripheral Diseases 0.000 description 1
- 239000005642 Oleic acid Substances 0.000 description 1
- ZQPPMHVWECSIRJ-UHFFFAOYSA-N Oleic acid Natural products CCCCCCCCC=CCCCCCCCC(O)=O ZQPPMHVWECSIRJ-UHFFFAOYSA-N 0.000 description 1
- MUBZPKHOEPUJKR-UHFFFAOYSA-N Oxalic acid Chemical compound OC(=O)C(O)=O MUBZPKHOEPUJKR-UHFFFAOYSA-N 0.000 description 1
- 102100037601 P2X purinoceptor 4 Human genes 0.000 description 1
- 229910019142 PO4 Inorganic materials 0.000 description 1
- NBIIXXVUZAFLBC-UHFFFAOYSA-L Phosphate ion(2-) Chemical compound OP([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-L 0.000 description 1
- 102000004160 Phosphoric Monoester Hydrolases Human genes 0.000 description 1
- 108090000608 Phosphoric Monoester Hydrolases Proteins 0.000 description 1
- ABLZXFCXXLZCGV-UHFFFAOYSA-N Phosphorous acid Chemical compound OP(O)=O ABLZXFCXXLZCGV-UHFFFAOYSA-N 0.000 description 1
- XBDQKXXYIPTUBI-UHFFFAOYSA-M Propionate Chemical compound CCC([O-])=O XBDQKXXYIPTUBI-UHFFFAOYSA-M 0.000 description 1
- 108010080192 Purinergic Receptors Proteins 0.000 description 1
- 108010070648 Pyridoxal Kinase Proteins 0.000 description 1
- 102100038517 Pyridoxal kinase Human genes 0.000 description 1
- 206010040047 Sepsis Diseases 0.000 description 1
- 206010040070 Septic Shock Diseases 0.000 description 1
- DWAQJAXMDSEUJJ-UHFFFAOYSA-M Sodium bisulfite Chemical compound [Na+].OS([O-])=O DWAQJAXMDSEUJJ-UHFFFAOYSA-M 0.000 description 1
- 229920002472 Starch Polymers 0.000 description 1
- 208000006011 Stroke Diseases 0.000 description 1
- 206010042434 Sudden death Diseases 0.000 description 1
- QAOWNCQODCNURD-UHFFFAOYSA-L Sulfate Chemical compound [O-]S([O-])(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-L 0.000 description 1
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical compound [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 description 1
- 108090000190 Thrombin Proteins 0.000 description 1
- 208000007536 Thrombosis Diseases 0.000 description 1
- DTQVDTLACAAQTR-UHFFFAOYSA-M Trifluoroacetate Chemical compound [O-]C(=O)C(F)(F)F DTQVDTLACAAQTR-UHFFFAOYSA-M 0.000 description 1
- 206010047295 Ventricular hypertrophy Diseases 0.000 description 1
- 229930003270 Vitamin B Natural products 0.000 description 1
- 229930003268 Vitamin C Natural products 0.000 description 1
- 238000009825 accumulation Methods 0.000 description 1
- IPBVNPXQWQGGJP-UHFFFAOYSA-N acetic acid phenyl ester Natural products CC(=O)OC1=CC=CC=C1 IPBVNPXQWQGGJP-UHFFFAOYSA-N 0.000 description 1
- 229960001138 acetylsalicylic acid Drugs 0.000 description 1
- 239000004480 active ingredient Substances 0.000 description 1
- 230000001154 acute effect Effects 0.000 description 1
- 239000000443 aerosol Substances 0.000 description 1
- 235000010443 alginic acid Nutrition 0.000 description 1
- 239000000783 alginic acid Substances 0.000 description 1
- 229920000615 alginic acid Polymers 0.000 description 1
- 229960001126 alginic acid Drugs 0.000 description 1
- 150000004781 alginic acids Chemical class 0.000 description 1
- 150000001338 aliphatic hydrocarbons Chemical group 0.000 description 1
- 125000004183 alkoxy alkyl group Chemical group 0.000 description 1
- 125000004453 alkoxycarbonyl group Chemical group 0.000 description 1
- 125000000278 alkyl amino alkyl group Chemical group 0.000 description 1
- 125000006350 alkyl thio alkyl group Chemical group 0.000 description 1
- AEMOLEFTQBMNLQ-BKBMJHBISA-N alpha-D-galacturonic acid Chemical compound O[C@H]1O[C@H](C(O)=O)[C@H](O)[C@H](O)[C@H]1O AEMOLEFTQBMNLQ-BKBMJHBISA-N 0.000 description 1
- XSDQTOBWRPYKKA-UHFFFAOYSA-N amiloride Chemical compound NC(=N)NC(=O)C1=NC(Cl)=C(N)N=C1N XSDQTOBWRPYKKA-UHFFFAOYSA-N 0.000 description 1
- 229960002576 amiloride Drugs 0.000 description 1
- 229940024606 amino acid Drugs 0.000 description 1
- 150000001413 amino acids Chemical class 0.000 description 1
- 125000003277 amino group Chemical group 0.000 description 1
- 229960000528 amlodipine Drugs 0.000 description 1
- ZPBWCRDSRKPIDG-UHFFFAOYSA-N amlodipine benzenesulfonate Chemical compound OS(=O)(=O)C1=CC=CC=C1.CCOC(=O)C1=C(COCCN)NC(C)=C(C(=O)OC)C1C1=CC=CC=C1Cl ZPBWCRDSRKPIDG-UHFFFAOYSA-N 0.000 description 1
- ORWYRWWVDCYOMK-HBZPZAIKSA-N angiotensin I Chemical compound C([C@@H](C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CC=1NC=NC=1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CC=1NC=NC=1)C(=O)N[C@@H](CC(C)C)C(O)=O)NC(=O)[C@@H](NC(=O)[C@H](CCCN=C(N)N)NC(=O)[C@@H](N)CC(O)=O)C(C)C)C1=CC=C(O)C=C1 ORWYRWWVDCYOMK-HBZPZAIKSA-N 0.000 description 1
- 150000001448 anilines Chemical class 0.000 description 1
- 230000003078 antioxidant effect Effects 0.000 description 1
- 229940127218 antiplatelet drug Drugs 0.000 description 1
- 230000006907 apoptotic process Effects 0.000 description 1
- 159000000032 aromatic acids Chemical class 0.000 description 1
- 238000010420 art technique Methods 0.000 description 1
- 208000021328 arterial occlusion Diseases 0.000 description 1
- 229960002274 atenolol Drugs 0.000 description 1
- 150000007514 bases Chemical class 0.000 description 1
- SRSXLGNVWSONIS-UHFFFAOYSA-M benzenesulfonate Chemical compound [O-]S(=O)(=O)C1=CC=CC=C1 SRSXLGNVWSONIS-UHFFFAOYSA-M 0.000 description 1
- 229940077388 benzenesulfonate Drugs 0.000 description 1
- WPYMKLBDIGXBTP-UHFFFAOYSA-N benzoic acid Chemical compound OC(=O)C1=CC=CC=C1 WPYMKLBDIGXBTP-UHFFFAOYSA-N 0.000 description 1
- 235000019445 benzyl alcohol Nutrition 0.000 description 1
- UIEATEWHFDRYRU-UHFFFAOYSA-N bepridil Chemical compound C1CCCN1C(COCC(C)C)CN(C=1C=CC=CC=1)CC1=CC=CC=C1 UIEATEWHFDRYRU-UHFFFAOYSA-N 0.000 description 1
- 229960003665 bepridil Drugs 0.000 description 1
- 239000011230 binding agent Substances 0.000 description 1
- 230000004071 biological effect Effects 0.000 description 1
- 230000031018 biological processes and functions Effects 0.000 description 1
- QAOWNCQODCNURD-UHFFFAOYSA-M bisulphate group Chemical group S([O-])(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-M 0.000 description 1
- 230000023555 blood coagulation Effects 0.000 description 1
- 230000036770 blood supply Effects 0.000 description 1
- 125000001246 bromo group Chemical group Br* 0.000 description 1
- 239000000872 buffer Substances 0.000 description 1
- 125000000484 butyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 229960000830 captopril Drugs 0.000 description 1
- FAKRSMQSSFJEIM-RQJHMYQMSA-N captopril Chemical compound SC[C@@H](C)C(=O)N1CCC[C@H]1C(O)=O FAKRSMQSSFJEIM-RQJHMYQMSA-N 0.000 description 1
- 229910052799 carbon Inorganic materials 0.000 description 1
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 1
- 230000036996 cardiovascular health Effects 0.000 description 1
- 230000005779 cell damage Effects 0.000 description 1
- 230000030833 cell death Effects 0.000 description 1
- 208000037887 cell injury Diseases 0.000 description 1
- 238000005119 centrifugation Methods 0.000 description 1
- 239000007795 chemical reaction product Substances 0.000 description 1
- 239000003638 chemical reducing agent Substances 0.000 description 1
- 239000003795 chemical substances by application Substances 0.000 description 1
- KVSASDOGYIBWTA-UHFFFAOYSA-N chloro benzoate Chemical compound ClOC(=O)C1=CC=CC=C1 KVSASDOGYIBWTA-UHFFFAOYSA-N 0.000 description 1
- 125000001309 chloro group Chemical group Cl* 0.000 description 1
- 230000001684 chronic effect Effects 0.000 description 1
- 230000004087 circulation Effects 0.000 description 1
- 229940110456 cocoa butter Drugs 0.000 description 1
- 235000019868 cocoa butter Nutrition 0.000 description 1
- 239000005515 coenzyme Substances 0.000 description 1
- 239000003086 colorant Substances 0.000 description 1
- 230000037020 contractile activity Effects 0.000 description 1
- 230000008602 contraction Effects 0.000 description 1
- 210000004351 coronary vessel Anatomy 0.000 description 1
- 238000011161 development Methods 0.000 description 1
- 230000035487 diastolic blood pressure Effects 0.000 description 1
- 150000001991 dicarboxylic acids Chemical class 0.000 description 1
- 235000014113 dietary fatty acids Nutrition 0.000 description 1
- SBZXBUIDTXKZTM-UHFFFAOYSA-N diglyme Chemical compound COCCOCCOC SBZXBUIDTXKZTM-UHFFFAOYSA-N 0.000 description 1
- NBIIXXVUZAFLBC-UHFFFAOYSA-M dihydrogenphosphate Chemical compound OP(O)([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-M 0.000 description 1
- 229960004166 diltiazem Drugs 0.000 description 1
- HSUGRBWQSSZJOP-RTWAWAEBSA-N diltiazem Chemical compound C1=CC(OC)=CC=C1[C@H]1[C@@H](OC(C)=O)C(=O)N(CCN(C)C)C2=CC=CC=C2S1 HSUGRBWQSSZJOP-RTWAWAEBSA-N 0.000 description 1
- XPPKVPWEQAFLFU-UHFFFAOYSA-J diphosphate(4-) Chemical compound [O-]P([O-])(=O)OP([O-])([O-])=O XPPKVPWEQAFLFU-UHFFFAOYSA-J 0.000 description 1
- 235000011180 diphosphates Nutrition 0.000 description 1
- LOKCTEFSRHRXRJ-UHFFFAOYSA-I dipotassium trisodium dihydrogen phosphate hydrogen phosphate dichloride Chemical compound P(=O)(O)(O)[O-].[K+].P(=O)(O)([O-])[O-].[Na+].[Na+].[Cl-].[K+].[Cl-].[Na+] LOKCTEFSRHRXRJ-UHFFFAOYSA-I 0.000 description 1
- 239000007884 disintegrant Substances 0.000 description 1
- 229940030606 diuretics Drugs 0.000 description 1
- 229940074654 diuril Drugs 0.000 description 1
- 239000003995 emulsifying agent Substances 0.000 description 1
- 229960000873 enalapril Drugs 0.000 description 1
- GBXSMTUPTTWBMN-XIRDDKMYSA-N enalapril Chemical compound C([C@@H](C(=O)OCC)N[C@@H](C)C(=O)N1[C@@H](CCC1)C(O)=O)CC1=CC=CC=C1 GBXSMTUPTTWBMN-XIRDDKMYSA-N 0.000 description 1
- 210000002889 endothelial cell Anatomy 0.000 description 1
- 239000002662 enteric coated tablet Substances 0.000 description 1
- 238000006911 enzymatic reaction Methods 0.000 description 1
- 239000012259 ether extract Substances 0.000 description 1
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 1
- 239000000284 extract Substances 0.000 description 1
- 238000000605 extraction Methods 0.000 description 1
- 239000000194 fatty acid Substances 0.000 description 1
- 229930195729 fatty acid Natural products 0.000 description 1
- 150000004665 fatty acids Chemical class 0.000 description 1
- 229960003580 felodipine Drugs 0.000 description 1
- 210000002950 fibroblast Anatomy 0.000 description 1
- 238000011049 filling Methods 0.000 description 1
- 238000003818 flash chromatography Methods 0.000 description 1
- 239000012530 fluid Substances 0.000 description 1
- 229910052731 fluorine Inorganic materials 0.000 description 1
- 239000011737 fluorine Substances 0.000 description 1
- 125000001153 fluoro group Chemical group F* 0.000 description 1
- 235000013305 food Nutrition 0.000 description 1
- 235000003599 food sweetener Nutrition 0.000 description 1
- 238000009472 formulation Methods 0.000 description 1
- 229960002490 fosinopril Drugs 0.000 description 1
- ZZUFCTLCJUWOSV-UHFFFAOYSA-N furosemide Chemical compound C1=C(Cl)C(S(=O)(=O)N)=CC(C(O)=O)=C1NCC1=CC=CO1 ZZUFCTLCJUWOSV-UHFFFAOYSA-N 0.000 description 1
- 229960003883 furosemide Drugs 0.000 description 1
- 229940050410 gluconate Drugs 0.000 description 1
- 125000005456 glyceride group Chemical group 0.000 description 1
- 229960003711 glyceryl trinitrate Drugs 0.000 description 1
- 230000034659 glycolysis Effects 0.000 description 1
- 239000008187 granular material Substances 0.000 description 1
- 230000036541 health Effects 0.000 description 1
- 229960002897 heparin Drugs 0.000 description 1
- 229920000669 heparin Polymers 0.000 description 1
- 229960002474 hydralazine Drugs 0.000 description 1
- 229910000040 hydrogen fluoride Inorganic materials 0.000 description 1
- 229910000043 hydrogen iodide Inorganic materials 0.000 description 1
- 230000001969 hypertrophic effect Effects 0.000 description 1
- 229960001195 imidapril Drugs 0.000 description 1
- KLZWOWYOHUKJIG-BPUTZDHNSA-N imidapril Chemical compound C([C@@H](C(=O)OCC)N[C@@H](C)C(=O)N1C(N(C)C[C@H]1C(O)=O)=O)CC1=CC=CC=C1 KLZWOWYOHUKJIG-BPUTZDHNSA-N 0.000 description 1
- 239000012729 immediate-release (IR) formulation Substances 0.000 description 1
- 230000006872 improvement Effects 0.000 description 1
- 230000008595 infiltration Effects 0.000 description 1
- 238000001764 infiltration Methods 0.000 description 1
- 230000004054 inflammatory process Effects 0.000 description 1
- 238000007918 intramuscular administration Methods 0.000 description 1
- 238000001990 intravenous administration Methods 0.000 description 1
- 239000002085 irritant Substances 0.000 description 1
- 231100000021 irritant Toxicity 0.000 description 1
- KQNPFQTWMSNSAP-UHFFFAOYSA-N isobutyric acid Chemical compound CC(C)C(O)=O KQNPFQTWMSNSAP-UHFFFAOYSA-N 0.000 description 1
- CJWQYWQDLBZGPD-UHFFFAOYSA-N isoflavone Natural products C1=C(OC)C(OC)=CC(OC)=C1C1=COC2=C(C=CC(C)(C)O3)C3=C(OC)C=C2C1=O CJWQYWQDLBZGPD-UHFFFAOYSA-N 0.000 description 1
- 150000002515 isoflavone derivatives Chemical class 0.000 description 1
- 235000008696 isoflavones Nutrition 0.000 description 1
- QXJSBBXBKPUZAA-UHFFFAOYSA-N isooleic acid Natural products CCCCCCCC=CCCCCCCCCC(O)=O QXJSBBXBKPUZAA-UHFFFAOYSA-N 0.000 description 1
- MOYKHGMNXAOIAT-JGWLITMVSA-N isosorbide dinitrate Chemical compound [O-][N+](=O)O[C@H]1CO[C@@H]2[C@H](O[N+](=O)[O-])CO[C@@H]21 MOYKHGMNXAOIAT-JGWLITMVSA-N 0.000 description 1
- 229960000201 isosorbide dinitrate Drugs 0.000 description 1
- 229960001632 labetalol Drugs 0.000 description 1
- 239000008101 lactose Substances 0.000 description 1
- 239000010410 layer Substances 0.000 description 1
- 229960002394 lisinopril Drugs 0.000 description 1
- RLAWWYSOJDYHDC-BZSNNMDCSA-N lisinopril Chemical compound C([C@H](N[C@@H](CCCCN)C(=O)N1[C@@H](CCC1)C(O)=O)C(O)=O)CC1=CC=CC=C1 RLAWWYSOJDYHDC-BZSNNMDCSA-N 0.000 description 1
- KJJZZJSZUJXYEA-UHFFFAOYSA-N losartan Chemical compound CCCCC1=NC(Cl)=C(CO)N1CC1=CC=C(C=2C(=CC=CC=2)C=2[N]N=NN=2)C=C1 KJJZZJSZUJXYEA-UHFFFAOYSA-N 0.000 description 1
- 229960004773 losartan Drugs 0.000 description 1
- 239000000314 lubricant Substances 0.000 description 1
- 235000019359 magnesium stearate Nutrition 0.000 description 1
- 230000005565 malate-aspartate shuttle Effects 0.000 description 1
- IWYDHOAUDWTVEP-UHFFFAOYSA-M mandelate Chemical compound [O-]C(=O)C(O)C1=CC=CC=C1 IWYDHOAUDWTVEP-UHFFFAOYSA-M 0.000 description 1
- 230000007246 mechanism Effects 0.000 description 1
- 125000005341 metaphosphate group Chemical group 0.000 description 1
- 125000004184 methoxymethyl group Chemical group [H]C([H])([H])OC([H])([H])* 0.000 description 1
- 229940095102 methyl benzoate Drugs 0.000 description 1
- 229920000609 methyl cellulose Polymers 0.000 description 1
- 239000001923 methylcellulose Substances 0.000 description 1
- 235000010981 methylcellulose Nutrition 0.000 description 1
- IUBSYMUCCVWXPE-UHFFFAOYSA-N metoprolol Chemical compound COCCC1=CC=C(OCC(O)CNC(C)C)C=C1 IUBSYMUCCVWXPE-UHFFFAOYSA-N 0.000 description 1
- 229960002237 metoprolol Drugs 0.000 description 1
- 230000003278 mimic effect Effects 0.000 description 1
- 150000007522 mineralic acids Chemical class 0.000 description 1
- 230000004048 modification Effects 0.000 description 1
- 238000012986 modification Methods 0.000 description 1
- 229960005170 moexipril Drugs 0.000 description 1
- 230000017074 necrotic cell death Effects 0.000 description 1
- 229960001783 nicardipine Drugs 0.000 description 1
- 229960001597 nifedipine Drugs 0.000 description 1
- HYIMSNHJOBLJNT-UHFFFAOYSA-N nifedipine Chemical compound COC(=O)C1=C(C)NC(C)=C(C(=O)OC)C1C1=CC=CC=C1[N+]([O-])=O HYIMSNHJOBLJNT-UHFFFAOYSA-N 0.000 description 1
- 229960000715 nimodipine Drugs 0.000 description 1
- 229910052757 nitrogen Inorganic materials 0.000 description 1
- WWZKQHOCKIZLMA-UHFFFAOYSA-M octanoate Chemical compound CCCCCCCC([O-])=O WWZKQHOCKIZLMA-UHFFFAOYSA-M 0.000 description 1
- ZQPPMHVWECSIRJ-KTKRTIGZSA-N oleic acid Chemical compound CCCCCCCC\C=C/CCCCCCCC(O)=O ZQPPMHVWECSIRJ-KTKRTIGZSA-N 0.000 description 1
- 150000007524 organic acids Chemical class 0.000 description 1
- 235000005985 organic acids Nutrition 0.000 description 1
- 239000007800 oxidant agent Substances 0.000 description 1
- 230000001575 pathological effect Effects 0.000 description 1
- 230000004963 pathophysiological condition Effects 0.000 description 1
- 230000002093 peripheral effect Effects 0.000 description 1
- 229940049953 phenylacetate Drugs 0.000 description 1
- WLJVXDMOQOGPHL-UHFFFAOYSA-N phenylacetic acid Chemical compound OC(=O)CC1=CC=CC=C1 WLJVXDMOQOGPHL-UHFFFAOYSA-N 0.000 description 1
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 description 1
- 239000010452 phosphate Substances 0.000 description 1
- 239000002953 phosphate buffered saline Substances 0.000 description 1
- 230000026731 phosphorylation Effects 0.000 description 1
- 238000006366 phosphorylation reaction Methods 0.000 description 1
- XNGIFLGASWRNHJ-UHFFFAOYSA-L phthalate(2-) Chemical compound [O-]C(=O)C1=CC=CC=C1C([O-])=O XNGIFLGASWRNHJ-UHFFFAOYSA-L 0.000 description 1
- 230000000704 physical effect Effects 0.000 description 1
- 239000002504 physiological saline solution Substances 0.000 description 1
- 239000006187 pill Substances 0.000 description 1
- 239000000106 platelet aggregation inhibitor Substances 0.000 description 1
- 239000002798 polar solvent Substances 0.000 description 1
- 229920001223 polyethylene glycol Polymers 0.000 description 1
- 230000003389 potentiating effect Effects 0.000 description 1
- 239000000843 powder Substances 0.000 description 1
- IENZQIKPVFGBNW-UHFFFAOYSA-N prazosin Chemical compound N=1C(N)=C2C=C(OC)C(OC)=CC2=NC=1N(CC1)CCN1C(=O)C1=CC=CO1 IENZQIKPVFGBNW-UHFFFAOYSA-N 0.000 description 1
- 229960001289 prazosin Drugs 0.000 description 1
- 238000001556 precipitation Methods 0.000 description 1
- 230000002265 prevention Effects 0.000 description 1
- 230000000069 prophylactic effect Effects 0.000 description 1
- AQHHHDLHHXJYJD-UHFFFAOYSA-N propranolol Chemical compound C1=CC=C2C(OCC(O)CNC(C)C)=CC=CC2=C1 AQHHHDLHHXJYJD-UHFFFAOYSA-N 0.000 description 1
- 125000001436 propyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 108090000623 proteins and genes Proteins 0.000 description 1
- ZUFQODAHGAHPFQ-UHFFFAOYSA-N pyridoxine hydrochloride Chemical compound Cl.CC1=NC=C(CO)C(CO)=C1O ZUFQODAHGAHPFQ-UHFFFAOYSA-N 0.000 description 1
- 229960004172 pyridoxine hydrochloride Drugs 0.000 description 1
- 235000019171 pyridoxine hydrochloride Nutrition 0.000 description 1
- 239000011764 pyridoxine hydrochloride Substances 0.000 description 1
- 229960001455 quinapril Drugs 0.000 description 1
- JSDRRTOADPPCHY-HSQYWUDLSA-N quinapril Chemical compound C([C@@H](C(=O)OCC)N[C@@H](C)C(=O)N1[C@@H](CC2=CC=CC=C2C1)C(O)=O)CC1=CC=CC=C1 JSDRRTOADPPCHY-HSQYWUDLSA-N 0.000 description 1
- 229960003401 ramipril Drugs 0.000 description 1
- HDACQVRGBOVJII-JBDAPHQKSA-N ramipril Chemical compound C([C@@H](C(=O)OCC)N[C@@H](C)C(=O)N1[C@@H](C[C@@H]2CCC[C@@H]21)C(O)=O)CC1=CC=CC=C1 HDACQVRGBOVJII-JBDAPHQKSA-N 0.000 description 1
- 239000002464 receptor antagonist Substances 0.000 description 1
- 229940044551 receptor antagonist Drugs 0.000 description 1
- 210000000664 rectum Anatomy 0.000 description 1
- 230000004044 response Effects 0.000 description 1
- 229940116351 sebacate Drugs 0.000 description 1
- CXMXRPHRNRROMY-UHFFFAOYSA-L sebacate(2-) Chemical compound [O-]C(=O)CCCCCCCCC([O-])=O CXMXRPHRNRROMY-UHFFFAOYSA-L 0.000 description 1
- 230000036303 septic shock Effects 0.000 description 1
- 208000013223 septicemia Diseases 0.000 description 1
- 210000000329 smooth muscle myocyte Anatomy 0.000 description 1
- 239000000661 sodium alginate Substances 0.000 description 1
- 235000010413 sodium alginate Nutrition 0.000 description 1
- 229940005550 sodium alginate Drugs 0.000 description 1
- 229910000030 sodium bicarbonate Inorganic materials 0.000 description 1
- 235000017557 sodium bicarbonate Nutrition 0.000 description 1
- 239000001509 sodium citrate Substances 0.000 description 1
- NLJMYIDDQXHKNR-UHFFFAOYSA-K sodium citrate Chemical compound O.O.[Na+].[Na+].[Na+].[O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O NLJMYIDDQXHKNR-UHFFFAOYSA-K 0.000 description 1
- 235000010267 sodium hydrogen sulphite Nutrition 0.000 description 1
- 229960002909 spirapril Drugs 0.000 description 1
- HRWCVUIFMSZDJS-SZMVWBNQSA-N spirapril Chemical compound C([C@@H](C(=O)OCC)N[C@@H](C)C(=O)N1[C@@H](CC2(C1)SCCS2)C(O)=O)CC1=CC=CC=C1 HRWCVUIFMSZDJS-SZMVWBNQSA-N 0.000 description 1
- 108700035424 spirapril Proteins 0.000 description 1
- 239000003381 stabilizer Substances 0.000 description 1
- 235000019698 starch Nutrition 0.000 description 1
- 239000008107 starch Substances 0.000 description 1
- 239000007858 starting material Substances 0.000 description 1
- 230000035882 stress Effects 0.000 description 1
- 238000007920 subcutaneous administration Methods 0.000 description 1
- TYFQFVWCELRYAO-UHFFFAOYSA-L suberate(2-) Chemical compound [O-]C(=O)CCCCCCC([O-])=O TYFQFVWCELRYAO-UHFFFAOYSA-L 0.000 description 1
- 239000000126 substance Substances 0.000 description 1
- KDYFGRWQOYBRFD-UHFFFAOYSA-L succinate(2-) Chemical compound [O-]C(=O)CCC([O-])=O KDYFGRWQOYBRFD-UHFFFAOYSA-L 0.000 description 1
- LSNNMFCWUKXFEE-UHFFFAOYSA-L sulfite Chemical compound [O-]S([O-])=O LSNNMFCWUKXFEE-UHFFFAOYSA-L 0.000 description 1
- 229910052717 sulfur Inorganic materials 0.000 description 1
- 239000011593 sulfur Substances 0.000 description 1
- 229910021653 sulphate ion Inorganic materials 0.000 description 1
- 239000000829 suppository Substances 0.000 description 1
- 239000004094 surface-active agent Substances 0.000 description 1
- 238000013268 sustained release Methods 0.000 description 1
- 239000007939 sustained release tablet Substances 0.000 description 1
- 239000012730 sustained-release form Substances 0.000 description 1
- 239000003765 sweetening agent Substances 0.000 description 1
- 208000020408 systemic-onset juvenile idiopathic arthritis Diseases 0.000 description 1
- 230000035488 systolic blood pressure Effects 0.000 description 1
- 229940095064 tartrate Drugs 0.000 description 1
- UMOZLQVSOVNSCA-UHFFFAOYSA-N tert-butyl n-(diaminomethylidene)carbamate Chemical class CC(C)(C)OC(=O)NC(N)=N UMOZLQVSOVNSCA-UHFFFAOYSA-N 0.000 description 1
- BCNZYOJHNLTNEZ-UHFFFAOYSA-N tert-butyldimethylsilyl chloride Chemical compound CC(C)(C)[Si](C)(C)Cl BCNZYOJHNLTNEZ-UHFFFAOYSA-N 0.000 description 1
- 125000001981 tert-butyldimethylsilyl group Chemical group [H]C([H])([H])[Si]([H])(C([H])([H])[H])[*]C(C([H])([H])[H])(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 239000002562 thickening agent Substances 0.000 description 1
- 229960004072 thrombin Drugs 0.000 description 1
- 230000009424 thromboembolic effect Effects 0.000 description 1
- 229960004605 timolol Drugs 0.000 description 1
- 210000001519 tissue Anatomy 0.000 description 1
- 238000005891 transamination reaction Methods 0.000 description 1
- 230000035897 transcription Effects 0.000 description 1
- 238000013518 transcription Methods 0.000 description 1
- ITMCEJHCFYSIIV-UHFFFAOYSA-M triflate Chemical compound [O-]S(=O)(=O)C(F)(F)F ITMCEJHCFYSIIV-UHFFFAOYSA-M 0.000 description 1
- ACWBQPMHZXGDFX-QFIPXVFZSA-N valsartan Chemical compound C1=CC(CN(C(=O)CCCC)[C@@H](C(C)C)C(O)=O)=CC=C1C1=CC=CC=C1C1=NN=NN1 ACWBQPMHZXGDFX-QFIPXVFZSA-N 0.000 description 1
- 229960004699 valsartan Drugs 0.000 description 1
- 230000002792 vascular Effects 0.000 description 1
- 230000002861 ventricular Effects 0.000 description 1
- 229960001722 verapamil Drugs 0.000 description 1
- 125000000391 vinyl group Chemical group [H]C([*])=C([H])[H] 0.000 description 1
- 229920002554 vinyl polymer Polymers 0.000 description 1
- 235000019156 vitamin B Nutrition 0.000 description 1
- 239000011720 vitamin B Substances 0.000 description 1
- 239000011718 vitamin C Substances 0.000 description 1
- 235000019154 vitamin C Nutrition 0.000 description 1
- 238000009736 wetting Methods 0.000 description 1
- 239000000080 wetting agent Substances 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D213/00—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members
- C07D213/02—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members
- C07D213/04—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D213/24—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom with substituted hydrocarbon radicals attached to ring carbon atoms
- C07D213/36—Radicals substituted by singly-bound nitrogen atoms
- C07D213/40—Acylated substituent nitrogen atom
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
- A61P7/02—Antithrombotic agents; Anticoagulants; Platelet aggregation inhibitors
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/04—Inotropic agents, i.e. stimulants of cardiac contraction; Drugs for heart failure
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/06—Antiarrhythmics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/12—Antihypertensives
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D213/00—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members
- C07D213/02—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members
- C07D213/04—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D213/24—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom with substituted hydrocarbon radicals attached to ring carbon atoms
- C07D213/44—Radicals substituted by doubly-bound oxygen, sulfur, or nitrogen atoms, or by two such atoms singly-bound to the same carbon atom
- C07D213/46—Oxygen atoms
- C07D213/48—Aldehydo radicals
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D213/00—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members
- C07D213/02—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members
- C07D213/04—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D213/60—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D213/62—Oxygen or sulfur atoms
- C07D213/63—One oxygen atom
- C07D213/65—One oxygen atom attached in position 3 or 5
- C07D213/66—One oxygen atom attached in position 3 or 5 having in position 3 an oxygen atom and in each of the positions 4 and 5 a carbon atom bound to an oxygen, sulphur, or nitrogen atom, e.g. pyridoxal
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings
- C07D401/06—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings linked by a carbon chain containing only aliphatic carbon atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings
- C07D401/12—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings linked by a chain containing hetero atoms as chain links
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Cardiology (AREA)
- Veterinary Medicine (AREA)
- General Chemical & Material Sciences (AREA)
- Medicinal Chemistry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Pharmacology & Pharmacy (AREA)
- Life Sciences & Earth Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Heart & Thoracic Surgery (AREA)
- Hospice & Palliative Care (AREA)
- Urology & Nephrology (AREA)
- Vascular Medicine (AREA)
- Diabetes (AREA)
- Hematology (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Pyridine Compounds (AREA)
- Plural Heterocyclic Compounds (AREA)
Description
- Gebiet der Erfindung
- Die vorliegende Erfindung bezieht sich auf Pyridoxin- und Pyridoxalanalogverbindungen sowie Pyridoxin- und Pyridoxalanalogverbindungen enthaltende pharmazeutische Zusammensetzungen. Die Pyridoxin- und Pyridoxalanaloge können bei der Behandlung kardiovaskulärer oder verwandter Erkrankungen und deren Symptomen eingesetzt werden.
- Hintergrund der Erfindung
- Pyridoxal-5'-phosphat (PLP), ein Endprodukt des Vitamin B6-Metabolismus, spielt eine lebenswichtige Rolle bei der Gesundheit von Säugern. Vitamin B6 bezieht sich typischerweise auf Pyridoxin, das chemisch als 2-Methyl-3-hydroxy-4,5-di(hydroxymethyl)pyridin bekannt ist und durch Formel I dargestellt wird:
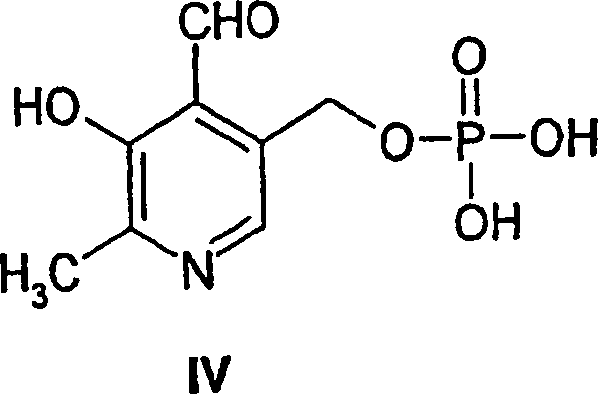
- Zwei weitere Verbindungen, Pyridoxal der Formel II und Pyridoxamin der Formel III werden ebenfalls als Vitamin B6 bezeichnet. Alle drei Verbindungen dienen als Vorstufen für Pyridoxal-5'-phosphat (PLP), das chemisch als 3-Hydroxy-2-methyl-5-[(phosphonooxy)methyl]-4-pyridincarboxaldehyd bekannt ist und durch Formel IV dargestellt wird:
- PLP ist die biologisch aktive Form des Vitamin B6 in Zellen und Blutplasma. Säuger können PLP nicht de novo synthetisieren und müssen auf Nahrungsquellen der Vorstufen Pyridoxin, Pyridoxal und Pyridoxamin, die zu PLP verstoffwechselt werden, zurückgreifen. Säuger produzieren PLP z.B. durch Phosphorylierung von Pyridoxin mittels Pyridoxalkinasewirkung und anschließende Oxidation des phosphorylierten Produktes.
- PLP reguliert biologische Prozesse und ist ein Cofaktor bei mehr als einhundert Enzymreaktionen. Es hat sich als Antagonist eines purinergen Rezeptors und damit als die ATP-Bindung beeinträchtigend erwiesen, ist an der Modulation der Plättchenaggregation beteiligt, ist ein Inhibitor bestimmter Phosphataseenzyme und ist an der Steuerung der Gentranskription beteiligt. In früheren Patenten (
US 6,051,587 undUS 6,043,259 ) ist die Rolle von Pyridoxal-5'-phosphat und seinen Vorstufen Pyridoxal und Pyridoxin (Vitamin B6) bei der Vermittlung kardiovaskulärer Gesundheit und der Behandlung kardiovaskulärer oder verwandter Erkrankungen offenbart. PLP ist außerdem ein Coenzym bei bestimmten enzymkatalysierten Prozessen, z.B. bei der Glycogenolyse auf der Glycogenphosphorylaseebene, bei der Malat-Asparatat-Shuttle-Glycolyse und -Glycogenolyse auf der Transaminierungsebene und beim Homocysteinmetabolismus. - Es besteht Bedarf an der Identifizierung und Verabreichung von Medikamenten, die eine oder mehrere der bekannten biologischen Wirkungen von Vitamin B6-Kongenen imitieren können, in ihrem speziellen Wirkmodus aber wirksamer sind als die Vitamin B6-Kongene.
- Zusammenfassung der Erfindung
- Die vorliegende Erfindung stellt Pyridoxin- und Pyridoxalanaloge, Pyridoxin- und Pyridoxalanaloge enthaltende pharmazeutische Zusammensetzungen und Behandlungsverfahren auf der Basis der Verabreichung therapeutisch wirksamer Mengen der Pyridoxin- und Pyridoxalanaloge bereit. Die erfindungsgemäßen Verbindungen und Zusammensetzungen können bei der Behandlung kardiovaskulärer oder verwandter Erkrankungen und deren Symptomen eingesetzt werden.
-
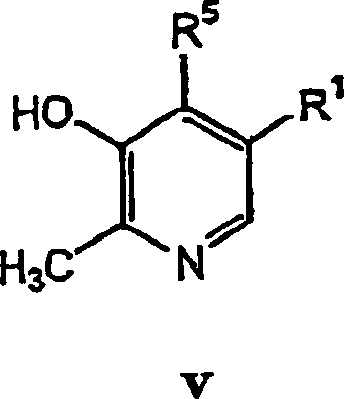
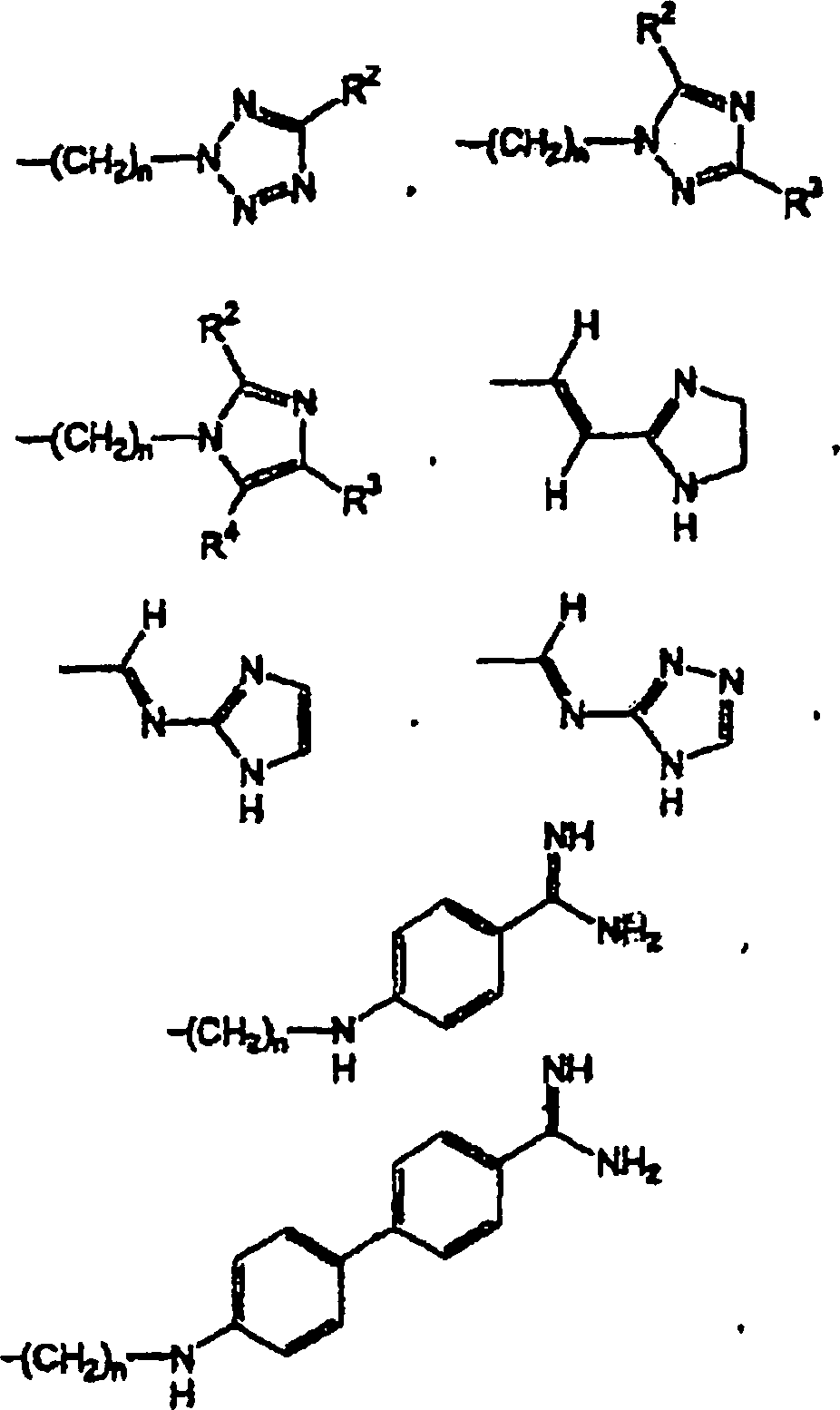
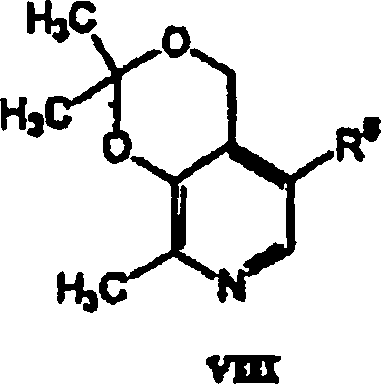
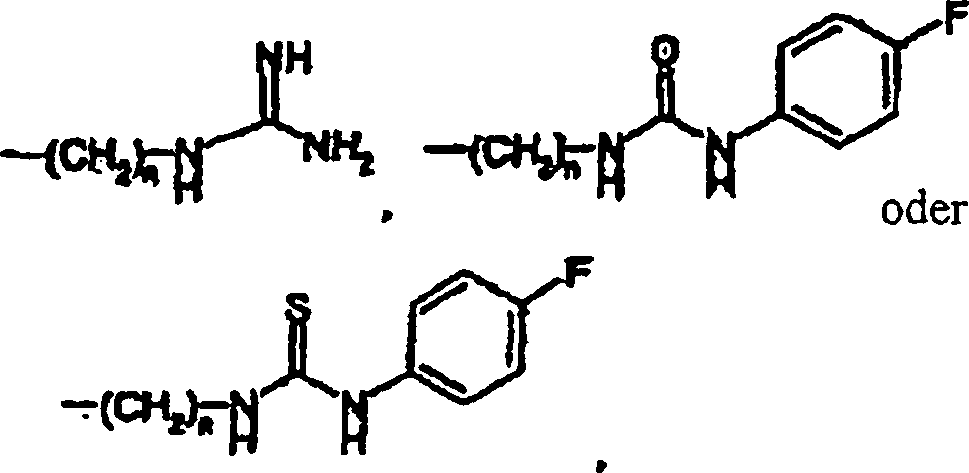
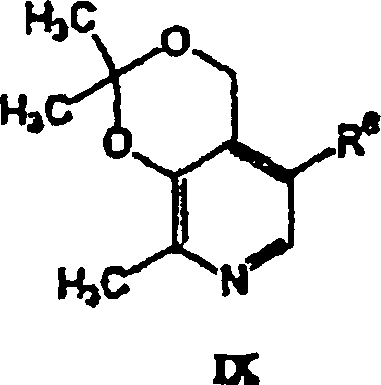
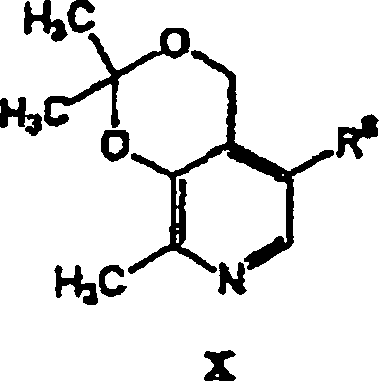
- In einem anderen Aspekt bezieht sich die Erfindung auf eine pharmazeutische Zusammensetzung, die einen pharmazeutisch annehmbaren Träger in Kombination mit einer therapeutisch wirksamen Menge einer Verbindung der Formel V oder eines pharmazeutisch annehmbaren Säureadditionssalzes einer Verbindung der Formel V enthält.
- In einem weiteren Aspekt bezieht sich die Erfindung auf die Verwendung einer Verbindung der Formel V bei der Herstellung eines Medikaments, das in einem Verfahren zur Behandlung kardiovaskulärer oder verwandter Erkrankungen und deren Symptomen nützlich ist. Das Verfahren beinhaltet die Verabreichung einer Verbindung der Formel V oder eines pharmazeutisch annehmbaren Säureadditionssalzes einer Verbindung der Formel V in einer Einheitsdosierungsform an einen Säuger. Das Verfahren kann weiterhin die gleichzeitige Verabreichung eines weiteren Therapeutikums beinhalten.
- Detaillierte Beschreibung der Erfindung
- Die Erfindung stellt Pyridoxal- und Pyridoxinanaloge sowie diese Pyridoxin- und Pyridoxalanaloge enthaltende pharmazeutische Zusammensetzungen bereit. Die Pyridoxin- und Pyridoxalanaloge können bei der Behandlung kardiovaskulärer oder verwandter Erkrankungen und deren Symptomen eingesetzt werden.
- Kardiovaskuläre oder verwandte Erkrankungen sind z.B. cerebrale Ischämie, Hirnblutung, ischämischer Schlaganfall, hämorrhagischer Schlaganfall, Bluthochdruck, Myokardinfarkt, Ischämie/Reperfusionsverletzung, myokardiale Ischämie, dekompensierte Herzinsuffizienz, Blutgerinnungsstörungen, Herzhypertrophie und Plättchenaggregation. Kardiovaskuläre oder verwandte Erkrankungen sind weiterhin Erkrankungen, die sich aus thrombotischen und prothrombotischen Zuständen ergeben, bei denen die Gerinnungskaskade aktiviert wird, z.B. tiefe Venenthrombose, disseminierte intravaskuläre Koagulopathie und Lungenembolie.
- Herzinsuffizienz ist ein pathophysiologischer Zustand, bei dem das Herz das Blut nicht mehr in der Geschwindigkeit pumpen kann, wie es für die Metabolisierung der Gewebe notwendig ist, bzw. nur noch bei erhöhtem Fülldruck (erhöhter Last). Daher ist das Herz nur noch in verringertem Maße in der Lage, die Arbeitslast zu bewältigen. Im Laufe der Zeit führt dieser Zustand zur Ansammlung überschüssiger Flüssigkeit, z.B. einem peripheren Ödem, was als dekompensierte Herzinsuffizienz bezeichnet wird.
- Wird auf eine Herzkammer ein übermäßiger Druck oder eine übermäßige Volumenlast ausgeübt, entwickelt sich als Kompensationsmechanismus eine myokardiale Hypertrophie (d.h. eine Vergrößerung des Herzmuskels). Die Hypertrophie erlaubt der Herzkammer die Aufrechterhaltung einer erhöhten Last, da sich der Herzmuskel mit stärkerer Kraft zusammenziehen kann. Eine über längere Zeit einer pathologisch erhöhten Last ausgesetzte Herzkammer kann jedoch letztlich trotz des Vorliegens einer ventrikulären Hypertrophie die erhöhte Last nicht mehr aufrecht erhalten, so dass es schlussendlich zum Pumpversagen kommen kann.
- Herzinsuffizienz kann sich aus jeder Erkrankung des Herzens, die den Kreislauf beeinträchtigt, entwickeln. Beispielsweise schwächt eine Erkrankung, die die Arbeitslast des Herzmuskels erhöht, z.B. Bluthochdruck, letztendlich die Kontraktionskraft des Herzens. Bluthochdruck ist ein Zustand, bei dem der Widerstand gegen den Blutfluss im Gefäßsystem erhöht ist. Dieser Widerstand führt zu einem erhöhten systolischen und/oder diastolischen Blutdruck. Bluthochdruck setzt das linksventrikuläre Myokard unter erhöhten Druck, was dazu führt, dass sich dieses versteift und hypertrophiert, und beschleunigt die Entwicklung einer Atherosklerose in den Koronararterien. Die Kombination aus erhöhter Beanspruchung und verringerter Versorgung erhöht die Wahrscheinlichkeit einer myokardialen Ischämie, die zu Myokardinfarkt, plötzlichem Tod, Arrhythmien und dekompensierter Herzinsuffizienz führen kann.
- Ischämie ist ein Zustand, bei dem ein Organ oder ein Teil des Körpers nicht mehr ausreichend mit Blut versorgt wird. Wird ein Organ nicht ausreichend mit Blut versorgt, ist es hypoxisch. Ein Organ wird auch hypoxisch, wenn die Blutversorgung nur vorübergehend zum Erliegen kommt, z.B. während einer Operation oder eines vorübergehenden Arterienverschlusses. Ischämie führt zunächst zu einer Abnahme oder einem Verlust der Kontraktionsaktivität. Ist das betroffene Organ das Herz, ist dieser Zustand als myokardiale Ischämie bekannt. Myokardiale Ischämie führt zunächst zu einer pathologischen elektrischen Aktivität; diese kann eine Arrhythmie erzeugen. Bei ausreichendem Schweregrad und Dauer der myokardialen Ischämie können Zellverletzungen zum Zelltod, d.h. Myokardinfarkt, und anschließend zu einer Herzinsuffizienz, Hypertrophie oder dekompensierten Herzinsuffizienz führen.
- Zu einer ischämischen Reperfusion des Organs kommt es, wenn das Blut nach der vorübergehenden Unterbrechung des Blutflusses wieder in das Organ strömt. Die Reperfusion eines ischämischen Myokards kann z.B. die Auswirkungen eines Koronarverschlusses, eines Zustandes, der zu myokardialer Ischämie führt, kompensieren. Eine ischämische Reperfusion in das Myokard kann zu einer Reperfusionsarrhythmie oder einer Reperfusionsverletzung führen. Der Schweregrad der Reperfusionsverletzung wird von zahlreichen Faktoren bestimmt, z.B. von der Dauer und dem Schweregrad der Ischämie der und Geschwindigkeit der Reperfusion. Zu den bei einer ischämischen Reperfusionsverletzung beobachteten Zuständen gehören Neutrophileninfiltration, Nekrose und Apoptose.
- Pyridoxal- und Pyridoxinanalogverbindungen
-
- Der Begriff „Alkyl", wie er hierin verwendet wird, bezieht sich auf eine gerade oder verzweigte gesättigte aliphatische Kohlenwasserstoffkette mit 1 bis 8 Kohlenstoffatomen, z.B. Methyl, Ethyl, Propyl, Isopropyl-(1-methylethyl), Butyl, tert-Butyl-(1,1-dimethylethyl) und dergleichen. Die Alkylkette kann durch ein Heteroatom, z.B. ein Stickstoff-, Schwefel- oder Sauerstoffatom, unter-brochen sein, so dass Alkylaminoalkyl, Alkylthioalkyl oder Alkoxyalkyl entsteht. Beispiele für eine durch Heteroatome unterbrochene Alkylkette sind Methylaminoethyl, Ethylthiopropyl, Methoxymethyl und dergleichen. Das Alkyl kann am endständigen Kohlenstoff mit Gruppen wie Hydroxy, Alkoxy, Alkanoyloxy, Alkoxycarbonyl oder Carboxy substituiert sein. Der Begriff „Alkoxy" bezieht sich auf eine mit einem Sauerstoffatom verbundene Alkylgruppe. In einigen Ausführungsformen besitzt das Alkoxy 1 bis 4 Kohlenstoffatome in einer geraden oder verzweigten Kette, z.B. Methoxy, Ethoxy, Propoxy, Isopropoxy-(1-methlethoxy), Butoxy, tert-Butoxy-(1,1-dimethylethoxy) und dergleichen.
-
- Beispiele für ein Alkanoyloxy sind Methanoyloxy, Ethanoyloxy, Propanoyloxy und dergleichen.
- Der Begriff „Halo" bezieht sich auf eine Brom-, Chlor- oder Fluorgruppe. In einigen Ausführungsformen ist Halo Fluor.
- Pharmazeutisch annehmbare Säureadditionssalze der Verbindungen der Formel V sind z.B. die von nicht-toxischen anorganischen Säuren wie Salz-, Salpeter-, Phosphor-, Schwefel-, Bromwasser-stoff-, Jodwasserstoff, Fluorwasserstoff-, Phosphonsäure und dergleichen abgeleiteten Salze sowie die von nicht-toxischen organischen Säuren wie aliphatischen Mono- und Dicarbonsäuren, phenyl-substituierten Alkansäuren, Hydroxyalkansäuren, Alkandicarbonsäuren, aromatischen Säuren, aliphatischen und aromatischen Sulfonsäuren, usw. abgeleiteten Salze. Solche Salze sind daher z.B. Sulfat, Pyrosulfat, Bisulfat, Sulfit, Bisulfit, Nitrat, Phosphat, Monohydrogenphosphat, Dihydrogenphosphat, Metaphosphat, Pyrophosphat, Chlorid, Bromid, Jodid, Acetat, Trifluoracetat, Propionat, Caprylat, Isobutyrat, Oxalat, Malonat, Succinat, Suberat, Sebacat, Fumarat, Maleat, Mandelat, Benzoat, Chlorbenzoat, Methylbenzoat, Dinitrobenzoat, Phthalat, Benzolsulfonat, Toluolsulfonat, Phenylacetat, Citrat, Lactat, Maleat, Tartrat, Methansulfonat und dergleichen. Es werden auch Salze von Aminosäuren wie Arginat und dergleichen sowie Gluconat, Galacturonat, N-Methylglutamin, usw. erwogen (siehe z.B. Berge et al., J. Pharmaceutical Science, 66:1-19, 1977). Die Säureadditionssalze der basischen Verbindungen werden auf herkömmliche Weise durch Kontaktieren der freien Basenform mit einer ausreichenden Menge der gewünschten Säure zur Bildung des Salzes hergestellt. Die freie Basenform kann durch Kontaktieren der Salzform mit einer Base und Isolieren der freien Base auf herkömmliche Weise wiederhergestellt werden. Zwar unterscheiden sich die freien Basenformen bezüglich bestimmter physikalischer Eigenschaften wie Löslichkeit in polaren Lösungsmitteln etwas von ihren jeweiligen Salzformen, doch ansonsten entsprechen die Salze ihrer jeweiligen freien Base für die erfindungsgemäßen Zwecke.
-
-
-
-
-
-
- Verfahren zur Herstellung der Pyridoxal- und Pyridoxinanalogverbindungen
- Ein weiterer Aspekt der Erfindung stellt ein Verfahren zur Herstellung der Pyridoxin- und Pyridoxalanaloge bereit. Die erfindungsgemäßen Verbindungen lassen sich aus einer Verbindung der Formel VI, VII, VIII, IX oder X herstellen. VI R6 = (CH2)pOH mit p = 1 bis 5
VII R6 = CH2)qBr mit q = 1 bis 5
VIII R6 = (CH2)rCOH mit r = 0 bis 4
IX R6 = (CH2)sN3 mit s = 1 bis 5
X R6 = (CH2)tNH2 mit t = 1 bis 5 - Zur Bildung der Verbindungen der Formel V durch eine Reihe chemischer Reaktionen zur Herstellung der Pyridoxinanaloge kann eine Verbindung der Formel VI, VII, VIII, IX oder X verwendet werden. Die Pyridoxinanaloge können anschließend oxidiert werden, so dass die entsprechenden Pyridoxalanaloge entstehen.
- In einigen Ausführungsformen der Erfindung werden die Pyridoxin- und Pyridoxalanaloge durch Umsetzung einer Bromidverbindung der Formel VII mit einem substituierten oder nicht-substituierten Tetrazol, einem substituierten oder nicht-substituierten Triazol oder einem substituierten oder nicht-substituierten Imidazol hergestellt. Das Tetrazol, Triazol oder Imidazol kann mit einem Aryl, Biaryl, Amino, Acylamino, Anilino oder Guanidin substituiert sein. Ein Aryl oder Biaryl kann weiterhin mit einer Cyano-, Alkyl-, Alkoxy-, Amino-, Hydroxy-, Halo-, Nitro- oder Alkanoyloxygruppe substituiert sein. Ein Anilin kann weiterhin mit einer Cyano-, Alkyl-, Alkoxy-, Amino-, Hydroxy-, Halo-, Nitro- oder Alkanoyloxygruppe substituiert sein. Wie in Schema 1 dargestellt kann zur Herstellung des Derivats XI z.B. eine Bromidverbindung der Formel VII (q = 1) mit 1H-Tetrazol umgesetzt werden. Das Derivat XI wird anschließend mit Essigsäure behandelt, so dass 5-Tetrazolpyridoxin XII entsteht. Zur Herstellung des entsprechendes Pyridoxals XIII kann 5-Tetrazolpyridoxin XII in Gegenwart eines Katalysators wie z.B. Mangandioxid oxidiert werden. Schema 1
- In anderen Ausführungsformen der Erfindung wird durch Umsetzung eines Alkohols der Formel VI mit einem geeigneten Oxidationsmittel wie z.B. Mangandioxid ein Aldehyd der Formel VIII hergestellt. Die Pyridoxin- und Pyridoxalanaloge der Formel V werden durch Umsetzung eines Aldehyds der Formel VIII mit einem substituierten oder nicht-substituierten Triazol, einem substituierten oder nicht-substituierten Imidazol oder einem substituierten oder nicht-substituierten Anilin hergestellt. Das Triazol oder Imidazol kann mit einem Aryl, Biaryl, Amino, Acylamino, Anilino oder Guanidin substituiert sein. Ein Aryl oder Biaryl kann weiterhin mit einer Cyano-, Alkyl-, Alkoxy-, Amino-, Hydroxy-, Halo-, Nitro- oder Alkanoyloxygruppe substituiert sein. Ein Anilin kann weiterhin mit einer Cyano-, Alkyl-, Alkoxy-, Amino-, Hydroxy-, Halo-, Nitro- oder Alkanoyloxygruppe substituiert sein.
-
- In einem anderen Beispiel kann eine erfindungsgemäße Verbindung wie in Schema 3 dargestellt durch Umsetzung eines Aldehyds der Formel VIII (r = 0) mit 4-Cyanoanilin zu einer Schiffschen Base hergestellt werden. Die Schiffsche Base XXXII wird mit einem starken Reduktionsmittel wie z.B. Natriumborhydrid umgesetzt. Das entstandene Amin XXXIII kann in Gegenwart von trockenem Wasserstoffchloridgas mit Ethanol zu einer Verbindung der Formel XXXIV reagieren. Die Verbindung der Formel XXXIV kann zur Bildung der Verbindung der Formel XXXV mit 2M NH3 in MeOH in einem Druckbehälter behandelt werden. Schema 3 In einer anderen Ausführungsform zur Herstellung der Verbindungen der Formel V kann ein Amin der Formel X mit einem substituierten Guanidin reagieren.
-
- In einer anderen Ausführungsform zur Herstellung der Verbindungen der Formel V ist ein Azid der Formel IX die Vorstufe. Die Isopropylidengruppe wird zunächst hydrolysiert. Die in der Hydrolysereaktion gebildeten Hydroxygruppen werden anschließend durch Umsetzung mit einem Reagens wie z.B. tert-Butyldimethylsilylchlorid geschützt. Die Azidgruppe kann zu einer Amin-guppe hydriert werden. Die entstandene Aminverbindung kann mit einer aromatischen Gruppe reagieren, die ein substituiertes oder nicht-substituiertes Aryl- oder Biarylisocyanat oder ein substituiertes Thioisocyanat enthält. Das Aryl oder Biaryl kann mit einem Cyano, Alkyl, Alkoxy, Amino, Hydroxy, Halo, Nitro oder Alkanoyloxy substituiert sein. Die nach der Hydrolysereaktion zugesetzten Schutzgruppen können entfernt werden, so dass eine Pyridoxinverbindung entsteht.
- Wie in Schema 5 dargestellt kann z.B. eine mit Arylharnstoff und Arylthioharnstoff substituierte erfindungsgemäße Verbindung mittels einer Azidverbindung der Formel IX (s = 1) hergestellt werden. Die Isopropylidengruppe kann durch Behandlung mit Essigsäure hydrolysiert werden, so dass eine Verbindung der Formel XLI entsteht. Die ungeschützten Hydroxylgruppen werden mit tert-Butyldimethylsilylchlorid zu XLII umgesetzt. Die Azidgruppe kann in Gegenwart eines Katalysators mit Wasserstoff zu dem Amin XLIII hydriert werden. Das Amin kann mit 4-Fluorphenylisocyanat zu der Verbindung XLIV reagieren. Die Synthese der Verbindungen XLVI und XLVII erfolgt nach dem für XLIV und XLV dargelegten Verfahren unter Verwendung von 4-Fluorphenylthioisocyanat anstelle von 4-Fluorphenylisocyanat. Schema 5
- Die Produkte der hierin beschriebenen Reaktionen werden mittels herkömmlicher Verfahren wie Extraktion, Destillation, Chromatographie und dergleichen isoliert.
- Der Fachmann kann aus den dargestellten oder anderweitig bekannten Analogreaktionen auch andere Variationen der Reaktionsreihenfolge und geeigneten Reaktionsbedingungen erkennen, die in den zuvor beschriebenen Verfahren zur Herstellung der Verbindungen der Formel V hierin geeigneterweise eingesetzt werden können.
- Pharmazeutische Zusammensetzungen
- Zwar kann die erfindungsgemäße Pyridoxin- und Pyridoxalanalogverbindung allein in einer Einheitsdosierungsform verabreicht werden, doch die Verbindungen werden typischerweise in Form einer pharmazeutischen Zusammensetzung in Mischung als Einheitsdosierungsform verabreicht. Die Erfindung stellt pharmazeutische Zusammensetzungen bereit, die mindestens eine Pyridoxin- oder Pyridoxalanalogverbindung der Formel V enthält. Eine pharmazeutische Zusammensetzung umfasst einen pharmazeutisch annehmbaren Träger in Kombination mit einer Verbindung der Formel V oder einem pharmazeutisch annehmbaren Säureadditionssalz einer Verbindung der Formel V.
- Pharmazeutisch annehmbare Träger sind z.B., aber nicht ausschließlich physiologische Kochsalzlösung, Ringer-Lösung, phosphatgepufferte Kochsalzlösung und andere im Stand der Technik bekannte Träger. Pharmazeutische Zusammensetzungen können auch Zusatzstoffe wie z.B. Stabilisatoren, Antioxidationsmittel, Farbmittel, Arzneimittelträger, Bindemittel, Verdickungsmittel, Dispersionsmittel, Resorptionsverstärker, Puffer, Tenside, Konservierungsmittel, Emulgatoren, Isotonisierungsmittel und Verdünnungsmittel einschließen. Pharmazeutisch annehmbare Träger und Zusatzstoffe werden so ausgewählt, dass die Nebenwirkungen der pharmazeutischen Verbindung minimiert werden und das Leistungsvermögen der Verbindung nicht verloren geht oder bis zu einem Grad inhibiert wird, dass die Behandlung unwirksam ist.
- Verfahren zur Herstellung pharmazeutischer Zusammensetzungen aus einem pharmazeutisch annehmbaren Träger in Kombination mit einer therapeutischen Verbindung der Formel V oder einem pharmazeutisch annehmbaren Säureadditionssalz einer Verbindung der Formel V sind dem Fachmann bekannt. Alle Verfahren können den Schritt des Kontaktierens der erfindungsgemäßen Verbindung mit dem Träger und den Zusatzstoffen einschließen. Die Formulierungen werden im Allgemeinen durch gleichmäßiges und intimes Kontaktieren der erfindungsgemäßen Verbindung mit einem flüssigen Träger und/oder einem fein verteilten festen Träger und ggf. anschließendes Formen des Produkts zu den gewünschten Einheitsdosierungsformen hergestellt.
- Zur oralen Verabreichung als Suspension können die Zusammensetzungen nach im Stand der Technik bekannten Techniken zur pharmazeutischen Formulierung hergestellt werden. Die Zusammensetzungen können mikrokristalline Cellulose zur Verleihung von Volumen, Alginsäure oder Natriumalginat als Suspensionsmittel, Methylcellulose als Viskositätsverstärker sowie Süßungsmittel oder Aromastoffe enthalten. Als Tabletten mit sofortiger Freisetzung können die Zusammensetzungen mikrokristalline Cellulose, Stärke, Magnesiumstearat und Lactose oder andere im Stand der Technik bekannte Arzneimittelträger, Bindemittel, Streckmittel, Aufschlussmittel, Verdünnungsmittel und Schmiermittel enthalten.
- Zur Verabreichung mittels Inhalation oder als Aerosol können die Zusammensetzungen nach im Stand der Technik bekannten Techniken zur pharmazeutischen Formulierung hergestellt werden. Die Zusammensetzungen können mit Benzylalkohol oder anderen geeigneten Konservierungs-mitteln, Absorptionsverstärkern zur Verbesserung der Bioverfügbarkeit, Fluorkohlenwasserstoffen oder anderen im Stand der Technik bekannten Lösungsvermittlern oder Dispersionsmitteln als Lösungen in Kochsalzlösung hergestellt werden.
- Zur Verabreichung als injizierbare Lösungen oder Suspensionen können die Zusammensetzungen nach im Stand der Technik bekannten Techniken mit geeigneten Dispersions- oder Benetzungs- und Suspensionsmitteln wie sterilen Ölen, z.B. synthetischen Mono- oder Diglyceriden, und Fettsäuren wie Oleinsäure formuliert werden.
- Zur rektalen Verabreichung als Zäpfchen können die Zusammensetzungen durch Mischen mit einem geeigneten, nicht reizenden Arzneimittelträger wie z.B. Kakaobutter, synthetischen Glycerid-estern oder Polyethylenglycolen, die bei Umgebungstemperaturen fest sind, sich aber im Rektum verflüssigen oder auflösen, so dass das Medikament freigesetzt wird, hergestellt werden.
- Medizinische Verwendung von Pyridoxal- und Pyridoxinanalogverbindungen
- In einem anderen Aspekt der Erfindung wird die Verwendung der Verbindungen der Formel V bei der Herstellung eines Medikaments zur Behandlung kardiovaskulärer oder verwandter Erkrankungen und deren Symptomen bereitgestellt.
- Die Begriffe „Behandlung" und „behandeln", wie sie hierin verwendet werden, schließen die Vorbeugung, Inhibierung, Linderung und Heilung kardiovaskulärer oder verwandter Vitamin B6-Erkrankungen oder deren Symptomen ein. Die Behandlung kann durch Verabreichung einer therapeutisch wirksamen Menge einer erfindungsgemäßen Verbindung erfolgen. Der Begriff „therapeutisch wirksame Menge", wie er hierin verwendet wird, ist eine prophylaktische Menge, z.B. eine Menge, die den zuvor genannten Erkrankungen und deren Symptomen wirksam vorbeugt oder vor diesen schützt, oder eine Menge, die die zuvor genannten Erkrankungen und deren Symptome wirksam lindert oder heilt.
- Ein Arzt oder Veterinär mit normaler Fachkenntnis kann einen Säuger, der Symptome einer oder mehrerer der zuvor beschriebenen Erkrankungen aufweist, leicht feststellen. Ungeachtet des ausgewählten Verabreichungsweges kann eine Verbindung der Formel V oder ein pharmazeutisch annehmbares Säureadditionssalz einer Verbindung der Formel V mittels herkömmlicher, im pharmazeutischen Stand der Technik bekannter Verfahren zu pharmazeutisch annehmbaren Einheitsdosierungsformen formuliert werden. Bei der Behandlung wird eine wirksame aber nicht-toxische Menge der Verbindung eingesetzt. Die Verbindungen können in enteralen Einheitsdosierungsformen wie z.B. als Tabletten, Retard-Tabletten, magensaftresistente Tabletten, Kapseln, Retard-Kapseln, magensaftresistente Kapseln, Pillen, Pulver, Granulate, Lösungen und dergleichen verabreicht werden. Sie können auch parenteral, z.B. subkutan, intramuskulär, intradermal, intramammär, intravenös und nach anderen im Stand der Technik bekannten Verabreichungsverfahren verabreicht werden.
- Ein Arzt oder Veterinär mit normaler Fachkenntnis kann die therapeutisch wirksame Menge der Verbindung zur Behandlung der Erkrankung, gegen die die Behandlung verabreicht wird, leicht feststellen und verschreiben. Dabei kann der Arzt oder Veterinär zunächst relativ niedrige Dosierungen anwenden und die Dosis nachfolgend bis zum Erreichen einer maximalen Response steigern. Typischerweise werden die jeweilige Erkrankung, der Schweregrad der Erkrankung, die zu verabreichende Verbindung, der Verabreichungsweg und die Charakteristiken des zu behandelnden Säugers, z.B. Alter, Geschlecht und Gewicht bei der Bestimmung der wirksamen Verabreichungsmenge berücksichtigt. Die Verabreichung einer therapeutischen Menge einer erfindungsgemäßen Verbindung zur Behandlung kardiovaskulärer oder verwandter Erkrankungen und deren Symptomen liegt im Bereich von 0,1 bis 100 mg/kg Körpergewicht des Patienten, noch bevorzugter im Bereich von 0,5 bis 50 mg/kg Körpergewicht des Patienten als Tagesdosis. Die Verbindung kann kurz- oder langfristig verabreicht werden. Auch wenn im Einzelfall das Gegenteil zutreffen kann, wird die kurzfristige Verabreichung, z.B. über 30 Tage oder weniger, einer Dosis von mehr als 25 mg/kg Körpergewicht des Patienten einer langfristigen Verabreichung vorgezogen. Ist eine langfristige Verabreichung, z.B. über Monate oder Jahre, notwendig, überschreitet die vorgeschlagene Dosis für gewöhnlich 25 mg/kg Körpergewicht des Patienten nicht.
- Eine therapeutisch wirksame Menge einer Verbindung der Formel V oder eines pharmazeutisch annehmbaren Säureadditionssalzes einer Verbindung der Formel V zur Behandlung der zuvor genannten Erkrankungen oder deren Symptomen kann vor, gleichzeitig oder nach Einsetzen der Erkrankung oder des Symptoms verabreicht werden. Eine erfindungsgemäße Verbindung kann gleichzeitig verabreicht werden. Die Begriffe „gleichzeitige Verabreichung" und „gleichzeitig verabreicht", wie sie hierin verwendet werden, beinhalten die Verabreichung einer erfindungsgemäßen Verbindung in Mischung mit einem anderen Therapeutikum, z.B. in einer pharmazeutischen Zusammensetzung bzw. Lösung, oder separat, z.B. als separate pharmazeutische Zusammensetzungen oder Lösungen, die nacheinander, gleichzeitig oder zu verschiedenen Zeitpunkten verabreicht werden, jedoch zeitlich nicht so weit auseinander liegend, dass die erfindungsgemäße Verbindung und das andere Therapeutikum nicht miteinander in Wechselwirkung treten können und keine niedrigere Dosierung des Wirkstoffes verabreicht werden kann.
- Das Verfahren zur Behandlung kardiovaskulärer oder verwandter Erkrankungen umfasst außerdem die Verabreichung einer therapeutisch wirksamen Menge einer Verbindung der Formel V oder eines pharmazeutisch annehmbaren Säureadditionssalzes einer Verbindung der Formel V in einer Einheitsdosierungsform an einen Säuger. Die kardiovaskulären oder verwandten Erkrankungen, die behandelt werden können, sind z.B. Hypertrophie, Bluthochdruck, dekompensierte Herzinsuffizienz, Herzinsuffizienz nach Myokardinfarkt, myokardiale Ischämie, cerebrale Ischämie, Ischämie/Reperfusionsverletzung, Arrhythmie, Blutgerinnungsstörungen oder Plättchenaggregation. Vorzugsweise ist die behandelte kardiovaskuläre Erkrankung Hypertrophie, dekompensierte Herzinsuffizienz, Arrhythmie oder Ischämie/Reperfusionsverletzung.
- Die erfindungsgemäße Verbindung kann auch zur Behandlung kardiovaskulärer Erkrankungen oder anderer Erkrankungen, die sich aus thrombotischen und prothrombotischen Zuständen, bei denen die Gerinnungskaskade aktiviert wird, ergeben, verabreicht werden, z.B. tiefe Venenthrombose, disseminierte intravaskuläre Koagulopathie, Kasabach-Merritt-Syndrom, Lungenembolie, Myokardinfarkt, Schlaganfall, thromboembolische OP-Komplikationen und peripherer Arterienverschluss. Die erfindungsgemäße Verbindung kann auch zur Behandlung von ARDS (Adult Respiratory Distress Syndrome), septischem Schock, Septikämie oder Entzündungsreaktionen wie Ödemen und akuter oder chronischer Atherosklerose nützlich sein, da sich herausgestellt hat, dass Thrombin eine große Anzahl Zellen außerhalb des Gerinnungsprozesses aktiviert, z.B. Neutrophile, Fibroblasten, Endothelzellen und Zellen der glatten Muskulatur.
- Das Verfahren zur Behandlung kardiovaskulärer oder verwandter Erkrankungen kann weiterhin die gleichzeitige Verabreichung anderer Therapeutika, die sich bekanntermaßen für die Behandlung der zuvor genannten Erkrankungen eignen, umfassen.
- Erfindungsgemäße Verfahren sind z.B. die gleichzeitige Verabreichung einer Verbindung der Formel V oder eines pharmazeutisch annehmbaren Säureadditionssalzes einer Verbindung der Formel V in Kombination mit einer therapeutischen kardiovaskulären Verbindung zur Behandlung von Hypertrophie, Bluthochdruck, dekompensierter Herzinsuffizienz, Herzinsuffizienz nach Myokardinfarkt, myokardialer Ischämie, Ischämie/Reperfusionsverletzung, Arrhythmie oder Myokardinfarkt. Vorzugsweise ist die behandelte kardiovaskuläre Erkrankung Hypertrophie, dekompensierte Herzinsuffizienz, Arrhythmie oder Ischämie/Reperfusionsverletzung.
- Andere therapeutische kardiovaskuläre Verbindungen, die gleichzeitig mit einer erfindungsgemäßen Verbindung oder Zusammensetzung verabreicht werden können, sind z.B. ein Inhibitor des Angiotensin-Converting-Enzyme, ein Angiotensin II-Rezeptor-Antagonist, ein Calciumkanalblocker, ein antithrombotisches Mittel, ein Antagonist des β-adrenergen Rezeptors, ein Vasodilatator, ein Diuretikum, ein Antagonist des α-adrenergen Rezeptors, ein Antioxidationsmittel und eine Mischung davon. In einer Ausführungsform wird eine erfindungsgemäße Verbindung gleichzeitig mit PPADS (Pyridoxalphosphat-6-azophenyl-2',4'-disulfonsäure), ebenfalls einer therapeutischen kardiovaskulären Verbindung, oder mit PPADS und einer weiteren bekannten therapeutischen kardiovaskulären Verbindung wie bereits beschrieben verabreicht.
- Vorzugsweise ist die andere therapeutische kardiovaskuläre Verbindung, die gleichzeitig mit einer Verbindung der Formel V oder einem pharmazeutisch annehmbaren Säureadditionssalz einer Verbindung der Formel V verabreicht wird, ein Inhibitor des Angiotensin-Converting-Enzyme, ein Angiotensin II-Rezeptor-Antagonist, ein Diuretikum, ein Antagonist des α-adrenergen Rezeptors oder ein Calciumkanalblocker.
- Bekannte Inhibitoren des Angiotensin-Converting-Enzyme sind z.B. Captopril, Enalapril, Lisino-pril, Benazapril, Fosinopril, Quinapril, Ramipril, Spirapril, Imidapril und Moexipril.
- Beispiele für bekannte Angiotensin II-Rezeptor-Antagonisten sind Angiotensin I-Rezeptor-Antagonisten und Angiotensin II-Rezeptor-Antagonisten. Geeignete Angiotensin II-Rezeptor-Antagonisten sind z.B. Losartan und Valsartan.
- Geeignete Calciumkanalblocker sind z.B. Verapamil, Diltiazem, Nicardipin, Nifedipin, Amlodipin, Felodipin, Nimodipin und Bepridil.
- Beispiele für bekannte Antagonisten des β-adrenergen Rezeptors sind Atenolol, Propanolol, Timolol und Metoprolol.
- Geeignete Vasodilatatoren sind z.B. Hydralazin, Nitroglycerin und Isosorbiddinitrat.
- Geeignete Diuretika sind z.B. Furosemid, Diuril, Amilorid und Hydrodiuril.
- Geeignete Antagonisten des α-adrenergen Rezeptors sind z.B. Prazosin, Doxazocin und Labetalol.
- Geeignete Antioxidationsmittel sind z.B. Vitamin B, Vitamin C und Isoflavone.
- Diese anderen therapeutischen kardiovaskulären Verbindungen werden im Allgemeinen zur Behandlung kardiovaskulärer oder verwandter Erkrankungen und deren Symptomen eingesetzt. Ein Arzt oder Veterinär mit normaler Fachkenntnis kann einen Probanden, der Symptome einer oder mehrerer der zuvor beschriebenen Erkrankungen aufweist, leicht feststellen und bestimmen, welche Verbindung sich im Allgemeinen für die Behandlung spezifischer kardiovaskulärer Zustände und Symptome eignet.
- Myokardiale Ischämie kann z.B. durch Verabreichung einer Verbindung der Formel V oder eines pharmazeutisch annehmbaren Säureadditionssalzes einer Verbindung der Formel V zusammen mit einem weiteren Therapeutikum behandelt werden. Andere geeignete Therapeutika sind z.B. ein Inhibitor des Angiotensin-Converting-Enzyme, ein Angiotensin II-Rezeptor-Antagonist, ein Calciumkanalblocker, ein antithrombotisches Mittel, ein Antagonist des β-adrenergen Rezeptors, ein Diuretikum, ein Antagonist des α-adrenergen Rezeptors oder eine Mischung davon.
- Als weiteres Beispiel kann eine dekompensierte Herzinsuffizienz durch Verabreichung einer Verbindung der Formel V oder eines pharmazeutisch annehmbaren Säureadditionssalzes einer Verbindung der Formel V zusammen mit einem weiteren Therapeutikum behandelt werden. Andere geeignete Therapeutika sind z.B. ein Inhibitor des Angiotensin-Converting-Enzyme, ein Angiotensin II-Rezeptor-Antagonist, ein Calciumkanalblocker, ein Vasodilatator, ein Diuretikum oder eine Mischung davon.
- Ein Myokardinfarkt kann durch Verabreichung einer Verbindung der Formel V oder eines pharmazeutisch annehmbaren Säureadditionssalzes einer Verbindung der Formel V zusammen mit einem weiteren Therapeutikum behandelt werden. Andere geeignete Therapeutika sind z.B. ein Inhibitor des Angiotensin-Converting-Enzyme, ein Calciumkanalblocker, ein antithrombotisches Mittel, ein Antagonist des β-adrenergen Rezeptors, ein Diuretikum, ein Antagonist des α-adrenergen Rezeptors oder eine Mischung davon.
- Bluthochdruck kann durch Verabreichung einer Verbindung der Formel V oder eines pharmazeutisch annehmbaren Säureadditionssalzes einer Verbindung der Formel V zusammen mit einem weiteren Therapeutikum behandelt werden. Andere geeignete Therapeutika sind z.B. ein Inhibitor des Angiotensin-Converting-Enzyme, ein Calciumkanalblocker, ein Antagonist des β-adrenergen Rezeptors, ein Vasodilatator, ein Diuretikum, ein Antagonist des α-adrenergen Rezeptors oder eine Mischung davon.
- Eine Arrhythmie kann durch Verabreichung einer Verbindung der Formel V oder eines pharmazeutisch annehmbaren Säureadditionssalzes einer Verbindung der Formel V zusammen mit einem weiteren Therapeutikum behandelt werden. Andere geeignete Therapeutika sind z.B. ein Calciumkanalblocker, ein Antagonist des β-adrenergen Rezeptors oder eine Mischung davon.
- Blutgerinnsel in den Arterien können durch Verabreichung einer Verbindung der Formel V oder eines pharmazeutisch annehmbaren Säureadditionssalzes einer Verbindung der Formel V zusammen mit einem antithrombotischen Mittel reduziert oder entfernt werden. Im Stand der Technik bekannte antithrombotische Mittel sind Plättchenaggregationshemmer, Aspirin und Heparin.
- Hypertrophie kann durch Verabreichung einer Verbindung der Formel V oder eines pharmazeutisch annehmbaren Säureadditionssalzes einer Verbindung der Formel V zusammen mit einem weiteren Therapeutikum behandelt werden. Andere geeignete Therapeutika sind z.B. ein Inhibitor des Angiotensin-Converting-Enzyme, ein Angiotensin II-Rezeptor-Antagonist, ein Calciumkanal-blocker oder eine Mischung davon.
- Eine Ischämie/Reperfusionsverletzung kann durch Verabreichung einer Verbindung der Formel V oder eines pharmazeutisch annehmbaren Säureadditionssalzes einer Verbindung der Formel V zusammen mit einem weiteren Therapeutikum behandelt werden. Andere geeignete Therapeutika sind z.B. ein Inhibitor des Angiotensin-Converting-Enzyme, ein Angiotensin II-Rezeptor-Antagonist, ein Calciumkanalblocker oder eine Mischung davon.
- Die vorliegende Erfindung ist weiterhin durch die nachfolgenden Beispiele gekennzeichnet.
- BEISPIELE
- Herstellung der Ausgangsmaterialien
- Das Bromid VII (q = 1) wurde nach einem Verfahren aus der Literatur hergestellt (Imperalli et al., J. Org. Chem., 60, 1891-1894, 1995). Der Alkohol VI (p = 1) wurde hergestellt, indem man HCl-Gas bei 0 bis 5°C (Eisbad) durch eine Lösung von Pyridoxinhydrochlorid (50 g, 0,24 Mol) in Aceton (500 ml) perlen ließ, bis die Lösung klar wurde. Um die Ausfällung des danach abfiltrierten Hydrochloridsalzes zu induzieren, wurde Diethylether (ca. 1 1) zugesetzt. Das Salz wurde in einer Mischung aus Methylenchlorid (ca. 1 1) und gesättigter wässriger NaHCO3 (ca. 500 ml) gelöst. Die Schichten wurden getrennt und die organische Schicht mit gesättigter wässriger NaHCO3 gewaschen. Die kombinierten organischen Schichten wurden getrocknet (MgSO4) und verdampft, so dass 40,5 g (80%) eines farblosen Feststoffes entstanden.
- Der Alkohol VI (p = 1) wurde in Dichlormethan gelöst und auf 0°C abgekühlt. Über einen Zeitraum von etwa fünf Minuten wurden kleine Mengen Triphenylphosphin bzw. N-Bromsuccinimid zugesetzt. Das Reaktionsgemisch wurde etwa 20 Minuten lang gerührt und anschließend in vacuo konzentriert. Das Rohprodukt, das Bromid VII (q = 1), wurde mittels Flash-Chromatographie unter Verwendung einer 2:1-Mischung aus Ether und Hexan als Eluierungsmittel gereinigt. Das Produkt wurde unverzüglich verwendet.
- Das Aldehyd VIII (r = 0) wurde durch Vergleich mit Literaturdaten identifiziert (Kortynk et al., J. Org. Chem., 29, 574-579, 1964). Eine Lösung des Alkohols VI (p = 1) (25 g, 119,6 mmol) in Toluol (900 ml) wurde mit MnO2 (Aldrich 21, 764-6) (49,9 g, 85%, 487 mmol) versetzt. Das entstandene Gemisch wurde bei 40°C 24 Stunden lang gerührt und anschließend durch Celite filtriert. Die Stammlösung wurde verdampft, so dass ein hellgelber Feststoff entstand. Der Feststoff wurde aus Hexan:Ethylether (1:1) umkristallisiert, so dass ein hellgelber Feststoff entstand. Der Feststoff wurde filtriert und mit Hexan:Ethylether (1:1) gewaschen, so dass das reine Aldehyd VIII (17,51 g, 71%) entstand.
- Das Azid IX (s = 1) und das Amin X (t = 1) wurden aus dem Bromid VII (q = 1) hergestellt. Das Bromid VII (q = 1) (1,08 g, 4,0 mmol) in wasserfreiem DMF (20 ml) wurde bei Raumtemperatur mit Natriumazid (260 mg, 4,0 mmol) behandelt. Nach 1- stündigem Rühren bei Raumtemperatur wurde die Lösung mit Diethylether (5 × 20 ml) extrahiert. Die kombinierten Extrakte wurden mit Wasser (10 ml) und Salzsole (10 ml) gewaschen und anschließend getrocknet (MgSO4). Das Lösungsmittel wurde verdampft und das Rohprodukt mittels Chromatographie auf Silicagel unter Verwendung von Ether:Hexan (2:1) als Eluierungsmittel gereinigt, so dass das Azid IX (s = 1) als farblose Flüssigkeit (552 mg, 60%) entstand.
1H NMR (CDCl3, TMS) δ 1,57 (s, 6H), 2,42 (s, 3H), 4,23 (s, 2H), 4,86 (s, 2H), 7,96 (s, 1H). - Das gereinigte Azid IX (s = 1) (100 mg, 0,4 mmol) wurde in 95% Ethanol gelöst und in Gegenwart eines Lindlar-Katalysators (50 mg) eine Stunden lang bei 1 atm hydriert. Der Katalysator wurde mittels Filtration (Celite) entfernt und das Lösungsmittel entfernt, so dass das Rohamin X (t = 1) entstand. Die Reinigung erfolgte mittels Chromatographie auf Silicagel unter Verwendung von CH2Cl2:MeOH (5:1) als Eluierungsmittel, so dass das Produkt (80 mg, 82%) entstand.
1H NMR (CD2Cl2) 1,53 (s, 6H), 2,34 (s, 3H), 3,72 (s, 2H), 4,91 (s, 2H), 5,31 (s, 2H), 7,93 (s, 1H). - Alle anderen, in den nachfolgenden Beispielen verwendeten Reagenzien können von Aldrich Chemical Company (Milwaukee, WI oder Allentown, PA) bezogen werden.
- Beispiel 1
-
- Ein Gemisch aus Tetrazol (94,2 mg, 1,29 mmol) und pulverisiertem wasserfreiem Kaliumcarbonat (1,5 g) in wasserfreiem Acetonitril (10 ml) wurde bei 0°C 15 Minuten lang gerührt. Dann wurde dem Reaktionsgemisch das Bromid VII (q = 1) (350 mg, 1,29 mmol) in wasserfreiem Acetonitril (3 ml) zugesetzt und die Reaktionstemperatur die nächsten 30 Minuten lang gehalten. Nach Abschluss der Reaktion lieferte die Routineaufarbeitung das Rohprodukt. Die Reinigung des Rohgemisches auf einer Silicagelsäule ergab das gewünschte Produkt XI in beträchtlicher Ausbeute.
1H NMR (CDCl3, TMS): δ 1,52 (6H, s), 2,44 (3H, s), 4,77 (2H, s), 5,47 (2H, s), 8,07 (1H, s), 8,55 (1H, s, Tetrazol-H). - Das gereinigte Derivat XI (100 mg, 0,4 mmol) wurde in 80% wässriger Essigsäure (10 ml) aufgenommen und bei 60°C 1 Stunde lang erwärmt. Die Reinigung mittels Chromatographie auf Silicagel lieferte 5-Tetrazolpyridoxin XII in guter Ausbeute.
1H NMR (CD3OD, TMS): δ 2,42 (3H, s), 4,96 (2H, s), 5,97 (2H, s), 7,92 (1H, s), 8,69 (1H, s, Tetrazol-H). - Beispiel 2
- Synthese des tetrazol-substituierten Pyridoxalanalogs der Formel XIII
- 5-Tetrazolpyridoxin XII (100 mg, 0,42 mmol) wurde in wasserfreiem Toluol (10 ml) gelöst. Der Lösung wurde aktiviertes Mangandioxid (243 mg, 2,76 mmol) zugesetzt und das Reaktionsgemisch bei 40°C 2 Stunden lang erwärmt, um eine vollständige Oxidation zu gewährleisten. Die Filtration des Katalysators und die anschließende Verdampfung des Lösungsmittels lieferten den Rohrückstand, der mittels Chromatographie auf Silicagel leicht gereinigt wurde, so dass das gewünschte Aldehyd XIII in einer Ausbeute von 70% entstand.
1H NMR (CD2Cl2, TMS): δ 2,82 (3H, s), 6,00 (1H, s), 6,15 (1H, s), 8,11 (1H, s), 8,57 (1H, s, Tetrazol-H), 10,77 (1H, s, Aldehyd-H). - Beispiel 3
-
- Eine Mischung aus Tetrazol (94,2 mg, 1,29 mmol) und pulverisiertem wasserfreiem Kaliumcarbonat (1,5 g) in wasserfreiem Acetonitril (10 ml) wurde bei 0°C 15 Minuten lang gerührt. Dann wurde das Reaktionsgemisch mit dem Bromid VII (q = 1) (350 mg, 1,29 mmol) in wasserfreiem Acetonitril (3 ml) versetzt und die nächsten 30 Minuten lang bei 0°C gehalten. Die Routineaufarbeitung lieferte das Rohprodukt. Die Reinigung des Rohgemisches mittels Chromatographie auf Silicagel ergab das gewünschte Produkt XIV in beträchtlicher Ausbeute.
1H NMR (CDCl3, TMS): δ 1,53 (6H, s), 2,42 (3H, s), 4,91 (2H, s), 5,66 (2H, s), 8,14 (1H, s), 8,50 (1H, s, Tetrazol-H). - Das gereinigte Derivat XIV (100 mg, 0,4 mmol) wurde in 80% wässriger Essigsäure (10 ml) gelöst und bei 60°C 1 Stunde lang erwärmt. Die Reinigung mittels Chromatographie auf einer Silicagelsäule lieferte 5-Tetrazolpyridoxin XV in guter Ausbeute.
1H NMR (CD3OD, TMS): δ 2,43 (3H, s), 4,89 (2H, s), 5,77 (2H, s), 7,91 (1H, s), 9,17 (1H, s, Tetrazol-H). - Beispiel 4
-
- Eine Mischung aus Aminotetrazol (110,2 mg, 1,30 mmol) und pulverisiertem wasserfreiem Kaliumcarbonat (1,5 g) in wasserfreiem Acetonitril (10 ml) wurde bei 0°C 15 Minuten lang gerührt. Dann wurde das Reaktionsgemisch mit dem Bromid VII (q = 1) (360 mg, 1,30 mmol) in wasserfreiem Acetonitril (3 ml) versetzt und die nächsten 30 Minuten lang bei 0°C gehalten. Die Routineaufarbeitung lieferte das Rohprodukt. Die Reinigung des Rohgemisches mittels Chromatographie auf einer Silicagelsäule ergab das gewünschte Produkt XVI in beträchtlicher Ausbeute.
1H NMR (CD3OD, TMS): δ 1,52 (6H, s), 2,36 (3H, s), 4,96 (2H, s), 5,56 (2H, s), 7,96 (1H, s). - Das gereinigte Derivat XVI (100 mg, 0,37 mmol) wurde in 80% wässriger Essigsäure (10 ml) gelöst und bei 60°C 1 Stunde lang erwärmt. Die Reinigung mittels Chromatographie auf Silicagel lieferte 5-Tetrazolpyridoxin XVII in guter Ausbeute.
1H NMR (CD3OD, TMS): δ 2,42 (3H, s), 4,94 (2H, s), 5,66 (2H, s), 7,91 (1H, s), 7,87 (1H, s). - Beispiel 5
-
- Eine Mischung aus Triazol (136 mg, 2,00 mmol) und pulverisiertem wasserfreiem Kaliumcarbonat (2,5 g) in wasserfreiem Acetonitril (20 ml) wurde bei 0°C 15 Minuten lang gerührt. Dann wurde das Reaktionsgemisch mit dem Bromid VII (q = 1) (720 mg, 2,00 mmol) in wasserfreiem Acetoni-tril (5 ml) versetzt und die nächsten 30 Minuten lang bei 0°C gehalten. Die Routineaufarbeitung lieferte das Rohprodukt. Die Reinigung des Rohgemisches mittels Chromatographie auf einer Silicagelsäule ergab das gewünschte Produkt XVIIIa in beträchtlicher Ausbeute.
1H NMR (CDCl3, TMS): δ 1,53 (6H, s), 2,42 (3H, s), 4,80 (2H, s), 5,24 (2H, s), 7,94 (1H, s, Triazol-H), 7,99 (1H, s, Triazol-H), 8,15 (1H, s). - Das gereinigte Derivat XVIIIa (100 mg, 0,35 mmol) wurde in 80% wässriger Essigsäure (10 ml) gelöst und bei 60°C erwärmt. Die Reinigung mittels Chromatographie auf einer Silicagelsäule lieferte 5-Triazolpyridoxin XIXa in guter Ausbeute.
1H NMR (CD3OD, TMS): δ 2,42 (3H, s), 4,91 (2H, s), 5,50 (2H, s), 7,82 (1H, s, Triazol-H), 7,97 (1H, s, Triazol-H), 8,52 (1H, s). - Beispiel 6
- Synthese des triazol-substituierten Pyridoxalanalogs der Formel XXa
- Entsprechend Schema 8 wurde 5-Triazolpyridoxin XIXa (100 mg, 0,42 mmol) in wasserfreiem Toluol (10 ml) gelöst. Der Lösung wurde aktiviertes Mangandioxid (243 mg, 2,76 mmol) zugesetzt und das Reaktionsgemisch bei 40°C 2 Stunden lang erwärmt, um eine vollständige Oxidation zu gewährleisten. Die Filtration des Katalysators und die anschließende Verdampfung des Lösungsmittels lieferten den Rohrückstand, der mittels Chromatographie auf Silicagel leicht gereinigt wurde, so dass das gewünschte Aldehyd XXa in einer Ausbeute von 70% entstand.
1H NMR (CD3OD, TMS): δ 2,70 (3H, s), 6,00 (2H, s), 6,28 (2H, s), 8,41 (1H, s, Triazol-H), 8,85 (1H, s, Triazol-H), 9,85 (1H, s). - Beispiel 7
- Synthese des triazol-substituierten Pyridoxinanalogs der Formel XIXb
- Entsprechend Schema 8 wurde eine Mischung aus 3-Aminotriazol (142 mg, 2,00 mmol) und pulverisiertem wasserfreiem Kaliumcarbonat (2,5 g) in wasserfreiem Acetonitril (20 ml) 15 Minuten lang bei 0°C gerührt. Dann wurde das Reaktionsgemisch mit dem Bromid VII (q = 1) (720 mg, 2,00 mmol) in wasserfreiem Acetonitril (5 ml) versetzt und die nächsten 30 Minuten lang bei 0°C gehalten. Die Routineaufarbeitung lieferte das Rohprodukt. Die Reinigung des Rohgemisches mittels Chromatographie auf Silicagel ergab das gewünschte Produkt XVIIIb in beträchtlicher Ausbeute.
1H NMR (CD3OD, TMS): δ 1,57 (6H, s), 2,36 (3H, s), 4,84 (2H, s), 4,99 (2H, s), 7,84 (1H, s, Triazol-H), 8,13 (1H, s). - Das gereinigte Derivat XVIIIb (100 mg, 0,35 mmol) wurde in 80% wässriger Essigsäure (10 ml) gelöst und bei 60°C 1 Stunde lang erwärmt. Die Reinigung mittels Chromatographie auf Silicagel lieferte 3-Aminotriazolpyridoxin XIXb in guter Ausbeute.
1H NMR (DMSO-d6, TMS): δ 2,34 (3H, s), 4,72 (2H, s), 5,17 (2H, s), 7,79 (1H, s, Triazol-H), 8,03 (1H, s). - Beispiel 8
- Synthese des triazol-substituierten Pyridoxinanalogs der Formel XIXc
- Entsprechend Schema 8 wurde eine Mischung aus 5-Aminotriazol (142 mg, 2,00 mmol) und pulverisiertem wasserfreiem Kaliumcarbonat (2,5 g) in wasserfreiem Acetonitril (20 ml) 15 Minuten lang bei 0°C gerührt. Dann wurde das Reaktionsgemisch mit dem Bromid VII (q = 1) (720 mg, 2,00 mmol) in wasserfreiem Acetonitril (5 ml) versetzt und die nächsten 30 Minuten lang bei 0°C gehalten. Die Routineaufarbeitung lieferte das Rohprodukt. Die Reinigung des Rohgemisches mittels Chromatographie auf Silicagel ergab das gewünschte Produkt XVIIIc in beträchtlicher Ausbeute.
1H NMR (CD3OD, TMS): δ 1,53 (6H, s), 2,36 (3H, s), 4,84 (2H, s), 5,04 (2H, s), 7,46 (1H, s, Triazol-H), 7,68 (1H, s). - Das gereinigte Derivat XVIIIc (100 mg, 0,35 mmol) wurde in 80% wässriger Essigsäure (10 ml) gelöst und bei 60°C 1 Stunde lang erwärmt. Die Reinigung mittels Chromatographie auf Silicagel lieferte 3-Aminotriazolpyridoxin XIXc in guter Ausbeute.
1H NMR (DMSO-d6, TMS): δ 2,32 (3H, s), 4,75 (2H, s), 5,11 (2H, s), 7,35 (1H, s, Triazol-H), 7,58 (1H, s). - Beispiel 9
-
- Eine Mischung aus 2-Methylimidazol (164 mg, 2,00 mmol) und pulverisiertem wasserfreiem Kaliumcarbonat (2,5 g) in wasserfreiem Acetonitril (20 ml) wurde 15 Minuten lang bei 0°C gerührt. Dann wurde das Reaktionsgemisch mit dem Bromid VII (q = 1) (720 mg, 2,00 mmol) in wasserfreiem Acetonitril (5 ml) versetzt und die nächsten 30 Minuten lang bei 0°C gehalten. Die Routineaufarbeitung lieferte das Rohprodukt. Die Reinigung des Rohgemisches mittels Chromato-graphie auf Silicagel ergab das gewünschte Produkt XXIa in beträchtlicher Ausbeute.
1H NMR (CDCl3, TMS): δ 1,51 (6H, s), 2,40 (3H, s), 2,42 (3H, s, Imidazol-CH3), 4,50 (2H, s), 4,88 (2H, s), 6,65 (1H, s, Imidazol-H), 6,93 (1H, s, Imidazol-H), 7,82 (1H, s). - Das gereinigte Derivat XXIa (100 mg, 0,35 mmol) wurde in 80% wässriger Essigsäure (10 ml) gelöst und bei 60°C 1 Stunde lang erwärmt. Die Reinigung mittels Chromatographie auf Silicagel lieferte 2-Methylimidazolpyridoxin XXIIa in guter Ausbeute.
1H NMR (DMSO-d6, TMS): δ 2,40 (3H, s), 2,21 (3H, s, Imidazol-CH3), 5,11 (2H, s), 5,20 (2H, s), 6,77 (1H, s, Imidazol-H), 6,92 (1H, s, Imidazol-H), (2H, s), 7,47 (1H, s). - Beispiel 10
- Synthese des imidazol-substituierten Pyridoxinanalogs der Formel XXIIb
- Entsprechend Schema 9 wurde eine Mischung aus 4-Methylimidazol (164 mg, 2,00 mmol) und pulverisiertem wasserfreiem Kaliumcarbonat (2,5 g) in wasserfreiem Acetonitril (20 ml) 15 Minuten lang bei 0°C gerührt. Dann wurde das Reaktionsgemisch mit dem Bromid VII (q = 1) (720 mg, 2,00 mmol) in wasserfreiem Acetonitril (5 ml) versetzt und die nächsten 30 Minuten lang bei 0°C gehalten. Die Routineaufarbeitung lieferte das Rohprodukt. Die Reinigung des Rohgemisches mittels Chromatographie auf Silicagel ergab das gewünschte Produkt XXIb in beträchtlicher Ausbeute.
1H NMR (CDCl3, TMS): δ 1,50 (6H, s), 2,43 (3H, s), 2,20 (3H, s, Imidazol-CH3), 4,54 (2H, s), 4,92 (2H, s), 6,52 (1H, s, Imidazol-H), 7,42 (1H, s, Imidazol-H), 7,94 (1H, s). - Das gereinigte Derivat XXIb (100 mg, 0,35 mmol) wurde in 80% wässriger Essigsäure (10 ml) gelöst und bei 60°C 1 Stunde lang erwärmt. Die Reinigung mittels Chromatographie auf Silicagel lieferte 4-Methylimidazolpyridoxin XXIIb in guter Ausbeute.
1H NMR (CDCl3, TMS): δ 2,20 (3H, s, Imidazol-CH3), 2,46 (3H, s), 4,72 (2H, s), 4,90 (2H, s), 6,48 (1H, s, Imidazol-H), 7,24 (1H, s, Imidazol-H), 7,84 (1H, s). - Beispiel 11
- Synthese des imidazol-substituierten Pyridoxinanalogs der Formel XXIIc
- Entsprechend Schema 9 wurde eine Mischung aus 4-Nitroimidazol (172 mg, 2,00 mmol) und pulverisiertem wasserfreiem Kaliumcarbonat (2,5 g) in wasserfreiem Acetonitril (20 ml) 15 Minuten lang bei 0°C gerührt. Dann wurde das Reaktionsgemisch mit dem Bromid VII (q = 1) (720 mg, 2,00 mmol) in wasserfreiem Acetonitril (5 ml) versetzt und die nächsten 30 Minuten lang bei 0°C gehalten. Die Routineaufarbeitung lieferte das Rohprodukt. Die Reinigung des Rohgemisches mittels Chromatographie auf Silicagel ergab das gewünschte Produkt XXIc in beträchtlicher Ausbeute.
1H NMR (CDCl3, TMS): δ 1,52 (6H, s), 2,42 (3H, s), 4,60 (2H, s), 5,09 (2H, s), 7,46 (1H, s, Imidazol-H), 7,69 (1H, s, Imidazol-H), 8,01 (1H, s). - Das gereinigte Derivat XXIc (110 mg, 0,35 mmol) wurde in 80% wässriger Essigsäure (10 ml) gelöst und bei 60°C 1 Stunde lang erwärmt. Die Reinigung mittels Chromatographie auf Silicagel lieferte 4-Nitroimidazolpyridoxin XXIIc in guter Ausbeute.
1H NMR (DMSO-d6, TMS): δ 2,42 (3H, s), 4,74 (2H, s), 5,35 (2H, s), 7,77 (1H, s, Imidazol-H), 7,95 (1H, s), 8,14 (1H, s, Imidazol-H). - Beispiel 12
- Synthese des imidazol-substituierten Pyridoxinanalogs der Formel XXIId
- Entsprechend Schema 9 wurde eine Mischung aus 2-Aminoimidazol (132 mg, 2,00 mmol) und pulverisiertem wasserfreiem Kaliumcarbonat (2,5 g) in wasserfreiem Acetonitril (20 ml) 15 Minuten lang bei 0°C gerührt. Dann wurde das Reaktionsgemisch mit dem Bromid VII (q = 1) (720 mg, 2,00 mmol) in wasserfreiem Acetonitril (5 ml) versetzt und die nächsten 30 Minuten lang bei 0°C gehalten. Die Routineaufarbeitung lieferte das Rohprodukt. Die Reinigung des Rohgemisches mittels Chromatographie auf Silicagel ergab das gewünschte Produkt XXId in beträchtlicher Ausbeute.
1H NMR (CD3OD, TMS): δ 1,52 (6H, s), 2,35 (3H, s), 4,68 (2H, s), 4,88 (2H, s), 6,44 (1H, s, Imidazol-H), 6,53 (1H, s, Imidazol-H), 7,64 (1H, s). - Das gereinigte Derivat XXId (106 mg, 0,35 mmol) wurde in 80% wässriger Essigsäure (10 ml) gelöst und bei 60°C 1 Stunde lang erwärmt. Die Reinigung mittels Chromatographie auf Silicagel lieferte 2-Aminoimidazolpyridoxin XXIId in guter Ausbeute.
1H NMR (CD3OD, TMS): δ 2,15 (3H, s), 4,55 (2H, s), 4,75 (2H, s), 6,24 (1H, s, Imidazol-H), 6,32 (1H, s, Imidazol-H), 7,23 (1H, s). - Beispiel 13
-
- Eine Lösung des 5-Aminopyridoxinderivats X (t = 1) (90 mg, 0,43 mmol) in wasserfreiem Di-chlormethan (5 ml) wurde mit einer Lösung eines mit Triflat behandelten BOC-Guanidinderivats (153,6 mg, 0,39 mmol) in wasserfreiem Dichlormethan (5 ml) und wasserfreiem Triethylamin (60 μl) versetzt. Diese Lösung wurde 1 Stunde lang bei Raumtemperatur gerührt. Das Reaktionsge-misch wurde mit 2M Natriumbisulfit (10 ml) und anschließend gesättigter wässriger NaHCO3 gewaschen. Das Verdampfen des Dichlormethans hinterließ einen Rückstand, der mittels Chromatographie auf Silicagel gereinigt wurde, so dass das Guanidinderivat XXIII in beträchtlicher Ausbeute entstand.
1H NMR (CD2Cl2, TMS): δ 1,46 (9H, s), 1,48 (9H, s), 1,54 (6H, s), 4,40 (2H, s), 4,88 (2H, s), 7,95 (1H, s), 8,43 (NH, s), 11,48 (NH, s). - Das gereinigte Derivat XXIII (100 mg, 0,36 mmol) wurde in 20% wässriger Trifluoressigsäure in wasserfreiem Dichlormethan (10 ml) gelöst und bei Raumtemperatur 1 Stunde lang gerührt. Die Reinigung des Reaktionsgemisches lieferte die beiden Produkte XXIV und XXV.
1H NMR (XXIV) (MeOD, TMS): δ 1,64 (6H, s), 2,63 (3H, s), 4,55 (2H, s), 5,10 (2H, s), 7,52 (1H, m), 8,13 (1H, s).
1H NMR (XXV) (DMSO-d6, TMS): δ 2,54 (3H, s), 3,96 (1H, s), 4,54 (2H, d), 4,81 (2H, s), 5,96 (1H, br s, NH), 7,44 (3H, br, NH), 8,07 (1H, s). - Beispiel 14
-
- Das Pyridoxalderivat VIII (r = 0) (400 mg, 1,91 mmol) und 3-Aminotriazol (178 mg, 2,12 mmol) in wasserfreiem Toluol (20 ml) wurden in einem dreihalsigen Kolben mit einem Kondensator und einer Dean-Stark-Falle bei 100°C 24 Stunden lang erwärmt. Die Routineaufarbeitung lieferte das Rohprodukt, das mittels Chromatographie auf Silicagel gereinigt wurde, so dass das geschützte Triazolinderivat XVI in mäßiger Ausbeute entstand.
1H NMR (CD3OD, TMS): δ 1,58 (6H, s), 2,46 (3H, s), 3,31 (1H, s), 5,31 (2H, s), 8,41 (1H, s), 9,23 (1H, s, Triazolin-CH). - Das vollständig geschützte Pyridoxinderivat XXVI (206 mg, 0,88 mmol) wurde in 80% wässriger Essigsäure (10 ml) gelöst und bei 60°C 1 Stunde lang erwärmt. Die Reinigung mittels Chromato-graphie auf Silicagel lieferte das triazolin-substituierte Pyridoxin XXVII in guter Ausbeute.
1H NMR (CD3OD, TMS): δ 2,46 (3H, s), 5,10 (2H, m), 6,78 (2H, s, Triazolin-CH), 7,92 (1H, s). - Beispiel 15
-
- Das Pyridoxalderivat VIII (r = 0) (2,07 g, 10,00 mmol) und 2-Methylimidazol (1,68 g, 20,00 mmol) in wasserfreiem Toluol (50 ml) wurden in einem dreihalsigen Kolben mit einem Kondensator und einer Dean-Stark-Falle bei 100°C 24 Stunden lang erwärmt. Die Routineaufarbeitung lieferte das Rohprodukt, das mittels Chromatographie auf Silicagel gereinigt wurde, so dass das geschützte Imidazolinderivat XXVIII in mäßiger Ausbeute entstand.
1H NMR (CD3OD, TMS): δ 1,56 (6H, s), 2,38 (3H, s), 3,76 (4H, s), 4,98 (2H, s), 6,63 (1H, s, Vinyl-CH), 7,26 (1H, s, Vinyl-CH), 8,20 (1H, s). - Das vollständig geschützte Pyridoxinderivat XXVIII (100 mg, 0,43 mmol) wurde in 80% wässriger Essigsäure (5 ml) gelöst und bei 60°C 1 Stunde lang erwärmt. Die Reinigung mittels Chromato-graphie auf Silicagel lieferte Imidazolin XXIX in guter Ausbeute.
1H NMR (CD3OD, TMS): δ 2,14 (3H, s), 3,09 (2H, s), 3,56 (4H, s), 4,74 (1H, s, Vinyl-CH), 4,87 (1H, s, Vinyl-CH), 5,24 (1H, d, NH), 7,26 (1H, s). - Beispiel 16
-
- Das Pyridoxalderivat VIII (r = 0) (800 mg, 3,82 mmol) und 2-Aminoimidazol (346 mg, 4,2 mmol) in wasserfreiem Dimethylsulfoxid (75 ml) wurden in einem dreihalsigen Kolben mit einem Kondensator und einer Dean-Stark-Falle bei 100°C 3 Tage lang erwärmt. Die Routineaufarbeitung lieferte das Rohprodukt, das mittels Chromatographie auf Silicagel gereinigt wurde, so dass das geschützte zyklische Guanidinderivat XXX in mäßiger Ausbeute entstand.
1H NMR (MeOD, TMS): δ 1,58 (6H, s), 2,49 (3H, s), 5,26 (2H, s), 7,07 (2H, s, Imidazol-H), 8,49 (1H, s), 9,27 (1H, s, Vinyl-H). - Das geschützte Pyridoxinderivat XXX (110 mg, 0,44 mmol) wurde in 80% wässriger Essigsäure (5 ml) gelöst und bei 60°C 1 Stunde lang erwärmt. Die Reinigung mittels Chromatographie auf Silicagel lieferte das zyklische Guanidin XXXI in guter Ausbeute.
1H NMR (MeOD, TMS): δ 2,45 (3H, s), 4,96 (2H, m), 5,12 (2H, dd), 6,43 (1H, d), 7,92 (1H, s). - Beispiel 17
-
- In einen dreihalsigen 250 ml-Kolben mit einem Kondensator und einer Dean-Stark-Falle wurden geschütztes Pyridoxinaldehyd VIII (r = 0) (3,31 g, 16 mmol), 4-Cyanoanilin (1,89 g, 15,9 mmol), p-Toluolsulfonsäure (0,3 g, 1,6 mmol) und trockenes Benzol (60 ml) gefüllt. Dann wurde das Reaktionsgemisch 16 Stunden lang mittels Reflux erwärmt. Anschließend wurde das Reaktionsgemisch mit 2N NaOH (5 ml) und danach mit Salzsole (10 ml) gewaschen und die organische Schicht mit wasserfreiem Na2SO4 getrocknet. Durch Entfernung des Lösungsmittels entstand das Rohprodukt, das mittels Chromatographie auf einer Silicagelsäule unter Verwendung von CH2Cl2:2M NH3-MeOH (100:1) als Eluierungsmittel gereinigt wurde. XXXII wurde als reiner gelber Feststoff gewonnen (2,98 g, 61% Ausbeute).
1H NMR (CDCl3): δ 1,58 (s, 6H), 2,49 (s, 3H), 5,27 (s, 2H), 7,20 (d, 2H), 7,68 (d, 2H), 8,31 (s, 1H), 8,44 (s, 1H). - Die Schiffsche Base XXXI (358 mg, 1,0 mmol) wurde in HOAc (5 ml) gelöst und die Lösung auf 0°C abgekühlt. Unter Rühren (10 Minuten bei 0°C und anschließend weitere 10 Minuten bei Raumtemperatur) wurde Natriumborhydrid (57 mg, 1,5 mmol) portionsweise zugesetzt. Die Reaktion wurde durch Zugabe von 5N NaOH (1,8 ml) abgeschreckt, um den pH-Wert der Lösung auf 9 einzustellen. Dann wurde das Produkt mit Diethylether (2 × 10 ml) extrahiert und über wasserfreiem Na2SO4 getrocknet. Das Verdampfen des Lösungsmittels und die anschließende Reinigung mittels Chromatographie auf einer Silicagelsäule in EtOAc:Hexan (1:1) lieferte XXXIII als hellgelben Feststoff (300 mg, 90%).
1H NMR (CDCl3): δ 1,54 (s, 6H), 2,40 (s, 3H), 4,20 (s, 2H), 4,36 (br, 1H), 4,84 (s, 2H), 6,62 (d, 2H), 7,45 (d, 2H), 8,00 (s, 1H). - Durch eine Lösung des Amins XXXIII (81 mg, 0,3 mmol) in Ethanol (6 ml) ließ man bei 0°C 30 Minuten lang Wasserstoffchloridgas (trocken) perlen. Das Reaktionsgemisch durfte sich langsam auf Raumtemperatur erwärmen und wurde 16 Stunden lang bei dieser Temperatur gerührt. Die Lösung wurde erneut auf 0°C abgekühlt und anschließend entgast, indem man 2 Stunden lang N2 hindurchperlen ließ. Nach dem Verdampfen des Lösungsmittels erhielt man XXXIV als hellgelben Feststoff.
1H NMR (MeOD): δ 1,57 (t, 3H), 2,64 (s, 3H), 4,54 (q, 2H), 4,65 (s, 2H), 5,14 (s, 2H), 6,82 (d, 2H), 7,89 (d, 2H), 8,00 (s, 1H). - Die Rohverbindung XXXIV (106 mg, 0,3 mmol) wurde in einem abgedichteten Hochdruckkolben mit 2M NH3-MeOH (10 ml) versetzt, das Gemisch auf –78°C abgekühlt und 15 Minuten lang bei dieser Temperatur gerührt. Das Reaktionsgemisch wurde allmählich auf Raumtemperatur und anschließend 2 Stunden lang auf 80°C erwärmt. Das Reaktionsgemisch wurde erneut auf –78°C abgekühlt und der abgedichtete Kolben geöffnet. Anschließend wurde die Lösung in einen Rundkolben überführt und das Lösungsmittel zur Trockne verdampft. Die Reinigung auf einer Silicagelsäule unter Verwendung von CH2Cl2:MeOH:H2O (100:20:1) als Eluierungsmittel lieferte XXXV als weißen Feststoff (88 mg, 82%).
1H NMR (MeOD): δ 2,43 (s, 3H), 4,45 (s, 2H), 4,96 (s, 2H), 6,78 (d, 2H), 7,64 (d, 2H), 7,84 (s, 1H). - Beispiel 18
-
- Das Verfahren zur Herstellung von XXXVI ähnelte dem Verfahren, das zur Synthese der Verbindung XXXIII eingesetzt wurde. Das Rohprodukt XXXVI war ein rotbrauner Feststoff, der im nächsten Schritt ohne Reinigung eingesetzt wurde.
1H NMR (CDCl3): δ 1,59 (s, 6H), 2,49 (s, 3H), 5,30 (s, 2H), 7,06 (d, 2H), 7,51 (d, 2H), 8,30 (s, 1H), 8,47 (s, 1H). - Das Verfahren zur Herstellung von XXXVII ähnelte dem Verfahren, das zur Synthese der Verbindung XXXIII eingesetzt wurde. Das Rohprodukt XXXVII wurde auf einer Silicagelsäule unter Verwendung von CH2Cl2:MeOH:H2O (5:1:1,5) als Eluierungsmittel gereinigt und lieferte einen weißen Feststoff (66% Ausbeute).
1H NMR (CDCl3): δ 1,55 (s, 6H), 2,41 (s, 3H), 3,68 (br, 1H), 4,12 (d, 2H), 4,87 (s, 2H), 6,51 (d, 2H), 7,27 (d, 2H), 8,01 (s, 1H). - Die Verbindung XXXVII (665 mg, 1,83 mmol) wurde in Diglyme (15 ml) gelöst und anschließend mit Pd (PPh3)4 (63 mg, 0,05 mmol) versetzt. Das Gemisch wurde 10 Minuten lang gerührt und anschließend zunächst mit p-Cyanophenylborsäure (269 mg, 2,01 mmol) und anschließend mit Natriumbicarbonat (461 mg in 8 ml H2O, 5,49 mmol) versetzt. Das Reaktionsgemisch wurde in einem Ölbad 5 Minuten lang auf 95°C erwärmt und anschließend 1,5 Stunden lang bei Raumtemperatur gerührt. Nach dem Verdampfen des Lösungsmittels erhielt man das dunkelviolette Rohprodukt XXXVIII, das mittels Chromatographie auf einer Silicagelsäule unter Verwendung von EtOAc:Hexan (1:1) gereinigt wurde (32% Ausbeute).
1H NMR (CDCl3): δ 1,56 (s, 6H), 2,42 (s, 3H), 3,96 (br, 1H), 4,22 (d, 2H), 4,91 (s, 2H), 6,72 (d, 2H), 7,47 (d, 2H), 7,65 (q, 4H), 8,06 (s, 1H). - Die Synthese der Verbindungen XXXIX und XL erfolge nach den für die Verbindungen XXXIV und XXXV dargelegten Verfahren. Die XL-Gesamtausbeute betrug für beide Schritte 63%.
1H NMR (XXXIX) (MeOD): δ 1,62 (t, 3H), 2,62 (s, 3H), 4,56 (s, 2H), 4,63 (q, 2H), 5,17 (s, 2H), 6,78 (d, 2H), 7,60 (d, 2H), 7,83 (d, 2H), 8,02 (s, 1H), 8,05 (d, 2H).
1H NMR (XL) (MeOD): δ 2,43 (s, 3H), 4,39 (s, 2H), 4,98 (s, 2H), 6,76 (d, 2H), 7,54 (d, 2H), 7,80 (m, 4H), 7,89 (s, 1H). - Beispiel 19
-
- Das Azid IX (t = 1) (790 mg, 3,4 mmol) wurde in 80% wässriger HOAc (40 ml) gelöst und 16 Stunden lang bei 60°C erwärmt, um die Isopropylidengruppe zu hydrolysieren. Die gleichzeitige Destillation mit Toluol zur Entfernung der Essigsäure lieferte das Rohprodukt, das mittels Chromatographie auf einer Silicagelsäule unter Verwendung von EtOAc:Hexan (1:1→4:1) gereinigt wurde, so dass XLI als weißer Feststoff entstand (410 mg, 63% Ausbeute).
1H NMR (MeOD): δ 2,43 (s, 3H), 4,42 (s, 2H), 4,92 (s, 2H), 7,86 (s, 1H). - Das deblockierte Azid XLI (388 mg, 2,0 mmol) in trockenem DMF (10 ml) wurde mit Imidazol (545 mg, 8,8 mmol) und TBDPSiCl (1,2 ml, 4,4 mmol) versetzt. Anschließend wurde das Reaktionsgemisch auf 50°C erwärmt und über Nacht gerührt. Dann wurde die Reaktion auf Raumtemperatur abgekühlt und mit Diethylether (2 × 25 ml) extrahiert und der Etherextrakt mit Wasser (2 × 10 ml) und Salzsole (1 × 10 ml) gewaschen. Die ätherische Lösung wurde über MgSO4 getrocknet und das Lösungsmittel bis zur Trockne verdampft, so dass XLII als weißer Feststoff entstand (1,3 g, 97% Ausbeute).
1H NMR (CDCl3): δ 0,87 (s, 9H), 0,96 (s, 9H), 2,15 (s, 3H), 4,49 (s, 2H), 4,52 (s, 2H), 7,38 (m, 2OH), 8,03 (s, 1H). - Der in Methanol (20 ml) gelösten Verbindung XLII (1,3 g, 1,94 mmol) wurde Lindlar-Katalysator (600 mg) zugesetzt und das Gemisch unter einem H2-Strom 1,5 Stunden lang hydriert, um die Reaktion abzuschließen. Die Routineaufarbeitung und Reinigung lieferten das Amin XLIII (0,95 g, 76%).
1H NMR (CDCl3): δ 0,83 (s, 9H), 0,96 (s, 9H), 1,51 (br, 2H), 2,11 (s, 3H), 3,89 (s, 2H), 4,57 (s, 2H), 7,33 (m, 20), 8,09 (s, 1H). - Ein Gemisch aus XLIII (645 mg, 1,0 mmol) und 4-Fluorphenylisocyanat (0,12 ml, 1,0 mmol) in trockenem Toluol (10 ml) wurde 16 Stunden lang mittels Reflux erwärmt. Nach der Entfernung des Lösungsmittels wurde das Rohprodukt mittels Chromatographie auf einer Silicagelsäule unter Verwendung von CH2Cl2:95% EtOH (100:1→100:2) als Eluierungsmittel gereinigt, so dass XLIV als weißer Feststoff entstand (619 mg, 79%).
1H NMR (CDCl3): δ 0,87 (s, 9H), 0,97 (s, 9H), 2,13 (s, 3H), 4,87 (d, 2H), 4,62 (s, 2H); 5,05 (br, 1H), 6,15 (br, 1H), 7,33 (m, 20H), 8,19 (s, 1H). 19F NMR (CDCl3): δ –120,40 (s). - Eine Lösung von XLIV (391 mg, 0,5 mmol) in trockenem THF (10 ml) wurde mit TRAF (0,32 ml, 2,2 mmol) versetzt und 16 Stunden lang bei Raumtemperatur gerührt. Die Entfernung des Lösungsmittels und die anschließende Reinigung mittels Chromatographie auf einer Silicagelsäule unter Verwendung von CH2Cl2:MeOH (20:1→10:1) als Eluierungsmittel lieferten XLV als weißen Feststoff (135 mg, 89%).
1H NMR (MeOD): δ 2,40 (s, 3H), 4,39 (s, 2H), 4,94 (s, 2H), 6,98 (m, 2H), 7,34 (m, 2H), 8,78 (s, 1H). 19F NMR (MeOD): δ –123,51 (m). - Die Synthese der Verbindungen XLVI und XLVII erfolge nach den für XLIV und XLV dargelegten Verfahren unter Verwendung von 4-Fluorphenylthioisocyanat anstelle von 4-Fluorphenylisocyanat. Die Ausbeute betrug 65% für XLVI und 60% für XLVII.
1H NMR (XLVI) (CDCl3): δ 0,82 (s, 9H), 0,88 (s, 9H), 2,09 (s, 3H), 4,52 (s, 2H), 5,00 (d, 2H), 5,29 (s, 1H), 6,36 (t, 1H), 7,33 (m, 20H), 8,02 (s, 1H). 19F NMR (CDCl3): δ –113,42 (s).
1H NMR (XLVII) (MeOD): δ 2,41 (s, 3H), 3,07 (m, 1H), 3,54 (m, 1H), 4,91 (s, 2H), 7,09 (t, 2H), 7,32 (q, 2H), 7,89 (s, 1H). 19F NMR (MeOD): δ –118,80 (m). - Beispiel 20
- Inhibition der Plättchenaggregation
- Durch Aufziehen von Vollblut in Natriumcitrat-Röhrchen (3,2%) und 10-minütiges Zentrifugieren mit 700 UpM erhielt man plättchenreiches Plasma (PRP). Durch Zentrifugieren der restlichen Probe bis zur Entfernung der Plättchen (10 Minuten mit 3200 UpM) erhielt man plättchenarmes Plasma (PPP). Das PRP wurde durch Mischen von PRP und PPP auf eine Plättchenzahl vom 280 × 109/l eingestellt. Das Inkubationsgemisch bestand aus 200 μl Plättchen und 25 μl der geeigneten Verbindung (18 mM-Stammlösung für eine Endkonzentration von 2 mM, 4,5 mM-Stammlösung für eine Endkonzentration von 500 μM), was eine ungefähre endgültige Plättchenzahl in dem Inkubationsgemisch von 250 × 109/l ergab. Nach 30-minütiger Inkubation bei Raumtemperatur wurden die Küvetten 3 Minuten lang bei 37°C inkubiert und in die Vertiefungen zum Mischen überführt. Nach Messung der Baseline-Durchlässigkeit mittels eines Aggregometers (Chrono-Log 4) wurden 25 μl des Agonisten zugesetzt, so dass eine Endkonzentration von 4 μM ADP, 1 μg/ml Kollagen, 5 μg/ml Kollagen oder 12 μM TRAP (Thrombinrezeptor aktivierendes Peptid) entstand. Anschließend wurde die endgültige Durchlässigkeit mittels Aggregometer gemessen (eine geringere prozentuale Durchlässigkeit bedeutet eine höhere Aggregation). Die Agonistenkonzentrationen wurden auf der Basis früheren Erfahrungen ausgewählt, die zeigten, dass dies die kleinsten Konzentrationen sind, die den vollen Aggregationsgrad in der normalen Population liefern. Tabelle V stellt die Ergebnisse des Aggregationsgrades für verschiedene Verbindungen als direkt vom Aggregometer abgelesene prozentuale Amplitude dar. Tabelle V – Aggregationsgrad als direkt vom Aggregometer abgelesene prozentuale Amplitude
Getestete Verbindung 5 μg/ml Kollagen 1 μg/ml Kollagen 4 μM ADP 12 μM TRAP Verdünnungsmittel der Verbindung Kochsalzlösung Kontrolle 82% 87% 83% 93% DMSO Kontrolle 85% 86% 55% 88% XL 2 mM 5% 4% 4% 4% Kochsalzlösung XL 500 μM 52% 4% 9% 3% Kochsalzlösung XL VII 2 mM 49% 30% 31% 42% 20% DMSO Kochsalzlösung XXXV 2 mM 67% 79% 15% 11% Kochsalzlösung XXXV 500 μM 75% 83% 70% 90% Kochsalzlösung XXIIb 2 mM 77% 32% 46% 84% 1 Teil DMSO 1 Teil Kochsalzlösung XXIIb 500 μM 82% 79% 59% 91% 1 Teil DMSO 1 Teil Kochsalzlösung PLP 2 mM 89% 84% 16% 91% Kochsalzlösung PLP 500 μM 87% 89% 69% 90% Kochsalzlösung - Es ist zu beachten, dass die Singularformen „ein, einer, eine" und „der, die das", wie sie in dieser Beschreibung und den beigefügten Ansprüchen verwendet werden, auch den Plural einschließen, sofern der Inhalt dem nicht eindeutig widerspricht. Daher schließt die Bezugnahme auf eine Zusammensetzung aus „einer Verbindung" auch eine Mischung aus zwei oder mehr Verbindungen ein.
- Zwar wurden zuvor Ausführungsformen der Erfindung beschrieben, doch ist diese nicht darauf beschränkt. Für den Fachmann ist offensichtlich, dass zahlreiche Modifikationen und Variationen Teil der vorliegenden Erfindung sind, sofern sie nicht vom Geist, der Beschaffenheit und dem Umfang der beanspruchten und beschriebenen Erfindung abweichen.
Claims (38)
- Verbindung der Formel V: oder ein pharmazeutisch annehmbares Säureadditionssalz davon, worin: R5 CH2OH oder CHO ist; R1 n eine ganze Zahl von 1 bis 5 ist; R2, R3 und R4 jeweils unabhängig Wasserstoff; gerades oder verzweigtes, gesättigtes, aliphatisches C1- bis C8-Alkyl; Amino; Anilino, worin der Anilinring mit einem Cyano, geraden oder verzweigten, gesättigten C1- bis C8-Alkyl, geraden oder verzweigten, gesättigten C1- bis C4-Alkoxy, Amino, Hydroxy, Halogen, Nitro oder geraden oder verzweigten, gesättigten C2- bis C8-Alkanoyloxy substituiert sein kann; Nitro; oder Guanidino sind.
- Verbindung gemäß Anspruch 2, worin R2 Wasserstoff, gerades oder verzweigtes, gesättigtes C1- bis C8-Alkyl oder Amino ist.
- Verbindung gemäß Anspruch 4, worin R2 und R3 jeweils unabhängig Wasserstoff, gerades oder verzweigtes, gesättigtes C1- bis C8-Alkyl, Amino oder Nitro ist.
- Verbindung gemäß Anspruch 6, worin R2, R3 und R4 unabhängig Wasserstoff, gerades oder verzweigtes, gesättigtes C1- bis C8-Alkyl oder Amino ist.
- Verbindung gemäß Anspruch 6, worin R2 Wasserstoff ist, R3 Methyl ist und R4 Wasserstoff ist.
- Pharmazeutische Zusammensetzung, umfassend: einen pharmazeutisch annehmbaren Träger und eine Verbindung gemäß Anspruch 1.
- Pharmazeutische Zusammensetzung gemäß Anspruch 12, wobei die pharmazeutische Zusammensetzung in einer für die enterale oder parenterale Verabreichung geeigneten Form vorliegt.
- Verwendung einer Verbindung gemäß Anspruch 1 bei der Herstellung eines Medikamentes zur Behandlung einer kardiovaskulären oder verwandten Erkrankung.
- Verwendung gemäß Anspruch 14, wobei das Medikament in einer Einheitsdosierungsform vorliegt.
- Verwendung gemäß Anspruch 14, wobei das Medikament die Verbindung in einem Bereich von 0,5 bis 100 mg/kg pro Tag des Körpergewichts vom Säuger umfasst.
- Verwendung gemäß Anspruch 14, wobei das Medikament für die enterale oder parenterale Verwendung ist.
- Verwendung gemäß Anspruch 14, wobei die kardiovaskuläre oder verwandte Erkrankung aus der Gruppe gewählt ist, die aus zerebraler Ischämie, Hirnblutung, ischämischem Schlaganfall und hämorrhagischem Schlaganfall besteht.
- Verwendung gemäß Anspruch 14, wobei die kardiovaskuläre oder verwandte Erkrankung Bluthochdruck ist.
- Verwendung gemäß Anspruch 19, wobei das Medikament ferner eine therapeutische kardiovaskuläre Verbindung umfasst, die aus einem Inhibitor für das Angiotensin-Converting-Enzym, einem Calciumkanalblocker, einem Antagonisten für β-adrenergen Rezeptor, einem Vasodilatator, einem Diuretikum, einem Antagonisten für α-adrenergen Rezeptor und Mischungen davon besteht.
- Verwendung gemäß Anspruch 14, wobei die kardiovaskuläre oder verwandte Erkrankung myocardialer Infarkt ist.
- Verwendung gemäß Anspruch 21, wobei das Medikament ferner eine therapeutische kardiovaskuläre Verbindung umfasst, die aus einem Inhibitor für das Angiotensin-Converting-Enzym, einem Calciumkanalblocker, einem antithrombotischen Mittel, einem Antagonisten für β-adrenergen Rezeptor, einem Diuretikum, einem Antagonisten für α-adrenergen Rezeptor und Mischungen davon gewählt wird.
- Verwendung gemäß Anspruch 14, wobei die kardiovaskuläre oder verwandte Erkrankung Ischämie-Reperfusions-Verletzung ist.
- Verwendung gemäß Anspruch 23, wobei das Medikament ferner eine therapeutische kardiovaskuläre Verbindung umfasst, die aus einem Inhibitor für das Angiotensin-Converting-Enzym, einem Angiotensin-II-Rezeptor-Antagonisten, einem Calciumkarialblocker und Mischungen davon gewählt wird.
- Verwendung gemäß Anspruch 14, wobei die kardiovaskuläre oder verwandte Erkrankung myokardiale Ischämie ist.
- Verwendung gemäß Anspruch 25, wobei das Medikament ferner eine therapeutische kardiovaskuläre Verbindung umfasst, die aus einem Inhibitor für das Angiotensin-Converting-Enzym, einem Angiotensin-II-Rezeptor-Antagonisten, einem Calciumkanalblocker, einem antithrombotischen Mittel, einem Antagonisten für β-adrenergen Rezeptor, einem Diuretikum, einem Antagonisten für α-adrenergen Rezeptor und Mischungen davon gewählt wird.
- Verwendung gemäß Anspruch 14, wobei die kardiovaskuläre oder verwandte Erkrankung dekompensierte Herzinsuffizienz ist.
- Verwendung gemäß Anspruch 27, wobei das Medikament ferner eine therapeutische kardiovaskuläre Verbindung umfasst, die aus einem Inhibitor für Angiotensin-Converting-Enzym, einem Angiotensin-II-Rezeptor-Antagonisten, einem Calciumkanalblocker, einem Vasodilatator, einem Diuretikum und Mischungen davon gewählt wird.
- Verwendung gemäß Anspruch 14, wobei die kardiovaskuläre oder verwandte Erkrankung Arrhythmie ist.
- Verwendung gemäß Anspruch 29, wobei das Medikament ferner eine therapeutische kardiovaskuläre Verbindung umfasst, die aus einem Calciumkanalblocker, einem Antagonisten für β-adrenergen Rezeptor und Mischungen davon gewählt wird.
- Verwendung gemäß Anspruch 14, wobei die kardiovaskuläre oder verwandte Erkrankung eine Blutkoagulationsstörung ist.
- Verwendung gemäß Anspruch 31, wobei das Medikament ferner ein antithrombotisches Mittel umfasst.
- Verwendung gemäß Anspruch 31, wobei die kardiovaskuläre oder verwandte Erkrankung Herzhypertrophie ist.
- Verwendung gemäß Anspruch 33, wobei das Medikament ferner eine therapeutische kardiovaskuläre Verbindung umfasst, die aus Inhibitor für Angiotensin-Converting-Enzym, einem Angiotensin-II-Rezeptor-Antagonisten, einem Calciumkanalblocker und Mischungen davon gewählt wird.
- Verwendung gemäß Anspruch 14, wobei die kardiovaskuläre oder verwandte Erkrankung sich aus thrombotischen und prothrombotischen Zuständen ergibt, in welchen die Koagulationskaskade aktiviert ist.
- Verwendung gemäß Anspruch 35, wobei die Erkrankung eine tiefe Venenthrombose, disseminierte intravaskuläre Koagulopathie oder Lungenembolismus ist.
- Verwendung gemäß Anspruch 14, wobei die kardiovaskuläre oder verwandte Erkrankung Plättchenaggregation ist.
- Verfahren zur Herstellung einer Verbindung gemäß Anspruch 1, wobei R1 ist, wobei das Verfahren Folgendes umfasst: (a) das Wählen einer Vorstufenverbindung der Formel VII: worin R6 (CH2)qBr ist, wobei q = 1 bis 5 ist; (b) das Umsetzen der Vorstufe mit einem substituierten oder nicht-substituierten Tetrazol, Triazol oder Imidazol, wobei der Substituent aus Anilino und Guanidin gewählt wird; und (c) das Hydrolysieren zur Entfernung der Isopropylidengruppe. 39. Verfahren der Herstellung einer Verbindung gemäß Anspruch 1, wobei R1 ist, wobei das Verfahren Folgendes umfasst: (a) das Wählen einer Vorstufenverbindung der Formel VIII: worin R6 (CH2)rCHO ist, mit r = 0 bis 4; (b) das Umsetzen der Vorstufe mit einer substituierten oder nicht-substituierten Triazol-, Imidazol- oder Anilinverbindung, wobei der Triazol- oder Imidazolsubstituent gewählt wird aus Amino, Anilin und Guanidin, und der Anilinsubstituent gewählt wird aus Cyano, geradem oder verzweigtem, gesättigtem C1- bis C8-Alkyl, geradem oder verzweigtem, gesättigtem C1- bis C4-Alkoxy, Amino, Hydroxy, Halogen, Nitro und geradem oder verzweigtem C2- bis C8-Alkanoyloxy; und (c) das Hydrolysieren zur Entfernung der Isopropylidengruppe. 40. Verfahren der Herstellung einer Verbindung gemäß Anspruch 1, wobei R1 ist, wobei das Verfahren Folgendes umfasst: (a) das Wählen einer Vorstufenverbindung der Formel IX: worin R6 (CH2)sN3 ist, worin s = 1 bis 5 ist; (b) das Reduzieren der Azidgruppe zur Bildung eines Aminderivats; (c) das Umsetzen des Aminderivats mit einem Guanidin, einem aromatischen Isocyanat oder einem aromatischen Thioisocyanat, wobei der aromatische Ring mit einem Substituenten substituiert sein kann, der aus Cyano, geradem oder verzweigtem, gesättigtem C1- bis C8-Alkyl, geradem oder verzeigtem, gesättigtem C1- bis C4-Alkoxy, Amino, Hydroxy, Halogen, Nitro und geradem oder verzweigtem, gesättigtem C2- bis C8-Alkanoyloxy gewählt wird; und (c) das Hydrolysieren zur Entfernung der Isopropylidengruppe. 41. Verfahren der Herstellung einer Verbindung gemäß Anspruch 1, wobei R1 ist, wobei das Verfahren Folgendes umfasst: (a) das Wählen einer Vorstufenverbindung der Formel X: worin R6 (CH2)tNH2 ist, worin t = 1 bis 5; (b) das Umsetzen der Vorstufe mit einem geschützten Guanidinderivat, einem aromatischen Isocyanat oder einem aromatischen Thioisocyanat, wobei der aromatische Ring mit einem Substituenten substituiert sein kann, der aus Cyano, geradem oder verzweigtem, gesättigtem C1- bis C8-Alkyl, geradem oder verzweigtem, gesättigtem C1- bis C4-Alkoxy, Amino, Hydroxy, Halogen, Nitro und geradem oder verzweigtem, gesättigtem C2- bis C8-Alkanoyloxy gewählt wird; und (c) das Hydrolysieren zur Entfernung der Isopropylidengruppe.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US21690700P | 2000-07-07 | 2000-07-07 | |
| US216907P | 2000-07-07 | ||
| PCT/CA2001/000994 WO2002004421A2 (en) | 2000-07-07 | 2001-07-06 | Pyridoxine and pyridoxal analogues: cardiovascular therapeutics |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| DE60128912D1 DE60128912D1 (en) | 2007-07-26 |
| DE60128912T2 true DE60128912T2 (de) | 2008-02-14 |
| DE60128912T9 DE60128912T9 (de) | 2008-06-26 |
Family
ID=22808954
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| DE60128912T Active DE60128912T9 (de) | 2000-07-07 | 2001-07-06 | Pyridoxin- und pyridoxalanaloga als cardiovasculäre therapeutika |
Country Status (9)
| Country | Link |
|---|---|
| US (1) | US6417204B1 (de) |
| EP (1) | EP1299358B1 (de) |
| JP (1) | JP2004502757A (de) |
| AT (1) | ATE364595T1 (de) |
| AU (2) | AU2001272263B2 (de) |
| CA (1) | CA2414188A1 (de) |
| DE (1) | DE60128912T9 (de) |
| NZ (1) | NZ523815A (de) |
| WO (1) | WO2002004421A2 (de) |
Families Citing this family (25)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2001003682A2 (en) * | 1999-07-13 | 2001-01-18 | Medicure Inc. | Use of pyridoxin derivatives for the treatment of diabetes and related complications |
| JP2003507418A (ja) * | 1999-08-24 | 2003-02-25 | メディキュア インターナショナル インコーポレイテッド | 心血管疾患とその関連疾患の治療 |
| US7442689B2 (en) * | 2000-02-29 | 2008-10-28 | Medicure International Inc. | Cardioprotective phosphonates and malonates |
| US6897228B2 (en) * | 2000-07-07 | 2005-05-24 | Medicure International Inc. | Pyridoxine and pyridoxal analogues: new uses |
| US20040121988A1 (en) * | 2001-03-28 | 2004-06-24 | Medicure International Inc. | Treatment of cerebrovascular disease |
| US20040186077A1 (en) * | 2003-03-17 | 2004-09-23 | Medicure International Inc. | Novel heteroaryl phosphonates as cardioprotective agents |
| JP2006523206A (ja) * | 2003-03-27 | 2006-10-12 | メディキュア インコーポレーテッド | 細胞死の調節 |
| JP2006521349A (ja) * | 2003-03-27 | 2006-09-21 | メディキュア インコーポレーテッド | 狭心症を治療するための組成物 |
| EP1750862B1 (de) | 2004-06-04 | 2011-01-05 | Teva Pharmaceutical Industries Ltd. | Irbesartan enthaltende pharmazeutische zusammensetzung |
| AU2005259735A1 (en) * | 2004-07-07 | 2006-01-12 | Medicure International Inc. | Combination therapies employing platelet aggregation drugs |
| US20070060549A1 (en) * | 2004-08-10 | 2007-03-15 | Friesen Albert D | Combination therapies employing ace inhibitors and uses thereof for the treatment of diabetic disorders |
| US7459468B2 (en) * | 2004-10-28 | 2008-12-02 | Medicure International, Inc. | Aryl sulfonic pyridoxines as antiplatelet agents |
| US20060094749A1 (en) * | 2004-10-28 | 2006-05-04 | Medicure International Inc. | Substituted pyridoxines as anti-platelet agents |
| JP2008517956A (ja) * | 2004-10-28 | 2008-05-29 | メディキュア・インターナショナル・インコーポレーテッド | 二重の抗血小板性/抗凝固性ピリドキシン類似体 |
| EP1853275A4 (de) * | 2004-11-26 | 2008-09-10 | Medicure Int Inc | FORMULIERUNGEN AUS PYRIDOXAL-5ý-PHOSPHAT UND HERSTELLUNGSVERFAHREN |
| JP2008521756A (ja) * | 2004-11-26 | 2008-06-26 | メディキュア インターナショナル インコーポレイテッド | ピリドキサール−5’−ホスフェートの新規配合物及び調製方法 |
| JP2008526783A (ja) * | 2005-01-05 | 2008-07-24 | メディキュア・インターナショナル・インコーポレーテッド | トリグリセリドレベルを調節するための化合物及び方法 |
| CA2503087A1 (en) * | 2005-03-30 | 2006-09-30 | Medicure International Inc. | Intravenous formulations of pyridoxal 5'-phosphate and method of preparation |
| US20070149485A1 (en) * | 2005-11-28 | 2007-06-28 | Medicure International, Inc. | Selected dosage for the treatment of cardiovascular and related pathologies |
| US20070249562A1 (en) * | 2006-04-25 | 2007-10-25 | Friesen Albert D | Treatment of atrial fibrillation |
| WO2010080871A1 (en) | 2009-01-08 | 2010-07-15 | Univation Technologies, Llc | Additive for gas phase polymerization processes |
| CA2761639C (en) | 2009-05-29 | 2016-06-07 | Raqualia Pharma Inc. | Aryl substituted carboxamide derivatives as calcium or sodium channel blockers |
| JP2013540145A (ja) * | 2010-10-21 | 2013-10-31 | ウニベルシテート デス ザールランデス | コルチゾール依存性疾患の治療用の選択的cyp11b1阻害剤 |
| CN102617455B (zh) * | 2011-12-26 | 2014-06-04 | 浙江工业大学 | 一种吡哆醛或盐酸吡哆醛的制备方法 |
| WO2018002673A1 (en) | 2016-07-01 | 2018-01-04 | N4 Pharma Uk Limited | Novel formulations of angiotensin ii receptor antagonists |
Family Cites Families (98)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3206463A (en) | 1965-09-14 | Pyridoxine aspartate and its process of preparation | ||
| FR846376A (fr) | 1938-08-23 | 1939-09-15 | Appareillage de navigation aérienne et de bombardement aérien | |
| GB966805A (en) | 1961-05-15 | 1964-08-19 | Merck & Co Inc | Process for the preparation of 2-methyl-3-hydroxypyridines |
| BE634408A (de) | 1962-07-05 | |||
| GB1228142A (de) | 1967-03-31 | 1971-04-15 | ||
| DE1802162A1 (de) | 1967-10-16 | 1969-04-30 | Tanabe Seiyaku Co | Neue N-Pyridylmethyliden-homocystein-thiolacton-Verbindung und Verfahren zu ihrer Herstellung |
| DE1767499A1 (de) | 1968-05-16 | 1971-09-09 | Merck Patent Gmbh | Verfahren zur Herstellung haltbarer Vitaminzubereitungen |
| ES360566A1 (es) | 1968-11-22 | 1970-10-16 | Made Labor Sa | Un metodo de obtencion de alfa-cetoglutarato de piridoxina y sus derivados. |
| GB1236531A (en) | 1969-02-12 | 1971-06-23 | Soc D Etudes Prod Chimique | Adenin derivative |
| US3910921A (en) | 1970-01-08 | 1975-10-07 | Soc D Etudes Prod Chimique | Papaverine monopyridoxal phosphate |
| GB1297080A (de) | 1970-04-17 | 1972-11-22 | ||
| FR2101010A1 (en) * | 1970-08-06 | 1972-03-31 | Lyocentre | Sparteine mono-and dipyridoxinates and prepn - as tonics for cardiova disorders |
| GB1493993A (en) | 1975-05-16 | 1977-12-07 | Howard A | Dietary supplement and dietary methods employing said supplement for the treatment of obesity |
| US4053607A (en) | 1972-04-04 | 1977-10-11 | Beecham Group Limited | Aryloxypyridine for treating hyperglycaemia |
| US4036844A (en) | 1972-04-04 | 1977-07-19 | Beecham Group Limited | Aryloxypyridines |
| GB1360536A (en) | 1972-04-25 | 1974-07-17 | Soc D Etudes Prod Chimique | Pyridoxyl-l-aspartic acid salt |
| BE790118A (fr) | 1972-10-09 | 1973-02-01 | Made Labor Sa | Derives de l'alpha-cetoglutarate de pyridoxal et de pyridoxamine, |
| US4032534A (en) | 1973-03-22 | 1977-06-28 | Ferlus-Chimie S.A. | Certain 2-(2-thioethyl)thiazolidine-4-carboxylic acids |
| FR2255883A1 (en) | 1973-12-28 | 1975-07-25 | Centre Etd Ind Pharma | Clofibric acid-vitamin B6 compsns. - with synergistic hypocholesterolaemic and normolipaemic activity |
| FR2275209A1 (fr) | 1974-06-21 | 1976-01-16 | Synthelabo | Nouveaux esters cetoniques, leurs sels, leur preparation et les medicaments qui les renferment |
| FR2276048A1 (fr) | 1974-06-27 | 1976-01-23 | Synthelabo | Nouveaux esters du cyclohexanol, leurs sels, leur preparation et les medicaments qui les renferment |
| DE2461742C2 (de) | 1974-12-28 | 1983-01-27 | Steigerwald Arzneimittelwerk Gmbh, 6100 Darmstadt | Pyridoxin-5'-phosphorsäureester-Derivate sowie deren Herstellung und diese Verbindungen enthaltende Arzneimittel |
| GB1525885A (en) | 1976-05-11 | 1978-09-20 | Soc D Etudes Prod Chimique | Vincamine salt of pyridoxal phosphate |
| DE2717478C2 (de) | 1977-04-20 | 1984-08-16 | Basf Ag, 6700 Ludwigshafen | Verfahren zur Herstellung von Pyridoxin |
| JPS5417130A (en) | 1977-07-08 | 1979-02-08 | Chugai Pharmaceut Co Ltd | Remedy for cardio-vasocular diseases |
| MTP837B (en) * | 1977-11-07 | 1979-10-22 | Hoffman La Roche And Co Aktien | Derivatives 2 finino-imidazolidire |
| BE863754A (fr) | 1978-02-08 | 1978-05-29 | Dechamps Pierre | Nouveaux derives de la vincamine utilisables comme regulateurs de la circulation cerebrale |
| FR2428640A1 (fr) | 1978-06-12 | 1980-01-11 | Parcor | Derives de pyridoxine, leur procede de preparation et leur application therapeutique |
| US4167562A (en) | 1978-08-28 | 1979-09-11 | Evers H Ray | Method and composition for treating arteriosclerosis |
| IL62602A (en) | 1980-05-19 | 1984-06-29 | Labaz Sanofi Nv | Pyridoxine derivatives,their preparation and pharmaceutical compositions containing them |
| IT1141070B (it) | 1980-09-22 | 1986-10-01 | Luso Farmaco Inst | Impiego dell'alfa-chetoglutarato di piridossina nella profilassi della iperlattacidemia |
| US4369172A (en) | 1981-12-18 | 1983-01-18 | Forest Laboratories Inc. | Prolonged release therapeutic compositions based on hydroxypropylmethylcellulose |
| US4528197A (en) | 1983-01-26 | 1985-07-09 | Kabivitrum Ab | Controlled triglyceride nutrition for hypercatabolic mammals |
| IN160104B (de) | 1983-04-05 | 1987-06-27 | Scras | |
| US4735950A (en) | 1983-04-05 | 1988-04-05 | Societe De Conseils De Recherches Et D'applications Scientifiques (S.C.R.A.S) | Furo-(3,4-C)-pyridine derivatives and therapeutic composition containing the same |
| US4515771A (en) | 1983-04-11 | 1985-05-07 | Fine Daniel H | Composition and method for the preventative treatment of dental disease and apparatus for dispensing said composition |
| JPS59199674A (ja) * | 1983-04-26 | 1984-11-12 | Terumo Corp | ピリドキシン誘導体およびそれを用いた血小板凝集阻止剤 |
| GB8330517D0 (en) | 1983-11-16 | 1983-12-21 | Scras | 6-vinyl-furo-(3,4-c)pyridine derivatives |
| GB8330658D0 (en) | 1983-11-17 | 1983-12-29 | Scras | 7-carboxymethoxy-furo-(3,4-c)-pyridine derivatives |
| IT1212792B (it) | 1983-11-30 | 1989-11-30 | Egidio Aldo Moja | Supplemento dietetico e alimento preconfezionato che lo contiene procedimento di preparazione e metodo di somministrazione |
| US5272165A (en) | 1984-03-19 | 1993-12-21 | The Rockefeller University | 2-alkylidene-aminoguanidines and methods of use therefor |
| US5130324A (en) | 1984-03-19 | 1992-07-14 | The Rockefeller University | 2-alkylidene-aminoguanidines and methods of use therefor |
| CH664158A5 (fr) | 1984-07-18 | 1988-02-15 | Symphar Sa | Derives propylidenediphosphonates-1,3 substitues en position 2, leur procede de preparation et compositions pharmaceutiques les contenant. |
| US4567179A (en) | 1984-10-11 | 1986-01-28 | Pfizer, Inc. | Antiinflammatory salts of piroxicam |
| DE3519693A1 (de) | 1985-06-01 | 1987-01-02 | Basf Ag | Pyridin-derivate, ihre herstellung und verwendung |
| US4837239A (en) | 1985-08-23 | 1989-06-06 | Syntex (U.S.A.) Inc. | Cardiotonic phosphodiesterase inhibitors complexed with water soluble vitamins |
| US5053396A (en) | 1985-08-27 | 1991-10-01 | Blass David H | Therapeutic composition |
| US4735956A (en) | 1985-09-13 | 1988-04-05 | Merck & Co., Inc. | Certain 1,4-dihydro-2,6-di-lower hydrocarbyl-4-heterocyclic-3,5-pyridine dicarboxylates which are useful as calcium channel blockers |
| US4605741A (en) | 1985-11-13 | 1986-08-12 | Lisapharma Spa | Pharmaceutically active salt derivative of 3-hydroxy-5-(hydroxymethyl)-2-methylisonicotinaldehyde phosphate |
| DE3634016A1 (de) | 1986-04-17 | 1987-10-29 | Lohmann Gmbh & Co Kg | Flaechenfoermiges therapeutisches system, verfahren zu seiner herstellung und seine verwendung |
| US5210083A (en) | 1986-07-17 | 1993-05-11 | Ed. Geistlich Sohne A.G. Fur Chemische Industrie | Pharmaceutical compositions |
| US5563126A (en) | 1986-11-20 | 1996-10-08 | Metabolite Laboratories | Method for treatment and prevention of deficiencies of vitamins B12, folic acid, and B6 |
| NZ222664A (en) | 1986-11-29 | 1990-06-26 | Vesta Med Pty Ltd | Pharmaceutical compositions containing pyridoxal as a source of vitamin b6 |
| US5631271A (en) | 1986-11-29 | 1997-05-20 | Serfontein; Willem J. | Methods and preparations for the treatment and prophylaxis of metabolic disturbances |
| US5254572A (en) | 1987-11-27 | 1993-10-19 | Vesta Medicines (Pty) Ltd. | Method and composition for supplementing vitamin B6 where the PN-PLP pathway is disturbed |
| US4843071A (en) | 1986-12-05 | 1989-06-27 | Serotonin Industries Of Charleston | Method and composition for treating obesity, drug abuse, and narcolepsy |
| DE3705549A1 (de) | 1987-02-18 | 1988-09-01 | Ulrich Speck | Verwendung von pyridoxin-derivaten bei der prophylaxe und therapie von hyperlipidaemien und atherosklerose |
| US5288716A (en) | 1987-02-18 | 1994-02-22 | Ulrich Speck | Use of pyridoxine derivatives in the prevention and treatment of hyperlipidaemia and atherosclerosis |
| SE8701662L (sv) | 1987-04-22 | 1988-10-23 | Gelder Nico M Van | Saett och medel foer att behandla neurologiska sjukdomar, exempelvis migraen genom paaverkan av nervcellerna |
| US5213813A (en) | 1987-05-29 | 1993-05-25 | The University Of Vermont | Pyridoxal-5'-phosphate as an in vitro blood platelet stabilizer |
| US4931002A (en) * | 1987-05-29 | 1990-06-05 | The University Of Vermont | Pyridoxal-5'-phosphate as an in vitro anticoagulant for whole blood |
| ES2043897T3 (es) | 1988-01-28 | 1994-01-01 | Koeltringer Peter | Preparado de combinacion, en especial para el tratamiento de enfermedades de las celulas nerviosas. |
| NO179479C (no) | 1988-03-11 | 1996-10-16 | Teikoku Seiyaku Kk | Fremgangsmåte for fremstilling av et intravaginalt farmasöytisk preparat |
| US5254557A (en) | 1988-05-09 | 1993-10-19 | Beecham Group P.L.C. | Compound and treatment |
| US5088977A (en) | 1988-12-21 | 1992-02-18 | Drug Delivery Systems Inc. | Electrical transdermal drug applicator with counteractor and method of drug delivery |
| US5001115A (en) | 1989-05-17 | 1991-03-19 | University Of Florida | Prodrugs of biologically active hydroxyaromatic compounds |
| GB8918368D0 (en) | 1989-08-11 | 1989-09-20 | Amco Chemie Gmbh | Compositions for treating obstructive airways disease |
| DE4016963A1 (de) | 1990-05-25 | 1991-11-28 | Steigerwald Arzneimittelwerk | Verwendung von magnesium-pyridoxal-5'-phosphat-glutaminat zur verhinderung von erkrankungen, die sich infolge von gefaessschaeden ergeben |
| US5385937A (en) | 1991-04-10 | 1995-01-31 | Brigham & Women's Hospital | Nitrosation of homocysteine as a method for treating homocysteinemia |
| GB2254556B (en) | 1991-04-11 | 1995-04-12 | Fisons Plc | Formulations containing linolenic acid |
| WO1992020816A1 (en) | 1991-05-15 | 1992-11-26 | Yale University | Determination of prodrugs metabolizable by the liver and therapeutic use thereof |
| FR2678622B1 (fr) | 1991-07-03 | 1994-11-18 | Adir | Nouveaux complexes de vanadium, leur procede de preparation et les compositions pharmaceutiques qui les contiennent. |
| JPH07503010A (ja) | 1992-01-06 | 1995-03-30 | ヘルス・メインテナンス・プログラムズ,インコーポレイテッド | 薬学活性酸化防止剤含有組成物並びに該組成物を使用する血管形成後の再狭窄予防および治療方法 |
| US5420112A (en) | 1992-06-12 | 1995-05-30 | Lewis; Michael E. | Prevention and treatment of peripheral neuropathy |
| WO1993025219A1 (en) | 1992-06-12 | 1993-12-23 | Cephalon, Inc. | Prevention and treatment of peripheral neuropathy |
| US5330743A (en) | 1992-11-12 | 1994-07-19 | Magnetic Research, Inc. | Aminosaccharide contrast agents for magnetic resonance images |
| US5795873A (en) | 1992-12-29 | 1998-08-18 | Metabolite Laboratories, Inc. | Method for treatment and prevention of deficiencies of vitamins B12, folic acid and B6 |
| TW268948B (de) | 1993-04-02 | 1996-01-21 | Senju Pharma Co | |
| DE4344751A1 (de) | 1993-12-28 | 1995-06-29 | Carl Heinrich Dr Weischer | Neue Vitamin B6-Derivate und deren Herstellung und Verwendung als Arzneimittel und als Kosmetika |
| US5504090A (en) | 1994-03-30 | 1996-04-02 | Trustees Of The University Of Pennsylvania | Compositions and methods for the prevention and treatment of ischemia-reperfusion organ injury |
| ES2244966T3 (es) | 1994-12-12 | 2005-12-16 | Omeros Corporation | Solucion de irrigacion y su utilizacion para inhibir perioperatoriamente el dolor, la inflamacion y el espasmo en una herida. |
| US5569459A (en) | 1995-02-15 | 1996-10-29 | Bio-Virus Research Incorporated | Pharmaceutical compositions for the management of premenstrual syndrome and alleviation of menopausal disorders |
| US5733916A (en) | 1995-03-24 | 1998-03-31 | The Trustees Of The University Of Pennsylvania | Prevention and treatment of ischemia-reperfusion and endotoxin-related injury using adenosine and purino receptor antagonists |
| US5874443A (en) | 1995-10-19 | 1999-02-23 | Trega Biosciences, Inc. | Isoquinoline derivatives and isoquinoline combinatorial libraries |
| US5833998A (en) | 1995-11-06 | 1998-11-10 | The Procter & Gamble Company | Topical compositions for regulating the oily/shiny appearance of skin |
| US5733884A (en) | 1995-11-07 | 1998-03-31 | Nestec Ltd. | Enteral formulation designed for optimized wound healing |
| US5874420A (en) | 1995-12-26 | 1999-02-23 | Allegheny University Of The Health Sciences | Process for regulating vagal tone |
| US5847008A (en) | 1996-02-02 | 1998-12-08 | Merck & Co., Inc. | Method of treating diabetes and related disease states |
| US5859051A (en) | 1996-02-02 | 1999-01-12 | Merck & Co., Inc. | Antidiabetic agents |
| JPH09221425A (ja) * | 1996-02-13 | 1997-08-26 | Taiho Yakuhin Kogyo Kk | チオールプロテアーゼ阻害剤 |
| US5834446A (en) | 1996-06-21 | 1998-11-10 | Queen's University At Kingston | Nerve process growth modulators |
| US5770215A (en) | 1997-01-06 | 1998-06-23 | Moshyedi; Emil Payman | Multivitamin/vascular occlusion inhibiting composition |
| US5804594A (en) | 1997-01-22 | 1998-09-08 | Murad; Howard | Pharmaceutical compositions and methods for improving wrinkles and other skin conditions |
| US5944020A (en) | 1997-02-25 | 1999-08-31 | Cypros Pharmaceutical Corp. | Use of fructose-1 6-diphosphate as an inotrope drug after cardiopulmonary bypass surgery |
| US5888514A (en) | 1997-05-23 | 1999-03-30 | Weisman; Bernard | Natural composition for treating bone or joint inflammation |
| EP0891719A1 (de) | 1997-07-14 | 1999-01-20 | N.V. Nutricia | Narungszusammensetzungen mit Gehalt an Methionin |
| JPH11139969A (ja) * | 1997-08-07 | 1999-05-25 | Tanabe Seiyaku Co Ltd | 医薬組成物 |
| US6043259A (en) | 1998-07-09 | 2000-03-28 | Medicure Inc. | Treatment of cardiovascular and related pathologies |
-
2001
- 2001-07-06 US US09/900,718 patent/US6417204B1/en not_active Expired - Fee Related
- 2001-07-06 AU AU2001272263A patent/AU2001272263B2/en not_active Ceased
- 2001-07-06 JP JP2002509088A patent/JP2004502757A/ja active Pending
- 2001-07-06 AU AU7226301A patent/AU7226301A/xx active Pending
- 2001-07-06 DE DE60128912T patent/DE60128912T9/de active Active
- 2001-07-06 EP EP01951279A patent/EP1299358B1/de not_active Expired - Lifetime
- 2001-07-06 NZ NZ523815A patent/NZ523815A/en unknown
- 2001-07-06 WO PCT/CA2001/000994 patent/WO2002004421A2/en not_active Ceased
- 2001-07-06 CA CA002414188A patent/CA2414188A1/en not_active Abandoned
- 2001-07-06 AT AT01951279T patent/ATE364595T1/de not_active IP Right Cessation
Also Published As
| Publication number | Publication date |
|---|---|
| DE60128912T9 (de) | 2008-06-26 |
| WO2002004421A3 (en) | 2002-04-04 |
| WO2002004421A2 (en) | 2002-01-17 |
| NZ523815A (en) | 2004-07-30 |
| ATE364595T1 (de) | 2007-07-15 |
| CA2414188A1 (en) | 2002-01-17 |
| AU7226301A (en) | 2002-01-21 |
| EP1299358A2 (de) | 2003-04-09 |
| US6417204B1 (en) | 2002-07-09 |
| JP2004502757A (ja) | 2004-01-29 |
| EP1299358B1 (de) | 2007-06-13 |
| AU2001272263B2 (en) | 2005-12-15 |
| DE60128912D1 (en) | 2007-07-26 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| DE60128912T2 (de) | Pyridoxin- und pyridoxalanaloga als cardiovasculäre therapeutika | |
| DE60023125T2 (de) | Pyridoxal-analoge zur behandlung von störungen ausgelöst durch einen vitamin b6 mangel | |
| DE69628856T2 (de) | Substituierte n-[(aminoiminomethyl oder aminomethyl)phenyl]propylamide | |
| CH644116A5 (de) | Imidazolderivate. | |
| AU2001272263A1 (en) | Pyridoxine and pyridoxal analogues: cardiovascular therapeutics | |
| DE68917556T2 (de) | Quinolyloxazol-2-one, nützlich als Proteinkinase-C-Inhibitoren. | |
| DE4321030A1 (de) | 4-bicyclisch substituierte Dihydropyridine, Verfahren zu ihrer Herstellung und ihre Verwendung in Arzneimittel | |
| EP0325129B1 (de) | Disubstituierte Pyridine | |
| DE4215588A1 (de) | Biphenylmethyl-substituierte Pyridone | |
| EP0546389B1 (de) | Piperidylmethyl substituierte Chromanderivate als Wirkstoffe zur Behandlung von Erkrankungen des Zentralnervensystems | |
| DE69214113T2 (de) | Neue Pyrrolidinderivate, Verfahren zu ihrer Herstellung und diese enthaltende Arzneimittel | |
| DE4313693A1 (de) | 2-Amino-4-chinolin-dihydropyridine, Verfahren zu ihrer Herstellung und ihre Verwendung | |
| EP0770082B1 (de) | Dioxo-thiopyrano-pyridin-carbonsäure-derivate und ihre verwendung als arzneimittel | |
| DE3874394T2 (de) | 1,3-dioxane. | |
| EP0315018A2 (de) | Fluormethoxyphenyl-dihydropyridine, Verfahren zur Herstellung und ihre Verwendung in Arzneimitteln | |
| EP0435153A2 (de) | R-(-)-1-(5-Hydroxyhexyl)-3-methyl-7-propylxanthin, Verfahren zu dessen Herstellung und diese Verbindung enthaltende Arzneimittel | |
| EP0519291A1 (de) | Aminomethyl-substituierte 2,3-Dihydropyrano(2,3-b)pyridine, Verfahren zu ihrer Herstellung und ihre Verwendung in Arzneimitteln | |
| EP0489327A1 (de) | Chromanderivate | |
| DE3607821A1 (de) | Aminoester-dihydropyridine, verfahren zur herstellung und ihre verwendung | |
| DE69529807T2 (de) | Neue Parabansäure-Derivate als Aldose-Reduktase Inhibitoren | |
| EP0214437B1 (de) | Verfahren zur Herstellung von 1,4-Dihydropyridinderivaten über neue Zwischenprodukte | |
| EP0180833B1 (de) | 4-Oxo-pyrido[2,3]pyrimidin-Derivate, Verfahren zur deren Herstellung und diese ethaltende Arzneimittel | |
| EP0351720A2 (de) | Verwendung substituierter 3,4-Dihydro-2H-benzopyrane als Heilmittel gegen obstruktive Funktionsstörungen der Lunge | |
| DE3876859T2 (de) | Cardiotonische tricyclische oxazolone. | |
| DE60013607T2 (de) | Bemzimidazolverbindungen und medikamente die diese enthalten |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| 8364 | No opposition during term of opposition |