RU2485095C2 - Кристаллическое основание миноциклина и способы его получения - Google Patents
Кристаллическое основание миноциклина и способы его получения Download PDFInfo
- Publication number
- RU2485095C2 RU2485095C2 RU2009135403/04A RU2009135403A RU2485095C2 RU 2485095 C2 RU2485095 C2 RU 2485095C2 RU 2009135403/04 A RU2009135403/04 A RU 2009135403/04A RU 2009135403 A RU2009135403 A RU 2009135403A RU 2485095 C2 RU2485095 C2 RU 2485095C2
- Authority
- RU
- Russia
- Prior art keywords
- minocycline
- base
- crystalline
- amorphous
- peaks
- Prior art date
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C237/00—Carboxylic acid amides, the carbon skeleton of the acid part being further substituted by amino groups
- C07C237/24—Carboxylic acid amides, the carbon skeleton of the acid part being further substituted by amino groups having the carbon atom of at least one of the carboxamide groups bound to a carbon atom of a ring other than a six-membered aromatic ring of the carbon skeleton
- C07C237/26—Carboxylic acid amides, the carbon skeleton of the acid part being further substituted by amino groups having the carbon atom of at least one of the carboxamide groups bound to a carbon atom of a ring other than a six-membered aromatic ring of the carbon skeleton of a ring being part of a condensed ring system formed by at least four rings, e.g. tetracycline
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/65—Tetracyclines
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/04—Antibacterial agents
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Medicinal Chemistry (AREA)
- Animal Behavior & Ethology (AREA)
- Life Sciences & Earth Sciences (AREA)
- Pharmacology & Pharmacy (AREA)
- Oncology (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Communicable Diseases (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Epidemiology (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
Abstract
Группа изобретений относится к кристаллическому основанию миноциклина, а именно трем кристаллическим формам, обозначаемым как форма I, форма II и форма III, и способам их (форм I, II и III) получения. Технический результат заключается в получении новых, более стабильных форм основания миноциклина. 7 н. и 7 з.п. ф-лы, 6 пр., 8 ил.
Description
В настоящем изобретении предлагается кристаллическое основание миноциклина, включая три его новые полиморфные формы, и описывается также способ получения чистого основания миноциклина в кристаллической форме, где осуществляется контроль всех примесей, особенно, примеси 4-эпиминоциклина, на очень низком уровне.
Уровень техники
Миноциклин является членом тетрациклиновых антибиотиков широкого спектра действия, который обладает более широким спектром действия, чем другие члены этой группы соединений.
Миноциклин широко используется в терапии в первую очередь для лечения акне и розовых угрей в однократной суточной дозе 100 мг.
Получение миноциклина раскрыто в патентах США 3148212; 3226436 и 4849136.
Миноциклин может быть использован в виде основания сам по себе или в виде нетоксичных аддитивных солей органических или неорганических кислот, например, сульфоновой, трихлоруксусной или хлороводородной кислоты.
Основание миноциклина, известное ранее только в аморфной форме, не является таким стабильным как соответствующие аддитивные соли кислот, и поэтому были изучены методы получения стабильной формы основания миноциклина, которая обеспечила бы преимущества при его использовании в качестве активного ингредиента.
Подробное описание
В настоящем изобретении описывается кристаллическое основание миноциклина, включая новые полиморфные формы кристаллического основания миноциклина и новые способы их получения.
Авторы настоящего изобретения неожиданно обнаружили, что основание миноциклина действительно может быть предоставлено в стабильной кристаллической форме. Они также обнаружили три новых полиморфных формы кристаллического основания миноциклина.
Соответственно, в самом широком аспекте изобретение относится к кристаллическому основанию миноциклина.
В одном аспекте предлагается полиморфная форма I кристаллического основания миноциклина. Существование данной кристаллической формы основания миноциклина, которое до сегодняшнего дня было известно только в своей аморфной форме, подтверждено с помощью физических параметров, применение которых в этой области хорошо известно специалистам.
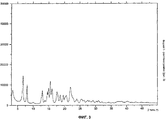
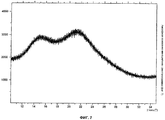
Кристаллическая форма I основания миноциклина имеет характерную рентгенограмму, представленную на фиг.1, и инфракрасный спектр фиг.2.
Кристаллическая форма I характеризуется рентгенограммой, имеющей пики при 5,2, 7,6, 8,8, 12,8, 14,5, 15,0, 15,3, 15,9, 16,4, 17,8, 19,3, 19,5, 20,7, 21,3, 21,8, 22,3, 23,1, 24,0, 25,3, 25,7 и 26,5±0,2° 2θ, как показано на фиг.1. Она дополнительно характеризуется инфракрасным спектром, имеющим пики при 1646, 1602, 1581, 1470, 1397, 1364, 1286, 1218, 1182, 1134, 1072, 1061, 1023, 1001, 969, 950, 874, 850, 716, 636, 620 и 545±4 см-1, как показано на фиг.2.
В другом аспекте в изобретении предлагается способ получения полиморфной формы I кристаллического основания миноциклина, включающий растворение и/или суспендирование аморфного основания миноциклина в органическом растворителе, выбранном из простых эфиров, с последующей кристаллизацией из смеси.
Предпочтительно, способ включает суспендирование аморфного основания миноциклина в органическом растворителе, выбранном из простых эфиров, охлаждение гетерогенной смеси до температуры от 0°С до 30°С с предпочтительным диапазоном, составляющим от 10°С до 15°С и выделение формы I из реакционной смеси.
В качестве растворителя может быть использован любой подходящий простой эфир, но предпочтительно использовать метил-трет-бутиловый эфир.
В другом аспекте предлагается полиморфная форма II кристаллического основания миноциклина. Существование данной кристаллической формы основания миноциклина, которое до сегодняшнего дня было известно только в своей аморфной форме, подтверждено с помощью физических параметров, применение которых в данной области хорошо известно специалистам.
Кристаллическая форма II основания миноциклина имеет характерную рентгенограмму, представленную на фиг.3, и инфракрасный спектр фиг.4.
Кристаллическая форма II характеризуется рентгенограммой, имеющей пики при 3,4, 6,8, 8,0, 10,0, 13,0, 13,8, 14,6, 14,9, 15,5, 16,1, 17,6, 17,8, 18,6, 19,5, 20,2, 20,6, 21,9, 22,6, 23,9, 24,2, 25,4, 26,3, 27,1, 27,5, 28,0 и 29,1±0,2° 2θ, как показано на фиг.3. Она дополнительно характеризуется инфракрасным спектром, имеющим пики при 1644, 1607, 1582, 1469, 1453, 1413, 1396, 1358, 1287, 1251, 1217, 1186, 1166, 1136, 1061, 999, 970, 874, 716, 621 и 585±4 см-1, как показано на фиг.4.
В другом аспекте способ получения полиморфной формы II кристаллического основания миноциклина включает растворение и/или суспендирование аморфного основания миноциклина в органическом растворителе, выбранном из сложных эфиров, с последующей кристаллизацией из смеси.
Предпочтительно, способ включает суспендирование аморфного основания миноциклина в органическом растворителе, выбранном из сложных эфиров, охлаждение гетерогенной смеси до температуры от 0°С до 30°С с предпочтительным диапазоном, составляющим от 10°С до 15°С и выделение формы II из реакционной смеси.
В качестве растворителя может быть использован любой подходящий сложный эфир, но предпочтительно использовать этилацетат.
В другом аспекте предлагается полиморфная форма III кристаллического основания миноциклина. Существование данной кристаллической формы основания миноциклина, которое до сегодняшнего дня было известно только в своей аморфной форме, подтверждено с помощью физических параметров, применение которых в данной области хорошо известно специалистам.
Кристаллическая форма III основания миноциклина имеет характерную рентгенограмму дифракционных полос, представленную на фиг.5, и инфракрасный спектр фиг.6.
Кристаллическая форма III характеризуется рентгенограммой, имеющей пики при 6,5, 10,0, 13,2, 15,1, 16,5, 17,9, 19,6, 20,2, 21,1, 22,3, 23,7, 24,8, 26,4, 28,1 и 30,5±0,2° 2θ, как показано на фиг.5. Она дополнительно характеризуется инфракрасным спектром, имеющим пики при 1647, 1605, 1581, 1470, 1399, 1307, 1286, 1251, 1216, 1195, 1179, 1136, 1094, 1058, 1024, 1000, 973, 950, 870, 825, 806, 716, 680, 634, 615, 584, 515, 496 и 413±4 см-1, как показано на фиг.6.
В другом аспекте способ получения полиморфной формы III кристаллического основания миноциклина включает растворение и/или суспендирование аморфного основания миноциклина в органическом растворителе, выбранном из спиртов, с последующей кристаллизацией из смеси.
Предпочтительно способ включает суспендирование аморфного основания миноциклина в органическом растворителе, выбранном из спиртов, охлаждение гетерогенной смеси до температуры от 0°С до 30°С с предпочтительным диапазоном, составляющим от 10°С до 15°С и выделение формы III из реакционной смеси.
В качестве растворителя может быть использован любой подходящий спирт, но предпочтительно использовать этанол.
Кристаллические основания миноциклина в формах I, II и III, полученные с помощью способов, описанных выше, обладают высокой чистотой с контролем всех примесей, особенно 4-эпиминоциклина, который обычно составляет менее 1,2% масс./масс. (т.е. по массе основания).
В другом аспекте, следовательно, в изобретении предлагается кристаллическое основание миноциклина, по существу свободное от 4-эпициклина. Под «по существу свободным» заявители подразумевают, что присутствует не более чем приблизительно 1,2% примеси по массе полиморфа (масс./масс.). Предпочтительно уровень примесей составляет менее 1,2% масс./масс.
В дополнительном аспекте, следовательно, в изобретении предлагается кристаллическое основание миноциклина, включающее менее 1,2% масс./масс. (по массе основания) 4-эпиминоциклина.
В другом аспекте в изобретении предлагаются способы получения аморфного основания миноциклина в промышленном масштабе, где основание миноциклина получают с высокой степенью чистоты, особенно при поддержании низких уровней содержания 4-эпиминоциклина.
В одном аспекте предлагается способ получения аморфного основания миноциклина, включающий распылительную сушку раствора или суспензии миноциклина в органическом растворителе, предпочтительно выбранном из метил-трет-бутилового эфира, дихлорметана или изопропилацетата.
Предпочтительный способ получения аморфного основания миноциклина включает:
1) растворение основания миноциклина в одном или боле органических растворителях с образованием раствора или суспензии;
2) распылительную сушку раствора или суспензии, полученных на стадии 1;
3) необязательную сушку полученного таким образом аморфного основания миноциклина, если необходимо в вакууме, при температуре от 25°С до 45°С, предпочтительно от 35°С до 45°С.
Может быть использован любой подходящий растворитель, и предпочтительные растворители включают метил-трет-бутиловый эфир, дихлорметан или изопропилацетат.
Может быть использован любой подходящий способ распылительной сушки. Например, могут быть использованы традиционные способы распылительной сушки (как должно быть ясно специалистам в данной области техники).
Примеры
Для иллюстрации настоящего изобретения, но не для какого-либо ограничения его объема, предлагаются следующие примеры.
Пример 1: получение формы I кристаллического основания миноциклина
Аморфное основание миноциклина (0,5 г) суспендируют в метил-трет-бутиловом эфире (4 мл) и полученную гетерогенную смесь перемешивают в течение приблизительно 2 часов при температуре от 0°С до 30°С, предпочтительно от 10°С до 15°С.
Продукт фильтруют, промывают метил-трет-бутиловым эфиром (1 мл) и сушат в вакууме при приблизительно 45°С-50°С с получением кристаллического основания миноциклина.
Выход: 0,38 г
Картина XRPD и инфракрасный спектр представлены на фиг.1 и фиг.2.
4-эпиминоциклин: 0,06% по площади (ВЭЖХ)
Точка плавления: 113°С.
Пример 2: получение формы I кристаллического основания миноциклина
Аморфное основание миноциклина (0,5 г) растворяют в метил-трет-бутиловом эфире (6 мл) и полученный раствор перемешивают при температуре от 0°С до 30ºС, предпочтительно от 10°С до 15°С.
Приблизительно через 5 минут форма I кристаллического основания миноциклина осаждается из раствора.
Полученную суспензию фильтруют, промывают метил-трет-бутиловым эфиром (1 мл) и сушат в вакууме при приблизительно 45°С-50°С с получением формы I кристаллического основания миноциклина.
Выход: 0,45 г
Точка плавления: 113°С.
Пример 3: получение формы II кристаллического основания миноциклина
Аморфное основание миноциклина (20 г) суспендируют в этилацетате (160 мл) и полученную гетерогенную смесь перемешивают в течение приблизительно 3 часов при температуре от 0°С до 30°С, предпочтительно от 10°С до 15°С.
Продукт фильтруют, промывают этилацетатом (10 мл) и сушат в вакууме при приблизительно 45°С-50°С с получением кристаллического основания миноциклина.
Выход: 17,4 г
Чистота по ВЭЖХ: 99,5% по площади
4-эпиминоциклин: 0,11% по площади.
Точка плавления: 187°С.
Картина XRPD и инфракрасный спектр представлены на фиг.3 и фиг.4.
Пример 4: получение формы II кристаллического основания миноциклина
Аморфное основание миноциклина (5 г) растворяют в этилацетате (40 мл) и полученный раствор перемешивают в течение приблизительно 3 часов при температуре от 0°С до 30°С, предпочтительно от 10°С до 15°С после чего форма II кристаллического основания миноциклина осаждается.
Продукт фильтруют, промывают этилацетатом (5 мл) и сушат в вакууме при приблизительно 45°С-50°С с получением формы II кристаллического основания миноциклина.
Выход: 3,2 г
Точка плавления: 187°С.
Пример 5: получение формы III основания миноциклина
Аморфное основание миноциклина (0,5 г) суспендируют в этиловом спирте (2,5 мл) и полученную гетерогенную смесь перемешивают в течение, по меньшей мере, 10 часов при температуре от 0°С до 30°С, предпочтительно от 10°С до 15°С.
Продукт фильтруют, промывают этиловым спиртом (0,5 мл) и сушат в вакууме при приблизительно 45°С-50°С с получением формы III кристаллического основания миноциклина.
Выход: 0,44 г
Картина XRPD и инфракрасный спектр представлены на фиг.5 и фиг.6.
4-эпиминоциклин: 0,12% по площади (ВЭЖХ)
Точка плавления: 193°С.
Пример 6: получение аморфного основания миноциклина
Раствор основания миноциклина в дихлорметане, изопропилацетате или метил-трет-бутиловом эфире выделяют распылительной сушкой на обычном оборудовании для распылительной сушки с использованием температуры на входе от 45°С до 105°С и температуры на выходе от 30°С до 75°С.
Выделенный продукт может быть использован непосредственно для получения любой из форм кристаллического основания миноциклина или может быть подвергнут последующей стадии сушки в вакууме при приблизительно 45°С с выходом чистого аморфного основания миноциклина.
Выход: 24,5 г
Чистота ВЭЖХ: 98,6% по площади.
Картина XRPD и инфракрасный спектр представлены на фиг.7 и фиг.8.
Claims (14)
1. Форма I кристаллического основания миноциклина, характеризующаяся рентгенограммой, имеющей пики при 5,2, 7,6, 8,8, 12,8, 14,5, 15,0, 15,3, 15,9, 16,4, 17,8, 19,3, 19,5, 20,7, 21,3, 21,8, 22,3, 23,1, 24,0, 25,3, 25,7 и 26,5±0,2° 2θ, как показано на фиг.1.
2. Форма I кристаллического основания миноциклина по п.1, дополнительно характеризующаяся инфракрасным спектром, имеющим пики при 1646, 1602, 1581, 1470, 1397, 1364, 1286, 1218, 1182, 1134, 1072, 1061, 1023, 1001, 969, 950, 874, 850, 716, 636, 620 и 545±4 см-1, как показано на фиг.2.
3. Способ получения формы I кристаллического основания миноциклина, включающий растворение и/или суспендирование аморфного основания миноциклина в органическом растворителе, выбранном из простых эфиров, с последующей кристаллизацией из смеси.
4. Способ по п.3, где органический растворитель представляет собой метил-трет-бутиловый эфир.
5. Форма II кристаллического основания миноциклина, характеризующаяся рентгенограммой, имеющей пики при 3,4, 6,8, 8,0, 10,0, 13,0, 13,8, 14,6, 14,9, 15,5, 16,1, 17,6, 17,8, 18,6, 19,5, 20,2, 20,6, 21,9, 22,6, 23,9, 24,2, 25,4, 26,3, 27,1, 27,5, 28,0 и 29,1±0,2° 2θ, как показано на фиг.3.
6. Форма II кристаллического основания миноциклина по п.5, дополнительно характеризующаяся инфракрасным спектром, имеющим пики при 1644, 1607, 1582, 1469, 1453, 1413, 1396, 1358, 1287, 1251, 1217, 1186, 1166, 1136, 1061, 999, 970, 874, 716, 621 и 585±4 см-1, как показано на фиг.4.
7. Способ получения формы II кристаллического основания миноциклина, включающий растворение и/или суспендирование аморфного основания миноциклина в органическом растворителе, выбранном из сложных эфиров, с последующей кристаллизацией из смеси.
8. Способ по п.7, где органический растворитель представляет собой этилацетат.
9. Форма III кристаллического основания миноциклина, характеризующаяся рентгенограммой, имеющей пики при 6,5, 10,0, 13,2, 15,1, 16,5, 17,9, 19,6, 20,2, 21,1, 22,3, 23,7, 24,8, 26,4, 28,1 и 30,5±0,2° 2θ, как показано на фиг.5.
10. Форма III кристаллического основания миноциклина по п.10, дополнительно характеризующаяся инфракрасным спектром, имеющим пики при 1647, 1605, 1581, 1470, 1399, 1307, 1286, 1251, 1216, 1195, 1179, 1136, 1094, 1058, 1024, 1000, 973, 950, 870, 825, 806, 716, 680, 634, 615, 584, 515, 496 и 413±4 см-1, как показано на фиг.6.
11. Способ получения формы III кристаллического основания миноциклина, включающий растворение и/или суспендирование аморфного основания миноциклина в органическом растворителе, выбранном из спиртов, с последующей кристаллизацией из смеси.
12. Способ по п.11, где органический растворитель представляет собой этанол.
13. Способ по любому из пп.3-4, 7-8 или 11-12, где содержание 4-эпиминоциклина составляет менее 1,2% мас./мас.
14. Кристаллическое основание миноциклина, подходящее для применения в качестве антибиотика, включающее менее 1,2% мас./мас. 4-эпиминоциклина.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| PT103661 | 2007-02-23 | ||
| PT103661A PT103661B (pt) | 2007-02-23 | 2007-02-23 | Processo de preparação de minociclina base cristalina |
| PCT/GB2008/000625 WO2008102161A2 (en) | 2007-02-23 | 2008-02-22 | Crystalline minocycline base and processes for its preparation |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2013112021/04A Division RU2577331C2 (ru) | 2007-02-23 | 2008-02-22 | Кристаллическое основание миноциклина и способы его получения |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| RU2009135403A RU2009135403A (ru) | 2011-03-27 |
| RU2485095C2 true RU2485095C2 (ru) | 2013-06-20 |
Family
ID=39432804
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2013112021/04A RU2577331C2 (ru) | 2007-02-23 | 2008-02-22 | Кристаллическое основание миноциклина и способы его получения |
| RU2009135403/04A RU2485095C2 (ru) | 2007-02-23 | 2008-02-22 | Кристаллическое основание миноциклина и способы его получения |
Family Applications Before (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2013112021/04A RU2577331C2 (ru) | 2007-02-23 | 2008-02-22 | Кристаллическое основание миноциклина и способы его получения |
Country Status (20)
| Country | Link |
|---|---|
| US (2) | US8258327B2 (ru) |
| EP (1) | EP2125705B1 (ru) |
| JP (4) | JP2010519247A (ru) |
| KR (1) | KR101391132B1 (ru) |
| CN (1) | CN101679218B (ru) |
| AU (1) | AU2008217619B2 (ru) |
| BR (2) | BR122021000846B1 (ru) |
| CA (2) | CA2835788C (ru) |
| DK (1) | DK2125705T3 (ru) |
| ES (1) | ES2610434T3 (ru) |
| HU (1) | HUE033030T2 (ru) |
| IL (1) | IL200544A0 (ru) |
| MX (2) | MX2009008980A (ru) |
| NO (1) | NO20092960L (ru) |
| NZ (1) | NZ579626A (ru) |
| PL (1) | PL2125705T3 (ru) |
| PT (1) | PT103661B (ru) |
| RU (2) | RU2577331C2 (ru) |
| WO (1) | WO2008102161A2 (ru) |
| ZA (1) | ZA200906517B (ru) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2789325C2 (ru) * | 2015-02-13 | 2023-02-01 | Ховионе Сциентиа Лимитед | Новые полиморфные формы миноциклинового основания и способы их получения |
Families Citing this family (33)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| IL152486A0 (en) | 2002-10-25 | 2003-05-29 | Meir Eini | Alcohol-free cosmetic and pharmaceutical foam carrier |
| US7700076B2 (en) | 2002-10-25 | 2010-04-20 | Foamix, Ltd. | Penetrating pharmaceutical foam |
| US20080138296A1 (en) | 2002-10-25 | 2008-06-12 | Foamix Ltd. | Foam prepared from nanoemulsions and uses |
| US9668972B2 (en) | 2002-10-25 | 2017-06-06 | Foamix Pharmaceuticals Ltd. | Nonsteroidal immunomodulating kit and composition and uses thereof |
| US9265725B2 (en) | 2002-10-25 | 2016-02-23 | Foamix Pharmaceuticals Ltd. | Dicarboxylic acid foamable vehicle and pharmaceutical compositions thereof |
| US10117812B2 (en) | 2002-10-25 | 2018-11-06 | Foamix Pharmaceuticals Ltd. | Foamable composition combining a polar solvent and a hydrophobic carrier |
| AU2003279493B2 (en) | 2002-10-25 | 2009-08-20 | Foamix Pharmaceuticals Ltd. | Cosmetic and pharmaceutical foam |
| US7704518B2 (en) | 2003-08-04 | 2010-04-27 | Foamix, Ltd. | Foamable vehicle and pharmaceutical compositions thereof |
| US9211259B2 (en) | 2002-11-29 | 2015-12-15 | Foamix Pharmaceuticals Ltd. | Antibiotic kit and composition and uses thereof |
| US8722650B1 (en) | 2005-06-24 | 2014-05-13 | Medicis Pharmaceutical Corporation | Extended-release minocycline dosage forms |
| US20080242642A1 (en) | 2007-04-02 | 2008-10-02 | Medicis Pharmaceutical Corporation | Minocycline oral dosage forms for the treatment of acne |
| US20080260655A1 (en) | 2006-11-14 | 2008-10-23 | Dov Tamarkin | Substantially non-aqueous foamable petrolatum based pharmaceutical and cosmetic compositions and their uses |
| PT103661B (pt) | 2007-02-23 | 2010-09-07 | Hovione Farmaciencia S A | Processo de preparação de minociclina base cristalina |
| US8636982B2 (en) | 2007-08-07 | 2014-01-28 | Foamix Ltd. | Wax foamable vehicle and pharmaceutical compositions thereof |
| WO2009069006A2 (en) | 2007-11-30 | 2009-06-04 | Foamix Ltd. | Foam containing benzoyl peroxide |
| WO2009072007A2 (en) | 2007-12-07 | 2009-06-11 | Foamix Ltd. | Carriers, formulations, methods for formulating unstable active agents for external application and uses thereof |
| WO2010017310A1 (en) | 2008-08-06 | 2010-02-11 | Medicis Pharmaceutical Corporation | Method for the treatment of acne and certain dosage forms thereof |
| PT104350A (pt) * | 2009-01-23 | 2010-07-23 | Hovione Farmaci Ncia S A | Processo de isolamento de tigeciclina |
| US20120087872A1 (en) | 2009-04-28 | 2012-04-12 | Foamix Ltd. | Foamable Vehicles and Pharmaceutical Compositions Comprising Aprotic Polar Solvents and Uses Thereof |
| PT104644B (pt) | 2009-06-26 | 2012-11-06 | Hovione Farmaciencia S A | Formulação tópica contendo uma tetraciclina e método de tratamento de infecções cutâneas usando a mesma |
| CA2769625C (en) | 2009-07-29 | 2017-04-11 | Foamix Ltd. | Non surfactant hydro-alcoholic foamable compositions, breakable foams and their uses |
| WO2011013008A2 (en) | 2009-07-29 | 2011-02-03 | Foamix Ltd. | Non surface active agent non polymeric agent hydro-alcoholic foamable compositions, breakable foams and their uses |
| US9849142B2 (en) | 2009-10-02 | 2017-12-26 | Foamix Pharmaceuticals Ltd. | Methods for accelerated return of skin integrity and for the treatment of impetigo |
| CN102686205A (zh) | 2009-10-02 | 2012-09-19 | 弗艾米克斯有限公司 | 局部四环素组合物 |
| US9561241B1 (en) | 2011-06-28 | 2017-02-07 | Medicis Pharmaceutical Corporation | Gastroretentive dosage forms for minocycline |
| PT106063B (pt) | 2011-12-19 | 2017-05-30 | Inst Superior Técnico | Minociclina cristalina termorresistente produzida por recristalização com dióxido de carbono |
| CN104151186B (zh) * | 2014-08-11 | 2016-06-15 | 重庆福安药业(集团)股份有限公司 | 替加环素杂质的立体选择性制备方法 |
| PT108223B (pt) * | 2015-02-13 | 2018-05-08 | Hovione Farm S A | Novas formas polimórficas de minociclina base e processos para a sua preparação |
| JP6793715B2 (ja) | 2015-03-23 | 2020-12-02 | バイオファーミクス・インコーポレイテッドBioPharmX, Inc. | テトラサイクリンの皮膚用医薬組成物 |
| WO2017097891A1 (en) * | 2015-12-10 | 2017-06-15 | Sandoz Ag | Crystalline eravacycline |
| MX2017011630A (es) | 2016-09-08 | 2018-09-25 | Foamix Pharmaceuticals Ltd | Composiciones y metodos para tratar rosacea y acne. |
| WO2021191273A1 (en) | 2020-03-24 | 2021-09-30 | Hovione Scientia Limited | Compositions for use in treating meibomian gland dysfunction |
| WO2022043457A1 (en) | 2020-08-27 | 2022-03-03 | Hovione Scientia Limited | Methods and compositions for treating rosacea |
Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US299111A (en) * | 1884-05-27 | Process of and apparatus | ||
| US3226436A (en) * | 1963-05-17 | 1965-12-28 | American Cyanamid Co | 7-and 9-alkylamino-6-deoxytetracycline |
| US4918208A (en) * | 1987-07-28 | 1990-04-17 | Nippon Kayaku Kabushiki Kaisha | Process for producing 7-dimethylamino-6-demethyl-6-deoxytetracycline |
| US5202449A (en) * | 1987-07-28 | 1993-04-13 | Nippon Kayaku Kabushiki Kaisha | Process for purifying 7-dimethylamino-6-demethyl-6-deoxytetracycline |
Family Cites Families (17)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3148212A (en) * | 1961-12-22 | 1964-09-08 | American Cyanamid Co | Reductive alkylation process |
| US3526629A (en) * | 1968-04-02 | 1970-09-01 | American Cyanamid Co | Beta-hydroxyethylpiperazinocarboxymethyl - 7 - dimethylamino - 6 - deoxy-6-demethyltetracycline |
| JPS5245716B1 (ru) * | 1970-07-10 | 1977-11-17 | ||
| NL158172B (nl) * | 1972-09-18 | 1978-10-16 | Farmaceutici Italia | Werkwijze voor het bereiden van tetracyclinederivaten met een substituent op de 7-plaats. |
| CN85101404A (zh) * | 1985-05-16 | 1987-01-17 | 帝人株式会社 | 头孢菌素衍生物的生产过程 |
| JPH0737433B2 (ja) * | 1987-06-11 | 1995-04-26 | 協和醗酵工業株式会社 | 7−アミノ−6−デメチル−6−デオキシテトラサイクリンの製造法 |
| JPH04235188A (ja) * | 1990-06-19 | 1992-08-24 | Takeda Chem Ind Ltd | ペネム化合物の結晶、その製造方法および抗菌剤 |
| US5262173A (en) * | 1992-03-02 | 1993-11-16 | American Cyanamid Company | Pulsatile once-a-day delivery systems for minocycline |
| DE4235133A1 (de) * | 1992-10-19 | 1994-04-21 | Bayer Ag | Kristallines (R)-(-)-2-Cycloheptyl-N-methylsulfonyl-[4-(2-chinolinyl-methoxy)-phenyl]-acetamid |
| JP3623531B2 (ja) * | 1993-06-07 | 2005-02-23 | ビーエーエスエフ アクチェンゲゼルシャフト | 結晶質l−アスコルビン酸−2−燐酸エステルマグネシウム塩の製造法 |
| PL193479B1 (pl) * | 1995-07-17 | 2007-02-28 | Warner Lambert Co | Formy krystaliczne hydratu atorwastatyny, kompozycja farmaceutyczna zawierająca formę krystaliczną I hydratu atorwastatyny oraz jej zastosowanie |
| DE69821984T2 (de) | 1997-12-22 | 2004-12-30 | Schering Corp. | Zubereitung enthaltend eine molekulardispersion mit erhöhter bioverfügbarkeit |
| IE991013A1 (en) * | 1998-12-01 | 2000-07-12 | Atropos Ltd | A Device |
| CL2004001884A1 (es) * | 2003-08-04 | 2005-06-03 | Pfizer Prod Inc | Procedimiento de secado por pulverizacion para la formacion de dispersiones solidas amorfas de un farmaco y polimeros. |
| AR057649A1 (es) * | 2005-05-27 | 2007-12-12 | Wyeth Corp | Formas solidas cristalinas de tigeciclina y metodos para preparar las mismas |
| US20070093455A1 (en) * | 2005-07-21 | 2007-04-26 | Paul Abato | 10-substituted tetracyclines and methods of use thereof |
| PT103661B (pt) | 2007-02-23 | 2010-09-07 | Hovione Farmaciencia S A | Processo de preparação de minociclina base cristalina |
-
2007
- 2007-02-23 PT PT103661A patent/PT103661B/pt active IP Right Grant
-
2008
- 2008-02-22 BR BR122021000846-9A patent/BR122021000846B1/pt active IP Right Grant
- 2008-02-22 MX MX2009008980A patent/MX2009008980A/es active IP Right Grant
- 2008-02-22 AU AU2008217619A patent/AU2008217619B2/en not_active Ceased
- 2008-02-22 RU RU2013112021/04A patent/RU2577331C2/ru active
- 2008-02-22 HU HUE08709507A patent/HUE033030T2/hu unknown
- 2008-02-22 US US12/528,209 patent/US8258327B2/en not_active Expired - Fee Related
- 2008-02-22 JP JP2009550320A patent/JP2010519247A/ja not_active Withdrawn
- 2008-02-22 CA CA2835788A patent/CA2835788C/en active Active
- 2008-02-22 KR KR1020097019750A patent/KR101391132B1/ko active IP Right Grant
- 2008-02-22 BR BRPI0807319-8A patent/BRPI0807319B1/pt active IP Right Grant
- 2008-02-22 CA CA2722496A patent/CA2722496C/en active Active
- 2008-02-22 PL PL08709507T patent/PL2125705T3/pl unknown
- 2008-02-22 WO PCT/GB2008/000625 patent/WO2008102161A2/en active Application Filing
- 2008-02-22 NZ NZ579626A patent/NZ579626A/en not_active IP Right Cessation
- 2008-02-22 CN CN2008800059328A patent/CN101679218B/zh active Active
- 2008-02-22 DK DK08709507.1T patent/DK2125705T3/en active
- 2008-02-22 RU RU2009135403/04A patent/RU2485095C2/ru active
- 2008-02-22 EP EP08709507.1A patent/EP2125705B1/en active Active
- 2008-02-22 ES ES08709507.1T patent/ES2610434T3/es active Active
-
2009
- 2009-08-21 MX MX2012005474A patent/MX340539B/es unknown
- 2009-08-23 IL IL200544A patent/IL200544A0/en active IP Right Grant
- 2009-09-04 NO NO20092960A patent/NO20092960L/no not_active Application Discontinuation
- 2009-09-18 ZA ZA200906517A patent/ZA200906517B/en unknown
-
2012
- 2012-08-30 US US13/599,116 patent/US9416097B2/en not_active Expired - Fee Related
-
2014
- 2014-05-20 JP JP2014104022A patent/JP2014169319A/ja active Pending
-
2016
- 2016-09-28 JP JP2016189162A patent/JP2017039742A/ja active Pending
-
2019
- 2019-03-27 JP JP2019059559A patent/JP2019142882A/ja active Pending
Patent Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US299111A (en) * | 1884-05-27 | Process of and apparatus | ||
| US3226436A (en) * | 1963-05-17 | 1965-12-28 | American Cyanamid Co | 7-and 9-alkylamino-6-deoxytetracycline |
| US4918208A (en) * | 1987-07-28 | 1990-04-17 | Nippon Kayaku Kabushiki Kaisha | Process for producing 7-dimethylamino-6-demethyl-6-deoxytetracycline |
| US5202449A (en) * | 1987-07-28 | 1993-04-13 | Nippon Kayaku Kabushiki Kaisha | Process for purifying 7-dimethylamino-6-demethyl-6-deoxytetracycline |
Non-Patent Citations (5)
| Title |
|---|
| BERNARDI ET. AL. «Tetracycline derivatives» IL FARMACO, EDIZIONE SCIENTIFICA 1975, V.30, No: 9, p.736-741. * |
| CAIRA M R., «CRYSTALLINE POLYMORPHISM OF ORGANIC COMPOUNDS» TOPICS IN CURRENT CHEMISTRY, 1998 V.198, p.163-208. * |
| CAIRA M R., «CRYSTALLINE POLYMORPHISM OF ORGANIC COMPOUNDS» TOPICS IN CURRENT CHEMISTRY, 1998 V.198, p.163-208. Church et al. «Synthesis of 7-Dimethylamino-6-demethyl-6-deoxy tetracycline (Minocycline) via 9-nitro-6-demethyl-6-deoxytetra cycline» J. Org. Chem.1971, Vol.36, №5 p.723-725. BERNARDI ET. AL. «Tetracycline derivatives» IL FARMACO, EDIZIONE SCIENTIFICA 1975, V.30, No: 9, p.736-741. ХИМИЧЕСКАЯ ЭНЦИКЛОПЕДИЯ. /Под ред. И.Л.Кнунянца и др. - М.: Советская энциклопедия, т.2; 1990, с.525, 527-529. * |
| Church et al. «Synthesis of 7-Dimethylamino-6-demethyl-6-deoxy tetracycline (Minocycline) via 9-nitro-6-demethyl-6-deoxytetra cycline» J. Org. Chem.1971, Vol.36, No.5 p.723-725. * |
| ХИМИЧЕСКАЯ ЭНЦИКЛОПЕДИЯ. /Под ред. И.Л.Кнунянца и др. - М.: Советская энциклопедия, т.2; 1990, с.525, 527-529. * |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2789325C2 (ru) * | 2015-02-13 | 2023-02-01 | Ховионе Сциентиа Лимитед | Новые полиморфные формы миноциклинового основания и способы их получения |
| RU2789331C2 (ru) * | 2015-02-13 | 2023-02-01 | Ховионе Сциентиа Лимитед | Новые полиморфные формы миноциклинового основания и способы их получения |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| RU2485095C2 (ru) | Кристаллическое основание миноциклина и способы его получения | |
| JP6535748B2 (ja) | ベンズイミダゾール誘導体の新規結晶形及びその製造方法 | |
| US5354760A (en) | Crystalline Tiagabine monohydrate, its preparation and use | |
| US10870654B2 (en) | Pharmaceutically acceptable salts and polymorphic forms of hydrocodone benzoic acid enol ester and processes for making same | |
| EP2882753B1 (en) | Process for the preparation of pemetrexed and lysin salt thereof | |
| CA2530964A1 (en) | Crystalline form of rabeprazole sodium | |
| KR102210848B1 (ko) | 3-포르밀리파마이신 sv 및 3-포르밀리파마이신 s의 3-(4-신나밀-1-피페라지닐) 아미노 유도체를 함유하는 제약 제제 및 그의 제조 방법 | |
| WO2012001357A1 (en) | Crystalline form of prulifloxacin and processes for its preparation | |
| WO2022200426A1 (en) | Preparation method of quinoline derivative compounds | |
| CN117700354A (zh) | 一种雷芬那辛的晶体形式及其制备方法 | |
| KR20100125124A (ko) | 피타바스타틴 헤미칼슘염의 신규한 결정형 및 그의 제조방법 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PC41 | Official registration of the transfer of exclusive right |
Effective date: 20151007 |