KR20190029576A - 핵산 카고용 하이브리드 담체 - Google Patents
핵산 카고용 하이브리드 담체 Download PDFInfo
- Publication number
- KR20190029576A KR20190029576A KR1020197000593A KR20197000593A KR20190029576A KR 20190029576 A KR20190029576 A KR 20190029576A KR 1020197000593 A KR1020197000593 A KR 1020197000593A KR 20197000593 A KR20197000593 A KR 20197000593A KR 20190029576 A KR20190029576 A KR 20190029576A
- Authority
- KR
- South Korea
- Prior art keywords
- cys
- nucleic acid
- sequence
- peptide
- rna
- Prior art date
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C215/00—Compounds containing amino and hydroxy groups bound to the same carbon skeleton
- C07C215/02—Compounds containing amino and hydroxy groups bound to the same carbon skeleton having hydroxy groups and amino groups bound to acyclic carbon atoms of the same carbon skeleton
- C07C215/04—Compounds containing amino and hydroxy groups bound to the same carbon skeleton having hydroxy groups and amino groups bound to acyclic carbon atoms of the same carbon skeleton the carbon skeleton being saturated
- C07C215/06—Compounds containing amino and hydroxy groups bound to the same carbon skeleton having hydroxy groups and amino groups bound to acyclic carbon atoms of the same carbon skeleton the carbon skeleton being saturated and acyclic
- C07C215/14—Compounds containing amino and hydroxy groups bound to the same carbon skeleton having hydroxy groups and amino groups bound to acyclic carbon atoms of the same carbon skeleton the carbon skeleton being saturated and acyclic the nitrogen atom of the amino group being further bound to hydrocarbon groups substituted by amino groups
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/62—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being a protein, peptide or polyamino acid
- A61K47/64—Drug-peptide, drug-protein or drug-polyamino acid conjugates, i.e. the modifying agent being a peptide, protein or polyamino acid which is covalently bonded or complexed to a therapeutically active agent
- A61K47/645—Polycationic or polyanionic oligopeptides, polypeptides or polyamino acids, e.g. polylysine, polyarginine, polyglutamic acid or peptide TAT
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/69—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the conjugate being characterised by physical or galenical forms, e.g. emulsion, particle, inclusion complex, stent or kit
- A61K47/6921—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the conjugate being characterised by physical or galenical forms, e.g. emulsion, particle, inclusion complex, stent or kit the form being a particulate, a powder, an adsorbate, a bead or a sphere
- A61K47/6927—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the conjugate being characterised by physical or galenical forms, e.g. emulsion, particle, inclusion complex, stent or kit the form being a particulate, a powder, an adsorbate, a bead or a sphere the form being a solid microparticle having no hollow or gas-filled cores
- A61K47/6929—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the conjugate being characterised by physical or galenical forms, e.g. emulsion, particle, inclusion complex, stent or kit the form being a particulate, a powder, an adsorbate, a bead or a sphere the form being a solid microparticle having no hollow or gas-filled cores the form being a nanoparticle, e.g. an immuno-nanoparticle
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K48/00—Medicinal preparations containing genetic material which is inserted into cells of the living body to treat genetic diseases; Gene therapy
- A61K48/0008—Medicinal preparations containing genetic material which is inserted into cells of the living body to treat genetic diseases; Gene therapy characterised by an aspect of the 'non-active' part of the composition delivered, e.g. wherein such 'non-active' part is not delivered simultaneously with the 'active' part of the composition
- A61K48/0025—Medicinal preparations containing genetic material which is inserted into cells of the living body to treat genetic diseases; Gene therapy characterised by an aspect of the 'non-active' part of the composition delivered, e.g. wherein such 'non-active' part is not delivered simultaneously with the 'active' part of the composition wherein the non-active part clearly interacts with the delivered nucleic acid
- A61K48/0041—Medicinal preparations containing genetic material which is inserted into cells of the living body to treat genetic diseases; Gene therapy characterised by an aspect of the 'non-active' part of the composition delivered, e.g. wherein such 'non-active' part is not delivered simultaneously with the 'active' part of the composition wherein the non-active part clearly interacts with the delivered nucleic acid the non-active part being polymeric
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0048—Eye, e.g. artificial tears
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P21/00—Drugs for disorders of the muscular or neuromuscular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P27/00—Drugs for disorders of the senses
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P27/00—Drugs for disorders of the senses
- A61P27/02—Ophthalmic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P27/00—Drugs for disorders of the senses
- A61P27/16—Otologicals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/02—Nutrients, e.g. vitamins, minerals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/04—Antibacterial agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P33/00—Antiparasitic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/04—Immunostimulants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/06—Immunosuppressants, e.g. drugs for graft rejection
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/08—Antiallergic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P5/00—Drugs for disorders of the endocrine system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C215/00—Compounds containing amino and hydroxy groups bound to the same carbon skeleton
- C07C215/02—Compounds containing amino and hydroxy groups bound to the same carbon skeleton having hydroxy groups and amino groups bound to acyclic carbon atoms of the same carbon skeleton
- C07C215/40—Compounds containing amino and hydroxy groups bound to the same carbon skeleton having hydroxy groups and amino groups bound to acyclic carbon atoms of the same carbon skeleton with quaternised nitrogen atoms bound to carbon atoms of the carbon skeleton
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C233/00—Carboxylic acid amides
- C07C233/01—Carboxylic acid amides having carbon atoms of carboxamide groups bound to hydrogen atoms or to acyclic carbon atoms
- C07C233/16—Carboxylic acid amides having carbon atoms of carboxamide groups bound to hydrogen atoms or to acyclic carbon atoms having the nitrogen atom of at least one of the carboxamide groups bound to a carbon atom of a hydrocarbon radical substituted by singly-bound oxygen atoms
- C07C233/17—Carboxylic acid amides having carbon atoms of carboxamide groups bound to hydrogen atoms or to acyclic carbon atoms having the nitrogen atom of at least one of the carboxamide groups bound to a carbon atom of a hydrocarbon radical substituted by singly-bound oxygen atoms with the substituted hydrocarbon radical bound to the nitrogen atom of the carboxamide group by an acyclic carbon atom
- C07C233/20—Carboxylic acid amides having carbon atoms of carboxamide groups bound to hydrogen atoms or to acyclic carbon atoms having the nitrogen atom of at least one of the carboxamide groups bound to a carbon atom of a hydrocarbon radical substituted by singly-bound oxygen atoms with the substituted hydrocarbon radical bound to the nitrogen atom of the carboxamide group by an acyclic carbon atom having the carbon atom of the carboxamide group bound to a carbon atom of an acyclic unsaturated carbon skeleton
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C233/00—Carboxylic acid amides
- C07C233/01—Carboxylic acid amides having carbon atoms of carboxamide groups bound to hydrogen atoms or to acyclic carbon atoms
- C07C233/56—Carboxylic acid amides having carbon atoms of carboxamide groups bound to hydrogen atoms or to acyclic carbon atoms having carbon atoms of carboxamide groups bound to carbon atoms of carboxyl groups, e.g. oxamides
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C237/00—Carboxylic acid amides, the carbon skeleton of the acid part being further substituted by amino groups
- C07C237/02—Carboxylic acid amides, the carbon skeleton of the acid part being further substituted by amino groups having the carbon atoms of the carboxamide groups bound to acyclic carbon atoms of the carbon skeleton
- C07C237/04—Carboxylic acid amides, the carbon skeleton of the acid part being further substituted by amino groups having the carbon atoms of the carboxamide groups bound to acyclic carbon atoms of the carbon skeleton the carbon skeleton being acyclic and saturated
- C07C237/10—Carboxylic acid amides, the carbon skeleton of the acid part being further substituted by amino groups having the carbon atoms of the carboxamide groups bound to acyclic carbon atoms of the carbon skeleton the carbon skeleton being acyclic and saturated having the nitrogen atom of at least one of the carboxamide groups bound to an acyclic carbon atom of a hydrocarbon radical substituted by nitrogen atoms not being part of nitro or nitroso groups
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C237/00—Carboxylic acid amides, the carbon skeleton of the acid part being further substituted by amino groups
- C07C237/02—Carboxylic acid amides, the carbon skeleton of the acid part being further substituted by amino groups having the carbon atoms of the carboxamide groups bound to acyclic carbon atoms of the carbon skeleton
- C07C237/04—Carboxylic acid amides, the carbon skeleton of the acid part being further substituted by amino groups having the carbon atoms of the carboxamide groups bound to acyclic carbon atoms of the carbon skeleton the carbon skeleton being acyclic and saturated
- C07C237/12—Carboxylic acid amides, the carbon skeleton of the acid part being further substituted by amino groups having the carbon atoms of the carboxamide groups bound to acyclic carbon atoms of the carbon skeleton the carbon skeleton being acyclic and saturated having the nitrogen atom of at least one of the carboxamide groups bound to an acyclic carbon atom of a hydrocarbon radical substituted by carboxyl groups
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/87—Introduction of foreign genetic material using processes not otherwise provided for, e.g. co-transformation
- C12N15/88—Introduction of foreign genetic material using processes not otherwise provided for, e.g. co-transformation using microencapsulation, e.g. using amphiphile liposome vesicle
Abstract
핵산 화합물의 전달을 위한 조성물이 제공되며 이는 양이온성 펩티드 또는 폴리머 및 리피도이드 화합물을 포함한다. 핵산 화합물은 임의 화학적으로 변성된 또는 변성되지 않은 DNA 또는 RNA일 수 있다. 조성물 내 리피도이드의 양은 양이온성 펩티드 또는 폴리머와 비교하여 바람직하게는 적다.
Description
본 발명은 의학 요법, 질병 예방 및 약물 전달 분야에 관한 것이다. 본 발명은 특히 특정 유형의 활성 성분을 이를 필요로 하는 대상체에게 전달하는데 유용한 담체에 관한 것이다. 더욱 구체적으로, 본 발명은 살아있는 유기체 내에서 생물학적 장벽을 가로질러 그 표적까지 예컨대 표적 장기, 조직, 또는 세포까지 전달하는 것이 어려운 생리활성 화합물을 나타내는 그러한 활성 성분의 전달에 관한 것이다. 큰 치료적 가치가 있고 동시에 그 생물학적 표적까지 전달하기 어려운 이러한 생리활성 화합물의 예로는 핵산 기반 백신 및 치료제가 있다.
오늘날 다양한 질병은 펩티드-, 단백질-, 핵산-기반 약물의 투여, 특히 핵산의 세포 또는 조직으로의 형질주입을 포함하는 치료를 필요로 한다. 펩티드-, 단백질-, 및 핵산-기반 약물의 완전한 치료 능력은 이들의 크기 및 전하로 인하여 포유류 세포의 원형질막을 가로지르는 이들의 제한된 능력에 의해 종종 손상되어, 불량한 세포 접근성 및 부적절한 치료 효능을 유발한다. 오늘날 이러한 장애물은 많은 바이오의약품의 바이오의학 개발 및 상업적 성공을 위한 주요 도전과제를 대표한다(예컨대, Foerg 및 Merkle, Journal of Pharmaceutical Sciences, www.interscience.wiley.com에서 온라인 공개, 2008, 97(1): 144-62 참조).
일부 질병 또는 장애에 대하여, 유전자 치료 접근법은, 예컨대, 결함있는 돌연변이 대립유전자가 기능성 유전체로 대체되는 유전성 질병의 경우에서, 유전자를 갖는 세포 또는 조직의 형질주입 및 세포의 DNA 내로의 이들의 삽입을 요구하는 이러한 치료의 특정 형태로서 개발되어 왔다. 그러나 핵산 또는 유전자를 개체의 세포 내로 옮기거나 삽입하는 것은, 유전자 치료의 중요한 치료 효과를 달성하는데 절대적으로 필요한 것임에도, 오늘날 여전히 중요한 도전 과제이다.
핵산 또는 유전자를 개체의 세포 내로 성공적으로 전달하기 위해서는, 여러 가지 상이한 장애물을 통과하여야만 한다. 핵산의 수송은 전형적으로 핵산과 세포막의 결합 및 이어서 엔도솜에 의한 흡수를 통해 일어난다. 엔도솜에서, 도입된 핵산은 시토졸(cytosol)로부터 분리된다. 발현이 시토졸에서 일어날 때, 이러한 핵산은 엔도솜을 떠나야만 한다. 엔도솜이 리소좀과 융합되기 전에 핵산이 엔도솜을 떠나지 않는다면, 이들은 엔도솜 내용물의 일반적인 운명을 겪게 되고 분해될 것이다. 대신에, 엔도솜은 세포막과 융합되어, 세포외 배지로 그 내용물을 복귀시킬 수 있다. 핵산을 효율적으로 전이시키기 위해, 엔도좀 탈출은 형질주입 자체의 효율성에 부가하여 가장 중요한 단계 중 하나인 것으로 보인다. 지금까지, 이러한 문제를 다루는 다양한 접근 방법이 있다. 그러나, 지금까지 모든 측면에서 완전히 성공한 접근법은 없었다.
오늘날 해당 업계에서 사용되는 형질주입 시약은 전형적으로 여러 유형의 펩티드, 폴리머, 지질, 뿐만 아니라 나노- 또는 마이크로입자로 응집될 수 있는 또 다른 담체 화합물을 포함한다(예컨대 Gao, X., K. S. Kim, 등 (2007), AAPS J 9(1): E92-104 참조). 이러한 형질주입 시약의 대부분은 체외 반응에서만 성공적으로 사용되었다. 살아있는 동물의 세포에 핵산을 형질주입시키려면, 추가 요구사항이 충족되어야 한다. 예를 들어, 핵산과 담체의 복합체는 응집과 관련하여 생리 식염수에서 안정적이어야만 한다. 또한, 이는 숙주의 보체의 일부분과 상호작용하지 않아야 한다. 또한, 복합체는 도처에 발생하는 뉴클레아제(nuclease)에 의한 초기 세포외 분해로부터 핵산을 보호해야 한다. 유전자 치료 응용 분야에서, 담체가 적응 면역계(면역원성)에 의해 인식되지 않고, 비특이적 사이토카인 폭풍(급성 면역 반응)을 자극하지 않는 것이 매우 중요하다(Gao, Kim 등, (2007, supra); Martin, M. E. 및 K. G. Rice (2007), AAPS J 9(1): E18-29; 그리고 Foerg 및 Merkle, (2008, supra) 참조).
Foerg 및 Merkle(2008, supra)은 펩티드-, 단백질- 및 핵산-기반 약물의 치료 능력에 대해 논의한다. 그들의 분석에 따르면, 이러한 약물의 완전한 치료 능력은 포유류 세포의 원형질막을 가로지르는 이들의 제한된 능력에 의해 종종 손상되어, 불향한 세포 접근성 및 부적절한 치료 효능을 유발한다. 오늘날 이러한 장애물은 많은 바이오의약품의 바이오의학 개발 및 상업적 성공을 위한 주요 도전과제를 대표한다.
이와 관련하여, Gao 등 (Gao 등 The AAPS Journal 2007; 9(1) Article 9)은 적절한 유전자 발현이 달성될 수 있는 선택된 세포에 치료 유전자를 전달하는 방법을 개발할 때 유전자 요법에 대한 주요 도전과제를 인식하였다. 그렇지만, 유전자 전달 및 특히 핵산의 세포 또는 조직으로의 성공적인 도입은 간단하지 않고 일반적으로 많은 요인에 의존한다. 성공적인 전달, 예컨대, 핵산 또는 유전자의 세포 또는 조직으로의 전달을 위해, 많은 장애물이 극복되어야 한다. Gao 등 (2007)에 따르면 이상적인 유전자 전달 방법은 3 가지 주요 기준을 충족해야 한다: (1) 세포간 기질에서 뉴클레아제에 의한 분해로부터 형질전환유전자(transgene)를 보호해야 하며, (2) 혈질전환유전자를 원형질막을 가로질러 운반해야 하며, 그리고 (3) 유해한 효과가 없어야 한다.
전형적으로, 세포에 핵산을 혈질주입하는 것은 바이러스성 또는 비-바이러스성 벡터 또는 담체를 사용하여 수행된다. 성공적인 전달을 위해서, 이러한 바이러스성 또는 비-바이러스성 벡터는 위에서 언급한 장벽을 극복할 수 있어야 한다. 현재 이용가능한 가장 성공적인 유전자 치료 전략은 아데노바이러스, 아데노-관련 바이러스, 레트로바이러스, 및 헤르페스 바이러스와 같은 바이러스성 벡터의 사용에 의존한다. 바이러스성 벡터는 고효율 및 장기 유전자 발현의 가능성으로 유전자 전이를 매개할 수 있으며, 3개 기준 중 2개를 만족한다. 그러나, 유전자 치료 임상 실험에서 밝혀진 급성 면역 반응, 면역원성, 및 삽입 돌연변이생성은 일반적으로 사용되는 일부 바이러스성 벡터에 대한 심각한 안전 문제를 제기하였다.
이러한 문제에 대한 해결책은 비-바이러스성 벡터의 사용에서 밝혀질 수 있다. 비-바이러스성 벡터가 바이러스성 벡터만큼 효율적이지는 않지만, 유전자 치료에서 더욱 안전한 대안을 제공하기 위해 많은 비-바이러스성 벡터가 개발되었다. 비-바이러스성 유전자 전달 방법은 물리적(담체 없는 유전자 전달) 및 화학적 접근법(합성 벡터-기반 유전자 전달)을 사용하여 연구되었다. 물리적 접근법은 일반적으로 주사 바늘을 이용한 단순 주사법, 전기천공법, 유전자 총(gene gun), 초음파, 및 유체역학적 전달을 포함한다. 이러한 접근법 중 일부는 세포막을 투과하여 세포내 유전자 전달을 촉진시키는 물리적인 힘을 이용한다. 화학적 접근법은 전형적으로 합성 또는 자연 발생 화합물, 예컨대 양이온성 지질 또는 양이온성 폴리머를, 형질전환유전자를 세포 내로 전달하기 위한 담체로서 사용한다. 다양한 비-바이러스성 유전자 전달 시스템의 기초 과학 및 응용에 상당한 진전이 있었지만, 비-바이러스성 접근법의 대부분은, 특히 생체 내 유전자 전달에 대하여, 바이러스성 벡터보다 효율적이지 못하다(Gao 등 The AAPS Journal 2007; 9(1) Article 9 참조).
지난 10년 동안, 핵산의 세포 전달에 있어서 실질적인 개선에 대한 매력적인 전망이 발표되었는데, 이는 또한 단백질-전달 도메인(PTD)이라고도 하는 소위 세포 투과성 펩티드(CPP)에 대한 물리적 어셈블리 또는 화학적 결합으로 인해 야기된 것으로 알려졌다(Foerg 및 Merkle, (2008, supra) 참조). CPP는 포유류 세포의 원형질막을 가로지를 수 있는 10 내지 약 30개 아미노산의 짧은 펩티드 서열을 나타내며, 따라서 세포 약물 전달에 대한 전례없는 기회를 제공할 수 있다. 거의 모든 이러한 펩티드는 낮은 pH에서 α-헬릭스를 형성하는 서열과 함께 일련의 양이온성 아미노산을 포함한다. 양성자 펌프에 의해 pH가 생체 내에서 지속적으로 낮아짐에 따라, 펩티드의 구조적 변화는 대개 빠르게 시작된다. 이러한 헬릭스 모티프는 엔도솜의 막 내로의 삽입을 매개하여 그 내용물의 세포질 내로의 방출을 유도한다(Foerg 및 Merkle, (2008, supra); 및 Vives, E., P. Brodin, 등 (1997); A truncated HIV-1 Tat protein basic domain rapidly translocates through the plasma membrane and accumulates in the cell nucleus. J Biol Chem 272(25): 16010-7 참조). 이러한 장점에도 불구하고, CPP 매개 약물 전달에 대한 주요 장애는 상피와 내피의 효소적 장벽에 접촉하거나 통과할 때 펩티드의 신속한 대사적 제거(metabolic clearance)에 있다고 간주된다. 결과적으로, CPP의 대사 안정성은 이들의 세포적 생체이용율에 대한 중요한 바이오의약적 요인을 나타낸다. 그러나, 한편으로는 이들이 대사적으로 절단되기 전에 이들의 카고(cargo)를 표적에 운반하기에 충분히 안정적이며, 다른 한편으로 이들이 축적되어 독성 수전에 도달할 수 있기 전에 이들이 조직으로부터 제거될 수 이는, 이러한 해당 분야에 이용가능한 CCP는 없다.
예컨대 유전자 치료를 위해 카고 분자를 세포 내로 전달하기 위한 해당 분야의 또 다른 접근법은 또 다른 유형의 펩티드 리간드의 사용을 포함한다(Martin 및 Rice, AAPS Journal 2007, 9 (1) Article 3) 참조). 이러한 펩티드 리간드는 암세포를 표적화하는데 사용되는 EGF 펩티드와 같은, 수용체 인식에 필요한 필수 아미노산을 나타내는 더 큰 단백질로부터 취해진 짧은 서열일 수 있다. 또 다른 펩티드 리간드가 확인되었는데 렉틴-유사 산화 LDL 수용체(LOX-1)를 표적화하는데 사용된 리간드를 포함한다. 내피 세포에서 LOX-1의 상향 조절은 고혈압 및 죽상경화증과 같은 기능장애 상태와 관련이 있다. 그러나, 이러한 펩티드 리간드는 많은 유전자 치료 접근법에 적절하지 않는데, 왜냐하면 이들이 복합체형성 또는 부착에 의해 이들의 카고 분자에 연결될 수는 없으나, 전형적으로 세포 내에서 세포독성 효과를 나타내는 공유결합, 예컨대 가교결합제를 요구하기 때문이다.
합성 벡터는 또한 예컨대 유전자 요법의 목적으로 카고 분자를 세포 내로 전달하기 위해 사용될 수 있다. 그러나, 많은 합성 벡터의 주된 단점 중 하나는 바이러스성 벡터에 비해 형질주입 효율성이 낮기 때문에 향후 임상 개발을 위해서는 상당한 개선이 필요하다는 것이다. 생체 외 및 생체 내에서 핵산 전달을 제한하는 몇 가지 장애물이 확인되었으며, 생리적 조건에서 벡터의 불량한 세포내 전달, 독성, 및 불안정성을 포함한다(예컨대 Read, M. L., K. H. Bremner, 등 (2003): Vectors based on reducible polycations facilitate intracellular release of nucleic acids. J Gene Med 5(3): 232-45 참조).
유전자 요법에서 하나의 특정 접근법은 양이온 또는 양이온화가능 지질을 사용한다. 그러나, 많은 양이온 또는 양이온화가능 지질이 세포 배양에서 우수한 형질주입 활성을 나타내지만, 대부분은 혈청 존재 하에서는 잘 수행되지 않으며, 단지 일부만 생체 내에서 활성이다. 리포플렉스가 혈액, 점액 상피 라이닝 액, 또는 조직 기질에 존재하는 음전하를 띠고 종종 양친성인 단백질 및 다당류의 압도적인 양에 노출될 때, 크기, 표면 전하, 및 지질 조성의 극적인 변화가 발생한다. 생체 내에서 투여되면, 리포플렉스는 음으로 하전된 혈액 성분과 상호작용하여 거대 응집체를 형성하는 경향이 있으며 이는 순환하는 적혈구 세포의 표면에 흡수되거나, 두꺼운 점액 층에 갇히거나 또는 미소혈관계에서 색전형성되며, 이는 이들이 원위 위치에서 의도된 표적 세포에 도달하는 것을 방지한다. 또한, 리포플렉스와 관련된 독성이 관찰되었다. 증상은 특히 염증성 사이토카인의 도입을 포함한다. 인체에서, 플루-유사 증상을 비롯하여, 다양한 정도의 불리한 염증 반응이 리포플렉스를 투여받은 피검자 사이에서 나타났다. 따라서, 특히 반복 투여가 필요할 때 리포플렉스가 인간에게 안전하게 사용될 수 있는지 여부는 의문의 여지가 있다.
유전자 요법에서의 또 하나의 접근법은 양이온성 또는 양이온화가능 폴리머를 사용한다. 이러한 폴리머는 핵산의 전달에 효율적으로 밝혀졌는데, 왜냐하면 이들은 음으로 하전된 핵산을 강하게 결합시키고 응축시킬 수 있기 때문이다. 따라서, 많은 양이온성 또는 양이온화가능 폴리머가 생체 외 및 생체 내 유전자 전달을 위한 담체로서 개발되었다. 이들은 폴리에틸렌이민(PEI), 폴리아미도아민 및 폴리프로필아민 덴드리머, 폴리알릴아민, 양이온성 덱스트란, 키토산, 다양한 단백질 및 펩티드를 포함한다. 대부분의 이온성 또는 양이온화가능 폴리머가 DNA를 작은 입자로 응축시키고 세포 표면의 음이온 부위와의 전하-전하 상호작용을 통해 엔도사이토시스를 통한 세포 흡수를 촉진하지만, 이들의 형질주입 활성 및 독성은 극적으로 다르다. 흥미롭게도, 양이온성 또는 양이온화가능 폴리머는 음으로 하전된 핵산 카고의 더 강한 복합체화로 인해 분자량이 증가함에 따라 형질주입 효율이 더 우수하다. 그러나, 분자량의 증가는 또한 폴리머의 독성을 증가시킨다. PEI는 아마도 유전자 전달에 있어서 가장 활성이며 가장 많이 연구된 폴리머일 수 있으나, 형질주입 시약으로서의 이의 주된 단점은 비-생물분해성 속성 및 독성과 관련이 있다. 또한, 고분자량 폴리머에 의해 형성된 폴리플렉스가 생리학적 조건 하에서 개선된 안정성을 보일지라도, 데이터는 이러한 폴리머가 벡터 언패킹(vector unpacking)을 방해할 수 있다는 것을 나타냈다. 예를 들어, 19 및 36 아미노산 잔기의 폴리(L-라이신) (PLL)은 180 잔기의 PLL보다 DNA로부터 더 빨리 해리되어 현저히 향상된 단기간 유전자 발현을 유발하는 것으로 나타났다. 수용체-매개 유전자 전달에서 활성인 구조체로 DNA를 압축하기 위해서는 6 내지 8 개의 양이온성 아미노산의 최소 길이가 필요하다. 그러나, 짧은 폴리양이온으로 형성된 폴리플렉스는 생리학적 조건 하에서 불안정하고 전형적으로 생리 식염수에서 빠르게 응집한다. 이러한 부정적 영향을 극복하기 위해서, Read 등 (참조 Read, M. L., K. H. Bremner, et al. (2003): Vectors based on reducible polycations facilitate intracellular release of nucleic acids. J Gene Med 5(3): 232-45; 및 Read, M. L., S. Singh, et al. (2005): A versatile reducible polycation-based system for efficient delivery of a broad range of nucleic acids. Nucleic Acids Res 33(9): e86)은 핵산의 방출을 촉진하기 위해 세포 내 환경에 의해 절단될 수 있는 펩티드 Cys-Lys10-Cys의 산화 중축 합(polycondensation)에 의해 제조된 선형 환원성 폴리양이온(RPC)에 기초한 새로운 유형의 합성 벡터를 개발했다. 이들은 RPC에 의해 형성된 폴리플렉스가 DNA 및 mRNA의 효율적인 방출을 가능하게 하는 환원 조건에 의해 불안정하게 된다는 것을 보여줄 수 있다. RPC의 절단은 또한 저분자량 펩티드에 상응하는 수준으로 폴리양이온의 독성을 감소시켰다. Read 등 (2003, supra)의 이러한 접근법의 단점은 엔도소몰리틱 시약(endosomolytic agent) 클로로퀸 또는 양이온성 지질 DOTAP가 형질주입 효율을 적절한 수준으로 향상시키기 위해 부가적으로 필요하다는 점이다. 결과적으로 Read 등 (2005, supra)은 알려진 엔도솜 완충 능력을 갖는 RPC에 히스티딘 잔기를 포함하였다. 이들은 히스티딘-풍부 RPC가, 엔도소몰리틱 시약 클로로퀸을 필요로 하지 않으면서, 세포 내 환원 환경에 의해 분해되어 플라스미드 DNA, mRNA 및 siRNA 분자를 포함한 광범위한 핵산의 효율적인 세포질 전달을 가능하게 할 수 있음을 보여줄 수 있다.
Read 등 (2005, supra)은 히스티딘-풍부 RPC가 생체 내 응용에 직접적으로 사용될 수 있는지 여부를 평가하지 않았다. 이들의 연구에서, 세포 흡수를 제한하는 폴리플렉스에 혈청 단백질을 결합하여 생길 수 있는 유전자 전달을 강화시키는 히스티딘 잔기의 능력을 차폐하는 것을 회피하기 위해 혈청 없이 형질주입이 수행되었다. 예비 실험은 히스티딘-풍부 RPC 폴리플렉스의 형질주입 특성이 혈청 단백질의 존재에 의해 영향을 받을 수 있는데 10% FCS(태아 송아지 혈청)에서 관찰된 GFP-양성 세포에서 50% 감소만큼 영향을 받을 수 있음을 나타낸다. 생체 내 응용을 위하여 이들은 친수성 폴리머 폴리-[N-(2하이드록시-프로필)메타크릴아마이드]에 의한 변성을 제안한다. 따라서, Read 등 (2005, supra)은 폴리플렉스의 응집 방지 및 폴리양이온성 단백질의 혈청 단백질에 대한 결합을 달성하지 못했다. 또한, 높은 N/P 비를 특징으로 하는 과량의 폴리머로 인해, 핵산과 복합체를 형성할 때 강한 복합체가 형성되며, 이는 염 유도 응집 및 혈청 내용물과의 상호작용(옵소닌화)에 대한 강한 경향성으로 인하여 생체 내에서 제한적으로 사용된다. 또한, 이러한 복합체는 유전자 요법의 목적으로 사용될 때 급성 면역 반응을 일으킬 수 있다. Read 등 (2003, supra)은 문헌에 제시된 RPC 기반 복합체에 대한 생체 내 데이터를 제공하지 않았다. 이러한 강력한 RPC 기반 복합체는 진피 내로 국소 투여한 후에 완전히 비활성인 것으로 밝혀졌다. 또한 Read 등 (2005, supra)은 핵산 카고의 완전한 복합체화를 보장하기 위해 가능한 한 긴 사슬 길이("단계-성장 폴리머화")를 갖는 고분자 폴리머의 생성을 유도하기 위해 엄격한 산화 조건(30% DMSO)을 사용했다.
Read 등과 유사한 접근법에서, McKenzie 등 (McKenzie, D. L., K. Y. Kwok, 등 (2000), J Biol Chem 275(14): 9970-7., McKenzie, D. L., E. Smiley, 등 (2000), Bioconjug Chem 11(6): 901-9, 및 US 6,770,740 B1)은 고분자 폴리양이온에서 관찰되는 독성을 줄이기 위한 목적으로 짧은 합성 펩티드에 여러 시스테인을 삽입함으로써 유전자 전달 시약으로서 자가-가교결합 펩티드를 개발했다. DNA의 복합체를 형성하기 위해 이들은 자가-가교결합 펩티드를 DNA과 혼합시켜 DNA 카고의 복합체화와 동시에 펩티드간 디설파이드 결합을 유도하였다. 생체 내 유전자 전달 접근법을 위해 그들은 각 말단으로부터 멀리 있는 위치에서 펩티드에 작동가능하게 부착된 스텔싱 시약(stealthing agent)(예컨대, 폴리에틸렌 글리콜) 또는 표적화 시약에 의한 자가-가교결합 펩티드의 유도체화를 제안한다. 또 다른 접근법으로 동일한 저자는 DNA 펩티드 응축물을 차폐하여 이로 인해 혈액 성분과의 상호작용을 감소시키기 위한 목적으로, 환원성 또는 비-환원성 결합에 의해 펩티드 CWK18과 폴리에틸렌 글리콜의 비가교결합의 유도체화를 개발하였다(Kwok, K. Y., D. L. McKenzie, et al. (1999). "Formulation of highly soluble poly(ethylene glycol)-peptide DNA condensates." J Pharm Sci 88(10): 996-1003.).
상기 내용을 요약하면, 상기 예시한 바에 따라 현재의 선행기술은 다양한 불리한점이 있다. Read 등 (2003, supra) 또는 McKenzie 등 (2000 I and II, supra and US 6,770,740 B1)이 기술한 바에 따르면 자가-가교결합 펩티드의 한 가지 특정 단점은 형성된 입자의 표면 상의 높은 양 전하에 관한 것이다. 이러한 전하 때문에, 이들 입자를 생체 내에서 증가된 염 농도로 처리할 때 입자들은 응집화에 대한 높은 불안정성을 나타낸다. 그러나, 그러한 염 농도는 생체 내에서 세포 매질 또는 세포외 매질에서 전형적으로 발생한다. 또한, 높은 양 전하를 갖는 복합체들은 강한 옵소닌화(opsonization) 경향성을 나타낸다. 이는 대식세포에 의해 증가된 흡수를 유도하고 분해로 인한 복합체의 빠른 비활성화를 유도한다. 특히 면역계 세포에 의한 이들 복합체의 흡수는 일반적으로 상이한 사이토카인의 하류 촉진을 유도한다. 그러나 이러한 선천성 면역계의 비특이적 활성화는 이러한 계의 몇 가지 단점을 나타내며 회피되어야 하며, 특히 유전자 요법의 몇 가지 관점의 목적을 위하여 급성 면역 반응(사이토카인 폭풍)은 특히나 회피되어야 한다. 또한, 생체계(biological systems)에서 양으로 하전된 복합체는 세포외 기질 또는 혈청의 음으로 하전된 성분에 의해 쉽게 결합되거나 고정될 수 있다. 또한, 복합체 내의 핵산은 너무 초기에 방출되어, 생체 내에서 복합체의 전이 및 반감기의 감소된 효율성을 유발한다. 또한, 생체 내 유전자 전달에 유리한 스텔싱 시약, 예컨대 폴리에틸렌 글리콜(PEG)에 의한 담체의 가역적 유도체화는 펩티드 모노머에 대하여만 가능하였으나 자가-결합 펩티드에 대하여는 불가능하였고 또한 정의된 폴리머 사슬 길이를 갖는 폴리머성 담체에 대하여는 불가능하였다. 특히, 이러한 가역적 유도체화는 가교결합된 양이온성 펩티드 담체의 말단에서 불가능하였다. 또한, 선행 기술에는, 긴 폴리머 사슬을 갖거나 또는 자가-가교결합 펩티드로 구성된 미정의된 폴리머 사슬 길이를 갖는 고분자 폴리머만이 개시되어 있는데, 이는 불행하게도 세포 내에서 카고 방출이 제한되는 정도로 이들의 카고를 압축한다. 매우 미정의된 폴리머 사슬 길이는 RPC에 기반한 의약품의 규제 승인과 관련하여 더욱 문제가 된다. 이러한 승인을 위한 하나의 전제 조건은 의약품의 모든 조제가 동일한 조성, 동일한 구조 및 동일한 성질을 갖는다는 것이다. 이는 종래 기술로부터의 RPC에 기초한 복합체에 대해서는 보장될 수 없다. 또한, 선행 기술에 제공된 RPC-기반 폴리머 또는 복합체는 이들의 미정의된 구조 또는 폴리머 사슬 길이로 인해 특징화하기가 어렵다.
그 결과, 유전자 요법 및 또 다른 치료적 응용의 목적을 위하여 핵산을 압축하고 안정화시킬 수 있고, 예컨대, 자가-가교결합 폴리머에 의한 핵산의 가역적 스텔싱 및 가역적 복합체의 조합으로 인하여, 특히 생체 내에서 그리고 낮은 독성 또는 심지어 무독성에서 핵산 카고의 우수한 방출을 동반하는 우수한 형질주입 활성을 나타내는 일반적으로 활용가능한 방법 또는 담체가 오늘날까지 제안되지 않았다. 따라서, 대사적으로 절단되기 전에 이들의 카고를 표적에 운반하기에 충분히 안정하고 그럼에도 불구하고 이들이 축적되어 독성 수준에 도달하기 전에 조직으로부터 제거되는, 유전자 전달의 목적을 위한 개량된 담체를 제고할 필요성이 해당 분야에 여전히 존재한다.
따라서 본 발명의 기본이 되는 목적은 치료적 또는 예방적 용도를 위한 특히 핵산 전달용 담체를 제공하는 것이며, 이는 핵산을 압축할 수 있고 생체 외에서 상이한 세포계(cell line) 내로의 이들의 효율적인 도입을 가능하게 하며 또한 셍체 내 형질주입을 가능하게 한다. 세포에 의한 흡수가 엔도솜 경로를 통해 일어나므로, 그러한 담체 또는 착화제는 엔도솜으로부터 핵산의 효율적인 방출을 허용하거나 제공해야한다. 또 다른 목적은 핵산과의 복합체 형성시 응집에 대한 저항성을 나타내는 담체를 제공하는 것이다. 또 다른 목적은 혈청 함유 매질에 대하여 핵산 카고에 향상된 안정성을 제공하는 것이다. 또 다른 목적은 강한 급성 면역 반응 없이 효율적인 생체 내 활성을 가능하게 하는 것이다. 또 다른 목적은, 예를 들어 전술한 바와 같은, 핵산 전달을 위한 공지된 담체의 단점 또는 한계를 극복하는 것이다. 본 발명에 의해 해결되는 또 다른 목적은 하기의 설명, 실시예 및 특허 청구범위에 기초하여 명백해질 것이다.
상기 목적들은 특허 청구범위에 기재된 본 발명의 주제(subject matter)에 의해 해결된다.
발명의 개요
첫 번째 양상에서, 본 발명은 양이온성 펩티드 또는 폴리머, 양이온성 리피도이드 화합물, 및 핵산 화합물을 포함하는 조성물을 제공한다. 리피도이드 화합물은 바람직하게는 2개 이상의 양이온성 질소 원자 및 적어도 2개의 친유성 꼬리를 포함하는 화합물이다. 많은 통상적인 양이온성 지질과는 대조적으로, 리피도이드 화합물은 가수분해성 연결기, 특히 가수분해성 에스테르, 아마이드 또는 카바메이트 그룹을 포함하는 연결기가 없을 수 있다. 리피도이드의 양이온성 질소 원자는 양이온화 가능하거나 또는 영구적으로 양이온성일 수 있거나, 또는 양이온성 질소의 두 가지 유형 모두가 화합물에 존재할 수 있다.
하나의 구체예에서, 리피도이드 화합물은 화학식 I에 따른 화합물이며
(화학식 I)
여기서 RA는 각각 독립적으로 비치환, 고리형 또는 비고리형, 분지쇄 또는 비분지쇄 C1-20 지방족; 치환 또는 비치환, 고리형 또는 비고리형, 분지쇄 또는 비분지쇄 C1-20 헤테로지방족; 치환 또는 비치환 아릴; 치환 또는 비치환 헤테로아릴;
여기서 적어도 하나의 RA는
또한, R5는 각각 독립적으로 비치환, 고리형 또는 비고리형, 분지쇄 또는 비분지쇄 C8-16 지방족; 치환 또는 비치환 아릴; 또는 치환 또는 비치환 헤테로아릴이다. x는 각각 1 내지 10의 정수이며; 그리고 y는 각각 1 내지 10의 정수이다. 또한, 화학식 I의 화합물의 임의의 약학적으로 허용가능한 염이 리피도이드 화합물의 범위 내에 포함된다. 일부 구체예에서 화학식 I에 따른 리피도이드 화합물은 PEG 원자단을 포함한다.
또 다른 구체예에서, 리피도이드는 화학식 IIa 및/또는 화학식 IIb의 2개 또는 3개의 원자단을 포함하는 화합물이다:
-N(R1)-CH2-CH(R5)-R2 (화학식 IIa)
-N+(R3)(R4)-CH2-CH(R5)-R2 (화학식 IIb)
여기서, 독립적으로 화학식 IIa 또는 화학식 IIb의 각 개별 원자단에 대하여, R1은 수소 또는 C1-C4-알킬로부터 선택되며; R2는 선형 또는 분지쇄, 포화 또는 불포화 C6-C16 하이드로카르빌 사슬로부터 선택되며, R3 및 R4는 각각 독립적으로 C1-C4-알킬로부터 선택되며, 그리고 R5는 수소 또는 하이드록실이며, 바람직하게는 하이드록실이다. 일부 구체예에서 화학식 IIa 및/또는 IIb에 따른 리피도이드 화합물은 PEG 원자단을 포함한다.
또 다른 구체예에서, 리피도이드는 화학식 III에 따른 화합물이며
(화학식 III)
여기서 R1 및 R2는 각각 독립적으로 수소, 선택사항으로서 치환, 포화 또는 불포화 C1-C20 하이드로카르빌, 및 선택사항으로서 치환, 포화 또는 불포화 C6-C20 아실로 구성된 군으로부터 선택되며; L1 및 L2는 각각 독립적으로 선택사항으로서 치환, 포화 또는 불포화 C1-C30 하이드로카르빌로부터 선택되며; m 및 o는 각각 독립적으로 0 및 임의 양의 정수로 구성된 군으로부터 선택되며; 그리고 n은 임의 양의 정수이다. 본 발명의 일부 구체예에서 R1, R2, L1 및/또는 L2는 각각 독립적으로 PEG 원자단이거나 또는 PEG 원자단으로 치환된다.
양이온성 펩티드 또는 폴리머는 예를 들어, Arg, Lys, His 및/또는 Orn으로부터 선택된 염기성 아미노산을 포함하거나 이를 기반으로 하는 올리고- 또는 폴리펩티드일 수 있다. 그 대신에, 아미노산이 아닌 모노머 단위체에 기초한 폴리머, 예컨대 양이온성 다당류, 폴리이민 또는 폴리아크릴레이트일 수 있다.
핵산 화합물은 예를 들어 화학적으로 변성된 또는 변성되지 않은 DNA, 단일 가닥 또는 이중 가닥 DNA, 코딩 또는 비-코딩 DNA로부터 선택될 수 있으며, 선택사항으로서 플라스미드, (짧은) 올리고데옥시뉴클레오타이드 (즉, (짧은) DNA 올리고뉴클레오타이드), 게놈 DNA, DNA 프라이머, DNA 프로브, 면역자극성 DNA, 앱타머, 또는 이들의 조합으로부터 선택될 수 있다. 그 대신에, 또는 이에 부가하여, 이러한 핵산 분자는 예컨대 임의 PNA(펩티드 핵산)로부터 선택될 수 있다. 또한 그 대신에, 또는 이에 부가하여, 그리고 특히 바람직한 구체예에 따르면, 핵산은 화학적으로 변성된 또는 변성되지 않은 RNA, 단일-가닥 또는 이중-가닥 RNA, 코딩 또는 비-코딩 RNA로부터 선택되며, 선택사항으로서 메신저 RNA (mRNA), (짧은) 올리고리보뉴클레오타이드 (즉 (짧은) RNA 올리고뉴클레오타이드), 바이러스성 RNA, 레플리콘 RNA, 전이 RNA (tRNA), 리보솜 RNA (rRNA), 면역자극성 RNA (isRNA), 마이크로RNA, 작은 간섭 RNA (siRNA), 작은 핵 RNA (snRNA), 작은-헤어핀 RNA (shRNA), 또는 리보스위치, RNA 앱타머, RNA 데코이(decoy), 안티센스 RNA, 리보자임, 또는 이들의 임의 조합으로부터 선택된다. 바람직하게는, 복합체의 핵산 분자는 RNA이다. 더욱 바람직하게는, 복합체의 핵산 분자는 (선형) 단일-가닥 RNA, 더더욱 바람직하게는 mRNA 또는 면역자극성 RNA이다.
조성물은 리피도이드의 양이 양이온성 펩티드 또는 폴리머의 양, 또는 핵산의 양에 비해 상대적으로 낮다는 것을 추가로 특징으로 할 수 있다. 하나의 구체예에서, 양이온성 펩티드 또는 폴리머 대 핵산 화합물의 중량비는 적어도 약 1이며, 리피도이드 대 핵산 화합물의 비는 약 15 nmol/μg 이하이다. 또 다른 구체예에서, 리피도이드 대 양이온성 펩티드 또는 폴리머의 중량비는 약 약 1:50 이하이며, 및/또는 리피도이드 대 양이온성 펩티드 또는 폴리머의 비는 약 2 nmol/μg 이하이다.
또 다른 양상에서, 본 발명은 양이온 성 펩티드 또는 폴리머, 리피도이드 및 핵산 화합물을, 예를 들어 복합체의 형태로 포함하는 나노입자를 제공한다.
또 다른 양상에서, 본 발명은 이러한 나노 입자 또는 복수의 이러한 나노입자를 포함하는 조성물을 제공한다. 조성물은 예를 들어 무균 액체 분산액으로서 또는 수성 액체 담체로 재구성하기 위한 분말 또는 동결건조 형태와 같은 무균 고체 조성물로서 제형화될 수 있다.
또 다른 양상에서, 본 발명은 상기 정의된 바와 같은 조성물을 제조하기 위한 키트를 제공한다. 예를 들어, 키트는 양이온성 펩티드 또는 폴리머, 및/또는 리피도이드를 포함하는 제1 키트 성분; 및 상기 핵산 화합물을 포함하는 제2 키트 성분을 포함할 수 있다.
또 다른 양상에서, 본 발명은 상기 양상 중 어느 하나에 따른 조성물, 나노입자, 또는 키트의 의학적 용도에 관한 것이다. 의학적 용도는, 예를 들어, 암 또는 종양 질환, 감염성 질환, 바람직하게는 (바이러스성, 세균성 또는 원생생물학적) 감염성 질환, 자가면역 질환, 알레르기 또는 알레르기 질환, 단일유전자 질환, 즉 (유전성) 질환, 또는 일반적인 유전 질환, 유전적 상속 배경을 가지고 있으며 일반적으로 정의된 유전자 결함에 의해 유발되고 멘델의 법칙에 따라 유전되는 질병, 심혈관 질환, 신경 질환, 호흡기 질환, 소화기 질환, 피부병, 근골격계 장애, 결합조직의 장애, 신생물, 면역 결핍, 내분비, 영양 및 대사성 질환, 안 질환, 귀 질환 및 펩티드 또는 단백질 결핍과 관련된 질병으로부터 선택되는 질병의 예방, 치료 및/또는 개선을 포함할 수 있다.
카고 물질이 세포에 의해 효과적으로 흡수되지만 반면에 일반적으로 리피도이드와 관련된 독성은 실질적으로 감소된다는 점에서, 본 발명은 핵산과 같은 생물학적 활성 카고 물질의 특정 조직 또는 표적 세포까지의 전달이, 양이온성 펩티드 또는 폴리머를 리피도이드와 결합시키는 운반체를 사용함으로써 실질적으로 개선될 수 있다는 발견에 기초한다.
본 발명의 또 다른 목적, 양상, 유용한 구체예, 응용, 유리한 효과 및 장점은 하기 상세한 설명, 실시예 및 청구범위에 기초하여 명백해질 것이다.
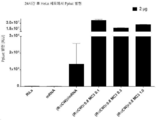
도 1A 내지 1C는 본 발명의 폴리머-지질 또는 폴리머-리피도이드 제형이 생체 외에서 Sol8 근육 세포의 형질주입 효율에 미치는 효과를 나타낸다. 모든 형질주입 실험은 GpLuc mRNA(SEQ ID NO: 12)를 카고로서 사용하여 3회 수행하였다. 또한, 음성 대조군(완충액, 수동 펄싱)이 포함되어있다. 본 발명의 폴리머-지질 또는 폴리머-리피도이드 형질주입 시약 이외에, 폴리머는 단지 형질주입 시약을 사용하지 않는 순수한 GpLuc mRNA과의 비교만을 위해 사용되었다(또한 여기서 R2851로 표지됨).
유사하게, 도 2A 및 2B는 본 발명의 폴리머-리피도이드 제형이 생체 외에서 HepG2 세포의 mRNA의 형질주입 효율에 미치는 효과를 나타낸다. 특히, 양이온화가능 3-C12 및 3-C12-OH 및 영구적 양이온성 3-C12-OH-cat이 비교되었다. 자세한 내용은 실시예 3을 참조하라.
도 3은 상이한 폴리머-지질 또는 리피도이드 복합체화된 GpLuc mRNA로 처리 후 인간 말초 혈액 단핵 세포(PBMC)에서 사이토카인 인터페론 알파(INFa)의 생체 외 방출을 나타낸다. 자세한 내용은 실시예 4를 참조하라.
도 4는 본 발명의 폴리머-지질 또는 폴리머-리피도이드 제형의 망막하 주입 24 시간 후, PpLuc mRNA(SEQ ID NO: 19)의 쥐 안구로의 망막 내 주사에 대한 주사 레이저 검안경검사(SLO) 분석을 상대적 발광 단위(Relative Light Unit, RLU)로 나타낸다. 주사 요법 및 자세한 내용은 실시예 5를 참조하라.
도 5는 HA-mRNA 또는 '벗겨진(naked)' HA-mRNA 단독의 본 발명의 폴리머-리피도이드 제형을 사용하여 HA-mRNA(R2564, SEQ ID NO: 17)로 Balb/c 마우스(n=8)의 근육내 백신접종 이후 유도된 HA 단백질(헤마글루티닌)에 대한 항체의 역가를 나타낸다. 각 점은 개별 동물을 나타내고 수평선은 중간 값을 나타낸다. 자세한 내용은 실시예 6을 참조하라.
도 6은 mRNA로 형질주입된 A549 세포에서의 GpLuc 단백질 발현이 비-CVCM/PB83 폴리머를 사용하여 R2851을 구성하는 것을 나타낸다.
도 7A 및 7B는 mRNA로 형질주입된 BHK 및 분화된 Sol8 세포에서의 GpLuc 단백질 발현이 비-CVCM/PB83 폴리머를 사용하여 R2851를 구성하는 것을 나타낸다.
도 7C는 mRNA로 형질주입된 HeLa 세포에서의 PpLuc 단백질 발현이 비-CVCM/PB83 폴리머를 사용하여 R2244를 구성하는 것을 나타낸다.
도 8은 mRNA로 형질주입된 Hep G2 세포에서의 GpLuc 단백질 발현이 R2851을 구성하는 것을 나타낸다.
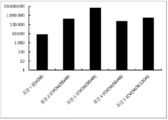
도 9는 유리체내 주사시 PpLuc 단백질 발현을 나타낸다.
도 10은 mRNA로 형질주입된 A549 세포에서의 GpLuc 단백질 발현이 상이한 폴리머/지질 조성물로 제형화된 R2851을 구성하는 것을 나타낸다.
도 11A 및 도 11B는 mRNA로 형질주입된 A549 세포에서의 GpLuc 단백질 발현이 페길화된 지질(pegylated lipid)로 제형화된 R2851을 구성하는 것을 나타낸다.
유사하게, 도 2A 및 2B는 본 발명의 폴리머-리피도이드 제형이 생체 외에서 HepG2 세포의 mRNA의 형질주입 효율에 미치는 효과를 나타낸다. 특히, 양이온화가능 3-C12 및 3-C12-OH 및 영구적 양이온성 3-C12-OH-cat이 비교되었다. 자세한 내용은 실시예 3을 참조하라.
도 3은 상이한 폴리머-지질 또는 리피도이드 복합체화된 GpLuc mRNA로 처리 후 인간 말초 혈액 단핵 세포(PBMC)에서 사이토카인 인터페론 알파(INFa)의 생체 외 방출을 나타낸다. 자세한 내용은 실시예 4를 참조하라.
도 4는 본 발명의 폴리머-지질 또는 폴리머-리피도이드 제형의 망막하 주입 24 시간 후, PpLuc mRNA(SEQ ID NO: 19)의 쥐 안구로의 망막 내 주사에 대한 주사 레이저 검안경검사(SLO) 분석을 상대적 발광 단위(Relative Light Unit, RLU)로 나타낸다. 주사 요법 및 자세한 내용은 실시예 5를 참조하라.
도 5는 HA-mRNA 또는 '벗겨진(naked)' HA-mRNA 단독의 본 발명의 폴리머-리피도이드 제형을 사용하여 HA-mRNA(R2564, SEQ ID NO: 17)로 Balb/c 마우스(n=8)의 근육내 백신접종 이후 유도된 HA 단백질(헤마글루티닌)에 대한 항체의 역가를 나타낸다. 각 점은 개별 동물을 나타내고 수평선은 중간 값을 나타낸다. 자세한 내용은 실시예 6을 참조하라.
도 6은 mRNA로 형질주입된 A549 세포에서의 GpLuc 단백질 발현이 비-CVCM/PB83 폴리머를 사용하여 R2851을 구성하는 것을 나타낸다.
도 7A 및 7B는 mRNA로 형질주입된 BHK 및 분화된 Sol8 세포에서의 GpLuc 단백질 발현이 비-CVCM/PB83 폴리머를 사용하여 R2851를 구성하는 것을 나타낸다.
도 7C는 mRNA로 형질주입된 HeLa 세포에서의 PpLuc 단백질 발현이 비-CVCM/PB83 폴리머를 사용하여 R2244를 구성하는 것을 나타낸다.
도 8은 mRNA로 형질주입된 Hep G2 세포에서의 GpLuc 단백질 발현이 R2851을 구성하는 것을 나타낸다.
도 9는 유리체내 주사시 PpLuc 단백질 발현을 나타낸다.
도 10은 mRNA로 형질주입된 A549 세포에서의 GpLuc 단백질 발현이 상이한 폴리머/지질 조성물로 제형화된 R2851을 구성하는 것을 나타낸다.
도 11A 및 도 11B는 mRNA로 형질주입된 A549 세포에서의 GpLuc 단백질 발현이 페길화된 지질(pegylated lipid)로 제형화된 R2851을 구성하는 것을 나타낸다.
발명의 상세한 설명
달리 정의되지 않는 한, 또는 특정 문맥에 달리 요구되지 않는 한, 본 명세서에서 사용되는 모든 기술 용어는 관련 기술 분야의 숙련자에 의해 일반적으로 이해되는 것과 동일한 의미를 갖는다.
문맥상 달리 나타내거나 요구하지 않는 한, 단어 "포함하다", "포함하다" 및 "포함하는"이라는 표현 및 유사한 표현은 본 설명 및 청구범위에서 "포함하지만, 이에 국한되는 것은 아니다"로서 개방적이고 포괄적인 의미로 해석되어야한다.
"하나의 구체예", "구체예", "특정 구체예"등과 같은 표현은 특정 특징, 물성 또는 특성, 또는 특정 특징, 물성 또는 특성의 그룹 또는 조합이, 각각의 표현과 혼합되어 사용되어, 본 발명의 구체예의 적어도 하나에서 제시되는 것을 의미한다. 본 설명을 통해 다양한 위치에서 이러한 표현의 발생은 반드시 동일한 구체예를 지칭하지는 않는다. 또한, 특정한 특징, 물성 또는 특성은 하나 이상의 구체예에서 임의의 적합한 방식으로 결합될 수 있다.
단수 형태 "a", "an" 및 "the"는 문맥 상 명확하게 달리 지시하지 않는 한 복수 인용 문헌을 포함하는 것으로 이해되어야 한다.
숫자의 맥락에서 백분율은 각 항목의 총 수를 기준으로 이해해야 한다. 다른 경우에서, 문맥에 달리 지시되지 않는 한, 백분율은 중량 백분율(중량%)로서 이해되어야 한다.
첫 번째 양상에서, 본 발명은 양이온성 펩티드 또는 폴리머, 양이온성 리피도이드 화합물, 및 핵산 화합물을 포함하는 조성물을 제공한다.
본 발명의 내용에서, "조성물"은 특정 성분이 선택사항으로서 임의의 추가 성분과 함께 혼입될 수 있는 임의의 유형의 조성물을 지칭한다. 따라서, 조성물은 분말 또는 과립과 같은 건조 조성물, 또는 동결건조 형태 또는 정제와 같은 고체 단위체일 수 있다. 그 대신에, 조성물은 액체 형태일 수 있고, 각각의 성분은 독립적으로 용해되거나 분산된(예컨대, 현탁 또는 유화된) 형태로 혼입될 수 있다. 바람직한 구체예 중 하나에서, 조성물은 수성 액체 담체로 재구성하기 위한 분말 또는 동결건조 형태와 같은 무균 고체 조성물로서 제형화될 수 있다. 이러한 제형은 또한 하기에서 더 상세히 설명되는 핵산 카고를 포함하는 조성물의 이러한 버전에 바람직하다.
여기에 사용된 "화합물"은 본질적으로 동일한 화학적 구조 및 특성을 갖는 분자로 구성된 물질인 화학 물질을 의미한다. 소분자 화합물의 경우, 분자는 이들의 원자 구성 및 구조적 구성에 대하여 일반적으로 동일하다. 거대분자 또는 폴리머성 화합물의 경우, 화합물의 분자는 매우 유사하지만 모든 분자가 반드시 동일한 것은 아니다. 예를 들어, 50 개의 모노머 단위체로 구성되도록 지정된 폴리머의 세그먼트는 또한 예를 들어, 48 개 또는 53 개 모노머 단위체를 갖는 개별 분자를 함유할 수 있다.
여기서 사용되는 펩티드는 펩티드 또는 아마이드 결합에 의해 연결된 복수의 아미노산 모노머를 포함하는 화합물이다. 펩티드의 크기에 따라, 올리고펩티드 또는 폴리펩티드라고도 한다. 원칙적으로, 단백질은 또한 폴리펩티드이다.
본 발명의 내용에서, 폴리머는 그 분자가 복수의 반복 서브단위체로 구성된 화합물이다. 폴리머는 코폴리머와 같이 상이한 서브단위체를 기반으로 할 수 있다.
리피도이드 화합물은 또한 간단히 리피도이드라고도 하며, 지질-유사 화합물, 즉 지질-유사 물리적 성질을 갖는 양친매성 화합물이다. 리피도이드 화합물은 바람직하게는 2개 이상의 양이온성 질소 원자 및 적어도 2개의 친유성 꼬리를 포함하는 화합물이다. 많은 통상적인 양이온성 지질과는 대조적으로, 리피도이드 화합물은 가수분해성 연결기, 특히 가수분해성 에스테르, 아마이드 또는 카바메이트 그룹을 포함하는 연결기가 없을 수 있다. 리피도이드의 양이온성 질소 원자는 양이온화 가능하거나 또는 영구적으로 양이온성일 수 있거나, 또는 양이온성 질소의 두 가지 유형 모두가 화합물에 존재할 수 있다.
다른 의미가 특정 문맥으로부터 명확하지 않는 한, 용어 "양이온성"은 각각의 구조체가 영구적으로 또는 영구적이지는 않지만 pH와 같은 특정 조건에 반응하여 양의 하전을 갖는 것을 의미한다. 따라서, 용어 "양이온성"은 "영구적인 양이온성" 및 "양이온화가능" 둘 모두를 포함한다.
여기서 사용되는 "영구적인 양이온성"은 각 화합물 또는 그룹 또는 원자가 그 환경의 임의의 pH 값 또는 수소 이온 활성도에서 양으로 하전된 것을 의미한다. 전형적으로, 양전하는 4차 질소 원자의 존재에 기인한다. 화합물이 그러한 양전하들을 다수 보유하는 경우, 이는 영구적인 양이온성의 하위카테고리인 영구적인 폴리양이온성으로 지칭될 수 있다.
이와 관련하여, 접두사 "폴리-"는 화합물에서 각각의 성질을 갖는 다수의 원자 또는 그룹을 의미한다. 괄호 안에 표시하면, 복수의 존재는 선택 사항이다. 예를 들어, (폴리)양이온성은 양이온성 및/또는 폴리양이온성을 의미한다. 그러나, 접두어가 없는 것이 복수를 배제하는 것으로 해석되어서는 안된다. 예를 들어, 폴리양이온성 화합물은 또한 양이온성 화합물이기도 하며, 이와 같이 지칭될 수도 있다.
"양이온화가능"은 화합물, 또는 그룹 또는 원자가 낮은 pH에서 양으로 하전되고 그 환경의 보다 높은 pH에서 하전되지 않는다는 것을 의미한다. 또한 pH 값이 결정될 수 없는 비수용성 환경에서, 양이온화가능 화합물, 그룹 또는 원자는 높은 수소 이온 농도에서 양으로 하전되고 수소 이온의 낮은 농도 또는 활성도에서는 하전되지 않는다. 이것은 양이온화가능 또는 폴리양이온화가능 화합물의 개별 특성, 특히 각각의 양이온화가능 그룹 또는 원자의 pKa, 즉 어느 pH 또는 수소 이온 농도에서 이것이 하전되거나 하전되지 않는지에 의존한다. 희석된 수용액 환경에서, 양전하를 띠는 양이온화가능 화합물, 그룹 또는 원자의 분율은 해당 분야의 통상의 기술자에게 공지된 소위 핸더슨-하셀바흐 방정식(Henderson-Hasselbalch equation)을 사용하여 평가될 수 있다.
예를 들어, 화합물 또는 원자단이 양이온화가능한 경우, 약 1 내지 9, 바람직하게는 4 내지 9, 5 내지 8 또는 심지어 6 내지 8의 pH 값, 더욱 바람직하게는 9 이하, 8 이하, 7 이하의 pH 값, 가장 바람직하게는 생리적 pH 값, 예컨대 약 7.3 내지 7.4, 즉 생리학적 조건하에서, 특히 생체 내에서 세포의 생리식염 조건 하에서 양으로 하전되는 것이 바람직하다.
특정 문맥으로부터 다른 의미가 명확하지 않으면, "양이온화된"은 전형적으로 예를 들어 중성 생리학적 환경에서 아르기닌과 같은 염기성 아미노산의 경우에, 양이온화가능 구조체가 실제로 양전하를 띠는 상태에 있음을 의미한다.
화합물의 "멀티머"는, 적어도 하나의 양이온성 원자단 P를 포함하는 양이온성 화합물의 디설파이드-결합된 멀티머의 경우로서, 멀티머가 되는 제1 화합물의 적어도 2개의 단위체를 포함하는 화합물로서 이해되어야 한다. 이것은 제1 화합물이 이미 복수의 반복 단위체를 함유하고 있는지의 여부와 무관하다.
-SH 그룹은 설프하이드릴(sulfhydryl) 그룹을 의미한다.
본 발명은 리피도이드와 양이온성 펩티드 또는 폴리머의 결합이 예상치 못한 내약성 정도에서 핵산을 복합체화시키고 세포 내로 전달하는데 매우 효과적이라는 발견에 기초한다. 더욱 구체적으로, 본 발명자들은 이러한 결합이 카고를 세포 내로 전달하는 효과에 있어서 담체 성분(즉, 리피도이드 및 폴리머 또는 펩티드)의 부가적인 효과를 나타내는 반면, 독성과 관련하여 부가적인 효과가 전혀 없거나 매우 조금 있다는 것을 밝혔다.
유리하게, 양이온성 펩티드 또는 폴리머는 그 펩티드 또는 폴리머 내용물을 상당히 변화시켜 이에 따라 생물리학적/생화학적 특성을 매우 쉽게 조절할 수 있는데, 예컨대 다양한 종류의 양이온성 또는 양이온화가능 펩티드, 단백질 또는 폴리머를 혼입시키고 선택사항으로서 또 다른 성분, 예컨대 또 다른 아미노산 성분을 추가할 수 있다.
또한 매우 놀라운 발견은 양이온성 펩티드 또는 폴리머의 양에 비하여, 및/또는 핵산 화합물에 비하여 매우 소량의 리피도이드가 조성물의 바람직하기 않은 효과 또는 독성의 실질적인 증가 없이 핵산 카고의 세포 전달을 향상시킬 수 있다는 것이다. 본 발명은 예컨대 RNA의 전달 및 세포의 형질주입을 위하여 제안되었던 리포플렉스 또는 지질 나노입자에 사용된 지질의 전형적인 양의 약 0.1 내지 약 10%만큼의 적은 양으로 실시될 수 있다. 이론에 구속되기를 바라지 않고, 본 발명자는 이러한 소량의 리피도이드가 본 발명의 조성물의 높은 내약성을 달성하는데 중추적인 역할을 했다고 간주한다.
양이온성 펩티드 또는 폴리머는 아미노산을 나타낼 수도 있고 나타내지 않을 수도 있는 모노머 단위체를 기반으로 하는 임의의 영구적인 양이온성 또는 양이온화가능 화합물일 수 있다. 양이온성 펩티드 또는 폴리머는 예를 들어 핵산 화합물과 복합체를 형성하는 능력을 갖는 것으로 알려진 양이온성 펩티드 또는 폴리머로부터 선택될 수 있다.
하나의 구체예에서, 양이온성 펩티드 또는 폴리머는 프로타민, 뉴클레오린, 올리고- 또는 폴리라이신, 올리고- 또는 폴리아르기닌, 세포-투과성 펩티드, 키메라 CPP, 트란스포르탄, MPG 펩티드, HIV-결합 펩티드, Tat, HIV-1 Tat, Tat-유래 펩티드, 페네트라틴 군(penetratin family)의 일부, 페네트라틴, 안테나페디아-유래 펩티드, pAntp, pIsl, 항균물질-유래 CPP, 부포린-2, Bac715-24, SynB, SynB(1), pVEC, hCT-유래 펩티드, SAP, MAP, KALA, PpTG20, FGF, 락토페린, 히스톤, VP22, VP22-유래 펩티드s, HSV, 단백질 전달 도메인, PpT620, 프롤린-풍부 펩티드, 아르기닌-풍부 펩티드, 라이신-풍부 펩티드, Pep-1, 칼시토닌 펩티드, β-아미노산, 역전(reversed) 폴리아마이드, 폴리(N-에틸-4-비닐피리디늄 브로마이드), 폴리(디메틸아미노에틸 메틸아크릴레이트), 폴리(아미도아민), 폴리베타아미노에스테르, 디아민-변성 1,4-부탄디올 디아크릴레이트-코-5-아미노-1-펜탄올 폴리머, 폴리프로필아민 덴드리머, pAMAM-기반 덴드리머, 폴리이민s, 폴리(에틸렌이민), 폴리(프로필렌이민), 폴리알릴아민, 1,5-디메틸-1,5-디아자운데카메틸렌 폴리메토브로마이드, 헥사디메트린 브로마이드, 양이온성 다당류, 양이온성 사이클로덱스트린-기반 폴리머, 양이온성 덱스트란-기반 폴리머, 키토산, 실란 주쇄(silane backbone)-기반 폴리머, PMOXA-PDMS 코폴리머, 하나 이상의 양이온성 블록과 하나 이상의 중성 블록의 블록 코폴리머로부터 선택된다.
하나의 구체예에서, 양이온성 펩티드 또는 폴리머는 천연 펩티드로부터 선택된다. 천연은 펩티드가 자연적으로, 즉 살아있는 유기체에 의해 생성된다는 것을 의미한다. 물론, 천연 펩티드 역시 화학적으로 합성될 수 있지만 그럼에도 불구하고 자연에서 발생하는 펩티드이다. 선택사항으로서, 천연 펩티드는 화학적으로 변성될 수 있다.
본 발명의 조성물에 대해 선택되는 천연 양이온성 펩티드는 예를 들어, 세포-투과성 펩티드(CPP) 그룹의 일원일 수 있다. 많은 CPP는 라이신 또는 아르기닌과 같은 염기성 아미노산에 풍부한 아미노산 조성을 갖는다.
하나의 구체예에서, 세포-투과성 펩티드는 Tat-유래 펩티드(TAT는 "전사의 트란스-활성화제(trans-activator of transcription)"를 의미함)의 시스테인-없는 버전의 그룹, 예컨대 TAT 또는 HIV1-TAT, Tat-AIE 도트, TAT(47-57), TAT(49-57), TAT(48-60), R9-TAT, Tat-GFP-Tat, Tat-GFP, 6His-TAT-Ainp1, 6His-TAT-GFP, 6xHis-TAT-SOD, TAT-겔로닌, pTat, EGFP-TAT, Tat-Dex, Tat-PCP, P42-TAT로부터 유래한다.
또 다른 구체예에서, 세포-투과성 펩티드는 안테나페디아-유래 펩티드의 그룹, 즉 페네트라틴 군 또는 pAntp로 알려진, 예컨대 pAntp43 -58.로부터 유래한다.
또 다른 구체예에서, 세포-투과성 펩티드는 hCT-유래 펩티드, 예컨대 hCT9-32, hCT12-32, hCT15-32, hCT18-32, hCT21-32로부터 선택된다. 잠재적으로 관심 있는 세포-투과성 펩티드의 또 다른 그룹은 히스톤 그룹, 예컨대 H2A 또는 H4이다.
또 다른 구체예에 따르면, 세포-투과성 펩티드는 항균물질-유래 양이온성 CPP, 예컨대 부포린-2, 마가이닌 II, 세크로핀, 안드로핀, 모리신, 세라토톡신, 멜릿틴, 봅비닌, 브레비닌-1, 에스컬렌틴, CAP18, LL37, Bac715-24 / BAC715-24, Bac1-7, Bac1-15, Bac1-17, Bac1-24, , Bac5-24, Bac7-24, Bac9-24, Bac11-24, Bac13-24, Bac15-24 , SynB1, SynB3, SynB5 , 데르마셉틴 S4, 아바이신, 아피다에신, 프로페닌 또는 인돌리시딘이다.
선택사항으로서, CPP는 트란스포르탄 군의 시스테인-없는 일원이다.
선택사항으로서, CPP는 키메라성 또는 합성적으로 변성된 펩티드, 예컨대 예컨대 MPG 펩티드 군의 일원, 예컨대 MPG-NLS, EGFP-MPG, MPGα, MPGβ; 또는 비오티닐-페네트라틴, PAF26, PAF95, PAF96, CRGDK, P28, RALA 펩티드, RTAT-ELPBC, GST-(HE)12EFG5-TAT, FabRev1-Tat, G3R6TAT, MAP, Pep-1, ppTG, ppTG1, ppTG20, EGFP-ppTG20; 또는 MPG, KLA-TAT(47-57), 또는 TatLK15이다.
또 다른 구체예에 따르면, 양이온성 펩티드 또는 폴리머는 자연에서 발생하는 것으로 알려지지 않은 합성 펩티드, 또는 올리고- 또는 폴리(아미노산)으로 구성된 군으로부터 유래한다. 바람직한 합성 펩티드는 2 내지 약 50 개 아미노산 잔기, 또는 더욱 바람직하게는 약 5 내지 약 30 개 아미노산 잔기로 구성된 화합물이며, 이는 아르기닌, 라이신, 히스티딘, 및/또는 오르니틴과 같은 염기성 아미노산이 풍부하다. 바람직하게는, 양이온성 펩티드의 아미노산 잔기의 적어도 약 50%는 염기성 아미노산으로 표시된다.
선택사항으로서, 양이온성 펩티드는 전체가 또는 대부분이 하나의 특정 염기성 아미노산, 예컨대 약 5 내지 약 30 개 Arg, Lys, His 또는 Orn의 세그먼트, 예를 들어 다음으로 구성된다:
Arg5, Arg6, Arg7, Arg8, Arg9, Arg10, Arg11, Arg12, Arg13, Arg14, Arg15 -30; Lys5, Lys6, Lys7, Lys8, Lys9, Lys10, Lys11, Lys12, Lys13, Lys14, Lys15 - 30; His5, His6, His7, His8, His9, His10, His11, His12, His13, His14, His15 -30; 또는 Orn5, Orn6, Orn7, Orn8, Orn9, Orn10, Orn11, Orn12, Orn13, Orn14, Orn15 -30.
또 다른 유용한 펩티드는 다음의 예에서와 같이 둘 이상의 상이한 염기성 아미노산으로 이루어지며, 이는 아미노산 잔기가 발생하는 특정 순서를 명시하지 않은 서열의 조성을 의미한다:
Arg(4-29)Lys1, Arg(4-29)His1, Arg(4-29)Orn1, Lys(4-29)His1, Lys(4-29)Orn1, His(4-29)Orn1, Arg(3-28)Lys2, Arg(3-28)His2, Arg(3-28)Orn2, Lys(3-28)His2, Lys(3-28)Orn2, His(3-28)Orn2, Arg(2-27)Lys3, Arg(2-27)His3, Arg(2-27)Orn3, Lys(2-27)His3, Lys(2-27)Orn3, His(2-27)Orn3, Arg(1-26)Lys4, Arg(1-26)His4, Arg(1-26)Orn4, Lys(1-26)His4, Lys(1-26)Orn4, His(1-26)Orn4, Arg(3-28)Lys1His1, Arg(3-28)Lys1Orn1, Arg(3-28)His1Orn1, Arg1Lys(3-28)His1, Arg1Lys(3-28)Orn1, Lys(3-28)His1Orn1, Arg1Lys1His(3-28), Arg1His(3-28)Orn1, Lys1His(3-28)Orn1;
Arg(2-27)Lys2His1, Arg(2-27)Lys1His2, Arg(2-27)Lys2Orn1, Arg(2-27)Lys1Orn2, Arg(2-27)His2Orn1, Arg(2-27)His1Orn2, Arg2Lys(2-27)His1, Arg1Lys(2-27)His2, Arg2Lys(2-27)Orn1, Arg1Lys(2-27)Orn2, Lys(2-27)His2Orn1, Lys(2-27)His1Orn2, Arg2Lys1His(2-27), Arg1Lys2His(2-27), Arg2His(2-27)Orn1, Arg1His(2-27)Orn2, Lys2His(2-27)Orn1, Lys1His(2-27)Orn2;
Arg(1-26)Lys3His1, Arg(1-26)Lys2His2, Arg(1-26)Lys1His3, Arg(1-26)Lys3Orn1, Arg(1-26)Lys2Orn2, Arg(1-26)Lys1Orn3, Arg(1-26)His3Orn1, Arg(1-26)His2Orn2, Arg(1-26)His1Orn3, Arg3Lys(1-26)His1, Arg2Lys(1-26)His2, Arg1Lys(1-26)His3, Arg3Lys(1-26)Orn1, Arg2Lys(1-26)Orn2, Arg1Lys(1-26)Orn3, Lys(1-26)His3Orn1, Lys(1-26)His2Orn2, Lys(1-26)His1Orn3, Arg3Lys1His(1-26), Arg2Lys2His(1-26), Arg1Lys3His(1-26), Arg3His(1-26)Orn1, Arg2His(1-26)Orn2, Arg1His(1-26)Orn3, Lys3His(1-26)Orn1, Lys2His(1-26)Orn2, Lys1His(1-26)Orn3;
Arg(2-27)Lys1His1Orn1, Arg1Lys(2-27)His1Orn1, Arg1Lys1His(2-27)Orn1, Arg1Lys1His1Orn(2-27);
Arg(1-26)Lys2His1Orn1, Arg(1-26)Lys1His2Orn1, Arg(1-26)Lys1His1Orn2, Arg2Lys(1-26)His1Orn1, Arg1Lys(1-26)His2Orn1, Arg1Lys(1-26)His1Orn2, Arg2Lys1His(1-26)Orn1, Arg1Lys2His(1-26)Orn1, Arg1Lys1His(1-26)Orn2, Arg2Lys1His1Orn(1-26), Arg1Lys2His1Orn(1-26), Arg1Lys1His2Orn(1-26).
양이온성 펩티드 내에 염기성 아미노산과 함께 하나 이상의 친수성 아미노산 잔기를 포함시키는 것이 더 유용할 수 있다. 이러한 목적에 유용한 친수성 아미노산 중에서, 비하전된 극성 측쇄를 갖는 것이 바람직하고, 특히 Thr, Ser, Asn 및/또는 Gln이 바람직하다. 이러한 아미노산 또는 이러한 아미노산이 풍부한 서열의 포함은 핵산 카고에 대한 더욱 유연한 결합을 가능하게 한다. 이는 핵산 카고의 더욱 효과적인 압축을 초래할 수 있으며 따라서 뉴클레아제 및 원치 않는 압축 해제에 대한 더 나은 보호를 제공합니다. 또한, 전체 암체에 걸쳐 감소된 양이온성 전하를 나타내는 담체를 제공할 수 있으며, 이와 관련하여 바람직하거나 필요한 경우, 더욱 잘 조절된 결합 특성을 제공할 수 있다.
양이온에 혼입되는 유용한 부분 서열의 예는 다음을 포함한다: Ser-Thr, Thr-Ser, Ser-Ser, Thr-Thr, Ser-Thr-Ser, Thr-Ser-Thr, Ser-Ser-Ser, Thr-Thr-Thr, Ser-Thr-Ser-Thr, Thr-Ser-Thr-Ser, Ser-Ser-Ser-Ser, Thr-Thr-Thr-Thr, Gln-Asn, Asn-Gln, Gln-Gln, Asn-Asn, Gln-Asn-Gln, Asn-Gln-Asn, Gln-Gln-Gln, Asn-Asn-Asn, Gln-Asn-Gln-Asn, Asn-Gln-Asn-Gln, Gln-Gln-Gln-Gln, Asn-Asn-Asn-Asn, Ser-Asn, Asn-Ser, Ser-Ser, Asn-Asn, Ser-Asn-Ser, Asn-Ser-Asn, Ser-Ser-Ser, Asn-Asn-Asn, Ser-Asn-Ser-Asn, Asn-Ser-Asn-Ser, Ser-Ser-Ser-Ser, 또는 Asn-Asn-Asn-Asn, 등. 이러한 서열은 예컨대 1 회, 2 회, 3 회, 4 회, 5 회, 6 회, 7 회, 8 회, 9 회, 10 회, 12 회, 13 회, 14 회, 15 회 또는 그 이상 또는 서로 적절하게 조합된 횟수로 반복될 수 있다.
선택사항으로, 친수성 아미노산이 풍부한 서열은 Ser, Thr 및 Asn의 긴 서열의 구조 브레이커(structure breaker)로서 작용할 수 있는 적어도 하나의 프롤린을 함유할 수 있다. 2 개, 3 개 또는 그 이상의 프롤린이 특히 더 긴 서열에 혼입될 수 있다.
양이온성 펩티드 내에 하나 이상의 친유성 아미노산, 특히 Leu, Val, Ile, Ala, 및/또는 Met를 혼입시키는 것이 더욱 유용할 수 있다. 이러한 친유성 아미노산은 양이온성 펩티드와 핵산 카고의 조합에 의해 형성된 복합체에 참여할 수 있다.
친유성 아미노산의 사용은 핵산의 더욱 강력한 압축을 가능하게 한다. 이는 담체와 카고 사이에 형성된 복합체의 추가적인 안정성을 제공하는 친유성 아미노산과 핵산 카고의 특정 상호작용 때문일 수 있다. 안정화는 폴리머 가닥 사이의 비공유성 결합 또는 가교결합과 유사할 수 있다. 특히 수성 환경에서, 이러한 유형의 상호작용은 일반적으로 강하며 현저한 효과를 제공한다.
유용한 하위서열의 예는 Leu-Val, Val-Leu, Leu-Leu, Val-Val, Leu-Val-Leu, Val-Leu-Val, Leu-Leu-Leu, Val-Val-Val, Leu-Val-Leu-Val, Val-Leu-Val-Leu, Leu-Leu-Leu-Leu, Val-Val-Val-Val, Ile-Ala, Ala-Ile, Ile-Ile, Ala-Ala, Ile-Ala-Ile, Ala-Ile-Ala, Ile-Ile-Ile, Ala-Ala-Ala, Ile-Ala-Ile-Ala, Ala-Ile-Ala-Ile, Ile-Ile-Ile-Ile, Ala-Ala-Ala-Ala, Met-Ala, Ala-Met, Met-Met, Ala-Ala, Met-Ala-Met, Ala-Met-Ala, Met-Met-Met, Ala-Ala-Ala, Met-Ala-Met-Ala, Ala-Met-Ala-Met, 또는 Met-Met-Met-Met 등을 포함한다. 이러한 서열은 예컨대 1 회, 2 회, 3 회, 4 회, 5 회, 6 회, 7 회, 8 회, 9 회, 10 회, 12 회, 13 회, 14 회, 15 회 또는 그 이상 또는 서로 조합된 횟수로 반복될 수 있다. 선택사항으로, 친유성 아미노산이 풍부한 서열은 Leu, Val, Ile, Ala 및/또는 Met의 긴 서열의 구조 브레이커(structure breaker)로서 작용할 수 있는 적어도 하나의 프롤린을 함유할 수 있다. 2 개, 3 개 또는 그 이상의 프롤린이 특히 더 긴 서열에 혼입될 수 있다.
양이온성 펩티드의 특성은 그 서열에 비-천연 아미노산을 포함시킴으로써 또는 펩티드의 화학적 변형에 의해 추가로 조절될 수 있다. 예를 들어, 특정 화학 그룹이 도입될 수 있다. 이러한 그룹은 (예컨대, 카르복시산, 설폰산, 아민 등과의 반응에 의한) 아마이드 형성에 의한, (예컨대, 말레인이미드 원자단, α,β불포화 카르보닐을 사용하는 ) 마이클 첨가반응에 의한, (예컨대, 아지드 또는 알킨을 사용하는) 클릭 화학에 의한, (예컨대, 알켄 또는 알킨을 사용하는) 알켄/알킨 복분해에 의한, (알데히드 또는 케톤, 하이드라진, 하이드록실아민, 아민을 사용하는) 이민 또는 하이드로존 형성, (아비딘, 비오틴, 프로틴 G 등을 사용하는) 복합체화 반응 또는 (예컨대, 할로겐알칸, 티올, 알코올, 아민, 하이드라진, 하이드라지드, 설폰산 에스테르, 옥시포스포늄 염과의) Sn-유형 치환 반응을 허용하는 성분 또는 추가 성분의 부착에 사용될 수 있는 또 다른 화학적 원자단에 의한, 추가 성분 또는 리간드의 부착을 허용하도록 선택될 수 있다.
또 다른 구체예에서, 양이온성 펩티드 또는 폴리머는 천연, 합성 또는 반합성 폴리머로부터 선택된다. 바람직하게는, 폴리머는 각각 약 0.5 kDa 내지 약 20 kDa, 예컨대 약 0.5 kDa 내지 약 11.5 kDa, 또는 약 1 kDa 내지 약 10 kDa, 또는 약 0.1 kDa 내지 약 8 kDa, 또는 약 0.1 kDa 내지 약 6 kDa, 또는 약 0.1 kDa 내지 약 5 kDa, 또는 약 0.5 kDa 내지 약 5 kDa, 또는 약 0.3 kDa 내지 약 20 kDa, 또는 약 0.3 kDa 내지 약 10 kDa, 또는 약 0.4 kDa 내지 약 10 kDa, 또는 약 0.5 kDa 내지 약 10 kDa, 또는 약 0.5 kDa 내지 약 7.5 kDa, 또는 약 0.5 kDa 내지 약 4 kDa, 또는 약 0.5 kDa 내지 약 3 kDa, 또는 약 0.67 kDa 내지 약 2.7 kDa을 나타낸다.
하나의 구체예에서, 양이온성 폴리머는 선택사항으로서 변성된 폴리아크릴레이트, 키토산, 폴리에틸렌이민, 폴리아민, 폴리아미노에스테르, 또는 폴리아미도아민, 또는 이들의 임의 코폴리머이다.
구체적인 바람직한 양이온성 폴리머는 예컨대 변성 폴리아미노산, 예컨대 β-아미노산-폴리머 또는 역전 폴리아마이드; 변성 폴리에틸렌, 예컨대 (폴리(N-에틸-4-비닐피리디늄 브로마이드)) (PEVP), 등,; 변성 아크릴레이트, 예컨대 (폴리(디메틸아미노에틸 메틸아크릴레이트)) (pDMAEMA), 등; 변성 아미도아민 예컨대 (폴리(아미도아민)) (pAMAM), 등; 변성 폴리베타아미노에스테르 (PBAE), 예컨대 디아민 말단 변성 1,4 부탄디올 디아크릴레이트-코-5-아미노-1-펜탄올 폴리머, 등; 덴드리머, 예컨대 폴리프로필아민 덴드리머 또는 pAMAM 기반 덴드리머, 등; 폴리이민(들), 예컨대 폴리(에틸렌이민) (PEI 또는 pEI), 폴리(프로필렌이민), 등; 폴리알릴아민, (1,5-디메틸-1,5-디아자운데카메틸렌 폴리메토브로마이드, 또는 헥사디메트린 브로마이드를 포함한다.
또한 양이온성 다당류, 즉 당 주쇄-기반 폴리머, 예컨대 사이클로덱스트린 기반 폴리머, 덱스트란 기반 폴리머, 키토산, 등; 실란 주쇄-기반 폴리머, 예컨대 PMOXA-PDMS 코폴리머, 등; 뿐만 아니라 하나 이상의 양이온성 블록(예컨대 전술한 바와 같은 양이온성 폴리머로부터 선택됨)과 하나 이상의 친수성- 또는 소수성 블록(예컨대 폴리에틸렌 글리콜)의 조합으로 구성된 블록폴리머가 선호된다.
바람직한 구체예 중 하나에서, 양이온성 펩티드 또는 폴리머는 디설파이드 결합을 형성할 수 있는 적어도 하나의 -SH 그룹을 갖는 적어도 하나의 양이온성 원자단 P를 포함하는 양이온성 화합물, 또는 이의 디설파이드-결합된 멀티머이며, 여기서 원자단 P는 분자량 약 0.5 kDa 내지 약 30 kDa을 갖는 폴리머 원자단이거나, 또는 펩티드 원자단의 아미노산의 전체 수의 적어도 10%가 아르기닌(Arg), 라이신(Lys), 히스티딘(His) 및/또는 오르니틴(Orn)으로부터 선택되는 염기성 아미노산을 나타내는, 적어도 3 내지 약 100 개 아미노산으로 구성된 펩티드 원자단이다.
한 구체예에서, 양이온성 화합물의 양이온성 원자단 P는 3 내지 100 개 아미노산으로 구성된 펩티드 원자단이며, 여기서 펩티드 원자단의 아미노산의 전체 수의 적어도 10%가 Arg, Lys, His 및/또는 Orn으로부터 선택되는 염기성 아미노산을 나타낸다. 이러한 펩티드의 예는 예컨대 WO2012/013326에 개시되며, 본 문헌은 그 전체가 참조로 여기에 수록된다.
이와 관련하여, "염기성 아미노산"은 생리학적 환경에서 양이온화되는 아미노산, 또는 -더욱 정확하게는- 이들 분자의 대부분이 비교적 중성 pH에서, 예컨대 세포외 체액의 생리학적 pH에서 순수 양전하를 갖는 아미노산이다. 이는 Arg, Lys, His 및 Orn의 경우이다.
P가 펩티드 원자단의 경우, P의 "디설파이드-결합된 멀티머"는 펩티드 P의 적어도 2 개의 분자 사이에서 적어도 하나의 디설파이드 결합의 형성으로부터 산출되는 펩티드 또는 단백질을 의미한다. 예를 들어, 펩티드 P의 2 개 분자는 하나의 디설파이드 결합을 통하여 연결되어 예컨대 더 긴 펩티드 사슬을 형성할 수 있거나; 또는 이들은 2 개의 디설파이드 결합을 통하여 연결되어 디설파이드 결합의 형성에 참여하는 -SH 그룹의 위치에 따라 예컨대 사이클릭 펩티드, 더 긴 펩티드 사슬, 또는 심지어 또 다른 구조를 형성할 수 있다. 2 개 초과의 펩티드 P로부터의 디설파이드-결합된 멀티머는 또한 P 및 형성된 디설파이드 결합의 성질에 따라 다양한 형태를 가질 수 있다. 조성물이 둘 이상의 상이한 펩티드 P를 포함하는 경우, 멀티머는 동일 분자 또는 상이한 분자 사이의 디설파이드 결합으로부터 산출될 수 있다.
바람직하게는, 원자단 P로서 선택된 펩티드 원자단은 약 3 내지 약 50 개 아미노산, 더욱 바람직하게는 약 7 내지 약 30 개 아미노산, 또는 약 3 내지 약 25 개 아미노산의 길이를 갖는다. 또한 약 3 내지 약 20 개 아미노산, 또는 약 5 내지 약 20 개 아미노산, 또는 약 7 내지 약 30 개 아미노산, 또는 약 6 내지 약 18 개 아미노산, 또는 약 7 내지 약 17 개 아미노산, 예컨대 약 5 내지 약 15 개 아미노산 범위의 길이가 바람직하다.
전형적으로, 원자단 P로서 선택된 펩티드 원자단은 약 0.3 kDa 내지 약 50 kDa, 특히 약 0.5 kDa 내지 약 30 kDa, 또는 약 0.6 kDa 내지 약 10 kDa, 또는 약 0.8 kDa 내지 약 5 kDa, 예컨대 약 1 kDa 내지 약 3 kDa 범위의 분자량을 갖는다.
이러한 펩티드 원자단 중의 -SH 그룹(들)은, P를 나타내는 펩티드 서열 중의 임의 아미노산 잔기의 화학적 변성에 의하거나, 아미노산이 아니며 설프하이드릴 그룹을 포함하는 구조 단위체의 혼입에 의하거나, 및/또는 시스테인(Cys)과 같은 이러한 -SH 그룹을 포함하는 하나 이상의 아미노산에 의해 제공될 수 있다. 바람직한 구체예 중 하나에서, P를 나타내는 펩티드 원자단의 -SH 그룹의 적어도 하나는 Cys에 의해 제공된다. 또 다른 구체예에서, P의 실질적으로 모든 -SH 그룹은 Cys 잔기에 의해 제공된다. 예를 들어, P는 Cys에 의해 제공되는 하나의 -SH 그룹을 포함할 수 있거나, 또는 둘 모두가 Cys에 의해 제공되는 2 개의 -SH 그룹을 제공할 수 있다.
또 다른 바람직한 구체예에서, 원자단 P는 7 내지 30 개 아미노산으로 구성되는 펩티드 원자단이며, 여기서 적어도 하나의 -SH 그룹은 Cys 잔기에 의해 제공된다. 또한 이러한 구체예에서 하나 또는 두 개의 -SH 그룹을 포함하는 펩티드 원자단이 바람직하며, 이들 -SH 그룹 각각은 Cys에 의해 제공된다. 또한, 그러한 펩티드 원자단은, 예를 들어 선형 펩티드 서열의 경우와 같이, 2 개의 종결 말단을 가질 수 있고, Cys 잔기는 상기 종결 말단 중 하나에 또는 그 근처에 위치할 수 있다. 또한 2 개의 종결 말단 및 적어도 2 개의 Cys 잔기를 갖는 이러한 펩티드 원자단이 바람직하며, 여기서 Cys 잔기 중 적어도 하나는 상기 종결 말단 각각에, 또는 그 근처에 위치한다.
P로서 선택된 펩티드 원자단 중의 염기성 아미노산의 양은 각각 펩티드 서열의 아미노산의 전체 수의 적어도 10%, 바람직하게는 그 이상, 예컨대 적어도 약 20 %, 또는 적어도 약 30 %, 또는 적어도 약 40 %, 또는 적어도 약 50 %, 또는 적어도 약 60 %, 또는 적어도 약 70 %이다. 펩티드가 또한 전형적으로, 시스테인 잔기 또는 -SH 그룹을 갖도록 변성된 또 다른 아미노산과 같이, 디설파이드 결합을 형성할 수 있는 -SH 그룹을 갖는 적어도 하나, 더욱 바람직하게는 적어도 두 개의 잔기를 혼입시키는 것을 요구한다는 점을 고려하면, 염기성 아미노산의 양은 또한 펩티드의 길이 관점에서 선택될 수도 있다. 바람직한 구체예 중 하나에서, 펩티드 내의 염기성 아미노산의 수는 펩티드 내의 아미노산의 전체 수보다 2 내지 5 개 적으며, 특히 아미노산의 전체 수보다 2 내지 4 개 적으며, 예컨대 P 내의 아미노산의 전체 수보다 2 또는 3 개 적다. 특정 구체예에서, 펩티드는 2 개 Cys으로 구성되고 그렇지 않는 경우 단지 염기성 아미노산으로만 구성된다.
P로서 선택된 펩티드 원자단은 염기성 아미노산이 풍부한 공지된 펩티드 또는 단백질로부터 유래하는 코어 서열을 포함할 수 있다. 이와 관련하여, "유래된"은 이로부터 유래된 공지된 펩티드에 존재하지 않는 또 다른 아미노산, 예컨대 디설파이드 결합을 형성하기 위한 능력을 위해 요구되는 것들, 예컨대 Cys을 포함할 수 있음을 의미한다. 염기성 아미노산이 풍분한 이러한 공지된 펩티드의 예는 프로타민, 뉴클레오린, 스페르민 또는 스페르미딘, 올리고- 또는 폴리-L-라이신 (PLL), 염기성 폴리펩티드, 올리고- 또는 폴리아르기닌, 세포 투과성 펩티드(CPP), 키메라 CPP, 예컨대 트란스포르탄, 또는 MPG 펩티드, HIV-결합 펩티드, Tat, HIV-1 Tat (HIV), Tat-유래 펩티드, 페네트라틴 군(penetratin family)의 일원, 예컨대 페네트라틴, 안테나페디아-유래 펩티드(특히 드로소필라 안테나페디아로부터 유래됨), pAntp, pIsl, 등, 항균물질-유래 CPP, 예컨대, 부포린-2, Bac715-24, SynB, SynB(1), pVEC, hCT-유래 펩티드, SAP, PpTG20, FGF, 락토페린, 히스톤, VP22 유래 또는 유사 펩티드, HSV, VP22 (단순 포진), MAP, KALA 또는 단백질 전달 도메인(PTD, PpT620, 프롤린-풍부 펩티드, 아르기닌-풍부 펩티드, 라이신-풍부 펩티드, Pep-1, L-올리고머, 칼시토닌 펩티드(들)를 포함한다.
바람직한 구체예 중 일부에서, P로서 선택된 펩티드 원자단은 전체가 또는 대부분이 하나의 특정 염기성 아미노산, 예컨대 약 5 내지 약 30 개 Arg, Lys, His 또는 Orn의 세그먼트, 예를 들어 다음으로 구성되는 코어 서열을 포함한다:
Arg5, Arg6, Arg7, Arg8, Arg9, Arg10, Arg11, Arg12, Arg13, Arg14, Arg15 - 30; Lys5, Lys6, Lys7, Lys8, Lys9, Lys10, Lys11, Lys12, Lys13, Lys14, Lys15 - 30; His5, His6, His7, His8, His9, His10, His11, His12, His13, His14, His15 -30; 또는 Orn5, Orn6, Orn7, Orn8, Orn9, Orn10, Orn11, Orn12, Orn13, Orn14, Orn15 -30.
용어 "코어 서열"은 하나 이상의 추가 아미노산이 각각의 코어 서열, 특히 시스테인과 같이 -SH 그룹을 나타내는 아미노산의 외부의 펩티드에 존재할 수 있음을 의미한다. 또 다른 유용한 코어 서열은 다음의 예에서와 같이 둘 이상의 상이한 염기성 아미노산으로 이루어지며, 이는 아미노산이 발생하는 특정 순서를 명시하지 않은 서열의 조성을 의미한다:
Arg(4-29)Lys1, Arg(4-29)His1, Arg(4-29)Orn1, Lys(4-29)His1, Lys(4-29)Orn1, His(4-29)Orn1, Arg(3-28)Lys2, Arg(3-28)His2, Arg(3-28)Orn2, Lys(3-28)His2, Lys(3-28)Orn2, His(3-28)Orn2, Arg(2-27)Lys3, Arg(2-27)His3, Arg(2-27)Orn3, Lys(2-27)His3, Lys(2-27)Orn3, His(2-27)Orn3, Arg(1-26)Lys4, Arg(1-26)His4, Arg(1-26)Orn4, Lys(1-26)His4, Lys(1-26)Orn4, His(1-26)Orn4, Arg(3-28)Lys1His1, Arg(3-28)Lys1Orn1, Arg(3-28)His1Orn1, Arg1Lys(3-28)His1, Arg1Lys(3-28)Orn1, Lys(3-28)His1Orn1, Arg1Lys1His(3-28), Arg1His(3-28)Orn1, Lys1His(3-28)Orn1;
Arg(2-27)Lys2His1, Arg(2-27)Lys1His2, Arg(2-27)Lys2Orn1, Arg(2-27)Lys1Orn2, Arg(2-27)His2Orn1, Arg(2-27)His1Orn2, Arg2Lys(2-27)His1, Arg1Lys(2-27)His2, Arg2Lys(2-27)Orn1, Arg1Lys(2-27)Orn2, Lys(2-27)His2Orn1, Lys(2-27)His1Orn2, Arg2Lys1His(2-27), Arg1Lys2His(2-27), Arg2His(2-27)Orn1, Arg1His(2-27)Orn2, Lys2His(2-27)Orn1, Lys1His(2-27)Orn2;
Arg(1-26)Lys3His1, Arg(1-26)Lys2His2, Arg(1-26)Lys1His3, Arg(1-26)Lys3Orn1, Arg(1-26)Lys2Orn2, Arg(1-26)Lys1Orn3, Arg(1-26)His3Orn1, Arg(1-26)His2Orn2, Arg(1-26)His1Orn3, Arg3Lys(1-26)His1, Arg2Lys(1-26)His2, Arg1Lys(1-26)His3, Arg3Lys(1-26)Orn1, Arg2Lys(1- 26)Orn2, Arg1Lys(1-26)Orn3, Lys(1-26)His3Orn1, Lys(1-26)His2Orn2, Lys(1-26)His1Orn3, Arg3Lys1His(1-26), Arg2Lys2His(1-26), Arg1Lys3His(1-26), Arg3His(1-26)Orn1, Arg2His(1-26)Orn2, Arg1His(1-26)Orn3, Lys3His(1-26)Orn1, Lys2His(1-26)Orn2, Lys1His(1-26)Orn3;
Arg(2-27)Lys1His1Orn1, Arg1Lys(2-27)His1Orn1, Arg1Lys1His(2-27)Orn1, Arg1Lys1His1Orn(2-27);
Arg(1-26)Lys2His1Orn1, Arg(1-26)Lys1His2Orn1, Arg(1-26)Lys1His1Orn2, Arg2Lys(1-26)His1Orn1, Arg1Lys(1-26)His2Orn1, Arg1Lys(1-26)His1Orn2, Arg2Lys1His(1-26)Orn1, Arg1Lys2His(1-26)Orn1, Arg1Lys1His(1-26)Orn2, Arg2Lys1His1Orn(1-26), Arg1Lys2His1Orn(1-26), Arg1Lys1His2Orn(1-26).
언급한 바와 같이, 이들은 코어 서열이며, 이러한 펩티드 원자단 P의 완전한 펩티드 서열은 디설파이드 결합을 형성할 수 있는 적어도 하나의 -SH 그룹을 더욱 포함한다. Cys은 그러한 -SH 그룹을 갖는 펩티드의 바람직한 원자단 중 하나이다. 따라서, 상기 제시된 코어 서열은 바람직하게는 하나 또는 두 개의 Cys와 같이, 적어도 하나의 Cys를 더욱 포함하는 펩티드 원자단의 일부이며, 여기서 하나 또는 두 개의 Cys 잔기는 각각 종결 말단 중 하나에 위치하거나 또는 펩티드의 각각의 종결 말단에 위치한다. 원자단 P로 선택된 이러한 특히 바람직한 서열은 다음을 포함한다:
하나의 종결 Cys 잔기를 갖는 서열: CysArg5, CysArg6, CysArg7, CysArg8, CysArg9, CysArg10, CysArg11, CysArg12, CysArg13, CysArg14, CysArg15, CysArg16, CysArg17, CysArg18, CysArg19, CysArg20, CysArg21 -30; CysLys5, CysLys6, CysLys7, CysLys8, CysLys9, CysLys10, CysLys11, CysLys12, CysLys13, CysLys14, CysLys15, CysLys16, CysLys17, CysLys18, CysLys19, CysLys20, CysLys21 -30; CysHis5, CysHis6, CysHis7, CysHis8, CysHis9, CysHis10, CysHis11, CysHis12, CysHis13, CysHis14, CysHis15, CysHis16, CysHis17, CysHis18, CysHis19, CysHis20, CysHis21 -30; CysOrn5, CysOrn6, CysOrn7, CysOrn8, CysOrn9, CysOrn10, CysOrn11, CysOrn12, CysOrn13, CysOrn14, CysOrn15, CysOrn16, CysOrn17, CysOrn18, CysOrn19, CysOrn20, CysOrn21 -30.
두 개의 종결 Cys 잔기를 갖는 서열: CysArg5Cys, CysArg6Cys, CysArg7Cys, CysArg8Cys, CysArg9Cys, CysArg10Cys, CysArg11Cys, CysArg12Cys, CysArg13Cys, CysArg14Cys, CysArg15Cys, CysArg16Cys, CysArg17Cys, CysArg18Cys, CysArg19Cys, CysArg20Cys, CysArg21 - 30Cys; CysLys5Cys, CysLys6Cys, CysLys7Cys, CysLys8Cys, CysLys9Cys, CysLys10Cys, CysLys11Cys, CysLys12Cys, CysLys13Cys, CysLys14Cys, CysLys15Cys, CysLys16Cys, CysLys17Cys, CysLys18Cys, CysLys19Cys, CysLys20Cys, CysLys21-30Cys; CysHis5Cys, CysHis6Cys, CysHis7Cys, CysHis8Cys, CysHis9Cys, CysHis10Cys, CysHis11Cys, CysHis12Cys, CysHis13Cys, CysHis14Cys, CysHis15Cys, CysHis16Cys, CysHis17Cys, CysHis18Cys, CysHis19Cys, CysHis20Cys, CysHis21 - 30Cys; CysOrn5Cys, CysOrn6Cys, CysOrn7Cys, CysOrn8Cys, CysOrn9Cys, CysOrn10Cys, CysOrn11Cys, CysOrn12Cys, CysOrn13Cys, CysOrn14Cys, CysOrn15Cys, CysOrn16Cys, CysOrn17Cys, CysOrn18Cys, CysOrn19Cys, CysOrn20Cys, CysOrn21 - 30Cys.
물론, 조성물 내에서 P로서 선택된 상기 기술된 바와 같은 상이한 펩티드 원자단을 갖는 2 종 이상의 상이한 양이온성 화합물을 포함하는 것이나, 또는 펩티드 원자단 P를 이하에 기재된 바와 같은 화학식 I의 화합물과 결합시키는 것도 본 발명의 범위 내에 있다.
또한, 조성물은, P의 정의 내에 속하지 않지만 본 발명의 조성물이 핵산과 같은 카고 물질과 결합될 때 형성되는 복합체 또는 담체계의 물리적, 화학적 또는 생물학적 특정을 조절하는데 유용할 수 있는 하나 또는 그 이상의 또 다른 펩티드와 결합된 양이온성 펩티드 원자단 P를 포함할 수 있다. P의 정의를 따르지 않는 그러한 또 다른 펩티드 서열은 원자단 P를 포함하는 양이온성 화합물 또는 그의 디설파이드-결합된 멀티머의 일부일 수 있거나, 또는 이들은 본 발명의 조성물 내에 별도의 화합물로서 혼입될 수도 있다. 이러한 별도의 화합물이 또한 양이온성 원자단 P를 포함하는 양이온성 화합물과의 디설파이드 결합을 형성할 수 있는 하나 이상의 -SH 그룹을 또한 포함하는 것이 바람직하다.
예를 들어, Trp, Tyr, 또는 Phe와 같은 1종 이상의 방향족 아미노산을 포함하는 펩티드를 혼입시키는 것이 유용할 수 있다. 물론, 방향족 아미노산이 또한 원자단 P 자체에 혼입될 수도 있다. 대안적으로, 이러한 방향족 아미노산은 예컨대 양이온성 원자단 P를 포함하는 양이온성 화합물과 같은 또 다른 성분과 디설파이드 결합을 형성할 수 있는 하나 이상의 -SH 그룹을 포함하는 또 다른 펩티드의 형태로서 조성물에 혼입될 수 있다. 이러한 방식으로, 방향족 아미노산은 담체 조성물과 핵산 카고의 결합 시에 형성되는 복합체에 참여할 것이다.
방향족 아미노산의 혼입은 아미노산의 방향족 구조와 핵산의 염기의 상호작용으로 인하여 핵산 카고에 대한 담체의 추가적인 결합을 가능하게 하며, 이는 더욱 안정한 복합체에 기여할 수 있다. 이러한 결합은 양이온성 또는 양이온화된 그룹과 핵산의 인산염 주쇄와의 상호작용과는 다르다. 방향족 아미노산과 핵산의 염기 사이의 상호작용은 예컨대 삽입(intercalation)에 의하거나 또는 사소한 또는 주요한 홈 결합(groove binding)에 의해 일어날 수 있다. 주로 생체 내에서 세포외 기질에서 발견되는 음이온성 복합체화 파트너(예컨대, 헤파린, 히알루론산)에 의한 압축해제는 일어날 경향이 없으며, 또한 염 효과에 덜 민감하다.
일부 특정 구체예에서, 조성물은 방향족 아미노산이 풍부하거나 또는 실질적으로 방향족 아미노산으로 구성되는 코어 서열을 포함하는 하나 이상의 펩티드를 포함한다. 이러한 펩티드 내의 방향족 아미노산은 서로 동일하거나 상이할 수 있다. 코어 서열은 바람직하게는 디설파이드 결합을 형성하는 능력을 부여하는, Cys와 같은 -SH 그룹을 포함하는 하나 또는 - 더욱 바람직하게는 - 2 개의 원자단이 측면에 위치한다.
유용한 코어 서열의 예는 Trp-Tyr, Tyr-Trp, Trp-Trp, Tyr-Tyr, Trp-Tyr-Trp, Tyr-Trp-Tyr, Trp-Trp-Trp, Tyr-Tyr-Tyr, Trp-Tyr-Trp-Tyr, Tyr-Trp-Tyr-Trp, Trp-Trp-Trp-Trp, Phe-Tyr, Tyr-Phe, Phe-Phe, Phe-Tyr-Phe, Tyr-Phe-Tyr, Phe-Phe-Phe, Phe-Tyr-Phe-Tyr, Tyr-Phe-Tyr-Phe, Phe-Phe-Phe-Phe, Phe-Trp, Trp-Phe, Phe-Phe, Phe-Trp-Phe, Trp-Phe-Trp, Phe-Trp-Phe-Trp, Trp-Phe-Trp-Phe, 및 Tyr-Tyr-Tyr-Tyr, 등을 포함한다. 이러한 서열은 1 회, 2 회, 3 회, 4 회, 5 회, 6 회, 7 회, 8 회, 9 회, 10 회, 12 회, 13 회, 14 회, 15 회 또는 그 이상 반복될 수 있다. 이들은 서로 적절하게 조합될 수 있다.
또한 종결 Cys 잔기를 포함하는 완전한 펩티드 서열의 예는 예컨대 아래와 같다:
Cys-Tyr, Cys-Trp, Cys-Trp-Tyr, Cys-Tyr-Trp, Cys-Trp-Trp, Cys-Tyr-Tyr, Cys-Trp-Tyr-Trp, Cys-Tyr-Trp-Tyr, Cys-Trp-Trp-Trp, Cys-Tyr-Tyr-Tyr, Cys-Trp-Tyr-Trp-Tyr, Cys-Tyr-Trp-Tyr-Trp, Cys-Trp-Trp-Trp-Trp, Cys-Tyr-Tyr-Tyr-Tyr, Cys-Phe, Cys-Phe-Tyr, Cys-Tyr-Phe, Cys-Phe-Phe, Cys-Tyr-Tyr, Cys-Phe-Tyr-Phe, Cys-Tyr-Phe-Tyr, Cys-Phe-Phe-Phe, Cys-Tyr-Tyr-Tyr, Cys-Phe-Tyr-Phe-Tyr, Cys-Tyr-Phe-Tyr-Phe, 또는 Cys-Phe-Phe-Phe-Phe, Cys-Phe-Trp, Cys-Trp-Phe, Cys-Phe-Phe, Cys-Phe-Trp-Phe, Cys-Trp-Phe-Trp, Cys-Phe-Trp-Phe-Trp, Cys-Trp-Phe-Trp-Phe;
Cys-Tyr-Cys, Cys-Trp-Cys, Cys-Trp-Tyr-Cys, Cys-Tyr-Trp-Cys, Cys-Trp-Trp-Cys, Cys-Tyr-Tyr-Cys, Cys-Trp-Tyr-Trp-Cys, Cys-Tyr-Trp-Tyr-Cys, Cys-Trp-Trp-Trp-Cys, Cys-Tyr-Tyr-Tyr-Cys, Cys-Trp-Tyr-Trp-Tyr-Cys, Cys-Tyr-Trp-Tyr-Trp-Cys, Cys-Trp-Trp-Trp-Trp-Cys, Cys-Tyr-Tyr-Tyr-Tyr-Cys, Cys-Phe-Cys, Cys-Phe-Tyr-Cys, Cys-Tyr-Phe-Cys, Cys-Phe-Phe-Cys, Cys-Tyr-Tyr-Cys, Cys-Phe-Tyr-Phe-Cys, Cys-Tyr-Phe-Tyr-Cys, Cys-Phe-Phe-Phe-Cys, Cys-Tyr-Tyr-Tyr-Cys, Cys-Phe-Tyr-Phe-Tyr-Cys, Cys-Tyr-Phe-Tyr-Phe-Cys, 또는 Cys-Phe-Phe-Phe-Phe-Cys, Cys-Phe-Trp-Cys, Cys-Trp-Phe-Cys, Cys-Phe-Phe-Cys, Cys-Phe-Trp-Phe-Cys, Cys-Trp-Phe-Trp-Cys, Cys-Phe-Trp-Phe-Trp-Cys, Cys-Trp-Phe-Trp-Phe-Cys, 등. 각각의 Cys는 또한 유리된 -SH- 원자단을 갖는 변성 아미노산 또는 화학적 화합물로 대체될 수 있다. 예컨대 1 회, 2 회, 3 회, 4 회, 5 회, 6 회, 7 회, 8 회, 9 회, 10 회, 12 회, 13 회, 14 회, 15 회 또는 그 이상의 서열의 조합 또는 반복을 나타내는 펩티드, 특히 2 개의 종결 Cys 잔기를 갖는 것들이 사용될 수도 있다.
또한, 방향족 아미노산이 풍부한 이러한 펩티드는 Trp, Tyr 및 Phe의 더 긴 서열의 구조 브레이커로서 작용할 수 있는 적어도 하나의 프롤린을 함유할 수 있다. 방향족 아미노산 서열의 길이에 따라, 2 개, 3 개 또는 그 이상의 프롤린을 혼입하는 것이 바람직할 수 있다.
본 발명의 조성물 내에 펩티드 원자단 P를 포함하는 양이온성 화합물과 함께 하나 이상의 친수성 아미노산을 포함하는 펩티드를 혼입시키는 것이 더 유용할 수 있다. 물론, 친수성 아미노산이 또한 펩티드 원자단 P 자체에 혼입될 수도 있다. 대안적으로, 이러한 아미노산은 하나 이상의 -SH 그룹, 또는 디설파이드 결합을 또한 다시 포함하는 또 다른 펩티드의 형태로 조성물에 혼입될 수 있으며, 담체 조성물과 헥산 카고의 결합 시에 형성되는 복합체에 참여하여 복합체의 특성을 변성시킬 수도 있다.
이러한 목적에 유용한 친수성 아미노산 중에서, 비하전된 극성 측쇄를 갖는 것이 바람직하고, 특히 Thr, Ser, Asn 및/또는 Gln이 바람직하다. 이러한 아미노산 또는 이러한 아미노산이 풍부한 서열의 포함은 핵산 카고에 대한 더욱 유연한 결합을 가능하게 한다. 이는 핵산 카고의 더욱 효과적인 압축을 초래할 수 있으며 따라서 뉴클레아제 및 원치 않는 압축 해제에 대한 더 나은 보호를 제공합니다. 또한, 전체 암체에 걸쳐 감소된 양이온성 전하를 나타내는 담체를 제공할 수 있으며, 이와 관련하여 바람직하거나 필요한 경우, 더욱 잘 조절된 결합 특성을 제공할 수 있다.
유용한 코어 서열에 대한 예는 다음과 같은 동일하거나 상이한 친수성 아미노산을 기반으로 하는 서열을 포함한다: Ser-Thr, Thr-Ser, Ser-Ser, Thr-Thr, Ser-Thr-Ser, Thr-Ser-Thr, Ser-Ser-Ser, Thr-Thr-Thr, Ser-Thr-Ser-Thr, Thr-Ser-Thr-Ser, Ser-Ser-Ser-Ser, Thr-Thr-Thr-Thr, Gln-Asn, Asn-Gln, Gln-Gln, Asn-Asn, Gln-Asn-Gln, Asn-Gln-Asn, Gln-Gln-Gln, Asn-Asn-Asn, Gln-Asn-Gln-Asn, Asn-Gln-Asn-Gln, Gln-Gln-Gln-Gln, Asn-Asn-Asn-Asn, Ser-Asn, Asn-Ser, Ser-Ser, Asn-Asn, Ser-Asn-Ser, Asn-Ser-Asn, Ser-Ser-Ser, Asn-Asn-Asn, Ser-Asn-Ser-Asn, Asn-Ser-Asn-Ser, Ser-Ser-Ser-Ser, 또는 Asn-Asn-Asn-Asn, 등. 다시 언급하면, 이러한 서열은 예컨대 1 회, 2 회, 3 회, 4 회, 5 회, 6 회, 7 회, 8 회, 9 회, 10 회, 12 회, 13 회, 14 회, 15 회 또는 그 이상 또는 서로 적절하게 조합된 횟수로 반복될 수 있다. 또한, 코어 서열은 바람직하게는 디설파이드 결합을 형성하는 능력을 부여하는, Cys와 같이, -SH 그룹을 포함하거나 디설파이드 결합을 형성하는 하나 또는 2 개의 잔기가 측면에 위치한다.
이러한 종결 Cys 잔기를 또한 포함하는 완전한 펩티드 서열의 예는 다음과 같다: Cys-Thr-Cys, Cys-Ser-Cys, Cys-Ser-Thr-Cys, Cys-Thr-Ser-Cys, Cys-Ser-Ser-Cys, Cys-Thr-Thr-Cys, Cys-Ser-Thr-Ser-Cys, Cys-Thr-Ser-Thr-Cys, Cys-Ser-Ser-Ser-Cys, Cys-Thr-Thr-Thr-Cys, Cys-Ser-Thr-Ser-Thr-Cys, Cys-Thr-Ser-Thr-Ser-Cys, Cys-Ser-Ser-Ser-Ser-Cys, Cys-Thr-Thr-Thr-Thr-Cys, Cys-Asn-Cys, Cys-Gln-Cys, Cys-Gln-Asn-Cys, Cys-Asn-Gln-Cys, Cys-Gln-Gln-Cys, Cys-Asn-Asn-Cys, Cys-Gln-Asn-Gln-Cys, Cys-Asn-Gln-Asn-Cys, Cys-Gln-Gln-Gln-Cys, Cys-Asn-Asn-Asn-Cys, Cys-Gln-Asn-Gln-Asn-Cys, Cys-Asn-Gln-Asn-Gln-Cys, Cys-Gln-Gln-Gln-Gln-Cys, Cys-Asn-Asn-Asn-Asn-Cys, Cys-Asn-Cys, Cys-Ser-Cys, Cys-Ser-Asn-Cys, Cys-Asn-Ser-Cys, Cys-Ser-Ser-Cys, Cys-Asn-Asn-Cys, Cys-Ser-Asn-Ser-Cys, Cys-Asn-Ser-Asn-Cys, Cys-Ser-Ser-Ser-Cys, Cys-Asn-Asn-Asn-Cys, Cys-Ser-Asn-Ser-Asn-Cys, Cys-Asn-Ser-Asn-Ser-Cys, Cys-Ser-Ser-Ser-Ser-Cys, 또는 Cys-Asn-Asn-Asn-Asn-Cys, 등. 각각의 Cys는 또한 유리된 -SH- 원자단 또는 디설파이드 결합에 참여하는 황 원자를 갖는 변성 아미노산 또는 화학적 화합물로 대체될 수 있다. 서열은 예컨대 1 회, 2 회, 3 회, 4 회, 5 회, 6 회, 7 회, 8 회, 9 회, 10 회, 12 회, 13 회, 14 회, 15 회 또는 그 이상 또는 서로 조합된 횟수로 반복될 수 있다.
선택사항으로, 친수성 아미노산이 풍부한 서열은 Ser, Thr 및 Asn의 긴 서열의 구조 브레이커(structure breaker)로서 작용할 수 있는 적어도 하나의 프롤린을 함유할 수 있다. 2 개, 3 개 또는 그 이상의 프롤린이 특히 더 긴 서열에 혼입될 수 있다.
본 발명의 조성물 내에 펩티드 원자단 P를 포함하는 양이온성 화합물과 함께 하나 이상의 친유성 아미노산을 포함하는 펩티드, 특히 Leu, Val, Ile, Ala, 및/또는 Met를 혼입시키는 것이 더 유용할 수 있다. 이러한 친유성 아미노산은 또한 펩티드 원자단 P 자체에 혼입될 수도 있다. 대안적으로, 이들은 하나 이상의 -SH 그룹, 또는 디설파이드 결합을 또한 다시 포함하는 또 다른 펩티드의 형태로 조성물에 혼입될 수 있으며, 이는 담체 조성물과 헥산 카고의 결합 시에 형성되는 복합체에 참여할 수 있다.
친유성 아미노산의 사용은 핵산의 더욱 강력한 압축을 가능하게 한다. 이는 담체와 카고 사이에 형성된 복합체의 추가적인 안정성을 제공하는 친유성 아미노산과 핵산 카고의 특정 상호작용 때문일 수 있다. 안정화는 폴리머 가닥 사이의 비공유성 결합 또는 가교결합과 유사할 수 있다. 특히 수성 환경에서, 이러한 유형의 상호작용은 일반적으로 강하며 현저한 효과를 제공한다.
유용한 코어 서열의 예는 동일하거나 상이한 친유성 아미노산에 기반한 서열, 예컨대 Leu-Val, Val-Leu, Leu-Leu, Val-Val, Leu-Val-Leu, Val-Leu-Val, Leu-Leu-Leu, Val-Val-Val, Leu-Val-Leu-Val, Val-Leu-Val-Leu, Leu-Leu-Leu-Leu, Val-Val-Val-Val, Ile-Ala, Ala-Ile, Ile-Ile, Ala-Ala, Ile-Ala-Ile, Ala-Ile-Ala, Ile-Ile-Ile, Ala-Ala-Ala, Ile-Ala-Ile-Ala, Ala-Ile-Ala-Ile, Ile-Ile-Ile-Ile, Ala-Ala-Ala-Ala, Met-Ala, Ala-Met, Met-Met, Ala-Ala, Met-Ala-Met, Ala-Met-Ala, Met-Met-Met, Ala-Ala-Ala, Met-Ala-Met-Ala, Ala-Met-Ala-Met, 또는 Met-Met-Met-Met 등을 포함한다. 이러한 서열은 예컨대 1 회, 2 회, 3 회, 4 회, 5 회, 6 회, 7 회, 8 회, 9 회, 10 회, 12 회, 13 회, 14 회, 15 회 또는 그 이상 또는 서로 조합된 횟수로 반복될 수 있다. 또한, 코어 서열은, Cys와 같이, -SH 그룹, 또는 디설파이드 결합에 참여하는 황 원자를 포함하는 하나 또는 2 개의 잔기가 측면에 위치한다.
이러한 종결 Cys 잔기를 또한 포함하는 완전한 펩티드 서열의 예는 다음과 같다: Cys-Val-Cys, Cys-Leu-Cys, Cys-Leu-Val-Cys, Cys-Val-Leu-Cys, Cys-Leu-Leu-Cys, Cys-Val-Val-Cys, Cys-Leu-Val-Leu-Cys, Cys-Val-Leu-Val-Cys, Cys-Leu-Leu-Leu-Cys, Cys-Val-Val-Val-Cys, Cys-Leu-Val-Leu-Val-Cys, Cys-Val-Leu-Val-Leu-Cys, Cys-Leu-Leu-Leu-Leu-Cys, Cys-Val-Val-Val-Val-Cys, Cys-Ala-Cys, Cys-Ile-Cys, Cys-Ile-Ala-Cys, Cys-Ala-Ile-Cys, Cys-Ile-Ile-Cys, Cys-Ala-Ala-Cys, Cys-Ile-Ala-Ile-Cys, Cys-Ala-Ile-Ala-Cys, Cys-Ile-Ile-Ile-Cys, Cys-Ala-Ala-Ala-Cys, Cys-Ile-Ala-Ile-Ala-Cys, Cys-Ala-Ile-Ala-Ile-Cys, Cys-Ile-Ile-Ile-Ile-Cys, 또는 Cys-Ala-Ala-Ala-Ala-Cys, Cys-Met-Cys, Cys-Met-Ala-Cys, Cys-Ala-Met-Cys, Cys-Met-Met-Cys, Cys-Ala-Ala-Cys, Cys-Met-Ala-Met-Cys, Cys-Ala-Met-Ala-Cys, Cys-Met-Met-Met-Cys, Cys-Ala-Ala-Ala-Cys, Cys-Met-Ala-Met-Ala-Cys, Cys-Ala-Met-Ala-Met-Cys, Cys-Met-Met-Met-Met-Cys, 또는 Cys-Ala-Ala-Ala-Ala-Cys, 등. 각각의 Cys는 또한 유리된 -SH-그룹 또는 이러한 -SH 그룹으로부터 유래된 디설파이드 결합에 참여하는 그룹을 갖는 변성 아미노산 또는 화학적 화합물로 대체될 수 있다. 이러한 서열은 예컨대 1 회, 2 회, 3 회, 4 회, 5 회, 6 회, 7 회, 8 회, 9 회, 10 회, 12 회, 13 회, 14 회, 15 회 또는 그 이상 또는 서로 조합된 횟수로 반복될 수 있다.
선택사항으로, 친유성 아미노산이 풍부한 서열은 Leu, Val, Ile, Ala 및/또는 Met의 긴 서열의 구조 브레이커(structure breaker)로서 작용할 수 있는 적어도 하나의 프롤린을 함유할 수 있다. 2 개, 3 개 또는 그 이상의 프롤린이 특히 더 긴 서열에 혼입될 수 있다.
선택사항으로서, 펩티드 원자단 P는 기능성 펩티드 서열을 함유할 수 있다. 그 대신에 또는 부가적으로, 기능성 펩티드는 선택사항으로서 하나 이상의 -SH 그룹 또는 디설파이드 결합에 참여하는 황 원자를 나타내도록 변성된 이후에, 펩티드 원자단 P를 포함하는 양이온성 화합물과 함께 본 발명의 조성물 내에 혼입될 수 있다. 대안적으로, 이러한 기능성 펩티드 서열은 산-불안정한 결합을 통해, 바람직하게는 담체 성분의 측쇄를 통해 펩티드 P와 같은 또 다른 담체 성분에 부착될 수 있으며, 이는 낮은 pH 값에서, 예컨대 생리학적 pH 값에서 기능성 펩티드를 분리 또는 방출할 수 있다.
기능성 펩티드 또는 펩티드 서열은 신호 펩티드 또는 신호 서열, 국지화 신호 또는 서열, 핵 국지화 신호 또는 서열 (NLS), 항체, 세포 투과성 펩티드, (예컨대 TAT), 등을 나타내거나 이들로부터 유래할 수 있다.
이와 관련하여, 신호 펩티드, 국지화 신호 또는 서열 또는 핵 국지화 신호 또는 서열(NLS)은, 담체-카고 복합체를 특정 표적 세포(예컨대 간세포 또는 항원-제시 세포s) 또는 서브세포(subcellular) 구조체로 유도시키는데 사용될 수 있으며 특정 표적으로, 예컨대 세포 내로, 핵 내로, 엔도솜 구획 내로, 미토콘드리아 기질, 원형질막, 골지체, 핵, 세포질 및 세포골격, 소포체 등으로의 초국지화(translocalisation)를 가능하게 할 수 있다. 신호 서열 또는 핵 국지화 신호는 여기서 정의된 임의의 핵산, 특히 RNA 또는 DNA, 더욱 바람직하게는 shRNA 또는 pDNA의 예컨대 핵 내로의 수송을 위해 사용될 수 있다. 핵 국지화 서열은 예컨대 KDEL, DDEL, DEEL, QEDL, RDEL, GQNLSTSN, PKKKRKV, PQKKIKS, QPKKP, RKKR, RKKRRQRRRAHQ, RQARRNRRRRWRERQR, MPLTRRRPAASQALAPPTP, GAALTILV, 또는 GAALTLLG를 포함할 수 있다. 엔도솜 구획에 대한 국지화 서열의 예는 MDDQRDLISNNEQLP이다. 미토콘드리아 기질에 대한 예시적인 국지화 서열은 MLFNLRXXLNNAAFRHGHNFMVRNFRCGQPLX이다. 원형질막에 대한 국지화 서열은 예컨대 GCVCSSNP, GQTVTTPL, GQELSQHE, GNSPSYNP, GVSGSKGQ, GQTITTPL, GQTLTTPL, GQIFSRSA, GQIHGLSP, GARASVLS, 및 GCTLSAEE를 포함한다. 소포체 및 핵에 대한 국지화 서열은 GAQVSSQK 및 GAQLSRNT를 포함한다. 골지체, 핵, 세포질 및 세포골격에 대한 국지화 서열은 GNAAAAKK를 포함한다. 세포질 및 세포골격에 대한 국지화 서열은 GNEASYPL을 포함한다. 원형질막 및 세포골격에 대한 국지화 서열은 GSSKSKPK를 포함한다. 분비 신호 펩티드 서열의 예는 고전적 또는 비-고전적 MHC-서열(예컨대, MHC I 및 II 분자의 신호 서열, 예컨대 MHC 클래스 I 분자 HLA-A*0201의 신호 서열)을 포함한다. 유용한 펩티드는 또한 면역글로불린 또는 항체의 불변 사슬의 신호 서열과 같은 사이토카인 또는 면역글로불린의 신호 서열; Lamp1, 타파신, Erp57, 칼레티큘린(calreticulin), 칼렉신(calnexin), 또 다른 막-관련 단백질, 또는 소포체(ER) 또는 엔도솜-리소좀(endosomal-lysosomal) 구획과 관련된 단백질의 신호 서열을 혼입할 수 있다. MHC 클래스 I 분자 HLA-A*0201의 신호 서열이 특히 바람직하다.
펩티드 원자단 P의 특성은 그 서열에 비-천연 아미노산을 포함시킴으로써 또는 펩티드의 화학적 변형에 의해 추가로 조절될 수 있다. 예를 들어, 특정 화학 그룹이 도입될 수 있다. 이러한 그룹은 (예컨대, 카르복시산, 설폰산, 아민 등과의 반응에 의한) 아마이드 형성에 의한, (예컨대, 말레인이미드 원자단, α,β 불포화 카르보닐을 사용하는 ) 마이클 첨가반응에 의한, (예컨대, 아지드 또는 알킨을 사용하는) 클릭 화학에 의한, (예컨대, 알켄 또는 알킨을 사용하는) 알켄/알킨 복분해에 의한, (알데히드 또는 케톤, 하이드라진, 하이드록실아민, 아민을 사용하는) 이민 또는 하이드로존 형성, (아비딘, 비오틴, 프로틴 G 등을 사용하는) 복합체화 반응 또는 (예컨대, 할로겐알칸, 티올, 알코올, 아민, 하이드라진, 하이드라지드, 설폰산 에스테르, 옥시포스포늄 염과의) Sn-유형 치환 반응을 허용하는 성분 또는 추가 성분의 부착에 사용될 수 있는 또 다른 화학적 원자단에 의한, 추가 성분 또는 리간드의 부착을 허용하도록 선택될 수 있다.
펩티드 원자단 P를 갖는 양이온성 화합물을 포함하는 본 발명의 조성물의 특별한 장점 중 하나는 그러한 펩티드 원자단이 특정 치료 목적 또는 적용과 관련된 특정 요구에 쉽게 고안되고 적응될 수 있다는 것이다. 예를 들어, 핵산 구조와 같은 특정 카고와 복합체를 형성하는데 필요한 양전하의 양은 펩티드 서열에서 염기성 아미노산의 함량을 변화시킴으로써 최적화될 수 있다. 동시에, 펩티드의 길이는 생분해성과 내약성을 최적화하기 위해 다양할 수 있다.
본 발명자들은 펩티드 분자가 핵산 카고와의 복합체 형성을 허용하는 조건 하에서 서로 디설파이드 결합을 용이하게 형성한다는 것을 발견하였다. 예컨대 시토졸성 GSH가 존재하는 전형적인 시토졸 환경에서와 같은 특정 생체 내 조건 하에서, 디설파이드 결합이 감소되어 대부분의 세포에 의해 쉽게 대사되는 더 작은 펩티드 단위로 이어지고, 이는 먼저 작은 올리고펩티드로, 결국에는 아미노산으로 변하게 된다. 전술한 바와 같이 더 큰 올리고펩티드에 대해서도 유의미한 독성이 발견되지 않았다.
또 다른 바람직한 구체예에서, 원자단 P를 포함하는 양이온성 화합물은 화학식 IV에 따른 화합물이며
L1-P1-[P-]n-P3-L2 (화학식 IV)
여기서 P는 앞서 정의된 바와 같으며, 즉 P는 분자량 약 0.5 kDa 내지 약 30 kDa을 갖는 폴리머 원자단, 또는 3 내지 100 개 아미노산으로 구성된 펩티드 원자단이며, 여기서 펩티드 원자단의 아미노산의 전체 수의 적어도 10%는 Arg, Lys, His 및/또는 Orn으로부터 선택되는 염기성 아미노산을 나타낸다. P3은 선택사항이다. P1 및 P3는 (존재하는 경우) 독립적으로 선택되며, 각각은 폴리에틸렌 글리콜 (PEG), 폴리-N-(2-하이드록시프로필)메타크릴아마이드, 폴리-2-(메타크릴로일옥시)에틸 포스포릴콜린, 폴리(하이드록시알킬 L-아스파라긴), 폴리(2-(메타크릴로일옥시)에틸 포스포릴콜린), 하이드록시에틸스타치 또는 폴리(하이드록시알킬 L-글루타민)으로부터 선택되는 선형 또는 분지쇄 친수성 폴리머 사슬을 나타내며, 여기서 상기 폴리머 사슬은 분자량 약 1 kDa 내지 약 100 kDa을 나타내며, P1 및 P3는 각각 디설파이드 결합을 통하여 원자단 P에 결합된다. L1 및 L2는 선택사항인 리간드이며 독립적으로 RGD, RGD 펩티드, 트란스페린, 엽산, 신호 펩티드 또는 신호 서열, 국지화 신호 또는 서열, 핵 국지화 신호 또는 서열 (NLS), 항체, 세포 투과성 펩티드 예컨대 WEAKLAKALAKALAKHLAKALAKALKACEA, TAT, 수용체의 리간드, 사이토카인, 호르몬, 성장 인자, 소분자, 카르보하이드레이트, 만노오스, 갈락토오스, n-아세틸갈락토오스아민, 합성 리간드, 소분자 작용제, 수용체의 억제제 또는 길항제, 또는 RGD 펩티드모방 유사체(peptidomimetic analogue)로부터 선택된다.
또한, n은 화학식 IV에서 1 내지 약 50, 바람직하게는 2, 3, 4, 또는 5 내지 약 10의 범위, 또는 2, 3, 또는 4 내지 약 9의 범위, 예컨대 6, 또는 7로부터 선택되는 정수이며; n이 1보다 큰 경우, 각각의 원자단 P는 디설파이드 결합을 통하여 또 다른 원자단 P에 결합된다. n이 2 내지 약 20, 또는 약 4 내지 약 10의 범위, 예컨대 약 4, 5, 6, 7, 8, 9 또는 10으로부터 선택되는 것이 또한 바람직하다.
선택사항인 세그먼트 L1, L2, 또는 P3에 대한 참조는 해당 세그먼트가 존재하는 선택적 구체예에 적용가능한 것으로 해석되어야 한다.
화학식 IV로부터 명백하듯이, 각각의 양이온성 화합물은 적어도 각각 성분 또는 원자단 P, P1 및 P3 사이에 디설파이드 결합을 포함하며, 선택사항으로서 원자단 P 내에, 및/또는 P1과 L1 및/또는 P3와 L3 사이에 디설파이드 결합을 더욱 포함한다. 디설파이드 결합은 Cys와 같은 잔기, 또는 화학적으로 변성된 아미노산, 또는 환원된 형태에서 -SH 그룹을 갖는 또 다른 잔기로부터 기원할 수 있는 -SH 그룹으로부터 유래한다.
선택사항으로서, 하나 이상의 추가 -SH 그룹 또는 디설파이드 결합이 화합물 내에 존재하여, 예컨대 아미노산 성분, 예컨대 항원 에피토프, 항원, 항체, 세포 투과성 펩티드(예컨대 TAT), 리간드 등과 같은 또 다른 성분을 부착시킬 수 있다.
화학식 II에 따른 화합물 및 그 제조 방법의 또 다른 예는 예컨대 WO 2011/026641에 개시되어 있으며, 그 개시 내용은 전체가 본 명세서에 수록된다.
본 발명을 수행하기 위한 화학식 IV에 따른 화합물의 사용은 높은 다양성의 이점과 관련된다. 또한, 화학식 II에 기반한 구체예는 폴리머 사슬의 길이를 정의하게 하고, 하나의 폴리머 내에서 상이한 짧은 폴리머의 원하는 특성을 조합할 수 있게 하며, 예컨대 활동성의 손실 없이 유전자 요법 또는 또 다른 치료적 응용의 목적을 위하여 핵산의 효율적인 형질주입의 목적을 위하여 핵산을 효율적으로 압축하게 하며, 특히 생체 외 뿐만 아니라 형질주입 생체 내에서 상이한 세포계로 핵산의 효율적인 형질주입을 가능하게 한다. 담체 분자는 또한 세포에 대한 독성이 없으며 그 핵산 카고를 효율적으로 방출한다. 마지막으로, 특히 분자의 종결 말단에 대한 친수성 폴리머 사슬(예컨대 PEG)의 가역적 첨가로 인하여 응집에 대한 향상된 저항성이 제시되며, 이는 혈청 함유 매질과 관련하여 핵산 카고의 향상된 안정성을 제공하며 면역계 또는 혈청 내용물과의 또 다른 바람직하지 않은 상호작용에 의한 폴리머성 담체 카고 복합체의 인식을 방지한다. 시토졸에서, 세그먼트 P1 및 P3에 의해 달성되는 "코팅"은 세포의 환원 조건 하에서 쉽게 제거된다. 또한 이 효과는 시토졸에서 핵산 카고의 방출을 촉진한다.
앞서 정의된 바와 같이, 리간드 L1 및 L2는 화학식 IV에 따른 화합물에 선택사항으로서 포함될 수 있다. 이들은 예컨대 복합체화된 핵산과 같은 카고를 특정 세포로 유도하기 위한 것이다. 그들은 서로 독립적으로 선택될 수 있다. 잠재적으로 적절한 리간드의 예는 RGD, 트란스페린, 엽산, 신호 펩티드 또는 신호 서열, 국지화 신호 또는 서열, 핵 국지화 신호 또는 서열 (NLS), 항체, 세포 투과성 펩티드, (예컨대 TAT), 수용체의 리간드 (예컨대 사이토카인, 호르몬, 성장 인자 등), 소분자 (예컨대 카르보하이드레이트 유사 만노오스 또는 갈락토오스 또는 합성 리간드), 소분자 작용제, 수용체의 억제제 또는 길항제(예컨대 RGD 펩티드모방 유사체) 등을 포함한다.
바람직한 리간드의 예는 WEAKLAKALAKALAKHLAKALAKALKACEA (또한 KALA로 칭함) 및 N-아세틸갈락토오스아민(GalNac)을 포함한다. 이와 관련하여 세포 막 상에 만노오스 수용체를 갖는 항원 제시 세포를 표적화하는 리간드로서 만노오스가 또한 바람직하다. 또 다른 바람직한 구체예에서, 선택사항인 리간드로서 갈락토오스가 간세포를 표적화하기 위하여 사용될 수 있다.
이러한 리간드 L1 및 L2는 가역적 디설파이드 결합에 의하거나 또는 또 다른 가능한 화학적 부착에 의해, 예컨대 3-티오 프로피온산 또는 2-이미노티올란(트라우트 시약)의 결합에 의해, 아마이드 형성에 의해(예컨대 카르복실산, 설폰산, 아민, 등), 마이클 첨가반응(Michael addition)에 의해 (예컨대 말레인이미드 원자단, 불포화 카르보닐, 등), 클릭 화학(click chemistry)에 의해(예컨대 아지드 또는 알킨), 알켄/알킨 복분해에 의해(예컨대 알켄 또는 알킨), 이민 또는 하이드로존 형성 (알데히드 또는 케톤, 하이드라진, 하이드록실아민, 아민), 복합체화 반응 (아비딘, 비오틴, 프로틴 G) 또는 Sn-유형 치환 반응을 허용하는 성분(예컨대 할로겐알칸, 티올, 알코올, 아민, 하이드라진, 하이드라지드, 설폰산 에스테르, 옥시포스포늄 염) 또는 추가 성분의 부착에 사용될 수 있는 또 다른 화학적 원자단에 의해 성분 P1 및/또는 P3에 부착될 수 있다.
앞서 정의된 바와 같이, 성분 P1 및 P3은 독립적으로 선택되고, 각각 성분 P와의 디설파이드 결합에 참여하는 적어도 하나의 황 원자를 함유하는 선형 또는 분지쇄 친수성 폴리머 사슬을 나타낸다. P1 및 P3 각각의 폴리머 사슬은 독립적으로 폴리에틸렌 글리콜 (PEG), 폴리-N-(2-하이드록시프로필)메타크릴아마이드, 폴리-2-(메타크릴로일옥시)에틸 포스포릴콜린, 폴리(하이드록시알킬 L-아스파라긴), 폴리(2-(메타크릴로일옥시)에틸 포스포릴콜린), 하이드록시에틸스타치 또는 폴리(하이드록시알킬 L-글루타민)으로부터 선택된다. P1 및 P3은 각각 분자량 약 1 kDa 내지 약 100 kDa을 나타낸다.
P1 및/또는 P3의 폴리머 사슬의 분자량은 바람직하게는 약 1 kDa 내지 약 75 kDa, 또는 약 5 kDa 내지 약 50 kDa, 심지어 더욱 바람직하게는 약 5 kDa 내지 약 25 kDa이다. 또 달리 바람직하게는, P1 및/또는 P3는 선택사항으로서 약 5 kDa 내지 약 25 kDa의 변성된 폴리에틸렌 글리콜 사슬이다.
디설파이드 결합을 가능하게 하는 황 원자는, 환원된 형태에서 그리고 화학식 IV의 화합물에 혼입되기 전에 -SH 원자단을 갖는 임의 또 다른 (변성된) 아미노산 또는 내부 시스테인에 의해, 각각의 친수성 폴리머 사슬 P1 및 P3에 제공될 수 있다.
대안적으로, 친수성 폴리머 사슬 P1 및/또는 P3는 바람직하게는 -SH 원자단을 갖는 화합물과의 화학적 반응을 통해, -SH 원자단에 의해 변성된 폴리머로부터 유래될 수 있으며, 이에 따라 각각의 친수성 폴리머 P1 및 P3는 화학식 IV의 화합물에 혼입되기 전에 적어도 하나의 이러한 -SH 원자단을 갖는다. -SH 원자단을 갖는 이러한 화합물은 예컨대 (또 다른) 시스테인이거나 또는 -SH 원자단을 갖는 임의 또 다른 (변성된) 아미노산일 수 있다.
이러한 화합물은 -SH 원자단을 친수성 폴리머 사슬 P1 및 P3 내로 도입하는 것을 허용하거나 이를 함유하는 임의 비-아미노 화합물 또는 원자단일 수 있다. 이러한 비-아미노 화합물은 화합물의 화학 반응 또는 결합을 통하여, 예컨대 예컨대 3-티오 프로피온산 또는 티오이몰란(트라우트 시약)의 결합에 의해, 아마이드 형성에 의해(예컨대 카르복실산, 설폰산, 아민, 등), 마이클 첨가반응(Michael addition)에 의해 (예컨대 말레인이미드 원자단, 불포화 카르보닐, 등), 클릭 화학(click chemistry)에 의해(예컨대 아지드 또는 알킨), 알켄/알킨 복분해에 의해(예컨대 알켄 또는 알킨), 이민 또는 하이드로존 형성 (알데히드 또는 케톤, 하이드라진, 하이드록실아민, 아민), 복합체화 반응 (아비딘, 비오틴, 프로틴 G) 또는 Sn-유형 치환 반응을 허용하는 성분(예컨대 할로겐알칸, 티올, 알코올, 아민, 하이드라진, 하이드라지드, 설폰산 에스테르, 옥시포스포늄 염) 또는 추가 성분의 부착에 사용될 수 있는 또 다른 화학적 원자단에 의해 P1 및/또는 P3에 부착될 수 있다. 이와 관련하여 특히 바람직한 PEG 유도체는 알파-메톡시-오메가-머캅토 폴리(에틸렌 글리콜)이다. 각각의 경우에, 예컨대 시스테인 또는 임의 또 다른 (변성된) 아미노산 또는 화합물의 디설파이드 결합에 참여하는 황 원자는 종결 말단에 또는 P1 및 P3의 임의 위치에 내부적으로 존재할 수 있다. 하나의 구체예에서, 각각의 P1 및 P3는 하나의 종결 말단에서의 적어도 하나의 디설파이드 결합 및 적어도 하나의 또 다른 -SH 그룹 또는 디설파이드 결합을 나타내며, 이는 여기에 정의된 또 다른 성분, 에컨대 리간드, 아미노산 성분 (AA)x, 항체, 세포 투과성 펩티드(예컨대 TAT), 등에 추가적으로 부착하는데 사용될 수 있다.
또 다른 바람직한 구체예에 따르면, 친수성 폴리머 사슬 P1 및 P3는 각각 또한 적어도 하나의 또 다른 작용기를 함유할 수 있으며 이는 여기에 정의된 바와 같이 또 다른 성분, 예컨대 리간드, 아미노산 성분(AA)x 등에 예컨대 아마이드 형성에 의해(예컨대 카르복실산, 설폰산, 아민, 등), 마이클 첨가반응(Michael addition)에 의해 (예컨대 말레인이미드 원자단, 불포화 카르보닐, 등), 클릭 화학(click chemistry)에 의해(예컨대 아지드 또는 알킨), 알켄/알킨 복분해에 의해(예컨대 알켄 또는 알킨), 이민 또는 하이드로존 형성 (알데히드 또는 케톤, 하이드라진, 하이드록실아민, 아민), 복합체화 반응 (아비딘, 비오틴, 프로틴 G) 또는 Sn-유형 치환 반응을 허용하는 성분(예컨대 할로겐알칸, 티올, 알코올, 아민, 하이드라진, 하이드라지드, 설폰산 에스테르, 옥시포스포늄 염) 또는 추가 성분의 부착에 사용될 수 있는 또 다른 화학적 그룹을 통하여 부착될 수 있다.
앞서 정의된 바와 같이, 화학식 IV의 화합물 중의 P는 분자량 약 0.5 kDa 내지 약 30 kDa을 갖는 폴리머 원자단, 또는 3 내지 100 개 아미노산으로 구성된 펩티드 원자단이며, 여기서 펩티드 원자단의 아미노산의 전체 수의 적어도 10%는 Arg, Lys, His 및/또는 Orn으로부터 선택되는 염기성 아미노산을 나타낸다. P가 펩티드 원자단인 경우, P와 관련하여 일반적으로 앞서 설명한 유추에 의해 동일한 선호도가 적용될 수 있음; -SH 그룹과 관련된 선호도는 그러한 -SH 그룹으로부터 유래된 화학식 II의 화합물 중의 디설파이드 결합에도 적용되어야 한다.
예를 들어, 화학식 IV의 화합물에서 P로서 선택된 펩티드 원자단은 바람직하게는 약 3 내지 약 50 개 아미노산, 더욱 바람직하게는 약 7 내지 약 30 개 아미노산, 또는 약 3 내지 약 25 개 아미노산의 길이를 갖는다. 또한 약 3 내지 약 20 개 아미노산, 또는 약 5 내지 약 20 개 아미노산, 또는 약 7 내지 약 30 개 아미노산, 또는 약 6 내지 약 18 개 아미노산, 또는 약 7 내지 약 17 개 아미노산, 예컨대 약 5 내지 약 15 개 아미노산 범위의 길이가 바람직하다. 화학식 II에서 펩티드 원자단 P가 약 0.3 kDa 내지 약 50 kDa, 특히 약 0.5 kDa 내지 약 30 kDa, 또는 약 0.6 kDa 내지 약 10 kDa, 또는 약 0.8 kDa 내지 약 5 kDa, 예컨대 약 1 kDa 내지 약 3 kDa 범위의 분자량을 갖는 것이 또한 바람직하다.
또한 화학식 IV에서 P로서 선택된 펩티드 원자단 중의 염기성 아미노산의 양은 각각 펩티드 서열의 아미노산의 전체 수의 적어도 10%, 바람직하게는 그 이상, 예컨대 적어도 약 20 %, 또는 적어도 약 30 %, 또는 적어도 약 40 %, 또는 적어도 약 50 %, 또는 적어도 약 60 %, 또는 적어도 약 70 %이다.
바람직한 구체예 중 일부에서, 화학식 IV의 화합물에서 P로서 선택된 펩티드 원자단은 전체가 또는 대부분이 하나의 특정 염기성 아미노산, 예컨대 약 5 내지 약 30 개 Arg, Lys, His 또는 Orn의 세그먼트로 구성되는 코어 서열을 포함하며, 하나 또는 두 개의 종결 Cys 잔기가 측면에 위치한다. 화학식 IV에서 펩티드 원자단 P의 이러한 바람직한 형태의 예는 다음을 포함한다:
하나의 종결 Cys 잔기를 갖는 P의 서열: CysArg5, CysArg6, CysArg7, CysArg8, CysArg9, CysArg10, CysArg11, CysArg12, CysArg13, CysArg14, CysArg15, CysArg16, CysArg17, CysArg18, CysArg19, CysArg20, CysArg21 -30; CysLys5, CysLys6, CysLys7, CysLys8, CysLys9, CysLys10, CysLys11, CysLys12, CysLys13, CysLys14, CysLys15, CysLys16, CysLys17, CysLys18, CysLys19, CysLys20, CysLys21 -30; CysHis5, CysHis6, CysHis7, CysHis8, CysHis9, CysHis10, CysHis11, CysHis12, CysHis13, CysHis14, CysHis15, CysHis16, CysHis17, CysHis18, CysHis19, CysHis20, CysHis21 -30; CysOrn5, CysOrn6, CysOrn7, CysOrn8, CysOrn9, CysOrn10, CysOrn11, CysOrn12, CysOrn13, CysOrn14, CysOrn15, CysOrn16, CysOrn17, CysOrn18, CysOrn19, CysOrn20, CysOrn21-30.
두 개의 종결 Cys 잔기를 갖는 P의 서열: CysArg5Cys, CysArg6Cys, CysArg7Cys, CysArg8Cys, CysArg9Cys, CysArg10Cys, CysArg11Cys, CysArg12Cys, CysArg13Cys, CysArg14Cys, CysArg15Cys, CysArg16Cys, CysArg17Cys, CysArg18Cys, CysArg19Cys, CysArg20Cys, CysArg21 - 30Cys; CysLys5Cys, CysLys6Cys, CysLys7Cys, CysLys8Cys, CysLys9Cys, CysLys10Cys, CysLys11Cys, CysLys12Cys, CysLys13Cys, CysLys14Cys, CysLys15Cys, CysLys16Cys, CysLys17Cys, CysLys18Cys, CysLys19Cys, CysLys20Cys, CysLys21 - 30Cys; CysHis5Cys, CysHis6Cys, CysHis7Cys, CysHis8Cys, CysHis9Cys, CysHis10Cys, CysHis11Cys, CysHis12Cys, CysHis13Cys, CysHis14Cys, CysHis15Cys, CysHis16Cys, CysHis17Cys, CysHis18Cys, CysHis19Cys, CysHis20Cys, CysHis21-30Cys; CysOrn5Cys, CysOrn6Cys, CysOrn7Cys, CysOrn8Cys, CysOrn9Cys, CysOrn10Cys, CysOrn11Cys, CysOrn12Cys, CysOrn13Cys, CysOrn14Cys, CysOrn15Cys, CysOrn16Cys, CysOrn17Cys, CysOrn18Cys, CysOrn19Cys, CysOrn20Cys, CysOrn21 - 30Cys.
대안적으로, 화학식 IV에서 원자단 P에 유용한 펩티드 서열은 둘 이상의 상이한 염기성 아미노산으로 이루어지며, 다음의 예에서와 같이 이는 아미노산이 발생하는 특정 순서를 명시하지 않은 서열의 조성을 의미하며, 한편 Cys 잔기는 종결 위치에 있다:
CysArg(4-29)Lys1, CysArg(4-29)His1, CysArg(4-29)Orn1, CysLys(4-29)His1, CysLys(4-29)Orn1, CysHis(4-29)Orn1, CysArg(3-28)Lys2, CysArg(3-28)His2, CysArg(3-28)Orn2, CysLys(3-28)His2, CysLys(3-28)Orn2, CysHis(3-28)Orn2, CysArg(2-27)Lys3, CysArg(2-27)His3, CysArg(2-27)Orn3, CysLys(2-27)His3, CysLys(2-27)Orn3, CysHis(2-27)Orn3, CysArg(1-26)Lys4, CysArg(1-26)His4, CysArg(1-26)Orn4, CysLys(1-26)His4, CysLys(1-26)Orn4, CysHis(1-26)Orn4, CysArg(3-28)Lys1His1, CysArg(3-28)Lys1Orn1, CysArg(3-28)His1Orn1, CysArg1Lys(3-28)His1, CysArg1Lys(3-28)Orn1, CysLys(3-28)His1Orn1, CysArg1Lys1His(3-28), CysArg1His(3-28)Orn1, CysLys1His(3-28)Orn1;
CysArg(2-27)Lys2His1, CysArg(2-27)Lys1His2, CysArg(2-27)Lys2Orn1, CysArg(2-27)Lys1Orn2, CysArg(2-27)His2Orn1, CysArg(2-27)His1Orn2, CysArg2Lys(2-27)His1, CysArg1Lys(2-27)His2, CysArg2Lys(2-27)Orn1, CysArg1Lys(2-27)Orn2, CysLys(2-27)His2Orn1, CysLys(2-27)His1Orn2, CysArg2Lys1His(2-27), CysArg1Lys2His(2-27), CysArg2His(2-27)Orn1, CysArg1His(2-27)Orn2, CysLys2His(2-27)Orn1, CysLys1His(2-27)Orn2;
CysArg(1-26)Lys3His1, CysArg(1-26)Lys2His2, CysArg(1-26)Lys1His3, CysArg(1-26)Lys3Orn1, CysArg(1-26)Lys2Orn2, CysArg(1-26)Lys1Orn3, CysArg(1-26)His3Orn1, CysArg(1-26)His2Orn2, CysArg(1-26)His1Orn3, CysArg3Lys(1-26)His1, CysArg2Lys(1-26)His2, CysArg1Lys(1-26)His3, CysArg3Lys(1-26)Orn1, CysArg2Lys(1-26)Orn2, CysArg1Lys(1-26)Orn3, CysLys(1-26)His3Orn1, CysLys(1-26)His2Orn2, CysLys(1-26)His1Orn3, CysArg3Lys1His(1-26), CysArg2Lys2His(1-26), CysArg1Lys3His(1-26), CysArg3His(1-26)Orn1, CysArg2His(1-26)Orn2, CysArg1His(1-26)Orn3, CysLys3His(1-26)Orn1, CysLys2His(1-26)Orn2, CysLys1His(1-26)Orn3;
CysArg(2-27)Lys1His1Orn1, CysArg1Lys(2-27)His1Orn1, CysArg1Lys1His(2-27)Orn1, CysArg1Lys1His1Orn(2-27), CysArg(1-26)Lys2His1Orn1, CysArg(1-26)Lys1His2Orn1, CysArg(1-26)Lys1His1Orn2, CysArg2Lys(1-26)His1Orn1, CysArg1Lys(1-26)His2Orn1, CysArg1Lys(1-26)His1Orn2, CysArg2Lys1His(1-26)Orn1, CysArg1Lys2His(1-26)Orn1, CysArg1Lys1His(1-26)Orn2, CysArg2Lys1His1Orn(1-26), CysArg1Lys2His1Orn(1-26), CysArg1Lys1His2Orn(1-26);
CysArg(4-29)Lys1Cys, CysArg(4-29)His1Cys, CysArg(4-29)Orn1Cys, CysLys(4-29)His1Cys, CysLys(4-29)Orn1Cys, CysHis(4-29)Orn1Cys, CysArg(3-28)Lys2Cys, CysArg(3-28)His2Cys, CysArg(3-28)Orn2Cys, CysLys(3-28)His2Cys, CysLys(3-28)Orn2Cys, CysHis(3-28)Orn2Cys, CysArg(2-27)Lys3Cys, CysArg(2-27)His3Cys, CysArg(2-27)Orn3Cys, CysLys(2-27)His3Cys, CysLys(2-27)Orn3Cys, CysHis(2-27)Orn3Cys, CysArg(1-26)Lys4Cys, CysArg(1-26)His4Cys, CysArg(1-26)Orn4Cys, CysLys(1-26)His4Cys, CysLys(1-26)Orn4Cys, CysHis(1-26)Orn4Cys, CysArg(3-28)Lys1His1Cys, CysArg(3-28)Lys1Orn1Cys, CysArg(3-28)His1Orn1Cys, CysArg1Lys(3-28)His1Cys, CysArg1Lys(3-28)Orn1Cys, CysLys(3-28)His1Orn1Cys, CysArg1Lys1His(3-28)Cys, CysArg1His(3-28)Orn1Cys, CysLys1His(3-28)Orn1Cys;
CysArg(2-27)Lys2His1Cys, CysArg(2-27)Lys1His2Cys, CysArg(2-27)Lys2Orn1Cys, CysArg(2-27)Lys1Orn2Cys, CysArg(2-27)His2Orn1Cys, CysArg(2-27)His1Orn2Cys, CysArg2Lys(2-27)His1Cys, CysArg1Lys(2-27)His2Cys, CysArg2Lys(2-27)Orn1Cys, CysArg1Lys(2-27)Orn2Cys, CysLys(2-27)His2Orn1Cys, CysLys(2-27)His1Orn2Cys, CysArg2Lys1His(2-27)Cys, CysArg1Lys2His(2-27)Cys, CysArg2His(2-27)Orn1Cys, CysArg1His(2-27)Orn2Cys, CysLys2His(2-27)Orn1Cys, CysLys1His(2-27)Orn2Cys;
CysArg(1-26)Lys3His1Cys, CysArg(1-26)Lys2His2Cys, CysArg(1-26)Lys1His3Cys, CysArg(1-26)Lys3Orn1Cys, CysArg(1-26)Lys2Orn2Cys, CysArg(1-26)Lys1Orn3Cys, CysArg(1-26)His3Orn1Cys, CysArg(1-26)His2Orn2Cys, CysArg(1-26)His1Orn3Cys, CysArg3Lys(1-26)His1Cys, CysArg2Lys(1-26)His2Cys, CysArg1Lys(1-26)His3Cys, CysArg3Lys(1-26)Orn1Cys, CysArg2Lys(1-26)Orn2Cys, CysArg1Lys(1-26)Orn3Cys, CysLys(1-26)His3Orn1Cys, CysLys(1-26)His2Orn2Cys, CysLys(1-26)His1Orn3Cys, CysArg3Lys1His(1-26)Cys, CysArg2Lys2His(1-26)Cys, CysArg1Lys3His(1-26)Cys, CysArg3His(1-26)Orn1Cys, CysArg2His(1-26)Orn2Cys, CysArg1His(1-26)Orn3Cys, CysLys3His(1-26)Orn1Cys, CysLys2His(1-26)Orn2Cys, CysLys1His(1-26)Orn3Cys;
CysArg(2-27)Lys1His1Orn1Cys, CysArg1Lys(2-27)His1Orn1Cys, CysArg1Lys1His(2-27)Orn1Cys, CysArg1Lys1His1Orn(2-27)Cys, CysArg(1-26)Lys2His1Orn1Cys, CysArg(1-26)Lys1His2Orn1Cys, CysArg(1-26)Lys1His1Orn2Cys, CysArg2Lys(1-26)His1Orn1Cys, CysArg1Lys(1-26)His2Orn1Cys, CysArg1Lys(1-26)His1Orn2Cys, CysArg2Lys1His(1-26)Orn1Cys, CysArg1Lys2His(1-26)Orn1Cys, CysArg1Lys1His(1-26)Orn2Cys, CysArg2Lys1His1Orn(1-26)Cys, CysArg1Lys2His1Orn(1-26)Cys, CysArg1Lys1His2Orn(1-26)Cys.
또한, 화학식 IV의 펩티드 원자단 P는 앞서 상세히 기술된 바와 같이 하나 이상의 방향족 화합물, 특히 Trp, Tyr 또는 Phe를 포함할 수 있다. 선택사항으로서, 방향족 아미노산이 풍부한 펩티드 서열은 Trp, Tyr 및 Phe의 더 긴 서열의 구조 브레이커로서 작용할 수 있는 적어도 하나의 프롤린을 더욱 함유할 수 있다. 방향족 아미노산 서열의 길이에 따라, 2 개, 3 개 또는 그 이상의 프롤린을 혼입하는 것이 바람직할 수 있다.
선택사항으로서, 화학식 IV의 원자단 P에서, 펩티드 서열이 선택되는 경우, 이러한 서열은 특히 Thr, Ser, Asn 및/또는 Gln과 같이 비하전된 극성 측쇄를 갖는 것들로부터 선택되는 하나 이상의 친수성 아미노산을 더욱 함유한다. 일반적으로 P로의 이러한 아미노산의 혼입에 관하여 전술한 더욱 상세한 설명이 참조된다. 이는 원자단 P에서의 친유성 아미노산, 특히 Leu, Val, Ile, Ala, 및/또는 Met의 혼입, 및 P의 또 다른 변성에도 동일하게 적용된다.
대안적으로, 화학식 IV에 따른 양이온성 화합물은 분자량 약 0.5 kDa 내지 약 30 kDa를 갖는 폴리머 원자단으로 대표되는 원자단 P를 포함할 수 있다. 또한 이 경우에, 앞서 폴리머 원자단 P에 대해 일반적으로 기술된 선택사항 및 선호도는 P가 화학식 IV의 화합물의 일부인이 특별한 경우에 적용되어야 한다.
다시 말하지만, P가 이러한 경우에 P의 여러 단위를 포함하고 및/또는 P1 및 P3로 연결되고 -SH 그룹으로부터 유래된 디설파이드 결합에 의해 연결되는 멀티머 형태인 경우, P는 이러한 경우에 화학식 IV로 제시되는 산화된 형태에서 -SH 그룹을 더 이상 함유하지 않을 수 있다.
전술한 바와 같이, P는 선택사항으로서 변성된 폴리아크릴레이트, 키토산, 폴리에틸렌이민, 폴리아민, 폴리아미노에스테르, 또는 폴리아미도아민, 또는 이들의 임의 코폴리머일 수 있다.
바람직하게는, P에 대해 선택된 폴리머 원자단은 각각 약 0.5 kDa 내지 약 20 kDa, 예컨대 약 0.5 kDa 내지 약 11.5 kDa, 또는 약 1 kDa 내지 약 10 kDa, 또는 약 0.1 kDa 내지 약 8 kDa, 또는 약 0.1 kDa 내지 약 6 kDa, 또는 약 0.1 kDa 내지 약 5 kDa, 또는 약 0.5 kDa 내지 약 5 kDa, 또는 약 0.3 kDa 내지 약 20 kDa, 또는 약 0.3 kDa 내지 약 10 kDa, 또는 약 0.4 kDa 내지 약 10 kDa, 또는 약 0.5 kDa 내지 약 10 kDa, 또는 약 0.5 kDa 내지 약 7.5 kDa, 또는 약 0.5 kDa 내지 약 4 kDa, 또는 약 0.5 kDa 내지 약 3 kDa, 또는 약 0.67 kDa 내지 약 2.7 kDa을 나타낸다.
P에 대해 선택된 바람직한 폴리머 원자단은 예컨대 변성 폴리아미노산, 예컨대 β-아미노산-폴리머 또는 역전 폴리아마이드; 변성 폴리에틸렌, 예컨대 (폴리(N-에틸-4-비닐피리디늄 브로마이드)) (PEVP), 등,; 변성 아크릴레이트, 예컨대 (폴리(디메틸아미노에틸 메틸아크릴레이트)) (pDMAEMA), 등; 변성 아미도아민 예컨대 (폴리(아미도아민)) (pAMAM), 등; 변성 폴리베타아미노에스테르 (PBAE), 예컨대 디아민 말단 변성 1,4 부탄디올 디아크릴레이트-코-5-아미노-1-펜탄올 폴리머, 등; 덴드리머, 예컨대 폴리프로필아민 덴드리머 또는 pAMAM 기반 덴드리머, 등; 폴리이민(들), 예컨대 폴리(에틸렌이민) (PEI 또는 pEI), 폴리(프로필렌이민), 등; 폴리알릴아민, (1,5-디메틸-1,5-디아자운데카메틸렌 폴리메토브로마이드, 또는 헥사디메트린 브로마이드(Polybrene®)를 포함한다.
또한 양이온성 다당류, 즉 당 주쇄-기반 폴리머, 예컨대 사이클로덱스트린 기반 폴리머, 덱스트란 기반 폴리머, 키토산, 등; 실란 주쇄-기반 폴리머, 예컨대 PMOXA-PDMS 코폴리머, 등; 뿐만 아니라 하나 이상의 양이온성 블록(예컨대 전술한 바와 같은 양이온성 폴리머로부터 선택됨)과 하나 이상의 친수성- 또는 소수성 블록(예컨대 폴리에틸렌 글리콜)의 조합으로 구성된 블록폴리머가 선호된다.
하나의 구체예에서, 적어도 하나의 양이온성 원자단 P를 포함하는 양이온성 화합물은 화학식 IVa에 따른 화합물이며
L1-P1-{[P-]a[(AA)x-]b}P3-L2 (화학식 IVa)
여기서
P, P1, P3, L1, 및 L2는 앞서 정의된 바와 같으며;
(AA)x는 아미노산 (AA) 성분이며 여기서 x는 1 내지 약 100으로부터 선택되는 정수이며;
a 및 b는 독립적으로 1 내지 약 49로부터 선택되어 a + b의 합이 2 내지 약 50 범위인 정수이며;
원자단 [P-] 및 [(AA)x-]는 서브화학식 {[P-]a[(AA)x-]b} 내에서 임의 순서로 배열될 수 있으며; 그리고 여기서
P, P1, P3 및 (AA)x는 각각 디설파이드 결합을 통하여 각각 이웃하는 P, P1, P3 및 (AA)x에 결합된다.
다시 말하지만, 화학식 IV와 관련하여 P, P1, P3, L1, 및 L2에 대해 앞서 기술된 선택사항 및 선호도는 유추에 의해 본 구체예에도 또한 적용가능하다. 화학식 IVa는 화합물의 코어 영역에서 하나 이상의 원자단 P와 함께, 하나 이상의 펩티드 서열 (AA)x 를 더욱 포함한다는 점에서 화학식 IV와 다르다.
(AA)x의 각 개별 단위체는 독립적으로 선택되며, 또한 단위체 내의 각 아미노산도 그러하다. 하나 이상의 (AA)x 단위체는 특정 비-염기성 아미노산, 예컨대 하나 이상의 방향족 아미노산, 특히 Trp, Tyr, 및/또는 Phe; 또는 하나 이상의 친수성 아미노산, 특히 Thr, Ser, Asn 및/또는 Gln; 또는 친유성 아미노산, 특히 Leu, Val, Ile, Ala, 및/또는 Met를 도입하는데 사용될 수도 있다. 이와 같이, 그리고 전술한 바와 같이, (AA)x 단위체를 통한 혼입은 펩티드 서열 P 자체 내의 각각의 아미노산의 도입에 대한 대안이다. 화학식 IVa에 따른 (AA)x 단위체로서 별도로 혼입될 때, 이러한 (AA)x 단위체 각각은 디설파이드 결합을 통해 각각 이웃하는 P, P1, P3 및 (AA)x 원자단에 결합되고, 바람직한 구체예 중 하나에서 이는 전술한 바와 같이 종결 Cys 잔기를 포함한다.
바람직하게는, (AA)x 원자단 당 아미노산의 수는 약 2 내지 약 50, 또는 약 3 내지 약 50, 더욱 바람직하게는 약 7 내지 약 30, 또는 약 3 내지 약 25 개 이다. 또한 약 3 내지 약 20 개 아미노산, 또는 약 5 내지 약 20 개 아미노산, 또는 약 7 내지 약 30 개 아미노산, 또는 약 6 내지 약 18 개 아미노산, 또는 약 7 내지 약 17 개 아미노산, 예컨대 약 5 내지 약 15 개 아미노산 범위의 길이가 바람직하다.
화학식 IVa에서 P가 펩티드 원자단인 경우, 성분 {[P-]a[(AA)x-]b} 중의 양이온성 아미노산의 양은 적어도 10 %, 20 %, 또는 30 %, 바람직하게는 적어도 40 %, 더욱 바람직하게는 적어도 50 % 또는 60 %인 것이 바람직하다. 선택사항으로서, 이는 약 50±10 %, 60±10 %, 70±10 %, 또는 80±10 %이다. 이와 관련하여, 전체 성분 {[P-]a[(AA)x-]b} 중의 모든 아미노산의 양(즉, 수)이 100 %로 정의된다.
화학식 IVa에서 원자단 P가 폴리머 사슬인 경우, 여기서 정의된 바와 같이 (생리학적) pH에서 성분 {[P-]a[(AA)x-]b} 중의 양이온성 전하의 양은, 전체 성분 {[P-]a[(AA)x-]b} 중의 모든 전하, 예컨대 양전하 및 음전하의 양이 여기에 정의된 바와 같이 (생리학적) pH에서 100 %임을 가정한 경우, 바람직하게는 50 % 초과, 예컨대 적어도 60 %, 70 %, 80 %, 90 %, 또는 심지어 95 %, 96 %, 97 %, 98 %, 99 % 또는 100 %이거나, 또는 50 % 초과 내지 100 %의 범위, 또는 약 60 % 내지 약 100 %, 또는 전술한 값의 임의 두 개에 의해 형성되는 범위이다.
또 다른 구체예에서, 적어도 하나의 양이온성 원자단 P를 포함하는 양이온성 화합물은 아래 화학식 IVb 또는 IVc 중 하나에 따른 화합물이며;
L1-[(AA1)x1-]z1P1-[P-]n-P3-[(AA2)x2]z2-L2 (화학식 IVb) 또는
L1-[(AA1)x1-]z1P1-{[P-]a[(AA)x-]b}-P3-[(AA2)x2]z2-L2 (화학식 IVc)
여기서 P, P1, P3, (AA)x, L1, 및 L2는 앞서 정의된 바와 같으며;
(AA1)x1 및 (AA2)x2는 아미노산 (AA) 성분이며, 여기서 아미노산 AA1 및 AA2는 AA 및/또는 서로에 대하여 동일하거나 상이하며, x1 및 x2는 독립적으로 1 내지 약 100으로부터 선택되는 정수이며;
z1 및 z2는 독립적으로 1 내지 약 30으로부터 선택되는 정수이며;
원자단 [P-] 및 [(AA)x-]는 서브화학식 {[P-]a[(AA)x-]b} 내에서 임의 순서로 배열될 수 있으며; 그리고 여기서
P, P1, P3, (AA)x, (AA1)x1 또는 (AA2)x2 중 임의 것은 디설파이드 결합을 통하여 이웃하는 P, P1, P3, (AA)x, (AA1)x1, (AA2)x2 , L1 및/또는 L2에 결합될 수 있다.
다시 말하지만, 화학식 IV 및 화학식 IVa와 관련하여 P, P1, P3, L1, L2 및 (AA)x 뿐만 아니라 a 및 b에 대하여 앞서 기술된 선택사항 및 선호도는 또한 화학식 IVb 및 IVc에 따른 양이온성 화합물의 구체예에도 유추에 의해 적용될 수 있다. 앞서 x에 대해 기술된 선호도가 또한 x1 및 x2에도 적용된다. 아미노산 성분 (AA)x가 분자 당 1 내지 약 30 개 단위체 및 단위체 당 1 내지 약 100 개 아미노산을 갖는 독립적으로 선택된 아미노산 반복 단위체로서 정의되는 아미노산 성분 (AA1)x1 및 (AA2)x2로 대체되었고;
분자의 코어 부분 또는 그 근처에 위치하는 대신에, (AA1)x1 및 (AA2)x2 가 코어의 외부에서 P1과 선택적 성분 L1 사이 및 P3와 선택적 성분 L2 사이에 각각 위치해서 분자 구조의 물리적 그리고 생물학적 특성의 변화를 제공한다는 점에서 화학식 IVb는 화학식 VIa와 다르다. 화학식 IVc에 따른 화합물에서, 아미노산 성분은 화학식 IVa에서와 같이 분자의 코어 영역 및 또한 화학식 IVb에서와 같이 두 개의 종결 말단 모두에 존재한다.
정수 z1 및 z2는 각각 1 내지 약 30, 더욱 바람직하게는 약 1 내지 약 20, 또는 1 내지 약 15, 또는 1 내지 약 10의 범위로부터 선택된다.
하나의 구체예에서, 상기 조성물은 2 종 이상의 상이한 화학종의 양이온성 펩티드 및/또는 폴리머를 포함한다. 이러한 구체예에서, 양이온성 펩티드 및/또는 폴리머 각각은 개별적으로 선택될 수 있으며, 상기 언급된 모든 선택사항 및 선호도는 각각의 선택에 적용된다.
언급한 바와 같이, 양이온성 리피도이드 화합물은 또한 간단히 리피도이드라고도 하며, 지질-유사 화합물, 즉 지질-유사 물리적 성질을 갖는 양친매성 화합물이다.
하나의 구체예에서, 리피도이드는 적어도 2 개의 양이온성 질소 원자 및 적어도 2 개의 친유성 꼬리를 포함하는 화합물이다. 여기서 사용된 "꼬리"는 예컨대 적어도 4 개, 더욱 바람직하게는 적어도 6 개 탄소 원자의 선택사항으로서 치환된 하이드로카르빌, 아실 또는 아실옥실알킬 사슬과 같은, 사슬 또는 사슬-유사 구조를 나타내는 분자의 서브구조이다. 친유성 꼬리를 나타내는 선택사항으로서 치환된 하이드로카르빌, 아실 또는 아실옥시알킬 사슬은 양이온성 질소 원자와 직접 연결될 수 있다.
하나의 특정 구체예에서, 리피도이드는 두 개의 동일한 친유성 꼬리를 포함하는 화합물이며, 이들 각각은 양이온성 질소 원자와 직접 연결되어 있다. 또 다른 특정 구체예에서, 리피도이드는 세 개의 동일한 친유성 꼬리를 포함하는 화합물이며, 각각의 꼬리는 양이온성 질소 원자와 직접 연결되어 있다. 또 다른 특정 구체예에서, 리피도이드는 네 개 또는 그 이상의 동일한 친유성 꼬리를 포함하는 화합물이며, 각각의 꼬리는 양이온성 질소 원자와 직접 연결되어 있다. 이들 구체예 각각에서, 리피도이드는 선택사항으로서 친유성 꼬리가 연결되지 않은 또 다른 질소 원자를 포함할 수도 있다. 이러한 리피도이드는 올리고아민의 양이온성 질소에 또는 이들 중 일부에 부착되어 있는 친유성 꼬리를 갖는 올리고아민으로부터 유래된 양이온성 주쇄를 갖는 화합물로서 이해될 수도 있다.
친유성 꼬리가 치환된 하이드로카르빌 (예컨대 알킬) 사슬인 경우, 치환체는 예를 들어 메틸 또는 하이드록실일 수 있다.
선택사항으로서 치환된 하이드로카르빌 사슬은 포화되어 예컨대 알킬과 유사하거나, 또는 불포화되어 즉 알켄일 또는 알킨일일 수 있으며, 각각은 선택사항으로서 1 개, 2 개, 3 개 또는 그 이상의 탄소-탄소 이중 결합 및/또는 삼중 결합을 갖는다. 아실 또는 아실옥시알킬 그룹을 나타내거나 포함하는 꼬리 구조의 경우, 이들은 꼬리의 탄화수소 세그먼트에 1 개, 2 개 또는 그 이상의 탄소-탄소 이중 결합 및/또는 삼중 결합을 포함할 수 있다.
하나의 구체예에서, 리피도이드 화합물은 에스테르, 아마이드 또는 카바메이트 그룹과 같은 가수분해성 연결기가 없다. 여기서 사용된 바와 같이, 연결기는 리피도이드 분자의 친유성 꼬리를 양이온성 질소 원자를 포함하는 친수성 영역에 연결시키는 그룹이다. 핵산을 세포에 전달하고 형질주입을 향상시키기 위한 담체 또는 시약으로서 제안되었던 종래 양이온성 지질은 종정 -전형적인지는 않지만 - 가장 자주 가수분해성이며 및/또는 효소 절단성이있는 링커 또는 연결기를 종종 나타낸다. 특히, 에스테르 그룹을 가진 링커가 제안되었지만, 아마이드 그룹 또는 카바메이트 그룹을 갖는 링커도 모두 생체 내에서 가수분해성 및/또는 효소 절단성이 있다.
여기서 사용된 바와 같이, 가수분해성이란 초, 분, 시간 또는 일 이내에 생체 내 조건 하에서 생리학적 유체(간질 유체와 같은)에서 상당한 정도의 가수분해가 일어남을 의미하며; 바람직하게는, 각각의 화합물 또는 그룹이 7 일 이하 또는 2 일 이하의 기간 후에 50% 이상으로 가수분해된다.
본 발명의 일부 구체예에서, 리피도이드 화합물은 PEG 원자단을 포함한다.
전술한 바와 같이, 리피도이드 화합물은 양이온성이며, 이는 이것이 양이온화가능 또는 영구적인 양이온성임을 의미한다. 하나의 구체예에서, 리피도이드는 양이온화가능하며, 즉 이것이 하나 이상의 양이온화가능 질소 원자를 포함하나, 영구적인 양이온성 질소 원자는 포함하지 않는다. 또 다른 구체예에서, 리피도이드의 적어도 하나의 양이온성 질소 원자가 영구적인 양이온성이다. 선택사항으로서, 리피도이드는 2개의 영구적인 양이온성 질소 원자, 3 개의 영구적인 양이온성 질소 원자, 또는 심지어 4 개 이상의 영구적인 양이온성 질소 원자를 포함한다.
또 다른 구체예에서, 리피도이드 화합물은 화학식 I에 따른 화합물
(화학식 I)
또는 이의 약학적으로 허용가능한 염이다.
화학식 I에서, RA는 각각 독립적으로 비치환, 고리형 또는 비고리형, 분지쇄 또는 비분지쇄 C1-20 지방족; 치환 또는 비치환, 고리형 또는 비고리형, 분지쇄 또는 비분지쇄 C1-20 헤테로지방족; 치환 또는 비치환 아릴; 치환 또는 비치환 헤테로아릴;
여기서 적어도 하나의 RA는
또한, R5는 각각 독립적으로 비치환, 고리형 또는 비고리형, 분지쇄 또는 비분지쇄 C8-16 지방족; 치환 또는 비치환 아릴; 또는 치환 또는 비치환 헤테로아릴이다. 또한, x는 각각 1 내지 10의 정수이며, 그리고 y는 각각 1 내지 10의 정수이다. 본 발명의 일부 구체예에서 RA 또는 R5는 PEG-원자단이거나 PEG-원자단으로 치환될 수 있다.
선택사항으로서, 적어도 하나의 경우, 또는 심지어 각각의 경우 R5는 C8-C16 알킬이다. 바람직한 구체예 중 하나에 따르면, 적어도 하나의 x는 1 또는 2로부터 선택되고, 선택사항으로서 x는 모든 경우에 1 또는 2이다. 또한, 적어도 하나의 y는 1 또는 2로부터 선택되고, 선택사항으로서 y는 모든 경우에 1 또는 2이다. 또 다른 구체예에서, R5는 모든 경우에 C8-C16 알킬이고, x는 모든 경우에 1 또는 2이고, y는 모든 경우에 1 또는 2이다.
일부 구체예에서, 이러한 리피도이드는 용매 없이, 고온, 예컨대 80 내지 95 °C에서 올리고아민과 에폭사이드-종결 지방족 화합물을 반응시켜 제조될 수 있다. 이러한 리피도이드 화합물은 아민 및 소수성 지방족 꼬리에 의한 에폭사이드의 개환으로 인해 생성되는 친수성 부분을 포함한다. 바람직하게는, 올리고아민은 2 내지 5 개 질소 원자를 포함한다. 이중에서 바람직한 올리고아민은 비제한적으로 다음과 같다:
H2N-CH2-CH2-NH2
H2N-CH2-CH2-CH2-NH2
H3C-NH-CH2-CH2-CH2-NH2
H3C-NH-CH2-CH2-CH2-NH-CH3
H2N-CH2-CH2-NH-CH2-CH2-OH
H2N-CH2-CH2-NH-CH2-CH2-NH2
H2N-CH2-CH2-CH2-NH-CH2-CH2-NH2
H2N-CH2-CH2-NH(CH3)-CH2-CH2-NH2
HO-CH2-CH2-NH-CH2-CH2-NH-CH2-CH2-OH
H2N-CH2-CH2-NH-CH2-CH2-NH-CH2-CH2-NH2
H2N-CH2-CH2-N(CH2-CH2-NH2)-CH2-CH2-NH2
H2N-CH2-CH2-NH-CH2-CH2-NH-CH2-CH2-NH-CH2-CH2-NH2
본 발명의 일부 구체예에서, 올리고아민 기반 리피도이드는 선택사항으로서 PEG 원자단으로 치환된다.
바람직한 에폭사이드-종결 지방족 화합물은 비제한적으로 2-알킬옥시란이며 여기서 알킬은 부틸, 헥실, 옥틸, 데실, 도데실, 테트라데실 또는 옥타데실이다. 선택사항으로서, 알킬기는 메틸, 에틸, 프로필 또는 이소프로필 측쇄와 같은 알킬 측쇄를 추가로 나타낼 수 있다. 또한, 2-알킬옥시란의 알킬 그룹은 또한 산소와 같은 하나 이상의 헤테로원자를 포함할 수 있다. 또한, 에폭사이드-종결 지방족 화합물은 하나 이상의 탄소-탄소 이중 또는 삼중 결합을 포함할 수 있다.
이러한 리피도이드 화합물의 제조에 관한 추가 지침은 US8969353을 참조하며, 이의 개시 내용은 전체가 본 명세서에 포함된다.
또 다른 구체예에 따르면, 여기서 리피도이드 화합물은 화학식 IIa 및/또는 화학식 IIb의 2개 또는 3개 원자단을 포함하며:
-N(R1)-CH2-CH(R5)-R2 (화학식 IIa)
-N+(R3)(R4)-CH2-CH(R5)-R2 (화학식 IIb)
여기서 독립적으로 화학식 IIa 또는 화학식 IIb의 각각의 개별 원자단에 대하여, R1은 수소 또는 C1-C4-알킬로부터 선택되며; R2는 선형 또는 분지쇄, 포화 또는 불포화 C6-C16 하이드로카르빌 사슬로부터 선택되며; R3 및 R4는 C1-C4-알킬로부터 선택되며, 그리고 R5는 수소 또는 하이드록실이다. 선택적으로, 일부 구체예에서, 화학식 IIa 및/또는 IIb의 각각의 원자단은 개별적으로 PEG 원자단으로 치환될 수도 있고 치환되지 않을 수도 있다.
R1은 각각의 경우에 동일하거나 상이할 수 있다. 하나의 구체예에서, 특히 R1이 수소 또는 메틸인 경우, 이는 각각의 경우에 동일하다. R3 및 R4는 또한, 예를 들어, R3 및 R4가 메틸일 수 있는 모든 경우에, 각각의 경우에 대하여 동일할 수 있다.
또 다른 구체예에서, 리피도이드 화합물은 화학식 IIa 및/또는 화학식 IIb의 3 개의 동일한 원자단을 포함하는 화합물이며, 여기서 R1은 수소이며, R2는 선형 또는 분지쇄 C6-C16 알킬 사슬이며, R3 및 R4는 메틸이며, R5는 하이드록실이다. 예를 들어, 화학식 IIa에 따른 화합물은 다음과 같은 올리고아민 주쇄를 기반으로 할 수 있으며
H2N-CH2-CH2-N(CH2-CH2-NH2)-CH2-CH2-NH2
여기서 3 개의 일차 아미노 그룹 각각에 대하여, 수소 원자 중 하나가 다음으로 치환되며
-CH2-CH(OH)-R2,
-CH2-O-C(O)-R2,
CH2-O-C(O)-CH(OH)-R2,
CH2-O-C(O)-CH(N(R6)2)-R2
및/또는
-코-CH(N(R6)2)-R2
여기서 R2는 선형 또는 분지쇄 C6-C16 알킬, 특히 선형 C6, C8, C10 또는 C12 알킬이며 각각의 R6은 독립적으로 H 또는 CH3일 수 있다. 화학식 IIb에 따른 화합물은 동일한 올리고아민 주쇄 및 동일한 치환체 -CH2-CH(OH)-R2,를 기반으로 할 수 있으나, 이에 부가하여 질소 원자 각각에서 2 개의 메틸 그룹을 가지며 여기에 또한 치환체 -CH2-CH(OH)-R2가 부착된다. 다시 말하지만, R2는 선형 또는 분지쇄 C6-C16 알킬, 특히 선형 C6, C8, C10 또는 C12 알킬이다.
선택사항으로서, 3 개의 일차 아미노 그룹 각각에 대하여, 수소 원자 중 하나가 PEG 원자단으로 치환되거나 PEG화 된다.
하나의 특정 구체예에서, 영구적인 양이온성 리피도이드는 화학식 IX로 도시되는 양이온:
및 또한 선택사항으로서 음이온, 바람직하게는 전술한 양이온을 포함하는 화합물이다. 화합물은 먼저 아래 화학식의 올리고아민을
H2N-CH2-CH2-N(CH2-CH2-NH2)-CH2-CH2-NH2
비분지쇄, 포화된 종결 C12 알킬 에폭사이드와 반응시키고 이어서 메틸 아이오다이드와 같은 활성 메틸로 4차화시켜 제조될 수 있다. 본 발명의 하나의 양상은 이러한 화합물, 및 이의 임의 염에 관한 것이다.
본 발명의 또 다른 특정 구체예에서, 리피도이드은 화학식 X에 따른 화합물이다:
선택사항으로서, 리피도이드 화합물은 화학식 X에 따른 리피도이드 화합물이며, 여기서 일차 아민들은 각각 독립적으로 메틸로 1회 또는 2회 치환된다. 특히 바람직한 구체예에서, 리피도이드 화합물은 화학식 Xa에 따른 화합물이다:
본 발명의 또 다른 특히 바람직한 구체예에서, 리피도이드 화합물은 화학식 Xb에 따른 화합물이다:
특히 바람직한 구체예에서, 리피도이드 화합물은 아래 구조식을 포함하는 화합물이다:
본 발명의 또 다른 바람직한 구체예에서, 리피도이드 화합물은 아래 구조식을 포함하는 화합물이다:
또 다른 구체예에서, 리피도이드 화합물은 화학식 III에 따른 화합물이며
(화학식 III)
여기서 R1 및 R2는 각각 독립적으로 수소, 선택사항으로서 치환, 포화 또는 불포화 C1-C20 하이드로카르빌, 및 선택사항으로서 치환, 포화 또는 불포화 C6-C20 아실로 구성된 군으로부터 선택된다. 또한, L1 및 L2는 각각 독립적으로 선택사항으로서 치환, 포화 또는 불포화 C1-C30 하이드로카르빌로부터 선택되며; m 및 o는 각각 독립적으로 0 및 임의 양의 정수로 구성된 군으로부터 선택되며; 그리고 n은 임의 양의 정수이다. 일부 구체예에서, 화학식 I 또는 II에 따른 리피도이드는 PEG화 된다. 또 다른 구체예에서, 화학식 III에 따른 리피도이드는 PEG화 된다. 또 다른 구체예에서, 일반적인 양이온성 또는 이온화가능 지질은 PEG화 된다. 일부 구체예에서, PEG 중의 에틸렌 글리콜 원자단의 수는 5 내지 9, 10 내지 20, 21-30, 31-40, 41 내지 50 또는 그 이상이거나 또는 PEG 원자단은 PEG200 내지 PEG10000으로부터 선택된다. 바람직하게는 PEG 원자단은 PEG500 내지 PEG2000으로부터 선택된다. 또 다른 구체예에서, 분지쇄이고, Y 형상 또는 빗 형상인 PEG 폴리머가 사용된다.
바람직한 구체예 중 하나에서, 화학식 III의 리피도이드의 R1 및 R2는 둘 모두 C1-C20 알킬, 더욱 바람직하게는 C1-C6 알킬, 특히 메틸, 에틸, 프로필 또는 이소프로필이다. 예를 들어, R1 및 R2 둘 모두는 메틸일 수 있다. 또한, n은 바람직하게는 약 5 이하, 특히 약 2 이하, 예컨대 1 이하이다. 또한, o는 바람직하게는 0 또는 1로부터 선택되고, m은 바람직하게는 1 내지 6의 범위, 예컨대 1, 2, 3, 4, 5 또는 6으로부터 선택된다.
또 다른 구체예에서, L1 및 L2는 각각 독립적으로 불포화 C6-C22 하이드로카르빌, 특히 C10-C22 하이드로카르빌로부터 선택된다. 바람직한 하이드로카르빌 중에는 14, 16, 18, 20 또는 22 개의 탄소 원자를 갖는 선형 오메가-6 및 오메가 -9 불포화 탄화수소 사슬이 있다.
R1 및 R2 둘 모두가 메틸이고, m이 3 또는 4이고, n이 1이고, o가 0 또는 1이고, 그리고 L1 및 L2가 16 또는 18 개의 탄소 원자를 갖는 동일한 선형 오메가-6 및 오메가-9 불포화 탄화수소 사슬인 화학식 III의 리피도이드가 또한 바람직하다. 일부 구체예에서 R1, R2, L1 또는 L2 중 적어도 하나가 PEG 원자단이거나 PEG 원자단으로 치환될 수 있다.
또 다른 구체예에서, 리피도이드는 n이 0인 점을 제외하고는 앞서 정의된 화학식 III에 따른 화합물이다.
선택사항으로서, 조성물은 2 개 이상의 리피도이드를 포함하며, 각각은 상기 기재된 바와 같이 독립적으로 선택되거나; 또는 이는 리피도이드와 또 다른 양이온성 지질의 조합을 포함할 수 있다.
하나의 구체예에서, 상기 조성물은 상기 정의된 리피도이드 이외의 지질을 실질적으로 함유하지 않거나; 또는 청구범위 중 하나에서 정의된 것 이외의 지질을 실질적으로 함유하지 않는다. 실제로, 핵산의 효과적인 전달 측면에서 리피도이드의 특성 및 유리한 효과로부터 이익을 얻지만 양이온 성이 아닌 다른 지질의 존재를 요구하지 않는 것이 본 발명의 특별한 이점 중 하나이며 종종 헬퍼 지질이라고도 지칭되는 양쪽이온성 인지질 또는 콜레스테롤과 같은 스테로이드와 같은 리포플렉스 또는 지질 나노 입자를 제조하는데 종종 사용된다. 따라서, 조성물이 중성 또는 양쪽이온성 지질을 함유하지 않는 것; 또는 콜레스테롤과 같은 스테로이드가 없다는 것이 본 발명의 바람직한 구체예 중 하나이다.
여기에 제한되지 않으면서, 본 발명에서는 다음의 리피도이드 구조가 사용되었다:
전술한 바와 같이 본 발명의 조성물에 포함되거나, 또는 본 발명의 나노입자에 포함된 생물학적 활성 카고 물질은 바람직하게는 핵산 화합물 또는 복합체이다. 조성물에 포함된 핵산 화합물은 임의 유형의 핵산 또는 핵산 유도체일 수 있다. 바람직한 구체예 중 일부에서, 핵산 화합물은 화학적으로 변성된 또는 변성되지 않은 DNA, 단일 가닥 또는 이중 가닥 DNA, 코딩 또는 비-코딩 DNA로부터 선택될 수 있으며, 선택사항으로서 플라스미드, (짧은) 올리고데옥시뉴클레오타이드 (즉, (짧은) DNA 올리고뉴클레오타이드), 게놈 DNA, DNA 프라이머, DNA 프로브, 면역자극성 DNA, 앱타머, 또는 이들의 조합으로부터 선택될 수 있다. 그 대신에, 또는 이에 부가하여, 이러한 핵산 분자는 예컨대 임의 PNA(펩티드 핵산)로부터 선택될 수 있다. 또한 그 대신에, 또는 이에 부가하여, 그리고 특히 바람직한 구체예에 따르면, 핵산은 화학적으로 변성된 또는 변성되지 않은 RNA, 단일-가닥 또는 이중-가닥 RNA, 코딩 또는 비-코딩 RNA로부터 선택되며, 선택사항으로서 메신저 RNA (mRNA), (짧은) 올리고리보뉴클레오타이드 (즉 (짧은) RNA 올리고뉴클레오타이드), 바이러스성 RNA, 레플리콘 RNA, 전이 RNA (tRNA), 리보솜 RNA (rRNA), 면역자극성 RNA (isRNA), 마이크로RNA, 작은 간섭 RNA (siRNA), 작은 핵 RNA (snRNA), 작은-헤어핀 RNA (shRNA) 또는 리보스위치, RNA 앱타머, RNA 데코이(decoy), 안티센스 RNA, 리보자임, 또는 이들의 임의 조합으로부터 선택된다. 바람직하게는, 복합체의 핵산 분자는 RNA이다. 더욱 바람직하게는, 복합체의 핵산 분자는 (선형) 단일-가닥 RNA, 더더욱 바람직하게는 mRNA 또는 면역자극성 RNA이다.
선택사항으로서, 생물학적 활성 카고 물질은 둘 이상의 핵산 화합물의 조합이다.
상이한 관점에서 기술하면, 핵산은 단일- 또는 이중-가닥 핵산 화합물 또는 복합체일 수 있다. 엄격하게 말하면, 이중-가닥 핵산은 또한 비-공유 결합에 의한 결합에 의해 핵삭 복합체를 형성하는 두 개의 핵산 화합물(즉, 두 개의 비평행 가닥)의 조합으로 고려될 수 있다. 그렇지만, 통상의 기술적 용어에서와 같이, 이중-가닥 핵산은 또한 하나의 화합물 또는 분자로 기술될 수도 있다. 핵산은 부분적으로 이중-가닥 또는 부분적으로 단일 가닥 핵산일 수 있으며, 적어도 부분적으로 자가-상보적인 두 개의 가닥을 포함한다. 이러한 부분적인 이중-가닥 또는 부분적인 단일 가닥 핵산 분자는 전형적으로 더 긴 그리고 더 ?은 단일-가닥 핵산 분자로 형성되거나 또는 길이가 대략 동일한 두 개의 단일 가닥 핵산 분자로 형성되며, 여기서 하나의 단일-가닥 핵산 분자는 또 다른 단일-가닥 핵산 분자와 부분적으로 상보적이며 따라서 둘 모두가 이러한 영역에서 이중-가닥 핵산 분자, 즉 부분적으로 중-가닥 또는 부분적으로 단일 가닥 핵산(분자)을 형성한다. 바람직하게는, 핵산 화합물은 단일-가닥 핵산이다. 또한, 핵산 화합물은 고리형 또는 선형 핵산, 바람직하게는 선형 핵산일 수 있다.
선택사항으로서, 핵산은 인공 핵산일 수 있다. "인공 핵산 분자" 또는 "인공 핵산"은 자연적으로 발생하지 않는 핵산 분자, 예컨대 DNA 또는 RNA로서 이해될 수 있다. 환언하면, 인공 핵산 분자는 비-천연 핵산 분자로서 이해될 수 있다. 이러한 핵산 분자는 (자연적으로 발생하지 않는) 개별 서열 및/또는 자연적으로 발생하지 않는 또 다른 변성, 예컨대 뉴클레오타이드의 구조적 변성때문에 비-천연적일 수 있다. 인공 핵산 분자는 DNA 분자, RNA 분자 또는 DNA 및 RNA 부분을 포함하는 하이브리드-분자일 수 있다. 전형적으로, 인공 핵산 분자는 뉴클레오타이드의 원하는 인공 서열(이종 서열)에 대응하는 유전자 조작 방법에 의해 디자인 및/또는 생성될 수 있다. 이와 관련하여, 인공 서열은 일반적으로 자연적으로 발생하지 않는 서열이며, 즉 이는 적어도 하나의 뉴클레오타이드에 의해 야생형 서열과 다르다. 용어 "야생형(wild type)"은 자연적으로 발생하는 서열로서 이해될 수 있다. 또한, 용어 "인공 핵산 분자"는 "하나의 단일 분자"를 의미하는 것으로 한정되지 않으며, 전형적으로 동일 분자의 앙상블을 포함하는 것으로 이해된다. 따라서, 이는 부분표본(aliquot)에 함유된 복수의 동일 분자에 관한 것이다.
또 다른 구체예에서, 본 발명에서 정의되는 서열(단백질, 또는 각각의 핵산)은 상기 서열(단백질, 또는 각각의 핵산)에 대하여 적어도 5%, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 또는 99%의 서열 동일성을 갖는 서열(단백질, 또는 각각의 핵산)을 포함하거나 이들로 구성된다.
두 개 이상의 상이한 핵산의 조합은 예를 들면, 항체의 중쇄를 인코딩하는 핵산(예컨대 RNA) 뿐만 아니라 동일 항체의 경쇄를 인코딩하는 핵산을 포함하는 조성물의 경우에 유리할 수 있다. 또 다른 예는 CRISPR/Cas 시스템으로 불리는 유기체 면역계의 일부에 영향을 미치는 둘 이상의 핵산의 조합이다(CRISPR: 주기적 간격으로 분포하고 짧은 회문 구조 반복서열(clustered regularly interspaced short palindromic repeats); Cas: CRISPR 관련 단백질).
또 다른 예는 본 발명의 조성물 또는 나노입자 내의 가이드 RNA(gRNA)과 인코딩 핵산의 조합이다.
코딩 핵산
핵산은 단백질 또는 펩티드를 인코딩할 수 있으며, 이는 비제한적으로 치료 활성 단백질 또는 펩티드, 예컨대 항원, 예컨대 종양 항원, 병원성 항원(예컨대 동물 항원, 바이러스성 항원, 원생동물 항원, 세균 항원으로부터 선택됨), 알레르기 항원, 자가면역 항원, 또는 또 다른 항원, 알레르겐, 항체, 면역자극성 단백질 또는 펩티드, 항원-특이성 T-세포 수용체, 또는 특정 (치료) 용도에 적합한 또 다른 단백질 또는 펩티드로부터 선택되며, 여기서 코딩 핵산은 세포, 조직 또는 유기체로 수송될 수 있으며, 단백질은 후속하여 이러한 세포, 조직 또는 유기체에서 발현될 수 있다.
바이시스트론성 핵산 또는 RNA 및 멀티시스트론성 핵산 또는 RNA: 바이시스트론성 또는 멀티시스트론성 핵산 또는 RNA는 전형적으로 둘 (바이시스트론성) 또는 그 이상 (멀티시스트론성) 코딩 영역을 가질 수 있는 전형적으로 핵산 또는 RNA, 바람직하게는 mRNA이다. 이와 관련하여 코딩 영역은 펩티드 또는 단백질로 번역될 수 있는 코돈의 서열이다.
본 발명의 일부 구체예에 다르면, 핵산은 바람직하게는 여기서 정의된 바와 같이 모노-, 바이-, 또는 멀티시스트론성이다. 바이- 또는 멀티시스트론성 핵산 분자 내 코딩 서열은 바람직하게는 여기에 정의된 별도의 단백질 또는 펩티드 또는 이의 절편 또는 변이체를 인코딩한다. 바람직하게는, 둘 이상의 단백질 또는 펩티드를 인코딩하는 코딩 서열은 이하에서 정의되는 적어도 하나의 IRES (내부 리보솜 도입 부위(internal ribosomal entry site)) 서열에 의해 바이- 또는 멀티시스트론성 핵산 내에서 분리될 수 있다. 따라서, 용어 "둘 이상의 단백질 또는 펩티드를 인코딩하기"는 비제한적으로, 바이- 또는 심지어 멀티시스트론성 핵산이 여기에 제공된 정의 내의 예컨대, 적어도 2 개, 3 개, 4 개, 5 개, 6 개 또는 그 이상의 (바람직하게는 상이한) 단백질 또는 팹티드 및/또는 단백질 또는 펩티드 또는 그 절편 또는 변이체를 인코딩할 수 있음을 의미한다. 더욱 바람직하게는, 비제한적으로, 바이- 또는 심지어 멀티시스트론성 핵산은 예를 들면, 적어도 2 개, 3 개, 4 개, 5 개, 6 개 또는 그 이상의 (바람직하게는 상이한) 여기에 정의된 단백질 또는 팹티드 또는 여기에 정의된 그 절편 및 변이체를 인코딩할 수 있다. 이와 관련하여, 앞서 정의된 소위 IRES(내부 리보솜 도입 부위) 서열은 유일한 리보솜 결합 부위로서 기능할 수 있지만, 또한 상기 정의된 바와 같은 바이- 또는 심지어 멀티시스트론성 핵산을 제공하는 역할을 할 수 있으며, 이는 서로 독립적으로 리보솜에 의해 번역될 몇몇 단백질 또는 펩티드를 인코딩한다. 본 발명에 따라 사용될 수 있는 IRES 서열의 예는 피코르나바이러스(예컨대 FMDV), 페스티바이러스(CFFV), 폴리오바이러스(PV), 뇌심근염 바이러스(ECMV), 구제역 바이러스(FMDV), C형 간염 바이러스(HCV), 고전 돼지 열병 바이러스(CSFV), 마우스 백혈병 바이러스(MLV), 사마귀 면역결핍 바이러스(SIV) 또는 크리켓 마비 바이러스(CrPV)로부터 기인한 것들이다.
또 다른 구체예에 따르면, 본 발명에 따르는 핵산 서열의 적어도 하나의 코딩 서열은 아미노산 링커 서열에 의해 연결되거나 연결되지 않은 여기에 정의된 적어도 2 개, 3 개, 4 개, 5 개, 6 개, 7 개, 8 개 및 그 이상의 단백질 또는 펩티드(또는 이들의 절편 및 유도체)를 인코딩할 수 있으며, 여기서 상기 링커 서열은 강성(rigid) 링커, 가요성(flexible) 링커, 절단성(cleavable) 링커(예컨대, 자가-절단 펩티드) 또는 이들의 조합을 포함할 수 있다. 그 안에서, 단백질 또는 펩티드는 동일하거나 상이하거나 또는 이의 조합일 수 있다. 특정 단백질 또는 펩티드 조합은 여기에 설명된 바와 같이 적어도 2 개의 단백질 또는 펩티드를 인코딩하는 상기 핵산(또한 여기서 '멀티-항원-구조체/핵산'으로 불림)에 의해 인코딩될 수 있다.
본 발명과 관련하여, (예컨대, 적어도 두 개의 상이한 단백질을 포함하는) 코딩 서열의 특정 조합은 모노-, 바이-, 및 멀티시스트론성 핵산 및/또는 멀티-항원-구조체/핵산의 임의 조합에 의해 생성되어 폴리- 또는 심지어 다가 핵산 혼합물을 획득할 수 있음이 밝혀졌다.
특히 바람직한 양상에서, 인코딩된 펩티드 또는 단백질은 인간, 바이러스, 세균, 원생생물 단백질 또는 펩티드로부터 선택된다.
a)
치료 활성 단백질
본 발명과 관련하여, 치료 활성 단백질 또는 펩티드는 본 발명의 나노입자에 포함된 핵산에 의해 인코딩될 수 있다. 치료 활성 단백질은 여기서 정의된 바와 같이 질병을 치유, 예방적으로 예방 또는 치료적으로 치료하는데 효과를 갖는 단백질로서 정의되거나, 또는 개체가 개체의 유기체가 생산하지 않거나 불충분한 양만 생산하는 예컨대 천연 단백질 또는 변성된 천연 단백질을 필요로 하는 그러한 단백질로서 정의된다. 이들은 통상의 기술자에게 공지된 임의 자연 발생하는 또는 합성 설계된 재조합 또는 단리된 단백질로부터 선택될 수 있다. 이에 한정되는 것은 아니지만, 치료 활성 단백질은 세포에서의 신호 전달을 자극하거나 억제할 수 있는 단백질, 예컨대 사이토카인, 림포카인, 모노키인, 성장 인자, 수용체, 신호 전달 분자, 전사 인자 등; 항응고제; 안티트롬빈; 항알레르기성 단백질; 아폽토시스 인자 또는 아폽토시스 관련 단백질, 치료 활성 효소 및 임의의 획득된 질환 또는 임의의 유전성 질환과 관련된 임의의 단백질을 포함할 수 있다.
b)
항원
핵산은 대안적으로 항원을 인코딩할 수 있다. 본 발명에 따르면, 용어 "항원"은 면역계에 의해 인식되고 예컨대 적응성 면역 반응의 일부로서 항체 또는 항원-특이성 T-세포의 형성에 의해 항원-특이성 면역 반응을 유발할 수 있는 물질을 의미한다. 이와 관련하여, 단백질의 항원성 에피토프, 절편 또는 펩티드는 특히 B 세포, 항체 또는 T 세포에 의해 각각 인식될 수 있는 B 세포 및 T 세포 에피토프를 의미한다.
본 발명과 관련하여, 핵산에 의해 인코딩되는 항원은 전형적으로 상기 정의에 속하는 임의의 항원, 항원성 에피토프 또는 항원성 펩티드를 나타내고, 바람직하게는 단백질 및 펩티드 항원, 예컨대 종양 항원, 알레르기 항원, 자가-면역 자기-항원, 병원성 항원 등이다. 특히, 항원은 바이러스 항원, 세균 항원, 진균 항원, 원생동물 항원, 동물 항원, 알레르기 항원 등과 같은 숙주 유기체(예컨대 사람 대상체) 자체인 또 다른 유기체로부터 유래된 항원일 수 있다. 알레르기 항원은 또한 알레르기 항원 또는 알레르겐으로 불리며, 일반적으로 인간 대상체에서 알레르기를 유발할 수 있는 항원이다.
대안적으로, 핵산에 의해 인코딩되는 항원은 숙주 자체로부터 유래될 수 있다. 이러한 항원의 예는 종양 항원, 자기-항원 또는 자가-항원, 예컨대 자가-면역 자기-항원, 뿐만 아니라 본래 숙주 유기체 외부의 세포로부터 유래하였으나 예컨대 프로테아제 분해 또는 또 다른 유형의 신진대사에 의해 숙주 유기체, 조직 또는 세포 내에서 절편화되거나 분해된 여기서 정의된 바와 같은 (비-자기) 항원을 포함한다.
본 발명과 관련하여 선호되는 항원의 한 종류는 종양 항원이다. 선호되는 종양 항원 중에서는 종양 세포의 표면에 위치하는 종양 항원이 있다. 종양 항원은 또한 정상 세포와 비교하여 종양 세포에서 과발현되는 단백질을 나타낼 수 있다. 또한, 종양 항원은 또한 세포 내에서 발현된 항원을 포함하는데, 이러한 세포는 종양 세포가 아니거나 또는 본래 아니였고 종양과 관련된 것이다. 예를 들면, 종양-공급 혈관, 특히 신생혈관형성과 관련된 것들, 예컨대 VEGF 또는 bFGF와 같은 성장 인자의 형성 또는 재형성과 관련된 항원이 또한 중요하다. 종양과 관련된 항원은 또한 종양이 삽입되어 있는 세포 또는 조직으로부터의 항원을 포함한다. 또한, 특정 또 다른 단백질 또는 펩티드가 종양이 발생한 환자의 체액에서 증가된 농도로 (과도하게) 발현되고 발생할 수 있다. 엄격하게 말하면, 면역 반응을 유도하지 않는다는 점에서 항원이 아니더라도 이러한 물질을 종양 항원 또는 종양-관련 항원이라고 한다.
종양 항원은 종양-특이성 항원(TSA)과 종양-관련 항원(TAA)으로 더 분류될 수 있다. TSA는 건강한 세포가 아닌 종양 세포에 의해서만 나타날 수 있다. 그들은 전형적으로 종양-특이성 돌연변이로부터 유래한다. TAA는 더욱 일반적이며 일반적으로 종양 및 건강한 세포 둘 모두에 의해 생성된다. 이들 항원은 면역계에 의해 인식되며 항원-제시 세포가 세포독성 T 세포에 의해 파괴될 수 있다. 또한, 종양 항원은 예를 들어 돌연변이된 수용체의 형태로 종양 표면에서 발생할 수 있다. 이 경우, 이들은 또한 항체에 의해 인식될 수 있다.
인코딩된 항원이 알레르겐인 경우, 그러한 항원은 동물, 식물, 곰팡이, 균류, 세균 등의 출처의 항원으로부터 선택될 수 있다. 식물-유래 알레르겐은 예를 들어 꽃가루에서 유래된 알레르겐일 수 있다. 다시 말하지만, 나노입자에 혼입된 핵산은 천연 항원 또는 그의 절편 또는 에피토프를 인코딩할 수 있다.
c)
항체
또 다른 구체예에 따르면, 핵산 화합물은 항체 또는 항체 절편을 인코딩한다. 항체 또는 그 절편은 (i) 단일-사슬 항체, (ii) 단일-사슬 항체 절편, (iii) 다중-사슬 항체, 및 (iv) 다중-사슬 항체 절편으로 구성된 군으로부터 선택된다.
일반적으로, 항체는 가변 및 불변 도메인을 갖는 경쇄 및 중쇄로 구성된다. 경쇄는 N-종결 가변 도메인, VL, 및 C-종결 불변 도메인, CL로 구성된다. 이오 대조적으로, IgG 항체의 중쇄는, 예를 들면, N-종결 가변 도메인, VH, 및 세 개의 불변 도메인, CH1, CH2 및 CH3를 포함한다.
바람직한 구체예 중 하나에서, 항체는 완전-길이 항체로부터 선택된다. 이러한 항체는 재조합적으로 생산되거나 자연적으로 발생하는 항체, 특히 치료적, 진단적 또는 과학적 목적에 적합한 항체, 또는 면역학적 질환 또는 암과 같은 질환과 관련된 항체일 수 있다. 용어 "항체"는 가장 넓은 의미로 사용되며, 특히 폴리에피토프 특이성을 갖는 단클론 및 다클론 항체(작용체, 길항제, 및 차단 또는 중화 항체) 및 항체 종을 포함한다. 항체는 IgM, IgD, IgG, IgA 및 IgE 항체와 같은 항체의 모든 클래스에 속할 수 있다. 또한, 항체는 숙주 유기체에서 면역화에 의해 생성된 항체, 또는 이의 재조합적으로 조작된 버전, 키메라 항체, 인간 항체, 인간화 항체, 이중특이성 항원, 인트라바디와 유사할 수 있다.
또한, 핵산 화합물은 항체 절편, 변이체, 항체의 부가체 또는 유도체, 예컨대 단일-사슬 가변 절편, 디아바디 또는 트리아바디를 인코딩할 수 있다. 항체 절편은 바람직하게는 전술한 유형의 항체의 Fab, Fab', F(ab')2, Fc, Facb, pFc', Fd 및 Fv 절편으로부터 선택된다. 일반적으로, 항체 절편은 해당 업계에 공지되어 있다. 예를 들면, Fab("절편, 항원 결합") 절편은 중쇄 및 경쇄 각각의 하나의 불변 도메인 및 하나의 가변 도메인으로 구성된다. 두 개의 가변 도메인은 특정 항원의 에피토프에 결합한다. 두 개의 사슬은 디설파이드 결합을 통하여 연결된다. scFv ("단일 사슬 가변 절편") 절편은, 예를 들면, 전형적으로 경쇄 및 중쇄의 가변 도메인으로 구성된다. 도메인은 인공 결합, 일반적으로 15-25 개 글리신, 프롤린 및/또는 세린 잔기로 구성된 펩티드와 같은 폴리펩티드 결합으로 연결된다.
하나의 구체예에서, 생물학적 활성 카고 물질은 적어도 2 개의 별도의 RNA의 조합을 포함하며, 하나의 RNA는 항체 또는 그 절편의 중쇄를 인코딩하고 다른 RNA는 항체 또는 그 절편의 대응하는 경쇄를 인코딩한다.
또 다른 구체예에서, 생물학적 활성 카고 물질은 적어도 2 개의 별도의 RNA의 조합을 포함하며, 하나의 RNA는 항체 또는 그 절편의 중쇄 가변 영역을 인코딩하고 다른 RNA는 항체 또는 그 절편의 대응하는 경쇄 가변 영역을 인코딩한다.
또한, 항체 또는 항체 절편의 상이한 사슬은 폴리시스트론성 핵산이라 불리는 멀티시스트론성 핵산에 의해 인코딩되는 것이 바람직하다. 대안적으로, 항체 또는 항체 절편의 상이한 균주는 여러 개의 모노시스트론성 핵산에 의해 인코딩된다.
또 다른 구체예에 따르면, 본 발명은 생물학적 활성 카고 물질의 제조를 위한 적어도 하나의 핵산 분자의 용도를 포함한다. 하나 초과의 핵산 분자가 사용되는 경우, 복합체화된 핵산 분자는 상이할 수 있으며, 즉 적어도 두 개의 별도의 (복합체화된) 핵산 분자의 혼합물을 형성할 수 있다.
하나의 구체예에서, 생물학적 활성 카고 물질은 다음을 포함한다:
(i) CRISPR 관련 단백질을 인코딩하는 핵산 분자; 및/또는
(ii) 하나 이상의 가이드 RNA(들) 서열(들).
용어 "CRISPR 관련 분자"는 비제한적으로 CAS9 (CRISPR-관련 단백질 9), CSY4, dCAS9, 및 dCAS9-실행기 도메인 (활성제 및/또는 억제제 도메인) 융합 단백질을 포함한다. CRISPR 관련 분자는 스트렙토코커스 피오게네스 (Streptococcus pyogenes), 리스테리아 이노쿠아 ( Listeria innocua ), 및 스트렙토코커스 써머필러스 (Streptococcus thermophilus )를 포함하여 많은 종으로부터 유래한다.
용어 "가이드 RNA(gRNA)"는, 또한 "인공 가이드 RNA", "단일 가이드 RNA", "소형 가이드 RNA" 또는 "sgRNA"로도 불리며, 전사 시작 부위 상류의 관심 유전자의 5'UTR의 하나의 가닥에 상보적인 전형적으로 20-25 개 뉴클레오타이드 긴 서열을 포함하는 RNA를 의미한다. sgRNA 설계에 대한 설명은 예컨대 Mali et al., 2013, Science 339:823-826에서 찾을 수 있다. 인공 sgRNA는 관심 유전자를 표적으로 하여, 인공 폴리뉴클레오타이드에 의해 인코딩된 CRISPR 관련 분자를 관심 분자, 예컨대 전사 조절이 요구되는 유전자와 상호작용하도록 유도한다. 관심 유전자는 용도에 따라 선택된다.
하나의 구체예에서, 본 발명의 조성물 또는 나노입자(들)에 포함된 본 발명의 단일 핵산 분자는 상기 CRISPR 관련 분자 및 동시에 상기 가이드 RNA(들)을 인코딩하는 단일 핵산 분자를 포함한다.
또 다른 구체예에서, 생물학적 활성 카고 물질은 둘 이상의 핵산 분자의 조합을 포함한다. 또 다른 구체예에서, 본 발명의 하나 초과의 핵산 분자는 CRISPR 관련 분자 및 상기 가이드 RNA(들)를 인코딩하는 상기 핵산 분자를 포함한다. 이런 경우, 생물학적 활성 카고 물질은 Cas9 단백질과 표적-특이성 gRNA를 발현하는 두 개의 별도의 RNA를 포함한다.
siRNA
또 다른 바람직한 구체예에서, 본 발명의 나노입자에 혼입된 핵산 화합물은 dsRNA의 형태, 바람직하게는 siRNA의 형태이다. dsRNA, 또는 siRNA는 RNA 간섭과 관련하여 특히 중요하다. RNA 간섭(RNAi)의 생체 외 기술은 유전자 발현의 서열-특이성 억제를 유발하는 이중-가닥 RNA 분자(dsRNA)를 기반으로 한다(Zamore (2001) Nat. Struct. Biol. 9: 746-750; Sharp (2001) Genes Dev. 5:485-490: Hannon (2002) Nature 41: 244-251). 긴 dsRNA를 가진 포유류 세포의 형질주입에서, 단백질 키나아제 R과 RnaseL의 활성화는 예를 들어 인터페론 반응과 같은 비특이적 인 효과를 가져온다(Stark et al. (1998) Annu. Rev. Biochem. 67: 227-264; He and Katze (2002) Viral Immunol. 15: 95-119). 이러한 비특이적 효과는 더 짧은, 예를 들면 21- 내지 23-mer, 소위 siRNA (작은 간섭 RNA)가 사용될 때 회피되는데, 왜냐하면 비특이적 효과가 30 bp보다 더 짧은 siRNA에 의해 유발되기 때문이다(Elbashir et al. (2001) Nature 411: 494-498).
핵산은 예를 들면, 약 17 내지 약 29 개 염기 쌍, 바람직하게는 약 19 내지 약 25 개 염기 쌍의 길이를 갖는 이중-가닥 RNA (dsRNA)일 수 있다. dsRNA는 전술한 바와 같이 치료 관련 단백질 또는 항원의 핵산 서열의 섹션, 즉 코딩 또는 비-코딩 섹션, 바람직하게는 코딩 섹션에 대하여 (dsRNA의 뉴클레오타이드에 관하여) 바람직하게는 적어도 90 %, 더욱 바람직하게는 적어도 95 %, 예컨대 100 % 상보적이다. 90 % 상보적이라는 것은 예를 들면, 20 개 뉴클레오타이드의 dsRNA의 길이에 대하여, 이것이 각각의 단백질을 인코딩하는 mRNA의 대응 섹션에 대하여 상보성이 없는 2개 이하의 뉴클레오타이드를 함유한다는 것을 의미한다. 또한 그 서열이 전술한 치료 관련 단백질 또는 항원의 핵산의 섹션과 완전히 상보적인 이중-가닥 RNA가 바람직하다.
하나의 구체예에서, dsRNA는 일반 구조식 5'-(N17-29)-3', 바람직하게는 각각 일반 구조식 5'-(N19-25)-3', 또는 5'-(N19-24)-3', 또는 5'-(N21-23)-3'를 가지며, 여기서 각각의 N은 뉴클레오타이드이며, 뉴클레오타이드 서열은 전술한 치료 관련 단백질 또는 항원에 대응하는 mRNA의 섹션에 상보적이다. 원칙적으로, mRNA의 코딩 영역에서 발생하는 17 내지 29 개, 바람직하게는 19 내지 25 개 염기 쌍의 길이를 갖는 모든 섹션은 여기서 dsRNA에 대한 표적 서열로서 작용할 수 있다. 동일하게, 핵산으로 사용되는 dsRNA는 mRNA의 코딩 영역, 특히 5' 비-코딩 영역에 속하지 않는 전술한 (치료 관련) 단백질 또는 항원의 뉴클레오타이드 서열에 대항하여 유도되며, 따라서, 예를 들면, 조절 기능을 갖는 mRNA의 비-코딩 영역에 대항하여 유도된다. 그러므로 핵산으로 사용되는 dsRNA의 표적 서열은 전술한 단백질 또는 항원의 제어 요소의 영역에서 mRNA의 번역된 및 번역안된 영역에 존재할 수 있다. 핵산으로 사용되는 dsRNA의 표적 서열은 또한 번역안된 및 번역된 서열의 중첩 영역에 존재할 수 있으며; 특히, 표적 서열은 mRNA의 코딩 영역의 시작 삼중항의 상류에 존재하는 적어도 하나의 뉴클레오타이드를 포함할 수 있다.
면역자극성 핵산
a)
면역자극성 CpG 핵산
또 다른 구체예에 따르면, 본 발명의 나노입자에 혼입된 핵산은 면역자극성 CpG 핵산, 특히 CpG-RNA 또는 CpG-DNA이며, 이는 바람직하게는 선천적 면역 반응을 유발한다. 잠재적으로 적합한 면역자극성 CpG 핵산의 예는 비제한적으로 단일-가닥 CpG-DNA (ss CpG-DNA), 이중-가닥 CpG-DNA (dsDNA), 단일-가닥 CpG-RNA (ss CpG-RNA), 및 이중-가닥 CpG-RNA (ds CpG-RNA)를 포함한다. 바람직하게는, CpG 핵산은 CpG-RNA, 특히 단일-가닥 CpG-RNA (ss CpG-RNA)이다. 뉴클레오타이드 또는 염기 쌍에 관한 CpG 핵산의 바람직한 길이는 전술한 바와 같이 siRNA에 대하여 바람직한 것과 유사하다. 바람직하게는, CpG 모티프는 비메틸화된다.
b)
면역자극성 RNA (isRNA)
또 다른 대안에 따르면, 본 발명의 나노입자 내에 생물학적 활성 카고 물질로서 혼입된 핵산은 면역자극성 RNA(isRNA)의 형태일 수 있으며, 이는 바람직하게는 선천적 면역 반응을 일으킨다.
이러한 isRNA는 이중-가닥 RNA, 단일-가닥 RNA, 또는 부분적인 이중-가닥 RNA, 또는 짧은 RNA 올리고뉴클레오타이드일 수 있다. 바람직한 구체예 중 하나에서, 이는 단일-가닥 RNA이다.
또한, isRNA는 고리형 또는 선형일 수 있다. 바람직한 구체예 중 하나에서, 선형 isRNA가 사용되는데, 예컨대 선형 단일-가닥 RNA, 또는 긴 단일-가닥 RNA이다.
또한, isRNA는 코딩 또는 비-코딩 RNA일 수 있다. 바람직한 구체예 중 하나에 따르면, 비-코딩 RNA가 isRNA로서 사용되며, 예컨대 비-코딩 단일-가닥 RNA, 비-코딩 선형 RNA, 비-코딩 선형 단일-가닥 RNA, 또는 비-코딩 긴 선형 단일-가닥 RNA이다.
하나의 또 다른 바람직한 구체예에 따르면, isRNA는 생체 외 전사 RNA의 경우와 같이 그의 5'-말단에 트리포스페이트를 갖는다. 이러한 선호도는 전술한 모든 유형의 선형 isRNA에 적용된다.
다시 말하면, 본 발명에 따른 생물학적 활성 카고 물질로서 사용되는 isRNA는 선천적 면역 반응을 유발할 수 있거나, 및/또는 항원에 의해 유도된 적응성 면역 반응을 향상 또는 지지할 수 있는, 자연적으로 발생하거나 합성인 임의 종류 또는 클래스의 RNA로부터 선택될 수 있다.
이와 관련하여, 면역 반응은 다양한 방식으로 발생할 수 있다. 적절한 적응성 면역 반응에 대한 실질적인 요소는 특정 T-세포 하위-집단의 자극이다. T-림프구는 전형적으로 두 개의 하위-집단, 즉 T-헬퍼 1 (Th1) 세포 및 T-헬퍼 2 (Th2) 세포로 나뉘어지는데, 이에 의해 면역계가 세포 내 (Th1) 및 세포 외 (Th2) 병원체, 예컨대 항원을 파괴할 수 있다. 두 개의 Th 세포 집단은 그것들에 의해 생성된 실행기 단백질(사이토카인)의 패턴이 상이하다. 따라서 Th1 세포는 대식세포와 세포독성 T-세포의 활성화에 의해 세포 면역 반응을 보조한다. 다른 한편으로, Th2 세포는 혈장 세포로의 전환을 위한 B-세포의 자극 및 (예컨대 항원에 대항하는) 항체의 형성에 의해 체액성 면역 반응을 촉진한다. 따라서 Th1/Th2 비율은 적응성 면역 반응의 유도 및 유지에 매우 중요하다.
본 발명과 관련하여, 적응성 면역 반응의 Th1/Th2 비율은 세포 반응(Th1 반응)쪽으로 이동하는 것이 바람직하며, 즉 세포 면역 반응이 유도되거나 증진되는 것이 바람직하다. 예를 들면, 적응성 면역 반응을 지원할 수 있는 선천적 면역계는 톨-유사(Toll-like) 수용체(TLR)의 리간드에 의해 활성화될 수 있다. TLR은 병원체-관련 분자 패턴(PAMP)을 인식하고 포유 동물의 선천적 면역에 결정적인 역할을 하는 고도로 보존된 패턴 인식 수용체(PRR) 폴리펩티드의 패밀리이다. 현재, 적어도 13 개 패밀리 멤버가 확인되었고 톨-유사(toll-like) 수용체 TLR1, TLR2, TLR3, TLR4, TLR5, TLR6, TLR7, TLR8, TLR9, TLR10, TLR11, TLR12 및 TLR13으로서 지정되었다. 또한, 많은 특정 TLR 리간드가 확인되었다. 비메틸화 세균 DNA 및 이의 합성 유사체(CpG DNA)는 TLR9에 리간드인 것으로 밝혀졌다(Hemmi H et al. (2000) Nature 408:740-5; Bauer S et al. (2001) Proc NatlAcadSci USA 98, 9237-42). 또한, 특정 TLR의 리간드에는 특정 핵산 분자가 포함되어 있으며 RNA의 특정 유형은 서열-독립적 방식 또는 서열-의존적 방식으로 면역작극성이며, 이러한 다양한 면역자극성 RNA는 TLR3, TLR7, 또는 TLR8, 또는 RIG-I, MDA-5 등의 세포내 수용체를 자극할 수 있다고 보고되었다. Lipford 등은 특정 G,U-함유 올리고리보뉴클레오타이드를 TLR7 및 TLR8을 통한 작용에 의한 면역자극성으로 결정하였다(WO 03/086280 참조). Lipford 등에 의해 기술된 면역자극성 G,U-함유 올리고리보뉴클레오타이드는 리보솜 RNA, 전이 RNA, 메신저 RNA, 및 바이러스성 RNA를 비롯한 RNA 원천으로부터 유래될 수 있는 것으로 여겨졌다.
따라서, 본 발명의 맥락에서 사용된 isRNA는 비제한적으로 예컨대 쥐과 구성원 TLR1 내지 TLR13, 또는 더욱 바람직하게는 인간 패밀리 구성원 TLR1 내지 TLR10, 특히 TLR7 또는 TLR8로부터 선택되는 TLR의 리간드; 또는 RIG-I 또는 MDA-5와 같은 RNA에 대한 세포 내 수용체에 대한 리간드를 나타내거나 및/또는 인코딩하는 RNA 서열을 비롯하여 면역자극성으로 알려진 임의의 RNA 서열을 포함할 수 있다(참조, 예컨대 Meylan, E., Tschopp, J. (2006): Toll-like receptors and RNA helicases: Two parallel ways to trigger antiviral responses. Mol. Cell 22, 561-569).
비제한적으로, isRNA는 리보솜 RNA (rRNA), 전이 RNA (tRNA), 메신저 RNA (mRNA), 및 바이러스성 RNA (vRNA)를 포함할 수 있다. 이는 각각 최대 약 5000 뉴클레오타이드, 예컨대 약 5 내지 약 5000 뉴클레오타이드, 또는 약 5 내지 약 1000, 또는 약 500 내지 약 5000, 또는 약 5 내지 약 500, 또는 약 5 내지 약 250, 또는 약 5 내지 약 100, 또는 약 5 내지 약 50 또는 약 5 내지 약 30 뉴클레오타이드를 포함할 수도 있다.
본 구체예의 또 다른 바람직한 양상에 따르면, isRNA는 화학식 V 또는 VI의 핵산을 포함하거나 핵산으로 구성되며:
(NuGlXmGnNv)a
(화학식 V)
여기서:
G는 구아노신 (구아닌), 우리딘 (우라실) 또는 구아노신 (구아닌) 또는 우리딘 (우라실)의 유사체이며, 바람직하게는 구아노신 (구아닌) 또는 이의 유사체이며;
X는 구아노신 (구아닌), 우리딘 (우라실), 아데노신 (아데닌), 티미딘 (티민), 시티딘 (시토신), 또는 이러한 뉴클레오타이드 (뉴클레오사이드)의 유사체이며, 바람직하게는 우리딘 (우라실) 또는 이의 유사체이며;
N은 약 4 내지 50, 바람직하게는 약 4 내지 40, 더욱 바람직하게는 약 4 내지 30 또는 4 내지 20 개 핵산의 길이를 갖는 핵산 서열이며, 각각의 N은 독립적으로 구아노신 (구아닌), 우리딘 (우라실), 아데노신 (아데닌), 티미딘 (티민), 시티딘 (시토신) 또는 이들 뉴클레오타이드 (뉴클레오사이드)의 유사체로부터 선택되며;
a는 1 내지 20, 바람직하게는 1 내지 15, 가장 바람직하게는 1 내지 10의 정수이며;
l은 1 내지 40의 정수이며,
여기서 l = 1인 경우, G는 구아노신 (구아닌) 또는 이의 유사체이며, 그리고 l > 1인 경우, 이들 뉴클레오타이드 (뉴클레오사이드)의 적어도 50%는 구아노신 (구아닌) 또는 이의 유사체이며;
m은 정수이며 적어도 3이며; m = 3인 경우, X는 우리딘 (우라실) 또는 이의 유사체이며, m > 3인 경우, 적어도 3 개의 연속 우리딘 (우라실) 또는 우리딘 (우라실)의 유사체가 발생하며;
n은 1 내지 40의 정수이며, n = 1인 경우, G는 구아노신 (구아닌) 또는 이의 유사체이며, n > 1인 경우, 이들 뉴클레오타이드 (뉴클레오사이드)의 적어도 50%는 구아노신 (구아닌) 또는 이의 유사체이며;
u, v는 서로 독립적으로 0 내지 50의 정수이며, 바람직하게는 u = 0인 경우, v ₃ 1이거나, 또는 v = 0인 경우, u ₃ 1이며;
여기서 화학식 V의핵산 분자는 적어도 50 개 뉴클레오타이드, 바람직하게는 적어도 100 개 뉴클레오타이드, 더욱 바람직하게는 적어도 150 개 뉴클레오타이드, 심지어 더욱 바람직하게는 적어도 200 개 뉴클레오타이드 및 가장 바람직하게는 적어도 250 개 뉴클레오타이드의 길이를 가지며;
(NuClXmCnNv)a
(화학식 VI)
여기서:
C는 시티딘(시토신), 우리딘(우라실) 또는 시티딘(시토신) 또는 우리딘(우라실)의 유사체이며, 바람직하게는 시티딘(시토신) 또는 이의 유사체이며;
X는 구아노신 (구아닌), 우리딘 (우라실), 아데노신 (아데닌), 티미딘 (티민), 시티딘 (시토신) 또는 상기 언급한 뉴클레오타이드 (뉴클레오사이드)의 유사체이며, 바람직하게는 우리딘 (우라실) 또는 이의 유사체이며;
N은 각각 약 4 내지 50, 바람직하게는 약 4 내지 40, 더욱 바람직하게는 약 4 내지 30 또는 4 내지 20 개 핵산의 길이를 갖는 핵산 서열이며, 각각의 N은 독립적으로 구아노신 (구아닌), 우리딘 (우라실), 아데노신 (아데닌), 티미딘 (티민), 시티딘 (시토신) 또는 이들 뉴클레오타이드 (뉴클레오사이드)의 유사체로부터 선택되며;
a는 1 내지 20, 바람직하게는 1 내지 15, 가장 바람직하게는 1 내지 10의 정수이며;
l은 1 내지 40의 정수이며,
여기서 l = 1인 경우, C는 시티딘(시토신) 또는 이의 유사체이며, 그리고 l > 1인 경우, 이들 뉴클레오타이드 (뉴클레오사이드)의 적어도 50%는 시티딘(시토신) 또는 이의 유사체이며;
m은 정수이며 적어도 3이며; m = 3인 경우, X는 우리딘 (우라실) 또는 이의 유사체이며, m > 3인 경우, 적어도 3 개의 연속 우리딘 (우라실) 또는 우리딘 (우라실)의 유사체가 발생하며;
n은 1 내지 40의 정수이며, n = 1인 경우, C는 시티딘(시토신) 또는 이의 유사체이며, n > 1인 경우, 이들 뉴클레오타이드 (뉴클레오사이드)의 적어도 50%는 시티딘(시토신) 또는 이의 유사체이며;
u, v는 서로 독립적으로 0 내지 50의 정수이며, 바람직하게는 u = 0인 경우, v ₃ 1이거나, 또는 v = 0인 경우, u ₃ 1이며;
여기서 화학식 VI의핵산 분자는 적어도 50 개 뉴클레오타이드, 바람직하게는 적어도 100 개 뉴클레오타이드, 더욱 바람직하게는 적어도 150 개 뉴클레오타이드, 심지어 더욱 바람직하게는 적어도 200 개 뉴클레오타이드 및 가장 바람직하게는 적어도 250 개 뉴클레오타이드의 길이를 가진다.
화학식 VI에 대하여, 요소 N (즉 Nu 및 Nv) 및 X (Xm), 특히 앞서 정의된 코어 구조, 뿐만 아니라 정수 a, l, m, n, u 및 v에 대하여 앞서 제시된 모든 정의는 화학식 V의 요소에 대응하여 유사하게 적용되며, 여기서 화학식 VI에서 코어 구조는 ClXmCn로 정의된다. 경계 요소 Nu 및 Nv의 정의는 Nu 및 Nv에 대하여 앞서 제시된 정의와 동일하다.
본 구체예의 특히 바람직한 양상에 따르면, 화학식 V에 따른 핵산 분자는 예컨대 아래 서열 중 임의 것으로부터 선택될 수 있다:
UAGCGAAGCUCUUGGACCUAGGUUUUUUUUUUUUUUUGGGUGCGUUCCUAGAAGUACACG (SEQ ID NO: 1)
UAGCGAAGCUCUUGGACCUAGGUUUUUUUUUUUUUUUGGGUGCGUUCCUAGAAGUACACGAUCGCUUCGAGAACCUGGAUCCAAAAAAAAAAAAAAACCCACGCAAGGAUCUUCAUGUGC (SEQ ID NO: 2)
GGGAGAAAGCUCAAGCUUGGAGCAAUGCCCGCACAUUGAGGAAACCGAGUUGCAUAUCUCAGAGUAUUGGCCCCCGUGUAGGUUAUUCUUGACAGACAGUGGAGCUUAUUCACUCCCAGGAUCCGAGUCGCAUACUACGGUACUGGUGACAGACCUAGGUCGUCAGUUGACCAGUCCGCCACUAGACGUGAGUCCGUCAAAGCAGUUAGAUGUUACACUCUAUUAGAUC (SEQ ID NO: 3)
GGGAGAAAGCUCAAGCUUGGAGCAAUGCCCGCACAUUGAGGAAACCGAGUUGCAUAUCUCAGAGUAUUGGCCCCCGUGUAGGUUAUUCUUGACAGACAGUGGAGCUUAUUCACUCCCAGGAUCCGAGUCGCAUACUACGGUACUGGUGACAGACCUAGGUCGUCAGUUGACCAGUCCGCCACUAGACGUGAGUCCGUCAAAGCAGUUAGAUGUUACACUCUAUUAGAUCUCGGAUUACAGCUGGAAGGAGCAGGAGUAGUGUUCUUGCUCUAAGUACCGAGUGUGCCCAAUACCCGAUCAGCUUAUUAACGAACGGCUCCUCCUCUUAGACUGCAGCGUAAGUGCGGAAUCUGGGGAUCAAAUUACUGACUGCCUGGAUUACCCUCGGACAUAUAACCUUGUAGCACGCUGUUGCUGUAUAGGUGACCAACGCCCACUCGAGUAGACCAGCUCUCUUAGUCCGGACAAUGAUAGGAGGCGCGGUCAAUCUACUUCUGGCUAGUUAAGAAUAGGCUGCACCGACCUCUAUAAGUAGCGUGUCCUCUAG (SEQ ID NO: 4)
GGGAGAAAGCUCAAGCUUGGAGCAAUGCCCGCACAUUGAGGAAACCGAGUUGCAUAUCUCAGAGUAUUGGCCCCCGUGUAGGUUAUUCUUGACAGACAGUGGAGCUUAUUCACUCCCAGGAUCCGAGUCGCAUACUACGGUACUGGUGACAGACCUAGGUCGUCAGUUGACCAGUCCGCCACUAGACGUGAGUCCGUCAAAGCAGUUAGAUGUUACACUCUAUUAGAUCUCGGAUUACAGCUGGAAGGAGCAGGAGUAGUGUUCUUGCUCUAAGUACCGAGUGUGCCCAAUACCCGAUCAGCUUAUUAACGAACGGCUCCUCCUCUUAGACUGCAGCGUAAGUGCGGAAUCUGGGGAUCAAAUUACUGACUGCCUGGAUUACCCUCGGACAUAUAACCUUGUAGCACGCUGUUGCUGUAUAGGUGACCAACGCCCACUCGAGUAGACCAGCUCUCUUAGUCCGGACAAUGAUAGGAGGCGCGGUCAAUCUACUUCUGGCUAGUUAAGAAUAGGCUGCACCGACCUCUAUAAGUAGCGUGUCCUCUAGAGCUACGCAGGUUCGCAAUAAAAGCGUUGAUUAGUGUGCAUAGAACAGACCUCUUAUUCGGUGAAACGCCAGAAUGCUAAAUUCCAAUAACUCUUCCCAAAACGCGUACGGCCGAAGACGCGCGCUUAUCUUGUGUACGUUCUCGCACAUGGAAGAAUCAGCGGGCAUGGUGGUAGGGCAAUAGGGGAGCUGGGUAGCAGCGAAAAAGGGCCCCUGCGCACGUAGCUUCGCUGUUCGUCUGAAACAACCCGGCAUCCGUUGUAGCGAUCCCGUUAUCAGUGUUAUUCUUGUGCGCACUAAGAUUCAUGGUGUAGUCGACAAUAACAGCGUCUUGGCAGAUUCUGGUCACGUGCCCUAUGCCCGGGCUUGUGCCUCUCAGGUGCACAGCGAUACUUAAAGCCUUCAAGGUACUCGACGUGGGUACCGAUUCGUGACACUUCCUAAGAUUAUUCCACUGUGUUAGCCCCGCACCGCCGACCUAAACUGGUCCAAUGUAUACGCAUUCGCUGAGCGGAUCGAUAAUAAAAGCUUGAAUU (SEQ ID NO: 5)
GGGAGAAAGCUCAAGCUUAUCCAAGUAGGCUGGUCACCUGUACAACGUAGCCGGUAUUUUUUUUUUUUUUUUUUUUUUGACCGUCUCAAGGUCCAAGUUAGUCUGCCUAUAAAGGUGCGGAUCCACAGCUGAUGAAAGACUUGUGCGGUACGGUUAAUCUCCCCUUUUUUUUUUUUUUUUUUUUUAGUAAAUGCGUCUACUGAAUCCAGCGAUGAUGCUGGCCCAGAUC (SEQ ID NO: 6)
GGGAGAAAGCUCAAGCUUAUCCAAGUAGGCUGGUCACCUGUACAACGUAGCCGGUAUUUUUUUUUUUUUUUUUUUUUUGACCGUCUCAAGGUCCAAGUUAGUCUGCCUAUAAAGGUGCGGAUCCACAGCUGAUGAAAGACUUGUGCGGUACGGUUAAUCUCCCCUUUUUUUUUUUUUUUUUUUUUAGUAAAUGCGUCUACUGAAUCCAGCGAUGAUGCUGGCCCAGAUCUUCGACCACAAGUGCAUAUAGUAGUCAUCGAGGGUCGCCUUUUUUUUUUUUUUUUUUUUUUUGGCCCAGUUCUGAGACUUCGCUAGAGACUACAGUUACAGCUGCAGUAGUAACCACUGCGGCUAUUGCAGGAAAUCCCGUUCAGGUUUUUUUUUUUUUUUUUUUUUCCGCUCACUAUGAUUAAGAACCAGGUGGAGUGUCACUGCUCUCGAGGUCUCACGAGAGCGCUCGAUACAGUCCUUGGAAGAAUCUUUUUUUUUUUUUUUUUUUUUUGUGCGACGAUCACAGAGAACUUCUAUUCAUGCAGGUCUGCUCUAG (SEQ ID NO: 7)
GGGAGAAAGCUCAAGCUUAUCCAAGUAGGCUGGUCACCUGUACAACGUAGCCGGUAUUUUUUUUUUUUUUUUUUUUUUGACCGUCUCAAGGUCCAAGUUAGUCUGCCUAUAAAGGUGCGGAUCCACAGCUGAUGAAAGACUUGUGCGGUACGGUUAAUCUCCCCUUUUUUUUUUUUUUUUUUUUUAGUAAAUGCGUCUACUGAAUCCAGCGAUGAUGCUGGCCCAGAUCUUCGACCACAAGUGCAUAUAGUAGUCAUCGAGGGUCGCCUUUUUUUUUUUUUUUUUUUUUUUGGCCCAGUUCUGAGACUUCGCUAGAGACUACAGUUACAGCUGCAGUAGUAACCACUGCGGCUAUUGCAGGAAAUCCCGUUCAGGUUUUUUUUUUUUUUUUUUUUUCCGCUCACUAUGAUUAAGAACCAGGUGGAGUGUCACUGCUCUCGAGGUCUCACGAGAGCGCUCGAUACAGUCCUUGGAAGAAUCUUUUUUUUUUUUUUUUUUUUUUGUGCGACGAUCACAGAGAACUUCUAUUCAUGCAGGUCUGCUCUAGAACGAACUGACCUGACGCCUGAACUUAUGAGCGUGCGUAUUUUUUUUUUUUUUUUUUUUUUUCCUCCCAACAAAUGUCGAUCAAUAGCUGGGCUGUUGGAGACGCGUCAGCAAAUGCCGUGGCUCCAUAGGACGUGUAGACUUCUAUUUUUUUUUUUUUUUUUUUUUCCCGGGACCACAAAUAAUAUUCUUGCUUGGUUGGGCGCAAGGGCCCCGUAUCAGGUCAUAAACGGGUACAUGUUGCACAGGCUCCUUUUUUUUUUUUUUUUUUUUUUUCGCUGAGUUAUUCCGGUCUCAAAAGACGGCAGACGUCAGUCGACAACACGGUCUAAAGCAGUGCUACAAUCUGCCGUGUUCGUGUUUUUUUUUUUUUUUUUUUUGUGAACCUACACGGCGUGCACUGUAGUUCGCAAUUCAUAGGGUACCGGCUCAGAGUUAUGCCUUGGUUGAAAACUGCCCAGCAUACUUUUUUUUUUUUUUUUUUUUCAUAUUCCCAUGCUAAGCAAGGGAUGCCGCGAGUCAUGUUAAGCUUGAAUU (SEQ ID NO: 8)
또 다른 매우 특히 바람직한 구체예에 따르면, 화학식 VI에 따른 핵산 분자는 예컨대 아래 서열 중 임의 것으로부터 선택될 수 있다:
UAGCGAAGCUCUUGGACCUACCUUUUUUUUUUUUUUCCCUGCGUUCCUAGAAGUACACG
(SEQ ID NO: 9)
또는
UAGCGAAGCUCUUGGACCUACCUUUUUUUUUUUUUUUCCCUGCGUUCCUAGAAGUACACGAUCGCUUCGAGAACCUGGAUGGAAAAAAAAAAAAAAAGGGACGCAAGGAUCUUCAUGUGC
(SEQ ID NO: 10)
또 다른 구체예에서, 본 발명에 따른 생물학적 활성 카고 물질로서 사용되는 핵산 화합물은 화학적 변성 핵산의 형태이거나, 또는 안정화된 핵산, 바람직하게는 안정화된 RNA 또는 DNA, 예컨대 본질적으로 엑소- 또는 엔도뉴클레아제에 의한 생체 내 분해에 내성을 갖는 RNA이다.
화학적 변성:
핵산과 관련하여 여기서 사용되는 용어 "변성(들)", "화학적 변성(들)", "변성된" 등은 주쇄 변성뿐만 아니라 당 변성 도는 염기 변성을 포함하는 화학적 변성을 의미한다. 변성의 개별 생성물은 예를 들어 "변성 핵산" 또는 "화학적 변성 핵산"으로 불릴 수 있다.
본 발명과 관련하여 주쇄 변성은 핵산 화합물, 바람직하게는 mRNA에 함유된 뉴클레오타이드의 주쇄의 포스페이트가 화학적으로 변성된 변성이다. 당 변성은 핵산의 뉴클레오타이드의 당의 화학적 변성이다. 또한, 본 발명과 관련한 염기 변성은 인공 핵산, 바람직하게는 mRNA의 뉴클레오타이드의 염기 원자단의 화학적 변성이다. 이와 관련하여, 뉴클레오타이드 유사체 또는 변성은 바람직하게는 전사 및/또는 번역에 적용가능한 뉴클레오타이드 유사체로부터 선택된다.
당 변성:
전술한 바와 같이, 뉴클레오사이드 및 뉴클레오타이드는 당 원자단에서 변성될 수 있다. 예를 들면, 2'-하이드록실 그룹(OH)은 많은 상이한 "옥시" 또는 "데옥시" 치환체로 변성되거나 치환될 수 있다. "옥시" -2'-하이드록실 그룹 변성의 예는 비제한적으로 알콕시 또는 아릴옥시(-OR, 예컨대, R = H, 알킬, 사이클로알킬, 아릴, 아랄킬, 헤테로아릴 또는 당); 폴리에틸렌글리콜(PEG), -O(CH2CH2O)nCH2CH2OR; 2'-하이드록실이 예컨대 메틸렌 다리에 의해 동일한 리보오스 당의 4'-탄소에 결합된 "잠긴(locked)" 핵산(LNA); 및 아미노 그룹(-O-아미노, 여기서 아미노 그룹, 예컨대, NRR은 알킬아미노, 디알킬아미노, 헤테로사이클일, 아릴아미노, 디아릴아미노, 헤테로아릴아미노, 또는 디헤테로아릴 아미노, 에틸렌 디아민, 폴리아미노일 수 있음) 또는 아미노알콕시를 포함한다.
"데옥시" 변성은 수소, 아미노(예컨대 NH2; 알킬아미노, 디알킬아미노, 헤테로사이클일, 아릴아미노, 디아릴 아미노, 헤테로아릴 아미노, 디헤테로아릴 아미노, 또는 아미노산)를 포함하거나; 또는 아미노 그룹은 링커를 통해 당에 연결될 수 있으며, 여기서 링커는 원자 C, N, 및 O 중 하나 이상을 포함한다.
당 그룹은 또한 리보오스 내의 상응하는 탄소와 반대되는 입체화학적 구성을 갖는 하나 이상의 탄소를 함유할 수 있다. 따라서, 인공 핵산, 바람직하게는 mRNA는 예를 들어 아라비노스(arabinose)를 당으로서 함유하는 뉴클레오타이드를 포함할 수 있다.
주쇄 변성(Backbone Modification)
핵산 화합물의 주쇄의 포스페이트 그룹은 하나 이상의 산소 원자를 다른 치환기로 치환함으로써 변성될 수 있다. 또한, 변성 뉴클레오사이드 및 뉴클레오타이드는 미변성 포스페이트 원자단의 여기에 개시된 변성 포스페이트에 의한 완전 치환을 포함할 수 있다. 변성 포스페이트 그룹의 예는 비제한적으로 포스포로티오에이트, 포스포로셀레네이트, 보라노 포스페이트, 보라노 포스페이트 에스테르, 하이드로젠 포스포네이트, 포스포로아미데이트, 알킬 또는 아릴 포스포네이트 및 포스포트리에스테르를 포함한다. 포스포로디티오에이트는 비-결합 산소가 모두 황으로 치환되어있다. 포스페이트 링커는 또한 연결 산소를 질소(가교된 포스포로아미데이트), 황(가교된 포스포로티오에이트) 및 탄소(가교된 메틸렌-포스포네이트)로 대체함으로써 변성될 수 있다.
염기 변성:
선택사항으로서, 변성은 핵산 화합물의 핵염기 원자단과 관련될 수 있다. RNA와 같은 핵산에서 발견되는 핵염기의 예는 비제한적으로 아데닌, 구아닌, 시토신 및 우라실을 포함한다. 예를 들면, 여기에 개시된 뉴클레오사이드 및 뉴클레오타이드는 주요 홈 면 상에서 화학적으로 변성될 수 있다. 일부 구체예에서, 주요 홈(groove) 화학적 변성은 아미노 그룹, 티올 그룹, 알킬 그룹, 또는 할로 그룹을 포함할 수 있다.
본 발명의 특히 바람직한 구체예에서, 염기 변성은 다음으로부터 선택된다: 2-아미노-6-클로로푸린리보사이드-5'-트리포스페이트, 2-아미노푸린-리보사이드-5'-트리포스페이트; 2-아미노아데노신-5'-트리포스페이트, 2'-아미노-2'-데옥시시티딘-트리포스페이트, 2-티오시티딘-5'-트리포스페이트, 2-티오우리딘-5'-트리포스페이트, 2'-플루오로티미딘-5'-트리포스페이트, 2'-O-메틸 이노신-5'-트리포스페이트 4-티오우리딘-5'-트리포스페이트, 5-아미노알릴시티딘-5'-트리포스페이트, 5-아미노알릴우리딘-5'-트리포스페이트, 5-브로모시티딘-5'-트리포스페이트, 5-브로모우리딘-5'-트리포스페이트, 5-브로모-2'-데옥시시티딘-5'-트리포스페이트, 5-브로모-2'-데옥시우리딘-5'-트리포스페이트, 5-아이오도시티딘-5'-트리포스페이트, 5-아이오도-2'-데옥시시티딘-5'-트리포스페이트, 5-아이오도우리딘-5'-트리포스페이트, 5-아이오도-2'-데옥시우리딘-5'-트리포스페이트, 5-메틸시티딘-5'-트리포스페이트, 5-메틸우리딘-5'-트리포스페이트, 5-프로피닐-2'-데옥시시티딘-5'-트리포스페이트, 5-프로피닐-2'-데옥시우리딘-5'-트리포스페이트, 6-아자시티딘-5'-트리포스페이트, 6-아자우리딘-5'-트리포스페이트, 6-클로로푸린리보사이드-5'-트리포스페이트, 7-데아자아데노신-5'-트리포스페이트, 7-데아자구아노신-5'-트리포스페이트, 8-아자아데노신-5'-트리포스페이트, 8-아지도아데노신-5'-트리포스페이트, 벤즈이미다졸-리보사이드-5'-트리포스페이트, N1-메틸아데노신-5'-트리포스페이트, N1-메틸구아노신-5'-트리포스페이트, N6-메틸아데노신-5'-트리포스페이트, O6-메틸구아노신-5'-트리포스페이트, 슈도우리딘-5'-트리포스페이트, 또는 푸로마이신-5'-트리포스페이트, 크산토신-5'-트리포스페이트. 5-메틸시티딘-5'-트리포스페이트, 7-데아자구아노신-5'-트리포스페이트, 5-브로모시티딘-5'-트리포스페이트, 및 슈도우리딘-5'-트리포스페이트로 구성된 염기-변성 뉴클레오타이드의 그룹으로부터 선택되는 염기 변성에 대한 뉴클레오타이드가 특히 바람직하다.
일부 구체예에서, 변성 뉴클레오사이드는 피리딘-4-온 리보뉴클레오사이드, 5-아자-우리딘, 2-티오-5-아자-우리딘, 2-티오우리딘, 4-티오-슈도우리딘, 2-티오-슈도우리딘, 5-하이드록시우리딘, 3-메틸우리딘, 5-카르복시메틸-우리딘, 1-카르복시메틸-슈도우리딘, 5-프로피닐-우리딘, 1-프로피닐-슈도우리딘, 5-타우리노메틸우리딘, 1-타우리노메틸-슈도우리딘, 5-타우리노메틸-2-티오-우리딘, l-타우리노메틸-4-티오-우리딘, 5-메틸-우리딘, 1-메틸-슈도우리딘, 4-티오-1-메틸-슈도우리딘, 2-티오-l-메틸-슈도우리딘, 1-메틸-1-데아자-슈도우리딘, 2-티오-1-메틸-1-데아자-슈도우리딘, 디하이드로우리딘, 디하이드로슈도우리딘, 2-티오-디하이드로우리딘, 2-티오-디하이드로슈도우리딘, 2-메톡시우리딘, 2-메톡시-4-티오-우리딘, 4-메톡시-슈도우리딘, 및 4-메톡시-2-티오-슈도우리딘을 포함한다.
일부 구체예에서, 변성 뉴클레오사이드는 5-아자-시티딘, 슈도이소시티딘, 3-메틸-시티딘, N4-아세틸시티딘, 5-포르밀시티딘, N4-메틸시티딘, 5-하이드록시메틸시티딘, 1-메틸-슈도이소시티딘, 피롤로-시티딘, 피롤로-슈도이소시티딘, 2-티오-시티딘, 2-티오-5-메틸-시티딘, 4-티오-슈도이소시티딘, 4-티오-1-메틸-슈도이소시티딘, 4-티오-1-메틸-1-데아자-슈도이소시티딘, 1-메틸-1-데아자-슈도이소시티딘, 제불라린, 5-아자-제불라린, 5-메틸-제불라린, 5-아자-2-티오-제불라린, 2-티오-제불라린, 2-메톡시-시티딘, 2-메톡시-5-메틸-시티딘, 4-메톡시-슈도이소시티딘, 및 4-메톡시-l-메틸-슈도이소시티딘을 포함한다.
또 다른 구체예에서, 변성 뉴클레오사이드는 2-아미노푸린, 2, 6-디아미노푸린, 7-데아자-아데닌, 7-데아자-8-아자-아데닌, 7-데아자-2-아미노푸린, 7-데아자-8-아자-2-아미노푸린, 7-데아자-2,6-디아미노푸린, 7-데아자-8-아자-2,6-디아미노푸린, 1-메틸아데노신, N6-메틸아데노신, N6-이소펜텐일아데노신, N6-(cis-하이드록시이소펜텐일)아데노신, 2-메틸티오-N6-(cis-하이드록시이소펜텐일) 아데노신, N6-글리신일카바모일아데노신, N6-트레온일카바모일아데노신, 2-메틸티오-N6-트레온일 카바모일아데노신, N6,N6-디메틸아데노신, 7-메틸아데닌, 2-메틸티오-아데닌, 및 2-메톡시-아데닌을 포함한다.
또 다른 구체예에서, 변성 뉴클레오사이드는 이노신, 1-메틸-이노신, 와이오신(wyosine), 와이부토신(wybutosine), 7-데아자-구아노신, 7-데아자-8-아자-구아노신, 6-티오-구아노신, 6-티오-7-데아자-구아노신, 6-티오-7-데아자-8-아자-구아노신, 7-메틸-구아노신, 6-티오-7-메틸-구아노신, 7-메틸이노신, 6-메톡시-구아노신, 1-메틸구아노신, N2-메틸구아노신, N2,N2-디메틸구아노신, 8-옥소-구아노신, 7-메틸-8-옥소-구아노신, 1-메틸-6-티오-구아노신, N2-메틸-6-티오-구아노신, 및 N2,N2-디메틸-6-티오-구아노신을 포함한다.
일부 구체예에서, 뉴클레오타이드는 주요 홈 면(major groove face) 상에서 변성될 수 있며 우라실의 C-5 상의 수소를 메틸 그룹 또는 할로 그룹으로 치환하는 것을 포함할 수 있다.
특정 구체예에서, 변성 뉴클레오사이드는 5'-O-(1-티오포스페이트)-아데노신, 5'-O-(1-티오포스페이트)-시티딘, 5'-O-(1-티오포스페이트)-구아노신, 5'-O-(1-티오포스페이트)-우리딘 또는 5'-O-(1-티오포스페이트)-슈도우리딘이다.
또 다른 특정 구체예에서, 변성 핵산 화합물, 바람직하게는 mRNA는, 6-아자-시티딘, 2-티오-시티딘, α-티오-시티딘, 슈도-이소-시티딘, 5-아미노알릴-우리딘, 5-아이오도-우리딘, N1-메틸-슈도우리딘, 5,6-디하이드로우리딘, α-티오-우리딘, 4-티오-우리딘, 6-아자-우리딘, 5-하이드록시-우리딘, 데옥시-티미딘, 5-메틸-우리딘, 피롤로-시티딘, 이노신, α-티오-구아노신, 6-메틸-구아노신, 5-메틸-시티딘, 8-옥소-구아노신, 7-데아자-구아노신, N1-메틸-아데노신, 2-아미노-6-클로로-푸린, N6-메틸-2-아미노-푸린, 슈도-이소-시티딘, 6-클로로-푸린, N6-메틸-아데노신, α-티오-아데노신, 8-아지도-아데노신, 7-데아자-아데노신으로부터 선택되는 뉴클레오사이드 변성을 포함할 수 있다.
하나의 구체예에서, 핵산는 지질 변성을 나타낸다. 여기에 정의된 바와 같은 이러한 지질-변성 핵산 또는 RNA는 전형적으로 해당 핵산 또는 RNA와 공유 결합된 적어도 하나의 링커, 및 각각의 링커와 공유 결합된 적어도 하나의 지질을 더욱 포함한다. 대안적으로, 지질-변성 핵산은 여기서 정의된 바와 같은 적어도 하나의 핵산 및 해당 핵산과 (링커 없이) 공유 결합된 적어도 하나의 (이작용성) 지질을 포함한다. 세 번째 대안에 따르면, 지질-변성 핵산은 여기에 정의된 바와 같은 핵산 분자, 해당 RNA와 공유 결합된 적어도 하나의 링커, 및 각각의 링커와 공유 결합된 적어도 하나의 지질, 및 또한 해당 핵산과 (링커 없이) 공유 결합된 적어도 하나의 (이작용성) 지질을 포함한다. 이와 관련하여, 지질 변성이 선형 핵산 서열의 종결 말단에 존재하는 것이 특히 바람직하다.
본 발명의 또 다른 바람직한 구체예에 따르면, 여기서 정의된 바와 같은 변성 핵산 서열, 특히 여기서 정의된 바와 같은 변성 RNA는 소위 '5' 캡'구조의 첨가에 의해 변성될 수 있으며, 이는 바람직하게는 여기서 정의된 바와 같은 핵산을 안정화시킨다. 5'-캡은 개체, 전형적으로 변성 뉴클레오타이드 개체이며, 이는 일반적으로 성숙한 RNA의 5'-말단을 "캡핑"한다. 5'-캡은 전형적으로 변성 뉴클레오타이드에 의해, 특히 구아닌 뉴클레오타이드의 유도체에 의해 형성될 수 있다. 바람직하게는, 5'-캡은 5'-5'-트리포스페이트 결합을 통해 5'-말단에 연결된다. 5'-캡은 메틸화될 수 있는데, 예컨대 m7GpppN일 수 있는데, 여기서 N은 5'-캡을 갖는 핵산의 종결 5' 뉴클레오타이드, 전형적으로 RNA의 5'-말단이다. m7GpppN은 5'-캡 구조이며, 이는 폴리머라제 II에 의해 전사된 RNA에서 자연적으로 발생하며, 따라서 이와 관련하여 바람직하게는 이는 변성 RNA에 포함된 변성으로 간주되지 않는다. 따라서, 본 발명의 변성 RNA 서열은 5'-캡으로서 m7GpppN을 포함할 수 있지만, 이에 부가하여 상기 변성 RNA 서열은 전형적으로 여기에 정의된 바와 같은 적어도 하나의 추가 변성을 포함한다.
5'캡 구조의 또 다른 예는 글리세릴, 도치된 데옥시 비염기성 잔기 (원자단), 4',5' 메틸렌 뉴클레오타이드, 1-(베타-D-에리스로푸라노실) 뉴클레오타이드, 4'-티오 뉴클레오타이드, 카보사이클릭 뉴클레오타이드, 1,5-안하이드로헥시톨 뉴클레오타이드, L-뉴클레오타이드, 알파-뉴클레오타이드, 변성 염기성 뉴클레오타이드, 트레오-펜토푸라노실 뉴클레오타이드, 비고리형 3',4'-세코 뉴클레오타이드, 비고리형 3,4-디하이드록시부틸 뉴클레오타이드, 비고리형 3,5 디하이드록시펜틸 뉴클레오타이드, 3'-3'-도치된 뉴클레오타이드 원자단, 3'-3'-도치된 비염기성 원자단, 3'-2'-도치된 뉴클레오타이드 원자단, 3'-2'-도치된 비염기성 원자단, 1,4-부탄디올 포스페이트, 3'-포스포라미데이트, 헥실포스페이트, 아미노헥실 포스페이트, 3'-포스페이트, 3'포스포로티오에이트, 포스포로디티오에이트, 또는 가교 또는 비-가교 메틸포스포네이트 원자단을 포함한다. 이러한 변성 5'-캡 구조는 이와 관련하여 적어도 하나의 변성으로 간주된다.
특히 바람직한 변성 5'-캡 구조는 캡1 (m7G의 인접한 뉴클레오타이드의 리보오스의 메틸화), 캡2 (m7G의 하류에 있는 2nd 뉴클레오타이드의 리보오스의 추가 메틸화), 캡3 (m7G의 하류에 있는 3rd 뉴클레오타이드의 리보오스의 추가 메틸화), 캡4 (m7G의 하류에 있는 4th 뉴클레오타이드의 리보오스의 메틸화), ARCA (도치-방지(anti-reverse) 캡 유사체, 변성 ARCA (예컨대 포스포티오에이트 변성 ARCA), 이노신, N1-메틸-구아노신, 2'-플루오로-구아노신, 7-데아자-구아노신, 8-옥소-구아노신, 2-아미노-구아노신, LNA-구아노신, 및 2-아지도-구아노신이다. 따라서, 본 발명에 따른 RNA는 바람직하게는 5'-캡 구조를 포함한다.
바람직한 구체예에서, 5'-캡 구조는 여기에 정의된 바와 같은 RNA 생체 외 전사 반응에서 여기서 정의된 바와 같은 캡-유사체를 사용하여 공동-전사적으로(co-transcriptionally) 첨가된다. 또 다른 구체예에서, 5'-캡 구조는 캡핑 효소(예컨대 백시니아 바이러스 캡핑 효소)를 사용하는 효소적 캡핑을 통해 첨가된다.
선택사항으로서, 본질적으로 엑소- 또는 엔도뉴클레아제에 의한 생체 내 분해에 내성을 갖는 mRNA를 나타내는 핵산이 선택될 수 있다. 그러한 안정화는 예를 들면, 주쇄의 포스페이트를 화학적으로 변성시킴으로써 수행될 수 있다. 당 또는 염기 변성이 추가로 사용될 수 있다. mRNA는 또한 소위 "5' 캡" 구조의 첨가에 의해 RNase에 의한 분해에 대항하여 안정화될 수 있다. 이와 관련하여, 5'캡 구조(N은 A, G, C 또는 N)로서의 G(5')ppp(5')G 또는 m7G(5')ppp(5')N이 특히 바람직하다. 또 다른 예에 따르면, mRNA는 전형적으로 약 10 내지 약 200 개 아데노신 뉴클레오타이드, 바람직하게는 약 10 내지 약 100 개 아데노신 뉴클레오타이드, 또는 약 20 내지 약 100 개 아데노신 뉴클레오타이드 또는 심지어 약 40 내지 약 80 개 아데노신 뉴클레오타이드의 3' 말단에서 폴리-A 꼬리를 나타낼 수 있다. 또 다른 예에 따르면, 전형적으로 약 10 내지 약 200 개 시토신 뉴클레오타이드, 바람직하게는 약 10 내지 약 100 개 시토신 뉴클레오타이드, 또는 약 20 내지 약 70 개 시토신 뉴클레오타이드, 또는 약 20 내지 약 60 개 또는 심지어 약 10 내지 약 40 개 시토신 뉴클레오타이드의 3' 말단에서 폴리-C 꼬리를 가질 수 있다.
또 다른 구체예에 따르면, 본 발명의 핵산 서열은 핵산 서열의 구아노신/시토신 (G/C) 함량을 변성시킴으로써 변성되고, 따라서 안정화될 수 있다.
본 발명의 특히 바람직한 구체예에서, 본 발명의 핵산 서열의 코딩 서열의 G/C 함량은 대응하는 야생형 핵산 서열, 즉 비변성 핵산의 코딩 서열의 G/C 함량과 비교하여, 변성되고 특히 증가된다. 핵산에 의해 인코딩된 아미노산 서열은 바람직하게는 대응하는 야생형 핵산에 의해 인코딩된 아미노산 서열과 비교하여 변성되지 않는다. 본 발명의 핵산 서열의 이러한 변성은 임의 핵산 영역의 서열, 특히 번역될 임의 RNA 영역의 서열이 해당 핵산, 특히 해당 RNA의 효율적인 번역에 중요하다는 사실에 기초한다. 따라서, 핵산의 조성과 다양한 뉴클레오타이드의 서열이 중요하다. 특히, RNA의 경우, 증가된 G (구아노신)/C (시토신) 함량을 갖는 서열이 증가된 A (아데노신)/U (우라실) 함량을 갖는 서열보다 더욱 안정하다. 따라서, 본 발명에 따르면, 핵산의 코돈은 대응하는 야생형 핵산과 비교하여 번역된 아미노산 서열을 유지하면서 증가된 양의 G/C 뉴클레오타이드를 포함하도록 변화된다. 여러 코돈이 하나의 동일한 아미노산을 인코딩한다는 사실(소위 유전자 코드의 퇴화)과 관련하여, 안정성을 위한 가장 유리한 코돈이 결정될 수 있다(소위 대체 코돈 사용법). 핵산에 의해 인코딩될 아미노산에 따라, 야생형 서열과 비교하여 핵산 서열의 변성에 대한 다양한 가능성이 존재한다.
이하의 변성은 RNA 분자에 적용될 수 있으며, 또한 DNA 분자로 전이될 수 있다: G 또는 C 뉴클레오타이드만을 배타적으로 함유하는 코돈에 의해 인코딩되는 아미노산의 경우, 코돈의 변성이 필요하지 않다. 따라서, A 또는 U가 없기 때문에 Pro (CCC 또는 CCG), Arg (CGC 또는 CGG), Ala (GCC 또는 GCG) 및 Gly (GGC 또는 GGG)에 대한 코돈은 변성이 필요하지 않다. 이와 대조적으로, A 및/또는 U 뉴클레오타이드를 함유하는 코돈은, 동일한 아미노산을 인코딩하지만 A 및/또는 U를 함유하지 않는 또 다른 코돈의 치환에 의해 변성될 수 있다. 이들의 예는 다음과 같다: Pro에 대한 코돈은 CCU 또는 CCA에서 CCC 또는 CCG로 변성될 수 있고; Arg에 대한 코돈은 CGU 또는 CGA 또는 AGA 또는 AGG에서 CGC 또는 CGG로 변성될 수 있고; Ala에 대한 코돈은 GCU 또는 GCA에서 GCC 또는 GCG로 변성될 수 있고; Gly에 대한 코돈은 GGU 또는 GGA에서 GGC 또는 GGG로 변성될 수 있다. 또 다른 경우, A 또는 U 뉴클레오타이드가 코돈에서 제거될 수 없음에도 불구하고, A 및/또는 U 뉴클레오타이드의 함량이 낮은 코돈을 사용하여 A 및 U 함량을 감소시킬 수 있다. 이들의 예는 다음과 같다: Phe에 대한 코돈은 UUU에서 UUC로 변성될 수 있고; Leu에 대한 코돈은 UUA, UUG, CUU 또는 CUA에서 CUC 또는 CUG로 변성될 수 있고; Ser에 대한 코돈은 UCU 또는 UCA 또는 AGU에서 UCC, UCG 또는 AGC로 변성될 수 있고; Tyr에 대한 코돈은 UAU에서 UAC로 변성될 수 있고; Cys에 대한 코돈은 UGU에서 UGC로 변성될 수 있고; His에 대한 코돈은 CAU에서 CAC로 변형 될 수 있고; Gln에 대한 코돈은 CAA에서 CAG로 변성될 수 있고; Ile에 대한 코돈은 AUU 또는 AUA에서 AUC로 변성될 수 있고; Thr에 대한 코돈은 ACU 또는 ACA에서 ACC 또는 ACG로 변성될 수 있고; Asn에 대한 코돈은 AAU에서 AAC로 변성될 수 있고; Lys에 대한 코돈은 AAA에서 AAG로 변성될 수 있고; Val에 대한 코돈은 GUU 또는 GUA에서 GUC 또는 GUG로 변성될 수 있고; Asp에 대한 코돈은 GAU에서 GAC로 변성될 수 있고; Glu에 대한 코돈은 GAA에서 GAG로 변성될 수 있고; 정지 코돈 UAA는 UAG 또는 UGA로 변성될 수 있다. 반면, Met (AUG) 및 Trp (UGG)에 대한 코돈의 경우, 서열 변성의 가능성은 없다. 상기 열거된 치환은 개별적으로 또는 가능한 모든 조합으로 사용되어 이의 특정 야생형 RNA(즉, 원래 서열)와 비교하여 본 발명의 RNA 서열의 G/C 함량을 증가시킬 수 있다. 따라서, 예를 들어, 야생형 서열에서 발생하는 Thr에 대한 모든 코돈은 ACC(또는 ACG)로 변성될 수 있다. 바람직하게는, 그러나, 예를 들면, 상기 치환 가능성의 조합이 사용된다:
- 원래의 서열(야생형 RNA)에서 Thr을 인코딩하는 모든 코돈의 ACC(또는 ACG)로의 치환 및
- 원래 Ser을 인코딩하는 모든 코돈의 UCC(또는 UCG 또는 AGC)로의 치환; 원래의 서열에서 Ile를 인코딩하는 모든 코돈의 AUC로의 치환 및
- 원래 Lys를 인코딩하는 모든 코돈의 AAG로의 치환 및
- 원래 Tyr를 인코딩하는 모든 코돈의 UAC로의 치환; 원래의 서열에서 Val를 인코딩하는 모든 코돈의 GUC(또는 GUG)로의 치환 및
- 원래 Glu를 인코딩하는 모든 코돈의 GAG로의 치환 및
- 원래 Ala를 인코딩하는 모든 코돈의 GCC(또는 GCG)로의 치환 및
- 원래 Arg를 인코딩하는 모든 코돈의 CGC(또는 CGG)로의 치환; 원래의 서열에서 Val를 인코딩하는 모든 코돈의 GUC(또는 GUG)로의 치환 및
- 원래 Glu를 인코딩하는 모든 코돈의 GAG로의 치환 및
- 원래 Ala를 인코딩하는 모든 코돈의 GCC(또는 GCG)로의 치환 및
- 원래 Gly를 인코딩하는 모든 코돈의 GGC(또는 GGG)로의 치환 및
- 원래 Asn를 인코딩하는 모든 코돈의 AAC로의 치환; 원래의 서열에서 Val를 인코딩하는 모든 코돈의 GUC(또는 GUG)로의 치환 및
- 원래 Phe를 인코딩하는 모든 코돈의 UUC로의 치환 및
- 원래 Cys를 인코딩하는 모든 코돈의 UGC로의 치환 및
- 원래 Leu를 인코딩하는 모든 코돈의 CUG(또는 CUC)로의 치환 및
- 원래 Gln를 인코딩하는 모든 코돈의 CAG로의 치환 및
- 원래 Pro를 인코딩하는 모든 코돈의 CCC(또는 CCG)로의 치환; 등.
특정 구체예에 따르면 여기서 정의된 펩티드 또는 단백질 또는 그 절편 또는 변이체 또는 야생형 RNA 서열의 전체 서열을 인코딩하는 영역에서 치환가능한 코돈의 적어도 5%, 10%, 20%, 30%, 40%, 50%, 60%, 더욱 바람직하게는 적어도 70 %, 심지어 더욱 바람직하게는 적어도 80% 및 가장 바람직하게는 적어도 90%, 95% 또는 심지어 100%가 치환되어, 이에 따라 상기 서열의 G/C 함량을 증가시킨다. 이와 관련하여, 본 발명의 RNA 서열, 바람직하게는 본 발명에 따르는 RNA 서열의 적어도 하나의 코딩 서열의 G/C 함량을 야생형 서열과 비교하여 최대치까지 (즉, 치환가능한 코돈의 100%) 증가시키는 것이 특히 바람직하다. 본 발명에 따르면, 본 발명의 RNA 서열의 또 다른 바람직한 변성은 번역 효율이 또한 세포에서 tRNA의 발생에 있어서 상이한 빈도에 의해 결정된다는 발견에 기초한다. 따라서, 소위 "희귀 코돈(rare codon)"이 본 발명의 RNA 서열에 증가된 정도로 존재하면, 상응하는 변성 RNA 서열은 비교적 "빈번한" tRNA를 인코딩하는 코돈이 존재하는 경우보다 현저히 빈약한 정도로 번역된다. 본 발명에 따르면, 본 발명의 변성 RNA 서열에서, 여기서 정의된 바와 같은 펩티드 또는 단백질 또는 그의 절편 또는 변이체를 인코딩하는 영역은 야생형 RNA 서열의 상응하는 영역과 비교하여 변성되어 이에 따라 세포에서 비교적 희귀한 tRNA를 인코딩하는 야생형 서열의 적어도 하나의 코돈은 세포에서 비교적 빈번하고 비교적 희귀한 tRNA와 동일한 아미노산을 갖는 tRNA를 인코딩하는 코돈으로 교환된다. 이러한 변성에 의해, 빈번하게 발생하는 tRNA가 이용가능한 코돈이 삽입되도록 본 발명의 RNA의 서열이 변성된다. 바꾸어 말하면, 본 발명에 따르면, 이러한 변성에 의해, 세포에서 비교적 희귀한 tRNA를 인코딩하는 야생형 서열의 모든 코돈은 각각의 경우에 세포에서 비교적 빈번하고 각각의 경우에 비교적 희귀한 tRNA와 동일한 아미노산을 갖는 tRNA를 인코딩하는 코돈으로 교환될 수 있다. 어떤 tRNA가 세포 내에서 상대적으로 빈번하게 발생하는지, 반대로, 상대적으로 드물게 발생하는지는 해당 분야의 통상의 기술자에게 공지되어 있다; 참조, 예컨대 Akashi, Curr. Opin. Genet. Dev. 2001, 11(6): 660-666. 특정 아미노산에 대하여 가장 빈번하게 일어나는 tRNA를 사용하는 코돈, 예컨대 Gly 코돈, (인간) 세포에서 가장 빈번하게 일어나는 tRNA를 사용하는 코돈이 특히 바람직하다. 본 발명에 따르면, 본 발명의 변성 RNA 서열에서 증가된, 특히 최대화된 결과적인 G/C 함량을, RNA 서열의 코딩 서열에 의해 인코딩된 단백질의 아미노산 서열을 변성시키지 않으면서 "빈번한" 코돈과 연결시키는 것이 특히 바람직하다. 이러한 바람직한 구체예는 본 발명의 특히 효율적으로 번역되고 안정화된 (변성) RNA 서열을 제공할 수 있게 한다. 상기 개시된 바와 같은 본 발명의 변성 RNA 서열의 결정(증가된 G/C 함량; tRNA의 교환)은 WO02/098443에서 설명된 컴퓨터 프로그램을 사용하여 수행될 수 있으며- 상기 문헌의 내용은 본 발명에 그 전체 범위가 포함된다. 이 컴퓨터 프로그램을 사용하여, 원하는 RNA 서열의 뉴클레오타이드 서열은 세포에서 가능한 빈번하게 발생하는 tRNA를 인코딩하는 코돈의 사용과 함께 유전자 코드 또는 그 퇴행성 특성의 도움으로 최대 G/C 함량이 얻어지도록 변성될 수 있으며, 변성 RNA 서열에 의해 인코딩된 아미노산 서열은 비-변성 서열과 비교하여 변성되지 않는다. 대안적으로, 원래 서열과 비교하여 G/C 함량만 변성시키거나 또는 코돈 사용만을 변성시킬수도 있다. Visual Basic 6.0의 소스 코드(사용된 개발 환경: Microsoft Visual Studio Enterprise 6.0 with Servicepack 3)가 또한 WO 02/098443에 개시된다. 본 발명의 또 다른 바람직한 구체예에서, 본 발명의 RNA 서열의 리보솜 결합 부위의 환경에서 A/U 함량은 그의 대응하는 야생형 RNA의 리보솜 결합 부위의 환경에서의 A/U 함량과 비교하여 증가된다. 이러한 변성(리보솜 결합 부위 주변의 증가된 A/U 함량)은 RNA에 대한 리보솜 결합의 효율을 증가시킨다. 리보솜 결합 부위(예컨대 Kozak 서열에 대한)에 대한 리보솜의 효과적인 결합은 RNA의 효율적인 번역의 효과를 갖는다. 본 발명의 또 다른 구체예에 따르면, 본 발명의 RNA 서열은 잠재적으로 불안정 서열 요소에 대해 변성될 수 있다. 특히, 이러한 RNA 서열의 5' 및/또는 3' 비번역 영역은 대응하는 야생형 RNA와 비교하여 변성될 수 있어, 이에 따라 불안정 서열 요소를 함유하지 않으며, 변성 RNA 서열의 인코딩된 아미노산 서열은 바람직하게는 그의 대응하는 야생형 RNA와 비교하여 변성되지 않는다. 예를 들어 진핵생물 RNA의 서열에서 불안정 서열 요소(DSE)가 발생하고 여기에 신호 단백질이 결합하여 생체 내에서 RNA의 효소 분해를 조절하는 것으로 알려져 있다. 변성 RNA 서열의 추가 안정화를 위해, 선택사항으로서 본 명세서에서 정의된 적어도 하나의 펩티드 또는 단백질 또는 그의 절편 또는 변이체를 인코딩하는 영역에서, 야생형 RNA의 상응하는 영역과 비교하여 하나 이상의 그러한 변성이 수행될 수 있어서, 이에 따라 불안정 서열 요소가 함유되지 않거나 실질적으로 함유되지 않는다. 본 발명에 따르면, 번역되지 않은 영역(3'- 및/또는 5'-UTR)에 존재하는 DSE는 또한 이러한 변성에 의해 본 발명의 RNA 서열로부터 제거될 수 있다. 이러한 불안정 서열은 예컨대 AU-풍부 서열(AURES)이며, 이는 많은 불안정한 RNA의 3'-UTR 섹션에서 일아난다(Caput et al., Proc. Natl. Acad. Sci. USA 1986, 83: 1670 to 1674). 따라서, 본 발명의 RNA 서열은 바람직하게는 대응하는 야생형 RNA와 비교하여 변성되고 이에 따라 본 발명의 RNA 서열은 그러한 불안정 서열을 함유하지 않는다. 이는 가능한 엔도뉴클레아제, 예컨대 트란스페린 수용체를 인코딩하는 유전자의 3'-UTR 세그먼트에 함유된 서열 GAACAAG에 의해 인식되는 이러한 서열 모티프에 적용된다(Binder et al., EMBO J. 1994, 13: 1969 to 1980). 이들 서열 모티프는 또한 바람직하게는 본 발명의 RNA 서열에서 제거된다.
또 다른 바람직한 구체예에 따르면, 본 발명의 문맥에서 사용된 mRNA는 바람직하게는 그 코딩 영역에서, G/C 함량이 변성되어 있으며, 이는 바람직하게는 인코딩된 아미노산 서열을 변화시키지 않으면서, 그의 대응하는 야생형 mRNA의 코딩 영역의 G/C 함량과 비교하여, 변성되고 특히 증가된다는 것을 의미한다. 예를 들면, 코딩 영역의 G/C 함량은 여기서 정의된 항원, 항원성 단백질 또는 항원성 펩티드, 또는 그 절편 또는 변이체를 인코딩하는 야생형 mRNA의 그것과 비교하여, 적어도 7 %, 또는 적어도 15 %, 또는 적어도 20 % 만큼 증가될 수 있다. 특정 구체예에 따르면, 코딩 영역 또는 전체 서열에서 치환가능한 코돈의 적어도 5 %, 10 %, 20 %, 30 %, 40 %, 50 %, 60 %, 70 %, 또는 80 %, 예컨대 90 % 또는 그 이상, 95 % 또는 그 이상, 또는 심지어 100 %가 치환되어 G/C 함량을 증가시킨다. 이와 관련하여, 100 % 치환은 코딩 영역의 치환가능한 실질적으로 모든 코돈이 치환됨을 의미하며, 이는 본 발명의 바람직한 구체예 중 하나이다. 또 다른 바람직한 구체예에서, mRNA가 사용되는데 여기서 세포 내에서 비교적 희귀한 tRNA를 인코딩하는 야생형 서열의 적어도 하나의 코돈이 세포 내에서 비교적 빈번하지만 상기 비교적 희귀한 tRNA와 동일한 아미노산을 인코딩하는 tRNA를 인코딩하는 코돈으로 교환되도록 코딩 영역이 변성된다. 세포 내에서 비교적 희귀하게 또는 빈번하게 발생하는 tRNA는 해당 분야의 통상의 기술자에게 공지되어 있다; 참조, 예컨대 Akashi, Curr. Opin. Genet. Dev. 2001, 11(6): 660-666. 특정 아미노산에 대해 가장 자주 발생하는 tRNA가 특히 선호된다.
또 다른 구체예에 따르면, 본 발명의 핵산 서열은 서열을 인간 코돈 사용에 적응시킴으로써 변성되고, 따라서 안정화될 수 있다.
본 발명에 따르면, 본 발명의 핵산 서열의 또 다른 바람직한 변성은 전형적으로 동일한 아미노산을 인코딩하는 코돈이 상이한 빈도로 발생한다는 발견에 기초한다. 본 발명에 따르면, 본 발명의 변성 핵산 서열에서, 여기서 정의된 바와 같은 코딩 서열은 바람직하게는 대응하는 야생형 핵산의 상응하는 코딩 서열과 비교하여 변성되어 동일한 아미노산을 인코딩하는 코돈의 빈도가 인간 코돈 사용에 따른 코돈의 자연 발생 빈도에 대응하며 이는 예컨대 표 B에 제시된다.
예를 들면, 본 발명에 따른 핵산 서열의 적어도 하나의 코딩 서열에 의해 인코딩되는 아미노산 서열에 존재하는 아미노산 알라닌(Ala)의 경우에, 상기 야생형 코딩 서열은 바람직하게는, 코돈 "GCC"가 0.40의 빈도로 사용되고, 코돈 "GCT"가 0.28의 빈도로 사용되고, 코돈 "GCA"가 0.22의 빈도로 사용되고 그리고 코돈 "GCG"가 0.10의 빈도로 사용되는 등의 방식으로 적용된다.(표 B 참조).
전술한 바와 같이 본 발명에 따르면, 이러한 변성에 의해, 세포에서 비교적 희귀한 tRNA를 인코딩하는 야생형 서열의 모든 코돈은 세포에서 비교적 빈번하고 각각의 경우에 비교적 희귀한 tRNA와 동일한 아미노산을 갖는 tRNA를 인코딩하는 코돈으로 교환될 수 있는 것이 바람직하다. 그러므로 가장 빈번한 코돈이 각각의 인코딩된 아미노산에 사용되는 것이 특히 바람직하다(표 B 참조, 가장 빈번한 코돈은 별표로 표시됨). 이러한 최적화 절차는 코돈 적응 지수(codon adaptation index, CAI)를 증가시키고 궁극적으로 CAI를 최대화시킨다. 본 발명과 관련하여, 증가되거나 최대화된 CAI를 갖는 서열은 전형적으로 "코돈-최적화된" 서열 및/또는 CAI 증가된 및/또는 최대화된 서열로 지칭된다. 바람직한 구체예에 따르면, 본 발명의 핵산 서열은 적어도 하나의 코딩 서열을 포함하며, 여기서 코딩 서열/서열은 여기서 정의된 바와 같이 코돈-최적화된다. 더욱 바람직하게는, 적어도 하나의 코딩 서열의 코돈 적응 지수(CAI)는 적어도 0.5, 적어도 0.8, 적어도 0.9 또는 적어도 0.95이다. 가장 바람직하게는, 적어도 하나의 코딩 서열의 코돈 적응 지수(CAI)는 1이다.
예를 들면, 본 발명에 따른 핵산 서열의 적어도 하나의 코딩 서열에 의해 인코딩된 아미노산 서열 내에 존재하는 아미노산 알라닌(Ala)의 경우, 야생형 코딩 서열은 가장 빈번한 인간 코돈 "GCC"가 항상 상기 아미노산, 또는 상기 아미노산 시스테인(Cys)에 대하여 사용되는 방식으로 적응되며, 야생형 서열은 가장 빈번한 인간 코돈 "TGC"가 항상 상기 아미노산에 대하여 사용되는 방식 등으로 적응된다.
또 다른 구체예에 따르면, 본 발명의 핵산 서열은 핵산 서열, 바람직하게는 핵산 서열의 코딩 서열, 더욱 바람직하게는 RNA 서열의 코딩 서열의 시토신(C) 함량을 변성시킴으로써, 바람직하게는 증가시킴으로써 변성될 수 있다.
본 발명의 특히 바람직한 구체예에서, 본 발명의 핵산 서열의 코딩 서열의 C 함량은 대응하는 야생형 핵산, 즉 비변성 핵산의 코딩 서열의 C 함량과 비교하여, 변성되고 바람직하게는 증가된다. 본 발명의 핵산 서열의 적어도 하나의 코딩 서열에 의해 인코딩된 아미노산 서열은 바람직하게는 대응하는 야생형 핵산에 의해 인코딩된 아미노산 서열과 비교하여 변성되지 않는다.
본 발명의 바람직한 구체예에서, 변성 핵산, 특히 변성 RNA 서열은, 이론적으로 가능한 최대 시토신-함량 또는 심지어 최대 시토신-함량의 적어도 10%, 20%, 30%, 40%, 50%, 60%, 70% 또는 80%, 또는 적어도 90%가 달성되도록 변성된다.
또 다른 바람직한 구체예에서, "시토신 함량 최적화가능한", 표적 핵산, 특히 변성 RNA 야생형 서열의 코돈의 적어도 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% 또는 심지어 100%가 야생형 서열에 존재하는 것보다 더 높은 시토신-함량을 갖는 코돈에 의해 대체된다.
또 다른 바람직한 구체예에서, 비교적 빈번한 tRNA에 대한 치환된 코돈이 원래의 야생형 코돈의 비교적 희귀한 tRNA와 동일한 아미노산을 갖는 경우, 야생형 코딩 서열의 코돈 중 일부는 추가로 변성되어, 세포 내에서 비교적 희귀한 tRNA에 대한 코돈이 세포 내에서 비교적 빈번한 tRNA에 대한 코돈에 의해 교환된다. 바람직하게는, 비교적 희귀한 tRNA에 대한 모든 코돈은, 시토신을 함유하지 않는 코돈에 의해 배타적으로 인코딩되는 아미노산을 인코딩하는 코돈을 제외하거나, 또는 각각 동일한 수의 시토신을 함유하는 두 개의 코돈에 의해 인코딩되는 글루타민(Gln)을 제외하고, 세포 내에서 비교적 빈번한 tRNA에 대한 코돈에 의해 대체된다.
본 발명의 또 다른 바람직한 구체예에서, 변성 표적 핵산, 바람직하게는 RNA는, 이론적으로 가능한 최대 시토신-함량 또는 심지어 최대 시토신-함량의 적어도 80%, 또는 적어도 90%가, 아미노산 서열을 변하지 않게 유지하면서 세포 내에서 비교적 빈번한 tRNA를 인코딩하는 코돈에 의해 달성되도록 변성된다.
유전자 코드의 자연 발생형 퇴화로 인해, 하나 초과의 코돈이 특정 아미노산을 인코딩할 수 있다. 따라서, 20 개 중 18 개의 자연 발생형 아미노산이 하나 초과의 코돈(Tryp 및 Met는 예외임)에 의해, 예컨대 2 개의 코돈에 의해(예컨대 Cys, Asp, Glu), 3 개의 코돈에 의해(예컨대 Ile), 4 개의 코돈에 의해(예컨대 Al, Gly, Pro) 또는 6 개의 코돈에 의해(예컨대 Leu, Arg, Ser) 인코딩된다. 그러나, 동일한 아미노산을 인코딩하는 모든 코돈이 생체 내 조건 하에서 동일한 빈도로 사용되는 것은 아니다. 각각의 단일 유기체에 따라, 전형적인 코돈 사용 프로파일이 확립된다.
본 발명의 문맥에서 사용되는 용어 '시토신 함량-최적화 가능한 코돈'은 동일한 아미노산을 인코딩하는 또 다른 코돈보다 시토신의 함량이 낮은 코돈을 말한다. 따라서, 동일한 아미노산을 인코딩하고 그 코돈 내에 시토신의 수가 더 많은 또 다른 코돈으로 대체될 수 있는 모든 야생형 코돈은 시토신-최적화가능(C-최적화가능)으로 간주된다. 야생형 코딩 서열 내의 특정 C-최적화 코돈에 의한 C- 최적화가능 야생형 코돈의 그러한 치환은 그의 전체 C-함유량을 증가시키고 C-풍부 변성 핵산 서열을 반영한다. 바람직한 구체예에 따르면, 핵산 서열, 특히 본 발명의 RNA 서열, 바람직하게는 본 발명의 핵산 서열의 적어도 하나의 코딩 서열은 모든 잠재적으로 C-최적화가능 코돈에 대한 C-최적화된 코돈을 함유하는 C-최대화된 RNA 서열을 포함하거나 이것으로 구성된다. 따라서, 이론적으로 대체가능한 C-최적화가능 코돈의 100 % 또는 전부는 바람직하게는 코딩 서열의 전체 길이에 걸쳐 C-최적화된 코돈에 의해 대체된다.
이와 관련하여, 시토신-함량 최적화가능 코돈은 동일한 아미노산을 인코딩하는 또 다른 코돈보다 적은 수의 시토신을 함유하는 코돈이다.
코돈 GCG, GCA, GCU 중 임의 코돈은 아미노산 Ala를 인코딩하며, 이는 동일한 아미노산을 인코딩하는 코돈 GCC에 의해 교환될 수 있으며, 및/또는
Cys를 인코딩하는 코돈 UGU는 동일한 아미노산을 인코딩하는 코돈 UGC에 의해 교환될 수 있으며, 및/또는
Asp를 인코딩하는 코돈 GAU는 동일한 아미노산을 인코딩하는 코돈 GAC에 의해 교환될 수 있으며, 및/또는
Phe를 인코딩하는 코돈 UUU는 동일한 아미노산을 인코딩하는 코돈 UUC에 의해 교환될 수 있으며, 및/또는
Gly를 인코딩하는 코돈 GGG, GGA, GGU 중 임의 것은 동일한 아미노산을 인코딩하는 코돈 GGC에 의해 교환될 수 있으며, 및/또는
His를 인코딩하는 코돈 CAU는 동일한 아미노산을 인코딩하는 코돈 CAC에 의해 교환될 수 있으며, 및/또는
Ile를 인코딩하는 코돈 AUA, AUU 중 임의 것은 코돈 AUC에 의해 교환될 수 있으며, 및/또는
Leu를 인코딩하는 코돈 UUG, UUA, CUG, CUA, CUU 중 임의 것은 동일한 아미노산을 인코딩하는 코돈 CUC에 의해 교환될 수 있으며, 및/또는
Asn를 인코딩하는 코돈 AAU는 동일한 아미노산을 인코딩하는 코돈 AAC에 의해 교환될 수 있으며, 및/또는
Pro를 인코딩하는 코돈 CCG, CCA, CCU 중 임의 것은 동일한 아미노산을 인코딩하는 코돈 CCC에 의해 교환될 수 있으며, 및/또는
Arg를 인코딩하는 코돈 AGG, AGA, CGG, CGA, CGU 중 임의 것은 동일한 아미노산을 인코딩하는 코돈 CGC에 의해 교환될 수 있으며, 및/또는
Ser을 인코딩하는 코돈 AGU, AGC, UCG, UCA, UCU 중 임의 것은 동일한 아미노산을 인코딩하는 코돈 UCC에 의해 교환될 수 있으며, 및/또는
Thr을 인코딩하는 코돈 ACG, ACA, ACU 중 임의 것은 동일한 아미노산을 인코딩하는 코돈 ACC에 의해 교환될 수 있으며, 및/또는
Val을 인코딩하는 코돈 GUG, GUA, GUU 중 임의 것은 동일한 아미노산을 인코딩하는 코돈 GUC에 의해 교환될 수 있으며, 및/또는
Tyr을 인코딩하는 코돈 UAU는 동일한 아미노산을 인코딩하는 코돈 UAC에 의해 교환될 수 있다.
위의 경우에서, 시토신의 수는 교환된 코돈 당 1 씩 증가한다. 코딩 서열의 모든 비(non) C-최적화된 코돈(C-최적화가능 코돈에 대응함)의 교환은 C-최대화된 코딩 서열을 산출한다. 본 발명과 관련하여, 본 발명에 따르는 RNA 서열의 적어도 하나의 코딩 서열 내의 비 C-최적화된 코돈의 적어도 70%, 바람직하게는 적어도 80%, 더욱 바람직하게는 적어도 90%가 C-최적화된 코돈에 의해 대체된다.
일부 아미노산에 대하여 C-최적화된 코돈에 의해 대체되는 C-최적화가능 코돈의 백분율이 70% 미만인 반면, 또 다른 아미노산에 대하여 대체된 코돈의 백분율이 70% 초과이어서 코딩 서열의 모든 C-최적화가능 야생형 코돈의 적어도 70%의 C-최대화의 전체 백분율을 만족시키는 것이 바람직할 수 있다.
바람직하게는, 본 발명의 C-최대화된 RNA 서열에서, 임의 주어진 아미노산에 대하여 C-최적화가능 야생형 코돈의 적어도 50%가 C-최적화된 코돈에 의해 대체되며, 예컨대 임의 변성 C-풍부 RNA 서열이 바람직하게는 상기 언급한 아미노산 Ala, Cys, Asp, Phe, Gly, His, Ile, Leu, Asn, Pro, Arg, Ser, Thr, Val 및 Tyr 중 임의 것을 인코딩하는 C-최적화가능 야생형 코돈 위치에서 적어도 50% C-최적화된 코돈, 바람직하게는 적어도 60%를 함유한다.
이러한 맥락에서 시토신 함량 최적화가 가능하지 않고 적어도 두 개 코돈으로 인코딩된 아미노산을 인코딩하는 코돈은 추가 선택 과정 없이 사용될 수 있다. 그러나, 세포, 예컨대 인간 세포 내에서 비교적 희귀한 tRNA를 인코딩하는 야생형 서열의 코돈은 세포 내에서 비교적 빈번한 tRNA를 인코딩하는 코돈으로 교환될 수 있으며, 둘 모두 동일한 아미노산을 인코딩한다. 따라서, Glu를 인코딩하는 비교적 희귀한 GAA는 동일한 아미노산을 인코딩하는 비교적 빈번한 코돈 GAG에 의해 교환될 수 있으며, 및/또는
Lys를 인코딩하는 비교적 희귀한 AAA는 동일한 아미노산을 인코딩하는 비교적 빈번한 코돈 AAG에 의해 교환될 수 있으며, 및/또는
Gln을 인코딩하는 비교적 희귀한 CAA는 동일한 아미노산을 인코딩하는 비교적 빈번한 코돈 CAG로 교환될 수 있다.
이와 관련하여, 각각 단지 하나의 코돈에 의해 인코딩되는 아미노산 Met(AUG) 및 Trp(UGG)는 변하지 않고 유지된다. 정지 코돈은 시토신-함량 최적화되어있지 않지만, 비교적 희귀한 정지 코돈 암버(amber), 오커(ochre) (UAA, UAG)가 비교적 빈번한 정지 코돈 오팔(opal)(UGA)에 의해 교환될 수 있다.
상기 나열된 단일 치환은 야생형 핵산 서열과 비교하여 변성 핵산 서열의 시토신-함량을 최적화하기 위해 가능한 모든 조합뿐만 아니라 개별적으로 사용될 수 있다.
따라서, 아미노산이 적어도 둘 이상의 코돈으로 인코딩되고 이들 코돈 중 하나가 하나의 추가 시토신을 포함하며 이러한 코돈은 하나의 추가 시토신을 포함하는 C-최적화된 코돈에 의해 교환될 수 있으며 여기서 아미노산은 바람직하게는 야생형 서열과 비교하여 변하지 않는 방식으로, 여기서 정의된 적어도 하나의 코딩 서열이 대응하는 야생형 핵산의 코딩 서열과 비교하여 교환될 수 있다.
또 다른 바람직한 구체예에 따르면, 본 발명의 핵산 서열, 특히 RNA 서열은 전형적으로 약 10 내지 200 개 아데노신 뉴클레오타이드, 바람직하게는 약 10 내지 100 개 아데노신 뉴클레오타이드, 더욱 바람직하게는 약 40 내지 80 개 아데노신 뉴클레오타이드 또는 심지어 더욱 바람직하게는 약 50 내지 70 개 아데노신 뉴클레오타이드의 3' 말단에서 폴리-A 코리를 함유할 수 있다.
바람직하게는, 본 발명의 RNA 서열 중의 폴리(A) 서열은 RNA 생체 외 전사에 의해 DNA 주형으로부터 유도된다. 폴리(A) 서열은 DNA-전구체로부터의 필수적 전사 없이 화학적-합성의 통상적인 방법에 의해 생체 외에도 수득될 수 있다. 또한, 폴리(A) 서열, 또는 폴리(A) 꼬리는 상업적으로 입수가능한 폴리아데닐화 키트 및 당업계에 공지된 상응하는 프로토콜을 사용하여 본 발명에 따른 RNA의 효소적 폴리아데닐화에 의해 생성될 수 있다.
대안적으로, 여기에 기술된 RNA는 선택사항으로서 폴리아데닐화 신호를 포함하며, 이는 여기서 특정 단백질 인자(예컨대 절단 및 폴리아데닐화 특이성 인자(CPSF), 절단 자극 인자(CstF), 절단 인자 I 및 II (CF I 및 CF II), 폴리(A) 폴리머라제(PAP))에 의해 (전사된) RNA로 폴리아데닐화를 전달하는 신호로서 정의된다. 이와 관련하여, NN(U/T)ANA 컨센서스 서열을 포함하는 컨센서스 폴리아데닐화 신호가 바람직하다. 특히 바람직한 양상에서, 폴리아데닐화 신호는 하기 서열 중 하나를 포함한다: AA(U/T)AAA 또는 A(U/T)(U/T)AAA (여기서 우리딘은 대개 RNA에 존재하며 티미딘은 대개 DNA에 존재한다).
또 다른 바람직한 구체예에 따르면, 본 발명의 핵산 서열, 특히 RNA 서열은 전형적으로 약 10 내지 200 개 시토신 뉴클레오타이드, 바람직하게는 약 10 내지 100 개 시토신 뉴클레오타이드, 더욱 바람직하게는 약 20 내지 70 개 시토신 뉴클레오타이드 또는 심지어 더욱 바람직하게는 약 20 내지 60 개 또는 심지어 약 10 내지 40 개 시토신 뉴클레오타이드의 3' 말단에서 폴리(C) 코리를 함유할 수 있다. 바람직하게는, 본 발명의 RNA 서열 중의 폴리(C) 서열은 RNA 생체 외 전사에 의해 DNA 주형으로부터 유도된다.
바람직한 구체예에서, 본 발명에 따른 핵산 서열, 특히 RNA 서열은 적어도 하나의 5'- 또는 3'-UTR 요소를 포함한다. 이와 관련하여, UTR 요소는 임의의 자연 발생 유전자의 5'- 또는 3'-UTR로부터 유도되거나 또는 유전자의 5'- 또는 3'-UTR의 절편, 동족체 또는 변이체로부터 유래된 핵산 서열을 포함하거나 이것으로 이루어진다. 바람직하게는, 본 발명에 따라 사용된 5'- 또는 3'-UTR 요소는 본 발명의 RNA 서열의 적어도 하나의 코딩 서열과 이종이다. 자연 발생 유전자로부터 유래된 5'- 또는 3'-UTR 요소가 바람직하더라도, 합성적으로 조작된 UTR 요소가 본 발명과 관련하여 사용될 수 있다.
용어 '3'UTR 요소'는 전형적으로 3'UTR 또는 3'UTR의 변이체로부터 유래된 핵산 서열을 포함하거나 핵산 서열로 이루어진 핵산 서열을 지칭한다. 본 발명의 의미에서 3'UTR 요소는 핵산 분자, 특히 RNA 또는 DNA, 바람직하게는 mRNA의 3'UTR을 나타낼 수 있다. 따라서, 본 발명의 견지에서, 바람직하게는, 3'UTR 요소는 RNA, 바람직하게는 mRNA의 3'UTR 일 수 있거나, 또는 이는 RNA의 3'UTR에 대한 전사 주형일 수 있다. 따라서, 3'UTR 요소는 바람직하게는 RNA의 3'UTR에 상응하는 핵산 서열, 바람직하게는 유전자 조작된 벡터 구조체의 전사에 의해 얻어진 mRNA와 같은 mRNA의 3'UTR에 상응하는 핵산 서열이다. 바람직하게는, 3'UTR은 3'UTR의 기능을 수행하거나 3'UTR의 기능을 수행하는 서열을 인코딩한다.
바람직하게는, 적어도 하나의 3'UTR 요소는 척색동물 유전자(chordate gene), 바람직하게는 척추동물 유전자(vertebrate gene), 더욱 바람직하게는 포유동물 유전자(mammalian gene), 가장 바람직하게는 인간 유전자의 3'UTR로부터 유래하거나, 또는 척색동물 유전자, 바람직하게는 척추동물 유전자, 더욱 바람직하게는 포유동물 유전자, 가장 바람직하게는 인간 유전자의 3'UTR의 변이체로부터 유래된 핵산 서열을 포함하거나 이것으로 구성된다.
바람직하게는, 본 발명의 핵산 서열, 특히 RNA 서열은 향상된 반감기(안정한 RNA를 제공함)를 갖는 RNA와 관련된 유전자로부터 유래될 수 있는 3'UTR 요소, 예를 들면 이하에서 정의되고 설명되는 3'UTR 요소를 포함한다. 바람직하게는, 3' UTR 요소는 바람직하게는 안정한 RNA를 인코딩하는 유전자의 3' UTR로부터 유래되거나, 또는 상기 유전자의 동족체, 절편 또는 변이체로부터 유래된 핵산 서열이다.
특히 바람직한 구체예에서, 3'UTR 요소는 알부민 유전자, 알파-글로빈 유전자, 베타-글로빈 유전자, 티로신 하이드록실라제 유전자, 리폭시게나제 유전자, 및 콜라겐 알파 유전자, 예컨대 콜라겐 알파 1(I) 유전자로 구성된 군으로부터 선택된 유전자의 3'UTR로부터 유래되거나, 또는 알부민 유전자, 알파-글로빈 유전자, 베타-글로빈 유전자, 티로신 하이드록실라제 유전자, 리폭시게나제 유전자, 및 콜라겐 알파 유전자, 예컨대 참조로 여기에 수록되는 특허 출원 WO2013/143700의 SEQ ID NO: 1369-1390에 따른 콜라겐 알파 1(I) 유전자로 구성된 군으로부터 선택된 유전자의 3'UTR의 변이체로부터 유래되거나, 또는 이의 동족체, 절편 또는 변이체로부터 유래되는 핵산 서열을 포함하거나 이것으로 구성된다. 특히 바람직한 구체예에서, 3'UTR 요소는 알부민 유전자, 바람직하게는 척추동물 알부민 유전자, 더욱 바람직하게는 포유동물 알부민 유전자, 가장 바람직하게는 인간 알부민 유전자의 3'UTR로부터 유래되는 핵산 서열을 포함하거나 이것으로 구성된다.
이와 관련하여 본 발명에 따르는 RNA 서열은 특허 출원 WO2013/143700의 SEQ ID NO: 1369-1390에 따르는 핵산, 또는 이의 절편, 동족체 또는 변이체로부터 유래된 대응하는 RNA 서열을 포함하는 3'-UTR 요소를 포함하는 것이 특히 바람직하다.
또 다른 특히 바람직한 구체예에서, 3'UTR 요소는 알파-또는 베타-글로빈 유전자, 바람직하게는 척추동물 알파-또는 베타-글로빈 유전자, 더욱 바람직하게는 포유동물 알파-또는 베타-글로빈 유전자, 가장 바람직하게는 인간 알파-또는 베타-글로빈 유전자의 3'UTR로부터 유래되는 핵산 서열을 포함하거나 이것으로 구성된다.
용어 '[...] 유전자의 3'UTR로부터 유래된 핵산 서열'은 바람직하게는 [...] 유전자의 3'UTR 서열 또는 그 일부에 기초한 핵산 서열, 예컨대 알부민 유전자, 알파-글로빈 유전자, 베타-글로빈 유전자, 티로신 하이드록실라제 유전자, 리폭시게나제 유전자, 또는 콜라겐 알파 유전자, 예컨대 콜라겐 알파 1(I) 유전자, 바람직하게는 알부민 유전자의 3'UTR 또는 그 일부에 기초한 핵산 서열을 의미한다. 이러한 용어는 전체 3'UTR 서열, 즉 유전자의 전체 길이 3'UTR 서열에 대응하는 서열을 포함하며, 유전자, 예컨대 알부민 유전자, 알파-글로빈 유전자, 베타-글로빈 유전자, 티로신 하이드록실라제 유전자, 리폭시게나제 유전자, 또는 콜라겐 알파 유전자, 예컨대 콜라겐 알파 1(I) 유전자, 바람직하게는 알부민 유전자의 3'UTR 서열의 절편에 대응하는 서열을 포함한다.
용어 '[...] 유전자의 3'UTR의 변이체로부터 유래된 핵산 서열'은 바람직하게는 유전자의 3'UTR의 변이체에 기초한, 예컨대 알부민 유전자, 알파-글로빈 유전자, 베타-글로빈 유전자, 티로신 하이드록실라제 유전자, 리폭시게나제 유전자, 또는 콜라겐 알파 유전자, 예컨대 콜라겐 알파 1(I) 유전자의 3'UTR의 변이체에 기초하거나 또는 전술한 바와 같이 그 일부에 기초한 핵산 서열을 의미한다. 이러한 용어는 유전자의 3'UTR의 변이체의 전체 서열, 즉 유전자의 전체 길이 변이체 3'UTR 서열에 상응하는 서열, 및 유전자의 변이체 3'UTR 서열의 절편에 상응하는 서열을 포함한다. 이와 관련하여 절편은 바람직하게는, 전체-길이 변이체 3'UTR의 적어도 20%, 바람직하게는 적어도 30%, 더욱 바람직하게는 적어도 40%, 더욱 바람직하게는 적어도 50%, 심지어 더욱 바람직하게는 적어도 60%, 심지어 더욱 바람직하게는 적어도 70%, 심지어 더욱 바람직하게는 적어도 80%, 및 가장 바람직하게는 적어도 90%를 나타내는, 전체-길이 변이체 3'UTR 중의 뉴클레오타이드의 연속 스트레치에 대응하는 뉴클레오타이드의 연속 스트레치로 구성된다. 본 발명의 의미에서 변이체의 그러한 절편은 바람직하게는 여기에 기재된 변이체의 기능적 절편을 포함한다.
바람직한 구체예에 따르면, 본 발명에 따른 핵산 서열, 특히 RNA 서열은 5'-캡 구조 및/또는 적어도 하나의 3'-비번역 영역 요소(3'-UTR 요소)를 포함하며, 바람직하게는 이하에서 정의된다. 더욱 바람직하게는, RNA는 여기서 정의된 5'-UTR 요소를 더욱 포함한다.
특히 바람직한 구체예에서, RNA 서열은 바람직하게는 5'-에서 3'-방향으로 다음을 포함한다:
a.)
5'-캡 구조, 바람직하게는 m7GpppN;
b.)
관심 단백질 또는 관심 펩티드 또는 이의 절편 또는 변이체로부터 유래된 적어도 하나의 항원성 펩티드 또는 단백질, 또는 이의 절편 또는 변이체를 인코딩하는 적어도 하나의 코딩 서열,
c.)
알파 글로빈 유전자, 이의 동족체, 절편 또는 변이체로부터 유래한 핵산 서열을 포함하거나 이것으로 구성된 3'-UTR 요소;
d.)
선택사항으로서, 바람직하게는 64 개 아데노신을 포함하는, 폴리(A) 서열;
e.)
선택사항으로서, 바람직하게는 30 개 시토신을 포함하는, 폴리(C) 서열; 및
특히 바람직한 구체예에서, 적어도 하나의 핵산 서열, 특히, RNA 서열은 적어도 하나의 5'-비번역 영역 요소(5'-UTR 요소)를 포함한다. 바람직하게는, 적어도 하나의 5'-UTR 요소는, TOP 유전자의 5'-UTR로부터 유래되거나 또는 TOP 유전자의 5'-UTR의 절편, 동족체 또는 변이체로부터 유래된 핵산 서열을 포함하거나 이것으로 구성된다.
5'-UTR 요소는 상기 정의된 TOP-모티프 또는 5'-TOP를 포함하지 않는 것이 특히 바람직하다.
일부 구체예에서, TOP 유전자의 5'-UTR로부터 유래된 5'-UTR 요소의 핵산 서열은 유전자 또는 이로부터 유래된 RNA의 시작 코돈(예컨대 A(U/T)G)의 상류에 있는 위치 1, 2, 3, 4, 5, 6, 7, 8, 9 또는 10에 위치한 뉴클레오타이드를 갖는 그의 3'- 말단에서 종결된다. 따라서, 5'-UTR 요소는 단백질 코딩 서열의 일부를 포함하지 않는다. 따라서, 바람직하게는, 적어도 하나의 핵산 서열, 특히 RNA 서열의 유일한 단백질 코딩 부분은 코딩 서열에 의해 제공된다.
TOP 유전자의 5'-UTR로부터 유래된 핵산 서열은 바람직하게는 진핵생물 TOP 유전자, 바람직하게는 식물 또는 동물 TOP 유전자, 더욱 바람직하게는 척색동물 TOP 유전자, 심지어 더욱 바람직하게는 척추동물 TOP 유전자, 가장 바람직하게는 포유동물 TOP 유전자, 예컨대 인간 TOP 유전자로부터 유래된다.
예를 들면, 5'-UTR 요소는 바람직하게는 핵산 서열을 포함하거나 이것으로 구성되는데, 이는 참조로 여기에 수록되는 특허 출원 WO2013/143700의 SEQ ID NO: 1-1363, SEQ ID NO: 1395, SEQ ID NO: 1421 및 SEQ ID NO: 1422로 구성된 군으로부터 선택된 핵산 서열로부터 유래하거나, 특허 출원 WO2013/143700의 SEQ ID NO: 1-1363, SEQ ID NO: 1395, SEQ ID NO: 1421 및 SEQ ID NO: 1422의 동족체로부터 유래하거나, 이의 변이체로부터 유래하거나, 또는 바람직하게는 대응하는 RNA 서열로부터 유래한다. 용어 "특허 출원 WO2013/143700의 SEQ ID NO: 1-1363, SEQ ID NO: 1395, SEQ ID NO: 1421 및 SEQ ID NO: 1422의 동족체"는 특허 출원 WO2013/143700의 SEQ ID NO: 1-1363, SEQ ID NO: 1395, SEQ ID NO. 1421 및 SEQ ID NO: 1422에 따르는 서열과 상동성이 있는, 호모 사피엔스 이외의 다른 종의 서열을 의미한다.
바람직한 구체예에서, 본 발명에 따르는 핵산 서열, 특히 RNA 서열의 5'-UTR 요소는 핵산 서열을 포함하거나 이것으로 구성되는데, 이는 특허 출원 WO2013/143700의 SEQ ID NO: 1-1363, SEQ ID NO: 1395, SEQ ID NO: 1421 및 SEQ ID NO: 1422로부터 선택되는 핵산 서열의, 5 위치에 있는 뉴클레오타이드(즉, 서열의 5 위치에 위치하는 뉴클레오타이드)로부터 시작 코돈(서열의 3' 말단에 위치함)의 5' 위치에 있는 뉴클레오타이드, 예컨대 ATG 서열의 5' 위치에 있는 뉴클레오타이드까지 연장되는 핵산 서열로부터, 특허 출원 WO2013/143700의 SEQ ID NOs: 1-1363, SEQ ID NO: 1395, SEQ ID NO: 1421 및 SEQ ID NO: 1422의 동족체로부터, 이의 변이체로부터, 또는 대응하는 RNA 서열로부터 유래된다. 5' UTR 요소는 특허 출원 WO2013/143700의 SEQ ID NO: 1-1363, SEQ ID NO: 1395, SEQ ID NO: 1421 및 SEQ ID NO: 1422로부터 선택되는 핵산 서열의, 5'-TOP의 3' 위치에 있는 뉴클레오타이드로부터 시작 코돈(서열의 3' 말단에 위치함)의 5' 위치에 있는 뉴클레오타이드, 예컨대 ATG 서열의 5' 위치에 있는 뉴클레오타이드까지 연장되는 핵산 서열로부터, 특허 출원 WO2013/143700의 SEQ ID NOs: 1-1363, SEQ ID NO: 1395, SEQ ID NO: 1421 및 SEQ ID NO: 1422의 동족체로부터, 이의 변이체로부터, 또는 대응하는 RNA 서열로부터 유래되는 것이 특히 바람직하다.
특히 바람직한 구체예에서, 5'-UTR 요소는 리보솜 단백질을 인코딩하는 TOP 유전자의 5'-UTR로부터 유래하거나 또는 리보솜 단백질을 인코딩하는 TOP 유전자의 5'-UTR의 변이체로부터 유래하는 핵산 서열을 포함하거나 이것으로 구성된다. 예를 들면, 5'-UTR 요소는 특허 출원 WO2013/143700의 SEQ ID NO: 67, 170, 193, 244, 259, 554, 650, 675, 700, 721, 913, 1016, 1063, 1120, 1138, 및 1284-1360에 따르는 핵산 서열, 대응하는 RNA 서열, 이의 동족체, 여기에 개시된 이의 변이체의 5'-UTR로부터 유래되는 핵산 서열을 포함하거나 이것으로 구성되며, 바람직하게는 5'-TOP 모티프가 없다. 전술한 바와 같이, 5 위치로부터 ATG(서열의 3'말단에 위치함)의 5' 위치에 있는 뉴클레오타이드까지 연장된 서열은 상기 서열의 5'-UTR에 상응한다.
바람직하게는, 5'-UTR 요소는 리보솜 거대 단백질(RPL)을 인코딩하는 TOP 유전자의 5'-UTR로부터 유래하거나 또는 리보솜 거대 단백질(RPL)을 인코딩하는 TOP 유전자의 5'-UTR의 동족체 또는 변이체로부터 유래하는 핵산 서열을 포함하거나 이것으로 구성된다. 예를 들면, 5'-UTR 요소는 특허 출원 WO2013/143700의 SEQ ID NOs: 67, 259, 1284-1318, 1344, 1346, 1348-1354, 1357, 1358, 1421 및 1422에 따르는 핵산 서열, 대응하는 RNA 서열, 이의 동족체, 여기에 개시된 이의 변이체의 5'-UTR로부터 유래되는 핵산 서열을 포함하거나 이것으로 구성되며, 바람직하게는 5'-TOP 모티프가 없다.
특히 바람직한 구체예에서, 5'-UTR 요소는 리보솜 단백질 거대 32 유전자, 바람직하게는 척추동물 리보솜 단백질 거대 32 (L32) 유전자, 더욱 바람직하게는 포유동물 리보솜 단백질 거대 32 (L32) 유전자, 가장 바람직하게는 인간 보솜 단백질 거대 32 (L32) 유전자의 5'-UTR로부터 유래하거나, 또는 리보솜 단백질 거대 32 유전자, 바람직하게는 척추동물 리보솜 단백질 거대 32 (L32) 유전자, 더욱 바람직하게는 포유동물 리보솜 단백질 거대 32 (L32) 유전자, 가장 바람직하게는 인간 리보솜 단백질 거대 32 (L32) 유전자의 5'UTR의 변이체로부터 유래하는 핵산 서열을 포함하거나 이것으로 구성되며, 여기서 바람직하게는 5'-UTR 요소는 상기 유전자의 5'-TOP를 포함하지 않는다.
따라서, 특히 바람직한 구체예에서, 5'-UTR 요소가 핵산 서열을 포함하거나 이것으로 구성되는데, 이는 SEQ ID NO: 13 (5' 말단 올리고피리미딘 트랙이 없는 인간 리보솜 단백질 거대 32의 5'-UTR: GGCGCTGCCTACGGAGGTGGCAGCCATCTCCTTCTCGGCATC; 특허 출원 WO 2013/143700의 SEQ ID No. 1368에 대응함)에 따르는 핵산 서열에 대하여, 바람직하게는 대응하는 RNA 서열에 대하여 적어도 약 40%, 바람직하게는 적어도 약 50%, 바람직하게는 적어도 약 60%, 바람직하게는 적어도 약 70%, 더욱 바람직하게는 적어도 약 80%, 더욱 바람직하게는 적어도 약 90%, 더욱 더 바람직하게는 적어도 약 95%, 더욱 더 바람직하게는 적어도 약 99%의 동일성을 갖거나, 또는 적어도 하나의 5'UTR 요소가 핵산 서열의 절편을 포함하거나 이것으로 구성되는데, 이는 전술한 서열의 핵산 서열에 대하여 적어도 약 40 %, 바람직하게는 적어도 약 50 %, 바람직하게는 적어도 약 60 %, 바람직하게는 적어도 약 70 %, 더욱 바람직하게는 적어도 약 80 %, 더욱 바람직하게는 적어도 약 90 %, 더욱 더 바람직하게는 적어도 약 95 %, 더욱 더 바람직하게는 적어도 약 99 %의 동일성을 가지며, 여기서 바람직하게는, 절편은 전술한 바와 같은데, 즉 전체-길이 5'UTR의 적어도 20% 등을 나타내는 뉴클레오타이드의 연속적 스트레치이다. 바람직하게는, 절편은 적어도 약 20 개 뉴클레오타이드 또는 그 이상, 바람직하게는 적어도 약 30 개 뉴클레오타이드 또는 그 이상, 더욱 바람직하게는 적어도 약 40 개 뉴클레오타이드 또는 그 이상의 길이를 나타낸다. 바람직하게는, 절편은 여기서 기재한 바와 같이 기능적 절편이다.
일부 구체예에서, 본 발명에 따르는 RNA 서열은 포유동물, 예를 들어 RPSA, RPS2, RPS3, RPS3A, RPS4, RPS5, RPS6, RPS7, RPS8, RPS9, RPS10, RPS11, RPS12, RPS13, RPS14, RPS15, RPS15A, RPS16, RPS17, RPS18, RPS19, RPS20, RPS21, RPS23, RPS24, RPS25, RPS26, RPS27, RPS27A, RPS28, RPS29, RPS30, RPL3, RPL4, RPL5, RPL6, RPL7, RPL7A, RPL8, RPL9, RPL10, RPL10A, RPL11, RPL12, RPL13, RPL13A, RPL14, RPL15, RPL17, RPL18, RPL18A, RPL19, RPL21, RPL22, RPL23, RPL23A, RPL24, RPL26, RPL27, RPL27A, RPL28, RPL29, RPL30, RPL31, RPL32, RPL34, RPL35, RPL35A, RPL36, RPL36A, RPL37, RPL37A, RPL38, RPL39, RPL40, RPL41, RPLP0, RPLP1, RPLP2, RPLP3, RPLP0, RPLP1, RPLP2, EEF1A1, EEF1B2, EEF1D, EEF1G, EEF2, EIF3E, EIF3F, EIF3H, EIF2S3, EIF3C, EIF3K, EIF3EIP, EIF4A2, PABPC1, HNRNPA1, TPT1, TUBB1, UBA52, NPM1, ATP5G2, GNB2L1, NME2, UQCRB, 또는 이의 동족체 또는 변이체로부터 선택되는 인간 TOP 유전자와 같은 척추동물 TOP 유전자의 5'-UTR로부터 유래된 핵산 서열을 포함하거나 이것으로 구성된 5'-UTR 요소를 포함하며, 여기서 바람직하게는 5'-UTR 요소는 상기 유전자의 TOP-모티프 또는 5'-TOP를 포함하지 않으며, 여기서 선택사항으로서 5'-UTR 요소는 5'-종결 올리고피리미딘 트랙(TOP)의 하류에 있는 위치 1, 2, 3, 4, 5, 6, 7, 8, 9 또는 10에 위치한 뉴클레오타이드를 갖는 이의 5'-말단에서 시작하며, 여기서 추가 선택사항으로서, TOP 유전자의 5'-UTR로부터 유래된 5'UTR 요소는 이로부터 유래된 유전자의 시작 코돈(A(U/T)G)의 상류에 있는 위치 1, 2, 3, 4, 5, 6, 7, 8, 9 또는 10에 위치한 뉴클레오타이드를 갖는 이의 3'-말단에서 종결한다.
또 다른 특히 바람직한 구체예에서, 5'-UTR 요소는 리보솜 단백질 거대 32 유전자(RPL32), 리보솜 단백질 거대 35 유전자(RPL35), 리보솜 단백질 거대 21 유전자(RPL21), ATP 합성효소, H+ 수송(transporting), 미토콘드리아 F1 복합체, 알파 서브유닛 1, 심근 (ATP5A1) 유전자, 하이드록시스테로이드 (17-베타) 디하이드로게나아제 4 유전자(HSD17B4), 안드로겐-유도된 1 유전자(AIG1), 시토크롬 c 옥시다아제 서브유닛 VIc 유전자(COX6C), 또는 N-아실스핑고신 아미도하이드롤라아제(애시드 세라미다아제) 1 유전자 (ASAH1)의 5'-UTR로부터 또는 이의 변이체로부터, 바람직하게는 척추동물 리보솜 단백질 거대 32 유전자(RPL32), 척추동물 리보솜 단백질 거대 35 유전자 (RPL35), 척추동물 리보솜 단백질 거대 21 유전자(RPL21), 척추동물 ATP 합성효소, H+ 수송, 미토콘드리아 F1 복합체, 알파 서브유닛 1, 심근 (ATP5A1) 유전자, 척추동물 하이드록시스테로이드 (17-베타) 디하이드로게나아제 4 유전자(HSD17B4), 척추동물 안드로겐-유도된 1 유전자(AIG1), 척추동물 시토크롬 c 옥사다아제 서브유닛 VIc 유전자(COX6C), 또는 척추동물 N-아실스핑고신 아미도하이드롤라아제(애시드 세라미다아제) 1 유전자 (ASAH1)로부터 또는 이의 변이체로부터, 더욱 바람직하게는 포유동물 리보솜 단백질 거대 32 유전자(RPL32), 리보솜 단백질 거대 35 유전자(RPL35), 리보솜 단백질 거대 21 유전자(RPL21), 포유동물 ATP 합성효소, H+ 수송, 미토콘드리아 F1 복합체, 알파 서브유닛 1, 심근 (ATP5A1) 유전자, 포유동물 하이드록시스테로이드 (17-베타) 디하이드로게나아제 4 유전자(HSD17B4), 포유동물 안드로겐 유도된 1 유전자(AIG1), 포유동물 시토크롬 c 옥사다아제 서브유닛 VIc 유전자(COX6C), 또는 포유동물 N-아실스핑고신 아미도하이드롤라아제(애시드 세라미다아제) 1 유전자(ASAH1)로부터 또는 이의 변이체로부터, 가장 바람직하게는 인간 리보솜 단백질 거대 32유전자(RPL32), 인간 리보솜 단백질 거대 35 유전자(RPL35), 인간 리보솜 단백질 거대 21 유전자(RPL21), 인간 ATP 합성효소, H+ 수송, 미토콘드리아 F1 복합체, 알파 서브유닛 1, 심근 (ATP5A1) 유전자, 인간 하이드록시스테로이드 (17-베타) 디하이드로게나아제 4 유전자(HSD17B4), 인간 안드로겐 유도된 1 유전자(AIG1), 인간 시토크롬 c 옥사다아제 서브유닛 VIc 유전자(COX6C), 또는 인간 N-아실스핑고신 아미도하이드롤라아제(애시드 세라미다아제) 1 유전자(ASAH1)로부터 또는 이의 변이체로부터 유래된 핵산 서열을 포함하거나 이로 이루어지며, 여기서 바람직하게 5'-UTR 요소는 상기 유전자의 5'TOP를 포함하지 않는다.
따라서, 특히 바람직한 구체예에서, 5'-UTR 요소가 핵산 서열을 포함하거나 이것으로 구성되는데, 이는 특허 출원 WO2013/143700의 SEQ ID NO: 1412-1420에 따르는 핵산 서열에 대하여, 또는 대응하는 RNA 서열에 대하여 적어도 약 40%, 바람직하게는 적어도 약 50%, 바람직하게는 적어도 약 60%, 바람직하게는 적어도 약 70%, 더욱 바람직하게는 적어도 약 80%, 더욱 바람직하게는 적어도 약 90%, 더욱 더 바람직하게는 적어도 약 95%, 더욱 더 바람직하게는 적어도 약 99%의 동일성을 갖거나, 또는 적어도 하나의 5'UTR 요소가 핵산 서열의 절편을 포함하거나 이것으로 구성되는데 이는 특허 출원 WO2013/143700의 SEQ ID NOs: 1412-1420에 따르는 핵산 서열에 대하여 적어도 약 40%, 바람직하게는 적어도 약 50%, 바람직하게는 적어도 약 60%, 바람직하게는 적어도 약 70%, 더욱 바람직하게는 적어도 약 80%, 더욱 바람직하게는 적어도 약 90%, 더욱 더 바람직하게는 적어도 약 95%, 더욱 더 바람직하게는 적어도 약 99%의 동일성을 가지며, 여기서 바람직하게는, 절편은 전술한 바와 같은데, 즉 전체-길이 5'UTR의 적어도 20% 등을 나타내는 뉴클레오타이드의 연속적 스트레치이다. 바람직하게는, 절편은 적어도 약 20 개 뉴클레오타이드 또는 그 이상, 바람직하게는 적어도 약 30 개 뉴클레오타이드 또는 그 이상, 더욱 바람직하게는 적어도 약 40 개 뉴클레오타이드 또는 그 이상의 길이를 나타낸다. 바람직하게는, 절편은 여기서 기재한 바와 같이 기능적 절편이다.
따라서, 특히 바람직한 구체예에서, 5'-UTR 요소가 핵산 서열을 포함하거나 이것으로 구성되는데, 이는 SEQ ID NO: 14 (5' 말단 올리고피리미딘 트랙이 없는 ATP5A1의 5'-UTR: GCGGCTCGGCCATTTTGTCCCAGTCAGTCCGGAGGCTGCGGCTGCAGAAGTACCGCCTGCGGAGTAACTGCAAAG; 특허 출원 WO 2013/143700의 SEQ ID No. 1414에 대응함)에 따르는 핵산 서열에 대하여, 바람직하게는 대응하는 RNA 서열에 대하여 적어도 약 40%, 바람직하게는 적어도 약 50%, 바람직하게는 적어도 약 60%, 바람직하게는 적어도 약 70%, 더욱 바람직하게는 적어도 약 80%, 더욱 바람직하게는 적어도 약 90%, 더욱 더 바람직하게는 적어도 약 95%, 더욱 더 바람직하게는 적어도 약 99%의 동일성을 갖거나, 또는 적어도 하나의 5'UTR 요소가 핵산 서열의 절편을 포함하거나 이것으로 구성되는데, 이는 전술한 핵산 서열에 대하여 적어도 약 40 %, 바람직하게는 적어도 약 50 %, 바람직하게는 적어도 약 60 %, 바람직하게는 적어도 약 70 %, 더욱 바람직하게는 적어도 약 80 %, 더욱 바람직하게는 적어도 약 90 %, 더욱 더 바람직하게는 적어도 약 95 %, 더욱 더 바람직하게는 적어도 약 99 %의 동일성을 가지며, 여기서 바람직하게는, 절편은 전술한 바와 같은데, 즉 전체-길이 5'UTR의 적어도 20 % 등을 나타내는 뉴클레오타이드의 연속적 스트레치이다. 바람직하게는, 절편은 적어도 약 20 개 뉴클레오타이드 또는 그 이상, 바람직하게는 적어도 약 30 개 뉴클레오타이드 또는 그 이상, 더욱 바람직하게는 적어도 약 40 개 뉴클레오타이드 또는 그 이상의 길이를 나타낸다. 바람직하게는, 절편은 여기서 기재한 바와 같이 기능적 절편이다.
바람직하게는, 적어도 하나의 5'-UTR 요소 및 적어도 하나의 3'UTR 요소는 전술한 적어도 하나의 RNA 서열로부터 단백질 생산을 증가시키기 위해 상승효과적으로(synergistically) 작용한다.
특히 바람직한 구체예에 따르면 본 발명에 다른 RNA 서열은 바람직하게는 5'-에서 3'-방향으로 다음을 포함한다:
a.)
5'-캡 구조, 바람직하게는 m7GpppN;
b.)
TOP 유전자의 5'-UTR, 이의 동족체, 절편 또는 변이체로부터 유래한 핵산 서열을 포함하거나 이것으로 구성된 5'-UTR 요소;
b.)
관심 단백질 또는 관심 펩티드 또는 이의 절편 또는 변이체로부터 유래된 적어도 하나의 항원성 펩티드 또는 단백질을 인코딩하는 적어도 하나의 코딩 서열,
c.)
안정한 RNA, 이의 동족체, 절편 또는 변이체를 제공하는 유전자로부터 유래된 핵산 서열을 포함하거나 이것으로 구성된 3'-UTR 요소;
e.)
선택사항으로서, 바람직하게는 64 개 아데노신을 포함하는 폴리(A) 서열; 및
f.)
선택사항으로서, 바람직하게는 30 개 시토신을 포함하는, 폴리(C) 서열.
특히 바람직한 구체예에서, 본 발명에 따라 사용된 핵산 서열, 특히 RNA 서열은 히스톤 줄기-루프 서열/구조를 포함한다. 이러한 히스톤 줄기-루프 서열은 바람직하게는 WO 2012/019780에 개시된 히스톤 줄기-루프 서열로부터 선택되며, 상기 문헌은 참조로 여기에 수록된다.
본 발명에서 사용되기에 적합한 히스톤 줄기-루프 서열은 하기 화학식 VII 또는 VII 중 적어도 하나로부터 선택된다:
여기서:
줄기1 또는 줄기2 경계 요소 N1-6 은 1 내지 6 개, 바람직하게는 2 내지 6 개, 더욱 바람직하게는 2 내지 5 개, 더욱 더 바람직하게는 3 내지 5 개, 가장 바람직하게는 4 내지 5 개 또는 5 개 N의 연속적인 서열이며, 여기서 각각의 N은 A, U, T, G 및 C로부터 선택되는 뉴클레오타이드, 또는 이의 뉴클레오타이드 유사체로부터 서로 독립적으로 선택되고;
줄기1 [N0-2GN3-5]는 요소 줄기2와 역상보적 또는 부분적으로 역상보적이며, 5 내지 7 개 뉴클레오타이드들 사이의 연속적인 서열이고;
여기서 N0-2은 0 내지 2 개, 바람직하게는 0 내지 1 개, 더욱 바람직하게는 1 개 N의 연속적인 서열이며, 여기서 각각의 N은 A, U, T, G 및 C로부터 선택되는 뉴클레오타이드, 또는 이의 뉴클레오타이드 유사체로부터 서로 독립적으로 선택되고;
여기서 N3-5은 3 내지 5 개, 바람직하게는 4 내지 5 개, 더욱 바람직하게는 4 개 N의 연속적인 서열이며, 여기서 각각의 N은 A, U, T, G 및 C로부터 선택되는 뉴클레오타이드, 또는 이의 뉴클레오타이드 유사체로부터 서로 독립적으로 선택되고; 그리고
여기서 G는 구아노신 또는 이의 유사체이며, 그리고 선택사항으로서 만약 줄기2에서 그것의 상보적인 뉴클레오타이드 시티딘이 구아노신으로 치환되면, 시티딘 또는 이의 유사체로 치환될 수 있고;
루프 서열 [N0-4(U/T)N0-4]는 요소 줄기1 및 줄기2 사이에 위치하며, 3 내지 5 개 뉴클레오타이드, 더욱 바람직하게는 4 개 뉴클레오타이드의 연속적인 서열이고;
여기서 각각의 N0-4은 0 내지 4 개, 바람직하게는 1 내지 3 개, 더욱 바람직하게는 1 내지 2 개 N의 또 다른 연속적인 서열로부터 독립적으로 선택되며, 여기서 각각의 N은 A, U, T, G 및 C로부터 선택되는 뉴클레오타이드 또는 이의 뉴클레오타이드 유사체로부터 서로 독립적으로 선택되고; 그리고
여기서 U/T 는 우리딘, 또는 선택적사항으로서 티미딘을 나타내고;
줄기2 [N3-5CN0-2]는 요소 줄기1과 역상보적 또는 부분적으로 역상보적이며, 5 내지 7 개 뉴클레오타이드들 사이의 연속적인 서열이고;
여기서 N3-5은 3 내지 5 개, 바람직하게는 4 내지 5 개, 더욱 바람직하게는 4 개 N의 연속적인 서열이며, 여기서 각각의 N은 A, U, T, G 및 C로부터 선택되는 뉴클레오타이드, 또는 이의 뉴클레오타이드 유사체로부터 서로 독립적으로 선택되고;
여기서 N0-2은 0 내지 2 개, 바람직하게는 0 내지 1 개, 더욱 바람직하게는 1 개 N의 연속적인 서열이며, 여기서 각각의 N은 A, U, T, G 또는 C로부터 선택되는 뉴클레오타이드, 또는 이의 뉴클레오타이드 유사체로부터 서로 독립적으로 선택되고; 그리고
여기서 C는 시티딘 또는 이의 유사체이며, 그리고 선택사항으로서 만약 줄기1에서 그것의 상보적인 뉴클레오사이드 구아노신이 시티딘으로 치환되면, 구아노신 또는 이의 유사체로 치환될 수 있고;
여기서 줄기1 및 줄기2는 역상보적 서열을 형성하면서 서로 염기 페어링을 할 수 있으며, 여기서 염기 페어링은 줄기1 및 줄기2 사이에서 발생할 수 있으며, 예를 들어, 뉴클레오타이드 A 및 U/T 또는 G 및 C의 왓슨-크릭(Watson-Crick) 염기 페어링에 의해 또는 예를 들어, 워블(wobble) 염기 페어링, 역(reverse) 왓슨-크릭(Watson-Crick) 염기 페어링, 후그스틴(Hoogsteen) 염기 페어링, 역 후그스틴(Hoogsteen) 염기 페어링와 같은 비-왓슨-크릭(Watson-Crick) 염기 페어링에 의해 발생할 수 있거나 또는 부분적으로 역상보적 서열을 형성하면서 서로 염기 페어링를 할 수 있으며, 하나의 줄기에서 하나 이상의 염기들은 다른 줄기의 역상보적 서열에서 상보적인 염기를 갖지 않음에 기초하여, 상기 불완전한 염기 페어링는 줄기1 및 줄기2 사이에서 발생할 수 있다.
또 다른 바람직한 구체예에 따르면, 핵산 서열, 특히 RNA 서열은 하기 특정 화학식 VIIa 또는 VIIIa 중 적어도 하나에 따른 적어도 하나의 히스톤 줄기-루프 서열을 포함할 수 있다:
여기서 N, C, G, T 및 U는 앞서 정의된 바와 같다.
또 다른 더욱 특히 바람직한 구체예에 따르면, 적어도 하나의 핵산, 바람직하게는 적어도 하나의 RNA는 하기 특정 화학식 VIIb 또는 VIIIb 중 적어도 하나에 따른 적어도 하나의 히스톤 줄기-루프 서열을 포함할 수 있다:
여기서 N, C, G, T 및 U는 앞서 정의된 바와 같다.
특히 바람직한 히스톤 줄기-루프 서열은 서열 CAAAGGCTCTTTTCAGAGCCACCA (SEQ ID NO: 15에 따름) 또는 더욱 바람직하게는 대응하는 RNA 서열 CAAAGGCUCUUUUCAGAGCCACCA (SEQ ID NO: 16에 따름)이다.
모든 상기 변성은 본 발명의 핵산 서열, 특히 DNA 및/또는 RNA 서열에 적용될 수 있고, 또한 본 발명과 관련하여 사용되는 임의의 DNA 또는 RNA에 적용될 수 있으며, 적합하거나 필요한 경우, 임의의 조합으로 서로 결합될 수 있으며, 이들 변성의 조합은 각각의 핵산 서열에서 서로 간섭하지 않는다. 통상의 기술자는 이에 따라 그의 선택을 취할 수 있을 것이다.
본 발명에 따른 핵산 서열, 특히 여기에 정의된 적어도 하나의 코딩 서열을 포함하는 본 발명에 따른 RNA 서열은 바람직하게는 적어도 하나의 히스톤 줄기-루프를 함유하는 5' UTR 및/또는 3' UTR을 포함할 수 있다. 본 발명에 따르는 RNA 서열의 3' UTR은 여기서 정의된 폴리(A) 및/또는 폴리(C) 서열을 또한 포함한다. 3' UTR의 단일 요소는 본 발명의 RNA 서열의 서열을 따라 5 '에서 3'까지 임의의 순서로 거기에서 발생할 수 있다. 또한, 여기에 정의된 또 다른 요소, 예컨대 여기에 정의된 안정화 서열(예컨대 글로빈 유전자의 UTR로부터 유래 된 것), IRES 서열 등이 또한 함유될 수 있다. 각 요소는 또한 본 발명에 따른 RNA 서열에서 적어도 1회(특히, 디- 또는 멀티시스트론성 구조체에서), 바람직하게는 2 회 이상 반복될 수 있다. 예로서, 단일 요소는 핵산 서열, 특히 본 발명에 따른 RNA 서열에서 다음의 순서로 존재할 수있다:
5' - 코딩 서열 - 히스톤 줄기-루프 - 폴리(A)/(C) 서열 - 3'; 또는
5' - 코딩 서열 - 폴리(A)/(C) 서열 - 히스톤 줄기-루프 - 3'; 또는
5' - 코딩 서열 - 히스톤 줄기-루프 - 폴리아데닐화 신호 - 3'; 또는
5' - 코딩 서열 - 폴리아데닐화 신호- 히스톤 줄기-루프 - 3'; 또는
5' - 코딩 서열 - 히스톤 줄기-루프 - 히스톤 줄기-루프 - 폴리(A)/(C) 서열 - 3'; 또는
5' - 코딩 서열 - 히스톤 줄기-루프 - 히스톤 줄기-루프 - 폴리아데닐화 신호- 3'; 또는
5' - 코딩 서열 - 안정화 서열 - 폴리(A)/(C) 서열 - 히스톤 줄기-루프 - 3'; 또는
5' - 코딩 서열 - 안정화 서열 - 폴리(A)/(C) 서열 - 폴리(A)/(C) 서열 - 히스톤 줄기-루프 - 3'; 등.
또 다른 구체예에 따르면, 본 발명에서 사용되는 핵산 서열, 특히 RNA 서열은, 바람직하게는 하기 구조적 요소 중 적어도 하나를 포함한다: 5'- 및/또는 3'- 비번역 영역 요소(UTR 요소), 특히 TOP 유전자의 5'-UTR로부터 또는 이의 절편, 동족체 또는 변이체로부터 유래된 핵산 서열을 포함하거나 이로 이루어진 5'-UTR 요소, 또는 바람직하게는 안정한 RNA를 제공하는 유전자로부터, 또는 이의 동족체, 절편 또는 변이체로부터 유래할 수 있는 5'- 및/또는 3'-UTR 요소; 히스톤-줄기-루프 구조, 바람직하게는 이의 3' 비번역 영역 내 히스톤-줄기-루프; 5'-캡(CAP) 구조; 폴리-A 꼬리; 또는 폴리(C) 서열.
특히 바람직한 구체예에서, 핵산 서열, 특히, RNA 서열은 바람직하게는 5'-에서 3'-방향으로 다음을 포함한다:
a.)
5'-캡 구조, 바람직하게는 m7GpppN;
b.)
관심대상인 적어도 하나의 항원성 펩티드 또는 관심 단백질 또는 이의 절편 또는 변이체를 인코딩하는 적어도 하나의 코딩 서열,
c.)
알파 글로빈 유전자, 이의 동족체, 절편 또는 변이체로부터 유래한 핵산 서열을 포함하거나 이것으로 구성된 3'-UTR 요소;
d.)
선택사항으로서, 바람직하게는 64 개 아데노신을 포함하는, 폴리(A) 서열;
e.)
선택사항으로서, 바람직하게는 30 개 시토신을 포함하는, 폴리(C) 서열; 및
f.)
선택사항으로서, 바람직하게는 SEQ ID NO: 16에 따른 RNA 서열을 포함하는, 히스톤 줄기-루프.
또 다른 특히 바람직한 구체예에 따르면, 핵산 서열, 특히, 본 발명에 따라 사용되는 RNA 서열은 바람직하게는 5'-에서 3'-방향으로 다음을 포함한다:
a.)
5'-캡 구조, 바람직하게는 m7GpppN;
b.)
TOP 유전자의 5'-UTR, 이의 동족체, 절편 또는 변이체로부터 유래한 핵산 서열을 포함하거나 이것으로 구성된 5'-UTR 요소;
c.)
관심대상인 적어도 하나의 항원성 펩티드 또는 관심 단백질 또는 이의 절편 또는 변이체를 인코딩하는 적어도 하나의 코딩 서열,
d.)
안정한 RNA를 제공하는 유전자로부터 유래된 핵산 서열을 포함하거나 이것으로 구성된 3'-UTR 요소;
e.)
선택사항으로서, 바람직하게는 64 개 아데노신을 포함하는 폴리(A) 서열;
f.)
선택사항으로서, 바람직하게는 30 개 시토신을 포함하는, 폴리(C) 서열; 및
선택사항으로서, 바람직하게는 SEQ ID NO: 16에 따른 RNA 서열을 포함하는, 히스톤 줄기-루프.
본 발명에 따라 사용된 핵산은 해당 업계에 공지된 임의의 방법에 의해 제조될 수 있으며, 예를 들어, 고체상 합성뿐만 아니라 생체 외 전사 반응 또는 생체 내 반응과 같은 생체 외 방법, 예컨대 박테리아에서의 DNA 플라스미드의 증식을 포함한다.
또 다른 바람직한 구체예에 따르면, 핵산은 코딩 핵산의 형태이고, 바람직하게는 분비성 신호 펩티드를 부가적으로 또는 대안적으로 인코딩하는 mRNA의 형태이다. 이러한 신호 펩티드는 전형적으로 약 15 내지 30 개 아미노산의 길이를 나타내고, 바람직하게는 인코딩된 펩티드의 N-말단에 위치하며, 이에 제한되지 않는다. 여기서 정의된 신호 펩티드는 바람직하게는 인코딩된 단백질 또는 펩티드의 특정 세포 영역으로의 또는 특정 세포 구획으로의, 예컨대 세포 표면, 소포체(ER) 또는엔도솜-리소좀 구획으로의 수송을 허용한다.
핵산에 의해 인코딩된 단백질 또는 펩티드는 자연 발생 단백질의 절편 또는 변이체를 나타낼 수 있다. 이러한 절편 또는 변이체는 전형적으로 핵산 수준에서 또는 아미노산 수준에서 전체 야생형 서열에 대하여, 전술한 단백질 또는 펩티드 또는 이들의 인코딩 핵산 서열의 서열과의 적어도 5 %, 10 %, 20 %, 30 %, 40 %, 50 %, 60 %, 바람직하게는 적어도 70 %, 더욱 바람직하게는 적어도 80 %, 동일하게 더욱 바람직하게는 적어도 85 %, 더욱 더 바람직하게는 적어도 90 % 및 가장 바람직하게는 적어도 95 % 또는 심지어 97 %의 서열 동일성을 갖는 서열을 포함할 수 있다.
본 발명의 내용에서 단백질 또는 펩티드의 "절편"은 여기서 정의된 단백질 또는 펩티드의 서열을 포함할 수 있는데, 이는 이의 아미노산 서열 또는 이의 인코딩된 핵산 서열과 관련하여, 천연 단백질의 아미노산 서열 또는 이의 인코딩된 핵산 서열과 비교하여, N-종결에서, C-종결에서 및/또는 서열내에서 절단된다. 이러한 절단은 아미노산 수준 또는 핵산 수준에서 발생할 수 있다. 그러므로 그러한 절편에 관한 서열 동일성은 전체 단백질 또는 펩티드 또는 전체 코딩 핵산 서열을 참조할 수 있다. 따라서 핵산에도 똑같이 적용된다.
단백질 또는 펩티드의 이러한 절편은, MHC 클래스 I 분자에 의해 가공되고 제시되며 바람직하게는 약 8 내지 약 10 개 아미노산, 예컨대 8, 9, 또는 10 개, (또는 심지어 6, 7, 11, 또는 12 개 아미노산)의 길이를 갖는 절편, 뿐만 아니라 MHC 클래스 II 분자에 의해 가공되고 제시되며 바람직하게는 약 13 또는 그 이상의 아미노산, 예컨대 13, 14, 15, 16, 17, 18, 19, 20 또는 심지어 그 이상의 아미노산의 길이를 갖는 절편을 비롯하여, 약 6 내지 약 20 개 또는 그 이상의 아미노산의 서열을 포함할 수 있으며, 여기서 이들 절편은 아미노산 서열의 임의의 부분으로부터 선택될 수 있다. 이들 절편은 전형적으로 펩티드 절편 및 MHC 분자로 구성된 복합체의 형태로 T-세포에 의하여 인지되며, 즉 절편은 전형적으로 이들의 천연 형태로 인지되지 않는다.
단백질 또는 펩티드의 절편은 또한 이들 단백질 또는 펩티드의 에피토프를 포함할 수 있다. 에피토프(또한 "항원 결정요인"으로 불림)는, 본 발명의 맥락에서, 바람직하게는 5 내지 15 개 아미노산, 더욱 바람직하게는 5 내지 12 개 아미노산, 6 내지 9 개 아미노산을 가지며, 천연 형태로 항체 또는 B-세포 수용체에 의해 인식될 수 있는, 천연 단백질 또는 펩티드의 외부 표면에 위치하는 절편이다. 이러한 에피토프는 또한 이러한 단백질 또는 펩티드의 여기서 언급된 임의 변이체로부터 선택될 수 있다. 이와 관련하여, 항원 결정요인은 단백질 또는 펩티드의 아미노산 서열에서 불연속적인 단백질 또는 펩티드의 세그먼트로 이루어진 구조적 또는 불연속적 에피토프일 수 있으나, 단일 폴리펩티드 사슬로 이루어진 3-차원 구조 또는 연속적 또는 선형 에피토프와 합쳐질 수 있다.
여기서 정의된 단백질 또는 펩티드의 "변이체"는 인코딩된 아미노산 서열이 변경되도록 단백질 또는 펩티드를 인코딩하는 뉴클레오타이드가 치환된 핵산에 의해 인코딩될 수 있다. 이로써 하나 이상의 치환된, 삽입된 및/또는 결실된 아미노산과 같은 하나 이상의 돌연변이를 갖는 단백질 또는 펩티드가 생성된다. 이러한 절편 및/또는 변이체는 전체-길이 천연 단백질과 비교하여 동일한 생물학적 기능 또는 특이적 활동, 예컨대 이의 특이적 항원 특성을 갖는다.
하나의 구체예에서, 양이온성 펩티드 또는 폴리머 대 핵산 화합물의 중량비는 적어도 약 1이다. 예를 들면, 이는 약 1 내지 약 20, 또는 약 1 내지 약 15, 예컨대 약 2±1, 3±1, 4±1, 5±1, 6±1, 7±1, 8±1, 9±1, 10±1, 11±1, 12±1, 13±1, 14±1. 범위일 수 있다.
μg 핵산 화합물 당 양이온성 리피도이드의 nmol로 표현하면, 이 양은 바람직하게는 약 40 nmol/μg 이하이다. 또 다른 구체예에서, 이 비율은 약 15 nmol/μg 이하이고, 특히 10 nmol/μg 이하이다. 일부 특정 구체예에서, 양은 훨씬 더 적을 수 있는데, 예컨대 각각 약 2 nmol/μg 또는 그 미만, 또는 약 1.5 nmol/μg 또는 그 미만, 또는 심지어 약 1 nmol/μg 또는 그 미만, 예컨대 약 0.05 내지 약 2 nmol/μg, 또는 약 0.1 내지 약 1.5 nmol/μg, 또는 약 0.25 내지 약 1.0 nmol/μg, 또는 약 0.3 내지 약 0.8 nmol/μg의 범위, 예컨대 약 0.4 nmol/μg일 수 있다.
하나의 구체예에서, 양이온성 펩티드 또는 폴리머 대 핵산 화합물의 중량비는 적어도 약 1이며, 리피도이드 대 핵산 화합물의 비는 약 15 nmol/μg 이하이다.
리피도이드의 양은 핵산 카고와 관련하여 상대적으로 적을뿐만 아니라 양이온성 펩티드 또는 폴리머와 관련하여도 상대적으로 적다. 리피도이드 대 양이온성 펩티드 또는 폴리머의 중량비가 각각 약 1:10 이하, 또는 약 1:20 이하, 또는 1:30 이하, 또는 1:40 이하인 것이 일반적으로 바람직하다. 또 다른 바람직한 구체예에서, 각각의 비율은 약 1:50 이하이며, 및/또는 리피도이드 대 핵산의 비율은 약 2 nmol/μg 이하이다.
다른 N/P 비율을 의미한다는 것이 문맥으로부터 명확하지 않는 한, 상기 조성물은 또한 본 발명에 따라 양이온성 펩티드 또는 폴리머의 염기성 그룹의 질소 원자("N") 대 카고로서 사용되는 핵산 화합물의 포스페이트 그룹("P")의 몰비로서 정의되는 N/P 비율을 특징으로 한다. 하나의 구체예에서, N/P 비율은 약 0.1 내지 약 20, 또는 약 0.2 내지 약 15, 또는 약 2 내지 약 15, 또는 약 2 내지 약 12이다.
N/P 비율은 예를 들면, RNA가 염기의 통계적 분포를 나타내는 경우, 일반적으로 1 μg RNA가 약 3 nmol 포스페이트 잔기를 함유한다는 것을 기초로 계산할 수 있다. 펩티드 또는 폴리머의 "N"-값은 분자량, 또는 펩티드 또는 폴리머가 분자량 분포를 갖는 경우의 평균 분자량, 및 양이온성 또는 양이온화가능 그룹의 상대 함량을 기초로 하여 계산될 수 있다. 또 다른 바람직한 구체예에서, N/P 비율은 약 0.2 내지 약 15의 범위, 또는 각각 약 0.2 내지 약 13, 또는 약 0.3 내지 약 12, 또는 약 0.5 내지 약 10, 또는 약 0.6 내지 약 8의 범위이다.
하나의 구체예에서, N/P 비율은 약 2 내지 약 15, 또는 약 2 내지 약 12의 범위에서 선택된다. 그러한 N/P 비율을 나타내는 본 발명에 따르는 조성물은 조성물의 정맥 내 투여를 포함하는 용도에 특히 적합하다.
전술한 바와 같이, 본 발명의 조성물 및 나노입자(들)에서의 리피도이드의 양은 전형적으로 카고로서의 핵산에 대한 통상적인 지질-기반 담체에서보다 훨씬 더 낮다.
이론적으로, 리피도이드의 양은 또한 N/P-비율로서 표현될 수 있다. 이 경우, "N"은 리피도이드의 염기성 그룹의 몰을 나타내고, "P"는 카고로 사용되는 핵산의 포스페이트 그룹을 나타낸다. 본 발명의 조성물 및 이에 따른 본 발명의 나노입자에서, 이러한 리피도이드-관련 N/P-비율은 바람직하게는 약 3 이하, 특히 약 2 이하이다. 리피도이드-관련 N/P-비율이 각각 1 또는 그 미만의 범위, 예컨대 약 0.01 내지 약 1, 또는 약 0.02 내지 약 0.8, 또는 약 0.05 내지 약 0.6, 또는 약 0.1 내지 약 0.5의 범위인 것이 또한 바람직하다.
본 발명의 조성물은 하나 이상의 비활성 성분, 보조제 또는 부형제와 같은 추가적인 성분을 포함할 수 있다. 하나의 구체예에서, 상기 조성물은 표적제, 세포 침투제, 및 스텔스제로부터 독립적으로 선택되는 1종 이상의 화합물을 포함한다.
여기서 사용된 바와 같이, 표적제(targeting agent)는 표적 세포의 표면에 또는 그 위에 위치하는 표적, 또는 세포내 표적과 같은 표적에 대한 친화력을 갖는 화합물이다. 예를 들면, 표적제는 항체, 항체 절편, 또는 관심 표적에 대한 친화도를 갖는 소분자 시약을 나타낼 수 있다. 선택사항으로서, 이러한 시약은 양이온성 펩티드 또는 폴리머 내에 혼입될 수 있다. 또 다른 경우, 이러한 시약은 임의의 담체 화합물에 대한 공유결합없이 추가 성분으로서 조성물에 혼입 될 수 있다.
선택사항인 세포 침투제 및/또는 스텔스제에도 동일하게 적용된다. 여기서 사용된 바와 같이, 세포 침투제는 세포-투과성 펩티드(CPP), 뿐만 아니라 세포 내로의 카고의 흡수를 용이하게 하기 위하여 유사한 생물학적 또는 생체모방적 기능을 갖는 임의의 또 다른 화합물을 포함한다. 본 발명의 문맥에서, 스텔스제(stealth agent)는, 카고 분자 또는 입자에 부착될 때, 정맥 주사 또는 주입에 의해 투여되는 대상체의 혈류에서 더욱 긴 순환 시간을 유발하는 화합물 또는 물질을 의미한다. 스텔스제의 예는 페길화된 지질(pegylated lipid)인데 이의 지질 도메인은 예를 들어 리피도이드의 소수성 그룹과의 상호작용에 의해 나노입자에 대한 앵커로서 작용할 수 있으며, 한편 그 폴리에틸렌 글리콜(PEG) 도메인은 "스텔스(stealth)" 성질을 부여할 수 있는데, 이는 카고 물질이 혈류를 순환하면서 대상체의 면역계와의 감소된 상호작용을 나타내는 것을 의미하며, 이는 전형적으로 혈액으로부터의 연장된 제거 반감기와 연관되어 있으며, 뿐만 아니라 감소된 면역원성 및 항원성도 연관되어 있다.
유용한 페길화된 지질(pegylated lipid)의 예는 1-(모노메톡시-폴리에틸렌글리콜)-2,3-디미리스토일글리세롤 (PEG-DMG), N-[(메톡시 폴리(에틸렌 글리콜)2000)카바모일]-1,2-디미리스틸옥시프로필-3-아민 (PEG-C-DMA), 또는 1,2-디아실알-sn-글리세로-3-포스포에탄올아민-N-[메톡시(폴리에틸렌 글리콜)]을 포함하며;
후자의 경우, 아실은 예컨대 미리스토일, 팔미토일, 스테아로일 또는 올레오일을 의미할 수 있으며, 폴리에틸렌 글리콜은 전형적으로 폴리에틸렌 글리콜-350 내지 폴리에틸렌 글리콜-5000, 특히 폴리에틸렌 글리콜-750, 폴리에틸렌 글리콜-1000, 폴리에틸렌 글리콜-2000, 및 폴리에틸렌 글리콜-3000이다.
본 발명의 조성물에서, 성분, 즉 양이온성 펩티드 또는 폴리머, 리피도이드, 및 핵산 화합물은 하나 이상의 나노입자 내에 혼입될 수 있다. 즉, 조성물은 양이온성 펩티드 또는 폴리머, 리피도이드, 및 핵산 화합물을 포함하는 하나 이상의 나노입자를 포함할 수 있다. 대안적으로, 조성물은 적어도 양이온성 펩티드 또는 폴리머 및 핵산 화합물을 포함하는 하나 이상의 나노입자를 포함할 수 있다. 이들 구체예들에서, 구성요소들 각각은 이러한 특징들에 관한 모든 옵션들 및 선호도를 포함하여, 상술된 바와 같이 선택될 수 있다.
전형적으로, 이러한 나노입자는 양이온성 펩티드 또는 폴리머 및 선택사항으로서 또한 리피도이드가 핵산 화합물과 결합될 때 형성되며, 이는 핵산 화합물과 함께 결합되며, 이는 함께 상세히 후술하는 바와 같이 담체-카고 복합체를 형성할 수 있다. 그러나, 두 가지 성분, 즉 폴리머 또는 펩티드 및 핵산 화합물이 나노입자를 닮은 콜로이드 구조체를 형성하기 위해 상호작용할 수 있는 반면, 리피도이드가 이러한 복합체 또는 나노입자 내에 혼입되지 않거나 완전히 혼입되지 않을 수 있다.
본 명세서에서 사용되는 "나노 입자"는 임의의 구조 또는 형태를 갖는 서브마이크론(submicron) 입자이다. 서브마이크론 입자는 또한 콜로이드 또는 콜로이드성이라고 불릴수도 있다. 나노입자가 기초로 하는 물질, 및 구조 또는 형태와 관련하여, 나노입자는, 특정 유형의 나노입자의 가능한 명칭 중 몇 가지만 언급하면, 나노캡슐, 소낭(vesicle), 리포솜, 지질 나노입자, 미셀, 가교된 미셀, 리포플렉스, 폴리플렉스, 혼합 또는 하이브리드 복합체로서 분류될 수 있다.
이러한 양상에 따르면, 본 발명은 또한 이러한 앞서-정의된 나노입자, 뿐만 아니라 복수의 이러한 나노입자에 관한 것이며, 특히 이하에서 더욱 상세하게 설명되는 복수의 바람직한 나노입자에 관한 것이다.
바람직한 구체예 중 하나에서, 나노입자는 핵산 화합물 및 양이온성 펩티드 또는 폴리머 및/또는 리피도이드에 의해 형성된 복합체를 포함한다. 또 다른 특정 구체예에서, 나노입자는 이러한 성분 (a), (b) 및 (c)로 실질적으로 구성된다. 또 다른 특정 구체예에서, 나노입자는 (a) 하나 이상의 양이온성 펩티드 및/또는 폴리머; (b) 하나 이상의 리피도이드; (c) 하나 이상의 핵산 화합물; 및 선택사항으로서 (d) 표적제, 세포 침투제, 및 스텔스제로부터 독립적으로 선택되는 1종 이상의 화합물로 실질적으로 구성된다. 또한, 이들 구체예에 대해서도, 개별 구성요소에 관해 상기 설명된 옵션 및 선호도가 완전히 적용 가능하다.
바람직한 구체예 중 하나에서, 본 발명의 나노입자(들)는 양이온성 펩티드 또는 폴리머 및 양이온성 리피도이드의 복합체; 또는 핵산 화합물과 양이온성 펩티드 또는 폴리머 및/또는 양이온성 리피도이드와의 복합체를 포함한다. 다시 말해서, 나노입자는 복합체를 포함할 수도 있고, 실질적으로 복합체를 나타낼 수도 있으며, 이러한 복합체는 다음 중 임의의 두 개의 구성원 또는 세 개의 모든 구성원으로 구성될 수 있다:
(a) 양이온성 펩티드 또는 폴리머;
(b) 양이온성 리피도이드; 및/또는
(c) 핵산 화합물.
본 명세서에서 사용되는 "복합체"는 분자가 공유 화학 결합보다 약한 힘에 의해 함께 결합된 더 큰 단위체로 결합된 것이다. 이러한 복합체는 또한 결합 복합체로 지칭될 수 있다. 복합체가 함께 결합되는 힘은 종종 수소 가교로 알려진 수소 결합, 런던 힘(London force), 및/또는 쌍극자 인력이다. 지질 또는 리피도이드 및 핵산을 포함하는 복합체는 종종 리포플렉스(lipoplex)라고 불리고, 폴리머와 핵산 사이의 복합체는 폴리플렉스(polyplex)로 알려져있다.
본 발명에 따라 제공되는 양이온성 펩티드 또는 폴리머 및 리피도이드의 존재 하에, 핵산은 동시에 리포플렉스 및 폴리플렉스의 특성을 갖는 하이브리드 복합체를 형성할 수 있다. 이론에 구속되기를 바라지 않고, 발명자는 이러한 하이브리드 복합체는, 본 발명의 조성물 또는 나노입자에서 형성되는 경우, 이들이 카고와 또 다른 유형의 담체 사이에서의 여러 유형의 상호작용을 조합하여, 카고 분자의 상이한 도메인 또는 영역을 포함한다는 점에서, 특히 안정할 수 있다고 유추한다. 다른 한편, 핵산 화합물의 복합체화는, 본 발명을 수행할 때, 특히 단지 비교적 소량의 리피도이드가 사용되는 경우, 양이온성 펩티드 또는 단백질에 의해 주로 달성되고, 그리고 리피도이드의 존재는 그것이 살아있는 세포에 의해 흡수되었을 때 주로 복합체의 운명에 영향을 미친다는 것이 가능하다고 간주된다. 어떠한 경우에도, 본 발명은 임의의 이론에 의해 제한되지 않고, 본원에서 정의된 둘 이상의 성분으로부터 형성된 임의의 복합체는 본 발명에 따른 복합체로 이해되어야한다.
바람직한 구체예 중 하나에서, 본 발명의 나노입자는 상기 정의된 카고-담체 복합체로 실질적으로 구성된다. 이 특정 문맥에서, "실질적으로 구성된다"라는 표현은 용제, 공용매, 계면활성제, 등장화제 등과 같은 나노입자 내의 미량의 보조 물질의 존재를 배제하는 것으로 이해되어서는 안된다.
대안적으로, 본 발명의 조성물에서 나노입자의 적어도 약 50 wt.-%, 또는 각각 이의 적어도 60 wt.-%, 이의 적어도 70 wt.-%, 이의 적어도 80 wt.-%, 이의 적어도 85 wt.-%, 이의 적어도 90 wt.-%, 또는 이의 적어도 95 wt.-%가 양이온성 펩티드 또는 폴리머, 리피도이드, 및 생물학적 활성 카고 물질로 구성된다.
본 발명의 내용에서, "생물학적 활성 카고 물질"은 일반적으로, 임의의 유형의 예방, 치료, 진단 또는 개선 효과를 비롯하는 약리학적 효과와 같은 목적하는 생물학적 효과를 달성하기 위해, 제형 담체, 벡터 또는 비히클에 의해, 대상체, 또는 대상체의 기관, 조직, 또는 세포에 전달되도록 의도된 화합물, 또는 화합물의 혼합물 또는 배합물을 의미한다. 생물학적 활성 카고 물질의 전달은 그러한 물질을 포함하는 제품을 투여하는 목적이며, 일부 경우에는 생물학적으로 활성이라고 간주될 수 있는 제형, 또는 담체, 벡터 또는 비히클이 카고 물질을 전달하기 위한 주요 수단이다. 문맥 상 다른 의미가 분명하지 않으면, "생물학적 활성 카고 물질", "생물학적 활성 화합물", "카고 물질", "카고"등의 표현은 동의어로 사용된다. 본 발명의 조성물뿐만 아니라 본 발명의 나노입자는 생물학적 활성 카고 물질로서 적어도 하나의 핵산 화합물, 또는 핵산-기반 물질을 포함한다. 핵산 화합물을 나타낼 수도 있고 나타내지 않을 수도 있는 하나 이상의 또 다른 활성 성분이 존재할 수 있고 또한 카고의 일부를 형성할 수 있다.
여기서 사용되는 "담체" 또는 "비히클"은 일반적으로 생물학적 활성 화합물 또는 물질의 전달을 돕거나, 가능하게 하거나, 또는 개선시키는 제형의 일부인 모든 화합물, 구조체 또는 물질을 의미할 수 있다. 이것은 생물학적으로 실질적으로 불활성일 수 있거나, 또는 이것이 대상체의 조직, 세포 또는 세포하위 성분과 실질적으로 상호 작용하여, 예를 들어 생물학적 활성 카고 물질의 흡수를 증진시킨다는 점에서 생물학적으로 활성일 수 있다. 본 발명의 문맥에서, 용어는 리피도이드, 양이온성 펩티드 또는 폴리머, 또는 이 둘의 배합물 또는 혼합물에도 적용될 수 있다.
제형에 혼입되고 제형에 의해 투여되는 생물학적 활성 화합물과 관련하여 "제형(formulation)"은 적어도 하나의 생물학적 활성 화합물 및 하나의 부형제, 담체, 비히클 또는 기타 보조 물질을 포함하는 조성물 또는 제조 방법의 관점에서 약학적으로 허용가능한 임의 제품이다.
언급한 바와 같이, 본 발명의 조성물은 전술한 바와 같이 표적제, 세포 침투제 및 스텔스제로부터 독립적으로 선택되는 1종 이상의 화합물과 같은 추가적인 성분을 포함할 수 있다. 이들 추가적인 성분 중 임의의 성분은 선택사항으로서 나노입자(들)에 혼입될 수 있다.
여기서 사용된 바와 같이, 표적제(targeting agent)는 표적 세포의 표면에 또는 그 위에 위치하는 표적, 또는 세포내 표적과 같은 표적에 대한 친화력을 갖는 화합물이다. 예를 들면, 표적제는 항체, 항체 절편, 또는 관심 표적에 대한 친화도를 갖는 소분자 시약을 나타낼 수 있다. 원자단 P 또는 이의 디설파이드-결합된 멀티머를 갖는 화합물과 관련하여 논의된 바와 같이, 이러한 시약은 선택사항으로서 이러한 화합물 내에 혼입될 수 있다. 또 다른 경우, 이러한 시약은 임의의 담체 화합물에 대한 공유결합없이 추가 성분으로서 나노입자에 혼입 될 수 있다.
선택사항인 세포 침투제 및/또는 스텔스제에도 동일하게 적용된다. 여기서 사용된 바와 같이, 세포 침투제는 전술한 세포-투과성 펩티드(CPP), 뿐만 아니라 세포 내로의 카고의 흡수를 용이하게 하기 위하여 유사한 생물학적 또는 생체모방적 기능을 갖는 임의의 또 다른 화합물을 포함한다. 스텔스제는, 본 발명과 관련하여, 양이온성 리피도이드를 포함하는 나노입자에 혼입될 때, 원자단 P 또는 이의 디설파이드-결합된 멀티머, 및 핵산 카고를 포함하는 화합물이, 나노입자가 예컨대 정맥 주사 또는 주입에 의해 투여되는 대상체의 혈류에서 나노입자의 더 긴 순환 시간을 유발하는 이러한 화합물 또는 물질을 의미한다. 스텔스제의 예는 페길화된 지질(pegylated lipid)인데 이의 지질 도메인은 예를 들어 리피도이드의 소수성 그룹과의 상호작용에 의해 나노입자에 대한 앵커로서 작용할 수 있으며, 한편 그 폴리에틸렌 글리콜(PEG) 도메인은 "스텔스(stealth)" 성질을 나노입자에 부여할 수 있는데, 이는 나노입자가 혈류를 순환하면서 대상체의 면역계와의 감소된 상호작용을 나타내는 것을 의미하며, 이는 전형적으로 나노입자의 혈액으로부터의 연장된 제거 반감기와 연관되어 있으며, 뿐만 아니라 감소된 면역원성 및 항원성도 연관되어 있다.
유용한 페길화된 지질(pegylated lipid)의 예는 1-(모노메톡시-폴리에틸렌글리콜)-2,3-디미리스토일글리세롤 (PEG-DMG), N-[(메톡시 폴리(에틸렌 글리콜)2000)카바모일]-1,2-디미리스틸옥시프로필-3-아민 (PEG-C-DMA), 또는 1,2-디아실알-sn-글리세로-3-포스포에탄올아민-N-[메톡시(폴리에틸렌 글리콜)]을 포함하며;
후자의 경우, 아실은 예컨대 미리스토일, 팔미토일, 스테아로일 또는 올레오일을 의미할 수 있으며, 폴리에틸렌 글리콜은 전형적으로 폴리에틸렌 글리콜-350 내지 폴리에틸렌 글리콜-5000, 특히 폴리에틸렌 글리콜-750, 폴리에틸렌 글리콜-1000, 폴리에틸렌 글리콜-2000, 및 폴리에틸렌 글리콜-3000이다.
또 다른 중성 지질은 본 발명의 조성물, 또는 나노입자(들)에 일반적으로 혼입될 필요가 없다. 이는 본 발명의 또 다른 이점이며, 전형적으로 심지어 상당량의 소위 헬퍼 지질의 혼입을 필요로 하는 핵산 카고의 복합체화 및 전달에 적합한 대부분의 공지된 지질 담체 시스템과는 대조적이다. 본 명세서에서 사용되는 헬퍼 지질은 핵산과 배합된 지질 나노입자의 안정성에 기여할 수 있는 비-양이온성 또는 양이온화가능 (양쪽 이온이 아닌 한) 인지질 또는 스테로이드이다. 따라서, 본 발명의 조성물뿐만 아니라 나노입자는 이러한 헬퍼 지질이 없다는 것이 본 발명의 바람직한 구체예 중 하나이다.
나노입자는 약 1,000nm 이하의 동적 레이저 산란에 의해 결정되는 유체역학적 지름을 갖는다. 더욱 바람직하게는, 이들의 유체역학적 지름은 약 800 nm 이하, 예컨대 약 30 nm 내지 약 800 nm 범위이다. 또 다른 바람직한 구체예에서, 유체역학적 지름은 각각 약 50 nm 내지 약 300 nm, 또는 약 60 nm 내지 약 250 nm, 약 60 nm 내지 약 150 nm, 또는 약 60 nm 내지 약 120 nm 범위이다. 이것이 개별 나노입자의 바람직한 지름이지만, 이는 본 발명의 조성물에서 또 다른 지름의 나노입자의 존재를 배제하지 않는다. 그러나, 본 발명은 바람직하게는 많은 또는 심지어 대부분의 나노입자가 그러한 지름을 나타내는 조성물로 실시된다.
또한, 복수의 이러한 나노입자를 포함하는 본 발명에 따른 조성물은 또한 동적 레이저 산란에 의해 결정되는 평균 유체역학적 지름을 특징으로 할 수 있으며, 이는 또한 바람직하게는 800nm 이하, 예컨대 약 30 nm 내지 약 800 nm 범위이다. 유체역학적 지름과 관련하여, "평균"은 누적 평균이라고도 알려진 Z-평균으로 이해해야 한다. 명백하게, 동적 레이저 산란에 의한 측정은 사용되는 분석 장비 제조업체의 권장 사항에 따라 적절한 분산제 및 적절한 희석제를 사용하여 수행해야 한다. 각각 약 50 nm 내지 약 300 nm, 또는 약 60 nm 내지 약 250 nm, 약 60 nm 내지 약 150 nm, 또는 약 60 nm 내지 약 120 nm 범위의 평균 유체역학적 지름이 특히 바람직하다.
나노입자는 동역학적 전위에 의해 더욱 특징지어질 수 있는데, 이것은 제타 전위로 표현될 수 있다. 바람직한 구체예에서, 제타 전위는 각각 약 0 mV 내지 약 50 mV, 또는 약 0 mV 내지 약 10 mV 범위이다. 또 다른 바람직한 구체예에서, 제타 전위는 양의 값, 즉 0 mV 초과, 그러나 각각 50 mV, 또는 40 mV, 또는 30 mV, 또는 20 mV, 또는 10 mV 이하이다.
또 다른 구체예에서, 제타 전위는 각각 약 0 mV 내지 약
-50 mV, 또는 약 0 mV 내지 약 -10 mV 범위이다. 또 다른 구체예에서, 제타 전위는 음의 값, 즉 0 mV 미만, 그러나 각각 -50 mV, 또는 -40 mV, 또는 -30 mV, 또는 -20 mV, 또는 -10 mV 이상이다.
또 다른 구체예에서, 제타 전위는 1 미만의 N/P 비율을 갖는 입자(특히 국소 투여에 적합)에 대하여 0 mV 내지 -50 mV 범위이다. 또 다른 구체예에서, 제타 전위는 1 초과의 N/P 비율을 갖는 입자(특히 정맥 또는 기타 혈관내 적용에 적합)에 대하여 0 mV 내지 +50 mV 범위이다.
양이온성 원자단 P를 포함하는 양이온성 화합물의 양 또는 이의 디설파이드-결합된 멀티머의 양은 핵산 카고의 양을 고려하여 선택해야 한다. 바람직한 구체예 중 하나에서, 이러한 양은 약 0.1 내지 약 20의 범위에서 N/P 비율를 산출하도록 선택된다. 이와 관련하여, N/P 비율은 원자단 P를 포함하는 화합물 또는 이의 디설파이드-결합된 멀티머의 염기성 질소-함유 그룹의 질소 원자("N") 대 카고로서 사용되는 핵산의 포스페이트 그룹("P")의 몰 비율로서 정의된다. N/P 비율은 예를 들면, RNA가 염기의 통계적 분포를 나타내는 경우, 일반적으로 1 μg RNA가 약 3 nmol 포스페이트 잔기를 함유한다는 것을 기초로 계산할 수 있다. 펩티드 또는 폴리머의 "N"-값은 분자량, 또는 펩티드 또는 폴리머가 분자량 분포를 갖는 경우의 평균 분자량, 및 양이온성 또는 양이온화가능 그룹의 상대 함량을 기초로 하여 계산될 수 있다. 또 다른 바람직한 구체예에서, N/P 비율은 약 0.2 내지 약 15의 범위, 또는 각각 약 0.2 내지 약 13, 또는 약 0.3 내지 약 12, 또는 약 0.5 내지 약 10, 또는 약 0.6 내지 약 8의 범위이다.
하나의 구체예에서, N/P 비율은 약 2 내지 약 15, 또는 약 2 내지 약 12의 범위에서 선택된다. 그러한 N/P 비율을 나타내는 본 발명에 따르는 조성물은 조성물의 정맥 내 투여를 포함하는 용도에 특히 적합하다.
전술한 바와 같이, 본 발명의 조성물 및 나노입자(들)에서의 양이온성 리피도이드의 양은 전형적으로 카고로서의 핵산에 대한 통상적인 리피도이드-기반 담체에서보다 훨씬 더 낮다. 본 발명은 예컨대 RNA의 전달 및 세포의 형질주입을 위하여 제안되었던 리포플렉스 또는 리피도이드 나노입자에 사용된 리피도이드의 전형적인 양의 약 0.1 내지 약 10%만큼의 적은 양으로 실시될 수 있다. 이론에 구속되기를 바라지 않고, 본 발명자는 이러한 소량의 리피도이드가 본 발명의 조성물의 높은 내약성을 달성하는데 중추적인 역할을 했다고 간주한다.
리피도이드의 양은 또한 N/P-비율로서 표현될 수 있다. 이 경우, "N"은 양이온성 리피도이드의 염기성 그룹의 몰을 나타내고, "P"는 카고로 사용되는 핵산의 포스페이트 그룹을 나타낸다. 본 발명의 조성물 및 이에 따른 본 발명의 나노입자에서, 이러한 리피도이드-관련 N/P-비율은 바람직하게는 약 3 이하, 특히 약 2 이하이다. 리피도이드-관련 N/P-비율이 각각 약 0.016 내지 약 0.650, 또는 약 0.032 내지 약 0.484, 또는 약 0.080 내지 약 0.323, 또는 약 0.968 내지 약 0.258의 범위, 예컨대 약 0.129인 것이 또한 바람직하다.
양이온성 리피도이드의 양은 카고와 관하여 비교적 낮을 뿐만 아니라, 펩티드 또는 폴리머 담체와 비교하여도, 즉 원자단 P를 포함하는 화합물 또는 이의 멀티머의 양과 비교하여도 그러하다. 양이온성 리피도이드 대 원자단 P 또는 이의 디설파이드-결합된 멀티머를 포함하는 화합물의 중량비가 각각 약 1:10 이하, 또는 약 1:20 이하, 또는 1:30 이하, 또는 1:40 이하인 것이 일반적으로 바람직하다. 또 다른 바람직한 구체예에서, 각각의 비율은 약 1:50 이하이다.
나노입자는 (i) 하나 이상의 양이온성 펩티드 및/또는 폴리머; (ii) 앞서 정의되며, 선택사항으로서 적절한 용매(예컨대 에탄올, DMSO)에 용해된 하나 이상의 리피도이드; 및 (iii) 하나 이상의 핵산 화합물을 조합하는 단계를 포함하는 방법에 의해 제조될 수 있으며, 상기 조합은 수성 액체의 존재하에 수행되어 나노입자 또는 복수의 나노입자의 형성을 가능하게 한다. 상이한 시약을 잘 혼합하기 위하여, 리피도이드는 핵산과 혼합되기 전에 양이온성 복합체와 혼합될 수 있다. 혼합은 적절한 혼합 장치에 의해 수행될 수 있다(예컨대 T 또는 Y 밸브를 이용하는 층류 혼합; 미세유체 장치 또는 교반 용액에 대한 간단한 첨가).
양이온성 펩티드 또는 폴리머, 리피도이드, 카고로서 핵산 화합물 및/또는 1종 이상의 비활성 성분을 포함하는 본 발명의 나노입자 또는 나노입자를 포함하는 조성물, 특히 앞서 정의된 나노입자를 포함하는 조성물은 바람직하게는 대상체, 특히 동물 또는 인간 대상체에 투여하기에 적절하도록 제형화되고 가공된다. 바람직하게는, 조성물은 무균이다.
이와 관련하여, 상기 조성물은 약학 조성물이라 칭할 수도 있다. 이는 조성물 또는 나노입자의 성분 및 다른 특징과 관련하여 여기서 설명된 임의의 옵션 및 선호도에 적용될 수 있는 일반적인 이점이다. 즉, 본 발명은 또한 예컨대 여기에 정의된 약학 조성물에 관한 것이며 여기서 화합물은 적어도 하나의 펩티드 또는 단백질을 인코딩하는 코딩 핵산이다. 예를 들면, 코딩 핵산은 치료적 활성 단백질 또는 항원을 인코딩할 수 있다. 본 발명은 또한 이러한 약학 조성물을 포함하는 백신에 관한 것이고, 여기서 코딩 핵산은 적어도 하나의 항원을 인코딩한다. 이와 관련하여, 백신은 약학 조성물로 구성될 수 있거나, 또는 이는 또 다른 성분과 함께 이것을 포함할 수도 있다.
본 발명의 약학 조성물, 나노입자 또는 상기 나노입자를 포함하는 조성물은 국소적으로(topically), 직장으로(rectally), 코로(nasally), 구강으로(buccally), 질로(vaginally) 흡입제 스프레이(inhalation spray)를 이용하거나 또는 이식된 저장장치를 이용하여 경구투여(orally), 비경구투여(parenterally) 될 수 있다. 여기서 정의된 용어 비경구(parenteral)는 피하(subcutaneous), 정맥내(intravenous), 근육내(intramuscular), 관절내(intra-articular), 활액막내(intra-synovial), 흉골내(intrasternal), 척추강내(intrathecal), 간장내(intrahepatic), 병소내(intralesional), 두개내(intracranial), 경피(transdermal), 피내(intradermal), 폐내(intrapulmonal), 복강내(intraperitoneal), 심장내(intracardial), 동맥내(intraarterial), 그리고 설하(sublingual) 주사 또는 주입기술(infusion techniques)을 포함한다. 일부 구체예에서, 본 발명의 약학 조성물, 나노입자 또는 상기 나노입자를 포함하는 조성물은 안구 전달에 의해 투여될 수 있다. 특정 구체예에서, 본 발명의 약학 조성물, 나노입자 또는 상기 나노입자를 포함하는 조성물은 망막아래 또는 유리체내 주사에 의해 투여된다. 바람직한 구체예에서, 본 발명의 약학 조성물, 나노입자 또는 상기 나노입자를 포함하는 조성물은 유리체내 주사에 의해 투여된다. 또 다른 바람직한 구체예에서, 본 발명의 약학 조성물, 나노입자 또는 상기 나노입자를 포함하는 조성물은 망막아래 주사에 의해 투여된다.
본 발명은 또한 안 질환, 장애 또는 질병을 앓고 있거나 감염되기 쉬운 대상체를 치료하는데 사용될 수 있다. 본원에서 사용된 "안 질환, 장애 또는 질병"은 눈 및/또는 시력에 영향을 미치는 질환, 장애 또는 질병을 의미한다. 일부 구체예에서, 안 질환, 장애 또는 질병은 눈 또는 시력과 관련된 해부학적 부위에서 단백질 결힙 또는 기능장애에 의해 유발될 수 있다. 안 질환, 장애 또는 질병의 예는 비제한적으로 연령 관련 황반변성(age-related macular degeneration, AMD), 색소 포도막염(pigmentary uveitis, PU), 망막 정맥 폐쇄(branch retinal vein occlusion, BRVO), 중심 망막 정맥 폐쇄(central retinal vein occlusion, CRVO), 당뇨성 황반부종(diabetic macular edema, DME), 낭포성 황반부종(cystoid macular edema, CME), 부신막 황반부종(uveitic macular edema, UME), 거대세포바이러스 (CMV) 망막염(cytomegalovirus (CMV) retinitis), 안내염(endophthalmitis), 염증(inflammation), 녹내장(glaucoma), 시력 감퇴(macular degeneration), 공막염(scleritis), 맥락망막염(choriotetinitis), 및 포도막염(uveitis)을 포함한다.
다양한 구체예에서, 본 발명은 여기에 기재된 안 질환, 장애 또는 질병 중 임의 것에서 결핍된 단백질을 인코딩하는 mRNA를 전달하는데 사용될 수 있다.
바람직하게는, 본 발명의 약학 조성물, 나노입자 또는 상기 나노입자를 포함하는 조성물은 비경구 주사에 의해 투여될 수 있으며, 더욱 바람직하게는 피하(subcutaneous), 정맥내(intravenous), 근육내(intramuscular), 관절내(intra-articular), 활액막내(intra-synovial), 흉골내(intrasternal), 척추강내(intrathecal), 간장내(intrahepatic), 병소내(intralesional), 두개내(intracranial), 경피(transdermal), 피내(intradermal), 폐내(intrapulmonal), 복강내(intraperitoneal), 심장내(intracardial), 동맥내(intraarterial), 망막아래(subretinal), 전안방내(intracameral), 결막아래(subconjunctival), 테논아래(subtenon), 안구후부(retrobulbar), 국소적(topical), 및/또는 턱관절후부(posterior juxtascleral) 투여, 섬모 근육(ciliary muscle) 내 투여, 그리고 설하(sublingual) 주사 또는 주입기술(infusion techniques)에 의해 투여될 수 있다. 피내(intradermal) 및 근육내 주사가 특히 바람직하다. 본 발명의 약학 조성물의 무균 주사용 형태는 수성 또는 유성 현탁액일 수 있다. 이러한 현탁액은 적합한 분산제 또는 습윤제 및 현탁제를 사용하여 해당 업계에 공지된 기술에 따라 제형화될 수 있다.
여기서 정의된 바와 같이 본 발명의 약학 조성물, 나노입자 또는 상기 나노입자를 포함하는 조성물은 비제한적으로, 캡슐, 정제, 수성 현탁액 또는 용액을 포함하는 임의의 경구적으로 허용가능한 투여 형태로 경구 투여될 수 있다.
본 발명의 약학 조성물, 나노입자 또는 상기 나노입자를 포함하는 조성물은, 예를 들어, 피부 또는 또 다른 접근가능한 상피 조직의 질병을 포함하여, 특히 치료 표적이 국소 도포에 의해 용이하게 접근 가능한 영역 또는 기관을 포함하는 경우, 국소 투여될 수 있다. 적합한 국소 제형은 이들 영역 또는 기관 각각에 대해 용이하게 제조된다. 국소 도포를 위해, 본 발명의 약학 조성물은 하나 이상의 담체에 현탁되거나 용해된 여기서 정의된 핵산을 함유하는 적합한 연고로 제형화될 수 있다.
본 발명의 약학 조성물, 나노입자 또는 상기 나노입자를 포함하는 조성물은 전형적으로 본 발명의 약학 조성물의 성분, 특히 여기에 정의된 핵산 서열의 "안전하고 효과적인 함량"을 포함한다. 여기서 사용된 "안전하고 효과적인 함량"은 여기서 정의된 바와 같은 질환 또는 장애의 양성 변성을 유의적으로 유도하기에 충분한 여기서 정의된 핵산 서열(들)의 양을 의미한다. 그러나 동시에, "안전하고 효과적인 함량"은 심각한 부작용을 피하고 장점과 위험 사이의 합리적인 관계를 허용하도록 충분히 적다. 이러한 한계의 결정은 전형적으로 현명한 의학적 판단의 범위 내에 있다.
따라서, 본 발명에 따른 백신은 여기에 기재된 (약학) 조성물과 동일한 성분을 기반으로 한다. 따라서 여기에 제공된 (약학) 조성물의 설명을 참조할 수 있다. 바람직하게는, 본 발명에 따른 백신은 여기서 정의된 바와 같은 적어도 하나의 핵산 서열을 포함하는 적어도 하나의 핵산 및 약학적으로 허용가능한 담체를 포함한다. 구체예에서, 백신이 하나 초과의 핵산, 특히 하나 초과의 mRNA 서열을 포함하는 경우(예컨대 본 발명에 따르는 복수의 RNA 서열, 여기서 각각은 바람직하게는 별도의 항원성 펩티드 또는 단백질을 인코딩함), 백신은 물리적으로 분리된 형태로 제공될 수 있으며 별도의 투여 단계에 의해 투여될 수 있다. 본 발명에 따른 백신은, 특히 mRNA 서열이 하나의 단일 조성물에 의해 제공되는 경우, 여기에 기재된 바와 같은 (약학) 조성물에 상응할 수 있다. 그러나, 본 발명의 백신은 물리적으로 분리되어 제공될 수도 있다. 예를 들어, 구체예에서, 백신이 2 개 이상의 mRNA 서열/종을 포함하는 경우, 각각 별도의 항원성 펩티드 또는 단백질을 인코딩하는 적어도 하나의 mRNA 종/서열 각각(예컨대 3 개의 별도의 mRNA 종/서열)을 함유할 수 있는, 예를 들어 2 개, 3 개, 4 개, 5 개 또는 6 개의 분리된 조성물이 제공되며 이들이 조합되거나 조합되지 않을 수 있도록, 상기 RNA 종이 제공될 수 있다. 또한, 본 발명의 백신은 적어도 2 개의 별도의 조성물의 조합일 수 있으며, 각각의 조성물은 여기서 정의된 항원성 펩티드 또는 단백질 중 적어도 하나를 인코딩하는 적어도 하나의 mRNA를 포함한다. 대안적으로, 백신은 여기서 정의된 항원성 펩티드 또는 단백질 중 하나를 각각 인코딩하는 적어도 하나의 mRNA, 바람직하게는 적어도 2 개, 3 개, 4 개, 5 개, 6 개 또는 그 이상의 mRNA의 조합으로서 제공될 수 있다. 백신은 그 사용 전에 하나의 단일 조성물을 제공하기 위해 조합될 수 있거나, 또는 여기에 정의된 항원성 펩티드 또는 단백질 중 임의 것을 인코딩하는 별도의 mRNA 서열/종을 투여하는데 하나 초과의 투여가 요구되도록 사용될 수 있다. 백신이 여기서 정의된 항원 조합을 인코딩하는 적어도 하나의 mRNA 서열, 전형적으로 적어도 2개의 mRNA 서열을 함유하는 경우, 이는 예컨대 한번의 단일 투여(모든 mRNA 종/서열을 조합)에 의해, 적어도 두 번의 별도 투여에 의해 투여될 수 있다. 따라서; 적어도 하나의 항원성 펩티드 또는 단백질 또는 여기서 저으이된 항원의 임의 조합(및 선택사항으로서 또 다른 항원)을 인코딩하고 개별 개체(하나의 mRNA 종을 함유)로서 또는 혼합된 개체(하나 이상의 mRNA 종을 함유함)로서 제공되는 모노-, 바이- 또는 멀티시스트론성 mRNA의 임의 조합은 본 발명에 따르는 백신으로 이해된다.
본 발명에 따른 (약학) 조성물과 마찬가지로, 백신의 개체는 액체 및/또는 건조(예컨대 동결건조) 형태로 제공될 수 있다. 이들은 또 다른 성분, 특히 이의 약학적 용도를 위한 추가 성분을 함유할 수 있다. 백신 또는 (약학) 조성물은 약학적으로 허용가능한 담체 및/또는 추가적인 보조 물질 및 첨가제를 추가로 포함할 수 있다.
백신 또는 (약학) 조성물은 전형적으로 여기에 정의된 항원성 펩티드 또는 단백질 또는 이의 절편 또는 변이체 또는 바람직하게는 여기에 정의된 항원의 조합을 인코딩하는 여기에 정의된 본 발명에 따르는 핵산, 특히 mRNA의 안전하고 효과적인 함량을 포함한다. 본 명세서에서 사용된 "안전하고 효과적인 함량"은 암 또는 암과 관련된 질환 또는 장애의 양성 변성을 유의미하게 유도하기에 충분한 mRNA의 양을 의미한다. 그러나 동시에, "안전하고 효과적인 함량"은 심각한 부작용을 피하도록, 즉 장점과 위험 사이의 합리적인 관계를 허용하도록 충분히 적다. 이러한 한계의 결정은 전형적으로 현명한 의학적 판단의 범위 내에 있다. 본 발명의 백신 또는 (약학) 조성물과 관련하여, "안전하고 효과적인 함량"이라는 표현은 바람직하게는 과도하거나 손상 주는 면역 반응이 일어나지 않지만 또한 측정 가능한 수준 이하로 이러한 면역 반응도 나타나지 않는 방식으로 적응 면역계를 자극하기에 적합한 mRNA의 양(및 따라서 인코딩된 항원의 양)을 의미한다. 여기서 정의된 (약학) 조성물 또는 백신의 mRNA의 이러한 "안전하고 효과적인 함량"은 또한 mRNA의 유형, 예를 들어, 모노시스트론성, 바이- 또는 심지어 멀티시스트론성 mRNA의 유형에 따라 선택될 수 있는데, 왜냐하면 바이- 또는 심지어 멀티시스트론성 mRNA가 동일한 양의 모노시스트론성 mRNA의 사용보다 현저하게 더 높은 인코딩된 항원의 발현을 유도할 수 있기 때문이다. 상기 정의된 바와 같은 (약학) 조성물 또는 백신의 mRNA의 "안전하고 효과적인 함량"은 또한 치료될 특정 상태 및 또한 치료될 환자의 연령 및 신체 상태, 상태의 심각성, 치료 기간, 동반하는 요법의 성질, 사용되는 특정한 약학적으로 허용가능한 담체의 성질, 및 유사한 요인에 따라, 동반된 의사의 지식 및 경험 내에서 변할 것이다. 본 발명에 따른 백신 또는 조성물은 인간을 위해 그리고 또한 수의학적 목적을 위해, 약학 조성물 또는 백신으로서 본 발명에 따라 사용될 수 있다.
바람직한 구체예에서, 본 발명에 따르는 (약학) 조성물, 백신 또는 부품 키트의 핵산, 특히 mRNA는 동결건조 형태로 제공된다. 바람직하게는, 동결건조된 mRNA는, 투여 전에, 유리하게는 수성 담체를 기반으로 하는 적절한 완충액, 예컨대 바람직하게는 링거-락테이트 용액(Ringer-Lactate solution), 링거 용액, 포스페이트 완충 용액 내에서 재구성된다. 바람직한 구체예에서, 본 발명에 따르는 (약학) 조성물, 백신 또는 부품 키트는 적어도 1 개, 2 개, 3 개, 4 개, 5 개, 6 개 또는 그 이상의 mRNA를 함유하며, 바람직하게는 별도로 동결건조 형태로 제공되며 (선택사항으로서 적어도 1종의 또 다른 첨가제와 함께) 그리고 바람직하게는 사용 전에 적절한 완충액(예컨대 링거-락테이트 용액)에서 별도로 재구성되어 (모노시스트론성) mRNA 각각의 개별적 투여를 허용하는 그러한 mRNA를 함유한다.
본 발명에 따르는 백신 또는 (약학) 조성물은 전형적으로 약학적으로 허용가능한 담체를 함유한다. 여기서 사용된 용어 "약학적으로 허용가능한 담체"는 바람직하게는 본 발명의 백신의 액체 또는 비-액체 기저물질(basis)을 포함한다. 만약 본 발명의 백신이 액체 형태로 제공되면, 상기 담체는 일반적으로 발열성물질(pyrogen)이 없는 물; 등장 식염액 또는 완충된 (수용성) 용액, 예를 들면 인산염, 시트르산염 등의 완충된 용액일 것이다. 특히 본 발명의 백신의 주사를 위해서, 나트륨염, 바람직하게는 적어도 50 mM의 나트륨염, 칼슘염, 바람직하게는 적어도 0.01 mM의 칼슘염을 포함하며, 선택사항으로서 칼륨염, 바람직하게는 적어도 3 mM의 칼륨염을 포함하는 물 또는 바람직하게는 완충액, 더욱 바람직하게는 수용성 완충액이 사용될 수 있다. 바람직한 구체예에 따르면, 나트륨염, 칼슘염, 및 선택사항으로서 칼륨염은 예를 들면 염화물(chlorides), 요오드화물(iodides) 또는 브롬화물(bromides)과 같은 할로겐화물 형태에서 그들의 수산화물(hydroxides), 탄산염(carbonates), 탄산수소염(hydrogen carbonates), 황산염(sulfates) 등의 형태로 발생할 수 있다. 이들에 제한되지않고, 나트륨염의 예는 예를 들어 NaCl, NaI, NaBr, Na2CO3, NaHCO3, Na2SO4를 포함하고, 선택사항인 칼륨염의 예는 예를 들어 KCl, KI, KBr, K2CO3, KHCO3, K2SO4를 포함하며, 그리고 칼슘염의 예는 예를 들어 CaCl2, CaI2, CaBr2, CaCO3, CaSO4, Ca(OH)2를 포함한다. 또한, 앞서 언급된 양이온의 유기 음이온은 완충액 내에 포함될 수 있다. 더욱 바람직한 구체예에 따르면, 앞서 정의돈 주사 목적에 적합한 완충액을 염화 나트륨(NaCl), 염화 칼슘(CaCl2) 그리고 선택사항으로서 염화 칼륨(KCl)으로부터 선택된 염을 함유할 수 있고, 여기서 또 다른 음이온이 염화물에 추가하여 존재할 수도 있다. CaCl2는 또한 KCl과 같은 또 다른 염으로 대체될 수 있다. 일반적으로 주사 완충액 내의 염은 적어도 50 Mm의 염화 나트륨(NaCl), 적어도 3 Mm의 염화 칼륨(KCl) 그리고 적어도 0.01 Mm의 염화 칼슘(CaCl2)의 농도로 존재한다. 주사 완충액은 특정 기준 배지와 관련하여 고장액(hypertonic), 등장액(isotonic) 또는 저장액(hypotonic)일 수 있는데, 즉 상기 완충액은 특정 기준 배지와 관련하여 더 높거나, 같거나, 더 낮은 염 함량을 가질 수 있으며, 여기서 바람직하게는 이러한 앞서 언급된 염의 농도는 삼투압 또는 또 다른 농도 효과로 인하여 세포의 손실을 유발하지 않도록 사용될 수 있다. 기준 배지는 예를 들어 "생체내" 방법에서 발생하는 액체, 예를 들어 혈액, 림프액, 시토졸 액, 또는 또 다른 체액이거나, 또는 예를 들어 통상적인 완충액 또는 액체류 같은 "생체 외" 방법에서 기준 배지로 사용될 수 있는 액체류이다. 이러한 통상적인 완충액 또는 액체류는 통상의 기술자에게 공지되어 있다. 링거-락테이트 용액(Ringer-Lactate solution)이 특히 액체 기저물질로서 바람직하다.
그러나, 사람에게 투여하기에 적합한 하나 이상의 호환성 고체 또는 액체 충진제 또는 희석제 또는 캡슐화 화합물을 사용할 수도 있다. 여기서 사용된 용어 "호환성"은 본 발명의 백신의 성분이 상호작용이 일어나지 않는 방식으로 여기서 정의된 본 발명의 핵산, 특히 mRNA와 혼합될 수 있음을 의미하며, 이는 일반적인 사용 조건 하에서 본 발명의 백신의 약효를 실질적으로 감소시킨다. 약학적으로 허용가능한 담체, 충진제 및 희석제는 치료될 사람에게 투여하기에 적합하게 되도록 현저히 높은 순도 및 충분히 낮은 독성을 당연히 가져야만 한다. 약학적으로 허용가능한 담체, 충진제 또는 그 성분으로서 사용될 수 있는 화합물의 일부 예는 당류, 예를 들면, 락토오스, 글루코오스, 트레할로스 및 수크로오스; 전분류, 예를 들면, 옥수수 전분 또는 감자 전분; 덱스트로스; 셀룰로오스 및 그 유도체, 예를 들어 나트륨 카르복시메틸셀룰로오스, 에틸셀룰로오스, 셀룰로오스 아세테이트; 분말형 트래거캔트; 맥아; 젤라틴; 수지 양초(tallow); 고체 활택제, 예를 들어, 스테아르산, 마그네슘 스테아레이트; 황산 칼슘; 식물성 오일, 예를 들면, 땅콩 기름, 면실유, 참기름, 올리브유, 옥수수 기름 및 테오브로마유; 폴리올, 예를 들어, 폴리프로필렌 글리콜, 글리세롤, 소르비톨, 만니톨 및 폴리에틸렌 글리콜; 알긴산이다.
약학적으로 허용가능한 담체의 선택은 원칙적으로 본 발명에 따르는 약학 조성물 또는 백신이 투여되는 방식에 의해 결정된다. 조성물 또는 백신은 예를 들면 전신 또는 국소 투여 할 수있다. 일반적으로 전신 투여를 위한 경로는 예를 들면, 피하(subcutaneous), 정맥내(intravenous), 근육내(intramuscular), 동맥내(intraarterial), 피내(intradermal) 및 복강내(intraperitoneal) 주사, 안내(intraocular), 유리체내(intravitreal), 망막아래(subretinal), 전안방내(intracameral), 결막아래(subconjunctival), 테논아래(subtenon), 안구후부(retrobulbar), 국소적(topical), 및/또는 턱관절후부(posterior juxtascleral) 투여, 섬모 근육(ciliary muscle) 내 투여 및/또는 비강내(intranasal) 투여 경로를 비롯하여, 경피(transdermal), 경구(oral), 비경구(parenteral) 경로를 포함한다. 일반적으로 국소 투여를 위한 경로는 예를 들면 국소적(topical) 투여 경로뿐만 아니라 피내(intradermal), 경피(transdermal), 피하(subcutaneous), 또는 근육내 주사 또는 병소내(intralesional), 두개내(intracranial), 폐내(intrapulmonal), 심장내(intracardial), 및 설하(sublingual) 주사를 포함한다. 더욱 바람직하게는, 본 발명에 따르는 조성물 또는 백신은 피내(intradermal), 피하(subcutaneous), 또는 근육내(intramuscular) 경로에 의해, 바람직하게는 주사에 의해 투여될 수 있으며, 이는 무바늘 주사 및/또는 바늘 주사일 수 있다. 따라서 조성물/백신은 액체 또는 고체 형태로 제형화된다. 투여되는 본 발명에 따른 백신 또는 조성물의 적절한 양은 통상적인 실험, 예를 들면, 동물 모델을 사용하여 결정될 수 있다. 그러한 모델은 비제한적으로 토끼, 양, 마우스(mouse), 쥐(rat), 개 및 비인간 영장류 모델을 포함한다. 주사를 위한 바람직한 단위 투여 형은 물, 생리 식염수 또는 이들의 혼합물의 무균 용액을 포함한다. 그러한 용액의 pH는 약 7.4로 조정되어야 한다. 주사에 적합한 담체는 하이드로겔, 제어 방출 또는 지연 방출을 위한 장치, 폴리락트산 및 콜라겐 기질을 포함한다. 국소적 도포에 적합한 약학적으로 허용가능한 담체는 로션, 크림, 젤 등에 사용하기에 적합한 것을 포함한다. 본 발명의 조성물 또는 백신이 경구 투여되는 경우, 정제, 캡슐 등이 바람직한 단위 투여 형태이다. 경구 투여에 사용될 수 있는 단위 투여 형태의 제조를 위한 약학적으로 허용가능한 담체는 선행 기술에 잘 알려져 있다. 이의 선택은 맛, 비용 및 저장성과 같은 2차 고려사항에 의존할 것이며, 이는 본 발명의 목적에 중요하지 않고 통상의 기술자에 의해 어려움없이 이루어질 수 있다.
본 발명의 백신 또는 조성물은 면역원성을 증가시키기 위해 1종 이상의 보조 물질을 더욱 함유할 수 있다. 본 발명의 조성물에 포함된 핵산과 전술한 바와 같이 본 발명의 백신 또는 조성물과 함께 제형화될 수 있는 (또는 별도로 제형화될 수 있는) 보조 물질의 상승효과적 작용(synergistic action)이 바람직하게는 이로써 달성된다. 다양한 형태의 보조 물질에 따라, 다양한 메커니즘이 본 양상에서 중요한 역할을 할 수 있다.
본 발명의 백신 또는 조성물에 포함될 수 있는 또 다른 첨가제는 유화제, 예를 들어, 트윈(Tween); 습윤제, 예를 들어, 라우릴 황산나트륨; 착색제; 맛-부여제, 약제학적 담체; 정제-형성제; 안정화제; 항산화제; 방부제이다.
본 발명의 백신 또는 조성물은 또한 인간 톨-유사 수용체 TLR1, TLR2, TLR3, TLR4, TLR5, TLR6, TLR7, TLR8, TLR9, TLR10에 대한 (리간드로서) 결합 친화력 때문에 또는 쥐의 톨-유사 수용체 TLR1, TLR2, TLR3, TLR4, TLR5, TLR6, TLR7, TLR8, TLR9, TLR10, TLR11, TLR12 또는 TLR13에 대한 (리간드로서) 결합 친화력 때문에 면역-자극성으로 알려진 임의 또 다른 화합물을 추가적으로 함유할 수 있다.
이와 관련하여 본 발명의 백신 또는 조성물에 첨가될 수 있는 또 다른 종류의 화합물은 CpG핵산, 특히 CpG-RNA 또는 CpG-DNA일 수 있다. CpG-RNA 또는CpG-DNA는 단일-가닥 CpG-DNA(ss CpG-DNA), 이중-가닥 CpG-DNA(dsDNA), 단일-가닥 CpG-RNA(ss CpG-RNA) 또는 이중-가닥 CpG-RNA(ds CpG-RNA)일 수 있다. CpG 핵산은 바람직하게는 CpG-RNA 형태이고, 더욱 바람직하게는 단일-가닥 CpG-RNA(ss CpG-RNA) 형태이다. CpG 핵산은 바람직하게는 적어도 하나 또는 그 이상의 (미토겐) 시토신/구아닌 디뉴클레오타이드 서열(들) (CpG 모티프(들))을 포함한다. 첫 번째 바람직한 대안에 따르면, 이러한 서열에 포함된 적어도 하나의 CpG 모티프, 즉 CpG 모티브의 C (시토신) 및 G (구아닌)는 메틸화되어 있지 않다. 선택사항으로서 이러한 서열에 포함된 모든 또 다른 시토신 또는 구아닌은 메틸화되거나 메틸화되지 않을 수 있다. 그러나, 또 다른 바람직한 대안에 따르면, CpG 모티프의 C(시토신) 및 G(구아닌)은 메틸화된 형태로 존재할 수 있다.
여기서 사용되듯이, 용어 '본 발명의 조성물'은 적어도 하나의 인공 핵산을 포함하는 본 발명의 조성물을 지칭할 수 있다. 마찬가지로, 용어 '본 발명의 백신'은, 이와 관련하여 사용되듯이, 인공 핵산을 기반으로 하는, 즉 적어도 하나의 인공 핵산을 포함하거나 상기 인공 핵산을 포함하는 본 발명의 조성물을 포함하는 본 발명의 백신을 의미할 수 있다.
조성물은 즉시 사용 가능한 주사용 제형으로 설계될 수 있다. 예를 들면, 이는 주사에 적합한 무균 액체로서 제형화될 수 있다. 이러한 경우, 바람직하게는 pH가 약 4 내지 약 9, 또는 더욱 바람직하게는 약 4.5 내지 약 8.5인, 나노입자의 무균 수용액 또는 무균 수성 현탁액으로서 제공될 수 있다. 이러한 액체 조성물의 삼투압은 바람직하게는 약 150 내지 약 500 mOsmol/kg, 및 더욱 바람직하게는 약 200 내지 약 400 mOsmol/kg이다. 조성물이 정맥내로 주사되는 경우, pH는 또한 약 4.5 내지 약 8, 또는 약 5 내지 약 7.5 범위일 수 있으며; 삼투압은 이 경우에는 바람직하게는 각각 약 220 내지 약 350 mOsmol/kg, 또는 약 250 내지 약 330 mOsmol/kg 범위에서 선택될 수 있다.
대안적으로, 조성물은 사용 전에 희석 또는 심지어 재구성이 필요한 농축된 형태로 제형화될 수 있다. 예를 들면, 이는 수성 용매 또는 희석제로 희석을 요구하는 수성 및/또는 유기 액체 제형일 수 있는, 액체 농축물의 형태일 수 있다. 액체 농축물이 유기 용매를 포함하는 경우, 그러한 용매는 바람직하게는 에탄올 또는 프로필렌 글리콜과 같은 비교적 낮은 독성을 갖는 수-혼화성(water-miscible) 유기 용매로부터 선택된다.
바람직한 구체예 중 하나에서, 본 발명의 조성물은 주사에 적합한 액체 제형을 생성시키도록 액체 담체로 재구성하기 위한 건조 제형으로서 제공된다. 특히, 건조 제형은 수성 액체 담체로 재구성하기 위한 무균 분말 또는 동결건조된 형태일 수 있다.
이의 성능, 안정성 또는 내약성을 최적화하기 위해, 조성물은 선택사항으로서 필요하거나 유용한 약학 부형제를 포함할 수 있다. 잠재적으로 유용한 부형제는 산, 염기, 삼투제, 산화방지제, 안정화제, 계면활성제, 상승작용제, 착색제, 증점제, 벌크제 및 필요하다면 방부제를 포함한다.
본 발명은 또한 여기서 정의된 바와 같은 본 발명의 조성물의 성분을 포함하는 키트, 특히 부품 키트에 관한 것이다. 즉, 본 발명은 임의의 이러한 조성물을 제조하기 위한 키트를 제공한다. 본 발명의 약학 조성물은 키트의 하나의 또는 상이한 부품에서 발생할 수 있는데, 상기 키트는 양이온성 펩티드 또는 폴리머, 및/또는 리피도이드 화합물을 포함하는 제1 키트 성분, 및 핵산 화합물을 포함하는 제2 키트 성분을 포함한다.
예를 들면, 제1 키트 성분은 동결건조된 형태 또는 분말과 같은 무균 고체 조성물, 또는 무균 액체 조성물로서 제공될 수 있다. 양이온성 펩티드 또는 폴리머 및/또는 리피도이드에 부가하여 , 제1 키트 성분은 전술한 바와 같은 1종 이상의 비활성 성분을 포함할 수 있다. 유사하게, 제2 키트 성분은 예를 들면 무균 고체 또는 액체 조성물로서 제형화될 수 있으며, 또한 핵산 화합물에 부가하여 1종 이상의 추가적인 비활성 성분을 함유할 수 있다. 본 발명의 조성물은 두 성분의 내용물을 조합하고 선택사항으로서 혼합하여 얻어진다. 리피도이드는 양이온성 펩티드 또는 폴리머와 함께 제1 키트 성분보다는 제3 키트 성분에 수용될 수 있다.
대안적으로, 그러나 본 발명의 범위 내에서, 적어도 하나의 양이온성 펩티드 또는 폴리머, 적어도 하나의 리피도이드, 및 적어도 하나의 핵산 화합물 또는 적어도 하나의 핵산 서열 또는 핵산 서열을 포함하는 백신을 포함하고, 예컨대 무균 고체 또는 액체 제형으로 제형화되는 제1 키트 성분, 상기 제1 키트 성분은 선택사항으로서 약학적 담체 또는 비히클과 같은 여기서 정의된 1종 이상의 또 다른 성분을 포함함; 및 전술한 바와 같은 본 발명의 조성물을 얻기 위하여 제1 키트 성분의 내용물을 용해 또는 분산시키기 위한 액체 담체를 포함하는 제2 키트 성분을 포함하는 키트가 제공된다. 다시 말해, 키트 성분은 바람직하게는 고체 또는 액체 여부에 관계없이 무균 형태로 제공되며, 이들 각각은 1종 이상의 추가 부형제 또는 비활성 성분을 포함할 수 있다.
키트 또는 부품 키트가 다수의 핵산 서열을 포함하는 경우, 키트의 하나의 성분은 키트에 포함된 단지 하나의, 수 개의 또는 모든 핵산 서열을 포함할 수 있다. 대안적인 구체예에서 모든/각 핵산 서열은 각 성분이 키트의 일부를 형성하도록 키트의 상이한/분리된 성분으로 포함될 수 있다. 또한, 하나 초과의 핵산이 키트의 일부로서 제1 성분에 포함될 수 있는 반면, 하나 이상의 또 다른 (제2, 제3 등) 성분(키트의 하나 이상의 또 다른 부분을 제공함)은 하나 또는 둘 이상의 핵산을 함유할 수 있으며, 이는 제1 성분과 동일하거나 부분적으로 동일하거나 다를 수 있다.
선택사항으로서, 상기 기술된 임의의 키트 성분은 고체 또는 액체 형태의 농축물을 나타내기 위해 제형화되며, 이는 선택사항으로서 키트의 일부가 아닌 생체호환성 또는 생리학적 내약성 액체 담체, 예컨대 무균 식염수 용액, 무균 완충액, 또는 주사용 약물의 액체 희석제로서 빈번하게 사용되는 또 다른 용액에 의해 희석되도록 설계될 수 있다.
주사용 제형의 이러한 맥락에서, "액체 담체"라는 표현은 전형적으로 생리학적으로 허용가능한 조성, pH 및 삼투압을 갖는 내약성이 우수한 수성 주사용 액체 조성물을 의미한다.
키트 또는 부품 키트는 핵산 서열, 본 발명의 약학 조성물 또는 키트가 부품 키트로 제조된 경우 그 성분 또는 부품 중 임의 것의 투여 또는 투여량에 관한 정보가 포함된 기술적 지침서를 더욱 함유할 수 있다.
전술한 바와 같이 나노입자, 키트 및 조성물은 특히 핵산 카고를 살아 있는 세포로 전달하는데, 예컨대 세포를 핵산으로 형질주입시키는데 유용할 수 있다. 이는 과학적 연구 목적, 진단 응용 또는 치료를 제공할 수 있다. 바람직한 구체예 중 하나에서, 나노입자(들) 또는 조성물은 약제로서 사용된다.
본 명세서에서 사용되는 "약제(medicament)"는, 질환 또는 질병의 임의 증상의 예방, 치료 또는 개선을 포함하여, 질병 또는 질환의 예방, 방지, 치료, 치유, 완화 치료, 개선, 관리, 개선, 지연, 안정화, 또는 재발 또는 확산의 예방 또는 지연에 유용한 임의 화합물, 물질, 조성물 또는 제형을 의미한다.
생체 내에서 진단제 또는 약제로서 사용하기에 적합하기 위해, 본 발명의 조성물은 액체 형태로 제공될 수 있으며, 각각의 성분은 용해되거나 분산된 (예컨대 현탁된 또는 유화된) 형태로 독립적으로 혼입될 수 있다. 예를 들면, 조성물은 주사에 의해 대상체에게 투여하기에 적합한 무균 수용액의 형태일 수 있다. 또 다른 바람직한 구체예에서, 조성물은 수성 액체 담체로 재구성하기 위한 무균 분말 또는 동결건조 형태와 같은 무균 고체 조성물로서 제형화될 수 있다.
또 다른 바람직한 구체예에서, 여기에 기술된 나노입자(들) 및/또는 조성물은 펩티드 또는 단백질 결핍과 관련된 질환의 예방, 치료 및/또는 개선에 사용된다. 따라서, 본 발명은 또한 펩티드 또는 단백질 결핍과 관련된 질환의 예방, 치료 및/또는 개선을 위한 약제의 제조를 위한 나노입자(들) 및/또는 조성물의 용도에 관한 것이다. 또한, 본 발명은 펩티드 또는 단백질 결핍과 관련된 질병 또는 질환의 위험이 있거나 또는 그 영향을 받는 대상체를 치료하는 방법을 제공하며, 상기 방법은 상기 나노입자(들) 및/또는 상기 조성물을 그 대상체에 투여하는 것을 포함한다.
본 발명은 또한 인공 핵산, 적어도 하나의 인공 핵산을 포함하는 본 발명의 조성물, 여기에 기술된 본 발명의 폴리펩티드, 적어도 하나의 본 발명의 폴리펩티드 또는 본 발명의 백신을 포함하는 본 발명의 조성물의 또는 이들을 포함하는 키트의 여러 응용 또는 용도에 관한 것이다. 특히, 본 발명의 (약학) 조성물(들) 또는 본 발명의 백신은 인간 및 또한 수의학적 의학 목적을 위하여, 바람직하게는 인간 의학 목적을 위하여, 일반적인 약학 조성물 또는 백신으로서 사용될 수 있다.
또 다른 양상에서, 본 발명은 예컨대 바이러스 감염의 예방적 (노출-전 예방 또는 노출-후 예방) 및/또는 치료적 처리 방법에서의 사용을 위한 인공 핵산, 적어도 하나의 인공 핵산을 포함하는 본 발명의 조성물, 여기에 기술된 본 발명의 폴리펩티드, 적어도 하나의 본 발명의 폴리펩티드를 포함하는 본 발명의 조성물 , 본 발명의 백신 또는 본 발명의 키트 또는 부품 키트를 제공한다. 결과적으로, 또 다른 양상에서, 본 발명은 인공 핵산, 여기에 기술된 적어도 하나의 인공 핵산을 포함하는 본 발명의 조성물, 여기에 기술된 본 발명의 폴리펩티드, 적어도 하나의 본 발명의 폴리펩티드를 포함하는 본 발명의 조성물, 본 발명의 백신 또는 여기에 기술된 본 발명의 키트 또는 부품 키트의 약제로서의 제1 의학적 용도에 관한 것이다. 특히, 본 발명은 적어도 하나의 예컨대 여기에 기술된 바이러스 단백질 또는 펩티드를 포함하는 적어도 하나의 폴리펩티드를 인코딩하는 적어도 하나의 코딩 영역을 포함하는 인공 핵산, 또는 여기에 기술된 이의 절편 또는 변이체의 약제의 제조를 위한 용도를 제공한다.
또 다른 양상에 다르면, 본 발명은 여기에 기술된 인공 핵산, 여기에 기술된 적어도 하나의 인공 핵산을 포함하는 본 발명의 조성물, 여기에 기술된 본 발명의 폴리펩티드, 적어도 하나의 본 발명의 폴리펩티드를 포함하는 본 발명의 조성물, 본 발명의 백신 또는 본 발명의 키트 부품 키트의 예컨대 바이러스 감염 또는 감염과 관련된 질환 또는 질병의 치료를 위한 제2 의학적 용도에 관한 것이다.
본 발명의 조성물 또는 본 발명의 백신, 특히 여기에 기술된 적어도 하나의 인공 핵산을 포함하는 본 발명의 조성물, 여기에 기술된 본 발명의 폴리펩티드 또는 적어도 하나의 본 발명의 폴리펩티드를 포함하는 본 발명의 조성물은 예를 들면 전신으로 또는 국소적으로 투여될 수 있다. 일반적으로 전신 투여를 위한 경로는 예를 들면, 피하(subcutaneous), 정맥내(intravenous), 근육내(intramuscular), 동맥내(intraarterial), 피내(intradermal) 및 복강내(intraperitoneal) 주사, 전안방내(intracameral), 결막아래(subconjunctival), 테논아래(subtenon), 안구후부(retrobulbar), 국소적(topical), 및/또는 턱관절후부(posterior juxtascleral) 투여, 섬모 근육(ciliary muscle) 내 투여 및/또는 비강내(intranasal) 투여 경로를 비롯하여, 경피(transdermal), 경구(oral), 비경구(parenteral) 경로를 포함한다. 일반적으로 국소 투여를 위한 경로는 예를 들면 국소적(topical) 투여 경로뿐만 아니라 피내(intradermal), 경피(transdermal), 피하(subcutaneous), 또는 근육내 주사 또는 병소내(intralesional), 두개내(intracranial), 폐내(intrapulmonal), 심장내(intracardial), 및 설하(sublingual) 주사를 포함한다. 더욱 바람직하게는, 백신은 피내(intradermal), 피하(subcutaneous), 또는 근육내(intramuscular) 경로로 투여될 수 있다. 본 발명의 백신은 따라서 바람직하게는 액체 (또는 가끔 고체) 형태로 제형화된다. 바람직하게는, 본 발명의 백신은 기존의 바늘 주사 또는 무바늘 주사로 투여될 수 있다. 바람직한 구체예에서 본 발명의 백신 또는 조성물은 여기에 정의된 제트 주사에 의해, 바람직하게는 근육내로(intramuscularly) 또는 피내로(intradermally), 더욱 바람직하게는 피내로(intradermally) 투여될 수 있다.
바람직한 구체예에서, 인공 핵산, 조성물 또는 백신의 단일 투여량은 여기에 개시된 바와 같은 인공 핵산의 특정 양을 포함한다. 바람직하게는, 인공 핵산은 투약 당 적어도 40 μg의 양으로, 바람직하게는 투약 당 40 내지 700 μg의 양으로, 더욱 바람직하게는 투약 당 80 내지 400 μg의 양으로 제공된다. 더욱 구체적으로, 피내(intradermal) 주사의 경우, 바람직하게는 기존의 바늘을 사용하여 수행되는데, 단일 투여량에 포함되는 본 발명의 인공 핵산의 양은 전형적으로 적어도 200 μg, 바람직하게는 200 μg 내지 1.000 μg, 더욱 바람직하게는 300 μg 내지 850 μg, 더욱 더 바람직하게는 300 μg 내지 700 μg이다. 피내(intradermal) 주사의 경우, 바람직하게는 제트 주사(예컨대 Tropis 장치 사용)를 통하여 수행되는데, 단일 투여량에 포함되는 인공 핵산의 양은 전형적으로 적어도 80 μg, 바람직하게는 80 μg 내지 700 μg, 더욱 바람직하게는 80 μg 내지 400 μg이다. 또한, 근육내 주사의 경우, 바람직하게는 기존의 바늘을 사용하거나 제트 주사를 통하여 수행되는데, 단일 투여량에 포함되는 인공 핵산의 양은 전형적으로 적어도 80 μg, 바람직하게는 80 μg 내지 1.000 μg, 더욱 바람직하게는 80 μg 내지 850 μg, 더욱 더 바람직하게는 80 μg 내지 700 μg이다.
예컨대 바이러스 감염의 치료 또는 예방을 위한 면역화 프로토콜, 즉 예컨대 바이러스에 대한 대상체의 면역화는 전형적으로 본 발명의 조성물 또는 본 발명의 백신의 일련의 단일 투여량 또는 투약량을 포함한다. 여기서 사용되는 단일 투여량은 각각 최초/제1 투여량, 제2 투여량 또는 임의 추가 투여량을 의미하며, 이는 바람직하게는 면역 반응을 "부스트(boost)"하기 위해 투여된다.
바람직한 구체예에 따르면, 여기에 기술된 인공 핵산, 여기에 기술된 적어도 하나의 인공 핵산을 포함하는 본 발명의 조성물, 여기에 기술된 본 발명의 폴리펩티드, 적어도 하나의 본 발명의 폴리펩티드를 포함하는 본 발명의 조성물, 본 발명의 백신 또는 본 발명의 키트 부품 키트는 치료 또는 예방, 바람직하게는 예컨대 바이러스 감염 또는 관련된 장애 또는 질병의 치료 또는 예방에서의 사용을 위하여 제공되며, 여기서 치료 또는 예방은 추가 활성 약학 성분의 투여를 포함한다. 더욱 바람직하게는, 본 발명의 백신 또는 조성물의 경우, 이는 본 발명의 인공 핵산을 기반으로 하며, 폴리펩티드가 추가 활성 약학 성분으로서 함께 투여될 수 있다. 예를 들면, 여기에 기술된 적어도 하나의 예컨대 바이러스 단백질 또는 펩티드, 또는 이의 절편 또는 변이체가 면역 반응을 유도 또는 향상시키기 위해 함께 투여될 수 있다. 유사하게, 본 발명의 백신 또는 조성물의 경우, 이는 여기에 기술된 본 발명의 폴리펩티드를 기반으로 하며, 여기에 기술된 인공 핵산이 추가 활성 약학 성분으로서 함께 투여될 수 있다. 예를 들면, 여기에 기술된 적어도 하나의 폴리펩티드를 인코딩하는 여기에 기술된 인공 핵산이 면역 반응을 유도 또는 향상시키기 위해 함께 투여될 수 있다.
본 발명의 백신 또는 조성물의 추가 성분은 면역글로불린, 바람직하게는 IgGs, 단클론 또는 다클론 항체, 다클론 혈청 또는 혈청들, 등, 가장 바람직하게는 예컨대 바이러스에 대해 유도된 면역글로불린으로부터 선택될 수 있는 면역치료제일 수 있다. 바람직하게는, 이러한 추가 면역치료제는 펩티드/단백질로서 제공될 수 있거나 또는 핵산에 의해, 바람직하게는 DNA 또는 RNA에 의해, 더욱 바람직하게는 mRNA에 의해 인코딩될 수 있다. 이러한 면역치료제는 본 발명의 인공 핵산 또는 본 발명의 폴리펩티드에 의해 유발된 능동 백신접종에 추가하여 수동 백신접종을 제공할 수 있다.
또 다른 양상에서 본 발명은 장애의 치료 또는 예방 방법을 제공하며, 여기서 상기 장애는 바람직하게는 예컨대 바이러스에 의한 감염 또는 예컨대 바이러스에 의한 감염과 관련된 장애이며, 상기 방법은 이를 필요로 하는 대상체에 여기에 기술된 인공 핵산, 여기에 기술된 적어도 하나의 인공 핵산을 포함하는 본 발명의 조성물, 여기에 기술된 본 발명의 폴리펩티드, 적어도 하나의 본 발명의 폴리펩티드를 포함하는 본 발명의 조성물, 본 발명의 백신 또는 본 발명의 키트 부품 키트를 투여하는 단계를 포함한다.
특히, 이러한 방법은 바람직하게는 다음 단계를 포함할 수 있다:
a)
여기에 기술된 인공 핵산, 여기에 기술된 적어도 하나의 인공 핵산을 포함하는 본 발명의 조성물, 여기에 기술된 본 발명의 폴리펩티드, 적어도 하나의 본 발명의 폴리펩티드를 포함하는 본 발명의 조성물, 본 발명의 백신 또는 본 발명의 키트 부품 키트를 제공하는 단계;
b)
여기에 기술된 인공 핵산, 여기에 기술된 적어도 하나의 인공 핵산을 포함하는 본 발명의 조성물, 여기에 기술된 본 발명의 폴리펩티드, 적어도 하나의 본 발명의 폴리펩티드를 포함하는 본 발명의 조성물, 본 발명의 백신 또는 본 발명의 키트 부품 키트를 조직 또는 유기체에 적용 또는 투여하는 단계;
c)
선택사항으로서 예컨대 바이러스에 대한 면역글로불린(IgGs)을 투여하는 단계.
또 다른 양상에 따르면, 본 발명은 또한 예컨대 적어도 하나의 바이러스를 포함하는 적어도 하나의 폴리펩티드 또는 이의 절편 또는 변이체의 발현 방법을 제공하며, 여기서 상기 방법은 바람직하게는 다음 단계들을 포함한다:
a) 바람직하게는 여기에 기술된 바와 같은, 예컨대 적어도 하나의 바이러스를 포함하는 적어도 하나의 폴리펩티드를 인코딩하는 적어도 하나의 코딩 영역을 포함하는 본 발명의 인공 핵산, 또는 이의 절편 또는 변이체, 또는 상기 인공 핵산을 포함하는 조성물을 제공하는 단계; 및
b) 본 발명의 인공 핵산 또는 상기 인공 핵산을 포함하는 본 발명의 조성물은 발현 시스템, 예컨대 무-세포 발현 시스템, 세포(예컨대 발현 숙주 세포 또는 또는 체세포), 조직 또는 유기체에 적용 또는 투여하는 단계.
이 방법은 실험실용, 연구용, 진단용, 펩티드 또는 단백질의 상업적 생산 및/또는 치료 목적으로 적용될 수 있다. 이와 관련하여, 전형적으로 여기에 기술된 본 발명의 인공 핵산 또는 여기에 기술된 본 발명의 조성물 또는 백신을 제공한 이후에, 이는 무-세포 발현 시스템, 세포 (예컨대 발현 숙주 세포 또는 체세포), 조직 또는 유기체에, 예컨대 벗겨진 또는 복합체화된 형태로 또는 여기에 기술된 (약학) 조성물 또는 백신으로서, 바람직하게는 형질주입을 통하거나 또는 여기에 기술된 투여 방식 중 임의 것을 사용하여, 적용되거나 투여된다. 상기 방법은 생체 외(in vitro), 생체 내(in vivo) 또는 엑스 비보(ex vivo)에서 수행될 수 있다. 상기 방법은 또한 특정 질병의 치료, 특히 감염성 질환, 또는 관련된 장애의 치료와 관련하여 수행될 수 있다.
이와 관련하여, 생체 외는 여기서 기술된 본 발명의 인공 핵산 또는 여기서 기술된 본 발명의 조성물 또는 백신의 유기체 외부의 배양에서의 세포 내로의 형질주입 또는 형질도입으로 여기서 정의되며; 생체 내는 본 발명의 인공 핵산 또는 본 발명의 조성물 또는 백신의 본 발명의 mRNA의 적용에 의한 세포 내로의 형질주입 또는 형질도입 또는 본 발명의 조성물의 전체 유기체 또는 개체로의 형질주입 또는 형질도입으로서 여기서 정의되며 그리고 엑스 비보는 본 발명의 인공 핵산 또는 본 발명의 조성물 또는 백신의 유기체 또는 개체의 외부에서의 세포 내로의 형질주입 또는 형질도입 및 후속하여 협질주입된 세포의 유기체 또는 개체로의 적용으로 여기서 정의된다.
마찬가지로, 또 다른 양상에 따르면, 본 발명은 또한, 예컨대 여기서 정의된 본 발명의 인공 핵산 또는 여기서 정의된 본 발명의 조성물 또는 백신을 예컨대 무-세포 발현 시스템, 세포(예컨대 발현 숙주 세포 또는 체세포), 조직 또는 유기체에 적용 또는 투여함으로써, 바람직하게는 진단 또는 치료 목적으로, 예컨대 인코딩된 바이러스 항원성 펩티드 또는 단백질의 발현을 위한, 여기서 정의된 본 발명의 인공 핵산 또는 여기서 정의된 본 발명의 조성물 또는 백신의 용도를 제공한다. 이 용도는 (진단용) 실험실용, 연구용, 진단용, 펩티드 또는 단백질의 상업적 생산 및/또는 치료 목적으로 적용될 수 있다. 이와 관련하여, 전형적으로 여기에 기술된 본 발명의 인공 핵산 또는 여기에 기술된 본 발명의 조성물 또는 백신을 제공한 이후에, 이는 무-세포 발현 시스템, 세포 (예컨대 발현 숙주 세포 또는 체세포), 조직 또는 유기체에, 바람직하게는 벗겨진 형태 또는 복합체화된 형태로 또는 여기에 기술된 (약학) 조성물 또는 백신으로서, 바람직하게는 형질주입을 통하거나 또는 여기에 기술된 투여 방식 중 임의 것을 사용하여, 적용되거나 투여된다. 상기 사용은 시험관 내, 생체 내 또는 생체 외에서 수행될 수 있다. 상기 용도는 또한 특정 질병의 치료, 특히 예컨대 바이러스 감염 또는 관련된 장애의 치료와 관련하여 수행될 수 있다.
특히 바람직한 구체예에서, 본 발명은 여기서 정의된 용도, 바람직하게는 약제로서의 용도, 치료 또는 예방에서의 용도, 바람직하게는 예컨대 바이러스 감염 또는 관련된 장애의 치료 또는 예방에서의 용도, 또는 백신으로서의 용도를 위하여 인공 핵산, 본 발명의 조성물 또는 본 발명의 백신을 제공한다.
조성물 또는 백신은 통상적인 바늘 주사 또는 무-바늘 주사에 의해, 예를 들면, 종양 조직에 인접하여 및/또는 종양 조직에 매우 근접하여 투여될 수 있다. 바람직한 구체예에서, 본 발명의 조성물 또는 본 발명의 약학 조성물은 제트 주사에 의해 투여된다. 제트 주사(Jet injection)는 무-바늘 주사 방법을 말하며, 여기서 본 발명의 조성물 및 선택사항으로서 또 다른 안정한 부형제를 포함하는 유체를 오리피스를 통해 강제로 분사하여, 포유동물 피부를 침투할 수 있는 고압의 초-미세 액체 스트림을 생성한다. 원칙적으로, 액체 스트림은 피부에 구멍을 형성하며, 이 구멍을 통해 액체 스트림이 표적 조직, 예컨대 종양 조직으로 밀려 들어간다. 따라서, 제트 주사는 예컨대 본 발명의 조성물의 종양 내 적용을 위한 것이다.
또 다른 구체예에서, 본 발명의 조성물 또는 본 발명의 약학 조성물은 경구로(orally), 비경구로(parenterally), 흡입 스프레이(inhalation spray)에 의해, 국소적으로(topically), 직장으로(rectally), 코로(nasally), 구강으로(buccally), 질로(vaginally) 또는 이식된 저장장치(implanted reservoir)를 통하여 투여될 수 있다. 여기서 사용된 용어 비경구(parenteral)는 피하(subcutaneous), 정맥내(intravenous), 근육내(intramuscular), 관절내(intraarticular), 마디내(intranodal), 활액막내(intrasynovial), 흉골내(intrasternal), 척추강내(intrathecal), 간장내(intrahepatic), 병소내(intralesional), 두개내(intracranial), 경피(transdermal), 피내(intradermal), 폐내(intrapulmonal), 복강내(intraperitoneal), 심장내(intracardial), 동맥내(intraarterial), 전안방내(intracameral), 결막아래(subconjunctival), 테논아래(subtenon), 안구후부(retrobulbar), 국소적(topical), 및/또는 턱관절후부(posterior juxtascleral) 투여, 섬모 근육(ciliary muscle) 내 투여, 및 설하(sublingual) 주사 또는 주입 기술을 포함한다.
더욱 특히 바람직한 투여 경로는 피내(intradermal) 및 근육내 주사이다.
그럼에도, 본 발명의 약학 조성물은 약학 조성물의 성분의 투여 및 흡수를 촉진시키기 위한 추가 성분을 포함할 수 있다. 이러한 추가 성분은 적절한 담체 또는 비히클, 항균제 및/또는 항바이러스제일 수 있다.
본 발명의 약학 조성물의 또 다른 성분은 면역글로불린, 바람직하게는 IgGs, 단클론 또는 다클론 항체, 다클론 혈청 또는 혈청들 등으로부터 선택될 수 있는 면역치료제일 수 있다. 바람직하게는, 이러한 추가 면역치료제는 펩티드/단백질로서 제공될 수 있거나 또는 핵산, 바람직하게는 DNA 또는 RNA, 더욱 바람직하게는 mRNA에 의해 인코딩될 수 있다.
본 발명의 약학 조성물은 전형적으로 본 발명의 약학 조성물의 성분, 특히 여기에 기술된 RNA 분자(들)의 "안전하고 효과적인 함량"을 포함한다. 여기서 사용된 "안전하고 효과적인 함량"은 예컨대 종양 또는 암 질병의 양성 변성을 유의적으로 유도하기에 충분한 여기서 정의된 RNA 분자(들)의 양을 의미한다. 그러나 동시에, "안전하고 효과적인 함량"은 심각한 부작용을 피하고 장점과 위험 사이의 합리적인 관계를 허용하도록 충분히 적다. 이러한 한계의 결정은 전형적으로 현명한 의학적 판단의 범위 내에 있다.
본 발명의 약학 조성물은 인간 및 또한 수의학적 의학 목적을 위하여, 바람직하게는 인간 의학 목적을 위하여, 일반적인 약학 조성물로서 사용될 수 있다.
본 발명은 또한 여기서 정의된 핵산 서열, 여기서 정의된 복수의 핵산 서열을 포함하는 본 발명의 조성물, 여기서 정의된 핵산 서열을 포함하는 본 발명의 약학 조성물, 또는 이를 포함하는 키트의 여러 응용 및용도를 제공한다.
하나의 특정 양상에 따르면, 본 발명은, 특히 유전자 치료에서, 바람직하게는 여기에 정의된 질병의 치료를 위하여, 여기서 정의된 핵산 서열 또는 여기서 정의된 복수의 핵산 서열을 포함하는 본 발명의 조성물의 약제로서의 제1 의학적 용도에 관한 것이다.
또 다른 양상에 따르면, 본 발명은, 여기서 정의된 질병의 치료를 위한, 여기서 정의된 핵산 서열 또는 여기서 정의된 복수의 핵산 서열을 포함하는 본 발명의 조성물의 제2 의학적 용도, 바람직하게는 여기서 정의된 질병의 예방, 치료 및/또는 개선을 위한 약제의 제조를 위한, 여기서 정의된 핵산 서열, 여기서 정의된 복수의 핵산 서열을 포함하는 본 발명의 조성물, 이를 포함하는 약학 조성물 또는 이를 포함하는 키트의 용도에 관한 것이다. 바람직하게는, 약학 조성물은 이러한 목적으로 사용되거나 또는 이를 필요로하는 대상체에게 투여될 수 있다.
바람직하게는, 여기서 언급된 질병은 바람직하게는 감염성 질환, 신생물(예컨대 암 또는 종양 질환), 혈액 및 혈액-형성 기관의 질병, 내분비, 영양 및 대사 질환, 신경계 질환, 순환계 질환, 호흡계 질환, 소화계 질환, 피부 및 피하 조직 질환, 근골격계 및 결합 조직 질환, 비뇨 생식기 질환으로부터 선택된다.
이러한 내용에 있어서, 유전 질환은 다음과 같은 질환들로부터 선택되는 것이 특히 바람직하다: 1p36 결손 증후군; 18p 결손 증후군; 21-하이드록실라제 결핍증; 45,X(터너 증후군); 47,XX,+21(다운 증후군); 47,XXX(XXX 증후군); 47,XXY(클라인펠터 증후군); 47,XY,+21(다운 증후군); 47,XYY 증후군; 5-ALA 탈수 효소-결핍 포르피린증(ALA 탈수 효소 결핍증); 5-아미노라에불리닉 탈수 효소 결핍 포르피린증(ALA 탈수 효소 결핍증); 5p 결손 증후군(고양이 울음 증후군) 5p-증후군(고양이 울음 증후군); A-T(운동 실조-모세 혈관 확장증); AAT(알파-1 항트립신 결핍증); 정관 형성 부전증(선천성 양측 정관 형성 부전증); 맥관 부전증(Absent vasa)(선천성 양측 정관 형성 부전증); 아세룰로플라스미네미아(aceruloplasminemia); ACG2(제II형 연골 무형성증); ACH(연골 발육 부전증); 제II형 연골 무형성증; 연골 발육 부전증; 산 베타-글루코시다제 결핍증(제1형 고셔병); 첨두 합지증(애퍼트)(애퍼트 증후군); 첨두 합지증, 제V형(파이퍼 증후군); 첨두 합지증(애퍼트 증후군); 급성 뇌 고셔병(제2형 고셔병); 급성 간헐성 포르피린증; ACY2 결핍증(카나반병); AD(알츠하이머병); 아델라이드형 두개골 유합증(뮌케 증후군); 대장 선종성 폴립증(가족 성선 종성 용종증); 결장 선종성 폴립증(가족 성선 종성 용종증); ADP(ALA 탈수 효소 결핍증); 아데닐로숙시네이트 라이아제 결핍증; 부신 질환(21-하이드록실라제 결핍증); 부신 성기 증후군(21-하이드록실라제 결핍증); 부신 백질 이영양증; AIP(급성 간헐성 포르피린증); AIS(안드로겐 무감성 증후군); AKU(알캅톤뇨증); ALA 탈수 효소 포르피린증(ALA 탈수 효소 결핍증); ALA-D 포르피린증(ALA 탈수 효소 결핍증); ALA 탈수 효소 결핍증; 알캅톤 뇨증(알캅톤뇨증); 알렉산더병; 알캅톤뇨증; 알캅톤뇨 조직 갈변증(알캅톤뇨증); 알파-1 항트립신 결핍증; 알파-1 단백 분해 효소 억제제(알파-1 항트립신 결핍증); 알파-1 관련 폐기종(알파-1 항트립신 결핍증); 알파-갈락토시다제 A 결핍증(파브리병); ALS(근위축성 측색 경화증); 알스트롬 증후군; ALX(알렉산더병); 알츠하이머병; 법랑질 형성 부전증; 아미노 레불린산 탈수 효소 결핍증(ALA 탈수 효소 결핍증); 아미노아실라제 2 결핍증(카나반병); 근위축성 측색 경화증; 앤더슨-파브리병(파브리병); 안드로겐 무감성 증후군; 빈혈; 유전성 철적아구성 빈혈(X 염색체-연관 철적아구성 빈혈); 성별 연관 혈색소 감소 철적아구성 빈혈(X 염색체-연관 철적아구성 빈혈); 비장 가족성 빈혈(고셔병); 앵겔만 증후군; 미만성 구간혈관각화종(파브피병); 확산성 혈관 각화종(Angiokeratoma diffuse)(파브피병); 망막 혈관종(폰 히펠-린다우병); ANH1(X 염색체-연관 철적아구성 빈혈); APC 내성, 라이덴형(인자 V 라이덴 혈전성향증);애퍼트 증후군; AR 결핍증(안드로겐 무감성 증후군); AR-CMT2 ee(제2형 샤르코-마리-투스 질환(Charcot-Mare-Tooth disease)); 거미 손가락증(마르판 증후군); ARNSHL(비증후군 난청#상염색체 열성); 유전성 진행형 관절안질환(스티클러 증후군#COL2A1); 선천성 다발성 관절 이완증(Arthrochalasis multiplex congenita)(엘러스-단로스 증후군#관절 이완형); AS(앵겔만 증후군); Asp 결핍증(카나반병); Aspa 결핍증(카나반병); 아스파르토아실라제 결핍증(카나반병); 운동 실조-모세 혈관 확장증; 자폐증-치매-운동 실조-목적성 손 사용 상실(Loss of Purposeful Hand Use) 증후군(레트 증후군); 상 염색체 우성 소아 ALS(제4형 근위축성 측색 경화증); 상 염색체 우성 오피츠 G/BBB 증후군(22q11.2 결손 증후군); 제3형 소아 ALS의 상 염색체 열성형(근위축성 측색 경화증#제2형); 상 염색체 열성 비 증후군성 청각 상실(비 증후군성 난청#상 염색체 열성); 상 염색체 열성 감각 신경 청각 장애 및 갑상선종(흑색 가시세포증리드 증후군); AxD(알렉산더병); 아이에르자 증후군(원발성 폐고혈압); 헥소사미니다제 GM2 강글리오시드 축적증의 B 변이형(샌드호프병); BANF(신경섬유종증 2); 비아레-스티븐슨 뇌회상 두피 증후군(Beare-Stevenson cutis gyrata syndrome); 양성 발작성 복막염(가족성 지중해열); 벤자민 증후군; 베타 지중해 빈혈; BH4 결핍증(테트라하이드로비오프테린 결핍증); 양측성 청 신경섬유종증(신경섬유종증 2); 바이오티니다제 결핍증; 방광암; 출혈성 질환(인자 V 라이덴 혈전성향증); 블로크-슐쯔베르거 증후군(색소 실조증); 블룸 증후군; 골 질환; 골수 질환(X 염색체-연관 철적아구성 빈혈); 보네비-율리히 증후군(터너 증후군); 부르네빌병(결절성 경화증); 부르네빌 모반증(결절성 경화증); 뇌 질환(프리온 질환); 유방암; 버트-호그-두베 증후군; 취약성 골절(골 형성 부전증); 넓은 엄지-할룩스 증후군(Broad Thumb-Hallux syndrome)(루빈스타인-타이비 증후군); 청동색 당뇨병(혈색소증); 청동 간경변(혈색소증); 연수 척추성 근육 위축증, X 염색체-연관(케네디병); 버거-그러츠 증후군(지단백 지질 분해 효소 결핍증, 가족성); CADASIL; CGD 만성 육아종성 장애; 캠프토멜릭 이형성; 카나반병; 암; 암 가계 증후군(유전성 비용종증 대장암); 유방의 암(유방암); 방광의 암(방광암); 카복실라제 결핍증, 다발성, 말기 발생(바이오티니다제 결핍증); 심근증(누난 증후군); 고양이 울음 증후군(고양이 울음); CAVD(선천성 양측 정관 형성 부전증); 카일로 심안면 증후군(22q11.2 결손 증후군); CBAVD(선천성 양측 정관 형성 부전증); 셀리악병; CEP(선천성 적혈구조성 포르피린증); 세라미드 트리헥소시다제 결핍증(파브리병); 소뇌망막 혈관종(Cerebelloretinal Angiomatosis), 가족성(폰 히펠-린다우병); 피질하 경색 및 백질뇌증을 동반하는 대뇌 동맥병증(CADASIL); 대뇌 경화증(결절성 경화증); 대뇌 위축성 고암모니아혈증(레트 증후군); 세레브로시드 지질 축적 증후군(고셔병); CF(낭포성 섬유증); CH(선천성 갑상성 기능 저하증); 샤르코병(근위축성 측색 경화증); 샤르코-마리-투스병; 사지 단지증(연골 발육 부전증); 사지 단지 증후군(연골 발육 부전증); 감각 신경 난청을 동반하는 사지 단지증(귀척추거대골단이형성증); 연골 형성 부전증(제II형 연골 무형성증); 무도 무정위 운동 자가-돌연변이 고요산혈증 증후군(레쉬-니한 증후군); 전형적 갈락토스혈증(갈락토스혈증); 전형적 엘러스-단로스 증후군(엘러스-단로스 증후군#전형적 유형); 전형적 페닐케톤뇨증(페닐케톤뇨증); 구순구개열(스티클러 증후군); 치명적 난장이증 동반 클로버 잎 모양 두개골(치명적 이형성증#제2형); CLS(코핀-로우리 증후군); CMT(샤르코-마리-투스병); 코케인 증후군(Cockayne syndrome); 코핀-로우리 증후군; 콜라겐병증, 제II형 및 제XI형; 결장암, 가족성 비용종증(유전성 비용종증 대장암); 가족성 결장암(가족 성선 종성 용종증); 대장암; 완전 HPRT 결핍증(레쉬-니한 증후군); 완전 하이포잔틴-구아닌 포스포리보실 트랜스퍼라제 결핍증(레쉬-니한 증후군); 압박 신경 장애(압박 마비에 대한 책임을 동반하는 유전성 신경 장애); 선천성 부신 과형성증(21-하이드록실라제 결핍증); 선천성 양측 정관 형성 부전증(선천성 정관 형성 부전증); 선천성 적혈구조성 포르피린증; 선천성 심장 질환; 선천성 수초 형성 부전증(샤르코-마리-투스병#제1형/샤르코-마리-투스병#제4형; 선천성 갑상선 기능 저하증; 선천성 메트헤모글로빈혈증(메트헤모글로빈혈증#선천성 메트헤모글로빈혈증); 선천성 골경화증(연골 발육 부전증); 선천성 철적아구성 빈혈(X 염색체-연관 철적아구성 빈혈); 결합 조직병; 뿔줄기 기형 안면 증후군(22q11.2 결손 증후군); 쿨리 빈혈(베타 지중해 빈혈); 구리 축적병(윌슨병); 구리 운반병(멩케 증후군); 유전성 코프로포르피린증(유전적 코프로포르피린증); 코프로포르피리노겐 옥시다제 결핍증(유전성 코프로포르피린증); 카우덴 증후군; CPO 결핍증(유전성 코프로포르피린증); CPRO 결핍증(유전성 코프로포르피린증); CPX 결핍증(유전성 코프로포르피린증); 두개 안면 관절 기형(크루존 증후군); 두개 안면 골 형성 부전증(크루존 증후군); 크레틴병(선천성 갑상선 기능 저하증); 크로이펠츠-야콥병(프리온 질환); 고양이 울음 증후군(크론병, 섬유협착성(fibrostenosing)); 크루존 증후군; 흑색 가시세포증 동반 크루존 증후군(크루존 피부골격 증후군(Crouzonodermoskeletal syndrome); 크루존 피부골격 증후군; CS(코케인 증후군)(카우덴 증후군); 쿠루슈만-배튼-스타이너트 증후군(근 긴장성 이영양증); 비아레-스티븐슨의 뇌회상 두피 증후군(비아레-스티븐슨 뇌회상 두피 증후군); 장애 돌연 변이 염색체; D-글리서레이트 탈수소효소결핍증(원발성 고수산뇨증); 얼룩 골간단 증후군(Dappled metaphysis syndrome)(척추골단골간단 이형성증, 스트루드위크형); DAT-치매 알츠하이머형(알츠하이머병); 유전적 고칼슘뇨증(덴트병); DBMD(근이영양증, 듀센-베커형); 갑상선종 동반 난청(펜드리드 증후군); 난청-망막 색소 변성 증후군(어셔 증후군); 결핍성 질환, 페닐알라닌 하이드록실라제(페닐케톤뇨증); 퇴행성 신경병; 드 그루쉬 증후군 1(드 그루쉬 증후군); 데제린-소타스 증후군(샤르코-마리-투스병); 델타-아미노레불리네이트 탈수 효소 결핍증 포르피린증(ALA 탈수 효소 결핍증); 치매(CADASIL); 탈수초성 백질 이영양증(알렉산더병); 엘러스-단로스 증후군의 피부 파열형(엘러스-단로스 증후군#피부 파열증형); 피부 파열증(엘러스-단로스 증후군#피부 파열증형); 발달 장애; dHMN(근위축성 측색 경화증#제4형); DHMN-V(제V형 말단 척추 근육 위축증); DHTR 결핍증(안드로겐 무감성 증후군); 확산성 글로보이드체 경화증(크라베병); 디조지 증후군; 디하이드로테스토스테론 수용체 결핍증(안드로겐 무감성 증후군); 제V형 말단 척추 근육 위축증; DM1(근 긴장성 이영양증#제1형); DM2(근 긴장성 이영양증#제2형); 다운 증후군; DSMAV(제V형 말단 척추 근육 위축증); DSN(샤르코-마리-투스병#제4형); DSS(제4형 샤르코-마리-투스병); 듀센/베커 근이영양증(근이영양증, 듀센-베커형); 연골 형성 부전 난장이증(연골 발육 부전증); 치명적 난장이증(치명적 이형성증); 난장이증; 난장이증-망막 감퇴-난청 증후군(코케인 증후군); 수초 이형성 유발성 백질 이영양증(알렉산더병); 근 긴장 이영양증(근 긴장성 이영양증); 색소성 망막 이영양증-골 형성 부전증 증후군(어셔 증후군); 조기 발생 가족성 알츠하이머병(EOFAD)(알츠하이머병); EDS(엘러스-단로스 증후군); 엘러스-단로스 증후군; 에크만-롭슈타인병(골 형성 부전증); 교액성 신경 장애(압박 마비에 대한 책임을 동반하는 유전성 신경 장애); 결절 경화증(결절성 경화증); EPP(적혈구조성 프로토포르피린증); 적아세포성 빈혈(베타 지중해 빈혈); 적혈구-간성 프로토포르피린증(적혈구조성 프로토포르피린증); 에리스로이드 5-아미노레불리네이트 합성 효소 결핍증(X 염색체-연관 철적아구성 빈혈); 적혈구조성 포르피린증(선천성 적혈구조성 포르피린증); 적혈구조성 프로토포르피린증; 적혈구조성 유로포르피린증(선천성 적혈구조성 포르피린증); 안암(망막모세포종 FA - 프리드리히운동 실조); 파브리병; 얼굴 부상 및 장애; 인자 V 라이덴 혈전성향증; FALS(근위축성 측색 경화증); 가족성 청 신경종(제II형 신경섬유종증); 가족 성선 종성 용종증; 가족성 알츠하이머병(FAD)(알츠하이머병); 가족성 근위축성 측색 경화증(근위축성 측색 경화증); 가족성 자율 신경 실조증; 가족성 지방 유도성 고중성조직구증(가족성 지단백 리파제 결핍증); 가족성 혈색소증(혈색소증); 가족성 LPL 결핍증(가족성 지단백 리파제 결핍증); 가족성 비용종증 결장암(유전성 비용종증 대장암); 가족성 발작성 다발 장막염(가족성 지중해열); 가족성 PCT(만발성 피부 포르피린증); 가족성 압박 감수성 신경병증(압박 마비에 대한 책임을 동반하는 유전성 신경병증); 가족성 원발성 폐고혈압(FPPH)(원발성 폐고혈압); 가족성 터너 증후군(누난 증후군); 가족성 맥관성 백질 뇌증(CADASIL); FAP(가족 성선 종성 용종증); FD(가족성 자율 신경 실조증); 여성 유사 터너 증후군(누난 증후군); 페로케라타아제 결핍증(적혈구조성 프로토포르피린증); 페로포르틴병(혈색소증#제4형); 열(가족성 지중해열); FG 증후군; FGFR3-연관 기관상봉합기조유합증(뮈엔케 증후군(Muenke syndrome)); 성상교세포의 유섬유소변성(알렉산더병); 췌장의 섬유낭포성유선증(낭포성 섬유증); FMF(가족성 지중해열); 폴링병(페닐케톤뇨증); fra(X) 증후군(취약 X 증후군); 취약 X 증후군; 골형성부전증(골 형성 부전증); FRAXA 증후군(취약 X 증후군); FRDA(프리드리히 운동 실조); 프리드리히 운동 실조(프리드리히 운동 실조); 프리드리히 운동 실조; FXS(취약 X 증후군); G6PD 결핍증; 갈락토키나제 결핍성 질환(갈락토스혈증); 갈락토스-1-인산염 우리딜 트랜스퍼라제 결핍성 질환(갈락토스혈증); 갈락토스혈증; 갈락토실세라미다제 결핍성 질환(크라베병); 갈락토실세라미드 지방증(크라베병); 갈락토실세레브로시다제 결핍증(크라베병); 갈락토실스핑고신 지방증(크라베병); GALC 결핍증(크라베병); GALT 결핍증(갈락토스혈증); 고셔병; 고셔병 유사 질환(유사 고셔병); GBA 결핍증(제1형 고셔병); GD(고셔병); 유전성 뇌질환; 유전성 폐기종(알파-1 항트립신 결핍증); 유전성 혈색소증(혈색소증); 신생아 거대 세포 간염(신생아 혈색소증); GLA 결핍증(파브리병); 망막 교모세포종(망막모세포종); 망막 신경교종(망막모세포종); 글로보이드 세포 백질 이영양증(GCL, GLD)(크라베병); 글로보이드 세포 백질 뇌증(크라베병); 글루코세레브로시다제 결핍증(고셔병); 글루코세레브로시드 축적증(고셔병); 글루코실 세레브로시드 지방증(고셔병) ; 글루코실세라미다제 결핍증(고셔병); 글루코실세라미드 베타-글루코시다제 결핍증(고셔병); 글루코실세라미드 지방증(고셔병); 글리세린 산뇨증(원발성 고수산뇨증); 글리신 뇌병증(비케톤성 고글리신혈증); 글리콜 산뇨증(원발성 고수산뇨증); 제1형 GM2 강글리오시드축적증(테이-삭스병); 갑상샘종-난청 증후군(펜리드 증후군); 그레페-어셔 증후군(어셔 증후군); 그론블라드-스트랜드버그 증후군(탄력섬유성위황색종); 괸터 포르피린증(선천성 적혈구조성 포르피린증); 군터병(선천성 적혈구조성 포르피린증); 혈색소증(혈색소증); 홀그렌 증후군(Hallgren syndrome)(어셔 증후군); 할리퀸 어린선; Hb S 질환(겸상적혈구빈혈); HCH(연골저형성증); HCP(유전성 코프로포르피린증); 두부 및 뇌 기형; 청각 장애 및 난청; 아동의 청력 장애; HEF2A(혈색소증#제2형); HEF2B(혈색소증#제2형); 헤마토포르피린증(포르피린증); 헴 합성 효소 결핍증(적혈구조성 프로토포르피린증); 혈 색소증(혈색소증); 혈색소증; 헤모글로빈 M 질환(메트헤모글로빈혈증#베타-글로빈형); 헤모글로빈 S 질환(겸상적혈구빈혈); 혈우병; HEP(간적혈구조성 포르피린증); 간 AGT 결핍증(고수산뇨증, 원발성); 간적혈구조성 포르피린증; 간렌즈핵변성증 증후군(윌슨병); 유전성 관절안질환(스티클러 증후군); 유전성 코프로포르피린증; 유전성 디스토피아 지방증(파브리병); 유전성혈색소증(HHC)(혈색소증); 유전성 봉입체 근육병(골격근 신생); 유전성 철-부하성 빈혈(X 염색체-연관 철적아구성 빈혈); 유전성 이동 및 감각 신경병증(샤르코-마리-투스병); 유전성 이동신경병증(척추근위축증); 제V형 유전성 이동신경병증(제V형 말단 척추 근육 위축증); 유전성 다발성 외골증; 유전성 비폴립증 대장암; 유전성 주기열 증후군(가족성 지중해열); 유전성 대장 폴립증(가족 성선 종성 용종증); 유전성 폐 폐기종(알파-1 항트립신 결핍증); 활성화된 단백질 C에 대한 유전성 내성(인자 V 라이덴 혈전성향증); 제III형 유전성 감각 및 자율 신경병증(가족성 자율 신경 실조증); 유전성 경련성 하지대마비(영아 발병 증가성 유전적 경련성 마비); 유전성 척추 운동 실조(프리드리히 운동 실조); 유전성 척추 경화증(프리드리히 운동 실조); 헤릭 빈혈(겸상적혈구빈혈); 이형접합성 OSMED(비센바허-쯔바이뮐러 증후군); 이형접합성 귀척추거대골단이형성증(비센바허-쯔바이뮐러 증후군); HexA 결핍증(테이-삭스병); 헥소사미니다제 A 결핍증(테이-삭스병); 헥소사미니다제 알파-서브유닛 결핍증(변이형 B)(테이-삭스병); HFE-연관 혈색소증(혈색소증); HGPS(조로증); 히펠-린다우병(폰 히펠-린다우병); HLAH(혈색소증); HMN V(제V형 말단 척추 근육 위축증); HMSN(샤르코-마리-투스병); HNPCC(유전성 비폴립증 대장암); HNPP(압박 마비에 대한 책임을 동반하는 유전성 신경병증); 호모시스틴뇨증; 호모겐티신산 옥시다제 결핍증(알캅톤뇨증); 호모겐티신산뇨증(알캅톤뇨증); 동형접합성 만발성 피부 포르피린증(간적혈구조성 포르피린증); HP1(고수산뇨증, 원발성); HP2(고수산뇨증, 원발성); HPA(고페닐알라닌혈증); HPRT - 하이포잔틴-구아닌 포스포리보실트랜스퍼라제 결핍증(레쉬-니한 증후군); 제III형 HSAN(가족성 자율 신경 실조증); HSAN3(가족성 자율 신경 실조증); HSN-III(가족성 자율 신경 실조증); 사람 피부파열증(엘러스-단로스 증후군#피부파열증형); 헌팅톤병; 허치슨-길포드조로증후군(조로증); 21-하이드록실라제 결핍증(21-하이드록실라제 결핍증)으로 인한 비전형적 안드로겐과다증; 가족성 고카일로마이크론혈증(가족성 지단백 리파제 결핍증); 케토산증 및 백혈구감소증을 동반하는 고글리신혈증(프로피온산혈증); 제I형 고지단백혈증(가족성 지단백 리파제 결핍증); 원발성 고수산뇨증; 고 페닐알라닌 혈증(고페닐알라닌혈증); 고페닐알라닌혈증; 연골이형성증(연골저형성증); 연골 저형성증; 연골저형성증; 혈색소 감소 빈혈(X 염색체-연관 철적아구성 빈혈); 선천성 구리부족혈증; 멩케 증후군); 하이포잔틴 포스포리보실트랜스퍼라제(HPRT) 결핍증(레쉬-니한 증후군); IAHSP(영아 발병 증가 유전적 경련성 마비); 특발성 혈색소증(제3형 혈색소증); 특발성 신생아 혈색소증(신생아 혈색소증); 특발성 폐고혈압(원발성 폐고혈압); 면역계 질환(X 염색체-연관 중증 복합 면역결핍증); 색소 실조증; 영아 뇌 고셔병(제2형 고셔병); 영아 고셔병(제2형 고셔병); 영아 발병 증가 유전성 경련 마비; 불임; 유전성 폐기종(알파-1 항트립신 결핍증); 유전성 사람 전염 해면형 뇌질환(프리온 질환); 압박 마비에 대한 유전 성향(압박 마비에 대한 책임을 동반하는 유전성 신경병증); 인슬리-아슬리 증후군(귀척추거대골단이형성증); 간헐적 급성 포르피린증후군(급성 간헐성포르피린증); 장 용종증-피부 색소침착 증후군(푸에츠-제거스 증후군); IP(색소 실조증); 철 축적 질환(혈색소증); 동완 15(idic15); 고립형 난청(비증후군성 난청); 잭슨-바이스 증후군; JH(혈색소증#제2형); 주버트 증후군; JPLS(소아 원발성 측색 경화증); 소아 근위축성 측색 경화증(근위축성 측색 경화증#제2형); 소아 장 무도무정위운동, 정신지체 증후군(레쉬-니한 증후군); 소아 과뇨산혈증후군(레쉬-니한 증후군); JWS(잭슨-바이스 증후군); KD(X 염색체-연관 척추-연수 근육 위축증); 케네디병(X 염색체-연관 척추-연수 근육 위축증); 케네디 척추 및 연수 근육 위축증(X 염색체-연관 척추-연수 근육 위축증); 케라신 조직구증(고셔병); 케라신 유지증(고셔병); 케라신 케라신 축적증(고셔병); 케톤형 글리신혈증(프로피온산혈증); 케톤형 고글리신혈증(프로피온산혈증); 신장 질환(원발성 고수산뇨증); 클라인펠터 증후군; 클라인펠터 증후군; 니스트 이형성증; 크라베병; 열공성 치매(CADASIL); 랑거-살디노 연골 무형성증(제II형 연골 무형성증); 랑거-살디노 이형성증(제II형 연골 무형성증); 후발성 알츠하이머병(알츠하이머병#제2형); 후발 가족성 알츠하이머병(AD2)(알츠하이머병#제2형); 후발성 크라베병(LOKD)(크라베병); 학습 장애(학습 부진); 구주위 흑자증(푸에츠-제거스 증후군); 레쉬-니한 증후군; 백질 이영양증; 로젠탈 섬유 생성 백질 이영양증(알렉산더병); 해면형 백질 이영양증(카나반병); LFS(리-프라우메니 증후군); 리-프라우메니증후군; 리파제 D 결핍증(가족성 지단백 리파제 결핍증); LIPD 결핍증(가족성 지단백 리파제 결핍증); 세레브로시드 지방증(고셔병); 영아 강글리오시드 지방증(테이-삭스병); 리포이드조직구증(케라신형)(고셔병); 가족성 지단백 리파제 결핍증; 간 질환(갈락토스혈증); 루게릭병(근위축성 측색 경화증); 루이-바 증후군(운동 실조-모세 혈관 확장증); 린치 증후군(유전성 비폴립증 대장암); 리실-하이드록실라제 결핍증(엘러스-단로스 증후군#척추만곡증형); 마카도-조셉병(척수소뇌 운동 실조#제3형); 남성 유방암(유방암); 남성 생식기 질환; 남성 터너 증후군(누난 증후군); 유방 악성 신생물(유방암); 유방 악성 종양(유방암); 방광 악성 종양(방광암); 유선암(유방암); 마르판 증후군 15; 마커 X 증후군(취약 X 증후군); 마틴-벨 증후군(취약 X 증후군); 맥쿤-알브라이트 증후군; 맥러드 증후군; MEDNIK; 지중해 빈혈(베타 지중해 빈혈); 가족성 지중해열; 거대골단 난장이증(귀척추거대골단이형성증); 멩케아 증후군(멩케 증후군); 멩케 증후군; 골연골이상을 동반하는 정신 지체(코핀-로우리 증후군); 대사 질환; 제II형 영양위축성 난장이증(니스트 이형성증); 제II형 영양위축성 이형성증(니스트 이형성증); 메트헤모글로빈혈증#베타-글로빈형; 메틸말론산혈증; MFS(마르판 증후군); MHAM(카우덴 증후군); MK(멩케 증후군);마이크로 증후군; 소두증; MMA(메틸말론산혈증); MNK(멩케 증후군); 1염색체성 1p36 증후군(1p36 결손 증후군); 1염색체성 X(터너 증후군); 운동 신경 질환, 근위축성 측색 경화증(근위축성 측색 경화증); 운동 장애; 모왓-윌슨 증후군; 점액다당류증(MPS I); 점액성 점착증(낭포성 섬유증); 뮌케 증후군; 다발경색치매(CADASIL); 후발성 다발 카복실라제 결핍증(바이오티니다제 결핍증); 다발성 과오종 증후군(카우덴 증후군); 다발성 신경섬유종증(신경섬유종증); 근이영양증; 듀센-베커형 근이영양증; 근 긴장 이영양증(근 긴장성 이영양증); 근긴장 이영양증(근 긴장성 이영양증); 근 긴장성 이영양증; 선천성 점액수종(선천성 갑상선 기능 저하증); 낸스-인슬리 증후군(귀척추거대골단이형성증); 낸스-스위니 연골이형성증(귀척추거대골단이형성증); NB1A1(판토테네이트 키나제-연관 신경퇴화); 네일-딩월 증후군(코케인 증후군); 망막신경아세포종(망막모세포종); 제1형 뇌내 철 축적을 동반하는 신경퇴화(판토테네이트 키나제-연관 신경퇴화); 제I형 신경섬유종증; 제II형 신경섬유종증; 신경 질환; 신경근 질환; 제V형 원위 유전성 운동신경병증(말단 척추 근육 위축증#제V형); 피라미드 특징을 동반하는 원위 유전성 운동신경병증(근위축성 측색 경화증#제4형); NF(신경섬유종증); 니만-픽(니만-픽병); 노악 증후군(파이퍼 증후군); 비케톤성 고글리신혈증(글리신 뇌병증); 비신경계침윤 고셔병(제1형 고셔병); 비페닐케톤뇨 고페닐알라닌혈증(테트라하이드로바이오프테린 결핍증); 비증후군성 난청; 누난 증후군; 노보트니 고셔병(Norrbottnian Gaucher disease)(제3형 고셔병); 조직갈변증(알캅톤뇨증); 퇴자병성 관절염(알캅톤뇨증); OI(골 형성 부전증); OSMED(귀척추거대골단이형성증); 골 형성 부전증; 골취약증(골 형성 부전증); 선천성 골경화증 (연골 발육 부전증); 귀척추거대골단 이형성증(귀척추거대골단이형성증); 귀척추거대골단이형성증; 수산증(고수산뇨증, 원발성); 원발성 옥살산뇨(원발성 고수산뇨증); 판토테네이트 키나제-연관 신경퇴화; 파타우 증후군(3염색체성 13); PBGD 결핍증(급성 간헐성포르피린증); PCC 결핍증(프로피온산혈증); PCT(포르피린증 만발성 피부); PDM(근 긴장성 이영양증#제2형); 펜리드 증후군; 주기적 질환(가족성 지중해열); 주기적 복막염(가족성 지중해열); 구주위 흑자증 증후군(푸에츠-제거스 증후군); 말초 신경 질환(가족성 자율 신경 실조증); 말초 신경섬유종증(신경섬유종증 1); 비골근위축증(샤르코-마리-투스병); 퍼옥시좀 알라닌:글리옥실레이트 아미노트랜스퍼라제 결핍증(고수산뇨증, 원발성); 푸에츠-제거스 증후군; 파이퍼 증후군; 페일알라닌 하이드록실라제 결핍성 질환(페닐케톤뇨증); 페닐케톤뇨증; 갈색세포종(폰 히펠-린다우병); 태아연골이형성증을 동반하는 피에르 로빈 증후군(비센바허-쯔바이뮐러 증후군); 색소침착경변(혈색소증); PJS(푸에츠-제거스 증후군); PKAN(판토테네이트 키나제-연관 신경퇴화); PKU(페닐케톤뇨증); 플럼보 포르피린증(ALA 결핍증 포르피린증); PMA(샤르코-마리-투스병); 다골성 섬유성골 이형성증(맥쿤-알브라이트 증후군); 대장 용종증(가족 성선 종성 용종증); 과오종 장 용종증(푸에츠-제거스 증후군); 장 용종증 II(푸에츠-제거스 증후군); 폴립-및-스팟 증후군(polyps-and-spots syndrome)(푸에츠-제거스 증후군); 포르포빌리노겐 합성 효소 결핍증(ALA 결핍 포르피린증); 포르피린증; 포르피린 질환(포르피린증); PPH(원발성 폐고혈압); PPOX 결핍증(반문상 포르피린증); 프레이더-랩하트-윌리 증후군(프레이더-윌리 증후군); 프레이더-윌리 증후군; 초로기 및 노인성 치매(알츠하이머병); 원발성 혈색소증(혈색소증); 원발성 과뇨산혈증 증후군(레쉬-니한 증후군); 원발성 폐고혈압; 원발 노인성 퇴행 치매(알츠하이머병); 프리온 질환; 돌연변이 프로콜라겐형 EDS VII(엘러스-단로스 증후군#관절이완증형); 조로증(허친슨 길포드 조로증후군); 조로증 유사 증후군(코케인 증후군); 조로성 왜소증(코케인 증후군); 유전적 만성 진행성 무도병(헌팅톤)(헌팅톤병); 진행성 근위축증(척추 근위축증); 정상 공막 진행성 변형 골 형성 부전증(골 형성 부전증#제III형); PROMM(근 긴장성 이영양증#제2형); 프로피온산혈증; 프로피오닐-CoA 카복실라제 결핍증(프로피온산혈증); 단백질 C 결핍증; 단백질 S 결핍증; 프로토포르피린증(적혈구조성 프로토포르피린증); 프로토포르피리노겐 옥시다제 결핍증(반문상 포르피린증); 근위 근 긴장성 이영양증(근 긴장성 이영양증#제2형); 근위 근 긴장성 근육병(근 긴장성 이영양증#제2형); 유사 고셔병; 유사 율리히-터너 증후군(누난 증후군); 탄력섬유성위황색종; 사이코신 지방증(크라베병); 폐동맥 고혈압(원발성 폐고혈압); 폐고혈압(원발성 폐고혈압); PWS(프레이더-윌리 증후군); PXE - 탄력섬유성위황색종(탄력섬유성위황색종); Rb(망막모세포종); 신경 레클링하우젠병(신경섬유종증 1); 재발성 다발 장막염(가족성 지중해열); 망막 질환; 망막색소변성증-난청 증후군(어셔 증후군); 망막모세포종; 레트 증후군; 제3형 RFALS(근위축성 측색 경화증#제2형); 리커 증후군(근 긴장성 이영양증#제2형); 릴리-데이 증후군(가족성 자율 신경 실조증); 로우시-레비 증후군(샤르코-마리-투스병); RSTS(루빈스타인-테이비 증후군); RTS(레트 증후군)(루빈스타인-테이비 증후군); RTT(레트 증후군); 루빈스타인-테이비 증후군; 색-바라바스 증후군(Sack-Barabas syndrome)(맥관형 엘러스-단로스 증후군); SADDAN; 리 앤 프라우마니 육종 집단 증후군(리-프라우메니증후군); 유방 육종, 백혈병 및 부신(SBLA) 증후군(리-프라우메니증후군); SBLA 증후군(리-프라우메니증후군); SBMA(X 염색체-연관 척추-연수 근육 위축증); SCD(겸상적혈구빈혈); 양측성 청각 슈반종(신경섬유종증 2); SCIDX1(X 염색체-연관 중증 복합 면역결핍증); 결절 경화증(결절성 경화증); SDAT(알츠하이머병); 선천성 SED(선천성 척추골단 이형성증); SED 스트루드위크(스트루드위크형 척추골단골간단 이형성증); SEDc(선천성 척추골단 이형성증); SEMD,스트루드위크형(스트루드위크형 척추골단골간단 이형성증); 노인성 치매(알츠하이머병#제2형); 발달 지연 및 흑색 가시세포증 동반 중증 연골 발육 부전증(SADDAN); 스프린젠 증후군(Shprintzen syndrome)(22q11.2 결손 증후군); 겸상적혈구빈혈; 골격-피부-뇌 증후군(SADDAN); 피부 색소침착 질환; SMA(척추 근위축증); SMED,스트루드위크형(스트루드위크형 척추골단골간단 이형성증); 제I형 SMED(스트루드위크형 척추골단골간단 이형성증); 스미스 렘리 오피츠 증후군; 유전성 남아프리카 포르피린증(반문상 포르피린증); 영아 발병 증가 경련성 마비(영아 발병 증가 유전적 경련성 마비); 언어 및 소통 장애; 스핑고지방증, 테이-삭스(테이-삭스병); 척추-연수 근육위축증; 척추 근위축증; 제V형 원위 척추 근위축증(말단 척추 근육 위축증#제V형); 주로 팔에 발병하는 원위 척추 근위축증(원위 척추 근위축증#제V형); 척수소뇌 운동 실조; 스트루드위크형 척추골단골간단 이형성증; 선천성 척추골단 이형성증 ; 척추골단 이형성증(제II형 및 제XI형 콜라겐요법); 선천성 스트루드위크형 척추사지끝골간단 이형성증(스트루드위크형 척추골단골간단 이형성증); 척추사지골간단 이형성증(SMD)(스트루드위크형 척추골단골간단 이형성증); 스트루드위크형 척추사지골간단 이형성증(스트루드위크형 척추골단골간단 이형성증); 중추 신경계의 해면상 변성(카나반병); 뇌의 해면상 변성(카나반병); 영아 백질 해면상 변성(카나반병); 산발성 원발 폐고혈압(원발성 폐고혈압); SSB 증후군(SADDAN); 붉은 머리 증후군(steely hair syndrome)(멩케 증후군); 슈타이너트병(근 긴장성 이영양증); 슈타이너트 근 긴장성 이영양 증후군(근 긴장성 이영양증); 스티클러 증후군; 뇌졸중(CADASIL); 스트루드위크 증후군(스트루드위크형 척추골단골간단 이형성증); 아급성 신경계침윤 고셔병(제3형 고셔병); 스웨덴 유전성 포르피린증(급성 간헐성포르피린증); 스웨덴 포르피린증(급성 간헐성포르피린증); 스위스 치즈 연골 이형성증(니스트 이형성증); 테이-삭스병; TD - 치명적 난장이증(치명적 이형성증); 곧은 대퇴골 및 클로버잎 모양 두개골을 보이는 TD(치명적 이형성증#제2형); 소뇌-안구피부 모세 혈관 확장증(운동 실조-모세 혈관 확장증); 정소성 여성화 증후군(안드로겐 무감성 증후군); 테트라하이드로비오프테린 결핍증; TFM - 정소성 여성화 증후군(안드로겐 무감성 증후군); 지중해 빈혈 매개물(베타 지중해 빈혈); 종증성 지중해 빈혈(베타 지중해 빈혈); 치명적 이형성증; 진성 당뇨병 및 감각신경 난청을 동반하는 티아민 반응 거대적아구성 빈혈; 활성화된 단백질 C에 대한 보조 인자 결핍으로 인한 라이덴형 혈전성향증(인자 V 라이덴 혈전성향증); 갑상선 질환; 순대양 신경병증(압박 마비에 대한 책임을 동반하는 유전성신경병증); 총 HPRT 결핍증(레쉬-니한 증후군); 총 하이포잔틴-구아닌 포스포리보실 트랜스퍼라제 결핍증(레쉬-니한 증후군); 투렛 증후군; 전염성 치매(프리온 질환); 전염성 해면형 뇌질환(프리온 질환); 트리처 콜린스 증후군; 트리아스 취약성 골(Trias fragilitis ossium)(골 형성 부전증#제I형); XXX 증후군; 3중 X 증후군(XXX 증후군); 3염색체 21(다운 증후군); 3염색체 X(XXX 증후군); 트로이시에-하놋-쇼파르 증후군(Troisier-Hanot-Chauffard syndrome)(혈색소증); TS(터너 증후군); TSD(테이-삭스병); TSEs(프리온 질환); 결정 경화증(결절성 경화증); 결절성 경화증; 터너 증후군; X 염색체를 가지는, 여성의 터너 증후군(누난 증후군); 정상 핵형의 터너 발현증(누난 증후군); 터너의 증후군(터너 증후군); 터너 유사 증후군(누난 증후군); 제2형 고셔병(고셔병 제2형); 제3형 고셔병(고셔병 제3형); UDP-갈락토스-4-에피머라제 결핍성 질환(갈락토스혈증); UDP 글루코스 4-에피머라제 결핍성 질환(갈락토스혈증); UDP 글루코스 헥소스-1-인산염 우리딜트랜스퍼라제 결핍증(갈락토스혈증); 율리히-누난 증후군(누난 증후군); 율리히-터너 증후군(터너 증후군); 미분화 난청(비증후군성 난청); UPS 결핍증(급성 간헐성포르피린증); 방광 암(방광암); UROD 결핍증(포르피린증 만발성 피부); 유로포르피리노겐 탈탄산효소 결핍증(포르피린증 만발성 피부); 유로포르피리노겐 합성 효소 결핍증(급성 간헐성포르피린증); UROS 결핍증(선천성 적혈구조성 포르피린증); 어셔 증후군; UTP 헥소스-1-인산염 우리딜릴트랜스퍼라제 결핍증(갈락토스혈증); 반 보갸르트-베르트란트 증후군(카나반병); 판 데르 회브 증후군(골 형성 부전증#제I형); 반문상 포르피린증; 안모구개 증후군(Velocardiofacial syndrome)(22q11.2 결손 증후군); VHL 증후군(폰 히펠-린다우병); 시력 손상 및 실명(알스트롬 증후군); 폰 보가에르트-베르트란트병(카나반병); 폰 히펠-린다우병; 폰 레클렌하우젠-애플바움병(혈색소증); 폰 레클렌하우젠병(신경섬유종증 1); VP(반문상 포르피린증); 브롤릭병(골 형성 부전증); 바르덴부르크 증후군; 바르부르크 쇼 플레델리우스 증후군(Warburg Sjo Fledelius syndrome)(마이크로 증후군); WD(윌슨병); 비센바허-쯔바이뮐러 증후군; 윌슨 병(윌슨병); 볼프-허시혼 증후군; 볼프 주기적 질환(가족성 지중해열); WZS(비센바허-쯔바이뮐러 증후군); 색소성 건피증; X 염색체-연관 정신 지체 및 거대고환증(취약 X 증후군); X 염색체-연관 원발성 과뇨산혈증(레쉬-니한 증후군); X 염색체-연관 중증 복합 면역결핍증; X 염색체-연관 철적아구성 빈혈; X 염색체-연관 척추-연수 근육 위축증(케네디병); X 염색체-연관 요산뇨증 효소 결함(레쉬-니한 증후군); X-SCID(X 염색체-연관 중증 복합 면역결핍증); XLSA(X 염색체-연관 철적아구성 빈혈); XSCID(X 염색체-연관 중증 복합 결핍증); XXX 증후군(XXX 증후군); XXXX 증후군(48, XXXX); XXXXX 증후군(49, XXXXX); XXY 증후군(클라인펠터 증후군); XXY 3염색체(클라인펠터 증후군); XYY 핵형(47, XYY 증후군); XYY 증후군(47, XYY 증후군); 및 YY 증후군(47, XYY 증후군).
또 다른 바람직한 양상에서, 여기서 정의된 핵산 서열 또는 여기서 정의된 복수의 핵산 서열을 포함하는 본 발명의 조성물은 약학 조성물의 제조를 위하여, 특히 여기서 정의된 목적을 위하여, 바람직하게는 여기서 정의된 질병의 치료에서 유전자 요법에서의 사용을 위하여 사용될 수 있다.
본 발명의 약학 조성물은 또한 바람직하게는 특히 여기서 정의된 질병 또는 장애의 치료에서 유전자 요법에서 사용될 수 있다.
본 발명은 또한 본 발명의 RNA 함유 조성물, 또는 약학 조성물, 또는 백신, 또는 여기서 정의된 키트 또는 부품 키트의 여러 응용 및 용도를 제공한다. 하나의 구체예에서, 조성물 또는 약학 조성물 또는 키트 또는 부품 키트는 즉 종양 또는 암 질환의 치료를 위한 약제로서 사용될 수 있다. 이와 관련하여 치료는 바람직하게는 종양내 주입, 특히 종양 세포 내 주사에 의해 수행된다. 또 다른 양상에 따르면, 본 발명은 RNA 함유 조성물 또는 약학 조성물, 또는 백신, 또는 앞서 기술된 키트 또는 부품 키트의 제2 의학적 용도에 관한 것이며, 여기서 이러한 주제는 종양 또는 암 질환의 치료를 위한 종양 내 적용(투여)를 위한 약제의 제조에 사용된다.
바람직하게는, 여기서 언급한 질병은 바람직하게는 예컨대 다음을 포함하는 종양 또는 암 질병으로부터 선택된다: 급성 림프아구성 백혈병, 급성 골수성 백혈병, 부신피질암종, AIDS-관련 암, AIDS-관련 림프종, 항문암, 맹장암, 성상세포종, 기저세포암, 담도암, 방광암, 골암, 골육종/악성 섬유성 조직구종(Osteo-sarcoma/Malignant fibrous histiocytoma), 뇌간 신경교종, 뇌종양, 소뇌별아교세포종(cerebellar astrocytoma), 별아교세포종/악성 뇌교종(cerebral astrocytoma/malignant glioma), 상의세포종(ependymoma), 수아세포종, 원시신경외배엽 종양(supratentorial primitive neuroectodermal tumors), 시각 경로 및 시상하부 교종(visual pathway and hypothalamic glioma), 유방암, 기관지 선종/유암종(Bronchial adenomas/carcinoids), 버킷 림프종, 소아 유암종(childhood Carcinoid tumor), 위장관 유암종(gastrointestinal Carcinoid tumor), 원발 부위 미상암(Carcinoma of unknown primary), 일차 중추신경계 림프종(primary Central nervous system lymphoma), 소아 소뇌별아교세포종, 소아 별아교세포종/악성 뇌교종, 자궁경부암, 소아암, 만성 림프구성 백혈병, 만성 골수성 백혈병, 만성 골수증식성 질환, 결장암(colon cancer), 피부 T-세포 림프종(Cutaneous T-cell lymphoma), 결합조직성 소원형세포 종양(Desmoplastic small round cell tumor), 자궁내막암, 상의세포종, 식도암, 종양의 유잉 패밀리에서의 유잉 육종(Ewing's sarcoma in the Ewing family of tumors), 소아 두개외 생식세포 종양(Childhood Extracranial germ cell tumor), 고환외 생식세포 종양(Extragonadal Germ cell tumor), 간외 담도암(Extrahepatic bile duct cancer), 안구내 흑색종(Intraocular 흑색종), 망막아세포종(Retinoblastoma), 담낭암, 위암, 위장관 유암종, 위장관 기질 종양(gastrointestinal stromal tumor, GIST), 두개외, 고환외 또는 난소 생식세포 종양(extracranial, extragonadal, or ovarian Germ cell tumor), 임신 육모성 종양(Gestational trophoblastic tumor), 뇌간 신경교종(Glioma of the brain stem), 소아 별아교세포종, 소아 시각 경로 및 시상하부 교종, 위유암종, 모양 세포성 백혈병(Hairy cell leukemia), 두경부암, 심장암, 간세포(간) 암, 호지킨 림프종, 하인두암, 소아 시상하부 및 시각 경로 교종(childhood Hypothalamic and visual pathway glioma), 안내 흑색종, 섬세포암종(Islet Carcinoma)(내분비 췌장), 카포시 육종(Kaposi sarcoma), 신장암(신장세포암), 후두암, 백혈병, 급성 림프아구성 백혈병, 급성 골수성 백혈병, 만성 림프구성 백혈병, 만성 골수성 백혈병, 모양 세포성 백혈병, 입술 및 구강암, 지방육종, 간암, 비소세포 폐암, 소세포 폐암, 림프종, AIDS-관련 림프종, 버킷 림프종, 피부 T-세포 림프종, 호지킨 림프종, 비-호지킨 림프종, 일차 중추신경계 림프종, 발덴스트룀 매크로글로불린혈증(Waldenstroem Macroglobulinemia), 뼈의 악성 섬유성 조직구종/골육종(Malignant Fibrous Histiocytoma of Bone/Osteosarcoma), 소아 수모세포종(Childhood Medulloblastoma), 흑색종, 안내(눈) 흑색종, 머켈세포암(Merkel Cell Carcinoma), 성인 악성 중피종(Adult Malignant Mesothelioma), 소아 중피종(Childhood Mesothelioma), 잠복 원발 경부 편평 전이암(Metastatic Squamous Neck Cancer with Occult Primary), 구강암(mouth cancer), 소아 다발성 내분비 신생물 증후군(Childhood Multiple Endocrine Neoplasia Syndrome), 다발성 골수종/형질 세포 종양(Multiple Myeloma/Plasma Cell Neoplasm), 균상 식육종(Mycosis Fungoides), 골수이형성 증후군(Myelodysplastic Syndromes), 골수이형성/골수증식성 질환(Myelodysplastic/Myeloproliferative Diseases), 만성 골수성 백혈병, 성인 급성 골수성 백혈병, 소아 급성 골수성 백혈병, 다발성 골수종(골수의 암), 만성 골수증식성 질환, 비강암 및 부비동암(Nasal cavity and paranasal sinus cancer), 비인두암(Nasopharyngeal carcinoma), 신경모세포종(Neuroblastoma), 구강암(Oral cancer), 구인두암(Oropharyngeal cancer), 골육종/뼈의 악성 섬유조직구종(Osteosarcoma/malignant fibrous histiocytoma of bone), 난소암(Ovarian cancer), 난소 상피암(Ovarian epithelial cancer)(표면 상피-기질 종양(Surface epithelial-stromal tumor)), 난소 생식세포 종양(varian germ cell tumor), 난소 저악성 잠재성 종양(Ovarian low malignant potential tumor), 췌장암(Pancreatic cancer), 섬세포 췌장암(isleT cell Pancreatic cancer), 부비동 및 비강암(Paranasal sinus and nasal cavity cancer), 부갑상선암(Parathyroid cancer), 음경암(Penile cancer), 인두암(Pharyngeal cancer), 크롬 친화성 세포종(Pheochromocytoma), 송과체 성상세포종(Pineal astrocytoma), 송과체 배아세포종(Pineal germinoma), 소아 솔방울샘모세포종 및 원시신경외배엽 종양(childhood Pineoblastoma and supratentorial primitive neuroectodermal tumors), 뇌하수체 선종(Pituitary adenoma), 혈장 세포 종양형성/다발성 골수종(Plasma cell neoplasia/Multiple myeloma), 흉막 폐 모세포종(Pleuropulmonary blastoma), 일차 중추신경계 림프종, 전립선 암, 직장암(Rectal cancer), 신장 세포 암종(신장암), 신우 및 수뇨관의 암, 망막아세포종, 소아 횡문근육종(childhood Rhabdomyosarcoma), 침샘 암(Salivary gland cancer), 유잉 패밀리 종양의 육종(Sarcoma of the Ewing family of tumors), 카포시 육종, 연부 조직 육종(soft tissue Sarcoma), 자궁 육종(uterine Sarcoma), 시자리 증후군(Sezary syndrome), 피부암(비흑색종), 피부암(흑색종), 머켈 세포 피부 암종(Merkel cell Skin carcinoma), 소장암, 편평세포 암종(Squamous cell carcinoma), 잠복 원발 경부 편평 전이암, 소아 천막상 원시신경외배엽 종양(childhood Supratentorial primitive neuroectodermal tumor), 고환암, 인후암, 소아 흉선종(childhood Thymoma), 흉선종 및 흉선암, 갑상선암, 소아 갑상선암, 신우 및 수뇨관의 이행세포암(Transitional cell cancer of the renal pelvis and ureter), 임신 육모성 종양, 요도암, 자궁내막암(endometrial Uterine cancer), 자궁 육종, 질암, 소아 시각 경로 및 시상하부 교종, 외음부암, 발덴스트룀 매크로글로불린혈증, 및 소아 윌름 종양(childhood Wilms tumor)(신장암).
종양 내 투여에 적합한 종양 또는 암의 특히 바람직한 예는 전립선 암, 폐암, 유방암, 뇌암, 두 경부암, 갑상선암, 대장 암, 위암, 간암, 췌장암, 난소 암, 피부 암, 방광, 자궁 및 자궁경부 등이다.
특정 구체예에 따라, 약제는 환자에게 단일 투여량 또는 수 회 투여량으로 투여될 수 있다. 특정 구체예에서, 약제는 환자에게 단일 투여량 및 후속적으로 제2 투여량 및 후속적으로 선택사항으로서 심지어 제3, 제4 (또는 그 이상의) 투여량 등으로 투여될 수 있다.
바람직하게는, 본 발명의 조성물은 투여량 당 적어도 40 μg RNA의 양으로 제공된다. 더욱 구체적으로, 단일 투여량에 포함되는 mRNA의 양은 전형적으로 적어도 200 μg, 바람직하게는 200 μg 내지 1.000 μg, 더욱 바람직하게는 300 μg 내지 850 μg, 더욱 더 바람직하게는 300 μg 내지 700 μg이다.
또 다른 구체예에서, 본 발명의 조성물의 뉴클레오타이드 애시드 분자, 바람직하게는 mRNA 분자는 적어도 하나의 항원의 적어도 하나의 에피토프를 인코딩한다. 본 발명의 바람직한 구체예에서 적어도 하나의 항원은 감염성 질환과 관련된 병원체로부터의 항원, 알러지와 관련된 항원, 자가면역 질환과 관련된 항원, 암 또는 종양 질환과 관련된 항원, 또는 상기 항원의 절편, 변이체 및/또는 유도체로 구성된 군으로부터 선택된다.
바람직하게는 적어도 하나의 항원은 병원체, 바람직하게는 바이러스, 박테리아, 곰팡이 또는 원생생물 병원체로부터 유래되며, 바람직하게는 다음으로 구성된 목록으로부터 선택된다: 라비 바이러스(Rabies virus),에볼라바이러스(Ebolavirus), 마르부르그바이러스(Marburgvirus), B형 간염 바이러스(Hepatitis B virus), 인간 유두종 바이러스(human Papilloma virus) (hPV), 탄저균(Bacillus anthracis), 호흡기 합포체 바이러스(Respiratory syncytial virus) (RSV), 단순 포진 바이러스(Herpes simplex virus) (HSV), 뎅기 바이러스(Dengue virus), 로타바이러스(Rotavirus), 인플루엔자 바이러스(Influenza virus), 인간 면역결핍 바이러스(human immunodeficiency virus) (HIV), 황색열 바이러스(Yellow Fever virus), 결핵균(Mycobacterium tuberculosis), 열대열(Plasmodium), 포도상구균(Staphylococcus aureus), 클라미디아 트라코마 티스(Chlamydia trachomatis), 거대세포바이러스(Cytomegalovirus)(CMV) 및 HB형 간염 바이러스(Hepatitis B virus)(HBV).
이와 관련하여 본 발명의 조성물의 mRNA는 단백질 또는 펩티드를 인코딩하며, 이는 병원성 항원 또는 이의 절편, 변이체 또는 유도체의 적어도 하나의 에피토프를 포함한다. 이러한 병원성 항원은 병원체성 유기체, 특히 세균성, 바이러스성 또는 원생생물학적(다세포성) 병원체성 유기체에서 유래한 것으로, 이는 대상체, 특히 포유동물 대상체, 더욱 특히 인간에 의한 면역 반응을 일으킨다. 더욱 구체적으로, 병원성 항원은 바람직하게는 표면 항원, 예컨대 바이러스 또는 박테리아 또는 원생생물 유기체의 표면에 위치하는 단백질(또는 단백질의 절편, 예컨대 표면 항원의 외부 부분)이다.
병원성 항원은 바람직하게는 감염성 질환과 관련된 병원체로부터 유래하는 펩티드 또는 단백질 항원이며 이는 다음의 병원체로부터 유래하는 항원으로부터 선택된다: 아시네토박터 바우마니(Acinetobacter baumannii), 아나플라스마 속(Anaplasma genus), 아나플라스마 파고사이토필룸(Anaplasma phagocytophilum), 브라질 구충(Ancylostoma braziliense), 두비니 구충(Ancylostoma duodenale), 용혈성 아카노박테륨(Arcanobacterium haemolyticum), 회충(Ascaris lumbricoides), 아스페르길루스 속(Aspergillus genus), 아스트로바이러스 과(Astroviridae), 바베시아 속(Babesia genus), 탄저균(Bacillus anthracis), 바실러스 세레우스(Bacillus cereus), 바르토넬라 헨셀라에(Bartonella henselae), BK 바이러스(BK virus), 블라스토시스티스 호미니스(Blastocystis hominis), 블라스토미세스 더마티티디스(Blastomyces dermatitidis), 보르데텔라 백일해균(Bordetella pertussis), 보렐리아 부르그도르페리(Borrelia burgdorferi), 보렐리아 속(Borrelia genus), 보렐리아 종(Borrelia spp), 브루셀라 속(Brucella genus), 말레이사상충(Brugia malayi), 부니아바이러스 과(Bunyaviridae family), 부르크홀데리아 세파시아(Burkholderia cepacia) 및 다른 부르크홀데리아 종, 부르크홀데리아 말레이(Burkholderia mallei), 부르크홀데리아 슈도말레이(Burkholderia pseudomallei), 칼리시바이러스 과(Caliciviridae family), 캄필로박터 속(Campylobacter genus), 칸디다 알비칸스(Candida albicans), 칸디다 종(Candida spp), 트라코마 클라미디아(Chlamydia trachomatis), 클라미노필라 뉴모니에(Chlamydophila pneumoniae), 클라미노필라 프시타시(Chlamydophila psittaci), CJD 프리온, 간흡충(Clonorchis sinensis), 클로스트리디움 보툴리눔(Clostridium botulinum), 클로스트리디움 디피실리(Clostridium difficile), 클로스트리디움 퍼프리젠스(Clostridium perfringens), 클로스트리디움 종(Clostridium spp), 파상풍균(Clostridium tetani), 콕시디오이데스 종(Coccidioides spp), 코로나바이러스(coronaviruses), 코리네박테리움 디프테리아(Corynebacterium diphtheriae), 콕시엘라 부르네티(Coxiella burnetii), 크림-콩고 출혈열 바이러스(Crimean-Congo hemorrhagic fever virus), 크립토코커스 네오포르만스(Cryptococcus neoformans), 크립토스포리듐 속(Cryptosporidium genus), 시토메갈로바이러스(Cytomegalovirus, CMV), 뎅기열 바이러스(Dengue viruses)(DEN-1, DEN-2, DEN-3 및 DEN-4), 이핵 아메바(Dientamoeba fragilis), 에볼라 바이러스(Ebolavirus, EBOV), 에키노코쿠스 속(Echinococcus genus), 에를리히아 샤펜시스(Ehrlichia chaffeensis), 에를리히아 에윈기(Ehrlichia ewingii), 에를리히아 속(Ehrlichia genus), 이질 아메바(Entamoeba histolytica), 엔테로코쿠스 속(Enterococcus genus), 엔테로바이러스 속(Enterovirus genus), 엔테로바이러스(Enteroviruses), 주로 콕사키 A 바이러스(주로 Coxsackie A virus) 및 엔테로바이러스 71(EV71), 표피균 종(Epidermophyton spp), 엡스타인바 바이러스(Epstein-Barr Virus, EBV), 대장균 O157:H7, 0111 및 0104:H4(Escherichia coli O157:H7, O111 and O104:H4), 간질(Fasciola hepatica) 및 거대 간질(Fasciola gigantica), FFI 프리온, 필라리오이디아 상과(Filarioidea superfamily), 플라비바이러스(Flaviviruses), 야토균(Francisella tularensis), 푸소박테륨 속(Fusobacterium genus), 게오트리쿰 칸디둠(Geotrichum candidum), 장편모충(Giardia intestinalis), 악구충 종(Gnathostoma spp), GSS 프리온, 구아나리토 바이러스(Guanarito virus), 헤모필루스 듀크레이(Haemophilus ducreyi), 헤모필루스 인플루엔자(Haemophilus influenzae), 헬리코박터 파일로리(Helicobacter pylori), 헤니파바이러스(Henipavirus)(헨드라 바이러스 니파 바이러스), A형 간염 바이러스(Hepatitis A Virus), B형 간염 바이러스(Hepatitis B Virus, HBV), C형 간염 바이러스(HCV), D형 간염 바이러스, E형 간염 바이러스, 단순 포진 바이러스 1 및 2(Herpes simplex virus 1 and 2, HSV-1 및 HSV-2), 히스토플라스마 캡슐라툼(Histoplasma capsulatum), HIV(인간 면역결핍 바이러스(Human immunodeficiency virus)), 호르테아 웨르넥키(Hortaea werneckii), 인간 보카바이러스(HBoV), 인간 헤르페스바이러스 6(HHV-6) 및 인간 헤르페스바이러스 7(HHV-7), 인간 메타뉴모바이러스(Human metapneumovirus, hMPV), 인유두종 바이러스(Human papillomavirus, HPV), 인간 파라인플루엔자 바이러스(Human parainfluenza viruses, HPIV), 일본 뇌염 바이러스(Japanese encephalitis virus), JC 바이러스, 쥬닌 바이러스(Junin virus), 킨젤라 킨가에(Kingella kingae), 클렙시엘라 그래눌로마티스(Klebsiella granulomatis), 쿠루 프리온(Kuru prion), 라사 바이러스(Lassa virus), 레지로넬라 뉴모필라(Legionella pneumophila), 레슈마니아 속(Leishmania genus), 렙토스피라 속(Leptospira genus), 리스테리아 모노사이토제니스(Listeria monocytogenes), 림프구성 맥락수막염 바이러스(Lymphocytic choriomeningitis virus, LCMV), 마츄포바이러스(Machupo virus), 말라세지아 종(Malassezia spp), 마르부르크 바이러스(Marburg virus), 홍역 바이러스(Measles virus), 메타고니무스 요카가와이(Metagonimus yokagawai), 마이크로스포리디아 필룸(Microsporidia phylum), 전염성 연속종 바이러스(Molluscum contagiosum virus, MCV), 멈프스 바이러스(Mumps virus), 나균(Mycobacterium leprae) 및 나종균(Mycobacterium lepromatosis), 결핵균(Mycobacterium tuberculosis)), 마이코박테륨 울세란스(Mycobacterium ulcerans), 마이코플라스마뉴모니에(Mycoplasma pneumoniae), 파울러 자유아메바(Naegleria fowleri), 아메리카 구충(Necator americanus), 임균(Neisseria gonorrhoeae), 수막구균(Neisseria meningitidis), 노카르디아 아스테로이디즈(Nocardia asteroides), 노카르디아 종(Nocardia spp), 회선사상충(Onchocerca volvulus), 오리엔티아 쯔쯔가무시균(Orientia tsutsugamushi), 오르토믹소바이러스 과(Orthomyxoviridae family)(인플루엔자), 파라콕시디오이디즈 브라질리엔시스(Paracoccidioides brasiliensis), 파라고니무스 종(Paragonimus spp), 폐흡충(Paragonimus westermani), 파보바이러스 B19(Parvovirus B19), 파스퇴렐라 속(Pasteurella genus), 플라스모디움 속(Plasmodium genus), 주폐포자충(Pneumocystis jirovecii), 폴리오바이러스(Poliovirus), 광견병 바이러스(Rabies virus), 호흡기 세포융합 바이러스(respiratory syncytial virus, RSV), 리노바이러스(Rhinovirus), 리노바이러스(Rhinoviruses), 리케치아 아카리(Rickettsia akari), 리케치아 속(Rickettsia genus), 리케치아 프로바체키(Rickettsia prowazekii), 리케치아 리케치(Rickettsia rickettsii), 리케치아 티피(Rickettsia typhi), 리프트 밸리열 바이러스(Rift Valley fever virus), 로타바이러스(Rotavirus), 루벨라 바이러스(Rubella virus), 사비아 바이러스(Sabia virus), 살모넬라 속, 옴진드기(Sarcoptes scabiei), 사스 코로나바이러스(SARS coronavirus), 주혈흡충 속(Schistosoma genus), 시겔라 속(Shigella genus), 신 놈브레 바이러스(Sin Nombre virus), 한타바이러스(Hantavirus), 스포로트릭스 셴키(Sporothrix schenckii), 스타필로코쿠스 속(Staphylococcus genus), 스트렙토코쿠스 아갈락티아(Streptococcus agalactiae), 스트렙토코쿠스 뉴모니에(Streptococcus pneumoniae), 스트렙토코쿠스 피요제네스(Streptococcus pyogenes), 분선충(Strongyloides stercoralis), 테니아 속(Taenia genus), 유구조충(Taenia solium), 진드기 매개 뇌염 바이러스(tick-borne encephalitis virus, TBEV), 개회충(Toxocara canis) 또는 고양이회충(Toxocara cati), 톡소포자충(Toxoplasma gondii), 트레포네마팔리둠(Treponema pallidum), 선모충(Trichinella spiralis), 질편모충(Trichomonas vaginalis), 트라이코파이톤 종(Trichophyton spp), 편충(Trichuris trichiura), 트리파노소마 브루세이(Trypanosoma brucei), 트리파노소마 크루지(Trypanosoma cruzi), 우레아플라스마 우레알리티쿰(Ureaplasma urealyticum), 수두 대상포진 바이러스(varicella zoster virus, VZV), 대두창(Variola major) 또는 소두창(Variola minor), vCJD 프리온, 베네수엘라 말뇌염 바이러스(Venezuelan equine encephalitis virus), 콜레라균(Vibrio cholerae), 웨스트 나일 바이러스(West Nile virus), 서부형 말뇌염 바이러스(Western equine encephalitis virus), 반크로프트사상충(Wuchereria bancrofti), 황열 바이러스(Yellow fever virus), 예르시니아 엔테로콜리티카(Yersinia enterocolitica), 페스트균(Yersinia pestis) 및 예르시니아 슈도투베르쿨로시스(Yersinia pseudotuberculosis).
또한, 병원성 항원(감염성 질환과 관련된 병원체로부터 유래된 항원)은 바람직하게는 아래 항원으로부터 선택될 수 있다: 외막 단백질 A OmpA, 바이오필름 관련 단백질 Bap, 수송 단백질 MucK (아시네토박터 바우마니, 염아시네토박터 감염); 가변 표면 당단백질 VSG, 마이크로튜불 결합 단백질 MAPP15, 트랜스시알리다제 TSA (트리파노소마 브루세이, 아프리카 수면병(African 수면병)(아프리카 파동편모충증(African 트리파노소마증)); HIV p24 항원, HIV 외피 단백질(Gp120, Gp41, Gp160), 다단백질 GAG, 음성 인자 단백질 Nef, 전사의 트랜스 작용인자 Tat(HIV(인간 면역결핍 바이러스(Human immunodeficiency virus)), AIDS(후천성 면역결핍 증후군)); 갈락토스 억제성 접착 단백질 GIAP, 29 kDa 항원 Eh29, Gal/GalNAc 렉틴, 단백질 CRT, 125 kDa 면역우성 항원, 단백질 M17, 부착소 ADH112, 단백질 STIRP (이질 아메바, 아메바증); 메이저 표면 단백질 1-5 (MSP1a, MSP1b, MSP2, MSP3, MSP4, MSP5), IV형 분비계 단백질 (VirB2, VirB7, VirB11, VirD4) (아나플라스마 속, 아나플라스마증(Anaplasmosis)); 보호 항원 PA, 부종 인자 EF, lethal facotor LF, S층 상동 단백질 SLH (탄저균, 탄저병(Anthrax)); 아크라놀리신, 포스포리파제 D, 콜라겐 결합 단백질 CbpA (용혈성 아카노박테륨, 용혈성 아카노박테륨 감염); 뉴클레오캡시드 단백질 NP, 당단백질 전구체 GPC, 당단백질 GP1, 당단백질 GP2 (쥬닌 바이러스, 아르헨티나 출혈열); 키틴-단백질 층 단백질(chitin-protein layer proteins), 14 kDa 표면 항원 A14, 주요 정자 단백질(major sperm protein) MSP, MSP 중합-조직화 단백질(polymerization-organizing protein) MPOP, MSP 섬유 단백질 2 MFP2, MSP 중합-활성화 키나아제(polymerization-activating kinase) MPAK, ABA-1-유사 단백질 ALB, 단백질 ABA-1, 표피소CUT-1 (회충, 회충증(Ascariasis)); 41 kDa 알레르겐 Asp v13, 알레르겐 Asp f3, 주요 분생자 표면 단백질 로드릿 A(major conidial surface protein rodlet A), 프로테아제 Pep1p, GPI-정착 단백질 Gel1p, GPI-정착 단백질 Crf1p (아스페르길루스 속, 아스페르길루스증(Aspergillosis)); 패밀리 VP26 단백질, VP29 단백질(아스트로바이러스 과, 아스트로바이러스 감염); 롭트리 관련 단백질 1 RAP-1, 낭충 표면 항원 MSA-1, MSA-2 (a1, a2, b, c), 12D3, 11C5, 21B4, P29, 상이 적혈구 표면 항원 VESA1, 정단막 항원 1 AMA-1 (바베시아 속, 바베시아 감염증(Babesiosis)); 용혈소, 장독소 C, PXO1-51, 글리콜산 옥시다제, ABC-수송체, 페니실린 결합 단백질, 아연 수송체 패밀리 단백질, 슈도우리딘 신타제 Rsu, 플라스미드 복제 단백질 RepX, 올리고엔도펩티다아제 F, 프로파지 막단백질, 단백질 HemK, 편모 항원 H, 28.5-kDa 세포 표면 항원 (바실러스 세레우스, 바실러스 세레우스 infection); 라지 T 항원 LT, 스몰 T 항원, 캡시드 단백질 VP1, 캡시드 단백질 VP2 (BK 바이러스, BK 바이러스 감염); 29 kDa-단백질, 카스파제-3-유사 항원, 당단백질 (블라스토시스티스 호미니스, 블라스토시스티스 호미니스 감염); 효모 표면 부착소 WI-1(블라스토미세스 더마티티디스, 블라스토마이코시스(Blastomycosis)); 핵단백질 N, 중합 효소 L, 기질 단백질 Z, 당단백질 GP (마츄포바이러스, 볼리비아 출혈열); 외부 표면 단백질 A OspA, 외부 표면 단백질 OspB, 외부 표면 단백질 OspC, 데코린 결합 단백질 A DbpA, 데코린 결합 단백질 B DbpB, 편모 필라멘트 41 kDa 코어 단백질 Fla, 염기성 막단백질 A 전구체 BmpA(면역우성 항원 P39), 외부 표면 22 kDa 지질단백질 전구체(항원 IPLA7), 가변 표면 지질단백질 vlsE (보렐리아 속, 보렐리아 감염); 보툴리눔 신경독소 BoNT/A1, BoNT/A2, BoNT/A3, BoNT/B, BoNT/C, BoNT/D, BoNT/E, BoNT/F, BoNT/G, 재조합 보툴리눔 독소 F Hc 도메인 FHc (클로스트리디움 보툴리눔, 보튤리눔 중독증(Botulism)(및 유아 보튤리눔 중독증)); 뉴클레오캡시드, 당단백질 전구체 (사비아 바이러스, 브라질 출혈열); 구리/아연 과산화물 디스무타제 SodC, 박테리오페리틴Bfr, 50S 리보솜 단백질 RplL, OmpA-유사 트랜스멤브레인 도메인-함유 단백질 Omp31, 면역성 39-kDa 단백질 M5 P39, 아연 ABC 수송체 주변세포질 아연-결합 단백질 znuA, 주변세포질 면역성 단백질 Bp26, 30S 리보솜 단백질 S12 RpsL, 글리세르알데히드-3-인산 탈수소효소 Gap, 25 kDa 외막 면역성 단백질 전구체 Omp25, 침습 단백질 B lalB, 트리건 인자 Tig, 분자 샤페론 DnaK, 추정 펩티딜-프롤릴 시스-트랜스 아이소머라제 SurA, 지질단백질 Omp19, 외막 단백질 MotY Omp16, 보존 외막 단백질 D15, 말산염 탈수소효소 Mdh, IV-형 분비계(T4SS)의 요소 VirJ(component of the Type-IV secretion system), 알려지지 않은 기능의 지질 단백질 BAB1_0187(브루셀라 속, 브루셀라병(Brucellosis)); ABC 수송체 패밀리의 멤버 (LolC, OppA, 및 PotF), 추정 지질단백질 방출 시스템 트랜스멤브레인 단백질 LolC/E, 플라젤린 FliC, 부르크홀데리아 세포내 운동성 A BimA, 박테리아 신장 인자-Tu EF-Tu, 17 kDa OmpA-유사 단백질, boaA 코딩 단백질, boaB 코딩 단백질 (부르크홀데리아 세파시아 및 다른 부르크홀데리아 종, 부르크홀데리아 감염); 마이콜릴-트랜스퍼라제 Ag85A, 열충격 단백질 Hsp65, 단백질 TB10.4, 19 kDa 항원, 단백질 PstS3, 열충격 단백질 Hsp70(마이코박테륨 울세란스, 브롤리 궤양(Buruli ulcer)); 노로바이러스 메이저 및 마이너 바이러스성 캡시드 단백질 VP1 및 VP2, 게놈 다단백질, 사포바이러스 캡시드 단백질 VP1, 단백질 Vp3, 게놈 다단백질 (칼리시바이러스 과, 칼리시바이러스 감염 (노로바이러스 및 사포바이러스)); 메이저 외막 단백질 PorA, 플라젤린 FlaA, 표면 항원 CjaA, 피브로넥틴 결합 단백질 CadF, 아스파르테이트/글루타메이트-결합 ABC 수송체 단백질 Peb1A, 단백질 FspA1, 단백질 FspA2 (캄필로박터 속, 캄필로박터증(Campylobacteriosis)); 글리콜 효소 에놀라제, 분비된 아스파르틸 프로테아제 SAP1-10, 글리코포스파티딜이노시톨 (GPI)-연결 세포벽 단백질, 단백질 Hyr1, 보체 수용체 3-관련 단백질 CR3-RP, 부착소 Als3p, 열충격 단백질 90 kDa hsp90, 세포 표면 소수성 단백질 CSH (보통 칸디다 알비칸스 및 다른 칸디다 종, 칸디다증(Candidiasis)); 17-kDa 항원, 단백질 P26, 삼량체 자가수송체 부착소 TAAs, 바르토넬라 부착소 A BadA, 가변적으로 발현된 외막 단백질 Vomps, 단백질 Pap3, 단백질 HbpA, 외피 관련 프로테아제 HtrA, 단백질 OMP89, 단백질 GroEL, 단백질 LalB, 단백질 OMP43, 디하이드로리포아미드 숙시닐트랜스퍼라제 SucB (바르토넬라 헨셀라에, 고양이 할큄병(Cat-scratch disease)); 무편모충체 표면 단백질-2, 무편모충체-특이적 표면 단백질 SSP4, 크루지페인, 트랜스시알리다제 TS, 파동편모충 표면 당단백질 TSA-1(trypomastigote surface glycoprotein TSA-1), 보체 조절 단백질 CRP-10, 단백질 G4, 단백질 G2, 파락소네말 로드 단백질 PAR2, 파라프라젤라 로드 성분 Par1, 뮤신-관련 표면 단백질 MPSP (트리파노소마 크루지, 샤가스병(미국 파동편모충증(American 트리파노소마증))); 외피 당단백질 (gB, gC, gE, gH, gI, gK, gL) (수두 대상포진 바이러스(VZV), 수두(Chickenpox)); 메이저 외막 단백질 MOMP, 가능한(probable) 외막 단백질 PMPC, 외막 복합체 단백질 B OmcB, 열충격 단백질 Hsp60 HSP10, 단백질 IncA, III형 분비계로부터의 단백질, 리보뉴클레오타이드 환원효소 스몰 체인 NrdB, 플라스미드 단백질 Pgp3, 클라미디아 외부 단백질 N CopN, 항원 CT521, 항원 CT425, 항원 CT043, 항원 TC0052, 항원 TC0189, 항원 TC0582, 항원 TC0660, 항원 TC0726, 항원 TC0816, 항원 TC0828(트라코마 클라미디아, 클라미디아(Chlamydia)); 저 칼슘 반응 단백질 E LCrE, 클라미디아 외부 단백질 N CopN, 세린/트레오닌-단백질 키나제 PknD, 아실-캐리어-단백질 S-말로닐트랜스퍼라제 FabD, 단일 가닥 DNA-결합 단백질 Ssb, 메이저 외막 단백질 MOMP, 외막 단백질 2 Omp2, 다형성 막단백질 패밀리 (Pmp1, Pmp2, Pmp3, Pmp4, Pmp5, Pmp6, Pmp7, Pmp8, Pmp9, Pmp10, Pmp11, Pmp12, Pmp13, Pmp14, Pmp15, Pmp16, Pmp17, Pmp18, Pmp19, Pmp20, Pmp21) (클라미노필라 뉴모니에, 클라미노필라 뉴모니에 감염); 콜레라 독소 B CTB, 독소 공조절 필린 A TcpA, 독소 공조절 필린(toxin coregulated pilin) TcpF, 독소 공조절 필러스 생합성 단백질 F TcpF, 콜레라 장독소 서브유닛 A, 콜레라 장독소 서브유닛 B, 열안정성 장독소 ST, 만노스 감응성 헤마글루티닌 MSHA, 외막 단백질 U 포린 ompU, 포린 B 단백질, 다형성 막단백질-D (콜레라균, 콜레라); 프로피오닐-CoA 카르복실라제 PCC, 14-3-3 단백질, 프로히비틴, 시스테인 프로테아제, 글루타티온 트랜스퍼라제, 겔솔린, 카텝신 L 프로테아제 CatL, 표피 단백질 20.8 kDa TP20.8, 표피 단백질 31.8 kDa TP31.8, 리소포스파티드산 포스파타아제 LPAP, (간흡충, 간흡충증(Clonorchiasis)); 표면층 단백질 SLPs, 글루탐산 탈수소효소 항원 GDH, 톡신 A, 톡신 B, 시스테인 프로테아제 Cwp84, 시스테인 프로테아제 Cwp13, 시스테인 프로테아제 Cwp19, 세포벽 단백질 CwpV, 편모 단백질 FliC, 편모 단백질 FliD (클로스트리디움 디피실리, 클로스트리디움 디피실리 감염); 리노바이러스: 캡시드 단백질 VP1, VP2, VP3, VP4; 코로나바이러스: 스프라이크 단백질 S, 외피 단백질E, 막 단백질 M, 뉴클레오캡시드 단백질 N (보통 리노바이러스 및 코로나바이러스, 감기(급성 바이러스 비인두염(Acute viral rhinopharyngitis); 급성 코리자(Acute coryza))); 프리온 단백질 Prp (CJD 프리온, 크로이츠펠트-야콥병(Creutzfeldt-Jakob disease, CJD)); 외피 단백질 Gc, 외피 단백질 Gn, 뉴클레오캡시드 단백질 (크림-콩고 출혈열 바이러스, 크림-콩고 출혈열(CCHF)); 독성 관련 DEAD-박스 RNA 헬리카제 VAD1, 갈락토실로만난-단백질 GalXM, 글루쿠로녹실로만난 GXM, 만노단백질 MP (크립토코커스 네오포르만스, 크립토코커스증(Cryptococcosis)); 산성 리보솜 단백질 P2 CpP2, 뮤신 항원 Muc1, Muc2, Muc3 Muc4, Muc5, Muc6, Muc7, 표면 부착 단백질 CP20, 표면 부착 단백질 CP23, 표면 단백질 CP12, 표면 단백질 CP21, 표면 단백질 CP40, 표면 단백질 CP60, 표면 단백질 CP15, 표면-관련 글리코펩타이드 gp40, 표면-관련 글리코펩타이드 gp15, 오시스트 벽 단백질 AB, 프로필린 PRF, 아피라제 (크립토스포리듐 속, 크립토스포리디오시스증(Cryptosporidiosis)); 지방산 및 레티놀 결합 단백질-1 FAR-1, 메탈로프로테인네이즈의 조직 억제자 TIMP (TMP), 시스테인 프로테아제 ACEY-1, 시스테인 프로테아제 ACCP-1, 표면 항원 Ac-16, 분비 단백질 2 ASP-2, 메탈로프로테아제 1 MTP-1, 아스파르틸 프로테아제 억제제 API-1, 표면-관련 항원 SAA-1, 성인-특이적 분비 인자 Xa 세린 프로테아제 억제자 항응고제 AP, 카텝신 D-유사 아스파틱 프로테아제 ARR-1 (보통 브라질 구충; 다수의 다른 기생동물, 피부의 유층 이행증 (CLM)); 카텝신 L-유사 프로테아제, 53/25-kDa 항원, 8kDa 패밀리 멤버, 주변부 트립신-유사 활성을 갖는 낭미충 단백질 TsAg5, 육구유충 단백질 TSOL18, 육구유충 단백질 TSOL45-1A, 락트산 탈수소효소 A LDHA, 락트산 탈수소효소 B LDHB (유구조충, 낭미충증(Cysticercosis)); pp65 항원, 막 단백질 pp15, 캡시드-근위의 표피 단백질 pp150, 단백질 M45, DNA 중합 효소 UL54, 헬리카제 UL105, 당단백질 gM, 당단백질 gN, glco단백질 H, 당단백질 B gB, 단백질 UL83, 단백질 UL94, 단백질 UL99 (시토메갈로바이러스(CMV), 시토메갈로바이러스 감염); 캡시드 단백질 C, 프리멤브레인 단백질 prM, 막 단백질 M, 외피 단백질 E (도메인 I, 도메인 II, 도메인 II), 단백질 NS1, 단백질 NS2A, 단백질 NS2B, 단백질 NS3, 단백질 NS4A, 단백질 2K, 단백질 NS4B, 단백질 NS5 (뎅기열 바이러스(DEN-1, DEN-2, DEN-3 및 DEN-4)-플라비바이러스, 뎅기열); 39 kDa 단백질 (이핵 아메바, 디엔트아메바증(Dientamoebiasis)); 디프테리아 독소 전구체 Tox, 디프테리아 독소, 필린-특이적 소르타제rtA, 샤프트 필린 단백질 SpaA, 팁 필린 단백질 SpaC, 마이너 필린 단백질 SpaB, 표면 관련 단백질 DIP1281(코리네박테리움 디프테리아, 디프테리아); 당단백질 GP, 핵단백질 NP, 마이너 기질 단백질 VP24, 메이저 기질 단백질 VP40, 활성제 VP30, 중합 효소 공동인자 VP35, RNA 중합 효소 L (에볼라 바이러스(EBOV), 에볼라 출혈열); 프리온 단백질 (vCJD 프리온, 변이체 크로이츠펠트-야콥병 (vCJD, nvCJD)); UvrABC 시스템 단백질 B, 단백질 Flp1, 단백질 Flp2, 단백질 Flp3, 단백질 TadA, 헤모글로빈 수용체 HgbA, 외막 단백질 TdhA, 단백질 CpsRA, 조절자 CpxR, 단백질 SapA, 18 kDa 항원, 외막 단백질 NcaA, 단백질 LspA, 단백질 LspA1, 단백질 LspA2, 단백질 LspB, 외막 요소 DsrA, 렉틴 DltA, 지질단백질 Hlp, 메이저 외막 단백질 OMP, 외막 단백질 OmpA2 (헤모필루스 듀크레이, 무른 궤양); 아스파르틸 프로테아제 1 Pep1, 포스포리파제 B PLB, 알파-만노시다제 1 AMN1, 글루카노실트랜스퍼라제(glucanosyltransferase) GEL1, 우레아제 URE, 퍼옥시좀 기질 단백질 Pmp1, 프롤린-풍부 항원 Pra, 인간 T-세포 반응성 단백질 TcrP (콕시디오이데스 임미티스 및 콕시디오이데스 포사다시, 콕시디오이데스진균증(Coccidioidomycosis)); 알레르겐 Tri r 2, 열충격 단백질 60 Hsp60, 곰팡이 액틴 Act, 항원 Tri r2, 항원 Tri r4, 항원 Tri t1, 단백질 IV, 글리세롤-3-포스페이트 탈수소효소 Gpd1, 삼투압 감응자 HwSho1A, 삼투압 감응자 HwSho1B, 히스티딘 키나제 HwHhk7B, 알레르겐 Mala s 1, 알레르겐 Mala s 11, 티오레독신 Trx Mala s 13, 알레르겐 Mala f, 알레르겐 Mala s (보통 트라이코파이톤 종, 표피균 종., 말라세지아 종., 호르테아 웨르넥키, 피부사상균증(Dermatophytosis)); 단백질 EG95, 단백질 EG10, 단백질 EG18, 단백질 EgA31, 단백질 EM18, 항원 EPC1, 항원 B, 항원 5, 단백질 P29, 단백질 14-3-3, 8-kDa 단백질, 마이오필린, 열충격 단백질 20 HSP20, 당단백질 GP-89, 지방산 결합 단백질 FAPB (에키노코쿠스 속, 포충증(Echinococcosis)); 메이저 표면 단백질 2 MSP2, 메이저 표면 단백질 4 MSP4, MSP 변이체 SGV1, MSP 변이체 SGV2, 외막 단백질 OMP, 외막 단백질 19 OMP-19, 메이저 항원 단백질 MAP1, 메이저 항원 단백질 MAP1-2, 메이저 항원 단백질 MAP1B, 메이저 항원 단백질 MAP1-3, Erum2510 코딩 단백질, 단백질 GroEL, 단백질 GroES, 30-kDA 메이저 외막 단백질, GE 100-kDa 단백질, GE 130-kDa 단백질, GE 160-kDa 단백질 (에를리히아 속, 에를리히증(Ehrlichiosis)); 분비 항원 SagA, sagA-유사 단백질 SalA and SalB, 콜라겐 부착소 Scm, 표면 단백질 Fms1(EbpA(fm), Fms5 (EbpB(fm), Fms9 (EpbC(fm) and Fms10, 단백질 EbpC(fm), 96 kDa 면역방어 당단백질 G1(엔테로코쿠스 속, 엔테로코쿠스 감염); 게놈 다단백질, 중합 효소 3D, 바이러스성 캡시드 단백질 VP1, 바이러스성 캡시드 단백질 VP2, 바이러스성 캡시드 단백질 VP3, 바이러스성 캡시드 단백질 VP4, 프로테아제 2A, 프로테아제 3C (엔테로바이러스 속, 엔테로바이러스 감염); 외막 단백질 OM, 60 kDa 외막 단백질, 세포 표면 항원 OmpA, 세포 표면 항원 OmpB (sca5), 134 kDa 외막 단백질, 31 kDa 외막 단백질, 29.5 kDa 외막 단백질, 세포 표면 단백질 SCA4, 세포 표면 단백질 Adr1(RP827), 세포 표면 단백질 Adr2 (RP828), 세포 표면 단백질 SCA1, 침습 단백질 invA, 세포 분할 단백질 fts, 분비 단백질 sec 0family, 독성 단백질 virB, tlyA, tlyC, 파불린-유사 단백질 Plp, 전구단백질 전위효소 SecA, 120-kDa 표면 단백질 항원 SPA, 138 kD 복합체 항원, 메이저 100-kD 단백질 (단백질 I), 세포질내 단백질 D, 방어 표면 단백질 항원 SPA(리케치아 프로바체키, 발진 티푸스); 엡스타인바 핵 항원 (EBNA-1, EBNA-2, EBNA-3A, EBNA-3B, EBNA-3C, EBNA-리더 단백질 (EBNA-LP)), 잠재 막 단백질 (LMP-1, LMP-2A, LMP-2B), 초기 항원 EBV-EA, 막 항원 EBV-MA, 바이러스성 캡시드 항원 EBV-VCA, 알칼리성 뉴클레아제 EBV-AN, 당단백질 H, 당단백질 gp350, 당단백질 gp110, 당단백질 gp42, 당단백질 gHgL, 당단백질 gB (엡스타인바 바이러스(EBV), 엡스타인바 바이러스 감염성 단핵구증); cpasid 단백질 VP2, 캡시드 단백질 VP1, 메이저 단백질 NS1(파보바이러스 B19, 전염성 홍반(제5병)); pp65 항원, 당단백질 105, 메이저 캡시드 단백질, 외피 당단백질 H, 단백질 U51(인간 헤르페스바이러스 6 (HHV-6) 및 인간 헤르페스바이러스 7(HHV-7), 돌발진(Exanthem subitum)); 티오레독신-글루타티온 환원효소 TGR, 카텝신 L1 및 L2, 쿠니츠형 단백질 KTM, 류신 아미노펩티다아제 LAP, 시스테인 프로테아제 Fas2, 사포신-유사 단백질-2 SAP-2, 티오레독신 과산화효소 TPx, Prx-1, Prx-2, 카텝신 L 시스테인 프로테아제 CL3, 프로테아제 카텝신 L CL1, 포스포글리세르산 키나제 PGK, 27-kDa 분비성 단백질, 60 kDa 단백질 HSP35알파, 글루타티온 트랜스퍼라제 GST, 28.5 kDa 표피 항원 28.5 kDa TA, 카텝신 B3 프로테아제 CatB3, I형 시스타틴 스테핀-1, 카텝신 L5, 카텝신 L1g 및 카텝신 B, 지방산 결합 단백질 FABP, 류신 아미노펩티다아제 LAP (간질 및 거대 간질, 간질증(Fasciolosis)); 프리온 단백질 (FFI 프리온, 치명적 가족성 불면증(FFI)); 베놈 알레르겐 동족체-유사 단백질 VAL-1, 어번던트 라바 트랜스크립트 ALT-1, 어번던트 라바 트랜스크립트 ALT-2, 티오레독신 과산화효소 TPX, 말벌 알레르겐 동족체 VAH, 티오르독신 과산화효소 2 TPX-2, 항원 단백질 SXP(펩타이드 N, N1, N2, 및 N3), 활성화 관련 단백질-1 ASP-1, 티오레독신 TRX, 트랜스글루타미나제 BmTGA, 글루타티온-S-트랜스퍼라제 GST, 미오신, 말벌 알레르겐 동족체 VAH, 175 kDa 콜라게나제, 글리세르알데히드-3-인산 탈수소효소 GAPDH, 표피 콜라겐 Col-4, 분비된 라바 산성 단백질 SLAPs, 키티나제 CHI-1, 말토스 결합 단백질 MBP, 당분해 효소 과당-1,6-비스포스페이트 알돌라제 Fba, 트로포미오신 TMY-1, 선충 특이적 유전자 생성물 OvB20, 온코시스타틴 CPI-2, Cox-2 (필라리오이디아 상과, 필라리아증(Filariasis)); 포스포리파제 C PLC, 열불안정 장독소 B, 이오타 독소 요소 Ib, 단백질 CPE1281, 피루베이트 페레독신 산화환원효소, 신장 인자 G EF-G, 퍼플린고라이신 O Pfo, 글리세르알데히드-3-인산 탈수소효소 GapC, 프럭토스-비스포스페이트 알돌라제 Alf2, 클로스트리디움 퍼프리젠스 장독소 CPE, 알파 독소 AT, 알파 변성독소 ATd, 엡실론-변성독소 ETd, 단백질 HP, 라지 세포독소 TpeL, 엔도-베타-N-아세틸글루코사미니다제 Naglu, 포스포글리세로뮤타제 Pgm (클로스트리디움 퍼프리젠스, 클로스트리디움 퍼프리젠스에 의한 식중독); 류코톡신 lktA, 부착소 FadA, 외막 단백질 RadD, 고분자량 아르기닌 결합 단백질 (푸소박테륨 속, 푸소박테리아 감염); 포스포리파제 C PLC, 열불안정 장독소 B, 이오타 독소 요소 Ib, 단백질 CPE1281, 피루베이트 페레독신 산화환원효소, 신장 인자 G EF-G, 퍼플린고라이신 O Pfo, 글리세르알데히드-3-인산 탈수소효소 GapC, 프럭토스-비스포스페이트 알돌라제 Alf2, 클로스트리디움 퍼프리젠스 장독소 CPE, 알파 독소 AT, 알파 변성독소 ATd, 엡실론-변성독소 ETd, 단백질 HP, 라지 세포독소 TpeL, 엔도-베타-N-아세틸글루코사미니다제 Naglu, 포스포글리세로뮤타제 Pgm (보통 클로스트리디움 퍼프리젠스; 다른 클로스트리디움 종, 가스 괴저병(Gas gangrene)(클로스트리듐근 괴사(Clostridial myonecrosis))); 리파아제 A, 리파아제 B, 과산화효소 Dec1(게오트리쿰 칸디둠, 게오트리쿰증(Geotrichosis)); 프리온 단백질 (GSS 프리온, 게르스트만 슈트로이슬러 샤잉커 증후군 (GSS)); 낭종 벽 단백질 CWP1, CWP2, CWP3, 변이체 표면 단백질 VSP, VSP1, VSP2, VSP3, VSP4, VSP5, VSP6, 56 kDa 항원, 피루베이트 페레독신 산화환원효소 PFOR, 알코올 탈수소효소 E ADHE, 알파-지아르딘, 알파8-지아르딘, 알파1-지아르딘, 베타-지아르딘, 시스테인 프로테아제, 글루타티온-S-트랜스퍼라제 GST, 아르기닌 디이미나제 ADI, 프럭토오스-1,6-비스포스파트 알돌라아제(fructose-1,6-bisphosphat aldolase) FBA, 지아르디아 영양체 항원 GTA(GTA1, GTA2), 오르니틴 카르복실 트랜스퍼라제 OCT, 줄무늬 섬유-조립 -유사 단백질 SALP, 우리딘 포스포릴-유사 단백질 UPL, 알파-튜불린, 베타-튜불린 (장편모충, 편모충증); ABC 수송체 패밀리의 멤버 (LolC, OppA, 및 PotF), 추정 지질단백질 방출 시스템 트랜스멤브레인 단백질 LolC/E, 플라젤린 FliC, 부르크홀데리아 세포내 운동성 A BimA, 박테리아 신장 인자-Tu EF-Tu, 17 kDa OmpA-유사 단백질, boaA 코딩 단백질 (부르크홀데리아 말레이, 마비저); 시클로필린 CyP, 24 kDa 3단계 라바 단백질 GS24, 배설-분비 생성물 ESPs (40, 80, 120 and 208 kDa) (유극악구충 및 강극악구충, 악구충증(Gnathostomiasis)); 필린 단백질, 마이너 필린-관련 서브유닛 pilC, 메이저 필린 서브유닛 및 변이체 pilE, pilS, 상변이 단백질 porA, 포린 B PorB, 단백질 TraD, 나이세리아 외막 항원 H.8, 70kDa 항원, 메이저 외막 단백질 PI, 외막 단백질 PlA 및 PlB, W 항원, 표면 단백질 A NspA, 트랜스페린 결합 단백질 TbpA, 트랜스페린 결합 단백질 TbpB, PBP2, mtrR 코딩 단백질, ponA 코딩 단백질, 막 투과효소 FbpBC, FbpABC 단백질 시스템, LbpAB 단백질, 외막 단백질 Opa, 외막 수송체 FetA, 철-억제된 조절자 MpeR (임균, 임질(Gonorrhea); 외막 단백질 A OmpA, 외막 단백질 C OmpC, 외막 단백질 K17 OmpK17 (클렙시엘라 그래눌로마티스, 사타구니육아종(Granuloma inguinale)(도너반증(Donovanosis))); 피브로넥틴-결합 단백질 Sfb, 피브로넥틴/피브리노겐-결합 단백질 FBP54, 피브로넥틴-결합 단백질 FbaA, 1형 M 단백질 Emm1, 6형 M 단백질 Emm6, 면역글로불린-결합 단백질 35 Sib35, 표면 단백질 R28 Spr28, 수퍼옥시드 디스무타제 SOD, C5a 펩티다아제 ScpA, 항원 I/II AgI/II, 부착소 AspA, G-관련 알파2-매크로글로불린-결합 단백질 GRAB, 표면 미소섬유 단백질 M5 (스트렙토코쿠스 피요제네스, A군 연쇄상구균 감염(Group A streptococcal infection)); C 단백질 베타 항원, 아르기닌 디이미나제 단백질, 부착소 BibA, 105 kDA 단백질 BPS, 표면 항원 c, 표면 항원 R, 표면 항원 X, 트립신-저항성 단백질 R1, 트립신-저항성 단백질 R3, 트립신-저항성 단백질 R4, 표면 면역성 단백질 Sip, 표면 단백질 Rib, 류신-풍부 반복 단백질 LrrG, 세린-풍부 반복 단백질 Srr-2, C 단백질 알파-항원 Bca, 베타 항원 Bag, 표면 항원 엡실론, 알파-유사 단백질 ALP1, 알파-유사 단백질 ALP5 표면 항원 델타, 알파-유사 단백질 ALP2, 알파-유사 단백질 ALP3, 알파-유사 단백질 ALP4, C베타 단백질 Bac (스트렙토코쿠스 아갈락티아, B군 연쇄상구균 감염); 트랜스페린-결합 단백질 2 Tbp2, 포스파타아제 P4, 외막 단백질 P6, 펩티도글리칸-관련 지질단백질 Pal, 단백질 D, 단백질 E, 부착 및 침투 단백질 Hap, 외막 단백질 26 Omp26, 외막 단백질 P5 (핌브린(Fimbrin)), 외막 단백질 D15, 외막 단백질 OmpP2, 5'-뉴클레오티다제 NucA, 외막 단백질 P1, 외막 단백질 P2, 외막 지질단백질 Pcp, 지질단백질 E, 외막 단백질 P4, 푸쿨로키나제 FucK, [Cu,Zn]-수퍼옥시드 디스무타제 SodC, 프로테아제 HtrA, 단백질 O145, 알파-갈락토실세라마이드 (헤모필루스 인플루엔자, 헤모필루스 인플루엔자 감염); 중합 효소 3D, 바이러스성 캡시드 단백질 VP1, 바이러스성 캡시드 단백질 VP2, 바이러스성 캡시드 단백질 VP3, 바이러스성 캡시드 단백질 VP4, 프로테아제 2A, 프로테아제 3C (엔테로바이러스, 주로 콕사키 A 바이러스 및 엔테로바이러스 71(EV71), 수족구병 (HFMD)); RNA 중합 효소 L, 단백질 L, 당단백질 Gn, 당단백질 Gc, 뉴클레오캡시드 단백질 S, 외피 당단백질 G1, 핵단백질 NP, 단백질 N, 다단백질 M (신 놈브레 바이러스, 한타바이러스, 한타바이러스 폐 증후군(HPS)); 열충격 단백질 HspA, 열충격 단백질 HspB, 시트레이트 합성효소 GltA, 단백질 UreB, 열충격 단백질 Hsp60, 호중구-활성화 단백질 NAP, 카탈라아제 KatA, 액포 형성 세포독소 VacA, 우레아제 알파 UreA, 우레아제 베타 Ureb, 단백질 Cpn10, 단백질 groES, 열충격 단백질 Hsp10, 단백질 MopB, 세포독성-관련 10 kDa 단백질 CAG, 36 kDa 항원, 베타-락타마제 HcpA, 베타-락타마제 HcpB (헬리코박터 파일로리, 헬리코박터 파일로리 감염); 내포된 막 단백질, 응집하기 쉬운 단백질, O-항원, 옥소-항원 Stx2B, 옥소-항원 Stx1B, 부착소-항원 단편 Int28, 단백질 EspA, 단백질 EspB, 인티민, 단백질 Tir, 단백질 IntC300, 단백질 Eae (대장균 O157:H7, O111 및 O104:H4, 용혈성-요독성 증후군(Hemolytic-uremic syndrome, HUS)); RNA 중합 효소 L, 단백질 L, 당단백질 Gn, 당단백질 Gc, 뉴클레오캡시드 단백질 S, 외피 당단백질 G1, 핵단백질 NP, 단백질 N, 다단백질 M (부니아바이러스 과, 신증후성 출혈열(Hemorrhagic fever with renal syndrome, HFRS)); 당단백질 G, 기질 단백질 M, 핵단백질 N, 융합 단백질 F, 중합 효소 L, 단백질 W, 단백질C, 인단백질 p, 비구조적 단백질 V (헤니파바이러스(헨드라 바이러스 니파 바이러스), 헤니파바이러스 감염); 다단백질, 당단백질 Gp2, A형 감염 표면 항원 HBAg, 단백질 2A, 바이러스 단백질 VP1, 바이러스 단백질 VP2, 바이러스 단백질 VP3, 바이러스 단백질 VP4, 단백질 P1B, 단백질 P2A, 단백질 P3AB, 단백질 P3D (A형 간염 바이러스, A형 감염); B형 감염 표면 항원 HBsAg, B형 감염 코어 항원 HbcAg, 중합 효소, 단백질 Hbx, preS2 중간 표면 단백질, 표면 단백질 L, 라지 S 단백질, 바이러스 단백질 VP1, 바이러스 단백질 VP2, 바이러스 단백질 VP3, 바이러스 단백질 VP4 (B형 간염 바이러스(HBV), B형 간염); 외피 당단백질 E1 gp32 gp35, 외피 당단백질 E2 NS1 gp68 gp70, 캡시드 단백질 C, 코어 단백질 Core, 다단백질, 바이러스 단백질 VP1, 바이러스 단백질 VP2, 바이러스 단백질 VP3, 바이러스 단백질 VP4, 항원 G, 단백질 NS3, 단백질 NS5A, (C형 간염 바이러스, C형 간염); 바이러스 단백질 VP1, 바이러스 단백질 VP2, 바이러스 단백질 VP3, 바이러스 단백질 VP4, 라지 간염 델타 항원, 스몰 간염 델타 항원 (D형 간염 바이러스, D형 간염); 바이러스 단백질 VP1, 바이러스 단백질 VP2, 바이러스 단백질 VP3, 바이러스 단백질 VP4, 캡시드 단백질 E2 (E형 간염 바이러스, E형 간염); 당단백질 L UL1, 우라실-DNA 글리코실라제 UL2, 단백질 UL3, 단백질 UL4, DNA 복제 단백질 UL5, 포탈 단백질 UL6, 비리온 성숙 단백질 UL7, DNA 헬리카제 UL8, 복제 원점-결합 단백질 UL9, 당단백질 M UL10, 단백질 UL11, 알칼리성 엑소뉴클레아제 UL12, 세린-트레오닌 단백질 키나제 UL13, 외피 단백질 UL14, 터미나제 UL15, 외피 단백질 UL16, 단백질 UL17, 캡시드 단백질 VP23 UL18, 메이저 캡시드 단백질 VP5 UL19, 막 단백질 UL20, 외피 단백질 UL21, 당단백질 H (UL22), 티미딘 키나제 UL23, 단백질 UL24, 단백질 UL25, 캡시드 단백질 P40(UL26, VP24, VP22A), 당단백질 B (UL27), ICP18.5 단백질 (UL28), 메이저 DNA-결합 단백질 ICP8(UL29), DNA 중합 효소 UL30, 핵 기질 단백질 UL31, 외피 당단백질 UL32, 단백질 UL33, 내부 핵 막 단백질 UL34, 캡시드 단백질 VP26 (UL35), 라지 외피 단백질 UL36, 캡시드 어셈블리 단백질 UL37, VP19C 단백질 (UL38), 리보뉴클레오타이드 환원효소 (라지 서브유닛) UL39, 리보뉴클레오타이드 환원효소 (스몰 서브유닛) UL40, 외피 단백질/비리온 숙주 차단 VHS 단백질 (UL41), DNA 중합 효소 반응진행성 인자 UL42, 막 단백질 UL43, 당단백질 C (UL44), 막 단백질 UL45, 외피 단백질 VP11/12 (UL46), 외피 단백질 VP13/14 (UL47), 비리온 성숙 단백질 VP16 (UL48, 알파-TIF), 외피 단백질 UL49, dUTP 디포스파타아제 UL50, 외피 단백질 UL51, DNA 헬리카제/프리마아제 복합체 단백질 UL52, 당단백질 K (UL53), 전사 조절 단백질 IE63 (ICP27, UL54), 단백질 UL55, 단백질 UL56, 바이러스 복제 단백질 ICP22 (IE68, US1), 단백질 US2, 세린/트레오닌-단백질 키나제 US3, 당단백질 G (US4), 당단백질 J (US5), 당단백질 D (US6), 당단백질 I (US7), 당단백질 E (US8), 외피 단백질 US9, 캡시드/외피 단백질 US10, Vmw21 단백질 (US11), ICP47 단백질 (IE12, US12), 메이저 전사 활성제 ICP4 (IE175, RS1), E3 유비퀴틴 리가아제 ICP0(IE110), 잠재기-관련 단백질 1 LRP1, 잠재기-관련 단백질 2 LRP2, 신경병원성 인자 RL1(ICP34.5), 잠재기-관련 전사인자 LAT (단순 포진 바이러스 1 및 2 (HSV-1 및 HSV-2), 단순포진(Herpes simplex)); 열충격 단백질 Hsp60, 세포 표면 단백질 H1C, 디펩티딜 펩티다아제 IV형 DppIV, M 항원, 70 kDa 단백질, 17 kDa 히스톤-유사 단백질 (히스토플라스마 캡슐라툼, 히스토플라스마증(Histoplasmosis)); 지방산 및 레티놀 결합 단백질-1 FAR-1, 메탈로프로테인네이즈의 조직 억제자 TIMP (TMP), 시스테인 프로테아제 ACEY-1, 시스테인 프로테아제 ACCP-1, 표면 항원 Ac-16, 분비 단백질 2 ASP-2, 메탈로프로테아제 1 MTP-1, 아스파르틸 프로테아제 억제제 API-1, 표면-관련 항원 SAA-1, 표면-관련 항원 SAA-2, 성인-특이적 분비 인자 Xa, 세린 프로테아제 억제자 항응고제 AP, 카텝신 D-유사 아스파틱 프로테아제 ARR-1, 글루타티온 S-트랜스퍼라제 GST, 아스파르틱 프로테아제 APR-1, 아세틸콜린에스테라제AChE (두비니 구충 및 아메리카 구충, 구충 감염(Hookworm infection)); 단백질 NS1, 단백질 NP1, 단백질 VP1, 단백질 VP2, 단백질 VP3 (인간 보카바이러스(HBoV), 인간 보카바이러스 감염); 메이저 표면 단백질 2 MSP2, 메이저 표면 단백질 4 MSP4, MSP 변이체 SGV1, MSP 변이체 SGV2, 외막 단백질 OMP, 외막 단백질 19 OMP-19, 메이저 항원 단백질 MAP1, 메이저 항원 단백질 MAP1-2, 메이저 항원 단백질 MAP1B, 메이저 항원 단백질 MAP1-3, Erum2510 코딩 단백질, 단백질 GroEL, 단백질 GroES, 30-kDA 메이저 외막 단백질, GE 100-kDa 단백질, GE 130-kDa 단백질, GE 160-kDa 단백질 (에를리히아 에윈기, 인간 에윈기 에를리히증(Human ewingii ehrlichiosis)); 메이저 표면 단백질 1-5 (MSP1a, MSP1b, MSP2, MSP3, MSP4, MSP5), IV형 분비계 단백질 VirB2, VirB7, VirB11, VirD4 (아나플라스마 파고사이토필룸, 인간 과립구 아나플라스마증(Human granulocytic anaplasmosis, HGA)); 단백질 NS1, 스몰 소수성 단백질 NS2, SH 단백질, 융합 단백질 F, 당단백질 G, 기질 단백질 M, 기질 단백질 M2-1, 기질 단백질 M2-2, 인단백질 P, 핵단백질 N, 중합 효소 L (인간 메타뉴모바이러스(hMPV), 인간 메타뉴모바이러스 감염); 메이저 표면 단백질 2 MSP2, 메이저 표면 단백질 4 MSP4, MSP 변이체 SGV1, MSP 변이체 SGV2, 외막 단백질 OMP, 외막 단백질 19 OMP-19, 메이저 항원 단백질 MAP1, 메이저 항원 단백질 MAP1-2, 메이저 항원 단백질 MAP1B, 메이저 항원 단백질 MAP1-3, Erum2510 코딩 단백질, 단백질 GroEL, 단백질 GroES, 30-kDA 메이저 외막 단백질, GE 100-kDa 단백질, GE 130-kDa 단백질, GE 160-kDa 단백질 (에를리히아 샤펜시스, 인간 단핵구 에를리히증(Human monocytic ehrlichiosis)); 복제 단백질 E1, 조절 단백질E2, 단백질 E3, 단백질 E4, 단백질 E5, 단백질 E6, 단백질 E7, 단백질 E8, 메이저 캡시드 단백질 L1, 마이너 캡시드 단백질 L2 (인유두종 바이러스(HPV), 인유두종 바이러스(HPV) 감염); 융합 단백질 F, 헤마글루티닌-뉴라미다제 HN, 당단백질 G, 기질 단백질 M, 인단백질 P, 핵단백질 N, 중합 효소 L (인간 파라인플루엔자 바이러스(HPIV), 인간 파라인플루엔자 바이러스 감염); 헤마글루티닌 (HA), 뉴라미니다아제 (NA), 핵단백질 (NP), M1 단백질, M2 단백질, NS1 단백질, NS2 단백질 (NEP 단백질: 핵 수출 단백질), PA 단백질, PB1 단백질 (중합 효소 염기성 1 단백질), PB1-F2 단백질 및 PB2 단백질 (오르토믹소바이러스 과, 인플루엔자 바이러스(flu)); 게놈 다단백질, 단백질 E, 단백질 M, 캡시드 단백질 C (일본 뇌염 바이러스, 일본 뇌염); RTX 독소, IV형 선모, 메이저 선모 서브유닛 PilA, 조절 전사 인자 PilS 및 PilR, 단백질 sigma54, 외막 단백질 (킨젤라 킨가에, 킨젤라 킨가에 감염); 프리온 단백질 (쿠루 프리온, 쿠루); 핵단백질 N, 중합 효소 L, 기질 단백질 Z, 당단백질 GP (라사 바이러스, 라사열); 펩티도글리칸-관련 지질단백질 PAL, 60 kDa 샤페로닌 Cpn60(groEL, HspB), IV형 필린 PilE, 외막 단백질 MIP, 메이저 외막 단백질 MompS, 아연 메탈로프로테인나제 MSP (레지로넬라 뉴모필라, 레지오넬라증(재향군인병(Legionnaires' disease), 폰티액열(Pontiac fever))); P4 뉴클레아제, 단백질 WD, 리보뉴클레오타이드 환원효소 M2, 표면 막 당단백질 Pg46, 시스테인 프로테아제 CP, 글루코오스 조절 단백질 78 GRP-78, 단계-특이적 S 항원-유사 단백질 A2, ATPase F1, 베타-튜불린, 열충격 단백질 70 Hsp70, KMP-11, 당단백질 GP63, 단백질 BT1, 뉴클레오사이드 가수분해효소 NH, 세포 표면 단백질 B1, 리보솜 단백질 P1-유사 단백질 P1, 스테롤 24-c-메틸트랜스퍼라제 SMT, LACK 단백질, 히스톤 H1, SPB1 단백질, 티올 특이적 항산화제TSA, 단백질 항원 STl1, 시그널 펩티다아제 SP, 히스톤 H2B, 표면 항원 PSA-2, 시스테인 프로테이나아제 b Cpb (레슈마니아 속, 리슈마니어증(Leishmaniasis)); 메이저 막 단백질 I, 세린-풍부 항원- 45 kDa, 10 kDa 카페로닌 GroES, HSP kDa 항원, 아미노-옥소노나노에이트 신타아제 AONS, 단백질 재조합효소 A RecA, 아세틸/프로피닐-코엔자임 A 카르복실라아제 알파, 알라닌 라세미화 효소, 60 kDa 샤페로닌 2, ESAT-6-유사 단백질 EcxB (L-ESAT-6), 단백질 Lsr2, 단백질 ML0276, 헤파린 결합 헤마글루티닌 HBHA, 열충격 단백질 65 Hsp65, mycP1 또는 ML0041 코딩 단백질, htrA2 또는 ML0176 코딩 단백질, htrA4 또는 ML2659 코딩 단백질, gcp 또는 ML0379 코딩 단백질, clpC 또는 ML0235 코딩 단백질 (나균 및 나종균, 한센병(Leprosy)); 외막 단백질 LipL32, 막 단백질 LIC10258, 막 단백질 LP30, 막 단백질 LIC12238, Ompa-유사 단백질 Lsa66, 표면 단백질 LigA, 표면 단백질 LigB, 메이저 외막 단백질 OmpL1, 외막 단백질 LipL41, 단백질 LigAni, 표면 단백질 LcpA, 부착 단백질 LipL53, 외막 단백질 UpL32, 표면 단백질 Lsa63, 플라젤린 FlaB1, 막 지질단백질 LipL21, 막 단백질 pL40, 렙토스피라 표면 부착소 Lsa27, 외막 단백질 OmpL36, 외막 단백질 OmpL37, 외막 단백질 OmpL47, 외막 단백질 OmpL54, 아실트랜스퍼라제 LpxA (렙토스피라 속, 렙토스피라증); 리스테리올리신 O 전구체 Hly (LLO), 침습 관련 단백질 Iap (P60), 리스테리올리신 조절 단백질 PrfA, 아연 메탈로프로테인나제 Mpl, 포스파티딜이노시톨-특이적 포스포리파제 C PLC (PlcA, PlcB), O-아세틸트랜스퍼라제 Oat, ABC-운반체 투과효소 Im.G_1771, 부착 단백질 LAP, LAP 수용체 Hsp60, 부착소 LapB, 헤몰리신 리스테리올리신 O LLO, 단백질 ActA, 인터날린 A InlA, 단백질 lnlB (리스테리아 모노사이토제니스, 리스테리아증(Listeriosis)); 외부 표면 단백질 A OspA, 외부 표면 단백질 OspB, 외부 표면 단백질 OspC, 데코린 결합 단백질 A DbpA, 데코린 결합 단백질 B DbpB, 편모 필라멘트 41 kDa 코어 단백질 Fla, 염기성 막 단백질 A BmpA(면역우성 항원 P39), 외부 표면 22 kDa 지질단백질 전구체(항원 IPLA7), 가변 표면 지질단백질 vlsE (보통 보렐리아 부르그도르페리 및 다른 보렐리아 종, 라임병(Lyme disease)(라임 보렐리아증(Lyme borreliosis))); 베놈 알레르겐 동족체-유사 단백질 VAL-1, 어번던트 라바 트랜스크립트 ALT-1, 어번던트 라바 트랜스크립트 ALT-2, 티오레독신 과산화효소 TPX, 말벌 알레르겐 동족체 VAH, 티오르독신 과산화효소 2 TPX-2, 항원 단백질 SXP(펩타이드 N, N1, N2, 및 N3), 활성화 관련 단백질-1 ASP-1, 티오레독신 TRX, 트랜스글루타미나제 BmTGA, 글루타티온-S-트랜스퍼라제 GST, 미오신, 말벌 알레르겐 동족체 VAH, 175 kDa 콜라게나제, 글리세르알데히드-3-인산 탈수소효소 GAPDH, 표피 콜라겐 Col-4, 분비된 라바 산성 단백질 SLAPs, 키티나제 CHI-1, 말토스 결합 단백질 MBP, 당분해 효소 과당-1,6-비스포스페이트 알돌라제 Fba, 트로포미오신 TMY-1, 선충 특이적 유전자 생성물 OvB20, 온코시스타틴 CPI-2, 단백질 Cox-2 (반크로프트사상충 및 말레이사상충, 림프사상충증 (상피병)); 당단백질 GP, 기질 단백질 Z, 중합 효소 L, 핵단백질 N (림프구성 맥락수막염 바이러스(LCMV), 림프구성 맥락수막염); 트롬보스폰딘 관련 어나니머스 단백질 TRAP, SSP2 포자소체 표면 단백질 2, 정단막 항원 1 AMA1, 롭트리 막 항원 RMA1, 산성 염기성 반복 항원 ABRA, 세포 순회 단백질 PF, 단백질 Pvs25, 낭충 표면 단백질 1 MSP-1, 낭충 표면 단백질 2 MSP-2, 링 감염 적혈구 표면 항원 RESA간 단계 항원 3 LSA-3, 단백질 Eba-175, 세린 반복 항원 5 SERA-5, 포자소체 단백질 CS, 낭충 표면 단백질 3 MSP3, 낭충 표면 단백질 8 MSP8, 에놀라아제 PF10, 간세포 적혈구 단백질 17 kDa HEP17, 적혈구 막 단백질 1 EMP1, 단백질 K베타낭충 표면 단백질 4/5 MSP 4/5, 열충격 단백질 Hsp90, 글루타메이트-풍부 단백질 GLURP, 낭충 표면 단백질 4 MSP-4, 단백질 STARP, 포자소체 단백질-관련 항원 전구체 CRA(플라스모디움 속, 말라리아); 핵단백질 N, 막-관련 단백질 VP24, 마이너 핵단백질 VP30, 중합 효소 공동인자 VP35, 중합 효소 L, 기질 단백질 VP40, 외피 당단백질 GP (마르부르크 바이러스, 마르부르크 출혈열 (MHF)); 단백질 C, 기질 단백질 M, 인단백질 P, 비구조적 단백질 V, 헤마글루티닌 당단백질 H, 중합 효소 L, 핵단백질 N, 융합 단백질 F (홍역 바이러스, 홍역); ABC 수송체 패밀리의 멤버 (LolC, OppA, 및 PotF), 추정 지질단백질 방출 시스템 트랜스멤브레인 단백질 LolC/E, 플라젤린 FliC, 부르크홀데리아 세포내 운동성 A BimA, 박테리아 신장 인자-Tu EF-Tu, 17 kDa OmpA-유사 단백질, boaA 코딩 단백질, boaB 코딩 단백질 (부르크홀데리아 슈도말레이, 멜리오이도시스(Melioidosis)(휘트모어병(Whitmore's disease)); 필린 단백질, 마이너 필린-관련 서브유닛 pilC, 메이저 필린 서브유닛 및 변이체 pilE, pilS, 상변이 단백질 porA, 포린 B PorB, 단백질 TraD, 나이세리아 외막 항원 H.8, 70kDa 항원, 메이저 외막 단백질 PI, 외막 단백질 PlA 및 PlB, W 항원, 표면 단백질 A NspA, 트랜스페린 결합 단백질 TbpA, 트랜스페린 결합 단백질 TbpB, PBP2, mtrR 코딩 단백질, ponA 코딩 단백질, 막 투과효소 FbpBC, FbpABC 단백질 시스템, LbpAB 단백질, 외막 단백질 Opa, 외막 수송체 FetA, 철-억제된 조절자 MpeR, 인자 H-결합 단백질 fHbp, 부착소 NadA, 단백질 NhbA, 억제자 FarR (수막구균, 수막구균성 수막염(Meningococcal disease)); 66 kDa 단백질, 22 kDa 단백질 (보통 메타고니무스 요카가와이, 요코가와흡충증(Metagonimiasis)); 극성관 단백질 (글루게아에서 34, 75 및 170 kDa), 엔세팔리토준에서 35, 55 및 150kDa), 키네신-관련 단백질, RNA 중합 효소 II 최대 서브유닛, similar ot 내포된 막 단백질 YIPA, 침묵 방지 단백질 1, 열충격 전사 인자 HSF, 단백질 키나제, 티미딘 키나제, NOP-2 유사 핵소체 단백질 (마이크로스포리디아 필룸, 미포자충증(Microsporidiosis)); CASP8 and FADD-유사 아폽토시스 조절자, 글루타티온 과산화효소 GPX1, RNA 헬리카제 NPH-II NPH2, Poly(A) 중합 효소 촉매 소단위 PAPL, Major 외피 단백질 P43K, 초기 전사 인자 70 kDa 서브유닛 VETFS, 초기 전사 인자 82 kDa 서브유닛 VETFL, 메탈로엔도펩티다아제 G1-형, 뉴클레오사이드 트리포스파타아제 I NPH1, 복제 단백질 A28-유사 MC134L, RNA polymease 7 kDa 서브유닛 RPO7(전염성 연속종 바이러스(MCV), 전염성 연속종 (MC)); 기질 단백질 M, 인단백질 P/V, 스몰 소수성 단백질 SH, 핵단백질 N, 단백질 V, 융합 당단백질 F, 헤마글루티닌-뉴라미니다아제 HN, RNA 중합 효소 L (멈프스 바이러스, 멈프스); 외막 단백질 OM, 세포 표면 항원 OmpA, 세포 표면 항원 OmpB (sca5), 세포 표면 단백질 SCA4, 세포 표면 단백질 SCA1, 세포질내 단백질 D, 결정질 표면층 단백질 SLP, 방어 표면 단백질 항원 SPA(리케치아 티피, 발진열(Murine typhus)(지방성 발진티푸스(Endemic typhus))); 부착소 P1, 부착소 P30, 단백질 p116, 단백질 P40, 세포골격 단백질 HMW1, 세포골격 단백질 HMW2, 세포골격 단백질 HMW3, MPN152 코딩 단백질, MPN426 코딩 단백질, MPN456 코딩 단백질, MPN-500코딩 단백질 (마이코플라스마뉴모니에, 마이코플라스마 폐렴(Mycoplasma pneumonia)); NocA, 철 의존성 조절 단백질, VapA, VapD, VapF, VapG, 카제인 분해성 프로테아제, 필라멘트 팁-관련 43-kDa 단백질, 단백질 P24, 단백질 P61, 15-kDa 단백질, 56-kDa 단백질 (보통 노카르디아 아스테로이디즈 및 다른 노카르디아 종, 노카르디아증(Nocardiosis)); 베놈 알레르겐 동족체-유사 단백질 VAL-1, 어번던트 라바 트랜스크립트 ALT-1, 어번던트 라바 트랜스크립트 ALT-2, 티오레독신 과산화효소 TPX, 말벌 알레르겐 동족체 VAH, 티오르독신 과산화효소 2 TPX-2, 항원 단백질 SXP(펩타이드 N, N1, N2, 및 N3), 활성화 관련 단백질-1 ASP-1, 티오레독신 TRX, 트랜스글루타미나제 BmTGA, 글루타티온-S-트랜스퍼라제 GST, 미오신, 말벌 알레르겐 동족체 VAH, 175 kDa 콜라게나제, 글리세르알데히드-3-인산 탈수소효소 GAPDH, 표피 콜라겐 Col-4, 분비된 라바 산성 단백질 SLAPs, 키티나제 CHI-1, 말토스 결합 단백질 MBP, 당분해 효소 과당-1,6-비스포스페이트 알돌라제 Fba, 트로포미오신 TMY-1, 선충 특이적 유전자 생성물 OvB20, 온코시스타틴 CPI-2, Cox-2 (회선사상충, 회선사상충증(Onchocerciasis)(하천 실명(River blindness))); 43 kDa 분비 당단백질, 당단백질 gp0, 당단백질 gp75, 항원 Pb27, 항원 Pb40, 열충격 단백질 Hsp65, 열충격 단백질 Hsp70, 열충격 단백질 Hsp90, 단백질 P10, 트리오스포스페이트 이성화효소 TPI, N-아세틸-글루코사민-결합 렉틴 파라콕신, 28 kDa 단백질 Pb28(파라콕시디오이디즈 브라질리엔시스, Para콕시디오이데스진균증 (남미 블라스토마이코시스)); 28-kDa 크루지페인-유사 시스테인 프로테아제 Pw28CCP (보통 폐흡충 및 다른 파라고늄 종, 폐흡충증); 외막 단백질 OmpH, 외막 단백질 Omp28, 단백질 PM1539, 단백질 PM0355, 단백질 PM1417, 복구 단백질 MutL, 단백질 BcbC, 단백질 PM0305, 포름산탈수소효소-N, 단백질 PM0698, 단백질 PM1422, DNA 자이레이스, 지질단백질 PlpE, 부착성 단백질 Cp39, 헴 획득 시스템 수용체 HasR, 39 kDa 캡슐 단백질, 철-조절 OMP IROMP, 외막 단백질 OmpA87, 가는 털 단백질 Ptf, 가는 털 서브유닛 단백질 PtfA, 트랜스페린 결합 단백질 Tbpl, 에스테라제 효소 MesA, 파스퇴렐라 물토시다 독소 PMT, 부착성 단백질 Cp39 (파스퇴렐라 속, 파스퇴렐라증(Pasteurellosis)); "필라멘트 헤마글루티닌 FhaB, 아데닐산 고리화효소CyaA, 백일해 독소 서브유닛 4 전구체 PtxD, 퍼탁틴 전구체 Prn, 독소 서브유닛 1 PtxA, 단백질 Cpn60, 단백질 brkA, 백일해 독소 서브유닛 2 전구체PtxB, 백일해 독소 서브유닛 3 전구체 PtxC, 백일해 독소 서브유닛 5 전구체 PtxE, 퍼탁틴 Prn, 단백질 Fim2, 단백질 Fim3; " (보르데텔라 백일해균, 백일해(Pertussis)(Whooping cough)); "F1 캡슐 항원, 독성-관련 V 항원, 분비 작동인자 단백질 LcrV, V 항원, 외막 프로테아제 Pla, 분비 작동인자 단백질 YopD, 추정 분비 단백질-티로신 포스파타아제 YopH, 니들 복합체 메이저 서브유닛 YscF, 단백질 키나제 YopO, 추정 자가수송체 단백질 YapF, 내막 ABC-수송체 YbtQ (Irp7), 추정 당 결합 단백질 YPO0612, 열충격 단백질 90 HtpG, 추정 설파타아제 단백질 YdeN, 외막 지질단백질 캐리어 단백질 LolA, 분비 샤페론 YerA, 추정 지질단백질 YPO0420, 용혈소 활성자 단백질 HpmB, 페스티신/예르시니아박틴 외막 수용체 Psn, 분비 작동인자 단백질 YopE, 분비 작동인자 단백질 YopF, 분비 작동인자 단백질 YopK, 외막 단백질 YopN, 외막 단백질 YopM, 응고효소/섬유소용해효소 전구체 Pla; " (페스트균, 페스트); 단백질 PhpA, 표면 부착소 PsaA, 폐렴구균 용혈소 Ply, ATP-의존성 프로테아제 Clp, 리포산염-단백질 리가아제 LplA, 세포벽 표면 정착 단백질 psrP, 소르타아제 SrtA, 글루타밀-tRNA 합성효소 GltX, 콜린 결합 단백질 A CbpA, 폐렴구균 표면 단백질 A PspA, 폐렴구균 표면 단백질 C PspC, 6-포스포글루코네이트 탈수소효소 Gnd, 철-결합 단백질 PiaA, 무레인 가수분해효소 LytB, 프로테온LytC, 프로테아제 A1(스트렙토코쿠스 뉴모니에, 폐렴구군 감염(Pneumococcal infection)); 메이저 표면 단백질 B, 켁신-유사 프로테아제 KEX1, 단백질 A12, 55 kDa 항원 P55, 메이저 표면 당단백질 Msg (주폐포자충, 주폐포자충 폐렴 (PCP)); 게놈 다단백질, 중합 효소 3D, 바이러스성 캡시드 단백질 VP1, 바이러스성 캡시드 단백질 VP2, 바이러스성 캡시드 단백질 VP3, 바이러스성 캡시드 단백질 VP4, 프로테아제 2A, 프로테아제 3C (폴리오바이러스, 회백수염(Poliomyelitis)); 단백질 Nfa1, 엑센딘-3, 분비성 리파아제, 카텝신 B-유사 프로테아제, 시스테인 프로테아제, 카텝신, 페록시레독신, 단백질 Cry1Ac (보통 파울러 자유아메바, 원발성 아메바성 수막뇌염(Primary amoebic meningoencephalitis, PAM)); 아그노단백질, 라지 T 항원, 스몰 T 항원, 메이저 캡시드 단백질 VP1, 마이너 캡시드 단백질 Vp2 (JC 바이러스, 진행성 다병소성 백질뇌증(Progressive multifocal leukoencephalopathy)); 저 칼슘 반응 단백질 E LCrE, 클라미디아 외부 단백질 N CopN, 세린/트레오닌-단백질 키나제 PknD, 아실-캐리어-단백질 S-말로닐트랜스퍼라제 FabD, 단일 가닥 DNA-결합 단백질 Ssb, 메이저 외막 단백질 MOMP, 외막 단백질 2 Omp2, 다형성 막단백질 패밀리 (Pmp1, Pmp2, Pmp3, Pmp4, Pmp5, Pmp6, Pmp7, Pmp8, Pmp9, Pmp10, Pmp11, Pmp12, Pmp13, Pmp14, Pmp15, Pmp16, Pmp17, Pmp18, Pmp19, Pmp20, Pmp21) (클라미노필라 프시타시, 앵무새병(Psittacosis)); 외막 단백질 P1, 열충격 단백질 B HspB, 펩타이드 ABC 수송체, GTP-결합 단백질, 단백질 IcmB, 리보뉴클레아제 R, 포스파타아제 SixA, 단백질 DsbD, 외막 단백질 TolC, DNA-결합 단백질 PhoB, ATPase DotB, 열충격 단백질 B HspB, 막 단백질 Com1, 28 kDa 단백질, DNA-3-메틸아데닌 글리코시다아제 I, p외막 단백질 OmpH, 외막 단백질 AdaA, 글리신 분해 시스템 T-단백질 (콕시엘라 부르네티, Q열); 핵단백질 N, 라지 구조적 단백질 L, 인단백질 P, 기질 단백질 M, 당단백질 G (광견병 바이러스, 광견병); 융합단백질 F, 핵단백질 N, 기질 단백질 M, 기질 단백질 M2-1, 기질 단백질 M2-2, 인단백질 P, 스몰 소수성 단백질 SH, 메이저 표면 당단백질 G, 중합 효소 L, 비구조적 단백질 1 NS1, 비구조적 단백질 2 NS2 (호흡기 세포융합 바이러스(RSV), 호흡기 세포융합 바이러스 감염); 게놈 다단백질, 중합 효소 3D, 바이러스성 캡시드 단백질 VP1, 바이러스성 캡시드 단백질 VP2, 바이러스성 캡시드 단백질 VP3, 바이러스성 캡시드 단백질 VP4, 프로테아제 2A, 프로테아제 3C (리노바이러스, 리노바이러스 감염); 외막 단백질 OM, 세포 표면 항원 OmpA, 세포 표면 항원 OmpB (sca5), 세포 표면 단백질 SCA4, 세포 표면 단백질 SCA1, 단백질 PS120, 세포질내 단백질 D, 방어 표면 단백질 항원 SPA(리케치아 속, 리케치아 감염); 외막 단백질 OM, 세포 표면 항원 OmpA, 세포 표면 항원 OmpB (sca5), 세포 표면 단백질 SCA4, 세포 표면 단백질 SCA1, 세포질내 단백질 D (리케치아 아카리, 리케치아 두창(Rickettsialpox)); 외피 당단백질 GP, 중합 효소 L, 핵단백질 N, 비구조적 단백질 NSS (리프트 밸리열 바이러스, 리프트 밸리열 (RVF)); 외막 단백질 OM, 세포 표면 항원 OmpA, 세포 표면 항원 OmpB (sca5), 세포 표면 단백질 SCA4, 세포 표면 단백질 SCA1, 세포질내 단백질 D (리케치아 리케치, 록키산 홍반열(Rocky mountain spotted fever, RMSF)); "비구조적 단백질 6 NS6, 비구조적 단백질 2 NS2, 중간 캡시드 단백질 VP6, 내부 캡시드 단백질 VP2, 비구조적 단백질 3 NS3, RNA-의존성 RNA 중합 효소 L, 단백질 VP3, 비구조적 단백질 1 NS1, 비구조적 단백질 5 NS5, 외부 캡시드 당단백질 VP7, 비구조적 당단백질 4 NS4, 외부 캡시드 단백질 VP4; " (로타바이러스, 로타바이러스 감염); 다단백질 P200, 당단백질 E1, 당단백질 E2, 단백질 NS2, 캡시드 단백질 C (루벨라 바이러스, 루벨라); 샤페로닌 GroEL (MopA), 이노시톨 포스페이트 포스파타아제 SopB, 열충격 단백질 HslU, 샤페론 단백질 DnaJ, 단백질 TviB, 단백질 IroN, 플라젤린 FliC, 침습 단백질 SipC, 당단백질 gp43, 외막 단백질 LamB, 외막 단백질 PagC, 외막 단백질 TolC, 외막 단백질 NmpC, 외막 단백질 FadL, 수송 단백질 SadA, 트랜스퍼라제 WgaP, 작동인자 단백질 SifA, SteC, SseL, SseJ 및 SseF (살모넬라 속, 살모넬라증); "단백질 14, 비구조적 단백질 NS7b, 비구조적 단백질 NS8a, 단백질 9b, 단백질 3a, 핵단백질 N, 비구조적 단백질 NS3b, 비구조적 단백질 NS6, 단백질 7a, 비구조적 단백질 NS8b, 막 단백질 M, 외피 스몰 막 단백질 EsM, 복제효소 다단백질 1a, 스파이크 당단백질 S, 복제효소 다단백질 1ab ; " (사스 코로나바이러스, SARS (중증 급성 호흡기 증후군)); 세린 프로테아제, 비정형 천공개선충 항원 1 ASA1, 글루타티온 S-트랜스퍼라제 GST, 시스테인 프로테아제, 세린 프로테아제, 아포지질단백질 (옴진드기, 옴(Scabies)); 글루타티온 S-트랜스퍼라제 GST, 파라미오신, 헤모글리비나아제 SM32, 메이저 충란 항원, 14 kDa 지방산-결합 단백질 Sm14, 메이저 라바 표면 항원 P37, 22,6 kDa 표피 항원, 칼페인 CANP, 트리포스페이트 이성화효소 Tim, 표면 단백질 9B, 외부 캡시드 단백질 VP2, 23 kDa 내포된 막 단백질 Sm23, Cu/Zn-수퍼옥시드 디스무타제, 당단백질 Gp, 미오신 (주혈흡충 속, 주혈흡충증(Schistosomiasis)(빌하르쯔 주혈흡충증)); 60 kDa 샤페로닌, 56 kDa 타입-특이적 항원, 피루베이트 포스페이트 다이키나아제, 4-하이드록시벤조에이트 옥타프레닐트랜스퍼라제 (오리엔티아 쯔쯔가무시균, 쯔쯔가무시병(Scrub typhus)); 탈수소효소 GuaB, 침습 단백질 Spa32, 인바신 IpaA, 인바신 IpaB, 인바신 IpaC, 인바신 IpaD, 인바신 IpaH, 인바신 IpaJ (시겔라 속, 시겔라증(Shigellosis)(세균성 이질(Bacillary dysentery))); 단백질 P53, 비리온단백질 US10 동족체, 전사 조절자 IE63, 전사 트랜스작용인자 IE62, 프로테아제 P33, 알파 트랜스-유도 인자 74 kDa 단백질, 데옥시우리딘 5'-트리포스페이트 뉴클레오티도하이드롤라아제, 전사 트랜스작용인자 IE4, 막 단백질 UL43 동족체, 핵 인단백질 UL3 동족체, 핵 단백질 UL4 동족체, 복제 원점-결합 단백질, 막 단백질 2, 인단백질 32, 단백질 57,DNA 중합 효소 반응진행성 인자, 포탈 단백질 54, DNA 프리마아제, 외피 단백질 UL14 동족체, 외피 단백질 UL21 동족체, 외피 단백질 UL55 동족체,트리파르티테 터미나제 서브유닛 UL33 동족체,트리파르티테 터미나제 서브유닛 UL15 동족체, 캡시드-결합 단백질 44, 비리온-패키징 단백질 43 (수두 대상포진 바이러스(VZV), 띠헤르페스(Shingles)(대상포진(Herpes zoster))); 잘린 3-베타 하이드록시-5-엔 스테로이드 탈수소효소 동족체, 비리온막 단백질 A13, 단백질 A19, 단백질 A31, 잘린 단백질 A35 동족체, 단백질 A37.5 동족체, 단백질 A47, 단백질 A49, 단백질 A51, 세마포린-유사 단백질 A43, 세린 프로테이나아제 억제제 1, 세린 프로테이나아제 억제제 2, 세린 프로테이나아제 억제제 3, 단백질 A6, 단백질 B15, 단백질 C1, 단백질 C5, 단백질 C6, 단백질 F7, 단백질 F8, 단백질 F9, 단백질 F11, 단백질 F14, 단백질 F15, 단백질 F16 (대두창 또는 소두창, 두창 (천연두)); 부착소/당단백질 gp70, 프로테아제 (스포로트릭스 셴키, 스포로트릭스증); 헴-철 결합 단백질 IsdB, 콜라겐 부착소 Cna, 응괴 인자 A ClfA, 단백질 MecA, 피브로넥틴-결합 단백질 A FnbA, 장독소 A형 EntA, 장독소 B형 EntB, 장독소 C형 EntC1, 장독소 C형 EntC2, 장독소 type D EntD, 장독소 type E EntE, 유독성 쇼크 증후군 독소-1 TSST-1, 스타필로키나아제, 페니실린 결합 단백질 2a PBP2A(MecA), 분비성 항원 SssA(스타필로코쿠스 속, 포도상구균성 식중독); 헴-철 결합 단백질 IsdB, 콜라겐 부착소 Cna, 응괴 인자 A ClfA, 단백질 MecA, 피브로넥틴-결합 단백질 A FnbA, 장독소 A형 EntA, 장독소 B형 EntB, 장독소 C형 EntC1, 장독소 C형 EntC2, 장독소 type D EntD, 장독소 type E EntE, 유독성 쇼크 증후군 독소-1 TSST-1, 스타필로키나아제, 페니실린 결합 단백질 2a PBP2A(MecA), 분비성 항원 SssA(스타필로코쿠스 속 예를 들어 아우레우스, 포도상구균 감염); 항원 Ss-IR, 항원 NIE, 스트롱길라스타신, Na+-K+ ATPase Sseat-6, 트로포마이신 SsTmy-1, 단백질 LEC-5, 41 kDa a항원 P5, 41-kDa 라바 단백질, 31-kDa 라바 단백질, 28-kDa 라바 단백질 (분선충, 분선충증(Strongyloidiasis)); 글리세로포스포디에스테르 포스포디에스페라제 GlpQ (Gpd), 외막 단백질 TmpB, 단백질 Tp92, 항원 TpF1, 반복 단백질 Tpr, 반복 단백질 F TprF, 반복 단백질 G TprG, 반복 단백질 I TprI, 반복 단백질 J TprJ, 반복 단백질 K TprK, 트레포네마 막 단백질 A TmpA, 지질단백질, 15 kDa Tpp15, 47 kDa 막 항원, 미니페리틴 TpF1, 부착소 Tp0751, 지질단백질 TP0136, 단백질 TpN17, 단백질 TpN47, 외막 단백질 TP0136, 외막 단백질 TP0155, 외막 단백질 TP0326, 외막 단백질 TP0483, 외막 단백질 TP0956 (트레포네마팔리둠, 매독(Syphilis)); 카텝신 L-유사 프로테아제, 53/25-kDa 항원, 8kDa 패밀리 멤버, 주변부 트립신-유사 활성을 갖는 낭미충 단백질 TsAg5, 육구유충 단백질 TSOL18, 육구유충 단백질 TSOL45-1A, 락트산 탈수소효소 A LDHA, 락트산 탈수소효소 B LDHB (테니아 속, 조충증(Taeniasis)); 파상풍 독소 TetX, 파상풍 독소 C TTC, 140 kDa S층 단백질, 플라보단백질 베타-서브유닛 CT3, 포스포리파제 (레시티나아제), 포스포캐리어 단백질 HPr (파상풍균, 파상풍(개구불능(Lockjaw))); 게놈 다단백질, 단백질 E, 단백질 M, 캡시드 단백질 C (진드기 매개 뇌염 바이러스(TBEV), 진드기 매개 뇌염); 58-kDa 항원, 68-kDa 항원, 개회충속 라바 배설성-분비성 항원 TES, 32-kDa 당단백질, 당단백질 TES-70, 당단백질 GP31, 배설성-분비성 항원 TcES-57, 장주위 액체 항원 Pe, 가용성 추출 항원 Ex, 배설성-분비성 라바 항원 ES, 항원 TES-120, 다단백질 알레르겐 TBA-1, 카텝신 L-유사 시스테인 프로테아제 c-cpl-1, 26-kDa 단백질 (개회충 또는 고양이회충, 톡소카라증 (유충안구이행증(Ocular Larva Migrans, OLM) 및 장기유충이행증(Visceral Larva Migrans, VLM))); 미세간상체 단백질 ( MIC1, MIC2, MIC3, MIC4, MIC5, MIC6, MIC7, MIC8), 롭트리 단백질 Rop2, 롭트리 단백질 (Rop1, Rop2, Rop3, Rop4, Rop5, Rop6, Rop7, Rop16, Rjop17), 단백질 SR1,표면 항원 P22, major 항원 p24, 메이저 표면 항원 p30, 치밀 과립 단백질 (GRA1, GRA2, GRA3, GRA4, GRA5, GRA6, GRA7, GRA8, GRA9, GRA10), 28 kDa 항원, 표면 항원 SAG1, SAG2 관련 항원, 뉴클레오사이드-트리포스파타아제 1, 뉴클레오사이드-트리포스파타아제 2, 단백질 Stt3, HesB-유사 도메인-함유 단백질, 롬보이드-유사 프로테아제 5, 톡소멥신 1(톡소포자충, 톡소플라스마증(Toxoplasmosis)); 43 kDa 분비 당단백질, 53 kDa 분비 당단백질, 파라미오신, 항원 Ts21, 항원 Ts87, 항원 p46000, TSL-1 항원, 카베올린-1 CAV-1, 49 kDa 신생 라바 항원, 프로사포신 동족체, 세린 프로테아제, 세린 프로테이나아제 억제제, 45 kDa 당단백질 Gp45 (선모충, 선모충증(Trichinellosis)); Myb-유사 전사 인자(Myb1, Myb2, Myb3), 부착 단백질 AP23, 부착 단백질 AP33, 부착소 단백질 AP33-3, 부착소s AP51, 부착소 AP65, 부착 단백질 AP65-1, 알파-액티닌, 키네신-관련 단백질, 테뉴린, 62 kDa 프로테이나아제, 서브틸리신-유사 세린 프로테아제 SUB1, 시스테인 프로테아제 유전자 3 CP3, 알파-에놀라아제 Eno1, 시스테인 프로테아제 CP30, 열충격 단백질 (Hsp70, Hsp60), 면역성 단백질 P270, (질편모충, 질편모충증(Trichomoniasis)); 베타-튜불린, 47-kD 단백질, 분비성 백혈구-유사 프로테이나아제-1 SLP-1, 50-kDa 단백질 TT50, 17 kDa 항원, 43/47 kDa 단백질 (편충, 편충증(Trichuriasis)(편충 감염(Whipworm infection))); 단백질 ESAT-6 (EsxA), 10 kDa 여과액 항원 EsxB, 분비 항원 85-B FBPB, 피브로넥틴-결합 단백질 A FbpA(Ag85A), 세린 프로테아제 PepA, PPE 패밀리 단백질 PPE18, 피브로넥틴-결합 단백질 D FbpD, 면역성 단백질 MPT64, 분비 단백질 MPT51, 카탈라아제-과산화효소-페록시니트리타아제 T KATG, 주변세포질 포스페이트-결합 지질단백질 PSTS3 (PBP-3, Phos-1), 철-조절 헤파린 결합 헤마글루티닌 Hbha, PPE 패밀리 단백질 PPE14, PPE 패밀리 단백질 PPE68, 단백질 Mtb72F, 단백질 Apa, 면역성 단백질 MPT63, 주변세포질 포스페이트-결합 지질단백질 PSTS1(PBP-1), 분자 샤페론 DnaK, 세포 표면 지질단백질 Mpt83, 지질단백질 P23, 포스페이트 수송 시스템 투과효소 단백질 pstA, 14 kDa 항원, 피브로넥틴-결합 단백질 C FbpC1, 알라닌 탈수소효소 TB43, 글루타민 합성효소 1, ESX-1 단백질, 단백질 CFP10, TB10.4 단백질, 단백질 MPT83, 단백질 MTB12, 단백질 MTB8, Rpf-유사 단백질, 단백질 MTB32, 단백질 MTB39, 크리스탈린, 열충격 단백질 HSP65, 단백질 PST-S (보통 결핵균, 결핵); 외막 단백질 FobA, 외막 단백질 FobB, 세포내 성장 자리 lglC1, 세포내 성장 자리 IglC2, 아미노트랜스퍼라제 Wbtl, 샤페로닌 GroEL, 17 kDa 메이저 막 단백질 TUL4, 지질단백질 LpnA, 키티나제 패밀리 18 단백질, 이소시트레이트 탈수소효소, Nif3 패밀리 단백질, IV형 선모 글리코실화 단백질, 외막 단백질 tolC, FAD 결합 패밀리 단백질, IV형 필린 다중체 외막 단백질, 2개 인자 센서 단백질 KdpD, 샤페론 단백질 DnaK, 단백질 TolQ (야토균, 야토병); "MB 항원, 우레아제, 단백질 GyrA, 단백질 GyrB, 단백질 ParC, 단백질 ParE, 지질 관련 막 단백질 LAMP, 티미딘 키나제 TK, 포스포리파제 PL-A1, 포스포리파제 PL-A2, 포스포리파제 PL-C, 표면-발현 96-kDa 항원; " (우레아플라스마 우레알리티쿰, 우레아플라스마 우레알리티쿰 감염); 비구조적 다단백질, 구조적 다단백질, 캡시드 단백질 CP, 단백질 E1, 단백질 E2, 단백질 E3, 프로테아제 P1, 프로테아제 P2, 프로테아제 P3 (베네수엘라 말뇌염 바이러스, 베네수엘라 말뇌염); 당단백질 GP, 기질 단백질 Z, 중합 효소 L, 핵단백질 N (구아나리토 바이러스, 베네수엘라 출혈열); 다단백질, 단백질 E, 단백질 M, 캡시드 단백질 C, 프로테아제 NS3, 단백질 NS1, 단백질 NS2A, 단백질 AS2B, 단백질 NS4A, 단백질 NS4B, 단백질 NS5 (웨스트 나일 바이러스, 웨스트나일열); 캡시드 단백질 CP, 단백질 E1, 단백질 E2, 단백질 E3, 프로테아제 P2 (서부형 말뇌염 바이러스, 서부형 말뇌염); 게놈 다단백질, 단백질 E, 단백질 M, 캡시드 단백질 C, 프로테아제 NS3, 단백질 NS1, 단백질 NS2A, 단백질 AS2B, 단백질 NS4A, 단백질 NS4B, 단백질 NS5 (황열 바이러스, 황열); 추정 Yop 표적화 단백질 YobB, 작동인자 단백질 YopD, 작동인자 단백질 YopE, 단백질 YopH, 작동인자 단백질 YopJ, 단백질 전좌 단백질 YopK, 작동인자 단백질 YopT, 단백질 YpkA, 편모 생합성 단백질 FlhA, 펩티다아제 M48, 칼륨 유출 시스템 KefA, 전사 조절자 RovA, 부착소 Ifp, 전이체 단백질 LcrV, 단백질 PcrV, 인바신 Inv, 외막 단백질 OmpF-유사 포린, 부착소 YadA, 단백질 키나제 C, 포스포리파제 C1, 단백질 PsaA, 만노실트랜스퍼라제-유사 단백질 WbyK, 단백질 YscU, 항원 YPMA(예르시니아 슈도투베르쿨로시스, 예르시니아 슈도투베르쿨로시스 감염); 작동인자 단백질 YopB, 60 kDa 샤페로닌, 단백질 WbcP, 티로신-단백질 포스파타아제 YopH, 단백질 YopQ, 장독소, 갈락토시드 투과효소, 환원효소 NrdE, 단백질 YasN, 인바신 Inv, 부착소 YadA, 외막 포린 F OmpF, 단백질 UspA1, 단백질 EibA, 단백질 Hia, 세포 표면 단백질 Ail, 샤페론 SycD, 단백질 LcrD, 단백질 LcrG, 단백질 LcrV, 단백질 SycE, 단백질 YopE, 조절자 단백질 TyeA, 단백질 YopM, 단백질 YopN, 단백질 YopO, 단백질 YopT, 단백질 YopD, 프로테아제 ClpP, 단백질 MyfA, 단백질 FilA, 및 단백질 PsaA(예르시니아 엔테로콜리티카, 예르시니아증). (괄호 안에는 항원(들)이 유래된 특정 병원체 또는 병원체 계열 및 병원체가 관련된 감염성 질환이 있다).
특히 바람직한 구체예에서 병원성 항원은 다음으로부터 선택된다:
a)감염성 질환이 HIV, 바람직하게 인간 면역결핍 바이러스에 의한 감염인 경우, HIV p24 항원, HIV 외피 단백질(Gp120, Gp41, Gp160), 다단백질 GAG, 음성 인자 단백질 Nef, 전사의 트랜스-작용인자 Tat,
b)감염성 질환이 트라코마 클라미디아(Chlamydia trachomatis)에 의한 감염인 경우, 메이저 외막 단백질 MOMP, 가능한 외막 단백질 PMPC, 외막 복합체 단백질 B OmcB, 열충격 단백질 Hsp60 HSP10, 단백질 IncA, III형 분비계로부터의 단백질, 리보뉴클레오타이드 환원효소 스몰 체인 NrdB, 플라스미드 단백질 Pgp3, 클라미디아 외부 단백질 N CopN, 항원CT521, 항원 CT425, 항원 CT043, 항원 TC0052, 항원 TC0189, 항원 TC0582, 항원 TC0660, 항원 TC0726, 항원 TC0816, 항원 TC0828,
c)감염성 질환이 시토메갈로바이러스 감염, 바람직하게 시토메갈로바이러스(CMV)에 의한 감염인 경우, pp65 항원, 막 단백질 pp15, 캡시드-근위의 표피 단백질 pp150, 단백질 M45, DNA 중합 효소 UL54, 헬리카제 UL105, 당단백질 gM, 당단백질 gN, 당단백질 H, 당단백질 B gB, 단백질 UL83, 단백질 UL94, 단백질 UL99;
d)감염성 질환이 뎅기열, 바람직하게 뎅기열 바이러스(DEN-1, DEN-2, DEN-3 및 DEN-4)-플라비바이러스에 의한 감염인 경우, 캡시드 단백질 C, 프리멤브레인 단백질 prM, 막 단백질 M, 외피 단백질 E (도메인 I, 도메인 II, 도메인 II), 단백질 NS1, 단백질 NS2A, 단백질 NS2B, 단백질 NS3, 단백질 NS4A, 단백질 2K, 단백질 NS4B, 단백질 NS5;
e)감염성 질환이 B형 간염, 바람직하게 B형 간염 바이러스(HBV)에 의한 감염인 경우, B형 감염 표면 항원HBsAg, B형 감염 코어 항원 HbcAg, 중합 효소, 단백질 Hbx, preS2 중간 표면 단백질, 표면 단백질 L, 라지 S 단백질, 바이러스 단백질 VP1, 바이러스 단백질 VP2, 바이러스 단백질 VP3, 바이러스 단백질 VP4;
f)감염성 질환이 인유두종 바이러스(HPV) 감염, 바람직하게 인유두종 바이러스(HPV)에 의한 감염인 경우, 복제단백질 E1, 조절 단백질E2, 단백질 E3, 단백질 E4, 단백질 E5, 단백질 E6, 단백질 E7, 단백질 E8, 메이저 캡시드 단백질 L1, 마이너 캡시드 단백질 L2;
g)감염성 질환이 인간 파라인플루엔자 바이러스 감염, 바람직하게 인간 파라인플루엔자 바이러스(HPIV)에 의한 감염인 경우, 융합 단백질 F, 헤마글루티닌-뉴라미다제 HN, 당단백질 G, 기질 단백질 M, 인단백질 P, 핵단백질 N, 중합 효소 L;
h)헤마글루티닌 (HA), 뉴라미니다아제 (NA), 핵단백질 (NP), M1 단백질, M2 단백질, NS1 단백질, NS2 단백질 (NEP 단백질: 핵 수출 단백질), PA 단백질, PB1 단백질(중합 효소 염기성 1 단백질), PB1-F2 단백질 및 PB2 단백질 (오르토믹소바이러스 과, 인플루엔자 바이러스(flu));
i)감염성 질환이 광견병, 바람직하게 광견병 바이러스에 의한 감염인 경우, 핵단백질 N, 라지 구조적 단백질 L, 인단백질 P, 기질 단백질 M, 당단백질 G;
j)감염성 질환이 호흡기 세포융합 바이러스 감염, 바람직하게 호흡기 세포융합 바이러스(RSV)에 의한 감염인 경우, 융합단백질 F, 핵단백질 N, 기질 단백질 M, 기질 단백질 M2-1, 기질 단백질 M2-2, 인단백질 P, 스몰 소수성 단백질 SH, 메이저 표면 당단백질 G, 중합 효소 L, 비구조적 단백질 1 NS1, 비구조적 단백질 2 NS2;
k)분비성 항원 SssA(스타필로코쿠스 속, 포도상구균성 식중독); 분비성 항원 SssA(스타필로코쿠스 속 예를 들어 아우레우스포도상구균 감염); 감염성 질환이 결핵, 바람직하게 결핵균에 의한 감염인 경우, 분자 샤페론 DnaK, 세포 표면 지질단백질 Mpt83, 지질단백질 P23, 포스페이트 수송 시스템 투과효소 단백질 pstA, 14 kDa 항원, 피브로넥틴-결합 단백질 C FbpC1, 알라닌 탈수소효소 TB43, 글루타민 합성효소 1, ESX-1 단백질, 단백질 CFP10, TB10.4 단백질, 단백질 MPT83, 단백질 MTB12, 단백질 MTB8, Rpf-유사 단백질, 단백질 MTB32, 단백질 MTB39, 크리스탈린, 열충격 단백질 HSP65, 단백질 PST-S;
또는 감염성 질환이 황열, 바람직하게 황열 바이러스에 의한 감염인 경우, 게놈 다단백질, 단백질 E, 단백질 M, 캡시드 단백질 C, 프로테아제 NS3, 단백질 NS1, 단백질 NS2A, 단백질 AS2B, 단백질 NS4A, 단백질 NS4B, 단백질 NS5.
실시예
아래 실시예들은 본 발명을 더욱 예증하기 위한 의도이다. 이들은 단지 예시적이며 본 발명의 주제의 범위를 한정하고자 하는 의도는 아니다.
실시예 1: 본 발명에 따른 조성물의 제조
아래 실시예들에 대하여, 가우시아 프린셉스 루시퍼라제(Gaussia princeps luciferase, GpLuc)를 인코딩하는 DNA 서열을 제조하고 후속하는 RNA 생체 외 전사 반응을 위하여 사용하였다. 획득된 mRNA 구조체를 추가 생체 외 및 생체 내 실험에 대하여 사용하였다. GpLuc 및 PpLuc의 각각의 아미노산 서열 및 mRNA 서열뿐만 아니라 제조 단계 상세사항이 이하에서 제공된다.
GpLuc, 아미노산 서열 (SEQ ID NO: 11):
MGVKVLFALICIAVAEAKPTENNEDFNIVAVASNFATTDLDADRGKLPGKKLPLEVLKEMEANARKAGCTRGCLICLSHIKCTPKMKKFIPGRCHTYEGDKESAQGGIGEAIVDIPEIPGFKDLEPMEQFIAQVDLCVDCTTGCLKGLANVQCSDLLKKWLPQRCATFASKIQGQVDKIKGAGGD
GpLuc, mRNA 서열 (SEQ ID NO: 12), 또한 여기서 R2851로 표지됨:
GGGGCGCUGCCUACGGAGGUGGCAGCCAUCUCCUUCUCGGCAUCAAGCUUACCAUGGGCGUGAAGGUCCUGUUCGCCCUCAUCUGCAUCGCCGUGGCGGAGGCCAAGCCCACCGAGAACAACGAGGACUUCAACAUCGUGGCCGUCGCCAGCAACUUCGCCACCACGGACCUGGACGCGGACCGGGGGAAGCUGCCGGGCAAGAAGCUCCCCCUGGAGGUGCUGAAGGAGAUGGAGGCCAACGCCCGCAAGGCCGGGUGCACCCGGGGCUGCCUCAUCUGCCUGUCCCACAUCAAGUGCACCCCCAAGAUGAAGAAGUUCAUCCCCGGGCGCUGCCACACCUACGAGGGCGACAAGGAGAGCGCGCAGGGCGGGAUCGGCGAGGCCAUCGUGGACAUCCCGGAGAUCCCCGGGUUCAAGGACCUGGAGCCCAUGGAGCAGUUCAUCGCCCAGGUCGACCUCUGCGUGGACUGCACGACCGGCUGCCUGAAGGGGCUGGCCAACGUGCAGUGCUCCGACCUCCUGAAGAAGUGGCUGCCCCAGCGGUGCGCCACCUUCGCGAGCAAGAUCCAGGGCCAGGUCGACAAGAUCAAGGGCGCCGGGGGCGACUGAGGACUAGUGCAUCACAUUUAAAAGCAUCUCAGCCUACCAUGAGAAUAAGAGAAAGAAAAUGAAGAUCAAUAGCUUAUUCAUCUCUUUUUCUUUUUCGUUGGUGUAAAGCCAACACCCUGUCUAAAAAACAUAAAUUUCUUUAAUCAUUUUGCCUCUUUUCUCUGUGCUUCAAUUAAUAAAAAAUGGAAAGAACCUAGAUCUAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAUGCAUCCCCCCCCCCCCCCCCCCCCCCCCCCCCCCCAAAGGCUCUUUUCAGAGCCACCAGAAUU
PpLuc, 아미노산 서열 (SEQ ID NO: 18):
MEDAKNIKKGPAPFYPLEDGTAGEQLHKAMKRYALVPGTIAFTDAHIEVDITYAEYFEMSVRLAEAMKRYGLNTNHRIVVCSENSLQFFMPVLGALFIGVAVAPANDIYNERELLNSMGISQPTVVFVSKKGLQKILNVQKKLPIIQKIIIMDSKTDYQGFQSMYTFVTSHLPPGFNEYDFVPESFDRDKTIALIMNSSGSTGLPKGVALPHRTACVRFSHARDPIFGNQIIPDTAILSVVPFHHGFGMFTTLGYLICGFRVVLMYRFEEELFLRSLQDYKIQSALLVPTLFSFFAKSTLIDKYDLSNLHEIASGGAPLSKEVGEAVAKRFHLPGIRQGYGLTETTSAILITPEGDDKPGAVGKVVPFFEAKVVDLDTGKTLGVNQRGELCVRGPMIMSGYVNNPEATNALIDKDGWLHSGDIAYWDEDEHFFIVDRLKSLIKYKGYQVAPAELESILLQHPNIFDAGVAGLPDDDAGELPAAVVVLEHGKTMTEKEIVDYVASQVTTAKKLRGGVVFVDEVPKGLTGKLDARKIREILIKAKKGGKIAV
PpLuc, mRNA 서열 (SEQ ID NO: 19):
GGGGCGCUGCCUACGGAGGUGGCAGCCAUCUCCUUCUCGGCAUCAAGCUUGAGGAUGGAGGACGCCAAGAACAUCAAGAAGGGCCCGGCGCCCUUCUACCCGCUGGAGGACGGGACCGCCGGCGAGCAGCUCCACAAGGCCAUGAAGCGGUACGCCCUGGUGCCGGGCACGAUCGCCUUCACCGACGCCCACAUCGAGGUCGACAUCACCUACGCGGAGUACUUCGAGAUGAGCGUGCGCCUGGCCGAGGCCAUGAAGCGGUACGGCCUGAACACCAACCACCGGAUCGUGGUGUGCUCGGAGAACAGCCUGCAGUUCUUCAUGCCGGUGCUGGGCGCCCUCUUCAUCGGCGUGGCCGUCGCCCCGGCGAACGACAUCUACAACGAGCGGGAGCUGCUGAACAGCAUGGGGAUCAGCCAGCCGACCGUGGUGUUCGUGAGCAAGAAGGGCCUGCAGAAGAUCCUGAACGUGCAGAAGAAGCUGCCCAUCAUCCAGAAGAUCAUCAUCAUGGACAGCAAGACCGACUACCAGGGCUUCCAGUCGAUGUACACGUUCGUGACCAGCCACCUCCCGCCGGGCUUCAACGAGUACGACUUCGUCCCGGAGAGCUUCGACCGGGACAAGACCAUCGCCCUGAUCAUGAACAGCAGCGGCAGCACCGGCCUGCCGAAGGGGGUGGCCCUGCCGCACCGGACCGCCUGCGUGCGCUUCUCGCACGCCCGGGACCCCAUCUUCGGCAACCAGAUCAUCCCGGACACCGCCAUCCUGAGCGUGGUGCCGUUCCACCACGGCUUCGGCAUGUUCACGACCCUGGGCUACCUCAUCUGCGGCUUCCGGGUGGUCCUGAUGUACCGGUUCGAGGAGGAGCUGUUCCUGCGGAGCCUGCAGGACUACAAGAUCCAGAGCGCGCUGCUCGUGCCGACCCUGUUCAGCUUCUUCGCCAAGAGCACCCUGAUCGACAAGUACGACCUGUCGAACCUGCACGAGAUCGCCAGCGGGGGCGCCCCGCUGAGCAAGGAGGUGGGCGAGGCCGUGGCCAAGCGGUUCCACCUCCCGGGCAUCCGCCAGGGCUACGGCCUGACCGAGACCACGAGCGCGAUCCUGAUCACCCCCGAGGGGGACGACAAGCCGGGCGCCGUGGGCAAGGUGGUCCCGUUCUUCGAGGCCAAGGUGGUGGACCUGGACACCGGCAAGACCCUGGGCGUGAACCAGCGGGGCGAGCUGUGCGUGCGGGGGCCGAUGAUCAUGAGCGGCUACGUGAACAACCCGGAGGCCACCAACGCCCUCAUCGACAAGGACGGCUGGCUGCACAGCGGCGACAUCGCCUACUGGGACGAGGACGAGCACUUCUUCAUCGUCGACCGGCUGAAGUCGCUGAUCAAGUACAAGGGCUACCAGGUGGCGCCGGCCGAGCUGGAGAGCAUCCUGCUCCAGCACCCCAACAUCUUCGACGCCGGCGUGGCCGGGCUGCCGGACGACGACGCCGGCGAGCUGCCGGCCGCGGUGGUGGUGCUGGAGCACGGCAAGACCAUGACGGAGAAGGAGAUCGUCGACUACGUGGCCAGCCAGGUGACCACCGCCAAGAAGCUGCGGGGCGGCGUGGUGUUCGUGGACGAGGUCCCGAAGGGCCUGACCGGGAAGCUCGACGCCCGGAAGAUCCGCGAGAUCCUGAUCAAGGCCAAGAAGGGCGGCAAGAUCGCCGUGUAAGACUAGUGCAUCACAUUUAAAAGCAUCUCAGCCUACCAUGAGAAUAAGAGAAAGAAAAUGAAGAUCAAUAGCUUAUUCAUCUCUUUUUCUUUUUCGUUGGUGUAAAGCCAACACCCUGUCUAAAAAACAUAAAUUUCUUUAAUCAUUUUGCCUCUUUUCUCUGUGCUUCAAUUAAUAAAAAAUGGAAAGAACCUAGAUCUAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAUGCAUCCCCCCCCCCCCCCCCCCCCCCCCCCCCCCCAAAGGCUCUUUUCAGAGCCACCAGAAUU
DNA 및 mRNA 구조체의 제조:
가우시아 프린셉스 루시퍼라아제를 인코딩하는 DNA 서열은 안정화를 위해 GC-최적화된 서열을 도입하여 야생형 인코딩 DNA 서열을 변형시킴으로써 제조되었다. 서열을 유도된 pUC19 벡터 내로 도입시키고 32L4-5'-UTR 리보솜 5'TOP UTR(32L4) 및 알부민 7로부터 유래된 3'UTR로부터 유래된 안정화 UTR 서열을 포함하도록 변형시키고, 히스톤 줄기-루프 서열, 3'-종결 말단(폴리-A-꼬리)에서의 64x 아데노신의 스트레치 및 3'- 종결 말단(폴리-C-꼬리)에서의 30x 시토신의 스트레치를 코딩 서열의 3'에 도입하였다. 서열은 다음의 서열 요소를 함유한다: 가우시아 루시퍼라아제를 인코딩하는 코딩 서열; 32L4-5'-UTR 리보솜 5'TOP UTR (32L4)로부터 유래된 안정화 서열; 3'-종결 말단(폴리-A-꼬리)에서의 64x 아데노신; 5 뉴클레오타이드, 3'- 종결 말단(폴리-C-꼬리)에서의 30 x 시토신 및 5 추가 뉴클레오타이드.
본 문맥에서 언급된 R2851은 64 개 아데닐레이트를 갖는 폴리(A)-서열, 이어서 5 개 뉴클레오타이드, 이어서 30 개 시티딜레이트를 갖는 폴리(C)-서열 및 히스톤 줄기-루프 서열 이어서 또 다른 5 개 뉴클레오타이드를 갖는 가우시아 프린셉스 루시퍼라아제를 인코딩하는 GC-풍부 mRNA 서열을 닮는다.
RNA 생체 외 전사:
각각의 DNA 플라스미드를 각각의 완충 조건 하에서 뉴클레오타이드 혼합물의 존재 하에 DNA 의존성 T7 RNA 폴리머라제를 사용하여 생체 외에서 효소적으로 선형화하고 전사하였다. GpLuc mRNA를 뉴클레오타이드 혼합물에 캡 유사체(m7GpppG)를 첨가함으로써 동시-전사적으로 캡핑하였다.
mRNA 구조체의 정제:
수득된 mRNA 구조체를 PureMessenger® (CureVac, Tbingen, Germany; WO 2008/077592 A1)를 사용하여 정제하고 추가 실험에 사용하였다.
양이온성 펩티드/폴리머의 제조
PB83, 디설파이드-결합된 폴리에틸렌 글리콜/펩티드 콘쥬게이트를 아래와 같이 제조하였다. 20 mg 펩티드 (CHHHHHHRRRRHHHHHHC-NH2) TFA 염을 2 mL 붕산 완충액 pH 8.5에 용해시키고 실온에서 약 18 시간 동안 교반하였다. 그런 다음, N-메틸피롤리돈에 용해된 12.6 mg PEG-SH 5000(선 브라이트)을 펩티드 용액에 첨가하고 붕산염 완충액 pH 8.5로 3 mL까지 채웠다. 실온에서 18 시간 동안 배양한 후, 반응 혼합물을 정제하고 센트리콘 과정(centricon procedure)(MWCO 10kDa)에 의해 농축시키고, 물로 세척하고 동결건조시켰다. 동결건조 후, 동결건조물을 ELGA 물에 용해시키고 농도를 10 mg/mL로 조정하였다. 획득된 폴리에틸렌 글리콜/펩티드 폴리머 (HO-PEG 5000-S-(S-CHHHHHHRRRRHHHHHHC-S-)7-S-PEG 5000-OH)를 추가 제형 실험을 위해 사용하였고, 이하에서 이를 PB83이라 한다.
리피도이드의 제조
리피도이드
및
를 제조하였다. 리피도이드 3-C12는 활성화된 라우르산(C12) 유도체로 tris(2-아미노에틸)아민을 아실화한 후 아마이드의 환원에 의해 수득될 수 있다. 대안적으로, 이는 상응하는 알데히드를 사용한 환원성 아미노화에 의해 제조될 수 있다. 리피도이드 3-C12-OH는 Love et al., pp. 1864-1869, PNAS, vol. 107 (2010), no. 5 (화합물 C12-110 참조)에 따라 동일한 올리고아민을 갖는 말단 C12 알킬 에포사이드의 첨가에 의해 제조된다.
화학식 IX에 따른 양이온을 포함하는 리피도이드 3-C12-OH-cat를:
3-C12-OH를 메틸 아이오다이드와 같은 활성화된 메틸 그룹과 반응시켜 제조하였다.
폴리머-리피도이드 복합체화된 mRNA의 나노입자를 갖는 조성물의 제조:
먼저, 링거 락테이트 완충액(RiLa; 대안적으로 예를 들어 식염수(NaCl) 또는 PBS 완충액을 사용할 수 있음), 상응하는 양의 리피도이드, 및 상응하는 양의 폴리머(PB83)을 혼합하여 리피도이드 및 펩티드 또는 폴리머를 포함하는 조성물을 제조하였다. 그 다음, 담체 조성물을 사용하여 mRNA를 상응하는 양의 폴리머-리피도이드 담체와 혼합하고 상온에서 10 분의 배양 기간을 허용하여 리피도이드, 폴리머 및 mRNA 사이의 복합체 형성을 가능하게 함으로써 나노입자를 mRNA와 결합시켰다. 나노입자를 그 후 추가 생체 외 및 생체 내 실험에 대하여 사용하였다. 그와 관련하여 관련된 파라미터는 리피도이드의 양과 종류, 폴리머의 양과 종류, 그리고 N/P 비율이다.
얻어진 폴리머-리피도이드 복합체화된 mRNA 입자의 완전성을 특성화하기 위해, RNA 아가로오스 겔 이동 분석을 수행하였다. 또한, 얻어진 나노입자가 균일한 크기 프로파일을 갖는지를 평가하기 위해 크기 측정을 수행하였다.
RNA 겔 이동 분석을 위해, 통상적인 RNA 아가로오스 겔을 준비하고 각각의 폴리머-리피도이드 복합체화된 mRNA 입자를 넣었다. 겔 밴드를 바이오 이미저를 사용하여 가시화하였다. 모든 시험된 폴리머-리피도이드 복합체화된 mRNA를 분석하여 각각의 조건 하에서 안정한 것으로 결정하였다(데이터 미제시).
입자 크기를 결정하기 위해, 폴리머-리피도이드 복합체화된 mRNA를 포함하는 샘플을 링거 락테이트(또는 염수)에서 최종 부피 50 μL로 희석하였다. 크기 측정은 Zetasizer® 장치를 사용하여 수행하였다.
겔 이동 분석과 입자 크기 분석의 결과는 얻어진 폴리머-리피도이드-mRNA 복합체가 넓은 범위의 폴리머-대-리피도이드 비율에 대해 안정하고 균일하다는 것을 보여주었다.
실시예 2: 생체 외에서 Sol8 근육 세포의 형질주입 효율성에 대한 상이한 폴리머-리피도이드 제형의 효과
본 실시예는 분화된 Sol8 세포에서 양성 및 음성 대조군과 비교하여 GpLuc mRNA(SEQ ID NO: 12)를 포함하는 본 발명에 따른 다양한 조성물의 형질주입 효율성을 나타낸다. 양이온성 폴리머-펩티드 콘쥬게이트(PB83)에 매우 소량의 리피도이드(즉, 3-C12 및 3-C12-OH)를 첨가하면 도 1A 내지 1C에서 볼 수 있는 바와 같이 형질주입 효율성의 현저한 증가를 유발한다는 것을 알 수 있었다.
Sol8 세포의 형질주입:
Sol8은 정상적인 C3H 마우스의 다리에서 취한 가자미근(soleus muscle)의 일차 배양으로부터 Daubas 등에 의해 분리된 근원 세포계(myogenic cell line)이다. 1 일째에 96 웰 유리 바닥 플레이트(콜라겐으로 코팅 된 소프트웰 하이드로겔, 탄성 E = 12 kPa)에 0.2 mL 부피의 Sol8 세포(20.000 세포)를 접종하였다. 각 웰에서 배지를 제거한 후, 100 μL DMEM 배지(2% 말 혈청 포함)를 각 웰에 첨가하였다. 그 후, 2 일째에, Sol8 세포를 실시예 1에 따라 제조된 폴리머-리피도이드 복합체 및 각각의 대조군(3 개씩)의 100 μL의 형질주입 혼합물(3개씩)로 형질주입시키고, 세포를 37 ℃ 및 5 % CO2에서 120 분 동안 배양하였다. 배양 후, 150 μL 배지를 10 % 태아 송아지 혈청이 보충된 150 μL의 신선한 DMEM 배지로 교환하였다. 형질 주입 24 시간 후, 즉 3 일째, 각 웰의 상청액 10 μL를 추출하고 하기 기술된 바와 같이 수행된 추가의 발광 분석을 위해 사용하였다. 카고의 성공적인 형질주입은 루시퍼라아제 단백질의 번역과 Gp 루시퍼라아제 단백질의 세포 배양 상청액으로의 분비로 이어진다.
발광 분석을 위해, 10 μL의 상청액을 GpLuc 측정용 96 웰 플레이트로 옮겼다. 그런 다음, 코엘렌테라진 작업 용액(100 μM)을 분비하였다(5 mM NaCl, pH 7.2로 보충된 49 mL 인산염 완충 식염수 중의 1 mL 코엘렌테라진 저장 용액(EtOH 중의 4.72 mM)). 100 μL 부피의 코엘렌테라진 작업 용액을 GpLuc의 기질로 사용하고 상업적으로 입수가능한 마이크로플레이트 판독기에서 5 초 후에 측정하였다.
실시예 3: 생체 외에서 HepG2 세포의 형질주입 효율성에 대한 상이한 폴리머-리피도이드 제형의 효과
본 실시예는 HepG2 세포에서 양성 및 음성 대조군과 비교하여 GpLuc mRNA를 포함하는 본 발명에 따른 다양한 조성물의 형질주입 효율성을 나타낸다. 양이온성 폴리머-펩티드 콘쥬게이트(PB83)에 매우 소량의 리피도이드((3-C12; 3-C12-OH, 또는 3-C12-OH-cat))를 첨가하면 도 2A 및 2BC에서 볼 수 있는 바와 같이 형질주입 효율성의 현저한 증가를 유발한다는 것을 알 수 있었다.
HepG2 세포가 Sol8 세포 대신에 형질주입된 것을 제외하고는 실험을 이전의 실시예에 기재된 바와 같이 수행하였다. 0.2 mL 부피의 HepG2 세포(10.000 세포)를 96 웰 조직 배양 플레이트에 접종하였다. 각 웰에서 배지를 제거한 후, 100 μL RPMI 1640 배지(1 % 페니실린 및 1 % 스트렙토마이신, 1 % L- 글루타민 포함)를 각 웰에 첨가하였다. 그 후, HepG2 세포를 폴리머-리피도이드 mRNA 복합체 및 각각의 대조군(3 개씩)의 100 μL의 형질주입 혼합물(3개씩)로 형질주입시키고, 세포를 37 ℃ 및 5 % CO2에서 90 분 동안 배양하였다. 배양 후, 150 μL 배지를 10 % 태아 송아지 혈청이 보충된 150 μL의 신선한 RPMI 1640 배지로 교환하였다. 형질 주입 24 시간 후, 각 웰의 상청액 10 μL를 추출하고 추가의 발광 분석을 위해 사용하였다.
실시예 4: 인간 PBMC에서 생체 외 사이토카인 자극
본 실시예에서, 본 발명의 나노입자에 의해 유발된 면역계의 고유 자극(intrinsic stimulation)을 평가하였다. 본 발명의 제형이 면역 자극에 미치는 영향을 평가하기 위해, 상이한 폴리머-지질 복합체화된 GpLuc mRNA로 처리한 후 인간 말초 혈액 단핵 세포(PBMC)에서 사이토카인 인터페론 알파(INFa) 및 종양 괴사 인자 알파(TNFa)의 방출을 측정하였다.
건강한 공여자의 말초 혈액으로부터 인간 말초 혈액 단핵 세포(PBMC)를 피콜 그라디언트(Ficoll gradient)를 사용하여 단리하고 이어서 1 x PBS (인산염 완충 식염수)로 세척하였다. 단리된 세포를 96 웰 마이크로타이터 플레이트(2 x 105 세포/웰)에 접종하였다. PBMC를 24 시간 동안 10 μL의 각각의 폴리머-리피도이드 복합체화된 mRNA 입자(실시예 1에 따라 제조) 또는 특정 대조군(예컨대, 벗겨진 RNA, 링거 락테이트 완충액, CpG2216, RNAdjuvant®)으로 X-VIVO 15 배지(Lonza)에서 3개 씩 배양시켰다. 인간 INFa를 검출하는 특정 항체를 이용하여 사이토카인 생산을 검출함으로써 PBMC 자극에 대한 면역 자극성 효과를 측정하였다.
ELISA 마이크로타이터 플레이트(Nunc Maxisorb)를 하룻밤 동안 (o/n) 특정 사이토카인 항체를 부가적으로 함유하는 결합 완충액(0.02 % NaN3, 15 mM Na2CO3, 15 mM NaHCO3, pH 9.7)으로 배양하였다. 세포를 1 % BSA(소 혈청 알부민)를 함유하는 1 x PBS로 블로킹시켰다. 세포 상청액을 첨가하고 37 ℃에서 4 시간 동안 배양하였다. 이어서, 마이크로타이터 플레이트를 0.05 % Tween-20을 포함하는 1 x PBS로 세척한 후 비오틴-표식 2 차 항체(BD Pharmingen, Heidelberg, Germany)로 배양하였다. 스트렙타비딘-결합된 호스래디시 퍼옥시다제(Horseradish Peroxidase)를 플레이트에 첨가하였다. 그 후, 플레이트를 다시 0.05 % Tween-20을 포함하는 1 x PBS로 세척하고, ABTS(2,2'-아지노-비스(3-에틸-벤즈티아졸린-6-설폰산)을 기질로서 첨가하였다. 사이토카인의 양은 Tecan(Crailsheim, Germany)의 Sunrise ELISA-Reader를 사용하여 재조합 사이토카인에 대한 표준 곡선(BD Pharmingen, Heidelberg, Germany)을 사용하여 405 nm에서의 흡광도(OD 405)를 측정하여 결정하였다. 병행하여, 세포 배양 상청액 중의 GpLuc 농도도 측정하였다.
결과에서, 시험된 조성물은 도 3에서 볼 수 있는 바와 같이 인간 PBMC에서 사이토카인의 분비를 자극하지 않았으며, 이는 본 발명의 나노입자가 CpG 올리고데옥시뉴클레오타이드와 같은 강력한 양성 대조군의 부존재 하에서 면역계를 자극시키는 매우 미미한 고유 능력을 갖는다는 것을 나타낸다.
실시예 5: 루시퍼라아제-mRNA의 망막아래 주입으로부터 24 시간 후 쥐 눈의 주사 레이저 검안경검사(SLO) 분석
mRNA 복합체를 PpLuc mRNA(SEQ ID NO: 19)와 양이온성 폴리머-지질 또는 리피도이드 용액(예컨대 MC3-cat 또는 3-C12-OH)을 상이한 전하 비율에서 혼합시켜 제조하였다. 링거 완충액으로 처리한 동물을 대조군으로 사용하였다. 동결건조된 제형을 링거 완충액으로 재수화 시켰다. 최종 mRNA 농도는 2.5 μg/μl였다. 2 μl의 2회 투약을 각각의 눈에 주입하였다. 그룹 당 4 개 눈(2 마리 쥐)를 처리하였다. 치료 24 시간 후, 비-침습성 주사 레이저 검안경검사(SLO)를 사용하여 망막을 영상화하였다(데이터 제시하지 않음). 루시페린 용액을 쥐의 꼬리 정맥에 주입하고, 2 분의 배양 시간 후에 약 10 분 동안 분석하였다. 이 시간 동안 쥐는 냄새를 맡기 위해 추가로 루시페린 용액을 받았다. 자세한 분석을 위해, 동물을 희생시키고 눈을 제거하고 동결시켰다. 이어서, 눈 샘플을 형질주입 수준에 대하여 분석하였다. 마지막으로 눈을 TissueLyser에서 기계적으로 파괴하고 용해시켰다. 각 샘플의 루시퍼라아제 활성을 조도계(luminometer)에서 분석하였다.
루시퍼라아제-mRNA (PpLuc mRNA)의 망막아래 주입의 결과는 도 4에 상대적 발광 단위(RLU)로 나타내었다.
실시예 6: 마우스의 근육 내 백신접종 후 체액성 및 세포성 면역 반응의 유도
DNA 및 mRNA 구조체의 제조
본 실시예에 대하여, A형 인플루엔자 바이러스(A/Netherlands/602/2009(H1N1))의 헤마글루티닌(hemagglutinin, HA) 단백질을 인코딩하는 DNA 서열을 준비하고 이후의 생체 외 전사 반응에 사용하였다. 각각의 mRNA 서열 및 백신접종 요법에 대한 추가 상세사항이 이하에서 제공된다.
A형 인플루엔자 바이러스(A/Netherlands/602/2009(H1N1))의 헤마글루티닌(HA) 단백질을 인코딩하는 G/C-풍부 mRNA 서열 R2564(SEQ ID NO 17):
GGGGCGCUGCCUACGGAGGUGGCAGCCAUCUCCUUCUCGGCAUCAAGCUUACCAUGAAGGCCAUCCUGGUGGUCCUCCUGUACACCUUCGCCACCGCGAACGCCGACACGCUGUGCAUCGGCUACCACGCCAACAACAGCACCGACACCGUGGACACCGUGCUCGAGAAGAACGUCACGGUGACCCACUCCGUGAACCUGCUGGAGGACAAGCACAACGGGAAGCUCUGCAAGCUGCGGGGCGUCGCCCCGCUGCACCUCGGGAAGUGCAACAUCGCCGGCUGGAUCCUGGGGAACCCGGAGUGCGAGAGCCUGUCCACCGCGAGCUCCUGGAGCUACAUCGUGGAGACCUCCAGCUCCGACAACGGCACGUGCUACCCCGGCGACUUCAUCGACUACGAGGAGCUCCGCGAGCAGCUGAGCUCCGUGAGCUCCUUCGAGCGGUUCGAGAUCUUCCCCAAGACCAGCUCCUGGCCCAACCACGACAGCAACAAGGGGGUCACCGCCGCCUGCCCGCACGCCGGCGCGAAGUCCUUCUACAAGAACCUGAUCUGGCUCGUGAAGAAGGGGAACAGCUACCCCAAGCUGUCCAAGAGCUACAUCAACGACAAGGGCAAGGAGGUGCUGGUCCUCUGGGGGAUCCACCACCCCAGCACCUCCGCCGACCAGCAGAGCCUGUACCAGAACGCCGACGCCUACGUGUUCGUGGGCUCCAGCCGCUACUCCAAGAAGUUCAAGCCCGAGAUCGCCAUCCGGCCGAAGGUCCGCGACCAGGAGGGCCGGAUGAACUACUACUGGACGCUGGUGGAGCCCGGGGACAAGAUCACCUUCGAGGCGACCGGCAACCUCGUGGUCCCCCGCUACGCCUUCGCCAUGGAGCGGAACGCCGGGAGCGGCAUCAUCAUCUCCGACACCCCCGUGCACGACUGCAACACGACCUGCCAGACCCCGAAGGGCGCCAUCAACACCAGCCUGCCCUUCCAGAACAUCCACCCCAUCACGAUCGGGAAGUGCCCCAAGUACGUGAAGUCCACCAAGCUGCGCCUCGCGACCGGCCUGCGGAACGUCCCGAGCAUCCAGUCCCGCGGGCUGUUCGGCGCCAUCGCCGGGUUCAUCGAGGGCGGCUGGACCGGGAUGGUGGACGGCUGGUACGGGUACCACCACCAGAACGAGCAGGGCAGCGGGUACGCCGCCGACCUCAAGUCCACGCAGAACGCGAUCGACGAGAUCACCAACAAGGUGAACAGCGUCAUCGAGAAGAUGAACACCCAGUUCACCGCCGUGGGCAAGGAGUUCAACCACCUGGAGAAGCGGAUCGAGAACCUGAACAAGAAGGUCGACGACGGCUUCCUCGACAUCUGGACGUACAACGCCGAGCUGCUGGUGCUCCUGGAGAACGAGCGCACCCUGGACUACCACGACUCCAACGUGAAGAACCUCUACGAGAAGGUCCGGAGCCAGCUGAAGAACAACGCCAAGGAGAUCGGGAACGGCUGCUUCGAGUUCUACCACAAGUGCGACAACACCUGCAUGGAGUCCGUGAAGAACGGGACCUACGACUACCCCAAGUACAGCGAGGAGGCCAAGCUGAACCGCGAGGAGAUCGACGGCGUGAAGCUCGAGUCCACGCGGAUCUACCAGAUCCUGGCGAUCUACAGCACCGUCGCCAGCUCCCUGGUGCUCGUGGUCAGCCUGGGGGCCAUCUCCUUCUGGAUGUGCAGCAACGGCUCCCUGCAGUGCCGCAUCUGCAUCUGACCACUAGUGCAUCACAUUUAAAAGCAUCUCAGCCUACCAUGAGAAUAAGAGAAAGAAAAUGAAGAUCAAUAGCUUAUUCAUCUCUUUUUCUUUUUCGUUGGUGUAAAGCCAACACCCUGUCUAAAAAACAUAAAUUUCUUUAAUCAUUUUGCCUCUUUUCUCUGUGCUUCAAUUAAUAAAAAAUGGAAAGAACCUAGAUCUAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAUGCAUCCCCCCCCCCCCCCCCCCCCCCCCCCCCCCCAAAGGCUCUUUUCAGAGCCACCAGAAUU
첫 번째 제조에 따라, 상기 mRNA를 인코딩하는 DNA 서열을 제조하였다. 구조체 R2564(SEQ ID NO: 17)를, 리보솜 단백질 32L로부터 유래된 5'-TOP-UTR을 도입하고, 안정화를 위한 GC-최대화된 서열, 이어서 알부민-3'-UTR로부터 유래된 안정화 서열, 64 개 아데노신 (폴리(A)-서열)의 스트레치, 30 개 시토신 (폴리(C)-서열)의 스트레치, 및 히스톤 줄기 루프를 도입하여 야생형 코딩 서열을 변성시켜 제조하였다.
백신 제조
'벗겨진' mRNA R2564를 링거 락테이트 용액(RiLa)에 투여하였다. PB83 및 3-C12-OH를 갖는 벗겨진 mRNA R2564의 동시-제형을 투여 직전에 모든 성분을 혼합함으로써 생성하였다.
면역화
Balb/c 마우스(그룹당 n = 8)를 0 일째에 근육 주사(좌측 M. tibialis)하고 10 μg HA-mRNA (R2564, SEQ ID NO: 17, '벗겨진' HA- mRNA) 단독 또는 PB83 N/P 0.7, 0.4 3-C12-OH와 함께 동시-제형된 10 μg HA-mRNA로 25 일째에 부양시켰다(boosted); 아래 표 1 참조. 여기서, μg으로 표시된 양은 핵산 분자 그 자체의 질량을 나타낸다.
모든 동물들은 25 일째에 부스트 주사(boost injection)를 받았다. 기능성 체액 반응의 유도는 혈액 샘플을 채취하고 인플루엔자 바이러스 감염에 대한 면역 보호의 대리 표지로서 일반적으로 사용되는 혈청 혈구응집 억제 (HI) 항체 역가를 결정함으로써 40 일째에 분석되었다(하기 표 2 참조). 1 : 40 이상의 HI 역가는 일반적으로 보호를 부여하는 것으로 간주된다. 링거 락테이트-완충액(RiLa) 처리된 마우스를 음성 대조군으로 사용하였다.
혈구응집 억제 검사
혈구응집 억제 (HI) 검사를 위해 마우스 혈청을 가열하여 비활성화시키고(56 ℃, 30 분), 카올린으로 배양하고, 닭 적혈구(CRBC)에 사전-흡착시켰다(Labor Dr. Merck & Kollegen, Ochsenhausen, Germany). HI 검사를 위해, 전처리된 혈청의 2배 희석액 50 μL를 비활성화된 A/California/5 7/2009 (NIBSC, Potters Bar, UK)의 4 개 혈구응집 단위(HAU)로 45 분 동안 배양하고, 50 μL 0.5 % CRBC를 첨가하였다.
결과:
도 5에서 볼 수 있듯이, PB83 N/P 0.7, 0.4 3-C12-OH-제형으로 백신접종된 모든 마우스는 HI-역가 =1:40을 나타냈다. 도 5는 또한 HA-mRNA (R2564) 및 PB83과 3-C12-OH에 기초한 폴리머-리피도이드를 포함하는 제형으로 근육 내 백신접종이 HA-mRNA (R2564) 단독과 비교하여 HA 단백질에 대한 더 높은 항체 역가를 유도한다는 것을 보여준다.
실시예 7: A549 세포에 대한 상이한 지질과 조합된 또 다른 폴리머의 형질주입 효율성
본 실시예는 A549 세포(인간 폐 암종 세포계)의 형질주입 효율성에 대한 상이한 지질과 결합한 PB83 이외의 폴리머의 효과 평가를 기술한다. 이를 위해, mRNA를 효율적으로 전달하기 위해 폴리양이온성 블록 폴리머 선브라이트 AS50-DT-A (NOF Corporation, Tokyo)를 사용하였다. 형질주입 효율성을 판독하기 위해, 가우시아 프린셉스 루시퍼라아제 GpLuc mRNA를 카고로서 사용하였다. 카고의 성공적인 형질주입은 루시퍼라아제 단백질의 번역과 루시퍼라아제 단백질의 세포 배양 상청액으로의 분비로 이어진다.
따라서, A549 세포를 세포 배양 배지에서 웰 당 75.000 세포의 밀도로 24-웰 플레이트에 접종하였다(Gibco (ThermoFisher) Ham's F-12K (Kaighn's) 배지, 10% 태아 소 혈청 (FBS), 1% L-글루타민, 1 % 페니실린/스트렙토마이신). A549 세포를 상이한 담체-지질 제형으로 그리고 GpLuc(SEQ ID NO:12; R2851)를 인코딩하는 mRNA로 하기에 기재된 바와 같이 두 번 형질주입시켰다. 음성 대조군으로서, PB83 담체가 없는 GpLuc를 인코딩하는 mRNA를 사용하였다. 루시퍼라아제 발현을 24 시간 후에 정량화하였다.
결과:
도 6은 GpLuc 단백질이 비-PB83 폴리머를 사용하여 mRNA 구조체 R2851로 형질전환된 A549 세포에서 발현되었고 첨가된 지질을 갖는 시험된 제형이 첨가된 지질이 없는 선브라이트 폴리머 대조군에 비해 더욱 효율적이라는 것을 보여준다. 이것은 양이온성 폴리머 시스템을 사용할 때 아주 적은 양의 지질과 mRNA의 조합이 형질주입 효율성을 증가시킬 수 있음을 보여준다.
실시예 7: BHK 세포에 대한 상이한 지질과 조합된 또 다른 폴리머의 형질주입 효율성
본 실시예는 아기 햄스터 신장(Baby Hamster Kidney, BHK) 세포 및 Sol8 (무스 근육 골격근(Mus musculus skeletal muscle)) 세포의 형질주입 효율성에 대한 상이한 지질과 결합한 PB83 이외의 폴리머의 효과 평가를 기술한다. 이를 위하여, 분자
- GH5R4H5GC-S-S-CGH5R4H5G ('삽입-다이머'; S-S는 단위체가 시스테인 S-S 결합을 통해 공유 결합되어 있음을 나타냄; Intavis Bioanalytical Instruments AG, Germany/Cologne);
- K(EEEKK)3SGGGGH5R4H5GC-S-S-CGH5R4H5GGGGS(KKEEE)3K ('(KKEEE)3K-다이머'; S-S는 단위체가 시스테인 S-S 결합을 통해 공유 결합되어 있음을 나타냄; Intavis Bioanalytical Instruments AG, Germany/Cologne);
- 폴리양이온성 선형 다당류 키토산 95/50 ('키토산', CAS 9012-76-4; Intavis Bioanalytical Instruments AG, Germany/Cologne);
- (R12C)-(CR12C)-(R12C) ('트리머'; R12C 및 CR12C 단위체는 시스테인 S-S 결합을 통해 공유 결합되어 있음; Intavis Bioanalytical Instruments AG, Germany/Cologne);
- R12C-PEG5000 ('R12C-PEG'); 및
- (R12CW)2 (2 개의 R12CW-단위체는 시스테인 S-S 결합을 통해 공유 결합되어 있음)
를 mRNA의 전달을 위해 사용하였다. 형질주입 효율성을 판독하기 위해, 가우시아 프린셉스 루시퍼라아제 GpLuc mRNA를 카고로서 사용하였다. 카고의 성공적인 형질주입은 루시퍼라아제 단백질의 번역과 루시퍼라아제 단백질의 세포 배양 상청액으로의 분비로 이어진다.
따라서, BHK 세포의 경우, 세포를 세포 배양 배지에서 웰 당 10.000 세포의 밀도로 96-웰-플레이트에 접종하였다(RPMI, 10% FCS, 1% L-글루타민, 1% 페니실린/스트렙토마이신). BHK 세포를 상이한 담체-지질 제형으로 그리고 GpLuc(SEQ ID NO:12; R2851)를 인코딩하는 mRNA로 하기에 기재된 바와 같이 중복하여 형질주입시켰다. 음성 대조군으로서, PB83 담체가 없는 GpLuc를 인코딩하는 mRNA를 사용하였다. 루시퍼라아제 발현을 형질주입하고 24 시간 후에 정량화하였다.
따라서, Sol8 (분화된) 세포의 경우, 세포를 형질주입 7일 이전에 세포 배양 배지에서 웰 당 10.000 세포의 밀도로 96-웰-플레이트에 접종하였다(DMEM, 1% 페니실린/스트렙토마이신, 1 % L-글루타민, 1% FCS). 접종 후 1일 째 배지를 제거하고 1 % FCS를 함유하는 DMEM을 세포에 첨가하였다. 접종 3일 후, 세포의 배지를 교체하였다(DMEM, 1% FCS). 8일 째, Sol8 세포를 상이한 담체-지질 제형으로 그리고 GpLuc(SEQ ID NO:12; R2851)를 인코딩하는 mRNA로 하기에 기재된 바와 같이 세 번 형질주입시켰다. 음성 대조군으로서, CVCM/PB83 담체가 없는 GpLuc를 인코딩하는 mRNA를 사용하였다. 루시퍼라아제 발현을 형질주입하고 24 시간 후에 정량화하였다.
따라서, HeLa 세포의 경우, 세포를 세포 배양 배지에서 웰 당 10.000 세포의 밀도로 96-웰-플레이트에 접종하였다(RPMI, 10% FCS, 1% L-글루타민, 1% 페니실린/스트렙토마이신). HeLa 세포를 상이한 담체-지질 제형으로 그리고 PpLuc (SEQ ID NO:19; R2244; 아래 표 참조)를 인코딩하는 2μg mRNA로 하기에 기재된 바와 같이 두 번 형질주입시켰다. 음성 대조군으로서, PB83 담체가 없는 PpLuc를 인코딩하는 mRNA를 사용하였다. 루시퍼라아제 발현을 형질주입하고 24 시간 후에 정량화하였다.
결과:
도 7A 및 7B는 GpLuc 단백질이 비-PB83 폴리머를 사용하여 mRNA 구조체 R2851로 형질전환된 BHK 및 분화된 Sol8 세포에서 발현되었고 첨가된 지질을 갖는 시험된 제형이 첨가된 지질이 없는 각각의 폴리머 대조군에 비해 더욱 효율적이라는 것을 보여준다. 도 7C는 PpLuc 단백질이 HeLa 세포에서 발현되었음을 보여준다. 이것은 양이온성 폴리머 시스템을 사용할 때 아주 적은 양의 지질과 mRNA의 조합이 형질주입 효율성을 증가시킬 수 있음을 보여준다.
실시예 8: 3-C12-아마이드 지질과 조합된 또 다른 폴리머의 형질주입 효율성
본 실시예는 FCS를 포함하지 않는 HepG2 세포에서 형질주입 효율성에 대한 상이한 폴리머-지질 제형의 효과 평가를 기술한다. 형질주입 효율성을 판독하기 위해, 가우시아 프린셉스 루시퍼라아제 GpLuc mRNA를 카고로서 사용하였다. 카고의 성공적인 형질주입은 루시퍼라아제 단백질의 번역과 루시퍼라아제 단백질의 세포 배양 상청액으로의 분비로 이어진다.
따라서, HepG2 세포를 세포 배양 배지에서 웰 당 10.000 세포의 밀도로 24-웰-플레이트에 접종하였다(RPMI 1640 w/ 25mM HEPES 500ml, 10% FCS, 1% L-글루타민, 1% 페니실린/스트렙토마이신; Lonza Group AG BE12-115F / 6MB205; Basel/Switzerland). HepG2 세포를 상이한 담체-지질 제형으로 그리고 0.7의 N/P 비율을 갖는 GpLuc(SEQ ID NO:12; R2851)를 인코딩하는 mRNA로 하기에 기재된 바와 같이 두 번 형질주입시켰다. 음성 대조군으로서, CVCM/PB83 담체가 없는 GpLuc를 인코딩하는 mRNA를 사용하였다. 루시퍼라아제 발현을 24 시간 후에 정량화하였다.
3-C12-아마이드 (화학식 X)
3-C12-아마이드 모노메틸-유도체 (화학식 Xa)
3-C12-아마이드 디-메틸-유도체 (화학식 Xb)
결과:
도 8은 GpLuc 단백질이 mRNA 구조체 R2851로 형질전환된 Hep G2 세포에서 발현되었고 첨가된 지질을 갖는 시험된 제형이 첨가된 지질이 없는 대조군에 비해 매우 효율적이라는 것을 보여준다. 이것은 아주 적은 양의 지질과 mRNA의 조합이 형질주입 효율성을 증가시킬 수 있음을 보여준다.
실시예 9: 유리체내 전달 동안 상이한 지질과 조합된 또 다른 폴리머의 형질주입 효율성
본 실시예는 안구 전달을 수행할 때 형질주입 효율성에 대한 상이한 폴리머-지질 제형의 효과 평가를 기술한다. 형질주입 효율성을 판독하기 위해, 포티누스 피랄리스(Photinus pyralis) 루시퍼라아제 Ppluc mRNA를 카고로서 사용하였다. 카고의 성공적인 형질주입은 루시퍼라아제 단백질의 번역과 루시퍼라아제 단백질의 세포 배양 상청액으로의 분비로 이어진다.
mRNA 복합체를 PpLuc mRNA (SEQ ID NO:19 R2244)와 양이온성 폴리머 - 지질 용액을 동일한 전하 비율에서 혼합하여 제조하였다. 제형을 링거 완충액에서 다음 반응식에 따라 제조하여 2 μg/μl의 최종 mRNA 농도를 얻었다.
제형 1 (PpLuc mRNA R2244)
20 ml의 mRNA (5 g/l) + 25 ml 물 + 5 ml의 10 x RiLa
는 50 ml 중의 100 mg의 mRNA를 산출하며 이는 2 mg/ml와 동등함
제형 2 (PB83 N/P 0.7, 0.4 3-C12-OH 중의 PpLuc mRNA R2244)
20 ml CVCM (PB83, 10 g/l) + 0.4 ml 3-C12-OH (100 μmol/ml) + 4.5 ml 물 + 5 ml의 10 x RiLa
를 20 ml의 mRNA (R2244 - 루시퍼라아제; 5 g/l)에 첨가하여
50 ml 중의 100 mg의 mRNA를 산출하며 이는 2 mg/ml와 동등함
5 μl를 각 눈에 주사하였다(유리체내). 그룹 당 4 개 눈을 처리하였다. 링거 완충액에서 제조된 비-제형화된 mRNA로 처리한 동물을 대조군으로 사용하였다. 처리하고 24 시간 후에, 동물을 희생시키고 눈을 제거하고 동결시켰다. 이어서, 눈 샘플을 형질주입 수준에 대하여 분석하였다. 마지막으로 눈을 TissueLyser에서 기계적으로 파괴하고 용해시켰다. 각 샘플의 루시퍼라아제 활성을 조도계(luminometer)에서 분석하였다. 루시퍼라아제 활성의 결과를 상대적 발광 단위(RLU)로 표현한다.
결과:
도 9는 PpLuc 단백질이 유리체내 주사시에 발현되었고 첨가된 지질을 갖는 시험된 제형이 첨가된 지질이 없는 대조군에 비해 매우 효율적이라는 것을 보여준다. 이것은 아주 적은 양의 지질과 mRNA의 조합이 유리체내 투여에서 형질주입 효율성을 증가시킬 수 있음을 보여준다.
실시예 10: A549 세포에 대한 상이한 폴리머-지질 조합의 형질주입 효율성
본 실시예는 A549 세포 (인간 폐 암종 세포계)에서 형질주입 효율성에 대한 상이한 폴리머-지질 제형의 효과 평가를 기술한다. 형질주입 효율성을 판독하기 위해, 가우시아 프린셉스 루시퍼라아제 GpLuc mRNA를 카고로서 사용하였다. 카고의 성공적인 형질주입은 루시퍼라아제 단백질의 번역과 루시퍼라아제 단백질의 세포 배양 상청액으로의 분비로 이어진다.
따라서, A549 세포를 세포 배양 배지에서 웰 당 75.000 세포의 밀도로 24-웰 플레이트에 접종하였다(Gibco (ThermoFisher) Ham's F-12K (Kaighn's) 배지, 10% 태아 소 혈청 (FBS), 1% L-글루타민, 1 % 페니실린/스트렙토마이신). A549 세포를 상이한 담체-지질 제형으로 그리고 GpLuc(SEQ ID NO:12; R2851)를 인코딩하는 mRNA로 하기에 기재된 바와 같이 두 번 형질주입시켰다. 음성 대조군으로서, CVCM/PB83 담체가 없는 GpLuc를 인코딩하는 mRNA를 사용하였다. 루시퍼라아제 발현을 24 시간 후에 정량화하였다.
본 작업 실시예에서, 양이온성 지질 DDAB(디메틸디옥타데실암모늄; CAS 번호 3700-67-2; Avanti Polar Lipids, Alabaster, USA)를 사용하였다:
결과:
도 10은 GpLuc 단백질이 mRNA 구조체 R2851로 형질전환된 A549 세포에서 발현되었고 첨가된 지질을 갖는 시험된 제형이 첨가된 지질이 없는 대조군에 비해 매우 효율적이라는 것을 보여준다. 이것은 아주 적은 양의 지질과 mRNA의 조합이 형질주입 효율성을 증가시킬 수 있음을 보여준다.
실시예 11: A549 세포에 대한 상이한 폴리머-PEG-지질 조합의 형질주입 효율성
본 실시예는 A549 세포 (인간 폐 암종 세포계)에서 형질주입 효율성에 대한 상이한 폴리머-지질 제형의 효과 평가를 기술한다. 형질주입 효율성을 판독하기 위해, 가우시아 프린셉스 루시퍼라아제 GpLuc mRNA를 카고로서 사용하였다. 카고의 성공적인 형질주입은 루시퍼라아제 단백질의 번역과 루시퍼라아제 단백질의 세포 배양 상청액으로의 분비로 이어진다.
따라서, A549 세포를 세포 배양 배지에서 웰 당 75.000 세포의 밀도로 24-웰 플레이트에 접종하였다(Gibco (ThermoFisher) Ham's F-12K (Kaighn's) 배지, 10% 태아 소 혈청 (FBS), 1% L-글루타민, 1 % 페니실린/스트렙토마이신). A549 세포를 상이한 담체-지질 제형으로 그리고 GpLuc(SEQ ID NO:12; R2851)를 인코딩하는 mRNA로 하기에 기재된 바와 같이 두 번 형질주입시켰다. 음성 대조군으로서, CVCM/PB83 담체가 없는 GpLuc를 인코딩하는 mRNA를 사용하였다. 루시퍼라아제 발현을 24 시간 후에 정량화하였다.
본 작업 실시예에서, (R12CW)2를 담체 폴리머로 사용하고(2개의 R12CW-단위체가 시스테인 S-S 결합을 통해 공유 결합됨) 그리고 페길화된(pegylated) 3-C12-OH 지질(ChiroBlock, Bitterfeld-Wolfen, Germany)을 사용하였다:
두 번째 부분에서, (R12CW)2를 담체 폴리머로 사용하고(2개의 R12CW-단위체가 시스테인 S-S 결합을 통해 공유 결합됨) 그리고
(ChiroBlock, Bitterfeld-Wolfen, Germany)를 사용하였다:
결과:
도 11A 및 11B은 GpLuc 단백질이 mRNA 구조체 R2851로 형질전환된 A549 세포에서 발현되었고 첨가된 페길화된 지질을 갖는 시험된 제형이 첨가된 지질이 없는 대조군에 비해 매우 효율적이라는 것을 보여준다. 이것은 아주 적은 양의 페길화된 지질과 mRNA의 조합이 형질주입 효율성을 증가시킬 수 있음을 보여준다.
SEQUENCE LISTING
<110> CureVac AG
<120> HYBRID CARRIERS FOR NUCLEIC ACID CARGO
<130> CRV16P02PC2 - CV146 - P231
<160> 19
<170> PatentIn version 3.5
<210> 1
<211> 60
<212> RNA
<213> Artificial Sequence
<220>
<223> formula_V
<400> 1
uagcgaagcu cuuggaccua gguuuuuuuu uuuuuuuggg ugcguuccua gaaguacacg 60
<210> 2
<211> 120
<212> RNA
<213> Artificial Sequence
<220>
<223> formula_V
<400> 2
uagcgaagcu cuuggaccua gguuuuuuuu uuuuuuuggg ugcguuccua gaaguacacg 60
aucgcuucga gaaccuggau ccaaaaaaaa aaaaaaaccc acgcaaggau cuucaugugc 120
<210> 3
<211> 229
<212> RNA
<213> Artificial Sequence
<220>
<223> formula_V
<400> 3
gggagaaagc ucaagcuugg agcaaugccc gcacauugag gaaaccgagu ugcauaucuc 60
agaguauugg cccccgugua gguuauucuu gacagacagu ggagcuuauu cacucccagg 120
auccgagucg cauacuacgg uacuggugac agaccuaggu cgucaguuga ccaguccgcc 180
acuagacgug aguccgucaa agcaguuaga uguuacacuc uauuagauc 229
<210> 4
<211> 547
<212> RNA
<213> Artificial Sequence
<220>
<223> formula_V
<400> 4
gggagaaagc ucaagcuugg agcaaugccc gcacauugag gaaaccgagu ugcauaucuc 60
agaguauugg cccccgugua gguuauucuu gacagacagu ggagcuuauu cacucccagg 120
auccgagucg cauacuacgg uacuggugac agaccuaggu cgucaguuga ccaguccgcc 180
acuagacgug aguccgucaa agcaguuaga uguuacacuc uauuagaucu cggauuacag 240
cuggaaggag caggaguagu guucuugcuc uaaguaccga gugugcccaa uacccgauca 300
gcuuauuaac gaacggcucc uccucuuaga cugcagcgua agugcggaau cuggggauca 360
aauuacugac ugccuggauu acccucggac auauaaccuu guagcacgcu guugcuguau 420
aggugaccaa cgcccacucg aguagaccag cucucuuagu ccggacaaug auaggaggcg 480
cggucaaucu acuucuggcu aguuaagaau aggcugcacc gaccucuaua aguagcgugu 540
ccucuag 547
<210> 5
<211> 1083
<212> RNA
<213> Artificial Sequence
<220>
<223> formula_V
<400> 5
gggagaaagc ucaagcuugg agcaaugccc gcacauugag gaaaccgagu ugcauaucuc 60
agaguauugg cccccgugua gguuauucuu gacagacagu ggagcuuauu cacucccagg 120
auccgagucg cauacuacgg uacuggugac agaccuaggu cgucaguuga ccaguccgcc 180
acuagacgug aguccgucaa agcaguuaga uguuacacuc uauuagaucu cggauuacag 240
cuggaaggag caggaguagu guucuugcuc uaaguaccga gugugcccaa uacccgauca 300
gcuuauuaac gaacggcucc uccucuuaga cugcagcgua agugcggaau cuggggauca 360
aauuacugac ugccuggauu acccucggac auauaaccuu guagcacgcu guugcuguau 420
aggugaccaa cgcccacucg aguagaccag cucucuuagu ccggacaaug auaggaggcg 480
cggucaaucu acuucuggcu aguuaagaau aggcugcacc gaccucuaua aguagcgugu 540
ccucuagagc uacgcagguu cgcaauaaaa gcguugauua gugugcauag aacagaccuc 600
uuauucggug aaacgccaga augcuaaauu ccaauaacuc uucccaaaac gcguacggcc 660
gaagacgcgc gcuuaucuug uguacguucu cgcacaugga agaaucagcg ggcauggugg 720
uagggcaaua ggggagcugg guagcagcga aaaagggccc cugcgcacgu agcuucgcug 780
uucgucugaa acaacccggc auccguugua gcgaucccgu uaucaguguu auucuugugc 840
gcacuaagau ucauggugua gucgacaaua acagcgucuu ggcagauucu ggucacgugc 900
ccuaugcccg ggcuugugcc ucucaggugc acagcgauac uuaaagccuu caagguacuc 960
gacgugggua ccgauucgug acacuuccua agauuauucc acuguguuag ccccgcaccg 1020
ccgaccuaaa cugguccaau guauacgcau ucgcugagcg gaucgauaau aaaagcuuga 1080
auu 1083
<210> 6
<211> 229
<212> RNA
<213> Artificial Sequence
<220>
<223> formula_V
<400> 6
gggagaaagc ucaagcuuau ccaaguaggc uggucaccug uacaacguag ccgguauuuu 60
uuuuuuuuuu uuuuuuuuga ccgucucaag guccaaguua gucugccuau aaaggugcgg 120
auccacagcu gaugaaagac uugugcggua cgguuaaucu ccccuuuuuu uuuuuuuuuu 180
uuuuuaguaa augcgucuac ugaauccagc gaugaugcug gcccagauc 229
<210> 7
<211> 547
<212> RNA
<213> Artificial Sequence
<220>
<223> formula_V
<400> 7
gggagaaagc ucaagcuuau ccaaguaggc uggucaccug uacaacguag ccgguauuuu 60
uuuuuuuuuu uuuuuuuuga ccgucucaag guccaaguua gucugccuau aaaggugcgg 120
auccacagcu gaugaaagac uugugcggua cgguuaaucu ccccuuuuuu uuuuuuuuuu 180
uuuuuaguaa augcgucuac ugaauccagc gaugaugcug gcccagaucu ucgaccacaa 240
gugcauauag uagucaucga gggucgccuu uuuuuuuuuu uuuuuuuuuu uggcccaguu 300
cugagacuuc gcuagagacu acaguuacag cugcaguagu aaccacugcg gcuauugcag 360
gaaaucccgu ucagguuuuu uuuuuuuuuu uuuuuuccgc ucacuaugau uaagaaccag 420
guggaguguc acugcucucg aggucucacg agagcgcucg auacaguccu uggaagaauc 480
uuuuuuuuuu uuuuuuuuuu uugugcgacg aucacagaga acuucuauuc augcaggucu 540
gcucuag 547
<210> 8
<211> 1083
<212> RNA
<213> Artificial Sequence
<220>
<223> formula_V
<400> 8
gggagaaagc ucaagcuuau ccaaguaggc uggucaccug uacaacguag ccgguauuuu 60
uuuuuuuuuu uuuuuuuuga ccgucucaag guccaaguua gucugccuau aaaggugcgg 120
auccacagcu gaugaaagac uugugcggua cgguuaaucu ccccuuuuuu uuuuuuuuuu 180
uuuuuaguaa augcgucuac ugaauccagc gaugaugcug gcccagaucu ucgaccacaa 240
gugcauauag uagucaucga gggucgccuu uuuuuuuuuu uuuuuuuuuu uggcccaguu 300
cugagacuuc gcuagagacu acaguuacag cugcaguagu aaccacugcg gcuauugcag 360
gaaaucccgu ucagguuuuu uuuuuuuuuu uuuuuuccgc ucacuaugau uaagaaccag 420
guggaguguc acugcucucg aggucucacg agagcgcucg auacaguccu uggaagaauc 480
uuuuuuuuuu uuuuuuuuuu uugugcgacg aucacagaga acuucuauuc augcaggucu 540
gcucuagaac gaacugaccu gacgccugaa cuuaugagcg ugcguauuuu uuuuuuuuuu 600
uuuuuuuuuc cucccaacaa augucgauca auagcugggc uguuggagac gcgucagcaa 660
augccguggc uccauaggac guguagacuu cuauuuuuuu uuuuuuuuuu uuuucccggg 720
accacaaaua auauucuugc uugguugggc gcaagggccc cguaucaggu cauaaacggg 780
uacauguugc acaggcuccu uuuuuuuuuu uuuuuuuuuu uucgcugagu uauuccgguc 840
ucaaaagacg gcagacguca gucgacaaca cggucuaaag cagugcuaca aucugccgug 900
uucguguuuu uuuuuuuuuu uuuuuuguga accuacacgg cgugcacugu aguucgcaau 960
ucauagggua ccggcucaga guuaugccuu gguugaaaac ugcccagcau acuuuuuuuu 1020
uuuuuuuuuu uucauauucc caugcuaagc aagggaugcc gcgagucaug uuaagcuuga 1080
auu 1083
<210> 9
<211> 59
<212> RNA
<213> Artificial Sequence
<220>
<223> formula_VI
<400> 9
uagcgaagcu cuuggaccua ccuuuuuuuu uuuuuucccu gcguuccuag aaguacacg 59
<210> 10
<211> 120
<212> RNA
<213> Artificial Sequence
<220>
<223> formula_VI
<400> 10
uagcgaagcu cuuggaccua ccuuuuuuuu uuuuuuuccc ugcguuccua gaaguacacg 60
aucgcuucga gaaccuggau ggaaaaaaaa aaaaaaaggg acgcaaggau cuucaugugc 120
<210> 11
<211> 185
<212> PRT
<213> Artificial Sequence
<220>
<223> GpLuc amino acid sequence
<400> 11
Met Gly Val Lys Val Leu Phe Ala Leu Ile Cys Ile Ala Val Ala Glu
1 5 10 15
Ala Lys Pro Thr Glu Asn Asn Glu Asp Phe Asn Ile Val Ala Val Ala
20 25 30
Ser Asn Phe Ala Thr Thr Asp Leu Asp Ala Asp Arg Gly Lys Leu Pro
35 40 45
Gly Lys Lys Leu Pro Leu Glu Val Leu Lys Glu Met Glu Ala Asn Ala
50 55 60
Arg Lys Ala Gly Cys Thr Arg Gly Cys Leu Ile Cys Leu Ser His Ile
65 70 75 80
Lys Cys Thr Pro Lys Met Lys Lys Phe Ile Pro Gly Arg Cys His Thr
85 90 95
Tyr Glu Gly Asp Lys Glu Ser Ala Gln Gly Gly Ile Gly Glu Ala Ile
100 105 110
Val Asp Ile Pro Glu Ile Pro Gly Phe Lys Asp Leu Glu Pro Met Glu
115 120 125
Gln Phe Ile Ala Gln Val Asp Leu Cys Val Asp Cys Thr Thr Gly Cys
130 135 140
Leu Lys Gly Leu Ala Asn Val Gln Cys Ser Asp Leu Leu Lys Lys Trp
145 150 155 160
Leu Pro Gln Arg Cys Ala Thr Phe Ala Ser Lys Ile Gln Gly Gln Val
165 170 175
Asp Lys Ile Lys Gly Ala Gly Gly Asp
180 185
<210> 12
<211> 940
<212> RNA
<213> Artificial Sequence
<220>
<223> GpLuc mRNA
<400> 12
ggggcgcugc cuacggaggu ggcagccauc uccuucucgg caucaagcuu accaugggcg 60
ugaagguccu guucgcccuc aucugcaucg ccguggcgga ggccaagccc accgagaaca 120
acgaggacuu caacaucgug gccgucgcca gcaacuucgc caccacggac cuggacgcgg 180
accgggggaa gcugccgggc aagaagcucc cccuggaggu gcugaaggag auggaggcca 240
acgcccgcaa ggccgggugc acccggggcu gccucaucug ccugucccac aucaagugca 300
cccccaagau gaagaaguuc auccccgggc gcugccacac cuacgagggc gacaaggaga 360
gcgcgcaggg cgggaucggc gaggccaucg uggacauccc ggagaucccc ggguucaagg 420
accuggagcc cauggagcag uucaucgccc aggucgaccu cugcguggac ugcacgaccg 480
gcugccugaa ggggcuggcc aacgugcagu gcuccgaccu ccugaagaag uggcugcccc 540
agcggugcgc caccuucgcg agcaagaucc agggccaggu cgacaagauc aagggcgccg 600
ggggcgacug aggacuagug caucacauuu aaaagcaucu cagccuacca ugagaauaag 660
agaaagaaaa ugaagaucaa uagcuuauuc aucucuuuuu cuuuuucguu gguguaaagc 720
caacacccug ucuaaaaaac auaaauuucu uuaaucauuu ugccucuuuu cucugugcuu 780
caauuaauaa aaaauggaaa gaaccuagau cuaaaaaaaa aaaaaaaaaa aaaaaaaaaa 840
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaugca uccccccccc cccccccccc 900
cccccccccc ccaaaggcuc uuuucagagc caccagaauu 940
<210> 13
<211> 42
<212> DNA
<213> Artificial Sequence
<220>
<223> 5'-UTR of human ribosomal protein Large 32 lacking the 5'
terminal oligopyrimidine tract
<400> 13
ggcgctgcct acggaggtgg cagccatctc cttctcggca tc 42
<210> 14
<211> 75
<212> DNA
<213> Artificial Sequence
<220>
<223> 5'-UTR of ATP5A1 lacking the 5' terminal oligopyrimidine tract
<400> 14
gcggctcggc cattttgtcc cagtcagtcc ggaggctgcg gctgcagaag taccgcctgc 60
ggagtaactg caaag 75
<210> 15
<211> 24
<212> DNA
<213> Artificial Sequence
<220>
<223> histone stem-loop sequence
<400> 15
caaaggctct tttcagagcc acca 24
<210> 16
<211> 24
<212> RNA
<213> Artificial Sequence
<220>
<223> histone stem-loop sequence
<400> 16
caaaggcucu uuucagagcc acca 24
<210> 17
<211> 2083
<212> RNA
<213> Artificial Sequence
<220>
<223> HA-R2564 mRNA
<400> 17
ggggcgcugc cuacggaggu ggcagccauc uccuucucgg caucaagcuu accaugaagg 60
ccauccuggu gguccuccug uacaccuucg ccaccgcgaa cgccgacacg cugugcaucg 120
gcuaccacgc caacaacagc accgacaccg uggacaccgu gcucgagaag aacgucacgg 180
ugacccacuc cgugaaccug cuggaggaca agcacaacgg gaagcucugc aagcugcggg 240
gcgucgcccc gcugcaccuc gggaagugca acaucgccgg cuggauccug gggaacccgg 300
agugcgagag ccuguccacc gcgagcuccu ggagcuacau cguggagacc uccagcuccg 360
acaacggcac gugcuacccc ggcgacuuca ucgacuacga ggagcuccgc gagcagcuga 420
gcuccgugag cuccuucgag cgguucgaga ucuuccccaa gaccagcucc uggcccaacc 480
acgacagcaa caaggggguc accgccgccu gcccgcacgc cggcgcgaag uccuucuaca 540
agaaccugau cuggcucgug aagaagggga acagcuaccc caagcugucc aagagcuaca 600
ucaacgacaa gggcaaggag gugcuggucc ucugggggau ccaccacccc agcaccuccg 660
ccgaccagca gagccuguac cagaacgccg acgccuacgu guucgugggc uccagccgcu 720
acuccaagaa guucaagccc gagaucgcca uccggccgaa gguccgcgac caggagggcc 780
ggaugaacua cuacuggacg cugguggagc ccggggacaa gaucaccuuc gaggcgaccg 840
gcaaccucgu ggucccccgc uacgccuucg ccauggagcg gaacgccggg agcggcauca 900
ucaucuccga cacccccgug cacgacugca acacgaccug ccagaccccg aagggcgcca 960
ucaacaccag ccugcccuuc cagaacaucc accccaucac gaucgggaag ugccccaagu 1020
acgugaaguc caccaagcug cgccucgcga ccggccugcg gaacgucccg agcauccagu 1080
cccgcgggcu guucggcgcc aucgccgggu ucaucgaggg cggcuggacc gggauggugg 1140
acggcuggua cggguaccac caccagaacg agcagggcag cggguacgcc gccgaccuca 1200
aguccacgca gaacgcgauc gacgagauca ccaacaaggu gaacagcguc aucgagaaga 1260
ugaacaccca guucaccgcc gugggcaagg aguucaacca ccuggagaag cggaucgaga 1320
accugaacaa gaaggucgac gacggcuucc ucgacaucug gacguacaac gccgagcugc 1380
uggugcuccu ggagaacgag cgcacccugg acuaccacga cuccaacgug aagaaccucu 1440
acgagaaggu ccggagccag cugaagaaca acgccaagga gaucgggaac ggcugcuucg 1500
aguucuacca caagugcgac aacaccugca uggaguccgu gaagaacggg accuacgacu 1560
accccaagua cagcgaggag gccaagcuga accgcgagga gaucgacggc gugaagcucg 1620
aguccacgcg gaucuaccag auccuggcga ucuacagcac cgucgccagc ucccuggugc 1680
ucguggucag ccugggggcc aucuccuucu ggaugugcag caacggcucc cugcagugcc 1740
gcaucugcau cugaccacua gugcaucaca uuuaaaagca ucucagccua ccaugagaau 1800
aagagaaaga aaaugaagau caauagcuua uucaucucuu uuucuuuuuc guugguguaa 1860
agccaacacc cugucuaaaa aacauaaauu ucuuuaauca uuuugccucu uuucucugug 1920
cuucaauuaa uaaaaaaugg aaagaaccua gaucuaaaaa aaaaaaaaaa aaaaaaaaaa 1980
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaau gcaucccccc cccccccccc 2040
cccccccccc cccccaaagg cucuuuucag agccaccaga auu 2083
<210> 18
<211> 550
<212> PRT
<213> Artificial Sequence
<220>
<223> Ppluc amino acid sequence
<400> 18
Met Glu Asp Ala Lys Asn Ile Lys Lys Gly Pro Ala Pro Phe Tyr Pro
1 5 10 15
Leu Glu Asp Gly Thr Ala Gly Glu Gln Leu His Lys Ala Met Lys Arg
20 25 30
Tyr Ala Leu Val Pro Gly Thr Ile Ala Phe Thr Asp Ala His Ile Glu
35 40 45
Val Asp Ile Thr Tyr Ala Glu Tyr Phe Glu Met Ser Val Arg Leu Ala
50 55 60
Glu Ala Met Lys Arg Tyr Gly Leu Asn Thr Asn His Arg Ile Val Val
65 70 75 80
Cys Ser Glu Asn Ser Leu Gln Phe Phe Met Pro Val Leu Gly Ala Leu
85 90 95
Phe Ile Gly Val Ala Val Ala Pro Ala Asn Asp Ile Tyr Asn Glu Arg
100 105 110
Glu Leu Leu Asn Ser Met Gly Ile Ser Gln Pro Thr Val Val Phe Val
115 120 125
Ser Lys Lys Gly Leu Gln Lys Ile Leu Asn Val Gln Lys Lys Leu Pro
130 135 140
Ile Ile Gln Lys Ile Ile Ile Met Asp Ser Lys Thr Asp Tyr Gln Gly
145 150 155 160
Phe Gln Ser Met Tyr Thr Phe Val Thr Ser His Leu Pro Pro Gly Phe
165 170 175
Asn Glu Tyr Asp Phe Val Pro Glu Ser Phe Asp Arg Asp Lys Thr Ile
180 185 190
Ala Leu Ile Met Asn Ser Ser Gly Ser Thr Gly Leu Pro Lys Gly Val
195 200 205
Ala Leu Pro His Arg Thr Ala Cys Val Arg Phe Ser His Ala Arg Asp
210 215 220
Pro Ile Phe Gly Asn Gln Ile Ile Pro Asp Thr Ala Ile Leu Ser Val
225 230 235 240
Val Pro Phe His His Gly Phe Gly Met Phe Thr Thr Leu Gly Tyr Leu
245 250 255
Ile Cys Gly Phe Arg Val Val Leu Met Tyr Arg Phe Glu Glu Glu Leu
260 265 270
Phe Leu Arg Ser Leu Gln Asp Tyr Lys Ile Gln Ser Ala Leu Leu Val
275 280 285
Pro Thr Leu Phe Ser Phe Phe Ala Lys Ser Thr Leu Ile Asp Lys Tyr
290 295 300
Asp Leu Ser Asn Leu His Glu Ile Ala Ser Gly Gly Ala Pro Leu Ser
305 310 315 320
Lys Glu Val Gly Glu Ala Val Ala Lys Arg Phe His Leu Pro Gly Ile
325 330 335
Arg Gln Gly Tyr Gly Leu Thr Glu Thr Thr Ser Ala Ile Leu Ile Thr
340 345 350
Pro Glu Gly Asp Asp Lys Pro Gly Ala Val Gly Lys Val Val Pro Phe
355 360 365
Phe Glu Ala Lys Val Val Asp Leu Asp Thr Gly Lys Thr Leu Gly Val
370 375 380
Asn Gln Arg Gly Glu Leu Cys Val Arg Gly Pro Met Ile Met Ser Gly
385 390 395 400
Tyr Val Asn Asn Pro Glu Ala Thr Asn Ala Leu Ile Asp Lys Asp Gly
405 410 415
Trp Leu His Ser Gly Asp Ile Ala Tyr Trp Asp Glu Asp Glu His Phe
420 425 430
Phe Ile Val Asp Arg Leu Lys Ser Leu Ile Lys Tyr Lys Gly Tyr Gln
435 440 445
Val Ala Pro Ala Glu Leu Glu Ser Ile Leu Leu Gln His Pro Asn Ile
450 455 460
Phe Asp Ala Gly Val Ala Gly Leu Pro Asp Asp Asp Ala Gly Glu Leu
465 470 475 480
Pro Ala Ala Val Val Val Leu Glu His Gly Lys Thr Met Thr Glu Lys
485 490 495
Glu Ile Val Asp Tyr Val Ala Ser Gln Val Thr Thr Ala Lys Lys Leu
500 505 510
Arg Gly Gly Val Val Phe Val Asp Glu Val Pro Lys Gly Leu Thr Gly
515 520 525
Lys Leu Asp Ala Arg Lys Ile Arg Glu Ile Leu Ile Lys Ala Lys Lys
530 535 540
Gly Gly Lys Ile Ala Val
545 550
<210> 19
<211> 2035
<212> RNA
<213> Artificial Sequence
<220>
<223> Ppluc mRNA
<400> 19
ggggcgcugc cuacggaggu ggcagccauc uccuucucgg caucaagcuu gaggauggag 60
gacgccaaga acaucaagaa gggcccggcg cccuucuacc cgcuggagga cgggaccgcc 120
ggcgagcagc uccacaaggc caugaagcgg uacgcccugg ugccgggcac gaucgccuuc 180
accgacgccc acaucgaggu cgacaucacc uacgcggagu acuucgagau gagcgugcgc 240
cuggccgagg ccaugaagcg guacggccug aacaccaacc accggaucgu ggugugcucg 300
gagaacagcc ugcaguucuu caugccggug cugggcgccc ucuucaucgg cguggccguc 360
gccccggcga acgacaucua caacgagcgg gagcugcuga acagcauggg gaucagccag 420
ccgaccgugg uguucgugag caagaagggc cugcagaaga uccugaacgu gcagaagaag 480
cugcccauca uccagaagau caucaucaug gacagcaaga ccgacuacca gggcuuccag 540
ucgauguaca cguucgugac cagccaccuc ccgccgggcu ucaacgagua cgacuucguc 600
ccggagagcu ucgaccggga caagaccauc gcccugauca ugaacagcag cggcagcacc 660
ggccugccga aggggguggc ccugccgcac cggaccgccu gcgugcgcuu cucgcacgcc 720
cgggacccca ucuucggcaa ccagaucauc ccggacaccg ccauccugag cguggugccg 780
uuccaccacg gcuucggcau guucacgacc cugggcuacc ucaucugcgg cuuccgggug 840
guccugaugu accgguucga ggaggagcug uuccugcgga gccugcagga cuacaagauc 900
cagagcgcgc ugcucgugcc gacccuguuc agcuucuucg ccaagagcac ccugaucgac 960
aaguacgacc ugucgaaccu gcacgagauc gccagcgggg gcgccccgcu gagcaaggag 1020
gugggcgagg ccguggccaa gcgguuccac cucccgggca uccgccaggg cuacggccug 1080
accgagacca cgagcgcgau ccugaucacc cccgaggggg acgacaagcc gggcgccgug 1140
ggcaaggugg ucccguucuu cgaggccaag gugguggacc uggacaccgg caagacccug 1200
ggcgugaacc agcggggcga gcugugcgug cgggggccga ugaucaugag cggcuacgug 1260
aacaacccgg aggccaccaa cgcccucauc gacaaggacg gcuggcugca cagcggcgac 1320
aucgccuacu gggacgagga cgagcacuuc uucaucgucg accggcugaa gucgcugauc 1380
aaguacaagg gcuaccaggu ggcgccggcc gagcuggaga gcauccugcu ccagcacccc 1440
aacaucuucg acgccggcgu ggccgggcug ccggacgacg acgccggcga gcugccggcc 1500
gcgguggugg ugcuggagca cggcaagacc augacggaga aggagaucgu cgacuacgug 1560
gccagccagg ugaccaccgc caagaagcug cggggcggcg ugguguucgu ggacgagguc 1620
ccgaagggcc ugaccgggaa gcucgacgcc cggaagaucc gcgagauccu gaucaaggcc 1680
aagaagggcg gcaagaucgc cguguaagac uagugcauca cauuuaaaag caucucagcc 1740
uaccaugaga auaagagaaa gaaaaugaag aucaauagcu uauucaucuc uuuuucuuuu 1800
ucguuggugu aaagccaaca cccugucuaa aaaacauaaa uuucuuuaau cauuuugccu 1860
cuuuucucug ugcuucaauu aauaaaaaau ggaaagaacc uagaucuaaa aaaaaaaaaa 1920
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa augcaucccc 1980
cccccccccc cccccccccc cccccccaaa ggcucuuuuc agagccacca gaauu 2035
Claims (43)
- 다음을 포함하는 조성물:
(a) 양이온성 펩티드 또는 폴리머;
(b) 양이온성 리피도이드 화합물; 및
(c) 핵산 화합물. - 청구항 1에 있어서, 상기 리피도이드 화합물은 2개 이상의 양이온성 질소 원자 및 적어도 2개의 친유성 꼬리를 포함하는 조성물.
- 청구항 1 또는 청구항 2에 있어서, 상기 리피도이드 화합물은 (a) 에스테르, 아마이드 또는 카바메이트 그룹과 같은, 가수분해가능 연결기를 포함하거나; 또는 (b) 가수분해가능 연결기가 없는, 조성물.
- 청구항 2 또는 청구항 3에 있어서, 상기 리피도이드 화합물의 양이온성 질소 원자 중 적어도 하나는 영구적인 양이온성인, 조성물.
- 청구항 1 내지 청구항 3 중 어느 한 항에 있어서, 상기 리피도이드 화합물은 화학식 I에 따른 화합물
(화학식 I)
여기서
- RA는 독립적으로 각각의 경우에 비치환, 고리형 또는 비고리형, 분지쇄 또는 비분지쇄 C1-20 지방족 그룹; 치환 또는 비치환, 고리형 또는 비고리형, 분지쇄 또는 비분지쇄 C1-20 헤테로지방족 그룹; 치환 또는 비치환 아릴; 치환 또는 비치환 헤테로아릴;
로부터 선택되며;
여기서 적어도 하나의 RA는
이며;
- R5는 독립적으로 각각의 경우에 비치환, 고리형 또는 비고리형, 분지쇄 또는 비분지쇄 C8-16 지방족; 치환 또는 비치환 아릴; 또는 치환 또는 비치환 헤테로아릴로부터 선택되며;
- x는 각각 1 내지 10의 정수이며;
- y는 각각 1 내지 10의 정수이며;
또는 이의 약학적으로 허용가능한 염인, 조성물. - 전술한 청구항 중 어느 한 항에 있어서, 상기 리피도이드 화합물은 화학식 IIa 및/또는 화학식 IIb의 2개 또는 3개 원자단을 포함하는, 조성물:
-N(R1)-CH2-CH(R5)-R2 (화학식 IIa)
-N+(R3)(R4)-CH2-CH(R5)-R2 (화학식 IIb)
여기서 독립적으로 화학식 IIa 또는 화학식 IIb의 각각의 개별 원자단에 대하여
- R1은 수소 또는 C1-C4-알킬로부터 선택되며,
- R2는 선형 또는 분지쇄, 포화 또는 불포화 C6-C16 하이드로카르빌 사슬로부터 선택되며,
- R3 및 R4는 C1-C4-알킬로부터 선택되며, 및
- R5는 수소 또는 하이드록실임. - 청구항 6에 있어서, 상기 리피도이드 화합물은 화학식 IIa 및/또는 화학식 IIb의 3개의 동일한 원자단을 포함하는 화합물인, 조성물:
여기서
- R1은 수소이며,
- R2는 선형 또는 분지쇄 C6-C16 알킬 사슬이며, 및
- R3 및 R4는 메틸임. - 청구항 1 내지 청구항 3 중 어느 한 항에 있어서, 상기 리피도이드 화합물은 화학식 III에 따른 화합물인, 조성물:
(화학식 III)
여기서
- R1 및 R2는 각각 독립적으로 수소, 선택사항으로서 치환, 포화 또는 불포화 C1-C20 하이드로카르빌, 및 선택사항으로서 치환, 포화 또는 불포화 C6-C20 아실로 구성된 군으로부터 선택되며;
- L1 및 L2는 각각 독립적으로 선택사항으로서 치환, 포화 또는 불포화 C1-C30 하이드로카르빌로부터 선택되며;
- m 및 o는 각각 독립적으로 0 및 임의 양의 정수로 구성된 군으로부터 선택되며; 및
- n은 임의 양의 정수임. - 전술한 청구항 중 어느 한 항에 있어서, 상기 양이온성 펩티드 또는 폴리머는 디설파이드 결합, 또는 이의 디설파이드-결합된 멀티머를 형성할 수 있는 적어도 하나의 -SH 그룹을 갖는 적어도 하나의 양이온성 원자단 P를 포함하는 화합물이며, 상기 원자단 P는 다음으로부터 선택되는, 조성물:
- 분자량 약 0.5 kDa 내지 약 30 kDa을 갖는 폴리머 원자단, 또는
- 펩티드 원자단의 아미노산의 전체 수의 적어도 10%가 Arg, Lys, His 및/또는 Orn으로부터 선택되는 염기성 아미노산을 나타내는, 적어도 3 내지 약 100 개 아미노산으로 구성된 펩티드 원자단. - 청구항 9에 있어서, 상기 원자단 P는 다음과 같은, 조성물:
- 7 내지 30 개 아미노산으로 구성되는 펩티드 원자단, 여기서 적어도 하나의 -SH 그룹은 Cys 잔기에 의해 제공됨; 또는
- 선택사항으로서 변성된 폴리아크릴레이트, 키토산, 폴리에틸렌이민, 폴리아민, 폴리아미노에스테르, 또는 폴리아미도아민, 또는 이들의 임의 코폴리머로부터 선택되는 폴리머 원자단. - 청구항 10에 있어서, 상기 펩티드 원자단은 2 개의 종결 말단을 가지며, 여기서 - Cys 잔기는 상기 종결 말단 중 하나에 또는 그 근처에 위치하거나; 또는 여기서
- 상기 펩티드 원자단은 적어도 2 개의 Cys 잔기를 포함하며, 그리고 여기서 상기 Cys 잔기 중 적어도 하나는 상기 종결 말단 각각에, 또는 그 근처에 위치하는, 조성물. - 청구항 9 내지 청구항 11 중 어느 한 항에 있어서, 상기 양이온성 펩티드 또는 폴리머는 화학식
L1-P1-[P-]n-P3-L2 (화학식 IV)
에 따른 화합물이며,
여기서
P는 앞서 정의된 바와 같으며;
P3는 선택사항이며;
P1 및 P3는 독립적으로 선택되며, 각각은 폴리에틸렌 글리콜 (PEG), 폴리-N-(2-하이드록시프로필)메타크릴아마이드, 폴리-2-(메타크릴로일옥시)에틸 포스포릴콜린, 폴리(하이드록시알킬 L-아스파라긴), 폴리(2-(메타크릴로일옥시)에틸 포스포릴콜린), 하이드록시에틸스타치 또는 폴리(하이드록시알킬 L-글루타민)으로부터 선택되는 선형 또는 분지쇄 친수성 폴리머 사슬을 나타내며, 여기서 상기 폴리머 사슬은 분자량 약 1 kDa 내지 약 100 kDa을 나타내며, 그리고 P1 및 P3는 각각 디설파이드 결합을 통하여 원자단 P에 결합되며;
L1 및 L2는 선택사항인 리간드이며 독립적으로 RGD, RGD 펩티드, 트란스페린, 엽산, 신호 펩티드 또는 신호 서열, 국지화 신호 또는 서열, 핵 국지화 신호 또는 서열 (NLS), 항체, 세포 투과성 펩티드 예컨대 WEAKLAKALAKALAKHLAKALAKALKACEA, TAT, 수용체의 리간드, 사이토카인, 호르몬, 성장 인자, 소분자, 카르보하이드레이트, 만노오스, 갈락토오스, n-아세틸갈락토오스아민, 합성 리간드, 소분자 작용제, 수용체의 억제제 또는 길항제, 또는 RGD 펩티드모방 유사체로부터 선택되며;
n은 1 내지 약 50, 바람직하게는 2, 3, 4, 또는 5 내지 약 10의 범위, 또는 2, 3, 또는 4 내지 약 9의 범위, 예컨대 6, 또는 7로부터 선택되는 정수이며;
그리고, n이 1보다 큰 경우, 각각의 원자단 P는 디설파이드 결합을 통하여 또 다른 원자단 P에 결합되는, 조성물. - 전술한 청구항 중 어느 한 항에 있어서, 양이온성 펩티드 또는 폴리머 대 핵산 화합물의 중량비는 적어도 약 1이며, 리피도이드 화합물 대 핵산 화합물의 비는 약 15 nmol/μg 이하인, 조성물.
- 전술한 청구항 중 어느 한 항에 있어서, 리피도이드 화합물 대 양이온성 펩티드 또는 폴리머의 중량비는 약 약 1:50 이하이며, 및/또는 리피도이드 화합물 대 양이온성 펩티드 또는 폴리머의 비는 약 2 nmol/μg 이하인, 조성물.
- 전술한 청구항 중 어느 한 항에 있어서, N/P 비율 약 0.1 내지 약 20, 또는 약 0.2 내지 약 15, 또는 약 2 내지 약 15, 또는 약 2 내지 약 12를 가지며, 여기서 N/P 비율은 양이온성 펩티드 또는 폴리머의 염기성 그룹의 질소 원자 대 핵산 화합물의 포스페이트 그룹의 몰비로서 정의되는, 조성물.
- 전술한 청구항 중 어느 한 항에 있어서, 청구항 2 내지 청구항 8 중 어느 한 항에서 정의된 리피도이드 화합물 이외에 지질이 실질적으로 없는, 조성물.
- 전술한 청구항 중 어느 한 항에 있어서, 2 종 이상의 상이한 화학종의 양이온성 펩티드 및/또는 폴리머를 포함하는, 조성물.
- 전술한 청구항 중 어느 한 항에 있어서, 상기 핵산 화합물은
- 화학적으로 변성된 또는 변성되지 않은 DNA, 단일 가닥 또는 이중 가닥 DNA, 코딩 또는 비-코딩 DNA로부터 선택되며, 선택사항으로서 플라스미드, 올리고데옥시뉴클레오타이드, 게놈 DNA, DNA 프라이머s, DNA 프로브, 면역자극성 DNA, 앱타머, 또는 이들의 임의 조합으로부터 선택되며, 및/또는
- 화학적으로 변성된 또는 변성되지 않은 RNA, 단일-가닥 또는 이중-가닥 RNA, 코딩 또는 비-코딩 RNA로부터 선택되며, 선택사항으로서 메신저 RNA (mRNA), 올리고리보뉴클레오타이드, 바이러스성 RNA, 레플리콘 RNA, 전이 RNA (tRNA), 리보솜 RNA (rRNA), 면역자극성 RNA (isRNA), 마이크로RNA, 작은 간섭 RNA (siRNA), 작은 핵 RNA (snRNA), 작은-헤어핀 RNA (shRNA) 또는 리보스위치, RNA 앱타머, RNA 데코이(decoy), 안티센스 RNA, 리보자임, 또는 이들의 임의 조합으로부터 선택되는, 조성물. - 전술한 청구항 중 어느 한 항에 있어서, 표적제, 세포 침투제, 및 스텔스제로부터 독립적으로 선택되는 1종 이상의 화합물을 더욱 포함하는, 조성물.
- 전술한 청구항 중 어느 한 항에 있어서, 양이온성 펩티드 또는 폴리머, 리피도이드 화합물 및 핵산 화합물이 나노입자에 포함되는, 조성물.
- 청구항 1 내지 청구항 20에 따른 조성물을 포함하는 나노입자.
- 청구항 21에 있어서, 핵산 화합물 및 양이온성 펩티드 또는 폴리머 및/또는 리피도이드 화합물에 의해 형성된 복합체를 포함하는, 나노입자.
- 청구항 21 또는 청구항 22에 있어서, 동적 레이저 산란에 의해 결정되는 각각 약 30 nm 내지 약 800 nm, 바람직하게는 약 50 nm 내지 약 300 nm, 또는 약 60 nm 내지 약 250 nm, 또는 약 60 nm 내지 약 150 nm, 또는 약 60 nm 내지 약 120 nm의 유체역학적 지름을 갖는, 나노입자.
- 청구항 21 내지 청구항 23 중 어느 한 항에 있어서, 약 0 mV 내지 약 -50 mV, 또는 약 0 mV 내지 약 -10 mV 범위의 제타 전위를 갖는, 나노입자.
- 청구항 21 내지 청구항 24 중 어느 한 항에 있어서,
(a) 하나 이상의 양이온성 펩티드 및/또는 폴리머;
(b) 하나 이상의 리피도이드 화합물;
(c) 하나 이상의 핵산 화합물;
및 선택사항으로서
(d) 표적제, 세포 침투제, 및 스텔스제로부터 독립적으로 선택되는 1종 이상의 화합물
로 실질적으로 구성되는, 나노입자. - 나노입자로서
(i) 하나 이상의 양이온성 펩티드 및/또는 폴리머;
(ii) 청구항 2 내지 청구항 8 중 어느 한 항에 정의된 하나 이상의 리피도이드 화합물; 및
(iii) 하나 이상의 핵산 화합물
을 수성 액체의 존재하에 조합하여 나노입자의 형성을 가능하게 하는 단계를 포함하는 방법에 의해 획득가능한 나노입자. - 청구항 21 내지 청구항 26 중 어느 한 항의 복수의 나노입자를 포함하는 조성물.
- 청구항 27에 있어서, 상기 나노입자는 동적 레이저 산란에 의해 결정되는 각각 약 30 nm 내지 약 800 nm, 바람직하게는 약 50 nm 내지 약 300 nm, 또는 약 60 nm 내지 약 250 nm, 또는 약 60 nm 내지 약 150 nm, 또는 약 60 nm 내지 약 120 nm의 유체역학적 지름을 갖는, 조성물.
- 청구항 27 또는 청구항 28에 있어서, 무균 액체로서 제형화되는, 조성물.
- 청구항 27 또는 청구항 28에 있어서, 수성 액체 담체로 재구성하기 위한 분말 또는 동결건조 형태와 같은 무균 고체 조성물로서 제형화되는, 조성물.
- 청구항 27 내지 청구항 30 중 어느 한 항의 조성물을 제조하기 위한 키트로서, 다음을 포함하는 키트:
(a) 양이온성 펩티드 또는 폴리머, 및/또는 리피도이드 화합물을 포함하는 제1 키트 성분; 및
(b) 핵산 화합물을 포함하는 제2 키트 성분. - 약제로서의 사용을 위한 청구항 21 내지 청구항 26 중 어느 한 항의 나노입자 또는 청구항 27 내지 청구항 30 중 어느 한 항의 조성물.
- 청구항 32에 따른 용도용 나노입자 또는 조성물로서, 상기 용도는 암 또는 종양 질환, 감염성 질환, 바람직하게는 (바이러스성, 세균성 또는 원생생물학적) 감염성 질환, 자가면역 질환, 알레르기 또는 알레르기 질환, 단일유전자 질환, 즉 (유전성) 질환, 또는 일반적인 유전 질환, 유전적 상속 배경을 가지고 있으며 일반적으로 정의된 유전자 결함에 의해 유발되고 멘델의 법칙에 따라 유전되는 질병, 심혈관 질환, 신경 질환, 호흡기 질환, 소화기 질환, 피부병, 근골격계 장애, 결합조직의 장애, 신생물, 면역 결핍, 내분비, 영양 및 대사성 질환, 안 질환, 귀 질환 및 펩티드 또는 단백질 결핍과 관련된 질병으로부터 선택되는 질병의 예방, 치료 및/또는 개선을 포함하는, 나노입자 또는 조성물.
- 화학식 I, II 또는 III에 따른 리피도이드로서, 상기 리피도이드는 PEG화된(PEGylated) 리피도이드.
- 나노입자 또는 조성물이 안구 전달을 통하여 투여되는, 청구항 21 내지 청구항 26 또는 청구항 32-33 중 어느 한 항의 나노입자 또는 청구항 1-20 또는 청구항 27 내지 청구항 30 중 어느 한 항의 조성물 또는 백신 또는 청구항 32 또는 청구항 33 중 어느 한 항에 따른 용도용의 청구항 34 내지 청구항 37 중 어느 한 항의 리피도이드 화합물.
- 안구 전달이 유리체내(intravitreal), 전안방내(intracameral), 결막아래(subconjunctival), 망막아래, 테논아래(subtenon), 안구후부(retrobulbar), 국소적(topical), 및/또는 턱관절후부(posterior juxtascleral) 투여를 포함하는, 청구항 21 내지 청구항 26 중 어느 한 항의 나노입자 또는 청구항 1-20, 또는 청구항 27 내지 청구항 30 중 어느 한 항의 조성물 또는 백신 또는 청구항 32 내지 청구항 34 중 어느 한 항에 따른 용도용의 청구항 34 내지 청구항 37 중 어느 한 항의 리피도이드 화합물.
- 안구 전달이 섬모 근육(ciliary muscle) 내 투여를 포함하는, 청구항 21 내지 청구항 26 중 어느 한 항의 나노입자 또는 청구항 1-20 또는 청구항 27 내지 청구항 30 중 어느 한 항의 조성물 또는 백신 또는 청구항 32 내지 청구항 34 중 어느 한 항에 따른 용도용의 청구항 34 내지 청구항 37 중 어느 한 항의 리피도이드 화합물.
- 단백질을 인코딩하는 mRNA를 포함하는 청구항 21 내지 청구항 26 또는 청구항 32-33 중 어느 한 항의 나노입자 또는 청구항 1-20 또는 청구항 27 내지 청구항 30 중 어느 한 항의 조성물 또는 백신 또는 청구항 34 내지 청구항 37 중 어느 한 항의 리피도이드 화합물의 전달을 필요로 하는 대상체의 눈에 투여하는 단계를 포함하고, 이에 따라 조성물의 투여가 눈 안에서 mRNA에 의해 인코딩되는 단백질의 발현 및/또는 활성을 유발하는, mRNA의 안구 전달 방법.
- 청구항 40에 있어서, mRNA는 대상체의 눈 안으로 유리체내(intravitreal), 전안방내(intracameral), 결막아래(subconjunctival), 망막아래, 테논아래(subtenon), 안구후부(retrobulbar), 국소적(topical), 및/또는 턱관절후부(posterior juxtascleral) 투여를 통하여 투여되거나 또는 mRNA가 섬모 근육(ciliary muscle) 내로 투여되는, 방법.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| EPPCT/EP2016/063226 | 2016-06-09 | ||
| EP2016063226 | 2016-06-09 | ||
| PCT/EP2017/064059 WO2017212009A1 (en) | 2016-06-09 | 2017-06-09 | Hybrid carriers for nucleic acid cargo |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20190029576A true KR20190029576A (ko) | 2019-03-20 |
Family
ID=56134336
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020197000593A KR20190029576A (ko) | 2016-06-09 | 2017-06-09 | 핵산 카고용 하이브리드 담체 |
Country Status (12)
| Country | Link |
|---|---|
| US (2) | US11478552B2 (ko) |
| EP (1) | EP3468613A1 (ko) |
| JP (1) | JP7145579B2 (ko) |
| KR (1) | KR20190029576A (ko) |
| CN (1) | CN109475640B (ko) |
| AU (1) | AU2017277731B2 (ko) |
| BR (1) | BR112018075479A2 (ko) |
| CA (1) | CA3023174A1 (ko) |
| MX (1) | MX2018013919A (ko) |
| RU (1) | RU2751001C2 (ko) |
| SG (1) | SG11201809912UA (ko) |
| WO (1) | WO2017212009A1 (ko) |
Families Citing this family (57)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN109045289A (zh) | 2013-02-22 | 2018-12-21 | 库瑞瓦格股份公司 | 疫苗接种和抑制pd-1途径的组合 |
| JP6896421B2 (ja) | 2013-08-21 | 2021-06-30 | キュアバック アーゲー | 呼吸器合胞体ウイルス(rsv)ワクチン |
| DE202015010000U1 (de) | 2014-12-12 | 2023-07-03 | CureVac SE | Artifizielle Nukleinsäuremoleküle für eine verbesserte Proteinexpression |
| EP3294885B1 (en) | 2015-05-08 | 2020-07-01 | CureVac Real Estate GmbH | Method for producing rna |
| EP3744843A1 (en) | 2015-05-29 | 2020-12-02 | CureVac Real Estate GmbH | A method for producing and purifying rna, comprising at least one step of tangential flow filtration |
| EP3362576A1 (en) | 2015-10-12 | 2018-08-22 | CureVac AG | Automated method for isolation, selection and/or detection of microorganisms or cells comprised in a solution |
| WO2017081110A1 (en) | 2015-11-09 | 2017-05-18 | Curevac Ag | Rotavirus vaccines |
| EP3701963A1 (en) | 2015-12-22 | 2020-09-02 | CureVac AG | Method for producing rna molecule compositions |
| WO2017109161A1 (en) | 2015-12-23 | 2017-06-29 | Curevac Ag | Method of rna in vitro transcription using a buffer containing a dicarboxylic acid or tricarboxylic acid or a salt thereof |
| SG11201806340YA (en) | 2016-02-17 | 2018-09-27 | Curevac Ag | Zika virus vaccine |
| US11920174B2 (en) | 2016-03-03 | 2024-03-05 | CureVac SE | RNA analysis by total hydrolysis and quantification of released nucleosides |
| EP3448427A1 (en) | 2016-04-29 | 2019-03-06 | CureVac AG | Rna encoding an antibody |
| WO2017191264A1 (en) | 2016-05-04 | 2017-11-09 | Curevac Ag | Nucleic acid molecules and uses thereof |
| EP3452101A2 (en) | 2016-05-04 | 2019-03-13 | CureVac AG | Rna encoding a therapeutic protein |
| WO2017212009A1 (en) | 2016-06-09 | 2017-12-14 | Curevac Ag | Hybrid carriers for nucleic acid cargo |
| US11279923B2 (en) | 2016-11-28 | 2022-03-22 | Curevac Ag | Method for purifying RNA |
| WO2018104540A1 (en) | 2016-12-08 | 2018-06-14 | Curevac Ag | Rnas for wound healing |
| CN110582304A (zh) | 2016-12-08 | 2019-12-17 | 库尔维科公司 | 用于治疗或预防肝脏疾病的rna |
| WO2018115507A2 (en) | 2016-12-23 | 2018-06-28 | Curevac Ag | Henipavirus vaccine |
| WO2018115525A1 (en) | 2016-12-23 | 2018-06-28 | Curevac Ag | Lassa virus vaccine |
| WO2018115527A2 (en) | 2016-12-23 | 2018-06-28 | Curevac Ag | Mers coronavirus vaccine |
| JP2020513824A (ja) | 2017-03-24 | 2020-05-21 | キュアバック アーゲー | Crispr関連タンパク質をコードする核酸、及びその使用 |
| BR112019028280A2 (pt) | 2017-07-04 | 2020-07-14 | Curevac Ag | moléculas de ácido nucleico |
| EP3673069A1 (en) | 2017-08-22 | 2020-07-01 | CureVac AG | Bunyavirales vaccine |
| US11692002B2 (en) | 2017-11-08 | 2023-07-04 | CureVac SE | RNA sequence adaptation |
| US11931406B2 (en) | 2017-12-13 | 2024-03-19 | CureVac SE | Flavivirus vaccine |
| SG11202005760PA (en) | 2017-12-21 | 2020-07-29 | Curevac Ag | Linear double stranded dna coupled to a single support or a tag and methods for producing said linear double stranded dna |
| EP3773702A2 (en) | 2018-04-05 | 2021-02-17 | CureVac AG | Novel yellow fever nucleic acid molecules for vaccination |
| SG11202008225PA (en) * | 2018-04-17 | 2020-11-27 | Curevac Ag | Novel rsv rna molecules and compositions for vaccination |
| US11541105B2 (en) | 2018-06-01 | 2023-01-03 | The Research Foundation For The State University Of New York | Compositions and methods for disrupting biofilm formation and maintenance |
| WO2020002525A1 (en) | 2018-06-27 | 2020-01-02 | Curevac Ag | Novel lassa virus rna molecules and compositions for vaccination |
| CN113453707A (zh) | 2018-12-21 | 2021-09-28 | 库瑞瓦格股份公司 | 用于疟疾疫苗的rna |
| WO2020161342A1 (en) | 2019-02-08 | 2020-08-13 | Curevac Ag | Coding rna administered into the suprachoroidal space in the treatment of ophtalmic diseases |
| CN110124020B (zh) * | 2019-05-05 | 2023-03-14 | 海南医学院 | 基于胞外诱捕网原理制成的肿瘤细胞疫苗及其制备方法 |
| EP3986452A1 (en) | 2019-06-18 | 2022-04-27 | CureVac AG | Rotavirus mrna vaccine |
| JP2022544412A (ja) | 2019-08-14 | 2022-10-18 | キュアバック アーゲー | 免疫賦活特性が減少したrna組み合わせおよび組成物 |
| CN110448695B (zh) * | 2019-08-23 | 2021-07-27 | 中山大学肿瘤防治中心 | 一种mRNA疫苗递送载体及其制备方法 |
| JPWO2021080020A1 (ko) * | 2019-10-25 | 2021-04-29 | ||
| CN111041025B (zh) | 2019-12-17 | 2021-06-18 | 深圳市瑞吉生物科技有限公司 | 基于结合N-乙酰半乳糖胺多肽的mRNA靶向分子及其制备方法 |
| CN112111524B (zh) * | 2020-01-10 | 2024-02-27 | 深圳瑞吉生物科技有限公司 | mRNA-GalNAc靶向分子的制备方法及其体内递送系统和应用 |
| IL293571A (en) | 2020-02-04 | 2022-08-01 | Curevac Ag | Corona virus vaccine |
| US11241493B2 (en) | 2020-02-04 | 2022-02-08 | Curevac Ag | Coronavirus vaccine |
| US11576966B2 (en) | 2020-02-04 | 2023-02-14 | CureVac SE | Coronavirus vaccine |
| WO2021205077A1 (en) | 2020-04-09 | 2021-10-14 | Finncure Oy | Mimetic nanoparticles for preventing the spreading and lowering the infection rate of novel coronaviruses |
| BR112022024248A2 (pt) | 2020-05-29 | 2023-10-10 | CureVac SE | Vacinas de combinação à base de ácido nucleico |
| CN111744019B (zh) | 2020-07-01 | 2023-08-04 | 深圳瑞吉生物科技有限公司 | 基于甘露糖的mRNA靶向递送系统及其应用 |
| EP4172194A1 (en) | 2020-07-31 | 2023-05-03 | CureVac SE | Nucleic acid encoded antibody mixtures |
| EP4157344A2 (en) | 2020-08-31 | 2023-04-05 | CureVac SE | Multivalent nucleic acid based coronavirus vaccines |
| AU2021405281A1 (en) | 2020-12-22 | 2023-07-06 | CureVac SE | Rna vaccine against sars-cov-2 variants |
| CN112662644B (zh) * | 2021-01-19 | 2022-04-22 | 华南理工大学 | 一种甘油磷酸二酯磷酸二酯酶突变体及其应用 |
| WO2022162027A2 (en) | 2021-01-27 | 2022-08-04 | Curevac Ag | Method of reducing the immunostimulatory properties of in vitro transcribed rna |
| CN113144182B (zh) * | 2021-04-22 | 2023-03-10 | 成都欧林生物科技股份有限公司 | 一种幽门螺杆菌口服缓释疫苗及其制备与应用 |
| EP4334446A1 (en) | 2021-05-03 | 2024-03-13 | CureVac SE | Improved nucleic acid sequence for cell type specific expression |
| WO2023073228A1 (en) | 2021-10-29 | 2023-05-04 | CureVac SE | Improved circular rna for expressing therapeutic proteins |
| WO2023144330A1 (en) | 2022-01-28 | 2023-08-03 | CureVac SE | Nucleic acid encoded transcription factor inhibitors |
| CN116813493A (zh) * | 2022-03-21 | 2023-09-29 | 苏州科锐迈德生物医药科技有限公司 | 一种脂质化合物及基于其的脂质载体、核酸脂质纳米粒组合物和药物制剂 |
| WO2023227608A1 (en) | 2022-05-25 | 2023-11-30 | Glaxosmithkline Biologicals Sa | Nucleic acid based vaccine encoding an escherichia coli fimh antigenic polypeptide |
Family Cites Families (107)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5795587A (en) | 1995-01-23 | 1998-08-18 | University Of Pittsburgh | Stable lipid-comprising drug delivery complexes and methods for their production |
| WO1999015206A1 (en) | 1997-09-23 | 1999-04-01 | Megabios Corporation | Methods for preparing lipids/polynucleotide transfection complexes |
| US6770740B1 (en) | 1999-07-13 | 2004-08-03 | The Regents Of The University Of Michigan | Crosslinked DNA condensate compositions and gene delivery methods |
| EP1619254B1 (en) | 1999-09-09 | 2010-12-22 | CureVac GmbH | Transfer of mRNA using polycationic compounds |
| GB9930533D0 (en) | 1999-12-23 | 2000-02-16 | Mitsubishi Tokyo Pharm Inc | Nucleic acid delivery |
| EP1285081A2 (en) | 2000-05-30 | 2003-02-26 | ICH Productions Limited | Improved methods of transfection |
| ES2340532T3 (es) | 2001-06-05 | 2010-06-04 | Curevac Gmbh | Arnm con un contenido g/c aumentado que codifica para un antigeno bacteriano y utilizacion del mismo. |
| DE10162480A1 (de) | 2001-12-19 | 2003-08-07 | Ingmar Hoerr | Die Applikation von mRNA für den Einsatz als Therapeutikum gegen Tumorerkrankungen |
| EP3006043B1 (en) | 2002-04-04 | 2019-05-29 | Zoetis Belgium S.A. | Immunostimulatory g,u-containing oligoribonucleotides |
| DE10229872A1 (de) | 2002-07-03 | 2004-01-29 | Curevac Gmbh | Immunstimulation durch chemisch modifizierte RNA |
| DE10335833A1 (de) | 2003-08-05 | 2005-03-03 | Curevac Gmbh | Transfektion von Blutzellen mit mRNA zur Immunstimulation und Gentherapie |
| DE102004042546A1 (de) | 2004-09-02 | 2006-03-09 | Curevac Gmbh | Kombinationstherapie zur Immunstimulation |
| DE102005023170A1 (de) | 2005-05-19 | 2006-11-23 | Curevac Gmbh | Optimierte Formulierung für mRNA |
| DE102006035618A1 (de) | 2006-07-31 | 2008-02-07 | Curevac Gmbh | Nukleinsäure der Formel (I): GlXmGn, insbesondere als immunstimulierendes Adjuvanz |
| DE102006061015A1 (de) | 2006-12-22 | 2008-06-26 | Curevac Gmbh | Verfahren zur Reinigung von RNA im präparativen Maßstab mittels HPLC |
| DE102007001370A1 (de) | 2007-01-09 | 2008-07-10 | Curevac Gmbh | RNA-kodierte Antikörper |
| WO2009030254A1 (en) | 2007-09-04 | 2009-03-12 | Curevac Gmbh | Complexes of rna and cationic peptides for transfection and for immunostimulation |
| US7973019B1 (en) * | 2007-10-03 | 2011-07-05 | Alcon Research, Ltd. | Transferrin/transferrin receptor-mediated siRNA delivery |
| WO2009046739A1 (en) | 2007-10-09 | 2009-04-16 | Curevac Gmbh | Composition for treating prostate cancer (pca) |
| WO2009046738A1 (en) | 2007-10-09 | 2009-04-16 | Curevac Gmbh | Composition for treating lung cancer, particularly of non-small lung cancers (nsclc) |
| CA2710534C (en) | 2008-01-31 | 2018-09-04 | Curevac Gmbh | Nucleic acids of formula (i) (nuglxmgnnv)a and derivatives thereof as an immunostimulating agent/adjuvant |
| US20110200624A1 (en) | 2008-07-31 | 2011-08-18 | Molecular Transfer, Inc. | Novel peptides for use in transfection |
| WO2010037408A1 (en) | 2008-09-30 | 2010-04-08 | Curevac Gmbh | Composition comprising a complexed (m)rna and a naked mrna for providing or enhancing an immunostimulatory response in a mammal and uses thereof |
| WO2010062322A2 (en) | 2008-10-27 | 2010-06-03 | Massachusetts Institute Of Technology | Modulation of the immune response |
| JP6087504B2 (ja) * | 2008-11-07 | 2017-03-01 | マサチューセッツ インスティテュート オブ テクノロジー | アミノアルコールリピドイドおよびその使用 |
| WO2010088927A1 (en) | 2009-02-09 | 2010-08-12 | Curevac Gmbh | Use of pei for the improvement of endosomal release and expression of transfected nucleic acids, complexed with cationic or polycationic compounds |
| US20110053829A1 (en) | 2009-09-03 | 2011-03-03 | Curevac Gmbh | Disulfide-linked polyethyleneglycol/peptide conjugates for the transfection of nucleic acids |
| WO2011069529A1 (en) | 2009-12-09 | 2011-06-16 | Curevac Gmbh | Mannose-containing solution for lyophilization, transfection and/or injection of nucleic acids |
| EP2449113B8 (en) | 2010-07-30 | 2015-11-25 | CureVac AG | Complexation of nucleic acids with disulfide-crosslinked cationic components for transfection and immunostimulation |
| WO2012019630A1 (en) | 2010-08-13 | 2012-02-16 | Curevac Gmbh | Nucleic acid comprising or coding for a histone stem-loop and a poly(a) sequence or a polyadenylation signal for increasing the expression of an encoded protein |
| WO2012089225A1 (en) | 2010-12-29 | 2012-07-05 | Curevac Gmbh | Combination of vaccination and inhibition of mhc class i restricted antigen presentation |
| WO2012116715A1 (en) | 2011-03-02 | 2012-09-07 | Curevac Gmbh | Vaccination in newborns and infants |
| WO2012113413A1 (en) | 2011-02-21 | 2012-08-30 | Curevac Gmbh | Vaccine composition comprising complexed immunostimulatory nucleic acids and antigens packaged with disulfide-linked polyethyleneglycol/peptide conjugates |
| WO2012116714A1 (en) | 2011-03-02 | 2012-09-07 | Curevac Gmbh | Vaccination in elderly patients |
| US10213529B2 (en) * | 2011-05-20 | 2019-02-26 | Surmodics, Inc. | Delivery of coated hydrophobic active agent particles |
| EP2623121A1 (en) | 2012-01-31 | 2013-08-07 | Bayer Innovation GmbH | Pharmaceutical composition comprising a polymeric carrier cargo complex and an antigen |
| WO2013113326A1 (en) | 2012-01-31 | 2013-08-08 | Curevac Gmbh | Pharmaceutical composition comprising a polymeric carrier cargo complex and at least one protein or peptide antigen |
| WO2013113325A1 (en) | 2012-01-31 | 2013-08-08 | Curevac Gmbh | Negatively charged nucleic acid comprising complexes for immunostimulation |
| WO2013120497A1 (en) | 2012-02-15 | 2013-08-22 | Curevac Gmbh | Nucleic acid comprising or coding for a histone stem-loop and a poly(a) sequence or a polyadenylation signal for increasing the expression of an encoded therapeutic protein |
| WO2013120499A1 (en) | 2012-02-15 | 2013-08-22 | Curevac Gmbh | Nucleic acid comprising or coding for a histone stem-loop and a poly (a) sequence or a polyadenylation signal for increasing the expression of an encoded pathogenic antigen |
| WO2013120500A1 (en) | 2012-02-15 | 2013-08-22 | Curevac Gmbh | Nucleic acid comprising or coding for a histone stem-loop and a poly(a) sequence or a polyadenylation signal for increasing the expression of an encoded tumour antigen |
| WO2013120498A1 (en) | 2012-02-15 | 2013-08-22 | Curevac Gmbh | Nucleic acid comprising or coding for a histone stem-loop and a poly(a) sequence or a polyadenylation signal for increasing the expression of an encoded allergenic antigen or an autoimmune self-antigen |
| ES2660459T3 (es) | 2012-03-27 | 2018-03-22 | Curevac Ag | Moléculas de ácido nucleico artificiales |
| CN104321432B (zh) | 2012-03-27 | 2018-08-10 | 库瑞瓦格股份公司 | 包含5′top utr的人工核酸分子 |
| AU2013242404B2 (en) | 2012-03-27 | 2018-08-30 | CureVac SE | Artificial nucleic acid molecules for improved protein or peptide expression |
| US20150306249A1 (en) | 2012-05-25 | 2015-10-29 | Curevac Gmbh | Reversible immobilization and/or controlled release of nucleic acid containing nanoparticles by (biodegradable) polymer coatings |
| CN109045289A (zh) | 2013-02-22 | 2018-12-21 | 库瑞瓦格股份公司 | 疫苗接种和抑制pd-1途径的组合 |
| EA036400B1 (ru) | 2013-06-28 | 2020-11-06 | Этрис Гмбх | Композиции для введения рнк в клетки |
| WO2015024667A1 (en) | 2013-08-21 | 2015-02-26 | Curevac Gmbh | Method for increasing expression of rna-encoded proteins |
| CA2915730A1 (en) | 2013-08-21 | 2015-02-26 | Karl-Josef Kallen | A combination rsv/influenza a vaccine |
| JP6896421B2 (ja) | 2013-08-21 | 2021-06-30 | キュアバック アーゲー | 呼吸器合胞体ウイルス(rsv)ワクチン |
| SG11201510748PA (en) | 2013-08-21 | 2016-03-30 | Curevac Ag | Composition and vaccine for treating lung cancer |
| RU2016109938A (ru) | 2013-08-21 | 2017-09-26 | Куревак Аг | Композиция и вакцина для лечения рака предстательной железы |
| CA2915712A1 (en) | 2013-08-21 | 2015-02-26 | Margit SCHNEE | Rabies vaccine |
| ES2806575T3 (es) | 2013-11-01 | 2021-02-18 | Curevac Ag | ARN modificado con propiedades inmunoestimuladoras disminuidas |
| SG11201603144QA (en) | 2013-12-30 | 2016-07-28 | Curevac Ag | Artificial nucleic acid molecules |
| AU2014375404C1 (en) | 2013-12-30 | 2020-11-19 | CureVac Manufacturing GmbH | Methods for RNA analysis |
| WO2015101415A1 (en) | 2013-12-30 | 2015-07-09 | Curevac Gmbh | Artificial nucleic acid molecules |
| CA2935878C (en) | 2014-03-12 | 2023-05-02 | Curevac Ag | Combination of vaccination and ox40 agonists |
| CA2936286A1 (en) | 2014-04-01 | 2015-10-08 | Curevac Ag | Polymeric carrier cargo complex for use as an immunostimulating agent or as an adjuvant |
| MX2016016170A (es) | 2014-06-10 | 2017-03-28 | Curevac Ag | Metodos y medios para aumentar la produccion de arn. |
| DE202015010000U1 (de) | 2014-12-12 | 2023-07-03 | CureVac SE | Artifizielle Nukleinsäuremoleküle für eine verbesserte Proteinexpression |
| EP3233113A1 (en) | 2014-12-16 | 2017-10-25 | CureVac AG | Ebolavirus and marburgvirus vaccines |
| AU2015373404B2 (en) | 2014-12-30 | 2021-09-09 | CureVac SE | Artificial nucleic acid molecules |
| WO2016165825A1 (en) | 2015-04-13 | 2016-10-20 | Curevac Ag | Method for producing rna compositions |
| WO2016165831A1 (en) | 2015-04-17 | 2016-10-20 | Curevac Ag | Lyophilization of rna |
| JP6912384B2 (ja) | 2015-04-22 | 2021-08-04 | キュアバック アーゲー | 癌疾患の処置のための、rna含有組成物 |
| SG11201708681SA (en) | 2015-04-30 | 2017-11-29 | Curevac Ag | Method for in vitro transcription using an immobilized restriction enzyme |
| SG11201708867UA (en) | 2015-04-30 | 2017-11-29 | Curevac Ag | Immobilized poly(n)polymerase |
| EP3294885B1 (en) | 2015-05-08 | 2020-07-01 | CureVac Real Estate GmbH | Method for producing rna |
| US11559570B2 (en) | 2015-05-15 | 2023-01-24 | CureVac SE | Prime-boost regimens involving administration of at least one mRNA construct |
| WO2016184575A1 (en) | 2015-05-20 | 2016-11-24 | Curevac Ag | Dry powder composition comprising long-chain rna |
| EP3297682B1 (en) | 2015-05-20 | 2021-07-14 | CureVac AG | Dry powder composition comprising long-chain rna |
| EP4098743A1 (en) | 2015-05-29 | 2022-12-07 | CureVac AG | Method for adding cap structures to rna using immobilized enzymes |
| EP3744843A1 (en) | 2015-05-29 | 2020-12-02 | CureVac Real Estate GmbH | A method for producing and purifying rna, comprising at least one step of tangential flow filtration |
| WO2016203025A1 (en) | 2015-06-17 | 2016-12-22 | Curevac Ag | Vaccine composition |
| EP4239080A3 (en) | 2015-07-01 | 2023-11-01 | CureVac Manufacturing GmbH | Method for analysis of an rna molecule |
| US10501768B2 (en) | 2015-07-13 | 2019-12-10 | Curevac Ag | Method of producing RNA from circular DNA and corresponding template DNA |
| US20200085852A1 (en) | 2015-08-05 | 2020-03-19 | Curevac Ag | Epidermal mrna vaccine |
| EP3332019B1 (en) | 2015-08-07 | 2019-12-18 | CureVac AG | Process for the in vivo production of rna in a host cell |
| CN108138187B (zh) | 2015-08-10 | 2022-07-19 | 库瑞瓦格房地产有限公司 | 增加环状dna分子复制的方法 |
| CN108026537B (zh) | 2015-08-28 | 2022-02-08 | 库瑞瓦格股份公司 | 人工核酸分子 |
| EP3362576A1 (en) | 2015-10-12 | 2018-08-22 | CureVac AG | Automated method for isolation, selection and/or detection of microorganisms or cells comprised in a solution |
| US20180312545A1 (en) | 2015-11-09 | 2018-11-01 | Curevac Ag | Optimized nucleic acid molecules |
| WO2017081110A1 (en) | 2015-11-09 | 2017-05-18 | Curevac Ag | Rotavirus vaccines |
| WO2017108087A1 (en) | 2015-12-21 | 2017-06-29 | Curevac Ag | Inlay for a culture plate and corresponding method for preparing a culture plate system with such inlay |
| EP3701963A1 (en) | 2015-12-22 | 2020-09-02 | CureVac AG | Method for producing rna molecule compositions |
| WO2017109161A1 (en) | 2015-12-23 | 2017-06-29 | Curevac Ag | Method of rna in vitro transcription using a buffer containing a dicarboxylic acid or tricarboxylic acid or a salt thereof |
| EP3414340B1 (en) | 2016-02-12 | 2023-08-09 | CureVac SE | Method for analyzing rna |
| EP3417069A1 (en) | 2016-02-15 | 2018-12-26 | CureVac AG | Method for analyzing by-products of rna in vitro transcription |
| SG11201806340YA (en) | 2016-02-17 | 2018-09-27 | Curevac Ag | Zika virus vaccine |
| US11920174B2 (en) | 2016-03-03 | 2024-03-05 | CureVac SE | RNA analysis by total hydrolysis and quantification of released nucleosides |
| WO2017162297A1 (en) | 2016-03-24 | 2017-09-28 | Curevac Ag | Immobilized inorganic pyrophosphatase (ppase) |
| EP3445392A1 (en) | 2016-04-22 | 2019-02-27 | CureVac AG | Rna encoding a tumor antigen |
| EP3448427A1 (en) | 2016-04-29 | 2019-03-06 | CureVac AG | Rna encoding an antibody |
| WO2017191264A1 (en) | 2016-05-04 | 2017-11-09 | Curevac Ag | Nucleic acid molecules and uses thereof |
| EP3452086A1 (en) | 2016-05-04 | 2019-03-13 | CureVac AG | Influenza mrna vaccines |
| US20180126003A1 (en) | 2016-05-04 | 2018-05-10 | Curevac Ag | New targets for rna therapeutics |
| EP3452101A2 (en) | 2016-05-04 | 2019-03-13 | CureVac AG | Rna encoding a therapeutic protein |
| EP3464619A1 (en) | 2016-05-25 | 2019-04-10 | CureVac AG | Novel biomarkers |
| WO2017212009A1 (en) | 2016-06-09 | 2017-12-14 | Curevac Ag | Hybrid carriers for nucleic acid cargo |
| US20190381180A1 (en) | 2016-06-09 | 2019-12-19 | Curevac Ag | Hybrid carriers for nucleic acid cargo |
| US20190336611A1 (en) | 2016-06-09 | 2019-11-07 | Curevac Ag | Hybrid carriers for nucleic acid cargo |
| EP3468609A1 (en) | 2016-06-09 | 2019-04-17 | CureVac AG | Cationic carriers for nucleic acid delivery |
| SG10201913631TA (en) | 2016-08-19 | 2020-03-30 | Curevac Ag | Rna for cancer therapy |
| BR112019008481A2 (pt) | 2016-10-26 | 2020-03-03 | Curevac Ag | Vacinas de mrna de nanopartículas lipídicas |
| BR112019028280A2 (pt) | 2017-07-04 | 2020-07-14 | Curevac Ag | moléculas de ácido nucleico |
-
2017
- 2017-06-09 WO PCT/EP2017/064059 patent/WO2017212009A1/en unknown
- 2017-06-09 KR KR1020197000593A patent/KR20190029576A/ko not_active IP Right Cessation
- 2017-06-09 AU AU2017277731A patent/AU2017277731B2/en active Active
- 2017-06-09 BR BR112018075479-0A patent/BR112018075479A2/pt unknown
- 2017-06-09 SG SG11201809912UA patent/SG11201809912UA/en unknown
- 2017-06-09 JP JP2018564340A patent/JP7145579B2/ja active Active
- 2017-06-09 EP EP17730741.0A patent/EP3468613A1/en active Pending
- 2017-06-09 MX MX2018013919A patent/MX2018013919A/es unknown
- 2017-06-09 US US16/308,632 patent/US11478552B2/en active Active
- 2017-06-09 RU RU2018140462A patent/RU2751001C2/ru active
- 2017-06-09 CN CN201780036069.1A patent/CN109475640B/zh active Active
- 2017-06-09 CA CA3023174A patent/CA3023174A1/en active Pending
-
2022
- 2022-10-20 US US18/048,423 patent/US20230302146A1/en not_active Abandoned
Also Published As
| Publication number | Publication date |
|---|---|
| SG11201809912UA (en) | 2018-12-28 |
| EP3468613A1 (en) | 2019-04-17 |
| CN109475640A (zh) | 2019-03-15 |
| JP7145579B2 (ja) | 2022-10-03 |
| US20200179526A1 (en) | 2020-06-11 |
| MX2018013919A (es) | 2019-04-15 |
| CA3023174A1 (en) | 2017-12-14 |
| RU2018140462A3 (ko) | 2020-07-14 |
| AU2017277731A1 (en) | 2018-11-22 |
| WO2017212009A1 (en) | 2017-12-14 |
| BR112018075479A2 (pt) | 2019-03-19 |
| US20230302146A1 (en) | 2023-09-28 |
| RU2018140462A (ru) | 2020-07-14 |
| JP2019517553A (ja) | 2019-06-24 |
| CN109475640B (zh) | 2023-03-10 |
| US11478552B2 (en) | 2022-10-25 |
| AU2017277731B2 (en) | 2021-02-18 |
| RU2751001C2 (ru) | 2021-07-07 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP7145579B2 (ja) | 核酸カーゴ用のハイブリッド担体 | |
| US20190336608A1 (en) | Cationic carriers for nucleic acid delivery | |
| US20190381180A1 (en) | Hybrid carriers for nucleic acid cargo | |
| US20190336611A1 (en) | Hybrid carriers for nucleic acid cargo | |
| JP6720234B2 (ja) | コードされている病原体抗原の発現を増加させるための、ヒストンステムループとポリ(a)配列又はポリアデニル化シグナルとを含むか又はコードしている核酸 | |
| JP6893177B2 (ja) | 少なくとも1つのmRNAコンストラクトの投与を含むプライムブーストレジメン(PRIME−BOOST REGIMENS) | |
| KR20190093816A (ko) | 지질 나노입자 mRNA 백신 | |
| WO2016203025A1 (en) | Vaccine composition | |
| MX2014008497A (es) | Composicion farmaceutica que comprende un complejo de carga con portador polimerico y al menos y un antigeno proteinico o peptidico. | |
| JP2023546908A (ja) | イオン化可能脂質ならびにその製造及び使用の方法 | |
| CN116917266A (zh) | 可离子化脂质及其制造和使用方法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| AMND | Amendment | ||
| E902 | Notification of reason for refusal | ||
| AMND | Amendment | ||
| E601 | Decision to refuse application | ||
| X091 | Application refused [patent] | ||
| AMND | Amendment | ||
| X601 | Decision of rejection after re-examination |