KR20190003958A - 암의 치료 및 모니터링 방법 - Google Patents
암의 치료 및 모니터링 방법 Download PDFInfo
- Publication number
- KR20190003958A KR20190003958A KR1020187032990A KR20187032990A KR20190003958A KR 20190003958 A KR20190003958 A KR 20190003958A KR 1020187032990 A KR1020187032990 A KR 1020187032990A KR 20187032990 A KR20187032990 A KR 20187032990A KR 20190003958 A KR20190003958 A KR 20190003958A
- Authority
- KR
- South Korea
- Prior art keywords
- level
- expression
- patient
- biological sample
- fold
- Prior art date
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/68—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving nucleic acids
- C12Q1/6876—Nucleic acid products used in the analysis of nucleic acids, e.g. primers or probes
- C12Q1/6883—Nucleic acid products used in the analysis of nucleic acids, e.g. primers or probes for diseases caused by alterations of genetic material
- C12Q1/6886—Nucleic acid products used in the analysis of nucleic acids, e.g. primers or probes for diseases caused by alterations of genetic material for cancer
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
- A61K39/39533—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals
- A61K39/3955—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals against proteinaceous materials, e.g. enzymes, hormones, lymphokines
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/22—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against growth factors ; against growth regulators
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2803—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily
- C07K16/2827—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily against B7 molecules, e.g. CD80, CD86
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/574—Immunoassay; Biospecific binding assay; Materials therefor for cancer
- G01N33/57407—Specifically defined cancers
- G01N33/57438—Specifically defined cancers of liver, pancreas or kidney
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
- A61K2039/507—Comprising a combination of two or more separate antibodies
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/55—Medicinal preparations containing antigens or antibodies characterised by the host/recipient, e.g. newborn with maternal antibodies
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/57—Medicinal preparations containing antigens or antibodies characterised by the type of response, e.g. Th1, Th2
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/20—Immunoglobulins specific features characterized by taxonomic origin
- C07K2317/24—Immunoglobulins specific features characterized by taxonomic origin containing regions, domains or residues from different species, e.g. chimeric, humanized or veneered
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/76—Antagonist effect on antigen, e.g. neutralization or inhibition of binding
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/30—Non-immunoglobulin-derived peptide or protein having an immunoglobulin constant or Fc region, or a fragment thereof, attached thereto
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q2600/00—Oligonucleotides characterized by their use
- C12Q2600/106—Pharmacogenomics, i.e. genetic variability in individual responses to drugs and drug metabolism
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q2600/00—Oligonucleotides characterized by their use
- C12Q2600/158—Expression markers
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2800/00—Detection or diagnosis of diseases
- G01N2800/52—Predicting or monitoring the response to treatment, e.g. for selection of therapy based on assay results in personalised medicine; Prognosis
Abstract
본 발명은 암, 예를 들어, 신장암에 대한 치료 및 진단 방법 및 조성물을 제공한다. 본 발명은 특히, 암을 치료하는 방법 및 VEGF 길항제 (예컨대, 항-VEGF 항체) 및 PD-L1 축 결합 길항제 (예컨대, 항-PD-L1 항체)를 포함하는 항암 요법으로의 치료에 대한 암을 갖는 환자의 반응을 모니터링하는 방법을 제공한다.
Description
서열 목록
본원은 ASCⅡ 포맷으로 전자 형식으로 제출되어, 그 전체가 참조로 본원에 편입된 서열 목록을 포함한다. 2017년 4월 13일 목요일에 작성된 상기의 ASCⅡ 사본은 파일명을 "50474-132WO2_Sequence_Listing_4_13_17_ST25"라고 하고, 크기는 110,043 바이트이다.
기술분야
본 발명은 일반적으로 암, 예를 들어, 신장암의 진단, 모니터링 및 치료 방법에 관한 것이다.
암은 인간 건강에 가장 치명적인 위협들 중 하나로 남아 있다. 미국에서만, 암은 매년 거의 130만명의 신규 환자에게 영향을 미치고 있고, 심혈관 질환 다음으로 두 번째로 주요한 사망 원인으로, 사망 4건 당 약 1건을 차지한다. 고형 종양은 대부분의 사망에 대한 원인으로 작용한다. 특정 암의 의학적 치료에 유의미한 진전이 있어 왔지만, 모든 암에 대한 총 5년 생존율은 지난 20년에 걸쳐 약 10%만 개선된 바 있다. 특히, 신장암은 1990년대부터 발병률이 높아지고 있으며, 현재 남성과 여성 모두에서 가장 흔한 10가지 암 중 하나이다.
항-혈관형성 제제를 기타 항암제, 예컨대 항-종양 면역성을 촉진하는 약물과 조합하는 병용요법은 암, 예컨대 신장암의 치료를 위한 유망한 신규 접근법을 제공한다.
따라서, 신장암을 포함하는 암에 대한 개선된 요법 및 진단 방법에 대한 이 분야의 요구가 충족되지 않고 있다.
본 발명은 암, 예를 들어, 신장암 [예컨대, 전이성 신장 세포 암종 (mRCC)]을 모니터링하고, 진단하고, 그리고 치료하기 위한 조성물 및 방법을 제공한다.
일 양태에서, 본 발명은 VEGF 길항제 및 PD-L1 축 결합 길항제를 포함하는 항암 요법으로의 치료에 대한 신장암을 갖는 환자의 반응을 모니터링하는 방법을 특징으로 하며, 상기 방법은 하기를 포함한다: (a) 항암 요법의 투여 후 시점에서 환자로부터 수득된 생물학적 샘플에서, 하기 유전자 중 하나 이상의 발현 수준을 측정하는 단계: CD8A, CD8B, EOMES, GZMA, GZMB, IFNG, 또는 PRF1; CXCL9, CXCL10, CXCL11, 또는 CXCL13; 또는 GZMB, KLRK1, 또는 SLAMF7; 및 (b) 생물학적 샘플 내 하나 이상의 유전자의 발현 수준을 참조 수준과 비교하고, 이로써 상기 항암 요법으로의 치료에 대한 환자의 반응을 모니터링하는 단계.
일부 구현예에서, CD8A, CD8B, EOMES, GZMA, GZMB, IFNG, 또는 PRF1 중 하나 이상의 발현 수준은 종양 미세환경 내 CD8+ T 효과기 (Teff) 세포의 존재와 상관관계가 있다. 일부 구현예에서, CXCL9, CXCL10, CXCL11, 또는 CXCL13 중 하나 이상의 발현 수준은 종양 미세환경 내 Th1 케모카인의 존재와 상관관계가 있다. 일부 구현예에서, GZMB, KLRK1, 또는 SLAMF7의 존재는 종양 미세환경에서 자연 살해(NK) 세포의 존재와 상관관계가 있다.
일부 구현예에서, CD8A, CD8B, EOMES, GZMA, GZMB, IFNG 또는 PRF1 중 하나 이상의 발현 수준이 계측된다. 일부 구현예에서, CD8A, CD8B, EOMES, GZMA, GZMB, IFNG 또는 PRF1 중 적어도 2개, 적어도 3개, 적어도 4개, 적어도 5개, 또는 적어도 6개의 발현 수준이 계측된다. 일부 구현예에서, CD8A, CD8B, EOMES, GZMA, GZMB, IFNG 및 PRF1의 발현 수준이 계측된다.
일부 구현예에서, CXCL9, CXCL10, CXCL11, 또는 CXCL13 중 하나 이상의 발현 수준이 계측된다. 일부 구현예에서, CXCL9, CXCL10, CXCL11 또는 CXCL13 중 적어도 2개 또는 적어도 3개의 발현 수준이 계측된다. 일부 구현예에서, CXCL9, CXCL10, CXCL11 및 CXCL13의 발현 수준이 계측된다.
일부 구현예에서, GZMB, KLRK1, 또는 SLAMF7 중 하나 이상의 발현 수준이 계측된다. 일부 구현예에서, GZMB, KLRK1, 또는 SLAMF7 중 적어도 2개의 발현 수준이 계측된다. 일부 구현예에서, GZMB, KLRK1, 및 SLAMF7의 발현 수준이 계측된다.
일부 구현예에서, 참조 수준은 (i) 항암 요법의 투여 이전에 수득된 환자 유래의 생물학적 샘플 내 하나 이상의 유전자의 발현 수준; (ⅱ) 참조 집단에서 하나 이상의 유전자의 발현 수준; (ⅲ) 하나 이상의 유전자에 대한 사전-배정된 발현 수준; (ⅳ) 항암 요법의 투여 후인, 사전 시점에서 환자로부터 수득된 생물학적 샘플 내 하나 이상의 유전자의 발현 수준; 또는 (v) 후속 시점에서 환자로부터 수득된 생물학적 샘플 내 하나 이상의 유전자의 발현 수준으로 이루어진 군으로부터 선택된다. 일부 구현예에서, 하나 이상의 유전자의 발현 수준은, 참조 수준과 비교하여 환자로부터 수득된 생물학적 샘플 내에서 증가된다.
일부 구현예에서, CD8A, CD8B, EOMES, GZMA, GZMB, IFNG 또는 PRF1 중 하나 이상의 발현 수준은 참조 수준과 비교하여 적어도 약 2배 증가된다. 일부 구현예에서, CD8A, CD8B, EOMES, GZMA, GZMB, IFNG 또는 PRF1 중 하나 이상의 발현 수준은 참조 수준과 비교하여 적어도 약 15배 증가된다. 일부 구현예에서, CD8A, CD8B, EOMES, GZMA, GZMB, IFNG, 또는 PRF1 중 하나 이상의 발현 수준은 참조 수준과 비교하여 적어도 약 50배 증가된다.
일부 구현예에서, CXCL9, CXCL10, CXCL11, 또는 CXCL13 중 하나 이상의 발현 수준은 참조 수준과 비교하여 적어도 약 3배 증가된다. 일부 구현예에서, CXCL9, CXCL10, CXCL11, 또는 CXCL13 중 하나 이상의 발현 수준은 참조 수준과 비교하여 적어도 약 80배 증가된다. 일부 구현예에서, CXCL9, CXCL10, CXCL11, 또는 CXCL13 중 하나 이상의 발현 수준은 참조 수준과 비교하여 적어도 약 250배 증가된다.
일부 구현예에서, GZMB, KLRK1, 또는 SLAMF7 중 하나 이상의 발현 수준은 참조 수준과 비교하여 적어도 약 2배 증가된다. 일부 구현예에서, GZMB, KLRK1, 또는 SLAMF7 중 하나 이상의 발현 수준은 참조 수준과 비교하여 적어도 약 8배 증가된다. 일부 구현예에서, GZMB, KLRK1, 또는 SLAMF7 중 하나 이상의 발현 수준은 참조 수준과 비교하여 적어도 약 13배 증가된다.
일부 구현예에서, 하나 이상의 유전자의 증가된 발현 수준은 환자가 VEGF 길항제에 반응함을 표지한다.
또 다른 양태에서, 본 발명은 VEGF 길항제 및 PD-L1 축 결합 길항제를 포함하는 항암 요법으로의 치료에 대한 신장암을 갖는 환자의 반응을 모니터링하는 방법을 특징으로 하며, 상기 방법은 하기를 포함한다: (a) 항암 요법의 투여 후 시점에서 환자로부터 수득된 생물학적 샘플 내 MHC-I의 발현 수준을 계측하는 단계; 및 (b) 생물학적 샘플 내 MHC-I의 발현 수준과 참조 수준을 비교하고, 이로써 항암 요법으로의 치료에 대한 환자의 반응을 모니터링하는 단계. 일부 구현예에서, 참조 수준은 (i) 항암 요법의 투여 이전에 수득된 환자 유래의 생물학적 샘플 내 MHC-I의 발현 수준; (ⅱ) 참조 집단에서 MHC-I의 발현 수준; (ⅲ) MHC-I에 대한 사전-배정된 발현 수준; (ⅳ) 항암 요법의 투여 후인, 사전 시점에서 환자로부터 수득된 생물학적 샘플 내 MHC-I의 발현 수준; 또는 (v) 후속 시점에서 환자로부터 수득된 생물학적 샘플 내 MHC-I의 발현 수준으로 이루어진 군으로부터 선택된다.
일부 구현예에서, MHC-I의 발현 수준은, 참조 수준과 비교하여 환자로부터 수득된 생물학적 샘플 내에서 증가된다. 일부 구현예에서, MHC-I의 발현 수준은 참조 수준과 비교하여 적어도 2배 증가된다. 일부 구현예에서, MHC-I의 증가된 발현 수준은 환자가 항암 요법에 반응함을 표지한다.
또 다른 양태에서, 본 발명은 VEGF 길항제 및 PD-L1 축 결합 길항제를 포함하는 항암 요법으로의 치료에 대한 신장암을 갖는 환자의 반응을 모니터링하는 방법을 특징으로 하며, 상기 방법은 하기를 포함한다: (a) 항암 요법의 투여 후 시점에서 환자로부터 수득된 생물학적 샘플에서, 하기 유전자 중 하나 이상의 발현 수준을 계측하는 단계: CX3CR1, CCL2, CCL5, CCR5, CX3CL1, CCR7, 또는 CXCL10; 및 (b) 생물학적 샘플 내 하나 이상의 유전자의 발현 수준을 참조 수준과 비교하고, 이로써 상기 항암 요법으로의 치료에 대한 환자의 반응을 모니터링하는 단계.
일부 구현예에서, CX3CR1, CCL2, CCL5, CCR5, CX3CL1, CCR7, 또는 CXCL10 중 적어도 2개, 적어도 3개, 적어도 4개, 적어도 5개 또는 적어도 6개의 발현 수준이 계측된다. 일부 구현예에서, CX3CR1, CCL2, CCL5, CCR5, CX3CL1, CCR7 및 CXCL10의 발현 수준이 계측된다.
일부 구현예에서, 참조 수준은 (i) 항암 요법의 투여 이전에 수득된 환자 유래의 생물학적 샘플 내 하나 이상의 유전자의 발현 수준; (ⅱ) 참조 집단에서 하나 이상의 유전자의 발현 수준; (ⅲ) 하나 이상의 유전자에 대한 사전-배정된 발현 수준; (ⅳ) 항암 요법의 투여 후인, 사전 시점에서 환자로부터 수득된 생물학적 샘플 내 하나 이상의 유전자의 발현 수준; 또는 (v) 후속 시점에서 환자로부터 수득된 생물학적 샘플 내 하나 이상의 유전자의 발현 수준으로 이루어진 군으로부터 선택된다.
일부 구현예에서, 하나 이상의 유전자의 발현 수준은 참조 수준과 비교하여 증가된다. 일부 구현예에서, 하나 이상의 유전자의 증가된 발현 수준은 환자가 항암 요법에 반응함을 표지한다.
선행 양태 중 임의의 것의 일부 구현예에서, 환자 유래의 생물학적 샘플은 항암 요법의 투여로부터 약 4 내지 약 6주 후에 수득된다. 일부 구현예에서, 상기 방법은, MHC-I 또는 하나 이상의 유전자의 발현 수준이 참조 수준과 비교하여 증가된 환자에게 1회 이상의 추가 용량의 항암 요법을 투여하는 단계를 추가로 포함한다.
또 다른 양태에서, 본 발명은 VEGF 길항제 및 PD-L1 축 결합 길항제를 포함하는 항암 요법으로 신장암을 갖는 환자를 치료하는 방법을 특징으로 하며, 상기 방법은 하기를 포함한다: (a) 항암 요법의 투여 후 시점에서 환자로부터 수득된 생물학적 샘플에서, 하기 유전자 중 하나 이상의 발현 수준을 계측하는 단계: CD8A, CD8B, EOMES, GZMA, GZMB, IFNG, 또는 PRF1; CXCL9, CXCL10, CXCL11, 또는 CXCL13; 또는 GZMB, KLRK1, 또는 SLAMF7; (b) 생물학적 샘플 내 하나 이상의 유전자의 발현 수준을 참조 수준과 비교하는 단계; 및 (c) 이들의 하나 이상의 유전자의 발현 수준이 참조 수준과 비교하여 증가될 경우, 환자에게 항암 요법을 투여하는 것을 계속하는 단계.
일부 구현예에서, CD8A, CD8B, EOMES, GZMA, GZMB, IFNG, 또는 PRF1 중 하나 이상의 발현 수준은 종양 미세환경 내 CD8+ T 효과기 (Teff) 세포의 존재와 상관관계가 있다. 일부 구현예에서, CXCL9, CXCL10, CXCL11, 또는 CXCL13 중 하나 이상의 발현 수준은 종양 미세환경 내 Th1 케모카인의 존재와 상관관계가 있다. 일부 구현예에서, GZMB, KLRK1, 또는 SMALF7의 존재는 종양 미세환경에서 자연 살해(NK) 세포의 존재와 상관관계가 있다.
일부 구현예에서, CD8A, CD8B, EOMES, GZMA, GZMB, IFNG, 또는 PRF1 중 하나 이상의 발현 수준이 계측된다. 일부 구현예에서, CD8A, CD8B, EOMES, GZMA, GZMB, IFNG, 또는 PRF1 중 적어도 2개, 적어도 3개, 적어도 4개, 적어도 5개, 또는 적어도 6개의 발현 수준이 계측된다. 일부 구현예에서, CD8A, CD8B, EOMES, GZMA, GZMB, IFNG, 및 PRF1의 발현 수준이 계측된다.
일부 구현예에서, CXCL9, CXCL10, CXCL11, 또는 CXCL13 중 하나 이상의 발현 수준이 계측된다. 일부 구현예에서, CXCL9, CXCL10, CXCL11, 또는 CXCL13 중 적어도 2개, 또는 적어도 3개의 발현 수준이 계측된다. 일부 구현예에서, CXCL9, CXCL10, CXCL11, 및 CXCL13의 발현 수준이 계측된다.
일부 구현예에서, GZMB, KLRK1, 또는 SLAMF7 중 하나 이상의 발현 수준이 계측된다. 일부 구현예에서, GZMB, KLRK1, 또는 SLAMF7 중 적어도 2개의 발현 수준이 계측된다. 일부 구현예에서, GZMB, KLRK1, 및 SLAMF7의 발현 수준이 계측된다.
일부 구현예에서, 참조 수준은 (i) 항암 요법의 투여 이전에 수득된 환자 유래의 생물학적 샘플 내 하나 이상의 유전자의 발현 수준; (ⅱ) 참조 집단에서 하나 이상의 유전자의 발현 수준; (ⅲ) 하나 이상의 유전자에 대한 사전-배정된 발현 수준; (ⅳ) 항암 요법의 투여 후인, 사전 시점에서 환자로부터 수득된 생물학적 샘플 내 하나 이상의 유전자의 발현 수준; 또는 (v) 후속 시점에서 환자로부터 수득된 생물학적 샘플 내 하나 이상의 유전자의 발현 수준으로 이루어진 군으로부터 선택된다.
일부 구현예에서, CD8A, CD8B, EOMES, GZMA, GZMB, IFNG 또는 PRF1 중 하나 이상의 발현 수준은 참조 수준과 비교하여 적어도 약 2배 증가된다. 일부 구현예에서, CD8A, CD8B, EOMES, GZMA, GZMB, IFNG, 또는 PRF1 중 하나 이상의 발현 수준은 참조 수준과 비교하여 적어도 약 15배 증가된다. 일부 구현예에서, CD8A, CD8B, EOMES, GZMA, GZMB, IFNG, 또는 PRF1 중 하나 이상의 발현 수준은 참조 수준과 비교하여 적어도 약 50배 증가된다.
일부 구현예에서, CXCL9, CXCL10, CXCL11, 또는 CXCL13 중 하나 이상의 발현 수준은 참조 수준과 비교하여 적어도 약 3배 증가된다. 일부 구현예에서, CXCL9, CXCL10, CXCL11, 또는 CXCL13 중 하나 이상의 발현 수준은 참조 수준과 비교하여 적어도 약 80배 증가된다. 일부 구현예에서, CXCL9, CXCL10, CXCL11, 또는 CXCL13 중 하나 이상의 발현 수준은 참조 수준과 비교하여 적어도 약 250배 증가된다.
일부 구현예에서, GZMB, KLRK1, 또는 SLAMF7 중 하나 이상의 발현 수준은 참조 수준과 비교하여 적어도 약 2배 증가된다. 일부 구현예에서, GZMB, KLRK1, 또는 SLAMF7 중 하나 이상의 발현 수준은 참조 수준과 비교하여 적어도 약 8배 증가된다. 일부 구현예에서, GZMB, KLRK1, 또는 SLAMF7 중 하나 이상의 발현 수준은 참조 수준과 비교하여 적어도 약 13배 증가된다.
또 다른 양태에서, 본 발명은 VEGF 길항제 및 PD-L1 축 결합 길항제를 포함하는 항암 요법으로 신장암을 갖는 환자를 치료하는 방법을 특징으로 하며, 상기 방법은 하기를 포함한다: (a) 항암 요법의 투여 후 시점에서 환자로부터 수득된 생물학적 샘플 내 MHC-I의 발현 수준을 계측하는 단계; (b) 생물학적 샘플 내 MHC-I의 발현 수준과 참조 수준을 비교하는 단계; 및 (c) 이들의 하나 이상의 유전자의 발현 수준이 참조 수준과 비교하여 증가될 경우, 환자에게 항암 요법을 투여하는 것을 계속하는 단계. 일부 구현예에서, 참조 수준은 (i) VEGF 길항제의 투여 이전에 수득된 환자 유래의 생물학적 샘플 내 MHC-I의 발현 수준; (ⅱ) 참조 집단에서 MHC-I의 발현 수준; (ⅲ) MHC-I에 대한 사전-배정된 발현 수준; (ⅳ) VEGF 길항제의 투여 후인, 사전 시점에서 환자로부터 수득된 생물학적 샘플 내 MHC-I의 발현 수준; 또는 (v) 후속 시점에서 환자로부터 수득된 생물학적 샘플 내 MHC-I의 발현 수준으로 이루어진 군으로부터 선택된다. 일부 구현예에서, MHC-I의 발현 수준은 참조 수준과 비교하여 적어도 2배 증가된다.
또 다른 양태에서, 본 발명은 VEGF 길항제 및 PD-L1 축 결합 길항제를 포함하는 항암 요법으로 신장암을 갖는 환자를 치료하는 방법을 특징으로 하며, 상기 방법은 하기를 포함한다: (a) 항암 요법의 투여 후 시점에서 환자로부터 수득된 생물학적 샘플에서, 하기 유전자 중 하나 이상의 발현 수준을 계측하는 단계: CX3CR1, CCL2, CCL5, CCR5, CX3CL1, CCR7, 또는 CXCL10; (b) 생물학적 샘플 내 하나 이상의 유전자의 발현 수준을 참조 수준과 비교하는 단계; 및 (c) 이들의 하나 이상의 유전자의 발현 수준이 참조 수준과 비교하여 증가될 경우, 환자에게 항암 요법을 투여하는 것을 계속하는 단계. 일부 구현예에서, CX3CR1, CCL2, CCL5, CCR5, CX3CL1, CCR7, 또는 CXCL10 중 적어도 2개, 적어도 3개, 적어도 4개, 적어도 5개, 또는 적어도 6개의 발현 수준이 계측된다. 일부 구현예에서, CX3CR1, CCL2, CCL5, CCR5, CX3CL1, CCR7, 및 CXCL10의 발현 수준이 계측된다. 일부 구현예에서, 참조 수준은 (i) 항암 요법의 투여 이전에 수득된 환자 유래의 생물학적 샘플 내 하나 이상의 유전자의 발현 수준; (ⅱ) 참조 집단에서 하나 이상의 유전자의 발현 수준; (ⅲ) 하나 이상의 유전자에 대한 사전-배정된 발현 수준; (ⅳ) 항암 요법의 투여 후인, 사전 시점에서 환자로부터 수득된 생물학적 샘플 내 하나 이상의 유전자의 발현 수준; 또는 (v) 후속 시점에서 환자로부터 수득된 생물학적 샘플 내 하나 이상의 유전자의 발현 수준으로 이루어진 군으로부터 선택된다.
선행 양태 중 임의의 것의 일부 구현예에서, 환자 유래의 생물학적 샘플은 항암 요법의 투여로부터 약 4 내지 약 6주 후에 수득된다. 일부 구현예에서, 상기 VEGF 길항제는 항-VEGF 항체, 예컨대 베바시주맙이다. 일부 구현예에서, PD-L1 축 결합 길항제는 PD-L1 결합 길항제, PD-1 결합 길항제, 및 PD-L2 결합 길항제로 이루어진 군으로부터 선택된다.
선행 양태 중 임의의 것의 일부 구현예에서, PD-L1 축 결합 길항제는 PD-L1 결합 길항제이다. 일부 구현예에서, PD-L1 결합 길항제는 PD-L1의 이의 리간드 결합 상대 중 하나 이상에 대한 결합을 억제한다. 일부 구현예에서, PD-L1 결합 길항제는 PD-1에 대한 PD-L1의 결합을 억제한다. 일부 구현예에서, PD-L1 결합 길항제는 B7-1에 대한 PD-L1의 결합을 억제한다. 일부 구현예에서, PD-L1 결합 길항제는 PD-1 및 B7-1 둘 모두에 대한 PD-L1의 결합을 억제한다.
일부 구현예에서, PD-L1 결합 길항제는 항체이다. 일부 구현예에서, 항체는 하기로 이루어진 군으로부터 선택된다: MPDL3280A (아테졸리주맙), YW243.55.S70, MDX-1105, MEDI4736 (두르발루맙), 및 MSB0010718C (아벨루맙). 일부 구현예에서, 상기 항체는 서열 번호 19의 HVR-H1 서열, 서열 번호 20의 HVR-H2 서열, 및 서열 번호 21의 HVR-H3 서열을 포함하는 중쇄; 및 서열 번호 22의 HVR-L1 서열, 서열 번호 23의 HVR-L2 서열, 및 서열 번호 24의 HVR-L3 서열을 포함하는 경쇄를 포함한다. 일부 구현예에서, 항체는 서열 번호 26의 아미노산 서열을 포함하는 중쇄 가변 영역 및 서열 번호 4의 아미노산 서열을 포함하는 경쇄 가변 영역을 포함한다.
일부 구현예에서, PD-L1 축 결합 길항제는 PD-1 결합 길항제이다. 일부 구현예에서, PD-1 결합 길항제는 PD-1의 이의 리간드 결합 상대의 하나 이상에 대한 결합을 억제한다. 일부 구현예에서, PD-1 결합 길항제는 PD-L1에 대한 PD-1의 결합을 억제한다. 일부 구현예에서, PD-1 결합 길항제는 PD-L2에 대한 PD-1의 결합을 억제한다. 일부 구현예에서, PD-1 결합 길항제는 PD-L1 및 PD-L2 둘 모두에 대한 PD-1의 결합을 억제한다.
일부 구현예에서, PD-1 결합 길항제는 항체이다. 일부 구현예에서, 항체는 하기로 이루어진 군으로부터 선택된다: MDX-1106 (니볼루맙), MK-3475 (펨브롤리주맙), CT-011 (피딜리주맙), MEDI-0680 (AMP-514), PDR001, REGN2810, 및 BGB-108. 일부 구현예에서, PD-1 결합 길항제는 Fc-융합 단백질이다. 일부 구현예에서, Fc-융합 단백질은 AMP-224이다.
선행 양태 중 임의의 것의 일부 구현예에서, 본 방법은 환자에게 추가 치료제를 투여하는 단계를 추가로 포함한다. 일부 구현예에서, 추가 치료제는 하기로 이루어진 군으로부터 선택된다: 면역치료제, 세포독성제, 성장 억제제, 방사선 치료제, 항-혈관형성제, 및 이들의 조합.
선행 양태 중 임의의 것의 일부 구현예에서, 신장암은 신장 세포 암종이다. 일부 구현예에서, 신장 세포 암종은 전이성 신장세포 암종이다.
선행 양태 중 임의의 것의 일부 구현예에서, 발현 수준은 mRNA 발현 수준이다. 일부 구현예에서, mRNA 발현 수준은 정량적 폴리머라제 연쇄 반응 (qPCR), 역전사 qPCR (RT-qPCR), RNA 서열분석, 마이크로어레이 분석, 동일계내 하이브리드화(in situ hybridization), 및 유전자 발현의 연속 분석 (SAGE)으로 이루어진 군으로부터 선택된 방법을 사용하여 계측된다.
선행 양태 중 임의의 것의 일부 구현예에서, 발현 수준은 단백질 발현 수준이다. 일부 구현예에서, 단백질 발현 수준은 면역조직화학 (IHC), 면역형광, 질량 분광분석, 유세포측정(flow cytometry) 및 웨스턴 블롯으로 이루어진 군으로부터 선택된 방법을 사용하여 계측된다.
선행 양태 중 임의의 것의 일부 구현예에서, 환자로부터 수득된 생물학적 샘플은 종양 샘플 또는 세포 샘플이다. 일부 구현예에서, 종양 샘플은 포르말린 고정및 파라핀 포매된, 신선한, 또는 보관, 또는 동결된 것이다. 일부 구현예에서, 세포 샘플은 말초 CD8+ T 세포를 포함한다.
선행 양태 중 임의의 것의 일부 구현예에서, 환자는 인간 환자이다.
또 다른 양태에서, 본 발명은 신장암을 앓는 환자를 치료하는 방법에서 사용하기 위한 VEGF 길항제 및 PD-L1 축 결합 길항제를 포함하는 항암 요법을 특징으로 하며, 여기서 환자로부터 수득된 생물학적 샘플은 참조 수준과 비교하여 하기 유전자 중 하나 이상의 발현 수준이 증가된 것으로 계측된다: CD8A, CD8B, EOMES, GZMA, GZMB, IFNG, 또는 PRF1; CXCL9, CXCL10, CXCL11, 또는 CXCL13; 또는 GZMB, KLRK1, 또는 SLAMF7.
또 다른 양태에서, 본 발명은 신장암을 앓는 환자를 치료하는 방법에서 사용하기 위한 약제의 제조에 있어서의 VEGF 길항제 및 PD-L1 축 결합 길항제를 포함하는 항암 요법의 용도를 특징으로 하며, 여기서 환자로부터 수득된 생물학적 샘플은 참조 수준과 비교하여 하기 유전자 중 하나 이상의 발현 수준이 증가된 것으로 계측된다: CD8A, CD8B, EOMES, GZMA, GZMB, IFNG, 또는 PRF1; CXCL9, CXCL10, CXCL11, 또는 CXCL13; 또는 GZMB, KLRK1, 또는 SLAMF7.
또 다른 양태에서, 본 발명은 신장암을 앓는 환자의 치료에서 사용하기 위한 VEGF 길항제 및 PD-L1 축 결합 길항제를 포함하는 조성물을 특징으로 하며, 여기서 환자로부터 수득된 생물학적 샘플은 참조 수준과 비교하여 하기 유전자 중 하나 이상의 발현 수준이 증가된 것으로 계측된다: CD8A, CD8B, EOMES, GZMA, GZMB, IFNG, 또는 PRF1; CXCL9, CXCL10, CXCL11, 또는 CXCL13; 또는 GZMB, KLRK1, 또는 SLAMF7.
또 다른 양태에서, 본 발명은 신장암을 앓는 환자를 치료하는 방법에서 사용하기 위한 VEGF 길항제 및 PD-L1 축 결합 길항제를 포함하는 항암 요법을 특징으로 하며, 여기서 환자로부터 수득된 생물학적 샘플은 참조 수준과 비교하여 MHC-I의 발현 수준이 증가된 것으로 계측된다.
또 다른 양태에서, 본 발명은 신장암을 앓는 환자의 치료에서 사용하기 위한 약제의 제조에 있어서의 VEGF 길항제 및 PD-L1 축 결합 길항제를 포함하는 항암 요법의 용도를 특징으로 하며, 여기서 환자로부터 수득된 생물학적 샘플은 참조 수준과 비교하여 MHC-I의 발현 수준이 증가된 것으로 계측된다.
또 다른 양태에서, 본 발명은 신장암을 앓는 환자의 치료에서 사용하기 위한 VEGF 길항제 및 PD-L1 축 결합 길항제를 포함하는 조성물을 특징으로 하며, 여기서 환자로부터 수득된 생물학적 샘플은 참조 수준과 비교하여 MHC-I의 발현 수준이 증가된 것으로 계측된다.
또 다른 양태에서, 본 발명은 신장암을 앓는 환자를 치료하는 방법에서 사용하기 위한 VEGF 길항제 및 PD-L1 축 결합 길항제를 포함하는 항암 요법을 특징으로 하며, 여기서 환자로부터 수득된 생물학적 샘플은 참조 수준과 비교하여 CX3CR1, CCL2, CCL5, CCR5, CX3CL1, 또는 CCR7로부터 선택된 하나 이상의 유전자의 발현 수준이 증가된 것으로 계측된다.
또 다른 양태에서, 본 발명은 신장암을 앓는 환자의 치료에서 사용하기 위한 약제의 제조에 있어서의 VEGF 길항제 및 PD-L1 축 결합 길항제를 포함하는 항암 요법의 용도를 특징으로 하며, 여기서 환자로부터 수득된 생물학적 샘플은 참조 수준과 비교하여 CX3CR1, CCL2, CCL5, CCR5, CX3CL1, 또는 CCR7로부터 선택된 하나 이상의 유전자의 발현 수준이 증가된 것으로 계측된다.
또 다른 양태에서, 본 발명은 신장암을 앓는 환자의 치료에서 사용하기 위한 VEGF 길항제 및 PD-L1 축 결합 길항제를 포함하는 조성물을 특징으로 하며, 여기서 환자로부터 수득된 생물학적 샘플은 참조 수준과 비교하여 CX3CR1, CCL2, CCL5, CCR5, CX3CL1 또는 CCR7로부터 선택된 하나 이상의 유전자의 발현 수준이 증가된 것으로 계측된다. 일부 구현예에서, PD-L1 축 결합 길항제는 PD-L1 결합 길항제이다. 일부 구현예에서, PD-L1 결합 길항제는 항체이다. 일부 구현예에서, 항체는 하기로 이루어진 군으로부터 선택된다: MPDL3280A (아테졸리주맙), YW243.55.S70, MDX-1105, MEDI4736 (두르발루맙), 및 MSB0010718C (아벨루맙). 일부 구현예에서, 상기 VEGF 길항제는 항-VEGF 항체이다. 일부 구현예에서, 상기 항-VEGF 항체는 베바시주맙이다.
또 다른 양태에서, 본 발명은 VEGF 길항제 및 PD-L1 축 결합 길항제를 포함하는 항암 요법으로 치료된, 신장암을 갖는 환자의 반응을 모니터링하는 방법을 특징으로 하며, 상기 방법은 하기를 포함한다: (a) 항암 요법의 투여 후 시점에서 환자로부터 수득된 종양 샘플 내 CD8+ T 세포 및/또는 CD68+/CD163+ 대식세포의 수를 계측하는 단계; 및 (b) 종양 샘플 내 CD8+ T 세포 및/또는 CD68+/CD163+ 대식세포의 수를 참조 샘플과 비교하고, 이로써 진행중인 항암 요법으로의 치료에 대한 환자의 반응을 모니터링하는 단계.
또 다른 양태에서, 본 발명은 VEGF 길항제 및 PD-L1 축 결합 길항제를 포함하는 항암 요법으로 신장암을 갖는 환자를 치료하는 방법을 특징으로 하며, 상기 방법은 하기를 포함한다: (a) 항암 요법의 투여 후 시점에서 환자로부터 수득된 종양 샘플 내 CD8+ T 세포 및/또는 CD68+/CD163+ 대식세포의 수를 계측하는 단계; (b) 종양 샘플 내 CD8+ T 세포 및/또는 CD68+/CD163+ 대식세포의 수를 참조 샘플과 비교하는 단계; 및 (c) 환자 샘플 내 CD8+ T 세포 및/또는 CD68+/CD163+ 대식세포의 수가 참조 수준과 비교하여 증가될 경우, 환자에게 항암 요법을 투여하는 것을 계속하는 단계. 일부 구현예에서, 환자로부터 수득된 종양 샘플은 참조 샘플과 비교하여 CD8+ T 세포의 수가 증가하였다. 일부 구현예에서, 환자로부터 수득된 종양 샘플은 참조 샘플과 비교하여 CD8+ T 세포의 수가 적어도 2배 증가하였다. 일부 구현예에서, 환자로부터 수득된 종양 샘플은 참조 샘플과 비교하여 CD8+ T 세포의 수가 5배 증가하였다. 일부 구현예에서, 환자로부터 수득된 종양 샘플은 참조 샘플과 비교하여 CD68+/CD163+ 대식세포의 수가 증가하였다.
선행 양태 중 임의의 것의 일부 구현예에서, 참조 샘플은 항암 요법의 투여 이전에 수득된 환자 유래의 종양 샘플이다.
도 1은 아테졸리주맙 및 베바시주맙 병용 치료를 받는 신장 세포 암종 (RCC) 환자의 종양 부하를 경시적으로 나타낸 그래프이다. 그래프 상의 점은 표적 병변에 대한 가장 긴 직경 (SLD)의 합계에서 기준선으로부터의 최대 감소를 나타낸다. PR, 부분 반응; PD, 진행성 질환; SD, 무변성 질환.
도 2는 각 RCC 환자에 대한 연구 치료의 지속 기간을 보여주는 그래프이다. 제1 PR 또는 CR 시간은 원으로 표시되며; 제1 PD의 시간은 삼각형으로 표시되며; 치료 중단은 흑색 막대로 표시되고; 및 분석 시점에서 치료를 받고 있는 환자는 화살표로 표시된다.
도 3은 베바시주맙 ("Bev") 치료 후 종양 바이오마커의 유전자 발현 수준을 나타낸 그래프이다. 치료중(on-treatment) 종양 샘플의 발현 수준은 기준선 발현 수준 (전처리)과 관련하여 나타낸다. 혈관 특질 유전자 (ANGPT2, CD34, DLL4, EGFL7 및 ESM1)가 흑색으로 표시되며, CD8 T 세포 효과기 유전자 (CD8A, CD8B, EOMES, GZMA, IFNG 및 PRF1)는 패턴화된 회색으로 표시되며, Th1 케모카인 (CXCL10, CXCL11, CXCL13 및 CXCL9)은 백색으로 표시되고, 자연 살해 (NK) 세포 유전자 (GZMB, KLRK1 및 SLAMF7)는 완전 회색(solid gray)으로 표시된다.
도 4는 아테졸리주맙 및 베바시주맙 병용 ("Bev+Atezo") 치료 후 종양 바이오마커의 유전자 발현 수준을 나타낸 그래프이다. 치료중(on-treatment) 종양 샘플의 발현 수준은 기준선 발현 수준 (전처리)과 관련하여 나타낸다. 혈관 특질 유전자 (ANGPT2, CD34, DLL4, EGFL7 및 ESM1)가 흑색으로 표시되며, CD8 T 세포 효과기 유전자 (CD8A, CD8B, EOMES, GZMA, IFNG 및 PRF1)는 패턴화된 회색으로 표시되며, Th1 케모카인 (CXCL10, CXCL11, CXCL13 및 CXCL9)은 백색으로 표시되고, NK 세포 유전자 (GZMB, KLRK1 및 SLAMF7)는 완전 회색으로 표시된다.
도 5는 면역조직화학 (IHC)에 의하여 평가 시 환자 3 유래의 종양 샘플 내 면역 및 맥관구조 마커의 단백질 발현을 나타내는 일련의 대표적인 이미지이다. CD31은 암회색으로 염색되어 있으며 (제1 행), CD8은 암회색으로 염색되어 있으며 (제2 행), MHC-I는 암회색으로 염색되어 있으며 (제3 행), 및 PD-L1은 암회색으로 염색되어 있다 (제4 행). 전처리 샘플은 왼쪽 칼럼에 나타나 있으며, 베바시주맙-후 샘플은 중간 칼럼에 나타나 있으며, 베바시주맙+아테졸리주맙-후 샘플은 오른쪽 칼럼에 나타나 있다.
도 6은 IHC에 의해 평가 시, 지시된 시점에서의 면역 및 혈관(vasculature) 마커의 정량화를 나타내는 일련의 그래프이다. CD31 발현은 최상부 패널에 나타나 있으며, CD8 발현은 중간 패널에 나타나 있으며, MHC-I 발현은 하단 패널에 나타나 있다. P 값은 쌍형성된 t-시험에 의해 계측되었다. "VPOSVE"는 혈관 밀도의 척도이다.
도 7은 IHC에 의해 평가된, 환자 3 유래의 종양 샘플의 연속 절편으로부터 면역 및 맥관구조 마커의 단백질 발현을 나타내는 일련의 대표적인 이미지이다. 제1 행은 CD34, 알파 평활근 액틴 (αSMA) 및 포도플라닌의 발현을 나타낸다. 제2 행은 CD8 및 Ki67의 발현을 나타낸다. 제3 행은 CD68 및 CD163의 발현을 나타낸다. 전처리 샘플은 왼쪽 칼럼에 나타나 있으며, 베바시주맙-후 샘플은 중간 칼럼에 나타나 있으며, 및 베바시주맙+아테졸리주맙-후 샘플은 오른쪽 칼럼에 나타나 있다.
도 8은 IHC에 의해 평가된, 종양 샘플에서의 CD34 및 αSMA의 단백질 발현을 나타내는 일련의 대표적인 이미지이다. 전처리 샘플은 왼쪽 칼럼에 나타나 있으며, 베바시주맙-후 샘플은 중간 칼럼에 나타나 있으며, 및 베바시주맙+아테졸리주맙-후 샘플은 오른쪽 칼럼에 나타나 있다. 개별 환자 1-6의 섹션이 각각의 행에 배열된다. 각 환자의 반응도 또한 표시된다.
도 9는 IHC에 의해 평가 시, 종양의 연속 절편으로부터 면역 및 맥관구조 마커의 단백질 발현을 나타내는 일련의 대표적인 이미지이다. 제1 행은 CD34, αSMA 및 포도플라닌의 발현을 나타낸다. 제2 행은 CD8 및 Ki67의 발현을 나타낸다. 제3 행은 CD68 및 CD163의 발현을 나타낸다. 베바시주맙-후 샘플은 왼쪽 칼럼에 나타나 있으며, 및 베바시주맙+아테졸리주맙-후 샘플은 오른쪽 칼럼에 나타나 있다.
도 10은 IHC에 의해 평가된, 종양 베바시주맙+아테졸리주맙-후의 연속 절편으로부터 면역 및 맥관구조 마커의 단백질 발현을 나타내는 일련의 대표적인 이미지이다. 상부의 이미지는 CD34, αSMA 및 포도플라닌의 발현을 나타낸다. 중간 이미지는 CD8 및 Ki67의 발현을 나타낸다. 하단의 이미지는 CD68 및 CD163의 발현을 나타낸다.
도 11은 베바시주맙 및 베바시주맙 + 아테졸리주맙 치료에 반응하여 종양에서의 VEGF 전사체 발현의 상향조절을 나타내는 그래프이다. 발현은 하우스 키핑 (HK) 유전자 발현으로 정규화된다. 각각의 라인은 개별 환자를 나타낸다.
도 12는 IHC에 의해 평가 시, 종양 절편으로부터 CD8 (염색된 암회색)의 단백질 발현을 나타내는 일련의 대표적인 이미지이다. 전처리 샘플은 왼쪽 칼럼에 나타나 있으며, 베바시주맙-후 샘플은 중간 칼럼에 나타나 있으며, 및 베바시주맙+아테졸리주맙-후 샘플은 오른쪽 칼럼에 나타나 있다. 개별 환자 1-6의 섹션이 각각의 행에 배열된다. 각 환자의 반응도 또한 표시된다.
도 13은 IHC에 의해 평가 시, 종양 절편 유래의 CD8 및 Ki67의 단백질 발현을 나타내는 일련의 대표적인 이미지이다. 전처리 샘플은 왼쪽 칼럼에 나타나 있으며, 베바시주맙-후 샘플은 중간 칼럼에 나타나 있으며, 베바시주맙+아테졸리주맙-후 샘플은 오른쪽 칼럼에 나타나 있다. 개별 환자 1-6의 섹션이 각각의 행에 배열된다.
도 14a 내지 도 14c는 전처리 시점에서 각각의 환자의 경우, 종양 면적 제곱 밀리미터(㎟) 당 CD8, 또는 Ki67 및 CD8 모두를 발현하는 세포의 수를 나타내는 일련의 그래프이다. 도 14a는 환자 1 및 2에 대한 데이터를 나타낸다. 도 14b는 환자 3 및 4에 대한 데이터를 나타낸다. 도 14c는 환자 5에 대한 데이터를 나타낸다. 각 환자의 반응도 또한 표시된다.
도 15a 내지 도 15c는 베바시주맙 이후 시점에서 각각의 환자의 경우, 종양 면적 ㎟ 당 CD8, 또는 Ki67 및 CD8 모두를 발현하는 세포의 수를 나타내는 일련의 그래프이다. 도 15a는 환자 1 및 2에 대한 데이터를 나타낸다. 도 15b는 환자 3 및 5에 대한 데이터를 나타낸다. 도 15c는 환자 6에 대한 데이터를 나타낸다. 각 환자의 반응도 또한 표시된다.
도 16a 내지 도 16c는 베바시주맙+아테졸리주맙-후 시점에서 각각의 환자의 경우, 종양 면적 ㎟ 당 CD8, 또는 Ki67 및 CD8 모두를 발현하는 세포의 수를 나타내는 일련의 그래프이다. 도 16a는 환자 1 및 2에 대한 데이터를 나타낸다. 도 16b는 환자 3 및 4에 대한 데이터를 나타낸다. 도 16c는 환자 5 및 6에 대한 데이터를 나타낸다. 각 환자의 반응도 또한 표시된다.
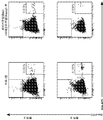
도 17a 및 17b는 CX3CR1을 발현하는 종양 샘플에서의 CD8+ 세포의 백분율을 보여주는 일련의 유세포측정 플롯이다. 전처리 샘플은 왼쪽 칼럼에 나타나 있으며, 베바시주맙-후 샘플은 중간 칼럼에 나타나 있으며, 베바시주맙+아테졸리주맙-후 샘플은 오른쪽 칼럼에 나타나 있다. 각각의 행은 개별 환자의 결과를 보여준다. 도 17a는 환자 2 및 3에 대한 데이터를 나타낸다. 도 17b는 환자 5 및 6에 대한 데이터를 나타낸다.
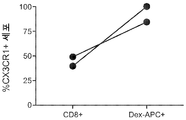
도 18은 유세포측정 분석을 기초로 한, 전체 CD8+ 세포 (왼쪽)의 백분율 및 종양 항원-특이적 (Dex-APC+) T 세포 (오른쪽)의 백분율로서의 CX3CR1의 발현을 나타내는 그래프이다.
도 19는 혈액내 항원-특이적 T 세포의 대표적인 빈도를 나타내는 일련의 유세포측정법이다. 종양 생검시점에 맞춰 채혈한 2명의 HLA-A2 양성 환자로부터의 대표적인 데이터가 나타나 있다.
도 20은 종양에서 표시된 치료 시점에서의 케모카인 발현 (CCL2, CCL5, CCR5, CX3CL1, CCR7 및 CXCL10)의 변화를 나타내는 일련의 그래프이다. 발현은 하우스 키핑 (HK) 유전자 발현으로 정규화되었다.
도 21a 내지 21c는 환자 6의 종양 샘플에서 치료 전후의 침윤 림프구 (TIL)의 TCRβ 서열분석 결과를 보여주는 일련의 그래프이다. 각각의 그룹의 최상부 클론 (최대 25개)이 표시되어 있다. 경향이 있는 TCRβ 클론 집단의 유병률은 도 21a (하부 패널), 22b 및 22c에 더 진한 선으로 표시되어 있다.
도 22는 베바시주맙 + 아테졸리주맙 치료 전후의 환자 3 TIL로부터의 TCRβ 서열분석 결과를 나타내는 그래프이다.
도 23a 및 23b는 환자 2, 3 및 6의 전처리 PBMC, 베바시주맙+아테졸리주맙-후 말초 혈액 단핵 세포 (PBMC), 및 베바시주맙+아테졸리주맙-후 TIL의 TCRβ 서열분석 결과를 보여주는 일련의 그래프이다. 도 23a는 환자 2 및 3에 대한 데이터를 도시하며, 그리고 도 23b는 환자 6에 대한 데이터를 도시한다. 각각의 그룹의 최상부 클론 (최대 25개)이 표시되어 있다.
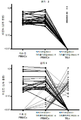
도 24는 환자 3 및 6의 각각의 치료 시점에서의 PBMC 풀(pool) 대 TIL 풀에서 바이러스성 항원-특이적 클론의 수를 나타내는 히트맵이다.
도 2는 각 RCC 환자에 대한 연구 치료의 지속 기간을 보여주는 그래프이다. 제1 PR 또는 CR 시간은 원으로 표시되며; 제1 PD의 시간은 삼각형으로 표시되며; 치료 중단은 흑색 막대로 표시되고; 및 분석 시점에서 치료를 받고 있는 환자는 화살표로 표시된다.
도 3은 베바시주맙 ("Bev") 치료 후 종양 바이오마커의 유전자 발현 수준을 나타낸 그래프이다. 치료중(on-treatment) 종양 샘플의 발현 수준은 기준선 발현 수준 (전처리)과 관련하여 나타낸다. 혈관 특질 유전자 (ANGPT2, CD34, DLL4, EGFL7 및 ESM1)가 흑색으로 표시되며, CD8 T 세포 효과기 유전자 (CD8A, CD8B, EOMES, GZMA, IFNG 및 PRF1)는 패턴화된 회색으로 표시되며, Th1 케모카인 (CXCL10, CXCL11, CXCL13 및 CXCL9)은 백색으로 표시되고, 자연 살해 (NK) 세포 유전자 (GZMB, KLRK1 및 SLAMF7)는 완전 회색(solid gray)으로 표시된다.
도 4는 아테졸리주맙 및 베바시주맙 병용 ("Bev+Atezo") 치료 후 종양 바이오마커의 유전자 발현 수준을 나타낸 그래프이다. 치료중(on-treatment) 종양 샘플의 발현 수준은 기준선 발현 수준 (전처리)과 관련하여 나타낸다. 혈관 특질 유전자 (ANGPT2, CD34, DLL4, EGFL7 및 ESM1)가 흑색으로 표시되며, CD8 T 세포 효과기 유전자 (CD8A, CD8B, EOMES, GZMA, IFNG 및 PRF1)는 패턴화된 회색으로 표시되며, Th1 케모카인 (CXCL10, CXCL11, CXCL13 및 CXCL9)은 백색으로 표시되고, NK 세포 유전자 (GZMB, KLRK1 및 SLAMF7)는 완전 회색으로 표시된다.
도 5는 면역조직화학 (IHC)에 의하여 평가 시 환자 3 유래의 종양 샘플 내 면역 및 맥관구조 마커의 단백질 발현을 나타내는 일련의 대표적인 이미지이다. CD31은 암회색으로 염색되어 있으며 (제1 행), CD8은 암회색으로 염색되어 있으며 (제2 행), MHC-I는 암회색으로 염색되어 있으며 (제3 행), 및 PD-L1은 암회색으로 염색되어 있다 (제4 행). 전처리 샘플은 왼쪽 칼럼에 나타나 있으며, 베바시주맙-후 샘플은 중간 칼럼에 나타나 있으며, 베바시주맙+아테졸리주맙-후 샘플은 오른쪽 칼럼에 나타나 있다.
도 6은 IHC에 의해 평가 시, 지시된 시점에서의 면역 및 혈관(vasculature) 마커의 정량화를 나타내는 일련의 그래프이다. CD31 발현은 최상부 패널에 나타나 있으며, CD8 발현은 중간 패널에 나타나 있으며, MHC-I 발현은 하단 패널에 나타나 있다. P 값은 쌍형성된 t-시험에 의해 계측되었다. "VPOSVE"는 혈관 밀도의 척도이다.
도 7은 IHC에 의해 평가된, 환자 3 유래의 종양 샘플의 연속 절편으로부터 면역 및 맥관구조 마커의 단백질 발현을 나타내는 일련의 대표적인 이미지이다. 제1 행은 CD34, 알파 평활근 액틴 (αSMA) 및 포도플라닌의 발현을 나타낸다. 제2 행은 CD8 및 Ki67의 발현을 나타낸다. 제3 행은 CD68 및 CD163의 발현을 나타낸다. 전처리 샘플은 왼쪽 칼럼에 나타나 있으며, 베바시주맙-후 샘플은 중간 칼럼에 나타나 있으며, 및 베바시주맙+아테졸리주맙-후 샘플은 오른쪽 칼럼에 나타나 있다.
도 8은 IHC에 의해 평가된, 종양 샘플에서의 CD34 및 αSMA의 단백질 발현을 나타내는 일련의 대표적인 이미지이다. 전처리 샘플은 왼쪽 칼럼에 나타나 있으며, 베바시주맙-후 샘플은 중간 칼럼에 나타나 있으며, 및 베바시주맙+아테졸리주맙-후 샘플은 오른쪽 칼럼에 나타나 있다. 개별 환자 1-6의 섹션이 각각의 행에 배열된다. 각 환자의 반응도 또한 표시된다.
도 9는 IHC에 의해 평가 시, 종양의 연속 절편으로부터 면역 및 맥관구조 마커의 단백질 발현을 나타내는 일련의 대표적인 이미지이다. 제1 행은 CD34, αSMA 및 포도플라닌의 발현을 나타낸다. 제2 행은 CD8 및 Ki67의 발현을 나타낸다. 제3 행은 CD68 및 CD163의 발현을 나타낸다. 베바시주맙-후 샘플은 왼쪽 칼럼에 나타나 있으며, 및 베바시주맙+아테졸리주맙-후 샘플은 오른쪽 칼럼에 나타나 있다.
도 10은 IHC에 의해 평가된, 종양 베바시주맙+아테졸리주맙-후의 연속 절편으로부터 면역 및 맥관구조 마커의 단백질 발현을 나타내는 일련의 대표적인 이미지이다. 상부의 이미지는 CD34, αSMA 및 포도플라닌의 발현을 나타낸다. 중간 이미지는 CD8 및 Ki67의 발현을 나타낸다. 하단의 이미지는 CD68 및 CD163의 발현을 나타낸다.
도 11은 베바시주맙 및 베바시주맙 + 아테졸리주맙 치료에 반응하여 종양에서의 VEGF 전사체 발현의 상향조절을 나타내는 그래프이다. 발현은 하우스 키핑 (HK) 유전자 발현으로 정규화된다. 각각의 라인은 개별 환자를 나타낸다.
도 12는 IHC에 의해 평가 시, 종양 절편으로부터 CD8 (염색된 암회색)의 단백질 발현을 나타내는 일련의 대표적인 이미지이다. 전처리 샘플은 왼쪽 칼럼에 나타나 있으며, 베바시주맙-후 샘플은 중간 칼럼에 나타나 있으며, 및 베바시주맙+아테졸리주맙-후 샘플은 오른쪽 칼럼에 나타나 있다. 개별 환자 1-6의 섹션이 각각의 행에 배열된다. 각 환자의 반응도 또한 표시된다.
도 13은 IHC에 의해 평가 시, 종양 절편 유래의 CD8 및 Ki67의 단백질 발현을 나타내는 일련의 대표적인 이미지이다. 전처리 샘플은 왼쪽 칼럼에 나타나 있으며, 베바시주맙-후 샘플은 중간 칼럼에 나타나 있으며, 베바시주맙+아테졸리주맙-후 샘플은 오른쪽 칼럼에 나타나 있다. 개별 환자 1-6의 섹션이 각각의 행에 배열된다.
도 14a 내지 도 14c는 전처리 시점에서 각각의 환자의 경우, 종양 면적 제곱 밀리미터(㎟) 당 CD8, 또는 Ki67 및 CD8 모두를 발현하는 세포의 수를 나타내는 일련의 그래프이다. 도 14a는 환자 1 및 2에 대한 데이터를 나타낸다. 도 14b는 환자 3 및 4에 대한 데이터를 나타낸다. 도 14c는 환자 5에 대한 데이터를 나타낸다. 각 환자의 반응도 또한 표시된다.
도 15a 내지 도 15c는 베바시주맙 이후 시점에서 각각의 환자의 경우, 종양 면적 ㎟ 당 CD8, 또는 Ki67 및 CD8 모두를 발현하는 세포의 수를 나타내는 일련의 그래프이다. 도 15a는 환자 1 및 2에 대한 데이터를 나타낸다. 도 15b는 환자 3 및 5에 대한 데이터를 나타낸다. 도 15c는 환자 6에 대한 데이터를 나타낸다. 각 환자의 반응도 또한 표시된다.
도 16a 내지 도 16c는 베바시주맙+아테졸리주맙-후 시점에서 각각의 환자의 경우, 종양 면적 ㎟ 당 CD8, 또는 Ki67 및 CD8 모두를 발현하는 세포의 수를 나타내는 일련의 그래프이다. 도 16a는 환자 1 및 2에 대한 데이터를 나타낸다. 도 16b는 환자 3 및 4에 대한 데이터를 나타낸다. 도 16c는 환자 5 및 6에 대한 데이터를 나타낸다. 각 환자의 반응도 또한 표시된다.
도 17a 및 17b는 CX3CR1을 발현하는 종양 샘플에서의 CD8+ 세포의 백분율을 보여주는 일련의 유세포측정 플롯이다. 전처리 샘플은 왼쪽 칼럼에 나타나 있으며, 베바시주맙-후 샘플은 중간 칼럼에 나타나 있으며, 베바시주맙+아테졸리주맙-후 샘플은 오른쪽 칼럼에 나타나 있다. 각각의 행은 개별 환자의 결과를 보여준다. 도 17a는 환자 2 및 3에 대한 데이터를 나타낸다. 도 17b는 환자 5 및 6에 대한 데이터를 나타낸다.
도 18은 유세포측정 분석을 기초로 한, 전체 CD8+ 세포 (왼쪽)의 백분율 및 종양 항원-특이적 (Dex-APC+) T 세포 (오른쪽)의 백분율로서의 CX3CR1의 발현을 나타내는 그래프이다.
도 19는 혈액내 항원-특이적 T 세포의 대표적인 빈도를 나타내는 일련의 유세포측정법이다. 종양 생검시점에 맞춰 채혈한 2명의 HLA-A2 양성 환자로부터의 대표적인 데이터가 나타나 있다.
도 20은 종양에서 표시된 치료 시점에서의 케모카인 발현 (CCL2, CCL5, CCR5, CX3CL1, CCR7 및 CXCL10)의 변화를 나타내는 일련의 그래프이다. 발현은 하우스 키핑 (HK) 유전자 발현으로 정규화되었다.
도 21a 내지 21c는 환자 6의 종양 샘플에서 치료 전후의 침윤 림프구 (TIL)의 TCRβ 서열분석 결과를 보여주는 일련의 그래프이다. 각각의 그룹의 최상부 클론 (최대 25개)이 표시되어 있다. 경향이 있는 TCRβ 클론 집단의 유병률은 도 21a (하부 패널), 22b 및 22c에 더 진한 선으로 표시되어 있다.
도 22는 베바시주맙 + 아테졸리주맙 치료 전후의 환자 3 TIL로부터의 TCRβ 서열분석 결과를 나타내는 그래프이다.
도 23a 및 23b는 환자 2, 3 및 6의 전처리 PBMC, 베바시주맙+아테졸리주맙-후 말초 혈액 단핵 세포 (PBMC), 및 베바시주맙+아테졸리주맙-후 TIL의 TCRβ 서열분석 결과를 보여주는 일련의 그래프이다. 도 23a는 환자 2 및 3에 대한 데이터를 도시하며, 그리고 도 23b는 환자 6에 대한 데이터를 도시한다. 각각의 그룹의 최상부 클론 (최대 25개)이 표시되어 있다.
도 24는 환자 3 및 6의 각각의 치료 시점에서의 PBMC 풀(pool) 대 TIL 풀에서 바이러스성 항원-특이적 클론의 수를 나타내는 히트맵이다.
I. 도입
본 발명은 암, 예를 들어, 신장암 (예컨대, 신장 세포 암종 (RCC), 예컨대, 전이성 RCC)을 진단하고, 모니터링하고, 그리고 치료하기 위한 방법을 제공한다. 본 발명은 VEGF 길항제 (예컨대, 항-VEGF 항체, 예컨대, 베바시주맙) 및/또는 PD-L1 축 결합 길항제 (예컨대, 항-PD-L1 항체, 예컨대, 아테졸리주맙)를 포함하는 항암 요법으로 치료하는 것이 바이오마커(예를 들어, 면역학적 바이오마커, 예를 들어, CD8+ Teff 세포와 관련된 유전자 (예를 들어, CD8A, CD8B, EOMES, GZMA, GZMB, IFNG 및 PRF1), Th1 케모카인 (예를 들어, CXCL9, CXLC10, CXCL11 및 CXCL13), NK 세포 (예를 들어, GZMB, KLRK1, 및 SLAMF7), 항원 제시 (예를 들어, MHC-I), 및 면역 수송 분자 (예를 들어, CCL2, CCL5, CCR5, CXCL1, 및 CCR7), 및/또는 면역 세포의 종양 침윤 (예컨대, CD8+ Teff 세포 및/또는 CD68+/CD163+ 대식세포))의 발현 수준의 변화를 초래한다는 발견에 적어도 부분적으로 기반한다. 본 발명은, 본 발명의 바이오마커의 발현 수준을 검출하고 비교함으로써 VEGF 길항제 (예컨대, 항-VEGF 항체, 예컨대, 베바시주맙) 및 PD-L1 축 결합 길항제 (예컨대, 항-PD-L1 항체, 예컨대, 아테졸리주맙)을 포함하는 병용 항암 요법으로의 치료에 대한 암 (예컨대, 신장암)을 갖는 환자의 반응을 모니터링하기 위한 방법을 제공한다. 본 발명은 또한 VEGF 길항제 (예컨대, 항-VEGF 항체, 예컨대, 베바시주맙) 및 PD-L1 축 결합 길항제 (예컨대, 항-PD-L1 항체, 예컨대, 아테졸리주맙)를 투여함에 의하여 암 (예컨대, 신장암)을 갖는 환자를 치료하기 위한 방법을 제공한다.
Ⅱ.정의
본원에 기재된 발명의 양태 및 구현예는 "포함하는(comprising)", "구성되는(consisting) 및 "~로 본질적으로 구성되는"의 양태 및 구현예를 포함하는 것으로 이해된다. 본원에 사용된 것으로서, 단수 용어("a," "an" 및 "the")는, 내용이 달리 명확하게 표지되지 않는 한 복수의 지시대상을 포함한다.
본 명세서에 사용된 용어 "약"은 당업자에게 용이하게 알려진 각각의 값에 대한 보통의 오차 범위를 지칭한다. 본원에서 "약(about)" 값 또는 파라미터에 대한 지칭은 상기 값 또는 파라미터 그 자체에 관한 구현예를 포함한다 (그리고 기술한다).
본원에 사용된 바와 같이, 용어 "개체", "환자" 또는 "피험체"는 상호교환가능하게 사용되며, 예를 들면, 치료가 요구되는 임의의 단일 동물, 더 바람직하게는 포유동물(비-인간 동물, 예를 들면, 개, 고양이, 말, 토끼, 동물원 동물, 소, 돼지, 양, 및 비-인간 영장류 포함)을 지칭한다. 특정 구현예에서, 본원에서 환자는 인간이다. 상기 환자는 "암 환자" 즉, 암의 하나 또는 그 이상의 증상을 앓거나, 암을 앓을 위험이 있거나, 또는 암을 앓고 있는 사람일 수 있다.
용어 "암" 및 "암성"은 전형적으로 조절되지 않은 세포 성장을 특징으로 하는 포유동물에서의 생리적 조건을 지칭하거나 또는 이를 기술한다. 상기 정의에는 양성 및 악성 암뿐만 아니라 휴면기 종양 또는 미세전이물이 포함된다. 암의 예는, 비제한적으로, 하기를 포함한다: 암종, 림프종, 아세포종 (수아세포종 및 망막아세포종 포함), 육종 (지방육종 및 활막 세포 육종 포함), 신경내분비 종양 (카르시노이드 종양, 가스트린종, 및 소도 세포 암 포함), 중피종, 신경집종 (청신경종 포함), 수막종, 선암종, 흑색종, 및 백혈병 또는 림프양 악성종양. 상기 암은 더욱 특정한 예시는 하기를 포함한다: 신장암 (예를 들어, 신장 세포 암종 (RCC), 예를 들어 전이성 RCC), 편평상피 세포 암 (예를 들어, 상피성 편평상피 세포 암), 폐암 (소세포 폐암 (SCLC), 비-소세포 폐암 (NSCLC), 폐의 선암종 및 폐의 편평상피 암종), 복막암, 간세포암, 위장 암을 포함하는 위장암 또는 위암, 췌장암, 교모세포종, 자궁경부암, 난소암, 간암, 간종양, 유방암 (전이성 유방암 포함), 방광암, 결장암, 직장암, 결장직장암, 자궁 내막 또는 자궁 암종, 타액샘 암종, 전립선암, 외음부 암, 갑상선암, 간 암종, 항문 암종, 음경 암종, 머켈세포암, 균상식육종(mycoses fungoids), 고환암, 식도암, 담관 종양, 두경부암, B-세포 림프종 (저등급/여포성 비-호지킨 림프종 (NHL); 소 림프구성 (SL) NHL; 중급/여포성 NHL; 중급 확산 NHL; 고급 면역아세포성 NHL; 고급 림프아구성 NHL; 고급 소형 비-절단 세포 NHL; 거대 질환 NHL; 맨틀 세포 림프종; AIDS-관련 림프종; 및 발덴스트롬(Waldenstrom) 거대글로불린혈증); 만성 림프구성 백혈병 (CLL); 급성 림프아구성 백혈병 (ALL); 모발 세포 백혈병; 만성 골수아세포 백혈병; 이식 후 림프증식성 장애 (PTLD), 모반증과 관련된 비정상 혈관 증식, 부종 (예컨대, 뇌종양과 관련된 것) 또는 메이그스(Meigs) 증후군. 일부 구현예에서, 암은 신장암이다. 특정 구현예에서, 신장암은 RCC (예를 들어, mRCC)이다.
"초기 단계 암" 또는 "초기 단계 종양"은 침습성 또는 전이성이 아니거나 0, I, 또는 Ⅱ 단계의 암으로 분류된 암을 의미한다.
"진행성" 암은 국소 침습 또는 전이에 의해 부위 또는 본래의 기관 밖으로 퍼진 암이다.
"난치성" 암은 화학치료제와 같은 항-종양제가 암 환자에게 투여되고 있음에도 불구하고 진행되는 암이다. 난치성 암의 예로는 백금 불응성인 암이 있다.
"재발성" 암은, 초기 요법에 대한 반응 이후, 초기 부위 또는 원위 부위에서, 재성장한 것이다.
용어 "세포 증식성 장애" 및 "증식성 장애"는 일정 정도의 비정상 세포 증식과 연관된 장애를 지칭한다. 일 구현예에서, 세포 증식성 장애는 암이다.
본원에 사용된 바와 같이, 용어 "종양"은 악성이든 양성이든, 모든 신생물성 세포 성장 및 증식, 그리고 모든 전-암성 및 암성 세포 및 조직을 지칭한다.
용어들 "암", "암성", "세포 증식성 장애", "증식성 장애" 및 "종양"은 본원에서 상호 배타적인 것이 아니다.
"장애"는 하기를 비제한적으로 포함하는 치료로부터 이점을 얻을 임의의 병태이다: 포유동물이 문제 장애를 갖기 용이하게 만드는 병리적 상태를 포함하는 만성 및 급성 장애 또는 질환.
용어 "검출"은 직접 및 간접 검출을 포함하는, 검출의 임의의 수단을 포함한다.
본원에 사용된 바와 같은 용어 "샘플,"은 예를 들어, 물리적, 생화학적, 화학적 및/또는 생리학적 특성을 기준으로 특성화되고/되거나 식별되어야만 하는 세포 및/또는 다른 분자 실체를 함유하는 목적하는 환자 및/또는 개체로부터 수득되거나 유래된 조성물을 지칭한다. 예를 들어, 어구 "질환 샘플" 및 이의 변화는 특성화되는 세포성 및/또는 분자 독립체를 함유하기 위해 공지된 또는 예상될 해당 환자로부터 수득된 임의의 샘플을 지칭한다. 샘플은 하기를 포함하나, 이에 제한되지 않는다: 조직 샘플, 원발성 또는 배양된 세포 또는 세포주, 세포 상청액, 세포 용해물, 혈소판, 혈청, 혈장, 활액, 림프액, 활막 유체, 여포성 유체, 정액, 양수, 밀크, 전혈, 혈액-유도된 세포, 소변, 뇌척수액, 타액, 가래, 눈물, 땀, 점액, 종양 용해물, 및 조직 배양 배지, 조직 추출물 예컨대 균질화된 조직, 종양 조직, 세포성 추출물, 및 이들의 조합.
본원에 사용된 바와 같은, 표현 "세포", "세포주", 및 "세포 배양물"은 상호교환적으로 사용되고 모든 상기 지정은 후손을 포함한다. 따라서, 단어 "변형체" 및 "변형된 세포"는 전달 수와 관련 없이 주요 피험체 세포 및 그들로부터 유래된 배양물을 포함한다. 또한, 모든 후손이 의도하거나 의도하지 않은 돌연변이로 인해 DNA 함량에서 정확하게 동일하지 않을 수 있는 것으로 이해된다. 본래 변형된 세포에서 스크리닝된 바와 같은 동일한 기능 또는 생물학적 활성을 갖는 돌연변이체 자손이 포함된다. 뚜렷이 다른 지정이 의도되는 경우, 맥락에서 명확해질 것이다.
용어 "바이오마커" 및 "마커"는 환자의 샘플에서 표준 방법 (또는 본원에 개시된 방법)에 의해 검출될 수 있는 DNA, RNA, 단백질, 탄수화물, 당지질 또는 세포-기반 분자 마커 발현 또는 존재를 지칭하기 위해 상호교환적으로 사용된다. 상기 바이오마커는, 비제한적으로, 표 2에서 제시된 유전자 및 단백질을 포함한다. 일부 구현예에서, 마커는 세포 (예컨대, CD8+ T 세포 또는 CD68+/CD163+ 대식세포)일 수 있다. 상기 바이오마커의 발현은 참조 수준 (예를 들어, 환자, 예를 들어, 암을 가진 환자 및 VEGF 길항제 및/또는 PD-L1 축 결합 길항제에 대한 반응성을 시험하는 환자의 그룹/집단으로부터의 샘플 내 바이오마커의 발현 수준 중앙값; 환자, 예를 들어, 암을 가진 환자 및 VEGF 길항제 및/또는 PD-L1 축 결합 길항제에 대하여 반응하지 않는 것으로 확인된 환자의 그룹/집단으로부터의 샘플 내 바이오마커의 발현 수준 중앙값; 이전에 개별적으로 수득된 이전 샘플 내 수준; 또는 원발성 종양 환경에서 VEGF 길항제 및/또는 PD-L1 축 결합 길항제로 전처리받은 환자, 및 현재 전이를 경험하고 있는 환자로부터의 샘플 내 수준 포함) 보다 VEGF 길항제 및/또는 PD-L1 축 결합 길항제에 민감하거나 반응하는 환자로부터 수득된 샘플에서 보다 높거나 보다 낮은 것으로 계측될 수 있다.
본원에서 사용되는 용어 "CD8A"는, 달리 표지되지 않으면, 영장류 (예컨대, 인간) 및 설치류 (예컨대, 마우스 및 랫트)와 같은 포유동물을 포함한 임의의 척추동물 공급원 유래의 임의의 천연 CD8A를 나타낸다. 용어는 "전장" 비가공된 CD8A 뿐만 아니라 세포에서의 가공으로부터 야기되는 CD8A의 임의의 형태를 포함한다. 상기 용어는 또한 CD8A의 자연 발생 변이체, 예컨대, 스플라이스 변이체 또는 대립유전자 변이체를 포함한다. 예시적인 인간 CD8A의 핵산 서열은 서열 번호 34에 명시되어 있다. 인간 CD8A에 의하여 암호화된 예시적인 단백질의 아미노산 서열은 서열 번호 35에 도시된다.
본원에서 사용되는 용어 "CD8B"는, 달리 표지되지 않으면, 영장류 (예컨대, 인간) 및 설치류 (예컨대, 마우스 및 랫트)와 같은 포유동물을 포함한 임의의 척추동물 공급원 유래의 임의의 천연 CD8B를 나타낸다. 용어는 "전장" 비가공된 CD8B 뿐만 아니라 세포에서의 가공으로부터 야기되는 CD8B의 임의의 형태를 포함한다. 용어는 또한 CD8B의 자연 발생 변이체, 예컨대, 스플라이스 변이체 또는 대립유전자 변이체를 포함한다. 예시적인 인간 CD8B의 핵산 서열은 서열 번호 36에 명시되어 있다. 인간 CD8B에 의하여 암호화된 예시적인 단백질의 아미노산 서열은 서열 번호 37에 도시된다.
본원에서 사용되는 용어 "EOMES"는, 달리 표지되지 않으면, 영장류 (예컨대, 인간) 및 설치류 (예컨대, 마우스 및 랫트)와 같은 포유동물을 포함한 임의의 척추동물 공급원 유래의 임의의 천연 EOMES (에오메소데르민)를 나타낸다. 상기 용어는 "전장"의 가공되지 않은 EOMES 뿐만 아니라 세포에서의 가공에서 비롯된 임의의 형태의 EOMES를 포함한다. 상기 용어는 또한 EOMES의 천연 변이체, 예컨대, 스플라이스 변이체 또는 대립유전자 변이체를 포함한다. 예시적인 인간 EOMES의 핵산 서열은 서열 번호 38에 명시되어 있다. 인간 EOMES에 의하여 암호화된 예시적인 단백질의 아미노산 서열은 서열 번호 39에 도시된다.
본원에서 사용되는 용어 "GZMA"는, 달리 표지되지 않으면, 영장류 (예컨대, 인간) 및 설치류 (예컨대, 마우스 및 랫트)와 같은 포유동물을 포함한 임의의 척추동물 공급원 유래의 임의의 천연 GZMA (그란자임 A)를 나타낸다. 상기 용어는 "전장"의 가공되지 않은 GZMA 뿐만 아니라 세포에서의 가공에서 비롯된 임의의 형태의 GZMA를 포함한다. 상기 용어는 또한 GZMA의 천연 변이체, 예컨대, 스플라이스 변이체 또는 대립유전자 변이체를 포함한다. 예시적인 인간 GZMA의 핵산 서열은 서열 번호 40에 명시되어 있다. 인간 GZMA에 의하여 암호화된 예시적인 단백질의 아미노산 서열은 서열 번호 41에 도시된다.
본원에서 사용되는 용어 "GZMB"는, 달리 표지되지 않으면, 영장류 (예컨대, 인간) 및 설치류 (예컨대, 마우스 및 랫트)와 같은 포유동물을 포함한 임의의 척추동물 공급원 유래의 임의의 천연 GZMB (그란자임 B)를 나타낸다. 상기 용어는 "전장"의 가공되지 않은 GZMB 뿐만 아니라 세포에서의 가공에서 비롯된 임의의 형태의 GZMB를 포함한다. 상기 용어는 또한 GZMB의 천연 변이체, 예컨대, 스플라이스 변이체 또는 대립유전자 변이체를 포함한다. 예시적인 인간 GZMB의 핵산 서열은 서열 번호 42에 명시되어 있다. 인간 GZMB에 의하여 암호화된 예시적인 단백질의 아미노산 서열은 서열 번호 43에 도시된다.
본원에서 사용되는 용어 "IFNG"는, 달리 표지되지 않으면, 영장류 (예컨대, 인간) 및 설치류 (예컨대, 마우스 및 랫트)와 같은 포유동물을 포함한 임의의 척추동물 공급원 유래의 임의의 천연 IFNG (인터페론, 감마)를 나타낸다. 상기 용어는 "전장"의 가공되지 않은 IFNG 뿐만 아니라 세포에서의 가공에서 비롯된 임의의 형태의 IFNG를 포함한다. 상기 용어는 또한 IFNG의 천연 변이체, 예컨대, 스플라이스 변이체 또는 대립유전자 변이체를 포함한다. 예시적인 인간 IFNG의 핵산 서열은 서열 번호 44에 명시되어 있다. 인간 IFNG에 의하여 암호화된 예시적인 단백질의 아미노산 서열은 서열 번호 45에 도시된다.
본원에 사용된 바와 같은 용어 "PRF1"는 달리 지적되지 않는 경우 임의의 척추동물 공급원 유래의 임의의 천연 PRF1 (페르포린 1; 또한 공극 형성 단백질로서 공지됨)을 지칭하고, 이는 영장류 (예를 들어, 인간) 및 설치류 (예를 들어, 마우스 및 랫트)와 같은 포유동물을 포함한다. 용어는 "전장" 비가공된 PRF1 뿐만 아니라 세포에서의 가공으로부터 야기되는 PRF1의 임의의 형태를 포함한다. 용어는 또한 PRF1의 자연 발생 변이체, 예컨대, 스플라이스 변이체 또는 대립유전자 변이체를 포함한다. 예시적인 인간 PRF1의 핵산 서열은 서열 번호 46에 명시되어 있다. 인간 PRF1에 의하여 암호화된 예시적인 단백질의 아미노산 서열은 서열 번호 47에 도시된다.
본원에서 사용되는 용어 "CXCL9"는, 달리 표지되지 않으면, 영장류 (예컨대, 인간) 및 설치류 (예컨대, 마우스 및 랫트)와 같은 포유동물을 포함한 임의의 척추동물 공급원 유래의 임의의 천연 CXCL9 (케모카인 (C-X-C 모티프) 리간드 9)를 지칭한다. 용어는 "전장" 비가공된 CXCL9 뿐만 아니라 세포에서의 가공으로부터 야기되는 CXCL9의 임의의 형태를 포함한다. 용어는 또한 CXCL9의 자연 발생 변이체, 예컨대, 스플라이스 변이체 또는 대립유전자 변이체를 포함한다. 예시적인 인간 CXCL9의 핵산 서열은 서열 번호 48에 명시되어 있다. 인간 CXCL9에 의하여 암호화된 예시적인 단백질의 아미노산 서열은 서열 번호 49에 도시된다.
본원에서 사용되는 용어 "CXCL10"는, 달리 표지되지 않으면, 영장류 (예컨대, 인간) 및 설치류 (예컨대, 마우스 및 랫트)와 같은 포유동물을 포함한 임의의 척추동물 공급원 유래의 임의의 천연 CXCL10 (케모카인 (C-X-C 모티프) 리간드 10)를 지칭한다. 용어는 "전장" 비가공된 CXCL10 뿐만 아니라 세포에서의 가공으로부터 야기되는 CXCL10의 임의의 형태를 포함한다. 용어는 또한 CXCL10의 자연 발생 변이체, 예컨대, 스플라이스 변이체 또는 대립유전자 변이체를 포함한다. 예시적인 인간 CXCL10의 핵산 서열은 서열 번호 50에 명시되어 있다. 인간 CXCL10에 의하여 암호화된 예시적인 단백질의 아미노산 서열은 서열 번호 51에 도시된다.
본원에서 사용되는 용어 "CXCL11"는, 달리 표지되지 않으면, 영장류 (예컨대, 인간) 및 설치류 (예컨대, 마우스 및 랫트)와 같은 포유동물을 포함한 임의의 척추동물 공급원 유래의 임의의 천연 CXCL11 (케모카인 (C-X-C 모티프) 리간드 11)를 지칭한다. 용어는 "전장" 비가공된 CXCL11 뿐만 아니라 세포에서의 가공으로부터 야기되는 CXCL11의 임의의 형태를 포함한다. 용어는 또한 CXCL11의 자연 발생 변이체, 예컨대, 스플라이스 변이체 또는 대립유전자 변이체를 포함한다. 예시적인 인간 CXCL11의 핵산 서열은 서열 번호 52에 명시되어 있다. 인간 CXCL11에 의하여 암호화된 예시적인 단백질의 아미노산 서열은 서열 번호 53에 도시된다.
본원에서 사용되는 용어 "CXCL13"는, 달리 표지되지 않으면, 영장류 (예컨대, 인간) 및 설치류 (예컨대, 마우스 및 랫트)와 같은 포유동물을 포함한 임의의 척추동물 공급원 유래의 임의의 천연 CXCL13 (케모카인 (C-X-C 모티프) 리간드 11)를 지칭한다. 용어는 "전장" 비가공된 CXCL13 뿐만 아니라 세포에서의 가공으로부터 야기되는 CXCL13의 임의의 형태를 포함한다. 용어는 또한 CXCL13의 자연 발생 변이체, 예컨대, 스플라이스 변이체 또는 대립유전자 변이체를 포함한다. 예시적인 인간 CXCL13의 핵산 서열은 서열 번호 54에 명시되어 있다. 인간 CXCL13에 의하여 암호화된 예시적인 단백질의 아미노산 서열은 서열 번호 55에 도시된다.
본원에서 사용되는 용어 "KLRK1"는, 달리 표지되지 않으면, 영장류 (예컨대, 인간) 및 설치류 (예컨대, 마우스 및 랫트)와 같은 포유동물을 포함한 임의의 척추동물 공급원 유래의 임의의 천연 KLRK1 (킬러 세포 렉틴-유사 수용체 서브패밀리 K (카파), 구성원 1)를 지칭한다. 용어는 "전장" 비가공된 KLRK1 뿐만 아니라 세포에서의 가공으로부터 야기되는 KLRK1의 임의의 형태를 포함한다. 용어는 또한 KLRK1의 자연 발생 변이체, 예컨대, 스플라이스 변이체 또는 대립유전자 변이체를 포함한다. 예시적인 인간 KLRK1의 핵산 서열은 서열 번호 56에 명시되어 있다. 인간 KLRK1에 의하여 암호화된 예시적인 단백질의 아미노산 서열은 서열 번호 57에 도시된다.
본원에서 사용되는 용어 "SLAMF7"는, 달리 표지되지 않으면, 영장류 (예컨대, 인간) 및 설치류 (예컨대, 마우스 및 랫트)와 같은 포유동물을 포함한 임의의 척추동물 공급원 유래의 임의의 천연 SLAMF7 (SLAM 패밀리 구성원 7)을 지칭한다. 용어는 "전장" 비가공된 SLAMF7 뿐만 아니라 세포에서의 가공으로부터 야기되는 SLAMF7의 임의의 형태를 포함한다. 용어는 또한 SLAMF7의 자연 발생 변이체, 예컨대, 스플라이스 변이체 또는 대립유전자 변이체를 포함한다. 예시적인 인간 SLAMF7의 핵산 서열은 서열 번호 58에 명시되어 있다. 인간 SLAMF7에 의하여 암호화된 예시적인 단백질의 아미노산 서열은 서열 번호 59에 도시된다.
본 명세서에 사용된 용어 "CX3CR1"은 달리 명시되지 않는 한, 포유동물, 예컨대 영장류(예를 들어, 인간)및 설치류(예를 들어, 마우스 및 랫트)를 포함하는, 임의의 척추동물 공급원 유래의 임의의 천연 CX3CR1 (CXC3 케모카인 수용체 1, 또한 프렉탈카인 수용체 또는 G-단백질 커플링된 수용체 13 (GPR13)으로도 알려져 있음)을 지칭한다. 용어는 "전장" 비가공된 CX3CR1 뿐만 아니라 세포에서의 가공으로부터 야기되는 CX3CR1의 임의의 형태를 포함한다. 용어는 또한 CX3CR1의 자연 발생 변이체, 예컨대, 스플라이스 변이체 또는 대립유전자 변이체를 포함한다. 예시적인 인간 CX3CR1의 핵산 서열은 서열 번호 70에 명시되어 있다. 인간 CX3CR1에 의하여 암호화된 예시적인 단백질의 아미노산 서열은 서열 번호 71에 도시된다.
본원에서 사용되는 용어 "CCL2"는, 달리 표지되지 않으면, 영장류 (예컨대, 인간) 및 설치류 (예컨대, 마우스 및 랫트)와 같은 포유동물을 포함한 임의의 척추동물 공급원 유래의 임의의 천연 CCL2 (케모카인 (C-C 모티프) 리간드 2)를 지칭한다. 용어는 "전장" 비가공된 CCL2 뿐만 아니라 세포에서의 가공으로부터 야기되는 CCL2의 임의의 형태를 포함한다. 용어는 또한 CCL2의 자연 발생 변이체, 예컨대, 스플라이스 변이체 또는 대립유전자 변이체를 포함한다. 예시적인 인간 CCL2의 핵산 서열은 서열 번호 60에 명시되어 있다. 인간 CCL2에 의하여 암호화된 예시적인 단백질의 아미노산 서열은 서열 번호 61에 도시된다.
본원에서 사용되는 용어 "CCL5"는, 달리 표지되지 않으면, 영장류 (예컨대, 인간) 및 설치류 (예컨대, 마우스 및 랫트)와 같은 포유동물을 포함한 임의의 척추동물 공급원 유래의 임의의 천연 CCL5 (케모카인 (C-C 모티프) 리간드 5)를 지칭한다. 용어는 "전장" 비가공된 CCL5 뿐만 아니라 세포에서의 가공으로부터 야기되는 CCL5의 임의의 형태를 포함한다. 용어는 또한 CCL5의 자연 발생 변이체, 예컨대, 스플라이스 변이체 또는 대립유전자 변이체를 포함한다. 예시적인 인간 CCL5의 핵산 서열은 서열 번호 62에 명시되어 있다. 인간 CCL5에 의하여 암호화된 예시적인 단백질의 아미노산 서열은 서열 번호 63에 도시된다.
본원에서 사용되는 용어 "CCR5"는, 달리 표지되지 않으면, 영장류 (예컨대, 인간) 및 설치류 (예컨대, 마우스 및 랫트)와 같은 포유동물을 포함한 임의의 척추동물 공급원 유래의 임의의 천연 CCR5 (케모카인 (C-C 모티프) 수용체 5)를 지칭한다. 용어는 "전장" 비가공된 CCR5 뿐만 아니라 세포에서의 가공으로부터 야기되는 CCR5의 임의의 형태를 포함한다. 용어는 또한 CCR5의 자연 발생 변이체, 예컨대, 스플라이스 변이체 또는 대립유전자 변이체를 포함한다. 예시적인 인간 CCR5의 핵산 서열은 서열 번호 64에 명시되어 있다. 인간 CCR5에 의하여 암호화된 예시적인 단백질의 아미노산 서열은 서열 번호 65에 도시된다.
본원에 사용된 바와 같은 용어 "CX3CL1"는 달리 지적되지 않는 경우 임의의 척추동물 공급원 유래의 임의의 천연 CX3CL1 (케모카인 (C-X3-C 모티프) 리간드 1; 또한 프렉탈카인으로서 본 분야에서 공지됨)을 지칭하고, 이는 영장류 (예를 들어, 인간) 및 설치류 (예를 들어, 마우스 및 랫트)와 같은 포유동물을 포함한다. 용어는 "전장" 비가공된 CX3CL1 뿐만 아니라 세포에서의 가공으로부터 야기되는 CX3CL1의 임의의 형태를 포함한다. 용어는 또한 CX3CL1의 자연 발생 변이체, 예컨대, 스플라이스 변이체 또는 대립유전자 변이체를 포함한다. 예시적인 인간 CX3CL1의 핵산 서열은 서열 번호 66에 명시되어 있다. 인간 CX3CL1에 의하여 암호화된 예시적인 단백질의 아미노산 서열은 서열 번호 67에 도시된다.
본원에서 사용되는 용어 "CCR7"는, 달리 표지되지 않으면, 영장류 (예컨대, 인간) 및 설치류 (예컨대, 마우스 및 랫트)와 같은 포유동물을 포함한 임의의 척추동물 공급원 유래의 임의의 천연 CCR7 (케모카인 (C-C 모티프) 수용체 7)를 지칭한다. 용어는 "전장" 비가공된 CCR7 뿐만 아니라 세포에서의 가공으로부터 야기되는 CCR7의 임의의 형태를 포함한다. 용어는 또한 CCR7의 자연 발생 변이체, 예컨대, 스플라이스 변이체 또는 대립유전자 변이체를 포함한다. 예시적인 인간 CCR7의 핵산 서열은 서열 번호 68에 명시되어 있다. 인간 CCR7에 의하여 암호화된 예시적인 단백질의 아미노산 서열은 서열 번호 69에 도시된다.
본원에서 사용되는 용어 "MHC-I"는, 달리 표지되지 않으면, 영장류 (예컨대, 인간) 및 설치류 (예컨대, 마우스 및 랫트)와 같은 포유동물을 포함한 임의의 척추동물 공급원 유래의 임의의 천연 MHC-I (주요 조직적합성 복합체-I)를 지칭한다. 인간 MHC-I은 또한 인간 백혈구 항원 I (HLA-I)로도 지칭된다. MHC-I 또는 HLA-I의 발현 수준은 임의의 HLA-I 유전자 또는 위유전자 (예를 들어, HLA-A, HLA-B, HLA-C, HLA-E, HLA-F, HLA-G, HLA-K 또는 HLA-L), 또는 그의 일배체형을 계측함으로써 평가될 수 있다. 발현 수준은 유전자 또는 위유전자 (예를 들어, MHC-I 알파 사슬 또는 HLA-I 조직적합성 항원 알파 사슬)의 전부 또는 일부의 검출에 의해 평가될 수 있다.
일반적으로 용어 "발현의 수준" 또는 "발현 수준"은 상호교환하여 사용가능하고, 일반적으로 생물학적 샘플 중의 바이오마커의 양을 가리킨다. "발현"은 일반적으로 정보(예컨대, 유전자-암호화 및/또는 후성적 정보)가 상기 세포에 존재하고 작동하는 구조체로 전환되는 과정을 가리킨다. 따라서, 본 명세서에서 사용된 바와 같이, "발현"은 폴리뉴클레오티드로 전사, 폴리펩티드, 또는 더욱이 폴리뉴클레오티드 및/또는 폴리펩티드 변형으로 번역 (예를 들면, 폴리펩티드의 번역후 변형)을 지칭한다. 전사된 폴리뉴클레오티드, 번역된 폴리펩티드, 또는 폴리뉴클레오티드 및/또는 폴리펩티드 변형 (예컨대, 폴리펩티드의 변역 후 변형)의 단편 또한 이들이 대안적 스플라이싱(alternative splicing)에 의해 생성된 전사물 또는 분해된 전사물에서 유래되든지, 또는 예컨대, 단백질 가수분해에 의한 상기 폴리펩티드의 번역후 과정에서 유래되든, 발현된 것으로 간주되어야 한다. "발현된 유전자"는 mRNA로 폴리뉴클레오티드로 전사되고 그리고 그 다음 폴리펩티드로 번역된 것 및 또한 RNA로 전사되었지만 폴리펩티드로 번역되지 않은 것 (예를 들면, 이동 및 리보솜 RNA들)을 포함한다.
"증가된 발현", "증가된 발현 수준", "증가된 수준", "상승된 발현", "상승된 발현 수준" 또는 "상승된 수준"은 대조군, 예컨대 질환 또는 장애 (예를 들어, 암)을 앓고 있지 않은 개체 또는 개체들, 내부 대조군 (예를 들어, 하우스키핑 바이오마커), 또는 요법(예를 들어, VEGF 길항제 및/또는 PD-L1 길항제를 포함하는 항암 요법)의 투여 전에 얻은 샘플 내 바이오마커 수준에 비해 개체 내 바이오마커의 증가된 발현 또는 증가된 수준을 지칭한다.
"감소된 발현", "감소된 발현 수준", "감소된 수준", "저하된 발현", "저하된 발현 수준" 또는 "저하된 수준"은 대조군, 예컨대 질환 또는 장애 (예를 들어, 암)을 앓고 있지 않은 개체 또는 개체들, 내부 대조군 (예를 들어, 하우스키핑 바이오마커), 또는 요법(예를 들어, VEGF 길항제 및/또는 L1 길항제를 포함하는 항암 요법)의 투여 전에 얻은 샘플 내 바이오마커 수준에 비해 개체 내 바이오마커의 감소된 발현 또는 감소된 수준을 지칭한다. 일부 구현예에서, 저하된 발현은 발현이 거의 없거나 아예 없는 것이다).
목적 단백질을 "발현하는" 샘플 또는 세포는 단백질 또는 단백질 단편을 포함하는 단백질을 암호화하는 mRNA가 샘플 또는 세포에 존재하는 것으로 계측된 것이다.
개체에 증가된 임상 이득과 관련된 바이오마커의 "양" 또는 "수준"은 생물학적 샘플에서 검출가능한 수준이다. 이들은 당해 기술의 숙련가에게 알려지고 본원에 의해 개시된 방법들에 의해 측정될 수 있다. 평가된 바이오마커의 발현 수치 또는 양은 상기 치료에 대한 반응을 계측하는 데 사용될 수 있다.
본원에 사용된, 어구 "을 기준으로 하여"는, 상기 정보가 하나 이상의 바이오마커가 치료 결정, 패키지 삽입물 상에 제공된 정보, 또는 마케팅/홍보 안내사항 등을 알리는데 사용된다는 것을 의미한다.
용어 "하우스키핑(housekeeping) 바이오마커"는 모든 세포 유형에 전형적으로 유사하게 존재하는 바이오마커 또는 일단의 바이오마커(예컨대, 폴리뉴클레오티드 및/또는 폴리펩티드)를 가리킨다. 일부 구현예에서, 하우스키핑 바이오마커는 "하우스키핑 유전자"이다. "하우스키핑 유전자"는 본원에서 세포 작용의 유지를 위해 필수적인 활성을 갖는 단백질을 암호화하고 전형적으로 모든 세포 유형에 유사하게 존재하는 유전자 또는 유전자 그룹을 지칭한다.
본원에 사용되는 "증폭"은 일반적으로 원하는 서열의 다수의 사본을 생성하는 과정을 가리킨다. "다수의 사본"은 적어도 2개의 사본을 의미한다. "사본"은 반드시 상기 주형 서열에 대한 완전한 서열 상보성 또는 동일성을 의미하지 않는다. 예를 들어, 사본에는 뉴클레오티드 유사체 예컨대 데옥시이노신, 의도적 서열 변경 (예컨대 혼성가능하나 상기 주형에 상보적이지 않은 서열을 포함하는 프라이머를 통해 유도되는 서열 변경), 및/또는 증폭 중에 발생하는 서열 오류가 포함된다.
용어 "다중-PCR"은 단일 반응에서 2 이상의 DNA 서열을 증폭할 목적으로 설정된 2 이상의 프라이머를 사용하여 단일 공급원(예컨대, 개체)에서 수득된 핵산에서 수행된 단일 PCR를 가리킨다.
본원에 사용되는 "중합효소 연쇄반응" 즉 "PCR" 기법은 일반적으로 핵산, RNA 및/또는 DNA의 특정 조각의 소량이 예를 들어, 미국 특허 번호 4,683,195에 기술된 바와 같이 증폭되는 절차를 지칭한다. 일반적으로, 관심대상의 영역의 말단 또는 그것을 초과하는 것에서 유래된 서열 정보가 확보가능하여, 올리고뉴클레오티드 프라이머가 설계될 수 있어야 하며; 이와 같은 프라이머는 증폭될 주형의 반대 가닥에 대하여 서열에서 동일하거나 또는 유사하다. 상기 2개 프라이머의 5' 말단 뉴클레오티드는 증폭된 재료의 말단과 동일할 수 있다. PCR이 특정 RNA 서열, 총 게놈 DNA 유래 특정 DNA 서열, 및 총 세포 RNA에서 전사된 cDNA, 박테리오파지 또는 플라스미드 서열 등을 증폭하기 위해 사용될 수 있다. 일반적으로 하기를 참고한다: Mullis et al., Cold Spring Harbor Symp . Quant . Biol . 51:263 (1987) 및 Erlich, ed., PCR Technology, (Stockton Press, NY, 1989). 본원에 사용되는 PCR는 핵산 검사 샘플을 증폭하기 위한 핵산 폴리머라제 반응 방법의 하나의 예(그러나 유일하지 않음)로 간주되고(여기에는 알려진 핵산(DNA 또는 RNA)을 프라이머로 사용하는 것이 포함됨), 핵산 폴리머라제를 활용하여 핵산의 특정 조각을 증폭 또는 생성하거나 또는 특정 핵산에 상보적인 핵산의 특정 조각을 증폭 또는 생성한다.
"정량적 실시간 폴리머라제 연쇄 반응" 또는 "qRT-PCR"은 PCR 생성물의 양이 PCR 반응에서 각 단계에서 측정되는 PCR의 형태를 지칭한다. 이 기술은 하기 문헌을 포함하는 다양한 공보에 기재되었다: 예를 들어, Cronin et al., Am. J. Pathol. 164(1):35-42 (2004) 및 Ma et al., Cancer Cell 5:607-616 (2004).
용어 "미세유전자배열"은 기질 상에서의 하이브리드화 가능한 배열 요소들, 바람직하게는 폴리뉴클레오티드 프로브의 순서상 배열을 가리킨다.
용어 "진단"은, 본원에서 분자적 또는 병리학적 상태, 질환 또는 병태 (예컨대, 암)의 식별 또는 분류를 지칭하는데 사용된다. 예를 들어, "진단"은 암의 특정 유형의 식별을 지칭할 수 있다. "진단"은, 또한, 예를 들어 조직병리학적 기준에 의한, 또는 분자적 특징 (예컨대, 일 바이오마커 또는 이의 조합의 발현에 의해 특성화된 하위유형 (예컨대, 상기 유전자에 의하여 암호화된 특정 유전자 또는 단백질))에 의한 암의 특정 하위유형의 분류를 지칭할 수 있다.
본원에 사용된 바와 같은 "종양-침윤 면역 세포"는 이의 종양 또는 샘플 내 존재하는 임의의 면역 세포를 지칭한다. 종양-침윤 면역 세포는 비제한적으로 하기를 포함한다: 종양내 면역 세포, 종양주변 면역 세포, 기타 종양 기질 세포 (예컨대, 섬유아세포), 또는 이의 임의의 조합. 종양-침윤 면역 세포는, 하기일 수 있다: T 림프구 (예컨대 CD8+ T 림프구 및/또는 CD4+ T 림프구), B 림프구, 또는 기타 골수-계통 세포 (과립구 (예컨대, 호중구, 호산구, 및 호염기구) 포함), 단핵구, 대식세포 (예컨대, CD68+/CD163+ 대식세포), 수지상 세포 (예컨대, 지상감입 수지상 세포), 조직구, 및 자연 살해 (NK) 세포.
"종양 세포"는, 본원에 사용된 바와 같이, 이의 종양 또는 샘플 내에 존재하는 임의의 종양 세포를 지칭한다. 종양 세포는, 본원에 기술되고/되거나 본 분야에 공지된 방법을 사용하여, 종양 샘플, 예를 들어, 기질 세포 및 종양-침윤 면역 세포에 존재할 수 있는 기타 세포와 구별될 수 있다.
"참조 샘플, "참조 세포, "참조 조직, "대조군 샘플, "대조군 세포" 또는 "대조군 조직"은, 본원에 사용된 바와 같이, 비교 목적으로 사용되는 샘플, 세포, 조직, 표준, 또는 수준을 지칭한다. 일 구현예에서, 참조 샘플, 참조 세포, 참조 조직, 대조군 샘플, 대조군 세포, 또는 대조군 조직은, 동일한 환자 또는 개체의 신체(예를 들어, 조직 또는 세포)의 건강하고/하거나 비-이환 부분으로부터 수득될 수 있다. 예를 들어, 참조 샘플, 참조 세포, 참조 조직, 대조군 샘플, 대조군 세포, 또는 대조군 조직은, 이환 세포에 근접한 건강하고/하거나 비-이환 세포 또는 조직 (예컨대, 종양에 근접한 세포 또는 조직)일 수 있다. 또 다른 구현예에서, 참조 샘플은 동일한 환자 또는 개체의 신체의 비처리된 조직 및/또는 세포로부터 수득된다. 추가의 또 다른 구현예에서, 참조 샘플, 참조 세포, 참조 조직, 대조군 샘플, 대조군 세포, 또는 대조군 조직은, 상기 환자 또는 개체가 아닌 개체의 신체(예를 들어, 조직 또는 세포)의 건강하고/하거나 비-이환 부분으로부터 수득될 수 있다. 추가의 기타 구현예에서, 참조 샘플, 참조 세포, 참조 조직, 대조군 샘플, 대조군 세포, 또는 대조군 조직은, 상기 환자 또는 개체가 아닌 개체의 신체의 비처리된 조직 및/또는 세포로부터 수득될 수 있다. 또 다른 구현예에서, 요법 (예를 들어, VEGF 길항제 및/또는 PD-L1 축 결합 길항제를 포함하는 항암 요법)의 투여 전에 환자로부터 참조 샘플, 참조 세포, 참조 조직, 대조군 샘플, 대조군 세포, 또는 대조군 조직이 수득된다.
"상관관계가 있다" 또는 "상관관계가 있는"은 모든 방식으로 제1 분석 또는 프로토콜의 성능 및/또는 결과를 제2 분석 또는 프로토콜의 성능 및/또는 결과와 비교하는 것을 의미한다. 예를 들어, 두 번째 프로토콜을 수행할 때 첫 번째 분석 또는 프로토콜의 결과를 사용하거나 및/또는 두 번째 분석 또는 프로토콜이 수행되어야 하는지 여부를 계측하기 위해 첫 번째 분석 또는 프로토콜의 결과를 사용할 수 있다. 폴리펩티드 분석 또는 프로토콜의 구현예와 관련하여, 특정 치료 레지멘이 수행되어야 하는지 여부를 결정하기 위해 폴리펩티드 발현 분석 또는 프로토콜의 결과를 사용할 수 있다. 폴리뉴클레오티드 분석 또는 프로토콜의 구현예와 관련하여, 특정 치료 요법이 수행되어야 하는지 여부를 계측하기 위해 폴리뉴클레오티드 발현 분석 또는 프로토콜의 결과를 사용할 수 있다.
본원에서 사용되는 "치료"(및 "치료하다" 또는 "치료하는"과 같은 이의 문법적 변형)는 치료되는 개체의 자연적인 과정을 변경하려는 임상적 중재술을 나타내며, 예방을 위해 또는 임상 병리학의 과정 동안 수행될 수 있다. 바람직한 치료 효과는 질환의 발병 또는 재발 방지, 증상의 완화, 질환의 임의의 직접적 또는 간접적인 병리학적 결과의 감소, 전이 방지, 질환 진행 속도의 감소, 질환 상태의 개선 또는 완화, 및 관해 또는 개선된 예후를 포함하지만, 이에 제한되지 않는다. 일부 구현예에서, 항체 (예컨대, 항-VEGF 항체, 항-PD-L1 항체, 항-PD-1 항체, 또는 이의 조합)는 질환의 발병을 지연시키거나, 또는 질환 또는 장애의 진행을 서행시키기 위해 사용된다.
본 명세서에서 사용된 바와 같이, "투여함"은 주어진 투여량의 화합물 (예컨대, VEGF 길항제 (예컨대, 항-VEGF 항체) 및/또는 PD-L1 축 결합 길항제 (예컨대, 항-PD-L1 항체)) 또는 조성물 (예컨대, 약제학적 조성물, 예컨대, VEGF 길항제 및/또는 PD-L1 축 결합 길항제를 포함하는 약제학적 조성물)을 환자에게 투여하는 방법을 의미한다. 본원에 기재된 방법에 사용되는 조성물은, 예를 들면, 근육내로, 정맥내로, 피내로, 경피로, 동맥내로, 복강내로, 병변내로, 두개골내로, 관절내로, 전립선내로, 흉막내로, 기관내로, 척추강내로, 비강내로, 질내로, 직장내로, 국소로, 종양내로, 복강내로, 피하로, 결막하로, 소포내로, 점막으로, 심막내로, 탯줄내로, 안구내로, 안와내로, 유리체내로 (예컨대, 유리체내 주입에 의하여), 경구로, 국소적으로, 경피로, 흡입에 의해, 주사에 의해, 이식에 의해, 주입에 의해, 연속 주입에 의해, 직접 국부 관류욕 표적 세포에 의해, 카테터에 의해, 세정에 의해, 크림으로 또는 지질 조성물로 투여할 수 있다. 본 명세서에서 기재된 방법에서 이용된 조성물은 또한 전신으로 또는 국소로 투여될 수 있다. 투여 방법은 다양한 인자 (예를 들면, 투여될 화합물 또는 조성물 및 치료될 병태, 질환, 또는 장애의 중증도)에 따라 가변될 수 있다.
"치료적 유효량"은 포유동물에서 질환 또는 장애를 치료하거나 예방하기 위한 치료제의 양을 나타낸다. 암의 경우, 치료제의 치료적 유효량은 암 세포의 수를 감소시키고; 원발성 종양 크기를 감소시키고; 말초 기관 내로의 암 세포 침윤을 억제하고(즉, 얼마간 지연하고 바람직하게는 중지시키고); 종양 전이를 억제하고(즉, 얼마간 지연하고 바람직하게는 중지시키고); 종양 성장을 얼마간 억제하고; 상기 장애와 관련된 하나 이상의 증상을 얼마간 경감시킬 수 있다. 상기 약물이 성장을 방지하거나 및/또는 기존 암 세포를 사멸시킬 정도이면, 상기 약물은 세포증식 억제제 및/또는 세포독성일 수 있다. 암 요법을 위해, 생체내 효능은, 예를 들면 생존 기간, 질환 진행까지의 시간 (TTP), 반응 속도 (예컨대, 완전 반응 (CR) 및 부분 반응 (PR)), 반응 기간, 및/또는 삶의 질 평가에 의해 측정될 수 있다.
용어 "동시에"는 2 이상의 치료제의 투여를 가리키기 위해 사용되는데, 적어도 투여의 일부가 시간적으로 겹치는 것을 가리킨다. 따라서, 동시 투여에는 하나 이상의 다른 제제(들)의 투여를 중단한 후 하나 이상의 제제(들)의 투여가 이어질 때의 투여 레지멘이 포함된다. 예를 들어, 일부 구현예에서, VEGF 길항제 및 PD-L1 축 결합 길항제는 동시에 투여될 수 있다.
"감소 또는 억제"는 20%, 30%, 40%, 50%, 60%, 70%, 75%, 80%, 85%, 90%, 95%, 또는 그 이상의 전체적 감소를 유발하는 능력을 의미한다. 감소 또는 억제는 예를 들어 원발성 종양의 크기, 전이의 크기 또는 존재, 또는 치료될 장애의 증상을 감소 또는 억제시키는 것을 지칭한다.
본원에서 치료제의 "고정된" 또는 "변동없는" 용량은 환자의 중량 (WT) 또는 체표면적 (BSA)을 고려하지 않고 인간 환자에 투여된 용량을 지칭한다. 고정된 또는 변동없는 용량은 따라서 mg/kg 용량 또는 mg/m2 용량으로서 제공되지 않지만, 오히려 치료제의 절대적인 양으로서 제공된다.
본원에서 "부하" 용량은 일반적으로 환자에게 투여되는 치료제의 초기 용량을 포함하며, 이의 하나 이상의 유지 용량(들)이 이어진다. 일반적으로, 단일 부하 용량이 투여되지만, 다회 부하 용량이 본 명세서에서 상정된다. 보통, 투여되는 부하 용량(들)의 양은 투여되는 유지 용량(들)의 양을 초과하고/하거나 부하 용량(들)은 유지 용량(들)보다 더 빈번하게 투여되어서, 유지 용량(들)에 의해 달성될 수 있는 것보다 더 조기에 치료제의 목적으로 하는 농도를 달성할 수 있다.
본원에서의 "유지" 용량 또는 "연장된" 용량은 치료 시기에 걸쳐 환자에 투여되는 치료제의 1회 이상의 용량을 지칭한다. 보통, 상기 유지 용량은 치료 간격을 두고, 예컨대 대략 1주, 대략 2주, 대략 3주, 또는 대략 4주 간격으로 투여된다.
본 발명의 문맥에서 "반응성"이라는 어구는 암(예를 들어, 신장암, 예를 들어, RCC, 예를 들어 전이성 RCC)을 앓거나, 상기를 앓는 것으로 의심되거나, 또는 상기가 발병되기 쉬운 환자가 요법, 예컨대, VEGF 길항제 (예컨대, 항-VEGF 항체, 예컨대, 베바시주맙) 및/또는 PD-L1 축 결합 길항제 (예컨대, 항-PD-L1 항체, 예컨대, 아테졸리주맙)을 포함하는 항암 요법에 대한 반응을 나타낸다는 것을 표지한다. 당업자는 본 발명의 방법에 따른 VEGF 길항제 (예컨대, 항-VEGF 항체, 예컨대, 베바시주맙) 및/또는 PD-L1 축 결합 길항제 (예컨대, 항-PD-L1 항체, 예컨대, 아테졸리주맙)로 치료된 사람이 반응을 나타내는지 여부를 용이하게 계측할 위치에 있을 것이다. 예를 들어, 반응은 종양 성장의 감소 및/또는 정지, 종양 크기의 감소 및/또는 암의 하나 이상의 증상의 개선과 같은 암으로 인한 고통의 감소에 의해 반영될 수 있다. 바람직하게는, 반응은 암 또는 암의 지수의 전이성 전환의 지표의 감소 또는 완화, 예를 들어 전이의 형성의 예방 또는 전이의 수 또는 크기의 감소에 의해 반영될 수 있다.
용어 "항암 요법"은 암 치료에 유용한 요법을 지칭한다. 항암 치료제의 예시에는 비제한적으로 세포독성제, 화학치료제, 성장 억제제, 방사선 요법에서 사용되는 제제, 항-신생혈관제, 세포자멸제, 항-튜불린 제제, 및 암을 치료하기 위한 다른 제제, 예를 들어, 항-CD20 항체, 혈소판 유도된 성장 인자 억제제(예를 들면, GLEEVEC™ (이마티닙 메실레이트)), COX-2 억제제(예를 들면, 셀레콕시브), 인터페론, 사이토카인, 하나 이상의 하기 표적 중 하나 이상에 결합하는 길항제 (예컨대, 중화 항체): PDGFR-β, BIγS, APRIL, BCMA 수용체(들), TRAIL/Apo2, 다른 생물활성 및 유기 화학 제제 등. 이의 조합물이 또한 본 발명에 포함된다.
"항-혈관형성 제제" 또는 "혈관형성 억제제"는 직접적으로 또는 간접적으로 혈관형성, 맥관형성, 또는 바람직하지 않은 혈관 투과성을 억제하는 저분자량 물질, 폴리뉴클레오티드, 폴리펩티드, 단리된 단백질, 재조합 단백질, 항체, 또는 이들의 접합체 또는 융합 단백질을 가리킨다. 항-혈관형성 제제에는 혈관형성 인자 또는 이것의 수용체의 혈관형성의 활성을 구속 및 차단하는 제제들이 포함되는 것으로 이해되어야 한다. 예를 들어, 항-혈관형성 제제는 상기 정의된 바와 같은 혈관형성 제제에 대한 항체 또는 기타 길항제로, 예컨대, VEGF-A 또는 VEGF-A 수용체(예컨대, KDR 수용체 또는 Flt-1 수용체)에 대한 항체, 항-PDGFR 억제제, 예컨대 GLEEVEC™ (이마티닙 메실레이트)이다. 항-혈관형성 제제는 또한 천연 혈관형성 억제제, 예를 들면, 안지오스타틴, 엔도스타틴, 등을 포함한다. 참고: 예를 들어, Klagsbrun and D’Amore, Annu . Rev. Physiol ., 53:217-39 (1991); Streit and Detmar, Oncogene, 22:3172-3179 (2003) (예를 들면, 악성 흑색종에서의 항-혈관형성 요법을 기재하는 표 3); Ferrara & Alitalo, Nature Medicine 5(12):1359-1364 (1999); Tonini et al., Oncogene, 22:6549-6556 (2003) and, Sato Int . J. Clin . Oncol., 8:200-206 (2003).
용어 "세포독성제"는 본원에서 사용된 바와 같이 세포의 기능을 억제 또는 예방 및/또는 세포의 파괴를 유발시키는 물질을 지칭한다. 상기 용어는 방사성 동위원소 (예를 들면, At211, I131, I125, Y90, Re186, Re188, Sm153, Bi212, P32, 및 Lu의 방사성 동위원소); 화학치료제 또는 예를 들면, 메토트렉세이트, 아드리아마이신, 빈카 알카로이드 (빈크리스틴, 빈블라스틴, 에토포시드), 독소루비신, 멜팔란, 미토마이신 C, 클로르암부실, 다우노루비신 또는 다른 개재 약물); 효소 및 이의 단편 예컨대 핵산분해 효소; 항생제; 및 독소 예컨대 소분자 독소 또는 박테리아, 진균, 식물 또는 동물 기원의 효소적으로 활성인 독소 (단편 및/또는 이의 변이체 포함); 및 하기 개시된 다양한 항종양 또는 항암제를 포함하는 것으로 의도된다. 종양파괴 제제는 종양 세포의 파괴를 유발시킨다.
"화학치료제"는 암의 치료에 유용한 화학적 화합물을 포함한다. 화학치료제의 예는 하기를 포함한다: 에를로티닙 (TARCEVA®, Genentech/OSI Pharm.), 보르테조밉 (VELCADE®, Millennium Pharm.), 디설피람, 에피갈로카테킨 갈레이트 , 살리노스포라미드 A, 카필조밉, 17-AAG (겔다나마이신), 라디시콜, 락테이트 탈수소효소 A (LDH-A), 풀베스트란트 (FASLODEX®, AstraZeneca), 서니팁 (SUTENT®, Pfizer/Sugen), 레트로졸 (FEMARA®, Novartis), 이마티닙 메실레이트 (GLEEVEC®, Novartis), 피나서네이트 (VATALANIB®, Novartis), 옥살리플라틴 (ELOXATIN®, Sanofi), 5-FU (5-플루오로우라실), 류코보린, 라파마이신 (시롤리무스, RAPAMUNE®, Pfizer), 라파티닙 (TYKERB®, GSK572016, Glaxo Smith Kline), 로나파밉 (SCH 66336), 소라페닙 (NEXAVAR®, Bayer Labs), 제피티닙 (IRESSA®, AstraZeneca), AG1478, 알킬화제 예컨대 티오테파 및 CYTOXAN® 사이클로포스파마이드; 알킬 설포네이트 예컨대 부설판, 임프로설판 및 피포설판; 아지리딘 예컨대 벤조도파, 카보쿠온, 메투레도파, 및 우레도파; 에틸렌이민 및 메틸라멜라민 (알트레타민, 트리에틸렌멜라민 포함), 트리에틸렌포스포르아미드, 트리에틸렌티오포스포르아미드 및 트리메틸로멜라민; 아세토게닌 (특히 불라타신 및 불라타시논); 캄프토테신 (토포테칸 및 이리노테칸 포함); 브리오스타틴; 칼리스타틴; CC-1065 (이의 아도젤레신, 카르젤레신 및 바이젤레신 합성 유사체 포함); 크립토파이신 (특히 크립토파이신 1 및 크립토파이신 8); 아데노코르티코이드 (포함 프레드니손 및 프레드니솔론); 시프로테론 아세테이트; 5α-환원효소 포함 피나스테라이드 및 두타스테라이드; 보리노스타트, 로미뎁신, 파노비노스태트, 발프로산, 모세티노스타트 돌라스타틴; 알데스류킨, 탈크 듀오카르마이신 (합성 유사체, KW-2189 및 CB1-TM1 포함); 엘류테로빈; 판크라티스타틴; 사르코딕티인; 스폰지스타틴; 질소 머스타드 예컨대 클로르암부실, 클로마파진, 클로로포스파마이드, 에스트라무스틴, 이포스파마이드, 메클로레타민, 메클로레타민 옥사이드 하이드로클로라이드, 멜팔란, 노벰비친, 펜에스테린, 프레드니무스틴, 트로포스파마이드, 우라실 머스타드; 니트로소우레아 예컨대 카르무스틴, 클로로조토신, 포테무스틴, 로무스틴, 니무스틴, 및 라님무스틴; 항생제 예컨대 엔디인 항생제 (예컨대, 칼리키아마이신, 특히 칼리키아마이신 γ1I 및 칼리키아마이신 ω1I (Angew Chem. Intl. Ed. Engl. 33:183-186, 1994); 다이네마이신 (다이네마이신 A 포함); 비스포스포네이트, 예컨대 클로드로네이트; 에스페라마이신; 뿐만 아니라 네오카르지노스타틴 발색단 및 관련 색소단백질 엔디인 항생 발색단), 아클라시노마이신, 악티노마이신, 오트라마이신, 아자세린, 블레오마이신, 칵티노마이신, 카라비신, 카미노마이신, 카르지노필린, 크로모마이시니스, 닥티노마이신, 다우노루비신, 데토루비신, 6-디아조-5-옥소-L-노르류신, ADRIAMYCIN® (독소루비신), 모르폴리노-독소루비신, 시아노모폴리노-독소루비신, 2-피롤리노-독소루비신 및 데옥시독소루비신), 에피루비신, 에소루비신, 아이다루비신, 마르셀로마이신, 미토마이신 예컨대 미토마이신 C, 마이코페놀산, 노갈라마이신, 올리보마이신, 페플로마이신, 포르피로마이신, 퓨로마이신, 쿠엘라마이신, 로도루비신, 스트렙토니그린, 스트렙토조신, 투베르시딘, 우베니멕스, 지노스타틴, 조루비신; 항-대사물질 예컨대 메토트렉세이트 및 5-플루오로우라실 (5-FU); 엽산 유사체 예컨대 데노프테린, 메토트렉세이트, 프테로프테린, 트리메트렉세이트; 퓨린 유사체 예컨대 플루다라빈, 6-머캅토퓨린, 티아미프린, 티오구아닌; 피리미딘 유사체 예컨대 안시타빈, 아자시티딘, 6아자우리딘, 카모푸르, 사이타라빈, 디데옥시우리딘, 독시플루리딘, 에노시타빈, 플록수리딘; 안드로겐 예컨대 칼루스테론, 드로모스타놀론 프로피오네이트, 에피티오스탄올, 메피티오스탄, 테스토락톤; 항-부신제 예컨대 아미노글루테트이미드, 미토탄, 트릴로스탄; 엽산 보충물 예컨대 프롤린산; 아세글라톤; 알도포스파마이드 글리코사이드; 아미노레벌린산; 에닐우라실; 암사크린; 베스트라부실; 비스안트렌; 에다트락세이트; 데포파민; 데메콜신; 디아지쿠온; 엘포미틴; 엘립티늄 아세테이트; 에포틸론; 에토글루시드; 갈륨 니트레이트; 하이드록시우레아; 렌티난; 로니다이닌; 메이탄시노이드 예컨대 메이탄신 및 안사미토신; 미토구아존; 미톡산트론; 모피담놀; 니트라에린; 펜토스타틴; 페나메트; 피라루비신; 로속산트론; 포도필린산; 2-에틸하이드라자이드; 프로카바진; PSK® 다당류 착물 (JHS Natural Products, Eugene, Oreg.); 라족산; 라이족신; 시조푸란; 스피로게르마늄; 테누아존산; 트리아지쿠온; 2,2',2''-트리클로로트리에틸아민; 트리코테센 (특히 T-2 독소, 베라쿠린 A, 로리딘 A 및 안구이딘); 우레탄; 빈데신; 다카바진; 만노무스틴; 미토브로니톨; 미토락톨; 피포브로만; 가시토신; 아라바이노사이드 ("Ara-C"); 사이클로포스파미드; 티오테파; 탁소이드, 예컨대, 탁솔(TAXOL) (파클리탁셀; Bristol-Myers Squibb Oncology, Princeton, N.J.), ABRAXANE® (크레모포어-없음), 파클리탁셀의 알부민-가공 나노입자 제형 (American Pharmaceutical Partners, Schaumberg, Ill.), 및 TAXOTERE® (도세탁셀, 독세탁셀; Sanofi-Aventis); 클로르람부실; GEMZAR® (젬시타빈); 6-티오구아닌; 머캅토퓨린; 메토트렉세이트; 백금 유사체 예컨대 시스플라틴 및 카보플라틴; 빈블라스틴; 에토포사이드 (VP-16); 이포스파마이드; 미톡산트론; 빈크리스틴; NAVELBINE® (비노렐빈); 노반트론; 테니포사이드; 에다트렉세이트; 다우노마이신; 아미노프테린; 카페시타빈 (XELODA®); 이반드로네이트; CPT-11; 토포이소머라제 억제제 RFS 2000; 디플루오로메틸오르니틴 (DMFO); 레티노이드 예컨대 레티노산; 및 상기 중 임의의 약제학적으로 허용가능한 염, 산 및 유도체.
화학치료제는 또한 하기를 포함한다: 하기를 포함하는, 항-에스트로겐 및 선택적 에스트로겐 수용체 조절인자 (SERM)와 같이 종양에 대한 호르몬 작용을 조절하거나 억제하는 작용을 하는 항호르몬제: 예를 들어, 타목시펜 (NOLVADEX®; 타목시펜 시트레이트 포함), 랄록시펜, 드롤록시펜, 아이오독시펜, 4-하이드록시타목시펜, 트리옥시펜, 케옥시펜, LY117018, 오나프리스톤, 및 FARESTON® (토레미핀 시트레이트); 하기와 같은, 부신에서 에스트로겐 생산을 조절하는 효소 아로마타제를 억제하는 아로마타제 억제제: 예를 들어, 4(5)-이미다졸, 아미노글루테트이미드, MEGASE® (메게스트롤 아세테이트), AROMASIN® (엑세메스탄; Pfizer), 포르메스타니, 파드로졸, RIVISOR® (보로졸), FEMARA® (레트로졸; Novartis), 및 ARIMIDEX® (아나스트로졸; AstraZeneca); 항-안드로겐 예컨대 플루타미드, 닐루타미드, 비칼루타미드, 류프롤리드 및 고세렐린; 부세렐린, 트립테레린, 메드록시프로게스테론 아세테이트, 디에틸스틸베스트롤, 프레마린, 플루옥시메스테론, 모든 트랜스레티온산, 펜레티나이드, 뿐만 아니라 트록사시타빈 (1,3-디옥솔란 뉴클레오시드 시토신 유사체); 단백질 키나아제 억제제; 지질 키나아제 억제제; 안티센스 올리고뉴클레오티드, 특히 비정상적인 세포 증식에서 연루된 신호전달 경로에서 유전자의 발현을 억제하는 것들, 예컨대, 예를 들어, PKC-알파, Ralf 및 H-Ras; 리보자임 예컨대 VEGF 발현 억제제 (예컨대, ANGIOZYME®) 및 HER2 발현 억제제; 백신, 예컨대 유전자 요법 백신, 예를 들어, ALLOVECTIN®, LEUVECTIN®, 및 VAXID®; PROLEUKIN®, rIL-2; 토포이소머라제 1 억제제 예컨대 LURTOTECAN®; ABARELIX® rmRH; 및 상기 중 임의의 약제학적으로 허용가능한 염, 산 및 유도체.
화학치료제는 또한 하기를 포함한다: 알렘투주맙(캄파스(Campath)), 베바시주맙(AVASTIN®, Genentech); 세툭시맙(ERBITUX®, Imclone); 파니투무맙(VECTIBIX®, Amgen), 리툭시맙(RITUXAN®, Genentech/Biogen Idec), 퍼투주맙(OMNITARG®, 2C4, Genentech), 트라스투주맙(HERCEPTIN®, Genentech), 토시투모맙(Bexxar, Corixia) 및 항체 약물 콘주게이트, 겜투주맙 오조가미신(MYLOTARG®, Wyeth). 본 발명의 화합물과 조합된 제제로서 치료적 잠재력을 갖는 추가의 인간화된 단클론성 항체는 하기를 포함한다: 아폴리주맙, 아셀리주맙, 아틀리주맙, 바피뉴주맙, 비바투주맙 메르탄신, 칸투주맙 메르탄신, 세델리주맙, 세르톨리주맙 페골, 시드푸시투주맙, 시드투주맙, 다클리주맙, 에쿨리주맙, 에팔리주맙, 에프라투주맙, 에를리주맙, 펠비주맙, 폰톨리주맙, 젬투주맙 오조가미신, 이노투주맙 오조가미신, 이필리무맙, 라베투주맙, 린투주맙, 마투주맙, 메폴리주맙, 모타비주맙, 모토비주맙, 나탈리주맙, 니모투주맙, 놀로비주맙, 누마비주맙, 오크렐리주맙, 오말리주맙, 팔리비주맙, 파스콜리주맙, 펙푸시투주맙, 펙투주맙, 펙셀리주맙, 랄리비주맙, 라니비주맙, 레슬리비주맙, 레슬리주맙, 레시비주맙, 로벨리주맙, 루플리주맙, 시브로투주맙, 시플리주맙, 손투주맙, 타카투주맙 테트락세탄, 타도시주맙, 탈리주맙, 테피바주맙, 토실리주맙, 토랄리주맙, 트라스투주맙, 투코투주맙 셀모류킨, 투쿠시투주맙, 우마비주맙, 유르톡사주맙, 유스테키누맙, 및 비실리주맙, 항-인터류킨-12 (예컨대, ABT-874/J695, Wyeth Research and Abbott Laboratories) (인터류킨-12 p40 단백질을 인식하기 위하여 유전적으로 변형된 재조합 배타적 인간-서열, 전장 IgG1 λ 항체).
화학치료제는 또한 하기를 포함한다: "EGFR 억제제," (EGFR에 결합하거나, 달리는 이에 직접 상호작용하고, 이의 신호전달 활성을 예방 또는 감소시키는 화합물로 지칭되고, 대안적으로 "EGFR 길항제"로 지칭됨). 상기 제제의 예시는 EGFR에 결합하는 항체 및 소분자를 포함한다. EGFR에 결합하는 항체의 예시는 하기를 포함한다: MAb 579 (ATCC CRL HB 8506), MAb 455 (ATCC CRL HB8507), MAb 225 (ATCC CRL 8508), MAb 528 (ATCC CRL 8509) (참고: 미국 특허 번호 4,943, 533, Mendelsohn et al.) 및 이의 변이체, 예컨대 키메라화된 225 (C225 또는 세툭시맙; ERBUTIX®) 및 재형상화된 인간 225 (H225) (참고: WO 96/40210, Imclone Systems Inc.); IMC-11F8, 완전 인간, EGFR-표적 항체 (Imclone); 유형 Ⅱ 돌연변이체 EGFR에 결합하는 항체 (미국 특허 번호 5,212,290); 미국 특허 번호 5,891,996에 기재된, EGFR에 결합하는 인간화되고 키메라성인 항체; 및 EGFR에 결합하는 인간 항체, 예컨대 파니투무맙의 ABX-EGF (참고: WO98/50433, Abgenix/Amgen); EMD 55900 (Stragliotto et al. Eur . J. Cancer 32A:636-640 (1996)); EMD7200 (마투주맙) EGFR 결합 (EMD/Merck)을 위하여 EGF 및 TGF-알파 둘 모두와 경쟁하는 EGFR에 대하여 지향된, 인간화된 EGFR 항체; 및 인간 EGFR 항체, HuMax-EGFR (GenMab); 완전 인간 항체 (하기로 공지됨: E1.1, E2.4, E2.5, E6.2, E6.4, E2.11, E6.3 및 E7.6.3, 그리고 하기에서 기술됨: US 6,235,883; MDX-447 (Medarex Inc); 및 mAb 806 또는 인간화 mAb 806 (Johns et al., J. Biol . Chem . 279(29):30375-30384 (2004)). 항-EGFR 항체는 세포독성제와 콘주게이트되어 이로써 면역콘주게이트를 생성할 수 있다 (참고: 예를 들어 EP659,439A2, Merck Patent GmbH). EGFR 길항제는 미국 특허 번호 5,616,582, 5,457,105, 5,475,001, 5,654,307, 5,679,683, 6,084,095, 6,265,410, 6,455,534, 6,521,620, 6,596,726, 6,713,484, 5,770,599, 6,140,332, 5,866,572, 6,399,602, 6,344,459, 6,602,863, 6,391,874, 6,344,455, 5,760,041, 6,002,008, 및 5,747,498, 뿐만 아니라 하기의 PCT 공보: WO98/14451, WO98/50038, WO99/09016, 및 WO99/24037에 기술된 화합물과 같은 소분자를 포함한다. 특정한 소분자 EGFR 길항제는 하기를 포함한다: OSI-774 (CP-358774, 에를로티닙, TARCEVA® Genentech/OSI Pharmaceuticals); PD 183805 (CI 1033, 2-프로펜아미드, N-[4-[(3-클로로-4-플루오로페닐)아미노]-7-[3-(4-모폴리닐)프로폭시]-6-퀴나졸리닐]-, 디하이드로클로라이드, Pfizer Inc.); ZD1839, 게피티닙 (IRESSA®) 4-(3’-클로로-4’-플루오로아닐리노)-7-메톡시-6-(3-모폴리노프로폭시)퀴나졸린, AstraZeneca); ZM 105180 ((6-아미노-4-(3-메틸페닐-아미노)-퀴나졸린, Zeneca); BIBX-1382 (N8-(3-클로로-4-플루오로-페닐)-N2-(1-메틸-피페리딘-4-일)-피리미도[5,4-d]피리미딘-2,8-디아민, Boehringer Ingelheim); PKI-166 ((R)-4-[4-[(1-페닐에틸)아미노]-1H-피롤로[2,3-d]피리미딘-6-일]-페놀); (R)-6-(4-하이드록시페닐)-4-[(1-페닐에틸)아미노]-7H-피롤로[2,3-d]피리미딘); CL-387785 (N-[4-[(3-브로모페닐)아미노]-6-퀴나졸리닐]-2-부틴아미드(butynamide); EKB-569 (N-[4-[(3-클로로-4-플루오로페닐)아미노]-3-시아노-7-에톡시-6-퀴놀리닐]-4-(디메틸아미노)-2-부텐아미드) (Wyeth); AG1478 (Pfizer); AG1571 (SU 5271; Pfizer); 이중 EGFR/HER2 티로신 키나제 억제제 예컨대 라파티닙 (TYKERB®, GSK572016 또는 N-[3-클로로-4-[(3 플루오로페닐)메톡시]페닐]-6[5[[[2메틸설포닐)에틸]아미노]메틸]-2-푸라닐]-4-퀴나졸린아민).
화학치료제는 또한 하기를 포함할 수 있다: 티로신 키나제 억제제 (선행 단락에 주지된 EGFR-표적화된 약물 포함); 소분자 HER2 티로신 키나제 억제제, 예컨대 TAK165 (Takeda로부터 이용가능함); CP-724,714, ErbB2 수용체 티로신 키나제의 경구 선택적 억제제 (Pfizer 및 OSI); 이중-HER 억제제 예컨대 EKB-569 (Wyeth로부터 이용가능함) (EGFR에 우선적으로 결합하지만 HER2 및 EGFR-과발현 세포 둘 모두를 억제함); 라파티닙 (GSK572016; Glaxo-SmithKline로부터 이용가능함), 경구 HER2 및 EGFR 티로신 키나제 억제제; PKI-166 (Novartis로부터 이용가능함); 팬(pan)-HER 억제제 예컨대 카네르티닙 (CI-1033; Pharmacia); Raf-1 억제제 예컨대 안티센스 제제 ISIS-5132 (Raf-1 신호전달을 억제하는 ISIS 의약품으로부터 이용가능함); 비-HER 표적화된 TK 억제제, 예컨대 이마티닙 메실레이트 (GLEEVEC®, Glaxo SmithKline로부터 이용가능함); 다중-표적화된 티로신 키나제 억제제 예컨대 수니티닙 (SUTENT®, Pfizer로부터 이용가능함); VEGF 수용체 티로신 키나제, 억제제 예컨대 바탈라닙 (PTK787/ZK222584, Novartis/Schering AG로부터 이용가능함); MAPK 세포외 조절된 키나제 I 억제제 CI-1040 (Pharmacia로부터 이용가능함); 퀴나졸린, 예컨대 PD 153035,4-(3-클로로아닐리노) 퀴나졸린; 피리도피리미딘; 피리미도피리미딘; 피롤로피리미딘, 예컨대 CGP 59326, CGP 60261 및 CGP 62706; 피라졸로피리미딘, 4-(페닐아미노)-7H-피롤로[2,3-d] 피리미딘; 커큐민 (디페룰로일 메탄, 4,5-비스 (4-플루오로아닐리노)프탈이미드); 타이르포스틴 (니트로티오펜 모이어티 함유); PD-0183805 (Warner-Lamber); 안티센스 분자 (예를 들면, HER-암호화 핵산에 결합하는 것들); 퀴녹살린 (미국 특허 번호 5,804,396); 트리포스틴 (미국 특허 번호 5,804,396); ZD6474 (Astra Zeneca); PTK-787 (Novartis/Schering AG); 팬(pan)-HER 억제제 예컨대 CI-1033 (Pfizer); 아피니탁 (ISIS 3521; Isis/Lilly); 이마티닙 메실레이트 (GLEEVEC®); PKI 166 (Novartis); GW2016 (Glaxo SmithKline); CI-1033 (Pfizer); EKB-569 (Wyeth); 세막시닙 (Pfizer); ZD6474 (AstraZeneca); PTK-787 (Novartis/Schering AG); INC-1C11 (Imclone), 라파마이신 (시롤리무스, RAPAMUNE®); 또는 하기 특허 공보 중 임의의 것에 기재된 것들: 미국 특허 번호 5,804,396, WO 1999/09016, WO 1998/43960, WO 1997/38983, WO 1999/06378, WO 1999/06396, WO 1996/30347, WO 1996/33978, WO 1996/3397, 및 WO 1996/33980.
화학치료제는 덱사메타손, 인터페론, 콜히친, 메토프린, 사이클로스포린, 암포테리신, 메트로니다졸, 알렘투주맙, 알리트레티노인, 알로푸리놀, 아미포스틴, 삼산화비소, 아스파라기나제, BCG 생균, 베바쿠지맙, 벡사로텐, 클라드리빈, 클로파라빈, 다베포에틴 알파, 데니류킨, 덱스라족산, 에포에틴 알파, 엘로티닙, 필그라스팀, 히스트렐린 아세테이트, 이브리투모맙, 인터페론 알파-2a, 인터페론 알파-2b, 레날리도미드, 레바미졸, 메스나, 메톡살렌, 난드롤론, 넬라라빈, 노페투모맙, 오프렐베킨, 팔리페르민, 파미드로네이트, 페가데마제, 페가스파가제, 페그필그라스팀, 페메트렉세드 2나트륨, 플리카마이신, 포르피머 나트륨, 퀴나크린, 라스부리카제, 사르그라모스팀, 테모졸로미드, VM-26, 6-TG, 토레미펜, 트레티노인, 전체-트랜스 레티노산 (ATRA), 발루비신, 졸레드로네이트 및 졸레드론산 및 이들의 약제학적으로 허용가능한 염을 포함한다.
본원에 사용된 바와 같이, 용어 "전구약물"은 친계 약물과 비교하여 종양 세포에 덜 세포독성이고, 더욱 활성인 친계 형태로 전환 또는 효소적으로 활성화될 수 있는 약제학적 활성 물질의 전구체 또는 유도체를 지칭한다. 하기를 참고한다: 예를 들어, Wilman, "Prodrugs in Cancer Chemotherapy" Biochemical Society Transactions, 14, pp. 375-382, 615th Meeting Belfast (1986) 및 Stella et al., "Prodrugs: A Chemical Approach to Targeted Drug Delivery," Directed Drug Del ivery, Borchardt et al., (ed.), pp. 247-267, Humana Press (1985). 본 발명의 전구약물은 비제한적으로 하기를 포함한다: 포스페이트-함유 전구약물, 티오포스페이트-함유 전구약물, 설페이트-함유 전구약물, 펩티드-함유 전구약물, D-아미노산-변형된 전구약물, 글리코실화된 전구약물, β-락탐-함유 전구약물, 선택적으로 치환된 페녹시아세트아미드-함유 전구약물 또는 선택적으로 치환된 페닐아세트아미드-함유 전구약물, 5-플루오로시토신 및 다른 5-플루오로우리딘 전구약물 (보다 더 활성인 세포독성 없는 약물로 전환될 수 있음). 본 발명에서의 사용을 위하여 전구약물 형태로 유도될 수 있는 세포독성 약물의 예시는 상기 기재된 화학치료제를 포함하나, 이에 제한되지 않는다.
본원에서 사용될 경우, "성장 억제제"는 시험관내 또는 생체내에서 세포(예를 들면, 성장이 PD-L1 발현에 의존적인 세포)의 성장 및/또는 증식을 억제하는 화합물 또는 조성물을 지칭한다. 따라서, 성장 억제제는 S 상에서 세포의 백분율을 유의미하게 감소시키는 것일 수 있다. 성장 억제제의 예는 (S 상 이외의 위치에서) 세포 주기 진행을 차단하는 제제, 예컨대 G1 상 및 M-상 정지를 유도하는 제제를 포함한다. 고전적 M-상 차단제는 하기를 포함한다: 빈카 (빈크리스틴 및 빈블라스틴), 탁산, 및 토포이소머라제 Ⅱ 억제제 예컨대 안트라사이클린 항생제 독소루비신 ((8S-시스)-10-[(3-아미노-2,3,6-트리데옥시-α-L-릭소-헥사피라노실)옥시]-7,8,9,10-테트라하이드로-6,8,11-트리하이드록시-8-(하이드록시아세틸)-1-메톡시-5,12-나프타센디온), 에피루비신, 다우노루비신, 에토포시드, 및 블레오마이신. G1을 정지시키고, 또한 S-상 정지로 확대되는 제제는 예를 들면, DNA 알킬화제, 예컨대 타목시펜, 프레드니손, 다카르바진, 메클로르에타민, 시스플라틴, 메토트렉세이트, 5-플루오로우라실, 및 아라-C이다. 추가 정보는 하기에서 발견될 수 있다: "The Molecular Basis of Cancer," Mendelsohn and Israel, eds., Chapter 1, entitled "Cell cycle regulation, oncogenes, and antineoplastic drugs" by Murakami et al. (WB Saunders: Philadelphia, 1995), 특히 p. 13. 탁산(파클리탁셀 및 도세탁셀)은 둘 다 주목(yew tree)에서 유도된 항암 약물이다. 유럽 주목에서 유도된 도세탁셀(TAXOTERE®, Rhone-Poulenc Rorer)은 파클리탁셀의 반합성 유사체(TAXOL®, Bristol-Myers Squibb)이다. 파클리탁셀 및 도세탁셀은 튜불린 이량체로부터 미세소관의 어셈블리를 촉진하고, 탈중합 방지에 의해 미세소관을 안정화하여 세포에서 유사분열의 억제를 야기한다.
"방사선 요법"은 세포를 정상적으로 작용하도록 하거나 세포를 파괴하는 것을 함께 제한하기 위하여 세포에 충분한 손상을 유도하기 위하여 지시된 감마선 또는 베타선의 사용을 의미한다. 치료의 투여량 또는 기간을 결정하기 위하여 본 분야에서 많은 방법이 있을 것이라는 것이 고려된다. 전형적인 치료를 1회성 투여로 실시하였으며, 전형적인 투여량은 1일 당 10 내지 200 단위 (Grays)의 범위이다.
용어 "약제학적 제형"은 그 안에 함유된 활성 성분의 생물학적 활성이 효과적이도록 하기 위한 형태인, 그리고 제형이 투여되는 환자에 허용불가능하게 독성인 추가의 성분을 함유하지 않는 제형을 지칭한다.
"약제학적으로 허용가능한 담체"는 환자에 무독성인, 활성 성분 이외의, 약제학적 제형 중의 성분을 나타낸다. 약제학적으로 허용가능한 담체는, 이로써 제한되는 것은 아니지만, 완충제, 부형제, 안정화제 또는 보존제를 포함한다.
용어 "패키지 삽입물"은 치료학적 제품의 상업 패키지에 통상적으로 포함되는 설명서를 지칭하기 위해 사용되고 이는 상기 치료학적 제품의 사용에 관한 적응증, 용도, 투여량, 투여, 병용 요법, 사용금지 사항 및/또는 경고에 관한 정보를 함유한다.
"멸균된" 제형은 무균성이거나 또는 모든 살아있는 미생물 및 그의 포자가 없다.
"제조 물품"은 적어도 하나의 시약, 예를 들면 본 발명의 바이오마커 유전자 또는 단백질을 특이적으로 검출하기 위한 프로브 또는 질환 또는 장애 (예를 들면, 암)의 치료를 위한 약제를 포함하는 임의의 제조물 또는 키트 (예를 들면, 패키지 또는 용기)이다. 특정 구현예에서, 상기 제조물 또는 키트는 바람직하게는 본 발명의 방법들을 수행하기 위한 단위로서 선전, 유통 또는 판매된다.
용어 "소분자"는 2000 달톤 이하, 바람직하게는 약 500 달톤 이하의 분자량을 갖는 임의의 분자를 지칭한다.
단어 "표지"는, 본원에 사용될 경우, 시약, 예컨대 폴리뉴클레오티드 프로브 또는 항체에 직접 또는 간접적으로 콘주게이트되거나 또는 융합되고, 이것이 콘주게이트되거나 또는 융합되는 상기 시약의 검출을 용이하게 하는 화합물 또는 조성물을 지칭한다. 상기 표지는 그 자체로 검출가능하거나(예컨대 , 방사성 동위원소 표지 또는 형광 표지), 또는 효소 표지의 경우, 검출가능한 기질 화합물 또는 조성물의 화학적 변경을 촉매할 수 있다. 상기 용어는 하기를 포괄하는 것으로 의도된다: 검출가능한 물질을 프로브 또는 항체에 커플링 (즉, 물리적으로 연결)함에 의한 프로브 또는 항체의 직접 표지, 뿐만 아니라 직접적으로 표지된 또 다른 시약과의 반응성에 의한 프로브 또는 항체의 간접 표지. 간접 표지의 예시는 형광-표지 2차 항체를 사용한 1차 항체, 및 비오틴에 의한 DNA 프로브의 말단-표지의 검출을 포함하며, 이로써 이는 형광-표지 스트렙타비딘에 의하여 검출될 수 있다.
용어 "항체"는 광범위한 의미로 사용되며, 구체적으로는 단클론성 항체 (전장 단클론성 항체 포함), 다클론성 항체, 다중특이적 항체 (예를 들면, 이중특이적 항체), 및 원하는 생물학적 활성을 나타내기만 한다면 항체 단편을 포함한다.
"천연 항체"는 보통 2개의 동일한 경(L) 쇄 및 2개의 동일한 중(H) 쇄로 구성된 약 150,000 달톤의 이형사량체 당단백질이다. 각 경쇄는 하나의 공유 디설파이드 결합에 의해 중쇄에 연결되고, 반면 디설파이드 연결기의 수는 상이한 면역글로불린 이소형의 중쇄 중에서 가변한다. 각 중쇄 및 경쇄는 또한 규칙적으로 이격된 사슬내 디설파이드 가교를 가진다. 각각의 중쇄는 하나의 말단에서 가변 도메인(VH) 다음에 다수의 불변 도메인을 가진다. 각각의 경쇄는 하나의 말단에 가변 도메인을(VL) 그리고 그 다른 말단에 불변 도메인을 가지며; 경쇄의 불변 도메인은 중쇄의 제1 불변 도메인과 정렬되며, 경쇄 가변 도메인은 중쇄의 가변 도메인과 정렬된다. 특정한 아미노산 잔기가 경쇄 및 중쇄 가변 도메인 간 계면을 형성하는 것으로 여겨진다.
"단리된" 항체는 이의 천연 환경의 성분으로부터 식별되고, 분리되고, 그리고/또는 회수된 항체이다. 그 천연 환경의 오염물질 성분은 항체에 대한 연구, 진단적 및/또는 치료적 사용을 방해할 물질이며, 효소, 호르몬, 및 다른 단백질성 또는 비단백질성 용질이 포함될 수 있다. 일부 구현예에서, 항체는 (1) 예를 들면, Lowry 방법에 의해 계측된 항체의 95 중량% 초과로, 일부 구현예에서 99 중량% 초과로; (2) 예를 들면, 회전 컵 시쿼네이터(spinning cup sequenator)를 이용해서 N-말단 또는 내부 아미노산 서열의 적어도 15 개 잔기를 수득하기 충분한 정도로, 또는 (3) 예를 들면, 쿠마씨 블루 또는 은 염색을 이용해서 환원 또는 비환원 조건 하에 SDS-PAGE에 의해 균질성으로까지, 정제된다. 단리된 항체는 항체의 천연 환경의 적어도 하나의 성분이 존재하지 않기 때문에 재조합 세포 내에서 동일계내에 항체를 포함한다. 그러나, 통상적으로, 단리된 항체는 적어도1종의 정제 단계에 의해 제조될 것이다.
"차단" 항체 또는 "길항제" 항체는, 그것이 결합되는 항원의 생물학적 활성을 억제시키거나 또는 감소시키는 것이다. 예를 들어, VEGF-특이적 길항제 항체는 VEGF를 결합시키고 VEGF가 혈관 내피 세포 증식을 유도하는 능력을 억제한다. 바람직한 차단 항체 또는 길항제 항체는 항원의 생물학적 활성을 완전히 억제한다.
달리 명시하지 않는 한, 본 명세서 전반에 걸쳐 "다가 항체(multivalent antibody)"라는 표현은 3개 이상의 항원 결합 부위를 포함하는 항체를 나타내기 위해 사용된다. 다가 항체는 바람직하게는 3개 이상의 항원 결합 부위를 갖도록 가공되고 일반적으로 천연 서열 IgM 또는 IgA 항체가 아니다.
임의의 포유동물 종 유래의 항체 (면역글로불린)의 "경쇄"는, 이들의 불변 도메인의 아미노산 서열에 기초하여, 카파 ("κ") 및 람다 ("λ")로 불리는 2개의 명확하게 구별되는 유형 중 하나에 할당될 수 있다.
용어 "불변 도메인"은, 항원 결합 부위를 함유하는, 면역글로불린의 다른 부분, 즉 가변 도메인에 비하여 더욱 보존된 아미노산 서열을 갖는 면역글로불린 분자의 부분을 지칭한다. 불변 도메인은 중쇄의 CH1, CH2 및 CH3 도메인 (집합적으로, CH) 및 경쇄의 CHL (또는 CL) 도메인을 함유한다.
항체의 "가변 영역" 또는 "가변 도메인"은 항체의 중쇄 또는 경쇄의 아미노-말단 도메인을 지칭한다. 중쇄의 가변 도메인은 "VH"로 지칭될 수 있다. 경쇄의 가변 도메인은 "VL"로 지칭될 수 있다. 이들 도메인은 일반적으로 항체의 가장 가변성 부분이고 항원-결합 부위를 함유한다.
용어 "가변"은 가변 도메인의 특정 분절에서 항체 간 서열이 항체 중 차례로 광범위하게 상이한 사실을 지칭한다. 가변 또는 "V" 도메인은 항원 결합을 매개하고, 그의 특정 항원에 대한 특정 항체의 특이성을 정의한다. 그러나, 가변성은 가변 도메인의 범위에 균일하게 분포되지 않는다. 대신에, V 영역은 각각 9-12 아미노산 길이인 "초가변성 영역"이라 불리는 극단적인 가변성의 짧은 영역에 의해 분리된 15-30 아미노산의 프레임워크 영역 (FR)으로 불리는 상대적으로 비변이적인 연신부로 구성된다. 본 명세서에서 사용될 때 용어 "초가변성 영역" 또는 "HVR"은 항원-결합을 담당하는 항체의 아미노산 잔기를 지칭한다. 초가변 영역은 일반적으로, 예를 들어, VL에서 약 잔기 24-34 (L1), 50-56 (L2) 및 89-97 (L3) 부근, 및 VH에서 약 잔기 26-35 (H1), 49-65 (H2) 및 95-102 (H3) 부근으로부터 아미노산 잔기를 포함한다 (일 구현예에서, H1은 약 잔기 31-35 부근이다); Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD. (1991)) 및/또는 "초가변성 루프"로부터의 이들 잔기 (예를 들면 VL 내 잔기 26-32 (L1), 50-52 (L2) 및 91-96 (L3), 및 VH 내 26-32 (H1), 53-55 (H2) 및 96-101 (H3); Chothia and Lesk, J. Mol . Biol . 196:901-917 (1987). 천연 중쇄 및 경쇄의 가변 도메인 각각은 3개의 초가변 영역에 의해 연결된, 크게는 베타-시트 입체배치를 채택한 4개의 FR을 포함하여, 베타-시트 구조를 연결하고, 그리고 일부 경우에는 베타-시트 구조의 일부를 형성하는 루프를 형성한다. 각 쇄의 초가변 영역은 FR에 의해 근접하여 함께 유지되고, 그리고 다른 쇄로부터의 초가변 영역과 함께 항체의 항원-결합 부위의 형성에 기여한다 (참고: Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD. (1991)). 따라서 HVR과 FR 서열은 일반적으로 VH (또는 VL)에서 하기 순서로 출현한다: FR1-H1(L1)-FR2-H2(L2)-FR3-H3(L3)-FR4. 불변 도메인은 항원에 항체를 결합하는 것에 직접적으로 관여하지는 않지만, 항체 의존성 세포독성 (ADCC)에서의 항체의 참여와 같은 다양한 효과기 작용을 나타낸다.
본원의 목적을 위해 "수용체 인간 프레임워크"는 아래에 정의된 바와 같은 인간 면역글로불린 프레임워크 또는 인간 공통 프레임워크로부터 유도된 경쇄 가변 도메인(VL) 프레임워크 또는 중쇄 가변 도메인(VH) 프레임워크의 아미노산 서열을 포함하는 프레임워크이다. 인간 면역글로불린 프레임워크 또는 인간 공통 프레임워크"로부터 유도된" 수용체 인간 프레임워크는 이의 동일한 아미노산 서열을 포함할 수 있거나, 또는 이것은 아미노산 서열 변화를 함유할 수 있다. 일부 구현예에서, 아미노산 변화의 수는 10개 이하, 9개 이하, 8개 이하, 7개 이하, 6개 이하, 5개 이하, 4개 이하, 3개 이하, 또는 2개 이하이다. 일부 구현예에서, VL 수용체 인간 프레임워크는 서열에 있어서 VL 인간 면역글로불린 프레임워크 서열 또는 인간 컨센서스 프레임워크 서열과 동일하다.
본원에서 사용될 경우, 용어 "초가변 영역", "HVR" 또는 "HV"는 서열이 초가변성이고/이거나 구조적으로 정의된 루프를 형성하는 항체-가변 도메인 영역을 나타낸다. 일반적으로, 항체는 6개의 HVR: VH (H1, H2, H3)로 3개, 및 VL (L1, L2, L3)로 3개를 포함한다. 천연 항체에서, H3 및 L3은 6개 HVR의 가장 큰 다양성을 나타내며, H3은 특히 항체에 대해 미세한 특이성을 부여하는데 있어서 독특한 역할을 담당하는 것으로 여겨진다. 하기를 참고한다: 예를 들어, Xu et al., Immunity 13:37-45 (2000); Johnson and Wu, in Methods in Molecular Biology 248:1-25 (Lo, ed., Human Press, Totowa, N.J., 2003). 사실상, 중쇄만으로 구성된 천연 발생 낙타과(camelid) 항체는 경쇄의 부재 하에서 작용적이고 무변성이다. 참고: 예를 들어, Hamers-Casterman et al., Nature 363:446-448 (1993); Sheriff et al., Nature Struct. Biol. 3:733-736 (1996).
수많은 HVR 묘사가 사용되며, 본원에서 포괄된다. 카밧 상보성-결정 영역(CDR)은 서열 가변성에 기반하며, 가장 일반적으로 사용된다(Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md. (1991)). 초티아는 대신에, 구조적 루프의 위치를 지칭한다 (Chothia and Lesk, J. Mol . Biol . 196:901-917 (1987)). AbM HVR은 카밧 HVR 및 초티아 구조적 루프 간 절충을 나타내며, Oxford Molecular의 AbM 항체-모델링 소프트웨어에 의해 이용된다. "접촉" HVR은 이용 가능한 복합체 결정 구조의 분석에 기반한다. 이들 HVR 각각으로부터의 잔기가 아래에 주지된다.
HVR은 하기와 같이 "연장된 HVR"을 포함할 수 있다: 24-36 또는 24-34 (L1), 46-56 또는 50-56 (L2) 및 89-97 또는 89-96 (L3) (VL 중) 및 26-35 (H1), 50-65 또는 49-65 (H2) 및 93-102, 94-102, 또는 95-102 (H3) (VH 중). 초가변 도메인 잔기들은 이들 정의의 각각에 대해 문헌(Kabat et al., 상기)에 따라 넘버링된다.
"프레임워크" 또는 "FR" 잔기는 본원에서 정의된 바와 같이 HVR 잔기 이외의 가변-도메인 잔기이다.
"인간 공통 프레임워크"는 인간 면역글로불린 VL 또는 VH 프레임워크 서열의 선택에서 가장 통상적으로 존재하는 아미노산 잔기를 나타내는 프레임워크이다. 일반적으로, 인간 면역글로불린 VL 또는 VH 서열의 선택은 가변 도메인 서열의 서브그룹 유래의 것이다. 일반적으로, 서열의 하위그룹은 하기에서의 것과 같다: Kabat et al., Sequences of Proteins of Immunological Interest, Fifth Edition, NIH Publication 91-3242, Bethesda MD (1991), vols. 1-3. 일 구현예에서, VL에 대하여, 하위그룹은 Kabat et al, 상기에서와 같이 하위그룹 카파 I이다. 일 구현예에서, VH에 대해, 하위그룹은 Kabat et al., 상기에서와 같이 하위그룹 Ⅲ이다.
용어 "카밧에서의 가변-도메인 잔기-넘버링" 또는 "카밧에서의 아미노산-위치 넘버링" 및 이들의 변이체는 [Kabat et al.,상기]에서 항체 편집의 중쇄 가변 도메인 또는 경쇄 가변 도메인에 대하여 사용된 넘버링 시스템을 지칭한다. 상기 넘버링 시스템을 이용하여, 실제 선형 아미노산 서열은 가변 도메인의 FR 또는 HVR의 단축 또는 이것으로의 삽입에 대응하는 더 적거나 더 많은 아미노산을 포함할 수 있다. 예를 들면, 중쇄 가변 도메인에는 H2의 잔기 52 뒤에 단일 아미노산 삽입(카밧에 따른 잔기 52a) 및 중쇄 FR 잔기 82 뒤에 삽입된 잔기(예를 들면, 카밧에 따른 잔기 82a, 82b, 및 82c 등)가 포함될 수 있다. 잔기의 카밧 넘버링은 항체 서열의 상동성 영역에서 "표준" 카밧 넘버링된 서열과의 정렬에 의해 주어진 항체에 대해 결정될 수 있다.
카밧 넘버링 시스템은 가변 도메인 내 잔기 (대략 경쇄의 잔기 1-107, 및 중쇄의 잔기 1-113)에 대하여 지칭할 때 일반적으로 사용된다(예를 들면, Kabat et al., Sequences of Immunological Interest. 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md. (1991)). "EU 넘버링 시스템" 또는 "EU 지수"는 일반적으로, 면역글로불린 중쇄 불변 영역 내의 잔기를 지칭할 경우 사용된다 (예컨대, 상기 Kabat et al. 에 보고된 EU 지수). "카밧으로의 EU 지수"는 인간 IgG1 EU 항체의 잔기 넘버링을 지칭한다. 본 명세서에서 달리 언급되지 않는 한, 항체의 가변 도메인에서 잔기 수에 대한 언급은 카밧 넘버링 시스템에 의한 잔기 넘버링을 의미한다. 본원에서 달리 언급하지 않는다면, 항체의 불변 도메인의 잔기 수에 대한 언급은, EU 넘버링 시스템 (예컨대, 참고: 미국 가출원 번호 60/640,323, EU 넘버링에 대한 도면)에 의한 잔기 넘버링을 의미한다.
다르게 명시되지 않으면, 가변 도메인 (예를 들면, FR 잔기)에서 HVR 잔기 및 다른 잔기는 Kabat et al., 상기에 따라 본원에서 넘버링된다.
본원에서 사용된 용어들 "전장 항체", "무손상 항체" 및 "전체 항체"는 상호교환적으로 아래에서 정의된 바와 같이 항체 단편이 아닌 그 실질적으로 무손상 형태의 항체를 나타낸다. 상기 용어는 특히 Fc 영역을 함유하는 중쇄를 갖는 항체를 나타낸다.
"항체 단편"은 바람직하게는 이들의 항원-결합 영역을 포함하는 무손상 항체의 일부를 포함한다. 일부 구현예에서, 본원에 기술된 항체 단편은 항원-결합 단편이다. 항체 단편의 예는 Fab, Fab', F(ab')2, 및 Fv 단편; 디아바디; 선형 항체(linear antibodies); 단일-쇄 항체 분자; 및 항체 단편으로부터 형성된 다중특이적 항체를 포함한다.
항체의 파파인 소화는 각각 단일 항원-결합 부위를 갖는 "Fab" 단편으로 불리는 2 개의 동일한 항원-결합 단편 및 그 명칭이 쉽게 결정화하는 그 능력을 반영하는 잔여 "Fc" 단편을 생성한다. 펩신 처리는 F(ab')2 단편을 산출하는데, 이것은 2개의 항원 결합 부위를 갖고 항원을 여전히 가교결합할 수 있다.
본원에서 용어 "Fc 영역"은 적어도 불변 영역의 일부를 함유하는 면역글로불린 중쇄의 C-말단 영역을 정의하는데 사용된다. 상기 용어는 천연 서열 Fc 영역 및 변이체 Fc 영역을 포함한다. 일 구현예에서, 인간 IgG 중쇄 Fc 영역은 중쇄의 Cys226 또는 Pro230으로부터 카복실-말단까지 연장된다. 그러나, Fc 영역의 C-말단 라이신 (Lys447)은 존재할 수 있거나 또는 존재하지 않을 수 있다. 본원에서 달리 특정되지 않으면, Fc 영역 또는 불변 영역 내에 아미노산 잔기의 넘버링은 하기에서 설명된 바와 같이, EU 인덱스로 불리는 EU 넘버링 시스템에 따른다: Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD (1991).
"효과기 기능"은 항체의 Fc 영역에 기인할 수 있는 생물학적 활성을 나타내며, 이것은 항체 이소형에 따라 가변한다. 항체 효과기 기능의 예는 하기를 포함한다: C1q 결합 및 보체 의존적 세포독성 (CDC); Fc 수용체 결합; 항체-의존적 세포-매개된 세포독성 (ADCC); 식세포작용; 세포 표면 수용체의 하향 조절 (예를 들면, B 세포 수용체); 및 B 세포 활성화.
"Fv"는 완전한 항원-결합 부위를 함유하는 최소 항체 단편이다. 일 구현예에서, 2개의 사슬 Fv 종은 단단하게 비공유 결합된 하나의 중쇄 가변 도메인 및 하나의 경쇄 가변 도메인의 이합체로 구성된다. 단일-쇄 Fv(scFv) 종에서, 1개의 중쇄 및 1개의 경쇄 가변 도메인은 경쇄 및 중쇄가 2-쇄 Fv 종에서와 비슷한 "이량체" 구조로 결합할 수 있도록 가요성 펩티드 링커에 의해 공유 결합될 수 있다. 이는 상기 입체 배지에서 각각의 가변 도메인의 3개의 HVR은 VH-VL 이량체의 표면 상에서 항원-결합 부위를 정의하도록 상호작용한다. 총괄적으로, 6개의 HVR은 항체에 대한 항원-결합 특이성을 부여한다. 그러나, 전체 결합 부위에 비해 더 낮은 친화도에서지만, 단일 가변 도메인(또는 항원에 대해 특이적인 3개의 HVR만을 포함하는 Fv의 절반)도 항원을 인식하고 결합하는 능력을 갖는다.
Fab 단편은 중쇄- 및 경쇄 가변 도메인을 함유하며, 또한 경쇄의 불변 도메인 및 중쇄의 제1 불변 도메인 (CH1)을 함유한다. Fab' 단편은 항체 힌지 영역으로부터 하나 이상의 시스테인을 포함하는 중쇄 CH1 도메인의 카복시 말단에서 몇 개의 잔기를 첨가함으로써 Fab 단편과 상이하다. Fab’-SH는 불변 도메인의 시스테인 잔기(들)가 자유 티올기를 갖는 Fab’에 대한 본원에서의 명칭이다. F(ab')2 항체 단편은 본래 이들 사이에 힌지 시스테인을 갖는 Fab' 단편의 쌍으로서 생산되었다. 항체 단편의 다른 화학적 커플링이 또한 공지되어 있다.
"단일-쇄 Fv" 또는 "scFv" 항체 단편은 항체의 VH 및 VL 도메인을 포함하며, 여기서 이들 도메인은 단일 폴리펩티드 쇄에 존재한다. 일반적으로, scFv 폴리펩티드는 VH와 VL 도메인 사이에 폴리펩티드 링커를 추가로 포함하며, 그것은 scFv가 항원 결합을 위한 목적 구조를 형성할 수 있게 한다. sFv의 재고를 위해, 예를 들어, 하기를 참고한다: , The Pharmacology of Monoclonal Antibodies, vol. 113, Rosenburg and Moore eds., (Springer-Verlag, New York, 1994), pp. 269-315.
용어 "다중특이적 항체"는 가장 넓은 의미에서 사용되고 특이적으로 중쇄 가변 도메인 (VH) 및 경쇄 가변 도메인 (VL)을 포함하는 항체에 이르고, 여기에서 VH-VL 유닛은 폴리에피토프 특이성을 갖는다 (즉, 1개의 생물학적 분자에서 2개의 상이한 에피토프 또는 상이한 생물학적 분자에서 각각의 에피토프에 결합할 수 있다). 상기 다중특이적 항체는 전장 항체, 2개 이상의 VL 및 VH 도메인을 갖는 항체, Fab, Fv, dsFv, scFv, 디아바디, 이중특이적 디아바디 및 트리아바디와 같은 항체 단편, 공유적으로 또는 비공유적으로 결합된 항체 단편을 포함하지만 이에 국한되지 않는다. "다중에피토프 특이성"은 동일하거나 상이한 표적(들)상에 2개 이상의 상이한 에피토프에 특이적으로 결합하는 능력을 지칭한다. "이중에피토프 특이성" 또는 "이중특이성"은 동일하거나 상이한 표적(들) 상에 2개 이상의 상이한 에피토프에 특이적으로 결합하는 능력을 지칭한다. 그러나, 이중특이적 항체와 대조적으로, 이중-특이적 항체는 아미노산 서열에서 동일한 2개 항원-결합 아암을 갖고 각각의 Fab 아암은 2개 항원을 인식할 수 있다. 이중-특이성은 단일 Fab 또는 IgG 분자로서 2개의 상이한 항원과 높은 친화성으로 항체를 상호작용하게 한다. 일 구현예에 따라서, IgG1 형태의 다중특이적 항체는 5 μM 내지 0.001 pM, 3 μM 내지 0.001 pM, 1 μM 내지 0.001 pM, 0.5 μM 내지 0.001 pM, 또는 0.1 μM 내지 0.001 pM의 친화도로 각 에피토프에 결합한다. "단일 특이적"은 오직 하나의 에피토프에 결합하는 능력을 언급한다.
용어 "디아바디"는 동일한 폴리펩티드 사슬 (VH-VL) 내에 경쇄 가변 도메인 (VL)에 연결된 중쇄 가변 도메인 (VH)을 포함하는 2개의 항원-결합 부위를 갖는 항체 단편을 지칭한다. 동일한 쇄 상에서 2 개의 도메인 간 쌍형성을 허용하기에는 너무 짧은 링커를 이용함으로써, 도메인은 또 하나의 쇄의 상보적 도메인과 쌍을 이루고 2개의 항원-결합 부위를 생성하도록 유도된다. 디아바디는 2가 또는 이중특이적일 수 있다. 디아바디는 하기에 더욱 충분히 기술된다: 예를 들면, EP 404,097; WO 1993/01161; Hudson et al., Nat. Med . 9:129-134 (2003); 및 Hollinger et al., Proc . Natl . Acad . Sci . USA 90: 6444-6448 (1993). 트리아바디 및 테트라바디가 또한 하기에 기술된다: Hudson et al., Nat. Med . 9:129-134 (2003).
항체의 "부류"는 이의 중쇄가 소유하는 불변 도메인 또는 불변 영역의 유형을 지칭한다. 5개 주요 부류의 항체가 있다: IgA, IgD, IgE, IgG, 및 IgM (이들 중 몇몇은 하위부류(이소형), 예를 들면 IgG1, IgG2, IgG3, IgG4, IgA1, 및 IgA2 로 추가 구분될 수 있음). 항체의 상이한 부류에 상응하는 중쇄 불변 도메인은 각각 α, δ, ε, γ 및 μ로 지칭된다.
용어 "단클론성 항체"는 본원에서 사용된 바와 같이 실질적으로 균질한 항체 집단에서 수득된 항체를 지칭하며, 예컨대 상기 집단을 포함하는 개별 항체는 가능한 돌연변이, 예를 들면 소량으로 존재할 수 있는 천연 발생 돌연변이를 제외하고 동일하다. 따라서, 수식어 "단일클론"은 구별된 항체의 혼합물이 아닌 항체의 특징을 표지한다. 특정 구현예에서, 그와 같은 단클론성 항체에는 전형적으로 표적에 결합하는 폴리펩티드 서열을 포함하는 항체가 포함되며, 여기서 상기 표적 결합 폴리펩티드 서열은 복수의 폴리펩티드 서열로부터의 단일 표적 결합 폴리펩티드 서열의 선택이 포함되는 방법에 의해 수득되었다. 예를 들면, 선택 방법은 복수의 클론, 예컨대 하이브리도마 클론, 파아지 클론, 또는 재조합 DNA 클론의 풀로부터의 고유 클론의 선택일 수 있다. 선택된 표적 결합 서열이, 예를 들면 표적에 대한 친화도를 향상하기 위해, 표적 결합 서열을 인간화하기 위해, 세포 배양에서 그 생성을 향상하기 위해, 생체내 그 면역원성을 감소시키기 위해, 다중특이적 항체를 생성하기 위해 등등 추가 변경될 수 있으며, 변경된 표적 결합 서열을 포함하는 항체가 또한 본 발명의 단클론성 항체라는 것이 이해되어야 한다. 전형적으로 상이한 결정인자(에피토프)에 대하여 지향된 상이한 항체가 포함되는 다클론성 항체 제조물과는 대조적으로, 단클론성-항체 제조물의 각각의 단클론성 항체는 항원 상의 단일 결정인자에 대하여 지향된다. 이들의 특이성에 부가하여, 단클론성-항체 제조물은 이들이 전형적으로 다른 면역글로불린에 의해 오염되지 않는다는 점에서 유리하다.
수식어 "단클론성"은 항체의 실질적으로 균질한 집단으로부터 수득되는 항체의 특징을 시사하며, 임의의 특정한 방법에 의한 항체의 생산을 필요로 하는 것으로 해석되어서는 안 된다. 예를 들어, 본 발명에 따라 사용될 단클론성 항체는, 예를 들면 하기를 포함하는 다양한 기술에 의하여 작제될 수 있다: 하이브리도마 방법 (예컨대, Kohler and Milstein, Nature 256:495-97 (1975); Hongo et al., Hybridoma 14 (3): 253-260 (1995), Harlow et al., Antibodies: A Laboratory Manual (Cold Spring Harbor Laboratory Press, 2nd ed. 1988); Hammerling et al., in: Monoclonal Antibodies and T cell Hybridomas 563-681 (Elsevier, N.Y., 1981)), 재조합 DNA 방법 (참고: 예컨대, 미국 특허 번호 4,816,567), 파지-디스플레이 기술 (참고: 예컨대, Clackson et al., Nature, 352: 624-628, 1991; Marks et al., J. Mol . Biol . 222: 581-597, 1992; Sidhu et al., J. Mol . Biol . 338(2): 299-310, 2004; Lee et al., J. Mol . Biol . 340(5): 1073-1093, 2004; Fellouse, Proc . Natl . Acad . Sci . USA 101(34): 12467-12472 ,2004; 및 Lee et al., J. Immunol . Methods 284(1-2): 119-132, 2004; 및 인간 면역글로불린 유전자좌(locus) 또는 인간 면역글로불린 서열을 암호화하는 유전자의 일부 또는 모두를 갖는 동물에서 인간 또는 인간-유사 항체를 생산하기 위한 기술 (참고: 예를 들면, WO 1998/24893; WO 1996/34096; WO 1996/33735; WO 1991/10741; Jakobovits et al., Proc . Natl . Acad . Sci . USA 90: 2551, 1993; Jakobovits et al., Nature 362: 255-258, 1993; Bruggemann et al., Year in Immunol. 7:33, 1993; 미국 특허 번호 5,545,807; 5,545,806; 5,569,825; 5,625,126; 5,633,425; 및 5,661,016; Marks et al., Bio/Technology 10: 779-783 (1992); Lonberg et al., Nature 368: 856-859, 1994; Morrison, Nature 368: 812-813, 1994; Fishwild et al., Nature Biotechnol . 14: 845-851, 1996; Neuberger, Nature Biotechnol . 14: 826, 1996; 및 Lonberg et al., Intern. Rev. Immunol. 13: 65-93, 1995).
본원의 단클론성 항체는 구체적으로 중쇄 및/또는 경쇄 부분이 특정 종으로부터 유래되거나 특정 항체 부류 또는 하위부류에 속하는 항체에서 상응하는 서열과 동일하거나 상동성이고 나머지 쇄(들)은 또 다른 종으로부터 유래되거나 또 다른 항체 부류 또는 하위부류에 속하는 항체에서 상응하는 서열과 동일하거나 상동성인 "키메라" 항체, 및 이들이 목적하는 생물학적 활성을 나타내는 한 상기 항체의 단편들을 포함한다 (참고: 예를 들어, 미국 특허 번호 4,816,567; 및 Morrison et al., Proc . Natl . Acad . Sci . USA 81:6851-6855 (1984)). 키메라성 항체에는 PRIMATIZED® 항체가 포함되며, 여기서 항체의 상기 항원-결합 영역은, 예를 들면 관심 항원으로 마카크 원숭이를 면역화하여 생성된 항체로부터 유도된다.
"인간 항체"는 인간 또는 인간 세포에 의해 생산되거나 인간 항체 레퍼토리 또는 기타의 인간 항체-암호화 서열을 사용하는 비-인간 공급원으로부터 유도되는 항체의 아미노산 서열에 상응하는 아미노산 서열을 보유하는 것이다. 인간 항체의 이러한 정의는 특이적으로 비인간 항원-결합 잔기를 포함하는 인간화 항체를 배제한다.
비-인간 (예를 들면, 설치류) 항체의 "인간화된" 형태는 비-인간 항체로부터 유도된 최소 서열을 함유하는 키메라성 항체이다. 대개, 인간화된 항체는 수령체의 초가변 영역으로부터의 잔기가 원하는 항체 특이성, 친화도, 및 능력을 가지는 비-인간 종 (공여체 항체) 예컨대 마우스, 랫트, 토끼 또는 비인간 영장류의 초가변 영역으로부터의 잔기로 대체된 인간 면역글로불린 (수령체 항체)이다. 일부 경우에, 인간 면역글로불린의 FR 잔기는 상응하는 비-인간 잔기들에 의해 대체된다. 더욱이, 인간화 항체는 수용자 항체 또는 공여자 항체에서 발견되지 않는 잔기를 포함할 수 있다. 이들 변형은 항체 수행능을 추가로 개선하기 위해 수행된다. 일반적으로, 인간화된 항체는 실질적으로 적어도 하나, 그리고 전형적으로는 2개의 모든 가변 도메인을 포함할 것이며, 모든 또는 실질적으로 모든 초가변성 루프는 비-인간 면역글로불린의 것과 상응하고 모든 또는 실질적으로 모든 FR은 인간 면역글로불린 서열의 것들이다. 인간화된 항체는 선택적으로 또한 면역글로불린 불변 영역 (Fc)의 적어도 일부, 전형적으로 인간 면역글로불린의 부분을 포함할 것이다. 추가 세부사항에 대해서는, 하기를 참고한다: Jones et al., Nature 321:522-525, 1986; Riechmann et al., Nature 332:323-329, 1988; 및 Presta, Curr . Op. Struct. Biol . 2:593-596, 1992.
개시 또는 참조 폴리펩티드 (예를 들면, 참조 항체 또는 이의 가변 도메인(들)/HVR(들))의 "변이체" 또는 "돌연변이체"는 (1) 개시 또는 참조 폴리펩티드의 것과 상이한 아미노산 서열을 갖는 그리고 (2) 천연 또는 인공 (사람이 만든) 돌연변이생성을 통해 개시 또는 참조 폴리펩티드로부터 유래된 폴리펩티드이다. 상기 변이체는, 예를 들어, 본 명세서에서 "아미노산 잔기 변경"으로서 지칭된, 관심 폴리펩티드의 아미노산 서열 이내 잔기의 결실, 및/또는 삽입 및/또는 치환을 포함한다. 따라서, 변이체 HVR은 개시 또는 참조 폴리펩티드 서열 (예컨대 공급원 항체 또는 항원 결합 단편의 것)에 대해 변이체 서열을 포함하는 HVR을 지칭한다. 아미노산 잔기 변경은, 상기 맥락에서, 개시 또는 참조 폴리펩티드 서열 (예컨대 참조 항체 또는 이들의 단편의 것)에서 대응하는 위치에 아미노산과 상이한 아미노산을 지칭한다. 최종 변이체 또는 돌연변이체 작제물에 도달하도록 결실, 삽입, 및 치환의 임의의 조합이 이루어질 수 있으며, 단, 최종 작제물은 목적 기능적 특징을 가져야 한다. 아미노산 변화는 또한 글리코실화 부위의 수 또는 위치를 변화시키는 것과 같은 폴리펩티드의 번역 후 과정을 변화시킬 수 있다.
"야생형 (WT)" 또는 "참조" 서열 또는 "야생형" 또는 "참조" 단백질/폴리펩티드, 예컨대 참조 항체의 HVR 또는 가변 도메인은 변이체 폴리펩티드가 돌연변이의 도입을 통해 유래되는 참조 서열일 수 있다. 일반적으로, 제공된 단백질용 "야생형" 서열은 자연에서 가장 흔한 서열이다. 유사하게, "야생형" 유전자 서열은 자연에서 가장 흔하게 발견되는 그 유전자용 서열이다. 돌연변이는 "야생형" 유전자 (및 따라서 암호화하는 단백질)에 어느 한쪽 자연적 과정을 통해 또는 인간-유도된 수단을 통해 도입될 수 있다. 상기 공정의 생성물은 최초 "야생형" 단백질 또는 유전자의 "변이체" 또는 "돌연변이체" 형태이다.
"참조 항체"는, 본 명세서에서 사용된 바와 같이, 본 명세서에서 기재된 기준에 따른 다양성이 수행되는 경우 항원-결합 서열이 주형 서열로서 작용하는 항체 또는 이들의 단편을 지칭한다. 항원-결합 서열은 일반적으로 항체 가변 영역, 바람직하게는 적어도 1종의 HVR을 포함하고, 바람직하게는 프레임워크 영역을 포함한다.
본 명세서에서 사용된 바와 같이, "라이브러리"는 복수의 항체 또는 항체 단편 서열 (예컨대, 본 발명의 항-VEGF 항체 또는 항-PD-L1 항체), 또는 이들 서열을 암호화하는 핵산을 지칭하고, 상기 서열은, 본 발명의 방법에 따라서, 이들 서열에 도입되는 변이체 아미노산의 조합에서 상이하다.
"친화도"는 분자 (예를 들면, 항체)의 단일 결합 부위와 그 결합 상대 (예를 들면, 항원) 사이의 비공유 상호작용의 총계의 강도를 지칭한다. 달리 표시되지 않은 한, 본 명세서에 기재된 "결합 친화도"는 결합쌍(예를 들면, 항체 및 항원)의 구성원 간의 1:1 상호작용을 반영하는 고유 결합 친화도를 의미한다. 그 파트너 Y에 대한 분자 X의 친화성은 일반적으로 해리 상수 (Kd)로 나타낼 수 있다. 친화성은 본원에서 기재된 것을 포함하여 당해분야에서 공지된 공통의 방법으로 측정될 수 있다. 결합 친화성을 측정하기 위한 특정 도해적 및 예시적 구현예가 본원에 기재되어 있다.
표적 분자에 대한 항체의 결합에 관하여, 특정한 폴리펩티드 또는 특정한 폴리펩티드 표적 상의 에피토프에 "특이적 결합" 또는 "특이적으로 결합한다" 또는 "특이적인"이라는 용어는 비-특이적 상호작용과는 다른 측정가능한 결합을 의미한다. 특이적 결합은 예를 들어, 대조군 분자로의 결합과 비교하여 분자로의 결합을 계측함에 의해 측정될 수 있다. 예를 들어, 특이적 결합은 표적, 예를 들어 과량의 비표지된 표적과 유사한 조절 분자와의 경쟁에 의해 계측될 수 있다. 이 경우에, 프로브에 대한 표지된 표적의 결합이 과량의 비표지된 표적에 의해 경쟁적으로 억제되는 경우 특이적 결합이 나타난다. 본원에 사용된, 용어 특정 폴리펩티드 또는 특정 폴리펩티드 상의 에피토프에 "특이적 결합" 또는 "에 특이적으로 결합한다" 또는 "에 특이적인"은, 예를 들어, 표적에 대해 10-4 M 이하, 대안적으로 10-5 M 이하, 대안적으로 10-6 M 이하, 대안적으로 10-7 M 이하, 대안적으로 10-8 M 이하, 대안적으로 10-9 M 이하, 대안적으로 10-10 M 이하, 대안적으로 10-11 M 이하, 대안적으로 10-12 M 이하의 KD 또는 10-4 M 내지 10-6 M 또는 10-6 M 내지 10-10 M 또는 10-7 M 내지 10-9 M 범위의 Kd를 갖는 분자에 의해 나타낼 수 있다. 당업자에게 인지되는 바와 같이, 친화성 및 Kd 값은 역으로 관련된다. 항원에 대한 고친화성은 낮은 Kd 값에 의해 측정된다. 일 구현예에서, 용어 "특이적 결합"은 분자가 임의의 다른 폴리펩티드 또는 폴리펩티드 에피토프에 실질적으로 결합하는 것 없이 특정 폴리펩티드 상의 특정 폴리펩티드 또는 에피토프에 결합하는 경우의 결합을 언급한다.
"친화도 성숙" 항체는 항원에 대한 항체의 친화도에 있어서의 개선을 야기하는 변경을 갖지 않는 친계 항체와 비교하여, 하나 이상의 초가변 영역(HVR)에 하나 이상의 변경을 갖는 항체를 나타내며, 상기 변경은 항원에 대한 항체의 친화도에 있어서의 개선을 야기한다.
참조 항체와 "상동한 에피토프에 결합하는 항체"는 경쟁 검정에서 참조 항체의 이의 항원으로의 결합을 50% 이상 차단하는 항체를 지칭하고, 역으로, 참조 항체는 경쟁 검정에서 50% 이상으로 항체의 이의 항원으로의 결합을 차단한다.
"면역콘주게이트"는 세포독성제를 포함하지만 이에 제한되지 않는 하나 이상의 이종성 분자(들)에 콘주게이트된 항체이다.
본원에서 사용된 바와 같이, 용어 "면역접합체(immunoadhesin)"는 이종성 단백질 ("접합체")의 결합 특이성을 면역글로불린 불변 도메인의 효과기 작용과 조합하는 항체-유사 분자를 가리킨다. 구조적으로, 면역접합체는 원하는 결합 특이성을 갖는 아미노산 서열의 융합을 포함하고, 이는 항체의 항원 인식 및 결합 부위 (즉, "이형"임) 및 면역글로불린 불변 도메인 서열 이외의 것이다. 면역접합체 분자의 접합체 부분은 전형적으로 적어도 수용체 또는 리간드의 결합 부위를 포함하는 인접 아미노산 서열이다. 면역접합체 내의 면역글로불린 불변 도메인 서열은 임의의 면역글로불린, 예컨대 IgG1, IgG2 (IgG2A 및 IgG2B 포함), IgG3, 또는 IgG4 하위유형, IgA (IgA1 및 IgA2 포함), IgE, IgD, 또는 IgM으로부터 수득될 수 있다. Ig 융합은 바람직하게는 하기를 포함한다: 본원에 기술된 폴리펩티드 또는 항체의 도메인의, Ig 분자 내의 적어도 1종의 가변 영역을 대신한 치환. 특히 바람직한 구현예에서, 면역글로불린 융합은 IgG1 분자의 힌지, CH2 및 CH3, 또는 힌지, CH1, CH2 및 CH3 영역을 포함한다. 면역글로불린 융합의 생산에 관하여는, 또한 미국 특허 번호 5,428,130을 참고한다. 예를 들어, 본원의 요법에 대해 유용한 약제로서의 유용한 면역접합체는 하기를 포함하는 폴리펩티드를 포함한다: 면역글로불린 서열의 불변 도메인, 예컨대 PD-L1 ECD-Fc, PD-L2 ECD-Fc, 및 PD-1 ECD-Fc, 각각에 융합된, PD-L1 또는 PD-L2의 세포외 도메인 (ECD) 또는 PD-1-결합 부분, 또는 PD-1 의 세포외 또는 PD-L1- 또는 PD-L2-결합 부분. Ig Fc 및 세포 표면 수용체의 ECD의 면역접합체 조합은 종종 가용성 수용체로 불린다.
"융합 단백질" 및 "융합 폴리펩티드"는 함께 공유 결합된 2개 부분을 갖는 폴리펩티드를 지칭하며, 상기 부분의 각각은 상이한 특성을 갖는 폴리펩티드이다. 상기 특성은 생물학적 특성, 예컨대 시험관내 또는 생체내에서의 활성일 수 있다. 상기 특성은 또한 단순한 화학적 또는 물리적 특성, 예컨대 표적 분자로의 결합, 반응의 촉매작용 등일 수 있다. 상기 2개 부분은 단일 펩티드 결합에 의하여 직접, 또는 펩티드 링커를 통하여 연결될 수 있으나, 서로 해독 틀 내에 존재한다.
본원에 식별된 폴리펩티드 서열과 관련하여 "퍼센트 (%) 아미노산 서열 동일성"은 서열을 정렬하고 필요한 경우 최대 퍼센트 서열 동일성을 성취하기 위해 갭을 도입한 후 비교되는 폴리펩티드 내 아미노산 잔기와 동일한 후보 서열에서의 아미노산 잔기의 %로서 정의되고 서열 동일성의 일부로서 임의의 보존성 치환을 고려하지 않는다. 아미노산 서열 동일성 퍼센트를 계측하기 위한 목적으로의 정렬은, 예를 들면, BLAST, BLAST-2, ALIGN 또는 Megalign (DNASTAR) 소프트웨어와 같은 공개적으로 이용 가능한 컴퓨터 소프트웨어를 사용하여 당업계의 재량 내에 있는 다양한 방식으로 달성될 수 있다. 당업자는 정렬을 측정하기 위하여, 비교되는 서열의 전장에 걸쳐서 최대 정렬을 달성하는 데 필요한 임의의 알고리즘을 포함하여, 적절한 파라미터를 결정할 수 있다. 그러나, 본원에서의 목적을 위해, % 아미노산 서열 동일성 값은 서열 비교 컴퓨터 프로그램 ALIGN-2를 사용하여 생성된다. ALIGN-2 서열 비교 컴퓨터 프로그램은 제조사 (Genentech, Inc.)에 의해 개발되었고, 소스 코드는 사용자 기록문서와 함께 미국 저작권 청, 워싱턴 D.C., 20559 (미국 저작권 등록 번호 TXU510087 하에서 등록됨)와 같이 제출되었다. ALIGN-2 프로그램은 캘리포니아 주 사우스샌프란시스코 소재의 Genentech, Inc.을 통해 공공연하게 이용가능하다. ALIGN-2 프로그램은 UNIX 운영 체제, 바람직하게는 디지털 UNIX V4.0D 상에서 사용하기 위해 컴파일링되어야 한다. 모든 서열 비교 파라미터는 ALIGN-2 프로그램에 의해 설정되며 변하지 않는다.
ALIGN-2가 아미노산 서열 비교에 사용되는 상황에서, 소정의 아미노산 서열 A 내지, 및, 또는 소정의 아미노산 서열 B (이것은 소정의 아미노산 서열 B에 대해 특정의 아미노산 서열 동일성 %를 갖거나 포함하는 소정의 아미노산 서열 A로서 표현될 수 있음)의 아미노산 서열 동일성 %는 다음과 같이 계산된다:
분수 X/Y의 100배
여기서, X는 A 및 B의 프로그램 정렬에서 서열 정렬 프로그램 ALIGN-2에 의한 동일한 매치로서 스코어되는 아미노산 잔기의 수이고 Y는 B에서 아미노산 잔기의 총 수이다. 아미노산 서열 A의 길이가 아미노산 서열 B의 길이와 동일하지 않은 경우, A 대 B의 % 아미노산 서열 동일성은 B 대 A의 % 아미노산 서열 동일성은 동일하지 않음을 인식할 것이다. 달리 구체적으로 기재하지 않은 경우, 본원에 사용된 모든 % 아미노산 서열 동일성 값은 ALIGN-2 컴퓨터 프로그램을 사용하여 바로 직전의 문단에 기재된 바와 같이 수득한다.
"폴리뉴클레오티드", 또는 "핵산"은, 본원에서 상호교환적으로 사용되는 바와 같이, 임의의 길이의 뉴클레오티드의 폴리머를 지칭하고, DNA 및 RNA를 포함한다. 뉴클레오티드는 데옥시리보뉴클레오티드, 리보뉴클레오티드, 변형된 뉴클레오티드 또는 염기, 및/또는 그의 유사체, 또는 DNA 또는 RNA 폴리머라제에 의해, 또는 합성 반응에 의해 폴리머에 편입될 수 있는 임의의 기질일 수 있다. 따라서, 예를 들어, 본원에 정의된 폴리뉴클레오티드에는, 비제한적으로, 단일- 및 이중-가닥 DNA, 단일- 및 이중-가닥 영역을 포함하는 DNA, 단일- 및 이중-가닥 RNA, 및 단일- 및 이중-가닥 영역을 포함하는 RNA, 단일-가닥, 또는 좀 더 전형적으로, 이중-가닥일 수 있는 DNA 및 RNA 또는 단일- 및 이중-가닥 영역을 포함하는 하이브리드 분자가 포함된다. 뿐만 아니라, 본원에 사용되는 용어 "폴리뉴클레오티드"는 RNA 또는 DNA를 포함하거나 또는 RNA 및 DNA를 모두 포함하는 삼중-가닥 영역를 포함한다. 이와 같은 영역에서의 가닥은 동일한 분자에서 유래되거나 또는 상이한 분자에서 유래된 것일 수 있다. 상기 영역에는 상기 분자들 중 하나 이상의 모두가 포함될 수 있으나, 좀 더 전형적으로 상기 분자들의 일부의 한 영역만이 수반된다. 삼중-나선 영역의 분자들 중 하나는 올리고뉴클레오티드이다. 용어 "폴리뉴클레오티드"에는 구체적으로 cDNA가 포함된다.
폴리뉴클레오티드는 변형된 뉴클레오티드, 예컨대 메틸화된 뉴클레오티드 및 그의 유사체를 포함할 수 있다. 존재한다면, 뉴클레오티드 구조에 대한 변형은 폴리머의 어셈블리 이전 또는 이후 부여될 수 있다. 뉴클레오티드의 서열은 비-뉴클레오티드 성분에 의해 방해될 수 있다. 폴리뉴클레오티드는 합성 이후, 예컨대 표지를 이용한 콘주게이션에 의해 추가로 변형될 수 있다. 변형의 다른 유형은, 예를 들어, 하기를 포함한다: "캡(caps)", 하나 이상의 자연 발생 뉴클레오티드의 유사체로의 치환, 뉴클레오티드간 변형 예컨대, 예를 들어, 비하전된 연결 (예를 들면, 메틸 포스포네이트, 포스포트리에스테르, 포스포아미데이트, 카바메이트, 등) 및 하전된 연결 (예를 들면, 포스포로티오에이트, 포스포로디티오에이트, 등)을 가진 것, 펜던트 모이어티, 예컨대, 예를 들어, 단백질 (예를 들면, 뉴클레아제, 독소, 항체, 신호 펩티드, 폴리-L-라이신, 등)을 함유한 것, 삽입제 (예를 들면, 아크리딘, 소랄렌, 등)을 가진 것, 킬레이터 (예를 들면, 금속, 방사성 금속, 붕소, 산화적 금속, 등)을 가진 것, 알킬화제를 함유한 것, 폴리뉴클레오티드(들)의 변형된 연결 (예를 들면, 알파 아노머성 핵산, 등), 뿐만 아니라 비변형된 형태를 가진 것. 추가로, 당류에 통상적으로 존재하는 임의의 하이드록실기는, 예를 들어, 포스포네이트 기, 포스페이트 기에 의해 대체될 수 있거나, 표준 보호기에 의해 보호될 수 있거나, 또는 추가 뉴클레오티드에 추가 연결을 제조하기 위해 활성화될 수 있거나, 또는 고형 또는 반-고형 지지체에 접합될 수 있다. 5' 및 3' 말단 OH는 1 내지 20개의 탄소 원자의 아민 또는 유기 캡핑 기 모이어티로 인산화 또는 치환될 수 있다. 다른 하이드록실은 또한 표준 보호기로 유도될 수 있다. 폴리뉴클레오티드는 또한, 예를 들면, 2'-O-메틸-, 2'-O-알릴, 2'-플루오로- 또는 2'-아지도-리보오스, 카보사이클릭 당 유사체, α-아노머성 당, 에피머 당류 예컨대 아라비노오스, 자일로스 또는 릭소스, 파이라노스 당, 푸라노스 당, 세도헵툴로스, 비환식 유사체 및 무염기성 뉴클레오사이드 유사체 예컨대 메틸 리보사이드를 포함하여, 당해기술에 일반적으로 공지되는 리보오스 또는 데옥시리보스 당류의 유사 형태를 함유할 수 있다. 하나 이상의 포스포디에스테르 연결기는 대안적인 연결기에 의해 대체될 수 있다. 이러한 대안적인 결합기는, 비제한적으로 구현예들을 포함하며, 여기서 포스페이트는 P(O)S ("티오에이트"), P(S)S ("디티오에이트"), (O)NR2 ("아미데이트"), P(O)R, P(O)OR', CO 또는 CH2 ("포름아세탈(formacetal)")로 교체될 수 있으며, 여기서 각 R 또는 R'은 독립적으로 H 또는 선택적으로 에터 (-O-) 결합, 아릴, 알케닐, 시클로알킬, 시클로알케닐, 또는 아랄딜을 함유하는 치환된 또는 비치환된 알킬 (1-20개 C)이다. 폴리뉴클레오티드에서 모든 연결기가 동일할 필요는 없다. 이전의 설명은 RNA 및 DNA를 포함하여 본원에서 언급되는 모든 폴리뉴클레오티드에 적용한다.
"올리고뉴클레오티드"는, 본원에서 사용된 바와 같이, 짧고, 일반적으로 단일 가닥이고, 필수적인 것은 아니나 길이가 250개 뉴클레오티드 미만인, 폴리뉴클레오티드를 지칭한다. 올리고뉴클레오티드는 합성일 수 있다. 용어 "올리고뉴클레오티드" 및 "폴리뉴클레오티드"는 상호 배타적이지 않다. 폴리뉴클레오티드에 대한 상기 기술은 올리고뉴클레오티드에 동등하게, 그리고 완전하게 적용가능하다.
용어 "프라이머"는 핵산에 하이브리드화할 수 있고, 일반적으로 유리 3'-OH 작용기를 제공함으로써, 상보적 핵산의 중합화를 허용할 수 있는 단일 가닥 폴리뉴클레오티드를 지칭한다.
용어 "숙주 세포", "숙주 세포주" 및 "숙주 세포 배양물"은 상호교환적으로 사용되고 상기 세포의 후손을 포함하는, 외인성 핵산이 도입된 세포를 언급한다. 숙주 세포는 1차 변형된 세포 및 계대 횟수와 상관없이 이로부터 유래된 후손을 포함하는 "변형체" 및 "변형된 세포"를 포함한다. 자손은 핵산 함량에서 부모 세포와 완전히 동일하지 않고, 돌연변이를 내포할 수도 있다. 원래 변형된 세포에 대해 스크리닝되거나 선택된 바와 동일한 기능 또는 생물학적 활성을 갖는 돌연변이 자손이 본원에 포함된다.
본원에서 사용된 바와 같이, 용어 "벡터"는 연결되는 또 다른 핵산을 전파시킬 수 있는 핵산 분자를 지칭한다. 용어는 자가-복제 핵산 구조로서의 벡터 뿐만 아니라 이것이 도입되는 숙주 세포의 게놈에 삽입되는 벡터를 포함한다. 특정 벡터는 이들이 작동적으로 연결되는 핵산의 발현을 지시할 수 있다. 상기 벡터는 본원에서 "발현 벡터"로서 지칭된다.
"단리된" 핵산 분자는, 본래 핵산의 천연 공급원과 관계된 적어도 하나의 오염물질 핵산 분자로부터 동정 및 분리된 핵산 분자이다. 단리된 핵산 분자는 자연에서 발견되는 형태 또는 설정 이외의 것이다. 따라서 단리된 핵산 분자는 이것이 천연 세포 내에 존재하는 핵산 분자와 구별된다. 그러나 단리된 핵산 분자에는, 예를 들면 핵산 분자가 천연 세포와 상이한 염색체 위치에 있는, 항체를 대개 발현하는 세포 내에 함유된 핵산 분자가 포함된다.
"돌연변이"는 참조 뉴클레오티드 서열, 예컨대 야생형 서열에 비해 뉴클레오티드(들)의 결실, 삽입, 또는 치환이다.
본 명세서에서 사용된 바와 같이, "코돈 세트"는 요망된 변이체 아미노산을 암호화하는 사용된 일련의 상이한 뉴클레오티드 삼중항 서열을 지칭한다. 일련의 올리고뉴클레오티드는, 예를 들어, 코돈 세트에 의해 제공된 뉴클레오티드 삼중항의 모든 가능한 조합을 나타내는 그리고 아미노산의 요망된 그룹을 암호화할 서열을 포함하는, 고상 합성에 의해 합성될 수 있다. 코돈 지정의 표준 양식은, 당해 기술에 공지되어 있고 본원에 기술된, IUB 코드의 것이다. 코돈 세트는 전형적으로 이탤릭체로 3개의 대문자, 예를 들면, NNK , NNS , XYZ, DVK 및 동종에 의해 표시된다. 특정 위치에서 선택된 뉴클레오티드 "축퇴"로 올리고뉴클레오티드의 합성은 그 종래 기술, 예를 들어 TRIM 접근법에서 공지된 웰이다 (Knappek et al., J. Mol . Biol. 296:57-86, 1999); Garrard et al., Gene 128:103, 1993). 특정 코돈 세트를 갖는 올리고뉴클레오티드의 상기 세트는 (예를 들어, Applied Biosystems, Foster City, CA로부터 이용가능한) 상업적 핵산 합성기를 이용하여 합성될 수 있거나, 상업적으로 (예를 들어, Life Technologies, Rockville, MD로부터) 수득될 수 있다. 따라서, 특정한 코돈 세트를 갖는 합성된 일련의 올리고뉴클레오티드는 전형적으로 상이한 서열, 전체 서열 이내 코돈 세트에 의해 확립된 차이를 가진 복수의 올리고뉴클레오티드를 포함할 것이다. 올리고뉴클레오티드는, 본 발명에 따라 사용된 바와 같이, 가변 도메인 핵산 주형에 하이브리드화를 허용하는 서열을 갖고 또한, 예를 들어, 클로닝 목적에 유용한 제한 효소 부위를 포함할 수 있지만, 필연적으로 포함하지 않는다.
표현 "조절 서열"은 특정한 숙주 유기체에서 작동가능하게 연결된 암호화 서열의 발현에 필요한 DNA 서열을 나타낸다. 원핵 세포에 적합한 조절 서열은, 예를 들어, 프로모터, 선택적으로 오퍼레이터 서열 및 리보솜 결합 부위를 포함한다. 진핵 세포는 프로모터, 폴리아데닐화 신호 및 인핸서를 사용하는 것으로 공지되어 있다.
핵산은 이것이 또 하나의 핵산 서열과 기능적 관계로 놓이는 경우, "작동가능하게 연결된" 것이다. 예를 들어, 전구서열 또는 분비 리더에 대한 DNA는 폴리펩티드의 분비에 참여하는 전구단백질로서 발현되는 경우에 폴리펩티드에 대한 DNA에 작동 가능하게 연결되거나; 프로모터 또는 인핸서는 서열의 전사에 영향을 미치는 경우에 암호화 서열에 작동 가능하게 연결되거나; 또는 리보좀 결합 부위는 번역을 촉진시키도록 위치할 경우에 암호화 서열에 작동 가능하게 연결된다. 일반적으로, "작동가능하게 연결된"은 연결된 DNA 서열이 인접하고, 분비 리더의 경우 인접하며 해독 상에 있음을 의미한다. 그러나, 인핸서는 인접할 필요가 없다. 연결은 편리한 제한 부위에서의 결찰에 의해 달성된다. 이러한 부위가 존재하지 않는 경우, 합성 올리고뉴클레오티드 어댑터 또는 링커가 관례에 따라 사용된다.
"혈관 내피 성장 인자" 또는 "VEGF"라는 용어는 Swiss Prot 수탁 번호 P15692, 유전자 ID (NCBI): 7422에 의해 예시된 바와 같은 혈관 내피 성장 인자 단백질 A를 지칭한다. 용어 "VEGF"는 하기를 포괄한다: Swiss Prot 수탁 번호 P15692, 유전자 ID (NCBI): 7422 (뿐만 아니라 이의 동족체 및 동형체)의 아미노산 서열을 갖는 단백질. "VEGF"라는 용어는 또한 하기에 기재된 VEGF165 의 플라스민 절단에 의해 생성된 110개의 아미노산 인간 혈관 내피 세포 성장 인자를 포함하여, VEGF의 공지된 동형체, 예를 들어 스플라이스 동형체, 예를 들어, VEGF111, VEGF121, VEGF145, VEGF165, VEGF189, 및 VEGF206을 그의 자연-발생 대립유전자 및 가공된 형태와 함께 포함한다: Ferrara Mol . Biol . Cell. 21:687, 2010; Leung et al., Science, 246:1306. 1989; 및 Houck et al., Mol . Endocrin ., 5:1806, 1991. 용어 "VEGF"는 또한 비-인간 종, 예컨대 마우스, 랫트 또는 영장류에서 유래된 VEGF를 지칭한다. 때로, 특정 종에서 유래된 VEGF는 예컨대 인간 VEGF에 대한 hVEGF, 뮤린 VEGF에 대한 mVEGF 등과 같은 용어에 의해 명시된다. 용어 "VEGF"는 또한 165-아미노산 인간 혈관 내피 세포 성장 인자의 아미노산 8 내지 109 또는 1 내지 109를 포함하는 폴리펩티드의 절단된 형태를 지칭하기 위해 사용된다. VEGF의 모든 형태에 대한 언급은 본원에서 예컨대, "VEGF109," "VEGF (8-109)," "VEGF (1-109)" 또는 "VEGF165 에 의해 식별될 수 있다. "절단된(truncated)" 천연 VEGF에 대한 아미노산 위치는 상기 천연 VEGF 서열에서 명시되는 바와 같이 숫자로 표시된다. 예를 들어, 절단된 천연 VEGF의 아미노산 위치 17(메티오닌)은 또한 천연 VEGF에서의 위치 17 (메티오닌)이다. 상기 절단된 천연 VEGF는 천연 VEGF에 필적하는 KDR와 Flt-1 수용체에 대한 결합 친화도를 갖는다. 본 명세서에서 사용된 용어 "VEGF 변이체"는 천연 VEGF 서열에서 하나 이상의 아미노산 돌연변이를 포함하는 VEGF 폴리펩티드를 지칭한다. 선택적으로, 하나 이상의 아미노산 돌연변이는 아미노산 치환(들)을 포함한다. 본 명세서에 기술된 VEGF 변이체의 약칭 목적을 위해, 숫자는 추정의 천연 VEGF의 아미노산 서열을 따르는 아미노산 잔기 위치를 지칭함이 주목된다 (Leung et al., 상기 및 Houck et al, 상기에서 제공됨). 달리 구체화되지 않는 한, 본 명세서에서 사용된 용어 "VEGF"는 VEGF-A를 나타낸다.
"VEGF 길항제" 또는 "VEGF-특이적 길항제"는, 비제한적으로, 하나 이상의 VEGF 수용체에 결합하는 VEGF, VEGF 신호전달, 및 VEGF 매개된 혈관형성 및 내피 세포 생존 또는 증식을 포함하여, VEGF에 결합할 수 있고, VEGF 발현 수준을 감소시키거나 또는 VEGF 생물학적 활성을 중화, 차단, 억제, 소거, 감소 또는 방해하는 분자를 지칭한다. 예를 들면, VEGF 생물학적 활성을 중화, 차단, 억제, 소거, 감소 또는 방해하는 분자는 하나 이상의 VEGF 수용체 (VEGFR) (예를 들면, VEGFR1, VEGFR2, VEGFR3, 막-결합 VEGF 수용체 (mbVEGFR), 또는 가용성 VEGF 수용체 (sVEGFR))에 결합함에 의해 그것의 효과를 발휘할 수 있다. 본 발명의 방법에 유용한 VEGF-특이적 길항제로서 포함되는 것은, VEGF에 특이적으로 결합하여 하나 이상의 수용체, 융합 단백질 [예컨대, VEGF-트랩(Trap)(리제네론(Regeneron)] 및 VEGF121-겔로닌(gelonin) [페레그린(Peregrine)]과의 결합을 격리시키는 VEGF, 항-VEGF 항체 및 이들의 항원-결합 단편, 수용체 분자, 및 유도체에 특이적으로 결합하는 폴리펩티드이다. VEGF-특이적 길항제는 또한 VEGF 폴리펩티드의 길항제 변이체, VEGF 폴리펩티드를 암호화하는 적어도 핵산 분자의 단편에 상보적인 안티센스 핵염기 올리고머; VEGF 폴리펩티드를 암호화하는 적어도 핵산 분자의 단편에 상보적인 작은 RNA; VEGF를 표적하는 리보자임; VEGF에 대한 펩티바디; 및 VEGF 압타머를 포함한다. VEGF 길항제는 또한 VEGFR에 결합하여 이로써 VEGF 생물학적 활성 (예를 들면, VEGF 신호전달)을 차단, 억제, 소거, 감소 또는 방해하는 VEGFR, 항-VEGFR 항체, 및 이의 항원 결합 단편에 결합하는 폴리펩티드를 포함한다. VEGF-특이적 길항제는 또한 VEGF 또는 VEGFR에 결합하고 그리고 VEGF 생물학적 활성을 차단, 억제, 소거, 감소 또는 방해할 수 있는 비펩티드 소분자를 포함한다. 따라서, 용어 "VEGF 활성"은 특이적으로 VEGF의 VEGF 매개된 생물학적 활성을 포함한다. 특정 구현예에서, VEGF 길항제는 VEGF의 발현 수준 또는 생물학적 활성을, 적어도 약 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% 또는 그 이상 만큼 감소시키거나 억제한다. 일부 구현예에서, VEGF-특이적 길항제에 의해 억제되는 VEGF는 VEGF(8-109), VEGF(1-109) 또는 VEGF165이다.
본 명세서에서 사용된 바와 같이 VEGF 길항제는, 비제한적으로, 항-VEGFR2 항체 및 관련된 분자 (예를 들면, 라무시루맙, 타니비루맙, 아플리베르셉트), 항-VEGFR1 항체 및 관련된 분자 (예를 들면, 이크루쿠맙, 아플리베르셉트 (VEGF 트랩-아이(Trap-Eye); EYLEA®), 및 지브-아플리베르셉트 (VEGF 트랩(Trap); ZALTRAP®)), 이중특이적 VEGF 항체 (예를 들면, MP-0250, 바누시주맙 (VEGF-ANG2), 및 US 2001/0236388에 개시된 이중특이적 항체), 항-VEGF, 항-VEGFR1, 및 항-VEGFR2 아암 중 둘의 조합을 포함하는 이중특이적 항체, 항-VEGFA 항체 (예를 들면, 베바시주맙, 세바시주맙), 항-VEGFB 항체, 항-VEGFC 항체 (예를 들면, VGX-100), 항-VEGFD 항체, 및 비펩티드 소분자 VEGF 길항제 (예를 들면, 파조파닙, 악시티닙, 반데타닙, 스티바가, 카보잔티닙, 렌바티닙, 닌테다닙, 오란티닙, 텔라티닙, 도비티니그, 세디라닙, 모테사닙, 설파티닙, 아파티닙, 포레티닙, 파미티닙, 및 티보자닙)를 포함할 수 있다.
"항-VEGF 항체"는 충분한 친화도 및 특이성이 있는 VEGF와 결합하는 항체이다. 특정 구현예에서, 항체는 일반적으로 VEGF에 대한 충분히 강한 결합 친화도를 가질 것이며, 예를 들어, 상기 항체는 100 nM 내지 1 pM 사이의 Kd 값을 갖는 hVEGF와 결합할 수 있다. 항체 친화도는, 예를 들면 표면 플라즈몬 공명 기반 분석(예컨대 PCT 출원 공개 번호 WO2005/012359에 기재된 BIAcore® 분석); 효소-결합 면역흡착제 분석(ELISA); 및 경쟁 분석(예를 들면 방사면역검정(RIA))에 의해 계측될 수 있다.
특정 구현예에서, 항-VEGF 항체는 질환 또는 질환을 표적으로 삼을 때 및 방해할 때 치료제로서 사용될 수 있되, VEGF 활성이 수반된다. 또한 상기 항체는 예컨대, 치료로서 효과성을 평가하기 위해 기타 생물학적 활성 분석을 받을 수 있다. 이와 같은 분석은 당해기술에 알려져 있고 표적 항원 및 상기 항체에 대한 의도된 사용에 의존한다. 예시는 하기를 포함한다: HUVEC 억제 분석; 종양 세포 성장 억제 분석(예를 들어 WO 89/06692에 기술된 바와 같음); 항체-의존 세포 세포독성(ADCC) 및 보완-매개 세포독성(CDC) 분석(미국 특허 번호 5,500,362); 및 길항(agonistic) 활성 또는 조혈 분석(WO 95/27062 참조). 항-VEGF 항체는 일반적으로 다른 VEGF 상동체, 예컨대 VEGF-B 또는 VEGF-C, 또는 기타 다른 성장 인자, 예컨대 PIGF, PDGF 또는 bFGF와 결합하지 않는다. 일 구현예에서, 항-VEGF 항체는 하이브리도마(hybridoma) ATCC HB 10709에 의해 생산된 단클론성 항-VEGF 항체 A4.6.1과 동일한 에피토프에 결합하는 단클론성 항체이다. 또 다른 구현예에서, 항-VEGF 항체는 Presta et al. (Cancer Res. 57:4593-4599, 1997)에 따라 생성된 재조합 인간화 항-VEGF 단클론성 항체이다 (비제한적으로 베바시주맙 (BV; AVASTIN®)으로 공지된 항체를 포함함).
"rhuMAb VEGF" 또는 "AVASTIN®"으로도 공지된 항-VEGF 항체 "베바시주맙(BV)"은 Presta et al. (Cancer Res. 57:4593-4599, 1997)에 따라 산출된 재조합 인간화 항-VEGF 단클론성 항체이다. 이는 그 수용체에 대한 인간 VEGF의 결합을 차단하는 뮤린 항-hVEGF 단클론성 항체 A.4.6.1 유래의 항원-결합 상보성-결정 영역 및 돌연변이된 인간 IgG1 프레임워크 영역을 포함한다. 베바시주맙의 아미노산 서열의 대략 93%, 예를 들면 상기 프레임워크 영역의 대부분이, 인간 IgG1에서 유도되고, 상기 서열의 약 7%가 뮤린 항체 A4.6.1에서 유도된다. 베바시주맙은 약 149,000 달톤의 분자량을 가지며 글리코실화된다. 베바시주맙과 기타 인간화된 항-VEGF 항체는 2005년 2월 26일에 발행된 미국 특허 제6,884,879호에 추가로 기술되었으며, 이의 전체 개시내용이 본원에 참고로 명시적으로 편입된다. 추가 바람직한 항체는 하기를 포함한다: G6 또는 B20 시리즈 항체 (예컨대, G6-31, B20-4.1) (PCT 출원 공보 번호 WO 2005/012359에 기술됨). 추가 바람직한 항체에 대하여, 하기를 참고한다: 미국 특허 7,060,269, 6,582,959, 6,703,020; 6,054,297; WO98/45332; WO 96/30046; WO94/10202; EP 0666868B1; 미국 특허 출원 공보 번호 2006009360, 20050186208, 20030206899, 20030190317, 20030203409, 및 20050112126; 및 Popkov et al., (Journal of Immunological Methods 288:149-164, 2004). 기타 바람직한 항체는 잔기 F17, M18, D19, Y21, Y25, Q89, 191, K101, E103, 및 C104를 포함하거나, 대안적으로 잔기 F17, Y21, Q22, Y25, D63, 183 및 Q89를 포함하는 인간 VEGF 상에서 기능적 에피토프에 결합하는 것들을 포함한다.
VEGF 길항제는, "단일 항-종양제"로서 투여되는 경우, 암을 치료하기 위해 투여되는 유일한 항-종양제이며, 즉 화학요법과 같은 다른 항-종양제와 병용 투여되지 않는다.
"항-VEGF 항체를 암호화하는 핵산"은 항체 중쇄 및 경쇄 (또는 이의 단편)를 암호화하는 하나 이상의 핵산 분자를 이러한 핵산 분자(들)를 단일 벡터 또는 별도의 벡터로 포함하여 나타내며, 이러한 핵산 분자(들)는 숙주 세포의 하나 이상의 위치에 존재한다.
면역 기능이상의 맥락에서의 용어 "기능이상"은 항원성 자극에 대한 감소된 면역 반응성의 상태를 지칭한다. 상기 용어는 항원 인식이 발생할 수 있으나, 차후의 면역 반응이 감염 또는 종양 성장을 조절하기에 비효과적인 고갈 및/또는 무감작(anergy) 둘 모두의 통상적 요소를 포함한다.
용어 "기능이상"은, 본원에 사용된 바와 같이, 또한 항원 인식에 대한 난치성 또는 비반응성, 특히 항원 인식을 다운-스트림 T 세포 효과기 작용, 예컨대 증식, 시토카인 생산 (예컨대, IL-2) 및/또는 표적 세포 사멸로 번역하는 능력의 손상을 포함한다.
용어 "무감작"은, T 세포 수용체를 통하여 전달된 불완전하거나 불충분한 신호로 인하여 유발된 항원 자극에 대한 비반응성 상태 (예컨대, Ras 활성화의 부재 하에서 세포내 Ca2 + 의 증가)를 지칭한다. T 세포 무감작은 또한, 공-자극의 부재하에서 항원에 의한 자극에서의 결과일 수 있으며, 이는 세포 내에서 공자극의 맥락 내에서도 항원에 의한 차후 활성화에 난치성이 되는 것을 유발한다. 비반응성 상태는 종종 인터류킨-2의 존재에 의하여 무시될 수 있다. 무감작 T 세포는 클론성 증식을 경험하고/하거나 효과기 작용을 획득하지 않는다.
용어 "고갈"은 다수의 만성 감염 및 암 동안 발생하는 지속된 TCR 신호전달로부터 야기된 T 세포 기능이상의 상태로서의 T 세포 고갈을 지칭한다. 이는, 이것이 불완전하거나 결핍된 신호전달을 통하여 야기되나, 지속된 신호전달로부터 야기된다는 점에서 무감작과 구별된다. 이는 하기에 의하여 정의된다: 불량한 효과기 작용, 억제성 수용체의 지속된 발현, 및 작용성 효과기 또는 기억 T 세포의 것과 구별되는 전사 상태. 고갈은 염증 및 종양의 최적 조절을 방해한다. 고갈은 하기 둘 모두에 의하여 유발될 수 있다: 음성 조절 경로 (예컨대, 면역조절 시토카인), 뿐만 아니라 세포 고유 음성 조절 (공자극) 경로 (PD-1, B7-H3, B7-H4 등).
"T 세포 작용 증진"은, 지속되거나 증폭된 생물학적 작용을 갖기 위하여, 또는 고갈되거나 비활성인 T 세포를 갱신하거나 재활성화하기 위하여, T 세포를 유도, 유발, 또는 자극하는 것을 의미한다. T 세포 작용 증진의 예시는 하기를 포함한다: CD8+ T-세포 유래의 γ-인터페론의 증가된 분비, 증가된 증식, 증가된 항원 반응성 (예컨대, 바이러스, 병원체, 또는 종양 청소율) (중재술 전 수준과 비교하여). 일 구현예에서, 증진의 수준은 적어도 50%, 대안적으로 60%, 70%, 80%, 90%, 100%, 120%, 150%, 또는 200%의 증진이다. 이러한 증진을 측정하는 방식은 본 분야의 숙련가에게 잘 알려져 있다.
"종양 면역성"은 종양이 면역 인식 및 청소율에 대해 회피되는 과정을 지칭한다. 따라서, 치료 개념으로서, 종양 면역성은, 상기 회피가 약화되고, 상기 종양이 면역계에 의하여 인식되고 공격될 경우 "치료된" 것이다. 종양 인식의 예시는 종양 결합, 종양 수축, 및 종양 청소를 포함한다.
"면역원성"은 면역 반응을 일으키는 특정 물질의 능력을 지칭한다. 종양은 면역원성이며, 면역 반응에 의한 종양 세포의 청소를 보조하는 종양 면역원성을 증진시킨다. 종양 면역원성을 증진시키는 예는 PD-L1 축 결합 길항제로의 치료를 포함한다.
용어들 "프로그래밍된 사망 리간드 1" 및 "PD-L1"은 본 명세서에서 천연 서열 PD-L1 폴리펩티드, 폴리펩티드 변이체, 및 (본 명세서에서 추가로 정의된) 천연 서열 폴리펩티드와 폴리펩티드 변이체의 단편에 대하여 지칭한다. 본원에 기술된 PD-L1 폴리펩티드는 다양한 공급원으로부터, 예를 들면, 인간 조직 유형으로부터 또는 다른 공급원으로부터 단리되거나, 또는 재조합 또는 합성 방법에 의해 제조될 수 있다.
"천연 서열 PD-L1 폴리펩티드"는, 상응하는 천연 유래의 PD-L1 폴리펩티드와 상동한 아미노산 서열을 갖는 폴리펩티드를 포함한다.
"PD-L1 폴리펩티드 변이체", 또는 이들의 변형은 PD-L1 폴리펩티드, 일반적으로 본 명세서에서 개시된 바와 같은 임의의 천연 서열 PD-L1 폴리펩티드 서열과 적어도 약 80% 아미노산 서열 동일성을 갖는 본 명세서에서 정의된 바와 같은 활성 PD-L1 폴리펩티드를 의미한다. 상기 PD-L1 폴리펩티드 변이체는, 예를 들면, 하나 이상의 아미노산 잔기가 천연 아미노산 서열의 N 또는 C-말단에서 첨가되거나, 또는 결실된 PD-L1 폴리펩티드를 포함한다. 통상적으로, PD-L1 폴리펩티드 변이체는 본 명세서에서 개시된 바와 같은 천연 서열 PD-L1 폴리펩티드 서열에 적어도 약 80% 아미노산 서열 동일성, 대안적으로 적어도 약 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 또는 99% 아미노산 서열 동일성을 가질 것이다. 보통, PD-L1 변이체 폴리펩티드는, 길이가 적어도 약 10 아미노산, 대안적으로 길이가 적어도 약 20, 30, 40, 50, 60, 70, 80, 90, 100, 110, 120, 130, 140, 150, 160, 170, 180, 190, 200, 210, 220, 230, 240, 250, 260, 270, 280, 281, 282, 283, 284, 285, 286, 287, 288, 또는 289 아미노산 이상이다. 선택적으로, PD-L1 변이체 폴리펩티드는 PD-L1 천연 폴리펩티드 서열에 비교하여 1 이하 보존적 아미노산 치환, 대안적으로 천연 PD-L1 폴리펩티드 서열에 비교하여 약 2, 3, 4, 5, 6, 7, 8, 9, 또는 10 이하 보존적 아미노산 치환을 가질 것이다.
용어 "PD-L1 축 결합 길항제"는, 복구되거나 증진된 T-세포 작용을 갖는, PD-L1 신호전달 축 상의 신호전달로부터 유발된, T-세포 기능이상을 제거하기 위하여, 이의 결합 상대 중 하나 이상과의 PD-1 축 결합 상대의 상호작용을 억제하는 분자를 지칭한다. 본 명세서에서 사용된 바와 같이, PD-L1 축 결합 길항제는 PD-L1 결합 길항제 및 PD-1 결합 길항제뿐만 아니라 PD-L1과 PD-1 사이의 상호작용 (예를 들면, PD-L2-Fc 융합)을 억제하는 분자를 포함한다.
용어들 "항-PD-L1 항체" 및 "PD-L1에 결합하는 항체"는 항체가 PD-L1를 표적화하는데 있어서 진단 및/또는 치료제로서 유용하도록 충분한 친화도를 가지고 PD-L1에 결합할 수 있는 항체를 지칭한다. 일 구현예에서, 비관련, 비-PD-L1 단백질에 대한 항-PD-L1 항체의 결합 정도는, 예를 들면, RIA로 측정 시, 약 10% 미만의 PD-L1에 대한 항체의 결합이다. 특정 구현예에서, 항-PD-L1 항체는 상이한 종 유래의 PD-L1 중 보존되어 있는 PD-L1의 에피토프에 결합한다.
용어 "항-PD-1 항체" 및 "PD-1에 결합하는 항체"는 항체가 PD-1을 표적화하는데 있어서 진단제 및/또는 치료제로서 유용하도록 하기에 충분한 친화도로 PD-1에 결합할 수 있는 항체를 나타낸다. 일 구현예에서, 비관련, 비-PD-1 단백질에 대한 항-PD-1 항체의 결합 정도는, 예를 들면, RIA로 측정 시, 약 10% 미만의 PD-1에 대한 항체의 결합이다. 특정 구현예에서, 항-PD-1 항체는 상이한 종 유래의 PD-1 중 보존되어 있는 PD-1의 에피토프에 결합한다.
본원에 사용된 바와 같이, "PD-L1 결합 길항제"는, PD-L1의, 이의 결합 상대 예컨대 PD-1 및/또는 B7-1 중 하나 이상과의 상호작용으로부터 유발된 신호 형질도입을 감소, 차단, 억제, 폐지 또는 억제하는 분자이다. 일부 구현예에서, PD-L1 결합 길항제는 이의 결합상대로의 PD-L1 결합을 억제하는 분자이다. 특정 양태에서, PD-L1 결합 길항제는 PD-1 및/또는 B7-1로의 PD-L1 결합을 억제한다. 일부 구현예에서, PD-L1 결합 길항제는 하기를 포함한다: PD-L1의, 이의 결합 상대 예컨대 PD-1 및/또는 B7-1 중 하나 이상과의 상호작용으로부터 유발된 신호 형질도입을 감소, 차단, 억제, 폐지 또는 억제하는, 항-PD-L1 항체 및 이의 항원-결합 단편, 면역접합체, 융합 단백질, 올리고펩티드, 소분자 길항제, 폴리뉴클레오티드 길항제, 및 기타 분자. 일 구현예에서, PD-L1 결합 길항제는 작용이상 T-세포에 보다 낮은 작용이상성을 부여하기 위하여, 하기를 감소시킨다: T 림프구 상에 발현된 세포 표면 단백질, 및 기타 세포를 통하여, 또는 이에 의하여 매개된 음성 신호, PD-L1 또는 PD-1 을 통하여 매개된 신호전달. 일부 구현예에서, PD-L1 결합 길항제는 항-PD-L1 항체이다. 특정 양태에서, 항-PD-L1 항체는 YW243.55.S70이다. 또 다른 특정 양태에서, 항-PD-L1 항체는 MDX-1105이다. 또한 또 다른 특정 양태에서, 항-PD-L1 항체는 MEDI4736 (드루발루맙)이다. 또한 또 다른 특정 양태에서, 항-PD-L1 항체는 MSB0010718C (아벨루맙)이다. 한편 또 다른 특정 양태에서, 항-PD-L1 항체는 본원에 기술된 아테졸리주맙(MPDL3280A)이다.
본원에 사용된 바와 같이, "PD-1 결합 길항제"는, PD-1의, 이의 결합 상대 예컨대 PD-L1 및/또는 PD-L2 중 하나 이상과의 상호작용으로부터 유발된 신호 형질도입을 감소, 차단, 억제, 폐지 또는 억제하는 분자이다. 일부 구현예에서, PD-1 결합 길항제는 이의 결합 상대로의 PD-1 결합을 억제하는 분자이다. 특정 양태에서, PD-1 결합 길항제는 PD-L1 및/또는 PD-L2로의 PD-1 결합을 억제한다. 예를 들어, PD-1 결합 길항제는 하기를 포함한다: PD-L1 및/또는 PD-L2 와의 PD-1 의 상호작용으로 유발된 신호 형질도입을 감소, 차단, 억제, 폐지 또는 억제하는, 항-PD-1 항체 및 이의 항원-결합 단편, 면역접합체, 융합 단백질, 올리고펩티드, 소분자 길항제, 폴리뉴클레오티드 길항제, 및 기타 분자. 일 구현예에서, PD-1 결합 길항제는 작용이상 T-세포에 보다 낮은 작용이상성을 부여하기 위하여, 하기를 감소시킨다: T 림프구 상에 발현된 세포 표면 단백질, 및 기타 세포를 통하여, 또는 이에 의하여 매개된 음성 신호, PD-1 또는 PD-L1 을 통하여 매개된 신호전달. 일부 구현예에서, PD-1 결합 길항제는 항-PD-1 항체이다. 특정 양태에서, PD-1 결합 길항제는 MDX-1106 (니볼루맙)이다. 또 다른 특정 양태에서, PD-1 결합 길항제는 MK-3475 (펨브롤리주맙)이다. 또 다른 특정 양태에서, PD-1 결합 길항제는 CT-011 (피딜리주맙)이다. 또 다른 특정 양태에서, PD-1 결합 길항제는 MEDI-0680 (AMP-514)이다. 또 다른 특정 양태에서, PD-1 결합 길항제는 PDR001 이다. 또 다른 특정 양태에서, PD-1 결합 길항제는 REGN2810 이다. 또 다른 특정 양태에서, PD-1 결합 길항제는 BGB-108 이다. 또 다른 특정 양태에서, PD-1 결합 길항제는 AMP-224 이다.
PD-L1 축-결합 길항제는, "단일 항-종양제"로서 투여되는 경우, 암을 치료하기 위해 투여되는 유일한 항-종양제이며, 즉 화학요법과 같은 다른 항-종양제와 병용 투여되지 않는다.
"PD-L1 축-결합 길항제를 암호화하는 핵산"은 항체 중쇄 및 경쇄 (또는 이의 단편)를 암호화하는 하나 이상의 핵산 분자를 이러한 핵산 분자(들)를 단일 벡터 또는 별도의 벡터로 포함하여 나타내며, 이러한 핵산 분자(들)는 숙주 세포의 하나 이상의 위치에 존재한다.
"개체 반응" 또는 "반응"은 상기 개체에 대한 이점을 표지하는 임의의 종료점을 사용하여 평가될 수 있으며, 이는 비제한적으로 하기를 포함한다: 지연 및 완전한 정지를 포함하는, 질환 진행 (예컨대, 암 진행)의, 일정 정도까지의, 억제; 종양 크기의 감소; 인접 말초 기관 및/또는 조직으로 암 세포 침윤의 억제 (즉, 감소, 지연, 또는 완전한 정지); 전이의 억제 (즉, 감소, 지연 또는 완전한 정지); 질환 또는 장애 (예컨대, 암)과 연관된 하나 이상의 증상의, 일정 정도까지의, 완화; 전체 생존 및 무진행 생존의 길이 증가 또는 연장; 및/또는 치료 후 소정의 시간에서 감소된 사망률.
약제로의 치료에 환자의 "효과적인 반응" 또는 환자의 "반응성" 및 유사한 문구는 질환 또는 장애 예컨대 암 발병 위험이 있거나 또는 암을 앓는 환자에게 주어진 임상적 또는 치료적 이점을 지칭한다. 일 구현예에서, 상기 이점에는 하기 중 하나 이상이 포함된다: 연장된 생존 (전체 생존 및 무진행 생존 포함); 객관적 반응의 유발 (완전한 반응 또는 부분적 반응 포함); 또는 암의 징후 또는 증상의 개선. 일 구현예에서, 바이오마커 (예컨대, 예를 들어, IHC를 사용하여 계측 시, 종양-침윤 면역 세포 내 PD-L1 발현)는, 바이오마커를 발현하지 않은 환자와 비교하여, 약제로의 치료 (예컨대, PD-L1 축 결합 길항제, 예컨대, 항-PD-L1 항체를 포함하는 치료)에 반응성일, 증가된 공산을 가질 것으로 예측되는 환자를 식별하는데 사용된다. 일 구현예에서, 바이오마커 (예컨대, 예를 들어, IHC를 사용하여 계측시, 종양-침윤 면역 세포 내 CD8A 발현)는, 바이오마커를 상동한 수준으로 발현하지 않은 환자와 비교하여, 약제(예컨대, 항-VEGF 항체 및/또는 항-PD-L1 항체)로의 치료에 반응성일, 증가된 공산을 가질 것으로 예측되는 환자를 식별하는데 사용된다. 일 구현예에서, 바이오마커의 존재는, 바이오마커의 존재를 갖지 않는 환자와 비교하여, 약제로의 치료에 반응성일 보다 큰 공산을 갖는 환자를 식별하는데 사용된다. 또 다른 구현예에서, 바이오마커의 존재는, 바이오마커의 존재를 갖지 않는 환자와 비교하여, 환자가 약제로의 치료로부터 이점을 얻을 증가된 공산을 가질 것임을 계측하는데 사용된다.
"객관적 반응"은 측정가능한 반응, 예를 들면 완전한 반응(CR) 또는 부분적 반응(PR)을 가리킨다. 일부 구현예에서, "객관적 반응 속도" (ORR)은 완전 반응 (CR) 속도 및 부분 반응 (PR) 속도의 총합을 지칭한다.
"완전한 반응" 또는 "CR"이란 치료 반응에서 암의 모든 조짐의 사라짐 (예컨대, 모든 표적 병변의 사라짐)이 의도된다. 이것은 암이 치유되었다는 것을 항상 의미하는 것은 아니다.
본원에 사용된 바와 같이, "부분적 반응" 또는 "PR"는 치료에 대한 반응에서 하나 이상의 종양 또는 병변의 크기, 또는 체내에서 암의 길이의 감소를 가리킨다. 예를 들어, 일부 구현예에서, PR은, 기준선 SLD를 참조로, 표적 병변의 가장 긴 직경 (SLD)의 총합의 적어도 30%의 감소를 지칭한다.
"지속된 반응"은, 치료 중지 후 종양 성장 감소에 대한 지속된 효과를 지칭한다. 예를 들어, 종양 크기는, 투여 단계의 개시시점에서의 크기와 비교하여 상동하거나 보다 작게 유지될 수 있다. 일부 구현예에서, 지속된 반응은, 적어도 치료 기간의 적어도 1.5×, 2.0×, 2.5×, 또는 3.0× 길이의 치료 기간 또는 그 이상의 기간과 상동한 기간을 갖는다.
본원에 사용된 바와 같이, "무변성 질환" 또는 "SD"는 치료 개시 이래 가장 작은 합계 직경(SLD)을 참조로 고려하여 PD에 대한 자격이 되도록 충분히 증가하지 않거나 또는 PR에 대한 자격이 되도록 표적 병변의 충분한 위축이 발생하지 않은 상태를 지칭한다.
본원에 사용된 바와 같이, "진행성 질환" 또는 "PD"는 표적 병변의 SLD의 적어도 20% 증가를 지칭한다 (치료 개시 또는 하나 이상의 신규 병변의 존재 이후 보고된 최소 SLD를 참고로 하여).
용어 "생존"은 살아남은 상기 환자를 가리키며, 전체 생존 뿐만 아니라 무진행 생존을 포함한다.
본 발명의 맥락에서 어구 "무진행 생존"은 치료 의사 또는 조사자의 평가에 따라, 환자의 질환이 더 나빠지지 않는, 즉 진행하지 않는 치료 동안 및 치료 후 시간의 길이를 지칭한다. 숙련가가 인지하는 바와 같이, 환자의 무진행 생존은 환자가 유사한 상황 환자의 대조군의 평균 또는 중간 무진행 생존 시간과 비교하여 질환이 진행되지 않는 더 긴 시간을 경험하는 경우, 개선되거나 향상된다.
본원에 사용된 바와 같이, "전체 생존" (OS) 은 특정 기간 후 생존할 가능성이 큰 군 중 개체의 백분율을 지칭한다.
"생존율 연장"이란 미치료 환자에 대한 (즉, 상기 약제로 치료받지 않은 환자 대비), 또는 지정된 수치로 또는 바이오마커를 발현하지 않는 환자에 대한, 그리고/또는 승인된 항-종양 제제 (예컨대, 항-VEGF 항체 또는 PD-L1 축 결합 길항제)로 치료 받은 환자에 대한, 치료 받은 환자에서의 전체 또는 무진행 생존율 증가를 의미한다.
용어 "이점"은 가장 넓은 의미로 사용되고, 임의의 바람직한 효과를 지칭하고 그리고 특이적으로 본 명세서에서 정의된 바와 같은 임상 이득을 포함한다. 임상적 이점은, 예를 들어, 감속 및 완전 정지를 포함하여 질환 진행의 어느 정도 억제; 질환 발병 및/또는 증상의 수 감소; 병변 크기의 감소; 인접한 말초 기관 및/또는 조직으로의 질환 세포 침윤의 억제(즉, 감소, 감속 또는 완전 정지); 질환 전파의 억제(즉, 감소, 감속 또는 완전 정지); 병변의 퇴행 또는 절제를 초래할 수 있지만 그럴 필요가 없는 자가-면역 반응의 감소; 장애와 관련된 하나 이상의 증상의 어느 정도 완화; 치료 후 무병 상태의 표현의 길이 예를 들어 무진행 생존율의 증가; 전체 생존율 증가; 높은 반응 속도; 및/또는 치료 후 주어진 시점에서의 사망률 감소와 같은 다양한 종료점을 평가함으로써 측정될 수 있다.
Ⅲ. 방법
일 양태에서, 본 발명은 부분적으로 하나 이상의 면역학적 바이오마커 (예를 들어, CD8A, CD8B, EOMES, GZMA, GZMB, IFNG, PRF1, CXCL9, CXCL10, CXCL11, CXCL13, KLRK1, SLAMF7, MHC-I, CX3CR1, CCL2, CCL5, CCR5, CCR7, CX3CL1)의 발현 수준의 변화 및/또는 면역 세포 (예를 들어, CD8+ Teff 세포 및/또는 CD68+/CD163+ 대식세포)의 종양 침윤은 VEGF 길항제 (예컨대, 항-VEGF 항체, 예컨대, 베바시주맙) 및/또는 PD-L1 축 결합 길항제 (예컨대, PD-L1 결합 길항제, 예컨대, 아테졸리주맙)를 포함하는 항암 요법에 대한 환자 반응과 관련되어 있다는 발견에, 부분적으로, 기반을 두고 있다. 특정 구현예에서, 이러한 바이오마커의 발현에 따른 치료에 대한 환자의 반응을 모니터링하는 방법이 제공된다. 기타 구현예에서, 상기 바이오마커의 발현 수준 또는 수에 따라 암 (예컨대, 신장암) 을 치료하는 방법이 제공된다. 일부 구현예에서, VEGF 길항제 및 PD-L1 축 결합 길항제를 포함하는 항암 요법으로부터 이점을 얻을 공산이 있는 암 환자를 식별하는 방법이 제공된다. 일부 구현예에서, 암 환자에 대한 VEGF 길항제 및 PD-L1 축 결합 길항제를 포함하는 항암 요법을 선택하는 방법이 제공된다. 본 발명은 또한 암 (예컨대, 신장암, 예컨대 RCC, 예컨대, mRCC)을 갖는 환자를 치료하기 위한 방법을 제공한다. 일부 경우에서, 본 발명의 방법은 본 발명의 바이오마커의 발현 수준에 기반하여 VEGF 길항제 및 PD-L1 축 결합 길항제를 포함하는 항암 요법을 환자에게 투여하는 단계를 포함한다.
A. 치료, 진단, 예후 및 환자 선택에 대한 반응을
모니터링하는
방법
본 발명은, VEGF 길항제 (예컨대, 항-VEGF 항체, 예컨대 베바시주맙) 및/또는 PD-L1 축 결합 길항제 (예컨대, PD-L1 결합 길항제, 예컨대 아테졸리주맙)에 대한 반응과 상관관계가 있는, 암, 예컨대 신장암 [예컨대, 신장 세포 암종 (RCC), 예컨대, 전이성 RCC (mRCC)]의 바이오마커 (예컨대, 면역학적 바이오마커)의 식별, 선택, 및 사용에 관한 것이다. 이런 점에서, 본 발명은 VEGF 길항제 (예컨대, 항-VEGF 항체, 예컨대 베바시주맙) 및 PD-L1 축 결합 길항제 (예컨대, PD-L1 결합 길항제, 예컨대 아테졸리주맙)의 병용에 민감성이거나 반응성인 환자를 식별하기 위한 하나 이상의 바이오마커에 대한 참조 수준(들)에 대한 본 발명의 하나 이상의 바이오마커의 발현 프로파일(들)의 용도에 관한 것이다. 일부 경우에서, VEGF 길항제 (예컨대, 항-VEGF 항체, 예컨대 베바시주맙) 및 PD-L1 축 결합 길항제 (예컨대, PD-L1 결합 길항제, 예컨대 아테졸리주맙)의 투여는 참조 수준(들)에 대한 하나 이상의 바이오마커의 발현 수준(들)의 계측 및/또는 비교에 기반을 두고 있다.
본 발명은 VEGF 길항제 (예컨대, 항-VEGF 항체, 예컨대 베바시주맙) 및 PD-L1 축 결합 길항제 (예컨대, PD-L1 결합 길항제, 예컨대 아테졸리주맙)를 포함하는 항암 요법으로의 치료에 대한 암 (예컨대, 신장암)을 갖는 환자의 반응을 모니터링하는 방법을 제공하며, 이는 환자로부터 수득된 샘플 내 하나 이상의 면역학적 바이오마커의 발현 수준을 계측하는 단계 및 샘플 내 하나 이상의 바이오마커의 발현 수준을 참조 수준과 비교하고, 이로써 항암 요법으로의 치료에 대한 환자의 반응을 모니터링하는 단계를 포함한다. 일부 구현예에서, 발현 수준은 참조 수준과 비교하여 증가된다. 예시적인 면역학적 바이오마커의 목록이 하기 표 2에 제시되어 있다. 일부 구현예에서, 본 방법은 하기 표 2에 명시된 바이오마커의 발현 수준을 기준으로 하여 환자에 대한 VEGF 길항제 (예컨대, 항-VEGF 항체, 예컨대 베바시주맙) 및 PD-L1 축 결합 길항제 (예컨대, PD-L1 결합 길항제, 예컨대 아테졸리주맙)를 포함하는 항암 요법을 선택하는 단계를 포함한다.
표 2. 면역학적
바이오마커
기타 구현예에서, 본 발명은 VEGF 길항제 (예컨대, 항-VEGF 항체, 예컨대 베바시주맙) 및 PD-L1 축 결합 길항제 (예컨대, PD-L1 결합 길항제, 예컨대 아테졸리주맙)를 포함하는 항암 요법으로의 치료로부터 이점을 얻을 공산이 있는 암 (예컨대, 신장암)을 갖는 환자를 식별하는 방법을 제공하며, 이는 환자로부터 수득된 생물학적 샘플 내 하나 이상의 면역학적 바이오마커의 발현 수준을 계측하는 단계, 및 샘플 내 하나 이상의 바이오마커의 발현 수준을 참조 수준과 비교하고, 이로써 항암 요법으로의 치료로부터 이점을 얻을 공산이 있는 환자를 식별하는 단계를 포함한다. 일부 구현예에서, 참조 수준과 비교하여 생물학적 샘플 내 하나 이상의 면역학적 바이오마커의 발현 수준의 변화 (예컨대, 증가 또는 감소)는 항암 요법으로의 치료로부터 이점을 얻을 공산이 있는 환자를 식별한다. 일부 구현예에서, 면역학적 바이오마커는 표 2에 제시되어 있다. 기타 구현예에서, 면역학적 바이오마커는 MHC-I이다.
또 다른 구현예에서, 본 발명은 암 (예컨대, 신장암)을 진단하거나 예측하는 방법을 제공하며, 상기 방법은 환자로부터 수득된 생물학적 샘플 내 하나 이상의 면역학적 바이오마커의 발현 수준을 계측하는 단계, 및 샘플 내 하나 이상의 바이오마커의 발현 수준을 참조 수준을 비교하고, 이로써 암을 진단하거나 예측하는 단계를 포함한다. 일부 구현예에서, 참조 수준과 비교하여 생물학적 샘플 내 하나 이상의 면역학적 바이오마커의 발현 수준의 변화 (예컨대, 증가 또는 감소)는 환자를 진단하고, 그리고 예측한다. 일부 구현예에서, 면역학적 바이오마커는 표 2에 제시되어 있다. 기타 구현예에서, 면역학적 바이오마커는 MHC-I이다.
추가의 또 다른 구현예에서, 본 발명은 암 (예컨대, 신장암)을 갖는 환자가 VEGF 길항제 (예컨대, 항-VEGF 항체, 예컨대 베바시주맙) 및 PD-L1 축 결합 길항제 (예컨대, PD-L1 결합 길항제, 예컨대 아테졸리주맙)를 포함하는 항암 요법으로의 치료에 대해 반응할 공산이 있는지 여부를 계측하는 방법을 제공하며, 이는 환자로부터 수득된 생물학적 샘플 내 하나 이상의 면역학적 바이오마커의 발현 수준을 계측하는 단계, 및 샘플 내 하나 이상의 바이오마커의 발현 수준을 참조 수준과 비교하고, 이로써 항암 요법에 대해 반응할 공산이 있는 환자를 식별하는 단계를 포함한다. 일부 구현예에서, 참조 수준과 비교하여 생물학적 샘플 내 하나 이상의 면역학적 바이오마커의 발현 수준의 변화 (예컨대, 증가 또는 감소)는 항암 요법으로의 치료에 반응할 공산이 있는 환자를 식별한다. 일부 구현예에서, 면역학적 바이오마커는 표 2에 제시되어 있다. 기타 구현예에서, 면역학적 바이오마커는 MHC-I이다.
기타 구현예에서, 본 발명은 암 (예컨대, 신장암)을 갖는 환자가 VEGF 길항제 (예컨대, 항-VEGF 항체, 예컨대 베바시주맙) 및 PD-L1 축 결합 길항제 (예컨대, PD-L1 결합 길항제, 예컨대 아테졸리주맙)를 포함하는 항암 요법의 치료 효능을 최적화하는 방법을 제공하며, 이는 환자로부터 수득된 생물학적 샘플 내 하나 이상의 면역학적 바이오마커의 발현 수준을 계측하는 단계, 및 샘플 내 하나 이상의 바이오마커의 발현 수준을 참조 수준과 비교하는 단계를 포함하며, 여기서 참조 수준과 비교하여 생물학적 샘플 내 하나 이상의 면역학적 바이오마커의 발현 수준의 변화 (예컨대, 증가 또는 감소)는 항암 요법에 대해 반응할 공산이 있는 환자를 식별한다. 일부 구현예에서, 면역학적 바이오마커는 표 2에 제시되어 있다. 기타 구현예에서, 면역학적 바이오마커는 MHC-I이다.
또 다른 추가 구현예에서, 본 발명은 암 (예컨대, 신장암)을 갖는 환자에 대해 VEGF 길항제 (예컨대, 항-VEGF 항체, 예컨대 베바시주맙) 및 PD-L1 축 결합 길항제 (예컨대, PD-L1 결합 길항제, 예컨대 아테졸리주맙)를 포함하는 항암 요법을 선택하는 방법을 제공하며, 상기 방법은 환자로부터 수득된 생물학적 샘플 내 하나 이상의 면역학적 바이오마커의 발현 수준을 계측하는 단계, 생물학적 샘플 내 하나 이상의 바이오마커의 발현 수준을 참조 수준과 비교하는 단계, 및 하나 이상의 면역학적 바이오마커의 발현 수준을 기준으로 하여 환자에 대하여 VEGF 길항제 및 PD-L1 축 결합 길항제를 포함하는 항암 요법을 선택하는 단계를 포함한다. 일부 구현예에서, 참조 수준과 비교하여 생물학적 샘플 내 하나 이상의 면역학적 바이오마커의 발현 수준의 변화 (예컨대, 증가 또는 감소)는 항암 요법을 선택하기 위하여 사용된다. 일부 구현예에서, 면역학적 바이오마커는 표 2에 제시되어 있다. 기타 구현예에서, 면역학적 바이오마커는 MHC-I이다.
일부 구현예에서, 본 발명은 VEGF 길항제 (예컨대, 항-VEGF 항체, 예컨대 베바시주맙) 및 PD-L1 축 결합 길항제 (예컨대, PD-L1 결합 길항제, 예컨대 아테졸리주맙)을 포함하는 항암 요법으로의 치료에 대한 암 (예컨대, 신장암)을 갖는 환자의 반응을 모니터링하는 방법을 제공하며, 이는 항암 요법의 투여 후 시점에서 환자로부터 수득된 생물학적 샘플 내 CD8A, CD8B, EOMES, GZMA, GZMB, IFNG, PRF1, CXCL9, CXCL10, CXCL11, CXCL13, KLRK1, 및/또는 SLAMF7 중 하나 이상 (예컨대, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 또는 13개)의 발현 수준을 계측하는 단계, 및 CD8A, CD8B, EOMES, GZMA, GZMB, IFNG, PRF1, CXCL9, CXCL10, CXCL11, CXCL13, KLRK1, 및/또는 SLAMF7의 하나 이상 (예컨대, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 또는 13개)의 발현 수준을 참조 수준과 비교하고, 이로써 항암 요법으로의 치료에 대하여 환자의 반응을 모니터링하는 단계를 포함한다.
기타 구현예에서, 본 발명은 VEGF 길항제 (예컨대, 항-VEGF 항체, 예컨대 베바시주맙) 및 PD-L1 축 결합 길항제 (예컨대, PD-L1 결합 길항제, 예컨대 아테졸리주맙)를 포함하는 항암 요법으로의 치료로부터 이점을 얻을 공산이 있는 암 (예컨대, 신장암)을 갖는 환자를 식별하는 방법을 제공하며, 상기 방법은 하기를 포함한다: 환자로부터 수득된 생물학적 샘플 내 CD8A, CD8B, EOMES, GZMA, GZMB, IFNG, PRF1, CXCL9, CXCL10, CXCL11, CXCL13, KLRK1, 및/또는 SLAMF7의 하나 이상 (예컨대, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 또는 13개)의 발현 수준을 계측하는 단계, 및 생물학적 샘플 내 CD8A, CD8B, EOMES, GZMA, GZMB, IFNG, PRF1, CXCL9, CXCL10, CXCL11, CXCL13, KLRK1, 및/또는 SLAMF7 중 하나 이상의 발현 수준을 참조 수준과 비교하고, 이로써 항암 요법으로의 치료로부터 이점을 얻을 공산이 있는 환자를 식별하는 단계. 일부 구현예에서, 참조 수준과 비교하여 생물학적 샘플 내 CD8A, CD8B, EOMES, GZMA, GZMB, IFNG, PRF1, CXCL9, CXCL10, CXCL11, CXCL13, KLRK1, 및/또는 SLAMF7 중 하나 이상의 발현 수준의 변화 (예컨대, 증가 또는 감소)는 항암 요법으로의 치료로부터 이점을 얻을 공산이 있는 환자를 식별한다. 일부 구현예에서, 변화는 증가이다. 기타 구현예에서, 변화는 감소이다.
또 다른 구현예에서, 본 발명은 암 (예컨대, 신장암)을 진단하거나 예측하는 방법을 제공하며, 상기 방법은 하기를 포함한다: 환자로부터 수득된 생물학적 샘플 내 CD8A, CD8B, EOMES, GZMA, GZMB, IFNG, PRF1, CXCL9, CXCL10, CXCL11, CXCL13, KLRK1, 및/또는 SLAMF7의 하나 이상 (예컨대, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 또는 13개)의 발현 수준을 계측하는 단계, 및 생물학적 샘플 내 CD8A, CD8B, EOMES, GZMA, GZMB, IFNG, PRF1, CXCL9, CXCL10, CXCL11, CXCL13, KLRK1, 및/또는 SLAMF7 중 하나 이상의 발현 수준을 참조 수준과 비교하고, 이로써 암을 진단하고 예측하는 단계. 일부 구현예에서, 참조 수준과 비교하여 생물학적 샘플 내 CD8A, CD8B, EOMES, GZMA, GZMB, IFNG, PRF1, CXCL9, CXCL10, CXCL11, CXCL13, KLRK1, 및/또는 SLAMF7 중 하나 이상의 발현 수준의 변화 (예컨대, 증가 또는 감소)는 환자를 진단하거나 예측한다. 일부 구현예에서, 변화는 증가이다. 기타 구현예에서, 변화는 감소이다.
추가의 또 다른 구현예에서, 본 발명은 암 (예컨대, 신장암)을 갖는 환자가 VEGF 길항제 (예컨대, 항-VEGF 항체, 예컨대 베바시주맙) 및 PD-L1 축 결합 길항제 (예컨대, PD-L1 결합 길항제, 예컨대 아테졸리주맙)를 포함하는 항암 요법에 대한 치료에 대하여 반응할 공산이 있는지 여부를 계측하는 방법을 제공하며, 상기 방법은 하기를 포함한다: 환자로부터 수득된 생물학적 샘플 내 CD8A, CD8B, EOMES, GZMA, GZMB, IFNG, PRF1, CXCL9, CXCL10, CXCL11, CXCL13, KLRK1, 및/또는 SLAMF7의 하나 이상 (예컨대, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 또는 13개)의 발현 수준을 계측하는 단계, 및 생물학적 샘플 내 CD8A, CD8B, EOMES, GZMA, GZMB, IFNG, PRF1, CXCL9, CXCL10, CXCL11, CXCL13, KLRK1, 및/또는 SLAMF7 중 하나 이상의 발현 수준을 참조 수준과 비교하고, 이로써 항암 요법에 반응할 공산이 있는 환자를 식별하는 단계. 일부 구현예에서, 참조 수준과 비교하여 생물학적 샘플 내 CD8A, CD8B, EOMES, GZMA, GZMB, IFNG, PRF1, CXCL9, CXCL10, CXCL11, CXCL13, KLRK1, 및/또는 SLAMF7 중 하나 이상의 발현 수준의 변화 (예컨대, 증가 또는 감소)는 항암 요법으로의 치료에 반응할 공산이 있는 환자를 식별한다. 일부 구현예에서, 변화는 증가이다. 기타 구현예에서, 변화는 감소이다.
기타 구현예에서, 본 발명은 VEGF 길항제 (예컨대, 항-VEGF 항체, 예컨대 베바시주맙) 및 PD-L1 축 결합 길항제 (예컨대, PD-L1 결합 길항제, 예컨대 아테졸리주맙)를 포함하는 항암 요법의 치료 효능을 최적화하는 방법을 제공하며, 상기 방법은 하기를 포함한다: 환자로부터 수득된 생물학적 샘플 내 CD8A, CD8B, EOMES, GZMA, GZMB, IFNG, PRF1, CXCL9, CXCL10, CXCL11, CXCL13, KLRK1, 및/또는 SLAMF7의 하나 이상 (예컨대, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 또는 13개)의 발현 수준을 계측하는 단계, 및 생물학적 샘플 내 CD8A, CD8B, EOMES, GZMA, GZMB, IFNG, PRF1, CXCL9, CXCL10, CXCL11, CXCL13, KLRK1, 및/또는 SLAMF7 중 하나 이상의 발현 수준을 참조 수준과 비교하는 단계 (여기서 참조 수준과 비교하여 생물학적 샘플 내 CD8A, CD8B, EOMES, GZMA, GZMB, IFNG, PRF1, CXCL9, CXCL10, CXCL11, CXCL13, KLRK1, 및/또는 SLAMF7 중 하나 이상의 발현 수준의 변화 (예컨대, 증가 또는 감소)는 항암 요법에 반응할 공산이 있는 환자를 식별함). 일부 구현예에서, 변화는 증가이다. 기타 구현예에서, 변화는 감소이다.
또 다른 추가 구현예에서, 본 발명은 암 (예컨대, 신장암)을 갖는 환자에 대하여 VEGF 길항제 (예컨대, 항-VEGF 항체, 예컨대 베바시주맙) 및 PD-L1 축 결합 길항제 (예컨대, PD-L1 결합 길항제, 예컨대 아테졸리주맙)를 포함하는 항암 요법을 선택하는 방법을 제공하며, 상기 방법은 하기를 포함한다: 환자로부터 수득된 생물학적 샘플 내 CD8A, CD8B, EOMES, GZMA, GZMB, IFNG, PRF1, CXCL9, CXCL10, CXCL11, CXCL13, KLRK1, 및/또는 SLAMF7의 하나 이상 (예컨대, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 또는 13개)의 발현 수준을 계측하는 단계, 생물학적 샘플 내 CD8A, CD8B, EOMES, GZMA, GZMB, IFNG, PRF1, CXCL9, CXCL10, CXCL11, CXCL13, KLRK1, 및/또는 SLAMF7 중 하나 이상의 발현 수준을 참조 수준과 비교하는 단계, 및 참조 수준과 비교하여 생물학적 샘플 내 CD8A, CD8B, EOMES, GZMA, GZMB, IFNG, PRF1, CXCL9, CXCL10, CXCL11, CXCL13, KLRK1, 및/또는 SLAMF7 중 하나 이상의 발현 수준을 기준으로 하여 환자에 대하여 VEGF 길항제 및 PD-L1 축 결합 길항제를 포함하는 항암 요법을 선택하는 단계. 일부 구현예에서, 참조 수준과 비교하여 생물학적 샘플 내 CD8A, CD8B, EOMES, GZMA, GZMB, IFNG, PRF1, CXCL9, CXCL10, CXCL11, CXCL13, KLRK1, 및/또는 SLAMF7 중 하나 이상의 발현 수준의 변화 (예컨대, 증가 또는 감소)는 항암 요법을 선택하기 위하여 사용된다. 일부 구현예에서, 변화는 증가이다. 기타 구현예에서, 변화는 감소이다.
선행 방법 중 임의의 것의 일부 구현예에서, CD8A, CD8B, EOMES, GZMA, GZMB, IFNG, 또는 PRF1 중 하나 이상 (예컨대, 1, 2, 3, 4, 5, 6, 또는 7개)의 발현 수준은 종양 미세환경 내 CD8+ T 효과기 (Teff) 세포의 존재와 상관관계가 있다. 일부 구현예에서, GZMB, KLRK1, 또는 SLAMF7의 하나 이상 (예컨대, 1, 2, 또는 3개)의 발현 수준은 종양 미세환경에서 자연 살해(NK) 세포의 존재와 상관관계가 있다. CD8+ Teff 세포 및/또는 NK 세포의 존재를 검출하는 방법은 본 명세서에 기재되어 있으며, 예를 들어 종양 샘플 세포에 대한 유세포측정 분석(예를 들어, 종양 생검에서 종양-침윤하는 면역 세포의 분석)을 포함한다. 특정 구현예에서, CXCL9, CXCL10, CXCL11, 또는 CXCL13 중 하나 이상(예컨대, 1, 2, 3, 또는 4개)의 발현 수준은 종양 미세환경 내 Th1 케모카인의 존재와 상관관계가 있다. 종양 미세환경에서 Th1 케모카인의 존재를 검출하는 방법은 본 명세서에 기재되어 있으며, 종양 샘플 (예를 들어, 종양 생검 용해물)에 대한 예컨대, ELISA 분석을 포함한다.
선행 방법 중 임의의 것의 특정 구현예에서, CD8A, CD8B, EOMES, GZMA, GZMB, IFNG, 또는 PRF1 중 하나 이상 (예컨대, 1, 2, 3, 4, 5, 6, 또는 7개)의 발현 수준이 계측된다. 일부 구현예에서, CD8A, CD8B, EOMES, GZMA, GZMB, IFNG, 또는 PRF1 중 적어도 2개, 적어도 3개, 적어도 4개, 적어도 5개, 또는 적어도 6개의 발현 수준이 계측된다. 일부 구현예에서, CD8A, CD8B, EOMES, GZMA, GZMB, IFNG, 및 PRF1의 발현 수준이 계측된다. 일부 구현예에서, CD8A의 수준은 참조 수준과 비교하여 약 1배 내지 약 60배 (예를 들어, 약 1배, 약 2배, 약 3배, 약 4배, 약 5배, 약 10배, 약 15배, 약 17배, 약 20배, 약 25배, 약 30배, 약 35배, 약 40배, 약 45배, 약 50배, 약 55배, 약 60배, 또는 약 1배 내지 약 50배) 증가된다. 일부 구현예에서, CD8A의 수준은 참조 수준과 비교하여 약 50배 이상 (예컨대, 약 50배, 100배, 200배, 250배, 500배, 1000배 이상) 증가된다. 일부 구현예에서, CD8B의 수준은 참조 수준과 비교하여 약 1배 내지 약 60배 (예를 들어, 약 1배, 약 2배, 약 3배, 약 4배, 약 5배, 약 10배, 약 15배, 약 17배, 약 20배, 약 25배, 약 30배, 약 35배, 약 40배, 약 45배, 약 50배, 약 55배, 약 60배, 또는 약 1배 내지 약 50배) 증가된다. 일부 구현예에서, CD8B의 수준은 참조 수준과 비교하여 약 50배 이상 (예컨대, 약 50배, 100배, 200배, 250배, 500배, 1000배 이상) 증가된다. 일부 구현예에서, 의 수준은 참조 수준과 비교하여 약 1배 내지 약 60배 (예를 들어, 약 1배, 약 2배, 약 3배, 약 4배, 약 5배, 약 10배, 약 15배, 약 17배, 약 20배, 약 25배, 약 30배, 약 35배, 약 40배, 약 45배, 약 50배, 약 55배, 약 60배, 또는 약 1배 내지 약 50배) 증가된다. 일부 구현예에서, EOMES의 수준은 참조 수준과 비교하여 약 50배 이상 (예컨대, 약 50배, 100배, 200배, 250배, 500배, 1000배 이상) 증가된다. 일부 구현예에서, GZMA의 수준은 참조 수준과 비교하여 약 1배 내지 약 60배 (예를 들어, 약 1배, 약 2배, 약 3배, 약 4배, 약 5배, 약 10배, 약 15배, 약 17배, 약 20배, 약 25배, 약 30배, 약 35배, 약 40배, 약 45배, 약 50배, 약 55배, 약 60배, 또는 약 1배 내지 약 50배) 증가된다. 일부 구현예에서, GZMA의 수준은 참조 수준과 비교하여 약 50배 이상 (예컨대, 약 50배, 100배, 200배, 250배, 500배, 1000배 이상) 증가된다. 일부 구현예에서, GZMB의 수준은 참조 수준과 비교하여 약 1배 내지 약 60배 (예를 들어, 약 1배, 약 2배, 약 3배, 약 4배, 약 5배, 약 10배, 약 15배, 약 17배, 약 20배, 약 25배, 약 30배, 약 35배, 약 40배, 약 45배, 약 50배, 약 55배, 약 60배, 또는 약 1배 내지 약 50배) 증가된다. 일부 구현예에서, GZMB의 수준은 참조 수준과 비교하여 약 50배 이상 (예컨대, 약 50배, 100배, 200배, 250배, 500배, 1000배 이상) 증가된다. 일부 구현예에서, IFNG의 수준은 참조 수준과 비교하여 약 1배 내지 약 60배 (예를 들어, 약 1배, 약 2배, 약 3배, 약 4배, 약 5배, 약 10배, 약 15배, 약 17배, 약 20배, 약 25배, 약 30배, 약 35배, 약 40배, 약 45배, 약 50배, 약 55배, 약 60배, 또는 약 1배 내지 약 50배) 증가된다. 일부 구현예에서, IFNG의 수준은 참조 수준과 비교하여 약 50배 이상 (예컨대, 약 50배, 100배, 200배, 250배, 500배, 1000배 이상) 증가된다. 일부 구현예에서, PRF1의 수준은 참조 수준과 비교하여 약 1배 내지 약 60배 (예를 들어, 약 1배, 약 2배, 약 3배, 약 4배, 약 5배, 약 10배, 약 15배, 약 17배, 약 20배, 약 25배, 약 30배, 약 35배, 약 40배, 약 45배, 약 50배, 약 55배, 약 60배, 또는 약 1배 내지 약 50배) 증가된다. 일부 구현예에서, PRF1의 수준은 참조 수준과 비교하여 약 50배 이상 (예컨대, 약 50배, 100배, 200배, 250배, 500배, 1000배 이상) 증가된다. 일부 구현예에서, CXCL9, CXCL10, CXCL11, 또는 CXCL13 중 하나 이상 (예컨대, 1, 2, 3, 또는 4개)의 발현 수준이 계측된다. 일부 구현예에서, CXCL9, CXCL10, CXCL11, 또는 CXCL13 중 적어도 2개 또는 적어도 3개의 발현 수준이 계측된다. 일부 구현예에서, CXCL9, CXCL10, CXCL11, 및 CXCL13의 발현 수준이 계측된다. 일부 구현예에서, CXCL9의 수준은 참조 수준과 비교하여 약 1배 내지 약 300배 (예컨대, 약 1배, 약 2배, 약 3배, 약 4배, 약 5배, 약 10배, 약 20배, 약 30배, 약 50배, 약 60배, 약 70배, 약 80배, 약 90배, 약 100배, 약 150배, 약 200배, 약 250배, 약 3배 내지 약 250배, 또는 약 1배 내지 약 80배) 증가된다. 일부 구현예에서, CXCL9의 수준은 참조 수준과 비교하여 약 50배 이상 (예컨대, 약 50배, 80배, 100배, 150배, 200배, 250배, 1000배 이상) 증가된다. 일부 구현예에서, CXCL10의 수준은 참조 수준과 비교하여 약 1배 내지 약 300배 (예컨대, 약 1배, 약 2배, 약 3배, 약 4배, 약 5배, 약 10배, 약 20배, 약 30배, 약 50배, 약 60배, 약 70배, 약 80배, 약 90배, 약 100배, 약 150배, 약 200배, 약 250배, 약 3배 내지 약 250배, 또는 약 1배 내지 약 80배) 증가된다. 일부 구현예에서, CXCL10의 수준은 참조 수준과 비교하여 약 50배 이상 (예컨대, 약 50배, 80배, 100배, 150배, 200배, 250배, 1000배 이상) 증가된다. 일부 구현예에서, CXCL11의 수준은 참조 수준과 비교하여 약 1배 내지 약 300배 (예컨대, 약 1배, 약 2배, 약 3배, 약 4배, 약 5배, 약 10배, 약 20배, 약 30배, 약 50배, 약 60배, 약 70배, 약 80배, 약 90배, 약 100배, 약 150배, 약 200배, 약 250배, 약 3배 내지 약 250배, 또는 약 1배 내지 약 80배) 증가된다. 일부 구현예에서, CXCL11의 수준은 참조 수준과 비교하여 약 50배 이상 (예컨대, 약 50배, 80배, 100배, 150배, 200배, 250배, 1000배 이상) 증가된다. 일부 구현예에서, CXCL13의 수준은 참조 수준과 비교하여 약 1배 내지 약 300배 (예컨대, 약 1배, 약 2배, 약 3배, 약 4배, 약 5배, 약 10배, 약 20배, 약 30배, 약 50배, 약 60배, 약 70배, 약 80배, 약 90배, 약 100배, 약 150배, 약 200배, 약 250배, 약 3배 내지 약 250배, 또는 약 1배 내지 약 80배) 증가된다. 일부 구현예에서, CXCL13의 수준은 참조 수준과 비교하여 약 50배 이상 (예컨대, 약 50배, 80배, 100배, 150배, 200배, 250배, 1000배 이상) 증가된다.
선행 방법 중 임의의 것의 일부 구현예에서, GZMB, KLRK1, 또는 SLAMF7 중 하나 이상 (예컨대, 1, 2, 또는 3개)의 발현 수준이 계측된다. 일부 구현예에서, GZMB, KLRK1, 또는 SLAMF7 중 적어도 2개의 발현 수준이 계측된다. 일부 구현예에서, GZMB, KLRK1, 및 SLAMF7의 발현 수준이 계측된다. 일부 구현예에서, GZMB의 수준은 참조 수준과 비교하여 약 1배 내지 약 20배 (예컨대, 약 1배, 약 2배, 약 3배, 약 4배, 약 5배, 약 6배, 약 7배, 약 8배, 약 9배, 약 10배, 약 12배, 약 13배, 약 15배, 약 20배, 약 1배 내지 약 8배, 또는 약 1배 내지 약 13배) 증가된다. 일부 구현예에서, GZMB의 수준은 참조 수준과 비교하여 약 8배 이상 (예컨대, 약 8배, 9배, 10배, 13배, 15배, 20배, 50배, 100배, 1000배 이상) 증가된다. 일부 구현예에서, KLRK1의 수준은 참조 수준과 비교하여 약 1배 내지 약 20배 (예컨대, 약 1배, 약 2배, 약 3배, 약 4배, 약 5배, 약 6배, 약 7배, 약 8배, 약 9배, 약 10배, 약 12배, 약 13배, 약 15배, 약 20배, 약 1배 내지 약 8배, 또는 약 1배 내지 약 13배) 증가된다. 일부 구현예에서, KLRK1의 수준은 참조 수준과 비교하여 약 8배 이상 (예컨대, 약 8배, 9배, 10배, 13배, 15배, 20배, 50배, 100배, 1000배 이상) 증가된다. 일부 구현예에서, SLAMF7의 수준은 참조 수준과 비교하여 약 1배 내지 약 20배 (예컨대, 약 1배, 약 2배, 약 3배, 약 4배, 약 5배, 약 6배, 약 7배, 약 8배, 약 9배, 약 10배, 약 12배, 약 13배, 약 15배, 약 20배, 약 1배 내지 약 8배, 또는 약 1배 내지 약 13배) 증가된다. 일부 구현예에서, SLAMF7의 수준은 참조 수준과 비교하여 약 8배 이상 (예컨대, 약 8배, 9배, 10배, 13배, 15배, 20배, 50배, 100배, 1000배 이상) 증가된다.
선행 방법 중 임의의 것의 일부 구현예에서, 환자로부터 수득된 생물학적 샘플 중 CD8A, CD8B, EOMES, GZMA, GZMB, IFNG, PRF1, CXCL9, CXCL10, CXCL11, CXCL13, KLRK1 및/또는 SLAMF7 중 하나 이상의 (예를 들어, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 또는 13) 발현 수준은 참조 수준과 비교하여 (예를 들어, 약 1.1배, 약 1.2배, 약 1.3배, 약 1.4배, 약 1.5배, 약 1.6배, 약 1.7배, 약 1.8배, 약 1.9배, 약 2배, 약 2.1배, 약 2.2배, 약 2.3배, 약 2.4배, 약 2.5배, 약 3배, 약 3.5배, 약 4배, 약 4.5배, 약 5배, 약 5.5배, 약 6배, 약 6.5배, 약 7배, 약 7.5배, 약 8배, 약 8.5배, 약 9배, 약 9.5배, 약 10배, 약 11배, 약 12배, 약 13배, 약 14배, 약 15배, 약 16배, 약 17배, 약 18배, 약 19배, 약 20배, 약 30배, 약 40배, 약 50배, 약 100배, 약 500배, 약 1,000배 또는 그 초과) 증가된다.
선행 방법 중 임의의 것의 일부 구현예에서, 참조 수준은 항암 요법의 투여 이전 (예컨대, 수분, 수시간, 수일, 수주 (예컨대, 1, 2, 3, 4, 5, 6, 또는 7주), 수개월, 또는 수년 이전) 수득된 환자 유래의 생물학적 샘플 내 하나 이상의 유전자 (예컨대, CD8A, CD8B, EOMES, GZMA, GZMB, IFNG, PRF1, CXCL9, CXCL10, CXCL11, CXCL13, KLRK1, 및/또는 SLAMF7)의 발현 수준이다. 특정 구현예에서, 참조 수준은 참조 집단에서 하나 이상의 유전자의 발현 수준이다. 특정 구현예에서, 참조 수준은 하나 이상의 유전자에 대한 사전-할당된 발현 수준이다. 일부 구현예에서, 참조 수준은 사전 시점에서 환자로부터 수득된 생물학적 샘플 내 하나 이상의 유전자의 발현 수준이며, 여기서 상기 사전 시점은 항암 요법의 투여 후의 시점이다. 기타 구현예에서, 참조 수준은 후속 시점에서의 (예컨대, 항암 요법의 투여로부터 수분, 수시간, 수일, 수주, 수개월, 또는 수년 후의) 환자로부터 수득된 생물학적 샘플 내 하나 이상의 유전자의 발현 수준이다.
또 다른 양태에서, 본 발명은 VEGF 길항제 (예컨대, 항-VEGF 항체, 예컨대 베바시주맙) 및 PD-L1 축 결합 길항제 (예컨대, PD-L1 결합 길항제, 예컨대 아테졸리주맙)을 포함하는 항암 요법으로의 치료에 대한 암 (예컨대, 신장암)을 갖는 환자의 반응을 모니터링하는 방법을 제공하며, 이는 항암 요법의 투여 후 시점에서 환자로부터 수득된 생물학적 샘플 내 MHC-I의 발현 수준을 계측하는 단계, 및 생물학적 샘플 내 MHC-I의 발현 수준을 참조 수준과 비교하고, 이로써 항암 요법으로의 치료에 대한 환자의 반응을 모니터링하는 단계를 포함한다. 일부 구현예에서, 환자로부터 수득된 생물학적 샘플 내 발현 수준은, 참조 수준과 비교하여 증가된다.
기타 구현예에서, 본 발명은 VEGF 길항제 (예컨대, 항-VEGF 항체, 예컨대 베바시주맙) 및 PD-L1 축 결합 길항제 (예컨대, PD-L1 결합 길항제, 예컨대 아테졸리주맙)를 포함하는 항암 요법으로의 치료로부터 이점을 얻을 공산이 있는 암 (예컨대, 신장암)을 갖는 환자를 식별하는 방법을 제공하며, 상기 방법은 환자로부터 수득된 생물학적 샘플 내 MHC-I의 발현 수준을 계측하는 단계, 및 생물학적 샘플 내 MHC-I의 발현 수준을 참조 수준과 비교하고, 이로써 항암 요법으로의 치료로부터 이점을 얻을 공산이 있는 환자를 식별하는 단계를 포함한다. 일부 구현예에서, 참조 수준과 비교하여 생물학적 샘플 내 MHC-I의 발현 수준의 변화 (예컨대, 증가 또는 감소)는 항암 요법으로의 치료로부터 이점을 얻을 공산이 있는 환자를 식별한다. 일부 구현예에서, 변화는 증가이다. 기타 구현예에서, 변화는 감소이다.
또 다른 구현예에서, 본 발명은 암 (예컨대, 신장암)을 진단하거나 예측하는 방법을 제공하며, 상기 방법은 환자로부터 수득된 생물학적 샘플 내 MHC-I의 발현 수준을 계측하는 단계, 및 환자 샘플 내 MHC-I의 발현 수준을 참조 수준과 비교하고, 이로써 암을 예측하거나 진단하는 단계를 포함한다. 일부 구현예에서, 참조 수준과 비교하여 생물학적 샘플 내 MHC-I의 발현 수준의 변화 (예컨대, 증가 또는 감소)는 환자를 진단하고, 그리고 예측한다. 일부 구현예에서, 변화는 증가이다. 기타 구현예에서, 변화는 감소이다.
추가의 또 다른 구현예에서, 본 발명은 암 (예컨대, 신장암)을 갖는 환자가 VEGF 길항제 (예컨대, 항-VEGF 항체, 예컨대 베바시주맙) 및 PD-L1 축 결합 길항제 (예컨대, PD-L1 결합 길항제, 예컨대 아테졸리주맙)를 포함하는 항암 요법으로의 치료에 대해 반응할 공산이 있는지 여부를 계측하는 방법을 제공하며, 상기 방법은 환자로부터 수득된 생물학적 샘플 내 MHC-I의 발현 수준을 계측하는 단계, 및 환자 샘플 내 MHC-I의 발현 수준을 참조 수준과 비교하고, 이로써 항암 요법에 대해 반응할 공산이 있는 환자를 식별하는 단계를 포함한다. 일부 구현예에서, 참조 수준과 비교하여 생물학적 샘플 내 MHC-I의 발현 수준의 변화 (예컨대, 증가 또는 감소)는 항암 요법으로의 치료에 대해 반응할 공산이 있는 환자를 식별한다. 일부 구현예에서, 변화는 증가이다. 기타 구현예에서, 변화는 감소이다.
기타 구현예에서, 본 발명은 암 (예컨대, 신장암)을 갖는 환자가 VEGF 길항제 (예컨대, 항-VEGF 항체, 예컨대 베바시주맙) 및 PD-L1 축 결합 길항제 (예컨대, PD-L1 결합 길항제, 예컨대 아테졸리주맙)를 포함하는 항암 요법의 치료 효능을 최적화하는 방법을 제공하며, 이는 환자로부터 수득된 생물학적 샘플 내 MHC-I의 발현 수준을 계측하는 단계, 및 환자 샘플 내 MHC-I의 발현 수준을 참조 수준과 비교하는 단계를 포함하며, 여기서 참조 수준과 비교하여 생물학적 샘플 내 MHC-I의 발현 수준의 변화 (예컨대, 증가 또는 감소)는 항암 요법에 대해 반응할 공산이 있는 환자를 식별한다. 일부 구현예에서, 변화는 증가이다. 기타 구현예에서, 변화는 감소이다.
또 다른 추가 구현예에서, 본 발명은 암 (예컨대, 신장암)을 갖는 환자에 대해 VEGF 길항제 (예컨대, 항-VEGF 항체, 예컨대 베바시주맙) 및 PD-L1 축 결합 길항제 (예컨대, PD-L1 결합 길항제, 예컨대 아테졸리주맙)을 포함하는 항암 요법을 선택하는 방법을 제공하며, 상기 방법은 환자로부터 수득된 생물학적 샘플 내 MHC-I의 발현 수준을 계측하는 단계, 및 생물학적 샘플 내 MHC-I의 발현 수준을 참조 수준과 비교하는 단계, 및 참조 수준과 비교하여 환자 샘플 내 MHC-I의 발현 수준을 기준으로 하여 환자에 대하여 VEGF 길항제 및 PD-L1 길항제를 포함하는 항암 요법을 선택하는 단계를 포함한다. 일부 구현예에서, 참조 수준과 비교하여 생물학적 샘플 내 MHC-I의 발현 수준의 변화 (예컨대, 증가 또는 감소)는 항암 요법을 선택하기 위하여 사용된다. 일부 구현예에서, 변화는 증가이다. 기타 구현예에서, 변화는 감소이다.
선행 방법 중 임의의 것의 일부 구현예에서, MHC-I의 발현 수준은, 본원에 기술된 검출 방법 중 임의의 것에 의하여, 임의의 인간 백혈구 항원 부류 I (HLA-I) 유전자 또는 위유전자 (예컨대, HLA-A, HLA-B, HLA-C, HLA-E, HLA-F, HLA-G, HLA-K, 또는 HLA-L) 또는 이의 일배체형의 발현 수준을 계측함에 의하여 측정된다. 일부 구현예에서, MHC-I의 발현 수준은 MHC-I 알파 쇄, 또는 HLA-I 조직적합성 항원 알파 쇄의 단백질 발현에 의하여 평가된다.
선행 방법 중 임의의 것의 일부 구현예에서, 참조 수준은 항암 요법의 투여 이전 (예컨대, 수분, 수시간, 수일, 수주 (예컨대, 1, 2, 3, 4, 5, 6, 또는 7주), 수개월, 또는 수년 이전) 수득된 환자 유래의 생물학적 샘플 내 MHC-I의 발현 수준이다. 기타 구현예에서, 참조 수준은 참조 집단에서 MHC-I 발현 수준이다. 기타 구현예에서, 참조 수준은 MHC-I에 대해 사전-할당된 발현 수준이다. 기타 구현예에서, 참조 수준은 사전 시점에서 환자로부터 수득된 생물학적 샘플 내 MHC-I의 발현 수준이며, 여기서 상기 사전 시점은 항암 요법의 투여 후의 시점이다. 기타 구현예에서, 참조 수준은 후속 시점에서의 (예컨대, 항암 요법의 투여로부터 수분, 수시간, 수일, 수주, 수개월, 또는 수년 후의) 환자로부터 수득된 생물학적 샘플 내 MHC-I의 발현 수준이다.
선행 방법 중 임의의 것의 일부 구현예에서, 환자로부터 수득된 생물학적 샘플 중 MHC-I의 발현 수준은 참조 수준과 비교하여 (예컨대, 약 1.1배, 약 1.2배, 약 1.3배, 약 1.4배, 약 1.5배, 약 1.6배, 약 1.7배, 약 1.8배, 약 1.9배, 약 2배, 약 2.1배, 약 2.2배, 약 2.3배, 약 2.4배, 약 2.5배, 약 3배, 약 3.5배, 약 4배, 약 4.5배, 약 5배, 약 5.5배, 약 6배, 약 6.5배, 약 7배, 약 7.5배, 약 8배, 약 8.5배, 약 9배, 약 9.5배, 약 10배, 약 11배, 약 12배, 약 13배, 약 14배, 약 15배, 약 16배, 약 17배, 약 18배, 약 19배, 약 20배, 약 30배, 약 40배, 약 50배, 약 100배, 약 500배, 약 1,000배 이상 만큼) 증가된다. 일부 구현예에서, 환자로부터 수득된 생물학적 샘플 내 MHC-I의 발현 수준은 적어도 약 2배 만큼 증가된다.
추가 양태에서, 본 발명은, VEGF 길항제 (예컨대, 항-VEGF 항체, 예컨대 베바시주맙) 및 PD-L1 축 결합 길항제 (예컨대, PD-L1 결합 길항제, 예컨대 아테졸리주맙)를 포함하는 항암 요법으로의 치료에 대한 암 (예컨대, 신장암)을 갖는 환자의 반응을 모니터링하는 방법을 제공하며, 이는 하기를 포함한다: 하기 유전자 중 하나 이상 (예컨대, 1, 2, 3, 4, 5, 6, 또는 7개)의 발현 수준을 계측하는 단계: 항암 요법의 투여 후 시점에서 환자로부터 수득된 생물학적 샘플 내 CX3CR1, CCL2, CCL5, CCR5, CX3CL1, CCR7, 또는 CXCL10, 및 생물학적 샘플 내 CX3CR1, CCL2, CCL5, CCR5, CX3CL1, CCR7, 또는 CXCL10 중 하나 이상의 발현 수준을 참조 수준과 비교하고, 이로써 항암 요법으로의 치료에 대한 환자의 반응을 모니터링하는 단계.
기타 구현예에서, 본 발명은, VEGF 길항제 (예컨대, 항-VEGF 항체, 예컨대 베바시주맙) 및 PD-L1 축 결합 길항제 (예컨대, PD-L1 결합 길항제, 예컨대 아테졸리주맙)를 포함하는 항암 요법으로의 치료로부터 이점을 얻을 공산이 있는 암 (예컨대, 신장암)을 갖는 환자를 식별하는 방법을 제공하며, 상기 방법은 하기를 포함한다: 하기 유전자 중 하나 이상 (예컨대, 1, 2, 3, 4, 5, 6, 또는 7개)의 발현 수준을 계측하는 단계: 환자로부터 수득된 생물학적 샘플 내 CX3CR1, CCL2, CCL5, CCR5, CX3CL1, CCR7, 또는 CXCL10, 및 생물학적 샘플 내 CX3CR1, CCL2, CCL5, CCR5, CX3CL1, CCR7, 또는 CXCL10 중 하나 이상의 발현 수준을 참조 수준과 비교하고, 이로써 항암 요법으로의 치료로부터 이점을 얻을 공산이 있는 환자를 식별하는 단계. 일부 구현예에서, 참조 수준과 비교하여 생물학적 샘플 내 CX3CR1, CCL2, CCL5, CCR5, CX3CL1, CCR7, 또는 CXCL10 중 하나 이상의 발현 수준의 변화 (예컨대, 증가 또는 감소)는 항암 요법으로의 치료로부터 이점을 얻을 공산이 있는 환자를 식별한다. 일부 구현예에서, 변화는 증가이다. 기타 구현예에서, 변화는 감소이다.
또 다른 구현예에서, 본 발명은 암 (예를 들어, 신장암)을 진단하거나 예측하는 방법을 제공하며, 이 방법은 하나 이상의 (예를 들어, 1, 2, 3, 4, 5, 6 또는 7개의) 하기 유전자들의 발현 수준을 측정하는 단계: 환자로부터 수득된 생물학적 샘플 내 CX3CR1, CCL2, CCL5, CCR5, CX3CL1, CCR7, 또는 CXCL10, 및 생물학적 샘플 내 CX3CR1, CCL2, CCL5, CCR5, CX3CL1, CCR7, 또는 CXCL10 중 하나 이상의 발현 수준을 참조 수준과 비교하고, 이로써 암을 진단하거나 예측하는 단계. 일부 구현예에서, 참조 수준과 비교하여 생물학적 샘플 내 CX3CR1, CCL2, CCL5, CCR5, CX3CL1, CCR7, 또는 CXCL10 중 하나 이상의 발현 수준의 변화 (예컨대, 증가 또는 감소)는 환자를 진단하거나 예측한다. 일부 구현예에서, 변화는 증가이다. 기타 구현예에서, 변화는 감소이다.
추가의 또 다른 구현예에서, 본 발명은, 암 (예컨대, 신장암)을 갖는 환자가 VEGF 길항제 (예컨대, 항-VEGF 항체, 예컨대 베바시주맙) 및 PD-L1 축 결합 길항제 (예컨대, PD-L1 결합 길항제, 예컨대 아테졸리주맙)를 포함하는 항암 요법으로의 치료에 반응할 공산이 있는지 여부를 계측하는 방법을 제공하며, 상기 방법은 하기를 포함한다: 하기 유전자 중 하나 이상 (예컨대, 1, 2, 3, 4, 5, 6, 또는 7개)의 발현 수준을 계측하는 단계: 환자로부터 수득된 생물학적 샘플 내 CX3CR1, CCL2, CCL5, CCR5, CX3CL1, CCR7, 또는 CXCL10, 및 생물학적 샘플 내 CX3CR1, CCL2, CCL5, CCR5, CX3CL1, CCR7, 또는 CXCL10 중 하나 이상의 발현 수준을 참조 수준과 비교하고, 이로써 항암 요법에 반응할 공산이 있는 환자를 식별하는 단계. 일부 구현예에서, 참조 수준과 비교하여 생물학적 샘플 내 CX3CR1, CCL2, CCL5, CCR5, CX3CL1, CCR7, 또는 CXCL10 중 하나 이상의 발현 수준의 변화 (예컨대, 증가 또는 감소)는 항암 요법으로의 치료에 반응할 공산이 있는 환자를 식별한다. 일부 구현예에서, 변화는 증가이다. 기타 구현예에서, 변화는 감소이다.
기타 구현예에서, 본 발명은, VEGF 길항제 (예컨대, 항-VEGF 항체, 예컨대 베바시주맙) 및 PD-L1 축 결합 길항제 (예컨대, PD-L1 결합 길항제, 예컨대 아테졸리주맙)를 포함하는 항암 요법의 치료 효능을 최적화하는 방법을 제공하며, 상기 방법은 하기를 포함한다: 하기 유전자 중 하나 이상 (예컨대, 1, 2, 3, 4, 5, 6, 또는 7개)의 발현 수준을 계측하는 단계: 환자로부터 수득된 생물학적 샘플 내 CX3CR1, CCL2, CCL5, CCR5, CX3CL1, CCR7, 또는 CXCL10, 및 생물학적 샘플 내 CX3CR1, CCL2, CCL5, CCR5, CX3CL1, CCR7, 또는 CXCL10 중 하나 이상의 발현 수준을 참조 수준과 비교하는 단계를 포함하며, 상기 참조 수준과 비교하여 생물학적 샘플 내 CX3CR1, CCL2, CCL5, CCR5, CX3CL1, CCR7, 또는 CXCL10 중 하나 이상의 발현 수준의 변화 (예를 들어, 증가 또는 감소)는 항암 요법에 반응할 가능성이 있는 환자를 식별한다. 일부 구현예에서, 변화는 증가이다. 기타 구현예에서, 변화는 감소이다.
또 다른 추가 구현예에서, 본 발명은 암 (예컨대, 신장암)을 갖는 환자에 대하여 VEGF 길항제 (예컨대, 항-VEGF 항체, 예컨대 베바시주맙) 및 PD-L1 축 결합 길항제 (예컨대, PD-L1 결합 길항제, 예컨대 아테졸리주맙)를 포함하는 항암 요법을 선택하는 방법을 제공하며, 상기 방법은 하기를 포함한다: 하기 유전자 중 하나 이상 (예컨대, 1, 2, 3, 4, 5, 6, 또는 7개)의 발현 수준을 계측하는 단계: 환자로부터 수득된 생물학적 샘플 내 CX3CR1, CCL2, CCL5, CCR5, CX3CL1, CCR7, 또는 CXCL10, 생물학적 샘플 내 CX3CR1, CCL2, CCL5, CCR5, CX3CL1, CCR7, 또는 CXCL10 중 하나 이상의 발현 수준을 참조 수준과 비교하는 단계, 및 참조 수준과 비교하여 생물학적 샘플 내 CX3CR1, CCL2, CCL5, CCR5, CX3CL1, CCR7, 또는 CXCL10 중 하나 이상의 발현 수준을 기준으로 하여 환자에 대하여 VEGF 길항제 및 PD-L1 축 결합 길항제를 포함하는 항암 요법을 선택하는 단계. 일부 구현예에서, 참조 수준과 비교하여 생물학적 샘플 내 CX3CR1, CCL2, CCL5, CCR5, CX3CL1, CCR7, 또는 CXCL10 중 하나 이상의 발현 수준의 변화 (예컨대, 증가 또는 감소)는 항암 요법을 선택하기 위하여 사용된다. 일부 구현예에서, 변화는 증가이다. 기타 구현예에서, 변화는 감소이다.
선행 방법 중 임의의 것의 일부 구현예에서, 환자로부터 수득된 생물학적 샘플의 발현 수준은 참조 수준과 비교하여 증가된다. 일부 구현예에서, CX3CR1, CCL2, CCL5, CCR5, CX3CL1, CCR7, 또는 CXCL10 중 적어도 2개, 적어도 3개, 적어도 4개, 적어도 5개, 또는 적어도 6개의 발현 수준이 계측된다. 일부 구현예에서, CX3CR1, CCL2, CCL5, CCR5, CX3CL1, CCR7, 및 CXCL10의 발현 수준이 계측된다.
선행 방법 중 임의의 것의 일부 구현예에서, 참조 수준은 항암 요법의 투여 이전 (예컨대, 수분, 수시간, 수일, 수주, 수개월, 또는 수년 이전) 수득된 환자 유래의 생물학적 샘플 내 하나 이상의 유전자 (예컨대, CX3CR1, CCL2, CCL5, CCR5, CX3CL1, CCR7, 및/또는 CXCL10)의 발현 수준이다. 기타 구현예에서, 참조 수준은 참조 집단에서 하나 이상의 유전자의 발현 수준이다. 기타 구현예에서, 참조 수준은 하나 이상의 유전자에 대한 사전-할당된 발현 수준이다. 기타 구현예에서, 참조 수준은 사전 시점에서 환자로부터 수득된 생물학적 샘플 내 하나 이상의 유전자의 발현 수준이며, 여기서 상기 사전 시점은 항암 요법의 투여 후의 시점이다. 기타 구현예에서, 참조 수준은 후속 시점에서 환자로부터 수득된 생물학적 샘플 내 하나 이상의 유전자의 발현 수준이다.
선행 방법 중 임의의 것의 일부 구현예에서, 환자로부터 수득된 생물학적 샘플 중 CX3CR1, CCL2, CCL5, CCR5, CX3CL1, CCR7, 및/또는 CXCL10 중 하나 이상 (예를 들어, 1, 2, 3, 4, 5, 6, 또는 7개)의 발현 수준은 참조 수준과 비교하여 (예컨대, 약 1.1배, 약 1.2배, 약 1.3배, 약 1.4배, 약 1.5배, 약 1.6배, 약 1.7배, 약 1.8배, 약 1.9배, 약 2배, 약 2.1배, 약 2.2배, 약 2.3배, 약 2.4배, 약 2.5배, 약 3배, 약 3.5배, 약 4배, 약 4.5배, 약 5배, 약 5.5배, 약 6배, 약 6.5배, 약 7배, 약 7.5배, 약 8배, 약 8.5배, 약 9배, 약 9.5배, 약 10배, 약 11배, 약 12배, 약 13배, 약 14배, 약 15배, 약 16배, 약 17배, 약 18배, 약 19배, 약 20배, 약 30배, 약 40배, 약 50배, 약 100배, 약 500배, 약 1,000배 이상 만큼) 증가된다.
상기 기술된 방법 중 임의의 것의 일부 구현예에서, 환자 유래의 생물학적 샘플은 항암 요법의 투여로부터 약 2 내지 약 10 주 (예컨대, 2, 3, 4, 5, 6, 7, 8, 9, 또는 10 주) 후 수득된다. 일부 구현예에서, 환자 유래의 생물학적 샘플은 항암 요법의 투여로부터 약 4 내지 약 6주 후에 수득된다.
선행 방법 중 임의의 것의 특정 구현예에서, 본 발명의 방법은 하나 이상의 (예를 들어, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 또는 그 이상의) 추가 용량의 항암 요법을 MHC-I 또는 하나 이상의 유전자 (예를 들어, CD8A, CD8B, EOMES, GZMA, GZMB, IFNG, PRF1, CXCL9, CXCL10, CXCL11, CXCL13, KLRK1, SLAMF7, CX3CR1, CCL2, CCL5, CCR5, CX3CL1, 및/또는 CCR7)의 발현 수준이 참조 수준과 비교하여 증가된 환자에게 투여하는 단계를 추가로 포함한다.
상기 기술된 바이오마커 중 임의의 것의 존재 및/또는 발현 수준은, 비제한적으로 DNA, mRNA, cDNA, 단백질, 단백질 단편 및/또는 유전자 사본수를 포함하는, 당해 기술에서 공지된 임의의 적합한 기준을 기준으로 하여 정성적으로 및/또는 정량적으로 평가될 수 있다. 비제한적으로 하기를 포함하는, 상기 바이오마커를 측정하기 위한 방법론은 본 분야에 알려져 있고, 숙련가에게 이해되는, 다양한 방법에 의하여 분석될 수 있다: 면역조직화학 ("IHC"), 웨스턴 블롯 분석, 면역침전, 분자 결합 검정, ELISA, ELIFA, 형광 활성 세포 분류 ("FACS"), 매스어레이(MassARRAY), 프로테오믹스, 정량적 혈액 기반 검정 (예를 들어 혈청 ELISA로서), 생화학 효소적 활성 검정, 생화학 효소 활성 검정, 동일계내 하이브리드화, 형광 동일계내 하이브리드화 (FISH), 서던 분석, 노던 분석, 전체 게놈 서열분석, 폴리머라제 쇄 반응 ("PCR") (정량적 실시간 PCR ("qRT-PCR") 및 기타 증폭 유형 검출 방법, 예컨대, 예를 들어 분지된 DNA, SISBA, TMA 등, RNA-서열(RNA-Seq), 마이크로어레이 분석, 유전 발현 프로파일링, 전체-게놈 서열분석 (WGS), 및/또는 유전자 발현의 일련 분석 ("SAGE"), 뿐만 아니라 단백질, 유전자, 및/또는 조직 어레이 분석에 의하여 수행될 수 있는 다양한 범위의 검정 중 임의의 것. 유전자 및 유전자 산물의 위치를 평가하기 위한 전형적인 프로토콜은, 예를 들어 하기에서 발견될 수 있다: Ausubel et al. eds. (Current Protocols In Molecular Biology, 1995), 유닛(Units) 2 (노던 블롯팅), 4 (서던 블롯팅), 15 (면역블롯팅), 및 18 (PCR 분석). 멀티플렉스 면역검정, 예컨대 Rules Based Medicine 또는 Meso Scale Discovery ("MSD")에서 이용가능한 것들이 또한 사용될 수 있다.
선행 방법 중 임의의 것에서, 바이오마커의 발현 수준은 단백질 발현 수준일 수 있다. 특정 구현예에서, 상기 방법은, 바이오마커의 결합이 허용되는 조건 하에서 본원에 기술된 바이오마커에 특이적으로 결합하는 항체를 생물학적 샘플에 접촉시키는 단계, 및 복합체가 항체 및 바이오마커 사이에서 형성되는지 여부를 검출하는 단계를 포함한다. 상기 방법은 시험관내 또는 생체내 방법일 수 있다. 일부 경우에서, 항체는 개체의 선택을 위한 VEGF 길항제 및/또는 PD-L1 축 결합 길항제, 예컨대, 바이오마커로의 요법에 적격인 환자를 선택하기 위해 사용된다. 당해 기술에서 공지된 또는 본 명세서에서 제공된 단백질 발현 수준을 측정하는 임의의 방법이 사용될 수 있다. 예를 들어, 일부 구현예에서, 바이오마커의 단백질 발현 수준은 유세포측정 (예를 들면, 형광-활성화된 세포 분류 (FACS™)), 웨스턴 블롯, 효소-결합 면역흡착 검정 (ELISA), 면역침강, 면역조직화학 (IHC), 면역형광, 방사선면역검정, 닷 블롯팅, 면역검출 방법, HPLC, 표면 플라즈몬 공명, 광학 분광법, 질량 분광검정, 및 HPLC로 이루어진 군으로부터 선택된 방법을 이용하여 계측된다. 일부 구현예에서, 바이오마커의 단백질 발현 수준은 종양-침윤 면역 세포에서 계측된다. 일부 구현예에서, 바이오마커의 단백질 발현 수준은 종양 세포에서 계측된다. 일부 구현예에서, 바이오마커의 단백질 발현 수준은 종양-침윤 면역 세포에서 그리고/또는 종양 세포에서 계측된다. 일부 구현예에서, 바이오마커의 단백질 발현 수준은 말초 혈액 단핵 세포 (PBMC)에서 계측된다.
특정 구현예에서, 샘플 내 바이오마커 단백질의 존재 및/또는 발현 수준/양은 IHC 및 염색 프로토콜을 사용하여 측정될 수 있다. 조직 절편의 IHC 염색이 샘플에서 단백질의 존재를 계측하거나 검출하는 신뢰할 만한 방법임이 밝혀진 바 있다. 임의의 방법, 검정 및/또는 키트의 일부 구현예에서, 바이오마커는 하기 유전자의 단백질 발현 생성물 중 하나 이상이다: CD8A, CD8B, EOMES, GZMA, GZMB, IFNG, PRF1, CXCL9, CXCL10, CXCL11, CXCL13, KLRK1, SLAMF7, CX3CR1, CCL2, CCL5, CCR5, CX3CL1, CCR7, 및 MHC-I. 일 구현예에서, 바이오마커의 발현 수준은 하기를 포함하는 방법을 사용하여 계측된다: (a) 항체로 샘플 (예컨대 환자로부터 수득된 종양 샘플)의 IHC 분석을 수행하는 단계; 및 (b) 샘플 내 바이오마커의 발현 수준을 계측하는 단계. 일부 구현예에서, IHC 염색 강도는 참조치와 비교하여 계측된다. 일부 구현예에서, 참조는 참조 값이다. 일부 구현예에서, 참조는 참조 샘플 (예를 들어, 대조군 세포주 염색 샘플, 비-암성 환자로부터의 조직 샘플 또는 관심 바이오마커에 대해 음성으로 계측된 종양 샘플)이다.
IHC는 추가의 기술, 예컨대 형태학적 염색 및/또는 동일계내 하이브리드화 (예컨대, FISH)와 조합하여 수행될 수 있다. IHC의 2개의 일반적인 방법이 이용가능하며; 이는 직접 검정 및 간접 검정이다. 제1 검정에 따라서, 항체의 표적 항원으로의 결합이 직접적으로 계측된다. 이와 같은 직접적인 검정은 표지된 시약, 예컨대 형광 태그 또는 효소로 표지된 1차 항체(추가적인 항체 상호작용 없이 가시화될 수 있음)를 사용한다. 전형적인 간접적 검정에서, 비-콘주게이트된 1차 항체는 상기 항원에 결합하고, 이어서 표지된 2차 항체가 상기 1차 항체에 결합한다. 상기 2차 항체가 효소 표지에 콘주게이트된 경우, 발색성 또는 형광성 기질이 첨가되어 항원의 가시화를 제공한다. 신호 증폭은 여러 2차 항체가 상기 1차 항체 상의 상이한 에피토프와 반응할 수 있기 때문에 발생한다.
IHC을 위해 사용되는 상기 1차 및/또는 2차 항체는 전형적으로 검출가능한 모이어티로 표지될 것이다. 일반적으로 다음의 범주로 나뉠 수 있는 수많은 표지가 이용가능하다: (a) 방사성 동위원소, 예컨대 35S, 14C, 1251, 3H, 및 131I; (b) 콜로이드성 금 입자; (c) 형광 표지, 예컨대 비제한적으로, 희토류 킬레이트(유로퓸 킬레이트), 텍사스 레드, 로다민, 플루오레세인, 단실, 리스사민, 엄벨리페론, 파이코크리테린, 파이코시아닌 또는 상업적으로 사용가능한 형광단, 예컨대 SPECTRUM ORANGE7 및 SPECTRUM GREEN7 및/또는 상기의 것들 중 하나 이상의 유도체; (d) 다양한 효소-기질 표지가 이용가능하며, 미국 특허 번호 4,275,149는 이들 중 일부의 고찰을 제공한다. 효소 표지의 예에는 루시퍼라아제(예컨대, 반딧불이 루시퍼라아제 및 세균성 루시퍼라아제; 참고: 예컨대 미국 특허 제4,737,456호), 루시페린, 2,3-디히드로프탈라진디온, 말레이트 데하이드로게나아제, 우레아제, 과산화효소, 예컨대 호스래디쉬 퍼옥시다제(HRPO), 알칼리성 포스파타제, β-갈락토시다아제, 글루코아밀라아제, 라이소자임, 사카라이드 옥시다아제(예컨대, 글루코오스 옥시다아제, 갈락토오스 옥시다아제 및 글루코오스-6-포스페이트 데하이드로게나아제), 헤테로환계 옥시다아제(예컨대 유리카아제 및 잔틴 옥시다아제), 락토퍼록시다아제, 마이크로퍼록시다아제 등이 포함된다.
효소-기질 조합의 예시는 하기를 포함한다: 예를 들어, 수소 퍼옥시다제를 기질로서 갖는 호스래디쉬 퍼옥시다제 (HRPO); 발색성 기질로서 니트로페닐 포스페이트를 갖는 알칼리성 인산가수분해효소 (AP); 발색성 기질 (예컨대, p-니트로페닐-β-D-갈락토시다아제) 또는 형광원성 기질 (예컨대, 4-메틸엄벨리페릴-β-D-갈락토시다아제)를 갖는 β-D-갈락토시다아제 (β-D-Gal). 이들의 일반적인 고찰을 위하여, 예를 들면, 미국 특허 4,275,149 및 4,318,980를 참고한다.
시료는, 예를 들어, 매뉴얼대로, 또는 자동화된 염색 기기 (예컨대, Ventana BenchMark XT 또는 Benchmark ULTRA 기기)를 사용하여 제조될 수 있다. 이렇게 제조된 시료는 장착되어 유리덮개로 덮일 수 있다. 슬라이드 평가가 이후 계측되며, 예를 들어, 본 분야에서 일상적으로 사용되는, 현미경 및 염색 강도 기준을 사용하는 것이 이용될 수 있다. 일 구현예에서, 하기가 이해될 것이다: 종양 유래의 세포 및/또는 조직이 IHC 염색을 사용하여 측정될 경우, 염색은 일반적으로 종양 세포(들) 및/또는 조직에서 계측 또는 평가된다 (샘플 내 존재할 수 있는 기질 또는 주변 조직에 대향하여). 일부 구현예에서, 하기가 이해될 것이다: 종양 유래의 세포 및/또는 조직이 IHC 염색을 사용하여 측정될 경우, 염색은 종양내 또는 종양주변 면역 세포를 포함하는, 종양-침윤 면역 세포 내에서 계측 또는 평가하는 것을 포함한다. 일부 구현예에서, 바이오마커의 존재는 하기로 IHC에 의하여 검출된다: 샘플의 >0%로, 샘플의 적어도 1%, 샘플의 적어도 5%, 샘플의 적어도 10%, 샘플의 적어도 15%, 샘플의 적어도 15%, 샘플의 적어도 20%, 샘플의 적어도 25%, 샘플의 적어도 30%, 샘플의 적어도 35%, 샘플의 적어도 40%, 샘플의 적어도 45%, 샘플의 적어도 50%, 샘플의 적어도 55%, 샘플의 적어도 60%, 샘플의 적어도 65%, 샘플의 적어도 70%, 샘플의 적어도 75%, 샘플의 적어도 80%, 샘플의 적어도 85%, 샘플의 적어도 90%, 샘플의 적어도 95%, 또는 그 이상으로. 샘플은, 예를 들어, 병리학자에 의하여, 또는 자동화 이미지 분석을 사용하여, 본 발명에 공지된 임의의 방법을 사용하여 스코어링될 수 있다.
상기 방법들의 일부 구현예에서, 바이오마커는 진단 항체 (즉, 1차 항체)를 사용하여 면역조직화학에 의해 검출된다. 일부 구현예에서, 진단성 항체는 인간 항원에 특이적으로 결합한다. 일부 구현예에서, 진단성 항체는 비-인간 항체이다. 일부 구현예에서, 진단성 항체는 랫트, 마우스, 또는 토끼 항체이다. 일부 구현예에서, 진단성 항체는 토끼 항체이다. 일부 구현예에서, 진단성 항체는 단클론성 항체이다. 일부 구현예에서, 진단성 항체는 직접적으로 표지된다. 기타 구현예에서, 진단성 항체는 간접적으로 표지된다.
선행 방법 중 임의의 것의 기타 구현예에서, 바이오마커의 발현 수준은 핵산 발현 수준 (예를 들어, DNA 발현 수준 또는 RNA 발현 수준 (예를 들어, mRNA 발현 수준))일 수 있다. 핵산 발현 수준을 계측하는 임의의 적합한 방법이 사용될 수 있다. 일부 구현예에서, 핵산 발현 수준은 qPCR, rtPCR, RNA-seq, 다중 qPCR 또는 RT-qPCR, 마이크로어레이 분석, 유전자 발현 (SAGE)의 일련 분석, MassARRAY 기술, 동일계내 하이브리드화 (예컨대, FISH), 또는 이의 조합을 사용하여 계측된다.
세포에서 mRNA의 평가를 위한 방법은 잘 알려져 있고 그리고, 예를 들면, 유전자 발현의 일련 분석 (SAGE), 전체 게놈 서열분석 (WGS), 상보적 DNA 프로브를 사용한 하이브리드화 검정 (예컨대 하나 이상의 유전자에 특이적인 표지된 리보프로브를 사용한 동일계내 하이브리드화, 노던 블롯 및 관련된 기술) 및 다양한 핵산 증폭 검정 [예컨대 유전자 중 하나 이상에 특이적인 상보적 프라이머를 사용한 RT-PCR (예컨대, qRT-PCR)], 및 다른 증폭 유형 검출 방법, 예컨대, 예를 들면, 분지형 DNA, SISBA, TMA 등)을 포함한다. 게다가, 이와 같은 방법에는 생물학적 샘플 내 표적 mRNA의 수준을 계측하도록 하는 하나 이상의 단계들(예컨대, 하우스키핑 유전자, 예컨대 액틴 패밀리 구성원의 비교 대조군 mRNA 서열 수준을 동시에 조사함으로써)이 포함될 수 있다. 선택적으로, 상기 증폭된 표적 cDNA의 서열이 계측될 수 있다. 선택적인 방법은 마이크로어레이 기술에 의해 조직 또는 세포 샘플 내에서 mRNA, 예컨대 표적 mRNA를 조사하거나 또는 검출하는 프로토콜을 포함한다. 핵산 마이크로어레이를 사용하여, 시험 및 대조군 조직 샘플로부터 시험 및 대조군 mRNA 샘플이 역전사되고 그리고 표지되어 cDNA 프로브를 생성한다. 상기 프로브는 그런 다음 고형 지지체 상에 고정된 핵산의 배열에 하이브리드화된다. 상기 배열은 배열의 각 구성원의 서열 및 위치를 알 수 있도록 구성된다. 예를 들어, 그의 발현이 PD-L1 축 결합 길항제를 포함하는 치료의 증가된 또는 감소된 임상 이득과 상관되는 유전자의 선택은 고형 지지체 상에 배열되어 질 수 있다. 특정 배열 구성원으로 표지된 프로브의 하이브리드화는 프로브가 유도된 샘플이 그 유전자를 발현한다는 것을 나타낸다.
일부 구현예에서, 본 발명은, 항암 요법의 투여 후 시점에서 환자로부터 수득된 종양 샘플 내 CD8+ T 세포 및/또는 CD68+/CD163+ 대식세포의 수를 계측하는 것, 및 종양 샘플 내 CD8+ T 세포 및/또는 CD68+/CD163+ 대식세포의 수를 참조 샘플과 비교하고, 이로써 항암 요법으로의 치료가 진행중인 환자의 반응을 모니터링하는 것에 의한, VEGF 길항제 (예컨대, 항-VEGF 항체, 예컨대 베바시주맙) 및 PD-L1 축 결합 길항제 (예컨대, PD-L1 결합 길항제, 예컨대 아테졸리주맙)를 포함하는 항암 요법으로 치료된 암 (예컨대, 신장암)을 갖는 환자의 반응을 모니터링하는 방법을 제공한다.
기타 구현예에서, 본 발명은 VEGF 길항제 (예컨대, 항-VEGF 항체, 예컨대 베바시주맙) 및 PD-L1 축 결합 길항제 (예컨대, PD-L1 결합 길항제, 예컨대 아테졸리주맙)를 포함하는 항암 요법으로의 치료로부터 이점을 얻을 공산이 있는, 암 (예컨대, 신장암)을 갖는 환자를 식별하는 방법을 제공하며, 상기 방법은 환자로부터 수득된 종양 샘플 중 CD8+ T 세포 및/또는 CD68+/CD163+ 대식세포의 수를 계측하는 단계, 및 종양 샘플 내 CD8+ T 세포 및/또는 CD68+/CD163+ 대식세포의 수를 참조 샘플과 비교하고, 이로써 항암 요법으로의 치료로부터 이점을 얻을 공산이 있는 환자를 식별하는 단계를 포함한다. 일부 구현예에서, 참조 샘플과 비교하여 종양 내 CD8+ T 세포 및/또는 CD68+/CD163+ 대식세포의 수의 변화 (예컨대, 증가 또는 감소)는 항암 요법으로의 치료로부터 이점을 얻을 공산이 있는 환자를 식별한다. 일부 구현예에서, 변화는 증가이다. 기타 구현예에서, 변화는 감소이다.
또 다른 구현예에서, 본 발명은 암 (예컨대, 신장암)을 진단하거나 예측하는 방법을 제공하며, 상기 방법은 환자로부터 수득된 종양 샘플 내 CD8+ T 세포 및/또는 CD68+/CD163+ 대식세포의 수를 계측하는 단계, 및 종양 샘플 내 CD8+ T 세포 및/또는 CD68+/CD163+ 대식세포의 수를 참조 샘플과 비교하고, 이로써 암을 진단하거나 예측하는 단계를 포함한다. 일부 구현예에서, 참조 샘플과 비교하여 종양 내 CD8+ T 세포 및/또는 CD68+/CD163+ 대식세포의 수의 변화 (예컨대, 증가 또는 감소)는 환자를 진단하고 예측한다. 일부 구현예에서, 변화는 증가이다. 기타 구현예에서, 변화는 감소이다.
추가의 또 다른 구현예에서, 본 발명은 암 (예컨대, 신장암)을 갖는 환자가, VEGF 길항제 (예컨대, 항-VEGF 항체, 예컨대 베바시주맙) 및 PD-L1 축 결합 길항제 (예컨대, PD-L1 결합 길항제, 예컨대 아테졸리주맙)로의 항암 요법으로의 치료에 대하여 반응할 공산이 있는지 여부를 계측하는 방법을 제공하며, 상기 방법은 환자로부터 수득된 종양 샘플 중 CD8+ T 세포 및/또는 CD68+/CD163+ 대식세포의 수를 계측하는 단계, 및 종양 샘플 내 CD8+ T 세포 및/또는 CD68+/CD163+ 대식세포의 수를 참조 샘플과 비교하고, 이로써 항암 요법에 반응할 공산이 있는 환자를 식별하는 단계를 포함한다. 일부 구현예에서, 참조 샘플과 비교하여 종양 내 CD8+ T 세포 및/또는 CD68+/CD163+ 대식세포의 수의 변화 (예컨대, 증가 또는 감소)는 항암 요법으로의 치료에 대하여 반응할 공산이 있는 환자를 식별한다. 일부 구현예에서, 변화는 증가이다. 기타 구현예에서, 변화는 감소이다.
기타 구현예에서, 본 발명은 VEGF 길항제 (예컨대, 항-VEGF 항체, 예컨대 베바시주맙) 및 PD-L1 축 결합 길항제 (예컨대, PD-L1 결합 길항제, 예컨대 아테졸리주맙)를 포함하는 항암 요법의 치료 효능을 최적화하는 방법을 제공하며, 상기 방법은 환자로부터 수득된 종양 샘플 내 CD8+ T 세포 및/또는 CD68+/CD163+ 대식세포의 수를 계측하는 단계 및 종양 샘플 내 CD8+ T 세포 및/또는 CD68+/CD163+ 대식세포의 수를 참조 샘플과 비교하는 단계를 포함하며, 여기서 환자로부터 수득된 종양 샘플 내 CD8+ T 세포 및/또는 CD68+/CD163+ 대식세포의 수를 계측하는 것 및 종양 샘플 내 CD8+ T 세포 및/또는 CD68+/CD163+ 대식세포의 수를 참조 샘플과 비교하는 것은 항암 요법에 반응할 공산이 있는 환자를 식별한다. 일부 구현예에서, 변화는 증가이다. 기타 구현예에서, 변화는 감소이다.
또 다른 추가 구현예에서, 본 발명은 암 (예컨대, 신장암)을 갖는 환자에 대하여 VEGF 길항제 (예컨대, 항-VEGF 항체, 예컨대 베바시주맙) 및 PD-L1 축 결합 길항제 (예컨대, PD-L1 결합 길항제, 예컨대 아테졸리주맙)을 포함하는 항암 요법을 선택하는 방법을 제공하며, 상기 방법은 환자로부터 수득된 종양 샘플 내 CD8+ T 세포 및/또는 CD68+/CD163+ 대식세포의 수를 계측하는 단계, 종양 샘플 내 CD8+ T 세포 및/또는 CD68+/CD163+ 대식세포의 수를 참조 샘플과 비교하는 단계, 및 참조 샘플과 비교하여 종양 샘플 내 CD8+ T 세포 및/또는 CD68+/CD163+ 대식세포의 수를 기준으로 하여 환자에 대하여 VEGF 길항제 및 PD-L1 축 결합 길항제를 포함하는 항암 요법을 선택하는 단계를 포함한다. 일부 구현예에서, 참조 샘플과 비교하여 종양 샘플 내 CD8+ T 세포 및/또는 CD68+/CD163+ 대식세포의 수의 변화는 항암 요법을 선택하기 위하여 사용된다. 일부 구현예에서, 변화는 증가이다. 기타 구현예에서, 변화는 감소이다.
선행 방법 중 임의의 것의 일부 구현예에서, 환자로부터 수득된 종양 샘플은 참조 샘플과 비교하여 증가된 수의 CD8+ T 세포 및/또는 대식세포 (예컨대, CD68+/CD163+ 대식세포) (예컨대, 적어도 약 1.1배, 약 1.2배, 약 1.3배, 약 1.4배, 약 1.5배, 약 1.6배, 약 1.7배, 약 1.8배, 약 1.9배, 약 2배, 약 2.1배, 약 2.2배, 약 2.3배, 약 2.4배, 약 2.5배, 약 2.6배, 약 2.7배, 약 2.8배, 약 2.9배, 약 3배, 약 3.1배, 약 3.2배, 약 3.3배, 약 3.4배, 약 3.5배, 약 3.6배, 약 3.7배, 약 3.8배, 약 3.9배, 약 4배, 약 4.1배, 약 4.2배, 약 4.3배, 약 4.4배, 약 4.5배, 약 4.6배, 약 4.7배, 약 4.8배, 약 4.9배, 약 5배, 약 5.5배, 약 6배, 약 6.5배, 약 7배, 약 7.5배, 약 8배, 약 8.5배, 약 9배, 약 9.5배, 약 10배, 약 11배, 약 12배, 약 13배, 약 14배, 약 15배, 약 16배, 약 17배, 약 18배, 약 19배, 약 20배, 약 30배, 약 40배, 약 50배, 약 100배, 약 500배, 약 1,000배 이상 만큼)를 갖는다.
선행 방법 중 임의의 것의 일부 구현예에서, 환자 유래의 생물학적 샘플은 항암 요법의 투여로부터 약 2 내지 약 10 주 (예컨대, 2, 3, 4, 5, 6, 7, 8, 9, 또는 10 주) 후 수득된다. 일부 구현예에서, 환자 유래의 생물학적 샘플은 항암 요법의 투여로부터 약 4 내지 약 6주 후에 수득된다.
선행 방법 중 임의의 것의 일부 구현예에서, 바이오마커의 발현 수준 또는 수는 하기에서 검출된다: 조직 샘플, 1차 또는 배양 세포 또는 세포주, 세포 상청액, 세포 용해물, 혈소판, 혈청, 혈장, 활액, 림프액, 활막 유체, 여포성 유체, 정액, 양수, 밀크, 전혈, 혈액-유도된 세포, 소변, 뇌척수액, 타액, 가래, 눈물, 땀, 점액, 종양 용해물, 및 조직 배양 배지, 조직 추출물 예컨대 균질화된 조직, 종양 조직, 세포성 추출물, 또는 이의 임의의 조합.
예를 들어, 선행 방법 중 임의의 것의 일부 구현예에서, 바이오마커의 발현 수준은 공지된 기술 (예를 들어, 유세포측정 또는 IHC)을 사용하여 종양-침윤 면역 세포, 종양 세포, PBMC 또는 이들의 조합에서 검출된다. 종양-침윤 면역 세포는 비제한적으로 하기를 포함한다: 종양내 면역 세포, 종양주변 면역 세포 또는 이의 임의의 조합, 및 기타 종양 기질 세포 (예컨대, 섬유아세포). 상기 종양-침윤 면역 세포는, 하기일 수 있다: T 림프구 (예컨대 CD8+ T 림프구 (예컨대, CD8+ T 효과기 (Teff) 세포) 및/또는 CD4+ T 림프구 (예컨대, CD4+ Teff 세포), B 림프구, 또는 과립구 (호중구, 호산구, 호염기구)를 포함하는 기타 골수-계통 세포, 단핵구, 대식세포, 수지상 세포 (예컨대, 지상감입 수지상 세포), 조직구, 및 자연 살해 (NK) 세포. 일부 구현예에서, 바이오마커에 대한 염색은 막 염색, 세포질 염색 또는 이의 조합으로서 검출된다. 기타 구현예에서, 바이오마커의 부재는 참조 샘플과 비교하여 샘플 내 염색의 부재 또는 없음으로서 검출된다.
선행 방법 중 임의의 것의 일부 구현예에서, 환자로부터 수득된 샘플은 조직, 전혈, 혈장, 혈청, 및 이들의 조합으로 이루어진 군으로부터 선택될 수 있다. 일부 구현예에서, 샘플은 조직 샘플이다. 일부 구현예에서, 조직 샘플은 종양 샘플이다. 일부 구현예에서, 종양 샘플은 종양-침윤 면역 세포, 종양 세포, 기질 세포, 또는 이들의 임의의 조합을 포함한다. 선행 구현예 중 임의의 것에서, 종양 샘플은 포르말린-고정 및 파라핀-포매(FFPE) 종양 샘플, 보관 종양 샘플, 신선한 종양 샘플, 또는 동결된 종양 샘플일 수 있다.
선행 방법 중 임의의 것의 특정 구현예에서, 바이오마커의 발현 수준은 암 세포를 함유하거나 상기를 함유하는 것으로 의심되는 생물학적 샘플 내에서 평가된다. 샘플은 예를 들어 조직 생검, 또는 암 (예컨대, 신장암, 특히 신장 세포 암종)으로 앓거나, 상기를 앓는 것으로 의심되거나 상기로 진단받은 환자로부터 수득된 전이성 병변일 수 있다. 일부 구현예에서, 샘플은 순환 암 세포, 예컨대, 신장암 세포를 포함하는 것으로 공지되거나 의심되는 신장 조직의 샘플, 신장 종양의 생검, 공지되거나 의심되는 전이성 신장암 병변 또는 절편, 또는 혈액 샘플, 예컨대, 말초 혈액 샘플이다. 샘플은 암 세포, 즉 종양 세포 및 비-암성 세포 (예컨대, 림프구, 예컨대 T 세포 또는 NK 세포) 둘 모두를 포함할 수 있으며, 그리고 특정 구현예에서, 암성 및 비-암성 세포 둘 모두를 포함한다. 조직 절제, 생검, 및 체액, 예를 들면, 암/종양 세포를 포함하는 혈액 샘플을 포함하는 생물학적 샘플을 수득하는 방법은 당해 기술에 공지되어 있다.
선행 방법 중 임의의 것의 일부 구현예에서, 환자로부터 수득된 샘플은 항암 요법, 예를 들어, 암의 치료 또는 이의 증상의 관리 또는 완화를 위한 요법의 시작 후 수집된다. 따라서, 일부 구현예에서, 샘플은 화학치료제의 투여 또는 화학요법 레지멘의 시작 후에 수집된다.
선행 방법 중 임의의 것의 일부 구현예에서, 환자는 하기를 갖는다: 암종, 림프종, 아세포종 (수아세포종 및 망막아세포종 포함), 육종 (지방육종 및 활막 세포 육종 포함), 신경내분비 종양 (카르시노이드 종양, 가스트린종, 및 소도 세포 암 포함), 중피종, 신경집종 (청신경종 포함), 수막종, 선암종, 흑색종, 및 백혈병 또는 림프양 악성종양. 일부 구현예에서, 암은 신장암 (예를 들어, 신장 세포 암종 (RCC), 예를 들어 전이성 RCC), 편평상피 세포 암 (예를 들어, 상피성 편평상피 세포 암), 폐암 (소세포 폐암 (SCLC), 비-소세포 폐암 (NSCLC), 폐의 선암종 및 폐의 편평상피 암종), 복막 암, 간세포 암, 위장 암을 포함하는 위장암 또는 위암, 췌장암, 교모세포종, 자궁경부암, 난소암, 간암, 간종양, 유방암 (전이성 유방암 포함), 방광암, 결장암, 직장암, 결장직장암, 자궁 내막 또는 자궁 암종, 타액샘 암종, 전립선 암, 외음부 암, 갑상선암, 간 암종, 항문 암종, 음경 암종, 머켈 세포 암, 균상식육종(mycoses fungoids), 고환암, 식도암, 담관 종양, 두경부암, B-세포 림프종 (저등급/여포성 비-호지킨 림프종 (NHL); 소 림프구성 (SL) NHL; 중급/여포성 NHL; 중급 확산 NHL; 고급 면역아세포성 NHL; 고급 림프아구성 NHL; 고급 소형 비-절단 세포 NHL; 거대 질환 NHL; 맨틀 세포 림프종; AIDS-관련 림프종; 및 발덴스트롬(Waldenstrom) 거대글로불린혈증); 만성 림프구성 백혈병 (CLL); 급성 림프아구성 백혈병 (ALL); 모발 세포 백혈병; 만성 골수아세포 백혈병; 이식 후 림프증식성 장애 (PTLD), 모반증과 관련된 비정상 혈관 증식, 부종 (예컨대, 뇌종양과 관련된 것) 또는 메이그스(Meigs) 증후군이다. 바람직한 구현예에서, 환자는 신장암 (예컨대, RCC, 예컨대, mRCC)을 갖는다. 환자는 선택적으로 진행성, 난치성, 재발성, 화학요법-내성 및/또는 백금-내성 형태의 암을 가질 수 있다.
특정 구현예에서, 제1 샘플에서 바이오마커의 존재 및/또는 발현 수준/양은 제2 샘플에서 존재/부재 및/또는 발현 수준/양에 비교될 때 증가되거나 또는 상승되었다. 특정 구현예에서, 제1 샘플에서 바이오마커의 존재/부재 및/또는 발현 수준/양은 제2 샘플에서 존재 및/또는 발현 수준/양에 비교될 때 감소되거나 또는 줄었다. 특정 구현예에서, 제2 샘플은 참조 샘플, 참조 세포, 참조 조직, 대조군 샘플, 대조군 세포, 또는 대조군 조직이다.
특정 구현예에서, 참조 샘플, 참조 세포, 참조 조직, 대조군 샘플, 대조군 세포, 또는 대조군 조직은 시험 샘플이 수득될 때보다 하나 이상의 상이한 시점에서 수득된 동일한 환자 또는 개체로부터 단일 샘플 또는 합치된 다중 샘플이다. 예를 들어, 참조 샘플, 참조 세포, 참조 조직, 대조군 샘플, 대조군 세포, 또는 대조군 조직은 시험 샘플이 수득될 때보다 동일한 환자 또는 개체로부터 조기 시점에서 수득된다. 이러한 참조 샘플, 참조 세포, 참조 조직, 대조군 샘플, 대조군 세포, 또는 대조군 조직은 만일 참조 샘플이 암의 초기 진단 동안 수득되고 그리고 시험 샘플은 암이 전이성이 된 때 나중에 수득되면 유용할 수 있다.
특정 구현예에서, 참조 샘플, 참조 세포, 참조 조직, 대조군 샘플, 대조군 세포, 또는 대조군 조직은 환자가 아닌 하나 이상의 건강한 개체 유래의 조합된 다중 샘플이다. 특정 구현예에서, 참조 샘플, 참조 세포, 참조 조직, 대조군 샘플, 대조군 세포, 또는 대조군 조직은 상기 환자 또는 개체가 아닌 질환 또는 장애 (예를 들면, 암)를 갖는 하나 이상의 개체 유래의 조합된 다중 샘플이다. 특정 구현예에서, 참조 샘플, 참조 세포, 참조 조직, 대조군 샘플, 대조군 세포, 또는 대조군 조직은 환자가 아닌 하나 이상의 개인으로부터 정상 조직 또는 풀링된 혈장 또는 혈청 샘플로부터 풀링된 RNA 샘플이다. 특정 구현예에서, 참조 샘플, 참조 세포, 참조 조직, 대조군 샘플, 대조군 세포, 또는 대조군 조직은 환자가 아닌 질환 또는 장애 (예를 들면, 암)를 갖는 하나 이상의 개인으로부터 종양 조직 또는 풀링된 플라즈마 또는 혈청 샘플로부터 풀링된 RNA 샘플이다.
선행 방법 중 임의의 것의 일부 구현예에서, 상승된 또는 증가된 발현 또는 수는 참조 샘플, 참조 세포, 참조 조직, 대조군 샘플, 대조군 세포, 또는 대조군 조직과 비교하여 본원에 기술되고/되거나 본 분야에 공지된 방법의 표준 기술에 의해 검출된, 바이오마커 (예를 들면, 단백질, 핵산 (예를 들면, 유전자 또는 mRNA) 또는 세포)의 수준 또는 수에서의 약 임의의 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95%, 96%, 97%, 98%, 99% 이상의 전체 증가를 지칭한다. 특정 구현예에서, 상승된 발현 또는 수는 샘플 내 바이오마커의 발현 수준/양의 증가를 지칭하며, 상기 증가는 참조 샘플, 참조 세포, 참조 조직, 대조군 샘플, 대조군 세포, 또는 대조군 조직내 각각의 바이오마커의 발현 수준/양의 적어도 약 1.1×, 1.2×, 1.3×, 1.4×, 1.5×, 1.6×, 1.7×, 1.8×, 1.9×, 2×, 2.1×, 2.2×, 2.3×, 2.4×, 2.5×, 2.6×, 2.7×, 2.8×, 2.9×, 3×, 3.5×, 4×, 4.5×, 5×, 6×, 7×, 8×, 9×, 10×, 15×, 20×, 30×, 40×, 50×, 100×, 500×, 또는 1000× 중 임의의 것이다. 일부 구현예에서, 상승된 발현 또는 수는 참조 샘플, 참조 세포, 참조 조직, 대조군 샘플, 대조군 세포, 대조군 조직 또는 내부 대조군(예를 들어, 하우스키핑 유전자)와 비교하여 약 1.1배, 약 1.2배, 약 1.3배, 약 1.4배, 약 1.5배, 약 1.6배, 약 1.7배 약 1.8배, 약 1.9배, 약 2배, 약 2.1배, 약 2.2배, 약 2.3배, 약 2.4배, 약 2.5배, 약 2.6배, 약 2.7배 약 2.8배, 약 2.9배, 약 3배, 약 3.5배, 약 4배, 약 4.5배, 약 5배, 약 6배, 약 7배, 약 8배 약 9배, 약 10배, 약 15배, 약 20배, 약 30배, 약 40배, 약 50배, 약 100배, 약 500배, 약 1,000배 또는 그 초과 이상의 전체 증가를 지칭한다.
선행 방법 중 임의의 것의 일부 구현예에서, 감소된 발현 또는 수는 참조 샘플, 참조 세포, 참조 조직, 대조군 샘플, 대조군 세포, 또는 대조군 조직에 비교될 때 본 명세서에서 기재된 것과 같은 공지된 방법의 표준 기술에 의해 검출된, 바이오마커 (예를 들면, 단백질, 핵산 (예를 들면, 유전자 또는 mRNA) 또는 세포)의 수준에서 약 임의의 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95%, 96%, 97%, 98%, 99% 이상의 전체 감소를 지칭한다. 특정 구현예에서, 감소된 발현 또는 수는 바이오마커의 발현 수준/양에서의 감소를 지칭하고 여기서 상기 감소는 참조 샘플, 참조 세포, 참조 조직, 대조군 샘플, 대조군 세포, 또는 대조군 조직에서 각각의 바이오마커의 적어도 약 임의의 0.9×, 0.8× 0.7×, 0.6×, 0.5×, 0.4×, 0.3×, 0.2×, 0.1×, 0.05×, 또는 0.01× 발현 수준/양이다. 일부 구현예에서, VEGF 길항제 및 PD-L1 축 결합 길항제를 포함하는 항암 요법의 투여 후 상기 열거된 바이오마커의 감소된 발현 수준은, 상기 환자가 항암 요법에 적절하게 반응하지 않는다는 것을 표지한다.
B. 치료 방법
본 발명은 또한 암 (예컨대, 신장암, 예컨대 RCC, 예컨대, mRCC)을 갖는 환자를 치료하기 위한 방법을 제공한다. 일부 경우에서, 본 발명의 방법은 본 발명의 바이오마커의 발현 수준에 기반하여 VEGF 길항제 및 PD-L1 축 결합 길항제를 포함하는 항암 요법을 환자에게 투여하는 단계를 포함한다. 본원에 공지되거나, 본원에 기술된 (예컨대, "조성물" 또는 실시예" 섹션 내 기술된) VEGF 길항제, PD-L1 축 결합 길항제, 또는 기타 항암제 중 임의의 것이 본 방법에서 사용될 수 있다.
일부 경우에서, 상기 방법은, 항암 요법의 투여 후 시점에서 환자로부터 수득된 생물학적 샘플 내 바이오마커 (예컨대, 면역학적 바이오마커, 예컨대 표 2에 열거된 바이오마커)의 존재 및/또는 발현 수준을 계측하는 단계, 생물학적 샘플 내 유전자 중 하나 이상의 발현 수준을 참조 수준과 비교하는 단계, 및 상기 발현 수준이 상기 발현 수준과 비교될 경우 환자에게 항암 요법의 투여를 계속하는 단계를 포함한다. 유전자 발현 수준은 본 명세서에 기재된 또는 당해 분야에 공지된 방법 중 임의의 방법을 사용하여 결정 또는 비교될 수 있다. 본 발명은 추가로, VEGF 길항제 (예컨대, 항-VEGF 항체, 예컨대 베바시주맙) 및 PD-L1 축 결합 길항제 (예컨대, PD-L1 결합 길항제, 예컨대 아테졸리주맙)를 포함하는 항암 요법의 투여에 의한, 신장암 (예컨대, RCC, 예컨대, mRCC)을 앓는 환자의 무진행 생존 (PFS) 및/또는 전체 생존 (OS)을 개선하는 방법에 관한 것이다. 본 명세서에 기재된 임의의 바이오마커의 발현 수준 또는 수는 당해 분야에 공지된, 및/또는 본 명세서에, 예를 들어 상기 섹션 A 및/또는 연구 실시예에 기재된 임의의 방법을 사용하여 계측될 수 있다.
일부 구현예에서, 본 발명은, 환자로부터 수득된 생물학적 샘플 내 CD8A, CD8B, EOMES, GZMA, GZMB, IFNG, PRF1, CXCL9, CXCL10, CXCL11, CXCL13, KLRK1, SLAMF7 중 하나 이상 (예컨대, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 또는 13개)의 발현 수준을 계측하는 것, CD8A, CD8B, EOMES, GZMA, GZMB, IFNG, PRF1, CXCL9, CXCL10, CXCL11, CXCL13, KLRK1, SLAMF7 중 하나 이상의 발현 수준을 참조 수준과 비교하는 것, 및 상기 하나 이상의 유전자의 발현 수준이 참조 수준과 비교하여 환자 샘플 내에서 변화(예컨대, 증가되거나 감소)될 경우, 환자에게 항암 요법을 투여하는 것에 의한, VEGF 길항제 (예컨대, 항-VEGF 항체, 예컨대 베바시주맙) 및 PD-L1 축 결합 길항제 (예컨대, PD-L1 결합 길항제, 예컨대 아테졸리주맙)를 포함하는 항암 요법으로 암 (예컨대, 신장암)을 갖는 환자를 치료하는 방법을 제공한다. 일부 구현예에서, 항암 요법은 하나 이상의 유전자의 발현 수준이 참조 수준과 비교하여 증가될 경우 환자에게 투여된다.
기타 구현예에서, 본 발명은, 환자로부터 수득된 생물학적 샘플 내 CD8A, CD8B, EOMES, GZMA, GZMB, IFNG, PRF1, CXCL9, CXCL10, CXCL11, CXCL13, KLRK1, SLAMF7 중 하나 이상 (예컨대, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 또는 13개)의 발현 수준을 항암 요법의 투여 후 시점에서 계측하는 것, 및 CD8A, CD8B, EOMES, GZMA, GZMB, IFNG, PRF1, CXCL9, CXCL10, CXCL11, CXCL13, KLRK1, SLAMF7 중 하나 이상 (예컨대, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 또는 13개)의 발현 수준을 참조 수준과 비교하는 것, 및 상기 하나 이상의 유전자의 발현 수준이 참조 수준과 비교하여 증가될 경우, 환자에게 항암 요법의 투여를 계속하는 것에 의한, VEGF 길항제 (예컨대, 항-VEGF 항체, 예컨대 베바시주맙) 및 PD-L1 축 결합 길항제 (예컨대, PD-L1 결합 길항제, 예컨대 아테졸리주맙)를 포함하는 항암 요법으로 암 (예컨대, 신장암)을 갖는 환자를 치료하는 방법을 제공한다.
특정 구현예에서, CD8A, CD8B, EOMES, GZMA, GZMB, IFNG, 또는 PRF1 중 하나 이상 (예컨대, 1, 2, 3, 4, 5, 6 또는 7개)의 발현 수준이 계측된다. 일부 구현예에서, CD8A, CD8B, EOMES, GZMA, GZMB, IFNG, 또는 PRF1 중 하나 이상 (예컨대, 1, 2, 3, 4, 5, 6, 또는 7개)의 발현 수준은 종양 미세환경 내 CD8+ Teff 세포의 존재와 상관관계가 있다. 일부 구현예에서, CXCL9, CXCL10, CXCL11, 또는 CXCL13 중 하나 이상 (1, 2, 3 또는 4개)의 발현 수준이 계측된다. 일부 구현예에서, CXCL9, CXCL10, CXCL11, 또는 CXCL13 중 하나 이상(1, 2, 3, 또는 4개)의 발현 수준은 종양 미세환경 내 Th1 케모카인의 존재와 상관관계가 있다. 일부 구현예에서, GZMB, KLRK1, 또는 SLAMF7 중 하나 이상 (예컨대, 1, 2 또는 3개)의 존재가 계측된다. 일부 구현예에서, GZMB, KLRK1, 또는 SLAMF7의 하나 이상 (예컨대, 1, 2, 또는 3개)의 존재는 종양 미세환경에서 자연 살해(NK) 세포의 존재와 상관관계가 있다.
특정 구현예에서, CD8A, CD8B, EOMES, GZMA, GZMB, IFNG, 또는 PRF1 중 하나 이상 (예컨대, 1, 2, 3, 4, 5, 6 또는 7개)의 발현 수준이 계측된다. 일부 구현예에서, CD8A, CD8B, EOMES, GZMA, GZMB, IFNG, 또는 PRF1 중 적어도 2개, 적어도 3개, 적어도 4개, 적어도 5개, 또는 적어도 6개의 발현 수준이 계측된다. 일부 구현예에서, CD8A, CD8B, EOMES, GZMA, GZMB, IFNG, 및 PRF1의 발현 수준이 계측된다. 일부 구현예에서, CD8A의 수준은 참조 수준과 비교하여 약 1배 내지 약 60배 (예를 들어, 약 1배, 약 2배, 약 3배, 약 4배, 약 5배, 약 10배, 약 15배, 약 17배, 약 20배, 약 25배, 약 30배, 약 35배, 약 40배, 약 45배, 약 50배, 약 55배, 약 60배, 또는 약 1배 내지 약 50배) 증가된다. 일부 구현예에서, CD8A의 수준은 참조 수준과 비교하여 약 50배 이상 (예컨대, 약 50배, 100배, 200배, 250배, 500배, 1000배 이상) 증가된다. 일부 구현예에서, CD8B의 수준은 참조 수준과 비교하여 약 1배 내지 약 60배 (예를 들어, 약 1배, 약 2배, 약 3배, 약 4배, 약 5배, 약 10배, 약 15배, 약 17배, 약 20배, 약 25배, 약 30배, 약 35배, 약 40배, 약 45배, 약 50배, 약 55배, 약 60배, 또는 약 1배 내지 약 50배) 증가된다. 일부 구현예에서, CD8B의 수준은 참조 수준과 비교하여 약 50배 이상 (예컨대, 약 50배, 100배, 200배, 250배, 500배, 1000배 이상) 증가된다. 일부 구현예에서, 의 수준은 참조 수준과 비교하여 약 1배 내지 약 60배 (예를 들어, 약 1배, 약 2배, 약 3배, 약 4배, 약 5배, 약 10배, 약 15배, 약 17배, 약 20배, 약 25배, 약 30배, 약 35배, 약 40배, 약 45배, 약 50배, 약 55배, 약 60배, 또는 약 1배 내지 약 50배) 증가된다. 일부 구현예에서, EOMES의 수준은 참조 수준과 비교하여 약 50배 이상 (예컨대, 약 50배, 100배, 200배, 250배, 500배, 1000배 이상) 증가된다. 일부 구현예에서, GZMA의 수준은 참조 수준과 비교하여 약 1배 내지 약 60배 (예를 들어, 약 1배, 약 2배, 약 3배, 약 4배, 약 5배, 약 10배, 약 15배, 약 17배, 약 20배, 약 25배, 약 30배, 약 35배, 약 40배, 약 45배, 약 50배, 약 55배, 약 60배, 또는 약 1배 내지 약 50배) 증가된다. 일부 구현예에서, GZMA의 수준은 참조 수준과 비교하여 약 50배 이상 (예컨대, 약 50배, 100배, 200배, 250배, 500배, 1000배 이상) 증가된다. 일부 구현예에서, GZMB의 수준은 참조 수준과 비교하여 약 1배 내지 약 60배 (예를 들어, 약 1배, 약 2배, 약 3배, 약 4배, 약 5배, 약 10배, 약 15배, 약 17배, 약 20배, 약 25배, 약 30배, 약 35배, 약 40배, 약 45배, 약 50배, 약 55배, 약 60배, 또는 약 1배 내지 약 50배) 증가된다. 일부 구현예에서, GZMB의 수준은 참조 수준과 비교하여 약 50배 이상 (예컨대, 약 50배, 100배, 200배, 250배, 500배, 1000배 이상) 증가된다. 일부 구현예에서, IFNG의 수준은 참조 수준과 비교하여 약 1배 내지 약 60배 (예를 들어, 약 1배, 약 2배, 약 3배, 약 4배, 약 5배, 약 10배, 약 15배, 약 17배, 약 20배, 약 25배, 약 30배, 약 35배, 약 40배, 약 45배, 약 50배, 약 55배, 약 60배, 또는 약 1배 내지 약 50배) 증가된다. 일부 구현예에서, IFNG의 수준은 참조 수준과 비교하여 약 50배 이상 (예컨대, 약 50배, 100배, 200배, 250배, 500배, 1000배 이상) 증가된다. 일부 구현예에서, PRF1의 수준은 참조 수준과 비교하여 약 1배 내지 약 60배 (예를 들어, 약 1배, 약 2배, 약 3배, 약 4배, 약 5배, 약 10배, 약 15배, 약 17배, 약 20배, 약 25배, 약 30배, 약 35배, 약 40배, 약 45배, 약 50배, 약 55배, 약 60배, 또는 약 1배 내지 약 50배) 증가된다. 일부 구현예에서, PRF1의 수준은 참조 수준과 비교하여 약 50배 이상 (예컨대, 약 50배, 100배, 200배, 250배, 500배, 1000배 이상) 증가된다.
일부 구현예에서, CXCL9, CXCL10, CXCL11, 또는 CXCL13 중 하나 이상 (예컨대, 1, 2, 3, 또는 4개)의 발현 수준이 계측된다. 일부 구현예에서, CXCL9, CXCL10, CXCL11, 또는 CXCL13 중 적어도 2개 또는 적어도 3개의 발현 수준이 계측된다. 일부 구현예에서, CXCL9, CXCL10, CXCL11, 및 CXCL13의 발현 수준이 계측된다. 일부 구현예에서, CXCL9의 수준은 참조 수준과 비교하여 약 1배 내지 약 300배 (예컨대, 약 1배, 약 2배, 약 3배, 약 4배, 약 5배, 약 10배, 약 20배, 약 30배, 약 50배, 약 60배, 약 70배, 약 80배, 약 90배, 약 100배, 약 150배, 약 200배, 약 250배, 약 3배 내지 약 250배, 또는 약 1배 내지 약 80배) 증가된다. 일부 구현예에서, CXCL9의 수준은 참조 수준과 비교하여 약 50배 이상 (예컨대, 약 50배, 80배, 100배, 150배, 200배, 250배, 1000배 이상) 증가된다. 일부 구현예에서, CXCL10의 수준은 참조 수준과 비교하여 약 1배 내지 약 300배 (예컨대, 약 1배, 약 2배, 약 3배, 약 4배, 약 5배, 약 10배, 약 20배, 약 30배, 약 50배, 약 60배, 약 70배, 약 80배, 약 90배, 약 100배, 약 150배, 약 200배, 약 250배, 약 3배 내지 약 250배, 또는 약 1배 내지 약 80배) 증가된다. 일부 구현예에서, CXCL10의 수준은 참조 수준과 비교하여 약 50배 이상 (예컨대, 약 50배, 80배, 100배, 150배, 200배, 250배, 1000배 이상) 증가된다. 일부 구현예에서, CXCL11의 수준은 참조 수준과 비교하여 약 1배 내지 약 300배 (예컨대, 약 1배, 약 2배, 약 3배, 약 4배, 약 5배, 약 10배, 약 20배, 약 30배, 약 50배, 약 60배, 약 70배, 약 80배, 약 90배, 약 100배, 약 150배, 약 200배, 약 250배, 약 3배 내지 약 250배, 또는 약 1배 내지 약 80배) 증가된다. 일부 구현예에서, CXCL11의 수준은 참조 수준과 비교하여 약 50배 이상 (예컨대, 약 50배, 80배, 100배, 150배, 200배, 250배, 1000배 이상) 증가된다. 일부 구현예에서, CXCL13의 수준은 참조 수준과 비교하여 약 1배 내지 약 300배 (예컨대, 약 1배, 약 2배, 약 3배, 약 4배, 약 5배, 약 10배, 약 20배, 약 30배, 약 50배, 약 60배, 약 70배, 약 80배, 약 90배, 약 100배, 약 150배, 약 200배, 약 250배, 약 3배 내지 약 250배, 또는 약 1배 내지 약 80배) 증가된다. 일부 구현예에서, CXCL13의 수준은 참조 수준과 비교하여 약 50배 이상 (예컨대, 약 50배, 80배, 100배, 150배, 200배, 250배, 1000배 이상) 증가된다.
일부 구현예에서, GZMB, KLRK1, 또는 SLAMF7 중 하나 이상 (예컨대, 1, 2, 또는 3개)의 발현 수준이 계측된다. 일부 구현예에서, GZMB, KLRK1, 또는 SLAMF7 중 적어도 2개의 발현 수준이 계측된다. 일부 구현예에서, GZMB, KLRK1, 및 SLAMF7의 발현 수준이 계측된다. 일부 구현예에서, GZMB의 수준은 참조 수준과 비교하여 약 1배 내지 약 20배 (예컨대, 약 1배, 약 2배, 약 3배, 약 4배, 약 5배, 약 6배, 약 7배, 약 8배, 약 9배, 약 10배, 약 12배, 약 13배, 약 15배, 약 20배, 약 1배 내지 약 8배, 또는 약 1배 내지 약 13배) 증가된다. 일부 구현예에서, GZMB의 수준은 참조 수준과 비교하여 약 8배 이상 (예컨대, 약 8배, 9배, 10배, 13배, 15배, 20배, 50배, 100배, 1000배 이상) 증가된다. 일부 구현예에서, KLRK1의 수준은 참조 수준과 비교하여 약 1배 내지 약 20배 (예컨대, 약 1배, 약 2배, 약 3배, 약 4배, 약 5배, 약 6배, 약 7배, 약 8배, 약 9배, 약 10배, 약 12배, 약 13배, 약 15배, 약 20배, 약 1배 내지 약 8배, 또는 약 1배 내지 약 13배) 증가된다. 일부 구현예에서, KLRK1의 수준은 참조 수준과 비교하여 약 8배 이상 (예컨대, 약 8배, 9배, 10배, 13배, 15배, 20배, 50배, 100배, 1000배 이상) 증가된다. 일부 구현예에서, SLAMF7의 수준은 참조 수준과 비교하여 약 1배 내지 약 20배 (예컨대, 약 1배, 약 2배, 약 3배, 약 4배, 약 5배, 약 6배, 약 7배, 약 8배, 약 9배, 약 10배, 약 12배, 약 13배, 약 15배, 약 20배, 약 1배 내지 약 8배, 또는 약 1배 내지 약 13배) 증가된다. 일부 구현예에서, SLAMF7의 수준은 참조 수준과 비교하여 약 8배 이상 (예컨대, 약 8배, 9배, 10배, 13배, 15배, 20배, 50배, 100배, 1000배 이상) 증가된다.
일부 구현예에서, 환자로부터 수득된 생물학적 샘플 중 CD8A, CD8B, EOMES, GZMA, GZMB, IFNG, PRF1, CXCL9, CXCL10, CXCL11, CXCL13, KLRK1 및/또는 SLAMF7 중 하나 이상의 (예를 들어, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 또는 13) 발현 수준은 참조 수준과 비교하여 (예를 들어, 약 1.1배, 약 1.2배, 약 1.3배, 약 1.4배, 약 1.5배, 약 1.6배, 약 1.7배, 약 1.8배, 약 1.9배, 약 2배, 약 2.1배, 약 2.2배, 약 2.3배, 약 2.4배, 약 2.5배, 약 3배, 약 3.5배, 약 4배, 약 4.5배, 약 5배, 약 5.5배, 약 6배, 약 6.5배, 약 7배, 약 7.5배, 약 8배, 약 8.5배, 약 9배, 약 9.5배, 약 10배, 약 11배, 약 12배, 약 13배, 약 14배, 약 15배, 약 16배, 약 17배, 약 18배, 약 19배, 약 20배, 약 30배, 약 40배, 약 50배, 약 100배, 약 500배, 약 1,000배 또는 그 초과) 증가된다.
일부 구현예에서, 참조 수준은 항암 요법의 투여 이전 (예컨대, 수분, 수시간, 수일, 수주 (예컨대, 1, 2, 3, 4, 5, 6, 또는 7주), 수개월, 또는 수년 이전) 수득된 환자 유래의 생물학적 샘플 내 하나 이상의 유전자 (예컨대, CD8A, CD8B, EOMES, GZMA, GZMB, IFNG, PRF1, CXCL9, CXCL10, CXCL11, CXCL13, KLRK1, 및/또는 SLAMF7)의 발현 수준이다. 특정 구현예에서, 참조 수준은 참조 집단에서 하나 이상의 유전자의 발현 수준이다. 특정 구현예에서, 참조 수준은 하나 이상의 유전자에 대한 사전-할당된 발현 수준이다. 일부 구현예에서, 참조 수준은 사전 시점에서 환자로부터 수득된 생물학적 샘플 내 하나 이상의 유전자의 발현 수준이며, 여기서 상기 사전 시점은 항암 요법의 투여 후의 시점이다. 기타 구현예에서, 참조 수준은 후속 시점에서의 (예컨대, 항암 요법의 투여로부터 수분, 수시간, 수일, 수주, 수개월, 또는 수년 후의) 환자로부터 수득된 생물학적 샘플 내 하나 이상의 유전자의 발현 수준이다.
일부 구현예에서, 본 발명은 암 (예컨대, 신장암)을 갖는 환자를 치료하는 방법을 제공하며, 상기 방법은 일 시점에서 환자로부터 수득된 생물학적 샘플 (예컨대, 종양 샘플) 내 MHC-I의 발현 수준을 계측하는 단계, MHC-I의 발현 수준을 참조 수준과 비교하는 단계, 및 MHC-I의 발현 수준이 참조 수준과 비교하여 환자 샘플 내에서 변화될(예컨대, 증가되거나 감소될) 경우 환자에게 항암 요법을 투여하는 단계를 포함한다. 일부 구현예에서, 항암 요법은, MHC-I의 발현 수준이 참조 수준과 비교하여 환자 샘플 내에서 증가될 경우 환자에게 투여된다.
일부 구현예에서, 본 발명은 암 (예컨대, 신장암)을 갖는 환자를 치료하는 방법을 제공하며, 상기 방법은 항암 요법의 투여 후 시점에서 환자로부터 수득된 생물학적 샘플 (예컨대, 종양 샘플) 내 MHC-I의 발현 수준을 계측하는 단계, MHC-I의 발현 수준을 참조 수준과 비교하는 단계, 및 MHC-I의 발현 수준이 증가될 경우 환자에게 항암 요법의 투여를 지속하는 단계를 포함한다. 일부 구현예에서, 참조 수준은 항암 요법의 투여 이전 (예컨대, 수분, 수시간, 수일, 수주 (예컨대, 1, 2, 3, 4, 5, 6, 또는 7주), 수개월, 또는 수년 이전) 수득된 환자 유래의 생물학적 샘플 내 MHC-I의 발현 수준이다. 기타 구현예에서, 참조 수준은 참조 집단에서 MHC-I 발현 수준이다. 기타 구현예에서, 참조 수준은 MHC-I에 대해 사전-할당된 발현 수준이다. 기타 구현예에서, 참조 수준은 사전 시점에서 환자로부터 수득된 생물학적 샘플 내 MHC-I의 발현 수준이며, 여기서 상기 사전 시점은 항암 요법의 투여 후의 시점이다. 기타 구현예에서, 참조 수준은 후속 시점에서의 (예컨대, 항암 요법의 투여로부터 수분, 수시간, 수일, 수주, 수개월, 또는 수년 후의) 환자로부터 수득된 생물학적 샘플 내 MHC-I의 발현 수준이다.
일부 구현예에서, MHC-I의 발현 수준은 참조 수준과 비교하여 (예컨대, 약 1.1배, 약 1.2배, 약 1.3배, 약 1.4배, 약 1.5배, 약 1.6배, 약 1.7배, 약 1.8배, 약 1.9배, 약 2배, 약 2.1배, 약 2.2배, 약 2.3배, 약 2.4배, 약 2.5배, 약 2.6배, 약 2.7배, 약 2.8배, 약 2.9배, 약 3배, 약 3.1배, 약 3.2배, 약 3.3배, 약 3.4배, 약 3.5배, 약 3.6배, 약 3.7배, 약 3.8배, 약 3.9배, 약 4배, 약 4.1배, 약 4.2배, 약 4.3배, 약 4.4배, 약 4.5배, 약 4.6배, 약 4.7배, 약 4.8배, 약 4.9배, 약 5배, 약 5.5배, 약 6배, 약 6.5배, 약 7배, 약 7.5배, 약 8배, 약 8.5배, 약 9배, 약 9.5배, 약 10배, 약 11배, 약 12배, 약 13배, 약 14배, 약 15배, 약 16배, 약 17배, 약 18배, 약 19배, 약 20배, 약 30배, 약 40배, 약 50배, 약 100배, 약 500배, 약 1,000배 이상) 증가된다. 일부 구현예에서, MHC-I의 발현 수준은 참조 수준과 비교하여 적어도 2배 증가된다.
일부 구현예에서, 본 발명은 암 환자 (예컨대, 신장암)을 치료하는 방법을 제공하며, 상기 방법은 환자로부터 수득된 생물학적 샘플 내 CX3CR1, CCL2, CCL5, CCR7, CX3CL1, CCR7, 또는 CXCL10의 하나 이상 (예컨대, 1, 2, 3, 4, 5, 6, 또는 7개)의 발현 수준을 계측하는 단계, 발현 수준을 참조 수준과 비교하는 단계, 및 발현 수준이 참조 수준과 비교하여 변화 (예컨대, 증가되거나 감소)될 경우 환자에게 항암 요법을 투여하는 단계를 포함한다. 일부 구현예에서, 항암 요법은, 하나 이상의 유전자의 발현 수준이 참조 수준과 비교하여 환자 샘플 내에서 증가될 경우 환자에게 투여된다. 일부 구현예에서, CX3CR1, CCL2, CCL5, CCR5, CX3CL1, CCR7, 또는 CXCL10 중 적어도 2개, 적어도 3개, 적어도 4개, 적어도 5개, 또는 적어도 6개의 발현 수준이 계측된다. 일부 구현예에서, CX3CR1, CCL2, CCL5, CCR5, CX3CL1, CCR7, 및 CXCL10의 발현 수준이 계측된다.
기타 구현예에서, 본 발명은 암 환자 (예컨대, 신장암)을 치료하는 방법을 제공하며, 상기 방법은 항암 요법의 투여 후 시점에서 환자로부터 수득된 생물학적 샘플 내 CX3CR1, CCL2, CCL5, CCR7, CX3CL1, CCR7, 또는 CXCL10의 하나 이상 (예컨대, 1, 2, 3, 4, 5, 6, 또는 7개)의 발현 수준을 계측하는 단계, 발현 수준을 참조 수준과 비교하는 단계, 및 발현 수준이 참조 수준과 비교하여 증가될 경우 환자에게 항암 요법의 투여를 계속하는 단계를 포함한다. 일부 구현예에서, CX3CR1, CCL2, CCL5, CCR5, CX3CL1, CCR7, 또는 CXCL10 중 적어도 2개, 적어도 3개, 적어도 4개, 적어도 5개, 또는 적어도 6개의 발현 수준이 계측된다. 일부 구현예에서, CX3CR1, CCL2, CCL5, CCR5, CX3CL1, CCR7, 및 CXCL10의 발현 수준이 계측된다.
일부 구현예에서, 참조 수준은 항암 요법의 투여 이전 (예컨대, 수분, 수시간, 수일, 수주, 수개월, 또는 수년 이전) 수득된 환자 유래의 생물학적 샘플 내 하나 이상의 유전자 (예컨대, CX3CR1, CCL2, CCL5, CCR5, CX3CL1, CCR7, 및/또는 CXCL10)의 발현 수준이다. 기타 구현예에서, 참조 수준은 참조 집단에서 하나 이상의 유전자의 발현 수준이다. 기타 구현예에서, 참조 수준은 하나 이상의 유전자에 대한 사전-할당된 발현 수준이다. 일부 구현예에서, 참조 수준은 사전 시점에서 환자로부터 수득된 생물학적 샘플 내 하나 이상의 유전자의 발현 수준이며, 여기서 상기 사전 시점은 항암 요법의 투여 후의 시점이다. 기타 구현예에서, 참조 수준은 후속 시점에서 환자로부터 수득된 생물학적 샘플 내 하나 이상의 유전자의 발현 수준이다.
일부 구현예에서, 환자로부터 수득된 생물학적 샘플 중 CX3CR1, CCL2, CCL5, CCR5, CX3CL1, CCR7, 및/또는 CXCL10 중 하나 이상 (예를 들어, 1, 2, 3, 4, 5, 6, 또는 7개)의 발현 수준은 참조 수준과 비교하여 (예컨대, 약 1.1배, 약 1.2배, 약 1.3배, 약 1.4배, 약 1.5배, 약 1.6배, 약 1.7배, 약 1.8배, 약 1.9배, 약 2배, 약 2.1배, 약 2.2배, 약 2.3배, 약 2.4배, 약 2.5배, 약 3배, 약 3.5배, 약 4배, 약 4.5배, 약 5배, 약 5.5배, 약 6배, 약 6.5배, 약 7배, 약 7.5배, 약 8배, 약 8.5배, 약 9배, 약 9.5배, 약 10배, 약 11배, 약 12배, 약 13배, 약 14배, 약 15배, 약 16배, 약 17배, 약 18배, 약 19배, 약 20배, 약 30배, 약 40배, 약 50배, 약 100배, 약 500배, 약 1,000배 이상 만큼) 증가된다.
또 다른 양태에서, 본 발명은 암 (예컨대, 신장암)을 갖는 환자를 치료하는 방법을 제공하며, 상기 방법은 환자로부터 수득된 종양 샘플 내 T 세포 (예컨대, CD8+ T 세포, 예컨대, CD8+ Teff 세포) 및/또는 대식세포 (예컨대, CD68+, CD168+, 또는 CD68+CD168+ 대식세포)의 수를 계측하는 단계, 종양 샘플 내 T 세포 (예컨대, CD8+ T 세포, 예컨대, CD8+ Teff 세포) 및/또는 대식세포 (예컨대, CD68+, CD168+, 또는 CD68+CD168+ 대식세포)의 수를 참조 샘플 내 T 세포 (예컨대, CD8+ T 세포, 예컨대, CD8+ Teff 세포) 및/또는 대식세포 (예컨대, CD68+, CD168+, 또는 CD68+CD168+ 대식세포)의 수와 비교하는 단계, 및 환자 샘플 내 T 세포 (예컨대, CD8+ T 세포, 예컨대, CD8+ Teff 세포) 및/또는 대식세포 (예컨대, CD68+, CD168+, 또는 CD68+CD168+ 대식세포)의 수가 참조 샘플과 비교하여 변화 (예컨대, 증가되거나 감소)될 경우 VEGF 길항제 및 PD-L1 축 결합 길항제를 포함하는 항암 요법을 투여하는 단계를 포함한다. 일부 구현예에서, 항암 요법은, 환자로부터 수득된 생물학적 샘플 내 T 세포 (예컨대, CD8+ T 세포, 예컨대, CD8+ Teff 세포) 및/또는 대식세포 (예컨대, CD68+, CD168+, 또는 CD68+CD168+ 대식세포)의 수가 참조 수준과 비교하여 증가될 경우, 환자에게 투여된다.
추가의 또 다른 양태에서, 본 발명은, 항암 요법의 투여 후 시점에서 환자로부터 수득된 종양 샘플 내 T 세포 (예컨대, CD8+ T 세포, 예컨대, CD8+ Teff 세포) 및/또는 대식세포 (예컨대, CD68+, CD168+, 또는 CD68+CD168+ 대식세포)의 수를 계측하는 것, 종양 샘플 내 T 세포 (예컨대, CD8+ T 세포, 예컨대, CD8+ Teff 세포) 및/또는 대식세포 (예컨대, CD68+, CD168+, 또는 CD68+CD168+ 대식세포)의 수를 참조 샘플 내 T 세포 (예컨대, CD8+ T 세포, 예컨대, CD8+ Teff 세포) 및/또는 대식세포 (예컨대, CD68+, CD168+, 또는 CD68+CD168+ 대식세포)의 수와 비교하는 것, 및 환자 샘플 내 T 세포 (예컨대, CD8+ T 세포, 예컨대, CD8+ Teff 세포) 및/또는 대식세포 (예컨대, CD68+, CD168+, 또는 CD68+CD168+ 대식세포)의 수가 참조 샘플과 비교하여 증가될 경우 항암 요법의 투여를 계속하는 것에 의한 암 (예컨대, 신장암)을 갖는 환자를 치료하는 방법을 제공한다. 일부 구현예에서, 항암제는 VEGF 길항제 및 PD-L1 축 결합 길항제를 포함한다.
선행 방법 중 임의의 것의 일부 구현예에서, 환자로부터 수득된 종양 샘플은 참조 샘플과 비교하여 증가된 수의 CD8+ T 세포 및/또는 대식세포 (예컨대, 적어도 약 1.1배, 약 1.2배, 약 1.3배, 약 1.4배, 약 1.5배, 약 1.6배, 약 1.7배, 약 1.8배, 약 1.9배, 약 2배, 약 2.1배, 약 2.2배, 약 2.3배, 약 2.4배, 약 2.5배, 약 2.6배, 약 2.7배, 약 2.8배, 약 2.9배, 약 3배, 약 3.1배, 약 3.2배, 약 3.3배, 약 3.4배, 약 3.5배, 약 3.6배, 약 3.7배, 약 3.8배, 약 3.9배, 약 4배, 약 4.1배, 약 4.2배, 약 4.3배, 약 4.4배, 약 4.5배, 약 4.6배, 약 4.7배, 약 4.8배, 약 4.9배, 약 5배, 약 5.5배, 약 6배, 약 6.5배, 약 7배, 약 7.5배, 약 8배, 약 8.5배, 약 9배, 약 9.5배, 약 10배, 약 11배, 약 12배, 약 13배, 약 14배, 약 15배, 약 16배, 약 17배, 약 18배, 약 19배, 약 20배, 약 30배, 약 40배, 약 50배, 약 100배, 약 500배, 약 1,000배 이상 만큼)를 갖는다.
선행 방법 중 임의의 것의 일부 구현예에서, VEGF 길항제 (예컨대, 항-VEGF 항체, 예컨대 베바시주맙)와 PD-L1 축 결합 길항제 (예컨대, PD-L1 결합 길항제, 예컨대 아테졸리주맙)를 병용한 요법은 바람직하게는 무진행 생존 (PFS) 및/또는 전체 생존 (OS)을 포함하는 생존을 연장하고/하거나 개선시킨다. 일 구현예에서, VEGF 길항제 (예컨대, 항-VEGF 항체, 예컨대 베바시주맙)와 PD-L1 축 결합 길항제 (예컨대, PD-L1 결합 길항제, 예컨대 아테졸리주맙)를 병용한 요법은, 치료되는 암에 대하여 개선된 항-종양 제제, 또는 돌봄 표준를 투여함에 의하여 달성된 생존과 비교하여, 적어도 약 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 200% 이상 만큼 생존을 신장시킨다.
선행 방법 중 임의의 것의 일부 구현예에서, 바이오마커의 발현 수준 또는 수는 하기에서 검출된다: 조직 샘플, 1차 또는 배양 세포 또는 세포주, 세포 상청액, 세포 용해물, 혈소판, 혈청, 혈장, 활액, 림프액, 활막 유체, 여포성 유체, 정액, 양수, 밀크, 전혈, 혈액-유도된 세포, 소변, 뇌척수액, 타액, 가래, 눈물, 땀, 점액, 종양 용해물, 및 조직 배양 배지, 조직 추출물 예컨대 균질화된 조직, 종양 조직, 세포성 추출물, 또는 이의 임의의 조합.
예를 들어, 선행 방법 중 임의의 것의 일부 구현예에서, 바이오마커의 발현 수준은 공지된 기술 (예를 들어, 유세포측정 또는 IHC)을 사용하여 종양-침윤 면역 세포, 종양 세포, PBMC 또는 이들의 조합에서 검출된다. 종양-침윤 면역 세포는 비제한적으로 하기를 포함한다: 종양내 면역 세포, 종양주변 면역 세포 또는 이의 임의의 조합, 및 기타 종양 기질 세포 (예컨대, 섬유아세포). 상기 종양-침윤 면역 세포는, 하기일 수 있다: T 림프구 (예컨대 CD8+ T 림프구 (예컨대, CD8+ T 효과기 (Teff) 세포) 및/또는 CD4+ T 림프구 (예컨대, CD4+ Teff 세포), B 림프구, 또는 과립구 (호중구, 호산구, 호염기구)를 포함하는 기타 골수-계통 세포, 단핵구, 대식세포, 수지상 세포 (예컨대, 지상감입 수지상 세포), 조직구, 및 자연 살해 (NK) 세포. 일부 구현예에서, 바이오마커에 대한 염색은 막 염색, 세포질 염색 또는 이의 조합으로서 검출된다. 기타 구현예에서, 바이오마커의 부재는 참조 샘플과 비교하여 샘플 내 염색의 부재 또는 없음으로서 검출된다.
선행 방법 중 임의의 것의 일부 구현예에서, 환자로부터 수득된 샘플은 조직, 전혈, 혈장, 혈청, 및 이들의 조합으로 이루어진 군으로부터 선택될 수 있다. 일부 구현예에서, 샘플은 조직 샘플이다. 일부 구현예에서, 조직 샘플은 종양 샘플이다. 일부 구현예에서, 종양 샘플은 종양-침윤 면역 세포, 종양 세포, 기질 세포, 또는 이들의 임의의 조합을 포함한다. 선행 구현예 중 임의의 것에서, 종양 샘플은 포르말린-고정 및 파라핀-포매(FFPE) 종양 샘플, 보관 종양 샘플, 신선한 종양 샘플, 또는 동결된 종양 샘플일 수 있다.
선행 방법 중 임의의 것의 특정 구현예에서, 바이오마커의 발현 수준 또는 수는 암 세포를 함유하거나 상기를 함유하는 것으로 의심되는 생물학적 샘플 내에서 평가된다. 샘플은 예를 들어 조직 생검, 또는 암 (예컨대, 신장암, 특히 신장 세포 암종)으로 앓거나, 상기를 앓는 것으로 의심되거나 상기로 진단받은 환자로부터 수득된 전이성 병변일 수 있다. 일부 구현예에서, 샘플은 순환 암 세포, 예컨대, 신장암 세포를 포함하는 것으로 공지되거나 의심되는 신장 조직의 샘플, 신장 종양의 생검, 공지되거나 의심되는 전이성 신장암 병변 또는 절편, 또는 혈액 샘플, 예컨대, 말초 혈액 샘플이다. 샘플은 암 세포, 즉 종양 세포 및 비-암성 세포 (예컨대, 림프구, 예컨대 T 세포 또는 NK 세포) 둘 모두를 포함할 수 있으며, 그리고 특정 구현예에서, 암성 및 비-암성 세포 둘 모두를 포함한다. 조직 절제, 생검, 및 체액, 예를 들면, 암/종양 세포를 포함하는 혈액 샘플을 포함하는 생물학적 샘플을 수득하는 방법은 당해 기술에 공지되어 있다.
일부 구현예에서, 환자로부터 수득된 샘플은 항암 요법의 시작 후, 예를 들어, 암의 치료 또는 이의 증상의 관리 또는 완화를 위해 수집된다. 따라서, 일부 구현예에서, 샘플은 화학요법의 투여 또는 화학요법의 시작 후에 수집된다.
선행 방법 중 임의의 것의 일부 구현예에서, 환자는 하기를 갖는다: 암종, 림프종, 아세포종 (수아세포종 및 망막아세포종 포함), 육종 (지방육종 및 활막 세포 육종 포함), 신경내분비 종양 (카르시노이드 종양, 가스트린종, 및 소도 세포 암 포함), 중피종, 신경집종 (청신경종 포함), 수막종, 선암종, 흑색종, 및 백혈병 또는 림프양 악성종양. 일부 구현예에서, 암은 신장암 (예를 들어, 신장 세포 암종 (RCC), 예를 들어 전이성 RCC), 편평상피 세포 암 (예를 들어, 상피성 편평상피 세포 암), 폐암 (소세포 폐암 (SCLC), 비-소세포 폐암 (NSCLC), 폐의 선암종 및 폐의 편평상피 암종), 복막 암, 간세포 암, 위장 암을 포함하는 위장암 또는 위암, 췌장암, 교모세포종, 자궁경부암, 난소암, 간암, 간종양, 유방암 (전이성 유방암 포함), 방광암, 결장암, 직장암, 결장직장암, 자궁 내막 또는 자궁 암종, 타액샘 암종, 전립선 암, 외음부 암, 갑상선암, 간 암종, 항문 암종, 음경 암종, 머켈 세포 암, 균상식육종(mycoses fungoids), 고환암, 식도암, 담관 종양, 두경부암, B-세포 림프종 (저등급/여포성 비-호지킨 림프종 (NHL); 소 림프구성 (SL) NHL; 중급/여포성 NHL; 중급 확산 NHL; 고급 면역아세포성 NHL; 고급 림프아구성 NHL; 고급 소형 비-절단 세포 NHL; 거대 질환 NHL; 맨틀 세포 림프종; AIDS-관련 림프종; 및 발덴스트롬(Waldenstrom) 거대글로불린혈증); 만성 림프구성 백혈병 (CLL); 급성 림프아구성 백혈병 (ALL); 모발 세포 백혈병; 만성 골수아세포 백혈병; 이식 후 림프증식성 장애 (PTLD), 모반증과 관련된 비정상 혈관 증식, 부종 (예컨대, 뇌종양과 관련된 것) 또는 메이그스(Meigs) 증후군이다. 바람직한 구현예에서, 환자는 신장암 (예컨대, RCC, 예컨대, mRCC)을 갖는다. 환자는 선택적으로 진행성, 난치성, 재발성, 화학요법-내성 및/또는 백금-내성 형태의 암을 가질 수 있다.
암의 예방 또는 치료를 위해, VEGF 길항제 (예컨대, 항-VEGF 항체, 예컨대 베바시주맙) 및/또는 PD-L1 축 결합 길항제 (예컨대, PD-L1 결합 길항제, 예컨대 아테졸리주맙)의 용량은 상기 정의한 바와 같은 치료할 암의 형태, 항체가 예방학적 또는 치료학적 목적으로 투여되든지 간에, 질환의 중증정도 및 과정, 선행 치료법, 환자의 임상적 히스토리 및 약물에 대한 반응과, 주치의 판단에 따라 좌우될 것이다.
일부 구현예에서, VEGF 길항제 (예컨대, 항-VEGF 항체, 예컨대 베바시주맙) 및/또는 PD-L1 축 결합 길항제 (예컨대, PD-L1 결합 길항제, 예컨대 아테졸리주맙)는 1회에, 또는 일련의 치료에 걸쳐 환자에게 적절히 투여될 수 있다. 한 가지 전형적인 일일 투여량은 전술한 인자에 따라, 약 1 ㎍/kg 내지 100 mg/kg 또는 그 이상의 범위에서 변할 수 있다. 수 일 또는 그 이상에 걸친 반복된 투여의 경우, 병태에 따라, 치료는 일반적으로 질환 증상의 목적하는 억제가 일어날 때까지 지속될 것이다. 상기 투여는 간헐적으로, 예를 들면, (예를 들면, 환자가 약 2 내지 약 20회, 또는 예를 들면, 약 6회 용량의 VEGF 길항제 및/또는 PD-L1 축 결합 길항제를 제공받도록) 매주 또는 3주마다 투여될 수 있다. 초기 더 높은 부하 용량에 이어서, 1회 이상의 저용량이 투여될 수 있다. 그러나, 다른 투여 레지멘이 유용할 수 있다. 이러한 요법의 진행은 전통적인 기술과 검정에 의해 쉽게 모니터링된다.
예를 들어, 일반적인 경우에서, 인간에게 투여된 VEGF 길항제 (예컨대, 항-VEGF 항체, 예컨대 베바시주맙) 및/또는 PD-L1 축 결합 길항제 (예컨대, PD-L1 결합 길항제, 예컨대 아테졸리주맙)의 치료적 유효량은, 1회 이상의 투여에 의해 환자 체중당 약 0.01 내지 약 50 mg/kg의 범위일 것이다. 일부 구현예에서, 사용된 항체는, 예를 들어, 하기로 매일, 매주, 매 2주마다, 매 3주마다, 또는 매월 투여된다: 약 0.01 mg/kg 내지 약 45 mg/kg, 약 0.01 mg/kg 내지 약 40 mg/kg, 약 0.01 mg/kg 내지 약 35 mg/kg, 약 0.01 mg/kg 내지 약 30 mg/kg, 약 0.01 mg/kg 내지 약 25 mg/kg, 약 0.01 mg/kg 내지 약 20 mg/kg, 약 0.01 mg/kg 내지 약 15 mg/kg, 약 0.01 mg/kg 내지 약 10 mg/kg, 약 0.01 mg/kg 내지 약 5 mg/kg, 또는 약 0.01 mg/kg 내지 약 1 mg/kg. 일부 구현예에서, 항체는 15 mg/kg 로 투여된다. 그러나, 다른 투여 레지멘이 유용할 수 있다. 일 구현예에서, VEGF 길항제 (예를 들어, 항-VEGF 항체, 예컨대 베바시주맙) 및/또는 PD-L1 축 결합 길항제 (예를 들어, PD-L1 결합 길항제, 예컨대 아테졸리주맙)는 21-일 주기 중 1일에 (3주마다, q3w) 약 100 mg, 약 200mg, 약 300mg, 약 400mg, 약 420mg, 약 500mg, 약 525mg, 약 600mg, 약 700mg, 약 800mg, 약 840mg, 약 900mg, 약 1000mg, 약 1050mg, 약 1100mg, 약 1200mg, 약 1300mg, 약 1400mg, 약 1500mg, 약 1600mg, 약 1700mg, 또는 약 1800mg의 용량으로 인간에게 투여된다.
일부 구현예에서, 아테졸리주맙은 3주마다(q3w) 정맥내로 1200mg로 투여된다. 일부 구현예에서, 베바시주맙은 한꺼번에 또는 일련의 치료에 걸쳐 고정 용량으로 투여된다. 고정 용량이 투여될 경우, 바람직하게는 이는 약 5mg 내지 약 2000 mg의 범위이다. 예를 들어, 고정 용량은 대략 420mg, 대략 525mg, 대략 840mg, 또는 대략 1050mg일 수 있다. 일부 구현예에서, 베바시주맙은 매 2주마다 10 mg/kg으로 정맥내 투여된다. 일부 구현예에서, 베바시주맙은 매 3주마다 정맥내로 15 mg/kg로 투여된다. VEGF 길항제 및/또는 PD-L1 축 결합 길항제의 용량은 단일 용량 또는 다중 용량 (예를 들어, 2, 3, 4, 5, 6, 7, 8, 9 또는 10 회 이상의 용량)으로 투여될 수 있다. 일련의 투여가 투여될 경우, 이들은 예를 들어, 대략 1주 마다, 대략 2주 마다, 대략 3주 마다, 또는 대략 4주 마다 투여될 수 있다. 병용 치료 중 투여된 항체의 투여는, 단일 치료와 비교하여, 감소될 수 있다. 이 치료법의 과정은 통상적인 기술에 의해 용이하게 모니터링된다.
본원에 기술된 VEGF 길항제 (예컨대, 항-VEGF 항체, 예컨대, 베바시주맙) 및 PD-L1 축 결합 길항제 (예컨대, 항체, 결합 폴리펩티드, 및/또는 소분자) (임의의 추가 치료제)는 양호한 의학적 실시와 일치하는 방식으로 제형화되고, 복용되고, 그리고 투여될 수 있다. 본 맥락에서 고려되는 인자는 치료되는 특정 장애, 치료되는 특정 동물, 개별적인 환자의 임상 조건, 장애의 원인, 제제의 전달 부위, 투여 방법, 투여 스케줄, 및 의사에에 공지된 다른 인자를 포함한다. 꼭 그런 것은 아니지만, PD-L1 축 결합 길항제 및/또는 VEGF 길항제는 문제의 장애를 예방 또는 치료하기 위해 현재 사용되는 하나 이상의 제제와 선택적으로 제형화 및/또는 투여된다. 유효량의 상기 기타 제제는 제형에 존재하는 PD-L1 축 결합 길항제 및/또는 VEGF 길항제의 양, 장애 또는 치료의 유형, 및 위에서 논의된 다른 요인에 의존한다. 이들은 일반적으로 본원에 기재된 바와 동일한 투여량으로 및 투여 경로로, 또는 본원에 기재된 용량의 약 1 내지 99%, 또는 적절하다고 경험적/임상적으로 결정된 임의 용량으로 및 임의 경로에 의해 사용된다.
일부 구현예에서, VEGF 길항제 (예를 들어, 항-VEGF 항체, 예를 들어, 베바시주맙)는 PD-L1 축 결합 길항제 (예를 들어, 항 PD-L1 항체, 예를 들어, 아테졸리주맙)와 동시에 투여된다. 일부 구현예에서, VEGF 길항제 (예컨대, 항-VEGF 항체, 예컨대, 베바시주맙) 및 PD-L1 축 결합 길항제 (예컨대, 항-PD-L1 항체, 예컨대, 아테졸리주맙)는 상동한 제형의 일부로서 투여된다. 기타 구현예에서, VEGF 길항제 (예를 들어, 항-VEGF 항체, 예를 들어, 베바시주맙)는 PD-L1 축 결합 길항제 (예를 들어, 항 PD-L1 항체, 예를 들어, 아테졸리주맙)와 별도로 투여된다.
일부 구현예에서, 선행 방법 중 임의의 것은 추가의 치료제를 투여하는 단계를 추가로 포함할 수 있다. 일부 구현예에서, 추가 치료제는 하기로 이루어진 군으로부터 선택된다: 면역치료제, 세포독성제, 성장 억제제, 방사선 치료제, 항-혈관형성제, 및 이들의 조합.
일부 구현예에서, VEGF 길항제 (예컨대, 항-VEGF 항체, 예컨대, 베바시주맙) 및 PD-L1 축 결합 길항제 (예컨대, 항-PD-L1 항체, 예컨대, 아테졸리주맙)는 활성화 공-자극성 분자에 대하여 지향된 효능제와 동시에 투여된다. 일부 구현예에서, 활성화 공통자극 분자는 CD40, CD226, CD28, OX40, GITR, CD137, CD27, HVEM, 또는 CD127을 포함할 수 있다. 일부 구현예에서, 활성화 공통자극 분자에 대하여 지향된 효능제는 CD40, CD226, CD28, OX40, GITR, CD137, CD27, HVEM, 또는 CD127에 결합하는 효능제 항체이다. 일부 구현예에서, VEGF 길항제 (예컨대, 항-VEGF 항체, 예컨대, 베바시주맙) 및 PD-L1 축 결합 길항제 (예컨대, 항-PD-L1 항체, 예컨대, 아테졸리주맙)는 억제성 공-자극성 분자에 대하여 지향된 길항제와 결합하여 투여될 수 있다. 일부 구현예에서, 억제성 공-자극성 분자는 CTLA-4 (CD152로도 공지됨), TIM-3, BTLA, VISTA, LAG-3, B7-H3, B7-H4, IDO, TIGIT, MICA/B, 또는 아르기나제를 포함할 수 있다. 일부 구현예에서, 억제성 공-자극성 분자에 대하여 지향된 길항제는 CTLA-4, TIM-3, BTLA, VISTA, LAG-3, B7-H3, B7-H4, IDO, TIGIT, MICA/B, 또는 아르기나제에 결합하는 길항제 항체이다.
일부 구현예에서, VEGF 길항제 (예컨대, 항-VEGF 항체, 예컨대, 베바시주맙) 및 PD-L1 축 결합 길항제 (예컨대, 항-PD-L1 항체, 예컨대, 아테졸리주맙)는 CTLA-4 (또한 CD152로서 공지됨)에 대하여 지향된 길항제, 예컨대, 차단 항체와 결합하여 투여될 수 있다. 일부 구현예에서, VEGF 길항제 (예컨대, 항-VEGF 항체, 예컨대, 베바시주맙) 및 PD-L1 축 결합 길항제 (예컨대, 항-PD-L1 항체, 예컨대, 아테졸리주맙)는 이필리무맙 (또한 MDX-010, MDX-101, 또는 YERVOY®로서 공지됨)과 결합하여 투여될 수 있다. 일부 구현예에서, VEGF 길항제 (예컨대, 항-VEGF 항체, 예컨대, 베바시주맙) 및 PD-L1 축 결합 길항제 (예컨대, 항-PD-L1 항체, 예컨대, 아테졸리주맙)는 트레멜리무맙 (또한 티실리무맙 또는 CP-675,206로서 공지됨)과 결합하여 투여될 수 있다. 일부 구현예에서, VEGF 길항제 (예컨대, 항-VEGF 항체, 예컨대, 베바시주맙) 및 PD-L1 축 결합 길항제 (예컨대, 항-PD-L1 항체, 예컨대, 아테졸리주맙)는 B7-H3 (또한 CD276로서 공지됨)에 대하여 지향된 길항제, 예컨대, 차단 항체와 결합하여 투여될 수 있다. 일부 구현예에서, VEGF 길항제 (예컨대, 항-VEGF 항체, 예컨대, 베바시주맙) 및 PD-L1 축 결합 길항제 (예컨대, 항-PD-L1 항체, 예컨대, 아테졸리주맙)는 MGA271과 결합하여 투여될 수 있다. 일부 구현예에서, VEGF 길항제 (예컨대, 항-VEGF 항체, 예컨대, 베바시주맙) 및 PD-L1 축 결합 길항제 (예컨대, 항-PD-L1 항체, 예컨대, 아테졸리주맙)는 TGF-베타, 예컨대, 메텔리무맙 (또한 CAT-192로서 공지됨), 프레솔리무맙 (또한 GC1008로서 공지됨), 또는 LY2157299에 대하여 지향된 길항제와 결합하여 투여될 수 있다.
일부 구현예에서, VEGF 길항제 (예컨대, 항-VEGF 항체, 예컨대, 베바시주맙) 및 PD-L1 축 결합 길항제 (예컨대, 항-PD-L1 항체, 예컨대, 아테졸리주맙)는 CD137 (또한 TNFRSF9, 4-1BB, 또는 ILA로서 공지됨)에 대하여 지향된 효능제, 예컨대, 활성화 항체와 결합하여 투여될 수 있다. 일부 구현예에서, VEGF 길항제 (예컨대, 항-VEGF 항체, 예컨대, 베바시주맙) 및 PD-L1 축 결합 길항제 (예컨대, 항-PD-L1 항체, 예컨대, 아테졸리주맙)는 우렐리맙 (또한 BMS-663513으로서 공지됨)과 결합하여 투여될 수 있다. 일부 구현예에서, VEGF 길항제 (예컨대, 항-VEGF 항체, 예컨대, 베바시주맙) 및 PD-L1 축 결합 길항제 (예컨대, 항-PD-L1 항체, 예컨대, 아테졸리주맙)는 CD40에 대하여 지향된 효능제, 예컨대, 활성화 항체와 결합하여 투여될 수 있다. 일부 구현예에서, VEGF 길항제 (예컨대, 항-VEGF 항체, 예컨대, 베바시주맙) 및 PD-L1 축 결합 길항제 (예컨대, 항-PD-L1 항체, 예컨대, 아테졸리주맙)는 CP-870893과 결합하여 투여될 수 있다. 일부 구현예에서, VEGF 길항제 (예컨대, 항-VEGF 항체, 예컨대, 베바시주맙) 및 PD-L1 축 결합 길항제 (예컨대, 항-PD-L1 항체, 예컨대, 아테졸리주맙)는 OX40 (또한 CD134로서 공지됨)에 대하여 지향된 효능제, 예컨대, 활성화 항체와 결합하여 투여될 수 있다. 일부 구현예에서, VEGF 길항제 (예컨대, 항-VEGF 항체, 예컨대, 베바시주맙) 및 PD-L1 축 결합 길항제 (예컨대, 항-PD-L1 항체, 예컨대, 아테졸리주맙)는 항-OX40 항체 (예컨대, AgonOX)와 결합하여 투여될 수 있다. 일부 구현예에서, VEGF 길항제 (예컨대, 항-VEGF 항체, 예컨대, 베바시주맙) 및 PD-L1 축 결합 길항제 (예컨대, 항-PD-L1 항체, 예컨대, 아테졸리주맙)는 CD27에 대하여 지향된 효능제, 예컨대, 활성화 항체와 결합하여 투여될 수 있다. 일부 구현예에서, VEGF 길항제 (예컨대, 항-VEGF 항체, 예컨대, 베바시주맙) 및 PD-L1 축 결합 길항제 (예컨대, 항-PD-L1 항체, 예컨대, 아테졸리주맙)는 CDX-1127과 결합하여 투여될 수 있다. 일부 구현예에서, VEGF 길항제 (예컨대, 항-VEGF 항체, 예컨대, 베바시주맙) 및 PD-L1 축 결합 길항제 (예컨대, 항-PD-L1 항체, 예컨대, 아테졸리주맙)는 TIGIT에 대하여 지향된 길항제, 예를 들어, 항-TIGIT 항체와 결합하여 투여될 수 있다. 일부 구현예에서, VEGF 길항제 (예컨대, 항-VEGF 항체, 예컨대, 베바시주맙) 및 PD-L1 축 결합 길항제 (예컨대, 항-PD-L1 항체, 예컨대, 아테졸리주맙)는 인돌아민-2,3-2산소화효소 (IDO)에 대하여 지향된 길항제와 결합하여 투여될 수 있다. 일부 구현예에서, IDO 길항제는 1-메틸-D-트립토판 (또한 1-D-MT로서 공지됨)이다.
일부 구현예에서, VEGF 길항제 (예컨대, 항-VEGF 항체, 예컨대, 베바시주맙) 및 PD-L1 축 결합 길항제 (예컨대, 항-PD-L1 항체, 예컨대, 아테졸리주맙)는 암 백신과 결합하여 투여될 수 있다. 일부 구현예에서, 암 백신은, 일부 구현예에서 개인화된 펩티드 백신인, 펩티드 암 백신을 포함할 수 있다. 일부 구현예에서 펩티드 암 백신은, 다가의 긴 펩티드, 다중-펩티드, 펩티드 칵테일, 혼성 펩티드, 또는 펩티드-펄스(peptide-pulsed) 수지상 세포 백신 (참고: 예컨대, Yamada et al., Cancer Sci . 104:14-21, 2013). 일부 구현예에서, VEGF 길항제 (예컨대, 항-VEGF 항체, 예컨대, 베바시주맙) 및 PD-L1 축 결합 길항제 (예컨대, 항-PD-L1 항체, 예컨대, 아테졸리주맙)는 아쥬반트와 결합하여 투여될 수 있다. 일부 구현예에서, VEGF 길항제 (예컨대, 항-VEGF 항체, 예컨대, 베바시주맙) 및 PD-L1 축 결합 길항제 (예컨대, 항-PD-L1 항체, 예컨대, 아테졸리주맙)는 TLR 효능제, 예컨대, 폴리-ICLC (또한 HILTONOL®로서 공지됨), LPS, MPL, 또는 CpG ODN을 포함하는 치료와 결합하여 투여될 수 있다. 일부 구현예에서, VEGF 길항제 (예컨대, 항-VEGF 항체, 예컨대, 베바시주맙) 및 PD-L1 축 결합 길항제 (예컨대, 항-PD-L1 항체, 예컨대, 아테졸리주맙)는 종양 괴사 인자 (TNF) 알파와 결합하여 투여될 수 있다. 일부 구현예에서, VEGF 길항제 (예컨대, 항-VEGF 항체, 예컨대, 베바시주맙) 및 PD-L1 축 결합 길항제 (예컨대, 항-PD-L1 항체, 예컨대, 아테졸리주맙)는 IL-1과 결합하여 투여될 수 있다. 일부 구현예에서, VEGF 길항제 (예컨대, 항-VEGF 항체, 예컨대, 베바시주맙) 및 PD-L1 축 결합 길항제 (예컨대, 항-PD-L1 항체, 예컨대, 아테졸리주맙)는 HMGB1과 결합하여 투여될 수 있다. 일부 구현예에서, VEGF 길항제 (예컨대, 항-VEGF 항체, 예컨대, 베바시주맙) 및 PD-L1 축 결합 길항제 (예컨대, 항-PD-L1 항체, 예컨대, 아테졸리주맙)는 IL-10 길항제와 결합하여 투여될 수 있다. 일부 구현예에서, VEGF 길항제 (예컨대, 항-VEGF 항체, 예컨대, 베바시주맙) 및 PD-L1 축 결합 길항제 (예컨대, 항-PD-L1 항체, 예컨대, 아테졸리주맙)는 IL-4 길항제와 결합하여 투여될 수 있다. 일부 구현예에서, VEGF 길항제 (예컨대, 항-VEGF 항체, 예컨대, 베바시주맙) 및 PD-L1 축 결합 길항제 (예컨대, 항-PD-L1 항체, 예컨대, 아테졸리주맙)는 IL-13 길항제와 결합하여 투여될 수 있다. 일부 구현예에서, VEGF 길항제 (예컨대, 항-VEGF 항체, 예컨대, 베바시주맙) 및 PD-L1 축 결합 길항제 (예컨대, 항-PD-L1 항체, 예컨대, 아테졸리주맙)는 HVEM 길항제와 결합하여 투여될 수 있다. 일부 구현예에서, VEGF 길항제 (예컨대, 항-VEGF 항체, 예컨대, 베바시주맙) 및 PD-L1 축 결합 길항제 (예컨대, 항-PD-L1 항체, 예컨대, 아테졸리주맙)는 예컨대, ICOS에 대하여 지향된 작용적 항체 또는 ICOS-L의 투여에 의하여, ICOS 효능제와 결합하여 투여될 수 있다. 일부 구현예에서, VEGF 길항제 (예컨대, 항-VEGF 항체, 예컨대, 베바시주맙) 및 PD-L1 축 결합 길항제 (예컨대, 항-PD-L1 항체, 예컨대, 아테졸리주맙)는 CX3CL1을 표적화하는 치료와 결합하여 투여될 수 있다. 일부 구현예에서, VEGF 길항제 (예컨대, 항-VEGF 항체, 예컨대, 베바시주맙) 및 PD-L1 축 결합 길항제 (예컨대, 항-PD-L1 항체, 예컨대, 아테졸리주맙)는 CXCL9를 표적화하는 치료와 결합하여 투여될 수 있다. 일부 구현예에서, VEGF 길항제 (예컨대, 항-VEGF 항체, 예컨대, 베바시주맙) 및 PD-L1 축 결합 길항제 (예컨대, 항-PD-L1 항체, 예컨대, 아테졸리주맙)는 CXCL10을 표적화하는 치료와 결합하여 투여될 수 있다. 일부 구현예에서, VEGF 길항제 (예컨대, 항-VEGF 항체, 예컨대, 베바시주맙) 및 PD-L1 축 결합 길항제 (예컨대, 항-PD-L1 항체, 예컨대, 아테졸리주맙)는 CCL5를 표적화하는 치료와 결합하여 투여될 수 있다. 일부 구현예에서, VEGF 길항제 (예컨대, 항-VEGF 항체, 예컨대, 베바시주맙) 및 PD-L1 축 결합 길항제 (예컨대, 항-PD-L1 항체, 예컨대, 아테졸리주맙)는 LFA-1 또는 ICAM1 효능제와 결합하여 투여될 수 있다. 일부 구현예에서, VEGF 길항제 (예컨대, 항-VEGF 항체, 예컨대, 베바시주맙) 및 PD-L1 축 결합 길항제 (예컨대, 항-PD-L1 항체, 예컨대, 아테졸리주맙)는 셀렉틴 효능제와 결합하여 투여될 수 있다.
만일 투여된다면, 화학치료제는 보통 따라서 공지된 투여량으로 투여되거나, 또는 선택적으로 화학치료제의 투여에 기인하는 음성적 부작용 또는 약물의 조합된 작용에 기인하여 낮아진다. 그와 같은 화학치료제에 대한 제조 및 투여 일정은 제조자의 설명서에 따라 또는 당업자에 의해 실험적으로 결정된 바에 따라 사용될 수 있다. 화학치료제가 파클리탁셀인 경우, 바람직하게는 이는 약 130mg/㎡ 내지 200mg/㎡ (예를 들어, 약 175mg/㎡)의 투여량으로 예를 들어 3시간에 걸쳐 3주에 1회 투여된다. 화학치료제가 카보플라틴인 경우, 바람직하게는 이것은 환자의 기존의 신장 기능 또는 신장 기능 및 원하는 혈소판 최하점에 기반한 캘버트 식을 사용하여 카보플라틴의 용량을 계산함에 의해 투여된다. 신장 배출은 카보플라틴에 대한 제거의 주요 경로이다. 체표면적에 기반한 경험적 용량 계산에 비교할 때, 이 투약 식의 사용은 그렇지 않으면 과소투약 (평균 신장 기능 이상인 환자) 또는 과다투약 (손상된 신장 기능이 있는 환자)을 초래할 수 있는 전처리 신장 기능에서 환자 편차를 보상할 수 있다. 단일 제제 카보플라틴을 사용한 4-6 mg/㎖/min의 표적 AUC는 이전에 치료된 환자에서 가장 적절한 용량 범위를 제공하는 것으로 보인다.
상기 치료적 요법에 부가하여, 환자는 종양 및/또는 암 세포의 외과 제거를 받을 수 있다.
상기 주지된 이러한 병용 요법은 병용 투여(2 이상의 치료제가 동일한 또는 별도의 제형에 포함되어 있는 경우), 및 별도의 투여를 포함하며, 이 경우, VEGF 길항제 및/또는 PD-L1 축 결합 길항제의 투여는 추가의 치료제 또는 치료제들의 투여 전, 투여와 동시에 및/또는 투여 후에 일어날 수 있다. 일 구현예에서, VEGF 길항제 및/또는 PD-L1 축 결합 길항제의 투여 및 추가 치료제의 투여는 약 1달 내, 또는 약 1주, 2주 또는 3주 내, 또는 약 1, 2, 3, 4, 5, 또는 6일 내에 발생한다.
VEGF 길항제 또는 PD-L1 축 결합 길항제가 항체 (예컨대, 베바시주맙 또는 아테졸리주맙)인 구현예에서, 투여된 항체는 네이키드 항체일 수 있다. 투여된 VEGF 길항제 (예컨대, 항-VEGF 항체, 예컨대 베바시주맙) 및/또는 PD-L1 축 결합 길항제 (예컨대, PD-L1 결합 길항제, 예컨대 아테졸리주맙)는 세포독성제와 콘주게이트될 수 있다. 바람직하게는, 결합된 콘주게이트 및/또는 항원은 세포에 의해 내재화되어 이것이 결합하는 암 세포의 사멸에서 콘주게이트의 증가된 치료적 효능을 유발한다. 바람직한 구현예에서, 세포독성제는 암 세포에서 핵산을 표적으로 하거나 이를 방해할 수 있다. 그와 같은 세포독성제의 예에는 메이탄시노이드, 칼리키아마이신, 리보뉴클레아제 및 DNA 엔도뉴클레아제가 포함된다.
본 명세서에서 기재된 방법에서 이용된 조성물은 하기를 포함하는 임의의 적합한 방법에 의하여 투여될 수 있다: 예를 들면, 정맥내로, 근육내로, 피하로, 진피내로, 피부를 통하게, 동맥내로, 복강내로, 병소내로, 두개내로, 관절내로, 전립선내로, 늑막내로, 기관내로, 척추강내로, 비강내로, 질내로, 직장내로, 국소로, 종양내로, 복막으로, 결막하로, 방광내로, 점막으로, 심막내로, 탯줄내로, 안구내로, 안와내로, 경구로, 국소로, 경피로, 초자체내로 (예를 들면, 초자체내 주사에 의하여), 점안액에 의하여, 흡입으로, 주사로, 이식에 의하여, 주입에 의하여, 연속 주입에 의하여, 표적 세포를 직접적으로 국지화 관류 욕 (localized perfusion bathing)함으로써, 카테터에 의하여, 세척에 의하여, 크림 제형으로, 또는 지질 조성물로. 본 명세서에서 기재된 방법에서 이용된 조성물은 또한 전신으로 또는 국소로 투여될 수 있다. 투여 방법은 다양한 인자 (예를 들면, 투여될 화합물 또는 조성물 및 치료될 병태, 질환, 또는 장애의 중증도)에 따라 가변될 수 있다. 일부 구현예에서, PD-L1 축 결합 길항제는 정맥내로, 근육내로, 피하로, 국소로, 경구로, 경피로, 복강내로, 안와내로, 이식에 의하여, 흡입으로, 척추강내로, 심실내로, 또는 비강내로 투여된다. 투여는 모든 적합한 경로, 예컨대 부분적으로 상기 투여가 간단한 것이냐 또는 만성적인 것이냐에 따라, 주사, 예컨대 정맥내 또는 피하 주사에 의해 이루어진다. 다양한 시점 상에서 단일 또는 다중 투여를 포함하지만 이에 제한되지 않는 다양한 투여 스케줄, 볼러스 투여 및 펄스 주입이 본원에서 고려된다.
Ⅳ. 조성물
일 양태에서, 본 발명은 VEGF 길항제 (예컨대, 항-VEGF 항체, 예컨대 베바시주맙) 및 PD-L1 축 결합 길항제 (예컨대, 항-PD-L1 항체, 예컨대 아테졸리주맙)의 병용이 암 예컨대 신장암에서 항-종양 효과를 갖는다는 발견에 부분적으로 기반한다. 특정 구현예에서, VEGF 길항제 및 PD-L1 축 결합 길항제가 제공된다. 이들 제제들 및 이들의 조합은 예를 들어, 본 명세서에 기재된 임의의 방법 중 일부로서 암의 치료에 유용하다.
A. 예시적인
VEGF
길항제
본 발명의 VEGF 길항제는 VEGF에 결합하거나, VEGF 발현 수준을 감소시키거나, 또는 VEGF 생물학적 활성을 중화, 차단, 억제, 제거, 감소 또는 방해할 수 있는 임의의 분자를 포함한다. 예시적인 인간 VEGF는 UniProtKB/Swiss-Prot 수탁 번호 P15692, 유전자 ID (NCBI): 7422 하에 도시된다.
일부 경우에서, 상기 VEGF 길항제는 항-VEGF 항체이다. 일부 구현예에서, 상기 항-VEGF 항체는 베바시주맙 (또한 "rhuMab VEGF" 또는 "AVASTIN®"로서 공지됨)이다. 또 다른 구현예에서, 베바시주맙은 Presta et al. (Cancer Res. 57:4593-4599, 1997)에 따라 생성된 재조합 인간화 항-VEGF 단클론성 항체이다. 이는 그 수용체에 대한 인간 VEGF의 결합을 차단하는 뮤린 항-hVEGF 단클론성 항체 A.4.6.1로부터의 항원-결합 상보성-결정 영역 및 돌연변이된 인간 IgG1 프레임워크 영역을 포함한다. 베바시주맙의 아미노산 서열의 대략 93%, 예를 들면 상기 프레임워크 영역의 대부분이, 인간 IgG1에서 유도되고, 상기 서열의 약 7%가 뮤린 항체 A4.6.1에서 유도된다. 베바시주맙은 약 149,000 달톤의 분자량을 가지며 글리코실화된다. 베바시주맙과 기타 인간화된 항-VEGF 항체는 2005년 2월 26일에 발행된 미국 특허 제6,884,879호에 추가로 기술되었으며, 이의 전체 개시내용이 본원에 참고로 명시적으로 편입된다. 추가 바람직한 항체는 하기를 포함한다: G6 또는 B20 시리즈 항체 (예컨대, G6-31, B20-4.1) (PCT 출원 공보 번호 WO 2005/012359에 기술됨). 추가 바람직한 항체에 대하여, 하기를 참고한다: 미국 특허 번호 7,060,269, 6,582,959, 6,703,020; 6,054,297; WO98/45332; WO 96/30046; WO94/10202; EP 0666868B1; 미국 특허 출원 공개 번호 2006009360, 20050186208, 20030206899, 20030190317, 20030203409, 및 20050112126; 및 Popkov et al. (Journal of Immunological Methods 288:149-164, 2004). 기타 바람직한 항체는 잔기 F17, M18, D19, Y21, Y25, Q89, 191, K101, E103, 및 C104를 포함하거나, 대안적으로 잔기 F17, Y21, Q22, Y25, D63, 183 및 Q89를 포함하는 인간 VEGF 상에서 기능적 에피토프에 결합하는 것들을 포함한다.
기타 경우에서, VEGF 길항제는 항-VEGFR2 항체 또는 관련 분자 (예를 들면, 라무시루맙, 타니비루맙, 아플리베르셉트), 항-VEGFR1 항체 및 관련된 분자 (예를 들면, 이크루쿠맙, 아플리베르셉트 (VEGF 트랩-아이(Trap-Eye); EYLEA®), 및 지브-아플리베르셉트 (VEGF 트랩; ZALTRAP®)), 이중특이적 VEGF 항체 (예를 들면, MP-0250, 바누시주맙 (VEGF-ANG2), 또는 US 2001/0236388에 개시된 이중특이적 항체), 항-VEGF, 항-VEGFR1, 및 항-VEGFR2 아암 중 둘의 조합을 포함하는 이중특이적 항체, 항-VEGFA 항체 (예를 들면, 베바시주맙, 세바시주맙), 항-VEGFB 항체, 항-VEGFC 항체 (예를 들면, VGX-100), 항-VEGFD 항체, 및 비펩티드 소분자 VEGF 길항제 (예를 들면, 파조파닙, 악시티닙, 반데타닙, 스티바가, 카보잔티닙, 렌바티닙, 닌테다닙, 오란티닙, 텔라티닙, 도비티니그, 세디라닙, 모테사닙, 설파티닙, 아파티닙, 포레티닙, 파미티닙, 또는 티보자닙)이다.
상기 열거된 구현예 중 임의의 것에서 사용하기 위한 본 명세서에 기재된 VEGF 길항제 항체 또는 다른 항체 (예를 들어, VEGF 발현 수준의 검출을 위한 항-VEGF 항체)는 하기 섹션 C의 i 내지 Ⅶ에 기재된, 임의의 특징을 단독으로 또는 조합하여 가질 수 있음이 명확히 고려된다.
B. 예시적 PD-L1 축 결합 길항제
본 발명의 PD-L1 축 결합 길항제는 PD-1 결합 길항제, PD-L1 결합 길항제, 및 PD-L2 결합 길항제를 포함한다. PD-1 (프로그램된 사멸 1) 은 또한 본 분야에서 "프로그램된 세포 사멸 1," "PDCD1," "CD279" 및 "SLEB2"로 지칭된다. 예시적 인간 PD-1는 UniProtKB/Swiss-Prot 수탁번호 Q15116에 나타난다. PD-L1 (프로그램된 사멸 리간드 1)은 또한 본 분야에서 "프로그램된 세포 사멸 1 리간드 1," "PDCD1LG1", "CD274", "B7-H" 및 "PDL1"로 지칭된다. 예시적 인간 PD-L1는 UniProtKB/Swiss-Prot 수탁번호 Q9NZQ7.1에 나타난다. PD-L2 (프로그램된 사멸 리간드 2)은 또한 본 분야에서 "프로그램된 세포 사멸 1 리간드 2," "PDCD1LG2," "CD273," "B7-DC," "Btdc," 및 "PDL2"로 지칭된다. 예시적 인간 PD-L2는 UniProtKB/Swiss-Prot 수탁번호 Q9BQ51에 나타난다. 일부 구현예에서, PD-1, PD-L1, 및 PD-L2 는 인간 PD-1, PD-L1 및 PD-L2이다.
일부 경우에서, PD-L1 축 결합 길항제는 PD-L1 결합 길항제이다. 일부 경우에서, PD-L1 결합 길항제는 이의 리간드 결합 상대의 하나 이상으로의 PD-L1의 결합을 억제한다. 기타 경우에서, PD-L1 결합 길항제는 PD-1로의 PD-L1의 결합을 억제한다. 추가 기타 경우에서, PD-L1 결합 길항제는 B7-1로의 PD-L1의 결합을 억제한다. 일부 경우에서, PD-L1 결합 길항제는 PD-1 및 B7-1 둘 모두으로의 PD-L1의 결합을 억제한다. 일부 경우에서, PD-L1 결합 길항제는 항체이다. 일부 구현예에서, 항체는 하기로 이루어진 군으로부터 선택된다: YW243.55.S70, MPDL3280A (아테졸리주맙), MDX-1105, MEDI4736 (두르발루맙), 및 MSB0010718C (아벨루맙). 일부 구현예에서, 항체는 하기를 포함한다: 서열 번호 19의 HVR-H1 서열, 서열 번호 20의 HVR-H2 서열, 서열 번호 21의 HVR-H3 서열을 포함하는 중쇄, 및 서열 번호 22의 HVR-L1 서열, 서열 번호 23의 HVR-L2 서열, 서열 번호 24의 HVR-L3 서열을 포함하는 경쇄. 일부 구현예에서, 항체는 하기를 포함한다: 서열 번호 26의 아미노산 서열을 포함하는 중쇄 가변 영역, 및 서열 번호 4의 아미노산 서열을 포함하는 경쇄 가변 영역.
일부 경우에서, PD-L1 축 결합 길항제는 PD-1 결합 길항제이다. 예를 들어, 일부 경우에서, PD-1 결합 길항제는 이의 리간드 결합 상대의 하나 이상으로의 PD-1의 결합을 억제한다. 일부 경우에서, PD-1 결합 길항제는 PD-L1으로의 PD-1의 결합을 억제한다. 기타 경우에서, PD-1 결합 길항제는 PD-L2으로의 PD-1의 결합을 억제한다. 추가 기타 경우에서, PD-1 결합 길항제는 PD-L1 및 PD-L2 둘 모두으로의 PD-1의 결합을 억제한다. 일부 경우에서, PD-1 결합 길항제는 항체이다. 일부 경우에서, 항체는 하기로 이루어진 군으로부터 선택된다: MDX 1106 (니볼루맙), MK-3475 (펨브롤리주맙), CT-011 (피딜리주맙), MEDI-0680 (AMP-514), PDR001, REGN2810, 및 BGB-108. 일부 경우에서, PD-1 결합 길항제는 Fc-융합 단백질이다. 예를 들어, 일부 경우에서, Fc-융합 단백질은 AMP-224이다.
추가 양태에서, 본 발명은 약제의 제작 또는 제조에서 PD-L1 축 결합 길항제의 사용를 위해 제공된다. 하나의 구현예에서, 약제는 암의 치료용이다. 추가 구현예에서, 약제는 암 (예컨대, 신장암 (예컨대, 신장 세포 암종 (RCC), 예컨대, 전이성 RCC (mRCC))을 앓는 환자에게 유효량의 약제를 투여하는 단계를 포함하는, 암을 치료하는 방법에서 사용하기 위한 것이다. 일 상기 구현예에서, 상기 방법은 예를 들어, 하기 기재된 바와 같이 적어도 하나의 추가 치료제의 유효량을 개체에게 투여하는 단계를 추가로 포함한다.
일부 구현예에서, PD-1 결합 길항제는 이의 리간드 결합 상대로의 PD-1 결합을 억제하는 분자이다. 특정 양태에서, PD-1 리간드 결합 상대는 PD-L1 및/또는 PD-L2이다. 일부 구현예에서, PD-L1 결합 길항제는 이의 결합 리간드로의 PD-L1 결합을 억제하는 분자이다. 특정 양태에서, PD-L1 결합 상대는 PD-1 및/또는 B7-1이다. 또 다른 구현예에서, PD-L2 결합 길항제는 이의 리간드 결합 상대로의 PD-L2 결합을 억제하는 분자이다. 특정 양태에서, PD-L2 결합 리간드 상대는 PD-1이다. 길항제는 하기일 수 있다: 항체, 이의 항원 결합 단편, 면역콘주게이트, 융합 단백질, 또는 올리고펩티드.
일부 구현예에서, PD-1 결합 길항제는 예를 들어, 하기에 기술된, 항-PD-1 항체 (예컨대, 인간 항체, 인간화 항체, 또는 키메라 항체)이다. 일부 구현예에서, 항-PD-1 항체는 하기로 이루어진 군으로부터 선택된다: MDX-1106 (니볼루맙), MK-3475 (펨브롤리주맙), CT-011 (피딜리주맙), MEDI-0680 (AMP-514), PDR001, REGN2810, 및 BGB-108. MDX-1106 (또한 MDX-1106-04, ONO-4538, BMS-936558, 또는 니볼루맙으로 공지됨)은 WO2006/121168에 기술된 항-PD-1 항체이다. MK-3475 (또한 펨브롤리주맙 또는 람브롤리주맙으로 공지됨)은 WO 2009/114335에 기술된 항-PD-1 항체이다. CT-011 (또한 hBAT, hBAT-1 또는 피딜리주맙으로 공지됨)은 WO 2009/101611 에 기술된 항-PD-1 항체이다. 일부 구현예에서, PD-1 결합 길항제는, 면역접합체 (예컨대, 불변 영역 (예컨대, 면역글로불린 서열의 Fc 영역)에 융합된 PD-L1 또는 PD-L2의 세포외 또는 PD-1 결합부를 포함하는 면역접합체)이다. 일부 구현예에서, PD-1 결합 길항제는 AMP-224이다. AMP-224 (또한 B7-DCIg 로 공지됨)은 WO 2010/027827 및 WO 2011/066342에 기술된 PD-L2 Fc 융합 가용성 수용체이다.
일부 구현예에서, 항-PD-1 항체는 MDX-1106이다. "MDX-1106"에 대한 대안적 명칭은 하기를 포함한다: MDX-1106-04, ONO-4538, BMS-936558, 및 니볼루맙. 일부 구현예에서, 항-PD-1 항체는 하기이다: 니볼루맙 (CAS 등록 번호: 946414-94-4). 또한 추가의 구현예에서, 하기를 포함하는 단리된 항-PD-1 항체가 제공된다: 서열 번호 1 유래의 중쇄 가변 영역 아미노산 서열을 포함하는 중쇄 가변 영역 및/또는 서열 번호 2 유래의 경쇄 가변 영역 아미노산 서열을 포함하는 경쇄 가변 영역. 또한 추가의 구현예에서, 중쇄 및/또는 경쇄 서열을 포함하는 단리된 항-PD-1 항체가 본원에서 제공되고, 여기서:
(a) 중쇄 서열은, 상기 중쇄 서열에 대한 적어도 85%, 적어도 90%, 적어도 91%, 적어도 92%, 적어도 93%, 적어도 94%, 적어도 95%, 적어도 96%, 적어도 97%, 적어도 98%, 적어도 99% 또는 100% 서열 동일성을 갖고:
(b) 경쇄 서열은, 상기 경쇄 서열에 대한 적어도 85%, 적어도 90%, 적어도 91%, 적어도 92%, 적어도 93%, 적어도 94%, 적어도 95%, 적어도 96%, 적어도 97%, 적어도 98%, 적어도 99% 또는 100% 서열 동일성을 갖는다:
일부 구현예에서, PD-L1 축 결합 길항제는 PD-L2 결합 길항제이다. 일부 구현예에서, PD-L2 결합 길항제는 항-PD-L2 항체 (예컨대, 인간 항체, 인간화 항체, 또는 키메라 항체)이다. 일부 구현예에서, PD-L2 결합 길항제는 면역접합체이다.
일부 구현예에서, PD-L1 결합 길항제는 예를 들어 하기에 기술된 바와 같은 항-PD-L1 항체이다. 일부 구현예에서, 항-PD-L1 항체는 PD-L1 및 PD-1 사이의 및/또는 PD-L1 및 B7-1 사이의 결합을 억제할 수 있다. 일부 구현예에서, 항-PD-L1 항체는 단클론성 항체이다. 일부 구현예에서, 항-PD-L1 항체는 Fab, Fab’-SH, Fv, scFv, 및 (Fab’)2 단편으로 이루어진 군으로부터 선택된 항체 단편이다. 일부 구현예에서, 항-PD-L1 항체는 인간화 항체이다. 일부 구현예에서, 항-PD-L1 항체는 인간 항체이다. 일부 구현예에서, 항-PD-L1 항체는 하기로 이루어진 군으로부터 선택된다: YW243.55.S70, MPDL3280A (아테졸리주맙), MDX-1105, 및 MEDI4736 (두르발루맙), 및 MSB0010718C (아벨루맙). 항체 YW243.55.S70은 WO 2010/077634에 기술된 항-PD-L1 이다. MDX-1105 (또한 BMS-936559로 공지됨)는 WO2007/005874에 기술된 항-PD-L1 항체이다. MEDI4736 (두르발루맙)은 WO2011/066389 및 US2013/034559에 기술된 항-PD-L1 단클론성 항체이다. 본 발명의 방법에 유용한 항-PD-L1 항체 및 이를 제조하기 위한 방법의 예시는 하기에 기술된다: PCT 특허 출원 WO 2010/077634, WO 2007/005874, WO 2011/066389, 미국 특허 번호 8,217,149, 및 US 2013/034559 (이의 내용이 본원에 참조로서 편입됨).
WO 2010/077634 A1 및 US 8,217,149에 기재된 항-PD-L1 항체가 본 명세서에서 기재된 방법에서 사용될 수 있다. 일부 구현예에서, 항-PD-L1 항체는 하기를 포함한다: 서열 번호 3의 중쇄 가변 영역 서열 및/또는 서열 번호 4의 경쇄 가변 영역 서열. 또한 추가의 구현예에서, 중쇄 가변 영역 및/또는 경쇄 가변 영역 서열을 포함하는 단리된 항-PD-L1 항체가 본원에서 제공되고, 여기서:
(a) 중쇄 서열은, 상기 중쇄 서열에 대한 적어도 85%, 적어도 90%, 적어도 91%, 적어도 92%, 적어도 93%, 적어도 94%, 적어도 95%, 적어도 96%, 적어도 97%, 적어도 98%, 적어도 99% 또는 100% 서열 동일성을 갖고:
(b) 경쇄 서열은, 상기 경쇄 서열에 대한 적어도 85%, 적어도 90%, 적어도 91%, 적어도 92%, 적어도 93%, 적어도 94%, 적어도 95%, 적어도 96%, 적어도 97%, 적어도 98%, 적어도 99% 또는 100% 서열 동일성을 갖는다:
일 구현예에서, 상기 항-PD-L1 항체는 HVR-H1, HVR-H2 및 HVR-H3 서열을 포함하는 중쇄 가변 영역을 포함하고, 여기서:
(a) HVR-H1 서열은 하기이다: GFTFSX1SWIH (서열 번호 5);
(b) HVR-H2 서열은 하기이다: AWIX2PYGGSX3YYADSVKG (서열 번호 6);
(c) HVR-H3 서열은 하기이다: RHWPGGFDY (서열 번호 7);
추가로, 상기 식 중에서, X1은 D 또는 G이며; X2는 S 또는 L이며; X3은 T 또는 S이다. 일 특정 양태에서, X1는 D이며; X2는 S이며, 그리고 X3는 T이다. 또 다른 양태에서, 상기 폴리펩티드는 다음 구조식에 따른 HVR들 사이에 나란히 놓인 가변 영역 중쇄 프레임워크 서열을 추가로 포함한다: (FR-H1)-(HVR-H1)-(FR-H2)-(HVR-H2)-(FR-H3)-(HVR-H3)-(FR-H4). 추가의 또 다른 양태에서, 상기 프레임워크 서열은 인간 공통 프레임워크 서열로부터 유도된다. 추가 양태에서, 상기 프레임워크 서열은 VH 하위그룹 Ⅲ 공통 프레임워크이다. 또 다른 추가의 양태에서, 상기 프레임워크 서열 중 적어도 하나는 하기와 같다:
FR-H1은 하기임: EVQLVESGGGLVQPGGSLRLSCAAS (서열 번호 8)
FR-H2은 하기임: WVRQAPGKGLEWV (서열 번호 9)
FR-H3은 하기임: RFTISADTSKNTAYLQMNSLRAEDTAVYYCAR (서열 번호 10)
FR-H4은 하기임: WGQGTLVTVSA (서열 번호 11).
또 다른 추가의 양태에서, 중쇄 폴리펩티드는 HVR-L1, HVR-L2 및 HVR-L3를 포함하는 가변 영역 경쇄와 추가로 조합되고, 여기서:
(a) HVR-L1 서열은 하기이다: RASQX4X5X6TX7X8A(서열 번호 12);
(b) HVR-L2 서열은 하기이다: SASX9LX10S, (서열 번호 13);
(c) HVR-L3 서열은 하기이다: QQX11X12X13X14PX15T(서열 번호 14);
여기서: X4는 D 또는 V이며; X5는 V 또는 I이며; X6는 S 또는 N이며; X7는 A 또는 F이며; X8는 V 또는 L이며; X9는 F 또는 T이며; X10는 Y 또는 A이며; X11는 Y, G, F, 또는 S이며; X12는 L, Y, F 또는 W이며; X13는 Y, N, A, T, G, F 또는 I이며; X14 는 H, V, P, T 또는 I이며; X15는 A, W, R, P 또는 T이다. 또 다른 추가의 양태에서, X4는 D이며; X5는 V이며; X6는 S이며; X7는 A이며; X8는 V이며; X9는 F이며; X10는 Y이며; X11는 Y이며; X12는 L이며; X13는 Y이며; X14는 H이며; X15는 A이다.
또 다른 추가 양태에서, 경쇄는 하기 화학식에 따라 HVR들 사이에 병치된 가변 영역 중쇄 프레임워크 서열을 추가로 포함한다: (FR-L1)-(HVR-L1)-(FR-L2)-(HVR-L2)-(FR-L3)-(HVR-L3)-(FR-L4). 또 다른 추가의 양태에서, 상기 프레임워크 서열은 인간 공통 프레임워크 서열로부터 유도된다. 또 다른 추가의 양태에서, 상기 프레임워크 서열은 VL 카파 I 공통 프레임워크이다. 또 다른 추가의 양태에서, 상기 프레임워크 서열 중 적어도 하나는 하기와 같다:
FR-L1은 하기임: DIQMTQSPSSLSASVGDRVTITC(서열 번호 15)
FR-L2은 하기임: WYQQKPGKAPKLLIY(서열 번호 16)
FR-L3은 하기임: GVPSRFSGSGSGTDFTLTISSLQPEDFATYYC(서열 번호 17)
FR-L4은 하기임: FGQGTKVEIKR(서열 번호 18).
또 다른 구현예에서, 중쇄 및 경쇄 가변 영역 서열을 포함하는 단리된 항-PD-L1 항체 또는 항원 결합 단편이 제공되고, 여기서:
(a) 상기 중쇄는 그리고 HVR-H1, HVR-H2 및 HVR-H3를 포함하고, 여기서 추가로:
(i) HVR-H1 서열은 하기이다: GFTFSX1SWIH; (서열 번호 5)
(ⅱ) HVR-H2 서열은 하기이다: AWIX2PYGGSX3YYADSVKG (서열 번호 6)
(ⅲ) HVR-H3 서열은 하기이다: RHWPGGFDY (서열 번호 7)
(b) 상기 경쇄는 HVR-L1, HVR-L2 및 HVR-L3를 포함하고, 여기서 추가로:
(i) HVR-L1 서열은 하기이다: RASQX4X5X6TX7X8A (서열 번호 12)
(ⅱ) HVR-L2 서열은 하기이다: SASX9LX10S(서열 번호 13)
(ⅲ) HVR-L3 서열은 하기이다: QQX11X12X13X14PX15T; (서열 번호 14)
상기 식 중: X1는 D 또는 G이며; X2는 S 또는 L이며; X3는 T 또는 S이며; X4는 D 또는 V이며; X5는 V 또는 I이며; X6는 S 또는 N이며; X7는 A 또는 F이며; X8는 V 또는 L이며; X9는 F 또는 T이며; X10는 Y 또는 A이며; X11는 Y, G, F, 또는 S이며; X12는 L, Y, F 또는 W이며; X13는 Y, N, A, T, G, F 또는 I이며; X14는 H, V, P, T 또는 I이며; X15는 A, W, R, P 또는 T이다. 특정 양태에서, X1는 D이며; X2는 S이고, 그리고 X3는 T이다. 또 다른 양태에서, X4 는 D이며; X5는 V이며; X6는 S이며; X7는 A이며; X8는 V이며; X9는 F이며; X10는 Y이며; X11는 Y이며; X12는 L이며; X13는 Y이며; X14는 H이며; X15는 A이다. 추가의 또 다른 양태에서, X1는 D이며; X2는 S이고, 그리고 X3는 T이며, X4는 D이며; X5는 V이며; X6는 S이며; X7는 A이며; X8는 V이며; X9는 F이며; X10는 Y이며; X11는 Y이며; X12는 L이며; X13는 Y이며; X14는 H이고, 그리고 X15 는 A이다.
추가 양태에서, 중쇄 가변 영역은 다음과 같이 HVR들 사이에 나란히 놓인 하나 이상의 프레임워크 서열을 포함한다: (FR-H1)-(HVR-H1)-(FR-H2)-(HVR-H2)-(FR-H3)-(HVR-H3)-(FR-H4),그리고 경쇄 가변 영역은 다음과 같이 HVR들 사이에 나란히 놓인 하나 이상의 프레임워크 서열을 포함한다: (FR-L1)-(HVR-L1)-(FR-L2)-(HVR-L2)-(FR-L3)-(HVR-L3)-(FR-L4). 또 다른 추가의 양태에서, 상기 프레임워크 서열은 인간 공통 프레임워크 서열로부터 유도된다. 또 다른 추가의 양태에서, 중쇄 프레임워크 서열은 카밧 하위그룹 I, Ⅱ 또는 Ⅲ 서열로부터 유도된다. 또 다른 추가의 양태에서, 중쇄 프레임워크 서열은 VH 하위그룹 Ⅲ 공통 프레임워크이다. 또 다른 추가의 양태에서, 중쇄 프레임워크 서열 중 하나 이상은 서열 번호 8, 9, 10 및 11로 제시된다. 또 다른 추가 양태에서, 경쇄 프레임워크 서열은 카밧 카파 I, Ⅱ, Ⅲ 또는 Ⅳ 하위그룹 서열로부터 유도된다. 또 다른 추가 양태에서, 경쇄 프레임워크 서열은 VL 카파 I 공통 프레임워크이다. 또 다른 추가의 양태에서, 경쇄 프레임워크 서열 중 하나 이상은 서열 번호 15, 16, 17 및 18로 제시된다.
추가의 특정 양태에서, 항체는 인간 또는 뮤린 불변 영역을 추가로 포함한다. 또 다른 추가 양태에서, 인간 불변 영역은 IgG1, IgG2, IgG2, IgG3, IgG4로 이루어진 군으로부터 선택된다. 또 다른 추가의 특정 양태에서, 인간 불변 영역은 IgG1이다. 또 다른 추가 양태에서, 뮤린 불변 영역은 IgG1, IgG2A, IgG2B, IgG3로 이루어진 군으로부터 선택된다. 또 다른 추가 양태에서, 뮤린 불변 영역은 IgG2A이다. 또 다른 추가의 특이적 양태에서, 항체는 감소되거나 최소의 효과기 기능을 갖는다. 또 다른 추가의 특정 양태에서, 최소의 효과기 기능은 "효과기-미만(effector-less) Fc 변형" 또는 탈글리코실화로부터 유발된다. 또 다른 추가 구현예에서, 효과기-없는 Fc 돌연변이는 불변 영역에서 N297A 또는 D265A/N297A 치환이다.
추가의 또 다른 구현예에서, 중쇄 및 경쇄 가변 영역 서열을 포함하는 항-PD-L1 항체가 제공되고, 여기서:
(a) 중쇄는 추가로 GFTFSDSWIH (서열 번호 19), AWISPYGGSTYYADSVKG (서열 번호 20) 및 RHWPGGFDY (서열 번호 21)의 각각에 대해 적어도 85%의 서열 동일성을 갖는 HVR-H1, HVR-H2 및 HVR-H3 서열을 포함하거나, 또는
(b) 경쇄는 추가로 RASQDVSTAVA (서열 번호 22), SASFLYS (서열 번호 23) 및 QQYLYHPAT (서열 번호 24)의 각각에 대해 적어도 85%의 서열 동일성을 갖는 HVR-L1, HVR-L2 및 HVR-L3 서열을 포함한다.
특정 양태에서, 서열 동일성은 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% 또는 100%이다.
또 다른 양태에서, 중쇄 가변 영역은 다음과 같이 HVR들 사이에 나란히 놓인 하나 이상의 프레임워크 서열을 포함한다: (FR-H1)-(HVR-H1)-(FR-H2)-(HVR-H2)-(FR-H3)-(HVR-H3)-(FR-H4), 그리고 경쇄 가변 영역은 다음과 같이 HVR들 사이에 나란히 놓인 하나 이상의 프레임워크 서열을 포함한다: (FR-L1)-(HVR-L1)-(FR-L2)-(HVR-L2)-(FR-L3)-(HVR-L3)-(FR-L4). 추가의 또 다른 양태에서, 상기 프레임워크 서열은 인간 공통 프레임워크 서열로부터 유도된다. 또 다른 추가의 양태에서, 중쇄 프레임워크 서열은 카밧 하위그룹 I, Ⅱ 또는 Ⅲ 서열로부터 유도된다. 또 다른 추가의 양태에서, 중쇄 프레임워크 서열은 VH 하위그룹 Ⅲ 공통 프레임워크이다. 또 다른 추가의 양태에서, 중쇄 프레임워크 서열 중 하나 이상은 서열 번호 8, 9, 10 및 11로 제시된다. 또 다른 추가 양태에서, 경쇄 프레임워크 서열은 카밧 카파 I, Ⅱ, Ⅲ 또는 Ⅳ 하위그룹 서열로부터 유도된다. 또 다른 추가 양태에서, 경쇄 프레임워크 서열은 VL 카파 I 공통 프레임워크이다. 또 다른 추가의 양태에서, 경쇄 프레임워크 서열 중 하나 이상은 서열 번호 15, 16, 17 및 18로 제시된다.
추가의 특정 양태에서, 항체는 인간 또는 뮤린 불변 영역을 추가로 포함한다. 또 다른 추가 양태에서, 인간 불변 영역은 IgG1, IgG2, IgG2, IgG3, IgG4로 이루어진 군으로부터 선택된다. 또 다른 추가의 특정 양태에서, 인간 불변 영역은 IgG1이다. 또 다른 추가 양태에서, 뮤린 불변 영역은 IgG1, IgG2A, IgG2B, IgG3로 이루어진 군으로부터 선택된다. 또 다른 추가 양태에서, 뮤린 불변 영역은 IgG2A이다. 또 다른 추가의 특이적 양태에서, 항체는 감소되거나 최소의 효과기 기능을 갖는다. 또 다른 추가의 특정 양태에서, 최소의 효과기 기능은 "효과기-미만(effector-less) Fc 변형" 또는 탈글리코실화로부터 유발된다. 또 다른 추가 구현예에서, 효과기-없는 Fc 돌연변이는 불변 영역에서 N297A 또는 D265A/N297A 치환이다.
또 다른 추가의 구현예에서, 중쇄 및 경쇄 가변 영역 서열을 포함하는 단리된 항-PD-L1 항체가 본원에서 제공되고, 여기서:
(a) 중쇄 서열은 하기 중쇄에 적어도 85% 서열 동일성을 가지며:
(b) 경쇄 서열은 하기 경쇄에 적어도 85% 서열 동일성을 갖는다:
특정 양태에서, 서열 상동성은 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% 또는 100%이다. 또 다른 양태에서, 중쇄 가변 영역은 다음과 같이 HVR들 사이에 나란히 놓인 하나 이상의 프레임워크 서열을 포함한다: (FR-H1)-(HVR-H1)-(FR-H2)-(HVR-H2)-(FR-H3)-(HVR-H3)-(FR-H4), 그리고 경쇄 가변 영역은 다음과 같이 HVR들 사이에 나란히 놓인 하나 이상의 프레임워크 서열을 포함한다: (FR-L1)-(HVR-L1)-(FR-L2)-(HVR-L2)-(FR-L3)-(HVR-L3)-(FR-L4). 추가의 또 다른 양태에서, 상기 프레임워크 서열은 인간 공통 프레임워크 서열로부터 유도된다. 추가 양태에서, 중쇄 프레임워크 서열은 카밧 하위그룹 I, Ⅱ, 또는 Ⅲ 서열로부터 유도된다. 또 다른 추가의 양태에서, 중쇄 프레임워크 서열은 VH 하위그룹 Ⅲ 공통 프레임워크이다. 또 다른 추가의 양태에서, 중쇄 프레임워크 서열 중 하나 이상은 서열 번호 8, 9, 10 및 WGQGTLVTVSS (서열 번호 27)로 제시된다.
또 다른 추가 양태에서, 경쇄 프레임워크 서열은 카밧 카파 I, Ⅱ, Ⅲ 또는 Ⅳ 하위그룹 서열로부터 유도된다. 또 다른 추가 양태에서, 경쇄 프레임워크 서열은 VL 카파 I 공통 프레임워크이다. 또 다른 추가의 양태에서, 경쇄 프레임워크 서열 중 하나 이상은 서열 번호 15, 16, 17 및 18로 제시된다.
추가의 특정 양태에서, 항체는 인간 또는 뮤린 불변 영역을 추가로 포함한다. 또 다른 추가 양태에서, 인간 불변 영역은 IgG1, IgG2, IgG2, IgG3, IgG4로 이루어진 군으로부터 선택된다. 또 다른 추가의 특정 양태에서, 인간 불변 영역은 IgG1이다. 또 다른 추가 양태에서, 뮤린 불변 영역은 IgG1, IgG2A, IgG2B, IgG3로 이루어진 군으로부터 선택된다. 또 다른 추가 양태에서, 뮤린 불변 영역은 IgG2A이다. 또 다른 추가의 특이적 양태에서, 항체는 감소되거나 최소의 효과기 기능을 갖는다. 또 다른 추가의 특정 양태에서, 최소의 효과기 작용은 원핵세포 생산으로부터 유발된다. 또 다른 추가의 특정 양태에서, 최소의 효과기 기능은 "효과기-미만 Fc 변형" 또는 탈글리코실화로부터 유발된다. 또 다른 추가 구현예에서, 효과기-없는 Fc 돌연변이는 불변 영역에서 N297A 또는 D265A/N297A 치환이다.
추가 양태에서, 중쇄 가변 영역은 다음과 같이 HVR들 사이에 병치된 하나 이상의 프레임워크 서열을 포함한다: (FR-H1)-(HVR-H1)-(FR-H2)-(HVR-H2)-(FR-H3)-(HVR-H3)-(FR-H4). 그리고 경쇄 가변 영역은 다음과 같이 HVR들 사이에 나란히 놓인 하나 이상의 프레임워크 서열을 포함한다: (FR-L1)-(HVR-L1)-(FR-L2)-(HVR-L2)-(FR-L3)-(HVR-L3)-(FR-L4). 또 다른 추가의 양태에서, 상기 프레임워크 서열은 인간 공통 프레임워크 서열로부터 유도된다. 또 다른 추가의 양태에서, 중쇄 프레임워크 서열은 카밧 하위그룹 I, Ⅱ 또는 Ⅲ 서열로부터 유도된다. 또 다른 추가의 양태에서, 중쇄 프레임워크 서열은 VH 하위그룹 Ⅲ 공통 프레임워크이다. 또 다른 추가 양태에서, 하나 이상의 중쇄 프레임워크 서열은 하기이다:
또 다른 추가 양태에서, 경쇄 프레임워크 서열은 카밧 카파 I, Ⅱ, Ⅲ, 또는 Ⅳ 하위그룹 서열로부터 유도된다. 또 다른 추가 양태에서, 경쇄 프레임워크 서열은 VL 카파 I 공통 프레임워크이다. 또 다른 추가 양태에서, 하나 이상의 경쇄 프레임워크 서열은 하기이다:
추가의 특정 양태에서, 항체는 인간 또는 뮤린 불변 영역을 추가로 포함한다. 또 다른 추가 양태에서, 인간 불변 영역은 IgG1, IgG2, IgG2, IgG3, IgG4로 이루어진 군으로부터 선택된다. 또 다른 추가의 특정 양태에서, 인간 불변 영역은 IgG1이다. 또 다른 추가 양태에서, 뮤린 불변 영역은 IgG1, IgG2A, IgG2B, IgG3로 이루어진 군으로부터 선택된다. 또 다른 추가 양태에서, 뮤린 불변 영역은 IgG2A이다. 또 다른 추가의 특이적 양태에서, 항체는 감소되거나 최소의 효과기 기능을 갖는다. 또 다른 추가의 특정 양태에서, 최소의 효과기 기능은 "효과기-미만 Fc 변형" 또는 탈글리코실화로부터 유발된다. 또 다른 추가 구현예에서, 효과기-없는 Fc 돌연변이는 불변 영역에서 N297A 또는 D265A/N297A 치환이다.
추가의 또 다른 구현예에서, 중쇄 및 경쇄 가변 영역 서열을 포함하는 항-PD-L1 항체가 제공되고, 여기서:
(c) 중쇄는 추가로 GFTFSDSWIH (서열 번호 19), AWISPYGGSTYYADSVKG (서열 번호 20) 및 RHWPGGFDY (서열 번호 21)의 각각에 대해 적어도 85%의 서열 동일성을 갖는 HVR-H1, HVR-H2 및 HVR-H3 서열을 포함하며, 그리고/또는
(d) 경쇄는 추가로 RASQDVSTAVA (서열 번호 22), SASFLYS (서열 번호 23) 및 QQYLYHPAT (서열 번호 24) 각각에 대해 적어도 85%의 서열 동일성을 갖는 HVR-L1, HVR-L2 및 HVR-L3 서열을 포함한다.
특정 양태에서, 서열 동일성은 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% 또는 100%이다.
또 다른 양태에서, 중쇄 가변 영역은 다음과 같이 HVR들 사이에 나란히 놓인 하나 이상의 프레임워크 서열을 포함한다: (FR-H1)-(HVR-H1)-(FR-H2)-(HVR-H2)-(FR-H3)-(HVR-H3)-(FR-H4), 그리고 경쇄 가변 영역은 다음과 같이 HVR들 사이에 나란히 놓인 하나 이상의 프레임워크 서열을 포함한다: (FR-L1)-(HVR-L1)-(FR-L2)-(HVR-L2)-(FR-L3)-(HVR-L3)-(FR-L4). 추가의 또 다른 양태에서, 상기 프레임워크 서열은 인간 공통 프레임워크 서열로부터 유도된다. 또 다른 추가의 양태에서, 중쇄 프레임워크 서열은 카밧 하위그룹 I, Ⅱ, 또는 Ⅲ 서열로부터 유도된다. 또 다른 추가의 양태에서, 중쇄 프레임워크 서열은 VH 하위그룹 Ⅲ 공통 프레임워크이다. 또 다른 추가의 양태에서, 중쇄 프레임워크 서열 중 하나 이상은 서열 번호 8, 9, 10 및 WGQGTLVTVSSASTK (서열 번호 31)로 제시된다.
또 다른 추가 양태에서, 경쇄 프레임워크 서열은 카밧 카파 I, Ⅱ, Ⅲ, 또는 Ⅳ 하위그룹 서열로부터 유도된다. 또 다른 추가 양태에서, 경쇄 프레임워크 서열은 VL 카파 I 공통 프레임워크이다. 또 다른 추가의 양태에서, 경쇄 프레임워크 서열 중 하나 이상은 서열 번호 15, 16, 17 및 18로 제시된다. 추가의 특정 양태에서, 항체는 인간 또는 뮤린 불변 영역을 추가로 포함한다. 또 다른 추가 양태에서, 인간 불변 영역은 IgG1, IgG2, IgG2, IgG3, IgG4로 이루어진 군으로부터 선택된다. 또 다른 추가의 특정 양태에서, 인간 불변 영역은 IgG1이다. 또 다른 추가 양태에서, 뮤린 불변 영역은 IgG1, IgG2A, IgG2B, IgG3로 이루어진 군으로부터 선택된다. 또 다른 추가 양태에서, 뮤린 불변 영역은 IgG2A이다. 또 다른 추가의 특이적 양태에서, 항체는 감소되거나 최소의 효과기 기능을 갖는다. 또 다른 추가의 특정 양태에서, 최소의 효과기 기능은 "효과기-미만 Fc 변형" 또는 탈글리코실화로부터 유발된다. 또 다른 추가 구현예에서, 효과기-없는 Fc 돌연변이는 불변 영역에서 N297A 또는 D265A/N297A 치환이다.
또한 추가의 구현예에서, 중쇄 및 경쇄 가변 영역 서열을 포함하는 단리된 항-PD-L1 항체가 본원에서 제공되고, 여기서:
(a) 중쇄 서열은 하기 중쇄에 적어도 85% 서열 동일성을 갖는다:
(b) 경쇄 서열은 하기 경쇄에 적어도 85% 서열 동일성을 갖는다:
일부 구현예에서, 중쇄 및 경쇄 가변 영역 서열을 포함하는 단리된 항-PD-L1 항체가 제공되며, 여기서 상기 경쇄 가변 영역 서열은 서열 번호 4의 아미노산 서열에 적어도 85%, 적어도 86%, 적어도 87%, 적어도 88%, 적어도 89%, 적어도 90%, 적어도 91%, 적어도 92%, 적어도 93%, 적어도 94%, 적어도 95%, 적어도 96%, 적어도 97%, 적어도 98%, 적어도 99% 또는 100% 서열 동일성을 갖는다. 일부 구현예에서, 중쇄 및 경쇄 가변 영역 서열을 포함하는 단리된 항-PD-L1 항체가 제공되며, 여기서 상기 중쇄 가변 영역 서열은 서열 번호 26의 아미노산 서열에 적어도 85%, 적어도 86%, 적어도 87%, 적어도 88%, 적어도 89%, 적어도 90%, 적어도 91%, 적어도 92%, 적어도 93%, 적어도 94%, 적어도 95%, 적어도 96%, 적어도 97%, 적어도 98%, 적어도 99% 또는 100% 서열 동일성을 갖는다. 일부 구현예에서, 중쇄 및 경쇄 가변 영역 서열을 포함하는 단리된 항-PD-L1 항체가 제공되며, 여기서 상기 경쇄 가변 영역 서열은 서열 번호 4의 아미노산 서열에 적어도 85%, 적어도 86%, 적어도 87%, 적어도 88%, 적어도 89%, 적어도 90%, 적어도 91%, 적어도 92%, 적어도 93%, 적어도 94%, 적어도 95%, 적어도 96%, 적어도 97%, 적어도 98%, 적어도 99% 또는 100% 서열 동일성을 가지며, 그리고 상기 중쇄 가변 영역 서열은 서열 번호 26의 아미노산 서열에 적어도 85%, 적어도 86%, 적어도 87%, 적어도 88%, 적어도 89%, 적어도 90%, 적어도 91%, 적어도 92%, 적어도 93%, 적어도 94%, 적어도 95%, 적어도 96%, 적어도 97%, 적어도 98%, 적어도 99% 또는 100% 서열 동일성을 갖는다. 일부 구현예에서, 중쇄 및/또는 경쇄의 N-말단에서 1, 2, 3, 4 또는 5 아미노산 잔기가 결실, 치환된 또는 변형될 수 있다.
또한 추가의 구현예에서, 중쇄 및 경쇄 서열을 포함하는 단리된 항-PD-L1 항체가 본원에서 제공되고, 여기서:
(a) 중쇄 서열은 하기 중쇄에 적어도 85% 서열 동일성을 가지며:
(b) 경쇄 서열은 하기 경쇄에 적어도 85% 서열 동일성을 갖는다:
일부 구현예에서, 중쇄 및 경쇄 서열을 포함하는 단리된 항-PD-L1 항체가 제공되며, 여기서 상기 경쇄 서열은 서열 번호 33의 아미노산 서열에 적어도 85%, 적어도 86%, 적어도 87%, 적어도 88%, 적어도 89%, 적어도 90%, 적어도 91%, 적어도 92%, 적어도 93%, 적어도 94%, 적어도 95%, 적어도 96%, 적어도 97%, 적어도 98%, 또는 적어도 99% 서열 동일성을 갖는다. 일부 구현예에서, 중쇄 및 경쇄 서열을 포함하는 단리된 항-PD-L1 항체가 제공되며, 여기서 상기 중쇄 서열은 서열 번호 32의 아미노산 서열에 적어도 85%, 적어도 86%, 적어도 87%, 적어도 88%, 적어도 89%, 적어도 90%, 적어도 91%, 적어도 92%, 적어도 93%, 적어도 94%, 적어도 95%, 적어도 96%, 적어도 97%, 적어도 98%, 또는 적어도 99% 서열 동일성을 갖는다. 일부 구현예에서, 중쇄 및 경쇄 서열을 포함하는 단리된 항-PD-L1 항체가 제공되며, 여기서 상기 경쇄 서열은 서열 번호 33의 아미노산 서열에 적어도 85%, 적어도 86%, 적어도 87%, 적어도 88%, 적어도 89%, 적어도 90%, 적어도 91%, 적어도 92%, 적어도 93%, 적어도 94%, 적어도 95%, 적어도 96%, 적어도 97%, 적어도 98%, 또는 적어도 99% 서열 동일성을 가지며, 그리고 상기 중쇄 서열은 서열 번호 32의 아미노산 서열에 적어도 85%, 적어도 86%, 적어도 87%, 적어도 88%, 적어도 89%, 적어도 90%, 적어도 91%, 적어도 92%, 적어도 93%, 적어도 94%, 적어도 95%, 적어도 96%, 적어도 97%, 적어도 98%, 또는 적어도 99% 서열 동일성을 갖는다.
일부 구현예에서, 단리된 항-PD-L1 항체는 탈글리코실화된다. 항체의 글리코실화는 전형적으로 N-연결 또는 O-연결이다. "N-연결됨"은 탄수화물 모이어티가 아스파라긴 잔기의 측쇄에 부착하는 것을 지칭한다. 트리펩티드 서열 아스파라긴-X-세린, 및 아스파라긴-X-트레오닌 (여기에서 X는 프롤린을 제외한 임의의 아미노산이다)은 아스파라긴 측쇄에 탄수화물 모이어티의 효소 부착을 위한 인식 서열이다. 따라서, 폴리펩티드 내 상기 트리펩티드 서열의 존재는 잠재적인 글리코실화 부위를 생성한다. O-연결된 글리코실화는 하이드록시아미노산, 가장 일반적으로는 세린 또는 트레오닌으로의 당 N-아세틸갈락토사민, 갈락토오스 또는 자일로스의 부착을 의미하지만, 5-하이드록시프롤린 또는 5-하이드록시라이신이 또한 사용될 수 있다. 항체에 글리코실화 부위 형태의 제거는, 아미노산 서열을 변경함으로써 편리하게 달성되고 이로써 (N-연결 글리코실화 부위에 대한) 상기-기재된 트리펩티드 서열 중 하나가 제거된다. 글리코실화 부위 내에 아스파라긴, 세린 또는 트레오닌 잔기 또 다른 아미노산 잔기 (예를 들면, 글리신, 알라닌 또는 보존적 치환)의 치환에 의한 변경이 있을 수 있다.
본원에서의 구현예 중 임의의 것에서, 상기 단리된 항-PD-L1 항체는 인간 PD-L1, 하기에 나타난 바와 같은 인간 PD-L1 또는 이의 변이체에 결합할 수 있다: UniProtKB/Swiss-Prot 수탁 번호 Q9NZQ7.1.
또한 추가의 구현예에서, 본원에 기술된 항체 중 임의의 것을 암호화하는 단리된 핵산이 제공된다. 일부 구현예에서, 핵산은 추가로 하기를 포함한다: 이전에 기술된 항-PD-L1 항체 중 임의의 것을 암호화하는 핵산의 발현에 적절한 벡터. 또 다른 추가 특정 양태에서, 벡터는 핵산의 발현에 적절한 숙주 세포 내에 존재한다. 또 다른 추가 특정 양태에서, 숙주 세포는 진핵생물 세포 또는 원핵생물 세포이다. 또 다른 추가 특정 양태에서, 진핵생물 세포는 포유동물 세포, 예컨대 차이니즈 햄스터 난소 (CHO) 세포이다.
항체 또는 이의 항원 결합 단편은 예를 들면, 하기 단계를 포함하는 공정에 의하여 본 분야에 공지된 방법을 사용하여 제조될 수 있다: 상기 항체 또는 단편을 생산하기에 적절한 조건 하에서 발현에 적절한 형태의, 이전에 기술된 항-PD-L1 항체 또는 항원 결합 단편 중 임의의 것을 암호화하는 핵산을 함유하는 숙주 세포를 배양하는 단계, 및 항체 또는 단편을 회수하는 단계.
하기가 명백하게 고려된다: 상기 열거된 구현예 중 임의의 것에서 사용하기 위한, 본원에 기술된 PD-L1 축 결합 길항제 항체 (예컨대, 항-PD-L1 항체, 항-PD-1 항체, 및 항-PD-L2 항체), 또는 기타 항체 (예컨대, PD-L1 발현 수준의 검출을 위한 항-PD-L1 항체)는 하기 섹션 C의 섹션 i-Ⅶ에 기술된 특징 중 임의의 것을 단독으로, 또는 조합하여 가질 수 있다.
C. 항체
i. 항체 친화도
특정 구현예에서, 본원에 제공된 항체 (예컨대, 항-VEGF 항체, 항-PD-L1 항체 또는 항-PD-1 항체)는 ≤1 μM, ≤100 nM, ≤10 nM, ≤1 nM, ≤0.1 nM, ≤0.01 nM, 또는 ≤0.001 nM (예컨대, 10-8 M 이하, 예를 들면 10-8 M 내지 10-13 M, 예를 들면 10-9 M 내지 10-13 M)의 해리 상수 (Kd)를 갖는다.
일 구현예에서, Kd는 방사표지된 항원 결합 검정(RIA)에 의해 측정된다. 일 구현예에서, RIA는 관심의 대상인 항체의 Fab 버전 및 이의 항원으로 수행된다. 예를 들어, 항원에 대한 Fab의 용액 결합 친화성은 일련의 적정된 비표지된 항원의 존재하에 최소 농도의 (125I)-표지된 항원으로 Fab를 평형화시키고 이어서 결합된 항원을 항-Fab 항체 코팅된 플레이트로 포획함에 의해 측정된다 (예를 들어, 참고: Chen et al., J. Mol . Biol . 293:865-881, 1999). 검정용 조건을 수립하기 위해, MICROTITER® 다중-웰 플레이트 (Thermo Scientific)는 50 mM 탄산나트륨 (pH 9.6)에서 포착 항-Fab 항체 (Cappel Labs)의 5 ㎍/㎖로 밤새 코팅되고, 그리고 그 뒤에 2 내지 5 시간동안 실온 (대략 23℃)에서 PBS내 2% (w/v) 소 혈청 알부민으로 차단된다. 비-흡착제 플레이트 (Nunc #269620)에서, 100 pM 또는 26 pM [125I]-항원은 해당 Fab의 연속 희석으로 혼합된다 (예를 들면, 항-VEGF 항체, Fab-12의 평가와 일치하게, Presta et al., Cancer Res. 57:4593-4599, 1997). 그 다음 해당 Fab는 밤새 항온처리되지만; 그러나, 항온처리는 평형이 달성됨을 확인하기 위해 더 오랜 기간 (예를 들면, 약 65시간)동안 계속할 수 있다. 그 후에, 혼합물은 실온에서 (예를 들면, 1시간 동안) 항온처리를 위해 포획 플레이트로 이동된다. 이어서, 상기 용액을 제거하고 플레이트는 PBS 중에서 0.1% 폴리소르베이트 20 (TWEEN-20®)으로 8회 세척하였다. 플레이트가 건조되어 있을 경우, 150㎕/웰의 발광제(scintillant; MICROSCINT-20™; Packard)를 첨가하고, 플레이트를 10분간 탑카운트 감마(TOPCOUNT™ gamma) 카운터 (Packard) 상에서 카운팅하였다. 최대 결합의 20% 이하를 제공하는 각 Fab의 농도가 경쟁 결합 검정에서 사용하기 위해 선택된다.
또 다른 구현예에 따르면, Kd는 BIACORE® 표면 플라스몬 공명 검정을 사용하여 측정된다. 예를 들면, BIACORE®-2000 또는 BIACORE®-3000(BIAcore, Inc., Piscataway, NJ)을 사용한 검정은 25℃에서 고정화된 항원 CM5 칩으로 ~10 반응 단위(RU)로 수행한다. 일 구현예에서, 카복시메틸화된 덱스트란 바이오센서 칩 (CM5, BIACORE, Inc.)은 공급자의 설명서에 따라 N-에틸-N'-(3-디메틸아미노프로필)-카보디이미드 하이드로클로라이드 (EDC) 및 N-하이드록시석신이미드 (NHS)로 활성화된다. 항원은 pH 4.8, 10 mM 아세트산나트륨으로 5㎍/㎖ (~0.2 μM)까지 희석되고, 그 다음 5㎕/분의 유속으로 주입되어 커플링된 단백질의 대략 10 공명 단위 (RU)를 달성한다. 항원 주사 후, 1 M 에탄올아민을 주사하여 미반응된 그룹을 차단시킨다. 역학적 측정을 위해, 2배 연속 희석된 Fab (0.78 nM 내지 500 nM)를 대략 25㎕/분의 유속으로 25℃에서 PBS 중에서 0.05% 폴리소르베이트 20 (TWEEN-20™) 계면활성제 (PBST)와 함께 사용한다. 결합 속도 (kon) 및 해리 속도 (koff)를 결합 및 해리 센서그램의 동시 피팅(simultaneously fitting)에 의하여 단순한 일 대 일 랭뮤어(Langmuir) 결합 모델 (BIACORE® 평가 소프트웨어 버젼 3.2)을 사용하여 산출하였다. 평형 해리 상수(Kd)는 koff/kon 비율로서 산출된다. 예를 들어, 하기를 참고한다: Chen et al., (J. Mol . Biol . 293:865-881, 1999). 만일 온-레이트(on-rate)가 상기 표면 플라즈몬 공명 검정에 의해 106 M-1s-1 를 초과하면, 분광기, 예컨대 정지-유동 구비된 분광광도계 (Aviv Instruments) 또는 교반된 큐벳을 갖춘 8000-시리즈 SLM-AMINCOTM 분광광도계 (ThermoSpectronic)에서 측정된 바와 같이 항원의 증가 농도의 존재하에 25℃에서 pH 7.2, PBS 내 20 nM 항-항원 항체 (Fab 형태)의 형광 방출 세기 (여기 = 295 nm; 방출 = 340nm, 16nm 대역통과)에서의 증가 또는 감소를 측정하는 형광성 켄칭 기술을 이용함으로써 온-레이트가 계측될 수 있다.
Ⅱ. 항체 단편
특정 구현예에서, 본 명세서에서 제공된 항체 (예를 들면, 항-PD-L1 항체 또는 항-PD-1 항체)는 항체 단편이다. 항체 단편은 Fab, Fab’, Fab’-SH, F(ab’)2, Fv, 및 scFv 단편, 및 하기된 다른 단편을 포함하지만 이에 제한되지 않는다. 특정 항체 단편의 검토를 위해, 하기를 참고한다: Hudson et al. (Nat. Med . 9:129-134, 2003). sFv 단편의 검토를 위하여, 예를 들어, 하기를 참고한다: , in The Pharmacology of Monoclonal Antibodies, vol. 113, Rosenburg and Moore eds., (Springer-Verlag, New York), pp. 269-315 (1994). 또한 하기를 참고한다: WO 93/16185; 및 미국 특허 번호 5,571,894 및 5,587,458. 에피토프 잔기를 결합하는 회수 수용체를 포함하고 증가된 생체내 반감기를 갖는 Fab 및 F(ab')2 단편의 논의를 위해, 미국 특허 번호 5,869,046을 참고한다.
디아바디는 2가 또는 이특이적일 수 있는 2개의 항원 결합 부위를 갖는 항체 단편이다. 하기를 참고한다: 예를 들면, EP 404,097, WO 1993/01161, Hudson et al. Nat. Med . 9:129-134, 2003, 및 Hollinger et al. Proc . Natl . Acad . Sci . USA 90: 6444-6448, 1993. 트리아바디 및 테트라바디는 또한 하기에 기술된다: Hudson et al. (Nat. Med . 9:129-134, 2003).
단일-도메인 항체는 항체의 중쇄 가변 도메인의 전부 또는 일부 또는 경쇄 가변 도메인의 전부 또는 일부를 포함하는 항체 단편이다. 특정 구현예에서, 단일-도메인 항체는 인간 단일-도메인 항체 (Domantis, Inc., Waltham, MA; 참고, 예를 들면, 미국 특허 번호 6,248,516 B1)이다.
항체 단편은 공지된 방법에 따라 무손상 항체의 단백질 가수분해 소화 뿐만 아니라 재조합 숙주 세포(예컨대, 이. 콜라이 또는 파지)에 의한 생산을 포함하지만 이에 제한되지 않는 다양한 기술들로 제조될 수 있다.
Ⅲ. 키메라 및 인간화 항체
특정 구현예에서, 본 명세서에서 제공된 항체 (예컨대, 항-VEGF 항체, 항-PD-L1 항체 또는 항-PD-1 항체)는 키메라 항체이다. 특정 키메라성 항체는, 예를 들면 하기에 기재되어 있다: 미국 특허 번호 4,816,567 및 Morrison et al. (Proc. Natl . Acad . Sci . USA, 81:6851-6855, 1984). 일 예시에서, 키메라 항체는 비-인간 가변 영역(예컨대, 마우스, 랫트, 햄스터, 토끼, 또는 비-인간 영장류, 예컨대 원숭이에서 유도된 가변 영역)과 인간 불변 영역을 포함한다. 추가의 예에서, 키메라 항체는 부류 또는 하위부류가 친계 항체의 부류로부터 변화된 "부류 스위칭된" 항체이다. 키메라 항체는 이의 항원 결합 단편을 포함한다.
특정 구현예에서, 키메라 항체는 인간화된 항체이다. 전형적으로, 비-인간 항체는 인간화되어 인간에 대한 면역원성이 감소되어 있고 친계 비-인간 항체의 특이성 및 친화성을 보유한다. 일반적으로, 인간화 항체는, HVR, 예를 들면, CDR, (또는 그 일부)가 비인간 항체로부터 유도되고, FR (또는 그 일부)가 인간 항체 서열로부터 유도되는 하나 이상의 가변 도메인을 포함한다. 인간화된 항체는 선택적으로 또한 인간 불변 영역의 적어도 일부를 포함한다. 일부 구현예에서, 인간화 항체에서 일부 FR 잔기는 비인간 항체 (예를 들면, HVR 잔기가 유도되는 항체)로부터 상응하는 잔기로 치환되어, 예를 들면, 항체 특이성 또는 친화성을 회복 또는 개선한다.
인간화 항체 및 이의 제조 방법은, 예를 들면, 하기에 고찰되고: Almagro and Fransson, (Front. Biosci . 13:1619-1633 (2008), 그리고 추가로 하기에 기재된다: 예를 들면, Riechmann et al., (Nature 332:323-329, 1988); Queen et al. (Proc. Natl . Acad . Sci . USA 86:10029-10033, 1989); 미국 특허 번호 5, 821,337, 7,527,791, 6,982,321, 및 7,087,409; Kashmiri et al. (Methods 36:25-34, 2005) (특이성 결정 영역 (SDR) 그라프팅 기재); Padlan Mol . Immunol . 28:489-498, 1991) ("재표면화" 기재); Dall’Acqua et al. (Methods 36:43-60, 2005) ("FR셔플링" 기재); Osbourn et al. (Methods 36:61-68, 2005), 및 Klimka et al. (Br. J. Cancer, 83:252-260, 2000) (FR 셔플링에 대한 "유도된 선택" 접근법을 기재함).
인간화를 위해 사용될 수 있는 인간 프레임워크 영역에는 비제한적으로 하기를 포함한다: "베스트-피트(best-fit)" 방법을 사용하여 선택된 프레임워크 영역 (참고: 예를 들어, Sims et al. J. Immunol . 151:2296, 1993); 특정 하위그룹의 경쇄 또는 중쇄 가변 영역의 인간 항체의 공통 서열로부터 유래된 프레임워크 영역 (참고: 예를 들어, Carter et al. Proc . Natl . Acad . Sci . USA, 89:4285, 1992; 및 Presta et al. J. Immunol ., 151:2623, 1993); (체세포적으로 돌연변이된) 인간 성숙 프레임워크 영역 또는 인간 생식계열 프레임워크 영역 (예를 들면, 참고: Almagro and Fransson, Front. Biosci . 13:1619-1633, 2008); 및 스크리닝 FR 라이브러리로부터 유래된 프레임워크 영역 (참고: 예를 들어, Baca et al., J. Biol . Chem . 272:10678-10684, 1997; 및 Rosok et al. J. Biol. Chem. 271:22611-22618, 1996).
Ⅳ. 인간 항체
특정 구현예에서, 본 명세서에서 제공된 항체 (예컨대, 항-VEGF 항체, 항-PD-L1 항체 또는 항-PD-1 항체)는 인간 항체이다. 인간 항체는 당업계에 공지된 다양한 기술을 사용하여 제조될 수 있다. 인간 항체는 일반적으로 다음 문헌에 기재되어 있다: van Dijk and van de Winkel, (Curr . Opin . Pharmacol . 5: 368-74, 2001) 및 Lonberg (Curr. Opin. Immunol. 20:450-459, 2008).
인간 항체는 항원 유발(antigenic challenge)에 응답하여 무손상 인간 항체 또는 인간 가변 영역을 갖는 무손상 항체를 제조하도록 변형된 형질전환 동물에 면역원을 투여함으로써 제조될 수 있다. 상기 동물은 전형적으로 내인성 면역글로불린 유전자좌를 대체하거나 염색체외적으로 존재하거나 동물의 염색체에 무작위로 통합된 인간 면역글로불린 유전자좌 모두 또는 일부를 함유한다. 상기 형질전환 마우스에서, 내인성 면역글로불린 유전자좌는 일반적으로 불활성화되어 있다. 형질전환 동물로부터 인간 항체를 수득하는 방법의 검토를 위해, 하기를 참조한다: Lonberg, (Nat. Biotech. 23:1117-1125, 2005). 또한, 예를 들어, 미국 특허 제6,075,181호 및 제6,150,584호 (XENOMOUSETM 기술을 설명함); 미국 특허 제 5,770,429호 (HUMAB® 기술을 설명함); 미국 특허 제7,041,870호 (K-M MOUSE® 기술을 설명함), 및 미국 특허 출원 공보 번호 US 2007/0061900 (VELOCIMOUSE® 기술을 설명함)를 참고한다. 이와 같은 동물에 의해 생성된 무손상 항체의 인간 가변 영역은, 예컨대 상이한 인간 불변영역과 조합함으로써, 추가로 변형될 수 있다. 인간 항체는 또한 하이브리도마 기반 방법에 의해 제조될 수 있다.
인간 항체는 또한 하이브리도마 기반 방법에 의해 제조될 수 있다. 인간 단클론성 항체의 제조를 위한 인간 골수종 및 마우스-인간 이종골수종 세포주가 기재되었다. 하기를 참고한다: 예컨대, Kozbor, (J. Immunol . 133: 3001, 1984); Brodeur et al. (Monoclonal Antibody Production Techniques and Applications, pp. 51-63, Marcel Dekker, Inc., New York, 1987); 및 Boerner et al. (J. Immunol., 147: 86, 1991). 인간 B 세포 하이브리도마 기술을 통해 제조된 인간 항체가 또한 다음 문헌에 기재되어 있다: Li et al., Proc . Natl . Acad . Sci . USA, 103:3557-3562, 2006. 추가의 방법은, 예를 들면, 미국 특허 번호 7,189,826 (하이브리도마 세포주로부터 단클론성 인간 IgM 항체의 생산 기재) 및 Ni, (Xiandai Mianyixue, 26(4):265-268, 2006) (인간-인간 하이브리도마 기재)에 기재된 것을 포함한다. 인간 하이브리도마 기술 (Trioma technology)은 다음 문헌에 기재되어 있다: Vollmers and Brandlein, Histology and Histopathology, 20(3):927-937, 2005 및 Vollmers and Brandlein, Methods and Findings in Experimental and Clinical Pharmacology, 27(3):185-91, 2005.
인간 항체는 또한 인간 유래된 파아지 디스플레이 라이브러리로부터 선택된 Fv 클론 가변 도메인 서열을 단리시킴에 의해 생성될 수 있다. 상기 가변 도메인 서열은 이어서 목적하는 인간 불변 도메인과 조합될 수 있다. 항체 라이브러리로부터 인간 항체를 선택하기 위한 기술은 하기에 기재되어 있다.
v. 라이브러리-유래 항체
본 발명의 항체(예컨대, 항-VEGF 항체, 항-PD-L1 항체, 또는 항-PD-1 항체)는 목적하는 활성 또는 활성들을 갖는 항체에 대해 조합 라이브러리를 스크리닝함으로써 단리될 수 있다. 예를 들어, 파아지 디스플레이 라이브러리를 생성하고 이러한 라이브러리에 대해 원하는 결합 특징을 갖는 항체를 스크리닝하는 다양한 방법이 당업계에 알려져 있다. 그러한 방법은 하기에 검토되며: 예컨대, Hoogenboom et al. (Methods in Molecular Biology 178:1-37, O’Brien et al., ed., Human Press, Totowa, NJ, 2001), 그리고 추가로 하기에 기술된다: 예를 들어, McCafferty et al. (Nature 348:552-554, 1990); Clackson et al. (Nature 352: 624-628, 1991); Marks et al. (J. Mol . Biol . 222: 581-597, 1992); Marks and Bradbury, (Methods in Molecular Biology 248:161-175, Lo, ed., Human Press, Totowa, NJ, 2003); Sidhu et al. (J. Mol . Biol . 338(2): 299-310, 2004); Lee et al. (J. Mol . Biol . 340(5): 1073-1093, 2004); Fellouse, (Proc . Natl . Acad . Sci. USA 101(34): 12467-12472, 2004); 및 Lee et al. (J. Immunol . Methods 284(1-2): 119-132, 2004).
특정 파아지 디스플레이 방법에서, VH 및 VL 유전자 레퍼토리는 폴리머라제 연쇄 반응(PCR)에 의해 별도로 클로닝되고 파아지 라이브러리에서 무작위로 재조합되며, 이후 하기에 기술된 바와 같이 항원-결합 파아지에 대해 스크리닝될 수 있다: Winter et al., (Ann. Rev. Immunol ., 12: 433-455, 1994). 파아지는 전형적으로 항체 단편을, 단일-쇄 Fv (scFv) 단편으로서 또는 Fab 단편으로서 디스플레이한다. 면역화된 공급원 유래의 라이브러리는 하이브리도마를 작제할 필요 없이 면역원에 대한 고친화성 항체를 제공한다. 대안적으로, 단순 레퍼토리는 (예를 들면, 인간으로부터) 클로닝되어 하기에 기재된 바와 같이 임의의 면역화 없이 광범위한 비자가 및 자가 항원에 항체의 단일 공급원을 제공할 수 있다: Griffiths et al. (EMBO J, 12: 725-734, 1993). 최종적으로, 순수 라이브러리는 또한 줄기 세포로부터 비재배열된 V-유전자 분절을 클로닝하고 고도의 가변성 CDR3 영역을 암호화하고 시험관내 재배열을 성취하기 위해 무작위 서열을 함유하는 PCR 프라이머를 사용함에 의해 합성적으로 제조될 수 있고, 이는 다음 문헌에 기재된 바와 같다: Hoogenboom and Winter, (J. Mol . Biol ., 227: 381-388, 1992). 인간 항체 파아지 라이브러리를 기재하는 특허 공보는 예를 들어, 다음의 문헌을 포함한다: 미국 특허 번호 5,750,373, 및 미국 특허 공개 번호 2005/0079574, 2005/0119455, 2005/0266000, 2007/0117126, 2007/0160598, 2007/0237764, 2007/0292936, 및 2009/0002360.
인간 항체 라이브러리에서 단리된 항체 또는 항체 절편은 본원의 인간 항체 또는 인간 항체 단편으로 간주된다.
vi. 다중특이적 항체
상기 양태 중 임의의 것에서, 본원에 제공된 항체 (예컨대, 항-VEGF 항체, 항-PD-L1 항체, 또는 항-PD-1 항체)는 다중특이적 항체, 예를 들어, 이중특이적 항체일 수 있다. 다중특이적 항체는 최소한 2개의 상이한 부위에 대해 결합 특이성을 갖는 단클론성 항체이다. 특정 구현예에서, 본원에서 제공된 항체는 다중특이적 항체, 예를 들면, 이중특이적 항체이다. 특정 구현예에서, 결합 특이성 중 하나는 PD-L1에 대한 것이고, 다른 하나는 임의의 다른 항원에 대한 것이다. 특정 구현예에서, 결합 특이성 중 하나는 VEGF에 대한 것이고, 다른 하나는 임의의 다른 항원에 대한 것이다. 특정 구현예에서, 이중특이적 항체는 PD-L1 의 2개의 상이한 에피토프에 결합할 수 있다. 특정 구현예에서, 이중특이적 항체는 VEGF의 2개의 상이한 에피토프에 결합할 수 있다. 이중특이적 항체는 또한 PD-L1 또는 VEGF를 발현하는 세포에 세포독성제를 국소화하는데 사용될 수 있다. 이중특이적 항체는 전장 항체 또는 항체 단편으로 제조될 수 있다.
다중특이적 항체를 제조하기 위한 기술은 비제한적으로 하기를 포함한다: 상이한 특이성을 갖는 2개의 면역글로불린 중쇄-경쇄 쌍의 재조합 공-발현 (참고: Milstein and Cuello, Nature 305: 537, 1983), WO 93/08829 및 Traunecker et al. EMBO J. 10: 3655, 1991), 및 "놉-인-홀(knob-in-hole)" 가공 (참고: 예를 들면, 미국 특허 번호 5,731,168). 다중-특이적 항체는 또한 다음과 같이 제조될 수 있다: 항체 Fc-이종이량체 분자를 제조하기 위한 정전기 스티어링 효과를 가공함에 의해 (참고: 예컨대, WO 2009/089004A1); 2개 이상의 항체 또는 단편을 가교 결합시킴에 의해 (참고: 예를 들면, 미국 특허 번호 4,676,980, 및 Brennan et al. Science 229: 81, 1985); 이중특이적 항체를 제조하기 위해 류신 지퍼를 사용함에 의해(참고: 예를 들어, Kostelny et al. J. Immunol . 148(5): 1547-1553 (1992)); 이중특이적 항체 단편을 제조하기 위해 "디아바디" 기술을 사용함에 의해 (참고: 예를 들어, Hollinger et al. Proc . Natl . Acad . Sci . USA 90:6444-6448, 1993); 및 단일쇄 Fv(sFv) 이량체를 사용함에 의해 (참고: 예를 들어, Gruber et al. J. Immunol . 152:5368, 1994); 및 다음 문헌에 기재된 바와 같이 3특이적 항체를 제조함에 의해 (참고: 예를 들어, Tutt et al. J. Immunol . 147: 60, 1991).
"옥토퍼스 항체(octopus antibody)"를 포함하는, 3개 이상의 기능성 항원 결합 부위를 갖는 가공된 항체가 또한 본원에 포함된다 (문헌참조: 예를 들어 US 2006/0025576A1).
본원에서 항체 또는 단편은 PD-L1 및 또 다른 상이한 항원에 결합하는 항원 결합 부위를 포함하는 "이원 작용(dual acting) FAb" 또는 "DAF"를 포함한다. 본원에서 항체 또는 단편은 VEGF 및 또 다른, 상이한 항원에 결합하는 항원 결합 부위를 포함하는 DAF를 포함한다.
Ⅶ. 항체 변이체
특정 구현예에서, 본 발명의 항체 (예컨대, 항-VEGF 항체, 항-PD-L1 항체, 및 항-PD-1 항체)의 아미노산 서열 변이체가 고려된다. 예를 들어, 항체의 결합 친화성 및/또는 다른 생물학적 특성을 개선시키는 것이 바람직할 수 있다. 항체의 아미노산 서열 변이체는 항체를 암호화하는 뉴클레오티드 서열로 적당한 변형을 도입하거나 펩티드 합성에 의해 제조될 수 있다. 상기 변형은 예를 들어, 항체의 아미노산 서열내 잔기들로부터의 결실 및/또는 이들로의 삽입 및/또는 치환을 포함한다. 결실, 삽입, 및 치환의 임의의 조합은 최종 작제물이 원하는 특징, 예를 들어, 항원-결합을 보유하는 경우, 최종 작제물에 도달하도록 이뤄질 수 있다.
a. 치환, 삽입 및 결실 변이체
특정 구현예에서, 하나 이상의 아미노산 치환을 갖는 항체 변이체가 제공된다. 치환적 돌연변이생성을 위한 목적하는 부위는 HVR 및 FR을 포함한다. 보존적 치환은 "바람직한 치환"의 제목하에 표 1에서 보여준다. 보다 실질적 변화는 "예시적 치환"의 표제하에 표 1에 제공되고, 추가로 아미노산 측쇄 부류를 참조로 하기에 기재된 바와 같다. 아미노산 치환이 관심 항체 내로 도입될 수 있고, 원하는 활성, 예를 들어, 유지된/개선된 항원 결합, 감소된 면역원성, 또는 개선된 ADCC 또는 CDC에 대하여 스크리닝될 수 있다.
표 1. 예시적이고 바람직한 아미노산 치환
아미노산은 통상의 측쇄 성질에 따라 분류될 수 있다:
(1) 소수성: 노르류신, Met, Ala, Val, Leu, Ile;
(2) 중성 친수성: Cys, Ser, Thr, Asn, Gln;
(3) 산성: Asp, Glu;
(4) 염기성: His, Lys, Arg;
(5) 쇄 배향에 영향을 주는 잔기: Gly, Pro;
(6) 방향족: Trp, Tyr, Phe.
비보존적 치환은 이들 부류 중 하나의 구성원을 다른 부류로 교환하는 것을 수반할 것이다.
치환형 변이체의 한 유형은 친계 항체 (예를 들면 인간화 또는 인간 항체)의 하나 이상 초가변 영역 잔기의 치환을 포함한다. 일반적으로 추가의 연구를 위해 선택된 수득한 변이체(들)은 친계 항체와 비교하여 특정 생물학적 성질 (예를 들어, 증가된 친화도, 및/또는 감소된 면역원성)에서 변형(예를 들어, 개선)을 갖고/갖거나 상기 친계 항체의 특정 생물학적 성질을 실질적으로 보유한다. 예시적인 치환형 변이체는, 예컨대, 본원에 기재된 것과 같은 파아지 디스플레이-기반의 친화도 성숙 기술을 사용하여, 간편하게 생성될 수 있는 친화도 성숙된 항체이다. 간단히, 하나 이상의 HVR 잔기는 돌연변이화되고 파아지에서 변이체 항체 표시되고 특정한 생물학적 활성 (예를 들면, 결합 친화도)에 대하여 스크리닝된다.
변경(예컨대, 치환)은 HVR에서, 예컨대, 항체 친화도를 개선시키기 위해 이루어질 수 있다. 상기 변경은 HVR "핫스팟", 즉, 체세포 성숙 공정 동안 높은 빈도로 돌연변이하는 코돈에 의해 암호화된 잔기 (참고: 예를 들면, Chowdhury, Methods Mol . Biol . 207:179-196, 2008), 및/또는 항원과 접촉하는 잔기에서 이루어질 수 있으며, 이때 생성된 변이체 VH 또는 VL가 결합 친화도에 대하여 시험된다. 2차 라이브러리로부터 작제하고 재선택함에 의한 친화성 성숙화가 하기에 기술되었다: 예를 들어, Hoogenboom et al. (Methods in Molecular Biology 178:1-37, O’Brien et al., ed., Human Press, Totowa, NJ, 2001). 친화도 성숙화의 일부 구현예에서, 다양성이 임의의 다양한 방법 (예를 들어, 오류 발생 경향 PCR, 쇄 셔플링 또는 올리고뉴클레오티드 지시된 돌연변이생성)에 의한 성숙화를 위해 선택되는 가변 유전자에 도입된다. 이후 2차 라이브러리가 형성된다. 이후 라이브러리를 스크리닝하여 목적하는 친화도를 갖는 임의의 항체 변이체를 식별한다. 다양성을 도입하는 또 다른 방법은 HVR-지시된 접근법을 포함하며, 여기서 몇몇 HVR 잔기(예컨대, 한번에 4-6개 잔기)가 무작위화된다. 항원 결합에 관련된 HVR 잔기는 특히, 예컨대, 알라닌 주사 돌연변이생성(alanine scanning mutagenesis) 또는 모델링을 사용하여 식별할 수 있다. 특히, CDR-H3 및 CDR-L3이 흔히 표적화된다.
특정 구현예에서, 치환, 삽입, 또는 결실은 이러한 변형이 항체가 항원에 결합하는 능력을 실질적으로 감소시키지 않는 한 하나 이상의 HVR 내에서 일어날 수 있다. 예를 들면, 결합 친화도를 실질적으로 감소시키지 않는 보존적 변경(예컨대, 본원에 제공된 바와 같은 보존적 치환)은 HVR에서 이루어질 수 있다. 상기 변경은, 예를 들면, HVR에서 항원 접촉 잔기의 외부일 수 있다. 상기 제공된 변이체 VH 및 VL 서열의 특정 구현예에서, 각각의 HVR는 변경되지 않거나, 또는 1, 2 또는 3 이하의 아미노산 치환을 함유한다.
돌연변이생성을 위해 표적화될 수 있는 항체의 잔기들 또는 영역들의 식별을 위해 유용한 방법은 다음 문헌에 기재된 바와 같이 "알라닌 스캐닝 돌연변이생성"로 불리운다: Cunningham and Wells (Science, 244:1081-1085, 1989). 상기 방법에서, 잔기 또는 표적 잔기들 그룹 (예를 들어, Arg, Asp, His, Lys 및 Glu와 같은 하전된 잔기들)은 중성 또는 음으로 하전된 아미노산(예를 들어, 알라닌 또는 폴리알라닌)에 의해 동정되고 대체되어 항체와 항원의 상호작용이 영향받는지를 계측한다. 추가의 치환은 초기 치환에 대한 기능적 감도를 입증하는 아미노산 위치에서 도입될 수 있다. 대안적으로, 또는 추가로, 항체와 항원 간의 접촉 지점을 식별하기 위한 항원-항체 복합체의 결정 구조. 상기 접촉 잔기 및 인접 잔기가 치환을 위한 후보물질로서 표적화되거나 제거될 수 있다. 변이체는 이들이 목적하는 특성을 함유하는지 계측하기 위해 스크리닝될 수 있다.
아미노산 서열 삽입은 1 잔기 내지 100 이상 잔기를 함유하는 폴리펩티드 길이 범위의 아미노- 및/또는 카복실-말단 융합, 뿐만 아니라 단일 또는 다중 아미노산 잔기의 서열간 삽입을 포함한다. 말단 삽입의 예는 N-말단 메티오닐 잔기를 갖는 항체를 포함한다. 항체 분자의 또 다른 삽입 변이체는 항체의 혈청 반감기를 증가시키는 폴리펩티드 또는 효소(예컨대, ADEPT에 대한)에 대한 항체의 N- 또는 C-말단에 융합을 포함한다.
b. 글리코실화 변이체
특정 구현예에서, 본 발명의 항체는 항체가 글리코실화된 정도를 증가시키거나 감소시키기 위해 변경될 수 있다. 본 발명의 항체에 대한 글리코실화 부위의 부가 또는 결실은 하나 이상의 글리코실화 부위가 생성되거나 제거되도록 아미노산 서열을 변경시킴으로써 간편하게 달성될 수 있다.
항체가 Fc 영역을 포함하는 경우, 이에 부착된 탄수화물이 변경될 수 있다. 포유동물 세포에 의해 생산된 천연 항체는 전형적으로 Fc 영역의 CH2 도메인의 Asn297에 대한 N-연결부에 의해 일반적으로 부착되는 분지형, 2분지형 올리고당을 포함한다. 예를 들면, 하기를 참고한다: Wright et al. TIBTECH 15:26-32, 1997. 올리고당은 다양한 탄수화물, 예를 들면, 만노스, N-아세틸 글루코사민 (GlcNAc), 갈락토오스, 및 시알산, 뿐만 아니라 2분지형 올리고당 구조의 "줄기"에서 GlcNAc에 부착된 푸코오스를 포함할 수 있다. 일부 구현예에서, 본 발명의 항체에서 올리고당의 변형은 특정 개선된 특성을 갖는 항체 변이체를 제조하기 위해 실시될 수 있다.
일 구현예에서, Fc 영역에 (직접적으로 또는 간접적으로) 부착된 푸코오스가 부족한 탄수화물 구조를 갖는 항체 변이체가 제공된다. 예를 들면, 상기 항체에서 푸코오스의 양은 1% 내지 80%, 1% 내지 65%, 5% 내지 65% 또는 20% 내지 40%일 수 있다. 푸코오스의 양은, 예를 들어, WO 2008/077546에 기술된 바와 같이, MALDI-TOF 질량 분광계에 의하여 측정 시, Asn 297에 부착된 모든 당구조(glycostructure) (예를 들어, 복합체, 혼성체 및 고 만노스 구조)의 총합과 비교하여, Asn297에서의 당 쇄 내의 푸코오스의 평균 양을 산출함으로써 계측될 수 있다. Asn297은 Fc 영역에서의 대략 위치 297 (Fc 영역 잔기의 EU 넘버링)에 배치된 아스파라긴 잔기를 지칭하지만; 그러나, Asn297은, 항체내 작은 서열 변이로 인해, 위치 297의 약 ± 3 아미노산 업스트림 또는 다운스트림, 즉, 위치 294 와 300 사이에 또한 배치될 수 있다. 상기 푸코실화 변이체는 개선된 ADCC 작용을 가질 수 있다. 하기를 참고한다: 예를 들어, 미국 특허 공보 번호 US 2003/0157108; US 2004/0093621. "탈푸코실화된" 또는 "푸코스-결핍" 항체 변이체와 관련된 공보의 예는 하기를 포함한다: US 2003/0157108; WO 2000/61739; WO 2001/29246; US 2003/0115614; US 2002/0164328; US 2004/0093621; US 2004/0132140; US 2004/0110704; US 2004/0110282; US 2004/0109865; WO 2003/085119; WO 2003/084570; WO 2005/035586; WO 2005/035778; WO2005/053742; WO2002/031140; Okazaki et al. (J. Mol . Biol . 336:1239-1249, 2004); 및 Yamane-Ohnuki et al. (Biotech. Bioeng . 87: 614, 2004). 탈푸코실화 항체를 생산할 수 있는 세포주의 예는 하기를 포함한다: 단백질 푸코실화가 결핍된 Lec13 CHO 세포 (Ripka et al. Arch. Biochem . Biophys . 249:533-545, 1986); 미국 특허 출원 번호 US 2003/0157108 A1; 및 WO 2004/056312 A1, 특히 실시예 11), 및 녹아웃 세포주, 예컨대 알파-1,6-푸코실전달효소 유전자, FUT8, 녹아웃 CHO 세포 (참고: 예를 들면, Yamane-Ohnuki et al. Biotech. Bioeng . 87: 614, 2004; Kanda, Y. et al. Biotechnol. Bioeng. 94(4):680-688, 2006; 및 WO 2003/085107).
항체 변이체는, 예를 들어 항체의 Fc 영역에 부착된 2분지 올리고당이 GlcNAc에 의해 이등분된, 이등분된 올리고당으로 추가적으로 제공된다. 이러한 항체 변이체는 감소된 푸코실화 및/또는 개선된 ADCC 작용을 가질 수 있다. 이러한 항체 변이체의 예는, 예를 들면, 하기에 기술된다: WO 2003/011878; 미국 특허 번호 6,602,684; 및 US 2005/0123546. Fc 영역에 부착된 올리고당에 적어도 하나의 갈락토스 잔기를 갖는 항체 변이체가 또한 제공된다. 상기 항체 변이체는 CDC 기능을 개선시킬 수 있다. 상기 항체 변이체는, 예를 들면, 하기에 기술된다: WO 1997/30087; WO 1998/58964; 및 WO 1999/22764.
c. Fc 영역 변이체
특정 구현예에서, 하나 이상의 아미노산 변형이 본 발명의 항체의 Fc 영역에 도입되어, Fc 영역 변이체를 생성할 수 있다. Fc 영역 변이체는 하나 또는 그 이상의 아미노산 위치에서 아미노산 변형 (가령, 치환)을 포함하는 인간 Fc 영역 서열 (가령, 인간 IgG1, IgG2, IgG3 또는 IgG4 Fc 영역)을 포함할 수 있다.
특정 구현예에서, 본 발명은 모든 반응기 작용은 아니지만 일부 반응기 작용을 지니는 항체 변이체를 고려하며, 이 기능은 상기 항체 변이체를 생체내 항체 반감기가 중요하지만 특정 효과기 기능(예컨대 보완 및 ADCC)은 불필요하거나 해로운 용도에 바람직한 후보로 만든다. 시험관내 및/또는 생체내 세포독성 검정은 CDC 및/또는 ADCC 활성의 경감/고갈을 확인하기 위해 수행될 수 있다. 예를 들면, Fc 수용체(FcR) 결합 검정은 항체가 FcγR 결합은 결핍되지만(따라서 ADCC 활성이 결핍될 것 같음), FcRn 결합 능력을 보유하도록 보장하기 위해 수행될 수 있다. ADCC, NK 세포 매개용 1차 세포는 FcγRⅢ 만을 발현하고, 반면에 단핵구는 FcγRI, FcγRⅡ 및 FcγRⅢ을 발현한다. 조혈 세포상의 FcR 발현은 다음 문헌의 464 페이지 상의 표 3에 요약되어 있다: Ravetch and Kinet, (Annu . Rev. Immunol . 9:457-492, 1991). 해당 분자의 ADCC 활성을 평가하기 위한 시험관내 검정의 비-제한적인 예는 하기에 기재된다: 미국 특허 번호 5,500,362 (참고: 예를 들면 Hellstrom, I. et al. Proc . Natl . Acad . Sci . USA 83:7059-7063, 1986) 및 Hellstrom, I et al. Proc . Natl . Acad . Sci . USA 82:1499-1502, 1985; 미국 특허 번호 5,821,337; Bruggemann et al. J. Exp . Med . 166:1351-1361, 1987). 대안적으로, 하기와 같은 비-방사능활성 검정 방법이 사용될 수 있다: 예를 들어, 유동 세포측정을 위한 ACTI™ 비-방사능활성 세포독성 검정 (CellTechnology, Inc. Mountain View, CA); 및 CYTOTOX 96® 비 방사성 세포독성 검정 (Promega, Madison, WI). 이러한 검정을 위한 유용한 효과기 세포는 말초 혈액 단핵 세포 (PBMC) 및 자연 살해 (NK) 세포를 포함한다. 대안적으로, 또는 부가적으로, 관심 분자의 ADCC 활성은 하기와 같이 생체내 평가된다: 예를 들면, Clynes et al. (Proc . Natl . Acad . Sci . USA 95:652-656, 1998)에 기술된 바와 같은 동물 모델. C1q 결합 검정은 또한 항체가 C1q를 결합할 수 없음에 따라서 CDC 활성이 부재임을 식별하기 위해 수행될 수 있다. 하기를 참고한다: 예를 들면, WO 2006/029879 및 WO 2005/100402에서 C1q 및 C3c 결합 ELISA. 보체 활성화를 평가하기 위해, CDC 검정이 수행될 수 있다 (참고: 예를 들어, Gazzano-Santoro et al. J. Immunol . Methods 202:163, 1996; Cragg et al. Blood. 101:1045-1052, 2003; 및 Cragg et al. Blood. 103:2738-2743, 2004). FcRn 결합 및 생체내 청소율/반감기 측정은 또한 당업계에 공지된 방법을 사용하여 수행될 수 있다 (참고: 예를 들어, Petkova et al. Int ’l. Immunol . 18(12):1759-1769, 2006).
감소된 효과기 기능을 가진 항체는 하나 이상의 Fc 영역 잔기 238, 265, 269, 270, 297, 327 및 329의 치환을 갖는 것들을 포함한다 (미국 특허 번호 6,737,056 및 8,219,149). 상기 Fc 돌연변이체는, 알라닌에 대하여 잔기 265 및 297의 치환을 갖는 소위 "DANA" Fc 돌연변이체를 포함하여, 2 이상의 아미노산 위치 265, 269, 270, 297 및 327에서 치환을 갖는 Fc 돌연변이체를 포함한다 (미국 특허 번호 7,332,581 및 8,219,149).
FcR로의 개선되거나 감소된 결합을 갖는 특정 항체 변이체가 기재되어 있다 (예를 들어, 참고: 미국 특허 번호 6,737,056; WO 2004/056312, 및 Shields et al., J. Biol . Chem . 9(2): 6591-6604, 2001).
특정 구현예에서, 항체 변이체는 ADCC를 개선시키는 하나 이상의 아미노산 치환, 예를 들어, Fc 영역의 위치 298, 333, 및/또는 334에서의 치환(잔기들의 EU 넘버링)을 갖는 Fc 영역을 포함한다.
일부 구현예에서, 변경은 예를 들어, 하기에 기술된 바와 같이, 변경된 (즉, 개선되거나 감쇠된) C1q 결합 및/또는 보체 의존적 세포독성 (CDC)을 유발하는 Fc 영역 내에서 제조된다: 미국 특허 번호 6,194,551, WO 99/51642, 및 Idusogie et al. (J. Immunol. 164: 4178-4184, 2000).
증가된 반감기 및 태아로의 모체 IgG의 이동에 원인으로 작용하는, 신생아 Fc 수용체 (FcRn)로의 개선된 결합을 갖는 항체 (Guyer et al., J. Immunol . 117:587, 1976; 및 Kim et al. J. Immunol . 24:249, 1994)는 하기에 기술된다: 미국 공보 번호 2005/0014934A1. 상기 항체는 FcRn에 대한 Fc 영역의 결합을 개선하는 그안에 하나 이상의 치환을 갖는 Fc 영역을 포함한다. 상기 Fc 변이체는 Fc 영역 잔기: 238, 256, 265, 272, 286, 303, 305, 307, 311, 312, 317, 340, 356, 360, 362, 376, 378, 380, 382, 413, 424 또는 434의 하나 이상에서 치환, 예를 들면, Fc 영역 잔기 434의 치환을 갖는 것을 포함한다 (미국 특허 번호 7,371,826).
Fc 영역 변이체의 다른 예에 관하여 또한 하기를 참고한다: Duncan and Winter, (Nature 322:738-40, 1988); 미국 특허 번호 5,648,260; 미국 특허 번호 5,624,821; 및 WO 94/29351.
d. 시스테인 가공된 항체 변이체
특정 구현예에서, 시스테인이 가공된 항체, 예컨대, "thioMAbs"(항체의 하나 이상의 잔기가 시스테인 잔기로 치환된 것임)를 형성하는 것이 바람직할 수 있다. 특정 구현예에서, 치환된 잔기는 항체의 접근가능한 부위에서 발생한다. 상기 잔기를 시스테인으로 치환시킴으로써, 반응성 티올기는 그렇게 함으로써 항체의 접근가능한 부위에 배치되고, 다른 모이어티, 예컨대 약물 모이어티 또는 링커-약물 모이어티에 항체를 콘주게이트하는데 사용되어, 본원에서 추가로 기재된 바와 같이, 면역콘주게이트를 제조할 수 있다. 특정 구현예에서, 하기의 잔기들 중 임의의 하나 이상은 시스테인으로 치환될 수 있다: 경쇄의 V205 (카밧 넘버링); 중쇄의 A118 (EU 넘버링); 및 중쇄 Fc 영역의 S400 (EU 넘버링). 시스테인 가공된 항체는, 예를 들면, 미국 특허 제7,521,541호에 기재된 바와 같이 생성될 수 있다.
e. 항체 유도체
특정 구현예에서, 본원에 제공된 항체는 당업계에 공지되어 있고 용이하게 이용 가능한 추가의 비단백질성 모이어티를 함유하도록 추가로 변형될 수 있다. 항체의 유도체화에 적합한 모이어티는 비제한적으로 수용성 폴리머를 포함한다. 수용성 폴리머의 비제한적 예에는, 비제한적으로, 폴리에틸렌 글리콜(PEG), 에틸렌 글리콜/프로파일렌 글리콜의 코폴리머, 카복시메틸셀룰로스, 덱스트란, 폴리비닐 알코올, 폴리비닐 피롤리돈, 폴리-1, 3-디옥솔란, 폴리-1,3,6-트리옥산, 에틸렌/말레산 무수물 코폴리머, 폴리아미노산(호모폴리머 또는 랜덤 코폴리머), 및 덱스트란 또는 폴리(n-비닐피롤리돈)폴리에틸렌 글리콜, 프로프로파일렌 글리콜 호모폴리머, 프롤리프로파일렌 옥사이드/에틸렌 옥사이드 코폴리머, 폴리옥시에틸화된 폴리올(예컨대, 글리세롤), 폴리비닐 알코올 및 이들의 혼합물이 포함된다. 폴리에틸렌 글리콜 프로피온알데하이드는 물에서 그 안정성 때문에 제조시 이점을 가질 수 있다. 폴리머는 임의의 분자량일 수 있고, 그리고 분지형 또는 비분지형일 수 있다. 항체에 부착된 폴리머의 수는 다양할 수 있고, 만일 1 초과의 폴리머가 부착되면, 이들은 동일 또는 상이한 분자일 수 있다. 일반적으로, 유도체화에 사용된 폴리머의 수 및/또는 유형은, 만일 항체 유도체가 한정된 조건하에서의 요법 등에서 사용된다면, 비제한적으로, 개선되는 항체의 특정한 특성 또는 기능을 포함하는 고려사항에 기반하여 결정될 수 있다.
또 다른 구현예에서, 방사선에 노출에 의해 선택적으로 가열될 수 있는 비단백질성 모이어티 및 항체의 콘주게이트가 제공된다. 일 구현예에서, 비단백질성 모이어티는 탄소 나노튜브이다 (Kam et al. Proc . Natl . Acad . Sci . USA 102: 11600-11605, 2005). 방사선은 임의의 파장일 수 있으며, 보통의 세포에는 유해하지 않지만 비단백질성 모이어티를 항체-비단백질성 모이어티에 근접한 세포가 사멸하는 온도로 가열시키는 파장을 포함하지만, 이에 제한되지 않는다.
f. 면역콘주게이트
본 발명은 또한 하나 이상의 세포독성제, 예컨대 화학치료제 또는 약물, 성장 억제제, 독소 (예를 들면, 단백질 독소, 박테리아, 진균, 식물, 또는 동물 기원의 효소적 활성 독소, 또는 그 단편), 또는 방사성 동위원소에 콘주게이트되는 본원의 항체 (예컨대, 항-VEGF 항체, 항-PD-L1 항체, 또는 항-PD-1 항체)를 포함하는 면역콘주게이트를 제공한다.
일 구현예에서, 면역콘주게이트는 항체가 비제한적으로 하기를 포함하는 하나 이상의 약물에 콘주게이트되는 항체-약물 콘주게이트 (ADC)이다: 메이탄시노이드(미국 특허 번호 5,208,020 및 5,416,064 및 유럽 특허 EP 0 425 235 B1); 아우리스타틴, 예컨대 모노메틸아우리스타틴 약물 모이어티 DE 및 DF(MMAE 및 MMAF)(참고: 미국 특허 번호 5,635,483, 5,780,588, 및 7,498,298); 돌라스타틴; 칼리케아미신 또는 이것의 유도체(참고: 미국 특허 번호 5,712,374, 5,714,586, 5,739,116, 5,767,285, 5,770,701, 5,770,710, 5,773,001, 및 5,877,296; Hinman et al. Cancer Res. 53:3336-3342, 1993; 및 Lode et al. Cancer Res. 58:2925-2928, 1998); 안트라사이클린, 예컨대 다우노마이신 또는 독소루비신(참고: Kratz et al. Current Med . Chem . 13:477-523, 2006; Jeffrey et al. Bioorganic & Med . Chem . Letters 16:358-362, 2006; Torgov et al., Bioconj . Chem. 16:717-721 (2005); Nagy et al., Proc . Natl . Acad . Sci . USA 97:829-834 (2000); Dubowchik et al., Bioorg . & Med . Chem . Letters 12:1529-1532, 2002; King et al., J. Med . Chem . 45:4336-4343, 2002; 및 미국 특허 번호 6,630,579); 메토트렉세이트; 빈데신; 탁산 예컨대 도세탁셀, 파클리탁셀, 라로탁셀, 테세탁셀, 및 오르타탁셀; 트리코테센; 및 CC1065.
또 다른 구현예에서, 면역콘주게이트는 디프테리아 A 쇄, 디프테리아 독소의 비결합 활성 단편, (슈도모나스 애루기노사(Pseudomonas aeruginosa)로부터의) 외독소 A 쇄, 리신 A 쇄, 아브린 A 쇄, 모덱신 A 쇄, 알파-사르신, 유동(Aleurites fordⅡ) 단백질, 디안틴 단백질, 미국 자리공(Phytolaca americana) 단백질(PAPI, PAPⅡ, 및 PAP-S), 모모르디카 카란티아(momordica charantia) 억제제, 쿠르신, 크로틴, 사파오나리아 오피시날리스(sapaonaria officinalis) 억제제, 젤로닌, 미토젤린, 레스트릭토신, 페노마이신, 에노마이신, 및 트리코테센을 포함하지만 이에 제한되지 않는 효소 활성 독소 또는 이의 단편에 콘주게이트된 본원에 기재된 바와 같은 항체를 포함한다.
또 다른 구현예에서, 면역콘주게이트는 본원에 기술된 바와 같이, 방사성 활성 원자에 콘주게이트되어 방사콘주게이트를 형성하는 항체를 포함한다. 다양한 방사성 활성 동위원소가 방사콘주게이트의 생산을 위해 사용가능하다. 예시는 하기를 포함한다: At211, I131, I125, Y90, Re186, Re188, Sm153, Bi212, P32, Pb212 및 Lu의 방사성 동위원소. 방사콘주게이트가 검출을 위해 사용되는 경우, 이것은 신티그래프 연구를 위한 방사성 원자, 예를 들면 tc99m 또는 I123, 또는 핵자기 공명(NMR) 영상화(자기 공명 영상화, MRI 로도 공지됨)를 위한 스핀 표지, 예를 들면, 아이오딘-123, 아이오딘-131, 인듐-111, 불소-19, 탄소-13, 질소-15, 산소-17, 가돌리늄, 망간 또는 철을 포함할 수 있다. 항체 및 세포독성제의 콘주게이트는 다양한 이작용성 단백질 커플링제, 예를 들면, N-석신이미딜-3-(2-피리딜디티오) 프로피오네이트(SPDP), 석신이미딜-4-(N-말레이미도메틸) 사이클로헥산-1-카르복실레이트(SMCC), 이미노티올란(IT), 이미도에스테르의 이작용성 유도체(예를 들면, 디메틸 아디프이미데이트 HCl), 활성 에스테르(예를 들면, 디석신이미딜 수베레이트), 알데히드(예를 들면, 글루타르알데히드), 비스-아지도 화합물(예를 들면, 비스(p-아지도벤조일) 헥산디아민), 비스-디아조늄 유도체(예를 들면, 비스-(p-디아조늄벤조일)-에틸렌디아민), 디이소시아네이트(예를 들면, 톨루엔 2,6-디이소시아네이트), 및 비스-활성 불소 화합물(예를 들면, 1,5-디플루오로-2,4-디니트로벤젠)을 사용하여 제조될 수 있다. 예를 들어, 리신 면역독소는 하기에 기술된 바와 같이 제조될 수 있다: Vitetta et al. (Science 238:1098, 1987). 탄소-14-표지된 1-이소티오시아네이토벤질-3-메틸디에틸렌 트리아민펜타아세트산(MX-DTPA)이 항체에의 방사성 뉴클레오티드의 콘주게이션을 위한 예시적인 킬레이트제이다. 참고: WO94/11026. 상기 링커는 상기 세포에서 세포독성 약물의 방출을 용이하게 하는 "쪼개질 수 있는 링커"일 수 있다. 예를 들어, 산-불안정 링커, 펩티다제-민감성 링커, 광불안정성 링커, 디메틸 링커 또는 이황화물-함유 링커 (Chari et al., Cancer Res. 52:127-131, 1992; 및 미국 특허 번호 5,208,020)가 사용될 수 있다.
본원에서 면역콘주게이트 또는 ADC는 상업적으로 가용한 (가령, Pierce Biotechnology, Inc., Rockford, IL., U.S.A로부터) BMPS, EMCS, GMBS, HBVS, LC-SMCC, MBS, MPBH, SBAP, SIA, SIAB, SMCC, SMPB, SMPH, 설포-EMCS, 설포-GMBS, 설포-KMUS, 설포-MBS, 설포-SIAB, 설포-SMCC 및 설포-SMPB, 그리고 SVSB (숙신이미딜-(4-비닐술폰)벤조에이트)를 포함하지만 이들에 한정되지 않는 교차연결제 시약으로 제조된 이와 같은 콘주게이트를 명시적으로 예기하지만, 이들에 한정되지 않는다.
D. 약제학적 제형
본 발명에 따라 사용된 VEGF 길항제 및 PD-L1 축 결합 길항제 (예컨대, 항-VEGF 항체, 예컨대 베바시주맙, 및 항-PD-L1 항체, 예컨대 아테졸리주맙)의 치료적 제형은 동결건조된 제형 또는 수용액 형태로 원하는 정도의 순도를 갖는 길항제를 선택적인 약제학적으로 허용 가능한 담체, 부형제, 또는 안정제와 혼합하여 보관을 위해 제조된다. 제형에 관한 일반적인 정보에 대해서는, 예를 들어, 하기를 참고한다: Gilman et al. (eds.) The Pharmacological Bases of Therapeutics, 8th Ed., Pergamon Press, 1990; A. Gennaro (ed.), Remington ’s Pharmaceutical Sciences, 18th Edition, Mack Publishing Co., Pennsylvania, 1990; Avis et al. (eds.) Pharmaceutical Dosage Forms: Parenteral Medications Dekker, New York, 1993; Lieberman et al. (eds.) Pharmaceutical Dosage Forms: Tablets Dekker, New York, 1990; Lieberman et al. (eds.), Pharmaceutical Dosage Forms: Disperse Systems Dekker, New York, 1990; 및 Walters (ed.) Dermatological and Transdermal Formulations (Drugs and the Pharmaceutical Sciences), Vol 119, Marcel Dekker, 2002.
허용 가능한 담체, 부형제, 또는 안정제는 이용된 투여량 및 농도에서 수령체에 비독성이며, 그리고 이는 버퍼, 예컨대 포스페이트, 시트레이트, 및 다른 유기산; 아스코르브산 및 메티오닌을 포함하는 항산화제; 보존제(예컨대 옥타데실디메틸벤질 암모늄 클로라이드; 헥사메토늄 클로라이드; 벤즈알코늄 클로라이드, 벤즈에토늄 클로라이드; 페놀, 부틸 또는 벤질 알코올; 알킬 파라벤, 예컨대 메틸 또는 프로필 파라벤; 카테콜; 레조르시놀; 주기로헥산올; 3-펜탄올; 및 m-크레졸); 저분자량(약 10 잔기 미만) 폴리펩티드; 단백질, 예컨대 혈청 알부민, 젤라틴, 또는 면역글로불린; 친수성 폴리머, 예컨대 폴리비닐피롤리돈; 아미노산, 예컨대 글리신, 글루타민, 아스파라긴, 히스티딘, 아르기닌, 또는 라이신; 모노사카라이드, 디사카라이드, 및 글루코스, 만노스, 또는 덱스트린을 포함하는 다른 탄수화물; 킬레이트제, 예컨대 EDTA; 당류, 예컨대 수크로스, 만니톨, 트레할로스 또는 소르비톨; 염 형성 짝이온, 예컨대 나트륨; 금속 착물(예를 들면, Zn-단백질 복합체); 및/또는 비-이온성 계면활성제, 예컨대 TWEEN™, PLURONICS™, 또는 폴리에틸렌 글리콜(PEG)를 포함한다.
본원에서 제형은 또한 1 초과의 활성 화합물, 바람직하게는 서로 부정적으로 영향을 미치지 않는 상보적 활성을 갖는 것들을 포함할 수 있다. 그와 같은 약제의 유형 및 유효량은, 예를 들면 제형에 존재하는 길항제의 양 및 유형, 그리고 환자의 임상 파라미터에 의존한다.
활성 성분은 또한, 예를 들어, 코아세르베이션 기술 또는 계면 중합에 의해 제조된 마이크로캡슐, 예를 들어, 하이드록시메틸셀룰로오스 또는 젤라틴-마이크로캡슐 및 폴리-(메틸메타실레이트) 마이크로캡슐, 각각에, 콜로이드성 약물 전달 시스템 (예를 들어, 리포좀, 알부민 미소구체, 마이크로에멀젼, 나노-입자 및 나노캡슐)에 또는 매크로에멀젼에 포집될 수 있다. 상기 기술은 하기에서 개시되어 있다: Remington ’s Pharmaceutical Sciences 16th edition, Osol, A. Ed., 1980.
서방형 제제가 제조될 수 있다. 서방형 제제의 적당한 예에는 길항제를 함유하는 고체 소수성 중합체의 반-투과성 매트릭스가 포함되며, 이 매트릭스는 형상화된 물품, 예를 들면, 필름, 또는 마이크로캡슐의 형태이다. 서방형 매트릭스의 예에는 폴리에스테르, 하이드로겔 (예를 들면, 폴리(2-하이드록시에틸-메타크릴레이트), 또는 폴리(비닐알코올)), 폴리락타이드 (미국 특허 번호 3,773,919), L-글루탐산 및 γ 에틸-L-글루타메이트의 공중합체, 비-분해성 에틸렌-비닐 아세테이트, 분해성 락트산-글라이콜산 공중합체, 예컨대 LUPRON DEPOT™ (락트산-글라이콜산 공중합체 및 류프롤라이드 아세테이트로 이루어진 주사형 마이크로구형체), 및 폴리-D-(-)-3-하이드록시부티르산이 포함된다.
생체내 투여를 위해 사용되는 제형은 멸균되어야 한다. 이는 멸균된 여과 막을 통한 여과에 의해 용이하게 달성된다.
하기가 이해된다: 상기 제조 물품 중 임의의 것은 PD-L1 축 결합 길항제 대신에 또는 이에 추가로 본원에 기술된 면역콘주게이트를 포함할 수 있다.
실시예
실시예
1: 재료
및 방법
A. 연구
설계
실시예 1 내지 4에서 기술된 단계 Ib 연구의 목표는 이전에 치료되지 않은 진행성 전이성 신장 세포 암종 (mRCC) 환자에게 3주마다 (q3w) 정맥내 주입에 의해 동시에 투여되는 인간, 단클론성, 조작된 항-VEGF 항체인 베바시주맙과 조합된 항-PD-L1 항체 아테졸리주맙의 안전성 및 내성을 평가하는 것이다. 조사자의 의견으로 환자가 임상적 이득을 경험하는 한 (즉, 질환의 진행에 기인하는 허용될 수 없는 독성 또는 증상의 악화가 없는 경우) 치료가 계속되었다. 가성 진행 (pseudoprogression)이 의심되거나 혼합된 반응의 증거가 있는 경우, 환자는 조사자의 재량에 따라 연구 치료를 계속 받을 수 있었다. 연구 목적은 베바시주맙과 아테졸리주맙의 투여와 관련된 종양 및 순환 약동학적 마커의 평가 및 치료 조합의 항 종양 활성에 대한 예비 평가를 포함했다.
스크리닝 및 임상 시험에서 안전성 평가 (임상 및 실험실)가 수행되었다. 최종 평가는 마지막 복용 후 30 일까지 이루어졌다. 부작용 (AEs)의 발병률, 특성 및 중증도는 국립 암 연구소 부작용평가 척도(National Cancer Institute Common Terminology Criteria for Adverse Events, CTCAE) 버전 4.0에 따라 등급이 매겨졌다.
임의의 평가가능한, 또는 측정가능한 질환이 스크리닝시 문서로 기록되었으며, 각각의 종양 평가시 재평가되었다. 종양 평가는 주기 2, 4, 6, 8, 12 및 16의 말기에 또는 임상적으로 지시된대로 수행하였다. 평가는 약물 투여 주기의 마지막 주 동안, 및 다음 주기의 치료 시작 전에 수행되었다. 질환 진행 이외의 이유로 연구 치료를 중단한 환자는 그 환자가 질환 진행을 경험하거나 추가의 전신 암 요법을 시작하거나, 사망할 때까지 12 주마다 종양 평가를 계속했다.
프로토콜-정의된 용량-제한 독성 (DLT) 기준에는 표준 등급 ≥ 3 또는 4개의 혈액성 및 비-혈액성 독성이 포함되었다. 투약은 베바시주맙의 q3w 용량과 조합 투여된 아테졸리주맙의 2상 권장 용량으로 시작하였으며, 어떠한 DLT도 보고되지 않았다.
B. 환자
이전의 전신 요법을 받지 않은 진행성 또는 전이성 RCC를 가진 환자는 이 Ib 상 연구의 코호트에 참여할 자격이 있었다. 환자는 적어도 18세이어야 하며; 적절한 혈액 및 말초-장기 기능을 가지고 있어야 하며; 동부 협력 종양학 그룹의 성능 상태가 0 또는 1이어야 했다. 고형 종양의 반응 평가 기준(RECIST)에 따라 질환을 측정할 수 있어야했다. 공지된 1차 중추신경계 (CNS) 악성 종양 또는 증상을 보이는 CNS 전이, 자가 면역 질환의 병력 또는 위험, 또는 인간 면역결핍 바이러스, B형 간염 또는 C형 간염 감염의 병력이 있는 환자는 제외되었다. 또한 연구 시작전 지정된 기간내에 전신 면역자극성 제제 또는 전신 면역억제성 약물로 치료받은 환자뿐만 아니라 항-CTLA-4, 항-PD-1 또는 항-PD-L1 치료 항체 또는 경로-표적 치료제로 사전 치료를 받은 환자도 제외되었다.
연구에 참여한 10명의 환자 중 6명은 후처리 시점 모두에서 충분한 생존가능한 종양 세포를 가진 생검을 산출했다. 6쌍 (즉, 양쪽 치료 시점에서 동일한 환자로부터의 생검) 중, 7개는 신장 병변으로부터 유래되었고, 4개는 복벽/흉벽으로부터 유래되었고, 1개는 폐 병변으로부터 유래되었고, 1개는 림프절로부터 유래되었으며, 및 5개는 개시되지 않은 병변으로부터 유래되었다.
C. PD-L1, CD8 및
MHC
-I에 대한 면역조직화학 분석
4 μm 두께의 포르말린-고정된, 파라핀- 포매된 (FFPE) 조직 절편이 디아미노벤지딘에 의한 신호 가시화로, 4.3mg/㎖의 농도를 사용하는 자동화된 염색 플랫폼 (BenchMark; Ventana)에서 항-인간 PD-L1 토끼 단클론성 항체 (클론 SP142; Ventana, Tucson, AZ)로 PD-L1에 대해 염색되었고; 절편은 하에마톡실린으로 대조-염색되었다. PD-L1 발현이 종양 세포 및 종양-침윤 면역 세포 상에서 평가되었다. 종양 세포의 경우, PD-L1-양성 종양 세포의 비율은 종양 세포의 전체 수의 백분율로 추정되었으며; 종양 세포는 전형적으로 세포질 염색의 가변적으로 강한 성분으로 막성 염색을 나타냈다. 주어진 종양 샘플 내의 PD-L1-양성 종양 세포의 분포는 전형적으로 매우 집중적이었으며; 응집하는 고체로서 성장하는 종양에서, PD-L1-양성 종양 세포는 악성 세포와 종양-침윤성 면역 세포를 함유하는 기질 사이의 계면에서 통상적으로 더 많이 관찰되었다. 종양-침윤성 면역 세포의 경우, 종양을 차지하는 PD-L1-양성 종양-침윤 면역 세포의 백분율을 계측하였다. 명확하게 식별가능한 세포질을 갖는 종양-침윤 면역 세포, 예컨대 대식세포 및 수지상 세포는 PD-L1에 대한 막성 염색 패턴을 나타냈다. 이것은 적은 양의 세포질로 작은 림프양 형태의 세포를 계측하는 것이 더 어려웠다. PD-L1-양성 종양-침윤 면역 세포는 전형적으로 종양 덩어리의 주변, 종괴를 해부하는 기질 밴드, 기질내에 산란된 단일 세포, 또는 종양-침윤성 면역 세포 응집체 내에서 가변적으로-크기의 응집체로 보였다. 시료는 영역 당 세포의 < 1%, ≥ 1% 그러나 < 5%, ≥ 5% 그러나 < 10%, 또는 ≥ 10%가 각각 PD-L1 양성일 경우, IHC 0, 1, 2, 또는 3으로서 스코어링되었다. 다중 샘플을 가진 환자의 PD-L1 IHC 스코어는 최고 스코어를 기반으로 한다. CD8 (클론 SP16 (Epitomics)) IHC는 CC1 항원 회수 및 OMNIMAPTM (Ventana) 검출 기술을 사용하여 디스커버리(Discovery) XT 자동염색기 (Ventana)에서 수행되었다.
전체 MHC-I IHC 단계는 벤타나 디스커버리 XT 자동화 플랫폼 (Ventana Medical Systems; Tucson, AZ) 상에서 수행되었다. 절편을 세포 컨디셔너 1, 표준 시간으로 처리한 후 1:5000 희석된 1차 항체, MHC 부류 I (EP1395Y, Novus, cat. # NB110-57201)에서 37℃에서 60분 동안 항온처리하였다. 결합된 1차 항체를 OMNIMAPTM 항-토끼 HRP 검출 키트, 이후 DAB (Ventana Medical Systems; Tucson, AZ)에 의하여 검출하였다. 절편을 헤마톡실린 Ⅱ (Ventana 의료 시스템, AZ, Tucson, AZ)로 4분간 대조염색한 후, 4분 동안 용액을 블루잉(bluing)한 다음 탈수시키고, 커버-슬립시켰다. 저, 중 및 고 MHC-I을 내인성으로 발현하는 인간 세포 펠릿을 양성 대조군으로 병행하여 사용하였다. 토끼 단클론 항체 (클론 DA1E, 세포 신호전달 기술, Cat#3900S) 이소형 항체를 사용하여 음성 대조군을 수행하였다. 종양 세포에서의 MHC-I 염색은 H-스코어 시스템을 사용하여 채점하였다. 간단히, 종양 세포막의 염색 강도를 각각 무, 저, 중, 또는 고 3,3'-디아미노벤지딘 (DAB) 신호 강도에 상응하는 0, 1, 2 또는 3의 수치로 배정하였다. 전체 종양 면적에 대해, 상이한 염색 강도에서의 세포의 백분율을 시각적인 평가에 의해 계측하였다. 최종 스코어는 막 강도 스코어에 주어진 종양 샘플 내에 존재하는 각각의 집단의 면적 백분율을 하기와 같이 곱함으로써 계산되었다: 1 × (1 + 세포의 %) + 2 × (2+ 세포의 %) + 3 × (3+ 세포의 %) = H 스코어. 사례는 2명의 독립적인 병리학자에 의해 채점되었다. 평점 괄호(scoring bracket)는 ≤100, 101-200 및 201-300의 점수로 정의되었으며, 일치도는 동일한 괄호 안에 있는 독립적인 스코어로 정의되었다. 임의의 불일치는 사례에 대한 상호 검토시 해결되었다.
D. 이중- 및 삼중-색상 면역조직화학 및 전체 슬라이드 디지털 분석
FFPE 종양 조직의 연속 4 μm의 두께 섹션을 벤타나 벤치마크(Ventana Benchmark) XT 또는 벤치마크 울트라 자동화 플랫폼(Ventana Medical Systems; Tucson, AZ)을 사용하여 하기의 자체 개발된 IHC 분석 염색하였다: Ki67/CD8, PDPN/CD34/ASMA, 및 CD163/CD68.
Ki67/CD8 검정을 위하여, 절편을 세포 컨디셔너 1로 64분 동안 처리하였다. 절편을 이후 37℃에서 4분 동안 1차 항체, Ki67 (30-9, RTU, Ventana)에서 항온처리하였다. 결합된 1차 항체를 Optiview DAB IHC 검출 키트 (Ventana Medical Systems; Tucson, AZ)에 의하여 검출하였다. 후속해서, 슬라이드를 1차 항체 항-CD8 (SP239, Spring Biosciences)에서 37℃에서 60분 동안 1:100으로 희석하여 배양하였다. 결합된 1차 항체를 UltraView Universal AP 적색 검출 키트 (Ventana Medical Systems; Tucson, AZ)에 의하여 검출하였다. 절편을 헤마톡실린 Ⅱ (Ventana 의료 시스템, AZ, Tucson, AZ)로 4분간 대조염색한 후, 4분 동안 용액을 블루잉(bluing)한 다음 탈수시키고, 커버-슬립시켰다.
PDPN/CD34/ASMA 분석을 위해, 절편을 세포 컨디셔너 1로 32분 동안 처리하였다. 절편을 이후 37℃에서 16분 동안 1차 항체 항-포도플라닌 (D2-40, RTU, Ventana)에서 항온처리하였다. 결합된 1차 항체를 Optiview DAB IHC 검출 키트 (Ventana Medical Systems; Tucson, AZ)에 의하여 검출하였다. 후속해서, 슬라이드를 1차 항체 항-CD34 (QBEnd/10; RTU, Ventana)에서 37℃에서 16분 동안 항온처리하였다. 결합된 1차 항체를 iview Blue Plus 검출 키트 (Ventana Medical Systems; Tucson, AZ)에 의하여 검출하였다. 최종적으로, 슬라이드를 37℃에서 16분 동안 1차 항체 항-평활근 액틴 ("SMActin") (1A4; RTU, Ventana)에서 항온처리하였다. 결합된 1차 항체를 UltraView Universal AP 적색 검출 키트 (Ventana Medical Systems; Tucson, AZ)에 의하여 검출하였다. 절편을 헤마톡실린 Ⅱ (Ventana 의료 시스템, AZ, Tucson, AZ)로 4분간 대조염색한 후, 4분 동안 용액을 블루잉한 다음 탈수시키고, 커버-슬립시켰다.
CD163/CD68 검정을 위하여, 절편을 세포 컨디셔너 1로 32분 동안 처리하고, 37℃에서 8분 동안 1차 항체 항-CD163 (MRQ-26, RTU, Ventana)에서 항온처리하였다. 결합된 1차 항체를 Optiview DAB IHC 검출 키트 (Ventana Medical Systems; Tucson, AZ)에 의하여 검출하였다. 후속하여, 슬라이드를 37℃에서 8분 동안 1차 항체 항-CD68 (KP-1, RTU, Ventana)에서 항온처리하였다. 결합된 1차 항체를 UltraView Universal AP 적색 검출 키트 (Ventana Medical Systems; Tucson, AZ)에 의하여 검출하였다. 절편을 헤마톡실린 Ⅱ (Ventana 의료 시스템, AZ, Tucson, AZ)로 4분간 대조염색한 후, 4분 동안 용액을 블루잉한 다음 탈수시키고, 커버-슬립시켰다. 적절한 음성 및 양성 대조군을 공지된 방법에 따라 수행하였다.
전체 슬라이드 기반에서 IHC-염색된 물체를 검출하고 분류하는 알고리즘은 Matlab에 작성되었다. 명시야 염색 비혼합 후, IHC-염색된 물체가 세포 후보로 검출되었다. 모든 세포 후보에 대해 정량적인 특징이 추출되었다. 이후, 후보는 감독된 기계 학습을 사용하여 다양한 세포 부류 (예를 들어, CD8+/Ki67- 세포)로 분류되었다. 분류 방법은 진짜 및 거짓 염색된 물체(병리학자에 의해 제공됨)의 그라운드 진실 갤러리(ground truth gallery)를 사용하여 숙련되었다. 마지막으로, 분류된 세포 및 종양 면적 (디지털 슬라이드 주석을 통해 병리학자에 의해 제공됨)이 보고되고, 병리학 검토를 위해 품질 관리 (QC) 이미지가 생성되었다. 종양 면적에 대한 자동화된 디지털 슬라이드 분석의 결과가 아래와 같이 보고되었다: Ki67-/CD8+ 및 Ki67+/CD8+ 세포 밀도 (mm2 당 세포 수), 면적 적용범위(전체 종양 면적과 관련된 면적 적용범위)의 CD68+/CD163+ 및 CD68+/CD163- %, CD34+/αSMA- 및 CD34+/αSMA+ 혈관 밀도 (mm2 당 혈관 수).
E.
FFPE
종양 조직으로부터의 RNA 단리
RNA 단리는 Schleifman 등에 기재된 바와 같이 수행하였다. (PLoS One 8:e74231, 2014). 간단히, 종양 FFPE 섹션은 신생물성 조직에 대해 풍부하도록 매크로-해부되고 그리고 조직은 종양 세포용해 버퍼 및 프로테이나제 K를 사용하여 용해되어 완벽한 소화 및 핵산의 방출을 허용하였다. RNA는 제조자의 프로토콜에 따라 하이 퓨어 FFPE RNA 마이크로 키트 (로슈 어플라이드 사이언스, 인디애나주 인디아나폴리스 소재)를 사용하여 단리되었다. 제조자의 프로토콜에 따라 DNA를 QIAAMP® DNA FFPE 조직 키트 (Qiagen, Hilden, Germany)를 사용하여 단리하였다. RNA와 DNA는 분석이 수행될 때까지 280 uC에서 저장했다.
F.
플루이다임
및 나노스트링 발현 분석
유전자-발현 분석은 이전에 기재된 바와 같이 BioMark HD™ 실시간 PCR 플랫폼 (플루이다임)을 사용하여 수행되었다: Schleifman et al. (PLoS One 8:e74231, 2014). 발현 패널의 모든 TAQMAN® 분석에는 FAM™ 염료-표지된 TAQMAN® 소홈 결합제 (MGB) 프로브가 사용되었으며, 및 4가지 기준 유전자를 포함하여, Life Technologies에서 주문 제작되었거나 구입-설계하였다: SP2, GUSB, TMEM55B 및 VPS33B. 네 개의 참조 유전자 (SP2, GUSB, TMEM55B 및 VPS33B)에 대한 Ct 값의 기하 중앙값이 각 샘플에 대해 계산되었고 그리고 발현 수준은 아래와 같이 델타 Ct (ΔCt) 방법을 사용하여 결정되었다: Ct (표적 유전자)2지오메디안(GeoMedian) Ct (참조 유전자). 연구 대상 환자 전체의 [면역칩 (iChip)에 의해 측정된] mRNA 발현 수준 중앙값은 높은-발현 대 낮은-발현 범주화를 도출하기 위한 컷오프로 사용되었다. P 값은 t 시험에 의해 계측되었다.
나노스트링(NanoString) 유전자 발현 데이터는 R/Bioconductor 패키지 "NanoStringQCPro"를 사용하여 처리하였다. 원시 계수는 프로브- 및 레인-특정 배경이 음성 대조군과 블랭크 측정 모두를 기반으로 계산되기 전에 양성 대조군 계수에 의해 조정되었다. 백그라운드 정정 후, 하우스키핑 유전자 발현 (TMEM55B, VPS33B, TBP 및 TUBB)에 의해 카운트가 log2 전환되고, 및 정규화되었다.
G.
TCR
서열분석
TCRβ 레퍼토리의 증폭 및 서열분석은 Klinger 등에 의해 기재된 바와 같이 Adaptive Biotechnologies에서 수행되었다. (PLoS One 8:e74231, 2013).
H. 유동 세포측정
CD3, CD8, HLA-DR 및 Ki-67 발현을 위한 전혈 유세포측정은 확립된 프로토콜에 따라 LabCorp 중앙 연구소에서 수행되었다. Precision Bioservices에서 말초 혈액 단핵 세포 (PBMCs)를 단리하고, 동결보존된 샘플을 프렉탈카인 수용체 발현 분석 및 종양-특이적 T 세포 검출을 위해 Genentech로 운송했다. PBMC를 해동하고, 밤새 휴지시켰으며, 및 HLA-A2 상태를 결정하기 위해 항-HLA-A2-FITC (BB7.2, BD) 및 항-CD45-APC-H7 (2D1, BD)로 세포의 작은 분획을 염색하였다. 잔존 세포를 HLA-A*0201/펩티드 덱스트라머 및 오량체의 혼합물(Immudex 및 Proimmune, 표 1 참조)로 실온에서 10분 동안 염색한 후, 항-CD3-BV510 (UCHTI, Biolegend), 항-CD8-A700 (RPA-T8, BD), 항-CD4-PE-Cy7 (RPA-T4, eBioscience), 항-CD45RA-eVolve605 (HI100, eBioscience), 항-CCR7-BV421 (G043H7, Biolegend), 항-CX3CR1-PerCP-eFluor710 (2A9-1, eBioscience) 및 고정가능한 생존력(Fixable Viability) 염료 eFluor780 (eBioscience)으로 얼음 상에서 30분 동안 염색하였다. 샘플을 FACSDIVATM v8 소프트웨어를 실행하는 BD FACSARIATM에서 데이터 수집 및 분류 전에 2회 세정했다. 50,000개의 CD8+ T 세포 중 최소 10개의 덱스트라머-양성 반응이 종양-특이적 반응으로 간주된다. 표 3은 유세포 측정에 사용된 덱스트라머의 목록을 보여준다.
표 3.
유세포
측정용
덱스트라머
I.
통계적
분석
아테졸리주맙과 베바시주맙의 1회 용량 이상을 21일 간격으로 정맥내로 투여받은, RCC를 가진 모든 10명의 환자로부터의 데이터를 기준선 특성과 부작용 비율을 결정하는데 사용했다. 효능은 RECIST v1.1에 따라 평가되었다. 가장 잘 확인된 전체 객관적 반응속도는 조사자-보고된 평가에서 얻었다. 객관적 반응속도 (ORR)는 전체 또는 부분적인 반응의 전체 객관적 반응이 가장 좋은 환자의 수를 기준선 종양 평가를 받은 환자의 총 수로 나눈 값으로 정의된다.
컷오프 일자에 살아 있었고, 질환 진행을 경험하지 않은 환자를 마지막 종양 평가 시점에서 검열하였다. 반응 지속 기간은 Kaplan Meier 방법으로 얻었다. 모든 AE, 치료와 관련된 AE, 및 등급 3-4의 AE에 대한 요약은 10명의 모든 환자로부터 제공된다.
실시예
2: 유전자 발현 분석은
베바시주맙
단일요법 및
베바시주맙
및
아테졸리주맙
병용 요법과 관련된
바이오마커를
확인한다
이전에 치료받지 않은 mRCC 환자 10명에게 C1D1에 대한 단일 용량의 베바시주맙을 투여한 후, C2D1을 시작으로 3주마다 아테졸리주맙과 베바시주맙을 병용 투여하는, 1b상 임상 연구가 수행되었다. 환자 코호트의 기준선 인구 통계는 표 4에 개시되어 있다. RECIST v1.1을 사용한 10명의 환자 중 4명에서 부분적인 반응 (PR)이 관측되었고, 반면 추가의 5명의 환자는 장기적인 무변성 질환(SD)을 가졌다 (도 1 및 2). 이 작은 코호트에서 관측된 임상 활성은 단일 요법으로 이전에 수득된 것보다 높았다. 반응 지속 기간에 도달하지 않았고, 반응 시간 중앙값은 4.2 개월이었다.
표 4. 기준선 인구 통계
안전성, 내성 및 임상 활성 외에도 위에서 기재된 Ib상 연구의 핵심 목표 중 하나는 조합 활성의 기전을 평가하는 것이었다. 시험 설계에는 베바시주맙과 병행하여 베바시주맙이 국소 종양 면역 미세환경에 미치는 영향을 구체적으로 조사한 후 아테졸리주맙을 이용한 면역 관문 봉쇄와 병용 요법이 포함되었다. 종양 생검 및 혈액은 치료 전, 베바시주맙 후 15 내지 18 일, 아테졸리주맙 및 베바시주맙 병용 치료가 시작된 후 4 내지 6 주 후에 수집되었다.
베바시주맙 단일 요법 또는 병용 요법과 관련된 종양 마커를 확인하기 위해, 90 유전자 PCR-기반 플루이다임 패널과 800 유전자 맞춤형 나노스트링(NanoString) 패널을 사용하여 유전자 발현 분석을 수행하였다. VEGF 다운스트림 신호전달 활성을 반영하는, 네오-맥관구조와 관련된 유전자는 모든 환자의 치료 시점 모두에서 상당히 감소되어 (도 3), 베바시주맙의 항-혈관형성 활성을 확인하였다. 놀랍게도, 전처리 시점과 베바시주맙 단독 치료 시점을 비교하면, Th1 케모카인 (CXCL9, CXLC10, CXCL11 및 CXCL13) (전처리 수준에 비해 약 0.7배 내지 6.9배 범위), CD8 T-효과기 마커 (CD8A, CD8B, EOMES, GZMA, GZMB, IFNG 및 PRF1) (전처리 수준에 비해 약 0.4배 내지 6.2배 범위), 뿐만 아니라 NK 세포 마커 (GZMB, KLRK1 및 SLAMF7) (전처리 수준에 비해 약 0.7배 내지 8.2배 범위)의 유전자 발현이 증가한 것으로 나타났다(도 3). 베바시주맙 치료로 6명의 환자 중 4명이 Th1 신호전달과 관련된 유전자 특질의 유의미한 증가를 보였다. 중요하게는, 개별 환자 수준에서, 이들 특질은 VEGF 의존적 특질의 감소 정도로부터 탈락되었다. IHC에 의한 FasL 발현은 RCC를 포함한 몇개의 암에서 면역 세포에 대한 잠재적인 장벽으로 기재되어왔다 (Motz et al. Nat. Med . 20:607-615, 2014). 이 연구에서, 베바시주맙 또는 병용 치료에 의한 FasL 유전자 발현의 일관된 변화는 관측되지 않았다. 전반적으로, 이러한 차이는 베바시주맙 단독 요법이 종양 미세환경에서 가장 중요한 치료-유도된 변경을 반영하는 Th1-관련된 특질을 가진 종양 면역 미세환경의 조절을 초래한다는 것을 나타낸다.
Th1 케모카인 (CXCL9, CXLC10, CXCL11, 및 CXCL13), CD8 T-효과기 마커 (CD8A, CD8B, EOMES, GZMA, GZMB, IFNG, 및 PRF1), 및 NK 세포 마커 (GZMB, KLRK1, 및 SLAMF7)의 증가된 발현은 아테졸리주맙과 베바시주맙의 병용 투여 시 증진된다 (도 4). Th1 케모카인 특질의 발현 수준은 전처리 수준과 비교하여 베바시주맙+아테졸리주맙 시점에서 2.9- 내지 250.4배 증가되며, 그리고 베바시주맙 단독 시점에서 0.9- 내지 81.8배 증가된다. CD8 Teff 특질의 발현 수준은 전처리 수준과 비교하여 베바시주맙+아테졸리주맙 시점에서 0.8- 내지 51.8배 증가되며, 그리고 베바시주맙 단독 시점에서 0.3- 내지 17.6배 증가된다. NK 세포 특질의 발현 수준은 전처리 수준과 비교하여 베바시주맙+아테졸리주맙 시점에서 0.7- 내지 7.8배 증가되며, 그리고 베바시주맙 단독 시점에서 0.4- 내지 13.1배 증가된다.
실시예
3: 치료중
시점에서의
베바시주맙
단일요법 또는 병용 요법 후의 혈관 및 면역 반응
바이오마커의
특성규명
종양에서 관측된 면역 및 혈관 유전자 발현 변화를 확인하기 위해, 전처리 및 치료중 조직에서의 면역 및 혈관 단백질 발현 변화를 면역조직화학으로 평가하였다. 혈관-내피 세포의 마커인 CD31의 감소가 관측되었다 (도 5 및 6). 알파-평활근 액틴 (αSMA)을 가진 내피 세포의 또 다른 마커인 CD34의 이중 염색은 미성숙한 또는 유변성 혈관 (CD34+/αSMA-)이 주로 베바시주맙 치료에 의해 영향을 받는다는 것을 보여주었으며(도 7 및 8), 다른 공개된 보고서와 일치한다 (참고: 예를 들어, Gasparini et al. Nat. Clin . Pract . Oncol . 2:562-577, 2005). 내피 세포의 형태적 변화는 병용 치료에서도 분명했으며, 이필루미맙 및 베바시주맙 치료 후 전이성 흑색종의 발견과 일치한다 (참고: 예컨대, Hodi et al. Cancer Immunol . Res. 2:632-642, 2014). 또한, 미성숙한 혈관에 인접한 4명의 치료중 환자에서는 CD68+/CD163- 대식세포가 아닌, CD68+/CD163+의 맥락막 국소화가 확인되었으나, 성숙한 혈관에서는 관측되지 않았으며, 이는 베바시주맙 요법에 크게 영향을 받지 않았다 (도 7, 9, 및 10). 이론에 의해 구속되기를 바라지 않으면서, 하나의 잠재적인 설명은 유변성 혈관에 국한된 대식세포가 베바시주맙에 의해 야기된 염증 및 혈관-유도된 변화에 반응할 수 있다는 것이다. 대식세포는 VEGF를 분비하여 혈관형성을 촉진시키는 것으로 나타났으며(Lamagna et al. J. Leukoc . Biol . 80:705-713, 2006), 그리고 VEGF 전사체 발현은 치료중인 종양에서 상향조절되었다 (도 11).
종양내 CD8+ T 세포 증가는 환자 중 하나를 제외한 모든 환자에서 병용 치료 후에 확연했다 (도 5, 6, 및 12). 그러나, IFN-γ 반응 유전자인 PD-L1의 상향조절은 PR을 입증한 1명의 환자에서 면역조직화학에 의해서만 검출되었다 (도 5). 반대로 및 예상외로, 베바시주맙과 병용 요법 모두 후에 MHC-I 염색의 수반되는 증가가 관측되었다 (도 5 및 6). 항-VEGF 항체 요법에 의한 MHC-I의 조절은 이전에 기술되지 않았으며, CD8+ T 세포의 증가와 일관되게 연관되지 않았다. 저산소증이 HIF-1α를 통한 증가된 MHC-I 발현과 연관되어 있다는 이전의 연구 결과가 있다 (Ghosh et al. Mol . Cell. Biol . 33: 2718-2731, 2013).
병용 요법시 CD8+ T 세포 밀도의 증가가 향상된 종양내 증식 또는 증가된 수송에 기인한 경우를 다루기 위해, 증식 마커 Ki67에 의한 CD8의 이중 면역조직화학 염색이 사용되었다. 치료중에 변화가 없었던 Ki67+/CD8+ 세포와 Ki67-/CD8+ 세포의 비율(도 7, 13, 14a-14c, 15a-15c 및 16a-16c)은, CD8+ T 세포 증가가 향상된 종양내 증식보다는 증식하는 CD8+ T 세포의 증가된 수송 및 침윤으로 인한 것임을 시사한다.
실시예
4: 병용
요법에 따른 항원-특이적 T 세포 반응의 특성규명
종양 내 CD8+ T 세포의 상승이 증가된 수송로 인한 것인지 확인하기 위해, 말초의 세포 집단을 유세포측정으로 표현형 결정했다. 이전에 기술된 RCC 종양 항원 펩티드 (표 1)를 함유하는 HLA-A2 덱스트라머를 사용하여 항원-특이적 T 세포가 환자 혈액내에 존재하는지 여부 및 이들 세포 집단이 치료에 따라 변하는지를 결정하였다. 10명의 환자 중 단지 2명의 HLA-A2 양성 환자에서 Dex-APC 채널의 세포가 치료전 시점에서 양성이었다 (도 19). 이 두 환자 중 환자 6만이 종양 내 CD8+ T 세포의 증가를 입증했다. 흥미롭게도, Dex-APC-양성 염색은 환자 6의 후 병용 치료 시점에서 적어도 3배 감소했지만, 종양내 CD8+ T 세포의 증가를 나타내지 않은 환자 2에서는 감소하지 않았다. 이러한 변화는 RCC 항원-특이적 T 세포가 말초에서 종양으로 이동함을 시사할 수 있다.
유전자 발현 데이터는 또한 치료중인 환자의 종양에서 몇 가지 다른 케모카인과 케모카인 수용체가 증가함을 나타냈다 (도 20). 가장 유의미한 변화는 염증성 또는 저산소 환경에서 활성화된 내피 세포막에서 발현되는 것으로 알려진 프렉탈카인 (CX3CL1)에서 나타났다 (Szukiewicz et al. Mediators Inflamm. 2013:437576, 2013; Umehara et al. Arterioscler . Thromb . Vasc . Biol. 24:34-40, 2004).
프렉탈카인 수용체인 CX3CR1은 아암된 CD8+ T 세포 (페르포린+/그란자임 B+)에서 발현되는 것으로 나타났다 (Nishimura et al. J. Immunol. 168:6173-6180, 2002). 본 연구에서 CX3CR1은 병용 치료 후 말초 CD8+ T 세포에서 상향조절되었다 (도 13). 게다가, 대부분의 덱스트라머-양성 세포 (도 19)는 또한 CX3CR1을 발현하였다 (각각 환자 2 및 6의 경우 84% 및 100%; 도 16a 및 16c). 종양내 프렉탈카인 및 다른 케모카인과 치료중 CD8+ T 세포 상에서의 CX3CR1의 일치성 상향조절은 CD8+ T 세포의 증가된 종양 침윤에 대한 기전을 시사한다.
종양에 대해 T 세포 수용체 (TCR) 서열분석을 수행하고, CD8+ T 세포를 매칭된 PBMC로부터 분류하여, T 세포 레퍼토리의 치료-유도된 변화 및 T 세포의 종양으로의 수송을 조사하였다. 환자 3 및 6에 대한 전처리 및 치료중 TIL로부터의 최상부 클론의 비교는 일부 클론이 치료 중에 유지되었음을 보여 주었다 (도 21a 내지 21c 및 22). 베바시주맙 단독 투여 후 나타나는 클론이 있었지만, 다른 클론은 병용 요법 후에만 나타났다. 치료전에 검출된 클론도 있었으나, 치료중인 종양에서는 발견되지 않았다. 전체적으로, 종양 내 T 세포 조성의 상기 동적 변화는 항-종양 T 세포 반응이 치료 중 진화하고 있음을 시사한다.
분류된 말초 CD8+ T 세포 유래의 TCR 서열의 평가는, 다수의 상부 클론이 전처리 및 치료중 샘플 사이에서 유지되나, 치료중 TIL에 대한 PBMC에서 발견된 클론 사이에 일부 중첩이 또한 존재한다 (도 23a 및 23b). 특히, 종양 내 CD8+ T 세포가 치료 중에 증가하지 않은 환자인 환자 2의 PBMC와 TIL 사이에는 공유된 클론이 없었다. 환자 3 및 6의 경우, PBMC와 TIL 사이의 유사한 빈도로 존재하는 일부 클론이 존재했다. 적응성 공공 클론 데이터베이스 (Adaptive Public Clone Database)의 폭발로 인해 최상부 PBMC 클론의 일부가 바이러스 항원을 인식하는 것으로 나타났으나, 이들 클론 중 일부만 TIL에서 검출되어, 종양 항원-특이적 T 세포가 종양으로 이동하고 있을 수 있음을 추가로 시사하였다 (도 24). 치료 중인 TIL의 최상부 클론의 대다수는 혈액에서 훨씬 낮은 농도로 존재하지만 혈액에서 가장 우세한 클론은 종양에서 검출되지 않는다. 최상부 클론의 상대적인 비율이 TIL에 비해 PBMC에서 유지되지 않기 때문에, 이것은 병용 치료에 의해 유도된 종양의 CD8+ T 세포의 증가가 선택적 수송 기전을 통해 발생함을 시사할 수 있다. 침윤이 편향되지 않고 종양내 항원-특이적 T 세포의 보유도 또한 가능하다.
기타
구현예
비록 전술한 발명이 이해의 명확함을 위해 설명 및 실시예로서 일부 상세히 기재되었지만, 설명 및 실시예는 본 발명의 범위를 제한하는 것으로 해석되어서는 안된다. 본원에서 인용된 모든 특허 및 과학적 문헌의 개시내용은 명확히 그 전체가 참고로 편입된다.
SEQUENCE LISTING
<110> Genentech, Inc.
F. Hoffmann-La Roche AG
<120> METHODS FOR MONITORING AND TREATING CANCER
<130> 50474-132WO2
<150> US 62/323,297
<151> 2016-04-15
<160> 71
<170> PatentIn version 3.5
<210> 1
<211> 440
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<400> 1
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Asp Cys Lys Ala Ser Gly Ile Thr Phe Ser Asn Ser
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Trp Tyr Asp Gly Ser Lys Arg Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Phe
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Thr Asn Asp Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser
100 105 110
Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser
115 120 125
Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp
130 135 140
Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr
145 150 155 160
Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr
165 170 175
Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Lys
180 185 190
Thr Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp
195 200 205
Lys Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala
210 215 220
Pro Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro
225 230 235 240
Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val
245 250 255
Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val
260 265 270
Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln
275 280 285
Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln
290 295 300
Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly
305 310 315 320
Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro
325 330 335
Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr
340 345 350
Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser
355 360 365
Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr
370 375 380
Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr
385 390 395 400
Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe
405 410 415
Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys
420 425 430
Ser Leu Ser Leu Ser Leu Gly Lys
435 440
<210> 2
<211> 214
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypetide
<400> 2
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Ser Ser Asn Trp Pro Arg
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 3
<211> 118
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<400> 3
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asp Ser
20 25 30
Trp Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Trp Ile Ser Pro Tyr Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Arg His Trp Pro Gly Gly Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ala
115
<210> 4
<211> 108
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<400> 4
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Val Ser Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Phe Leu Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Leu Tyr His Pro Ala
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg
100 105
<210> 5
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<220>
<221> MOD_RES
<222> (6)..(6)
<223> Xaa is Asp or Gly
<400> 5
Gly Phe Thr Phe Ser Xaa Ser Trp Ile His
1 5 10
<210> 6
<211> 18
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<220>
<221> MOD_RES
<222> (4)..(4)
<223> Xaa is Ser or Leu
<220>
<221> MOD_RES
<222> (10)..(10)
<223> Xaa is Thr or Ser
<400> 6
Ala Trp Ile Xaa Pro Tyr Gly Gly Ser Xaa Tyr Tyr Ala Asp Ser Val
1 5 10 15
Lys Gly
<210> 7
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<400> 7
Arg His Trp Pro Gly Gly Phe Asp Tyr
1 5
<210> 8
<211> 25
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<400> 8
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser
20 25
<210> 9
<211> 13
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<400> 9
Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
1 5 10
<210> 10
<211> 32
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<400> 10
Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr Leu Gln
1 5 10 15
Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Arg
20 25 30
<210> 11
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<400> 11
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ala
1 5 10
<210> 12
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<220>
<221> MOD_RES
<222> (5)..(5)
<223> Xaa is Asp or Val
<220>
<221> MOD_RES
<222> (6)..(6)
<223> Xaa is Val or Ile
<220>
<221> MOD_RES
<222> (7)..(7)
<223> Xaa is Ser or Asn
<220>
<221> MOD_RES
<222> (9)..(9)
<223> Xaa is Ala or Phe
<220>
<221> MOD_RES
<222> (10)..(10)
<223> Xaa is Val or Leu
<400> 12
Arg Ala Ser Gln Xaa Xaa Xaa Thr Xaa Xaa Ala
1 5 10
<210> 13
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<220>
<221> MOD_RES
<222> (4)..(4)
<223> Xaa is Phe or Thr
<220>
<221> MOD_RES
<222> (6)..(6)
<223> Xaa is Tyr or Ala
<400> 13
Ser Ala Ser Xaa Leu Xaa Ser
1 5
<210> 14
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<220>
<221> MOD_RES
<222> (3)..(3)
<223> Xaa is Tyr, Gly, Phe, or Ser
<220>
<221> MOD_RES
<222> (4)..(4)
<223> Xaa is Leu, Tyr, Phe, or Trp
<220>
<221> MOD_RES
<222> (5)..(5)
<223> Xaa is Tyr, Asn, Ala, Thr, Gly, Phe, or Ile
<220>
<221> MOD_RES
<222> (6)..(6)
<223> Xaa is His, Val, Pro, Thr, or Ile
<220>
<221> MOD_RES
<222> (8)..(8)
<223> Xaa is Ala, Trp, Arg, Pro, or Thr
<400> 14
Gln Gln Xaa Xaa Xaa Xaa Pro Xaa Thr
1 5
<210> 15
<211> 23
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<400> 15
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys
20
<210> 16
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<400> 16
Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile Tyr
1 5 10 15
<210> 17
<211> 32
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<400> 17
Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr
1 5 10 15
Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys
20 25 30
<210> 18
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<400> 18
Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg
1 5 10
<210> 19
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<400> 19
Gly Phe Thr Phe Ser Asp Ser Trp Ile His
1 5 10
<210> 20
<211> 18
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<400> 20
Ala Trp Ile Ser Pro Tyr Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
1 5 10 15
Lys Gly
<210> 21
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<400> 21
Arg His Trp Pro Gly Gly Phe Asp Tyr
1 5
<210> 22
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<400> 22
Arg Ala Ser Gln Asp Val Ser Thr Ala Val Ala
1 5 10
<210> 23
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<400> 23
Ser Ala Ser Phe Leu Tyr Ser
1 5
<210> 24
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<400> 24
Gln Gln Tyr Leu Tyr His Pro Ala Thr
1 5
<210> 25
<211> 118
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<400> 25
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asp Ser
20 25 30
Trp Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Trp Ile Ser Pro Tyr Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Arg His Trp Pro Gly Gly Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 26
<211> 122
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<400> 26
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asp Ser
20 25 30
Trp Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Trp Ile Ser Pro Tyr Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Arg His Trp Pro Gly Gly Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser Ala Ser Thr Lys
115 120
<210> 27
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<400> 27
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
1 5 10
<210> 28
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<400> 28
Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
1 5 10
<210> 29
<211> 30
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<400> 29
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser
20 25 30
<210> 30
<211> 14
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<400> 30
Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ala
1 5 10
<210> 31
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<400> 31
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys
1 5 10 15
<210> 32
<211> 447
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<400> 32
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asp Ser
20 25 30
Trp Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Trp Ile Ser Pro Tyr Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Arg His Trp Pro Gly Gly Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro
115 120 125
Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly
130 135 140
Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn
145 150 155 160
Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln
165 170 175
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser
180 185 190
Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser
195 200 205
Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr
210 215 220
His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser
225 230 235 240
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg
245 250 255
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro
260 265 270
Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
275 280 285
Lys Thr Lys Pro Arg Glu Glu Gln Tyr Ala Ser Thr Tyr Arg Val Val
290 295 300
Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr
305 310 315 320
Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr
325 330 335
Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu
340 345 350
Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys
355 360 365
Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
370 375 380
Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp
385 390 395 400
Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser
405 410 415
Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala
420 425 430
Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440 445
<210> 33
<211> 214
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Polypeptide
<400> 33
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Val Ser Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Phe Leu Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Leu Tyr His Pro Ala
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 34
<211> 1975
<212> RNA
<213> Homo sapiens
<400> 34
acuuuccccc cucggcgccc caccggcucc cgcgcgccuc cccucgcgcc cgagcuucga 60
gccaagcagc guccugggga gcgcgucaug gccuuaccag ugaccgccuu gcuccugccg 120
cuggccuugc ugcuccacgc cgccaggccg agccaguucc gggugucgcc gcuggaucgg 180
accuggaacc ugggcgagac aguggagcug aagugccagg ugcugcuguc caacccgacg 240
ucgggcugcu cguggcucuu ccagccgcgc ggcgccgccg ccagucccac cuuccuccua 300
uaccucuccc aaaacaagcc caaggcggcc gaggggcugg acacccagcg guucucgggc 360
aagagguugg gggacaccuu cguccucacc cugagcgacu uccgccgaga gaacgagggc 420
uacuauuucu gcucggcccu gagcaacucc aucauguacu ucagccacuu cgugccgguc 480
uuccugccag cgaagcccac cacgacgcca gcgccgcgac caccaacacc ggcgcccacc 540
aucgcgucgc agccccuguc ccugcgccca gaggcgugcc ggccagcggc ggggggcgca 600
gugcacacga gggggcugga cuucgccugu gauaucuaca ucugggcgcc ccuggccggg 660
acuugugggg uccuucuccu gucacugguu aucacccuuu acugcaacca caggaaccga 720
agacguguuu gcaaaugucc ccggccugug gucaaaucgg gagacaagcc cagccuuucg 780
gcgagauacg ucuaacccug ugcaacagcc acuacauuac uucaaacuga gauccuuccu 840
uuugagggag caaguccuuc ccuuucauuu uuuccagucu uccucccugu guauucauuu 900
ucaugauuau uauuuuagug ggggcggggu gggaaagauu acuuuuucuu uauguguuug 960
acgggaaaca aaacuaggua aaaucuacag uacaccacaa gggucacaau acuguugugc 1020
gcacaucgcg guagggcgug gaaaggggca ggccagagcu acccgcagag uucucagaau 1080
caugcugaga gagcuggagg cacccaugcc aucucaaccu cuuccccgcc cguuuuacaa 1140
agggggaggc uaaagcccag agacagcuug aucaaaggca cacagcaagu caggguugga 1200
gcaguagcug gagggaccuu gucucccagc ucagggcucu uuccuccaca ccauucaggu 1260
cuuucuuucc gaggccccug ucucagggug aggugcuuga gucuccaacg gcaagggaac 1320
aaguacuucu ugauaccugg gauacugugc ccagagccuc gaggagguaa ugaauuaaag 1380
aagagaacug ccuuuggcag aguucuauaa uguaaacaau aucagacuuu uuuuuuuuau 1440
aaucaagccu aaaauuguau agaccuaaaa uaaaaugaag uggugagcuu aacccuggaa 1500
aaugaauccc ucuaucucua aagaaaaucu cugugaaacc ccuacgugga ggcggaauug 1560
cucucccagc ccuugcauug cagaggggcc caugaaagag gacaggcuac cccuuuacaa 1620
auagaauuug agcaucagug agguuaaacu aaggcccucu ugaaucucug aauuugagau 1680
acaaacaugu uccugggauc acugaugacu uuuuauacuu uguaaagaca auuguuggag 1740
agccccucac acagcccugg ccuccgcuca acuagcagau acagggauga ggcagaccug 1800
acucucuuaa ggaggcugag agcccaaacu gcugucccaa acaugcacuu ccuugcuuaa 1860
gguaugguac aagcaaugcc ugcccauugg agagaaaaaa cuuaaguaga uaaggaaaua 1920
agaaccacuc auaauucuuc accuuaggaa uaaucuccug uuaauauggu guaca 1975
<210> 35
<211> 235
<212> PRT
<213> Homo sapiens
<400> 35
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Ser Gln Phe Arg Val Ser Pro Leu Asp Arg Thr
20 25 30
Trp Asn Leu Gly Glu Thr Val Glu Leu Lys Cys Gln Val Leu Leu Ser
35 40 45
Asn Pro Thr Ser Gly Cys Ser Trp Leu Phe Gln Pro Arg Gly Ala Ala
50 55 60
Ala Ser Pro Thr Phe Leu Leu Tyr Leu Ser Gln Asn Lys Pro Lys Ala
65 70 75 80
Ala Glu Gly Leu Asp Thr Gln Arg Phe Ser Gly Lys Arg Leu Gly Asp
85 90 95
Thr Phe Val Leu Thr Leu Ser Asp Phe Arg Arg Glu Asn Glu Gly Tyr
100 105 110
Tyr Phe Cys Ser Ala Leu Ser Asn Ser Ile Met Tyr Phe Ser His Phe
115 120 125
Val Pro Val Phe Leu Pro Ala Lys Pro Thr Thr Thr Pro Ala Pro Arg
130 135 140
Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg
145 150 155 160
Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly
165 170 175
Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr
180 185 190
Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Asn His
195 200 205
Arg Asn Arg Arg Arg Val Cys Lys Cys Pro Arg Pro Val Val Lys Ser
210 215 220
Gly Asp Lys Pro Ser Leu Ser Ala Arg Tyr Val
225 230 235
<210> 36
<211> 1411
<212> RNA
<213> Homo sapiens
<400> 36
gcgacugucu ccgccgagcc cccggggcca ggugucccgg gcgcgccacg augcggccgc 60
ggcuguggcu ccuccuggcc gcgcagcuga caguucucca uggcaacuca guccuccagc 120
agaccccugc auacauaaag gugcaaacca acaagauggu gaugcugucc ugcgaggcua 180
aaaucucccu caguaacaug cgcaucuacu ggcugagaca gcgccaggca ccgagcagug 240
acagucacca cgaguuccug gcccucuggg auuccgcaaa agggacuauc cacggugaag 300
agguggaaca ggagaagaua gcuguguuuc gggaugcaag ccgguucauu cucaaucuca 360
caagcgugaa gccggaagac aguggcaucu acuucugcau gaucgucggg agccccgagc 420
ugaccuucgg gaagggaacu cagcugagug ugguugauuu ccuucccacc acugcccagc 480
ccaccaagaa guccacccuc aagaagagag ugugccgguu acccaggcca gagacccaga 540
agggcccacu uuguagcccc aucacccuug gccugcuggu ggcuggcguc cugguucugc 600
ugguuucccu gggaguggcc auccaccugu gcugccggcg gaggagagcc cggcuucguu 660
ucaugaaaca auuuuacaaa uaagcagaga auacgguuuu gguguccugc uacaaaaaga 720
caucggucag uaaugagcac gauguggaaa aaugagagaa gggacacauu caacccugga 780
gaguucaaug gcugcugaag cugccugcuu uucacugcug caaggccuuu cuguguguga 840
ugugcauggg agcaacuugu ucguggguca ucgggaauac uagggagaag guuucauugc 900
ccccagggca cuucacagag ugugcuggag gacugaguaa gaaaugcugc ccaugccacc 960
gcuuccggcu ccugugcuuu cccugaacug ggaccuuuag ugguggccau uuagccacca 1020
ucuuugcagg uugcuuugcc cugguagggc aguaacauug gguccugggu cuuucauggg 1080
gugaugcugg gcuggcuccc ucuuggucuu cccaggcugg ggcugaccuu ccucgcagag 1140
aggccaggug cagguuggga augaggcuug cugagagggg cuguccaguu cccagaaggc 1200
auaucagucu cugagggcuu ccuuuggggc cgggaacuug cggguuugag gauaggaguu 1260
cacuucaucu ucucagcucc cauuucuacu cuuaaguuuc uccccauuuc uacucuuaag 1320
uuucucagcu cccauuucua cucucccaug gcuucaugcu ucuuucauuu uucuguuugu 1380
uuuauacaaa uguguuaguu guacaaauaa a 1411
<210> 37
<211> 210
<212> PRT
<213> Homo sapiens
<400> 37
Met Arg Pro Arg Leu Trp Leu Leu Leu Ala Ala Gln Leu Thr Val Leu
1 5 10 15
His Gly Asn Ser Val Leu Gln Gln Thr Pro Ala Tyr Ile Lys Val Gln
20 25 30
Thr Asn Lys Met Val Met Leu Ser Cys Glu Ala Lys Ile Ser Leu Ser
35 40 45
Asn Met Arg Ile Tyr Trp Leu Arg Gln Arg Gln Ala Pro Ser Ser Asp
50 55 60
Ser His His Glu Phe Leu Ala Leu Trp Asp Ser Ala Lys Gly Thr Ile
65 70 75 80
His Gly Glu Glu Val Glu Gln Glu Lys Ile Ala Val Phe Arg Asp Ala
85 90 95
Ser Arg Phe Ile Leu Asn Leu Thr Ser Val Lys Pro Glu Asp Ser Gly
100 105 110
Ile Tyr Phe Cys Met Ile Val Gly Ser Pro Glu Leu Thr Phe Gly Lys
115 120 125
Gly Thr Gln Leu Ser Val Val Asp Phe Leu Pro Thr Thr Ala Gln Pro
130 135 140
Thr Lys Lys Ser Thr Leu Lys Lys Arg Val Cys Arg Leu Pro Arg Pro
145 150 155 160
Glu Thr Gln Lys Gly Pro Leu Cys Ser Pro Ile Thr Leu Gly Leu Leu
165 170 175
Val Ala Gly Val Leu Val Leu Leu Val Ser Leu Gly Val Ala Ile His
180 185 190
Leu Cys Cys Arg Arg Arg Arg Ala Arg Leu Arg Phe Met Lys Gln Phe
195 200 205
Tyr Lys
210
<210> 38
<211> 2061
<212> RNA
<213> Homo sapiens
<400> 38
augcaguugg gagagcagcu cuuggugagc ucagugaacc ugccuggcgc gcacuucuac 60
ccgcuggaga gugcgcgagg cggcagcggc gggagcgcug gccaccuccc cagcgcggcc 120
cccucuccuc agaaguugga cuuaggcaaa gcguccaaga aguuuuccgg cagucucucc 180
ugcgaggcgg ugagcgggga gccugcagcc gccagcgcag gggcccccgc ggccaugcuu 240
agugacaccg acgccgggga cgcauuugcc agcgcugcgg caguggccaa gccggggccc 300
ccggacggcc gcaagggcuc ccccugcggg gaggaggagc ugcccuccgc cgcugcagcc 360
gccgccgccg ccgccgccgc ggcugcggcc acugcgcgcu acuccaugga cagccugagc 420
uccgugcggu acuaccucca gucccccggu ccucaggggu cggagcuggc ugcgcccugc 480
ucacucuucc cguaccaggc ggcggcuggg gcgccccacg gaccugugua cccggcuccu 540
aacggggcgc gcuaccccua cggcuccaug cugccccccg gcggcuuccc cgcggcugcg 600
ugcccacccg ggagggcgca guucggccca ggagccggug cgggcagugg cgcgggcggu 660
aucaacggcg ggggcggcgg cccgggcacc uaucaguaca gccagggggc uccgcucuac 720
gggccguacc cuggagccgc agcggcggga ucuugcggag gacugggggg ccuggggguu 780
ccaaguucug gcuuccgugc ccacgucuac cugugcaacc ggccucugug gcucaaauuc 840
caccggcacc aaacugagau gaucaucacc aaacagggca ggcgcauguu uccuuucuug 900
agcuucaaca uaaacggacu caaccccacc gcccacuaca auguuuucgu ggaagugguu 960
cuggccgacc cuaaccacug gcgcuuccag gggggcaaau gggugaccug uggcaaagcc 1020
gacaauaaca ugcagggcaa caaaauguau guucacccag agucuccuaa uacugguucc 1080
cacuggauga gacaggagau uucauucggg aaauuaaaac ucaccaauaa caaaggcgca 1140
aauaacaaca acacccagau gauagucuua caauccuuac acaaauacca accccgacug 1200
cauauuguug aaguuacaga ggauggcgug gaggacuuga augagcccuc aaagacccag 1260
acuuuuaccu ucucagaaac gcaauucauu gcagugacug ccuaccaaaa caccgauauu 1320
acucaacuaa agauugauca uaaccccuuu gcaaaaggcu ucagagacaa cuaugauuca 1380
ucccaucaga uugucccugg aggucgguac ggcguucaau ccuucuuccc ggagcccuuu 1440
gucaacacuu uaccucaagc ccgcuauuau aauggcgaga gaaccgugcc acagaccaac 1500
ggccuccuuu caccccaaca gagcgaagag guggccaacc cuccccagcg guggcuuguc 1560
acgccugucc agcaaccugg gaccaacaaa cuagacauca guuccuauga aucugaauau 1620
acuucuagca cauugcuccc auauggcauu aaauccuugc cccuucagac aucccaugcc 1680
cugggguauu acccagaccc aaccuuuccu gcaauggcag gguggggagg ucgagguucu 1740
uaccagagga agauggcagc uggacuacca uggaccucca gaacaagccc cacuguguuc 1800
ucugaagauc agcucuccaa ggagaaagug aaagaggaaa uuggcucuuc uuggauagag 1860
acacccccuu ccaucaaauc ucuagauucc aaugauucag gaguauacac cagugcuugu 1920
aagcgaaggc ggcugucucc uagcaacucc aguaaugaaa auucacccuc cauaaagugu 1980
ggggacauua augcugaaga guauaguaaa gacaccucaa aaggcauggg aggguauuau 2040
gcuuuuuaca caagucccua g 2061
<210> 39
<211> 686
<212> PRT
<213> Homo sapiens
<400> 39
Met Gln Leu Gly Glu Gln Leu Leu Val Ser Ser Val Asn Leu Pro Gly
1 5 10 15
Ala His Phe Tyr Pro Leu Glu Ser Ala Arg Gly Gly Ser Gly Gly Ser
20 25 30
Ala Gly His Leu Pro Ser Ala Ala Pro Ser Pro Gln Lys Leu Asp Leu
35 40 45
Asp Lys Ala Ser Lys Lys Phe Ser Gly Ser Leu Ser Cys Glu Ala Val
50 55 60
Ser Gly Glu Pro Ala Ala Ala Ser Ala Gly Ala Pro Ala Ala Met Leu
65 70 75 80
Ser Asp Thr Asp Ala Gly Asp Ala Phe Ala Ser Ala Ala Ala Val Ala
85 90 95
Lys Pro Gly Pro Pro Asp Gly Arg Lys Gly Ser Pro Cys Gly Glu Glu
100 105 110
Glu Leu Pro Ser Ala Ala Ala Ala Ala Ala Ala Ala Ala Ala Ala Ala
115 120 125
Ala Ala Thr Ala Arg Tyr Ser Met Asp Ser Leu Ser Ser Glu Arg Tyr
130 135 140
Tyr Leu Gln Ser Pro Gly Pro Gln Gly Ser Glu Leu Ala Ala Pro Cys
145 150 155 160
Ser Leu Phe Pro Tyr Gln Ala Ala Ala Gly Ala Pro His Gly Pro Val
165 170 175
Tyr Pro Ala Pro Asn Gly Ala Arg Tyr Pro Tyr Gly Ser Met Leu Pro
180 185 190
Pro Gly Gly Phe Pro Ala Ala Val Cys Pro Pro Gly Arg Ala Gln Phe
195 200 205
Gly Pro Gly Ala Gly Ala Gly Ser Gly Ala Gly Gly Ser Ser Gly Gly
210 215 220
Gly Gly Gly Pro Gly Thr Tyr Gln Tyr Ser Gln Gly Ala Pro Leu Tyr
225 230 235 240
Gly Pro Tyr Pro Gly Ala Ala Ala Ala Gly Ser Cys Gly Gly Leu Gly
245 250 255
Gly Leu Gly Val Pro Gly Ser Gly Phe Arg Ala His Val Tyr Leu Cys
260 265 270
Asn Arg Pro Leu Trp Leu Lys Phe His Arg His Gln Thr Glu Met Ile
275 280 285
Ile Thr Lys Gln Gly Arg Arg Met Phe Pro Phe Leu Ser Phe Asn Ile
290 295 300
Asn Gly Leu Asn Pro Thr Ala His Tyr Asn Val Phe Val Glu Val Val
305 310 315 320
Leu Ala Asp Pro Asn His Trp Arg Phe Gln Gly Gly Lys Trp Val Thr
325 330 335
Cys Gly Lys Ala Asp Asn Asn Met Gln Gly Asn Lys Met Tyr Val His
340 345 350
Pro Glu Ser Pro Asn Thr Gly Ser His Trp Met Arg Gln Glu Ile Ser
355 360 365
Phe Gly Lys Leu Lys Leu Thr Asn Asn Lys Gly Ala Asn Asn Asn Asn
370 375 380
Thr Gln Met Ile Val Leu Gln Ser Leu His Lys Tyr Gln Pro Arg Leu
385 390 395 400
His Ile Val Glu Val Thr Glu Asp Gly Val Glu Asp Leu Asn Glu Pro
405 410 415
Ser Lys Thr Gln Thr Phe Thr Phe Ser Glu Thr Gln Phe Ile Ala Val
420 425 430
Thr Ala Tyr Gln Asn Thr Asp Ile Thr Gln Leu Lys Ile Asp His Asn
435 440 445
Pro Phe Ala Lys Gly Phe Arg Asp Asn Tyr Asp Ser Ser His Gln Ile
450 455 460
Val Pro Gly Gly Arg Tyr Gly Val Gln Ser Phe Phe Pro Glu Pro Phe
465 470 475 480
Val Asn Thr Leu Pro Gln Ala Arg Tyr Tyr Asn Gly Glu Arg Thr Val
485 490 495
Pro Gln Thr Asn Gly Leu Leu Ser Pro Gln Gln Ser Glu Glu Val Ala
500 505 510
Asn Pro Pro Gln Arg Trp Leu Val Thr Pro Val Gln Gln Pro Gly Thr
515 520 525
Asn Lys Leu Asp Ile Ser Ser Tyr Glu Ser Glu Tyr Thr Ser Ser Thr
530 535 540
Leu Leu Pro Tyr Gly Ile Lys Ser Leu Pro Leu Gln Thr Ser His Ala
545 550 555 560
Leu Gly Tyr Tyr Pro Asp Pro Thr Phe Pro Ala Met Ala Gly Trp Gly
565 570 575
Gly Arg Gly Ser Tyr Gln Arg Lys Met Ala Ala Gly Leu Pro Trp Thr
580 585 590
Ser Arg Thr Ser Pro Thr Val Phe Ser Glu Asp Gln Leu Ser Lys Glu
595 600 605
Lys Val Lys Glu Glu Ile Gly Ser Ser Trp Ile Glu Thr Pro Pro Ser
610 615 620
Ile Lys Ser Leu Asp Ser Asn Asp Ser Gly Val Tyr Thr Ser Ala Cys
625 630 635 640
Lys Arg Arg Arg Leu Ser Pro Ser Asn Ser Ser Asn Glu Asn Ser Pro
645 650 655
Ser Ile Lys Cys Glu Asp Ile Asn Ala Glu Glu Tyr Ser Lys Asp Thr
660 665 670
Ser Lys Gly Met Gly Gly Tyr Tyr Ala Phe Tyr Thr Thr Pro
675 680 685
<210> 40
<211> 849
<212> RNA
<213> Homo sapiens
<400> 40
augaggaacu ccuauagauu ucuggcaucc ucucucucag uugucguuuc ucuccugcua 60
auuccugaag augucuguga aaaaauuauu ggaggaaaug aaguaacucc ucauucaaga 120
cccuacaugg uccuacuuag ucuugacaga aaaaccaucu gugcuggggc uuugauugca 180
aaagacuggg uguugacugc agcucacugu aacuugaaca aaagguccca ggucauucuu 240
ggggcucacu caauaaccag ggaagagcca acaaaacaga uaaugcuugu uaagaaagag 300
uuucccuauc caugcuauga cccagccaca cgcgaaggug accuuaaacu uuuacagcug 360
acggaaaaag caaaaauuaa caaauaugug acuauccuuc aucuaccuaa aaagggggau 420
gaugugaaac caggaaccau gugccaaguu gcaggguggg ggaggacuca caauagugca 480
ucuugguccg auacucugag agaagucaau aucaccauca uagacagaaa agucugcaau 540
gaucgaaauc acuauaauuu uaacccugug auuggaauga auaugguuug ugcuggaagc 600
cuccgaggug gaagagacuc gugcaaugga gauucuggaa gcccuuuguu gugcgagggu 660
guuuuccgag gggucacuuc cuuuggccuu gaaaauaaau gcggagaccc ucgugggccu 720
ggugucuaua uucuucucuc aaagaaacac cucaacugga uaauuaugac uaucaaggga 780
gcaguuuaaa uaaccguuuc cuuucauuua cuguggcuuc uuaaucuuuu cacaaauaaa 840
aucaauuug 849
<210> 41
<211> 262
<212> PRT
<213> Homo sapiens
<400> 41
Met Arg Asn Ser Tyr Arg Phe Leu Ala Ser Ser Leu Ser Val Val Val
1 5 10 15
Ser Leu Leu Leu Ile Pro Glu Asp Val Cys Glu Lys Ile Ile Gly Gly
20 25 30
Asn Glu Val Thr Pro His Ser Arg Pro Tyr Met Val Leu Leu Ser Leu
35 40 45
Asp Arg Lys Thr Ile Cys Ala Gly Ala Leu Ile Ala Lys Asp Trp Val
50 55 60
Leu Thr Ala Ala His Cys Asn Leu Asn Lys Arg Ser Gln Val Ile Leu
65 70 75 80
Gly Ala His Ser Ile Thr Arg Glu Glu Pro Thr Lys Gln Ile Met Leu
85 90 95
Val Lys Lys Glu Phe Pro Tyr Pro Cys Tyr Asp Pro Ala Thr Arg Glu
100 105 110
Gly Asp Leu Lys Leu Leu Gln Leu Met Glu Lys Ala Lys Ile Asn Lys
115 120 125
Tyr Val Thr Ile Leu His Leu Pro Lys Lys Gly Asp Asp Val Lys Pro
130 135 140
Gly Thr Met Cys Gln Val Ala Gly Trp Gly Arg Thr His Asn Ser Ala
145 150 155 160
Ser Trp Ser Asp Thr Leu Arg Glu Val Asn Ile Thr Ile Ile Asp Arg
165 170 175
Lys Val Cys Asn Asp Arg Asn His Tyr Asn Phe Asn Pro Val Ile Gly
180 185 190
Met Asn Met Val Cys Ala Gly Ser Leu Arg Gly Gly Arg Asp Ser Cys
195 200 205
Asn Gly Asp Ser Gly Ser Pro Leu Leu Cys Glu Gly Val Phe Arg Gly
210 215 220
Val Thr Ser Phe Gly Leu Glu Asn Lys Cys Gly Asp Pro Arg Gly Pro
225 230 235 240
Gly Val Tyr Ile Leu Leu Ser Lys Lys His Leu Asn Trp Ile Ile Met
245 250 255
Thr Ile Lys Gly Ala Val
260
<210> 42
<211> 934
<212> RNA
<213> Homo sapiens
<400> 42
ugagaagaug caaccaaucc ugcuucugcu ggccuuccuc cugcugccca gggcagaugc 60
aggggagauc aucgggggac augaggccaa gccccacucc cgccccuaca uggcuuaucu 120
uaugaucugg gaucagaagu cucugaagag gugcgguggc uuccugauac aagacgacuu 180
cgugcugaca gcugcucacu guuggggaag cuccauaaau gucaccuugg gggcccacaa 240
uaucaaagaa caggagccga cccagcaguu uaucccugug aaaagaccca ucccccaucc 300
agccuauaau ccuaagaacu ucuccaacga caucaugcua cugcagcugg agagaaaggc 360
caagcggacc agagcugugc agccccucag gcuaccuagc aacaaggccc aggugaagcc 420
agggcagaca ugcagugugg ccggcugggg gcagacggcc ccccugggaa aacacucaca 480
cacacuacaa gaggugaaga ugacagugca ggaagaucga aagugcgaau cugacuuacg 540
ccauuauuac gacaguacca uugaguugug cgugggggac ccagagauua aaaagacuuc 600
cuuuaagggg gacucuggag gcccucuugu guguaacaag guggcccagg gcauugucuc 660
cuauggacga aacaauggca ugccuccacg agccugcacc aaagucucaa gcuuuguaca 720
cuggauaaag aaaaccauga aacgcuacua acuacaggaa gcaaacuaag cccccgcugu 780
aaugaaacac cuucucugga gccaagucca gauuuacacu gggagaggug ccagcaacug 840
aauaaauacc ucucccagug uaaaucugga gccaagucca gauuuacacu gggagaggug 900
ccagcaacug aauaaauacc ucuuagcuga gugg 934
<210> 43
<211> 247
<212> PRT
<213> Homo sapiens
<400> 43
Met Gln Pro Ile Leu Leu Leu Leu Ala Phe Leu Leu Leu Pro Arg Ala
1 5 10 15
Asp Ala Gly Glu Ile Ile Gly Gly His Glu Ala Lys Pro His Ser Arg
20 25 30
Pro Tyr Met Ala Tyr Leu Met Ile Trp Asp Gln Lys Ser Leu Lys Arg
35 40 45
Cys Gly Gly Phe Leu Ile Arg Asp Asp Phe Val Leu Thr Ala Ala His
50 55 60
Cys Trp Gly Ser Ser Ile Asn Val Thr Leu Gly Ala His Asn Ile Lys
65 70 75 80
Glu Gln Glu Pro Thr Gln Gln Phe Ile Pro Val Lys Arg Pro Ile Pro
85 90 95
His Pro Ala Tyr Asn Pro Lys Asn Phe Ser Asn Asp Ile Met Leu Leu
100 105 110
Gln Leu Glu Arg Lys Ala Lys Arg Thr Arg Ala Val Gln Pro Leu Arg
115 120 125
Leu Pro Ser Asn Lys Ala Gln Val Lys Pro Gly Gln Thr Cys Ser Val
130 135 140
Ala Gly Trp Gly Gln Thr Ala Pro Leu Gly Lys His Ser His Thr Leu
145 150 155 160
Gln Glu Val Lys Met Thr Val Gln Glu Asp Arg Lys Cys Glu Ser Asp
165 170 175
Leu Arg His Tyr Tyr Asp Ser Thr Ile Glu Leu Cys Val Gly Asp Pro
180 185 190
Glu Ile Lys Lys Thr Ser Phe Lys Gly Asp Ser Gly Gly Pro Leu Val
195 200 205
Cys Asn Lys Val Ala Gln Gly Ile Val Ser Tyr Gly Arg Asn Asn Gly
210 215 220
Met Pro Pro Arg Ala Cys Thr Lys Val Ser Ser Phe Val His Trp Ile
225 230 235 240
Lys Lys Thr Met Lys Arg Tyr
245
<210> 44
<211> 1193
<212> RNA
<213> Homo sapiens
<400> 44
ugaagaucag cuauuagaag agaaagauca guuaaguccu uuggaccuga ucagcuugau 60
acaagaacua cugauuucaa cuucuuuggc uuaauucucu cggaaacgau gaaauauaca 120
aguuauaucu uggcuuuuca gcucugcauc guuuuggguu cucuuggcug uuacugccag 180
gacccauaug uaaaagaagc agaaaaccuu aagaaauauu uuaaugcagg ucauucagau 240
guagcggaua auggaacucu uuucuuaggc auuuugaaga auuggaaaga ggagagugac 300
agaaaaauaa ugcagagcca aauugucucc uuuuacuuca aacuuuuuaa aaacuuuaaa 360
gaugaccaga gcauccaaaa gaguguggag accaucaagg aagacaugaa ugucaaguuu 420
uucaauagca acaaaaagaa acgagaugac uucgaaaagc ugacuaauua uucgguaacu 480
gacuugaaug uccaacgcaa agcaauacau gaacucaucc aagugauggc ugaacugucg 540
ccagcagcua aaacagggaa gcgaaaaagg agucagaugc uguuucaagg ucgaagagca 600
ucccaguaau gguuguccug ccugcaauau uugaauuuua aaucuaaauc uauuuauuaa 660
uauuuaacau uauuuauaug gggaauauau uuuuagacuc aucaaucaaa uaaguauuua 720
uaauagcaac uuuuguguaa ugaaaaugaa uaucuauuaa uauauguauu auuuauaauu 780
ccuauauccu gugacugucu cacuuaaucc uuuguuuucu gacuaauuag gcaaggcuau 840
gugauuacaa ggcuuuaucu caggggccaa cuaggcagcc aaccuaagca agaucccaug 900
gguugugugu uuauuucacu ugaugauaca augaacacuu auaagugaag ugauacuauc 960
caguuacugc cgguuugaaa auaugccugc aaucugagcc agugcuuuaa uggcauguca 1020
gacagaacuu gaauguguca ggugacccug augaaaacau agcaucucag gagauuucau 1080
gccuggugcu uccaaauauu guugacaacu gugacuguac ccaaauggaa aguaacucau 1140
uuguuaaaau uaucaauauc uaauauauau gaauaaagug uaaguucaca acu 1193
<210> 45
<211> 166
<212> PRT
<213> Homo sapiens
<400> 45
Met Lys Tyr Thr Ser Tyr Ile Leu Ala Phe Gln Leu Cys Ile Val Leu
1 5 10 15
Gly Ser Leu Gly Cys Tyr Cys Gln Asp Pro Tyr Val Lys Glu Ala Glu
20 25 30
Asn Leu Lys Lys Tyr Phe Asn Ala Gly His Ser Asp Val Ala Asp Asn
35 40 45
Gly Thr Leu Phe Leu Gly Ile Leu Lys Asn Trp Lys Glu Glu Ser Asp
50 55 60
Arg Lys Ile Met Gln Ser Gln Ile Val Ser Phe Tyr Phe Lys Leu Phe
65 70 75 80
Lys Asn Phe Lys Asp Asp Gln Ser Ile Gln Lys Ser Val Glu Thr Ile
85 90 95
Lys Glu Asp Met Asn Val Lys Phe Phe Asn Ser Asn Lys Lys Lys Arg
100 105 110
Asp Asp Phe Glu Lys Leu Thr Asn Tyr Ser Val Thr Asp Leu Asn Val
115 120 125
Gln Arg Lys Ala Ile His Glu Leu Ile Gln Val Met Ala Glu Leu Ser
130 135 140
Pro Ala Ala Lys Thr Gly Lys Arg Lys Arg Ser Gln Met Leu Phe Arg
145 150 155 160
Gly Arg Arg Ala Ser Gln
165
<210> 46
<211> 1668
<212> RNA
<213> Homo sapiens
<400> 46
auggcagccc gucugcuccu ccugggcauc cuucuccugc ugcugccccu gcccgucccu 60
gccccgugcc acacagccgc acgcucagag ugcaagcgca gccacaaguu cgugccuggu 120
gcauggcugg ccggggaggg uguggacgug accagccucc gccgcucggg cuccuuccca 180
guggacacac aaagguuccu gcggcccgac ggcaccugca cccucuguga aaaugcccua 240
caggagggca cccuccagcg ccugccucug gcgcucacca acuggcgggc ccagggcucu 300
ggcugccagc gccauguaac cagggccaaa gucagcucca cugaagcugu ggcccgggau 360
gcggcucgua gcauccgcaa cgacuggaag gucgggcugg acgugacucc uaagcccacc 420
agcaaugugc augugucugu ggccggcuca cacucacagg cagccaacuu ugcagcccag 480
aagacccacc aggaccagua cagcuucagc acugacacgg uggagugccg cuucuacagu 540
uuccaugugg uacacacucc cccgcugcac ccugacuuca agagggcccu cggggaccug 600
ccccaccacu ucaacgccuc cacccagccc gccuaccuca ggcuuaucuc caacuacggc 660
acccacuuca uccgggcugu ggagcugggu ggccgcauau cggcccucac ugcccugcgc 720
accugcgagc uggcccugga agggcucacg gacaacgagg uggaggacug ccugacuguc 780
gaggcccagg ucaacauagg cauccacggc agcaucucug ccgaagccaa ggccugugag 840
gagaagaaga agaagcacaa gaugacggcc uccuuccacc aaaccuaccg ggagcgccac 900
ucggaagugg uuggcggcca ucacaccucc auuaacgacc ugcuguucgg gauccaggcc 960
gggcccgagc aguacucagc cuggguaaac uccgugcccg gcagcccugg ccugguggac 1020
uacacccugg aaccccugca cgugcugcug gacagccagg acccgcggcg ggaggcacug 1080
aggagggccc ugagucagua ccugacggac agggcucgcu ggagggacug cagccggccg 1140
ugcccaccag ggcggcagaa gagcccccga gacccaugcc agugugugug ccauggcuca 1200
gcggucacca cccaggacug cugcccucgg cagaggggcc uggcccagcu ggaggugacc 1260
uucauccaag cauggagccu guggggggac ugguucacug ccacggaugc cuaugugaag 1320
cucuucuuug guggccagga gcugaggacg agcaccgugu gggacaauaa caaccccauc 1380
uggucagugc ggcuggauuu uggggaugug cuccuggcca caggggggcc ccugagguug 1440
caggucuggg aucaggacuc uggcagggac gaugaccucc uuggcaccug ugaucaggcu 1500
cccaagucug guucccauga ggugagaugc aaccugaauc auggccaccu aaaauuccgc 1560
uaucaugcca ggugcuugcc ccaccuggga ggaggcaccu gccuggacua ugucccccaa 1620
augcuucugg gggagccucc aggaaaccgg aguggggccg ugugguga 1668
<210> 47
<211> 555
<212> PRT
<213> Homo sapiens
<400> 47
Met Ala Ala Arg Leu Leu Leu Leu Gly Ile Leu Leu Leu Leu Leu Pro
1 5 10 15
Leu Pro Val Pro Ala Pro Cys His Thr Ala Ala Arg Ser Glu Cys Lys
20 25 30
Arg Ser His Lys Phe Val Pro Gly Ala Trp Leu Ala Gly Glu Gly Val
35 40 45
Asp Val Thr Ser Leu Arg Arg Ser Gly Ser Phe Pro Val Asp Thr Gln
50 55 60
Arg Phe Leu Arg Pro Asp Gly Thr Cys Thr Leu Cys Glu Asn Ala Leu
65 70 75 80
Gln Glu Gly Thr Leu Gln Arg Leu Pro Leu Ala Leu Thr Asn Trp Arg
85 90 95
Ala Gln Gly Ser Gly Cys Gln Arg His Val Thr Arg Ala Lys Val Ser
100 105 110
Ser Thr Glu Ala Val Ala Arg Asp Ala Ala Arg Ser Ile Arg Asn Asp
115 120 125
Trp Lys Val Gly Leu Asp Val Thr Pro Lys Pro Thr Ser Asn Val His
130 135 140
Val Ser Val Ala Gly Ser His Ser Gln Ala Ala Asn Phe Ala Ala Gln
145 150 155 160
Lys Thr His Gln Asp Gln Tyr Ser Phe Ser Thr Asp Thr Val Glu Cys
165 170 175
Arg Phe Tyr Ser Phe His Val Val His Thr Pro Pro Leu His Pro Asp
180 185 190
Phe Lys Arg Ala Leu Gly Asp Leu Pro His His Phe Asn Ala Ser Thr
195 200 205
Gln Pro Ala Tyr Leu Arg Leu Ile Ser Asn Tyr Gly Thr His Phe Ile
210 215 220
Arg Ala Val Glu Leu Gly Gly Arg Ile Ser Ala Leu Thr Ala Leu Arg
225 230 235 240
Thr Cys Glu Leu Ala Leu Glu Gly Leu Thr Asp Asn Glu Val Glu Asp
245 250 255
Cys Leu Thr Val Glu Ala Gln Val Asn Ile Gly Ile His Gly Ser Ile
260 265 270
Ser Ala Glu Ala Lys Ala Cys Glu Glu Lys Lys Lys Lys His Lys Met
275 280 285
Thr Ala Ser Phe His Gln Thr Tyr Arg Glu Arg His Ser Glu Val Val
290 295 300
Gly Gly His His Thr Ser Ile Asn Asp Leu Leu Phe Gly Ile Gln Ala
305 310 315 320
Gly Pro Glu Gln Tyr Ser Ala Trp Val Asn Ser Leu Pro Gly Ser Pro
325 330 335
Gly Leu Val Asp Tyr Thr Leu Glu Pro Leu His Val Leu Leu Asp Ser
340 345 350
Gln Asp Pro Arg Arg Glu Ala Leu Arg Arg Ala Leu Ser Gln Tyr Leu
355 360 365
Thr Asp Arg Ala Arg Trp Arg Asp Cys Ser Arg Pro Cys Pro Pro Gly
370 375 380
Arg Gln Lys Ser Pro Arg Asp Pro Cys Gln Cys Val Cys His Gly Ser
385 390 395 400
Ala Val Thr Thr Gln Asp Cys Cys Pro Arg Gln Arg Gly Leu Ala Gln
405 410 415
Leu Glu Val Thr Phe Ile Gln Ala Trp Gly Leu Trp Gly Asp Trp Phe
420 425 430
Thr Ala Thr Asp Ala Tyr Val Lys Leu Phe Phe Gly Gly Gln Glu Leu
435 440 445
Arg Thr Ser Thr Val Trp Asp Asn Asn Asn Pro Ile Trp Ser Val Arg
450 455 460
Leu Asp Phe Gly Asp Val Leu Leu Ala Thr Gly Gly Pro Leu Arg Leu
465 470 475 480
Gln Val Trp Asp Gln Asp Ser Gly Arg Asp Asp Asp Leu Leu Gly Thr
485 490 495
Cys Asp Gln Ala Pro Lys Ser Gly Ser His Glu Val Arg Cys Asn Leu
500 505 510
Asn His Gly His Leu Lys Phe Arg Tyr His Ala Arg Cys Leu Pro His
515 520 525
Leu Gly Gly Gly Thr Cys Leu Asp Tyr Val Pro Gln Met Leu Leu Gly
530 535 540
Glu Pro Pro Gly Asn Arg Ser Gly Ala Val Trp
545 550 555
<210> 48
<211> 2545
<212> RNA
<213> Homo sapiens
<400> 48
auccaauaca ggagugacuu ggaacuccau ucuaucacua ugaagaaaag ugguguucuu 60
uuccucuugg gcaucaucuu gcugguucug auuggagugc aaggaacccc aguagugaga 120
aagggucgcu guuccugcau cagcaccaac caagggacua uccaccuaca auccuugaaa 180
gaccuuaaac aauuugcccc aagcccuucc ugcgagaaaa uugaaaucau ugcuacacug 240
aagaauggag uucaaacaug ucuaaaccca gauucagcag augugaagga acugauuaaa 300
aagugggaga aacaggucag ccaaaagaaa aagcaaaaga augggaaaaa acaucaaaaa 360
aagaaaguuc ugaaaguucg aaaaucucaa cguucucguc aaaagaagac uacauaagag 420
accacuucac caauaaguau ucuguguuaa aaauguucua uuuuaauuau accgcuauca 480
uuccaaagga ggauggcaua uaauacaaag gcuuauuaau uugacuagaa aauuuaaaac 540
auuacucuga aauuguaacu aaaguuagaa aguugauuuu aagaauccaa acguuaagaa 600
uuguuaaagg cuaugauugu cuuuguucuu cuaccaccca ccaguugaau uucaucaugc 660
uuaaggccau gauuuuagca auacccaugu cuacacagau guucacccaa ccacauccca 720
cucacaacag cugccuggaa gagcagcccu aggcuuccac guacugcagc cuccagagag 780
uaucugaggc acaugucagc aaguccuaag ccuguuagca ugcuggugag ccaagcaguu 840
ugaaauugag cuggaccuca ccaagcugcu guggccauca accucuguau uugaaucagc 900
cuacaggccu cacacacaau gugucugaga gauucaugcu gauuguuauu ggguaucacc 960
acuggagauc accagugugu ggcuuucaga gccuccuuuc uggcuuugga agccauguga 1020
uuccaucuug cccgcucagg cugaccacuu uauuucuuuu uguuccccuu ugcuucauuc 1080
aagucagcuc uucuccaucc uaccacaaug cagugccuuu cuucucucca gugcaccugu 1140
cauaugcucu gauuuaucug agucaacucc uuucucaucu uguccccaac accccacaga 1200
agugcuuucu ucucccaauu cauccucacu caguccagcu uaguucaagu ccugccucuu 1260
aaauaaaccu uuuuggacac acaaauuauc uuaaaacucc uguuucacuu gguucaguac 1320
cacaugggug aacacucaau gguuaacuaa uucuugggug uuuauccuau cucuccaacc 1380
agauugucag cuccuugagg gcaagagcca caguauauuu cccuguuucu uccacagugc 1440
cuaauaauac uguggaacua gguuuuaaua auuuuuuaau ugauguuguu augggcagga 1500
uggcaaccag accauugucu cagagcaggu gcuggcucuu uccuggcuac uccauguugg 1560
cuagccucug guaaccucuu acuuauuauc uucaggacac ucacuacagg gaccagggau 1620
gaugcaacau ccuugucuuu uuaugacagg auguuugcuc agcuucucca acaauaagaa 1680
gcacguggua aaacacuugc ggauauucug gacuguuuuu aaaaaauaua caguuuaccg 1740
aaaaucauau aaucuuacaa ugaaaaggac uuuauagauc agccagugac caaccuuuuc 1800
ccaaccauac aaaaauuccu uuucccgaag gaaaagggcu uucucaauaa gccucagcuu 1860
ucuaagaucu aacaagauag ccaccgagau ccuuaucgaa acucauuuua ggcaaauaug 1920
aguuuuauug uccguuuacu uguuucagag uuuguauugu gauuaucaau uaccacacca 1980
ucucccauga agaaagggaa cggugaagua cuaagcgcua gaggaagcag ccaagucggu 2040
uaguggaagc augauuggug cccaguuagc cucugcagga uguggaaacc uccuuccagg 2100
ggagguucag ugaauugugu aggagagguu gucuguggcc agaauuuaaa ccuauacuca 2160
cuuucccaaa uugaaucacu gcucacacug cugaugauuu agagugcugu ccgguggaga 2220
ucccacccga acgucuuauc uaaucaugaa acucccuagu uccuucaugu aacuucccug 2280
aaaaaucuaa guguuucaua aauuugagag ucugugaccc acuuaccuug caucucacag 2340
guagacagua uauaacuaac aaccaaagac uacauauugu cacugacaca cacguuauaa 2400
ucauuuauca uauauauaca uacaugcaua cacucucaaa gcaaauaauu uuucacuuca 2460
aaacaguauu gacuuguaua ccuuguaauu ugaaauauuu ucuuuguuaa aauagaaugg 2520
uaucaauaaa uagaccauua aucag 2545
<210> 49
<211> 125
<212> PRT
<213> Homo sapiens
<400> 49
Met Lys Lys Ser Gly Val Leu Phe Leu Leu Gly Ile Ile Leu Leu Val
1 5 10 15
Leu Ile Gly Val Gln Gly Thr Pro Val Val Arg Lys Gly Arg Cys Ser
20 25 30
Cys Ile Ser Thr Asn Gln Gly Thr Ile His Leu Gln Ser Leu Lys Asp
35 40 45
Leu Lys Gln Phe Ala Pro Ser Pro Ser Cys Glu Lys Ile Glu Ile Ile
50 55 60
Ala Thr Leu Lys Asn Gly Val Gln Thr Cys Leu Asn Pro Asp Ser Ala
65 70 75 80
Asp Val Lys Glu Leu Ile Lys Lys Trp Glu Lys Gln Val Ser Gln Lys
85 90 95
Lys Lys Gln Lys Asn Gly Lys Lys His Gln Lys Lys Lys Val Leu Lys
100 105 110
Val Arg Lys Ser Gln Arg Ser Arg Gln Lys Lys Thr Thr
115 120 125
<210> 50
<211> 1172
<212> RNA
<213> Homo sapiens
<400> 50
gagacauucc ucaauugcuu agacauauuc ugagccuaca gcagaggaac cuccagucuc 60
agcaccauga aucaaacugc gauucugauu ugcugccuua ucuuucugac ucuaaguggc 120
auucaaggag uaccucucuc uagaaccgua cgcuguaccu gcaucagcau uaguaaucaa 180
ccuguuaauc caaggucuuu agaaaaacuu gaaauuauuc cugcaagcca auuuugucca 240
cguguugaga ucauugcuac aaugaaaaag aagggugaga agagaugucu gaauccagaa 300
ucgaaggcca ucaagaauuu acugaaagca guuagcaagg aaaugucuaa aagaucuccu 360
uaaaaccaga ggggagcaaa aucgaugcag ugcuuccaag gauggaccac acagaggcug 420
ccucucccau cacuucccua cauggaguau augucaagcc auaauuguuc uuaguuugca 480
guuacacuaa aaggugacca augaugguca ccaaaucagc ugcuacuacu ccuguaggaa 540
gguuaauguu caucauccua agcuauucag uaauaacucu acccuggcac uauaauguaa 600
gcucuacuga ggugcuaugu ucuuagugga uguucugacc cugcuucaaa uauuucccuc 660
accuuuccca ucuuccaagg guacuaagga aucuuucugc uuugggguuu aucagaauuc 720
ucagaaucuc aaauaacuaa aagguaugca aucaaaucug cuuuuuaaag aaugcucuuu 780
acuucaugga cuuccacugc cauccuccca aggggcccaa auucuuucag uggcuaccua 840
cauacaauuc caaacacaua caggaaggua gaaauaucug aaaauguaug uguaaguauu 900
cuuauuuaau gaaagacugu acaaaguaua agucuuagau guauauauuu ccuauauugu 960
uuucagugua cauggaauaa cauguaauua aguacuaugu aucaaugagu aacaggaaaa 1020
uuuuaaaaau acagauagau auaugcucug cauguuacau aagauaaaug ugcugaaugg 1080
uuuucaaaua aaaaugaggu acucuccugg aaauauuaag aaagacuauc uaaauguuga 1140
aagaucaaaa gguuaauaaa guaauuauaa cu 1172
<210> 51
<211> 98
<212> PRT
<213> Homo sapiens
<400> 51
Met Asn Gln Thr Ala Ile Leu Ile Cys Cys Leu Ile Phe Leu Thr Leu
1 5 10 15
Ser Gly Ile Gln Gly Val Pro Leu Ser Arg Thr Val Arg Cys Thr Cys
20 25 30
Ile Ser Ile Ser Asn Gln Pro Val Asn Pro Arg Ser Leu Glu Lys Leu
35 40 45
Glu Ile Ile Pro Ala Ser Gln Phe Cys Pro Arg Val Glu Ile Ile Ala
50 55 60
Thr Met Lys Lys Lys Gly Glu Lys Arg Cys Leu Asn Pro Glu Ser Lys
65 70 75 80
Ala Ile Lys Asn Leu Leu Lys Ala Val Ser Lys Glu Arg Ser Lys Arg
85 90 95
Ser Pro
<210> 52
<211> 995
<212> RNA
<213> Homo sapiens
<400> 52
gaauucggcc aaagaggccu acuuccaaga agagcagcaa agcugaagua gcagcaacag 60
caccagcagc aacagcaaaa aacaaacaug agugugaagg gcauggcuau agccuuggcu 120
gugauauugu gugcuacagu uguucaaggc uuccccaugu ucaaaagagg acgcugucuu 180
ugcauaggcc cugggguaaa agcagugaaa guggcagaua uugagaaagc cuccauaaug 240
uacccaagua acaacuguga caaaauagaa gugauuauua cccugaaaga aaauaaagga 300
caacgaugcc uaaaucccaa aucgaagcaa gcaaggcuua uaaucaaaaa aguugaaaga 360
aagaauuuuu aaaaauauca aaacauauga aguccuggaa aagggcaucu gaaaaaccua 420
gaacaaguuu aacugugacu acugaaauga caagaauucu acaguaggaa acugagacuu 480
uucuaugguu uugugacuuu caacuuuugu acaguuaugu gaaggaugaa agguggguga 540
aaggaccaaa aacagaaaua cagucuuccu gaaugaauga caaucagaau uccacugccc 600
aaaggagucc aacaauuaaa uggauuucua ggaaaagcua ccuuaagaaa ggcugguuac 660
caucggaguu uacaaagugc uuucacguuc uuacuuguug uauuauacau ucaugcauuu 720
cuaggcuaga gaaccuucua gauuugaugc uuacaacuau ucuguuguga cuaugagaac 780
auuucugucu cuagaaguua ucugucugua uugaucuuua ugcuauauua cuaucugugg 840
uuacagugga gacauugaca uuauuacugg agucaagccc uuauaaguca aaagcaccua 900
ugugucguaa agcauuccuc aaacauuuaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 960
aaaaaaaaaa aaaaaaaaaa aaaaaaagcg gccgc 995
<210> 53
<211> 94
<212> PRT
<213> Homo sapiens
<400> 53
Met Ser Val Lys Gly Met Ala Ile Ala Leu Ala Val Ile Leu Cys Ala
1 5 10 15
Thr Val Val Gln Gly Phe Pro Met Phe Lys Arg Gly Arg Cys Leu Cys
20 25 30
Ile Gly Pro Gly Val Lys Ala Val Lys Val Ala Asp Ile Glu Lys Ala
35 40 45
Ser Ile Met Tyr Pro Ser Asn Asn Cys Asp Lys Ile Glu Val Ile Ile
50 55 60
Thr Leu Lys Glu Asn Lys Gly Gln Arg Cys Leu Asn Pro Lys Ser Lys
65 70 75 80
Gln Ala Arg Leu Ile Ile Lys Lys Val Glu Arg Lys Asn Phe
85 90
<210> 54
<211> 1216
<212> RNA
<213> Homo sapiens
<400> 54
uucggcacuu gggagaagau guuugaaaaa acugacucug cuaaugagcc uggacucaga 60
gcucaagucu gaacucuacc uccagacaga augaaguuca ucucgacauc ucugcuucuc 120
augcugcugg ucagcagccu cucuccaguc caagguguuc uggaggucua uuacacaagc 180
uugaggugua gaugugucca agagagcuca gucuuuaucc cuagacgcuu cauugaucga 240
auucaaaucu ugccccgugg gaaugguugu ccaagaaaag aaaucauagu cuggaagaag 300
aacaagucaa uugugugugu ggacccucaa gcugaaugga uacaaagaau gauggaagua 360
uugagaaaaa gaaguucuuc aacucuacca guuccagugu uuaagagaaa gauucccuga 420
ugcugauauu uccacuaaga acaccugcau ucuucccuua ucccugcucu ggauuuuagu 480
uuugugcuua guuaaaucuu uuccagggag aaagaacuuc cccauacaaa uaaggcauga 540
ggacuaugug aaaaauaacc uugcaggagc ugauggggca aacucaagcu ucuucacuca 600
cagcacccua uauacacuug gaguuugcau ucuuauucau cagggaggaa aguuucuuug 660
aaaauaguua uucaguuaua aguaauacag gauuauuuug auuauauacu uguuguuuaa 720
uguuuaaaau uucuuagaaa acaauggaau gagaauuuaa gccucaaauu ugaacaugug 780
gcuugaauua agaagaaaau uauggcauau auuaaaagca ggcuucuaug aaagacucaa 840
aaagcugccu gggaggcaga uggaacuuga gccugucaag aggcaaagga auccauguag 900
uagauauccu cugcuuaaaa acucacuacg gaggagaauu aaguccuacu uuuaaagaau 960
uucuuuauaa aauuuacugu cuaagauuaa uagcauucga agauccccag acuucauaga 1020
auacucaggg aaagcauuua aagggugaug uacacaugua uccuuucaca cauuugccuu 1080
gacaaacuuc uuucacucac aucuuuuuca cugacuuuuu uugugggggc ggggccgggg 1140
ggacucuggu aucuaauucu uuaaugauuc cuauaaaucu aaugacauuc aauaaaguug 1200
agcaaacauu uuacuu 1216
<210> 55
<211> 109
<212> PRT
<213> Homo sapiens
<400> 55
Met Lys Phe Ile Ser Thr Ser Leu Leu Leu Met Leu Leu Val Ser Ser
1 5 10 15
Leu Ser Pro Val Gln Gly Val Leu Glu Val Tyr Tyr Thr Ser Leu Arg
20 25 30
Cys Arg Cys Val Gln Glu Ser Ser Val Phe Ile Pro Arg Arg Phe Ile
35 40 45
Asp Arg Ile Gln Ile Leu Pro Arg Gly Asn Gly Cys Pro Arg Lys Glu
50 55 60
Ile Ile Val Trp Lys Lys Asn Lys Ser Ile Val Cys Val Asp Pro Gln
65 70 75 80
Ala Glu Trp Ile Gln Arg Met Met Glu Val Leu Arg Lys Arg Ser Ser
85 90 95
Ser Thr Leu Pro Val Pro Val Phe Lys Arg Lys Ile Pro
100 105
<210> 56
<211> 1770
<212> RNA
<213> Homo sapiens
<400> 56
gaggagugga uuacauauuc caacaguugu uauuacauug guaaggaaag aagaacuugg 60
gaagaaagag uuugcuggcc ugugcuucga agaacucuga ucugcuuucu auagauaaug 120
aggaagaaau gguaugugug gggacuuccc aguuggcugu aaguugccau uugaacuaaa 180
cgaaauagau caggaacuga ggacauaucu aaauuuucua guuuuauaga aggcuuuuau 240
ccacaagaau caagaucuuc ccucucugag caggaauccu uugugcauug aagacuuuag 300
auuccucucu gcgguagacg ugcacuuaua aguauuugau gggguggauu cguggucgga 360
ggucucgaca cagcugggag augagugaau uucauaauua uaacuuggau cugaagaaga 420
gugauuuuuc aacacgaugg caaaagcaaa gauguccagu agucaaaagc aaauguagag 480
aaaaugcauc uccauuuuuu uucugcugcu ucaucgcugu agccauggga auccguuuca 540
uuauuauggu agcaauaugg agugcuguau uccuaaacuc auuauucaac caagaaguuc 600
aaauucccuu gaccgaaagu uacuguggcc cauguccuaa aaacuggaua uguuacaaaa 660
auaacugcua ccaauuuuuu gaugagagua aaaacuggua ugagagccag gcuucuugua 720
ugucucaaaa ugccagccuu cugaaaguau acagcaaaga ggaccaggau uuacuuaaac 780
uggugaaguc auaucauugg augggacuag uacacauucc aacaaaugga ucuuggcagu 840
gggaagaugg cuccauucuc ucacccaacc uacuaacaau aauugaaaug cagaagggag 900
acugugcacu cuaugccucg agcuuuaaag gcuauauaga aaacuguuca acuccaaaua 960
cauacaucug caugcaaagg acuguguaaa gaugaucaac caucucaaua aaagccagga 1020
acagagaaga gauuacacca gcgguaacac ugccaaccga gacuaaagga aacaaacaaa 1080
aacaggacaa aaugaccaaa gacugucaga uuucuuagac uccacaggac caaaccauag 1140
aacaauuuca cugcaaacau gcaugauucu ccaagacaaa agaagagaga uccuaaaggc 1200
aauucagaua uccccaaggc ugccucuccc accacaagcc cagaguggau gggcuggggg 1260
aggggugcug uuuuaauuuc uaaagguagg accaacaccc aggggaucag ugaaggaaga 1320
gaaggccagc agaucaguga gagugcaacc ccacccucca caggaaauug ccucaugggc 1380
agggccacag cagagagaca cagcaugggc agugccuucc cugccugugg gggucaugcu 1440
gccacuuuua auggguccuc cacccaacgg ggucagggag guggugcugc cccagugggc 1500
caugauuauc uuaaaggcau uauucuccag ccuuaagauc uuaggacguu uccuuugcua 1560
ugauuuguac uugcuugagu cccaugacug uuucucuucc ucucuuucuu ccuuuuggaa 1620
uaguaauauc cauccuaugu uugucccacu auuguauuuu ggaagcacau aacuuguuug 1680
guuucacagg uucacaguua agaaggaauu uugccucuga auaaauagaa ucuugagucu 1740
caugcaaaaa aaaaaaaaaa aaaaaaaaaa 1770
<210> 57
<211> 216
<212> PRT
<213> Homo sapiens
<400> 57
Met Gly Trp Ile Arg Gly Arg Arg Ser Arg His Ser Trp Glu Met Ser
1 5 10 15
Glu Phe His Asn Tyr Asn Leu Asp Leu Lys Lys Ser Asp Phe Ser Thr
20 25 30
Arg Trp Gln Lys Gln Arg Cys Pro Val Val Lys Ser Lys Cys Arg Glu
35 40 45
Asn Ala Ser Pro Phe Phe Phe Cys Cys Phe Ile Ala Val Ala Met Gly
50 55 60
Ile Arg Phe Ile Ile Met Val Ala Ile Trp Ser Ala Val Phe Leu Asn
65 70 75 80
Ser Leu Phe Asn Gln Glu Val Gln Ile Pro Leu Thr Glu Ser Tyr Cys
85 90 95
Gly Pro Cys Pro Lys Asn Trp Ile Cys Tyr Lys Asn Asn Cys Tyr Gln
100 105 110
Phe Phe Asp Glu Ser Lys Asn Trp Tyr Glu Ser Gln Ala Ser Cys Met
115 120 125
Ser Gln Asn Ala Ser Leu Leu Lys Val Tyr Ser Lys Glu Asp Gln Asp
130 135 140
Leu Leu Lys Leu Val Lys Ser Tyr His Trp Met Gly Leu Val His Ile
145 150 155 160
Pro Thr Asn Gly Ser Trp Gln Trp Glu Asp Gly Ser Ile Leu Ser Pro
165 170 175
Asn Leu Leu Thr Ile Ile Glu Met Gln Lys Gly Asp Cys Ala Leu Tyr
180 185 190
Ala Ser Ser Phe Lys Gly Tyr Ile Glu Asn Cys Ser Thr Pro Asn Thr
195 200 205
Tyr Ile Cys Met Gln Arg Thr Val
210 215
<210> 58
<211> 1083
<212> RNA
<213> Homo sapiens
<400> 58
cagagagcaa uauggcuggu uccccaacau gccucacccu caucuauauc cuuuggcagc 60
ucacaggguc agcagccucu ggacccguga aagagcuggu cgguuccguu gguggggccg 120
ugacuuuccc ccugaagucc aaaguaaagc aaguugacuc uauugucugg accuucaaca 180
caaccccucu ugucaccaua cagccagaag ggggcacuau cauagugacc caaaaucgua 240
auagggagag aguagacuuc ccagauggag gcuacucccu gaagcucagc aaacugaaga 300
agaaugacuc agggaucuac uaugugggga uauacagcuc aucacuccag cagcccucca 360
cccaggagua cgugcugcau gucuacgagc accugucaaa gccuaaaguc accauggguc 420
ugcagagcaa uaagaauggc accuguguga ccaaucugac augcugcaug gaacaugggg 480
aagaggaugu gauuuauacc uggaaggccc uggggcaagc agccaaugag ucccauaaug 540
gguccauccu ccccaucucc uggagauggg gagaaaguga uaugaccuuc aucugcguug 600
ccaggaaccc ugucagcaga aacuucucaa gccccauccu ugccaggaag cucugugaag 660
gugcugcuga ugacccagau uccuccaugg uccuccugug ucuccuguug gugccccucc 720
ugcucagucu cuuuguacug gggcuauuuc uuugguuucu gaagagagag agacaagaag 780
aguacauuga agagaagaag agaguggaca uuugucggga aacuccuaac auaugccccc 840
auucuggaga gaacacagag uacgacacaa ucccucacac uaauagaaca auccuaaagg 900
aagauccagc aaauacgguu uacuccacug uggaaauacc gaaaaagaug gaaaaucccc 960
acucacugcu cacgaugcca gacacaccaa ggcuauuugc cuaugagaau guuaucuaga 1020
cagcagugca cugccccuaa gucucugcuc aaaaaaaaaa caauucucgg cccaaagaaa 1080
aca 1083
<210> 59
<211> 335
<212> PRT
<213> Homo sapiens
<400> 59
Met Ala Gly Ser Pro Thr Cys Leu Thr Leu Ile Tyr Ile Leu Trp Gln
1 5 10 15
Leu Thr Gly Ser Ala Ala Ser Gly Pro Val Lys Glu Leu Val Gly Ser
20 25 30
Val Gly Gly Ala Val Thr Phe Pro Leu Lys Ser Lys Val Lys Gln Val
35 40 45
Asp Ser Ile Val Trp Thr Phe Asn Thr Thr Pro Leu Val Thr Ile Gln
50 55 60
Pro Glu Gly Gly Thr Ile Ile Val Thr Gln Asn Arg Asn Arg Glu Arg
65 70 75 80
Val Asp Phe Pro Asp Gly Gly Tyr Ser Leu Lys Leu Ser Lys Leu Lys
85 90 95
Lys Asn Asp Ser Gly Ile Tyr Tyr Val Gly Ile Tyr Ser Ser Ser Leu
100 105 110
Gln Gln Pro Ser Thr Gln Glu Tyr Val Leu His Val Tyr Glu His Leu
115 120 125
Ser Lys Pro Lys Val Thr Met Gly Leu Gln Ser Asn Lys Asn Gly Thr
130 135 140
Cys Val Thr Asn Leu Thr Cys Cys Met Glu His Gly Glu Glu Asp Val
145 150 155 160
Ile Tyr Thr Trp Lys Ala Leu Gly Gln Ala Ala Asn Glu Ser His Asn
165 170 175
Gly Ser Ile Leu Pro Ile Ser Trp Arg Trp Gly Glu Ser Asp Met Thr
180 185 190
Phe Ile Cys Val Ala Arg Asn Pro Val Ser Arg Asn Phe Ser Ser Pro
195 200 205
Ile Leu Ala Arg Lys Leu Cys Glu Gly Ala Ala Asp Asp Pro Asp Ser
210 215 220
Ser Met Val Leu Leu Cys Leu Leu Leu Val Pro Leu Leu Leu Ser Leu
225 230 235 240
Phe Val Leu Gly Leu Phe Leu Trp Phe Leu Lys Arg Glu Arg Gln Glu
245 250 255
Glu Tyr Ile Glu Glu Lys Lys Arg Val Asp Ile Cys Arg Glu Thr Pro
260 265 270
Asn Ile Cys Pro His Ser Gly Glu Asn Thr Glu Tyr Asp Thr Ile Pro
275 280 285
His Thr Asn Arg Thr Ile Leu Lys Glu Asp Pro Ala Asn Thr Val Tyr
290 295 300
Ser Thr Val Glu Ile Pro Lys Lys Met Glu Asn Pro His Ser Leu Leu
305 310 315 320
Thr Met Pro Asp Thr Pro Arg Leu Phe Ala Tyr Glu Asn Val Ile
325 330 335
<210> 60
<211> 741
<212> RNA
<213> Homo sapiens
<400> 60
aaccgagagg cugagacuaa cccagaaaga uccaauucuc aaacugaagc ucgcacucuc 60
gccuccagca ugaaagucuc ugccgcccuu cugugccugc ugcucauagc agccaccuuc 120
auuccccaag ggcucgcuca gccagaugca aucaaugccc cagucaccug cuguuauaac 180
uucaccaaua ggaagaucuc agugcagagg cucgcgagcu auagaagaau caccagcagc 240
aaguguccca aagaagcugu gaucuucaag accauugugg ccaaggagau cugugcugac 300
cccaagcaga aguggguuca ggauuccaug gaccaccugg acaagcaaac ccaaacuccg 360
aagacuugaa cacucacucc acaacccaag aaucugcagc uaacuuauuu uccccuagcu 420
uuccccagac acccuguuuu auuuuauuau aaugaauuuu guuuguugau gugaaacauu 480
augccuuaag uaauguuaau ucuuauuuaa guuauugaug uuuuaaguuu aucuuucaug 540
guacuagugu uuuuuagaua cagagacuug gggaaauugc uuuuccucuu gaaccacagu 600
ucuaccccug ggauguuuug agggucuuug caagaaucau uaauacaaag aauuuuuuuu 660
aacauuccaa ugcauugcua aaauauuauu guggaaauga auauuuugua acuauuacac 720
caaauaaaua uauuuuugua c 741
<210> 61
<211> 99
<212> PRT
<213> Homo sapiens
<400> 61
Met Lys Val Ser Ala Ala Leu Leu Cys Leu Leu Leu Ile Ala Ala Thr
1 5 10 15
Phe Ile Pro Gln Gly Leu Ala Gln Pro Asp Ala Ile Asn Ala Pro Val
20 25 30
Thr Cys Cys Tyr Asn Phe Thr Asn Arg Lys Ile Ser Val Gln Arg Leu
35 40 45
Ala Ser Tyr Arg Arg Ile Thr Ser Ser Lys Cys Pro Lys Glu Ala Val
50 55 60
Ile Phe Lys Thr Ile Val Ala Lys Glu Ile Cys Ala Asp Pro Lys Gln
65 70 75 80
Lys Trp Val Gln Asp Ser Met Asp His Leu Asp Lys Gln Thr Gln Thr
85 90 95
Pro Lys Thr
<210> 62
<211> 1160
<212> RNA
<213> Homo sapiens
<400> 62
ccuccgacag ccucuccaca gguaccauga aggucuccgc ggcacgccuc gcugucaucc 60
ucauugcuac ugcccucugc gcuccugcau cugccucccc auauuccucg gacaccacac 120
ccugcugcuu ugccuacauu gcccgcccac ugccccgugc ccacaucaag gaguauuucu 180
acaccagugg caagugcucc aacccagcag ucgucuuugu cacccgaaag aaccgccaag 240
ugugugccaa cccagagaag aaauggguuc gggaguacau caacucuuug gagaugagcu 300
aggauggaga guccuugaac cugaacuuac acaaauuugc cuguuucugc uugcucuugu 360
ccuagcuugg gaggcuuccc cucacuaucc uaccccaccc gcuccuugaa gggcccagau 420
ucugaccacg acgagcagca guuacaaaaa ccuuccccag gcuggacgug guggcucagc 480
cuuguaaucc cagcacuuug ggaggccaag guggguggau cacuugaggu caggaguucg 540
agacagccug gccaacauga ugaaacccca uguguacuaa aaauacaaaa aauuagccgg 600
gcgugguagc gggcgccugu agucccagcu acucgggagg cugaggcagg agaauggcgu 660
gaacccggga gcggagcuug cagugagccg agaucgcgcc acugcacucc agccugggcg 720
acagagcgag acuccgucuc aaaaaaaaaa aaaaaaaaaa aaaaaauaca aaaauuagcc 780
gcgugguggc ccacgccugu aaucccagcu acucgggagg cuaaggcagg aaaauuguuu 840
gaacccagga gguggaggcu gcagugagcu gagauugugc cacuucacuc cagccugggu 900
gacaaaguga gacuccguca caacaacaac aacaaaaagc uuccccaacu aaagccuaga 960
agagcuucug aggcgcugcu uugucaaaag gaagucucua gguucugagc ucuggcuuug 1020
ccuuggcuuu gcaagggcuc ugugacaagg aaggaaguca gcaugccucu agaggcaagg 1080
aagggaggaa cacugcacuc uuaagcuucc gccgucucaa ccccucacag gagcuuacug 1140
gcaaacauga aaaaucgggg 1160
<210> 63
<211> 91
<212> PRT
<213> Homo sapiens
<400> 63
Met Lys Val Ser Ala Ala Ala Leu Ala Val Ile Leu Ile Ala Thr Ala
1 5 10 15
Leu Cys Ala Pro Ala Ser Ala Ser Pro Tyr Ser Ser Asp Thr Thr Pro
20 25 30
Cys Cys Phe Ala Tyr Ile Ala Arg Pro Leu Pro Arg Ala His Ile Lys
35 40 45
Glu Tyr Phe Tyr Thr Ser Gly Lys Cys Ser Asn Pro Ala Val Val Phe
50 55 60
Val Thr Arg Lys Asn Arg Gln Val Cys Ala Asn Pro Glu Lys Lys Trp
65 70 75 80
Val Arg Glu Tyr Ile Asn Ser Leu Glu Met Ser
85 90
<210> 64
<211> 3383
<212> RNA
<213> Homo sapiens
<400> 64
agaagagcug agacauccgu uccccuacaa gaaacucucc ccggguggaa caagauggau 60
uaucaagugu caaguccaau cuaugacauc aauuauuaua caucggagcc cugccaaaaa 120
aucaauguga agcaaaucgc agcccgccuc cugccuccgc ucuacucacu gguguucauc 180
uuugguuuug ugggcaacau gcuggucauc cucauccuga uaaacugcaa aaggcugaag 240
agcaugacug acaucuaccu gcucaaccug gccaucucug accuguuuuu ccuucuuacu 300
guccccuucu gggcucacua ugcugccgcc cagugggacu uuggaaauac aaugugucaa 360
cucuugacag ggcucuauuu uauaggcuuc uucucuggaa ucuucuucau cauccuccug 420
acaaucgaua gguaccuggc ugucguccau gcuguguuug cuuuaaaagc caggacgguc 480
accuuugggg uggugacaag ugugaucacu uggguggugg cuguguuugc gucucuccca 540
ggaaucaucu uuaccagauc ucaaaaagaa ggucuucauu acaccugcag cucucauuuu 600
ccauacaguc aguaucaauu cuggaagaau uuccagacau uaaagauagu caucuugggg 660
cugguccugc cgcugcuugu cauggucauc ugcuacucgg gaauccuaaa aacucugcuu 720
cggugucgaa augagaagaa gaggcacagg gcugugaggc uuaucuucac caucaugauu 780
guuuauuuuc ucuucugggc ucccuacaac auuguccuuc uccugaacac cuuccaggaa 840
uucuuuggcc ugaauaauug caguagcucu aacagguugg accaagcuau gcaggugaca 900
gagacucuug ggaugacgca cugcugcauc aaccccauca ucuaugccuu ugucggggag 960
aaguucagaa acuaccucuu agucuucuuc caaaagcaca uugccaaacg cuucugcaaa 1020
ugcuguucua uuuuccagca agaggcuccc gagcgagcaa gcucaguuua cacccgaucc 1080
acuggggagc aggaaauauc ugugggcuug ugacacggac ucaagugggc uggugaccca 1140
gucagaguug ugcacauggc uuaguuuuca uacacagccu gggcuggggg ugggguggga 1200
gaggucuuuu uuaaaaggaa guuacuguua uagagggucu aagauucauc cauuuauuug 1260
gcaucuguuu aaaguagauu agaucuuuua agcccaucaa uuauagaaag ccaaaucaaa 1320
auauguugau gaaaaauagc aaccuuuuua ucuccccuuc acaugcauca aguuauugac 1380
aaacucuccc uucacuccga aaguuccuua uguauauuua aaagaaagcc ucagagaauu 1440
gcugauucuu gaguuuagug aucugaacag aaauaccaaa auuauuucag aaauguacaa 1500
cuuuuuaccu aguacaaggc aacauauagg uuguaaaugu guuuaaaaca ggucuuuguc 1560
uugcuauggg gagaaaagac augaauauga uuaguaaaga aaugacacuu uucaugugug 1620
auuuccccuc caagguaugg uuaauaaguu ucacugacuu agaaccaggc gagagacuug 1680
uggccuggga gagcugggga agcuucuuaa augagaagga auuugaguug gaucaucuau 1740
ugcuggcaaa gacagaagcc ucacugcaag cacugcaugg gcaagcuugg cuguagaagg 1800
agacagagcu gguugggaag acauggggag gaaggacaag gcuagaucau gaagaaccuu 1860
gacggcauug cuccgucuaa gucaugagcu gagcagggag auccugguug guguugcaga 1920
agguuuacuc uguggccaaa ggagggucag gaaggaugag cauuuagggc aaggagacca 1980
ccaacagccc ucaggucagg gugaggaugg ccucugcuaa gcucaaggcg ugaggauggg 2040
aaggagggag guauucguaa ggaugggaag gagggaggua uucgugcagc auaugaggau 2100
gcagagucag cagaacuggg guggauuugg uuuggaagug agggucagag aggagucaga 2160
gagaaucccu agucuucaag cagauuggag aaacccuuga aaagacauca agcacagaag 2220
gaggaggagg agguuuaggu caagaagaag auggauuggu guaaaaggau gggucugguu 2280
ugcagagcuu gaacacaguc ucacccagac uccaggcugu cuuucacuga augcuucuga 2340
cuucauagau uuccuuccca ucccagcuga aauacugagg ggucuccagg aggagacuag 2400
auuuaugaau acacgaggua ugaggucuag gaacauacuu cagcucacac augagaucua 2460
ggugaggauu gauuaccuag uagucauuuc auggguuguu gggaggauuc uaugaggcaa 2520
ccacaggcag cauuuagcac auacuacaca uucaauaagc aucaaacucu uaguuacuca 2580
uucagggaua gcacugagca aagcauugag caaagggguc ccauauaggu gagggaagcc 2640
ugaaaaacua agaugcugcc ugcccagugc acacaagugu agguaucauu uucugcauuu 2700
aaccgucaau aggcaaaggg gggaagggac auauucauuu ggaaauaagc ugccuugagc 2760
cuuaaaaccc acaaaaguac aauuuaccag ccuccguauu ucagacugaa uggggguggg 2820
gggggcgccu uagguacuua uuccagaugc cuucuccaga caaaccagaa gcaacagaaa 2880
aaaucgucuc ucccucccuu ugaaaugaau auaccccuua guguuugggu auauucauuu 2940
caaagggaga gagagagguu uuuuucuguu cuuucucaua ugauugugca cauacuugag 3000
acuguuuuga auuuggggga uggcuaaaac caucauagua cagguaaggu gagggaauag 3060
uaagugguga gaacuacuca gggaaugaag gugucagaau aauaagaggu gcuacugacu 3120
uucucagccu cugaauauga acggugagca uuguggcugu cagcaggaag caacgaaggg 3180
aaaugucuuu ccuuuugcuc uuaaguugug gagagugcaa caguagcaua ggacccuacc 3240
cucugggcca agucaaagac auucugacau cuuaguauuu gcauauucuu auguauguga 3300
aaguuacaaa uugcuugaaa gaaaauaugc aucuaauaaa aaacaccuuc uaaaauaaaa 3360
aaaaaaaaaa aaaaaaaaaa aaa 3383
<210> 65
<211> 352
<212> PRT
<213> Homo sapiens
<400> 65
Met Asp Tyr Gln Val Ser Ser Pro Ile Tyr Asp Ile Asn Tyr Tyr Thr
1 5 10 15
Ser Glu Pro Cys Gln Lys Ile Asn Val Lys Gln Ile Ala Ala Arg Leu
20 25 30
Leu Pro Pro Leu Tyr Ser Leu Val Phe Ile Phe Gly Phe Val Gly Asn
35 40 45
Met Leu Val Ile Leu Ile Leu Ile Asn Cys Lys Arg Leu Lys Ser Met
50 55 60
Thr Asp Ile Tyr Leu Leu Asn Leu Ala Ile Ser Asp Leu Phe Phe Leu
65 70 75 80
Leu Thr Val Pro Phe Trp Ala His Tyr Ala Ala Ala Gln Trp Asp Phe
85 90 95
Gly Asn Thr Met Cys Gln Leu Leu Thr Gly Leu Tyr Phe Ile Gly Phe
100 105 110
Phe Ser Gly Ile Phe Phe Ile Ile Leu Leu Thr Ile Asp Arg Tyr Leu
115 120 125
Ala Val Val His Ala Val Phe Ala Leu Lys Ala Arg Thr Val Thr Phe
130 135 140
Gly Val Val Thr Ser Val Ile Thr Trp Val Val Ala Val Phe Ala Ser
145 150 155 160
Leu Pro Gly Ile Ile Phe Thr Arg Ser Gln Lys Glu Gly Leu His Tyr
165 170 175
Thr Cys Ser Ser His Phe Pro Tyr Ser Gln Tyr Gln Phe Trp Lys Asn
180 185 190
Phe Gln Thr Leu Lys Ile Val Ile Leu Gly Leu Val Leu Pro Leu Leu
195 200 205
Val Met Val Ile Cys Tyr Ser Gly Ile Leu Lys Thr Leu Leu Arg Cys
210 215 220
Arg Asn Glu Lys Lys Arg His Arg Ala Val Arg Leu Ile Phe Thr Ile
225 230 235 240
Met Ile Val Tyr Phe Leu Phe Trp Ala Pro Tyr Asn Ile Val Leu Leu
245 250 255
Leu Asn Thr Phe Gln Glu Phe Phe Gly Leu Asn Asn Cys Ser Ser Ser
260 265 270
Asn Arg Leu Asp Gln Ala Met Gln Val Thr Glu Thr Leu Gly Met Thr
275 280 285
His Cys Cys Ile Asn Pro Ile Ile Tyr Ala Phe Val Gly Glu Lys Phe
290 295 300
Arg Asn Tyr Leu Leu Val Phe Phe Gln Lys His Ile Ala Lys Arg Phe
305 310 315 320
Cys Lys Cys Cys Ser Ile Phe Gln Gln Glu Ala Pro Glu Arg Ala Ser
325 330 335
Ser Val Tyr Thr Arg Ser Thr Gly Glu Gln Glu Ile Ser Val Gly Leu
340 345 350
<210> 66
<211> 1635
<212> RNA
<213> Homo sapiens
<400> 66
ggcacgaggg cacugagcuc ugccgccugg cucuagccgc cugccuggcc cccgccggga 60
cucuugccca cccucagcca uggcuccgau aucucugucg uggcugcucc gcuuggccac 120
cuucugccau cugacugucc ugcuggcugg acagcaccac ggugugacga aaugcaacau 180
cacgugcagc aagaugacau caaagauacc uguagcuuug cucauccacu aucaacagaa 240
ccaggcauca ugcggcaaac gcgcaaucau cuuggagacg agacagcaca ggcuguucug 300
ugccgacccg aaggagcaau gggucaagga cgcgaugcag caucuggacc gccaggcugc 360
ugcccuaacu cgaaauggcg gcaccuucga gaagcagauc ggcgagguga agcccaggac 420
caccccugcc gccgggggaa uggacgaguc ugugguccug gagcccgaag ccacaggcga 480
aagcaguagc cuggagccga cuccuucuuc ccaggaagca cagagggccc uggggaccuc 540
cccagagcug ccgacgggcg ugacugguuc cucagggacc aggcuccccc cgacgccaaa 600
ggcucaggau ggagggccug ugggcacgga gcuuuuccga gugccucccg ucuccacugc 660
cgccacgugg cagaguucug cuccccacca accugggccc agccucuggg cugaggcaaa 720
gaccucugag gccccgucca cccaggaccc cuccacccag gccuccacug cguccucccc 780
agccccagag gagaaugcuc cgucugaagg ccagcgugug uggggucagg gacagagccc 840
caggccagag aacucucugg agcgggagga gauggguccc gugccagcgc acacggaugc 900
cuuccaggac ugggggccug gcagcauggc ccacgucucu guggucccug ucuccucaga 960
agggaccccc agcagggagc caguggcuuc aggcagcugg accccuaagg cugaggaacc 1020
cauccaugcc accauggacc cccagaggcu gggcguccuu aucacuccug ucccugacgc 1080
ccaggcugcc acccggaggc aggcgguggg gcugcuggcc uuccuuggcc uccucuucug 1140
ccugggggug gccauguuca ccuaccagag ccuccagggc ugcccucgaa agauggcagg 1200
agagauggcg gagggccuuc gcuacauccc ccggagcugu gguaguaauu cauauguccu 1260
ggugcccgug ugaacuccuc uggccugugu cuaguuguuu gauucagaca gcugccuggg 1320
aucccucauc cucauaccca cccccaccca agggccuggc cugagcuggg augauuggag 1380
gggggaggug ggauccucca ggugcacaag cuccaagcuc ccaggcauuc cccaggaggc 1440
cagccuugac cauucuccac cuuccaggga cagagggggu ggccucccaa cucaccccag 1500
ccccaaaacu cuccucugcu gcuggcuggu uagagguucc cuuugacgcc aucccagccc 1560
caaugaacaa uuauuuauua aaugcccagc cccuucugaa aaaaaaaaaa aaaaaaaaaa 1620
aaaaaaaaaa aaaaa 1635
<210> 67
<211> 397
<212> PRT
<213> Homo sapiens
<400> 67
Met Ala Pro Ile Ser Leu Ser Trp Leu Leu Arg Leu Ala Thr Phe Cys
1 5 10 15
His Leu Thr Val Leu Leu Ala Gly Gln His His Gly Val Thr Lys Cys
20 25 30
Asn Ile Thr Cys Ser Lys Met Thr Ser Lys Ile Pro Val Ala Leu Leu
35 40 45
Ile His Tyr Gln Gln Asn Gln Ala Ser Cys Gly Lys Arg Ala Ile Ile
50 55 60
Leu Glu Thr Arg Gln His Arg Leu Phe Cys Ala Asp Pro Lys Glu Gln
65 70 75 80
Trp Val Lys Asp Ala Met Gln His Leu Asp Arg Gln Ala Ala Ala Leu
85 90 95
Thr Arg Asn Gly Gly Thr Phe Glu Lys Gln Ile Gly Glu Val Lys Pro
100 105 110
Arg Thr Thr Pro Ala Ala Gly Gly Met Asp Glu Ser Val Val Leu Glu
115 120 125
Pro Glu Ala Thr Gly Glu Ser Ser Ser Leu Glu Pro Thr Pro Ser Ser
130 135 140
Gln Glu Ala Gln Arg Ala Leu Gly Thr Ser Pro Glu Leu Pro Thr Gly
145 150 155 160
Val Thr Gly Ser Ser Gly Thr Arg Leu Pro Pro Thr Pro Lys Ala Gln
165 170 175
Asp Gly Gly Pro Val Gly Thr Glu Leu Phe Arg Val Pro Pro Val Ser
180 185 190
Thr Ala Ala Thr Trp Gln Ser Ser Ala Pro His Gln Pro Gly Pro Ser
195 200 205
Leu Trp Ala Glu Ala Lys Thr Ser Glu Ala Pro Ser Thr Gln Asp Pro
210 215 220
Ser Thr Gln Ala Ser Thr Ala Ser Ser Pro Ala Pro Glu Glu Asn Ala
225 230 235 240
Pro Ser Glu Gly Gln Arg Val Trp Gly Gln Gly Gln Ser Pro Arg Pro
245 250 255
Glu Asn Ser Leu Glu Arg Glu Glu Met Gly Pro Val Pro Ala His Thr
260 265 270
Asp Ala Phe Gln Asp Trp Gly Pro Gly Ser Met Ala His Val Ser Val
275 280 285
Val Pro Val Ser Ser Glu Gly Thr Pro Ser Arg Glu Pro Val Ala Ser
290 295 300
Gly Ser Trp Thr Pro Lys Ala Glu Glu Pro Ile His Ala Thr Met Asp
305 310 315 320
Pro Gln Arg Leu Gly Val Leu Ile Thr Pro Val Pro Asp Ala Gln Ala
325 330 335
Ala Thr Arg Arg Gln Ala Val Gly Leu Leu Ala Phe Leu Gly Leu Leu
340 345 350
Phe Cys Leu Gly Val Ala Met Phe Thr Tyr Gln Ser Leu Gln Gly Cys
355 360 365
Pro Arg Lys Met Ala Gly Glu Met Ala Glu Gly Leu Arg Tyr Ile Pro
370 375 380
Arg Ser Cys Gly Ser Asn Ser Tyr Val Leu Val Pro Val
385 390 395
<210> 68
<211> 2154
<212> RNA
<213> Homo sapiens
<400> 68
ggaauuccgu agugcgaggc cgggcacagc cuuccugugu gguuuuaccg cccagagagc 60
gucauggacc uggggaaacc aaugaaaagc gugcuggugg uggcucuccu ugucauuuuc 120
cagguaugcc ugugucaaga ugaggucacg gacgauuaca ucggagacaa caccacagug 180
gacuacacuu uguucgaguc uuugugcucc aagaaggacg ugcggaacuu uaaagccugg 240
uuccucccua ucauguacuc caucauuugu uucgugggcc uacugggcaa ugggcugguc 300
guguugaccu auaucuauuu caagaggcuc aagaccauga ccgauaccua ccugcucaac 360
cuggcggugg cagacauccu cuuccuccug acccuucccu ucugggccua cagcgcggcc 420
aaguccuggg ucuucggugu ccacuuuugc aagcucaucu uugccaucua caagaugagc 480
uucuucagug gcaugcuccu acuucuuugc aucagcauug accgcuacgu ggccaucguc 540
caggcugucu cagcucaccg ccaccgugcc cgcguccuuc ucaucagcaa gcuguccugu 600
gugggcagcg ccauacuagc cacagugcuc uccaucccag agcuccugua cagugaccuc 660
cagaggagca gcagugagca agcgaugcga ugcucucuca ucacagagca uguggaggcc 720
uuuaucacca uccagguggc ccagauggug aucggcuuuc uggucccccu gcuggccaug 780
agcuucuguu accuugucau cauccgcacc cugcuccagg cacgcaacuu ugagcgcaac 840
aaggccauca aggugaucau cgcugugguc guggucuuca uagucuucca gcugcccuac 900
aauggggugg uccuggccca gacgguggcc aacuucaaca ucaccaguag caccugugag 960
cucaguaagc aacucaacau cgccuacgac gucaccuaca gccuggccug cguccgcugc 1020
ugcgucaacc cuuucuugua cgccuucauc ggcgucaagu uccgcaacga uaucuucaag 1080
cucuucaagg accugggcug ccucagccag gagcagcucc ggcagugguc uuccugucgg 1140
cacauccggc gcuccuccau gaguguggag gccgagacca ccaccaccuu cuccccauag 1200
gcgacucuuc ugccuggacu agagggaccu cucccagggu cccuggggug gggauaggga 1260
gcagaugcaa ugacucagga cauccccccg ccaaaagcug cucaggggaa aaagcagcuc 1320
uccccucaga gugcaagccc cugcuccaga agauagcuuc accccaaucc cagcuaccuc 1380
aaccaaugcc aaaaaaagac agggcugaua agcuaacacc agacagacaa cacugggaaa 1440
cagaggcuau uguccccuaa accaaaaacu gaaagugaaa guccagaaac uguucccacc 1500
ugcuggagug aaggggccaa ggagggugag ugcaaggggc gugggagugg ccugaagagu 1560
ccucugaaug aaccuucugg ccucccacag acucaaaugc ucagaccagc ucuuccgaaa 1620
accaggccuu aucuccaaga ccagagauag uggggagacu ucuuggcuug gugaggaaaa 1680
gcggacauca gcuggucaaa caaacucucu gaaccccucc cuccaucguu uucuucacug 1740
uccuccaagc cagcgggaau ggcagcugcc acgccgcccu aaaagcacac ucauccccuc 1800
acuugccgcg ucgcccuccc aggcucucaa caggggagag ugugguguuu ccugcaggcc 1860
aggccagcug ccuccgcgug aucaaagcca cacucugggc uccagagugg ggaugacaug 1920
cacucagcuc uuggcuccac ugggauggga ggagaggaca agggaaaugu caggggcggg 1980
gagggugaca guggccgccc aaggccacga gcuuguucuu uguucuuugu cacagggacu 2040
gaaaaccucu ccucauguuc ugcuuucgau ucguuaagag agcaacauuu uacccacaca 2100
cagauaaagu uuucccuuga ggaaacaaca gcuuuaaaaa aaaaaaagga auuc 2154
<210> 69
<211> 378
<212> PRT
<213> Homo sapiens
<400> 69
Met Asp Leu Gly Lys Pro Met Lys Ser Val Leu Val Val Ala Leu Leu
1 5 10 15
Val Ile Phe Gln Val Cys Leu Cys Gln Asp Glu Val Thr Asp Asp Tyr
20 25 30
Ile Gly Asp Asn Thr Thr Val Asp Tyr Thr Leu Phe Glu Ser Leu Cys
35 40 45
Ser Lys Lys Asp Val Arg Asn Phe Lys Ala Trp Phe Leu Pro Ile Met
50 55 60
Tyr Ser Ile Ile Cys Phe Val Gly Leu Leu Gly Asn Gly Leu Val Val
65 70 75 80
Leu Thr Tyr Ile Tyr Phe Lys Arg Leu Lys Thr Met Thr Asp Thr Tyr
85 90 95
Leu Leu Asn Leu Ala Val Ala Asp Ile Leu Phe Leu Leu Thr Leu Pro
100 105 110
Phe Trp Ala Tyr Ser Ala Ala Lys Ser Trp Val Phe Gly Val His Phe
115 120 125
Cys Lys Leu Ile Phe Ala Ile Tyr Lys Met Ser Phe Phe Ser Gly Met
130 135 140
Leu Leu Leu Leu Cys Ile Ser Ile Asp Arg Tyr Val Ala Ile Val Gln
145 150 155 160
Ala Val Ser Ala His Arg His Arg Ala Arg Val Leu Leu Ile Ser Lys
165 170 175
Leu Ser Cys Val Gly Ile Trp Ile Leu Ala Thr Val Leu Ser Ile Pro
180 185 190
Glu Leu Leu Tyr Ser Asp Leu Gln Arg Ser Ser Ser Glu Gln Ala Met
195 200 205
Arg Cys Ser Leu Ile Thr Glu His Val Glu Ala Phe Ile Thr Ile Gln
210 215 220
Val Ala Gln Met Val Ile Gly Phe Leu Val Pro Leu Leu Ala Met Ser
225 230 235 240
Phe Cys Tyr Leu Val Ile Ile Arg Thr Leu Leu Gln Ala Arg Asn Phe
245 250 255
Glu Arg Asn Lys Ala Ile Lys Val Ile Ile Ala Val Val Val Val Phe
260 265 270
Ile Val Phe Gln Leu Pro Tyr Asn Gly Val Val Leu Ala Gln Thr Val
275 280 285
Ala Asn Phe Asn Ile Thr Ser Ser Thr Cys Glu Leu Ser Lys Gln Leu
290 295 300
Asn Ile Ala Tyr Asp Val Thr Tyr Ser Leu Ala Cys Val Arg Cys Cys
305 310 315 320
Val Asn Pro Phe Leu Tyr Ala Phe Ile Gly Val Lys Phe Arg Asn Asp
325 330 335
Leu Phe Lys Leu Phe Lys Asp Leu Gly Cys Leu Ser Gln Glu Gln Leu
340 345 350
Arg Gln Trp Ser Ser Cys Arg His Ile Arg Arg Ser Ser Met Ser Val
355 360 365
Glu Ala Glu Thr Thr Thr Thr Phe Ser Pro
370 375
<210> 70
<211> 3100
<212> RNA
<213> Homo sapiens
<400> 70
acucgucucu gguaaagucu gagcaggaca ggguggcuga cuggcagauc cagagguucc 60
cuuggcaguc cacgccaggc cuucaccaug gaucaguucc cugaaucagu gacagaaaac 120
uuugaguacg augauuuggc ugaggccugu uauauugggg acaucguggu cuuugggacu 180
guguuccugu ccauauucua cuccgucauc uuugccauug gccugguggg aaauuuguug 240
guaguguuug cccucaccaa cagcaagaag cccaagagug ucaccgacau uuaccuccug 300
aaccuggccu ugucugaucu gcuguuugua gccacuuugc ccuucuggac ucacuauuug 360
auaaaugaaa agggccucca caaugccaug ugcaaauuca cuaccgccuu cuucuucauc 420
ggcuuuuuug gaagcauauu cuucaucacc gucaucagca uugauaggua ccuggccauc 480
guccuggccg ccaacuccau gaacaaccgg accgugcagc auggcgucac caucagccua 540
ggcgucuggg cagcagccau uuugguggca gcaccccagu ucauguucac aaagcagaaa 600
gaaaaugaau gccuugguga cuaccccgag guccuccagg aaaucuggcc cgugcuccgc 660
aauguggaaa caaauuuucu uggcuuccua cucccccugc ucauuaugag uuauugcuac 720
uucagaauca uccagacgcu guuuuccugc aagaaccaca agaaagccaa agccauuaaa 780
cugauccuuc ugguggucau cguguuuuuc cucuucugga cacccuacaa cguuaugauu 840
uuccuggaga cgcuuaagcu cuaugacuuc uuucccaguu gugacaugag gaaggaucug 900
aggcuggccc ucagugugac ugagacgguu gcauuuagcc auuguugccu gaauccucuc 960
aucuaugcau uugcugggga gaaguucaga agauaccuuu accaccugua ugggaaaugc 1020
cuggcugucc ugugugggcg cucaguccac guugauuucu ccucaucuga aucacaaagg 1080
agcaggcaug gaaguguucu gagcagcaau uuuacuuacc acacgaguga uggagaugca 1140
uugcuccuuc ucugaaggga aucccaaagc cuugugucua cagagaaccu ggaguuccug 1200
aaccugaugc ugacuaguga ggaaagauuu uuguuguuau uucuuacagg cacaaaauga 1260
uggacccaau gcacacaaaa caacccuaga guguuguuga gaauugugcu caaaauuuga 1320
agaaugaaca aauugaacuc uuugaaugac aaagaguaga cauuucucuu acugcaaaug 1380
ucaucagaac uuuuugguuu gcagaugaca aaaauucaac ucagacuagu uuaguuaaau 1440
gaggguggug aauauuguuc auauuguggc acaagcaaaa gggugucuga gcccucaaag 1500
ugaggggaaa ccagggccug agccaagcua gaauucccuc ucucugacuc ucaaaucuuu 1560
uagucauuau agauccccca gacuuuacau gacacagcuu uaucaccaga gagggacuga 1620
cacccauguu ucucuggccc caagggaaaa uucccaggga agugcucuga uaggccaagu 1680
uuguaucagg ugcccauccc uggaaggugc uguuauccau ggggaaggga uauauaagau 1740
ggaagcuucc aguccaaucu cauggagaag cagaaauaca uauuuccaag aaguuggaug 1800
gguggguacu auucugauua cacaaaacaa augccacaca ucacccuuac caugugccug 1860
auccagccuc uccccugauu acaccagccu cgucuucauu aagcccucuu ccaucauguc 1920
cccaaaccug caagggcucc ccacugccua cugcaucgag ucaaaacuca aaugcuuggc 1980
uucucauacg uccaccaugg gguccuacca auagauuccc cauugccucc uccuucccaa 2040
aggacuccac ccauccuauc agccugucuc uuccauauga ccucaugcau cuccaccugc 2100
ucccaggcca guaagggaaa uagaaaaacc cugcccccaa auaagaaggg auggauucca 2160
accccaacuc caguagcuug ggacaaauca agcuucaguu uccuggucug uagaagaggg 2220
auaagguacc uuucacauag agaucauccu uuccagcaug aggaacuagc caccaacucu 2280
ugcaggucuc aacccuuuug ucugccucuu agacuucugc uuuccacacc ugcacugcug 2340
ugcugugccc aaguuguggu gcugacaaag cuuggaagag ccugcaggug ccuuggccgc 2400
gugcauagcc cagacacaga agaggcuggu ucuuacgaug gcacccagug agcacuccca 2460
agucuacaga gugauagccu uccguaaccc aacucuccug gacugccuug aauauccccu 2520
cccagucacc uugugcaagc cccugcccau cugggaaaau accccaucau ucaugcuacu 2580
gccaaccugg ggagccaggg cuaugggagc agcuuuuuuu uccccccuag aaacguuugg 2640
aacaauguaa aacuuuaaag cucgaaaaca auuguaauaa ugcuaaagaa aaagucaucc 2700
aaucuaacca caucaauauu gucauuccug uauucacccg uccagaccuu guucacacuc 2760
ucacauguuu agaguugcaa ucguaaugua cagaugguuu uauaaucuga uuuguuuucc 2820
ucuuaacguu agaccacaaa uagugcucgc uuucuaugua guuugguaau uaucauuuua 2880
gaagacucua ccagacugug uauucauuga agucagaugu gguaacuguu aaauugcugu 2940
guaucugaua gcucuuuggc agucuauaug uuuguauaau gaaugagaga auaagucaug 3000
uuccuucaag aucauguacc ccaauuuacu ugccauuacu caauugauaa acauuuaacu 3060
uguuuccaau guuuagcaaa uacauauuuu auagaacuuc 3100
<210> 71
<211> 355
<212> PRT
<213> Homo sapiens
<400> 71
Met Asp Gln Phe Pro Glu Ser Val Thr Glu Asn Phe Glu Tyr Asp Asp
1 5 10 15
Leu Ala Glu Ala Cys Tyr Ile Gly Asp Ile Val Val Phe Gly Thr Val
20 25 30
Phe Leu Ser Ile Phe Tyr Ser Val Ile Phe Ala Ile Gly Leu Val Gly
35 40 45
Asn Leu Leu Val Val Phe Ala Leu Thr Asn Ser Lys Lys Pro Lys Ser
50 55 60
Val Thr Asp Ile Tyr Leu Leu Asn Leu Ala Leu Ser Asp Leu Leu Phe
65 70 75 80
Val Ala Thr Leu Pro Phe Trp Thr His Tyr Leu Ile Asn Glu Lys Gly
85 90 95
Leu His Asn Ala Met Cys Lys Phe Thr Thr Ala Phe Phe Phe Ile Gly
100 105 110
Phe Phe Gly Ser Ile Phe Phe Ile Thr Val Ile Ser Ile Asp Arg Tyr
115 120 125
Leu Ala Ile Val Leu Ala Ala Asn Ser Met Asn Asn Arg Thr Val Gln
130 135 140
His Gly Val Thr Ile Ser Leu Gly Val Trp Ala Ala Ala Ile Leu Val
145 150 155 160
Ala Ala Pro Gln Phe Met Phe Thr Lys Gln Lys Glu Asn Glu Cys Leu
165 170 175
Gly Asp Tyr Pro Glu Val Leu Gln Glu Ile Trp Pro Val Leu Arg Asn
180 185 190
Val Glu Thr Asn Phe Leu Gly Phe Leu Leu Pro Leu Leu Ile Met Ser
195 200 205
Tyr Cys Tyr Phe Arg Ile Ile Gln Thr Leu Phe Ser Cys Lys Asn His
210 215 220
Lys Lys Ala Lys Ala Ile Lys Leu Ile Leu Leu Val Val Ile Val Phe
225 230 235 240
Phe Leu Phe Trp Thr Pro Tyr Asn Val Met Ile Phe Leu Glu Thr Leu
245 250 255
Lys Leu Tyr Asp Phe Phe Pro Ser Cys Asp Met Arg Lys Asp Leu Arg
260 265 270
Leu Ala Leu Ser Val Thr Glu Thr Val Ala Phe Ser His Cys Cys Leu
275 280 285
Asn Pro Leu Ile Tyr Ala Phe Ala Gly Glu Lys Phe Arg Arg Tyr Leu
290 295 300
Tyr His Leu Tyr Gly Lys Cys Leu Ala Val Leu Cys Gly Arg Ser Val
305 310 315 320
His Val Asp Phe Ser Ser Ser Glu Ser Gln Arg Ser Arg His Gly Ser
325 330 335
Val Leu Ser Ser Asn Phe Thr Tyr His Thr Ser Asp Gly Asp Ala Leu
340 345 350
Leu Leu Leu
355
Claims (123)
- VEGF 길항제 및 PD-L1 축 결합 길항제를 포함하는 항암 요법으로의 치료에 대한 신장암을 갖는 환자의 반응을 모니터링하는 방법으로서, 하기를 포함하는, 방법:
(a) 상기 항암 요법의 투여 후 시점에서 환자로부터 수득된 생물학적 샘플에서, 하기 유전자 중 하나 이상의 발현 수준을 계측하는 단계: 및
CD8A, CD8B, EOMES, GZMA, GZMB, IFNG, 또는 PRF1;
CXCL9, CXCL10, CXCL11, 또는 CXCL13; 또는
GZMB, KLRK1, 또는 SLAMF7;
(b) 상기 생물학적 샘플 내 상기 하나 이상의 유전자의 발현 수준을 참조 수준과 비교하고, 이로써 상기 항암 요법으로의 치료에 대한 상기 환자의 반응을 모니터링하는 단계. - 청구항 1에 있어서, CD8A, CD8B, EOMES, GZMA, GZMB, IFNG, 또는 PRF1 중 하나 이상의 발현 수준은 종양 미세환경 내 CD8+ T 효과기 (Teff) 세포의 존재와 상관관계가 있는, 방법.
- 청구항 1에 있어서, CXCL9, CXCL10, CXCL11, 또는 CXCL13 중 하나 이상의 발현 수준은 종양 미세환경 내 Th1 케모카인의 존재와 상관관계가 있는, 방법.
- 청구항 1에 있어서, GZMB, KLRK1, 또는 SLAMF7의 존재는 종양 미세환경에서 자연 살해(NK) 세포의 존재와 상관관계가 있는, 방법.
- 청구항 1 내지 4 중 어느 한 항에 있어서, CD8A, CD8B, EOMES, GZMA, GZMB, IFNG, 또는 PRF1 중 하나 이상의 발현 수준이 계측되는, 방법.
- 청구항 5에 있어서, CD8A, CD8B, EOMES, GZMA, GZMB, IFNG, 또는 PRF1 중 적어도 2개, 적어도 3개, 적어도 4개, 적어도 5개, 또는 적어도 6개의 발현 수준이 계측되는, 방법.
- 청구항 6에 있어서, CD8A, CD8B, EOMES, GZMA, GZMB, IFNG 및 PRF1의 발현 수준이 계측되는, 방법.
- 청구항 1 내지 7 중 어느 한 항에 있어서, CXCL9, CXCL10, CXCL11 또는 CXCL13 중 하나 이상의 발현 수준이 계측되는, 방법.
- 청구항 8에 있어서, CXCL9, CXCL10, CXCL11, 또는 CXCL13 중 적어도 2개 또는 적어도 3개의 발현 수준이 계측되는, 방법.
- 청구항 9에 있어서, CXCL9, CXCL10, CXCL11, 및 CXCL13의 발현 수준이 계측되는, 방법.
- 청구항 1 내지 10 중 어느 한 항에 있어서, GZMB, KLRK1, 또는 SLAMF7 중 하나 이상의 발현 수준이 계측되는, 방법.
- 청구항 11에 있어서, GZMB, KLRK1 또는 SLAMF7 중 적어도 2개의 발현 수준이 계측되는, 방법.
- 청구항 12에 있어서, GZMB, KLRK1, 및 SLAMF7의 발현 수준이 계측되는, 방법.
- 청구항 1 내지 13 중 어느 한 항에 있어서, 상기 참조 수준은, (i) 상기 항암 요법의 투여 이전에 수득된, 상기 환자 유래의 생물학적 샘플 내 상기 하나 이상의 유전자의 발현 수준; (ⅱ) 참조 집단에서의 상기 하나 이상의 유전자의 발현 수준; (ⅲ) 상기 하나 이상의 유전자에 대한 사전-배정된 발현 수준; (ⅳ) 상기 항암 요법의 투여 후인 사전 시점에서, 상기 환자로부터 수득된 생물학적 샘플 내 상기 하나 이상의 유전자의 발현 수준; 또는 (v) 후속 시점에서 상기 환자로부터 수득된 생물학적 샘플 내 상기 하나 이상의 유전자의 발현 수준으로 이루어진 군으로부터 선택되는, 방법.
- 청구항 1 내지 14 중 어느 한 항에 있어서, 상기 하나 이상의 유전자의 발현 수준은, 상기 참조 수준과 비교하여 상기 환자로부터 수득된 상기 생물학적 샘플 내에서 증가되는, 방법.
- 청구항 15에 있어서, CD8A, CD8B, EOMES, GZMA, GZMB, IFNG, 또는 PRF1 중 하나 이상의 발현 수준은, 상기 참조 수준과 비교하여 적어도 약 2배 증가되는, 방법.
- 청구항 16에 있어서, CD8A, CD8B, EOMES, GZMA, GZMB, IFNG, 또는 PRF1 중 하나 이상의 발현 수준은, 상기 참조 수준과 비교하여 적어도 약 15배 증가되는, 방법.
- 청구항 17에 있어서, CD8A, CD8B, EOMES, GZMA, GZMB, IFNG, 또는 PRF1 중 하나 이상의 발현 수준은, 상기 참조 수준과 비교하여 적어도 약 50배 증가되는, 방법.
- 청구항 15 내지 18 중 어느 한 항에 있어서, CXCL9, CXCL10, CXCL11, 또는 CXCL13 중 하나 이상의 발현 수준은, 상기 참조 수준과 비교하여 적어도 약 3배 증가되는, 방법.
- 청구항 19에 있어서, CXCL9, CXCL10, CXCL11, 또는 CXCL13 중 하나 이상의 발현 수준은, 상기 참조 수준과 비교하여 적어도 약 80배 증가되는, 방법.
- 청구항 20에 있어서, CXCL9, CXCL10, CXCL11, 또는 CXCL13 중 하나 이상의 발현 수준은, 상기 참조 수준과 비교하여 적어도 약 250배 증가되는, 방법.
- 청구항 15 내지 21 중 어느 한 항에 있어서, GZMB, KLRK1, 또는 SLAMF7 중 하나 이상의 발현 수준은, 상기 참조 수준과 비교하여 적어도 약 2배 증가되는, 방법.
- 청구항 22에 있어서, GZMB, KLRK1, 또는 SLAMF7 중 하나 이상의 발현 수준은, 상기 참조 수준과 비교하여 적어도 약 8배 증가되는, 방법.
- 청구항 23에 있어서, GZMB, KLRK1, 또는 SLAMF7 중 하나 이상의 발현 수준은, 상기 참조 수준과 비교하여 적어도 약 13배 증가되는, 방법.
- 청구항 15 내지 24 중 어느 한 항에 있어서, 상기 하나 이상의 유전자의 증가된 발현 수준은 상기 환자가 상기 VEGF 길항제에 대하여 반응함을 표지하는, 방법.
- VEGF 길항제 및 PD-L1 축 결합 길항제를 포함하는 항암 요법으로의 치료에 대한, 신장암을 갖는 환자의 반응을 모니터링하는 방법으로서, 하기를 포함하는, 방법:
(a) 상기 항암 요법의 투여 후 시점에서, 상기 환자로부터 수득된 생물학적 샘플에서 MHC-I의 발현 수준을 계측하는 단계; 및
(b) 상기 생물학적 샘플 내 MHC-I의 발현 수준을 참조 수준과 비교하고, 이로써 상기 항암 요법으로의 치료에 대한 상기 환자의 반응을 모니터링하는 단계. - 청구항 26에 있어서, 상기 참조 수준은 (i) 상기 항암 요법의 투여 이전에 수득된, 상기 환자 유래의 생물학적 샘플 내 MHC-I의 발현 수준; (ⅱ) 참조 집단에서의 MHC-I의 발현 수준; (ⅲ) MHC-I에 대한 사전-배정된 발현 수준; (ⅳ) 상기 항암 요법의 투여 후인 사전 시점에서, 상기 환자로부터 수득된 생물학적 샘플 내 MHC-I의 발현 수준; 또는 (v) 후속 시점에서 상기 환자로부터 수득된 생물학적 샘플 내 MHC-I의 발현 수준으로 이루어진 군으로부터 선택되는, 방법.
- 청구항 26 또는 27에 있어서, MHC-I의 발현 수준이 상기 참조 수준과 비교하여 상기 환자로부터 수득된 상기 생물학적 샘플에서 증가되는, 방법.
- 청구항 26 내지 28 중 어느 한 항에 있어서, MHC-I의 발현 수준은 상기 참조 수준과 비교하여 적어도 약 2배 증가되는, 방법.
- 청구항 28 또는 29에 있어서, MHC-I의 증가된 발현 수준은 상기 환자가 상기 항암 요법에 반응함을 표지하는, 방법.
- VEGF 길항제 및 PD-L1 축 결합 길항제를 포함하는 항암 요법으로의 치료에 대한, 신장암을 갖는 환자의 반응을 모니터링하는 방법으로서, 하기를 포함하는, 방법:
(a) 상기 항암 요법의 투여 후 시점에서 상기 환자로부터 수득된 생물학적 샘플에서, 하기 유전자 중 하나 이상의 발현 수준을 계측하는 단계: 및
CX3CR1, CCL2, CCL5, CCR5, CX3CL1, CCR7, 또는 CXCL10;
(b) 상기 생물학적 샘플 내 상기 하나 이상의 유전자의 발현 수준을 참조 수준과 비교하고, 이로써 상기 항암 요법으로의 치료에 대한 상기 환자의 반응을 모니터링하는 단계. - 청구항 31에 있어서, CX3CR1, CCL2, CCL5, CCR5, CX3CL1, CCR7, 또는 CXCL10 중 적어도 2개, 적어도 3개, 적어도 4개, 적어도 5개, 또는 적어도 6개의 발현 수준이 계측되는, 방법.
- 청구항 32에 있어서, CX3CR1, CCL2, CCL5, CCR5, CX3CL1, CCR7, 및 CXCL10의 발현 수준이 계측되는, 방법.
- 청구항 31 내지 33 중 어느 한 항에 있어서, 상기 참조 수준은 (i) 상기 항암 요법의 투여 이전에 수득된, 상기 환자 유래의 생물학적 샘플 내 상기 하나 이상의 유전자의 발현 수준; (ⅱ) 참조 집단에서의 상기 하나 이상의 유전자의 발현 수준; (ⅲ) 상기 하나 이상의 유전자에 대한 사전-배정된 발현 수준; (ⅳ) 상기 항암 요법의 투여 후인, 사전 시점에서 상기 환자로부터 수득된 생물학적 샘플 내 상기 하나 이상의 유전자의 발현 수준; 또는 (v) 후속 시점에서 상기 환자로부터 수득된 생물학적 샘플 내 상기 하나 이상의 유전자의 발현 수준으로 이루어진 군으로부터 선택되는, 방법.
- 청구항 31 내지 34 중 어느 한 항에 있어서, 상기 하나 이상의 유전자의 발현 수준은, 상기 참조 수준과 비교하여 증가되는, 방법.
- 청구항 35에 있어서, 상기 하나 이상의 유전자의 증가된 발현 수준은 상기 환자가 상기 항암 요법에 대하여 반응함을 표지하는, 방법.
- 청구항 1 내지 36 중 어느 한 항에 있어서, 상기 환자 유래의 상기 생물학적 샘플은 상기 항암 요법의 투여로부터 약 4 내지 약 6주 후에 수득되는, 방법.
- 청구항 1 내지 37 중 어느 한 항에 있어서, MHC-I 또는 상기 하나 이상의 유전자의 발현 수준이 상기 참조 수준과 비교하여 증가된 환자에게, 1회 이상의 추가 용량의 상기 항암 요법을 투여하는 단계를 추가로 포함하는, 방법.
- VEGF 길항제 및 PD-L1 축 결합 길항제를 포함하는 항암 요법으로 신장암을 갖는 환자를 치료하는 방법으로서, 하기를 포함하는, 방법:
(a) 상기 항암 요법의 투여 후 시점에서 상기 환자로부터 수득된 생물학적 샘플에서, 하기 유전자 중 하나 이상의 발현 수준을 계측하는 단계:
CD8A, CD8B, EOMES, GZMA, GZMB, IFNG, 또는 PRF1;
CXCL9, CXCL10, CXCL11, 또는 CXCL13; 또는
GZMB, KLRK1, 또는 SLAMF7;
(b) 상기 생물학적 샘플 내 상기 하나 이상의 유전자의 발현 수준을 참조 수준과 비교하는 단계; 및
(c) 상기 환자의 하나 이상의 유전자의 발현 수준이 참조 수준과 비교하여 증가될 경우, 상기 환자에게 상기 항암 요법의 투여를 계속하는 단계. - 청구항 39에 있어서, CD8A, CD8B, EOMES, GZMA, GZMB, IFNG, 또는 PRF1 중 하나 이상의 발현 수준은 종양 미세환경 내 CD8+ T 효과기 (Teff) 세포의 존재와 상관관계가 있는, 방법.
- 청구항 39에 있어서, CXCL9, CXCL10, CXCL11, 또는 CXCL13 중 하나 이상의 발현 수준은 종양 미세환경 내 Th1 케모카인의 존재와 상관관계가 있는, 방법.
- 청구항 39에 있어서, GZMB, KLRK1, 또는 SMALF7의 존재는 종양 미세환경에서 자연 살해(NK) 세포의 존재와 상관관계가 있는, 방법.
- 청구항 39 내지 42 중 어느 한 항에 있어서, CD8A, CD8B, EOMES, GZMA, GZMB, IFNG, 또는 PRF1 중 하나 이상의 발현 수준이 계측되는, 방법.
- 청구항 43에 있어서, CD8A, CD8B, EOMES, GZMA, GZMB, IFNG, 또는 PRF1 중 적어도 2개, 적어도 3개, 적어도 4개, 적어도 5개, 또는 적어도 6개의 발현 수준이 계측되는, 방법.
- 청구항 44에 있어서, CD8A, CD8B, EOMES, GZMA, GZMB, IFNG 및 PRF1의 발현 수준이 계측되는, 방법.
- 청구항 39 내지 45 중 어느 한 항에 있어서, CXCL9, CXCL10, CXCL11 또는 CXCL13 중 하나 이상의 발현 수준이 계측되는, 방법.
- 청구항 46에 있어서, CXCL9, CXCL10, CXCL11, 또는 CXCL13 중 적어도 2개 또는 적어도 3개의 발현 수준이 계측되는, 방법.
- 청구항 47에 있어서, CXCL9, CXCL10, CXCL11, 및 CXCL13의 발현 수준이 계측되는, 방법.
- 청구항 39 내지 48 중 어느 한 항에 있어서, GZMB, KLRK1, 또는 SLAMF7 중 하나 이상의 발현 수준이 계측되는, 방법.
- 청구항 49에 있어서, GZMB, KLRK1 또는 SLAMF7 중 적어도 2개의 발현 수준이 계측되는, 방법.
- 청구항 50에 있어서, GZMB, KLRK1, 및 SLAMF7의 발현 수준이 계측되는, 방법.
- 청구항 39 내지 51 중 어느 한 항에 있어서, 상기 참조 수준은 (i) 상기 항암 요법의 투여 이전에 수득된 상기 환자 유래의 생물학적 샘플 내 상기 하나 이상의 유전자의 발현 수준; (ⅱ) 참조 집단에서의 상기 하나 이상의 유전자의 발현 수준; (ⅲ) 상기 하나 이상의 유전자에 대한 사전-배정된 발현 수준; (ⅳ) 상기 항암 요법의 투여 후인, 사전 시점에서 상기 환자로부터 수득된 생물학적 샘플 내 상기 하나 이상의 유전자의 발현 수준; 또는 (v) 후속 시점에서 상기 환자로부터 수득된 생물학적 샘플 내 상기 하나 이상의 유전자의 발현 수준으로 이루어진 군으로부터 선택되는, 방법.
- 청구항 39 내지 52 중 어느 한 항에 있어서, CD8A, CD8B, EOMES, GZMA, GZMB, IFNG, 또는 PRF1 중 하나 이상의 발현 수준은 상기 참조 수준과 비교하여 적어도 약 2배 증가되는, 방법.
- 청구항 53에 있어서, CD8A, CD8B, EOMES, GZMA, GZMB, IFNG, 또는 PRF1 중 하나 이상의 발현 수준은 상기 참조 수준과 비교하여 적어도 약 15배 증가되는, 방법.
- 청구항 54에 있어서, CD8A, CD8B, EOMES, GZMA, GZMB, IFNG, 또는 PRF1 중 하나 이상의 발현 수준은 상기 참조 수준과 비교하여 적어도 약 50배 증가되는, 방법.
- 청구항 39 내지 55 중 어느 한 항에 있어서, CXCL9, CXCL10, CXCL11, 또는 CXCL13 중 하나 이상의 발현 수준은 상기 참조 수준과 비교하여 적어도 약 3배 증가되는, 방법.
- 청구항 56에 있어서, CXCL9, CXCL10, CXCL11, 또는 CXCL13 중 하나 이상의 발현 수준은 상기 참조 수준과 비교하여 적어도 약 80배 증가되는, 방법.
- 청구항 57에 있어서, CXCL9, CXCL10, CXCL11, 또는 CXCL13 중 하나 이상의 발현 수준은 상기 참조 수준과 비교하여 적어도 약 250배 증가되는, 방법.
- 청구항 39 내지 58 중 어느 한 항에 있어서, GZMB, KLRK1, 또는 SLAMF7 중 하나 이상의 발현 수준은 상기 참조 수준과 비교하여 적어도 약 2배 증가되는, 방법.
- 청구항 59에 있어서, GZMB, KLRK1, 또는 SLAMF7 중 하나 이상의 발현 수준은 상기 참조 수준과 비교하여 적어도 약 8배 증가되는, 방법.
- 청구항 60에 있어서, GZMB, KLRK1, 또는 SLAMF7 중 하나 이상의 발현 수준은 상기 참조 수준과 비교하여 적어도 약 13배 증가되는, 방법.
- VEGF 길항제 및 PD-L1 축 결합 길항제를 포함하는 항암 요법으로 신장암을 갖는 환자를 치료하는 방법으로서, 하기를 포함하는, 방법:
(a) 상기 항암 요법의 투여 후 시점에서 상기 환자로부터 수득된 생물학적 샘플에서 MHC-I의 발현 수준을 계측하는 단계;
(b) 상기 생물학적 샘플 내 MHC-I의 발현 수준을 참조 수준과 비교하는 단계; 및
(c) 상기 환자의 하나 이상의 유전자의 발현 수준이 상기 참조 수준과 비교하여 증가될 경우, 상기 환자에게 상기 항암 요법의 투여를 계속하는 단계. - 청구항 62에 있어서, 상기 참조 수준은 (i) 상기 VEGF 길항제의 투여 이전에 수득된 상기 환자 유래의 생물학적 샘플 내 MHC-I의 발현 수준; (ⅱ) 참조 집단에서의 MHC-I의 발현 수준; (ⅲ) MHC-I에 대한 사전-배정된 발현 수준; (ⅳ) 상기 VEGF 길항제의 투여 후인, 사전 시점에서 상기 환자로부터 수득된 생물학적 샘플 내 MHC-I의 발현 수준; 또는 (v) 후속 시점에서 상기 환자로부터 수득된 생물학적 샘플 내 MHC-I의 발현 수준으로 이루어진 군으로부터 선택되는, 방법.
- 청구항 62 또는 63에 있어서, MHC-I의 발현 수준은 상기 참조 수준과 비교하여 적어도 약 2배 증가되는, 방법.
- VEGF 길항제 및 PD-L1 축 결합 길항제를 포함하는 항암 요법으로 신장암을 갖는 환자를 치료하는 방법으로서, 하기를 포함하는, 방법:
(a) 상기 항암 요법의 투여 후 시점에서 상기 환자로부터 수득된 생물학적 샘플에서, 하기 유전자 중 하나 이상의 발현 수준을 계측하는 단계:
CX3CR1, CCL2, CCL5, CCR5, CX3CL1, CCR7, 또는 CXCL10;
(b) 상기 생물학적 샘플 내 상기 하나 이상의 유전자의 발현 수준을 참조 수준과 비교하는 단계; 및
(c) 상기 환자의 하나 이상의 유전자의 발현 수준이 상기 참조 수준과 비교하여 증가될 경우, 상기 환자에게 상기 항암 요법의 투여를 계속하는 단계. - 청구항 65에 있어서, CX3CR1, CCL2, CCL5, CCR5, CX3CL1, CCR7, 또는 CXCL10 중 적어도 2개, 적어도 3개, 적어도 4개, 적어도 5개, 또는 적어도 6개의 발현 수준이 계측되는, 방법.
- 청구항 66에 있어서, CX3CR1, CCL2, CCL5, CCR5, CX3CL1, CCR7, 및 CXCL10의 발현 수준이 계측되는, 방법.
- 청구항 65 내지 67 중 어느 한 항에 있어서, 상기 참조 수준은 (i) 상기 항암 요법의 투여 이전에 수득된 상기 환자 유래의 생물학적 샘플 내 상기 하나 이상의 유전자의 발현 수준; (ⅱ) 참조 집단에서의 상기 하나 이상의 유전자의 발현 수준; (ⅲ) 상기 하나 이상의 유전자에 대한 사전-배정된 발현 수준; (ⅳ) 상기 항암 요법의 투여 후인 사전 시점에서, 상기 환자로부터 수득된 생물학적 샘플 내 상기 하나 이상의 유전자의 발현 수준; 또는 (v) 후속 시점에서 상기 환자로부터 수득된 생물학적 샘플 내 상기 하나 이상의 유전자의 발현 수준으로 이루어진 군으로부터 선택되는, 방법.
- 청구항 1 내지 68 중 어느 한 항에 있어서, 상기 환자 유래의 상기 생물학적 샘플은 상기 항암 요법의 투여로부터 약 4 내지 약 6주 후에 수득되는, 방법.
- 청구항 1 내지 69 중 어느 한 항에 있어서, 상기 VEGF 길항제는 항-VEGF 항체인, 방법.
- 청구항 70에 있어서, 상기 항-VEGF 항체가 베바시주맙인, 방법.
- 청구항 1 내지 71 중 어느 한 항에 있어서, 상기 PD-L1 축 결합 길항제가 PD-L1 결합 길항제, PD-1 결합 길항제, 및 PD-L2 결합 길항제로 이루어진 군으로부터 선택되는, 방법.
- 청구항 72에 있어서, 상기 PD-L1 축 결합 길항제가 PD-L1 결합 길항제인, 방법.
- 청구항 73에 있어서, 상기 PD-L1 결합 길항제는 PD-L1의 이의 리간드 결합 상대 중 하나 이상에 대한 결합을 억제하는, 방법.
- 청구항 74에 있어서, 상기 PD-L1 결합 길항제는 PD-1에 대한 PD-L1의 결합을 억제하는, 방법.
- 청구항 74에 있어서, 상기 PD-L1 결합 길항제는 B7-1에 대한 PD-L1의 결합을 억제하는, 방법.
- 청구항 74 내지 76 중 어느 한 항에 있어서, 상기 PD-L1 결합 길항제는 PD-1 및 B7-1 둘 모두에 대한 PD-L1의 결합을 억제하는, 방법.
- 청구항 73 내지 77 중 어느 한 항에 있어서, 상기 PD-L1 결합 길항제가 항체인, 방법.
- 청구항 78에 있어서, 상기 항체는 하기로 이루어진 군으로부터 선택되는, 방법: MPDL3280A (아테졸리주맙), YW243.55.S70, MDX-1105, MEDI4736 (두르발루맙), 및 MSB0010718C (아벨루맙).
- 청구항 78에 있어서, 상기 항체는 서열 번호 19의 HVR-H1 서열, 서열 번호 20의 HVR-H2 서열, 및 서열 번호 21의 HVR-H3 서열을 포함하는 중쇄; 및 서열 번호 22의 HVR-L1 서열, 서열 번호 23의 HVR-L2 서열, 및 서열 번호 24의 HVR-L3 서열을 포함하는 경쇄를 포함하는, 방법.
- 청구항 78에 있어서, 상기 항체는 서열 번호 26의 아미노산 서열을 포함하는 중쇄 가변 영역, 및 서열 번호 4의 아미노산 서열을 포함하는 경쇄 가변 영역을 포함하는, 방법.
- 청구항 72에 있어서, 상기 PD-L1 축 결합 길항제가 PD-1 결합 길항제인, 방법.
- 청구항 82에 있어서, 상기 PD-1 결합 길항제는 PD-1의 이의 리간드 결합 상대 중 하나 이상에 대한 결합을 억제하는, 방법.
- 청구항 83에 있어서, 상기 PD-1 결합 길항제는 PD-L1에 대한 PD-1의 결합을 억제하는, 방법.
- 청구항 83에 있어서, 상기 PD-1 결합 길항제는 PD-L2에 대한 PD-1의 결합을 억제하는, 방법.
- 청구항 83 내지 85 중 어느 한 항에 있어서, 상기 PD-1 결합 길항제가 PD-L1 및 PD-L2 둘 모두에 대한 PD-1의 결합을 억제하는, 방법.
- 청구항 82 내지 86 중 어느 한 항에 있어서, 상기 PD-1 결합 길항제가 항체인, 방법.
- 청구항 87에 있어서, 상기 항체는 하기로 이루어진 군으로부터 선택되는, 방법: MDX-1106 (니볼루맙), MK-3475 (펨브롤리주맙), CT-011 (피딜리주맙), MEDI-0680 (AMP-514), PDR001, REGN2810, 및 BGB-108.
- 청구항 82 내지 86 중 어느 한 항에 있어서, 상기 PD-1 결합 길항제가 Fc-융합 단백질인, 방법.
- 청구항 89에 있어서, 상기 Fc-융합 단백질이 AMP-224인, 방법.
- 청구항 1 내지 90 중 어느 한 항에 있어서, 상기 환자에 추가 치료제를 투여하는 단계를 추가로 포함하는, 방법.
- 청구항 91에 있어서, 상기 추가 치료제는 면역치료제, 세포독성제, 성장 억제제, 방사선 치료제, 항-혈관형성제 및 이들의 조합물로 이루어진 군으로부터 선택되는, 방법.
- 청구항 1 내지 92 중 어느 한 항에 있어서, 상기 신장암은 신장 세포 암종인, 방법.
- 청구항 93에 있어서, 상기 신장 세포 암종이 전이성 신장 세포 암종인, 방법.
- 청구항 1 내지 94 중 어느 한 항에 있어서, 상기 발현 수준은 mRNA 발현 수준인, 방법.
- 청구항 95에 있어서, 상기 mRNA 발현 수준은 정량적 폴리머라제 연쇄 반응 (qPCR), 역전사 qPCR (RT-qPCR), RNA 서열분석, 마이크로어레이 분석, 동일계내(in situ) 하이브리드화 및 유전자 발현의 연속 분석 (SAGE)으로 이루어진 군으로부터 선택된 방법을 사용하여 계측되는, 방법.
- 청구항 1 내지 96 중 어느 한 항에 있어서, 상기 발현 수준은 단백질 발현 수준인, 방법.
- 청구항 97에 있어서, 상기 단백질 발현 수준이 면역조직화학 (IHC), 면역형광, 질량 분광분석, 유동 세포측정 및 웨스턴 블롯으로 이루어진 군으로부터 선택된 방법을 사용하여 계측되는, 방법.
- 청구항 1 내지 98 중 어느 한 항에 있어서, 상기 환자로부터 수득된 상기 생물학적 샘플은 종양 샘플 또는 세포 샘플인, 방법.
- 청구항 99에 있어서, 상기 종양 샘플은 포르말린-고정되고, 파라핀-포매되고, 신선하고, 보관 또는 동결된 것인, 방법.
- 청구항 99에 있어서, 세포 샘플은 말초 CD8+ T 세포를 포함하는, 방법.
- 청구항 1 내지 101 중 어느 한 항에 있어서, 상기 환자가 인간 환자인, 방법.
- 신장암을 앓는 환자를 치료하는 방법에서 사용하기 위한, VEGF 길항제 및 PD-L1 축 결합 길항제를 포함하는 항암 요법으로서,
상기 환자로부터 수득된 생물학적 샘플은 참조 수준과 비교하여 하기 유전자 중 하나 이상의 발현 수준이 증가된 것으로 계측된, 항암 요법:
CD8A, CD8B, EOMES, GZMA, GZMB, IFNG, 또는 PRF1;
CXCL9, CXCL10, CXCL11, 또는 CXCL13; 또는
GZMB, KLRK1, 또는 SLAMF7. - 신장암을 앓는 환자의 치료에서 사용하기 위한 약제의 제조에 있어서의, VEGF 길항제 및 PD-L1 축 결합 길항제를 포함하는 항암 요법의 용도로서,
상기 환자로부터 수득된 생물학적 샘플은 참조 수준과 비교하여 하기 유전자 중 하나 이상의 발현 수준이 증가된 것으로 계측된, 용도:
CD8A, CD8B, EOMES, GZMA, GZMB, IFNG, 또는 PRF1;
CXCL9, CXCL10, CXCL11, 또는 CXCL13; 또는
GZMB, KLRK1, 또는 SLAMF7. - 신장암을 앓는 환자의 치료에서 사용하기 위한, VEGF 길항제 및 PD-L1 축 결합 길항제를 포함하는 조성물로서,
상기 환자로부터 수득된 생물학적 샘플은 참조 수준과 비교하여 하기 유전자 중 하나 이상의 발현 수준이 증가된 것으로 계측된, 조성물:
CD8A, CD8B, EOMES, GZMA, GZMB, IFNG, 또는 PRF1;
CXCL9, CXCL10, CXCL11, 또는 CXCL13; 또는
GZMB, KLRK1, 또는 SLAMF7. - 신장암을 앓는 환자를 치료하는 방법에서 사용하기 위한, VEGF 길항제 및 PD-L1 축 결합 길항제를 포함하는 항암 요법으로서,
상기 환자로부터 수득된 생물학적 샘플은 참조 수준과 비교하여 MHC-I의 발현 수준이 증가된 것으로 계측된, 항암 요법. - 신장암을 앓는 환자의 치료에서 사용하기 위한 약제의 제조에 있어서의, VEGF 길항제 및 PD-L1 축 결합 길항제를 포함하는 항암 요법의 용도로서,
상기 환자로부터 수득된 생물학적 샘플은 참조 수준과 비교하여 MHC-I의 발현 수준이 증가된 것으로 계측된, 용도. - 신장암을 앓는 환자의 치료에서 사용하기 위한, VEGF 길항제 및 PD-L1 축 결합 길항제를 포함하는 조성물로서,
상기 환자로부터 수득된 생물학적 샘플은 참조 수준과 비교하여 MHC-I의 발현 수준이 증가된 것으로 계측된, 조성물. - 신장암을 앓는 환자를 치료하는 방법에서 사용하기 위한, VEGF 길항제 및 PD-L1 축 결합 길항제를 포함하는 항암 요법으로서,
상기 환자로부터 수득된 생물학적 샘플은 참조 수준과 비교하여 CX3CR1, CCL2, CCL5, CCR5, CX3CL1, 또는 CCR7로부터 선택된 하나 이상의 유전자의 발현 수준이 증가된 것으로 계측된, 항암 요법. - 신장암을 앓는 환자의 치료에서 사용하기 위한 약제의 제조에 있어서의, VEGF 길항제 및 PD-L1 축 결합 길항제를 포함하는 항암 요법의 용도로서,
상기 환자로부터 수득된 생물학적 샘플은 참조 수준과 비교하여 CX3CR1, CCL2, CCL5, CCR5, CX3CL1, 또는 CCR7로부터 선택된 하나 이상의 유전자의 발현 수준이 증가된 것으로 계측된, 용도. - 신장암을 앓는 환자의 치료에서 사용하기 위한, VEGF 길항제 및 PD-L1 축 결합 길항제를 포함하는 조성물로서,
상기 환자로부터 수득된 생물학적 샘플은 참조 수준과 비교하여 CX3CR1, CCL2, CCL5, CCR5, CX3CL1, 또는 CCR7로부터 선택된 하나 이상의 유전자의 발현 수준이 증가된 것으로 계측된, 조성물. - 청구항 103 내지 111 중 어느 한 항에 있어서, 상기 PD-L1 축 결합 길항제가 PD-L1 결합 길항제인, 항암 요법, 용도, 또는 조성물.
- 청구항 112에 있어서, 상기 PD-L1 결합 길항제가 항체인, 항암 요법, 용도, 또는 조성물.
- 청구항 113에 있어서, 상기 항체는 하기로 이루어진 군으로부터 선택되는, 항암 요법, 용도, 또는 조성물:
MPDL3280A (아테졸리주맙), YW243.55.S70, MDX-1105, MEDI4736 (두르발루맙), 및 MSB0010718C (아벨루맙). - 청구항 103 내지 114 중 어느 한 항에 있어서, 상기 VEGF 길항제는 항-VEGF 항체인, 항암 요법, 용도, 또는 조성물.
- 청구항 115에 있어서, 상기 항-VEGF 항체가 베바시주맙인, 항암 요법, 용도, 또는 조성물.
- VEGF 길항제 및 PD-L1 축 결합 길항제를 포함하는 항암 요법으로 치료된 신장암을 갖는 환자의 반응을 모니터링하는 방법으로서, 하기를 포함하는, 방법:
(a) 상기 항암 요법의 투여 후 시점에서, 상기 환자로부터 수득된 종양 샘플 내 CD8+ T 세포 및/또는 CD68+/CD163+ 대식세포의 수를 계측하는 단계; 및
(b) 상기 종양 샘플 내 CD8+ T 세포 및/또는 CD68+/CD163+ 대식세포의 수를 참조 샘플과 비교하고, 이로써 상기 항암 요법으로 치료 중인 상기 환자의 반응을 모니터링하는 단계. - VEGF 길항제 및 PD-L1 축 결합 길항제를 포함하는 항암 요법으로 신장암을 갖는 환자를 치료하는 방법으로서, 하기를 포함하는, 방법:
(a) 상기 항암 요법의 투여 후 시점에서, 상기 환자로부터 수득된 종양 샘플 내 CD8+ T 세포 및/또는 CD68+/CD163+ 대식세포의 수를 계측하는 단계;
(b) 상기 종양 샘플 내 CD8+ T 세포 및/또는 CD68+/CD163+ 대식세포의 수를 참조 샘플과 비교하는 단계; 및
(c) 상기 환자 샘플 내 CD8+ T 세포 및/또는 CD68+/CD163+ 대식세포의 수가 상기 참조 수준과 비교하여 증가될 경우, 상기 환자에게 상기 항암 요법의 투여를 계속하는 단계. - 청구항 117 또는 118에 있어서, 상기 환자로부터 수득된 상기 종양 샘플은 상기 참조 샘플과 비교하여 CD8+ T 세포의 수가 증가된, 방법.
- 청구항 119에 있어서, 상기 환자로부터 수득된 상기 종양 샘플은 상기 참조 샘플과 비교하여 CD8+ T 세포의 수가 적어도 2배 증가된, 방법.
- 청구항 120에 있어서, 상기 환자로부터 수득된 상기 종양 샘플은 상기 참조 샘플과 비교하여 CD8+ T 세포의 수가 5배 증가된, 방법.
- 청구항 117 내지 121 중 어느 한 항에 있어서, 상기 환자로부터 수득된 상기 종양 샘플은 상기 참조 샘플과 비교하여 CD68+/CD163+ 대식세포의 수가 증가된, 방법.
- 청구항 117 내지 122 중 어느 한 항에 있어서, 상기 참조 샘플은 상기 항암 요법의 투여 이전에 수득된 상기 환자 유래의 종양 샘플인, 방법.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201662323297P | 2016-04-15 | 2016-04-15 | |
| US62/323,297 | 2016-04-15 | ||
| PCT/US2017/027768 WO2017181111A2 (en) | 2016-04-15 | 2017-04-14 | Methods for monitoring and treating cancer |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20190003958A true KR20190003958A (ko) | 2019-01-10 |
Family
ID=59276818
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020187032990A KR20190003958A (ko) | 2016-04-15 | 2017-04-14 | 암의 치료 및 모니터링 방법 |
Country Status (12)
| Country | Link |
|---|---|
| US (2) | US20190032151A1 (ko) |
| EP (1) | EP3443350B1 (ko) |
| JP (1) | JP2019521641A (ko) |
| KR (1) | KR20190003958A (ko) |
| CN (1) | CN109154613A (ko) |
| AU (1) | AU2017250296A1 (ko) |
| CA (1) | CA3019921A1 (ko) |
| ES (1) | ES2850428T3 (ko) |
| IL (1) | IL262225A (ko) |
| MX (2) | MX2018012492A (ko) |
| PL (1) | PL3443350T3 (ko) |
| WO (1) | WO2017181111A2 (ko) |
Families Citing this family (23)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| PL3400246T3 (pl) | 2016-01-08 | 2021-03-08 | F. Hoffmann-La Roche Ag | Sposoby leczenia nowotworów z dodatnim markerem cea z wykorzystaniem antagonistów wiążących oś pd-1 oraz przeciwciał dwuswoistych anty-cea/anty-cd3 |
| EP3443120A2 (en) * | 2016-04-15 | 2019-02-20 | H. Hoffnabb-La Roche Ag | Methods for monitoring and treating cancer |
| EP3589754B1 (en) | 2017-03-01 | 2023-06-28 | F. Hoffmann-La Roche AG | Diagnostic and therapeutic methods for cancer |
| KR20200016899A (ko) | 2017-06-01 | 2020-02-17 | 싸이톰스 테라퓨틱스, 인크. | 활성화가능 항-pdl1 항체, 및 이의 이용 방법 |
| CN112020647A (zh) * | 2018-04-26 | 2020-12-01 | 日本电气株式会社 | 信息处理装置、控制方法和程序 |
| JP2021532084A (ja) * | 2018-07-12 | 2021-11-25 | コーバス・ファーマシューティカルズ・インコーポレイテッド | アデノシン経路活性化を有する癌を検出および治療するための方法 |
| CN109053895B (zh) * | 2018-08-30 | 2020-06-09 | 中山康方生物医药有限公司 | 抗pd-1-抗vegfa的双功能抗体、其药物组合物及其用途 |
| CN113286881A (zh) | 2018-09-27 | 2021-08-20 | 格里尔公司 | 甲基化标记和标靶甲基化探针板 |
| EP3891182A4 (en) * | 2018-12-03 | 2022-08-17 | Immuneonco Biopharmaceuticals (Shanghai) Co., Ltd | RECOMBINATION PROTEIN TARGETING PD-L1 AND VEGF |
| JP2022511502A (ja) * | 2018-12-05 | 2022-01-31 | ジェネンテック, インコーポレイテッド | がんの免疫療法のための診断方法及び診断用組成物 |
| CN111378044B (zh) * | 2018-12-28 | 2022-07-15 | 长春金赛药业有限责任公司 | 抗体融合蛋白、制备方法及其应用 |
| CN111789949A (zh) * | 2019-04-08 | 2020-10-20 | 北京昱嘉科技集团有限公司 | 基于特异性趋化因子受体的阿尔兹海默病治疗靶点 |
| US20220289854A1 (en) * | 2019-04-30 | 2022-09-15 | Dana-Farber Cancer Institute, Inc. | Methods for treating cancer using combinations of anti-cx3cr1 and immune checkpoint blockade agents |
| CN114269376A (zh) * | 2019-05-03 | 2022-04-01 | 豪夫迈·罗氏有限公司 | 用抗pd-l1抗体治疗癌症的方法 |
| WO2020245054A1 (en) * | 2019-06-01 | 2020-12-10 | Ares Trading S.A. | Pd-1 axis binding antagonist to treat cancer with genetic mutations in specific genes |
| BR112022012821A2 (pt) * | 2020-01-13 | 2022-12-13 | Cytodyn Inc | Agente de ligação a ccr5 para tratamento de câncer metastático positivo para ccr5 |
| CN111257563B (zh) * | 2020-01-22 | 2022-08-23 | 广州泛恩生物科技有限公司 | Cxcl13检测剂在制备预测免疫治疗效果的试剂盒中的用途 |
| US11211147B2 (en) | 2020-02-18 | 2021-12-28 | Tempus Labs, Inc. | Estimation of circulating tumor fraction using off-target reads of targeted-panel sequencing |
| US11475981B2 (en) | 2020-02-18 | 2022-10-18 | Tempus Labs, Inc. | Methods and systems for dynamic variant thresholding in a liquid biopsy assay |
| US11211144B2 (en) | 2020-02-18 | 2021-12-28 | Tempus Labs, Inc. | Methods and systems for refining copy number variation in a liquid biopsy assay |
| WO2021205274A1 (en) * | 2020-04-08 | 2021-10-14 | Immunitybio, Inc. | Methods for assessing chemokine activity |
| US20220267445A1 (en) * | 2021-02-17 | 2022-08-25 | Novocure Gmbh | Methods and Compositions for Determining Susceptibility to Treatment with Checkpoint Inhibitors |
| WO2022197236A1 (en) * | 2021-03-19 | 2022-09-22 | Mezheyeuski Artur | Novel biomarker |
Family Cites Families (155)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3773919A (en) | 1969-10-23 | 1973-11-20 | Du Pont | Polylactide-drug mixtures |
| CU22545A1 (es) | 1994-11-18 | 1999-03-31 | Centro Inmunologia Molecular | Obtención de un anticuerpo quimérico y humanizado contra el receptor del factor de crecimiento epidérmico para uso diagnóstico y terapéutico |
| US4275149A (en) | 1978-11-24 | 1981-06-23 | Syva Company | Macromolecular environment control in specific receptor assays |
| US4318980A (en) | 1978-04-10 | 1982-03-09 | Miles Laboratories, Inc. | Heterogenous specific binding assay employing a cycling reactant as label |
| US4816567A (en) | 1983-04-08 | 1989-03-28 | Genentech, Inc. | Recombinant immunoglobin preparations |
| US4943533A (en) | 1984-03-01 | 1990-07-24 | The Regents Of The University Of California | Hybrid cell lines that produce monoclonal antibodies to epidermal growth factor receptor |
| US4683195A (en) | 1986-01-30 | 1987-07-28 | Cetus Corporation | Process for amplifying, detecting, and/or-cloning nucleic acid sequences |
| US4737456A (en) | 1985-05-09 | 1988-04-12 | Syntex (U.S.A.) Inc. | Reducing interference in ligand-receptor binding assays |
| US4676980A (en) | 1985-09-23 | 1987-06-30 | The United States Of America As Represented By The Secretary Of The Department Of Health And Human Services | Target specific cross-linked heteroantibodies |
| US6548640B1 (en) | 1986-03-27 | 2003-04-15 | Btg International Limited | Altered antibodies |
| IL85035A0 (en) | 1987-01-08 | 1988-06-30 | Int Genetic Eng | Polynucleotide molecule,a chimeric antibody with specificity for human b cell surface antigen,a process for the preparation and methods utilizing the same |
| EP0307434B2 (en) | 1987-03-18 | 1998-07-29 | Scotgen Biopharmaceuticals, Inc. | Altered antibodies |
| US5606040A (en) | 1987-10-30 | 1997-02-25 | American Cyanamid Company | Antitumor and antibacterial substituted disulfide derivatives prepared from compounds possessing a methyl-trithio group |
| US5770701A (en) | 1987-10-30 | 1998-06-23 | American Cyanamid Company | Process for preparing targeted forms of methyltrithio antitumor agents |
| WO1989006692A1 (en) | 1988-01-12 | 1989-07-27 | Genentech, Inc. | Method of treating tumor cells by inhibiting growth factor receptor function |
| GB8823869D0 (en) | 1988-10-12 | 1988-11-16 | Medical Res Council | Production of antibodies |
| JP2919890B2 (ja) | 1988-11-11 | 1999-07-19 | メディカル リサーチ カウンスル | 単一ドメインリガンド、そのリガンドからなる受容体、その製造方法、ならびにそのリガンドおよび受容体の使用 |
| US5225538A (en) | 1989-02-23 | 1993-07-06 | Genentech, Inc. | Lymphocyte homing receptor/immunoglobulin fusion proteins |
| DE3920358A1 (de) | 1989-06-22 | 1991-01-17 | Behringwerke Ag | Bispezifische und oligospezifische, mono- und oligovalente antikoerperkonstrukte, ihre herstellung und verwendung |
| CA2066428C (en) | 1989-09-08 | 2000-11-28 | Bert Vogelstein | Structural alterations of the egf receptor gene in human gliomas |
| CA2026147C (en) | 1989-10-25 | 2006-02-07 | Ravi J. Chari | Cytotoxic agents comprising maytansinoids and their therapeutic use |
| US5208020A (en) | 1989-10-25 | 1993-05-04 | Immunogen Inc. | Cytotoxic agents comprising maytansinoids and their therapeutic use |
| US6150584A (en) | 1990-01-12 | 2000-11-21 | Abgenix, Inc. | Human antibodies derived from immunized xenomice |
| US6075181A (en) | 1990-01-12 | 2000-06-13 | Abgenix, Inc. | Human antibodies derived from immunized xenomice |
| ATE139258T1 (de) | 1990-01-12 | 1996-06-15 | Cell Genesys Inc | Erzeugung xenogener antikörper |
| US5633425A (en) | 1990-08-29 | 1997-05-27 | Genpharm International, Inc. | Transgenic non-human animals capable of producing heterologous antibodies |
| US5625126A (en) | 1990-08-29 | 1997-04-29 | Genpharm International, Inc. | Transgenic non-human animals for producing heterologous antibodies |
| US5770429A (en) | 1990-08-29 | 1998-06-23 | Genpharm International, Inc. | Transgenic non-human animals capable of producing heterologous antibodies |
| US5545806A (en) | 1990-08-29 | 1996-08-13 | Genpharm International, Inc. | Ransgenic non-human animals for producing heterologous antibodies |
| KR100272077B1 (ko) | 1990-08-29 | 2000-11-15 | 젠팜인터내셔날,인코포레이티드 | 이종 항체를 생산할 수 있는 전이유전자를 가진 인간이외의 동물 |
| US5661016A (en) | 1990-08-29 | 1997-08-26 | Genpharm International Inc. | Transgenic non-human animals capable of producing heterologous antibodies of various isotypes |
| CA2095633C (en) | 1990-12-03 | 2003-02-04 | Lisa J. Garrard | Enrichment method for variant proteins with altered binding properties |
| US5571894A (en) | 1991-02-05 | 1996-11-05 | Ciba-Geigy Corporation | Recombinant antibodies specific for a growth factor receptor |
| US20030206899A1 (en) | 1991-03-29 | 2003-11-06 | Genentech, Inc. | Vascular endothelial cell growth factor antagonists |
| US6582959B2 (en) | 1991-03-29 | 2003-06-24 | Genentech, Inc. | Antibodies to vascular endothelial cell growth factor |
| WO1994004679A1 (en) | 1991-06-14 | 1994-03-03 | Genentech, Inc. | Method for making humanized antibodies |
| DE69233254T2 (de) | 1991-06-14 | 2004-09-16 | Genentech, Inc., South San Francisco | Humanisierter Heregulin Antikörper |
| GB9114948D0 (en) | 1991-07-11 | 1991-08-28 | Pfizer Ltd | Process for preparing sertraline intermediates |
| US5587458A (en) | 1991-10-07 | 1996-12-24 | Aronex Pharmaceuticals, Inc. | Anti-erbB-2 antibodies, combinations thereof, and therapeutic and diagnostic uses thereof |
| WO1993008829A1 (en) | 1991-11-04 | 1993-05-13 | The Regents Of The University Of California | Compositions that mediate killing of hiv-infected cells |
| GB9300059D0 (en) | 1992-01-20 | 1993-03-03 | Zeneca Ltd | Quinazoline derivatives |
| EP1997894B1 (en) | 1992-02-06 | 2011-03-30 | Novartis Vaccines and Diagnostics, Inc. | Biosynthetic binding protein for cancer marker |
| HU225646B1 (en) | 1992-10-28 | 2007-05-29 | Genentech Inc | Hvegf receptors as vascular endothelial cell growth factor antagonists |
| DE122004000036I1 (de) | 1992-11-13 | 2005-07-07 | Biogen Idec Inc | Therapeutische Verwendung von chimerischen und markierten Antik¦rper gegen menschlichen B Lymphozyt beschr{nkter Differenzierung antigen f}r die Behandlung von B-Zell-Lymphoma. |
| US5635483A (en) | 1992-12-03 | 1997-06-03 | Arizona Board Of Regents Acting On Behalf Of Arizona State University | Tumor inhibiting tetrapeptide bearing modified phenethyl amides |
| US5780588A (en) | 1993-01-26 | 1998-07-14 | Arizona Board Of Regents | Elucidation and synthesis of selected pentapeptides |
| WO1994029351A2 (en) | 1993-06-16 | 1994-12-22 | Celltech Limited | Antibodies |
| GB9314893D0 (en) | 1993-07-19 | 1993-09-01 | Zeneca Ltd | Quinazoline derivatives |
| PT659439E (pt) | 1993-12-24 | 2002-04-29 | Merck Patent Gmbh | Imunoconjugados |
| IL112248A0 (en) | 1994-01-25 | 1995-03-30 | Warner Lambert Co | Tricyclic heteroaromatic compounds and pharmaceutical compositions containing them |
| IL112249A (en) | 1994-01-25 | 2001-11-25 | Warner Lambert Co | Pharmaceutical compositions containing di and tricyclic pyrimidine derivatives for inhibiting tyrosine kinases of the epidermal growth factor receptor family and some new such compounds |
| US5654307A (en) | 1994-01-25 | 1997-08-05 | Warner-Lambert Company | Bicyclic compounds capable of inhibiting tyrosine kinases of the epidermal growth factor receptor family |
| US5635388A (en) | 1994-04-04 | 1997-06-03 | Genentech, Inc. | Agonist antibodies against the flk2/flt3 receptor and uses thereof |
| US5773001A (en) | 1994-06-03 | 1998-06-30 | American Cyanamid Company | Conjugates of methyltrithio antitumor agents and intermediates for their synthesis |
| HU216142B (hu) | 1994-07-21 | 1999-04-28 | Akzo Nobel N.V. | Ciklusos keton-peroxidokat tartalmazó kompozíciók, és azok alkalmazása (ko)polimerek módosítására |
| US5804396A (en) | 1994-10-12 | 1998-09-08 | Sugen, Inc. | Assay for agents active in proliferative disorders |
| US5731168A (en) | 1995-03-01 | 1998-03-24 | Genentech, Inc. | Method for making heteromultimeric polypeptides |
| IL117645A (en) | 1995-03-30 | 2005-08-31 | Genentech Inc | Vascular endothelial cell growth factor antagonists for use as medicaments in the treatment of age-related macular degeneration |
| DK0817775T3 (da) | 1995-03-30 | 2001-11-19 | Pfizer | Quinazolinderivater |
| US5869046A (en) | 1995-04-14 | 1999-02-09 | Genentech, Inc. | Altered polypeptides with increased half-life |
| GB9508538D0 (en) | 1995-04-27 | 1995-06-14 | Zeneca Ltd | Quinazoline derivatives |
| EP0822830B1 (en) | 1995-04-27 | 2008-04-02 | Amgen Fremont Inc. | Human anti-IL-8 antibodies, derived from immunized xenomice |
| GB9508565D0 (en) | 1995-04-27 | 1995-06-14 | Zeneca Ltd | Quiazoline derivative |
| EP0823941A4 (en) | 1995-04-28 | 2001-09-19 | Abgenix Inc | HUMAN ANTIBODIES DERIVED FROM IMMUNIZED XENO MOUSES |
| US5747498A (en) | 1996-05-28 | 1998-05-05 | Pfizer Inc. | Alkynyl and azido-substituted 4-anilinoquinazolines |
| JPH11507535A (ja) | 1995-06-07 | 1999-07-06 | イムクローン システムズ インコーポレイテッド | 腫瘍の成長を抑制する抗体および抗体フラグメント類 |
| US5714586A (en) | 1995-06-07 | 1998-02-03 | American Cyanamid Company | Methods for the preparation of monomeric calicheamicin derivative/carrier conjugates |
| US5712374A (en) | 1995-06-07 | 1998-01-27 | American Cyanamid Company | Method for the preparation of substantiallly monomeric calicheamicin derivative/carrier conjugates |
| CA2224435C (en) | 1995-07-06 | 2008-08-05 | Novartis Ag | Pyrrolopyrimidines and processes for the preparation thereof |
| US5760041A (en) | 1996-02-05 | 1998-06-02 | American Cyanamid Company | 4-aminoquinazoline EGFR Inhibitors |
| GB9603095D0 (en) | 1996-02-14 | 1996-04-10 | Zeneca Ltd | Quinazoline derivatives |
| GB9603256D0 (en) | 1996-02-16 | 1996-04-17 | Wellcome Found | Antibodies |
| PL190489B1 (pl) | 1996-04-12 | 2005-12-30 | Warner Lambert Co | Nieodwracalne inhibitory kinaz tyrozyny, kompozycja farmaceutyczna je zawierająca i ich zastosowanie |
| PT912559E (pt) | 1996-07-13 | 2003-03-31 | Glaxo Group Ltd | Compostos heterociclicos fundidos como inibidores de proteina tirosina quinase |
| ID18494A (id) | 1996-10-02 | 1998-04-16 | Novartis Ag | Turunan pirazola leburan dan proses pembuatannya |
| CA2273194C (en) | 1996-12-03 | 2011-02-01 | Abgenix, Inc. | Transgenic mammals having human ig loci including plural vh and vk regions and antibodies produced therefrom |
| UA73073C2 (uk) | 1997-04-03 | 2005-06-15 | Уайт Холдінгз Корпорейшн | Заміщені 3-ціанохіноліни, спосіб їх одержання та фармацевтична композиція |
| US6002008A (en) | 1997-04-03 | 1999-12-14 | American Cyanamid Company | Substituted 3-cyano quinolines |
| US20020032315A1 (en) | 1997-08-06 | 2002-03-14 | Manuel Baca | Anti-vegf antibodies |
| IL132239A0 (en) | 1997-04-07 | 2001-03-19 | Genentech Inc | Humanized antibodies and methods for forming humanized antibodies |
| US6884879B1 (en) | 1997-04-07 | 2005-04-26 | Genentech, Inc. | Anti-VEGF antibodies |
| WO1998045331A2 (en) | 1997-04-07 | 1998-10-15 | Genentech, Inc. | Anti-vegf antibodies |
| US6235883B1 (en) | 1997-05-05 | 2001-05-22 | Abgenix, Inc. | Human monoclonal antibodies to epidermal growth factor receptor |
| ES2201484T3 (es) | 1997-05-06 | 2004-03-16 | Wyeth Holdings Corporation | Utilizacion de compuestos de quinazolina para el tratamiento de la enfermedad de la poliquistosis renal. |
| WO1998058964A1 (en) | 1997-06-24 | 1998-12-30 | Genentech, Inc. | Methods and compositions for galactosylated glycoproteins |
| ZA986729B (en) | 1997-07-29 | 1999-02-02 | Warner Lambert Co | Irreversible inhibitors of tyrosine kinases |
| ZA986732B (en) | 1997-07-29 | 1999-02-02 | Warner Lambert Co | Irreversible inhibitiors of tyrosine kinases |
| TW436485B (en) | 1997-08-01 | 2001-05-28 | American Cyanamid Co | Substituted quinazoline derivatives |
| ATE419009T1 (de) | 1997-10-31 | 2009-01-15 | Genentech Inc | Methoden und zusammensetzungen bestehend aus glykoprotein-glykoformen |
| CA2306155A1 (en) | 1997-11-06 | 1999-05-20 | Philip Frost | Use of quinazoline derivatives as tyrosine kinase inhibitors for treating colonic polyps |
| US6610833B1 (en) | 1997-11-24 | 2003-08-26 | The Institute For Human Genetics And Biochemistry | Monoclonal human natural antibodies |
| BR9813365A (pt) | 1997-12-05 | 2004-06-15 | Scripps Research Inst | Método para produção e humanização de um anticorpo monoclonal de rato |
| EP1068241B1 (en) | 1998-04-02 | 2007-10-10 | Genentech, Inc. | Antibody variants and fragments thereof |
| US6194551B1 (en) | 1998-04-02 | 2001-02-27 | Genentech, Inc. | Polypeptide variants |
| ES2434961T5 (es) | 1998-04-20 | 2018-01-18 | Roche Glycart Ag | Ingeniería de glicosilación de anticuerpos para mejorar la citotoxicidad celular dependiente del anticuerpo |
| SK283688B6 (sk) | 1998-11-19 | 2003-12-02 | Warner-Lambert Company | N-[4-(3-chlór-4-fluór-fenylamino)-7-(3-morfolín-4-yl-propoxy)- chinazolín-6-yl]-akrylamid jeho použitie a farmaceutický prípravok na jeho báze |
| US6737056B1 (en) | 1999-01-15 | 2004-05-18 | Genentech, Inc. | Polypeptide variants with altered effector function |
| CN1763097B (zh) | 1999-01-15 | 2011-04-13 | 杰南技术公司 | 具有改变的效应功能的多肽变体 |
| ES2420835T3 (es) | 1999-04-09 | 2013-08-27 | Kyowa Hakko Kirin Co., Ltd. | Procedimiento para controlar la actividad de las moléculas inmunofuncionales |
| US6703020B1 (en) | 1999-04-28 | 2004-03-09 | Board Of Regents, The University Of Texas System | Antibody conjugate methods for selectively inhibiting VEGF |
| WO2001029246A1 (fr) | 1999-10-19 | 2001-04-26 | Kyowa Hakko Kogyo Co., Ltd. | Procede de production d'un polypeptide |
| JP2003516755A (ja) | 1999-12-15 | 2003-05-20 | ジェネンテック・インコーポレーテッド | ショットガン走査、すなわち機能性タンパク質エピトープをマッピングするための組み合わせ方法 |
| NZ518764A (en) | 1999-12-29 | 2004-02-27 | Immunogen Inc | Cytotoxic agents comprising modified doxorubicins and daunorubicins and their therapeutic use |
| BR0110610A (pt) | 2000-04-11 | 2003-04-29 | Genentech Inc | Anticorpos isolados, imunoconjugados, cadeias de polipeptìdeos, ácido nucléico isolado, vetor, célula hospedeira, processo de produção de anticorpo ou cadeia de polipeptìdeos, método de tratamento de disfunções em mamìferos, método de indução da apoptose de uma célula cancerosa, método para matar uma célula b, método para matar uma célula que expresse um receptor de erbb e usos dos anticorpos isolados |
| US7064191B2 (en) | 2000-10-06 | 2006-06-20 | Kyowa Hakko Kogyo Co., Ltd. | Process for purifying antibody |
| US6946292B2 (en) | 2000-10-06 | 2005-09-20 | Kyowa Hakko Kogyo Co., Ltd. | Cells producing antibody compositions with increased antibody dependent cytotoxic activity |
| ES2620359T3 (es) | 2000-10-06 | 2017-06-28 | Kyowa Hakko Kirin Co., Ltd. | Células que producen unas composiciones de anticuerpo |
| US6596541B2 (en) | 2000-10-31 | 2003-07-22 | Regeneron Pharmaceuticals, Inc. | Methods of modifying eukaryotic cells |
| EP1916303B1 (en) | 2000-11-30 | 2013-02-27 | Medarex, Inc. | Nucleic acids encoding rearranged human immunoglobulin sequences from transgenic transchromosomal mice |
| KR20100018071A (ko) | 2001-08-03 | 2010-02-16 | 글리카트 바이오테크놀로지 아게 | 항체 의존적 세포 독성이 증가된 항체 글리코실화 변이체 |
| US20030157108A1 (en) | 2001-10-25 | 2003-08-21 | Genentech, Inc. | Glycoprotein compositions |
| US20040093621A1 (en) | 2001-12-25 | 2004-05-13 | Kyowa Hakko Kogyo Co., Ltd | Antibody composition which specifically binds to CD20 |
| WO2003085119A1 (fr) | 2002-04-09 | 2003-10-16 | Kyowa Hakko Kogyo Co., Ltd. | Procede d'amelioration de l'activite d'une composition d'anticorps de liaison avec le recepteur fc$g(g) iiia |
| JPWO2003085118A1 (ja) | 2002-04-09 | 2005-08-11 | 協和醗酵工業株式会社 | 抗体組成物の製造方法 |
| EP1500698B1 (en) | 2002-04-09 | 2011-03-30 | Kyowa Hakko Kirin Co., Ltd. | Cell with depression or deletion of the activity of protein participating in gdp-fucose transport |
| WO2003085107A1 (fr) | 2002-04-09 | 2003-10-16 | Kyowa Hakko Kogyo Co., Ltd. | Cellules à génome modifié |
| EP1502603A4 (en) | 2002-04-09 | 2006-12-13 | Kyowa Hakko Kogyo Kk | AN ANTIBODY COMPOSITION CONTAINING MEDICAMENT FOR PATIENTS WITH Fc gamma RIIIa POLYMORPHISM |
| JPWO2003084569A1 (ja) | 2002-04-09 | 2005-08-11 | 協和醗酵工業株式会社 | 抗体組成物含有医薬 |
| EP1513879B1 (en) | 2002-06-03 | 2018-08-22 | Genentech, Inc. | Synthetic antibody phage libraries |
| US7361740B2 (en) | 2002-10-15 | 2008-04-22 | Pdl Biopharma, Inc. | Alteration of FcRn binding affinities or serum half-lives of antibodies by mutagenesis |
| BRPI0316779B8 (pt) | 2002-12-16 | 2023-02-28 | Genentech Inc | Anticorpo anti-cd20 humano ou fragmento de ligação ao antígeno do mesmo, seus usos, composição, artigo manufaturado e formulação líquida |
| US20050079574A1 (en) | 2003-01-16 | 2005-04-14 | Genentech, Inc. | Synthetic antibody phage libraries |
| CN1829741A (zh) | 2003-05-30 | 2006-09-06 | 健泰科生物技术公司 | 利用抗-vegf抗体的治疗 |
| US20050106667A1 (en) | 2003-08-01 | 2005-05-19 | Genentech, Inc | Binding polypeptides with restricted diversity sequences |
| WO2005035586A1 (ja) | 2003-10-08 | 2005-04-21 | Kyowa Hakko Kogyo Co., Ltd. | 融合蛋白質組成物 |
| JPWO2005035778A1 (ja) | 2003-10-09 | 2006-12-21 | 協和醗酵工業株式会社 | α1,6−フコシルトランスフェラーゼの機能を抑制するRNAを用いた抗体組成物の製造法 |
| ME01775B (me) | 2003-11-05 | 2011-02-28 | Glycart Biotechnology Ag | Cd20 antitijela sa povećanim afinitetom vezivanja za fc receptor i efektornom funkcijom |
| BR122018071808B8 (pt) | 2003-11-06 | 2020-06-30 | Seattle Genetics Inc | conjugado |
| JPWO2005053742A1 (ja) | 2003-12-04 | 2007-06-28 | 協和醗酵工業株式会社 | 抗体組成物を含有する医薬 |
| US7527791B2 (en) | 2004-03-31 | 2009-05-05 | Genentech, Inc. | Humanized anti-TGF-beta antibodies |
| US7785903B2 (en) | 2004-04-09 | 2010-08-31 | Genentech, Inc. | Variable domain library and uses |
| BR122019012028B1 (pt) | 2004-04-13 | 2023-09-26 | F. Hoffmann-La Roche Ag | Anticorpos anti-p-selectina, molécula de ácido nucléico, vetor, e composição |
| US20060009360A1 (en) | 2004-06-25 | 2006-01-12 | Robert Pifer | New adjuvant composition |
| TWI309240B (en) | 2004-09-17 | 2009-05-01 | Hoffmann La Roche | Anti-ox40l antibodies |
| EP3088004B1 (en) | 2004-09-23 | 2018-03-28 | Genentech, Inc. | Cysteine engineered antibodies and conjugates |
| EP1896582A4 (en) * | 2005-05-09 | 2009-04-08 | Ono Pharmaceutical Co | HUMAN MONOCLONAL ANTIBODIES FOR PROGRAMMED DEATH 1 (MP-1) AND METHODS FOR TREATING CANCER USING ANTI-MP-1 ANTIBODIES ALONE OR ASSOCIATED WITH OTHER IMMUNOTHERAPIES |
| US8219149B2 (en) | 2005-06-29 | 2012-07-10 | Nokia Corporation | Mobile communication terminal |
| CN101248089A (zh) | 2005-07-01 | 2008-08-20 | 米德列斯公司 | 抗程序性死亡配体1(pd-l1)的人单克隆抗体 |
| ES2577292T3 (es) | 2005-11-07 | 2016-07-14 | Genentech, Inc. | Polipéptidos de unión con secuencias hipervariables de VH/VL diversificadas y consenso |
| US20070237764A1 (en) | 2005-12-02 | 2007-10-11 | Genentech, Inc. | Binding polypeptides with restricted diversity sequences |
| WO2007134050A2 (en) | 2006-05-09 | 2007-11-22 | Genentech, Inc. | Binding polypeptides with optimized scaffolds |
| US20080226635A1 (en) | 2006-12-22 | 2008-09-18 | Hans Koll | Antibodies against insulin-like growth factor I receptor and uses thereof |
| CN100592373C (zh) | 2007-05-25 | 2010-02-24 | 群康科技(深圳)有限公司 | 液晶显示面板驱动装置及其驱动方法 |
| EP2235064B1 (en) | 2008-01-07 | 2015-11-25 | Amgen Inc. | Method for making antibody fc-heterodimeric molecules using electrostatic steering effects |
| JP2011512332A (ja) | 2008-02-11 | 2011-04-21 | キュアー テック リミテッド | 腫瘍治療のためのモノクローナル抗体 |
| US8168757B2 (en) | 2008-03-12 | 2012-05-01 | Merck Sharp & Dohme Corp. | PD-1 binding proteins |
| US20110159023A1 (en) | 2008-08-25 | 2011-06-30 | Solomon Langermann | Pd-1 antagonists and methods for treating infectious disease |
| CN102245640B (zh) | 2008-12-09 | 2014-12-31 | 霍夫曼-拉罗奇有限公司 | 抗-pd-l1抗体及它们用于增强t细胞功能的用途 |
| JP2013512251A (ja) | 2009-11-24 | 2013-04-11 | アンプリミューン、インコーポレーテッド | Pd−l1/pd−l2の同時阻害 |
| NZ599405A (en) | 2009-11-24 | 2014-09-26 | Medimmune Ltd | Targeted binding agents against b7-h1 |
| TWI426920B (zh) | 2010-03-26 | 2014-02-21 | Hoffmann La Roche | 雙專一性、雙價抗-vegf/抗-ang-2抗體 |
| MY186099A (en) * | 2012-05-31 | 2021-06-22 | Genentech Inc | Methods of treating cancer using pd-l1 axis binding antagonists and vegf antagonists |
| CN109793893B (zh) * | 2012-09-07 | 2023-05-26 | 达特茅斯大学理事会 | 用于诊断和治疗癌症的vista调节剂 |
| AU2014235453A1 (en) * | 2013-03-15 | 2015-10-08 | Genentech, Inc. | Biomarkers and methods of treating PD-1 and PD-L1 related conditions |
| ES2819209T3 (es) * | 2013-07-16 | 2021-04-15 | Hoffmann La Roche | Procedimientos de tratamiento del cáncer usando antagonistas de unión al eje de PD-1 e inhibidores de TIGIT |
-
2017
- 2017-04-14 CN CN201780030368.4A patent/CN109154613A/zh not_active Withdrawn
- 2017-04-14 WO PCT/US2017/027768 patent/WO2017181111A2/en active Application Filing
- 2017-04-14 EP EP17735254.9A patent/EP3443350B1/en active Active
- 2017-04-14 JP JP2018553112A patent/JP2019521641A/ja active Pending
- 2017-04-14 MX MX2018012492A patent/MX2018012492A/es unknown
- 2017-04-14 KR KR1020187032990A patent/KR20190003958A/ko not_active Application Discontinuation
- 2017-04-14 ES ES17735254T patent/ES2850428T3/es active Active
- 2017-04-14 CA CA3019921A patent/CA3019921A1/en not_active Abandoned
- 2017-04-14 AU AU2017250296A patent/AU2017250296A1/en not_active Abandoned
- 2017-04-14 PL PL17735254T patent/PL3443350T3/pl unknown
-
2018
- 2018-10-09 IL IL262225A patent/IL262225A/en unknown
- 2018-10-11 MX MX2021008053A patent/MX2021008053A/es unknown
- 2018-10-11 US US16/157,853 patent/US20190032151A1/en not_active Abandoned
-
2022
- 2022-11-03 US US18/052,264 patent/US20230340613A1/en active Pending
Also Published As
| Publication number | Publication date |
|---|---|
| EP3443350B1 (en) | 2020-12-09 |
| JP2019521641A (ja) | 2019-08-08 |
| IL262225A (en) | 2018-11-29 |
| WO2017181111A3 (en) | 2017-12-07 |
| US20230340613A1 (en) | 2023-10-26 |
| AU2017250296A1 (en) | 2018-11-01 |
| PL3443350T3 (pl) | 2021-05-31 |
| MX2021008053A (es) | 2021-08-05 |
| ES2850428T3 (es) | 2021-08-30 |
| WO2017181111A2 (en) | 2017-10-19 |
| CA3019921A1 (en) | 2017-10-19 |
| US20190032151A1 (en) | 2019-01-31 |
| CN109154613A (zh) | 2019-01-04 |
| MX2018012492A (es) | 2019-06-06 |
| EP3443350A2 (en) | 2019-02-20 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US20230340613A1 (en) | Methods for monitoring and treating cancer | |
| JP7256127B2 (ja) | がんのための診断及び治療方法 | |
| CN111213059B (zh) | 用于癌症的诊断和治疗方法 | |
| CN109196121B (zh) | 用于癌症的治疗和诊断方法 | |
| JP7048319B2 (ja) | 癌のための治療方法及び診断方法 | |
| KR20190072528A (ko) | 암에 대한 치료 및 진단 방법 | |
| KR20200093518A (ko) | 암에 대한 치료 및 진단 방법 | |
| KR20180012753A (ko) | 암에 대한 치료 및 진단 방법 | |
| KR20190003957A (ko) | 암 모니터링 및 치료 방법 | |
| KR20210079311A (ko) | 육종성 신장암에 대한 진단과 치료 방법 | |
| KR20210063330A (ko) | 방광암에 대한 치료 및 진단 방법 | |
| JP2023520515A (ja) | がんに対する治療方法及び診断方法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| E902 | Notification of reason for refusal | ||
| E902 | Notification of reason for refusal | ||
| E601 | Decision to refuse application |