KR20100137585A - 강력한 복합체 및 친수성 링커 - Google Patents
강력한 복합체 및 친수성 링커 Download PDFInfo
- Publication number
- KR20100137585A KR20100137585A KR1020107026963A KR20107026963A KR20100137585A KR 20100137585 A KR20100137585 A KR 20100137585A KR 1020107026963 A KR1020107026963 A KR 1020107026963A KR 20107026963 A KR20107026963 A KR 20107026963A KR 20100137585 A KR20100137585 A KR 20100137585A
- Authority
- KR
- South Korea
- Prior art keywords
- antibody
- bond
- complex
- cell
- drug
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/535—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with at least one nitrogen and one oxygen as the ring hetero atoms, e.g. 1,2-oxazines
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/535—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with at least one nitrogen and one oxygen as the ring hetero atoms, e.g. 1,2-oxazines
- A61K31/5375—1,4-Oxazines, e.g. morpholine
- A61K31/5386—1,4-Oxazines, e.g. morpholine spiro-condensed or forming part of bridged ring systems
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/40—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with one nitrogen as the only ring hetero atom, e.g. sulpiride, succinimide, tolmetin, buflomedil
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/535—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with at least one nitrogen and one oxygen as the ring hetero atoms, e.g. 1,2-oxazines
- A61K31/537—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with at least one nitrogen and one oxygen as the ring hetero atoms, e.g. 1,2-oxazines spiro-condensed or forming part of bridged ring systems
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/54—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an organic compound
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/56—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an organic macromolecular compound, e.g. an oligomeric, polymeric or dendrimeric molecule
- A61K47/59—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an organic macromolecular compound, e.g. an oligomeric, polymeric or dendrimeric molecule obtained otherwise than by reactions only involving carbon-to-carbon unsaturated bonds, e.g. polyureas or polyurethanes
- A61K47/60—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an organic macromolecular compound, e.g. an oligomeric, polymeric or dendrimeric molecule obtained otherwise than by reactions only involving carbon-to-carbon unsaturated bonds, e.g. polyureas or polyurethanes the organic macromolecular compound being a polyoxyalkylene oligomer, polymer or dendrimer, e.g. PEG, PPG, PEO or polyglycerol
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
- A61K47/6801—Drug-antibody or immunoglobulin conjugates defined by the pharmacologically or therapeutically active agent
- A61K47/6803—Drugs conjugated to an antibody or immunoglobulin, e.g. cisplatin-antibody conjugates
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
- A61K47/6835—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site
- A61K47/6843—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site the antibody targeting a material from animals or humans
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
- A61K47/6835—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site
- A61K47/6849—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site the antibody targeting a receptor, a cell surface antigen or a cell surface determinant
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
- A61K47/6835—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site
- A61K47/6851—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site the antibody targeting a determinant of a tumour cell
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
- A61K47/6889—Conjugates wherein the antibody being the modifying agent and wherein the linker, binder or spacer confers particular properties to the conjugates, e.g. peptidic enzyme-labile linkers or acid-labile linkers, providing for an acid-labile immuno conjugate wherein the drug may be released from its antibody conjugated part in an acidic, e.g. tumoural or environment
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P33/00—Antiparasitic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/06—Immunosuppressants, e.g. drugs for graft rejection
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D498/00—Heterocyclic compounds containing in the condensed system at least one hetero ring having nitrogen and oxygen atoms as the only ring hetero atoms
- C07D498/12—Heterocyclic compounds containing in the condensed system at least one hetero ring having nitrogen and oxygen atoms as the only ring hetero atoms in which the condensed system contains three hetero rings
- C07D498/18—Bridged systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2803—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/30—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants from tumour cells
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
- A61K47/6835—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site
- A61K47/6851—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site the antibody targeting a determinant of a tumour cell
- A61K47/6863—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site the antibody targeting a determinant of a tumour cell the tumour determinant being from stomach or intestines cancer cell
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
- A61K47/6891—Pre-targeting systems involving an antibody for targeting specific cells
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/20—Immunoglobulins specific features characterized by taxonomic origin
- C07K2317/24—Immunoglobulins specific features characterized by taxonomic origin containing regions, domains or residues from different species, e.g. chimeric, humanized or veneered
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02A—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE
- Y02A50/00—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE in human health protection, e.g. against extreme weather
- Y02A50/30—Against vector-borne diseases, e.g. mosquito-borne, fly-borne, tick-borne or waterborne diseases whose impact is exacerbated by climate change
Abstract
폴리에틸렌 글리콜 스페이서를 도입하여 약물을 세포 결합제와 결합시키는 링커를 친수성 링커로 개질한다.
치료 내성이 있는 세포 표면이나 암 세포에서 소수의 항원을 발현하는 것을 포함하는 다양한 암 세포류에서 세포결합제-약물 복합체(conjugates)의 효력이나 효능은 놀랍게도 수 배 증진된다.
치료 내성이 있는 세포 표면이나 암 세포에서 소수의 항원을 발현하는 것을 포함하는 다양한 암 세포류에서 세포결합제-약물 복합체(conjugates)의 효력이나 효능은 놀랍게도 수 배 증진된다.
Description
본 발명은 약물 활성 증진에 기여하는, 약물 (예컨대, 세포독성제)을 세포결합제(예컨대, 항체)와 연결하는 신규 링커에 관한 것이다. 특히, 본 발명은 치료 내성이 있는 세포면이나 암에서 소수의 항원을 발현하는 다양한 암 세포 형태에서 세포결합제-약물 복합체(conjugates)의 효력이나 효능을 수배 증진하는 신규 친수성 링커의 이용에 관한 것이다.
세포독성 약물의 항체 복합체는 표적-특이 치료제로 개발되고 있다. 다양한 암 세포-표면 항원에 대한 항체는 미소관 등 다양한 중요한 세포 표적을 저해하는 다른 세포독성제와 복합화되었다 (마이탄시노이드, 아루리스타틴, 탁산: 미국 특허 제 5,208,020; 5,416,064; 6.333,410; 6,441,163; 6,340,701; 6,372,738; 6,436,931; 6,596,757; 7,276.497), DNA (칼리케아마이신, 독소루비신, CC-1065 유사체; 미국 특허 제 5,475,092; 5,585,499; 5,846,545; 6,534,660; 6,756,397; 6,630,579). 이들 세포독성 약물의 항체 복합체는 암 치료 임상에서 활발하게 연구되고 있다 (Richart, A. D., and Tolcher, A. W., 2007, Nature Clinical Practice, 4, 245-255).
항체-세포독성제 복합체는 리신 아미노기 또는 시스테인기 등 항체의 반응 부분을 초기 개질하여 제조되는 것이 전형적이다 (분자생물학 방법을 이용하여 항체에 자체 디설파이드 결합을 환원하거나 별도의 외래 시스테인 잔기를 도입하여 생성). 따라서, 항체는 앞서 기술한 것과 SPDB, SMCC 및 SIAB에 예시한 바와 같이 우선 이종이관능성 링커 시약으로 개질하여 (미국 특허 제 6,913,758호 및 미국 특허 공개 제 20050169933호) 링커와 혼합 피리딜설파이드, 말레이미드 또는 할로아세트아미드 등 반응기를 통합한다. 항체에 도입된 반응성 링커기는 그 후에 티올기 등 반응성 부분을 포함하는 세포독성제와 복합화한다. 또 다른 복합 경로는 티올-반응기(할로아세트아미드 또는 말레이미드 등)를 포함하는 세포독성제 유도체 와 세포결합제의 티올기와의 반응이다. 티올기는 자체 디설파이드 잔부 (R. Singh et al., Anal . Biochem ., 2002, 304, 147-156)의 환원, 또는 도입된 디설파이드 부분 (SPDP에 의한 숙신이미딜 3-(2-피리딜디티오)프로피오네이트)의 환원 후, 디티오트레이톨과의 반응 (D. G. Gilliland et al., Proc . Natl . Acad . Sci USA ., 1980, 77, 4539-4543), 또는 추가로 외래 시스테인 잔부의 도입 (J. B. Stimmel et al., J. Biol . Chem ., 2000, 275, 30445-30450), 또는 2-이미노티올란 (R. Jue et al., Biochemistry , 1978, 17, 5399-5406)이나 메틸 3-머캅토프로피온이미데이트 에스테르 (T. P. King et al, Biochemistry , 1978, 17, 1499-1506)와의 반응에 의한 티올기의 도입에 의해 항체 등 세포결합제에 도입된다.
디설파이드 또는 티오에테르로 연결된 항체-세포독성제 복합체는 세포 내 (리소좀에서) 분해되어 암 세포 내로 활성 세포독성제를 운반한다 (H. K. Erickson et al., 2006, Cancer Research , 66, 4626-4433). 환원성 디설파이드로 연결된 항체-세포독성제 복합체는 표적 세포를 제거할 뿐 아니라, 항원 음성 세포와 항원 양성 세포의 혼합 군집에서 인접하는 항원 음성 세포를 제거하여, 이종 항원 발현으로 종양 내 인접 비항원발현 세포에 대한 효능을 증진하는 포적 세포 용리 세포독성제의 역할을 제시한다 (Y. V. Kovtun et al., Cancer Research, 2006, 66, 3214-3221).
항체-세포독성 약물 복합체는 시험관 내 세포 제거 활성과 생체 내 항암 활성을 나타내고, 이들의 효력은 여러 경우, 특히, 표적 암 세포에서 항원 발현이 낮은 경우나, 표적 세포가 치료제에 내성이 있는 경우에 감소한다. 이는 보통은 환자의 항암 활성을 낮거나 준수한 정도로 낮추는 임상 시험의 경우이다. 내성을 피할 수 있는 방법은 친수성기 또는 소유성기 (G. Szokacs 등, Nature Reviews , 5; 219-235, 2006 참조)를 포함하는 신규 약물을 합성하는 것이다. 그러나, 이 공정은 다루기 힘들고, 여러 유사체가 합성되어야 하고, 약물 구조의 개질이 생물학적 활성의 손실을 초래할 수도 있다. 따라서, 다른 방법이 필요하다.
본 발명은 링커가 약물의 활성 증가에 기여할 수 있도록 세포결합제에 약물을 연결하는 새로운 링커를 설계하여 내성 문제를 해결한다. 따라서, 본 발명은 링커 설계가 종양(특히, 낮은 항원 발현 또는 약물 내성 종양)의 폭넓은 스펙트럼에서 활성이 있는 복합체를 제공할 수 있는 약물을 세포결합제와 연결하는 방법을 개선한다.
본 발명은 폴리에틸렌 글리콜 [PEGn, (-CH2CH2O)n)] 스페이서를 도입하여 종래의 링커 (미국 특허 공개 제 20050169933에 기술된 SMCC, SIAB 등)를 친수성 링커로 개질하면 세포 표면에 소수의 항원을 발현하는 다양한 암 세포에서 세포결합제-약물 복합체의 효력이나 효능이 놀랍게도 수배 향상되는 것을 새로 발견하여 이루어졌다.
또한, 이들 PEG-포함 복합체는 예상외로 치료 내성이 있는 세포 류에 대한 전술한 복합체보다 효능이 우수하다.
또한, 항체 복합체의 경우, 친수성 링커를 도입하면 수율이 높고, 응집과 침전을 초래하지 않는 항체당 약물 분자 수가 15 이하인 복합화가 가능하다. 이들 친수성 링커를 갖는 복합체 표적 항원과 높은 친화력으로 결합한 (개질되지 않은 항체와 유사) 항체 분자당 결합한 약물 분자 수가 15 이하이다.
따라서, 본 발명은 화학식 (1)의 화합물 또는 화학식 (1')의 특정 화합물을 제공한다:
Z-Xl-(-CH2-CH2-O-)n-Yp-D (1)
D-Yp-(-CH2-CH2-O-)n-Xl-Z (1')
상기 식에서,
Z는 세포결합제와 아미드 또는 티오에테르 결합을 형성할 수 있는 반응성 관능기를 나타내고;
D는 약물을 나타내고;
X는 티오에테르 결합, 아미드 결합, 카르밤산 결합 또는 에테르 결합을 통해 세포결합제에 결합한 지방족, 방향족 또는 이종고리 단위를 나타내고;
Y는 티오에테르 결합, 아미드 결합, 카르밤산 결합, 에테르 결합, 아미드 결합, 탄소-탄소 결합 및 히드라존 결합으로 구성되는 군으로부터 선택되는 공유 결합을 통해 약물에 결합한 지방족, 방향족 또는 이종고리 단위를 나타내고;
l은 0 또는 1이고;
p는 0 또는 1이고;
n은 1 내지 2000의 정수이다.
본 발명의 다른 양태는 하기 화학식 (2)의 약물 또는 화학식 (2')의 특정 화합물의 세포결합제 약물 복합체이다:
CB-[Xl-(-CH2-CH2-O-)n-Yp-D]m (2)
[D-Yp-(-CH2-CH2-O-)n-Xl]m-CB (2')
상기 식에서,
CB는 세포결합제를 나타내고;
D는 약물을 나타내고;
X는 티오에테르 결합, 아미드 결합, 카르밤산 결합, 또는 에테르 결합을 통해 세포결합제와 결합한 지방족, 방향족 또는 이종고리 단위를 나타내고;
Y는 티오에테르 결합, 아미드 결합, 카르밤산 결합, 에테르 결합, 아미드 결합, 탄소-탄소 결합 및 히드라존 결합으로 구성되는 군으로부터 선택되는 공유 결합을 통해 약물에 결합하는 지방족, 방향족, 또는 이종고리 단위를 나타내고;
l은 0 또는 1이고;
p는 0 또는 1이고;
m은 2 내지 15의 정수이고;
n은 1 내지 2000의 정수이다.
본 발명의 다른 양태는 화학식 (3)의 화합물 또는 화학식 (3')의 특정 화합물이다:
Z-Xl-(-CH2-CH2O-)n-Y-D (3)
D-Y-(-CH2-CH2O-)n-Xl-Z (3')
상기 식에서,
Z는 세포결합제와 아미드 또는 티오에테르 결합을 형성할 수 있는 반응성 관능기를 나타내고;
D는 약물을 나타내고;
X는 티오에테르 결합, 아미드 결합, 카르밤산 결합, 또는 에테르 결합을 통해 세포결합제와 결합한 지방족, 방향족 또는 이종고리 단위를 나타내고;
Y는 디설파이드 결합을 통해 약물과 결합한 지방족, 비방향족 이종고리 또는 방향족 이종고리 단위를 나타내고;
1은 0 또는 1이고;
n은 1 내지 14의 정수이다.
본 발명의 다른 양태는 화학식 (4)의 또는 화학식 (4')의 특정 화합물의 세포결합제 약물 복합체이다:
CB-(Xl-(-CH2-CH2O-)n-Y-D)m (4)
[D-Y-(-CH2-CH2O-)n-Xl]m-CB (4')
상기 식에서,
CB는 세포결합제를 나타내고;
D는 약물을 나타내고;
X는 티오에테르 결합, 아미드 결합, 카르밤산 결합, 또는 에테르 결합을 통해 세포결합제에 결합한 지방족, 방향족 또는 이종고리 단위를 나타내고;
Y는 디설파이드 결합을 통해 약물에 결합한 지방족, 방향족 또는 이종고리 단위를 나타내고;
1은 0 또는 1이고;
m은 3 내지 8의 정수이고;
n은 1 내지 14의 정수이다.
본 발명의 다른 양태는 화학식 (2) 또는 (4)의 복합체를 포함하는 조성물의 유효량을 이를 필요로 하는 환자에게 비경구 투여하는 것을 포함하는 치료에 민감한 암을 치료하는 방법이다.
본 발명은 링커가 약물의 활성 증가에 기여할 수 있도록 세포결합제에 약물을 연결하는 새로운 링커를 설계하여 내성 문제를 해결한다. 따라서, 본 발명은 링커 설계가 종양(특히, 낮은 항원 발현 또는 약물 내성 종양)의 폭넓은 스펙트럼에서 활성이 있는 복합체를 제공할 수 있는 약물을 세포결합제와 연결하는 방법을 개선한다.
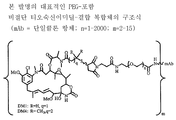
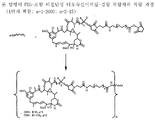
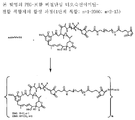
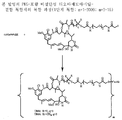
도 1은 본 발명의 대표적인 PEG-포함 티오숙신이미딜-결합 복합체의 구조식을 나타낸다 (mAb = 단일클론 항체).
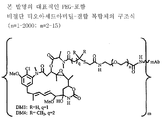
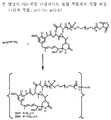
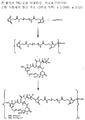
도 2는 본 발명의 대표적인 PEG-포함 티오아세트아미딜-결합 복합체의 구조식을 나타낸다.
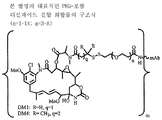
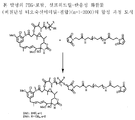
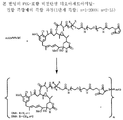
도 3은 본 발명의 대표적인 PEG-포함 디설파이드 결합 화합물의 구조식을 나타낸다.
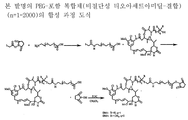
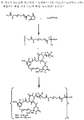
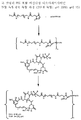
도 4는 본 발명의 PEG-포함 티오숙신이미딜-결합 복합체에 대한 합성 과정을 나타낸다.
도 5는 본 발명의 PEG-포함 티오아세트아미딜-결합 복합체에 대한 합성 과정을 나타낸다.
도 6은 본 발명의 EG-포함 디설파이드 결합 화합물에 대한 합성 과정을 나타낸다: a.) 1단계 복합을 위한 PEG-포함 디설파이드 결합 화합물과 세포결합제의 합성; 및 b.) 이종이관능성 PEG-포함 디설파이드 결합 가교 화합물의 합성.
도 7은 본 발명의 PEG-포함 티오숙신이미딜-결합 복합체의 복합 과정을 나타낸다 (1단계 복합).
도 8은 본 발명의 PEG-포함 티오숙신이미딜-결합 복합체의 복합 과정을 나타낸다 (2단계 복합).
도 9는 본 발명의 PEG-포함 티오에테르-결합 (티오아세트아미딜-결합) 복합체의 복합 과정을 나타낸다 (1단계 복합).
도 10은 본 발명의 PEG-포함 티오에테르-결합 (티오아세트아미딜-결합) 복합체의 복합 과정을 나타낸다 (2단계 복합).
도 11은 본 발명의 PEG-포함 디설파이드 결합 복합체의 복합 과정을 나타낸다 (1단계 복합).
도 12는 본 발명의 PEG-포함 디설파이드 결합 복합체의 복합 과정을 나타낸다 (2단계 복합).
도 13은 본 발명의 PEG-포함, 설프히드릴-반응, 티오숙신이미딜-결합 화합물에 대한 합성 과정을 나타낸다.
도 14는 본 발명의 PEG-포함 티오숙신이미딜-결합 복합체의 합성 과정을 나타낸다 (1단계 복합).
도 15는 본 발명의 PEG-포함 티오숙신이미딜-결합 복합체의 합성 과정을 나타낸다 (2단계 복합)
도 16는 본 발명의 PEG-포함, 설프히드릴-반응, 티오아세트아미딜-결합 화합물의 합성 과정을 나타낸다; a.) 1단계 복합을 위한 PEG-포함, 설프히드릴-반응, 티오아세트아미드 결합 화합물의 합성; 및 b.) 2단계 복합을 위한 이종이관능성 PEG-포함, 설프히드릴-반응 가교 화합물의 합성.
도 17은 본 발명의 PEG-포함 티오아세트아미딜-결합 복합체에 대한 복합 과정을 나타낸다(1단계 복합).
도 18은 본 발명의 PEG-포함 티오아세트아미딜-결합 복합체에 대한 복합 과정을 나타낸다 (2단계 복합).
도 19는 본 발명의 PEG-포함, 설프히드릴-반응, 티오에테르-결합 화합물에 대한 합성 과정을 나타낸다: a.) 1단계 복합을 위한 PEG-포함, 설프히드릴-반응, 티오아세트아미딜 결합 화합물의 합성; 및 b.) 2단계 복합을 위한 동종이관능성 PEG-포함, 설프히드릴-반응 가교 화합물의 합성.
도 20은 본 발명의 PEG-포함 티오아세트아미딜-결합 복합체의 복합 과정을 나타낸다 (1단계 복합).
도 21은 본 발명의 PEG-포함 티오아세트아미딜-결합 복합체의 복합 과정을 나타낸다 (2단계 복합).
도 22는 탈글리코실화 HuAb-PEG4Mal-DMl 복합체 (10.7 DMl/Ab, 평균)의 질량 스펙트럼 (MS)을 나타낸다.
도 23은 탈글리코실화 HuAb-PEG4Mal-DMl 복합체 (10.7 DMl/Ab, 평균)의 크기 배제 크로마토그래피 (SEC)를 나타낸다.
도 24는 HuAb-PEG4Mal-DM 1 복합체 (10.7 마이탄시노이드/항체)의 FACS 결합이 개질하지 않은 항체와 유사함을 나타낸다.
도 25는 다제 내성 COLO205-MDR 세포에서 항-EpCAM 항체-마이탄시노이드 복합체의 세포독성을 나타낸다.
도 26은 다제 내성 COLO205-MDR 세포에서 항-CanAg 항체-마이탄시노이드 복합체의 세포독성을 나타낸다.
도 27은 Molp-8 다발성 골수증 세포에서 항-CD56 항체-마이탄시노이드 복합체의 세포독성을 나타낸다.
도 28은 HCTl 5 세포에서 항-EpCAM 항체-마이탄시노이드 복합체의 세포독성을 나타낸다.
도 29는 COLO 205 mdr 세포에서 항-EpCAM 항체-마이탄시노이드 복합체의 세포독성을 나타낸다.
도 30은 이종이식에서 항-EpCAM 항체- 마이탄시노이드 복합체의 생체 내 항암 활성을 나타낸다.
도 31은 COLO205 mdr 이종이식에서 항-EpCAM 항체-마이탄시노이드 복합체의 생체 내 항암 활성을 나타낸다.
도 32는 COLO 205 이종이식에서 항-EpCAM 항체-마이탄시노이드 복합체의 생체내 항암 활성을 나타낸다.
도 33은 COLO 205 mdr 이종이식에서 항-CanAg 항체-마이탄시노이드 복합체의 생체내 항암 활성을 나타낸다.
도 34는 항-CanAg 항체 (huC242)-PEG24-Mal-DMl 복합체 (17 D/A 범위까지)의 결합을 나타낸다.
도 35는 COLO 205 세포에 대한 4 내지 17 D/A를 갖는 항-CanAg 항체 (huC242)-PEG24-Mal-DMl 복합체의 시험관 내 효능을 나타낸다.
도 36은 다제 내성 (pgp+) COLO205-MDR 세포에 대한 4 내지 17 D/A를 갖는 항-CanAg 항체 (huC242)-PEG24-Mal-DMl 복합체의 시험관 내 효능을 나타낸다.
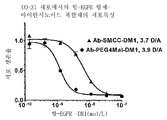
도 37은 UO-31 세포에서의 항-EGFR 항체-마이탄시노이드 복합체의 세포독성을 나타낸다.
도 38은 항체-PEG4-Mal-DM1의 혈장 약물동태를 나타낸다.
도 2는 본 발명의 대표적인 PEG-포함 티오아세트아미딜-결합 복합체의 구조식을 나타낸다.
도 3은 본 발명의 대표적인 PEG-포함 디설파이드 결합 화합물의 구조식을 나타낸다.
도 4는 본 발명의 PEG-포함 티오숙신이미딜-결합 복합체에 대한 합성 과정을 나타낸다.
도 5는 본 발명의 PEG-포함 티오아세트아미딜-결합 복합체에 대한 합성 과정을 나타낸다.
도 6은 본 발명의 EG-포함 디설파이드 결합 화합물에 대한 합성 과정을 나타낸다: a.) 1단계 복합을 위한 PEG-포함 디설파이드 결합 화합물과 세포결합제의 합성; 및 b.) 이종이관능성 PEG-포함 디설파이드 결합 가교 화합물의 합성.
도 7은 본 발명의 PEG-포함 티오숙신이미딜-결합 복합체의 복합 과정을 나타낸다 (1단계 복합).
도 8은 본 발명의 PEG-포함 티오숙신이미딜-결합 복합체의 복합 과정을 나타낸다 (2단계 복합).
도 9는 본 발명의 PEG-포함 티오에테르-결합 (티오아세트아미딜-결합) 복합체의 복합 과정을 나타낸다 (1단계 복합).
도 10은 본 발명의 PEG-포함 티오에테르-결합 (티오아세트아미딜-결합) 복합체의 복합 과정을 나타낸다 (2단계 복합).
도 11은 본 발명의 PEG-포함 디설파이드 결합 복합체의 복합 과정을 나타낸다 (1단계 복합).
도 12는 본 발명의 PEG-포함 디설파이드 결합 복합체의 복합 과정을 나타낸다 (2단계 복합).
도 13은 본 발명의 PEG-포함, 설프히드릴-반응, 티오숙신이미딜-결합 화합물에 대한 합성 과정을 나타낸다.
도 14는 본 발명의 PEG-포함 티오숙신이미딜-결합 복합체의 합성 과정을 나타낸다 (1단계 복합).
도 15는 본 발명의 PEG-포함 티오숙신이미딜-결합 복합체의 합성 과정을 나타낸다 (2단계 복합)
도 16는 본 발명의 PEG-포함, 설프히드릴-반응, 티오아세트아미딜-결합 화합물의 합성 과정을 나타낸다; a.) 1단계 복합을 위한 PEG-포함, 설프히드릴-반응, 티오아세트아미드 결합 화합물의 합성; 및 b.) 2단계 복합을 위한 이종이관능성 PEG-포함, 설프히드릴-반응 가교 화합물의 합성.
도 17은 본 발명의 PEG-포함 티오아세트아미딜-결합 복합체에 대한 복합 과정을 나타낸다(1단계 복합).
도 18은 본 발명의 PEG-포함 티오아세트아미딜-결합 복합체에 대한 복합 과정을 나타낸다 (2단계 복합).
도 19는 본 발명의 PEG-포함, 설프히드릴-반응, 티오에테르-결합 화합물에 대한 합성 과정을 나타낸다: a.) 1단계 복합을 위한 PEG-포함, 설프히드릴-반응, 티오아세트아미딜 결합 화합물의 합성; 및 b.) 2단계 복합을 위한 동종이관능성 PEG-포함, 설프히드릴-반응 가교 화합물의 합성.
도 20은 본 발명의 PEG-포함 티오아세트아미딜-결합 복합체의 복합 과정을 나타낸다 (1단계 복합).
도 21은 본 발명의 PEG-포함 티오아세트아미딜-결합 복합체의 복합 과정을 나타낸다 (2단계 복합).
도 22는 탈글리코실화 HuAb-PEG4Mal-DMl 복합체 (10.7 DMl/Ab, 평균)의 질량 스펙트럼 (MS)을 나타낸다.
도 23은 탈글리코실화 HuAb-PEG4Mal-DMl 복합체 (10.7 DMl/Ab, 평균)의 크기 배제 크로마토그래피 (SEC)를 나타낸다.
도 24는 HuAb-PEG4Mal-DM 1 복합체 (10.7 마이탄시노이드/항체)의 FACS 결합이 개질하지 않은 항체와 유사함을 나타낸다.
도 25는 다제 내성 COLO205-MDR 세포에서 항-EpCAM 항체-마이탄시노이드 복합체의 세포독성을 나타낸다.
도 26은 다제 내성 COLO205-MDR 세포에서 항-CanAg 항체-마이탄시노이드 복합체의 세포독성을 나타낸다.
도 27은 Molp-8 다발성 골수증 세포에서 항-CD56 항체-마이탄시노이드 복합체의 세포독성을 나타낸다.
도 28은 HCTl 5 세포에서 항-EpCAM 항체-마이탄시노이드 복합체의 세포독성을 나타낸다.
도 29는 COLO 205 mdr 세포에서 항-EpCAM 항체-마이탄시노이드 복합체의 세포독성을 나타낸다.
도 30은 이종이식에서 항-EpCAM 항체- 마이탄시노이드 복합체의 생체 내 항암 활성을 나타낸다.
도 31은 COLO205 mdr 이종이식에서 항-EpCAM 항체-마이탄시노이드 복합체의 생체 내 항암 활성을 나타낸다.
도 32는 COLO 205 이종이식에서 항-EpCAM 항체-마이탄시노이드 복합체의 생체내 항암 활성을 나타낸다.
도 33은 COLO 205 mdr 이종이식에서 항-CanAg 항체-마이탄시노이드 복합체의 생체내 항암 활성을 나타낸다.
도 34는 항-CanAg 항체 (huC242)-PEG24-Mal-DMl 복합체 (17 D/A 범위까지)의 결합을 나타낸다.
도 35는 COLO 205 세포에 대한 4 내지 17 D/A를 갖는 항-CanAg 항체 (huC242)-PEG24-Mal-DMl 복합체의 시험관 내 효능을 나타낸다.
도 36은 다제 내성 (pgp+) COLO205-MDR 세포에 대한 4 내지 17 D/A를 갖는 항-CanAg 항체 (huC242)-PEG24-Mal-DMl 복합체의 시험관 내 효능을 나타낸다.
도 37은 UO-31 세포에서의 항-EGFR 항체-마이탄시노이드 복합체의 세포독성을 나타낸다.
도 38은 항체-PEG4-Mal-DM1의 혈장 약물동태를 나타낸다.
본 발명은 폴리에틸렌 글리콜 또는 폴리에틸렌 옥사이드 링커((-CH2CH2O)n)에 의해 세포독성제 등의 약물과 결합한 항체 등의 세포결합제의 복합체는 전형적인 지방족 링커를 이용하고 약물 용량이 유사한 종래의 세포결합제 약물 복합체와 비교했을 때 예상보다 표적 암 세포에 대한 세포독성이 수 배 이상 높다. 중요한 것은 본 발명에서 기술한 복합체가 다제 내성 (mdr, multidrug resistant) 암 세포에서 효능이나 효과가 높고, 세포독성 약물 치료에 대한 민감성이 낮은 점이다. 암 치료는 다른 화학 치료제를 이용하는 일련의 치료 후에 접하게 되는 약물 내성 메카니즘을 극복해야 하는 문제가 있다. 다제 내성이라는 암 세포에서 관찰되는 메카니즘은 ATP-결합 카세트 (ABC) 수송물질에 의한 약물의 방출 증가에 기인한다 (C. Drumond, B. I. Sikic, J. Clin. Oncology, 1999, 17, 1061-1070, G, Szokacs et al., Nature Reviews , 5; 219 - 234, 2006). 암 세포에 의해 약물의 유출을 방해하거나 막는 이들 약물 내성 메카니즘을 극복하는 치료는 매우 유용하다. 다제 내성 암 세포에 대한 세포결합제와 세포독성 약물의 PEG-결합 복합체의 세포독성을 평가하여, PEG-링커가 이들 내성 세포에 대한 이점을 부여할 수 있는 지를 시험한다. mdr 세포에 대한 이들 분석에서, 세포결합제와 세포독성 약물의 PEG 결합 복합체는 예기치 않게도 종래의 링커로부터 유래하는 훨씬 덜 강력한 복합체에 비해, mdr 세포의 강력한 세포 제거를 나타내었다. 또한, 본 발명의 복합체는 다제 내성 종양 세포로 확립된 동물 모델에서 현저하게 높은 항암 활성도 나타낸다.
친수성 폴리에틸렌 글리콜 또는 폴리에틸렌 옥사이드 링커 (PEG 또는 PEO; (-CH2CH2O)n)를 이용하면 치료 용도에 바람직한 1 mg/ml 보다 높은 농도에서 90%보다 높은 단백질 단량체 비율을 갖는 세포결합제 분자에 대하여 상대적으로 많은 약물의 도입이 가능하다. 게다가, 세포독성 약물 용량 범위를 포함하는 세포결합제의 폴리에틸렌 글리콜 (PEG)-결합 복합체 (세포결합제에 결합한 약물의 수는 작게는 2 내지 많게는 15)는 복합체의 증가된 약물 용량을 토대로 하는 약물 전달의 화학량론적 증가로 예측되는 것보다 더 향상된 표적 암세포에 대한 세포독성을 나타내었다. 본 발명에서는 PEG 스페이서를 포함하는 세포결합제와 약물의 복합체는 기술하였고, 이는 유사한 약물 용량에서 종래에 제조한 복합체에 비해 표적 암 세포에 대한 효능이 260-650배 향상된 세포독성의 초화학량론적 증가를 나타내었다.
따라서, 본 발명의 양태에 있어서, 폴리에틸렌 글리콜 스페이서 (-CH2CH2O)n와 세포결합제와 반응할 수 있는 반응기를 포함하는 링커를 포함하는 약물이 개시된다.
본 양태에서는 화학식 (1)의 개질 화합물 또는 화학식 (1')의 특정 화합물을 구체적으로 고려한다:
Z-Xl-(-CH2-CH2-O-)n-Yp-D (1)
D-Yp-(-CH2-CH2-O-)n-Xl-Z (1')
상기 식에서,
Z는 세포결합제와 아미드 또는 티오에테르 결합을 형성할 수 있는 반응성 관능기를 나타내고;
D는 약물을 나타내고;
X는 티오에테르 결합, 아미드 결합, 카르밤산 결합 또는 에테르 결합을 통해 세포결합제에 결합한 지방족, 방향족 또는 이종고리 단위를 나타내고;
Y는 티오에테르 결합, 아미드 결합, 카르밤산 결합, 에테르 결합, 아미드 결합, 탄소-탄소 결합 및 히드라존 결합으로 구성되는 군으로부터 선택되는 공유 결합을 통해 약물에 결합한 지방족, 방향족 또는 이종고리 단위를 나타내고;
l은 0 또는 1이고;
p는 0 또는 1이고;
n은 1 내지 2000의 정수이다.
바람직하게는, Y를 약물과 결합하는 공유 결합은 티오에테르 결합 또는 아미드 결합이다.
바람직하게는, n은 1 내지 100의 정수이다. 보다 바람직하게는, n은 1 내지 14의 정수이다. 가장 바람직한 양태에 있어, n은 1 내지 4의 정수이다.
본 발명의 제 2 양태에 있어, 세포결합제와 폴리에틸렌 글리콜 링커 (-CH2CH2O)n를 갖는 약물의 새로운 복합체가 기술된다. 이들 복합체는 종래의 링커와 동일한 약물 용량을 이용한 복합체보다 암 세포에 대한 효능이 우수하다.
바람직한 양태에서 구체적으로 고려하는 것은 세포결합제와 화학식 (2)의 약물 또는 화학식 (2')의 특정 화합물의 복합체이다:
CB-[Xl-(-CH2-CH2-O-)n-Yp-D]m (2)
[D-Yp-(-CH2-CH2-O-)n-Xl]m-CB (2')
상기 식에서,
CB는 세포결합제를 나타내고;
D는 약물을 나타내고;
X는 티오에테르 결합, 아미드 결합, 카르밤산 결합, 또는 에테르 결합을 통해 세포결합제와 결합한 지방족, 방향족 또는 이종고리 단위를 나타내고;
Y는 티오에테르 결합, 아미드 결합, 카르밤산 결합, 에테르 결합, 아미드 결합, 탄소-탄소 결합 및 히드라존 결합으로 구성되는 군으로부터 선택되는 공유 결합을 통해 약물에 결합하는 지방족, 방향족, 또는 이종고리 단위를 나타내고;
l은 0 또는 1이고;
p는 0 또는 1이고;
m은 2 내지 15의 정수이고;
n은 1 내지 2000의 정수이다.
바람직하게는, 공유 결합은 티오에테르 결합 또는 아미드 결합이다.
바람직하게는, m은 3 내지 8의 정수이다.
바람직하게는, n은 1 내지 100의 정수이다. 보다 바람직하게는, n은 1 내지 14의 정수이다. 가장 바람직한 양태에 있어, n은 1 내지 4의 정수이다.
본 발명은 디설파이드 결합에 의해 항체가 세포독성 약물에 결합되어 있는 항체 복합체의 경우에 면역복합체의 효력이나 효능을 증강하는 데 약물 결합수와 폴리에틸렌 글리콜 스페이서 길이 사이에 중요한 상관 관계가 있다는 새로운 발견을 통해 이루어졌다. 이러한 링커 설계의 부가적인 이점은 바람직하게 높은 단량체 비율과 항체-약물 복합체의 응집 최소화이다. 따라서, 일 양태에 있어, 본 발명은 디설파이드-결합 복합체에서 폴리에틸렌 글리콜 스페이서는 2 내지 8의 에틸렌옥시 단위로 구성되고 결합한 약물의 수는 3 내지 8 범위일 때, 이는 가장 우수한 생물학적 효력이나 효능을 나타내는 항체-약물 복합체를 제공하고, 바람직한 높은 단량체 함량을 제공하는 주요한 발견을 기초로 한다.
다른 바람직한 양태에 있어, 세포결합제와 반응할 수 있는 관능기를 갖는 짧은 폴리에틸렌 글리콜 스페이서 ((CH2CH2O)n=1-14)를 갖는 디설파이드기(-S-S-)를 통해 결합한 세포독성 약물이 기술된다.
본 양태에서 구체적으로 고려하는 것은 화학식 (3)의 세포독성 화합물 또는화학식 (3')의 특정 화합물이다:
Z-Xl-(-CH2-CH2O-)n-Y-D (3)
D-Y-(-CH2-CH2O-)n-Xl-Z (3')
상기 식에서,
Z는 세포결합제와 아미드 또는 티오에테르 결합을 형성할 수 있는 반응성 관능기를 나타내고;
D는 약물을 나타내고;
X는 티오에테르 결합, 아미드 결합, 카르밤산 결합, 또는 에테르 결합을 통해 세포결합제와 결합한 지방족, 방향족 또는 이종고리 단위를 나타내고;
Y는 디설파이드 결합을 통해 약물과 결합한 지방족, 비방향족 이종고리 또는 방향족 이종고리 단위를 나타내고;
1은 0 또는 1이고;
n은 1 내지 14의 정수이다.
바람직하게는, n은 2 내지 8의 정수이다.
다른 바람직한 양태에 있어, 암 세포에 대한 생물학적 활성이 더 강력하고, 높은 복합 수율과 높은 단량체 비율과 단백질 응집의 최소화의 바람직한 생화학적 활성을 갖는, 3 내지 8의 좁은 약물 용량 범위를 갖는 폴리에틸렌 글리콜 스페이서 ((CH2CH2O)n=1-14)를 포함하는 디설파이드기 (-S-S-)를 통해 결합한 세포결합제와 약물의 복합체가 기술된다.
본 양태에서는 화학식 (4)의 또는 화학식 (4')의 특정 화합물의 세포결합제 약물 복합체를 구체적으로 고려한다:
CB-(Xl-(-CH2-CH2O-)n-Y-D)m (4)
[D-Y-(-CH2-CH2O-)n-Xl]m-CB (4')
상기 식에서,
CB는 세포결합제를 나타내고;
D는 약물을 나타내고;
X는 티오에테르 결합, 아미드 결합, 카르밤산 결합, 또는 에테르 결합을 통해 세포결합제에 결합한 지방족, 방향족 또는 이종고리 단위를 나타내고;
Y는 디설파이드 결합을 통해 약물에 결합한 지방족, 방향족 또는 이종고리 단위를 나타내고;
1은 0 또는 1이고;
m은 3 내지 8의 정수이고;
n은 1 내지 14의 정수이다.
바람직하게는, m은 3 내지 6의 정수이다.
또한, 바람직하게는, n은 2 내지 8의 정수이다.
본 발명에서, 약물은 항체 등 세포결합제와 복합되어, 단백질 응집이나 침전에 의해 수율 저하를 초래하는 친유성 분자이다. 세포결합제당 결합하는 약물의 수가 증가하면 전형적으로 단백질 응집과 침전, 이에 따른 낮은 단량체 비율과 저 수율을 낮출 수 있다. 종래의 링커를 이용한 전형적인 복합체 거동과는 대조적으로, PEG 링커는 치료 목적에 유용한 고농도 (1 mg/ml 이상)의 약물과 세포결합제의 복합체의 단량체 백분율 (>90% 단량체)와 수율 (>70%)의 바람직한 증가를 초래한다. 또한, 이들 복합체는 4℃에서 장기간 저장시에도 안정하다.
모든 양태에서, "지방족 단위(aliphatic unit)"는 알킬기, 알케닐기 또는 알키닐기로 정의된다. 알킬기는 바람직하게는 사슬 내 탄소 원자수가 1 내지 20인 직쇄형 또는 분지형 또는 환형 지방족 탄화수소기이고, 바람직하게는 탄소 원자수가 3 내지 10인 직쇄형 또는 분지형 또는 환형 지방족 탄화수소기이다. 사슬 내 탄소 원자수가 1 내지 12인 알킬기가 가장 바람직하다. "분지형(Branched)"은 하나 이상의 메틸, 에틸 또는 프로필 등 저급 알킬기가 선형 알킬 사슬과 결합한 것을 의미한다. 대표적인 알킬기로는 메틸, 에틸, n-프로필, i-프로필, n-부틸, t-부틸, n-펜틸, 3-펜틸, 옥틸, 노닐, 데실, 사이클로펜틸 및 사이클로헥실을 들 수 있다.
알케닐기는 탄소-탄소 이중 결합을 포함하는 바람직하게는 사슬 내 탄소 원자수가 2 내지 15인 직쇄형 또는 분지형 지방족 탄화수소기이고, 사슬 내 탄소 원자수가 약 2 내지 4인 직쇄형 또는 분지형 지방족 탄화수소기가 보다 바람직하다. 대표적인 알케닐기로는 에테닐, 프로페닐, n-부테닐, i-부테닐, 3-메틸부트-2-에닐, n-펜테닐, 헵테닐, 옥테닐, 노네닐, 데세닐을 들 수 있다.
알키닐기는 탄소-탄소 삼중 결합을 포함하는 사슬 내 탄소 원자수가 2 내지 15인 직쇄형 또는 분지형 지방족 탄화수소기가 바람직하고, 사슬 내 탄소 원자수가 2 내지 12인 직쇄형 또는 분지형 지방족 탄화수소기가 보다 바람직하다. 사슬 내 탄소 원자수가 2 내지 4인 직쇄형 또는 분지형 지방족 탄화수소기가 보다 바람직하다. 대표적인 알키닐기로는 에티닐, 프로피닐, n-부티닐, 2-부티닐, 3-메틸부티닐, n-펜티닐, 헵티닐, 옥티닐 및 데키닐을 들 수 있다.
여기서 사용한 "방향족 단위(aromatic unit)"라는 용어는 탄소 원자수가 6 내지 14인, 바람직하게는 탄소 원자수가 6 내지 10인, 방향족 단일환 또는 다중환 탄화수소 고리계로 구성되는 치환되거나 치환되지 않은 아릴이다. 대표적인 아릴기는 페닐과 나프틸이다. 치환기는 알킬기, 할로겐, 니트로, 아미노, 히드록시 및 알콕시기를 포함하지만, 이에 제한되는 것은 아니다.
할로겐은 불소, 염소, 브롬 및 요오드 원자를 포함한다. 불소 및 염소 원자가 바람직하다.
여기서 사용한 "이종고리 단위(heterocyclic unit)"라는 용어는 포화, 부분적으로 치환되지 않거나 치환되지 않은, 비방향족 안정형 3각형 내지 14각형, 바람직하게는 5각형 내지 10각형 고리의 적어도 하나의 부분이 헤테로 원자, 또는 방향족인, 단일, 이중 또는 다중환 고리, 바람직하게는 적어도 하나의 헤테로 원자를 포함하는 5각형 내지 10각형 단일, 이중 또는 다중환 고리를 말한다. 전형적으로, 헤테로 원자는 산소, 질소, 황, 셀레늄 및 인 원자를 포함하지만 이에 제한되는 것은 아니다. 바람직한 헤테로 원자는 산소, 질소 및 황이다.
바람직한 이종고리 단위는 피롤리디닐, 피라졸리디닐, 이미다졸리디닐, 옥시라닐, 테트라하이드로퓨라닐, 디옥소라닐, 테트라하이드로-피라닐, 디옥사닐, 피페리딜, 피페라지닐, 모르포리닐, 피라닐, 이미다졸리닐, 피롤리닐, 피라졸리닐, 티아졸리디닐, 테트라하이드로티오피라닐, 디티아닐, 티오모르포리닐, 디하이드로-피라닐, 테트라하이드로피라닐, 디하이드로피라닐, 테트라하이드로-피리딜, 디하이드로피리딜, 테트라하이드로피리니디닐, 디하이드로티오피라닐, 아제파닐, 피롤릴, 피리딜, 피라졸릴, 티에닐, 피리미디닐, 피라지닐, 테트라졸릴, 인돌릴, 퀴놀리닐, 푸리닐, 이미다졸릴, 티에닐, 티아졸릴, 벤조티아졸릴, 후라닐, 벤조후라닐, 1 ,2,4-티아디아졸릴, 이소티아졸릴, 트리아조일, 테트라졸릴, 이소퀴놀릴, 벤조티에닐, 이소벤조푸릴, 피라졸릴, 카바졸릴, 벤즈이미다졸릴, 및 이소옥사졸릴, 피리딜-N-옥사이드, 및 페닐기와 축합하여 얻은 융합계를 포함하지만, 이에 제한되는 것은 아니다.
X와 Y로 나타내는 지방족, 방향족 및 이종고리 단위는 전하를 갖는 치환체를 포함할 수도 있다. 전하를 갖는 치환체는 카르복시산염, 술폰산염 및 인산염으로부터 선택되는 음전하 형태이거나, 3차 또는 4차 아미노기로부터 선택되는 양전하 형태일 수도 있으나, 이제 제한되는 것은 아니다.
여기서 사용한 "세포결합제와 결합(linked to a cell-binding agent)"이라는 표현은 적합한 연결기 또는 그것의 전구체를 통해 세포결합제에 결합한 적어도 하나의 약물 유도체를 포함하는 복합체 분자를 말한다. 바람직한 연결기는 티올 또는 디설파이드 결합 또는 이들의 전구체이다.
여기서 사용한 주어진 기의 "전구체(precursor)"는 탈보호, 화학적 개질 또는 커플링 반응에 의해 그 기를 초래하는 임의의 기를 말한다. 예를 들면, 전구체는 티올 전구체로서 티오에스테르 또는 티오에테르로 예시되는 적절하게 보호된 관능기일 수 있다.
여기서 사용한 "반응성 관능기(reactive functionality)"라는 용어는 아민-, 티올- 또는 히드록시기-반응성 관능기를 말한다. 달리 말하면, 반응 관능기는 세포결합제에 존재하는 아민, 설프히드릴 (티올) 또는 히드록시기와 반응할 수 있다. 예를 들면, 아민-반응성 관능기에 있어, 관능기는 아미드 결합을 부여하는 반응성 카르복시 에스테르 (N-숙신이미딜, N-설포숙신이미딜, N-나프탈이미딜, N-설포프탈이미딜, 2-니트로페닐, 4-니트로페닐, 2,4-디니트로페닐, 3-설포-4-니트로페닐, 3-카르복시-4-니트로페닐, 테트라플루오로페닐 에스테르를 포함), 반응성 설폰산 유도체, 또는 반응성 티오에스테르일 수 있고; 티올-반응성 관능기에 있어, 관능기는 티오에테르 결합을 부여하는 말레이미드, 할로아세트아미드, 또는 비닐 설폰일 수 있고; 히드록시기-반응 관능기에 있어, 관능기는 에스테르 결합을 부여하는 카르복시 에스테르일 수 있다.
A. 친수성 링커를 갖는 개질 약물 및 개질 세포 결합제
링커는 안정한 공유 방식으로 세포결합제에 마이탄시노이드 등 약물을 결합할 수 있는 화학적 부분이다. 링커는 약물이나 세포결합제가 활성을 유지하는 조건하에 산 유도 분해, 광 유도 분해, 펩티다아제 유도 분해, 에스테르아제-유도 분해, 및 이황화 결합 분해에 취약하거나 실질적으로 내성이 있을 수 있다. 도 1, 2 및 3은 본 발명의 복합체의 구조를 예시적으로 도시한다.
약물과 세포결합제 간 링커를 형성하는 친수성 PEG 사슬을 포함하는 적합한 가교 시약은 본 기술 분야에 공지되어 있거나 시판되고 있다 (예를 들면, Quanta Biodesign, Powell, Ohio사). 적합한 PEG-포함 가교제는 본 기술분야의 당업자에게 공지되어 있는 표준 합성 화학 기법을 이용하여 시판되는 PEG 자체로부터 합성될 수도 있다. 약물은 여기에서 기술한 방법으로 이관능성 PEG-포함 가교제와 반응시켜 화학식 (1)의 화합물, Z-X1-(-CH2-CH2-O-)n-Yp-D를 얻을 수 있다. 예를 들면, 티올-포함 마이탄시노이드 약물을 PEG 스페이서를 갖는 비스-말레이미도 가교제와 반응시켜 티오에테르 결합을 통해 PEG 스페이서와 결합한 마이탄시노이드 약물을 얻을 수 있다 (예를 들면 도 13 참조). 이러한 PEG 스페이서와 말단 말레이미도기를 갖는 마이탄시노이드는 개질되고, 도 14에 예시한 바와 같이, 세포결합제와 반응하여 본 발명의 화학식 (2)의 세포 결합제-약물 복합체를 얻는다.
다른 방법으로는, 우선 세포결합제를 N-히드록시숙신이미드 에스테르 등 아민 반응기를 갖는 이관능성 PEG-포함 가교제의 말단과 반응시켜 아미드 결합을 통해 링커와 공유 결합한 개질 세포 결합제를 얻는다 (예를 들면, 도 15 참조). 다음 단계에서, 마이탄시노이드를 PEG 스페이서의 다른 말단에 있는 말레이미도 치환체와 반응시켜 본 발명의 세포결합제-약물 복합체를 얻는다.
도 16 및 17은 PEG 가교제의 합성과 티오아세트아미도 결합에 의한 이것의 마이탄시노이드와의 반응을 예시하여 나타낸다. 그 후, 말레이미도 치환체는 PEG에 도입되어 티오에테르 결합을 통해 세포결합제와 반응할 수 있다. 다른 방법으로는, 예를 들면, 도 18에 나타낸 바와 같이, 세포 결합제는 우선 티오에테르 결합을 통해 PEG 가교제와 결합한다. 그 후, 개질된 세포결합제를 마이탄시노이드 약물과 반응시켜 복합체를 얻는다. PEG 스페이서의 양단은 티오에테르 결합을 통해 세포독성 약물과 세포결합제의 결합을 가능하게 하는 아이오도아세트아미드 부분을 포함하여 친수성 PEG 스페이서를 포함하는 복합체를 얻는 동종이관능성 PEG 가교제의 합성을 도 19에 예시한다. 본 발명의 복합체를 얻기 위한 복합 과정은 도 20 및 21에 예시한다.
본 기술 분야의 당업자는 여기에 기술한 방법으로 다양한 반응기를 갖는 다른 PEG-포함 가교제를 용이하게 합성할 수 있음을 알게 될 것이다. 예를 들면, 19-디메틸마이탄시노이드 등 히드록시기를 갖는 약물 (미국 특허 제 4,361,650호)을 탄산 칼륨 등 염기 존재 하에 아이오도-아세틸-PEG 링커 (도 5)와 반응시켜 에테르 결합으로 마이탄시노이드를 결합할 수 있다. 마찬가지로, 아민-포함 마이탄시노이드(미국 특허 제 7,301,019에 기술된 바와 같이 합성)를 피리딘 또는 트리에틸아민 등 염기 존재하에 아이오도아세틸 PEG (도 5에 도시)과 반응시켜 아민 결합을 통해 PEG와 결합한 마이탄시노이드를 얻는다. 아미드 결합에 의한 PEG와 약물의 결합에서, 카르복시-PEG (도 5에 도시)를 디사이클로헥실카르보디이미드 등 축합제 존재하에 아민-포함 마이탄시노이드와 반응시켜 아미드 결합 PEG-마이탄시노이드를 얻는다. 카르밤산 결합에 의해 약물과 PEG 스페이서를 결합시키기 위해서는, 우선, PEG를 디포스겐과 반응시켜 PEG 클로로포름산을 얻은 후, 트리에틸아민 등 염기 존재하에 아민-포함 마이탄시노이드와 반응시켜 카르밤산 결합 PEG-마이탄시노이드를 얻는다.
적합한 링커의 예로는 세포결합제와 결합하는 N-숙신이미딜 에스테르 또는 N-설포숙신이미딜 에스테르 부분을 갖는 링커뿐만 아니라, 약물과 반응하는 말레이미도계 또는 할로아세틸계 부분을 포함한다. PEG 스페이서는 여기에서 기술한 방법으로 본 기술 분야에 공지된 임의의 가교제에 도입될 수 있다. PEG 스페이서와 도입될 수 있는 말레이미도계 부분을 포함하는 가교 시약의 예로는 N-숙신이미딜 4-(말레이미도메틸)사이클로헥산카르복시레이트 (SMCC), SMCC (LC-SMCC)의 "장쇄" 유사체인 N-숙신이미딜-4-(N-말레이미도메틸)-사이클로헥산-l-카르복시-(6-아미도카프로에이트), Κ-말레이미도운데칸산 N-숙신이미딜 에스테르 (KMUA), γ-말레이미도부틸산 N-숙신이미딜 에스테르 (GMBS), ε-말레이미도카프로산 N-히드록시숙신이미드 에스테르 (EMCS), m-말레이미도벤조일-N-히드록시숙신이미드 에스테르 (MBS), N-(α-말레이미도아세톡시)-숙신이미드 에스테르 (AMAS), 숙신이미딜-6-(β-말레이미도프로피온아미드)헥사노에이트 (SMPH), N-숙신이미딜 4-(p-말레이미도페닐)-부티레이트 (SMPB), 및 N-(p-말레이미도페닐)이소시아네이트 (PMPI)를 들 수 있으나, 이에 제한되는 것은 아니다. 할로아세틸계 부분을 포함하는 가교 시약으로는 N-숙신이미딜-4-(아이오도아세틸)-아미노벤조에이트 (SIAB), N-숙신이미딜 아이오도아세테이트 (SIA), N-숙신이미딜 브로모아세테이트 (SBA), 및 N-숙신이미딜 3-(브로모아세트아미도)프로피오네이트 (SBAP)를 들 수 있다.
본 발명에서는 황 원자를 포함하지 않는 다른 가교 시약도 이용될 수 있다. 이러한 링커는 디카르복시산계 부분에서 유래할 수 있다. 예를 들면, 적합한 디카르복시산계 부분은 하기 일반식의 α,ω-디카르복시산을 포함하지만, 이에 제한되는 것은 아니다.
HOOC
-
A'
p
-
E'
q
(
CH
2
CH
2
O
)
n
G'r-
COOH
상기 식에서, A'는 선택적으로 탄소 원자수가 2 내지 20인 선형 또는 분지형 알킬기, 알케닐기 또는 알키닐기이고, E'는 선택적으로 탄소 원자수가 3 내지 10인 사이클로알킬기 또는 사이클로알케닐기이고, G'는 탄소 원자수가 6 내지 10인 선택적으로 치환되거나 치환되지 않은 방향족기이거나, 헤테로 원자가 N, O 또는 S인 치환되거나 치환되지 않은 이종고리기이고, p, q 및 r은 각각 0 또는 1이고 (단, p, q 및 r은 동시에 모두 0은 아니다), n은 1 내지 2000의 정수이다.
여기서 기술한 다수의 링커는 미국 특허 공개 제 20050169933호에 상세하게 기술되어 있다.
본 발명의 다른 양태에 있어, 세포결합제를 이관능성 가교 시약과 반응시켜 개질함으로써 세포결합제를 링커 분자의 공유 결합한다. 여기서 사용한 "이관능성 가교 시약(bifunctional crosslinking reagent)"은 여기서 기술한 약물 등 약물에 세포결합제를 공유 결합하는 화학 부분(moiety)을 말한다. 본 발명의 바람직한 양태에 있어, 연결 부분의 일부는 약물에 의해 부여된다. 이와 관련하여, 약물은 세포결합제의 약물과의 결합에 이용되는 거대한 링커 분자의 일부인 연결 부분을 포함한다. 예를 들면, 마이탄시노이드 DM1를 형성하기 위해, 마이탄신의 C-3 히드록시기의 측쇄를 자유 설프히드릴기 (SH)를 갖도록 개질한다. 이러한 티올화 형태의 메이탄신은 개질된 세포결합제와 반응하여 복합체를 형성한다. 따라서, 최종 링커는 두 성분, 이를 테면, 가교 시약에 의해 얻은 성분과 DM1으로부터 측쇄에 의해 얻은 성분과 유사하다.
본 발명의 다른 양태에 있어서, 약물은 이황화 결합을 통해 세포결합제와 결합된다. 링커 분자는 세포결합제와 반응할 수 있는 반응성 화학기를 포함한다. 세포결합제와 반응하는 바람직한 반응성 화학기는 N-숙신이미딜 에스테르와 N-설포숙신이미딜 에스테르이다. 또한, 링커 분자는 반응성 화학기, 바람직하게는 약물과 반응하여 디설파이드 결합을 형성할 수 있는 디티오피리딘기를 포함한다. 특히 바람직한 링커 분자의 예로는, N-숙신이미딜 3-(2-피리딜디티오)프로피오네이트 (SPDP) (Carlsson et al., Biochem . J, 173: 723-737 (1978) 등 참조), N-숙신이미딜 4-(2-피리딜디티오)부타노에이트 (SPDB) (미국 특허 제 4,563,304호 등 참조), N-숙신이미딜 4-(2-피리딜디티오)펜타노에이트 (SPP) (CAS 등록 번호 341498-08-6), 미국 특허 제 6,913,748호에 기술된 다른 반응성 가교제를 들 수 있으며, 이들은 그 전문이 참조 문헌으로 본문에 편입된다.
이와는 달리, 미국 특허 제 6,441,163 B1에 기술된 바와 같이, 약물은 우선 세포결합제와 반응하기에 적합한 반응성 에스테르를 도입하도록 개질된다.
활성화 링커 부분을 포함하는 이들 약물과 세포결합제의 반응은 또 다른 세포결합제 약물 복합체의 제조 방법을 제공한다. siRNA 결합에 있어, siRNA는 올리고뉴클레오티드의 개질에 일반적으로 이용되는 방법에 의해 본 발명의 가교제와 결합할 수 있다(예를 들면, 미국 특허 공개 20050107325 및 20070213292 참조). 따라서, 3' 또는 5'-포스포로이미다이트 형태의 siRNA는 히드록시기를 갖는 가교제의 일 말단과 반응하여 siRNA와 가교제 간의 에스테르 결합을 부여한다. 마찬가지로, siRNA 포스포라이미다이트와 말단 아미노기를 갖는 가교제와의 반응은 아민을 통한 가교제와 siRNA의 결합을 초래한다.
B.
세포결합제
본 발명에서 이용되는 세포결합제는 암 세포에서 표적 항원과 특이적 결합을 하는 단백질(예를 들면, 면역글로불린 및 비면역글로불린 단백질)이다. 이들 세포결합제는,
-재 표면처리된 항체 (미국 특허 제 5,639,641호)와;
-인간화되거나 완전 인간 항체와 (인간화되거나 완전 인간 항체는 huMy9-6, huB4, huC242, huN901, DS6, CD38, IGF-IR, CNTO 95, B-B4, 트라스투주맙(trastuzumab), 비바투주맙(bivatuzumab), 시브로투주맙(sibrotuzumab), 퍼투주맙 (pertuzumab) 및 리투시맙(rituximab) (예컨대, 미국 특허 제 5,639,641, 5,665,357, 및 7,342,110; 미국 특허 가출원 제 60/424,332호, 국제 특허 출원 WO 02/16,401, 미국 특허 공개 번호 제 20060045877호, 미국 특허 공개 번호 20060127407, 미국 특허 공개 제 20050118183호, Pedersen et al ., (1994) J Mol . Biol. 235, 959-973, Roguska et al ., (1994) Proceedings of the National Academy of Sciences, Vol 91, 969-973, Colomer et al., Cancer Invest ., 19: 49-56 (2001), Heider et al., Eur . J. Cancer , 31A: 2385-2391 (1995), Welt et al., J Clin . Oncol , 12: 1193-1203 (1994), 및 Maloney et al., Blood, 90: 2188-2195 (1997).)로부터 선택되지만, 이에 제한되는 것은 아니다)와;
- sFv, Fab, Fab', 및 F(ab')2 등 항체의 에피토프 결합 부분(Parham, J. Immunol. 131 :2895-2902 (1983); Spring et al, J. Immunol . 113:470-478 (1974); Nisonoff et al, Arch . Biochem . Biophys . 89:230-244 (I960))을 포함하는 항체를 포함한다.
추가의 세포결합제의 예로는 하기와 같이 예시되는 다른 세포 결합 단백질과 폴리펩티드를 들 수 있으나, 이에 제한되는 것은 아니다:
-안키린 반복 단백질 (DARPins; Zahnd et al., J. Biol . Chem ., 281, 46, 35167-35175, (2006); Binz, H.K., Amstutz, P. & Pluckthun, A. (2005) Nature Biotechnology, 23, 1257-1268) 또는 예를 들면, 미국 특허 공개 제 20070238667호; 미국 특허 제 7,101,675호; WO/2007/147213; 및 WO/2007/062466에 기술된 안키린-유사 반복 단백질 또는 합성 펩티드);
-인터페론 (α, β, γ 등);
-IL-2, IL-3, IL-4, IL-6 등 림포카인;
-인슐린 등 호르몬, TRH (갑상선 자극 호르몬 방출 호르몬), MSH (멜라닌 세포 자극 호르몬), 안드로겐 및 에스트로겐 등 스테로이드 호르몬; 및
- EGF, TGF-α, IGF-l, G-CSF, M-CSF 및 GM-CSF (Burgess, Immunology Today 5:155-158 (1984)) 등 성장 인자 및 콜로니 자극 인자.
세포결합제가 항체인 경우에는, 세포결합제는 폴리펩티드인 항원과 결합하거나 막 횡단 분자 (수용체 등) 또는 성장 인자 등 리간드일 수 있다. 대표적인 항원은 레닌 등 분자; 인간 성장 호르몬과 소 성장 호르몬을 포함하는 성장 호르몬; 성장 호르몬 방출 인자; 부갑상선 호르몬; 갑상선 자극 호르몬; 리포단백질; 알파-1-안티트립신; 인슐린 A 사슬; 인슐린 B 사슬; 프로인슐린; 여포 자극 호르몬; 칼시토닌; 황체 형성 호르몬; 글루카곤; vmc 인자, IX 인자, 조직 인자 (TF), 및 빌러블란트씨 인자 등 응혈 인자; 단백질 C 등 항응혈 인자; 심방나트륨이뇨성인자; 폐 계면활성제; 우로키나아제 또는 인간 소변형 또는 조직형 플라스미노겐 활성화인자 (t-PA) 등 플라스미노겐 활성화인자; 봄베신; 트롬빈; 조혈제 성장 인자; 알파 및 베타 종양 괴사 인자; 엔케팔리나제; RANTES (정상 T-세포 발현 및 분비의 활성화 조절); 인간 대식세포 염증 단백질(MIP-1-알파); 인간 혈청 알부민 등 혈청 알부민; 뮐러관 저해 물질; 릴랙신 A 사슬; 릴랙신 B 사슬; 프로릴랙신; 쥐 성선 자극 호르몬 관련 펩티드; 베타-락타마아제 등 미생물 단백질; DNase; IgE; CTL A-4 등 세포독성 T-임파구 관련 항원 (CTLA); 인히빈; 악티빈; 혈관 내피 성장 인자 (VEGF); 호르몬 또는 성장 인자 수용체; 단백질 A 또는 D; 류머티즘 인자; 신골-유래 신경성장 인자 등 신경성장 인자 (BDNF), 신경성장인자 -3, -4, -5, 또는 -6 (NT-3, NT4, NT-5, 또는 NT-6), 또는 NGF-β 등 신경 성장 인자; 혈소판-유래 성장 인자 (PDGF); aFGF 및 bFGF 등 섬유아세포 성장 인자; 표피 성장 인자 (EGF); TGF-βl, TGF-β2, TGF-β3, TGF-β4, 또는 TGF-β5를 포함하는 TGF-알파 및 TGF-베타 등 형질전환 성장 인자 (TGF); 인슐린-유사 성장 인자-I 및 -II (IGF-I 및 IGF-II); des(l-3)-IGF-I (뇌 IGF-I), 인슐린-유사 성장 인자 결합 단백질, EpCAM, GD3, FLT3, PSMA, PSCA, MUCl, MUC16, STEAP, CEA, TENB2, EphA 수용체, EphB 수용체, 엽산 수용체, FOLRl, 메소텔린, 크립토, 알파v베타6, 인터그린, VEGF, VEGFR, 트렌스페린 수용체, IRTAl, IRTA2, IRTA3, IRTA4, IRTA5; CD2, CD3, CD4, CD5, CD6, CD8, CDl1, CD14, CD19, CD20, CD21, CD22, CD23, CD25, CD26, CD28, CD30, CD33, CD36, CD37, CD38, CD40, CD44, CD52, CD55, CD56, CD59, CD70, CD79, CD80, CD81, CD103, CD105, CD134, CD137, CD138, CD152 등 CD 단백질; 에리트로포에틴; 골 유도 인자; 항체독소; 뼈 형성 단백질 (BMP); 알파, 베타, 및 감마 인터페론 등 인터페론; M-CSF, GM-CSF, 및 G-CSF 등 콜로니 자극 인자 (CSFs); IL-I 내지 IL-IO 등 인터루킨 (ILs); 과산소디스뮤타아제; T-세포 수용체; 표면 막 단백질; 붕괴 촉진 인자; HIV 봉투 일부 등 바이러스 항원; 수송 단백질; 귀환(homing) 수용체; 아드레신; 조절 단백질; CD11a, CD11b, CD11c, CD18, ICAM, VLA-4 및 VCAM 등 인터그린; HER2, HER3 또는 HER4 수용체 등 종양 관련 항원; 및 앞서 나열한 폴리펩티드의 단편, 항체 모사 아드넥틴스 (Adnectins) (미국 출원 제 20070082365호), 또는 참조 문헌으로 본문에 그 전문이 혼입되는 미국 공개 제 20080171040호 또는 미국 공개 제 20080305044호에 기술되어 있는 하나 이상의 종양 관련 항원 또는 세포면 수용체와 결합하는 항체를 들 수 있다.
또한, 골수 세포와 결합하는 GM-CSF는 급성 골수성 백혈병에서 병든 세포까지 세포 결합제로 이용될 수 있다. 활성화된 T-세포와 결합하는 IL-2는 조직 이식 거부의 예방, 이식편대 숙주 질병의 치료와 예방, 및 급성 T세포 백혈병 치료에 이용될 수 있다. 멜라닌 세포와 결합하는 MSH는 흑색종 치료에 이용될 수 있다. 엽산은 난소 및 다른 종양에 발현되는 엽산 수용체를 표적으로 하는 데 이용될 수 있다. 표피 성장 인자는 페, 머리 및 목 등 편평암을 표적으로 하는 데 이용될 수 있다. 소마토스타틴은 표적 신경아세포종과 다른 종양 형태를 표적으로 하는 데 이용될 수 있다.
유방암과 고환암은 세포결합제로서 각각 에스트로겐 (또는 에스트로겐 유사체) 또는 안드로겐 (또는 안드로겐 유사체)과 성공적으로 표적화될 수 있다.
본 발명에 포함되는 항체에 대한 바람직한 항원은 CD2, CD3, CD4, CD5, CD6, CD8, CDl1, CD14, CD18, CD19, CD20, CD21, CD22, CD25, CD26, CD28, CD30, CD33, CD36, CD37, CD38, CD40, CD44, CD52, CD55, CD56, CD70, CD79, CD80, CD81, CD103, CD105, CD134, CD137, CD138, 및 CD152 등 CD 단백질; EGF 수용체 등 ErbB 수용체류, HER2, HER3 또는 HER4 수용체; LFA-1, Macl, p150.95, VLA-4, ICAM-1, VCAM, EpCAM, 알파4/베타7 인터그린 및 이들의 알파 또는 베타 서브유닛을 포함하는 알파v/베타3 인터그린 등 세포 흡착 분자(항-CD11a, 항-CD18 또는 항-CD11b 항체 등); VEGF 등 성장 인자; 조직 인자 (TF); TGF-β; 알파 인터페론 (알파-IFN); IL-8 등 인터루킨; IgE; 혈액군 항원 Apo2, 사멸 수용체; flk2/flt3 수용체; 비만 (OB) 수용체; mpl 수용체; CTLA-4; 단백질 C 등을 포함한다. 여기서 가장 바람직한 표적은 IGF-IR, CanAg, EphA2, MUCl, MUC16, VEGF, TF, CD19, CD20, CD22, CD33, CD37, CD38, CD40, CD44, CD56, CD 138, CA6, Her2/neu, EpCAM, 크립토 (다수의 인간 유방암 세포에서 고농도로 생성되는 단백질), 다핀, 알파v/베타3 인터그린, 알파v/베타5 인터그린, 알파v/베타6 인터그린, TGF-β, CDl1a, CDl8, Apo2 및 C242, 또는 참조 문헌으로서 본문에 편입되는 미국 공개 번호 제 20080171040호 또는 미국 공개 번호 제 20080305044호에 기술된 하나 이상의 종양 관련 항원이나 세포면 수용체와 결합하는 항체를 포함한다.
또한, 본 발명에 포함되는 항체에 대한 바람직한 항원은 CD3, CD4, CD8, CD19, CD20, CD34, CD37, CD38, CD46, CD56 및 CD 138 등 CD 단백질; EGF 수용체 등 ErbB 수용체류, HER2, HER3 또는 HER4 수용체; LFA-1, Macl, p150.95, VLA-4, ICAM-1, VCAM, EpCAM, 알파4/베타7 인터그린, 및 이들의 알파 또는 베타 서브 유닛을 포함하는 알파v/베타3 인터그린 (항-CD11a, 항-CD18 또는 항-CD11b 항체) 등 세포 흡착 분자; VEGF 등 성장 인자; 조직 인자 (TF); TGF-β; 알파 인터페론 (알파-IFN); IL-8 등 인터루킨; IgE; 혈액군 항원 Apo2, 사멸 수용체; flk2/flt3 수용체; 비만 (OB) 수용체; mpl 수용체; CTLA-4; 단백질 C 등을 포함한다. 여기서 가장 바람직한 표적은 IGF-IR, CanAg, EGF-R, EphA2, MUCl, MUC16, VEGF, TF, CD19, CD20, CD22, CD33, CD37, CD38, CD40, CD44, CD56, CD138, CA6, Her2/neu, 크립토 (많은인간 유방암 세포에서 고농도로 생성되는 단백질), 알파v/베타3 인터그린, 알파v/베타5 인터그린, TGF-β, CDl1a, CD18, Apo2, EpCAM 및 C242이다.
단일클론 항체 기법으로 단일클론 항체 형태로 특정 세포결합제의 생성이 가능하다. 본 기술 분야에 특히 잘 알려져 있는 것은 본래의 표적 세포, 표적 세포에서 분리된 항원, 모든 바이러스, 약화된 모든 바이러스 및 바이러스 피복 단백질 등 바이러스성 단백질 등 이로운 항원으로 마우스, 랫, 햄스터 또는 임의의 다른 포유류에 면역력을 부여하여 생성된 단일클론 항체를 형성하는 기법이다. 민감화인간 세포를 이용할 수도 있다. 다른 단일클론 항체 형성 방법은 sFv (단일쇄 변이분절)의 파지 도서관, 특히, 인간 sFv {예컨대, Griffiths 등, 미국 특허 제 5,885,793; McCafferty 등, WO 92/01047; Liming 등, WO 99/06587 참조)을 이용하는 것이다.
적합한 세포결합제의 선택은 표적이 되는 특정 세포 군집에 따라 선택할 문제지만, 적절한 것이 이용될 수 있다면, 일반적인 단일클론 항체 및 이들의 에피토프 결합 단편이 바람직하다.
예를 들면, 단일클론 항체 My9는 급성 골수성 백혈병 (AML) 세포 (Roy et al. Blood 77:2404-2412 (1991))에서 발견되는 CD33 항원에 특이적이고 AML 환자의 치료에 이용될 수 있는 쥐의 IgG2a 항체이다. 마찬가지로, 단일클론 항체 항-B4는 B 세포 (Nadler et al, J. Immunol . 131 :244-250 (1983))의 CD 19 항원과 결합하고, 비호지킨 림프종이나 만성 림프아구성 표적 세포가 백혈병 등에서 이 항원을 발현하는 B 세포 또는 병든 세포인 경우 이용될 수 있는 쥐의 IgG1이다. 항체 N901는 소 세포 폐 암종 세포와 다른 신경내분비에서 기원하는 종양 세포에서 발견되는 CD56과 결합하는 (Roy et al. J. Nat . Cancer Inst . 88:1136-1145 (1996))쥐의 단일클론 IgG1 항체이다; huC242는 CanAg 항원과 결합하는 항체이고; 트라스투주맙(Trastuzumab)은 HER2/neu와 결합하는 항체이고; 항-EGF 수용체 항체는 EGF 수용체과 결합한다.
C. 약물
본 발명에 이용되는 약물은 세포결합제와 결합할 수 있는 세포독성 약물이다. 적합한 약물의 예로는 마이탄시노이드, CC-1065과 그것의 유사체, 칼리체아마이신, 독소루비신 및 그것의 유사체, 빈카 알칼로이드, 크립토피신, 돌라스타틴, 아루리스타틴 및 이들의 유사체, 튜불리신, 에포틸론, 탁소이드 및 siRNA 등 DNA-결합 약물을 포함한다.
바람직한 마이탄시노이드는 미국 특허 제 5,208,020; 5,416,064; 6,333.410; 6,441,163; 6,716,821; RE39.151 및 7,276,497에 기술된 바와 같다. 바람직한 CC-1065 유사체는 미국 특허 제 5,475,092; 5,595,499; 5,846,545; 6,534,660; 6,586,618; 6,756,397 및 7,049,316에 기술된 바와 같다. 바람직한 독소루비신과 이들의 유사체는 미국 특허 제 6,630,579호에 기술된 바와 같다. 바람직한 탁소이드는 미국 특허 제 6,340,701; 6,372,738; 6.436,931; 6,596,757; 6,706,708; 7,008,942; 7,217,819 및 7,276,499에 기술된 바와 같다. 칼리케아마이신은 미국 특허 제 5,714,586호와 제 5,739,116호에 기술된 바와 같다.
빈카 알칼로이드 화합물, 돌라스타틴 화합물, 및 크립토피신 화합물은 WO O1/24763에 상세히 기술되어 있다. 아루리스타틴은 아루리스타틴 E, 아루리스타틴 EB (AEB), 아루리스타틴 EFP (AEFP), 모노메틸 아루리스타틴 E (MMAE)을 포함하고 이는 미국 특허 제 5,635,483, Int . J. Oncol . 15:367-72 (1999); Molecular Cancer Therapeutics, vol. 3, No. 8, pp. 921-932 (2004); 미국 출원 번호 제 11/134826. 미국 특허 공개 번호 제 20060074008호, 2006022925호에 기술되어 있다. 튜불리신 화합물은 미국 특허 공개 번호 제 20050249740호에 기술되어 있다. 크립토피신 화합물은 미국 특허 제 6,680,311 및 제 6,747,021호에 기술되어 있다. 에포틸론은 미국 특허 제 6,956,036호 및 제 6,989,450호에 기술되어 있다.
siRNA은 미국 특허 공개 번호: 20070275465, 20070213292, 20070185050, 20070161595, 20070054279, 20060287260, 20060035254, 20060008822, 20050288244, 20050176667에 상세하게 기술되어 있다.
유사체와 유도체
세포독성제 기술 분야의 당업자는 결과로 얻는 화합물이 출발 화합물의 특이성 및/또는 활성을 계속 보유하도록 여기서 기술한 각 세포독성제는 개질될 수 있음을 용이하게 이해할 수 있을 것이다. 당업자는 이들 화합물의 다수가 여기서 기술하는 세포독성제 대신에 이용될 수 있다. 따라서, 본 발명의 세포독성제는 여기서 기술한 화합물의 유사체와 유도체를 포함한다.
세포결합제는 앞서 기술한 방법으로 세포독성 약물과 복합화할 수 있다 (미국 특허 제 6,013,748; 6,441,1631, 및 6,716,821; 미국 특허 공개 20050169933; 및 WO2006/034488 A2).
D. 치료 용도
본 발명의 세포결합제 약물 복합체 (예컨대, 면역복합체)는 화학 치료제와 병용될 수도 있다. 이러한 화학 치료제는 미국 특허 제 7,303,749호에 기술되어 있다.
본 발명의 세포결합제 약물 복합체 (예컨대, 면역복합체)는 시험관내, 생체내 및/또는 생체외 투여되어 환자를 치료하고/하거나 폐암, 혈액암, 혈장암, 유방암, 결장암, 전립선암, 신장암, 췌장암, 뇌암, 골암, 난소암, 고환암, 및 림프 기관암; 전신 홍반, 류머티스성 관절염, 및 다발성 경화증 등 자가면역 질환; 신장 이식 거부, 간 이식 거부, 폐 이식 거부, 심장 이식 거부, 및 골수 이식 거부 등 이식 거부; 이식대숙주 병; CMV 감염, HIV 감염 및 AIDS 등 바이러스성 감염; 및 편모충증, 아메바성, 주혈흡충병 등 기생충 감염 등으로부터 선택되는 세포 군집의 성장을 조절한다. 바람직하게는, 본 발명의 면역복합체와 화학 치료제는 시험관내, 생체 내 및/또는 생체 외 투여되어 환자의 암을 치료하고/하거나 혈액암, 혈장암, 폐암, 결장암, 전립선암, 신장암, 췌장암, 뇌암, 골암, 난소암, 고환암 및 림프 기관암에서 선택되는 세포 군집의 성장을 조절하고, 보다 바람직하게는 폐암, 결장 전립선암, 혈액암, 혈장암, 혈액암 또는 결장암에서 선택되는 세포 군집의 성장을 조절한다. 가장 바람직한 양태에 있어, 암은 다발성 골수증이다.
"선택된 세포 군집의 성장의 조절"은 선택된 세포 군집(MOLP-8 세포, 0PM2 세포, H929 세포 등 다발성 골수증 세포 군집)이 분열하여 더 많은 세포를 형성하는 증식의 저해; 예컨대, 처리되지 않은 세포에 비해, 세포 분열 증가 속도의 감소; 선택된 세포 군집의 제거; 및/또는 선택된 세포 군집 전이 방지 (암 세포 등)를 포함한다. 선택된 세포 군집의 성장은 시험관내, 생체내 또는 생체외 조절된다.
본 발명의 방법에서, 세포결합제 약물 복합체 (예컨대, 면역복합체)는 시험관 내, 생체 내, 또는 생체 외 투여될 수 있다. 세포결합제 약물 복합체 (예컨대, 면역복합체)는 임상 상황 보증인, 본 기술 분야의 당업자에게 자명하고, 선택될 수 있는 적합한 약제학상 허용되는 담체, 희석제, 및/또는 부형제와 함께 이용될 수 있다. 적합한 담체의 예로서 희석제 및/또는 부형제는 (1) 약 1 mg/ml 내지 25 mg/ml의 인간 혈청 알부민을 포함할 수 있는 둘베코(Dulbecco's) 인산 완충 식염수 (pH 약 6.5), (2) 0.9% 식염수 (0.9% w/v NaCl), 및 (3) 5% (w/v) 덱스트로즈를 포함한다.
여기서 기술한 화합물과 조성물은 적절한 형태로 투여될 수 있고, 바람직하게는 비경구 투여될 수 있고, 보다 바람직하게는 정맥내 투여될 수 있다. 비경구 투여에 있어, 화합물 또는 조성물은 수성 또는 비수성 멸균액, 서스펜션 또는 에멀젼일 수 있다. 프로필렌 글리콜, 식물성 오일 및 에틸 올레이트 등 주사형 유기 에스테르는 용매나 비하이클로 이용될 수 있다. 조성물은 보조제, 유화제 또는 분산제도 포함할 수 있다.
조성물은 멸균수나 기타 주사형 멸균 매체에 용해되거나 분산될 수 있는 멸균 고체 조성물 형태일 수도 있다.
여기서 기술한 세포결합제 약물 복합체 (예컨대, 면역복합체)의 "치료에 효과적인 양(therapeutically effective amount)"는 선택된 세포 군집의 성장을 조절하고/조절하거나 환자의 질병을 치료하기 위한 투약 방법을 말하고, 환자의 나이, 체중, 성별, 식이요법 및 건강 상태, 질병의 심각도, 투여 경로 및 이용한 특정 화합물의 활성, 효능, 약물 동력 및 독성 프로파일 등 약리적 고려 사항을 포함한 다양한 인자에 따라 결정된다. "치료에 효과적인 양"은 Physicians Desk Reference 2004 등 참조 의학 문서를 참고하여 결정될 수 있다. 환자는 바람직하게는 동물이고, 보다 바람직하게는 포유류이고, 가장 바람직하게는 인간이다. 환자는 남성 또는 여성일 수 있고, 유아, 어린이 또는 성인일 수 있다.
적합한 세포결합제 약물 복합체 (예컨대, 면역복합체) 투여 프로토콜의 예는 다음과 같다. 복합체는 약 5일간 매일 일 회분씩 정맥 투여하거나, 약 5일간 지속적으로 주입하여 약 5일간 매일 공급받는다.
다른 방법으로, 복합체는 6주 이상 일 주일에 한 번씩 투여받는다. 또 다른 방법으로, 복합체는 2주 또는 3주에 한 번 투여받을 수 있다. 1회 복용량은 인간 혈청 알부민 약 5 내지 약 10 ml을 첨가한 일반 식염수 약 50 내지 약 400 ml로 제공된다. 지속적인 주입은 인간 혈청 알부민 약 25 내지 약 50 ml을 첨가한 일반 식염수 약 250 내지 약 500 ml로 24시간 마다 제공된다. 복용은 환자당 약 10 pg 내지 약 1000 mg/kg 정맥 투여한다 (약 100 ng 내지 약 100 mg/kg 범위).
치료 후 약 1주 내지 약 4주 후, 환자는 2차 치료 코스를 받을 수 있다. 투여 경로, 부형제, 희석제, 복용량 및 시간과 관련되는 특정 임상 프로토콜은 임상 상황 보증인인, 기술 분야의 당업자에 의해 결정될 수도 있다.
화합물 및 복합체 (예컨대, 면역복합체)는 세포 (예컨대, 암)의 비정상 성장을 특징으로 하는 질환을 치료하거나 그 심각도를 경감하는 데 효과적인 약제의 제조에 이용될 수도 있다.
본 발명은 하나 이상의 면역복합체 및 하나 이상의 화학 치료제를 포함하는 본 발명의 약제학상 화합물 및/또는 조성물의 성분 중 하나 이상이 충진된 하나 이상의 용기를 포함하는 약물 키트를 제공할 수도 있다. 이러한 키트는 다른 화합물 및/또는 조성물과, 다른 화합물 및/또는 조성물의 투여 장치와, 약제학상 또는 생물학상 제품 제조, 이용 또는 판매를 규율하는 정부에 의해 규정된 형태의 사용 지침 문서를 포함한다.
암 치료제와 이들의 복용, 투여 경로 및 권고 사용법은 본 기술 분야에 공지되어 있고, Physician's Desk Reference (PDR)와 같은 문헌에 기술되었다. PDR은 다양한 암의 치료에 이용되어 온 치료제의 복용을 기술한다. 전술한 화학치료제의 치료에 효과적인 복용 방법과 복용량은 치료 대상인 특정 암, 질환의 정도, 본 기술 분야의 당업자인 전문의에게 친숙한 기타 요인에 따르며, 내과 전문의에 의해 결정된다. 예를 들면, Physician's Desk Reference 2006판에는 탁소테레는 튜불린 탈중합 저해제이고 (p 2947 참조); 독소루비신 (p 786 참조), 독실 (p 3302 참조) 및 옥살리프라틴은 DNA 상호작용제이고 (p 2908 참조); 이리노테칼 ( p. 2602 참조)은 토포아이소머라이제 (Topoisomerase) I 저해제이고, 에리툭스 (Erbitux) (p 937 참조)와 타르세바 (Tarceva, p 2470 참조)는 표피 성장 인자 수용체와 상호 작용하는 것으로 기술되어 있다. PDR의 내용은 참조 문헌으로 그 전문이 편입된다. 본 기술 분야의 당업자는 다음 인자의 하나 이상을 이용하여 PDR 을 검토하여 본 발명에 교시된 바에 따라 사용될 수 있는 화학 치료제 및 복합체의 복용 방법과 복용량을 결정할 수 있다. 이들 인자는 다음을 포함한다.
1. 종합 색인
a) 제조사
b) 제품 (회사나 상표등록된 약물 이름)
c) 카테로리 색인 (예를 들면, "항히스타민제", "DNA 알킬화제" 탁산 등)
d) 유전적/화학적 색인 (비상품 통상적인 약물 이름)
2. 약물의 칼라 사진
3. FDA 표지화에 따른 제품 정보
a) 화학 정보
b) 기능/작용
c) 징후 및 사용 금지 사유
d) 실험 조사, 부작용, 주의 사항
상기 참조문헌, 특허 출원 및 특허의 각 전문은 상세한 설명, 청구 범위, 요약서뿐만 아니라 이들의 도식, 표 또는 도면에 제한되지 않고 이를 포함하는 전문 그대로 편입된다.
실시예
본 방법은 특정 양태에 의해 제한되지 않고 세포결합제와 복합화되는 다양한 반응성 링커를 이용한 폴리에틸렌 글리콜 ((CH2CH2O)n)-결합 약물의 합성에 대해 기술된다. 이들 복합 방법은 N-히드록시숙신이미드 (NHS) 반응기에서 반응에 의해 폴리에틸렌 글리콜 ((CH2CH2O)n) 링커를 통해 결합한 마이탄시노이드 등 약물과 항체의 일단계 복합화를 포함한다.
또한, 항체와 복합화되는 상이한 반응 링커를 이용한 디설파이드기 포함 폴리에틸렌 글리콜 ((CH2CH2O)n)-결합 약물의 합성방법도 개시된다. 이들 복합 방법은 N-히드록시숙신이미드 (NHS) 반응기에서의 반응에 의해 디설파이드기를 포함하는 폴리에틸렌 글리콜 ((CH2CH2O)n) 링커를 이용하는 마이탄시노이드 등 약물과 항체의 일단계 복합화를 포함한다.
하기 실시예는 예시 목적으로 제시되었을 뿐, 본 발명을 제한하는 것은 아니다.
실시예
I
종래의 지방족 탄소 스페이서를 포함하는 디설파이드 링커에 의해 항체 분자 마다 복수 개 결합되어 있는 마이탄시노이드 분자의 복합체:
항체와 마이탄시노이드 DM4 또는 DMl의 여러 분자를 복합화하는 2단계 공정에서, 먼저, 항체 분자에 여러 링커 분자를 도입할 수 있도록 인간화 항체를 아민-반응성 N-히드록시숙신이미드기 (NHS기)와 티올-반응성 2-피리딜디티오기(-SSPy기)를 모두 포함하는 상업적으로 이용되는 이종이관능성 링커(SPDB)로 개질한다 (W.C. Widdison et al., J. Med . Chem ., 2006, 49, 4392-4408에 기술됨). 항체 분자에 반응성 링커를 도입한 후, 제 2 반응 단계에서, 반응성 티올기가 부여된 마이탄시노이드 DM4 또는 DMl를 링커-개질 항체에 부가하여 디설파이드 결합을 통해 마이탄시노이드와 항체를 복합화한다. 특정 실시예에서는, 5-10 mg/ml 농도의 인간화 항체를 -(CH2)-n 알킬기 (SPDB, SPP, SPDP 등)를 갖는 상업적으로 이용되는 이종이관능성 링커의 10-15배 몰 초과량으로 pH 5-8 버퍼 수용액에서 실온에서 0.25-3 시간 개질한 후, 겔 여과 (Sephadex G25 크로마토그래피 등 이용)로 정제하여 항체 분자 당 평균 8 내지 12의 링커기로 개질된 고수율(전형적으로 80-90% 수율)의 항체를 얻는다. 연결기는 소량의 링커-개질 항체 시료에 과량의 1,4-디티오트레이톨 (DTT) 시약을 첨가할 때, 343 nm (ε343 nm = 8080 M-1 cm-1 )에서의 흡광도에 따른 2-티오피리돈의 방출량을 측정하여 추정하였다. 항체에 결합한 반응기를 측정한 후, 2.5 mg/ml 농도의 링커-개질 항체는 과량의 마이탄시노이드 DM4 (반응 링커의 1.7배 몰 초과량의 DM4 티올)와 pH 6.5에서 복합화되었다. 그러나, 항체-마이탄시노이드 복합화 반응 중에 침전이 관찰되었고, 겔 여과에 의해 항체-마이탄시노이드 복합체를 정제했을 때 저 수율의 항체-마이탄시노이드 복합체 (수율: 38-60%)을 얻었다. 항체 분자당 결합한 마이탄시노이드의 수는 252 nm와 280 nm에서 흡수 계수를 이용하여 252 nm 과 280 nm에서 흡광도를 측정하여 결정되었다. 침전과 저수율의 항체-마이탄시노이드 복합체 (1-1.5 mg/ml)뿐만 아니라, 항체 분자당 도입된 마이탄시노이드 수는 훨씬 높은 항체 분자당 도입된 평균 초기 반응성 링커기 수 (항체 분자당 반응성 링커 기수는 8-12)에 따라 예상한 것보다 훨씬 낮고 (항체 분자당 평균 마이탄시노이드 분자수는 5.2-5.5), 이는 더 많은 마이탄시노이드를 포함하는 항체 복합체의 침전을 암시한다. 다른 실시예에서, 인간화 항체는 먼저 SPDB 이종이관능성 링커로 개질되어 항체 분자당 11개의 피리딜디티오 기를 도입하고, 1.7배 몰 초과량의 DM4 마이탄시노이드 티올과 2차 반응할 때, 반응 혼합물에서 현저한 침전이 나타나, 30% 미만의 항체-마이탄시노이드 복합체의 매우 낮은 회수율을 초래한다. 지방족 스페이서를 포함하는 SPDB 또는 SPDP 등 상업적으로 이용되는 이종이관능성 링커를 이용하여 전형적으로 1 mg/ml 이상의 농도의 항체-마이탄시노이드 복합체에서 높은 복합률로 항체당 4 또는 5 이상의 마이탄시노이드 분자를 복합화하기는 어렵다. 관찰된 SPDB- 또는 SPDP-유래 링커를 포함하는 항체-마이탄시노이드 복합체의 침전과 낮은 수율은 SPDB- 또는 SPDP-링커의 항체의 초기 개질(마이탄시노이드와 복합화되기 전)에서는 나타나지 않는다. 이는 항체-마이탄시노이드 복합체의 응집과 침전이 소수성 분자의 결합에 의해 야기된 것으로 예측되었다.
실시예
II
친수성 폴리에틸렌
옥사이드
스페이서((
PEG
n
, 또는 (-
CH
2
-
CH
2
-O)
n=1-14
)를 포함하는
디설파이드
링커에 의해 항체분자당 여러 개의
마이탄시노이드
분자가
결합되어
있는 복합체:
폴리에틸렌 옥사이드 (PEGn, 또는 (-CH2-CH2-O)n=1-14) 등 친수성 스페이서가 다수의 마이탄시노이드 분자 (항체 분자당 평균 4 이상)를 이용하는 항체-마이탄시노이드 복합체의 응집과 침전을 방지할 수 있는 지를 확인하기 위해, 항체 직접 결합이나, 리신 잔사에서 항체의 초기 유도 후, 마이탄시노이드의 반응을 포함하는 2단계 반응에 의해 항체에 복합할 수 있는 복수의 새로운 이종이관능성, 단일관능성 마이탄시노이드 유도체를 제조하였다 (예를 들면, 도 3, 6, 11, 및 12 참조).
15-(2-
피리딜디티오
)-4,7,10,13-
테트라옥사펜타데칸산의
합성
10 mL 둥근 바닥 플라스크에서 1,2-디메톡시에탄 5.0 mL 중 알드리티올-2 (1.17 g, 5.31 mmol) 용액을 제조하였다. 반응 플라스크에 1,2-디메톡시에탄 1.0 mL에 녹인 3-(2-티오테트라에틸렌글리콜) 프로피온산 (QuantaBiodesign, 490 mg, 1.73 mmol) 용액을 첨가하였다. 교반하면서 3.5 시간 반응을 진행하고, 생성물을 실리카 크로마토그래피로 정제하였다 (염화 메틸렌 중 5% 메탄올로 용리). 용매를 진공 제거하여 목적 생성물 432 mg (수율: 64%)을 얻었다.
PySS
-
PEG
4
-
NHS
[15-(2-
피리딜디티오
)-4,7,10,13-
테트라옥사펜타데칸산
-N-
히드록시숙신이미드
에스테르]의 합성
lO mL 둥근 바닥 플라스크에 15-(2-피리딜디티오)-4,7,10,13-테트라옥사펜타데칸산 (431 mg, 1.10 mmol), 염화 메틸렌 5.0 mL 및 교반 막대를 넣었다. 반응 용기에 N-히드록시 숙신이미드 (3.6 mg, 0.31 mmol)와 l-[3-(디메틸아미노)프로필]-3-에틸카르보디이미드 하이드로클로라이드 (6.8 mg, 0.036 mmol)을 가하고, 2시간 실온에서 교반하면서 반응을 수행하였다. 생성물을 실리카 크로마토그래피로 정제하였다 (염화 메틸렌 중 7% 1,2-디메톡시에탄으로 용리). 용매를 진공 제거하여 목적 생성물 206 mg (수율: 38%)을 얻었다. MS: m/z: 관측치: 511.1 (M + Na)+, 계산치: 511.2.
15-(
DM4
-
디티오
)-4,7,10,13-
테트라옥사펜타데칸산의
합성
N2'-데아세틸-N2'-(4-메르캅토-4-메틸-1-옥소펜틸) 메이탄신 (DM4, 18.6 mg, 0.0239 mmol)과 15-(2-피리딜디티오)-4,7,10,13-테트라옥사펜타데칸산 (14.0 mg, 0.0358 mmol)의 용액을 1,2-디메톡시에탄 0.75 mL에서 제조하였다. 반응 용기에 4-메틸모폴린 (6.0 mg, 0.0597 mmol)를 가하고, 실온에서 24시간 교반하면서 반응을 진행하였다. 반응 종료시, 조 반응 혼합물을 진공 건조하고 더 정제하지 않고사용하였다 (도 6).
15-(
DM4
-
디티오
)-4,7,10,13-
테트라옥사펜타데칸산
-N-히드록시
숙신이미드
에스테르 (
DM4
-
SPEG
4
-
NHS
)의 합성
15-(DM4-디티오)-4,7,10,13-테트라옥사펜타데칸산 원액을 염화 메틸렌 2.0 mL에 용해하고, N-히드록시 숙신이미드 (3.6 mg, 0.31 mmol) 및 l-[3-(디메틸아미노)프로필]-3-에틸카르보디이미드 하이드로클로라이드 (6.8 mg, 0.036 mmol)와 결합시킨다. 용액을 2.5 시간 교반하고, 생성물을 실리카 크로마토그래피 (염화 메틸렌 중 4% 메탄올로 용리)로 정제하였다. 용매를 진공 제거하여 목적 생성물 15.0 mg (54% 수율)을 얻었다. MS: m/z: 관측치: 1179.3 (M + Na)+, 계산치: 1179.4 (도 6).
친수성 폴리에틸렌 옥사이드 스페이서 ( PEGn , 또는 (- CH 2 - CH 2 -O) n=1-14 )를 포함하는 디설파이드 링커를 이용한 항체 분자당 복수의 마이탄시노이드 분자가 결합되어 있는 이단계 복합화:
폴리에틸렌 옥사이드(PEGn, 또는 (-CH2-CH2-O)n=1-14) 등 친수성 스페이서를 갖는 새로운 이종이관능성 시약을 이용하여 항체를 개질한 후, DM4 티올과 복합화하는 경우, 새로운 관찰이 이루어졌다. 친수성 PEGn 스페이서와 항체-마이탄시노이드 복합체의 복합 혼합물은 침전을 나타내지 않고, 단량체 비율이 매우 높은 (>90%) 복합체 수율 (>70%)을 일관적으로 얻게 된다. 실시예로서, 8 mg/ml 농도의 인간화 항체를 항체 몰 농도 수 배의 과량의 PySS-PEG4-NHS 시약으로 pH 8 버퍼 한 시간 동안 3O℃에서 개질한 후, 겔 여과로 정제하였다. 항체 분자에 결합한 디티오피리딘기 수는 1.4배 몰 과량의 DM4 마이탄시노이드 티올을 각 디티오피리딜-PEGn-링커 개질 항체 용액에 가해 pH 6.5, 25℃에서 밤새 복합화하고, 복합체를 겔 여과로 정제하는 경우, 과량의 디티오트레이톨을 이용한 분액의 2-티오피리딘 방출 분석에 의해 4 내지 16인 것으로 예측되었다 (도 12). 다른 초기 링커 도입을 이용한 다른 복합 혼합물에서, 최종 도입된 항체에 대한 마이탄시노이드는 3 내지 9 범위의 항체 분자당 평균 마이탄시노이드수를 갖고, 침전이 관찰되지 않고, 수율은 70%보다 높고, 단량체 비율은 매우 높았다 (20% 이소프로판올 또는 0.4 M 과염소산 나트륨을 이용한 크기 배제 TSK-GEL G3000 HPLC을 통한 단량체 비율: >90%). 최종 복합체에서 비복합 약물은 HiSep Mixed-Mode 크로마토그래피 (HiSep column, Supelco)에 의해 0.6% 미만으로 결정되었고, 이는 마이탄시노이드가 항체와 공유 결합하고 있음을 암시한다. 다른 실시예에서, 8 mg/ml 농도의 인간화 항체는 pH 6.5 버퍼에서, 1.5 시간, 25℃에서 항체보다 수 배 높은 몰 농도의 PySS-PEG4-NHS 시약으로 개질한 후, 겔 여과로 정제하였다. 항체 시료의 디티오피리딜-PEGn를 갖는 링커기 수는 항체 분자당 6-18로 예측되었고, 1.3-1.7배 몰 과량의 DM4 마이탄시노이드 티올을 pH 6.5, 25℃에서 밤새 반응시킨 후, 겔 여과로 정제하였다. 침전은 관찰되지 않았고, 최종 항체-마이탄시노이드 복합체 시료 (1-2 mg/ml)는 응집이 없음을 암시하는 높은 단량체 비율 (>90%)을 나타내고, 복합화하지 않은 비율이 매우 낮은 마이탄시노이드 (HiSep 크로마토그래피에 의해 예측한 복합하지 않은 마이탄시노이드: <1.7%)에 있어서, 항체당 공유 결합한 마이탄시노이드 분자수가 높다 (~3.1 내지 7.1). 항체당 약물량이 높은 복합체는 최장기간 분석하더라도 (1.5 개월) 4℃에서 저장시 안정하였다.
친수성 폴리에틸렌 옥사이드스페이서 ( PEG n , 또는 (- CH 2 - CH 2 -O) n=1-14 )를 포함하는 디설파이드 링커를 이용한 항체 분자당 다수의 마이탄시노이드가 결합한 일단계 복합:
1단계 복합화 방법에서, 친수성 폴리에틸렌 옥사이드 스페이서 (PEGn, 또는 (-CH2-CH2-O)n=1-14)를 포함하는 디설파이드 링커와 항체-마이탄시노이드 복합체는 pH 8 버퍼에서, 2시간 동안, 3O℃에 4 mg/ml 농도의 인간화 항체와 10-20배 몰 과량의 DM4-SPEG4-NHS 시약을 복합하여 생성한 후, 겔 여과로 정제하여 항체 분자당 복합된 마이탄시노이드 (82% 단량체)수가 6.6인 1.4 mg/ml 농도의 항체-마이탄시노이드 복합체를 얻었다 (도 11). 따라서, 2단계 및 1단계 방법을 이용하여 친수성 폴리에틸렌 옥사이드 스페이서 (PEGn, 또는 (-CH2-CH2-O)n=1-14)를 포함하는 디설파이드 링커를 이용하여 항체 분자에 많은 수가 결합한 마이탄시노이드를 얻었다.
실시예
III
친수성 폴리에틸렌
옥사이드스페이서
(
PEG
n
, 또는 (-
CH
2
-
CH
2
-O
)n
)를 포함하는 티오에테르 링커에 의해 항체와 이에 다수 결합한
마이탄시노이드의
복합화
항체의 리신 잔사를 직접 개질하기 위해, 마이탄시노이드의 N-히드록시숙신이미드 에스테르를 SPP에서 유래한 알킬 링커 등 종래의 지방족 링커를 이용하여 (W.C. Widdison et al., J Med . Chem ., 2006, 49, 4392-4408) 초기에 1단계 방법으로 항체를 복합화하였다. 8배 몰 과량의 테스트 시약으로서 (5 mg/ml) DMl-SPP-NHS 시약으로 인간화 항체를 pH 8 버퍼, 3O℃에서 2시간 복합 (그 후 겔 여과 및 투석)하는 시도는 현저한 침전과 응집을 초래하여, 최종 복합체는 항체당 결합 마이탄시노이드수가 약 3.3인 61% 단량체가 된다. 대조적으로, 유사 조건에서 DMl-Mal-PEG4-NHS 시약을 이용하면, 항체당 결합한 마이탄시노이드 분자수가 5.4인 복합체(1.1 mg/ml)를 얻게 되고, 최종 복합체에서 침전은 없다 (도 7 또는 9). 마찬가지로, DMl-Mal-PEG2-NHS 시약을 이용하여 항체 분자 티오에테르 결합을 통해 항체 분자에 결합한 다수의 복합 마이탄시노이드를 얻었다. 다른 실시예에서, 쥐 IgG1 항체(4 mg/ml)를 10배 내지 20배 몰 과량의 DMl-Mal-PEG4-NHS 시약과, pH 8 버퍼에서 2시간 3O℃에서 복합한 후, 겔 여과하여 검출할 수 없는 정도의 복합화되지 않은 약물 (HiSep HPLC 분석)과 항체 분자(98% 단량체)당 공유 결합한 복합 마이탄시노이드 분자수가 4.1 및 7.8인 항체-마이탄시노이드 복합체 (1 mg/ml 농도)를 얻었다. 다른 실시예에서, 인간화 항체를 과량의 DMl-Mal-PEG4-NHS 시약과 복합하여 항체당 결합한 평균 마이탄시노이드 분자수가 10.7 (99% 단량체; 1.1 mg/ml 농도)인 복합체를 얻었다. 도 8 및 도 10에 간략하게 기술한 2단계 복합 과정을 이용하여 항체로부터 PEG4-결합 티오에테르 복합체도 제조하였다. 따라서, PEGn 또는 (-CH2-CH2-O)n 등 친수성 링커를 이용하여 항체 분자당 다수의 마이탄시노이드 분자를 도입할 수 있다 (예를 들면, 도 1, 2, 4, 5, 7, 8, 9, 10, 13, 14, 15, 16, 17, 18, 19, 20, 및 21 참조).
DMl-Mal-PEG2-NHS의 합성
THF 0.70 mL 중 N 2' -데아세틸-N 2' -(3-메르캅토-l-옥소프로필)-메이탄신 (DMl, 13.4 mg, 0.0182 mmol) 용액을 제조하고, 숙신이미딜-[(N-말레이미도프로피온아미드)-디에틸렌글리콜] 에스테르 (NHS-PEG2-말레이미드, Quanta Biodesign, 11.6 mg, 0.0273 mmol)를 인산 칼륨 완충 수용액 (50 mM, pH 6)과 THF의 2:1 (v/v) 혼합물 (1.5 mL)에 가하였다. 실온에서 한 시간 교반하면서 반응을 수행하고, TLC 분석으로 반응의 완결을 확인하였다. 조 반응 혼합물을 실리카 크로마토그래피 (염화 메틸렌 중 8% 에탄올로 용리)로 정제하고, 용매를 진공 제거하여 목적 생성물 (6.0 mg, 28% 수율)을 얻었다. MS: m/z 측정치: 1185.3 (M + Na)+, 계산치: 1184.4 (도 4).
DMl
-
Ma1
-
PEG
4
-
NHS
의 합성
N 2 '-데아세틸-N 2' -(3-메르캅토-l-옥소프로필)-메이탄신 (DMl, 28.1 mg, 0.0381 mmol) 용액을 THF 0.50 mL에서 제조하였고, 숙신이미딜-[(N-말레이미도프로피온아미드)-테트라에틸렌글리콜] 에스테르 (NHS-PEG4-말레이미드, Quanta Biodesign, 39.1 mg, 0.0762 mmol)을 인산 칼륨 완충 수용액 (50 mM, pH 6)과 THF의 2:1 (v/v) 혼합물 (1.5 mL)에 가하였다. 실온에서 한 시간 교반하면서 반응을 진행하고, 반응의 종결을 TLC 분석으로 확인하였다. 조 반응 혼합물을 실리카 크로마토그래피 (염화 메틸렌 중 6% 에탄올로 용리)로 정제하고, 용매를 진공 제거하여 목적 생성물 (9.6 mg, 20% 수율)을 얻었다. MS: m/z: 측정치: 1273.5 (M + Na)+, 계산치: 1273.5 (도 4).
실시예
IV
항체 종을 포함하는 다수의
마이탄시노이드의
질량 분광 분석
친수성 PEG 링커를 포함하는 항체 종을 갖는 다수의 마이탄시노이드를 분석하기 위해서, 항체당 평균 DM1 수가 10.7인 Ab-PEG4-Mal-DMl 복합체를 갖는 다량의 마이탄시노이드를 선택하였다. 복합체를 탈글리코실화한 후, ESI-TOF MS 분석하였다 (도 22). 질량 스펙트럼은 항체당 약물의 수가 4-15 범위이고, 항체당 최대 약물 수가 약 8-9 범위인 상이한 결합 수를 갖는 마이탄시노이드로 표지화한 다양한 항체 종을 나타내었다. 이 분포는 고농도의 약물을 함유하는 종에서는 선택적 소멸이 관찰되지 않았고, 이는 최종 복합체의 높은 용해도와 일관됨을 정상적으로 암시한다. 항체당 평균 DM1 수가 10.7인 Ab-PEG4-Mal-DMl 복합체를 갖는 고농도의 마이탄시노이드의 크기 배제 크로마토그래피 HPLC는 놀랍게도 99% 이상의 다량의 단량체를 나타내었다 (도 23).
실시예
V
항체 종을 갖는 고농도의 마이탄시노이드의 FACS 결합은 개질되지 않은 항체와 유사하다:
유동세포계수법으로 여러 항체의 복합체를 포함하는 고농도의 마이탄시노이드의 결합을 EpCAM, CanAg 및 CD56 등 다른 표적에 대한 개질되지 않은 항체와 비교하였다. 간단히 말해, 항원 양성 세포를 복합체나 개질되지 않은 항체로 4℃에서 배양한 후, 이차 항체-FITC 복합체로 4℃에서 배양하고, 포름알데히드 (PBS 중 1%)로 고정하고, 유동세포계수법으로 분석하였다.
모든 평가되는 복합체에 있어 복합체의 결합과 개질되지 않은 항체의 결합 간의 큰 차이는 관찰되지 않았다. 도 24에 예시한 실시예에서, 항원 양성 세포와 결합한 Ab-PEG4-Mal-DMl 복합체를 갖는 10.7 마이탄시노이드는 개질되지 않은 항체와 유사한 높은 친화성을 갖는다.
실시예
VI
폴리에틸렌
옥사이드
스페이서
(
PEG
n
, 또는 (-
CH
2
-
CH
2
-O)
n
)를 포함하는
티오에테르
및
디설파이드
링커를 이용한 항체의
마이탄시노이드
복합체의 시험관 내 세포독성 평가
PEGn 스페이서를 포함하는 티오에테르 및 디설파이드 링커를 이용한 항체-마이탄시노이드 복합체의 세포독성 효과는 전형적으로 복합체를 이용하여 암 세포를 4-5일 연속 배양한 후에 WST-8 세포 생존율 분석을 이용하여 평가하였다. 항원 발현 암 세포 (1000-5000 세포/웰)는 96웰 플레이트에 다양한 농도의 항체-마이탄시노이드 복합체와 우 태아 혈청을 함유하는 보통의 성장 매체에 약 5일간 배양하였다. WST-8 시약을 가하고, 2-5 시간 후 450 nm에서 플레이트 흡광도를 측정하였다. 복합체 농도에 따른 생존율을 표시하여, 복합체의 IC50값 (50% 세포 사멸 농도)를 결정하였다.
도 25는 PEG4 결합 티오에테르 복합체 (Ab-PEG4-Mal-DMl)에서 약물량을 증가한 항-EpCAM Ab-마이탄시노이드 복합체의 효능 증진을 나타내고, 이는 EpCAM 항원 양성 COLO205-멀티 약물 내성 세포 (COLO205-MDR 세포)에 대해 유사한 약물량의 항체당 약 4 마이탄시노이드에서 티오에테르-결합 SMCC-DMl과 디설파이드-결합 SPDB-DM4 복합체보다 우수한 활성을 나타낸다. 마이탄시노이드 용량이 4.1 및 7.8인 티오에테르-결합 항-EpCAM Ab-PEG4-Mal-DMl 복합체의 효능은 신규하고 치료 용도에 매우 유망하다.
도 26은 항-CanAg Ab-마이탄시노이드 복합체의 CanAg 항원 양성 COLO205-MDR 세포에 대한 세포독성 활성을 나타낸다. 또한, 유사한 마이탄시노이드 용량에서도 티오에테르-결합 Ab-PEG4-Mal-DMl 및 Ab-PEG2-Mal-DMl 복합체는 티오에테르-결합 Ab-SMCC-DMl 복합체에 비해 우수한 효능을 나타내었다.
도 27은 CD56-발현 Molp-8 다발성 골수증 세포에서의 PEG-함유 티오에테르와 디설파이드 링커를 이용한 항-CD56 항체-마이탄시노이드 복합체의 세포독성 활성을 나타낸다. 항체당 약물 수가 7.7인 티오에테르-결합 PEG4 복합체는(Ab-PEG4Mal-DMl)는 약물 수가 3.8인 (IC 50 = 1.9 nM) 복합체에 비해 예상외로 세포독성 효능이 100배 증가하였다 (IC 50 = 0.019 nM).
도 28은 EpCAM-양성 멀티 약물 내성 HCT 15 세포에 대해 항체당 유사한 약물량의 약 4 마이탄시노이드에서 종래의 티오에테르-결합 SMCC-DMl에 비해 PEG4 결합 티오에테르 복합체 (Ab-PEG4-Mal-DMl)를 갖는 항-EpCAM Ab-마이탄시노이드 복합체의 효능 증진을 나타낸다. 티오에테르-결합 항-EpCAM Ab-PEG4-Mal-DMl 복합체의 높은 효능은 새로운 발견이고, 치료 용도에 매우 유망하다.
도 29는 EpCAM-양성 멀티 약물 내성 COLO 205 세포에 대해 항체당 약 4 마이탄시노이드의 유사한 약물량에서 종래의 티오에테르-결합 SMCC-DMl에 비해 PEG4 결합 티오에테르 복합체 (Ab-PEG4-Mal-DMl)를 포함하는 항-EpCAM Ab-마이탄시노이드 복합체의 효능 증진을 나타낸다. 티오에테르-결합 항-EpCAM Ab-PEG4-Mal-DMl 복합체의 높은 효능은 새로운 발견이고, 치료 용도에 매우 유망하다. 도 37은 EGFR-양성 UO-31 인간 신장 암종 세포에 대해 3.7 마이탄시노이드/Ab를 갖는 비친수성 SMCC-DMl 복합체에 비해, 친수성 티오에테르-결합 PEG4 링커 (Ab-PEG4-Mal-DMl)를 갖는 항-EGFR Ab-마이탄시노이드 복합체의 강력한 세포독성 증진을 나타낸다. PEG4-Mal-DMl의 효능은 종래의 링커를 포함하는 SMCC-DMl 복합체보다 약 10배 높다.
실시예 VII
생체 내 약물동태:
친수성 PEG4 링커를 포함하고 6.7의 D/A (마이탄시노이드/항체)를 갖는 인간화 항-CD56 항체 (Ab)-PEG4-Mal-DMl 복합체의 혈장 약물동태를 종래의 지방족 탄소 사슬 링커를 포함하고, 4의 D/A을 갖는 Ab-SMCC-DMl 복합체과 비교하였다 (도 38 A). 5 mg/kg 복합체 (항체 기준 복용량; 3 마리/군)의 일 회 투여량을 CDl 마우스에 정맥 내 주사하였다. 4주간 혈장 시료를 여러 번 수집하였다. ELISA를 이용하여 혈장 시료의 항체 농도와 복합체 농도를 분석하였다. 항체 ELISA에서, 코팅되고 고정된 염소-항-인간 IgG (H+L) 항체를 포함하는 마이크로티터 플레이트에 혈장 시료를 가하고, 세척하고, 양고추냉이 과산화 효소-복합 염소-항-인간 IgG (Fcγ) 항체를 이용하여 검출하였다. 복합체 농도에 있어, 코팅되고 고정된 염소-항-인간 IgG (H+L) 항체를 포함하는 마이크로티터 플레이트에 혈장 시료를 가하고, 세척하고, 바이오틴화 항-메이탄신 항체와 알칼리 인산염-복합 스트렙타비딘을 항체를 이용하여 검출하였다. 항체 농도와 복합체 농도 ELISA 결과는 6.7 DMl/Ab값이 높은 친수성 PEG4 링커를 포함하는 Ab-PEG4-Mal-DMl 복합체는 4주의 연구 기간 동안 혈장에서 잘 유지되었음을 증명해 준다.
도 38A는 4 DMl/Ab를 갖는 표준 링커 복합체와 비교했을 때 마이탄시노이드량이 높은 (6.7 DMl/Ab) PEG4 링커를 이용한 항체-마이탄시노이드 복합체의 생체 내 약물동태를 나타낸다. 마이탄시노이드 용량이 높더라도, 6.7 마이탄시노이드/Ab를 갖는 PEG4 결합 티오에테르 복합체 (Ab-PEG4-Mal-DMl)는 표준 복합체보다 반감기가 길다. 다른 실시예에서, CD-I 마우스에서 (10-12 mg/kg 정맥내 주사) 3H-표지 DMl (3.3 마이탄시노이드/Ab)를 갖는 인간화 C242 Ab-PEG4-Mal-3H-DMl 복합체의 혈장 약물동태를 복합화하지 않은 항체와 종래의 지방족 탄소 사슬 링커를 포함하고, 유사한 4.2 D/A 양을 갖는 Ab-SMCC-3H-DMl 복합체를 비교하였다(도 38B). Ab-PEG4-Mal-3H-DMl 복합체는 유사량의 마이탄시노이드를 이용한 종래의 SMCC-링커 복합체에 비해, 항체 농도(ELISA; 도 38B)와 복합체 농도(3H-표지 수)로 측정된 바와 같이, 4주간 더 높은 혈장 농도를 나타내었다. PEG4-Mal 결합 복합체의 반감기는 SMCC-결합 복합체의 12.6일보다 훨씬 증가한 16일이었다 (도 38B). 중요한 것은, CD-I 마우스에서 3.3 D/A를 갖는 Ab-PEG4-Mal-DMl 복합체 (10 mg/kg, 정맥 내 투여, AUC = 38790 h.μg/mL)의 곡선 (AUC) 하부 면적은, 유사 투여량 (12 mg/kg, 정맥 내 투여, AUC = 38798 h.μg/mL) 조건에서 복합되지 않은 항체와 유사하고, Ab-SMCC-DMl 복합체 (4.2 D/A, 10 mg/kg 정맥 내 투여, AUC = 25910 h.μg/mL)보다 높았다(도 38B).
실시예
VIII
내성 결장암 (
HCTl
5) 이종이식에 대해 항-
EpCAM
-
마이탄시노이드
복합체와 muB38.1-MCC-DMl와
muB38
.1-
PEG4
-
mal
-
DMl
복합체의 생체 내 항암 활성 비교
muB38.1-MCC-DMl와 muB38.1-PEG4-mal-DMl 복합체의 항종양 효과는 인간 결장 암종, HCTl 5의 이종이식 모델에서 평가하였고, 이는 P-당단백질을 과발현하고 다양한 약물에 내성이 있는 것으로 나타났다. HCT 15 세포는 SCID 마우스의 오른쪽 어깨 하부에 피하 주사하였다 (1 x 107 세포/동물). 종양 부피가 약 140 mm3 크기에 이르면(종양 세포 접종 후 9일), 마우스를 종양 부피에 의해 무작위 추출하여 세 군으로 분류하고 (5 마리/군), 각 군은 muB38.1-MCC-DMl (20 mg 복합체 단백질/kg), muB38.1-PEG4-mal-DMl (20 mg 복합체 단백질/kg) 또는 인산 버퍼 식염수 (비하이클 대조군) 단일 투여량 처리하였다. 매주 2회 종양 크기를 특정하여 종양 성장은 관찰하였다. 종양 크기는 길이 x 폭 x 높이 x 1/2으로 계산하였다.
종양 부피의 평균 변화량은 도 30에 예시하였다. PBS 대조군에서, 종양 부피는 세포 접종 후 20일에 600 mm3에 이르렀다. muB38.1-MCC-DM1 처리군은 15일 종양 성장이 지연되었다. muB38.1-PEG4-mal-DMl 처리군은 더 우수한 항-종양 효과를 나타내었다. 다섯 마리 중 두 마리는 종양이 완전히 사라지고, 44일 계속되었으며, 세 마리는 32일간 종양 성장이 지연되었다.
따라서, 본 발명의 복합체 muB38.1-PEG4-mal-DMl는 이러한 인간 결장 암 이종이식 모델에서 muB38.1-MCC-DMl보다 효능이 매우 우수하다.
실시예
IX
내성 결장 암(
COLO205
-
MDR
)의 이종 이식에 있어 항-
EpCAM
-
마이탄시노이드
복합체 (
muB38
.1-
MCC
-
DMl
및
muB38
.1-
PEG4
-
mal
-
DMl
)의 생체 내 항암 활성 비교
muB38.1-MCC-DMl와 muB38.1-PEG4-mal-DMl 복합체의 항종양 효과는 인간 결장 암종, COLO205-MDR의 이종이식 모델에서 평가하였고, 이는 P-당단백질을 과발현하는 것으로 나타났다. COLO205-MDR 세포는 SCID 마우스의 오른쪽 어깨 하부에 피하 주사하였다 (1 x 107 세포/동물). 종양 부피가 약 170 mm3 크기가 되면(종양 세포 접종 후 8일), 마우스를 종양 부피에 의해 무작위 추출하여 세 군으로 분류하고 (5 마리/군), 각 군은 muB38.1-MCC-DMl (20 mg 복합체 단백질/kg), muB38.1-PEG4-mal-DMl (항체 복용량 20 mg/kg) 또는 인산 버퍼 식염수 (비하이클 대조군)의 단일 투여량 처리하였다. 매주 2회 종양 크기를 특정하여 종양 성장은 관찰하였다. 종양 크기는 길이 x 폭 x 높이 x 1/2으로 계산하였다.
종양 부피의 평균 변화량은 도 31에 예시하였다. PBS 대조군에서, 종양 부피는 세포 접종 후 38일 후에 1000 mm3에 이르렀다. muB38.1-MCC-DM1의 처리군은 15일 종양 성장이 지연되었다. muB38.1-PEG4-mal-DMl 처리군은 현저한 항종양 효과를 나타내어, 여섯 마리 모두 종양이 완전히 사라졌다 (도 31).
COLO 205 이종이식에서도 유사한 실험을 수행하였다. B38.1-PEG4-mal-DMl을 다시 처리하면 효능이 더 우수하여, 종양이 완전히 사라졌고, 이에 반해 표준 SMCC 복합체는 양호한 종양 성장 지연을 나타내었다 (도 32).
인간화 항-CanAg 항체의 복합체에서 유사 결과를 얻었다 (도 33).
따라서, 본 발명의 복합체, muB38.1-PEG4-mal-DMl는 인간 결장암 이종이식 모델에서 앞서 기술한 링커로 제조된 복합체 muB38.1-MCC-DMl보다 상당히 우수한 효능을 나타내었다.
실시예 X
PEG 길이의 평가:
PEG4, PEG8, PEG12, PEG24 링커와 항체에 도입된 다수의 DMx로 여러 Ab-PEGn-Mal-DMx 복합체를 제조하였다. 도 34는 매우 높은 D/A (17.1)을 갖는 Ab-PEG24-Mal-DMl 복합체는 개질되지 않은 항체와 유사한 항원 발현 암 세포와의 결합을 나타낸다 (유동세포계수법에 의한 상대 평균 형광 RMF에서 측정되는 결합). 또한, D/A가 4 내지 8인 Ab-PEG8-Mal-DMl와 Ab-PEG12-Mal-DMl 복합체는 세포결합 유동세포계수법에 의해 개질되지 않은 항체와 유사한 결합을 나타낸다. PEG4, PEG8, PEG12, PEG24 링커로 제조한 Ab-PEGn-Mal-DMx 복합체는 항원 양성 세포에 대한 세포독성이 강력하다. 도 35는 D/A가 4 내지 17인 항-CanAg 항체 (huC242)-PEGn-Mal-DMl 복합체가 5일간 약 0.1-0.5 nM의 강력한 IC50을 갖는 CanAg 항원 양성 COLO205 세포를 제거하였다. pgp-발현 다제 내성 COLO205-MDR 세포는 IC50가 약 0.05 내지 0.5 nM인 효과적으로 4 내지 17 D/A를 갖는 huC242-PEGn-Mal-DMl 복합체에 의해 제거되었다 (도 36). 높은 D/A(17.1)를 갖는 PEG24-Mal-DMl 복합체는 4 D/A를 갖는 PEG24-Mal-DMl 복합체보다 세포독성이 더 우수하다 (도 34, 36).
Claims (17)
- 화학식 (1) 또는 (1')의 화합물:
Z-Xl-(-CH2-CH2-O-)n-Yp-D (1)
D-Yp-(-CH2-CH2-O-)n-Xl-Z (1')
상기 식에서,
Z는 세포결합제와 아미드 또는 티오에테르 결합을 형성할 수 있는 반응성 관능기를 나타내고;
D는 약물을 나타내고;
X는 티오에테르 결합, 아미드 결합, 카르밤산 결합 또는 에테르 결합을 통해 세포결합제에 결합한 지방족, 방향족 또는 이종고리 단위를 나타내고;
Y는 티오에테르 결합, 아미드 결합, 카르밤산 결합, 에테르 결합, 아미드 결합, 탄소-탄소 결합 및 히드라존 결합으로 구성되는 군으로부터 선택되는 공유 결합을 통해 약물에 결합한 지방족, 방향족 또는 이종고리 단위를 나타내고;
l은 0 또는 1이고;
p는 0 또는 1이고;
n은 1 내지 2000의 정수이다. - 화학식 (2) 또는 화학식 (2')의 세포 결합제 세포독성 약물 복합체:
CB-[Xl-(-CH2-CH2-O-)n-Yp-D]m (2)
[D-Yp-(-CH2-CH2-O-)n-Xl]m-CB (2')
상기 식에서,
CB는 세포결합제를 나타내고;
D는 약물을 나타내고;
X는 티오에테르 결합, 아미드 결합, 카르밤산 결합, 또는 에테르 결합을 통해 세포결합제와 결합한 지방족, 방향족 또는 이종고리 단위를 나타내고;
Y는 티오에테르 결합, 아미드 결합, 카르밤산 결합, 에테르 결합, 아미드 결합, 탄소-탄소 결합 및 히드라존 결합으로 구성되는 군으로부터 선택되는 공유 결합을 통해 약물에 결합하는 지방족, 방향족, 또는 이종고리 단위를 나타내고;
l은 0 또는 1이고;
p는 0 또는 1이고;
m은 2 내지 15의 정수이고;
n은 1 내지 2000의 정수이다. - 화학식 (3) 또는 (3')의 화합물:
Z-Xl-(-CH2-CH2O-)n-Y-D (3)
D-Y-(-CH2-CH2O-)n-Xl-Z (3')
상기 식에서,
Z는 세포결합제와 아미드 또는 티오에테르 결합을 형성할 수 있는 반응성 관능기를 나타내고;
D는 약물을 나타내고;
X는 티오에테르 결합, 아미드 결합, 카르밤산 결합, 또는 에테르 결합을 통해 세포결합제와 결합한 지방족, 방향족 또는 이종고리 단위를 나타내고;
Y는 디설파이드 결합을 통해 약물과 결합한 지방족, 비방향족 이종고리 또는 방향족 이종고리 단위를 나타내고;
1은 0 또는 1이고;
n은 1 내지 14의 정수이다. - 화학식 (4) 또는 (4')의 세포결합제 세포독성 약물 복합체:
CB-(Xl-(-CH2-CH2O-)n-Y-D)m (4)
[D-Y-(-CH2-CH2O-)n-Xl]m-CB (4')
상기 식에서,
CB는 세포결합제를 나타내고;
D는 약물을 나타내고;
X는 티오에테르 결합, 아미드 결합, 카르밤산 결합, 또는 에테르 결합을 통해 세포결합제에 결합한 지방족, 방향족 또는 이종고리 단위를 나타내고;
Y는 디설파이드 결합을 통해 약물에 결합한 지방족, 방향족 또는 이종고리 단위를 나타내고;
1은 0 또는 1이고;
m은 3 내지 8의 정수이고;
n은 1 내지 14의 정수이다. - 제 2항 또는 제 4항에 있어서, 상기 세포결합제는 항체, 단쇄 항체, 표적 세포와 우선적으로 결합하는 항체 단편, 단일클론 항체, 단쇄 단일클론 항체, 단일클론 항체, 이중특이성(bispecific) 항체, 표적 세포와 특이적으로 결합하는 단편, 항체 모방 아드넥틴스(adnectins®), 안키린 반복 단백질 (DARPins), 림포카인, 사이토카인, 호르몬, 성장 인자, 효소, 또는 영양분 수송 분자인 복합체.
- 제 2항 또는 제 4항에 있어서, 상기 세포결합제는 재표면화 단일클론 항체, 재표면화 단쇄 단일클론 항체, 또는 표적 세포와 우선적으로 결합하는 재표면화 단일클론 항체 단편인 복합체.
- 제 2항 또는 제 4항에 있어서, 상기 세포결합제는 인간화 단일클론 항체, 인간화 단쇄 단일클론 항체, 또는 표적 세포와 우선적으로 결합하는 인간화 단일클론 항체인 복합체.
- 제 5항에 있어서, 상기 항체는 키메라(chimeric) 항체, 키메라 항체 단편, 도메인 항체, 또는 이들의 도메인 항체 단편인 복합체.
- 제 5항에 있어서, 상기 항체는 MY9, 항-B4, EpCAM, CD2, CD3, CD4, CD5, CD6, CDl1, CD19, CD20, CD22, CD26, CD30, CD33, CD37, CD38, CD40, CD44, CD56, CD79, CD105, CD138, EphA 수용체, EphB 수용체, EGFR, EGFRvIII, HER2, HER3, 메소텔린, 크립토, 알파v베타3 알파v베타5 알파v베타6 인터그린 또는 C242인 복합체.
- 제 5항에 있어서, 상기 항체는 My9-6, B4, C242, N901, DS6, EphA2 수용체, CD38, IGF-IR, CNTO 95, B-B4, 트라스투주맙(trastuzumab), 퍼투주맙(pertuzumab), 비바투주맙(bivatuzumab), 시브로투주맙(sibrotuzumab), 또는 리투시맙(rituximab)으로부터 선택되는 인간화, 인간 또는 재표면화 항체인 복합체.
- 제 2항 또는 제 4항에 있어서, 상기 세포결합제는 종양 세포; 바이러스 감염 세포, 미생물 감염 세포, 기생충 감염 세포, 자가면역 세포, 활성화 세포, 골수성 세포, 활성화 T-세포, B 세포, 또는 멜라닌 세포; IGF-IR, CanAg, EGFR, MUCl, MUC16, VEGF, TF, MY9, 항-B4, EpCAM, CD2, CD3, CD4, CD5, CD6, CD1l, CD11a, CD18, CD19, CD20, CD22, CD26, CD30, CD33, CD37, CD38, CD40, CD44, CD56, CD70, CD79, CD105, CD138, EphA 수용체, EphB 수용체, EGFRvIII, HER2/neu, HER3, 메소텔린, 크립토, 알파v베타3 인터그린, 알파v베타5 인터그린, 알파v베타6 인터그린, Apo2, 및 C242 항원 중 하나 또는 하나 이상을 발현하는 세포; 또는 인슐린 성장 인자 수용체, 표피 성장 인자 수용체 및 엽산 수용체를 발현하는 세포로부터 선택되는 표적 세포와 결합하는 복합체.
- 제 11항에 있어서, 상기 종양 세포는 유방암 세포, 전립선암 세포, 난소암 세포, 결장암 세포, 위암 세포, 편평암 세포, 소세포폐암 세포, 및 고환암 세포로부터 선택되는 복합체.
- 제 2항 또는 제 4항의 약물-세포결합제 복합체의 유효량과, 약제학상 허용가능한 염 또는 이들의 용매화물과, 약제학상 허용가능한 담체, 희석제 또는 부형제를 포함하는 약제 조성물.
- 제 2항 또는 제 4항의 복합체의 유효량을 이를 필요로 하는 환자에게 비경구 투여하는 것을 포함하는 치료에 민감한 질병을 치료하는 방법.
- 제 14항에 있어서, 상기 질병은 종양, 자가면역 질환, 이식 거부, 이식대숙주병, 바이러스성 감염, 및 기생충 감염으로부터 선택되는 치료에 민감한 질병을 치료하는 방법.
- 제 15항에 있어서, 상기 종양은 폐암, 혈액암, 혈장암, 유방암, 결장암, 전립선암, 신장암, 췌장암, 뇌암, 골암, 난소암, 고환암, 림프기관암 중 하나 또는 하나 이상으로부터 선택되는 복합체.
- 제 15항에 있어서, 상기 종양은 IGF-IR, FOLRl, CanAg, EGFR, EphA2, MUCl, MUC16, VEGF, TF, MY9, 항-B4, EpCAM, CD2, CD3, CD4, CD5, CD6, CDl1, CD11a, CD18, CD19, CD20, CD22, CD26, CD30, CD33, CD37, CD38, CD40, CD44, CD56, CD70, CD79, CD105, CD138, EphA, EphB, EGFRvIII, HER2/neu, HER3, 메소텔린, 크립토, 알파v베타3 인터그린, 알파v베타5 인터그린, 알파v베타6 인터그린, Apo2, 및 C242 항원 중 하나 또는 하나 이상을 발현하는 복합체.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US4928908P | 2008-04-30 | 2008-04-30 | |
| US61/049,289 | 2008-04-30 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20100137585A true KR20100137585A (ko) | 2010-12-30 |
Family
ID=41255418
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020107026963A KR20100137585A (ko) | 2008-04-30 | 2009-04-30 | 강력한 복합체 및 친수성 링커 |
Country Status (16)
| Country | Link |
|---|---|
| US (3) | US9150649B2 (ko) |
| EP (1) | EP2276506A4 (ko) |
| JP (2) | JP2011523628A (ko) |
| KR (1) | KR20100137585A (ko) |
| CN (2) | CN102083461B (ko) |
| AU (1) | AU2009243009B2 (ko) |
| BR (1) | BRPI0911442A2 (ko) |
| CA (1) | CA2722109A1 (ko) |
| IL (1) | IL208937A0 (ko) |
| MX (1) | MX2010011808A (ko) |
| NZ (1) | NZ588851A (ko) |
| RU (1) | RU2487877C2 (ko) |
| SG (1) | SG189817A1 (ko) |
| UA (1) | UA108598C2 (ko) |
| WO (2) | WO2009134952A2 (ko) |
| ZA (1) | ZA201007806B (ko) |
Families Citing this family (167)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US7276497B2 (en) * | 2003-05-20 | 2007-10-02 | Immunogen Inc. | Cytotoxic agents comprising new maytansinoids |
| WO2006012527A1 (en) | 2004-07-23 | 2006-02-02 | Endocyte, Inc. | Bivalent linkers and conjugates thereof |
| ES2390826T3 (es) | 2005-08-24 | 2012-11-16 | Immunogen Inc | Procedimiento para preparar conjugados de fármaco purificados |
| US9555139B2 (en) | 2007-03-14 | 2017-01-31 | Endocyte, Inc. | Binding ligand linked drug delivery conjugates of tubulysins |
| WO2008118970A2 (en) | 2007-03-27 | 2008-10-02 | Sea Lane Biotechnologies, Llc | Constructs and libraries comprising antibody surrogate light chain sequences |
| US9877965B2 (en) | 2007-06-25 | 2018-01-30 | Endocyte, Inc. | Vitamin receptor drug delivery conjugates for treating inflammation |
| US9138484B2 (en) | 2007-06-25 | 2015-09-22 | Endocyte, Inc. | Conjugates containing hydrophilic spacer linkers |
| AU2009243010B2 (en) | 2008-04-30 | 2015-02-05 | Immunogen, Inc. | Cross-linkers and their uses |
| SG189817A1 (en) | 2008-04-30 | 2013-05-31 | Immunogen Inc | Potent conjugates and hydrophilic linkers |
| US20120128671A1 (en) | 2009-05-13 | 2012-05-24 | Lawrence Horowitz | Neutralizing molecules to influenza viruses |
| AU2015201534B2 (en) * | 2009-06-03 | 2016-11-24 | Immunogen, Inc. | Conjugation methods |
| HUE043645T2 (hu) | 2009-06-03 | 2019-08-28 | Immunogen Inc | Konjugációs módszerek |
| FR2947269B1 (fr) | 2009-06-29 | 2013-01-18 | Sanofi Aventis | Nouveaux composes anticancereux |
| FR2949469A1 (fr) * | 2009-08-25 | 2011-03-04 | Sanofi Aventis | Derives anticancereux, leur preparation et leur application en therapeutique |
| JP2013504585A (ja) * | 2009-09-09 | 2013-02-07 | セントローズ, エルエルシー | 細胞外標的化薬物複合体 |
| UY32913A (es) * | 2009-10-02 | 2011-04-29 | Sanofi Aventis | Nuevos maitansinoides y el uso de dichos maitansinoides para preparar conjugados con un anticuero |
| JP2013506709A (ja) * | 2009-10-06 | 2013-02-28 | イミュノジェン・インコーポレーテッド | 有効なコンジュゲートおよび親水性リンカー |
| DK2538976T3 (en) | 2010-02-24 | 2017-02-27 | Immunogen Inc | IMMUNCONJUGATES AGAINST FOLATRECEPTOR-1 AND APPLICATIONS THEREOF |
| NZ602176A (en) | 2010-03-12 | 2015-01-30 | Immunogen Inc | Cd37-binding molecules and immunoconjugates thereof |
| FR2963007B1 (fr) | 2010-07-26 | 2013-04-05 | Sanofi Aventis | Derives anticancereux, leur preparation et leur application therapeutique |
| WO2012019024A2 (en) | 2010-08-04 | 2012-02-09 | Immunogen, Inc. | Her3-binding molecules and immunoconjugates thereof |
| TW201302793A (zh) | 2010-09-03 | 2013-01-16 | Glaxo Group Ltd | 新穎之抗原結合蛋白 |
| MX2013004761A (es) | 2010-10-29 | 2013-08-27 | Immunogen Inc | Nuevas moleculas de union al receptor del factor de crecimiento epidermico (egfr) e inmunoconjugados de estas. |
| BR112013010569A2 (pt) | 2010-10-29 | 2017-07-04 | Immunogen Inc | moléculas de ligação de egfr não antagonísticas e imunoconjugados das mesma |
| AU2011323316B2 (en) * | 2010-11-03 | 2016-02-25 | Immunogen, Inc. | Cytotoxic agents comprising new ansamitocin derivatives |
| CA2816426A1 (en) * | 2010-11-17 | 2012-06-07 | Genentech, Inc. | Alaninyl maytansinol antibody conjugates |
| EP3153504B1 (en) | 2010-12-09 | 2018-09-26 | ImmunoGen, Inc. | Methods for the preparation of charged crosslinkers |
| KR20190089048A (ko) | 2011-02-15 | 2019-07-29 | 이뮤노젠 아이엔씨 | 컨쥬게이트의 제조방법 |
| US20140079722A1 (en) * | 2011-03-09 | 2014-03-20 | Centrose, Llc | Extracellular targeted drug conjugates |
| PL2691155T3 (pl) | 2011-03-29 | 2019-06-28 | Immunogen, Inc. | Otrzymywanie koniugatu majtansynoidu przeciwciała jednoetapowym sposobem |
| WO2012135517A2 (en) | 2011-03-29 | 2012-10-04 | Immunogen, Inc. | Preparation of maytansinoid antibody conjugates by a one-step process |
| EA028805B1 (ru) | 2011-04-01 | 2018-01-31 | Иммьюноджен, Инк. | Способы повышения эффективности folr1 терапии рака |
| US20120282282A1 (en) * | 2011-04-04 | 2012-11-08 | Immunogen, Inc. | Methods for Decreasing Ocular Toxicity of Antibody Drug Conjugates |
| TW201245225A (en) * | 2011-04-21 | 2012-11-16 | Bristol Myers Squibb Co | Antibody polypeptides that antagonize CD40 |
| US8815226B2 (en) | 2011-06-10 | 2014-08-26 | Mersana Therapeutics, Inc. | Protein-polymer-drug conjugates |
| AU2012267447B2 (en) | 2011-06-10 | 2016-10-20 | Mersana Therapeutics, Inc. | Protein-polymer-drug conjugates |
| EP2736928B1 (en) | 2011-07-28 | 2019-01-09 | i2 Pharmaceuticals, Inc. | Sur-binding proteins against erbb3 |
| KR20140105765A (ko) | 2011-11-21 | 2014-09-02 | 이뮤노젠 아이엔씨 | EGfr 항체 세포독성제 접합체에 의한 EGfr 치료에 내성을 나타내는 종양의 치료 방법 |
| ES2710916T3 (es) | 2011-12-22 | 2019-04-29 | I2 Pharmaceuticals Inc | Proteínas de unión sustitutas |
| CN104023751B (zh) * | 2012-01-27 | 2016-11-09 | 弗·哈夫曼-拉罗切有限公司 | 靶向递送至表达vla-4的细胞的整联蛋白拮抗剂结合物 |
| WO2013126797A1 (en) | 2012-02-24 | 2013-08-29 | Purdue Research Foundation | Cholecystokinin b receptor targeting for imaging and therapy |
| US20140080175A1 (en) | 2012-03-29 | 2014-03-20 | Endocyte, Inc. | Processes for preparing tubulysin derivatives and conjugates thereof |
| RS60217B1 (sr) | 2012-08-31 | 2020-06-30 | Immunogen Inc | Dijagnostički testovi i kompleti za detekciju folatnog receptora 1 |
| US10035817B2 (en) | 2012-10-04 | 2018-07-31 | Immunogen, Inc. | Method of purifying cell-binding agent-cytotoxic agent conjugates with a PVDF membrane |
| WO2014055842A1 (en) * | 2012-10-04 | 2014-04-10 | Immunogen, Inc. | Process for preparing stable antibody maytansinoid conjugates |
| BR112015008365A2 (pt) | 2012-10-16 | 2017-07-04 | Endocyte Inc | composto da fórmula b-l(d)x, ou um sal farmaceuticamente aceitável do mesmo, composição farmacêutica, uso de um composto, composição de forma de dosagem unitária ou dose unitária, composição para tratar um câncer em um paciente, e método para tratar um câncer em um paciente |
| EP2911700B1 (en) * | 2012-10-24 | 2017-02-08 | Polytherics Limited | Drug-protein conjugates |
| NO2789793T3 (ko) | 2012-10-24 | 2018-01-27 | ||
| US10131682B2 (en) | 2012-11-24 | 2018-11-20 | Hangzhou Dac Biotech Co., Ltd. | Hydrophilic linkers and their uses for conjugation of drugs to a cell binding molecules |
| US9353150B2 (en) | 2012-12-04 | 2016-05-31 | Massachusetts Institute Of Technology | Substituted pyrazino[1′,2′:1 ,5]pyrrolo[2,3-b]-indole-1,4-diones for cancer treatment |
| CN104688740A (zh) * | 2012-12-21 | 2015-06-10 | 百奥泰生物科技(广州)有限公司 | 类美登素衍生物及其制备方法和用途 |
| CN103288957B (zh) | 2012-12-21 | 2015-01-28 | 百奥泰生物科技(广州)有限公司 | 一种抑制肿瘤生长的抗体药物衍生物及其制备方法和用途 |
| FR3002454B1 (fr) * | 2013-02-26 | 2015-04-10 | Commissariat Energie Atomique | Composition immunogene sous forme d'emulsion |
| US9968673B2 (en) * | 2013-02-26 | 2018-05-15 | Commissariat á l'ènergie atomique et aux ènergies alternatives | Immunogenic composition in emulsion form comprising two dispersed phases, one comprising an antigen and the other comprising an immunostimulating agent |
| US9999680B2 (en) * | 2013-02-28 | 2018-06-19 | Immunogen, Inc. | Conjugates comprising cell-binding agents and maytansinoids as cytotoxic agents |
| DK2968440T3 (da) | 2013-03-15 | 2019-07-22 | Zymeworks Inc | Cytotoksiske og antimitotiske forbindelser samt fremgangsmåder til anvendelse heraf |
| MA38496B2 (fr) | 2013-03-15 | 2021-01-29 | Regeneron Pharma | Molécules biologiquement actives, leurs conjugués, et utilisations thérapeutiques |
| WO2014177617A1 (en) * | 2013-05-02 | 2014-11-06 | F. Hoffmann-La Roche Ag | Combination therapy of an afucosylated cd20 antibody with a cd22 antibody-drug conjugate |
| US10208125B2 (en) | 2013-07-15 | 2019-02-19 | University of Pittsburgh—of the Commonwealth System of Higher Education | Anti-mucin 1 binding agents and uses thereof |
| TWI641620B (zh) | 2013-08-21 | 2018-11-21 | 再生元醫藥公司 | 抗-prlr抗體及其用途 |
| KR102252925B1 (ko) | 2013-08-26 | 2021-05-18 | 리제너론 파마슈티칼스 인코포레이티드 | 마크롤라이드 디아스테레오머를 포함하는 약제학적 조성물, 이의 합성 방법 및 치료학적 용도 |
| AU2014312086B2 (en) | 2013-08-30 | 2020-03-12 | Immunogen, Inc. | Antibodies and assays for detection of folate receptor 1 |
| SG10201801779XA (en) | 2013-09-05 | 2018-04-27 | Jackson Lab | Compositions for rna-chromatin interaction analysis and uses thereof |
| KR20220136468A (ko) | 2013-10-08 | 2022-10-07 | 이뮤노젠 아이엔씨 | 항-folr1 면역접합체 투여 레지멘 |
| RU2016117810A (ru) | 2013-10-11 | 2017-11-17 | Асана Биосайенсис, Ллк | Конъюгаты белок-полимер-лекарственное средство |
| CA2926586C (en) * | 2013-10-11 | 2020-04-07 | Mersana Therapeutics, Inc. | Polymeric scaffold based on phf for targeted drug delivery |
| CN103483357B (zh) * | 2013-10-12 | 2015-11-18 | 齐鲁制药有限公司 | 一种抗体-美登素偶联物的中间体新晶型及其制备方法 |
| US9562059B2 (en) * | 2013-12-02 | 2017-02-07 | Hong Kong Baptist University | Anticancer maytansinoids with two fused macrocyclic rings |
| MX2016008444A (es) | 2013-12-27 | 2017-01-11 | Zymeworks Inc | Sistemas de enlace que contienen sulfonamida para conjugados de farmacos. |
| JP2017510548A (ja) * | 2014-01-29 | 2017-04-13 | シャンハイ ヘンルイ ファーマスーティカル カンパニー リミテッドShanghai Hengrui Pharmaceutical Co., Ltd. | リガンド‐細胞傷害性薬物抱合体、その製造方法、およびその用途 |
| MY178160A (en) | 2014-03-11 | 2020-10-06 | Regeneron Pharma | Anti-egfrviii antibodies and uses thereof |
| MA39774A (fr) | 2014-03-24 | 2021-05-12 | Roche Sequencing Solutions Inc | Procédés chimiques pour produire des nucléotides étiquetés |
| CN106856656B (zh) * | 2014-04-29 | 2021-01-26 | 启德医药科技(苏州)有限公司 | 一种稳定型抗体药物耦联物及其制备方法和用途 |
| CA2953371C (en) | 2014-06-30 | 2021-08-24 | Tarveda Therapeutics, Inc. | Targeted conjugates and particles and formulations thereof |
| ES2785551T3 (es) | 2014-06-30 | 2020-10-07 | Glykos Finland Oy | Derivado de sacárido de una carga útil tóxica y sus conjugados con anticuerpos |
| EP3188761A4 (en) | 2014-09-02 | 2018-04-18 | ImmunoGen, Inc. | Methods for formulating antibody drug conjugate compositions |
| US9669102B2 (en) | 2014-09-03 | 2017-06-06 | Immunogen, Inc. | Cytotoxic benzodiazepine derivatives |
| EP3189057A1 (en) | 2014-09-03 | 2017-07-12 | ImmunoGen, Inc. | Cytotoxic benzodiazepine derivatives |
| RU2017110068A (ru) | 2014-09-03 | 2018-10-03 | Иммуноджен, Инк. | Конъюгаты, содержащие клеточносвязывающие агенты и цитотоксические агенты |
| PL3194421T3 (pl) | 2014-09-17 | 2022-02-28 | Zymeworks Inc. | Związki cytotoksyczne i przeciwmitotyczne oraz sposoby ich wykorzystania |
| KR20170131587A (ko) | 2015-03-27 | 2017-11-29 | 리제너론 파아마슈티컬스, 인크. | 메이탄시노이드 유도체, 이의 컨주게이트, 및 사용 방법 |
| RS60222B1 (sr) | 2015-05-04 | 2020-06-30 | Cytomx Therapeutics Inc | Anti-cd166 antitela koja mogu da se aktiviraju i postupci za njihovu upotrebu |
| WO2016197946A1 (zh) * | 2015-06-09 | 2016-12-15 | 凯惠科技发展(上海)有限公司 | 抗体药物偶联物、中间体、制备方法、药物组合物及应用 |
| SI3313845T1 (sl) | 2015-06-29 | 2021-01-29 | Immunogen, Inc. | Konjugati spremenjenih protiteles cisteina |
| EP3317246A4 (en) * | 2015-07-04 | 2019-02-27 | Suzhou M-conj Biotech Co., Ltd. | SPECIFIC CONJUGATION OF A CELL BINDING MOLECULE |
| KR20180025865A (ko) | 2015-07-06 | 2018-03-09 | 리제너론 파마슈티칼스 인코포레이티드 | 다중특이적 항원 결합 분자 및 이의 용도 |
| WO2017015495A1 (en) | 2015-07-21 | 2017-01-26 | Immunogen, Inc. | Methods of preparing cytotoxic benzodiazepine derivatives |
| EP3331569A1 (en) | 2015-08-07 | 2018-06-13 | Gamamabs Pharma | Antibodies, antibody drug conjugates and methods of use |
| CN108601828B (zh) | 2015-09-17 | 2023-04-28 | 伊缪诺金公司 | 包含抗folr1免疫缀合物的治疗组合 |
| EP3368546A4 (en) | 2015-10-28 | 2019-06-26 | Tarveda Therapeutics, Inc. | SSTR TARGETED CONJUGATES, AND ITS PARTICLES AND FORMULATIONS |
| ES2956013T3 (es) | 2015-11-10 | 2023-12-11 | Childrens Res Institute Childrens National Medical Center | Formulación de equinomicina, método de producción y método de uso de la misma |
| US20170189548A1 (en) | 2015-11-25 | 2017-07-06 | Immunogen, Inc. | Pharmaceutical formulations and methods of use thereof |
| US20180362654A1 (en) | 2015-12-11 | 2018-12-20 | Regeneron Pharmaceuticals, Inc. | Methods for Reducing or Preventing Growth of Tumors Resistant to EGFR and/or ErbB3 Blockade |
| CA3011440A1 (en) | 2016-01-25 | 2017-08-03 | Regeneron Pharmaceuticals, Inc. | Maytansinoid derivatives, conjugates thereof, and methods of use |
| MX2018010562A (es) * | 2016-03-02 | 2019-02-20 | Eisai R&D Man Co Ltd | Conjugados de anticuerpo y farmaco basados en eribulina y metodos para su uso. |
| CN109071419A (zh) * | 2016-03-07 | 2018-12-21 | 韩美药品株式会社 | 聚乙二醇衍生物及其用途 |
| US11352446B2 (en) | 2016-04-28 | 2022-06-07 | Regeneron Pharmaceuticals, Inc. | Methods of making multispecific antigen-binding molecules |
| WO2017197045A1 (en) | 2016-05-11 | 2017-11-16 | Movassaghi Mohammad | Convergent and enantioselective total synthesis of communesin analogs |
| RS61828B1 (sr) | 2016-06-08 | 2021-06-30 | Abbvie Inc | Anti-b7-h3 antitela i antitelske konjugacije lekova |
| WO2018002902A1 (en) | 2016-07-01 | 2018-01-04 | Glaxosmithkline Intellectual Property (No.2) Limited | Antibody-drug conjugates and therapeutic methods using the same |
| RU2653443C2 (ru) * | 2016-07-15 | 2018-05-08 | Закрытое Акционерное Общество "Биокад" | Биспецифичные анти-her2/анти-her3 антитела |
| SI3515946T1 (sl) | 2016-09-23 | 2022-09-30 | Regeneron Pharmaceuticals, Inc. | Protitelesa proti-MUC16 (MUCIN 16) |
| KR102520731B1 (ko) | 2016-09-23 | 2023-04-14 | 리제너론 파아마슈티컬스, 인크. | 항-steap2 항체, 항체-약물 컨쥬게이트, 및 steap2 및 cd3에 결합하는 이중특이적 항원-결합 분자, 및 이의 용도 |
| BR112019009019A2 (pt) | 2016-11-08 | 2019-07-09 | Regeneron Pharma | esteroides e conjugados de proteínas dos mesmos |
| TWI782930B (zh) | 2016-11-16 | 2022-11-11 | 美商再生元醫藥公司 | 抗met抗體,結合met之雙特異性抗原結合分子及其使用方法 |
| KR20230133935A (ko) | 2016-11-23 | 2023-09-19 | 이뮤노젠 아이엔씨 | 벤조다이아제핀 유도체의 선택적인 설폰화 |
| CN110382534B (zh) | 2016-11-29 | 2023-05-09 | 里珍纳龙药品有限公司 | 治疗prlr阳性乳腺癌的方法 |
| PL3558391T3 (pl) | 2016-12-23 | 2022-05-16 | Immunogen, Inc. | Immunokoniugaty skierowane wobec białka adam9 i sposoby ich stosowania |
| TW201825515A (zh) | 2017-01-04 | 2018-07-16 | 美商伊繆諾金公司 | Met抗體以及其免疫結合物及用途 |
| CN116785450A (zh) | 2017-02-28 | 2023-09-22 | 伊缪诺金公司 | 具有自分解肽接头的类美登素衍生物和其缀合物 |
| CN110475569B (zh) | 2017-02-28 | 2023-11-21 | 第一三共株式会社 | Egfr-tki耐受性的非小细胞肺癌的治疗剂以及抗her3抗体-药物偶联物的应用 |
| EP3381474A1 (en) * | 2017-03-27 | 2018-10-03 | Alfasigma S.p.A. | Histone deacetylase inhibitors-based antibody drug conjugates (adcs) and use in therapy |
| CN110475802B (zh) | 2017-03-30 | 2022-03-08 | 日油株式会社 | 异双官能性单分散聚乙二醇以及使用该异双官能性单分散聚乙二醇的缀合物 |
| US20180346488A1 (en) | 2017-04-20 | 2018-12-06 | Immunogen, Inc. | Cytotoxic benzodiazepine derivatives and conjugates thereof |
| WO2018209239A1 (en) | 2017-05-11 | 2018-11-15 | Massachusetts Institute Of Technology | Potent agelastatin derivatives as modulators for cancer invasion and metastasis |
| JP7364471B2 (ja) | 2017-05-18 | 2023-10-18 | レゲネロン ファーマシューティカルス,インコーポレーテッド | シクロデキストリンタンパク質薬物コンジュゲート |
| CN111065622A (zh) | 2017-05-18 | 2020-04-24 | 里珍纳龙药品有限公司 | 双八氢菲羧酰胺类化合物及其蛋白质偶联物 |
| KR20200017519A (ko) * | 2017-06-20 | 2020-02-18 | 소렌토 쎄라퓨틱스, 인코포레이티드 | Cd38 항체 약물 접합체 |
| US10640508B2 (en) | 2017-10-13 | 2020-05-05 | Massachusetts Institute Of Technology | Diazene directed modular synthesis of compounds with quaternary carbon centers |
| CN109771658B (zh) * | 2017-11-14 | 2021-12-10 | 博瑞生物医药(苏州)股份有限公司 | 靶向多臂偶联物 |
| EP3732178A1 (en) | 2017-12-28 | 2020-11-04 | ImmunoGen, Inc. | Benzodiazepine derivatives |
| MX2020006994A (es) | 2018-01-08 | 2020-11-06 | Regeneron Pharma | Esteroides y conjugados de anticuerpos de los mismos. |
| WO2019140141A1 (en) * | 2018-01-12 | 2019-07-18 | Immunogen, Inc. | Methods for antibody drug conjugation, purification, and formulation |
| US20210246224A1 (en) | 2018-04-30 | 2021-08-12 | Regeneron Pharmaceuticals, Inc. | Antibodies, and bispecific antigen-binding molecules that bind her2 and/or aplp2, conjugates, and uses thereof |
| KR20210008008A (ko) | 2018-05-09 | 2021-01-20 | 리제너론 파마슈티칼스 인코포레이티드 | 항-msr1 항체 및 이의 사용 방법 |
| EA202091135A1 (ru) | 2018-05-09 | 2020-10-14 | Регенерон Фармасьютикалз, Инк. | Гидрофильные линкеры для конъюгатов антитело-лекарственное средство |
| US20210079109A1 (en) | 2018-05-17 | 2021-03-18 | Regeneron Pharmaceuticals, Inc. | Anti-cd63 antibodies, conjugates, and uses thereof |
| EP3814378A1 (en) | 2018-06-26 | 2021-05-05 | ImmunoGen, Inc. | Immunoconjugates targeting adam9 and methods of use thereof |
| WO2020014306A1 (en) | 2018-07-10 | 2020-01-16 | Immunogen, Inc. | Met antibodies and immunoconjugates and uses thereof |
| KR20210062005A (ko) | 2018-09-20 | 2021-05-28 | 다이이찌 산쿄 가부시키가이샤 | 항 her3 항체-약물 콘쥬게이트 투여에 의한 her3 변이암의 치료 |
| CN109350748B (zh) * | 2018-10-24 | 2021-06-11 | 沈阳药科大学 | 氧化还原双敏感键桥连小分子前药及其自组装纳米粒 |
| TW202029980A (zh) | 2018-10-26 | 2020-08-16 | 美商免疫遺傳股份有限公司 | E p C A M 抗體、可活化抗體及免疫偶聯物以及其用途 |
| MA53455B1 (fr) | 2018-11-20 | 2022-11-30 | Regeneron Pharma | Dérivés de bis-octahydrophénanthrène carboxamide et leurs conjugués protéiques destinés à être utilisés en tant qu'agonistes de lxr |
| CA3123607A1 (en) | 2018-12-21 | 2020-06-25 | Regeneron Pharmaceuticals, Inc. | Rifamycin analogs and antibody-drug conjugates thereof |
| MX2021007235A (es) | 2018-12-21 | 2021-09-23 | Regeneron Pharma | Tubulisinas y conjugados de proteina-tubulisina. |
| CN113905767A (zh) | 2019-01-08 | 2022-01-07 | 里珍纳龙药品有限公司 | 无痕连接体及其蛋白质偶联物 |
| JP2022523360A (ja) | 2019-02-21 | 2022-04-22 | リジェネロン・ファーマシューティカルズ・インコーポレイテッド | Metに結合する抗met抗体および二特異性抗原結合分子を使用した眼癌の治療方法 |
| US20220162299A1 (en) | 2019-03-20 | 2022-05-26 | The Regents Of The University Of California | Claudin-6 antibodies and drug conjugates |
| CN113661172A (zh) | 2019-03-29 | 2021-11-16 | 伊缪诺金公司 | 用于抑制异常细胞生长或治疗增生性疾病的细胞毒性双苯并二氮杂䓬衍生物及其与细胞结合剂的缀合物 |
| PT3958977T (pt) | 2019-04-26 | 2023-12-15 | Immunogen Inc | Derivados de camptotecina |
| US11535634B2 (en) | 2019-06-05 | 2022-12-27 | Massachusetts Institute Of Technology | Compounds, conjugates, and compositions of epipolythiodiketopiperazines and polythiodiketopiperazines and uses thereof |
| EP3996749A1 (en) | 2019-07-10 | 2022-05-18 | Cybrexa 3, Inc. | Peptide conjugates of microtubule-targeting agents as therapeutics |
| US11634508B2 (en) | 2019-07-10 | 2023-04-25 | Cybrexa 2, Inc. | Peptide conjugates of cytotoxins as therapeutics |
| EP4031574A1 (en) | 2019-09-16 | 2022-07-27 | Regeneron Pharmaceuticals, Inc. | Radiolabeled met binding proteins for immuno-pet imaging |
| US11814428B2 (en) | 2019-09-19 | 2023-11-14 | Regeneron Pharmaceuticals, Inc. | Anti-PTCRA antibody-drug conjugates and uses thereof |
| JP2023511956A (ja) | 2020-01-24 | 2023-03-23 | レゲネロン ファーマシューティカルス,インコーポレーテッド | タンパク質-抗ウイルス化合物コンジュゲート |
| MX2022010457A (es) | 2020-02-25 | 2022-11-16 | Mediboston Ltd | Derivados de camptotecina y conjugados de esta. |
| JP2023515941A (ja) | 2020-02-28 | 2023-04-17 | リジェネロン・ファーマシューティカルズ・インコーポレイテッド | Her2に結合する二重特異性抗原結合分子およびその使用方法 |
| MX2022012821A (es) | 2020-04-16 | 2022-11-07 | Regeneron Pharma | Metodos de conjugacion de diels-alder. |
| WO2021262910A2 (en) | 2020-06-24 | 2021-12-30 | Regeneron Pharmaceuticals, Inc. | Tubulysins and protein-tubulysin conjugates |
| WO2022010797A2 (en) | 2020-07-07 | 2022-01-13 | Bionecure Therapeutics, Inc. | Novel maytansinoids as adc payloads and their use for the treatment of cancer |
| KR20240038138A (ko) | 2020-07-13 | 2024-03-22 | 리제너론 파마슈티칼스 인코포레이티드 | 단백질에서 글루타민 잔기에 접합된 캄토테신 유사체 및 그의 용도 |
| BR112023000711A2 (pt) | 2020-07-17 | 2023-01-31 | Daiichi Sankyo Co Ltd | Método para produzir uma composição de conjugado de anticorpo-fármaco, e, composição de conjugado de anticorpo-fármaco |
| WO2022056494A1 (en) | 2020-09-14 | 2022-03-17 | Regeneron Pharmaceuticals, Inc. | Antibody-drug conjugates comprising glp1 peptidomimetics and uses thereof |
| MX2023004434A (es) | 2020-10-22 | 2023-05-08 | Regeneron Pharma | Anticuerpos anti-fgfr2 y metodos para usarlos. |
| UY39610A (es) | 2021-01-20 | 2022-08-31 | Abbvie Inc | Conjugados anticuerpo-fármaco anti-egfr |
| US20220378929A1 (en) | 2021-02-25 | 2022-12-01 | MediBoston Limted | Anti-her2 antibody-drug conjugates and uses thereof |
| EP4304658A1 (en) | 2021-03-08 | 2024-01-17 | Genequantum Healthcare (Suzhou) Co., Ltd. | Antibody-immune agonist conjugate and applications thereof |
| WO2022218331A1 (en) | 2021-04-14 | 2022-10-20 | Genequantum Healthcare (Suzhou) Co., Ltd. | Linkers, conjugates and applications thereof |
| CA3220081A1 (en) | 2021-07-28 | 2023-02-02 | Thomas Nittoli | Protein-antiviral compound conjugates |
| WO2023114861A1 (en) * | 2021-12-15 | 2023-06-22 | The Administrators Of The Tulane Educational Fund | Conjugates, their compositions, and their related methods |
| WO2023129518A1 (en) | 2021-12-29 | 2023-07-06 | Regeneron Pharmaceuticals, Inc. | Tubulysins and protein-tubulysin conjugates |
| WO2023137026A1 (en) | 2022-01-12 | 2023-07-20 | Regeneron Pharmaceuticals, Inc. | Camptothecin analogs conjugated to a glutamine residue in a protein, and their use |
| US20230277682A1 (en) | 2022-01-14 | 2023-09-07 | Regeneron Pharmaceuticals, Inc. | Verrucarin a derivatives and antibody drug conjugates thereof |
| WO2023173132A1 (en) | 2022-03-11 | 2023-09-14 | Regeneron Pharmaceuticals, Inc. | Anti-glp1r antibody-drug conjugates comprising glp1 peptidomimetics and uses thereof |
| WO2024020164A2 (en) | 2022-07-21 | 2024-01-25 | Firefly Bio, Inc. | Glucocorticoid receptor agonists and conjugates thereof |
| US20240108744A1 (en) | 2022-07-27 | 2024-04-04 | Mediboston Limited | Auristatin derivatives and conjugates thereof |
Family Cites Families (22)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6958212B1 (en) * | 1999-02-01 | 2005-10-25 | Eidgenossische Technische Hochschule Zurich | Conjugate addition reactions for the controlled delivery of pharmaceutically active compounds |
| US7291673B2 (en) * | 2000-06-02 | 2007-11-06 | Eidgenossiche Technische Hochschule Zurich | Conjugate addition reactions for the controlled delivery of pharmaceutically active compounds |
| US7157458B2 (en) * | 2001-04-17 | 2007-01-02 | Cryolife, Inc. | Bifunctional energy-reversible acyl-compositions |
| WO2002087497A2 (en) * | 2001-04-26 | 2002-11-07 | Board Of Regents, The University Of Texas System | Therapeutic agent/ligand conjugate compositions, their methods of synthesis and use |
| US6441163B1 (en) * | 2001-05-31 | 2002-08-27 | Immunogen, Inc. | Methods for preparation of cytotoxic conjugates of maytansinoids and cell binding agents |
| US6716821B2 (en) * | 2001-12-21 | 2004-04-06 | Immunogen Inc. | Cytotoxic agents bearing a reactive polyethylene glycol moiety, cytotoxic conjugates comprising polyethylene glycol linking groups, and methods of making and using the same |
| US8877901B2 (en) * | 2002-12-13 | 2014-11-04 | Immunomedics, Inc. | Camptothecin-binding moiety conjugates |
| US6596757B1 (en) * | 2002-05-14 | 2003-07-22 | Immunogen Inc. | Cytotoxic agents comprising polyethylene glycol-containing taxanes and their therapeutic use |
| US8088387B2 (en) | 2003-10-10 | 2012-01-03 | Immunogen Inc. | Method of targeting specific cell populations using cell-binding agent maytansinoid conjugates linked via a non-cleavable linker, said conjugates, and methods of making said conjugates |
| US7276497B2 (en) * | 2003-05-20 | 2007-10-02 | Immunogen Inc. | Cytotoxic agents comprising new maytansinoids |
| CA2525130C (en) | 2003-05-20 | 2014-04-15 | Immunogen, Inc. | Improved cytotoxic agents comprising new maytansinoids |
| US9005625B2 (en) * | 2003-07-25 | 2015-04-14 | Novo Nordisk A/S | Antibody toxin conjugates |
| ZA200601182B (en) * | 2003-10-10 | 2007-04-25 | Immunogen Inc | Method of targeting specific cell populations using cell-binding agent maytansinoid conjugates linked via a non-cleavable linker, said conjugates, and methods of making said conjugates |
| CN114053429A (zh) * | 2004-06-01 | 2022-02-18 | 健泰科生物技术公司 | 抗体-药物偶联物和方法 |
| RU2412947C2 (ru) * | 2004-09-23 | 2011-02-27 | Дженентек, Инк. | Антитела, сконструированные на основе цистеинов, и их конъюгаты |
| US20060121042A1 (en) * | 2004-10-27 | 2006-06-08 | Medimmune, Inc. | Modulation of antibody specificity by tailoring the affinity to cognate antigens |
| WO2006086733A2 (en) * | 2005-02-11 | 2006-08-17 | Immunogen, Inc. | Process for preparing maytansinoid antibody conjugates |
| US20090226465A1 (en) * | 2005-10-31 | 2009-09-10 | Jackson David Y | Macrocyclic depsipeptide antibody-drug conjugates and methods |
| KR101328756B1 (ko) * | 2006-05-30 | 2013-11-18 | 제넨테크, 인크. | 항체 및 면역접합체 및 이들의 용도 |
| US20080311040A1 (en) * | 2007-03-06 | 2008-12-18 | Flagship Ventures | METHODS AND COMPOSITIONS FOR IMPROVED THERAPEUTIC EFFECTS WITH siRNA |
| CN101802013B (zh) * | 2007-07-16 | 2014-07-02 | 健泰科生物技术公司 | 人源化抗cd79b抗体和免疫偶联物及使用方法 |
| SG189817A1 (en) | 2008-04-30 | 2013-05-31 | Immunogen Inc | Potent conjugates and hydrophilic linkers |
-
2009
- 2009-04-30 SG SG2013033188A patent/SG189817A1/en unknown
- 2009-04-30 EP EP09739778.0A patent/EP2276506A4/en not_active Withdrawn
- 2009-04-30 BR BRPI0911442-4A patent/BRPI0911442A2/pt not_active IP Right Cessation
- 2009-04-30 KR KR1020107026963A patent/KR20100137585A/ko active IP Right Grant
- 2009-04-30 CN CN200980125295.2A patent/CN102083461B/zh not_active Expired - Fee Related
- 2009-04-30 RU RU2010148740/04A patent/RU2487877C2/ru not_active IP Right Cessation
- 2009-04-30 AU AU2009243009A patent/AU2009243009B2/en not_active Ceased
- 2009-04-30 MX MX2010011808A patent/MX2010011808A/es active IP Right Grant
- 2009-04-30 WO PCT/US2009/042203 patent/WO2009134952A2/en active Application Filing
- 2009-04-30 UA UAA201014270A patent/UA108598C2/ru unknown
- 2009-04-30 CN CN201410407711.0A patent/CN104258413A/zh active Pending
- 2009-04-30 CA CA2722109A patent/CA2722109A1/en not_active Abandoned
- 2009-04-30 JP JP2011507633A patent/JP2011523628A/ja not_active Withdrawn
- 2009-04-30 NZ NZ588851A patent/NZ588851A/xx not_active IP Right Cessation
- 2009-04-30 WO PCT/US2009/042259 patent/WO2009134976A1/en active Application Filing
- 2009-10-06 US US12/574,466 patent/US9150649B2/en not_active Expired - Fee Related
-
2010
- 2010-10-26 IL IL208937A patent/IL208937A0/en unknown
- 2010-11-01 ZA ZA2010/07806A patent/ZA201007806B/en unknown
-
2012
- 2012-05-17 US US13/473,974 patent/US20120226026A1/en not_active Abandoned
-
2015
- 2015-04-24 JP JP2015089052A patent/JP5980989B2/ja not_active Expired - Fee Related
- 2015-08-25 US US14/835,236 patent/US20160114052A1/en not_active Abandoned
Also Published As
| Publication number | Publication date |
|---|---|
| US9150649B2 (en) | 2015-10-06 |
| IL208937A0 (en) | 2011-01-31 |
| NZ588851A (en) | 2013-05-31 |
| CN102083461A (zh) | 2011-06-01 |
| RU2487877C2 (ru) | 2013-07-20 |
| US20100129314A1 (en) | 2010-05-27 |
| AU2009243009A1 (en) | 2009-11-05 |
| WO2009134952A2 (en) | 2009-11-05 |
| ZA201007806B (en) | 2013-01-30 |
| WO2009134976A1 (en) | 2009-11-05 |
| RU2010148740A (ru) | 2012-06-10 |
| UA108598C2 (xx) | 2015-05-25 |
| CA2722109A1 (en) | 2009-11-05 |
| WO2009134952A3 (en) | 2010-01-07 |
| MX2010011808A (es) | 2011-03-04 |
| EP2276506A4 (en) | 2014-05-07 |
| JP2011523628A (ja) | 2011-08-18 |
| CN104258413A (zh) | 2015-01-07 |
| JP5980989B2 (ja) | 2016-08-31 |
| BRPI0911442A2 (pt) | 2019-03-12 |
| CN102083461B (zh) | 2014-09-17 |
| US20120226026A1 (en) | 2012-09-06 |
| US20160114052A1 (en) | 2016-04-28 |
| SG189817A1 (en) | 2013-05-31 |
| AU2009243009B2 (en) | 2014-09-11 |
| EP2276506A1 (en) | 2011-01-26 |
| JP2015163622A (ja) | 2015-09-10 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP5980989B2 (ja) | 有効なコンジュゲートおよび親水性リンカー | |
| WO2010126551A1 (en) | Potent conjugates and hydrophilic linkers | |
| KR101343676B1 (ko) | 메이탠시노이드 화합물 | |
| AU2006236489B2 (en) | Elimination of heterogeneous or mixed cell population in tumors | |
| JP2013506709A5 (ko) |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A201 | Request for examination | ||
| E902 | Notification of reason for refusal | ||
| E701 | Decision to grant or registration of patent right |