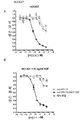
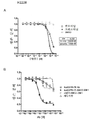
KR20140105765A - EGfr 항체 세포독성제 접합체에 의한 EGfr 치료에 내성을 나타내는 종양의 치료 방법 - Google Patents
EGfr 항체 세포독성제 접합체에 의한 EGfr 치료에 내성을 나타내는 종양의 치료 방법 Download PDFInfo
- Publication number
- KR20140105765A KR20140105765A KR1020147016745A KR20147016745A KR20140105765A KR 20140105765 A KR20140105765 A KR 20140105765A KR 1020147016745 A KR1020147016745 A KR 1020147016745A KR 20147016745 A KR20147016745 A KR 20147016745A KR 20140105765 A KR20140105765 A KR 20140105765A
- Authority
- KR
- South Korea
- Prior art keywords
- egfr
- antibody
- cancer
- cell
- patient
- Prior art date
Links
- 238000000034 method Methods 0.000 title claims abstract description 67
- 206010028980 Neoplasm Diseases 0.000 title claims description 123
- 238000011282 treatment Methods 0.000 title claims description 56
- 229940127089 cytotoxic agent Drugs 0.000 title claims description 34
- 108060006698 EGF receptor Proteins 0.000 title claims description 32
- 239000002254 cytotoxic agent Substances 0.000 title claims description 23
- 231100000599 cytotoxic agent Toxicity 0.000 title claims description 22
- 238000002560 therapeutic procedure Methods 0.000 title claims description 16
- 229940127121 immunoconjugate Drugs 0.000 claims abstract description 75
- 210000004881 tumor cell Anatomy 0.000 claims abstract description 60
- 230000004614 tumor growth Effects 0.000 claims abstract description 18
- 230000002401 inhibitory effect Effects 0.000 claims abstract description 14
- 210000004027 cell Anatomy 0.000 claims description 182
- 201000011510 cancer Diseases 0.000 claims description 78
- 230000035772 mutation Effects 0.000 claims description 56
- 108090000623 proteins and genes Proteins 0.000 claims description 33
- 102000001301 EGF receptor Human genes 0.000 claims description 31
- 239000000427 antigen Substances 0.000 claims description 30
- 108091007433 antigens Proteins 0.000 claims description 30
- 102000036639 antigens Human genes 0.000 claims description 30
- 229960005395 cetuximab Drugs 0.000 claims description 30
- 239000002246 antineoplastic agent Substances 0.000 claims description 27
- 239000012634 fragment Substances 0.000 claims description 27
- 229940121647 egfr inhibitor Drugs 0.000 claims description 26
- -1 N-maleimidopropionamido Chemical group 0.000 claims description 22
- 208000002154 non-small cell lung carcinoma Diseases 0.000 claims description 22
- 229920001223 polyethylene glycol Polymers 0.000 claims description 22
- 208000029729 tumor suppressor gene on chromosome 11 Diseases 0.000 claims description 22
- 230000004913 activation Effects 0.000 claims description 21
- AAKJLRGGTJKAMG-UHFFFAOYSA-N erlotinib Chemical compound C=12C=C(OCCOC)C(OCCOC)=CC2=NC=NC=1NC1=CC=CC(C#C)=C1 AAKJLRGGTJKAMG-UHFFFAOYSA-N 0.000 claims description 21
- 230000037361 pathway Effects 0.000 claims description 16
- 230000004544 DNA amplification Effects 0.000 claims description 14
- AOJJSUZBOXZQNB-TZSSRYMLSA-N Doxorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(=O)CO)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 AOJJSUZBOXZQNB-TZSSRYMLSA-N 0.000 claims description 14
- 239000000203 mixture Substances 0.000 claims description 14
- 101000605639 Homo sapiens Phosphatidylinositol 4,5-bisphosphate 3-kinase catalytic subunit alpha isoform Proteins 0.000 claims description 13
- 102100038332 Phosphatidylinositol 4,5-bisphosphate 3-kinase catalytic subunit alpha isoform Human genes 0.000 claims description 13
- 229940122531 Anaplastic lymphoma kinase inhibitor Drugs 0.000 claims description 12
- 101001034652 Homo sapiens Insulin-like growth factor 1 receptor Proteins 0.000 claims description 12
- 102100039688 Insulin-like growth factor 1 receptor Human genes 0.000 claims description 12
- 239000005551 L01XE03 - Erlotinib Substances 0.000 claims description 12
- 108010011536 PTEN Phosphohydrolase Proteins 0.000 claims description 11
- 102000014160 PTEN Phosphohydrolase Human genes 0.000 claims description 11
- 101150040459 RAS gene Proteins 0.000 claims description 11
- 101150076031 RAS1 gene Proteins 0.000 claims description 11
- 229960001433 erlotinib Drugs 0.000 claims description 11
- 102000016914 ras Proteins Human genes 0.000 claims description 11
- 102100033793 ALK tyrosine kinase receptor Human genes 0.000 claims description 10
- 101710168331 ALK tyrosine kinase receptor Proteins 0.000 claims description 10
- 239000005411 L01XE02 - Gefitinib Substances 0.000 claims description 10
- XGALLCVXEZPNRQ-UHFFFAOYSA-N gefitinib Chemical compound C=12C=C(OCCCN3CCOCC3)C(OC)=CC2=NC=NC=1NC1=CC=C(F)C(Cl)=C1 XGALLCVXEZPNRQ-UHFFFAOYSA-N 0.000 claims description 10
- 101150105382 MET gene Proteins 0.000 claims description 9
- 150000002148 esters Chemical class 0.000 claims description 9
- 229960002584 gefitinib Drugs 0.000 claims description 9
- 230000012010 growth Effects 0.000 claims description 9
- 238000004519 manufacturing process Methods 0.000 claims description 9
- 230000005945 translocation Effects 0.000 claims description 9
- 101001012157 Homo sapiens Receptor tyrosine-protein kinase erbB-2 Proteins 0.000 claims description 8
- 206010027476 Metastases Diseases 0.000 claims description 8
- 102100030086 Receptor tyrosine-protein kinase erbB-2 Human genes 0.000 claims description 8
- 208000020816 lung neoplasm Diseases 0.000 claims description 8
- 230000009401 metastasis Effects 0.000 claims description 8
- 201000010536 head and neck cancer Diseases 0.000 claims description 7
- 208000014829 head and neck neoplasm Diseases 0.000 claims description 7
- 239000003112 inhibitor Substances 0.000 claims description 7
- 229940002612 prodrug Drugs 0.000 claims description 7
- 239000000651 prodrug Substances 0.000 claims description 7
- PVGATNRYUYNBHO-UHFFFAOYSA-N (2,5-dioxopyrrolidin-1-yl) 4-(2,5-dioxopyrrol-1-yl)butanoate Chemical compound O=C1CCC(=O)N1OC(=O)CCCN1C(=O)C=CC1=O PVGATNRYUYNBHO-UHFFFAOYSA-N 0.000 claims description 6
- JSHOVKSMJRQOGY-UHFFFAOYSA-N (2,5-dioxopyrrolidin-1-yl) 4-(pyridin-2-yldisulfanyl)butanoate Chemical compound O=C1CCC(=O)N1OC(=O)CCCSSC1=CC=CC=N1 JSHOVKSMJRQOGY-UHFFFAOYSA-N 0.000 claims description 6
- GTBCXYYVWHFQRS-UHFFFAOYSA-N (2,5-dioxopyrrolidin-1-yl) 4-(pyridin-2-yldisulfanyl)pentanoate Chemical group C=1C=CC=NC=1SSC(C)CCC(=O)ON1C(=O)CCC1=O GTBCXYYVWHFQRS-UHFFFAOYSA-N 0.000 claims description 6
- 206010058467 Lung neoplasm malignant Diseases 0.000 claims description 6
- 229940034982 antineoplastic agent Drugs 0.000 claims description 6
- 201000005202 lung cancer Diseases 0.000 claims description 6
- UOWVMDUEMSNCAV-WYENRQIDSA-N rachelmycin Chemical compound C1([C@]23C[C@@H]2CN1C(=O)C=1NC=2C(OC)=C(O)C4=C(C=2C=1)CCN4C(=O)C1=CC=2C=4CCN(C=4C(O)=C(C=2N1)OC)C(N)=O)=CC(=O)C1=C3C(C)=CN1 UOWVMDUEMSNCAV-WYENRQIDSA-N 0.000 claims description 6
- 239000000126 substance Substances 0.000 claims description 6
- 101150029707 ERBB2 gene Proteins 0.000 claims description 5
- AMRJKAQTDDKMCE-UHFFFAOYSA-N dolastatin Chemical compound CC(C)C(N(C)C)C(=O)NC(C(C)C)C(=O)N(C)C(C(C)C)C(OC)CC(=O)N1CCCC1C(OC)C(C)C(=O)NC(C=1SC=CN=1)CC1=CC=CC=C1 AMRJKAQTDDKMCE-UHFFFAOYSA-N 0.000 claims description 5
- 229960004679 doxorubicin Drugs 0.000 claims description 5
- 206010041823 squamous cell carcinoma Diseases 0.000 claims description 5
- FWMNVWWHGCHHJJ-SKKKGAJSSA-N 4-amino-1-[(2r)-6-amino-2-[[(2r)-2-[[(2r)-2-[[(2r)-2-amino-3-phenylpropanoyl]amino]-3-phenylpropanoyl]amino]-4-methylpentanoyl]amino]hexanoyl]piperidine-4-carboxylic acid Chemical compound C([C@H](C(=O)N[C@H](CC(C)C)C(=O)N[C@H](CCCCN)C(=O)N1CCC(N)(CC1)C(O)=O)NC(=O)[C@H](N)CC=1C=CC=CC=1)C1=CC=CC=C1 FWMNVWWHGCHHJJ-SKKKGAJSSA-N 0.000 claims description 4
- 101150039808 Egfr gene Proteins 0.000 claims description 4
- JKHVDAUOODACDU-UHFFFAOYSA-N (2,5-dioxopyrrolidin-1-yl) 3-(2,5-dioxopyrrol-1-yl)propanoate Chemical compound O=C1CCC(=O)N1OC(=O)CCN1C(=O)C=CC1=O JKHVDAUOODACDU-UHFFFAOYSA-N 0.000 claims description 3
- FUHCFUVCWLZEDQ-UHFFFAOYSA-N 1-(2,5-dioxopyrrolidin-1-yl)oxy-1-oxo-4-(pyridin-2-yldisulfanyl)butane-2-sulfonic acid Chemical compound O=C1CCC(=O)N1OC(=O)C(S(=O)(=O)O)CCSSC1=CC=CC=N1 FUHCFUVCWLZEDQ-UHFFFAOYSA-N 0.000 claims description 3
- 239000002136 L01XE07 - Lapatinib Substances 0.000 claims description 3
- 229940049706 benzodiazepine Drugs 0.000 claims description 3
- 229930188854 dolastatin Natural products 0.000 claims description 3
- 230000007705 epithelial mesenchymal transition Effects 0.000 claims description 3
- 229960004891 lapatinib Drugs 0.000 claims description 3
- BCFGMOOMADDAQU-UHFFFAOYSA-N lapatinib Chemical compound O1C(CNCCS(=O)(=O)C)=CC=C1C1=CC=C(N=CN=C2NC=3C=C(Cl)C(OCC=4C=C(F)C=CC=4)=CC=3)C2=C1 BCFGMOOMADDAQU-UHFFFAOYSA-N 0.000 claims description 3
- OWDQCSBZQVISPN-UHFFFAOYSA-N 2-[(2,5-dioxopyrrolidin-1-yl)amino]-4-(2-iodoacetyl)benzoic acid Chemical compound OC(=O)C1=CC=C(C(=O)CI)C=C1NN1C(=O)CCC1=O OWDQCSBZQVISPN-UHFFFAOYSA-N 0.000 claims description 2
- NNPUPCNWEHWRPW-UHFFFAOYSA-N 4-(pyridin-2-yldisulfanyl)-2-sulfobutanoic acid Chemical compound OC(=O)C(S(O)(=O)=O)CCSSC1=CC=CC=N1 NNPUPCNWEHWRPW-UHFFFAOYSA-N 0.000 claims description 2
- 108010044540 auristatin Proteins 0.000 claims description 2
- 108700021358 erbB-1 Genes Proteins 0.000 claims description 2
- YACHGFWEQXFSBS-RJXCBBHPSA-N leptomycin Chemical class OC(=O)/C=C(C)/C[C@H](C)[C@@H](O)[C@H](C)C(=O)[C@H](C)/C=C(\C)/C=C/C[C@@H](C)\C=C(/CC)\C=C\[C@@H]1OC(=O)C=C[C@@H]1C YACHGFWEQXFSBS-RJXCBBHPSA-N 0.000 claims description 2
- 150000001557 benzodiazepines Chemical class 0.000 claims 1
- 108010087914 epidermal growth factor receptor VIII Proteins 0.000 claims 1
- 208000017572 squamous cell neoplasm Diseases 0.000 claims 1
- 125000000020 sulfo group Chemical group O=S(=O)([*])O[H] 0.000 claims 1
- 102000052116 epidermal growth factor receptor activity proteins Human genes 0.000 abstract description 175
- 108700015053 epidermal growth factor receptor activity proteins Proteins 0.000 abstract description 174
- YOHYSYJDKVYCJI-UHFFFAOYSA-N n-[3-[[6-[3-(trifluoromethyl)anilino]pyrimidin-4-yl]amino]phenyl]cyclopropanecarboxamide Chemical compound FC(F)(F)C1=CC=CC(NC=2N=CN=C(NC=3C=C(NC(=O)C4CC4)C=CC=3)C=2)=C1 YOHYSYJDKVYCJI-UHFFFAOYSA-N 0.000 abstract description 173
- 230000008261 resistance mechanism Effects 0.000 abstract description 12
- 239000000562 conjugate Substances 0.000 description 81
- 239000003814 drug Substances 0.000 description 59
- 229940079593 drug Drugs 0.000 description 47
- 125000005647 linker group Chemical group 0.000 description 43
- 239000011230 binding agent Substances 0.000 description 29
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 23
- 201000010099 disease Diseases 0.000 description 21
- 230000001472 cytotoxic effect Effects 0.000 description 20
- 230000000694 effects Effects 0.000 description 20
- 150000001875 compounds Chemical class 0.000 description 18
- 101710113436 GTPase KRas Proteins 0.000 description 17
- 102000003745 Hepatocyte Growth Factor Human genes 0.000 description 13
- 108090000100 Hepatocyte Growth Factor Proteins 0.000 description 13
- 108060003951 Immunoglobulin Proteins 0.000 description 12
- 239000003431 cross linking reagent Substances 0.000 description 12
- 102000018358 immunoglobulin Human genes 0.000 description 12
- 239000003446 ligand Substances 0.000 description 12
- 150000003573 thiols Chemical class 0.000 description 12
- 238000003556 assay Methods 0.000 description 11
- 102000004169 proteins and genes Human genes 0.000 description 11
- 229940124597 therapeutic agent Drugs 0.000 description 11
- 206010009944 Colon cancer Diseases 0.000 description 10
- 108010021625 Immunoglobulin Fragments Proteins 0.000 description 10
- 102000008394 Immunoglobulin Fragments Human genes 0.000 description 10
- 150000001413 amino acids Chemical class 0.000 description 10
- 208000029742 colonic neoplasm Diseases 0.000 description 10
- 108090000765 processed proteins & peptides Proteins 0.000 description 10
- 108020004459 Small interfering RNA Proteins 0.000 description 9
- 238000012217 deletion Methods 0.000 description 9
- 230000037430 deletion Effects 0.000 description 9
- 229920001184 polypeptide Polymers 0.000 description 9
- 102000004196 processed proteins & peptides Human genes 0.000 description 9
- JJAHTWIKCUJRDK-UHFFFAOYSA-N succinimidyl 4-(N-maleimidomethyl)cyclohexane-1-carboxylate Chemical compound C1CC(CN2C(C=CC2=O)=O)CCC1C(=O)ON1C(=O)CCC1=O JJAHTWIKCUJRDK-UHFFFAOYSA-N 0.000 description 9
- 230000004083 survival effect Effects 0.000 description 9
- 230000014509 gene expression Effects 0.000 description 8
- 210000000130 stem cell Anatomy 0.000 description 8
- 238000012360 testing method Methods 0.000 description 8
- 231100000588 tumorigenic Toxicity 0.000 description 8
- 230000000381 tumorigenic effect Effects 0.000 description 8
- 239000004971 Cross linker Substances 0.000 description 7
- 208000009956 adenocarcinoma Diseases 0.000 description 7
- 230000004071 biological effect Effects 0.000 description 7
- 230000001404 mediated effect Effects 0.000 description 7
- 230000002018 overexpression Effects 0.000 description 7
- 210000001519 tissue Anatomy 0.000 description 7
- 102100033810 RAC-alpha serine/threonine-protein kinase Human genes 0.000 description 6
- 102100029986 Receptor tyrosine-protein kinase erbB-3 Human genes 0.000 description 6
- 101710100969 Receptor tyrosine-protein kinase erbB-3 Proteins 0.000 description 6
- 238000006243 chemical reaction Methods 0.000 description 6
- 231100000433 cytotoxic Toxicity 0.000 description 6
- 238000002784 cytotoxicity assay Methods 0.000 description 6
- 231100000263 cytotoxicity test Toxicity 0.000 description 6
- 125000002228 disulfide group Chemical group 0.000 description 6
- 230000002062 proliferating effect Effects 0.000 description 6
- 230000004565 tumor cell growth Effects 0.000 description 6
- 206010069755 K-ras gene mutation Diseases 0.000 description 5
- 208000000102 Squamous Cell Carcinoma of Head and Neck Diseases 0.000 description 5
- 239000005557 antagonist Substances 0.000 description 5
- 125000003118 aryl group Chemical group 0.000 description 5
- 230000001588 bifunctional effect Effects 0.000 description 5
- 230000015572 biosynthetic process Effects 0.000 description 5
- 238000003776 cleavage reaction Methods 0.000 description 5
- 201000000459 head and neck squamous cell carcinoma Diseases 0.000 description 5
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 5
- 230000004048 modification Effects 0.000 description 5
- 238000012986 modification Methods 0.000 description 5
- 230000002093 peripheral effect Effects 0.000 description 5
- 108091033319 polynucleotide Proteins 0.000 description 5
- 239000002157 polynucleotide Substances 0.000 description 5
- 102000040430 polynucleotide Human genes 0.000 description 5
- 102000005962 receptors Human genes 0.000 description 5
- 108020003175 receptors Proteins 0.000 description 5
- 230000002829 reductive effect Effects 0.000 description 5
- 230000007017 scission Effects 0.000 description 5
- 230000019491 signal transduction Effects 0.000 description 5
- 230000008685 targeting Effects 0.000 description 5
- 230000001225 therapeutic effect Effects 0.000 description 5
- 125000003396 thiol group Chemical group [H]S* 0.000 description 5
- 229940121358 tyrosine kinase inhibitor Drugs 0.000 description 5
- 239000005483 tyrosine kinase inhibitor Substances 0.000 description 5
- HBAQYPYDRFILMT-UHFFFAOYSA-N 8-[3-(1-cyclopropylpyrazol-4-yl)-1H-pyrazolo[4,3-d]pyrimidin-5-yl]-3-methyl-3,8-diazabicyclo[3.2.1]octan-2-one Chemical class C1(CC1)N1N=CC(=C1)C1=NNC2=C1N=C(N=C2)N1C2C(N(CC1CC2)C)=O HBAQYPYDRFILMT-UHFFFAOYSA-N 0.000 description 4
- 108010047041 Complementarity Determining Regions Proteins 0.000 description 4
- 206010061818 Disease progression Diseases 0.000 description 4
- 102000019149 MAP kinase activity proteins Human genes 0.000 description 4
- 108040008097 MAP kinase activity proteins Proteins 0.000 description 4
- 241000124008 Mammalia Species 0.000 description 4
- 241000699666 Mus <mouse, genus> Species 0.000 description 4
- 108091000080 Phosphotransferase Proteins 0.000 description 4
- XQJCEKXQUJQNNK-ZLUOBGJFSA-N Ser-Ser-Ser Chemical compound OC[C@H](N)C(=O)N[C@@H](CO)C(=O)N[C@@H](CO)C(O)=O XQJCEKXQUJQNNK-ZLUOBGJFSA-N 0.000 description 4
- 125000001931 aliphatic group Chemical group 0.000 description 4
- 239000000611 antibody drug conjugate Substances 0.000 description 4
- 229940049595 antibody-drug conjugate Drugs 0.000 description 4
- 230000000890 antigenic effect Effects 0.000 description 4
- 210000000988 bone and bone Anatomy 0.000 description 4
- 230000010261 cell growth Effects 0.000 description 4
- 239000003795 chemical substances by application Substances 0.000 description 4
- 238000002512 chemotherapy Methods 0.000 description 4
- 230000006552 constitutive activation Effects 0.000 description 4
- 230000005750 disease progression Effects 0.000 description 4
- 238000002474 experimental method Methods 0.000 description 4
- 125000000623 heterocyclic group Chemical group 0.000 description 4
- 230000005764 inhibitory process Effects 0.000 description 4
- 229940043355 kinase inhibitor Drugs 0.000 description 4
- WKPWGQKGSOKKOO-RSFHAFMBSA-N maytansine Chemical compound CO[C@@H]([C@@]1(O)C[C@](OC(=O)N1)([C@H]([C@@H]1O[C@@]1(C)[C@@H](OC(=O)[C@H](C)N(C)C(C)=O)CC(=O)N1C)C)[H])\C=C\C=C(C)\CC2=CC(OC)=C(Cl)C1=C2 WKPWGQKGSOKKOO-RSFHAFMBSA-N 0.000 description 4
- 239000002773 nucleotide Substances 0.000 description 4
- 125000003729 nucleotide group Chemical group 0.000 description 4
- 230000002688 persistence Effects 0.000 description 4
- 230000026731 phosphorylation Effects 0.000 description 4
- 238000006366 phosphorylation reaction Methods 0.000 description 4
- 102000020233 phosphotransferase Human genes 0.000 description 4
- 239000003757 phosphotransferase inhibitor Substances 0.000 description 4
- 230000011664 signaling Effects 0.000 description 4
- 210000004872 soft tissue Anatomy 0.000 description 4
- 125000006850 spacer group Chemical group 0.000 description 4
- 241000894007 species Species 0.000 description 4
- 230000005740 tumor formation Effects 0.000 description 4
- 239000013598 vector Substances 0.000 description 4
- 0 C*(*)CN(C)*C(*)=*(C)C Chemical compound C*(*)CN(C)*C(*)=*(C)C 0.000 description 3
- 102000000905 Cadherin Human genes 0.000 description 3
- 108050007957 Cadherin Proteins 0.000 description 3
- 108020004705 Codon Proteins 0.000 description 3
- BWGNESOTFCXPMA-UHFFFAOYSA-N Dihydrogen disulfide Chemical compound SS BWGNESOTFCXPMA-UHFFFAOYSA-N 0.000 description 3
- 101000851181 Homo sapiens Epidermal growth factor receptor Proteins 0.000 description 3
- 206010025323 Lymphomas Diseases 0.000 description 3
- PDIDTSZKKFEDMB-UWVGGRQHSA-N Lys-Pro-Gly Chemical compound [H]N[C@@H](CCCCN)C(=O)N1CCC[C@H]1C(=O)NCC(O)=O PDIDTSZKKFEDMB-UWVGGRQHSA-N 0.000 description 3
- 229930126263 Maytansine Natural products 0.000 description 3
- 241001465754 Metazoa Species 0.000 description 3
- 108091005804 Peptidases Proteins 0.000 description 3
- 102000035195 Peptidases Human genes 0.000 description 3
- 230000002159 abnormal effect Effects 0.000 description 3
- 239000002253 acid Substances 0.000 description 3
- 238000013459 approach Methods 0.000 description 3
- 230000008901 benefit Effects 0.000 description 3
- 230000000903 blocking effect Effects 0.000 description 3
- 125000004432 carbon atom Chemical group C* 0.000 description 3
- JJWKPURADFRFRB-UHFFFAOYSA-N carbonyl sulfide Chemical compound O=C=S JJWKPURADFRFRB-UHFFFAOYSA-N 0.000 description 3
- 125000003636 chemical group Chemical group 0.000 description 3
- 238000009295 crossflow filtration Methods 0.000 description 3
- 230000003247 decreasing effect Effects 0.000 description 3
- 238000000502 dialysis Methods 0.000 description 3
- 238000010494 dissociation reaction Methods 0.000 description 3
- 230000005593 dissociations Effects 0.000 description 3
- 229940082789 erbitux Drugs 0.000 description 3
- RTZKZFJDLAIYFH-UHFFFAOYSA-N ether Substances CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 3
- 238000009472 formulation Methods 0.000 description 3
- 238000002523 gelfiltration Methods 0.000 description 3
- 102000045108 human EGFR Human genes 0.000 description 3
- 238000000338 in vitro Methods 0.000 description 3
- 230000008595 infiltration Effects 0.000 description 3
- 238000001764 infiltration Methods 0.000 description 3
- 230000003993 interaction Effects 0.000 description 3
- 230000002147 killing effect Effects 0.000 description 3
- 230000003211 malignant effect Effects 0.000 description 3
- 239000000178 monomer Substances 0.000 description 3
- 231100001221 nontumorigenic Toxicity 0.000 description 3
- 210000000056 organ Anatomy 0.000 description 3
- 235000019833 protease Nutrition 0.000 description 3
- 230000009467 reduction Effects 0.000 description 3
- 230000004044 response Effects 0.000 description 3
- 239000000523 sample Substances 0.000 description 3
- 208000024891 symptom Diseases 0.000 description 3
- VBEQCZHXXJYVRD-GACYYNSASA-N uroanthelone Chemical compound C([C@@H](C(=O)N[C@H](C(=O)N[C@@H](CS)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CS)C(=O)N[C@H](C(=O)N[C@@H]([C@@H](C)CC)C(=O)NCC(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)N[C@@H](CO)C(=O)NCC(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CS)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(O)=O)C(C)C)[C@@H](C)O)NC(=O)[C@H](CO)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CO)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@@H](NC(=O)[C@H](CC=1NC=NC=1)NC(=O)[C@H](CCSC)NC(=O)[C@H](CS)NC(=O)[C@@H](NC(=O)CNC(=O)CNC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CS)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)CNC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CO)NC(=O)[C@H](CO)NC(=O)[C@H]1N(CCC1)C(=O)[C@H](CS)NC(=O)CNC(=O)[C@H]1N(CCC1)C(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CO)NC(=O)[C@@H](N)CC(N)=O)C(C)C)[C@@H](C)CC)C1=CC=C(O)C=C1 VBEQCZHXXJYVRD-GACYYNSASA-N 0.000 description 3
- 238000001262 western blot Methods 0.000 description 3
- JWDFQMWEFLOOED-UHFFFAOYSA-N (2,5-dioxopyrrolidin-1-yl) 3-(pyridin-2-yldisulfanyl)propanoate Chemical compound O=C1CCC(=O)N1OC(=O)CCSSC1=CC=CC=N1 JWDFQMWEFLOOED-UHFFFAOYSA-N 0.000 description 2
- QCHPKSFMDHPSNR-VKHMYHEASA-N (S)-3-aminoisobutyric acid Chemical compound [NH3+]C[C@H](C)C([O-])=O QCHPKSFMDHPSNR-VKHMYHEASA-N 0.000 description 2
- HZAXFHJVJLSVMW-UHFFFAOYSA-N 2-Aminoethan-1-ol Chemical compound NCCO HZAXFHJVJLSVMW-UHFFFAOYSA-N 0.000 description 2
- 206010069754 Acquired gene mutation Diseases 0.000 description 2
- CREYEAPXISDKSB-FQPOAREZSA-N Ala-Thr-Tyr Chemical compound [H]N[C@@H](C)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC1=CC=C(O)C=C1)C(O)=O CREYEAPXISDKSB-FQPOAREZSA-N 0.000 description 2
- AOHKLEBWKMKITA-IHRRRGAJSA-N Arg-Phe-Ser Chemical compound C1=CC=C(C=C1)C[C@@H](C(=O)N[C@@H](CO)C(=O)O)NC(=O)[C@H](CCCN=C(N)N)N AOHKLEBWKMKITA-IHRRRGAJSA-N 0.000 description 2
- GLWFAWNYGWBMOC-SRVKXCTJSA-N Asn-Leu-Leu Chemical compound [H]N[C@@H](CC(N)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(C)C)C(O)=O GLWFAWNYGWBMOC-SRVKXCTJSA-N 0.000 description 2
- XYBJLTKSGFBLCS-QXEWZRGKSA-N Asp-Arg-Val Chemical compound NC(N)=NCCC[C@@H](C(=O)N[C@@H](C(C)C)C(O)=O)NC(=O)[C@@H](N)CC(O)=O XYBJLTKSGFBLCS-QXEWZRGKSA-N 0.000 description 2
- QNFRBNZGVVKBNJ-PEFMBERDSA-N Asp-Ile-Gln Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CCC(=O)N)C(=O)O)NC(=O)[C@H](CC(=O)O)N QNFRBNZGVVKBNJ-PEFMBERDSA-N 0.000 description 2
- 229940125431 BRAF inhibitor Drugs 0.000 description 2
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 2
- 206010006187 Breast cancer Diseases 0.000 description 2
- 208000026310 Breast neoplasm Diseases 0.000 description 2
- 101100505161 Caenorhabditis elegans mel-32 gene Proteins 0.000 description 2
- 102000000844 Cell Surface Receptors Human genes 0.000 description 2
- 108010001857 Cell Surface Receptors Proteins 0.000 description 2
- 102100027100 Echinoderm microtubule-associated protein-like 4 Human genes 0.000 description 2
- 108090000371 Esterases Proteins 0.000 description 2
- 108700024394 Exon Proteins 0.000 description 2
- JXFLPKSDLDEOQK-JHEQGTHGSA-N Gln-Gly-Thr Chemical compound C[C@@H](O)[C@@H](C(O)=O)NC(=O)CNC(=O)[C@@H](N)CCC(N)=O JXFLPKSDLDEOQK-JHEQGTHGSA-N 0.000 description 2
- OACQOWPRWGNKTP-AVGNSLFASA-N Gln-Tyr-Asp Chemical compound [H]N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC1=CC=C(O)C=C1)C(=O)N[C@@H](CC(O)=O)C(O)=O OACQOWPRWGNKTP-AVGNSLFASA-N 0.000 description 2
- IESFZVCAVACGPH-PEFMBERDSA-N Glu-Asp-Ile Chemical compound CC[C@H](C)[C@@H](C(O)=O)NC(=O)[C@H](CC(O)=O)NC(=O)[C@@H](N)CCC(O)=O IESFZVCAVACGPH-PEFMBERDSA-N 0.000 description 2
- YBTCBQBIJKGSJP-BQBZGAKWSA-N Glu-Pro Chemical compound OC(=O)CC[C@H](N)C(=O)N1CCC[C@H]1C(O)=O YBTCBQBIJKGSJP-BQBZGAKWSA-N 0.000 description 2
- CLODWIOAKCSBAN-BQBZGAKWSA-N Gly-Arg-Asp Chemical compound NC(N)=NCCC[C@H](NC(=O)CN)C(=O)N[C@@H](CC(O)=O)C(O)=O CLODWIOAKCSBAN-BQBZGAKWSA-N 0.000 description 2
- BYYNJRSNDARRBX-YFKPBYRVSA-N Gly-Gln-Gly Chemical compound NCC(=O)N[C@@H](CCC(N)=O)C(=O)NCC(O)=O BYYNJRSNDARRBX-YFKPBYRVSA-N 0.000 description 2
- QCBYAHHNOHBXIH-UWVGGRQHSA-N His-Pro-Gly Chemical compound C([C@H](N)C(=O)N1[C@@H](CCC1)C(=O)NCC(O)=O)C1=CN=CN1 QCBYAHHNOHBXIH-UWVGGRQHSA-N 0.000 description 2
- CSTDQOOBZBAJKE-BWAGICSOSA-N His-Tyr-Thr Chemical compound C[C@H]([C@@H](C(=O)O)NC(=O)[C@H](CC1=CC=C(C=C1)O)NC(=O)[C@H](CC2=CN=CN2)N)O CSTDQOOBZBAJKE-BWAGICSOSA-N 0.000 description 2
- QYZYJFXHXYUZMZ-UGYAYLCHSA-N Ile-Asn-Asn Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CC(=O)N)C(=O)N[C@@H](CC(=O)N)C(=O)O)N QYZYJFXHXYUZMZ-UGYAYLCHSA-N 0.000 description 2
- NZGTYCMLUGYMCV-XUXIUFHCSA-N Ile-Lys-Arg Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCCN=C(N)N)C(=O)O)N NZGTYCMLUGYMCV-XUXIUFHCSA-N 0.000 description 2
- CAHCWMVNBZJVAW-NAKRPEOUSA-N Ile-Pro-Ser Chemical compound CC[C@H](C)[C@@H](C(=O)N1CCC[C@H]1C(=O)N[C@@H](CO)C(=O)O)N CAHCWMVNBZJVAW-NAKRPEOUSA-N 0.000 description 2
- 206010061598 Immunodeficiency Diseases 0.000 description 2
- HXWALXSAVBLTPK-NUTKFTJISA-N Leu-Ala-Trp Chemical compound C[C@@H](C(=O)N[C@@H](CC1=CNC2=CC=CC=C21)C(=O)O)NC(=O)[C@H](CC(C)C)N HXWALXSAVBLTPK-NUTKFTJISA-N 0.000 description 2
- IRMLZWSRWSGTOP-CIUDSAMLSA-N Leu-Ser-Ala Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H](CO)C(=O)N[C@@H](C)C(O)=O IRMLZWSRWSGTOP-CIUDSAMLSA-N 0.000 description 2
- RFQATBGBLDAKGI-VHSXEESVSA-N Lys-Gly-Pro Chemical compound C1C[C@@H](N(C1)C(=O)CNC(=O)[C@H](CCCCN)N)C(=O)O RFQATBGBLDAKGI-VHSXEESVSA-N 0.000 description 2
- SKRGVGLIRUGANF-AVGNSLFASA-N Lys-Leu-Glu Chemical compound [H]N[C@@H](CCCCN)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(O)=O)C(O)=O SKRGVGLIRUGANF-AVGNSLFASA-N 0.000 description 2
- AIRZWUMAHCDDHR-KKUMJFAQSA-N Lys-Leu-Leu Chemical compound [H]N[C@@H](CCCCN)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(C)C)C(O)=O AIRZWUMAHCDDHR-KKUMJFAQSA-N 0.000 description 2
- 108091054455 MAP kinase family Proteins 0.000 description 2
- 102000043136 MAP kinase family Human genes 0.000 description 2
- PEEHTFAAVSWFBL-UHFFFAOYSA-N Maleimide Chemical compound O=C1NC(=O)C=C1 PEEHTFAAVSWFBL-UHFFFAOYSA-N 0.000 description 2
- SPSSJSICDYYTQN-HJGDQZAQSA-N Met-Thr-Gln Chemical compound CSCC[C@H](N)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@H](C(O)=O)CCC(N)=O SPSSJSICDYYTQN-HJGDQZAQSA-N 0.000 description 2
- NWIBSHFKIJFRCO-WUDYKRTCSA-N Mytomycin Chemical compound C1N2C(C(C(C)=C(N)C3=O)=O)=C3[C@@H](COC(N)=O)[C@@]2(OC)[C@@H]2[C@H]1N2 NWIBSHFKIJFRCO-WUDYKRTCSA-N 0.000 description 2
- 108091034117 Oligonucleotide Proteins 0.000 description 2
- 241000283973 Oryctolagus cuniculus Species 0.000 description 2
- 206010061902 Pancreatic neoplasm Diseases 0.000 description 2
- 239000002202 Polyethylene glycol Substances 0.000 description 2
- 206010060862 Prostate cancer Diseases 0.000 description 2
- 208000000236 Prostatic Neoplasms Diseases 0.000 description 2
- 102000004022 Protein-Tyrosine Kinases Human genes 0.000 description 2
- 108090000412 Protein-Tyrosine Kinases Proteins 0.000 description 2
- 239000012979 RPMI medium Substances 0.000 description 2
- 241000700159 Rattus Species 0.000 description 2
- 229920005654 Sephadex Polymers 0.000 description 2
- 239000012507 Sephadex™ Substances 0.000 description 2
- ULVMNZOKDBHKKI-ACZMJKKPSA-N Ser-Gln-Asp Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC(O)=O)C(O)=O ULVMNZOKDBHKKI-ACZMJKKPSA-N 0.000 description 2
- UIGMAMGZOJVTDN-WHFBIAKZSA-N Ser-Gly-Ser Chemical compound OC[C@H](N)C(=O)NCC(=O)N[C@@H](CO)C(O)=O UIGMAMGZOJVTDN-WHFBIAKZSA-N 0.000 description 2
- NADLKBTYNKUJEP-KATARQTJSA-N Ser-Thr-Leu Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(C)C)C(O)=O NADLKBTYNKUJEP-KATARQTJSA-N 0.000 description 2
- JZRYFUGREMECBH-XPUUQOCRSA-N Ser-Val-Gly Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](C(C)C)C(=O)NCC(O)=O JZRYFUGREMECBH-XPUUQOCRSA-N 0.000 description 2
- GXUWHVZYDAHFSV-FLBSBUHZSA-N Thr-Ile-Thr Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H]([C@@H](C)O)C(O)=O GXUWHVZYDAHFSV-FLBSBUHZSA-N 0.000 description 2
- BIBYEFRASCNLAA-CDMKHQONSA-N Thr-Phe-Gly Chemical compound C[C@@H](O)[C@H](N)C(=O)N[C@H](C(=O)NCC(O)=O)CC1=CC=CC=C1 BIBYEFRASCNLAA-CDMKHQONSA-N 0.000 description 2
- YLRLHDFMMWDYTK-KKUMJFAQSA-N Tyr-Cys-Leu Chemical compound CC(C)C[C@@H](C(O)=O)NC(=O)[C@H](CS)NC(=O)[C@@H](N)CC1=CC=C(O)C=C1 YLRLHDFMMWDYTK-KKUMJFAQSA-N 0.000 description 2
- RIJPHPUJRLEOAK-JYJNAYRXSA-N Tyr-Gln-His Chemical compound C1=CC(=CC=C1C[C@@H](C(=O)N[C@@H](CCC(=O)N)C(=O)N[C@@H](CC2=CN=CN2)C(=O)O)N)O RIJPHPUJRLEOAK-JYJNAYRXSA-N 0.000 description 2
- HRHYJNLMIJWGLF-BZSNNMDCSA-N Tyr-Ser-Phe Chemical compound C([C@H](N)C(=O)N[C@@H](CO)C(=O)N[C@@H](CC=1C=CC=CC=1)C(O)=O)C1=CC=C(O)C=C1 HRHYJNLMIJWGLF-BZSNNMDCSA-N 0.000 description 2
- 230000003187 abdominal effect Effects 0.000 description 2
- 238000002835 absorbance Methods 0.000 description 2
- 230000003213 activating effect Effects 0.000 description 2
- 230000001919 adrenal effect Effects 0.000 description 2
- HAXFWIACAGNFHA-UHFFFAOYSA-N aldrithiol Chemical compound C=1C=CC=NC=1SSC1=CC=CC=N1 HAXFWIACAGNFHA-UHFFFAOYSA-N 0.000 description 2
- 150000001412 amines Chemical class 0.000 description 2
- 230000003042 antagnostic effect Effects 0.000 description 2
- 229940045799 anthracyclines and related substance Drugs 0.000 description 2
- 229940121363 anti-inflammatory agent Drugs 0.000 description 2
- 239000002260 anti-inflammatory agent Substances 0.000 description 2
- 229940041181 antineoplastic drug Drugs 0.000 description 2
- 230000006907 apoptotic process Effects 0.000 description 2
- 108010068265 aspartyltyrosine Proteins 0.000 description 2
- 125000003310 benzodiazepinyl group Chemical class N1N=C(C=CC2=C1C=CC=C2)* 0.000 description 2
- 210000000481 breast Anatomy 0.000 description 2
- 229940022399 cancer vaccine Drugs 0.000 description 2
- 238000009566 cancer vaccine Methods 0.000 description 2
- 229930003827 cannabinoid Natural products 0.000 description 2
- 239000003557 cannabinoid Substances 0.000 description 2
- 230000030833 cell death Effects 0.000 description 2
- 230000004663 cell proliferation Effects 0.000 description 2
- 230000008859 change Effects 0.000 description 2
- 238000004587 chromatography analysis Methods 0.000 description 2
- 210000001072 colon Anatomy 0.000 description 2
- 238000012790 confirmation Methods 0.000 description 2
- 230000037011 constitutive activity Effects 0.000 description 2
- 239000000824 cytostatic agent Substances 0.000 description 2
- 230000036425 denaturation Effects 0.000 description 2
- 238000004925 denaturation Methods 0.000 description 2
- 230000004069 differentiation Effects 0.000 description 2
- 210000002249 digestive system Anatomy 0.000 description 2
- 238000010790 dilution Methods 0.000 description 2
- 239000012895 dilution Substances 0.000 description 2
- 208000035475 disorder Diseases 0.000 description 2
- 239000003534 dna topoisomerase inhibitor Substances 0.000 description 2
- 230000002124 endocrine Effects 0.000 description 2
- 210000000981 epithelium Anatomy 0.000 description 2
- 230000001747 exhibiting effect Effects 0.000 description 2
- 239000012091 fetal bovine serum Substances 0.000 description 2
- 230000006870 function Effects 0.000 description 2
- 208000005017 glioblastoma Diseases 0.000 description 2
- 108010010147 glycylglutamine Proteins 0.000 description 2
- 108010015792 glycyllysine Proteins 0.000 description 2
- 230000036541 health Effects 0.000 description 2
- 108091008039 hormone receptors Proteins 0.000 description 2
- 206010020718 hyperplasia Diseases 0.000 description 2
- 230000001900 immune effect Effects 0.000 description 2
- 230000028993 immune response Effects 0.000 description 2
- 229940072221 immunoglobulins Drugs 0.000 description 2
- 238000001727 in vivo Methods 0.000 description 2
- 239000000543 intermediate Substances 0.000 description 2
- 230000003902 lesion Effects 0.000 description 2
- 230000000670 limiting effect Effects 0.000 description 2
- 210000004185 liver Anatomy 0.000 description 2
- 238000011068 loading method Methods 0.000 description 2
- 208000037841 lung tumor Diseases 0.000 description 2
- 210000004324 lymphatic system Anatomy 0.000 description 2
- 229940124302 mTOR inhibitor Drugs 0.000 description 2
- 208000015486 malignant pancreatic neoplasm Diseases 0.000 description 2
- 239000003628 mammalian target of rapamycin inhibitor Substances 0.000 description 2
- 239000003550 marker Substances 0.000 description 2
- 239000000463 material Substances 0.000 description 2
- 230000002503 metabolic effect Effects 0.000 description 2
- 239000003147 molecular marker Substances 0.000 description 2
- 210000000653 nervous system Anatomy 0.000 description 2
- 210000000496 pancreas Anatomy 0.000 description 2
- 201000002528 pancreatic cancer Diseases 0.000 description 2
- 208000008443 pancreatic carcinoma Diseases 0.000 description 2
- 229960001972 panitumumab Drugs 0.000 description 2
- 230000000849 parathyroid Effects 0.000 description 2
- 210000004197 pelvis Anatomy 0.000 description 2
- 210000004303 peritoneum Anatomy 0.000 description 2
- 239000008194 pharmaceutical composition Substances 0.000 description 2
- 108010051242 phenylalanylserine Proteins 0.000 description 2
- 230000001817 pituitary effect Effects 0.000 description 2
- 239000000843 powder Substances 0.000 description 2
- 230000000069 prophylactic effect Effects 0.000 description 2
- RXWNCPJZOCPEPQ-NVWDDTSBSA-N puromycin Chemical compound C1=CC(OC)=CC=C1C[C@H](N)C(=O)N[C@H]1[C@@H](O)[C@H](N2C3=NC=NC(=C3N=C2)N(C)C)O[C@@H]1CO RXWNCPJZOCPEPQ-NVWDDTSBSA-N 0.000 description 2
- 238000003127 radioimmunoassay Methods 0.000 description 2
- 230000003439 radiotherapeutic effect Effects 0.000 description 2
- 102200006531 rs121913529 Human genes 0.000 description 2
- 210000003491 skin Anatomy 0.000 description 2
- 150000003384 small molecules Chemical class 0.000 description 2
- 230000037439 somatic mutation Effects 0.000 description 2
- 210000000952 spleen Anatomy 0.000 description 2
- 238000003786 synthesis reaction Methods 0.000 description 2
- XOAAWQZATWQOTB-UHFFFAOYSA-N taurine Chemical compound NCCS(O)(=O)=O XOAAWQZATWQOTB-UHFFFAOYSA-N 0.000 description 2
- 210000001550 testis Anatomy 0.000 description 2
- 125000000101 thioether group Chemical group 0.000 description 2
- 229940044693 topoisomerase inhibitor Drugs 0.000 description 2
- 231100000331 toxic Toxicity 0.000 description 2
- 230000002588 toxic effect Effects 0.000 description 2
- 108010044292 tryptophyltyrosine Proteins 0.000 description 2
- 108010003137 tyrosyltyrosine Proteins 0.000 description 2
- 210000002229 urogenital system Anatomy 0.000 description 2
- 239000002525 vasculotropin inhibitor Substances 0.000 description 2
- VRDGQQTWSGDXCU-UHFFFAOYSA-N (2,5-dioxopyrrolidin-1-yl) 2-iodoacetate Chemical compound ICC(=O)ON1C(=O)CCC1=O VRDGQQTWSGDXCU-UHFFFAOYSA-N 0.000 description 1
- VEEGZPWAAPPXRB-BJMVGYQFSA-N (3e)-3-(1h-imidazol-5-ylmethylidene)-1h-indol-2-one Chemical compound O=C1NC2=CC=CC=C2\C1=C/C1=CN=CN1 VEEGZPWAAPPXRB-BJMVGYQFSA-N 0.000 description 1
- INAUWOVKEZHHDM-PEDBPRJASA-N (7s,9s)-6,9,11-trihydroxy-9-(2-hydroxyacetyl)-7-[(2r,4s,5s,6s)-5-hydroxy-6-methyl-4-morpholin-4-yloxan-2-yl]oxy-4-methoxy-8,10-dihydro-7h-tetracene-5,12-dione;hydrochloride Chemical compound Cl.N1([C@H]2C[C@@H](O[C@@H](C)[C@H]2O)O[C@H]2C[C@@](O)(CC=3C(O)=C4C(=O)C=5C=CC=C(C=5C(=O)C4=C(O)C=32)OC)C(=O)CO)CCOCC1 INAUWOVKEZHHDM-PEDBPRJASA-N 0.000 description 1
- DIYPCWKHSODVAP-UHFFFAOYSA-N 1-[3-(2,5-dioxopyrrol-1-yl)benzoyl]oxy-2,5-dioxopyrrolidine-3-sulfonic acid Chemical compound O=C1C(S(=O)(=O)O)CC(=O)N1OC(=O)C1=CC=CC(N2C(C=CC2=O)=O)=C1 DIYPCWKHSODVAP-UHFFFAOYSA-N 0.000 description 1
- NFGXHKASABOEEW-UHFFFAOYSA-N 1-methylethyl 11-methoxy-3,7,11-trimethyl-2,4-dodecadienoate Chemical compound COC(C)(C)CCCC(C)CC=CC(C)=CC(=O)OC(C)C NFGXHKASABOEEW-UHFFFAOYSA-N 0.000 description 1
- MOMFXATYAINJML-UHFFFAOYSA-N 2-Acetylthiazole Chemical group CC(=O)C1=NC=CS1 MOMFXATYAINJML-UHFFFAOYSA-N 0.000 description 1
- FYKCKCYYMXDNHZ-UHFFFAOYSA-N 2-sulfobutanoic acid Chemical compound CCC(C(O)=O)S(O)(=O)=O FYKCKCYYMXDNHZ-UHFFFAOYSA-N 0.000 description 1
- AGAYQLZJBWFZQV-UHFFFAOYSA-N 3-acetyloxolane-2,5-dione Chemical compound CC(=O)C1CC(=O)OC1=O AGAYQLZJBWFZQV-UHFFFAOYSA-N 0.000 description 1
- QUHGSDZVAPFNLV-UHFFFAOYSA-N 4-[(5-acetamidofuran-2-carbonyl)amino]-n-[3-(dimethylamino)propyl]-1-propylpyrrole-2-carboxamide Chemical compound C1=C(C(=O)NCCCN(C)C)N(CCC)C=C1NC(=O)C1=CC=C(NC(C)=O)O1 QUHGSDZVAPFNLV-UHFFFAOYSA-N 0.000 description 1
- QQWUGDVOUVUTOY-UHFFFAOYSA-N 5-chloro-N2-[2-methoxy-4-[4-(4-methyl-1-piperazinyl)-1-piperidinyl]phenyl]-N4-(2-propan-2-ylsulfonylphenyl)pyrimidine-2,4-diamine Chemical compound COC1=CC(N2CCC(CC2)N2CCN(C)CC2)=CC=C1NC(N=1)=NC=C(Cl)C=1NC1=CC=CC=C1S(=O)(=O)C(C)C QQWUGDVOUVUTOY-UHFFFAOYSA-N 0.000 description 1
- 101150023956 ALK gene Proteins 0.000 description 1
- 208000005676 Adrenogenital syndrome Diseases 0.000 description 1
- WYPUMLRSQMKIJU-BPNCWPANSA-N Ala-Arg-Tyr Chemical compound [H]N[C@@H](C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC1=CC=C(O)C=C1)C(O)=O WYPUMLRSQMKIJU-BPNCWPANSA-N 0.000 description 1
- IOFVWPYSRSCWHI-JXUBOQSCSA-N Ala-Thr-Leu Chemical compound CC(C)C[C@@H](C(O)=O)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](C)N IOFVWPYSRSCWHI-JXUBOQSCSA-N 0.000 description 1
- 101100067974 Arabidopsis thaliana POP2 gene Proteins 0.000 description 1
- ISJWBVIYRBAXEB-CIUDSAMLSA-N Arg-Ser-Glu Chemical compound [H]N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CO)C(=O)N[C@@H](CCC(O)=O)C(O)=O ISJWBVIYRBAXEB-CIUDSAMLSA-N 0.000 description 1
- XPGVTUBABLRGHY-BIIVOSGPSA-N Asp-Ala-Pro Chemical compound C[C@@H](C(=O)N1CCC[C@@H]1C(=O)O)NC(=O)[C@H](CC(=O)O)N XPGVTUBABLRGHY-BIIVOSGPSA-N 0.000 description 1
- WBDWQKRLTVCDSY-WHFBIAKZSA-N Asp-Gly-Asp Chemical compound OC(=O)C[C@H](N)C(=O)NCC(=O)N[C@@H](CC(O)=O)C(O)=O WBDWQKRLTVCDSY-WHFBIAKZSA-N 0.000 description 1
- WMLFFCRUSPNENW-ZLUOBGJFSA-N Asp-Ser-Ala Chemical compound [H]N[C@@H](CC(O)=O)C(=O)N[C@@H](CO)C(=O)N[C@@H](C)C(O)=O WMLFFCRUSPNENW-ZLUOBGJFSA-N 0.000 description 1
- HTSSXFASOUSJQG-IHPCNDPISA-N Asp-Tyr-Trp Chemical compound [H]N[C@@H](CC(O)=O)C(=O)N[C@@H](CC1=CC=C(O)C=C1)C(=O)N[C@@H](CC1=CNC2=C1C=CC=C2)C(O)=O HTSSXFASOUSJQG-IHPCNDPISA-N 0.000 description 1
- 206010004446 Benign prostatic hyperplasia Diseases 0.000 description 1
- 206010005003 Bladder cancer Diseases 0.000 description 1
- 208000003174 Brain Neoplasms Diseases 0.000 description 1
- 206010055113 Breast cancer metastatic Diseases 0.000 description 1
- 206010006256 Breast hyperplasia Diseases 0.000 description 1
- HWZPNHUWUDVELV-FNORWQNLSA-N CC/C=C(\C(Cl)=C)/OC Chemical compound CC/C=C(\C(Cl)=C)/OC HWZPNHUWUDVELV-FNORWQNLSA-N 0.000 description 1
- 201000009030 Carcinoma Diseases 0.000 description 1
- 208000032862 Clinical Deterioration Diseases 0.000 description 1
- 208000008448 Congenital adrenal hyperplasia Diseases 0.000 description 1
- 241000699800 Cricetinae Species 0.000 description 1
- SZQCDCKIGWQAQN-FXQIFTODSA-N Cys-Arg-Ala Chemical compound [H]N[C@@H](CS)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](C)C(O)=O SZQCDCKIGWQAQN-FXQIFTODSA-N 0.000 description 1
- OZHXXYOHPLLLMI-CIUDSAMLSA-N Cys-Lys-Ala Chemical compound [H]N[C@@H](CS)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](C)C(O)=O OZHXXYOHPLLLMI-CIUDSAMLSA-N 0.000 description 1
- 108020004414 DNA Proteins 0.000 description 1
- 230000006820 DNA synthesis Effects 0.000 description 1
- 238000012286 ELISA Assay Methods 0.000 description 1
- 101710203446 Echinoderm microtubule-associated protein-like 4 Proteins 0.000 description 1
- 102000004190 Enzymes Human genes 0.000 description 1
- 108090000790 Enzymes Proteins 0.000 description 1
- 102400001368 Epidermal growth factor Human genes 0.000 description 1
- 101800003838 Epidermal growth factor Proteins 0.000 description 1
- 108050001049 Extracellular proteins Proteins 0.000 description 1
- 208000000901 Focal Epithelial Hyperplasia Diseases 0.000 description 1
- 102100030708 GTPase KRas Human genes 0.000 description 1
- XOKGKOQWADCLFQ-GARJFASQSA-N Gln-Arg-Pro Chemical compound C1C[C@@H](N(C1)C(=O)[C@H](CCCN=C(N)N)NC(=O)[C@H](CCC(=O)N)N)C(=O)O XOKGKOQWADCLFQ-GARJFASQSA-N 0.000 description 1
- XSBGUANSZDGULP-IUCAKERBSA-N Gln-Gly-Lys Chemical compound [H]N[C@@H](CCC(N)=O)C(=O)NCC(=O)N[C@@H](CCCCN)C(O)=O XSBGUANSZDGULP-IUCAKERBSA-N 0.000 description 1
- ZFBBMCKQSNJZSN-AUTRQRHGSA-N Gln-Val-Gln Chemical compound [H]N[C@@H](CCC(N)=O)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CCC(N)=O)C(O)=O ZFBBMCKQSNJZSN-AUTRQRHGSA-N 0.000 description 1
- KIEICAOUSNYOLM-NRPADANISA-N Glu-Val-Ala Chemical compound [H]N[C@@H](CCC(O)=O)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](C)C(O)=O KIEICAOUSNYOLM-NRPADANISA-N 0.000 description 1
- HUFUVTYGPOUCBN-MBLNEYKQSA-N Gly-Thr-Ile Chemical compound [H]NCC(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H]([C@@H](C)CC)C(O)=O HUFUVTYGPOUCBN-MBLNEYKQSA-N 0.000 description 1
- UIQGJYUEQDOODF-KWQFWETISA-N Gly-Tyr-Ala Chemical compound OC(=O)[C@H](C)NC(=O)[C@@H](NC(=O)CN)CC1=CC=C(O)C=C1 UIQGJYUEQDOODF-KWQFWETISA-N 0.000 description 1
- GBYYQVBXFVDJPJ-WLTAIBSBSA-N Gly-Tyr-Thr Chemical compound C[C@H]([C@@H](C(=O)O)NC(=O)[C@H](CC1=CC=C(C=C1)O)NC(=O)CN)O GBYYQVBXFVDJPJ-WLTAIBSBSA-N 0.000 description 1
- 241000282412 Homo Species 0.000 description 1
- 101100118549 Homo sapiens EGFR gene Proteins 0.000 description 1
- 101001057929 Homo sapiens Echinoderm microtubule-associated protein-like 4 Proteins 0.000 description 1
- 101500025419 Homo sapiens Epidermal growth factor Proteins 0.000 description 1
- 101000584612 Homo sapiens GTPase KRas Proteins 0.000 description 1
- 238000009015 Human TaqMan MicroRNA Assay kit Methods 0.000 description 1
- 102000009786 Immunoglobulin Constant Regions Human genes 0.000 description 1
- 108010009817 Immunoglobulin Constant Regions Proteins 0.000 description 1
- 108010067060 Immunoglobulin Variable Region Proteins 0.000 description 1
- 102000017727 Immunoglobulin Variable Region Human genes 0.000 description 1
- WMTOVWLLDGQGCV-GUBZILKMSA-N Leu-Glu-Cys Chemical compound CC(C)C[C@@H](C(=O)N[C@@H](CCC(=O)O)C(=O)N[C@@H](CS)C(=O)O)N WMTOVWLLDGQGCV-GUBZILKMSA-N 0.000 description 1
- KIZIOFNVSOSKJI-CIUDSAMLSA-N Leu-Ser-Cys Chemical compound CC(C)C[C@@H](C(=O)N[C@@H](CO)C(=O)N[C@@H](CS)C(=O)O)N KIZIOFNVSOSKJI-CIUDSAMLSA-N 0.000 description 1
- MVJRBCJCRYGCKV-GVXVVHGQSA-N Leu-Val-Gln Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CCC(N)=O)C(O)=O MVJRBCJCRYGCKV-GVXVVHGQSA-N 0.000 description 1
- UWKNTTJNVSYXPC-CIUDSAMLSA-N Lys-Ala-Ser Chemical compound OC[C@@H](C(O)=O)NC(=O)[C@H](C)NC(=O)[C@@H](N)CCCCN UWKNTTJNVSYXPC-CIUDSAMLSA-N 0.000 description 1
- DIBZLYZXTSVGLN-CIUDSAMLSA-N Lys-Ser-Ser Chemical compound [H]N[C@@H](CCCCN)C(=O)N[C@@H](CO)C(=O)N[C@@H](CO)C(O)=O DIBZLYZXTSVGLN-CIUDSAMLSA-N 0.000 description 1
- VOOINLQYUZOREH-SRVKXCTJSA-N Met-Gln-Leu Chemical compound CC(C)C[C@@H](C(=O)O)NC(=O)[C@H](CCC(=O)N)NC(=O)[C@H](CCSC)N VOOINLQYUZOREH-SRVKXCTJSA-N 0.000 description 1
- 108091022875 Microtubule Proteins 0.000 description 1
- 102000029749 Microtubule Human genes 0.000 description 1
- 241000699670 Mus sp. Species 0.000 description 1
- 108010079364 N-glycylalanine Proteins 0.000 description 1
- 102000048850 Neoplasm Genes Human genes 0.000 description 1
- 108700019961 Neoplasm Genes Proteins 0.000 description 1
- 108091028043 Nucleic acid sequence Proteins 0.000 description 1
- 206010033128 Ovarian cancer Diseases 0.000 description 1
- 206010061535 Ovarian neoplasm Diseases 0.000 description 1
- GNRMAQSIROFNMI-IXOXFDKPSA-N Phe-Thr-Ser Chemical compound [H]N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CO)C(O)=O GNRMAQSIROFNMI-IXOXFDKPSA-N 0.000 description 1
- 108090000430 Phosphatidylinositol 3-kinases Proteins 0.000 description 1
- 102000003993 Phosphatidylinositol 3-kinases Human genes 0.000 description 1
- 208000010067 Pituitary ACTH Hypersecretion Diseases 0.000 description 1
- 208000020627 Pituitary-dependent Cushing syndrome Diseases 0.000 description 1
- 239000004698 Polyethylene Substances 0.000 description 1
- 208000004403 Prostatic Hyperplasia Diseases 0.000 description 1
- 108010029485 Protein Isoforms Proteins 0.000 description 1
- 102000001708 Protein Isoforms Human genes 0.000 description 1
- 102100029981 Receptor tyrosine-protein kinase erbB-4 Human genes 0.000 description 1
- 101710100963 Receptor tyrosine-protein kinase erbB-4 Proteins 0.000 description 1
- 241000283984 Rodentia Species 0.000 description 1
- 238000011579 SCID mouse model Methods 0.000 description 1
- RYMZZMVNJRMUDD-UHFFFAOYSA-N SJ000286063 Natural products C12C(OC(=O)C(C)(C)CC)CC(C)C=C2C=CC(C)C1CCC1CC(O)CC(=O)O1 RYMZZMVNJRMUDD-UHFFFAOYSA-N 0.000 description 1
- 101100123851 Saccharomyces cerevisiae (strain ATCC 204508 / S288c) HER1 gene Proteins 0.000 description 1
- 206010039491 Sarcoma Diseases 0.000 description 1
- 206010070834 Sensitisation Diseases 0.000 description 1
- 238000012300 Sequence Analysis Methods 0.000 description 1
- UQFYNFTYDHUIMI-WHFBIAKZSA-N Ser-Gly-Ala Chemical compound OC(=O)[C@H](C)NC(=O)CNC(=O)[C@@H](N)CO UQFYNFTYDHUIMI-WHFBIAKZSA-N 0.000 description 1
- BMKNXTJLHFIAAH-CIUDSAMLSA-N Ser-Ser-Leu Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CO)C(=O)N[C@@H](CC(C)C)C(O)=O BMKNXTJLHFIAAH-CIUDSAMLSA-N 0.000 description 1
- XJDMUQCLVSCRSJ-VZFHVOOUSA-N Ser-Thr-Ala Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](C)C(O)=O XJDMUQCLVSCRSJ-VZFHVOOUSA-N 0.000 description 1
- LGIMRDKGABDMBN-DCAQKATOSA-N Ser-Val-Lys Chemical compound CC(C)[C@@H](C(=O)N[C@@H](CCCCN)C(=O)O)NC(=O)[C@H](CO)N LGIMRDKGABDMBN-DCAQKATOSA-N 0.000 description 1
- 108010071390 Serum Albumin Proteins 0.000 description 1
- 102000007562 Serum Albumin Human genes 0.000 description 1
- 208000000453 Skin Neoplasms Diseases 0.000 description 1
- 229940123237 Taxane Drugs 0.000 description 1
- NJEMRSFGDNECGF-GCJQMDKQSA-N Thr-Ala-Asp Chemical compound C[C@@H](O)[C@H](N)C(=O)N[C@@H](C)C(=O)N[C@H](C(O)=O)CC(O)=O NJEMRSFGDNECGF-GCJQMDKQSA-N 0.000 description 1
- LAFLAXHTDVNVEL-WDCWCFNPSA-N Thr-Gln-Lys Chemical compound C[C@H]([C@@H](C(=O)N[C@@H](CCC(=O)N)C(=O)N[C@@H](CCCCN)C(=O)O)N)O LAFLAXHTDVNVEL-WDCWCFNPSA-N 0.000 description 1
- KZSYAEWQMJEGRZ-RHYQMDGZSA-N Thr-Leu-Val Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](C(C)C)C(O)=O KZSYAEWQMJEGRZ-RHYQMDGZSA-N 0.000 description 1
- GRIUMVXCJDKVPI-IZPVPAKOSA-N Thr-Thr-Tyr Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC1=CC=C(O)C=C1)C(O)=O GRIUMVXCJDKVPI-IZPVPAKOSA-N 0.000 description 1
- MNYNCKZAEIAONY-XGEHTFHBSA-N Thr-Val-Ser Chemical compound C[C@@H](O)[C@H](N)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CO)C(O)=O MNYNCKZAEIAONY-XGEHTFHBSA-N 0.000 description 1
- VOCHZIJXPRBVSI-XIRDDKMYSA-N Trp-Met-Gln Chemical compound CSCC[C@@H](C(=O)N[C@@H](CCC(=O)N)C(=O)O)NC(=O)[C@H](CC1=CNC2=CC=CC=C21)N VOCHZIJXPRBVSI-XIRDDKMYSA-N 0.000 description 1
- UOXPLPBMEPLZBW-WDSOQIARSA-N Trp-Val-Lys Chemical compound C1=CC=C2C(C[C@H](N)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CCCCN)C(O)=O)=CNC2=C1 UOXPLPBMEPLZBW-WDSOQIARSA-N 0.000 description 1
- SZEIFUXUTBBQFQ-STQMWFEESA-N Tyr-Pro-Gly Chemical compound [H]N[C@@H](CC1=CC=C(O)C=C1)C(=O)N1CCC[C@H]1C(=O)NCC(O)=O SZEIFUXUTBBQFQ-STQMWFEESA-N 0.000 description 1
- 208000007097 Urinary Bladder Neoplasms Diseases 0.000 description 1
- OWFGFHQMSBTKLX-UFYCRDLUSA-N Val-Tyr-Tyr Chemical compound CC(C)[C@@H](C(=O)N[C@@H](CC1=CC=C(C=C1)O)C(=O)N[C@@H](CC2=CC=C(C=C2)O)C(=O)O)N OWFGFHQMSBTKLX-UFYCRDLUSA-N 0.000 description 1
- 102000013127 Vimentin Human genes 0.000 description 1
- 108010065472 Vimentin Proteins 0.000 description 1
- JXLYSJRDGCGARV-WWYNWVTFSA-N Vinblastine Natural products O=C(O[C@H]1[C@](O)(C(=O)OC)[C@@H]2N(C)c3c(cc(c(OC)c3)[C@]3(C(=O)OC)c4[nH]c5c(c4CCN4C[C@](O)(CC)C[C@H](C3)C4)cccc5)[C@@]32[C@H]2[C@@]1(CC)C=CCN2CC3)C JXLYSJRDGCGARV-WWYNWVTFSA-N 0.000 description 1
- 229940122803 Vinca alkaloid Drugs 0.000 description 1
- JLCPHMBAVCMARE-UHFFFAOYSA-N [3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-hydroxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methyl [5-(6-aminopurin-9-yl)-2-(hydroxymethyl)oxolan-3-yl] hydrogen phosphate Polymers Cc1cn(C2CC(OP(O)(=O)OCC3OC(CC3OP(O)(=O)OCC3OC(CC3O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c3nc(N)[nH]c4=O)C(COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3CO)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cc(C)c(=O)[nH]c3=O)n3cc(C)c(=O)[nH]c3=O)n3ccc(N)nc3=O)n3cc(C)c(=O)[nH]c3=O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)O2)c(=O)[nH]c1=O JLCPHMBAVCMARE-UHFFFAOYSA-N 0.000 description 1
- 230000001594 aberrant effect Effects 0.000 description 1
- 230000005856 abnormality Effects 0.000 description 1
- 239000004480 active ingredient Substances 0.000 description 1
- 230000001780 adrenocortical effect Effects 0.000 description 1
- 238000005273 aeration Methods 0.000 description 1
- 239000000443 aerosol Substances 0.000 description 1
- 230000002776 aggregation Effects 0.000 description 1
- 238000004220 aggregation Methods 0.000 description 1
- 108010069020 alanyl-prolyl-glycine Proteins 0.000 description 1
- 108010086434 alanyl-seryl-glycine Proteins 0.000 description 1
- 125000003545 alkoxy group Chemical group 0.000 description 1
- 125000000539 amino acid group Chemical group 0.000 description 1
- 125000003277 amino group Chemical group 0.000 description 1
- 239000004037 angiogenesis inhibitor Substances 0.000 description 1
- 229940121369 angiogenesis inhibitor Drugs 0.000 description 1
- 238000010171 animal model Methods 0.000 description 1
- 239000003242 anti bacterial agent Substances 0.000 description 1
- 238000011123 anti-EGFR therapy Methods 0.000 description 1
- 229940088710 antibiotic agent Drugs 0.000 description 1
- 238000003782 apoptosis assay Methods 0.000 description 1
- 239000012062 aqueous buffer Substances 0.000 description 1
- 239000003125 aqueous solvent Substances 0.000 description 1
- 108010084758 arginyl-tyrosyl-aspartic acid Proteins 0.000 description 1
- 108010092854 aspartyllysine Proteins 0.000 description 1
- 230000035578 autophosphorylation Effects 0.000 description 1
- VSRXQHXAPYXROS-UHFFFAOYSA-N azanide;cyclobutane-1,1-dicarboxylic acid;platinum(2+) Chemical compound [NH2-].[NH2-].[Pt+2].OC(=O)C1(C(O)=O)CCC1 VSRXQHXAPYXROS-UHFFFAOYSA-N 0.000 description 1
- 239000011324 bead Substances 0.000 description 1
- 230000006399 behavior Effects 0.000 description 1
- 230000031018 biological processes and functions Effects 0.000 description 1
- 238000001574 biopsy Methods 0.000 description 1
- 210000004369 blood Anatomy 0.000 description 1
- 239000008280 blood Substances 0.000 description 1
- 210000004899 c-terminal region Anatomy 0.000 description 1
- HXCHCVDVKSCDHU-LULTVBGHSA-N calicheamicin Chemical compound C1[C@H](OC)[C@@H](NCC)CO[C@H]1O[C@H]1[C@H](O[C@@H]2C\3=C(NC(=O)OC)C(=O)C[C@](C/3=C/CSSSC)(O)C#C\C=C/C#C2)O[C@H](C)[C@@H](NO[C@@H]2O[C@H](C)[C@@H](SC(=O)C=3C(=C(OC)C(O[C@H]4[C@@H]([C@H](OC)[C@@H](O)[C@H](C)O4)O)=C(I)C=3C)OC)[C@@H](O)C2)[C@@H]1O HXCHCVDVKSCDHU-LULTVBGHSA-N 0.000 description 1
- 229930195731 calicheamicin Natural products 0.000 description 1
- 208000035269 cancer or benign tumor Diseases 0.000 description 1
- 229940065144 cannabinoids Drugs 0.000 description 1
- 150000001720 carbohydrates Chemical class 0.000 description 1
- 239000011203 carbon fibre reinforced carbon Substances 0.000 description 1
- 229960004562 carboplatin Drugs 0.000 description 1
- 239000013592 cell lysate Substances 0.000 description 1
- 238000001516 cell proliferation assay Methods 0.000 description 1
- 230000003833 cell viability Effects 0.000 description 1
- 239000000919 ceramic Substances 0.000 description 1
- 238000001311 chemical methods and process Methods 0.000 description 1
- 238000007385 chemical modification Methods 0.000 description 1
- 230000000973 chemotherapeutic effect Effects 0.000 description 1
- 210000000038 chest Anatomy 0.000 description 1
- WIIZWVCIJKGZOK-RKDXNWHRSA-N chloramphenicol Chemical compound ClC(Cl)C(=O)N[C@H](CO)[C@H](O)C1=CC=C([N+]([O-])=O)C=C1 WIIZWVCIJKGZOK-RKDXNWHRSA-N 0.000 description 1
- 229960005091 chloramphenicol Drugs 0.000 description 1
- 238000011260 co-administration Methods 0.000 description 1
- 201000010897 colon adenocarcinoma Diseases 0.000 description 1
- 230000001447 compensatory effect Effects 0.000 description 1
- 230000002860 competitive effect Effects 0.000 description 1
- 230000006957 competitive inhibition Effects 0.000 description 1
- 230000000295 complement effect Effects 0.000 description 1
- 239000002299 complementary DNA Substances 0.000 description 1
- 230000021615 conjugation Effects 0.000 description 1
- 239000000356 contaminant Substances 0.000 description 1
- 238000011254 conventional chemotherapy Methods 0.000 description 1
- 239000006071 cream Substances 0.000 description 1
- 238000012866 crystallographic experiment Methods 0.000 description 1
- 230000001085 cytostatic effect Effects 0.000 description 1
- 230000003013 cytotoxicity Effects 0.000 description 1
- 231100000135 cytotoxicity Toxicity 0.000 description 1
- 230000006378 damage Effects 0.000 description 1
- 238000013461 design Methods 0.000 description 1
- 238000011161 development Methods 0.000 description 1
- 239000000032 diagnostic agent Substances 0.000 description 1
- 229940039227 diagnostic agent Drugs 0.000 description 1
- KZNICNPSHKQLFF-UHFFFAOYSA-N dihydromaleimide Natural products O=C1CCC(=O)N1 KZNICNPSHKQLFF-UHFFFAOYSA-N 0.000 description 1
- 238000006471 dimerization reaction Methods 0.000 description 1
- 125000005414 dithiopyridyl group Chemical group 0.000 description 1
- 231100000673 dose–response relationship Toxicity 0.000 description 1
- 230000007783 downstream signaling Effects 0.000 description 1
- 230000037437 driver mutation Effects 0.000 description 1
- 239000006196 drop Substances 0.000 description 1
- 239000003118 drug derivative Substances 0.000 description 1
- 229960005501 duocarmycin Drugs 0.000 description 1
- VQNATVDKACXKTF-XELLLNAOSA-N duocarmycin Chemical class COC1=C(OC)C(OC)=C2NC(C(=O)N3C4=CC(=O)C5=C([C@@]64C[C@@H]6C3)C=C(N5)C(=O)OC)=CC2=C1 VQNATVDKACXKTF-XELLLNAOSA-N 0.000 description 1
- 229930184221 duocarmycin Natural products 0.000 description 1
- 230000008482 dysregulation Effects 0.000 description 1
- 230000002500 effect on skin Effects 0.000 description 1
- 201000006828 endometrial hyperplasia Diseases 0.000 description 1
- 229940116977 epidermal growth factor Drugs 0.000 description 1
- 210000002919 epithelial cell Anatomy 0.000 description 1
- 125000004185 ester group Chemical group 0.000 description 1
- VJJPUSNTGOMMGY-MRVIYFEKSA-N etoposide Chemical compound COC1=C(O)C(OC)=CC([C@@H]2C3=CC=4OCOC=4C=C3[C@@H](O[C@H]3[C@@H]([C@@H](O)[C@@H]4O[C@H](C)OC[C@H]4O3)O)[C@@H]3[C@@H]2C(OC3)=O)=C1 VJJPUSNTGOMMGY-MRVIYFEKSA-N 0.000 description 1
- 229960005420 etoposide Drugs 0.000 description 1
- 238000011156 evaluation Methods 0.000 description 1
- 230000007717 exclusion Effects 0.000 description 1
- 238000001943 fluorescence-activated cell sorting Methods 0.000 description 1
- 239000007850 fluorescent dye Substances 0.000 description 1
- 239000004052 folic acid antagonist Substances 0.000 description 1
- 230000004927 fusion Effects 0.000 description 1
- 108020001507 fusion proteins Proteins 0.000 description 1
- 102000037865 fusion proteins Human genes 0.000 description 1
- 108010063718 gamma-glutamylaspartic acid Proteins 0.000 description 1
- 239000000499 gel Substances 0.000 description 1
- 238000007429 general method Methods 0.000 description 1
- 238000003205 genotyping method Methods 0.000 description 1
- VPZXBVLAVMBEQI-UHFFFAOYSA-N glycyl-DL-alpha-alanine Natural products OC(=O)C(C)NC(=O)CN VPZXBVLAVMBEQI-UHFFFAOYSA-N 0.000 description 1
- 108010050848 glycylleucine Proteins 0.000 description 1
- 230000009036 growth inhibition Effects 0.000 description 1
- 125000005179 haloacetyl group Chemical group 0.000 description 1
- 210000003128 head Anatomy 0.000 description 1
- 230000002440 hepatic effect Effects 0.000 description 1
- 229940022353 herceptin Drugs 0.000 description 1
- 238000004128 high performance liquid chromatography Methods 0.000 description 1
- 230000036732 histological change Effects 0.000 description 1
- 229940116978 human epidermal growth factor Drugs 0.000 description 1
- 238000009396 hybridization Methods 0.000 description 1
- 210000004408 hybridoma Anatomy 0.000 description 1
- BHEPBYXIRTUNPN-UHFFFAOYSA-N hydridophosphorus(.) (triplet) Chemical compound [PH] BHEPBYXIRTUNPN-UHFFFAOYSA-N 0.000 description 1
- 125000004435 hydrogen atom Chemical group [H]* 0.000 description 1
- 125000004356 hydroxy functional group Chemical group O* 0.000 description 1
- 229910052588 hydroxylapatite Inorganic materials 0.000 description 1
- 125000004029 hydroxymethyl group Chemical group [H]OC([H])([H])* 0.000 description 1
- 238000003384 imaging method Methods 0.000 description 1
- 230000002163 immunogen Effects 0.000 description 1
- 230000006872 improvement Effects 0.000 description 1
- 239000004615 ingredient Substances 0.000 description 1
- 239000007924 injection Substances 0.000 description 1
- 238000002347 injection Methods 0.000 description 1
- 238000001361 intraarterial administration Methods 0.000 description 1
- 230000003834 intracellular effect Effects 0.000 description 1
- 238000007917 intracranial administration Methods 0.000 description 1
- 239000007927 intramuscular injection Substances 0.000 description 1
- 238000010255 intramuscular injection Methods 0.000 description 1
- 238000007912 intraperitoneal administration Methods 0.000 description 1
- 239000007928 intraperitoneal injection Substances 0.000 description 1
- 238000001990 intravenous administration Methods 0.000 description 1
- 238000005342 ion exchange Methods 0.000 description 1
- 229940084651 iressa Drugs 0.000 description 1
- 108010044374 isoleucyl-tyrosine Proteins 0.000 description 1
- 210000002510 keratinocyte Anatomy 0.000 description 1
- 208000032839 leukemia Diseases 0.000 description 1
- 108700009084 lexitropsin Proteins 0.000 description 1
- 108020001756 ligand binding domains Proteins 0.000 description 1
- 150000002632 lipids Chemical class 0.000 description 1
- 239000007788 liquid Substances 0.000 description 1
- 230000007774 longterm Effects 0.000 description 1
- 239000006210 lotion Substances 0.000 description 1
- 210000004072 lung Anatomy 0.000 description 1
- 108010038320 lysylphenylalanine Proteins 0.000 description 1
- 125000005439 maleimidyl group Chemical group C1(C=CC(N1*)=O)=O 0.000 description 1
- 210000004962 mammalian cell Anatomy 0.000 description 1
- 230000007246 mechanism Effects 0.000 description 1
- 230000010534 mechanism of action Effects 0.000 description 1
- SGDBTWWWUNNDEQ-LBPRGKRZSA-N melphalan Chemical compound OC(=O)[C@@H](N)CC1=CC=C(N(CCCl)CCCl)C=C1 SGDBTWWWUNNDEQ-LBPRGKRZSA-N 0.000 description 1
- 229960001924 melphalan Drugs 0.000 description 1
- 238000002844 melting Methods 0.000 description 1
- 230000008018 melting Effects 0.000 description 1
- 210000004379 membrane Anatomy 0.000 description 1
- 239000012528 membrane Substances 0.000 description 1
- 125000000956 methoxy group Chemical group [H]C([H])([H])O* 0.000 description 1
- 238000002493 microarray Methods 0.000 description 1
- 210000004688 microtubule Anatomy 0.000 description 1
- 230000003278 mimic effect Effects 0.000 description 1
- 229960004857 mitomycin Drugs 0.000 description 1
- 238000011294 monotherapeutic Methods 0.000 description 1
- 210000004400 mucous membrane Anatomy 0.000 description 1
- 229960000513 necitumumab Drugs 0.000 description 1
- 210000003739 neck Anatomy 0.000 description 1
- GVUGOAYIVIDWIO-UFWWTJHBSA-N nepidermin Chemical compound C([C@@H](C(=O)N[C@@H]([C@@H](C)CC)C(=O)NCC(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CS)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(O)=O)NC(=O)CNC(=O)[C@@H](NC(=O)[C@@H](NC(=O)[C@H](CS)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CS)NC(=O)[C@H](C)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CCCCN)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](C)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@@H](NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CCSC)NC(=O)[C@H](CS)NC(=O)[C@@H](NC(=O)CNC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC=1NC=NC=1)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CS)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)CNC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC=1NC=NC=1)NC(=O)[C@H](CO)NC(=O)[C@H](CC(C)C)NC(=O)[C@H]1N(CCC1)C(=O)[C@H](CS)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CO)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CO)NC(=O)[C@@H](N)CC(N)=O)C(C)C)[C@@H](C)CC)C(C)C)C(C)C)C1=CC=C(O)C=C1 GVUGOAYIVIDWIO-UFWWTJHBSA-N 0.000 description 1
- 229950010203 nimotuzumab Drugs 0.000 description 1
- 239000002674 ointment Substances 0.000 description 1
- 230000003287 optical effect Effects 0.000 description 1
- 210000001672 ovary Anatomy 0.000 description 1
- 238000007911 parenteral administration Methods 0.000 description 1
- 230000001575 pathological effect Effects 0.000 description 1
- 230000007170 pathology Effects 0.000 description 1
- 230000008259 pathway mechanism Effects 0.000 description 1
- 239000013610 patient sample Substances 0.000 description 1
- XYJRXVWERLGGKC-UHFFFAOYSA-D pentacalcium;hydroxide;triphosphate Chemical compound [OH-].[Ca+2].[Ca+2].[Ca+2].[Ca+2].[Ca+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O XYJRXVWERLGGKC-UHFFFAOYSA-D 0.000 description 1
- PKXOMKJRBRYJSW-UHFFFAOYSA-N phosphono dihydrogen phosphate;pyrimidine Chemical compound C1=CN=CN=C1.OP(O)(=O)OP(O)(O)=O PKXOMKJRBRYJSW-UHFFFAOYSA-N 0.000 description 1
- 150000008300 phosphoramidites Chemical class 0.000 description 1
- 238000003566 phosphorylation assay Methods 0.000 description 1
- 230000004962 physiological condition Effects 0.000 description 1
- 229940063179 platinol Drugs 0.000 description 1
- 210000004910 pleural fluid Anatomy 0.000 description 1
- 230000010287 polarization Effects 0.000 description 1
- 239000002243 precursor Substances 0.000 description 1
- 238000002360 preparation method Methods 0.000 description 1
- 230000008569 process Effects 0.000 description 1
- 208000037821 progressive disease Diseases 0.000 description 1
- 230000035755 proliferation Effects 0.000 description 1
- 230000002035 prolonged effect Effects 0.000 description 1
- 230000004845 protein aggregation Effects 0.000 description 1
- 230000005180 public health Effects 0.000 description 1
- 230000004144 purine metabolism Effects 0.000 description 1
- 229950010131 puromycin Drugs 0.000 description 1
- 238000010791 quenching Methods 0.000 description 1
- 239000002534 radiation-sensitizing agent Substances 0.000 description 1
- 238000001959 radiotherapy Methods 0.000 description 1
- 239000011541 reaction mixture Substances 0.000 description 1
- 238000003753 real-time PCR Methods 0.000 description 1
- 238000001525 receptor binding assay Methods 0.000 description 1
- 102000027426 receptor tyrosine kinases Human genes 0.000 description 1
- 108091008598 receptor tyrosine kinases Proteins 0.000 description 1
- 238000003259 recombinant expression Methods 0.000 description 1
- 230000000306 recurrent effect Effects 0.000 description 1
- 238000007894 restriction fragment length polymorphism technique Methods 0.000 description 1
- 230000000717 retained effect Effects 0.000 description 1
- 230000002441 reversible effect Effects 0.000 description 1
- 150000003839 salts Chemical class 0.000 description 1
- 238000001963 scanning near-field photolithography Methods 0.000 description 1
- 238000012216 screening Methods 0.000 description 1
- 230000008313 sensitization Effects 0.000 description 1
- 238000012163 sequencing technique Methods 0.000 description 1
- RYMZZMVNJRMUDD-HGQWONQESA-N simvastatin Chemical compound C([C@H]1[C@@H](C)C=CC2=C[C@H](C)C[C@@H]([C@H]12)OC(=O)C(C)(C)CC)C[C@@H]1C[C@@H](O)CC(=O)O1 RYMZZMVNJRMUDD-HGQWONQESA-N 0.000 description 1
- 229960002855 simvastatin Drugs 0.000 description 1
- 238000005549 size reduction Methods 0.000 description 1
- 201000000849 skin cancer Diseases 0.000 description 1
- 238000002415 sodium dodecyl sulfate polyacrylamide gel electrophoresis Methods 0.000 description 1
- VSIVTUIKYVGDCX-UHFFFAOYSA-M sodium;4-[2-(2-methoxy-4-nitrophenyl)-3-(4-nitrophenyl)tetrazol-2-ium-5-yl]benzene-1,3-disulfonate Chemical compound [Na+].COC1=CC([N+]([O-])=O)=CC=C1[N+]1=NC(C=2C(=CC(=CC=2)S([O-])(=O)=O)S([O-])(=O)=O)=NN1C1=CC=C([N+]([O-])=O)C=C1 VSIVTUIKYVGDCX-UHFFFAOYSA-M 0.000 description 1
- 239000000243 solution Substances 0.000 description 1
- 238000001179 sorption measurement Methods 0.000 description 1
- 239000007921 spray Substances 0.000 description 1
- 150000003431 steroids Chemical class 0.000 description 1
- 238000007920 subcutaneous administration Methods 0.000 description 1
- 239000007929 subcutaneous injection Substances 0.000 description 1
- 125000001424 substituent group Chemical group 0.000 description 1
- 238000006467 substitution reaction Methods 0.000 description 1
- 239000000758 substrate Substances 0.000 description 1
- 229960002317 succinimide Drugs 0.000 description 1
- 239000000829 suppository Substances 0.000 description 1
- 230000009897 systematic effect Effects 0.000 description 1
- 238000009121 systemic therapy Methods 0.000 description 1
- 229940120982 tarceva Drugs 0.000 description 1
- 229960003080 taurine Drugs 0.000 description 1
- DKPFODGZWDEEBT-QFIAKTPHSA-N taxane Chemical class C([C@]1(C)CCC[C@@H](C)[C@H]1C1)C[C@H]2[C@H](C)CC[C@@H]1C2(C)C DKPFODGZWDEEBT-QFIAKTPHSA-N 0.000 description 1
- 150000003568 thioethers Chemical class 0.000 description 1
- CNHYKKNIIGEXAY-UHFFFAOYSA-N thiolan-2-imine Chemical compound N=C1CCCS1 CNHYKKNIIGEXAY-UHFFFAOYSA-N 0.000 description 1
- 210000000115 thoracic cavity Anatomy 0.000 description 1
- 210000001541 thymus gland Anatomy 0.000 description 1
- 210000001685 thyroid gland Anatomy 0.000 description 1
- 238000011200 topical administration Methods 0.000 description 1
- 230000000699 topical effect Effects 0.000 description 1
- 239000003053 toxin Substances 0.000 description 1
- 231100000765 toxin Toxicity 0.000 description 1
- 108700012359 toxins Proteins 0.000 description 1
- 230000001131 transforming effect Effects 0.000 description 1
- 230000009261 transgenic effect Effects 0.000 description 1
- 230000007704 transition Effects 0.000 description 1
- 229960000575 trastuzumab Drugs 0.000 description 1
- 108010038745 tryptophylglycine Proteins 0.000 description 1
- 239000000107 tumor biomarker Substances 0.000 description 1
- 150000004917 tyrosine kinase inhibitor derivatives Chemical class 0.000 description 1
- 125000001493 tyrosinyl group Chemical group [H]OC1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])C([H])(N([H])[H])C(*)=O 0.000 description 1
- 201000005112 urinary bladder cancer Diseases 0.000 description 1
- 210000005048 vimentin Anatomy 0.000 description 1
- 229960003048 vinblastine Drugs 0.000 description 1
- JXLYSJRDGCGARV-XQKSVPLYSA-N vincaleukoblastine Chemical compound C([C@@H](C[C@]1(C(=O)OC)C=2C(=CC3=C([C@]45[C@H]([C@@]([C@H](OC(C)=O)[C@]6(CC)C=CCN([C@H]56)CC4)(O)C(=O)OC)N3C)C=2)OC)C[C@@](C2)(O)CC)N2CCC2=C1NC1=CC=CC=C21 JXLYSJRDGCGARV-XQKSVPLYSA-N 0.000 description 1
- OGWKCGZFUXNPDA-XQKSVPLYSA-N vincristine Chemical compound C([N@]1C[C@@H](C[C@]2(C(=O)OC)C=3C(=CC4=C([C@]56[C@H]([C@@]([C@H](OC(C)=O)[C@]7(CC)C=CCN([C@H]67)CC5)(O)C(=O)OC)N4C=O)C=3)OC)C[C@@](C1)(O)CC)CC1=C2NC2=CC=CC=C12 OGWKCGZFUXNPDA-XQKSVPLYSA-N 0.000 description 1
- 229960004528 vincristine Drugs 0.000 description 1
- OGWKCGZFUXNPDA-UHFFFAOYSA-N vincristine Natural products C1C(CC)(O)CC(CC2(C(=O)OC)C=3C(=CC4=C(C56C(C(C(OC(C)=O)C7(CC)C=CCN(C67)CC5)(O)C(=O)OC)N4C=O)C=3)OC)CN1CCC1=C2NC2=CC=CC=C12 OGWKCGZFUXNPDA-UHFFFAOYSA-N 0.000 description 1
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 1
- 229950008250 zalutumumab Drugs 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2863—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against receptors for growth factors, growth regulators
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
- A61K39/39533—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals
- A61K39/39558—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals against tumor tissues, cells, antigens
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
- A61K47/6801—Drug-antibody or immunoglobulin conjugates defined by the pharmacologically or therapeutically active agent
- A61K47/6803—Drugs conjugated to an antibody or immunoglobulin, e.g. cisplatin-antibody conjugates
- A61K47/68033—Drugs conjugated to an antibody or immunoglobulin, e.g. cisplatin-antibody conjugates the drug being a maytansine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
- A61K47/6835—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site
- A61K47/6851—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site the antibody targeting a determinant of a tumour cell
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/20—Immunoglobulins specific features characterized by taxonomic origin
- C07K2317/24—Immunoglobulins specific features characterized by taxonomic origin containing regions, domains or residues from different species, e.g. chimeric, humanized or veneered
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Engineering & Computer Science (AREA)
- Life Sciences & Earth Sciences (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Immunology (AREA)
- Medicinal Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Organic Chemistry (AREA)
- Epidemiology (AREA)
- Biophysics (AREA)
- Biochemistry (AREA)
- Genetics & Genomics (AREA)
- Molecular Biology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Cell Biology (AREA)
- Oncology (AREA)
- Mycology (AREA)
- Microbiology (AREA)
- Biomedical Technology (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Peptides Or Proteins (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicinal Preparation (AREA)
- Measuring Or Testing Involving Enzymes Or Micro-Organisms (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
Abstract
본 발명은 EGFR 항체 면역접합체가 EGFR 및/또는 ALK 내성 기전을 발생시킨 종양 세포의 성장을 억제하는 데 효과적이라는 확인에 관한 것이다. 내성 종양 세포를 갖는 환자에게 EGFR 항체 면역접합체를 투여하는 방법이 또한 개시되어 있다.
Description
본 발명은 EGFR 항체 면역접합체가 EGFR 내성 기전을 발생시킨 종양 세포의 성장을 억제하는 데 효과적이라는 확인에 관한 것이다.
표피 성장 인자 수용체(EGFR; ErbB-1; HER1)는 세포외 단백질 리간드의 표피 성장 인자(epidermal growth factor: EGF) 패밀리에 대한 세포 표면 수용체이다(Herbst RS. Int J Radiat Oncol Bio Phys 59: 21 (2004)). EGFR은 EGFR, HER2/c-neu(ErbB2), HER3(ErbB-3) 및 HER4(ErbB-4)의 4개의 밀접하게 관련된 수용체 티로신 키나제의 하위패밀리인 수용체의 ErbB 패밀리의 구성원이다. EGFR 활성화는 표피 성장 인자(EGF) 및 형질전환 성장 인자-a(TGFa)와 같은 이의 특이적 리간드의 결합에 의해 유발된다. 리간드 결합 시, EGFR은 불활성 단량체 형태로부터 활성 동형이량체로의 이행을 겪는다. 또한, EGFR은 HER2 및 HER3과 같은 ErbB 수용체 패밀리의 다른 구성원과 쌍을 지어 활성 이형이량체를 생성할 수 있다. EGFR 이량체화는 카복시 말단에서 몇몇 티로신 잔기를 자기인산화시키는 이의 고유 세포내 단백질 티로신 키나제 활성을 자극한다(Downward J. et al., Nature 311: 483 (1984)). 이후, 자기인산화는 다운스트림 신호전달 케스케이드, 원칙적으로 MAPK, Akt 및 JNK 경로를 유발하여 DNA 합성 및 세포 증식을 발생시킨다.
EGFR은 중요한 암유전자이다. 구성적 활성화를 발생시키는 EGFR 과발현 및 돌연변이는 폐암, 결장암, 두경부암 및 교모세포종을 포함하는 여러 암과 관련된다(Zhang H. et al., J Clin Invest 117: 2051 (2007)). 이러한 발견은 EGFR에 대한 항암 치료제를 개발시켰다. 2개의 소분자 티로신 키나제 억제제(TKI)인 엘로티닙(Tarceva) 및 게피티닙(Iressa)은 비소세포 폐암(NSCLC) 및 췌장암에 허가받았다. 또한, EGFR에 대한 2개의 길항적 단일클론 항체인 세툭시맙(Erbitux) 및 파니튜무맙(Vectibix)이 두경부의 편평 세포 암종(SCCHN) 및 결장암(CRC)에 허가받았다.
2개의 EGFR 키나제 억제제인 엘로티닙 및 게피티닙은 L858R 및/또는 엑손 19 결실 EGFR 돌연변이를 보유하는 선암 조직을 갖는 NSCLC에서 단일 물질 치료제로서 예상외로 효과적이다(Lynch TJ et al., N Engl J Med 350: 2129 (2004), Paez JG. et al. Science 304: 1497 (2004)). 이러한 감작화 EGFR 돌연변이를 갖는 환자는 이러한 EGFR 키나제 억제제에 의해 종래의 화학치료에 대한 반응 속도를 초과하는 약 70%의 반응 속도를 나타낸다. 그러나, 실질적인 초기 반응에도 불구하고, 이 암은 결국 키나제 억제제에 내성을 발생시킨다. 일반적으로, EGFR 치료에 대한 내성 기전은 (1) EGFR 돌연변이, 예컨대 EGFRvIII 및 T790M 돌연변이, (2) PIK3CA, RAS 및 PTEN의 돌연변이와 같은 EGFR 다운스트림 경로를 활성화시키는 돌연변이 및 (3) 보상 경로, 예컨대 MET 및 IGF1R 경로의 활성화의 3개의 주요한 카테고리로 나눌 수 있다. EGFR 표적화 치료에 대한 내성의 다양한 기전의 발견은 후속하는 EGFR 치료 생성에 대한 새로운 도전과제를 제시한다.
2개의 EGFR 길항적 항체인 세툭시맙 및 파니튜무맙은 리간드 결합의 봉쇄를 통해 EGFR 신호전달을 억제한다(Gill et al., J Biol Chem, 259:7755-7760 (1984), Goldstein et al., Clin Cancer Res, 1:1311-1318 (1995), Prewett et al., Clin Cancer Res, 4:2957-2966 (1998)). 세툭시맙 치료는 화학치료에 반응하지 않는 결장암을 앓는 환자에서 전체 생존율 및 무진행 생존율을 개선하고 삶의 질을 보존한다. 그러나, 세툭시맙 치료는 코돈 12 및 13에서 흔히 발견되는 KRAS 돌연변이를 갖는 결장암 환자에 임상 이익을 갖지 않는다(Karapetis C et al., N Engl J Med 359: 1757 (2008)). 유사하게, SCCHN에서, EGFR 항체는 EGFR의 엑손 2-7 결실 돌연변이(EGFRvIII)를 보유하는 암에서 덜 효과적이다(Sok J. et al. Clin Cancer Res 12: 5064 (2006)). 따라서, EGFR 표적화 치료에 대한 흔한 내성 기전을 극복할 수 있는 새로운 암 치료에 대한 수요가 존재한다.
본 발명은 EGFR 항체 면역접합체가 항-EGFR 치료에 내성을 나타내는 종양 세포의 성장을 억제하는 데 있어서 효과적이라는 확인에 관한 것이다. 특정한 실시양태에서, EGFR 항체 면역접합체는 또한 역형성 림프종 키나제(anaplastic lymphoma kinase: ALK) 억제제 내성을 나타내는 종양 세포의 성장을 억제하는 데 있어서 효과적이다.
따라서, 일 실시양태에서, 본 발명은 상기 종양 세포를 유효량의 EGFR 항체 면역접합체와 접촉시키는 단계를 포함하는 EGFR 치료에 내성 또는 불응성을 나타내는 EGFR 발현 종양 세포의 성장을 억제하는 방법을 제공한다. 일 실시양태에서, 세포가 내성을 나타내는 EGFR 치료는 엘로티닙(erlotinib), 게피티닙(gefitinib), 라파티닙(lapatinib), BIB2992, 세툭시맙(cetuximab), 파니튜무맙(panitumumab), 잘루튜무맙(zalutumumab), 네시튜무맙(necitumumab) 및 니모튜무맙(nimotuzumab)으로 이루어진 군으로부터 선택된다. 다른 실시양태에서, 하나 이상의 종양 세포는 (1) EGFR 코딩 유전자에서 하나 이상의 돌연변이를 포함하거나; (2) PIK3CA, RAS 또는 PTEN 코딩 유전자에서 하나 이상의 돌연변이를 포함하거나; (3) 활성화 MET 또는 IGF1R 경로를 갖거나; (4) 간엽성 조직학을 갖거나 상피-간엽성 전이를 겪거나; 또는 (5) ERBB2 유전자 증폭 또는 HER2 단백질의 생성 증가를 갖는다. 다른 실시양태에서, EGFR 돌연변이는 EGFRvIII 또는 T790M 돌연변이를 포함한다. 다른 실시양태에서, 하나 이상의 종양 세포는 예를 들면 PIK3CA, RAS 또는 PTEN 코딩 유전자의 돌연변이에 의한 활성화 EGFR 다운스트림 경로를 갖는다. 다른 실시양태에서, 하나 이상의 종양 세포는 MET 또는 IGF1R 경로와 같은 대안적인 활성화 경로(들)를 갖는다. MET 활성화는 MET 유전자 증폭 및/또는 MET 리간드 발현에 의해 발생된다.
특정한 실시양태에서, EGFR 항체 면역접합체는 또한 역형성 림프종 키나제(ALK) 억제제 내성을 나타내는 EGFR 내성/불응성 종양 세포의 성장을 억제하는 데 효과적이다. 일 실시양태에서, 하나 이상의 종양 세포는 EML4-ALK 전좌를 포함한다. 다른 실시양태에서, 종양 세포는 비소세포 폐 종양이다.
본 발명은 또한 환자에서 암을 치료하는 방법으로서, 상기 환자에서 종양 세포의 성장을 억제하기 위한 유효량의 EGFR 항체 면역접합체를 투여하는 단계를 포함하고, 하나 이상의 종양 세포는 (1) EGFR 코딩 유전자에서 하나 이상의 돌연변이를 포함하거나; (2) PIK3CA, RAS 또는 PTEN 코딩 유전자에서 하나 이상의 돌연변이를 포함하거나; (3) 활성화 MET 또는 IGF1R 경로를 갖거나; (4) 간엽성 조직학을 갖거나 상피-간엽성 전이를 겪거나; 또는 (5) ERBB2 유전자 증폭 또는 HER2 단백질의 생성 증가를 갖는 방법을 제공한다. 일 실시양태에서, MET 활성화는 MET 유전자 증폭에 의해 발생된다.
본 발명은 또한 환자에서 암을 치료하는 방법으로서, (a) 상기 환자로부터 (1) EGFR 코딩 유전자에서 하나 이상의 돌연변이를 포함하거나; (2) PIK3CA, RAS 또는 PTEN 코딩 유전자에서 하나 이상의 돌연변이를 포함하거나; (3) 활성화 MET 또는 IGF1R 경로를 갖거나; 또는 (4) 간엽성 조직학을 갖거나 상피-간엽성 전이를 겪거나; (5) ERBB2 유전자 증폭 또는 HER2 단백질의 생성 증가를 갖는 상기 환자로부터 종양 세포를 확인하는 단계; 및 (b) 유효량의 EGFR 항체 면역접합체를 상기 환자에게 투여하는 단계를 포함하는 방법을 제공한다. 일 실시양태에서, MET 활성화는 MET 유전자 증폭에 의해 발생된다. 일 실시양태에서, 암은 편평 세포 암종, 폐암, 두경부암 또는 EGFR 양성 암이다.
일 실시양태에서, 환자는 EGFR 치료에 이전에 실패하였거나 현재 실패하고 있다. 다른 실시양태에서, 치료는 EGFR 항체 또는 EGFR 키나제 억제제의 투여를 포함한다. 다른 실시양태에서, EGFR 항체는 세툭시맙 또는 파니튜무맙이다. 다른 실시양태에서, EGFR 키나제 억제제는 엘로티닙 또는 게피티닙이다.
특정한 실시양태에서, EGFR 항체 면역접합체는 하나 이상의 ALK 억제제 내성 종양 세포를 포함하는 환자에서 암을 치료하는 데 효과적이다. 일 실시양태에서, 하나 이상의 종양 세포는 EML4-ALK 전좌를 포함한다. 다른 실시양태에서, 종양 세포는 비소세포 폐 종양이다.
일 실시양태에서, 항체 면역접합체는 화학식 (A)-(L)-(C)를 갖고, (A)는 EGFR에 특이적으로 결합하는 항체 또는 이의 항원 결합 단편이고; (L)은 링커이며; (C)는 세포독성제이고; 상기 링커(L)는 (A)를 (C)에 연결시킨다. 다른 실시양태에서, EGFR 항체는 서열 번호 1의 중쇄 가변 영역 및 서열 번호 2 또는 3의 경쇄 가변 영역을 포함한다. 다른 실시양태에서, 링커는 개열형 링커, 비개열형 링커, 친수성 링커 및 다이카복실산계 링커로 이루어진 군으로부터 선택된다. 다른 실시양태에서, 링커는 비개열형 링커이다. 다른 실시양태에서, 링커는 N-숙신이미딜 4-(2-피리딜다이티오)펜타노에이트(SPP); N-숙신이미딜 4-(2-피리딜다이티오)뷰타노에이트(SPDB) 또는 N-숙신이미딜 4-(2-피리딜다이티오)-2-설포뷰타노에이트(설포-SPDB); N-숙신이미딜 4-(말레이미도메틸) 사이클로헥산카복실레이트(SMCC); N-설포숙신이미딜 4-(말레이미도메틸) 사이클로헥산카복실레이트(설포SMCC); N-숙신이미딜-4-(요오도아세틸)-아미노벤조에이트(SIAB); N-숙신이미딜-[(N-말레이미도프로피온아미도)-테트라에틸렌글라이콜] 에스터(NHS-PEG4-말레이미드), N-(베타-말레이미도프로필옥시)숙신이미드 에스터(BMPS); 및 감마-말레이미도뷰티르산 N-숙신이미딜 에스터(GMBS)로 이루어진 군으로부터 선택된다. 다른 실시양태에서, 세포독성제는 메이타시노이드, 메이타시노이드 유사체, 독소루비신, 변형 독소루비신, 벤조디아제핀, 탁소이드, CC-1065, CC-1065 유사체, 듀오카르마이신, 듀오카르마이신 유사체, 칼리키아미신, 돌라스타틴, 돌라스타틴 유사체, 아리스타틴, 토메이마이신 유도체 및 렙토마이신 유도체 또는 상기 물질의 프로드럭으로 이루어진 군으로부터 선택된다. 다른 실시양태에서, 세포독성제는 메이타시노이드이다. 다른 실시양태에서, 세포독성제는 N(2')-데아세틸-N(2')-(3-머캅토-1-옥소프로필)-메이탄신(DM1) 또는 N(2')-데아세틸-N2-(4-머캅토-4-메틸-1-옥소펜틸)-메이탄신(DM4)이다. 다른 실시양태에서, EGFR 항체 면역접합체는 서열 번호 1의 중쇄 가변 영역 및 서열 번호 2 또는 서열 번호 3의 경쇄 가변 영역을 포함하는 항체; 링커 SMCC; 및 메이타시노이드 DM1을 포함한다.
일 실시양태에서, 항체 면역접합체는 하나 이상의 추가의 항신생물제와 투여된다. 다른 실시양태에서, EGFR 항체 면역접합체는 항신생물제와 동시에 투여된다. 다른 실시양태에서, EGFR 항체 면역접합체 및 항신생물제는 임의의 시간상 순서로 투여된다. 다른 실시양태에서, 환자는 인간이다.
특정한 실시양태에서, 치료는 본 발명의 EGFR 면역접합체 및 하나 이상의 추가의 표적화 치료제의 병용 투여를 포함한다. 유용한 표적화 치료제 종류는 예를 들면 (1) HER2 억제제, (2) EGFR 억제제(예를 들면, 티로신 키나제 억제제 또는 표적화 항-EGFR 항체), (3) BRAF 억제제, (4) ALK 억제제, (5) 호르몬 수용체 억제제, (6) mTOR 억제제, (7) VEGF 억제제 또는 (8) 암 백신을 포함하지만, 이들로 제한되지는 않는다. 티로신 키나제 억제제는 EGFR에 특이적이거나 다중 특이적일 수 있고, EGFR 이외에 또는 이것에 추가로 하나 이상의 키나제의 활성을 억제할 수 있다.
도 1은 L858R 및 T790M EGFR 돌연변이를 보유하는 NCI-H1975 NSCLC 종양 세포주에 대한 huEGFR-7R 네이키드 항체 및 huEGFR-7R-SMCC-DM1 접합체의 세포독성 활성을 도시한 선 그래프이다.
도 2는 50ng/㎖의 간세포 성장 인자(HGF)의 존재 또는 부재 하의 HCC827 NSCLC 세포주에 대한 엘로티닙의 세포독성 활성을 도시한 선 그래프이다.
도 3은 50ng/㎖의 HGF의 부재(A) 또는 존재(B) 하의 HCC827 NSCLC 세포주에 대한 세툭시맙, huEGFR-7R 네이키드 항체 및 huEGFR-7R-SMCC-DM1 접합체의 세포독성 활성을 도시한 선 그래프이다.
도 4는 NCI-H226인 간엽성 NSCLC 세포주에 대한 huEGFR-7R 네이키드 항체 및 huEGFR-7R-SMCC-DM1 접합체의 세포독성 활성을 도시한 선 그래프이다.
도 5는 엘로티닙 내성 HCC827 NSCLC 세포주의 규명을 도시한 것이다. (A)는 부모 HCC827 세포주 및 엘로티닙 내성 HCC827-ER 세포주에 대한 엘로티닙의 세포독성 활성을 도시한 선 그래프이다. (B)는 부모 HCC827 세포주 및 엘로티닙 내성 HCC827-ER 세포주의 조직학적 사진이다. (C)는 부모 HCC827 세포주 및 엘로티닙 내성 HCC827-ER 세포주의 웨스턴 블롯 분석이다.
도 6은 부모 HCC827 세포주 및 엘로티닙 내성 HCC827-ER 세포주에 대한 EGFR, HER3 및 MET의 발현을 도시한 유동 세포계수법 히스토그램을 보여준다.
도 7은 부모 HCC827 세포주인 엘로티닙 내성 HCC827-ER 및 HCC827-ER-E4 세포주에 대한 엘로티닙의 세포독성 활성을 도시한 선 그래프이다.
도 8은 기재된 용량에서의 엘로티닙의 16시간 치료 후 부모 HCC827 세포주 및 엘로티닙 내성 HCC827-ER-E4 세포주의 웨스턴 블롯 분석을 보여준다.
도 9는 부모 HCC827 세포주 및 엘로티닙 내성 HCC827-ER-E4 세포주에 대한 세툭시맙, huEGFR-7R 네이키드 항체 및 huEGFR-7R-SMCC-DM1 접합체의 세포독성 활성을 도시한 선 그래프이다.
도 10은 G12V KRAS 돌연변이를 보유하는 SW620 결장 선암 세포주에 대한 huEGFR-7R-SMCC-DM1 접합체의 세포독성 활성을 도시한 선 그래프이다.
도 11은 H1047R PIK3CA 돌연변이를 보유하는 두경부의 데트로이트(Detroit) 562 편평 세포 암종(SCCHN) 세포주에 대한 세툭시맙, huEGFR-7R 네이키드 항체 및 huEGFR-7R-SMCC-DM1 접합체의 세포독성 활성을 도시한 선 그래프이다.
도 12는 부모 HCC827 세포(A), 엘로티닙 내성 HCC827 ER 세포(B) 및 HCC827 EPR 세포(C)에 대한 huEGFR-7R 항체, huEGFR-7R-SMCC-DM1 접합체, chKTI-SMCC-DM1 접합체, 세툭시맙 및 엘로티닙의 세포독성 활성을 보여준다.
도 13은 EML4-ALK 유전자 전좌를 보유하는 H2228 NSCLC 선암 세포주에 대한 크리조티닙 및 엘로티닙(A); 및 huEGFR-7R 항체, huEGFR-7R-SMCC-DM1 접합체, chKTI-SMCC-DM1 접합체 및 세툭시맙(B)의 세포독성 활성을 보여준다.
도 2는 50ng/㎖의 간세포 성장 인자(HGF)의 존재 또는 부재 하의 HCC827 NSCLC 세포주에 대한 엘로티닙의 세포독성 활성을 도시한 선 그래프이다.
도 3은 50ng/㎖의 HGF의 부재(A) 또는 존재(B) 하의 HCC827 NSCLC 세포주에 대한 세툭시맙, huEGFR-7R 네이키드 항체 및 huEGFR-7R-SMCC-DM1 접합체의 세포독성 활성을 도시한 선 그래프이다.
도 4는 NCI-H226인 간엽성 NSCLC 세포주에 대한 huEGFR-7R 네이키드 항체 및 huEGFR-7R-SMCC-DM1 접합체의 세포독성 활성을 도시한 선 그래프이다.
도 5는 엘로티닙 내성 HCC827 NSCLC 세포주의 규명을 도시한 것이다. (A)는 부모 HCC827 세포주 및 엘로티닙 내성 HCC827-ER 세포주에 대한 엘로티닙의 세포독성 활성을 도시한 선 그래프이다. (B)는 부모 HCC827 세포주 및 엘로티닙 내성 HCC827-ER 세포주의 조직학적 사진이다. (C)는 부모 HCC827 세포주 및 엘로티닙 내성 HCC827-ER 세포주의 웨스턴 블롯 분석이다.
도 6은 부모 HCC827 세포주 및 엘로티닙 내성 HCC827-ER 세포주에 대한 EGFR, HER3 및 MET의 발현을 도시한 유동 세포계수법 히스토그램을 보여준다.
도 7은 부모 HCC827 세포주인 엘로티닙 내성 HCC827-ER 및 HCC827-ER-E4 세포주에 대한 엘로티닙의 세포독성 활성을 도시한 선 그래프이다.
도 8은 기재된 용량에서의 엘로티닙의 16시간 치료 후 부모 HCC827 세포주 및 엘로티닙 내성 HCC827-ER-E4 세포주의 웨스턴 블롯 분석을 보여준다.
도 9는 부모 HCC827 세포주 및 엘로티닙 내성 HCC827-ER-E4 세포주에 대한 세툭시맙, huEGFR-7R 네이키드 항체 및 huEGFR-7R-SMCC-DM1 접합체의 세포독성 활성을 도시한 선 그래프이다.
도 10은 G12V KRAS 돌연변이를 보유하는 SW620 결장 선암 세포주에 대한 huEGFR-7R-SMCC-DM1 접합체의 세포독성 활성을 도시한 선 그래프이다.
도 11은 H1047R PIK3CA 돌연변이를 보유하는 두경부의 데트로이트(Detroit) 562 편평 세포 암종(SCCHN) 세포주에 대한 세툭시맙, huEGFR-7R 네이키드 항체 및 huEGFR-7R-SMCC-DM1 접합체의 세포독성 활성을 도시한 선 그래프이다.
도 12는 부모 HCC827 세포(A), 엘로티닙 내성 HCC827 ER 세포(B) 및 HCC827 EPR 세포(C)에 대한 huEGFR-7R 항체, huEGFR-7R-SMCC-DM1 접합체, chKTI-SMCC-DM1 접합체, 세툭시맙 및 엘로티닙의 세포독성 활성을 보여준다.
도 13은 EML4-ALK 유전자 전좌를 보유하는 H2228 NSCLC 선암 세포주에 대한 크리조티닙 및 엘로티닙(A); 및 huEGFR-7R 항체, huEGFR-7R-SMCC-DM1 접합체, chKTI-SMCC-DM1 접합체 및 세툭시맙(B)의 세포독성 활성을 보여준다.
본 발명은 EGFR 항체 접합체가 비접합 EGFR 항체 및/또는 ALK 억제제를 포함하는 EGFR 치료제에 내성을 나타내는 종양 세포를 치료하는 데 유용하다는 발견에 관한 것이다. 특히, 피부 각질세포와 같은 EGFR을 발현하는 정상 세포에 제한된 효과를 미치면서 EGFR 경로에 의한 종양 세포 성장을 억제하는 능력을 갖는 EGFR 항체를 포함하는 항체 약물 접합체가 EGFR 치료 내성 종양에 효과적인 것으로 밝혀졌다. 중요한 것은 다른 EGFR 억제제와 유사한 EGFR 항체 성분은 단독으로는 EGFR 표적화 치료에 내성을 나타내는 종양 세포에 비효과적이라는 것이다. 그러나, 메이타시노이드 페이로드(payload)와 커플링될 때, 접합체는 놀랍게도 EGFR 억제제에 다양한 내성 기전을 갖는 종양 세포에 대해 양호한 활성을 나타낸다.
I. 정의
본 발명의 이해를 돕기 위해, 여러 용어 및 구문이 하기 정의되어 있다.
"표피 성장 인자 수용체" 또는 "EGFR"은 티로신 키나제 세포 표면 수용체이다. 용어 "가용성 EGFR" 또는 "sEGFR"은 EGFR의 세포외 리간드-결합 도메인을 포함하는 EGFR의 부분을 의미한다. 더 구체적으로, sEGFR은 성숙 EGFR의 1-619번 아미노산을 포함한다(Ullrich et al., Human Epidermal Growth Factor cDNA Sequence and Aberrant Expression of the Amplified Gene in A-431 Epidermoid Carcinoma Cells, Nature, Vol. 309, 418-25 (1986)). 본 명세서에 기재된 "표피 성장 인자 수용체" 또는 "EGFR"은 야생형 또는 전장 EGFR뿐만 아니라 EGFR의 모든 돌연변이체 형태를 포함하는 것으로 의도되고, 이들 중 몇몇 형태는 하기 기재되어 있다.
"EGFRvIII"는 엑손 2 내지 7이 결실되어 EGFR의 세포외 도메인에서 267개의 아미노산 프레임내 결실을 발생시키는 EGFR의 변이체를 의미한다. EGFRvIII는 또한 III형 돌연변이체, 델타-EGFR, EGFRde2-7 및 ?FR로 공지되어 있고, 미국 특허 제6,455,498호, 제6,127,126호, 제5,981,725호, 제5,814,317호, 제5,710,010호, 제5,401,828호 및 제5,212,290호에 기재되어 있다.
"결실된 EGFR 변이체"는 세포외 도메인의 부분이 손실되어 EGFR 신호전달이 리간드에 적어도 부분적으로 독립적으로 되는 EGFR의 결실 변이체를 의미한다.
"ALK 억제제"는 역형성 림프종 키나제(ALK)의 변이, 예컨대 EML4-ALK 전좌를 갖는 종양에 작용하는 항암 약물을 의미한다. EML4-ALK 전좌는 EML4-ALK 양성 암을 발생시킨다. EML4-ALK 양성 암은 세포가 극피동물 미세소관 관련 단백질 유사물 4(echinoderm microtubule-associated protein-like 4: EML4) 유전자가 ALK 유전자에 융합된 DNA의 특징적인 비정상 배좌를 포함하는 원발성 악성 종양을 의미한다. 이 비정상 유전자 융합은 많은 경우에 암 세포의 악성 거동을 증진시키고 유지시키는 것으로 보이는 단백질(EML4-ALK)을 생성시킨다.
용어 "K-ras 돌연변이체"는 야생형 K-ras(또는 이러한 K-ras 단백질을 코딩하는 뉴클레오타이드 서열)와 비교하여 하나 이상의 아미노산 돌연변이를 포함하는 K-ras 단백질을 의미한다. K-ras 돌연변이체는 대립유전자 변이체, 스플라이스 변이체, 치환 변이체, 결실 변이체 및 삽입 변이체를 포함할 수 있지만, 이들로 제한되지는 않는다. 용어 "K-ras 돌연변이"는 야생형 서열(또는 이러한 K-ras 단백질을 코딩하는 뉴클레오타이드 서열)과 비교하여 K-ras 단백질의 서열에서의 하나 이상의 아미노산 돌연변이를 의미한다. 용어 "K-ras 돌연변이체 종양" 또는 "K-ras 돌연변이를 포함(또는 함유)하는 종양"은 본 명세서에서 상호 교환되어 사용되고 K-ras 돌연변이가 단백질 또는 뉴클레오타이드 수준에서 결실될 수 있는 종양 세포 집단을 의미한다. 용어 "K-ras 돌연변이를 포함(또는 함유)하는 암"은 본 명세서에서 K-ras 돌연변이가 단백질 또는 뉴클레오타이드 수준에서 결실될 수 있는 암 세포 집단을 의미한다. PCR 기반 검정(예를 들면, 중합효소 사슬 반응-제한효소 단편 길이 다형성(PCR-RFLP) 검정, 중합효소 사슬 반응-단일 가닥 구조 다형성(PCR-SSCP) 검정, 실시간 PCR 검정, PCR 서열분석, 돌연변이체 대립유전자-특이적 PCR 증폭(MASA) 검정), 직접 서열분석, 프라이머 연장 반응, 전기영동, 올리고뉴클레오타이드 결찰 검정, 하이브리드화 검정, TaqMan 검정, SNP 유전형 검정, 고해상 용융 검정 및 마이크로어레이 분석(이들로 제한되지는 않음)을 비롯한 당업자에게 공지된 기법 및 방법에 의해 K-ras 및 EGFR 돌연변이를 검출할 수 있다.
용어 "활성화 돌연변이"는 신호전달 경로의 K-ras 및 구성적 활성화와 같은 단백질의 구성적 활성화를 발생시키는 돌연변이를 의미한다. 몇몇 실시양태에서, 활성화 돌연변이를 포함하는 K-ras 단백질은 MAP 키나제 케스케이드 및 PI3 키나제 케스케이드(이들로 제한되지는 않음)를 비롯한 여러 경로의 구성적 활성을 개시시킨다. 몇몇 실시양태에서, K-ras 돌연변이체 및 신호전달 경로에 의한 구성적 활성은 중요하게는 세포 증식 조절이상, 분화 손상, 아폽토시스 감소 및 세포 생존 연장을 비롯한 악성 표현형의 여러 양태에 기여한다.
구문 "EGFR 중재 암"은 EGFR이 상응하는 정상 상피 조직에서보다 높은 수준으로 비정상적으로 활성화되는 상피 종양을 특징으로 하는 암이다. 이러한 더 높은 수준의 EGFR 활성은 여러 암의 유형에서 종양 성장을 촉진한다. 이러한 암은 비소세포 폐암, 유방암, 결장암, 두경부암, 전립선암 및 교모세포종을 포함하지만, 이들로 제한되지는 않는다. EGFR의 비정상 활성화는 수용체의 과발현, 유전자 증폭, 활성화 돌연변이, 수용체 리간드의 과발현 및/또는 EGFR 활성의 조절자 손실로부터 발생할 수 있다.
용어 "항체"는 면역글로불린 분자의 가변 영역 내의 하나 이상의 항원 인식 자리를 통해 표적, 예컨대 단백질, 폴리펩타이드, 펩타이드, 탄수화물, 폴리뉴클레오타이드, 지질 또는 상기의 조합을 인식하고 이에 특이적으로 결합하는 면역글로불린 분자를 의미한다. 본 명세서에서 사용되는 용어 "항체"는, 항체가 원하는 생물학적 활성을 나타내는 한, 비손상 다중클론 항체, 비손상 단일클론 항체, 항체 단편(예컨대, Fab, Fab', F(ab')2 및 Fv 단편), 단쇄 Fv(scFv) 돌연변이체, 다중특이적 항체, 예컨대 적어도 2개의 비손상 항체로부터 생성된 이중특이적 항체, 키메라 항체, 인간화 항체, 인간 항체, 항체의 항원 결정 부분을 포함하는 융합 단백질 및 항원 인식 자리를 포함하는 임의의 다른 변형 면역글로불린 분자를 포함한다. 항체는 각각 알파, 델타, 엡실론, 감마 및 뮤라 칭하는 이의 중쇄 불변 도메인의 아이덴티티에 기초하여 IgA, IgD, IgE, IgG 및 IgM 또는 이의 아형(아이소타입)(예를 들면, IgG1, IgG2, IgG3, IgG4, IgA1 및 IgA2)의 임의의 5개의 주요 종류의 면역글로불린일 수 있다. 상이한 종류의 면역글로불린은 널리 알려진 상이한 서브유닛 구조 및 3차원 입체배열을 갖는다. 항체는 네이키드이거나 독소, 방사성 동위원소 등과 같은 다른 분자에 접합될 수 있다.
"차단" 항체 또는 "길항제" 항체는 이 항체가 결합하는 항원, 예컨대 EGFR의 생물학적 활성을 억제하거나 감소시키는 것이다. 몇몇 실시양태에서, 차단 항체 또는 길항제 항체는 항원의 생물학적 활성을 실질적으로 또는 완전히 억제한다. 생물학적 활성은 10%, 20%, 30%, 50%, 70%, 80%, 90%, 95% 또는 심지어 100% 감소할 수 있다.
본 명세서에서 항체와 관련하여 사용되는 구문 "EGFR 활성화를 억제하는 능력"은 EGFR에 대한 항체의 결합이 수용체의 활성화 시 발생하는 인간 EGFR 활성화 및 인간 EGFR의 생물학적 활성을 억제시키는 항체를 의미하도록 의도된다. 세포 증식 검정, 아폽토시스 검정, 수용체 결합 검정, 수용체 인산화 검정 또는 마우스 종양 모델을 이용하여 결정되는 EGFR 생물학적 활성의 하나 이상의 표시자를 측정하는 것은 EGFR 활성화를 억제하는 항체의 능력을 평가할 수 있다.
용어 "항-EGFR 항체" 또는 "EGFR에 결합하는 항체"는 충분한 친화도를 갖는 EGFR와 결합할 수 있는 항체여서, 이 항체가 EGFR을 표적화하는 데 있어서 진단제 및/또는 치료제로서 유용한 항체를 의미한다. 몇몇 항-EGFR 항체가 당해 분야에 공지되어 있다. 예를 들면, 세툭시맙(Ab 225) 및 528 Ab는 미국 특허 제4,943,533호(본 명세서에서 그 전문이 참조문헌으로 포함됨)에 기재되어 있다.
관련되지 않은 비-EGFR 단백질에 대한 항-EGFR 항체의 결합 정도는 예를 들면 방사선 면역검정(RIA)으로 측정할 때 EGFR에 대한 항체의 결합의 약 10% 미만일 수 있다. 특정한 실시양태에서, EGFR에 결합하는 항체는 해리 상수(Kd)가 =1μM, =100nM, =10nM, =1nM 또는 =0.1nM이다. 다른 실시양태에서, 항체는 약 100nM 내지 약 0.1nM, 약 10nM 내지 약 0.1nM 또는 약 1nM 내지 약 0.1nM의 해리 상수로 EGFR에 결합한다.
용어 "항체 단편"은 비손상 항체의 부분을 의미하고 비손상 항체의 항원 결정 가변 영역을 의미한다. 항체 단편의 예는 Fab, Fab', F(ab')2 및 Fv 단편, 선형 항체, 단쇄 항체 및 항체 단편으로부터 형성된 다중특이적 항체를 포함하지만, 이들로 제한되지는 않는다.
"단일클론 항체"는 단일 항원 결정부위 또는 에피토프의 고특이적 인식 및 결합에 관련되는 동종 항체 집단을 의미한다. 이는 상이한 항원 결정부위에 지시된 상이한 항체를 통상적으로 포함하는 다중클론 항체와 대조적이다. 용어 "단일클론 항체"는 비손상 단일클론 항체 및 전장 단일클론 항체 둘 다 및 항체 단편(예컨대, Fab, Fab', F(ab')2, Fv), 단쇄(scFv) 돌연변이체, 항체 부분을 포함하는 융합 단백질 및 항원 인식 자리를 포함하는 임의의 다른 변형 면역글로불린 분자를 포함한다. 게다가, "단일클론 항체"는 하이브리도마, 파지 선택, 재조합 발현 및 형질전환 동물(이들로 제한되지는 않음)을 비롯한 임의의 여러 방식으로 제조된 항체를 의미한다.
용어 "인간화 항체"는 특이적 면역글로불린 사슬인 비인간(예를 들면, 쥣과) 항체, 키메라 면역글로불린 또는 최소 비인간(예를 들면, 쥣과) 서열을 포함하는 이의 단편의 형태를 의미한다. 통상적으로, 인간화 항체는 상보적 결정 구역(complementary determining region: CDR)으로부터의 잔기가 원하는 특이성, 친화도 및 능력을 갖는 비인간 종(예를 들면, 마우스, 랫트, 래빗, 햄스터)의 CDR로부터의 잔기로 대체되는 인간 면역글로불린이다(Jones et al., 1986, Nature, 321:522-525; Riechmann et al., 1988, Nature, 332:323-327; Verhoeyen et al., 1988, Science, 239:1534-1536). 몇몇 경우에, 인간 면역글로불린의 Fv 프레임워크 구역(FR) 잔기는 원하는 특이성, 친화도 및 능력을 갖는 비인간 종으로부터의 항체에서 상응하는 잔기로 대체된다. 인간화 항체는 항체 특이성, 친화도 및/또는 능력을 개선하고 최적화하기 위해 Fv 프레임워크 구역에서 및/또는 대체된 비인간 잔기 내에 추가의 잔기의 치환으로 추가로 변형될 수 있다. 일반적으로, 인간화 항체는 비인간 면역글로불린에 상응하는 모든 또는 실질적으로 모든 CDR 구역을 포함하는 실질적으로 모든 1개 이상, 통상적으로 2개 또는 3개의 가변 도메인을 포함하고, 모든 또는 실질적으로 모든 FR 구역은 인간 면역글로불린 공통 서열의 구역이다. 인간화 항체는 또한 면역글로불린 불변 구역 또는 도메인(Fc), 통상적으로 인간 면역글로불린의 구역의 적어도 일부를 포함할 수 있다. 인간화 항체를 생성시키기 위해 이용되는 방법의 예는 미국 특허 제5,225,539호에 기재되어 있다.
항체의 "가변 영역"은 단독 또는 조합된 항체 경쇄의 가변 영역 또는 항체 중쇄의 가변 영역을 의미한다. 중쇄 및 경쇄의 가변 영역은 각각 초가변 영역으로도 공지된 3개의 상보성 결정 구역(CDR)에 연결된 4개의 프레임워크 구역(FR)으로 이루어진다. 각각의 사슬에서의 CDR은 FR에 의해 매우 인접하게 고정되고, 다른 사슬로부터의 CDR에 의해, 항체의 항원 결합 자리의 형성에 기여한다. (1) 교차 종 서열 가변성에 기초한 접근법(즉, 카밧(Kabat) 등의 문헌. Sequences of Proteins of Immunological Interest, (5th ed., 1991, National Institutes of Health, Bethesda Md.)); 및 (2) 항원-항체 복합체의 결정학적 연구에 기초한 접근법(Al-lazikani et al (1997) J. Molec. Biol. 273:927-948))의 CDR을 결정하기 위한 적어도 2가지 기법이 존재한다. 또한, CDR을 결정하기 위해 이러한 2가지 접근법의 조합이 당해 분야에서 종종 사용된다.
카밧 넘버링 시스템은 가변 도메인에서의 잔기(대략 경쇄의 1-107번 잔기 및 중쇄의 1-113번 잔기)를 언급할 때 일반적으로 사용된다(예를 들면, 카밧 등의 문헌, Sequences of Immunological Interest. 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md. (1991)).
용어 "인간 항체"는 인간에 의해 생성된 항체 또는 당해 분야에 공지된 임의의 기법을 이용하여 제조된 인간에 의해 생성된 항체에 상응하는 아미노산 서열을 갖는 항체를 의미한다. 인간 항체의 이 정의는 비손상 또는 전장 항체, 이의 단편 및/또는 하나 이상의 인간 중쇄 및/또는 경쇄 폴리펩타이드를 포함하는 항체, 예를 들면 쥣과 경쇄 및 인간 중쇄 폴리펩타이드를 포함하는 항체를 포함한다.
용어 "키메라 항체"는 면역글로불린 분자의 아미노산 서열이 2개 이상의 종 유래인 항체를 의미한다. 통상적으로, 경쇄 및 중쇄 둘 다의 가변 영역은 원하는 특이성, 친화도 및 능력을 갖는 포유동물(예를 들면, 마우스, 랫트, 래빗 등)의 하나의 종 유래의 항체의 가변 영역에 상응하고, 그 종에서 면역 반응의 발생을 피하기 위해 불변 구역은 다른 종(보통 인간) 유래의 항체에서의 서열에 동종성이다.
용어 "에피토프" 또는 "항원 결정부위"는 본 명세서에서 상호 교환되어 사용되고, 특정한 항체를 인식하고 이에 의해 특이적으로 결합될 수 있는 항원의 부분을 의미한다. 항원이 폴리펩타이드일 때, 에피토프는 단백질의 3차원 폴딩에 의해 병치된 비인접 아미노산 및 인접 아미노산 둘 다로부터 형성될 수 있다. 인접 아미노산으로부터 형성된 에피토프는 통상적으로 단백질 변성 시 보유되고, 3차원 폴딩에 의해 형성된 에피토프는 통상적으로 단백질 변성 시 소실된다. 에피토프는 독특한 공간 구성에서 통상적으로 적어도 3개, 더 일반적으로, 적어도 5개 또는 8-10개의 아미노산을 포함한다.
"결합 친화도"는 일반적으로 분자(예를 들면, 항체)의 단일 결합 자리와 이의 결합 파트너(예를 들면, 항원) 사이의 비공유 상호작용의 전체 합의 강도를 의미한다. 달리 표시되지 않은 한, 본 명세서에 기재된 "결합 친화도"는 결합쌍(예를 들면, 항체 및 항원)의 구성원 간의 1:1 상호작용을 반영하는 고유 결합 친화도를 의미한다. 분자 X의 이의 파트너 Y에 대한 친화도는 일반적으로 해리 상수(Kd)로 표시될 수 있다. 본 명세서에 기재된 방법을 비롯하여 당해 분야에 공지된 일반 방법에 의해 친화도를 측정할 수 있다. 저친화도 항체는 일반적으로 항원에 천천히 결합하고 용이하게 분해되는 경향이 있고, 고친화도 항체는 일반적으로 항원에 신속히 결합하고 더 오래 결합된 채 있는 경향이 있다. 결합 친화도를 결정하는 다양한 방법이 당해 분야에 공지되어 있고, 이들 중 임의의 것이 본 발명의 목적을 위해 사용될 수 있다. 특정한 예시적인 실시양태가 하기 기재되어 있다.
결합 친화도를 언급하기 위해 본 명세서에서 사용될 때 "또는 우수"는 분자와 이의 결합 파트너 사이의 더 강한 결합을 나타낸다. 본 명세서에서 사용될 때 "또는 우수"는 더 적은 숫자 Kd 값으로 표시되는 더 강한 결합을 의미한다. 예를 들면, "0.6nM 또는 우수"한 항원에 대한 친화도를 갖는 항체인, 항원에 대한 항체의 친화도는 <0.6nM, 즉 0.59nM, 0.58nM, 0.57nM 등 또는 0.6nM 미만의 임의의 값이다.
"특이적으로 결합한다"는 일반적으로 항체가 이의 항원 결합 도메인을 통해 에피토프에 결합하고 결합이 항원 결합 도메인과 에피토프 사이의 약간의 상보성을 수반한다는 것을 의미한다. 이 정의에 따르면, 항체는 관련되지 않은 무작위의 에피토프에 결합하는 것보다 용이하게 이의 항원 결합 도메인을 통해 항체가 에피토프에 결합할 때 에피토프에 "특이적으로 결합한다"라고 말한다. 용어 "특이성"은 본 명세서에서 특정한 항체가 특정한 에피토프에 결합하는 상대 친화도를 정량화하기 위해 사용된다. 예를 들면, 항체 "A"는 항체 "B"보다 소정의 에피토프에 더 높은 특이성을 갖는다고 생각될 수 있거나, 항체 "A"가 관련된 에피토프 "D"보다 더 높은 특이성으로 에피토프 "C"에 결합한다고 말할 수 있다.
"우선적으로 결합한다"는 항체가 유사한 관련된 상동성 또는 유사한 에피토프에 결합하는 것보다 용이하게 에피토프에 특이적으로 결합한다는 것을 의미한다. 따라서, 소정의 에피토프에 "우선적으로 결합하는" 항체는, 이러한 항체가 관련된 에피토프와 교차 반응할 수 있더라고, 관련된 에피토프보다 그 에피토프에 더 결합할 것이다.
항체가 에피토프에 대한 기준 항체의 결합을 어느 정도 차단하는 정도로 에피토프에 우선적으로 결합하는 경우 항체가 소정의 에피토프에 대한 기준 항체의 결합을 "경쟁적으로 억제한다"라고 말한다. 예를 들면, 경쟁 ELISA 검정과 같은 당해 분야에 공지된 임의의 방법에 의해 경쟁적 억제를 결정할 수 있다. 항체가 소정의 에피토프에 대한 기준 항체의 결합을 적어도 90%, 적어도 80%, 적어도 70%, 적어도 60% 또는 적어도 50% 경쟁적으로 억제한다고 말할 수 있다.
본 명세서에서 사용되는 구문 "실질적으로 유사한" 또는 "실질적으로 동일한"은 2개의 숫자 값(일반적으로 본 발명의 항체와 관련된 값 및 기준/경쟁자 항체와 관련된 값) 사이의 충분히 높은 정도의 유사성을 의미하여, 당업자는 상기 값(예를 들면, Kd 값)에 의해 측정된 생물학적 특징의 맥락 내에서 2개의 값 사이의 차이가 생물학적 및/또는 통계학적 유의성이 없거나 거의 없다고 생각한다. 상기 2개의 값 사이의 차이는 기준/경쟁자 항체에 대한 값의 함수로서 약 50% 미만, 약 40% 미만, 약 30% 미만, 약 20% 미만 또는 약 10% 미만일 수 있다. 2개의 "실질적으로 유사한 결합 친화도" 사이의 차이는 기준/경쟁자 항체에 대한 값의 함수로서 일반적으로 약 10% 미만이다.
본 명세서에서 사용되는 "리간드 독립적 결합"은 EGFR과의 리간드 상호작용의 부재 하에 인간 EGFR 위의 에피토프에 결합하는 EGFR 결합제의 능력을 의미한다.
"단리"된 폴리펩타이드, 항체, 폴리뉴클레오타이드, 벡터, 세포 또는 조성물은 자연에서 발견되지 않는 형태인 폴리펩타이드, 항체, 폴리뉴클레오타이드, 벡터, 세포 또는 조성물이다. 단리된 폴리펩타이드, 항체, 폴리뉴클레오타이드, 벡터, 세포 또는 조성물은 자연에서 발견되는 형태로 더 이상 존재하지 않는 정도로 정제된 것을 포함한다. 몇몇 실시양태에서, 단리된 항체, 폴리뉴클레오타이드, 벡터, 세포 또는 조성물은 실질적으로 순수하다.
본 명세서에 기재된 "실질적으로 순수한"은 적어도 50% 순수한(즉, 오염물질 비함유), 적어도 90% 순수한, 적어도 95% 순수한, 적어도 98% 순수한 또는 적어도 99% 순수한 물질을 의미한다.
본 명세서에서 사용되는 용어 "면역접합체" 또는 "접합체"는 세포 결합제(즉, 항-EGFR 항체 또는 이의 단편)에 연결된 화합물 또는 이의 유도체를 의미하고, C-L-A의 일반식(여기서, C는 세포독소이고, L은 링커이며, A는 세포 결합제 또는 항-EGFR 항체 또는 항체 단편임)으로 표시된다. 면역접합체는 또한 A-L-C의 반대 순서의 일반식으로 정의될 수 있다.
"링커"는 화합물, 보통 약물, 예컨대 메이타시노이드를 안정한 공유 방식으로 세포 결합제, 예컨대 항-EGFR 항체 또는 이의 단편에 결합시킬 수 있는 임의의 화학 모이어티이다. 링커는 화합물 또는 항체가 활성으로 있는 조건에서 산 유도 개열, 광 유도 개열, 펩티다제 유도 개열, 에스터라제 유도 개열 및 이황화 결합 개열에 민감하거나 실질적으로 저항적일 수 있다. 적합한 링커는 당해 분야에 널리 공지되어 있고, 예를 들면 다이설파이드기, 티오에터기, 산 불안정 기, 광 불안정 기, 펩티다제 불안정 기 및 에스터라제 불안정 기를 포함한다. 링커는 또한 본 명세서에서 기재되어 있고 당해 분야에 공지된 하전 링커 및 이의 친수성 형태를 포함한다.
용어 "암" 및 "암성"은 비조절된 세포 성장을 특징으로 하는 포유동물에서 생리학적 조건을 의미하거나 이를 기술한다. 암의 예는 암종, 림프종, 아세포종, 육종 및 백혈병을 포함하지만, 이들로 제한되지는 않는다. "종양" 및 "신생물"은 전암성 병변을 비롯한 양성(비암성) 또는 악성(암성)의 과도한 세포 성장 또는 증식으로부터 생기는 하나 이상의 세포를 의미한다. 치료되고/되거나 예방될 수 있는 "암" 또는 "종양형성" 질환의 예는 복부, 뼈, 유방, 소화계, 간, 췌장, 복막, 내분비선(부신, 부갑상선, 뇌하수체, 고환, 난소, 흉선, 갑상선), 눈, 두경부, 신경계(중추 및 말초), 림프계, 골반, 피부, 연조직, 비장, 흉부 구역 및 비뇨생식계의 신생물을 포함한다.
용어 "암 세포", "종양 세포" 및 문법상 등가물은 종양 세포 집단 대부분을 포함하는 비종양형성 세포 및 종양형성 줄기 세포(암 줄기 세포) 둘 다를 포함하는 종양 또는 전암성 병변 유래의 전체 세포 집단을 의미한다. 본 명세서에서 사용되는 용어 "종양 세포"는 신생시키고 분화시키는 능력이 결여된 이 종양 세포를 단독으로 언급할 때 암 줄기 세포로부터 이 종양 세포를 구별하기 위해 용어 "비종양형성"으로 변형된다.
용어 "피험체"는 특정한 치료의 수용인인 인간, 비인간 영장류, 설치류 등(이들로 제한되지는 않음)을 비롯한 임의의 동물(예를 들면, 포유동물)을 의미한다. 통상적으로, 용어 "피험체" 및 "환자"는 인간 피험체를 언급할 때 본 명세서에서 상호 교환되어 사용된다.
하나 이상의 추가의 치료제와 "병용하는" 투여는 동시(공존) 투여 및 임의의 순서의 연속 투여를 포함한다.
용어 "약제학적 제제"는 활성 성분의 생물학적 활성이 효과적이도록 하는 형태로 있고 제제가 투여되는 피험체에게 허용되지 않게 독성인 추가의 성분을 포함하지 않는 제제를 의미한다. 제제는 무균일 수 있다.
본 명세서에 개시된 "유효량"의 항체는 구체적으로 설명된 목적을 수행하기에 충분한 양이다. "유효량"은 언급된 방식과 관련하여 경험상 및 일상적 방식으로 결정할 수 있다.
용어 "치료학적 유효량"은 피험체 또는 포유동물에서 질환 또는 질병을 "치료"하는 데 효과적인 항체 또는 다른 약물의 양을 의미한다. 암의 경우, 치료학적 유효량의 약물은 암 세포수를 감소시키고/시키거나; 종양 크기를 감소시키고/시키거나; 말초 장기로의 암 세포 침윤을 억제(즉, 어느 정도 느리게 하거나 정지)하고/하거나; 종양 전이를 억제(즉, 어느 정도 느리게 하거나 정지)하고/하거나; 종양 성장을 어느 정도로 억제하고/하거나; 암과 관련된 하나 이상의 증상을 어느 정도로 완화시킬 수 있다. 본 명세서에서 "표적화"의 정의를 참조한다. 약물이 성장을 예방하고/하거나 존재하는 암 세포를 사멸할 수 있는 정도로, 이는 세포분열억제 및/또는 세포독성일 수 있다. "예방학적 유효량"은 필요한 용량에서 및 시간 동안 원하는 예방학적 결과를 성취하기 위해 효과적인 양을 의미한다. 초기 질환 병기 전에 또는 이 병기에서 피험체에서 예방학적 용량을 사용할 수 있으므로, 반드시 그런 것은 아니지만 통상적으로 예방학적 유효량은 치료학적 유효량보다 적다.
단어 "라벨"은 본 명세서에서 사용될 때 "라벨링된" 항체를 생성하도록 항체에 직접적으로 또는 간접적으로 접합된 탈착형 화합물 또는 조성물을 의미한다. 라벨은 그 자체가 탈착형(예를 들면, 방사성 동위원소 라벨 또는 형광 라벨)이거나, 효소 라벨의 경우, 탈착형인 기질 화합물 또는 조성물의 화학 변경을 촉매화할 수 있다.
"화학치료제"는 작용 기전과 무관하게 암의 치료에 유용한 화학 화합물이다.
"치료하는" 또는 "치료" 또는 "치료하기 위해" 또는 "완화하는" 또는 "완화하기 위해"와 같은 용어는 진단된 병리학적 병증 또는 질병을 치유하고/하거나, 느리게 하고/하거나, 이의 증상을 경감시키고/시키거나, 이의 진행을 중지시키는 치료학적 수단을 의미한다. 따라서, 치료를 필요로 하는 사람은 이미 질환을 앓고 있는 사람; 질환을 앓기 쉬운 사람; 및 질환을 예방하고자 하는 사람을 포함한다. 특정한 실시양태에서, 환자가 암 세포수의 감소 또는 암 세포의 완전한 부재; 종양 크기 감소; 예를 들면, 연조직 및 뼈로의 암의 확산을 비롯하여 말초 장기로의 암 세포 침윤의 억제 또는 부재; 종양 전이의 억제 또는 부재; 종양 성장의 억제 또는 부재; 특정 암과 관련된 하나 이상의 증상의 경감; 이환율 및 사망률 감소; 삶의 질 개선; 종양의 종양형성, 종양형성 빈도 또는 종양형성 능력 감소; 종양에서 암 줄기 세포의 수 또는 빈도 감소; 종양형성 세포의 비종양형성 상태로의 분화; 또는 이 효과의 여러 조합 중 하나 이상을 나타내는 경우, 피험체는 본 발명의 방법에 따라 암에 효과적으로 "치료"된다.
본 명세서에서 사용되는 구문 "실질적으로 비반응성"은 치료제의 투여 후에도 안정한 성장 또는 성장 증가를 보이는 종양 또는 암을 의미한다. 이 구문은 치료제의 투여 후에도 안정한 질환 또는 진행성 질환을 보이는 환자를 의미할 수 있다. 이 구문은 치료제에 의한 치료에 내성을 나타내는 종양 또는 암을 의미할 때 사용될 수 있다. 본 명세서에서 사용되는 구문 "EGFR 억제제에 실질적으로 비반응성"은 EGFR 억제제의 투여 후에도 안정한 성장 또는 성장 증가를 보이는 종양 또는 암을 의미한다. 몇몇 실시양태에서, EGFR 억제제를 치료를 필요로 하는 환자에게 투여하고, EGFR 억제제에 "실질적으로 비반응성"이라는 것은 암 세포수의 비감소 또는 암 세포 성장 지속; 종양 크기 비감소; 종양 크기 증가; 예를 들면, 연조직 및 뼈로의 암의 확산을 비롯하여 말초 장기로의 암 세포 침윤의 비억제 또는 지속; 종양 전이의 비억제 또는 지속; 종양 성장의 비억제 또는 지속; 특정 암과 관련된 하나 이상의 증상의 비경감 또는 약간의 경감; 종양의 종양형성, 종양형성 빈도 또는 종양형성 능력의 비감소 또는 약간의 감소; 종양에서 암 줄기 세포의 수 또는 빈도의 비감소 또는 약간의 감소; 또는 이 효과의 여러 조합을 포함한다.
본 명세서에서 사용되는 치료에 "불응성"인 질병은 초기에 비반응성이거나, 시간이 지남에 따라 비반응성이 되거나(예를 들면, 3개월 내에(즉, 치료 시 또는 치료 3개월 내에 질환 진행이 발견될 수 있음)), 치료 중단 직후 재발하는 질병이다. 몇몇 실시양태에서, 치료에 "불응성"인 암은 치료에 반응하지 않는 암이다.
본 명세서에서 사용되는 치료에 "내성"을 나타내는 질병은 치료에 비반응성인 질병이다. 일 실시양태에서, 암은 치료 시작 시 내성을 나타내거나, 치료 동안 내성을 나타낼 수 있다. 특정한 실시양태에서, "불응성" 암은 "내성" 암이라고도 칭한다.
본 개시내용 및 특허청구범위에서 사용되는 단수 용어 "하나", "이" 및 "그"는 문맥상 명확히 달리 표시하지 않은 한 복수 형태를 포함한다.
실시양태가 본 명세서에서 "포함하는"의 언어로 기재되어 어떤 곳에서도, "이루어진" 및/또는 "실질적으로 이루어진"의 용어에서 기재된 그 외 유사한 실시양태가 또한 제공되는 것으로 이해된다.
본 명세서에서 "A 및/또는 B"와 같은 구문에서 사용되는 용어 "및/또는"는 "A 및 B", "A 또는 B", "A" 및 "B" 둘 다를 의미하는 것으로 의도된다. 마찬가지로, "A, B 및/또는 C"와 같은 구문에서 사용되는 용어 "및/또는"은 A, B 및 C; A, B 또는 C; A 또는 C; A 또는 B; B 또는 C; A 및 C; A 및 B; B 및 C; A(단독); B(단독); 및 C(단독)의 각각의 실시양태를 포함하는 것으로 의도된다.
II. EGFR 항체
EGFR에 특이적으로 결합하는 항체(즉, "EGFR 항체") 또는 이의 항원 결합 단편은 본 발명에서 유용한 EGFR 면역접합체를 생성시키기 위해 사용될 수 있다. 본 발명은 임의의 유형의 EGFR 항체 또는 이의 EGFR결합 단편, 일부 또는 다른 항원 결합을 포함한다. 이는 예를 들면 제한 없이 다양한 형태의 항체 및 이의 단편, 예컨대 다중클론 또는 단일클론 항체 또는 이의 항원 결합 단편; 키메라, 영장류화, 인간화, 완전 인간 항체 또는 이의 항원 결합 단편; 또는 항체의 에피토프 결합 단편, 예컨대 단쇄, Fv, sFv, scFv, Fab, Fab' 및 F(ab')2를 포함한다(Parham, J. Immunol. 131:2895-2902 (1983); Spring et al, J. Immunol. 113:470-478 (1974); Nisonoff et al, Arch. Biochem. Biophys. 89:230-244 (1960)).
EGFR 면역접합체의 생성에 특히 유용한 EGFR 항체는 동시 계류 중인 미국 출원 공보 제2012/0156217호에 기재되어 있다. 이러한 하나의 항체인 huEGFR-7R은 서열 번호 1의 중쇄 가변 영역 및 서열 번호 2 또는 서열 번호 3의 경쇄 가변 영역을 포함하는 인간화 항체이다.
이러한 항체는 네시튜무맙, 세툭시맙, 파니튜무맙, 니모튜무맙, 잘루튜무맙, mAb 806을 포함한다(J Clin Invest. 2007;117(2):346-52).
III. EGFR 면역접합체
본 발명은 또한 약물 또는 프로드럭에 연결되거나 접합된 본 명세서에서 개시된 항-EGFR 항체, 항체 단편 및 이의 기능상 등가물을 포함하는 접합체(본 명세서에서 면역접합체라고도 칭함)에 관한 것이다. 적합한 약물 또는 프로드럭이 당해 분야에 공지되어 있다. 약물 또는 프로드럭은 세포독성제일 수 있다. 본 발명의 세포독성 접합체에 사용되는 세포독성제는 세포사를 발생시키거나 세포사를 유도하거나 여러 방식으로 세포 생존을 감소시키는 임의의 화합물일 수 있고, 예를 들면 메이타시노이드 및 메이타시노이드 유사체를 포함한다. 다른 적합한 세포독성제는 예를 들면 벤조디아제핀, 탁소이드, CC-1065 및 CC-1065 유사체, 듀오카르마이신 및 듀오카르마이신 유사체, 엔다이인, 예컨대 칼리키아미신, 아우리스타틴을 포함하는 돌라스타틴 및 돌라스타틴 유사체, 토메이마이신 유도체, 렙토마이신 유도체, 메토트렉세이트, 시스플라틴, 카보플라틴, 다우노루비신, 독소루비신, 빈크리스틴, 빈블라스틴, 멜팔란, 미토마이신 C, 클로르암부실 및 모르폴리노 독소루비신이다.
약물 또는 프로드럭을 항체 또는 기능상 균등물에 연결시키기 위해 연결기를 사용하여 면역접합체를 제조할 수 있다. 적합한 연결기는 당해 분야에 널리 공지되어 있고, 예를 들면 다이설파이드기, 티오에터기, 산 불안정 기, 광 불안정 기, 펩티다제 불안정 기 및 에스터라제 불안정 기를 포함한다.
약물 또는 프로드럭은 예를 들면 이황화 결합을 통해 항-EGFR 항체 또는 이의 단편에 연결될 수 있다. 링커 분자 또는 가교결합제는 항-EGFR 항체 또는 이의 단편과 반응할 수 있는 반응성 화학기를 포함한다. 세포 결합제와의 반응을 위한 반응성 화학기는 N-숙신이미딜 에스터 및 N-설포숙신이미딜 에스터일 수 있다. 추가로, 링커 분자는 약물과 반응하여 이황화 결합을 형성할 수 있는 다이티오피리딜기일 수 있는 반응성 화학기를 포함한다. 링커 분자는 예를 들면 N-숙신이미딜 3-(2-피리딜다이티오) 프로피오네이트(SPDP)(예를 들면, Carlsson et al., Biochem. J., 173: 723-737 (1978)), N-숙신이미딜 4-(2-피리딜다이티오)뷰타노에이트(SPDB)(예를 들면, 미국 특허 제4,563,304호 참조), N-숙신이미딜 4-(2-피리딜다이티오)2-설포뷰타노에이트(설포-SPDB)(미국 공보 제2009/0274713호 참조), N-숙신이미딜 4-(2-피리딜다이티오) 펜타노에이트(SPP)(예를 들면, CAS 등록 번호 341498-08-6호 참조), 2-이미노티올란 또는 아세틸숙신산 무수물을 포함한다 예를 들면, 항체 또는 세포 결합제는 가교결합제로 변형될 수 있고, 이후 이렇게 유도된 자유 또는 보호된 티올기를 포함하는 항체 또는 세포 결합제를 다이설파이드 또는 티올 함유 메이타시노이드와 반응시켜 접합체를 제조한다. HPLC, 크기 배제, 흡착, 이온 교환 및 친화도 포획(이들로 제한되지는 않음)을 비롯한 크로마토그래피, 투석 또는 접선 유동 여과에 의해 접합체를 정제할 수 있다.
본 발명의 다른 양태에서, 항-EGFR 항체는 면역접합체의 효력, 용해도 또는 효능을 증대시키기 데 있어서 이황화 결합 및 폴리에틸렌 글라이콜 스페이서를 통해 세포독성 약물에 연결될 수 있다. 이러한 개열형 친수성 링커는 WO2009/134976 및 WO2003/068144에 기재되어 있다. 이 링커 설계의 추가의 이익은 원하는 높은 단량체 비율 및 항체-약물 접합체의 최소 응집이다. 2-8의 좁은 약물 로드 범위로 폴리에틸렌 글라이콜 스페이서((CH2CH2O)n=1-14)를 보유하는 다이설파이드기(-S-S-)를 통해 연결된 세포 결합제 및 약물의 접합체가 이 양태에서 구체적으로 고려된다. 이 접합체는 암 세포에 대해 비교적 매우 강력한 생물학적 활성을 보여주고 최소 단백질 응집으로 높은 접합 수율 및 높은 단량체 비율의 원하는 생화학적 특성을 갖는다.
하기 화학식 (I)의 항-EGFR 항체 약물 접합체 또는 하기 화학식 (I')의 접합체가 이 양태에서 구체적으로 고려된다:
여기서,
CB는 항-EGFR 항체 또는 단편을 나타내고;
D는 약물을 나타내며;
X는 티오에터 결합, 아마이드 결합, 카바메이트 결합 또는 에터 결합을 통해 세포 결합제에 부착된 지방족, 방향족 또는 헤테로사이클릭 단위를 나타내고;
Y는 이황화 결합을 통해 약물에 부착된 지방족, 방향족 또는 헤테로사이클릭 단위를 나타내며;
l은 0 또는 1이고;
m은 2 내지 8의 정수이며;
n은 1 내지 24의 정수이다. 몇몇 실시양태에서, m은 2 내지 6의 정수이다. 몇몇 실시양태에서, m은 3 내지 5의 정수이다. 몇몇 실시양태에서, n은 2 내지 8의 정수이다.
대안적으로, 예를 들면, 미국 특허 제6,441,163호 및 제7,368,565호에 개시된 것처럼, 약물은 처음에 세포 결합제와 반응하기에 적합한 반응성 에스터를 도입하도록 변형될 수 있다. 활성화 링커 모이어티를 포함하는 이 약물과 세포 결합제의 반응은 세포 결합제 약물 접합체를 제조하는 다른 방법을 제공한다. 메이타시노이드는 또한 예를 들면 미국 특허 제6,716,821호에 기재된 PEG 연결기를 사용하여 항-EGFR 항체 또는 단편에 연결될 수 있다. 이 PEG 비개열형 연결기는 물 및 비수성 용매 둘 다 중에 가용성이고 하나 이상의 세포독성제를 세포 결합제에 연결시키는 데 사용될 수 있다. 예시적인 PEG 연결기는 일 말단에서 작용성 설프하이드릴 또는 다이설파이드기 및 다른 말단에서 활성 에스터기를 통해 링커의 반대 말단에서 세포독성제 및 세포 결합제와 반응하는 이종이작용성 PEG 링커를 포함한다. PEG 연결기를 사용한 세포독성 접합체의 합성의 일반적인 예로서, 미국 특허 제6,716,821호(본 명세서에 그 전문이 참조문헌으로 포함됨)를 다시 참조한다. 합성은 반응성 PEG 모이어티를 보유하는 하나 이상의 세포독성제와 세포 결합제의 반응으로 시작하여, 각각의 반응성 PEG 모이어티의 말단 활성 에스터를 세포 결합제의 아미노산 잔기로 대체시켜, PEG 연결기를 통해 세포 결합제에 공유 결합된 하나 이상의 세포독성제를 포함하는 세포독성 접합체를 생성시킨다. 대안적으로, 세포 결합은 반응성 다이설파이드 모이어티(예컨대, 피리딜다이설파이드)를 도입하는 이작용성 PEG 가교결합제(이후, 이는 티올 함유 메이타시노이드로 처리될 수 있음)로 변형되어 접합체를 제공할 수 있다. 다른 방법에서, 세포 결합은 티올 모이어티(예컨대, 피리딜다이설파이드)를 도입하는 이작용성 PEG 가교결합제(이후, 이는 반응성 다이설파이드 함유 메이타시노이드로 처리될 수 있음)로 변형되어 접합체를 제공할 수 있다.
비개열형 링커를 갖는 항체-메이타시노이드 접합체를 또한 제조할 수 있다. 이러한 가교결합제는 당해 분야에 기재되어 있고(미국 공보 제2005/0169933호 참조), N-숙신이미딜 4-(N-말레이미도메틸) 사이클로헥산-1-카복실레이트(SMCC), N-(베타-말레이미도프로필옥시)숙신이미드 에스터(BMPS); 및 감마-말레이미도뷰티르산 N-숙신이미딜 에스터(GMBS)를 포함하지만, 이들로 제한되지는 않는다. 몇몇 실시양태에서, 항체는 문헌에 기재된 바와 같은 1개 내지 10개의 반응성 기를 도입하는 가교결합제, 예컨대 숙신이미딜 4-(N-말레이미도메틸)-사이클로헥산-1-카복실레이트(SMCC), 설포-SMCC, m-말레이미도벤조일-N-하이드록시숙신이미드 에스터(MBS), 설포-MBS 또는 숙신이미딜-요오도아세테이트로 변형될 수 있다(Yoshitake et al, Eur. J. Biochem., 101:395-399 (1979); Hashida et al, J. Applied Biochem., 56-63 (1984); 및 Liu et al, Biochem., 18:690-697 (1979)). 이후, 변형된 항체를 티올 함유 메이타시노이드 유도체와 반응시켜 접합체를 제조할 수 있다. 세파덱스(Sephadex) G25 컬럼을 통한 겔 여과 또는 투석 또는 접선 유동 여과로 접합체를 정제할 수 있다. 변형된 항체를 티올 함유 메이타시노이드(1 내지 2몰 당량/말레이미도기)로 처리하고, 세파덱스 G-25 컬럼을 통한 겔 여과, 세라믹 수산화인회석 컬럼에서의 크로마토그래피, 투석 또는 접선 유동 여과 또는 이들 방법의 조합으로 항체-메이타시노이드 접합체를 정제한다. 통상적으로, 항체마다 평균 1개 내지 10개의 메이타시노이드가 연결된다. 하나의 방법은 항체를 말레이미도기를 도입하는 숙신이미딜 4-(N-말레이미도메틸)-사이클로헥산-1-카복실레이트(SMCC)로 변형한 후 변형된 항체를 티올 함유 메이타시노이드와 반응시켜 티오에터 연결 접합체를 생성하는 것이다. 다시 항체 분자마다 1개 내지 10개의 약물 분자를 갖는 접합체가 생긴다. 항체, 항체 단편 및 다른 단백질의 메이타시노이드 접합체를 동일한 방식으로 제조한다.
본 발명의 다른 양태에서, EGFR 항체는 PEG 스페이서의 중재를 통해 비개열형 결합을 통해 약물에 연결된다. 약물과 항-EGFR 항체 또는 단편 사이에 링커를 형성하는 친수성 PEG 사슬을 포함하는 적합한 가교결합제가 또한 당해 분야에 널리 공지되어 있거나 상업적으로 구입 가능하다(예를 들면, 미국 오하이오주 포웰에 소재하는 퀀타 바이오디자인(Quanta Biodesign)) 당업자에게 공지된 표준 합성 화학 기법을 이용하여 상업적으로 구입 가능한 PEG 자체로부터 적합한 PEG 함유 가교결합제를 또한 합성할 수 있다. 약물은 이작용성 PEG 함유 가교결합제와 반응하여 미국 특허 공보 제2009/0274713호 및 제WO2009/134976호에 자세히 기재된 방법에 의해 화학식 의 화합물을 생성시키고, 이후 이 화합물은 세포 결합제와 반응하여 접합체를 제공할 수 있다. 대안적으로, 세포 결합제는 티올 반응성 기(예컨대, 말레이미드 또는 할로아세트아마이드)를 도입하는 이작용성 PEG 가교결합제(이후, 이는 티올 함유 메이타시노이드로 처리될 수 있음)로 변형되어 접합체를 제공할 수 있다. 다른 방법에서, 세포 결합제는 티올 모이어티를 도입하는 이작용성 PEG 가교결합제(예컨대, 말레이미드 또는 할로아세트아마이드를 보유하는 메이타시노이드)(이후, 이는 티올 반응성 메이타시노이드로 처리될 수 있음)로 변형되어 접합체를 제공할 수 있다.
따라서, 본 발명의 다른 양태는 하기 화학식 (II) 또는 하기 화학식 (II')의 항-EGFR 항체 약물 접합체이다:
상기 식 중, CB는 항-EGFR 항체 또는 단편을 나타내고;
D는 약물을 나타내며;
X는 티오에터 결합, 아마이드 결합, 카바메이트 결합 또는 에터 결합을 통해 세포 결합제에 결합된 지방족, 방향족 또는 헤테로사이클릭 단위를 나타내고;
Y는 티오에터 결합, 아마이드 결합, 카바메이트 결합, 에터 결합, 아민 결합, 탄소-탄소 결합 및 하이드라존 결합으로 이루어진 군으로부터 선택되는 공유 결합을 통해 약물에 결합된 지방족, 방향족 또는 헤테로사이클릭 단위를 나타내며;
l은 0 또는 1이고;
p는 0 또는 1이며;
m은 2 내지 15의 정수이고;
n은 1 내지 2000의 정수이다.
몇몇 실시양태에서, m은 2 내지 8의 정수이고;
몇몇 실시양태에서, n은 1 내지 24의 정수이다.
몇몇 실시양태에서, m은 2 내지 6의 정수이다.
몇몇 실시양태에서, m은 3 내지 5의 정수이다.
몇몇 실시양태에서, n은 2 내지 8의 정수이다. 적합한 PEG 함유 링커의 예는 항-EGFR 항체 또는 이의 단편과의 반응을 위한 N-숙신이미딜 에스터 또는 N-설포숙신이미딜 에스터 모이어티, 및 상기 화합물과의 반응을 위한 말레이미도계 또는 할로아세틸계 모이어티를 갖는 링커를 포함한다. PEG 스페이서를 본 명세서에 기재된 방법에 의해 당해 분야에 공지된 임의의 가교결합제로 혼입할 수 있다.
본 명세서에서 개시된 많은 링커가 미국 특허 공보 제2005/0169933호 및 제2009/0274713호 및 제WO2009/134976호에 자세히 기재되어 있고; 이들 내용은 본 명세서에서 그 전문이 참조문헌으로 포함된다.
본 발명은 약 2개 내지 약 8개의 약물 분자("약물 로드"), 예를 들면 메이타시노이드가 항-EGFR 항체 또는 이의 단편에 연결되고, 접합체의 항종양 효과가 동일한 세포 결합제에 연결된 더 적거나 더 많은 약물의 약물 로드와 비교하여 훨씬 더 효과적인 양태를 포함한다. 본 명세서에서 사용되는 "약물 로드"는 세포 결합제(예를 들면, 항-EGFR 항체 또는 이의 단편)에 부착될 수 있는 약물 분자(예를 들면, 메이타시노이드)의 수를 의미한다. 일 양태에서, 세포 결합제에 부착될 수 있는 약물 분자의 수는 평균 약 2개 내지 약 8개(예를 들면, 1.9개, 2.0개, 2.1개, 2.2개, 2.3개, 2.4개, 2.5개, 2.6개, 2.7개, 2.8개, 2.9개, 3.0개, 3.1개, 3.2개, 3.3개, 3.4개, 3.5개, 3.6개, 3.7개, 3.8개, 3.9개, 4.0개, 4.1개, 4.2개, 4.3개, 4.4개, 4.5개, 4.6개, 4.7개, 4.8개, 4.9개, 5.0개, 5.1개, 5.2개, 5.3개, 5.4개, 5.5개, 5.6개, 5.7개, 5.8개, 5.9개, 6.0개, 6.1개, 6.2개, 6.3개, 6.4개, 6.5개, 6.6개, 6.7개, 6.8개, 6.9개, 7.0개, 7.1개, 7.2개, 7.3개, 7.4개, 7.5개, 7.6개, 7.7개, 7.8개, 7.9개, 8.0개, 8.1개)일 수 있다. N 2'-데아세틸-N 2'-(3-머캅토-1-옥소프로필)-메이탄신(DM1) 및 N 2'-데아세틸-N2'-(4-머캅토-4-메틸-1-옥소펜틸) 메이탄신(DM4)을 사용할 수 있다.
이작용성 가교결합제를 항-EGFR 항체 또는 이의 단편과 반응시켜, 링커 분자를 항-EGFR 항체 또는 이의 단편에 공유 결합시켜 항-EGFR 항체 또는 이의 단편을 변형할 수 있다. 본 명세서에서 사용된 "이작용성 가교결합제"는 세포 결합제를 약물, 예컨대 본 명세서에서 기재된 약물에 공유 결합시키는 임의의 화학 모이어티이다. 다른 방법에서, 약물에 의해 연결 모이어티의 부분이 제공된다. 이와 관련하여, 약물은 세포 결합제를 약물에 연결시키는 데 사용되는 더 큰 링커 분자의 일부인 연결 모이어티를 포함한다. 예를 들면, 메이타시노이드 DM1을 형성하기 위해, 메이탄신의 C-3 하이드록실기에서의 측쇄는 자유 설프하이드릴기(SH)를 갖도록 변형된다. 메이탄신의 이 티올화 형태는 변형된 세포 결합제와 반응하여 접합체를 형성할 수 있다. 따라서, 최종 링커는 2종의 성분으로부터 조립되고, 이즐 중 하나는 가교결합제에 의해 제공되고, 다른 하나는 DM1로부터의 측쇄에 의해 제공된다.
약물 분자는 또한 중재자 캐리어 분자, 예컨대 혈청 알부민을 통해 항체 분자에 연결될 수 있다.
본 명세서에서 사용되는 "세포 결합제에 연결된" 또는 "항-EGFR 항체 또는 단편에 연결된"의 표현은 적합한 연결기 또는 이의 전구체를 통해 세포 결합제 항-EGFR 항체 또는 단편에 결합된 하나 이상의 약물 유도체를 포함하는 접합체 분자를 의미한다. 하나의 연결기는 SMCC이다.
특정한 실시양태에서, 본 발명에서 유용한 세포독성제는 메이타시노이드 및 메이타시노이드 유사체이다. 적합한 메이타시노이드의 예는 메이타시놀의 에스터 및 메이타시놀 유사체를 포함한다. 메이타시놀 및 메이타시놀 유사체처럼 미세소관 형성을 억제하고 포유동물 세포에 매우 독성을 나타내는 임의의 약물이 포함된다.
적합한 메이타시놀 에스터의 예는 변형된 방향족 고리 및 다른 위치에서의 변형을 갖는 것을 포함한다. 이러한 적합한 메이타시노이드는 미국 특허 제4,424,219호; 제4,256,746호; 제4,294,757호; 제4,307,016호; 제4,313,946호; 제4,315,929호; 제4,331,598호; 제4,361,650호; 제4,362,663호; 제4,364,866호; 제4,450,254호; 제4,322,348호; 제4,371,533호; 제5,208,020호; 제5,416,064호; 제5,475,092호; 제5,585,499호; 제5,846,545호; 제6,333,410호; 제7,276,497호 및 제7,473,796호에 개시되어 있다.
특정한 실시양태에서, 본 발명의 면역접합체는 세포독성제로서 공식적으로 N 2'-데아세틸-N 2'-(3-머캅토-1-옥소프로필)-메이탄신이라 칭하는 티올 함유 메이타시노이드(DM1)를 사용한다. DM1은 하기 구조식 (III)으로 표시된다:
다른 실시양태에서, 본 발명의 접합체는 세포독성제로서 티올 함유 메이타시노이드 N 2'-데아세틸-N 2' (4-메틸-4-머캅토-1- 옥소펜틸)-메이탄신(예를 들면, DM4)을 사용한다. DM4는 하기 구조식 (IV)로 표시된다:
입체 장애 티올 결합을 포함하는 측쇄를 포함하는 다른 메이타시노이드는 하기 구조식 (V)로 표시되는 N 2'-데아세틸-N 2' (4-머캅토-1-옥소펜틸)-메이탄신(DM3이라 칭함)이다:
본 발명의 접합체에서 미국 특허 제5,208,020호 및 제7,276,497호에 교시된 각각의 메이타시노이드를 또한 사용할 수 있다. 이와 관련하여, 제5,208,020호 및 제7,276,697호의 전체 개시내용은 본 명세서에서 참조문헌으로 포함된다.
메이타시노이드에서의 많은 위치는 연결 모이어티를 화학적으로 연결시키는 위치로서 작용할 수 있다. 예를 들면, 하이드록실기를 갖는 C-3 위치, 하이드록시메틸로 변형된 C-14 위치, 하이드록시기로 변형된 C-15 위치 및 하이드록시기를 갖는 C-20 위치가 모든 유용한 것으로 예상된다. 몇몇 실시양태에서, C-3 위치는 모이어티를 화학적으로 연결시키는 위치로서 작용하고, 특정한 몇몇 실시양태에서, 메이타시놀의 C-3 위치는 연결 모이어티를 화학적으로 연결시키는 위치로서 작용할 수 있다.
몇몇 접합체의 구조 표현이 하기 도시되어 있다:
본 발명은 또한 본 명세서에 기재된 메이타시노이드 및 접합체(예를 들면, 화학식 (III) 내지 (V)의 메이타시노이드 및 화학식 (VI) 내지 (XIII)의 접합체)의 다양한 이성체 및 혼합물을 포함한다. 본 발명의 특정한 화합물 및 접합체가 다양한 입체이성체 형태로 존재할 수 있다. 입체이성체는 이의 공간 배열만이 다른 화합물이다. 거울상이성체는 거의 대부분 키랄 중심으로 작용하는 비대칭적으로 치환된 탄소 원자를 포함하므로 거울상이 중첩되지 않는 입체이성체의 쌍이다. "거울상이성체"는 서로 거울상이고 중첩되지 않는 분자의 쌍 중 하나를 의미한다. 부분입체이성체는 거의 대부분 비대칭적으로 치환된 2개 이상의 탄소 원자를 포함하므로 거울상과 관련되지 않는 입체이성체이다. "R" 및 "S"는 하나 이상의 키랄 탄소 원자 주위의 치환기의 입체배열을 나타낸다. 키랄 중심이 R 또는 S로 정의되지 않을 때, 순수한 거울상이성체 또는 입체배열 둘 다의 혼합물이 존재한다.
"라세미체" 또는 "라세미 혼합물"은 2개의 거울상이성체의 등몰 분량의 화합물을 의미하고, 이러한 혼합물은 광학 활성을 나타내지 않고; 즉, 편광면을 회전하지 않는다.
이러한 항체-메이타시노이드 접합체를 제조하기 위한 여러 설명이 미국 특허 제6,333,410호, 제6,441,163호, 제6,716,821호 및 제7,368,565호에 제공되어 있고, 이들 각각은 본 명세서에서 그 전문이 포함된다.
일반적으로, 수성 완충제 중의 항체의 용액을 반응성 기를 보유하는 다이설파이드 모이어티를 갖는 과몰량의 메이타시노이드와 항온처리할 수 있다. 과량의 아민(예컨대, 에탄올아민, 타우린 등)을 첨가하여 반응 혼합물을 급냉시킬 수 있다. 이후, 겔 여과로 메이타시노이드-항체 접합체를 정제할 수 있다.
252㎚ 및 280㎚에서의 흡광율의 비를 분광측광학적으로 측정하여 항체 분자마다 결합된 메이타시노이드 분자의 수를 결정할 수 있다. 메이타시노이드 분자/항체의 평균 수는 예를 들면 1개 내지 10개 또는 2개 내지 5개일 수 있다.
항-EGFR 면역접합체를 제조하기 위해 안트라사이클린 화합물, 및 유도체, 중간체 및 이의 변형된 버젼을 또한 사용할 수 있다. 항-EGFR 접합체에서 예를 들면 독소루비신, 독소루비신 유도체, 독소루비신 중간체 및 변형 독소루비신을 사용할 수 있다. 예시적인 화합물은 WO 제2010/009124호(본 명세서에서 그 전문이 참조문헌으로 포함됨)에 기재되어 있다. 이러한 화합물은 예를 들면 하기 화학식의 화합물 또는 이의 약제학적으로 허용되는 염을 포함한다:
상기 식 중, R1은 수소 원자, 하이드록시 또는 메톡시기이고, R2는 C1-Cs 알콕시기이다.
실험실내 다양한 원치 않는 세포주의 증식을 억제하는 이의 능력에 대해 항체와 메이타시노이드 또는 다른 약물의 접합체를 평가할 수 있다. 이러한 화합물의 세포독성의 평가를 위해 예를 들면 NCI-H226, NCI-H292 및 NCI-H322M과 같은 세포주를 용이하게 사용할 수 있다. 평가하고자 하는 세포를 4일 내지 5일 동안 화합물에 노출시키고 세포의 생존 분획을 공지된 방법으로 직접 검정으로 측정할 수 있다. 이후, 검정의 결과로부터 IC50 값을 계산할 수 있다.
면역접합체를, 본 명세서에 기재된 몇몇 실시양태에 따라, 세포로 내재화할 수 있다. 따라서, 면역접합체는 EGFR 발현 세포에 의해 흡수되거나 내재화되는 경우 치료학적 효과를 발휘할 수 있다. 특정한 몇몇 실시양태에서, 면역접합체는 개열형 링커에 의해 세포독성제에 연결된 항체, 항체 단편 또는 폴리펩타이드를 포함하고, 세포독성제는 항체, 항체 단편 또는 폴리펩타이드로부터 개열되고 EGFR 발현 세포에 의해 내재화된다.
몇몇 실시양태에서, 면역접합체는 종양 용적을 감소시킬 수 있다. 예를 들면, 몇몇 실시양태에서, 면역접합체에 의한 치료는 약 50% 미만, 약 45% 미만, 약 40% 미만, 약 35% 미만, 약 30% 미만, 약 25% 미만, 약 20% 미만, 약 15% 미만, 약 10% 미만 또는 약 5% 미만인 T/C 값(%)을 생성시킨다.
본 발명의 다른 양태에서, siRNA 분자는 약물 대신에 본 발명의 항체에 연결될 수 있다. siRNA는 올리고뉴클레오타이드의 변형에 통상 사용되는 방법에 의해 본 발명의 항체에 연결될 수 있다(예를 들면, 미국 특허 공보 제20050107325호 및 제20070213292호 참조) 따라서, 3' 또는 5'-포스포르아미다이트 형태에서의 siRNA는 하이드록실 작용기를 보유하는 가교결합제의 일 말단과 반응하여 siRNA와 가교결합제 사이의 에스터 결합을 생성할 수 있다. 유사하게, siRNA 포스포르아미다이트와 말단 아미노기를 보유하는 가교결합제의 반응은 아민을 통해 가교결합제를 siRNA에 연결시킨다. 대안적으로, 티올기를 도입하는 표준 화학 방법에 의해 siRNA를 유도체화할 수 있다. 이 티올 함유 siRNA를 활성 다이설파이드 또는 말레이미드 모이어티를 도입하도록 변형된 항체와 반응시켜 개열형 또는 비개열형 접합체를 제조할 수 있다. 이 방법에 의해 1개 내지 20개의 siRNA 분자를 항체에 연결할 수 있다.
IV. 치료 방법
상기 기재된 바대로, 본 발명의 EGFR 면역접합체는 EGFR 치료제 및/또는 ALK 억제제에 실질적으로 비반응성인 종양 세포의 성장을 억제하는 데 유용하다. 특정한 실시양태에서, 면역접합체는 종양 성장의 억제, 종양 용적의 감소 및/또는 종양의 종양형성 감소에 유용하다. 사용 방법은 실험실내, 생체외 또는 생체내 방법일 수 있다.
특정한 실시양태에서, EGFR 면역접합체로 치료된 질환은 고유 내성을 보유하거나 EGFR 표적화 비접합 항체 및/또는 소분자 ALK 억제제에 내성을 획득한 암이다. 일 실시양태에서, 이 질환은 본질적으로 EGFR 치료에 세포 내성을 만드는 특징(예를 들면, 체세포 돌연변이)을 포함하는 하나 이상의 종양 세포를 포함하는 것을 특징으로 한다. 특정한 실시양태에서, 암은 (1) 세포가 EGFR 코딩 유전자에서 하나 이상의 돌연변이를 포함하거나, (2) 세포가 PIK3CA, RAS 또는 PTEN 코딩 유전자에서 하나 이상의 돌연변이를 포함하거나, (3) 세포가 활성화된 MET 또는 IGF1R 경로와 같은 보상 경로를 포함하거나, (4) 다른 분자 변화, 예컨대 상피-간엽성 전이가 존재하는 하나 이상의 EGFR 발현 세포를 특징으로 한다. 상피-간엽성 전이 또는 전환은 분극화 상피 세포가 간엽성 세포 표현형을 띄게 하는, 이동 능력 증대, 침윤성, 아폽토시스에 대한 내성 증가 및 세포외 막 성분의 매우 높은 생성 증가를 포함하는, 여러 생화학 변화를 겪는 생물학적 과정이다.
특정한 실시양태에서, 암은 (1) EGFR 유전자 증폭, (2) H1047R과 같은 PIK3CA의 돌연변이, (3) 예를 들면 KRAS 코돈 12 및 13에서의 RAS 돌연변이, (4) PTEN 하향조절 또는 손실, (5) MET 유전자 증폭, MET 과발현 및/또는 HGF 과발현을 통한 MET 활성화, (6) IGF1R 활성화, (7) AKT의 활성화 또는 (8) ERK1/2의 활성화가 존재하는 EGFR 발현 세포를 특징으로 한다.
특정한 실시양태에서, EGFR 면역접합체로 치료된 질환은 종양 세포가 EGFR 치료에 대한 내성을 획득한 암이다. 이러한 실시양태에서, 종양 세포는 치료 기준으로서 사용되는 약물에 대한 내성을 획득하여, 이 약물은 종양 세포를 치료하는 데 있어서 더 이상 효과적이지 않다. 일 실시양태에서, EGFR 치료 기준은 EGFR 키나제 억제제, 예컨대 엘로티닙, 게피티닙, 라파티닙 및 BIB2992 및 항-EGFR 항체, 예컨대 세툭시맙, 파니튜무맙, 잘루튜무맙, 네시튜무맙 및 니모튜무맙을 포함하지만, 이들로 제한되지는 않는다.
특정한 실시양태에서, EGFR 면역접합체로 치료되는 질환은 종양 세포가 ALK 억제제 치료에 내성을 나타내는 암이다. 이러한 실시양태에서, 종양 세포는 치료 기준으로서 사용되는 약물에 대한 내성을 획득하여, 이 약물은 종양 세포를 치료하는 데 있어서 더 이상 효과적이지 않다. 일 실시양태에서, ALK 억제제 치료 기준은 크리조티닙을 포함하지만, 이것으로 제한되지는 않는다.
특정한 실시양태에서, 종양 세포는 초기에 표준 EGFR 치료에 감수성이고 시간이 지남에 따라 치료에 대한 내성을 획득한다. 특정한 실시양태에서, 종양 세포는 체세포 돌연변이를 통해 내성을 획득한다. 일 실시양태에서, EGFR 치료 기준 약물에 의한 치료 시 또는 치료 6개월 내에 질환 진행은 EGFR 치료 기준 약물이 더 이상 효과적이지 않다는 것을 나타낸다. 다른 실시양태에서, EGFR 치료 기준 약물에 의한 치료 시 또는 치료 12개월 내에 질환 진행은 EGFR 치료 기준 약물이 더 이상 효과적이지 않다는 것을 나타낸다. 특정한 실시양태에서, 당해 분야의 당업자는 EGFR 치료 기준에 대한 내성을 획득한 종양 세포를 나타내는 분자 마커의 존재에 대해 종양 샘플을 시험하여 질환 진행을 결정할 수 있다. 특정한 실시양태에서, 당해 분야의 당업자는 표준 영상화 수단, 종양 바이오마커 평가 또는 임상 악화의 징후에 의해 질환 진행을 결정할 수 있다.
추가의 양태에서, 본 발명은 방광암, 뇌암, 두경부암, 췌장암, 폐암, 유방방, 난소암, 대장암, 전립선암, 피부암 및 신장암을 비롯한 EGFR이 비정상적으로 발현된 세포 증식 질환을 치료하는 개선된 방법으로서, 본 발명의 치료학적 유효량의 항-EGFR 결합제를 이를 필요로 하는 인간 피험체에게 투여하는 단계를 포함하는 방법에 관한 것이다. 다른 실시양태에서, 항체는 인간화된다. 본 발명의 항-EGFR 결합제로 치료될 수 있는 세포 증식 질환의 예는 복부, 뼈, 유방, 소화계, 간, 췌장, 복막, 내분비(부신, 부갑상선, 뇌하수체, 고환, 난소, 흉선, 갑상선), 눈, 두경부, 신경계(중추 및 말초), 림프계, 골반, 피부, 연조직, 비장, 흉부 구역 및 비뇨생식계에 위치한 신생물을 포함하지만, 이들로 제한되지는 않는다.
유사하게, 다른 세포 증식 질환을 또한 본 발명의 EGFR 면역접합체로 치료할 수 있다. 이러한 세포 증식 질환의 예는 부신피질 과형성(쿠싱병), 선천성 부신 과형성, 자궁내막 증식증, 전립선 비대증, 유방 과형성, 내막 증식증, 국소 상피 증식증(헤크병), 피지샘 증식증, 대상성 간 과형성 및 상기 기재된 장기 시스템에 위치한 임의의 다른 세포 증식 질환을 포함하지만, 이들로 제한되지는 않는다.
몇몇 실시양태에서, 종양 성장의 억제 방법은 종양 또는 종양 세포를 생체내 EGFR 면역접합체와 접촉시키는 것을 포함한다. 특정한 실시양태에서, 동물 모델에서 종양 또는 종양 세포를 EGFR 면역접합체와 접촉시키는 것을 수행한다. 예를 들면, EGFR 면역접합체를 면역손상된 마우스(예를 들면, NOD/SCID 마우스)에서 성장된 하나 이상의 돌연변이된 EGFR을 발현하는 이종이식편에 투여하여 종양 성장을 억제할 수 있다. 몇몇 실시양태에서, 암 줄기 세포를 환자 샘플, 예를 들면 조직 생검, 흉수 또는 혈액 샘플로부터 단리하고 면역손상된 마우스에 주사하고, 이후 EGFR 면역접합체를 투여하여 종양 세포 성장을 억제한다. 몇몇 실시양태에서, EGFR 면역접합체를 동시에 또는 종양형성 세포를 동물로 도입한 직후 투여하여 종양 성장을 예방한다. 몇몇 실시양태에서, 종양형성 세포를 특정 크기로 성장시킨 후 EGFR 면역접합체를 치료제로서 투여한다.
특정한 실시양태에서, EGFR-치료 내성 종양 성장을 억제하는 방법은 치료학적 유효량의 EGFR 면역접합체를 피험체에게 투여하는 것을 포함한다. 특정한 실시양태에서, 피험체는 인간이다. 특정한 실시양태에서, 피험체는 종양을 갖거나 종양이 제거된다.
또한, 본 발명은 피험체에서 종양의 종양형성을 감소시키는 방법으로서, 치료학적 유효량의 EGFR 면역접합체를 피험체에게 투여하는 것을 포함하는 방법을 제공한다. 특정한 실시양태에서, 종양은 암 줄기 세포를 포함한다. 특정한 실시양태에서, 면역접합체를 투여하여 종양에서 암 줄기 세포의 빈도를 감소시킨다.
국소 또는 전신 치료를 위해 본 발명의 EGFR 면역접합체를 포함하는 약제학적 조성물을 임의의 방식으로 투여할 수 있다. 투여는 (예컨대, 질 및 직장 전달을 포함하는 점막에 대한) 국소 투여, 예컨대 경피 패취, 연고, 로션, 크림, 겔, 점적제, 좌제, 스프레이, 액체 및 산제; (예를 들면, 분무기에 의한 것을 포함하는 산제 또는 에어로졸의 흡입 또는 통기에 의한; 기관내, 비강내, 표피 및 경피) 폐 투여; 경구 투여; 또는 정맥내, 동맥내, 피하, 복강내 또는 근육내 주사 또는 점적주사를 비롯한 비경구 투여; 또는 두개내 투여(예를 들면, 지주막하 또는 뇌실내)일 수 있다.
특정한 실시양태에서, EGFR 면역접합체를 투여하는 것 이외에, 상기 방법 또는 치료는 (EGFR 면역접합체의 투여 전에, 동시에 및/또는 후에) 제2 항암제를 투여하는 것을 추가로 포함한다.
EGFR 면역접합체와 제2 항암제의 조합을 임의의 순서로 또는 함께 투여할 수 있는 것으로 이해된다. 선택된 실시양태에서, 이전에 제2 항암제에 의한 치료를 받은 환자에게 EGFR 면역접합체를 투여한다. 특정한 다른 실시양태에서, EGFR 면역접합체 및 제2 항암제를 실질적으로 동시에 또는 함께 투여한다. 예를 들면, 제2 항암제(예를 들면, 화학치료)의 치료를 받으면서 피험체에게 EGFR 면역접합체가 제공될 수 있다. 특정한 실시양태에서, 제2 항암제에 의한 치료의 1년 내에 EGFR 면역접합체를 투여한다. 대안적인 특정한 실시양태에서, 제2 항암제에 의한 임의의 치료의 10달, 8달, 6달, 4달 또는 2달 내에 EGFR 면역접합체를 투여한다. 특정한 다른 실시양태에서, 제2 항암제에 의한 임의의 치료의 4주, 3주, 2주 또는 1주 내에 EGFR 면역접합체를 투여한다. 몇몇 실시양태에서, 제2 항암제에 의한 임의의 치료의 5일, 4일, 3일, 2일 또는 1일 내에 EGFR 면역접합체를 투여한다. 2종의 물질 또는 치료제를 시간 또는 분(즉, 실질적으로 동시에) 내에 피험체에게 투여할 수 있는 것으로 추가로 이해된다.
유용한 종류의 항암제는 예를 들면 항튜불린제, 아우리스타틴, DNA 소홈 결합제, DNA 복제 억제제, 알킬화제(예를 들면, 백금 착제, 예컨대 시스-플라틴, 일핵(백금), 이핵(백금) 및 삼핵 백금 착제 및 카보플라틴), 안트라사이클린, 항생제, 엽산길항제, 대사길항제, 화학치료 감작제, 듀오카르마이신, 에토포사이드, 불화 피리미딘, 이오노포어, 렉시트롭신(lexitropsin), 나이트로소유레아, 플라티놀, 퍼포밍 화합물(performing compound), 퓨린 대사길항제, 퓨로마이신, 방사선 감작제, 스테로이드, 탁산, 토포아이소머라제 억제제, 빈카 알칼로이드 등을 포함한다. 특정한 실시양태에서, 제2 항암제는 대사길항제, 세포분열정지제, 토포아이소머라제 억제제 또는 혈관신생 억제제이다.
EGFR 면역접합체와 조합되어 투여될 수 있는 항암제는 화학치료제를 포함한다. 따라서, 몇몇 실시양태에서, 상기 방법 또는 치료는 본 발명의 면역접합체 및 화학치료제 또는 상이한 다수의 화학치료제의 칵테일의 병용 투여를 수반한다. 이러한 화학치료제에 대한 제조 및 투약 스케쥴은 제조업자의 지시에 따라 이용될 수 있거나 숙련된 기술자에 의해 경험적으로 결정될 수 있다. 이러한 화학치료제에 대한 제조 및 투약 스케쥴은 또한 문헌[Chemotherapy Service Ed., M. C. Perry, Williams & Wilkins, Baltimore, Md. (1992)]에 기재되어 있다.
특정한 실시양태에서, 상기 치료는 본 발명의 EGFR 면역접합체 및 방사선 치료의 병용 투여를 수반한다. 방사선 치료제의 투여 전에, 동시에 또는 후에 EGFR 면역접합체에 의한 치료가 발생할 수 있다. 숙련된 기술자에 의해 결정된 바대로 이러한 방사선 치료제에 대한 임의의 투약 스케쥴을 이용할 수 있다.
특정한 실시양태에서, 상기 치료는 본 발명의 EGFR 면역접합체 및 다른 표적화 치료제의 병용 투여를 수반한다. 유용한 표적화 치료제 종류는 예를 들면 (1) HER2 억제제, (2) EGFR 억제제(예를 들면, 티로신 키나제 억제제 또는 표적화 항-EGFR 항체), (3) BRAF 억제제, (4) ALK 억제제, (5) 호르몬 수용체 억제제, (6) mTOR 억제제, (7) VEGF 억제제 또는 (8) 암 백신을 포함하지만, 이들로 제한되지는 않는다. 티로신 키나제 억제제는 EGFR에 특이적이거나 다중 특이적일 수 있고, EGFR 이외에 또는 이것에 추가로 하나 이상의 키나제의 활성을 억제할 수 있다. 표적화 치료제의 투여 전에, 동시에 또는 후에 EGFR 면역접합체에 의한 치료가 발생할 수 있다.
본 개시내용의 특정한 항체 제조 및 본 개시내용의 항체를 사용하는 방법을 자세히 기술하는 하기 비제한적인 실시예를 참조하여 본 개시내용의 실시양태가 추가로 정의될 수 있다. 본 개시내용의 범위를 벗어남이 없이 재료 및 방법 둘 다에 대한 많은 변형이 실행될 수 있는 것이 당해 분야의 당업자에게 명확하다.
실시예
본 명세서에 기재된 실시예 및 실시양태가 오직 예시적인 목적을 위한 것이고 이에 대한 다양한 변경 또는 변형이 당해 분야의 당업자에게 제시되고 본원의 정신 및 이해범위 내에 포함되는 것으로 이해된다.
실시예 1
huEGFR-7R-SMCC-DM1 접합체는 T790M EGFR 돌연변이를 갖는 NSCLC 세포주에 대해 효과적이다
EGFR 돌연변이 T790M은 EGFR 티로신 키나제 억제제인 엘로티닙 및 게피티닙에 대한 가장 흔한 내성 기전 중 하나이다(Suda K. et al. Clin Cancer Res 16: 5489 (2010); Sequist L. et al. Sci Transl Med 3: 75ra26 (2011); 및 Uramoto H. et al. Lung Cancer 73: 361 (2011)). T790M 중재 내성을 극복하는 huEGFR-7R-SMCC-DM1 접합체의 능력을 시험하기 위해, NCI-H1975 세포주를 사용하여 실험실내 세포독성 검정을 수행하였다. NCI-H1975 세포주는 감작(L858R) 및 내성(T790M) EGFR 돌연변이 둘 다를 보유하는 NSCLC 선암 세포주여서(Cosmic database, Wellcome Trust Sanger Institute), 임상 설정에서 발견되는 EGFR 키나제 억제제 내성 종양을 매우 모방한다.
하기 대로 세포독성 검정을 수행하였다. 표적 세포를 10%의 소 태아 혈청(FBS)을 포함하는 100㎕의 완전 RPMI 배지 중에 웰마다 1,500개 내지 3,000개의 세포로 평판배양하였다. 시험 물품을 5배 희석 시리즈를 사용하여 완전 RPMI 배지에 희석하고 100㎕를 웰마다 첨가하였다. 최종 농도는 통상적으로 3x10-8M 내지 8x10-14M 범위였다. 세포를 습윤 5% CO2 항온처리기 내에서 37℃에서 4-5일 동안 항온처리하였다. 남은 세포의 생존율을 비색 WST-8 검정으로 결정하고 450㎚에서의 흡광도(A450)를 다중 웰 플레이트 판독기에서 측정하였다. 각각의 치료 샘플 값을 비치료 대조군의 평균 값으로 나눠 생존 비율을 계산하였다. 각각의 치료에 대해 반로그 도면으로 시험 물품에 대해 생존 비율 값을 작도하였다.
도 1에 도시된 것처럼, huEGFR-7R-SMCC-DM1 접합체는 3nM의 EC50으로 NCI-H1975 세포를 사멸하는 데 효과적이었다. 반대로, huEGFR-7R 네이키드 항체는 어떠한 효과도 갖지 않았고, 비결합 대조군 접합체인 chKTI-SMCC-DM1만이 10nM의 EC50 또는 huEGFR-7R-SMCC-DM1 접합체보다 3배 더 높은 농도로 종양 세포를 사멸하였다. 이 데이터는 huEGFR-7R-SMCC-DM1 접합체가 T790M 중재 EGFR 키나제 억제제 내성 기전을 극복할 수 있다는 것을 제시한다.
실시예 2
huEGFR-7R-SMCC-DM1 접합체는 MET/HGF 중재 EGFR 키나제 억제제 내성 기전을 극복할 수 있다
MET 유전자 증폭을 통한 MET 신호전달의 활성화, MET 단백질 과발현 및/또는 MET 리간드인 HGF의 과발현은 EGFR 키나제 억제제인 게피티닙 또는 엘로티닙에 대한 두번째로 가장 흔한 내성 기전이다(Uramoto H. et al. Lung Cancer 73: 361 (2011)). 야노(Yano) 등(Cancer Res 68: 9479 (2008))은 EGFR 리간드(EGF 및 TGF-a) 또는 IGF1R 리간드(IGF-1)가 아니라 HGF가 EGFR 감작 돌연변이를 갖는 폐 선암 세포주에서 게피티닙 내성을 유도할 수 있다는 것을 보여준다. 도 2에 도시된 실험은 이러한 발견을 확인시켜 준다. 이 실험에서, 엑손 19 결실 EGFR 감작 돌연변이를 보유하는 HCC827 세포주(Yano et al. Cancer Res 68: 9479 (2008))를 50ng/㎖의 간세포 성장 인자(HGF)의 존재 또는 부재 하에 엘로티닙 용량을 증가시키면서 항온처리하였다. HGF의 부재 하에, 엘로티닙은 종양 세포 성장을 효과적으로 억제할 수 있었다(EC50 = 0.9nM). 그러나, 50ng/㎖의 HGF의 첨가는 HCC827 세포가 엘로티닙 중재 세포 성장 억제에 강하게 내성을 나타내게 하였다.
huEGFR-7R-SMCC-DM1 접합체의 세포독성 활성을 시험하기 위해 이 실험실내 시스템을 사용하였다. 도 3에 도시된 것처럼, huEGFR-7R-SMCC-DM1 접합체는 HGF의 부재(도 3A) 또는 존재(도 3B) 하에 HCC827 세포를 억제하는 데 있어서 매우 효과적이었다(표 1). 세툭시맙 및 huEGFR-7R 네이키드 항체는 HCC827 세포에 대해 한계 활성을 나타냈고, 이 활성은 HGF의 존재 하에 추가로 감소하였다. 이 데이터는 huEGFR-7R-SMCC-DM1 접합체가 MET/HGF 경로의 활성화로 중재된 EGFR 키나제 억제제 내성을 극복할 수 있다는 것을 제시한다.
실시예 3
huEGFR-7R-SMCC-DM1 접합체는 간엽성 조직을 갖는 종양 세포주에 대해 효과적이다
간엽성 조직을 갖는 NSCLC 세포주는 상피 조직을 갖는 게피티닙보다 일반적으로 더 내성을 나타낸다(Yauch RL. et al. Clin Cancer Res 11: 8686 (2005)) 게피티닙 내성 간엽성 폐암 세포주에 대한 huEGFR-7R-SMCC-DM1 접합체의 세포독성 활성을 시험하기 위해, 실시예 1에 기재된 바대로 H226 세포주에 의한 세포독성 검정을 수행하였다. H226 세포주는 간엽성 조직을 갖는 편평 세포 암종이다. EGFR 고발현에도 불구하고, H226 세포주는 게피티닙에 내성을 나타낸다(Yauch RL. et al. Clin Cancer Res 11: 8686 (2005)). 도 4에 도시된 것처럼, huEGFR-7R-SMCC-DM1 접합체는 EC50 = 0.14nM으로 H226 세포주에 대해 매우 효과적이었다. 반대로, huEGFR-7R 항체도 세툭시맙도 H226 종양 세포 성장에 영향을 미치지 않았다. 비결합 대조군 접합체인 chKTI-SMCC-DM1만이 huEGFR-7R-SMCC-DM1 접합체보다 약 160배 더 높은 농도로 세포독성이었다. 이 데이터는 huEGFR-7R-SMCC-DM1 접합체가 EGFR 키나제 억제제 및 세툭시맙에 내성을 나타내는 간엽성 조직을 갖는 폐암 세포주에서 매우 효과적이라는 것을 제시한다.
실시예 4
엘로티닙 내성 NSCLC 선암 세포주의 생성 및 규명
EGFR 키나제 억제제 내성 설정에서 huEGFR-7R-SMCC-DM1 접합체의 세포독성 활성을 추가로 평가하기 위해, 엘로티닙 내성 HCC827 세포주를 생성하였다. HCC827 세포주는 엘로티닙을 포함하는 EGFR 키나제 억제제에 매우 감작성으로 만드는 엑손 19 결실 EGFR 돌연변이를 보유한다(Yano et al. Cancer Res 68: 9479 (2008))(도 2 및 도 5A). 간단히 말하면, 2nM에서 시작하여 2μM까지 엘로티닙의 농도를 증가시키면서 4달 이상 동안 HCC827 세포주를 계속해서 배양하였다. 생성된 HCC827-ER 세포주는 부모 세포주에 비교하여 엘로티닙에 고내성을 나타냈다(도 5A). 흥미롭게도, HCC827 세포의 조직은 엘로티닙에 대한 내성을 획득하였을 때 상피로부터 간엽으로 변했다(도 5B). 이 조직학적 변화는 분자 마커의 변화가 수반되었다. 부모 세포주는 E-카데린(상피 마커) 양성 및 비멘틴(간엽 마커) 음성이고, 엘로티닙 내성 HCC827-ER 세포주는 E-카데린 음성 및 비멘틴 양성이었다(도 5C). 도 6에 도시된 것처럼, HCC827-ER 세포주는 여전히 EGFR을 발현하였지만 부모 세포주에 비해 유의적으로 낮은 수준으로 발현하였다. HER3 및 MET의 세포 표면 발현은 엘로티닙 내성 HCC827-ER 세포주에서 또한 감소하였다. 도 6에 도시된 세포마다의 항체 결합(ABC)은 세포 표면에서의 항원 밀도를 나타내고; PE-퀀티브라이트(Quantibrite) 비드(비디 바이오사이언스(BD bioscience)) 및 PE로 라벨링된 상응하는 항원에 대한 표시된 항체를 1:1 비율로 사용하여 이를 측정하였다.
희석을 제한하여 HCC827-ER 세포주를 추가로 서브클로닝하였다. 도 7에 도시된 바대로, 생성된 서브클론 HCC827-ER-E4 세포주는 HCC827-ER 세포주로서 엘로티닙 내성을 유지하였고, EGFR 항원 밀도를 53,000개로 추가로 감소시켰다. 이 세포주를 더 자세히 규명하기 위해, HCC827-ER-E4 세포를 1주일 동안 엘로티닙의 부재 하에 배양하고 상이한 용량의 엘로티닙으로 16시간 동안 처리하였다. 세포 용해물을 수집하고 SDS-PAGE로 분리하고 웨스턴 블롯으로 분석하였다. 도 8에 도시된 것처럼, HCC827-ER-E4 세포주는 간엽 마커(E-카데린 음성 및 비멘틴 양성)를 유지하였다. FACS 데이터(도 6)와 일치하게, 부모 HCC827 세포주와 비교하여 EGFR 수준은 유의적으로 감소하였다. 엘로티닙의 존재 하에 세포주 둘 다에서의 EGFR 인산화가 완전히 억제되었다. HCC827 부모 세포주와 반대로, HCC827-ER-E4 세포주에서 HER3 인산화는 완전히 부재하였다. PTEN 수준은 변화가 없었다. 흥미롭게도, HCC827 부모 세포주에서의 AKT 수준은 용량 의존 방식으로 엘로티닙 치료에 의해 감소하였고, 이는 HCC827-ER-E4 세포주에서 변하지 않았다. 동시에, HCC827 세포주에서, AKT 인산화는 엘로티닙에 의해 억제되었고, HCC827-ER-E4 세포주에서, 포스포 AKT(pAKT) 수준은 변화가 거의 없었다. pAKT와 유사하게, 엘로티닙은 HCC827 부모 세포주에서 ERK1/2 인산화를 억제하였지만, HCC827-ER-E4 세포주에 더 적은 영향을 미쳤다. 게다가, EGFR 엑손 19, 20 및 21의 DNA 서열분석은 엑손 19 결실 이외에 임의의 추가의 돌연변이를 나타내지 않았다. 종합하면, 이 데이터는 엘로티닙의 존재 하에 HCC827-ER-E4 세포주가 EGFR 경로의 중요한 2가지 신호전달 경로 다운스트림인 AKT 및 ERK1/2 신호전달 경로를 유지시킬 수 있다는 것을 보여준다. HCC827-ER-E4 세포주에서의 EGFR 및 HER3 활성화의 부재는 이 세포주가 AKT 및 ERK1/2 신호전달 경로를 촉발하는 보상 경로 기전을 발생시키지만 엘로티닙에 의해 영향을 받지 않는다는 것을 제시한다.
huEGFR-7R-SMCC-DM1 접합체는 엘로티닙 내성 HCC827-ER-E4 세포주에 대해 효과적이다
huEGFR-7R-SMCC-DM1 접합체의 활성을 시험하기 위해, HCC827-ER 및 HCC827-ER-E4 세포주로 실시예 1에 기재된 실험실내 세포독성 검정을 수행하였다. 도 9 및 표 2에 도시된 것처럼, huEGFR-7R-SMCC-DM1은 유의적인 항원 밀도 감소에도 불구하고 엘로티닙 내성 세포를 사멸하는 데 있어서 매우 효과적이었다. 엘로티닙 내성 세포주에 대한 huEGFR-7R-SMCC-DM1 접합체의 EC50 값은 부모 HCC827 세포주에서의 것에 필적하였다(표 1). 세툭시맙, huEGFR-7R 항체 및 비결합 대조군 접합체인 chKTI-SMCC-DM1은 엘로티닙 내성 세포주에 거의 영향을 미치지 않았다.
실시예 5
huEGFR-7R-SMCC-DM1 접합체는 세툭시맙 내성 결장암 및 두경부암 세포주에 대해 효과적이다
세툭시맙(얼비툭스(Erbitux))은 결장암 및 두경부암의 치료에 허가받았다. 세툭시맙 치료는 화학치료에 반응하지 않는 결장암을 앓는 환자에서 전체 생존율 및 무진행 생존율을 개선하고 삶의 질을 보존한다. 그러나, 세툭시맙 치료는 코돈 12 및 13에서 흔히 발견되는 KRAS 돌연변이를 보유하는 환자에 이익을 갖지 않는다(Karapetis C et al., N Engl J Med 359: 1757 (2008)). huEGFR-7R-SMCC-DM1 접합체가 KRAS 돌연변이에 의해 중재된 세툭시맙 내성을 극복할 수 있는지를 시험하기 위해, 실시예 1에 기재된 바대로 G12V KRAS 돌연변이를 보유하는 결장암 세포주인 SW620을 사용한 실험실내 세포독성 검정(Cosmic database, Wellcome Trust Sanger Institute)을 수행하였다. 도 10에 도시된 것처럼, huEGFR-7R-SMCC-DM1 접합체는 4.1nM의 EC50으로 SW620 종양 세포를 사멸하는 데 있어서 효과적이었다. 비결합 접합체 대조군인 chKTI-SMCC-DM1은 또한 종양 세포를 사멸할 수 있지만, 10배 더 높은 농도(EC50 = 약 39nM)를 필요로 했다.
PIK3CA 돌연변이는 HER2+ 전이 유방암에서의 트라스투주맙(헤르셉틴(Herceptin)) 내성과 관련되고(Kataoka Y. et al., Ann Oncol 21: 255 (2010); Lee JY. et al., Science 317: 206 (2007)) 및 두경부암에서 세툭시맙(얼비툭스) 내성과 관련된다(Rebucci M. et al., Int J Oncol 38: 189 (2011)). huEGFR-7R-SMCC-DM1 접합체가 PIK3CA 돌연변이에 의해 중재된 내성을 극복할 수 있는지를 조사하기 위해, 실시예 1에 기재된 바대로 가장 흔한 H1047R PIK3CA 돌연변이 중 하나를 보유하는 SCCHN 암 세포주인 데트로이트 562를 사용한 실험실내 세포독성 검정(Cosmic database, Wellcome Trust Sanger Institute)을 수행하였다. 도 11에 도시된 것처럼, huEGFR-7R-SMCC-DM1 접합체는 0.62nM의 EC50으로 데트로이트 562 종양 세포 성장을 억제하는 데 있어서 매우 효과적이었다. 비결합 접합체 대조군인 chKTI-SMCC-DM1은 또한 종양 세포를 사멸하였지만, EC50은 huEGFR-7R-SMCC-DM1 접합체보다 30배 더 높은 19nM이었다. 반대로, 세툭시맙 및 huEGFR-7R 항체는 종양 세포 성장에 영향을 미치지 않았다. 종합하면, 이 데이터는 huEGFR-7R-SMCC-DM1 접합체가 세툭시맙에 대한 다양한 내성 기전을 극복할 수 있다는 것을 강하게 제시한다.
실시예 6
huEGFR-7R-SMCC-DM1 접합체는 T790M EGFR 돌연변이 및 MET 유전자 증폭을 갖는 엘로티닙 내성 HCC827 NSCLC 세포주에 대해 효과적이다
EGFR 억제제에 내성을 나타내는 NSCLC 세포에 대한 IMGN289의 활성을 추가로 입증하기 위해, 엘로티닙 또는 엘로티닙 및 PHA665,752(MET 억제제)의 농도를 각각 증가시키면서 엘로티닙 감작 HCC827 세포(부모 HCC827 세포)를 성장시켜 미츠도미(Mitsudomi) 박사의 실험실(일본 나고야에 소재하는 아이치 암 병동의 흉부외과)에서 생성된 HCC827 ER(Aichi) 및 HCC827 EPR(Aichi) 세포주로 실험실내 세포독성 검정을 수행하였다(Suda K. et al. Clin Cancer Res 16: 5489 (2010)). 문헌[Suda K. et al. Clin Cancer Res 16: 5489 (2010)] 및 도 12에 도시된 것처럼, HCC827 ER 및 HCC827 EPR 세포는 부모 HCC827 세포보다 엘로티닙에 유의적으로 더 내성을 나타냈다. 부모 HCC827, HCC827 ER(Aichi) 및 HCC827 EPR 세포에서의 엘로티닙의 EC50은 각각 2.94E-10 M, 약 7.28E-6 M 및 약 5.84E-6M이었다(표 3). HCC827 ER 세포주는 높은 MET 유전자 카피수를 포함하고 HCC827 EPR 세포주는 T790M EGFR 돌연변이를 포함한다(Suda K. et al. Clin Cancer Res 16: 5489 (2010)). 이 세포주는 EGFR 티로신 키나제 억제제에 대한 2가지 주요한 내성 기전을 반영한다(Sequist L. et al. Sci Transl Med 3: 75ra26 (2011)). 부모 HCC827, HCC827 ER 및 HCC827 EPR 세포주에 대한 EGFR 항원 밀도는 각각 192,600, 32,500 및 421,600이다.
세포독성 검정 결과(도 12)는 부모 HCC827(아이치) 세포가 1E-10M 범위의 EC50으로 엘로티닙, 세툭시맙 및 huEGFR-7R 항체에 의한 EGFR 신호전달 억제에 매우 민감하다는 것을 나타낸다(표 3). 반대로, HCC827 ER 및 EPR(Aichi) 세포는 엘로티닙, 세툭시맙 및 huEGFR-7R 항체에 높은 내성을 나타낸다. 중요한 것은 huEGFR-7R-SMCC-DM1 접합체가 MET 유전자 증폭 및 T790M EGFR 돌연변이를 갖는 엘로티닙 내성 세포주에 대해 매우 효과적이라는 것이다. 종합하면, 이 데이터는 huEGFR-7R-SMCC-DM1 접합체가 EGFR 티로신 키나제 억제제에 대한 다양한 내성 기전을 극복할 수 있다는 것을 강하게 제시한다.
실시예 7
huEGFR-7R-SMCC-DM1 접합체는 크리조티닙 내성 EML4-ALK+ H2228 NSCLC 세포주에 대해 효과적이다
EML4-ALK 유전자 전좌는 ALK 키나제의 구성적 활성화를 발생시키고 NSCLC 선암의 약 5%에서 드라이버 돌연변이로서 확인되었다(문헌[Castro-Carpeno J. et al., Clin Transl Oncol. 13:774-779 (2011)). ALK 억제제인 크리조티닙은 EML4-ALK 유전자 전좌를 갖는 종양에 대해 매우 효과적이고 ALK 양성 NSCLC의 치료에 대해 FDA에 의해 최근에 허가받았다. 불행하게도, EML4-ALK+ 종양의 약 40%는 크리조티닙에 내성을 나타낸다. 추가로, 크리조티닙에 감수성인 종양은 약물에 대해 내성을 신속히 발생시킬 수 있다(Castro-Carpeno J. et al., Clin Transl Oncol. 13:774-779 (2011)). H2228은 ALK 티로신 키나제 억제제인 TAE684에 대해 내성을 나타내는 EML4-ALK 유전자 전좌를 갖는 NSCLC 선암 세포주이다(Koivunen JP. et al., Clin Cancer Res 14:4275-4283 (2008)). 본 발명자들의 실험에서, H2228 세포는 또한 크리조티닙에 내성을 나타낸다(EC50 = 3.82E-6M)(도 13A). H2228 세포가 비교적 높은 수준의 EGFR(116,000개의 항원/세포)을 발현하므로, 본 발명자들은 이 세포주에서 엘로티닙, 세툭시맙, huEGFR-7R 항체 및 huEGFR-7R-SMCC-DM1 접합체의 활성을 시험하였다. 도 13A 및 도 13B에 도시된 것처럼, 엘로티닙은 고용량(EC50 = 2.61E-5M)에서만 활성이었다. 이 세포주에서의 엘로티닙 활성은 EGFR 억제제 내성 HCC827 세포주에서와 필적하여(실시예 6 참조), H2228 세포가 본래 엘로티닙에 내성을 나타낸다는 것을 제시한다. 세툭시맙 및 huEGFR-7R 항체 둘 다 3E-8M 농도에서 종양 성장을 불과 35% 이하로 억제하였다(도 13B). 반대로, huEGFR-7R-SMCC-DM1은 3.2E-11M의 EC50으로 종양 세포를 거의 대부분 사멸하였다. 이 데이터는 huEGFR-7R-SMCC-DM1 접합체가 ALK 억제제 내성 EML4-ALK+ H2228 세포주인 NSCLC 선암에 대해 매우 효과적이라는 것을 제시한다.
상기 구체적인 실시양태의 설명은, 본 발명의 일반적인 개념을 벗어남이 없이 부당한 실험 없이 다른 사람이 당해 기술 내에 지식을 적용하여 다양한 분야에 이러한 구체적인 실시양태를 쉽게 변경하고/하거나 변형할 수 있는 본 발명의 일반적인 성질을 충분히 기술하고 있다. 따라서, 이러한 변형 및 변경은 본 명세서에 제시된 교시 및 가이드라인을 토대로 개시된 실시양태의 의미 및 균등물의 범위 내에 있는 것으로 의도된다. 본 명세서에서의 어법 및 전문용어는 설명의 목적이고 제한이 아니며, 당업자가 교시 및 가이드라인의 견지에서 본 명세서의 전문용어 또는 어법을 해석할 수 있는 것으로 이해되어야 한다.
본 발명의 폭 및 범위는 상기 기재된 임의의 예시적인 실시양태에 의해 제한되지 않아야 하지만, 오직 하기 특허청구범위 및 이의 균등물에 따라 한정되어야 한다.
SEQUENCE LISTING
<110> IMMUNOGEN, INC.
<120> METHOD OF TREATMENT OF TUMORS THAT ARE RESISTANT TO EGFR
THERAPIES BY EGFR ANTIBODY CYTOTOXIC AGENT CONJUGATE
<130> WO2013/078271
<140> PCT/US2012/066205
<141> 2012-11-21
<150> US 61/562,157
<151> 2011-11-21
<150> US 61/639,452
<151> 2012-04-27
<160> 3
<170> PatentIn version 2.0
<210> 1
<211> 119
<212> PRT
<213> Artificial Sequence
<220>
<223> huEGFR-7R VH
<400> 1
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Ala Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met Gln Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Cys Ile
35 40 45
Gly Thr Ile Tyr Pro Gly Asp Gly Asp Thr Thr Tyr Thr Gln Lys Phe
50 55 60
Gln Gly Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Arg Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Tyr Asp Ala Pro Gly Tyr Ala Met Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 2
<211> 108
<212> PRT
<213> Artificial Sequence
<220>
<223> huEGFR-7R VL v1.0
<400> 2
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Ile Asn Asn Tyr
20 25 30
Leu Ala Trp Tyr Gln His Lys Pro Gly Lys Gly Pro Lys Leu Leu Ile
35 40 45
His Tyr Thr Ser Thr Leu His Pro Gly Ile Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Arg Asp Tyr Ser Phe Ser Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Tyr Cys Leu Gln Tyr Asp Asn Leu Leu Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Arg
100 105
<210> 3
<211> 108
<212> PRT
<213> Artificial Sequence
<220>
<223> huEGFR-7R VL v1.01
<400> 3
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asp Ile Asn Asn Tyr
20 25 30
Leu Ala Trp Tyr Gln His Lys Pro Gly Lys Gly Pro Lys Leu Leu Ile
35 40 45
His Tyr Thr Ser Thr Leu His Pro Gly Ile Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Arg Asp Tyr Ser Phe Ser Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Tyr Cys Leu Gln Tyr Asp Asn Leu Leu Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Arg
100 105
Claims (33)
- 표피 성장 인자 수용체(epidermal growth factor receptor: EGFR) 치료에 내성 또는 불응성을 나타내는 EGFR 발현 종양 세포의 성장의 억제 방법으로서, 상기 방법은 상기 종양 세포를 유효량의 EGFR 항체 면역접합체와 접촉시키는 단계를 포함하는, EGFR 발현 종양 세포의 성장 억제 방법.
- 제1항에 있어서, 상기 치료는 EGFR 항체 또는 EGFR 키나제 억제제의 투여를 포함하는 것인, EGFR 발현 종양 세포의 성장 억제 방법.
- 제1항 또는 제2항에 있어서, 세포가 내성을 나타내는 EGFR 치료는 엘로티닙, 게피티닙, 라파티닙, BIB2992, 세툭시맙, 파니튜무맙, 잘루튜무맙, 네시튜무맙 및 니모튜무맙으로 이루어진 군으로부터 선택되는 것인, EGFR 발현 종양 세포의 성장 억제 방법.
- 제1항 내지 제3항 중 어느 한 항에 있어서, 하나 이상의 종양 세포는 (1) EGFR 코딩 유전자에서 하나 이상의 돌연변이를 포함하거나; (2) PIK3CA, RAS 또는 PTEN 코딩 유전자에서 하나 이상의 돌연변이를 포함하거나; (3) 활성화 MET 또는 IGF1R 경로를 갖거나; (4) 간엽성 조직학을 갖거나 상피-간엽성 전이를 겪거나; 또는 (5) ERBB2 유전자 증폭 또는 HER2 단백질의 생성 증가를 갖는 것인, EGFR 발현 종양 세포의 성장 억제 방법.
- 제4항에 있어서, 돌연변이된 EGFR 유전자는 EGFRvIII 또는 T790M 돌연변이를 포함하는 것인, EGFR 발현 종양 세포의 성장의 억제 방법.
- 제4항에 있어서, 상기 하나 이상의 종양 세포는 PIK3CA, RAS 또는 PTEN 코딩 유전자에서 하나 이상의 돌연변이를 포함하는 것인, EGFR 발현 종양 세포의 성장의 억제 방법.
- 제4항에 있어서, MET 또는 IGF1R 경로는 활성화되는 것인, EGFR 발현 종양 세포의 성장의 억제 방법.
- 환자에서 암을 치료하는 방법으로서, 상기 환자에서 종양 세포의 성장을 억제하기 위한 유효량의 EGFR 항체 면역접합체를 투여하는 단계를 포함하되, 하나 이상의 종양 세포는 (1) EGFR 코딩 유전자에서 하나 이상의 돌연변이를 포함하거나; (2) PIK3CA, RAS 또는 PTEN 코딩 유전자에서 하나 이상의 돌연변이를 포함하거나; (3) 활성화 MET 또는 IGF1R 경로를 갖거나; (4) 간엽성 조직학을 갖거나 상피-간엽성 전이를 겪거나; 또는 (5) ERBB2 유전자 증폭 또는 HER2 단백질의 생성 증가를 갖는 것인, 암의 치료 방법.
- 환자에서 암을 치료하는 방법으로서,
(a) 상기 환자로부터 (1) EGFR 코딩 유전자에서 하나 이상의 돌연변이를 포함하거나; (2) PIK3CA, RAS 또는 PTEN 코딩 유전자에서 하나 이상의 돌연변이를 포함하거나; (3) 활성화 MET 또는 IGF1R 경로를 갖거나; 또는 (4) 간엽성 조직학을 갖거나 상피-간엽성 전이를 겪은 종양 세포를 확인하는 단계; 및
(b) 유효량의 EGFR 항체 면역접합체를 상기 환자에게 투여하는 단계를 포함하는, 암의 치료 방법. - 제8항 또는 제9항에 있어서, 상기 암은 편평 세포암, 폐암, 두경부암 또는 EGFR 양성 암인 것인, 암의 치료 방법.
- 제1항 내지 제4항 및 제7항 내지 제9항 중 어느 한 항에 있어서, 상기 MET 활성화는 MET 유전자 증폭에 의해 발생되는 것인, 암의 치료 방법.
- 제8항 내지 제11항 중 어느 한 항에 있어서, 상기 환자는 EGFR 치료에 이전에 실패하였거나 현재 실패한 것인, 암의 치료 방법.
- 제12항에 있어서, 상기 치료는 EGFR 항체 또는 EGFR 키나제 억제제의 투여를 포함하는 것인, 암의 치료 방법.
- 제13항에 있어서, 상기 EGFR 항체는 세툭시맙 또는 파니튜무맙인 것인, 암의 치료 방법.
- 제13항에 있어서, 상기 EGFR 키나제 억제제는 엘로티닙 또는 게피티닙인 것인, 암의 치료 방법.
- 환자에서 암을 치료하는 방법으로서, 상기 환자에서 종양 세포의 성장을 억제하기 위한 유효량의 EGFR 항체 면역접합체를 투여하는 단계를 포함하고, 하나 이상의 종양 세포는 역형성 림프종 키나제(anaplastic lymphoma kinase: ALK) 억제제를 포함하는 치료에 내성을 나타내는 것인, 암의 치료 방법.
- 환자에서 암을 치료하는 방법으로서,
(a) 상기 환자로부터 하나 이상의 ALK 억제제에 내성을 나타내는 종양 세포를 확인하는 단계; 및
(b) 유효량의 EGFR 항체 면역접합체를 상기 환자에게 투여하는 단계를 포함하는, 암의 치료 방법. - 제16항 또는 제17항에 있어서, 하나 이상의 종양 세포는 EML4-ALK 전좌를 포함하는 것인, 암의 치료 방법.
- 제16항 내지 제18항 중 어느 한 항에 있어서, 상기 암은 비소세포 폐암인, 암의 치료 방법.
- 제16항 내지 제19항 중 어느 한 항에 있어서, 상기 ALK 억제제는 크리조티닙인, 암의 치료 방법.
- 제1항 내지 제20항 중 어느 한 항에 있어서, 상기 면역접합체는 화학식 (A)-(L)-(C)를 갖되,
(A)는 EGFR에 특이적으로 결합하는 항체 또는 이의 항원 결합 단편이고;
(L)은 링커이며;
(C)는 세포독성제이고;
상기 링커(L)는 (A)를 (C)에 연결시키는 것인, 암의 치료 방법. - 제21항에 있어서, 상기 EGFR 항체는 서열 번호 1의 중쇄 가변 영역 및 서열 번호 2 또는 3의 경쇄 가변 영역을 포함하는 것인, 암의 치료 방법.
- 제22항에 있어서, 상기 링커는 개열형 링커, 비개열형 링커, 친수성 링커 및 다이카복실산계 링커로 이루어진 군으로부터 선택되는 것인, 암의 치료 방법.
- 제23항에 있어서, 상기 링커는 비개열형 링커인 것인, 암의 치료 방법.
- 제21항에 있어서, 상기 링커는 N-숙신이미딜 4-(2-피리딜다이티오)펜타노에이트(SPP); N-숙신이미딜 4-(2-피리딜다이티오)뷰타노에이트(SPDB) 또는 N-숙신이미딜 4-(2-피리딜다이티오)-2-설포뷰타노에이트(설포-SPDB); N-숙신이미딜 4-(말레이미도메틸) 사이클로헥산카복실레이트(SMCC); N-설포숙신이미딜 4-(말레이미도메틸) 사이클로헥산카복실레이트(설포SMCC); N-숙신이미딜-4-(요오도아세틸)-아미노벤조에이트(SIAB); N-숙신이미딜-[(N-말레이미도프로피온아미도)-테트라에틸렌글라이콜] 에스터(NHS-PEG4-말레이미드); N-(베타-말레이미도프로필옥시)숙신이미드 에스터(BMPS); 및 감마-말레이미도뷰티르산 N-숙신이미딜 에스터(GMBS)로 이루어진 군으로부터 선택되는 것인, 암의 치료 방법.
- 제21항에 있어서, 상기 세포독성제는 메이타시노이드, 메이타시노이드 유사체, 독소루비신, 변형 독소루비신, 벤조디아제핀, 탁소이드, CC-1065, CC-1065 유사체, 듀오카르마이신, 듀오카르마이신 유사체, 칼리키아미신, 돌라스타틴, 돌라스타틴 유사체, 아우리스타틴, 토메이마이신 유도체 및 렙토마이신 유도체 또는 상기 물질의 프로드럭으로 이루어진 군으로부터 선택되는 것인, 암의 치료 방법.
- 제26항에 있어서, 상기 세포독성제는 메이타시노이드인 것인, 암의 치료 방법.
- 제27항에 있어서, 상기 세포독성제는 N(2')-데아세틸-N(2')-(3-머캅토-1-옥소프로필)-메이탄신(DM1) 또는 N(2')-데아세틸-N2-(4-머캅토-4-메틸-1-옥소펜틸)-메이탄신(DM4)인 것인, 암의 치료 방법.
- 제1항 내지 제28항 중 어느 한 항에 있어서, EGFR 항체 면역접합체는 서열 번호 1의 중쇄 가변 영역 및 서열 번호 2 또는 서열 번호 3의 경쇄 가변 영역을 포함하는 항체; 링커 SMCC; 및 메이타시노이드 DM1을 포함하는 것인, 암의 치료 방법.
- 제1항 내지 제29항 중 어느 한 항에 있어서, EGFR 항체 면역접합체는 항신생물제와 투여되는 것인, 암의 치료 방법.
- 제30항에 있어서, EGFR 항체 면역접합체는 항신생물제와 동시에 투여되는 것인, 암의 치료 방법.
- 제30항에 있어서, EGFR 항체 면역접합체 및 항신생물제는 임의의 시간상 순서로 투여되는 것인, 암의 치료 방법.
- 제8항 내지 제32항 중 어느 한 항에 있어서, 상기 환자는 인간인 것인, 암의 치료 방법.
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201161562157P | 2011-11-21 | 2011-11-21 | |
| US61/562,157 | 2011-11-21 | ||
| US201261639452P | 2012-04-27 | 2012-04-27 | |
| US61/639,452 | 2012-04-27 | ||
| PCT/US2012/066205 WO2013078271A1 (en) | 2011-11-21 | 2012-11-21 | Method of treatment of tumors that are resistant to egfr therapies by egfr antibody cytotoxic agent conjugate |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20140105765A true KR20140105765A (ko) | 2014-09-02 |
Family
ID=48470279
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020147016745A KR20140105765A (ko) | 2011-11-21 | 2012-11-21 | EGfr 항체 세포독성제 접합체에 의한 EGfr 치료에 내성을 나타내는 종양의 치료 방법 |
Country Status (16)
| Country | Link |
|---|---|
| US (1) | US9233171B2 (ko) |
| EP (1) | EP2794010A4 (ko) |
| JP (1) | JP2014533954A (ko) |
| KR (1) | KR20140105765A (ko) |
| CN (1) | CN104066481A (ko) |
| AU (1) | AU2012340686A1 (ko) |
| BR (1) | BR112014012155A2 (ko) |
| CA (1) | CA2856411A1 (ko) |
| CL (1) | CL2014001282A1 (ko) |
| HK (1) | HK1201772A1 (ko) |
| IL (1) | IL232666A0 (ko) |
| MX (1) | MX2014006087A (ko) |
| PH (1) | PH12014501119A1 (ko) |
| RU (1) | RU2014121820A (ko) |
| SG (1) | SG11201402343SA (ko) |
| WO (1) | WO2013078271A1 (ko) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20160069070A (ko) * | 2014-12-05 | 2016-06-16 | 사회복지법인 삼성생명공익재단 | 교모세포종에서 표피 성장인자 수용체 억제제의 치료 효과를 예측하는 방법 |
Families Citing this family (16)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EA201390472A1 (ru) | 2010-10-29 | 2014-02-28 | Иммьюноджен, Инк. | Новые молекулы, связывающиеся с egfr, и их иммуноконъюгаты |
| AU2011320318B9 (en) | 2010-10-29 | 2015-11-19 | Immunogen, Inc. | Non-antagonistic EGFR-binding molecules and immunoconjugates thereof |
| CA2825255C (en) | 2011-01-24 | 2021-05-18 | Ym Biosciences Inc. | Antibodies selective for cells presenting egfr at high density |
| CN104066481A (zh) | 2011-11-21 | 2014-09-24 | 伊缪诺金公司 | 利用egfr抗体细胞毒性剂缀合物治疗抗egfr疗法的肿瘤的方法 |
| ES2809501T3 (es) * | 2013-07-05 | 2021-03-04 | Formation Biologics Inc | Conjugados de anticuerpo de EGFR |
| EP3044593A4 (en) * | 2013-09-09 | 2017-05-17 | Triact Therapeutics, Inc. | Cancer therapy |
| WO2015073721A1 (en) | 2013-11-13 | 2015-05-21 | Zymeworks Inc. | Monovalent antigen binding constructs targeting egfr and/or her2 and uses thereof |
| CN113425727A (zh) * | 2014-02-04 | 2021-09-24 | 安斯泰来制药株式会社 | 以二氨基杂环甲酰胺化合物为有效成分的医药组合物 |
| KR20160138177A (ko) * | 2014-03-21 | 2016-12-02 | 애브비 인코포레이티드 | 항-egfr 항체 및 항체 약물 접합체 |
| MA42561A (fr) | 2014-09-02 | 2018-04-25 | Immunogen Inc | Procédés de formulation de compositions de conjugués anticorps-médicament |
| MA40968A (fr) * | 2014-10-31 | 2017-10-04 | Formation Biologics Inc | Polythérapie à base d'anticorps anti-egfr |
| US20180117053A1 (en) * | 2015-05-27 | 2018-05-03 | Metastat, Inc. | The Method of Use for Inhibitors of Epidermal Growth Factor Receptor Variants II, III and VI |
| US10426842B2 (en) | 2015-07-15 | 2019-10-01 | The Curators Of The University Of Missouri | Targeted nanoparticle conjugate and method for co-delivery of siRNA and drug |
| KR20190138305A (ko) * | 2017-03-31 | 2019-12-12 | 더 큐레이터스 오브 더 유니버시티 오브 미주리 | 약물-내성 종양 치료용 조성물 및 이의 사용 방법 |
| CN107496933B (zh) * | 2017-08-21 | 2019-12-24 | 山东新华制药股份有限公司 | 一种用于治疗胰腺癌的抗体药物偶联物及其制备方法 |
| KR20230106506A (ko) * | 2022-01-03 | 2023-07-13 | 한국생명공학연구원 | Cda 억제제를 포함하는 alk 저해제 내성 비소세포폐암 치료용 조성물 |
Family Cites Families (82)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CU22545A1 (es) | 1994-11-18 | 1999-03-31 | Centro Inmunologia Molecular | Obtención de un anticuerpo quimérico y humanizado contra el receptor del factor de crecimiento epidérmico para uso diagnóstico y terapéutico |
| US4307016A (en) | 1978-03-24 | 1981-12-22 | Takeda Chemical Industries, Ltd. | Demethyl maytansinoids |
| US4256746A (en) | 1978-11-14 | 1981-03-17 | Takeda Chemical Industries | Dechloromaytansinoids, their pharmaceutical compositions and method of use |
| JPS55102583A (en) | 1979-01-31 | 1980-08-05 | Takeda Chem Ind Ltd | 20-acyloxy-20-demethylmaytansinoid compound |
| JPS55162791A (en) | 1979-06-05 | 1980-12-18 | Takeda Chem Ind Ltd | Antibiotic c-15003pnd and its preparation |
| JPS5645483A (en) | 1979-09-19 | 1981-04-25 | Takeda Chem Ind Ltd | C-15003phm and its preparation |
| EP0028683A1 (en) | 1979-09-21 | 1981-05-20 | Takeda Chemical Industries, Ltd. | Antibiotic C-15003 PHO and production thereof |
| JPS5645485A (en) | 1979-09-21 | 1981-04-25 | Takeda Chem Ind Ltd | Production of c-15003pnd |
| WO1982001188A1 (en) | 1980-10-08 | 1982-04-15 | Takeda Chemical Industries Ltd | 4,5-deoxymaytansinoide compounds and process for preparing same |
| US4450254A (en) | 1980-11-03 | 1984-05-22 | Standard Oil Company | Impact improvement of high nitrile resins |
| US4313946A (en) | 1981-01-27 | 1982-02-02 | The United States Of America As Represented By The Secretary Of Agriculture | Chemotherapeutically active maytansinoids from Trewia nudiflora |
| US4315929A (en) | 1981-01-27 | 1982-02-16 | The United States Of America As Represented By The Secretary Of Agriculture | Method of controlling the European corn borer with trewiasine |
| US4563304A (en) | 1981-02-27 | 1986-01-07 | Pharmacia Fine Chemicals Ab | Pyridine compounds modifying proteins, polypeptides or polysaccharides |
| JPS57192389A (en) | 1981-05-20 | 1982-11-26 | Takeda Chem Ind Ltd | Novel maytansinoid |
| US4943533A (en) | 1984-03-01 | 1990-07-24 | The Regents Of The University Of California | Hybrid cell lines that produce monoclonal antibodies to epidermal growth factor receptor |
| US5470571A (en) | 1988-01-27 | 1995-11-28 | The Wistar Institute | Method of treating human EGF receptor-expressing gliomas using radiolabeled EGF receptor-specific MAB 425 |
| AU4128089A (en) | 1988-09-15 | 1990-03-22 | Rorer International (Overseas) Inc. | Monoclonal antibodies specific to human epidermal growth factor receptor and therapeutic methods employing same |
| US5981725A (en) | 1989-09-08 | 1999-11-09 | The Johns Hopkins Univiersity | Structural alterations of the EGF receptor gene in human tumors |
| AU639726B2 (en) | 1989-09-08 | 1993-08-05 | Duke University | Structural alterations of the egf receptor gene in human gliomas |
| US5208020A (en) | 1989-10-25 | 1993-05-04 | Immunogen Inc. | Cytotoxic agents comprising maytansinoids and their therapeutic use |
| US5459061A (en) | 1990-01-26 | 1995-10-17 | W. Alton Jones Cell Science Center, Inc. | Hybridomas producing monoclonal antibodies which specifically bind to continuous epitope on the human EGF receptor and compete with EGF for binding to the EGF receptor |
| DK0564531T3 (da) | 1990-12-03 | 1998-09-28 | Genentech Inc | Berigelsesfremgangsmåde for variantproteiner med ændrede bindingsegenskaber |
| CZ282603B6 (cs) | 1991-03-06 | 1997-08-13 | Merck Patent Gesellschaft Mit Beschränkter Haftun G | Humanizované a chimerické monoklonální protilátky |
| US5795965A (en) | 1991-04-25 | 1998-08-18 | Chugai Seiyaku Kabushiki Kaisha | Reshaped human to human interleukin-6 receptor |
| EP0563475B1 (en) | 1992-03-25 | 2000-05-31 | Immunogen Inc | Cell binding agent conjugates of derivatives of CC-1065 |
| US5756291A (en) | 1992-08-21 | 1998-05-26 | Gilead Sciences, Inc. | Aptamers specific for biomolecules and methods of making |
| DE69428764T2 (de) | 1993-12-24 | 2002-06-20 | Merck Patent Gmbh | Immunokonjugate |
| DE69529649T2 (de) | 1994-03-17 | 2003-12-18 | Merck Patent Gmbh | Anti-egfr einkettige fvs und anti-egfr antikoerper |
| US5731168A (en) | 1995-03-01 | 1998-03-24 | Genentech, Inc. | Method for making heteromultimeric polypeptides |
| US5942602A (en) | 1997-02-13 | 1999-08-24 | Schering Aktiengessellschaft | Growth factor receptor antibodies |
| US6235883B1 (en) | 1997-05-05 | 2001-05-22 | Abgenix, Inc. | Human monoclonal antibodies to epidermal growth factor receptor |
| EP1033406A4 (en) | 1997-10-27 | 2005-03-09 | Sumitomo Electric Industries | INDUCER FOR THE PRODUCTION OF ANTIGEN-SPECIFIC ANTIBODY, EXPRESSION VECTOR CONTAINING THE GENE REQUIRED THEREFOR, AND METHOD FOR INDUCING THE PRODUCTION OF THE ANTIGEN-SPECIFIC ANTIBODY |
| US20040031072A1 (en) | 1999-05-06 | 2004-02-12 | La Rosa Thomas J. | Soy nucleic acid molecules and other molecules associated with transcription plants and uses thereof for plant improvement |
| AU775373B2 (en) | 1999-10-01 | 2004-07-29 | Immunogen, Inc. | Compositions and methods for treating cancer using immunoconjugates and chemotherapeutic agents |
| US7303749B1 (en) | 1999-10-01 | 2007-12-04 | Immunogen Inc. | Compositions and methods for treating cancer using immunoconjugates and chemotherapeutic agents |
| ATE349438T1 (de) | 1999-11-24 | 2007-01-15 | Immunogen Inc | Cytotoxische wirkstoffe enthaltend taxane und deren therapeutische anwendung |
| AU2001239857B9 (en) * | 2000-02-25 | 2006-07-27 | Duke University | Anti-EGFRvIII SCFVS with improved cytotoxicity and yield, immunotoxins based thereon, and methods of use thereof |
| US7097840B2 (en) | 2000-03-16 | 2006-08-29 | Genentech, Inc. | Methods of treatment using anti-ErbB antibody-maytansinoid conjugates |
| US6333410B1 (en) | 2000-08-18 | 2001-12-25 | Immunogen, Inc. | Process for the preparation and purification of thiol-containing maytansinoids |
| KR20030074839A (ko) | 2001-02-19 | 2003-09-19 | 메르크 파텐트 게엠베하 | 감소된 면역원성을 갖는 개질 항-egfr 항체 |
| CA2447139C (en) | 2001-05-11 | 2013-11-19 | Ludwig Institute For Cancer Research | Specific binding proteins and uses thereof |
| US6441163B1 (en) | 2001-05-31 | 2002-08-27 | Immunogen, Inc. | Methods for preparation of cytotoxic conjugates of maytansinoids and cell binding agents |
| US7595378B2 (en) | 2001-06-13 | 2009-09-29 | Genmab A/S | Human monoclonal antibodies to epidermal growth factor receptor (EGFR) |
| CN1966525A (zh) | 2001-06-13 | 2007-05-23 | 根马布股份公司 | 表皮生长因子受体(egfr)的人单克隆抗体 |
| GB0122914D0 (en) | 2001-09-22 | 2001-11-14 | Univ Nottingham | Modulation of stat activity |
| US6716821B2 (en) | 2001-12-21 | 2004-04-06 | Immunogen Inc. | Cytotoxic agents bearing a reactive polyethylene glycol moiety, cytotoxic conjugates comprising polyethylene glycol linking groups, and methods of making and using the same |
| ES2702942T3 (es) | 2003-04-17 | 2019-03-06 | Alnylam Pharmaceuticals Inc | Agentes de ARNi modificados |
| US8088387B2 (en) | 2003-10-10 | 2012-01-03 | Immunogen Inc. | Method of targeting specific cell populations using cell-binding agent maytansinoid conjugates linked via a non-cleavable linker, said conjugates, and methods of making said conjugates |
| US7276497B2 (en) | 2003-05-20 | 2007-10-02 | Immunogen Inc. | Cytotoxic agents comprising new maytansinoids |
| KR101531400B1 (ko) | 2003-06-27 | 2015-06-26 | 암젠 프레몬트 인코포레이티드 | 상피 성장 인자 수용체의 결실 돌연변이체 지향 항체 및 그용도 |
| CN1816351A (zh) * | 2003-06-27 | 2006-08-09 | 艾伯吉尼斯公司 | 针对表皮生长因子受体的缺失突变体的抗体及其使用 |
| TWI333977B (en) | 2003-09-18 | 2010-12-01 | Symphogen As | Method for linking sequences of interest |
| EP1697741A4 (en) | 2003-12-04 | 2008-02-13 | Xencor Inc | PROCESS FOR PRODUCING PROTEIN VARIANTS WITH INCREASED HOST STRUCTURE CONTENT AND COMPOSITIONS THEREOF |
| ATE501173T1 (de) | 2003-12-04 | 2011-03-15 | Abbott Biotherapeutics Corp | Anti-ip-10-antikörper |
| RU2362780C2 (ru) | 2003-12-22 | 2009-07-27 | Глаксо Груп Лимитед | Nogo-a-нейтрализующие иммуноглобулины для лечения неврологических заболеваний |
| EP1735348B1 (en) | 2004-03-19 | 2012-06-20 | Imclone LLC | Human anti-epidermal growth factor receptor antibody |
| CN104774931B (zh) | 2004-03-31 | 2017-11-10 | 综合医院公司 | 测定癌症对表皮生长因子受体靶向性治疗反应性的方法 |
| BRPI0510883B8 (pt) | 2004-06-01 | 2021-05-25 | Genentech Inc | composto conjugado de droga e anticorpo, composição farmacêutica, método de fabricação de composto conjugado de droga e anticorpo e usos de uma formulação, de um conjugado de droga e anticorpo e um agente quimioterapêutico e de uma combinação |
| US20070009972A1 (en) | 2005-02-16 | 2007-01-11 | Ginger Chao | Epidermal growth factor receptor polypeptides and antibodies |
| MX2007012817A (es) | 2005-04-15 | 2007-12-12 | Immunogen Inc | Eliminacion de poblacion celular heterogenea o mezclada en tumores. |
| US8101183B2 (en) | 2005-05-06 | 2012-01-24 | Zymogentics, Inc. | Variable region sequences of IL-31 monoclonal antibodies |
| US20070213292A1 (en) | 2005-08-10 | 2007-09-13 | The Rockefeller University | Chemically modified oligonucleotides for use in modulating micro RNA and uses thereof |
| US20090252681A1 (en) | 2005-10-11 | 2009-10-08 | Ablynx N.V. | Nanobodies and Polypeptides Against EGFR and IGF-IR |
| CN101646690B (zh) | 2006-08-11 | 2013-10-23 | 默沙东公司 | 抗il-17a抗体 |
| US20090258442A1 (en) | 2006-08-31 | 2009-10-15 | Cell Signaling Technology, Inc. | Reagents for the detection of protein phosphorylation in carcinoma signaling pathways |
| CN104013956B (zh) * | 2007-01-25 | 2018-12-18 | 达娜-法勃肿瘤研究所公司 | 抗egfr抗体在治疗egfr突变体介导的疾病中的用途 |
| WO2008098145A1 (en) | 2007-02-07 | 2008-08-14 | University Of Washington | Methods for modulating antigen-specific b cell responses |
| CA2676049C (en) | 2007-03-01 | 2018-04-10 | Symphogen A/S | Recombinant anti-epidermal growth factor receptor antibody compositions |
| US7892777B2 (en) | 2007-07-17 | 2011-02-22 | The Regents Of The University Of Michigan | Methods for measuring whether a treatment affects RPTP-κ activity |
| US20110256142A1 (en) | 2007-09-06 | 2011-10-20 | Genmab A/S | Novel methods and antibodies for treating cancer |
| US20090269343A1 (en) * | 2008-04-11 | 2009-10-29 | Duke University | Dual Specific Immunotoxin for Brain Tumor Therapy |
| EP2276506A4 (en) | 2008-04-30 | 2014-05-07 | Immunogen Inc | EFFICIENT CONJUGATES AND HYDROPHILIC BINDER |
| US8236319B2 (en) | 2008-04-30 | 2012-08-07 | Immunogen, Inc. | Cross-linkers and their uses |
| WO2010009124A2 (en) | 2008-07-15 | 2010-01-21 | Genentech, Inc. | Anthracycline derivative conjugates, process for their preparation and their use as antitumor compounds |
| RU2540146C2 (ru) | 2008-08-29 | 2015-02-10 | Симфоген А/С | Композиции рекомбинантных антител против рецептора эпидермального фактора роста |
| US20110217302A1 (en) | 2008-10-10 | 2011-09-08 | Emergent Product Development Seattle, Llc | TCR Complex Immunotherapeutics |
| WO2010055950A1 (ja) | 2008-11-17 | 2010-05-20 | 財団法人ヒューマンサイエンス振興財団 | 癌間質の構成因子に対して特異的結合能を有する物質と抗腫瘍性化合物との複合体による新規の癌ターゲティング治療 |
| IN2012DN02780A (ko) * | 2009-10-06 | 2015-09-18 | Immunogen Inc | |
| CN103003424B (zh) | 2010-05-18 | 2015-05-13 | 株式会社医学生物学研究所 | 结合转化生长因子α且对Ras基因突变的癌具有增殖抑制活性的抗体 |
| AU2011320318B9 (en) | 2010-10-29 | 2015-11-19 | Immunogen, Inc. | Non-antagonistic EGFR-binding molecules and immunoconjugates thereof |
| EA201390472A1 (ru) | 2010-10-29 | 2014-02-28 | Иммьюноджен, Инк. | Новые молекулы, связывающиеся с egfr, и их иммуноконъюгаты |
| CN104066481A (zh) | 2011-11-21 | 2014-09-24 | 伊缪诺金公司 | 利用egfr抗体细胞毒性剂缀合物治疗抗egfr疗法的肿瘤的方法 |
-
2012
- 2012-11-21 CN CN201280056769.4A patent/CN104066481A/zh active Pending
- 2012-11-21 US US13/682,948 patent/US9233171B2/en not_active Expired - Fee Related
- 2012-11-21 CA CA2856411A patent/CA2856411A1/en not_active Abandoned
- 2012-11-21 JP JP2014542584A patent/JP2014533954A/ja active Pending
- 2012-11-21 WO PCT/US2012/066205 patent/WO2013078271A1/en active Application Filing
- 2012-11-21 RU RU2014121820/15A patent/RU2014121820A/ru not_active Application Discontinuation
- 2012-11-21 EP EP12850911.4A patent/EP2794010A4/en not_active Withdrawn
- 2012-11-21 BR BR112014012155A patent/BR112014012155A2/pt not_active IP Right Cessation
- 2012-11-21 MX MX2014006087A patent/MX2014006087A/es not_active Application Discontinuation
- 2012-11-21 KR KR1020147016745A patent/KR20140105765A/ko not_active Application Discontinuation
- 2012-11-21 SG SG11201402343SA patent/SG11201402343SA/en unknown
- 2012-11-21 AU AU2012340686A patent/AU2012340686A1/en not_active Abandoned
-
2014
- 2014-05-15 CL CL2014001282A patent/CL2014001282A1/es unknown
- 2014-05-18 IL IL232666A patent/IL232666A0/en unknown
- 2014-05-19 PH PH12014501119A patent/PH12014501119A1/en unknown
-
2015
- 2015-03-10 HK HK15102403.0A patent/HK1201772A1/xx unknown
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20160069070A (ko) * | 2014-12-05 | 2016-06-16 | 사회복지법인 삼성생명공익재단 | 교모세포종에서 표피 성장인자 수용체 억제제의 치료 효과를 예측하는 방법 |
Also Published As
| Publication number | Publication date |
|---|---|
| RU2014121820A (ru) | 2015-12-27 |
| EP2794010A1 (en) | 2014-10-29 |
| SG11201402343SA (en) | 2014-06-27 |
| PH12014501119A1 (en) | 2014-08-04 |
| WO2013078271A1 (en) | 2013-05-30 |
| HK1201772A1 (en) | 2015-09-11 |
| MX2014006087A (es) | 2014-08-01 |
| CL2014001282A1 (es) | 2014-11-14 |
| CA2856411A1 (en) | 2013-05-30 |
| AU2012340686A1 (en) | 2014-06-19 |
| US9233171B2 (en) | 2016-01-12 |
| US20130156796A1 (en) | 2013-06-20 |
| IL232666A0 (en) | 2014-07-31 |
| JP2014533954A (ja) | 2014-12-18 |
| BR112014012155A2 (pt) | 2017-05-30 |
| CN104066481A (zh) | 2014-09-24 |
| EP2794010A4 (en) | 2015-10-21 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US9233171B2 (en) | Method of treatment of tumors that are resistant to EGFR antibody therapies by EGFR antibody cytotoxic agent conjugate | |
| JP7428680B2 (ja) | 癌治療用のaxl特異的抗体-薬物コンジュゲート | |
| US20200405875A1 (en) | Ckit antibody drug conjugates | |
| JP7401126B2 (ja) | 抗cubドメイン含有タンパク質1(cdcp1)抗体、抗体薬物コンジュゲート、およびその使用方法 | |
| TWI839325B (zh) | 抗體藥物結合物 | |
| US9789203B2 (en) | cKIT antibody drug conjugates | |
| CN105399831A (zh) | 非拮抗性egfr结合分子及其免疫偶联物 | |
| CN110121507A (zh) | 抗sez6l2抗体和抗体药物缀合物 | |
| US20230001006A1 (en) | Amhrii-binding antibody drug conjugates and their use thereof in the treatment of cancers | |
| EP4161581A1 (en) | Bispecific antibody-drug conjugates targeting egfr and muc1 and uses thereof | |
| US20230192885A1 (en) | Anti-ly6h antibodies and antibody drug conjugates | |
| WO2021260583A1 (en) | Combination of antibody-drug conjugate and dna-pk inhibitor | |
| US20230256110A1 (en) | Combination of antibody-drug conjugate and atm inhibitor | |
| WO2023061457A1 (zh) | 抗体药物偶联物及其用途 | |
| TW202333800A (zh) | 抗體-藥物結合物及rasg12c抑制劑之組合 | |
| JP2024521789A (ja) | EGFRを標的にするFc抗原結合性フラグメント-薬物抱合体 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| WITN | Application deemed withdrawn, e.g. because no request for examination was filed or no examination fee was paid |