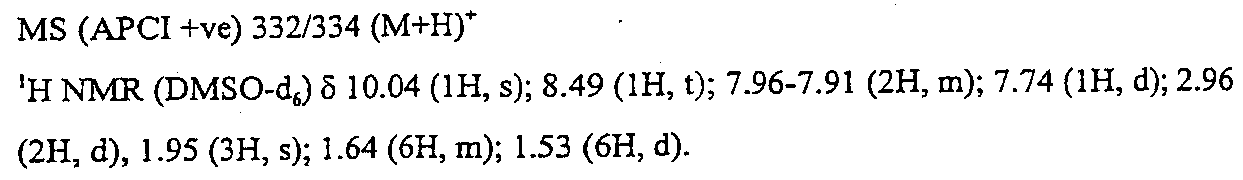KR20070012883A - 아다만탄 유도체를 함유하는 제약 조성물 - Google Patents
아다만탄 유도체를 함유하는 제약 조성물 Download PDFInfo
- Publication number
- KR20070012883A KR20070012883A KR1020077000596A KR20077000596A KR20070012883A KR 20070012883 A KR20070012883 A KR 20070012883A KR 1020077000596 A KR1020077000596 A KR 1020077000596A KR 20077000596 A KR20077000596 A KR 20077000596A KR 20070012883 A KR20070012883 A KR 20070012883A
- Authority
- KR
- South Korea
- Prior art keywords
- chloro
- tricyclo
- ylmethyl
- dec
- benzamide
- Prior art date
Links
- 0 *c(c(*)c1C(O)=O)ccc1I Chemical compound *c(c(*)c1C(O)=O)ccc1I 0.000 description 2
- DBWLIBCLDUEJQJ-UHFFFAOYSA-N CC(C)(CO)NCCCc(cc1)cc(C(NCC2(CC(CC3)C4)CC4C3CC2)=O)c1Cl Chemical compound CC(C)(CO)NCCCc(cc1)cc(C(NCC2(CC(CC3)C4)CC4C3CC2)=O)c1Cl DBWLIBCLDUEJQJ-UHFFFAOYSA-N 0.000 description 1
- OJXPXEPWQTZVAI-UHFFFAOYSA-N CC(COC)NCCCc(cc1)cc(C(NCC2(CC(C3)C4)CC4CC3C2)=O)c1Cl Chemical compound CC(COC)NCCCc(cc1)cc(C(NCC2(CC(C3)C4)CC4CC3C2)=O)c1Cl OJXPXEPWQTZVAI-UHFFFAOYSA-N 0.000 description 1
- DYSSYGMREMOBAZ-UHFFFAOYSA-N CCCCN(CC)CCCc(cc1)cc(C(NCC2(CC(C3)C4)CC4CC3C2)=O)c1Cl Chemical compound CCCCN(CC)CCCc(cc1)cc(C(NCC2(CC(C3)C4)CC4CC3C2)=O)c1Cl DYSSYGMREMOBAZ-UHFFFAOYSA-N 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C235/00—Carboxylic acid amides, the carbon skeleton of the acid part being further substituted by oxygen atoms
- C07C235/42—Carboxylic acid amides, the carbon skeleton of the acid part being further substituted by oxygen atoms having carbon atoms of carboxamide groups bound to carbon atoms of six-membered aromatic rings and singly-bound oxygen atoms bound to the same carbon skeleton
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C235/00—Carboxylic acid amides, the carbon skeleton of the acid part being further substituted by oxygen atoms
- C07C235/42—Carboxylic acid amides, the carbon skeleton of the acid part being further substituted by oxygen atoms having carbon atoms of carboxamide groups bound to carbon atoms of six-membered aromatic rings and singly-bound oxygen atoms bound to the same carbon skeleton
- C07C235/44—Carboxylic acid amides, the carbon skeleton of the acid part being further substituted by oxygen atoms having carbon atoms of carboxamide groups bound to carbon atoms of six-membered aromatic rings and singly-bound oxygen atoms bound to the same carbon skeleton with carbon atoms of carboxamide groups and singly-bound oxygen atoms bound to carbon atoms of the same non-condensed six-membered aromatic ring
- C07C235/46—Carboxylic acid amides, the carbon skeleton of the acid part being further substituted by oxygen atoms having carbon atoms of carboxamide groups bound to carbon atoms of six-membered aromatic rings and singly-bound oxygen atoms bound to the same carbon skeleton with carbon atoms of carboxamide groups and singly-bound oxygen atoms bound to carbon atoms of the same non-condensed six-membered aromatic ring having the nitrogen atoms of the carboxamide groups bound to hydrogen atoms or to acyclic carbon atoms
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/04—Drugs for disorders of the alimentary tract or the digestive system for ulcers, gastritis or reflux esophagitis, e.g. antacids, inhibitors of acid secretion, mucosal protectants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
- A61P11/06—Antiasthmatics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/12—Drugs for disorders of the urinary system of the kidneys
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
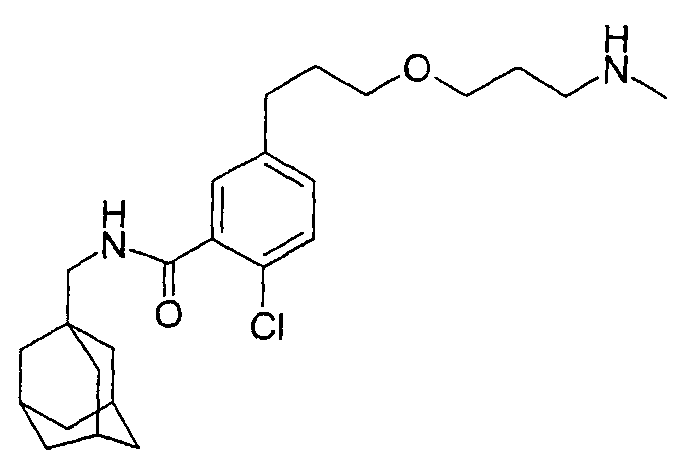
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/02—Drugs for dermatological disorders for treating wounds, ulcers, burns, scars, keloids, or the like
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/06—Antipsoriatics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/02—Drugs for skeletal disorders for joint disorders, e.g. arthritis, arthrosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/08—Drugs for skeletal disorders for bone diseases, e.g. rachitism, Paget's disease
- A61P19/10—Drugs for skeletal disorders for bone diseases, e.g. rachitism, Paget's disease for osteoporosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/28—Drugs for disorders of the nervous system for treating neurodegenerative disorders of the central nervous system, e.g. nootropic agents, cognition enhancers, drugs for treating Alzheimer's disease or other forms of dementia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/08—Drugs for disorders of the metabolism for glucose homeostasis
- A61P3/10—Drugs for disorders of the metabolism for glucose homeostasis for hyperglycaemia, e.g. antidiabetics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P33/00—Antiparasitic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/02—Antineoplastic agents specific for leukemia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/04—Antineoplastic agents specific for metastasis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/06—Immunosuppressants, e.g. drugs for graft rejection
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/08—Antiallergic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
- A61P7/02—Antithrombotic agents; Anticoagulants; Platelet aggregation inhibitors
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/08—Vasodilators for multiple indications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/14—Vasoprotectives; Antihaemorrhoidals; Drugs for varicose therapy; Capillary stabilisers
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C235/00—Carboxylic acid amides, the carbon skeleton of the acid part being further substituted by oxygen atoms
- C07C235/70—Carboxylic acid amides, the carbon skeleton of the acid part being further substituted by oxygen atoms having carbon atoms of carboxamide groups and doubly-bound oxygen atoms bound to the same carbon skeleton
- C07C235/84—Carboxylic acid amides, the carbon skeleton of the acid part being further substituted by oxygen atoms having carbon atoms of carboxamide groups and doubly-bound oxygen atoms bound to the same carbon skeleton with the carbon atom of at least one of the carboxamide groups bound to a carbon atom of a six-membered aromatic ring
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C237/00—Carboxylic acid amides, the carbon skeleton of the acid part being further substituted by amino groups
- C07C237/28—Carboxylic acid amides, the carbon skeleton of the acid part being further substituted by amino groups having the carbon atom of at least one of the carboxamide groups bound to a carbon atom of a non-condensed six-membered aromatic ring of the carbon skeleton
- C07C237/30—Carboxylic acid amides, the carbon skeleton of the acid part being further substituted by amino groups having the carbon atom of at least one of the carboxamide groups bound to a carbon atom of a non-condensed six-membered aromatic ring of the carbon skeleton having the nitrogen atom of the carboxamide group bound to hydrogen atoms or to acyclic carbon atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C323/00—Thiols, sulfides, hydropolysulfides or polysulfides substituted by halogen, oxygen or nitrogen atoms, or by sulfur atoms not being part of thio groups
- C07C323/23—Thiols, sulfides, hydropolysulfides or polysulfides substituted by halogen, oxygen or nitrogen atoms, or by sulfur atoms not being part of thio groups containing thio groups and nitrogen atoms, not being part of nitro or nitroso groups, bound to the same carbon skeleton
- C07C323/24—Thiols, sulfides, hydropolysulfides or polysulfides substituted by halogen, oxygen or nitrogen atoms, or by sulfur atoms not being part of thio groups containing thio groups and nitrogen atoms, not being part of nitro or nitroso groups, bound to the same carbon skeleton having the sulfur atoms of the thio groups bound to acyclic carbon atoms of the carbon skeleton
- C07C323/25—Thiols, sulfides, hydropolysulfides or polysulfides substituted by halogen, oxygen or nitrogen atoms, or by sulfur atoms not being part of thio groups containing thio groups and nitrogen atoms, not being part of nitro or nitroso groups, bound to the same carbon skeleton having the sulfur atoms of the thio groups bound to acyclic carbon atoms of the carbon skeleton the carbon skeleton being acyclic and saturated
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D231/00—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings
- C07D231/02—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings not condensed with other rings
- C07D231/10—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings not condensed with other rings having two or three double bonds between ring members or between ring members and non-ring members
- C07D231/12—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings not condensed with other rings having two or three double bonds between ring members or between ring members and non-ring members with only hydrogen atoms, hydrocarbon or substituted hydrocarbon radicals, directly attached to ring carbon atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D233/00—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings
- C07D233/54—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings having two double bonds between ring members or between ring members and non-ring members
- C07D233/56—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings having two double bonds between ring members or between ring members and non-ring members with only hydrogen atoms or radicals containing only hydrogen and carbon atoms, attached to ring carbon atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D233/00—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings
- C07D233/54—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings having two double bonds between ring members or between ring members and non-ring members
- C07D233/56—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings having two double bonds between ring members or between ring members and non-ring members with only hydrogen atoms or radicals containing only hydrogen and carbon atoms, attached to ring carbon atoms
- C07D233/61—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings having two double bonds between ring members or between ring members and non-ring members with only hydrogen atoms or radicals containing only hydrogen and carbon atoms, attached to ring carbon atoms with hydrocarbon radicals, substituted by nitrogen atoms not forming part of a nitro radical, attached to ring nitrogen atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D233/00—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings
- C07D233/54—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings having two double bonds between ring members or between ring members and non-ring members
- C07D233/64—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings having two double bonds between ring members or between ring members and non-ring members with substituted hydrocarbon radicals attached to ring carbon atoms, e.g. histidine
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D249/00—Heterocyclic compounds containing five-membered rings having three nitrogen atoms as the only ring hetero atoms
- C07D249/02—Heterocyclic compounds containing five-membered rings having three nitrogen atoms as the only ring hetero atoms not condensed with other rings
- C07D249/08—1,2,4-Triazoles; Hydrogenated 1,2,4-triazoles
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C2601/00—Systems containing only non-condensed rings
- C07C2601/02—Systems containing only non-condensed rings with a three-membered ring
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C2601/00—Systems containing only non-condensed rings
- C07C2601/06—Systems containing only non-condensed rings with a five-membered ring
- C07C2601/08—Systems containing only non-condensed rings with a five-membered ring the ring being saturated
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C2601/00—Systems containing only non-condensed rings
- C07C2601/12—Systems containing only non-condensed rings with a six-membered ring
- C07C2601/14—The ring being saturated
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C2603/00—Systems containing at least three condensed rings
- C07C2603/56—Ring systems containing bridged rings
- C07C2603/58—Ring systems containing bridged rings containing three rings
- C07C2603/70—Ring systems containing bridged rings containing three rings containing only six-membered rings
- C07C2603/74—Adamantanes
Abstract
Description
본 발명은 아다만탄 유도체, 그의 제조 방법, 그를 함유하는 제약 조성물, 상기 제약 조성물의 제조 방법 및 치료에 있어서 그의 용도에 관한 것이다.
리간드에 의해 개폐되는 이온 채널인 P2X7 수용체 (P2Z 수용체로 이미 공지되어 있음)는 다양한 세포 유형, 주로 염증/면역 과정에 관련된 것으로 공지된 세포, 특히 대식구, 비만 세포 및 림프구 (T 및 B) 상에 존재한다. 세포외 뉴클레오티드, 특히 아데노신 트리포스페이트에 의한 P2X7 수용체의 활성화는 인터루킨-1β(IL-1β)의 분비 및 거세포 형성 (대식세포/미세교세포), 탈과립 (비만 세포) 및 L-셀렉틴 탈락 (림프구)을 일으킨다. 또한, P2X7 수용체는 항원 제시 세포 (APC), 각질세포, 타액 선포 세포(이하선 세포), 간(肝)세포, 적혈구, 적백혈병 세포, 단핵 세포, 섬유아세포, 골수 세포, 신경 세포 및 신(腎)혈관간(間) 세포에 위치한다.
염증, 면역 또는 심혈관 질환의 치료, P2X7 수용체가 기능을 하는 병인학에 사용하기 위한 P2X7 수용체 길항제로서 효과적인 화합물을 제조하는 것이 바람직하다.
따라서, 본 발명은 하기 화학식 1의 화합물 또는 그의 제약상 허용되는 염 또는 용매화물을 제공한다.
상기 식에서,
D는 CH2 또는 CH2CH2, 바람직하게는 CH2를 나타내고,
E는 C(O)NH 또는 바람직하게는 NHC(O)를 나타내고,
R1 및 R2는 각각 독립적으로 수소, 할로겐 (예를 들어, 불소, 염소, 브롬 또는 요오드), 아미노 (NH2), 니트로 (NO2), C1-C6 알킬 또는 트리플루오로메틸을 나타내지만, R1 및 R2 둘다가 동시에 수소를 나타낼 수 없고,
R3은 하기 화학식 2의 기를 나타내고,
R4는 C1-C6 알킬기를 나타내고,
X는 산소 또는 황 원자 또는 NR13, SO 또는 SO2 기를 나타내고,
R5는 수소를 나타내거나, 또는 R5는 C1-C6 알킬 또는 C2-C6 알케닐을 나타내는데, 각각은 할로겐, 히드록실, (디)-C1-C6-알킬아미노, -Y-R6,
, 및 질소, 산소 및 황으로부터 독립적으로 선택된 1 내지 4 개의 헤테로원자를 포함하는 5원 또는 6원 헤테로방향족 고리로부터 선택된 하나 이상의 치환기에 의해 임의로 치환될 수 있고, 여기서 헤테로방향족 고리는 할로겐, 히드록실 및 C1-C6 알킬로부터 선택된 하나 이상의 치환기에 의해 임의로 치환될 수 있으며,
Y는 산소 또는 황 원자 또는 NH, SO 또는 SO2 기를 나타내고,
R6은 -R7Z 기를 나타내는데, R7은 C2-C6 알킬기를 나타내고 Z는 -OH, -CO2H, -NR8R9, -C(O)NR10R11 또는 -N(R12)C(O)-C1-C6 알킬기를 나타내고, Y가 산소 또는 황 원자 또는 NH 기를 나타내는 경우에, R6은 추가로 수소, C1-C6 알킬, C1-C6 알킬카르보닐, C1-C6 알콕시카르보닐, -C(O)NR14R15, -CH2OC(O)R16, -CH2OC(O)OR17 또는 -C(O)OCH2OR18을 나타내고,
R8, R9, R10, R11 및 R12는 각각 독립적으로 수소 원자 또는 C1-C6 알킬기를 나타내고,
R13은 수소, C3-C8 시클로알킬, C3-C8 시클로알킬메틸을 나타내거나, 또는 R13은 히드록실 및 C1-C6 알콕시로부터 선택된 하나 이상의 치환기에 의해 임의로 치환된 C1-C6 알킬기를 나타내고, 및
R14, R15, R16, R17 및 R18은 각각 독립적으로 C1-C6 알킬기를 나타내나, 단, E가 C(O)NH이고, X가 O, NH 또는 N(C1-C6 알킬)인 경우, R5는 수소 원자 또는 비치환된 C1-C6 알킬기외에 다른 것이다.
본원 명세서에서 달리 명시하지 않는 한, 알킬 치환기 또는 치환기 내의 알킬 잔기는 선형 또는 분지형일 수 있다. 본 발명에서, 6개 이하의 탄소 원자를 함유하는 알킬기 또는 잔기의 예로는 메틸, 에틸, n-프로필, 이소프로필, n-부틸, 이 소부틸, t-부틸, n-펜틸 및 n-헥실이 포함된다. C2-C6 알케닐기는 선형 또는 분지형일 수 있다. 디-C1-C6-알킬아미노기에서 알킬 잔기는 같거나 또는 다를 수 있다.
본 발명의 한 실시양태에서, E가 C(O)NH를 나타내는 경우, X는 S, SO 또는 SO2이다.
본 발명의 다른 실시양태에서, E가 NHC(O)를 나타내는 경우, X는 O 또는 NR13이다.
R1 및 R2는 각각 독립적으로 수소 또는 할로겐 원자, 또는 아미노, 니트로, C1-C4 알킬 또는 트리플루오로메틸 기를 나타내는 것이 바람직하나, R1 및 R2 둘다가 동시에 수소 원자를 나타낼 수는 없다.
R1 및 R2는 각각 독립적으로 수소, 염소 또는 브롬 원자, 또는 아미노, 니트로, C1-C3 알킬 또는 트리플루오로메틸 기를 나타내는 것이 더 바람직하나, R1 및 R2 둘다가 동시에 수소 원자를 나타낼 수는 없다.
R1 및 R2는 각각 독립적으로 수소 또는 염소 원자를 나타내는 것이 가장 바람직하나, R1 및 R2 둘다가 동시에 수소 원자를 나타낼 수는 없다.
R4는 C1-C6 알킬기, 예를 들어 CH2, (CH2)2, (CH2)3 또는 (CH2)4와 같은 선형 C1-C6 알킬기를 나타낸다.
X는 산소 원자 또는 특히, NR13 기를 나타내는 것이 바람직하다.
R5는 수소를 나타내거나, 또는 R5는 C1-C6 알킬 또는 C2-C6 알케닐, 예를 들어 에테닐 또는 -CH2CH=CH2를 나타내는데, 각각은 할로겐 (예를 들어 불소, 염소, 브롬 또는 요오드), 히드록실, (디)-C1-C6-알킬아미노 (예를 들어 메틸아미노, 에틸아미노, 디메틸아미노 또는 디에틸아미노), -Y-R6,
, 및 질소, 산소 및 황으로부터 독립적으로 선택된 1, 2, 3 또는 4 개의 헤테로원자를 포함하는 5원 또는 6원 헤테로방향족 고리로부터 선택된 하나 이상의 치환기, 예를 들어 1, 2, 또는 3 개의 치환기에 의해 임의로 치환될 수 있고, 여기서 헤테로방향족 고리는 할로겐 (예를 들어 불소, 염소, 브롬 또는 요오드), 히드록실 및 C1-C6 알킬, 바람직하게는 C1-C4 알킬, 예를 들어 이미다졸릴 (이미다졸-1-일 또는 이미다졸-4-일), 1-메틸이미다졸릴 (1-메틸이미다졸-4-일), 2,3,5-트리아졸릴 및 2,3,4,5-테트라졸릴로부터 선택된 하나 이상의 치환기, 예를 들어 1 또는 2 개의 치환기에 의해 임의로 치환될 수 있다.
바람직한 화합물은 R5가 임의로 치환된 C1-C6 알킬을 나타내는 화합물이다. 바람직한 임의의 치환기는 -Y-R6이다.
Y가 SO 또는 SO2를 나타내는 경우, R6은 -R7Z 기를 나타내는데, R7은 C2-C6 알킬기를 나타내고 Z는 -OH, -CO2H, -NR8R9, -C(O)NR10R11 또는 -N(R12)C(O)-C1-C6 알킬기를 나타낸다.
Y가 산소 또는 황 원자 또는 NH 기를 나타내는 경우, R6은 상기 정의된 -R7Z 기 (구체적으로 -(CH2)2OH 또는 -(CH2)3OH)를 나타낼 수 있거나 R6은 수소, C1-C6 알킬 (예를 들어, 메틸, 에틸, n-프로필, 이소프로필 또는 t-부틸), C1-C6 알킬카르보닐 (예를 들어, 메틸카르보닐, 에틸카르보닐, n-프로필카르보닐 또는 t-부틸카르보닐), C1-C6 알콕시카르보닐 (예를 들어, 메톡시카르보닐, 에톡시카르보닐, n-프로폭시카르보닐 또는 t-부톡시카르보닐), -C(O)NR14R15, -CH2OC(O)R16, -CH2OC(O)OR17 또는 -C(O)OCH2OR18을 나타낼 수 있다.
Y는 산소 또는 황 원자 또는 NH 기가 바람직하다.
본 발명의 한 실시양태에서, Y는 산소 또는 황 원자 또는 NH 기를 나타내고 R6은 -(CH2)2OH, -(CH2)3OH, 수소, 메틸, 이소프로필, 메틸카르보닐 또는 t-부틸카르 보닐을 나타낸다. 다른 실시양태에서, Y는 산소를 나타내고 R6은 수소를 나타낸다.
R8, R9, R10, R11 및 R12는 각각 독립적으로 수소 원자 또는 C1-C4 알킬기를 나타내는 것이 바람직하다.
R13은 수소, C3-C8, 바람직하게는 C3-C6, 시클로알킬, C3-C8 바람직하게는 C3-C6, 시클로알킬메틸을 나타내거나, 또는 R13은 히드록실 및 C1-C6 알콕시로부터 독립적으로 선택된 하나 이상의 치환기, 예를 들어 1, 2 또는 3개의 치환기에 의해 임의로 치환된 C1-C6 알킬기를 나타낸다. 바람직한 R13 기의 예는 수소, -(CH2)2OH, 메틸, 에틸, n-프로필, 이소프로필, n-부틸, n-펜틸, n-헥실, 시클로프로필, 시클로펜틸, 시클로헥실 및 시클로헥실메틸을 포함한다.
R14, R15, R16, R17 및 R18은 각각 독립적으로 C1-C6 또는 C1-C4 알킬기를 나타낸다.
본 발명의 바람직한 화합물은 하기의 화합물 및 그의 제약상 허용되는 염 및 용매화물을 포함한다:
2-클로로-5-[[2-(2-히드록시-에틸아미노)-에틸아미노]-메틸]-N-(트리시클로 [3.3.1.13,7]데크-1-일메틸)-벤즈아미드,
2-클로로-5-[[2-(2-히드록시에톡시)에틸아미노]메틸]-N-(트리시클로[3.3.1.1 3,7] 데크-1-일메틸)-벤즈아미드,
2-클로로-5-[(3-히드록시-2,2-디메틸프로필아미노)메틸]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드,
2-클로로-5-[(5-히드록시펜틸아미노)메틸]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드,
2-클로로-5-[[2-[(2-히드록시에틸티오)에틸아미노]메틸]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드,
2-클로로-5-[3-[(2-히드록시에틸)아미노]프로필]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드,
2-클로로-5-[3-[(3-히드록시프로필)아미노]프로필]-N-(트리시클로[3.3.1.13,7]-데크-1-일메틸)-벤즈아미드,
2-클로로-5-[3-(메틸아미노)프로필]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드,
2-클로로-5-[3-[(l-메틸에틸)아미노]프로필]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드,
5-[3-[(2-아미노-2-메틸프로필)아미노]프로필]-2-클로로-N-(트리시클로[3.3. 1.13,7]데크-1-일메틸)-벤즈아미드,
2-클로로-5-[3-[(4-히드록시부틸)아미노]프로필]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드,
2-클로로-5-[3-[(2-히드록시-2-메틸프로필)아미노]프로필]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드,
2-클로로-5-[3-[[2-(메틸아미노)에틸]아미노]프로필]-N-(트리시클로[3.3.1.13,7]데크-1- 일메틸)-벤즈아미드, 이염산염,
(S)-2-클로로-5-[3-[(2-히드록시프로필)아미노]프로필]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드, 염산염,
(R)-2-클로로-5-[3-[(2-히드록시프로필)아미노]프로필]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드, 염산염,
(R)-2-클로로-5-[3-[(2-히드록시-1-메틸에틸)아미노]프로필]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드, 염산염,
2-클로로-5-[3-[[2-히드록시-1-(히드록시메틸)-1-메틸에틸]아미노]프로필]-N (트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드,
5-[3-[[2-(아세틸아미노)에틸]아미노]프로필]-2-클로로-N-(트리시클로[3.3.1 .13,7]데크-1-일메틸)-벤즈아미드, 염산염,
2-클로로-5-[3-[[2-(디에틸아미노)에틸]아미노]프로필]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드, 이염산염,
2-클로로-5-[3-[(3-메톡시프로필)아미노]프로필]-N-(트리시클로 [3.3.1.13,7] 데크-1-일메틸)-벤즈아미드, 염산염,
2-클로로-5-[3-[(3-히드록시-3-메틸부틸)아미노]프로필]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드, 염산염,
2-클로로-5-[3-[(2-메톡시에틸)아미노]프로필]-N-(트리시클로[3.3.1.13,7]데크-1- 일메틸)-벤즈아미드, 염산염,
2-클로로-5-[[3-(메틸아미노)프로폭시]메틸]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드,
2-클로로-5-[[2-[(2-히드록시에틸)아미노]에톡시]메틸]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드, 아세트산염,
2-클로로-5-[[2-[(3-히드록시프로필)아미노]에톡시]메틸]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드, 아세트산염,
2-클로로-5-[[[3-[(1-메틸에틸)아미노]프로필]아미노]메틸]-N-(트리시클로[3 .3.1.13,7]데크-1-일메틸)-벤즈아미드,
5-[[(3-아미노프로필)아미노]메틸]-2-클로로-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드,
2-클로로-5-[[[2-[(1-메틸에틸)아미노]에틸]아미노]메틸]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드,
3-[[3-[4-클로로-3-[[(트리시클로[3.3.1.13,7]데크-1-일메틸)아미노]카르보닐]페닐]프로필]아미노]프로판산, 2,2-디메틸프로필 에스테르, 트리플루오로아세트산염,
5-(2-아미노에틸)-2-클로로-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드,
2-클로로-5-[3-[(2-히드록시에틸)펜틸아미노]프로필]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드,
2-클로로-5-[3-(메틸-2-프로페닐아미노)프로필]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드,
2-클로로-5-[3-[[2-(디메틸아미노)에틸]메틸아미노]프로필]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드,
5-[3-(부틸에틸아미노)프로필]-2-클로로-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드,
2-클로로-5-[3-(메틸펜틸아미노)프로필]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드,
2-클로로-5-[3-[[2-(디에틸아미노)에틸]에틸아미노]프로필]-N-(트리시클로 [3.3.1.13,7]데크-1-일메틸)-벤즈아미드,
2-클로로-5-[3-[(2-히드록시에틸)메틸아미노]프로필]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드,
2-클로로-5-[3-(디프로필아미노)프로필]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드,
2-클로로-5-[3-[(2-히드록시에틸)(1-메틸에틸)아미노]프로필]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드,
5-[3-[부틸(2-히드록시에틸)아미노]프로필]-2-클로로-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드,
2-클로로-5-[3-(디에틸아미노)프로필]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드,
2-클로로-5-[3-(디메틸아미노)프로필]-N-(트리시클로[3.3.1.13.7]데크-1-일메틸)-벤즈아미드,
5-[3-(부틸메틸아미노)프로필]-2-클로로-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드,
2-클로로-5-[3-[(2-히드록시에틸)프로필아미노]프로필]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드,
2-클로로-5-[3-[에틸(2-히드록시에틸)아미노]프로필]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드,
2-클로로-5-[3-(디부틸아미노)프로필]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드,
2-클로로-5-[3-(에틸프로필아미노)프로필]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드,
2-클로로-5-[3-[메틸(l-메틸에틸)아미노]프로필]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드,
2-클로로-5[3-[[3-(디메틸아미노)프로필]메틸아미노]프로필]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드,
2-클로로-5-[3-[시클로헥실(2-히드록시에틸)아미노]프로필]-N-(트리시클로[3 .3.1.13,7]데크-1-일메틸)-벤즈아미드,
2-클로로-5-[3-(시클로헥실메틸아미노)프로필]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드,
2-클로로-5-[3-(시클로헥실아미노)프로필]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드,
2-클로로-5-[3-[[l-(히드록시메틸)-2,2-디메틸프로필]아미노]프로필]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드,
2-클로로-5-[3-(시클로프로필아미노)프로필]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드,
2-클로로-5-[3-[[2-(디메틸아미노)에틸]아미노]프로필]-N-(트리시클로[3.3.1.13.7]데크-l-일메틸)-벤즈아미드,
2-클로로-5-[3-[(3-히드록시-2,2-디메틸프로필)아미노]프로필]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드,
2-클로로-5-[3-[(1,1-디메틸에틸)아미노]프로필]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드,
2-클로로-5[3-[[3-(디메틸아미노)프로필]아미노]프로필]-N-(트리시클로[3.3. 1.13,7]데크-1-일메틸)-벤즈아미드,
2-클로로-5-[3-(시클로펜틸아미노)프로필]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드,
2-클로로-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-5-[3-[(1,2,2-트리메틸프로필)아미노]프로필]-벤즈아미드,
5-[3-(부틸아미노)프로필]-2-클로로-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드,
2-클로로-5-[3-[[1-(히드록시메틸)-2-메틸프로필]아미노]프로필]-N-(트리시클로[3.3.1.13,7]데크-l-일메틸)-벤즈아미드,
2-클로로-5-[3-[(1-메틸프로필)아미노]프로필]-N-(트리시클로 [3.3.1.13,7]데크-1-일메틸)-벤즈아미드,
2-클로로-5-[3-[[2-(메틸티오)에틸]아미노]프로필]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드,
2-클로로-5-[3-[(2-히드록시-1,1-디메틸에틸)아미노]프로필]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드,
2-클로로-5-[3-[(시클로헥실메틸)아미노]프로필]-N-(트리시클로[3.3.1.13,7] 데크-1- 일메틸)-벤즈아미드,
2-클로로-5-[3-(2-프로페닐아미노)프로필]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드,
2-클로로-5-[3-[(2-플루오로에틸)아미노]프로필]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드,
2-클로로-5-[3-[(2-메톡시-1-메틸에틸)아미노]프로필]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드,
2-클로로-5-[3-[3-(메틸아미노)프로폭시]프로필]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드, 이염산염,
5-[[[(1-아미노시클로프로필)메틸](2-히드록시에틸)아미노]메틸]-2-클로로-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드,
5-[[(2-히드록시에틸)[2-(메틸아미노)에틸]아미노]메틸]-2-메틸-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드,
2-클로로-5-[3-[[2-(1-메틸-1H-이미다졸-4-일]에틸]아미노]프로필]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드,
2-클로로-5-[3-[[2-(1H-이미다졸-4-일)에틸]아미노]프로필]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드,
2-클로로-5-[3-[[3-(1H-이미다졸-1-일)프로필]아미노]프로필]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드.
본 발명은 하기의 단계를 포함하는 상기 정의된 화학식 1의 화합물의 제조 방법을 추가로 제공한다:
(a) X가 산소 또는 황 원자 또는 NR13 기를 나타내는 경우, 하기 화학식 3의 화합물을 임의로, 적합한 은 염 존재하에 하기 화학식 4의 화합물과 반응시키는 단계,
(b) X가 SO 또는 SO2를 나타내는 경우, X가 황원자를 나타내는 화학식 1의 상응하는 화합물을 적절한 산화제와 반응시키는 단계, 또는
(c) X가 NR13 기를 나타내는 경우, 하기 화학식 5의 화합물을 나트륨 트리아세톡시보로히드리드과 같은 환원제 존재하에 하기 화학식 6의 화합물과 반응시키는 단계,
및 임의로 (a), (b) 또는 (c) 단계 후에, 수득된 화학식 1의 화합물을 그의 제약상 허용되는 염 또는 용매화물로 전환하는 단계를 포함하는 화학식 1의 화합물의 제조 방법:
상기 식에서,
L1은 이탈기, 예를 들어 할로겐 원자 또는 트리플루오로메탄술포네이트 기를 나타내고, X'는 산소 또는 황 원자 또는 NR13 기를 나타내고, R20은 결합 또는 C1-C5 알킬기를 나타내고, 및
D, E, R1, R2, R4, R5 및 R13은 화학식 1에 정의된 바와 같다.
본 발명의 방법은 용매, 예를 들어 디클로로메탄, 1,2-디클로로에탄 또는 테트라히드로푸란과 같은 유기 용매 중에서, 예를 들어 0 내지 200℃, 바람직하게는 0 내지 150℃ 범위의 온도에서 용이하게 수행할 수 있다. 상기 (b) 단계에서 사용된 산화제는, 예를 들어 3-클로로퍼옥시벤조산 또는 등록상표 "OXONE"으로 시판되는 칼륨 퍼옥시모노술페이트일 수 있다.
R20이 결합을 나타내는 화학식 5의 화합물은 하기 화학식 7의 화합물을 t-부틸리튬과 같은 염기와 반응시킨 후, 디메틸포름아미드와 같은 포르밀화제와 반응시킴으로써 제조할 수 있다.
상기 식에서,
Hal은 브롬과 같은 할로겐 원자를 나타내고 D, E, R1 및 R2는 화학식 1에 정의된 바와 같다.
화학식 7의 화합물은 하기 화학식 8의 화합물을 하기 화학식 9의 화합물과 반응시킴으로써 제조할 수 있다.
상기 식에서,
R25는 NH2 또는 CO2H를 나타내고,
D는 화학식 1에 정의된 바와 같고,
R30은 CO2H 또는 NH2를 나타내고, 및
R1, R2 및 Hal은 화학식 7에 정의된 바와 같다.
R20이 C1-C5 알킬기를 나타내는 화학식 5의 화합물은, 예를 들어 R20이 결합을 나타내는 상응하는 화학식 5의 화합물을 염기 존재하에서 (메톡시메틸)디페닐포스핀옥시드와 반응 시키거나 또는 하기 화학식 10의 화합물과 반응시킨 후에, 수소화시킴으로써 제조할 수 있다.
상기 식에서,
n은 0, 1, 2 또는 3이고, 및
R 및 R'은 독립적으로 C1-C6 알킬기를 나타낸다.
별법으로, R20이 C2-C5 알킬기를 나타내는 화학식 5의 화합물은 화학식 7의 화합물을 팔라듐 촉매 존재하에서, 알케놀, 예를 들어 2-프로펜-1-올(알릴 알코올), 부트-3-엔올, 펜트-4-엔올 또는 헥스-5-엔올과 반응시킨후, 임의로 수소화 반응 및 데스-마틴 퍼요오디난 (Dess-Martin periodinane) 제를 사용하는 산화 반응 (알케놀이 알릴 알코올인 경우 마지막 2 단계는 필요치 않음)에 의해 제조할 수 있다.
다른 별법으로, R20이 C2-C5 알킬기를 나타내는 화학식 5의 화합물은 화학식 7의 화합물을 팔라듐 아세테이트와 같은 팔라듐 촉매 존재하에서 알케노에이트 에스테르, 예를 들어 메틸 아크릴레이트 또는 에틸 아크릴레이트와 반응시킨후, 에스테르 기를 히드록실 기로 환원시키고, 산화제, 예를 들어 데스-마틴 퍼요오디난 제를 사용하여 알데히드로 산화시킴으로써 제조할 수 있다.
R5가 -Y-R6 기 (Y가 O, S 또는 NH이고 R6이 상기 정의된 -R7Z 기를 나타낸다) 로 치환된 C2-C6 알킬기를 나타내는 화학식 1의 화합물은 R5가 히드록실 기로 치환된 C2-C6 알킬기를 나타내는 화학식 1의 상응하는 화합물을 트리에틸아민과 같은 염기 존재하에서 메탄술포닐 클로리드와 같은 히드록실 활성화제와 반응시킨후, 화학식 HO-R7Z, HS-R7Z 또는 H2N-R7Z의 화합물과 반응시킴으로써 제조할 수 있다.
E가 NHC(O) 기를 나타내는 화학식 1의 화합물은 하기 화학식 11의 화합물을 1,1'-카르보닐이미다졸과 같은 커플링제의 존재하에, 아다만틸메틸아민 또는 아다만틸에틸아민과 반응시킴으로써 제조할 수 있다.
상기 식에서,
R1, R2 및 R3은 화학식 1에 정의된 바와 같고, X는 O, S 또는 NR13을 나타낸다.
E가 C(O)NH 기를 나타내는 화학식 1의 화합물은 하기 화학식 12의 화합물을 트리에틸아민과 같은 염기 존재하에서 아다만틸아세틸 클로리드 또는 아다만틸프로파노일 클로리드와 반응시킴으로써 제조할 수 있다.
상기 식에서,
R1, R2 및 R3은 화학식 1에 정의된 바와 같고, X는 O, S 또는 NR13을 나타낸다.
화학식 11의 화합물은 화학식 13의 화합물을 임의의 은 트리플루오로메탄술포네이트와 같은 은 염 존재하에서, 상기 정의된 화학식 4의 화합물과 반응시킴으로써 제조할 수 있다.
상기 식에서,
L2 는 할로겐 원자 또는 트리플로오로메탄술포네이트 기와 같은 이탈기를 나타내고 R1, R2 및 R4는 화학식 1에서 정의된 바와 같다.
화학식 12의 화합물은 하기 화학식 14의 화합물을 임의로 은 트리플루오로메탄술포네이트와 같은 은 염 존재하에서, 상기 정의된 화학식 4의 화합물과 반응시 킴으로써 제조할 수 있다.
상기 식에서,
L3은 할로겐 원자 또는 트리플로오로메탄술포네이트 기와 같은 이탈기를 나타내고 R1, R2 및 R4는 화학식 1에서 정의된 바와 같다.
특정 화학식 1의 화합물은 추가의 화학식 1의 화합물로 전환시킬 수 있다. 예를 들어, -Y-R6이 -OH를 나타내는 화학식 1의 화합물은 아실화제와 반응시킴으로써 Y가 O이고 및 R6이 C1-C6 알콕시카르보닐인 화합물로 전환시킬 수 있다. 추가로, X가 NR13을 나타내고 R13이 수소 이외의 것, 예를 들어 시클로헥실 기인 화학식 1의 화합물은 X가 NH를 나타내는 화학식 1의 화합물을 나트륨 트리아세톡시보로히드리드와 같은 환원제 존재하에서 시클로헥사논과 반응시킴으로써 제조할 수 있다.
화학식 3, 4, 6, 8, 9, 10, 13 및 14의 화합물 뿐만 아니라 화합물 HO-R7Z, HS-R7Z 및 H2N-R7Z는 구입 가능하거나, 문헌에 잘 공지되어 있거나 또는 공지된 기술을 사용하여 쉽게 제조할 수 있다.
본 발명의 제조 방법에서, 출발 시약 또는 중간 화합물에서 히드록실, 카르복실, 알데히드, 카르보닐 또는 아미노기와 같은 특정 관능기는 보호기로 보호할 필요가 있다는 것을 당업자는 인지할 것이다. 따라서, 화학식 1의 화합물의 제조는 특정 단계에서 하나 이상의 보호기의 제거를 수반할 수 있다.
관능기의 보호 및 탈보호는 문헌 ['Protective Groups in Organic Chemistry', edited by J.W.F. McOmie, Plenum Press(1973) 및 'Protective Groups in Organic Synthesis', 2nd edition, T. W. Greene 및 P. G. M. Wuts, Wiley-Interscience (1991)]에 기재되어 있다.
상기 화학식 1의 화합물은 그의 제약상 허용되는 염 또는 용매화물, 바람직하게는 염산염, 브롬화수소산염, 인산염, 아세테이트, 푸마레이트, 말리에이트, 타르트레이트, 시트레이트, 옥살레이트, 메탄술포네이트 또는 p-톨루엔술포네이트와 같은 산 부가염, 또는 나트륨염 또는 칼륨염과 같은 알칼리 금속염으로 전환시킬 수 있다.
화학식 1의 특정 화합물은 입체이성질체 형태로 존재할 수 있다. 본 발명은 화학식 1의 화합물의 모든 기하 이성질체 및 광학 이성질체 및 라세미체를 포함한 그의 혼합물을 포함하는 것으로 이해될 것이다. 호변 이성체 및 그의 혼합물 또한 본 발명의 양태를 형성한다.
본 발명의 화합물은 약리학적 활성을 갖는다는 것과 P2X7 수용체 활성화의 조절체로서의 용도를 갖는다는 이점이 있다. 따라서, 본 발명의 화합물은 류마티 스성 관절염, 골관절염, 건선, 알러지성 피부염, 천식, 기도과민반응, 만성 폐쇄성 폐질환 (COPD), 기관지염, 패혈성 쇼크, 사구체신염, 염증성 장질환, 크론병, 울혈성 결장염, 죽상경화증, 악성종양 세포의 성장 및 전이, 근모세포성 백혈병, 당뇨병, 신경 퇴행성 질환, 알츠하이머병, 수막염, 골다공증, 화상, 허혈성 심장 질환, 졸증, 말초혈관계 질환 및 정맥류의 치료 또는 예방에 사용하기 위한 제약으로서 바람직하다.
따라서, 본 발명은 치료에 사용하기 위해 본원에서 앞서 정의된 바와 같은 화학식 1의 화합물 또는 그의 제약상 허용되는 염 또는 용매화물을 제공한다.
또 다른 양태에서, 본 발명은 치료에 사용하기 위한 의약의 제조에 있어 본원에서 앞서 정의된 바와 같은 화학식 1의 화합물 또는 그의 제약상 허용되는 염 또는 용매화물의 용도를 제공한다.
본 명세서에서, 용어 "치료"는 또한 반대로 특별히 지시하지 않는 한 "예방"을 포함한다. 용어 "치료적" 및 "치료적으로"는 이에 따라 해석해야 한다.
예방은 문제의 질환 또는 상태의 사전 발작을 경험했거나, 또는 이와는 달리, 질환 및 상태의 위험이 증가된 것으로 생각되는 사람의 치료에 더 적절한 것으로 예상된다. 특정 질환 또는 상태 발병의 위험에 있는 사람은 일반적으로 질환 또는 상태의 가족력을 가지고 있는 사람, 또는 질환 또는 상태의 발병이 더 쉽다는 것이 유전학 테스트 또는 스크린 (screen)에 의해 확인된 사람을 포함한다.
본 발명은 상기 정의된 화학식 1의 화합물, 또는 그의 제약상 허용되는 염 또는 용매화물의 치료 유효량을 환자에게 투여하는 것을 포함하는 면역 억제, 예를 들어 류마티스성 관절염, 염증성 장질환, 죽상경화증, 건선, COPD 또는 기관지염 같은 폐질환, 또는 알츠하이머병 또는 졸증 같은 중추신경계 질환의 치료를 이룩하는 방법을 추가로 제공한다.
상기에 언급된 치료 용도를 위한 투여량은, 물론 사용하는 화합물, 투여 형태, 원하는 치료 및 지시된 질병에 따라 다르다. 이룩하는 면역 억제를 위한 화학식 1의 화합물의 1일 투여량은 0.001 mg/kg 내지 30 mg/kg 이다.
화학식 1의 화합물 및 그의 제약상 허용되는 염 및 용매화물을 그 자체로 사용할 수 있지만, 일반적으로 화학식 1의 화합물/염/용매화물 (활성 성분)이 제약상 허용되는 보조제, 희석제 또는 담체와 결합된 제약 조성물의 형태로 투여될 것이다. 투여 형태에 따라, 제약 조성물은 전체 조성물의 중량을 기준으로 바람직하게는 0.05 내지 99 중량%, 보다 바람직하게는 0.10 내지 70 중량%의 활성 성분, 및 1 내지 99.95 중량%, 보다 바람직하게는 30 내지 99.90 중량%의 제약상 허용되는 보조제, 희석제 또는 담체를 포함하는 것이 바람직할 것이다.
따라서, 본 발명은 또한 상기에 정의된 화학식 1의 화합물 또는 그의 제약상 허용되는 염 또는 용매화물을 제약상 허용되는 보조제, 희석제 또는 담체와 함께 포함하는 제약 조성물을 제공한다.
본 발명은 상기에 정의된 화학식 1의 화합물, 또는 그의 제약상 허용되는 염 또는 용매화물을 제약상 허용되는 보조제, 희석제 또는 담체와 혼합하는 것을 포함하는 본 발명의 제약 조성물의 제조 방법을 추가로 제공한다.
본 발명의 제약 조성물은 용액, 현탁액, 헵타플루오로알칸 에어로졸 및 건조 분말 제형의 형태로 국소적으로 (예, 폐 및(또는) 기도 또는 피부에) 또는 정제, 캡슐, 시럽, 분말 또는 과립의 형태의 경구 투여, 또는 용액 또는 현탁액의 형태로 비경구 투여, 또는 피하 투여 또는 좌약의 형태로 직장 투여 또는 경피 투여에 의해 전신적으로 투여할 수 있다.
이제, 본 발명은 하기의 예시적인 실시예를 참고로 하여 추가로 설명할 것이다.
실시예
1
2-클로로-5-[[2-(2-히드록시-에틸아미노)-에틸아미노]-메틸]-N-(트리시클로 [3.3.1.13,7]데크-1-일메틸)-벤즈아미드 이염산염
a) 5-브로모-2-클로로-N-(트리시클로 [3.3.1.13,7]데크-1-일메틸)-벤즈아미드
0 ℃에서 디클로로메탄 (25 ml) 중 5-브로모-2-클로로벤조산 (5.00 g)의 현탁액에 옥살릴 클로리드 (3.7 ml) 및 DMF (5 방울)을 첨가하였다. 생성된 혼합물을 질소 대기하에서 1 시간 동안 실온에서 교반시킨후, 감압하에서 농축시켜 고체를 수득하였다. 고체를 디클로로메탄 (20 ml)에 용해시키고 디클로로메탄 (20 ml) 중 1-아다만탄메틸아민 (3.36 g) 및 N,N-디이소프로필에틸아민 (5.55 ml)의 용액을 적가하였다. 생성된 용액을 질소 대기하에서 20 시간 동안 실온에서 교반시켰다. 생성된 혼합물을 디클로로메탄으로 희석시키고 물, 10 % 수성 탄산 칼륨, 10 % 수성 황산 수소 칼륨 및 포화된 염수로 세척하였다. 유기상을 황산 나트륨으로 건조시키고 감압하에서 농축하여 고체인 부제 화합물 (7.84 g)을 수득하였다.
MS (APCI+ve) 382/384/386 (M+H)+
b) 2-클로로-5-포르밀-N-(트리시클로 [3.3.1.13,7]데크-1-일메틸)-벤즈아미드
테트라히드로푸란 (150 ml) 중 5-브로모-2-클로로-N-(트리시클로 [3.3.1.13,7]데크-1-일메틸)-벤즈아미드 (3.25 g, 실시예 1a)의 용액을 질소 대기하에서 -78 ℃로 냉각하였다. 디에틸 에테르 (6.1 ml) 중 1.4 M 메틸리튬의 용액을 2 분 동안 상기 용액에 첨가하였다. 혼합물을 10 분 동안 -78 ℃에서 교반시킨후, 펜탄 (10.0 ml) 중 1.7 M tert-부틸리튬의 용액을 적가하였다. 혼합물을 10 분 동안 추가로 -78 ℃에서 교반시킨후, 디메틸포름아미드 (1.0 ml)를 첨가하였다. 생성된 용액을 30 분 동안 -78 ℃에서 교반시키고, 포화된 염화 암모늄 수용액 (100 ml)으로 켄칭 (quenching)시키고 에틸 아세테이트로 추출하였다. 추출물을 혼합하고 황산 나트륨으로 건조시키고, 여과하며, 여액을 감압하에서 농축시켜 고체인 부제 화합물 (2.76 g)을 수득하였다.
c) 2-클로로-5-[[2-(2-히드록시-에틸아미노)-에틸아미노]-메틸]-N-(트리시클로 [3.3.1.13,7]데크-1-일메틸)-벤즈아미드 이염산염
2-클로로-5-포르밀-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드 (0.244 g, 실시예 1b), 2-(2-아미노에틸아미노)-에탄올 (0.154 g), p-톨루엔술폰산 (0.005 g) 및 톨루엔 (30 ml)의 혼합물을 딘-스타크 (Dean-Stark) 조건하에서 3 시간 동안 함께 환류시키고, 냉각하고 감압하에서 농축하여 오일을 얻었다. 오일을 에탄올 (30 ml)에 용해시키고 질소 대기하에서 0 ℃로 냉각하였다. 고체 수소화 붕소 나트륨 (0.030 g)을 상기 오일에 조금씩 첨가하였고 혼합물을 30 분 동안 실온에서 교반시켰다. 혼합물을 감압하에서 농축하였고 잔류물을 실리카 겔 (7:3:0.3 디클로로메탄/메탄올/35 % 수성 암모니아로 용출) 칼럼 크로마토그래피로 정제하여 유리 염기를 얻었다. 유리 염기를 메탄올 (10 ml)에 용해시키고 디옥산 (4 ml) 중 4 M 염산으로 처리하여 고체 침전물을 얻었다. 고체 침전을 여과하고 디에틸 에테르로 세척하여 고체인 표제 화합물 (0.165 g)을 수득하였다.
실시예
2
2-클로로-5-[[2-(2-히드록시에톡시)에틸아미노]메틸]-N-(트리시클로[3.3.1.13,7] 데크-1-일메틸)-벤즈아미드
1,2-디클로로에탄 (6 ml) 중 2-클로로-5-포르밀-N-(트리시클로 [3.3.1.13,7]데크-1-일메틸)-벤즈아미드 (0.150 g, 실시예 1b), 2-(2-아미노에톡시)-에탄올 (0.065 ml)의 용액에 나트륨 트리아세톡시보로히드리드 (0.134 g)를 첨가하고, 혼합물을 실온에서 밤새 교반시켰다. 물 (20 ml) 및 디클로로메탄 (20 ml)을 첨가하고 층을 분배시켰다. 유기물을 염수 (30 ml)로 세척하고, 무수 황산 마그네슘으로 건조시키고, 여과하며 감압하에서 농축시켰다. 잔류물을 디클로로메탄 중 0 내지 10 % 에탄올 구배로 용출하는 NPHPLC로 정제하여 백색 분말의 표제 화합물 (0.016 g)을 수득하였다.
MS (APCI+ve) 421/423 (M+H)+
실시예
3
2-클로로-5-[(3-히드록시-2,2-디메틸프로필아미노)메틸]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드
1,2-디클로로에탄 (6 ml) 중 2-클로로-5-포르밀-N-(트리시클로 [3.3.1.13,7]데크-1-일메틸)-벤즈아미드 (0.150 g, 실시예 1b), 3-아미노-2,2-디메틸프로판올 (0.093 g) 및 나트륨 트리아세톡시보로히드리드 (0.134 g)로부터 실시예 2에 기술된 방법에 따라 제조. 후처리 후에, 잔류물을 디클로로메탄 중 0 내지 10 % 에탄올 구배로 용출하는 NPHPLC로 정제하여 백색 분말의 표제 화합물 (0.035 g)을 수득하였다.
실시예
4
2-클로로-5-[(5-히드록시펜틸아미노)메틸]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드
2-클로로-5-포르밀-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드 (0.100 g, 실시예 1b), 5-아미노-1-펜탄올 (0.031 mg) 및 티타늄 (IV) 이소프로폭시드 (0.111 ml)의 혼합물을 질소 대기하에서 1 시간 동안 실온에서 교반시켰다. 수득된 점성 용액을 순수 에탄올 (2 ml)로 희석하였다. 수소화 시아노 붕소 나트륨 (0.013 g)을 첨가하였고, 용액을 실온에서 20 시간 동안 교반시켰다. 물 (5 ml)을 교반하면서 첨가하였고 생성된 침전물을 여과하고 에탄올로 세척하였다. 여액을 감압하에서 농축하였다. 정제하지 않은 생성물을 디클로로메탄 (20 ml)에 용해시키고 여과하여 남아있는 무기 잔류물을 제거하였다. 여액을 무수 황산 마그네슘으로 건조시키고, 여과하고 감압하에서 농축하였다. 잔류물을 디클로로메탄 중 0 내지 10 % 에탄올 구배로 용출하는 NPHPLC로 정제하여 백색 분말의 표제 화합물 (0.031 g)을 수득하였다.
실시예
5
2-클로로-5-[[2-[(2-히드록시에틸티오)에틸아미노]메틸]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드
1,2-디클로로에탄 (15 ml) 중 2-클로로-5-포르밀-N-(트리시클로 [3.3.1.13,7]데크-1-일메틸)-벤즈아미드 (0.800 g, 실시예 1b), 2-(2-아미노에틸티오)에탄올 (0.584 g) 및 나트륨 트리아세톡시보로히드리드 (0.715 g)로부터 실시예 2에 기술된 방법에 따라 제조. 후처리 후에, 잔류물을 디클로로메탄 중 0 내지 10 % 에탄올 구배로 용출하는 NPHPLC로 정제하여 백색 분말의 표제 화합물 (0.536 g)을 수득하였다.
실시예
6
2-클로로-5-[3-[(2-히드록시에틸)아미노]프로필]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드, 아세트산염
a) (2E)-3-[4-클로로-3-[[(트리시클로[3.3.1.13,7]데크-1-일메틸)아미노]카르보닐]페닐]-2-프로펜산, 메틸 에스테르
5-브로모-2-클로로-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드 (5 g), 메틸 아크릴레이트 (1.4 ml), 트리에틸아민 (2.1 ml), 팔라듐 아세테이트 (0.070 g) 및 트리-오르토톨릴 포스핀 (0.185 g)을 N,N-디메틸포름아미드 (20 ml)에 혼합하였다. 혼합물을 질소하의 밀폐된 튜브안에서 24 시간 동안 90 ℃에서 가열하였다. 냉각시킨 후에, 반응 혼합물을 디클로로메탄과 묽은 염산 사이에서 분배시켰고 상을 혼합하고 셀리트 (celite)로 여과하여 상을 분리하였다. 유기상을 묽은 염산 및 염수로 세척하였고, 황산 마그네슘으로 건조시키고 감압하에서 농축하여 디에틸 에테르로 연마한 잔류물을 얻었고, 여과하여 회백색 고체인 부제 화합물 (4.1 g)을 수득하였다.
b) 4-클로로-3-[[(트리시클로[3.3.1.13,7]데크-1-일메틸)아미노]카르보닐]-벤 젠프로판산, 메틸 에스테르
5 % 탄소상 로듐 (0.40 g)을 에틸 아세테이트/디클로로메탄 (4:1) (160 ml) 중 (2E)-3-[4-클로로-3-[[(트리시클로[3.3.1.13,7]데크-1-일메틸)아미노]카르보닐]페닐]-2-프로펜산, 메틸 에스테르 (실시예 6a, 2.2 g)의 용액에 첨가하였고 혼합물을 24 시간 동안 3 bar에서 수소화하였다. 여과하여 촉매를 제거하였고 여액을 농축하여 오일인 부제 화합물 (2.3 g)을 수득하였다.
c) 4-클로로-3-[[(트리시클로[3.3.1.13,7]데크-1-일메틸)아미노]카르보닐]-벤젠프로판산
물 (30 ml) 중 수산화 나트륨 (0.475 g)의 용액을 메탄올 (30 ml) 중 4-클로로-3-[[(트리시클로[3.3.1.13,7]데크-1-일메틸)아미노]카르보닐]-벤젠프로판산, 메틸 에스테르 (실시예 6b, 2.3 g)의 용액에 첨가하였다. 5 시간 후에 반응 혼합물을 진공에서 부피를 절반으로 감소시키고 묽은 염산으로 산성화하였다. 백색 고체가 침전되었고 이를 여과하여 수집하고 50 ℃에서 진공으로 건조시켜 부제 화합물 (1.2 g)을 수득하였다.
d) 2-클로로-5-(3-히드록시프로필)-N-(트리시클로[3.3.1.13,7]데크-1-일메틸) -벤즈아미드
0 ℃에서 이소부틸클로로포르메이트 (0.575 ml) 및 트리에틸아민 (0.63 ml)을 테트라히드로푸란 (30 ml) 중 4-클로로-3-[[(트리시클로[3.3.1.13,7]데크-1-일메틸)아미노]카르보닐]-벤젠프로판산 (실시예 6c, 1.64 g)의 용액에 첨가하였다. 1 시간 후에 침전물을 여과하여 제거하고 여액을 0 ℃에서 물 (10 ml) 중 수소화 붕소 나트륨 (0.18 g)의 용액에 조금씩 첨가하였다. 추가의 1 시간 후에 반응 혼합물을 묽은 염산에 붓고 에틸 아세테이트로 추출하였다. 유기상을 묽은 염산으로 2 회, 포화된 탄산 수소 나트륨 용액으로 2 회 및 염수로 1 회 추출하였고, 황산 마그네슘으로 건조시키고 감압하에서 농축하여 잔류물을 얻었다. 실리카 겔 크로마토그래피 (디클로로메탄/메탄올 96:4로 용출)로 정제하여, 고체인 부제 화합물 (1.3 g)을 수득하였다.
e) 2-클로로-5-[3-[(메틸술포닐)옥시]프로필]-N-(트리시클로[3.3.1.13,7]데크 -1-일메틸)-벤즈아미드
메탄술포닐 클로리드 (1.1 ml) 및 트리에틸아민 (2 ml)을 0 ℃에서 디클로로 메탄 중 2-클로로-5-(3-히드록시프로필)-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드 (실시예 6d, 2.65 g)의 용액에 첨가하였다. 1 시간 후에 반응 혼합물을 에틸 아세테이트로 희석하였고 물로 1 회, 포화된 탄산 수소 나트륨 용액으로 2 회 및 염수로 1 회 추출하였고, 황산 마그네슘으로 건조시키고 감압하에서 농축하여 천천히 고체화되는 오일인 부제 화합물 (3.2 g)을 수득하였다.
f) 2-클로로-5-[3-[(2-히드록시에틸)아미노]프로필]-N-(트리시클로 [3.3.1.13,7]데크-1-일메틸)-벤즈아미드, 아세트산염
에탄올아민 (0.07 ml)을 n-부탄올 (5 ml) 중 2-클로로-5-[3-[(메틸술포닐)옥시]프로필]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드 (실시예 6e, 0.170 g)의 현탁액에 첨가하고 밀폐된 용기에서 12 시간 동안 100 ℃에서 가열하였다. 주위의 온도로 냉각시키면서 용액을 에틸 아세테이트로 희석하였고 포화된 탄산 수소 나트륨 수용액으로 2 회 및 염수로 1 회 추출하였고, 황산 마그네슘으로 건조시키고 감압하에서 농축하였다. 조제 역상 HPLC (0.1 % 수성 암모늄 아세테이트 중 25 내지 95 % 아세토니트릴 구배로 용출)로 정제하여 아세테이트 염인 표제 화합물 (0.070 g)을 수득하였다.
실시예
7
2-클로로-5-[3-[(3-히드록시프로필)아미노]프로필]-N-(트리시클로[3.3.1.13,7]-데크-1-일메틸)-벤즈아미드, 염산염
3-아미노프로판올 (1 ml) 을 테트라히드로푸란 (30 ml) 중 2-클로로-5-[3-[(메틸술포닐)옥시]프로필]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드 (실시예 6e, 0.270 g)의 용액에 첨가하고 용액을 환류에서 12 시간 동안 가열하였다. 주위의 온도로 냉각시키면서 반응 혼합물을 물로 희석하고 디클로로메탄으로 3 회 추출하였다. 유기 추출물을 혼합하고, 황산 마그네슘으로 건조시키고 감압하에서 농축하였다. 아세토니트릴/0.1 % 수성 암모늄 아세테이트 구배 (25 내지 95 %)로 용출시키는 조제 역상 HPLC로 정제하여 아세트산염인 표제 화합물을 수득하였다. 디옥산 중 4 M 염산으로 처리하여 염산염인 표제 화합물 (0.070 g)을 수득하였다.
실시예
8
2-클로로-5-[3-(메틸아미노)프로필]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드, 아세트산염
메틸아민 (2 M 테트라히드로푸란, 8 ml)을 2-클로로-5-[3-[(메틸술포닐)옥시]프로필]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드 (실시예 6e, 0.250 g)에 첨가하고 밀폐된 튜브에서 18 시간 동안 70 ℃에서 가열하였다. 주위의 온도로 냉각시키면서, 용액을 에틸 아세테이트로 희석하고 포화된 탄산 수소 나트륨 용액으로 2 회 및 염수로 1 회 추출하였고, 황산 마그네슘으로 건조시키고 감압하에서 농축하였다. 0.1 % 수성 암모늄 아세테이트 중 아세토니트릴 구배 (25 내지 95 %)로 용출시키는 조제 역상 HPLC로 정제하여 아세트산염인 표제 화합물 (0.140 g)을 수득하였다.
실시예
9
2-클로로-5-[3-[(l-메틸에틸)아미노]프로필]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드, 염산염
이소프로필아민 (0.5 ml)을 테트라히드로푸란 (20 ml) 중 2-클로로-5-[3-[(메틸술포닐)옥시]프로필]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드 (실시예 6e, 0.250 g)의 용액에 첨가하고 밀폐된 튜브에서 24 시간 동안 70 ℃에서 가열하였다. 혼합물을 감압하에서 농축하고 잔류물을 SCX 수지에서 고체상 추출에 의해 정제하였다. 표제 화합물을 염산염 (0.10 g)으로 수득하였다.
실시예
10
5-[3-[(2-아미노-2-메틸프로필)아미노]프로필]-2-클로로-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드, 이염산염
2-메틸-1,2-프로판디아민 (0.12 ml)을 테트라히드로푸란 (4 ml) 중 2-클로로-5-[3-[(메틸술포닐)옥시]프로필]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드 (실시예 6e, 0.250 g)의 용액에 첨가하고 밀폐된 튜브에서 12 시간 동안 60 ℃에서 가열하였다. 주위의 온도로 냉각시키면서, 혼합물을 에틸 아세테이트로 희석하고 포화된 탄산 수소 나트륨 용액으로 2 회 및 염수로 1 회 추출하였고, 황산 마그네슘으로 건조시키고 감압하에서 농축하였다. 조제 역상 HPLC (0.1 % 수성 암모늄 아세테이트 중 25 내지 95 % 아세토니트릴 구배로 용출)로 정제하여 아세트산염인 표제 화합물을 수득하였다. 디옥산 중 4 M 염산으로 처리하여 이염산염인 표제 화합물 (0.045 g)을 수득하였다.
실시예
11
2-클로로-5-[3-[(4-히드록시부틸)아미노]프로필]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드
4-아미노-1-부탄올 (0.11 ml)을 테트라히드로푸란 (4 ml) 중 2-클로로-5-[3-[(메틸술포닐)옥시]프로필]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드 (실시예 6e, 0.25 g)에 첨가하고 밀폐된 튜브에서 12 시간 동안 60 ℃에서 가열하였다. 주위의 온도로 냉각시키면서, 혼합물을 에틸 아세테이트로 희석하고 포화된 탄산 수소 나트륨 수용액으로 2 회 및 염수로 1 회 추출하였고, 황산 마그네슘으로 건조시키고 감압하에서 농축하였다. 조제 역상 HPLC (0.1 % 수성 암모늄 아세테이트 중 25 내지 95 % 아세토니트릴 구배로 용출)로 정제하여 아세트산염인 표제 화합물을 수득하였다. 수성 2 M 수산화 나트륨으로 처리하고 에틸 아세테이트로 추출하여 표제 화합물 (0.065 g)을 수득하였다.
실시예
12
2-클로로-5-[3-[(2-히드록시-2-메틸프로필)아미노]프로필]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드, 아세트산염
2-히드록시-2-메틸-1-프로필아민 [Journal American Chemical Society (1941), 63, p 1034에 따라 제조](0.25 ml)을 부탄-1-올 (8 ml) 중 2-클로로-5-[3-[(메틸술포닐)옥시]프로필]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드 (실시예 6e, 0.250 g) 용액에 첨가하고 밀폐된 튜브에서 24 시간 동안 100 ℃에서 가열하였다. 주위의 온도로 냉각시키면서, 혼합물을 에틸 아세테이트로 희석하고 포화된 탄산 수소 나트륨 수용액으로 2 회 및 염수로 1 회 추출하였고, 황산 마그네슘으로 건조시키고 감압하에서 농축하였다. 잔류물을 SCX 수지에서 고체상 추출에 의해 정제하고 조제 역상 HPLC (0.1 % 수성 암모늄 아세테이트 중 25 내지 95 % 아세토니트릴 구배로 용출)로 정제하여 아세트산염인 표제 화합물 (0.160 g)을 수득하였다.
실시예
13
2-클로로-5-[3-[[2-(메틸아미노)에틸]아미노]프로필]-N-(트리시클로[3.3.1.13,7]데크-1- 일메틸)-벤즈아미드, 이염산염
a) 2-클로로-5-(3-옥소프로필)-벤조산
2-클로로-5-요오드벤조산 (5.0 g), 테트라부틸암모늄 클로리드 (5.0 g), 탄산 수소 나트륨 (5.3 g) 및 알릴 알코올 (1.6 ml)을 N,N-디메틸포름아미드 (50 ml)에 혼합하고 PdCl2 (0.6 g)를 질소하에서 첨가하였다. 24 시간 후에 에틸 아세테이트 및 2 M 염산을 정제하지 않은 반응 혼합물에 첨가하였고 침전된 Pd를 여과하였다. 유기상을 분리시키고 2 M 염산으로 3 회 세척한 후 염수로 1 회 세척하고 황산 마그네슘으로 건조시키고, 여과하며 증발시켰다. 실리카 (에틸 아세테이트:아세트산/19:1로 용출) 크로마토그래피로 정제하여 오일인 부제 화합물 (2.77 g)을 수득하였다.
b) 2-클로로-5-[3-[[(1,1-디메틸에톡시)카르보닐][2-[[(1,1-디메틸에톡시)카르보닐]메틸아미노]에틸]아미노]프로필]-벤조산
나트륨 트리아세톡시보로히드리드 (310 mg)를 메탄올 (15 ml) 중 (2-아미노에틸)메틸-1,1-디메틸에틸 카르바민산 에스테르 [J. Med. Chem (1990), 33(1), 100에 따라 제조](0.156 g) 및 2-클로로-5-(3-옥소프로필)-벤조산 (0.21 g, 실시예 13a)의 용액에 첨가하였다. 24 시간 후에, 아세트산 (0.2 ml)을 첨가하고 혼합물을 증발시켜 건조하였다. 잔류물을 디클로로메탄 (10 ml)에 재용해시키고, 트리에틸아민 (0.45 ml) 및 (1,1-디메틸에톡시)카르보닐 1,1-디메틸에틸 탄산 에스테르 (1 g)를 첨가하였다. 24 시간 후에 반응 혼합물을 10 % KHSO4로 2 회, 염수로 1 회 세척하고 황산 마그네슘으로 건조시키고, 여과하며 증발시켰다. 실리카 크로마토그래피 (이소-헥산:에틸 아세테이트:아세트산/80:20:1로 용출한 다음, 에틸 아세테이트:아세트산/100:1로 용출)로 정제하여 오일인 부제 화합물 (0.2 g)을 수득하였다.
MS (APCI+ve) 471/473 (M+H)+
c) 2-클로로-5-[3-[[2-(메틸아미노)에틸]아미노]프로필]-N-(트리시클로 [3.3.1.13,7]데크-1- 일메틸)-벤즈아미드, 이염산염
PyBrOP (0.2 g)을 N,N-디메틸포름아미드 (10 ml) 중 2-클로로-5-[3-[[(1,1-디메틸에톡시)카르보닐][2-[[(1,1-디메틸에톡시)카르보닐]메틸아미노]에틸]아미노]프로필]-벤조산 (0.2 g, 실시예 13b), 아다만탄메틸아민 (0.1 ml) 및 트리에틸아민 (0.15 ml)의 용액에 첨가하였다. 1 시간 후에 반응 혼합물을 에틸 아세테이트로 희석하고 물로 세척한 다음, 염화 암모늄 용액으로 2 회, 포화된 탄산 수소 나트륨 용액으로 2 회 및 염수로 1 회 세척하였다. 유기 추출물을 황산 마그네슘으로 건조시키고, 여과하고 증발시키며 실리카 (디클로로메탄:메탄올/2 내지 10 %로 용출) 크로마토그래피로 정제하였다. 생성물을 디클로로메탄:메탄올/1:1 (15 ml)에 재용해시키고 디옥산 (2 ml) 중 4 M 염산을 첨가하였다. 혼합물을 교반하여 완전히 탈보호시킨 후, 조제 RP-HPLC (아세노니트릴/0.1 % 수성 트리플루오로아세트산)으로 정제하였다. 1,4-디옥산/메탄올 중 4 M 염산으로 처리하여 염산염으로 전환시켜 표제 화합물 (0.055 g)을 수득하였다.
실시예
14
(S)-2-클로로-5-[3-[(2-히드록시프로필)아미노]프로필]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드, 염산염
a) 2-클로로-5-요오드-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드
2-클로로-5-요오드벤조산 (10.0 g)을 디클로로메탄 (160 ml)에 현탁시킨후 옥살릴 클로리드 (4.0 ml)를 첨가하고 N,N-디메틸포름아미드 (40 ㎕)를 첨가하였다. 24 시간 후에 용매를 증발시켜 백색 고체를 수득하였고, 백색 고체를 디클로로메탄 (160 ml)에 재용해시켰다. 30 ℃ 미만의 온도를 유지하도록 냉각하면서 트리에틸아민 (14.8 ml)을 첨가하고 아다만틸메틸아민 (6.9 ml)을 첨가하였다. 생성된 뿌연 혼합물을 1 시간 동안 교반시킨 후, 증발시켜 옅은 황색 고체를 수득하였다. 이 고체를 에틸 아세테이트 (400 ml) 및 2 M 염산 (300 ml)의 혼합물에서 교반시켜 고체를 용해시킴으로써 2 개의 분명한 상을 얻었다. 위쪽의 유기상을 분리시키고 2 M 수산화 나트륨 수용액 (300 ml)으로 세척한 후, 건조시키고 (Na2SO4) 증발시켜 황색 고체를 수득하였다. 고체를 이소-헥산 (100 ml)에 현탁시킨 후, 여과하고 추가의 이소-헥산 (40 ml)으로 세척하였다. 생성된 회백색 고체를 40 ℃의 진공 오븐에서 건조시켰다 (14.0 g).
b) 2-클로로-5-(3-옥소프로필)-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드
2-클로로-5-요오드-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드 (5.00 g, 실시예 14a), 테트라부틸암모늄 클로리드 (3.40 g) 및 탄산 수소 나트륨 (2.44 g)을 플라스크에 넣었다. Pd(OAc)2 (0.0533 g), 톨루엔 (50 ml) 및 알릴 알코올 (1.01 ml)을 첨가하여 옅은 갈색 혼합물을 수득하였고, 5 시간 동안 80 ℃에서 가열하였다. 생성된 짙은 갈색 혼합물을 주위의 온도로 냉각시킨 후 여과하여 고체 잔류물을 제거하였다. 이를 추가의 톨루엔 (2×50 ml)으로 세척하고 톨루엔 추출물을 혼합한 다음 물 (100 ml)로 세척하고, MgSO4로 건조시키며 농축하여 밝은 갈색 고체 (3.82 g)를 수득하였다.
c) (S)-2-클로로-5-[3-[(2-히드록시프로필)아미노]프로필]-N-(트리시클로 [3.3.1.13,7]데크-1-일메틸)-벤즈아미드, 염산염
나트륨 트리아세톡시보로히드리드 (0.6 g)를 디클로로메탄 (5 ml) 중 2-클로 로-5-(3-옥소프로필)-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드 (0.5 g, 실시예 14b) 및 (S)-2-히드록시프로필아민 (0.31 g)의 용액에 첨가하였다. 24 시간 후에 정제하지 않은 반응 혼합물을 플래쉬 크로마토그래피 (디클로로메탄 + 1 % 암모니아 중 5 내지 20 % 메탄올로 용출)로 정제하였고 에테르/메탄올 19:1로부터 염산염을 침전시켜, 백색 고체인 표제 화합물 (0.19 g)을 수득하였다.
실시예
15
(R)-2-클로로-5-[3-[(2-히드록시프로필)아미노]프로필]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드, 염산염
실시예 14에 기술된 방법에 따라 제조.
실시예
16
(R)-2-클로로-5-[3-[(2-히드록시-1-메틸에틸)아미노]프로필]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드, 염산염
실시예 14에 기술된 방법에 따라 제조.
실시예
17
2-클로로-5-[3-[[2-히드록시-1-(히드록시메틸)-1-메틸에틸]아미노]프로필]-N (트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드
실시예 14에 기술된 방법에 따라 제조.
실시예
18
5-[3-[[2-(아세틸아미노)에틸]아미노]프로필]-2-클로로-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드, 염산염
실시예 14에 기술된 방법에 따라 제조.
실시예
19
2-클로로-5-[3-[[2-(디에틸아미노)에틸]아미노]프로필]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드, 이염산염
실시예 14에 기술된 방법에 따라 제조.
MS (APCI+ve) 460/462 (M+H)+
실시예
20
2-클로로-5-[3-[(3-메톡시프로필)아미노]프로필]-N-(트리시클로 [3.3.1.13,7] 데크-1-일메틸)-벤즈아미드, 염산염
실시예 14에 기술된 방법에 따라 제조.
실시예
21
2-클로로-5-[3-[(3-히드록시-3-메틸부틸)아미노]프로필]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드, 염산염
실시예 14에 기술된 방법에 따라 제조.
실시예
22
2-클로로-5-[3-[(2-메톡시에틸)아미노]프로필]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드, 염산염
실시예 14에 기술된 방법에 따라 제조.
융점 245 내지 248 ℃
MS (APCI+ve) 419/421 (M+H)+
실시예
23
2-클로로-5-[[3-(메틸아미노)프로폭시]메틸]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드
a) 2-클로로-5-[[3-[[(1,1-디메틸에톡시)카르보닐]메틸아미노]프로폭시]메틸]-벤조산
테트라히드로푸란 (5 ml) 중 (3-히드록시프로필)메틸-카르바민산, 1,1-디메틸에틸 에스테르 (0.272 g)를 질소하에서 0 ℃로 냉각시켰다. 수소화 나트륨 (오일에 60 % 분산, 0.110 g)을 첨가하였다. 혼합물을 실온으로 데우고 30 분 동안 교반시켰다. 테트라히드로푸란 (3 ml) 중 5-(브로모메틸)-2-클로로-벤조산 (0.300 g)을 첨가하고 혼합물을 6 시간 동안 55 ℃에서 가열하였다. 용액을 냉각시키고, 포화된 황산 수소 칼륨 수용액에 붓고, 에틸 아세테이트 (×3)로 추출하고, 황산 마그네슘으로 건조시키고, 여과하며 감압하에서 농축시켜 부제 화합물 (0.431 g)을 수득하였다.
MS (APCI+ve) 358 (M+H)+ (ESI-ve) 356 (M+H)+
b) [3-[[4-클로로-3-[[(트리시클로[3.3.1.13,7]데크-1-일메틸)아미노]카르보닐]페닐]메톡시]프로필]메틸-카르바민산, 1,1-디메틸에틸 에스테르
2-클로로-5-[[3-[[(1,1-디메틸에톡시)카르보닐]메틸아미노]프로폭시]메틸]- 벤조산 (0.318 g, 실시예 23a), 카르보닐 디이미다졸 (0.165 g) 및 디메틸포름아미드 (10 ml)를 질소하에서 30 분 동안 50 ℃에서 가열하였다. 혼합물을 실온으로 냉각시키고 1-아다만탄메틸아민 (0.18 ml)을 첨가하였다. 혼합물을 실온에서 20 시간 동안 교반시킨 후 에틸 아세테이트에 붓고 포화된 탄산 수소 나트륨 수용액으로 세척하고 염수로 세척하였다. 용액을 황산 마그네슘으로 건조시키고, 여과하며 감압하에서 농축하였다. 잔류물을 실리카 겔 칼럼 크로마토그래피 (2:1 이소헥산/에닐 아세테이트로 용출)로 정제하여 부제 화합물 (0.236 g)을 수득하였다.
MS (ESI+ve) 505 (M+H)+
c) 2-클로로-5-[[3-(메틸아미노)프로폭시]메틸]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드
[3-[[4-클로로-3-[[(트리시클로[3.3.1.13,7]데크-1-일메틸)아미노]카르보닐]페닐]메톡시]프로필]메틸-카르바민산, 1,1-디메틸에틸 에스테르 (0.236 g, 실시예 23 b), 1,4-디옥산 (5 ml) 중 4 M 염산 및 메탄올 (5 ml)을 질소하에서 함께 3 시간 동안 교반시킨 후, 25 % 암모니아 수용액에 붓고 감압하에서 농축하여 유리 염기를 수득하였다. 유리 염기를 19:1:0.1/디클로로메탄:메탄올:암모니아로 용출시키는 실리카 겔 칼럼 크로마토그래피로 정제하여 오일인 표제 화합물 (0.106 g)을 수득하였다.
실시예
24
2-클로로-5-[[2-[(2-히드록시에틸)아미노]에톡시]메틸]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드, 아세트산염
a) 5-(브로모메틸)-2-클로로-N-(2-트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드
0 ℃의 디클로로메탄 (25 ml) 중 2-클로로-5-(브로모메틸)-벤조산 (1.0 g)의 용액에 디메틸포름아미드 (0.05 ml)를 첨가하고 옥살릴 클로리드 (0.52 ml)를 첨가하였다. 반응물을 실온으로 데우고 30 분 동안 교반시켰다. 휘발성 물질을 진공에서 제거하고 잔류물을 고진공에서 건조시켰다. 잔류물을 디클로로메탄 (20 ml)에 용해시키고 0 ℃의 디클로로메탄 (20 ml) 및 디이소프로필에틸아민 (2 ml) 중 2-아다만탄메틸아민 염산염 (0.95 g)의 용액에 첨가하였다. 반응물을 실온으로 데우고 2 시간 동안 교반시켰다. 유기물을 물 (20 ml)로 세척한 다음 포화된 염화 암모늄 수용액으로 세척하고 유기층을 황산 마그네슘으로 건조시킨 후 여과하였다. 여액을 감압하에서 농축시켜 고체를 수득하였다. 정제하지 않은 물질을 디클로로메탄/헥산으로부터 재결정화하여 백색 고체인 부제 화합물 (1.3 g)을 수득하였다.
b) [2-[[4-클로로-3-[[(트리시클로[3.3.1.13,7]데크-1-일메틸)아미노]카르보닐]페닐]메톡시]에틸](2-히드록시에틸)-카르바민산, 1,1-디메틸에틸 에스테르
디클로로메탄 (30 ml) 중 5-(브로모메틸)-2-클로로-N-(2-트리시클로 [3.3.1.13,7]데크-1-일메틸)-벤즈아미드 (실시예 24a, 0.300 g), 비스(2-히드록시에틸)-카르바민산, 1,1-디메틸에틸 에스테르 (0.312 g) 및 은 트리플루오로아세테이트 (0.336 g)의 혼합물을 실온에서 20 시간 동안 질소하에서 교반시켰다. 용액을 은 염으로부터 가만히 따라내고 디클로로메탄을 진공에서 건조시켰다. 정제하지 않은 물질을 실리카 겔 (에틸 아세테이트로 용출)에서 정제하여 오일인 부제 화합물 (0.249 g)을 수득하였다.
MS (ESI+ve) MW 521/523 (M+H)+
c) 2-클로로-5-[[2-[(2-히드록시에틸)아미노]에톡시]메틸]-N-(트리시클로 [3.3.1.13,7]데크-1-일메틸)-벤즈아미드, 아세트산염
[2-[[4-클로로-3-[[(트리시클로[3.3.1.13,7]데크-1-일메틸)아미노]카르보닐]페닐]메톡시]에틸](2-히드록시에틸)-카르바민산, 1,1-디메틸에틸 에스테르 (0.286 g, 실시예 23b), 1,4-디옥산 (10 ml) 중 4 M 염산 및 메탄올 (10 ml)을 20 시간 동 안 질소하에서 함께 교반시키고, 25 % 암모니아 수용액에 붓고 감압하에서 농축하여 유리 염기를 얻었다. 유리 염기를 19:1:0.1/디클로로메탄:메탄올:암모니아로 용출시키는 실리카 겔 칼럼 크로마토그래피로 정제하고 역상 hplc (75:25 내지 5:95/0.1 % 수성 암모늄 아세테이트:아세토니트릴)로 추가로 정제하여 오일인 표제 화합물 (0.051 g)을 수득하였다.
실시예
25
2-클로로-5-[[2-[(3-히드록시프로필)아미노]에톡시]메틸]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드, 아세트산염
a) 2-클로로-5-[(2-히드록시에톡시)메틸]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드
디클로로메탄 (10 ml) 중 5-(브로모메틸)-2-클로로-N-(2-트리시클로 [3.3.1.13,7]데크-1-일메틸)-벤즈아미드 (실시예 24a, 0.300 g), 에틸렌 글리콜 (0.094 g) 및 은 트리플루오로아세테이트 (0.336 g)의 혼합물을 실온에서 20 시간 동안 질소하에서 교반시켰다. 용액을 은 염으로부터 가만히 따라내고 디클로로메탄을 진공에서 제거하였다. 정제하지 않은 물질을 실리카 (에틸 아세테이트로 용출)에서 정제하여 오일인 부제 화합물 (0.228 g)을 수득하였다.
MS (ESI+ve) MW 378/380 (M+H)+
b) 2-클로로-5-[[2-[(메틸술포닐)옥시]에톡시]메틸]-N-(트리시클로 [3.3.1.13,7]데크-1-일메틸)-벤즈아미드
디클로로메탄 (10 ml) 중 2-클로로-5-[(2-히드록시에톡시)메틸]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드(0.228 g, 실시예 25a) 및 트리에틸아민 (0.21 ml)을 질소하에서 5℃로 냉각시키고 메탄술포닐 클로리드 (0.1 ml)를 첨가하였다. 혼합물을 실온에서 20 시간 동안 교반시킨 후 2 N 염산에 붓고, 에틸 아세테이트로 추출하였다. 추출물을 혼합하고 2 N 염산, 포화된 탄산 수소 나트륨 수용액으로 세척한 후 염수로 세척하고 황산 마그네슘으로 건조시켰다. 유기물을 여과하고 감압하에서 농축하여 백색 고체인 부제 화합물 (0.160 g)을 수득하였다.
c) 2-클로로-5-[[2-[(3-히드록시프로필)아미노]에톡시]메틸]-N-(트리시클로 [3.3.1.13,7]데크-1-일메틸)-벤즈아미드, 아세트산염
2-클로로-5-[[2-[(메틸술포닐)옥시]에톡시]메틸]-N-(트리시클로 [3.3.1.13,7]데크-1-일메틸)-벤즈아미드 (0.160 g, 실시예 25b), 3-아미노-1-프로판올 (0.27 ml) 및 n-부탄올 (4 ml)을 밀폐된 튜브에서 24 시간 동안 110 ℃에서 함께 가열하였다. 혼합물을 냉각시키고, 2 N 수산화 나트륨 용액에 붓고 에틸 아세테이트로 추출하였다. 추출물을 황산 나트륨으로 건조시키고, 여과하며 감압하에서 농축하였다. 실리카 겔 (19:1:0.1/디클로로메탄:메탄올:암모니아로 용출)로 크로마토그래피를 하고 역상 HPLC (75:25 내지 5:95/0.1 % 수성 암모늄 아세테이트:아세토니트릴)로 추가로 정제하여 백색 고체인 표제 화합물 (0.081 g)을 수득하였다.
실시예
26
2-클로로-5-[[[3-[(1-메틸에틸)아미노]프로필]아미노]메틸]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드
a) 5-브로모-2-클로로-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드
0 ℃의 디클로로메탄 (25 ml) 중 5-브로모-2-클로로벤조산 (5.00 g)의 현탁액에 옥살릴 클로리드 (3.7 ml) 및 DMF (5 방울)을 첨가하였다. 생성된 혼합물을 실온에서 1 시간 동안 질소하에서 교반시킨 후, 감압하에서 농축하여 고체를 수득하였다. 고체를 디클로로메탄 (20 ml)에 용해시키고 디클로로메탄 (20 ml) 중 1-아다만탄메틸아민 (3.36 g) 및 N,N-디이소프로필에틸아민 (5.55 ml)의 용액을 적가하였다. 생성된 용액을 실온에서 20 시간 동안 질소 대기하에서 교반시켰다. 반응 혼합물을 디클로로메탄으로 희석하고 물, 10 % 탄산 칼륨 수용액, 10 % 황산 수소 칼륨 및 포화된 염수로 차례로 세척하였다. 유기상을 황산 나트륨으로 건조시키고, 여과하며 감압하에서 농축하여 고체인 부제 화합물 (7.84 g)을 수득하였다.
b) 2-클로로-5-포르밀-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드
테트라히드로푸란 (150 ml) 중 5-브로모-2-클로로-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드 (3.25 g, 실시예 25a)의 용액을 질소 대기하에서 -78 ℃로 냉각시켰다. 디에틸 에테르 (6.1 ml) 중 1.4 M 메틸리튬의 용액을 2 분 동안 상기 용액에 첨가하였다. 혼합물을 10 분 동안 -78 ℃에서 교반시킨 후, 펜탄 (10.0 ml) 중 tert-부틸리튬 1.7 M 용액을 적가하였다. 혼합물을 10 분 동안 -78 ℃에서 교반시킨 후, 디메틸포름아미드 (1.0 ml)를 첨가하였다. 생성된 용액을 30 분 동안 -78 ℃에서 교반시키고, 포화된 염화 암모늄 수용액 (100 ml)으로 켄칭하고 에틸 아세테이트로 추출하였다. 추출물을 혼합하고 황산 나트륨으로 건조시키고, 여과하며, 여액을 감압하에서 농축하여 고체인 부제 화합물 (2.76 g)을 수득하였다.
c) 2-클로로-5-[[[3-[(1-메틸에틸)아미노]프로필]아미노]메틸]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드
2-클로로-5-포르밀-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드 (0.244 g, 실시예 25b), N-이소프로필-1,3-프로판디아민 (0.211 g), p-톨루엔술폰산 (0.005 g) 및 톨루엔 (30 ml)의 혼합물을 딘-스타크 조건하에서 3 시간 동안 함께 환류시켰다. 혼합물을 냉각시키고 감압하에서 농축하여 오일을 수득하였다. 오일을 에탄올 (30 ml)에 용해시키고 질소 대기하에서 0 ℃로 냉각시켰다. 고체 수소화 붕소 나트륨 (0.040 g)을 조금씩 첨가하고 혼합물을 30 분 동안 실온에서 교반시킨 후, 감압하에서 농축하고 잔류물을 실리카 (9:1:0.1 디클로로메탄/메탄올/35 % 수성 암모니아로 용출) 칼럼 크로마토그래피로 정제하여 표제 화합물 (0.015 g) 및 부산물 (실시예 27 참조)을 수득하였다.
실시예
27
5-[[(3-아미노프로필)아미노]메틸]-2-클로로-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드
상기 실시예 26c에서 부산물로서 형성됨 (0.125 g).
MS (APCI+ve) 390/392 (M+H)+
실시예
28
2-클로로-5-[[[2-[(1-메틸에틸)아미노]에틸]아미노]메틸]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드
2-클로로-5-포르밀-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드 (0.500 g, 실시예 25b) 및 N-이소프로필에틸렌디아민 (0.186 g)을 사용하여 실시예 26에서와 같이 합성하여 고체인 표제 화합물 (0.105 g)을 수득하였다.
실시예
29
3-[[3-[4-클로로-3-[[(트리시클로[3.3.1.13,7]데크-1-일메틸)아미노]카르보닐]페닐]프로필]아미노]프로판산, 2,2-디메틸프로필 에스테르, 트리플루오로아세트산염
a) 2-클로로-5-요오드-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드
2-클로로-5-요오드벤조산 (10.0 g)을 디클로로메탄 (160 ml)에 현탁시킨 후 옥살릴 클로리드 (4.0 ml)를 첨가하고 N,N-디메틸포름아미드 (40 ㎕)를 첨가하였다. 24 시간 후에 용매를 증발시켜 백색 고체를 수득하고, 백색 고체를 디클로로메탄 (160 ml)에 재용해시켰다. 30 ℃ 미만의 온도를 유지하도록 냉각시키면서 트리에틸아민 (14.8 ml)을 첨가하였고 아다만탄 메틸아민 (6.9 ml)을 첨가하였다. 생성된 약간 뿌연 혼합물을 1 시간 동안 교반시킨 후, 용매를 증발시켜 옅은 황색 고체를 수득하였다. 고체를 에틸 아세테이트 (400 ml) 및 2 M 염산 (300 ml)에서 교반시켜 2 개의 분명한 상을 얻었다. 위쪽의 유기상을 분리시키고 2 M 수산화 나트륨 용액 (300 ml)로 세척한 다음, 건조시키고 (Na2SO4) 증발시켜 황색 고체를 수득하였다. 고체를 이소-헥산 (100 ml)에 현탁시킨 후, 여과하고 추가의 이소-헥산 (40 ml)으로 세척하며, 생성된 회백색 고체를 진공에서 40 ℃에서 건조하여 부제 화합물 (14.0 g)을 수득하였다.
b) 2-클로로-5-(3-옥소프로필)-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드
2-클로로-5-요오드-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드 (5.00 g, 실시예 29a), 테트라부틸암모늄 클로리드 (3.40 g) 및 수소화 붕소 나트륨 (2.44 g)을 플라스크에 넣고, Pd(OAc)2 (53.3 mg), 톨루엔 (50 ml) 및 알릴 알코올 (1.01 ml)을 넣었다. 옅은 갈색 혼합물을 80 ℃에서 5 시간 동안 가열한 후, 주위의 온도로 냉각시켰다. 혼합물을 여과하고 잔류물을 추가의 톨루엔 (50 ml + 50 ml)로 세척하였다. 톨루엔 용액을 혼합하고 물 (100 ml)로 세척한 후, MgSO4로 건조시키고 증발시켜 밝은 갈색 고체 (3.82 g)를 수득하였다.
c) 2-클로로-5-[3-[(3-히드록시프로필)아미노]프로필]-N-(트리시클로 [3.3.1.13,7]데크-1-일메틸)-벤즈아미드
나트륨 트리아세톡시보로히드리드 (1.86 g)를 디클로로메탄 (150 ml) 중 2-클로로-5-(3-옥소프로필)-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드 (1.57 g, 실시예 29b) 및 3-아미노-1-프로판올 (0.8 ml)의 용액에 첨가하였다. 24 시간 후에 정제하지 않은 반응 혼합물을 크로마토그래피 (디클로로메탄 + 1 % 암모니아 중 5 내지 20 % 메탄올로 용출)로 정제하여 백색 고체인 부제 화합물 (1.05 g)을 수득하였다.
MS (APCI+ve) 419/421 (M+H)+
d) 3-[[3-[4-클로로-3-[[(트리시클로[3.3.1.13,7]데크-1-일메틸)아미노]카르보닐]페닐]프로필][(1,1-디메틸에톡시)카르보닐]아미노]프로판산, 2,2-디메틸프로필 에스테르
2-클로로-5-[3-[(3-히드록시프로필)아미노]프로필]-N-(트리시클로 [3.3.1.13,7]데크-1-일메틸)-벤즈아미드 (0.271 g, 실시예 29c), N,N-디이소프로필에틸아민 (0.50 ml)및 테트라히드로푸란 (10 ml)을 질소하에서 함께 교반시켰다. 트리메틸아세틸 클로리드 (0.26 ml)을 적가하고 혼합물을 실온에서 48 시간 동안 교반시킨 후, 물에 붓고 에틸 아세테이트로 추출하였다. 추출물을 혼합하여 황산 나트륨으로 건조시키고, 여과하고, 감압하에서 농축하며 실리카 (4:1 이소헥산/에틸 아세테이트로 용출)로 크로마토그래피하여 오일인 부제 화합물 (0.158 g)을 수득하였다.
MS (ESI+ve) 603/605 (M+H)+
e) 3-[[3-[4-클로로-3-[[(트리시클로[3.3.1.13,7]데크-1-일메틸)아미노]카르보닐]페닐]프로필]아미노]프로판산, 2,2-디메틸프로필 에스테르, 트리플루오로아세트산염
3-[[3-[4-클로로-3-[[(트리시클로[3.3.1.13,7]데크-1-일메틸)아미노]카르보닐]페닐]프로필][(1,1-디메틸에톡시)카르보닐]아미노]프로판산, 2,2-디메틸프로필 에스테르 (0.158 g, 실시예 29d), 트리플루오로아세트산 (2 ml) 및 디클로로메탄 (2 ml)을 15 분 동안 질소하에서 함께 교반시킨 후, 감압하에서 농축하여 표제 화합물 (0.170 g)을 수득하였다.
실시예
30
5-(2-아미노에틸)-2-클로로-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드
a) 2-클로로-5-(시아노메틸)-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)벤즈아미드
시안화 칼륨 (525 mg) 및 18-크라운-6 (150 mg)을 에탄올 (50 ml) 중 5-(브로모메틸)-2-클로로-N-(2-트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드 (실시예 24a, 1.8 g)의 용액에 첨가하고, 혼합물을 환류하에서 24 시간 동안 가열하였다. 냉각시키면서 반응 혼합물을 증발시켜 건조시키고 잔류물을 에틸 아세테이트와 포화된 탄산 수소 나트륨 용액 사이에서 분배시켰다. 유기물을 분리시키고, 염 수로 세척하고, 황산 마그네슘으로 건조시키고, 여과하며 증발시켰다. 실리카 (4:1 내지 6:4의 이소-헥산/에틸 아세테이트 구배로 용출) 크로마토그래피로 정제하여 분홍색 고체인 부제 생성물 (1.0 g)을 수득하였다.
b) [2-[4-클로로-3-[[(트리시클로[3.3.1.13,7]데크-1-일메틸)아미노]카르보닐]페닐]에틸]카르바민산, 1,1-디메틸에틸 에스테르
수소화 붕소 나트륨 (1.6 g)을 메탄올 (100 ml) 중 2-클로로-5-(시아노메틸)-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)벤즈아미드 (실시예 30a, 2.1 g), (1,1-디메틸에톡시)카르보닐 탄산, 1,1-디메틸에틸 에스테르 (2.67 g) 및 염화 코발트 (II) (1.6 g)의 냉각된 용액에 조금씩 첨가하였다. 1.5 시간 후에 용매를 증발시켰고 잔류물을 에틸 아세테이트와 포화된 탄산 수소 나트륨 용액 사이에 현탁시키고 불용성 코발트 염을 여과하였다. 유기상을 분리시키고 염수로 세척하고, 황산 나트륨으로 건조시키고, 여과하며 증발시켜 포말의 부제 생성물 (2.2 g)을 수득하였다.
c) 5-(2-아미노에틸)-2-클로로-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드
염산 (4M, 1,4-디옥산 중, 3.0 ml)을 메탄올/디클로로메탄 (1:1) (50 ml) 중 [2-[4-클로로-3-[[(트리시클로[3.3.1.13,7]데크-1-일메틸)아미노]카르보닐]페닐]에틸]카르바민산, 1,1-디메틸에틸 에스테르 (2.2 g, 실시예 30b)의 용액에 첨가하였다. 24 시간 후에 용매를 증발시켜 포말의 표제 화합물 (1.85 g)을 수득하였다.
실시예
31
2-클로로-5-[3-[(2-히드록시에틸)펜틸아미노]프로필]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드
실시예 6f에 기술된 방법에 따라 제조.
MS (APCI+ve) 475/477 (M+H)+
실시예
32
2-클로로-5-[3-(메틸-2-프로페닐아미노)프로필]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드
실시예 6f에 기술된 방법에 따라 제조.
MS (APCI+ve) 415/417 (M+H)+
실시예
33
2-클로로-5-[3-[[2-(디메틸아미노)에틸]메틸아미노]프로필]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드
실시예 6f에 기술된 방법에 따라 제조.
MS (APCI+ve) 446/448 (M+H)+
실시예
34
5-[3-(부틸에틸아미노)프로필]-2-클로로-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드
실시예 6f에 기술된 방법에 따라 제조.
MS (APCI+ve) 445/447 (M+H)+
실시예
35
2-클로로-5-[3-(메틸펜틸아미노)프로필]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드
실시예 6f에 기술된 방법에 따라 제조.
MS (APCI+ve) 445/447 (M+H)+
실시예
36
2-클로로-5-[3-[[2-(디에틸아미노)에틸]에틸아미노]프로필]-N-(트리시클로 [3.3.1.13,7]데크-1-일메틸)-벤즈아미드
실시예 6f에 기술된 방법에 따라 제조.
MS (APCI+ve) 488/490 (M+H)+
실시예
37
2-클로로-5-[3-[(2-히드록시에틸)메틸아미노]프로필]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드
실시예 6f에 기술된 방법에 따라 제조.
MS (APCI+ve) 419/421 (M+H)+
실시예
38
2-클로로-5-[3-(디프로필아미노)프로필]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드
실시예 6f에 기술된 방법에 따라 제조.
MS (APCI+ve) 445/447 (M+H)+
실시예
39
2-클로로-5-[3-[(2-히드록시에틸)(1-메틸에틸)아미노]프로필]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드
실시예 6f에 기술된 방법에 따라 제조.
MS (APCI+ve) 447/449 (M+H)+
실시예
40
5-[3-[부틸(2-히드록시에틸)아미노]프로필]-2-클로로-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드
실시예 6f에 기술된 방법에 따라 제조.
MS (APCI+ve) 461/463 (M+H)+
실시예
41
2-클로로-5-[3-(디에틸아미노)프로필]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드
실시예 6f에 기술된 방법에 따라 제조.
MS (APCI+ve) 417/419 (M+H)+
실시예
42
2-클로로-5-[3-(디메틸아미노)프로필]-N-(트리시클로[3.3.1.13.7]데크-1-일메 틸)-벤즈아미드
실시예 6f에 기술된 방법에 따라 제조.
MS (APCI+ve) 389/391 (M+H)+
실시예
43
5-[3-(부틸메틸아미노)프로필]-2-클로로-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드
실시예 6f에 기술된 방법에 따라 제조.
MS (APCI+ve) 431/433 (M+H)+
실시예
44
2-클로로-5-[3-[(2-히드록시에틸)프로필아미노]프로필]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드
실시예 6f에 기술된 방법에 따라 제조.
MS (APCI+ve) 447/449 (M+H)+
실시예
45
2-클로로-5-[3-[에틸(2-히드록시에틸)아미노]프로필]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드
실시예 6f에 기술된 방법에 따라 제조.
MS (APCI+ve) 433/435 (M+H)+
실시예
46
2-클로로-5-[3-(디부틸아미노)프로필]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드
실시예 6f에 기술된 방법에 따라 제조.
MS (APCI+ve) 473/475 (M+H)+
실시예
47
2-클로로-5-[3-(에틸프로필아미노)프로필]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드
실시예 6f에 기술된 방법에 따라 제조.
MS (APCI+ve) 431/433 (M+H)+
실시예
48
2-클로로-5-[3-[메틸(l-메틸에틸)아미노]프로필]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드
실시예 6f에 기술된 방법에 따라 제조.
MS (APCI+ve) 417/419 (M+H)+
실시예
49
2-클로로-5[3-[[3-(디메틸아미노)프로필]메틸아미노]프로필]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드
실시예 6f에 기술된 방법에 따라 제조.
MS (APCI+ve) 460/462 (M+H)+
실시예
50
2-클로로-5-[3-[시클로헥실(2-히드록시에틸)아미노]프로필]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드
실시예 6f에 기술된 방법에 따라 제조.
MS (APCI+ve) 487/489 (M+H)+
실시예
51
2-클로로-5-[3-(시클로헥실메틸아미노)프로필]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드
실시예 6f에 기술된 방법에 따라 제조.
MS (APCI+ve) 457/459 (M+H)+
실시예
52
2-클로로-5-[3-(시클로헥실아미노)프로필]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드
실시예 6f에 기술된 방법에 따라 제조.
MS (APCI+ve) 443/445 (M+H)+
실시예
53
2-클로로-5-[3-[[l-(히드록시메틸)-2,2-디메틸프로필]아미노]프로필]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드
실시예 6f에 기술된 방법에 따라 제조.
MS (APCI+ve) 461/463 (M+H)+
실시예
54
2-클로로-5-[3-(시클로프로필아미노)프로필]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드
실시예 6f에 기술된 방법에 따라 제조.
MS (APCI+ve) 401/403 (M+H)+
실시예
55
2-클로로-5-[3-[[2-(디메틸아미노)에틸]아미노]프로필]-N-(트리시클로[3.3.1.13.7]데크-l-일메틸)-벤즈아미드
실시예 6f에 기술된 방법에 따라 제조.
MS (APCI+ve) 432/434 (M+H)+
실시예
56
2-클로로-5-[3-[(3-히드록시-2,2-디메틸프로필)아미노]프로필]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드
실시예 6f에 기술된 방법에 따라 제조.
MS (APCI+ve) 447/449 (M+H)+
실시예
57
2-클로로-5-[3-[(1,1-디메틸에틸)아미노]프로필]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드
실시예 6f에 기술된 방법에 따라 제조.
MS (APCI+ve) 417/419 (M+H)+
실시예
58
2-클로로-5[3-[[3-(디메틸아미노)프로필]아미노]프로필]-N-(트리시클로[3.3. 1.13,7]데크-1-일메틸)-벤즈아미드
실시예 6f에 기술된 방법에 따라 제조.
MS (APCI+ve) 446/448 (M+H)+
실시예
59
2-클로로-5-[3-(시클로펜틸아미노)프로필]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드
실시예 6f에 기술된 방법에 따라 제조.
MS (APCI+ve) 429/431 (M+H)+
실시예
60
2-클로로-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-5-[3-[(1,2,2-트리메틸프로필)아미노]프로필]-벤즈아미드
실시예 6f에 기술된 방법에 따라 제조.
MS (APCI+ve) 445/447 (M+H)+
실시예
61
5-[3-(부틸아미노)프로필]-2-클로로-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드
실시예 6f에 기술된 방법에 따라 제조.
MS (APCI+ve) 417/419 (M+H)+
실시예
62
2-클로로-5-[3-[[1-(히드록시메틸)-2-메틸프로필]아미노]프로필]-N-(트리시클로[3.3.1.13,7]데크-l-일메틸)-벤즈아미드
실시예 6f에 기술된 방법에 따라 제조.
MS (APCI+ve) 447/449 (M+H)+
실시예
63
2-클로로-5-[3-[(1-메틸프로필)아미노]프로필]-N-(트리시클로 [3.3.1.13,7]데크-1-일메틸)-벤즈아미드
실시예 6f에 기술된 방법에 따라 제조.
MS (APCI+ve) 417/419 (M+H)+
실시예
64
2-클로로-5-[3-[[2-(메틸티오)에틸]아미노]프로필]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드
실시예 6f에 기술된 방법에 따라 제조.
MS (APCI+ve) 435/437 (M+H)+
실시예
65
2-클로로-5-[3-[(2-히드록시-1,1-디메틸에틸)아미노]프로필]-N-(트리시클로[ 3.3.1.13,7]데크-1-일메틸)-벤즈아미드
실시예 6f에 기술된 방법에 따라 제조.
MS (APCI+ve) 433/435 (M+H)+
실시예
66
2-클로로-5-[3-[(시클로헥실메틸)아미노]프로필]-N-(트리시클로[3.3.1.13,7]데크-1- 일메틸)-벤즈아미드
실시예 6f에 기술된 방법에 따라 제조.
MS (APCI+ve) 457/459 (M+H)+
실시예
67
2-클로로-5-[3-(2-프로페닐아미노)프로필]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드
실시예 6f에 기술된 방법에 따라 제조.
MS (APCI+ve) 401/403 (M+H)+
실시예
68
2-클로로-5-[3-[(2-플루오로에틸)아미노]프로필]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드
실시예 6f에 기술된 방법에 따라 제조.
MS (APCI+ve) 407/409 (M+H)+
실시예
69
2-클로로-5-[3-[(2-메톡시-1-메틸에틸)아미노]프로필]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드
실시예 6f에 기술된 방법에 따라 제조.
MS (APCI+ve) 433/435 (M+H)+
실시예
70
2-클로로-5-[3-[3-(메틸아미노)프로폭시]프로필]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드, 이염산염
a) 2-클로로-5-(3-요오드프로필)-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드
2-클로로-5-(3-히드록시프로필)-N-(트리시클로[3.3.1.13,7]데크-1-일메틸) -벤즈아미드 (5.9 g, 실시예 6d), 요오드 (6.2 g, 24.4 mmol), 트리페닐포스핀 (6.4 g, 24.4 mmol) 및 이미다졸 (1.66 g, 24.4 mmol)을 디클로로메탄 (100 ml)에서 1 시간 동안 실온에서 교반시켰다. 반응물을 포화된 수성 Na2S2O3로 켄칭하고 층은 분리시켰다. 수상을 에틸 아세테이트로 추출하였다. 유기상을 혼합하고 건조시키고 (Na2SO4), 농축시키며 실리카 (EtOAc:이소헥산/1:3으로 용출)에서 칼럼 크로마토그래피로 정제하여 옅은 황색 고체인 부제 화합물 (6.8 g)을 수득하였다.
MS (APCI+ve) 472/474 (M+H)+
b) 2-클로로-5-[3-[3-(메틸아미노)프로폭시]프로필]-N-(트리시클로 [3.3.1.13,7]데크-1-일메틸)-벤즈아미드, 이염산염
은 트리플루오로아세테이트 (0.7 g, 3.2 mmol)을 디클로로메탄 (20 ml) 중 1,1-디메틸에틸(3-히드록시프로필)메틸 카르바민산 (1.8 g, 9.5 mmol) [Synth. Commun. (1995), 25(14), 2135-43]에 첨가하였다. 10 분 후에 2-클로로-5-(3-요오드프로필)-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드(1.0 g, 실시예 70a)를 첨가하고 혼합물을 24 시간 동안 교반시켰다. 생성된 혼합물을 물로 세척하고 농축하였다. 1,4-디옥산/메탄올 중 4 M 염산으로 처리하고, 농축하며 RPHPLC로 정제하여 백색 고체인 표제 화합물 (26 mg)을 수득하였다.
MS (APCI+ve) 433/435 (M+H)+
실시예
71
5-[[[(1-아미노시클로프로필)메틸](2-히드록시에틸)아미노]메틸]-2-클로로-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드
a) 5-브로모메틸-2-클로로-벤조산
50 ℃의 클로로포름 (500 ml) 중 2-클로로-5-메틸-벤조산 (25 g)의 교반된 용액에 N-브로모숙신이미드 (27.40 g)을 첨가하였다. 플라스크를 질소로 퍼지 (purge)하고 아조비스이소부티로니트릴 (0.10 g)을 한 부분으로 첨가하였다. 용액을 1 시간 동안 환류에서 가열하였다. 추가의 아조비스이소부티로니트릴 (0.10 g)을 첨가하고 혼합물을 3 시간 동안 추가로 가열하였다. 용액을 진공으로 농축하고, 디에틸 에테르에 재용해시키고 여과하여 불용성 숙신이미드를 제거하였다. 에테르 용액을 2 N 염산 수용액, 염수로 세척하고 황산 마그네슘으로 건조시켰다. 용액을 농축시켜 부피를 150 ml 이 되게 한 다음 이소헥산으로 희석하였다. 추가로 부분 농축한 후에 결정화를 시작하였다. 혼합물을 1 시간 동안 얼음조에 두었다. 생성된 결정을 여과하고, 이소헥산으로 세척하며 진공에서 건조시켜 부제 화합물 (17 g)을 수득하였다.
b) 5-브로모메틸-2-클로로-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드
0 ℃의 디클로로메탄 (250 ml) 및 디메틸포름아미드 (0.12 ml) 중 5-브로모메틸-2-클로로-벤조산 (실시예 71a, 12.4 g)의 교반시킨 용액에 옥살릴 클로리드 (8.7 ml)를 첨가하였다. 냉각조를 제거하고 용액을 실온으로 데웠다. 기체 방출이 끝나면 용액을 진공으로 농축한다. 잔류물을 디클로로메탄 (300 ml)에 재용해시키고, 0 ℃로 냉각시키며 디이소프로필에틸아민 (12.4 ml) 및 아다만틸메틸아민 (7.54 ml)으로 처리한다. 15 분 후에, 0 ℃의 용액을 디에틸 에테르 (1 L)에 붓고 1 N 수성 염산으로 세척한 후 염수로 세척한다. 유기물을 황산 마그네슘으로 건조시키고 진공으로 농축하여 백색 분말인 표제 화합물 (19 g)을 수득하였다.
c) 2-클로로-5-[[(2-히드록시에틸)아미노]메틸]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드
톨루엔 (40 ml) 중 5-브로모메틸-2-클로로-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드 (실시예 71b, 0.300 g) 및 에탄올아민 (0.5 ml)의 혼합물을 24 시간 동안 100 ℃에서 가열하였다. 혼합물을 냉각시키고, 포화된 탄산 수소 나트륨 수용액에 붓고, 에틸 아세테이트로 추출하고, 황산 마그네슘으로 건조시키고 여과하며 감압하에서 농축하여 점성 물질인 부제 화합물 (0.280 g)을 수득하였다.
MS (APCI+ve) MW 377/379 (M+H)+
d)[1-[[[[4-클로로-3-[[(트리시클로[3.3.1.13,7]데크-1-일메틸)아미노]카르보닐]페닐]메틸](2-히드록시에틸)아미노]메틸]시클로프로필]-카르바민산, 1,1-디메틸에틸 에스테르
2-클로로-5-[[(2-히드록시에틸)아미노]메틸]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드 (0.250 g, 실시예 71c), (1-포르밀시클로프로필)-카르바민 산, 1,1-디메틸에틸 에스테르 (0.260 g), 나트륨 트리아세톡시보로히드리드 (0.600 g) 및 디클로로메탄 (50 ml)을 질소하에서 24 시간 동안 함께 교반시켰다. 혼합물을 포화된 탄산 수소 나트륨 수용액에 붓고, 디클로로메탄으로 추출하고, 황산 마그네슘으로 건조시키고, 여과하며 감압하에서 농축하였다. 정제하지 않은 물질을 실리카 겔 (에틸 아세테이트)에서 정제하여, 부제 화합물 (0.302 g)을 수득하였다.
MS (APCI+ve) MW 546/548 (M+H)+
e) 5-[[[(1-아미노시클로프로필)메틸](2-히드록시에틸)아미노]메틸]-2-클로로 -N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드
[1-[[[[4-클로로-3-[[(트리시클로[3.3.1.13,7]데크-1-일메틸)아미노]카르보닐]페닐]메틸](2-히드록시에틸)아미노]메틸]시클로프로필]-카르바민산, 1,1-디메틸에틸 에스테르 (실시예 71d, 0.302 g)를 메탄올 (10 ml)에 용해시키고 디옥산 (10 ml) 중 4 N HCl을 첨가하였다. 혼합물을 실온에서 14 시간 동안 교반시킨 다음, 25 % 암모니아 수용액에 붓고 감압하에서 농축하여 유리 염기를 수득하였다. 유리 염기를 실리카 (19:1:0.1 디클로로메탄/메탄올/암모니아로 용출)에서 칼럼 크로마토그래피로 정제하여 오일인 표제 화합물 (0.230 g)을 수득하였다.
실시예
72
5-[[(2-히드록시에틸)[2-(메틸아미노)에틸]아미노]메틸]-2-메틸-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드
a) [2-[(2-히드록시에틸)[[4-메틸-3-[[(트리시클로[3.3.1.13,7]데크-1-일메틸)아미노]카르보닐]페닐]메틸]아미노]에틸]메틸-카르바민산, 1,1-디메틸에틸 에스테르
2-클로로-5-[[(2-히드록시에틸)아미노]메틸]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드 (0.30 g, 실시예 71c), 메틸(2-옥소에틸)-카르바민산, 1,1-디메틸에틸 에스테르 (0.276 g), 나트륨 트리아세톡시보로히드리드 (0.720 g) 및 디클로로메탄 (50 ml)을 24 시간 동안 질소하에서 함께 교반시켰다. 혼합물을 포화된 탄산 수소 나트륨 수용액에 붓고, 디클로로메탄으로 추출하고, 황산 마그네슘으로 건조시키고, 여과하며 감압하에서 농축시켰다. 정제하지 않은 물질을 실리카 (19:1 디클로로메탄/메탄올로 용출)로 정제하여 부제 화합물 (0.285 g)을 수득하였다.
MS (APCI+ve) MW 534/536 (M+H)+
b) 5-[[(2-히드록시에틸)[2-(메틸아미노)에틸]아미노]메틸]-2-메틸-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드
[2-[(2-히드록시에틸)[[4-메틸-3-[[(트리시클로[3.3.1.13,7]데크-1-일메틸)아미노]카르보닐]페닐]메틸]아미노]에틸]메틸-카르바민산, 1,1-디메틸에틸 에스테르 (실시예 72a, 0.285 g)를 메탄올 (10 ml)에 용해시키고, 디옥산 (10 ml) 중 4 N HCl을 첨가하고 혼합물을 실온에서 14 시간 동안 교반시켰다. 용액을 25 % 암모니아 수용액에 붓고 감압하에서 농축시켜 유리 염기를 수득하였다. 유리 염기를 실리카 겔 (8:2:0.2 / 디클로로메탄:메탄올:암모니아로 용출) 크로마토그래피로 정제하여 오일인 표제 화합물 (0.167 g)을 수득하였다.
실시예
73
2-클로로-5-[3-[[2-(1-메틸-1H-이미다졸-4-일]에틸]아미노]프로필]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드
실시예 6f에 기술된 방법에 따라 2-클로로-5-[3-[(메틸술포닐)옥시]프로필]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드 (실시예 6e, 0.5 g) 및 3-메틸히스타민 (0.22 g)으로부터 합성하여 표제 화합물 (0.060 g)을 수득하였다.
실시예
74
2-클로로-5-[3-[[2-(1H-이미다졸-4-일)에틸]아미노]프로필]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)벤즈아미드
실시예 6f에 기술된 방법에 따라 2-클로로-5-[3-[(메틸술포닐)옥시]프로필]- N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드 (실시예 6e, 1 mg) 및 히스타민으로부터 합성하여 표제 화합물을 수득하였다.
MS (APCI+ve) 455/457 (M+H)+
실시예
75
2-클로로-5-[3-[[3-(1H-이미다졸-1-일)프로필]아미노]프로필]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)벤즈아미드
실시예 6f에 기술된 방법에 따라 2-클로로-5-[3-[(메틸술포닐)옥시]프로필]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드 (실시예 6e, 1 mg) 및 1-(3-아미노프로필)이미다졸로부터 합성하여 표제 화합물을 수득하였다.
MS (APCI+ve) 469/471 (M+H)+
실시예
76
2-클로로-5-[3-[(3-히드록시프로필)아미노]프로필]-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드, 염산염
나트륨 트리아세톡시보로히드리드 (4.10 g)를 디클로메탄 (200 ml) 중 2-클로로-5-(3-옥소프로필)-N-(트리시클로[3.3.1.13,7]데크-1-일메틸)-벤즈아미드 (3.46 g, 실시예 14b) 및 3-아미노프로판올 (1.73 ml)의 용액에 첨가하였다. 24 시간 후에 정제하지 않은 반응 혼합물을 플래쉬 크로마토그래피 (5 내지 20 % 메탄올/디클로로메탄 + 1 % 암모니아)로 정제하고 에테르/메탄올 19:1로부터 염산염을 침전시켜, 백색 고체인 표제 화합물 (1.60 g)을 수득하였다.
MS (APCI+ve) 419/421 (M+H)+
1H NMR (DMSO-d6)δ 8.67(2H,s); 8.31(1H,t); 7.41(1H,d); 7.30-7.25(2H,m); 4.74(1H,t); 3.47(2H,q); 2.95-2.85(6H,m); 2.67(2H,t); 2.00-1.84(5H,m); 1.76(2H,quin); 1.63(6H,q); 1.52(6H,s).
약리학적 분석
벤조일벤조일 아데노신 트리포스페이트 (bbATP) 등의 특정 화합물들은 P2X7 수용체의 작동제로서 혈장막에서 포어 형성에 영향을 미치는 것으로 공지되어 있다 (문헌 (Drug Development Research (1996), 37(3), p.126)). 그러므로, 에티듐브 로마이드 (형광 DNA 프로브)의 존재하에, bbATP를 사용하여 수용체를 활성화시키는 경우, 세포내 DNA에 결합한 에티듐브로마이드의 형광이 증가하는 것으로 관찰되었다. 형광의 증가는 P2X7 수용체 활성화의 척도로 사용될 수 있어서, P2X7 수용체에 대한 화합물의 영향을 정량할 수 있다.
이러한 방식으로, 실시예의 표제 화합물 각각을 P2X7 수용체에 대한 길항제 활성에 대해 시험했다. 예를 들어, 바닥이 편평한 96-웰 마이크로타이터 플레이트에서 시험하는 경우, 이 웰들에 10-4 M 에티듐브로마이드 함유 THP-1 세포 현탁액 (2.5 ×106 세포/㎖) 200 ㎕를 포함하는 시험 용액 250 ㎕, 10-5 M bbATP 함유 고칼륨 완충용액 25 ㎕, 및 시험 화합물을 3 ×10-5 M로 함유하는 고칼륨 완충용액 25 ㎕를 넣었다. 플레이트에 플라스틱 시트를 덮고, 37℃에서 1시간 동안 인큐베이션했다. 그 다음, 플레이트를 퍼킨-엘머 (Perkin-Elmer) 형광 플레이트 판독기 (여기 520 nm, 방출 595 nm, 슬릿 폭: 여기의 경우 15 nm, 방출의 경우 20 nm)에서 판독했다. 비교를 위해서, bbATP (P2X7 수용체 작동제) 및 피리독살 5-포스페이트 (P2X7 수용체 길항제)를 별개의 대조구로 시험에 사용했다. 판독값을 얻어 bbATP 작동제 활성을 50% 감소시키는데 필요한 시험 화합물 농도의 마이너스 로그값인 pIC50 값을 각각의 시험 화합물에 대해 계산했다. 실시예의 화합물들 각각은 pIC50 값이 5.0을 초과하는 길항제 활성을 가짐이 입증되었다.
본 발명의 화합물은 약리학적 활성을 갖는다는 것과 P2X7 수용체 활성화의 조절체로서의 용도를 갖는다는 이점이 있다.
Claims (4)
- 하기 화학식 I의 화합물 또는 그의 제약상 허용되는 염을 제약상 허용되는 보조제, 희석제 또는 담체와 함께 포함하는 면역억제용 제약 조성물.<화학식 I>상기 식에서,D는 CH2 또는 CH2CH2를 나타내고,E는 C(O)NH 또는 NHC(O)를 나타내고,R1 및 R2는 각각 독립적으로 수소, 할로겐, 아미노, 니트로, C1-C6 알킬 또는 트리플루오로메틸을 나타내지만, R1 및 R2 둘다가 동시에 수소를 나타낼 수 없고,R3은 하기 화학식 II의 기를 나타내고,<화학식 II>R4는 C1-C6 알킬기를 나타내고,X는 산소 또는 황 원자 또는 NR13, SO 또는 SO2 기를 나타내고,R5는 C1-C6 알킬 또는 C2-C6 알케닐을 나타내는데, 각각은 할로겐, 히드록실, (디)-C1-C6-알킬아미노, -Y-R6, 및 질소, 산소 및 황으로부터 독립적으로 선택된 1 내지 4 개의 헤테로원자를 포함하는 5원 또는 6원 헤테로방향족 고리로부터 선택된 하나 이상의 치환기에 의해 치환될 수 있고, 여기서 헤테로방향족 고리는 할로겐, 히드록실 및 C1-C6 알킬로부터 선택된 하나 이상의 치환기에 의해 치환될 수 있으며,Y는 산소 또는 황 원자, 또는 NH, SO 또는 SO2 기를 나타내고,R6은 -R7Z 기를 나타내는데, R7은 C2-C6 알킬기를 나타내고, Z는 -OH, -CO2H, -NR8R9, -C(O)NR10R11 또는 -N(R12)C(O)-C1-C6 알킬기를 나타내고, Y가 산소 또는 황 원자 또는 NH 기를 나타내는 경우에, R6은 추가로 수소, C1-C6 알킬, C1-C6 알킬카르보닐, C1-C6 알콕시카르보닐, -C(O)NR14R15, -CH2OC(O)R16, -CH2OC(O)OR17 또는 -C(O)OCH2OR18을 나타내고,R8, R9, R10, R11 및 R12는 각각 독립적으로 수소 원자 또는 C1-C6 알킬기를 나 타내고,R13은 수소, C3-C8 시클로알킬, C3-C8 시클로알킬메틸을 나타내거나, 또는 R13은 히드록실 및 C1-C6 알콕시로부터 선택된 하나 이상의 치환기에 의해 치환될 수 있는 C1-C6 알킬기를 나타내고, 및R14, R15, R16, R17 및 R18은 각각 독립적으로 C1-C6 알킬기를 나타내나, 단, E가 C(O)NH이고, X가 O, NH 또는 N(C1-C6 알킬)인 경우, R5는 비치환된 C1-C6 알킬기외에 다른 것이다.
- 제1항에 따른 화학식 I의 화합물 또는 그의 제약상 허용되는 염을 제약상 허용되는 보조제, 희석제 또는 담체와 혼합하는 것을 포함하는, 제1항에 따른 제약 조성물의 제조 방법.
- 제1항에 따른 화학식 I의 화합물 또는 그의 제약상 허용되는 염을 제약상 허용되는 보조제, 희석제 또는 담체와 함께 포함하는 류마티스성 관절염 치료용 제약 조성물.
- 제1항에 따른 화학식 I의 화합물 또는 그의 제약상 허용되는 염을 제약상 허 용되는 보조제, 희석제 또는 담체와 함께 포함하는 만성 폐쇄성 폐질환 치료용 제약 조성물.
Applications Claiming Priority (6)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| SE9904651A SE9904651D0 (sv) | 1999-12-17 | 1999-12-17 | Novel compounds |
| SE9904651-8 | 1999-12-17 | ||
| GB0015744A GB0015744D0 (en) | 2000-06-27 | 2000-06-27 | Novel compounds |
| GB0015744.6 | 2000-06-27 | ||
| GB0017942.4 | 2000-07-22 | ||
| GB0017942A GB0017942D0 (en) | 2000-07-22 | 2000-07-22 | Novel compounds |
Related Parent Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020027007702A Division KR100710110B1 (ko) | 1999-12-17 | 2000-12-12 | 아다만탄 유도체 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20070012883A true KR20070012883A (ko) | 2007-01-29 |
Family
ID=27255782
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020077000596A KR20070012883A (ko) | 1999-12-17 | 2000-12-12 | 아다만탄 유도체를 함유하는 제약 조성물 |
| KR1020027007702A KR100710110B1 (ko) | 1999-12-17 | 2000-12-12 | 아다만탄 유도체 |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020027007702A KR100710110B1 (ko) | 1999-12-17 | 2000-12-12 | 아다만탄 유도체 |
Country Status (32)
| Country | Link |
|---|---|
| US (5) | US6881754B2 (ko) |
| EP (5) | EP1862451A1 (ko) |
| JP (2) | JP3710418B2 (ko) |
| KR (2) | KR20070012883A (ko) |
| CN (1) | CN1312120C (ko) |
| AR (1) | AR035325A1 (ko) |
| AT (4) | ATE261933T1 (ko) |
| AU (2) | AU780506B2 (ko) |
| BR (1) | BRPI0016395B8 (ko) |
| CA (1) | CA2393352C (ko) |
| CO (1) | CO5251381A1 (ko) |
| CY (3) | CY1106357T1 (ko) |
| CZ (1) | CZ20022093A3 (ko) |
| DE (4) | DE60032823T2 (ko) |
| DK (4) | DK1352896T3 (ko) |
| EE (1) | EE05134B1 (ko) |
| ES (4) | ES2279031T3 (ko) |
| HK (2) | HK1057035A1 (ko) |
| HU (1) | HUP0300616A3 (ko) |
| IL (2) | IL150124A0 (ko) |
| IS (1) | IS2246B (ko) |
| MX (1) | MXPA02005789A (ko) |
| MY (1) | MY125978A (ko) |
| NO (1) | NO328682B1 (ko) |
| NZ (1) | NZ519378A (ko) |
| PL (1) | PL200836B1 (ko) |
| PT (4) | PT1352896E (ko) |
| SI (1) | SI1352895T1 (ko) |
| SK (1) | SK286987B6 (ko) |
| TR (1) | TR200401432T4 (ko) |
| TW (1) | TWI258462B (ko) |
| WO (1) | WO2001044170A1 (ko) |
Families Citing this family (43)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| SE9904505D0 (sv) | 1999-12-09 | 1999-12-09 | Astra Pharma Prod | Novel compounds |
| TWI258462B (en) * | 1999-12-17 | 2006-07-21 | Astrazeneca Ab | Adamantane derivative compounds, process for preparing the same and pharmaceutical composition comprising the same |
| SE9904738D0 (sv) | 1999-12-22 | 1999-12-22 | Astra Pharma Prod | Novel compounds |
| PA8557501A1 (es) | 2001-11-12 | 2003-06-30 | Pfizer Prod Inc | Benzamida, heteroarilamida y amidas inversas |
| WO2003042190A1 (en) | 2001-11-12 | 2003-05-22 | Pfizer Products Inc. | N-alkyl-adamantyl derivatives as p2x7-receptor antagonists |
| SE0200920D0 (sv) * | 2002-03-25 | 2002-03-25 | Astrazeneca Ab | Novel compounds |
| US7071223B1 (en) | 2002-12-31 | 2006-07-04 | Pfizer, Inc. | Benzamide inhibitors of the P2X7 receptor |
| PA8591801A1 (es) | 2002-12-31 | 2004-07-26 | Pfizer Prod Inc | Inhibidores benzamidicos del receptor p2x7. |
| SE0300445D0 (sv) * | 2003-02-18 | 2003-02-18 | Astrazeneca Ab | New combination |
| SE0300480D0 (sv) * | 2003-02-21 | 2003-02-21 | Astrazeneca Ab | Novel compounds |
| ES2396565T3 (es) * | 2003-05-12 | 2013-02-22 | Pah Usa 15 Llc | Inhibidores benzamida del receptor P2X7 |
| BRPI0410739A (pt) * | 2003-05-29 | 2006-06-27 | Astrazeneca Ab | composição farmacêutica compreendendo um antagonista do receptor p2x7 e um fator de necrose tumoral (alfa) |
| EP1644042A1 (en) * | 2003-05-29 | 2006-04-12 | AstraZeneca AB | A pharmaceutical composition containing a p2x7 receptor antagonist and methotrexate |
| US20070010497A1 (en) * | 2003-05-29 | 2007-01-11 | Nigel Boughton-Smith | Pharmaceutical composition comprising a p2x7 antagonist and sulfasalazine |
| SE0302192D0 (sv) * | 2003-08-08 | 2003-08-08 | Astrazeneca Ab | Novel compounds |
| SE0302488D0 (sv) * | 2003-09-18 | 2003-09-18 | Astrazeneca Ab | New combination |
| MXPA06014023A (es) * | 2004-06-29 | 2007-02-08 | Warner Lambert Co | Terapias combinadas que utilizan inhibidores de benzamida del receptor p2x7. |
| AU2005258911A1 (en) * | 2004-06-29 | 2006-01-12 | Pfizer Products Inc. | Method for preparing 5-`4-(2-hydroxy-propyl)-3,5-dioxo-4,5-dihydro-3H`1,2,4!triazin-2-YL!-benzamide derivatives by deprotecting the hydroxyl-protected precursers |
| SA05260265A (ar) * | 2004-08-30 | 2005-12-03 | استرازينيكا ايه بي | مركبات جديدة |
| US20060063834A1 (en) * | 2004-09-09 | 2006-03-23 | Frangioni John V | Substituted adamantanes, and methods of making the same |
| SE0402925D0 (sv) * | 2004-11-30 | 2004-11-30 | Astrazeneca Ab | Novel Compounds |
| WO2007008157A1 (en) * | 2005-07-11 | 2007-01-18 | Astrazeneca Ab | New combination 2 |
| US20080207577A1 (en) * | 2005-07-11 | 2008-08-28 | Astrazeneca Ab | Combination I |
| TW200819416A (en) * | 2006-09-05 | 2008-05-01 | Astrazeneca Ab | Novel process 470 |
| PT2242759E (pt) | 2008-02-06 | 2012-12-17 | Astrazeneca Ab | Compostos |
| NZ587799A (en) | 2008-03-25 | 2012-06-29 | Affectis Pharmaceuticals Ag | Novel p2x7r antagonists and their use |
| PL2243772T3 (pl) | 2009-04-14 | 2012-05-31 | Affectis Pharmaceuticals Ag | Nowi antagoniści p2x7r i ich zastosowanie |
| GB2469915A (en) * | 2009-04-30 | 2010-11-03 | Astrazeneca Ab | 2-chloro-5-[3-[(3-hydroxypropyl)amino]propyl]-N-(tricyclo[3.3.1.13,7]dec- 1-ylmethyl)-benzamide hydrochloride salt |
| GB0913342D0 (en) | 2009-07-31 | 2009-09-16 | Astrazeneca Ab | Compounds - 801 |
| EP2322149A1 (en) | 2009-11-03 | 2011-05-18 | Universidad del Pais Vasco | Methods and compositions for the treatment of ischemia |
| JP2013526496A (ja) | 2010-05-14 | 2013-06-24 | アフェクティス ファーマシューティカルズ アーゲー | P2x7r拮抗剤の新規調製方法 |
| JP2013249256A (ja) * | 2010-09-15 | 2013-12-12 | Astellas Pharma Inc | 脂肪性肝疾患治療薬 |
| WO2012110190A1 (en) | 2011-02-17 | 2012-08-23 | Affectis Pharmaceuticals Ag | Novel p2x7r antagonists and their use |
| WO2012163792A1 (en) | 2011-05-27 | 2012-12-06 | Affectis Pharmaceuticals Ag | Novel p2x7r antagonists and their use |
| WO2012163456A1 (en) | 2011-05-27 | 2012-12-06 | Affectis Pharmaceuticals Ag | Novel p2x7r antagonists and their use |
| BR112014001454A2 (pt) | 2011-07-22 | 2017-06-27 | Actelion Pharmaceuticals Ltd | derivados de amidas heterocíclicas como antagonistas do receptor de p2x7 |
| KR102033190B1 (ko) | 2012-01-20 | 2019-10-16 | 이도르시아 파마슈티컬스 리미티드 | P2x7 수용체 길항제로서의 헤테로시클릭 아미드 유도체 |
| TWI612034B (zh) | 2012-12-12 | 2018-01-21 | 愛杜西亞製藥有限公司 | 作爲p2x7受體拮抗劑之吲哚羧醯胺衍生物 |
| EP2935211B1 (en) | 2012-12-18 | 2016-11-09 | Actelion Pharmaceuticals Ltd. | Indole carboxamide derivatives as p2x7 receptor antagonists |
| CA2897459C (en) | 2013-01-22 | 2021-03-02 | Actelion Pharmaceuticals Ltd | Heterocyclic amide derivatives as p2x7 receptor antagonists |
| KR102222220B1 (ko) | 2013-01-22 | 2021-03-03 | 이도르시아 파마슈티컬스 리미티드 | P2x7 수용체 길항제로서의 헤테로시클릭 아미드 유도체 |
| WO2023158601A2 (en) * | 2022-02-15 | 2023-08-24 | The Children's Medical Center Corporation | Compositions and methods relating to atp/p2x7r signaling inhibition |
| EP4230196A1 (en) | 2022-02-21 | 2023-08-23 | Som Innovation Biotech, S.A. | Compounds for use in the treatment of dystrophinopathies |
Family Cites Families (37)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3029241A (en) | 1962-04-10 | Phenylpbperazinylacyl anilines | ||
| US3464998A (en) | 1968-03-04 | 1969-09-02 | Searle & Co | Adamantyl esters and amides of pyridinecarboxylic acids |
| US3732305A (en) | 1970-03-03 | 1973-05-08 | Us Army | S-substituted thiosulfuric acid derivatives and preparation thereof |
| US3789072A (en) | 1970-04-22 | 1974-01-29 | Squibb & Sons Inc | Carboxamides |
| FR2346011A1 (fr) | 1976-02-02 | 1977-10-28 | Orsymonde | Acetanilido-piperazines |
| ZA825719B (en) | 1981-09-03 | 1983-06-29 | Recordati Chem Pharm | Alkanoylanilides |
| CA2015473C (en) | 1989-04-28 | 1998-04-14 | Iwao Kinoshita | Triphenylmethane derivatives |
| US6021024A (en) * | 1992-02-21 | 2000-02-01 | Kabushiki Kaisha Toshiba | Magnetic disk drive having a constant skew angle |
| CA2091194A1 (en) | 1992-04-08 | 1993-10-09 | Richard D. Connell | 2-oxo-ethyl derivatives as immunosuppressants |
| CA2101311A1 (en) | 1992-07-31 | 1994-02-01 | Neelakantan Balasubramanian | Adenosine re-uptake inhibiting derivatives of diphenyl oxazoles, thiazoles and imidazoles |
| SG52229A1 (en) | 1993-08-10 | 1998-09-28 | Black James Foundation | Gastrin and cck receptor ligands |
| US5530018A (en) * | 1994-02-04 | 1996-06-25 | G. D. Searle & Co. | Meso-azanoradamantanes |
| GB9409150D0 (en) | 1994-05-09 | 1994-06-29 | Black James Foundation | Cck and gastrin receptor ligands |
| WO1995032949A1 (en) | 1994-05-27 | 1995-12-07 | James Black Foundation Limited | Gastrin and cck antagonists |
| WO1996013262A1 (en) | 1994-10-27 | 1996-05-09 | Merck & Co., Inc. | Muscarine antagonists |
| DE19608653A1 (de) | 1996-03-06 | 1997-09-11 | Thomae Gmbh Dr K | Pyrimido[5,4-d]pyrimidine, diese Verbindungen enthaltende Arzneimittel, deren Verwendung und Verfahren zu ihrer Herstellung |
| SE9704544D0 (sv) | 1997-12-05 | 1997-12-05 | Astra Pharma Prod | Novel compounds |
| SE9704546D0 (sv) | 1997-12-05 | 1997-12-05 | Astra Pharma Prod | Novel compounds |
| WO1999029640A2 (en) * | 1997-12-05 | 1999-06-17 | Eisai Co., Ltd. | Compositions and methods for modulating the activity of fibroblast growth factor |
| SE9704545D0 (sv) * | 1997-12-05 | 1997-12-05 | Astra Pharma Prod | Novel compounds |
| US6018089A (en) * | 1997-12-09 | 2000-01-25 | Shell Oil Company | Process for separating linear internal olefins from branched internal olefins |
| AU1924099A (en) | 1997-12-18 | 1999-07-05 | Lyonnaise Industrielle Pharmaceutique (Lipha) | Piperazine derivatives useful as hypoglycemic agents |
| AU3985699A (en) | 1998-05-19 | 1999-12-06 | Centaur Pharmaceuticals, Inc. | Amide therapeutics for the treatment of inflammatory bowel disease |
| BR0009651A (pt) | 1999-04-09 | 2002-01-08 | Astrazeneca Ab | Composto, processo para a preparação de um composto, composição farmacêutica, uso de um composto, e, método para tratar artrite reumatóide e uma doença obstrutiva das vias aéreas |
| SE9901875D0 (sv) | 1999-05-25 | 1999-05-25 | Astra Pharma Prod | Novel compounds |
| SE9904505D0 (sv) | 1999-12-09 | 1999-12-09 | Astra Pharma Prod | Novel compounds |
| TWI258462B (en) * | 1999-12-17 | 2006-07-21 | Astrazeneca Ab | Adamantane derivative compounds, process for preparing the same and pharmaceutical composition comprising the same |
| SE9904652D0 (sv) * | 1999-12-17 | 1999-12-17 | Astra Pharma Prod | Novel Compounds |
| SE9904738D0 (sv) * | 1999-12-22 | 1999-12-22 | Astra Pharma Prod | Novel compounds |
| GB0013737D0 (en) | 2000-06-07 | 2000-07-26 | Astrazeneca Ab | Novel compounds |
| US6555451B1 (en) * | 2001-09-28 | 2003-04-29 | The United States Of America As Represented By The Secretary Of The Navy | Method for making shallow diffusion junctions in semiconductors using elemental doping |
| SE0103836D0 (sv) | 2001-11-16 | 2001-11-16 | Astrazeneca Ab | Novel compounds |
| SE0200920D0 (sv) | 2002-03-25 | 2002-03-25 | Astrazeneca Ab | Novel compounds |
| SE0300480D0 (sv) | 2003-02-21 | 2003-02-21 | Astrazeneca Ab | Novel compounds |
| SE0302488D0 (sv) | 2003-09-18 | 2003-09-18 | Astrazeneca Ab | New combination |
| SA05260265A (ar) | 2004-08-30 | 2005-12-03 | استرازينيكا ايه بي | مركبات جديدة |
| SE0402925D0 (sv) | 2004-11-30 | 2004-11-30 | Astrazeneca Ab | Novel Compounds |
-
2000
- 2000-12-04 TW TW089125761A patent/TWI258462B/zh not_active IP Right Cessation
- 2000-12-12 DE DE60032823T patent/DE60032823T2/de not_active Expired - Lifetime
- 2000-12-12 AT AT00986155T patent/ATE261933T1/de active
- 2000-12-12 JP JP2001545259A patent/JP3710418B2/ja not_active Expired - Lifetime
- 2000-12-12 PT PT03013990T patent/PT1352896E/pt unknown
- 2000-12-12 CN CNB008189226A patent/CN1312120C/zh not_active Expired - Lifetime
- 2000-12-12 EP EP07014968A patent/EP1862451A1/en not_active Withdrawn
- 2000-12-12 EP EP03013989A patent/EP1352895B1/en not_active Expired - Lifetime
- 2000-12-12 AT AT03013989T patent/ATE358117T1/de active
- 2000-12-12 EP EP03013991A patent/EP1352897B1/en not_active Expired - Lifetime
- 2000-12-12 DE DE60034155T patent/DE60034155T2/de not_active Expired - Lifetime
- 2000-12-12 PT PT03013989T patent/PT1352895E/pt unknown
- 2000-12-12 PT PT00986155T patent/PT1242364E/pt unknown
- 2000-12-12 EP EP03013990A patent/EP1352896B1/en not_active Expired - Lifetime
- 2000-12-12 EE EEP200200330A patent/EE05134B1/xx not_active IP Right Cessation
- 2000-12-12 DE DE60009147T patent/DE60009147T2/de not_active Expired - Lifetime
- 2000-12-12 CA CA2393352A patent/CA2393352C/en not_active Expired - Lifetime
- 2000-12-12 EP EP00986155A patent/EP1242364B1/en not_active Expired - Lifetime
- 2000-12-12 AT AT03013990T patent/ATE376994T1/de active
- 2000-12-12 DE DE60036968T patent/DE60036968T2/de not_active Expired - Lifetime
- 2000-12-12 CZ CZ20022093A patent/CZ20022093A3/cs unknown
- 2000-12-12 DK DK03013990T patent/DK1352896T3/da active
- 2000-12-12 PT PT03013991T patent/PT1352897E/pt unknown
- 2000-12-12 ES ES03013991T patent/ES2279031T3/es not_active Expired - Lifetime
- 2000-12-12 US US10/149,549 patent/US6881754B2/en not_active Expired - Lifetime
- 2000-12-12 ES ES00986155T patent/ES2215777T3/es not_active Expired - Lifetime
- 2000-12-12 ES ES03013989T patent/ES2282546T3/es not_active Expired - Lifetime
- 2000-12-12 NZ NZ519378A patent/NZ519378A/en not_active IP Right Cessation
- 2000-12-12 KR KR1020077000596A patent/KR20070012883A/ko not_active Application Discontinuation
- 2000-12-12 AU AU22444/01A patent/AU780506B2/en not_active Expired
- 2000-12-12 BR BRPI0016395A patent/BRPI0016395B8/pt not_active IP Right Cessation
- 2000-12-12 DK DK00986155T patent/DK1242364T3/da active
- 2000-12-12 DK DK03013991T patent/DK1352897T3/da active
- 2000-12-12 CO CO00094336A patent/CO5251381A1/es not_active Application Discontinuation
- 2000-12-12 DK DK03013989T patent/DK1352895T3/da active
- 2000-12-12 ES ES03013990T patent/ES2294219T3/es not_active Expired - Lifetime
- 2000-12-12 KR KR1020027007702A patent/KR100710110B1/ko active IP Right Grant
- 2000-12-12 MX MXPA02005789A patent/MXPA02005789A/es active IP Right Grant
- 2000-12-12 SI SI200030950T patent/SI1352895T1/sl unknown
- 2000-12-12 SK SK841-2002A patent/SK286987B6/sk not_active IP Right Cessation
- 2000-12-12 PL PL355913A patent/PL200836B1/pl not_active IP Right Cessation
- 2000-12-12 IL IL15012400A patent/IL150124A0/xx not_active IP Right Cessation
- 2000-12-12 AT AT03013991T patent/ATE350364T1/de active
- 2000-12-12 WO PCT/SE2000/002505 patent/WO2001044170A1/en active Application Filing
- 2000-12-12 TR TR2004/01432T patent/TR200401432T4/xx unknown
- 2000-12-12 HU HU0300616A patent/HUP0300616A3/hu unknown
- 2000-12-15 MY MYPI20005926A patent/MY125978A/en unknown
- 2000-12-15 AR ARP000106695A patent/AR035325A1/es active IP Right Grant
-
2002
- 2002-05-31 IS IS6406A patent/IS2246B/is unknown
- 2002-06-14 NO NO20022856A patent/NO328682B1/no not_active IP Right Cessation
- 2002-11-11 HK HK03109398A patent/HK1057035A1/xx not_active IP Right Cessation
- 2002-11-11 HK HK02108164.1A patent/HK1046678B/zh not_active IP Right Cessation
-
2004
- 2004-03-31 US US10/813,426 patent/US7132457B2/en not_active Expired - Lifetime
-
2005
- 2005-05-27 AU AU2005202321A patent/AU2005202321B2/en not_active Ceased
- 2005-06-03 JP JP2005163710A patent/JP2005320340A/ja active Pending
-
2006
- 2006-09-29 US US11/529,746 patent/US7297818B2/en not_active Expired - Fee Related
-
2007
- 2007-03-06 CY CY20071100312T patent/CY1106357T1/el unknown
- 2007-05-17 CY CY20071100671T patent/CY1106602T1/el unknown
- 2007-06-20 US US11/812,673 patent/US20080139636A1/en not_active Abandoned
- 2007-12-19 CY CY20071101609T patent/CY1107838T1/el unknown
-
2008
- 2008-02-25 IL IL189758A patent/IL189758A0/en not_active IP Right Cessation
- 2008-12-04 US US12/314,156 patent/US20090176853A1/en not_active Abandoned
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR100710110B1 (ko) | 아다만탄 유도체 | |
| US6303659B2 (en) | Compounds | |
| KR20020060991A (ko) | 아다만탄 유도체 | |
| JP2001525406A (ja) | 新規な化合物 | |
| KR20040058290A (ko) | 제약 조성물로서의 n-아다만틸메틸 유도체 및 중간체 및그의 제조 방법 | |
| RU2272025C2 (ru) | Производные адамантана, способы их получения, фармацевтическая композиция на их основе и способ ее получения, способы лечения ревматоидного артрита и хронического обструктивного заболевания легких |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A107 | Divisional application of patent | ||
| A201 | Request for examination | ||
| E902 | Notification of reason for refusal | ||
| E601 | Decision to refuse application |