KR101974980B1 - 조직 인자 경로 억제제 (tfpi)에 대한 최적화된 모노클로날 항체 - Google Patents
조직 인자 경로 억제제 (tfpi)에 대한 최적화된 모노클로날 항체 Download PDFInfo
- Publication number
- KR101974980B1 KR101974980B1 KR1020187022511A KR20187022511A KR101974980B1 KR 101974980 B1 KR101974980 B1 KR 101974980B1 KR 1020187022511 A KR1020187022511 A KR 1020187022511A KR 20187022511 A KR20187022511 A KR 20187022511A KR 101974980 B1 KR101974980 B1 KR 101974980B1
- Authority
- KR
- South Korea
- Prior art keywords
- ser
- amino acid
- gly
- val
- leu
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/38—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against protease inhibitors of peptide structure
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
- A61P7/02—Antithrombotic agents; Anticoagulants; Platelet aggregation inhibitors
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
- A61P7/04—Antihaemorrhagics; Procoagulants; Haemostatic agents; Antifibrinolytic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/55—Fab or Fab'
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
- C07K2317/565—Complementarity determining region [CDR]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/76—Antagonist effect on antigen, e.g. neutralization or inhibition of binding
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/90—Immunoglobulins specific features characterized by (pharmaco)kinetic aspects or by stability of the immunoglobulin
- C07K2317/92—Affinity (KD), association rate (Ka), dissociation rate (Kd) or EC50 value
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/20—Fusion polypeptide containing a tag with affinity for a non-protein ligand
- C07K2319/21—Fusion polypeptide containing a tag with affinity for a non-protein ligand containing a His-tag
Abstract
인간 조직 인자 경로 억제제 (TFPI)에 결합하는 단리된 모노클로날 항체가 제공된다. TFPI에 결합하는 모노클로날 항체를 코딩하는 단리된 핵산 분자가 또한 고려된다. 항-TFPI 모노클로날 항체를 포함하는 제약 조성물 및 상기 항체의 투여에 의해 응고에서의 결핍 또는 결함을 치료하는 방법이 또한 제공된다. 상기 항체를 생산하는 방법이 또한 제공된다.
Description
<서열 목록 제출>
본 출원과 관련된 서열 목록은 EFS-Web을 통해 전자 포맷으로 제출하고, 본 명세서에 그 전문이 참고로 포함된다.
<실시양태의 분야>
인간 조직 인자 경로 억제제 (TFPI)에 결합하는 단리된 모노클로날 항체 및 그의 단편이 제공된다.
혈액 응고는 혈액이 출혈을 멈추기 위해 안정한 혈병을 형성하는 과정이다. 상기 과정에는 혈액 내에서 순환하는 수많은 효소 전구체 및 보조인자 전구체 (또는 "응고 인자")가 관여한다. 이러한 효소 전구체 및 보조인자 전구체는 이들이 순차적으로 또는 동시에 활성화 형태로 전환되는 여러 경로를 통해 상호작용한다. 궁극적으로, 상기 과정은 인자 Va, 이온성 칼슘 및 혈소판의 존재 하에 활성화 인자 X (FXa)에 의해 프로트롬빈을 트롬빈으로 활성화시킨다. 다시, 활성화된 트롬빈은 혈소판 응집을 유도하고 피브리노겐을 피브린으로 전환시키며, 이어서 피브린은 활성화 인자 XIII (FXIIIa)에 의해 가교되어 혈병을 형성한다.
인자 X의 활성화를 유발하는 과정은 2가지 특징적인 경로에 의해 수행될 수 있다: 접촉 활성화 경로 (이전에 내인성 경로로 공지됨) 및 조직 인자 경로 (이전에 외인성 경로로 공지됨). 이전에는 응고 캐스케이드가 공통적인 경로에 연결된, 동일한 중요성의 2가지 경로로 이루어진다고 생각되었다. 현재, 혈액 응고 개시를 위한 주요 경로는 조직 인자 경로임이 공지되어 있다.
인자 X는 활성화 인자 VII (FVIIa)와 조합된 조직 인자 (TF)에 의해 활성화될 수 있다. 인자 VIIa 및 그의 필수 보조인자 TF의 복합체는 응고 캐스케이드의 강력한 개시제다.
응고의 조직 인자 경로는 조직 인자 경로 억제제 ("TFPI")에 의해 음성적으로 제어된다. TFPI는 FVIIa/TF 복합체의 천연 FXa-의존성 피드백 억제제이다. 이는 다가 쿠니츠(Kunitz)-유형 세린 프로테아제 억제제의 구성원이다. 생리학상, TFPI는 활성화 인자 X (FXa)에 결합하여 이종이량체 복합체를 형성하고, 이것은 이후에 FVIIa/TF 복합체와 상호작용하여 그의 활성을 억제함으로써 응고의 조직 인자 경로를 차단한다. 원칙적으로, TFPI 활성의 차단은 FXa 및 FVIIa/TF 활성을 복원시킬 수 있고, 이에 따라 조직 인자 경로의 작용 기간을 연장시키고 혈우병 A 및 B에서의 공통적인 결함인 FXa의 생성을 증폭시킨다.
실제로, 일부 예비 실험적 증거는 TFPI에 대한 항체에 의한 TFPI 활성의 차단이 연장된 응고 시간을 정상으로 만들거나 출혈 시간을 단축시킨다는 것을 나타냈다. 예를 들어, 노르드팡(Nordfang) 등은 혈우병 혈장의 연장된 희박 프로트롬빈 시간이 상기 혈장을 TFPI에 대한 항체로 처리한 후에 정상으로 되었음을 보여주었다 (문헌 [Thromb. Haemost., 1991, 66(4): 464-467]). 유사하게, 에르하르트센(Erhardtsen) 등은 혈우병 A 토끼 모델에서의 출혈 시간이 항-TFPI 항체에 의해 유의하게 단축되었음을 보여주었다 (문헌 [Blood Coagulation and Fibrinolysis, 1995, 6: 388-394]). 이러한 연구는 항-TFPI 항체에 의한 TFPI의 억제가 혈우병 A 또는 B의 치료에 유용할 수 있음을 시사한다. 이들 연구에는 오직 폴리클로날 항-TFPI 항체만이 사용되었다.
하이브리도마 기술을 이용하여, 재조합 인간 TFPI (rhTFPI)에 대한 모노클로날 항체를 제조하고 확인하였다. 문헌 [Yang et al., Chin. Med. J., 1998, 111(8): 718-721]을 참조한다. 희박 프로트롬빈 시간 (PT) 및 활성화 부분 트롬보플라스틴 시간 (APTT)에 대한 모노클로날 항체의 효과를 시험하였다. 실험은 항-TFPI 모노클로날 항체가 인자 IX 결핍된 혈장의 희박 트롬보플라스틴 응고 시간을 단축시켰음을 보여주었다. 이는, 조직 인자 경로가 생리학적 응고에서 뿐만 아니라 혈우병의 출혈에서도 중요한 역할을 수행한다는 것을 시사한다 (문헌 [Yang et al., Hunan Yi Ke Da Xue Xue Bao, 1997, 22(4): 297-300]).
따라서, TFPI에 특이적인 항체가 혈액 질환 및 암의 치료에 필요하다.
일반적으로, 인간 질환을 위한 치료 항체는 뮤린, 키메라, 인간화 또는 완전 인간 항체 생성을 위한 유전 공학을 이용하여 생성되었다. 뮤린 모노클로날 항체는 짧은 혈청 반감기, 인간 이펙터 기능의 촉발 불능, 및 인간 항마우스-항체의 생산으로 인해 치료제로서는 사용이 제한된 것으로 나타난 바 있다 (문헌 [Brekke and Sandlie, "Therapeutic Antibodies for Human Diseases at the Dawn of the Twenty-first Century," Nature 2, 53, 52-62, Jan. 2003]). 키메라 항체는 인간 항-키메라 항체 반응을 야기하는 것으로 나타났다. 인간화 항체는 항체의 마우스 성분을 추가로 최소화한다. 그러나, 완전 인간 항체는 뮤린 요소와 관련이 있는 면역원성을 완벽하게 피한다. 따라서, 다른 형태의 유전자 조작된 모노클로날 항체와 관련이 있는 면역원성을 피하기 위해서 완전 인간 항체를 개발할 것이 요구된다. 특히, 항-TFPI 모노클로날 항체를 사용한 혈우병 치료에 필요한 것과 같은 만성 예방적 치료는, 뮤린 성분 또는 뮤린 기원을 갖는 항체가 사용되는 경우에 빈번한 투여가 요구되고 요법이 장기간 지속되기 때문에 상기 요법에 대한 면역 반응이 발생할 위험이 높다. 예를 들어, 혈우병 A에 대한 항체 요법은 환자의 생존 동안 매주 투여할 것이 요구될 수 있다. 이것은 면역계에 대한 지속적인 도전이다. 따라서, 혈우병 및 응고에서의 관련 유전적 및 후천적 결핍 또는 결함에 대한 항체 요법을 위한 완전 인간 항체가 필요하다.
치료 항체는 문헌 [Koehler and Milstein in "Continuous Cultures of Fused Cells Secreting Antibody of Predefined Specificity," Nature 256, 495-497 (1975)]에 기재된 하이브리도마 기술을 통해 제조되었다. 완전 인간 항체는 원핵생물 및 진핵생물에서 재조합 방식으로 제조될 수도 있다. 하이브리도마 생산 보다는 숙주 세포에서 항체를 재조합 생산하는 것이 치료 항체에 바람직하다. 재조합 생산은 산물의 일관성이 더 높고 생산 수준이 더 높을 수 있으며 동물-유래의 단백질의 존재를 최소화하거나 제거하는 제어된 제조가 가능하다는 이점을 갖는다. 이러한 이유로, 재조합 방식으로 생산된 모노클로날 항-TFPI 항체를 갖는 것이 바람직하다.
또한, TFPI가 활성화 인자 X (FXa)에 고 친화도로 결합하기 때문에, 효과적인 항-TFPI 항체는 대등한 친화도를 가져야 한다. 따라서, TFPI/FXa 결합과 경쟁할 수 있는 결합 친화도를 갖는 항-TFPI 항체를 갖는 것이 바람직하다.
인간 조직 인자 경로 억제제 (TFPI)에 대한 모노클로날 항체가 제공된다. 추가로, 이를 코딩하는 단리된 핵산 분자가 제공된다. 항-TFPI 모노클로날 항체를 포함하는 제약 조성물, 및 응고에서의 유전적 및 후천적 결핍 또는 결함, 예컨대 혈우병 A 및 B의 치료 방법이 또한 제공된다. 또한, 출혈 시간의 단축을 필요로 하는 환자에게 항-TFPI 모노클로날 항체를 투여하여 출혈 시간을 단축시키는 방법이 제공된다. 본 발명에 따라 인간 TFPI에 결합하는 모노클로날 항체를 생산하는 방법이 또한 제공된다.
일부 실시양태에서, 제공된 TFPI에 대한 모노클로날 항체는, 예를 들어 증가된 친화도 또는 증가된 기능적 활성을 갖도록 최적화되었다.
도 1은 dPT 검정을 이용하여 인간 혈우병 A 혈장에서 응고 시간 단축에서 더 높은 효능을 나타내는 단일 아미노산 치환을 갖는 선택된 2A8 변이체를 설명하는 막대 그래프를 도시한다.
도 2는 항-인자 VIII 항체-유도된 인간 혈우병 혈액의 응고 시간에 대한 선택된 단일 아미노산 돌연변이된 항-TFPI 항체의 효과를 보여주는 그래프를 도시한다.
도 3은 4B7-D62R이 모 4B7 항체와 비교하고, 보다 적은 정도로 2A8 내의 단일 아미노산 치환과 비교하여 인간 항체-유도된 혈우병 A 혈액에서의 응고 시간 단축에 훨씬 더 높은 효능을 갖는다는 것을 보여주는 그래프를 도시한다.
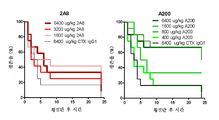
도 4는 대조군 마우스 IgG1 (CTX IgG1)과 비교하여 용량-의존성 방식으로 모 항체 2A8 및 다중 아미노산 치환을 갖는 2A8 변이체 (A200)로 치료한 혈우병 A 마우스의 생존을 보여주는 2개의 그래프를 도시한다.
도 5는 2A8 변이체가 용량-의존성 방식으로 인간 혈우병 C (FXI-결핍) 혈장에서 응고를 증진시키며, 그의 효과가 재조합 FVIIa의 효과와 대등하다는 것을 보여주는 그래프를 도시한다.
도 2는 항-인자 VIII 항체-유도된 인간 혈우병 혈액의 응고 시간에 대한 선택된 단일 아미노산 돌연변이된 항-TFPI 항체의 효과를 보여주는 그래프를 도시한다.
도 3은 4B7-D62R이 모 4B7 항체와 비교하고, 보다 적은 정도로 2A8 내의 단일 아미노산 치환과 비교하여 인간 항체-유도된 혈우병 A 혈액에서의 응고 시간 단축에 훨씬 더 높은 효능을 갖는다는 것을 보여주는 그래프를 도시한다.
도 4는 대조군 마우스 IgG1 (CTX IgG1)과 비교하여 용량-의존성 방식으로 모 항체 2A8 및 다중 아미노산 치환을 갖는 2A8 변이체 (A200)로 치료한 혈우병 A 마우스의 생존을 보여주는 2개의 그래프를 도시한다.
도 5는 2A8 변이체가 용량-의존성 방식으로 인간 혈우병 C (FXI-결핍) 혈장에서 응고를 증진시키며, 그의 효과가 재조합 FVIIa의 효과와 대등하다는 것을 보여주는 그래프를 도시한다.
<상세한 설명>
<정의>
본원에 사용된 바와 같이, 용어 "조직 인자 경로 억제제" 또는 "TFPI"는 세포에 의해 자연적으로 발현되는, 인간 TFPI의 임의의 변이체, 이소형 및 종 상동체를 지칭한다. 본 발명의 바람직한 실시양태에서, TFPI에 대한 본 발명의 항체의 결합은 혈액 응고 시간을 감소시킨다.
본원에 사용된 바와 같이, "항체"는 전체 항체 및 그의 임의의 항원 결합 단편 (즉, "항원-결합 부분") 또는 단일 쇄를 지칭한다. 상기 용어는 자연적으로 발생되거나 정상적인 이뮤노글로불린 유전자 단편 재조합 과정에 의해 형성된 전장 이뮤노글로불린 분자 (예를 들어, IgG 항체), 또는 이뮤노글로불린 분자에서 특이적 결합 활성을 보유하는 면역학적 활성 부분, 예컨대 항체 단편을 포함한다. 구조에 상관없이, 항체 단편은 전장 항체에 의해 인식되는 것과 동일한 항원과 결합한다. 예를 들어, 항-TFPI 모노클로날 항체 단편은 TFPI의 에피토프에 결합한다. 항체의 항원-결합 기능은 전장 항체의 단편에 의해 수행될 수 있다. 항체의 "항원-결합 부분"이라는 용어에 포함되는 결합 단편의 예는 하기를 포함한다: (i) Fab 단편 (VL, VH, CL 및 CH1 도메인으로 이루어진 1가 단편), (ii) F(ab')2 단편 (힌지 영역에서 디술피드 브릿지에 의해 연결된 2개의 Fab 단편을 포함하는 2가 단편), (iii) VH 및 CH1 도메인으로 이루어진 Fd 단편, (iv) 항체의 단일 아암(arm)의 VL 및 VH 도메인으로 이루어진 Fv 단편, (v) VH 도메인으로 이루어진 dAb 단편 (문헌 [Ward et al., (1989) Nature 341:544-546]), (vi) 단리된 상보성 결정 영역 (CDR), (vii) 미니바디, 디아바디, 트리아바디, 테트라바디 및 카파 바디 (예를 들어, 문헌 [Ill et al., Protein Eng 1997;10:949-57] 참조); (viii) 낙타 IgG; 및 (ix) IgNAR. 또한, Fv 단편의 2개의 도메인인 VL 및 VH가 별도의 유전자에 의해 코딩되지만, VL 및 VH 영역이 쌍을 이루어 1가 분자를 형성한 단일 단백질 쇄 (단일 쇄 Fv (scFv)로 공지됨; 예를 들어 문헌 [Bird et al. (1988) Science 242:423-426; 및 Huston et al. (1988) Proc. Natl. Acad. Sci. USA 85:5879-5883] 참조)로 만들어질 수 있게 하는 합성 링커에 의해 재조합 방법을 사용하여 이들을 연결할 수 있다. 이러한 단일 쇄 항체는 또한 항체의 "항원-결합 부분"이라는 용어 내에 포함되는 것으로 의도된다. 이들 항체 단편은 당업자에게 공지된 통상의 기술을 이용하여 수득되며, 이 단편들은 무손상 항체와 동일한 방식으로 유용성에 대해 분석된다.
또한, 항원 결합 단편이 항체 모방체에 포함될 수 있는 것으로 고려된다. 본원에 사용된 바와 같이, 용어 "항체 모방체" 또는 "모방체"는 항체와 유사한 결합을 보이지만 보다 작은 대안적 항체 또는 비-항체 단백질인 단백질을 의미한다. 이러한 항체 모방체는 스캐폴드로 구성될 수 있다. 용어 "스캐폴드"는 맞춤 기능 및 특성을 갖는 새로운 산물의 조작을 위한 폴리펩티드 플랫폼을 지칭한다.
본원에 사용된 바와 같이, 용어 "결합의 억제" 및 "결합의 차단" (예를 들어, TFPI에 대한 TFPI 리간드 결합의 억제/차단을 지칭함)은 교환가능하게 사용되고, 부분 및 완전 억제 또는 차단 둘 다를 포함한다. 억제 및 차단은 또한 항-TFPI 항체와 접촉한 TFPI를 항-TFPI 항체와 접촉하지 않은 TFPI와 비교한 경우에 생리학적 기질에 대한 TFPI의 결합 친화도의 임의의 측정가능한 감소, 예를 들어 TFPI와 인자 Xa의 상호작용 또는 TFPI-인자 Xa 복합체와 조직 인자, 인자 VIIa 또는 조직 인자/인자 VIIa의 복합체의 상호작용의 적어도 약 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95%, 96%, 97%, 98%, 99% 또는 100% 차단을 포함한다.
본원에 사용된 바와 같이, 용어 "모노클로날 항체" 또는 "모노클로날 항체 조성물"은 단일 분자 조성물의 항체 분자의 제제를 지칭한다. 모노클로날 항체 조성물은 특정 에피토프에 대해 단일 결합 특이성 및 친화도를 나타낸다. 따라서, 용어 "인간 모노클로날 항체"는 인간 배선 이뮤노글로불린 서열로부터 유래된 가변 및 불변 영역을 갖는, 단일 결합 특이성을 나타내는 항체를 지칭한다. 본 발명의 인간 항체는 인간 배선 이뮤노글로불린 서열에 의해 코딩되지 않는 아미노산 잔기 (예를 들어, 시험관내 무작위 또는 부위-특이적 돌연변이유발, 또는 생체내 체세포 돌연변이에 의해 도입된 돌연변이)를 포함할 수 있다.
본원에 사용된 바와 같이, "단리된 항체"는 상이한 항원 특이성을 갖는 다른 항체를 실질적으로 함유하지 않는 항체 (예를 들어, TFPI 이외의 항원에 결합하는 항체를 실질적으로 함유하지 않는, TFPI에 결합하는 단리된 항체)를 지칭한다. 그러나, 인간 TFPI의 에피토프, 이소형 또는 변이체에 결합하는 단리된 항체는 예를 들어 다른 종으로부터의 다른 관련 항원 (예를 들어, TFPI 종 상동체)과의 교차 반응성을 가질 수 있다. 또한, 단리된 항체는 다른 세포성 물질 및/또는 화학물질을 실질적으로 함유하지 않을 수 있다.
본원에 사용된 바와 같이, "특이적 결합"은 소정의 항원에 대한 항체 결합을 지칭한다. 전형적으로, 항체는 적어도 약 105M-1의 친화도로 결합하고, 소정의 항원 또는 밀접하게 관련된 항원 이외의 무관한 항원 (예를 들어, BSA, 카세인)에 대한 결합에 대한 친화도보다 더 높은, 예를 들어 적어도 2배 더 높은 친화도로 상기 소정의 항원에 결합한다. "항원을 인식하는 항체" 및 "항원에 특이적인 항체"란 어구는 본원에서 "항원에 특이적으로 결합하는 항체"라는 용어와 교환가능하게 사용된다.
본원에 사용된 바와 같이, IgG 항체에 대한 용어 "고 친화도"는 적어도 약 107M-1, 일부 실시양태에서는 적어도 약 108M-1, 일부 실시양태에서 적어도 약 109M-1, 1010M-1, 1011M-1 또는 그 초과, 예를 들어 1013M-1까지 또는 그 초과의 결합 친화도를 지칭한다. 그러나, "고 친화도" 결합은 다른 항체 이소형에 대해 달라질 수 있다. 예를 들어, IgM 이소형에 대한 "고 친화도" 결합은 적어도 약 1.0 x 107M-1의 결합 친화도를 지칭한다. 본원에 사용된 바와 같이, "이소형"은 중쇄 불변 영역 유전자에 의해 코딩되는 항체 클래스 (예를 들어, IgM 또는 IgG1)를 지칭한다.
"상보성-결정 영역" 또는 "CDR"은 결합된 항원의 3차원 구조에 상보적인 N-말단 항원-결합 표면을 형성하는, 항체 분자의 중쇄 가변 영역 또는 경쇄 가변 영역 내의 3개의 초가변 영역 중 하나를 지칭한다. 중쇄 또는 경쇄의 N-말단으로부터의 순서대로, 이들 상보성-결정 영역은 각각 "CDR1", "CDR2" 및 "CDR3"으로 표시된다. CDR은 항원-항체 결합에 관여하고, CDR3은 항원-항체 결합에 특이적인 고유 영역을 포함한다. 따라서, 항원-결합 부위는 중쇄 및 경쇄 V 영역 각각으로부터의 CDR 영역을 포함하는 6개의 CDR을 포함할 수 있다.
본원에 사용된 바와 같이, "보존적 치환"은 1개 이상의 아미노산을 해당 폴리펩티드의 생물학적 또는 생화학적 기능의 손실을 야기하지 않는 유사한 생화학적 특성을 갖는 아미노산으로 치환하는 것을 포함하는 폴리펩티드의 변형을 지칭한다. "보존적 아미노산 치환"은 아미노산 잔기를 유사한 측쇄를 갖는 아미노산 잔기로 대체시키는 치환이다. 유사한 측쇄를 갖는 아미노산 잔기 패밀리는 당업계에 규정되어 있다. 이들 패밀리는 염기성 측쇄를 갖는 아미노산 (예를 들어, 리신, 아르기닌, 히스티딘), 산성 측쇄를 갖는 아미노산 (예를 들어, 아스파르트산, 글루탐산), 비하전된 극성 측쇄를 갖는 아미노산 (예를 들어, 글리신, 아스파라긴, 글루타민, 세린, 트레오닌, 티로신, 시스테인), 비극성 측쇄를 갖는 아미노산 (예를 들어, 알라닌, 발린, 류신, 이소류신, 프롤린, 페닐알라닌, 메티오닌, 트립토판), 베타-분지형 측쇄를 갖는 아미노산 (예를 들어, 트레오닌, 발린, 이소류신) 및 방향족 측쇄를 갖는 아미노산 (예를 들어, 티로신, 페닐알라닌, 트립토판, 히스티딘)을 포함한다. 본 발명의 항체가 보존적 아미노산 치환을 갖고 여전히 활성을 보유할 수 있음이 예상된다.
핵산 및 폴리펩티드의 경우, 용어 "실질적 상동성"은 2개의 핵산 또는 2개의 폴리펩티드 또는 이들의 지정된 서열이 최적으로 정렬 및 비교되는 경우에 적절한 뉴클레오티드 또는 아미노산 삽입 또는 결실을 가지면 뉴클레오티드 또는 아미노산의 적어도 약 80%, 통상적으로는 뉴클레오티드 또는 아미노산의 적어도 약 85%, 바람직하게는 약 90%, 91%, 92%, 93%, 94% 또는 95%, 보다 바람직하게는 적어도 약 96%, 97%, 98%, 99%, 99.1%, 99.2%, 99.3%, 99.4%, 또는 99.5%에서 동일한 것을 나타낸다. 대안적으로, 절편이 선택적인 혼성화 조건 하에 그 가닥의 상보체와 혼성화되는 경우, 핵산에 대한 실질적 상동성이 존재한다. 본 발명은 본원에서 언급된 특정 핵산 서열 및 아미노산 서열에 대해 실질적 상동성을 갖는 핵산 서열 및 폴리펩티드 서열을 포함한다.
2개의 서열 사이의 동일성 퍼센트는 그 서열들이 공유하는 동일한 위치의 수에 관한 함수 (즉, 상동성 % = 동일한 위치의 #/위치의 총 # x 100)로서, 2개의 서열의 최적 정렬을 위해 도입될 필요가 있는 갭의 수 및 각각의 갭의 길이를 고려한다. 2개의 서열 사이의 서열 비교 및 동일성 퍼센트의 결정은 수학적 알고리즘, 예컨대 (이에 제한되지 않음) 벡터NTI(VectorNTI)TM의 얼라인엑스(AlignX)TM 모듈 (인비트로젠 코포레이션(Invitrogen Corp.), 캘리포니아주 칼스배드)을 이용하여 달성될 수 있다. 얼라인엑스TM의 경우, 다중 정렬의 디폴트 파라미터는 다음과 같다: 갭 개방 패널티: 10; 갭 연장 패널티: 0.05; 갭 분리 패널티 범위: 8; 정렬 지연에 대한 동일성 퍼센트: 40. (추가의 상세한 내용은 하기에서 찾아볼 수 있다: http://www.invitrogen.com/site/us/en/home/LINNEA-Online-Guides/LINNEA-Communities/Vector-NTI-Community/Sequence-analysis-and-data-management-software-for-PCs/AlignX-Module-for-Vector-NTI-Advance.reg.us.html).
쿼리 서열 (본 발명의 서열) 및 대상 서열 사이의 최상의 전반적인 매치를 결정하는 또 다른 방법은 글로벌 서열 정렬이라고도 지칭되며, 히긴스(Higgins) 등의 알고리즘 (문헌 [Computer Applications in the Biosciences (CABIOS), 1992, 8(2): 189-191])을 기반으로 하는 CLUSTALW 컴퓨터 프로그램 (문헌 [Thompson et al., Nucleic Acids Research, 1994, 2(22): 4673-4680])을 이용하여 결정할 수 있다. 서열 정렬시에 쿼리 및 대상 서열은 둘 다 DNA 서열이다. 상기 글로벌 서열 정렬의 결과는 동일성 퍼센트로 나타낸다. 쌍 형성 정렬을 통한 동일성 퍼센트 계산을 위해서 DNA 서열의 CLUSTALW 정렬에 사용되는 바람직한 파라미터는 다음과 같다: 매트릭스 = IUB, k-튜플 = 1, 탑 디아고날(Top Diagonal)의 수 = 5, 갭 패널티 = 3, 갭 개방 패널티 = 10, 갭 연장 패널티 = 0.1. 다중 정렬의 경우, 하기 CLUSTALW 파라미터가 바람직하다: 갭 개방 패널티 = 10, 갭 연장 파라미터 = 0.05, 갭 분리 패널티 범위 = 8, 정렬 지연에 대한 동일성 % = 40.
핵산은 온전한 세포 중에, 세포 용해물 중에, 또는 부분적으로 정제되거나 실질적으로 순수한 형태로 존재할 수 있다. 핵산은 천연 환경에서는 통상적으로 결합된 다른 세포 성분을 정제해 낸 경우에 "단리된" 또는 "실질적으로 순수"해진 것이다. 핵산을 단리하기 위해, 하기와 같은 표준 기술을 이용할 수 있다: 알칼리/SDS 처리, CsCl 밴딩, 칼럼 크로마토그래피, 아가로스 겔 전기영동 및 당업계 공지의 기타 기술.
고 친화도 및 기능적 활성을 위해 최적화된 모노클로날 항체
여러 항-TFPI 항체가 이전 연구에서 확인되었고, 2009년 8월 4일에 출원된 PCT 출원 번호 PCT/US2009/052702 (모든 목적을 위해 본원에 참고로 포함됨)에 기재되었다. 이러한 항-TFPI 항체는 예를 들어 TFPI에 대한 그의 친화도 및 차단 활성을 개선시킴으로써 추가로 최적화될 수 있다. 이러한 최적화는 예를 들어 상보성 결정 영역 (CDR) 또는 항체의 CDR과 매우 근접한 잔기, 즉 CDR과 인접한 약 3 또는 4개의 잔기의 부위 포화 돌연변이유발을 이용함으로써 수행할 수 있다.
또한, TFPI에 대해 증가된 또는 높은 친화도를 갖는 모노클로날 항체가 제공된다. 일부 실시양태에서, 항-TFPI 항체는 적어도 약 107M-1, 일부 실시양태에서 적어도 약 108M-1, 일부 실시양태에서 적어도 약 109M-1, 1010M-1, 1011M-1 또는 그 초과, 예를 들어 1013M-1까지 또는 그 초과의 결합 친화도를 갖는다.
2개의 항-TFPI 모 항체 (본원에서 2A8 및 4B7로 지정됨)의 CDR 내의 및 이에 인접한 부위 포화 돌연변이유발을 이용하여 친화도 및 기능적 활성에 대해 항체를 최적화시켰다. 또한, 동일한 최적화를 이전에 PCT/US2009/052702에 기재된 임의의 항체에 대해 수행할 수 있을 것으로 고려된다.
일부 실시양태에서, CDR의 부위 포화 돌연변이유발을 항-TFPI 항체에 대해 수행할 수 있다. 2A8의 경우, 서열 1에 제시된 중쇄의 CDR은 잔기 FTFRSYGMS (잔기 27 내지 35), SIRGSSSSTYYADSVKG (잔기 50 내지 66) 및 KYRYWFDY (잔기 99 내지 106)에 해당한다. 서열 2에 제시된 2A8 경쇄의 경우, CDR은 잔기 SGDNLRNYYAH (잔기 23 내지 33), YYDNNRPS (잔기 48 내지 55) 및 QSWDDGVPV (잔기 88 내지 96)에 해당한다. 4B7의 경우, 서열 3에 제시된 중쇄의 CDR은 잔기 DSVSSNSAAWS (잔기 27 내지 37), IIYKRSKWYNDYAVSVKS (잔기 52 내지 70) 및 WHSDKHWGFDY (잔기 102 내지 112)에 해당한다. 서열 4에 제시된 4B7 경쇄의 경우, CDR은 서열 4의 잔기 RSSQSLVFSDGNTYLN (잔기 24 내지 39), KGSNRAS (잔기 55 내지 61) 및 QQYDSYPLT (잔기 94 내지 102)에 해당한다. 변형은 6개의 CDR 중 어느 하나에서 개별적으로 만들어질 수 있거나 또는 변형이 조합이 만들어질 수 있다. 또한, 2개 이상의 변형이 단일 CDR에서 만들어질 수 있다. 다른 실시양태에서, 변형은 또한 CDR과 매우 근접한 부위에, 예를 들어 각각의 CDR의 어느 한 측면 상의 약 3 또는 4개의 잔기에 도입될 수 있다.
간략하게, 단일 및/또는 다중 아미노산 변형은 모 항체 2A8 및 4B7의 최적화 (예를 들어, 친화도 개선)를 위해 도입 및 분석되었다. 첫째로, 단일 아미노산 변형을 6개의 CDR 내로 또는 각각의 항체의 CDR에 인접한 부위에 도입한 후에 TFPI-결합 특성을 분석하였다. TFPI에 대한 결합 신호를 증가시키는 변형을 하나 이상의 다른 변형과의 조합을 위해 선택하고, 결합 신호의 추가의 증가에 대해 분석하였다. 각각의 분석 후에, 선택된 항체 변이체를 사용하여 TFPI에 대한 이들의 친화도 및 TFPI 활성의 차단 및 응고 시간의 단축에서의 활성을 측정하였다. 따라서, 일부 실시양태에서, 변형되지 않은 모 항체와 비교하여 TFPI에 대해 증가된 친화도를 갖는, 인간 조직 인자 경로 억제제에 결합하는 단리된 모노클로날 항체가 제공된다. 또한, 일부 실시양태에서, 변형되지 않은 모 항체와 비교하여 TFPI의 증가된 차단 활성을 갖는, 인간 조직 인자 경로 억제제에 결합하는 단리된 모노클로날 항체가 제공된다. 일부 실시양태에서, 변형되지 않은 모 항체와 비교하여 단축된 응고 시간을 갖는, 인간 조직 인자 경로 억제제에 결합하는 단리된 모노클로날 항체가 제공된다.
일부 실시양태에서, 추가의 아미노산 변형은 배선 서열로부터의 다양성을 감소시키기 위해 도입되었다. 다른 실시양태에서, 아미노산 변형은 큰 규모의 생산 공정을 위한 항체 생산을 용이하게 하기 위해 도입되었다.
항체는 종 특이적일 수 있거나, 다중 종과 교차 반응할 수 있다. 일부 실시양태에서, 항체는 특히 인간, 마우스, 래트, 토끼, 기니아 피그, 원숭이, 돼지, 개, 고양이 또는 다른 포유동물 종의 TFPI와 특이적으로 반응하거나 교차 반응할 수 있다.
항체는 다양한 클래스의 항체, 예컨대 (이에 제한되지 않음) IgG1, IgG2, IgG3, IgG4, IgM, IgA1, IgA2, 분비성 IgA, IgD 및 IgE 항체 중 임의의 것일 수 있다.
한 실시양태에서, 인간 조직 인자 경로 억제제에 대한 단리된 완전 인간 모노클로날 항체가 제공된다.
또 다른 실시양태에서, 인간 조직 인자 경로 억제제의 쿠니츠 도메인 2에 대한 단리된 완전 인간 모노클로날 항체가 제공된다.
2A8 변이체
따라서, 일부 실시양태에서, 서열 1에 제시된 아미노산 서열을 포함하는 중쇄를 포함하며, 여기서 상기 아미노산 서열은 하나 이상의 아미노산 변형을 포함하는 것인, 인간 조직 인자 경로 억제제에 결합하는 단리된 모노클로날 항체가 제공된다. 일부 실시양태에서, 2A8의 중쇄의 변형은 치환, 삽입 또는 결실이다.
일부 실시양태에서, 치환은 2A8의 중쇄의 CDR 내에 위치한다. 다른 실시양태에서, 치환은 2A8의 중쇄의 CDR 외부에 위치한다.
일부 실시양태에서, 2A8의 중쇄의 치환은 S31, G33, S35, I51, S54, S55, K99 및 F104로부터 선택된 위치에 존재한다. 일부 실시양태에서, 2A8의 중쇄의 치환은 또한 Q1, R30, M34, S50, R52 및 S56으로부터 선택된 위치를 포함할 수 있다. 예를 들어, 치환은 Q1E, R30S, S31P, S31V, G33A, G33K, G33P, M34I, M34K, S35L, S35D, S50A, I51D, I51E, R52S, S54F, S54D, S55A, S55G, S55R, S56G, K99V, K99L 및 F104Y로부터 선택될 수 있다. 또한, 일부 실시양태에서, 항체는 Q1E, R30S, S31P, S31V, G33A, G33K, G33P, M34I, M34K,S35L, S35D, S50A, I51D, I51E, R52S, S54F, S54D, S55A, S55G, S55R, S56G, K99V, K99L 및 F104Y로부터 선택된 2개 이상의 치환을 포함할 수 있다.
일부 실시양태에서, 2A8의 중쇄는 서열 1과 관련하여 하기 치환을 갖는다:
일부 실시양태에서, 2A8의 중쇄는 서열 1과 관련하여 하기 치환을 갖는다:
일부 실시양태에서, 2A8의 중쇄는 하나 이상의 결실을 갖는다. 일부 실시양태에서, 결실은 2A8의 중쇄의 CDR 내에 위치한다. 다른 실시양태에서, 결실은 2A8의 중쇄의 CDR 외부에 위치한다. 일부 실시양태에서, 예를 들어, 결실은 I51, S56 및 S57로부터 선택된 위치에 존재한다.
서열 2에 제시된 아미노산 서열을 포함하는 경쇄를 포함하며, 여기서 상기 아미노산 서열은 하나 이상의 아미노산 변형을 포함하는 것인, 인간 조직 인자 경로 억제제에 결합하는 단리된 모노클로날 항체가 또한 제공된다. 일부 실시양태에서, 변형은 치환, 삽입 또는 결실이다.
일부 실시양태에서, 치환은 2A8의 경쇄의 CDR 내에 위치한다. 다른 실시양태에서, 치환은 2A8의 경쇄의 CDR 외부에 위치한다.
일부 실시양태에서, 2A8의 경쇄의 치환은 A32, Y48, N51, N52, P54, D91, D92 및 V96으로부터 선택된 위치에 존재한다. 일부 실시양태에서, 2A8의 경쇄의 치환은 또한 D1, I2, A13, S21, N26, R28, N29, H33, Y49, G56, E80, S89, G93, V94 및 P95로부터 선택된 위치를 포함할 수 있다. 예를 들어, 치환은 D1S, I2Y, A13S, S21T, N26A, R28P, N29K, A32N, H33Y, Y48F, Y49R, N51S, N51V, N52G, P54L,G56D, E80M, S89A, D91L, D91R, D91W, D91K, D92S, D92T, G93S, V94T, P95V, P95A, V96G, V96M 및 V96W로부터 선택될 수 있다. 또한, 일부 실시양태에서, 항체는 D1S, I2Y, A13S, S21T, N26A, R28P, N29K, A32N, H33Y, Y48F, Y49R, N51S, N51V, N52G, P54L, G56D, E80M, S89A, D91L, D91R, D91W, D91K, D92S, D92T, G93S, V94T, P95V, P95A, V96G, V96M 및 V96W로부터 선택된 2개 이상의 치환을 포함할 수 있다.
일부 실시양태에서, 2A8의 경쇄는 서열 2와 관련하여 하기 치환을 갖는다:
일부 실시양태에서, 2A8의 경쇄는 서열 2와 관련하여 하기 치환을 갖는다:
a) 서열 1에 제시된 아미노산 서열을 포함하는 중쇄 (여기서, 상기 중쇄 아미노산 서열은 하나 이상의 아미노산 변형을 포함함); 및 b) 서열 2에 제시된 아미노산 서열을 포함하는 경쇄 (여기서, 상기 경쇄 아미노산 서열은 하나 이상의 아미노산 변형을 포함함)를 포함하는, 인간 조직 인자 경로 억제제에 결합하는 단리된 모노클로날 항체가 또한 제공된다. 만들어질 수 있는 변형의 예는 상기에 제공된다.
일부 실시양태에서, 인간 조직 인자 경로 억제제에 결합하는 단리된 모노클로날 항체는 서열 5, 6, 7, 8, 9, 10 및 11로부터 선택된 아미노산 서열을 포함하는 중쇄를 포함한다.
일부 실시양태에서, 인간 조직 인자 경로 억제제에 결합하는 단리된 모노클로날 항체는 서열 12, 13, 14, 15, 16, 17 및 18로부터 선택된 아미노산 서열을 포함하는 경쇄를 포함한다.
일부 실시양태에서, 인간 조직 인자 경로 억제제에 결합하는 단리된 모노클로날 항체는 a) 서열 5, 6, 7, 8, 9, 10 및 11로부터 선택된 아미노산 서열을 포함하는 중쇄; 및 b) 서열 12, 13, 14, 15, 16, 17 및 18로부터 선택된 아미노산 서열을 포함하는 경쇄를 포함한다. 일부 실시양태에서, 인간 조직 인자 경로 억제제에 결합하는 단리된 모노클로날 항체는 a) 서열 5에 제시된 아미노산 서열을 포함하는 중쇄; 및 b) 서열 12에 제시된 아미노산 서열을 포함하는 경쇄를 포함한다. 일부 실시양태에서, 인간 조직 인자 경로 억제제에 결합하는 단리된 모노클로날 항체는 a) 서열 6에 제시된 아미노산 서열을 포함하는 중쇄; 및 b) 서열 13에 제시된 아미노산 서열을 포함하는 경쇄를 포함한다. 일부 실시양태에서, 인간 조직 인자 경로 억제제에 결합하는 단리된 모노클로날 항체는 a) 서열 7에 제시된 아미노산 서열을 포함하는 중쇄; 및 b) 서열 14에 제시된 아미노산 서열을 포함하는 경쇄를 포함한다. 일부 실시양태에서, 인간 조직 인자 경로 억제제에 결합하는 단리된 모노클로날 항체는 a) 서열 8에 제시된 아미노산 서열을 포함하는 중쇄; 및 b) 서열 15에 제시된 아미노산 서열을 포함하는 경쇄를 포함한다. 일부 실시양태에서, 인간 조직 인자 경로 억제제에 결합하는 단리된 모노클로날 항체는 a) 서열 9에 제시된 아미노산 서열을 포함하는 중쇄; 및 b) 서열 16에 제시된 아미노산 서열을 포함하는 경쇄를 포함한다. 일부 실시양태에서, 인간 조직 인자 경로 억제제에 결합하는 단리된 모노클로날 항체는 a) 서열 10에 제시된 아미노산 서열을 포함하는 중쇄; 및 b) 서열 17에 제시된 아미노산 서열을 포함하는 경쇄를 포함한다. 일부 실시양태에서, 인간 조직 인자 경로 억제제에 결합하는 단리된 모노클로날 항체는 a) 서열 11에 제시된 아미노산 서열을 포함하는 중쇄; 및 b) 서열 18에 제시된 아미노산 서열을 포함하는 경쇄를 포함한다.
4B7 변이체
하나 이상의 아미노산 변형을 포함하는 서열 3에 제시된 아미노산 서열을 포함하는, 인간 조직 인자 경로 억제제에 결합하는 단리된 모노클로날 항체가 또한 제공된다. 일부 실시양태에서, 4B7의 중쇄의 변형은 치환, 삽입 또는 결실이다.
일부 실시양태에서, 치환은 4B7의 중쇄의 CDR 내에 위치한다. 다른 실시양태에서, 치환은 4B7의 중쇄의 CDR 외부에 위치한다.
일부 실시양태에서, 4B7의 중쇄의 치환은 S30, N32, S57, K58, N61, D62, H103, H107, G109 및 Y112로부터 선택된 위치에 존재한다. 일부 실시양태에서, 4B7의 중쇄의 치환은 또한 Q1, S37, G44, I53 및 K55로부터 선택된 위치를 포함할 수 있다. 예를 들어, 치환은 Q1E, S30R, N32D, N32E, S33G, S37N, G44S, I53T, K55Y, S57K, S57R, K58M, N61G, N61T, D62I, D62R, D62Q, D62L, D62S, D62V, D62N, D62K, H103D, H103G, H107M, G109A 및 Y112D로부터 선택될 수 있다. 또한, 일부 실시양태에서, 항체는 Q1E, S30R, N32D, N32E, S33G, S37N, G44S, I53T, K55Y, S57K, S57R, K58M, N61G, N61T, D62I, D62R, D62Q, D62L, D62S, D62V, D62N, D62K, H103D, H103G, H107M, G109A 및 Y112D로부터 선택된 2개 이상의 치환을 포함할 수 있다.
일부 실시양태에서, 4B7의 중쇄는 서열 3과 관련하여 하기 치환을 갖는다:
일부 실시양태에서, 4B7의 중쇄는 서열 3과 관련하여 하기 치환을 갖는다:
또한, 하나 이상의 아미노산 변형을 포함하는 서열 4에 제시된 아미노산 서열을 포함하는, 인간 조직 인자 경로 억제제에 결합하는 단리된 모노클로날 항체가 제공된다. 일부 실시양태에서, 4B7의 경쇄의 변형은 치환, 삽입 또는 결실로부터 선택된다.
일부 실시양태에서, 치환은 4B7의 경쇄의 CDR 내에 위치한다. 다른 실시양태에서, 치환은 4B7의 경쇄의 CDR 외부에 위치한다.
일부 실시양태에서, 4B7의 경쇄의 치환은 F31, S32, D33, N35, Y37, Y54, G56, S57, S61 및 D97로부터 선택된 위치에 존재한다. 일부 실시양태에서, 4B7의 경쇄의 치환은 또한 M4, V30, T36, N39, L42, K44, Q50, L51, K55, A60 및 S98로부터 선택된 위치를 포함할 수 있다. 예를 들어, 치환은 M4I, M4L, V30L, F31I, F31M, F31Y, F31H, S32L, S32R, S32Y, D33F, D33R, N35I, N35L, N35T, N35V, T36N, Y37F, N39D, L42Q, K44R, Q50R, L51R, Y54F, K55L, G56D, G56A, G56V, S57Y, A60D, S61C, D97M, D97T 및 S98H로부터 선택될 수 있다. 또한, 일부 실시양태에서, 항체는 M4I, M4L, V30L, F31I, F31M, F31Y, S32L, S32R, S32Y, D33F, D33R, N35I, N35L, N35T, N35V, T36N, Y37F, N39D, L42Q, K44R, Q50R, Y54F, K55L, G56D, G56A, G56V, S57Y, A60D, S61C, D97M, D97T 및 S98H로부터 선택된 2개 이상의 치환을 포함할 수 있다.
일부 실시양태에서, 4B7의 경쇄는 서열 4와 관련하여 하기 치환을 갖는다:
일부 실시양태에서, 4B7의 경쇄는 서열 4와 관련하여 하기 치환을 갖는다:
a) 서열 3에 제시된 아미노산 서열을 포함하는 중쇄 (여기서, 상기 중쇄 아미노산 서열은 하나 이상의 아미노산 변형을 포함함); 및 b) 서열 4에 제시된 아미노산 서열을 포함하는 경쇄 (여기서, 상기 경쇄 아미노산 서열은 하나 이상의 아미노산 변형을 포함함)를 포함하는, 인간 조직 인자 경로 억제제에 결합하는 단리된 모노클로날 항체가 또한 제공된다. 만들어질 수 있는 변형의 예는 상기에 제공된다.
일부 실시양태에서, 인간 조직 인자 경로 억제제에 결합하는 단리된 모노클로날 항체는 서열 19, 20, 21, 22, 23, 24, 25 및 26으로부터 선택된 아미노산 서열을 포함하는 중쇄를 포함한다.
일부 실시양태에서, 인간 조직 인자 경로 억제제에 결합하는 단리된 모노클로날 항체는 서열 27, 28, 29, 30, 31, 32, 33 및 34로부터 선택된 아미노산 서열을 포함하는 경쇄를 포함한다.
일부 실시양태에서, 인간 조직 인자 경로 억제제에 결합하는 단리된 모노클로날 항체는 a) 서열 19, 20, 21, 22, 23, 24, 25 및 26으로부터 선택된 아미노산 서열을 포함하는 중쇄; 및 b) 서열 27, 28, 29, 30, 31, 32, 33 및 34로부터 선택된 아미노산 서열을 포함하는 경쇄를 포함한다. 일부 실시양태에서, 인간 조직 인자 경로 억제제에 결합하는 단리된 모노클로날 항체는 a) 서열 19에 제시된 아미노산 서열을 포함하는 중쇄; 및 b) 서열 27에 제시된 아미노산 서열을 포함하는 경쇄를 포함한다. 일부 실시양태에서, 인간 조직 인자 경로 억제제에 결합하는 단리된 모노클로날 항체는 a) 서열 20에 제시된 아미노산 서열을 포함하는 중쇄; 및 b) 서열 28에 제시된 아미노산 서열을 포함하는 경쇄를 포함한다. 일부 실시양태에서, 인간 조직 인자 경로 억제제에 결합하는 단리된 모노클로날 항체는 a) 서열 21에 제시된 아미노산 서열을 포함하는 중쇄; 및 b) 서열 29에 제시된 아미노산 서열을 포함하는 경쇄를 포함한다. 일부 실시양태에서, 인간 조직 인자 경로 억제제에 결합하는 단리된 모노클로날 항체는 a) 서열 22에 제시된 아미노산 서열을 포함하는 중쇄; 및 b) 서열 30에 제시된 아미노산 서열을 포함하는 경쇄를 포함한다. 일부 실시양태에서, 인간 조직 인자 경로 억제제에 결합하는 단리된 모노클로날 항체는 a) 서열 23에 제시된 아미노산 서열을 포함하는 중쇄; 및 b) 서열 31에 제시된 아미노산 서열을 포함하는 경쇄를 포함한다. 일부 실시양태에서, 인간 조직 인자 경로 억제제에 결합하는 단리된 모노클로날 항체는 a) 서열 24에 제시된 아미노산 서열을 포함하는 중쇄; 및 b) 서열 32에 제시된 아미노산 서열을 포함하는 경쇄를 포함한다. 일부 실시양태에서, 인간 조직 인자 경로 억제제에 결합하는 단리된 모노클로날 항체는 a) 서열 25에 제시된 아미노산 서열을 포함하는 중쇄; 및 b) 서열 33에 제시된 아미노산 서열을 포함하는 경쇄를 포함한다. 일부 실시양태에서, 인간 조직 인자 경로 억제제에 결합하는 단리된 모노클로날 항체는 a) 서열 26에 제시된 아미노산 서열을 포함하는 중쇄; 및 b) 서열 34에 제시된 아미노산 서열을 포함하는 경쇄를 포함한다.
2A8/4B7 변이체 조합
또한, 인간 조직 인자 경로 억제제에 결합하는 단리된 모노클로날 항체가 2A8 및 4B7의 중쇄 및 경쇄의 조합을 포함할 수 있을 것으로 고려된다.
따라서, a) 서열 1에 제시된 아미노산 서열을 포함하는 2A8의 중쇄 (여기서, 상기 중쇄 아미노산 서열은 하나 이상의 아미노산 변형을 포함함); 및 b) 서열 4에 제시된 아미노산 서열을 포함하는 4B7의 경쇄 (여기서, 상기 경쇄 아미노산 서열은 하나 이상의 아미노산 변형을 포함함)를 포함하는, 인간 조직 인자 경로 억제제에 결합하는 단리된 모노클로날 항체가 제공된다. 만들어질 수 있는 변형의 예는 상기에 제공된다.
a) 서열 3에 제시된 아미노산 서열을 포함하는 4B7의 중쇄 (여기서, 상기 중쇄 아미노산 서열은 하나 이상의 아미노산 변형을 포함함); 및 b) 서열 2에 제시된 아미노산 서열을 포함하는 2A8의 경쇄 (여기서, 상기 경쇄 아미노산 서열은 하나 이상의 아미노산 변형을 포함함)를 포함하는, 인간 조직 인자 경로 억제제에 결합하는 단리된 모노클로날 항체가 또한 제공된다. 만들어질 수 있는 변형의 예는 상기에 제공된다.
일부 실시양태에서, a) 서열 5, 6, 7, 8, 9, 10, 11, 19, 20, 21, 22, 23, 24, 25 및 26으로 이루어진 군으로부터 선택된 아미노산 서열을 포함하는 중쇄; 및 b) 서열 12, 13, 14, 15, 16, 17, 18, 27, 28, 29, 30, 31, 32, 33 및 34로 이루어진 군으로부터 선택된 아미노산 서열을 포함하는 경쇄를 포함하는, 인간 조직 인자 경로 억제제에 결합하는 단리된 모노클로날 항체가 제공된다.
핵산, 벡터 및 숙주 세포
또한, 상기 기재된 임의의 모노클로날 항체를 코딩하는 단리된 핵산 분자가 제공된다.
따라서, 서열 1에 제시된 아미노산 서열을 포함하는 중쇄를 포함하며, 여기서 상기 중쇄 아미노산 서열은 하나 이상의 아미노산 변형을 포함하는 것인, 인간 조직 인자 경로 억제제에 결합하는 항체를 코딩하는 단리된 핵산 분자가 제공된다. 이러한 변형의 예는 상기 기재된다.
서열 2에 제시된 아미노산 서열을 포함하는 경쇄를 포함하며, 여기서 상기 경쇄 아미노산 서열은 하나 이상의 아미노산 변형을 포함하는 것인, 인간 조직 인자 경로 억제제에 결합하는 항체를 코딩하는 단리된 핵산 분자가 또한 제공된다. 이러한 변형의 예는 상기 기재된다.
서열 3에 제시된 아미노산 서열을 포함하는 중쇄를 포함하며, 여기서 상기 중쇄 아미노산 서열은 하나 이상의 아미노산 변형을 포함하는 것인, 인간 조직 인자 경로 억제제에 결합하는 항체를 코딩하는 단리된 핵산 분자가 또한 제공된다. 이러한 변형의 예는 상기 기재된다.
서열 4에 제시된 아미노산 서열을 포함하는 경쇄를 포함하며, 여기서 상기 경쇄 아미노산 서열은 하나 이상의 아미노산 변형을 포함하는 것인, 인간 조직 인자 경로 억제제에 결합하는 항체를 코딩하는 단리된 핵산 분자가 또한 제공된다. 이러한 변형의 예는 상기 기재된다.
또한, 상기 기재된 임의의 모노클로날 항체를 코딩하는 단리된 핵산 분자를 포함하는 벡터 및 이러한 벡터를 포함하는 숙주 세포도 제공된다.
TFPI에 대한 항체의 제조 방법
모노클로날 항체는 숙주 세포에서 본 발명의 실시양태에 따른 모노클로날 항체의 가변 영역을 코딩하는 뉴클레오티드 서열을 발현시켜 재조합 방식으로 생산될 수 있다. 뉴클레오티드 서열을 함유하는 핵산은 발현 벡터의 도움을 받아 이러한 생산에 적합한 숙주 세포로 형질감염되고 발현될 수 있다. 따라서, 또한
(a) 본 발명의 모노클로날 항체를 코딩하는 핵산 분자를 숙주 세포에 형질감염시키는 것,
(b) 숙주 세포에서 모노클로날 항체가 발현되도록 숙주 세포를 배양하는 것, 및 임의로
(c) 생산된 모노클로날 항체를 단리 및 정제하는 것을 포함하며, 여기서 핵산 분자는 본 발명의 모노클로날 항체를 코딩하는 뉴클레오티드 서열을 포함하는 것인,
인간 TFPI에 결합하는 모노클로날 항체의 생산 방법이 제공된다.
한 예에서, 항체 또는 그의 항체 단편을 발현시키기 위해, 표준 분자 생물학 기술로 수득된, 부분 또는 전장 경쇄 및 중쇄를 코딩하는 DNA를 발현 벡터 내로 삽입하여 상기 유전자가 전사 및 번역 제어 서열에 작동가능하게 연결되게 한다. 이와 관련하여, 용어 "작동가능하게 연결된"은 벡터 내의 전사 및 번역 제어 서열이 항체 유전자의 전사 및 번역을 조절하는 이들의 의도된 기능을 수행하도록, 항체 유전자가 벡터 내로 라이게이션되는 것을 의미한다. 발현 벡터 및 발현 제어 서열은 사용된 발현 숙주 세포와 상용가능한 것을 선택한다. 항체 경쇄 유전자 및 항체 중쇄 유전자를 별도의 벡터 내로 삽입할 수도 있고, 또는 보다 전형적으로는 이들 유전자 둘 다를 동일 발현 벡터 내로 삽입한다. 항체 유전자를 표준 방법 (예를 들어, 항체 유전자 단편 및 벡터 상의 상보적 제한 부위의 라이게이션, 또는 제한 부위가 존재하지 않는 경우에는 평활 말단 라이게이션)에 의해 발현 벡터 내로 삽입한다. 본원에 기재된 항체의 경쇄 및 중쇄 가변 영역을 사용하여, 이들을 바람직한 이소형의 중쇄 불변 및 경쇄 불변 영역을 이미 코딩하는 발현 벡터로 삽입하여 VH 절편이 벡터 내 CH 절편(들)에 작동가능하게 연결되게 하고 VL 절편이 벡터 내 CL 절편에 작동가능하게 연결되게 함으로써 임의의 항체 이소형의 전장 항체 유전자를 생성할 수 있다. 추가로 또는 대안적으로, 재조합 발현 벡터는 숙주 세포로부터의 항체 쇄 분비를 용이하게 하는 신호 펩티드를 코딩할 수 있다. 항체 쇄 유전자를 벡터 내로 클로닝하여 신호 펩티드가 항체 쇄 유전자의 아미노 말단에 인 프레임 연결되도록 할 수 있다. 신호 펩티드는 이뮤노글로불린 신호 펩티드 또는 이종 신호 펩티드 (즉, 비-이뮤노글로불린 단백질로부터의 신호 펩티드)일 수 있다.
항체 쇄 코딩 유전자 뿐만 아니라, 본 발명의 재조합 발현 벡터는 숙주 세포에서의 항체 쇄 유전자의 발현을 제어하는 조절 서열을 보유한다. 용어 "조절 서열"은 항체 쇄 유전자의 전사 또는 번역을 제어하는 프로모터, 인핸서 및 기타 발현 제어 요소 (예를 들어, 폴리아데닐화 신호)를 포함하는 것으로 의도된다. 이러한 조절 서열은 예를 들어 문헌 [Goeddel; Gene Expression Technology. Methods in Enzymology 185, Academic Press, San Diego, Calif. (1990)]에 기재되어 있다. 당업자는 조절 서열의 선택을 비롯한 발현 벡터의 설계가 형질전환될 숙주 세포의 선택, 바람직한 단백질의 발현 수준 등과 같은 요인에 따라 달라질 수 있음을 인지할 것이다. 포유동물 숙주 세포 발현을 위한 조절 서열의 예는 포유동물 세포에서의 높은 수준의 단백질 발현을 지시하는 바이러스 요소, 예컨대 시토메갈로바이러스 (CMV), 원숭이 바이러스 40 (SV40), 아데노바이러스 (예를 들어, 아데노바이러스 주요 후기 프로모터 (AdMLP)) 및 폴리오마로부터 유래된 프로모터 및/또는 인핸서를 포함한다. 대안적으로, 비바이러스 조절 서열, 예컨대 유비퀴틴 프로모터 또는 β-글로빈 프로모터를 사용할 수 있다.
항체 쇄 유전자 및 조절 서열 뿐만 아니라, 재조합 발현 벡터는 추가의 서열, 예를 들어 숙주 세포에서의 벡터의 복제를 조절하는 서열 (예를 들어, 복제 기점) 및 선택 마커 유전자를 보유할 수 있다. 선택 마커 유전자는 벡터가 도입된 숙주 세포의 선택을 용이하게 한다 (예를 들어, 미국 특허 번호 4,399,216, 4,634,665 및 5,179,017 (모두 Axel et al.) 참조). 예를 들어, 전형적으로, 선택 마커 유전자는 벡터가 도입된 숙주 세포에서 G418, 히그로마이신 또는 메토트렉세이트와 같은 약물에 대한 내성을 부여한다. 선택 마커 유전자의 예는 디히드로폴레이트 리덕타제 (DHFR) 유전자 (메토트렉세이트 선택/증폭을 이용하여 dhfr- 숙주 세포에서 사용하기 위함) 및 neo 유전자 (G418 선택을 위함)를 포함한다.
경쇄 및 중쇄의 발현을 위해, 중쇄 및 경쇄를 코딩하는 발현 벡터(들)를 표준 기술에 의해 숙주 세포로 형질감염시킨다. 다양한 형태의 용어 "형질감염"은 원핵 또는 진핵 숙주 세포 내로 외인성 DNA를 도입하는데 통상적으로 이용되는 광범위하게 다양한 기술, 예를 들어 전기천공, 칼슘-포스페이트 침전, DEAE-덱스트란 형질감염 등을 포함하는 것으로 의도된다. 본 발명의 항체를 원핵 또는 진핵 숙주 세포에서 발현시키는 것이 이론상 가능하긴 하지만, 항체를 진핵 세포, 가장 바람직하게는 포유동물 숙주 세포에서 발현시키는 것이 가장 바람직한데, 이는 이러한 진핵 세포, 특히 포유동물 세포가 적절하게 폴딩되고 면역학적으로 활성인 항체를 조립하고 분비하는데 있어서 원핵 세포보다 더 적합하기 때문이다.
재조합 항체를 발현시키기 위한 포유동물 숙주 세포의 예는 차이니즈 햄스터 난소 (CHO 세포) (예를 들어 문헌 [R. J. Kaufman and P. A. Sharp (1982) Mol. Biol. 159:601-621]에 기재된 바와 같이 DHFR 선택 마커와 함께 사용되는, 문헌 [Urlaub and Chasin, (1980) Proc. Natl. Acad. Sci. USA 77:4216-4220]에 기재된 dhfr- CHO 세포를 포함함), NSO 골수종 세포, COS 세포, HKB11 세포 및 SP2 세포를 포함한다. 항체 유전자를 코딩하는 재조합 발현 벡터가 포유동물 숙주 세포 내로 도입되는 경우, 항체는 숙주 세포에서의 항체 발현 또는 숙주 세포가 성장하는 배양 배지로의 항체 분비를 허용하기에 충분한 시간의 기간 동안 숙주 세포를 배양함으로써 생산된다. 항체는 표준 단백질 정제 방법, 예컨대 한외여과, 크기 배제 크로마토그래피, 이온 교환 크로마토그래피 및 원심분리를 이용하여 배양 배지로부터 회수될 수 있다.
무손상 항체를 발현하기 위한 부분 항체 서열의 사용
항체는 주로 6개의 중쇄 및 경쇄 CDR 내에 위치한 아미노산 잔기를 통해 표적 항원과 상호작용한다. 이러한 이유로, CDR 내의 아미노산 서열은 CDR 외부의 서열보다 개별 항체 사이에서 더 다양하다. CDR 서열이 대부분의 항체-항원 상호작용을 담당하기 때문에, 상이한 특성을 갖는 상이한 항체로부터의 프레임워크 서열로 이식된 특정 자연 발생 항체로부터의 CDR 서열을 포함하는 발현 벡터를 구축함으로써 특정 자연 발생 항체의 특성을 모방하는 재조합 항체를 발현시키는 것이 가능하다 (예를 들어, 문헌 [Riechmann, L. et al., 1998, Nature 332:323-327; Jones, P. et al., 1986, Nature 321:522-525; 및 Queen, C. et al., 1989, Proc. Natl. Acad. Sci. U.S.A. 86:10029-10033] 참조). 이러한 프레임워크 서열은 배선 항체 유전자 서열을 포함하는 공용 DNA 데이터베이스로부터 수득될 수 있다. 이들 배선 서열은, 이들이 B 세포 성숙 동안의 V(D)J 연결에 의해 형성되는 완전하게 조립된 가변 유전자를 포함하지 않을 것이기 때문에 성숙 항체 유전자 서열과는 상이할 것이다. 원래의 항체와 유사한 결합 특성을 갖는 무손상 재조합 항체를 재생성하기 위해서 특정 항체의 전체 DNA 서열을 수득할 필요는 없다 (WO 99/45962 참조). 전형적으로, CDR 영역에 걸쳐 있는 부분 중쇄 및 경쇄 서열이 이러한 목적에 충분하다. 부분 서열을 사용하여 재조합된 항체 가변 유전자에 기여하는 배선 가변 및 연결 유전자 절편을 결정한다. 이어서, 배선 서열을 사용하여 가변 영역의 손실 부분을 채운다. 중쇄 및 경쇄 리더 서열은 단백질 성숙 동안에 절단되고, 최종 항체의 특성에 기여하지 않는다. 이러한 이유로, 발현 구축물을 위한 상응하는 배선 리더 서열을 이용하는 것이 필요하다. 손실된 서열을 부가하기 위해, 클로닝된 cDNA 서열을 라이게이션 또는 PCR 증폭에 의해 합성 올리고뉴클레오티드와 조합시킬 수 있다. 대안적으로, 전체 가변 영역은 짧고 중첩되는 올리고뉴클레오티드 세트로 합성되고 PCR 증폭으로 조합되어 전체적으로 합성 가변 영역 클론을 생성할 수 있다. 이러한 공정은 특정한 제한 부위의 제거 또는 포함, 또는 특정한 코돈의 최적화와 같은 특정 이점을 갖는다.
중쇄 및 경쇄 전사체의 뉴클레오티드 서열은 합성 올리고뉴클레오티드의 중첩되는 세트를 설계하여 천연 서열과 동일한 아미노산 코딩 능력을 갖는 합성 V 서열을 생성하는데 사용된다. 합성 중쇄 및 경쇄 서열은 천연 서열과 상이할 수 있다. 예를 들어, 올리고뉴클레오티드 합성 및 PCR 증폭을 용이하게 하기 위해 반복된 뉴클레오티드 염기의 스트링이 개재되고, 코작(Kozak) 규칙 (문헌 [Kozak, 1991, J. Biol. Chem. 266:19867-19870])에 따라 최적의 번역 개시 부위가 혼입되고, 제한 부위가 번역 개시 부위의 상류 또는 하류에서 조작된다.
중쇄 및 경쇄 가변 영역 둘 다의 경우에, 최적화된 코딩 및 상응하는 비-코딩 가닥 서열은 상응하는 비-코딩 올리고뉴클레오티드의 중간 정도에서 30-50개 뉴클레오티드 분절로 절단된다. 따라서, 각 쇄마다 올리고뉴클레오티드는 150-400개 뉴클레오티드의 절편에 걸쳐 있는 중첩된 이중 가닥 세트로 조립될 수 있다. 이후, 상기 풀을 주형으로 사용하여 150-400개 뉴클레오티드의 PCR 증폭 산물을 생산한다. 전형적으로, 단일 가변 영역 올리고뉴클레오티드 세트는, 별도로 증폭되어 2개의 중첩된 PCR 산물을 생산하는 2개의 풀로 나뉠 것이다. 이어서, 이들 중첩 산물은 PCR 증폭에 의해 조합되어 완전 가변 영역을 형성한다. 또한, PCR 증폭시에 중쇄 또는 경쇄 불변 영역의 중첩된 단편을 포함시켜서 발현 벡터 구축물로 용이하게 클로닝될 수 있는 단편을 생성하는 것이 바람직할 수 있다.
이어서, 재구축된 중쇄 및 경쇄 가변 영역을 클로닝된 프로모터, 번역 개시, 불변 영역, 3' 비번역, 폴리아데닐화, 및 전사 종결 서열과 조합하여 발현 벡터 구축물을 형성한다. 중쇄 및 경쇄 발현 구축물을 단일 벡터 내로 조합하여 숙주 세포로 동시-형질감염시키거나 연속 형질감염시키거나 별도로 형질감염시킬 수 있고, 이어서 이는 융합되어 쇄를 둘 다 발현하는 숙주 세포를 형성한다.
따라서, 또 다른 측면에서, 인간 항-TFPI 항체의 구조적 특징을 사용하여 TFPI에 대한 결합 기능을 보유하는, 구조적으로 관련이 있는 인간 항-TFPI 항체를 생성한다. 보다 구체적으로, 본 발명의 모노클로날 항체의 구체적으로 확인된 중쇄 및 경쇄 영역의 1개 이상의 CDR은 공지의 인간 프레임워크 영역 및 CDR과 재조합 방식으로 조합되어 재조합 방식으로 조작된 본 발명의 추가의 인간 항-TFPI 항체를 생성할 수 있다.
제약 조성물
또한, 치료 유효량의 항-TFPI 모노클로날 항체 및 제약상 허용되는 담체를 포함하는 제약 조성물이 제공된다. "제약상 허용되는 담체"는 제제를 제제화하거나 또는 안정화시키는 것을 돕기 위해서 활성 성분에 추가될 수 있는 물질이고, 환자에게 유의한 해로운 독성 효과를 야기하지 않는다. 이러한 담체의 예는 당업자에게 공지되어 있으며, 물, 당, 예컨대 말토스 또는 수크로스, 알부민, 염, 예컨대 염화나트륨 등을 포함한다. 다른 담체는 예를 들어 문헌 [Remington's Pharmaceutical Sciences by E. W. Martin]에 기재되어 있다. 이러한 조성물은 치료 유효량의 적어도 하나의 항-TFPI 모노클로날 항체를 함유할 것이다.
제약상 허용되는 담체는 멸균 수용액 또는 분산액, 및 멸균 주사가능한 용액 또는 분산액의 즉석 제조를 위한 멸균 분말을 포함한다. 제약 활성 물질을 위한 이러한 매질 및 작용제의 사용은 당업계에 공지되어 있다. 조성물은 바람직하게는 비경구 주사용으로 제제화된다. 조성물은 용액, 마이크로에멀젼, 리포솜, 또는 높은 약물 농도에 적합한 다른 정렬된 구조로서 제제화될 수 있다. 담체는, 예를 들어 물, 에탄올, 폴리올 (예를 들어, 글리세롤, 프로필렌 글리콜 및 액체 폴리에틸렌 글리콜 등), 및 이들의 적합한 혼합물을 함유하는 용매 또는 분산 매질일 수 있다. 일부 경우에, 조성물 중에 등장화제, 예를 들어 당, 폴리알콜, 예컨대 만니톨, 소르비톨 또는 염화나트륨을 포함시킬 것이다.
멸균 주사가능한 용액은 필요량의 활성 화합물을 필요에 따라 상기 기재된 성분들 중 하나 또는 이들의 조합물과 함께 적절한 용매 중에 혼입시킨 후에 멸균 마이크로여과를 수행하여 제조될 수 있다. 일반적으로, 분산액은 활성 화합물을 염기성 분산 매질 및 상기 열거된 것으로부터 요구되는 다른 성분을 함유하는 멸균 비히클 내에 혼입시켜 제조한다. 멸균 주사가능한 용액를 제조하기 위한 멸균 분말의 경우, 일부 제조 방법은 활성 성분 및 임의의 추가의 바람직한 성분의 분말을 이것의 미리 멸균-여과시킨 용액으로부터 생성하는 진공 건조 및 냉동-건조 (동결건조)이다.
제약 용도
모노클로날 항체는 응고에서의 유전적 및 후천적 결핍 또는 결함을 치료하기 위한 치료 목적으로 사용될 수 있다. 예를 들어, 상기 기재된 실시양태에서의 모노클로날 항체는 TFPI와 FXa의 상호작용을 차단하거나 TF/FVIIa 활성의 TFPI-의존성 억제를 방지하는데 사용될 수 있다. 추가로, 모노클로날 항체는 또한 TF/FVIIa-구동된 FXa의 생성을 복원시켜서 FXa의 FVIII- 또는 FIX-의존성 증폭의 부족을 우회시키는데 사용될 수도 있다.
모노클로날 항체는 지혈 장애, 예컨대 혈소판감소증, 혈소판 장애 및 출혈 장애 (예를 들어, 혈우병 A, 혈우병 B 및 혈우병 C)의 치료에서 치료 용도를 갖는다. 이러한 장애는 치료 유효량의 항-TFPI 모노클로날 항체를 이러한 장애의 치료가 필요한 환자에게 투여함으로써 치료될 수 있다. 모노클로날 항체는 또한 외상 및 출혈성 뇌졸중과 같은 적응증에서의 제어되지 않는 출혈의 치료에서 치료 용도를 갖는다. 따라서, 또한, 치료 유효량의 본 발명의 항-TFPI 모노클로날 항체를 출혈 시간의 단축을 필요로 하는 환자에게 투여하는 것을 포함하는, 출혈 시간을 단축시키는 방법이 제공된다.
항체는 지혈 장애를 해결하기 위해 단일요법으로서 또는 다른 요법과 조합되어 사용될 수 있다. 예를 들어, 본 발명의 하나 이상의 항체와 응고 인자, 예컨대 인자 VIIa, 인자 VIII 또는 인자 IX의 공동 투여는 혈우병 치료에 유용하다고 여겨진다. 한 실시양태에서, (a) 인간 조직 인자 경로 억제제에 결합하는, 제1 양의 모노클로날 항체, 및 (b) 제2 양의 인자 VIII 또는 인자 IX를 투여하는 것을 포함하며, 여기서 상기 제1 및 제2 양은 함께 응고에서의 유전적 및 후천적 결핍 또는 결함의 치료에 효과적인 것인, 응고에서의 유전적 및 후천적 결핍 또는 결함을 치료하는 방법이 제공된다. 또 다른 실시양태에서, (a) 인간 조직 인자 경로 억제제에 결합하는, 제1 양의 모노클로날 항체, 및 (b) 제2 양의 인자 VIII 또는 인자 IX를 투여하는 것을 포함하며, 여기서 상기 제1 및 제2 양은 함께 응고에서의 유전적 및 후천적 결핍 또는 결함의 치료에 효과적이고, 추가로 여기서 인자 VII는 공동 투여되지 않는 것인, 응고에서의 유전적 및 후천적 결핍 또는 결함을 치료하는 방법이 제공된다. 본 발명은 또한 본 발명의 모노클로날 항체 및 인자 VIII 또는 인자 IX의 조합물의 치료 유효량을 포함하고 인자 VII는 함유하지 않는 제약 조성물을 포함한다. "인자 VII"는 인자 VII 및 인자 VIIa를 포함한다. 이러한 조합 요법은 응고 인자의 필요한 주입 빈도를 감소시킬 수 있다. 공동-투여 또는 조합 요법은, 각각 별도로 제제화되거나 하나의 조성물 중에 함께 제제화된 2종의 치료 약물의 투여를 의미하고, 별도로 제제화된 경우에는 대략 동일한 시간에 또는 상이한 시간이지만 동일한 치료 기간에 걸쳐서 투여된다.
일부 실시양태에서, 본원에 기재된 하나 이상의 항체는 지혈 장애를 다루기 위해 조합되어 사용될 수 있다. 예를 들어, 본원에 기재된 항체 중 2개 이상의 공동-투여는 혈우병 또는 다른 지혈 장애를 치료하기에 유용한 것으로 여겨진다.
제약 조성물은 혈우병 A 또는 B에 걸린 대상체에게 출혈 에피소드의 중증도에 따라 달라질 수 있거나 예방 요법의 경우에는 환자의 응고 결핍의 중증도에 따라 달라질 수 있는 투여량 및 빈도로 비경구 투여될 수 있다.
조성물은 볼루스로서 또는 연속 주입에 의해 필요한 환자에게 투여될 수 있다. 예를 들어, Fab 단편으로 제시되는 본 발명의 항체의 볼루스 투여는 0.0025 내지 100 mg/kg 체중, 0.025 내지 0.25 mg/kg, 0.010 내지 0.10 mg/kg 또는 0.10 내지 0.50 mg/kg의 양일 수 있다. 연속 주입의 경우, Fab 단편으로 제시되는 본 발명의 항체는 0.001 내지 100 mg/kg 체중/분, 0.0125 내지 1.25 mg/kg/분, 0.010 내지 0.75 mg/kg/분, 0.010 내지 1.0 mg/kg/분 또는 0.10 내지 0.50 mg/kg/분으로 1-24시간, 1-12시간, 2-12시간, 6-12시간, 2-8시간, 또는 1-2시간의 기간 동안 투여될 수 있다. 전장 항체 (완전 불변 영역을 가짐)로 제시되는 본 발명의 항체를 투여하는 경우, 투여량은 약 1-10 mg/kg 체중, 2-8 mg/kg, 또는 5-6 mg/kg일 수 있다. 이러한 전장 항체는 전형적으로 30분 내지 3시간의 기간 동안 지속되는 주입을 통해 투여된다. 투여 빈도는 상태의 중증도에 따라 달라진다. 빈도는 1주마다 3회 내지 2주 내지 6개월마다 1회의 범위일 수 있다.
추가로, 조성물은 피하 주사를 통해 환자에게 투여될 수 있다. 예를 들어, 10 내지 100 mg 용량의 항-TFPI 항체가 매주, 격주 또는 매달 피하 주사를 통해 환자에게 투여될 수 있다.
본원에 사용된 바와 같이, "치료 유효량"은 생체내 응고 시간을 효과적으로 증가시키거나 또는 필요한 환자에게 생체내 측정가능한 이점을 야기하는데 요구되는, 항-TFPI 모노클로날 항체 또는 이러한 항체 및 인자 VIII 또는 인자 IX의 조합물의 양을 의미한다. 정확한 양은 치료 조성물의 성분 및 물리적 특성, 의도된 환자 집단, 개별 환자의 고려사항 등을 포함하나 이에 제한되지 않는 수많은 요인에 따라 달라질 것이고 당업자가 용이하게 결정할 수 있다.
실시예
실시예 1. 클로닝, 발현 및 항체 발현 수준의 정량화
중쇄의 C-말단에 c-myc-태그 및 헥사-히스티딘 태그를 보유하는 야생형 Fab 2A8 및 4B7의 중쇄 및 경쇄를 pET28a 박테리아 발현 벡터 (노바젠(Novagen)/머크 케미칼스 리미티드(Merck Chemicals Ltd.), 영국 노팅엄) 내로 서브클로닝하고, Top10F' 세포 (인비트로젠 게엠베하(Invitrogen GmbH), 독일 카를스루에) 내로 형질전환시켰다. 대안적으로, 다른 박테리아 발현 벡터 (예를 들어, pQE 벡터 시스템, 퀴아젠 게엠베하(Qiagen GmbH), 독일 힐덴) 및 균주 (예를 들어, DH5α, 인비트로젠 게엠베하, 독일 카를스루에)를 사용할 수 있다. 표준 올리고-기반 부위-지정 돌연변이유발에 의해 변이체를 생성하고, DNA 서열분석에 의해 확인하였다. 특히, 상보성 결정 영역 내의 또는 주변의 아미노산 잔기가 중쇄 및/또는 경쇄 내에서 변형되었다.
야생형 또는 돌연변이체 항체를 경쟁자로 사용할 수 있도록 하기 위해, 중쇄의 C-말단에 위치한 에피토프-태그는 표준 PCR-기반 기술을 이용하여 제거 또는 대체하였다. 특히, 4B7의 경우에 c-myc-태그를 분석되는 모든 변이체에 대해 헤마글루티닌 (HA) 에피토프 태그로 교환하였다. 대조적으로, 경쟁자로 사용되는 4B7 야생형 또는 변이체는 c-myc-태그를 보유하였다. 2A8의 경우에, c-myc-에피토프 태그를 HA-태그에 의해 대체하거나 또는 결실시켜, 그의 C-말단에서 오직 6x 히스티딘 에피토프 태그를 디스플레이하는 변이체를 생성하였다.
발현을 위해, 변이체를 BL21starDE3 에스케리키아 콜라이(Escherichia coli) 균주 (인비트로젠, C6010-03) 내로 형질전환시키고, 카나마이신 (30 ㎍/ml)을 함유하는 LB 배지에서 밤샘 배양물 내로 접종하고, 37℃에서 18시간 동안 인큐베이션하였다. 밤샘 배양물을 카나마이신 (30 ㎍/ml)이 함유된 새로운 LB 배지 내로 1:20으로 접종함으로써 발현 배양물을 생성하였다. 6시간 후, 1 mM 이소프로필-b-D-1-티오갈락토피라노시드 (로쓰(Roth), 2316.5)를 첨가하여 항체 발현을 유도하고, 배양물을 추가의 18시간 동안 30℃에서 인큐베이션하였다. 대안적으로, 밤샘 배양물을 자가유도 배지 밤샘 발현 TB 배지 (머크, 71491) 내로 1:20으로 접종하고, 24시간 동안 30℃에서 인큐베이션하였다.
발현 수준의 정량화을 위해, ELISA 접근법을 사용하였다. 간략하게, MTP 플레이트 (눈크 맥시소르프 블랙(Nunc maxisorp black), 460518)를 코팅 완충제 (칸도르 바이오사이언스 게엠베하(Candor Bioscience GmbH), 121500)에서 희석된 Fab-특이적 항체 (시그마(Sigma), I5260)와 4℃에서 밤새 인큐베이션하고, PBST (포스페이트 완충 염수: 137mM NaCl, 머크 1.06404.5000; 2.7mM KCl, 머크 1.04936.1000; 10mM Na2HPO4, 머크 1.06586.2500, 1.8mM KH2PO4 , 머크 1.04871.5000; 0.05% 트윈 20 아크로스 오가닉스(Acros Organics), 233360010 함유)로 세척하고, PBST 중 2% 우유로 실온에서 1시간 동안 차단하고, 다시 세척하였다. 배양물을 PBS에서 0.25% 탈지유 (플루카 어낼리티컬(Fluka analytical), 70166)에 희석하고 실온에서 1시간 동안 MTP 플레이트에 결합시켰다. PBST로 세척한 후에, 포획된 항체를 HRP-커플링된 항-Fab 항체 (시그마, A0293)와 인큐베이션하고, 플레이트를 10 μM 암플렉스 레드(amplex red) 기질 (인비트로젠, A12222)과 어두운 곳에서 10 내지 30분 동안 실온에서 인큐베이션한 후 형광 측정에 의해 검출하였다. 발현 수준은 야생형 정제된 항체 (2A8 또는 4B7)와 관련하여 농도를 결정한 후 정규화하였다.
실시예 2. 생성된 항체 변이체의 활성 및 종간 교차 반응성의 결정
인간 또는 마우스 TFPI 상의 돌연변이된 항체 변이체 (각각 아메리칸 다이아그노스티카(American Diagnostica), 4900B 및 R&D 시스템즈(R&D Systems), 2975-P1)의 활성을 결정하기 위해, 평형 또는 경쟁적 ELISA 검정 포맷을 이용하였다. 간략하게, MTP 플레이트 (메조스케일 디스커버리(Mesoscale Discovery), L21XA-4 또는 눈크 맥시소르프 블랙, 460518)를 각각 포스페이트 완충 염수 (PBS) 또는 코팅 완충제 (칸도르 바이오사이언스 게엠베하, 121500)에 희석된 0.04-2 ㎍/ml의 인간 또는 마우스 TFPI로 코팅하고, 밤새 4℃에서 인큐베이션하였다. 세척 후에, 플레이트를 실온에서 1시간 동안 PBST 중 3% 소 혈청 알부민 (시그마, A4503)으로 차단하고, 세척 단계를 반복하였다. 항체의 결합을 위해, (달리 나타내지 않는 한) 그의 각각의 항체 발현 수준에 대해 정규화된 배양 상청액 10-25 ㎕를 RT에서 1시간 동안 플레이트에 첨가한 후에 PBST로 세척하였다. 이어서, 결합된 야생형 및 변이체를 에피토프 태그 특이적 항체에 의해 검출하거나 또는 경쟁 단계에 포함시켰다. 경쟁을 위해, 50-300 nM 경쟁자 또는 유리 항원을 첨가하고, 실온에서 20분 내지 24시간 동안 인큐베이션하였다. 세척 후에, 잔류 변이체를 양고추냉이 퍼옥시다제에 커플링된 에피토프 태그 특이적 항체 (바이오몰(Biomol), 2A8 변이체의 경우 항-c-myc A190-105P 및 4B7 변이체의 경우 항-HA A190-108P)로 또는 이전에 전기화학발광 검출에 대한 제조업체의 지시에 따라 술포-NHS 시약 (메조스케일 디스커버리, R91AN-1)으로 표지된 항-myc (시그마, C3956) 또는 항-HA 항체 (시그마, H6908)에 의해 검출하였다. 맥시소르프 플레이트에서의 신호 검출을 위해 10μM 암플렉스 레드 기질 (인비트로젠, A12222)을 첨가하고, 어두운 곳에서 10 내지 30분 동안 실온에서 인큐베이션한 후에 형광 측정하였다. MSD 플레이트에서의 검출을 위해, MSD 판독 완충제 T를 H2O 중에서 2x로 희석하고 (메조스케일 디스커버리, R92TC-1), 플레이트에 첨가하고, 전기화학발광 신호를 메조스케일 디스커버리 섹터 영상화기 6000을 이용하는 620 nm에서 검출하였다.
실시예 3. 단일 및 다중 아미노산 치환
2A8의 중쇄 또는 경쇄에 도입된 단일 아미노산 치환의 여러 예가 표 1에 제공된다. 변이체의 발현 수준은 정량화 ELISA에서 4중으로 분석하였다. 각각의 발현 수준에 대한 정규화 후에, 성능을 인간 및 뮤린 TFPI 상에서의 경쟁적 ELISA에서 4중으로 분석하고, 변이체 대 야생형 (wt) 비를 결정하였다. 오차는 표준 편차로부터의 오차 전파에 의해 계산하였다.
2A8 TFPI 항체 내의 조합된 아미노산 치환의 일부 예가 표 2에 제공된다. 모든 조합이 표 2에 제공된 것은 아니지만, TFPI 항체가 제공된 변형의 임의의 조합을 포함할 수 있을 것으로 고려된다. 변이체의 발현 수준은 정량화 ELISA에서 4중으로 분석하였다. 달리 나타내지 않는 한, 변이체를 각각의 발현 수준에 대해 정규화하고, 성능을 인간 및 뮤린 TFPI 상에서의 경쟁적 ELISA에서 4중으로 분석한 후에 변이체 대 참조물 (HC_K99L) 비를 계산하였다. 값은 변이체 성능을 사전 정규화하지 않고 분석한 경우에 "#"으로 표시하였고, 검정 신호를 발현 수준으로 나누어 변이체 대 참조물 비를 발현 수준에 대해 정규화하였다. 상이한 참조물이 경쟁적 ELISA에 사용되고, 변이체를 사전 정규화하지 않고 분석한 경우에, 값은 "*"로 표시하였다. 이러한 변이체의 경우, 변이체/대안적 참조물 비를 대안적 참조물/HC_K99L 비와 곱하여 표에 열거된 값을 계산하였다. 오차는 표준 편차로부터의 오차 전파에 의해 계산하였다.
4B7의 중쇄 및/또는 경쇄에 도입된 단일 및/또는 이중 아미노산 치환의 여러 예가 표 3에 제공된다. 변이체의 발현 수준은 정량화 ELISA에서 4중으로 분석하였다. 각각의 발현 수준에 대해 정규화한 후에, 성능을 인간 TFPI 상에서의 경쟁적 ELISA 및 뮤린 TFPI 상에서의 평형 ELISA에서 4중으로 분석한 후에 변이체 대 야생형 비를 결정하였다. 오차는 표준 편차로부터의 오차 전파에 의해 계산하였다.
4B7 TFPI 항체 내의 아미노산 치환의 조합의 일부 예가 표 4에 제공된다. 모든 조합이 표 4에 제공된 것은 아니지만, TFPI 항체가 제공된 변형의 임의의 조합을 포함할 수 있을 것으로 고려된다. 변이체의 발현 수준은 정량화 ELISA에서 4중으로 분석하였다. 달리 나타내지 않는 한, 변이체를 각각의 발현 수준에 대해 정규화하고, 성능을 인간 및 뮤린 TFPI 상에서의 경쟁적 ELISA에서 4중으로 분석한 후에 변이체 대 참조물 (HC_D62R) 비를 계산하였다. 상이한 참조물을 사용하고, 변이체를 사전 정규화하지 않고 분석한 경우에, 값은 "*"로 표시하였다. 이러한 변이체의 경우, 변이체/대안적 참조물 비를 대안적 참조물/HC_D62R 비와 곱하여 표에 열거된 값을 계산하였다. 오차는 표준 편차로부터의 오차 전파에 의해 계산하였다. nb: 사용된 검정 조건 하에 결합이 검출되지 않음.
실시예 4. 항체의 정제
세포를 4℃에서 30분 동안 9000 rpm에서 원심분리에 의해 수확하고, -20℃에 저장하였다. 상청액을 완충제 A (50 mM NaH2PO4, 300mM NaCl, 10 mM 이미다졸 pH8.0)로 완충제-교환하고, 농축시키고, 2-단계 정제 절차를 이용하여 정제하였다. 간략하게, 100 ml 농축된 상청액을 5 ml Ni-NTA 슈퍼플로우 칼럼 (퀴아젠, 1018142) 상에 로딩하고, 우선 5x 칼럼 부피의 완충제 A로 세척한 후에 5x 칼럼 부피의 4.3% 완충제 B (50 mM NaH2PO4, 300 mM NaCl, 250 mM 이미다졸 pH8.0)로 세척하고, 7 부피의 완충제 B로 용리하였다. 분획을 합하고, PBS에서 투석시켰다. 제2 정제 단계에서, Ni-NTA 정제된 항체를 경쇄-특이적 친화성 매트릭스, 즉 각각 2A8 및 4B7에 대해 포획 선택 람다 또는 카파 (각각 BAC 0849.010 및 BAC 0833.10)와 인큐베이션하였다. 4℃에서 밤새 인큐베이션한 후에, 매트릭스를 칼럼에 로딩하고, 5 부피의 PBS, 5 부피의 500 mM 아르기닌 100 mM NaH2PO4 , 100 mM NaCl pH6.0, 다시 5 부피의 PBS로 세척하였다. 항체를 6 부피의 100 mM 글리신 (pH3.0)에 이어 3 부피의 100 mM 글리신 (pH2.0)으로 용리하고, 용리액의 중화를 위해 총 부피의 1/10의 1M HEPES (pH 7.5)로 용리하였다. 최종적으로, 용리액을 4℃에서 밤새 PBS에서 투석시켰다. 정제된 항체를 SDS-PAGE 및 질량 분광측정법에 의해 분석하였다.
실시예 5. 표면 플라즈몬 공명 (비아코어(Biacore))를 이용하는 TFPI에 대한 항체 결합의 친화도의 측정
인간 또는 마우스 TFPI를 분석을 위해 표면 상에 고정시켰다. CM5-칩 및 아민 커플링 키트 (지이 헬쓰케어(GE HealthCare))를 사용하여 제조업체로부터의 지시에 따라 리간드를 고정시켰다. 고정된 TFPI의 양은 100 RU의 RMax를 생성할 수 있는 항체의 질량에 적합한 대략 70 RU였다. 모 및 친화도 성숙 항-TFPI 항체는 이동상에 있었다. 친화도 결정은 적어도 5가지 상이한 농도 (0.1, 0.4, 1.6, 6.4 및 25 nM)의 정제된 항체로 수행하였다.
CDR 영역에 단일 돌연변이를 함유하는 항체 변이체를 분석함으로써, 본 발명자들은 ELISA 결합 검정에서 더 높은 신호를 갖는 다수의 클론을 확인하였다. 선택된 클론을 정제하고, 인간 또는 마우스 TFPI에 대한 그의 친화도를 비아코어를 이용하여 분석하였다. 표 5 및 표 6에 나타낸 바와 같이, 이러한 클론은 모 항체 2A8 또는 4B7 보다 TFPI에 대해 더 높은 친화도를 갖는다. 2A8 돌연변이체의 일부가 모 항체 2A8 보다 더 느린 회합 속도 (ka)를 갖더라도, 모든 이러한 돌연변이체는 2A8 보다 훨씬 더 느린 해리 속도 (kd)를 갖는다. 전반적으로, 이러한 단일 돌연변이는 인간 TFPI에 대해 1.47 내지 7.22배의 범위 및 마우스 TFPI에 대해 1.71 내지 7.20배 범위로 2A8의 친화도를 증가시켰다. 본 발명자들이 4B7 변이체를 분석하였을 때, 중쇄 CDR2 도메인 내의 D62R 돌연변이는 신호를 현저하게 증가시켰다. 이 클론을 친화도 측정을 위해 선택하였다. 표 5 및 표 6에 나타낸 바와 같이, 이 단일 돌연변이는 인간 TFPI에 대한 4B7의 친화도를 11.1 nM에서 58.2 pM으로 증가시켰다 (191배 개선). 4B7HcD62R의 느린 해리 속도 (kd)는 주로 그의 친화도 개선 (4B7의 8.40x10-3/s에서 4B7HcD62R의 1.65x10-4로, 대략 50배 개선)에 기여한다. 유사하게, 이 돌연변이는 마우스 TFPI에 대한 4B7의 친화도를 58.6 nM에서 427 pM으로 증가시켰다 (137배 개선).
다음에, 2A8 및 4B7 내의 다중 돌연변이의 결합 친화도를 연구하였다. 표 7(a) 및 표 8(a)에 나타낸 바와 같이, CDR 도메인에 다중 돌연변이를 함유하는 2A8의 돌연변이체는 인간 TFPI 및 마우스 TFPI 결합 둘 다에 대해 단일 돌연변이된 2A8보다 더 높은 친화도를 갖는다. 예를 들어, 2A8-200은 인간 TFPI 결합에 대해 2A8보다 53.7배 더 높은 친화도를 갖고, 마우스 TFPI 결합에 대해 55.4배 더 높은 친화도를 갖는다. 표 7(b) 및 표 8(b)에 나타낸 바와 같이, CDR 도메인에 다중 돌연변이를 함유하는 4B7의 돌연변이체는 인간 TFPI 및 마우스 TFPI 결합 둘 다에 대해 단일 돌연변이된 4B7보다 더 높은 친화도를 갖는다. 표 7 및 8에 제공된 모 2A8 및 4B7 서열로부터의 이들 변이체가 또한 서열 목록에 제공되었다. 서열 5-11은 표 7 및 8에 열거된 2A8의 중쇄 변이체에 해당한다. 서열 12-18은 2A8의 경쇄 변이체에 해당한다. 서열 19-26은 표 7 및 8에 열거된 4B7의 중쇄 변이체에 해당한다. 서열 27-34는 4B7의 경쇄 변이체에 해당한다.
[표 7(a)]
[표 7(b)]
[표 8(a)]
[표 8(b)]
실시예 6. 친화도-개선된 항체는 FXa 활성의 복원에서 더 높은 효능을 보여주었다
친화도-개선된 항-TFPI 항체가 또한 TFPI 단백질의 억제 효과를 차단함으로써 FXa 활성의 복원에서 그의 효능을 개선시키는지 결정하기 위해, 본 발명자들은 FXa 복원 검정을 수행했다. 본 검정에서, 다양한 지정량의 개별 친화도-개선된 항체 (30 ㎕)를 실온에서 30분 동안 50 ㎕의 전체 반응 혼합물 중에서 고정량의 인간, 마우스 또는 래트 재조합 TFPI (20 ㎕, 6.6 nM)와 인큐베이션하였다. 인큐베이션 후에, 50 ㎕의 FXa (3.39 nM)를 반응 혼합물에 첨가하고, 30분 동안 37℃에서 인큐베이션하였다. 이어서, 20 ㎕의 스펙트로자임 FXa 기질을 반응 혼합물에 첨가하였다. 12분의 인큐베이션 후에, 각각의 웰의 흡광도는 플레이트 판독기 (몰레큘라 디바이스(Molecular Device))를 이용하여 405 nm에서 판독하였다. 각각의 실험을 위해, 공지된 양의 TFPI에 의해 억제된 동일량의 FXa (3.39 nM)의 선형 표준 곡선을 수득하였다. 100% 복원된 FXa 활성을 어떠한 양의 TFPI도 첨가하지 않은 FXa 활성으로 규정하고, 0% 활성을 TFPI 단백질 (6.6 nM)의 존재 하의 FXa 활성으로 규정하였다. 이에 따라, 절반 최대 억제 농도 (IC50)를 각각의 개별 항-TFPI 항체에 대해 계산하고, 이들 중 일부를 표 9에 제공하였다. 절반 최대 유효 농도 (EC50)를 또한 선택된 2A8 제2-라운드 변이체에 대해 계산하고, 표 10에 제공하였다.
실시예 7. 친화도-개선된 항체는 dPT 검정에서 응고 시간 단축에서 더 높은 효능을 보여주었다
이러한 친화도-개선된 항체가 또한 응고 시간 단축에서 효능을 개선시키는지 확인하기 위해, 인간 혈우병 A 혈장을 이용하여 응고 시간에 대한 선택된 친화도-성숙 항체의 효과를 결정하는 dPT를 수행하였다. dPT 검정은 본질적으로 문헌 [Welsch et al. (Thrombosis Res., 1991, 64(2): 213-222)]에 기재된 바와 같이 하여 수행하였다. 간략하게, 인간 혈우병 A 혈장 (조지 킹 바이오메디칼(George King Biomedical))은 혈장을 0.1 부피의 대조군 완충제 (음성 대조군으로서) 또는 지정된 항-TFPI 항체와 혼합함으로써 제조하였다. 30분 동안 25℃에서 인큐베이션한 후에, 각각의 제조된 혈장 샘플 (100 ㎕)을 트롬보플라스틴 공급원으로서의 적절하게 희석된 (1:500 희석) 심플라스틴(Simplastin) (바이오메티에욱스(Biometieux)) 100 ㎕ 및 25 mM 염화칼슘 100 ㎕와 합하였다. 응고 시간은 염화칼슘을 첨가한 직후에 섬유측정기 STA4 (스타고(Stago))를 이용하여 결정하였다.
실시예 8. 친화도-개선된 항체는 항-인자 VIII 항체-유도된 인간 혈우병 A 혈액을 이용하는 전혈 응고 시간 단축에서 더 높은 효능을 보여주었다
친화도-개선된 항체가 응고 시간 단축에서 더 높은 효능을 나타내는지 확인하기 위해, 본 발명자들은 로템(ROTEM) 시스템을 이용하여 억제제가 있는 혈우병 A 환자로부터의 혈액을 모방하는 인간 FVIII-중화 항체-유도된 혈우병 A 혈액에서의 응고 시간에 대한 이들 항체의 효과를 시험하였다. 로템 시스템 (펜타팜 게엠베하(Pentapharm GmbH))은 4-채널 기기, 컴퓨터, 혈장 표준물, 활성화제 및 1회용 컵 및 핀을 포함한다. 로템 지혈 시스템의 혈전탄성검사 파라미터는 다음을 포함한다: 응고 시간 (CT) (혈액 응고를 개시하기 위한 반응 시간 (데이터 수집 개시 후에 2 mm 크기를 수득하는데 필요한 시간)을 반영), 혈병 형성 시간 (CFT) 및 알파 각 (혈액 응고 전파를 반영), 및 최대 크기 및 최대 탄성 계수 (혈병 견고성을 반영). 로템 검정에서, FVIII 활성을 FVIII에 대한 폴리클로날 항체의 첨가에 의해 중화시킨, 새로 추가된 시트레이트화 전혈 300 ㎕를 사용하여 모 항-TFPI 항체와 비교한 친화도-개선된 항-TFPI 항체의 효과를 시험하였다. 모든 구성성분을 제조업체의 지시에 따라 재구성하고 혼합하여, 각각의 시스템에 필요한 시간의 기간 동안 데이터를 수집하였다. 간략하게, 자동화 피펫으로 혈액 또는 혈장 300 ㎕를 꺼내어 CaCl2 (200 mmol) 20 ㎕가 첨가된 로템 컵에 분배한 직후에 샘플을 혼합하는 방식으로 샘플을 혼합하고, 데이터 수집을 개시하였다. 컴퓨터-제어된 (소프트웨어 버전 2.96) 로템 시스템을 이용하여 2시간 동안 데이터를 수집하였다.
혈액 응고 시간 단축에서 친화도-개선된 항-TFPI 항체의 효과를 검출하는 로템 검정의 예시적인 결과를 도 2 및 3에 제시하였다. 도 2는 인간 항체-유도된 혈우병 혈액의 응고 시간에 대한 선택된 제1 라운드 친화도-성숙 항-TFPI 항체의 효과를 보여준다. 많이 친화도-개선된 항체, 2A8-9 및 2A8-17은 인간 항체-유도된 혈우병 A 혈액에서의 응고 시간 단축에서 훨씬 더 높은 효능을 나타낸 반면, TFPI에 대한 그의 결합 친화도가 개선되지 않은 2A8-10은 모 2A8 항체와 비교하여 유사한 응고 효능을 유지하였다.
실시예 9. 친화도-개선된 항체는 혈우병 A 마우스의 꼬리-정맥-횡절단 모델에서 더 우수한 생존율을 보여준다
친화도-개선된 항체가 출혈 중인 마우스에 대한 보호 효과에서 보다 높은 효능을 나타내는지 결정하기 위해, 혈우병 A 마우스의 꼬리-정맥-횡절단 모델을 이용하였다. 마우스에게 다양한 지정량의 모 항-TFPI 항체 2A8 또는 다양한 지정량의 A200을 손상 24시간 전에 꼬리 정맥 주입을 통해 투여하였다. 투여 24시간 후에, 꼬리의 왼쪽 정맥을 첨단부로부터의 2.7 mm (직경)에서 횡절단하였다. 횡절단 후 24시간에 걸쳐 생존을 관찰하였다. 생존율은 재조합 FVIII (10 IU/kg 내지 30 IU/kg)와 함께 투여된 경우 용량-의존성인 것으로 입증되었다.
도 4는 선택된 친화도-개선된 항체 A200이 대조군 마우스 IgG1 (CTX IgG1)과 비교하여 용량-의존성 방식으로 혈우병 A 마우스의 생존을 현저하게 연장시켰으며, 각각의 동등한 용량에서 모 항체 2A8보다 더 우수한 생존율을 나타내었음을 보여준다.
실시예 10. 친화도-개선된 항체는 인간 혈우병 C (FXI-결핍) 혈장을 이용하여 증진된 응고를 보여주었다
또한, 로템 검정을 이용하여 혈우병 C 환자를 모방하는 인간 인자 XI 결핍 (FXI-결핍) 혈장에서의 응고 시간에 대한 항체의 효과를 시험하였다. 혈장 응고 시간의 단축에서 친화도-개선된 항-TFPI 항체의 효과를 검출하는 이러한 로템 검정의 결과를 도 5에 제시하였다. 도 5는 2A8 변이체, 2A8-200이 용량-의존성 방식으로 인간 혈우병 C 혈장에서의 응고를 증진시켰으며, 그의 효과가 재조합 FVIIa의 효과와 대등하다는 것을 보여준다.
본 발명을 구체적 실시양태 및 실시예를 언급하며 기재하였지만, 본 발명의 실질적인 사상 및 범위에서 벗어나지 않고도 다양한 변형 및 변화가 가해질 수 있고 등가물이 대체될 수 있음을 이해해야 한다. 따라서, 명세서 및 실시예는 제한적인 의미가 아니라 예시적인 것으로서 간주되어야 한다. 추가로, 본원에서 언급된 모든 논문, 서적, 특허 출원 및 특허는 그 전문이 본원에 참고로 포함된다.
SEQUENCE LISTING
<110> Bayer HealthCare LLC
<120> Optimized Monoclonal Antibodies against Tissue Factor Pathway
Inhibitor (TFPI)
<130> BHC 10 5 001 PCT
<160> 34
<170> PatentIn version 3.5
<210> 1
<211> 117
<212> PRT
<213> Homo sapiens
<400> 1
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Arg Ser Tyr
20 25 30
Gly Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Arg Gly Ser Ser Ser Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Lys Tyr Arg Tyr Trp Phe Asp Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 2
<211> 108
<212> PRT
<213> Homo sapiens
<400> 2
Asp Ile Glu Leu Thr Gln Pro Pro Ser Val Ser Val Ala Pro Gly Gln
1 5 10 15
Thr Ala Arg Ile Ser Cys Ser Gly Asp Asn Leu Arg Asn Tyr Tyr Ala
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Val Val Ile Tyr
35 40 45
Tyr Asp Asn Asn Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Gly Thr Gln Ala Glu
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Gln Ser Trp Asp Asp Gly Val Pro Val
85 90 95
Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Gln
100 105
<210> 3
<211> 123
<212> PRT
<213> Homo sapiens
<400> 3
Gln Val Gln Leu Gln Gln Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Ile Ser Gly Asp Ser Val Ser Ser Asn
20 25 30
Ser Ala Ala Trp Ser Trp Ile Arg Gln Ser Pro Gly Arg Gly Leu Glu
35 40 45
Trp Leu Gly Ile Ile Tyr Lys Arg Ser Lys Trp Tyr Asn Asp Tyr Ala
50 55 60
Val Ser Val Lys Ser Arg Ile Thr Ile Asn Pro Asp Thr Ser Lys Asn
65 70 75 80
Gln Phe Ser Leu Gln Leu Asn Ser Val Thr Pro Glu Asp Thr Ala Val
85 90 95
Tyr Tyr Cys Ala Arg Trp His Ser Asp Lys His Trp Gly Phe Asp Tyr
100 105 110
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 4
<211> 114
<212> PRT
<213> Homo sapiens
<400> 4
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Val Phe Ser
20 25 30
Asp Gly Asn Thr Tyr Leu Asn Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Lys Gly Ser Asn Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Gln Gln Tyr
85 90 95
Asp Ser Tyr Pro Leu Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
Arg Thr
<210> 5
<211> 117
<212> PRT
<213> Artificial
<220>
<223> Variant
<400> 5
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Arg Ser Tyr
20 25 30
Gly Met Asp Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Arg Gly Ser Ser Ser Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Leu Tyr Arg Tyr Trp Phe Asp Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 6
<211> 117
<212> PRT
<213> Artificial
<220>
<223> Variant
<400> 6
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Arg Ser Tyr
20 25 30
Gly Met Asp Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Arg Gly Ser Arg Ser Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Leu Tyr Arg Tyr Trp Phe Asp Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 7
<211> 117
<212> PRT
<213> Artificial
<220>
<223> Variant
<400> 7
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Arg Ser Tyr
20 25 30
Gly Met Asp Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Arg Gly Ser Arg Ser Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Leu Tyr Arg Tyr Trp Phe Asp Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 8
<211> 117
<212> PRT
<213> Artificial
<220>
<223> Variant
<400> 8
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Arg Val Tyr
20 25 30
Gly Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Asp Arg Gly Ser Arg Ser Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Val Tyr Arg Tyr Trp Phe Asp Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 9
<211> 117
<212> PRT
<213> Artificial
<220>
<223> Variant
<400> 9
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Arg Ser Tyr
20 25 30
Gly Met Asp Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Arg Gly Ser Ser Ser Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Leu Tyr Arg Tyr Trp Phe Asp Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 10
<211> 117
<212> PRT
<213> Artificial
<220>
<223> Variant
<400> 10
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met Asp Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Arg Gly Ser Arg Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Leu Tyr Arg Tyr Trp Phe Asp Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 11
<211> 117
<212> PRT
<213> Artificial
<220>
<223> Variant
<400> 11
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Arg Val Tyr
20 25 30
Gly Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Asp Arg Gly Ser Arg Ser Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Val Tyr Arg Tyr Trp Phe Asp Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 12
<211> 108
<212> PRT
<213> Artificial
<220>
<223> Variant
<400> 12
Asp Ile Glu Leu Thr Gln Pro Pro Ser Val Ser Val Ala Pro Gly Gln
1 5 10 15
Thr Ala Arg Ile Ser Cys Ser Gly Asp Asn Leu Arg Asn Tyr Tyr Ala
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Val Val Ile Phe
35 40 45
Tyr Asp Val Asn Arg Pro Ser Asp Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Gly Thr Gln Ala Glu
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Gln Ser Trp Asp Asp Gly Val Pro Trp
85 90 95
Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Gln
100 105
<210> 13
<211> 108
<212> PRT
<213> Artificial
<220>
<223> Variant
<400> 13
Asp Ile Glu Leu Thr Gln Pro Pro Ser Val Ser Val Ala Pro Gly Gln
1 5 10 15
Thr Ala Arg Ile Ser Cys Ser Gly Asp Asn Leu Arg Asn Tyr Tyr Ala
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Val Val Ile Phe
35 40 45
Tyr Asp Val Asn Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Gly Thr Gln Ala Glu
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Gln Ser Trp Leu Asp Gly Val Pro Trp
85 90 95
Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Gln
100 105
<210> 14
<211> 108
<212> PRT
<213> Artificial
<220>
<223> Variant
<400> 14
Asp Ile Glu Leu Thr Gln Pro Pro Ser Val Ser Val Ala Pro Gly Gln
1 5 10 15
Thr Ala Arg Ile Ser Cys Ser Gly Asp Asn Leu Arg Asn Tyr Tyr Ala
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Val Val Ile Phe
35 40 45
Tyr Asp Val Asn Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Gly Thr Gln Ala Glu
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Gln Ser Trp Trp Asp Gly Val Pro Val
85 90 95
Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Gln
100 105
<210> 15
<211> 108
<212> PRT
<213> Artificial
<220>
<223> Variant
<400> 15
Asp Ile Glu Leu Thr Gln Pro Pro Ser Val Ser Val Ala Pro Gly Gln
1 5 10 15
Thr Ala Arg Ile Ser Cys Ser Gly Asp Asn Leu Arg Asn Tyr Tyr Ala
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Val Val Ile Phe
35 40 45
Tyr Asp Asn Asn Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Gly Thr Gln Ala Glu
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Gln Ser Trp Leu Asp Gly Val Pro Trp
85 90 95
Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Gln
100 105
<210> 16
<211> 108
<212> PRT
<213> Artificial
<220>
<223> Variant
<400> 16
Asp Ile Glu Leu Thr Gln Pro Pro Ser Val Ser Val Ala Pro Gly Gln
1 5 10 15
Thr Ala Arg Ile Ser Cys Ser Gly Asp Asn Leu Arg Asn Tyr Tyr Ala
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Val Val Ile Phe
35 40 45
Tyr Asp Asn Asn Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Gly Thr Gln Ala Glu
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Gln Ser Trp Leu Asp Gly Val Pro Trp
85 90 95
Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Gln
100 105
<210> 17
<211> 108
<212> PRT
<213> Artificial
<220>
<223> Variant
<400> 17
Ser Tyr Glu Leu Thr Gln Pro Pro Ser Val Ser Val Ser Pro Gly Gln
1 5 10 15
Thr Ala Arg Ile Thr Cys Ser Gly Asp Asn Leu Pro Lys Tyr Tyr Ala
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Val Val Ile Phe
35 40 45
Tyr Asp Val Asn Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Gly Thr Gln Ala Met
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Gln Ala Trp Trp Ser Ser Thr Pro Val
85 90 95
Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Gln
100 105
<210> 18
<211> 108
<212> PRT
<213> Artificial
<220>
<223> Variant
<400> 18
Ser Tyr Glu Leu Thr Gln Pro Pro Ser Val Ser Val Ser Pro Gly Gln
1 5 10 15
Thr Ala Arg Ile Thr Cys Ser Gly Asp Asn Leu Pro Lys Tyr Tyr Ala
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Val Val Ile Phe
35 40 45
Tyr Asp Ser Asn Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Gly Thr Gln Ala Met
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Gln Ser Trp Leu Ser Gly Thr Pro Trp
85 90 95
Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Gln
100 105
<210> 19
<211> 123
<212> PRT
<213> Artificial
<220>
<223> Variant
<400> 19
Gln Val Gln Leu Gln Gln Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Ile Ser Gly Asp Ser Val Ser Ser Asp
20 25 30
Ser Ala Ala Trp Ser Trp Ile Arg Gln Ser Pro Gly Arg Gly Leu Glu
35 40 45
Trp Leu Gly Ile Ile Tyr Lys Arg Ser Lys Trp Tyr Asn Gln Tyr Ala
50 55 60
Val Ser Val Lys Ser Arg Ile Thr Ile Asn Pro Asp Thr Ser Lys Asn
65 70 75 80
Gln Phe Ser Leu Gln Leu Asn Ser Val Thr Pro Glu Asp Thr Ala Val
85 90 95
Tyr Tyr Cys Ala Arg Trp His Ser Asp Lys His Trp Gly Phe Asp Asp
100 105 110
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 20
<211> 123
<212> PRT
<213> Artificial
<220>
<223> Variant
<400> 20
Gln Val Gln Leu Gln Gln Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Ile Ser Gly Asp Ser Val Ser Ser Asp
20 25 30
Ser Ala Ala Trp Ser Trp Ile Arg Gln Ser Pro Gly Arg Gly Leu Glu
35 40 45
Trp Leu Gly Ile Ile Tyr Lys Arg Ser Lys Trp Tyr Asn Arg Tyr Ala
50 55 60
Val Ser Val Lys Ser Arg Ile Thr Ile Asn Pro Asp Thr Ser Lys Asn
65 70 75 80
Gln Phe Ser Leu Gln Leu Asn Ser Val Thr Pro Glu Asp Thr Ala Val
85 90 95
Tyr Tyr Cys Ala Arg Trp His Ser Asp Lys His Trp Gly Phe Asp Asp
100 105 110
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 21
<211> 123
<212> PRT
<213> Artificial
<220>
<223> Variant
<400> 21
Gln Val Gln Leu Gln Gln Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Ile Ser Gly Asp Ser Val Ser Ser Asp
20 25 30
Ser Ala Ala Trp Ser Trp Ile Arg Gln Ser Pro Gly Arg Gly Leu Glu
35 40 45
Trp Leu Gly Ile Ile Tyr Lys Arg Ser Lys Trp Tyr Asn Arg Tyr Ala
50 55 60
Val Ser Val Lys Ser Arg Ile Thr Ile Asn Pro Asp Thr Ser Lys Asn
65 70 75 80
Gln Phe Ser Leu Gln Leu Asn Ser Val Thr Pro Glu Asp Thr Ala Val
85 90 95
Tyr Tyr Cys Ala Arg Trp His Ser Asp Lys His Trp Gly Phe Asp Asp
100 105 110
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 22
<211> 123
<212> PRT
<213> Artificial
<220>
<223> Variant
<400> 22
Gln Val Gln Leu Gln Gln Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Ile Ser Gly Asp Ser Val Ser Ser Asn
20 25 30
Ser Ala Ala Trp Ser Trp Ile Arg Gln Ser Pro Gly Arg Gly Leu Glu
35 40 45
Trp Leu Gly Ile Ile Tyr Lys Arg Ser Lys Trp Tyr Asn Arg Tyr Ala
50 55 60
Val Ser Val Lys Ser Arg Ile Thr Ile Asn Pro Asp Thr Ser Lys Asn
65 70 75 80
Gln Phe Ser Leu Gln Leu Asn Ser Val Thr Pro Glu Asp Thr Ala Val
85 90 95
Tyr Tyr Cys Ala Arg Trp His Ser Asp Lys His Trp Gly Phe Asp Asp
100 105 110
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 23
<211> 123
<212> PRT
<213> Artificial
<220>
<223> Variant
<400> 23
Gln Val Gln Leu Gln Gln Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Ile Ser Gly Asp Ser Val Ser Ser Asp
20 25 30
Ser Ala Ala Trp Ser Trp Ile Arg Gln Ser Pro Gly Arg Gly Leu Glu
35 40 45
Trp Leu Gly Ile Ile Tyr Lys Arg Ser Lys Trp Tyr Asn Arg Tyr Ala
50 55 60
Val Ser Val Lys Ser Arg Ile Thr Ile Asn Pro Asp Thr Ser Lys Asn
65 70 75 80
Gln Phe Ser Leu Gln Leu Asn Ser Val Thr Pro Glu Asp Thr Ala Val
85 90 95
Tyr Tyr Cys Ala Arg Trp His Ser Asp Lys His Trp Gly Phe Asp Asp
100 105 110
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 24
<211> 123
<212> PRT
<213> Artificial
<220>
<223> Variant
<400> 24
Gln Val Gln Leu Gln Gln Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Ile Ser Gly Asp Ser Val Ser Ser Asp
20 25 30
Ser Ala Ala Trp Ser Trp Ile Arg Gln Ser Pro Gly Arg Gly Leu Glu
35 40 45
Trp Leu Gly Ile Ile Tyr Lys Arg Ser Lys Trp Tyr Asn Arg Tyr Ala
50 55 60
Val Ser Val Lys Ser Arg Ile Thr Ile Asn Pro Asp Thr Ser Lys Asn
65 70 75 80
Gln Phe Ser Leu Gln Leu Asn Ser Val Thr Pro Glu Asp Thr Ala Val
85 90 95
Tyr Tyr Cys Ala Arg Trp His Ser Asp Lys His Trp Gly Phe Asp Asp
100 105 110
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 25
<211> 123
<212> PRT
<213> Artificial
<220>
<223> Variant
<400> 25
Glu Val Gln Leu Gln Gln Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Ile Ser Gly Asp Ser Val Ser Ser Asp
20 25 30
Ser Ala Ala Trp Ser Trp Ile Arg Gln Ser Pro Ser Arg Gly Leu Glu
35 40 45
Trp Leu Gly Ile Ile Tyr Tyr Arg Ser Lys Trp Tyr Asn Arg Tyr Ala
50 55 60
Val Ser Val Lys Ser Arg Ile Thr Ile Asn Pro Asp Thr Ser Lys Asn
65 70 75 80
Gln Phe Ser Leu Gln Leu Asn Ser Val Thr Pro Glu Asp Thr Ala Val
85 90 95
Tyr Tyr Cys Ala Arg Trp His Ser Asp Lys His Trp Gly Phe Asp Asp
100 105 110
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 26
<211> 123
<212> PRT
<213> Artificial
<220>
<223> Variant
<400> 26
Gln Val Gln Leu Gln Gln Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Ile Ser Gly Asp Ser Val Ser Ser Asp
20 25 30
Ser Ala Ala Trp Ser Trp Ile Arg Gln Ser Pro Ser Arg Gly Leu Glu
35 40 45
Trp Leu Gly Ile Ile Tyr Tyr Arg Ser Lys Trp Tyr Asn Arg Tyr Ala
50 55 60
Val Ser Val Lys Ser Arg Ile Thr Ile Asn Pro Asp Thr Ser Lys Asn
65 70 75 80
Gln Phe Ser Leu Gln Leu Asn Ser Val Thr Pro Glu Asp Thr Ala Val
85 90 95
Tyr Tyr Cys Ala Arg Trp His Ser Asp Lys His Trp Gly Phe Asp Asp
100 105 110
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 27
<211> 114
<212> PRT
<213> Artificial
<220>
<223> Variant
<400> 27
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Val Ile Ser
20 25 30
Phe Gly Ile Thr Tyr Leu Asn Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Lys Gly Ser Asn Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Gln Gln Tyr
85 90 95
Asp Ser Tyr Pro Leu Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
Arg Thr
<210> 28
<211> 114
<212> PRT
<213> Artificial
<220>
<223> Variant
<400> 28
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Val Phe Arg
20 25 30
Phe Gly Ile Thr Tyr Leu Asn Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Lys Gly Ser Asn Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Gln Gln Tyr
85 90 95
Thr Ser Tyr Pro Leu Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
Arg Thr
<210> 29
<211> 114
<212> PRT
<213> Artificial
<220>
<223> Variant
<400> 29
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Val Phe Ser
20 25 30
Asp Gly Thr Thr Tyr Leu Asn Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Lys Gly Ser Asn Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Gln Gln Tyr
85 90 95
Thr Ser Tyr Pro Leu Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
Arg Thr
<210> 30
<211> 114
<212> PRT
<213> Artificial
<220>
<223> Variant
<400> 30
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Val Phe Ser
20 25 30
Phe Gly Ile Thr Tyr Leu Asn Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Lys Gly Ser Asn Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Gln Gln Tyr
85 90 95
Asp Ser Tyr Pro Leu Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
Arg Thr
<210> 31
<211> 114
<212> PRT
<213> Artificial
<220>
<223> Variant
<400> 31
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Val Phe Arg
20 25 30
Phe Gly Ile Thr Tyr Leu Asn Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Lys Gly Ser Asn Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Gln Gln Tyr
85 90 95
Asp Ser Tyr Pro Leu Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
Arg Thr
<210> 32
<211> 114
<212> PRT
<213> Artificial
<220>
<223> Variant
<400> 32
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Val Phe Arg
20 25 30
Asp Gly Ile Thr Tyr Leu Asn Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Lys Gly Ser Asn Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Gln Gln Tyr
85 90 95
Asp Ser Tyr Pro Leu Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
Arg Thr
<210> 33
<211> 114
<212> PRT
<213> Artificial
<220>
<223> Variant
<400> 33
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Val Phe Arg
20 25 30
Asp Gly Ile Thr Tyr Leu Asn Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Lys Gly Ser Asn Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Gln Gln Tyr
85 90 95
Asp Ser Tyr Pro Leu Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
Arg Thr
<210> 34
<211> 114
<212> PRT
<213> Artificial
<220>
<223> Variant
<400> 34
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Val Phe Arg
20 25 30
Asp Gly Ile Thr Tyr Leu Asn Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Lys Gly Ser Asn Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Gln Gln Tyr
85 90 95
Asp Ser Tyr Pro Leu Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
Arg Thr
Claims (9)
- (a) (i) 서열 1의 아미노산 잔기 27 내지 35의 아미노산 서열을 가지되, R30S 및 S35D로 이루어진 군으로부터 선택된 하나 이상의 치환을 포함하는 CDR1 영역;
(ii) 서열 1의 아미노산 잔기 50 내지 66의 아미노산 서열을 가지되, S55R 및 S56G로 이루어진 군으로부터 선택된 하나 이상의 치환을 포함하는 CDR2 영역; 및
(iii) 서열 1의 아미노산 잔기 99 내지 106의 아미노산 서열을 가지되, K99L의 치환을 포함하는 CDR3 영역
을 포함하는 인간 중쇄, 및
(b) (i) 서열 2의 아미노산 잔기 23 내지 33의 아미노산 서열을 가지되, R28P 및 N29K로 이루어진 군으로부터 선택된 하나 이상의 치환을 포함하는 CDR1 영역;
(ii) 서열 2의 아미노산 잔기 48 내지 55의 아미노산 서열을 가지되, Y48F 및 N51V로 이루어진 군으로부터 선택된 하나 이상의 치환을 포함하는 CDR2 영역; 및
(iii) 서열 2의 아미노산 잔기 88 내지 96의 아미노산 서열을 가지되, D91W의 치환을 포함하거나 또는 S89A, D91W, D92S, G93S 및 V94T의 치환들을 포함하는 CDR3 영역
을 포함하는 인간 경쇄
를 포함하고, 서열 2에 대해서 S21T의 치환을 추가로 포함하는, 인간 조직 인자 경로 억제제(TFPI)에 특이적으로 결합하는 단리된 인간 모노클로날 항체. - (a) (i) 서열 3의 아미노산 잔기 27 내지 37의 아미노산 서열을 가지되, N32D의 치환을 포함하는 CDR1 영역;
(ii) 서열 3의 아미노산 잔기 52 내지 69의 아미노산 서열을 가지되, K55Y 및 D62R로 이루어진 군으로부터 선택된 하나 이상의 치환을 포함하는 CDR2 영역; 및
(iii) 서열 3의 아미노산 잔기 102 내지 112의 아미노산 서열을 가지되, Y112D의 치환을 포함하는 CDR3 영역
을 포함하는 인간 중쇄, 및
(b) (i) 서열 4의 아미노산 잔기 24 내지 39의 아미노산 서열을 가지되, S32R 및 N35I로 이루어진 군으로부터 선택된 하나 이상의 치환을 포함하는 CDR1 영역;
(ii) 서열 4의 아미노산 잔기 55 내지 61의 아미노산 서열을 가지는 CDR2 영역; 및
(iii) 서열 4의 아미노산 잔기 94 내지 102의 아미노산 서열을 가지는 CDR3 영역
을 포함하는 인간 경쇄
를 포함하고, 서열 3에 대해서 Q1E 치환을 추가로 포함하는, 쿠니츠(Kunitz) 도메인 2를 포함하는 인간 조직 인자 경로 억제제(TFPI)의 영역에 특이적으로 결합하는 단리된 인간 모노클로날 항체. - (a) (i) 서열 3의 아미노산 잔기 27 내지 37의 아미노산 서열을 가지되, N32D의 치환을 포함하는 CDR1 영역;
(ii) 서열 3의 아미노산 잔기 52 내지 69의 아미노산 서열을 가지되, K55Y 및 D62R로 이루어진 군으로부터 선택된 하나 이상의 치환을 포함하는 CDR2 영역; 및
(iii) 서열 3의 아미노산 잔기 102 내지 112의 아미노산 서열을 가지되, Y112D의 치환을 포함하는 CDR3 영역
을 포함하는 인간 중쇄, 및
(b) (i) 서열 4의 아미노산 잔기 24 내지 39의 아미노산 서열을 가지되, S32R 및 N35I로 이루어진 군으로부터 선택된 하나 이상의 치환을 포함하며, F31I 및 D33F로 이루어진 군으로부터 선택된 하나 이상의 치환을 추가로 포함하는 CDR1 영역;
(ii) 서열 4의 아미노산 잔기 55 내지 61의 아미노산 서열을 가지는 CDR2 영역; 및
(iii) 서열 4의 아미노산 잔기 94 내지 102의 아미노산 서열을 가지되, D97T의 치환을 포함할 수 있는 CDR3 영역
을 포함하는 인간 경쇄
를 포함하는, 쿠니츠(Kunitz) 도메인 2를 포함하는 인간 조직 인자 경로 억제제(TFPI)의 영역에 특이적으로 결합하는 단리된 인간 모노클로날 항체. - (a) (i) 서열 3의 아미노산 잔기 27 내지 37의 아미노산 서열을 가지되, N32D의 치환을 포함하는 CDR1 영역;
(ii) 서열 3의 아미노산 잔기 52 내지 69의 아미노산 서열을 가지되, K55Y 및 D62R로 이루어진 군으로부터 선택된 하나 이상의 치환을 포함하는 CDR2 영역; 및
(iii) 서열 3의 아미노산 잔기 102 내지 112의 아미노산 서열을 가지되, Y112D의 치환을 포함하는 CDR3 영역
을 포함하는 인간 중쇄, 및
(b) (i) 서열 4의 아미노산 잔기 24 내지 39의 아미노산 서열을 가지되, S32R 및 N35I로 이루어진 군으로부터 선택된 하나 이상의 치환을 포함하는 CDR1 영역;
(ii) 서열 4의 아미노산 잔기 55 내지 61의 아미노산 서열을 가지는 CDR2 영역; 및
(iii) 서열 4의 아미노산 잔기 94 내지 102의 아미노산 서열을 가지되, D97T의 치환을 포함하는 CDR3 영역
을 포함하는 인간 경쇄
를 포함하는, 쿠니츠(Kunitz) 도메인 2를 포함하는 인간 조직 인자 경로 억제제(TFPI)의 영역에 특이적으로 결합하는 단리된 인간 모노클로날 항체. - 제2항 내지 제4항 중 어느 한 항에 있어서, 서열 3에 대해서 G44S의 치환을 추가로 포함하는 항체.
- 제1항에 있어서, 서열 1에 대해서 Q1E의 치환을 추가로 포함하는 항체.
- 제1항에 있어서, 서열 2에 대해서 D1S, I2Y, A13S 또는 E80M의 치환 또는 이들의 조합을 추가로 포함하는 항체.
- 치료 유효량의 제1항 내지 제4항 중 어느 한 항의 모노클로날 항체 및 제약상 허용되는 담체를 포함하는, 혈우병 A, B 또는 C를 치료하기 위한 제약 조성물.
- 삭제
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US30929010P | 2010-03-01 | 2010-03-01 | |
| US61/309,290 | 2010-03-01 | ||
| PCT/US2011/026766 WO2011109452A1 (en) | 2010-03-01 | 2011-03-01 | Optimized Monoclonal Antibodies against Tissue Factor Pathway Inhibitor (TFPI) |
Related Parent Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020177034610A Division KR101903931B1 (ko) | 2010-03-01 | 2011-03-01 | 조직 인자 경로 억제제 (tfpi)에 대한 최적화된 모노클로날 항체 |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020197012160A Division KR20190047135A (ko) | 2010-03-01 | 2011-03-01 | 조직 인자 경로 억제제 (tfpi)에 대한 최적화된 모노클로날 항체 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| KR20180091116A KR20180091116A (ko) | 2018-08-14 |
| KR101974980B1 true KR101974980B1 (ko) | 2019-05-07 |
Family
ID=44542552
Family Applications (4)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020127025683A KR101807894B1 (ko) | 2010-03-01 | 2011-03-01 | 조직 인자 경로 억제제 (tfpi)에 대한 최적화된 모노클로날 항체 |
| KR1020197012160A KR20190047135A (ko) | 2010-03-01 | 2011-03-01 | 조직 인자 경로 억제제 (tfpi)에 대한 최적화된 모노클로날 항체 |
| KR1020177034610A KR101903931B1 (ko) | 2010-03-01 | 2011-03-01 | 조직 인자 경로 억제제 (tfpi)에 대한 최적화된 모노클로날 항체 |
| KR1020187022511A KR101974980B1 (ko) | 2010-03-01 | 2011-03-01 | 조직 인자 경로 억제제 (tfpi)에 대한 최적화된 모노클로날 항체 |
Family Applications Before (3)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020127025683A KR101807894B1 (ko) | 2010-03-01 | 2011-03-01 | 조직 인자 경로 억제제 (tfpi)에 대한 최적화된 모노클로날 항체 |
| KR1020197012160A KR20190047135A (ko) | 2010-03-01 | 2011-03-01 | 조직 인자 경로 억제제 (tfpi)에 대한 최적화된 모노클로날 항체 |
| KR1020177034610A KR101903931B1 (ko) | 2010-03-01 | 2011-03-01 | 조직 인자 경로 억제제 (tfpi)에 대한 최적화된 모노클로날 항체 |
Country Status (36)
| Country | Link |
|---|---|
| US (3) | USRE47150E1 (ko) |
| EP (2) | EP3345615B1 (ko) |
| JP (4) | JP6025570B2 (ko) |
| KR (4) | KR101807894B1 (ko) |
| CN (5) | CN105001335B (ko) |
| AU (1) | AU2011223710B2 (ko) |
| BR (1) | BR112012022258A2 (ko) |
| CA (3) | CA3101298A1 (ko) |
| CL (2) | CL2012002415A1 (ko) |
| CO (1) | CO6620068A2 (ko) |
| CR (1) | CR20120453A (ko) |
| CU (1) | CU23982B1 (ko) |
| CY (2) | CY1119410T1 (ko) |
| DK (2) | DK2542257T3 (ko) |
| DO (1) | DOP2012000239A (ko) |
| EA (2) | EA032189B9 (ko) |
| EC (2) | ECSP12012134A (ko) |
| ES (2) | ES2765418T3 (ko) |
| GT (1) | GT201200252A (ko) |
| HK (2) | HK1232232A1 (ko) |
| HR (2) | HRP20171472T1 (ko) |
| HU (2) | HUE047173T2 (ko) |
| IL (3) | IL221551B (ko) |
| LT (2) | LT3345615T (ko) |
| ME (2) | ME03578B (ko) |
| MX (2) | MX2012010198A (ko) |
| MY (1) | MY174760A (ko) |
| NZ (2) | NZ702494A (ko) |
| PE (1) | PE20160538A1 (ko) |
| PH (3) | PH12018500640A1 (ko) |
| PL (2) | PL2542257T3 (ko) |
| PT (2) | PT3345615T (ko) |
| RS (2) | RS56409B1 (ko) |
| SG (3) | SG10201502587SA (ko) |
| SI (2) | SI3345615T1 (ko) |
| WO (1) | WO2011109452A1 (ko) |
Families Citing this family (15)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| UA112050C2 (uk) * | 2008-08-04 | 2016-07-25 | БАЄР ХЕЛСКЕР ЛЛСі | Терапевтична композиція, що містить моноклональне антитіло проти інгібітора шляху тканинного фактора (tfpi) |
| AU2009331570C1 (en) † | 2008-12-22 | 2024-04-18 | Novo Nordisk A/S | Antibodies against tissue factor pathway inhibitor |
| SI3345615T1 (sl) | 2010-03-01 | 2020-03-31 | Bayer Healthcare Llc | Optimizirana monoklonska protitelesa proti zaviralcu poti tkivnega faktorja (TFPI) |
| WO2012001087A1 (en) * | 2010-06-30 | 2012-01-05 | Novo Nordisk A/S | Antibodies that are capable of specifically binding tissue factor pathway inhibitor |
| LT2694544T (lt) * | 2011-04-01 | 2019-04-25 | Bayer Healthcare Llc | Monokloniniai antikūnai prieš audinių faktoriaus kelio slopiklį (tfpi) |
| BR112014024373A2 (pt) * | 2012-03-30 | 2017-08-08 | Bayer Healthcare Llc | anticorpos regulados por protease |
| US9592297B2 (en) * | 2012-08-31 | 2017-03-14 | Bayer Healthcare Llc | Antibody and protein formulations |
| TW201522368A (zh) * | 2013-03-15 | 2015-06-16 | Bayer Healthcare Llc | 抗組織因子路徑抑制劑之前藥抗體 |
| ES2657304T3 (es) * | 2013-03-15 | 2018-03-02 | Bayer Healthcare Llc | Variantes de anticuerpo anti TFPI con unión diferencial a lo largo del intervalo de pH para mejorar la farmacocinética |
| EP4279128A3 (en) * | 2015-02-25 | 2024-02-28 | Mogam Institute for Biomedical Research | Novel antibody binding to tfpi and composition comprising the same |
| MY195443A (en) * | 2015-08-19 | 2023-01-21 | Pfizer | Tissue Factor Pathway Inhibitor Antibodies and uses Thereof |
| KR102337683B1 (ko) * | 2018-09-21 | 2021-12-13 | 주식회사 녹십자 | 고효율 항-tfpi 항체 조성물 |
| JP7289913B2 (ja) * | 2018-10-11 | 2023-06-12 | ファイザー・インク | Tfpiアンタゴニストのための投薬レジメン |
| CN112442127A (zh) * | 2019-08-29 | 2021-03-05 | 苏州康宁杰瑞生物科技有限公司 | 针对tfpi的单克隆抗体 |
| CN117285632A (zh) * | 2022-06-17 | 2023-12-26 | 安源医药科技(上海)有限公司 | 针对tfpi的单克隆抗体及其用途 |
Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2010017196A2 (en) * | 2008-08-04 | 2010-02-11 | Bayer Healthcare Llc | Monoclonal antibodies against tissue factor pathway inhibitor (tfpi) |
Family Cites Families (206)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CA1064396A (en) | 1975-02-18 | 1979-10-16 | Myer L. Coval | Fractional precipitation of gamma globulin with polyethylene glycol |
| US4075193A (en) | 1976-11-26 | 1978-02-21 | Parke, Davis & Company | Process for producing intravenous immune globulin |
| US4374763A (en) | 1979-09-17 | 1983-02-22 | Morishita Pharmaceutical Co., Ltd. | Method for producing gamma-globulin for use in intravenous administration and method for producing a pharmaceutical preparation thereof |
| US4634665A (en) | 1980-02-25 | 1987-01-06 | The Trustees Of Columbia University In The City Of New York | Processes for inserting DNA into eucaryotic cells and for producing proteinaceous materials |
| US4399216A (en) | 1980-02-25 | 1983-08-16 | The Trustees Of Columbia University | Processes for inserting DNA into eucaryotic cells and for producing proteinaceous materials |
| US5179017A (en) | 1980-02-25 | 1993-01-12 | The Trustees Of Columbia University In The City Of New York | Processes for inserting DNA into eucaryotic cells and for producing proteinaceous materials |
| US4499073A (en) | 1981-08-24 | 1985-02-12 | Cutter Laboratories, Inc. | Intravenously injectable immune serum globulin |
| US4816567A (en) | 1983-04-08 | 1989-03-28 | Genentech, Inc. | Recombinant immunoglobin preparations |
| US4597966A (en) | 1985-01-09 | 1986-07-01 | Ortho Diagnostic Systems, Inc. | Histidine stabilized immunoglobulin and method of preparation |
| US4966852A (en) | 1987-07-23 | 1990-10-30 | Monsanto Company | DNA clone of human tissue factor inhibitor |
| ATE82506T1 (de) | 1987-08-21 | 1992-12-15 | Imcera Group Inc | Stabilisierung von wachstumshormonen. |
| US4877608A (en) | 1987-11-09 | 1989-10-31 | Rorer Pharmaceutical Corporation | Pharmaceutical plasma protein formulations in low ionic strength media |
| US5096885A (en) | 1988-04-15 | 1992-03-17 | Genentech, Inc. | Human growth hormone formulation |
| EP0417193B1 (en) | 1988-05-27 | 1993-08-04 | Centocor, Inc. | Freeze-dried formulation for antibody products |
| EP0465513A1 (en) | 1989-03-27 | 1992-01-15 | Centocor, Inc. | FORMULATIONS FOR STABILIZING OF IgM ANTIBODIES |
| US6969586B1 (en) | 1989-05-16 | 2005-11-29 | Scripps Research Institute | Method for tapping the immunological repertoire |
| US5217954A (en) | 1990-04-04 | 1993-06-08 | Scios Nova Inc. | Formulations for stabilizing fibroblast growth factor |
| US6255458B1 (en) | 1990-08-29 | 2001-07-03 | Genpharm International | High affinity human antibodies and human antibodies against digoxin |
| DK261490D0 (da) | 1990-10-31 | 1990-10-31 | Novo Nordisk As | New pharmaceutical compound |
| JPH0565233A (ja) | 1991-03-08 | 1993-03-19 | Mitsui Toatsu Chem Inc | モノクローナル抗体含有凍結乾燥製剤 |
| US6165467A (en) | 1991-07-20 | 2000-12-26 | Yoshihide Hagiwara | Stabilized human monoclonal antibody preparation |
| GB9122820D0 (en) | 1991-10-28 | 1991-12-11 | Wellcome Found | Stabilised antibodies |
| EP0539975A1 (en) | 1991-10-31 | 1993-05-05 | Teijin Limited | Method for immunological assay of free lipoprotein-associated coagulation inhibitor (LACI) and kit therefor |
| US5849700A (en) | 1991-12-20 | 1998-12-15 | Novo Nordisk A/S | Pharmaceutical formulation |
| DE4223132A1 (de) | 1992-07-14 | 1994-01-20 | Deutsche Aerospace | Verfahren zur Schrittakt-Regeneration bei der Demodulation von digital modulierten Signalen und Anordnung zum Ausführen des Verfahrens |
| JPH06153985A (ja) | 1992-11-16 | 1994-06-03 | Teijin Ltd | モノクローナル抗体 |
| ATE197550T1 (de) | 1993-02-23 | 2000-12-15 | Genentech Inc | Stabilisierung von mit organischen lösungsmittel behandelten polypeptiden mit einem hilfsstoff |
| US5455338A (en) | 1993-11-05 | 1995-10-03 | Zymogenetics, Inc. | DNA encoding novel human kunitz-type inhibitors and methods relating thereto |
| DE4344824C1 (de) | 1993-12-28 | 1995-08-31 | Immuno Ag | Hochkonzentriertes Immunglobulin-Präparat und Verfahren zu seiner Herstellung |
| US5580856A (en) | 1994-07-15 | 1996-12-03 | Prestrelski; Steven J. | Formulation of a reconstituted protein, and method and kit for the production thereof |
| JPH0875736A (ja) | 1994-09-06 | 1996-03-22 | Chemo Sero Therapeut Res Inst | ヒト組織因子凝固系インヒビターの定量法 |
| GB9418092D0 (en) | 1994-09-08 | 1994-10-26 | Red Cross Found Cent Lab Blood | Organic compounds |
| US6111079A (en) | 1995-06-05 | 2000-08-29 | Bionebraska, Inc. | Lead binding polypeptides and nucleotides coding therefore |
| US6685940B2 (en) | 1995-07-27 | 2004-02-03 | Genentech, Inc. | Protein formulation |
| US6267958B1 (en) | 1995-07-27 | 2001-07-31 | Genentech, Inc. | Protein formulation |
| WO1997004801A1 (en) | 1995-07-27 | 1997-02-13 | Genentech, Inc. | Stabile isotonic lyophilized protein formulation |
| US5902582A (en) | 1995-09-05 | 1999-05-11 | Chiron Corporation | Use of TFPI inhibitor for treatment of cancer |
| US6686191B1 (en) | 1995-09-22 | 2004-02-03 | Bayer Healthcare Llc | Preparation of virally inactivated intravenously injectable immune serum globulin |
| US7368111B2 (en) | 1995-10-06 | 2008-05-06 | Cambridge Antibody Technology Limited | Human antibodies specific for TGFβ2 |
| JP3681206B2 (ja) * | 1995-12-26 | 2005-08-10 | 株式会社三菱化学ヤトロン | 抗ファクターXa・ティシュファクターパスウェイインヒビター複合体モノクローナル抗体及びその使用 |
| HUP9901355A3 (en) | 1996-01-25 | 2000-06-28 | Schering Ag | For using amino acids and - compounds for additives of x-ray contrast matter solucions, and making drugs and diagnostics |
| US5770700A (en) | 1996-01-25 | 1998-06-23 | Genetics Institute, Inc. | Liquid factor IX formulations |
| KR100236393B1 (ko) | 1996-02-02 | 1999-12-15 | 나까니시 히로유끼 | 사람성장호르몬을 함유하는 의약제제 |
| TW518219B (en) | 1996-04-26 | 2003-01-21 | Chugai Pharmaceutical Co Ltd | Erythropoietin solution preparation |
| GB9610992D0 (en) | 1996-05-24 | 1996-07-31 | Glaxo Group Ltd | Concentrated antibody preparation |
| US20040052799A1 (en) | 1996-11-15 | 2004-03-18 | Astra Aktiebolag | Nucleic acid and amino acid sequences relating to Helicobacter pylori for diagnostics and therapeutics |
| EP0852951A1 (de) | 1996-11-19 | 1998-07-15 | Roche Diagnostics GmbH | Stabile lyophilisierte pharmazeutische Zubereitungen von mono- oder polyklonalen Antikörpern |
| US6593291B1 (en) | 1997-02-06 | 2003-07-15 | Entremed, Inc. | Compositions and methods of use of ligands that bind components of the blood coagulation/clotting pathway for the treatment of cancer and angiogenic-based disease |
| WO1999046289A1 (en) | 1998-03-12 | 1999-09-16 | Human Genome Sciences, Inc. | 31 human secreted proteins |
| ES2513043T3 (es) | 1997-03-26 | 2014-10-24 | Imperial Innovations Limited | Proteína de fusión anticoagulante anclada a membrana de la célula |
| US5994511A (en) | 1997-07-02 | 1999-11-30 | Genentech, Inc. | Anti-IgE antibodies and methods of improving polypeptides |
| WO1999003496A1 (en) | 1997-07-21 | 1999-01-28 | The University Of North Carolina At Chapel Hill | Factor ix antihemophilic factor with increased clotting activity |
| US6617156B1 (en) | 1997-08-15 | 2003-09-09 | Lynn A. Doucette-Stamm | Nucleic acid and amino acid sequences relating to Enterococcus faecalis for diagnostics and therapeutics |
| EP1005776B1 (de) | 1997-08-21 | 2003-01-08 | Siemens Aktiengesellschaft | Verfahren zum übertragen von nutzdaten, die unterschiedlichen anwendungen zuordenbar sind |
| US6551795B1 (en) | 1998-02-18 | 2003-04-22 | Genome Therapeutics Corporation | Nucleic acid and amino acid sequences relating to pseudomonas aeruginosa for diagnostics and therapeutics |
| GB9820525D0 (en) | 1998-09-21 | 1998-11-11 | Allergy Therapeutics Ltd | Formulation |
| US6818749B1 (en) | 1998-10-31 | 2004-11-16 | The United States Of America As Represented By The Department Of Health And Human Services | Variants of humanized anti carcinoma monoclonal antibody cc49 |
| JP2000247903A (ja) | 1999-03-01 | 2000-09-12 | Chugai Pharmaceut Co Ltd | 長期安定化製剤 |
| US6914128B1 (en) | 1999-03-25 | 2005-07-05 | Abbott Gmbh & Co. Kg | Human antibodies that bind human IL-12 and methods for producing |
| US20040031072A1 (en) | 1999-05-06 | 2004-02-12 | La Rosa Thomas J. | Soy nucleic acid molecules and other molecules associated with transcription plants and uses thereof for plant improvement |
| US20100293669A2 (en) | 1999-05-06 | 2010-11-18 | Jingdong Liu | Nucleic Acid Molecules and Other Molecules Associated with Plants and Uses Thereof for Plant Improvement |
| US20090087878A9 (en) | 1999-05-06 | 2009-04-02 | La Rosa Thomas J | Nucleic acid molecules associated with plants |
| CN100389821C (zh) | 1999-10-04 | 2008-05-28 | 希龙公司 | 稳定化的含多肽的液体药物组合物 |
| US20050208558A1 (en) | 1999-10-19 | 2005-09-22 | Applera Corporation | Detection kits, such as nucleic acid arrays, for detecting the expression or 10,000 or more Drosophila genes and uses thereof |
| JP4623825B2 (ja) | 1999-12-16 | 2011-02-02 | 協和発酵バイオ株式会社 | 新規ポリヌクレオチド |
| US20020160934A1 (en) | 2000-01-14 | 2002-10-31 | Julie Broadus | Nucleic acid sequences from Drosophila melanogaster that encode proteins essential for larval viability and uses thereof |
| US20030232054A1 (en) | 2000-01-25 | 2003-12-18 | Tang Y. Tom | Novel nucleic acids and polypeptides |
| EP1260230A4 (en) | 2000-02-29 | 2008-08-06 | Chugai Pharmaceutical Co Ltd | LONG-TERM STABILIZED PREPARATIONS |
| IL152130A0 (en) | 2000-04-07 | 2003-05-29 | Ellis L Kline | Methods and compositions for treating neoplasms |
| US20110131679A2 (en) | 2000-04-19 | 2011-06-02 | Thomas La Rosa | Rice Nucleic Acid Molecules and Other Molecules Associated with Plants and Uses Thereof for Plant Improvement |
| US7834146B2 (en) | 2000-05-08 | 2010-11-16 | Monsanto Technology Llc | Recombinant polypeptides associated with plants |
| US20040181830A1 (en) | 2001-05-07 | 2004-09-16 | Kovalic David K. | Nucleic acid molecules and other molecules associated with plants and uses thereof for plant improvement |
| US7015194B2 (en) * | 2000-05-10 | 2006-03-21 | Novo Nordisk A/S | Pharmaceutical composition comprising factor VIIa and anti-TFPI |
| US20020082206A1 (en) | 2000-05-30 | 2002-06-27 | Leach Martin D. | Novel polynucleotides from atherogenic cells and polypeptides encoded thereby |
| WO2002002641A1 (en) | 2000-06-16 | 2002-01-10 | Human Genome Sciences, Inc. | Antibodies that immunospecifically bind to blys |
| WO2002011753A1 (fr) | 2000-08-04 | 2002-02-14 | Chugai Seiyaku Kabushiki Kaisha | Preparations proteiniques a injecter |
| AU2001277781A1 (en) | 2000-08-11 | 2002-02-25 | Chugai Seiyaku Kabushiki Kaisha | Stabilized antibody-containing preparations |
| AU8260701A (en) | 2000-09-01 | 2002-03-13 | Chugai Pharmaceutical Co Ltd | Solution preparations stabilized over long time |
| AU1344102A (en) | 2000-10-12 | 2002-04-22 | Genentech Inc | Reduced-viscosity concentrated protein formulations |
| US7214786B2 (en) | 2000-12-14 | 2007-05-08 | Kovalic David K | Nucleic acid molecules and other molecules associated with plants and uses thereof for plant improvement |
| GB0101879D0 (en) | 2001-01-24 | 2001-03-07 | Enzyme Res Lab Ltd | Anticoagulants and their uses |
| EP1379549A2 (fr) | 2001-02-07 | 2004-01-14 | Institut Pasteur | Sequence du genome de photorhabdus luminescens souche tto1 et utilisations |
| GB0103424D0 (en) | 2001-02-12 | 2001-03-28 | Chiron Spa | Gonococcus proteins |
| US7667004B2 (en) * | 2001-04-17 | 2010-02-23 | Abmaxis, Inc. | Humanized antibodies against vascular endothelial growth factor |
| US6891085B2 (en) | 2001-04-20 | 2005-05-10 | Pioneer Hi-Bred International, Inc. | Nucleic acid encoding the FUS6 antimicrobial polypeptide of Agrotis ipsilon and its use to enhance disease resistance in a plant |
| AU2002302247A1 (en) | 2001-05-21 | 2002-12-03 | Ecopia Biosciences Inc. | Genes and proteins involved in the biosynthesis of enediyne ring structures |
| GB0113179D0 (en) | 2001-05-31 | 2001-07-25 | Novartis Ag | Organic compounds |
| MXPA04000747A (es) | 2001-07-25 | 2004-07-08 | Protein Desing Labs Inc | Formulacion farmaceutica liofilizada estable de anticuerpos igg. |
| US20040142325A1 (en) | 2001-09-14 | 2004-07-22 | Liat Mintz | Methods and systems for annotating biomolecular sequences |
| EP1369431A4 (en) * | 2001-10-15 | 2005-01-12 | Kirin Brewery | ANTI-HLA-DR ANTIBODIES |
| MXPA04003640A (es) | 2001-10-16 | 2005-04-11 | Rxkinetix Inc | Formulaciones de proteina de alta concentracion y metodo de fabricacion. |
| US20040029129A1 (en) | 2001-10-25 | 2004-02-12 | Liangsu Wang | Identification of essential genes in microorganisms |
| US20030166004A1 (en) | 2001-11-01 | 2003-09-04 | Jeno Gyuris | Endothelial-cell binding peptides for diagnosis and therapy |
| CA2466034C (en) | 2001-11-08 | 2012-12-18 | Protein Design Labs, Inc. | Stable aqueous pharmaceutical formulations of daclizumab antibodies |
| AU2002363925A1 (en) | 2001-11-29 | 2003-06-17 | Wyeth Holdings Corporation | ALLOIOCOCCUS OTITIDIS OPEN READING FRAMES (ORFs) ENCODING POLYPEPTIDE ANTIGENS, IMMUNOGENIC COMPOSITIONS AND USES THEREOF |
| US20030138416A1 (en) | 2001-12-03 | 2003-07-24 | Jesper Lau | Use of glucokinase activator in combination with a glucagon antagonist for treating type 2 diabetes |
| US20050108791A1 (en) | 2001-12-04 | 2005-05-19 | Edgerton Michael D. | Transgenic plants with improved phenotypes |
| AU2002351353A1 (en) | 2001-12-19 | 2003-09-02 | Genentech, Inc. | Stabilizing polypeptides which have been exposed to urea |
| EP1468118A4 (en) | 2002-01-31 | 2006-08-02 | Millennium Pharm Inc | METHODS AND COMPOSITIONS FOR THE TREATMENT OF CANCER |
| CN1638798A (zh) | 2002-02-14 | 2005-07-13 | 中外制药株式会社 | 包含抗体的溶液制剂 |
| US7314974B2 (en) | 2002-02-21 | 2008-01-01 | Monsanto Technology, Llc | Expression of microbial proteins in plants for production of plants with improved properties |
| MXPA04008215A (es) | 2002-02-27 | 2004-11-26 | Immunex Corp | Formulacion polipeptidica. |
| US20060068386A1 (en) | 2002-03-04 | 2006-03-30 | Alexei Slesarev | Complete genome and protein sequence of the hyperthermophile methanopyrus kandleri av19 and monophyly of archael methanogens and methods of use thereof |
| US7074559B2 (en) | 2002-03-06 | 2006-07-11 | Refents of the University of Minnesota | Mycobacterial diagnostics |
| IL149820A0 (en) | 2002-05-23 | 2002-11-10 | Curetech Ltd | Humanized immunomodulatory monoclonal antibodies for the treatment of neoplastic disease or immunodeficiency |
| US7425618B2 (en) | 2002-06-14 | 2008-09-16 | Medimmune, Inc. | Stabilized anti-respiratory syncytial virus (RSV) antibody formulations |
| US20040022792A1 (en) | 2002-06-17 | 2004-02-05 | Ralph Klinke | Method of stabilizing proteins at low pH |
| CN1671741A (zh) | 2002-06-21 | 2005-09-21 | 拜奥根Idec公司 | 浓缩抗体的缓冲剂制剂及其使用方法 |
| WO2004003144A2 (en) | 2002-07-01 | 2004-01-08 | Human Genome Sciences, Inc. | Antibodies that specifically bind to reg iv |
| AU2003251906B2 (en) | 2002-07-12 | 2008-12-04 | Medarex, Inc. | Methods and compositions for preventing oxidative degradation of proteins |
| US20040033228A1 (en) | 2002-08-16 | 2004-02-19 | Hans-Juergen Krause | Formulation of human antibodies for treating TNF-alpha associated disorders |
| DE10239073A1 (de) | 2002-08-26 | 2004-03-11 | Basf Ag | Verfahren zur fermentativen Herstellung schwefelhaltiger Feinchemikalien |
| DK1556083T3 (da) | 2002-10-08 | 2011-04-04 | Rinat Neuroscience Corp | Fremgangsmåde til behandling af post-operative smerter ved indgivelse af en antistof mod nervevækstfaktor og sammensætning indeholdende samme |
| KR100542401B1 (ko) | 2002-10-23 | 2006-01-11 | 한국전자통신연구원 | 인터넷 차별 서비스 망에서의 연결 수락 제어방법 |
| EP1578947A4 (en) | 2002-12-02 | 2006-12-06 | Abgenix Inc | ANTIBODIES AGAINST A2 PHOSPHOLIPASE AND USES |
| WO2004055164A2 (en) | 2002-12-13 | 2004-07-01 | Abgenix, Inc. | System and method for stabilizing antibodies with histidine |
| CA2511598C (en) | 2002-12-24 | 2016-09-13 | Rinat Neuroscience Corp. | Anti-ngf antibodies and methods using same |
| US7569364B2 (en) | 2002-12-24 | 2009-08-04 | Pfizer Inc. | Anti-NGF antibodies and methods using same |
| WO2005032496A2 (en) | 2003-03-07 | 2005-04-14 | Diversa Corporation | Hydrolases, nucleic acids encoding them and mehods for making and using them |
| US20050158303A1 (en) | 2003-04-04 | 2005-07-21 | Genentech, Inc. | Methods of treating IgE-mediated disorders comprising the administration of high concentration anti-IgE antibody formulations |
| JP4869064B2 (ja) | 2003-04-04 | 2012-02-01 | ジェネンテック, インコーポレイテッド | 高濃度抗体及びタンパク質製剤 |
| CN1930187B (zh) * | 2003-06-27 | 2015-08-19 | 艾默根佛蒙特有限公司 | 针对表皮生长因子受体的缺失突变体的抗体及其使用 |
| NZ544751A (en) | 2003-07-15 | 2009-05-31 | Amgen Inc | Human anti-NGF neutralizing antibodies as selective NGF pathway inhibitors |
| TW201319088A (zh) | 2003-07-18 | 2013-05-16 | Amgen Inc | 對肝細胞生長因子具專一性之結合劑 |
| US7871610B2 (en) | 2003-08-12 | 2011-01-18 | Dyax Corp. | Antibodies to Tie1 ectodomain |
| US20060107345A1 (en) | 2003-09-30 | 2006-05-18 | Nickolai Alexandrov | Sequence-determined DNA fragments and corresponding polypeptides encoded thereby |
| EP3006463A1 (en) | 2003-10-01 | 2016-04-13 | Kyowa Hakko Kirin Co., Ltd. | Method for stabilizing antibody and stabilized solution-type antibody preparation |
| CA2445743A1 (en) | 2003-10-08 | 2005-04-08 | The University Of British Columbia | Methods for modulating neuronal responses |
| EP1532983A1 (en) | 2003-11-18 | 2005-05-25 | ZLB Bioplasma AG | Immunoglobulin preparations having increased stability |
| AU2004296768B2 (en) | 2003-12-03 | 2010-06-24 | University Of Rochester | Recombinant factor VIII having increased specific activity |
| ES2553987T3 (es) | 2003-12-25 | 2015-12-15 | Kyowa Hakko Kirin Co., Ltd. | Preparación farmacéutica de base acuosa estable que contiene anticuerpo |
| EP2216640A1 (en) | 2004-01-09 | 2010-08-11 | Novozymes, Inc. | Bacillus licheniformis chromosome |
| US20060041961A1 (en) | 2004-03-25 | 2006-02-23 | Abad Mark S | Genes and uses for pant improvement |
| EP2314621B1 (en) | 2004-05-27 | 2014-03-05 | Crucell Holland B.V. | Binding molecules capable of neutralizing rabies virus and uses thereof |
| CA2564791A1 (en) | 2004-06-14 | 2005-12-29 | Medimmune Vaccines, Inc. | High pressure spray-dry of bioactive materials |
| EP1781328A4 (en) | 2004-07-10 | 2009-06-03 | Alexion Pharma Inc | METHOD FOR DETECTING SPECIFIC ANTIBODIES TO CANCER CELLS AND ANTIBODIES SOUND |
| US20080008719A1 (en) | 2004-07-10 | 2008-01-10 | Bowdish Katherine S | Methods and compositions for the treatment of prostate cancer |
| US20060075522A1 (en) | 2004-07-31 | 2006-04-06 | Jaclyn Cleveland | Genes and uses for plant improvement |
| US20060051347A1 (en) | 2004-09-09 | 2006-03-09 | Winter Charles M | Process for concentration of antibodies and therapeutic products thereof |
| JO3000B1 (ar) | 2004-10-20 | 2016-09-05 | Genentech Inc | مركبات أجسام مضادة . |
| NZ556029A (en) | 2004-12-21 | 2010-04-30 | Astrazeneca Ab | Antibodies directed to angiopoietin-2 and uses thereof |
| US20080148432A1 (en) | 2005-12-21 | 2008-06-19 | Mark Scott Abad | Transgenic plants with enhanced agronomic traits |
| EP1851245B1 (en) | 2005-01-26 | 2012-10-10 | Amgen Fremont Inc. | Antibodies against interleukin-1 beta |
| DK1848744T3 (da) | 2005-01-27 | 2012-03-19 | Novimmune Sa | Humane anti-interferon-gamma-antistoffer og fremgangsmåder til anvendelse heraf |
| GT200600031A (es) | 2005-01-28 | 2006-08-29 | Formulacion anticuerpo anti a beta | |
| AR052469A1 (es) | 2005-01-28 | 2007-03-21 | Wyeth Corp | Formulaciones liquidas estabilizadas de polipeptido |
| WO2006086469A2 (en) | 2005-02-08 | 2006-08-17 | Genzyme Corporation | Antibodies to tgfbeta |
| US8088976B2 (en) | 2005-02-24 | 2012-01-03 | Monsanto Technology Llc | Methods for genetic control of plant pest infestation and compositions thereof |
| EP2194140A2 (en) | 2005-03-02 | 2010-06-09 | Metanomics GmbH | Process for the production of fine chemicals |
| ATE505488T1 (de) | 2005-03-04 | 2011-04-15 | Univ Illinois | Modulator von coagulationskaskaden und fibrinolytischen kaskaden |
| WO2006096488A2 (en) | 2005-03-08 | 2006-09-14 | Pharmacia & Upjohn Company Llc | Composition comprising human igg2 antibody and chelating agent |
| TW200714290A (en) | 2005-03-08 | 2007-04-16 | Pharmacia & Upjohn Co Llc | Anti-M-CSF antibody compositions having reduced levels of endotoxin |
| ES2407468T3 (es) | 2005-04-18 | 2013-06-12 | Yeda Research And Development Company Limited | Formulaciones de anticuerpos anti-hepatitis B (HBV) estabilizadas |
| US7889636B2 (en) | 2005-05-24 | 2011-02-15 | Cisco Technology, Inc. | System and method for implementing a mid-call policy in a RSVP environment |
| GB2426887B (en) | 2005-06-04 | 2009-01-07 | Ibm | Client responsibilities in messaging systems |
| WO2007094842A2 (en) | 2005-12-02 | 2007-08-23 | Genentech, Inc. | Binding polypeptides and uses thereof |
| EP1899462B1 (en) | 2005-07-02 | 2011-03-09 | Arecor Limited | Stable aqueous systems comprising proteins |
| CA2615122A1 (en) | 2005-08-03 | 2007-02-15 | Immunogen, Inc. | Immunoconjugate formulations |
| AU2006295340B2 (en) | 2005-08-05 | 2010-11-11 | Amgen Inc. | Stable aqueous protein or antibody pharmaceutical formulations and their preparation |
| US20070086433A1 (en) | 2005-10-19 | 2007-04-19 | Cunetto Philip C | Methods and apparatus for allocating shared communication resources to outdial communication services |
| JP5138601B2 (ja) | 2005-11-21 | 2013-02-06 | サノフィ パストゥール リミテッド | 組換えウイルス安定化製剤 |
| US7669228B2 (en) | 2005-12-27 | 2010-02-23 | Cisco Technology, Inc. | System and method for changing network behavior based on presence information |
| EP1977763A4 (en) | 2005-12-28 | 2010-06-02 | Chugai Pharmaceutical Co Ltd | STABILIZER PREPARATION CONTAINING ANTIBODIES |
| WO2007092772A2 (en) | 2006-02-03 | 2007-08-16 | Medimmune, Inc. | Protein formulations |
| DE102006005094A1 (de) | 2006-02-04 | 2007-08-09 | Degussa Gmbh | Titandioxid und Polycarboxylatether enthaltende Dispersion |
| WO2007112054A2 (en) | 2006-03-23 | 2007-10-04 | Sea Lane Biotechnologies, Llc | Facilitation of translocation of molecules through the gastrointestinal tract |
| JP2009540018A (ja) | 2006-06-13 | 2009-11-19 | ザイモジェネティクス, インコーポレイテッド | Il−17およびil−23アンタゴニストならびにその使用方法 |
| AU2007260769A1 (en) | 2006-06-14 | 2007-12-21 | Imclone Llc | Lyophilized formulations of anti-EGFR antibodies |
| JP5829004B2 (ja) | 2006-06-30 | 2015-12-09 | ノボ・ノルデイスク・エー/エス | 抗nkg2a抗体とその使用 |
| US8355333B2 (en) | 2006-08-31 | 2013-01-15 | Ciena Corporation | Methods and systems for session initiation protocol control of network equipment |
| BRPI0719250A2 (pt) | 2006-10-12 | 2015-06-16 | Wyeth Corp | Métodos e composições com opalescência reduzida. |
| EP2094729A1 (en) | 2006-12-11 | 2009-09-02 | F.Hoffmann-La Roche Ag | Abeta antibody parenteral formulation |
| US20100209434A1 (en) | 2007-03-30 | 2010-08-19 | Medimmune, Llc | Antibody formulation |
| GB0707938D0 (en) | 2007-04-25 | 2007-05-30 | Univ Strathclyde | Precipitation stabilising compositions |
| DK2170390T3 (en) | 2007-06-14 | 2019-01-21 | Biogen Ma Inc | NATALIZUMABANTISTIC FORMULATIONS |
| UA107557C2 (xx) | 2007-07-06 | 2015-01-26 | Композиція антитіла офатумумабу | |
| SI3002298T1 (sl) * | 2007-11-21 | 2019-12-31 | Oregon Health & Science University | Monoklonska protitelesa proti faktorju XI in postopki njihove uporabe |
| JP5490714B2 (ja) | 2007-11-28 | 2014-05-14 | メディミューン,エルエルシー | タンパク質製剤 |
| CA3102704A1 (en) | 2007-12-14 | 2009-06-25 | Novo Nordisk A/S | Antibodies against human nkg2d and uses thereof |
| KR101247418B1 (ko) | 2007-12-21 | 2013-03-25 | 에프. 호프만-라 로슈 아게 | 항체 제형 |
| WO2009083225A2 (en) | 2007-12-28 | 2009-07-09 | Biolnvent International Ab | Formulation |
| JP2011515073A (ja) | 2008-02-20 | 2011-05-19 | ジーツー インフラメイション プロプライエタリー リミテッド | ヒト化抗C5aR抗体 |
| WO2009120684A1 (en) | 2008-03-25 | 2009-10-01 | Medimmune, Llc | Antibody formulation |
| JP2011526591A (ja) | 2008-06-30 | 2011-10-13 | ノボ・ノルデイスク・エー/エス | 抗ヒトインターロイキン−20抗体 |
| RU2518278C2 (ru) | 2008-09-19 | 2014-06-10 | Пфайзер Инк. | Стабильный жидкий препарат антитела |
| CN102301235B (zh) | 2008-11-28 | 2014-11-19 | Abbvie公司 | 稳定的抗体组合物和用于稳定其的方法 |
| EP2196476A1 (en) | 2008-12-10 | 2010-06-16 | Novartis Ag | Antibody formulation |
| BRPI0922344A2 (pt) | 2008-12-19 | 2017-10-24 | 3B Pharmaceuticals Gmbh | inibidores de tfpi e métodos de uso |
| WO2010072687A1 (en) | 2008-12-22 | 2010-07-01 | Novo Nordisk A/S | Antibodies against tissue factor pathway inhibitor (tfpi) |
| AU2009331570C1 (en) | 2008-12-22 | 2024-04-18 | Novo Nordisk A/S | Antibodies against tissue factor pathway inhibitor |
| RU2011140498A (ru) | 2009-03-06 | 2013-04-20 | Дженентек, Инк. | Препарат антител |
| EP2442798A4 (en) | 2009-06-18 | 2013-03-13 | Wyeth Llc | LYOPHILIZED FORMULATIONS FOR SMALL-SCALE MODULAR IMMUNOPHARMACEUTICAL AGENTS |
| US9884117B2 (en) | 2009-09-03 | 2018-02-06 | Ablynx N.V. | Stable formulations of polypeptides and uses thereof |
| EP2332995A1 (en) | 2009-12-10 | 2011-06-15 | Bayer Schering Pharma Aktiengesellschaft | Neutralizing prolactin receptor antibodies and their therapeutic use |
| RU2012139181A (ru) | 2010-02-26 | 2014-04-10 | Ново Нордиск А/С | Стабильная композиция, содержащая антитело |
| SI3345615T1 (sl) * | 2010-03-01 | 2020-03-31 | Bayer Healthcare Llc | Optimizirana monoklonska protitelesa proti zaviralcu poti tkivnega faktorja (TFPI) |
| JP5730983B2 (ja) | 2010-03-19 | 2015-06-10 | バクスター・インターナショナル・インコーポレイテッドBaxter International Incorp0Rated | Tfpi阻害剤および使用方法 |
| WO2011147921A1 (en) | 2010-05-28 | 2011-12-01 | Novo Nordisk A/S | Stable multi-dose compositions comprising an antibody and a preservative |
| AU2012214148A1 (en) | 2011-02-11 | 2013-08-29 | Baxter Healthcare S.A. | Aptamers to tissue factor pathway inhibitor and their use as bleeding disorder therapeutics |
| LT2694544T (lt) | 2011-04-01 | 2019-04-25 | Bayer Healthcare Llc | Monokloniniai antikūnai prieš audinių faktoriaus kelio slopiklį (tfpi) |
| EP2827910A2 (en) | 2012-03-22 | 2015-01-28 | Baxter International Inc | Aptamers to tissue factor pathway inhibitor and their use as bleeding disorder therapeutics |
| US8613919B1 (en) | 2012-08-31 | 2013-12-24 | Bayer Healthcare, Llc | High concentration antibody and protein formulations |
| US9592297B2 (en) | 2012-08-31 | 2017-03-14 | Bayer Healthcare Llc | Antibody and protein formulations |
| ES2657304T3 (es) | 2013-03-15 | 2018-03-02 | Bayer Healthcare Llc | Variantes de anticuerpo anti TFPI con unión diferencial a lo largo del intervalo de pH para mejorar la farmacocinética |
| EP4279128A3 (en) | 2015-02-25 | 2024-02-28 | Mogam Institute for Biomedical Research | Novel antibody binding to tfpi and composition comprising the same |
| MY195443A (en) | 2015-08-19 | 2023-01-21 | Pfizer | Tissue Factor Pathway Inhibitor Antibodies and uses Thereof |
-
2011
- 2011-03-01 SI SI201131830T patent/SI3345615T1/sl unknown
- 2011-03-01 CN CN201510319455.4A patent/CN105001335B/zh not_active Expired - Fee Related
- 2011-03-01 KR KR1020127025683A patent/KR101807894B1/ko active IP Right Grant
- 2011-03-01 KR KR1020197012160A patent/KR20190047135A/ko not_active Application Discontinuation
- 2011-03-01 ES ES17172199T patent/ES2765418T3/es active Active
- 2011-03-01 US US15/208,498 patent/USRE47150E1/en active Active
- 2011-03-01 DK DK11751244.2T patent/DK2542257T3/en active
- 2011-03-01 NZ NZ702494A patent/NZ702494A/en not_active IP Right Cessation
- 2011-03-01 SG SG10201502587SA patent/SG10201502587SA/en unknown
- 2011-03-01 RS RS20170978A patent/RS56409B1/sr unknown
- 2011-03-01 CN CN201180022078.8A patent/CN102939098B/zh not_active Expired - Fee Related
- 2011-03-01 LT LTEP17172199.6T patent/LT3345615T/lt unknown
- 2011-03-01 LT LTEP11751244.2T patent/LT2542257T/lt unknown
- 2011-03-01 MX MX2012010198A patent/MX2012010198A/es active IP Right Grant
- 2011-03-01 US US13/582,401 patent/US9309324B2/en not_active Ceased
- 2011-03-01 CN CN201911010357.7A patent/CN110835373A/zh active Pending
- 2011-03-01 MY MYPI2012003902A patent/MY174760A/en unknown
- 2011-03-01 SG SG2012062121A patent/SG183443A1/en unknown
- 2011-03-01 CA CA3101298A patent/CA3101298A1/en not_active Abandoned
- 2011-03-01 HU HUE17172199A patent/HUE047173T2/hu unknown
- 2011-03-01 PL PL11751244T patent/PL2542257T3/pl unknown
- 2011-03-01 PL PL17172199T patent/PL3345615T3/pl unknown
- 2011-03-01 CN CN201711202426.5A patent/CN107987166A/zh active Pending
- 2011-03-01 PT PT171721996T patent/PT3345615T/pt unknown
- 2011-03-01 EA EA201290849A patent/EA032189B9/ru not_active IP Right Cessation
- 2011-03-01 EA EA201892184A patent/EA201892184A1/ru unknown
- 2011-03-01 PT PT117512442T patent/PT2542257T/pt unknown
- 2011-03-01 RS RS20191646A patent/RS59830B1/sr unknown
- 2011-03-01 EP EP17172199.6A patent/EP3345615B1/en active Active
- 2011-03-01 HU HUE11751244A patent/HUE036655T2/hu unknown
- 2011-03-01 KR KR1020177034610A patent/KR101903931B1/ko active IP Right Grant
- 2011-03-01 ES ES11751244.2T patent/ES2642512T3/es active Active
- 2011-03-01 DK DK17172199.6T patent/DK3345615T3/da active
- 2011-03-01 BR BR112012022258A patent/BR112012022258A2/pt active Search and Examination
- 2011-03-01 SI SI201131308T patent/SI2542257T1/en unknown
- 2011-03-01 KR KR1020187022511A patent/KR101974980B1/ko active IP Right Grant
- 2011-03-01 SG SG10201903166PA patent/SG10201903166PA/en unknown
- 2011-03-01 CA CA2791685A patent/CA2791685C/en not_active Expired - Fee Related
- 2011-03-01 WO PCT/US2011/026766 patent/WO2011109452A1/en active Application Filing
- 2011-03-01 NZ NZ602115A patent/NZ602115A/en not_active IP Right Cessation
- 2011-03-01 EP EP11751244.2A patent/EP2542257B1/en active Active
- 2011-03-01 CN CN201610539997.7A patent/CN106188301A/zh active Pending
- 2011-03-01 ME MEP-2019-366A patent/ME03578B/me unknown
- 2011-03-01 JP JP2012556192A patent/JP6025570B2/ja not_active Expired - Fee Related
- 2011-03-01 CA CA2976671A patent/CA2976671C/en not_active Expired - Fee Related
- 2011-03-01 AU AU2011223710A patent/AU2011223710B2/en not_active Ceased
- 2011-12-12 US US13/323,691 patent/US8481030B2/en active Active
-
2012
- 2012-08-20 IL IL221551A patent/IL221551B/en active IP Right Grant
- 2012-08-30 GT GT201200252A patent/GT201200252A/es unknown
- 2012-08-30 CU CU20120126A patent/CU23982B1/es active IP Right Grant
- 2012-08-31 CO CO12149294A patent/CO6620068A2/es unknown
- 2012-08-31 DO DO2012000239A patent/DOP2012000239A/es unknown
- 2012-08-31 CL CL2012002415A patent/CL2012002415A1/es unknown
- 2012-08-31 EC ECSP12012134 patent/ECSP12012134A/es unknown
- 2012-09-03 CR CR20120453A patent/CR20120453A/es unknown
- 2012-09-03 MX MX2014010845A patent/MX354743B/es unknown
- 2012-09-18 PE PE2012001387A patent/PE20160538A1/es not_active Application Discontinuation
-
2013
- 2013-04-29 HK HK17105555.7A patent/HK1232232A1/zh unknown
-
2016
- 2016-10-11 JP JP2016199718A patent/JP6475679B2/ja not_active Expired - Fee Related
-
2017
- 2017-03-24 ME MEP-2017-78A patent/ME02894B/me unknown
- 2017-10-02 HR HRP20171472TT patent/HRP20171472T1/hr unknown
- 2017-10-05 CY CY20171101040T patent/CY1119410T1/el unknown
- 2017-12-14 CL CL2017003218A patent/CL2017003218A1/es unknown
-
2018
- 2018-03-22 PH PH12018500640A patent/PH12018500640A1/en unknown
- 2018-03-22 PH PH12018500639A patent/PH12018500639A1/en unknown
- 2018-03-22 PH PH12018500641A patent/PH12018500641A1/en unknown
- 2018-10-17 IL IL262444A patent/IL262444B/en active IP Right Grant
- 2018-11-02 HK HK18114050.8A patent/HK1254947A1/zh unknown
-
2019
- 2019-02-01 JP JP2019016811A patent/JP6684369B2/ja not_active Expired - Fee Related
- 2019-04-09 EC ECSENADI201925350A patent/ECSP19025350A/es unknown
- 2019-12-20 HR HRP20192295TT patent/HRP20192295T1/hr unknown
-
2020
- 2020-01-09 CY CY20201100019T patent/CY1122476T1/el unknown
- 2020-03-27 JP JP2020057005A patent/JP2020115868A/ja not_active Withdrawn
- 2020-09-16 IL IL277391A patent/IL277391A/en unknown
Patent Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2010017196A2 (en) * | 2008-08-04 | 2010-02-11 | Bayer Healthcare Llc | Monoclonal antibodies against tissue factor pathway inhibitor (tfpi) |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR101974980B1 (ko) | 조직 인자 경로 억제제 (tfpi)에 대한 최적화된 모노클로날 항체 | |
| US20170342162A1 (en) | Monoclonal antibodies against tissue factor pathway inhibitor (tfpi) | |
| AU2018271420B2 (en) | Optimized monoclonal antibodies against tissue factor pathway inhibitor (TFPI) | |
| AU2013202745B2 (en) | Optimized monoclonal antibodies against tissue factor pathway inhibitor (TFPI) |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A107 | Divisional application of patent | ||
| E902 | Notification of reason for refusal | ||
| E701 | Decision to grant or registration of patent right |