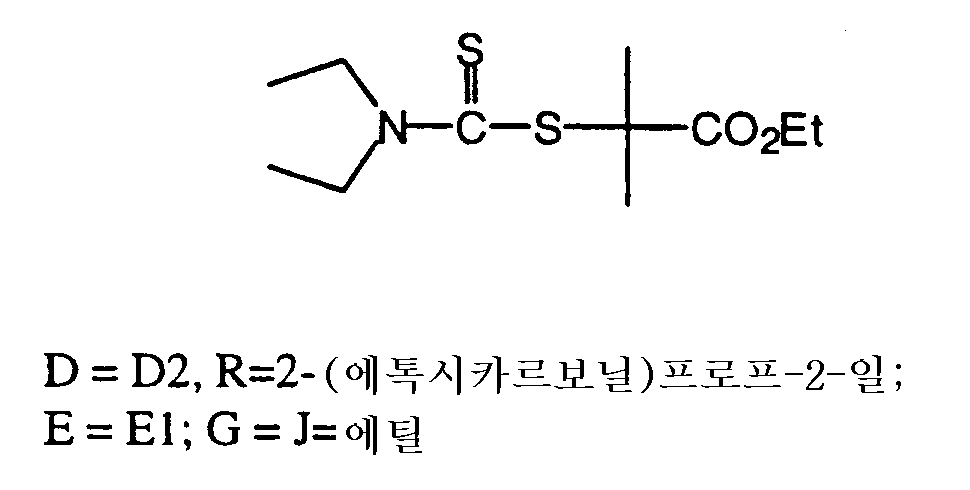본 발명은 자유 라디칼원, 및 전이 상수가 0.1 내지 5000의 범위인 하기 화학식 2로 표시되는 사슬 전이제의 존재하에 단량체 혼합물을 중합체로 중합시키는 것을 포함하는 중합체의 제조 방법에 관한 것이다.
상기 식에서,
D가 하기 화학식 3의 D1일 경우,
p는 1 내지 200이고, E는 Z'이고, 상기 전이제는 하기 화학식 4로 표시되고,
D가 하기 화학식 5의 D2일 경우,
p는 1 내지 200이고, E는 E1 또는 E2이고, 상기 전이제는 하기 화학식 6으로 표시되고,
D가 하기 화학식 7의 D3일 경우,
p'은 2 내지 200이고, E는 Z, E1 또는 E2이고, 상기 전이제는 하기 화학식 8로 표시되고,
또는, D가 하기 화학식 9의 D4일 경우,
E는 E3 또는 E4이고, 상기 전이제는 하기 화학식 10으로 표시되고,
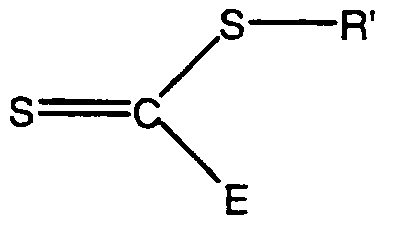
-S-R'
R은 치환되거나 비치환된 알칸, 치환되거나 비치환된 알켄, 치환되거나 비치환된 아렌, 불포화 또는 방향족 카르보시클릭 고리, 불포화 또는 포화 헤테로시클릭 고리, 유기금속 종, 및 중합체 사슬로 구성된 군에서 선택된 잔기로부터 유래된 p가의 잔기이고, R·은 자유 라디칼 중합을 개시하는, R로부터 얻어진 자유 라디칼 이탈기이며,
R* 및 R'은 서로 독립적으로, 치환되거나 비치환된 알킬, 치환되거나 비치환된 알케닐, 치환되거나 비치환된 아릴, 불포화 또는 방향족 카르보시클릭 고리, 불포화 또는 포화 헤테로시클릭 고리, 치환되거나 비치환된 알킬티오, 치환되거나 비치환된 알콕시, 치환되거나 비치환된 디알킬아미노, 유기금속 종, 및 중합체 사슬로 구성된 군에서 선택된 1가의 잔기이고, R*·은 자유 라디칼 중합을 개시하는, R*로부터 얻어진 자유 라디칼 이탈기이며,
X는 치환되거나 비치환된 메틴, 질소, 및 공액기로 구성된 군에서 선택되고,
Z'는 E1, E2, 할로겐, 치환되거나 비치환된 알킬, 치환되거나 비치환된 알케닐, 치환되거나 비치환된 아릴, 치환되거나 비치환된 헤테로시클릴, 치환되거나 비치환된 알킬티오, 치환되거나 비치환된 알콕시카르보닐, 치환되거나 비치환된 -COOR", 카르복시, 치환되거나 비치환된 -CONR"2, 시아노, -P(=O)(OR")2, -P(=O)R"2로 구성된 군에서 선택되고,
R"는 치환되거나 비치환된 알킬, 치환되거나 비치환된 알케닐, 치환되거나 비치환된 아릴, 치환되거나 비치환된 헤테로시클릴, 치환되거나 비치환된 아랄킬, 치환되거나 비치환된 알크아릴, 및 이들의 조합으로 구성된 군에서 선택되고,
Z"는 치환되거나 비치환된 알칸, 치환되거나 비치환된 알켄, 치환되거나 비치환된 아렌, 치환되거나 비치환된 헤테로사이클, 중합체 사슬, 유기금속 종, 및 이들의 조합으로 구성된 군에서 선택된 잔기로부터 유래된 p'가의 잔기이고,
Z는 할로겐, 치환되거나 비치환된 알킬, 치환되거나 비치환된 알케닐, 치환되거나 비치환된 아릴, 치환되거나 비치환된 헤테로시클릴, 치환되거나 비치환된 알킬티오, 치환되거나 비치환된 알콕시카르보닐, 치환되거나 비치환된 -COOR", 카르복시, 치환되거나 비치환된 -CONR"2, 시아노, -P(=O)(OR")2, -P(=O)R"
2로 구성된 군에서 선택되고,
E1은 질소 원자를 통해 결합된, 치환되거나 비치환된 헤테로사이클로부터 유래된 치환체 관능기이거나 하기 화학식 11로 표시되는 기이고,
(상기 식에서,
G 및 J는 서로 독립적으로, 수소, 치환되거나 비치환된 알킬, 치환되거나 비치환된 알케닐, 치환되거나 비치환된 알콕시, 치환되거나 비치환된 아실, 치환되거나 비치환된 아로일, 치환되거나 비치환된 아릴, 치환되거나 비치환된 헤테로아릴, 치환되거나 비치환된 알케닐, 치환되거나 비치환된 알킬술포닐, 치환되거나 비치환된 알킬술피닐, 치환되거나 비치환된 알킬포스포닐, 치환되거나 비치환된 아릴술포 닐, 치환되거나 비치환된 아릴술피닐, 치환되거나 비치환된 아릴포스포닐로 구성된 군에서 선택됨)
E2는 하기 화학식 12로 표시되는 기이고,
(상기 식에서, G'는 치환되거나 비치환된 알킬, 치환되거나 비치환된 알케닐, 치환되거나 비치환된 아릴로 구성된 군에서 선택됨)
E3은 하기 화학식 13으로 표시되는 기이고,
(상기 식에서,
p"'는 2 내지 200이고,
G"는 Z"이고,
J'는 수소, 치환되거나 비치환된 알킬, 치환되거나 비치환된 알케닐, 치환되거나 비치환된 알콕시, 치환되거나 비치환된 아실, 치환되거나 비치환된 아로일, 치환되거나 비치환된 아릴, 치환되거나 비치환된 헤테로아릴, 치환되거나 비치환된 알케닐, 치환되거나 비치환된 알킬술포닐, 치환되거나 비치환된 알킬술피닐, 치환되거나 비치환된 알킬포스포닐, 치환되거나 비치환된 아릴술포닐, 치환되거나 비치 환된 아릴술피닐, 치환되거나 비치환된 아릴포스포닐로 구성된 군에서 독립적으로 선택되거나, G"와 함께 5 내지 8원의 고리를 형성함)
E4는 하기 화학식 14로 표시되는 기이다.
상기 식에서, p"'는 2 내지 200이고, G"'는 Z"이다.
본 발명은 또한 본 발명의 방법으로 제조된 중합체에 관한 것이다. 실시태양 중의 한 가지는 하기 화학식 32의 중합체에 관한 것이다.
상기 식에서,
n은 1 내지 100,000의 양의 정수이고,
D가 D1이고 E가 Z'일 경우, A는 하기 화학식 34로 표시되고,
D가 D2이고 E가 E1일 경우, A는 하기 화학식 36으로 표시되고,
또는, D가 D2이고 E가 E2일 경우, A는 하기 화학식 38로 표시되고,
Q"는 말레산 무수물, N-알킬말레이미드, N-아릴말레이미드, 디알킬 푸마레이트, 시클로중합 가능한 단량체, 개환 단량체, 거대단량체, 하기 화학식 31의 비닐 단량체 및 이들의 혼합물로 구성된 군에서 선택된 단량체로부터 유래된 반복 단위이다.
상기 식에서,
L은 수소, 할로겐, 및 히드록시, 알콕시, OR", CO2H, O2CR", CO2R" 및 이들의 조합으로 구성된 군에서 독립적으로 선택된 치환체로 치환되거나 비치환된 C1-C4 알킬로 구성된 군에서 선택되고,
M은 수소, R", CO2H, CO2R", COR", CN, CONH2, CONHR", CONR"2, O2CR", OR", 및 할로겐으로 구성된 군에서 선택된다.
또다른 실시태양은 하기 화학식 40으로 표시되는 이성질체의 혼합물을 포함하는 중합체이다.
상기 식에서,
n은 1 내지 100,000의 양의 정수이고,
D는 D3이고,
E는 Z, E1 또는 E2이다.
또다른 실시태양은 하기 화학식 41의 중합체이다.
상기 식에서,
n은 1 내지 100,000의 양의 정수이고, D는 D4이고, E는 E3이다.
또다른 실시태양은 하기 화학식 41a의 중합체이다.
상기 식에서,
n은 1 내지 100,000의 양의 정수이고, D는 D4이고, E는 E4이다.
본 중합 시스템의 이점 중의 하나는 반응 화학량 및 단량체의 중합체로의 전환율을 조절함으로써 다양한 단량체 및 반응 조건에서 선결정된 분자량 및 분자량 분포가 좁은 중합체를 제조한다는 점이다.
본 발명의 방법의 또다른 이점은 여러가지 단량체를 반응 혼합물에 연속적으로 첨가함으로써, 다분산도가 낮고 원하는 분자량을 갖는 블록 중합체를 제조할 수 있다는 점이다.
본 발명의 방법의 또다른 이점은 복잡한 구조를 갖는 중합체, 예를 들어 그라프트, 스타 및 가지 중합체를 제조할 수 있다는 점이다.
본 발명의 또다른 이점으로는 배치, 반-배치, 연속 또는 피드 형 중 어떤 형으로든 유화, 용액, 또는 현탁 중합을 수행하기에 적절하다는 점이다.
본 발명의 또다른 이점은 수용성이거나 수분산 가능한 수성 중합체를 제조하기에 적절하다는 점이다.
본 발명의 또다른 이점은 용매 용해성 또는 용매 분산 가능한 용매성 중합체를 제조하기에 적절하다는 점이다.
본 명세서에서는 용어를 하기와 같이 정의한다.
"리빙 중합"은 대부분의 사슬이 중합 내내 계속해서 자라고, 추가의 단량체를 첨가하면 중합이 계속되는 (블록 공중합체는 여러가지 단량체를 차례로 첨가함으로써 제조할 수 있음) 메카니즘으로 진행되는 방법을 의미한다. 분자량은 반응의 화학량론에 의해 조절되며, 좁은 분자량 분포를 가진 중합체를 얻을 수 있다.
"라디칼 이탈기"는 반응 중에 균일 절단되어 자유 라디칼을 형성할 수 있는 결합으로 연결된 기를 의미한다.
"GPC 수평균 분자량" (Mn)은 겔 투과 크로마토그래피를 사용하여 측정된 수평균 분자량을 의미하고, "GPC 중량 평균 분자량" (Mw)은 겔 투과 크로마토그래피를 사용하여 측정된 중량 평균 분자량을 의미한다. 시차 굴절계 및 106, 105, 104, 103, 500 및 100 Å의 울트라스티라겔 (Ultrastyragel) 칼럼이 장치된 워터스 어소시에이츠 (Waters Associates)사제 액체 크로마토그래프를 사용하였다. 테트라히드로푸란 (유출 속도 1.0 mL/min)을 용출액으로 사용하였다. 분자량은 폴리스티렌 당량으로 제공하였다.
"다분산도" (Mw/Mn)는 GPC 중량 평균 분자량을 GPC 수평균 분자량으로 나눈 것을 의미한다.
"첨가-분절"은 라디칼 첨가 후 분절이 일어나 새로운 라디칼 종을 생성하는 2 단계 사슬 전이 메카니즘이다.
"사슬 전이 상수"는 단량체 및 CTA의 전환율 0에서의 성장 속도 상수에 대한 사슬 전이 속도 상수의 비를 의미한다. 사슬 전이가 첨가-분절에 의해 일어날 경우, 사슬 전이 속도 상수 (ktr)는 하기 수학식 1과 같다.
상기 식에서,
kadd는 CTA에 대한 첨가 속도 상수이고,
k-add 및 kβ는 각각 역방향 및 정방향에서의 분절 속도 상수이다.
"중합체 사슬"은 폴리에스테르 [예, 폴리카프로락톤, 폴리(에틸렌 테레프탈레이트)], 폴리카르보네이트, 폴리(알킬렌 옥시드) [예, 폴리(에틸렌 옥시드), 폴리(테트라메틸렌 옥시드)], 나일론, 폴리우레탄 등의 통상적인 축합 중합체, 또는 배위 중합 (예, 폴리에틸렌, 폴리프로필렌), 라디칼 중합 (예, 폴리(메트)아크릴레이트 및 폴리스티레닉) 또는 음이온 중합 (예, 폴리스티렌, 폴리부타디엔)에 의해 형성된 부가 중합체를 의미한다.
"시클로중합 가능한 단량체"는 분자내 및 분자간 첨가 단계의 순서에 따라 성장하면서 시클릭 단위를 중합체 주사슬에 도입할 수 있도록 적절하게 배치된 2개 이상의 불포화 결합을 함유하는 화합물을 의미한다. 이러한 유형의 대부분의 화합물은 디알릴암모늄 염 (예, 디알릴디메틸암모늄 클로라이드), 치환된 1,6-헵타디엔 (예, 6-디시아노-1,6-헵타디엔, 2,4,4,6-테트라키스(에톡시카르보닐)-1,6-헵타디엔) 및 하기 화학식의 단량체와 같은 1,6-디엔이다.
상기 식에서,
치환체 K, K', T, B 및 B'는 단량체가 시클로중합을 할 수 있도록 선택된다. 예를 들면,
B 및 B'은 서로 독립적으로 H, CH3, CN, CO2알킬, Ph로 구성된 군에서 선택되고,
K 및 K'는 CH2, C=O, Si(CH3)2, O로 구성된 군에서 선택되고,
T는 C(E)2, O, N(알킬)2 염, P(알킬)2 염 및 P(O)알킬로 구성된 군에서 선택된다.
문헌 [Moad and Solomon, "The Chemistry of Free Radical Polymerization", Pergamon, London, 1995, pp 162-170]에 나열된 다른 단량체들도 적절하다.
"개환 단량체"는 문헌 [Moad and Solomon, "The Chemistry of Free Radical Polymerization", Pergamon, London, 1995, pp 171-186]에 기재된 바와 같이 분자간 첨가 및 분자내 개환의 순서로 성장하도록 적절하게 배치된 카르보시클릭 또는 헤테로시클릭 고리를 함유하는 단량체이다.
"유기금속 종"은 라디칼 이탈기를 제공하고 중합을 개시하는 주기율표 상의 III족 및 IV족에 있는 하나 이상의 금속 원자 및 전이 원소, 및 유기 리간드를 포함하는 잔기, 바람직하게는 Si(X)3, Ge(X)3, 및 Sn(X)3의 종 (여기에서, X는 본 명세서에서 후에 논의함)을 의미한다.
"헤테로시클릭" 또는 "헤테로시클릴"은 O, N 및 S 중에서 선택된 것 중 하나 이상을 포함하고 3 내지 18개의 원자로 이루어져 있으며, 방향족이거나 아닐 수 있는 고리 구조를 의미한다. "헤테로시클릴" 잔기의 예로는 피리딜, 푸라닐, 티에닐, 피페리디닐, 피롤리디닐, 피라조일, 벤즈티아졸릴, 인돌릴, 벤조푸라닐, 벤조티오페닐, 피라지닐, 및 퀴놀릴을 들 수 있으며, 이들은 경우에 따라 하나 이상의 알킬, 할로알킬 및 할로기로 치환될 수 있다.
"질소 원자를 통해 결합된, 치환되거나 비치환된 헤테로사이클로부터 유래된 치환체 관능기"는 적당한 질소 함유 헤테로사이클로부터 1가의 질소 (예, >NH)를 제거함으로써 형성된 기를 의미한다. 상기 헤테로사이클은 피롤리딘, 피롤, 인돌, 이미다졸, 카르바졸, 벤즈이미다졸, 벤조트리아졸, 피페리딘 및 이사틴을 포함하고, 이들은 모두 치환되거나 비치환될 수 있다. 예를 들어, 피롤의 경우에 치환체 관능기는 1,3-부타디엔-1,4-디일이고, 피롤리딘의 경우에는 부탄-1,4-디일이다.
특별한 언급이 없으면, 본 명세서에서 언급하는 알킬기는 분지형 또는 비분지형일 수 있으며, 1 내지 18개의 탄소 원자를 포함한다. 알케닐기는 분지형 또는 비분지형일 수 있으며, 2 내지 18개의 탄소 원자를 포함한다. 포화 또는 불포화, 또는 카르보시클릭 또는 헤테로시클릭 고리는 3 내지 18개의 원자를 포함할 수 있다. 방향족 카르보시클릭 또는 헤테로시클릭 고리는 5 내지 18개의 탄소 원자를 포함할 수 있다.
"공액기"는 D가 D1인 화학식 2의 화합물의 경우에는 C=S 이중 결합과 S-R기의 비공유 쌍 사이에 오비탈 겹침이 있고, D가 D2이고 E가 E1인 화학식 2의 화합물의 경우에는 질소의 비공유 쌍에 오비탈 겹침이 있어서 회합된 전자의 비편재화를 제공하는 것이다. 이와 같은 공액기의 예는 하기 문헌에 제공된다.
"치환된"은 임의의 기가 알킬, 아릴, 에폭시, 히드록시, 알콕시, 옥소, 아실, 아실옥시, 카르복시, 카르복실레이트, 술폰산, 술폰산염, 알콕시- 또는 아릴옥시-카르보닐, 이소시아네이토, 시아노, 실릴, 할로, 디알킬아미노, 및 아미도로 구성된 군에서 독립적으로 선택된 하나 이상의 기로 치환될 수 있음을 의미한다. 모든 치환체는 실험 조건에서 상당한 반대의 상호 작용이 없도록 선택한다.
본 발명자들은 신규의 자유 라디칼 중합 방법 및 이 방법으로 제조된 신규 중합체를 발견하였다. 이 방법은 자유 라디칼원, 및 리빙 특성을 제공하도록 선택된 하나 이상의 황에 기초한 특정한 CTA의 존재하에 단량체 혼합물을 중합시키는 것이다. 이러한 CTA를 사용함으로써, 조절된 분자량 및 낮은 다분산도를 갖는 중합체를 얻을 수 있다.
본 발명에서 사용하기에 적절한, 황에 기초한 CTA는 사슬 전이 상수가 0.1 내지 5000, 바람직하게는 1 내지 2000, 더욱 바람직하게는 10 내지 500의 범위이다. CTA의 사슬 전이 상수가 범위의 상한을 초과하면 실질적으로 중합이 일어나지 않고, 이 상수가 하한 이하로 떨어지면 낮은 다분산도를 갖는 중합체를 제조할 수 없다. 본 발명의 CTA는 일반적으로 중합 공정 중에 단량체와 공중합해서는 안 된다. 따라서, 단치환된 단량체 (예, 아크릴계 단량체, 스티렌)를 기초로 하고 다분산도가 낮은 중합체를 다양한 반응 조건에서 제조할 수 있다.
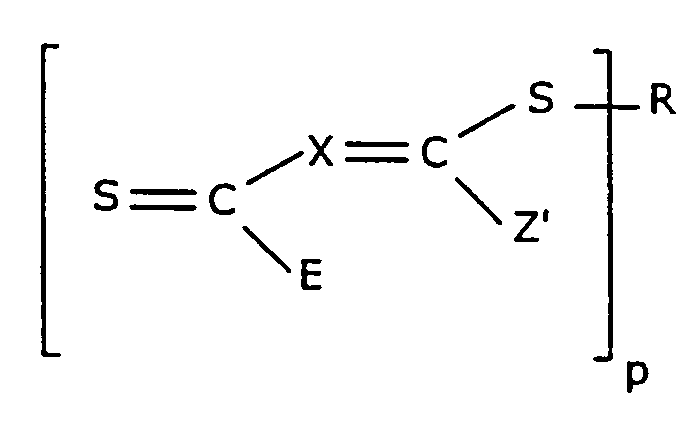
본 발명의 방법에서 사용하기에 적절한, 황에 기초한 CTA는 화학식 2의 화합물이다.
<화학식 2>
상기 식에서,
D가 하기 화학식 3의 D1일 경우,
p는 1 내지 200이고, E는 Z'이고, 상기 전이제는 하기 화학식 4로 표시되고,
<화학식 3>
<화학식 4>
D가 하기 화학식 5의 D2이고,
p는 1 내지 200이고, E는 E1 또는 E2이고, 상기 전이제는 하기 화학식 6으로 표시되고,
<화학식 5>
<화학식 6>
D가 하기 화학식 7의 D3이고,
p'는 2 내지 200이고, E는 Z, E1 또는 E2이고, 상기 전이제는 하기 화학식 8로 표시되고,
<화학식 7>
<화학식 8>
또는, D가 하기 화학식 9의 D4이고,
E는 E3 또는 E4이고, 상기 전이제는 하기 화학식 10으로 표시되고,
<화학식 9>
-S-R'
<화학식 10>
R은 치환되거나 비치환된 알칸, 치환되거나 비치환된 알켄, 치환되거나 비치환된 아렌, 불포화 또는 방향족 카르보시클릭 고리, 불포화 또는 포화 헤테로시클릭 고리, 유기금속 종, 및 중합체 사슬로 구성된 군에서 선택된 잔기로부터 유래된 p가의 잔기이고, R·은 자유 라디칼 중합을 개시하는, R로부터 얻어진 자유 라디칼 이탈기이며,
R* 및 R'은 서로 독립적으로, 치환되거나 비치환된 알킬, 치환되거나 비치환된 알케닐, 치환되거나 비치환된 아릴, 불포화 또는 방향족 카르보시클릭 고리, 불포화 또는 포화 헤테로시클릭 고리, 치환되거나 비치환된 알킬티오, 치환되거나 비치환된 알콕시, 치환되거나 비치환된 디알킬아미노, 유기금속 종, 및 중합체 사슬로 구성된 군에서 선택된 1가의 잔기이고, R*·은 자유 라디칼 중합을 개시하는, R*로부터 얻어진 자유 라디칼 이탈기이며,
X는 치환되거나 비치환된 메틴, 질소, 및 공액기로 구성된 군에서 선택되고,
Z'는 E1, E2, 할로겐, 치환되거나 비치환된 알킬, 치환되거나 비치환된 알케 닐, 치환되거나 비치환된 아릴, 치환되거나 비치환된 헤테로시클릴, 치환되거나 비치환된 알킬티오, 치환되거나 비치환된 알콕시카르보닐, 치환되거나 비치환된 -COOR", 카르복시, 치환되거나 비치환된 -CONR"2, 시아노, -P(=O)(OR")2, -P(=O)R"2로 구성된 군에서 선택되고,
R"는 치환되거나 비치환된 알킬, 치환되거나 비치환된 알케닐, 치환되거나 비치환된 아릴, 치환되거나 비치환된 헤테로시클릴, 치환되거나 비치환된 아랄킬, 치환되거나 비치환된 알크아릴, 및 이들의 조합으로 구성된 군에서 선택되고,
Z"는 치환되거나 비치환된 알칸, 치환되거나 비치환된 알켄, 치환되거나 비치환된 아렌, 치환되거나 비치환된 헤테로사이클, 중합체 사슬, 유기금속 종, 및 이들의 조합으로 구성된 군에서 선택된 잔기로부터 유래된 p'가의 잔기이고,
Z는 할로겐, 치환되거나 비치환된 알킬, 치환되거나 비치환된 알케닐, 치환되거나 비치환된 아릴, 치환되거나 비치환된 헤테로시클릴, 치환되거나 비치환된 알킬티오, 치환되거나 비치환된 알콕시카르보닐, 치환되거나 비치환된 -COOR", 카르복시, 치환되거나 비치환된 -CONR"2, 시아노, -P(=O)(OR")2, -P(=O)R"
2로 구성된 군에서 선택되고,
E1은 질소 원자를 통해 결합된, 치환되거나 비치환된 헤테로사이클로부터 유래된 치환체 관능기이거나 하기 화학식 11로 표시되는 기이고,
<화학식 11>
(상기 식에서,
G 및 J는 서로 독립적으로, 수소, 치환되거나 비치환된 알킬, 치환되거나 비치환된 알케닐, 치환되거나 비치환된 알콕시, 치환되거나 비치환된 아실, 치환되거나 비치환된 아로일, 치환되거나 비치환된 아릴, 치환되거나 비치환된 헤테로아릴, 치환되거나 비치환된 알케닐, 치환되거나 비치환된 알킬술포닐, 치환되거나 비치환된 알킬술피닐, 치환되거나 비치환된 알킬포스포닐, 치환되거나 비치환된 아릴술포닐, 치환되거나 비치환된 아릴술피닐, 치환되거나 비치환된 아릴포스포닐로 구성된 군에서 선택됨)
E2는 하기 화학식 12로 표시되는 기이고,
<화학식 12>
(상기 식에서, G'는 치환되거나 비치환된 알킬, 치환되거나 비치환된 알케닐, 치환되거나 비치환된 아릴로 구성된 군에서 선택됨)
E3는 하기 화학식 13으로 표시되는 기이고,
<화학식 13>
(상기 식에서,
p"'는 2 내지 200이고,
G"는 Z"이고,
J'는 수소, 치환되거나 비치환된 알킬, 치환되거나 비치환된 알케닐, 치환되거나 비치환된 알콕시, 치환되거나 비치환된 아실, 치환되거나 비치환된 아로일, 치환되거나 비치환된 아릴, 치환되거나 비치환된 헤테로아릴, 치환되거나 비치환된 알케닐, 치환되거나 비치환된 알킬술포닐, 치환되거나 비치환된 알킬술피닐, 치환되거나 비치환된 알킬포스포닐, 치환되거나 비치환된 아릴술포닐, 치환되거나 비치환된 아릴술피닐, 치환되거나 비치환된 아릴포스포닐로 구성된 군에서 독립적으로 선택됨)
E4는 화학식 14로 표시되는 기이다.
<화학식 14>
상기 식에서, p"'는 2 내지 200이고, G"'는 Z"이다.
상기 CTA는 하기 방법으로 제조된다.
비닐위치 디티오에스테르는 몇 가지 경로로 제조할 수 있다. 예를 들면, 3-벤질티오-5,5-디메틸시클로헥스-2-엔-1-티온은 다단계 공정으로 제조할 수 있다. 먼저, 강산의 존재하에 피페리딘을 5,5-디메틸시클로헥산-1,3-디온과 축합시켜 엔아미노케톤을 형성시키고, 이어서 티온 유도체로 전환시킨다. 벤질 클로라이드의 첨가 및 황화 수소 후처리 후에 3-벤질티오-5,5-디메틸시클로헥스-2-엔-1-티온을 보라색 오일로 단리한다.
벤질 3,3-디(벤질티오)프로프-2-엔디티오에이트 및 기타 비닐위치 디티오에스테르의 제조는 2 몰의 이황화탄소를 메틸 마그네슘 클로라이드와 같은 그리냐드 시약 1 몰에 가하여 개시한다. 낮은 온도에서 강염기로 처리하고, 벤질 클로라이드를 가하여 디티오에이트를 오렌지색 고상물로 수득한다.
알파-질소 원자가 있는 티오카르보닐티오 화합물은 상응하는 질소 화합물로부터 합성한다. 예를 들면, 벤질 1-피롤카르보디티오에이트는 피롤을 디메틸 술폭시드 중의 수소화 나트륨 현탁액에 가하고 이황화탄소를 가하여 제조한다. 벤질 클로라이드를 가하고, 디에틸 에테르로 추출하여 생성물인 벤질 1-피롤카르보디티오에이트를 단리시킨다.
상응하는 2-피롤리딘온 유도체는 피롤 대신 피롤리돈으로 시작함으로써 비슷한 방식으로 제조한다.
벤질 (1,2-벤젠디카르복스이미도)카르보디티오에이트는 이황화탄소를 포타슘 프탈이미드에 가하여 제조한다. 그런 다음, 벤질 클로라이드를 가하여 합성을 완료한다.
비스(티오카르보닐) 디술파이드는 다른 디티오에이트 화합물의 출발 물질일 수 있다. 2,2'-아조비스(2-시아노프로판)은 피롤 N-티오카르보닐 디술파이드의 존재하에 열분해되어 2-시아노프로프-2-일 1-피롤카르보디티오에이트를 생성한다. 2-시아노부트-2-일 1-피롤카르보디티오에이트는 2,2'-아조비스(2-시아노부탄) 및 피롤 N-티오카르보닐 디술파이드를 사용하여 비슷한 방법으로 제조한다.
벤질 1-이미다졸카르보디티오에이트는 또다른 방법으로 제조할 수 있다. 벤질 머캅탄을 디클로로메탄 중의 티오카르보닐디이미다졸 용액에 가한다. 그런 다음, 이 화합물을 노란색 오일로 단리한다.
크산테이트 유도체는 상응하는 할로화합물을 포타슘 O-에틸 디티오카르보네이트에 가하여 제조할 수 있다. 따라서, O-에틸 S-(1-페닐에틸)크산테이트는 1-(브로모에틸)벤젠을 포타슘 O-에틸 디티오카르보네이트에 가하여 제조한다. O-에틸 S-(2-에톡시카르보닐프로프-2-일) 크산테이트는 2-브로모이소부티레이트를 포타슘 O-에틸 디티오카르보네이트에 가하여 제조하고, O-에틸 S-(2-시아노이소프로필) 크산테이트는 2-브로모이소부티로니트릴을 포타슘 O-에틸 디티오카르보네이트에 가하여 제조한다.
일부 바람직한 CTA는
1. E1이 하기 화학식 16의 기일 경우, 하기 화학식 15의 D1을 함유하는 CTA;
2. E1이 하기 화학식 18 내지 20의 기이거나 E2가 하기 화학식 21 또는 22의 기일 경우, 하기 화학식 17의 D2를 함유하는 CTA;
3. E1이 하기 화학식 25의 기일 경우, 하기 화학식 23 또는 24의 D2를 함유하는 CTA; 또는
4. E2가 하기 화학식 29의 기일 경우, 하기 화학식 26, 27 또는 28의 D2를 함유하는 CTA를 포함한다.
-O-C2H5
원한다면, D가 D1이고, Z' 및 E는 E-C-X=C-Z'가 고리 구조를 형성하도록 할 경우, 화학식 2의 CTA는 시클릭 구조를 추가로 포함한다. 가교 관능기는 Z'와 E 사이에 가교를 형성한다. 시클릭 구조와 같은 것이 존재할 경우, Z' 및 E는 할로겐, 메틸 또는 카르복시 관능기가 아닐 수 있다.
가교 관능기가 있는 CTA 중의 하나는 하기 화학식 30의 화합물이다.
상기 식에서, E 및 Z'는 네오펜틸렌이다.
본 발명에서 사용하기에 적절한 자유 라디칼원은 자유 라디칼을 단량체에 가하여 성장 라디칼을 생성하는 화합물을 포함한다. 성장 라디칼은 하나 이상의 단량체 단위를 더한 후, 추가의 단량체 단위를 더할 수 있는 라디칼 종이다.
사용하는 자유 라디칼 개시제의 양은 얻어질 중합체의 원하는 다분산도, 분자량 및 중합체 구조에 의해 좌우된다. 그러나, 일반적으로는 10 퍼센트 미만, 바람직하게는 0.001 내지 5 퍼센트의 자유 라디칼 개시제를 사용하고, 모든 백분율은 단량체 혼합물의 총량을 기준으로 하는 중량 퍼센트이다.
라디칼을 개시시키는 원천은 단량체에 결합하여 성장 라디칼을 생성하는 자유 라디칼을 제공하는 임의의 적절한 자유 라디칼 발생 방법일 수 있다. 이것은 열적으로 유도되는 적절한 화합물 (예, 퍼옥시드, 퍼옥시에스테르 또는 아조 화합물)의 균일 분절, 단량체 (예, 스티렌)로부터의 자연 발생, 산화 환원 개시 시스템, 광화학적 개시 시스템, 또는 전자 빔, X- 또는 γ-방사와 같은 고에너지 방사 등의 원천을 포함한다. 개시 시스템은 실험 조건하에서, 개시제 또는 개시 라디칼과 전이제와의 상당한 역 상호작용이 없는 반응 조건이 되도록 선택한다. 또한 개시제는 반응 매질 또는 단량체 혼합물에 용해되어야 한다.
본 발명의 방법에서 자유 라디칼의 적절한 원천의 예로는
2,2'-아조비스(이소부티로니트릴), 2,2'-아조비스(2-시아노-2-부탄), 디메틸 2,2'-아조비스(메틸 이소부티레이트), 4,4'-아조비스(4-시아노펜탄산), 4,4'-아조비스(4-시아노펜탄-1-올), 1,1'-아조비스(시클로헥산카르보니트릴), 2-(t-부틸아조)-2-시아노프로판, 2,2'-아조비스[2-메틸-N-(1,1)-비스(히드록시메틸)-2-히드록시에틸]프로피온아미드, 2,2'-아조비스[2-메틸-N-히드록시에틸]-프로피온아미드, 2,2'-아조비스(N,N'-디메틸렌이소부티르아미딘) 디히드로클로라이드, 2,2'-아조비스(2-아미디노프로판) 디히드로클로라이드, 2,2'-아조비스(N,N'-디메틸렌이소부티르아민), 2,2'-아조비스(2-메틸-N-[1,1-비스(히드록시메틸)-2-히드록시에틸]프로피온아미드), 2,2'-아조비스(2-메틸-N-[1,1-비스(히드록시메틸)에틸]프로피온아미 드), 2,2'-아조비스[2-메틸-N-(2-히드록시에틸)프로피온아미드], 2,2'-아조비스(이소부티르아미드) 이수화물, 2,2'-아조비스(2,2,4-트리메틸펜탄), 2,2'-아조비스(2-메틸프로판), t-부틸 퍼옥시아세테이트, t-부틸 퍼옥시벤조에이트, t-부틸 퍼옥시옥토에이트, t-부틸 퍼옥시네오데카노에이트, t-부틸퍼옥시 이소부티레이트, t-아밀 퍼옥시피발레이트, t-부틸 퍼옥시피발레이트, 디-이소프로필 퍼옥시디카르보네이트, 디시클로헥실 퍼옥시디카르보네이트, 디큐밀 퍼옥시드, 디벤조일 퍼옥시드, 디라우로일 퍼옥시드, 포타슘 퍼옥시디술페이트, 암모늄 퍼옥시디술페이트, 디-t-부틸 차아질산염, 또는 디큐밀 차아질산염 등의 아조 화합물 및 퍼옥시드를 들 수 있다.
자유 라디칼은 단량체 (예, 스티렌)로부터 열적으로, 광화학적으로, 산화환원 개시 시스템으로부터, 또는 이런 방법의 조합으로 발생할 수도 있다.
광화학적 개시제 시스템은 반응 매질 또는 단량체 혼합물에 용해성이 있고, 중합 조건하에서 적절한 양자 수율로 라디칼이 발생하는 것으로 선택한다. 그 예로는 벤조인 유도체, 벤조페논, 아실 포스핀 옥시드 및 광-산화환원 시스템을 들 수 있다. D가 D2이고, E가 E1 또는 E2인 화학식 2의 화합물의 직접적인 광분해에 의해 자유 라디칼을 발생시키는 방법은 본 발명의 부분이 아니다.
산화환원 개시제 시스템은 반응 매질 또는 단량체 혼합물에 용해성이 있고, 중합 조건하에서 적절한 속도로 라디칼이 발생하는 것으로 선택하고, 이러한 개시제 시스템은 하기 산화제 및 환원제의 조합을 포함할 수 있다.
산화제 : 포타슘 퍼옥시디술페이트, 과산화수소, t-부틸 히드로퍼옥시드.
환원제 : 철 (II), 티타늄 (III), 포타슘 티오술파이트, 포타슘 비술파이트.
또다른 적절한 개시제 시스템은 최근의 문헌에 기재되어 있다 [예, Moad and Solomon, "The Chemistry of Free Radical Polymerization", Pergamon, London, 1995, pp 53-95 참조].
본 발명에서 사용하기에 적절한 단량체 혼합물은 하기 화학식 31로 표시되는 하나 이상의 비닐 단량체를 포함할 수 있다.
<화학식 31>
상기 식에서,
L은 수소, 할로겐, 및 OH, OR", CO2H, O2CR", CO2R" 및 이들의 조합으로 구성된 군에서 독립적으로 선택된 치환체로 치환되거나 비치환된 C1-C4 알킬로 구성된 군에서 선택되고,
M은 수소, R", CO2H, CO2R", COR", CN, CONH2, CONHR", CONR"2, O2CR", OR", 및 할로겐으로 구성된 군에서 선택되고,
R"은 상기에서 정의한 바와 같다.
원하는 중합체의 유형에 따라, 단량체 혼합물은 말레산 무수물, N-알킬말레이미드, N-아릴말레이미드, 디알킬 푸마레이트, 시클로중합 가능한 단량체, 개환 단량체, 또는 이들의 혼합물의 단량체를 포함할 수도 있다. 단량체 혼합물은 L 또 는 M이 중합체 사슬인 화학식 31의 화합물인 거대단량체도 포함할 수 있다.
화학식 31의 화합물의 단량체 또는 공단량체는 일반적으로 하나 이상의 아크릴레이트 및 메타크릴레이트 에스테르, 아크릴산 및 메타크릴산, 스티렌, 아크릴아미드, 메타크릴아미드, 아크릴로니트릴, 메타크릴로니트릴, 비닐 에스테르 및 이들 단량체의 혼합물, 및 이들 단량체와 다른 단량체의 혼합물을 포함한다. 당업자의 판단에 따라, 공단량체의 선택은 그의 입체 및 전자 특성에 따라 결정될 것이다. 다양한 단량체의 공중합 가능성을 결정하는 요소는 당업계에 공지되어 있다. 예를 들어, 문헌 [Greenley, R. Z. in Polymer Handbook 3rd Edition, Brandup, J., and Immergut, E.H Eds. Wiley: New York, 1989, p II/53]을 참고할 수 있다.
화학식 31의 구체적인 단량체 또는 공단량체는 메틸 메타크릴레이트, 에틸 메타크릴레이트, 프로필 메타크릴레이트 (모든 이성질체), 부틸 메타크릴레이트 (모든 이성질체), 2-에틸헥실 메타크릴레이트, 이소보르닐 메타크릴레이트, 메타크릴산, 벤질 메타크릴레이트, 페닐 메타크릴레이트, 메타크릴로니트릴, 알파-메틸스티렌, 메틸 아크릴레이트, 에틸 아크릴레이트, 프로필 아크릴레이트 (모든 이성질체), 부틸 아크릴레이트 (모든 이성질체), 2-에틸헥실 아크릴레이트, 이소보르닐 아크릴레이트, 아크릴산, 벤질 아크릴레이트, 페닐 아크릴레이트, 아크릴로니트릴, 스티렌; 및 글리시딜 메타크릴레이트, 2-히드록시에틸 메타크릴레이트, 히드록시프로필 메타크릴레이트 (모든 이성질체), 히드록시부틸 메타크릴레이트 (모든 이성질체), 메틸 α-히드록시메티아크릴레이트, 에틸 α-히드록시메티아크릴레이트, 부틸 α-히드록시메티아크릴레이트, N,N-디메틸아미노에틸 메타크릴레이트, N,N-디에틸 아미노에틸 메타크릴레이트, 트리에틸렌글리콜 메타크릴레이트, 이타콘산 무수물, 이타콘산, 글리시딜 아크릴레이트, 2-히드록시에틸 아크릴레이트, 히드록시프로필 아크릴레이트 (모든 이성질체), 히드록시부틸 아크릴레이트 (모든 이성질체), N,N-디메틸아미노에틸 아크릴레이트, N,N-디에틸아미노에틸 아크릴레이트, 트리에틸렌글리콜 아크릴레이트, 메타크릴아미드, N-메틸아크릴아미드, N,N-디메틸아크릴아미드, N-tert-부틸메타크릴아미드, N-n-부틸메타크릴아미드, N-메틸올메타크릴아미드, N-에틸올메타크릴아미드, N-tert-부틸아크릴아미드, N-n-부틸아크릴아미드, N-메틸올아크릴아미드, N-에틸올아크릴아미드, 비닐 벤조산 (모든 이성질체), 디에틸아미노스티렌 (모든 이성질체), 알파-메틸비닐 벤조산 (모든 이성질체), 디에틸아미노 알파-메틸스티렌 (모든 이성질체) 중에서 선택된 관능성 메타크릴레이트, 아크릴레이트 및 스티렌; 및 p-비닐벤젠 술폰산, p-비닐벤젠 술폰산 나트륨염, 트리메톡시실릴프로필 메타크릴레이트, 트리에톡시실릴프로필 메타크릴레이트, 트리부톡시실릴프로필 메타크릴레이트, 디메톡시메틸실릴프로필 메타크릴레이트, 디에톡시메틸실릴프로필 메타크릴레이트, 디부톡시메틸실릴프로필 메타크릴레이트, 디이소프로폭시실릴메틸프로필 메타크릴레이트, 디메톡시실릴프로필 메타크릴레이트, 디에톡시실릴프로필 메타크릴레이트, 디부톡시실릴프로필 메타크릴레이트, 디이소프로폭시실릴프로필 메타크릴레이트, 트리메톡시실릴프로필 아크릴레이트, 트리에톡시실릴프로필 아크릴레이트, 트리부톡시실릴프로필 아크릴레이트, 디메톡시메틸실릴프로필 아크릴레이트, 디에톡시메틸실릴프로필 아크릴레이트, 디부톡시메틸실릴프로필 아크릴레이트, 디이소프로폭시메틸실릴프로필 아크릴레이트, 디메톡시실 릴프로필 아크릴레이트, 디에톡시실릴프로필 아크릴레이트, 디부톡시실릴프로필 아크릴레이트, 디이소프로폭시실릴프로필 아크릴레이트, 비닐 아세테이트, 비닐 부티레이트, 비닐 벤조에이트, 비닐 클로라이드, 비닐 플루오라이드, 비닐 브로마이드, 말레산 무수물, N-페닐말레이미드, N-부틸말레이미드, N-비닐피롤리돈, N-비닐카르바졸, 부타디엔, 이소프렌, 클로로프렌, 에틸렌 및 프로필렌 중의 하나 이상을 포함한다.
또다른 적절한 단량체는 국제 특허 출원 PCT/AU94/00433 또는 문헌 [Moad and Solomon "The Chemistry of Free Radical Polymerization", Pergamon, London, 1995, pp 162-171]에 기재된 것과 같은 시클로중합 가능한 단량체, 및 문헌 [Moad and Solomon "The Chemistry of Free Radical Polymerization", Pergamon, London, 1995, pp 171-186]에 기재된 것과 같은 개환 단량체를 포함한다.
본 발명의 방법으로 얻은 중합체는 하기 화학식 32로 표시되는 것이다.
<화학식 32>
상기 식에서,
n은 1 내지 100,000 범위, 바람직하게는 5 내지 10000 범위, 더욱 바람직하게는 10 내지 1000의 범위인 양의 정수이고,
Q"는 말레산 무수물, N-알킬말레이미드, N-아릴말레이미드, 디알킬 푸마레이트, 시클로중합 가능한 단량체, 개환 단량체, 거대단량체, 화학식 31의 비닐 단량 체 (이 때, Q"는 하기 화학식 33의 구조를 가짐) 및 이들의 혼합물로 구성된 군에서 선택된 단량체로부터 유래된 반복 단위이다.
(상기 식에서,
L은 수소, 할로겐 및 OH, OR", CO2H, O2CR", CO2R" 및 이들의 조합으로 구성된 군에서 독립적으로 선택된 치환체로 치환되거나 비치환된 C1-C4 알킬로 구성된 군에서 선택되고,
M은 수소, R", CO2H, CO2R", COR", CN, CONH2, CONHR", CONR"2, O2CR", OR" 및 할로겐으로 구성된 군에서 선택되고,
R"은 상기에서 정의한 바와 같음)
화학식 32에서, D가 D1이고 E가 Z'일 경우, A는 하기 화학식 34의 기이다.
<화학식 34>
따라서, p가 1일 때 얻어지는 중합체는 하기 화학식 35의 이성질체의 혼합물 로 이루어질 것이다.
또한, D가 D2이고 E가 E1일 경우, A는 하기 화학식 36의 기이다.
<화학식 36>
따라서, p가 1일 때 얻어지는 중합체는 하기 화학식 37의 화합물이다.
또다른 실시 태양에서, D가 D2이고 E가 E2일 경우, A는 하기 화학식 38의 기이다.
<화학식 38>
따라서, p가 1일 때 얻어지는 중합체는 하기 화학식 39의 화합물이다.
본 발명의 방법으로 얻어지는 또다른 유형의 중합체는 하기 화학식 40의 구조를 갖는다 (생성물은 이성질체의 혼합물이다).
<화학식 40>
상기 식에서,
n은 1 내지 100,000 범위의 양의 정수이고,
D는 D3이고,
E는 Z, E1 또는 E2이다.
본 발명의 방법으로 얻어지는 또다른 유형의 중합체는 화학식 41 또는 41a의 구조를 갖는다.
<화학식 41>
상기 식에서,
n은 1 내지 100,000 범위의 양의 정수이고,
D는 D4이고,
E는 E3이다.
<화학식 41a>
상기 식에서,
n은 1 내지 100,000 범위의 양의 정수이고,
D는 D4이고,
E는 E4이다.
본 발명의 맥락에서, 다분산도가 낮은 중합체는 종래의 자유 라디칼 중합으로 제조된 것보다 다분산도가 현저히 낮은 중합체이다. 종래의 자유 라디칼 중합에서, 형성된 중합체의 다분산도는 대개 단량체 전환율이 0.1% 내지 10%의 범위로 낮을 경우에는 1.5 내지 2.0 범위이고, 단량체 전환율이 10% 내지 100%의 범위로 높을 경우에는 2 내지 10의 범위로 상당히 높다. 다분산도가 1.05 내지 1.5 범위로 낮은 중합체가 바람직하다. 다분산도가 1.05 내지 1.3의 범위로 낮은 것이 더욱 바람직하다. 또한 본 발명의 방법의 중요한 이점 중의 하나는 상기의 낮은 다분산도가 10% 내지 100%의 높은 단량체 전환율에서도 유지될수 있다는 점이다.
그러나, 원한다면 본 발명의 중합 공정이 끝난 후에 CTA를 조절하면서 가하 여 넓은 범위이지만 조절된 다분산도 또는 다중 봉형의 분자량 분포를 갖는 중합체를 제조할 수도 있음을 이해하여야 할 것이다.
본 발명은 그렇지 않으면 넓거나 매우 넓은 다분산도를 갖는 중합체를 생성할 중합에서 형성되는 중합체의 다분산도를 좁히는 데 사용할 수 있다. 이런 경우, 바람직한 다분산도는 CTA의 부재시 형성되는 것보다 낮은 것이다.
본 발명의 방법의 메카니즘은 임의의 특정 메카니즘에 제한되지 않고, 하기 반응식 1에 요약된 바와 같으리라고 생각된다. 성장 라디칼 Pn·은 라디칼 중합에 의해 생성된다. 이것은 사슬 전이제 RA와 가역적으로 반응하여 중간체 라디칼 PnA(·)R을 형성하고, 다시 분절되어 라디칼 R·(이것이 단량체에 결합하여 중합을 재개시함) 및 신규 전이제 PnA를 형성시킬 수 있다. 이 신규 전이제 PnA는 또다른 성장 라디칼 Pm·과 반응하여 중간체 라디칼 PnA(·)Pm을 형성하고, 분절되어 Pn· 및 RA와 비슷한 특성을 갖는 신규 전이제 PmA를 형성한다는 점에서 원래의 전이제 RA와 비슷한 특성을 지닌다. 이 과정이 사슬 평형에 대한 메카니즘 및 리빙 특성이 있는 중합에 대한 설명을 제공한다.
Pn· 및 Pm·은 각각 사슬 길이가 n 및 m인 성장 라디칼이다. R·은 중합을 개시하여 신규 성장 라디칼을 생성시킬 수 있는 사슬 전이제에서 유래한 라디칼이다. RA, PnA 및 PmA는 CTA이다.
본 발명의 방법으로 제조된 중합체의 분자량 및 다분산도는 하기의 것 중 하나 이상에 의해 조절된다.
중합 조건은 개시제 유도된 라디칼로부터 형성된 사슬의 수가 최소화되어 허용 가능한 중합 속도와 어느 정도 일치하도록 선택한다. 라디칼-라디칼 반응에 의한 중합의 종료는 활성기를 함유하지 않는 사슬을 얻게 되어 재활성화될 수 없다. 라디칼-라디칼 종료의 속도는 라디칼 농도의 제곱에 비례한다. 더우기, 블록, 스타 또는 가지 중합체의 합성시, 개시제로부터 유도된 라디칼로부터 형성된 사슬은 최종 생성물에 직쇄 단일중합체 불순물을 구성할 것이다. 따라서, 이러한 반응 조건에서는 개시제 농도, 및 경우에 따라서는 개시제 피드 (feed) 속도를 신중하게 선택하여야 한다.
성장 라디칼 방향으로의 전이 상수가 낮도록 중합 매질의 다른 성분 (예를 들어, 용매, 계면 활성제, 첨가제, 및 개시제)을 선택하는 것도 바람직하다. 이러한 종으로의 사슬 전이는 활성기를 함유하지 않는 사슬을 형성을 유도한다.
다분산도가 좁은 중합체의 중합을 위한 조건을 선택하는 데 있어서 일반적인 길잡이로서, 개시제의 농도 및 기타 반응 조건 [필요할 경우 용매, 반응 온도, 반응 압력, 필요할 경우 계면 활성제, 기타 첨가제]은 CTA의 부재시에 형성되는 중합 체의 분자량이 CTA의 존재시에 형성되는 것보다 2배 이상이 되도록 선택해야 한다. 라디칼-라디칼 종료가 불균등화 반응에 의해서만 일어나는 중합에서는, 이는 중합 동안 형성되는 개시 라디칼의 총 몰수가 CTA의 총 몰수의 0.000001 내지 0.5배의 범위가 되도록 개시제 농도를 선택하는 것과 같다. 더욱 바람직하게는, CTA의 부재시에 형성되는 중합체의 분자량이 CTA의 존재시 ([개시 라디칼]/[CTA]<0.2) 형성되는 것의 5배 이상인 조건을 선택하여야 한다.
따라서, 중합 매질에 가하는 자유 라디칼 개시제의 총 몰수에 대한 CTA의 총 몰수의 비율을 변화시킴으로써, 얻어지는 중합체의 다분산도를 조절한다. 따라서, 상기 비율을 감소시키면 다분산도가 보다 낮은 중합체를 얻고, 그 비율을 증가시키면 다분산도가 보다 높은 중합체를 얻는다.
이러한 조건에 따라, 본 발명에 따른 중합 공정은 통상적인 자유 라디칼 중합의 전형적인 조건하에서 시행한다. 본 발명의 CTA를 사용하는 중합은 반응 중에 -20℃ 내지 200℃ 범위, 바람직하게는 40 내지 160℃ 범위의 온도로 적절하게 수행한다.
종래의 자유 라디칼 중합 방법과는 달리, 본 발명의 방법으로 얻어지는 중합체의 분자량은 일반적으로 예상가능하며 직선적인 경향으로 증가하고, 하기 수학식 2로 표시되는 관계식에 따라 계산할 수 있다.
상기 식에서,
MWp는 단리된 중합체의 수평균 분자량이고,
MWm은 단량체의 분자량이고,
MWcta는 CTA의 분자량이다.
상기 식은 개시제 유도된 사슬의 수가 총 사슬의 10% 미만인 반응 조건하에서 및 첨가한 CTA가 완전히 반응했을 때 적용한다. 더욱 복잡한 식을 유도하여 다른 환경에서의 분자량을 예측할 수 있다.
실시예 19 및 20에서 제공된 데이타를 예시한다. 상기 식에 따라 계산한 분자량과 실험적으로 측정한 값이 상당히 일치한다.
| MWp (측정값) |
부분 전환 |
소비된 단량체 몰수 |
CTA의 몰수 |
MWp (계산값) |
| 37257 |
0.31000 |
0.017230 |
4.0952×10-5
|
36393 |
| 97127 |
0.89000 |
0.049467 |
4.0952×10-5
|
104090 |
| 110910 |
0.91000 |
0.050579 |
4.0952×10-5
|
106430 |
| 3381.0 |
0.22000 |
0.012228 |
0.00040952 |
2777.9 |
| 5952.0 |
0.47000 |
0.026123 |
0.00040952 |
5695.9 |
| 8762.0 |
0.74000 |
0.041130 |
0.00040952 |
8847.4 |
본 발명의 방법은 유화, 용액 또는 현탁액으로 배치, 반-배치, 연속 또는 피드형 중 어느 것으로든 수행할 수 있다. 그렇지 않으면, 통상적인 공정을 사용하여 다분산도가 좁은 중합체를 생성할 수 있다. 다분산도가 가장 낮은 중합체의 경우, 중합하기 전에 CTA를 넣기를 권한다. 예를 들어, 용액 중에서 배치 형으로 중합을 수행할 때, 반응기에 대개 CTA 및 단량체 또는 매질 더하기 단량체를 충전한다. 그런 다음, 이 혼합물에 원하는 양의 개시제를 가하고, 이 혼합물을 원하는 전환율 및 분자량을 갖도록 결정된 시간 동안 가열한다.
넓지만 조절된 다분산도 또는 다중 종형의 분자량 분포를 갖는 중합체는 중합 공정이 끝난 후에 CTA를 조절하면서 첨가하여 제조할 수 있다.
유화 또는 현탁 중합의 경우에, 흔히 중합 매질은 주로 물일 것이고, 통상적인 안정화제, 분산제 및 기타 첨가제가 존재할 수 있다.
용액 중합의 경우에, 중합 매질은 사용하는 단량체에 맞는 다양한 매질 중에서 선택할 수 있다. 그 예로 페트롤륨 나프타 또는 크실렌과 같은 방향족 탄화수소류; 메틸 아밀 케톤, 메틸 이소부틸 케톤, 메틸 에틸 케톤 또는 아세톤과 같은 케톤류; 부틸 아세테이트 또는 헥실 아세테이트와 같은 에스테르류; 및 프로필렌 글리콜 모노메틸 에테르 아세테이트와 같은 글리콜 아테르 에스테르류가 있다.
상기에서 언급한 바와 같이, 피드 중합 조건을 이용하면 전이 상수가 낮은 CTA를 사용할 수 있고, 배치 중합 방법으로는 쉽게 얻어지지 않는 중합체를 합성할 수 있다. 중합을 피드 시스템으로 수행할 경우, 반응은 하기와 같이 수행할 수 있다. 반응기에 선택한 중합 매질, CTA 및 경우에 따라서는 단량체 혼합물 일부를 넣어 충전시킨다. 남아 있는 단량체 혼합물을 별도의 용기에 넣는다. 자유 라디칼 개시제를 또다른 별도의 용기에서 중합 매질에 용해시키거나 현탁시킨다. 주사 펌프 또는 기타 펌프 기기 등으로 단량체 혼합물+매질 및 개시제+매질을 첨가하는 동안 반응기내 매질을 가열하고 교반시킨다. 피드 속도 및 시간은 용액의 양, 원하는 단량체/CTA/개시제 비율 및 중합 속도에 의해 주로 결정된다. 피드가 끝나고 추가 시간 동안 가열을 계속할 수 있다. 이어서 다른 단량체를 첨가하면 블록 또는 구배 (gradient) 공중합체를 얻을 것이다.
중합을 마친 후에, 매질 및 미반응 단량체를 제거하거나 불용성 용매를 사용하여 침전시킴으로써 중합체를 단리할 수 있다. 별법으로, 경우에 따라서는 중합체를 사용하는 데에 중합체 용액/유제를 사용할 수 있다.
본 발명의 방법은 다양한 단량체에 이용할 수 있고, 변화된 반응 조건에서 이용하여 다분산도가 낮은 중합체를 생성시킬 수 있다. 단량체 첨가 비율을 변화시키거나 중합 매질에 단량체를 가할 수 있는 순서를 변화시킴으로써 본 발명의 방법을 이용하여 블록 및 다-블록 및 구배 중합체를 제조할 수 있다. 원하는 관능기를 선택하여, 특정 말단 관능기를 갖는 말단-관능성 중합체를 용이하게 수득할 수 있다.
화학식 32의 그라프트 중합체의 선구물질인 화학식 6의 CTA의 예로는, 화학식 32에서 p가 n이고 R이 하기 화학식 43의 기일 경우, 화학식 42의 공중합체 및(또는) 크산테이트 또는 디티오카르바메이트 유도체를 포함한다.
통상적인 핵에 결합된 관능기를 함유하는 CTA의 예를 하기에 기재한다.
화학식 6에서, p가 2이고 R이 p-크실렌일 경우, CTA는 하기 화학식 44로 표시되고,
화학식 10에서, p"'가 2이고 E가 E4이고 G"'가 p-페닐렌일 경우, CTA는 하기 화학식 45으로 표시된다.
화학식 6에서, p가 4이고 R이 하기 화학식 47의 기일 경우, 하기 화학식 46의 화합물은 스타 중합체를 제공한다.
고정된 반응 조건하에서 얻어진 다분산도는 전이 상수 (Ctr)의 값에 민감하다. 전이 상수가 높은 CTA를 사용하면 다분산도가 낮아질 것이다. 상기 메카니즘에 따라서, 화합물 (RA, PnA 및 PmA)의 사슬 전이 활성은 C=S 이중 결합의 반응성, 및 출발 물질과 생성물 사이의 중간체 라디칼의 분절 및 분배 속도에 의해 결정될 것이다.
뮐러 (Mueller) 등은 가역적 사슬 전이에 의한 사슬 평형이 관여하는 중합에 대한 다분산도를 측정할 수 있는 관계식 (수학식 3)을 유도하였다 [Mueller, A. H. E.; Zhuang, R.; Yan, D.; Litvenko, G. Macromolecules, 28, 4326 (1995)].
상기 식에서, Ctr은 사슬 전이 상수이다.
상기 관계식은 개시제 라디칼 유도된 사슬의 수가 총 사슬에 비해 작고, 부반응이 없는 상황에서 모두 전환된 배치 중합에 적용해야 한다. 이 관계식은 배치 중합에서 다분산도를 1.5 미만으로 얻으려면 전이 상수가 2보다 커야함을 시사한다.
지속적인 공급에 의해 단량체 농도가 일정하게 유지되는 피드 중합에 대해서는, 뮐러 등은 하기 관계식 (수학식 4)을 적용하기를 제안한다 [Mueller, A. H. E.; Litvenko, G., Macromolecules 30, 1253 (1997)].
상기 식에서, Ctr은 사슬 전이 상수이고, DPn은 생성물의 중합도이다.
D가 D1인 화학식 2의 화합물의 경우, 확정된 것은 아니지만, 첨가-분절 단계의 가능한 메카니즘은 하기 반응식 2와 같다.
상기에 제시된 메카니즘은 실험적 관찰에 따른 것이다. 이 메카니즘에 따르면, X기는 원칙적으로 C=S 및 S-R기 사이에 공액을 유지하는 임의의 기일 수 있다. 가능한 일부 구조의 예로는 하기 화학식 48 내지 50의 화합물을 들 수 있다.
공액기를 갖는 CTA의 또다른 예로는 하기 화학식 51 내지 53의 화합물을 들 수 있다.
여러개의 알킬티오기를 포함하는 구조는 더 복잡한 구조의 중합체를 합성할 수 있다. 예를 들면, 하기 화학식 54에서와 같이 하기 화합물은 팔이 3개인 스타 중합체로 자랄 수 있다.
이어서 추가의 단량체를 가하면 블록 공중합체를 얻을 것이다.
당업자에게는 본 발명에서 CTA로서 유효려면 CTA의 R기가 자유 라디칼 이탈기일 뿐만 아니라 자유 라디칼 중합을 개시하는 종이어야 함은 명백하다. 이탈기 능력은 입체적인 요소뿐 아니라 라디칼 안정성에 의해 결정된다. CTA의 바람직한 R기로는 벤질 유도체 (-CR"'2Ph), 시아노알킬 유도체 (-CR"'2CN) 및 당업계에 자유 라디칼 이탈기로 알려진 다른 잔기를 예로 들 수 있다.
R·의 이탈기 능력은 중합에서 형성된 성장 종의 특성에 의해서도 결정된다. 예를 들면, 스티렌 중합에서 R은 바람직하게는 벤질, 1-페닐에틸, 2-페닐프로필, 2-(알콕시카르보닐)프로프-2-일, 2-시아노프로프-2-일, 2-시아노부트-2-일, 및 1-시아노시클로헥실로 구성된 군에서 선택된다. 메틸 메타크릴레이트 중합에서 R은 바람직하게는 2-페닐프로필, 2-시아노프로프-2-일, 2-시아노부트-2-일, 및 1-시아 노시클로헥실로 구성된 군에서 선택된다. 비닐 아세테이트 중합에서 R은 바람직하게는 2-(알콕시카르보닐)프로프-2-일, 시아노메틸, 2-시아노프로프-2-일, 2-시아노부트-2-일, 및 1-시아노시클로헥실로 구성된 군에서 선택된다.
R"'의 지연을 피하기 위해서는, 치환체를 R·이 용이하게 단량체에 결합하도록 선택해야 한다. 이런 맥락에서, 바람직한 R"'기는 수소 및 치환된 알킬로 구성된 군에서 독립적으로 선택된다. R·이 중합을 개시시키는 능력은 중합에 사용하는 단량체의 특성에 의해 결정된다. 스티렌 및 메타크릴레이트의 중합에서는 벤질 유도체 (-CR"'2Ph) 및 시아노알킬 유도체 (-CR"'2CN)이 효과적이다. 그러나 비닐 아세테이트 중합에서는 벤질 유도체 (-CR"'2Ph)는 서서히 중합을 개시시켜 지연이 관찰될 수 있지만, 시아노알킬 유도체 (-CR"'2CN) 및 상응하는 에스테르 (CR"'2CO2알킬)은 효과적이다.
(메트)아크릴레이트 및 스티렌의 중합에서, 본 발명자들은 공액 또는 디티오카르바메이트의 질소에 전자를 끄는 치환체가 있는 디티오카르바메이트 CTA (화학식 2, D=D2, E=E1)가 단순한 알킬 치환체가 있는 디티오카르바메이트 유도체보다 훨씬 효과적임을 발견하였다.
따라서, 이러한 응용을 위하여 E1으로 바람직한 기는 G-N-J가 하기 화학식 55 및 56과 같은 방향족 고리기의 일부를 형성하는 방향족 질소 헤테로고리, 및 G-N-J가 하기 화학식 57 내지 59와 같이 질소에 공액된 옥소와 같은 치환체가 있는 비-방향족 고리기의 일부를 형성하는 고리 아미드 등의 E1기이다.
상기 디티오카르바메이트의 더 높은 활성에 대한 한 가지 가능한 설명은 자유 라디칼 부가 쪽으로의 C=S 이중 결합의 반응성이 높다는 점이다. 이것은 C=S 이중 결합에 더 큰 이중 결합성을 공급하는 공액 또는 전자를 끄는 치환체의 효과에 기인한다.
카르바메이트 및 아미드에서, 비-결합 질소의 비공유 쌍과 카르보닐기의 p 전자의 비편재화로 인해 N-CO 연결기는 부분 이중 결합성을 갖는다 [Deslongchamps, P. Stereoelectronic effects in organic chemistry, Pergamon Press, NY, 1983]. 따라서, 카르보닐기의 산소는 부분적인 음전하를 띠게 된다. 황이 산소보다 전자 친화도가 더 높기 때문에, 디티오카르바메이트에서는 이 효과가 더욱 커질 것으로 기대된다.
질소의 비공유 쌍이 또다른 π-시스템 (예, 방향족 피롤 고리)에 참여할 경우, 비공유 쌍은 티오카르보닐 결합으로의 비편재화가 더 감소하여 C=S 이중 결합의 이중 결합성이 더욱 증가하고, 따라서 라디칼쪽으로의 CTA의 반응성이 더 증가한다.
크산테이트 에스테르의 경우에도 비슷한 생각을 적용할 수 있다. 본 발명자들은 아크릴레이트 중합에서 다분산도가 낮은 중합체를 제공하는 데 있어서, 크산테이트 에스테르 CTA (화학식 2, D=D2, E=E2)의 효율은 G'가 -OEt < -OC6H5 < -C6F5인 순서로 증가함을 발견하였다.
디티오카르바메이트 및 크산테이트 유도체 (화학식 2의 화합물, D=D2, 각각 E=E1 또는 E2)의 전이 상수는 사용하는 단량체에 크게 좌우된다. 따라서 D=D2이고 E=E1 또는 E2인 화학식 2 (여기에서, G, J 및 G'은 서로 독립적으로, 치환되거나 비치환된 알킬, 치환되거나 비치환된 알킬렌, 치환되거나 비치환된 아릴, 치환되거 나 비치환된 헤테로시클릴로 구성된 군에서 선택됨)의 디티오카르바메이트 및 크산테이트 유도체는 메타크릴레이트 또는 스티렌 단량체의 중합에서 전이 상수가 비교적 낮아서, 이러한 단량체의 배치 중합에서는 다분산도가 좁은 중합체를 얻기에는 효과적이지 않다.
그러나 비닐 아세테이트, 비닐 부티레이트, 비닐 벤조에이트, 비닐 클로라이드, 비닐 브로마이드, 비닐 플루오라이드, N-비닐피롤리돈, N-비닐카르바졸 및 비슷한 비닐 단량체의 중합에서는 이러한 디티오카르바메이트 및 크산테이트 유도체 (화학식 2의 화합물, D=D2, E=E1 또는 E2)의 전이 상수가 커서 다분산도가 낮은 중합체를 얻을 수 있다. 이러한 비닐 단량체에 사용하기에 바람직한 CTA는 D=D2이고 E=E1 또는 E2인 화학식 2의 화합물 (여기에서, G, J 및 G'은 서로 독립적으로, 치환되거나 비치환된 알킬, 치환되거나 비치환된 알킬렌, 치환되거나 비치환된 아릴, 치환되거나 비치환된 헤테로시클릴로 구성된 군에서 선택됨), 또는 E=E1일 경우, G-N-J가 비-방향족 시클릭 기의 일부를 형성하는 것을 예로 들 수 있다.
본 발명은 자유 라디칼 중합 분야에 널리 응용할 수 있으며, 자동차 OEM 및 재마무리제를 비롯한 코팅제용 조성물에서 프리머, 기초코팅제, 하부코팅제, 상부코팅제 및 투명코팅제로 사용하기에 적절한 중합체를 제조하는 데 사용할 수 있다. 이 중합체는 강철, 구리, 황동 및 알루미늄 등의 다양한 물질, 또는 목재, 가죽 및 콘크리트 등의 비-금속성 물질의 마무리를 유지하기 위한 조성물에도 사용하기에 적절하다.
본 발명의 방법으로 제조된 중합체를 포함하는 코팅 조성물은 안료, 안정화 제, 유동제, 강인화제, 충전제, 내구성제, 부식 및 산화 억제제, 레올로지 조절제, 금속성 플레이크 및 기타 첨가제와 같은 통상적인 첨가제를 포함할 수도 있다. 이와 같은 부가 첨가제는 물론 코팅 조성물을 사용하고자 하는 용도에 의해 좌우된다. 이 조성물을 투명 코팅제로 의도한다면 경화된 코팅의 투명성에 반하는 효과를 나타낼 충전제, 안료 및 기타 첨가제는 포함하지 않을 것이다.
블록 및 스타, 및 가지 중합체는 상용화제, 열가소성 엘라스토머, 분산제, 응집제, 계면 활성제, 레올로지 조절제, 또는 벌크 중합체 및 플라스틱의 표면 특성을 개질시키기 위한 첨가제로 사용할 수 있다. 본 발명의 중합체는 이미징, 전자 (예, 포토레지스트), 엔지니어링 플라스틱, 접착제, 밀폐제 (sealants), 종이 코팅제, 프린트용 잉크, 및 일반적인 중합체 분야에도 응용할 수 있다.
본 발명은 생체상용성, 생체안정성, 친수성, 소수성, 접착성 또는 마찰성을 조절하기 위한 목적으로 고상 중합체 또는 표면으로의 중합체 사슬의 그라프팅을 조절하는 데에도 적용할 수 있다.
단량체는 정제(억제제의 제거)하여 사용하기 직전에 새로 증류하였다. 동결-탈기 -해빙 순환을 반복하여 완전히 탈기시켰다. 일단 탈기가 완료되면, 앰풀을 진공에서 화염 밀봉하고, 특정 온도에서 특정 시간 동안 오일조에 완전히 담궈 두었다. 전환율은 중량 측정으로 계산하였다.
실시예 1 내지 6은 α-질소 치환체가 있는 티오카르보닐티오 화합물 (화학식 2의 디티오카르바메이트, D=D2, E=E1)의 합성을 예시한다.
과정 1
벤질 1-피롤카르보디티오에이트 (60)의 제조
피롤 (1.34 g, 20 mmol)을 디메틸 술폭시드 (20 ml) 중의 수소화 나트륨의 교반시킨 현탁액에 적가하였다. 첨가가 끝나면 얻어진 갈색의 용액을 실온에서 30분 동안 교반시키고, 이황화탄소 (1.52 g, 20 mmol)를 가하였다. 이 용액을 실온에서 추가로 30분 동안 교반시킨 후, 벤질 클로라이드 (2.53 g, 20 mmol)를 가하였다. 1시간 후에 물 (20 ml)을 가하고, 디에틸 에테르 (20 ml)를 가하였다. 유기층을 분리하고, 수층을 디에틸 에테르 (2×20 ml)로 추출하였다. 모은 추출액을 황산 마그네슘 상에서 건조시키고, 여과하고 용매를 제거하였다. 조생성물을 페트롤륨 주정 중의 5% 에틸 아세테이트를 사용하여 크로마토그래피하여, 생성물을 노란색 오일로 단리하였다 (2.34 g, 50%).
1H-NMR (CDCl3) δ 4.60 (2H), 6.30 (2H), 7.40 (5H), 7.70 (2H).
13C-NMR (CDCl3) δ 41.7, 114.2, 120.6, 128.0, 128.8, 129.4, 135.0, 189.0.
<실시예 1>
벤질 1-(2-피롤리디논)카르보디티오에이트 (61)의 제조
벤질 클로라이드 (0.8 g, 6.35 mmol)를 무수 에탄올 (10 ml) 중의 1-(2-피롤리디논)카르보디티온산 (0.97 g, 6.02 mmol) 및 탄산 칼륨 (0.84 g, 6.09 mmol)의 현탁 용액에 실온에서 가하였다. 얻어진 혼합물을 실온에서 3 시간 동안 교반시켰다. 물 (25 ml)을 가한 후, 에틸 아세테이트 (3×20 ml)로 추출하였다. 모은 유기층을 무수 황산 나트륨 상에서 건조시켰다. 용매를 제거한 후, 잔류물을 먼저 n-헥산 (미반응 벤질 클로라이드의 제거)으로, 이어서 에틸 아세테이트/n-헥산 3:7을 용출액으로 사용하여 칼럼 크로마토그래피 (Kieselgel-60, 70 내지 230 메쉬)하였다. 표제 화합물, 벤질 1-(2-피롤리디논)카르보디티오에이트 (61)를 밝은 노란색 고상물로 수득하였다 (1.1 g, 73%).
mp : 57-58℃.
1H-NMR (CDCl3) δ 2.11 (ddt, 2H), 2.73 (t, 2H), 4.25 (dd, 2H), 4.40 (s, 2H), 7.20-7.40 (m, 5H).
<실시예 2>
벤질 (1,2-벤젠디카르복스이미도)카르보디티오에이트 (62)의 제조
이황화탄소 (1.0 g, 13.1 mmol)를 디메틸 술폭시드 (20 ml) 중의 포타슘 프탈이미드 (1.85 g, 10 mmol)의 현탁액에 실온에서 10분에 걸쳐서 천천히 가하였다. 얻어진 혼합물을 실온에서 추가로 5시간 동안 교반시키고, 벤질 클로라이드 (1.26 g, 10 mmol)를 가하였다. 그런 다음, 이 혼합물을 50℃에서 3시간 동안 가열하였 다. 물 (30 ml)을 가하고, 혼합물을 에틸 아세테이트 (3×20 ml)로 추출하였다. 모은 유기층을 무수 황산 마그네슘 상에서 건조시키고, 여과하고, 회전 증발기에서 용매를 제거하여 노란색 오일을 얻었다. 조 반응 혼합물을 크로마토그래피 (Kieselgel-60, 70 내지 230 메쉬, 용출액 - 에틸 아세테이트/n-헥산 1:9)하여 벤질 (1,2-벤젠디카르복스이미도)카르보디티오에이트 (62)를 수득하였다 (180 mg, 5.8% 수율).
1H-NMR (CDCl3) δ 4.55 (s, 2H), 7.30-7.45 (m, 5H), 7.82 (dd, 2H), 7.98 (dd, 2H).
<실시예 3>
2-시아노프로프-2-일 1-피롤카르보디티오에이트 (63)의 제조
피롤 N-티오카르보닐 디술파이드 (0.15 g, 0.53 mmol) 및 2,2'-아조비스(이소부티로니트릴) (0.16 g, 1 mmol)을 에틸 아세테이트 (5 ml)에 용해시킨 후 영 (Young) 용기에 옮겼다. 내용물을 탈기시키고, 70℃에서 24시간 동안 가열하였다. 용매를 진공에서 제거하고, 잔류물을 실리카상에서 크로마토그래피 (10% 에틸 아세테이트/페트롤륨 주정)하여 2-시아노프로프-2-일 1-피롤카르보디티오에이트를 얻었다 (135 mg, 61%).
1H-NMR (CDCl3) δ 1.99 (6H), 6.38 (2H), 7.61 (2H).
13C-NMR (CDCl3) δ 27.0, 114.7, 120.7, 176.4, 193.2.
<실시예 4>
2-시아노부트-2-일 1-피롤카르보디티오에이트 (64)의 제조
피롤 N-티오카르보닐 디술파이드 (0.71 g, 2.5 mmol) 및 2,2'-아조비스(2-시아노부탄) (0.63 g, 3.3 mmol)을 에틸 아세테이트 (10 ml)에 용해시키고, 영 용기에 옮겼다. 내용물을 탈기시키고 70℃에서 24시간 동안 가열하였다. 용매를 진공에서 제거하고, 잔류물을 알루미나 (활성 III) 상에서 크로마토그래피 (15% 에틸 아세테이트/페트롤륨 주정)하여 2-시아노부트-2-일 1-피롤카르보디티오에이트를 오일로 수득하였다 (310 mg, 28%). 이 화합물은 실온에서 점진적으로 분해되므로 냉동고에 보관해야 한다.
1H-NMR (CDCl3) δ 1.10 (3H, t), 1.89 (3H, s), 2.22 (2H, m), 6.30 (2H), 7.65 (2H).
과정 2
벤질 1-이미다졸카르보디티오에이트 (65)의 제조
벤질 머캅탄 (0.68 g, 5.5 mmol)을 디클로로메탄 (10 ml) 중의 티오카르보닐 디이미다졸 (0.89 g, 5 mmol)의 용액에 실온에서 적가하였다. 이 용액을 30분 동안 같은 온도에서 교반시킨 후, 용매를 진공에서 제거하였다. 잔류물을 에틸 아세테이트/페트롤륨 주정 3:7을 용출액으로 사용하여 크로마토그래피 (Kieselgel-60, 70 내지 230 메쉬)하여 벤질 1-이미다졸카르보디티오에이트 (65)를 밝은 노란색 고상물로 수득하였다 (0.78 g, 54%).
1H-NMR (CDCl3) δ 4.60 (2H), 7.10 (1H), 7.40 (5H), 7.75 (1H), 8.45 (1H).
13C-NMR (CDCl3) δ 41.73, 117.6, 131.5, 135.0, 128.3, 128.9, 129.4, 133.8, 188.3.
<실시예 5>
N,N-디메틸-S-(2-시아노프로프-2-일) 디티오카르바메이트 (66)의 제조
테트라메틸티우람디술파이드 (1.2 g, 5 mmol) 및 2,2'-아조비스(이소부티로니트릴) (1.23 g, 7.5 mmol)을 벤젠에 용해시켰다. 10분 동안 질소를 용액 중에 버블링시켜 용액을 탈기시키고, 24시간 동안 환류 가열시켰다. 벤젠을 감압하여 제거하고, 조-잔류물을 크로마토그래피 (실리카 겔, 페트롤륨 주정 중 30% 에틸 아세테이트)하여 표제 화합물을 수득하였다 (1.74 g, 93%).
1H-NMR (CDCl3) δ 1.9 (6H), 3.4 (6H, bd).
13C-NMR (CDCl3) δ 27.4, 42.15, 62.5, 122.0, 190.0.
과정 3
N,N-디에틸 S-벤질 디티오카르바메이트 (67)의 제조
THF (10 ml) 중의 벤질 브로마이드 (2.05 g, 12 mmol)를 THF (25 ml) 중의 소듐 N,N-디에틸디티오카르바메이트 삼수화물 (2.25 g, 10 mmol)의 현탁액에 실온 에서 15분에 걸쳐 적가하였다. 이 용액을 실온에서 3시간 동안 교반시키고, 고상물을 여과 제거하고, 여과액을 농축시켰다. 조-잔류물을 칼럼 크로마토그래피 (실리카 겔, 페트롤륨 주정 중 20% 에틸 아세테이트)하여 표제 화합물을 수득하였다 (2.25 g, 94%).
1H-NMR (CDCl3) δ 1.3 (6H), 3.7 (2H), 4.1 (2H), 4.6 (2H), 7.3 (5H).
<실시예 6>
시아노메틸 1-(2-피롤리돈)카르보디티오에이트 (68)의 제조
클로로아세토니트릴 (1 ml, 15.9 mmol)을 아세토니트릴 (10 ml) 중의 1-(2-피롤리디논)카르보디티온산 (0.97 g, 6.02 mmol) 및 탄산 칼륨 (0.84 g, 6.09 mmol)의 현탁 용액에 실온에서 가하였다. 얻어진 혼합물을 실온에서 18시간 동안 교반시켰다. 물 (25 ml)을 가한 후, 에틸 아세테이트 (3×20 ml)로 추출하였다. 모은 유기층을 무수 황산 나트륨 상에서 건조시켰다. 용매를 제거하고, 잔류물을 에틸 아세테이트/n-헥산 1:4를 용출액으로 사용하여 칼럼 크로마토그래피 (Kieselgel-60, 70 내지 230 메쉬)하였다. 표제 화합물, 시아노메틸 1-(2-피롤리디논)카르보디티오에이트를 노란색 고상물로 수득하였다 (0.74 g, 65.5%).
mp : 65-66℃.
1H-NMR (CDCl3) δ 2.20 (ddt, 2H), 2.80 (t, 2H), 4.00 (s, 2H), 4.25 (dd, 2H).
과정 4
N,N-디에틸 S-(2-에톡시카르보닐프로프-2-일) 디티오카르바메이트 (69)의 제조
표제 화합물을 문헌 [T. Otsu, T. Mastunaga, T. Doi and A. Matsumoto, Eur. Polym. J. 31, 67-78 (1995)]에 따라서 제조하였다.
실시예 6 내지 11은 α-산소 치환체가 있는 티오카르보닐티오 화합물 (화학식 2의 크산테이트 에스테르, D=D2, E=E2)의 합성을 예시한다.
과정 5
O-에틸 S-(1-페닐에틸) 크산테이트 (70)의 제조
에탄올 (50 ml) 중의 1-(브로모에틸)벤젠 (3.7 g) 및 포타슘 O-에틸 디티오 카르보네이트 (3.2 g)의 용액을 실온에서 16시간 동안 교반시켰다. 이 반응물을 물 (50 ml)로 희석시키고, 유기층을 n-헥산으로 추출하였다. 모은 유기층을 물, 소금물로 씻어 주고, 황산 마그네슘 상에서 건조시켰다. 용매를 증발시키고, 표제 화합물을 노란색 오일로 수득하였다 (4.4 g, 97%).
<실시예 7>
O-에틸 S-(2-(에톡시카르보닐)프로프-2-일) 크산테이트 (71)의 제조
에탄올 (200 ml) 중의 2-브로모이소부티레이트 (19.5 g) 및 포타슘 O-에틸 디티오카르보네이트 (16.0 g)의 용액을 실온에서 20시간 동안 교반시킨 후, 50℃에서 16시간 동안 교반시켰다. 이 반응물을 물 (200 ml)로 희석시키고, 유기층을 n-헥산으로 추출하였다. 모은 유기층을 물, 소금물로 씻어 주고, 무수 황산 나트륨 상에서 건조시켰다. 용매를 증발시키고, 잔류물을 1:9 디에틸 에테르:n-헥산으로 용출하여 칼럼 크로마토그래피 (알루미나 옥시드 90, 70 내지 230 메쉬, 활성 II-III)함으로써 정제하여 표제 화합물을 노란색 오일로 수득하였다 (40% 수율).
<실시예 8>
포타슘 O-에틸 디티오카르보네이트로부터 O-에틸 S-(2-시아노프로프-2-일) 크산테이트 (72)의 제조
에탄올 (280 g) 중의 브로모이소부티로니트릴 (10 g) 및 포타슘 O-에틸 디티오카르보네이트 (10.84 g)의 용액을 40℃에서 40시간 동안 교반시키면서 가열하였다. 이 혼합물을 12일 동안 실온에서 교반시켰다. 반응 혼합물을 물 (400 ml)로 희석시키고, 유기층을 n-헥산으로 추출하였다. 모은 유기층을 물, 소금물로 씻어 주고, 황산 마그네슘 상에서 건조시켰다. 용매를 증발시키고, 잔류물을 1:9에서 1:4로 비율 변화가 있는 디에틸 에테르:헥산으로 용출하여 칼럼 크로마토그래피 (알루미나 옥시드 90, 70 내지 230 메쉬, 활성 II-III)함으로써 정제하였다.
<실시예 9>
O-에틸 크산토겐 디술파이드로부터 O-에틸 S-(2-시아노프로프-2-일) 크산테이트 (72)의 제조
O-에틸 크산토겐 디술파이드는 포타슘 O-에틸 디티오카르보네이트의 수용액을 I2/KI (10%) 용액으로 산화시킴으로써 제조하였다.
에틸 아세테이트 (30 ml) 중의 O-에틸 크산토겐 디술파이드 (2.16 g, 8.92 mmol) 및 2,2'-아조비스(이소부티로니트릴) (2.19 g, 13.35 mmol)의 용액을 제조하였다. 이 혼합물을 16시간 동안 환류 가열시켰다. 휘발성 물질을 감압하여 제거하고, 잔류물을 에틸 아세테이트:페트롤륨 주정 (3:47)의 혼합물을 용출액으로 사용하여 크로마토그래피하여 표제 화합물을 단리하였다 (3.17 g, 94%).
1H-NMR (CDCl3) δ 1.52 (t, 3H), 1.75 (s, 6H), 4.75 (q, 2H).
13C-NMR (CDCl3) δ13.4, 27.2, 40.8, 70.6, 121.1, 208.2.
<실시예 10>
O-에틸 S-시아노메틸 크산테이트 (73)의 제조
에탄올 (200 ml) 중의 브로모아세토니트릴 (12.4 g) 및 포타슘 O-에틸 디티 오카르보네이트 (16.0 g)의 용액을 실온에서 16시간 동안 교반시켰다. 이 반응물을 물 (100 ml)로 희석시키고, 유기층을 디에틸 에테르로 추출하였다. 모은 유기층을 물로 2회, 이어서 소금물로 씻어 주고, 무수 황산 마그네슘 상에서 건조시켰다. 용매를 증발시키고, 잔류물을 4:6 에틸 아세테이트:페트롤륨 주정으로 40 내지 60℃에서 용출하여 칼럼 크로마토그래피 (실리카-겔 60, 70 내지 230 메쉬)함으로써 정제하여 표제 화합물을 노란색 오일로 수득하였다 (14.6 g, 90.7%).
1H-NMR (CDCl3) δ 1.48 (t, 3H), 3.88 (s, 2H), 4.72 (q, 2H).
13C-NMR (CDCl3) δ 13.7, 21.3, 71.5, 115.7, 209.2.
<실시예 11>
O-페닐 S-벤질 크산테이트 (74)의 제조
벤질 머캅탄 (1.24 g, 10 mmol)을 NaOH (0.8 g, 20 mmol)의 수용액 (20 ml)에 실온에서 가하고, 15분 동안 교반시켰다. 그 다음, 페닐 티오노클로로포르메이트 (2.07 g, 12 mmol)를 이 용액에 같은 온도에서 적가하고, 추가로 2시간 동안 교반시켰다. 디에틸 에테르 (20 ml) 및 물 (50 ml)을 가하고, 유기층을 분리하였다. 수층을 디에틸 에테르 (3×20 ml)로 추출하였다. 모은 유기층을 Na2SO4 상에서 건조시키고, 여과하여 용매를 제거하고, 조 생성물을 크로마토그래피 (실라카 겔 사용, 페트롤륨 주정 중 2% 에틸 아세테이트)하여 표제 화합물을 노란색 오일로 수득하였다 (1.95 g, 75%).
1H-NMR (CDCl3) δ 4.43 (2H), 7.10-7.50 (10H).
13C-NMR (CDCl3) δ 41.7, 122.1, 126.7, 127.8, 128.8, 129.3, 129.6, 135.1, 154.0, 213.0.
<실시예 12>
O-펜타플루오로페닐 S-벤질 크산테이트 (75)의 제조
0℃에서 CHCl3 (10 ml) 중의 티오포스겐 (1.93 g, 16.6 mmol)을 0 내지 10℃로 냉각시킨 5% NaOH 중의 펜타플루오로페놀 (15 ml)을 적가하여 처리하였다. 이 용액을 같은 온도에서 1시간 동안 교반시키고, CHCl3 층을 분리하고 5% NaOH (10 ml), 5% HCl (10 ml) 및 H2O (10 ml)로 씻어 주었다. 유기 부분을 모으고, MgSO4 상에서 건조시키고, 여과하고 용매를 제거하여 퍼플루오로페닐 클로로포르메이트를 얻었다 (3.76 g).
벤질 머캅탄 (1.24 g, 10 mmol)을 H2O (20 ml) 중에 용해시킨 0.8 g의 NaOH에 가하고, 10분 동안 교반시켰다. 조-클로로포르메이트 (2.63 g, 10 mmol)을 이 용액에 가하고, 2시간 동안 교반시켰다. 이 수용액을 디에틸 에테르 (3×30 ml)로 추출하고, 유기 부분을 모으고, Na2SO4 상에서 건조시켜 여과하고, 용매를 제거하였다. 잔류물을 페트롤륨 주정 중의 2% 에틸아세테이트를 사용하여 크로마토그래피하여 생성물을 얻었다 (890 mg, 25%).
1H-NMR (CDCl3) δ 4.5 (2H), 7.3 (5H).
13C-NMR (CDCl3) δ42.9, 128.2, 128.9, 129.2, 134.0.
19F-NMR (CDCl3) δ -162.54 (2F, t), -156.94 (1F, t), -151.51 (2F, d).
실시예 13 및 14는 비닐계 디티오화합물 (화학식 2, D=D1)의 합성을 예시한다.
<화학식 30>
<실시예 13>
3-벤질티오-5,5-디메틸시클로헥스-2-엔-1-티온 (30)의 제조
5,5-디메틸-3-피페리디닐-시클로헥스-2-엔-1-온. 피페리딘 (7.0 ml, 0.0713 mol) 및 촉매량의 p-톨루엔술폰산 일수화물을 벤젠 (100 ml) 중의 5,5-디메틸시클로헥산-1,3-디온 (10.0 g, 0.0713 mol)의 용액에 가하고, 얻어진 용액을 환류 가열시켰다. 3시간 후에, 추가의 피페리딘 (0.71 ml, 7.13 mmol)을 가하고, 이 용액을 추가로 16시간 동안 환류시켰다. 반응 혼합물을 실온으로 냉각시키고, 10% NaHCO3 용액 (20 ml)으로 씻어 준 후, 무수 황산 나트륨 상에서 건조시키고, 용매를 진공에서 증발시켜 오렌지색 결정성 고상물을 수득하였다 (14.23 g, 96%).
1H-NMR (CDCl3) δ 5.3 (s 1H, H-2), 3.4-3.2 (m, 4H, H-2', H-6'), 2.2 (s, 2H, H-6), 2.1 (s, 2H, H-4), 1.75-1.4 (m, 6H, H-3', H-4', H-5'), 1.00 (s, 6H, 2×CH3).
5,5-디메틸-3-피페리디닐-시클로헥스-2-엔-1-티온. 이 화합물은 문헌 [Walter, W. and Proll, T., Synthesis, 941-2 (1979)]에 기재된 과정에 따라서 제조하였다. 무수 DME (10 ml) 중의 상기 엔아민 (1.0 g, 4.82 mmol)의 용액에 라우에슨 (Lawesson) 시약 (1.04 g, 2.57 mmol)을 20분에 걸쳐서 아르곤 대기하 실온에서 가하였다. 얻어진 현탁액을 실온에서 2시간 동안 교반시켰다. 이 혼합물을 빙수 (10 ml)에 가하고, CH2Cl2 (3×20 ml)로 추출하였다. 모은 추출액을 무수 황산 나트륨 상에서 건조시키고, 용매를 진공에서 증발시켜 오렌지색 고상물을 수득하였다. 조-고상물을 실리카겔과 염기성 알루미나 (1:1)의 혼합물 상에서 클로로포름을 용출액으로 사용하여 크로마토그래피하였다. 표제 화합물을 오렌지색 고상물로 수득하였다 (1.1 g, 100%).
1H-NMR (CDCl3) δ 6.75 (s, 1H, H-2), 3.6-3.4 (m, 4H, H-2', H-6'), 2.65 (s, 2H, H-6), 2.2 (s, 2H, H-4), 1.75-1.5 (m, 6H, H-3', H-4', H-5'), 1.00 (s, 6H, 2×CH3).
3-벤질티오-5,5-디메틸시클로헥스-2-엔-1-티온. 이 화합물은 문헌 [Timokhina, L. V. et al., Zh. Org. Khim., 14, 2226-7 (1978)]에 기재된 과정에 따라서 제조하였다. 무수 DMF (5 ml) 중의 상기 엔아미노티온 (0.50 g, 2.24 mmol)의 차가운 (0℃) 용액에 벤질 클로라이드 (0.35 g, 2.7 mmol)를 30분에 걸쳐서 아르곤 대기하에서 가하였다. 이 혼합물을 실온으로 가온하고, 추가로 2시간 동안 교반시켰다. 이 혼합물을 -50℃ (드라이아이스/벤질 아세테이트)로 냉각시키고 무수 H2S (g)를 이 용액에 2시간 동안 통과시켰다. 붉은색이 된 용액을 빙수 (10 ml)에 붓고, CH2Cl2 (2×20 ml)로 추출하였다. 모은 추출액을 무수 황산 나트륨 상에서 건조시키고, 용매를 진공에서 제거하여 보라색 오일을 수득하였다 (0.52 g, 89%).
1H-NMR (CDCl3) δ 7.4-7.1 (m, 5H, ArH), 6.9 (s, 1H, H-2), 4.15 (s, 2H, SCH2Ph), 2.8 (s, 2H, H-6), 2.25 (s, 2H, H-4), 1.00 (s, 6H, 2×CH3).
<실시예 14>
벤질 3,3-디(벤질티오)프로프-2-엔디티오에이트 (76)의 제조
이황화탄소 (0.76 g, 10 mmol)을 THF (3.5 ml) 중의 메틸 마그네슘 클로라이드 (1.67 ml, 5 mmol, 디에틸 에테르 중 3 M 용액)에 실온에서 적가하였다. 2시간 후에, 이 용액을 -78℃ (드라이아이스/아세톤)으로 냉각시키고, 리튬 디-이소프로필아미드 (10 mmol, 헥산 중 1.5 M 용액 6.67 ml)를 30분에 걸쳐서 가하였다. 이 용액을 -78℃에서 45분 동안 교반시키고, 실온에서 추가로 30분 동안 교반시킨 후, 벤질 브로마이드 (1.89 g, 15 mmol)를 가하였다. 이 용액을 40℃로 2시간 동안 가온하고, 실온에서 밤새 교반시켰다. NaHCO3 5% 용액 (30 ml)에 이어서 디에틸 에테르 (20 ml)를 이 혼합물에 가하고, 유기층을 분리하였다. 수층을 디에틸 에테르 (3×20 ml)로 추출하고, 유기층을 모아서 MgSO4 상에서 건조시키고 여과한 후 용매를 증발시켰다. 잔류물을 실리카 겔 상에서 크로마토그래피 (페트롤륨 주정 중 5% 에틸 아세테이트)하여 생성물을 오렌지색 고상물로 수득하였다 (0.63 g, 29% 수율).
1H-NMR (CDCl3) δ 4.19, 4.30, 4.42 (6H, s, CH2Ph), 7.05 (1H, CH), 7.35 (15H, ArH).
13C-NMR (CDCl3) δ 37.6, 39.6, 39.9, 124.4 (CH), 124.4, 127.4, 127.7, 128.2, 128.5, 128.7, 129.0, 129.2, 129.3, 133.8, 135.4, 136.2, 159.1, 209.4.
m/z : AP+ 439 (M+1), AP- 438 (M-1).
하기 실시예는 다분산도가 좁은 중합체의 합성에, 전자 끌개/공액기인 α-질소 치환체가 있는 디티오화합물을 사용하는 것을 설명한다.
<실시예 15 내지 19>
α-질소 디티오-화합물의 존재하에서의 스티렌 중합
스티렌의 열중합을 벤질 1-피롤카르보디티오에이트 (60), 벤질 1-(2-피롤리디논)카르보디티오에이트 (61), 및 벤질 (1,2-벤젠디카르복스이미도)카르보디티오에이트 (62)의 존재하에 수행하였다.
바로 증류한 스티렌 (1 ml)을 필요한 양의 디티오카르바메이트가 들어 있는 여섯 개의 개별 앰풀에 가하였다 (표 1 참조). 앰풀의 내용물을 탈기시키고, 밀봉한 후 110℃에서 16시간 동안 가열하였다. 휘발 성분을 제거한 후, 잔류물을 GPC를 사용하여 분석하였다.
디티오카르바메이트 (60 내지 62)의 존재하에 110℃에서 제조한 폴리스티렌의 분자량 및 전환율 데이타
| 실시예 |
디티오 화합물 |
디티오 (mg) |
Mn
|
Mw/Mn
|
전환율 (%) |
| 15 |
(60) |
6.92 |
30674 |
1.18 |
58 |
| 16 |
(60) |
13.75 |
16018 |
1.18 |
59 |
| 17 |
(61) |
7.42 |
40515 |
1.63 |
57 |
| 18 |
(61) |
14.82 |
22510 |
1.58 |
57 |
| 19 |
(62) |
9.07 |
23480 |
1.10 |
51 |
<실시예 20>
저농도의 벤질 1-피롤카르보디티오에이트 (60)의 존재하에서의 메틸 아크릴레이트 중합
벤젠 (20 ml) 중의 디티오카르바메이트 (60) (8.6 mg), 2,2'-아조비스(이소부티로니트릴) (3.0 mg) 및 메틸 아크릴레이트 (5 ml)의 모액을 제조하였다. 이 용액의 5 ml 분취량 3개를 앰풀에 옮기고, 탈기시키고 밀봉한 후 60℃에서 각각 1, 8 및 16시간 동안 가열하였다. 과잉의 단량체 및 용매를 제거한 후, 얻은 중합체는 GPC를 사용하여 분석하였다.
벤질 1-피롤카르보디티오에이트 (60) (8.6 mg)의 존재하에, 2,2'-아조비스(이소부티로니트릴)을 개시제로 사용하여 60℃에서 메틸 아크릴레이트를 중합한 것의 분자량 및 전환율 데이타
| 번호 |
시간 (hr) |
Mn
|
Mw/Mn
|
전환율 (%) |
| 1 |
1 |
37257 |
1.18 |
31 |
| 2 |
8 |
97127 |
1.37 |
89 |
| 3 |
16 |
110906 |
1.36 |
91 |
<실시예 21>
고농도의 벤질 1-피롤카르보디티오에이트 (60)의 존재하에서의 메틸 아크릴레이트 중합
벤젠 (20 ml) 중의 디티오카르바메이트 (60) (86.0 mg), 2,2'-아조비스(이소부티로니트릴) (3.0 mg) 및 메틸 아크릴레이트 (5 ml)의 용액을 제조하였다. 이 용액의 5 ml의 분취량 3개를 앰풀에 옮기고, 탈기시켜 밀봉하고 60℃에서 각각 4, 8 및 16시간 동안 가열하였다. 과잉의 단량체 및 용매를 제거한 후, 얻은 중합체는 GPC를 사용하여 분석하였다.
벤질 1-피롤카르보디티오에이트 (60) (86.0 mg)의 존재하에, 2,2'-아조비스(이소부티로니트릴)을 개시제로 사용하여 60℃에서 메틸 아크릴레이트를 중합한 것의 분자량 및 전환율 데이타
| 번호 |
시간 (hr) |
Mn
|
Mw/Mn
|
전환율 (%) |
| 1 |
4 |
3381 |
1.36 |
22 |
| 2 |
8 |
5952 |
1.22 |
47 |
| 3 |
16 |
8762 |
1.17 |
74 |
말단기 (피롤 및 벤질)의 존재는 1H NMR로 확인하였다.
<실시예 22 및 23>
벤질 1-(2-피롤리디논)카르보디티오에이트 (61) 및 벤질 (1,2-벤젠디카르복스이미도)카르보디티오에이트 (62)의 존재하에서의 메틸 아크릴레이트 중합
벤젠 (25 ml) 중의 2,2'-아조비스(이소부티로니트릴) (2.30 mg)의 모액을 제조하였다. 이것의 분취량 (6.0 ml)을 메틸 아크릴레이트 (4.0 ml) 및 디티오카르바메이트 [(61)의 경우, 4.63 mg; (62)의 경우, 5.20 mg]가 이미 들어있는 두 개의 개별 앰풀에 옮겼다. 두 앰풀의 내용물을 모두 탈기시킨 후, 밀봉하고 60℃에서 16시간 동안 가열하였다. 그 결과를 하기 표 4에 나열한다.
(61) 및 (62)의 존재하에 60℃에서 제조된 폴리(메틸 아크릴레이트)의 분자량 및 전환율 데이타.
| 실시예 |
디티오에스테르 |
디티오 (mg) |
Mn
|
Mw/Mn
|
전환율 (%) |
| 22 |
(61) |
4.63 |
161800 |
1.21 |
89 |
| 23 |
(62) |
5.20 |
59800 |
1.52a
|
48 |
| a 이중 종형의 분자량 분포 |
<실시예 24>
2-시아노프로프-2-일 1-피롤카르보디티오에이트 (63)의 존재하에서의 메틸 아크릴레이트 중합
벤젠 (20 ml) 중의 디티오카르바메이트 (63) (8.95 mg), 2,2'-아조(이소부티로니트릴) (3.1 mg) 및 메틸 아크릴레이트 (5 ml)의 용액을 제조하였다. 이 용액의 5 ml의 분취량 3개를 앰풀에 옮기고, 탈기시켜 밀봉하여 60℃에서 각각 1, 4 및 16시간 동안 가열하였다. 과잉의 단량체 및 용매를 제거한 후, 얻은 중합체는 GPC를 사용하여 분석하였다.
2-시아노프로프-2-일 1-피롤카르보디티오에이트 (63)의 존재하에, 2,2'-아조비스(이소부티로니트릴)을 개시제로 사용하여 60℃에서 메틸 아크릴레이트를 중합한 것의 분자량 및 전환율 데이타.
| 번호 |
시간 (hr) |
Mn
|
Mw/Mn
|
전환율 (%) |
| 1 |
1 |
30308 |
1.11 |
20 |
| 2 |
4 |
82255 |
1.13 |
56 |
| 3 |
16 |
131558 |
1.40 |
91 |
<실시예 25>
벤질 1-이미다졸 카르보디티오에이트 (65)의 존재하에서의 메틸 아크릴레이트 중합
벤젠 (20 ml) 중의 디티오카르바메이트 (65) (8.6 mg), 2,2'-아조비스(이소부티로니트릴) (2.7 mg), 및 메틸 아크릴레이트 (5 ml)의 용액을 제조하였다. 이 용액의 5 ml 분취량 3개를 앰풀에 옮기고, 탈기시켜 밀봉하여 60℃에서 각각 1, 4 및 16시간 동안 가열하였다. 과잉의 단량체 및 용매를 제거한 후, 얻은 중합체는 GPC를 사용하여 분석하였다.
벤질 1-이미다졸 카르보디티오에이트 (65) (8.6 mg)의 존재하에, 2,2'-아조비스(이소부티로니트릴)을 개시제로 사용하여 60℃에서 메틸 아크릴레이트를 중합한 것의 분자량 및 전환율 데이타
| 번호 |
시간 (hr) |
Mn
|
Mw/Mn
|
전환율 (%) |
| 1 |
1 |
22189 |
1.13 |
16 |
| 2 |
4 |
82574 |
1.14 |
66 |
| 3 |
16 |
107077 |
1.34 |
97 |
<실시예 26>
2-시아노프로프-2-일 1-피롤카르보디티오에이트 (63)의 존재하에서의 메틸 메타크릴레이트 중합
벤젠 (2.5 ml) 중의 디티오카르바메이트 (63) (10.4 mg), 2,2'-아조비스(이소부티로니트릴) (10.1 mg) 및 메틸 메타크릴레이트 (7.55 ml)의 용액을 제조하였다. 이 용액의 2 ml 분취량 4개를 앰풀에 옮기고, 탈기시키고 밀봉하여 60℃에서 각각 1, 4, 8 및 16시간 동안 가열하였다. 과잉의 단량체 및 용매를 제거한 후, 얻은 중합체는 GPC를 사용하여 분석하였다.
2-시아노프로프-2-일 1-피롤카르보디티오에이트 (63)의 존재하에, 2,2'-아조비스(이소부티로니트릴)을 개시제로 사용하여 60℃에서 메틸 메타크릴레이트를 중합한 것의 분자량 및 전환율 데이타
| 번호 |
시간 (hr) |
Mn
|
Mw/Mn
|
전환율 (%) |
| 1 |
1 |
42450 |
1.70 |
16 |
| 2 |
4 |
64025 |
1.50 |
51 |
| 3 |
8 |
114561 |
1.26 |
>95 |
| 4 |
16 |
117418 |
1.27 |
>95 |
<실시예 27>
2-시아노부트-2-일 1-피롤카르보디티오에이트 (64)의 존재하에서의 메틸 메타크릴레이트 중합
벤젠 (2.5 ml) 중의 CTA (64) (24.97 mg), 2,2'-아조비스(2-시아노부탄) (11.7 mg) 및 메틸 메타크릴레이트 (7.5 ml)의 용액을 제조하였다. 이 용액의 2 ml 분취량 4개를 앰풀에 옮기고, 탈기시키고 밀봉하여 60℃에서 각각 2, 4, 8 및 16시간 동안 가열하였다. 과잉의 단량체 및 용매를 제거한 후, 얻은 중합체는 GPC를 사용하여 분석하였다.
2-시아노부트-2-일 1-피롤카르보디티오에이트 (64)의 존재하에, 2,2'-아조비스(2-시아노부탄)을 개시제로 사용하여 60℃에서 메틸 메타크릴레이트를 중합한 것의 분자량 및 전환율 데이타
| 번호 |
시간 (hr) |
Mn
|
Mw/Mn
|
전환율 (%) |
| 1 |
2 |
19372 |
1.58 |
21 |
| 2 |
4 |
28752 |
1.44 |
52 |
| 3 |
8 |
35888 |
1.30 |
65 |
| 4 |
16 |
57378 |
1.21 |
99 |
하기 실시예는 폴리(메틸 메타크릴레이트)의 다분산도를 조절하는 데 있어서, 질소 비공유 쌍을 비편재화시킬 수 있는 α-질소 치환체가 있는 디티오카르바메이트의 영향을 예시한다. N,N-디메틸-S-(2-시아노프로프-2-일) 디티오카르바메이트 (66)을 사용하여 행한 대조 실험은, 단순한 알킬 치환체가 있는 디티오카르바메이트는 분자량 또는 다분산도를 조절하는 데 영향이 없음을 나타낸다.
<실시예 28>
2-시아노-2-일 1-피롤카르보디티오에이트 (63) 또는 N,N-디메틸-S-(2-시아노프로프-1-일) 디티오카르바메이트 (66)의 존재하에서의 메틸 메타크릴레이트 중합
5 ml의 벤젠 중 2,2'-아조비스(이소부티로니트릴) (24.09 mg)으로 구성된 모액 I, 2 ml의 MMA 중 N,N-디메틸-S-(2-시아노프로프-2-일) 디티오카르바메이트 (66) (5.61 mg)으로 구성된 모액 II, 및 5 ml의 MMA 중 2-시아노프로프-2-일 1-피롤카르보디티오에이트 (63) (15.67 mg)로 구성된 모액 III을 제조하였다. 모액 I의 0.5 ml 분취량 4개를 4개의 앰풀에 옮겼다. 모액 II의 1.5 ml의 분취량을 상기 앰풀 중 하나에 옮기고, 탈기시키고, 밀봉하여 60℃에서 8시간 동안 가열하였다. 모액 III의 1.5 ml 분취량 3개를 나머지 3개의 앰풀에 옮기고, 탈기시키고 밀봉하여 60℃에서 각각 2, 8 및 16시간 동안 가열하였다. 과잉의 단량체를 제거한 후, 각 중합체는 GPC를 사용하여 분석하였다.
디티오카르바메이트 유도체의 존재하에 60℃에서 제조한 폴리(메틸 메타크릴레이트)의 분자량 및 전환율 데이타
| 번호 |
디티오 화합물 |
시간 (hr) |
Mn
|
Mw/Mn
|
전환율 (%) |
| 1 |
(66) |
8 |
312462 |
1.94 |
>95 |
| 2 |
(63) |
2 |
22758 |
1.54 |
33.2 |
| 3 |
(63) |
8 |
48257 |
1.25 |
92.3 |
| 4 |
(63) |
16 |
51474 |
1.19 |
>95 |
하기 실시예는 폴리스티렌의 다분산도를 조절하는 데 있어서, 질소의 비공유 쌍을 비편재화시킬 수 있는 α-질소 치환체가 있는 디티오카르바메이트의 효과를 예시한다. N,N-디에틸 S-벤질 디티오카르바메이트 (67)를 사용하여 행한 대조 실험은, 단순한 알킬 치환체가 있는 디티오카르바메이트는 분자량 또는 다분산도를 조절하는 데 효과가 없음을 나타낸다.
<실시예 29>
벤질-1-피롤카르보디티오에이트 (60) 및 N,N-디에틸 S-벤질 디티오카르바메이트 (67)를 사용하는 스티렌 중합
8 ml의 스티렌 중의 벤질-1-피롤카르보디티오에이트 (60) (55.4 mg)의 용액 I, 및 2 ml의 스티렌 중의 N,N-디에틸 S-벤질 디티오카르바메이트 (67) (14.2 mg)의 용액 II를 제조하였다. 용액 I의 2 ml 분취량을 3개의 개별 앰풀에 옮기고, 탈기시키고 밀봉하여 100℃에서 각각 1, 6 및 30시간 동안 가열하였다. 용액 II를 하나의 앰풀에 넣고 탈기하고 밀봉한 후, 100℃에서 6시간 동안 가열하였다. 과잉 의 단량체를 제거한 후, 각 중합체는 GPC를 사용하여 분석하였다.
디티오화합물 (60 및 67)의 존재하에 100℃에서 제조한 폴리스티렌의 분자량 및 전환율 데이타
| 번호 |
크산테이트 |
시간 (hr) |
Mn
|
Mw/Mn
|
전환율 (%) |
| 5 |
(67) |
6 |
317114 |
1.86 |
15.3 |
| 6 |
(60) |
1 |
3844 |
1.63 |
2.9 |
| 7 |
(60) |
6 |
6478 |
1.46 |
10.2 |
| 8 |
(60) |
30 |
15605 |
1.20 |
59.6 |
하기 실시예는 단순 알킬 치환체가 있는 디티오카르바메이트가 폴리(비닐 아세테이트)의 분자량 및 다분산도를 조절하는 데 유효함을 나타낸다.
<실시예 30>
N,N-디에틸 S-(2-에톡시카르보닐프로프-2-일) 디티오카르바메이트 (69)의 존재하에 다분산도가 좁은 폴리(비닐 아세테이트)의 제조
1,1'-아조비스(시클로헥산카르보니트릴) (2.26 mg), 비닐 아세테이트 (10 ml), 및 N,N-디에틸 S-(2-에톡시카르보닐프로프-2-일) 디티오카르바메이트 (69) (231.53 mg)로 이루어진 모액을 제조하였다. 이 모액의 분취량들 (2 ml)을 앰풀에 옮겼다. 앰풀의 내용물을 탈기시키고, 밀봉하여 100℃에서 정해진 시간 동안 가열하였다. 결과를 표 11에 요약하였다.
N,N-디에틸 S-(2-에톡시카르보닐프로프-2-일) 디티오카르바메이트 (69)의 존재하에 100℃에서 중합한 폴리(비닐 아세테이트)의 분자량 및 전환율 데이타
| 번호 |
시간 (hr) |
Mn
|
Mw/Mn
|
전환율 (%) |
| 1 |
1 |
4500 |
1.64 |
8.4 |
| 2 |
2 |
6150 |
1.61 |
32.4 |
| 3 |
4 |
9500 |
1.47 |
68.0 |
| 4 |
16 |
10550 |
1.43 |
76.5 |
하기 실시예는 n-부틸 아크릴레이트 (실시예 31), t-부틸 아크릴레이트 (실시예 32, 33), 및 메틸 메타크릴레이트 (실시예 34)의 중합에서 크산테이트 유도체의 전이 상수의 측정에 관한 것이다. 전이 상수의 크기는 아크릴레이트 에스테르의 중합시 피드 중합 방법에서 좁은 다분산도 (<1.5)를 획득할 수 있어야 함을 나타낸다.
<실시예 31>
O-에틸 S-(1-페닐에틸) 크산테이트 (70)의 존재하에 폴리(n-부틸 아크릴레이트)의 제조
벤젠 (50 ml) 중의 2,2'-아조비스(이소부티로니트릴) (13.4 mg)로 이루어진 모액을 제조하였다. 이 모액의 분취량들 (2 ml)을 n-부틸 아크릴레이트 (4 ml), 벤젠 (4 ml) 및 O-에틸 S-(1-페닐에틸) 크산테이트가 들어 있는 4개의 개별 앰풀에 옮겼다. 앰풀의 내용물을 탈기시키고, 밀봉하고, 60℃에서 하루 동안 가열하였다. 그 결과를 하기 표 12에 요약하였다.
O-에틸 S-(1-페닐에틸) 크산테이트 (70)의 존재하에 60℃에서 중합한 폴리(n-부틸 아크릴레이트)의 분자량 및 전환율 데이타
| 번호 |
[CTA]/[MMA] |
Mn
|
Mw/Mn
|
전환율 (%) |
| 1 |
0 |
1027396 |
1.78 |
29 |
| 2 |
0.00081 |
70196 |
1.85 |
11 |
| 3 |
0.00166 |
40555 |
1.77 |
16 |
| 4 |
0.00325 |
19411 |
1.87 |
12 |
마요 (Mayo) 플롯을 통한 데이타의 분석은 n-부틸 아크릴레이트 중합에서 O-에틸 S-(1-페닐에틸) 크산테이트의 전이 상수가 2.0임을 나타낸다.
<실시예 32>
O-펜타플루오로페닐 S-벤질 크산테이트 (75)의 존재하에 폴리(t-부틸 아크릴레이트)의 제조
벤젠 (43.7 g, 50 ml) 중의 2,2'-아조비스(이소부티로니트릴) (13.4 mg)의 용액의 분취량 (2 ml)을 t-부틸 아크릴레이트 (4 ml), 벤젠 (4 ml) 및 필요한 양의 O-펜타플루오로페닐 S-벤질 크산테이트 (75)가 들어 있는 4개의 개별 앰풀에 가하였다. 이 앰풀들을 탈기시키고, 밀봉하여 60℃에서 60분 동안 가열하였다. 그 결과를 하기 표 13에 요약하였다.
O-펜타플루오로페닐 S-벤질 크산테이트 (75)의 존재하에 60℃에서 중합한 폴리(t-부틸 아크릴레이트)의 분자량 및 전환율 데이타a
| 번호 |
[CTA] (몰/L) |
[CTA]/[M] |
Mn
|
Mw/Mn
|
전환율 (%) |
| 1 |
0 |
0 |
1467774 |
1.68 |
45.1 |
| 2 |
2.886×10-3
|
1.057×10-3
|
42024 |
1.83 |
26.5 |
| 3 |
5.247×10-3
|
1.922×10-3
|
22214 |
1.83 |
24.1 |
| 4 |
1.140×10-2
|
4.176×10-3
|
10850 |
1.76 |
16.0 |
| a 25℃에서 [AIBN] = 3.273×10-4M, [t-부틸 아크릴레이트] = 2.73 M. |
마요 플롯을 통한 데이타 분석은 t-부틸 아크릴레이트 중합에서 O-펜타플루 오로페닐 S-벤질 크산테이트의 전이 상수가 2.7임을 나타낸다.
<실시예 33>
O-에틸 S-(2-시아노프로프-2-일) 크산테이트 (72)의 존재하에 폴리(t-부틸 아크릴레이트)의 제조
벤젠 (43.6 g, 50 ml) 중의 2,2'-아조비스(이소부티로니트릴) (13.5 mg)의 용액의 분취량 (2 ml)을 t-부틸 아크릴레이트 (4 ml), 벤젠 (4 ml) 및 필요한 양의 O-에틸 S-(2-시아노프로프-2-일) 크산테이트 (72)가 들어 있는 4개의 개별 앰풀에 가하였다. 각 앰풀을 탈기시키고, 밀봉하여 60℃에서 60분 동안 가열하였다. 그 결과를 하기 표 14에 요약하였다.
O-에틸 S-(2-시아노프로프-2-일) 크산테이트 (72)의 존재하에 중합한 폴리(t-부틸 아크릴레이트)의 분자량 및 전환율 데이타a
| 번호 |
[CTA] (몰/L) |
[CTA]/[M] |
Mn
|
Mw/Mn
|
전환율 (%) |
| 1 |
0 |
0 |
1790182 |
1.52 |
38.9 |
| 2 |
2.916×10-3
|
1.068×10-3
|
18775 |
1.81 |
7.68 |
| 3 |
5.320×10-3
|
1.948×10-3
|
9438 |
1.81 |
5.13 |
| 4 |
1.053×10-2
|
3.856×10-3
|
4611 |
1.80 |
4.26 |
| a 25℃에서 [AIBN] = 3.283×10-4M, [t-부틸 아크릴레이트] = 2.73 M. |
마요 플롯을 통한 데이타의 분석은 t-부틸 아크릴레이트 중합에서 O-에틸 S-(2-시아노프로프-2-일)크산테이트의 전이 상수가 7.25임을 나타낸다.
<실시예 34>
O-에틸 S-(2-시아노프로프-2-일) 크산테이트 (72)의 존재하에 폴리(메틸 메타크릴레이트)의 제조
메틸 메타크릴레이트 (23.4 g, 25 ml) 중의 아조비스(이소부티로니트릴) (50.3 mg)의 용액의 분취량 (5 ml)을 필요한 양의 O-에틸 S-(2-시아노프로프-2-일) 크산테이트 (72)가 들어 있는 4개의 개별 앰풀에 가하였다. 이 앰풀을 탈기하고, 밀봉하여 60℃에서 60분 동안 가열하였다. 결과를 하기 표 15에 요약하였다.
O-에틸 S-(2-시아노프로프-2-일) 크산테이트 (72)의 존재하에 제조된 폴리(메틸 메타크릴레이트)의 분자량 및 전환율 데이타
| 번호 |
[CTA]/[MMA] |
Mn
|
Mw/Mn
|
전환율 (%) |
| 1 |
0 |
316205 |
2.20 |
13.6 |
| 2 |
0.00073 |
278090 |
2.13 |
13.9 |
| 3 |
0.00176 |
255183 |
1.94 |
13.8 |
| 4 |
0.00303 |
233881 |
1.83 |
15.3 |
| a 25℃에서 [AIBN] = 1.225×10-2M, [메틸 메타크릴레이트] = 9.35 M. |
마요 플롯을 통한 데이타의 분석은 메틸 메타크릴레이트 중합에서 O-에틸 S-(2-시아노프로프-2-일) 크산테이트의 전이 상수가 대략 0.04임을 나타낸다.
하기 실시예는 소량의 유화 중합에서 형성되는 중합체의 분자량 및 다분산도를 조절하기 위해 크산테이트 에스테르를 사용할 수 있음을 보여준다.
<실시예 35>
O-에틸 S-(1-페닐에틸) 크산테이트 (70)를 사용하여 70℃에서 소량의 유화
중합을 통한 폴리스티렌의 제조
교반기, 콘덴서 및 열전대를 장착한 5구 반응 용기를 물 (75 g), 소듐 도데 실 술페이트 (215.2 mg), 세틸 알코올 (53 mg), 탄산수소 나트륨 (16.7 mg)으로 충전시켰다. 이 혼합물을 10분 동안 균일화시켰다. 스티렌 (18.84 g)을 가하고, 이 혼합물을 추가 5분 동안 균일화시켰다. 이 반응 혼합물을 70℃로 온도를 승온하면서 40분 동안 300 rpm으로 교반시켰다. O-에틸 S-(1-페닐에틸) 크산테이트 (87 mg) 및 2,2'-아조비스(2-시아노-2-부탄) (40.7 mg)을 가하였다.
O-에틸 S-(1-페닐에틸) 크산테이트 (70)를 사용하여 70℃에서 소량의 유화 중합으로 제조한 폴리스티렌의 분자량 및 전환율 데이타
| 실시예 |
반응 시간 (분) |
Mn
|
Mw/Mn
|
전환율 (%) |
| 대조물a
|
60 |
930564 |
6.98 |
13 |
| 35 |
60 |
84740 |
1.4 |
11 |
| a 크산테이트를 사용하지 않음. |
하기 실시예는 비닐 에스테르 중합체 (예, 비닐 벤조에이트, 비닐 아세테이트)의 분자량 및 다분산도를 조절하는 데 크산테이트 에스테르를 사용할 수 있음을 나타낸다.
<실시예 36>
O-에틸 S-(2-시아노프로프-2-일) 크산테이트 (72)의 존재하에 150℃에서 폴리(비닐 벤조에이트)의 제조
비닐 아세테이트 (3 g) 중의 아조비스(이소부티로니트릴) (비닐 벤조에이트 중 1% 용액 0.14 ml) 및 O-에틸 S-(2-시아노프로프-2-일) 크산테이트 (72) (43.5 mg)의 용액을 앰풀에 옮기고, 탈기시키고 밀봉하여 150℃에서 24시간 동안 가열하 였다. 비슷하게 제조한 대조물은 크산테이트를 포함시키지 않았다. 그 결과를 하기 표 17에 요약하였다.
O-에틸 S-(2-시아노프로프-2-일) 크산테이트 (72)의 존재하에 150℃에서 중합한 폴리(비닐 벤조에이트)의 분자량 및 전환율 데이타
| 실시예 |
반응 시간 (hr) |
Mn
|
Mw/Mn
|
전환율 (%) |
| 대조물a
|
24 |
381980 |
2.07 |
88 |
| 35 |
24 |
9140 |
1.43 |
12 |
| a 크산테이트 사용하지 않음. |
<실시예 37>
O-에틸 S-시아노메틸 크산테이트 (73)의 존재하에 다분산도가 좁은 폴리(비닐 아세테이트)의 제조
에틸 아세테이트 (25 ml) 중의 1,1'-아조비스(시클로헥산카르보니트릴) (2.11 mg), 비닐 아세테이트 (25 ml)의 모액 (I)을 제조하였다. 용액 (I)의 분취량 (10 ml)을 O-에틸 S-시아노메틸 크산테이트 (73) (20.18 mg)가 이미 들어 있는 10 ml 매스 플라스크에 넣어 모액 (II)을 제조하였다. 모액 (II)의 분취량 (2 ml)를 앰풀에 옮겼다. 이 앰풀을 탈기시키고 밀봉하여 100℃에서 정해진 시간 동안 가열하였다. 결과를 하기 표 18에 요약하였다.
O-에틸 S-시아노메틸 크산테이트 (73)의 존재하에 100℃에서 중합한 폴리(비닐 아세테이트)의 분자량 및 전환율 데이타
| 번호 |
반응 시간 (hr) |
Mn
|
Mw/Mn
|
전환율 (%) |
| 1 |
0.5 |
1680 |
1.44 |
3.4 |
| 2 |
1.5 |
11520 |
1.24 |
26.6 |
| 3 |
4 |
20977 |
1.39 |
59.7 |
| 4 (대조물)*
|
1.5 |
61560 |
1.69 |
40.1 |
| * O-에틸 S-시아노메틸 크산테이트를 사용하지 않음. |
<실시예 38>
O-에틸 S-시아노메틸 크산테이트 (73)의 존재하에 다분산도가 좁은 폴리(비닐 아세테이트)의 제조
에틸 아세테이트 (10 ml) 중의 1,1'-아조비스(시클로헥산카르보니트릴) (4 mg), 비닐 아세테이트 (10 ml) 및 O-에틸 S-시아노메틸 크산테이트 (73) (160.74 mg)로 이루어진 모액을 제조하였다. 이 모액의 분취량 (4 ml)을 4개의 개별 앰풀에 옮겼다. 앰풀의 내용물을 탈기시키고, 밀봉하여 100℃에서 정해진 시간 동안 가열하였다. 결과를 하기 표 19에 요약하였다.
O-에틸 S-시아노메틸 크산테이트 (73)의 존재하에 100℃에서 중합한 폴리(비닐 아세테이트)의 분자량 및 전환율 데이타
| 번호 |
반응 시간 (hr) |
Mn
|
Mw/Mn
|
전환율 (%) |
| 1 |
1 |
1440 |
1.23 |
13.2 |
| 2 |
2 |
4600 |
1.16 |
40.7 |
| 3 |
6 |
8420 |
1.34 |
82.3 |
| 4 |
16 |
9095 |
1.37 |
91.7 |
<실시예 39>
O-에틸 S-시아노메틸 크산테이트 (73)의 존재하에 다분산도가 좁은 폴리(비닐 아세테이트)의 제조
1,1'-아조비스(시클로헥산카르보니트릴) (2.12 mg), 비닐 아세테이트 (10 ml) 및 O-에틸 S-시아노메틸 크산테이트 (73) (160.45 mg)로 이루어진 모액을 제조하였다. 이 모액의 분취량 (2 ml)을 4개의 개별 앰풀에 옮겼다. 앰풀의 내용물을 탈기시키고, 밀봉하여 100℃에서 정해진 시간 동안 가열하였다. 결과를 하기 표 20에 요약하였다.
O-에틸 S-시아노메틸 크산테이트 (73)의 존재하에 100℃에서 중합한 폴리(비닐 아세테이트)의 분자량 및 전환율 데이타
| 번호 |
반응 시간 (hr) |
Mn
|
Mw/Mn
|
전환율 (%) |
| 1 |
1 |
615 |
1.34 |
7.4 |
| 2 |
2 |
2280 |
1.17 |
24.5 |
| 3 |
4 |
7030 |
1.18 |
66.3 |
| 4 |
16 |
10100 |
1.31 |
78.3 |
<실시예 40>
O-에틸 S-(2-시아노프로프-2-일) 크산테이트 (72)의 존재하에 다분산도가 좁은 폴리(비닐 아세테이트)의 제조
에틸 아세테이트 (12.5 ml) 중의 1,1'-아조비스(시클로헥산카르보니트릴) (2.10 mg), 비닐 아세테이트 (12.5 ml) 및 O-에틸 S-(2-시아노프로프-2-일) 크산테이트 (72) (23.65 mg)로 이루어진 모액을 제조하였다. 이 모액의 분취량 (2 ml)을 앰풀에 옮겼다. 앰풀의 내용물을 탈기시키고, 밀봉하여 100℃에서 정해진 시간 동안 가열하였다. 결과를 하기 표 21에 요약하였다.
O-에틸 S-(2-시아노프로필) 크산테이트 (72)의 존재하에 100℃에서 중합한 폴리(비닐 아세테이트)의 분자량 및 전환율 데이타
| 번호 |
반응 시간 (hr) |
Mn
|
Mw/Mn
|
전환율 (%) |
| 1 |
0.5 |
577 |
1.39 |
1.0 |
| 2 |
1.5 |
3350 |
1.39 |
9.0 |
| 3 |
4 |
19300 |
1.53 |
66.0 |
| 4 |
16 |
20750 |
1.66 |
93.0 |
<실시예 41>
O-에틸 S-(2-에톡시카르보닐프로프-2-일) 크산테이트 (71)의 존재하에 다분산도가 좁은 폴리(비닐 아세테이트)의 제조
1,1'-아조비스(시클로헥산카르보니트릴) (2.11 mg), 비닐 아세테이트 (25 ml) 및 에틸 아세테이트 (25 ml)로 이루어진 모액(I)을 제조하였다. 이 용액의 분취량 (10 ml)을 O-에틸 S-(2-에톡시카르보프로프-2-일) 크산테이트 (71) (29.50 mg)가 들어 있는 10 ml 매스 플라스크에 넣어 모액 (II)을 수득하였다. 이 모액 (II)의 분취량 (2 ml)을 4개의 개별 앰풀에 옮겼다. 앰풀의 내용물을 탈기시키고, 밀봉하여 100℃에서 정해진 시간 동안 가열하였다. 결과를 하기 표 22에 요약하였다.
O-에틸 S-(2-에톡시카르보닐프로프-2-일) 크산테이트 (72)의 존재하에 100℃에서 중합한 폴리(비닐 아세테이트)의 분자량 및 전환율 데이타
| 번호 |
반응 시간 (hr) |
Mn
|
Mw/Mn
|
전환율 (%) |
| 1 |
0.5 |
1010 |
1.43 |
1.0 |
| 2 |
1.5 |
3170 |
1.39 |
6.5 |
| 3 |
4 |
16100 |
1.22 |
34.0 |
| 4 |
8 |
20750 |
1.52 |
65.5 |
<실시예 42>
O-에틸 S-시아노메틸 크산테이트 (73)의 존재하에 다분산도가 좁은 폴리(비닐 아세테이트)의 제조
2,2'-아조비스(이소부티로니트릴) (10.09 mg), 비닐 아세테이트 (10 ml) 및 O-에틸 S-시아노메틸 크산테이트 (73) (160.89 mg)로 이루어진 모액을 제조하였다. 이 모액의 분취량 (2 ml)을 4개의 개별 앰풀에 옮겼다. 앰풀의 내용물을 탈기시키고, 밀봉하여 60℃에서 정해진 시간 동안 가열하였다. 결과를 하기 표 23에 요약하였다.
O-에틸 S-시아노메틸 크산테이트 (73)의 존재하에 60℃에서 중합한 폴리(비닐 아세테이트)의 분자량 및 전환율 데이타
| 번호 |
반응 시간 (hr) |
Mn
|
Mw/Mn
|
전환율 (%) |
| 1 |
1 |
326 |
1.30 |
4.2 |
| 2 |
2 |
517 |
1.26 |
6.0 |
| 3 |
4 |
866 |
1.30 |
9.3 |
| 4 |
16 |
11670 |
1.34 |
91.0 |
하기 실시예는 배치 중합 방법으로 형성되는 아크릴레이트 에스테르 중합체의 분자량 및 다분산도를 조절하는 데 크산테이트 에스테르를 사용할 수 있음을 예시한다. 산소 상에 전자를 끄는 치환체가 있는 크산테이트 (E=E2, G=펜타플루오로페닐)를 사용했을 때 가장 낮은 다분산도가 얻어졌다.
<실시예 43 및 44>
크산테이트 에스테르의 존재하에 다분산도가 좁은 폴리(t-부틸 아크릴레이트)의 제조
t-부틸 아크릴레이트 (3.34 g), 및 에틸 아세테이트 (6.66 g) 중의 크산테이 트 에스테르, 및 2,2'-아조비스(이소부티로니트릴) (5.445×10-2 M)로 이루어진 용액을 앰풀에 넣고, 탈기시키고, 밀봉하여 60℃에서 60분 동안 가열하였다. 결과를 하기 표 24에 요약하였다.
크산테이트 에스테르의 존재하에 60℃에서 중합한 폴리(t-부틸 아크릴레이트)의 분자량 및 전환율 데이타
| 실시예 |
크산테이트 |
[CTA] (몰/L) |
[M]/[CTA] |
Mn
|
Mw/Mn
|
전환율 (%) |
| 대조물 |
- |
0 |
0 |
129174 |
3.7 |
>99 |
| 43 |
(72) |
2.118×10-2
|
9.092×10-3
|
11032 |
1.77 |
71.5 |
| 44 |
(75) |
2.148×10-2
|
9.219×10-3
|
11247 |
1.40 |
81.3 |
<실시예 45>
O-펜타플루오로페닐-S-벤질 크산테이트 (75) 및 O-펜틸-S-벤질 크산테이트 (74)를 사용하는 스티렌 중합
5 ml의 스티렌 중의 O-펜타플루오로페닐-S-벤질 크산테이트 (75) (51.36 mg)의 용액 I, 및 3 ml의 스티렌 중의 O-페닐-S-벤질 크산테이트 (74)의 용액 II을 제조하였다. 용액 I의 2 ml 분취량을 2개의 개별 앰풀에 옮기고, 탈기시키고 밀봉하여 110℃에서 각각 6 및 20시간 동안 가열하였다. 용액 II의 2 ml 분취량을 앰풀에 옮기고, 탈기시키고 밀봉하여 110℃에서 6시간 동안 가열하였다. 과잉의 단량체를 제거한 후, 각 중합체는 GPC를 사용하여 분석하였다.
크산테이트 (75) 및 (74)의 존재하에 110℃에서 제조한 폴리스티렌의 분자량 및 전환율 데이타
| 번호 |
크산테이트 |
시간 (hr) |
Mn
|
Mw/Mn
|
전환율 (%) |
| 1 |
(74) |
6 |
23698 |
1.60 |
24.6 |
| 2 |
(75) |
6 |
14097 |
1.53 |
23.7 |
| 3 |
(75) |
20 |
18862 |
1.48 |
57.9 |
<실시예 46>
O-펜타플루오로페닐-S-벤질크산테이트 (75) 및 O-페닐-S-벤질크산테이트 (74)의 존재하에서의 메틸 아크릴레이트 중합
25 ml의 벤젠 중의 2,2'-아조비스(이소부티로니트릴) (3.75 mg)로 이루어진 모액 I, 2 ml의 메틸 아크릴레이트 중의 O-페닐-S-벤질크산테이트 (39.00 mg)으로 이루어진 모액 II, 및 3 ml의 메틸 아크릴레이트 중의 O-펜타플루오로페닐-S-벤질크산테이트 (78.75 mg)로 이루어진 모액 III을 제조하였다. 모액 I의 4 ml 분취량을 3개의 개별 앰풀에 옮겼다. 모액 II의 1 ml의 분취량을 상기 앰풀 중의 하나에 가하고, 탈기시키고 밀봉하여 60℃에서 4시간 동안 가열하였다. 모액 III의 1 ml 분취량을 나머지 두 개의 앰풀에 옮기고, 탈기시키고 밀봉하여 60℃에서 각각 4 및 16시간 동안 가열하였다. 과잉의 단량체를 제거한 후, 각 중합체는 GPC를 사용하여 분석하였다.
디티오-화합물의 존재하에 60℃에서 제조한 폴리(메틸 아크릴레이트)의 분자량 및 전환율 데이타
| 번호 |
디티오 화합물 |
시간 (hr) |
Mn
|
Mw/Mn
|
전환율 (%) |
| 1 |
(74) |
4 |
15450 |
1.49 |
54.3 |
| 2 |
(75) |
4 |
12049 |
1.47 |
48.7 |
| 3 |
(75) |
16 |
14806 |
1.43 |
85.6 |
하기 실시예는 비닐계 디티오에스테르를 사용하는 다분산도가 좁은 중합체의 합성을 설명한다.
<실시예 47>
3-벤질티오-5,5-디메틸시클로헥스-2-엔-1-티온 (30)의 존재하에서의 스티렌 중합
비닐계 디티오에스테르, 3-벤질티오-5,5-디메틸시클로헥스-2-엔-1-티온 (30) (40.5 mg, 0.154 mmol)을 스티렌 (5.0 g) ((17)의 농도 : 0.028 M)에 용해시켰다. 이 용액을 두 개의 앰풀에 동량으로 나누고 탈기시킨 후, 오일 조 중에서 110℃에서 각각 6 및 16시간 동안 가열하였다.
화합물 (30)의 존재하에 110℃에서 스티렌의 열중합으로 제조한 폴리스티렌의 분자량 및 전환율의 데이타
| 번호 |
시간 (hr) |
Mn
|
Mw/Mn
|
전환율 (%) |
| 1 |
6 |
5528 |
1.16 |
10.3 |
| 2 |
16 |
16561 |
1.35 |
25.1 |
<실시예 48>
화합물 (76)의 존재하에 스티렌의 열중합
스티렌 (5 ml) 중의 CTA (76) (64.1 mg)의 모액을 제조하였다. 이 용액의 2 ml 분취량 2개를 앰풀에 옮기고, 탈기시키고 밀봉하여 100℃에서 지시한 시간 동안 가열하였다. 휘발성분을 감압하여 제거하고, 잔류물을 일정한 중량이 유지될 때까 지 건조시켰다. 이 중합체는 GPC를 사용하여 분석하였다.
화합물 (76)의 존재하에 100℃에서 스티렌의 열중합으로 제조한 폴리스티렌의 분자량 및 전환율 데이타
| 번호 |
시간 (hr) |
Mn
|
Mw/Mn
|
전환율 (%) |
| 1 |
6 |
2393 |
1.23 |
9.8 |
| 2 |
64 |
20982a
|
1.54 |
87.7 |
| a 이중 종형의 분자량 분포 |
<실시예 49>
벤질 3,3-(디벤질티오)프로펜디티오에이트 (76)의 존재하에서의 메틸 아크릴레이트 중합
벤젠 (12 ml) 중의 CTA (76) (105 mg), 2,2'-아조비스(이소부티로니트릴) (1.8 mg) 및 메틸 아크릴레이트 (3 ml)의 용액을 제조하였다. 이 용액의 5 ml 분취량 2개를 앰풀에 옮기고, 탈기시키고, 밀봉하여 60℃에서 각각 8 및 16시간 동안 가열하였다. 과잉의 단량체 및 용매를 제거하고, 얻어진 중합체는 GPC를 사용하여 분석하였다.
벤질 3,3-(디벤질티오)프로펜디티오에이트 (76)의 존재하에 2,2'-아조비스(이소부티로니트릴)을 개시제로 사용하여 60℃에서 제조한 폴리(메틸 아크릴레이트)의 분자량 및 전환율 데이타
| 번호 |
시간 (hr) |
Mn
|
Mw/Mn
|
전환율 (%) |
| 1 |
8 |
2714 |
1.22 |
6.2 |
| 2 |
16 |
6390 |
1.11 |
9.6 |
<실시예 50>
2-시아노프로프-2-일-1-피롤카르보디티오에이트 (63)을 사용하는 MMA 중합
5 ml의 벤젠 중의 2,2'-아조비스(이소부티로니트릴) (24.03 mg)로 이루어진 모액 I, 및 5 ml의 MMA 중의 2-시아노프로프-2-일-1-피롤카르보디티오에이트 (156.28 mg)로 이루어진 모액 II를 제조하였다. 모액 I의 0.5 ml의 분취량을 4개의 개별 앰풀에 옮겼다. MMA의 1.5 ml의 분취량을 상기 앰풀 중 하나에 옮기고, 탈기시키고, 밀봉하여 60℃에서 2시간 동안 가열하였다 (대조물). 모액 II의 1.5 ml의 분취량 3개를 남아 있는 3개의 앰풀에 가하고, 탈기시키고, 밀봉하여 60℃에서 각각 2, 4, 및 8시간 동안 가열하였다. 과잉의 단량체를 제거한 후, GPC를 사용하여 각 중합체를 분석하였다.
디티오카르바메이트 (63)의 존재하에 60℃에서 제조한 폴리(메틸 메타크릴레이트)의 분자량 및 전환율 데이타
| 번호 |
시간 (hr) |
Mn
|
Mw/Mn
|
전환율 (%) |
| 1a
|
2 |
274929 |
1.67 |
23.6 |
| 2 |
2 |
3986 |
1.35 |
26.0 |
| 3 |
4 |
4992 |
1.28 |
53.3 |
| 4 |
8 |
6717 |
1.18 |
85.7 |
| a 대조물, 디티오카르바메이트를 가하지 않음. |
하기 실시예는 다분산도가 좁은 블록 공중합체의 합성을 예시한다.
<실시예 51>
다분산도가 낮은 폴리(메틸 메타크릴레이트-블록-스티렌)의 제조
폴리(메틸 메타크릴레이트) (Mn 6,717, Mw/Mn 1.18)를 실시예 49에 기재된 조 건하에서 제조하였다. 15 ml의 스티렌 중의 2,2'-아조비스(이소부티로니트릴) (4.5 mg)로 이루어진 모액을 제조하고, 상기 언급한 폴리(메틸 메타크릴레이트) (840 mg)를 이 용액 12 ml에 용해시켰다. 스티렌, PMMA 및 2,2'-아조비스(이소부티로니트릴) 혼합물의 10 ml의 분취량을 앰풀에 옮기고, 탈기시키고, 밀봉하여 60℃에서 20시간 동안 가열하였다. 과잉의 단량체를 제거한 후, 얻어진 중합체는 GPC를 사용하여 분석하였다. 이 블록 공중합체는 Mn이 25609, Mw/Mn가 1.15 (전환율 26.8%)였다.
하기 실시예는 다분산도가 좁은 공중합체의 합성을 예시한다.
<실시예 52>
다분산도가 낮은 폴리(t-부틸 아크릴레이트-co-비닐 아세테이트)의 제조
1,1'-아조비스(시클로헥산카르보니트릴) (2.30 mg) 및 비닐 아세테이트 (9.34 g)로 이루어진 모액을 제조하였다. 이 모액의 분취량 (400 ml)을 t-부틸 아크릴레이트 (200 ml) 및 O-펜타플루오로페닐-S-벤질 크산테이트 (75) (10.2 mg)가 들어 있는 앰풀에 가하였다. 이 앰풀을 탈기시키고, 밀봉하여 100℃에서 16시간 동안 가열하였다. 과잉의 단량체를 제거한 후, 얻어진 중합체는 GPC를 사용하여 분석하였다. 이 공중합체는 Mn이 16517이고, Mw/Mn이 1.31 (전환율 68%)였다.
하기 실시예는 통상적인 사슬 전이제의 존재하에서의 비닐 아세테이트의 중합을 예시한다. 다분산도는 특정 사슬 전이제 및 그의 농도에 크게 좌우된다. 사슬 전이 상수가 높으면 (예, 티올), 넓은 다분산도를 얻는다. 이는 >90% 전환되어 중합되는 동안 내내 좁은 다분산도가 유지되는 실시예 42와 비교가 된다.
<비교예 1>
사염화 탄소 존재하에서의 비닐 아세테이트 중합
비닐 아세테이트 (50 ml) 중의 2,2'-아조비스(이소부티로니트릴) (8.3 mg)의 모액을 제조하였다. 이 용액의 분취량 (10 ml)을 하기 표 31에서와 같이 다양한 양의 CCl4가 들어 있는 앰풀에 옮겼다. 앰풀의 내용물을 탈기시키고, 밀봉하여 60℃에서 1시간 동안 가열하였다.
사슬 전이제로서 사염화 탄소의 존재하에 제조된 폴리(비닐 아세테이트)의 분자량 및 전환율 데이타
| 번호 |
CCl4 (g) |
[CCl4]/[VAc] |
Mn
|
Mw/Mn
|
전환율 (%) |
| 1 (대조물) |
0 |
0 |
106350 |
1.9 |
13.1 |
| 2 |
0.16 |
0.00958 |
9800 |
1.8 |
9.3 |
| 3 |
0.32 |
0.01917 |
5200 |
1.8 |
10.5 |
| 4 |
0.64 |
0.03834 |
2600 |
1.8 |
10.8 |
마요 플롯을 통한 데이타의 분석은 비닐 아세테이트 중합에서 사염화탄소의 전이 상수가 0.83임을 나타낸다.
<비교예 2>
tert-부틸 머캅탄을 사용하는 비닐 아세테이트의 중합
바로 증류한 비닐 아세테이트 (50 ml) 중의 2,2'-아조비스(이소부티로니트릴) (14.3 mg)의 모액 (I), 및 바로 증류한 비닐 아세테이트 (10 ml) 중의 tert-부틸 머캅탄 (20.4 mg)으로 이루어진 모액 (II)을 제조하였다. 4개의 개별 앰풀을 다양한 양의 모액 (I) 및 (II)로 충전하여 지시한 농도로 만들었다. 앰풀을 탈기시키고, 밀봉하여 60℃에서 1시간 동안 가열하였다.
사슬 전이제로서 tert-부틸 머캅탄의 존재하에 제조된 폴리(비닐 아세테이트)의 분자량 및 전환율 데이타
| 번호 |
RSH (mg) |
[RSH]/[VAc] |
Mn
|
Mw/Mn
|
전환율 (%) |
| 1 (대조물) |
0 |
0 |
112300 |
1.8 |
18.7 |
| 2 |
2.04 |
0.00021 |
49680 |
2.9 |
12.3 |
| 3 |
4.08 |
0.00042 |
29950 |
4.3 |
12.1 |
| 4 |
8.16 |
0.00084 |
15000 |
7.5 |
11.9 |
마요 플롯을 통한 데이타의 분석은 비닐 아세테이트 중합에서 tert-부틸 머캅탄의 전이 상수가 5.97임을 나타낸다.