JP6982748B2 - 2−(1H−インダゾール−3−イル)−3H−イミダゾ[4,5−c]ピリジンおよびそれらの抗炎症的使用 - Google Patents
2−(1H−インダゾール−3−イル)−3H−イミダゾ[4,5−c]ピリジンおよびそれらの抗炎症的使用 Download PDFInfo
- Publication number
- JP6982748B2 JP6982748B2 JP2018523022A JP2018523022A JP6982748B2 JP 6982748 B2 JP6982748 B2 JP 6982748B2 JP 2018523022 A JP2018523022 A JP 2018523022A JP 2018523022 A JP2018523022 A JP 2018523022A JP 6982748 B2 JP6982748 B2 JP 6982748B2
- Authority
- JP
- Japan
- Prior art keywords
- weight
- compound
- less
- composition
- alkyl
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 0 CN(C)CCNc1cc(-c2cncc3c2nc(C2=C(*)CNc4ccc(C5C=CC=CIC5)cc24)[n]3)cc(F)c1 Chemical compound CN(C)CCNc1cc(-c2cncc3c2nc(C2=C(*)CNc4ccc(C5C=CC=CIC5)cc24)[n]3)cc(F)c1 0.000 description 17
- DCQFKIHQRGJOBO-ZQAIXUQXSA-N C/C(/C=C\C(\C1=C[IH]C=CC(CN(C)C)=C1)=C/[I]=C)=C\C(c1nc(c(-c2cc(F)cc(NCCN(C)C)c2)cnc2)c2[nH]1)=C Chemical compound C/C(/C=C\C(\C1=C[IH]C=CC(CN(C)C)=C1)=C/[I]=C)=C\C(c1nc(c(-c2cc(F)cc(NCCN(C)C)c2)cnc2)c2[nH]1)=C DCQFKIHQRGJOBO-ZQAIXUQXSA-N 0.000 description 1
- MFSGMISHCIGWBH-UHFFFAOYSA-N CC(C)(C)C(Nc1cc(-c(cc23)ccc2[nH]nc3-c([nH]c2cnc3)c(C)c2c3-c2cccnc2)cnc1)=O Chemical compound CC(C)(C)C(Nc1cc(-c(cc23)ccc2[nH]nc3-c([nH]c2cnc3)c(C)c2c3-c2cccnc2)cnc1)=O MFSGMISHCIGWBH-UHFFFAOYSA-N 0.000 description 1
- IZRYZAIDUBOVKA-UHFFFAOYSA-N CC(C)(C)CC(Nc1cc(-c(cc2)cc3c2[nH]nc3-c2nc(c(-c3cccnc3)cnc3)c3[nH]2)cnc1)=O Chemical compound CC(C)(C)CC(Nc1cc(-c(cc2)cc3c2[nH]nc3-c2nc(c(-c3cccnc3)cnc3)c3[nH]2)cnc1)=O IZRYZAIDUBOVKA-UHFFFAOYSA-N 0.000 description 1
- FOGDFKHTJQHKDK-UHFFFAOYSA-N CC(C)CC(Nc1cc(-c2cc(C(c([nH]c3cnc4)nc3c4-c3cccnc3)=C(C)CC3N)c3cc2)cnc1)=O Chemical compound CC(C)CC(Nc1cc(-c2cc(C(c([nH]c3cnc4)nc3c4-c3cccnc3)=C(C)CC3N)c3cc2)cnc1)=O FOGDFKHTJQHKDK-UHFFFAOYSA-N 0.000 description 1
- GOWRBLHHWUMFRF-UHFFFAOYSA-N CCCCNc1cc(-c2cncc3c2nc(-c2n[nH]c(cc4)c2cc4C2=C[IH]C=CC(NC(CC(C)(C)C)=O)=C2)[nH]3)cc(F)c1 Chemical compound CCCCNc1cc(-c2cncc3c2nc(-c2n[nH]c(cc4)c2cc4C2=C[IH]C=CC(NC(CC(C)(C)C)=O)=C2)[nH]3)cc(F)c1 GOWRBLHHWUMFRF-UHFFFAOYSA-N 0.000 description 1
- HNMSMACONDRSIN-UHFFFAOYSA-N CCNCc1cncc(-c(cc2)cc3c2[I](C)NN=C3c([nH]c2cnc3)nc2c3-c2cc(F)cc(NCCN(C)C)c2)c1 Chemical compound CCNCc1cncc(-c(cc2)cc3c2[I](C)NN=C3c([nH]c2cnc3)nc2c3-c2cc(F)cc(NCCN(C)C)c2)c1 HNMSMACONDRSIN-UHFFFAOYSA-N 0.000 description 1
- VAKJZVIKNBXAQA-UHFFFAOYSA-N O=C(c1ccccc1)Nc1cc(C2C=C3C(c4nc(C(c5cccnc5)=CN=CC5)c5[nH]4)=NNC3=CC2)cnc1 Chemical compound O=C(c1ccccc1)Nc1cc(C2C=C3C(c4nc(C(c5cccnc5)=CN=CC5)c5[nH]4)=NNC3=CC2)cnc1 VAKJZVIKNBXAQA-UHFFFAOYSA-N 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/4427—Non condensed pyridines; Hydrogenated derivatives thereof containing further heterocyclic ring systems
- A61K31/444—Non condensed pyridines; Hydrogenated derivatives thereof containing further heterocyclic ring systems containing a six-membered ring with nitrogen as a ring heteroatom, e.g. amrinone
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D471/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00
- C07D471/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00 in which the condensed system contains two hetero rings
- C07D471/04—Ortho-condensed systems
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/41—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with two or more ring hetero atoms, at least one of which being nitrogen, e.g. tetrazole
- A61K31/415—1,2-Diazoles
- A61K31/416—1,2-Diazoles condensed with carbocyclic ring systems, e.g. indazole
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/4353—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom ortho- or peri-condensed with heterocyclic ring systems
- A61K31/437—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom ortho- or peri-condensed with heterocyclic ring systems the heterocyclic ring system containing a five-membered ring having nitrogen as a ring hetero atom, e.g. indolizine, beta-carboline
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/4427—Non condensed pyridines; Hydrogenated derivatives thereof containing further heterocyclic ring systems
- A61K31/4439—Non condensed pyridines; Hydrogenated derivatives thereof containing further heterocyclic ring systems containing a five-membered ring with nitrogen as a ring hetero atom, e.g. omeprazole
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/445—Non condensed piperidines, e.g. piperocaine
- A61K31/4523—Non condensed piperidines, e.g. piperocaine containing further heterocyclic ring systems
- A61K31/4545—Non condensed piperidines, e.g. piperocaine containing further heterocyclic ring systems containing a six-membered ring with nitrogen as a ring hetero atom, e.g. pipamperone, anabasine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/496—Non-condensed piperazines containing further heterocyclic rings, e.g. rifampin, thiothixene
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/535—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with at least one nitrogen and one oxygen as the ring hetero atoms, e.g. 1,2-oxazines
- A61K31/5375—1,4-Oxazines, e.g. morpholine
- A61K31/5377—1,4-Oxazines, e.g. morpholine not condensed and containing further heterocyclic rings, e.g. timolol
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0019—Injectable compositions; Intramuscular, intravenous, arterial, subcutaneous administration; Compositions to be administered through the skin in an invasive manner
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/02—Drugs for skeletal disorders for joint disorders, e.g. arthritis, arthrosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07B—GENERAL METHODS OF ORGANIC CHEMISTRY; APPARATUS THEREFOR
- C07B2200/00—Indexing scheme relating to specific properties of organic compounds
- C07B2200/13—Crystalline forms, e.g. polymorphs
Description
本出願は2015年11月6日出願の米国仮出願第62/252,332号および2016年3月3日出願の米国仮出願第62/303,168号の恩典を主張するものであり、いずれもその全体が参照により本明細書に組み入れられる。
本出願は、炎症を伴う疾患または障害を処置するための方法に関する。提供される方法は、薬学的に許容される塩を含むインダゾール化合物の投与を含む。
炎症は、傷害または刺激に対する体組織の応答である。したがって、炎症は、物理的、化学的、または生物学的作用物質により引き起こされる傷害または異常刺激に応答する患部血管および隣接組織の細胞反応および化学反応の基本的で類型的な複合反応である。炎症は、通常は傷害部位において体液および血液細胞の蓄積を生じさせ、通常は治癒過程である。しかし、炎症は、通常は炎症の正常な進行が機能しないことを通じて、害を引き起こすことがある。炎症性疾患は、炎症に付随する疾患、炎症を特徴とする疾患、炎症を引き起こす疾患、炎症により生じる疾患、または炎症に影響される疾患である。
その必要がある対象において炎症性疾患または炎症性障害を処置するための組成物および方法が提供される。
ならびにそのプロドラッグおよび薬学的に許容される塩を投与する段階を含む、該対象において炎症を伴う疾患または障害を処置する方法を含む。
R1は-ヘテロアリールR3R4であり;
R2はH、-ヘテロアリールR5、-ヘテロシクリルR6、および-アリールR7からなる群より選択され;
R3はH、-ヘテロシクリルR8、-NHC(=O)R9、-NHSO2R10、-NR11R12、および-(C1〜6アルキル)NR11R12からなる群より選択されるが;
但し、R2およびR3の両方が水素であることはなく;
R4は、H、C1〜9アルキル、ハロゲン化物、-CF3、-CN、OR13、およびアミノからなる群よりそれぞれ選択される1〜3個の置換基であり;
各R5は独立して、H、C1〜9アルキル、ハロゲン化物、-CF3、-CN、OR13、-C(=O)R11、アミノ、および-(C1〜6アルキル)NR11R12からなる群よりそれぞれ選択される1〜4個の置換基であり;
各R6は独立して、H、C1〜9アルキル、ハロゲン化物、-CF3、-CN、OR13、およびアミノからなる群よりそれぞれ選択される1〜5個の置換基であり;
各R7は独立して、H、C1〜9アルキル、ハロゲン化物、-CF3、-CN、OR13、アミノ、-(C1〜6アルキル)NHSO2R11、-NR12(C1〜6アルキル)NR11R12、および-(C1〜6アルキル)NR11R12からなる群よりそれぞれ選択される1〜5個の置換基であり;
R8は、H、C1〜9アルキル、ハロゲン化物、-CF3、-CN、OR13、およびアミノからなる群よりそれぞれ選択される1〜5個の置換基であり;
R9はC1〜9アルキル、-ヘテロアリールR5、-ヘテロシクリルR6、-アリールR7、および-CH2カルボシクリルからなる群より選択され;
R10はC1〜9アルキル、-ヘテロアリールR5、-ヘテロシクリルR6、-アリールR7、および-カルボシクリルR14からなる群より選択され;
各R11は独立してC1〜6アルキルより選択され;
各R12は独立してHおよびC1〜6アルキルからなる群より選択され;
各R11およびR12は任意で連結されて5員または6員ヘテロシクリル環を形成し;
各R13は独立してHおよびC1〜6アルキルからなる群より選択され;
R14は、H、C1〜9アルキル、ハロゲン化物、-CF3、-CN、OR13、およびアミノからなる群よりそれぞれ選択される1〜5個の置換基である。
R1は-ヘテロアリールR3R4であり;
R2は-アリールR7であり;
R3は-NHC(=O)R9であり;
R4はHであり;
各R7は独立して、ハロゲン化物、-CF3、-CN、-(C1〜6アルキル)NHSO2R11、-(C1〜6アルキル)NR11R12、および-NR12(C1〜6アルキル)NR11R12からなる群よりそれぞれ選択される1〜2個の置換基であり;
R9は-(C1〜6アルキル)、-アリール、-カルボシクリル、および-CH2カルボシクリルからなる群より選択され;
各R11は独立して-(C1〜6アルキル)より選択され;
各R12は独立してHおよび-(C1〜6アルキル)からなる群より選択され;
各R11およびR12は任意で連結されて4〜6員ヘテロシクリル環を形成する。
その必要がある対象に式(I)の化合物またはその薬学的に許容される塩を投与する段階を含む、該対象において炎症を伴う疾患または障害を処置する方法:
式中、
R 1 は-ヘテロアリールR 3 R 4 であり;
R 2 はH、-ヘテロアリールR 5 、-ヘテロシクリルR 6 、および-アリールR 7 からなる群より選択され;
R 3 はH、-ヘテロシクリルR 8 、-NHC(=O)R 9 、-NHSO 2 R 10 、-NR 11 R 12 、および-(C 1〜6 アルキル)NR 11 R 12 からなる群より選択されるが;
但し、R 2 およびR 3 の両方が水素であることはなく;
R 4 は、H、C 1〜9 アルキル、ハロゲン化物、-CF 3 、-CN、OR 13 、およびアミノからなる群よりそれぞれ選択される1〜3個の置換基であり;
各R 5 は独立して、H、C 1〜9 アルキル、ハロゲン化物、-CF 3 、-CN、OR 13 、-C(=O)R 11 、アミノ、および-(C 1〜6 アルキル)NR 11 R 12 からなる群よりそれぞれ選択される1〜4個の置換基であり;
各R 6 は独立して、H、C 1〜9 アルキル、ハロゲン化物、-CF 3 、-CN、OR 13 、およびアミノからなる群よりそれぞれ選択される1〜5個の置換基であり;
各R 7 は独立して、H、C 1〜9 アルキル、ハロゲン化物、-CF 3 、-CN、OR 13 、アミノ、-(C 1〜6 アルキル)NHSO 2 R 11 、-NR 12 (C 1〜6 アルキル)NR 11 R 12 、および-(C 1〜6 アルキル)NR 11 R 12 からなる群よりそれぞれ選択される1〜5個の置換基であり;
R 8 は、H、C 1〜9 アルキル、ハロゲン化物、-CF 3 、-CN、OR 13 、およびアミノからなる群よりそれぞれ選択される1〜5個の置換基であり;
R 9 はC 1〜9 アルキル、-ヘテロアリールR 5 、-ヘテロシクリルR 6 、-アリールR 7 、および-CH 2 カルボシクリルからなる群より選択され;
R 10 はC 1〜9 アルキル、-ヘテロアリールR 5 、-ヘテロシクリルR 6 、-アリールR 7 、および-カルボシクリルR 14 からなる群より選択され;
各R 11 は独立してC 1〜6 アルキルより選択され;
各R 12 は独立してHおよびC 1〜6 アルキルからなる群より選択され;
各R 11 およびR 12 は任意で連結されて5員または6員ヘテロシクリル環を形成し;
各R 13 は独立してHおよびC 1〜6 アルキルからなる群より選択され;
R 14 は、H、C 1〜9 アルキル、ハロゲン化物、-CF 3 、-CN、OR 13 、およびアミノからなる群よりそれぞれ選択される1〜5個の置換基である。
[本発明1002]
R 1 がピリジンR 3 R 4 である、本発明1001の方法。
[本発明1003]
R 1 がピリジン-3-イルR 3 R 4 である、本発明1002の方法。
[本発明1004]
R 3 が-(C 1〜6 アルキル)NR 11 R 12 である、本発明1003の方法。
[本発明1005]
R 3 が-(C 1〜2 アルキル)NR 11 R 12 であり、R 11 が-(C 1〜2 アルキル)であり、R 12 が-(C 1〜2 アルキル)であり、R 4 がHである、本発明1004の方法。
[本発明1006]
R 11 およびR 12 が任意で連結されて5員または6員ヘテロシクリル環を形成し、R 4 がHである、本発明1004の方法。
[本発明1007]
5員または6員ヘテロシクリル環が1〜2個のフッ素で置換されている、本発明1006の方法。
[本発明1008]
R 3 が-NHC(=O)R 9 である、本発明1003の方法。
[本発明1009]
R 4 がHであり、R 9 が-(C 2〜5 アルキル)、フェニル、-カルボシクリル、および-CH 2 カルボシクリルからなる群より選択される、本発明1008の方法。
[本発明1010]
R 9 が-(C 2〜5 アルキル)である、本発明1009の方法。
[本発明1011]
R 3 が-NHSO 2 R 10 である、本発明1003の方法。
[本発明1012]
R 4 がHであり、R 10 が-(C 1〜4 アルキル)およびフェニルからなる群より選択される、本発明1011の方法。
[本発明1013]
R 3 が-ヘテロシクリルR 8 である、本発明1003の方法。
[本発明1014]
R 4 がHであり、ヘテロシクリルがモルホリン、ピペラジン、およびピペリジンからなる群より選択される、本発明1013の方法。
[本発明1015]
R 3 がHであり、R 4 がアミノである、本発明1003の方法。
[本発明1016]
R 2 が-ヘテロアリールR 5 である、本発明1003〜1015のいずれかの方法。
[本発明1017]
R 2 が-ピリジン-3-イルR 5 である、本発明1003〜1015のいずれかの方法。
[本発明1018]
R 2 が-ピリジン-3-イルR 5 であり、R 5 が1〜2個のフッ素原子である、本発明1003〜1015のいずれかの方法。
[本発明1019]
R 2 がチオフェンR 5 である、本発明1003〜1015のいずれかの方法。
[本発明1020]
R 2 が-ヘテロシクリルR 6 である、本発明1003〜1015のいずれかの方法。
[本発明1021]
R 2 が-ヘテロシクリルR 6 であり、R 6 がH、F、および-(C 1〜4 アルキル)からなる群より選択され、ヘテロシクリルがモルホリン、ピペラジン、およびピペリジンからなる群より選択される、本発明1003〜1015のいずれかの方法。
[本発明1022]
R 2 が-アリールR 7 である、本発明1003〜1015のいずれかの方法。
[本発明1023]
R 2 が-フェニルR 7 であり、R 7 が1〜2個のハロゲン化物である、本発明1022の方法。
[本発明1024]
R 7 がフルオロである、本発明1023の方法。
[本発明1025]
R 2 が-フェニルR 7 であり、R 7 が1個のフッ素原子と-NR 12 (C 1〜6 アルキル)NR 11 R 12 または-(C 1〜6 アルキル)NHSO 2 R 11 とからなる2個の置換基である、本発明1022の方法。
[本発明1026]
式(I)の化合物が以下またはその薬学的に許容される塩からなる群より選択される、本発明1001の方法:
。
[本発明1027]
式(I)の化合物が、以下またはその薬学的に許容される塩からなる群より選択される構造を有する、本発明1001の方法:
。
[本発明1028]
式(I)の化合物が、以下またはその薬学的に許容される塩からなる群より選択される構造を有する、本発明1001の方法:
。
[本発明1029]
式(I)の化合物が、以下またはその薬学的に許容される塩からなる群より選択される構造を有する、本発明1001の方法:
。
[本発明1030]
式(I)の化合物が以下またはその薬学的に許容される塩である、本発明1001の方法:
。
[本発明1031]
式(I)の化合物が多形である、本発明1030の方法。
[本発明1032]
多形が形態1である、または1重量%〜約20重量%の水を有する形態1の非化学量論的水和物である、本発明1031の方法。
[本発明1033]
炎症を伴う疾患または障害がアカラシア、尋常性ざ瘡、ツタウルシ、花粉、虫刺され、および特定の食物などの環境刺激に対するアレルギーおよびアレルギー応答、アルツハイマー病、アミロイドーシス、アンギナ、(狭心症)、強直性脊椎炎、虫垂炎、喘息、アテローム動脈硬化性心血管疾患(アテローム性動脈硬化症、ASVD)、自己免疫疾患、自己炎症性疾患、徐脈(徐脈性不整脈)、がん関連炎症、心肥大(心臓肥大)、セリアック病、慢性気管支炎、慢性閉塞性肺疾患(COPD)、慢性前立腺炎、肝硬変、大腸炎、皮膚炎(接触皮膚炎およびアトピー性皮膚炎を含む)、憩室炎、内皮細胞機能障害、エンドトキシンショック(敗血症性ショック)、線維症、糸球体腎炎、溶血性尿毒症、肝炎、HIVおよびAIDS、化膿性汗腺炎、過敏症、高血圧、炎症性腸疾患、間質性膀胱炎、内膜過形成、虚血、白血球欠損症(チェディアック・東症候群、ならびに結核、ハンセン病、サルコイドーシス、および珪肺症などの慢性肉芽腫症を含むがそれに限定されない)、局所炎症性疾患、肺炎症、ループス、片頭痛、ミオパチー、腎炎、腫瘍疾患(乳がんおよび前立腺がんなどであるがそれに限定されない上皮由来がんを非限定的に含む)、眼窩炎症性疾患、疼痛、膵炎、骨盤内炎症性疾患、多発性筋炎、感染後炎症、プリンツメタル狭心症(異型狭心症)、乾癬、肺高血圧症、レイノー病/レイノー現象、ライター症候群、腎不全、再灌流傷害、リウマチ熱、関節リウマチ、サルコイドーシス、強皮症、シェーグレン症候群、平滑筋細胞腫瘍および転移(平滑筋腫を含む)、平滑筋攣縮、狭窄、脳卒中、血栓性疾患、妊娠中毒症、移植拒絶反応、潰瘍、血管炎、ならびに脈管障害からなる群より選択される、本発明1001〜1032のいずれかの方法。
[本発明1034]
炎症を伴う疾患または障害がツタウルシ皮膚炎(poison ivy)、アルツハイマー病、強直性脊椎炎、自己免疫疾患、自己炎症性疾患、がん関連炎症、慢性閉塞性肺疾患(COPD)、大腸炎、皮膚炎(接触皮膚炎およびアトピー性皮膚炎を含む)、糖尿病、憩室炎、エンドトキシンショック(敗血症性ショック)、線維症、化膿性汗腺炎、炎症性腸疾患、クローン病、内膜過形成、局所炎症性疾患、ループス、モルフェア、眼窩炎症性疾患、特発性眼窩炎症性疾患、骨盤内炎症性疾患、乾癬、レイノー病/レイノー現象、関節リウマチ、変形性関節症、強皮症、シェーグレン症候群、腱障害、移植拒絶反応、潰瘍、血管炎、ならびに脈管障害からなる群より選択される、本発明1001〜1033のいずれかの方法。
[本発明1035]
式(I)の化合物の投与が、対象において炎症に関連するバイオマーカーの量の減少を生じさせる、本発明1001〜1034のいずれかの方法。
[本発明1036]
バイオマーカーが炎症性サイトカインである、本発明1035の方法。
[本発明1037]
炎症性サイトカインがIL-1α、IL-1β、IL-2、IL-4、IL-5、IL-6、IL-7、IL-8、IL-10、IL-12/IL23p40、IL-13、IL-15、IL-16、IL-17A、IL-17F、IL-21、IL-23、TNFα、TNF-β、IFN-γ、CXCL1、CD38、CD40、CD69、IgG、IP-10、L-17A、MCP-1、PGE2、sIL-2、およびsIL-6からなる群より選択される、本発明1036の方法。
[本発明1038]
対象に式(I)の化合物またはその薬学的に許容される塩を投与する段階を含む、該対象において炎症性疾患または炎症性障害に関連するバイオマーカーの量を減少させる方法:
式中、
R 1 は-ヘテロアリールR 3 R 4 であり;
R 2 はH、-ヘテロアリールR 5 、-ヘテロシクリルR 6 、および-アリールR 7 からなる群より選択され;
R 3 はH、-ヘテロシクリルR 8 、-NHC(=O)R 9 、-NHSO 2 R 10 、-NR 11 R 12 、および-(C 1〜6 アルキル)NR 11 R 12 からなる群より選択されるが;
但し、R 2 およびR 3 の両方が水素であることはなく;
R 4 は、H、C 1〜9 アルキル、ハロゲン化物、-CF 3 、-CN、OR 13 、およびアミノからなる群よりそれぞれ選択される1〜3個の置換基であり;
各R 5 は独立して、H、C 1〜9 アルキル、ハロゲン化物、-CF 3 、-CN、OR 13 、-C(=O)R 11 、アミノ、および-(C 1〜6 アルキル)NR 11 R 12 からなる群よりそれぞれ選択される1〜4個の置換基であり;
各R 6 は独立して、H、C 1〜9 アルキル、ハロゲン化物、-CF 3 、-CN、OR 13 、およびアミノからなる群よりそれぞれ選択される1〜5個の置換基であり;
各R 7 は独立して、H、C 1〜9 アルキル、ハロゲン化物、-CF 3 、-CN、OR 13 、アミノ、-(C 1〜6 アルキル)NHSO 2 R 11 、-NR 12 (C 1〜6 アルキル)NR 11 R 12 、および-(C 1〜6 アルキル)NR 11 R 12 からなる群よりそれぞれ選択される1〜5個の置換基であり;
R 8 は、H、C 1〜9 アルキル、ハロゲン化物、-CF 3 、-CN、OR 13 、およびアミノからなる群よりそれぞれ選択される1〜5個の置換基であり;
R 9 はC 1〜9 アルキル、-ヘテロアリールR 5 、-ヘテロシクリルR 6 、-アリールR 7 、および-CH 2 カルボシクリルからなる群より選択され;
R 10 はC 1〜9 アルキル、-ヘテロアリールR 5 、-ヘテロシクリルR 6 、-アリールR 7 、および-カルボシクリルR 14 からなる群より選択され;
各R 11 は独立してC 1〜6 アルキルより選択され;
各R 12 は独立してHおよびC 1〜6 アルキルからなる群より選択され;
各R 11 およびR 12 は任意で連結されて5員または6員ヘテロシクリル環を形成し;
各R 13 は独立してHおよびC 1〜6 アルキルからなる群より選択され;
R 14 は、H、C 1〜9 アルキル、ハロゲン化物、-CF 3 、-CN、OR 13 、およびアミノからなる群よりそれぞれ選択される1〜5個の置換基である。
[本発明1039]
R 1 がピリジンR 3 R 4 である、本発明1038の方法。
[本発明1040]
R 1 がピリジン-3-イルR 3 R 4 である、本発明1039の方法。
[本発明1041]
R 3 が-(C 1〜6 アルキル)NR 11 R 12 である、本発明1040の方法。
[本発明1042]
R 3 が-(C 1〜2 アルキル)NR 11 R 12 であり、R 11 が-(C 1〜2 アルキル)であり、R 12 が-(C 1〜2 アルキル)であり、R 4 がHである、本発明1041の方法。
[本発明1043]
R 11 およびR 12 が任意で連結されて5員または6員ヘテロシクリル環を形成し、R 4 がHである、本発明1041の方法。
[本発明1044]
5員または6員ヘテロシクリル環が1〜2個のフッ素で置換されている、本発明1043の方法。
[本発明1045]
R 3 が-NHC(=O)R 9 である、本発明1040の方法。
[本発明1046]
R 4 がHであり、R 9 が-(C 2〜5 アルキル)、フェニル、-カルボシクリル、および-CH 2 カルボシクリルからなる群より選択される、本発明1045の方法。
[本発明1047]
R 9 が-(C 2〜5 アルキル)である、本発明1046の方法。
[本発明1048]
R 3 が-NHSO 2 R 10 である、本発明1040の方法。
[本発明1049]
R 4 がHであり、R 10 が-(C 1〜4 アルキル)およびフェニルからなる群より選択される、本発明1048の方法。
[本発明1050]
R 3 が-ヘテロシクリルR 8 である、本発明1040の方法。
[本発明1051]
R 4 がHであり、ヘテロシクリルがモルホリン、ピペラジン、およびピペリジンからなる群より選択される、本発明1050の方法。
[本発明1052]
R 3 がHであり、R 4 がアミノである、本発明1040の方法。
[本発明1053]
R 2 が-ヘテロアリールR 5 である、本発明1040〜1052のいずれかの方法。
[本発明1054]
R 2 が-ピリジン-3-イルR 5 である、本発明1040〜1052のいずれかの方法。
[本発明1055]
R 2 が-ピリジン-3-イルR 5 であり、R 5 が1〜2個のフッ素原子である、本発明1040〜1052のいずれかの方法。
[本発明1056]
R 2 がチオフェンR 5 である、本発明1040〜1052のいずれかの方法。
[本発明1057]
R 2 が-ヘテロシクリルR 6 である、本発明1040〜1052のいずれかの方法。
[本発明1058]
R 2 が-ヘテロシクリルR 6 であり、R 6 がH、F、および-(C 1〜4 アルキル)からなる群より選択され、ヘテロシクリルがモルホリン、ピペラジン、およびピペリジンからなる群より選択される、本発明1040〜1052のいずれかの方法。
[本発明1059]
R 2 が-アリールR 7 である、本発明1040〜1052のいずれかの方法。
[本発明1060]
R 2 が-フェニルR 7 であり、R 7 が1〜2個のハロゲン化物である、本発明1059の方法。
[本発明1061]
R 7 がフルオロである、本発明1060の方法。
[本発明1062]
R 2 が-フェニルR 7 であり、R 7 が1個のフッ素原子と-NR 12 (C 1〜6 アルキル)NR 11 R 12 または-(C 1〜6 アルキル)NHSO 2 R 11 とからなる2個の置換基である、本発明1059の方法。
[本発明1063]
式(I)の化合物が、以下またはその薬学的に許容される塩からなる群より選択される構造を有する、本発明1038の方法:
。
[本発明1064]
式(I)の化合物が以下またはその薬学的に許容される塩である、本発明1038の方法:
。
[本発明1065]
式(I)の化合物が多形である、本発明1064の方法。
[本発明1066]
多形が形態1または水和形態1である、本発明1065の方法。
[本発明1067]
バイオマーカーが炎症性サイトカインである、本発明1038〜1066のいずれかの方法。
[本発明1068]
炎症性サイトカインがIL-1α、IL-1β、IL-2、IL-4、IL-5、IL-6、IL-7、IL-8、IL-10、IL-12/IL23p40、IL-13、IL-15、IL-16、IL-17A、IL-17F、IL-21、IL-23、TNFα、TNF-β、IFN-γ、CXCL1、CD38、CD40、CD69、IgG、IP-10、L-17A、MCP-1、PGE2、sIL-2、およびsIL-6からなる群より選択される、本発明1067の方法。
[本発明1069]
バイオマーカーの量が対象中で約10%〜約100%の量減少する、本発明1038〜1068のいずれかの方法。
[本発明1070]
炎症性疾患または炎症性障害がアカラシア、尋常性ざ瘡、ツタウルシ、花粉、虫刺され、および特定の食物などの環境刺激に対するアレルギーおよびアレルギー応答、アルツハイマー病、アミロイドーシス、アンギナ、(狭心症)、強直性脊椎炎、虫垂炎、喘息、アテローム動脈硬化性心血管疾患(アテローム性動脈硬化症、ASVD)、自己免疫疾患、自己炎症性疾患、徐脈(徐脈性不整脈)、がん関連炎症、心肥大(心臓肥大)、セリアック病、慢性気管支炎、慢性閉塞性肺疾患(COPD)、慢性前立腺炎、肝硬変、大腸炎、皮膚炎(接触皮膚炎およびアトピー性皮膚炎を含む)、憩室炎、内皮細胞機能障害、エンドトキシンショック(敗血症性ショック)、線維症、糸球体腎炎、溶血性尿毒症、肝炎、HIVおよびAIDS、化膿性汗腺炎、過敏症、高血圧、炎症性腸疾患、間質性膀胱炎、内膜過形成、虚血、白血球欠損症(チェディアック・東症候群、ならびに結核、ハンセン病、サルコイドーシス、および珪肺症などの慢性肉芽腫症を含むがそれに限定されない)、局所炎症性疾患、肺炎症、ループス、片頭痛、ミオパチー、腎炎、腫瘍疾患(乳がんおよび前立腺がんなどであるがそれに限定されない上皮由来がんを非限定的に含む)、眼窩炎症性疾患、疼痛、膵炎、骨盤内炎症性疾患、多発性筋炎、感染後炎症、プリンツメタル狭心症(異型狭心症)、乾癬、肺高血圧症、レイノー病/レイノー現象、ライター症候群、腎不全、再灌流傷害、リウマチ熱、関節リウマチ、サルコイドーシス、強皮症、シェーグレン症候群、平滑筋細胞腫瘍および転移(平滑筋腫を含む)、平滑筋攣縮、狭窄、脳卒中、血栓性疾患、妊娠中毒症、移植拒絶反応、潰瘍、血管炎、ならびに脈管障害からなる群より選択される、本発明1038〜1069のいずれかの方法。
[本発明1071]
炎症性疾患または炎症性障害がツタウルシ皮膚炎、アルツハイマー病、強直性脊椎炎、自己免疫疾患、自己炎症性疾患、がん関連炎症、慢性閉塞性肺疾患(COPD)、大腸炎、皮膚炎(接触皮膚炎およびアトピー性皮膚炎を含む)、糖尿病、憩室炎、エンドトキシンショック(敗血症性ショック)、線維症、化膿性汗腺炎、炎症性腸疾患、クローン病、内膜過形成、局所炎症性疾患、ループス、モルフェア、眼窩炎症性疾患、特発性眼窩炎症性疾患、骨盤内炎症性疾患、乾癬、レイノー病/レイノー現象、関節リウマチ、変形性関節症、強皮症、シェーグレン症候群、腱障害、移植拒絶反応、潰瘍、血管炎、ならびに脈管障害からなる群より選択される、本発明1038〜1070のいずれかの方法。
前述の一般的説明および以下の詳細な説明がいずれも例示的および説明的なものでしかなく、特許請求される本発明を限定するものではないということを理解すべきである。
1. 定義
別途定義がない限り、本明細書において使用されるすべての技術用語および科学用語は、本開示が属する技術分野の当業者が通常理解するものと同一の意味を有する。すべての特許、出願、出願公開、および他の刊行物は、その全体が参照により組み入れられる。本明細書における用語について複数の定義が存在する場合には、別途記載のない限り本節の定義が優先する。
本明細書に記載の化合物および組成物は、炎症を伴う疾患または障害を処置するために使用可能である。いくつかの態様では、本明細書に記載の化合物および組成物は抗炎症剤として作用する。いくつかの態様では、本化合物は1つまたは複数の炎症性サイトカインの阻害剤として使用可能である。いくつかの態様では、炎症性サイトカインはIL-1α、IL-1β、IL-2、IL-4、IL-5、IL-6、IL-7、IL-8、IL-10、IL-12/IL23p40、IL-13、IL-15、IL-16、IL-17A、IL-17F、IL-21、IL-23、TNFα、TNF-β、IFN-γ、CXCL1、CD38、CD40、CD69、IgG、IP-10、L-17A、MCP-1、PGE2、sIL-2、およびsIL-6からなる群より選択される。
治療有効量の式(I)の化合物またはその薬学的に許容される塩と、薬学的に許容される担体とを含む、本明細書に記載の方法における使用のための薬学的組成物が提供される。いくつかの態様では、式(I)の化合物は化合物10である。いくつかの態様では、式(I)の化合物は化合物10の多形形態である。
炎症を伴う疾患または障害を処置するための方法が提供される。本方法は、それを必要とする患者に、治療有効量の式(I)の化合物またはその薬学的に許容される塩と、薬学的に許容される担体とを投与する段階を含む。いくつかの態様では、本方法は、動物の炎症性疾患または炎症性障害を処置するために有効である。いくつかの態様では、本方法は、哺乳動物の炎症性疾患または炎症性障害を処置するために有効である。いくつかの態様では、哺乳動物はヒトである。
本明細書に記載され、かつ提供される方法において使用される、化合物の生物活性を、当業者に公知である任意の好適なアッセイを使用して試験することができる。例えば、いずれも参照によりその全体が組み入れられる国際公開公報第2001/053268号および国際公開公報第2005/009997号、ならびに以下の実施例を参照。
式(I)の化合物に対して、溶解度、多形性、および熱力学的安定性を決定するために多形スクリーニングを行った。
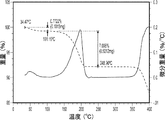
式(I)の出発固体化合物のX線粉末回折(XRD)、示差走査熱量測定(DSC)、および熱重量分析(TGA)走査図は、出発固体が結晶性材料であり、形態Iと1重量%〜約20重量%の水を有する形態1の非化学量論的水和物との混合物であることを示した。DSC走査図(図12B)によれば、固体は50℃〜100℃での広い吸熱を示し、284℃での鋭い発熱も示し、固体は最終的に364℃で融解した。TGA走査図(図12C)によれば、100℃の前に1.4%の重量減少が観察された。
形態1を生成した実験を以下の表5に示す。一般に、形態1は形態13または形態12の乾燥により得られた。形態1は脱水水和物と見なされうる。多くの二元溶媒(5%の水を有する)中での再スラリー化により形態1が生成された。残留固体の純度は98.9%であった。形態1(1つの試料)固体のKFは5.8%、形態1固体の残留MeOHは0.01%であった。完全乾燥形態1固体のTGA走査を行った(図1C)。100℃の前に0.33%の重量減少が観察された。
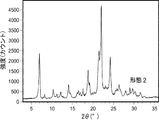
形態2、2*、および2**を生成した実験を以下の表7に示す。形態2、2*、および2**のXRD走査を行った(図2A、図2D、および図2Gはそれぞれ形態2、2*、および2**のXRD走査図を示す)。形態2および2*のXRDピークをそれぞれ以下の表8および表9に示す。DSC走査も行った(図2B、図2E、および図2Hはそれぞれ形態2、2*、および2**のDSC走査図を示す)。DSC走査図によれば、形態2、2*、および2**はそれぞれ、50℃〜100℃での広い吸熱、ならびに363℃で融解する前の複数の吸熱および発熱を示した。100℃の前での広い吸熱は、固体に水/溶媒が含まれることが理由でありうる。形態2はアセトニトリルから得られ、形態2*はエタノールから得られ、形態2**はn-プロパノール/5%水から得られた。
形態3を生成した実験を以下の表10に示す。形態3のXRDおよびDSC走査図を取得した(それぞれ図3Aおよび図3B)。以下の表11は形態3のXRDピークを示す。形態3のDSC走査図から複数の発熱および吸熱が観察された。
形態4、4*、および4**を生成した実験を以下の表12に示す。形態4、4*、および4**のXRDを取得した(それぞれ図4A、図4D、および図4G)。以下の表13および表14はそれぞれ形態4および形態4*のXRDピークを示す。形態4、4*、および4**のDSC走査も行った(それぞれ図4B、図4E、および図4H)。DSC走査図によれば、形態4は50℃〜100℃で広い吸熱を、続いて複数の吸熱/発熱を示し、次に約367℃で融解した。形態4*および4**は形態4と同様のDSCパターンを示した。
形態5および5*を生成した実験を以下の表15に示す。形態5および5*のXRD走査図を取得した(それぞれ図5Aおよび図5D)。形態5のXRDピークを以下の表16に示す。形態5のDSC走査も行い、走査図は50℃〜100℃での広い吸熱、ならびに363℃で融解する前の複数の吸熱および発熱を示した(図5B)。
形態6を生成した実験を以下の表17に示す。形態6のXRDおよびDSC走査図を取得した(それぞれ図6Aおよび図6B)。DSC走査図によれば、固体は250℃で小さな発熱を、358℃で鋭い融解吸熱を示した。
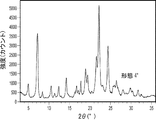
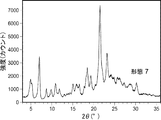
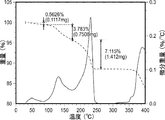
形態7を生成した実験を以下の表18に示す。形態7のXRDおよびDSC走査図を取得した(それぞれ図7Aおよび図7B)。形態7のXRDピークを以下の表19に示す。DSC走査図によれば、固体は227℃および299℃で2つの発熱を、続いて365℃で融解吸熱を示した。形態7はXRD上で低い結晶化度を示した。DSC走査図上での二重発熱は、XRD走査図上で観察された低い結晶化度と関連している可能性がある。
形態8を生成した実験を以下の表20に示す。形態8のXRDおよびDSC走査図を取得した(それぞれ図8Aおよび図8B)。形態8のXRDピークを以下の表21に示す。DSC走査図によれば、固体は205℃および231℃で2つの吸熱を、続いて279℃で発熱を、続いて362℃で融解吸熱を示した。形態8はXRD走査図上で低い結晶化度を示した。DSC走査図上での二重発熱によって、XRD上で見られた低い結晶化度が確認される可能性がある(低結晶化度の材料はより高結晶化度の固体に変換される)。
形態9を生成した実験を以下の表22に示す。形態9のXRDおよびDSC走査図を取得した(それぞれ図9Aおよび図9B)。形態9のXRDピークを以下の表23に示す。DSC走査図によれば、固体は364℃で単一の融解吸熱を示した。
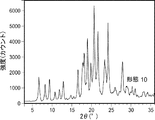
形態10および10*を生成した実験を以下の表24に示す。形態10および10*のXRD走査図を取得した(それぞれ図10Aおよび図10D)。形態10のXRDピークを以下の表25に示す。形態10および10*のDSC走査図も取得し、走査図は複数の吸熱/発熱を、続いて367℃での融解を示した(それぞれ図10Bおよび図10E)。
形態11および11*を生成した実験を以下の表26に示す。形態11および11*のXRD走査図を取得した(それぞれ図11Aおよび図11D)。形態11および形態11*のXRDピークをそれぞれ以下の表27および表28に示す。形態11および11*のDSC走査図も取得した(それぞれ図11Bおよび図11E)。DSC走査図によれば、固体は複数の吸熱/発熱を示し、最終的に368℃で融解した。両形態のXRDにおいて非晶質ハローが観察された。また、両形態のDSC上での二重発熱は、XRD走査図上で観察された非晶質ハローと関連している可能性がある。
形態13および形態12を生成した実験をそれぞれ以下の表29および表31に示す。形態12および13は、1重量%〜約20重量%の水を有する形態1の非化学量論的水和物の例である。形態13および形態12のXRD走査図を取得した(それぞれ図13Aおよび図12A)。形態13のXRDピークを以下の表30に示す。形態13および形態12のDSC走査図も取得した(それぞれ図13Bおよび図12B)。DSC走査図によれば、形態13固体は50℃〜100℃で広い吸熱を、続いて278℃で小さな発熱を、363℃で融解吸熱を示した。DSC走査図によれば、形態12固体は50℃〜100℃で広い吸熱を、続いて283℃で鋭い発熱を、364℃で融解吸熱を示した。
溶媒和物1、2、および3を生成した実験を以下の表32に示す。溶媒和物1および2の固体を空気に終夜曝露した後、XRDで分析した。分析後、固体を50℃で減圧乾燥させ、次にXRDで再度分析した。
異なる形態の間での熱力学的安定性を解明するために、いくつかの競合的スラリー化実験を行った。形態1、形態2、形態2*、形態3、形態4、形態4*、形態4**、形態5、形態7、形態8、形態9、形態10、形態11、形態11*、および形態13(各10mg)を溶媒2mL中、室温および50℃の両方で混合およびスラリー化した。固体を3〜5日間スラリー化した後、XRDで分析した。分析データによれば、形態2*が、MeOH系、EtOH系、およびアセトン系中、室温および50℃の両方で最も安定な形態であった。形態4または4*が、EA中、室温および50℃で最も安定であった。形態13が、水中、室温および50℃で最も安定であった。表33は、競合的スラリー化実験によるXRD走査結果を示す。
A. 血漿中濃度および血中最終排出半減期
1. ラットにおける放射標識化合物10の単回関節内(IA)注射後の血漿中濃度
Sprague Dawley(SD)ラットにおける単回関節内注射後の化合物10の血漿中濃度および血漿中分布を、トリチウム標識(3H)化合物10による放射標識および物質収支試験において調査した。[3H]-化合物10を、関節内(IA)注射用の0.5%カルボキシメチルセルロース/0.05%ポリソルベート80中懸濁液剤として製剤化し、非標識化合物10で適切な濃度に希釈し、1μg/膝に等しい用量レベルでラット膝関節に注射した。単回関節内注射後、LCMS法の感受性(LLOQ 0.1ng/mL)よりも50倍高い2pg/gまたはpg/mLという感受性を示す定量的放射化学分析(QRA)によって、ラット血漿中で、経時的(48〜168時間)に低下する低い循環血漿レベル(0.002〜0.075ng-当量/g)が検出された。平均放射能曝露量は低く、0.832〜1.548ng-当量・h/g(AUC(0-t)およびAUC(0-inf.))(雄)ならびに1.040〜1.818ng-当量・h/g(AUC(0-t)およびAUC(0-inf.))(雌)の範囲であり、Tmax値は1〜4時間であり、見かけの血中最終排出半減期は57時間および124時間(それぞれ雄および雌)であった。
トリチウムで放射標識された化合物10を含む上記懸濁液剤の1μg/膝の2箇所の単回関節内注射を、SDラットの両膝関節において行った。低い循環血漿放射能(0.010〜0.055ng-当量/g)が検出され、2箇所の(両側性の)関節内注射後に単回関節内注射(上記参照)に比べて用量比例的に増加し、48〜168時間で明らかに指数関数的に低下した。
1. ラットにおける定量的全身オートラジオグラフィー
SDラットにおける1μg/膝での2箇所の関節内注射後、定量的全身オートラジオグラフィー(QWBA)は、総放射能の約75%が胴体全体、糞便、尿、およびケージ洗浄器から回収されたことを示し、オートラジオグラフィー画像は、関節内注射の1時間〜168時間後の時点で、放射能がリンパ節(後肢からリンパを排出する鼠径リンパ節および腰部リンパ節)、小腸および大腸、ならびに糞便に限局され、主要臓器中では無視できる/検出不可能であることを示した。
排泄に関しては、排泄された放射能の95%が糞便中で回収され、尿中で回収されたのはわずか5%であった。QWBAのX線画像、ならびに糞便中の放射能の定量化、および尿中での大幅に低い回収率は、[3H]-化合物10が、腰部および鼠径のリンパ管およびリンパ節でのリンパ排出によって、かつ、緩徐に代謝される生体異物の主要な除去経路である緩徐で受動的な糞便排泄と一致した機序で小腸および大腸ならびに盲腸を通じて、除去されるという仮説を裏づけている。この過程中に、放射標識[3H]-化合物10は分解され、糞便中では親物質の約1.5%しか検出されなかった。
1. ウサギ膝関節
ウサギでは、4μg/膝(中間臨床量70μg/膝に対応)での両膝における2箇所の単回関節内注射の後で、投与された放射能の75%が1時間〜168時間後に膝において回収された。これはSDラット膝関節における回収率と一致している。ウサギ膝関節ミクロオートラジオグラフィーは、関節内注射後に放射能が、体液で満たされた滑液腔および滑液包に限局され、半月板ならびに大腿骨頭部および脛骨頭部を包囲したことを示した。
SDラットにおける1μg/膝での2箇所の関節内注射の後、後肢を切除し、関節内注射後の異なる時点、すなわち1時間、4時間、12時間、24時間、48時間、96時間、および168時間の時点での膝関節全体中での放射標識[3H]-化合物10の定量化用に可溶化した。これらの同じ動物をQWBA実験(上記)に使用した。膝関節回収率は、関節内注射の1時間後直ちに〜168時間(1週間)後に、投与された放射能の約60〜85%が各膝関節中で回収されたことを示した。1時間〜168時間において得られた値が変動したのは、QWBAに同じ動物を使用したこと、および可溶化のために動物全身から膝を不完全に切除したことが理由であったが、概して上記のウサギ膝関節中での回収値と一致している(上記参照)。
SDラットの膝関節中での[3H]-化合物10の半減期(T1/2)を、14日目〜180日目にラット後肢(膝関節)中で回収された放射能の値を使用して計算した: 消失速度定数Ke 0.01342でT1/2 = 51.64日(14日目〜180日目のすべての時点を含む)、および消失速度定数Ke 0.00687でT1/2 = 100.9日(14日目〜90日目の時点のみ、但し180日目を除外する)。
以下のアッセイ手順を使用して式(I)の代表的化合物をスクリーニングすることで、IL-6を阻害するそれらの能力を決定し、それによりそれらの抗炎症特性を実証した。
ヒト単球細胞株(THP-1細胞; カタログ番号TIB-202、バージニア州マナサス、ATCC)を、100単位/mLペニシリン、50μg/mLストレプトマイシン、2-メルカプトエタノール(0.05mM)[基本培地]、および10%ウシ胎仔血清(カタログ番号16140089、カリフォルニア州カールスバッド、Life Technologies)を補充した、1% L-グルタミン、1% HEPES、1%ピルビン酸ナトリウム、2%炭酸水素ナトリウム入りのRoswell Park Memorial Institute(RPMI)1640培地(カタログ番号21870-100、ニューヨーク州バッファロー)中、37℃および5% CO2で培養した。
アッセイの開始前に、THP-1細胞を1% FBS入りの基本培地中で24時間培養した。式(I)の各化合物をDMSOに10mMストックとして溶解させて、化合物源プレートを用意するために使用した。段階希釈(1:3、10μMから開始する10点用量反応曲線)および化合物移動を、ECHO 550(カリフォルニア州サニーベール、Labcyte)を使用して、384ウェル白色少量アッセイプレート(Greiner Bio-One)中へ、最終DMSO濃度0.1%に向けて適切にDMSOをバックフィルしながら行った。THP-1細胞を384ウェルプレートに細胞5000個/ウェルでプレーティングし、37℃で2時間インキュベートした。2時間後、LPS 500ng/mLを加え、細胞を37℃でさらに22時間インキュベートした。プレートを遠心分離機中、10,000rpmで1分間回転させ、再構成緩衝液(Cisbio Inc.)中に希釈された抗IL-6 XL665および抗IL-6クリプテートの混合物を各ウェルに加えた。室温で3時間のインキュベーション後、Envision(Perkin Elmer)を665nmおよび620nMで使用して均一時間分解蛍光(HTRF)を測定した。665nm対620nmの蛍光比をIL-6定量化のための読取値として使用した。すべての試料を二つ組で処理した。読取値をDMSO処理細胞に対して正規化し、正規化された活性を、GraphPad Prism 5.0(またはDotmatics)において利用可能な用量反応ロジスティック(阻害剤)対応答可変勾配(4パラメータ)非線形回帰特徴を使用するEC50計算に利用した。EC50 10μM超では、10μMでの阻害パーセントを示す。
A.滑膜線維芽細胞の産生
滑膜線維芽細胞(SW982細胞; ATCC)を10% FBS入りのLeibovitz L-15培地(ATCC)中にて37℃および0% CO2で培養した。アッセイ開始の24時間前に、培地を1% FBS入りのLeibovitz L-15培地に変更した。化合物10をDMSOに10mMストックとして溶解させて、化合物源プレートを用意するために使用した。段階希釈(8点用量反応)および化合物移動を、ECHO 550(カリフォルニア州サニーベール、Labcyte)を使用して、96ウェル透明底アッセイプレート(Greiner Bio-One)中へ、最終DMSO濃度0.05%に向けて適切にDMSOをバックフィルしながら行った。滑膜線維芽細胞を細胞2x10e4個/ウェルでプレーティングし、IL1β(20ng/ml)で刺激し、37℃で48時間インキュベートした。プレートを遠心分離機中、10,000rpmで1分間回転させ、上清をELISA用に収集した。
アッセイ培地を使用して、上清をTNFαアッセイ用に1:1に希釈し、IL6アッセイ用に1:4に希釈した。ヒトTNF-α ELISA MAX(商標)Deluxe(カタログ番号430204、カリフォルニア州サンジエゴ、Biolegend)およびヒトIL-6 ELISA MAX(商標)Deluxe(カタログ番号430504、カリフォルニア州サンジエゴ、Biolegend)キットを使用してELISAを行った。簡潔にいえば、96ウェルプレートを適切な捕捉抗体で終夜コーティングし、洗浄して過剰な抗体を除去した。ブロッキング緩衝液を加え、1時間インキュベートして非特異的結合を防止した。希釈上清をコーティングプレート中、室温で2時間インキュベートした。洗浄して未結合タンパク質を除去した後、ビオチン化検出抗体を加え、室温で30分間インキュベートし、続いて洗浄して過剰な未結合抗体を除去した。次にアビジン-HRPを加え、室温で30分間インキュベートした。数回洗浄して未結合アビジンHRPを除去した後、TMB基質を加え、プレートをCytation 3プレートリーダー(バーモント州ウィヌースキー、Biotek Inc.)上にて吸光度450nmで読み取り、570nmで補正した。すべての試料を三つ組で処理した。阻害プロファイルおよびEC50をPrism 5(米国カリフォルニア州ラホヤ、GraphPad Software Inc)を使用して計算した。図14Aおよび図14Bを参照。
滑膜線維芽細胞を6ウェルプレート中にて1% FBS入りのLeibovitz L-15培地中、ウェル当たり細胞50万個でプレーティングした。DMSOに溶解した化合物10を異なる濃度でウェルに加えた。37℃で2時間のインキュベーション後、細胞をIL1β(20ng/ml)で刺激し、37℃で24時間インキュベートした。細胞をトリプシン処理により収集し、ペレット化し、PBSで洗浄し、全RNAをRNeasy Miniキット(Qiagen)を使用して単離した。cDNAをQuantiTect逆転写キット(Qiagen)を使用して合成した。qRT-PCRを、CFX384(Biorad)を使用してQuantiTect SYBR Green PCRキット(Qiagen)および遺伝子特異的プライマーによって行った。転写物を比較Ct法により定量化し、内在性対照、β-アクチン、およびGAPDHに対して正規化した。阻害プロファイルを図14Aおよび図14Bに示す。
健康なヒトドナーから新たに単離された初代末梢血単核球(PBMC)をAllCells Inc.から得て、直ちにアッセイに使用した。化合物10をDMSOに10mMストックとして溶解させて、化合物源プレートを用意するために使用した。段階希釈(8点用量反応)および化合物移動を、ECHO 550(カリフォルニア州サニーベール、Labcyte)を使用して、96ウェル透明底アッセイプレート(Greiner Bio-One)中へ、最終DMSO濃度0.05%に向けて適切にDMSOをバックフィルしながら行った。PBMCを、100単位/mLペニシリン、50μg/mLストレプトマイシン、および1%ウシ胎仔血清(カタログ番号16140089、カリフォルニア州カールスバッド、Life Technologies)を補充した、1% L-グルタミン、1% HEPES、1%ピルビン酸ナトリウム、2%炭酸水素ナトリウム入りのRoswell Park Memorial Institute(RPMI)1640培地(カタログ番号21870-100、ニューヨーク州バッファロー)に細胞2x10e5個/ウェルでプレーティングした。2時間のインキュベーション後、LPS 500ng/mLをウェルに加えてサイトカイン産生を誘導し、細胞をさらに37℃で20時間インキュベートした。プレートを遠心分離機中、10,000rpmで1分間回転させ、上清をELISA用に収集した。
Claims (4)
- 式(I)の化合物:
またはその薬学的に許容される塩を含む、対象における変形性関節症に伴う炎症を処置するための薬学的組成物であって、
該式(I)の化合物は、1重量%〜20重量%の水を有し、かつ°2θ値6.8±0.2、12.4±0.2、および18.5±0.2にピークを含むX線粉末回折パターンを有する多形形態1の非化学量論的水和物として、および°2θ値4.9±0.2、18.6±0.2、および21.1±0.2にピークを含むX線粉末回折パターンを有する多形形態9として存在しており、
該組成物中の該式(I)の化合物の少なくとも50重量%が形態1であり、
形態9の量が、該組成物中の該式(I)の化合物の量の5重量%未満である、
薬学的組成物。 - 式(I)の化合物の投与が、対象において炎症に関連するバイオマーカーの量の減少を生じさせる、請求項1項記載の薬学的組成物。
- バイオマーカーが炎症性サイトカインである、請求項2記載の薬学的組成物。
- 炎症性サイトカインがIL-1α、IL-1β、IL-2、IL-4、IL-5、IL-6、IL-7、IL-8、IL-10、IL-12/IL23p40、IL-13、IL-15、IL-16、IL-17A、IL-17F、IL-21、IL-23、TNFα、TNF-β、IFN-γ、CXCL1、CD38、CD40、CD69、IgG、IP-10、L-17A、MCP-1、PGE2、sIL-2、およびsIL-6からなる群より選択される、請求項3記載の薬学的組成物。
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201562252332P | 2015-11-06 | 2015-11-06 | |
| US62/252,332 | 2015-11-06 | ||
| US201662303168P | 2016-03-03 | 2016-03-03 | |
| US62/303,168 | 2016-03-03 | ||
| PCT/US2016/060856 WO2017079759A1 (en) | 2015-11-06 | 2016-11-07 | 2-(1h-indazol-3-yl)-3h-imidazo[4,5-c]pyridines and their anti-inflammatory uses thereof |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2018538258A JP2018538258A (ja) | 2018-12-27 |
| JP2018538258A5 JP2018538258A5 (ja) | 2019-12-19 |
| JP6982748B2 true JP6982748B2 (ja) | 2021-12-17 |
Family
ID=58662851
Family Applications (3)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2018522974A Active JP6982747B2 (ja) | 2015-11-06 | 2016-11-07 | 変形性関節症の処置 |
| JP2018523022A Active JP6982748B2 (ja) | 2015-11-06 | 2016-11-07 | 2−(1H−インダゾール−3−イル)−3H−イミダゾ[4,5−c]ピリジンおよびそれらの抗炎症的使用 |
| JP2021172952A Pending JP2022009400A (ja) | 2015-11-06 | 2021-10-22 | 変形性関節症の処置 |
Family Applications Before (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2018522974A Active JP6982747B2 (ja) | 2015-11-06 | 2016-11-07 | 変形性関節症の処置 |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2021172952A Pending JP2022009400A (ja) | 2015-11-06 | 2021-10-22 | 変形性関節症の処置 |
Country Status (15)
| Country | Link |
|---|---|
| US (5) | US10899757B2 (ja) |
| EP (2) | EP3370721A4 (ja) |
| JP (3) | JP6982747B2 (ja) |
| KR (2) | KR20180080288A (ja) |
| CN (2) | CN108472290A (ja) |
| AU (1) | AU2016348639B2 (ja) |
| BR (1) | BR112018009252A2 (ja) |
| CA (2) | CA3004297A1 (ja) |
| CL (1) | CL2018001230A1 (ja) |
| IL (1) | IL259110A (ja) |
| MX (2) | MX2018005696A (ja) |
| NZ (1) | NZ742200A (ja) |
| PH (1) | PH12018500981A1 (ja) |
| RU (1) | RU2018120728A (ja) |
| WO (2) | WO2017079759A1 (ja) |
Families Citing this family (40)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| AU2012308570B2 (en) | 2011-09-14 | 2016-11-10 | Samumed, Llc | Indazole-3-carboxamides and their use as Wnt/b-catenin signaling pathway inhibitors |
| PH12017500997A1 (en) | 2012-04-04 | 2018-02-19 | Samumed Llc | Indazole inhibitors of the wnt signal pathway and therapeutic uses thereof |
| DK2770994T3 (da) | 2012-05-04 | 2019-11-11 | Samumed Llc | 1h-pyrazolo[3,4-b]pyridiner og terapeutiske anvendelser deraf |
| CN105120862A (zh) | 2013-01-08 | 2015-12-02 | 萨穆梅德有限公司 | Wnt信号途径的3-(苯并咪唑-2-基)-吲唑抑制剂及其治疗应用 |
| WO2016040193A1 (en) | 2014-09-08 | 2016-03-17 | Samumed, Llc | 3-(1h-imidazo[4,5-c]pyridin-2-yl)-1h-pyrazolo[3,4-b]pyridine and therapeutic uses thereof |
| WO2016040181A1 (en) | 2014-09-08 | 2016-03-17 | Samumed, Llc | 3-(1h-imidazo[4,5-c]pyridin-2-yl)-1h-pyrazolo[3,4-c]pyridine and therapeutic uses thereof |
| WO2016040180A1 (en) | 2014-09-08 | 2016-03-17 | Samumed, Llc | 3-(1h-benzo[d]imidazol-2-yl)-1h-pyrazolo[3,4-c]pyridine and therapeutic uses thereof |
| WO2016040185A1 (en) | 2014-09-08 | 2016-03-17 | Samumed, Llc | 2-(1h-indazol-3-yl)-3h-imidazo[4,5-b]pyridine and therapeutic uses thereof |
| WO2016040184A1 (en) | 2014-09-08 | 2016-03-17 | Samumed, Llc | 3-(3h-imidazo[4,5-b]pyridin-2-yl)-1h-pyrazolo[3,4-c]pyridine and therapeutic uses thereof |
| WO2016040190A1 (en) | 2014-09-08 | 2016-03-17 | Samumed, Llc | 3-(3h-imidazo[4,5-b]pyridin-2-yl)-1h-pyrazolo[3,4-b]pyridine and therapeutic uses thereof |
| US10392383B2 (en) | 2015-08-03 | 2019-08-27 | Samumed, Llc | 3-(1H-benzo[d]imidazol-2-yl)-1H-pyrazolo[4,3-b]pyridines and therapeutic uses thereof |
| US10463651B2 (en) | 2015-08-03 | 2019-11-05 | Samumed, Llc | 3-(1H-pyrrolo[3,2-C]pyridin-2-YL)-1H-indazoles and therapeutic uses thereof |
| WO2017024004A1 (en) | 2015-08-03 | 2017-02-09 | Samumed, Llc. | 3-(1h-pyrrolo[2,3-b]pyridin-2-yl)-1h-pyrazolo[4,3-b]pyridines and therapeutic uses thereof |
| US10188634B2 (en) | 2015-08-03 | 2019-01-29 | Samumed, Llc | 3-(3H-imidazo[4,5-C]pyridin-2-yl)-1 H-pyrazolo[4,3-B]pyridines and therapeutic uses thereof |
| WO2017024026A1 (en) | 2015-08-03 | 2017-02-09 | Samumed, Llc | 3-(1h-indol-2-yl)-1h-pyrazolo[3,4-c]pyridines and therapeutic uses thereof |
| WO2017023972A1 (en) | 2015-08-03 | 2017-02-09 | Samumed, Llc. | 3-(1h-imidazo[4,5-c]pyridin-2-yl)-1h-pyrazolo[4,3-b]pyridines and therapeutic uses thereof |
| US10206908B2 (en) | 2015-08-03 | 2019-02-19 | Samumed, Llc | 3-(1H-pyrrolo[3,2-C]pyridin-2-YL)-1H-pyrazolo[3,4-C]pyridines and therapeutic uses thereof |
| US10226448B2 (en) | 2015-08-03 | 2019-03-12 | Samumed, Llc | 3-(1H-pyrrolo[3,2-C]pyridin-2-yl)-1H-pyrazolo[3,4-B]pyridines and therapeutic uses thereof |
| US10231956B2 (en) | 2015-08-03 | 2019-03-19 | Samumed, Llc | 3-(1H-pyrrolo[3,2-C]pyridin-2-YL)-1 H-pyrazolo[4,3-B]pyridines and therapeutic uses thereof |
| US10383861B2 (en) | 2015-08-03 | 2019-08-20 | Sammumed, LLC | 3-(1H-pyrrolo[2,3-C]pyridin-2-yl)-1H-pyrazolo[3,4-C]pyridines and therapeutic uses thereof |
| WO2017024021A1 (en) | 2015-08-03 | 2017-02-09 | Samumed, Llc | 3-(1h-pyrrolo[2,3-b]pyridin-2-yl)-1h-indazoles and therapeutic uses thereof |
| US10519169B2 (en) | 2015-08-03 | 2019-12-31 | Samumed, Llc | 3-(1H-pyrrolo[2,3-C]pyridin-2-yl)-1 H-pyrazolo[4,3-B]pyridines and therapeutic uses thereof |
| US10226453B2 (en) | 2015-08-03 | 2019-03-12 | Samumed, Llc | 3-(1H-indol-2-yl)-1H-pyrazolo[4,3-B]pyridines and therapeutic uses thereof |
| WO2017024015A1 (en) | 2015-08-03 | 2017-02-09 | Samumed, Llc. | 3-(3h-imidazo[4,5-b]pyridin-2-yl)-1h-pyrazolo[4,3-b]pyridines and therapeutic uses thereof |
| WO2017023980A1 (en) | 2015-08-03 | 2017-02-09 | Samumed, Llc. | 3-(1h-pyrrolo[2,3-b]pyridin-2-yl)-1h-pyrazolo[3,4-c]pyridines and therapeutic uses thereof |
| US10604512B2 (en) | 2015-08-03 | 2020-03-31 | Samumed, Llc | 3-(1H-indol-2-yl)-1H-indazoles and therapeutic uses thereof |
| US10285983B2 (en) | 2015-08-03 | 2019-05-14 | Samumed, Llc | 3-(1H-pyrrolo[2,3-B]pyridin-2-yl)-1H-pyrazolo[3,4-B] pyridines and therapeutic uses thereof |
| PE20181885A1 (es) | 2015-11-06 | 2018-12-07 | Hoffmann La Roche | Derivados de indolin-2-ona |
| CA3004297A1 (en) | 2015-11-06 | 2017-05-11 | Samumed, Llc | 2-(1h-indazol-3-yl)-3h-imidazo[4,5-c]pyridines and their anti-inflammatory uses thereof |
| PL3464285T3 (pl) | 2016-06-01 | 2023-02-06 | Biosplice Therapeutics, Inc. | Sposób wytwarzania n-(5-(3-(7-(3-fluorofenylo)-3h-imidazo[4,5-c]pirydyn-2-ylo)-1h-indazol-5-ilo)pirydyn-3-ylo)-3-metylobutanoamidu |
| JP2019535672A (ja) | 2016-10-21 | 2019-12-12 | サミュメッド リミテッド ライアビリティ カンパニー | インダゾール−3−カルボキサミドの使用方法およびwnt/β−カテニンシグナル伝達経路阻害剤としてのそれらの使用 |
| MA46696A (fr) * | 2016-11-07 | 2019-09-11 | Samumed Llc | Formulations injectables à dose unique prêtes à l'emploi |
| KR20200126393A (ko) | 2018-02-23 | 2020-11-06 | 사뮤메드, 엘엘씨 | 5-헤테로아릴 치환된 인다졸-3-카복사미드 및 그의 제조 및 용도 |
| AU2019337786A1 (en) * | 2018-09-10 | 2021-04-15 | Merck Patent Gmbh | Markers useful in enrichment strategies for the treatment of osteoarthritis |
| EP3911317A2 (en) * | 2019-01-17 | 2021-11-24 | BioSplice Therapeutics, Inc. | Methods of treating cartilage disorders through inhibition of clk and dyrk |
| CN112341442B (zh) * | 2019-08-09 | 2021-10-22 | 成都先导药物开发股份有限公司 | 一种免疫调节剂 |
| WO2022012058A1 (zh) * | 2020-07-16 | 2022-01-20 | 江苏凯迪恩医药科技有限公司 | 稠环化合物及其中间体、制备方法和应用 |
| MX2023004205A (es) | 2020-10-13 | 2023-07-06 | Teva Czech Ind S R O | Formas en estado solido de lorecivivint. |
| CN113654889B (zh) * | 2021-08-13 | 2022-09-13 | 四川大学 | 一种检测关节软骨不同分层结构力学性质的方法 |
| CN115353508B (zh) * | 2022-08-24 | 2023-07-21 | 中国药科大学 | 5-吡啶-1h-吲唑类化合物、药物组合物和应用 |
Family Cites Families (178)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4164559A (en) | 1977-09-21 | 1979-08-14 | Cornell Research Foundation, Inc. | Collagen drug delivery device |
| ES8401486A1 (es) | 1981-11-10 | 1983-12-01 | Wellcome Found | Un procedimiento para la preparacion de nuevos derivados de imidazo (4,5-c)piridina. |
| US4474752A (en) | 1983-05-16 | 1984-10-02 | Merck & Co., Inc. | Drug delivery system utilizing thermosetting gels |
| US4783443A (en) | 1986-03-03 | 1988-11-08 | The University Of Chicago | Amino acyl cephalosporin derivatives |
| EP0410509A1 (en) | 1989-07-25 | 1991-01-30 | Duphar International Research B.V | New substituted 1H-indazole-3-carboxamides |
| GB9414139D0 (en) | 1994-07-13 | 1994-08-31 | Smithkline Beecham Plc | Novel compounds |
| US6440102B1 (en) | 1998-07-23 | 2002-08-27 | Durect Corporation | Fluid transfer and diagnostic system for treating the inner ear |
| DE19853299C2 (de) | 1998-11-19 | 2003-04-03 | Thomas Lenarz | Katheter zur Applikation von Medikamenten in Flüssigkeitsräumen des menschlichen Innenohrs |
| US6120484A (en) | 1999-02-17 | 2000-09-19 | Silverstein; Herbert | Otological implant for delivery of medicament and method of using same |
| NZ516292A (en) | 1999-05-21 | 2004-01-30 | Bristol Myers Squibb Co | Pyrrolotriazine inhibitors of kinases |
| KR100718830B1 (ko) | 1999-06-23 | 2007-05-17 | 사노피-아벤티스 도이칠란트 게엠베하 | 치환된 벤즈이미다졸 및 이의 제조방법 |
| PE20010306A1 (es) | 1999-07-02 | 2001-03-29 | Agouron Pharma | Compuestos de indazol y composiciones farmaceuticas que los contienen utiles para la inhibicion de proteina kinasa |
| TWI262914B (en) | 1999-07-02 | 2006-10-01 | Agouron Pharma | Compounds and pharmaceutical compositions for inhibiting protein kinases |
| US6844367B1 (en) | 1999-09-17 | 2005-01-18 | Millennium Pharmaceuticals, Inc. | Benzamides and related inhibitors of factor Xa |
| US6967023B1 (en) | 2000-01-10 | 2005-11-22 | Foamix, Ltd. | Pharmaceutical and cosmetic carrier or composition for topical application |
| YU54202A (sh) | 2000-01-18 | 2006-01-16 | Agouron Pharmaceuticals Inc. | Jedinjenja indazola, farmaceutske smeše i postupci za stimulisanje i inhibiranje ćelijske proliferacije |
| US20050009876A1 (en) | 2000-07-31 | 2005-01-13 | Bhagwat Shripad S. | Indazole compounds, compositions thereof and methods of treatment therewith |
| US6897231B2 (en) | 2000-07-31 | 2005-05-24 | Signal Pharmaceuticals, Inc. | Indazole derivatives as JNK inhibitors and compositions and methods related thereto |
| AU2001292670A1 (en) | 2000-09-15 | 2002-03-26 | Vertex Pharmaceuticals Incorporated | Pyrazole compounds useful as protein kinase inhibitors |
| AU2002222293A1 (en) | 2000-12-19 | 2002-07-01 | Smithkline Beecham P.L.C. | Pyrazolo(3,4-c)pyridines as gsk-3 inhibitors |
| US20050192262A1 (en) | 2001-03-13 | 2005-09-01 | Tomas Hagstrom | Treatment of tumours |
| WO2002088078A2 (en) | 2001-04-30 | 2002-11-07 | Vertex Pharmaceuticals Incorporated | INHIBITORS OF GSK-3 AND CRYSTAL STRUCTURES OF GSK-3β PROTEIN AND PROTEIN COMPLEXES |
| GB0115109D0 (en) | 2001-06-21 | 2001-08-15 | Aventis Pharma Ltd | Chemical compounds |
| WO2003004488A1 (en) | 2001-07-03 | 2003-01-16 | Chiron Corporation | Indazole benzimidazole compounds as tyrosine and serine/threonine kinase inhibitors |
| US7642278B2 (en) | 2001-07-03 | 2010-01-05 | Novartis Vaccines And Diagnostics, Inc. | Indazole benzimidazole compounds |
| WO2003024969A1 (en) | 2001-09-14 | 2003-03-27 | Merck & Co., Inc. | Tyrosine kinase inhibitors |
| AU2002368274A1 (en) | 2001-09-13 | 2004-06-03 | Genesoft, Inc. | Methods of treating infection by drug resistant bacteria |
| US6648873B2 (en) | 2001-09-21 | 2003-11-18 | Durect Corp. | Aural catheter system including anchor balloon and balloon inflation device |
| AU2002334217B2 (en) | 2001-10-26 | 2008-07-03 | Aventis Pharmaceuticals Inc. | Benzimidazoles and analogues and their use as protein kinases inhibitors |
| US6897208B2 (en) | 2001-10-26 | 2005-05-24 | Aventis Pharmaceuticals Inc. | Benzimidazoles |
| US7666867B2 (en) | 2001-10-26 | 2010-02-23 | University Of Connecticut | Heteroindanes: a new class of potent cannabimimetic ligands |
| FR2831536A1 (fr) | 2001-10-26 | 2003-05-02 | Aventis Pharma Sa | Nouveaux derives de benzimidazoles, leur procede de preparation, leur application a titre de medicament, compositions pharmaceutiques et nouvelle utilisation notamment comme inhibiteurs de kdr |
| US20030187026A1 (en) | 2001-12-13 | 2003-10-02 | Qun Li | Kinase inhibitors |
| AU2003225580A1 (en) | 2002-02-19 | 2003-09-09 | Pharmacia Corporation | Tricyclic pyrazole derivatives for the treatment of inflammation |
| MXPA04008680A (es) | 2002-02-19 | 2004-12-06 | Pharmacia Italia Spa | Derivados de pirazol triciclicos, procedimientos para su preparacion y su uso como agentes anti-tumorales. |
| ES2411655T3 (es) | 2002-05-17 | 2013-07-08 | Pfizer Italia S.R.L. | Derivados de aminoindazol activos como inhibidores de quinasas, procedimiento para su preparación y composiciones farmacéuticas que los comprenden |
| AU2003241925A1 (en) | 2002-05-31 | 2003-12-19 | Eisai R&D Management Co., Ltd. | Pyrazole compound and medicinal composition containing the same |
| ES2304511T3 (es) | 2002-06-04 | 2008-10-16 | Schering Corporation | Compuestos de pirazolo(1,5-a)pirimidina como agentes antivirales. |
| US7449488B2 (en) | 2002-06-04 | 2008-11-11 | Schering Corporation | Pyrazolopyrimidines as protein kinase inhibitors |
| US20050282733A1 (en) | 2002-06-27 | 2005-12-22 | Prins Johannes B | Differentiation modulating agents and uses therefor |
| GB0218625D0 (en) | 2002-08-10 | 2002-09-18 | Astex Technology Ltd | Pharmaceutical compounds |
| FR2845382A1 (fr) | 2002-10-02 | 2004-04-09 | Sanofi Synthelabo | Derives d'indazolecarboxamides, leur preparation et leur utilisation en therapeutique |
| DE602004029145D1 (de) | 2003-02-27 | 2010-10-28 | Palau Pharma Sa | Pyrazolopyridin-derivate |
| US7135575B2 (en) | 2003-03-03 | 2006-11-14 | Array Biopharma, Inc. | P38 inhibitors and methods of use thereof |
| ATE386034T1 (de) | 2003-07-03 | 2008-03-15 | Aventis Pharma Inc | Pyrazoloisoquinolinenderivaten als kinase inhibitoren |
| TWI372050B (en) | 2003-07-03 | 2012-09-11 | Astex Therapeutics Ltd | (morpholin-4-ylmethyl-1h-benzimidazol-2-yl)-1h-pyrazoles |
| PL1651612T3 (pl) | 2003-07-22 | 2012-09-28 | Astex Therapeutics Ltd | Związki 3,4-pochodne 1h-pirazolu i ich zastosowanie jako kinazy zależne od cyklin (cdk) i modulatory kinazy syntazy glikogenu-3 (gsk-3) |
| CN1829713A (zh) | 2003-07-30 | 2006-09-06 | 辉瑞大药厂 | 3,5二取代的吲唑化合物、药物组合物和介导或抑制细胞增殖的方法 |
| US7008953B2 (en) | 2003-07-30 | 2006-03-07 | Agouron Pharmaceuticals, Inc. | 3, 5 Disubstituted indazole compounds, pharmaceutical compositions, and methods for mediating or inhibiting cell proliferation |
| US20050090529A1 (en) | 2003-07-31 | 2005-04-28 | Pfizer Inc | 3,5 Disubstituted indazole compounds with nitrogen-bearing 5-membered heterocycles, pharmaceutical compositions, and methods for mediating or inhibiting cell proliferation |
| WO2005014554A1 (en) | 2003-08-08 | 2005-02-17 | Astex Therapeutics Limited | 1h-indazole-3-carboxamide compounds as mapkap kinase modulators |
| AU2004289539C1 (en) | 2003-11-14 | 2012-06-07 | Lorus Therapeutics Inc. | Aryl imidazoles and their use as anti-cancer agents |
| EP1532980A1 (en) | 2003-11-24 | 2005-05-25 | Novo Nordisk A/S | N-heteroaryl indole carboxamides and analogues thereof, for use as glucokinase activators in the treatment of diabetes |
| FR2864084B1 (fr) | 2003-12-17 | 2006-02-10 | Aventis Pharma Sa | Nouveaux derives organophosphores des indazoles et leur utilisation comme medicaments |
| FR2867778B1 (fr) | 2004-03-16 | 2006-06-09 | Sanofi Synthelabo | Utilisation de derives d'indazolecarboxamides pour la preparation d'un medicament destine au traitement et a la prevention du paludisme |
| JP4995075B2 (ja) | 2004-03-25 | 2012-08-08 | メモリー・ファーマシューティカルズ・コーポレイション | インダゾール、ベンゾチアゾール、ベンゾイソチアゾール、ベンズイソキサゾール、ならびにそれらの調製および使用 |
| US7488737B2 (en) | 2004-04-22 | 2009-02-10 | Memory Pharmaceutical Corporation | Indoles, 1H-indazoles, 1,2-benzisoxazoles, 1,2-benzoisothiazoles, and preparation and uses thereof |
| WO2005110410A2 (en) | 2004-05-14 | 2005-11-24 | Abbott Laboratories | Kinase inhibitors as therapeutic agents |
| WO2006003440A1 (en) | 2004-07-05 | 2006-01-12 | Astex Therapeutics Limited | 3,4-disubstituted pyrazoles as cyclin dependent kinases (cdk) or aurora kinase or glycogen synthase 3 (gsk-3) inhibitors |
| US7626021B2 (en) | 2004-07-27 | 2009-12-01 | Sgx Pharmaceuticals, Inc. | Fused ring heterocycle kinase modulators |
| CA2573573A1 (en) | 2004-07-27 | 2006-02-09 | Sgx Pharmaceuticals, Inc. | Fused ring heterocycle kinase modulators |
| AR050188A1 (es) | 2004-08-03 | 2006-10-04 | Uriach Y Compania S A J | Compuestos heterociclicos condensados utiles en terapia como inhibidores de quinasas p38 y composiciones farmaceuticas que los contienen |
| WO2006024945A1 (en) | 2004-09-03 | 2006-03-09 | Pfizer Inc. | Pharmaceutical compositions comprising a cdk inhibitor |
| US7652043B2 (en) | 2004-09-29 | 2010-01-26 | The Johns Hopkins University | WNT pathway antagonists |
| WO2006054143A1 (en) | 2004-11-17 | 2006-05-26 | Pfizer Inc. | Polymorphs of {5-[3-(4,6-difluoro-1h-benzoimidazol-2-yl)-1h-indazol-5-yl]-4-methyl-pyridin-3-ylmethyl}-ethyl-amine |
| US20060116519A1 (en) | 2004-11-17 | 2006-06-01 | Agouron Pharmaceuticals, Inc. | Synthesis of 5-bromo-4-methyl-pyridin-3-ylmethyl)-ethyl-carbamic acid tert-butyl ester |
| WO2006063302A2 (en) | 2004-12-10 | 2006-06-15 | Wyeth | Variants of glycogen synthase kinase 3 and uses thereof |
| US20060142247A1 (en) | 2004-12-17 | 2006-06-29 | Guy Georges | Tricyclic heterocycles |
| RU2416610C2 (ru) | 2004-12-30 | 2011-04-20 | Астекс Терапьютикс Лимитед | Фармацевтические соединения |
| EP1861161A4 (en) | 2005-01-24 | 2012-05-16 | Neurosystec Corp | APPARATUS AND METHOD FOR DISPENSING THERAPEUTIC AND / OR OTHER AGENTS IN THE INTERNAL EAR AND OTHER FABRICS |
| WO2006130673A1 (en) | 2005-05-31 | 2006-12-07 | Janssen Pharmaceutica, N.V. | 3-benzoimidazolyl-pyrazolopyridines useful in treating kinase disorders |
| AU2006283941A1 (en) | 2005-08-25 | 2007-03-01 | F. Hoffmann-La Roche Ag | P38 MAP kinase inhibitors and methods for using the same |
| US8106066B2 (en) | 2005-09-23 | 2012-01-31 | Memory Pharmaceuticals Corporation | Indazoles, benzothiazoles, benzoisothiazoles, benzisoxazoles, pyrazolopyridines, isothiazolopyridines, and preparation and uses thereof |
| AR055669A1 (es) | 2005-10-03 | 2007-08-29 | Astrazeneca Ab | Derivados de 3h - imidazo[4, 5 -b]piridina como inhibidores selectivos de gsk3, metodos e internediarios para su preparacion, composiciones farmaceuticas que los contienen y su uso para la elaboracion de un medicamento para el tratamiento de enfermedades neurodegenerativas y mentales. |
| TW200804338A (en) | 2005-11-24 | 2008-01-16 | Astrazeneca Ab | New compounds |
| US8399442B2 (en) | 2005-12-30 | 2013-03-19 | Astex Therapeutics Limited | Pharmaceutical compounds |
| GB0602178D0 (en) | 2006-02-03 | 2006-03-15 | Merck Sharp & Dohme | Therapeutic treatment |
| US20090291968A1 (en) | 2006-03-23 | 2009-11-26 | Guy Georges | Substituted indazole derivatives, their manufacture and use as pharmaceutical agents |
| MX2008012482A (es) | 2006-03-31 | 2008-10-10 | Abbott Lab | Compuestos de indazol. |
| ATE456565T1 (de) | 2006-06-22 | 2010-02-15 | Biovitrum Ab Publ | Pyridin- und pyrazinderivate als mnk- kinaseinhibitoren |
| US20090263398A1 (en) | 2006-07-14 | 2009-10-22 | Astex Therapeutics Limited | Pharmaceutical combinations |
| US7638518B2 (en) | 2006-10-17 | 2009-12-29 | Janssen Pharmaceutica | Substituted pyrazole kinase inhibitors |
| WO2008061109A2 (en) | 2006-11-15 | 2008-05-22 | Forest Laboratories Holdings Limited | Indazole derivatives useful as melanin concentrating receptor ligands |
| EP1932830A1 (en) | 2006-12-11 | 2008-06-18 | The Genetics Company, Inc. | Sulfonamides and their use as a medicament |
| DE602006021591D1 (de) | 2006-12-11 | 2011-06-09 | Genetics Co Inc | Aromatische 1,4-DI-Carboxylamide und deren Verwendung |
| JP2010513231A (ja) | 2006-12-14 | 2010-04-30 | バイエル・シエーリング・ファーマ アクチエンゲゼルシャフト | たんぱく質キナーゼインヒビターとして有用なジヒドロピリジン誘導体 |
| BRPI0809500A2 (pt) | 2007-04-10 | 2014-09-23 | Sgx Pharmaceuticals Inc | Composto, e, métodos para modular a atividade de uma proteína quinase e para tratar uma doença |
| WO2008137408A1 (en) | 2007-04-30 | 2008-11-13 | Genentech, Inc. | Pyrazole inhibitors of wnt signaling |
| ES2584188T3 (es) | 2007-05-10 | 2016-09-26 | Avalon Pharmaceuticals | Derivados de fluoreno, antraceno, xanteno, dibenzosuberona y acridina y usos de los mismos |
| US20080287452A1 (en) | 2007-05-16 | 2008-11-20 | Wyeth | Heteroaryl/aryl pyrimidine analogs and their use as agonists of the wnt-beta-catenin cellular messaging system |
| US8304408B2 (en) | 2007-05-24 | 2012-11-06 | The Regents Of The University Of California | Wnt signaling inhibitors, and methods for making and using them |
| CL2008001540A1 (es) | 2007-05-29 | 2009-05-22 | Sgx Pharmaceuticals Inc | Compuestos derivados de pirrolopiridinas y pirazolopiridinas; composicion farmaceutica; y uso en el tratamiento del cancer. |
| WO2008150845A1 (en) | 2007-05-31 | 2008-12-11 | Vanderbilt University | Screening for wnt pathway modulators and pyrvinium for the treatment of cance |
| KR20100032886A (ko) | 2007-06-08 | 2010-03-26 | 아보트 러보러터리즈 | 키나제 억제제로서의 5-헤테로아릴 치환된 인다졸 |
| US8648069B2 (en) | 2007-06-08 | 2014-02-11 | Abbvie Inc. | 5-substituted indazoles as kinase inhibitors |
| US20110301155A1 (en) | 2007-06-19 | 2011-12-08 | Tsuneo Yasuma | Indazole compounds for activating glucokinase |
| FR2917735B1 (fr) | 2007-06-21 | 2009-09-04 | Sanofi Aventis Sa | Nouveaux indazoles substitutes, leur preparation et leur utilisation en therapeutique |
| US20090069288A1 (en) | 2007-07-16 | 2009-03-12 | Breinlinger Eric C | Novel therapeutic compounds |
| US20100190736A1 (en) | 2007-08-02 | 2010-07-29 | Nerviano Medical Sciences S.R.L. | Morpholinyl anthracycline derivative combined with protein kinase inhibitors |
| RU2350271C1 (ru) | 2007-08-20 | 2009-03-27 | Федеральное государственное учреждение "Российский научный центр "Восстановительная травматология и ортопедия" имени академика Г.А. Илизарова Федерального агентства по высокотехнологичной медицинской помощи", ФГУ "РНЦ "ВТО" им. акад. Г.А. Илизарова Росмедтехнологий" | Способ лечения ранних стадий остеоартроза тазобедренного сустава |
| WO2009029609A1 (en) | 2007-08-27 | 2009-03-05 | Wyeth | Imidazopyridine analogs and their use as agonists of the wnt-beta-catenin cellular messaging system |
| US9259399B2 (en) | 2007-11-07 | 2016-02-16 | Cornell University | Targeting CDK4 and CDK6 in cancer therapy |
| AU2008343062B2 (en) * | 2007-12-19 | 2013-03-07 | Genentech, Inc. | 8-Anilinoimidazopyridines and their use as anti-cancer and/or anti-inflammatory agents |
| AU2009260503B2 (en) | 2008-05-27 | 2014-03-27 | The Board Of Regents Of The University Of Texas System | Wnt protein signalling inhibitors |
| KR20110036583A (ko) | 2008-06-20 | 2011-04-07 | 로타팜 에스.피.에이. | 6-1h-이미다조-퀴나졸린 및 퀴놀린 유도체, 신규 mao 억제제 및 이미다졸린 수용체 리간드 |
| KR101061599B1 (ko) | 2008-12-05 | 2011-09-02 | 한국과학기술연구원 | 비정상 세포 성장 질환의 치료를 위한 단백질 키나아제 저해제인 신규 인다졸 유도체, 이의 약학적으로 허용가능한염 및 이를 유효성분으로 함유하는 약학적 조성물 |
| CN101440092B (zh) | 2008-12-25 | 2010-11-17 | 浙江大学 | 2-吲唑-4-氮杂吲哚-5-氨基衍生物及制备和应用 |
| AR075858A1 (es) | 2009-03-18 | 2011-05-04 | Schering Corp | Compuestos biciclicos como inhibidores de diacilglicerol aciltransferasa |
| CA2755768A1 (en) | 2009-03-23 | 2010-09-30 | Merck Sharp & Dohme Corp. | P2x3, receptor antagonists for treatment of pain |
| JP2012526850A (ja) | 2009-05-13 | 2012-11-01 | ザ ユニバーシティ オブ ノース カロライナ アット チャペル ヒル | サイクリン依存性キナーゼ阻害剤及びその用法 |
| UA110324C2 (en) | 2009-07-02 | 2015-12-25 | Genentech Inc | Jak inhibitory compounds based on pyrazolo pyrimidine |
| SG177740A1 (en) | 2009-07-23 | 2012-02-28 | Univ Vanderbilt | Substituted benzoimidazolesulfonamides and substituted indolesulfonamides as mglur4 potentiators |
| BR112012002807B1 (pt) | 2009-08-07 | 2018-07-10 | Adama Makhteshim Ltd. | Derivados de 5-flúor-2-oxopirimidina-1(2h)- caboxilato, composição e processo para controle e prevenção de ataque fúngico em uma planta de ataque fúngico em uma planta |
| CA2770320A1 (en) * | 2009-08-10 | 2011-02-17 | Epitherix, Llc | Indazoles as wnt/b-catenin signaling pathway inhibitors and therapeutic uses thereof |
| DK2987487T3 (da) | 2009-08-10 | 2020-12-07 | Samumed Llc | Indazolinhibitorer af wnt-signalvejen og terapeutiske anvendelser deraf |
| US8348645B2 (en) | 2009-08-11 | 2013-01-08 | Woodward, Inc. | Balanced pressure, variable displacement, dual lobe, single ring, vane pump |
| WO2011050245A1 (en) | 2009-10-23 | 2011-04-28 | Yangbo Feng | Bicyclic heteroaryls as kinase inhibitors |
| DK3001903T3 (en) | 2009-12-21 | 2017-12-18 | Samumed Llc | 1H-PYRAZOLO [3,4 -?] PYRIDINES AND THERAPEUTIC APPLICATIONS THEREOF |
| RU2562977C2 (ru) | 2009-12-21 | 2015-09-10 | Эррэй Биофарма Инк. | СОЕДИНЕНИЯ ЗАМЕЩЕННОГО N-(1Н-ИНДАЗОЛ-4-ИЛ)ИМИДАЗОЛ[1,2-a]ПИРИДИН-3-КАРБОКСАМИДА КАК ИНГИБИТОРЫ cFMS |
| CA2795370C (en) | 2010-04-06 | 2018-03-27 | Peter Maccallum Cancer Institute | Radioprotector compounds and methods |
| DE102010043379A1 (de) | 2010-11-04 | 2012-05-10 | Bayer Schering Pharma Aktiengesellschaft | Substituierte 6-Fluor-1H-Pyrazolo[4,3-b]pyridine und ihre Verwendung |
| US20130310379A1 (en) | 2010-11-19 | 2013-11-21 | Constellation Pharmaceuticals | Modulators of methyl modifying enzymes, compositions and uses thereof |
| CA2824220C (en) | 2011-01-13 | 2020-09-01 | Novartis Ag | Novel heterocyclic derivatives and their use in the treatment of neurological disorders |
| US8889684B2 (en) | 2011-02-02 | 2014-11-18 | Boehringer Ingelheim International Gmbh | Azaindolylphenyl sulfonamides as serine/threonine kinase inhibitors |
| US9464065B2 (en) | 2011-03-24 | 2016-10-11 | The Scripps Research Institute | Compounds and methods for inducing chondrogenesis |
| JP2014509660A (ja) | 2011-04-01 | 2014-04-21 | ユニバーシティ・オブ・ユタ・リサーチ・ファウンデイション | PDK1キナーゼの阻害剤としての置換3−(1H−ベンゾ{d}イミダゾール−2−イル)−1H−インダゾール類似体 |
| WO2013019901A2 (en) | 2011-08-02 | 2013-02-07 | Buck Institute For Research On Aging | Tropinol esters and related compounds to promote normal processing of app |
| CN103889976A (zh) | 2011-08-12 | 2014-06-25 | 弗·哈夫曼-拉罗切有限公司 | 吲唑化合物、组合物及使用方法 |
| EP2742046A1 (en) | 2011-08-12 | 2014-06-18 | F.Hoffmann-La Roche Ag | PYRAZOLO[3,4-c]PYRIDINE COMPOUNDS AND METHODS OF USE |
| MX359032B (es) | 2011-09-01 | 2018-09-12 | Hoffmann La Roche | Inhibidores de pirrolopirazina cinasa. |
| AU2012308570B2 (en) | 2011-09-14 | 2016-11-10 | Samumed, Llc | Indazole-3-carboxamides and their use as Wnt/b-catenin signaling pathway inhibitors |
| PL2810198T3 (pl) | 2012-01-30 | 2024-01-22 | Universiteit Gent | Związki przeciwinwazyjne |
| US20150087687A1 (en) | 2012-03-23 | 2015-03-26 | Dennis Brown | Compositions and methods to improve the therapeutic benefit of indirubin and analogs thereof, including meisoindigo |
| PH12017500997A1 (en) | 2012-04-04 | 2018-02-19 | Samumed Llc | Indazole inhibitors of the wnt signal pathway and therapeutic uses thereof |
| US9056874B2 (en) | 2012-05-04 | 2015-06-16 | Novartis Ag | Complement pathway modulators and uses thereof |
| EA201401213A1 (ru) | 2012-05-04 | 2015-04-30 | Басф Се | Замещенные пиразолсодержащие соединения и их применение в качестве пестицидов |
| DK2770994T3 (da) | 2012-05-04 | 2019-11-11 | Samumed Llc | 1h-pyrazolo[3,4-b]pyridiner og terapeutiske anvendelser deraf |
| CN105120862A (zh) * | 2013-01-08 | 2015-12-02 | 萨穆梅德有限公司 | Wnt信号途径的3-(苯并咪唑-2-基)-吲唑抑制剂及其治疗应用 |
| US9346812B2 (en) | 2013-01-16 | 2016-05-24 | Signal Pharmaceuticals, Llc | Substituted pyrrolopyrimidine compounds, compositions thereof, and methods of treatment therewith |
| US9327886B2 (en) | 2013-03-13 | 2016-05-03 | Bayer Healthcare Llc | Vial container with collar cap |
| HUE035966T2 (en) * | 2013-03-14 | 2018-05-28 | Galapagos Nv | Compounds and compositions for the treatment of inflammatory diseases |
| FR3011239A1 (fr) | 2013-10-01 | 2015-04-03 | Univ Claude Bernard Lyon | Nouveaux derives comprenant un groupe pyrazole et un groupe indole, utiles en tant qu'inhibiteurs de la kinase gsk3 |
| BR112016021626A2 (pt) | 2014-03-20 | 2018-05-15 | Samumed, Llc | indazol-3-carboxamidas 5-substituídas e preparação e uso das mesmas |
| WO2016040180A1 (en) | 2014-09-08 | 2016-03-17 | Samumed, Llc | 3-(1h-benzo[d]imidazol-2-yl)-1h-pyrazolo[3,4-c]pyridine and therapeutic uses thereof |
| WO2016040193A1 (en) | 2014-09-08 | 2016-03-17 | Samumed, Llc | 3-(1h-imidazo[4,5-c]pyridin-2-yl)-1h-pyrazolo[3,4-b]pyridine and therapeutic uses thereof |
| WO2016040182A1 (en) | 2014-09-08 | 2016-03-17 | Samumed, Llc | 2-(1h-indazol-3-yl)-1h-imidazo[4,5-c]pyridine and therapeutic uses thereof |
| US9538272B2 (en) | 2014-09-08 | 2017-01-03 | Apple Inc. | Acoustic mesh and methods of use for electronic devices |
| WO2016040185A1 (en) | 2014-09-08 | 2016-03-17 | Samumed, Llc | 2-(1h-indazol-3-yl)-3h-imidazo[4,5-b]pyridine and therapeutic uses thereof |
| WO2016040184A1 (en) | 2014-09-08 | 2016-03-17 | Samumed, Llc | 3-(3h-imidazo[4,5-b]pyridin-2-yl)-1h-pyrazolo[3,4-c]pyridine and therapeutic uses thereof |
| WO2016040188A1 (en) | 2014-09-08 | 2016-03-17 | Samumed, Llc | 3-(3h-imidazo[4,5-c]pyridin-2-yl)-1h-pyrazolo[3,4-c]pyridine and therapeutic uses thereof |
| WO2016040190A1 (en) | 2014-09-08 | 2016-03-17 | Samumed, Llc | 3-(3h-imidazo[4,5-b]pyridin-2-yl)-1h-pyrazolo[3,4-b]pyridine and therapeutic uses thereof |
| WO2016040181A1 (en) | 2014-09-08 | 2016-03-17 | Samumed, Llc | 3-(1h-imidazo[4,5-c]pyridin-2-yl)-1h-pyrazolo[3,4-c]pyridine and therapeutic uses thereof |
| WO2017024021A1 (en) | 2015-08-03 | 2017-02-09 | Samumed, Llc | 3-(1h-pyrrolo[2,3-b]pyridin-2-yl)-1h-indazoles and therapeutic uses thereof |
| US20180228780A1 (en) | 2015-08-03 | 2018-08-16 | Samumed, Llc | 3-(1h-pyrrolo[2,3-c]pyridin-2-yl)-1h-indazoles and therapeutic uses thereof |
| US10231956B2 (en) | 2015-08-03 | 2019-03-19 | Samumed, Llc | 3-(1H-pyrrolo[3,2-C]pyridin-2-YL)-1 H-pyrazolo[4,3-B]pyridines and therapeutic uses thereof |
| WO2017024026A1 (en) | 2015-08-03 | 2017-02-09 | Samumed, Llc | 3-(1h-indol-2-yl)-1h-pyrazolo[3,4-c]pyridines and therapeutic uses thereof |
| WO2017023972A1 (en) | 2015-08-03 | 2017-02-09 | Samumed, Llc. | 3-(1h-imidazo[4,5-c]pyridin-2-yl)-1h-pyrazolo[4,3-b]pyridines and therapeutic uses thereof |
| WO2017023973A1 (en) | 2015-08-03 | 2017-02-09 | Samumed, Llc. | 3-(1h-indol-2-yl)-1h-pyrazolo[3,4-b]pyridines and therapeutic uses thereof |
| US10188634B2 (en) | 2015-08-03 | 2019-01-29 | Samumed, Llc | 3-(3H-imidazo[4,5-C]pyridin-2-yl)-1 H-pyrazolo[4,3-B]pyridines and therapeutic uses thereof |
| US10285983B2 (en) | 2015-08-03 | 2019-05-14 | Samumed, Llc | 3-(1H-pyrrolo[2,3-B]pyridin-2-yl)-1H-pyrazolo[3,4-B] pyridines and therapeutic uses thereof |
| WO2017023980A1 (en) | 2015-08-03 | 2017-02-09 | Samumed, Llc. | 3-(1h-pyrrolo[2,3-b]pyridin-2-yl)-1h-pyrazolo[3,4-c]pyridines and therapeutic uses thereof |
| US10383861B2 (en) | 2015-08-03 | 2019-08-20 | Sammumed, LLC | 3-(1H-pyrrolo[2,3-C]pyridin-2-yl)-1H-pyrazolo[3,4-C]pyridines and therapeutic uses thereof |
| US10392383B2 (en) | 2015-08-03 | 2019-08-27 | Samumed, Llc | 3-(1H-benzo[d]imidazol-2-yl)-1H-pyrazolo[4,3-b]pyridines and therapeutic uses thereof |
| US10226448B2 (en) | 2015-08-03 | 2019-03-12 | Samumed, Llc | 3-(1H-pyrrolo[3,2-C]pyridin-2-yl)-1H-pyrazolo[3,4-B]pyridines and therapeutic uses thereof |
| WO2017024015A1 (en) | 2015-08-03 | 2017-02-09 | Samumed, Llc. | 3-(3h-imidazo[4,5-b]pyridin-2-yl)-1h-pyrazolo[4,3-b]pyridines and therapeutic uses thereof |
| US10226453B2 (en) | 2015-08-03 | 2019-03-12 | Samumed, Llc | 3-(1H-indol-2-yl)-1H-pyrazolo[4,3-B]pyridines and therapeutic uses thereof |
| US10463651B2 (en) | 2015-08-03 | 2019-11-05 | Samumed, Llc | 3-(1H-pyrrolo[3,2-C]pyridin-2-YL)-1H-indazoles and therapeutic uses thereof |
| US10206908B2 (en) | 2015-08-03 | 2019-02-19 | Samumed, Llc | 3-(1H-pyrrolo[3,2-C]pyridin-2-YL)-1H-pyrazolo[3,4-C]pyridines and therapeutic uses thereof |
| WO2017024004A1 (en) | 2015-08-03 | 2017-02-09 | Samumed, Llc. | 3-(1h-pyrrolo[2,3-b]pyridin-2-yl)-1h-pyrazolo[4,3-b]pyridines and therapeutic uses thereof |
| US10604512B2 (en) | 2015-08-03 | 2020-03-31 | Samumed, Llc | 3-(1H-indol-2-yl)-1H-indazoles and therapeutic uses thereof |
| WO2017023981A1 (en) | 2015-08-03 | 2017-02-09 | Samumed, Llc. | 3-(1h-pyrrolo[2,3-c]pyridin-2-yl)-1h-pyrazolo[3,4-b]pyridines and therapeutic uses thereof |
| CA3004297A1 (en) | 2015-11-06 | 2017-05-11 | Samumed, Llc | 2-(1h-indazol-3-yl)-3h-imidazo[4,5-c]pyridines and their anti-inflammatory uses thereof |
| AR108325A1 (es) | 2016-04-27 | 2018-08-08 | Samumed Llc | Isoquinolin-3-il carboxamidas y preparación y uso de las mismas |
| PL3464285T3 (pl) | 2016-06-01 | 2023-02-06 | Biosplice Therapeutics, Inc. | Sposób wytwarzania n-(5-(3-(7-(3-fluorofenylo)-3h-imidazo[4,5-c]pirydyn-2-ylo)-1h-indazol-5-ilo)pirydyn-3-ylo)-3-metylobutanoamidu |
| JP2019535672A (ja) | 2016-10-21 | 2019-12-12 | サミュメッド リミテッド ライアビリティ カンパニー | インダゾール−3−カルボキサミドの使用方法およびwnt/β−カテニンシグナル伝達経路阻害剤としてのそれらの使用 |
| MA46696A (fr) | 2016-11-07 | 2019-09-11 | Samumed Llc | Formulations injectables à dose unique prêtes à l'emploi |
| WO2020006115A1 (en) | 2018-06-26 | 2020-01-02 | Betty Tam | Methods of treating cancer using a clk inhibitor |
| EP3911317A2 (en) | 2019-01-17 | 2021-11-24 | BioSplice Therapeutics, Inc. | Methods of treating cartilage disorders through inhibition of clk and dyrk |
-
2016
- 2016-11-07 CA CA3004297A patent/CA3004297A1/en active Pending
- 2016-11-07 US US15/773,737 patent/US10899757B2/en active Active
- 2016-11-07 WO PCT/US2016/060856 patent/WO2017079759A1/en active Application Filing
- 2016-11-07 RU RU2018120728A patent/RU2018120728A/ru unknown
- 2016-11-07 BR BR112018009252A patent/BR112018009252A2/pt not_active Application Discontinuation
- 2016-11-07 EP EP16863183.6A patent/EP3370721A4/en active Pending
- 2016-11-07 KR KR1020187015778A patent/KR20180080288A/ko not_active Application Discontinuation
- 2016-11-07 MX MX2018005696A patent/MX2018005696A/es unknown
- 2016-11-07 JP JP2018522974A patent/JP6982747B2/ja active Active
- 2016-11-07 NZ NZ742200A patent/NZ742200A/en unknown
- 2016-11-07 KR KR1020187015302A patent/KR20180080262A/ko not_active Application Discontinuation
- 2016-11-07 AU AU2016348639A patent/AU2016348639B2/en active Active
- 2016-11-07 JP JP2018523022A patent/JP6982748B2/ja active Active
- 2016-11-07 WO PCT/US2016/060868 patent/WO2017079765A1/en active Application Filing
- 2016-11-07 EP EP16863178.6A patent/EP3371187A4/en active Pending
- 2016-11-07 CA CA3004506A patent/CA3004506A1/en active Pending
- 2016-11-07 CN CN201680078031.6A patent/CN108472290A/zh active Pending
- 2016-11-07 CN CN201680075175.6A patent/CN108473491A/zh active Pending
- 2016-11-07 US US15/773,951 patent/US10544139B2/en active Active
- 2016-11-07 MX MX2018005694A patent/MX2018005694A/es unknown
-
2018
- 2018-05-03 IL IL259110A patent/IL259110A/en unknown
- 2018-05-07 PH PH12018500981A patent/PH12018500981A1/en unknown
- 2018-05-07 CL CL2018001230A patent/CL2018001230A1/es unknown
-
2019
- 2019-12-11 US US16/710,099 patent/US10882860B2/en active Active
-
2020
- 2020-12-01 US US17/108,544 patent/US11560378B2/en active Active
- 2020-12-04 US US17/112,282 patent/US11667632B2/en active Active
-
2021
- 2021-10-22 JP JP2021172952A patent/JP2022009400A/ja active Pending
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6982748B2 (ja) | 2−(1H−インダゾール−3−イル)−3H−イミダゾ[4,5−c]ピリジンおよびそれらの抗炎症的使用 | |
| JP6941147B2 (ja) | アリール受容体モジュレーターならびにその作製および使用方法 | |
| KR101676391B1 (ko) | 퇴행성 및 염증성 질병의 치료에 유용한 신규 화합물 | |
| CN105308036B (zh) | 用于激酶调节的化合物和方法及其适应症 | |
| JP5326092B2 (ja) | 高増殖性疾患及び血管形成関連疾患の治療に有用な置換2,3−ジヒドロイミダゾ[1,2−c]キナゾリン誘導体 | |
| TWI222971B (en) | Antagonists of MCP-1 function and methods of use thereof | |
| JP6345645B2 (ja) | 横隔膜機能を向上させるための方法 | |
| CA3077499C (en) | P38 kinase inhibitors reduce dux4 and downstream gene expression for the treatment of fshd | |
| CN102112478A (zh) | 用于激酶调节的5h-吡咯[2,3-b]吡嗪衍生物和其适应症 | |
| JP2012520307A (ja) | Rafキナーゼの阻害のためのピロロ[2,3−b]ピリジン誘導体 | |
| BRPI0813695B1 (pt) | Compostos de heteroaril piridil e fenil benzenossulfonamidas fundidas, composição, método de modular a função de ccr2, usos dos compostos e forma cristalina | |
| WO2018082587A1 (zh) | Hedgehog通路抑制剂在治疗纤维化疾病中的应用 | |
| CN109843883A (zh) | 作为选择性jak抑制剂化合物,该化合物的盐类及其治疗用途 | |
| RU2736123C1 (ru) | Производные 2-аминохиназолина в качестве ингибиторов p70s6 киназы | |
| KR20190053228A (ko) | 모르피난 유도체의 오피오이드 δ 수용체 아고니스트 관련 질환의 치료를 위한 사용 | |
| KR102128810B1 (ko) | 요산 또는 통풍 질환의 예방 또는 치료 | |
| NZ765534B2 (en) | P38 kinase inhibitors reduce dux4 and downstream gene expression for the treatment of fshd | |
| JP2024511801A (ja) | (フロピリミジン-4-イル)ピペラジン化合物及びその使用 | |
| JP2008120694A (ja) | ナフタレン−2,3−ジオール誘導体および抗癌剤 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20191106 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20191106 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20200909 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20201207 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20210121 |
|
| RD04 | Notification of resignation of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7424 Effective date: 20210301 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20210308 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20210604 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20210729 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20210922 |
|
| A711 | Notification of change in applicant |
Free format text: JAPANESE INTERMEDIATE CODE: A711 Effective date: 20211022 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20211022 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 6982748 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |