本明細書に別段の定義がない限り、本明細書で使用される全ての技術用語及び科学用語は、本発明の属する技術分野の当業者に一般的に理解される意味と同じ意味を有する。Singleton,et al.,DICTIONARY OF MICROBIOLOGY AND MOLECULAR BIOLOGY,2D Ed.,John Wiley and Sons,New York(1994)、及びHale & Margham,THE HARPER COLLINS DICTIONARY OF BIOLOGY,Harper Perennial,NY(1991)は、本発明で使用される用語の多くの一般的な辞書を当業者に提供する。本明細書に記載されるものと同様または同等の任意の方法及び材料を本発明の実践または試験に使用することができるが、好ましい方法及び材料を記載する。数値範囲は、その範囲を定義する数の境界値を含む。別段の記載がない限り、それぞれ、核酸は5’から3’への配向で左から右に書かれ、アミノ酸配列はアミノからカルボキシへの配向で左から右に書かれる。当該技術分野の定義及び用語について、実践者は特にSambrook et al.,1989、及びAusubel FM et al.,1993を参照されたい。方法論、プロトコル、及び試薬は異なり得るため、本発明は、記載される特定の方法論、プロトコル、及び試薬に限定されないものと理解されたい。
数値範囲は、その範囲を定義する数の境界値を含む。
別段の記載がない限り、それぞれ、核酸は5’から3’への配向で左から右に書かれ、アミノ酸配列はアミノからカルボキシへの配向で左から右に書かれる。
本明細書において提供される見出しは、本明細書全体を参照することにより得ることのできる様々な態様または実施形態の限定ではない。したがって、直下に定義される用語は、本明細書全体を参照することによって、より十分に定義される。
定義
本明細書における「多特異性抗原結合タンパク質」という用語は、2つ以上の抗原に結合することのできる結合タンパク質を指すよう最も広義に使用される。特定の態様において、多特異性結合タンパク質は、二重特異性抗体、例えば、ヒト二重特異性抗体、ヒト化二重特異性抗体、キメラ二重特異性抗体、またはマウス二重特異性抗体を指す。特定の実施形態において、本明細書において提供される多特異性抗原結合タンパク質、例えば二重特異性抗体などは、2つの異なる抗原に結合する。特定の実施形態において、多特異性抗原結合タンパク質、例えば二重特異性抗体などは、1つの抗原上の異なるエピトープに結合する。
本明細書における「抗体」という用語は、最も広義に使用され、2つの重鎖及び2つの軽鎖を含む任意の免疫グロブリン(Ig)分子、ならびにその任意の断片、変異体、変異形、または派生物が所望の生物活性(例えば、エピトープ結合活性)を示す限り、それらを指す。抗体の例としては、本明細書に記載されるモノクローナル抗体、ポリクローナル抗体、多特異性抗体(例えば、二重特異性抗体)、及び抗体断片が挙げられる。抗体は、マウス型、キメラ型、ヒト型、ヒト化型、及び/または親和性成熟型であり得る。
基準枠として、本明細書において使用される場合、抗体は、免疫グロブリンG(IgG)の構造を指す。しかしながら、任意の免疫グロブリンクラスの抗体が本明細書に記載の発明的な方法に利用され得ることは、当業者には理解/認識されよう。明確にするために述べると、IgG分子は、一対の重鎖(HC)及び一対の軽鎖(LC)を含む。各LCは、1つの可変ドメイン(VL)及び1つの定常ドメイン(CL)を有し、各HCは、1つの可変ドメイン(VH)及び3つの定常ドメイン(CH1、CH2、及びCH3)を有する。CH1ドメインとCH2ドメインとは、ヒンジ領域で接続されている。この構造は当該技術分野において周知である。
簡潔に述べると、基本的な4本鎖抗体ユニットは、2つの軽(L)鎖及び2つの重(H)鎖から構成されたヘテロ四量体糖タンパク質である(IgM抗体は、J鎖と呼ばれるさらなるポリペプチドと併せて、5つの基本的なヘテロ四量体ユニットから成り、したがって10個の抗原結合部位を含み、一方で、分泌型IgA抗体は、J鎖と併せて2〜5つの基本的な4本鎖ユニットを含む多価集合体を形成するように重合することができる)。IgGの場合、4本鎖ユニットは、概して約150,000ダルトンである。各L鎖は、1つのジスルフィド共有結合によってH鎖に連結されており、一方で、2つのH鎖は、H鎖アイソタイプに応じて、1つ以上のジスルフィド結合によって互いに連結されている。各H鎖及びL鎖は、規則的に離隔した鎖内ジスルフィド架橋も有する。各H鎖は、N末端に可変ドメイン(VH)を有し、続いてα鎖及びγ鎖のそれぞれについては3つの定常ドメイン(CH)、そしてμ及びεアイソタイプについては4つのCHドメインを有する。各L鎖は、N末端に可変ドメイン(VL)を有し、続いてその他方の端部に定常ドメイン(CL)を有する。VLはVHと並び、CLは、重鎖の第1の定常ドメイン(CH1)と並んでいる。特定のアミノ酸残基が軽鎖可変ドメインと重鎖可変ドメインとの間に界面を形成すると考えられている。VHとVLとが一緒に対合することにより、単一の抗原結合部位が形成される。異なるクラスの抗体の構造及び特性については、例えば、Basic and Clinical Immunology,8th edition,Daniel P.Stites,Abba I.Terr and Tristram G.Parslow(eds.),Appleton & Lange,Norwalk,CT,1994,page 71 and Chapter 6を参照されたい。
いかなる脊椎動物種由来のL鎖も、それらの定常ドメインのアミノ酸配列に基づいて、カッパ及びラムダと呼ばれる2つの明確に異なる種類のうちの一方に割り当てられ得る。それらの重鎖の定常ドメイン(CH)のアミノ酸配列に応じて、免疫グロブリンが、異なるクラスまたはアイソタイプに割り当てられ得る。免疫グロブリンには、IgA、IgD、IgE、IgG、及びIgMの5つのクラスが存在し、それぞれ、α、δ、γ、ε、及びμと称される重鎖を有する。γ及びαクラスは、CH配列及び機能の比較的わずかな差異に基づいてサブクラスにさらに分割され、例えば、ヒトは、次のサブクラス:IgG1、IgG2、IgG3、IgG4、IgA1、及びIgA2を発現する。
「VL」ドメインという用語には、免疫グロブリン軽鎖のアミノ末端可変ドメインが含まれる。
「VHドメイン」という用語には、免疫グロブリン重鎖のアミノ末端可変ドメインが含まれる。
「CLドメイン」という用語には、例えばKabat位置でおよそ107A〜216(EU位置108〜214(カッパ))に伸びる免疫グロブリン軽鎖の定常領域ドメインが含まれる。カッパCドメインのEu/Kabat変換表が、以下に提供される。CLドメインはVLドメインに隣接しており、免疫グロブリン軽鎖のカルボキシ末端を含む。遺伝子スプライシングの結果として成熟CLドメイン内に存在するN末端のR残基を含む、ヒトカッパ軽鎖のCLドメインの例示的なアミノ酸配列が、下記の配列番号30に示されている。
本明細書において使用される場合、ヒトIgGの「CH1ドメイン」という用語は、例えば、Kabat付番方式でおよそ114位〜223位(EU位置118〜215)に伸びる免疫グロブリン重鎖の第1の(最もアミノ末端側の)定常領域ドメインを含む。CH1ドメインは、VHドメインに隣接しており、免疫グロブリン重鎖分子のヒンジ領域に対してアミノ末端側にあり、免疫グロブリン重鎖のFc領域の一部を形成せず、かつ、免疫グロブリン軽鎖定常ドメイン(すなわち、「CL」)と二量体化することができる。
IgG1重鎖(配列番号65)のEU/Kabat変換表が、以下に提供される。例示的なCH1配列は配列番号53に示され、ヒンジ配列は配列番号129に示され、CH2配列は配列番号130に示され、CH3配列は配列番号131に示されている。
本明細書において使用される場合、「相補性」という用語は、例えば本明細書に記載の多特異性抗原結合タンパク質の重鎖のCH1と軽鎖のCLとの界面における、重鎖/軽鎖対合に影響を及ぼす相互作用の組み合わせを指す。「立体的相補性」または「立体構造相補性」は、例えば、重鎖のCH1ドメインと軽鎖のCLドメインとの相互作用表面における、三次元構造の適合性を指す。「静電的相補性」は、例えば、重鎖のCH1ドメインと軽鎖のCLドメイン、及び/または重鎖のVHドメインと軽鎖のVLドメインとの相互作用表面における、負荷電原子及び/または正荷電原子の配置の適合性を指す。
ヒトIgG Fc領域の「CH2ドメイン」という用語は、通常、EU付番方式によるIgGの残基およそ231〜およそ340を含む。CH2ドメインは、別のドメインと密接に対合しないという点で独特である。そうではなく、2つのN結合分岐状炭水化物鎖が、インタクトな天然IgG分子の2つのCH2ドメイン間に介在している。この炭水化物は、ドメイン−ドメイン対合の代替を提供し、CH2ドメインの安定化に役立ち得ると推測されている。Burton,Mol.lmmunol.22:161−206(1985)。
「CH3ドメイン」という用語は、Fc領域内のCH2ドメインに対してC末端側の残基(すなわち、EU付番方式によるとIgGのおよそアミノ酸残基341〜およそアミノ酸残基447)を含む。
本明細書において使用される「Fc領域」という用語は、概して、免疫グロブリン重鎖のC末端ポリペプチド配列を含む二量体複合体を指し、ここでC末端ポリペプチド配列は、インタクト抗体のパパイン消化によって得ることのできるものである。Fc領域は、天然または変異形のFc配列を含み得る。免疫グロブリン重鎖のFc配列の境界は様々であり得るが、ヒトIgG重鎖Fc配列は、およそCys226位から、またはおよそPro230位から、Fc配列のカルボキシル末端までを含む。本明細書で別段の指定がない限り、Fc領域または定常領域内のアミノ酸残基の付番は、Kabat et al.,Sequences of Proteins of Immunological Interest,5th Ed.Public Health Service,National Institutes of Health,Bethesda,MD,1991に記載されている、EUインデックスとも呼ばれるEU付番方式に従う。免疫グロブリンのFc配列は、概して、2つの定常ドメイン、1つのCH2ドメイン、及び1つのCH3ドメインを含み、場合によりCH4ドメインを含む。本明細書における「Fcポリペプチド」とは、Fc領域を構成するポリペプチドのうちの1つ、例えば単量体Fcを意味する。Fcポリペプチドは、ヒトIgG1、IgG2、IgG3、またはIgG4サブタイプ、IgA、IgE、IgD、またはIgMなどの、任意の好適な免疫グロブリンから得ることができる。Fcポリペプチドは、マウス、例えばマウスIgG2aから得てもよい。Fc領域は、ジスルフィドによって互いに結び付けられたH鎖両方のカルボキシ末端部分を含む。抗体のエフェクター機能は、Fc領域内の配列によって決定され、この領域はまた、特定の型の細胞に見られるFc受容体(FcR)によって認識される部分である。いくつかの実施形態では、Fcポリペプチドは、野生型ヒンジ配列(一般にそのN末端にある)の一部または全てを含む。いくつかの実施形態では、Fcポリペプチドは、機能的または野生型のヒンジ配列を含まない。
「機能的Fc領域」は、天然配列Fc領域の「エフェクター機能」を保有する。例示的な「エフェクター機能」としては、C1q結合、CDC、Fc受容体結合、ADCC、食作用、細胞表面受容体(例えば、B細胞受容体;BCR)の下方制御などが挙げられる。このようなエフェクター機能は、一般に、Fc領域と結合ドメイン(例えば、抗体可変ドメイン)との結合を必要とし、例えば、本明細書における定義に開示される様々なアッセイを使用して査定することができる。
「天然配列Fc領域」は、自然に見出されるFc領域のアミノ酸配列と同一のアミノ酸配列を含む。天然配列ヒトFc領域には、天然配列ヒトIgG1 Fc領域(非A及びAアロタイプ)、天然配列ヒトIgG2 Fc領域、天然配列ヒトIgG3 Fc領域、及び天然配列ヒトIgG4 Fc領域、ならびにそれらの自然発生変異形が含まれる。天然配列Fc領域には、天然配列マウスIgG2aも含まれる。
「変異形Fc領域」は、少なくとも1個のアミノ酸修飾、好ましくは1個以上のアミノ酸置換(複数可)によって天然配列Fc領域のものとは異なるアミノ酸配列を含む。好ましくは、変異形Fc領域は、天然配列Fc領域または親ポリペプチドのFc領域と比較して少なくとも1個のアミノ酸置換、例えば、天然配列Fc領域内または親ポリペプチドのFc領域内に約1個〜約10個のアミノ酸置換、好ましくは約1個〜約5個のアミノ酸置換を有する。本明細書における変異形Fc領域は、好ましくは、天然配列Fc領域及び/または親ポリペプチドのFc領域と少なくとも約80%の相同性、最も好ましくはそれらと少なくとも約90%の相同性、より好ましくはそれらと少なくとも約95%、少なくとも約96%、少なくとも約97%、少なくとも約98%、または少なくとも約99%の相同性を保有する。
本明細書において使用される「Fc構成要素」は、ヒンジ領域、Fc領域のCH2ドメイン、またはCH3ドメインを指す。
特定の実施形態において、Fc領域は、好ましくは野生型ヒトIgG Fc領域に由来する、IgG Fc領域を含む。特定の実施形態において、Fc領域は、マウスIgG2aなどの「野生型」マウスIgGに由来する。「野生型」ヒトIgG Fcまたは「野生型」マウスIgG Fcとは、それぞれ、ヒト集団またはマウス集団内で自然に発生するアミノ酸の配列を意味する。当然ながら、Fc配列が個体間でわずかに異なり得るのと全く同じように、野生型配列に1つ以上の変更を行っても依然として本発明の範囲内のままであり得る。例えば、Fc領域は、グリコシル化部位の変異または非天然アミノ酸の包含などの変更を含んでもよい。
「可変領域」または「可変ドメイン」という用語は、抗原への抗体の結合に関与する抗体の重鎖または軽鎖のドメインを指す。天然抗体の重鎖及び軽鎖の可変ドメイン(それぞれ、VH及びVL)は、一般に、各ドメインが4つの保存フレームワーク領域(FR)及び3つの超可変領域(HVR)を含む同様の構造を有する。(例えば、Kindt et al.Kuby Immunology,61st ed.,W.H.Freeman and Co.,page 91(2007)を参照されたい。)抗原結合特異性を付与するには、単一のVHドメインまたはVLドメインで十分であり得る。さらに、特定の抗原に結合する抗体は、それぞれ、相補的なVLドメインまたはVHドメインのライブラリをスクリーニングするために、その抗原に結合する抗体のVHドメインまたはVLドメインを使用して単離することができる。例えば、Portolano et al.,J.Immunol.150:880−887(1993)、Clarkson et al.,Nature 352:624−628(1991)を参照されたい。
本明細書において使用される「抗原結合アーム」、「標的分子結合アーム」、「標的結合アーム」という表現、及びそれらの変化形は、目的の標的に特異的に結合する能力を有する、本明細書において提供される多特異性抗原結合タンパク質の構成部分を指す。概して、また好ましくは、抗原結合アームは、免疫グロブリンポリペプチド配列、例えば、免疫グロブリン軽鎖及び重鎖のCDR及び/または可変ドメイン配列の複合体である。
「標的」または「標的分子」は、多特異性抗原結合タンパク質の結合アームによって認識される部分を指す。例えば、多特異性抗原結合タンパク質が抗体である場合、標的は、文脈に応じて、単一の分子上もしくは異なる分子上のエピトープ、または病原体もしくは腫瘍細胞であり得る。同様に、多特異性抗原結合タンパク質が受容体−Fc融合タンパク質である場合、標的は、その受容体に対する同族の結合パートナーである。標的が標的結合アームの結合特異性によって決定されること、及び異なる標的結合アームが異なる標的を認識し得ることは、当業者には理解されよう。標的は、本明細書において提供される多特異性抗原結合タンパク質と、1μM Kd(Scatchard分析による)よりも高い親和性で結合することが好ましい。標的分子の例としては、サイトカイン及び/またはサイトカイン受容体、アドヘシン、成長因子及び/またはそれらの受容体、ホルモン、ウイルス粒子(例えば、RSV Fタンパク質、CMV、Staph A、インフルエンザ、C型肝炎ウイルス)、微生物(例えば、細菌細胞タンパク質、真菌細胞)、アドヘシン、CDタンパク質及びそれらの受容体などの血清可溶性タンパク質及び/またはそれらの受容体が挙げられるが、これらに限定されない。
本明細書において使用される「界面」という用語は、第1の抗体ドメイン内の1つ以上のアミノ酸と、第2の抗体ドメインの1つ以上のアミノ酸との相互作用から生じる、会合表面を指す。例示的な界面としては、例えば、CH1/CL、VH/VL、及びCH3/CH3が挙げられる。いくつかの実施形態では、界面は、例えば、界面を形成するアミノ酸間の水素結合、静電相互作用、または塩橋を含む。
「インタクト」または「全長」の抗体の一例は、抗原結合アーム、ならびにCL及び少なくとも重鎖定常ドメイン、CH1、CH2、及びCH3を含むものである。定常ドメインは、天然配列定常ドメイン(例えば、ヒト天然配列定常ドメイン)またはそのアミノ酸配列変異形であり得る。
本明細書において使用される「カップリング」という用語は、第1及び第2の重鎖ポリペプチド(すなわち、H1及びH2)を互いに連結させるために必要なステップ、例えば、共有結合の形成を指す。そのようなステップには、鎖間ジスルフィド結合を形成するための、第1及び第2の重鎖ポリペプチド(すなわち、H1及びH2)内のシステイン残基の還元、アニーリング、及び/または酸化が含まれる。カップリングは、化学的な架橋またはレドックス系の使用によって実現され得る。例えば、Humphreys et al.,J.lmmunol.Methods(1998)217:1−10、及びZhu et al.,Cancer Lett.,(1994)86:127−134を参照されたい。
「単一特異性」抗原結合タンパク質は、抗体などの抗原結合タンパク質が1つのエピトープのみに結合する能力を指す。「二重特異性」抗原結合タンパク質は、抗原結合タンパク質が2つの異なるエピトープに結合する能力を指す。「多特異性」抗原結合タンパク質は、抗原結合タンパク質が1つより多くのエピトープに結合する能力を指す。特定の実施形態において、多特異性抗体などの多特異性抗原結合タンパク質は、二重特異性抗原結合タンパク質または二重特異性抗体を包含する。本明細書において提供される二重特異性及び多特異性の抗原結合タンパク質については、エピトープは同じ抗原上に存在してもよく、各エピトープが異なる抗原上に存在してもよい。したがって、特定の実施形態において、本明細書において提供される多特異性抗原結合タンパク質、例えば二重特異性抗体などは、2つの異なる抗原に結合する。特定の実施形態において、多特異性抗原結合タンパク質、例えば二重特異性抗体などは、1つの抗原上の異なるエピトープに結合する。特定の実施形態において、本明細書において提供される多特異性抗原結合タンパク質は、約≦1μM、約≦100nM、約≦10nM、約≦1nM、約≦0.1nM、約≦0.01nM、または約≦0.001nM(例えば、約10−8M以下、例えば、約10−8M〜約10−13M、例えば、約10−9M〜約10−13M)の解離定数(Kd)で、各エピトープに結合する。
「抗体断片」は、インタクト抗体の一部分、好ましくはインタクト抗体の抗原結合領域または可変領域を含む。抗体断片の例としては、Fab断片、Fab’断片、F(ab’)2断片、及びFv断片;ダイアボディ(Db);タンデムダイアボディ(taDb)、線状抗体(例えば、米国特許第5,641,870号、Zapata et al.,Protein Eng.8(10):1057−1062(1995));一アーム抗体、単一可変ドメイン抗体、ミニボディ、一本鎖抗体分子;ならびに抗体断片から形成された多特異性抗体(例えば、Db−Fc、taDb−Fc、taDb−CH3、及び(scFV)4−Fcを含むがこれらに限定されない)が挙げられる。
本明細書において提供される抗体は、重鎖及び/または軽鎖の一部分が、特定の種に由来するかまたは特定の抗体クラスもしくはサブクラスに属する抗体中の対応する配列と同一または相同である一方で、鎖(複数可)の残部が、別の種に由来するかまたは別の抗体クラスもしくはサブクラスに属する抗体中の対応する配列と同一または相同である「キメラ」抗体、ならびに、そのような抗体の断片とすることができるが、ただし、それらが所望の生物活性を示すことを条件とする(米国特許第4,816,567号、及びMorrison et al.,Proc.Natl.Acad.Sci.USA 81:6851−6855(1984))。本明細書における目的のキメラ抗体には、非ヒト霊長類(例えば、旧世界ザル、類人猿など)由来の可変ドメイン抗原結合配列と、ヒト定常領域配列とを含む、霊長類化抗体が含まれる。
非ヒト(例えば、齧歯類)抗体の「ヒト化」形態は、非ヒト抗体に由来する配列を最小限に含んだキメラ抗体である。ほとんどの場合、ヒト化抗体は、レシピエントの超可変領域からの残基が、所望の抗体特異性、親和性、及び能力を有するマウス、ラット、ウサギ、または非ヒト霊長類などの非ヒト種(ドナー抗体)の超可変領域からの残基に置き換えられている、ヒト免疫グロブリン(レシピエント抗体)である。いくつかの事例では、ヒト免疫グロブリンのフレームワーク領域(FR)残基は、対応する非ヒト残基に置き換えられる。さらに、ヒト化抗体は、レシピエント抗体またはドナー抗体には見出されない残基を含んでもよい。これらの修飾は、抗体性能をさらに洗練するために行われる。一般に、ヒト化抗体は、少なくとも1つ、典型的には2つの可変ドメインの実質的に全てを含むことになり、ここで、超可変ループの全てまたは実質的に全てが、非ヒト免疫グロブリンのものに対応し、FRの全てまたは実質的に全てが、ヒト免疫グロブリン配列のものである。ヒト化抗体はまた、場合により、免疫グロブリン定常領域(Fc)の少なくとも一部分、典型的にはヒト免疫グロブリンのものを含むことになる。さらなる詳細については、Jones et al.,Nature 321:522−525(1986)、Riechmann et al.,Nature 332:323−329(1988)、及びPresta,Curr.Op.Struct.Biol.2:593−596(1992)を参照されたい。
本明細書において使用される「複合体」または「複合された」は、ペプチド結合ではない結合及び/または力(例えば、ファンデルワールス力、疎水性力、親水性力)によって互いに相互作用する2個以上の分子の会合を指す。一実施形態において、複合体は、ヘテロ多量体である。本明細書において使用される「タンパク質複合体」または「ポリペプチド複合体」という用語には、タンパク質複合体中のタンパク質に非タンパク質要素(例えば、毒素または検出剤などの化学分子を含むがこれらに限定されない)が共役した複合体が含まれることを理解されたい。
本明細書において提供される、「目的の抗原に結合する」多特異性抗原結合タンパク質は、多特異性抗原結合タンパク質が、タンパク質またはそのタンパク質を発現する細胞もしくは組織の標的化において診断剤及び/または治療剤として有用であり、かつ他のタンパク質と著しく交差反応しないような十分な親和性で、抗原、例えばタンパク質と結合するものである。そのような実施形態では、「非標的」タンパク質に対する抗原結合タンパク質の結合の程度は、蛍光標識細胞分取(FACS)分析または放射性免疫沈降法(RIA)またはELISAによって判定した場合の、抗体のその特定の標的タンパク質に対する結合の約10%未満となる。標的分子に対する多特異性抗原結合タンパク質の結合に関して、特定のポリペプチド標的上の特定のポリペプチドもしくはエピトープの「特異的結合」、またはそれに「特異的に結合する」、またはそれに「特異的な」という用語は、非特異的相互作用とは測定可能な程度に異なる結合を意味する(例えば、非特異的相互作用は、ウシ血清アルブミンまたはカゼインへの結合であり得る)。特異的結合は、例えば、ある分子の結合を対照分子の結合と比較して判定することによって測定することができる。例えば、特異的結合は、標的と同様の対照分子、例えば、過剰な非標識標的との競合によって判定することができる。この事例では、プローブに対する標識標的の結合が、過剰な非標識標的によって競合的に阻害される場合に、特異的結合が示される。本明細書において使用される特定のポリペプチド標的上の特定のポリペプチドまたはエピトープの「特異的結合」、またはそれに「特異的に結合する」、またはそれに「特異的な」という用語は、例えば、少なくとも約200nM、あるいは少なくとも約150nM、あるいは少なくとも約100nM、あるいは少なくとも約60nM、あるいは少なくとも約50nM、あるいは少なくとも約40nM、あるいは少なくとも約30nM、あるいは少なくとも約20nM、あるいは少なくとも約10nM、あるいは少なくとも約8nM、あるいは少なくとも約6nM、あるいは少なくとも約4nM、あるいは少なくとも約2nM、あるいは少なくとも約1nM、またはより高い親和性の標的に対するKdを有する分子によって示され得る。一実施形態において、「特異的結合」という用語は、多特異性抗原結合タンパク質が、特定のポリペプチド上の特定のポリペプチドまたはエピトープに結合し、いかなる他のポリペプチドまたはポリペプチドのエピトープにも実質的に結合しないことを指す。
「結合親和性」は、一般に、分子(例えば、抗体または多特異性抗原結合タンパク質)の単一結合部位とその結合パートナー(例えば、抗原)との非共有結合的相互作用の合計の強度を指す。別段の記載がない限り、本明細書において使用される場合、「結合親和性」は、結合対のメンバー(例えば、抗体及び抗原)間の1:1の相互作用を反映する固有の結合親和性を指す。分子XのそのパートナーYに対する親和性は、一般に、解離定数(Kd)によって表すことができる。例えば、Kdは、約200nM以下、約150nM以下、約100nM以下、約60nM以下、約50nM以下、約40nM以下、約30nM以下、約20nM以下、約10nM以下、約8nM以下、約6nM以下、約4nM以下、約2nM以下、または約1nM以下であり得る。親和性は、本明細書に記載の方法を含め、当該技術分野で知られる一般的な方法によって測定することができる。低親和性抗体は、概して、抗原にゆっくり結合し、容易に解離する傾向があり、一方で高親和性抗体は、概して、抗原により速く結合し、より長く結合したままである傾向がある。結合親和性の多様な測定方法が当該技術分野で知られており、それらのいずれも、本発明において使用することができる。
一実施形態において、「Kd」または「Kd値」は、−10応答単位(RU)において、固定化された標的(例えば、抗原)CM5チップを用い、25℃でBIAcore(商標)−2000またはBIAcore(商標)−3000(BIAcore,Inc.,Piscataway,NJ)を使用した、表面プラズモン共鳴アッセイを使用することによって測定される。簡潔に述べると、カルボキシメチル化デキストリンバイオセンサチップ(CM5、BIAcore Inc.)を、供給業者の指示に従って、N−エチル−N’−(3−ジメチルアミノプロピル)−カルボジイミド塩酸塩(EDC)及びN−ヒドロキシスクシンイミド(NHS)で作動させる。抗原を10mMの酢酸ナトリウム(pH4.8)で5μg/ml(約0.2μM)まで希釈した後、カップリングされたタンパク質のおよそ10応答単位(RU)を実現するように、5μl/分の流量で注入する。抗原の注入後、1Mのエタノールアミンを注入して、未反応基をブロッキングする。動態測定については、Fabの2倍段階希釈(例えば、0.78nM〜500nM)を、0.05% Tween 20(PBST)を含むPBSに、25℃で、およそ25μl/分の流量で注入する。会合速度(kon)及び解離速度(koff)は、単純な1対1のLangmuir結合モデル(BIAcore Evaluation Softwareバージョン3.2)を使用して、会合センサグラムと解離センサグラムとを同時に当てはめることによって計算される。平衡解離定数(Kd)は、koff/konの比として計算される。例えば、Chen et al.,J.Mol.Biol.293:865−881(1999)を参照されたい。上記の表面プラズモン共鳴アッセイによるオン速度が106M−1s−1を超える場合、このオン速度は、撹拌されたキュベットを備えるストップフロー装着分光光度計(Aviv Instruments)または8000シリーズSLM−Aminco分光光度計(ThermoSpectronic)などの分光計で測定される、漸増濃度の抗原の存在下で、PBS(pH7.2)中20nMの抗抗原抗体(Fab型)の25℃における蛍光発光強度(励起=295nm、発光=340nm、16nm帯域通過)の上昇または減少を測定する、蛍光消光技法を使用することによって、判定することができる。
本明細書において提供される多特異性抗原結合タンパク質、例えば抗体(例えば、二重特異性抗体)、断片、またはそれらの誘導体などに関する、「生物学的に活性な」及び「生物活性」及び「生物学的特徴」は、別段の指定がある場合を除いて、生体分子に結合する能力を有することを意味する。
「単離された」とは、様々なヘテロ多量体ポリペプチドを説明するために使用される場合、ヘテロ多量体が、それが発現された細胞もしくは細胞培養物から分離及び/または回収されていることを意味する。その自然環境の混入成分は、ヘテロ多量体の診断上または治療上の使用を妨げる材料であり、これには、酵素、ホルモン、及び他のタンパク質性または非タンパク質性の溶質が含まれ得る。特定の実施形態において、ヘテロ多量体は、(1)ローリー法により判定した場合にタンパク質の95重量%超、最も好ましくは99重量%超まで、(2)スピニングカップ配列決定装置(spinning cup sequenator)の使用によってN末端もしくは内部アミノ酸配列の少なくとも15個の残基を得るのに十分な程度まで、または(3)クーマシーブルーもしくは好ましくは銀染料を使用して、還元条件もしくは非還元条件下でSDS PAGEにより均質になるまで、精製される。しかしながら、通常は、単離されたポリペプチドは、少なくとも1つの精製ステップによって調製される。
本明細書において提供される多特異性抗原結合タンパク質は、概して、実質的な均質性が得られるまで精製される。「実質的に均質な」、「実質的に均質な形態」」、及び「実質的な均質性」という表現は、望ましくないポリペプチドの組み合わせから生じる副産物を実質的に欠いている生成物(例えば、ホモ多量体)を示すために使用される。
純度に関して表現される、実質的な均質性とは、副産物の量が、10重量%、9重量%、8重量%、7重量%、6重量%、4重量%、3重量%、2重量%、もしくは1重量%を超えないこと、または1重量%未満であることを意味する。一実施形態において、副産物は5%未満である。
「生体分子」は、核酸、タンパク質、炭水化物、脂質、及びそれらの組み合わせを指す。一実施形態において、生体分子は、天然に存在する。
抗体「エフェクター機能」は、抗体のFc領域(天然配列Fc領域またはアミノ酸配列変異形Fc領域)に起因する生物学的活性を指し、抗体アイソタイプに応じて異なる。抗体エフェクター機能の例としては、C1q結合及び補体依存性細胞傷害、Fc受容体結合、抗体依存性細胞媒介細胞傷害(ADCC)、食作用、細胞表面受容体(例えば、B細胞受容体)の下方制御、ならびにB細胞活性化が挙げられる。
「抗体依存性細胞媒介細胞傷害」または「ADCC」は、特定の細胞傷害性細胞(例えば、ナチュラルキラー(NK)細胞、好中球、及びマクロファージ)上に存在するFc受容体(FcR)に結合した分泌型Igにより、これらの細胞傷害性エフェクター細胞が、抗原を有する標的細胞に特異的に結合し、その後、細胞傷害剤で標的細胞を殺滅することが可能になる、細胞傷害の形態を指す。抗体は細胞傷害性細胞を「備えて」おり、このような殺滅には絶対的に必要である。ADCCを媒介するための主要な細胞であるNK細胞は、FcγRIIIのみを発現するが、一方で単球は、FcγRI、FcγRII、及びFcγRIIIを発現する。造血細胞でのFcR発現は、Ravetch and Kinet,Annu.Rev.Immunol.9:457−92(1991)の464頁の表3に要約されている。目的の分子のADCC活性を査定するためには、米国特許第5,500,362号または同第5,821,337号に記載のものなどのインビトロADCCアッセイを行うことができる。そのようなアッセイに有用なエフェクター細胞としては、末梢血単核細胞(PBMC)及びナチュラルキラー(NK)細胞が挙げられる。代替的または追加的に、目的の分子のADCC活性は、インビボで、例えば、Clynes et al.,Proc.Natl.Acad.Sci.USA 95:652−656(1998)に開示されているものなどの動物モデルにおいて査定することができる。
「Fc受容体」または「FcR」は、抗体のFc領域に結合する受容体を表す。好ましいFcRは、ヒトFcRである。さらに、好ましいFcRは、IgG抗体(ガンマ受容体)に結合するものであり、これには、FcγRI、FcγRII、及びFcγRIIIサブクラスの受容体が、これらの受容体の対立遺伝子変異形及び選択的スプライシング形態を含めて含まれる。FcγRII受容体には、FcγRIIA(「活性化受容体」)及びFcγRIIB(「阻害性受容体」)が含まれ、これらは、それらの細胞質側ドメインが主に異なる同様のアミノ酸配列を有する。活性化受容体FcγRIIAは、その細胞質側ドメイン内に免疫受容体チロシン系活性化モチーフ(ITAM)を含む。阻害性受容体FcγRIIBは、その細胞質側ドメイン内に免疫受容体チロシン系阻害モチーフ(ITIM)を含む(概説M.Daeron,Annu.Rev.Immunol.15:203−234(1997)を参照されたい)。FcRは、Ravetch and Kinet,Annu.Rev.Immunol.9:457−492(1991)、Capel et al.,Immunomethods 4:25−34(1994)、及びde Haas et al.,J.Lab.Clin.Med.126:330−41(1995)において概説されている。他のFcRは、将来特定されるものも含め、本明細書における「FcR」という用語に包含される。この用語には、胎児への母体IgGの移入に関与する、新生児型受容体であるFcRnも含まれる(Guyer et al.,J.Immunol.117:587(1976)及びKim et al.,J.Immunol.24:249(1994))。
「ヒトエフェクター細胞」は、1つ以上のFcRを発現し、かつエフェクター機能を行う白血球である。好ましくは、この細胞は、少なくともFcγRIIIを発現し、ADCCエフェクター機能を行う。ADCCを媒介するヒト白血球の例としては、末梢血単核細胞(PBMC)、ナチュラルキラー(NK)細胞、単球、細胞傷害性T細胞、及び好中球が挙げられ、PBMC及びNK細胞が好ましい。エフェクター細胞は、天然の源、例えば血液から単離することができる。
「体依存性細胞傷害」または「CDC」は、補体の存在下での標的細胞の溶解を指す。古典的補体経路の活性化は、同族抗原に結合している(適切なサブクラスの)抗体に補体系(C1q)の第1の成分が結合することにより開始される。補体活性化を査定するためには、例えば、Gazzano−Santoro et al.,J.lmmunol.Methods 202:163(1996)に記載のCDCアッセイを行うことができる。
「治療有効量」という用語は、対象における疾患もしくは障害を治療するための抗体(多特異性抗体を含む)、その抗原結合抗体断片、またはその誘導体の量を指す。腫瘍(例えば、がん性腫瘍)の場合、治療有効量の抗体または抗体断片(例えば、多特異性抗体または抗体断片は、がん細胞の数の低減、原発腫瘍サイズの低減、がん細胞が末梢器官に浸潤することの阻害(すなわち、ある程度の減速、好ましくは停止)、腫瘍転移の阻害(すなわち、ある程度の減速、好ましくは停止)、腫瘍成長のある程度の阻害、及び/または障害に関連する症状のうちの1つ以上のある程度の緩和を行うことができる。抗体またはその抗体断片またはその誘導体が、成長の防止及び/または既存のがん細胞の殺滅を行うことができる限り、それは、細胞増殖抑制性及び/または細胞傷害性であり得る。がん療法に関して、インビボでの有効性は、例えば、生存期間、疾患進行までの時間(TTP)、奏効率(RR)、奏効期間、及び/または生活の質を査定することによって測定することができる。
ここで「低減または阻害」とは、好ましくは20%以上、より好ましくは50%以上、最も好ましくは75%、85%、90%、95%、またはそれ以上の全体的な減少を引き起こす能力を意味する。低減または阻害は、治療されている障害の症状、転移の存在もしくはサイズ、原発腫瘍のサイズ、または血管形成障害における血管のサイズもしくは数に言及する場合がある。
「がん」及び「がん性」という用語は、未制御の細胞成長/増殖によって典型的に特徴付けられる哺乳動物の生理的状態を指すか、またはそれを表す。この定義には、良性及び悪性のがんが含まれる。がんの例としては、細胞腫、リンパ腫、芽細胞腫、肉腫、及び白血病が挙げられるが、これらに限定されない。そのようながんのより具体的な例としては、扁平上皮細胞がん、小細胞肺がん、非小細胞肺がん、肺の腺癌、肺の扁平上皮癌、腹膜のがん、肝細胞がん、消化管がんを含む胃がん、膵臓がん、膠芽腫、神経膠腫、子宮頸がん、卵巣がん、肝臓がん、膀胱がん、肝細胞腫、乳がん、結腸がん、結腸直腸がん、子宮内膜癌または子宮癌、唾液腺癌、腎臓がん(例えば、腎細胞癌)、肝臓がん、前立腺がん、外陰部がん、甲状腺がん、肝癌、肛門癌、陰茎癌、黒色腫、及び様々な種類の頭頸部がんが挙げられる。ここで「早期がん」とは、浸潤性もしくは転移性ではないがん、または0期、I期、もしくはII期のがんとして分類されるがんを意味する。「前がん性」という用語は、典型的にがんに先行するかもしくはがんに発達する病態または成長を指す。ここで「非転移性」とは、良性であるがん、あるいは、原発部位に留まり、リンパ管もしくは血管系または原発部位以外の組織に浸透していないがんを意味する。一般に、非転移性がんは、0期、I期、またはII期のがんであるあらゆるがん、そして時としてIII期がんである。
本明細書における「自己免疫疾患」は、個体自体の組織から生じ、かつそれを対象とする疾患もしくは障害、またはその共分離もしくは顕在化、またはそれから生じる状態である。自己免疫疾患もしくは障害の例としては、リウマチ性関節炎、自己免疫性溶血性貧血(例えば、免疫汎血球減少症、発作性夜間ヘモグロビン尿症)、自己免疫性血小板減少症(例えば、特発性血小板減少性紫斑病、免疫媒介性血小板減少症)、甲状腺炎(例えば、グレーブス病、橋本甲状腺炎、若年性リンパ性甲状腺炎、萎縮性甲状腺炎)、真性糖尿病I型またはインスリン依存性糖尿病、中枢神経系及び末梢神経系の脱髄性疾患(例えば、多発性硬化症、特発性脱髄性多発ニューロパチー、またはギラン・バレー症候群)、慢性炎症性脱髄性多発ニューロパチー、水疱性皮膚症、多形性紅斑、接触性皮膚炎、ならびに自己免疫性慢性活動性肝炎が挙げられるが、これらに限定されない。
本明細書において使用される「細胞傷害剤」という用語は、細胞の機能を阻害もしくは防止する物質、及び/または細胞の破壊を引き起こす物質を指す。この用語は、放射性アイソトープ(例えば、At211、I131、I125、Y90、Re186、Re188、Sm153、Bi212、Ra223、P32、及びLuの放射性アイソトープ)、化学療法剤、例えば、メトトレキサート、アドリアマイシン、ビンカアルカロイド(ビンクリスチン、ビンブラスチン、エトポシド)、ドキソルビシン、メルファラン、マイトマイシンC、クロラムブシル、ダウノルビシン、もしくは他の挿入剤、核酸分解酵素などの酵素及びその断片、抗生物質、及び細菌、真菌、植物、もしくは動物起源の小分子毒素または酵素活性毒素などの毒素(その断片及び/または変異形を含む)、ならびに本明細書に開示される様々な抗腫瘍剤、抗がん剤、及び化学療法剤を含むことを意図する。他の細胞傷害剤が本明細書に記載される。殺腫瘍剤は、腫瘍細胞の破壊を引き起こす。
本明細書において使用される場合、「薬学的に許容される」または「薬学的に適合性の」とは、生物学的または他の理由で望ましくないことのない材料を意味し、例えば、この材料は、いかなる著しい望ましくない生物学的効果をも引き起こすことなく、またはそれが含有されている組成物の他の成分のいずれとも有害な様式で相互作用することなく、患者に投与される薬学的組成物に組み込まれ得る。薬学的に許容される担体または賦形剤は、毒性学的及び製造的な試験の必要基準を満たしていること、及び/または米国食品医薬品局により作成されたInactive Ingredient Guideに含まれていることが好ましい。
本明細書において使用される「抗がん療法」は、対象のがんを低減または阻害する治療を指す。抗がん療法の例には、細胞傷害性放射線療法、ならびに、治療有効量の細胞傷害剤、化学療法剤、成長阻害剤、がんワクチン、血管形成阻害薬、プロドラッグ、サイトカイン、サイトカイン拮抗薬、副腎皮質ステロイド、免疫抑制剤、制吐薬、抗体もしくは抗体断片、または鎮痛薬を対象に投与することが含まれる。
本出願に使用される「プロドラッグ」という用語は、親薬物と比較すると腫瘍細胞に対する細胞傷害性が低く、より活性な親形態に酵素的に活性化または変換されることのできる、薬学的に活性な物質の前駆体または誘導体形態を指す。例えば、Wilman,“Prodrugs in Cancer Chemotherapy”Biochemical Society Transactions,14,pp.375−382,615th Meeting Belfast(1986)、及びStella et al.,“Prodrugs:A Chemical Approach to Targeted Drug Delivery,”Directed Drug Delivery,Borchardt et al.,(ed.),pp.247−267,Humana Press(1985)を参照されたい。プロドラッグとしては、より活性な細胞傷害性遊離薬物へと変換され得る、ホスフェート含有プロドラッグ、チオホスフェート含有プロドラッグ、サルフェート含有プロドラッグ、ペプチド含有プロドラッグ、D−アミノ酸修飾プロドラッグ、グリコシル化プロドラッグ、ベータ−ラクタム含有プロドラッグ、任意に置換されているフェノキシアセトアミドを含有するプロドラッグ、または任意に置換されているフェニルアセトアミドを含有するプロドラッグ、5−フルオロシトシン及び他の5−フルオロウリジンプロドラッグが挙げられるが、これらに限定されない。本明細書における使用のためにプロドラッグ形態に誘導体化することのできる細胞傷害薬の例には、上述の化学療法剤が含まれるが、これらに限定されない。
「対象」は、哺乳動物などの脊椎動物、例えばヒトである。哺乳動物には、家畜(例えばウシなど)、競技用動物、愛玩動物(例えばネコ、イヌ、及びウマなど)、霊長類、マウス、及びラットが含まれるが、これらに限定されない。
文脈による別段の記載がある場合を除いて、「第1の」ポリペプチド(例えば重鎖(H1)または軽鎖(L1)など)、及び「第2の」ポリペプチド(例えば重鎖(H2)または軽鎖(L2)など)という用語、ならびにそれらの変化形は、単なる総称識別子であり、本明細書において提供される多特異性抗原結合タンパク質の特定のもしくは具体的なポリペプチドまたは成分を特定するものと解釈されないものとする。
実施例で言及される市販の試薬は、別段の記載がない限り、製造業者の指示に従って使用した。以下の実施例及び本明細書全体においてATCC受入番号により特定される細胞の供給元は、American Type Culture Collection,Manassas,VAである。別段の注記がない限り、本発明は、本明細書上文、及び次の教本:Sambrook et al.(上記)、Ausubel et al.,Current Protocols in Molecular Biology(Green Publishing Associates and Wiley Interscience,NY,1989)、Innis et al.,PCR Protocols:A Guide to Methods and Applications(Academic Press,Inc.,NY,1990)、Harlow et al.,Antibodies:A Laboratory Manual(Cold Spring Harbor Press,Cold Spring Harbor,1988)、Gait,Oligonucleotide Synthesis(IRL Press,Oxford,1984)、Freshney,Animal Cell Culture,1987、Coligan et al.,Current Protocols in Immunology,1991に記載されるものなどの、組換えDNA技術の標準的手順を使用する。
本明細書における「約」の値またはパラメータへの言及は、本技術分野の当業者であれば容易に分かるそれぞれの値の通常の誤差範囲を指す。本明細書における「約」の値またはパラメータへの言及は、その値またはパラメータ自体に関する態様を含む(そして表す)。例えば、「約X」に言及する説明は、「X」の説明を含む。
本明細書に記載される本発明の態様及び実施形態には、態様及び実施形態を「含む」、それらから「成る」、及びそれらから「本質的に成る」が含まれることが理解される。
特許出願及び公報を含む、本明細書に引用される全ての参考文献は、参照によりそれらの全体が本明細書に援用される。
変異体または修飾された重鎖/軽鎖対を含む多特異性抗原結合タンパク質
本出願は、重鎖/軽鎖対合選択性を改善させる、CH1/CL界面及び/またはVH/VL界面における新規の変異の特定に基づく。
本明細書において提供される多特異性抗原結合タンパク質は、重鎖ならびに軽鎖ポリペプチドの可変ドメイン及び/または定常ドメイン内にある特定の残基におけるアミノ酸修飾を含む。当業者には理解されるように、様々な付番の慣例が、IgG可変領域配列内の特定のアミノ酸残基を指定するために用いられ得る。一般的に使用される付番の慣例には、Kabat及びEUインデックスの付番が含まれる(Kabat et al.,Sequences of Proteins of Immunological Interest,5th Ed,Public Health Service,National Institutes of Health,Bethesda,MD(1991)を参照されたい)。可変ドメインの補正または代替的な付番方式を含む他の慣例には、Chothia(Chothia C,Lesk AM(1987),J Mal Biol 196:901−917、Chothia,et al.(1989),Nature 342:877−883)、IMGT(Lefranc,et al.(2003),Dev Comp Immunol 27:55−77)、及びAHo(Honegger A,Pluckthun A(2001)J Mol Biol 309:657−670)が含まれる。これらの参考文献は、抗体配列の可変領域アミノ酸残基の位置を定義する、免疫グロブリン可変領域のアミノ酸配列付番スキームを提供する。
本明細書に別段の明示的な記載がない限り、実施例及び特許請求の範囲に記載される免疫グロブリン重鎖可変領域(すなわち、VH)アミノ酸残基(すなわち番号)への全ての言及は、Kabat付番方式に基づくものであり、VL残基への全ての言及も同様である。実施例及び特許請求の範囲に記載される免疫グロブリン重鎖定常領域CH1残基(すなわち番号)への全ての言及は、EU方式に基づくものであり、CL残基への全ての言及も同様である。KabatまたはEUインデックス付番に従う残基番号の知識を用いて、当業者は、一般的に使用される付番の慣例のいずれかに従って、本明細書に記載されるアミノ酸配列修飾を特定することができる。
本明細書における実施例及び特許請求の範囲は、KabatまたはEUインデックスを用いて特定のアミノ酸残基を特定するが、本明細書に全体が援用される配列表に記載される配列番号は、所与のポリペプチド内のアミノ酸の連続的付番を行うものであり、したがって、KabatまたはEUインデックスにより提供される対応するアミノ酸番号と一致しないことが理解される。例えば、配列番号53のセリン残基番号66は、EU付番方式におけるCH1のS183に対応する。
本明細書において提供される項目、成分、または要素(例えば「多特異性抗原結合タンパク質」)は、単数形で記載または特許請求され得るが、単数形への限定が明確に述べられている場合を除いて、複数形もその範囲内であることが想定される。
以下により詳細に記載されるように、本明細書では、修飾を有しない配列を有する多特異性抗原結合タンパク質と比較した場合に、改善された正確な重鎖/軽鎖対合及び/または改善された収率を有する、単一細胞内で産生され得る修飾された多特異性抗原結合タンパク質が提供される。特定の実施形態において、多特異性抗原結合タンパク質は、正確な重鎖/軽鎖対合(すなわち、第1のエピトープに結合することのできる第1の重鎖/軽鎖対(すなわち、H1/L1)を形成するための第1の重鎖H1(またはその断片)と第1の軽鎖L1との対合、及び、第2の(例えば異なる)エピトープに結合することのできる第2の重鎖/軽鎖対(すなわち、H2/L2)を形成するための第2の重鎖H2(またはその断片)と第2の軽鎖L2との対合)を促進する、VH/VL及び/またはCH1/CL領域内の修飾(複数可)を含む。「H1」及び「H2」という用語が独断的名称であり、上記の実施形態のいずれにおける「H1」及び「H2」も反転できることは、当業者には明らかであろう。すなわち、H1のCH1ドメイン及びL1のCLドメイン内にあるものとして上述された変異のいずれも、代替的に、H2のCH1ドメイン及びL2のCLドメイン内に存在することができる。
特定の他の実施形態では、多特異性抗原結合タンパク質は、多特異性抗原結合タンパク質の2つのアームのヘテロ二量体化を促進するFc領域内の修飾(複数可)をさらに含む。
方略番号1
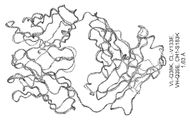
一態様において、驚くべきことに、重鎖のCH1ドメイン内のS183位(EU付番)に対する単一のアミノ酸修飾、及び軽鎖のCLドメイン内のV133(EU付番)位に対する単一のアミノ酸修飾が、修飾された重鎖と修飾された軽鎖との間の優先的対合、及び、例えば修飾された重鎖と修飾されていない軽鎖との間、または例えば修飾されていない重鎖と修飾された軽鎖との間の対合の低減を示すことが見出された。これらの残基は発現データから選択され、重鎖CH1ドメインならびに軽鎖CLドメインの構造及び機能の知識ならびに研究によって確認された。図1〜3、11C、及び12Cを参照されたい。
したがって、特定の実施形態において、(a)第1の抗原に結合することができ、第1の重鎖ポリペプチド(H1)及び第1の軽鎖ポリペプチド(L1)を含む、第1の重鎖/軽鎖対と、(b)第2の抗原に結合することができ、第2の重鎖ポリペプチド(H2)及び第2の軽鎖ポリペプチド(L2)を含む、第2の重鎖/軽鎖対と、を含み、各H1及びH2が、重鎖可変ドメイン(VH)及び重鎖定常ドメイン(CH1)を含み、各L1及びL2が、軽鎖可変ドメイン(VL)及び軽鎖定常ドメイン(CL)を含み、H1のCH1ドメインが、S183位(EU付番)におけるアミノ酸置換を含み、CLドメインが、V133位(EU付番)におけるアミノ酸置換変異を含む、多特異性抗原結合タンパク質が提供される。特定の実施形態において、H1のCH1ドメインは、S183位(EU付番)におけるアミノ酸置換から成り(例えばそれから本質的に成り)、CLドメインは、V133位(EU付番)におけるアミノ酸置換変異から成る(例えばそれから本質的に成る)。特定の実施形態において、第1の抗原及び第2の抗原は同じである。特定の実施形態において、第1の重鎖/軽鎖対及び第2の重鎖/軽鎖対はそれぞれ、同じ抗原上の異なるエピトープに結合する。特定の実施形態において、第1の抗原及び第2の抗原は異なる。特定の実施形態において、多特異性抗原結合タンパク質は、2つの異なる抗原に結合する二重特異性抗体である。特定の実施形態において、二重特異性抗体は、拮抗薬または作動薬抗体である。特定の実施形態において、二重特異性抗体は、一方または両方の抗原に対する拮抗薬であり、一方で他の実施形態では、二重特異性抗体は、一方または両方の抗原に対する作動薬である。本明細書において提供される多特異性抗原結合タンパク質(例えば二重特異性抗体など)の抗原結合断片もまた想定される。
特定の実施形態において、多特異性抗原結合タンパク質のH1のCH1ドメイン上のS183位(EU付番)におけるアミノ酸は、正荷電アミノ酸残基に置き換えられ、多特異性抗原結合タンパク質のCLドメイン上のV133位(EU付番)におけるアミノ酸は、負荷電残基に置き換えられる。特定の実施形態において、H1のCH1ドメイン上のS183位(EU付番)におけるアミノ酸は、負荷電アミノ酸残基に置き換えられ、CLドメイン上のV133位(EU付番)におけるアミノ酸は、正荷電残基に置き換えられる。特定の実施形態において、正荷電残基は、RまたはKから成る群から選択される。特定の実施形態において、負荷電残基は、D及びEから成る群から選択される。
特定の実施形態において、多特異性抗原結合タンパク質のCH1ドメインは、S183A、S183T、S183V、S183Y、S183F、S183H、S183N、S183D、S183E、S183R、及びS183K(EU付番)から成る群から選択されるアミノ酸置換を含み、CLドメインは、V133E、V133S、V133L、V133W、V133K、V133R、及びV133D(EU付番)から成る群から選択されるアミノ酸置換を含む。
特定の実施形態において、多特異性抗原結合タンパク質のCH1ドメインは、S183A、S183T、S183V、S183Y、S183F、S183H、S183N、S183D、S183E、S183R、及びS183K(EU付番)から成る群から選択されるアミノ酸置換から成り(例えばそれから本質的に成り)、CLドメインは、V133E、V133S、V133L、V133W、V133K、V133R、及びV133D(EU付番)から成る群から選択されるアミノ酸置換から成る(例えばそれから本質的に成る)。
「H1」及び「H2」という用語が独断的名称であり、上記の実施形態のいずれにおける「H1」及び「H2」も反転できることは、当業者には明らかであろう。すなわち、H1のCH1ドメイン及びL1のCLドメイン内にあるものとして上述された変異のいずれも、代替的に、H2のCH1ドメイン及びL2のCLドメイン内に存在することができる。
したがって、H1のCH1ドメイン上のS183位(EU付番)における置換変異と、L1のCLドメイン上のV133位(EU付番)における置換変異との対の組み合わせのあらゆる可能性が想定される。特定の実施形態では、H1のCH1ドメイン上のS183位(EU付番)における置換変異と、L1のCLドメイン上のV133位(EU付番)における置換変異との特定の組み合わせが想定される。そのような組み合わせとしては、以下の表1に提供されるものが挙げられるが、これらに限定されない。
特定の実施形態において、多特異性抗原結合タンパク質は、S183DまたはS183E変異(EU付番)を含むH1のCH1ドメインと、V133K変異(EU付番)を含むL1のCLドメインとを含む。特定の実施形態において、多特異性抗原結合タンパク質は、H1のCH1ドメイン及びL1のCLドメインを含み、CH1ドメインは、S183DまたはS183E変異(EU付番)から成り、L1のCLドメインは、V133K変異(EU付番)から成る。
2つの例示的なIgG1 CH1ドメインアミノ酸配列(配列番号53及び配列番号109)、例示的なIgG2 CH1ドメインアミノ酸配列(配列番号109)、例示的なIgG2 CH1ドメイン配列(配列番号110)、例示的なIgG3 CH1ドメインアミノ酸配列(配列番号111)、例示的なIgG4 CH1ドメインアミノ酸配列(配列番号112)、例示的なラムダCLドメインアミノ酸配列(配列番号113)、及び例示的なカッパCLドメインアミノ酸配列(配列番号54)が、以下に提供される。
全長4D5 IgG1重鎖(配列番号55)及び軽鎖(配列番号56)のアミノ酸配列が、以下に提供される。
4D5 HC(ヒトIgG1):
4D5 LC(ヒトカッパ):
特定の実施形態において、多特異性抗原結合タンパク質は、カッパ軽鎖を含む。特定の実施形態において、多特異性抗原結合タンパク質は、配列番号1に記載のアミノ酸配列、または配列番号1に記載の配列におけるアミノ酸11〜116を含む、L1のCLドメインを含む。特定の実施形態において、多特異性抗原結合タンパク質は、配列番号2に記載のアミノ酸配列、または配列番号2に記載の配列におけるアミノ酸11〜116を含む、L1のCLドメインを含む。特定の実施形態において、多特異性抗原結合タンパク質は、配列番号3に記載のアミノ酸配列、または配列番号3に記載の配列におけるアミノ酸11〜116を含む、L1のCLドメインを含む。特定の実施形態において、多特異性抗原結合タンパク質は、配列番号4に記載のアミノ酸配列、または配列番号4に記載の配列におけるアミノ酸11〜116を含む、L1のCLドメインを含む。特定の実施形態において、多特異性抗原結合タンパク質は、配列番号5に記載のアミノ酸配列、または配列番号5に記載の配列におけるアミノ酸11〜116を含む、L1のCLドメインを含む。特定の実施形態において、多特異性抗原結合タンパク質は、配列番号6に記載のアミノ酸配列、または配列番号6に記載の配列におけるアミノ酸11〜116を含む、L1のCLドメインを含む。特定の実施形態において、多特異性抗原結合タンパク質は、配列番号7に記載のアミノ酸配列、または配列番号7に記載の配列におけるアミノ酸11〜116を含む、L1のCLドメインを含む。
配列番号1〜7のアミノ酸配列が、以下の表2Aに提供される。特定の実施形態において、多特異性抗原結合タンパク質は、これらの配列のいずれかに記載されるCLドメインを含む、第1の軽鎖ポリペプチドL1を含む。配列番号54に記載のCLドメインは、配列番号1〜7のアミノ酸11〜116に対応する。したがって、L1は、配列番号1〜7のいずれかに記載のアミノ酸11〜116を含む、CLドメインを含み得る。
カッパ軽鎖のCLドメイン内のアミノ酸133位(EU付番)は、配列番号1〜7のアミノ酸35位に対応する。
特定の実施形態において、多特異性抗原結合タンパク質は、ラムダ軽鎖を含む。特定の実施形態において、多特異性抗原結合タンパク質は、配列番号114に記載のアミノ酸配列を含む、L1のCLドメインを含む。特定の実施形態において、多特異性抗原結合タンパク質は、配列番号115に記載のアミノ酸配列を含む、L1のCLドメインを含む。特定の実施形態において、多特異性抗原結合タンパク質は、配列番号116に記載のアミノ酸配列を含む、L1のCLドメインを含む。特定の実施形態において、多特異性抗原結合タンパク質は、配列番号117に記載のアミノ酸配列を含む、L1のCLドメインを含む。特定の実施形態において、多特異性抗原結合タンパク質は、配列番号118に記載のアミノ酸配列を含む、L1のCLドメインを含む。特定の実施形態において、多特異性抗原結合タンパク質は、配列番号119に記載のアミノ酸配列を含む、L1のCLドメインを含む。特定の実施形態において、多特異性抗原結合タンパク質は、配列番号120に記載のアミノ酸配列を含む、L1のCLドメインを含む。
配列番号114〜120のアミノ酸配列が、以下の表2Bに提供される。
カッパ軽鎖のCLドメイン内のアミノ酸133位(EU付番)は、ラムダ軽鎖のCLドメイン内のアミノ酸133位(Kabat付番)に対応し、これは、配列番号114〜120のアミノ酸27位に対応する。
特定の実施形態において、多特異性抗原結合タンパク質は、IgG1重鎖、IgG2重鎖、IgG3重鎖、またはIgG4重鎖を含む。特定の実施形態において、多特異性抗原結合タンパク質は、配列番号8に記載のアミノ酸配列を含む、H1のCH1ドメインを含む。特定の実施形態において、多特異性抗原結合タンパク質は、配列番号9に記載のアミノ酸配列を含む、H1のCH1ドメインを含む。特定の実施形態において、多特異性抗原結合タンパク質は、配列番号10に記載のアミノ酸配列を含む、H1のCH1ドメインを含む。特定の実施形態において、多特異性抗原結合タンパク質は、配列番号11に記載のアミノ酸配列を含む、H1のCH1ドメインを含む。特定の実施形態において、多特異性抗原結合タンパク質は、配列番号12に記載のアミノ酸配列を含む、H1のCH1ドメインを含む。特定の実施形態において、多特異性抗原結合タンパク質は、配列番号13に記載のアミノ酸配列を含む、H1のCH1ドメインを含む。特定の実施形態において、多特異性抗原結合タンパク質は、配列番号14に記載のアミノ酸配列を含む、H1のCH1ドメインを含む。特定の実施形態において、多特異性抗原結合タンパク質は、配列番号15に記載のアミノ酸配列を含む、H1のCH1ドメインを含む。特定の実施形態において、多特異性抗原結合タンパク質は、配列番号16に記載のアミノ酸配列を含む、H1のCH1ドメインを含む。特定の実施形態において、多特異性抗原結合タンパク質は、配列番号101に記載のアミノ酸配列を含む、H1のCH1ドメインを含む。特定の実施形態において、多特異性抗原結合タンパク質は、配列番号102に記載のアミノ酸配列を含む、H1のCH1ドメインを含む。特定の実施形態において、多特異性抗原結合タンパク質は、配列番号121に記載のアミノ酸配列を含む、H1のCH1ドメインを含む。特定の実施形態において、多特異性抗原結合タンパク質は、配列番号122に記載のアミノ酸配列を含む、H1のCH1ドメインを含む。特定の実施形態において、多特異性抗原結合タンパク質は、配列番号123に記載のアミノ酸配列を含む、H1のCH1ドメインを含む。特定の実施形態において、多特異性抗原結合タンパク質は、配列番号124に記載のアミノ酸配列を含む、H1のCH1ドメインを含む。特定の実施形態において、多特異性抗原結合タンパク質は、配列番号125に記載のアミノ酸配列を含む、H1のCH1ドメインを含む。特定の実施形態において、多特異性抗原結合タンパク質は、配列番号126に記載のアミノ酸配列を含む、H1のCH1ドメインを含む。
配列番号8〜16、101〜102、及び121〜126のアミノ酸配列が、以下の表3に提供される。
IgG1、IgG2、IgG3、及びIgG4のCH1ドメイン内のアミノ酸183位は、配列番号8〜16、101〜102、及び121〜126のアミノ酸64位に対応する。
配列番号1〜7または配列番号1〜7及び114〜120のアミノ酸11〜116と、配列番号8〜15、101〜102、及び121〜126との、あらゆる対の組み合わせの可能性が想定される。特定の実施形態では、配列番号1〜7または配列番号1〜7及び114〜120のアミノ酸11〜116と、配列番号8〜15及び101及び102との、特定の組み合わせが想定される。そのような組み合わせとしては、以下の表4に提供されるものが挙げられるが、これらに限定されない(別段の記載がない限り、HCはIgG1 HCである)。
表4中の各対における第1の配列番号はCH1ドメイン配列を指し、表4中の各対における第2の配列番号はCLドメイン配列を指す。
「H1」及び「H2」という用語が独断的名称であり、上記の実施形態のいずれにおける「H1」及び「H2」も反転できることは、当業者には明らかであろう。すなわち、H1のCH1ドメイン及びL1のCLドメイン内にあるものとして上述された変異のいずれも、代替的に、H2のCH1ドメイン及びL2のCLドメイン内に存在することができる。
特定の実施形態において、多特異性抗原結合タンパク質は、CH1/CL変異を含み、変異を有しない多特異性抗原結合タンパク質もしくは変異を有しない各親の単一特異性抗原結合タンパク質と比較可能であるかまたはそれよりも優れている、正確なタンパク質フォールディング及び/または発現レベルを示す。
特定の実施形態において、多特異性抗原結合タンパク質のH2のCH1ドメイン及びL2のCLドメインは、アミノ酸置換を含まない。特定の実施形態において、多特異性抗原結合タンパク質のH2のCH1は、S183(EU付番)における置換を含まず、多特異性抗原結合タンパク質のL2のCLは、V133(EU付番)における置換を含まない。
特定の実施形態において、本明細書において提供される多特異性抗原結合タンパク質のH1が由来する親のH1は、本明細書において提供される多特異性抗原結合タンパク質のL1が由来する親のL1に対する著しい優先度を示さない。特定の実施形態において。特定の実施形態において、本明細書において提供される多特異性抗原結合タンパク質のH1が由来する親のH1は、本明細書において提供される多特異性抗原結合タンパク質のL1が由来する親のL1に対する優先度を示す。
「H1」及び「H2」という用語が独断的名称であり、上記の実施形態のいずれにおける「H1」及び「H2」も反転できることは、当業者には明らかであろう。すなわち、H1のCH1ドメイン及びL1のCLドメイン内にあるものとして上述された変異のいずれも、代替的に、H2のCH1ドメイン及びL2のCLドメイン内に存在することができる。
方略番号2
本出願人らは、コンピュータの誘導による設計及びヒトの誘導による設計に補助された第2の方略を使用し、重鎖のCH1ドメインと軽鎖のCLドメインとの相互作用表面を再設計して、互いと立体的に適合性(例えば立体構造的に適合性)であるCH1/CL変異体対を生成した。各CH1/CL変異体対における修飾されたCH1ドメインは、野生型CLとさほど立体的に適合性(例えば立体構造的に適合性)ではなく、野生型CLとの対合の減少を示す。それに応じて、各CH1/CL変異体対における修飾されたCLドメインは、野生型CH1とさほど立体的に適合性(例えば立体構造的に適合性)ではなく、野生型CH1との対合の減少を示す。驚くべきことに、CH1ドメインとCLドメインとの界面に修飾を含むFabのTmが、CH1/CLドメインに対応する変異を有しないFabのTmと同じまたは実質的に同じであったことが発見された。
後述の設計方略を使用して特定される変異は、上記(すなわち、方略番号1)に詳解したS183/V133変異から独立して使用されてもよく、それに加えて使用されてもよい。
第1の手法(すなわち、「手法A」)では、1個以上のアミノ酸置換変異を軽鎖のCLドメインに導入して、CH1ドメインと相互作用するCLドメインの表面上に「ノブ」(または隆起)を作り出した。それに応じて、1個以上のアミノ酸置換変異を重鎖のCH1ドメインに導入して、CLドメインと相互作用するCH1ドメインの表面上に「ホール」(または空洞)を作り出した。例えば、図11Aを参照されたい。特定の実施形態において、修飾されたCH1/CL配列を含む多特異性抗原結合タンパク質は、CH1ドメイン及びCLドメイン内にアミノ酸置換変異を有する重鎖と軽鎖との優先的対合をもたらす。特定の実施形態において、修飾されたCH1/CL配列を含む多特異性抗原結合タンパク質は、対応するCH1/CL変異を有しない多特異性抗原結合タンパク質と比較して上昇したタンパク質発現レベルを示す。特定の実施形態において、置換アミノ酸(複数可)は、荷電残基(複数可)に置き換えられない。
第2の手法(すなわち、「手法B」)では、2個以上のアミノ酸置換変異を軽鎖のCLドメインに導入して、CH1ドメインと相互作用するCLドメインの表面上に「ノブ」(または隆起)及び「ホール」(または空洞)を作り出した。それに応じて、2個以上の変異を重鎖のCH1ドメインに導入して、CLドメインと相互作用するCH1ドメインの表面に「ホール」及び「ノブ」を作り出した。例えば、図11Bを参照されたい。特定の実施形態において、修飾されたCH1/CL配列を含む多特異性抗原結合タンパク質は、CH1ドメイン及びCLドメイン内にアミノ酸置換変異を有する重鎖と軽鎖との優先的対合を示す。特定の実施形態において、修飾されたCH1/CL配列を含む多特異性抗原結合タンパク質は、対応するCH1/CL変異を有しない多特異性抗原結合タンパク質と比較して増加したタンパク質発現を示す。特定の実施形態において、置換アミノ酸(複数可)は、荷電残基(複数可)に置き換えられない。
H1の修飾されたCH1ドメイン及びL1の修飾されたCLドメインを含む多特異性抗原結合タンパク質は、重鎖/軽鎖対合に関する改善された安定性及び改善された特異性を示す。本明細書では、a)第1の抗原に結合することができ、第1の重鎖ポリペプチド(H1)及び第1の軽鎖ポリペプチド(L1)を含む、第1の重鎖/軽鎖対と、b)第2の抗原に結合することができ、第2の重鎖ポリペプチド(H2)及び第2の軽鎖ポリペプチド(L2)を含む、第2の重鎖/軽鎖対と、を含み、各H1及びH2が、重鎖可変ドメイン(VH)及び重鎖定常ドメイン(CH1)を含み、各L1及びL2が、軽鎖可変ドメイン(VL)及び軽鎖定常ドメイン(CL)を含み、H1のCH1ドメインが、F170位(EU付番)におけるアミノ酸置換を含み、CLドメインが、S176位(EU付番)におけるアミノ酸置換を含む、多特異性抗原結合タンパク質が提供される。特定の実施形態において、第1の抗原及び第2の抗原は同じである。特定の実施形態において、第1の重鎖/軽鎖対及び第2の重鎖/軽鎖対はそれぞれ、同じ抗原上の異なるエピトープに結合する。特定の実施形態において、第1の抗原及び第2の抗原は異なる。特定の実施形態において、多特異性抗原結合タンパク質のH1のCH1ドメインは、A141、S181、S183、及びV185(全てEU付番)から成る群から選択される1個以上のアミノ酸置換をさらに含む。特定の実施形態において、多特異性抗原結合タンパク質のL1のCLドメインは、F116、S131、V133、L135、S162、S174、及びT178(全てEU付番)から成る群から選択される1個以上のアミノ酸置換をさらに含む。特定の実施形態において、多特異性抗原結合タンパク質のL1のCLドメインは、F116、V133、L135、S162、S174、及びT178(全てEU付番)から成る群から選択される1個以上のアミノ酸置換をさらに含む。特定の実施形態において、多特異性抗原結合タンパク質のL1のCLドメインは、F116、S131、L135、S162、S174、及びT178(全てEU付番)から成る群から選択される1個以上のアミノ酸置換をさらに含む。特定の実施形態において、多特異性抗原結合タンパク質のL1のCLドメインは、F116、L135、S174、及びT178(全てEU付番)から成る群から選択される1個以上のアミノ酸置換をさらに含む。特定の実施形態において、多特異性抗原結合タンパク質のL1のCLドメインは、F116、L135、S162、S174、及びT178(全てEU付番)から成る群から選択される1個以上のアミノ酸置換をさらに含む。特定の実施形態において、アミノ酸置換は、立体的相補性をもたらす。特定の実施形態において、アミノ酸置換は、立体構造相補性をもたらす。特定の実施形態において、置換アミノ酸(複数可)は、荷電残基(複数可)に置き換えられない。
特定の実施形態において、多特異性抗原結合タンパク質のH1のCH1ドメインは、A141及びF170(全てEU付番)から成る群から選択される1個以上のアミノ酸置換を含む(例えばそれらから成るか、またはそれらから本質的に成る)。特定の実施形態において、多特異性抗原結合タンパク質のL1のCLドメインは、F116、L135、S176、及びT178(全てEU付番)から成る群から選択される1個以上のアミノ酸置換を含む。特定の実施形態において、アミノ酸置換は、立体的相補性をもたらす。特定の実施形態において、アミノ酸置換は、立体構造相補性をもたらす。
特定の実施形態において、多特異性抗原結合タンパク質のH1のCH1ドメインは、F170、S181、及びS183(全てEU付番)から成る群から選択される1個以上のアミノ酸置換を含む(例えばそれらから成るか、またはそれらから本質的に成る)。特定の実施形態において、多特異性抗原結合タンパク質のL1のCLドメインは、F116及びS176(全てEU付番)から成る群から選択される1個以上のアミノ酸置換を含む。特定の実施形態において、アミノ酸置換は、立体的相補性をもたらす。特定の実施形態において、アミノ酸置換は、立体構造相補性をもたらす。
特定の実施形態において、多特異性抗原結合タンパク質のH1のCH1ドメインは、アミノ酸置換F170(EU付番)を含む(例えばそれから成るか、またはそれから本質的に成る)。特定の実施形態において、多特異性抗原結合タンパク質のL1のCLドメインは、F116、L135、S174、S176、及びT178(全てEU付番)から成る群から選択される1個以上のアミノ酸置換を含む。特定の実施形態において、アミノ酸置換は、立体的相補性をもたらす。特定の実施形態において、アミノ酸置換は、立体構造相補性をもたらす。
特定の実施形態において、多特異性抗原結合タンパク質のH1のCH1ドメインは、F170、S183、及びV185(全てEU付番)から成る群から選択される1個以上のアミノ酸置換を含む(例えばそれらから成るか、またはそれらから本質的に成る)。特定の実施形態において、多特異性抗原結合タンパク質のL1のCLドメインは、F116、S176、及びT178(全てEU付番)から成る群から選択される1個以上のアミノ酸置換を含む。特定の実施形態において、アミノ酸置換は、立体的相補性をもたらす。特定の実施形態において、アミノ酸置換は、立体構造相補性をもたらす。
特定の実施形態において、多特異性抗原結合タンパク質のH1のCH1ドメインは、F170、S181、及びV185(全てEU付番)から成る群から選択される1個以上のアミノ酸置換を含む(例えばそれらから成るか、またはそれらから本質的に成る)。特定の実施形態において、多特異性抗原結合タンパク質のL1のCLドメインは、F116、L135、及びS176(全てEU付番)から成る群から選択される1個以上のアミノ酸置換を含む。特定の実施形態において、アミノ酸置換は、立体的相補性をもたらす。特定の実施形態において、アミノ酸置換は、立体構造相補性をもたらす。
特定の実施形態において、多特異性抗原結合タンパク質のH1のCH1ドメインは、A141及びF170(全てEU付番)から成る群から選択される1個以上のアミノ酸置換を含む(例えばそれらから成るか、またはそれらから本質的に成る)。特定の実施形態において、多特異性抗原結合タンパク質のL1のCLドメインは、F116、L135、S174、S176、及びT178(全てEU付番)から成る群から選択される1個以上のアミノ酸置換を含む。特定の実施形態において、アミノ酸置換は、立体的相補性をもたらす。特定の実施形態において、アミノ酸置換は、立体構造相補性をもたらす。
特定の実施形態において、多特異性抗原結合タンパク質のH1のCH1ドメインは、A141、F170、及びS181(全てEU付番)から成る群から選択される1個以上のアミノ酸置換を含む(例えばそれらから成るか、またはそれらから本質的に成る)。特定の実施形態において、多特異性抗原結合タンパク質のL1のCLドメインは、F116、L135、S174、S176、及びT178(全てEU付番)から成る群から選択される1個以上のアミノ酸置換を含む。特定の実施形態において、アミノ酸置換は、立体的相補性をもたらす。特定の実施形態において、アミノ酸置換は、立体構造相補性をもたらす。
特定の実施形態において、多特異性抗原結合タンパク質のH1のCH1ドメインは、F170、S181、S183、及びV185(全てEU付番)から成る群から選択される1個以上のアミノ酸置換を含む(例えばそれらから成るか、またはそれらから本質的に成る)。特定の実施形態において、多特異性抗原結合タンパク質のL1のCLドメインは、L135、S174、S176、及びT178(全てEU付番)から成る群から選択される1個以上のアミノ酸置換を含む。特定の実施形態において、アミノ酸置換は、立体的相補性をもたらす。特定の実施形態において、アミノ酸置換は、立体構造相補性をもたらす。
特定の実施形態において、多特異性抗原結合タンパク質のH1のCH1ドメインは、A141、F170、S183、及びV185(全てEU付番)から成る群から選択される1個以上のアミノ酸置換を含む(例えばそれらから成るか、またはそれらから本質的に成る)。特定の実施形態において、多特異性抗原結合タンパク質のL1のCLドメインは、F116、S174、S176、及びT178(全てEU付番)から成る群から選択される1個以上のアミノ酸置換を含む。特定の実施形態において、アミノ酸置換は、立体的相補性をもたらす。特定の実施形態において、アミノ酸置換は、立体構造相補性をもたらす。
特定の実施形態において、多特異性抗原結合タンパク質のH1のCH1ドメインは、A141、F170、S181、及びV185(全てEU付番)から成る群から選択される1個以上のアミノ酸置換を含む(例えばそれらから成るか、またはそれらから本質的に成る)。特定の実施形態において、多特異性抗原結合タンパク質のL1のCLドメインは、F116、L135、S176、及びT178(全てEU付番)から成る群から選択される1個以上のアミノ酸置換を含む。特定の実施形態において、アミノ酸置換は、立体的相補性をもたらす。特定の実施形態において、アミノ酸置換は、立体構造相補性をもたらす。
特定の実施形態において、多特異性抗原結合タンパク質のH1のCH1ドメインは、A141、F170、S181、及びS183(全てEU付番)から成る群から選択される1個以上のアミノ酸置換を含む(例えばそれから成るか、またはそれから本質的に成る)。特定の実施形態において、多特異性抗原結合タンパク質のL1のCLドメインは、F116、L135、S174、及びS176(全てEU付番)から成る群から選択される1個以上のアミノ酸置換を含む。特定の実施形態において、アミノ酸置換は、立体的相補性をもたらす。特定の実施形態において、アミノ酸置換は、立体構造相補性をもたらす。
特定の実施形態において、多特異性抗原結合タンパク質のH1のCH1ドメインは、アミノ酸置換F170(EU付番)を含む(例えばそれから成るか、またはそれから本質的に成る)。特定の実施形態において、多特異性抗原結合タンパク質のL1のCLドメインは、F116、L135、S176、及びT178(全てEU付番)から成る群から選択される1個以上のアミノ酸置換を含む。特定の実施形態において、アミノ酸置換は、立体的相補性をもたらす。特定の実施形態において、アミノ酸置換は、立体構造相補性をもたらす。
特定の実施形態において、多特異性抗原結合タンパク質のH1のCH1ドメインは、A141 F170、及びV185(EU付番)から成る群から選択される1個以上のアミノ酸置換を含む(例えばそれらから成るか、またはそれらから本質的に成る)。特定の実施形態において、多特異性抗原結合タンパク質のL1のCLドメインは、F116及びS176変異(全てEU付番)から成る群から選択される1個以上のアミノ酸置換を含む。特定の実施形態において、アミノ酸置換は、立体構造相補性をもたらす。
特定の実施形態において、多特異性抗原結合タンパク質のH1のCH1ドメインは、A141、F170、及びS183(EU付番)から成る群から選択される1個以上のアミノ酸置換を含む(例えばそれらから成るか、またはそれらから本質的に成る)。特定の実施形態において、多特異性抗原結合タンパク質のL1のCLドメインは、F116及びS176変異(全てEU付番)から成る群から選択される1個以上のアミノ酸置換を含む。特定の実施形態において、アミノ酸置換は、立体構造相補性をもたらす。
特定の実施形態において、多特異性抗原結合タンパク質のH1のCH1ドメインは、F170及びV185(EU付番)から成る群から選択される1個以上のアミノ酸置換を含む(例えばそれらから成るか、またはそれらから本質的に成る)。特定の実施形態において、多特異性抗原結合タンパク質のL1のCLドメインは、F116及びS176変異(全てEU付番)から成る群から選択される1個以上のアミノ酸置換を含む。特定の実施形態において、アミノ酸置換は、立体構造相補性をもたらす。
特定の実施形態において、CH1/CL界面内で、CH1ドメインの1個以上のアミノ酸残基が、一部または全てがより大きな側鎖体積を有する同等数のアミノ酸残基に置き換えられ、それにより、CH1ドメインの表面上に隆起が生成されるように、かつ、CLドメインの1個以上のアミノ酸残基が、一部または全てがより小さな側鎖体積を有する同等数のアミノ酸残基に置き換えられ、それにより、CLドメインの表面上に空洞が生成されるように、多特異性抗原結合タンパク質のH1のCH1ドメイン及びL1のCLドメインが変更される。特定の実施形態において、CH1ドメイン及びCLドメイン上の修飾は、CH1/CL界面における立体的相補性を提供する。特定の実施形態において、CH1ドメイン及びCLドメイン上の修飾は、CH1/CL界面における立体構造相補性を提供する。
特定の実施形態において、CH1/Cl界面内で、CLドメインの1個以上のアミノ酸残基が、一部または全てがより大きな側鎖体積を有する同等数のアミノ酸残基に置き換えられ、それにより、CLドメインの表面上に隆起が生成されるように、かつ、CH1ドメインの1個以上のアミノ酸残基が、一部または全てがより小さな側鎖体積を有する同等数のアミノ酸残基に置き換えられ、それにより、CH1ドメインの表面上に空洞が生成されるように、多特異性抗原結合タンパク質のH1のCH1ドメイン及びL1のCLドメインが変更される。特定の実施形態において、CLドメインの1個以上の置換アミノ酸残基は、S176を含む。特定の実施形態において、CH1ドメインの1個以上の置換アミノ酸残基は、F170を含む。特定の実施形態において、CH1ドメイン及びCLドメイン上の修飾は、界面における立体的相補性を提供する。特定の実施形態において、CH1ドメイン及びCLドメイン上の修飾は、界面における立体構造相補性を提供する。
特定の実施形態において、H1のCH1ドメインは、F170S及びF170A(EU付番)から成る群から選択されるアミノ酸置換を含み、L1のCLドメインは、S176F(EU付番)から成る群から選択されるアミノ酸置換を含む。
特定の実施形態において、H1のCH1ドメインは、F170S変異(EU付番)を含み、L1のCLドメインは、S176F変異(EU付番)を含む。特定の実施形態において、H1のCH1ドメインは、F170A変異(EU付番)を含み、L1のCLドメインは、S176F変異(EU付番)を含む。
特定の実施形態において、多特異性抗原結合タンパク質は、A141I、F170S、S181M、S183V、及びV185A変異(EU付番)を含む(それらから成るもの、及びそれらから本質的に成るものを含む)H1のCH1ドメインと、F116A、V133I、L135V、S162M、S174A、S176F、及びT178V変異(EU付番)を含む(それらから成るもの、またはそれらから本質的に成るものを含む)L1のCLドメインと、を含む。
特定の実施形態において、多特異性抗原結合タンパク質は、A141I、F170S、S181M、S183A、及びV185A変異(EU付番)を含む(それらから成るもの、及びそれらから本質的に成るものを含む)H1のCH1ドメインと、F116A、S131D、L135V、S162A、S174A、S176F、及びT178I変異(EU付番)を含む(それらから成るもの、またはそれらから本質的に成るものを含む)L1のCLドメインと、を含む。
特定の実施形態において、多特異性抗原結合タンパク質は、A141I、F170S、S181M、S183A、及びV185A変異(EU付番)を含む(それらから成るもの、及びそれらから本質的に成るものを含む)H1のCH1ドメインと、F116A、L135V、S174A、S176F、及びT178V変異(EU付番)を含む(それらから成るもの、またはそれらから本質的に成るものを含む)L1のCLドメインと、を含む。特定の実施形態において、多特異性抗原結合タンパク質は、A141I、F170S、S181M、S183A、及びV185A変異(EU付番)から成る(例えばそれらから本質的に成る)H1のCH1ドメインと、F116A、L135V、S174A、S176F、及びT178V変異(EU付番)から成る(例えばそれらから本質的に成る)L1のCLドメインと、を含む。
特定の実施形態において、多特異性抗原結合タンパク質は、A141I、F170A、S181M、S183V、及びV185A変異(EU付番)を含む(それらから成るもの、及びそれらから本質的に成るものを含む)H1のCH1ドメインと、F116A、L135V、S162M、S174A、S176F、及びT178V変異(EU付番)を含む(それらから成るもの、またはそれらから本質的に成るものを含む)L1のCLドメインと、を含む。
特定の実施形態において、多特異性抗原結合タンパク質は、F170S、S181M、S183A、及びV185A変異(EU付番)を含む(それらから成るもの、及びそれらから本質的に成るものを含む)H1のCH1ドメインと、L135V、S174A、S176F、及びT178V変異(EU付番)を含む(それらから成るもの、またはそれらから本質的に成るものを含む)L1のCLドメインと、を含む。
特定の実施形態において、多特異性抗原結合タンパク質は、A141I、F170S、S183A、及びV185A変異(EU付番)を含む(それらから成るもの、及びそれらから本質的に成るものを含む)H1のCH1ドメインと、F116A、S174A、S176F、及びT178V変異(EU付番)を含む(それらから成るもの、またはそれらから本質的に成るものを含む)L1のCLドメインと、を含む。
特定の実施形態において、多特異性抗原結合タンパク質は、A141I、F170S、S181M、及びV185A変異(EU付番)を含む(それらから成るもの、及びそれらから本質的に成るものを含む)H1のCH1ドメインと、F116A、L135V、S176F、及びT178V変異(EU付番)を含む(それらから成るもの、またはそれらから本質的に成るものを含む)L1のCLドメインと、を含む。
特定の実施形態において、多特異性抗原結合タンパク質は、A141I、F170S、S181M、及びS183A変異(EU付番)を含む(それらから成るもの、及びそれらから本質的に成るものを含む)H1のCH1ドメインと、F116A、L135V、S174A、及びS176F変異(EU付番)を含む(それらから成るもの、またはそれらから本質的に成るものを含む)L1のCLドメインと、を含む。
特定の実施形態において、多特異性抗原結合タンパク質は、F170S、S183A、及びV185A変異(EU付番)を含む(それらから成るもの、及びそれらから本質的に成るものを含む)H1のCH1ドメインと、F116A、S176F、及びT178V変異(EU付番)を含む(それらから成るもの、またはそれらから本質的に成るものを含む)L1のCLドメインと、を含む。
特定の実施形態において、多特異性抗原結合タンパク質は、F170S、S181M、及びV185A変異(EU付番)を含む(それらから成るもの、及びそれらから本質的に成るものを含む)H1のCH1ドメインと、F116A、L135V、及びS176F変異(EU付番)を含む(それらから成るもの、またはそれらから本質的に成るものを含む)L1のCLドメインと、を含む。
特定の実施形態において、多特異性抗原結合タンパク質は、F170S、S181M、及びS183A変異(EU付番)を含む(それらから成るもの、及びそれらから本質的に成るものを含む)H1のCH1ドメインと、F116A及びS176F変異(EU付番)を含む(それらから成るもの、またはそれらから本質的に成るものを含む)L1のCLドメインと、を含む。
特定の実施形態において、多特異性抗原結合タンパク質は、A141I、F170S、及びV185A変異(EU付番)を含む(それらから成るもの、及びそれらから本質的に成るものを含む)H1のCH1ドメインと、F116A及びS176F変異を含む(それらから成るもの、またはそれらから本質的に成るものを含む)L1のCLドメインと、を含む。
特定の実施形態において、多特異性抗原結合タンパク質は、A141I、F170S、及びS183A変異(EU付番)を含む(それらから成るもの、及びそれらから本質的に成るものを含む)H1のCH1ドメインと、F116A及びS176F変異を含む(それらから成るもの、またはそれらから本質的に成るものを含む)L1のCLドメインと、を含む。
特定の実施形態において、多特異性抗原結合タンパク質は、A141I、F170S、及びS181M変異(EU付番)を含む(それらから成るもの、及びそれらから本質的に成るものを含む)H1のCH1ドメインと、F116A、L135V、S174A、S176F、及びT178V変異EU付番)を含む(それらから成るもの、またはそれらから本質的に成るものを含む)L1のCLドメインと、を含む。特定の実施形態において、多特異性抗原結合タンパク質のL1のVLドメインは、Q38K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH1のVHドメインは、Q39E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39K置換変異(Kabat付番)を含む。特定の実施形態において、多特異性抗原結合タンパク質のL1のVLドメインは、Q38E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH1のVHドメインは、Q39K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39E置換変異(Kabat付番)を含む。
特定の実施形態において、多特異性抗原結合タンパク質は、F170S及びV185A変異(EU付番)を含む(それらから成るもの、及びそれらから本質的に成るものを含む)H1のCH1ドメインと、F116A及びS176F変異を含む(それらから成るもの、またはそれらから本質的に成るものを含む)L1のCLドメインと、を含む。
特定の実施形態において、多特異性抗原結合タンパク質は、A141I及びF170S変異(EU付番)を含む(それらから成るもの、及びそれらから本質的に成るものを含む)H1のCH1ドメインと、F116A、L135V、S174A、S176F、及びT178V変異(EU付番)を含む(それらから成るもの、またはそれらから本質的に成るものを含む)L1のCLドメインと、を含む。特定の実施形態において、多特異性抗原結合タンパク質のL1のVLドメインは、Q38K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH1のVHドメインは、Q39E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39K置換変異(Kabat付番)を含む。特定の実施形態において、多特異性抗原結合タンパク質のL1のVLドメインは、Q38E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH1のVHドメインは、Q39K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39E置換変異(Kabat付番)を含む。
特定の実施形態において、多特異性抗原結合タンパク質は、A141I及びF170S変異(EU付番)を含む(それらから成るもの、及びそれらから本質的に成るものを含む)H1のCH1ドメインと、F116A、L135V、S176F、及びT178V変異(EU付番)を含む(それらから成るもの、またはそれらから本質的に成るものを含む)L1のCLドメインと、を含む。
特定の実施形態において、多特異性抗原結合タンパク質は、A141I及びF170S変異(EU付番)を含む(それらから成るもの、及びそれらから本質的に成るものを含む)H1のCH1ドメインと、F116A、L135V、S174A、及びS176F変異(EU付番)を含む(それらから成るもの、またはそれらから本質的に成るものを含む)L1のCLドメインと、を含む。
特定の実施形態において、多特異性抗原結合タンパク質は、A141I及びF170S変異(EU付番)を含む(それらから成るもの、及びそれらから本質的に成るものを含む)H1のCH1ドメインと、F116A、S176F、及びT178V変異(EU付番)を含む(それらから成るもの、またはそれらから本質的に成るものを含む)L1のCLドメインと、を含む。
特定の実施形態において、多特異性抗原結合タンパク質は、A141I及びF170S変異(EU付番)を含む(それらから成るもの、及びそれらから本質的に成るものを含む)H1のCH1ドメインと、F116A、L135V、及びS176F変異(EU付番)を含む(それらから成るもの、またはそれらから本質的に成るものを含む)L1のCLドメインと、を含む。
特定の実施形態において、多特異性抗原結合タンパク質は、A141I及びF170S変異(EU付番)を含む(それらから成るもの、及びそれらから本質的に成るものを含む)H1のCH1ドメインと、F116A及びS176F変異(EU付番)を含む(それらから成るもの、またはそれらから本質的に成るものを含む)L1のCLドメインと、を含む。
特定の実施形態において、多特異性抗原結合タンパク質は、F170S変異(EU付番)を含む(それから成るもの、及びそれから本質的に成るものを含む)H1のCH1ドメインと、F116A、L135V、S174A、S176F、及びT178V変異(EU付番)を含む(それらから成るもの、またはそれらから本質的に成るものを含む)L1のCLドメインと、を含む。特定の実施形態において、多特異性抗原結合タンパク質のL1のVLドメインは、Q38K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH1のVHドメインは、Q39E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39K置換変異(Kabat付番)を含む。特定の実施形態において、多特異性抗原結合タンパク質のL1のVLドメインは、Q38E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH1のVHドメインは、Q39K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39E置換変異(Kabat付番)を含む。
特定の実施形態において、多特異性抗原結合タンパク質は、F170S変異(EU付番)を含む(それから成るもの、及びそれから本質的に成るものを含む)H1のCH1ドメインと、F116A、L135V、S176F、及びT178V変異(EU付番)を含む(それらから成るもの、またはそれらから本質的に成るものを含む)L1のCLドメインと、を含む。
特定の実施形態において、多特異性抗原結合タンパク質は、F170S変異(EU付番)を含む(それから成るもの、及びそれから本質的に成るものを含む)H1のCH1ドメインと、F116A、L135V、S174A、及びS176F変異(EU付番)を含む(それらから成るもの、またはそれらから本質的に成るものを含む)L1のCLドメインと、を含む。
特定の実施形態において、多特異性抗原結合タンパク質は、F170S変異(EU付番)を含む(それから成るもの、及びそれから本質的に成るものを含む)H1のCH1ドメインと、F116A、S176F、及びT178V変異(EU付番)を含む(それらから成るもの、またはそれらから本質的に成るものを含む)L1のCLドメインと、を含む。
特定の実施形態において、多特異性抗原結合タンパク質は、F170S変異(EU付番)を含む(それから成るもの、及びそれから本質的に成るものを含む)H1のCH1ドメインと、F116A、L135V、及びS176F変異(EU付番)を含む(それらから成るもの、またはそれらから本質的に成るものを含む)L1のCLドメインと、を含む。
特定の実施形態において、多特異性抗原結合タンパク質は、F170S変異(EU付番)を含む(それから成るもの、及びそれから本質的に成るものを含む)H1のCH1ドメインと、F116A及びS176F変異(EU付番)を含む(それらから成るもの、またはそれらから本質的に成るものを含む)L1のCLドメインと、を含む。
特定の実施形態において、多特異性抗原結合タンパク質は、A141I、F170S、S181M、S183V、及びV185A変異(EU付番)から成る群から選択される、1個以下、2個以下、3個以下、4個以下、または5個以下のアミノ酸変異を含む、H1のCH1ドメインを含む。
特定の実施形態において、多特異性抗原結合タンパク質は、A141I、F170S、S181M、S183A、及びV185A変異(EU付番)から成る群から選択される、1個以下、2個以下、3個以下、4個以下、または5個以下のアミノ酸変異を含む、H1のCH1ドメインを含む。
特定の実施形態において、多特異性抗原結合タンパク質は、A141I、F170S、S181M、S183A、及びV185A変異(EU付番)から成る群から選択される、1個以下、2個以下、3個以下、4個以下、または5個以下のアミノ酸変異から成る、H1のCH1ドメインを含む。
特定の実施形態において、多特異性抗原結合タンパク質は、A141I、F170A、S181M、S183V、及びV185A変異(EU付番)から成る群から選択される、1個以下、2個以下、3個以下、4個以下、または5個以下のアミノ酸変異を含む、H1のCH1ドメインを含む。
特定の実施形態において、多特異性抗原結合タンパク質は、F116A、V133I、L135V、S162M、S174A、S176F、及びT178V変異(EU付番)から成る群から選択される、1個以下、2個以下、3個以下、4個以下、5個以下、6個以下、または7個以下のアミノ酸変異を含む、L1のCLドメインを含む。
特定の実施形態において、多特異性抗原結合タンパク質は、F116A、S131D、L135V、S162A、S174A、S176F、及びT178I変異(EU付番)から成る群から選択される、1個以下、2個以下、3個以下、4個以下、5個以下、6個以下、または7個以下のアミノ酸変異を含む、L1のCLドメインを含む。
特定の実施形態において、多特異性抗原結合タンパク質は、F116A、L135V、S174A、S176F、及びT178V変異(EU付番)から成る群から選択される、1個以下、2個以下、3個以下、4個以下、または5個以下のアミノ酸変異を含む、L1のCLドメインを含む。
特定の実施形態において、多特異性抗原結合タンパク質は、F116A、L135V、S174A、S176F、及びT178V変異(EU付番)から成る群から選択される、1個以下、2個以下、3個以下、4個以下、または5個以下のアミノ酸変異から成る、L1のCLドメインを含む。
特定の実施形態において、多特異性抗原結合タンパク質は、F116A、L135V、S162M、S174A、S176F、及びT178V変異(EU付番)から成る群から選択される、1個以下、2個以下、3個以下、4個以下、5個以下、または6個以下のアミノ酸変異を含む、L1のCLドメインを含む。
上述のCH1ドメインとL1ドメインとの対の組み合わせのあらゆる可能性が想定される。
特定の実施形態において、多特異性抗原結合タンパク質は、カッパ軽鎖を含む。特定の実施形態において、多特異性抗原結合タンパク質は、配列番号17〜27のいずれかに記載のCLドメインを含む、第1の軽鎖ポリペプチドL1を含む。配列番号54に記載のCLドメインは、配列番号17〜27のアミノ酸11〜116に対応する。したがって、L1は、配列番号17〜27のいずれかに記載のアミノ酸11〜116を含む、CLドメインを含み得る。特定の実施形態において、多特異性抗原結合タンパク質は、配列番号17に記載のアミノ酸配列、または配列番号17に記載の配列におけるアミノ酸11〜116を含む、L1のCLドメインを含む。特定の実施形態において、多特異性抗原結合タンパク質は、配列番号18に記載のアミノ酸配列、または配列番号18に記載の配列におけるアミノ酸11〜116を含む、L1のCLドメインを含む。特定の実施形態において、多特異性抗原結合タンパク質は、配列番号19に記載のアミノ酸配列、または配列番号19に記載の配列におけるアミノ酸11〜116を含む、L1のCLドメインを含む。特定の実施形態において、多特異性抗原結合タンパク質は、配列番号20に記載のアミノ酸配列、または配列番号20に記載の配列におけるアミノ酸11〜116を含む、L1のCLドメインを含む。特定の実施形態において、多特異性抗原結合タンパク質は、配列番号21に記載のアミノ酸配列、または配列番号21に記載の配列におけるアミノ酸11〜116を含む、L1のCLドメインを含む。特定の実施形態において、多特異性抗原結合タンパク質は、配列番号22に記載のアミノ酸配列、または配列番号22に記載の配列におけるアミノ酸11〜116を含む、L1のCLドメインを含む。特定の実施形態において、多特異性抗原結合タンパク質は、配列番号23に記載のアミノ酸配列、または配列番号23に記載の配列におけるアミノ酸11〜116を含む、L1のCLドメインを含む。特定の実施形態において、多特異性抗原結合タンパク質は、配列番号24に記載のアミノ酸配列、または配列番号24に記載の配列におけるアミノ酸11〜116を含む、L1のCLドメインを含む。特定の実施形態において、多特異性抗原結合タンパク質は、配列番号25に記載のアミノ酸配列、または配列番号25に記載の配列におけるアミノ酸11〜116を含む、L1のCLドメインを含む。特定の実施形態において、多特異性抗原結合タンパク質は、配列番号26に記載のアミノ酸配列、または配列番号26に記載の配列におけるアミノ酸11〜116を含む、L1のCLドメインを含む。特定の実施形態において、多特異性抗原結合タンパク質は、配列番号27に記載のアミノ酸配列、または配列番号27に記載の配列におけるアミノ酸11〜116を含む、L1のCLドメインを含む。
特定の実施形態において、多特異性抗原結合タンパク質は、ラムダ軽鎖を含む。特定の実施形態において、多特異性抗原結合タンパク質は、配列番号127に記載のアミノ酸配列を含む、L1のCLドメインを含む。
配列番号17〜27及び127のアミノ酸配列が、以下の表5に提供される(別段の記載がない限り、LCはカッパLCである)。
CL内のアミノ酸116位、118位、131位、133位、135位、162位、164位、174位、176位、及び178位(EU付番)は、それぞれ、配列番号17〜27におけるアミノ酸18位、20位、33位、35位、37位、64位、66位、76位、78位、及び80位に対応する。カッパ鎖のCLドメイン内のアミノ酸116位、118位、131位、133位、135位、162位、164位、174位、176位、及び178位(EU付番)は、ラムダ軽鎖のCLドメイン内のアミノ酸116位、118位、131位、133位、135位、162位、164位、174位、176位、及び178位(Kabat付番)に対応する。ラムダ軽鎖のCLドメイン内のアミノ酸116位、118位、131位、133位、135位、162位、164位、174位、176位、及び178位(Kabat付番)は、それぞれ、配列番号127におけるアミノ酸10位、12位、25位、27位、29位、56位、59位、67,69位、及び71位に対応する。
特定の実施形態において、多特異性抗原結合タンパク質は、IgG1、IgG2、IgG3、またはIgG4重鎖を含む。特定の実施形態において、多特異性抗原結合タンパク質は、配列番号28に記載のアミノ酸配列を含む、H1のCH1ドメインを含む。特定の実施形態において、多特異性抗原結合タンパク質は、配列番号29に記載のアミノ酸配列を含む、H1のCH1ドメインを含む。特定の実施形態において、多特異性抗原結合タンパク質は、配列番号31に記載のアミノ酸配列を含む、H1のCH1ドメインを含む。特定の実施形態において、多特異性抗原結合タンパク質は、配列番号32に記載のアミノ酸配列を含む、H1のCH1ドメインを含む。特定の実施形態において、多特異性抗原結合タンパク質は、配列番号33に記載のアミノ酸配列を含む、H1のCH1ドメインを含む。特定の実施形態において、多特異性抗原結合タンパク質は、配列番号34に記載のアミノ酸配列を含む、H1のCH1ドメインを含む。特定の実施形態において、多特異性抗原結合タンパク質は、配列番号35に記載のアミノ酸配列を含む、H1のCH1ドメインを含む。特定の実施形態において、多特異性抗原結合タンパク質は、配列番号36に記載のアミノ酸配列を含む、H1のCH1ドメインを含む。特定の実施形態において、多特異性抗原結合タンパク質は、配列番号37に記載のアミノ酸配列を含む、H1のCH1ドメインを含む。特定の実施形態において、多特異性抗原結合タンパク質は、配列番号38に記載のアミノ酸配列を含む、H1のCH1ドメインを含む。特定の実施形態において、多特異性抗原結合タンパク質は、配列番号39に記載のアミノ酸配列を含む、H1のCH1ドメインを含む。特定の実施形態において、多特異性抗原結合タンパク質は、配列番号40に記載のアミノ酸配列を含む、H1のCH1ドメインを含む。特定の実施形態において、多特異性抗原結合タンパク質は、配列番号41に記載のアミノ酸配列を含む、H1のCH1ドメインを含む。特定の実施形態において、多特異性抗原結合タンパク質は、配列番号42に記載のアミノ酸配列を含む、H1のCH1ドメインを含む。特定の実施形態において、多特異性抗原結合タンパク質は、配列番号43に記載のアミノ酸配列を含む、H1のCH1ドメインを含む。特定の実施形態において、多特異性抗原結合タンパク質は、配列番号44に記載のアミノ酸配列を含む、H1のCH1ドメインを含む。特定の実施形態において、多特異性抗原結合タンパク質は、配列番号103に記載のアミノ酸配列を含む、H1のCH1ドメインを含む。特定の実施形態において、多特異性抗原結合タンパク質は、配列番号104に記載のアミノ酸配列を含む、H1のCH1ドメインを含む。特定の実施形態において、多特異性抗原結合タンパク質は、配列番号105に記載のアミノ酸配列を含む、H1のCH1ドメインを含む。
配列番号28〜44のアミノ酸配列が、以下の表6に提供される(別段の記載がない限り、HCはIgG1アイソタイプのものである)。
CH1内のアミノ酸141、170、181、183、及び185位(EU付番)は、それぞれ、配列番号28〜44及び103〜105のアミノ酸22、51、62、64、及び66位に対応する。
配列番号17〜27または配列番号17〜27及び127のアミノ酸11〜116と、上述の配列番号28〜44及び103〜105との対の組み合わせのあらゆる可能性が想定される。特定の実施形態では、配列番号17〜27または配列番号17〜27及び127のアミノ酸11〜116と、配列番号28〜44及び103〜105との、特定の組み合わせが想定される。そのような組み合わせとしては、以下の表7に提供されるものが挙げられるが、これらに限定されない。
表7中の各対における第1の配列番号はCH1ドメイン配列を指し、表7中の各対における第2の配列番号はCLドメイン配列を指す。
関連する態様では、a)第1の抗原に結合することができ、第1の重鎖配列(H1)及び第1の軽鎖配列(L1)を含む、第1の重鎖/軽鎖対と、b)第2の重鎖配列(H2)及び第2の軽鎖配列(L2)を含む第2の重鎖/軽鎖対と、を含み、各H1及びH2が、重鎖可変ドメイン(VH)及び重鎖定常ドメイン(CH1)を含み、各L1及びL2が、軽鎖可変ドメイン(VL)及び軽鎖定常ドメイン(CL)を含む、多特異性抗原結合タンパク質が提供され、CH1/CL界面内で、CH1ドメインの1個以上のアミノ酸残基が、一部はより大きな側鎖体積を有し、一部はより小さな側鎖体積を有する、同等数のアミノ酸残基に置き換えられ、それにより、CH1ドメインの表面上に隆起及び空洞が生成されるように、かつ、CLドメインの1個以上のアミノ酸残基が、一部はより小さな側鎖体積を有し、一部はより大きな側鎖体積を有する、同等数のアミノ酸残基に置き換えられ、それにより、CLドメインの表面上に空洞及び隆起が生成されるように、多特異性抗原結合タンパク質のH1のCH1ドメイン及びL1のCLドメインが変更される。特定の実施形態において、CH1ドメイン及びCLドメイン上の修飾は、界面における立体的相補性(例えば立体構造相補性など)を提供する。
特定の実施形態において、H1のCH1ドメインは、L128位におけるアミノ酸置換を含み、L1のCLドメインは、F118位及びL135位(EU付番)におけるアミノ酸置換を含む。特定の実施形態において、第1の抗原及び第2の抗原は同じである。特定の実施形態において、第1の重鎖/軽鎖対及び第2の重鎖/軽鎖対はそれぞれ、同じ抗原上の異なるエピトープに結合する。特定の実施形態において、第1の抗原及び第2の抗原は異なる。特定の実施形態において、H1のCH1ドメインは、L128位及びV185位(EU付番)におけるアミノ酸置換を含み、L1のCLドメインは、F118位及びL135位(EU付番)におけるアミノ酸置換を含む。特定の実施形態において、第1の抗原及び第2の抗原は同じである。特定の実施形態において、第1の重鎖/軽鎖対及び第2の重鎖/軽鎖対はそれぞれ、同じ抗原上の異なるエピトープに結合する。特定の実施形態において、第1の抗原及び第2の抗原は異なる。特定の実施形態において、多特異性抗原結合タンパク質のH1のCH1ドメインは、A141、F170、S181、及びS183(全てEU付番)から成る群から選択される1個以上のアミノ酸置換をさらに含む。特定の実施形態において、多特異性抗原結合タンパク質のL1のCLドメインは、S131、V133、S162、S176、及びT178(全てEU付番)から成る群から選択される1個以上のアミノ酸置換をさらに含む。特定の実施形態において、アミノ酸置換は、野生型配列のものと比較可能であるかまたはそれを上回る立体的相補性(例えば立体構造相補性など)をもたらす。特定の実施形態において、多特異性抗原結合タンパク質のL1のCLドメインは、S131、V133、S162、T164、S176、及びT178(全てEU付番)から成る群から選択される1個以上のアミノ酸置換をさらに含む。
特定の実施形態において、多特異性抗原結合タンパク質は、F128、A141、F170、S181、及びS183(EU付番)から選択される1個以上のアミノ酸置換を含む(それらから成るもの、及びそれらから本質的に成るものを含む)H1のCH1ドメインを含む。特定の実施形態において、多特異性抗原結合タンパク質は、V118、S131、V133、S135、S162、T164、S176、及びT178(EU付番)から選択される1個以上のアミノ酸置換を含む(それらから成るもの、またはそれらから本質的に成るものを含む)L1のCLドメインを含む。特定の実施形態において、アミノ酸置換は、野生型配列のものと比較可能であるかまたはそれを上回る立体的相補性(例えば立体構造相補性など)をもたらす。
特定の実施形態において、多特異性抗原結合タンパク質は、F128、A141、F170、S181、S183、及びV185(EU付番)から選択される1個以上のアミノ酸置換を含む(それらから成るもの、及びそれらから本質的に成るものを含む)H1のCH1ドメインを含む。特定の実施形態において、多特異性抗原結合タンパク質は、V118、S131、V133、S135、S162、T164、S176、及びT178(EU付番)から選択される1個以上のアミノ酸置換を含む(それらから成るもの、またはそれらから本質的に成るものを含む)L1のCLドメインを含む。特定の実施形態において、アミノ酸置換は、野生型配列のものと比較可能であるかまたはそれを上回る立体的相補性(例えば立体構造相補性など)をもたらす。
特定の実施形態において、多特異性抗原結合タンパク質は、F128、A141、F170、S181、S183、及びV185(EU付番)から選択される1個以上のアミノ酸置換を含む(それらから成るもの、及びそれらから本質的に成るものを含む)H1のCH1ドメインを含む。特定の実施形態において、多特異性抗原結合タンパク質は、V118、S131、V133、S135、S162、S176、及びT178(EU付番)から選択される1個以上のアミノ酸置換を含む(それらから成るもの、またはそれらから本質的に成るものを含む)L1のCLドメインを含む。特定の実施形態において、アミノ酸置換は、野生型配列のものと比較可能であるかまたはそれを上回る立体的相補性(例えば立体構造相補性など)をもたらす。
特定の実施形態において、多特異性抗原結合タンパク質は、L128F、A141M、F170M、S181I、及びS183A変異(EU付番)を含む(それらから成るもの、及びそれらから本質的に成るものを含む)H1のCH1ドメインと、F118V、S131T、V133A、L135Y、S162A、T164S、S176M、及びT178L変異(EU付番)を含む(それらから成るもの、またはそれらから本質的に成るものを含む)L1のCLドメインと、を含む。
特定の実施形態において、多特異性抗原結合タンパク質は、L128F、A141M、F170Y、S181I、S183A、及びV185A変異(EU付番)を含む(それらから成るもの、及びそれらから本質的に成るものを含む)H1のCH1ドメインと、F118V、S131T、V133A、L135F、S162A、S176A、及びT178L変異(EU付番)を含む(それらから成るもの、またはそれらから本質的に成るものを含む)L1のCLドメインと、を含む。
特定の実施形態において、多特異性抗原結合タンパク質は、L128F、A141T、F170M、S181T、S183A、及びV185L変異(EU付番)を含む(それらから成るもの、及びそれらから本質的に成るものを含む)H1のCH1ドメインと、F118V、S131T、V133A、L135F、S162A、T164S、S176T、及びT178L変異(EU付番)を含む(それらから成るもの、またはそれらから本質的に成るものを含む)L1のCLドメインと、を含む。
特定の実施形態において、多特異性抗原結合タンパク質は、L128F、A141M、F170M、S181T、及びS183A変異(EU付番)を含む(それらから成るもの、及びそれらから本質的に成るものを含む)H1のCH1ドメインと、F118V、S131T、V133A、L135F、S162M、T164S、S176M、及びT178L変異(EU付番)を含む(それらから成るもの、またはそれらから本質的に成るものを含む)L1のCLドメインと、を含む。
特定の実施形態において、多特異性抗原結合タンパク質は、L128F、A141M、F170M、S181I、及びS183A変異(EU付番)から成る群から選択される、1個以下、2個以下、3個以下、4個以下、または5個以下のアミノ酸変異を含む、H1のCH1ドメインを含む。
特定の実施形態において、多特異性抗原結合タンパク質は、L128F、A141M、F170Y、S181I、S183A、及びV185A変異(EU付番)から成る群から選択される、1個以下、2個以下、3個以下、4個以下、5個以下、または6個以下のアミノ酸変異を含む、H1のCH1ドメインを含む。
特定の実施形態において、多特異性抗原結合タンパク質は、L128F、A141T、F170M、S181T、S183A、及びV185L変異(EU付番)から成る群から選択される、1個以下、2個以下、3個以下、4個以下、5個以下、または6個以下のアミノ酸変異を含む、H1のCH1ドメインを含む。
特定の実施形態において、多特異性抗原結合タンパク質は、L128F、A141M、F170M、S181T、及びS183A変異(EU付番)から成る群から選択される、1個以下、2個以下、3個以下、4個以下、または5個以下のアミノ酸変異を含む、H1のCH1ドメインを含む。
特定の実施形態において、多特異性抗原結合タンパク質は、F118V、S131T、V133A、L135Y、S162A、T164S、S176M、及びT178L変異(EU付番)から成る群から選択される、1個以下、2個以下、3個以下、4個以下、5個以下、6個以下、7個以下、または8個以下のアミノ酸変異を含む、L1のCLドメインを含む。
特定の実施形態において、多特異性抗原結合タンパク質は、F118V、S131T、V133A、L135F、S162A、S176A、及びT178L変異(EU付番)から成る群から選択される、1個以下、2個以下、3個以下、4個以下、5個以下、6個以下、または7個以下のアミノ酸変異を含む、L1のCLドメインを含む。
特定の実施形態において、多特異性抗原結合タンパク質は、F118V、S131T、V133A、L135F、S162A、T164S、S176T、及びT178L変異(EU付番)から成る群から選択される、1個以下、2個以下、3個以下、4個以下、5個以下、6個以下、7個以下、または8個以下のアミノ酸変異を含む、L1のCLドメインを含む。
特定の実施形態において、多特異性抗原結合タンパク質は、F118V、S131T、V133A、L135F、S162M、T164S、S176M、及びT178L変異(EU付番)から成る群から選択される、1個以下、2個以下、3個以下、4個以下、5個以下、6個以下、7個以下、または8個以下のアミノ酸変異を含む、L1のCLドメインを含む。
上述のCH1ドメインとL1ドメインとの対の組み合わせのあらゆる可能性が想定される。
特定の実施形態において、多特異性抗原結合タンパク質は、カッパ軽鎖を含む。特定の実施形態において、多特異性抗原結合タンパク質は、配列番号45〜48のいずれかに記載のCLドメインを含む、第1の軽鎖ポリペプチドL1を含む。配列番号54に記載のCLドメインは、配列番号45〜48のアミノ酸11〜116に対応する。したがって、L1は、配列番号45〜48のいずれかに記載のアミノ酸11〜116を含む、CLドメインを含み得る。特定の実施形態において、多特異性抗原結合タンパク質は、配列番号45に記載のアミノ酸配列、または配列番号45に記載の配列におけるアミノ酸11〜116を含む、L1のCLドメインを含む。特定の実施形態において、多特異性抗原結合タンパク質は、配列番号46に記載のアミノ酸配列、または配列番号46に記載の配列におけるアミノ酸11〜116を含む、L1のCLドメインを含む。特定の実施形態において、多特異性抗原結合タンパク質は、配列番号47に記載のアミノ酸配列、または配列番号47に記載の配列におけるアミノ酸11〜116を含む、L1のCLドメインを含む。特定の実施形態において、多特異性抗原結合タンパク質は、配列番号48に記載のアミノ酸配列、または配列番号48に記載の配列におけるアミノ酸11〜116を含む、L1のCLドメインを含む。
特定の実施形態において、多特異性抗原結合タンパク質は、ラムダ軽鎖を含む。特定の実施形態において、多特異性抗原結合タンパク質は、配列番号128に記載のアミノ酸配列を含む、L1のCLドメインを含む。
特定の実施形態において、多特異性抗原結合タンパク質は、IgG1、IgG2、IgG3、またはIgG4重鎖を含む。特定の実施形態において、多特異性抗原結合タンパク質は、配列番号49に記載のアミノ酸配列を含む、H1のCH1ドメインを含む。特定の実施形態において、多特異性抗原結合タンパク質は、配列番号50に記載のアミノ酸配列を含む、H1のCH1ドメインを含む。特定の実施形態において、多特異性抗原結合タンパク質は、配列番号51に記載のアミノ酸配列を含む、H1のCH1ドメインを含む。特定の実施形態において、多特異性抗原結合タンパク質は、配列番号52に記載のアミノ酸配列を含む、H1のCH1ドメインを含む。特定の実施形態において、多特異性抗原結合タンパク質は、配列番号106に記載のアミノ酸配列を含む、H1のCH1ドメインを含む。特定の実施形態において、多特異性抗原結合タンパク質は、配列番号107に記載のアミノ酸配列を含む、H1のCH1ドメインを含む。特定の実施形態において、多特異性抗原結合タンパク質は、配列番号108に記載のアミノ酸配列を含む、H1のCH1ドメインを含む。配列番号45〜52及び106〜108のアミノ酸配列が、以下の表8に提供される(別段の記載がない限り、LCはカッパLCであり、別段の記載がない限り、HCは、IgG1アイソタイプのものである)。
CL内のアミノ酸116位、118位、131位、133位、135位、162位、164位、174位、176位、及び178位(EU付番)は、それぞれ、配列番号45〜48におけるアミノ酸18位、20位、33位、35位、37位、64位、66位、76位、78位、及び80位に対応する。カッパ鎖のCLドメイン内のアミノ酸116位、118位、131位、133位、135位、162位、164位、174位、176位、及び178位(EU付番)は、ラムダ軽鎖のCLドメイン内のアミノ酸116位、118位、131位、133位、135位、162位、164位、174位、176位、及び178位(Kabat付番)に対応する。ラムダ軽鎖のCLドメイン内のアミノ酸116位、118位、131位、133位、135位、162位、164位、174位、176位、及び178位(Kabat付番)は、それぞれ、配列番号128におけるアミノ酸10位、12位、25位、27位、29位、56位、59位、67位、69位、及び71位に対応する。
CH1内のアミノ酸128位、141位、170位、181位、183位、及び185位(EU付番)は、それぞれ、配列番号49〜52及び106〜108のアミノ酸9位、22位、51位、62位、64位、及び66位に対応する。
配列番号45〜48または配列番号45〜48のアミノ酸11〜116と、配列番号49〜52との対の組み合わせのあらゆる可能性が想定される。特定の実施形態において、多特異性抗原結合タンパク質は、配列番号45〜48のいずれかに記載のCLドメインを含む、第1の軽鎖ポリペプチドL1を含む。配列番号54に記載のCLドメインは、配列番号45〜48のアミノ酸11〜116に対応する。したがって、L1は、配列番号45〜48のいずれかに記載のアミノ酸11〜116を含む、CLドメインを含み得る。特定の実施形態では、配列番号45〜48または配列番号45〜48及び128のアミノ酸11〜116と、配列番号49〜52及び106〜108との、特定の組み合わせが想定される。そのような組み合わせとしては、配列番号49/配列番号45または配列番号45のアミノ酸11〜116、配列番号50/配列番号46または配列番号46のアミノ酸11〜116、配列番号106/配列番号46または配列番号46のアミノ酸11〜116、配列番号107/配列番号46または配列番号46のアミノ酸11〜116、配列番号108/配列番号46または配列番号46のアミノ酸11〜116、配列番号51/配列番号47または配列番号47のアミノ酸11〜116、配列番号50/配列番号128、配列番号106/配列番号128、配列番号107/配列番号128、配列番号108/配列番号128、及び配列番号52/配列番号48または配列番号48のアミノ酸11〜116が挙げられるが、これらに限定されない。
「H1」及び「H2」という用語が独断的名称であり、上記の実施形態のいずれにおける「H1」及び「H2」も反転できることは、当業者には明らかであろう。すなわち、H1のCH1ドメイン及びL1のCLドメイン内にあるものとして上述された変異のいずれも、代替的に、H2のCH1ドメイン及びL2のCLドメイン内に存在することができる。
上記のように、方略番号2により特定されるCH1/CL界面内の変異は、方略番号1により特定されるCH1/CL界面内の変異から独立して使用されてもよく、それに加えて使用されてもよい。
したがって、例えば、本明細書では、A141I、F170S、S181M、S183A、及びV185A置換変異(EU付番)を含むH1のCH1ドメインと、F116A、L135V、S174A、S176F、及びT178V置換変異(EU付番)を含むL1のCLドメインと、S183E置換変異(EU付番)を含むH2のCH1ドメインと、V133K置換変異(EU付番)を含むL2のCLドメインと、を含む、多特異性抗原結合タンパク質が提供される。追加的に、特定の実施形態において、多特異性抗原結合タンパク質のL1のVLドメインは、Q38K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH1のVHドメインは、Q39E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39K置換変異(Kabat付番)を含む。特定の実施形態において、多特異性抗原結合タンパク質は、A141I、F170S、S181M、S183A、及びV185A置換変異(EU付番)を含むH1のCH1ドメインと、F116A、L135V、S174A、S176F、及びT178V置換変異(EU付番)を含むL1のCLドメインと、S183E置換変異(EU付番)から成るH2のCH1ドメインと、V133K置換変異(EU付番)から成るL2のCLドメインと、を含む。追加的に、特定の実施形態において、多特異性抗原結合タンパク質のL1のVLドメインは、Q38K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH1のVHドメインは、Q39E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39K置換変異(Kabat付番)を含む。特定の実施形態において、多特異性抗原結合タンパク質は、A141I、F170S、S181M、S183A、及びV185A置換変異(EU付番)から成るH1のCH1ドメインと、F116A、L135V、S174A、S176F、及びT178V置換変異(EU付番)から成るL1のCLドメインと、S183E置換変異(EU付番)から成るH2のCH1ドメインと、V133K置換変異(EU付番)から成るL2のCLドメインと、を含む。特定の実施形態において、多特異性抗原結合タンパク質のL1のVLドメインは、Q38K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH1のVHドメインは、Q39E置換変異(Kabat付番)を含む。特定の実施形態において、多特異性抗原結合タンパク質のL2のVLドメインは、Q38E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39K置換変異(Kabat付番)を含む。追加的に、特定の実施形態において、多特異性抗原結合タンパク質のL1のVLドメインは、Q38K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH1のVHドメインは、Q39E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39K置換変異(Kabat付番)を含む。特定の実施形態において、多特異性抗原結合タンパク質のL1のVLドメインは、Q38E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH1のVHドメインは、Q39K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39E置換変異(Kabat付番)を含む。特定の実施形態において、多特異性抗原結合タンパク質は、配列番号29のアミノ酸配列を含む(またはそれから成るか、もしくはそれから本質的に成る)H1のCH1ドメインと、配列番号19または配列番号19に記載の配列におけるアミノ酸11〜116を含む(またはそれから成るか、もしくはそれから本質的に成る)L1のCLドメインと、配列番号15のアミノ酸配列を含む(またはそれから成るか、もしくはそれから本質的に成る)H2のCH1ドメインと、配列番号5または配列番号5に記載の配列におけるアミノ酸11〜116を含む(またはそれから成るか、もしくはそれから本質的に成る)L2のCLドメインと、を含む。
特定の実施形態において、多特異性抗原結合タンパク質は、A141I、F170S、S181M、S183A、及びV185A置換変異(EU付番)を含むH1のCH1ドメインと、F116A、L135V、S174A、S176F、及びT178V置換変異(EU付番)を含むL1のCLドメインと、S183K置換変異(EU付番)を含むH2のCH1ドメインと、V133E置換変異(EU付番)を含むL2のCLドメインと、を含む。特定の実施形態において、多特異性抗原結合タンパク質は、A141I、F170S、S181M、S183A、及びV185A置換変異(EU付番)を含むH1のCH1ドメインと、F116A、L135V、S174A、S176F、及びT178V置換変異(EU付番)を含むL1のCLドメインと、S183K置換変異(EU付番)から成るH2のCH1ドメインと、V133E置換変異(EU付番)から成るL2のCLドメインと、を含む。特定の実施形態において、多特異性抗原結合タンパク質は、A141I、F170S、S181M、S183A、及びV185A置換変異(EU付番)から成るH1のCH1ドメインと、F116A、L135V、S174A、S176F、及びT178V置換変異(EU付番)から成るL1のCLドメインと、S183K置換変異(EU付番)から成るH2のCH1ドメインと、V133E置換変異(EU付番)から成るL2のCLドメインと、を含む。特定の実施形態において、多特異性抗原結合タンパク質のL1のVLドメインは、Q38K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH1のVHドメインは、Q39E置換変異(Kabat付番)を含む。特定の実施形態において、多特異性抗原結合タンパク質のL2のVLドメインは、Q38E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39K置換変異(Kabat付番)を含む。特定の実施形態において、多特異性抗原結合タンパク質のL1のVLドメインは、Q38K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH1のVHドメインは、Q39E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39K置換変異(Kabat付番)を含む。特定の実施形態において、多特異性抗原結合タンパク質のL1のVLドメインは、Q38E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH1のVHドメインは、Q39K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39E置換変異(Kabat付番)を含む。
特定の実施形態において、多特異性抗原結合タンパク質は、A141I、F170S、S181M、S183A、及びV185A置換変異(EU付番)を含むH1のCH1ドメインと、F116A、L135V、S174A、S176F、及びT178V置換変異(EU付番)を含むL1のCLドメインと、L128F、A141M、F170M、S181I、及びS183A置換変異(EU付番)を含むH2のCH1ドメインと、F118V、S131T、V133A、L135Y、S162A、T164S、S176M、及びS178L置換変異(EU付番)を含むL2のCLドメインと、を含む。特定の実施形態において、多特異性抗原結合タンパク質のL1のVLドメインは、Q38K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH1のVHドメインは、Q39E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39K置換変異(Kabat付番)を含む。特定の実施形態において、多特異性抗原結合タンパク質のL1のVLドメインは、Q38E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH1のVHドメインは、Q39K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39E置換変異(Kabat付番)を含む。
特定の実施形態において、多特異性抗原結合タンパク質は、A141I、F170S、S181M、S183A、及びV185A置換変異(EU付番)を含むH1のCH1ドメインと、F116A、L135V、S174A、S176F、及びT178V置換変異(EU付番)を含むL1のCLドメインと、L128F、A141M、F170Y、S181I、S183A、及びV185A置換変異(EU付番)を含むH2のCH1ドメインと、F118V、S131T、V133A、L135F、S162A、S176A、及びT178L置換変異(EU付番)を含むL2のCLドメインと、を含む。特定の実施形態において、多特異性抗原結合タンパク質のL1のVLドメインは、Q38K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH1のVHドメインは、Q39E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39K置換変異(Kabat付番)を含む。特定の実施形態において、多特異性抗原結合タンパク質のL1のVLドメインは、Q38E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH1のVHドメインは、Q39K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39E置換変異(Kabat付番)を含む。
特定の実施形態において、多特異性抗原結合タンパク質は、A141I、F170S、S181M、S183A、及びV185A変異(EU付番)を含むH1のCH1ドメインと、F116A、L135V、S174A、S176F、及びT178V変異(EU付番)を含むL1のCLドメインと、L128F、A141T、F170M、S181T、S183A、及びV185L置換変異(EU付番)を含むH2のCH1ドメインと、F118V、S131T、V133A、L135F、S162A、T164S、S176T、及びT178L置換変異(EU付番)を含むL2のCLドメインと、を含む。特定の実施形態において、多特異性抗原結合タンパク質のL1のVLドメインは、Q38K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH1のVHドメインは、Q39E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39K置換変異(Kabat付番)を含む。特定の実施形態において、多特異性抗原結合タンパク質のL1のVLドメインは、Q38E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH1のVHドメインは、Q39K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39E置換変異(Kabat付番)を含む。
特定の実施形態において、多特異性抗原結合タンパク質は、A141I、F170S、S181M、S183A、及びV185A置換変異(EU付番)を含むH1のCH1ドメインと、F116A、L135V、S174A、S176F、及びT178V置換変異(EU付番)を含むL1のCLドメインと、L128F、A141M、F170M、S181T、及びS183A置換変異(EU付番)を含むH2のCH1ドメインと、F118V、S131T、V133A、L135F、S162M、T164S、S176M、及びT178L置換変異(EU付番)を含むL2のCLドメインと、を含む。特定の実施形態において、多特異性抗原結合タンパク質のL1のVLドメインは、Q38K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH1のVHドメインは、Q39E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39K置換変異(Kabat付番)を含む。特定の実施形態において、多特異性抗原結合タンパク質のL1のVLドメインは、Q38E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH1のVHドメインは、Q39K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39E置換変異(Kabat付番)を含む。
特定の実施形態において、多特異性抗原結合タンパク質は、A141I、F170S、S181M、S183A、及びV185A置換変異(EU付番)を含むH1のCH1ドメインと、F116A、L135V、S174A、S176F、及びT178V置換変異(EU付番)を含むL1のCLドメインと、A141I、F170S、S181M、S183V、及びV185A置換変異(EU付番)を含むH2のCH1ドメインと、F116A、V133I、L135V、S162M、S174A、S176F、及びT178V置換変異(EU付番)を含むL2のCLドメインと、を含む。特定の実施形態において、多特異性抗原結合タンパク質のL1のVLドメインは、Q38K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH1のVHドメインは、Q39E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39K置換変異(Kabat付番)を含む。特定の実施形態において、多特異性抗原結合タンパク質のL1のVLドメインは、Q38E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH1のVHドメインは、Q39K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39E置換変異(Kabat付番)を含む。
特定の実施形態において、多特異性抗原結合タンパク質は、A141I、F170S、S181M、S183A、及びV185A置換変異(EU付番)を含むH1のCH1ドメインと、F116A、L135V、S174A、S176F、及びT178V置換変異(EU付番)を含むL1のCLドメインと、A141I、F170S、S181M、S183A、及びV185A置換変異(EU付番)を含むH2のCH1ドメインと、F116A、S131D、L135V、S162A、S174A、S176F、及びT178I置換変異(EU付番)を含むL2のCLドメインと、を含む。特定の実施形態において、多特異性抗原結合タンパク質のL1のVLドメインは、Q38K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH1のVHドメインは、Q39E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39K置換変異(Kabat付番)を含む。特定の実施形態において、多特異性抗原結合タンパク質のL1のVLドメインは、Q38E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH1のVHドメインは、Q39K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39E置換変異(Kabat付番)を含む。
特定の実施形態において、多特異性抗原結合タンパク質は、A141I、F170S、S181M、S183A、及びV185A置換変異(EU付番)を含むH1のCH1ドメインと、F116A、L135V、S174A、S176F、及びT178V置換変異(EU付番)を含むL1のCLドメインと、A141I、F170A、S181M、S183V、及びV185A置換変異(EU付番)を含むH2のCH1ドメインと、F116A、L135V、S162M、S174A、S176F、及びT178V置換変異(EU付番)を含むL2のCLドメインと、を含む。特定の実施形態において、多特異性抗原結合タンパク質のL1のVLドメインは、Q38K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH1のVHドメインは、Q39E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39K置換変異(Kabat付番)を含む。特定の実施形態において、多特異性抗原結合タンパク質のL1のVLドメインは、Q38E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH1のVHドメインは、Q39K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39E置換変異(Kabat付番)を含む。
特定の実施形態において、多特異性抗原結合タンパク質は、L128F、A141M、F170Y、S181I、S183A、及びV185A変異(EU付番)を含むH1のCH1ドメインと、F118V、S131T、V133A、L135F、S162A、S176A、及びT178L変異(EU付番)を含むL1のCLドメインと、S183E置換変異(EU付番)を含むH2のCH1ドメインと、V133K置換変異(EU付番)を含むL2のCLドメインと、を含む。特定の実施形態において、多特異性抗原結合タンパク質のL1のVLドメインは、Q38K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH1のVHドメインは、Q39E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39K置換変異(Kabat付番)を含む。特定の実施形態において、多特異性抗原結合タンパク質のL1のVLドメインは、Q38E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH1のVHドメインは、Q39K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39E置換変異(Kabat付番)を含む。
特定の実施形態において、多特異性抗原結合タンパク質は、L128F、A141M、F170Y、S181I、S183A、及びV185A変異(EU付番)を含むH1のCH1ドメインと、F118V、S131T、V133A、L135F、S162A、S176A、及びT178L変異(EU付番)を含むL1のCLドメインと、S183K置換変異(EU付番)を含むH2のCH1ドメインと、V133E置換変異(EU付番)を含むL2のCLドメインと、を含む。特定の実施形態において、多特異性抗原結合タンパク質のL1のVLドメインは、Q38K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH1のVHドメインは、Q39E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39K置換変異(Kabat付番)を含む。特定の実施形態において、多特異性抗原結合タンパク質のL1のVLドメインは、Q38E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH1のVHドメインは、Q39K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39E置換変異(Kabat付番)を含む。
特定の実施形態において、多特異性抗原結合タンパク質は、L128F、A141M、F170Y、S181I、S183A、及びV185A置換変異(EU付番)を含むH1のCH1ドメインと、F118V、S131T、V133A、L135F、S162A、S176A、及びT178L置換変異(EU付番)を含むL1のCLドメインと、L128F、A141M、F170M、S181I、及びS183A置換変異(EU付番)を含むH2のCH1ドメインと、F118V、S131T、V133A、L135Y、S162A、T164S、S176M、及びS178L置換変異(EU付番)を含むL2のCLドメインと、を含む。特定の実施形態において、多特異性抗原結合タンパク質のL1のVLドメインは、Q38K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH1のVHドメインは、Q39E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39K置換変異(Kabat付番)を含む。特定の実施形態において、多特異性抗原結合タンパク質のL1のVLドメインは、Q38E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH1のVHドメインは、Q39K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39E置換変異(Kabat付番)を含む。
特定の実施形態において、多特異性抗原結合タンパク質は、L128F、A141M、F170Y、S181I、S183A、及びV185A置換変異(EU付番)を含むH1のCH1ドメインと、F118V、S131T、V133A、L135F、S162A、S176A、及びT178L置換変異(EU付番)を含むL1のCLドメインと、A141I、F170S、S181M、S183A、及びV185A置換変異(EU付番)を含むH2のCH1ドメインと、F116A、L135V、S174A、S176F、及びT178V置換変異(EU付番)を含むL2のCLドメインと、を含む。特定の実施形態において、多特異性抗原結合タンパク質のL1のVLドメインは、Q38K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH1のVHドメインは、Q39E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39K置換変異(Kabat付番)を含む。特定の実施形態において、多特異性抗原結合タンパク質のL1のVLドメインは、Q38E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH1のVHドメインは、Q39K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39E置換変異(Kabat付番)を含む。
特定の実施形態において、多特異性抗原結合タンパク質は、L128F、A141M、F170Y、S181I、S183A、及びV185A置換変異(EU付番)を含むH1のCH1ドメインと、F118V、S131T、V133A、L135F、S162A、S176A、及びT178L置換変異(EU付番)を含むL1のCLドメインと、L128F、A141T、F170M、S181T、S183A、及びV185L置換変異(EU付番)を含むH2のCH1ドメインと、F118V、S131T、V133A、L135F、S162A、T164S、S176T、及びT178L置換変異(EU付番)を含むL2のCLドメインと、を含む。特定の実施形態において、多特異性抗原結合タンパク質のL1のVLドメインは、Q38K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH1のVHドメインは、Q39E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39K置換変異(Kabat付番)を含む。特定の実施形態において、多特異性抗原結合タンパク質のL1のVLドメインは、Q38E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH1のVHドメインは、Q39K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39E置換変異(Kabat付番)を含む。
特定の実施形態において、多特異性抗原結合タンパク質は、L128F、A141M、F170Y、S181I、S183A、及びV185A置換変異(EU付番)を含むH1のCH1ドメインと、F118V、S131T、V133A、L135F、S162A、S176A、及びT178L置換変異(EU付番)を含むL1のCLドメインと、L128F、A141M、F170M、S181T、及びS183A置換変異(EU付番)を含むH2のCH1ドメインと、F118V、S131T、V133A、L135F、S162M、T164S、S176M、及びT178L置換変異(EU付番)を含むL2のCLドメインと、を含む。特定の実施形態において、多特異性抗原結合タンパク質のL1のVLドメインは、Q38K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH1のVHドメインは、Q39E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39K置換変異(Kabat付番)を含む。特定の実施形態において、多特異性抗原結合タンパク質のL1のVLドメインは、Q38E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH1のVHドメインは、Q39K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39E置換変異(Kabat付番)を含む。
特定の実施形態において、多特異性抗原結合タンパク質は、L128F、A141M、F170Y、S181I、S183A、及びV185A置換変異(EU付番)を含むH1のCH1ドメインと、F118V、S131T、V133A、L135F、S162A、S176A、及びT178L置換変異(EU付番)を含むL1のCLドメインと、A141I、F170S、S181M、S183V、及びV185A置換変異(EU付番)を含むH2のCH1ドメインと、F116A、V133I、L135V、S162M、S174A、S176F、及びT178V置換変異(EU付番)を含むL2のCLドメインと、を含む。特定の実施形態において、多特異性抗原結合タンパク質のL1のVLドメインは、Q38K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH1のVHドメインは、Q39E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39K置換変異(Kabat付番)を含む。特定の実施形態において、多特異性抗原結合タンパク質のL1のVLドメインは、Q38E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH1のVHドメインは、Q39K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39E置換変異(Kabat付番)を含む。
「H1」及び「H2」という用語が独断的名称であり、上記の実施形態のいずれにおける「H1」及び「H2」も反転できることは、当業者には明らかであろう。すなわち、H1のCH1ドメイン及び/またはVHドメインならびにL1のCLドメイン及び/またはVLドメイン内にあるものとして上述された変異のいずれも、代替的に、H2のCH1ドメイン及び/またはVHドメインならびにL2のCLドメイン及び/またはVLドメイン内に存在することができる。
特定の実施形態において、多特異性抗原結合タンパク質は、L128F、A141M、F170Y、S181I、S183A、及びV185A置換変異(EU付番)を含むH1のCH1ドメインと、F118V、S131T、V133A、L135F、S162A、S176A、及びT178L置換変異(EU付番)を含むL1のCLドメインと、A141I、F170S、S181M、S183A、及びV185A置換変異(EU付番)を含むH2のCH1ドメインと、F116A、S131D、L135V、S162A、S174A、S176F、及びT178I置換変異(EU付番)を含むL2のCLドメインと、を含む。特定の実施形態において、多特異性抗原結合タンパク質のL1のVLドメインは、Q38K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH1のVHドメインは、Q39E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39K置換変異(Kabat付番)を含む。特定の実施形態において、多特異性抗原結合タンパク質のL1のVLドメインは、Q38E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH1のVHドメインは、Q39K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39E置換変異(Kabat付番)を含む。
特定の実施形態において、多特異性抗原結合タンパク質は、L128F、A141M、F170Y、S181I、S183A、及びV185A置換変異(EU付番)を含むH1のCH1ドメインと、F118V、S131T、V133A、L135F、S162A、S176A、及びT178L置換変異(EU付番)を含むL1のCLドメインと、A141I、F170A、S181M、S183V、及びV185A置換変異(EU付番)を含むH2のCH1ドメインと、F116A、L135V、S162M、S174A、S176F、及びT178V置換変異(EU付番)を含むL2のCLドメインと、を含む。特定の実施形態において、多特異性抗原結合タンパク質のL1のVLドメインは、Q38K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH1のVHドメインは、Q39E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39K置換変異(Kabat付番)を含む。特定の実施形態において、多特異性抗原結合タンパク質のL1のVLドメインは、Q38E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH1のVHドメインは、Q39K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39E置換変異(Kabat付番)を含む。
「H1」及び「H2」という用語が独断的名称であり、上記の実施形態のいずれにおける「H1」及び「H2」も反転できることは、当業者には明らかであろう。すなわち、H1のCH1ドメイン及び/またはVHドメインならびにL1のCLドメイン及び/またはVLドメイン内にあるものとして上述された変異のいずれも、代替的に、H2のCH1ドメイン及び/またはVHドメインならびにL2のCLドメイン及び/またはVLドメイン内に存在することができる。
特定の実施形態において、本明細書において提供される多特異性抗原結合タンパク質は、1個以下のアミノ酸置換変異、2個以下のアミノ酸置換変異、3個以下のアミノ酸置換変異、5個以下のアミノ酸置換変異、または6個以下のアミノ酸置換、7個以下のアミノ酸置換、8個以下のアミノ酸置換、9個以下のアミノ酸置換、10個以下のアミノ酸置換、11個以下のアミノ酸置換、もしくは12個以下のアミノ酸置換を含む、H1のCH1ドメインを含む。
特定の実施形態において、本明細書において提供される多特異性抗原結合タンパク質は、1個以下のアミノ酸置換変異、2個以下のアミノ酸置換変異、3個以下のアミノ酸置換変異、5個以下のアミノ酸置換変異、または6個以下のアミノ酸置換、7個以下のアミノ酸置換、8個以下のアミノ酸置換、9個以下のアミノ酸置換、10個以下のアミノ酸置換、11個以下のアミノ酸置換、もしくは12個以下のアミノ酸置換を含む、L1のCLドメインを含む。
特定の実施形態において、H1のCH1ドメインは、ヒト生殖系列またはアロタイプ重鎖CH1ドメインと、少なくとも約70%、少なくとも約71%、少なくとも約72%、少なくとも約73%、少なくとも約74%、少なくとも約75%、少なくとも約76%、少なくとも約77%、少なくとも約78%、少なくとも約79%、少なくとも約80%、少なくとも約81%、少なくとも約82%、少なくとも約83%、少なくとも約84%、少なくとも約85%、少なくとも約86%、少なくとも約87%、少なくとも約88%、少なくとも約89%、少なくとも約90%、少なくとも約91%、少なくとも約92%、少なくとも約93%、少なくとも約94%、少なくとも約95%、少なくとも約96%、少なくとも約97%、少なくとも約98%、または少なくとも約99%同一である。Jefferis et al.(2009)Mabs 1:332−338を参照されたい。以下には、ヒトIgG1 CH1ドメインのアミノ酸配列(すなわち、配列番号57)及びヒトIgG4 S228P CH1ドメインのアミノ酸配列(すなわち、配列番号58)が提供される。
いくつかの実施形態では、LC1はカッパ軽鎖である。いくつかの実施形態では、LC1のCLドメインは、ヒト生殖系列またはアロタイプカッパ鎖CLドメインと、少なくとも約70%、少なくとも約71%、少なくとも約72%、少なくとも約73%、少なくとも約74%、少なくとも約75%、少なくとも約76%、少なくとも約77%、少なくとも約78%、少なくとも約79%、少なくとも約80%、少なくとも約81%、少なくとも約82%、少なくとも約83%、少なくとも約84%、少なくとも約85%、少なくとも約86%、少なくとも約87%、少なくとも約88%、少なくとも約89%、少なくとも約90%、少なくとも約91%、少なくとも約92%、少なくとも約93%、少なくとも約94%、少なくとも約95%、少なくとも約96%、少なくとも約97%、少なくとも約98%、または少なくとも約99%同一である。以下には、ヒトカッパ軽鎖定常ドメインのアミノ酸配列(すなわち、配列番号59)が提供される。
いくつかの実施形態では、LC1はラムダ軽鎖である。いくつかの実施形態では、LC1のCLドメインは、ヒト生殖系列またはアロタイプラムダCLドメインと、少なくとも約70%、少なくとも約71%、少なくとも約72%、少なくとも約73%、少なくとも約74%、少なくとも約75%、少なくとも約76%、少なくとも約77%、少なくとも約78%、少なくとも約79%、少なくとも約80%、少なくとも約81%、少なくとも約82%、少なくとも約83%、少なくとも約84%、少なくとも約85%、少なくとも約86%、少なくとも約87%、少なくとも約88%、少なくとも約89%、少なくとも約90%、少なくとも約91%、少なくとも約92%、少なくとも約93%、少なくとも約94%、少なくとも約95%、少なくとも約96%、少なくとも約97%、少なくとも約98%、または少なくとも約99%同一である。以下には、ヒトラムダ軽鎖定常ドメインのアミノ酸配列(すなわち、配列番号113)が提供される。
特定の実施形態において、本明細書において提供される多特異性抗原結合タンパク質のH1が由来する親のH1は、本明細書において提供される多特異性抗原結合タンパク質のL1が由来する親のL1に対する著しい優先度を示さない。特定の実施形態において。特定の実施形態において、本明細書において提供される多特異性抗原結合タンパク質のH1が由来する親のH1は、本明細書において提供される多特異性抗原結合タンパク質のL1が由来する親のL1に対する優先度を示す。
「H1」及び「H2」という用語が独断的名称であり、上記の実施形態のいずれにおける「H1」及び「H2」も反転できることは、当業者には明らかであろう。すなわち、H1のCH1ドメイン及び/またはVHドメインならびにL1のCLドメイン及び/またはVLドメイン内にあるものとして上述された変異のいずれも、代替的に、H2のCH1ドメイン及び/またはVHドメインならびにL2のCLドメイン及び/またはVLドメイン内に存在することができる。
VHドメイン及びVLドメインへの修飾
特定の実施形態において、多特異性抗原結合タンパク質、またはその抗原結合断片は、VH及びVLドメイン(複数可)内のアミノ酸修飾、すなわち、本明細書に記載のCH1及びCLドメイン内の修飾から独立したものを含む。特定の実施形態において、本明細書において提供される多特異性抗原結合タンパク質は、VH及びVLドメイン(複数可)内のアミノ酸修飾を追加的に、すなわち、方略番号1により特定されるCH1/CL界面内の変異及び/または方略番号1により特定されるCH1/CL界面内の変異と組み合わせて含む。
特定の実施形態において、多特異性抗原結合タンパク質のH1のVHドメインは、Q39位(Kabat付番)におけるアミノ酸置換を含み、多特異性抗原結合タンパク質のL1のVLドメインは、Q38位(Kabat付番)におけるアミノ酸置換を含む。特定の実施形態において、H1のVHドメイン内のQ39位(Kabat付番)におけるアミノ酸は、正荷電残基に置き換えられ、L1のVLドメイン内のQ38位(Kabat付番)におけるアミノ酸は、負荷電残基に置き換えられる。特定の実施形態において、H1のVHドメイン内のQ39位(Kabat付番)におけるアミノ酸は、負荷電残基に置き換えられ、L1のVLドメイン内のQ38位(Kabat付番)におけるアミノ酸は、正荷電残基に置き換えられる。特定の実施形態において、正荷電残基は、R、H、及びKから成る群から選択される。特定の実施形態において、負荷電残基は、D及びEから成る群から選択される。
追加的または代替的に、特定の実施形態において、多特異性抗原結合タンパク質のH2のVHドメインは、Q39位(Kabat付番)におけるアミノ酸置換を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38位(Kabat付番)におけるアミノ酸置換を含む。特定の実施形態において、H2のVHドメイン内のQ39位(Kabat付番)におけるアミノ酸は、正荷電残基に置き換えられ、L2のVLドメイン内のQ38位(Kabat付番)におけるアミノ酸は、負荷電残基に置き換えられる。特定の実施形態において、H2のVHドメイン内のQ39位(Kabat付番)におけるアミノ酸は、負荷電残基に置き換えられ、L2のVLドメイン内のQ38位(Kabat付番)におけるアミノ酸は、正荷電残基に置き換えられる。特定の実施形態において、正荷電残基は、R、H、及びKから成る群から選択される。特定の実施形態において、負荷電残基は、D及びEから成る群から選択される。
特定の実施形態では、H1のVHドメイン上のQ39位(Kabat付番)における置換変異と、L1のVLドメイン上のQ38位(Kabat付番)における置換変異、及び/または、H2のVHドメイン上のQ39位(Kabat付番)における置換変異と、L2のVLドメイン上のQ38位(Kabat付番)における置換変異との、特定の組み合わせが想定される。そのような組み合わせとしては、以下の表9A及び9Bに示されるものが挙げられるが、これらに限定されない。
表9A中の各対における第1の変異はVHドメイン配列内の修飾を指し、表9A中の各対における第2の変異はVLドメイン配列内の修飾を指す。
表9B中の4文字の変異は、Q39XVH1/Q38XVL1/Q39XVH2/Q38XVL2におけるアミノ酸置換を指し、ここで「VH1」はH1のVHドメインを指し、「VL」はL1のVLドメインを指し、「VH2」はH2のVHドメインを指し、「VL2」はL2のVLドメインを指す。「H1」/「L1」及び「H2」/「L2」という用語が独断的名称であり、上記の実施形態のいずれにおける「H1」及び「L1」も、それぞれ「H2」及び「L2」と反転できることは、当業者には明らかであろう。すなわち、H1のVHドメイン及びL1のVLドメイン内にあるものとして上述された変異のいずれも、代替的に、H2のVHドメイン及びL2のVLドメイン内に存在することができる。
特定の実施形態において、多特異性抗原結合タンパク質のH1のVHドメインは、Q39E位(Kabat付番)におけるアミノ酸置換を含み、多特異性抗原結合タンパク質のL1のVLドメインは、Q38K位(Kabat付番)におけるアミノ酸置換を含む。特定の実施形態において、多特異性抗原結合タンパク質のH2のVHドメインは、Q39K位(Kabat付番)におけるアミノ酸置換を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38E位(Kabat付番)におけるアミノ酸置換を含む。特定の実施形態において、多特異性抗原結合タンパク質のH1のVHドメインは、Q39K位(Kabat付番)におけるアミノ酸置換を含み、多特異性抗原結合タンパク質のL1のVLドメインは、Q38E位(Kabat付番)におけるアミノ酸置換を含む。特定の実施形態において、多特異性抗原結合タンパク質のH2のVHドメインは、Q39E位(Kabat付番)におけるアミノ酸置換を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38K位(Kabat付番)におけるアミノ酸置換を含む。特定の実施形態において、多特異性抗原結合タンパク質のH1のVHドメインは、Q39E位(Kabat付番)におけるアミノ酸置換を含み、多特異性抗原結合タンパク質のL1のVLドメインは、Q38K位(Kabat付番)におけるアミノ酸置換を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39K位(Kabat付番)におけるアミノ酸置換を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38E位(Kabat付番)におけるアミノ酸置換を含む。特定の実施形態において、多特異性抗原結合タンパク質のH1のVHドメインは、Q39K位(Kabat付番)におけるアミノ酸置換を含み、多特異性抗原結合タンパク質のL1のVLドメインは、Q38E位(Kabat付番)におけるアミノ酸置換を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39E位(Kabat付番)におけるアミノ酸置換を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38K位(Kabat付番)におけるアミノ酸置換を含む。
特定の実施形態において、多特異性抗原結合タンパク質のH1のVHドメインは、Q39E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL1のVLドメインは、Q38R置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38E置換変異(Kabat付番)を含む。
特定の実施形態において、多特異性抗原結合タンパク質のH1のVHドメインは、Q39D置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL1のVLドメインは、Q38K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38E置換変異(Kabat付番)を含む。
特定の実施形態において、多特異性抗原結合タンパク質のH1のVHドメインは、Q39D置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL1のVLドメインは、Q38R置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38E置換変異(Kabat付番)を含む。
特定の実施形態において、多特異性抗原結合タンパク質のH1のVHドメインは、Q39E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL1のVLドメインは、Q38K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39R置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38E置換変異(Kabat付番)を含む。
特定の実施形態において、多特異性抗原結合タンパク質のH1のVHドメインは、Q39E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL1のVLドメインは、Q38R置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39R置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38E置換変異(Kabat付番)を含む。
特定の実施形態において、多特異性抗原結合タンパク質のH1のVHドメインは、Q39D置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL1のVLドメインは、Q38K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39R置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38E置換変異(Kabat付番)を含む。
特定の実施形態において、多特異性抗原結合タンパク質のH1のVHドメインは、置換変異Q39D(Kabat付番)を含み、多特異性抗原結合タンパク質のL1のVLドメインは、Q38R置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39R置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38E置換変異(Kabat付番)を含む。
特定の実施形態において、多特異性抗原結合タンパク質のH1のVHドメインは、Q39E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL1のVLドメインは、Q38K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38D置換変異(Kabat付番)を含む。
特定の実施形態において、多特異性抗原結合タンパク質のH1のVHドメインは、Q39E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL1のVLドメインは、Q38R置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38D置換変異(Kabat付番)を含む。
特定の実施形態において、多特異性抗原結合タンパク質のH1のVHドメインは、Q39D置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL1のVLドメインは、Q38K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38D置換変異(Kabat付番)を含む。
特定の実施形態において、多特異性抗原結合タンパク質のH1のVHドメインは、Q39D置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL1のVLドメインは、Q38R置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38D置換変異(Kabat付番)を含む。
特定の実施形態において、多特異性抗原結合タンパク質のH1のVHドメインは、Q39E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL1のVLドメインは、Q38K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39R置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38D置換変異(Kabat付番)を含む。
特定の実施形態において、多特異性抗原結合タンパク質のH1のVHドメインは、Q39E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL1のVLドメインは、Q38R置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39R置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38D置換変異(Kabat付番)を含む。
特定の実施形態において、多特異性抗原結合タンパク質のH1のVHドメインは、Q39D置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL1のVLドメインは、Q38K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39R置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38D置換変異(Kabat付番)を含む。
特定の実施形態において、多特異性抗原結合タンパク質のH1のVHドメインは、Q39D置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL1のVLドメインは、Q38R置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39R置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38D置換変異(Kabat付番)を含む。
特定の実施形態において、多特異性抗原結合タンパク質のH1のVHドメインは、Q39K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL1のVLドメインは、Q38E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38R置換変異(Kabat付番)を含む。
特定の実施形態において、多特異性抗原結合タンパク質のH1のVHドメインは、Q39K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL1のVLドメインは、Q38E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39D置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38K置換変異(Kabat付番)を含む。
特定の実施形態において、多特異性抗原結合タンパク質のH1のVHドメインは、Q39K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL1のVLドメインは、Q38E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39D置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38R置換変異(Kabat付番)を含む。
特定の実施形態において、多特異性抗原結合タンパク質のH1のVHドメインは、Q39R置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL1のVLドメインは、Q38E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38K置換変異(Kabat付番)を含む。
特定の実施形態において、多特異性抗原結合タンパク質のH1のVHドメインは、Q39R置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL1のVLドメインは、Q38E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38R置換変異(Kabat付番)を含む。
特定の実施形態において、多特異性抗原結合タンパク質のH1のVHドメインは、Q39R置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL1のVLドメインは、Q38E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39D置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38K置換変異(Kabat付番)を含む。
特定の実施形態において、多特異性抗原結合タンパク質のH1のVHドメインは、Q39R置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL1のVLドメインは、Q38E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39D置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38R置換変異(Kabat付番)を含む。
特定の実施形態において、多特異性抗原結合タンパク質のH1のVHドメインは、Q39K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL1のVLドメインは、Q38D置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38K置換変異(Kabat付番)を含む。
特定の実施形態において、多特異性抗原結合タンパク質のH1のVHドメインは、Q39K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL1のVLドメインは、Q38D置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38R置換変異(Kabat付番)を含む。
特定の実施形態において、多特異性抗原結合タンパク質のH1のVHドメインは、Q39K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL1のVLドメインは、Q38D置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39D置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38K置換変異(Kabat付番)を含む。
特定の実施形態において、多特異性抗原結合タンパク質のH1のVHドメインは、Q39K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL1のVLドメインは、Q38D置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39D置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38R置換変異(Kabat付番)を含む。
特定の実施形態において、多特異性抗原結合タンパク質のH1のVHドメインは、Q39R置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL1のVLドメインは、Q38D置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38K置換変異(Kabat付番)を含む。
特定の実施形態において、多特異性抗原結合タンパク質のH1のVHドメインは、Q39R置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL1のVLドメインは、Q38D置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38R置換変異(Kabat付番)を含む。
特定の実施形態において、多特異性抗原結合タンパク質のH1のVHドメインは、Q39R置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL1のVLドメインは、Q38D置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39D置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38K置換変異(Kabat付番)を含む。
特定の実施形態において、多特異性抗原結合タンパク質のH1のVHドメインは、Q39R置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL1のVLドメインは、Q38D置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39D置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38R置換変異(Kabat付番)を含む。
特定の実施形態において、多特異性抗原結合タンパク質のH1のVHドメインは、Q39H置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL1のVLドメインは、Q38D置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39D置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38H置換変異(Kabat付番)を含む。
特定の実施形態において、多特異性抗原結合タンパク質のH1のVHドメインは、Q39H置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL1のVLドメインは、Q38E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38H置換変異(Kabat付番)を含む。
特定の実施形態において、多特異性抗原結合タンパク質のH1のVHドメインは、Q39D置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL1のVLドメインは、Q38H置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39H置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38D置換変異(Kabat付番)を含む。
特定の実施形態において、多特異性抗原結合タンパク質のH1のVHドメインは、Q39E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL1のVLドメインは、Q38H置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39H置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38E置換変異(Kabat付番)を含む。
「H1」/「L1」及び「H2」/「L2」という用語が独断的名称であり、上記の実施形態のいずれにおける「H1」及び「L1」も、それぞれ「H2」及び「L2」と反転できることは、当業者には明らかであろう。すなわち、H1のVHドメイン及びL1のVLドメイン内にあるものとして上述された変異のいずれも、代替的に、H2のVHドメイン及びL2のVLドメイン内に存在することができる。
本明細書の他の箇所に注記されているように、いくつかの実施形態における本明細書において提供される多特異性抗原結合タンパク質は、VH及びVLドメイン(複数可)内のアミノ酸修飾、すなわち、例えば上述のアミノ酸修飾などを、方略番号1により特定されるCH1/CL界面内の変異及び/または方略番号2により特定されるCH1/CL界面内の変異と組み合わせて含む。
特定の実施形態において、多特異性抗原結合タンパク質のH1のVHドメインは、Q39E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL1のVLドメインは、Q38K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のCH1ドメインは、S183E置換変異(EU付番)を含み(例えばそれから成るか、またはそれから本質的に成り)、多特異性抗原結合タンパク質のL2のCLドメインは、V133K置換変異(EU付番)を含む(例えばそれから成るか、またはそれから本質的に成る)。
特定の実施形態において、多特異性抗原結合タンパク質のH1のVHドメインは、Q39K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL1のVLドメインは、Q38E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のCH1ドメインは、S183E置換変異(EU付番)を含み(例えばそれから成るか、またはそれから本質的に成り)、多特異性抗原結合タンパク質のL2のCLドメインは、V133K置換変異(EU付番)を含む(例えばそれから成るか、またはそれから本質的に成る)。
特定の実施形態において、多特異性抗原結合タンパク質のH1のVHドメインは、Q39E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL1のVLドメインは、Q38K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH1のCH1ドメインは、S183E置換変異(EU付番)を含み(例えばそれから成るか、またはそれから本質的に成り)、多特異性抗原結合タンパク質のL1のCLドメインは、V133K置換変異(EU付番)を含む(例えばそれから成るか、またはそれから本質的に成る)。
特定の実施形態において、多特異性抗原結合タンパク質のH1のVHドメインは、Q39K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL1のVLドメインは、Q38E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH1のCH1ドメインは、S183E置換変異(EU付番)を含み(例えばそれから成るか、またはそれから本質的に成り)、多特異性抗原結合タンパク質のL1のCLドメインは、V133K置換変異(EU付番)を含む(例えばそれから成るか、またはそれから本質的に成る)。
特定の実施形態において、多特異性抗原結合タンパク質のH1のVHドメインは、Q39E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL1のVLドメインは、Q38K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のCH1ドメインは、S183E置換変異(EU付番)を含み(例えばそれから成るか、またはそれから本質的に成り)、多特異性抗原結合タンパク質のL2のCLドメインは、V133K置換変異(EU付番)を含む(例えばそれから成るか、またはそれから本質的に成る)。
特定の実施形態において、多特異性抗原結合タンパク質のH1のVHドメインは、Q39E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL1のVLドメインは、Q38K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH1のCH1ドメインは、S183K置換変異(EU付番)を含み(例えばそれから成るか、またはそれから本質的に成り)、多特異性抗原結合タンパク質のL1のCLドメインは、V133E置換変異(EU付番)を含む(例えばそれから成るか、またはそれから本質的に成る)。
特定の実施形態において、多特異性抗原結合タンパク質のH1のVHドメインは、Q39E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL1のVLドメインは、Q38K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のCH1ドメインは、S183E置換変異(EU付番)を含み(例えばそれから成るか、またはそれから本質的に成り)、多特異性抗原結合タンパク質のL2のVLドメインは、Q38E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のCLドメインは、V133K置換変異(EU付番)を含む(例えばそれから成るか、またはそれから本質的に成る)。
特定の実施形態において、多特異性抗原結合タンパク質のH1のVHドメインは、Q39K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL1のVLドメインは、Q38E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のCH1ドメインは、S183E置換変異(EU付番)を含み(例えばそれから成るか、またはそれから本質的に成り)、多特異性抗原結合タンパク質のL2のVLドメインは、Q38K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のCLドメインは、V133K置換変異(EU付番)を含む(例えばそれから成るか、またはそれから本質的に成る)。
特定の実施形態において、多特異性抗原結合タンパク質のH1のVHドメインは、Q39K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL1のVLドメインは、Q38E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のCH1ドメインは、S183F置換変異(EU付番)を含み(例えばそれから成るか、またはそれから本質的に成り)、多特異性抗原結合タンパク質のL2のVLドメインは、Q38K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のCLドメインは、V133K置換変異(EU付番)を含む(例えばそれから成るか、またはそれから本質的に成る)。
特定の実施形態において、多特異性抗原結合タンパク質のH1のVHドメインは、Q39K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH1のCH1ドメインは、S183E置換変異(EU付番)を含み(例えばそれから成るか、またはそれから本質的に成り)、多特異性抗原結合タンパク質のL1のVLドメインは、Q38E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のCH1ドメインは、S183F置換変異(EU付番)を含み(例えばそれから成るか、またはそれから本質的に成り)、多特異性抗原結合タンパク質のL2のVLドメインは、Q38K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のCLドメインは、V133K置換変異(EU付番)を含む(例えばそれから成るか、またはそれから本質的に成る)。
特定の実施形態において、多特異性抗原結合タンパク質のH1のVHドメインは、Q39K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL1のVLドメインは、Q38E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のCH1ドメインは、S183T置換変異(EU付番)を含み(例えばそれから成るか、またはそれから本質的に成り)、多特異性抗原結合タンパク質のL2のVLドメインは、Q38K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のCLドメインは、V133K置換変異(EU付番)を含む(例えばそれから成るか、またはそれから本質的に成る)。
特定の実施形態において、多特異性抗原結合タンパク質のH1のVHドメインは、Q39K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH1のCH1ドメインは、S183E置換変異(EU付番)を含み(例えばそれから成るか、またはそれから本質的に成り)、多特異性抗原結合タンパク質のL1のVLドメインは、Q38E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のCH1ドメインは、S183T置換変異(EU付番)を含み(例えばそれから成るか、またはそれから本質的に成り)、多特異性抗原結合タンパク質のL2のVLドメインは、Q38K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のCLドメインは、V133K置換変異(EU付番)を含む(例えばそれから成るか、またはそれから本質的に成る)。
特定の実施形態において、多特異性抗原結合タンパク質のH1のVHドメインは、Q39K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL1のVLドメインは、Q38E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のCH1ドメインは、S183Y置換変異(EU付番)を含み(例えばそれから成るか、またはそれから本質的に成り)、多特異性抗原結合タンパク質のL2のVLドメインは、Q38K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のCLドメインは、V133K置換変異(EU付番)を含む(例えばそれから成るか、またはそれから本質的に成る)。
特定の実施形態において、多特異性抗原結合タンパク質のH1のVHドメインは、Q39K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH1のCH1ドメインは、S183E置換変異(EU付番)を含み(例えばそれから成るか、またはそれから本質的に成り)、多特異性抗原結合タンパク質のL1のVLドメインは、Q38E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のCH1ドメインは、S183Y置換変異(EU付番)を含み(例えばそれから成るか、またはそれから本質的に成り)、多特異性抗原結合タンパク質のL2のVLドメインは、Q38K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のCLドメインは、V133K置換変異(EU付番)を含む(例えばそれから成るか、またはそれから本質的に成る)。
特定の実施形態において、多特異性抗原結合タンパク質のH1のVHドメインは、Q39K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL1のCLドメインは、V133E置換変異(EU付番)を含み(例えばそれから成るか、またはそれから本質的に成り)、多特異性抗原結合タンパク質のL1のVLドメインは、Q38E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のCH1ドメインは、S183E置換変異(EU付番)を含み(例えばそれから成るか、またはそれから本質的に成り)、多特異性抗原結合タンパク質のL2のVLドメインは、Q38K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のCLドメインは、V133K置換変異(EU付番)を含む(例えばそれから成るか、またはそれから本質的に成る)。
特定の実施形態において、多特異性抗原結合タンパク質のH1のVHドメインは、Q39K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL1のVLドメインは、Q38E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のCH1ドメインは、S183K置換変異(EU付番)を含み(例えばそれから成るか、またはそれから本質的に成り)、多特異性抗原結合タンパク質のL2のVLドメインは、Q38K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のCLドメインは、V133E置換変異(EU付番)を含む(例えばそれから成るか、またはそれから本質的に成る)。
特定の実施形態において、多特異性抗原結合タンパク質のH1のVHドメインは、Q39E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL1のVLドメインは、Q38K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のCH1ドメインは、S183K置換変異(EU付番)を含み(例えばそれから成るか、またはそれから本質的に成り)、多特異性抗原結合タンパク質のL2のVLドメインは、Q38E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のCLドメインは、V133E置換変異(EU付番)を含む(例えばそれから成るか、またはそれから本質的に成る)。
特定の実施形態において、多特異性抗原結合タンパク質のH1のVHドメインは、Q39E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH1のCH1ドメインは、S183E置換変異(EU付番)を含み(例えばそれから成るか、またはそれから本質的に成り)、多特異性抗原結合タンパク質のL1のVLドメインは、Q38K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL1のCLドメインは、V133K置換変異(EU付番)を含み(例えばそれから成るか、またはそれから本質的に成り)、多特異性抗原結合タンパク質のH2のVHドメインは、Q39K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38E置換変異(Kabat付番)を含む。
特定の実施形態において、多特異性抗原結合タンパク質のH1のVHドメインは、Q39K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH1のCH1ドメインは、S183E置換変異(EU付番)を含み(例えばそれから成るか、またはそれから本質的に成り)、多特異性抗原結合タンパク質のL1のVLドメインは、Q38E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL1のCLドメインは、V133K置換変異(EU付番)を含み(例えばそれから成るか、またはそれから本質的に成り)、多特異性抗原結合タンパク質のH2のVHドメインは、Q39E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38K置換変異(Kabat付番)を含む。
特定の実施形態において、多特異性抗原結合タンパク質のH1のVHドメインは、Q39E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH1のCH1ドメインは、S183K置換変異(EU付番)を含み(例えばそれから成るか、またはそれから本質的に成り)、多特異性抗原結合タンパク質のL1のVLドメインは、Q38K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL1のCLドメインは、V133E置換変異(EU付番)を含み(例えばそれから成るか、またはそれから本質的に成り)、多特異性抗原結合タンパク質のH2のVHドメインは、Q39K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38E置換変異(Kabat付番)を含む。
特定の実施形態において、多特異性抗原結合タンパク質のH1のVHドメインは、Q39K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL1のVLドメインは、Q38E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH1のCH1ドメインは、S183K置換変異(EU付番)を含み(例えばそれから成るか、またはそれから本質的に成り)、多特異性抗原結合タンパク質のL1のCLドメインは、V133E置換変異(EU付番)を含む(例えばそれから成るか、またはそれから本質的に成る)。
特定の実施形態において、多特異性抗原結合タンパク質のH1のVHドメインは、Q39K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH1のCH1ドメインは、S183K置換変異(EU付番)を含み(例えばそれから成るか、またはそれから本質的に成り)、多特異性抗原結合タンパク質のL1のVLドメインは、Q38E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL1のCLドメインは、V133E置換変異(EU付番)を含み(例えばそれから成るか、またはそれから本質的に成り)、多特異性抗原結合タンパク質のH2のVHドメインは、Q39E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38K置換変異(Kabat付番)を含む。
特定の実施形態において、多特異性抗原結合タンパク質のH1のCH1ドメインは、S183K置換変異(EU付番)を含み、多特異性抗原結合タンパク質のL1のCLドメインは、V133E置換変異(EU付番)を含み、多特異性抗原結合タンパク質のH2のCH1ドメインは、S183E置換変異(EU付番)を含み、多特異性抗原結合タンパク質のL2のCLドメインは、V133K置換変異(EU付番)を含む。特定の実施形態において、多特異性抗原結合タンパク質のH1のCH1ドメインは、S183K置換変異(EU付番)から成り、多特異性抗原結合タンパク質のL1のCLドメインは、V133E置換変異(EU付番)から成り、多特異性抗原結合タンパク質のH2のCH1ドメインは、S183E置換変異(EU付番)から成り、多特異性抗原結合タンパク質のL2のCLドメインは、V133K置換変異(EU付番)から成る。
特定の実施形態において、多特異性抗原結合タンパク質のH1のVHドメインは、Q39E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL1のVLドメインは、Q38K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL1のCLドメインは、V133E置換変異(EU付番)を含み、多特異性抗原結合タンパク質のH2のCH1ドメインは、S183E置換変異(EU付番)を含み、多特異性抗原結合タンパク質のL2のCLドメインは、V133K置換変異(EU付番)を含む。
特定の実施形態において、多特異性抗原結合タンパク質のH1のCH1ドメインは、S183K置換変異(EU付番)を含み、多特異性抗原結合タンパク質のL1のCLドメインは、V133E置換変異(EU付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のCH1ドメインは、S183E置換変異(EU付番)を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のCLドメインは、V133K置換変異(EU付番)を含む。
特定の実施形態において、多特異性抗原結合タンパク質のH1のVHドメインは、Q39E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH1のCH1ドメインは、S183K置換変異(EU付番)を含み、多特異性抗原結合タンパク質のL1のVLドメインは、Q38K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL1のCLドメインは、V133E置換変異(EU付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のCH1ドメインは、S183E置換変異(EU付番)を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のCLドメインは、V133K置換変異(EU付番)を含む。
特定の実施形態において、多特異性抗原結合タンパク質のH1のVHドメインは、Q39E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH1のCH1ドメインは、S183K置換変異(EU付番)から成り、多特異性抗原結合タンパク質のL1のVLドメインは、Q38K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL1のCLドメインは、V133E置換変異(EU付番)から成り、多特異性抗原結合タンパク質のH2のVHドメインは、Q39K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のCH1ドメインは、S183E置換変異(EU付番)から成り、多特異性抗原結合タンパク質のL2のVLドメインは、Q38E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のCLドメインは、V133K置換変異(EU付番)から成る。
特定の実施形態において、多特異性抗原結合タンパク質のH1のVHドメインは、Q39K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH1のCH1ドメインは、S183K置換変異(EU付番)を含み、多特異性抗原結合タンパク質のL1のVLドメインは、Q38E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL1のCLドメインは、V133E置換変異(EU付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のCH1ドメインは、S183E置換変異(EU付番)を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のCLドメインは、V133K置換変異(EU付番)を含む。
特定の実施形態において、多特異性抗原結合タンパク質のH1のVHドメインは、Q39K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH1のCH1ドメインは、S183K置換変異(EU付番)から成り、多特異性抗原結合タンパク質のL1のVLドメインは、Q38E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL1のCLドメインは、V133E置換変異(EU付番)から成り、多特異性抗原結合タンパク質のH2のVHドメインは、Q39E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のCH1ドメインは、S183E置換変異(EU付番)から成り、多特異性抗原結合タンパク質のL2のVLドメインは、Q38K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のCLドメインは、V133K置換変異(EU付番)から成る。
特定の実施形態において、多特異性抗原結合タンパク質のH1のCH1ドメインは、S183E置換変異(EU付番)を含み、多特異性抗原結合タンパク質のL1のCLドメインは、V133K置換変異(EU付番)を含み、多特異性抗原結合タンパク質のH2のCH1ドメインは、S183K置換変異(EU付番)を含み、多特異性抗原結合タンパク質のL2のCLドメインは、V133E置換変異(EU付番)を含む。
特定の実施形態において、多特異性抗原結合タンパク質のH1のCH1ドメインは、S183E置換変異(EU付番)から成り、多特異性抗原結合タンパク質のL1のCLドメインは、V133K置換変異(EU付番)から成り、多特異性抗原結合タンパク質のH2のCH1ドメインは、S183K置換変異(EU付番)から成り、多特異性抗原結合タンパク質のL2のCLドメインは、V133E置換変異(EU付番)から成る。
特定の実施形態において、多特異性抗原結合タンパク質のH1のVHドメインは、Q39E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH1のCH1ドメインは、S183E置換変異(EU付番)を含み、多特異性抗原結合タンパク質のL1のVLドメインは、Q38K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL1のCLドメインは、V133K置換変異(EU付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のCH1ドメインは、S183K置換変異(EU付番)を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のCLドメインは、V133E置換変異(EU付番)を含む。
特定の実施形態において、多特異性抗原結合タンパク質のH1のVHドメインは、Q39E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH1のCH1ドメインは、S183E置換変異(EU付番)から成り、多特異性抗原結合タンパク質のL1のVLドメインは、Q38K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL1のCLドメインは、V133K置換変異(EU付番)から成り、多特異性抗原結合タンパク質のH2のVHドメインは、Q39K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のCH1ドメインは、S183K置換変異(EU付番)から成り、多特異性抗原結合タンパク質のL2のVLドメインは、Q38E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のCLドメインは、V133E置換変異(EU付番)から成る。
特定の実施形態において、多特異性抗原結合タンパク質のH1のVHドメインは、Q39K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH1のCH1ドメインは、S183E置換変異(EU付番)を含み、多特異性抗原結合タンパク質のL1のVLドメインは、Q38E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL1のCLドメインは、V133K置換変異(EU付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のCH1ドメインは、S183K置換変異(EU付番)を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のCLドメインは、V133E置換変異(EU付番)を含む。
特定の実施形態において、多特異性抗原結合タンパク質のH1のVHドメインは、Q39K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH1のCH1ドメインは、S183E置換変異(EU付番)から成り、多特異性抗原結合タンパク質のL1のVLドメインは、Q38E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL1のCLドメインは、V133K置換変異(EU付番)から成り、多特異性抗原結合タンパク質のH2のVHドメインは、Q39E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のCH1ドメインは、S183K置換変異(EU付番)から成り、多特異性抗原結合タンパク質のL2のVLドメインは、Q38K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のCLドメインは、V133E置換変異(EU付番)から成る。
特定の実施形態において、多特異性抗原結合タンパク質のH1のVHドメインは、Q39E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL1のVLドメインは、Q38K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL1のCLドメインは、V133E置換変異(EU付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のCH1ドメインは、S183E置換変異(EU付番)を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のCLドメインは、V133K置換変異(EU付番)を含む。
特定の実施形態において、多特異性抗原結合タンパク質のH1のVHドメインは、Q39E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL1のVLドメインは、Q38K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のCH1ドメインは、S183F置換変異(EU付番)を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のCLドメインは、V133K置換変異(EU付番)を含む。
特定の実施形態において、多特異性抗原結合タンパク質のH1のVHドメインは、Q39E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL1のVLドメインは、Q38K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のCH1ドメインは、S183T置換変異(EU付番)を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のCLドメインは、V133K置換変異(EU付番)を含む。
特定の実施形態において、多特異性抗原結合タンパク質のH1のVHドメインは、Q39E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL1のVLドメインは、Q38K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のCH1ドメインは、S183Y置換変異(EU付番)を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のCLドメインは、V133K置換変異(EU付番)を含む。
特定の実施形態において、多特異性抗原結合タンパク質のH1のVHドメインは、Q39E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL1のVLドメインは、Q38K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL1のCLドメインは、V133E置換変異(EU付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のCH1ドメインは、S183F置換変異(EU付番)を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のCLドメインは、V133K置換変異(EU付番)を含む。
特定の実施形態において、多特異性抗原結合タンパク質のH1のVHドメインは、Q39E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL1のVLドメインは、Q38K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL1のCLドメインは、V133E置換変異(EU付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のCH1ドメインは、S183T置換変異(EU付番)を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のCLドメインは、V133K置換変異(EU付番)を含む。
特定の実施形態において、多特異性抗原結合タンパク質のH1のVHドメインは、Q39E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL1のVLドメインは、Q38K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL1のCLドメインは、V133E置換変異(EU付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のCH1ドメインは、S183Y置換変異(EU付番)を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のCLドメインは、V133K置換変異(EU付番)を含む。
特定の実施形態において、多特異性抗原結合タンパク質のH1のVHドメインは、Q39E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH1のCH1ドメインは、S183T置換変異(EU付番)を含み、多特異性抗原結合タンパク質のL1のVLドメインは、Q38K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL1のCLドメインは、V133K置換変異(EU付番)を含む。特定の実施形態において、多特異性抗原結合タンパク質のH2のVHドメインは、Q39K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のCH1ドメインは、S183K置換変異(EU付番)を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のCLドメインは、V133T置換変異(EU付番)を含む。
特定の実施形態において、多特異性抗原結合タンパク質のH1のVHドメインは、Q39E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH1のCH1ドメインは、S183E置換変異(EU付番)を含み、多特異性抗原結合タンパク質のL1のVLドメインは、Q38K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL1のCLドメインは、V133K置換変異(EU付番)を含む。特定の実施形態において、多特異性抗原結合タンパク質のH2のVHドメインは、Q39K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のCH1ドメインは、S183K置換変異(EU付番)を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のCLドメインは、V133E置換変異(EU付番)を含む。
特定の実施形態において、多特異性抗原結合タンパク質のH1のVHドメインは、Q39K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH1のCH1ドメインは、S183E置換変異(EU付番)を含み、多特異性抗原結合タンパク質のL1のVLドメインは、Q38E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL1のCLドメインは、V133K置換変異(EU付番)を含む。特定の実施形態において、多特異性抗原結合タンパク質のH2のVHドメインは、Q39E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のCH1ドメインは、S183K置換変異(EU付番)を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のCLドメインは、V133E置換変異(EU付番)を含む。
特定の実施形態において、多特異性抗原結合タンパク質のH1のVHドメインは、Q39K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH1のCH1ドメインは、S183T置換変異(EU付番)を含み、多特異性抗原結合タンパク質のL1のVLドメインは、Q38E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL1のCLドメインは、V133K置換変異(EU付番)を含む。特定の実施形態において、多特異性抗原結合タンパク質のH2のVHドメインは、Q39E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のCH1ドメインは、S183K置換変異(EU付番)を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のCLドメインは、V133T置換変異(EU付番)を含む。
特定の実施形態において、多特異性抗原結合タンパク質のH1のVHドメインは、Q39E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL1のVLドメインは、Q38K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH1のCH1ドメインは、A141I、F170S、S181M、S183A、及びV185A変異(EU付番)を含み、多特異性抗原結合タンパク質のL1のCLドメインは、F116A、L135V、S174A、S176F、及びT178V変異(EU付番)を含む。
特定の実施形態において、多特異性抗原結合タンパク質のH1のCH1ドメインは、A141I、F170S、S181M、S183A、及びV185A変異(EU付番)を含み、多特異性抗原結合タンパク質のL1のCLドメインは、F116A、L135V、S174A、S176F、及びT178V変異(EU付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38E置換変異(Kabat付番)を含む。
特定の実施形態において、多特異性抗原結合タンパク質のH1のVHドメインは、Q39E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL1のVLドメインは、Q38K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH1のCH1ドメインは、A141I、F170S、S181M、S183A、及びV185A変異(EU付番)を含み、多特異性抗原結合タンパク質のL1のCLドメインは、F116A、L135V、S174A、S176F、及びT178V変異(EU付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38E置換変異(Kabat付番)を含む。
特定の実施形態において、多特異性抗原結合タンパク質のH1のVHドメインは、Q39E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL1のVLドメインは、Q38K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH1のCH1ドメインは、A141I、F170S、S181M、S183A、及びV185A変異(EU付番)から成り、多特異性抗原結合タンパク質のL1のCLドメインは、F116A、L135V、S174A、S176F、及びT178V変異(EU付番)から成り、多特異性抗原結合タンパク質のH2のVHドメインは、Q39K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38E置換変異(Kabat付番)を含む。
特定の実施形態において、多特異性抗原結合タンパク質のH1のVHドメインは、Q39K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL1のVLドメインは、Q38E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH1のCH1ドメインは、A141I、F170S、S181M、S183A、及びV185A変異(EU付番)を含み、多特異性抗原結合タンパク質のL1のCLドメインは、F116A、L135V、S174A、S176F、及びT178V変異(EU付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38K置換変異(Kabat付番)を含む。
特定の実施形態において、多特異性抗原結合タンパク質のH1のVHドメインは、Q39K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL1のVLドメインは、Q38E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH1のCH1ドメインは、A141I、F170S、S181M、S183A、及びV185A変異(EU付番)から成り、多特異性抗原結合タンパク質のL1のCLドメインは、F116A、L135V、S174A、S176F、及びT178V変異(EU付番)から成り、多特異性抗原結合タンパク質のH2のVHドメインは、Q39E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38K置換変異(Kabat付番)を含む。
特定の実施形態において、多特異性抗原結合タンパク質のH1のCH1ドメインは、A141I、F170S、S181M、S183A、及びV185A変異(EU付番)を含み、多特異性抗原結合タンパク質のL1のCLドメインは、F116A、L135V、S174A、S176F、及びT178V変異(EU付番)を含み、多特異性抗原結合タンパク質のH2のCH1ドメインは、S183E置換変異(EU付番)を含み、多特異性抗原結合タンパク質のL2のCLドメインは、V133K置換変異(EU付番)を含む。
特定の実施形態において、多特異性抗原結合タンパク質のH1のCH1ドメインは、A141I、F170S、S181M、S183A、及びV185A変異(EU付番)を含み、多特異性抗原結合タンパク質のL1のCLドメインは、F116A、L135V、S174A、S176F、及びT178V変異(EU付番)を含み、多特異性抗原結合タンパク質のH2のCH1ドメインは、S183E置換変異(EU付番)から成り、多特異性抗原結合タンパク質のL2のCLドメインは、V133K置換変異(EU付番)から成る。
特定の実施形態において、多特異性抗原結合タンパク質のH1のCH1ドメインは、A141I、F170S、S181M、S183A、及びV185A変異(EU付番)から成り、多特異性抗原結合タンパク質のL1のCLドメインは、F116A、L135V、S174A、S176F、及びT178V変異(EU付番)から成り、多特異性抗原結合タンパク質のH2のCH1ドメインは、S183E置換変異(EU付番)から成り、多特異性抗原結合タンパク質のL2のCLドメインは、V133K置換変異(EU付番)から成る。
特定の実施形態において、多特異性抗原結合タンパク質のH1のVHドメインは、Q39E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL1のVLドメインは、Q38K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH1のCH1ドメインは、A141I、F170S、S181M、S183A、及びV185A変異(EU付番)を含み、多特異性抗原結合タンパク質のL1のCLドメインは、F116A、L135V、S174A、S176F、及びT178V変異(EU付番)を含み、多特異性抗原結合タンパク質のH2のCH1ドメインは、S183E置換変異(EU付番)を含み、多特異性抗原結合タンパク質のL2のCLドメインは、V133K置換変異(EU付番)を含む。
特定の実施形態において、多特異性抗原結合タンパク質のH1のVHドメインは、Q39E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL1のVLドメインは、Q38K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH1のCH1ドメインは、A141I、F170S、S181M、S183A、及びV185A変異(EU付番)を含み、多特異性抗原結合タンパク質のL1のCLドメインは、F116A、L135V、S174A、S176F、及びT178V変異(EU付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のCH1ドメインは、S183E置換変異(EU付番)を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のCLドメインは、V133K置換変異(EU付番)を含む。
特定の実施形態において、多特異性抗原結合タンパク質のH1のVHドメインは、Q39E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL1のVLドメインは、Q38K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH1のCH1ドメインは、A141I、F170S、S181M、S183A、及びV185A変異(EU付番)を含み、多特異性抗原結合タンパク質のL1のCLドメインは、F116A、L135V、S174A、S176F、及びT178V変異(EU付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のCH1ドメインは、S183E置換変異(EU付番)から成り、多特異性抗原結合タンパク質のL2のVLドメインは、Q38E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のCLドメインは、V133K置換変異(EU付番)から成る。
特定の実施形態において、多特異性抗原結合タンパク質のH1のVHドメインは、Q39E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL1のVLドメインは、Q38K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH1のCH1ドメインは、A141I、F170S、S181M、S183A、及びV185A変異(EU付番)から成り、多特異性抗原結合タンパク質のL1のCLドメインは、F116A、L135V、S174A、S176F、及びT178V変異(EU付番)から成り、多特異性抗原結合タンパク質のH2のVHドメインは、Q39K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のCH1ドメインは、S183E置換変異(EU付番)から成り、多特異性抗原結合タンパク質のL2のVLドメインは、Q38E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のCLドメインは、V133K置換変異(EU付番)から成る。
特定の実施形態において、多特異性抗原結合タンパク質のH1のVHドメインは、Q39K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL1のVLドメインは、Q38E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH1のCH1ドメインは、A141I、F170S、S181M、S183A、及びV185A変異(EU付番)を含み、多特異性抗原結合タンパク質のL1のCLドメインは、F116A、L135V、S174A、S176F、及びT178V変異(EU付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のCH1ドメインは、S183E置換変異(EU付番)を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のCLドメインは、V133K置換変異(EU付番)を含む。
特定の実施形態において、多特異性抗原結合タンパク質のH1のVHドメインは、Q39K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL1のVLドメインは、Q38E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH1のCH1ドメインは、A141I、F170S、S181M、S183A、及びV185A変異(EU付番)を含み、多特異性抗原結合タンパク質のL1のCLドメインは、F116A、L135V、S174A、S176F、及びT178V変異(EU付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のCH1ドメインは、S183E置換変異(EU付番)から成り、多特異性抗原結合タンパク質のL2のVLドメインは、Q38K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のCLドメインは、V133K置換変異(EU付番)から成る。
特定の実施形態において、多特異性抗原結合タンパク質のH1のVHドメインは、Q39K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL1のVLドメインは、Q38E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH1のCH1ドメインは、A141I、F170S、S181M、S183A、及びV185A変異(EU付番)から成り、多特異性抗原結合タンパク質のL1のCLドメインは、F116A、L135V、S174A、S176F、及びT178V変異(EU付番)から成り、多特異性抗原結合タンパク質のH2のVHドメインは、Q39E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のCH1ドメインは、S183E置換変異(EU付番)から成り、多特異性抗原結合タンパク質のL2のVLドメインは、Q38K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のCLドメインは、V133K置換変異(EU付番)から成る。
特定の実施形態において、多特異性抗原結合タンパク質のH1のCH1ドメインは、A141I、F170S、S181M、S183A、及びV185A変異(EU付番)を含み、多特異性抗原結合タンパク質のL1のCLドメインは、F116A、L135V、S174A、S176F、及びT178V変異(EU付番)を含み、多特異性抗原結合タンパク質のH2のCH1ドメインは、S183K置換変異(EU付番)を含み、多特異性抗原結合タンパク質のL2のCLドメインは、V133E置換変異(EU付番)を含む。
特定の実施形態において、多特異性抗原結合タンパク質のH1のCH1ドメインは、A141I、F170S、S181M、S183A、及びV185A変異(EU付番)を含み、多特異性抗原結合タンパク質のL1のCLドメインは、F116A、L135V、S174A、S176F、及びT178V変異(EU付番)を含み、多特異性抗原結合タンパク質のH2のCH1ドメインは、S183K置換変異(EU付番)から成り、多特異性抗原結合タンパク質のL2のCLドメインは、V133E置換変異(EU付番)から成る。
特定の実施形態において、多特異性抗原結合タンパク質のH1のCH1ドメインは、A141I、F170S、S181M、S183A、及びV185A変異(EU付番)から成り、多特異性抗原結合タンパク質のL1のCLドメインは、F116A、L135V、S174A、S176F、及びT178V変異(EU付番)から成り、多特異性抗原結合タンパク質のH2のCH1ドメインは、S183K置換変異(EU付番)から成り、多特異性抗原結合タンパク質のL2のCLドメインは、V133E置換変異(EU付番)から成る。
特定の実施形態において、多特異性抗原結合タンパク質のH1のVHドメインは、Q39E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL1のVLドメインは、Q38K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH1のCH1ドメインは、A141I、F170S、S181M、S183A、及びV185A変異(EU付番)を含み、多特異性抗原結合タンパク質のL1のCLドメインは、F116A、L135V、S174A、S176F、及びT178V変異(EU付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のCH1ドメインは、S183K置換変異(EU付番)を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のCLドメインは、V133E置換変異(EU付番)を含む。
特定の実施形態において、多特異性抗原結合タンパク質のH1のVHドメインは、Q39E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL1のVLドメインは、Q38K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH1のCH1ドメインは、A141I、F170S、S181M、S183A、及びV185A変異(EU付番)を含み、多特異性抗原結合タンパク質のL1のCLドメインは、F116A、L135V、S174A、S176F、及びT178V変異(EU付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のCH1ドメインは、S183K置換変異(EU付番)から成り、多特異性抗原結合タンパク質のL2のVLドメインは、Q38E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のCLドメインは、V133E置換変異(EU付番)から成る。
特定の実施形態において、多特異性抗原結合タンパク質のH1のVHドメインは、Q39E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL1のVLドメインは、Q38K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH1のCH1ドメインは、A141I、F170S、S181M、S183A、及びV185A変異(EU付番)から成り、多特異性抗原結合タンパク質のL1のCLドメインは、F116A、L135V、S174A、S176F、及びT178V変異(EU付番)から成り、多特異性抗原結合タンパク質のH2のVHドメインは、Q39K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のCH1ドメインは、S183K置換変異(EU付番)から成り、多特異性抗原結合タンパク質のL2のVLドメインは、Q38E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のCLドメインは、V133E置換変異(EU付番)から成る。
特定の実施形態において、多特異性抗原結合タンパク質のH1のVHドメインは、Q39K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL1のVLドメインは、Q38E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH1のCH1ドメインは、A141I、F170S、S181M、S183A、及びV185A変異(EU付番)を含み、多特異性抗原結合タンパク質のL1のCLドメインは、F116A、L135V、S174A、S176F、及びT178V変異(EU付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のCH1ドメインは、S183K置換変異(EU付番)を含み、多特異性抗原結合タンパク質のL2のVLドメインは、Q38K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のCLドメインは、V133E置換変異(EU付番)を含む。
特定の実施形態において、多特異性抗原結合タンパク質のH1のVHドメインは、Q39K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL1のVLドメインは、Q38E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH1のCH1ドメインは、A141I、F170S、S181M、S183A、及びV185A変異(EU付番)を含み、多特異性抗原結合タンパク質のL1のCLドメインは、F116A、L135V、S174A、S176F、及びT178V変異(EU付番)を含み、多特異性抗原結合タンパク質のH2のVHドメインは、Q39E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のCH1ドメインは、S183K置換変異(EU付番)から成り、多特異性抗原結合タンパク質のL2のVLドメインは、Q38K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のCLドメインは、V133E置換変異(EU付番)から成る。
特定の実施形態において、多特異性抗原結合タンパク質のH1のVHドメインは、Q39K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL1のVLドメインは、Q38E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH1のCH1ドメインは、A141I、F170S、S181M、S183A、及びV185A変異(EU付番)から成り、多特異性抗原結合タンパク質のL1のCLドメインは、F116A、L135V、S174A、S176F、及びT178V変異(EU付番)から成り、多特異性抗原結合タンパク質のH2のVHドメインは、Q39E置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のH2のCH1ドメインは、S183K置換変異(EU付番)から成り、多特異性抗原結合タンパク質のL2のVLドメインは、Q38K置換変異(Kabat付番)を含み、多特異性抗原結合タンパク質のL2のCLドメインは、V133E置換変異(EU付番)から成る。
方略番号2により特定されるCH1/CL界面内の変異、方略番号1により特定されるCH1/CL界面内の変異、ならびにVHドメイン及びVLドメイン内の変異の追加の組み合わせ、すなわち、上述のものに限定されないものも想定される。
「H1」及び「H2」という用語が独断的名称であり、上記の実施形態のいずれにおける「H1」及び「H2」も反転できることは、当業者には明らかであろう。すなわち、H1のCH1ドメイン及び/またはVHドメインならびにL1のCLドメイン及び/またはVLドメイン内にあるものとして上述された変異のいずれも、代替的に、H2のCH1ドメイン及び/またはVHドメインならびにL2のCLドメイン及び/またはVLドメイン内に存在することができる。
Fc変異
特定の実施形態において、多特異性抗原結合タンパク質のH1及びH2のそれぞれは、CH2及びCH3ドメインを含むFc領域を含む。特定の実施形態において、H1及び/またはH2のFc領域は、IgG1、IgG2、またはIgG4 Fcである。特定の実施形態において、H1及びH2のCH3ドメインはそれぞれ界面で交わり、CH3ドメインのそれぞれは、H1のFc領域がH1と比較してH2のFc領域と優先的に対合するようなアミノ酸置換を含む。特定の実施形態において、CH3ドメイン内のアミノ酸置換は、CH3ドメイン内の置換を有しない野生型よりも高い静電的相補性をもたらす。タンパク質/タンパク質界面における静電的相補性の測定方法は、当該技術分野で知られており、例えば、McCoy et al.(1997)J Mol Biol 268,570−584、Lee et al.,(2001)Protein Sci.10,362−377、及びChau et al.(1994)J Comp Mol Des 8,51325に記載されている。特定の実施形態において、CH3ドメイン内のアミノ酸置換は、CH3ドメイン内の置換を有しない野生型よりも高い立体的相補性をもたらす。タンパク質/タンパク質界面における静電的相補性の測定方法は、当該技術分野で知られており、例えば、Lawrence et al.(1993)J Mol Biol 234,946−950、Walls et al.(1992)J Mol Biol228,277−297、及びSchueler−Furman et al.(2005)Proteins 60,187−194に記載されている。
特定の実施形態では、CH3/CH3界面内で、H1のCH3ドメイン内の1個以上のアミノ酸残基が、より大きな側鎖体積を有する1個以上のアミノ酸残基に置き換えられ、それにより、H1のCH3ドメインの表面上に隆起(またはノブ)が生成されるように、かつ、H1のCH3ドメインと相互作用するH2のCH3ドメイン内の1個以上、好ましくは2個または3個のアミノ酸残基が修飾され、小さな側鎖体積を有するアミノ酸残基に置き換えられ、それにより、H1のCH3ドメインと相互作用するH2のCH3ドメインの表面上に空洞(またはホール)が生成されるように、H1及びH2(例えば、本明細書に記載の実施形態のいずれかのH1及びH2)のCH3ドメインが変更される。特定の実施形態では、界面内で、H2のCH3ドメイン内の1個または2個のアミノ酸残基が、より大きな側鎖体積を有する同等数のアミノ酸残基に置き換えられ、それにより、H2のCH3ドメインの界面内に、H1のCH3ドメインの表面内の空洞(またはホール)内に配置可能な隆起(またはノブ)が生成されるように、H1及びH2(例えば、本明細書に記載の実施形態のいずれかのH1及びH2)のCH3ドメインが変更され、かつ、H2のCH3ドメインの界面と交わるH2のCH3ドメインの表面内で、2個または3個のアミノ酸残基が、より小さな側鎖体積を有する同等数のアミノ酸残基と置き換えられ、それにより、H1のCH3ドメインの界面内に空洞が生成されるように、H1のCH3ドメインが変更され、この空洞内に、H2のCH3ドメインの界面内の隆起が配置可能である。特定の実施形態において、より大きな側鎖体積を有する移入残基(import residue)は、フェニルアラニン(F)、チロシン(Y)、アルギニン(R)、またはトリプトファン(W)である。特定の実施形態において、隆起またはノブ変異は、366位におけるスレオニンのトリプトファンとの置換を含み、アミノ酸付番は、Kabat et al.(pp.688−696 in Sequences of proteins of immunological interest,5th ed.,Vol.1(1991;NIH,Bethesda,MD))のEU付番スキームに従う。特定の実施形態において、より小さな側鎖体積を有する移入残基は、セリン(S)、アラニン(A)、バリン(V)、またはスレオニン(T)である。特定の実施形態において、元の残基は、スレオニンである。特定の実施形態において、元の残基は、ロイシンである。特定の実施形態において、元の残基は、チロシンである。特定の実施形態において、移入残基は、システイン(C)ではない。一実施形態において、移入残基は、アラニン(A)である。空洞は、CH3ドメインの1個以上の元の残基を置き換えることによって生成することができる。例えば、一実施形態において、空洞を含むCH3ドメインは、スレオニン、ロイシン、及びチロシンから成る群から選択される2つ以上の元のアミノ酸の置換を含む。特定の実施形態において、空洞を含むCH3ドメインは、アラニン、セリン、スレオニン、及びバリンから成る群から選択される2個以上の移入残基を含む。特定の実施形態において、ノブ変異のための修飾はT366Wであり、ホール変異のための修飾は、T366S、L368A、及びY407Vのうちの少なくとも1つ、または少なくとも2つである。特定の実施形態において、ノブ変異のための修飾はT366Wであり、ホール変異のための修飾は、T366S、L368A、及びY407Vである。例えば、それぞれ参照により全体が本明細書に援用される、US 5,731,168、US 5,807,706、US 7,183,076を参照されたい。
移行性(Transferability)
上記のH1のCH1ドメイン及びL1のCLドメインに対する特定のアミノ酸修飾は、EU付番方式を参照して記載されているが、下記の内容を考慮すると、これらのアミノ酸修飾は、他の免疫グロブリン重鎖及び軽鎖に移行可能であり、1つの免疫グロブリン重鎖の、2つの免疫グロブリン軽鎖のうちの一方との優先的対合の同様のパターンがもたらされることが想定される。
免疫グロブリンの重鎖と軽鎖との界面内にあるCH1/CL界面残基は、比較的良好に保存されている(Padlan et al.,1986,Mol.Immunol.23(9):951−960)。進化抑制の結果であるこの配列保存は、軽鎖と重鎖との組み合わせの対合中に機能的に活性な抗体結合ドメインが形成される尤度を増加させる。この配列保存の結果として、優先的対合を推進する上記の配列修飾は、この領域が抗体間で高い配列保存を示すことから、他の重鎖及び軽鎖の対に移行し得るということになる。
特定の実施形態において、本明細書に記載のアミノ酸修飾は、ヒトまたはヒト化IgG1/κに基づく抗体の免疫グロブリン重鎖及び軽鎖に移行可能である。特定の実施形態において、本明細書に記載のアミノ酸修飾は、ヒトまたはヒト化IgG2/κに基づく抗体の免疫グロブリン重鎖及び軽鎖に移行可能である。特定の実施形態において、本明細書に記載のアミノ酸修飾は、ヒトまたはヒト化IgG3/κに基づく抗体の免疫グロブリン重鎖及び軽鎖に移行可能である。特定の実施形態において、本明細書に記載のアミノ酸修飾は、ヒトまたはヒト化IgG4/κに基づく抗体の免疫グロブリン重鎖及び軽鎖に移行可能である。特定の実施形態において、本明細書に記載のアミノ酸修飾は、ヒトまたはヒト化IgA1/κに基づく抗体の免疫グロブリン重鎖及び軽鎖に移行可能である。特定の実施形態において、本明細書に記載のアミノ酸修飾は、ヒトまたはヒト化IgA2/κに基づく抗体の免疫グロブリン重鎖及び軽鎖に移行可能である。特定の実施形態において、本明細書に記載のアミノ酸修飾は、ヒトまたはヒト化IgD/κに基づく抗体の免疫グロブリン重鎖及び軽鎖に移行可能である。特定の実施形態において、本明細書に記載のアミノ酸修飾は、ヒトまたはヒト化IgE/κに基づく抗体の免疫グロブリン重鎖及び軽鎖に移行可能である。特定の実施形態において、本明細書に記載のアミノ酸修飾は、ヒトまたはヒト化IgG/κに基づく抗体の免疫グロブリン重鎖及び軽鎖に移行可能である。特定の実施形態において、本明細書に記載のアミノ酸修飾は、ヒトまたはヒト化IgM/κに基づく抗体の免疫グロブリン重鎖及び軽鎖に移行可能である。
特定の実施形態において、本明細書に記載のアミノ酸修飾は、ヒトまたはヒト化IgG1/λに基づく抗体の免疫グロブリン重鎖及び軽鎖に移行可能である。特定の実施形態において、本明細書に記載のアミノ酸修飾は、ヒトまたはヒト化IgG2/λに基づく抗体の免疫グロブリン重鎖及び軽鎖に移行可能である。特定の実施形態において、本明細書に記載のアミノ酸修飾は、ヒトまたはヒト化IgG3/λに基づく抗体の免疫グロブリン重鎖及び軽鎖に移行可能である。特定の実施形態において、本明細書に記載のアミノ酸修飾は、ヒトまたはヒト化IgG4/λに基づく抗体の免疫グロブリン重鎖及び軽鎖に移行可能である。特定の実施形態において、本明細書に記載のアミノ酸修飾は、ヒトまたはヒト化IgA1/λに基づく抗体の免疫グロブリン重鎖及び軽鎖に移行可能である。特定の実施形態において、本明細書に記載のアミノ酸修飾は、ヒトまたはヒト化IgA2/λに基づく抗体の免疫グロブリン重鎖及び軽鎖に移行可能である。特定の実施形態において、本明細書に記載のアミノ酸修飾は、ヒトまたはヒト化IgD/λに基づく抗体の免疫グロブリン重鎖及び軽鎖に移行可能である。特定の実施形態において、本明細書に記載のアミノ酸修飾は、ヒトまたはヒト化IgE/λに基づく抗体の免疫グロブリン重鎖及び軽鎖に移行可能である。特定の実施形態において、本明細書に記載のアミノ酸修飾は、ヒトまたはヒト化IgG/λに基づく抗体の免疫グロブリン重鎖及び軽鎖に移行可能である。特定の実施形態において、本明細書に記載のアミノ酸修飾は、ヒトまたはヒト化IgM/λに基づく抗体の免疫グロブリン重鎖及び軽鎖に移行可能である。特定の実施形態において、本明細書に記載のアミノ酸修飾は、生殖系列に近いフレームワークを有する抗体の免疫グロブリン重鎖及び軽鎖に移行可能である。特定の実施形態において、本明細書に記載のアミノ酸修飾は、基準CLドメイン及びCH1ドメインを有する抗体の免疫グロブリン重鎖及び軽鎖に移行可能である。
特定の実施形態において、本明細書に記載のアミノ酸修飾は、マウス抗体の免疫グロブリン重鎖及び軽鎖に導入される。特定の実施形態において、本明細書に記載のアミノ酸修飾は、マウスIgG2a/λに基づく抗体の免疫グロブリン重鎖及び軽鎖に導入される。特定の実施形態において、本明細書に記載のアミノ酸修飾は、マウスIgG2a/κに基づく抗体の免疫グロブリン重鎖及び軽鎖に導入される。
マウスIgG2a定常領域のアミノ酸配列は、以下の配列番号60に記載される。
マウスカッパ軽鎖のアミノ酸配列は、以下の配列番号61に記載される。
マウスラムダ1軽鎖のアミノ酸配列は、以下の配列番号62に記載される。
マウスラムダ2軽鎖のアミノ酸配列は、以下の配列番号63に記載される。
マウスラムダ3軽鎖のアミノ酸配列は、以下の配列番号64に記載される。
特定の実施形態において、(例えば上述の免疫グロブリン重鎖及び軽鎖のいずれかに)移行可能であるアミノ酸修飾は、次の組み合わせの置換変異を含む:H1のVHドメイン上のQ39位(Kabat付番);L1のVLドメイン上のQ38位;H2のVHドメイン上のQ39位(Kabat付番);H2のCH1ドメイン上のS183位(EU付番);L2のVLドメイン上のQ38位(Kabat付番);及びL2のCLドメイン上のV133位(EU付番)。
特定の実施形態において、(例えば上述の免疫グロブリン重鎖及び軽鎖のいずれかに)移行可能であるアミノ酸修飾は、次の組み合わせの置換変異を含む:H1のVHドメイン上のQ39位(Kabat付番);H1のCH1ドメイン上のS183位(EU付番);L1のVLドメイン上のQ38位;L1のCLドメイン上のV133位(EU付番);H2のVHドメイン上のQ39位(Kabat付番);H2のCH1ドメイン上のS183位(EU付番);L2のVLドメイン上のQ38位(Kabat付番);及びL2のCLドメイン上のV133位(EU付番)。
特定の実施形態において、(例えば上述の免疫グロブリン重鎖及び軽鎖のいずれかに)移行可能であるアミノ酸修飾は、次の組み合わせの置換変異を含む(例えばそれらから成るか、またはそれらから本質的に成る):H1のVHドメイン上のQ39E位(Kabat付番);L1のVLドメイン上のQ38K位;H2のVHドメイン上のQ39K位(Kabat付番);H2のCH1ドメイン上のS183K位(EU付番);L1のVLドメイン上のQ38E位(Kabat付番);及びL2のCLドメイン上のV133E(EU付番)。
特定の実施形態において、(例えば上述の免疫グロブリン重鎖及び軽鎖のいずれかに)移行可能であるアミノ酸修飾は、次の組み合わせの置換変異を含む(例えばそれらから成るか、またはそれらから本質的に成る):H1のVHドメイン上のQ39K位(Kabat付番);L1のVLドメイン上のQ38E位;H2のVHドメイン上のQ39E位(Kabat付番);H2のCH1ドメイン上のS183K位(EU付番);L1のVLドメイン上のQ38K位(Kabat付番);及びL2のCLドメイン上のV133E(EU付番)。
特定の実施形態において、(例えば上述の免疫グロブリン重鎖及び軽鎖のいずれかに)移行可能であるアミノ酸修飾は、次の組み合わせの置換変異を含む(例えばそれらから成るか、またはそれらから本質的に成る):H1のVHドメイン上のQ39E位(Kabat付番);L1のVLドメイン上のQ38K位;H2のVHドメイン上のQ39K位(Kabat付番);H2のCH1ドメイン上のS183E位(EU付番);L1のVLドメイン上のQ38E位(Kabat付番);及びL2のCLドメイン上のV133K(EU付番)。
特定の実施形態において、(例えば上述の免疫グロブリン重鎖及び軽鎖のいずれかに)移行可能であるアミノ酸修飾は、次の組み合わせの置換変異を含む(例えばそれらから成るか、またはそれらから本質的に成る):H1のVHドメイン上のQ39K位(Kabat付番);L1のVLドメイン上のQ38E位;H2のVHドメイン上のQ39E位(Kabat付番);H2のCH1ドメイン上のS183E位(EU付番);L1のVLドメイン上のQ38K位(Kabat付番);及びL2のCLドメイン上のV133K(EU付番)。
特定の実施形態において、異なるIgG分子(例えば上述の免疫グロブリン重鎖及び軽鎖のいずれかなど)に導入されるアミノ酸修飾は、H1のVHドメイン内のQ39E置換変異(Kabat付番)、L1のVLドメイン内のQ38K置換変異(Kabat付番)、H1のCH1ドメイン内のA141I、F170S、S181M、S183A、及びV185A変異(EU付番)、L1のCLドメイン内のF116A、L135V、S174A、S176F、及びT178V変異(EU付番)、H2のVHドメイン内のQ39K置換変異(Kabat付番)、ならびにL2のVLドメイン内のQ38E置換変異(Kabat付番)を含む。
特定の実施形態において、異なるIgG分子(例えば上述の免疫グロブリン重鎖及び軽鎖のいずれかなど)に導入されるアミノ酸修飾は、H1のVHドメイン内のQ39E置換変異(Kabat付番)を含み、L1のVLドメイン内のQ38K置換変異(Kabat付番)を含み、H1のCH1ドメイン内のA141I、F170S、S181M、S183A、及びV185A変異(EU付番)から成り、L1のCLドメイン内のF116A、L135V、S174A、S176F、及びT178V変異(EU付番)から成り、H2のVHドメイン内のQ39K置換変異(Kabat付番)を含み、L2のVLドメイン内のQ38E置換変異(Kabat付番)を含む。
特定の実施形態において、異なるIgG分子(例えば上述の免疫グロブリン重鎖及び軽鎖のいずれかなど)に導入されるアミノ酸修飾は、H1のVHドメイン内のQ39K置換変異(Kabat付番)、L1のVLドメイン内のQ38E置換変異(Kabat付番)、H1のCH1ドメイン内のA141I、F170S、S181M、S183A、及びV185A変異(EU付番)、L1のCLドメイン内のF116A、L135V、S174A、S176F、及びT178V変異(EU付番)、H2のVHドメイン内のQ39E置換変異(Kabat付番)、ならびにL2のVLドメイン内のQ38K置換変異(Kabat付番)を含む。
特定の実施形態において、異なるIgG分子(例えば上述の免疫グロブリン重鎖及び軽鎖のいずれかなど)に導入されるアミノ酸修飾は、H1のVHドメイン内のQ39K置換変異(Kabat付番)を含み、L1のVLドメイン内のQ38E置換変異(Kabat付番)を含み、H1のCH1ドメイン内のA141I、F170S、S181M、S183A、及びV185A変異(EU付番)から成り、L1のCLドメイン内のF116A、L135V、S174A、S176F、及びT178V変異(EU付番)から成り、H2のVHドメイン内のQ39E置換変異(Kabat付番)を含み、L2のVLドメイン内のQ38K置換変異(Kabat付番)を含む。
特定の実施形態において、異なるIgG分子(例えば上述の免疫グロブリン重鎖及び軽鎖のいずれかなど)に導入されるアミノ酸修飾は、H1のCH1ドメイン内のA141I、F170S、S181M、S183A、及びV185A変異(EU付番)、L1のCLドメイン内のF116A、L135V、S174A、S176F、及びT178V変異(EU付番)、H2のCH1ドメイン内のS183E置換変異(EU付番)、ならびにL2のCLドメイン内のV133K置換変異(EU付番)を含む。
特定の実施形態において、異なるIgG分子(例えば上述の免疫グロブリン重鎖及び軽鎖のいずれかなど)に導入されるアミノ酸修飾は、H1のCH1ドメイン内のA141I、F170S、S181M、S183A、及びV185A変異(EU付番)を含み、L1のCLドメイン内のF116A、L135V、S174A、S176F、及びT178V変異(EU付番)を含み、H2のCH1ドメイン内のS183E置換変異(EU付番)から成り、L2のCLドメイン内のV133K置換変異(EU付番)から成る。
特定の実施形態において、異なるIgG分子(例えば上述の免疫グロブリン重鎖及び軽鎖のいずれかなど)に導入されるアミノ酸修飾は、H1のCH1ドメイン内のA141I、F170S、S181M、S183A、及びV185A変異(EU付番)、L1のCLドメイン内のF116A、L135V、S174A、S176F、及びT178V変異(EU付番)、H2のCH1ドメイン内のS183E置換変異(EU付番)、ならびにL2のCLドメイン内のV133K置換変異(EU付番)から成る。
特定の実施形態において、異なるIgG分子(例えば上述の免疫グロブリン重鎖及び軽鎖のいずれかなど)に導入されるアミノ酸修飾は、H1のVHドメイン内のQ39E置換変異(Kabat付番)、L1のVLドメイン内のQ38K置換変異(Kabat付番)、H1のCH1内のA141I、F170S、S181M、S183A、及びV185A変異(EU付番)、H1のCLドメイン内のF116A、L135V、S174A、S176F、及びT178V変異(EU付番)、H2のVHドメイン内のQ39K置換変異(Kabat付番)、H2のCH1内のS183E置換変異(EU付番)、L2のVLドメイン内のQ38E置換変異(Kabat付番)、ならびにL2のCLドメイン内のV133K置換変異(EU付番)を含む。
特定の実施形態において、異なるIgG分子(例えば上述の免疫グロブリン重鎖及び軽鎖のいずれかなど)に導入されるアミノ酸修飾は、H1のVHドメイン内のQ39E置換変異(Kabat付番)を含み、L1のVLドメイン内のQ38K置換変異(Kabat付番)を含み、H1のCH1内のA141I、F170S、S181M、S183A、及びV185A変異(EU付番)を含み、H1のCLドメイン内のF116A、L135V、S174A、S176F、及びT178V変異(EU付番)を含み、H2のVHドメイン内のQ39K置換変異(Kabat付番)を含み、H2のCH1内のS183E置換変異(EU付番)から成り、L2のVLドメイン内のQ38E置換変異(Kabat付番)を含み、L2のCLドメイン内のV133K置換変異(EU付番)から成る。
特定の実施形態において、異なるIgG分子(例えば上述の免疫グロブリン重鎖及び軽鎖のいずれかなど)に導入されるアミノ酸修飾は、H1のVHドメイン内のQ39E置換変異(Kabat付番)を含み、L1のVLドメイン内のQ38K置換変異(Kabat付番)を含み、H1のCH1内のA141I、F170S、S181M、S183A、及びV185A変異(EU付番)から成り、H1のCLドメイン内のF116A、L135V、S174A、S176F、及びT178V変異(EU付番)から成り、H2のVHドメイン内のQ39K置換変異(Kabat付番)を含み、H2のCH1内のS183E置換変異(EU付番)から成り、L2のVLドメイン内のQ38E置換変異(Kabat付番)を含み、L2のCLドメイン内のV133K置換変異(EU付番)から成る。
特定の実施形態において、異なるIgG分子(例えば上述の免疫グロブリン重鎖及び軽鎖のいずれかなど)に導入されるアミノ酸修飾は、H1のVHドメイン内のQ39K置換変異(Kabat付番)、L1のVLドメイン内のQ38E置換変異(Kabat付番)、H1のCH1ドメイン内のA141I、F170S、S181M、S183A、及びV185A変異(EU付番)、L1のCLドメイン内のF116A、L135V、S174A、S176F、及びT178V変異(EU付番)、H2のVHドメイン内のQ39E置換変異(Kabat付番)、H2のCH1ドメイン内のS183E置換変異(EU付番)、L2のVLドメイン内のQ38K置換変異(Kabat付番)、ならびにL2のCL内のV133K置換変異(EU付番)を含む。
特定の実施形態において、異なるIgG分子(例えば上述の免疫グロブリン重鎖及び軽鎖のいずれかなど)に導入されるアミノ酸修飾は、H1のVHドメイン内のQ39K置換変異(Kabat付番)を含み、L1のVLドメイン内のQ38E置換変異(Kabat付番)を含み、H1のCH1ドメイン内のA141I、F170S、S181M、S183A、及びV185A変異(EU付番)を含み、L1のCLドメイン内のF116A、L135V、S174A、S176F、及びT178V変異(EU付番)を含み、H2のVHドメイン内のQ39E置換変異(Kabat付番)を含み、H2のCH1ドメイン内のS183E置換変異(EU付番)から成り、L2のVLドメイン内のQ38K置換変異(Kabat付番)を含み、L2のCL内のV133K置換変異(EU付番)から成る。
特定の実施形態において、異なるIgG分子(例えば上述の免疫グロブリン重鎖及び軽鎖のいずれかなど)に導入されるアミノ酸修飾は、H1のVHドメイン内のQ39K置換変異(Kabat付番)を含み、L1のVLドメイン内のQ38E置換変異(Kabat付番)を含み、H1のCH1ドメイン内のA141I、F170S、S181M、S183A、及びV185A変異(EU付番)から成り、L1のCLドメイン内のF116A、L135V、S174A、S176F、及びT178V変異(EU付番)から成り、H2のVHドメイン内のQ39E置換変異(Kabat付番)を含み、H2のCH1ドメイン内のS183E置換変異(EU付番)から成り、L2のVLドメイン内のQ38K置換変異(Kabat付番)を含み、L2のCL内のV133K置換変異(EU付番)から成る。
特定の実施形態において、異なるIgG分子(例えば上述の免疫グロブリン重鎖及び軽鎖のいずれかなど)に導入されるアミノ酸修飾は、H1のCH1ドメイン内のA141I、F170S、S181M、S183A、及びV185A変異(EU付番)、L1のCLドメイン内のF116A、L135V、S174A、S176F、及びT178V変異(EU付番)、H2のCH1ドメイン内のS183K置換変異(EU付番)、ならびにL2のCLドメイン内のV133E置換変異(EU付番)を含む。
特定の実施形態において、異なるIgG分子(例えば上述の免疫グロブリン重鎖及び軽鎖のいずれかなど)に導入されるアミノ酸修飾は、H1のCH1ドメイン内のA141I、F170S、S181M、S183A、及びV185A変異(EU付番)を含み、L1のCLドメイン内のF116A、L135V、S174A、S176F、及びT178V変異(EU付番)を含み、H2のCH1ドメイン内のS183K置換変異(EU付番)から成り、L2のCLドメイン内のV133E置換変異(EU付番)から成る。
特定の実施形態において、異なるIgG分子(例えば上述の免疫グロブリン重鎖及び軽鎖のいずれかなど)に導入されるアミノ酸修飾は、H1のCH1ドメイン内のA141I、F170S、S181M、S183A、及びV185A変異(EU付番)、L1のCLドメイン内のF116A、L135V、S174A、S176F、及びT178V変異(EU付番)から成り、H2のCH1ドメイン内のS183K置換変異(EU付番)から成り、L2のCLドメイン内のV133E置換変異(EU付番)から成る。
特定の実施形態において、異なるIgG分子(例えば上述の免疫グロブリン重鎖及び軽鎖のいずれかなど)に導入されるアミノ酸修飾は、H1のVHドメイン内のQ39E置換変異(Kabat付番)、L1のVLドメイン内のQ38K置換変異(Kabat付番)、H1のCH1ドメイン内のA141I、F170S、S181M、S183A、及びV185A変異(EU付番)、L1のCLドメイン内のF116A、L135V、S174A、S176F、及びT178V変異(EU付番)、H2のVHドメイン内のQ39K置換変異(Kabat付番)、H2のCH1ドメイン内のS183K置換変異(EU付番)、L2のVLドメイン内のQ38E置換変異(Kabat付番)、ならびにL2のCLドメイン内のV133E置換変異(EU付番)を含む。
特定の実施形態において、異なるIgG分子(例えば上述の免疫グロブリン重鎖及び軽鎖のいずれかなど)に導入されるアミノ酸修飾は、H1のVHドメイン内のQ39E置換変異(Kabat付番)を含み、L1のVLドメイン内のQ38K置換変異(Kabat付番)を含み、H1のCH1ドメイン内のA141I、F170S、S181M、S183A、及びV185A変異(EU付番)を含み、L1のCLドメイン内のF116A、L135V、S174A、S176F、及びT178V変異(EU付番)を含み、H2のVHドメイン内のQ39K置換変異(Kabat付番)を含み、H2のCH1ドメイン内のS183K置換変異(EU付番)から成り、L2のVLドメイン内のQ38E置換変異(Kabat付番)を含み、L2のCLドメイン内のV133E置換変異(EU付番)から成る。
特定の実施形態において、異なるIgG分子(例えば上述の免疫グロブリン重鎖及び軽鎖のいずれかなど)に導入されるアミノ酸修飾は、H1のVHドメイン内のQ39E置換変異(Kabat付番)を含み、L1のVLドメイン内のQ38K置換変異(Kabat付番)を含み、H1のCH1ドメイン内のA141I、F170S、S181M、S183A、及びV185A変異(EU付番)から成り、L1のCLドメイン内のF116A、L135V、S174A、S176F、及びT178V変異(EU付番)から成り、H2のVHドメイン内のQ39K置換変異(Kabat付番)を含み、H2のCH1ドメイン内のS183K置換変異(EU付番)から成り、L2のVLドメイン内のQ38E置換変異(Kabat付番)を含み、L2のCLドメイン内のV133E置換変異(EU付番)から成る。
特定の実施形態において、異なるIgG分子(例えば上述の免疫グロブリン重鎖及び軽鎖のいずれかなど)に導入されるアミノ酸修飾は、H1のVHドメイン内のQ39K置換変異(Kabat付番)、L1のVLドメイン内のQ38E置換変異(Kabat付番)、H1のCH1ドメイン内のA141I、F170S、S181M、S183A、及びV185A変異(EU付番)、L1のCLドメイン内のF116A、L135V、S174A、S176F、及びT178V変異(EU付番)、H2のVHドメイン内のQ39E置換変異(Kabat付番)、H2のCH1ドメイン内のS183K置換変異(EU付番)、L2のVLドメイン内のQ38K置換変異(Kabat付番)、ならびにL2のCLドメイン内のV133E置換変異(EU付番)を含む。
特定の実施形態において、異なるIgG分子(例えば上述の免疫グロブリン重鎖及び軽鎖のいずれかなど)に導入されるアミノ酸修飾は、H1のVHドメイン内のQ39K置換変異(Kabat付番)を含み、L1のVLドメイン内のQ38E置換変異(Kabat付番)を含み、H1のCH1ドメイン内のA141I、F170S、S181M、S183A、及びV185A変異(EU付番)を含み、L1のCLドメイン内のF116A、L135V、S174A、S176F、及びT178V変異(EU付番)を含み、H2のVHドメイン内のQ39E置換変異(Kabat付番)を含み、H2のCH1ドメイン内のS183K置換変異(EU付番)から成り、L2のVLドメイン内のQ38K置換変異(Kabat付番)を含み、L2のCLドメイン内のV133E置換変異(EU付番)から成る。
特定の実施形態において、異なるIgG分子(例えば上述の免疫グロブリン重鎖及び軽鎖のいずれかなど)に導入されるアミノ酸修飾は、H1のVHドメイン内のQ39K置換変異(Kabat付番)を含み、L1のVLドメイン内のQ38E置換変異(Kabat付番)を含み、H1のCH1ドメイン内のA141I、F170S、S181M、S183A、及びV185A変異(EU付番)から成り、L1のCLドメイン内のF116A、L135V、S174A、S176F、及びT178V変異(EU付番)から成り、H2のVHドメイン内のQ39E置換変異(Kabat付番)を含み、H2のCH1ドメイン内のS183K置換変異(EU付番)から成り、L2のVLドメイン内のQ38K置換変異(Kabat付番)を含み、L2のCLドメイン内のV133E置換変異(EU付番)から成る。
特定の実施形態において、異なるIgG分子(例えば上述の免疫グロブリン重鎖及び軽鎖のいずれかなど)に導入されるアミノ酸修飾は、次の組み合わせの置換変異を含む(例えばそれらから成るか、またはそれらから本質的に成る):H1のCH1ドメイン上のL128F、A141M、F170M、S181I、及びS183A変異(EU付番)、ならびにL1のCLドメイン上のF118V、S131T、V133A、L135Y、S162A、T164S、S176M、及びT178L変異(EU付番)。
特定の実施形態において、異なるIgG分子(例えば上述の免疫グロブリン重鎖及び軽鎖のいずれかなど)に導入されるアミノ酸修飾は、次の組み合わせの置換変異を含む(例えばそれらから成るか、またはそれらから本質的に成る):H1のCH1ドメイン上のL128F、A141M、F170Y、S181I、S183A、及びV185A変異(EU付番)、ならびにL1のCLドメイン上のF118V、S131T、V133A、L135F、S162A、S176A、及びT178L変異(EU付番)。
特定の実施形態において、異なるIgG分子(例えば上述の免疫グロブリン重鎖及び軽鎖のいずれかなど)に導入されるアミノ酸修飾は、次の組み合わせの置換変異を含む(例えばそれらから成るか、またはそれらから本質的に成る):H1のCH1ドメイン上のL128F、A141T、F170M、S181T、S183A、及びV185L変異(EU付番)、ならびにL1のCLドメイン上のF118V、S131T、V133A、L135F、S162A、T164S、S176T、及びT178L変異(EU付番)。
特定の実施形態において、異なるIgG分子(例えば上述の免疫グロブリン重鎖及び軽鎖のいずれかなど)に導入されるアミノ酸修飾は、次の組み合わせの置換変異を含む(例えばそれらから成るか、またはそれらから本質的に成る):H1のCH1ドメイン上のL128F、A141M、F170M、S181T、及びS183A変異(EU付番)、ならびにL1のCLドメイン上のF118V、S131T、V133A、L135F、S162M、T164S、S176M、及びT178L変異(EU付番)。
特定の実施形態において、異なるIgG分子(例えば上述の免疫グロブリン重鎖及び軽鎖のいずれかなど)に導入されるアミノ酸修飾は、次の組み合わせの置換変異を含む(例えばそれらから成るか、またはそれらから本質的に成る):H1のCH1ドメイン上のA141I、F170S、S181M、S183V、及びV185A変異(EU付番)、ならびにL1のCLドメイン上のF116A、V133I、L135V、S162M、S174A、S176F、及びT178V変異(EU付番)。
特定の実施形態において、異なるIgG分子(例えば上述の免疫グロブリン重鎖及び軽鎖のいずれかなど)に導入されるアミノ酸修飾は、次の組み合わせの置換変異を含む(例えばそれらから成るか、またはそれらから本質的に成る):H1のCH1ドメイン上のA141I、F170S、S181M、S183A、及びV185A変異(EU付番)、ならびにL1のCLドメイン上のF116A、S131D、L135V、S162A、S174A、S176F、及びT178I変異(EU付番)。
特定の実施形態において、異なるIgG分子(例えば上述の免疫グロブリン重鎖及び軽鎖のいずれかなど)に導入されるアミノ酸修飾は、次の組み合わせの置換変異を含む:H1のCH1ドメイン上のA141I、F170S、S181M、S183A、及びV185A変異(EU付番)、ならびにL1のCLドメイン上のF116A、L135V、S174A、S176F、及びT178V変異(EU付番)。
特定の実施形態において、異なるIgG分子(例えば上述の免疫グロブリン重鎖及び軽鎖のいずれかなど)に導入されるアミノ酸修飾は、次の組み合わせの置換変異から成る:H1のCH1ドメイン上のA141I、F170S、S181M、S183A、及びV185A変異(EU付番)、ならびにL1のCLドメイン上のF116A、L135V、S174A、S176F、及びT178V変異(EU付番)。
特定の実施形態において、異なるIgG分子(例えば上述の免疫グロブリン重鎖及び軽鎖のいずれかなど)に導入されるアミノ酸修飾は、次の組み合わせの置換変異を含む(例えばそれらから成るか、またはそれらから本質的に成る):H1のCH1ドメイン上のA141I、F170A、S181M、S183V、及びV185A変異(EU付番)、ならびにL1のCLドメイン上のF116A、L135V、S162M、S174A、S176F、及びT178V変異(EU付番)。
方略番号2により特定されるCH1/CL界面内の変異、方略番号1により特定されるCH1/CL界面内の変異、ならびにVHドメイン及びVLドメイン内の変異の追加の組み合わせ、すなわち、上述のものに限定されないものも想定される。そのような組み合わせとしては、以下に記載されるものが挙げられるが、それらに限定されない。
「H1」及び「H2」という用語が独断的名称であり、上記の実施形態のいずれにおける「H1」及び「H2」も反転できることは、当業者には明らかであろう。すなわち、H1のCH1ドメイン及び/またはVHドメインならびにL1のCLドメイン及び/またはVLドメイン内にあるものとして上述された変異のいずれも、代替的に、H2のCH1ドメイン及び/またはVHドメインならびにL2のCLドメイン及び/またはVLドメイン内に存在することができる。
特性
優先的対合/優先的アセンブリ
「優先的対合」とは、第1のポリペプチドと第2のポリペプチドとの間で対合が起こるのと同時に1つ以上の追加の明確に異なるポリペプチドが存在するときの、第1のポリペプチド(例えばH1など)と第2のポリペプチド(例えばL1など)との対合パターンを表す。優先的対合は、例えば、H1が少なくともL1、及びL2と共発現されるとき、H1−L1重鎖−軽鎖対合の量がH1−L2対合の量よりも大きい場合に、本明細書において提供される多特異性抗原結合タンパク質のH1とL1との間で起こる。同様に、優先的対合は、例えば、H2が少なくともL1、及びL2と共発現されるとき、H2−L2重鎖−軽鎖対合の量がH2−L1対合の量よりも大きい場合に、本明細書において提供される多特異性抗原結合タンパク質のH2とL2との間で起こる。特定の実施形態において、優先的対合は、VH/VLドメイン及び/またはCH1/CLドメインのアミノ酸修飾から生じる。
特定の実施形態において、本明細書において提供される多特異性抗原結合タンパク質のH1は、L1と優先的に対合する。特定の実施形態において、本明細書において提供される多特異性抗原結合タンパク質のH2は、L2と優先的に対合する。特定の実施形態において、本明細書において提供される多特異性抗原結合タンパク質のH1は、L1と優先的に対合し、本明細書における多特異性抗原結合タンパク質のH2は、L2と優先的に対合する。特定の実施形態において、本明細書に記載の多特異性抗原結合タンパク質のH1が、H2、L1、及びL2と共発現される場合、所望の対合(例えば、H1−L1及びH2−L2)を含む多特異性抗原結合タンパク質は、少なくとも約30%、少なくとも約35%、少なくとも約40%、少なくとも約45%、少なくとも約50%、少なくとも約55%、少なくとも約60%、少なくとも約70%、少なくとも約71%、少なくとも約71%、少なくとも約72%、少なくとも約73%、少なくとも約74%、少なくとも約75%、少なくとも約76%、少なくとも約77%、少なくとも約78%、少なくとも約79%、少なくとも約80%、少なくとも約81%、少なくとも約82%、少なくとも約83%、少なくとも約84%、少なくとも約85%、少なくとも約86%、少なくとも約87%、少なくとも約88%、少なくとも約89%、少なくとも約90%、少なくとも約91%、少なくとも約92%、少なくとも約93%、少なくとも約94%、少なくとも約95%、少なくとも約96%、少なくとも約97%、少なくとも約98%、少なくとも約99%、または約99%超(これらの値間の任意の範囲を含む)の相対収率で産生される。所望の対合(例えば、H1−L1及びH2−L2)を含む多特異性抗原結合タンパク質の相対収率は、例えば、実施例に記載されるように、質量分析を使用して判定することができる。
特定の実施形態において、本明細書において提供される多特異性抗原結合タンパク質の発現されたポリペプチドは、誤対合した重鎖及び軽鎖の生成を低減させるように改善された特異性でアセンブルする。特定の実施形態において、本明細書において提供される多特異性抗原結合タンパク質のH1のCH1ドメインは、産生中にL1のCLドメインとアセンブルする。
優先的対合/優先的アセンブリの査定方法
多特異性抗原結合タンパク質のL1のCLドメインとのH1のCH1ドメインの優先的対合及び/または優先的アセンブリは、当業者に周知の多様な方法のうちの任意のものを使用して判定することができる。例えば、多特異性抗原結合タンパク質中のL1のCLドメインとのH1のCH1ドメインの優先的対合の度合いは、軽鎖競合アッセイ(LCCA)によって判定することができる。2013年10月3日出願の国際特許出願第PCT/US2013/063306号は、LCCAの様々な実施形態を記載し、参照によりその全体があらゆる目的のために本明細書に援用される。この方法は、共発現されたタンパク質の混合物中における重鎖と特異的な軽鎖との対合の定量分析を可能にし、これを使用して、重鎖及び軽鎖が共発現されるときに、1つの特定の免疫グロブリン重鎖が、2つの免疫グロブリン軽鎖のいずれか一方と選択的に会合するかどうかを判定することができる。この方法は、次のように簡単に説明される:重鎖が制限的な対合反応体となるような比率で、少なくとも1つの重鎖及び2つの異なる軽鎖を細胞内で共発現し、任意に、分泌タンパク質を細胞から分離させ、重鎖に結合した免疫グロブリン軽鎖ポリペプチドを分泌タンパク質の残りから分離させて、単離された重鎖対合画分を生成し、単離された重鎖画分中の異なる各軽鎖の量を検出し、単離された重鎖画分中の異なる各軽鎖の相対量を分析して、少なくとも1つの重鎖が軽鎖のうちの1つと選択的に対合する能力を判定する。
特定の実施形態において、多特異性抗原結合タンパク質のL1のCLドメインとのH1のCH1ドメインの優先的対合は、質量分析(例えば液体クロマトグラフィ質量分析(LC−MS)未変性質量分析、酸性質量分析など)によって判定される。質量分析は、分子量の差を使用し、各軽鎖を含む相対的なヘテロ二量体集団を数量化して、明確に異なる各種を特定するために使用される。
特定の実施形態において、多特異性抗原結合タンパク質のL1のCLドメインとのH1のCH1ドメインの優先的対合は、本明細書において提供される多特異性抗原結合タンパク質の重鎖/軽鎖対の熱的安定性をアッセイすることによって判定される。多特異性抗原結合タンパク質における重鎖/軽鎖対の熱的安定性は、当該技術分野で知られる方法に従って判定することができる。多特異性抗原結合タンパク質における重鎖/軽鎖対の溶融温度は、その熱的安定性を示す。重鎖/軽鎖対の融点は、示差走査熱量測定などの技術を使用して測定され得る(Chen et al(2003)Pharm Res 20:1952−60、Ghirlando et al(1999)Immunol Lett 68:47−52)。あるいは、重鎖/軽鎖対の熱的安定性は、円二色性を使用して測定されてもよい(Murray et al.(2002)J.Chromatogr Sci 40:343−9)。
特定の実施形態において、多特異性抗原結合タンパク質のL1のCLドメインとのH1のCH1ドメインの優先的対合は、重鎖/軽鎖対のそれらそれぞれの標的に対する結合親和性によって判定される。相互作用のオン速度及びオフ速度は、当該技術分野で周知の方法に従う競合結合アッセイによって判定することができる。特定の実施形態において、競合結合アッセイは、標識された標的(例えば、3Hまたは125I)を、本明細書において提供される多特異性抗原結合タンパク質と共に、増加する量の非標識標的の存在下でインキュベーションすることと、標識された標的に結合した多特異性抗原結合タンパク質を検出することとを含む、ラジオイムノアッセイである。特定の実施形態において、標的に対する多特異性抗原結合タンパク質の親和性及び結合オフ速度は、Scatchard分析による飽和データから判定することができる。
特定の実施形態において、多特異性抗原結合タンパク質のL1のCLドメインとのH1のCH1ドメインの優先的対合は、KD、koff、kon、Rmaxなどの動態パラメータを測定することによって判定される。特定の実施形態において、動態パラメータは、当該技術分野で知られる表面プラズモン共鳴(SPR)に基づくアッセイ(例えば、BIAcore動態分析)によって判定される。SPRに基づく技術の概説については、Mullet et al.,2000,Methods 22:77−91、Dong et al.,2002,Review in Mol.Biotech.,82:303−23、Fivash et al.,1998,Current Opinion in Biotechnology 9:97−101、Rich et al.,2000,Current Opinion In Biotechnology 11:54−61を参照されたい。さらに、米国特許第6,373,577号、同第6,289,286号、同第5,322,798号、同第5,341,215号、同第6,268,125号に記載されている、タンパク質−タンパク質相互作用を測定するためのSPR計器及びSPRに基づく方法のいずれもが想定される。
特定の実施形態において、蛍光標識細胞分取(FACS)が、当該技術分野で周知の方法に従って、多特異性抗原結合タンパク質のその標的(複数可)に対する親和性を測定するために使用される。L1のCLドメインとのH1のCH1ドメインの優先的対合をアッセイする他の方法は、例えば、WO 2014/081955、WO 2014/082179、及びWO 2014/150973に記載されており、これらは、参照によりそれらの全体があらゆる目的のために本明細書に援用される。
安定性
特定の実施形態において、H1のCH1ドメイン上に存在する1個以上のアミノ酸置換(複数可)及びL1のCL上に存在する1個以上のアミノ酸置換変異(複数可)は、本明細書において提供される多特異性抗原結合タンパク質の安定性を減少させない。特定の実施形態において、H1のCH1ドメイン上に存在する1個以上のアミノ酸置換(複数可)、L1のCL上に存在する1個以上のアミノ酸置換変異(複数可)、H1のVH上のQ39位(Kabat付番)におけるアミノ酸置換変異、及びL1のVLのQ38位(Kabat付番)におけるアミノ酸置換変異は、本明細書において提供される多特異性抗原結合タンパク質の安定性を減少させない。特定の実施形態において、H1のCH1ドメイン上に存在する1個以上のアミノ酸置換(複数可)、L1のCL上に存在する1個以上のアミノ酸置換変異(複数可)、H1のVH上のQ39位(Kabat付番)におけるアミノ酸置換変異、L1のVLのQ38位(Kabat付番)におけるアミノ酸置換変異、H2のVH上のQ39位(Kabat付番)におけるアミノ酸置換変異、及びL2のVLのQ38位(Kabat付番)におけるアミノ酸置換変異は、本明細書において提供される多特異性抗原結合タンパク質の安定性を減少させない。
特定の実施形態において、本明細書において提供される多特異性抗原結合タンパク質の安定性は、アミノ酸置換変異を有しない多特異性抗原結合タンパク質の安定性の少なくとも約80%、少なくとも約81%、少なくとも約82%、少なくとも約83%、少なくとも約84%、少なくとも約85%、少なくとも約86%、少なくとも約87%、少なくとも約88%、少なくとも約89%、少なくとも約90%、少なくとも約91%、少なくとも約92%、少なくとも約93%、少なくとも約94%、少なくとも約95%、少なくとも約96%、少なくとも約97%、少なくとも約98%、少なくとも約99%、または約99%超である。
多特異性抗原結合タンパク質の安定性は、当業者に知られるタンパク質安定性を査定するための多様な技術のうちの任意のものを使用して判定することができる。例えば、円二色性(CD)は、広範に、円偏光の吸収を測定する分光学的技術である。アルファヘリックス及びベータシートなどの構造は不斉であるため、円偏光の吸収は、タンパク質集団の折り畳みの度合いのマーカーとして働く。この技術は、この吸収の変化を温度の関数として測定することによってタンパク質の平衡アンフォールディングを測定するために使用されている。未変性状態及び変性状態の濃度が1である遷移中間点における温度は、タンパク質の溶融温度(Tm)として知られている。CDに関するさらなる詳細は、例えば、Kelly et al.(2000)Curr Prot and Peptide Sci 1,349−384、Correa et al.(2009)African J Biochem Res 3,164−173、及びGreenfield(2006)Nat Protoc.1,2527−2535に記載されている。
特定の実施形態において、本明細書に記載の多特異性抗原結合タンパク質(例えば、本明細書に記載のCH1/CL修飾及び/またはVH/VL修飾を含むもの)は、CH1/CLドメイン及び/またはVH/VLドメイン内にアミノ酸置換変異を含まない野生型多特異性抗原結合タンパク質のTmよりも約10℃以下、約9.5℃以下、約9℃以下、約8.5℃以下、約8℃以下、約7.5℃以下、約7.0℃以下、約6.5℃以下、約6.0℃以下、約5.5℃以下、約5.0℃以下、約4.5℃以下、約4℃以下、約3.5℃以下、約3℃以下、約2.5℃以下、約2℃以下、約1.5℃以下、約1℃以下、約0.5℃以下、または約0.5℃未満低い溶融温度を有する。特定の実施形態において、本明細書に記載の多特異性抗原結合タンパク質のFab(例えば、本明細書に記載のCH1/CL修飾及び/またはVH/VL修飾を含むもの)は、CH1/CLドメイン及び/またはVH/VLドメイン内にアミノ酸置換変異を含まない多特異性抗原結合タンパク質の野生型親抗体のFabのTmよりも約10℃以下、約9.5℃以下、約9℃以下、約8.5℃以下、約8℃以下、約7.5℃以下、約7.0℃以下、約6.5℃以下、約6.0℃以下、約5.5℃以下、約5.0℃以下、約4.5℃以下、約4℃以下、約3.5℃以下、約3℃以下、約2.5℃以下、約2℃以下、約1.5℃以下、約1℃以下、約0.5℃以下、または約0.5℃未満低い溶融温度を有する。
あるいは、多特異性抗原結合タンパク質の安定性は、例えば、タンパク質中の非共有結合形成を制御する熱力学的パラメータを測定する示差走査熱量測定(DSC)を使用して判定してもよい。DSCに関するさらなる詳細は、例えば、Ionescu et al.(2008)J Pharm Sci 97,1414−1426に記載されている。多特異性抗原結合タンパク質の安定性は、例えば、タンパク質が例えばリガンドまたは第2のタンパク質に結合する際の標的タンパク質の熱的安定性及びタンパク質の溶融温度の変化を測定する、示差走査蛍光定量(DSFまたは熱的シフトアッセイ)を使用して判定することもできる。DSFに関するさらなる詳細は、例えば、Niesen,et al.(2007)Nat Protoc 2,2212−2221に記載されている。
結合親和性
特定の実施形態において、H1のCH1ドメイン上に存在する1個以上のアミノ酸置換(複数可)及びL1のCL上に存在する1個以上のアミノ酸置換変異(複数可)は、本明細書において提供される多特異性抗原結合タンパク質の抗原に対する結合親和性を減少させない。特定の実施形態において、H1のCH1ドメイン上に存在する1個以上のアミノ酸置換(複数可)、L1のCL上に存在する1個以上のアミノ酸置換変異(複数可)、H1のVH上のQ39位(Kabat付番)におけるアミノ酸置換変異、及びL1のVLのQ38位(Kabat付番)におけるアミノ酸置換変異は、本明細書において提供される多特異性抗原結合タンパク質の抗原に対する結合親和性を減少させない。特定の実施形態において、H1のCH1ドメイン上に存在する1個以上のアミノ酸置換(複数可)、L1のCL上に存在する1個以上のアミノ酸置換変異(複数可)、H1のVH上のQ39位(Kabat付番)におけるアミノ酸置換変異、L1のVLのQ38位(Kabat付番)におけるアミノ酸置換変異、H2のVH上のQ39位(Kabat付番)におけるアミノ酸置換変異、及びL2のVLのQ38位(Kabat付番)におけるアミノ酸置換変異は、本明細書において提供される多特異性抗原結合タンパク質の抗原に対する結合親和性を減少させない。
結合親和性の測定方法
本明細書の他の箇所に注記されているように、本明細書において提供される多特異性抗原結合タンパク質の抗原結合は、Kd、kon、及び/またはkoffを含む多様な結合動態パラメータのいずれか1つを測定することによって査定することができる。Kdは、BIAcore(商標)−T100またはBIAcore(商標)−T200(GE Healthcare,Piscataway,NJ)を使用した表面プラズモン共鳴アッセイを使用して、25℃で、100応答単位(RU)で固定化された標的(例えば、抗原)CM5チップを用いて測定することができる。簡潔に述べると、カルボキシメチル化デキストリンバイオセンサチップ(CM5、BIAcore Inc.)を、供給業者の指示に従って、N−エチル−N’−(3−ジメチルアミノプロピル)−カルボジイミド塩酸塩(EDC)及びN−ヒドロキシスクシンイミド(NHS)で作動させる。抗原を10mMの酢酸ナトリウム(pH4.8)で5μg/ml(約0.2μM)まで希釈した後、カップリングされたタンパク質のおよそ100応答単位(RU)を実現するように、5μl/分の流量で注入する。抗原の注入後、1Mのエタノールアミンを注入して、未反応基をブロッキングする。動態測定については、Fabの2倍段階希釈(例えば、0.78nM〜500nM)を、0.05% Tween 20(PBST)を含むPBSに、25℃で、およそ25μl/分の流量で注入する。会合速度(kon)及び解離速度(koff)は、単純な1対1のLangmuir結合モデル(BIAcore Evaluation Software)を使用して、会合センサグラムと解離センサグラムとを同時に当てはめることによって計算される。平衡解離定数(Kd)は、koff/konの比として計算される。例えば、Chen et al.,J.Mol.Biol.293:865−881(1999)を参照されたい。上記の表面プラズモン共鳴アッセイによるオン速度が106M−1s−1を超える場合、このオン速度は、撹拌されたキュベットを備えるストップフロー装着分光光度計(Aviv Instruments)または8000シリーズSLM−Aminco分光光度計(ThermoSpectronic)などの分光計で測定される、漸増濃度の抗原の存在下で、PBS(pH7.2)中20nMの抗抗原抗体(Fab型)の25℃における蛍光発光強度(励起=295nm、発光=340nm、16nm帯域通過)の上昇または減少を測定する、蛍光消光技法を使用することによって、判定することができる。
特定の実施形態において、本明細書において提供される多特異性抗原結合タンパク質のKdは、CH1/CL界面に変異を含まない野生型結合タンパク質のKdの少なくとも約10%以上、約15%、約20%、約25%、約30%、約35%、約40%、約45%、約50%、または約50%超である。
免疫原性
特定の実施形態において、本明細書において提供される多特異性抗原結合タンパク質は、ヒトにおいて非免疫原性または実質的に非免疫原性である。特定の実施形態において、CH1領域の修飾(例えば1個以上のアミノ酸置換など)は、ヒトにおいて非免疫原性または実質的に非免疫原性である。特定の実施形態において、CL領域の修飾(例えば1個以上のアミノ酸置換など)は、ヒトにおいて非免疫原性または実質的に非免疫原性である。特定の実施形態において、CH1領域の修飾(例えば1個以上のアミノ酸置換など)は、ヒトT細胞エピトープをもたらさない。特定の実施形態において、CL領域の修飾(例えば1個以上のアミノ酸置換など)は、ヒトT細胞エピトープをもたらさない。本明細書において提供される多特異性抗原結合タンパク質の免疫原性は、当業者に周知の方法を使用して評価することができる。特定の実施形態において、本明細書において提供される多特異性抗原結合タンパク質の免疫原性は、ELISAによって査定される(例えば、Yin et al.(2015)Cell Immunol.295,118−126を参照されたい)。また、例えば、Hartmann et al.(2001)Clin Cancer Res.7,1873−1881を参照されたい。
薬物動態特性
特定の実施形態において、H1のCH1ドメイン上に存在する1個以上のアミノ酸置換(複数可)及びL1のCL上に存在する1個以上のアミノ酸置換変異(複数可)は、かかるアミノ酸置換を含まない多特異性抗原結合タンパク質と比較して、本明細書において提供される多特異性抗原結合タンパク質の薬物動態特性に著しく影響しない。特定の実施形態において、H1のCH1ドメイン上に存在する1個以上のアミノ酸置換(複数可)、L1のCL上に存在する1個以上のアミノ酸置換変異(複数可)、H1のVH上のQ39位(Kabat付番)におけるアミノ酸置換変異、及びL1のVLのQ38位(Kabat付番)におけるアミノ酸置換変異は、かかるアミノ酸置換を含まない多特異性抗原結合タンパク質と比較して、本明細書において提供される多特異性抗原結合タンパク質の薬物動態特性に著しく影響しない。特定の実施形態において、H1のCH1ドメイン上に存在する1個以上のアミノ酸置換(複数可)、L1のCL上に存在する1個以上のアミノ酸置換変異(複数可)、H1のVH上のQ39位(Kabat付番)におけるアミノ酸置換変異、L1のVLのQ38位(Kabat付番)におけるアミノ酸置換変異、H2のVH上のQ39位(Kabat付番)におけるアミノ酸置換変異、及びL2のVLのQ38位(Kabat付番)におけるアミノ酸置換変異は、かかるアミノ酸置換を含まない多特異性抗原結合タンパク質と比較して、本明細書において提供される多特異性抗原結合タンパク質の薬物動態特性に著しく影響しない。そのような薬物動態特性としては、例えば、Cmax、AUC、CL(すなわち、薬物クリアランス)、t1/2,β、V1、及びVssが挙げられる。特定の実施形態において、本明細書において提供される多特異性抗原結合タンパク質のCmaxは、H1のCH1、H1のVH、L1のCL、L1のVL、H2のCH1、H2のVH、L2のCL、及び/またはL2のVL内にアミノ酸置換を含まない多特異性抗原結合タンパク質の約50%、60%、70%、80%、90%、100%、110%、120%、130%、140%、150%、または160%のいずれか1つである(これらの値間の任意の範囲を含む)。特定の実施形態において、本明細書において提供される多特異性抗原結合タンパク質のAUCは、H1のCH1、H1のVH、L1のCL、L1のVL、H2のCH1、H2のVH、L2のCL、及び/またはL2のVL内にアミノ酸置換を含まない多特異性抗原結合タンパク質の約50%、60%、70%、80%、90%、100%、110%、120%、130%、140%、150%、または160%のいずれか1つである(これらの値間の任意の範囲を含む)。特定の実施形態において、本明細書において提供される多特異性抗原結合タンパク質のCL(すなわち薬物クリアランス)は、H1のCH1、H1のVH、L1のCL、L1のVL、H2のCH1、H2のVH、L2のCL、及び/またはL2のVL内にアミノ酸置換を含まない多特異性抗原結合タンパク質の約50%、60%、70%、80%、90%、100%、110%、120%、130%、140%、150%、または160%のいずれか1つである(これらの値間の任意の範囲を含む)。特定の実施形態において、本明細書において提供される多特異性抗原結合タンパク質のt1/2,βは、H1のCH1、H1のVH、L1のCL、L1のVL、H2のCH1、H2のVH、L2のCL、及び/またはL2のVL内にアミノ酸置換を含まない多特異性抗原結合タンパク質の約50%、60%、70%、80%、90%、100%、110%、120%、130%、140%、150%、または160%のいずれか1つである(これらの値間の任意の範囲を含む)。特定の実施形態において、本明細書において提供される多特異性抗原結合タンパク質のV1は、H1のCH1、H1のVH、L1のCL、L1のVL、H2のCH1、H2のVH、L2のCL、及び/またはL2のVL内にアミノ酸置換を含まない多特異性抗原結合タンパク質の約50%、60%、70%、80%、90%、100%、110%、120%、130%、140%、150%、または160%のいずれか1つである(これらの値間の任意の範囲を含む)。特定の実施形態において、本明細書において提供される多特異性抗原結合タンパク質のVssは、H1のCH1、H1のVH、L1のCL、L1のVL、H2のCH1、H2のVH、L2のCL、及び/またはL2のVL内にアミノ酸置換を含まない多特異性抗原結合タンパク質の約50%、60%、70%、80%、90%、100%、110%、120%、130%、140%、150%、または160%のいずれか1つである(これらの値間の任意の範囲を含む)。
多特異性抗体形式
本明細書において提供される多特異性抗原結合タンパク質は、当該技術分野で知られる多様な二重特異性または多特異性の抗体形式のうちの任意のものと共に使用することができる。複数の結合特異性を有する分子によって得られる治療機会に取り組むために、多数の形式が当該技術分野において開発されてきた。特異的な抗体軽鎖または断片が特異的な抗体重鎖または断片と対合する二重特異性抗体を調製するためのいくつかの手法が説明されている。
例えば、国際特許出願第PCT/EP2011/056388号(WO 2011/131746)は、還元条件下でのインキュベーションに際し、2つの単一特異性IgG4またはIgG4様抗体間での指向性「Fabアーム」または「半分子」交換を推進するために、2つの単一特異性出発タンパク質のCH3領域に非対称変異が導入される、ヘテロ二量体タンパク質を生成するためのインビトロ法を記載する。
Schaeferら(Roche Diagnostics GmbH)は、人工的なリンカーを使用することなく、2つの既存の抗体に由来する2つの重鎖及び2つの軽鎖をヒト二価二重特異性IgG抗体にアセンブルする方法を説明する(PNAS(2011)108(27):11187−11192及びUS 2009/0232811)。この方法は、二重特異性抗体(CrossMab)の半分の抗原結合断片(Fab)内で1つ以上の重鎖ドメインと軽鎖ドメインとを交換することを伴う。重鎖のヘテロ二量体化を可能にするノブ・イントゥ・ホール技術に基づいて、二重特異性抗体の半分の抗原結合断片(Fab)内における重鎖ドメインと軽鎖ドメインとの交換によって、軽鎖とそれらの同族の重鎖との正確な会合が実現される。この「クロスオーバー」は、抗原結合親和性を保持するが、軽鎖誤対合がもはや起こり得ないほど2つのアームを異なるものにする。それぞれ参照により全体が本明細書に援用される、WO2009/080251、WO2009/080252、WO2009/080253、及びWO2009/080254を参照されたい。
ノブ・イントゥ・ホールは、抗体のCH3ドメインのためのヘテロ二量体化技術である。これまで、ノブ・イントゥ・ホール技術は、単一の共通軽鎖(LC)を有するヒト全長二重特異性抗体の産生に適用されてきた(Merchant et al.“An efficient route to human bispecific IgG.”Nat Biotechnol.1998;16:677−81、Jackman et al.“Development of a two−part strategy to identify a therapeutic human bispecific antibody that inhibits IgE receptor signaling.”J Biol Chem.2010;285:20850−9。)また、参照により全体があらゆる目的のために本明細書に援用される、WO1996027011を参照されたい。
Stropら(Rinat−Pfizer Inc.)は、2つの目的の抗体を別々に発現させ精製し、その後指定されたレドックス条件下でそれらを一緒に混合することによる、安定な二重特異性抗体の産生方法を説明する(J.Mol.Biol.(2012)420:204−19)。
ホモ二量体と比べてヘテロ二量体の形成に対して強い優先度を有する他のヘテロ二量体化ドメインが、本多特異性抗原結合タンパク質に組み込まれてもよい。例証となる例には、例えば、WO2007147901(Kjaergaardら−Novo Nordisk:イオン相互作用を説明する)、WO 2009089004(Kannanら−Amgen:静電気的ステアリング効果を説明する)、WO 2010/034605(Christensenら−Genentech;コイルドコイルを説明する)が含まれるが、これらに限定されない。また、例えば、ロイシンジッパーを説明するPack,P.& Plueckthun,A.,Biochemistry 31,1579−1584(1992)、またはヘリックス−ターン−ヘリックスモチーフを説明するPack et al.,Bio/Technology 11,1271−1277(1993)を参照されたい。「ヘテロ多量体化ドメイン」及び「ヘテロ二量体化ドメイン」という表現は、本明細書では互換的に使用される。特定の実施形態において、多特異性抗原結合タンパク質は、1つ以上のヘテロ二量体化ドメインを含む。
Zhuら(Genentech)は、定常ドメインを完全に欠いている変異形ドメイン抗体断片から成るダイアボディ構築物のVL/VH界面内の変異を設計し、ヘテロ二量体ダイアボディを生成した(Protein Science(1997)6:781−788)。同様に、Igawaら(Chugai)も、ダイアボディの選択的発現を促進し、かつ立体構造異性化を阻害する、一本鎖ダイアボディのVL/VH界面内の変異を設計した(Protein Engineering,Design & Selection(2010)23:667−677)。
米国特許公開第2009/0182127号(Novo Nordisk,Inc.)は、一方の対の軽鎖が他方の対の重鎖と相互作用する能力を低減させる、軽鎖−重鎖対のFc界面及びCH1:CL界面におけるアミノ酸残基を修飾することによる二重特異性抗体の生成を記載する。
二重特異性T細胞エンゲージャー(BiTE)分子(例えば、Wolf et al.(2005)Drug Discovery Today 10:1237−1244)を参照されたい)に使用される別の形式は、一本鎖可変断片(scFv)モジュールに基づく。scFvは、可動性リンカーを介して融合した、抗体の軽鎖及び重鎖の可変領域から成り、これは、概して適切に折り畳むことができ、その結果、これらの領域は同族の抗原に結合することができる。BiTEは、異なる特異性の2つのscFvを一本鎖上で直列に連結させる。この構成は、同じ重鎖可変領域の2つのコピーを有する分子の産生を妨げる。加えて、このリンカー構成は、それぞれの軽鎖及び重鎖の正確な対合を確実にするように設計されている。
様々な二重特異性及び多特異性の抗体形式の概説が、Klein et al.,(2012)mAbs 4:6,653−663及びSpiess et al.(2015)“Alternative molecular formats and therapeutic applications for bispecific antibodies.”Mol.Immunol.(2015年1月27日オンライン公開、doi:10.1016/j.molimm.2015.01.003)に提供されている。
本明細書に記載の多特異性抗原結合タンパク質は、上述の形式のうちの任意のものに組み込むことができる。特定の実施形態において、本明細書に記載のCH1/CL変異及びVH/VL変異をCrossMab技術と組み合わせて、正確な重鎖/軽鎖対合をさらに確実にすることができる。
ポリヌクレオチド、ベクター、及び宿主細胞
ポリヌクレオチド
本明細書では、本明細書に記載の重鎖及び/または軽鎖の定常ドメイン及び/または可変ドメインをコードする核酸が提供される。特定の実施形態において、本明細書において提供される単離された核酸は、本明細書に記載の多特異性抗原結合タンパク質の少なくとも1つのポリペプチド配列をコードする。特定の実施形態において、本明細書において提供される単離された核酸は、本明細書に記載の多特異性抗原結合タンパク質の少なくとも2つのポリペプチド配列をコードする。特定の実施形態において、本明細書において提供される単離された核酸は、本明細書に記載の多特異性抗原結合タンパク質の少なくとも3つのポリペプチド配列をコードする。特定の実施形態において、本明細書において提供される単離された核酸は、本明細書に記載の多特異性抗原結合タンパク質の少なくとも4つのポリペプチド配列をコードする。特定の実施形態において、本明細書において提供される単離された核酸は、本明細書に記載の多特異性抗原結合タンパク質の4つより多くのポリペプチド配列をコードする。
本明細書において提供される核酸分子は、一本鎖形態と二本鎖形態との両方におけるDNA及びRNA、ならびに対応する相補的な配列を含む。DNAは、例えば、cDNA、ゲノムDNA、キメラ合成DNA、PCRにより増幅されたDNA、及びそれらの組み合わせを含む。本明細書において提供される核酸分子は、全長遺伝子またはcDNA分子、ならびにそれらの断片の組み合わせを含む。特定の実施形態において、本明細書において提供される核酸は、ヒト源に由来する。特定の実施形態において、本明細書において提供される核酸は、マウス源に由来する。
本明細書の他の箇所に注記されているように、「単離された」核酸は、自然発生源から単離された核酸の場合、その核酸が単離された生物のゲノム内に存在する隣接する遺伝子配列から分離されている核酸である。例えばPCR生成物、cDNA分子、またはオリゴヌクレオチドなどの、鋳型から酵素的に合成された核酸または化学的に合成された核酸の場合、そのようなプロセスから生じる核酸は、単離された核酸であると理解される。単離された核酸分子は、別々の断片の形態にある、またはより大きな核酸構築物の構成要素としての核酸分子を指す。
特定の実施形態において、核酸は、内在性汚染物質を実質的に含まない。核酸分子は、標準的な生化学的方法(例えば、Sambrook et al.,Molecular Cloning:A Laboratory Manual,2nd ed.,Cold Spring Harbor Laboratory,Cold Spring Harbor,NY(1989)に概説されているものなど)によって、実質的に純粋な形態で、かつその構成ヌクレオチド配列の特定、操作、及び回収を可能にする量または濃度で少なくとも1回単離されている、DNAまたはRNAから得られたものであることが好ましい。そのような配列は、真核生物の遺伝子中に典型的に存在する内部非翻訳配列、すなわちイントロンによって中断されていない、オープンリーディングフレームの形態で提供及び/または構築されることが好ましい。翻訳されないDNAの配列は、それがコード領域の操作または発現に干渉しないオープンリーディングフレームの5’側または3’側に存在し得る。
核酸変異形は通常、カセットもしくはPCR変異誘発または当該技術分野で周知の他の技術を使用して、変異形をコードするDNAを産生し、その後、本明細書に概説される細胞培養物中で組換えDNAを発現させる、ポリペプチドをコードするDNA内のヌクレオチドの部位特異性変異誘発によって調製される。しかしながら、最大約100〜150個の残基を有する変異形CDRを含む抗体またはその抗原結合断片は、確立された技術を使用するインビトロ合成によって調製されてもよい。変異形は典型的に、自然発生類似体と同じ定性的生物活性、例えば抗原への結合を示すが、改変された特徴を有する変異形が選択されてもよい。
当業者には理解されるように、遺伝コードの縮重のために、極端に多数の核酸が作製され得、その全てが、本明細書に記載の多量体抗原結合タンパク質のCDRならびに重鎖及び軽鎖または他の構成要素をコードする。したがって、特定のアミノ酸配列を特定したら、当業者は単に、コードされる多量体抗原結合タンパク質のアミノ酸配列を変化させない方法で1つ以上のコドンの配列を修飾することによって、任意の数の異なる核酸を作製することができる。
ベクター
少なくとも1つの本明細書に記載のポリヌクレオチドを含む、プラスミド、発現ベクター、転写カセット、または発現カセットの形態の発現系及び構築物が提供される。特定の実施形態において、本明細書において提供されるプラスミド、発現ベクター、転写カセット、または発現カセットは、本明細書において提供される多特異性抗原結合タンパク質の少なくとも1つのポリペプチド(例えば、第1の重鎖、第1の軽鎖、第2の重鎖、または第2の軽鎖)をコードするポリヌクレオチドを含む。特定の実施形態において、本明細書において提供されるプラスミド、発現ベクター、転写カセット、または発現カセットは、本明細書において提供される多特異性抗原結合タンパク質の少なくとも2つのポリペプチド(例えば、第1の重鎖及び第1の軽鎖、または第2の重鎖及び第2の軽鎖)をコードするポリヌクレオチドを含む。特定の実施形態において、本明細書において提供されるプラスミド、発現ベクター、転写カセット、または発現カセットは、本明細書において提供される多特異性抗原結合タンパク質の少なくとも4つのポリペプチド(例えば、第1の重鎖、第1の軽鎖、第2の重鎖、及び第2の軽鎖)をコードするポリヌクレオチドを含む。
典型的に、宿主細胞内で使用される発現ベクターは、プラスミド維持用ならびに外因性ヌクレオチド配列のクローニング及び発現用の配列を含む。かかる配列は、特定の実施形態では集合的に「フランキング配列」と呼ばれ、典型的に、次のヌクレオチド配列のうちの1つ以上を含む:プロモーター、1つ以上のエンハンサー配列、複製起点、転写終結配列、ドナー及びアクセプタースプライス部位を含む完全イントロン配列、ポリペプチド分泌のためのリーダー配列をコードする配列、リボソーム結合部位、ポリアデニル化配列、発現されるポリペプチドをコードする核酸を挿入するためのポリリンカー領域、ならびに選択可能マーカーエレメント。これらの配列のそれぞれを以下に詳解する。
任意に、ベクターは、「タグ」コード配列、すなわち、ポリペプチドコード配列の5’末端または3’末端に典型的に位置するオリゴヌクレオチド分子を含んでもよく、オリゴヌクレオチド配列は、ポリHis(例えばヘキサHis(配列番号66)など)、またはFLAG、HA(ヘマグルチニンインフルエンザウイルス)、もしくはmycなどの別の「タグ」をコードし、これらに対しては市販の抗体が存在する。このタグは典型的に、ポリペプチドの発現の際にポリペプチドに融合し、宿主細胞からのポリペプチドの親和性精製または検出のための手段として役立ち得る。親和性精製は、例えば、タグに対する抗体を親和性マトリクスとして使用するカラムクロマトグラフィによって達成することができる。任意に、タグはその後、切断のための特定のペプチダーゼの使用などの様々な手段によって、精製されたポリペプチドから除去されてもよい。
フランキング配列は、相同性(すなわち、宿主細胞と同じ種及び/または株由来)、異種性(すなわち、宿主細胞種または株以外の種由来)、ハイブリッド(すなわち、1つより多くの源由来のフランキング配列の組み合わせ)、合成、または天然であってもよい。したがって、フランキング配列の源は、フランキング配列が宿主細胞機構内で機能的であり、かつそれによって活性化され得る限り、任意の原核生物もしくは真核生物、任意の脊椎生物もしくは無脊椎生物、または任意の植物であってよい。
本明細書において提供されるベクターにおいて有用なフランキング配列は、当該技術分野で周知のいくつかの方法のうちのいずれによって得られてもよい。典型的に、本明細書において有用なフランキング配列は、マッピング及び/または制限エンドヌクレアーゼ消化によってこれまでに特定されているものであり、したがって、適切な制限エンドヌクレアーゼを使用して適当な組織源から単離することができる。一部の事例では、フランキング配列の完全なヌクレオチド配列が既知である場合がある。ここで、フランキング配列は、本明細書に記載される核酸合成またはクローニングのための方法を使用して合成され得る。
フランキング配列の全てが既知であるか一部分のみが既知であるかに関わらず、それは、ポリメラーゼ連鎖反応(PCR)の使用、及び/または同じ種もしくは別の種由来のオリゴヌクレオチド及び/またはフランキング配列断片などの好適なプローブを使用したゲノムライブラリのスクリーニングによって得ることができる。フランキング配列が既知でない場合、フランキング配列を含むDNAの断片は、例えば、コード配列またはさらには別の遺伝子(複数可)を含み得る、より大きな一片のDNAから単離され得る。単離は、制限エンドヌクレアーゼ消化によって適当なDNA断片を産生し、続いて、アガロースゲル精製、Qiagen(登録商標)カラムクロマトグラフィ(Chatsworth,CA)、または当業者に知られる他の方法を使用して単離を行うことによって達成され得る。この目的を達成するために好適な酵素の選択は、当業者には容易に明らかになるであろう。
複製起点は典型的に、商業的に購入される原核生物の発現ベクターの一部であり、この起点は、宿主細胞内のベクターの増幅を補助する。選ばれたベクターが複製起点部位を含まない場合、既知の配列に基づいて化学合成し、ベクターに連結してもよい。例えば、プラスミドpBR322(New England Biolabs,Beverly,MA)からの複製起点が、ほとんどのグラム陰性菌に好適であり、様々なウイルス起点(例えば、SV40、ポリオーマ、アデノウイルス、水疱性口内炎ウイルス(VSV)、またはHPVもしくはBPVなどのパピローマウイルス)が、哺乳動物細胞内でベクターをクローニングするのに有用である。一般に、複製起点成分は、哺乳動物発現ベクターには必要とされない(例えば、SV40起点は、単にそれがウイルスの初期プロモーターも含むことから使用されることが多い)。
転写終結配列は典型的にポリペプチドコード領域の末端の3’側に位置し、転写を終結させる働きをする。通常、原核細胞内の転写終結配列は、G−Cリッチ断片にポリT配列が続いたものである。この配列は容易にライブラリからクローニングされ、またはさらにはベクターの一部として商業的に購入されるが、本明細書に記載のものなどの核酸合成方法を使用して容易に合成することもできる。
選択可能マーカー遺伝子は、選択的培養培地中で成長する宿主細胞の生存及び成長に必要なタンパク質をコードする。典型的な選択マーカー遺伝子は、(a)抗生物質もしくは他の毒素、例えばアンピシリン、テトラサイクリン、もしくはカナマイシンに対する耐性を原核宿主細胞に付与するタンパク質、(b)細胞の栄養要求性欠損を補完するタンパク質、または(c)複合培地もしくは限定培地から入手不可能な必須栄養素を供給するタンパク質をコードする。具体的な選択可能マーカーは、カナマイシン耐性遺伝子、アンピシリン耐性遺伝子、及びテトラサイクリン耐性遺伝子である。有利なことに、ネオマイシン耐性遺伝子もまた、原核生物と真核生物との両方の宿主細胞における選択に使用され得る。
他の選択可能遺伝子を使用して、発現される遺伝子を増幅してもよい。増幅とは、成長または細胞生存に必須のタンパク質の産生に必要とされる遺伝子が、組換え細胞の連続的世代の染色体内で直列反復されるプロセスである。哺乳動物細胞の好適な選択可能マーカーの例としては、ジヒドロ葉酸レダクターゼ(DHFR)及びプロモーターレスチミジンキナーゼ遺伝子が挙げられる。哺乳動物細胞形質転換体が淘汰圧下に置かれ、ここで、形質転換体のみが、ベクター内に存在する選択可能遺伝子によって生存するように独特に適合される。淘汰圧は、培地中の選択剤の濃度が連続的に上昇する条件下で形質転換細胞を培養することによって課され、それにより、選択可能遺伝子と、抗体軽鎖または重鎖などの別の遺伝子をコードするDNAとの両方が増幅される。結果として、増加した量のポリペプチドが、増幅したDNAから合成される。
リボソーム結合部位は、mRNAの翻訳開始に通常必要であり、Shine−Dalgarno配列(原核生物)またはKozak配列(真核生物)によって特徴付けられる。このエレメントは典型的に、発現されるポリペプチドのプロモーターの3’側、そしてコード配列の5’側に位置する。特定の実施形態において、1つ以上のコード領域が内部リボソーム結合部位(IRES)に作動可能に連結されてもよく、これにより、単一のRNA転写物から2つのオープンリーディングフレームを翻訳することが可能になる。
真核宿主細胞発現系でグリコシル化が所望される場合などの一部の事例では、様々なプレ配列またはプロ配列を操作して、グリコシル化または収率を改善してもよい。例えば、特定のシグナルペプチドのペプチダーゼ切断部位を変更するか、またはプロ配列を追加してもよく、これもグリコシル化に影響を与え得る。最終的なタンパク質生成物は、完全に除去されていない場合がある、発現に付随する1つ以上の追加のアミノ酸を、(成熟タンパク質の第1のアミノ酸に対して)−1位に有し得る。例えば、最終的なタンパク質生成物は、アミノ末端に結合した、ペプチダーゼ切断部位に見出される1個または2個のアミノ酸残基を有し得る。あるいは、いくつかの酵素切断部位の使用は、その酵素が成熟ポリペプチド内のそのような領域で切断する場合、所望のポリペプチドのわずかに切断された形態をもたらし得る。
本明細書において提供される発現ベクター及びクローニングベクターは、典型的に、宿主生物によって認識され、かつポリペプチドをコードする分子に作動可能に連結されたプロモーターを含む。プロモーターは、構造遺伝子の転写を制御する、構造遺伝子の開始コドンの上流(すなわち、5’側)(概して約100〜1000bp以内)に位置する未転写配列である。プロモーターは、慣習的に、2つのクラス:誘導性プロモーター及び構成的プロモーターのうちの1つに分類される。誘導性プロモーターは、培養条件の何らかの変化、例えば栄養素の存在もしくは非存在、または温度の変化などに応答して、それらの制御下のDNAの上昇したレベルの転写を開始する。一方で、構成的プロモーターは、それらが作動可能に連結されている遺伝子を均一に、すなわち、遺伝子発現の制御をほとんどまたは全く行わずに転写する。多様な潜在的宿主細胞によって認識される多数のプロモーターが周知である。好適なプロモーターは、制限酵素消化によりソースDNAからプロモーターを除去し、所望のプロモーター配列をベクターに挿入することによって、例えば、重鎖または軽鎖をコードするDNAに作動可能に連結される。
酵母宿主で使用するのに好適なプロモーターも、当該技術分野で周知である。酵母エンハンサーは、酵母プロモーターと共に有利に使用される。哺乳動物宿主細胞で使用するのに好適なプロモーターが周知であり、これには、ポリオーマウイルス、鶏痘ウイルス、アデノウイルス(例えばアデノウイルス2など)、ウシパピローマウイルス、トリ肉腫ウイルス、サイトメガロウイルス、レトロウイルス、B型肝炎ウイルス、最も好ましくはサルウイルス40(SV40)といったウイルスのゲノムから得られるものが含まれるが、これらに限定されない。他の好適な哺乳動物プロモーターには、異種哺乳動物プロモーター、例えば、熱ショックプロモーター及びアクチンプロモーターが含まれる。
関心の対象となり得る追加のプロモーターには、SV40初期プロモーター(Benoist and Chambon,1981,Nature 290:304−310);CMVプロモーター(Thomsen et al.,1984,Proc.Natl.Acad.U.S.A.81:659−663);ラウス肉腫ウイルスの3’側の長い末端反復に含まれるプロモーター(Yamamoto et al.,1980,Cell 22:787−797);ヘルペスチミジンキナーゼプロモーター(Wagner et al.,1981,Proc.Natl.Acad.Sci.U.S.A.78:1444−1445);メタロチオネイン遺伝子由来のプロモーター及び制御配列(Prinster et al.,1982,Nature 296:39−42);ならびにベータ−ラクタマーゼプロモーターなどの原核生物プロモーター(Villa−Kamaroff et al.,1978,Proc.Natl.Acad.Sci.U.S.A.75:3727−3731);またはtacプロモーター(DeBoer et al.,1983,Proc.Natl.Acad.Sci.U.S.A.80:21−25)が含まれるが、これらに限定されない。組織特異性を示し、かつトランスジェニック動物で用いられている、次の動物の転写制御領域も関心の対象である:膵腺房細胞内で活性であるエラスターゼI遺伝子制御領域(Swift et al.,1984,Cell 38:639−646、Omitz et al.,1986,Cold Spring Harbor Symp.Quant.Biol.50:399−409、MacDonald,1987,Hepatology 7:425−515);膵ベータ細胞内で活性であるインスリン遺伝子制御領域(Hanahan,1985,Nature 315:115−122);リンパ系細胞内で活性である免疫グロブリン遺伝子制御領域(Grosschedl et al.,1984,Cell 38:647−658、Adames et al.,1985,Nature 318:533−538、Alexander et al.,1987,Mol.Cell.Biol.7:1436−1444);精巣細胞、乳房細胞、リンパ系細胞、及びマスト細胞内で活性であるマウス乳癌ウイルス制御領域(Leder et al.,1986,Cell 45:485−495);肝臓内で活性であるアルブミン遺伝子制御領域(Pinkert et al.,1987,Genes and Devel.1:268−276);肝臓内で活性であるアルファ−フェトタンパク質(alpha−feta−protein)遺伝子制御領域(Krumlauf et al.,1985,Mol.Cell.Biol.5:1639−1648、Hammer et al.,1987,Science 253:53−58);肝臓内で活性であるアルファ1アンチトリプシン遺伝子制御領域(Kelsey et al.,1987,Genes and Devel.1:161−171);骨髄系細胞内で活性であるベータグロビン遺伝子制御領域(Mogram et al.,1985,Nature 315:338−340、Kollias et al.,1986,Cell 46:89−94);脳内のオリゴデンドロサイト細胞内で活性であるミエリン塩基性タンパク質遺伝子制御領域(Readhead et al.,1987,Cell 48:703−712);骨格筋内で活性であるミオシン軽鎖2遺伝子制御領域(Sani,1985,Nature 314:283−286);ならびに視床下部内で活性である性腺刺激放出ホルモン遺伝子制御領域(Mason et al.,1986,Science 234:1372−1378)。
高等真核生物による本明細書において提供される軽鎖または重鎖をコードするDNAの転写を増加させるために、エンハンサー配列をベクターに挿入してもよい。エンハンサーは、プロモーターに作用して転写を増加させる、通常約10〜300bpの長さのDNAのシスエレメントである。エンハンサーは、比較的配向及び位置依存性であり、転写ユニットの5’側と3’側との両方の位置で見出されている。哺乳動物遺伝子から入手可能ないくつかのエンハンサー配列が知られている(例えば、グロビン、エラスターゼ、アルブミン、アルファフェトタンパク質、及びインスリン)。しかしながら、典型的には、ウイルス由来のエンハンサーが使用される。当該技術分野で知られるSV40エンハンサー、サイトメガロウイルス初期プロモーターエンハンサー、ポリオーマエンハンサー、及びアデノウイルスエンハンサーは、真核生物プロモーターの活性化のための例示的な増強エレメントである。エンハンサーはベクター内のコード配列の5’側または3’側のいずれに位置付けられてもよいが、典型的には、プロモーターから5’側の部位に位置する。適切な天然または異種のシグナル配列(リーダー配列またはシグナルペプチド)をコードする配列を発現ベクターに組み込んで、多特異性抗原結合タンパク質の細胞外分泌を促進することができる。シグナルペプチドすなわちリーダーの選択は、中で多特異性抗原結合タンパク質が産生される宿主細胞の型に左右され、異種シグナル配列は、天然シグナル配列を置き換えることができる。哺乳動物宿主細胞において機能的なシグナルペプチドの例としては、次のものが挙げられる:米国特許第4,965,195号に記載のインターロイキン−7(IL−7)のシグナル配列;Cosman et al.,1984,Nature 312:768に記載のインターロイキン−2受容体のシグナル配列;欧州特許第0367 566号に記載のインターロイキン−4受容体シグナルペプチド;米国特許第4,968,607号に記載のI型インターロイキン−I受容体シグナルペプチド;欧州特許第0 460 846号に記載のII型インターロイキン−I受容体シグナルペプチド。
ベクターは、ベクターが宿主細胞ゲノムに組み込まれたときに発現を促進する1つ以上のエレメントを含有してもよい。例としては、EASEエレメント(Aldrich et al.2003Biotechnol Prog.19:1433−38)及びマトリクス結合領域(MAR)が挙げられる。MARは、染色質の構造組織化を媒介し、組み込まれたベクターを「位置」効果から遮蔽する場合がある。したがってMARは、安定なトランスフェクタントを作り出すためにベクターが使用される場合に特に有用である。いくつかの天然及び合成のMAR含有核酸が、当該技術分野、例えば、米国特許第6,239,328号、同第7,326,567号、同第6,177,612号、同第6,388,066号、同第6,245,974号、同第7,259,010号、同第6,037,525号、同第7,422,874号、同第7,129,062号で知られている。
本明細書において提供される発現ベクターは、市販のベクターなどの出発ベクターから構築されてもよい。そのようなベクターは、所望のフランキング配列の全てを含有していても含有していなくてもよい。本明細書に記載のフランキング配列のうちの1つ以上がベクター内に既に存在していない場合、それらは個別に得られベクターに連結されてもよい。フランキング配列のそれぞれを得るために使用される方法は、当業者に周知である。
ベクターが構築され、軽鎖、重鎖、または軽鎖及び重鎖の配列をコードする核酸分子がベクターの適当な部位に挿入された後、完成したベクターは、増幅及び/またはポリペプチド発現のために好適な宿主細胞に挿入され得る。発現ベクターを選択された宿主細胞に形質転換することは、トランスフェクション、感染、リン酸カルシウム共沈殿、電気穿孔、微量注入、リポフェクション、DEAE−デキストラン媒介トランスフェクション、または他の既知の技術を含む周知の方法によって達成され得る。選択された方法は、部分的に、使用される宿主細胞の型の機能となる。これらの方法及び他の好適な方法は当業者に周知であり、例えば、Sambrook et al.,2001(上記)に記載されている。特定の実施形態において、第1の重鎖、第1の軽鎖、第2の重鎖、及び第1の軽鎖を発現することのできる1つ以上のベクターが、宿主細胞に導入される。
宿主細胞
加えて、上述の発現系または構築物を含む宿主細胞が提供される。特定の実施形態において、多特異性抗原結合タンパク質は、単一の宿主細胞から発現される。宿主細胞は、適切な条件下で培養された場合、多特異性抗原結合タンパク質を合成し、このタンパク質はその後、培養培地から(宿主細胞がそれを培地に分泌する場合)、またはそれを産生する宿主細胞から直接(それが分泌されない場合)収集することができる。適切な宿主細胞の選択は、所望の発現レベル、活性に望ましいまたは必要なポリペプチド修飾(例えばグリコシル化またはリン酸化など)、及び生物活性分子に折り畳むことの容易さといった様々な要素に左右される。宿主細胞は、真核細胞であっても原核細胞であってもよい。
発現の宿主として利用可能な哺乳動物細胞株は当該技術分野で周知であり、これには、限定されないが、American Type Culture Collection(ATCC)から入手可能な不死化細胞株が含まれ、当該技術分野で知られる発現系において使用されるあらゆる細胞株が、本明細書において提供される組換えポリペプチドを作製するために使用され得る。概して、宿主細胞は、所望の多特異性抗原結合タンパク質をコードするDNAを含む組換え発現ベクターを用いて形質転換される。用いられ得る宿主細胞には、原核細胞、酵母細胞、または高等真核細胞がある。原核生物には、グラム陰性またはグラム陽性の生物、例えばE.coliまたはbacilliが含まれる。高等真核細胞には、昆虫細胞及び哺乳動物起源の樹立細胞株が含まれる。好適な哺乳動物宿主細胞株の例としては、サル腎臓細胞のCOS−7株(ATCC CRL 1651)(Gluzman et al.,1981,Cell 23:175)、L細胞、293細胞、C127細胞、3T3細胞(ATCC CCL 163)、チャイニーズハムスター卵巣(CHO)細胞、またはVeggie CHOなどのそれらの誘導体、及び血清不含培地で成長する関連細胞株(Rasmussen et al.,1998,Cytotechnology 28:31)、HeLa細胞、BHK(ATCC CRL10)細胞株、ならびにMcMahan et al.,1991,EMBO J.10:2821に記載のアフリカミドリザル腎臓細胞株CVI(ATCC CCL 70)に由来するCVI/EBNA細胞株、293、293 EBNA、またはMSR 293などのヒト胚性腎臓細胞、ヒト上皮A431細胞、ヒトColo205細胞、他の形質転換霊長類細胞株、正常な二倍体細胞、一次組織、一次外植片、HL−60、U937、HaK、またはJurkat細胞のインビトロ培養に由来する細胞株が挙げられる。任意に、例えばHepG2/3B、KB、NIH 3T3、またはS49などの哺乳動物細胞株は、様々なシグナル形質導入またはレポーターアッセイにおいてポリペプチドを使用することが望ましい場合に、ポリペプチドの発現のために使用され得る。あるいは、酵母などの下等真核生物または細菌などの原核生物においてポリペプチドを産生することが可能である。好適な酵母としては、Saccharomyces cerevisiae、Schizosaccharomyces pombe、Kluyveromyces株、Candida株、Pichia株、または異種ポリペプチドを発現することのできる任意の酵母株が挙げられる。好適な細菌株としては、Escherichia coli、Bacillus subtilis、Salmonella typhimurium、または異種ポリペプチドを発現することの任意の細菌株が挙げられる。
特定の実施形態において、本明細書に記載の多特異性抗原結合タンパク質を発現する細胞株が提供される。特定の実施形態において、細胞株は、原核細胞株である。特定の実施形態において、細胞株は、E.coli細胞株である。特定の実施形態において、HC1、LC1、HC2、及びLC2は、同じ原核細胞で共発現される。特定の実施形態において、HC1、LC1、HC2、及びLC2は、同じE.coli細胞で共発現される。特定の実施形態において、HC1、LC1、HC2、及びLC2は、同じ真核細胞で共発現される。特定の実施形態において、細胞株は、真核細胞株である。特定の実施形態において、細胞株は、安定細胞株である。特定の実施形態において、安定細胞株は、哺乳動物細胞株である。特定の実施形態において、安定細胞株は、CHO細胞株である。特定の実施形態において、安定細胞株により発現される多特異性抗原結合タンパク質の少なくとも約85%、約86%、約87%、約88%、約89%、約90%、約91%、約92%、約93%、約94%、約95%、約96%、約97%、約98%、約99%、または約99%超が、正確にアセンブルされる(すなわち、LC1がHC1と対合し、LC2がHC2と対合する)。安定細胞株は、当該技術分野で知られる方法によって生成することができる。特定の実施形態において、安定細胞株は、HC1、LC1、HC2、及びLC2を発現するポリヌクレオチド(複数可)を、ランダムに、または標的を定めて、宿主細胞ゲノムに組み込むことによって生成される。
多特異性抗原結合タンパク質が酵母または細菌内で作製される場合、機能的な生成物を得るために、その中で産生された生成物を、例えば適切な部位のリン酸化またはグリコシル化によって修飾することが望ましい場合がある。そのような共有結合は、既知の化学的または酵素的な方法を使用して達成することができる。ポリペプチドは、本明細書において提供される単離された核酸を、1つ以上の昆虫発現ベクター内の好適な制御配列に作動可能に連結し、昆虫発現系を用いることによって産生することもできる。バキュロウイルス/昆虫細胞発現系に関する材料及び方法は、例えば、Invitrogen,San Diego,Calif.,U.S.A.からキット形態で市販されており(MaxBacキット)、かかる方法は、Summers and Smith,Texas Agricultural Experiment Station Bulletin No.1555(1987)、及びLuckow and Summers,Bio/Technology 6:47(1988)に記載されるように、当該技術分野で周知である。本明細書に開示される核酸構築物に由来するRNAを使用して抗体または断片などのポリペプチドを産生するために、細胞不含翻訳系が用いられてもよい。細菌、真菌、酵母、及び哺乳動物細胞の宿主で使用するのに適切なクローニングベクター及び発現ベクターは、Pouwelsら(Cloning Vectors:A Laboratory Manual,Elsevier,New York,1985)によって説明されている。好ましくは、少なくとも1つの発現制御配列に作動可能に連結された、本明細書において提供される単離された核酸を含む宿主細胞は、「組換え宿主細胞」である。
特定の実施形態において、細胞株は、どの細胞株が高い発現レベルを有し、所望の結合特性を有する多特異性抗原結合タンパク質を恒常的に産生するかを判定することによって、選択されてもよい。別の実施形態では、それ自体の抗体は作製しないが、異種の多特異性抗原結合タンパク質を作製し分泌する能力を有する、B細胞系譜由来の細胞株を選択することができる。
多特異性抗原結合タンパク質の産生及び精製
宿主細胞の培養
特定の実施形態において、(a)H1、H2、L1、及びL2をコードする一式のポリヌクレオチドを宿主細胞に導入することと、(b)宿主細胞を培養して多特異性抗原結合タンパク質を産生することとを含む、本明細書に記載の多特異性抗原結合タンパク質の産生方法が提供される。特定の実施形態において、L1及びL2をコードするポリヌクレオチドは、既定の比率(例えば、モル比または重量比)で宿主細胞に導入される。特定の実施形態において、L1及びL2をコードするポリヌクレオチドは、L1:L2の比率(例えば、モル比または重量比)が、約1:1、約1:1.5、約1:2、約1:2.5、約1:3、約1:3.5、約1:4、約1:4.5、約1:5、約1:5.5、約1.5:1、約2:1、約2.5:1、約3:1、約3.5:1、約4:1、約4.5:1、約5:1、または約5.5:1(これらの値間の任意の範囲を含む)になるように、宿主細胞に導入される。特定の実施形態において、この比率はモル比である。特定の実施形態において、この割当は重量比である。特定の実施形態において、H1及びH1をコードするポリヌクレオチドは、既定の比率(例えば、モル比または重量比)で宿主細胞に導入される。特定の実施形態において、H1及びH2をコードするポリヌクレオチドは、H1:H2の比率(例えば、モル比または重量比)が、約1:1、約1:1.5、約1:2、約1:2.5、約1:3、約1:3.5、約1:4、約1:4.5、約1:5、約1:5.5、約1.5:1、約2:1、約2.5:1、約3:1、約3.5:1、約4:1、約4.5:1、約5:1、または約5.5:1(これらの値間の任意の範囲を含む)になるように、宿主細胞に導入される。特定の実施形態において、この比率はモル比である。特定の実施形態において、この割当は重量比である。特定の実施形態において、H1、H2、L1、及びL2をコードするポリヌクレオチドは、既定の比率(例えば、モル比または重量比)で宿主細胞に導入される。特定の実施形態において、H1、H2、L1、及びL2をコードするポリヌクレオチドは、H1+H2:L1+L2の比率(例えば、モル比または重量比)が、約5:1、約5:2、約5:3、約5:4、約1:1、約4:5、約3:5、約2:5、または約1:5(これらの値間の任意の範囲を含む)になるように、宿主細胞に導入される。特定の実施形態において、LC1、LC2、HC1、及びHC2をコードするポリヌクレオチドは、LC1:LC2:HC1:HC2の比率(例えば、モル比または重量比)が、約1:1:1:1、約2.8:1:1:1、約1.4:1:1:1、約1:1.4:1:1、約1:2.8:1:1、約1:1:2.8:1、約1:1:1.4:1、約1:1:1:2.8、または約1:1:1:1.4(これらの値間の任意の範囲を含む)になるように、宿主細胞に導入される。特定の実施形態において、この比率はモル比である。特定の実施形態において、この割当は重量比である。
特定の実施形態において、多特異性抗原結合タンパク質の産生方法は、細胞への導入のためのポリヌクレオチドの最適な比率を決定することをさらに含む。特定の実施形態において、多特異性抗原結合タンパク質の収率(例えば二重特異性抗体の収率など)を判定するために質量分析が使用され、多特異性抗原結合タンパク質の収率(例えば二重特異性抗体の収率)を最大化させるように最適な鎖比が調節される。特定の実施形態において、多特異性抗原結合タンパク質の収率(例えば二重特異性抗体の収率など)を判定するために二重抗原ELISAが使用され、収率を最大化させるように最適な鎖比が調節される。特定の実施形態において、多特異性抗原結合タンパク質の産生方法は、多特異性抗原結合タンパク質を細胞培養物から採取または回収することをさらに含む。特定の実施形態において、多特異性抗原結合タンパク質の産生方法は、採取または回収された多特異性抗原結合タンパク質を精製することをさらに含む。
本明細書において提供される所望の多特異性抗原結合タンパク質(例えば二重特異性抗体など)を産生するために使用される宿主細胞は、多様な培地で培養され得る。Ham’s F10(Sigma)、最小必須培地((MEM)、(Sigma)、RPMI−1640(Sigma)、及びダルベッコ変法イーグル培地((DMEM)、Sigma)などの市販の培地が、宿主細胞の培養に好適である。加えて、Ham et al.,Meth.Enz.58:44(1979)、Barnes et al.,Anal.Biochem.102:255(1980)、米国特許第4,767,704号、同第4,657,866号、同第4,927,762号、同第4,560,655号、もしくは同第5,122,469号、WO 90/03430、WO 87/00195、または米国特許Re.30,985号に記載の培地のうちのいずれも、宿主細胞の培養培地として使用され得る。これらの培地のいずれにも、必要に応じて、ホルモン及び/または他の成長因子(例えばインスリン、トランスフェリン、または上皮成長因子など)、塩(例えば塩化ナトリウム、カルシウム、マグネシウム、及びリン酸塩など)、緩衝液(例えばHEPESなど)、ヌクレオチド(例えばアデノシン及びチミジンなど)、抗生物質(例えばGENTAMYCIN(商標)薬など)、微量元素(マイクロモル範囲の最終濃度で通常存在する無機化合物と定義される)、及びグルコースまたは同等のエネルギー源が補充され得る。任意の他の必要な補充物が、当業者には分かるであろう適切な濃度で含まれてもよい。温度、pHなどの培養条件は、発現のために選択された宿主細胞にこれまでに使用されているものであり、当業者には明らかであろう。
多特異性抗原結合タンパク質の採取または回収及び精製
関連する態様において、多特異性抗原結合タンパク質の発現を可能にする条件下で上述の宿主細胞を培養することと、多特異性抗原結合タンパク質を回収(例えば採取)することとを含む、本明細書に記載の多特異性抗原結合タンパク質の産生方法が提供される。特定の実施形態において、本方法は、回収された多特異性抗原結合タンパク質(例えば二重特異性抗体など)を精製して、例えばさらなるアッセイ及び使用のために、実質的に均質である調製物を得ることをさらに含む。
本明細書において提供される多特異性抗原結合タンパク質は、細胞内で産生されてもよく、培地に直接分泌されてもよい。多特異性抗原結合タンパク質が細胞内で産生される場合、第1のステップとして、宿主細胞あるいは溶解断片である微粒子状の残骸が、例えば、遠心分離または限外濾過によって除去される。多特異性抗原結合タンパク質が培地に分泌される場合、概して、市販のタンパク質濃縮フィルタ、例えばAmiconまたはMillipore Pellicon限外濾過ユニットを使用して、かかる発現系からの上清をまず濃縮する。タンパク質分解を阻害するために、PMSFなどのプロテアーゼ阻害薬が前述のステップのいずれかに含まれてもよく、外来性混入物の成長を防止するために、抗生物質が含まれてもよい。
当該技術分野で知られる標準的なタンパク質精製方法を用いて、細胞から多特異性抗原結合タンパク質の実質的に均質な調製物を得ることができる。次の手順は、好適な精製手順の例示である:免疫親和性カラムまたはイオン交換カラムでの分画、エタノール沈殿、逆相HPLC、シリカまたはDEAEなどのカチオン交換樹脂でのクロマトグラフィ、クロマトフォーカシング、SDS−PAGE、硫酸アンモニウム沈殿、及び例えばSephadex G−75を使用したゲル濾過。
追加的または代替的に、調製された多特異性抗原結合タンパク質は、例えば、ヒドロキシアパタイトクロマトグラフィ、ゲル電気泳動、透析、及び親和性クロマトグラフィを使用して精製することができ、親和性クロマトグラフィが好ましい精製技術である。
特定の態様では、上述の細胞培養培地から得られた調製物が、タンパク質A固定化固相に適用されて、タンパク質Aに対する目的の多特異性抗原結合タンパク質の特異的結合が可能になる。その後、固相が洗浄されて、固相に非特異的に結合した混入物が除去される。多特異性抗原結合タンパク質(例えば二重特異性抗体など)は、カオトロピック剤または穏やかな洗剤を含有する溶液への溶出によって、固相から回収される。例示的なカオトロピック剤及び穏やかな洗剤としては、グアニジン−HCl、尿素、過塩素酸リチウム、アルギニン、ヒスチジン、SDS(ドデシル硫酸ナトリウム)、Tween、Triton、及びNP−40が挙げられるがこれらに限定されず、これらは全て市販されている。
親和性リガンドとしてのタンパク質Aの好適性は、多特異性抗原結合タンパク質中に存在する任意の免疫グロブリンFcドメインの種及びアイソタイプに左右される。タンパク質Aは、ヒトγ1、γ2、またはγ4重鎖に基づく抗体を精製するために使用され得る(Lindmark et al.,J.Immunol.Meth.62:1−13(1983))。タンパク質Gは、全てのマウスアイソタイプ及びヒトγ3に推奨される(Guss et al.,EMBO J.5:15671575(1986))。親和性リガンドが結合するマトリクスは、ほとんどの場合アガロースであるが、他のマトリクスも利用可能である。孔制御ガラスまたはポリ(スチレンジビニル)ベンゼンなどの機械的に安定なマトリクスにより、アガロースで実現され得るものよりも速い流速及び短い処理時間が可能となる。多特異性抗原結合タンパク質がCH3ドメインを含む場合、Bakerbond ABX(商標)樹脂(J.T.Baker,Phillipsburg,NJ)が精製に有用である。タンパク質精製のための他の技術、例えばイオン交換カラムでの分画、エタノール沈殿、逆相HPLC、シリカでのクロマトグラフィ、ヘパリンでのクロマトグラフィ、アニオンもしくはカチオン交換樹脂(例えばポリアスパラギン酸カラムなど)でのSEPHAROSE(商標)クロマトグラフィ、クロマトフォーカシング、SDS−PAGE、及び硫酸アンモニウム沈殿なども、回収される多特異性抗原結合タンパク質に応じて利用可能である。
任意の予備精製ステップ(複数可)の後、目的の多特異性抗原結合タンパク質及び混入物を含む混合物は、約2.5〜4.5のpH溶出緩衝液を使用した、好ましくは低い塩濃度(例えば、約0〜0.25Mの塩)で行われる低pH疎水性相互作用クロマトグラフィに供され得る。多特異性抗原結合タンパク質の産生は、(前述の特定の方法のいずれかに対して)代替的または追加的に、ポリペプチドの混合物を含む溶液を透析することを含む。
多特異性抗原結合タンパク質のライブラリ
本明細書では、本明細書に記載される複数の多特異性抗原結合タンパク質を含むライブラリが提供される。特定の実施形態において、本ライブラリは、ポリヌクレオチドライブラリ(例えば、本明細書に記載のポリヌクレオチドのいずれかの複数)である。特定の実施形態において、本ライブラリは、ポリペプチドライブラリ(例えば、本明細書に記載のポリペプチドのいずれかの複数)である。特定の実施形態において、本明細書において提供されるポリペプチドライブラリは、ポリペプチドディスプレイライブラリである。そのようなポリペプチドディスプレイライブラリをスクリーニングして、治療、予防、獣医学、診断、試薬、または材料に関する用途を含むがこれらに限定されない、多様な用役のための所望される特定を有する結合タンパク質を選択及び/または進化させることができる。
特定の実施形態において、少なくとも2個、3個、4個、5個、10個、30個、100個、250個、500個、750個、1000個、2500個、5000個、7500個、10000個、25000個、50000個、75000個、100000個、250000個、500000個、750000個、1000000個、2500000個、5000000個、7500000個、10000000個、または10000000個超の異なる多特異性抗原結合タンパク質を含むライブラリが提供され、これらの多特異性抗原結合タンパク質はそれぞれ、H1のCH1ドメイン上のS183位(EU付番)におけるアミノ酸置換変異、及びL1のCLドメイン上のV133位(EU付番)におけるアミノ酸置換変異を含む。追加的または代替的に、ライブラリ内の多特異性抗原結合タンパク質は、A141I、F170S、S181M、S183V、及びV185A変異(EU付番)を含む(それらから成るもの、及びそれらから本質的に成るものを含む)H1のCH1ドメインと、F116A、V133I、L135V、S162M、S174A、S176F、及びT178V変異(EU付番)を含む(それらから成るもの、またはそれらから本質的に成るものを含む)L1のCLドメインと、を含む。追加的または代替的に、ライブラリ内の多特異性抗原結合タンパク質は、A141I、F170S、S181M、S183A、及びV185A変異(EU付番)を含む(それらから成るもの、及びそれらから本質的に成るものを含む)H1のCH1ドメインと、F116A、S131D、L135V、S162A、S174A、S176F、及びT178I変異(EU付番)を含む(それらから成るもの、またはそれらから本質的に成るものを含む)L1のCLドメインと、を含む。追加的または代替的に、ライブラリ内の多特異性抗原結合タンパク質は、A141I、F170S、S181M、S183A、及びV185A変異(EU付番)を含む(それらから成るもの、及びそれらから本質的に成るものを含む)H1のCH1ドメインと、F116A、L135V、S174A、S176F、及びT178V変異(EU付番)を含む(それらから成るもの、またはそれらから本質的に成るものを含む)L1のCLドメインと、を含む。追加的または代替的に、ライブラリ内の多特異性抗原結合タンパク質は、A141I、F170A、S181M、S183V、及びV185A変異(EU付番)を含む(それらから成るもの、及びそれらから本質的に成るものを含む)H1のCH1ドメインと、F116A、L135V、S162M、S174A、S176F、及びT178V変異(EU付番)を含む(それらから成るもの、またはそれらから本質的に成るものを含む)L1のCLドメインと、を含む。追加的または代替的に、ライブラリ内の多特異性抗原結合タンパク質は、L128F、A141M、F170M、S181I、及びS183A変異(EU付番)を含む(それらから成るもの、及びそれらから本質的に成るものを含む)H1のCH1ドメインと、F118V、S131T、V133A、L135Y、S162A、T164S、S176M、及びT178L変異(EU付番)を含む(それらから成るもの、またはそれらから本質的に成るものを含む)L1のCLドメインと、を含む。追加的または代替的に、ライブラリ内の多特異性抗原結合タンパク質は、L128F、A141M、F170Y、S181I、S183A、及びV185A変異(EU付番)を含む(それらから成るもの、及びそれらから本質的に成るものを含む)H1のCH1ドメインと、F118V、S131T、V133A、L135F、S162A、S176A、及びT178L変異(EU付番)を含む(それらから成るもの、またはそれらから本質的に成るものを含む)L1のCLドメインと、を含む。追加的または代替的に、ライブラリ内の多特異性抗原結合タンパク質は、L128F、A141T、F170M、S181T、S183A、及びV185L変異(EU付番)を含む(それらから成るもの、及びそれらから本質的に成るものを含む)H1のCH1ドメインと、F118V、S131T、V133A、L135F、S162A、T164S、S176T、及びT178L変異(EU付番)を含む(それらから成るもの、またはそれらから本質的に成るものを含む)L1のCLドメインと、を含む。追加的または代替的に、ライブラリ内の多特異性抗原結合タンパク質は、L128F、A141M、F170M、S181T、及びS183A変異(EU付番)を含む(それらから成るもの、及びそれらから本質的に成るものを含む)H1のCH1ドメインと、F118V、S131T、V133A、L135F、S162M、T164S、S176M、及びT178L変異(EU付番)を含む(それらから成るもの、またはそれらから本質的に成るものを含む)L1のCLドメインと、を含む。
追加的または代替的に、ライブラリ内の多特異性抗原結合タンパク質は、F170S、S181M、S183A、及びV185A変異(EU付番)を含む(それらから成るもの、及びそれらから本質的に成るものを含む)H1のCH1ドメインと、L135V、S174A、S176F、及びT178V変異(EU付番)を含む(それらから成るもの、またはそれらから本質的に成るものを含む)L1のCLドメインと、を含む。追加的または代替的に、ライブラリ内の多特異性抗原結合タンパク質は、A141I、F170S、S183A、及びV185A変異(EU付番)を含む(それらから成るもの、及びそれらから本質的に成るものを含む)H1のCH1ドメインと、F116A、S174A、S176F、及びT178V変異(EU付番)を含む(それらから成るもの、またはそれらから本質的に成るものを含む)L1のCLドメインと、を含む。追加的または代替的に、ライブラリ内の多特異性抗原結合タンパク質は、A141I、F170S、S181M、及びV185A変異(EU付番)を含む(それらから成るもの、及びそれらから本質的に成るものを含む)H1のCH1ドメインと、F116A、L135V、S176F、及びT178V変異(EU付番)を含む(それらから成るもの、またはそれらから本質的に成るものを含む)L1のCLドメインと、を含む。追加的または代替的に、ライブラリ内の多特異性抗原結合タンパク質は、A141I、F170S、S181M、及びS183A変異(EU付番)を含む(それらから成るもの、及びそれらから本質的に成るものを含む)H1のCH1ドメインと、F116A、L135V、S174A、及びS176F変異(EU付番)を含む(それらから成るもの、またはそれらから本質的に成るものを含む)L1のCLドメインと、を含む。追加的または代替的に、ライブラリ内の多特異性抗原結合タンパク質は、F170S、S183A、及びV185A変異(EU付番)を含む(それらから成るもの、及びそれらから本質的に成るものを含む)H1のCH1ドメインと、F116A、S176F、及びT178V変異(EU付番)を含む(それらから成るもの、またはそれらから本質的に成るものを含む)L1のCLドメインと、を含む。追加的または代替的に、ライブラリ内の多特異性抗原結合タンパク質は、F170S、S181M、及びV185A変異(EU付番)を含む(それらから成るもの、及びそれらから本質的に成るものを含む)H1のCH1ドメインと、F116A、L135V、及びS176F変異(EU付番)を含む(それらから成るもの、またはそれらから本質的に成るものを含む)L1のCLドメインと、を含む。追加的または代替的に、ライブラリ内の多特異性抗原結合タンパク質は、F170S、S181M、及びS183A変異(EU付番)を含む(それらから成るもの、及びそれらから本質的に成るものを含む)H1のCH1ドメインと、F116A及びS176F変異(EU付番)を含む(それらから成るもの、またはそれらから本質的に成るものを含む)L1のCLドメインと、を含む。追加的または代替的に、ライブラリ内の多特異性抗原結合タンパク質は、A141I、F170S、及びV185A変異(EU付番)を含む(それらから成るもの、及びそれらから本質的に成るものを含む)H1のCH1ドメインと、F116A及びS176F変異を含む(それらから成るもの、またはそれらから本質的に成るものを含む)L1のCLドメインと、を含む。追加的または代替的に、ライブラリ内の多特異性抗原結合タンパク質は、A141I、F170S、及びS183A変異(EU付番)を含む(それらから成るもの、及びそれらから本質的に成るものを含む)H1のCH1ドメインと、F116A及びS176F変異を含む(それらから成るもの、またはそれらから本質的に成るものを含む)L1のCLドメインと、を含む。追加的または代替的に、ライブラリ内の多特異性抗原結合タンパク質は、A141I、F170S、及びS181M変異(EU付番)を含む(それらから成るもの、及びそれらから本質的に成るものを含む)H1のCH1ドメインと、F116A、L135V、S174A、S176F、及びT178V変異EU付番)を含む(それらから成るもの、またはそれらから本質的に成るものを含む)L1のCLドメインと、を含む。追加的または代替的に、ライブラリ内の多特異性抗原結合タンパク質は、F170S及びV185A変異(EU付番)を含む(それらから成るもの、及びそれらから本質的に成るものを含む)H1のCH1ドメインと、F116A及びS176F変異を含む(それらから成るもの、またはそれらから本質的に成るものを含む)L1のCLドメインと、を含む。追加的または代替的に、ライブラリ内の多特異性抗原結合タンパク質は、A141I及びF170S変異(EU付番)を含む(それらから成るもの、及びそれらから本質的に成るものを含む)H1のCH1ドメインと、F116A、L135V、S174A、S176F、及びT178V変異(EU付番)を含む(それらから成るもの、またはそれらから本質的に成るものを含む)L1のCLドメインと、を含む。追加的または代替的に、ライブラリ内の多特異性抗原結合タンパク質は、F170S変異(EU付番)を含む(それから成るもの、及びそれから本質的に成るものを含む)H1のCH1ドメインと、F116A、L135V、S174A、S176F、及びT178V変異(EU付番)を含む(それらから成るもの、またはそれらから本質的に成るものを含む)L1のCLドメインと、を含む。追加的または代替的に、ライブラリ内の多特異性抗原結合タンパク質は、F170S変異(EU付番)を含む(それから成るもの、及びそれから本質的に成るものを含む)H1のCH1ドメインと、F116A、L135V、S176F、及びT178V変異(EU付番)を含む(それらから成るもの、またはそれらから本質的に成るものを含む)L1のCLドメインと、を含む。追加的または代替的に、ライブラリ内の多特異性抗原結合タンパク質は、F170S変異(EU付番)を含む(それから成るもの、及びそれから本質的に成るものを含む)H1のCH1ドメインと、F116A、L135V、S174A、及びS176F変異(EU付番)を含む(それらから成るもの、またはそれらから本質的に成るものを含む)L1のCLドメインと、を含む。追加的または代替的に、ライブラリ内の多特異性抗原結合タンパク質は、F170S変異(EU付番)を含む(それから成るもの、及びそれから本質的に成るものを含む)H1のCH1ドメインと、F116A、S176F、及びT178V変異(EU付番)を含む(それらから成るもの、またはそれらから本質的に成るものを含む)L1のCLドメインと、を含む。追加的または代替的に、ライブラリ内の多特異性抗原結合タンパク質は、F170S変異(EU付番)を含む(それから成るもの、及びそれから本質的に成るものを含む)H1のCH1ドメインと、F116A、L135V、及びS176F変異(EU付番)を含む(それらから成るもの、またはそれらから本質的に成るものを含む)L1のCLドメインと、を含む。
追加的または代替的に、ライブラリ内の多特異性抗原結合タンパク質は、F170S変異(EU付番)を含む(それから成るもの、及びそれから本質的に成るものを含む)H1のCH1ドメインと、F116AおよびS176F変異(EU付番)を含む(それらから成るもの、またはそれらから本質的に成るものを含む)L1のCLドメインと、を含む。追加的または代替的に、ライブラリ内の多特異性抗原結合タンパク質は、A141I及びF170S変異(EU付番)を含む(それらから成るもの、及びそれらから本質的に成るものを含む)H1のCH1ドメインと、F116A、L135V、S176F、及びT178V変異(EU付番)を含む(それらから成るもの、またはそれらから本質的に成るものを含む)L1のCLドメインと、を含む。追加的または代替的に、ライブラリ内の多特異性抗原結合タンパク質は、A141I及びF170S変異(EU付番)を含む(それらから成るもの、及びそれらから本質的に成るものを含む)H1のCH1ドメインと、F116A、L135V、S174A、及びS176F変異(EU付番)を含む(それらから成るもの、またはそれらから本質的に成るものを含む)L1のCLドメインと、を含む。追加的または代替的に、ライブラリ内の多特異性抗原結合タンパク質は、A141I及びF170S変異(EU付番)を含む(それらから成るもの、及びそれらから本質的に成るものを含む)H1のCH1ドメインと、F116A、S176F、及びT178V変異(EU付番)を含む(それらから成るもの、またはそれらから本質的に成るものを含む)L1のCLドメインと、を含む。追加的または代替的に、ライブラリ内の多特異性抗原結合タンパク質は、A141I及びF170S変異(EU付番)を含む(それらから成るもの、及びそれらから本質的に成るものを含む)H1のCH1ドメインと、F116A、L135V、及びS176F変異(EU付番)を含む(それらから成るもの、またはそれらから本質的に成るものを含む)L1のCLドメインと、を含む。追加的または代替的に、ライブラリ内の多特異性抗原結合タンパク質は、A141I及びF170S変異(EU付番)を含む(それらから成るもの、及びそれらから本質的に成るものを含む)H1のCH1ドメインと、F116A及びS176F変異(EU付番)を含む(それらから成るもの、またはそれらから本質的に成るものを含む)L1のCLドメインと、を含む。
追加的または代替的に、ライブラリ内の多特異性抗原結合タンパク質は、H1のVHドメイン上のQ39位(Kabat付番)におけるアミノ酸置換変異と、L1のVLドメイン上のQ38位(Kabat付番)におけるアミノ酸置換変異とを含む。追加的または代替的に、ライブラリ内の多特異性抗原結合タンパク質は、H2のVHドメイン上のQ39位(Kabat付番)におけるアミノ酸置換変異と、L2のVLドメイン上のQ38位(Kabat付番におけるアミノ酸置換変異とを含む。
特定の実施形態において、相補性決定領域(CDR)に特有の配列を有する本明細書において提供される多特異性抗原結合タンパク質を、少なくとも2個、3個、4個、5個、10個、30個、100個、250個、500個、750個、1000個、2500個、5000個、7500個、10000個、25000個、50000個、75000個、100000個、250000個、500000個、750000個、1000000個、2500000個、5000000個、7500000個、10000000個、または10000000個超含む(これらの値間の任意の範囲を含む)、ライブラリが提供される。特定の実施形態において、多特異性抗原結合タンパク質ライブラリは、約2、約5、約10、約50、約100、約250、約500、約750、約103、約104、約105、約106、約107、約108、約109、約1010、約1011、約1012、約1013、約1014、または約1014超(例えば約1015または約1016など)(これらの値間の任意の範囲を含む)の配列多様性を有する。
特定の実施形態において、多特異性抗原結合タンパク質ライブラリは、遺伝子操作によって生成される。変異誘発そしてその後のライブラリ構築のための多様な方法が、(スクリーニングまたは選択のための適切な方法と併せて)これまでに説明されている。そのような変異誘発方法としては、例えば、エラープローンPCR、ループシャフリング、もしくはオリゴヌクレオチド指向性変異誘発、ランダムヌクレオチド挿入、または組換え前の他の方法が挙げられるが、これらに限定されない。これらの方法に関するさらなる詳細は、例えば、Abou−Nadler et al.(2010)Bioengineered Bugs 1,337−340、Firth et al.(2005)Bioinformatics 21,3314−3315、Cirino et al.(2003)Methods Mol Biol 231,3−9、Pirakitikulr(2010)Protein Sci 19,2336−2346、Steffens et al.(2007)J.Biomol Tech 18,147−149などに記載されている。したがって、特定の実施形態において、遺伝子操作技術によって生成された多特異性抗原結合タンパク質ライブラリが提供される。
特定の実施形態において、多特異性抗原結合タンパク質ライブラリは、インビトロ翻訳によって生成される。簡潔に述べると、インビトロ翻訳は、プロモーターを含有するベクターにタンパク質コード配列(複数可)をクローニングし、クローニングされた配列(複数可)をRNAポリメラーゼで転写することによってmRNAを産生し、例えば、細胞不含抽出物を使用して、このmRNAのインビトロでの翻訳によってタンパク質を合成することを伴う。所望の変異体タンパク質は、単純に、クローニングされたタンパク質コード配列を変更することによって生成することができる。多くのmRNAが、コムギ胚芽抽出物またはウサギ網状赤血球ライセート中で効率的に翻訳され得る。インビトロ翻訳に関するさらなる詳細は、例えば、Hope et al.(1985)Cell 43,177−188、Hope et al.(1986)Cell 46,885−894、Hope et al.(1987)EMBO J.6,2781−2784、Hope et al.(1988)Nature 333,635−640、及びMelton et al.(1984)Nucl.Acids Res.12,7057−7070に記載されている。
したがって、本明細書に記載のポリペプチドディスプレイライブラリをコードする複数の核酸分子が提供される。複数の核酸分子に作動可能に連結された発現ベクターも、本明細書において提供される。
特定の実施形態において、多特異性抗原結合タンパク質ライブラリは、化学合成によって生成される。固相及び液相ペプチド合成の方法は、当該技術分野で周知であり、例えば、Methods of Molecular Biology,35,Peptide Synthesis Protocols,(M.W.Pennington and B.M.Dunn Eds),Springer,1994、Welsch et al.(2010)Curr Opin Chem Biol 14,1−15、Methods of Enzymology,289,Solid Phase Peptide Synthesis,(G.B.Fields Ed.),Academic Press,1997、Chemical Approaches to the Synthesis of Peptides and Proteins,(P.Lloyd−Williams,F.Albericio,and E.Giralt Eds),CRC Press,1997、Fmoc Solid Phase Peptide Synthesis,A Practical Approach,(W.C.Chan,P.D.White Eds),Oxford University Press,2000、Solid Phase Synthesis,A Practical Guide,(S.F.Kates,F Albericio Eds),Marcel Dekker,2000、P.Seneci,Solid−Phase Synthesis and Combinatorial Technologies,John Wiley & Sons,2000、Synthesis of Peptides and Peptidomimetics(M.Goodman,Editor−in−chief,A.Felix,L.Moroder,C.Tmiolo Eds),Thieme,2002、N.L.Benoiton,Chemistry of Peptide Synthesis,CRC Press,2005、Methods in Molecular Biology,298,Peptide Synthesis and Applications,(J.Howl Ed)Humana Press,2005、及びAmino Acids,Peptides and Proteins in Organic Chemistry,Volume 3,Building Blocks,Catalysts and Coupling Chemistry,(A.B.Hughs,Ed.)Wiley−VCH,2011に詳細に記載されている。したがって、特定の実施形態において、化学合成技術によって生成された多特異性抗原結合タンパク質ライブラリが提供される。
特定の実施形態において、多特異性抗原結合タンパク質ライブラリは、ディスプレイライブラリを含む。特定の実施形態において、ディスプレイライブラリは、ファージディスプレイライブラリ、ファージミドディスプレイライブラリ、ウイルスディスプレイライブラリ、細菌ディスプレイライブラリ、酵母ディスプレイライブラリ、λgt11ライブラリ、CISディスプレイライブラリ、及びインビトロ区画化ライブラリ、またはリボソームディスプレイライブラリである。かかるディスプレイライブラリの作製方法及びスクリーニング方法は、当業者に周知であり、例えば、Molek et al.(2011)Molecules 16,857−887、Boder et al.,(1997)Nat Biotechnol 15,553−557、Scott et al.(1990)Science 249,386−390、Brisette et al.(2007)Methods Mol Biol 383,203−213、Kenrick et al.(2010)Protein Eng Des Sel 23,9−17、Freudl et al.(1986)J Mol Biol 188,491−494、Getz et al.(2012)Methods Enzymol 503,75−97、Smith et al.(2014)Curr Drug Discov Technol 11,48−55、Hanes,et al.(1997)Proc Natl Acad Sci USA 94,4937−4942、Lipovsek et al.,(2004)J Imm Methods 290,51−67、Ullman et al.(2011)Brief.Funct.Genomics,10,125−134、Odegrip et al.(2004)Proc Natl Acad Sci USA 101,2806−2810、及びMiller et al.(2006)Nat Methods 3,561−570に記載されている。
特定の実施形態において、多特異性抗原結合タンパク質ライブラリは、例えば、Szostakら、US 6258558、US 6261804、US 5643768、及びUS 5658754に記載の技術によって生成されたRNA−タンパク質融合ライブラリを含む。特定の実施形態において、多特異性抗原結合タンパク質ライブラリは、例えば、US 6416950に記載のDNA−タンパク質ライブラリを含む。
多特異性抗原結合タンパク質ライブラリの定向進化
本明細書において提供される多特異性抗原結合タンパク質をスクリーニングして、例えば、2つ以上の目的の標的リガンドに対して改善された結合親和性を有する多価抗原結合タンパク質を特定することができる。したがって、本明細書では、少なくとも2つの目的の標的リガンド(例えば、本明細書の他の箇所に記載される2つ以上の目的の標的リガンド)に特異的に結合する多特異性抗原結合タンパク質を得る方法が提供される。
特定の実施形態において、本方法は、a)多特異性抗原結合タンパク質:第1の標的リガンド複合体の形成を可能にする条件下で、多特異性抗原結合タンパク質のライブラリ(例えば本明細書に記載のライブラリなど)と、第1の標的リガンドを接触させることと、(b)多特異性抗原結合タンパク質:第1の標的リガンド複合体の形成を検出することと、(c)第1の標的リガンドに特異的に結合する多特異性抗原結合タンパク質を複合体から得ることと、を含む。
追加的または代替的に、特定の実施形態において、本方法は、a)多特異性抗原結合タンパク質:第2の標的リガンド複合体の形成を可能にする条件下で、多特異性抗原結合タンパク質のライブラリ(例えば本明細書に記載のライブラリなど)と、第2の標的リガンドを接触させることと、(b)多特異性抗原結合タンパク質:第2の標的リガンド複合体の形成を検出することと、(c)第2の標的リガンドに特異的に結合する多特異性抗原結合タンパク質を複合体から得ることと、を含む。
特定の実施形態において、本明細書において提供される多特異性抗原結合タンパク質と、第1の標的リガンドとを含む複合体(すなわち、多特異性抗原結合タンパク質:標的リガンド複合体)が提供される。特定の実施形態において、本明細書において提供される多特異性抗原結合タンパク質と、第2の標的リガンドとを含む複合体が提供される。特定の実施形態において、本明細書において提供される多特異性抗原結合タンパク質と、第1の標的リガンドと、第2の標的リガンドとを含む複合体が提供される。特定の実施形態において、2つ以上の標的リガンドに結合することのできる多特異性抗原結合タンパク質が提供される。特定の実施形態において、本方法は、(d)2つ以上の標的リガンドに特異的に結合する多特異性抗原結合タンパク質の核酸配列を決定することをさらに含む。
特定の実施形態において、2つ以上の標的リガンドに特異的に結合する多特異性抗原結合タンパク質は、親和性成熟を受ける。このプロセスにおいて、多特異性抗原結合タンパク質は、第1の標的及び/または第2の標的に対する増加した親和性を選択するスキームにかけられる(Wu et al.(1998)Proc Natl Acad Sci USA.95,6037−42を参照されたい)。特定の実施形態において、第1の標的リガンドに特異的に結合する多特異性抗原結合タンパク質は、ライブラリスクリーンからの特定後にさらにランダム化される。例えば、特定の実施形態において、第1の標的リガンドに特異的に結合する多特異性抗原結合タンパク質を得る方法は、(e)さらなる多特異性抗原結合タンパク質を生成するために、事前に特定された多特異性抗原結合タンパク質:第1の標的リガンド複合体から得られた多特異性抗原結合タンパク質のCDR−H1、CDR−H2、CDR−H3、CDR−L1、CDR−L2、及び/またはCDR−L3をランダム化することと、(f)ランダム化されたさらなる多特異性抗原結合タンパク質と第1の標的リガンドを接触させることと、(g)ランダム化されたさらなる多特異性抗原結合タンパク質:第1の標的リガンド複合体の形成を検出することと、(h)第1の標的リガンドに特異的に結合するランダム化されたさらなる多特異性抗原結合タンパク質を複合体から得ることと、をさらに含む。追加的または代替的に、特定の実施形態において、ステップ(e)〜(h)は、第2の標的リガンドを用いて繰り返される。
特定の実施形態において、本方法は、(i)第1(及び/または第2)の標的リガンドに特異的に結合する多特異性抗原結合タンパク質の核酸配列を決定することをさらに含む。
特定の実施形態において、ランダム化されたさらなる多特異性抗原結合タンパク質は、第1のライブラリにおいて以前にランダム化されなかった、少なくとも1つまたは少なくとも2つのランダム化CDRを含む。第1及び/または第2の標的リガンドに対する十分な親和性を有するn個の多特異性抗原結合タンパク質(複数可)が得られるまで、複数ラウンドのランダム化、スクリーニング、及び選択を行うことができる。したがって、特定の実施形態において、ステップ(e)〜(h)またはステップ(e)〜(i)は、第1の標的リガンドに特異的に結合する多特異性抗原結合タンパク質を特定するために、1回、2回、3回、4回、5回、6回、7回、8回、9回、10回、または10回より多く繰り返される。追加的または代替的に、特定の実施形態において、ステップ(e)〜(h)またはステップ(e)〜(i)は、第2の標的リガンドに特異的に結合する多特異性抗原結合タンパク質を特定するために、1回、2回、3回、4回、5回、6回、7回、8回、9回、10回、または10回より多く繰り返される。
特定の実施形態において、少なくとも2ラウンド、3ラウンド、4ラウンド、5ラウンド、6ラウンド、7ラウンド、8ラウンド、9ラウンド、10ラウンド、または10ラウンドより多くのランダム化、スクリーニング、及び選択を受けた多特異性抗原結合タンパク質は、1ラウンドのランダム化、スクリーニング、及び選択を受けた多特異性抗原結合タンパク質の親和性と少なくとも同じ高さの親和性で標的リガンドに結合する。特定の実施形態において、少なくとも2ラウンド、3ラウンド、4ラウンド、5ラウンド、6ラウンド、7ラウンド、8ラウンド、9ラウンド、10ラウンド、または10ラウンドより多くのランダム化、スクリーニング、及び選択を受けた多特異性抗原結合タンパク質は、1ラウンドのランダム化、スクリーニング、及び選択を受けた多特異性抗原結合タンパク質の親和性よりも高い親和性で第1の標的リガンドに結合する。追加的または代替的に、特定の実施形態において、少なくとも2ラウンド、3ラウンド、4ラウンド、5ラウンド、6ラウンド、7ラウンド、8ラウンド、9ラウンド、10ラウンド、または10ラウンドより多くのランダム化、スクリーニング、及び選択を受けた多特異性抗原結合タンパク質は、1ラウンドのランダム化、スクリーニング、及び選択を受けた多特異性抗原結合タンパク質の親和性よりも高い親和性で第2の標的リガンドに結合する。
上述の方法が、3つの目的の標的リガンド、4つの目的の標的リガンド、5つの目的の標的リガンド、または5つより多くの目的の標的リガンドに特異的に結合する多特異性抗原結合タンパク質を特定するために繰り返され得ることは、当業者には容易に明らかになるであろう。
本明細書に記載の多特異性抗原結合タンパク質のライブラリは、標的リガンドに特異的に結合する新たなまたは改善された結合タンパク質を進化させるための、当該技術分野で知られる任意の技術によってスクリーニングされ得る。特定の実施形態において、標的リガンドは、固体支持体(例えばカラム樹脂またはマイクロタイタープレートウェルなど)に固定化し、標的リガンドは、候補多特異性抗原結合タンパク質のライブラリ(例えば本明細書に記載の任意のライブラリなど)と接触させる。選択技術は、例えば、ファージディスプレイ(Smith(1985)Science 228,1315−1317)、mRNAディスプレイ(Wilson et al.(2001)Proc Natl Acad Sci USA 98:3750−3755)、細菌ディスプレイ(Georgiou,et al.(1997)Nat Biotechnol 15:29−34.)、酵母ディスプレイ(Boder and Wittrup(1997)Nat.Biotechnol.15:553−5577)、またはリボソームディスプレイ(Hanes and Pluckthun(1997)Proc Natl Acad Sci U S A 94:4937−4942及びWO2008/068637)とすることができる。
特定の実施形態において、多特異性抗原結合タンパク質のライブラリは、ファージディスプレイライブラリである。特定の実施形態において、本明細書に記載の多特異性抗原結合タンパク質を提示するファージ粒子が提供される。特定の実施形態において、標的リガンドに結合することのできる本明細書に記載の多特異性抗原結合タンパク質を提示するファージ粒子が提供される。
ファージディスプレイとは、複数の多特異性抗原結合タンパク質変異形が、バクテリオファージ粒子の表面上のコートタンパク質に融合タンパク質として提示される技術である(Smith,G.P.(1985)Science,228:1315−7、Scott,J.K.and Smith,G.P.(1990)Science 249:386、Sergeeva,A.,et al.(2006)Adv.Drug Deliv.Rev.58:1622−54)。ファージディスプレイの有用性は、選択的にランダム化されたタンパク質変異形(またはランダムにクローニングされたcDNA)の大きなライブラリが、高い親和性で標的分子に結合する配列に関して高速かつ効率的に分取され得るという事実にある。
ファージ上でのペプチドライブラリ(Cwirla,S.E.et al.(1990)Proc.Natl.Acad.Sci.USA,87:6378)またはタンパク質ライブラリの提示(Lowman,H.B.et al.(1991)Biochemistry,30:10832、Clackson,T.et al.(1991)Nature,352:624、Marks,J.D.et al.(1991),J.Mol.Biol.,222:581、Kang,A.S.et al.(1991)Proc.Natl.Acad.Sci.USA,88:8363)は、特異的結合特性を有するものに関して数百万のポリペプチドまたはオリゴペプチドをスクリーニングするために使用されている(Smith,G.P.(1991)Current Opin.Biotechnol.,2:668、Wu et al.(1998)Proc Natl Acad Sci USA.May 95,6037−42)。多価ファージディスプレイ法は、繊維状ファージの遺伝子IIIまたは遺伝子VIIIのいずれかとの融合によって小型のランダムペプチド及び小タンパク質を提示するために使用されている。(Wells and Lowman,Curr.Opin.Struct.Biol.,3:355−362(1992)、及びその中に引用されている参考文献)。一価ファージディスプレイでは、タンパク質またはペプチドライブラリを遺伝子IIIまたはその一部分に融合し、ファージ粒子が融合タンパク質の1つのコピーを提示するかまたはそれを提示しないように、野生型遺伝子IIIタンパク質の存在下で低レベルで発現させる。多価ファージと比べて親和作用が低下しているため、分取は固有のリガンド親和性に基づき、ファージミドベクターが使用されることで、DNA操作が単純化される。(Lowman and Wells,Methods:A companion to Methods in Enzymology,3:205−0216(1991)。)
多特異性抗原結合タンパク質のファージライブラリの分取は、多数の変異形の構築及び増殖、標的リガンドを使用した親和性精製の手順、ならびに結合強化(binding enrichment)の結果を評価する手段を伴う(例えば、US 5223409、US 5403484、US 5571689、及びUS 5663143を参照されたい)。
ほとんどのファージディスプレイ法は、繊維状ファージ(例えばM13ファージなど)を使用する。ラムドイドファージディスプレイ系(WO1995/34683、US 5627024参照)、T4ファージディスプレイ系(Ren et al.(1998)Gene 215:439、Zhu et al.(1998)Cancer Research,58:3209−3214、Jiang et al.,(1997)Infection & Immunity,65:4770−4777、Ren et al.(1997)Gene,195:303−311、Ren(1996)Protein Sci.,5:1833、Efimov et al.(1995)Virus Genes,10:173)、及びT7ファージディスプレイ系(Smith and Scott(1993)Methods in Enzymology,217:228−257、US.5766905)も知られている。
現在では、ファージディスプレイの基本概念の改善形態及び変化形が、他にも多く開発されている。これらの改善形態は、ディスプレイ系が選択された標的分子への結合についてペプチドライブラリをスクリーニングする能力、及び機能タンパク質を提示する能力を、これらのタンパク質を所望の特性についてスクリーニングする潜在性と共に向上させる。ファージディスプレイ反応のためのコンビナトリアル反応デバイスが開発されており(WO 1998/14277)、ファージディスプレイライブラリは、二分子相互作用(WO 1998/20169、WO 1998/20159)及び制約されたヘリックスペプチドの特性(WO 1998/20036)を分析し制御するために使用されている。WO 1997/35196は、親和性リガンドの単離方法を記載しており、この方法では、ファージディスプレイライブラリを1つの溶液(この中ではリガンドは標的分子に結合する)及び第2の溶液(この中では親和性リガンドは標的分子に結合しない)と接触させて、結合リガンドを選択的に単離させる。WO 1997/46251は、親和性精製抗体を用いてランダムファージディスプレイライブラリのバイオパニングを行い、次に結合ファージを単離させ、続いて高親和性結合ファージを単離させるためにマイクロプレートウェルを使用したマイクロパニングプロセスを行う方法を記載している。かかる方法は、本明細書に開示される多特異性抗原結合タンパク質に適用することができる。Staphylococcus aureusタンパク質Aを親和性タグとして使用することも報告されている(Li et al.(1998)Mol Biotech.9:187)。WO 1997/47314は、ファージディスプレイライブラリであってもよいコンビナトリアルライブラリを使用して酵素特異性を区別するための基質減算ライブラリの使用を記載している。特異性結合タンパク質を選択する追加の方法が、US 5498538、US 5432018、及びWO 1998/15833に記載されている。また、ペプチドライブラリの生成方法及びこれらのライブラリのスクリーニング方法が、US 5723286、US 5432018、US 5580717、US 5427908、US 5498530、US 5770434、US 5734018、US 5698426、US 5763192、及びUS 5723323に開示されている。
抗原/標的分子
本明細書において提供される多特異性抗原結合タンパク質によって標的とされ得る分子の例としては、可溶性血清タンパク質及びそれらの受容体、ならびに他の膜結合タンパク質(例えば、アドヘシン)が挙げられるが、これらに限定されない。別の実施形態では、本明細書において提供される多特異性抗原結合タンパク質は、8MPI、8MP2、8MP38(GDFIO)、8MP4、8MP6、8MP8、CSFI(M−CSF)、CSF2(GM−CSF)、CSF3(G−CSF)、EPO、FGF1(αFGF)、FGF2(βFGF)、FGF3(int−2)、FGF4(HST)、FGF5、FGF6(HST−2)、FGF7(KGF)、FGF9、FGF10、FGF11、FGF12、FGF12B、FGF14、FGF16、FGF17、FGF19、FGF20、FGF21、FGF23、IGF1、IGF2、IFNA1、IFNA2、IFNA4、IFNA5、IFNA6、IFNA7、IFN81、IFNG、IFNWI、FEL1、FEL1(EPSELON)、FEL1(ZETA)、IL1A、IL1B、IL2、IL3、IL4、IL5、IL6、IL7、IL8、IL9、IL10、IL11、IL12A、IL12B、IL13、IL14、IL15、IL16、IL17、IL17B、IL18、IL19、IL20、IL22、IL23、IL24、IL25、IL26、IL27、IL28A、IL28B、IL29、IL30、PDGFA、PDGFB、TGFA、TGFB1、TGFB2、TGFBb3、LTA(TNF−β)、LTB、TNF(TNF−α)、TNFSF4(OX40リガンド)、TNFSF5(CD40リガンド)、TNFSF6(FasL)、TNFSF7(CD27リガンド)、TNFSF8(CD30リガンド)、TNFSF9(4−1BBリガンド)、TNFSF10(TRAIL)、TNFSF11(TRANCE)、TNFSF12(APO3L)、TNFSF13(April)、TNFSF13B、TNFSF14(HVEM−L)、TNFSF15(VEGI)、TNFSF18、HGF(VEGFD)、VEGF、VEGFB、VEGFC、IL1R1、IL1R2、IL1RL1、IL1RL2、IL2RA、IL2RB、IL2RG、IL3RA、IL4R、IL5RA、IL6R、IL7R、IL8RA、IL8RB、IL9R、IL10RA、IL10RB、IL11RA、IL12RB1、IL12RB2、IL13RA1、IL13RA2、IL15RA、IL17R、IL18R1、IL20RA、IL21R、IL22R、IL1HY1、IL1RAP、IL1RAPL1、IL1RAPL2、IL1RN、IL6ST、IL18BP、IL18RAP、IL22RA2、AIF1、HGF、LEP(レプチン)、PTN、及びTHPOから成る群から選択される1つ、2つ、またはより多くのサイトカイン、サイトカイン関連タンパク質、ならびにサイトカイン受容体に結合することができる。
別の実施形態では、標的分子は、CCLI(1−309)、CCL2(MCP−1/MCAF)、CCL3(MIP−Iα)、CCL4(MIP−Iβ)、CCL5(RANTES)、CCL7(MCP−3)、CCL8(mcp−2)、CCL11(エオタキシン)、CCL13(MCP−4)、CCL15(MIP−Iδ)、CCL16(HCC−4)、CCL17(TARC)、CCL18(PARC)、CCL19(MDP−3b)、CCL20(MIP−3α)、CCL21(SLC/エクソダス(exodus)−2)、CCL22(MDC/STC−1)、CCL23(MPIF−1)、CCL24(MPIF−2/エオタキシン−2)、CCL25(TECK)、CCL26(エオタキシン−3)、CCL27(CTACK/ILC)、CCL28、CXCLI(GROI)、CXCL2(GR02)、CXCL3(GR03)、CXCL5(ENA−78)、CXCL6(GCP−2)、CXCL9(MIG)、CXCL10(IP10)、CXCL11(1−TAC)、CXCL12(SDFI)、CXCL13、CXCL14、CXCL16、PF4(CXCL4)、PPBP(CXCL7)、CX3CL1(SCYDI)、SCYEI、XCLI(リンホタクチン)、XCL2(SCM−Iβ)、BLRI(MDR15)、CCBP2(D6/JAB61)、CCRI(CKRI/HM145)、CCR2(mcp−IRBIRA)、CCR3(CKR3/CMKBR3)、CCR4、CCR5(CMKBR5/ChemR13)、CCR6(CMKBR6/CKR−L3/STRL22/DRY6)、CCR7(CKR7/EBII)、CCR8(CMKBR8/TER1/CKR−L1)、CCR9(GPR−9−6)、CCRL1(VSHK1)、CCRL2(L−CCR)、XCR1(GPR5/CCXCR1)、CMKLR1、CMKOR1(RDC1)、CX3CR1(V28)、CXCR4、GPR2(CCR10)、GPR31、GPR81(FKSG80)、CXCR3(GPR9/CKR−L2)、CXCR6(TYMSTR/STRL33/Bonzo)、HM74、IL8RA(IL8Rα)、IL8RB(IL8Rβ)、LTB4R(GPR16)、TCP10、CKLFSF2、CKLFSF3、CKLFSF4、CKLFSF5、CKLFSF6、CKLFSF7、CKLFSF8、BDNF、C5R1、CSF3、GRCC10(C10)、EPO、FY(DARC)、GDF5、HDF1、HDF1α、DL8、PRL、RGS3、RGS13、SDF2、SLIT2、TLR2、TLR4、TREM1、TREM2、及びVHLから成る群から選択されるケモカイン、ケモカイン受容体、またはケモカイン関連タンパク質である。
別の実施形態では、本明細書において提供される多特異性抗原結合タンパク質は、ABCF1;ACVR1;ACVR1B;ACVR2;ACVR2B;ACVRL1;ADORA2A;アグリカン;AGR2;AICDA;AIF1;AIG1;AKAP1;AKAP2;AMH;AMHR2;ANGPTL;ANGPT2;ANGPTL3;ANGPTL4;ANPEP;APC;APOC1;AR;AZGP1(亜鉛−a−糖タンパク質);B7.1;B7.2;BAD;BAFF(BLys);BAG1;BAI1;BCL2;BCL6;BDNF;BLNK;BLRI(MDR15);BMP1;BMP2;BMP3B(GDF10);BMP4;BMP6;BMP8;BMPR1A;BMPR1B;BMPR2;BPAG1(プレクチン);BRCA1;C19orf10(IL27w);C3;C4A;C5;C5R1;CANT1;CASP1;CASP4;CAV1;CCBP2(D6/JAB61);CCL1(1−309);CCL11(エオタキシン);CCL13(MCP−4);CCL15(MIP1δ);CCL16(HCC−4);CCL17(TARC);CCL18(PARC);CCL19(MIP−3β);CCL2(MCP−1);MCAF;CCL20(MIP−3α);CCL21(MTP−2);SLC;エクソダス−2;CCL22(MDC/STC−1);CCL23(MPIF−1);CCL24(MPIF−2/エオタキシン−2);CCL25(TECK);CCL26(エオタキシン−3);CCL27(CTACK/ILC);CCL28;CCL3(MTP−Iα);CCL4(MDP−Iβ);CCL5(RANTES);CCL7(MCP−3);CCL8(mcp−2);CCNA1;CCNA2;CCND1;CCNE1;CCNE2;CCR1(CKRI/HM145);CCR2(mcp−IRβ/RA);CCR3(CKR/CMKBR3);CCR4;CCR5(CMKBR5/ChemR13);CCR6(CMKBR6/CKR−L3/STRL22/DRY6);CCR7(CKBR7/EBI1);CCR8(CMKBR8/TER1/CKR−L1);CCR9(GPR−9−6);CCRL1(VSHK1);CCRL2(L−CCR);CD164;CD19;CD1C;CD20;CD200;CD22;CD24;CD28;CD3;CD37;CD38;CD3E;CD3G;CD3Z;CD4;CD40;CD40L;CD44;CD45RB;CD52;CD69;CD72;CD74;CD79A;CD79B;CDS;CD80;CD81;CD83;CD86;CDH1(E−カドヘリン);CDH10;CDH12;CDH13;CDH18;CDH19;CDH20;CDH5;CDH7;CDH8;CDH9;CDK2;CDK3;CDK4;CDK5;CDK6;CDK7;CDK9;CDKN1A(p21/WAF1/Cip1);CDKN1B(p27/Kip1);CDKN1C;CDKN2A(P16INK4a);CDKN2B;CDKN2C;CDKN3;CEBPB;CER1;CHGA;CHGB;キチナーゼ;CHST10;CKLFSF2;CKLFSF3;CKLFSF4;CKLFSF5;CKLFSF6;CKLFSF7;CKLFSF8;CLDN3;CLDN7(クローディン−7);CLN3;CLU(クラスタリン);CMKLR1;CMKOR1(RDC1);CNR1;COL 18A1;COL1A1;COL4A3;COL6A1;CR2;CRP;CSFI(M−CSF);CSF2(GM−CSF);CSF3(GCSF);CTLA4;CTNNB1(b−カテニン);CTSB(カテプシンB);CX3CL1(SCYDI);CX3CR1(V28);CXCL1(GRO1);CXCL10(IP−10);CXCL11(I−TAC/IP−9);CXCL12(SDF1);CXCL13;CXCL14;CXCL16;CXCL2(GRO2);CXCL3(GRO3);CXCL5(ENA−78/LIX);CXCL6(GCP−2);CXCL9(MIG);CXCR3(GPR9/CKR−L2);CXCR4;CXCR6(TYMSTR/STRL33/Bonzo);CYB5;CYC1;CYSLTR1;DAB2IP;DES;DKFZp451J0118;DNCLI;DPP4;E2F1;ECGF1;EDG1;EFNA1;EFNA3;EFNB2;EGF;EGFR;ELAC2;ENG;ENO1;ENO2;ENO3;EPHB4;EPO;ERBB2(Her−2);EREG;ERK8;ESR1;ESR2;F3(TF);FADD;FasL;FASN;FCER1A;FCER2;FCGR3A;FGF;FGF1(αFGF);FGF10;FGF11;FGF12;FGF12B;FGF13;FGF14;FGF16;FGF17;FGF18;FGF19;FGF2(bFGF);FGF20;FGF21;FGF22;FGF23;FGF3(int−2);FGF4(HST);FGF5;FGF6(HST−2);FGF7(KGF);FGF8;FGF9;FGFR3;FIGF(VEGFD);FELl(EPSILON);FILl(ZETA);FLJ12584;FLJ25530;FLRTI(フィブロネクチン);FLT1;FOS;FOSL1(FRA−1);FY(DARC);GABRP(GABAa);GAGEB1;GAGEC1;GALNAC4S−6ST;GATA3;GDF5;GFI1;GGT1;GM−CSF;GNASI;GNRHI;GPR2(CCR10);GPR31;GPR44;GPR81(FKSG80);GRCCIO(C10);GRP;GSN(ゲルゾリン);GSTP1;HAVCR2;HDAC4;HDAC5;HDAC7A;HDAC9;HGF;HIF1A;HOP1;ヒスタミン及びヒスタミン受容体;HLA−A;HLA−DRA;HM74;HMOXI;HUMCYT2A;ICEBERG;ICOSL;1D2;IFN−a;IFNA1;IFNA2;IFNA4;IFNA5;IFNA6;IFNA7;IFNB1;IFNガンマ;DFNW1;IGBP1;IGF1;IGF1R;IGF2;IGFBP2;IGFBP3;IGFBP6;IL−l;IL10;IL10RA;IL10RB;IL11;IL11RA;IL−12;IL12A;IL12B;IL12RB1;IL12RB2;IL13;IL13RA1;IL13RA2;IL14;IL15;IL15RA;IL16;IL17;IL17B;IL17C;IL17R;IL18;IL18BP;IL18R1;IL18RAP;IL19;IL1A;IL1B;ILIF10;IL1F5;IL1F6;IL1F7;IL1F8;IL1F9;IL1HY1;IL1R1;IL1R2;IL1RAP;IL1RAPL1;IL1RAPL2;IL1RL1;IL1RL2、ILIRN;IL2;IL20;IL20RA;IL21R;IL22;IL22R;IL22RA2;IL23;IL24;IL25;IL26;IL27;IL28A;IL28B;IL29;IL2RA;IL2RB;IL2RG;IL3;IL30;IL3RA;IL4;IL4R;IL5;IL5RA;IL6;IL6R;IL6ST(糖タンパク質130);EL7;EL7R;EL8;IL8RA;DL8RB;IL8RB;DL9;DL9R;DLK;INHA;INHBA;INSL3;INSL4;IRAK1;ERAK2;ITGA1;ITGA2;ITGA3;ITGA6(a6インテグリン);ITGAV;ITGB3;ITGB4(b4インテグリン);JAG1;JAK1;JAK3;JUN;K6HF;KAI1;KDR;KITLG;KLF5(GC Box BP);KLF6;KLKIO;KLK12;KLK13;KLK14;KLK15;KLK3;KLK4;KLK5;KLK6;KLK9;KRT1;KRT19(ケラチン19);KRT2A;KHTHB6(毛髪特異型Hケラチン);LAMAS;LEP(レプチン);Lingo−p75;Lingo−Troy;LPS;LTA(TNF−b);LTB;LTB4R(GPR16);LTB4R2;LTBR;MACMARCKS;MAGまたはOMgp;MAP2K7(c−Jun);MDK;MIB1;ミッドカイン;MEF;MIP−2;MKI67;(Ki−67);MMP2;MMP9;MS4A1;MSMB;MT3(メタロチオネクチン(metallothionectin)−111);MTSS1;MUC1(ムチン);MYC;MY088;NCK2;ニューロカン;NFKB1;NFKB2;NGFB(NGF);NGFR;NgR−Lingo;NgR−Nogo66(Nogo);NgR−p75;NgR−Troy;NME1(NM23A);NOX5;NPPB;NR0B1;NR0B2;NR1D1;NR1D2;NR1H2;NR1H3;NR1H4;NR112;NR113;NR2C1;NR2C2;NR2E1;NR2E3;NR2F1;NR2F2;NR2F6;NR3C1;NR3C2;NR4A1;NR4A2;NR4A3;NR5A1;NR5A2;NR6A1;NRP1;NRP2;NT5E;NTN4;ODZI;OPRD1;P2RX7;PAP;PART1;PATE;PAWR;PCA3;PCNA;POGFA;POGFB;PECAM1;PF4(CXCL4);PGF;PGR;ホスファカン;PIAS2;PIK3CG;PLAU(uPA);PLG;PLXDC1;PPBP(CXCL7);PPID;PRI;PRKCQ;PRKDI;PRL;PROC;PROK2;PSAP;PSCA;
PTAFR;PTEN;PTGS2(COX−2);PTN;RAC2(p21 Rac2);RARB;RGSI;RGS13;RGS3;RNF110(ZNF144);ROBO2;S100A2;SCGB1D2(リポフィリンB);SCGB2A1(マンマグロビン2);SCGB2A2(マンマグロビン1);SCYEI(内皮単球活性化サイトカイン);SDF2;SERPINA1;SERPINA3;SERP1NB5(マスピン);SERPINE1(PAI−1);SERPDMF1;SHBG;SLA2;SLC2A2;SLC33A1;SLC43A1;SLIT2;SPPI;SPRR1B(Sprl);ST6GAL1;STABI;STAT6;STEAP;STEAP2;TB4R2;TBX21;TCPIO;TOGFI;TEK;TGFA;TGFBI;TGFB1II;TGFB2;TGFB3;TGFBI;TGFBRI;TGFBR2;TGFBR3;THIL;THBSI(トロンボスポンジン−1);THBS2;THBS4;THPO;TIE(Tie−1);TMP3;組織因子;TLR1;TLR2;TLR3;TLR4;TLR5;TLR6;TLR7;TLR8;TLR9;TLR10;TNF;TNF−a;TNFAEP2(B94);TNFAIP3;TNFRSFIIA;TNFRSF1A;TNFRSF1B;TNFRSF21;TNFRSF5;TNFRSF6(Fas);TNFRSF7;TNFRSF8;TNFRSF9;TNFSF10(TRAIL);TNFSF11(TRANCE);TNFSF12(AP03L);TNFSF13(April);TNFSF13B;TNFSF14(HVEM−L);TNFSF15(VEGI);TNFSF18;TNFSF4(OX40リガンド);TNFSF5(CD40リガンド);TNFSF6(FasL);TNFSF7(CD27リガンド);TNFSFS(CD30リガンド);TNFSF9(4−1 BBリガンド);TOLLIP;Toll様受容体;TOP2A(トポイソメラーゼEa);TP53;TPM1;TPM2;TRADD;TRAF1;TRAF2;TRAF3;TRAF4;TRAF5;TRAF6;TREM1;TREM2;TRPC6;TSLP;TWEAK;VEGF;VEGFB;VEGFC;バーシカン;VHLC5;VLA−4;XCL1(リンホタクチン);XCL2(SCM−1b);XCRI(GPR5/CCXCRI);YY1;及びZFPM2から成る群から選択される、1つ以上の標的に結合することができる。
本明細書において提供される抗体のための好ましい分子標的分子としては、CD3、CD4、CDS、CD16、CD19、CD20、CD34などのCDタンパク質;EGF受容体、HER2、HER3、またはHER4受容体などのErbB受容体ファミリーのCD64、CD200メンバー;LFA−1、Mac1、p150.95、VLA−4、ICAM−1、VCAM、アルファ4/ベータ7インテグリン、及びアルファあるいはベータサブユニットを含むアルファv/ベータ3インテグリンなどの細胞接着分子(例えば、抗CD11a、抗CD18、または抗CD11b抗体);VEGF−A、VEGF−Cなどの成長因子;組織因子(TF);アルファインターフェロン(アルファIFN);TNFアルファ、IL−1ベータ、IL−3、IL−4、IL−5、IL−S、IL−9、IL−13、IL17AF、IL−1S、IL−13Rアルファ1、IL13Rアルファ2、IL−4R、IL−5R、IL−9R、IgEなどのインターロイキン;血液型抗原;flk2/flt3受容体;肥満(OB)受容体;mpl受容体;CTLA−4;RANKL、RANK、RSV Fタンパク質、タンパク質Cなどが挙げられる。
一実施形態において、本明細書において提供される多特異性抗原結合タンパク質は、低密度リポタンパク質受容体関連タンパク質(LRP)−1もしくはLRP−8、またはトランスフェリン受容体、ならびに1)ベータ−セクレターゼ(BACE1またはBACE2)、2)アルファ−セクレターゼ、3)ガンマ−セクレターゼ、4)タウ−セクレターゼ、5)アミロイド前駆体タンパク質(APP)、6)細胞死受容体6(DR6)、7)アミロイドベータペプチド、8)アルファ−シヌクレイン、9)パーキン、10)ハンチンチン、11)p75 NTR、及び12)カスパーゼ−6から成る群から選択される少なくとも1つの標的に結合する。
一実施形態において、本明細書において提供される多特異性抗原結合タンパク質は、IL−1アルファ及びIL−1ベータ、IL−12及びIL−1S;IL−13及びIL−9;IL−13及びIL−4;IL−13及びIL−5;IL−5及びIL−4;IL−13及びIL−1ベータ;IL−13及びIL−25;IL−13及びTARC;IL−13及びMDC;IL−13及びMEF;IL−13及びTGF−〜;IL−13及びLHR作動薬;IL−12及びTWEAK、IL−13及びCL25;IL−13及びSPRR2a;IL−13及びSPRR2b;IL−13及びADAMS、IL−13及びPED2、IL17A及びIL17F、CD3及びCD19、CD138及びCD20;CD138及びCD40;CD19及びCD20;CD20及びCD3;CD3S及びCD13S;CD3S及びCD20;CD3S及びCD40;CD40及びCD20;CD−S及びIL−6;CD20及びBR3、TNFアルファ及びTGF−ベータ、TNFアルファ及びIL−1ベータ;TNFアルファ及びIL−2、TNFアルファ及びIL−3、TNFアルファ及びIL−4、TNFアルファ及びIL−5、TNFアルファ及びIL6、TNFアルファ及びIL8、TNFアルファ及びIL−9、TNFアルファ及びIL−10、TNFアルファ及びIL−11、TNFアルファ及びIL−12、TNFアルファ及びIL−13、TNFアルファ及びIL−14、TNFアルファ及びIL−15、TNFアルファ及びIL−16、TNFアルファ及びIL−17、TNFアルファ及びIL−18、TNFアルファ及びIL−19、TNFアルファ及びIL−20、TNFアルファ及びIL−23、TNFアルファ及びIFNアルファ、TNFアルファ及びCD4、TNFアルファ及びVEGF、TNFアルファ及びMIF、TNFアルファ及びICAM−1、TNFアルファ及びPGE4、TNFアルファ及びPEG2、TNFアルファ及びRANKリガンド、TNFアルファ及びTe38、TNFアルファ及びBAFF、TNFアルファ及びCD22、TNFアルファ及びCTLA−4、TNFアルファ及びGP130、TNF a及びIL−12p40、VEGF及びHER2、VEGF−A及びHER2、VEGF−A及びPDGF、HER1及びHER2、VEGFA及びANG2、VEGF−A及びVEGF−C、VEGF−C及びVEGF−D、HER2及びDR5、VEGF及びIL−8、VEGF及びMET、VEGFR及びMET受容体、EGFR及びMET、VEGFR及びEGFR、HER2及びCD64、HER2及びCD3、HER2及びCD16、HER2及びHER3;EGFR(HER1)及びHER2、EGFR及びHER3、EGFR及びHER4、IL−14及びIL−13、IL−13及びCD40L、IL4及びCD40L、TNFR1及びIL−1 R、TNFR1及びIL−6R及びTNFR1及びIL−18R、EpCAM及びCD3、MAPG及びCD28、EGFR及びCD64、CSPGs及びRGM A;CTLA−4及びBTN02;IGF1及びIGF2;IGF1/2及びErb2B;MAG及びRGM A;NgR及びRGM A;NogoA及びRGM A;OMGp及びRGM A;POL−l及びCTLA−4;ならびにRGM A及びRGM Bから成る群から選択される、少なくとも2個の標的分子に結合する。
場合により他の分子と共役している可溶性抗原またはその断片は、抗体を生成するための免疫原として使用することができる。受容体などの膜貫通分子の場合、これらの断片(例えば、受容体の細胞外ドメイン)を免疫原として使用することができる。あるいは、膜貫通分子を発現する細胞を免疫原として使用してもよい。かかる細胞は、天然源(例えば、がん細胞株)由来であってもよいし、膜貫通分子を発現するように組換え技術によって形質転換されている細胞であってもよい。抗体の調製に有用な他の抗原及びその形態は、当業者には明らかであろう。
活性アッセイ
本明細書において提供される多特異性抗原結合タンパク質は、当該技術分野で知られる様々なアッセイによって、それらの物理/化学特性及び生物学的機能について特徴付けることができる。
精製された多特異性抗原結合タンパク質は、N末端配列決定、アミノ酸分析、未変性サイズ排除高圧液体クロマトグラフィ(HPLC)、質量分析、イオン交換クロマトグラフィ、及びパパイン消化を含むがこれらに限定されない、一連のアッセイによってさらに特徴付けることができる。
特定の実施形態において、本明細書において提供される多特異性抗原結合タンパク質は、それらの生物活性について分析される。いくつかの実施形態では、多特異性抗原結合タンパク質は、それらの抗原結合活性について試験される。当該技術分野で知られており、本明細書において使用され得る抗原結合アッセイとしては、限定されないが、ウェスタンブロット、ラジオイムノアッセイ、ELISA(酵素結合免疫吸着測定法)、「サンドイッチ」イムノアッセイ、免疫沈降アッセイ、蛍光イムノアッセイ、及びタンパク質Aイムノアッセイなどの技術を使用した、任意の直接結合アッセイまたは競合結合アッセイが挙げられる。例示的な抗原結合アッセイは、以下の実施例において提供される。
一実施形態において、本明細書では、全てではなく一部のエフェクター機能を有し、そのため、多特異性抗原結合タンパク質のインビボの半減期は重要であるが特定のエフェクター機能(例えば補体及びADCCなど)は不必要または有害である多くの用途に関して望ましい候補となる、提供される改変された多特異性抗原結合タンパク質が提供される。特定の実施形態において、本明細書において提供される多特異性抗原結合タンパク質は、減少したFcγR結合活性を示す。特定の実施形態において、本明細書において提供される多特異性抗原結合タンパク質は、K322A、L234A、及びL235A(EU付番)から成る群から選択される、少なくとも1個、少なくとも2個、または3個の変異をFc領域に含む。特定の実施形態において、本明細書において提供される多特異性抗原結合タンパク質は、Fc領域内にN297A置換変異を含む非グリコシル化(aglycosylated)多特異性抗原結合タンパク質である。特定の実施形態において、本明細書において提供される多特異性抗原結合タンパク質は、Fc領域内に例えばN297G置換変異を含む非グリコシル化多特異性抗原結合タンパク質である。特定の実施形態において、本明細書において提供される多特異性抗原結合タンパク質は、H1及びH2のC末端リジンにおける欠失(ΔK447)を含む。特定の実施形態において、産生された多特異性抗原結合タンパク質のFc活性は、所望の特性のみが確実に維持されるように測定される。インビトロ及び/またはインビボの細胞傷害アッセイを行って、CDC活性及び/またはADCC活性の低減/枯渇を確認することができる。例えば、Fc受容体(FcR)結合アッセイを行って、多特異性抗原結合タンパク質がFcγR結合性を欠いている(したがってADCC活性を欠いている可能性が高い)が、FcRn結合能力を保持していることを確かめることができる。ADCCを媒介するための主要な細胞であるNK細胞は、FcγRIIIのみを発現するが、一方で単球は、FcγRI、FcγRII、及びFcγRIIIを発現する。造血細胞でのFcR発現は、Ravetch and Kinet,Annu.Rev.Immunol 9:457−92(1991)の464頁の表3に要約されている。目的の分子のADCC活性を査定するためのインビトロアッセイの一例は、米国特許第5,500,362号または同第5,821,337号に記載されている。そのようなアッセイに有用なエフェクター細胞としては、末梢血単核細胞(PBMC)及びナチュラルキラー(NK)細胞が挙げられる。代替的に、または追加的に、目的の分子のADCC活性は、インビボで、例えば、Clynes et al.PNAS(USA)95:652−656(1998)に開示されているものなどの動物モデルにおいて査定されてもよい。また、C1q結合アッセイを行って、多特異性抗原結合タンパク質がC1qに結合することができず、したがってCDC活性を欠いていることを確認してもよい。補体活性化を査定するためには、例えば、Gazzano−Santoro et al.,J.Immunol.Methods 202:163(1996)に記載のCDCアッセイを行ってもよい。当該技術分野で知られる方法を使用して、FcRn結合及びインビボクリアランス/半減期の決定を行うこともできる。
共役タンパク質
本明細書では、本明細書に記載の多特異性抗原結合タンパク質(例えば、本明細書に記載の方法に従って作製された多特異性抗原結合タンパク質)のいずれかを含む、共役多特異性抗原結合タンパク質または免疫共役体(例えば、「抗体−薬物共役体(antibody−drug conjugates)」すなわち「ADC」)などの共役タンパク質も提供され、ここで、軽鎖または重鎖の定常領域のうちの1つは、染料または細胞傷害剤、例えば化学療法剤、薬物、成長阻害剤、毒素(例えば、細胞、真菌、植物、もしくは動物起源の酵素活性毒素、またはその断片)、または放射性アイソトープなどの化学分子と共役している(すなわち、放射性共役体(radioconjugate))。特に、本明細書に記載されるように、ヘテロ多量体化ドメインの使用により、2つの異なる重鎖(HC1及びHC2)ならびに2つの異なる軽鎖(LC1及びLC2)を含有する抗体の構築が可能となる。本明細書に記載の方法を使用して構築された免疫共役体は、重鎖のいずれか1つのみ(HC1もしくはHC2)または軽鎖のいずれか1つのみ(LC1もしくはLC2)の定常領域と共役した細胞傷害剤を含有し得る。また、免疫共役体は1つの重鎖または軽鎖のみに結合した細胞傷害剤を有し得るため、対象に投与される細胞傷害剤の量は、重鎖及び/または軽鎖に結合した細胞傷害剤を有する多特異性抗原結合タンパク質の投与と比べて低減する。対象に投与される細胞傷害剤の量を低減することで、細胞傷害剤に関連する有害な副作用が限定される。
がん治療において、細胞傷害剤または細胞増殖抑制剤、すなわち、腫瘍細胞を殺滅または抑制するための薬物の局所送達のために、多特異性抗原結合タンパク質−薬物共役体を使用すること(Syrigos and Epenetos,Anticancer Research 19:605−614(1999)、Niculescu−Duvaz and Springer,Adv.Drg.Del.Rev.26:151−172(1997)、米国特許第4,975,278号)により、腫瘍を標的とした薬物部分の送達及びそこでの細胞内蓄積が可能になる。共役されていないこれらの薬剤の全身投与は、排除が求められる正常細胞ならびに腫瘍細胞に対する許容不可能なレベルの毒性をもたらし得る(Baldwin et al.Lancet(Mar.15,1986):603−605(1986)、Thorpe,(1985)“Antibody Carriers Of Cytotoxic Agents In Cancer Therapy:A Review,”in Monoclonal Antibodies‘84:Biological And Clinical Applications,A.Pinchera et al.(eds.),pp.475−506)。最小限の毒性を伴う最大限の有効性が求められる。ポリクローナル抗体とモノクローナル抗体との両方が、これらの方略で有用であると報告されている(Rowland et al.,Cancer Immunol.Immunother.21:183−187(1986))。これらの方法で使用される薬物としては、ダウノマイシン、ドキソルビシン、メトトレキサート、及びビンデシン(Rowland et al.(1986)(上記))が挙げられる。抗体−毒素共役体に使用される毒素としては、ジフテリア毒素などの細胞毒素、リシンなどの植物毒素、ゲルダナマイシン(Mandler et al.Jour.of the Nat.Cancer Inst.92(19):1573−1581(2000)、Mandler et al.Bioorganic & Med.Chem.Letters 10:1025−1028(2000)、Mandler et al.Bioconjugate Chem.13:786−791(2002))、マイタンシノイド(EP 1391213、Liu et al.Proc.Natl.Acad.Sci.USA 93:8618−8623(1996))、及びカリチアマイシン(Lode et al.Cancer Res.58:2928(1998)、Hinman et al.Cancer Res.53:3336−3342(1993))などの小分子毒素が挙げられる。毒素は、チューブリン結合、DNA結合、またはトポイソメラーゼ阻害を含む機序によって、それらの細胞傷害性及び細胞増殖抑制性の作用を及ぼし得る。一部の細胞傷害薬は、大型抗体またはタンパク質受容体リガンドと共役したときに不活性になるか、または活性が低下する傾向がある。
免疫共役体の生成に有用な化学療法剤は、本明細書(例えば上記)に記載されている。使用することのできる酵素活性毒素及びその断片としては、ジフテリアA鎖、ジフテリア毒素の非結合活性断片、外毒素A鎖(Pseudomonas aeruginosa由来)、リシンA鎖、アブリンA鎖、モデシンA鎖、アルファ−サルシン、Aleurites fordiiタンパク質、ジアンシンタンパク質、Phytolaca americanaタンパク質(PAPI、PAPII、及びPAP−S)、momordica charantia阻害薬、クルシン、クロチン、sapaonaria officinalis阻害薬、ゲロニン、ミトゲリン、レストリクトシン、フェノマイシン、エノマイシン、及びトリコテセンが挙げられる。例えば、1993年10月28日公開のWO 93/21232を参照されたい。多様な放射性核種が、放射性共役抗体の産生に利用可能である。例としては、212Bi、131I、131In、90Y、及び186Reが挙げられる。多特異性抗原結合タンパク質と細胞傷害剤との共役体は、N−サクシニミジル−3−(2−ピリジルジチオール)プロピオネート(SPDP)、イミノチオラン(IT)、イミドエステルの二官能性誘導体(例えばアジプイミド酸ジメチルHClなど)、活性エステル(例えばスベリン酸ジサクシニミジルなど)、アルデヒド(例えばグルタルアルデヒドなど)、ビス−アジド化合物(例えばビス(パジドベンゾイル)ヘキサンジアミンなど)、ビス−ジアゾニウム誘導体(例えばビス−(pジアゾニウムベンゾイル)−エチレンジアミンなど)、ジイソシアネート(例えばトルエン2,6−ジイソシアネートなど)、及びビス−活性フッ素化合物(例えば1,5−ジフルオロ−2,4−ジニトロベンゼンなど)といった、多様な二官能性タンパク質カップリング剤を使用して作製される。例えば、リシン免疫毒素は、Vitetta et al.Science 238:1098(1987)に記載のように調製することができる。炭素14で標識された1−イソチオシアナトベンジル−3−メチルジエチレントリアミン五酢酸(MX−DTPA)は、放射性核種を抗体と共役させるための例示的なキレート剤である。例えば、WO 94/11026を参照されたい。
多特異性抗原結合タンパク質と、1つ以上の小分子毒素、例えばカリチアマイシン、マイタンシノイド、ドラスタチン、オーロスタチン(aurostatins)、トリコテセン、及びCC1065など、ならびに毒素活性を有するこれらの毒素の誘導体との共役体も、本明細書において想定される。
マイタンシン及びマイタンシノイド
いくつかの実施形態では、免疫共役体は、1個以上のマイタンシノイド分子と共役した、本明細書において提供される多特異性抗原結合タンパク質(全長または断片)を含む。マイタンシノイドは、チューブリン重合を阻害することによって作用する有糸分裂阻害剤である。マイタンシンは、東アフリカの低木であるMaytenus serrataから最初に単離された(米国特許第3,896,111号)。その後、特定の微生物もマイタンシノール及びC−3マイタンシノールエステルなどのマイタンシノイドを産生することが発見された(米国特許第4,151,042号)。合成マイタンシノールならびにその誘導体及び類似体は、例えば、米国特許第4,137,230号、同第4,248,870号、同第4,256,746号、同第4,260,608号、同第4,265,814号、同第4,294,757号、同第4,307,016号、同第4,308,268号、同第4,308,269号、同第4,309,428号、同第4,313,946号、同第4,315,929号、同第4,317,821号、同第4,322,348号、同第4,331,598号、同第4,361,650号、同第4,364,866号、同第4,424,219号、同第4,450,254号、同第4,362,663号、及び同第4,371,533号に開示されている。
マイタンシノイド薬物部分は、(i)発酵または化学修飾、発酵産物の誘導体化により比較的調製しやすく、(ii)非ジスルフィドリンカーによる抗体との共役に好適な官能基を用いた誘導体化に適しており、(iii)血漿中で安定であり、かつ(iv)多様な腫瘍細胞株に対して有効であることから、抗体薬物共役体中の薬物部分として魅力的である。
マイタンシノイドを含有する免疫共役体、その作製方法、及びそれらの治療的使用は、例えば、米国特許第5,208,020号、同第5,416,064号、及び欧州特許第EP 0 425 235 81号に開示されており、これらの開示内容は、参照により本明細書に明示的に援用される。Liu et al.Proc.Natl.Acad.Sci.USA 93:8618−8623(1996)は、ヒト結腸直腸がんに対する、モノクローナル抗体C242に連結したDM1と称されるマイタンシノイドを含む、免疫共役体を記載した。この共役体は、培養された結腸がん細胞に対して高度に細胞傷害性であることが見出され、インビボ腫瘍成長アッセイにおいて抗腫瘍活性を示した。Chari et al.Cancer Research 52:127−131(1992)は、マイタンシノイドが、ジスルフィドリンカーを介して、ヒト結腸がん細胞株上の抗原に結合するマウス抗体A7と、またはHER−2/neu癌遺伝子に結合する別のマウスモノクローナル抗体TA.1と共役された、免疫共役体を記載している。TA.1−マイタンシノイド共役体の細胞傷害性は、細胞1個当たり3×105個のHER−2表面抗原を発現するヒト乳がん細胞株SK−BR−3において、インビトロで試験された。この薬物共役体は、遊離マイタンシノイド薬と同様の度合いの細胞傷害性を達成し、この度合いは、抗体分子1個当たりのマイタンシノイド分子の数を増加させることによって上昇させることができる。A7−マイタンシノイド共役体は、マウスにおいて低い全身細胞傷害性を示した。
多特異性抗原結合タンパク質−マイタンシノイド共役体は、多特異性抗原結合タンパク質とマイタンシノイド分子とのいずれの生物活性も著しく減弱させることなく、多特異性抗原結合タンパク質をマイタンシノイド分子に化学結合させることによって調製される。例えば、米国特許第5,208,020号を参照されたい(その開示内容は、参照により本明細書に明示的に援用される)。毒素/抗体の1個の分子でさえ、ネイキッド抗体の使用と比べて細胞傷害を向上させることが予想されるが、抗体分子1個当たり平均3〜4個のマイタンシノイド分子の共役は、抗体の機能または可溶性に負の影響を及ぼすことなく、標的細胞の細胞傷害性を向上させることにおいて有効性を示した。マイタンシノイドは当該技術分野で周知であり、既知の技術により合成することも、天然源から単離することもできる。好適なマイタンシノイドは、例えば、米国特許第5,208,020号ならびに本明細書上文で参照されている他の特許及び非特許公報に開示されている。好ましいマイタンシノイドは、マイタンシノール、及びマイタンシノール分子の芳香環内または他の位置で修飾されているマイタンシノール類似体、例えば様々なマイタンシノールエステルなどである。
例えば、米国特許第5,208,020号または欧州特許第0 425 235 B1号、Chari et al.Cancer Research 52:127−131(1992)、及び米国特許出願公開第2005/0169933号に開示されているものを含む、多特異性抗原結合タンパク質マイタンシノイド共役体を作製するための当該技術分野で知られる多くの連結基が存在し、これらの開示内容は、参照により本明細書に明示的に援用される。米国特許出願公開第2005/0169933号に開示されているように、リンカー成分SMCCを含む抗体−マイタンシノイド共役体が調製され得る。連結基としては、ジスルフィド基、チオエーテル基、酸不安定基、感光性基、ペプチダーゼ不安定基、または上記に特定した特許において開示されるエステラーゼ不安定基が挙げられ、ジスルフィド基及びチオエーテル基が好ましい。追加の連結基が、本明細書に記載及び例示される。
多特異性抗原結合タンパク質とマイタンシノイドとの共役体は、N−サクシニミジル−3−(2−ピリジルジチオ)プロピオネート(SPDP)、サクシニミジル−4−(N−マレイミドメチル)シクロヘキサン−1−カルボキシレート(SMCC)、イミノチオラン(IT)、イミドエステルの二官能性誘導体(例えばアジプイミド酸ジメチルHCIなど)、活性エステル(例えばスベリン酸ジサクシニミジルなど)、アルデヒド(例えばグルタルアルデヒドなど)、ビス−アジド化合物(例えばビス(p−アジドベンゾイル)ヘキサンジアミンなど)、ビス−ジアゾニウム誘導体(例えばビス−(p−ジアゾニウムベンゾイル)エチレンジアミンなど)、ジイソシアネート(例えばトルエン2,6−ジイソシアネートなど)、及びビス−活性フッ素化合物(例えば1,5−ジフルオロ−2,4−ジニトロベンゼンなど)といった、多様な二官能性タンパク質カップリング剤を使用して作製され得る。ジスルフィド結合をもたらすために特に好ましいカップリング剤としては、N−サクシニミジル−3−(2−ピリジルジチオ)プロピオネート(SPDP)(Carlsson et al.Biochem.J.173:723−737(1978))及びN−サクシニミジル−4−(2−ピリジルチオ)ペンタノエート(SPP)が挙げられる。
リンカーは、結合の種類に応じて様々な位置でマイタンシノイド分子に結合し得る。例えば、従来のカップリング技術を使用したヒドロキシル基との反応によって、エステル結合が形成されてもよい。この反応は、ヒドロキシル基を有するC−3位、ヒドロキシメチルで修飾されたC−14位、ヒドロキシル基で修飾されたC−15位、及びヒドロキシル基を有するC−20位で起こり得る。好ましい実施形態では、マイタンシノールまたはマイタンシノール類似体のC−3位で結合が形成される。
オーリスタチン及びドラスタチン
いくつかの実施形態では、免疫共役体は、ドラスタチンまたはドラスタチンペプチド類似体及び誘導体、オーリスタチンと共役した本明細書において提供される多特異性抗原結合タンパク質を含む(米国特許第5,635,483号及び同第5,780,588号)。ドラスタチン及びオーリスタチンは、微小管動態、GTP加水分解、ならびに核及び細胞の分裂に干渉し(Woyke et al.Antimicrob.Agents and Chemother.45(12):3580−3584(2001))、抗がん活性(米国特許第5,663,149号)及び抗真菌活性(Pettit et al.Antimicrob.Agents Chemother.42:2961−2965(1998))を有することが示されている。ドラスタチンまたはオーリスタチン薬物部分は、多特異性抗原結合タンパク質に、ペプチド薬物部分のN−(アミノ)末端を通じて結合していても、C−(カルボキシル)末端を通じて結合していてもよい(WO 02/088172)。
例示的なオーリスタチンの実施形態としては、米国出願公開第2005/0238649号の「Monomethylvaline Compounds Capable of Conjugation to Ligands」に開示されているN末端結合型モノメチルオーリスタチン薬物部分DE及びDFが挙げられ、この開示内容は、参照によりその全体が本明細書に明示的に援用される。
典型的に、ペプチド系薬物部分は、2つ以上のアミノ酸及び/またはペプチド断片間にペプチド結合を形成することによって調製することができる。かかるペプチド結合は、例えば、ペプチド化学の分野では周知である液相合成法に従って調製することができる(E.Schroder and K.Lubke,“The Peptides,”volume 1,pp.76−136,1965,Academic Pressを参照されたい)。オーリスタチン/ドラスタチン薬物部分は、米国特許第5,635,483号及び同第5,780,588号、Pettit et al.J.Nat.Prod.44:482−485(1981)、Pettit et al.Anti−Cancer Drug Design 13:47−66(1998)、Poncet,Curr.Pharm.Des.5:139−162(1999)、ならびにPettit,Fortschr.Chem.Org.Naturst.70:1−79(1997)の方法に従って調製され得る。また、Doronina,Nat.Biotechnol.21(7):778−784(2003)、及び、参照によりその全体が本明細書に援用される米国出願公開第2005/0238649号の「Monomethylvaline Compounds Capable of Conjugation to Ligands」(例えば、リンカー、ならびにリンカーと共役したMMAE及びMMAFなどのモノメチルバリン化合物の調製方法を開示している)も参照されたい。
カリチアマイシン
他の実施形態において、免疫共役体は、1個以上のカリチアマイシン分子と共役した、本明細書において提供される多特異性抗原結合タンパク質を含む。カリチアマイシンファミリーの抗生物質は、ピコモルを下回る濃度で二本鎖DNAの切断をもたらすことができる。カリチアマイシンファミリーの共役体の調製については、米国特許第5,712,374号、同第5,714,586号、同第5,739,116号、同第5,767,285号、同第5,770,701号、同第5,770,710号、同第5,773,001号、及び同第5,877,296号(全てAmerican Cyanamid Company)を参照されたい。使用され得るカリチアマイシンの構造類似体としては、γ1 I、α2 I、α3 I、N−アセチル−γ1 I、PSAG、及びθΙ 1が挙げられるが、これらに限定されない(Hinman et al.Cancer Research 53:3336−3342(1993)、Lode et al.Cancer Research 58:2925−2928(1998)、及び前述のAmerican Cyanamidの米国特許)。多特異性抗原結合タンパク質を共役させることのできる別の抗腫瘍薬は、葉酸代謝拮抗薬であるQFAである。カリチアマイシンとQFAとの両方が細胞内作用部位を有し、細胞膜を容易に横断しない。したがって、抗体媒介性内部移行によるこれらの薬剤の細胞取り込みは、それらの細胞傷害作用を大幅に向上させる。
他の細胞傷害剤
本明細書において提供される多特異性抗原結合タンパク質と共役することのできる他の抗腫瘍薬としては、BCNU、ストレプトゾイシン(streptozoicin)、ビンクリスチン及び5−フルオロウラシル、米国特許第5,053,394号及び同第5,770,710号に記載のLL−E33288複合体として集合的に知られる薬剤のファミリー、ならびにエスペラミシン(米国特許第5,877,296号)が挙げられる。
使用することのできる酵素活性毒素及びその断片としては、ジフテリアA鎖、ジフテリア毒素の非結合活性断片、外毒素A鎖(Pseudomonas aeruginosa由来)、リシンA鎖、アブリンA鎖、モデシンA鎖、アルファ−サルシン、Aleurites fordiiタンパク質、ジアンシンタンパク質、Phytolaca Americanaタンパク質(PAPI、PAPII、及びPAP−S)、momordica charantia阻害薬、クルシン、クロチン、sapaonaria officinalis阻害薬、ゲロニン、ミトゲリン、レストリクトシン、フェノマイシン、エノマイシン、及びトリコテセンが挙げられる(例えば、1993年10月28日公開のWO93/21232を参照されたい)。
本明細書に記載の多特異性抗原結合タンパク質と、核酸分解活性を有する化合物(例えば、リボヌクレアーゼ、またはデオキシリボヌクレアーゼ;DNアーゼなどのDNAエンドヌクレアーゼ)との間に形成された、免疫共役体も提供される。
腫瘍の選択的破壊のために、多特異性抗原結合タンパク質は、高放射性原子を含んでもよい。多様な放射性アイソトープが、放射性共役抗体の産生に利用可能である。例としては、At211、I131、I125、Y90、Re186、Re188、Sm153、Bi212、P32、Pb212、及びLuの放射性アイソトープが挙げられる。共役体が検出のために使用される場合、これは、シンチグラフィー研究用の放射性原子、例えばtc99mもしくはI123、または核磁気共鳴(NMR)画像法(磁気共鳴画像法、MRIとしても知られる)のためのスピン標識、例えば、繰り返しになるがヨウ素123、ヨウ素131、インジウム111、フッ素19、炭素13、窒素15、酸素17、ガドリニウム、マンガン、もしくは鉄などを含んでもよい。
放射標識または他の標識が、既知の方法で共役体に組み込まれてもよい。例えば、ペプチドは、生合成されてもよいし、例えば、水素の代わりにフッ素19を用いる、好適なアミノ酸前駆体を使用した化学的なアミノ酸合成によって合成されてもよい。tc99mまたはI123、Re186、Re188、及びIn111などの標識は、ペプチド内のシステイン残基を介して結合することができる。イットリウム−90は、リジン残基を介して結合することができる。IODOGEN法(Fraker et al.Biochem.Biophys.Res.Commun.80:49−57(1978))を使用して、ヨウ素123を組み込むことができる。「Monoclonal Antibodies in Immunoscintigraphy」(Chatal,CRC Press 1989)は、他の方法を詳細に記載している。
多特異性抗原結合タンパク質と細胞傷害剤との共役体は、N−サクシニミジル−3−(2−ピリジルジチオ)プロピオネート(SPDP)、サクシニミジル−4−(N−マレイミドメチル)シクロヘキサン−1−カルボキシレート(SMCC)、イミノチオラン(IT)、イミドエステルの二官能性誘導体(例えばアジプイミド酸ジメチルHCIなど)、活性エステル(例えばスベリン酸ジサクシニミジルなど)、アルデヒド(例えばグルタルアルデヒドなど)、ビス−アジド化合物(例えばビス(p−アジドベンゾイル)ヘキサンジアミンなど)、ビス−ジアゾニウム誘導体(例えばビス−(p−ジアゾニウムベンゾイル)エチレンジアミンなど)、ジイソシアネート(例えばトルエン2,6−ジイソシアネートなど)、及びビス−活性フッ素化合物(例えば1,5−ジフルオロ−2,4−ジニトロベンゼンなど)といった、多様な二官能性タンパク質カップリング剤を使用して作製され得る。例えば、リシン免疫毒素は、Vitetta et al.Science 238:1098(1987)に記載のように調製することができる。炭素14で標識された1−イソチオシアナトベンジル−3−メチルジエチレントリアミン五酢酸(MX−DTPA)は、放射性核種を多特異性抗原結合タンパク質と共役させるための例示的なキレート剤である。例えば、WO 94/11026を参照されたい。リンカーは、細胞内で細胞傷害薬の放出を促進する「切断可能リンカー」であってもよい。例えば、酸不安定リンカー、ペプチダーゼ感受性リンカー、感光性リンカー、ジメチルリンカー、またはジスルフィド含有リンカー(Chari et al.Cancer Research 52:127−131(1992)、米国特許第5,208,020号)が使用され得る。
そのような化合物としては、限定されないが、架橋試薬:BMPS、EMCS、GMBS、HBVS、LC−SMCC、MBS、MPBH、SBAP、SIA、SIAB、SMCC、SMPB、SMPH、スルホ−EMCS、スルホ−GMBS、スルホ−KMUS、スルホ−MBS、スルホ−SIAB、スルホ−SMCC、及びスルホ−SMPB、ならびにSVSB(サクシニミジル−(4−ビニルスルホン)ベンゾエート)を用いて調製されたADCが挙げられ、これらは、(例えば、Pierce Biotechnology,Inc.,Rockford,IL.,U.S.Aから)市販されている。2003−2004 Applications Handbook and Catalogの467〜498頁を参照されたい。
共役多特異性抗原結合タンパク質の調製
特定の実施形態において、本明細書において提供される多特異性抗原結合タンパク質は、多特異性抗原結合タンパク質1個当たり1個以上の部分(例えば薬物部分)、例えば、約1個〜約20個の部分と、任意にリンカーを介して共役する。共役抗体は、(1)多特異性抗原結合タンパク質の求核基を共有結合によって二価リンカー試薬と反応させ、続いて目的の部分と反応させること、及び(2)ある部分の求核基を共有結合によって二価リンカー試薬と反応させ、続いて多特異性抗原結合タンパク質の求核基と反応させることを含む、当業者に知られる有機化学反応、条件、及び試薬を用いた、いくつかの経路によって調製され得る。共役抗体を調製するための追加の方法が、本明細書に記載される。
リンカー試薬は、1つ以上のリンカー成分から構成されてもよい。例示的なリンカー成分としては、6−マレイミドカプロイル(「MC」)、マレイミドプロパノイル(「MP」)、p−アミノベンジルオキシカルボニル(「PAB」)、N−サクシニミジル4−(2−ピリジルチオ)ペンタノエート(「SPP」)、N−サクシニミジル4−(N−マレイミドメチル)シクロヘキサン−1−カルボキシレート(「SMCC」)、及びN−サクシニミジル(4−ヨード−アセチル)アミノベンゾエート(「SIAB」)が挙げられる。追加のリンカー成分が当該技術分野で知られており、いくつかが本明細書に記載される。内容が参照によりその全体において本明細書に援用される、米国出願公開第2005/0238649号の「Monomethylvaline Compounds Capable of Conjugation to Ligands」も参照されたい。
いくつかの実施形態では、リンカーは、アミノ酸残基を含み得る。例示的なアミノ酸リンカー成分としては、ジペプチド、トリペプチド、テトラペプチド、またはペンタペプチドが挙げられる。例示的なジペプチドとしては、バリン−シトルリン(vcまたはval−cit)、アラニン−フェニルアラニン(afまたはala−phe)が挙げられる。例示的なトリペプチドとしては、グリシン−バリン−シトルリン(gly−val−cit)及びグリシン−グリシン−グリシン(gly−gly−gly)が挙げられる。アミノ酸リンカー成分を含むアミノ酸残基には、自然発生するもの、ならびに微量アミノ酸及び自然に発生しないアミノ酸類似体、例えばシトルリンなどが含まれる。アミノ酸リンカー成分は、特定の酵素、例えば腫瘍関連プロテアーゼ、カテプシンB、C、及びD、またはプラスミンプロテアーゼによる酵素的切断に対するそれらの選択性について設計し、最適化することができる。
抗体上の求核基としては、(i)N末端アミン基、(ii)側鎖アミン基、例えばリジン、(iii)側鎖チオール基、例えばシステイン、及び(iv)多特異性抗原結合タンパク質がグリコシル化される糖ヒドロキシル基またはアミノ基が挙げられるが、これらに限定されない。アミン、チオール、及びヒドロキシル基は、求核性であり、(i)NHSエステル、HOBtエステル、ハロホルメート、及び酸ハロゲン化物などの活性エステル、(ii)ハロアセトアミドなどのハロゲン化アルキル及びハロゲン化ベンジル、(iii)アルデヒド、ケトン、カルボキシル、及びマレイミド基を含むリンカー部分及びリンカー試薬の求電子基と反応して、共有結合を形成することができる。特定の抗体は、還元可能な鎖間ジスルフィド、すなわち、システイン架橋を有する。抗体は、OTT(ジチオスレイトール)などの還元剤での処理によって、リンカー試薬との共役に対して反応性にすることができる。したがって各システイン架橋は、理論上、2つの反応性チオール求核剤を形成することになる。リジンと2−イミノチオラン(トラウト(Traut’s)試薬)との反応によって追加の求核基を抗体に導入し、アミンをチオールに変換させることができる。1個、2個、3個、4個、またはそれより多くのシステイン残基を導入すること(例えば、1個以上の非天然システインアミノ酸残基を含む変異体抗体を調製すること)によって、反応性チオール基を多特異性抗原結合タンパク質(またはその断片)に導入してもよい。
共役多特異性抗原結合タンパク質は、多特異性抗原結合タンパク質を修飾して、リンカー試薬もしくは薬物または他の部分の求核性置換基と反応することのできる求電子性部分を導入することによって、産生されてもよい。グリコシル化抗体の糖を、例えば、過ヨウ素酸酸化試薬で酸化させて、リンカー試薬もしくは薬物または他の部分のアミン基と反応し得るアルデヒドまたはケトン基を形成してもよい。結果として得られるイミンシッフ塩基群は、安定な結合を形成してもよいし、例えば、水素化ホウ素試薬によって還元されて、安定なアミン結合を形成してもよい。一実施形態において、グリコシル化された多特異性抗原結合タンパク質の炭水化物部分を、ガラクトースオキシダーゼ(glactose oxidase)またはメタ過ヨウ素酸ナトリウムのいずれかと反応させると、タンパク質中で、薬物または他の部分の適切な基と反応することのできるカルボニル(アルデヒド及びケトン)基がもたらされ得る(Hermanson,Bioconjugate Techniques)。別の実施形態では、N末端セリンまたはスレオニン残基を含有するタンパク質がメタ過ヨウ素酸ナトリウムと反応して、第1のアミノ酸の代わりにアルデヒドの産生がもたらされてもよい(Geoghegan and Stroh,Bioconjugate Chem.3:138−146(1992)、米国特許第5,362,852号)。かかるアルデヒドは、薬物部分またはリンカー求核剤と反応させることができる。
同様に、(薬物部分などの)部分の求核基としては、(i)NHSエステル、HOBtエステル、ハロホルメート、及び酸ハロゲン化物などの活性エステル、(ii)ハロアセトアミドなどのハロゲン化アルキル及びハロゲン化ベンジル、ならびに(iii)アルデヒド、ケトン、カルボキシル、及びマレイミド基を含むリンカー部分及びリンカー試薬の求電子基と反応して共有結合を形成することのできる、アミン、チオール、ヒドロキシル、ヒドラジド、オキシム、ヒドラジン、チオセミカルバゾン、ヒドラジンカルボキシレート、及びアリールヒドラジド基が挙げられるが、これらに限定されない。
あるいは、多特異性抗原結合タンパク質及び細胞傷害剤を含む融合タンパク質は、例えば、組換え技術またはペプチド合成によって作製されてもよい。DNAの長さは、互いに隣接しているか、あるいは共役体の所望の特性を破壊しないリンカーペプチドをコードする領域により隔てられている、共役体の2つの部分をコードするそれぞれの領域を含み得る。さらに別の実施形態では、多特異性抗原結合タンパク質は、腫瘍の事前標的化(pre−targeting)において利用するために、「受容体」(例えばストレプトアビジンなど)と共役してもよく、ここでは、多特異性抗原結合タンパク質−受容体共役体が個体に投与され、続いて、清澄剤を使用して、未結合の共役体が循環から除去され、次に、細胞傷害剤(例えば、ラジオヌクレオチド)と共役している「リガンド」(例えば、アビジン)が投与される。
有用性
本明細書において提供される本方法には、多特異性抗原結合タンパク質の産生における産業上の利用可能性がある。本明細書に記載の多特異性抗原結合タンパク質は、例えば、インビトロ、エクスビボ、及びインビボでの治療法において役立つ。本明細書では、これらの分子のうちの1個以上を使用することに基づく様々な方法が提供される。特定の病理学的条件において、多特異性抗原結合タンパク質(例えば二重特異性抗体など)を利用することが必要である及び/または望ましい。本明細書では、多様な目的のために、例えば治療薬、予防薬、及び診断薬として使用され得る、多特異性抗原結合タンパク質が提供される。例えば、疾患の治療方法が提供され、該方法は、治療を必要とする対象に、本明細書において提供される多特異性抗原結合タンパク質を投与することを含み、それにより、疾患が治療される。本明細書に記載の多特異性抗原結合タンパク質のうちのいずれも、本明細書に記載の治療法(または予防法もしくは診断法)に使用することができる。
例えば、本明細書において提供される多特異性抗原結合タンパク質の価値ある利益の1つは、それらがその抗原に対して提示する親和力の向上である。抗原基盤に対する結合ユニット(すなわち、Fab)に固有の高い親和性を有することに加えて、正常なIgG抗体はまた、親和作用を活用して、標的に対するそれらの二価結合の結果としての抗原とのそれらの会合を増加させる。
特定の実施形態において、本明細書において提供される多特異性抗原結合タンパク質は、2個以上の抗原分子上のエピトープに結合する。特定の実施形態において、多特異性抗原結合タンパク質は、同じ抗原分子上の2つ以上のエピトープに結合する。同じ抗原分子上の2つの別個のエピトープに対する多特異性抗原結合タンパク質は、(二価結合による)結合親和力の向上の利益を提供し得るだけでなく、親抗体のいずれにも関連していない新規の特性を獲得する場合もある。特定の実施形態において、本明細書において提供される多特異性抗原結合タンパク質は、例えば、受容体−リガンド相互作用の遮断に役立つ。
本明細書に記載の多特異性抗原結合タンパク質は、1個の分子で2つの標的のシグナル伝達経路を同時に遮断する用途においても役立つ。
治療的使用
多特異性抗原結合タンパク質(例えば本明細書に記載の抗体及び抗体断片など)は、治療用途に使用され得る。特定の実施形態において、本明細書に記載の多特異性抗原結合タンパク質を有効量で対象に投与することを含む、対象における疾患の治療方法が提供される。特定の実施形態において、疾患を治療するための薬物の製造における、本明細書において提供される多特異性抗原結合タンパク質の使用が提供される。特定の実施形態において、対象における疾患の治療に使用するための多特異性抗原結合タンパク質が提供される。
例えば、かかる多特異性抗原結合タンパク質は、前がん性、非転移性、転移性、及びがん性の腫瘍を含む腫瘍(例えば、早期がん)の治療、アレルギー性障害もしくは炎症性障害の治療、または自己免疫疾患の治療、またはがん(例えば、乳がん、結腸直腸がん、肺がん、腎細胞癌、神経膠腫、もしくは卵巣がん)、アレルギー性障害もしくは炎症性障害、または自己免疫疾患を発症するリスクがある対象の治療のために使用することができる。
がんという用語は、前がん性成長、良性腫瘍、及び悪性腫瘍を含むがこれらに限定されない、増殖性障害の集合を包含する。良性は、遠隔部位に浸潤または転移する。悪性腫瘍は、それらの周りの他の組織に浸潤し損傷する。悪性腫瘍はまた、それらが始まった場所から離脱し、通常は血流を通して、またはリンパ節が位置するリンパ系を通して、身体の他の部分に伝播(転移)する能力を得る場合がある。原発腫瘍は、それらが生じる組織の型によって分類され、転移性腫瘍は、がん細胞が由来する組織型によって分類される。経時的に、悪性腫瘍の細胞はより異常になり、正常細胞のようには見えなくなる。がん細胞の外観のこの変化は腫瘍悪性度と呼ばれ、がん細胞は、高分化型、中分化型、低分化型、または未分化型と説明される。高分化細胞はかなり正常な外観であり、それらが起源とする正常細胞に似ている。未分化細胞は、細胞の起源を判定するのがもはや不可能であるほど異常になった細胞である。
腫瘍は、固形腫瘍である場合も、非固形腫瘍もしくは軟組織腫瘍である場合もある。軟組織腫瘍の例としては、白血病(例えば、慢性骨髄性白血病、急性骨髄性白血病、成人急性リンパ性白血病、急性骨髄性白血病、成熟B細胞急性リンパ性白血病、慢性リンパ性白血病、前リンパ球性白血病、または有毛細胞性白血病)、またはリンパ腫(例えば、非ホジキンリンパ腫、皮膚T細胞リンパ腫、またはホジキン病)が挙げられる。固形腫瘍には、血液、骨髄、またはリンパ系以外の体組織のあらゆるがんが含まれる。固形腫瘍は、上皮細胞起源のものと非上皮細胞起源のものとにさらに分別することができる。上皮細胞固形腫瘍の例としては、消化管、結腸、乳房、前立腺、肺、腎臓、肝臓、膵臓、卵巣、頭頸部、口腔、胃、十二指腸、小腸、大腸、肛門、胆嚢、口唇、上咽頭、皮膚、子宮、男性生殖器、泌尿器、膀胱、及び皮膚の腫瘍が挙げられる。非上皮起源の固形腫瘍としては、肉腫、脳腫瘍、及び骨腫瘍が挙げられる。
上皮がんは一般に、良性腫瘍から前浸潤期(例えば、上皮内癌)に、そして基底膜を透過し上皮下間質に浸潤した悪性がんに発達する。多特異性抗原結合タンパク質複合体は、こうした治療用途にも使用することができ、HER2に結合する抗体は、特に、乳がん、結腸直腸がん、肺がん、腎細胞癌、神経膠腫、または卵巣がんの治療に使用することができる。
本明細書において提供される組成物を受ける候補である他の対象は、線維性血管性組織の異常増殖、酒さ性ざ瘡、後天性免疫不全症候群、動脈閉塞、アトピー性角膜炎、細菌性潰瘍、ベーチェット病、血液由来腫瘍、頸動脈閉塞性疾患、脈絡膜新血管新生、慢性炎症、慢性網膜剥離、慢性ぶどう膜炎、慢性硝子体炎、コンタクトレンズ過度装用、角膜移植後拒絶反応、角膜新血管新生、角膜移植新血管新生、クローン病、イールズ病、流行性角結膜炎、真菌性潰瘍、単純疱疹感染症、帯状疱疹感染症、過粘稠度症候群、カポジ肉腫、白血病、脂質変性、ライム病、辺縁角質溶解、モーレン潰瘍、ハンセン病以外のマイコバクテリア感染症、近視、眼性新生血管疾患、視窩、オスラー・ウェーバー症候群(オスラー・ウェーバー・ランデュ)、骨関節炎、パジェット病、毛様体扁平部炎、類天疱瘡、フリクテン症(phylectenulosis)、多発動脈炎、レーザー後合併症、原虫感染症、弾性線維性仮性黄色腫、翼状片乾燥角膜炎、放射状角膜切開、網膜新血管新生、未熟児網膜症、後水晶体線維増殖症、サルコイド、強膜炎、鎌状赤血球貧血、Sogren症候群、固形腫瘍、シュタルガルト病、スティーブンス・ジョンソン症候群、上輪部角膜炎、梅毒、全身性狼瘡、テリエン辺縁変性、トキソプラズマ症、ユーイング肉腫の腫瘍、神経芽細胞腫の腫瘍、骨肉腫の腫瘍、網膜芽細胞腫の腫瘍、横紋筋肉腫の腫瘍、潰瘍性大腸炎、静脈閉塞、ビタミンA欠乏症、ウェゲナーサルコイドーシス、糖尿病に関連する望ましくない血管形成、寄生虫症、創傷治癒異常、手術後の肥大、傷害または外傷(例えば、急性肺傷害/ARDS)、発毛阻害、排卵及び黄体形成の阻害、着床の阻害、ならびに子宮内の胚発生の阻害を有するか、またはそれらを発症するリスクがある。
本明細書に記載の方法に従って作製される多特異性抗原結合タンパク質を使用して治療され得るアレルギー性もしくは炎症性障害または自己免疫疾患もしくは障害の例としては、関節炎(急性関節炎、慢性リウマチ性関節炎、痛風関節炎、急性痛風関節炎、慢性炎症性関節炎、変形性関節炎、感染性関節炎、ライム関節炎、増殖性関節炎、乾癬性関節炎、椎骨関節炎、及び若年発症型リウマチ性関節炎、骨関節炎、進行性慢性関節炎(arthritis chronica progrediente)、変形関節炎(arthritis deformans)、原発性慢性多発性関節炎(polyarthritis chronica primaria)、反応性関節炎、ならびに強直性脊椎炎などのリウマチ性関節炎)、炎症性過剰増殖性皮膚病、尋常性乾癬、滴状乾癬、膿疱性乾癬、及び爪の乾癬などの乾癬、接触性皮膚炎、慢性接触性皮膚炎、アレルギー性皮膚炎、アレルギー性接触性皮膚炎、疱疹状皮膚炎、及びアトピー性皮膚炎を含む皮膚炎、x連鎖性高IgM症候群、慢性アレルギー性蕁麻疹及び慢性自己免疫性蕁麻疹を含む慢性特発性蕁麻疹などの蕁麻疹、多発性筋炎/皮膚筋炎、若年性皮膚筋炎、中毒性表皮壊死症、強皮症(全身性強皮症を含む)、硬化症、例えば全身性硬化症、視神経脊髄型(spina−optical)MS、原発性進行性MS(PPMS)、及び再発寛解型MS(RRMS)などの多発性硬化症(MS)、進行性全身性硬化症、粥状動脈硬化、動脈硬化症、播種性硬化症(sclerosis disseminata)、及び失調性硬化症、炎症性腸疾患(IBD)(例えば、クローン病、自己免疫媒介性胃腸疾患、潰瘍性大腸炎(ulcerative colitis)、潰瘍性大腸炎(colitis ulcerosa)、顕微鏡的大腸炎、コラーゲン大腸炎、ポリープ性大腸炎(colitis polyposa)、壊死性腸炎、及び貫壁性大腸炎などの大腸炎、ならびに自己免疫性炎症性腸疾患)、壊疽性膿皮症、結節性紅斑、原発性硬化性胆管炎、上強膜炎、成人性または急性の呼吸促迫症候群(ARDS)を含む呼吸促迫症候群、髄膜炎、ぶどう膜の全てまたは一部の炎症、虹彩炎、脈絡膜炎、自己免疫性血液疾患、リウマチ性脊椎炎、突発性難聴、アナフィラキシーならびにアレルギー性及びアトピー性の鼻炎などのIgE媒介性疾患、ラスムッセン脳炎ならびに辺縁系脳炎及び/または脳幹脳炎などの脳炎、前部ぶどう膜炎、急性前部ぶどう膜炎、肉芽腫性ぶどう膜炎、非肉芽腫性ぶどう膜炎、水晶体抗原性ぶどう膜炎(phacoantigenic uveitis)、後部ぶどう膜炎、または自己免疫性ぶどう膜炎などのぶどう膜炎、ネフローゼ症候群ありなし両方の糸球体腎炎(GN)、例えば慢性もしくは急性の糸球体腎炎、例えば原発性GN、免疫媒介性GN、膜性GN(膜性腎症)、特発性膜性GNまたは特発性膜性腎症、I型及びII型を含む膜増殖性または膜性増殖性GN(MPGN)、ならびに急速進行性GN、アレルギー状態、アレルギー反応、アレルギー性またはアトピー性の湿疹を含む湿疹、気管支喘息(asthma bronchiale)、気管支喘息(bronchial asthma)、及び自己免疫喘息などの喘息、T細胞の浸潤及び慢性炎症性応答を伴う状態、慢性肺炎症性疾患、自己免疫性心筋炎、白血球粘着不全症、全身性エリテマトーデス(SLE)または全身性紅斑性狼瘡、例えば皮膚SLE、亜急性皮膚エリテマトーデス、新生児ループス症候群(NLE)、播種性紅斑性狼瘡、狼瘡(腎炎、脳炎、小児性、非腎性、腎外、円板状、脱毛症を含む)、小児インスリン依存性真性糖尿病(IDDM)を含む若年発症型(I型)真性糖尿病、成人発症真性糖尿病(II型糖尿病)、自己免疫性糖尿病、特発性尿崩症、サイトカイン及びTリンパ球により媒介される急性及び遅延型の過敏症に関連する免疫応答、結核、サルコイドーシス、リンパ腫様肉芽腫症、ウェゲナー肉芽腫症を含む肉芽腫症、無顆粒球症、血管炎(大型血管炎(リウマチ性多発筋痛症及び巨細胞性(高安)動脈炎を含む)、中型血管炎(川崎病及び結節性多発動脈炎を含む)、顕微鏡的多発動脈炎、CNS血管炎、壊死性、皮膚性、もしくは過敏性の血管炎、全身性壊死性血管炎、及びチャーグ・ストラウス血管炎もしくは症候群(CSS)などのANCA関連血管炎を含む)を含む脈管炎、側頭動脈炎、再生不良性貧血、自己免疫性再生不良性貧血、クームス陽性貧血、ダイアモンド・ブラックファン貧血、自己免疫性溶血性貧血(AIHA)を含む溶血性貧血または免疫性溶血性貧血、悪性貧血(anemia perniciosa)、アジソン病、真正赤血球性貧血もしくは形成不全(PRCA)、第VIII因子欠乏症、血友病A、自己免疫性好中球減少症、汎血球減少症、白血球減少症、白血球漏出を伴う疾患、CNS炎症性障害、敗血症、外傷、もしくは出血に続発するものなどの多臓器障害症候群、抗原抗体複合体媒介性疾患、抗糸球体基底膜疾患、抗リン脂質抗体症候群、アレルギー性神経炎、ベーチェット(BechetまたはBehcet)病、キャッスルマン症候群、グッドパスチャー症候群、レイノー(Reynaud)症候群、シェーグレン症候群、スティーブンス・ジョンソン症候群、水疱性類天疱瘡及び皮膚類天疱瘡などの類天疱瘡、天疱瘡(尋常性天疱瘡、落葉状天疱瘡、天疱瘡粘膜類天疱瘡(pemphigus mucus−membrane pemphigoid)、及び紅斑性天疱瘡を含む)、自己免疫性多腺性内分泌不全症、ライター病または症候群、免疫複合体性腎炎、抗体媒介性腎炎、視神経脊髄炎、多発ニューロパチー、慢性ニューロパチー、例えばIgM多発ニューロパチーまたはIgM媒介性ニューロパチーなど、血栓性血小板減少性紫斑病(TTP)及び自己免疫性または免疫媒介性の血小板減少症を含む血小板減少症(例えば心筋梗塞患者が発症するもの)、例えば特発性血小板減少性紫斑病(ITP)(慢性または急性のITPを含む)、自己免疫性精巣炎及び卵巣炎を含む精巣及び卵巣の自己免疫疾患、原発性甲状腺機能低下症、副甲状腺機能低下症、自己免疫性甲状腺炎、橋本病、慢性甲状腺炎(橋本甲状腺炎)、または亜急性甲状腺炎などの甲状腺炎、自己免疫性甲状腺疾患、特発性甲状腺機能低下症、グレーブス病、自己免疫性多腺性症候群(または多腺性内分泌異常症候群)などの多腺性症候群を含む、自己免疫性内分泌疾患、神経学的腫瘍随伴症候群を含む腫瘍随伴症候群、例えばランバート・イートン筋無力症候群またはイートン・ランバート症候群、全身強直症候群または全身硬直症候群、アレルギー性脳脊髄炎(allergic encephalomyelitis)またはアレルギー性脳脊髄炎(encephalomyelitis allergica)及び実験的アレルギー性脳脊髄炎(EAE)などの脳脊髄炎、重症筋無力症、例えば胸腺腫関連重症筋無力症、小脳変性症、神経性筋強直症、眼球クローヌス症候群または眼球クローヌス・ミオクローヌス症候群(OMS)、及び感覚性ニューロパチー、多巣性運動ニューロパチー、シーハン症候群、自己免疫性肝炎、慢性肝炎、ルポイド肝炎、巨細胞性肝炎、慢性活動性肝炎または自己免疫性慢性活動性肝炎、リンパ球様間質性肺炎、NSIPに対する閉塞性細気管支炎(非移植)、ギラン・バレー症候群、ベルジェ病(IgA腎症)、特発性IgA腎症、線状IgA皮膚症、原発性胆汁性肝硬変、肺線維症、自己免疫性腸疾患症候群、セリアック病、小児脂肪便症、セリアックスプルー(グルテン腸症)、難治性スプルー、特発性スプルー、クリオグロブリン血症、筋萎縮性側索硬化症(ALS;ルー・ゲーリック病)、冠動脈疾患、自己免疫性内耳疾患(AIED)、自己免疫性難聴などの自己免疫性耳疾患、眼球クローヌス・ミオクローヌス症候群(OMS)、難治性または再発性の多発性軟骨炎などの多発性軟骨炎、肺胞蛋白症、アミロイドーシス、強膜炎、非がん性リンパ球増加症、モノクローナルB細胞リンパ球増加症(例えば、良性モノクローナル免疫グロブリン血症及び意義不明のモノクローナル免疫グロブリン血症、MGUS)を含む原発性リンパ球増加症、末梢性ニューロパチー、腫瘍随伴症候群、てんかん、片頭痛、不整脈、筋障害、聴覚消失、盲目、周期性麻痺、及びCNSのチャネル病などのチャネル病、自閉症、炎症性筋症、巣状分節性糸球体硬化症(FSGS)、内分泌性眼疾患、網膜ぶどう膜炎、脈絡網膜炎、自己免疫性肝臓病学的障害、線維筋痛症、多発性内分泌不全、シュミット症候群、副腎炎、胃の萎縮、初老期認知症、自己免疫性脱髄性疾患などの脱髄性疾患、糖尿病性腎症、Dressier症候群、円形脱毛症、CREST症候群(石灰沈着、レイノー現象、食道蠕動低下、強指症、及び毛細血管拡張症)、男性及び女性の自己免疫性不妊症、混合性結合組織病、シャーガス病、リウマチ熱、反復流産、農夫肺、多形性紅斑、開心術後症候群、クッシング症候群、愛鳥家肺、アレルギー性肉芽腫性血管炎、良性リンパ球性血管炎、アルポート症候群、アレルギー性肺胞炎及び線維性肺胞炎などの肺胞炎、間質性肺疾患、輸血反応、ハンセン病、マラリア、リーシュマニア症、キパノソミアシス(kypanosomiasis)、住血吸虫症、回虫症、アスペルギルス症、Sampter症候群、カプラン症候群、デング熱、心内膜炎、心内膜心筋線維症、びまん性間質性肺線維症、間質性肺線維症、特発性肺線維症、嚢胞性線維症、眼内炎、持久性隆起性紅斑(erythema elevatum et diutinum)、胎児赤芽球症、好酸球性筋膜炎、Shulman症候群、フェルティ症候群、フィラリア症、慢性毛様体炎、異時性毛様体炎、虹彩毛様体炎、またはフックス毛様体炎などの毛様体炎、ヘノッホ・シェーンライン紫斑病、ヒト免疫不全ウイルス(HIV)感染症、エコーウイルス感染症、心筋症、アルツハイマー病、パルボウイルス感染症、風疹ウイルス感染症、予防接種後症候群、先天性風疹感染症、エプスタイン・バーウイルス感染症、流行性耳下腺炎、エヴァンス症候群、
自己免疫性性腺機能不全、シデナム舞踏病、連鎖球菌感染後腎炎、閉塞性血栓血管炎(thromboangitis ubiterans)、甲状腺中毒症、脊髄癆、脈絡膜炎(chorioiditis)、巨細胞多発性筋痛、内分泌性眼疾患、慢性過敏性肺炎、乾性角結膜炎、流行性角結膜炎、特発性腎炎症候群、微小変化型腎症、良性家族性及び虚血再灌流傷害、網膜自己免疫、関節の炎症、気管支炎、慢性閉塞性気道疾患、珪肺症、アフタ、アフタ性口内炎、動脈硬化性障害、精子形成欠如、自己免疫性溶血、Boeck病、クリオグロブリン血症、デュピュイトラン拘縮、水晶体過敏性眼内炎、アレルギー性腸炎(enteritis allergica)、癩性結節性紅斑、特発性顔面麻痺、慢性疲労症候群、リウマチ性熱(febris rheumatica)、Hamman−Rich病、感覚神経性難聴、発作性ヘモグロビン尿症(hemoglobinuria paroxistica)、性腺機能低下症、限局性回腸炎(ileitis regionalis)、白血球減少、伝染性単核症(mononucleosis infectiosa)、横断性脊髄炎(traverse myelitis)、原発性特発性粘液水腫、ネフローゼ、交感性眼炎(ophthalmia simpatica)、肉芽腫性精巣炎、膵炎、急性多発神経根炎、壊疽性膿皮症、Quervain甲状腺炎、後天性膵臓萎縮(acquired spenic atrophy)、抗精子抗体(antispermatozoan antobodies)に起因する不妊症、非悪性胸腺腫、白斑、SCID及びエプスタイン・バーウイルスに関連する疾患、後天性免疫不全症候群(AIDS)、Leishmaniaなどの寄生虫症、毒素性ショック症候群、食中毒、T細胞の浸潤を伴う状態、白血球粘着不全症、サイトカイン及びTリンパ球により媒介される急性及び遅延型の過敏症に関連する免疫応答、白血球漏出を伴う疾患、多臓器障害症候群、抗原抗体複合体媒介性疾患、抗糸球体基底膜疾患、アレルギー性神経炎、自己免疫性多腺性内分泌不全症、卵巣炎、原発性粘液水腫、自己免疫性萎縮性胃炎、交感性眼炎(sympathetic ophthalmia)、リウマチ性疾患、混合性結合組織病、ネフローゼ症候群、膵島炎、多内分泌不全、末梢性ニューロパチー、自己免疫性多腺性症候群I型、成人発症特発性副甲状腺機能低下症(AOIH)、全頭脱毛症、拡張型心筋症、後天性表皮水疱症(EBA)、血色素症、心筋炎、ネフローゼ症候群、原発性硬化性胆管炎、化膿性または非化膿性の副鼻腔炎、急性または慢性の副鼻腔炎、篩骨洞炎、前頭洞炎、上顎洞炎、または蝶形骨洞炎、好酸球増加症、肺浸潤好酸球増加症、好酸球増多筋痛症候群、Loffler症候群、慢性好酸球性肺炎、熱帯性肺好酸球増多症、気管支肺アスペルギルス症、アスペルギルス腫、または好酸球を含む肉芽腫などの好酸球関連障害、アナフィラキシー、血清陰性脊椎関節炎、多内分泌自己免疫疾患、硬化性胆管炎、強膜、上強膜、慢性皮膚粘膜カンジダ症、ブルトン症候群、乳児期の一過性低ガンマグロブリン血症、ウィスコット・アルドリッチ症候群、毛細血管拡張性運動失調症、コラーゲン病に関連する自己免疫障害、リウマチ、神経疾患、虚血再灌流障害、血圧応答の低減、血管機能不全、血管拡張、組織損傷、心血管虚血、痛覚過敏、脳虚血、及び血管新生に付随する疾患、アレルギー性過敏性障害、糸球体腎炎、再灌流傷害、心筋または他の組織の再灌流傷害、急性炎症性要素を伴う皮膚疾患、急性化膿性髄膜炎または他の中枢神経系炎症性障害、眼及び眼窩の炎症性障害、顆粒球輸血関連症候群、サイトカイン誘発性毒性、急性の重篤な炎症、慢性難治性炎症、腎盂炎、肺硬変、糖尿病性網膜症、糖尿病性大動脈障害、動脈内の過形成(endarterial hyperplasia)、消化性潰瘍、弁膜炎、ならびに子宮内膜症が挙げられるが、これらに限定されない。
治療的使用に加えて、本明細書において提供される多特異性抗原結合タンパク質は、本明細書に記載の疾患及び状態の診断法などの診断法を含む他の目的に使用されてもよい。
薬用量、製剤、及び持続期間
本明細書において提供されるタンパク質は、適正な医療行為と一致した様式で製剤化され、投薬され、投与される。この文脈における検討要素には、治療されている特定の障害、治療されている特定の哺乳動物、個々の対象の臨床状態、障害の原因、薬剤の送達部位、投与方法、投与の予定、及び医療施術者に知られる他の要素が含まれる。投与されるタンパク質の「治療有効量」は、このような検討事項によって左右され、特定の障害(例えば、がん、アレルギー性もしくは炎症性の障害、または自己免疫障害)の防止、寛解、または治療に必要な最小量である。タンパク質は、場合により、その障害を防止または治療するために現在使用されている1つ以上の薬剤と共に製剤化されるが、その必要はない。かかる他の薬剤の有効量は、製剤中に存在するタンパク質の量、障害または治療の種類、及び上記に詳解した他の要素に左右される。これらは概して、これまでに使用されたものと同じ薬用量及び投与経路で、またはこれまでに用いられた薬用量の約1〜99%で使用される。一般に、がんの緩和または治療は、がんに関連する1つ以上の症状または医学的問題の軽減を伴う。薬物の治療有効量は、以下のうちの1つまたはそれらの組み合わせを達成することができる:がん細胞の数の(少なくとも10%、20%、30%、40%、50%、60%、70%、80%、90%、100%、またはそれ以上の)低減;腫瘍サイズまたは腫瘍負荷の低減もしくは抑制;がん細胞が末梢器官に浸潤することの阻害(すなわち、ある程度の減少及び/または停止);腺腫の場合はホルモン分泌の低減;血管密度の低減;腫瘍転移の阻害;腫瘍成長の低減または阻害;及び/またはがんに関連する症状のうちの1つ以上のある程度の緩和。いくつかの実施形態では、タンパク質は、対象におけるがんまたは自己免疫障害の発症もしくは再発を防止するために使用される。
一実施形態において、本明細書において提供される組成物は、がんもしくは自己免疫障害になりやすいか、またはそうと診断されたヒト対象の生存期間を延長するために使用される。生存期間は、薬物の第1の投与から死亡までの時間と定義される。生存期間は、治療中の対象の死亡リスクを表す、処置群対対照群の層別化ハザード比(stratified hazard ratio)(HR)によって測定されてもよい。
特定の実施形態において、治療は、がんになりやすいか、またはがんと診断された、様々な抗がん療法で治療されているヒト対象の群における奏効率を、著しく上昇させる。奏効率は、治療された対象のうち治療に応答したものの割合と定義される。一態様において、併用療法には、本明細書において提供される多特異性抗原結合タンパク質と、手術、放射線療法、または1つ以上の化学療法剤との使用であり、治療対象群における奏効率を、手術、放射線療法、または化学療法単独で治療された群と比較して有意に上昇させ、この上昇が0.005未満のカイ二乗p値を有するものが含まれる。がん治療における治療有効性の追加の測定は、米国特許出願公開第20050186208号に記載されている。
薬学的組成物及び製剤
本明細書に開示される多特異性抗原結合タンパク質は、投与に好適となるように、好適な担体または賦形剤と共に製剤化され得る。本明細書に開示される多特異性抗原結合タンパク質の好適な製剤は、所望の純度を有する本明細書に開示される多特異性抗原結合タンパク質を、任意の薬学的に許容される担体、賦形剤、または安定剤と混合することによって、凍結乾燥製剤または水溶液の形態で得られる(Remington’s Pharmaceutical Sciences 16th edition,Osol,A.Ed.(1980))。許容される担体、賦形剤、または安定剤は、用いられる薬用量及び濃度において受容者にとって無毒であり、リン酸、クエン酸、及び他の有機酸などの緩衝液;アスコルビン酸及びメチオニンを含む抗酸化剤;防腐剤(例えば塩化オクタデシルジメチルベンジルアンモニウム;塩化ヘキサメトニウム;塩化ベンザルコニウム、塩化ベンゼトニウム;フェノール、ブチル、もしくはベンジルアルコール;メチルパラベンもしくはプロピルパラベンなどのアルキルパラベン;カテコール;レゾルシノール;シクロヘキサノール;3−ペンタノール;及びm−クレゾール);低分子量(約10残基未満)のポリペプチド;血清アルブミン、ゼラチン、もしくは免疫グロブリンなどのタンパク質;ポリビニルピロリドンなどの親水性ポリマー;グリシン、グルタミン、アスパラギン、ヒスチジン、アルギニン、もしくはリジンなどのアミノ酸;グルコース、マンノース、もしくはデキストリンを含む単糖、二糖、及び他の炭水化物;EDTAなどのキレート剤;スクロース、マンニトール、トレハロース、もしくはソルビトールなどの糖;ナトリウムなどの塩形成対イオン;金属錯体(例えばZn−タンパク質複合体);及び/またはTWEEN(商標)、PLURONICS(商標)、もしくはポリエチレングリコール(PEG)などの非イオン性界面活性剤を含む。本明細書において提供される多特異性抗原結合タンパク質に適用することのできる例示的な抗体製剤は、参照により本明細書に明示的に援用されるWO98/56418に記載されている。皮下投与のために適合された凍結乾燥製剤は、WO97/04801に記載されている。かかる凍結乾燥製剤は、好適な希釈剤で高いタンパク質含有率まで再構成されてもよく、再構成された製剤は、本明細書において処置される哺乳動物に皮下投与されてもよい。
本明細書における製剤は、治療されている特定の適応症のために必要な場合、1つより多くの活性化合物、好ましくは互いに有害作用を及ぼさない相補的な活性を有するものを含んでもよい。例えば、抗悪性腫瘍薬、成長阻害剤、細胞傷害剤、または化学療法剤をさらに提供することが望ましい場合がある。そのような分子は、意図される目的に有効な量で組み合わさって存在することが好適である。かかる他の薬剤の有効量は、製剤中に存在する多特異性抗原結合タンパク質の量、疾患もしくは障害または治療の種類、及び詳解した他の要素に左右される。これらは概して、本明細書に記載のものと同じ薬用量及び投与経路で、またはこれまでに用いられた薬用量の約1〜99%で使用される。活性成分はまた、例えばコアセルベーション技術もしくは界面重合によって調製されたマイクロカプセル内、例えば、それぞれ、ヒドロキシメチルセルロースもしくはゼラチンのマイクロカプセル及びポリ−(メチルメタクリレート)マイクロカプセル内、コロイド薬物送達系(例えば、リポソーム、アルブミンマイクロスフェア、マイクロ乳濁液、ナノ粒子、及びナノカプセル)内、またはマクロ乳濁液中に、封入されてもよい。かかる技術は、Remington’s Pharmaceutical Sciences 16th edition,Osol,A.Ed.(1980)に開示されている。徐放性調製物を調製してもよい。徐放性調製物の好適な例としては、拮抗薬を含有する固体の疎水性ポリマーの半透性マトリクスが挙げられ、このマトリクスは、成形品、例えばフィルムまたはマイクロカプセルの形態にある。徐放性マトリクスの例としては、ポリエステル、ヒドロゲル(例えば、ポリ(2−ヒドロキシエチル−メタクリレート)、またはポリ(ビニルアルコール))、ポリラクチド(米国特許第3,773,919号)、L−グルタミン酸とエチル−L−グルタメートとのコポリマー、非分解性エチレン−ビニル、分解性乳酸−グリコール酸コポリマー、例えばLUPRON DEPOT(商標)(乳酸−グリコール酸コポリマー及びリュープロリド酢酸塩から構成された注射用マイクロスフェア)、及びポリ−D−(−)−3−ヒドロキシ酪酸が挙げられる。
リポフェクチンまたはリポソームは、本明細書に開示される多特異性抗原結合タンパク質または本明細書において提供される組成物を細胞内に送達するために使用することができる。
任意だが好ましくは、本製剤は、薬学的に許容される塩、好ましくは塩化ナトリウムを、好ましくはおよそ生理的な濃度で含有する。任意に、本製剤は、薬学的に許容される防腐剤を含有してもよい。いくつかの実施形態では、防腐剤の濃度は、典型的には体積/体積(v/v)で0.1〜2.0%の範囲である。好適な防腐剤としては、薬学の技術分野で知られるものが挙げられる。ベンジルアルコール、フェノール、m−クレゾール、メチルパラベン、及びプロピルパラベンが、好ましい防腐剤である。任意に、本製剤は、薬学的に許容される界面活性剤を0.005〜0.02%の濃度で含んでもよい。
徐放性調製物を調製してもよい。徐放性調製物の好適な例としては、多特異性抗原結合タンパク質を含有する固体の疎水性ポリマーの半透性マトリクスが挙げられ、このマトリクスは、成形品、例えばフィルムまたはマイクロカプセルの形態にある。徐放性マトリクスの例としては、ポリエステル、ヒドロゲル(例えば、ポリ(2−ヒドロキシエチルメタクリレート)、またはポリ(ビニルアルコール))、ポリラクチド(米国特許第3,773,919号)、L−グルタミン酸とエチル−L−グルタメートとのコポリマー、非分解性エチレン酢酸ビニル、分解性乳酸−グリコール酸コポリマー、例えばLUPRON DEPOT(商標)(乳酸−グリコール酸コポリマー及びリュープロリド酢酸塩から構成された注射用マイクロスフェア)、及びポリ−D−(−)−3−ヒドロキシ酪酸が挙げられる。エチレン酢酸ビニル及び乳酸−グリコール酸などのポリマーが100日間にわたる分子の放出を可能にする一方で、特定のヒドロゲルは、より短い期間にわたってタンパク質を放出する。カプセル化された多特異性抗原結合タンパク質(複数可)は、長期間にわたって体内に残存する場合、37℃における水分への曝露の結果として変性または凝集し、生物活性の損失、及び免疫原性の変化の可能性をもたらし得る。関与する機序に応じて、安定化のための合理的な方略を考案することができる。例えば、凝集機序がチオ−ジスルフィド相互交換による分子間S−S結合形成であると見出されたならば、安定化は、スルフヒドリル残基を修飾し、酸性溶液から凍結乾燥し、水分含有量を制御し、適切な添加剤を使用し、特定のポリマーマトリクス組成物を開発することにより実現されてもよい。
本明細書に記載のタンパク質(例えば、本明細書において提供される多特異性抗原結合タンパク質(例えば二重特異性抗体など))は、ボーラスとしての静脈内投与などの既知の方法に従って、または筋肉内、腹腔内、脳脊髄内、皮下、関節内、滑液嚢内、くも膜下腔内、経口、局所、もしくは吸入経路による一定期間にわたる持続注入によって、ヒト対象に投与される。タンパク質により認識される標的分子に対する拮抗作用に甚大な副作用または毒性が関連付けられる場合、局所投与が特に所望される場合がある。エクスビボの方略を治療用途に使用することもできる。エクスビボ方略は、対象から得られた細胞に、本明細書において提供されるタンパク質をコードするポリヌクレオチドをトランスフェクトまたは形質導入することを伴う。トランスフェクトまたは形質導入された細胞はその後、対象に戻される。これらの細胞は、限定されないが、造血細胞(例えば、骨髄細胞、マクロファージ、単球、樹状細胞、T細胞、またはB細胞)、線維芽細胞、上皮細胞、内皮細胞、角化細胞、または筋細胞を含む広範な種類のうちのいずれであってもよい。
一例において、多特異性抗原結合タンパク質(例えば二重特異性抗体など)は、障害または腫瘍の位置が許容すれば、例えば、直接注射によって局所投与され、注射は周期的に繰り返されてもよい。タンパク質複合体は、対象に全身的に送達されてもよいし、局所的再発または転移を防止もしくは低減させるために、腫瘍細胞に、例えば、腫瘍または腫瘍の外科切除後の腫瘍母地に直接送達されてもよい。
診断及び撮像
本明細書において提供される多特異性抗原結合タンパク質(例えば二重特異性抗体など)は、当業者に知られる古典的な免疫組織学的方法を使用して生体試料中のタンパク質レベルをアッセイするために使用することができる(例えば、Jalkanen,et al.,J.Cell.Biol.101:976−985(1985)、Jalkanen,et al.,J.Cell.Biol.105:3087−3096(1987)を参照されたい)。タンパク質遺伝子発現を検出するために有用な他の抗体ベースの方法としては、酵素結合免疫吸着測定法(ELISA)などのイムノアッセイが挙げられ、ラジオイムノアッセイ(RIA)は、本明細書において提供される多特異性抗原結合タンパク質(例えば二重特異性抗体など)での使用のために適合させることができる。好適なアッセイ標識は当該技術分野で知られており、これには、グルコースオキシダーゼなどの酵素標識;ヨウ素(131I、125I、123I、121I)、炭素(14C)、硫黄(35S)、トリチウム(3H)、インジウム(115mIn、113mIn、112In、111In)、及びテクネチウム(99Tc、99mTc)、タリウム(201Ti)、ガリウム(68Ga、67Ga)、パラジウム(103Pd)、モリブデン(99Mo)、キセノン(133Xe)、フッ素(18F)、153Sm、177Lu、159Gd、149Pm、140La、175Yb、166Ho、90Y、47Sc、186Re、188Re、142Pr、105Rh、97Ruなどのラジオアイソトープ;ルミノール;ならびにフルオレセイン及びローダミン、及びビオチンなどの蛍光標識が含まれる。
当該技術分野で知られる技術を、本明細書において提供される多特異性抗原結合タンパク質(例えば二重特異性抗体など)に適用することができる。かかる技術としては、二機能性共役剤の使用が挙げられるが、これに限定されない(例えば、米国特許第5,756,065号、同第5,714,631号、同第5,696,239号、同第5,652,361号、同第5,505,931号、同第5,489,425号、同第5,435,990号、同第5,428,139号、同第5,342,604号、同第5,274,119号、同第4,994,560号、及び同第5,808,003号を参照されたい)。また、例えば、本明細書において提供される多特異性抗原結合タンパク質(例えば二重特異性抗体など)での使用のために適合された抗体ベースアッセイ(例えば、1990年6月12日に発行された米国特許第4,933,294号、1991年4月18日に公開されたWO91/05264、1995年3月28日に発行された米国特許5,401,638号、及びSias et al.,J.Immunol.Methods 132:73−80(1990)も参照されたい)を使用し、血清などの生体液中の脱落した(shed)抗原(複数可)を測定することによって、1つ以上の目的の抗原の過剰発現を研究することができる。上記のアッセイの他に、様々なインビボアッセイ及びエクスビボアッセイが、熟練した施術者には利用可能である。例えば、検出可能な標識、例えば放射性アイソトープで任意に標識されている、本明細書において提供される多特異性抗原結合タンパク質(例えば二重特異性抗体など)に、哺乳動物の体内の細胞を曝露することができ、例えば、放射活性の外部走査によって、または多特異性抗原結合タンパク質に事前に曝露された哺乳動物から採取された試料(例えば生検または他の生体試料)を分析することによって、1つ以上の目的の抗原(複数可)に対する多特異性抗原結合タンパク質(例えば二重特異性抗体など)の結合を評価することができる。
製品及びキット
本明細書に記載の1つ以上の多特異性抗原結合タンパク質(例えば二重特異性抗体など)と障害(例えば、自己免疫疾患またはがん)の治療または診断に有用な材料とを含む製品も提供される。特定の実施形態において、本製品は、容器と、容器に接するまたは容器に関連付けられたラベルもしくは添付文書とを含む。好適な容器としては、例えば、ボトル、バイアル、シリンジなどが挙げられる。容器は、ガラスまたはプラスチックなどの多様な材料から形成され得る。容器は、状態を治療するのに有効な組成物を保持するものであり、滅菌アクセスポートを有してもよい(例えば、容器は、静注溶液バッグ、または皮下注射針によって穿刺可能なストッパーを有するバイアルであってもよい)。組成物中の少なくとも1つの活性薬剤は、本明細書において提供される多特異性抗原結合タンパク質(例えば二重特異性抗体など)である。ラベルまたは添付文書は、その組成物が特定の状態を治療するために使用されることを示す。ラベルまたは添付文書は、多特異性抗原結合タンパク質組成物を対象に投与するための指示をさらに含む。本明細書に記載の併用治療薬を含む製品及びキットも想定される。
「添付文書」は、適応症、使用法、薬用量、投与、禁忌症、及び/または治療用生成物の使用に関する警告に関する情報を含む、かかる治療用生成物の商用パッケージに通例含まれる指示書を指す。特定の実施形態において、添付文書は、その組成物が乳がん、結腸直腸がん、肺がん、腎細胞癌、神経膠腫、または卵巣がんを治療するために使用されることを示す。
追加的に、本製品は、静菌性注射用水(BWFI)、リン酸緩衝食塩水、リンゲル液、及びデキストロース溶液などの薬学的に許容される緩衝液を含む、第2の容器をさらに含んでもよい。本製品は、他の緩衝液、希釈剤、フィルタ、針、及びシリンジを含む、商業的観点及び使用者の観点から考慮される他の材料をさらに含んでもよい。
様々な目的のため、例えば、細胞から2つ以上の標的抗原を精製または免疫沈降するために有用なキットがまた、提供される。2つ以上の標的抗原の単離及び精製に関して、本キットは、ビーズ(例えば、Sepharoseビーズ)にカップリングされた多特異性抗原結合タンパク質(例えば、EGFR/HER2抗体)を含むことができる。インビトロで、例えば、ELISAまたはウェスタンブロットで抗原を検出及び定量化するための、多特異性抗原結合タンパク質(複数可)を含むキットが提供され得る。製品と同様に、本キットは、容器と、容器に接するまたは容器に関連付けられたラベルもしくは添付文書とを含む。容器は、本明細書において提供される少なくとも1つの多特異性抗原結合タンパク質(例えば二重特異性抗体など)を含む組成物を保持する。例えば、希釈剤及び緩衝液または対照抗体を含む、追加の容器が含まれてもよい。ラベルまたは添付文書は、組成物の説明ならびに意図されるインビトロまたは診断上の使用に関する指示を提供してもよい。
コンピュータ実装
本明細書では、1)第1の重鎖配列(H1)及び第1の軽鎖配列(L1)を含む第1の抗原に結合する第1の重鎖/軽鎖対と、2)第2の重鎖配列(H2)及び第2の軽鎖配列(L2)を含む第2の抗原に結合する第2の重鎖/軽鎖対と、を含み、各H1及びH2が、重鎖可変ドメイン(VH)及び重鎖定常ドメイン(CH1)を含み、各L1及びL2が、軽鎖可変ドメイン(VL)及び軽鎖定常ドメイン(CL)を含む、多特異性抗原結合タンパク質を評価するための、コンピュータ可読媒体が提供される。
特定の実施形態において、コンピュータ可読媒体は、H1、L1、H2、及びL2内のアミノ酸置換を表すデータを含むデータセットを含み、H1のCH1ドメイン内のアミノ酸置換のうちの少なくとも1つは、配列番号1を参照してS183位におけるアミノ酸置換を含み、CLドメインは、配列番号2を参照してV133位におけるアミノ酸置換を含む。特定の実施形態において、コンピュータ可読媒体は、H1、L1、H2、及びL2内のアミノ酸置換を表すデータを含むデータセットを含み、H1のCH1ドメイン内のアミノ酸置換のうちの少なくとも1つは、配列番号1を参照してF170位またはL128位及びV185位におけるアミノ酸置換を含み、CLドメインは、配列番号2を参照してS176位またはF118位及びL135位におけるアミノ酸置換を含む。特定の実施形態において、コンピュータ可読媒体は、H1、L1、H2、及びL2内のアミノ酸置換を表すデータを含むデータセットを含み、H1のCH1ドメイン内のアミノ酸置換のうちの少なくとも1つは、配列番号1を参照してS182位、F170位、またはL128位、及びV185位におけるアミノ酸置換を含み、CLドメインは、配列番号2を参照してV13位、S176位、またはF118位、及びL135位におけるアミノ酸置換を含む。
特定の実施形態において、多特異性抗原結合タンパク質を評価するためのコンピュータ可読媒体は、H1がL2と比較してL1と優先的に対合する尤度及び/またはH2がL1と比較してL2と優先的に対合する尤度を決定するためのコンピュータ実行可能コードを含む。
特定の実施形態において、コンピュータは、チップセットに連結された少なくとも1つのプロセッサを備える。チップセットには、メモリ、記憶デバイス、キーボード、グラフィックスアダプタ、ポインティングデバイス、及びネットワークアダプタも連結されている。グラフィックアダプタには、ディスプレイが連結されている。一実施形態において、チップセットの機能は、メモリコントローラハブ及びI/Oコントローラハブによって提供される。別の実施形態では、メモリは、チップセットの代わりにプロセッサに直接連結される。
記憶デバイスは、ハードドライブ、コンパクトディスク読み取り専用メモリ(CD−ROM)、DVD、または固体メモリデバイスのような、データを保持することのできる任意のデバイスである。メモリは、プロセッサにより使用される命令及びデータを保持する。ポインティングデバイスは、マウス、トラックボール、または他の種類のポインティングデバイスであってもよく、コンピュータシステムにデータを入力するためにキーボードと組み合わせて使用される。グラフィックスアダプタは、画像及び他の情報をディスプレイ上に表示する。ネットワークアダプタは、コンピュータシステムをローカルまたは広域ネットワークに連結する。
当該技術分野で知られているように、コンピュータは、これまでに記載したものと異なる構成要素及び/または他の構成要素を有してもよい。加えて、コンピュータは、特定の構成要素を欠いていてもよい。さらに、記憶デバイスは、コンピュータからローカル及び/またはリモートであっても(例えばストレージエリアネットワーク(SAN)内に統合されていても)よい。
当該技術分野で知られているように、コンピュータは、本明細書に記載の機能を提供するためのコンピュータプログラムモジュールを実行するように適合される。本明細書において使用される場合、「モジュール」という用語は、指定された機能を提供するために利用されるコンピュータプログラム論理を指す。したがって、モジュールは、ハードウェア、ファームウェア、及び/またはソフトウェアに実装することができる。一実施形態において、プログラムモジュールは、記憶デバイスに記憶され、メモリにロードされ、プロセッサによって実行される。
前述の説明は、当業者が本発明を実践することを可能にするのに十分であると考えられる。以下の実施例は例証目的のためだけに提示されるものであり、本発明の範囲をいかようにも限定することを意図しない。実際、本明細書に示され記載されたものに加えて、様々な修飾が前述の説明から当業者には明らかになり、それらは添付の特許請求の範囲に含まれる。
実施例1:方略番号1を使用した抗体重鎖/軽鎖対の操作
Fabアセンブリは、独立して、VH/VL及びCH1/CLドメインの相互作用によって推進される。CL不安定化変異は、抗原結合に対して中等度の効果しか有しない場合があるが、CH1ドメインとCLドメインとの間の相互作用の途絶は、哺乳動物細胞内での抗体のフォールディング及び分泌に干渉し得る(データ図示せず)。特異的かつ正確なHCとLCとの対合を誘導し、HC/LCの誤対合を最低限に抑えるために、CH1/CL変異対のパネルを生成した。正確な対合を誘導するCH1/CL変異対の能力は、以下にさら詳細に記載されるように検査した。
CLドメイン内のF118、V133、またはL135における変異は、CH1とのアセンブリを撹乱させることが見出された(データ図示せず)。変異したCLドメインとのアセンブリを回復させるCH1ドメイン内のアミノ酸位置を特定するために、PyMolを使用して抗体定常ドメインPDB ID 1CZ8を調製した。重鎖CH1ドメインならびに軽鎖CLドメインの構造及び機能の詳細な知識に基づいたヒトの誘導による設計を使用して、CH1ドメインのL128位、G143位、L145位、S183位、及びV185位における置換を、単独または組み合わせで試験した。S183位に荷電アミノ酸置換変異を有する重鎖は、逆電荷のCL置換変異との関連で抗体発現を改善させることが示された(図1A及び1B参照)。図1A及び1Bは、1mlの293T培養物からのタンパク質A回収を示す(A280吸光度単位(A.U.))。したがって、S183変異体をさらなる分析のために選択した。
変異CH1及び変異CLドメインをスクリーニングして、抗体発現を回復させる変異対を初めに特定した。初回スクリーニングとして、標準的な分子生物学技術を使用して、F118、V133、またはL135が正荷電アミノ酸(すなわち、KまたはR)に置き換えられたCLを有する抗体軽鎖を生成し、S183が負荷電アミノ酸(すなわち、EまたはD)に置き換えられたCH1を有する重鎖を生成し、哺乳動物の発現ベクターにクローニングした。以前に説明されているように(例えば、Bos et al.(2014)“Development of a semi−automated high throughput transient transfection system.”Journal of Biotechnology 180,10−16を参照されたい)、HEK293T細胞の一過性トランスフェクション培養物1mLを使用して、S183EまたはS183D変異を有する重鎖CH1ドメイン及びF118K、F118R、V133K、V133R、V135K、またはL135R置換変異を有する軽鎖CLドメインをコードするプラスミドを、等濃度でコトランスフェクトした。CH1変異体及びCL変異体のあらゆる対の組み合わせについて、この手順を繰り返した。
MabSelectSure(GE Healthcare,USA)により、製造業者のプロトコルに従って、哺乳動物培養上清からヒトIgG1を精製し、精製されたMabSelectSure溶離液のOD280測定によって、抗体発現を計算した。図2に示されるように、抗体発現は、V133Kを野生型CH1と対合させた場合と比較して、V133K CL変異をS183D CH1変異またはS183E CH1変異と対合させたときに改善した。150μL体積のMabSelectSure精製溶離液から得られた全抗体収量(μg)が、図2のy軸に示されている。
図3に提供されたX線結晶構造に示されるように、軽鎖定常ドメイン(CL)内のV133及び重鎖CH1ドメイン内のS183は、IgGの軽鎖CLドメイン及び重鎖CH1ドメインの界面の内側に存在する。この構造はIgG4において同様である。CH1のS183(EU付番、Kabat付番のS188と同等)はヒト及びマウスの生殖系列で保存されており、V133はヒト及びマウスのカッパ及びラムダ軽鎖内に存在する。いかなる1つの理論にも限定されるものではないが、V133における荷電アミノ酸の置換、及びS183における反対の電荷を有するアミノ酸の置換は、未修飾のCH1/CL界面内には存在しない周囲のアミノ酸残基(例えばCLドメイン内のS176及びS178など)との新たな安定化相互作用を作り出し得る。
さらなる実験を行って、良好なレベルの抗体発現を示したさらなる特異的V133X/S183X変異体対を特定した。上述の抗体発現アッセイを使用して、CH1−CL対合を優先するV133X/S183X変異体対を特定した。簡潔に述べると、CH1 S183X置換変異(例えば、S183A、S183T、S183V、S183Y、S183F、S183H、S183N、S183D、S183E、S183R、またはS183K)を有する抗体重鎖と、V133X置換変異(例えば、V133E、V133S、V133L、V133W、V133K、V133R、またはV133D)を有する軽鎖とを、上述のように生成した。上述のようにHEK293T細胞の一過性トランスフェクション培養物30mLを使用して、上記の変異CH1及びCL変異のそれぞれを有する重鎖及び軽鎖を発現するプラスミドを、等濃度でコトランスフェクトした。V133X/S183X変異体対のあらゆる組み合わせについて、この手順を繰り返した。全抗体収量(μg)は、上述のように決定した。各V133X/S183X変異体対の発現結果が、図4に提供されている。簡潔に述べると、図4は、各V133X/S183X変異体対に関する、30mlの293T培養物からの精製タンパク質のmgにおける全収量を示す。精製されたMabSelectSure溶離液のOD280測定から、抗体タンパク質レベルを計算した。良好なレベルの抗体発現を示した、V133K/S183T、V133K/S183V、V133K/S183Y、及びV133K/S183FなどのV133X/S183X変異体対を、抗Her2/抗CD3二重特異性抗体の1つのアームに導入した。V133K/S183E発現の初期結果は高くなかったが、V133K/S183Eもまた、抗Her2/抗CD3二重特異性抗体との関連で試験した。抗Her2(4D5)抗体及び抗CD3(UCHT1)抗体は、次の基準に基づいて選択した:a)重鎖と軽鎖との両方が抗原結合に必要とされること;b)成分抗体が十分に発現され、凝集しにくいこと;及びc)親抗体が非同族の重鎖/軽鎖対合と比べて同族に対する著しい優先度を示さないこと。「4D5」は、Carter et al.(1992)Proc.Natl.Acad.Sci.USA 89,4285−9に記載のヒト化4D5v8を指す。「UCHT1」は、Zhu and Carter(1995)J.Immunol.155,1903−10に記載のヒト化UCHT1v9を指す。
この実験において、UCHT1重鎖は、CH3ドメイン内にホール変異(T366S、L368A、Y407V)を含み、4D5重鎖は、CH3ドメイン内にノブ変異(T366W)を含む。UCHT1アーム内にV133K/S183E変異を有する4D5/UCHT1二重特異性抗体を発現させ、精製し、四重極飛行時間型(quadrupole−time−of−flight、QTOF)質量分析によって分析して、精製試料中に存在する抗体種のそれぞれの相対的存在量を数量化した。野生型配列の正確な重鎖/軽鎖対合とスクランブル型重鎖/軽鎖対合(すなわち、HC1/LC2及びHC2/LC1)の不偏期待量は50%である。以下の表14Cの第1及び第3の横列に示されるように、正確な重鎖/軽鎖対合は、UCHT1アーム内にV133K/S183Eを有する4D5/UCHT1抗体変異形において改善される。
V133K/S183T、V133K/S183V、V133K/S183Y、V133K/S183E、もしくはV133K/S183F変異対を4D5アームまたはUCHT1アームのいずれかに有する4D5/UCHT1抗体を発現させ、精製し、四重極飛行時間型(QTOF)質量分析によって分析して、精製試料中に存在する抗体種のそれぞれの相対的存在量を数量化した。
4D5/UCHT1抗体の発現、精製、及び分析の前に、以前に説明されている方法を使用して(例えば、Bos et al.(2014)、上記参照)、HEK293T細胞の一過性トランスフェクション培養物30mlを用い、軽鎖比最適化を実施した。2つの抗体重鎖をコードするプラスミドDNAの量は、全トランスフェクションを通じて一定のままであったが、軽鎖DNAのトランスフェクトされた量は、ある範囲のLC1(ノブ):LC2(ホール)DNA比にわたって異なった。軽鎖発現のバランスが最適な条件、すなわち、適切にアセンブルされた二重特異性抗体が最も高い割合で産生される条件を特定するために、一過性にトランスフェクトされた培養物の生成物を、Orbitrap質量分析によって分析した。
高分解能質量分析からの3つのピークの数量化に基づいて、正確に対合した軽鎖を有するBsIgG(すなわち、LC−1がHC−1と対合しており、LC−2がHC−2と対合している二重特異性抗体)の量を、2xLCスクランブル型種(すなわち、LC−2がHC−1と対合しており、LC−1がHC−2と対合している二重特異性抗体)と区別するために、数式を展開した。ノブ重鎖(HCノブ)及びホール重鎖(HCホール)のLC対合は完全に独立した事象であると仮定する。正確に対合したBsIgGの割合、すなわち%[BsIgG]は、次のように計算することができる:
%[BsIgG]=%[BsIgGと2xLCスクランブル型との合計]/2+SQRT((%[BsIgGと2xLCスクランブル型との合計]/2)2−%[2xLCノブ]*%[2xLCホール])
((%[BsIgGと2xLCスクランブル型との合計]/2)2−%[2xLCノブ]*%[2xLCホール])が負の数である場合、それは強制的にゼロにされ、
%[BsIgG]=%[BsIgGと2xスクランブル型との合計]/2
したがって、2xLCスクランブル型種の割合は、次のように計算される:
%[2xLCスクランブル型]=%[BsIgGと2xLCスクランブル型との合計]−%[BsIgG]
この数学的手法を実験的に確認するため、精製された二重特異性抗体の2つの試料を、質量分析によって分析した。試料1中のBsIgGと2xLCスクランブル型との合計分率は51.3%であり、試料2中のBsIgGと2xLCスクランブル型との合計分率は70.6%であった。上記の式を使用して、%[BsIgG]、%[2xLC
ノブ]、%[2xLC
ホール]、及び%[2xLCスクランブル型]の数を決定し(表10参照)、それらから、各Fab種の分率、すなわち%[Fab
ノブ]、%[Fab
ホール]、%[LC
ノブ/HC
ホール]、及び%[LC
ホール/HC
ノブ]も計算した(表11参照)。質量分析による分析の前に、両試料をリジルエンドペプチダーゼで処理した。次に、消化されたFab種の測定分率を、それらの計算値と比較した。両試料の測定された割合と計算された割合とが厳密に一致したことから、正確に対合したBsIgG種を数量化するための数学的手法が立証された。
表12中の例示的な結果に示されるように、二重特異性アセンブリの%は、V133X/S183X変異を有しない野生型配列と比較して増加した。二重特異性アセンブリの割合は、V133/S183変異体がUCHT1アーム内に存在するときと比較して、V133X/S183X変異体対が4D5アーム内に存在するときで比較可能であった。このような結果は、適当な二重特異性抗体のアセンブリが、V133X/S183X変異体対が導入されるアームによる著しい影響を受けないことを示唆する。
異なる二重特異性抗体を使用して、上述の実験を繰り返した。異なる二重特異性抗体を使用した結果も、二重特異性抗体のアセンブリが、V133X/S183X変異体対が導入されるアームによる著しい影響を受けないことを示唆する。親抗体が強い優先的な重鎖/軽鎖対合を既に示す場合、さらなる改善は実現または検出が困難であることも観察された。
次に、VH及びVLの非CDR領域内のさらなる変異がHCとLCとの対合をさらに改善させ得るかどうかを検査した。水素結合を形成するフレームワーク領域内のVL−Q38及びVH−Q39は、ほとんどの生殖系列で高度に保存されている。荷電残基を、IL13抗体のVL−Q38もしくはVH−Q39のいずれか、または両方の位置に導入した。VH/VL対合を優先するQ39X変異体、Q38X変異体、またはQ39X/Q38X変異体対を、抗IL13抗体における細菌表面提示によって特定した。簡潔に述べると、カナマイシン耐性を治癒させたE.coli列33D3のΔlpp誘導体において、変異抗体を発現させた(例えば、Simmons et al.(2002)“Expression of full−length immunoglobulins in Escherichia coli:rapid and efficient production of aglycosylated antibodies.”Journal of Immunological Methods.263,133−147を参照されたい)。個々のフレームワーク変異形を30℃で一晩培養物として成長させ、等しい体積で合わせ、1:100の希釈度で使用して、50mLのCRAP培養物を播種した。30℃で24時間後、1ODのアリコートを採取し、遠心分離(4分、6500rcf)によりペレット化した。2%のBSA及び5mMのEDTAを含む100μLのPBS中に細胞を再懸濁させ、4℃で30分間インキュベートした。初回インキュベーション後、SYTO 41または9の核酸染料(Molecular Probes,USA)を1:100の最終希釈度まで添加し、Alexa488またはAlexa647標識抗原を1〜2μMの最終濃度まで添加した。暗所で1時間にわたり4℃でインキュベーションを継続し、1時間の時点でMgCl2を10〜20mMの最終濃度まで添加した。1mL体積のPBS+20mM MgCl2で3回洗浄することによって、未結合のタンパク質を除去した。染色された細胞をSOC培地(New England Biolabs,USA)に再懸濁させ、Becton Dickenson FACS AriaIIフローサイトメーターを使用した分析のために1×107細胞/mlの最終濃度にした。このFACSゲーティング方略には、SYTO染料陽性の細胞が含まれた。二重項弁別ゲート(Doublet discrimination gates)を使用して二重項を除去し、最後に、抗原に結合する単一細胞の割合を決定するようにゲートを設定した。図5に示されるように、VL−Q38置換とVH−Q39置換との両方を有する変異形の中でも、VL−Q38K/VH−Q39E変異体対が、VL−Q38K/VH−Q39K変異体対よりも高い、最も高いFACSシグナルをもたらした(図6参照)。さらに、抗体は、Q38K VL変異をQ39E VH変異と対合させたときに、野生型と同等かまたはそれよりも良好なレベルまで発現された。図7を参照されたい。Q38K/Q39Kの発現がQ38K/野生型対に劣ったことから、正確なLC/HC対合のための最大の推進力を得るために、EKKE変異(ここでこの4文字は、それぞれ、Q39XHC1/Q38XLC1ノブ/Q39XHC2/Q38XLC2ホールにおけるアミノ酸置換を指す)を両方のアームに導入することにした。
次に、両重鎖及び両軽鎖内にQ39X/Q38X変異を含むように、4D5/UCHT1二重特異性抗体変異形を構築した。修飾された二重特異性抗体を発現させ、精製し、高分解能質量分析によって分析した。高分解能質量分析は、Orbitrap技術の向上した検出能力をEMR Exactive Plus質量分析器で利用する。定量化のために、マイクロスピンカラム(Spin−6、Bio−Rad)または逆相オフラインHPLCを使用して、PBS中の抗体生成物を0.1%トリフルオロ酢酸中に緩衝液交換した。結果として得られた試料画分を質量分析器に直接注いだ。電荷内状態(intra−charge state)の部分の基線分解能を可能にするように、パラメータをTuneモードで最適化した。Protein Deconvolutionソフトウェア(Thermo、スコアカットオフ50)を使用して、質量包絡線(Mass envelope)をデコンボリュートした。結果として得られるデコンボリュートされたピークの強度を記録し、これを使用して、「正確な」配列、誤対合、半抗体、及びホモ二量体の存在%を判定した。図8の例示的な結果は、適当な重鎖−軽鎖対合を有する「正確な」二重特異性抗体変異形の存在%を示す。試験した変異体がX軸上に示されている。変異の各セットにおける4文字は、それぞれ、Q39X
HC1/Q38X
LC1ノブ/Q39X
HC2/Q38X
LC2ホールにおけるアミノ酸置換を指す。図8に示される数量化結果が、以下の表13に提供される。これらの実験において、4D5抗体はノブ変異を保有し、UCHT1抗体はホール変異を保有した。これらの結果は、EKKEに加えて、Q39/Q38における他の変異も、正確な重鎖/軽鎖対合を改善させたことを示す。
VL−Q38 VH−Q39変異を4D5/UCHT1二重特異性抗体に導入した。4D5アームが、Q39E変異を有するVH及びQ38K変異を有するVLを含むように、かつ、UCHT1アームが、Q39K変異を有するVH及びQ38E変異を有するVLを含むように(すなわち、EKKE)、4D5/UCHT1二重特異性抗体を修飾した。この実験において、4D5抗体は、CH3ドメイン内にノブ変異を含み、UCHT1抗体は、CH3ドメイン内にホール変異を含む。図9に示されるQTOF分析において、重鎖−軽鎖の誤対合は、野生型二重特異性抗体(図9A参照)と比較して、修飾抗体で著しく低減した(図9B参照)。以下の表15により提供される例示的な結果にさらに示されるように、Q38/Q39変異は、単一細胞で産生された二重特異性IgGの%を改善させた。
VL−Q38E変異及びVH−Q39K変異を既に含んでいた二重特異性4D5/UCHT1抗体のUCHT1アームを、CL−V133K変異及びCH−1−S183E変異を含むようにさらに修飾した。4D5/UCHT1抗体の4D5アームは、VL−Q38K変異及びVH−Q39E変異を含むように修飾した。修飾された二重特異性抗体を発現させ、精製し、高分解能質量分析によって分析した。高分解能質量分析は、Orbitrap技術の向上した検出能力をEMR Exactive Plus質量分析器で利用する。定量化のために、マイクロスピンカラム(Spin−6、Bio−Rad)または逆相オフラインHPLCを使用して、PBS中の抗体生成物を0.1%トリフルオロ酢酸中に緩衝液交換した。結果として得られた試料画分を質量分析器に直接注いだ。電荷内状態の部分の基線分解能を可能にするように、パラメータをTuneモードで最適化した。Protein Deconvolutionソフトウェア(Thermo、スコアカットオフ50)を使用して、質量包絡線をデコンボリュートした。結果として得られるデコンボリュートされたピークの強度を記録し、これを使用して、「正確な」配列、誤対合、半抗体、及びホモ二量体の例示的な存在%を判定した。図10Bの拡大版を示す図10Aに示されるように、正確に対合した重鎖/軽鎖アームを含んだ抗体種が、試料中の主集団であった。(数量化結果については、以下の表14C中の第4の横列を参照されたい。)EKKE変異を有せずにUCHT1アーム内にCL−V133K変異及びCH−1−S183E変異を含むように修飾された二重特異性4D5/UCHT1を使用して、同じ実験を行った。図10Dの拡大版を示す図10Cに示されるように、2つの4D5軽鎖または2つのUCHT1軽鎖を含む種(すなわち、誤対合した二重特異性抗体)が、試料中の主集団であった。(数量化結果については、以下の表14C中の第3の横列を参照されたい。)図10Eは、未修飾の野生型4D5/UCHT1抗体の高分解能質量分析結果を提供し、同様に、2つの4D5軽鎖または2つのUCHT1軽鎖を含む種(すなわち、誤対合した二重特異性抗体)が、試料中の主集団であったことを示す。これらの結果は、二重特異性抗体のホールアーム上のV133X/S183X変異対が重鎖/軽鎖の誤対合を低減させ、EKKE変異の追加が二重特異性アセンブリをさらに改善させたことを示す。
両方のアームにQ39X/Q38X変異及び/またはV133X/S183X変異を有する変異形を含め、さらなる二重特異性抗体を生成し、発現させ、精製し、上述のように高分解能質量分析によって分析して、かかる二重特異性抗体が優先的な重鎖/軽鎖対合の増加を示すかどうかを判定した。高分解能質量分析の例示的な結果が、以下の表14A及び14Bに提供される。
ノブアーム及び/またはホールアームへのQ39X/Q38Xの導入、及び/またはホールアームへのV133X/S183X変異の導入を、様々な二重特異性抗体で行った。4文字の変異は、それぞれ、Q39X
HC1/Q38X
LC1ノブ/Q39X
HC2/Q38X
LC2ホールにおけるアミノ酸置換を指す。代表的な結果は、EKKE及びV133X/S183X変異(V133K/S183Eを使用して表14Cに例示されている)が、単独または組み合わせで、異なる抗体における二重特異性アセンブリを概して改善させたことを示す。親抗体が強い優先的な重鎖/軽鎖対合を既に示す実施例では、さらなる改善は実現または検出が困難である。V133X/S183X変異も二重特異性抗体のノブアームに導入したところ、比較可能な結果が示された。
# 抗VEGFA/ANG2試料において、正確にアセンブルされた二重特異性抗体(Ab)、「2xホールLC」抗体、及び「2Xノブ」抗体の分子量は酷似している。「正確な」集団を「2xホールLC」集団及び「2Xノブ」集団と区別するために、Orbitrap分解能を増加させ、したがって感度をわずかに減少させた。したがって、100%正確な対合は>95%に近くなると考えられる。
1.Schaefer,et al.A two−in−one antibody against HER3 and EGFR has superior inhibitory activity compared with monospecific antibodies.Cancer Cell.2011;20:472−86。
2.Merchant,et al.Monovalent antibody design and mechanism of action of onartuzumab,a MET antagonist with anti−tumor activity as a therapeutic agent.Proc Natl Acad Sci USA.2013;110:E2987−96。
3.Presta,et al.Humanization of an anti−vascular endothelial growth factor monoclonal antibody for the therapy of solid tumors and other disorders.Cancer Res.1997;57:4593−9。
4.Gogineni,et al.Inhibition of VEGF−C modulates distal lymphatic remodeling and secondary metastasis.PLoS One.2013;8:e68755。
5.WO 2014/165771
6.WO 2005/062967
7.Ultsch M,Bevers J,Nakamura G,Vandlen R,Kelley RF,Wu LC,et al.Structural basis of signaling blockade by anti−IL−13 antibody Lebrikizumab.J Mol Biol.2013;425:1330−9。
8.Carter P,Presta L,Gorman CM,Ridgway JB,Henner D,Wong WL,et al.Humanization of an anti−p185HER2 antibody for human cancer therapy.Proc Natl Acad Sci USA.1992;89:4285−9。
9.Zhu Z,Carter P.Identification of heav y chain residues in a humanized anti−CD3 antibody important for efficient antigen binding and T cell activation.J Immunol.1995;155:1903−10。
10.Liang WC,Wu X,Peale FV,Lee CV,Meng YG,Gutierrez J,et al.Cross−species vascular endothelial growth factor (VEGF)−blocking antibodies completely inhibit the growth of human tumor xenografts and measure the contribution of stromal VEGF.J Biol Chem.2006;281:951−61。
Q39E
HC1/Q38K
LC1ノブ/Q39K
HC2/Q38E
LC2ホール及びV133K/S183Eホール変異を含む抗HER2/CD3抗体を、V133E/S183Kノブ変異を含むようにさらに修飾した。この抗体を発現させ、精製し、上述のように高分解能質量分析によって分析して、かかる二重特異性抗体が優先的な重鎖/軽鎖対合の増加を示すかどうかを判定した。高分解能質量分析の例示的な結果が、以下の表14Dに提供される。
表14D中の例示的な結果は、EKKE及びV133K/S183Eホール変異と組み合わせたV133E/S183Kノブ変異が、二重特異性アセンブリをほぼ100%まで改善させたことを示す。
インビトロ細胞傷害アッセイにおいて、EKKE及びV133K/S183Eホール変異を有する抗HER2/CD3抗体の活性を、未修飾の抗HER2/CD3抗体の活性と比較した。簡潔に述べると、リンパ球分離培地(MP biomedicals,Solon,OH)を使用して、健康な献血者の血液から末梢血単核細胞(PBMC)を分離させた。MiltenyiのヒトCD8+単離キット(#130−094−156)を使用し、CD8+細胞を負の選択によってPBMCから抽出した。1×104個のPBMC細胞を96ウェルプレート上にプレーティングし、一晩インキュベートした。5×104個のCD8+T細胞を、(a)EKKE及びV133K/S183Eホール変異を有する抗HER2/CD3抗体あり、(b)EKKE及びV133K/S183Eホール変異を有する抗HER2/CD3抗体なし、(c)未修飾の抗HER2/CD3あり、及び(d)未修飾の抗HER2/CD3なしで添加した。これらの混合物を、48時間37℃でインキュベートした。PBSで2回洗浄することによって、T細胞を除去した。CellTiter−Glo(登録商標)発光細胞生存率アッセイ(Promega,Madison,WI)を使用して、PBMCの生存率を測定した。図23に示されるように、修飾された抗HER2/CD3抗体と未修飾の抗HER2/CD3抗体との活性は、比較可能であった。
示差走査蛍光定量(DSF)を行って、(a)VL−Q38K及びVH−Q39E変異を含むように修飾された4D5 Fab、(b)VL−Q38E、CL−V133K、VH−Q39K、及びCH−1 S183E変異を含むように修飾されたUCHT1Fab、ならびに(c)VL−Q38E、CL−V133K、VH−Q39K、及びCH−1 S183T変異を含むように修飾されたUCHT1アームの溶融温度を判定した(例えば、Niesen et al.(2007)Nat Protoc 2,2212−2221を参照されたい。)1:500の最終希釈度のSypro Orange染料ストック(Molecular Probes,USA)を用い、Biorad CFX96リアルタイムシステム(Biorad,USA)において、タンパク質安定性を判定した。PBS中の25μLのFab試料の蛍光を20〜100℃で記録した(0.2℃の増分、ステップごとに10秒の保持)。以下の表15に示される結果は、本明細書に記載の可変領域及び/または定常領域に導入された変異が、抗体のTmに大きく影響しないことを示す。
表15に示される結果に基づくと、試験した変異形の熱安定性は、主にHCの安定性によって推進されているようである。安定性は二重特異性対合の改善の説明となり得るが、このデータは、予想外なことに、最大の二重特異性対合を示す変異形が最大の熱安定性と必ずしも相関するとは限らないこと、例えば、適切に対合したFabが、誤対合したFabと比較して低いかまたはそれと同様の熱安定性を示す場合があることを示す。特定の機序(複数可)に束縛されるものではないが、変異は、代替的または追加的に、適当な対のアセンブリ動態に影響する場合があり、例えば、適当な対がより速くアセンブルし、重鎖と軽鎖との間のジスルフィド形成が続く場合がある。これは、鎖比最適化が二重特異性形成をさらに改善させたという観察によってさらに支持される。
Q39E
HC1/Q38K
LC1ノブ/Q39K
HC2/Q38E
LC2ホール変異及びV133K/S183Eホール変異を、ヒトIgG1アイソタイプ、ヒトIgG2アイソタイプ、ヒトIgG4アイソタイプ、及びマウスIgG2aアイソタイプの二重特異性抗4D5/UCHT1抗体に導入した。ヒトIgG2アイソタイプの抗体は、インビトロでのアセンブリに成功することが観察されていない。以下の表16中の例示的な結果は、軽鎖及び重鎖の可変ドメイン内の変異が、マウス二重特異性抗体においてだけではなく、異なるアイソタイプのヒト二重特異性抗体においても、二重特異性アセンブリを概して改善させたことを示す。
*結果は、最適化されたLC1:LC2比を使用して得られた
†全ピークに関する期待値から−110Daの性質不明の質量差。
#全ピークに関する期待値から+160Daの性質不明の質量差。
VL−Q38K変異、CL−V133E変異、VH−Q39E変異、及びCH1−S183K変異を含むように修飾された4D5 Fabの結晶構造を、1.63Åの分解能まで判定した。変異体の全体構造は野生型4D5 Fabと比較した有意差を示さず、4つのドメインの全てに導入された電荷変異が構造的整合性を撹乱させないことが示される。図11Aを参照されたい。しかしながら、変異残基VL−Q38KとVH−Q39Eとの間の塩橋に加えて、VL−Q38KとVH−Q39Eとの両方が、2個の溶媒水分子と余分な水素結合を形成することが見出された。VL−Q38Kはまた、それぞれ、水素結合でVH−Y95及びVL−K39と相互作用することが見出された。大規模な水素結合ネットワークは、変異したVLとVHとの間の対合を安定化させる。図11Bを参照されたい。CL−V133E変異及びCH1−S183K変異を含む定常ドメインにおいて、変異残基CL−V133EとCH1−S183Kとの間の塩橋に加えて、CL−V133EとCH1−S183Kとの両方が、3個の溶媒水分子と余分な水素結合を形成する。CL−V133E及びCH1−S183Kはまた、それぞれ、水素結合でVL−T178と相互作用する。予想外の大規模な水素結合ネットワークは、変異したCLとCH1との間の対合を安定化させ、これが、正確に対合したBsIgGの産生を促進する。図11Cを参照されたい。
VL−Q38E変異、CL−V133K変異、VH−Q39K変異、及びCH1−S183E変異を含むように修正された4D5の結晶構造を、1.61Åの分解能まで判定した。変異体の全体構造は野生型4D5 Fabと比較した有意差を示さず、4つのドメインの全てに導入された電荷変異が構造的整合性を撹乱させないことが示される。図12Aを参照されたい。VL−Q38E及びVH−Q39Kは水素結合を形成しないことが見出された。しかしながら、VL−Q38Eは、2個の溶媒水分子と水素結合を形成する。図12Bを参照されたい。CL−V133K変異及びCH1−S183E変異を含む定常ドメインにおいて、変異残基CL−V133KとCH1−S183Eとの間の塩橋に加えて、CL−V133KとCH1−S183Eとの両方が、それぞれ、2個の溶媒水分子と余分な水素結合を形成する。CL−V133Kはまた、CL−T178と水素結合を形成し、CH1−S183Eは、VL−T76と水素結合を形成する。予想外の大規模な水素結合ネットワークは、変異したCLとCH1との間の対合を安定化させ、これが、正確に対合したBsIgGの産生を促進する。図12Cを参照されたい。
要約すると、CLのV133における変異が、野生型重鎖と対合した場合に、抗体アセンブリを低減させたことが見出された。しかしながら、CH1のS183位におけるアミノ酸置換は、CLのV133位における変異と対合した場合に、抗体変異形のアセンブリを回復させた。したがって、V133X/S183X変異対は、単一細胞内で発現されたときに、特異的なLCとHCとの対合を誘導することができる。VHのQ39位及びVLのQ38位における変異は、単独またはCH1/CL変異との組み合わせで、二重特異性抗体との関連でLCとHCとの対合をさらに改善させ、ひいてはそれに対応して、2つの半抗体が単一細胞内で発現されたときに正確な二重特異性形成を改善させた。経験的に決定された、最適化された軽鎖比は、二重特異性アセンブリをさらに改善させた。VHのQ39位及びVLのQ38位における変異は、単独またはCH1/CL変異との組み合わせで、試験したヒト及びマウス抗体アイソタイプの全てにおいて、二重特異性アセンブリをさらに改善させた。予想外なことに、重鎖または軽鎖の可変領域及び定常領域内の変異は、単独または組み合わせで、抗体の熱安定性に大きく影響しない。
実施例2:方略番号2を使用した抗体重鎖/軽鎖対の操作
加えて、分子モデリングプログラムROSETTA(Leaver−Fay et al.(2011)“ROSETTA3:an object−oriented software suite for the simulation and design of macromolecules.”Methods Enzymol.487,545−74)を使用して、例示的な二重特異性抗体4D5のCH1−CL界面を計算的に再設計した。ROSETTAプログラムは、活発に開発されており、絶えず更新されている。簡潔に述べると、ROSETTAプログラムは、所与の設計手法に合わせて指定されたユーザ入力によるレパートリーからランダム配列を生成する。以下に詳細に記載されるように、2つの設計手法を行った。
第1の設計手法(すなわち、手法A、図13A参照)では、CLドメインのS176アミノ酸残基を、F、Y、またはWのいずれか1つに制限し、CH1ドメインのF170アミノ酸残基を、A、G、I、L、S、T、またはVのいずれか1つに制限した。残基同一性を保存しつつ最適化するために、CLドメインのF118アミノ酸残基を、F、Y、またはWのいずれか1つに制限し、CH1ドメインのF126アミノ酸残基を、F、Y、またはWのいずれか1つに制限し、CH1のS183アミノ酸残基を、A、G、I、L、S、T、またはVのいずれか1つに制限した。CLドメインのF116、V133、L135、S174アミノ酸残基、及びCH1ドメインのL128、G143、L145、S181アミノ酸残基は、非極性アミノ酸に制限した。CLドメインのS131、S162、T164、T178、及びCH1ドメインのA141、V185などの他の残基は、システイン以外の任意のアミノ酸として再設計されることを許可した。
第2の設計手法(すなわち、手法B、図13B参照)では、CLドメインのL135アミノ酸残基及びCH1ドメインのL128アミノ酸残基を、F、Y、またはWのいずれか1つに制限し、CLドメインのF118アミノ酸残基及びCH1ドメインのL145アミノ酸残基を、A、I、L、S、T、またはVのいずれか1つに制限した。CH1ドメインのS181アミノ酸残基も、A、I、L、S、T、またはVのいずれか1つに制限した。加えて、CLドメインのF116アミノ酸残基を、A、F、I、L、M、S、T、V、またはYのうちの1つに制限し、CLドメインのV133アミノ酸残基を、A、F、I、L、S、T、V、W、またはYのいずれか1つに制限し、CH1ドメインのV185アミノ酸残基を、非極性アミノ酸に制限した。CLドメインのS131、S162、T164、S176、及びT178アミノ酸残基、ならびにCH1ドメインのA141及びF170アミノ酸残基は、システイン以外の任意のアミノ酸として再設計されることを許可した。
ROSETTAは、再設計されたCH1ドメイン及び再設計されたCLドメイン(H’L’)、野生型CH1ドメイン及び再設計されたCLドメイン(HL’)、ならびに再設計されたCH1ドメイン及び野生型CLドメイン(H’L)を含むモデル化構造の、複数の結合エネルギースコアを計算した。その後、H’L’と、HL’とH’Lとの間のより安定な対との間のエネルギー差として、コントラストスコアを計算する。次に、好ましくない結合エネルギースコア及びコントラストスコアを有する配列を破棄するために、設計された配列全てを定義済みフィルタにかけた。
Score12及びTalarisは、ROSETTAにより採用されている2つのスコアリング関数である。両方を使用して、上述の設計手法を分析した。score12については、1,000個のCPUコアを用いて10週間にわたり、手法A及び手法Bを行った。以下の表17に示されるように、手法Aは、275個のユニーク配列を含む36,831個の全アウトプットを返し、手法Bは、184個のユニーク配列を含む3,464個の全アウトプットを返した。Talarisについては、1,000個のCPUコアを用いて5週間にわたり、両方の設計手法を行った。手法Aは、110個のユニーク配列を含む33,286個の全アウトプットを返し、手法Bは、47個のユニーク配列を含む1,253個の全アウトプットを返した。以下の表17を参照されたい。遺伝子の合成及び評価のために、182個の配列を選択した。
*1000個のCPUコア
配列のエネルギースコアに基づいて候補配列を選択したことに加えて、全616個のユニークアウトプット配列の系統樹を生成した。系統樹の各枝は、CH1/CL対合解(pairing solution)の種類を表すものと見なした。この計算プログラムは、コントラストエネルギー(誤対合に対する正確な対合の選択性)を予測するほど十分に的確ではない可能性があるため、各系統の枝から少なくとも1つの配列を選択することにより、全てのアウトプットの良好なサンプリングを行うことができた。実際、以下により詳細に記載されるYT65及びJS78などの最終候補は、それらの比較的弱いコントラストエネルギーにも関わらず、系統学的分析によるとそれらの配列がその他と明確に異なったために選ばれた。
方略番号2を使用して生成された、4D5 CL/CH1変異形の選ばれたアウトプット配列を合成した。軽鎖変異形は、KpnI/HindIII断片として発現ベクターpRK5 hu4D5−8 L鎖(Carter et al.(1992)“Humanization of an anti−p185HER2 antibody for human cancer therapy.Proc.Natl.Acad.Sci.USA 89,4285−9)にクローニングし、重鎖変異形は、ApaI/NdeI断片として発現ベクターpRK5 hu4D5−8 H鎖にクローニングした。重鎖のFc領域は、哺乳動物細胞内での非グリコシル化IgG産生のためのグリコシル化部位(N297G)における変異、及びC末端リジンにおける欠失(ΔK447)を保有した。これらの2個の変異は、精製後の酵素的処理を伴わない容易な質量分析に基づく数量化のための均一なIgGの質量をもたらした。試験対の軽鎖または重鎖遺伝子をそれぞれが保有する4つのプラスミドを、HEK239T細胞(1mlの培養物、96ウェルのディープウェルプレート)にコトランスフェクトすることによって、パートナー抗体であるUCHT1.v9を用いた、方略番号2の変異形のBsIgGの単一細胞での産生を実施した。抗体発現は、37℃で勢いよく振盪しながら7日間にわたって実施した。培養上清を収集し、300μl(50:50スラリー)のMabselect Sure樹脂(GE Healthcare)と共に一晩インキュベートした。次にこの樹脂をフィルタプレートに移し、20倍体積の樹脂ベッドで洗浄した。結合した材料を50mMのリン酸(pH3.0)で溶離させ、20×PBS(pH11.0)で中和した(1:20)。IgGタンパク質をフィルタ(0.22μm)滅菌した。試験した方略番号2の変異形それぞれのIgG収率は、野生型と比較可能であった。
図14に図示されるサンドイッチELISAアッセイを行って、単一細胞共発現からの二重特異性IgG含有量を決定した。まず、方略番号2の変異形に対するベンチマークとしてサンドイッチELISAに使用した二重特異性IgG(BsIgG)標準は、「ノブ」アームとしてのヒト化抗HER2(4D5)と、「ホール」アームとしての抗CD3(UCHT1.v9)とから構成されていた(Zhu et al.(1995)“Identification of heavy chain residues in a humanized anti−CD3 antibody important for efficient antigen binding and T cell activation.”J.Immunol.155,1903−10)。このBsIgG標準は、HEK293T細胞内で各アームを別々に発現させ、次にそれらをインビトロでアニーリングすることによって生成した(Schatz et al.(2013)“Knobs−into−holes antibody production in mammalian cell lines reveals that asymmetric afucosylation is sufficient for full antibody−dependent cellular cytotoxicity.”MAbs 5,872−881)。図14に示されるように、両方の抗原に対する二重特異性抗体の結合が、サンドイッチELISAシグナルの生成に必要とされる。次に、ELISAシグナル強度を、BsIgG標準(インビトロでアセンブルされたもの)のシグナル強度に対するベンチマークテストにかけ(benchmarked)、混合物中のBsIgG含有量を決定した。
簡潔に述べると、ELISAプレート(MaxiSorp,Nunc)をPBS中1μg/mlのHER2−ECD抗原でコーティングし、一晩4℃に保った。次に、抗原でコーティングされたプレートを、1%のBSAを含むPBST(1×PBSに加えて0.05%のTween−20)で1時間ブロッキングした。被験試料を別々の96ウェルプレート内で同じブロッキング緩衝液中に希釈し、1時間室温に保った。ブロッキングされた試料を、HER2でコーティングされた(ブロッキングされた)プレートに移し(100μl/ウェル)、2時間室温でインキュベートした。このプレートをPBSTで15回洗浄した。次に、第2の抗原であるCD3−ビオチンを、100μl/ウェル(ブロッキング緩衝液中0.5μg/mlのCD3−ビオチン)でプレートに加え、2時間室温でインキュベートした。このプレートをPBSTで15回洗浄した。ストレプトアビジン−HRP(Thermo Fisher,Rockford,IL)を、100μl/ウェル(0.1μg/ml)で添加し、30分間室温でインキュベートした。このプレートをPBSTで15回洗浄した。西洋ワサビペルオキシダーゼ基質、Sureblue Reserve TMB溶液(KPL,Gaithersburg,MD)を、100μl/ウェルで添加した。等体積の1.0Mリン酸(H3PO4)の添加によって、発色を停止させた。次に、このプレートをOD450で読み取った。図15に示されるように、4D5アーム内にJS20変異、JS78変異、YS18変異、及びYT65変異を有する変異形は、配列修飾による影響を受けていない野生型配列の正確な重鎖/軽鎖対合の不偏期待量である25%の二重特異性アセンブリ標準を超える、優先的な重鎖/軽鎖対合の増加を示した。
4D5.UCHT1二重特異性抗体について上述のように、軽鎖DNA比及び重鎖DNA比を最適化した。以下の表18に提供される例示的な結果に示されるように、軽鎖比及び重鎖比の最適化は、4D5.UCHT1抗体の二重特異性抗体形成を改善させた。LC
ノブ:LC
ホール:HC
ノブ:HC
ホールについて1:1.4:1:1のDNA比を、後述のさらなる実験で使用した。
*LC
ノブ:LC
ホール:HC
ノブ:HC
ホール
次の変異形抗体を発現させ、軽鎖比の最適化及び重鎖比の最適化の後に精製した:全てEKKE(4D5ノブ、Q39E/Q38K;UCHT1ホール、Q39K/Q38E)との関連での、4D5.UCHT1二重特異性と比較した場合の4D5.UCHT1.JS20、4D5.UCHT1.JS78、4D5.UCHT1.JT25、4D5.UCHT1.YS08、4D5.UCHT1.YS18、及び4D5.UCHT1.YT65。JS78、JT25、YS08、YS18、及びYT65変異は、各変異形の4D5アームに存在した。各変異形により産生された二重特異性抗体の割合を質量分析によって数量化した。これを以下の表19に示す。
S20、JS78、YS18、ならびにYT65重鎖のCH1ドメイン及びCLドメインの部分配列が図16Aに示され、S20、JS78、YS18、ならびにYT65軽鎖のCH1ドメイン及びCLドメインの部分配列が図16Bに示されている。
サンドイッチELISAの結果を、高分解能質量分析によって確認した。高分解能質量分析は、Orbitrap技術の向上した検出能力をEMR Exactive Plus質量分析器で利用する。定量化のために、マイクロスピンカラム(Spin−6、Bio−Rad)または逆相オフラインHPLCを使用して、PBS中の抗体生成物を0.1%トリフルオロ酢酸中に緩衝液交換した。結果として得られた試料画分を質量分析器に直接注いだ。電荷内状態の部分の基線分解能を可能にするように、パラメータをTuneモードで最適化した。Protein Deconvolutionソフトウェア(Thermo、スコアカットオフ50)を使用して、質量包絡線をデコンボリュートした。結果として得られるデコンボリュートされたピークの強度を記録し、これを使用して、「正確な」配列、誤対合、半抗体、及びホモ二量体の存在%を判定した。図17及び18の例示的な結果を参照されたい。図17A及び18Aは、野生型4D5/UCHT1二重特異性抗体に行った質量分析の結果を示し、図17B及び18Bは、4D5アーム上のYT65 CH1/CL変異及びVH−Q39E/VL−Q38K変異、ならびにUCHT1アーム上のVH−Q39K/VL−Q38E変異(「EKKE」)を含む、4D5/UCHT1抗体に行った質量分析の結果を示す。これらの例示的な結果は以下の表20に数量化されており、VH/VL変異及びCH1/CL変異は、単独または組み合わせで、4D5/UCHT1v.9二重特異性における正確な重鎖/軽鎖対合をさらに改善させた。
図16A及び16Bに示されるように、YT65重鎖配列及び軽鎖配列のそれぞれは、5個のアミノ酸置換を含む。YT65重鎖及び軽鎖を、1つ以上の位置における野生型アミノ酸を回復させるようにさらに修飾して、正確な重鎖/軽鎖対合を推進するのに必要とされる変異の最小数を決定した。「復帰変異した(back−mutated)」YT65重鎖及び軽鎖変異形のアミノ酸配列が、図19A及び19Bに提供されている。高分解能質量分析をYT65復帰変異変異形にも行って、かかる変異形が優先的な重鎖/軽鎖対合の増加を同様に示すかどうかを判定した。以下の表21に提供される例示的な結果に示されるように、試験した全ての復帰変異変異形が、二重特異性抗体との関連でLCとHCとの対合の改善を示し、ひいてはそれに従って、2つの半抗体が単一細胞内で発現されたときに正確な二重特異性形成を改善させた。
中性pH条件下での修飾された二重特異性試料の複雑性の定性的検査を、未変性質量分析によって行った。未変性MSは、抗体多量体及び他の形態の凝集物(すなわち、半抗体−単量体相互作用)に関する情報を提供する。SEC HPLCまたはスピンカラムを使用して、試料を10mM酢酸アンモニウム中に緩衝液交換し、直接注入によってEMR MS内に電離させた。10のスコアカットオフでProtein Deconvolutionソフトウェアを使用し、分析を行った。図20Aに示されるように、4D5アーム上のYT65 CH1/CL変異ならびにVL−Q38K変異及びVH−Q39E変異と、UCHT1アーム上のVL−Q38E変異及びVH−Q39K変異とを含む4D5/UCHT1抗体は、正確な重鎖/軽鎖対合の増加を示した。アッセイの感度及び検出限界を決定するため、かつ二重特異性抗体、2xLCノブ抗体、及び2XLCホール抗体種の数量化を補助するために、UCHT1抗体を試料中に混ぜた。図20Aは、2xLCノブ抗体及び2XLCホール抗体種の数量化限界が2.8%未満であることを示す。
図20Bは、図20Aのデータを得るために使用した分析の検出感度を確認する。図20B中、100%正確に対合したHER2/UCHT1を含む試料(すなわち、HER2 LC/HER2 HC/UCHT1 HC/UCHT1 LC、中央のピーク)に、2つのHER2 LCを含む誤対合HER2/UCHT1(すなわち、HER2 LC/HER2 HC/UCHT1 HC/HER2 LC、左のピーク)と、2つのUCHT1 LCを含む誤対合HER2/UCHT1(すなわち、UCHT1 LC/HER2 HC/UCHT1 HC/UCHT1 LC、右のピーク)との両方を、図20Bの左に示されるように、減少する比で混ぜた。図20Bの右に示される測定比は、試料中の種のそれぞれの実際の比と測定比との間に非常にわずかな差しかないことを示す。
実施例3:抗体変異形と野生型抗体とのTm及びK
Dの比較
示差走査熱量測定(DSC)を行って、(a)VH内のQ39E及びVL内のQ38K、(b)CH1内のS183K及びCL内のV133E、(c)VH内のQ39E、VL内のQ38K、CH1内のS183K、及びCL内のV133E、(d)VH内のQ39K及びVL内のQ38E、(e)CH1内のS183E及びCL内のV133K、(f)VH内のQ39K、VL内のQ38E、CH1内のS183E、及びCL内のV133K、(g)CH1及びCL内のYT65変異、または(h)VH内のQ39E及びVL内のQ38KならびにCH1及びCL内のYT65変異を含むように修飾された、4D5Fabの溶融温度を判定した(seeIonescu et al.(2008)J Pharm Sci 97,1414−1426)。並行して、変異を含まない4D5にDSCを行った。以下の表22−1に示される例示的な結果は、本明細書に記載の可変領域及び/または定常領域に導入された変異が、抗体のTmに大きく影響しないことを示す。
表面プラズモン共鳴(SPR)分析を行って、HER2に対する上述の4D5変異形の結合親和性を計算した。以下の表22−2に示される結果は、本明細書に記載の可変領域及び/または定常領域に導入された変異が、抗体のK
Dに大きく影響しないことを示す。
実施例4:他の二重特異性対へのVH/VL変異及びCH1/CL変異の適用
次に、4D5/UCHT1以外の二重特異性抗体における重鎖/軽鎖対合に対するYT65変異、EKKE変異、またはYT65変異及びEKKE変異の効果を分析した。簡潔に述べると、YT65 CH1/CL変異、EKKE VH/VL変異、またはYT65変異とEKKE変異との両方を、次の二重特異性抗体:抗IL4/IL13、抗EGFR/MET、抗VEGFA/ANG2、及び抗VEGFA/VEGFCのそれぞれに導入した。YT65 CH1/CL変異は、各二重特異性抗体のノブアームに導入した。未修飾の二重特異性抗体と修飾された二重特異性抗体とを、上述の高分解能質量分析によって分析した。表23及び図21に提供される例示的な結果に示されるように、EKKE変異及びYT.65変異は、単独または組み合わせで、異なる抗体における二重特異性アセンブリを概して改善させた。親抗体が強い優先的な重鎖/軽鎖対合を既に示す実施例では、さらなる改善は実現または検出が困難である。
上述のように、インビトロ細胞傷害アッセイにおいて、EKKE変異及びYT65ノブ変異を有する抗HER2/CD3抗体の活性を、未修飾の抗HER2/CD3抗体の活性と比較した。図23に示されるように、修飾された抗HER2/CD3抗体と未修飾の抗HER2/CD3抗体との活性は、比較可能であった。
異なるアイソタイプの二重特異性4D5/UCHT1抗体における重鎖/軽鎖対合に対するYT65変異及びEKKE変異の効果を分析した。Q39E
HC1/Q38K
LC1ノブ/Q39K
HC2/Q38E
LC2ホール及びYT65ノブ変異を、ヒトIgG1アイソタイプ、ヒトIgG2アイソタイプ、ヒトIgG4アイソタイプ、及びマウスIgG2aアイソタイプの二重特異性抗4D5/UCHT1抗体に導入した。ヒトIgG2アイソタイプの抗体は、インビトロでのアセンブリに成功することが観察されていない。以下の表24中の例示的な結果は、軽鎖及び重鎖の可変ドメイン内の変異が、異なるアイソタイプのヒト二重特異性抗体において、二重特異性アセンブリを著しく改善させたことを示す。
次に、Q39E
HC1/Q38K
LC1ノブ/Q39K
HC2/Q38E
LC2ホール変異及びYT65ノブ変異を有する二重特異性4D5/UCHT1抗体を発現する、安定細胞株を構築した。電気穿孔によってCHO細胞をトランスフェクトし、MSX(メチオニンスルホキシミン)の存在下で形質転換体を選択した。数週間後に単離物を選び、抗体の力価、及び正確にアセンブルされた二重特異性抗体の割合についてスクリーニングした。14日間のフェドバッチ培養プロセスを用いて、上位のクローンを評価した。二重特異性抗体を採取し、精製し、上述の高分解能質量分析によって分析した。以下の表25に提供される例示的な結果に示されるように、この細胞株から発現された二重特異性抗体の97%超が、正確にアセンブルされた。Q39E
HC1/Q38K
LC1ノブ/Q39K
HC2/Q38E
LC2ホール変異及びYT65ノブ変異を有する4D5/UCHT1抗体を発現する、一過性にトランスフェクトされた細胞株は、90%正確にアセンブルされた二重特異性抗体を発現することが見出された。このような結果は、この安定細胞株によって発現される正確にアセンブルされた二重特異性抗体の割合が、一過性にトランスフェクトされた細胞によって発現されるものと比較可能であることを示す。Q39E
HC1/Q38K
LC1ノブ/Q39K
HC2/Q38E
LC2ホール変異及びV133E/S183Kノブ/V133K/S183Eホール変異または抗IL13/IL4 Q39E
HC1/Q38K
LC1ノブ/Q39K
HC2/Q38E
LC2V133K/S183Eホール変異を有する4D5/UCHT1二重特異性抗体を発現する、安定細胞株を構築した。例示的な結果は、この細胞株から発現された二重特異性抗体の98%または91%超が、正確にアセンブルされたことを示す(表25)。
次に、4D5/UCHT1における重鎖/軽鎖対合に対するYT65変異、EKKE変異、及びV133K/S183E変異の組み合わせの効果を分析した。簡潔に述べると、EKKE変異、ノブアーム(すなわち、4D5アーム)上のYT65変異、及びホールアーム(すなわち、UCHT1アーム)上のV133K/S183E変異を含む4D5/UCHT1二重特異性抗体を構築し、産生し、精製し、上述の高分解能質量分析によって分析した。4D5/UCHT1.YT65
ノブ.V133K/S183E
ホール.EKKEの二重特異性アセンブリを、4D5/UCHT1.V133K/S183E
ホール.EKKEの二重特異性アセンブリと比較した。以下の表26中の例示的な結果は、V133K/S183E
ホール変異及びEKKE変異を有する4D5/UCHT1二重特異性抗体のノブアームへのYT65変異の導入が、正確な重鎖/軽鎖対合をおよそ95%から100%に改善させたことを示す。
さらなる実験を行って、表26中の試験した変異の、他の二重特異性抗体への移行性を査定した。以下の表27中の例示的な結果は、EKKE変異及びYT65
ノブ変異を有する5つの異なる二重特異性抗体のホールアームへのV133K/S183E変異の導入が、正確な重鎖/軽鎖対合をおよそ79〜95%から95〜100%に改善させたことを示す。
追加の実験を行って、表26及び27中の試験した変異の、他のヒトIgGサブクラスの抗HER2/CD3(4D5/UCHT1)二重特異性抗体への移行性を査定した。以下の表28中の例示的な結果は、EKKE変異及びYT65
ノブ変異を有する3つの異なるヒトIgGサブタイプのホールアームへのV133K/S183E変異の導入が、正確な重鎖/軽鎖対合をおよそ77〜85%から98〜100%に改善させたことを示す。
VL−Q38K変異、VH−Q39E変異、及びYT65変異を含む4D5 Fabの結晶構造を、1.72Åの分解能まで判定した。変異体の全体構造は野生型4D5 Fabと比較した有意差を示さず、CH1/CL界面に導入された変異が構造的整合性を撹乱させないことが示される。図22Aを参照されたい。CL−S176F変異及びCH1−F170S変異は、良好な立体構造相補性を示し、十分に充填されたCL/CH1界面をもたらした。これは、表22−1に記載されたYT65変異を含む4D5 Fabの高い熱安定性の観察と一致している。
変異残基CL−S176Fと野生型CH1−F170とは立体構造的に適合性でないため、構造に従って、CL−S176F変異は、変異体LCと野生型HCとの対合を嫌う。CH1−F170S変異が変異体HCと野生型LCとの対合を嫌うのは、そのような対合が、エネルギー的に不安定な疎水性コアにおける空孔を生成するからである。図22Bを参照されたい。したがって、CL−S176FとCH1−F170Sとの間の選択的対合は、正確に対合したBsIgG産生の収量の増加に寄与する。
以下の表29は、異なる組み合わせのEK
ノブ、EK
ホール、KE
ノブ、KE
ホール、EKKE、KEEK、S183E/V133K
ノブ、S183/V133K
ホール、S183K/V133
ノブ、S183K/V133E
ホール、YT65
ノブ、及びYT65
ホールの、抗HER2/CD3 IgG1、抗IL4/IL13 IgG1、抗EGFR/MET IgG1、抗VEGFA/ANG2 IgG1、抗VEGFA/VEGFC IgG1、抗HER2/CD3 IgG2、抗HER2/CD3 IgG4、及び抗HER2/CD3 mIgG2aへの移行性を査定するために行った実験の結果を提供する。以下の表29中の例示的な結果は、変異が正確な重鎖/軽鎖対合を改善させたことを示す。
実施例5:単一細胞で産生した二重特異性抗体の薬物動態研究
EKKE変異、YT65変異、及び/またはV133X/S183X(CL/CH1)変異を含む、単一細胞で産生した抗HER2/CD3ノブ・イン・ホール(knob−in−hole、KIH)二重特異性抗体の薬物動態(PK)特性(例えば非特異性クリアランスなど)を評価し、(a)VH/VL及びCH1/CLに変異を有しない、インビトロでアセンブルされた抗HER2/CD3ノブ・イン・ホール(KIH)二重特異性抗体、ならびに(b)C.B−17 SCIDマウスにおけるトラスツズマブ(すなわち、二価単一特異性抗HER2)と比較するために、追加の研究を設計した。
C.B−17 SCIDマウス(Charles River Laboratories,Hollister,CA)を、5つの群(n=9)に組織化した。第1群の各マウスには、インビトロでアセンブルされた抗HER2/CD3ノブ・イン・ホール二重特異性抗体5mg/kgを、静脈内(IV)に単回投薬した。第2群の各マウスには、インビトロでアセンブルされた抗gD/CD3ノブ・イン・ホール二重特異性抗体5mg/kgを、静脈内(IV)に単回投薬した。第3群の各マウスには、EKKE+YT65ノブ変異を有する、単一細胞で産生した抗HER2/CD3ノブ・イン・ホール二重特異性抗体5mg/kgを、静脈内(IV)に単回投薬した。第4群の各マウスには、EKKE+V133E/S183Kノブ+V133K/S183Eホール変異を有する、単一細胞で産生した抗HER2/CD3ノブ・イン・ホール二重特異性抗体5mg/kgを、静脈内(IV)に単回投薬した。第5群の各マウスには、トラスツズマブ(すなわち、抗HER2単一特異性二価抗体)5mg/kgを、静脈内(IV)に単回投薬した。これらの動物は、研究の開始時に6〜8週齢であり、およそ16.6〜21.4gの重さであった。血液試料を、28日までの様々な時点で大腿静脈から収集した。血清中の全抗体濃度をELISAによって判定し、PK評価に使用した。PKパラメータは、IVボーラス入力モデルを備えた2コンパートメントモデル(モデル8)(Phoenix(商標)WinNonlin(登録商標)、バージョン6.4、Pharsight Corporation、Mountain View,CA)を使用して推定した。公称試料収集時間及び公称用量濃度をデータ分析に使用した。全てのPK分析は、個別の動物の未処理のデータプールに基づいた。
(i)抗HER2/CD3ノブ・イン・ホール二重特異性抗体、(ii)EKKE+YT65ノブ変異を有する抗HER2/CD3ノブ・イン・ホール二重特異性抗体、及び(iii)EKKE+V133E/S183Kノブ+V133K/S183Eホール変異を有する抗HER2/CD3ノブ・イン・ホール二重特異性抗体の血清中濃度を、特異的ELISA(図14に例示されるように、HER2細胞外ドメインでコーティングされ、ビオチン化CD3で検出される)を使用して分析し、定量下限は0.08μg/mLであった。(iv)抗gD/CD3ノブ・イン・ホール二重特異性抗体及び(v)トラスツズマブの血清中濃度は、一般的ELISAを使用して判定した。このアッセイでは、捕捉試薬としてのヒツジ抗ヒトIgG、及び検出試薬としての西洋ワサビペルオキシダーゼと接合したヤギ抗ヒトIgGを使用し、定量下限は0.03μg/mLであった。
全ての抗体が、初期の分布が速くその後の排除が遅い、IgG抗体に典型的な二相性体内動態を示した(図24)。EKKE+YT65
ノブ変異を有する単一細胞で産生した抗HER2/CD3ノブ・イン・ホール二重特異性抗体、及びEKKE+V133E/S183K
ノブ+V133K/S183E
ホール変異を有する抗HER2/CD3ノブ・イン・ホール二重特異性抗体の薬物動態は、従来のインビトロでアセンブルされた抗HER2/CD3ノブ・イン・ホール二重特異性抗体と同様であった(以下の表30を参照されたい)。EKKE+YT65
ノブ変異を有する単一細胞で産生した抗HER2/CD3ノブ・イン・ホール二重特異性抗体、及びEKKE+V133E/S183K
ノブ+V133K/S183E
ホール変異を有する抗HER2/CD3ノブ・イン・ホール二重特異性抗体の薬物クリアランス(CL)は、7.14〜8.08mL/日/kgの範囲であり、t
1/2,βは、9.34〜9.38日の範囲であった。インビトロでアセンブルされた抗HER2/CD3ノブ・イン・ホール二重特異性抗体は、8.23mL/日/kgのCL、及び11.4日のt
1/2,βを有する。インビトロでアセンブルされた抗gD/CD3ノブ・イン・ホール二重特異性抗体は、インビトロでアセンブルされた抗HER2/CD3ノブ・イン・ホール二重特異性抗体と比較してわずかに遅いCL及び長い終末相半減期を有するようであった。この実験では、抗HER2/CD3ノブ・イン・ホール二重特異性抗体、EKKE+YT65
ノブを有する抗HER2/CD3ノブ・イン・ホール二重特異性抗体、及びEKKE+V133E/S183K
ノブ+V133K/S183E
ホールを有する抗HER2/CD3ノブ・イン・ホール二重特異性抗体は、トラスツズマブと比較しておよそ2倍速いクリアランス及び2倍短い半減期を有した。
AUC=血清濃度対時間曲線下面積;
CL=クリアランス;
C
max=最大濃度;IV=静脈内;
PK=薬物動態;
t
1/2,β=ベータ相半減期;
V
1=中央コンパートメントの分布容積;
V
ss=定常状態の分布容積。
先行の実施例は例証目的のためだけに提示されるものであり、本発明の範囲をいかようにも限定することを意図しない。本明細書に示され記載されたものに加えて、本発明の様々な変更形態が前述の説明から当業者には明らかになり、それらは添付の特許請求の範囲に含まれる。