JP6636070B2 - 免疫測定方法及び免疫測定用キット - Google Patents
免疫測定方法及び免疫測定用キット Download PDFInfo
- Publication number
- JP6636070B2 JP6636070B2 JP2018028373A JP2018028373A JP6636070B2 JP 6636070 B2 JP6636070 B2 JP 6636070B2 JP 2018028373 A JP2018028373 A JP 2018028373A JP 2018028373 A JP2018028373 A JP 2018028373A JP 6636070 B2 JP6636070 B2 JP 6636070B2
- Authority
- JP
- Japan
- Prior art keywords
- substance
- measured
- immunoassay
- labeling
- reagent
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Landscapes
- Peptides Or Proteins (AREA)
- Investigating Or Analysing Biological Materials (AREA)
Description
工程(1):測定対象物質と特異的に結合する物質(D)を固定化した固相担体(a)と測定対象物質(G)とを反応させて、物質(D)と測定対象物質(G)との複合体(J)を形成させる工程。
工程(2):標識物質(b)により標識された測定対象物質と特異的に結合する物質(F3)と複合体(J)とをアルカリ土類金属の有機酸塩(C)の含有量が0.05mM〜15mMである溶液中で反応させて、物質(D)と測定対象物質(G)と物質(F3)との複合体(L)を形成させる工程。
工程(2’):固相担体(a)に固定化された測定対象物質と特異的に結合する物質(D)と標識物質(b)により標識された測定対象物質(F1)又はその類似物質(F2)とをアルカリ土類金属の有機酸塩(C)の含有量が0.05mM〜15mMである溶液中で反応させて、物質(D)と物質(F1)又は(F2)との複合体(M)を形成させる工程。
工程(1):測定対象物質と特異的に結合する物質(D)を固定化した固相担体(a)と測定対象物質(G)とを反応させて、物質(D)と測定対象物質(G)との複合体(J)を形成させる工程。
工程(2):標識物質(b)により標識された測定対象物質と特異的に結合する物質(F3)と複合体(J)とをアルカリ土類金属の有機酸塩(C)の含有量が0.05mM〜15mMである溶液中で反応させて、物質(D)と測定対象物質(G)と物質(F3)との複合体(L)を形成させる工程。
工程(2’):固相担体(a)に固定化された測定対象物質と特異的に結合する物質(D)と標識物質(b)により標識された測定対象物質(F1)又はその類似物質(F2)とをアルカリ土類金属の有機酸塩(C)の含有量が0.05mM〜15mMである溶液中で反応させて、物質(D)と物質(F1)又は(F2)との複合体(M)を形成させる工程。
尚、本発明における金属酸化物及び後述の磁性シリカ粒子の体積平均粒子径は、任意の200個の粒子について走査型電子顕微鏡(日本電子株式会社製「JSM−7000F」)で観察して測定された粒子径の平均値である。
酸化鉄の内、特に化学的な安定性に優れることから、マグネタイト、γ−ヘマタイト、マグネタイト−α−ヘマタイト中間酸化鉄及びγ−ヘマタイト−α−ヘマタイト中間酸化鉄からなる群から選ばれる少なくとも1種が好ましく、大きな飽和磁化を有し、外部磁場に対する感応性が優れていることから、マグネタイトが更に好ましい。
超常磁性金属酸化物の含有量が60重量%以上であると、得られた磁性シリカ粒子(a11)の磁性が十分であり、実際の用途面における分離操作を短時間で行えるので好ましい。また、95重量%以下であると、合成が容易である。
体積平均粒子径が1μm以上であると、分離回収を短時間で行える傾向にあり、5μm以下であると、表面積が適度であり、固定化する物質[測定対象物質と特異的に結合する物質(D)]の結合量を適度にすることができ、結合効率がよい。
上記及び以下において、(アルキル)アルコキシシランとは、アルキルアルコキシシラン又はアルコキシシランを意味する。
これらの有機化合物の内、特定の物質(D)を結合させる観点から、官能基を有するアルキルアルコキシシランが更に好ましい。
尚、本発明において用いられる抗体には、パパインやペプシン等の蛋白質分解酵素、或いは化学的分解により生じるFab、F(ab’)2フラグメント等の分解産物も包含される。
ゼラチンとしては、例えばコラーゲンを酸又はアルカリによる化学処理後、加熱処理して製造した酸処理ゼラチン及びアルカリ処理ゼラチン等が挙げられる。更にこのゼラチンをアミノ基、イミノ基、カルボキシル基、メルカプト基及び水酸基等の官能基を周知の方法を利用し導入し、化学的に修飾したゼラチン誘導体を用いることもできる。
ゼラチンの含有量は、固相担体試薬(A)の保存安定性の観点から、固相担体試薬(A)の重量を基準として、1〜8重量%が好ましく、更に好ましくは2〜5重量%である。
タンパク質の含有量は、固相担体試薬(A)の保存安定性の観点から、固相担体試薬(A)の重量を基準として、0〜5重量%が好ましく、更に好ましくは0.1〜3重量%である。
単糖類としては、トリオース(ケトトリオース等)、テトロース(ケトテトロース等)、ペントース(ケトペントース、アルドペントース及びデオキシ糖類等)、ヘキソース[ケトヘキソース(プシコース、フルクトース、ソルボース及びタガトース等)、アルドヘキソース(アロース、アルトロース、グルコース、マンノース、グロース、イドース、ガラクトース及びタロース等)及びデオキシ糖(フコース、フクロース及びラムノース等)等]並びにヘプトース(セドヘプツロース等)等が挙げられる。
二糖類としては、上記単糖類の内、2分子が脱水縮合してグリコシド結合を形成したものが含まれ、具体的には、スクロース、ラクトース、マルトース及びセロビオース等が挙げられる。
多糖類としては、上記単糖類の内、3分子以上が脱水縮合してグリコシド結合を形成したものが含まれ、具体的には、アミロース、アミロペクチン、グリコーゲン、セルロース、ヒアルロン酸、コンドロイチン硫酸及びヘパリンが挙げられる。
糖類は、1種を単独で用いても2種以上を併用してもよい。
糖類としては、固相担体試薬(A)の保存安定性の観点から、二糖類が好ましく、更に好ましくはスクロース及びラクトースである。
糖類の含有量は、固相担体試薬(A)の保存安定性の観点から、固相担体試薬(A)の重量を基準として、5〜40重量%が好ましく、更に好ましくは10〜20重量%である。
無機塩は、1種を単独で用いても2種以上を併用してもよい。
これらの内、固相担体試薬(A)の保存安定性の観点から、塩化ナトリウム、塩化カリウム、塩化マグネシウム、硫酸ナトリウム、硫酸カリウム、硝酸ナトリウム及び硝酸カリウムからなる群から選ばれる少なくとも1種が好ましい。
無機塩の含有量は、固相担体試薬(A)の保存安定性の観点から、固相担体試薬(A)の重量を基準として、0.1〜2重量%が好ましく、更に好ましくは0.5〜1重量%である。
標識物質(b)により標識された測定対象物質の類似物質(F2)に用いられる測定対象物質の類似物質としては、上述の測定対象物質(G)の類似物質と同様のものが挙げられる。
標識物質(b)により標識された測定対象物質と特異的に結合する物質(F3)に用いられる測定対象物質と特異的に結合する物質としては、上述の測定対象物質と特異的に結合する物質(D)と同様のものが挙げられ、好ましいものも同様である。
これらの内、感度等の観点から、酵素、蛍光性物質が好ましく、更に好ましいのはアルカリホスファターゼ、ペルオキシダーゼ及びグルコースオキシダーゼであり、特に好ましいのはペルオキシダーゼである。
緩衝液としては、一般的に免疫測定の分野で用いられている、例えばトリス緩衝液、リン酸緩衝液、ベロナール緩衝液、ホウ酸緩衝液及びグッド緩衝液等が挙げられ、そのpHは、抗原抗体反応を抑制しない範囲であればよく、5〜9が好ましい。
また、このような緩衝液中には、目的の抗原抗体反応を阻害しないものであれば、例えばアルブミン、グロブリン、水溶性ゼラチン、ポリエチレングリコール等の安定化剤、界面活性剤及び糖類等を含有させておいてもよい。
アルカリ土類金属としては、非特異反応の低減の観点から、マグネシウム及びカルシウムが好ましく、特にマグネシウムが好ましい。
有機酸塩(C)を構成する有機酸としては、炭素数1〜5の有機酸、具体的には、カルボン酸{炭素数1〜5のモノカルボン酸(ギ酸、酢酸、プロピオン酸、酪酸及びイソ酪酸等)、炭素数2〜5のポリカルボン酸(2〜3価のものが含まれ、具体的にはシュウ酸、シュウ酸、マロン酸及びコハク酸等)等}並びにスルホン酸(炭素数1〜5のものが含まれ、具体的には、メタンスルホン酸、エタンスルホン酸、ブタンスルホン酸及びオクタンスルホン酸等)等が挙げられる。
有機酸としては、水への溶解性の観点から、炭素数1〜5の有機酸が好ましく、更に好ましいのは炭素数1〜5のカルボン酸であり、更に好ましいのはギ酸、酢酸及びシュウ酸であり、特に好ましいのは酢酸である。
有機酸塩(C)としては、水への溶解性の観点から、ギ酸マグネシウム、酢酸マグネシウム及びシュウ酸マグネシウムからなる群から選ばれる少なくとも1種が好ましく、更に好ましいのは酢酸マグネシウムである。
アルカリ土類金属の有機酸塩(C)は、1種を単独で用いても2種以上を併用してもよい。
タンパク質としては、一般的に免疫測定の分野で測定されるものであれば特に限定はされず、例えば、ウシ血清アルブミン(BSA)、カゼイン、スキムミルク等が挙げられる。タンパク質は、1種を単独で用いても2種以上を併用してもよい。
タンパク質の含有量は、感度及び試薬の保存安定性の観点から、標識試薬(B)の重量を基準として、0.001〜8重量%が好ましい。
尚、水溶性とは、25℃の水100gに10g溶解することを意味する。
水溶性の非イオン界面活性剤として、具体的には、HLBが12以上のポリオキシエチレンノニルフェニルエーテル、ポリオキシエチレンオクチルエーテル、ポリオキシエチレンアルキルエーテル及びポリオキシエチレンソルビタン脂肪族エステル等が挙げられる。
界面活性剤の含有量は、粒子の洗浄性の観点から、標識試薬(B)の重量を基準として、0.001〜4重量%である。
高分子化合物は、1種を単独で用いても2種以上を併用してもよい。
高分子化合物の含有量は、非特異的反応の抑制の観点から、標識試薬(B)の重量を基準として、高分子化合物の純分が、0.001〜3重量%であることが好ましく、更に好ましくは0.5〜1重量%である。
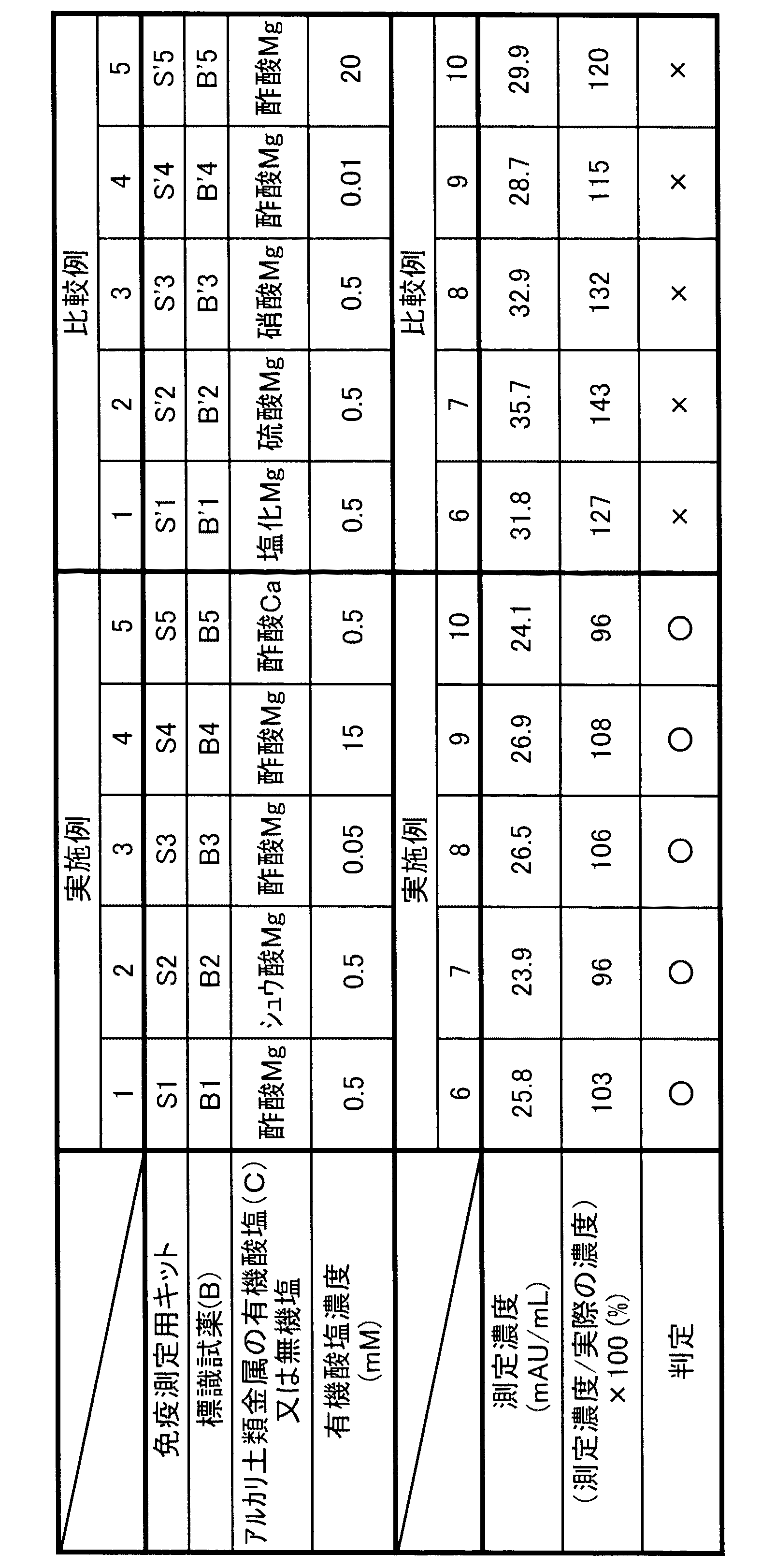
(C)の含有量が0.05mM未満であると、非特異反応を低減できず、正確性が低くなるという問題がある。また、15mMより大きいと、非特異反応が低減できず、正確性が低くなり、更に感度が低くなるという問題がある。
化学発光試薬(E)は、上記の標識物質(b)に基づき選択され、例えば、標識物質(b)がペルオキシダーゼである場合、2,3−ジヒドロ−1,4−フタラジンジオン化合物及び化学発光増強剤を必須構成成分とする化学発光試薬第1液と、酸化剤及び水を必須構成成分とする化学発光試薬第2液とを含む。
これらの内、ルミノール、イソルミノール、N−アミノヘキシル−N−エチルイソルミノール(AHEI)、N−アミノブチル−N−エチルイソルミノール(ABEI)及びこれらの金属塩(アルカリ金属塩等)が好ましく、更に好ましいのはルミノール及びその金属塩、特に好ましいのはルミノールのナトリウム塩である。
尚、pHは、JIS K0400−12−10:2000に準拠して測定温度25℃で測定される。
これらの内、保存安定性等の観点から、過酸化水素、過ホウ酸ナトリウム及び過ホウ酸カリウムが好ましく、更に好ましいのは過酸化水素である。
以下に示す方法により、固相担体試薬(A1)(抗PIVKA−IIモノクローナル抗体を固定化した磁性シリカ粒子を含有)、標識試薬(B1)(POD標識抗プロトロンビン抗体試薬)、免疫反応緩衝液、ルミノール発光試薬(E1)及び過酸化水素液(E2)から構成される本発明の免疫測定用キット(S1)を得た。
反応容器に塩化鉄(III)6水和物186部、塩化鉄(II)4水和物68部及び水1288部を仕込んで溶解させて50℃に昇温し、撹拌下温度を50〜55℃の保持しながら、25重量%アンモニア水280部を1時間かけて滴下し、水中にマグネタイト粒子を得た。得られたマグネタイト粒子に分散剤であるオレイン酸64部を加え、2時間撹拌を継続した。室温に冷却後、デカンテーションにより固液分離して得られたオレイン酸が吸着したマグネタイト粒子を水1000部で洗浄する操作を3回行い、更にアセトン1000部で洗浄する操作を2回行い、40℃で2日間乾燥させることで、体積平均粒子径が15nmの超常磁性金属酸化物粒子を得た。
磁性シリカ粒子の任意の20個について、走査型電子顕微鏡(型番JSM−7000F、メーカー名日本電子株式会社)で観察し、エネルギー分散型X線分光装置(型番INCA Wave/Energy、メーカー名オックスフォード社)により超常磁性金属酸化物粒子の含有量を測定し、その平均値を含有量Sとした。また、同測定にてシリカの含有量を測定し、その平均値を含有量Tとした。以下の計算式(1)にて、超常磁性金属酸化物粒子の含有量を求めた。
超常磁性金属酸化物粒子の含有量(重量%)={(S)/(S+T)}×100・・・(1)
1重量%γ−アミノプロピルトリエトキシシラン含有水溶液40mLの入った蓋付きポリスチレン瓶に上記で製造した磁性シリカ粒子40mgを加え、25℃で1時間反応させ、ネオジウム磁石で磁性シリカ粒子を集磁後、液をアスピレーターで吸引除去した。次いで脱イオン水40mLを加えて蓋をし、ポリスチレン瓶をゆっくりと2回倒置攪拌した後、ネオジウム磁石で磁性シリカ粒子を集磁後、液をアスピレーターで吸引除去して磁性シリカ粒子を洗浄した。この洗浄操作を5回行った。次いで、この洗浄後の磁性シリカ粒子を2重量%グルタルアルデヒド含有水溶液40mLの入った蓋付きポリスチレン瓶に加え、25℃で1時間反応させた。そして、脱イオン水40mLを加えて蓋をし、ポリスチレン瓶をゆっくりと2回倒置攪拌したのち、ネオジウム磁石で磁性シリカ粒子を集磁後、液をアスピレーターで吸引除去して磁性シリカ粒子を洗浄した。この洗浄操作を10回行った。更にこの洗浄後の磁性シリカ粒子を抗PIVKA−IIモノクローナル抗体(D−1)[コスモ・バイオ(株)製]を10μg/mLの濃度で含む0.02Mリン酸緩衝液(pH=8.7)120mLの入った蓋付きポリスチレン瓶に加え、25℃で1時間反応させた。反応後、ネオジウム磁石で磁性シリカ粒子を集磁後、抗PIVKA−IIモノクローナル抗体(D−1)含有リン酸緩衝液を除去した。次いで、得られた磁性シリカ粒子を1重量%のブロックエース[DSファーマバイオメディカル(株)製]含有の0.02Mリン酸緩衝液(pH7.0)40mLの入った蓋付きポリエチレン瓶に40mg加え、25℃で12時間浸漬させた。これにより、抗PIVKA−IIモノクローナル抗体(D−1)を固定化した磁性シリカ粒子を含有する固相担体試薬(A1)を得た。
抗プロトロンビンモノポリクローナル抗体[(株)アットモル製]、西洋ワサビ由来POD[東洋紡(株)製]を用い、文献(エス・ヨシタケ、エム・イマガワ、イー・イシカワ、エトール;ジェイ.バイオケム,Vol.92,1982,1413−1424)に記載の方法でPODで標識された抗プロトロンビン抗体(F3)を調製した。これを1.0重量%のカゼイン加水分解物[和光純薬工業(株)製]、0.5mM酢酸マグネシウム四水和物[ナカライテスク(株)製]含有の0.02Mリン酸緩衝液で、POD標識抗プロトロンビン抗体(F3)濃度として0.5μg/mLの濃度に希釈し、標識試薬(B1)を調製し、冷蔵(2〜10℃)で保存した。
ウシ血清アルブミン(Boval Campany製)を0.1重量%、エマルミンL−90−S[三洋化成工業(株)製]を1重量%、塩化ナトリウム[和光純薬工業(株)製]を0.85重量%を含有する0.02Mリン酸緩衝液(pH7.0)を調製し、冷蔵(2〜10℃)で保管した。
ルミノールのナトリウム塩[シグマ アルドリッチ ジャパン(株)製]0.7g及び4−(シアノメチルチオ)フェノール0.1gを1,000mLメスフラスコに仕込んだ。3−[4−(2−ヒドロキシエチル)−1−ピペラジニル]プロパンスルホン酸/水酸化ナトリウム緩衝液(10mM、pH=8.6)を溶液の容量が1,000mLになるように仕込み、25℃で均一混合してルミノール発光試薬(E1)を調製した。測定に用いるまで冷蔵(2〜10℃)保存した。
過酸化水素[和光純薬工業(株)製、試薬特級、濃度30重量%]6.6gを1,000mLメスフラスコに仕込んだ。脱イオン水を溶液の容量が1,000mLになるように仕込み、25℃で均一混合して過酸化水素液(E2)を調製した。測定に用いるまで冷蔵(2〜10℃)保存した。
実施例1の「標識試薬(B1)の作製」において、アルカリ土類金属の有機酸塩(C)の種類及び濃度を表1に記載のものとする以外は実施例1と同様にして標識試薬(B2)〜(B5)を作製し、実施例1と同じ固相担体試薬(A1)、免疫反応緩衝液、ルミノール発光試薬(E1)及び過酸化水素液(E2)と組み合わせて免疫測定用キット(S2)〜(S5)とした。
実施例1の「標識試薬(B1)の作製」において、アルカリ土類金属の有機酸塩(C)又は無機塩の種類及び濃度を表1に記載のものとする以外は実施例1と同様にして標識試薬(B’1)〜(B’5)を作製し、実施例1と同じ固相担体試薬(A1)、免疫反応緩衝液、ルミノール発光試薬(E1)及び過酸化水素液(E2)と組み合わせて比較用の免疫測定用キット(S’1)〜(S’5)とした。
酢酸Mg:「酢酸マグネシウム四水和物」、ナカライテスク(株)製
シュウ酸Mg:「シュウ酸マグネシウム二水和物」、和光純薬工業(株)製
酢酸Ca:「酢酸カルシウム一水和物」、ナカライテスク(株)製
塩化Mg:「塩化マグネシウム」、和光純薬工業(株)製
硫酸Mg:「硫酸マグネシウム」、和光純薬工業(株)製
硝酸Mg:「硝酸マグネシウム六水和物」、ナカライテスク(株)製
<免疫測定方法>
○工程(1)
実施例及び比較例で得られた免疫測定用キットの固相担体試薬(A1)をそれぞれ0.025mL、試験管に入れ、試験管の外側からネオジウム磁石で磁性シリカ粒子を10秒間集め、試験管中の液をアスピレーターで除き、ネオジウム磁石を側面から十分に離し、免疫反応緩衝液0.2mLと、測定対象物質であるPIVKA−II抗原(G)の濃度が25mAU/mLになるように調製したプール血清0.025mLとを試験管に入れて混合して、試験管中で37℃で3分間反応させ、抗PIVKA−IIモノクローナル抗体固定化磁性シリカ粒子上の抗PIVKA−IIモノクローナル抗体(D−1)とPIVKA―II(G)との複合体(J)を形成させた。反応後、試験管の外側からネオジウム磁石で磁性シリカ粒子を10秒間集め、試験管中の液をアスピレーターで除き、ネオジウム磁石を側面から十分に離し、生理食塩水0.5mLを加えて磁性シリカ粒子を分散させて集磁後、アスピレーターで液を除く洗浄操作を3回行った。
続いて、それぞれの免疫測定用キットの標識試薬0.1mLをそれぞれ試験管に注入し、試験管中で37℃で3分間反応させ、抗PIVKA−IIモノクローナル抗体固定化磁性シリカ粒子上に抗PIVKA−IIモノクローナル抗体(D−1)とPIVKA―II(G)とPOD標識抗プロトロンビン抗体(F3)との複合体(L)を形成させた。反応後、試験管の外側からネオジウム磁石で磁性シリカ粒子を10秒間集め、試験管中の液をアスピレーターで除き、ネオジウム磁石を側面から十分に離し、生理食塩水0.5mLを加えて磁性シリカ粒子を分散させて集磁後、アスピレーターで液を除く洗浄操作を2回行った。
最後に、ルミノール発光試薬(E1)0.1mLと過酸化水素液(E2)0.1mLとを同時に加え、37℃で発光反応させ、ルミノール発光試薬(E1)及び過酸化水素液(E2)を添加後40〜45秒の一秒当たりの平均発光量をルミノメーター[ベルトールドジャパン社製「Lumat LB9507」]で測定した。
標準液:免疫反応緩衝液にてPIVKA−II抗原(G)の濃度を0〜100mAU/mL(濃度ポイント:0、25、50、100mAU/mL)に調整したもの
正確性については、測定濃度と実際の濃度「25mAU/mL」との比率から、以下の基準で判定した。
○:(測定濃度/実際の濃度)×100=90%〜110%
×:(測定濃度/実際の濃度)×100<90%又は>110%
尚、測定濃度/実際の測定濃度が100%に近いほど、正確性が高いことを意味する。
Claims (8)
- 試料中の測定対象物質(G)の濃度を測定する免疫測定方法であって、下記工程(1)と、工程(2)又は工程(2’)とを含む免疫測定方法。
工程(1):測定対象物質と特異的に結合する物質(D)を固定化した固相担体(a)と測定対象物質(G)とを反応させて、物質(D)と測定対象物質(G)との複合体(J)を形成させる工程。
工程(2):標識物質(b)により標識された測定対象物質と特異的に結合する物質(F3)と複合体(J)とをアルカリ土類金属の有機酸塩(C)の含有量が0.05mM〜15mMである溶液中で反応させて、物質(D)と測定対象物質(G)と物質(F3)との複合体(L)を形成させる工程。
工程(2’):固相担体(a)に固定化された測定対象物質と特異的に結合する物質(D)と標識物質(b)により標識された測定対象物質(F1)又はその類似物質(F2)とをアルカリ土類金属の有機酸塩(C)の含有量が0.05mM〜15mMである溶液中で反応させて、物質(D)と物質(F1)又は(F2)との複合体(M)を形成させる工程。 - アルカリ土類金属の有機酸塩(C)が、ギ酸マグネシウム、酢酸マグネシウム及びシュウ酸マグネシウムからなる群から選ばれる少なくとも1種である請求項1記載の免疫測定方法。
- 固相担体(a)が、磁性粒子(a1)である請求項1又は2記載の免疫測定方法。
- 磁性粒子(a1)が、体積平均粒子径が1〜20nmの超常磁性金属酸化物を磁性粒子(a1)の重量を基準として60〜95重量%含有する磁性シリカ粒子(a11)である請求項3記載の免疫測定方法。
- 標識物質(b)が、ペルオキシダーゼである請求項1〜4のいずれか記載の免疫測定方法。
- 測定対象物質(G)がPIVKA−IIであり、物質(D)が抗PIVKA−IIモノクローナル抗体であり、物質(F3)が標識物質(b)で標識された抗プロトロンビン抗体である請求項1〜5のいずれか記載の免疫測定方法。
- 免疫測定用試薬として固相担体試薬(A)と標識試薬(B)とを含む免疫測定用キットであって、測定対象物質と特異的に結合する物質(D)を固定化した固相担体(a)を固相担体試薬(A)中に含有し、標識物質(b)により標識された測定対象物質(F1)、その類似物質(F2)又は標識物質(b)により標識された測定対象物質と特異的に結合する物質(F3)と、アルカリ土類金属の有機酸塩(C)とを標識試薬(B)中に含有する請求項1〜6のいずれか記載の免疫測定方法に用いられる免疫測定用キット。
- 更にルミノール発光試薬(E1)及び過酸化水素液(E2)を含む化学発光試薬(E)を含み、標識試薬(B)中の標識物質がペルオキシダーゼである請求項7記載の免疫測定用キット。
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2017034602 | 2017-02-27 | ||
| JP2017034602 | 2017-02-27 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2018141780A JP2018141780A (ja) | 2018-09-13 |
| JP6636070B2 true JP6636070B2 (ja) | 2020-01-29 |
Family
ID=63526610
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2018028373A Active JP6636070B2 (ja) | 2017-02-27 | 2018-02-21 | 免疫測定方法及び免疫測定用キット |
Country Status (1)
| Country | Link |
|---|---|
| JP (1) | JP6636070B2 (ja) |
Families Citing this family (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN111579778B (zh) * | 2020-05-07 | 2023-02-03 | 广州市妇女儿童医疗中心(广州市妇幼保健院、广州市儿童医院、广州市妇婴医院、广州市妇幼保健计划生育服务中心) | 支气管肺泡灌洗液中的IgE作为急性期腺病毒肺炎的病程诊断标记物的应用 |
Family Cites Families (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE69228817T2 (de) * | 1991-07-26 | 1999-09-23 | Dade Chemistry Systems Inc., Deerfield | Signalerkennungspruefung in der anwesenheit von einem suspendierten festen träger |
| JP3162125B2 (ja) * | 1991-10-01 | 2001-04-25 | 積水化学工業株式会社 | 免疫測定用磁性固相担体 |
| JP3993670B2 (ja) * | 1997-09-26 | 2007-10-17 | アルフレッサファーマ株式会社 | 感作金属コロイド試薬溶液の安定化方法および安定な感作金属コロイド試薬含有溶液 |
| JP5428166B2 (ja) * | 2007-06-29 | 2014-02-26 | Jnc株式会社 | 磁性粒子の凝集及び分散方法並びにこれを用いた分離、検出方法及び検出用キット |
| WO2012161288A1 (en) * | 2011-05-20 | 2012-11-29 | Abbott Japan Co. Ltd. | Immunoassay methods and reagents for decreasing nonspecific binding |
| JP5350516B2 (ja) * | 2011-06-15 | 2013-11-27 | 三洋化成工業株式会社 | 磁性粒子及びその製造方法 |
-
2018
- 2018-02-21 JP JP2018028373A patent/JP6636070B2/ja active Active
Also Published As
| Publication number | Publication date |
|---|---|
| JP2018141780A (ja) | 2018-09-13 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN103597353B (zh) | 使用磁性二氧化硅颗粒的测定方法和该测定方法用试剂 | |
| JP6182520B2 (ja) | 磁性シリカ粒子、該磁性シリカ粒子を用いた測定対象物質測定方法及び測定対象物質測定用試薬 | |
| JP5844195B2 (ja) | 磁性シリカ粒子並びにこれを用いた免疫測定法及び免疫測定用試薬 | |
| JP7578741B2 (ja) | 免疫学的測定方法、免疫学的測定用キット及び固相担体試薬 | |
| JP7269906B2 (ja) | 免疫測定用試薬、免疫測定用キット及び免疫測定方法 | |
| JP6636070B2 (ja) | 免疫測定方法及び免疫測定用キット | |
| JP6449221B2 (ja) | 粒子組成物、免疫測定用試薬及び免疫測定方法 | |
| JP5786188B2 (ja) | 試料中のc反応性蛋白質の測定試薬、測定方法及び測定範囲の拡大方法 | |
| JP2016136130A (ja) | 免疫測定用試薬及び免疫測定方法 | |
| JP2010101703A (ja) | 免疫学的測定方法および測定用試薬キット | |
| JP6635985B2 (ja) | 免疫測定用試薬、免疫測定用キット及び免疫測定方法 | |
| JP6636072B2 (ja) | 免疫測定用試薬、免疫測定用キット及び免疫測定方法 | |
| JP6672353B2 (ja) | 免疫測定方法及びそれに用いられる免疫測定用キット | |
| JP7431711B2 (ja) | 免疫測定方法及び免疫測定用キット | |
| JP7191913B2 (ja) | 免疫測定方法及び免疫測定用キット | |
| JP2018124277A (ja) | 粒子含有組成物、免疫測定用試薬、免疫測定方法及び粒子の保存方法 | |
| JP6646691B2 (ja) | 抗原又は抗体固定化粒子及び免疫測定試薬の製造方法並びに免疫測定方法 | |
| JP2019052905A (ja) | 免疫測定方法、免疫測定用試薬及びこれを含む免疫測定用キット | |
| JP7627161B2 (ja) | 免疫測定用試薬、免疫測定用キット及び免疫測定方法 | |
| JP7211748B2 (ja) | 免疫測定用試薬、免疫測定用キット及び免疫測定方法 | |
| JP6767452B2 (ja) | 免疫測定用試薬、免疫測定用キット及び免疫測定方法 | |
| JP3684454B2 (ja) | 沈殿可能な固相を用いる不均一系イムノアッセイ | |
| JP2019070645A (ja) | ペルオキシダーゼ標識抗体含有水溶液の製造方法及び免疫測定方法 | |
| JP2001050961A (ja) | 流動性改善剤 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20190307 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20191122 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20191203 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20191217 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 6636070 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |