JP5867950B2 - 癒着防止剤 - Google Patents
癒着防止剤 Download PDFInfo
- Publication number
- JP5867950B2 JP5867950B2 JP2015514792A JP2015514792A JP5867950B2 JP 5867950 B2 JP5867950 B2 JP 5867950B2 JP 2015514792 A JP2015514792 A JP 2015514792A JP 2015514792 A JP2015514792 A JP 2015514792A JP 5867950 B2 JP5867950 B2 JP 5867950B2
- Authority
- JP
- Japan
- Prior art keywords
- mono
- glycerol
- mmol
- adhesion
- erythritol
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 230000000181 anti-adherent effect Effects 0.000 title claims description 15
- 239000000853 adhesive Substances 0.000 title description 7
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 claims description 217
- 150000001875 compounds Chemical class 0.000 claims description 197
- -1 Mono-O- (5,9,13,17-tetramethyloctadeca-4-enoyl) diglycerol Chemical compound 0.000 claims description 122
- 239000003795 chemical substances by application Substances 0.000 claims description 92
- 239000004386 Erythritol Substances 0.000 claims description 81
- UNXHWFMMPAWVPI-UHFFFAOYSA-N Erythritol Natural products OCC(O)C(O)CO UNXHWFMMPAWVPI-UHFFFAOYSA-N 0.000 claims description 81
- 235000019414 erythritol Nutrition 0.000 claims description 81
- 229940009714 erythritol Drugs 0.000 claims description 81
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 claims description 72
- 239000007788 liquid Substances 0.000 claims description 56
- UNXHWFMMPAWVPI-ZXZARUISSA-N erythritol Chemical compound OC[C@H](O)[C@H](O)CO UNXHWFMMPAWVPI-ZXZARUISSA-N 0.000 claims description 53
- WXZMFSXDPGVJKK-UHFFFAOYSA-N pentaerythritol Chemical compound OCC(CO)(CO)CO WXZMFSXDPGVJKK-UHFFFAOYSA-N 0.000 claims description 41
- SRBFZHDQGSBBOR-IOVATXLUSA-N D-xylopyranose Chemical compound O[C@@H]1COC(O)[C@H](O)[C@H]1O SRBFZHDQGSBBOR-IOVATXLUSA-N 0.000 claims description 36
- 125000002887 hydroxy group Chemical group [H]O* 0.000 claims description 32
- GPLRAVKSCUXZTP-UHFFFAOYSA-N diglycerol Chemical compound OCC(O)COCC(O)CO GPLRAVKSCUXZTP-UHFFFAOYSA-N 0.000 claims description 31
- 230000003405 preventing effect Effects 0.000 claims description 28
- 239000012736 aqueous medium Substances 0.000 claims description 27
- KIUKXJAPPMFGSW-DNGZLQJQSA-N (2S,3S,4S,5R,6R)-6-[(2S,3R,4R,5S,6R)-3-Acetamido-2-[(2S,3S,4R,5R,6R)-6-[(2R,3R,4R,5S,6R)-3-acetamido-2,5-dihydroxy-6-(hydroxymethyl)oxan-4-yl]oxy-2-carboxy-4,5-dihydroxyoxan-3-yl]oxy-5-hydroxy-6-(hydroxymethyl)oxan-4-yl]oxy-3,4,5-trihydroxyoxane-2-carboxylic acid Chemical compound CC(=O)N[C@H]1[C@H](O)O[C@H](CO)[C@@H](O)[C@@H]1O[C@H]1[C@H](O)[C@@H](O)[C@H](O[C@H]2[C@@H]([C@@H](O[C@H]3[C@@H]([C@@H](O)[C@H](O)[C@H](O3)C(O)=O)O)[C@H](O)[C@@H](CO)O2)NC(C)=O)[C@@H](C(O)=O)O1 KIUKXJAPPMFGSW-DNGZLQJQSA-N 0.000 claims description 19
- 229920002674 hyaluronan Polymers 0.000 claims description 19
- 229960003160 hyaluronic acid Drugs 0.000 claims description 19
- PYMYPHUHKUWMLA-UHFFFAOYSA-N arabinose Natural products OCC(O)C(O)C(O)C=O PYMYPHUHKUWMLA-UHFFFAOYSA-N 0.000 claims description 18
- SRBFZHDQGSBBOR-UHFFFAOYSA-N beta-D-Pyranose-Lyxose Natural products OC1COC(O)C(O)C1O SRBFZHDQGSBBOR-UHFFFAOYSA-N 0.000 claims description 18
- 150000003839 salts Chemical class 0.000 claims description 16
- UAKIZGGUVUHCPF-UHFFFAOYSA-N CC(C)=CCCC(C)=CCCC(C)=CCCC(C)=CCCC(=O)OCC(O)CO Chemical compound CC(C)=CCCC(C)=CCCC(C)=CCCC(C)=CCCC(=O)OCC(O)CO UAKIZGGUVUHCPF-UHFFFAOYSA-N 0.000 claims description 14
- 239000007789 gas Substances 0.000 claims description 14
- 125000004435 hydrogen atom Chemical group [H]* 0.000 claims description 14
- 125000004430 oxygen atom Chemical group O* 0.000 claims description 12
- RMCSTOQSLGWIKN-UHFFFAOYSA-N CC(C)=CCCC(C)=CCCC(C)=CCCC(C)=CCCC(=O)OCC(CO)(CO)CO Chemical compound CC(C)=CCCC(C)=CCCC(C)=CCCC(C)=CCCC(=O)OCC(CO)(CO)CO RMCSTOQSLGWIKN-UHFFFAOYSA-N 0.000 claims description 9
- GDVTUROYCKNYSB-UHFFFAOYSA-N CC(C)=CCCC(C)=CCCC(C)=CCCC(=O)OCC(O)CO Chemical compound CC(C)=CCCC(C)=CCCC(C)=CCCC(=O)OCC(O)CO GDVTUROYCKNYSB-UHFFFAOYSA-N 0.000 claims description 8
- 229920002545 silicone oil Polymers 0.000 claims description 7
- WYVPJYXMKUJLDF-UHFFFAOYSA-N CC(C)=CCCC(C)=CCCC(C)=CCCC(C)=CCCCOCC(CO)(CO)CO Chemical compound CC(C)=CCCC(C)=CCCC(C)=CCCC(C)=CCCCOCC(CO)(CO)CO WYVPJYXMKUJLDF-UHFFFAOYSA-N 0.000 claims description 6
- KGUZVMZECWLOTQ-UHFFFAOYSA-N 2,3-dihydroxypropyl 5,9,13-trimethyltetradecanoate Chemical compound CC(C)CCCC(C)CCCC(C)CCCC(=O)OCC(O)CO KGUZVMZECWLOTQ-UHFFFAOYSA-N 0.000 claims description 5
- IFWMHOKJHZZASA-UHFFFAOYSA-N 2,3-dihydroxypropyl 5,9,13-trimethyltetradec-4-enoate Chemical compound CC(C)CCCC(C)CCCC(C)=CCCC(=O)OCC(O)CO IFWMHOKJHZZASA-UHFFFAOYSA-N 0.000 claims description 4
- 230000004888 barrier function Effects 0.000 claims description 4
- 239000003937 drug carrier Substances 0.000 claims description 4
- 239000008180 pharmaceutical surfactant Substances 0.000 claims description 4
- 239000004973 liquid crystal related substance Substances 0.000 description 110
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 106
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 87
- 235000011187 glycerol Nutrition 0.000 description 84
- 230000015572 biosynthetic process Effects 0.000 description 80
- 238000000425 proton nuclear magnetic resonance spectrum Methods 0.000 description 75
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 69
- 239000000243 solution Substances 0.000 description 68
- 238000003786 synthesis reaction Methods 0.000 description 68
- 238000005259 measurement Methods 0.000 description 59
- 238000012360 testing method Methods 0.000 description 58
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 57
- 239000007864 aqueous solution Substances 0.000 description 50
- 239000000203 mixture Substances 0.000 description 48
- UIIMBOGNXHQVGW-UHFFFAOYSA-M Sodium bicarbonate Chemical compound [Na+].OC([O-])=O UIIMBOGNXHQVGW-UHFFFAOYSA-M 0.000 description 44
- 239000000499 gel Substances 0.000 description 39
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 38
- 239000007921 spray Substances 0.000 description 37
- 238000011156 evaluation Methods 0.000 description 34
- 238000000034 method Methods 0.000 description 33
- 210000001519 tissue Anatomy 0.000 description 31
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 30
- 238000006243 chemical reaction Methods 0.000 description 29
- CSNNHWWHGAXBCP-UHFFFAOYSA-L Magnesium sulfate Chemical compound [Mg+2].[O-][S+2]([O-])([O-])[O-] CSNNHWWHGAXBCP-UHFFFAOYSA-L 0.000 description 28
- 150000002632 lipids Chemical class 0.000 description 26
- 229920006395 saturated elastomer Polymers 0.000 description 25
- RBNPOMFGQQGHHO-UHFFFAOYSA-N -2,3-Dihydroxypropanoic acid Natural products OCC(O)C(O)=O RBNPOMFGQQGHHO-UHFFFAOYSA-N 0.000 description 24
- 238000005507 spraying Methods 0.000 description 23
- 229910000030 sodium bicarbonate Inorganic materials 0.000 description 22
- 235000017557 sodium bicarbonate Nutrition 0.000 description 22
- HPALAKNZSZLMCH-UHFFFAOYSA-M sodium;chloride;hydrate Chemical class O.[Na+].[Cl-] HPALAKNZSZLMCH-UHFFFAOYSA-M 0.000 description 22
- 238000003756 stirring Methods 0.000 description 22
- 239000002270 dispersing agent Substances 0.000 description 21
- 238000001914 filtration Methods 0.000 description 21
- 239000003153 chemical reaction reagent Substances 0.000 description 20
- 238000010898 silica gel chromatography Methods 0.000 description 19
- 238000005160 1H NMR spectroscopy Methods 0.000 description 18
- RBNPOMFGQQGHHO-UWTATZPHSA-N D-glyceric acid Chemical compound OC[C@@H](O)C(O)=O RBNPOMFGQQGHHO-UWTATZPHSA-N 0.000 description 18
- 210000000056 organ Anatomy 0.000 description 18
- 239000000443 aerosol Substances 0.000 description 16
- 239000011248 coating agent Substances 0.000 description 16
- RTZKZFJDLAIYFH-UHFFFAOYSA-N ether Substances CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 16
- BWHMMNNQKKPAPP-UHFFFAOYSA-L potassium carbonate Chemical compound [K+].[K+].[O-]C([O-])=O BWHMMNNQKKPAPP-UHFFFAOYSA-L 0.000 description 16
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 15
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 15
- PMZURENOXWZQFD-UHFFFAOYSA-L Sodium Sulfate Chemical compound [Na+].[Na+].[O-]S([O-])(=O)=O PMZURENOXWZQFD-UHFFFAOYSA-L 0.000 description 15
- 229920002385 Sodium hyaluronate Polymers 0.000 description 15
- 239000002253 acid Substances 0.000 description 15
- 230000000694 effects Effects 0.000 description 15
- 210000004303 peritoneum Anatomy 0.000 description 15
- 229940010747 sodium hyaluronate Drugs 0.000 description 15
- YWIVKILSMZOHHF-QJZPQSOGSA-N sodium;(2s,3s,4s,5r,6r)-6-[(2s,3r,4r,5s,6r)-3-acetamido-2-[(2s,3s,4r,5r,6r)-6-[(2r,3r,4r,5s,6r)-3-acetamido-2,5-dihydroxy-6-(hydroxymethyl)oxan-4-yl]oxy-2-carboxy-4,5-dihydroxyoxan-3-yl]oxy-5-hydroxy-6-(hydroxymethyl)oxan-4-yl]oxy-3,4,5-trihydroxyoxane-2- Chemical compound [Na+].CC(=O)N[C@H]1[C@H](O)O[C@H](CO)[C@@H](O)[C@@H]1O[C@H]1[C@H](O)[C@@H](O)[C@H](O[C@H]2[C@@H]([C@@H](O[C@H]3[C@@H]([C@@H](O)[C@H](O)[C@H](O3)C(O)=O)O)[C@H](O)[C@@H](CO)O2)NC(C)=O)[C@@H](C(O)=O)O1 YWIVKILSMZOHHF-QJZPQSOGSA-N 0.000 description 15
- BJVUJIDTICYHLL-UHFFFAOYSA-N 1-chloro-3,7,11-trimethyldodeca-2,6,10-triene Chemical compound CC(C)=CCCC(C)=CCCC(C)=CCCl BJVUJIDTICYHLL-UHFFFAOYSA-N 0.000 description 14
- CIWBSHSKHKDKBQ-JLAZNSOCSA-N Ascorbic acid Chemical compound OC[C@H](O)[C@H]1OC(=O)C(O)=C1O CIWBSHSKHKDKBQ-JLAZNSOCSA-N 0.000 description 14
- 239000010408 film Substances 0.000 description 14
- 229910052943 magnesium sulfate Inorganic materials 0.000 description 14
- 235000019341 magnesium sulphate Nutrition 0.000 description 14
- 229920001983 poloxamer Polymers 0.000 description 14
- 241000700159 Rattus Species 0.000 description 13
- 239000012153 distilled water Substances 0.000 description 13
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 12
- 208000027418 Wounds and injury Diseases 0.000 description 12
- 229940008099 dimethicone Drugs 0.000 description 12
- 239000004205 dimethyl polysiloxane Substances 0.000 description 12
- 235000013870 dimethyl polysiloxane Nutrition 0.000 description 12
- 239000007924 injection Substances 0.000 description 12
- 238000002347 injection Methods 0.000 description 12
- 229920000435 poly(dimethylsiloxane) Polymers 0.000 description 12
- 238000002360 preparation method Methods 0.000 description 12
- 230000002265 prevention Effects 0.000 description 12
- 238000001356 surgical procedure Methods 0.000 description 12
- 239000000284 extract Substances 0.000 description 11
- 239000011259 mixed solution Substances 0.000 description 11
- OWEGMIWEEQEYGQ-UHFFFAOYSA-N 100676-05-9 Natural products OC1C(O)C(O)C(CO)OC1OCC1C(O)C(O)C(O)C(OC2C(OC(O)C(O)C2O)CO)O1 OWEGMIWEEQEYGQ-UHFFFAOYSA-N 0.000 description 10
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 10
- GUBGYTABKSRVRQ-PICCSMPSSA-N Maltose Natural products O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@@H](CO)OC(O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-PICCSMPSSA-N 0.000 description 10
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 10
- GUBGYTABKSRVRQ-QUYVBRFLSA-N beta-maltose Chemical compound OC[C@H]1O[C@H](O[C@H]2[C@H](O)[C@@H](O)[C@H](O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@@H]1O GUBGYTABKSRVRQ-QUYVBRFLSA-N 0.000 description 10
- 239000002552 dosage form Substances 0.000 description 10
- 239000008103 glucose Substances 0.000 description 10
- 239000002504 physiological saline solution Substances 0.000 description 10
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 9
- 210000003815 abdominal wall Anatomy 0.000 description 9
- 238000004458 analytical method Methods 0.000 description 9
- 238000000576 coating method Methods 0.000 description 9
- 238000010586 diagram Methods 0.000 description 9
- 150000002148 esters Chemical class 0.000 description 9
- CRDAMVZIKSXKFV-FBXUGWQNSA-N (2-cis,6-cis)-farnesol Chemical compound CC(C)=CCC\C(C)=C/CC\C(C)=C/CO CRDAMVZIKSXKFV-FBXUGWQNSA-N 0.000 description 8
- 239000000260 (2E,6E)-3,7,11-trimethyldodeca-2,6,10-trien-1-ol Substances 0.000 description 8
- 206010061218 Inflammation Diseases 0.000 description 8
- 239000007853 buffer solution Substances 0.000 description 8
- 238000001816 cooling Methods 0.000 description 8
- 229930002886 farnesol Natural products 0.000 description 8
- 229940043259 farnesol Drugs 0.000 description 8
- 230000004054 inflammatory process Effects 0.000 description 8
- 210000004185 liver Anatomy 0.000 description 8
- 229910000027 potassium carbonate Inorganic materials 0.000 description 8
- CRDAMVZIKSXKFV-UHFFFAOYSA-N trans-Farnesol Natural products CC(C)=CCCC(C)=CCCC(C)=CCO CRDAMVZIKSXKFV-UHFFFAOYSA-N 0.000 description 8
- OJISWRZIEWCUBN-QIRCYJPOSA-N (E,E,E)-geranylgeraniol Chemical compound CC(C)=CCC\C(C)=C\CC\C(C)=C\CC\C(C)=C\CO OJISWRZIEWCUBN-QIRCYJPOSA-N 0.000 description 7
- TXBCBTDQIULDIA-UHFFFAOYSA-N 2-[[3-hydroxy-2,2-bis(hydroxymethyl)propoxy]methyl]-2-(hydroxymethyl)propane-1,3-diol Chemical compound OCC(CO)(CO)COCC(CO)(CO)CO TXBCBTDQIULDIA-UHFFFAOYSA-N 0.000 description 7
- AGNTUZCMJBTHOG-UHFFFAOYSA-N 3-[3-(2,3-dihydroxypropoxy)-2-hydroxypropoxy]propane-1,2-diol Chemical compound OCC(O)COCC(O)COCC(O)CO AGNTUZCMJBTHOG-UHFFFAOYSA-N 0.000 description 7
- FBPFZTCFMRRESA-FSIIMWSLSA-N D-Glucitol Natural products OC[C@H](O)[C@H](O)[C@@H](O)[C@H](O)CO FBPFZTCFMRRESA-FSIIMWSLSA-N 0.000 description 7
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 7
- FBPFZTCFMRRESA-JGWLITMVSA-N D-glucitol Chemical compound OC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-JGWLITMVSA-N 0.000 description 7
- WQZGKKKJIJFFOK-QTVWNMPRSA-N D-mannopyranose Chemical compound OC[C@H]1OC(O)[C@@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-QTVWNMPRSA-N 0.000 description 7
- 229930195725 Mannitol Natural products 0.000 description 7
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 7
- WQZGKKKJIJFFOK-PHYPRBDBSA-N alpha-D-galactose Chemical compound OC[C@H]1O[C@H](O)[C@H](O)[C@@H](O)[C@H]1O WQZGKKKJIJFFOK-PHYPRBDBSA-N 0.000 description 7
- 239000011668 ascorbic acid Substances 0.000 description 7
- 235000010323 ascorbic acid Nutrition 0.000 description 7
- 229960005070 ascorbic acid Drugs 0.000 description 7
- 150000001732 carboxylic acid derivatives Chemical class 0.000 description 7
- 239000012043 crude product Substances 0.000 description 7
- 239000003814 drug Substances 0.000 description 7
- 238000005886 esterification reaction Methods 0.000 description 7
- 229930182830 galactose Natural products 0.000 description 7
- OJISWRZIEWCUBN-UHFFFAOYSA-N geranylnerol Natural products CC(C)=CCCC(C)=CCCC(C)=CCCC(C)=CCO OJISWRZIEWCUBN-UHFFFAOYSA-N 0.000 description 7
- 239000000594 mannitol Substances 0.000 description 7
- 235000010355 mannitol Nutrition 0.000 description 7
- 238000002156 mixing Methods 0.000 description 7
- 230000002441 reversible effect Effects 0.000 description 7
- 239000000600 sorbitol Substances 0.000 description 7
- 239000000263 2,3-dihydroxypropyl (Z)-octadec-9-enoate Substances 0.000 description 6
- RZRNAYUHWVFMIP-GDCKJWNLSA-N 3-oleoyl-sn-glycerol Chemical compound CCCCCCCC\C=C/CCCCCCCC(=O)OC[C@H](O)CO RZRNAYUHWVFMIP-GDCKJWNLSA-N 0.000 description 6
- YYROPELSRYBVMQ-UHFFFAOYSA-N 4-toluenesulfonyl chloride Chemical compound CC1=CC=C(S(Cl)(=O)=O)C=C1 YYROPELSRYBVMQ-UHFFFAOYSA-N 0.000 description 6
- CURLTUGMZLYLDI-UHFFFAOYSA-N Carbon dioxide Chemical compound O=C=O CURLTUGMZLYLDI-UHFFFAOYSA-N 0.000 description 6
- QMMFVYPAHWMCMS-UHFFFAOYSA-N Dimethyl sulfide Chemical compound CSC QMMFVYPAHWMCMS-UHFFFAOYSA-N 0.000 description 6
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 6
- TWRXJAOTZQYOKJ-UHFFFAOYSA-L Magnesium chloride Chemical compound [Mg+2].[Cl-].[Cl-] TWRXJAOTZQYOKJ-UHFFFAOYSA-L 0.000 description 6
- CDBYLPFSWZWCQE-UHFFFAOYSA-L Sodium Carbonate Chemical compound [Na+].[Na+].[O-]C([O-])=O CDBYLPFSWZWCQE-UHFFFAOYSA-L 0.000 description 6
- TVXBFESIOXBWNM-UHFFFAOYSA-N Xylitol Natural products OCCC(O)C(O)C(O)CCO TVXBFESIOXBWNM-UHFFFAOYSA-N 0.000 description 6
- 238000012377 drug delivery Methods 0.000 description 6
- 238000011049 filling Methods 0.000 description 6
- 239000012530 fluid Substances 0.000 description 6
- 230000002757 inflammatory effect Effects 0.000 description 6
- HEBKCHPVOIAQTA-UHFFFAOYSA-N meso ribitol Natural products OCC(O)C(O)C(O)CO HEBKCHPVOIAQTA-UHFFFAOYSA-N 0.000 description 6
- RZRNAYUHWVFMIP-UHFFFAOYSA-N monoelaidin Natural products CCCCCCCCC=CCCCCCCCC(=O)OCC(O)CO RZRNAYUHWVFMIP-UHFFFAOYSA-N 0.000 description 6
- 239000012299 nitrogen atmosphere Substances 0.000 description 6
- 239000003921 oil Substances 0.000 description 6
- 239000011541 reaction mixture Substances 0.000 description 6
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 6
- FYSNRJHAOHDILO-UHFFFAOYSA-N thionyl chloride Chemical compound ClS(Cl)=O FYSNRJHAOHDILO-UHFFFAOYSA-N 0.000 description 6
- JOXIMZWYDAKGHI-UHFFFAOYSA-N toluene-4-sulfonic acid Chemical compound CC1=CC=C(S(O)(=O)=O)C=C1 JOXIMZWYDAKGHI-UHFFFAOYSA-N 0.000 description 6
- 239000000811 xylitol Substances 0.000 description 6
- 235000010447 xylitol Nutrition 0.000 description 6
- HEBKCHPVOIAQTA-SCDXWVJYSA-N xylitol Chemical compound OC[C@H](O)[C@@H](O)[C@H](O)CO HEBKCHPVOIAQTA-SCDXWVJYSA-N 0.000 description 6
- 229960002675 xylitol Drugs 0.000 description 6
- WJHFZYAELPOJIV-UHFFFAOYSA-N (2E,6E)-3,7,11-trimethyl-2,6,10-dodecatrienoic acid Natural products CC(C)=CCCC(C)=CCCC(C)=CC(O)=O WJHFZYAELPOJIV-UHFFFAOYSA-N 0.000 description 5
- WJHFZYAELPOJIV-IJFRVEDASA-N (2E,6E)-farnesoic acid Chemical compound CC(C)=CCC\C(C)=C\CC\C(C)=C\C(O)=O WJHFZYAELPOJIV-IJFRVEDASA-N 0.000 description 5
- 239000002202 Polyethylene glycol Substances 0.000 description 5
- 239000002585 base Substances 0.000 description 5
- 230000000052 comparative effect Effects 0.000 description 5
- 238000010511 deprotection reaction Methods 0.000 description 5
- 230000032050 esterification Effects 0.000 description 5
- 238000006266 etherification reaction Methods 0.000 description 5
- XWRJRXQNOHXIOX-UHFFFAOYSA-N geranylgeraniol Natural products CC(C)=CCCC(C)=CCOCC=C(C)CCC=C(C)C XWRJRXQNOHXIOX-UHFFFAOYSA-N 0.000 description 5
- 150000002433 hydrophilic molecules Chemical class 0.000 description 5
- 239000010410 layer Substances 0.000 description 5
- 239000012280 lithium aluminium hydride Substances 0.000 description 5
- 239000012046 mixed solvent Substances 0.000 description 5
- 229920001223 polyethylene glycol Polymers 0.000 description 5
- 230000002194 synthesizing effect Effects 0.000 description 5
- 239000013076 target substance Substances 0.000 description 5
- RFJWEFKTEOIXBB-UHFFFAOYSA-N 3-hydroxy-2,2-bis(hydroxymethyl)-8,12,16-trimethylheptadeca-7,11,15-trienoic acid Chemical compound CC(=CCCCC(O)C(C(O)=O)(CO)CO)CCC=C(CCC=C(C)C)C RFJWEFKTEOIXBB-UHFFFAOYSA-N 0.000 description 4
- XEFQCLXNSJBVNZ-UHFFFAOYSA-N 5,9,13-trimethyltetradeca-4,8,12-trien-1-ol Chemical compound CC(C)=CCCC(C)=CCCC(C)=CCCCO XEFQCLXNSJBVNZ-UHFFFAOYSA-N 0.000 description 4
- JRNVZBWKYDBUCA-UHFFFAOYSA-N N-chlorosuccinimide Chemical compound ClN1C(=O)CCC1=O JRNVZBWKYDBUCA-UHFFFAOYSA-N 0.000 description 4
- NBIIXXVUZAFLBC-UHFFFAOYSA-N Phosphoric acid Chemical compound OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 description 4
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical compound C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 4
- KEAYESYHFKHZAL-UHFFFAOYSA-N Sodium Chemical compound [Na] KEAYESYHFKHZAL-UHFFFAOYSA-N 0.000 description 4
- 208000031737 Tissue Adhesions Diseases 0.000 description 4
- 239000002537 cosmetic Substances 0.000 description 4
- 238000002674 endoscopic surgery Methods 0.000 description 4
- 210000003722 extracellular fluid Anatomy 0.000 description 4
- 238000000605 extraction Methods 0.000 description 4
- YHRUHBBTQZKMEX-UHFFFAOYSA-N farnesal Chemical compound CC(C)=CCCC(C)=CCCC(C)=CC=O YHRUHBBTQZKMEX-UHFFFAOYSA-N 0.000 description 4
- IQDXAJNQKSIPGB-HQSZAHFGSA-N geranyllinalool Chemical compound CC(C)=CCC\C(C)=C\CC\C(C)=C\CCC(C)(O)C=C IQDXAJNQKSIPGB-HQSZAHFGSA-N 0.000 description 4
- 229930182470 glycoside Natural products 0.000 description 4
- FUZZWVXGSFPDMH-UHFFFAOYSA-N hexanoic acid Chemical compound CCCCCC(O)=O FUZZWVXGSFPDMH-UHFFFAOYSA-N 0.000 description 4
- 238000002357 laparoscopic surgery Methods 0.000 description 4
- 239000003915 liquefied petroleum gas Substances 0.000 description 4
- 239000000463 material Substances 0.000 description 4
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 4
- IJDNQMDRQITEOD-UHFFFAOYSA-N n-butane Chemical compound CCCC IJDNQMDRQITEOD-UHFFFAOYSA-N 0.000 description 4
- 239000011780 sodium chloride Substances 0.000 description 4
- 239000012312 sodium hydride Substances 0.000 description 4
- 229910000104 sodium hydride Inorganic materials 0.000 description 4
- 229910052938 sodium sulfate Inorganic materials 0.000 description 4
- 235000011152 sodium sulphate Nutrition 0.000 description 4
- 239000004094 surface-active agent Substances 0.000 description 4
- 238000005809 transesterification reaction Methods 0.000 description 4
- HDPNBNXLBDFELL-UHFFFAOYSA-N 1,1,1-trimethoxyethane Chemical compound COC(C)(OC)OC HDPNBNXLBDFELL-UHFFFAOYSA-N 0.000 description 3
- QKNYBSVHEMOAJP-UHFFFAOYSA-N 2-amino-2-(hydroxymethyl)propane-1,3-diol;hydron;chloride Chemical compound Cl.OCC(N)(CO)CO QKNYBSVHEMOAJP-UHFFFAOYSA-N 0.000 description 3
- HIQIXEFWDLTDED-UHFFFAOYSA-N 4-hydroxy-1-piperidin-4-ylpyrrolidin-2-one Chemical compound O=C1CC(O)CN1C1CCNCC1 HIQIXEFWDLTDED-UHFFFAOYSA-N 0.000 description 3
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 3
- UXVMQQNJUSDDNG-UHFFFAOYSA-L Calcium chloride Chemical compound [Cl-].[Cl-].[Ca+2] UXVMQQNJUSDDNG-UHFFFAOYSA-L 0.000 description 3
- LYCAIKOWRPUZTN-UHFFFAOYSA-N Ethylene glycol Chemical compound OCCO LYCAIKOWRPUZTN-UHFFFAOYSA-N 0.000 description 3
- FYYHWMGAXLPEAU-UHFFFAOYSA-N Magnesium Chemical compound [Mg] FYYHWMGAXLPEAU-UHFFFAOYSA-N 0.000 description 3
- 241001465754 Metazoa Species 0.000 description 3
- 239000004372 Polyvinyl alcohol Substances 0.000 description 3
- 241000700157 Rattus norvegicus Species 0.000 description 3
- VMHLLURERBWHNL-UHFFFAOYSA-M Sodium acetate Chemical compound [Na+].CC([O-])=O VMHLLURERBWHNL-UHFFFAOYSA-M 0.000 description 3
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 3
- 229930006000 Sucrose Natural products 0.000 description 3
- 239000005703 Trimethylamine hydrochloride Substances 0.000 description 3
- ZVQOOHYFBIDMTQ-UHFFFAOYSA-N [methyl(oxido){1-[6-(trifluoromethyl)pyridin-3-yl]ethyl}-lambda(6)-sulfanylidene]cyanamide Chemical compound N#CN=S(C)(=O)C(C)C1=CC=C(C(F)(F)F)N=C1 ZVQOOHYFBIDMTQ-UHFFFAOYSA-N 0.000 description 3
- 150000001298 alcohols Chemical class 0.000 description 3
- 210000004369 blood Anatomy 0.000 description 3
- 239000008280 blood Substances 0.000 description 3
- 239000001110 calcium chloride Substances 0.000 description 3
- 229910001628 calcium chloride Inorganic materials 0.000 description 3
- 239000001569 carbon dioxide Substances 0.000 description 3
- 229910002092 carbon dioxide Inorganic materials 0.000 description 3
- 239000000969 carrier Substances 0.000 description 3
- 239000006059 cover glass Substances 0.000 description 3
- IUNMPGNGSSIWFP-UHFFFAOYSA-N dimethylaminopropylamine Chemical compound CN(C)CCCN IUNMPGNGSSIWFP-UHFFFAOYSA-N 0.000 description 3
- 238000004299 exfoliation Methods 0.000 description 3
- 239000011521 glass Substances 0.000 description 3
- 125000001165 hydrophobic group Chemical group 0.000 description 3
- 229910001629 magnesium chloride Inorganic materials 0.000 description 3
- 238000004519 manufacturing process Methods 0.000 description 3
- 239000012567 medical material Substances 0.000 description 3
- RWFOWORQUNKNLT-UHFFFAOYSA-N methyl 5,9,13-trimethyltetradeca-4,8,12-trienoate Chemical compound COC(=O)CCC=C(C)CCC=C(C)CCC=C(C)C RWFOWORQUNKNLT-UHFFFAOYSA-N 0.000 description 3
- 239000012044 organic layer Substances 0.000 description 3
- 239000003960 organic solvent Substances 0.000 description 3
- 239000012071 phase Substances 0.000 description 3
- 235000020777 polyunsaturated fatty acids Nutrition 0.000 description 3
- 229920002451 polyvinyl alcohol Polymers 0.000 description 3
- OTYBMLCTZGSZBG-UHFFFAOYSA-L potassium sulfate Chemical compound [K+].[K+].[O-]S([O-])(=O)=O OTYBMLCTZGSZBG-UHFFFAOYSA-L 0.000 description 3
- 229910052939 potassium sulfate Inorganic materials 0.000 description 3
- 235000011151 potassium sulphates Nutrition 0.000 description 3
- 239000002243 precursor Substances 0.000 description 3
- 239000003380 propellant Substances 0.000 description 3
- 239000008213 purified water Substances 0.000 description 3
- 239000001632 sodium acetate Substances 0.000 description 3
- 235000017281 sodium acetate Nutrition 0.000 description 3
- 229910000029 sodium carbonate Inorganic materials 0.000 description 3
- 239000007787 solid Substances 0.000 description 3
- 238000001228 spectrum Methods 0.000 description 3
- 239000005720 sucrose Substances 0.000 description 3
- 239000010409 thin film Substances 0.000 description 3
- SZYJELPVAFJOGJ-UHFFFAOYSA-N trimethylamine hydrochloride Chemical compound Cl.CN(C)C SZYJELPVAFJOGJ-UHFFFAOYSA-N 0.000 description 3
- 229910021642 ultra pure water Inorganic materials 0.000 description 3
- 239000012498 ultrapure water Substances 0.000 description 3
- 229920003169 water-soluble polymer Polymers 0.000 description 3
- FQTLCLSUCSAZDY-UHFFFAOYSA-N (+) E(S) nerolidol Natural products CC(C)=CCCC(C)=CCCC(C)(O)C=C FQTLCLSUCSAZDY-UHFFFAOYSA-N 0.000 description 2
- SZNLKILVMCHHSD-OZFNKYQOSA-N (2E,6E,10E)-geranylgeranic acid Chemical compound CC(C)=CCC\C(C)=C\CC\C(C)=C\CC\C(C)=C\C(O)=O SZNLKILVMCHHSD-OZFNKYQOSA-N 0.000 description 2
- DLEQVGGJBICUJA-UHFFFAOYSA-N 2,3-dihydroxy-8,12,16-trimethylheptadeca-7,11,15-trienoic acid Chemical compound CC(=CCCCC(O)C(O)C(O)=O)CCC=C(CCC=C(C)C)C DLEQVGGJBICUJA-UHFFFAOYSA-N 0.000 description 2
- OHXWYYYYBHCUGN-UHFFFAOYSA-N 2,3-dihydroxypropyl 3,7,11-trimethyldodec-2-enoate Chemical compound CC(C)CCCC(C)CCCC(C)=CC(=O)OCC(O)CO OHXWYYYYBHCUGN-UHFFFAOYSA-N 0.000 description 2
- FIJSTHPQPCHJTN-UHFFFAOYSA-N 2-(hydroxymethyl)-2-(5,9,13-trimethyltetradec-4-enoxymethyl)propane-1,3-diol Chemical compound CC(C)CCCC(C)CCCC(C)=CCCCOCC(CO)(CO)CO FIJSTHPQPCHJTN-UHFFFAOYSA-N 0.000 description 2
- BKOOMYPCSUNDGP-UHFFFAOYSA-N 2-methylbut-2-ene Chemical compound CC=C(C)C BKOOMYPCSUNDGP-UHFFFAOYSA-N 0.000 description 2
- SDISMKKAORUZGC-UHFFFAOYSA-N 3,7,11-trimethyldodeca-2,6,10-trienoyl chloride Chemical compound CC(C)=CCCC(C)=CCCC(C)=CC(Cl)=O SDISMKKAORUZGC-UHFFFAOYSA-N 0.000 description 2
- DOQOVRQWQQJATN-UHFFFAOYSA-N 3-(3,7,11,15-tetramethylhexadeca-2,6,10,14-tetraenoxy)propane-1,2-diol Chemical compound CC(C)=CCCC(C)=CCCC(C)=CCCC(C)=CCOCC(O)CO DOQOVRQWQQJATN-UHFFFAOYSA-N 0.000 description 2
- VGIZXGYRSPTVQF-UHFFFAOYSA-N 3-(3,7,11-trimethyldodeca-2,6,10-trienoxy)propane-1,2-diol Chemical compound CC(C)=CCCC(C)=CCCC(C)=CCOCC(O)CO VGIZXGYRSPTVQF-UHFFFAOYSA-N 0.000 description 2
- BHSDPPHYEKMSMC-UHFFFAOYSA-N 3-(5,9,13,17-tetramethyloctadec-4-enoxy)propane-1,2-diol Chemical compound CC(C)CCCC(C)CCCC(C)CCCC(C)=CCCCOCC(O)CO BHSDPPHYEKMSMC-UHFFFAOYSA-N 0.000 description 2
- JPQQENYLAJOMSJ-UHFFFAOYSA-N 3-hydroxy-2,2-bis(hydroxymethyl)-6,10,14-trimethylpentadeca-5,9,13-trienoic acid Chemical compound CC(=CCC(O)C(C(O)=O)(CO)CO)CCC=C(CCC=C(C)C)C JPQQENYLAJOMSJ-UHFFFAOYSA-N 0.000 description 2
- AHHJODRZZZSTGZ-UHFFFAOYSA-N 3-hydroxy-2,2-bis(hydroxymethyl)-8,12,16-trimethyl-4-oxoheptadeca-7,11,15-trienoic acid Chemical compound CC(=CCCC(=O)C(O)C(C(O)=O)(CO)CO)CCC=C(CCC=C(C)C)C AHHJODRZZZSTGZ-UHFFFAOYSA-N 0.000 description 2
- QQRJXXJLDKVFJX-UHFFFAOYSA-N 5,9,13,17-tetramethyloctadec-4-enyl 4-methylbenzenesulfonate Chemical compound CC(C)CCCC(C)CCCC(C)CCCC(C)=CCCCOS(=O)(=O)C1=CC=C(C)C=C1 QQRJXXJLDKVFJX-UHFFFAOYSA-N 0.000 description 2
- CCJQUGJHOQEALP-UHFFFAOYSA-N 5,9,13,17-tetramethyloctadeca-4,8,12,16-tetraen-1-ol Chemical compound CC(C)=CCCC(C)=CCCC(C)=CCCC(C)=CCCCO CCJQUGJHOQEALP-UHFFFAOYSA-N 0.000 description 2
- VUJWAEIEOLCDCI-UHFFFAOYSA-N 5,9,13,17-tetramethyloctadecanoyl chloride Chemical compound CC(C)CCCC(C)CCCC(C)CCCC(C)CCCC(Cl)=O VUJWAEIEOLCDCI-UHFFFAOYSA-N 0.000 description 2
- YAOXMUWCMNYOEB-UHFFFAOYSA-N 5,9,13-trimethyltetradec-4-enyl 4-methylbenzenesulfonate Chemical compound CC(C)CCCC(C)CCCC(C)=CCCCOS(=O)(=O)C1=CC=C(C)C=C1 YAOXMUWCMNYOEB-UHFFFAOYSA-N 0.000 description 2
- XVMSFILGAMDHEY-UHFFFAOYSA-N 6-(4-aminophenyl)sulfonylpyridin-3-amine Chemical compound C1=CC(N)=CC=C1S(=O)(=O)C1=CC=C(N)C=N1 XVMSFILGAMDHEY-UHFFFAOYSA-N 0.000 description 2
- NLXLAEXVIDQMFP-UHFFFAOYSA-N Ammonia chloride Chemical compound [NH4+].[Cl-] NLXLAEXVIDQMFP-UHFFFAOYSA-N 0.000 description 2
- OXLITERWWUNNHI-UHFFFAOYSA-N CC(C)=CCCC(C)=CCCC(C)=CCCC(C)=CCCCOCC(O)CO Chemical compound CC(C)=CCCC(C)=CCCC(C)=CCCC(C)=CCCCOCC(O)CO OXLITERWWUNNHI-UHFFFAOYSA-N 0.000 description 2
- 0 CC(C)N(C(C)C(O*)=O)C=C(C)CC(C)(C)CC=C(C)CCCC=C(C)C Chemical compound CC(C)N(C(C)C(O*)=O)C=C(C)CC(C)(C)CC=C(C)CCCC=C(C)C 0.000 description 2
- QWOJMRHUQHTCJG-UHFFFAOYSA-N CC([CH2-])=O Chemical compound CC([CH2-])=O QWOJMRHUQHTCJG-UHFFFAOYSA-N 0.000 description 2
- URIYDZUSGJUCHX-UHFFFAOYSA-N CC1=CC=C(C=C1)S(=O)(=O)OCCCC=CCCC=CCCC=CC(C)(C)C Chemical compound CC1=CC=C(C=C1)S(=O)(=O)OCCCC=CCCC=CCCC=CC(C)(C)C URIYDZUSGJUCHX-UHFFFAOYSA-N 0.000 description 2
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 2
- XFXPMWWXUTWYJX-UHFFFAOYSA-N Cyanide Chemical compound N#[C-] XFXPMWWXUTWYJX-UHFFFAOYSA-N 0.000 description 2
- LCGLNKUTAGEVQW-UHFFFAOYSA-N Dimethyl ether Chemical compound COC LCGLNKUTAGEVQW-UHFFFAOYSA-N 0.000 description 2
- 206010016654 Fibrosis Diseases 0.000 description 2
- 239000007818 Grignard reagent Substances 0.000 description 2
- WQDUMFSSJAZKTM-UHFFFAOYSA-N Sodium methoxide Chemical compound [Na+].[O-]C WQDUMFSSJAZKTM-UHFFFAOYSA-N 0.000 description 2
- DKGAVHZHDRPRBM-UHFFFAOYSA-N Tert-Butanol Chemical compound CC(C)(C)O DKGAVHZHDRPRBM-UHFFFAOYSA-N 0.000 description 2
- 210000001015 abdomen Anatomy 0.000 description 2
- 230000003187 abdominal effect Effects 0.000 description 2
- 238000012084 abdominal surgery Methods 0.000 description 2
- 230000009471 action Effects 0.000 description 2
- 229910000147 aluminium phosphate Inorganic materials 0.000 description 2
- 230000033115 angiogenesis Effects 0.000 description 2
- 238000010171 animal model Methods 0.000 description 2
- 210000001124 body fluid Anatomy 0.000 description 2
- 239000010839 body fluid Substances 0.000 description 2
- 210000004556 brain Anatomy 0.000 description 2
- 239000003054 catalyst Substances 0.000 description 2
- 238000007796 conventional method Methods 0.000 description 2
- 238000011161 development Methods 0.000 description 2
- 230000018109 developmental process Effects 0.000 description 2
- 201000010099 disease Diseases 0.000 description 2
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 2
- 229940079593 drug Drugs 0.000 description 2
- 239000003792 electrolyte Substances 0.000 description 2
- 239000012156 elution solvent Substances 0.000 description 2
- 239000000839 emulsion Substances 0.000 description 2
- 230000001747 exhibiting effect Effects 0.000 description 2
- 230000004761 fibrosis Effects 0.000 description 2
- 239000010419 fine particle Substances 0.000 description 2
- 235000013305 food Nutrition 0.000 description 2
- 238000002695 general anesthesia Methods 0.000 description 2
- CCCXGQLQJHWTLZ-UHFFFAOYSA-N geranyl linalool Natural products CC(=CCCC(=CCCCC(C)(O)CCC=C(C)C)C)C CCCXGQLQJHWTLZ-UHFFFAOYSA-N 0.000 description 2
- 150000004676 glycans Chemical class 0.000 description 2
- 238000006206 glycosylation reaction Methods 0.000 description 2
- 150000004795 grignard reagents Chemical class 0.000 description 2
- 239000003112 inhibitor Substances 0.000 description 2
- 208000014674 injury Diseases 0.000 description 2
- 210000002977 intracellular fluid Anatomy 0.000 description 2
- 238000005342 ion exchange Methods 0.000 description 2
- 238000002350 laparotomy Methods 0.000 description 2
- 210000004880 lymph fluid Anatomy 0.000 description 2
- 229910052749 magnesium Inorganic materials 0.000 description 2
- 239000011777 magnesium Substances 0.000 description 2
- BDAGIHXWWSANSR-UHFFFAOYSA-N methanoic acid Natural products OC=O BDAGIHXWWSANSR-UHFFFAOYSA-N 0.000 description 2
- AQNNXEGYWCKFCQ-UHFFFAOYSA-N methyl 5,9,13-trimethyltetradecanoate Chemical compound COC(=O)CCCC(C)CCCC(C)CCCC(C)C AQNNXEGYWCKFCQ-UHFFFAOYSA-N 0.000 description 2
- WASNIKZYIWZQIP-AWEZNQCLSA-N nerolidol Natural products CC(=CCCC(=CCC[C@@H](O)C=C)C)C WASNIKZYIWZQIP-AWEZNQCLSA-N 0.000 description 2
- CTSLXHKWHWQRSH-UHFFFAOYSA-N oxalyl chloride Chemical compound ClC(=O)C(Cl)=O CTSLXHKWHWQRSH-UHFFFAOYSA-N 0.000 description 2
- WEXRUCMBJFQVBZ-UHFFFAOYSA-N pentobarbital Chemical compound CCCC(C)C1(CC)C(=O)NC(=O)NC1=O WEXRUCMBJFQVBZ-UHFFFAOYSA-N 0.000 description 2
- 210000002381 plasma Anatomy 0.000 description 2
- 235000010482 polyoxyethylene sorbitan monooleate Nutrition 0.000 description 2
- 229920001282 polysaccharide Polymers 0.000 description 2
- 239000005017 polysaccharide Substances 0.000 description 2
- 229920000053 polysorbate 80 Polymers 0.000 description 2
- 239000011148 porous material Substances 0.000 description 2
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Natural products COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 description 2
- 238000000926 separation method Methods 0.000 description 2
- 210000002966 serum Anatomy 0.000 description 2
- 238000006467 substitution reaction Methods 0.000 description 2
- 238000001308 synthesis method Methods 0.000 description 2
- 230000000451 tissue damage Effects 0.000 description 2
- 231100000827 tissue damage Toxicity 0.000 description 2
- 230000008733 trauma Effects 0.000 description 2
- WQGLPPVHTDRREK-NDHHSALASA-N (2E,6E)-3,7,11-trimethyldodeca-2,6,10-trien-1-ol 3,7,11-trimethyldodeca-2,6,10-trien-1-ol Chemical compound CC(C)=CCCC(C)=CCCC(C)=CCO.CC(C)=CCC\C(C)=C\CC\C(C)=C\CO WQGLPPVHTDRREK-NDHHSALASA-N 0.000 description 1
- 239000000456 (3S,6Z)-3,7,11-trimethyldodeca-1,6,10-trien-3-ol Substances 0.000 description 1
- FQTLCLSUCSAZDY-SDNWHVSQSA-N (6E)-nerolidol Chemical compound CC(C)=CCC\C(C)=C\CCC(C)(O)C=C FQTLCLSUCSAZDY-SDNWHVSQSA-N 0.000 description 1
- WRIDQFICGBMAFQ-UHFFFAOYSA-N (E)-8-Octadecenoic acid Natural products CCCCCCCCCC=CCCCCCCC(O)=O WRIDQFICGBMAFQ-UHFFFAOYSA-N 0.000 description 1
- 239000001707 (E,7R,11R)-3,7,11,15-tetramethylhexadec-2-en-1-ol Substances 0.000 description 1
- OOSZCNKVJAVHJI-UHFFFAOYSA-N 1-[(4-fluorophenyl)methyl]piperazine Chemical compound C1=CC(F)=CC=C1CN1CCNCC1 OOSZCNKVJAVHJI-UHFFFAOYSA-N 0.000 description 1
- CBSCDQNJIUTLES-UHFFFAOYSA-N 1-chloro-3,7,11,15-tetramethylhexadeca-2,6,10,14-tetraene Chemical compound CC(C)=CCCC(C)=CCCC(C)=CCCC(C)=CCCl CBSCDQNJIUTLES-UHFFFAOYSA-N 0.000 description 1
- OZPFVBLDYBXHAF-UHFFFAOYSA-N 2,2-dimethyl-1,3-dioxolane-4-carboxylic acid Chemical compound CC1(C)OCC(C(O)=O)O1 OZPFVBLDYBXHAF-UHFFFAOYSA-N 0.000 description 1
- SMDTVCXVXAMRDI-UHFFFAOYSA-N 2,3-dihydroxy-7,11,15-trimethylhexadeca-6,10,14-trienoic acid Chemical compound CC(=CCCC(O)C(O)C(O)=O)CCC=C(CCC=C(C)C)C SMDTVCXVXAMRDI-UHFFFAOYSA-N 0.000 description 1
- LPCGEFKEAAGXRE-UHFFFAOYSA-N 2,3-dihydroxypropyl 3,7,11-trimethyldodeca-2,6,10-trienoate Chemical compound CC(C)=CCCC(C)=CCCC(C)=CC(=O)OCC(O)CO LPCGEFKEAAGXRE-UHFFFAOYSA-N 0.000 description 1
- IMTCMWSWXFQQDL-UHFFFAOYSA-N 2,6,10-trimethyltetradecane Chemical compound CCCCC(C)CCCC(C)CCCC(C)C IMTCMWSWXFQQDL-UHFFFAOYSA-N 0.000 description 1
- LQJBNNIYVWPHFW-UHFFFAOYSA-N 20:1omega9c fatty acid Natural products CCCCCCCCCCC=CCCCCCCCC(O)=O LQJBNNIYVWPHFW-UHFFFAOYSA-N 0.000 description 1
- AJAKLDUGVSKVDG-UHFFFAOYSA-N 3,7,11,15-tetramethylhexadecan-1-ol Chemical compound CC(C)CCCC(C)CCCC(C)CCCC(C)CCO AJAKLDUGVSKVDG-UHFFFAOYSA-N 0.000 description 1
- LMFBTGOWEAEECX-UHFFFAOYSA-N 3,7,11-trimethyldodeca-2,6,10-trienoic acid Chemical compound C(C=C(C)CCC=C(C)CCC=C(C)C)(=O)O.CC(=CC(=O)O)CCC=C(CCC=C(C)C)C LMFBTGOWEAEECX-UHFFFAOYSA-N 0.000 description 1
- SXFOEZMBQWMAMI-UHFFFAOYSA-N 3-hydroxy-2,2-bis(hydroxymethyl)-7,11,15-trimethylhexadeca-6,10,14-trienoic acid Chemical compound CC(=CCCC(O)C(C(O)=O)(CO)CO)CCC=C(CCC=C(C)C)C SXFOEZMBQWMAMI-UHFFFAOYSA-N 0.000 description 1
- OSWFIVFLDKOXQC-UHFFFAOYSA-N 4-(3-methoxyphenyl)aniline Chemical compound COC1=CC=CC(C=2C=CC(N)=CC=2)=C1 OSWFIVFLDKOXQC-UHFFFAOYSA-N 0.000 description 1
- SKNHAISUDROJGH-UHFFFAOYSA-N 5,9,13,17-tetramethyloctadec-4-en-1-ol Chemical compound CC(C)CCCC(C)CCCC(C)CCCC(C)=CCCCO SKNHAISUDROJGH-UHFFFAOYSA-N 0.000 description 1
- GCVJPNZMLLXACL-UHFFFAOYSA-N 5,9,13,17-tetramethyloctadeca-4,8,12,16-tetraenyl 4-methylbenzenesulfonate Chemical compound C1(=CC=C(C=C1)S(=O)(=O)OCCCC=C(CCC=C(CCC=C(CCC=C(C)C)C)C)C)C GCVJPNZMLLXACL-UHFFFAOYSA-N 0.000 description 1
- UAGGOTNGGPCALF-UHFFFAOYSA-N 5,9,13,17-tetramethyloctadecanoic acid Chemical compound CC(C)CCCC(C)CCCC(C)CCCC(C)CCCC(O)=O UAGGOTNGGPCALF-UHFFFAOYSA-N 0.000 description 1
- OTFJPUDVUSYQDM-UHFFFAOYSA-N 5,9,13-trimethyltetradec-4-en-1-ol Chemical compound CC(C)CCCC(C)CCCC(C)=CCCCO OTFJPUDVUSYQDM-UHFFFAOYSA-N 0.000 description 1
- DLIYKLLDVCLJFG-UHFFFAOYSA-N 5,9,13-trimethyltetradeca-4,8,12-trienyl 4-methylbenzenesulfonate Chemical compound CC(C)=CCCC(C)=CCCC(C)=CCCCOS(=O)(=O)C1=CC=C(C)C=C1 DLIYKLLDVCLJFG-UHFFFAOYSA-N 0.000 description 1
- ZCYVEMRRCGMTRW-UHFFFAOYSA-N 7553-56-2 Chemical group [I] ZCYVEMRRCGMTRW-UHFFFAOYSA-N 0.000 description 1
- QSBYPNXLFMSGKH-UHFFFAOYSA-N 9-Heptadecensaeure Natural products CCCCCCCC=CCCCCCCCC(O)=O QSBYPNXLFMSGKH-UHFFFAOYSA-N 0.000 description 1
- 208000004998 Abdominal Pain Diseases 0.000 description 1
- WKBOTKDWSSQWDR-UHFFFAOYSA-N Bromine atom Chemical group [Br] WKBOTKDWSSQWDR-UHFFFAOYSA-N 0.000 description 1
- YGURIAZSDOKDDO-UHFFFAOYSA-N C(C(O)CO)(=O)O.CC(=CCC(=O)OCC(O)CO)CCC=C(CCC=C(C)C)C Chemical compound C(C(O)CO)(=O)O.CC(=CCC(=O)OCC(O)CO)CCC=C(CCC=C(C)C)C YGURIAZSDOKDDO-UHFFFAOYSA-N 0.000 description 1
- IYHNEBPXAHEOIV-UHFFFAOYSA-N CC(=CCCC(=O)C(O)C(CO)(CO)CO)CCC=C(CCC=C(CCC=C(C)C)C)C Chemical compound CC(=CCCC(=O)C(O)C(CO)(CO)CO)CCC=C(CCC=C(CCC=C(C)C)C)C IYHNEBPXAHEOIV-UHFFFAOYSA-N 0.000 description 1
- DSKADPSORQFYDD-UHFFFAOYSA-N CC(=CCCC(=O)C(O)C(O)C(O)=O)CCC=C(CCC=C(CCC=C(C)C)C)C.CC(=CCCC(=O)C(O)C(O)C(O)=O)CCC=C(CCC=C(CCC=C(C)C)C)C Chemical compound CC(=CCCC(=O)C(O)C(O)C(O)=O)CCC=C(CCC=C(CCC=C(C)C)C)C.CC(=CCCC(=O)C(O)C(O)C(O)=O)CCC=C(CCC=C(CCC=C(C)C)C)C DSKADPSORQFYDD-UHFFFAOYSA-N 0.000 description 1
- GSJPXQLNZBSYEN-UHFFFAOYSA-N CC(=CCCC(=O)OCC(O)CO)CCCC(CCCC(CCCC(C)C)C)C.CC(=CCCC(=O)OCC(O)CO)CCCC(CCCC(C)C)C Chemical compound CC(=CCCC(=O)OCC(O)CO)CCCC(CCCC(CCCC(C)C)C)C.CC(=CCCC(=O)OCC(O)CO)CCCC(CCCC(C)C)C GSJPXQLNZBSYEN-UHFFFAOYSA-N 0.000 description 1
- UATYROMAMFVACD-ZKXXLITBSA-N CC(=CCCCC1(O)[C@H](O)[C@@H](O)[C@H](O)CO1)CCC=C(CCC=C(C)C)C.C([C@H](O)[C@H](O)CO)O.C([C@H](O)[C@H](O)CO)O.C([C@H](O)[C@H](O)CO)O.C([C@H](O)[C@H](O)CO)O.C([C@H](O)[C@H](O)CO)O Chemical compound CC(=CCCCC1(O)[C@H](O)[C@@H](O)[C@H](O)CO1)CCC=C(CCC=C(C)C)C.C([C@H](O)[C@H](O)CO)O.C([C@H](O)[C@H](O)CO)O.C([C@H](O)[C@H](O)CO)O.C([C@H](O)[C@H](O)CO)O.C([C@H](O)[C@H](O)CO)O UATYROMAMFVACD-ZKXXLITBSA-N 0.000 description 1
- SUFWORHKWSSFRN-UHFFFAOYSA-N CC(C)CCCC(C)CCCC(C)CCCC(C)CCCC(=O)OCC(O)CO Chemical compound CC(C)CCCC(C)CCCC(C)CCCC(C)CCCC(=O)OCC(O)CO SUFWORHKWSSFRN-UHFFFAOYSA-N 0.000 description 1
- KGUHJOSCUWIQBM-UHFFFAOYSA-N CC(C=CCCC=CCCC=CCCC(=O)OC)(C)C Chemical compound CC(C=CCCC=CCCC=CCCC(=O)OC)(C)C KGUHJOSCUWIQBM-UHFFFAOYSA-N 0.000 description 1
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 1
- 238000006568 Claisen-Johnson rearrangement reaction Methods 0.000 description 1
- 208000005422 Foreign-Body reaction Diseases 0.000 description 1
- 235000010469 Glycine max Nutrition 0.000 description 1
- 244000068988 Glycine max Species 0.000 description 1
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 description 1
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 1
- 239000002841 Lewis acid Substances 0.000 description 1
- 239000000232 Lipid Bilayer Substances 0.000 description 1
- 241000124008 Mammalia Species 0.000 description 1
- BZLVMXJERCGZMT-UHFFFAOYSA-N Methyl tert-butyl ether Chemical compound COC(C)(C)C BZLVMXJERCGZMT-UHFFFAOYSA-N 0.000 description 1
- 238000005481 NMR spectroscopy Methods 0.000 description 1
- FQTLCLSUCSAZDY-ATGUSINASA-N Nerolidol Chemical compound CC(C)=CCC\C(C)=C\CC[C@](C)(O)C=C FQTLCLSUCSAZDY-ATGUSINASA-N 0.000 description 1
- 239000005642 Oleic acid Substances 0.000 description 1
- ZQPPMHVWECSIRJ-UHFFFAOYSA-N Oleic acid Natural products CCCCCCCCC=CCCCCCCCC(O)=O ZQPPMHVWECSIRJ-UHFFFAOYSA-N 0.000 description 1
- BLUHKGOSFDHHGX-UHFFFAOYSA-N Phytol Natural products CC(C)CCCC(C)CCCC(C)CCCC(C)C=CO BLUHKGOSFDHHGX-UHFFFAOYSA-N 0.000 description 1
- 229920003171 Poly (ethylene oxide) Polymers 0.000 description 1
- 229920001214 Polysorbate 60 Polymers 0.000 description 1
- ZLMJMSJWJFRBEC-UHFFFAOYSA-N Potassium Chemical compound [K] ZLMJMSJWJFRBEC-UHFFFAOYSA-N 0.000 description 1
- XUIMIQQOPSSXEZ-UHFFFAOYSA-N Silicon Chemical compound [Si] XUIMIQQOPSSXEZ-UHFFFAOYSA-N 0.000 description 1
- UIIMBOGNXHQVGW-DEQYMQKBSA-M Sodium bicarbonate-14C Chemical compound [Na+].O[14C]([O-])=O UIIMBOGNXHQVGW-DEQYMQKBSA-M 0.000 description 1
- NWGKJDSIEKMTRX-AAZCQSIUSA-N Sorbitan monooleate Chemical compound CCCCCCCC\C=C/CCCCCCCC(=O)OC[C@@H](O)[C@H]1OC[C@H](O)[C@H]1O NWGKJDSIEKMTRX-AAZCQSIUSA-N 0.000 description 1
- HNZBNQYXWOLKBA-UHFFFAOYSA-N Tetrahydrofarnesol Natural products CC(C)CCCC(C)CCCC(C)=CCO HNZBNQYXWOLKBA-UHFFFAOYSA-N 0.000 description 1
- ACIAHEMYLLBZOI-ZZXKWVIFSA-N Unsaturated alcohol Chemical compound CC\C(CO)=C/C ACIAHEMYLLBZOI-ZZXKWVIFSA-N 0.000 description 1
- RSTFOCYJXCUQHZ-CTJGMNNWSA-N [(2s,3r)-2,3,4-trihydroxybutyl] 5,9,13,17-tetramethyloctadecanoate Chemical compound CC(C)CCCC(C)CCCC(C)CCCC(C)CCCC(=O)OC[C@H](O)[C@H](O)CO RSTFOCYJXCUQHZ-CTJGMNNWSA-N 0.000 description 1
- AOBHONXRZWKQMG-UHFFFAOYSA-N [3-hydroxy-2,2-bis(hydroxymethyl)propyl] 5,9,13,17-tetramethyloctadecanoate Chemical compound CC(C)CCCC(C)CCCC(C)CCCC(C)CCCC(=O)OCC(CO)(CO)CO AOBHONXRZWKQMG-UHFFFAOYSA-N 0.000 description 1
- DPXJVFZANSGRMM-UHFFFAOYSA-N acetic acid;2,3,4,5,6-pentahydroxyhexanal;sodium Chemical compound [Na].CC(O)=O.OCC(O)C(O)C(O)C(O)C=O DPXJVFZANSGRMM-UHFFFAOYSA-N 0.000 description 1
- 239000000654 additive Substances 0.000 description 1
- 239000003905 agrochemical Substances 0.000 description 1
- 229910052783 alkali metal Inorganic materials 0.000 description 1
- 150000001340 alkali metals Chemical class 0.000 description 1
- 229910052784 alkaline earth metal Inorganic materials 0.000 description 1
- 150000001342 alkaline earth metals Chemical class 0.000 description 1
- BOTWFXYSPFMFNR-OALUTQOASA-N all-rac-phytol Natural products CC(C)CCC[C@H](C)CCC[C@H](C)CCCC(C)=CCO BOTWFXYSPFMFNR-OALUTQOASA-N 0.000 description 1
- 235000019270 ammonium chloride Nutrition 0.000 description 1
- 239000008346 aqueous phase Substances 0.000 description 1
- 239000012300 argon atmosphere Substances 0.000 description 1
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 1
- 239000000227 bioadhesive Substances 0.000 description 1
- 230000031709 bromination Effects 0.000 description 1
- 238000005893 bromination reaction Methods 0.000 description 1
- 239000000872 buffer Substances 0.000 description 1
- 239000001273 butane Substances 0.000 description 1
- 229910052791 calcium Inorganic materials 0.000 description 1
- 239000011575 calcium Substances 0.000 description 1
- 150000001720 carbohydrates Chemical class 0.000 description 1
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 1
- 239000001768 carboxy methyl cellulose Substances 0.000 description 1
- 235000010948 carboxy methyl cellulose Nutrition 0.000 description 1
- 239000008112 carboxymethyl-cellulose Substances 0.000 description 1
- 210000004534 cecum Anatomy 0.000 description 1
- 230000008859 change Effects 0.000 description 1
- 229910052801 chlorine Inorganic materials 0.000 description 1
- 125000001309 chloro group Chemical group Cl* 0.000 description 1
- WORJEOGGNQDSOE-UHFFFAOYSA-N chloroform;methanol Chemical compound OC.ClC(Cl)Cl WORJEOGGNQDSOE-UHFFFAOYSA-N 0.000 description 1
- 239000003086 colorant Substances 0.000 description 1
- 238000012790 confirmation Methods 0.000 description 1
- 239000013078 crystal Substances 0.000 description 1
- YPHMISFOHDHNIV-FSZOTQKASA-N cycloheximide Chemical compound C1[C@@H](C)C[C@H](C)C(=O)[C@@H]1[C@H](O)CC1CC(=O)NC(=O)C1 YPHMISFOHDHNIV-FSZOTQKASA-N 0.000 description 1
- 238000004042 decolorization Methods 0.000 description 1
- 239000003405 delayed action preparation Substances 0.000 description 1
- 150000001982 diacylglycerols Chemical class 0.000 description 1
- 229940105990 diglycerin Drugs 0.000 description 1
- 125000000118 dimethyl group Chemical group [H]C([H])([H])* 0.000 description 1
- OGQYPPBGSLZBEG-UHFFFAOYSA-N dimethyl(dioctadecyl)azanium Chemical compound CCCCCCCCCCCCCCCCCC[N+](C)(C)CCCCCCCCCCCCCCCCCC OGQYPPBGSLZBEG-UHFFFAOYSA-N 0.000 description 1
- 229910001873 dinitrogen Inorganic materials 0.000 description 1
- 239000006185 dispersion Substances 0.000 description 1
- NLEBIOOXCVAHBD-QKMCSOCLSA-N dodecyl beta-D-maltoside Chemical compound O[C@@H]1[C@@H](O)[C@H](OCCCCCCCCCCCC)O[C@H](CO)[C@H]1O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 NLEBIOOXCVAHBD-QKMCSOCLSA-N 0.000 description 1
- 238000001035 drying Methods 0.000 description 1
- 210000001198 duodenum Anatomy 0.000 description 1
- 229920001971 elastomer Polymers 0.000 description 1
- 230000007613 environmental effect Effects 0.000 description 1
- 125000004185 ester group Chemical group 0.000 description 1
- 150000002170 ethers Chemical class 0.000 description 1
- OAYLNYINCPYISS-UHFFFAOYSA-N ethyl acetate;hexane Chemical compound CCCCCC.CCOC(C)=O OAYLNYINCPYISS-UHFFFAOYSA-N 0.000 description 1
- 239000000706 filtrate Substances 0.000 description 1
- 235000019253 formic acid Nutrition 0.000 description 1
- 238000009472 formulation Methods 0.000 description 1
- 239000003205 fragrance Substances 0.000 description 1
- 230000002496 gastric effect Effects 0.000 description 1
- 108010025899 gelatin film Proteins 0.000 description 1
- 150000002338 glycosides Chemical class 0.000 description 1
- 125000005843 halogen group Chemical group 0.000 description 1
- 230000002140 halogenating effect Effects 0.000 description 1
- 210000002216 heart Anatomy 0.000 description 1
- 238000010438 heat treatment Methods 0.000 description 1
- 230000023597 hemostasis Effects 0.000 description 1
- 238000004128 high performance liquid chromatography Methods 0.000 description 1
- 239000000017 hydrogel Substances 0.000 description 1
- 230000007062 hydrolysis Effects 0.000 description 1
- 238000006460 hydrolysis reaction Methods 0.000 description 1
- 239000011261 inert gas Substances 0.000 description 1
- 208000000509 infertility Diseases 0.000 description 1
- 230000036512 infertility Effects 0.000 description 1
- 231100000535 infertility Toxicity 0.000 description 1
- 239000002198 insoluble material Substances 0.000 description 1
- 208000003243 intestinal obstruction Diseases 0.000 description 1
- 230000009545 invasion Effects 0.000 description 1
- 229910052740 iodine Inorganic materials 0.000 description 1
- 230000001678 irradiating effect Effects 0.000 description 1
- QXJSBBXBKPUZAA-UHFFFAOYSA-N isooleic acid Natural products CCCCCCCC=CCCCCCCCCC(O)=O QXJSBBXBKPUZAA-UHFFFAOYSA-N 0.000 description 1
- 210000002429 large intestine Anatomy 0.000 description 1
- 239000004816 latex Substances 0.000 description 1
- 229920000126 latex Polymers 0.000 description 1
- 150000007517 lewis acids Chemical class 0.000 description 1
- 239000002502 liposome Substances 0.000 description 1
- 210000005228 liver tissue Anatomy 0.000 description 1
- 210000004072 lung Anatomy 0.000 description 1
- 210000001365 lymphatic vessel Anatomy 0.000 description 1
- 210000004379 membrane Anatomy 0.000 description 1
- 239000012528 membrane Substances 0.000 description 1
- 229910052751 metal Inorganic materials 0.000 description 1
- 239000002184 metal Substances 0.000 description 1
- DOWWCCDWPKGNGX-UHFFFAOYSA-N methyl 2,2-dimethyl-1,3-dioxolane-4-carboxylate Chemical compound COC(=O)C1COC(C)(C)O1 DOWWCCDWPKGNGX-UHFFFAOYSA-N 0.000 description 1
- ROGNTTJMUNTEQX-UHFFFAOYSA-N methyl 5,9,13,17-tetramethyloctadeca-4,8,12,16-tetraenoate Chemical compound COC(=O)CCC=C(C)CCC=C(C)CCC=C(C)CCC=C(C)C ROGNTTJMUNTEQX-UHFFFAOYSA-N 0.000 description 1
- 125000004170 methylsulfonyl group Chemical group [H]C([H])([H])S(*)(=O)=O 0.000 description 1
- 239000000693 micelle Substances 0.000 description 1
- 239000002808 molecular sieve Substances 0.000 description 1
- OFBQJSOFQDEBGM-UHFFFAOYSA-N n-pentane Natural products CCCCC OFBQJSOFQDEBGM-UHFFFAOYSA-N 0.000 description 1
- 229910052757 nitrogen Inorganic materials 0.000 description 1
- 238000000655 nuclear magnetic resonance spectrum Methods 0.000 description 1
- HEGSGKPQLMEBJL-RKQHYHRCSA-N octyl beta-D-glucopyranoside Chemical compound CCCCCCCCO[C@@H]1O[C@H](CO)[C@@H](O)[C@H](O)[C@H]1O HEGSGKPQLMEBJL-RKQHYHRCSA-N 0.000 description 1
- ZQPPMHVWECSIRJ-KTKRTIGZSA-N oleic acid Chemical compound CCCCCCCC\C=C/CCCCCCCC(O)=O ZQPPMHVWECSIRJ-KTKRTIGZSA-N 0.000 description 1
- 210000001672 ovary Anatomy 0.000 description 1
- 210000003101 oviduct Anatomy 0.000 description 1
- 230000003647 oxidation Effects 0.000 description 1
- 238000007254 oxidation reaction Methods 0.000 description 1
- 239000001301 oxygen Substances 0.000 description 1
- 229910052760 oxygen Inorganic materials 0.000 description 1
- 239000006201 parenteral dosage form Substances 0.000 description 1
- 230000035515 penetration Effects 0.000 description 1
- 229960001412 pentobarbital Drugs 0.000 description 1
- 210000003516 pericardium Anatomy 0.000 description 1
- 238000005191 phase separation Methods 0.000 description 1
- 239000008055 phosphate buffer solution Substances 0.000 description 1
- WTJKGGKOPKCXLL-RRHRGVEJSA-N phosphatidylcholine Chemical compound CCCCCCCCCCCCCCCC(=O)OC[C@H](COP([O-])(=O)OCC[N+](C)(C)C)OC(=O)CCCCCCCC=CCCCCCCCC WTJKGGKOPKCXLL-RRHRGVEJSA-N 0.000 description 1
- BOTWFXYSPFMFNR-PYDDKJGSSA-N phytol Chemical compound CC(C)CCC[C@@H](C)CCC[C@@H](C)CCC\C(C)=C\CO BOTWFXYSPFMFNR-PYDDKJGSSA-N 0.000 description 1
- 229920001992 poloxamer 407 Polymers 0.000 description 1
- 239000000244 polyoxyethylene sorbitan monooleate Substances 0.000 description 1
- 229920001451 polypropylene glycol Polymers 0.000 description 1
- 229940068968 polysorbate 80 Drugs 0.000 description 1
- 229910052700 potassium Inorganic materials 0.000 description 1
- 239000011591 potassium Substances 0.000 description 1
- XAEFZNCEHLXOMS-UHFFFAOYSA-M potassium benzoate Chemical compound [K+].[O-]C(=O)C1=CC=CC=C1 XAEFZNCEHLXOMS-UHFFFAOYSA-M 0.000 description 1
- 239000003755 preservative agent Substances 0.000 description 1
- 238000003825 pressing Methods 0.000 description 1
- 230000003449 preventive effect Effects 0.000 description 1
- 239000000047 product Substances 0.000 description 1
- QQONPFPTGQHPMA-UHFFFAOYSA-N propylene Natural products CC=C QQONPFPTGQHPMA-UHFFFAOYSA-N 0.000 description 1
- RUOJZAUFBMNUDX-UHFFFAOYSA-N propylene carbonate Chemical compound CC1COC(=O)O1 RUOJZAUFBMNUDX-UHFFFAOYSA-N 0.000 description 1
- 125000004805 propylene group Chemical group [H]C([H])([H])C([H])([*:1])C([H])([H])[*:2] 0.000 description 1
- 125000006239 protecting group Chemical group 0.000 description 1
- 238000000746 purification Methods 0.000 description 1
- 239000010453 quartz Substances 0.000 description 1
- 210000000664 rectum Anatomy 0.000 description 1
- 238000005057 refrigeration Methods 0.000 description 1
- 210000003296 saliva Anatomy 0.000 description 1
- 210000000582 semen Anatomy 0.000 description 1
- 229910052710 silicon Inorganic materials 0.000 description 1
- 239000010703 silicon Substances 0.000 description 1
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N silicon dioxide Inorganic materials O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 1
- 210000000813 small intestine Anatomy 0.000 description 1
- 150000003384 small molecules Chemical class 0.000 description 1
- 238000001464 small-angle X-ray scattering data Methods 0.000 description 1
- 229910052708 sodium Inorganic materials 0.000 description 1
- 239000011734 sodium Substances 0.000 description 1
- URGAHOPLAPQHLN-UHFFFAOYSA-N sodium aluminosilicate Chemical compound [Na+].[Al+3].[O-][Si]([O-])=O.[O-][Si]([O-])=O URGAHOPLAPQHLN-UHFFFAOYSA-N 0.000 description 1
- 229920001027 sodium carboxymethylcellulose Polymers 0.000 description 1
- UKLNMMHNWFDKNT-UHFFFAOYSA-M sodium chlorite Chemical compound [Na+].[O-]Cl=O UKLNMMHNWFDKNT-UHFFFAOYSA-M 0.000 description 1
- 229960002218 sodium chlorite Drugs 0.000 description 1
- 229940074545 sodium dihydrogen phosphate dihydrate Drugs 0.000 description 1
- 159000000000 sodium salts Chemical class 0.000 description 1
- RNVYQYLELCKWAN-UHFFFAOYSA-N solketal Chemical compound CC1(C)OCC(CO)O1 RNVYQYLELCKWAN-UHFFFAOYSA-N 0.000 description 1
- 229950004959 sorbitan oleate Drugs 0.000 description 1
- 238000003892 spreading Methods 0.000 description 1
- 230000007480 spreading Effects 0.000 description 1
- 239000003381 stabilizer Substances 0.000 description 1
- 239000008223 sterile water Substances 0.000 description 1
- 210000002784 stomach Anatomy 0.000 description 1
- 239000000126 substance Substances 0.000 description 1
- 150000005846 sugar alcohols Polymers 0.000 description 1
- 150000003462 sulfoxides Chemical class 0.000 description 1
- 210000001138 tear Anatomy 0.000 description 1
- 210000002435 tendon Anatomy 0.000 description 1
- 150000003505 terpenes Chemical group 0.000 description 1
- 210000000115 thoracic cavity Anatomy 0.000 description 1
- HPGGPRDJHPYFRM-UHFFFAOYSA-J tin(iv) chloride Chemical compound Cl[Sn](Cl)(Cl)Cl HPGGPRDJHPYFRM-UHFFFAOYSA-J 0.000 description 1
- 230000017423 tissue regeneration Effects 0.000 description 1
- 125000002088 tosyl group Chemical group [H]C1=C([H])C(=C([H])C([H])=C1C([H])([H])[H])S(*)(=O)=O 0.000 description 1
- ILJSQTXMGCGYMG-UHFFFAOYSA-N triacetic acid Chemical compound CC(=O)CC(=O)CC(O)=O ILJSQTXMGCGYMG-UHFFFAOYSA-N 0.000 description 1
- 125000001527 trienoyl group Chemical group 0.000 description 1
- 235000021122 unsaturated fatty acids Nutrition 0.000 description 1
- 150000004670 unsaturated fatty acids Chemical class 0.000 description 1
- 229930195735 unsaturated hydrocarbon Natural products 0.000 description 1
- 210000002700 urine Anatomy 0.000 description 1
- 210000004291 uterus Anatomy 0.000 description 1
- 229940088594 vitamin Drugs 0.000 description 1
- 229930003231 vitamin Natural products 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/21—Esters, e.g. nitroglycerine, selenocyanates
- A61K31/215—Esters, e.g. nitroglycerine, selenocyanates of carboxylic acids
- A61K31/22—Esters, e.g. nitroglycerine, selenocyanates of carboxylic acids of acyclic acids, e.g. pravastatin
- A61K31/23—Esters, e.g. nitroglycerine, selenocyanates of carboxylic acids of acyclic acids, e.g. pravastatin of acids having a carboxyl group bound to a chain of seven or more carbon atoms
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/045—Hydroxy compounds, e.g. alcohols; Salts thereof, e.g. alcoholates
- A61K31/047—Hydroxy compounds, e.g. alcohols; Salts thereof, e.g. alcoholates having two or more hydroxy groups, e.g. sorbitol
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/21—Esters, e.g. nitroglycerine, selenocyanates
- A61K31/215—Esters, e.g. nitroglycerine, selenocyanates of carboxylic acids
- A61K31/22—Esters, e.g. nitroglycerine, selenocyanates of carboxylic acids of acyclic acids, e.g. pravastatin
- A61K31/23—Esters, e.g. nitroglycerine, selenocyanates of carboxylic acids of acyclic acids, e.g. pravastatin of acids having a carboxyl group bound to a chain of seven or more carbon atoms
- A61K31/231—Esters, e.g. nitroglycerine, selenocyanates of carboxylic acids of acyclic acids, e.g. pravastatin of acids having a carboxyl group bound to a chain of seven or more carbon atoms having one or two double bonds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/21—Esters, e.g. nitroglycerine, selenocyanates
- A61K31/215—Esters, e.g. nitroglycerine, selenocyanates of carboxylic acids
- A61K31/22—Esters, e.g. nitroglycerine, selenocyanates of carboxylic acids of acyclic acids, e.g. pravastatin
- A61K31/23—Esters, e.g. nitroglycerine, selenocyanates of carboxylic acids of acyclic acids, e.g. pravastatin of acids having a carboxyl group bound to a chain of seven or more carbon atoms
- A61K31/232—Esters, e.g. nitroglycerine, selenocyanates of carboxylic acids of acyclic acids, e.g. pravastatin of acids having a carboxyl group bound to a chain of seven or more carbon atoms having three or more double bonds, e.g. etretinate
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7028—Compounds having saccharide radicals attached to non-saccharide compounds by glycosidic linkages
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L26/00—Chemical aspects of, or use of materials for, wound dressings or bandages in liquid, gel or powder form
- A61L26/0009—Chemical aspects of, or use of materials for, wound dressings or bandages in liquid, gel or powder form containing macromolecular materials
- A61L26/0023—Polysaccharides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L26/00—Chemical aspects of, or use of materials for, wound dressings or bandages in liquid, gel or powder form
- A61L26/0061—Use of materials characterised by their function or physical properties
- A61L26/0076—Sprayable compositions
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P41/00—Drugs used in surgical methods, e.g. surgery adjuvants for preventing adhesion or for vitreum substitution
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C43/00—Ethers; Compounds having groups, groups or groups
- C07C43/02—Ethers
- C07C43/03—Ethers having all ether-oxygen atoms bound to acyclic carbon atoms
- C07C43/14—Unsaturated ethers
- C07C43/178—Unsaturated ethers containing hydroxy or O-metal groups
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C43/00—Ethers; Compounds having groups, groups or groups
- C07C43/02—Ethers
- C07C43/03—Ethers having all ether-oxygen atoms bound to acyclic carbon atoms
- C07C43/14—Unsaturated ethers
- C07C43/178—Unsaturated ethers containing hydroxy or O-metal groups
- C07C43/1785—Unsaturated ethers containing hydroxy or O-metal groups having more than one ether bound
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C69/00—Esters of carboxylic acids; Esters of carbonic or haloformic acids
- C07C69/52—Esters of acyclic unsaturated carboxylic acids having the esterified carboxyl group bound to an acyclic carbon atom
- C07C69/533—Monocarboxylic acid esters having only one carbon-to-carbon double bond
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C69/00—Esters of carboxylic acids; Esters of carbonic or haloformic acids
- C07C69/52—Esters of acyclic unsaturated carboxylic acids having the esterified carboxyl group bound to an acyclic carbon atom
- C07C69/587—Monocarboxylic acid esters having at least two carbon-to-carbon double bonds
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C69/00—Esters of carboxylic acids; Esters of carbonic or haloformic acids
- C07C69/66—Esters of carboxylic acids having esterified carboxylic groups bound to acyclic carbon atoms and having any of the groups OH, O—metal, —CHO, keto, ether, acyloxy, groups, groups, or in the acid moiety
- C07C69/67—Esters of carboxylic acids having esterified carboxylic groups bound to acyclic carbon atoms and having any of the groups OH, O—metal, —CHO, keto, ether, acyloxy, groups, groups, or in the acid moiety of saturated acids
- C07C69/675—Esters of carboxylic acids having esterified carboxylic groups bound to acyclic carbon atoms and having any of the groups OH, O—metal, —CHO, keto, ether, acyloxy, groups, groups, or in the acid moiety of saturated acids of saturated hydroxy-carboxylic acids
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Life Sciences & Earth Sciences (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Epidemiology (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Emergency Medicine (AREA)
- Engineering & Computer Science (AREA)
- Materials Engineering (AREA)
- Molecular Biology (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Surgery (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Medicinal Preparation (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
- Cosmetics (AREA)
Description
は一重結合又は2重結合を表し、Rは2つ以上の水酸基を有する親水性基を表す)
好ましい一実施形態では、前記式中のRがグリセロール、エリスリトール、ペンタエリスリトール、ジグリセロール、グリセリン酸、トリグリセロール、キシロース、ソルビトール、アスコルビン酸、グルコース、ガラクトース、マンノース、ジペンタエリスリトール、マルトース、マンニトール、及びキシリトールからなる群から選択されるいずれか1つから1つの水酸基が除かれた親水性基を表す。
モノO−(5,9,13−トリメチルテトラデカ−4−エノイル)グリセロール、
モノO−(5,9,13,17−テトラメチルオクタデカ−4−エノイル)ジグリセロール、
モノO−(5,9,13−トリメチルテトラデカノイル)グリセロール、
モノO−(5,9,13,17−テトラメチルオクタデカノイル)エリスリトール、
1−O−(3,7,11,15−テトラメチルヘキサデシル)−β−D−キシロピラノシド、及び
モノO−(5,9,13−トリメチルテトラデカ−4,8,12−トリエノイル)グリセロール。
好ましい一実施形態では、前記式中、nは1又は2を表し、mは2を表す。
モノO−(5,9,13,17−テトラメチルオクタデカ−4,8,12,16−テトラエノイル)グリセロール、
モノO−(5,9,13,17−テトラメチルオクタデカ−4,8,12,16−テトラエノイル)エリスリトール、
モノO−(5,9,13,17−テトラメチルオクタデカ−4,8,12,16−テトラエノイル)ペンタエリスリトール、
モノO−(5,9,13−トリメチルテトラデカ−4,8,12−トリエニル)エリスリトール、
モノO−(5,9,13−トリメチルテトラデカ−4,8,12−トリエニル)ペンタエリスリトール、
モノO−(3,7,11,15−テトラメチルヘキサデカ−2,6,10,14−テトラエノイル)ペンタエリスリトール、
モノO−(3,7,11,15−テトラメチルヘキサデカ−2,6,10,14−テトラエニル)エリスリトール、
モノO−(5,9,13,17−テトラメチルオクタデカ−4,8,12,16−テトラエニル)エリスリトール、及び
モノO−(5,9,13,17−テトラメチルオクタデカ−4,8,12,16−テトラエニル)ペンタエリスリトール。
モノO−(3,7,11−トリメチルドデカ−2,6,10−トリエノイル)グリセロール
グリセリン酸3,7,11−トリメチルドデカ−2,6,10−トリエニル
・n=0、m=2の化合物
モノO−(3,7,11,15−テトラメチルヘキサデカ−2,6,10,14−テトラエノイル)グリセロール
モノO−(3,7,11,15−テトラメチルヘキサデカ−2,6,10,14−テトラエノイル)エリスリトール
モノO−(3,7,11,15−テトラメチルヘキサデカ−2,6,10,14−テトラエノイル)ペンタエリスリトール
モノO−(3,7,11,15−テトラメチルヘキサデカ−2,6,10,14−テトラエノイル)ジグリセロール
グリセリン酸3,7,11,15−テトラメチルヘキサデカ−2,6,10,14−テトラエニル
・n=1、m=1の化合物
モノO−(4,8,12−トリメチルトリデカ−3,7,11−トリエノイル)グリセロール
グリセリン酸4,8,12−トリメチルトリデカ−3,7,11−トリエニル
・n=1、m=2の化合物
モノO−(4,8,12,16−テトラメチルヘプタデカ−3,7,11,15−テトラエノイル)グリセロール
モノO−(4,8,12,16−テトラメチルヘプタデカ−3,7,11,15−テトラエノイル)エリスリトール
モノO−(4,8,12,16−テトラメチルヘプタデカ−3,7,11,15−テトラエノイル)ペンタエリスリトール
モノO−(4,8,12,16−テトラメチルヘプタデカ−3,7,11,15−テトラエノイル)ジグリセロール
グリセリン酸4,8,12,16−テトラメチルヘプタデカ−3,7,11,15−テトラエニル
・n=2、m=1の化合物
モノO−(5,9,13−トリメチルテトラデカ−4,8,12−トリエノイル)グリセロール
モノO−(5,9,13−トリメチルテトラデカ−4,8,12−トリエノイル)エリスリトール
モノO−(5,9,13−トリメチルテトラデカ−4,8,12−トリエノイル)ペンタエリスリトール
モノO−(5,9,13−トリメチルテトラデカ−4,8,12−トリエノイル)ジグリセロール
グリセリン酸5,9,13−トリメチルテトラデカ−4,8,12−トリエニル
・n=2、m=2の化合物
モノO−(5,9,13,17−テトラメチルオクタデカ−4,8,12,16−テトラエノイル)グリセロール
モノO−(5,9,13,17−テトラメチルオクタデカ−4,8,12,16−テトラエノイル)エリスリトール
モノO−(5,9,13,17−テトラメチルオクタデカ−4,8,12,16−テトラエノイル)ペンタエリスリトール
モノO−(5,9,13,17−テトラメチルオクタデカ−4,8,12,16−テトラエノイル)ジグリセロール
グリセリン酸5,9,13,17−テトラメチルオクタデカ−4,8,12,16−テトラエニル
モノO−(3,7,11−トリメチルドデカ−2,6,10−トリエニル)グリセロール
モノO−(3,7,11−トリメチルドデカ−2,6,10−トリエニル)エリスリトール
モノO−(3,7,11−トリメチルドデカ−2,6,10−トリエニル)ペンタエリスリトール
1−O−(3,7,11−トリメチルドデカ−2,6,10−トリエニル)−D−キシロピラノシド
・n=0、m=2の化合物
モノO−(3,7,11,15−テトラメチルヘキサデカ−2,6,10,14−テトラエニル)グリセロール
モノO−(3,7,11,15−テトラメチルヘキサデカ−2,6,10,14−テトラエニル)エリスリトール
モノO−(3,7,11,15−テトラメチルヘキサデカ−2,6,10,14−テトラエニル)ペンタエリスリトール
1−O−(3,7,11,15−テトラメチルヘキサデカ−2,6,10,14−テトラエニル)−D−キシロピラノシド
モノO−(3,7,11,15−テトラメチルヘキサデカ−2,6,10,14−テトラエニル)ジグリセロール
・n=1、m=1の化合物
モノO−(4,8,12−トリメチルトリデカ−3,7,11−トリエニル)グリセロール
モノO−(4,8,12−トリメチルトリデカ−3,7,11−トリエニル)エリスリトール
モノO−(4,8,12−トリメチルトリデカ−3,7,11−トリエニル)ペンタエリスリトール
1−O−(4,8,12−トリメチルトリデカ−3,7,11−トリエニル)−D−キシロピラノシド
・n=1、m=2の化合物
モノO−(4,8,12,16−テトラメチルヘプタデカ−3,7,11,15−テトラエニル)グリセロール
モノO−(4,8,12,16−テトラメチルヘプタデカ−3,7,11,15−テトラエニル)エリスリトール
モノO−(4,8,12,16−テトラメチルヘプタデカ−3,7,11,15−テトラエノイル)ペンタエリスリトール
1−O−(4,8,12,16−テトラメチルヘプタデカ−3,7,11,15−テトラエニル)−D−キシロピラノシド
・n=2、m=1の化合物
モノO−(5,9,13−トリメチルテトラデカ−4,8,12−トリエニル)グリセロール
モノO−(5,9,13−トリメチルテトラデカ−4,8,12−トリエニル)エリスリトール
モノO−(5,9,13−トリメチルテトラデカ−4,8,12−トリエニル)ペンタエリスリトール
1−O−(5,9,13−トリメチルテトラデカ−4,8,12−トリエニル)−D−キシロピラノシド
モノO−(5,9,13−トリメチルテトラデカ−4,8,12−トリエニル)ジグリセロール
・n=2、m=2の化合物
モノO−(5,9,13,17−テトラメチルオクタデカ−4,8,12,16−テトラエニル)グリセロール
モノO−(5,9,13,17−テトラメチルオクタデカ−4,8,12,16−テトラエニル)エリスリトール
モノO−(5,9,13,17−テトラメチルオクタデカ−4,8,12,16−テトラエニル)ペンタエリスリトール
1−O−(5,9,13,17−テトラメチルオクタデカ−4,8,12,16−テトラエニル)−D−キシロピラノシド
モノO−(5,9,13,17−テトラメチルオクタデカ−4,8,12,16−テトラエニル)ジグリセロール
モノO−(5,9,13,17−テトラメチルオクタデカ−4−エノイル)グリセロール
モノO−(5,9,13,17−テトラメチルオクタデカ−4−エノイル)エリスリトール
モノO−(5,9,13,17−テトラメチルオクタデカ−4−エノイル)ペンタエリスリトール
モノO−(5,9,13,17−テトラメチルオクタデカ−4−エノイル)ジグリセロール
1−O−(3,7,11,15−テトラメチルヘキサデシル)−β−D−キシロピラノシド
モノO−(5,9,13,17−テトラメチルオクタデカノイル)グリセロール
モノO−(5,9,13,17−テトラメチルオクタデカノイル)エリスリトール
モノO−(5,9,13,17−テトラメチルオクタデカノイル)ペンタエリスリトール
1−O−(5,9,13,17−テトラメチルオクタデカニル)−β−D−キシロピラノシド
本発明に係る癒着防止剤に用いる両親媒性化合物は、液晶化合物であり、水性媒体中で非ラメラ液晶を形成することができる。本発明に係る癒着防止効果は、両親媒性化合物によって形成された非ラメラ液晶が組織表面を被覆(コーティング)することによって、もたらされるものである。なお本明細書中、両親媒性化合物を含む水性媒体を「両親媒性化合物/水系」と表すことがある。
両親媒性化合物が水性媒体中で液晶を形成するか否か、また、キュービック液晶であればI型かII型かを簡便に判定する方法として、ペネトレイション法が利用できる。少量(数mg)の両親媒性化合物を顕微鏡用スライドグラス上に置き、カバーグラスでそっと圧力を加え、スライドグラスとカバーグラスの間の間隙に10ミクロン程度の厚さの両親媒性化合物薄膜(直径1〜5mm位)を形成する。スライドグラスとカバーグラス間隙側面から毛管現象で水又は水性媒体を加えると、水は両親媒性化合物薄膜の外縁部から除々に内部に浸透し、両親媒性化合物薄膜/水界面から両親媒性化合物薄膜内部に向かって水含有量の勾配が形成される。これを偏光顕微鏡で観察すると、両親媒性化合物/水系の濃度に依存してどのような相ができるのかを判定でき、水領域と接して水領域と同じ等方性のテクスチャーを与える領域(キュービック液晶)、明るいテクスチャーを与える領域(ラメラ液晶)、及び等方性のテクスチャーを与える領域(ドライの両親媒性化合物)を観察することにより、この両親媒性化合物がキュービック液晶を形成することを確認できる。また、キュービック液晶が過剰の水と両親媒性化合物の界面部に安定に形成されていることからII型であることを判断できる。
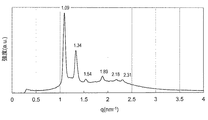
液晶形成を確認するために、エックス線小角散乱(SAXS)法により、液晶構造が立方格子を有することを調べてもよい。まず、所定の濃度の両親媒性化合物/水系サンプルを例えば石英製エックス線キャピラリーチューブに入れた後、キャピラリーを酸素バーナーで封じ、SAXS測定に供すればよい。
本発明で用いる上記両親媒性化合物は、後述の実施例の記載を参照して合成することができる。あるいは、一般式(III)で表される両親媒性化合物は、例えば、国際公開WO 2011/078383に記載された合成法に従って合成することができる。さらに、一般式(IV)で表される両親媒性化合物は、例えば、国際公開WO 2006/043705に記載された合成法に従って合成することができる。
本発明に係る癒着防止剤は、上記両親媒性化合物を有効量で含む。本発明に係る癒着防止剤に含まれる上記両親媒性化合物の濃度は、限定するものではないが、例えば、癒着防止剤の総量に対して1〜80%、好ましくは10〜50%であってよい。
本発明に係る癒着防止剤は、癒着の恐れがある組織に適用することにより、組織の癒着を防止することができる。本発明において「癒着防止効果」とは、組織が他の組織又は臓器と癒着して剥離困難になる状態を防止し、癒着を完全に又は低レベルに抑える効果をいう。
・グレード1 軽い牽引で剥離可能な癒着
・グレード2 強い牽引で剥離可能な癒着(軽い牽引では剥離できない)
・グレード3 剥離により組織損傷を伴う(強い脂肪の癒着)が他臓器との癒着なし
・グレード4 他臓器との癒着が認められ、剥離不可能を含む剥離困難な状態にある
無処置群と比較して癒着評価スコアが低い場合、癒着防止効果が認められると判断することができる。すなわち、本発明において「癒着防止」とは、無処置群と比較して癒着の頻度及び/又は程度を低減することを指す。
本発明は、本発明に係る癒着防止剤を、患者の患部、具体的には癒着のおそれがある部位、具体的には組織修復が起こると想定される部位(例えば体内の炎症部位又は損傷部位)に有効量で適用することを含む、患部における組織の癒着を防止する方法も提供する。そのような癒着のおそれがある部位の具体例としては、体内の外因性又は内因性の炎症部位、手術における切開部位などの創傷部位、手術中に触れるなどの人為的処理によって組織表面が損傷した部位などが挙げられる。本発明において「損傷部位」とは、手術、外傷、疾患等により損傷を受けた組織又は臓器の部分をいう。癒着防止剤を適用する組織又は臓器の例としては、腹膜、小腸、大腸、直腸、胃、十二指腸、盲腸、肝臓、子宮、卵管、リンパ管、心臓、心膜、肺、脳、卵巣、腱等が挙げられるが、これらに限定するものではない。典型例では、本発明に係る癒着防止剤は、手術の際、切開部、切開部周囲、又は切開部を有する臓器全体に適用される。本発明に係る癒着防止剤は、創傷部位や炎症部位などに接触する体内の部位に適用してもよい。
モノO−(5,9,13,17−テトラメチルオクタデカ−4,8,12,16−テトラエノイル)グリセロール、
モノO−(5,9,13,17−テトラメチルオクタデカ−4,8,12,16−テトラエノイル)エリスリトール、
モノO−(5,9,13,17−テトラメチルオクタデカ−4,8,12,16−テトラエノイル)ペンタエリスリトール、
モノO−(5,9,13−トリメチルテトラデカ−4,8,12−トリエニル)エリスリトール、
モノO−(5,9,13−トリメチルテトラデカ−4,8,12−トリエニル)ペンタエリスリトール、
モノO−(3,7,11,15−テトラメチルヘキサデカ−2,6,10,14−テトラエノイル)ペンタエリスリトール、
モノO−(3,7,11,15−テトラメチルヘキサデカ−2,6,10,14−テトラエニル)エリスリトール、
モノO−(5,9,13,17−テトラメチルオクタデカ−4,8,12,16−テトラエニル)エリスリトール、及び
モノO−(5,9,13,17−テトラメチルオクタデカ−4,8,12,16−テトラエニル)ペンタエリスリトール。
粘度:0.26Pa・s(せん断速度92 1/s)
合成されたモノO−(5,9,13−トリメチルテトラデカ−4,8,12−トリエノイル)グリセロールを以下、ファルネシル酢酸グリセリルとも称する。
粘度:4.7Pa・s(せん断速度92 1/s)
合成されたモノO−(5,9,13−トリメチルテトラデカ−4,8,12−トリエノイル)エリスリトールは低い粘度を示した。
粘度:2.5Pa・s(せん断速度92 1/s)
合成されたモノO−(5,9,13−トリメチルテトラデカ−4,8,12−トリエノイル)ペンタエリスリトールは低い粘度を示した。
(1)5,9,13,17−テトラメチルオクタデカ−4,8,12,16−テトラエン酸メチル(ゲラニルゲラニル酢酸メチル)の合成
窒素雰囲気下、3,7,11,15−テトラメチルヘキサデカ−1,6,10,14−テトラエン−3−オール(ゲラニルリナロール)58.1g(200mmol)、オルト酢酸トリメチル19mL(0.15mol)の溶液に、135℃でオルト酢酸トリメチル53mL(0.42mol)とn−ヘキサン酸5.0mL(40mmol)の溶液を8時間かけて滴下した。同一温度で6時間撹拌した後、さらにオルト酢酸トリメチル5.3mL(42mmol)とn−ヘキサン酸0.5mL(4mmol)の溶液を滴下し、さらに同一温度で2時間撹拌した。得られた反応溶液を酢酸エチル/ヘキサン混合溶媒(3:1,300mL)で希釈し、飽和重曹水(2回)、飽和食塩水で洗浄した後、硫酸マグネシウムで乾燥した。濾過後濃縮することによって、表題の化合物67.24gを粗生成物の液体として得た。本粗生成物をそのまま次の反応に用いた。
粘度:0.37Pa・s(せん断速度92 1/s)
合成されたモノO−(5,9,13,17−テトラメチルオクタデカ−4,8,12,16−テトラエノイル)グリセロールは非常に低い粘度を示した。
粘度:5.8Pa・s(せん断速度92 1/s)
合成されたモノO−(5,9,13,17−テトラメチルオクタデカ−4,8,12,16−テトラエノイル)エリスリトールは低い粘度を示した。
粘度:3.3Pa・s(せん断速度92 1/s)
合成されたモノO−(5,9,13,17−テトラメチルオクタデカ−4,8,12,16−テトラエノイル)ペンタエリスリトールは低い粘度を示した。
粘度:2.6Pa・s(せん断速度92 1/s)
合成されたモノO−(5,9,13,17−テトラメチルオクタデカ−4,8,12,16−テトラエノイル)ジグリセロールは低い粘度を示した。
合成されたモノO−(5,9,13−トリメチルテトラデカノイル)グリセロールを以下、飽和C17グリセリンエステルとも称する。
実施例1で得られたモノO−(5,9,13−トリメチルテトラデカ−4,8,12−トリエノイル)グリセロールの濃度が50質量%(水過剰条件)となるように、モノO−(5,9,13−トリメチルテトラデカ−4,8,12−トリエノイル)グリセロールと純水を混合デバイス中に加え、両者を室温(25℃)で混合操作を行い、24時間静置することで均一に混合し、分離した水分を除いた。その結果、外観上は白濁〜無色透明なゲル状組成物であるモノO−(5,9,13−トリメチルテトラデカ−4,8,12−トリエノイル)グリセロール/水系サンプルを得た(以下、ゲル状サンプルと呼ぶ)。
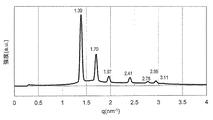
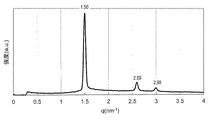
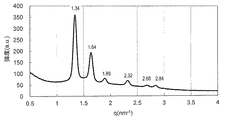
実施例4で得られたモノO−(5,9,13,17−テトラメチルオクタデカ−4,8,12,16−テトラエノイル)グリセロールと水を実施例9と同様の手順に従って均一に混合し、外観上は白濁したゲル状組成物であるモノO−(5,9,13,17−テトラメチルオクタデカ−4,8,12,16−テトラエノイル)グリセロール/水系サンプルを得た。このゲル状サンプルについて実施例9と同様にしてSAXS測定を行ったところ、少なくとも3本の散乱ピークが観測され、ピークの比は逆ヘキサゴナル液晶に特有の比:
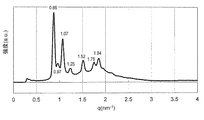
実施例5で得られたモノO−(5,9,13,17−テトラメチルオクタデカ−4,8,12,16−テトラエノイル)エリスリトールと水を実施例9と同様の手順に従って均一に混合し、外観上は無色透明なゲル状組成物であるモノO−(5,9,13,17−テトラメチルオクタデカ−4,8,12,16−テトラエノイル)エリスリトール/水系サンプルを得た。このゲル状サンプルについて実施例9と同様にしてSAXS測定を行ったところ、少なくとも6本の散乱ピークが観測され、ピークの比は結晶学的空間群Pn3mに属するキュービック液晶に特有の比:
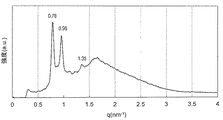
実施例6で得られたモノO−(5,9,13,17−テトラメチルオクタデカ−4,8,12,16−テトラエノイル)ペンタエリスリトールと水を実施例9と同様の手順に従って均一に混合し、外観上は白濁したゲル状組成物であるモノO−(5,9,13,17−テトラメチルオクタデカ−4,8,12,16−テトラエノイル)ペンタエリスリトール/水系サンプルを得た。このゲル状サンプルについて実施例9と同様にしてSAXS測定を行ったところ、少なくとも6本の散乱ピークが観測され、ピークの比は結晶学的空間群Pn3mに属するキュービック液晶に特有の比:
粘度:0.48Pa・s(せん断速度92 1/s)
合成されたモノO−(5,9,13−トリメチルテトラデカ−4−エノイル)グリセロールを以下、C17グリセリンエステルとも称する。
合成されたモノO−(5,9,13,17−テトラメチルオクタデカ−4−エノイル)ジグリセロールを以下、C22ジグリセリンエステルとも称する。
なお、合成された1−O−(3,7,11,15−テトラメチルヘキサデシル)−β−D−キシロピラノシドを以下、β−XPとも称する。
合成されたモノO−(5,9,13,17−テトラメチルオクタデカノイル)エリスリトールを以下、飽和C22エリスリトールエステルとも称する。
(1)試験サンプル1〜5: 脂質/水/0.65csジメチコン
表1に示す量に従い、上記実施例において合成した化合物(脂質)を蒸留水と混合した後、0.65csジメチコン(Dow Corning Q7−9180 Silocon Fluid 0.65CST)を添加して撹拌することにより、塗布剤として試験サンプル1〜5を調製した。
表2に示す量に従い、上記実施例において合成した化合物(脂質)にプルロニック(ユニループ70DP−950B、日油株式会社)及びエタノール(EtOH)を添加し、スターラーチップで1時間撹拌した後、蒸留水を添加してさらに1時間撹拌することによって、塗布剤として試験サンプル7〜12を調製した。
(1)試験サンプル17、18、22、24、25: 脂質/プルロニック/EtOH/水
表3に示す量に従い、上記実施例において合成した化合物(脂質)にプルロニック(ユニループ70DP−950B、日油株式会社)及びエタノールを添加し、スターラーチップで1時間撹拌した後、蒸留水を添加してさらに1時間撹拌した。得られた各溶液をそれぞれ2〜4mLずつ、市販の手動式簡易スプレーボトルに充填することによりポンプスプレー剤として試験サンプル17、18、22、24及び25を調製した。
表4に示す量に従い、上記実施例において合成した化合物(脂質)にプルロニック(ユニループ70DP−950B、日油株式会社)及びエタノールを添加し、スターラーチップで1時間撹拌した後、予め調製したヒアルロン酸ナトリウム(ヒアルロン酸FCH(FCH−80)、キッコーマンバイオケミファ株式会社)の水溶液を添加してさらに1時間撹拌した。得られた各溶液をそれぞれ2〜4mLずつ、市販の手動式簡易スプレーボトルに充填することによりポンプスプレー剤として試験サンプル19及び20を調製した。
表5に示す量に従い、上記実施例において合成した化合物(脂質)に0.65csジメチコン(Dow Corning Q7−9180 Silocon Fluid 0.65CST)を添加して撹拌した。得られた各溶液をそれぞれ2〜4mLずつ、市販の手動式簡易スプレーボトルに充填することによりポンプスプレー剤として試験サンプル13、14、21、23を調製した。
生理食塩水(大塚生食注、株式会社大塚製薬工場)2〜4mLを市販の手動式簡易スプレーボトルに充填することにより、生理食塩水のポンプスプレー剤を調製した。
ヒアルロン酸ナトリウム(ヒアルロン酸FCH(FCH−80)、キッコーマンバイオケミファ株式会社)50mgを蒸留水9.95gで溶解し、2〜4mLの溶液を市販の手動式簡易スプレーボトルに充填することにより、0.5%ヒアルロン酸ナトリウム水溶液のポンプスプレー剤を調製した。
(1)C17グリセリンエステル/n−ブタン=5:95
正立用定量バルブ及びストレートボタン(孔径0.9mm)を備えた容器に、C17グリセリンエステル 1.2g、液化石油ガス、0.15MPa、20℃)22.8gを充填してエアゾール剤を調製した。このエアゾール剤の内圧(25℃)は0.17MPaであった。
正立用定量バルブ及びストレートボタン(孔径0.9mm)を備えた容器に、C17グリセリンエステル 2.4g、液化石油ガス(0.15MPa、20℃)21.6gを充填してエアゾール剤を調製した。このエアゾール剤の内圧(25℃)は0.23MPaであった。
10週齢雄Wistarラットの上腹部壁側腹膜及び肝臓に対して、試験サンプル18を5回スプレーした。その結果、腹膜及び肝臓の組織表面がコーティングされたことが観察された。図5に試験サンプル18のスプレー前後の腹膜(図5A及びB)並びに肝臓(図5C及びD)の写真を示す。
(1)評価方法
本実施例では10週齢雄Wistarラットを用いて各試験サンプルの癒着防止効果を評価した。まず、ラットに対しペントバルビタールを用いて全身麻酔を施行し、仰臥位とし、約30mmの腹部正中切開で開腹した。左右上腹部壁側腹膜に約20mmの切開を加え、完全に止血した。5−0絹糸を用いて腹膜切開部を6針で連続縫合閉鎖した。
・グレード0 癒着なし
・グレード1 軽い牽引で剥離可能な癒着
・グレード2 強い牽引で剥離可能な癒着(軽い牽引では剥離できない)
・グレード3 剥離により組織損傷を伴う(強い脂肪の癒着)が他臓器との癒着なし
・グレード4 他臓器との癒着が認められ、剥離不可能を含む剥離困難な状態にある
なお、ラット無処置群(10検体)での癒着評価の平均スコアは平均±標準偏差2.90±1.10であった。
実施例17で調製した試験サンプル1〜12の溶液から、脂質換算量で10mgとなる量をピペッターで測りとり、縫合部に滴下後、ラテックス製手袋をはめた指で直径2.5〜3cmの略円形を描くように広げて塗布することにより、試験サンプル1〜12を縫合部に適用した。
実施例18(1)〜(3)で調製した各試験サンプル(ポンプスプレー剤)について、縫合部まで約2cmの距離を離して、所定回数(1〜3回のいずれか)をスプレーし、溶液が付着した範囲が縫合部を略円形に覆うように試験サンプルを適用した。
実施例19(1)及び(2)で調製した各試験サンプル(エアゾール剤)について、縫合部まで約10cmの距離を離して、所定回数(1〜3回のいずれか)をスプレーし、腹膜右側の縫合部を覆うように試験サンプルを適用した。2分間そのままの状態で置き、続いて実施例18(4)で調製した生理食塩水を縫合部に十分にスプレーした後、5〜10分間そのままの状態で置いてから、腹壁を2層で縫合閉鎖して手術を終了した。
GMO(リケマールXO−100L、理研ビタミン株式会社)1.00gに0.65csジメチコン(Dow Corning Q7−9180 Silocon Fluid 0.65CST)2.33gを添加して撹拌することによって溶液を調製した。
特表2008−528463公報の実施例14の記載に従って、GDO(4.30g)、SPC(レシノールS−10E、2.90g)、P80(1.80g)、エタノール(1.00g)を混合することによって、液晶前駆体組成物GDO/SPC/P80/EtOH=43:29:18:10を調製した。
実施例21(1)に示した方法を用い、試験サンプルの代わりに、セプラフィルム(科研製薬株式会社)を貼付して癒着防止効果を評価(ラット10検体)したところ、癒着評価の平均スコアは平均±標準偏差2.30±1.70であった。
実施例1、4、及び5で合成した化合物について、水を加えて調製したゲルの状態で粘度を測定した。具体的には、実施例9と同様の手順に従って均一に混合して得たゲル状サンプルについて、粘度・粘弾性測定装置(Gemini II、マルバーン社;コーンプレートφ25、コーン角度1°)を使用し、温度25℃でせん断粘度測定を行った。
粘度:3.0Pa・s(せん断速度92 1/s)
粘度:0.20Pa・s(せん断速度92 1/s)
粘度:1.6Pa・s(せん断速度92 1/s)
粘度:0.23Pa・s(せん断速度92 1/s)
粘度:1.2Pa・s(せん断速度92 1/s)
粘度:0.63Pa・s(せん断速度92 1/s)
粘度:0.37Pa・s(せん断速度92 1/s)
粘度:0.16Pa・s(せん断速度92 1/s)
粘度:3.8Pa・s(せん断速度92 1/s)
粘度:14Pa・s(せん断速度92 1/s)
粘度:0.26Pa・s(せん断速度92 1/s)
粘度:1.9Pa・s(せん断速度92 1/s)
粘度:2.9Pa・s(せん断速度92 1/s)
粘度:0.16Pa・s(せん断速度92 1/s)
粘度:0.78Pa・s(せん断速度92 1/s)
粘度:1.4Pa・s(せん断速度92 1/s)
粘度:0.23Pa・s(せん断速度92 1/s)
粘度:0.21Pa・s(せん断速度92 1/s)
粘度:0.45Pa・s(せん断速度92 1/s)
合成されたモノO−(3,7,11−トリメチルドデカ−2−エノイル)グリセロールを以下、C15グリセリンエステルとも称する。
粘度:10.6Pa・s(せん断速度92 1/s)
合成されたモノO−(3,7,11,15−テトラメチルヘキサデカ−2−エノイル)ペンタエリスリトールを以下、C20ペンタエリスリトールエステルとも称する。
粘度:0.98Pa・s(せん断速度92 1/s)
合成されたモノO−(5,9,13−トリメチルテトラデカ−4−エニル)ペンタエリスリトールを以下、C17ペンタエリスリトールエーテルとも称する。
合成されたモノO−(3,7,11,15−テトラメチルヘキサデカ−2−エニル)エリスリトールを以下、C20エリスリトールエーテルとも称する。
粘度:0.44Pa・s(せん断速度92 1/s)
合成されたモノO−(5,9,13,17−テトラメチルオクタデカ−4−エニル)グリセロールを以下、C22グリセリンエーテルとも称する。
(1)液晶ゲル
実施例32、33、43、45、49及び50で合成した化合物について、それぞれの化合物と水を実施例9と同様の手順に従って均一に混合し、ゲル状の外観を有するそれぞれの化合物/水系サンプルを得た。これらゲル状サンプルについて実施例9と同様にしてSAXS測定を行った。
C17グリセリンエステルに、プルロニック(ユニループ70DP−950B、日油株式会社)及びエタノールを添加し、スターラーチップで1時間撹拌した後、蒸留水を添加してさらに1時間撹拌することにより、o/w分散剤を調製した。なおC17グリセリンエステル:プルロニック:エタノール:蒸留水の混合比(重量比)は13.5:3.4:1.9:80.2とした。
実施例45及び50で合成した化合物並びに実施例13で合成したC17グリセリンエステルについて、水を加えて調製したゲルの状態で粘度を測定した。具体的には、実施例9と同様の手順に従って均一に混合して得たゲル状サンプルについて、粘度・粘弾性測定装置(Gemini II、マルバーン社;コーンプレートφ25、コーン角度1°)を使用し、温度25℃でせん断粘度測定を行った。
エタノールを用いないこと以外は実施例18(1)と同様の手順により、脂質としてC17グリセリンエステルを使用したo/w分散剤をポンプスプレー剤として調製した(o/w分散剤1)。C17グリセリンエステル:プルロニック:蒸留水の混合比(重量比)を6:2:92とした。
実施例61で調製したo/w分散剤1をポンプスプレー剤として用い、実施例21と同様にしてラット腹膜縫合部に適用し、癒着評価を行った。ラット無処置群についても実施例21と同様に癒着評価を行った。実施例61で調製したo/w分散剤2についても同様に実施例21に従って癒着評価を行った。なおo/w分散剤1は9検体、o/w分散剤2は12検体に適用し、評価した。
試験群では、実施例18で調製した試験サンプル18及び試験サンプル13をそれぞれ用いて、実施例18(3)と同様にして縫合部への適用を行った。無処置群では、切開創をつけるのみで縫合部への適用は行わなかった。さらに、比較群では、比較例3と同様にしてセプラフィルムを適用した。
本発明に係る脂質化合物(癒着防止剤)は水とともに非ラメラ液晶の被膜を形成する。本発明に係る癒着防止剤により患部で形成された液晶被膜は、生体接着性により、流れ落ちずに患部に一定期間留まると思われた。非ラメラ液晶が癒着防止効果を発揮する上で、その生体接着性は重要である。
Claims (10)
- 前記式中のRがグリセロール、エリスリトール、又はジグリセロールから1つの水酸基が除かれた親水性基を表す、請求項1に記載の癒着防止剤。
- 以下の両親媒性化合物:
モノO−(5,9,13−トリメチルテトラデカ−4−エノイル)グリセロール、
モノO−(5,9,13,17−テトラメチルオクタデカ−4−エノイル)ジグリセロール、
モノO−(5,9,13−トリメチルテトラデカノイル)グリセロール、
モノO−(5,9,13,17−テトラメチルオクタデカノイル)エリスリトール、
1−O−(3,7,11,15−テトラメチルヘキサデシル)−β−D−キシロピラノシド、及び
モノO−(5,9,13−トリメチルテトラデカ−4,8,12−トリエノイル)グリセロール
のいずれかを含む、癒着防止剤。 - 製薬上許容される担体をさらに含む、請求項1〜3のいずれか1項に記載の癒着防止剤。
- 前記担体が液体担体及び/又はガス担体である、請求項4に記載の癒着防止剤。
- 液体担体が、シリコーンオイル、アルコール及び水性媒体からなる群から選択される少なくとも1つを含む、請求項5に記載の癒着防止剤。
- 製薬上許容される界面活性剤をさらに含む、請求項1〜6のいずれか1項に記載の癒着防止剤。
- ヒアルロン酸又はその塩を含む、請求項1〜7のいずれか1項に記載の癒着防止剤。
- 前記化合物が以下のいずれかの化合物である、請求項9に記載の化合物又はその塩。
モノO−(5,9,13,17−テトラメチルオクタデカ−4,8,12,16−テトラエノイル)グリセロール、
モノO−(5,9,13,17−テトラメチルオクタデカ−4,8,12,16−テトラエノイル)エリスリトール、
モノO−(5,9,13,17−テトラメチルオクタデカ−4,8,12,16−テトラエノイル)ペンタエリスリトール、
モノO−(5,9,13,17−テトラメチルオクタデカ−4,8,12,16−テトラエニル)エリスリトール、及び
モノO−(5,9,13,17−テトラメチルオクタデカ−4,8,12,16−テトラエニル)ペンタエリスリトール
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2015514792A JP5867950B2 (ja) | 2013-05-01 | 2014-04-02 | 癒着防止剤 |
Applications Claiming Priority (4)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2013096499 | 2013-05-01 | ||
| JP2013096499 | 2013-05-01 | ||
| PCT/JP2014/059785 WO2014178256A1 (ja) | 2013-05-01 | 2014-04-02 | 癒着防止剤 |
| JP2015514792A JP5867950B2 (ja) | 2013-05-01 | 2014-04-02 | 癒着防止剤 |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2015255781A Division JP2016040339A (ja) | 2013-05-01 | 2015-12-28 | 癒着防止剤 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP5867950B2 true JP5867950B2 (ja) | 2016-02-24 |
| JPWO2014178256A1 JPWO2014178256A1 (ja) | 2017-02-23 |
Family
ID=51843391
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2015514792A Active JP5867950B2 (ja) | 2013-05-01 | 2014-04-02 | 癒着防止剤 |
| JP2015255781A Ceased JP2016040339A (ja) | 2013-05-01 | 2015-12-28 | 癒着防止剤 |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2015255781A Ceased JP2016040339A (ja) | 2013-05-01 | 2015-12-28 | 癒着防止剤 |
Country Status (5)
| Country | Link |
|---|---|
| US (1) | US20160067208A1 (ja) |
| EP (1) | EP2992910A4 (ja) |
| JP (2) | JP5867950B2 (ja) |
| CN (1) | CN105358190A (ja) |
| WO (1) | WO2014178256A1 (ja) |
Families Citing this family (11)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2016121962A1 (ja) * | 2015-01-30 | 2016-08-04 | 株式会社ファルネックス | メラニン産生抑制剤 |
| KR101784863B1 (ko) * | 2015-09-03 | 2017-10-13 | (주)진우바이오 | 히알루론산염이 코팅된 고 기능성 봉합사의 제조방법 및 이로부터 제조된 고 기능성 봉합사 |
| EP3391906A4 (en) * | 2015-12-18 | 2019-08-28 | Medigear International Corporation | BIODEGRADABLE TUMOR SEALANT |
| WO2018043731A1 (ja) * | 2016-09-05 | 2018-03-08 | 株式会社ファルネックス | 油分を含むエマルションを用いた癒着防止剤 |
| JP6620288B2 (ja) | 2017-10-25 | 2019-12-18 | メディギア・インターナショナル株式会社 | 生体分解性及び生体代謝性の腫瘍封止剤 |
| CN112770778A (zh) | 2018-09-07 | 2021-05-07 | 法纳克斯株式会社 | 含有非层状液晶形成脂质的外用剂 |
| US20230105725A1 (en) | 2020-01-27 | 2023-04-06 | Farnex Incorporated | Highly safe non-lamellar liquid crystal forming composition |
| JP7225486B2 (ja) * | 2020-04-24 | 2023-02-21 | 博唯弘展生技股▲フン▼有限公司 | 癒着防止用アミノ酸修飾ポリマーおよびその用途 |
| CN111772802B (zh) * | 2020-06-19 | 2023-09-19 | 南昌大学第二附属医院 | 一种疏血型手套的制作方法 |
| KR102388506B1 (ko) * | 2021-06-14 | 2022-04-20 | (주)씨앤엘디 | 유착방지용 조성물 |
| EP4378452A1 (en) * | 2021-07-27 | 2024-06-05 | Farnex Incorporated | Non-lamellar liquid crystal-forming composition and use thereof |
Citations (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPS6028946A (ja) * | 1983-07-28 | 1985-02-14 | Kao Corp | テルペンアルコ−ルのジグリセリンアルキルエ−テル及びこれを含有する化粧料 |
| JPS6028945A (ja) * | 1983-07-25 | 1985-02-14 | Kao Corp | テルペンアルコ−ルのグリセリルエ−テル及びこれを含有する化粧料 |
| JP2004059470A (ja) * | 2002-07-26 | 2004-02-26 | Kanebo Ltd | 養毛料 |
| WO2006043705A1 (ja) * | 2004-10-19 | 2006-04-27 | National Institute Of Advanced Industrial Scienceand Technology | Ii型キュービック液晶組成物 |
| WO2011078383A1 (ja) * | 2009-12-25 | 2011-06-30 | 株式会社サイトパスファインダー | 低粘度液晶化合物 |
| JP2012017318A (ja) * | 2010-06-07 | 2012-01-26 | Nikko Chemical Co Ltd | 液晶及びそれを含有する皮膚外用剤 |
Family Cites Families (11)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPS5826331B2 (ja) | 1974-09-02 | 1983-06-02 | 株式会社クラレ | 立体規制されたファルネシル酢酸エステルの製造方法 |
| JPS5820948B2 (ja) | 1974-09-02 | 1983-04-26 | 株式会社クラレ | デルタ 4 ,デルタ 8− トランスフアルネシルサクサン マタハ ソノエステルルイ ノ セイゾウホウ |
| JPS5826328B2 (ja) | 1974-09-02 | 1983-06-02 | 株式会社クラレ | リツタイキセイサレタ フアルネシルサクサン マタハ ソノエステル ノ セイゾウホウホウ |
| JPS5826330B2 (ja) | 1974-09-02 | 1983-06-02 | 株式会社クラレ | 立体規制されたファルネシル酢酸エステルの製造方法 |
| JPS5822457B2 (ja) | 1974-09-02 | 1983-05-09 | 株式会社クラレ | デルタ 4 ,デルタ 8− トランスフアルネシルサクサン マタハ ソノエステルルイ ノ セイゾウホウホウ |
| JP4566189B2 (ja) | 2004-03-15 | 2010-10-20 | テルモ株式会社 | 癒着防止材 |
| JP4617477B2 (ja) * | 2004-10-19 | 2011-01-26 | 独立行政法人産業技術総合研究所 | Ii型キュービック液晶組成物にリソソーム酵素を包埋した複合体 |
| US9060935B2 (en) | 2005-01-21 | 2015-06-23 | Camurus Ab | Pharmaceutical lipid compositions |
| GB0625965D0 (en) * | 2006-12-23 | 2007-02-07 | Renovo Ltd | Medicaments for wound healing |
| WO2010119994A1 (ja) | 2009-04-17 | 2010-10-21 | 帝人株式会社 | 多糖類誘導体およびそのハイドロゲル |
| JP5858732B2 (ja) | 2011-10-31 | 2016-02-10 | エア・ウォーター防災株式会社 | ガス供給ソケット |
-
2014
- 2014-04-02 JP JP2015514792A patent/JP5867950B2/ja active Active
- 2014-04-02 CN CN201480038464.XA patent/CN105358190A/zh active Pending
- 2014-04-02 EP EP14792315.5A patent/EP2992910A4/en not_active Withdrawn
- 2014-04-02 US US14/888,220 patent/US20160067208A1/en not_active Abandoned
- 2014-04-02 WO PCT/JP2014/059785 patent/WO2014178256A1/ja active Application Filing
-
2015
- 2015-12-28 JP JP2015255781A patent/JP2016040339A/ja not_active Ceased
Patent Citations (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPS6028945A (ja) * | 1983-07-25 | 1985-02-14 | Kao Corp | テルペンアルコ−ルのグリセリルエ−テル及びこれを含有する化粧料 |
| JPS6028946A (ja) * | 1983-07-28 | 1985-02-14 | Kao Corp | テルペンアルコ−ルのジグリセリンアルキルエ−テル及びこれを含有する化粧料 |
| JP2004059470A (ja) * | 2002-07-26 | 2004-02-26 | Kanebo Ltd | 養毛料 |
| WO2006043705A1 (ja) * | 2004-10-19 | 2006-04-27 | National Institute Of Advanced Industrial Scienceand Technology | Ii型キュービック液晶組成物 |
| WO2011078383A1 (ja) * | 2009-12-25 | 2011-06-30 | 株式会社サイトパスファインダー | 低粘度液晶化合物 |
| JP2012017318A (ja) * | 2010-06-07 | 2012-01-26 | Nikko Chemical Co Ltd | 液晶及びそれを含有する皮膚外用剤 |
Non-Patent Citations (3)
| Title |
|---|
| JPN6014025646; Bioorganic & Medicinal Chemistry Letters Vol.13,No.1, 2003, p43-46 * |
| JPN6014025648; Tetrahedron: Asymmetry Vol.10,No.7, 1999, p1263-1273 * |
| JPN6014025651; Journal of Biological Chemistry Vol.266,No.11, 1991, p6674-6677 * |
Also Published As
| Publication number | Publication date |
|---|---|
| WO2014178256A1 (ja) | 2014-11-06 |
| CN105358190A (zh) | 2016-02-24 |
| JPWO2014178256A1 (ja) | 2017-02-23 |
| US20160067208A1 (en) | 2016-03-10 |
| EP2992910A1 (en) | 2016-03-09 |
| JP2016040339A (ja) | 2016-03-24 |
| EP2992910A4 (en) | 2016-12-07 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP5867950B2 (ja) | 癒着防止剤 | |
| CN101378766B (zh) | 用于抑制粘连的组合物 | |
| JP5207420B2 (ja) | 低粘度液晶化合物 | |
| ES2531953T3 (es) | Compuestos y composiciones de poliglicerilo | |
| JPH08311104A (ja) | アルギン酸の部分エステル | |
| GB2148711A (en) | Topical pharmaceutical compositions | |
| JPH09503202A (ja) | ポリマー界面活性剤でカプセル封入された微小気泡および超音波画像形成でのその使用 | |
| Schiefelbein et al. | Synthesis, characterization and assessment of suitability of trehalose fatty acid esters as alternatives for polysorbates in protein formulation | |
| JP2000511157A (ja) | セミフルオロアルカン及びその使用 | |
| MX2012009068A (es) | Composicion portadora. | |
| CN101157612B (zh) | 一类有机酸的薄荷醇衍生物及含有该衍生物的经皮给药制剂 | |
| TW201002369A (en) | Percutaneously absorbable preparation | |
| JP2013071919A (ja) | 皮膚柔軟化用皮膚外用剤 | |
| WO2018043731A1 (ja) | 油分を含むエマルションを用いた癒着防止剤 | |
| JP2019193684A (ja) | 油分を含むエマルションを用いた癒着防止剤 | |
| AU708905B2 (en) | Prostaglandin derivatives | |
| WO2021153635A1 (ja) | 安全性の高い非ラメラ液晶形成性組成物 | |
| CN104415024B (zh) | 含双氯芬酸的巴布剂、及其组合物和制备方法 | |
| CN117794519A (zh) | 非层状液晶形成性组合物及其用途 | |
| JP6193278B2 (ja) | ビタミンc複合体 | |
| JPH01228920A (ja) | 吸収促進剤 | |
| WO2021043194A1 (zh) | 一种卤代四环三萜衍生物及其制备与应用 | |
| JPH07165575A (ja) | ヒドロキノン誘導体 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20151201 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20151228 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 5867950 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |