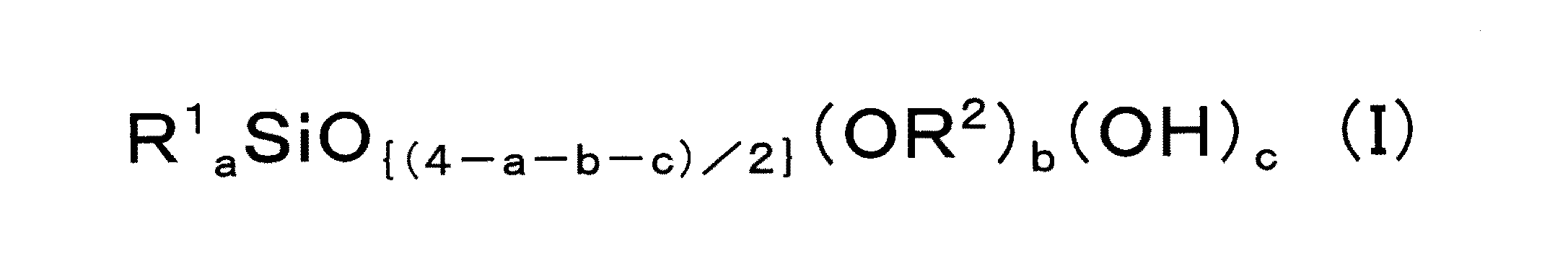JP5356830B2 - 脱アルコール縮合反応用触媒及びそれを用いたオルガノポリシロキサンの製造方法 - Google Patents
脱アルコール縮合反応用触媒及びそれを用いたオルガノポリシロキサンの製造方法 Download PDFInfo
- Publication number
- JP5356830B2 JP5356830B2 JP2008552161A JP2008552161A JP5356830B2 JP 5356830 B2 JP5356830 B2 JP 5356830B2 JP 2008552161 A JP2008552161 A JP 2008552161A JP 2008552161 A JP2008552161 A JP 2008552161A JP 5356830 B2 JP5356830 B2 JP 5356830B2
- Authority
- JP
- Japan
- Prior art keywords
- group
- average composition
- composition formula
- catalyst
- compound
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
- 229920001296 polysiloxane Polymers 0.000 title claims description 43
- 238000000034 method Methods 0.000 title claims description 7
- 239000003054 catalyst Substances 0.000 title description 40
- 238000006482 condensation reaction Methods 0.000 title description 37
- 239000000203 mixture Substances 0.000 claims description 77
- 150000001875 compounds Chemical class 0.000 claims description 60
- 238000004519 manufacturing process Methods 0.000 claims description 24
- XUIMIQQOPSSXEZ-UHFFFAOYSA-N Silicon Chemical group [Si] XUIMIQQOPSSXEZ-UHFFFAOYSA-N 0.000 claims description 22
- 125000002887 hydroxy group Chemical group [H]O* 0.000 claims description 22
- 125000001453 quaternary ammonium group Chemical group 0.000 claims description 22
- 229910052710 silicon Inorganic materials 0.000 claims description 22
- 239000010703 silicon Substances 0.000 claims description 22
- 125000003545 alkoxy group Chemical group 0.000 claims description 16
- 125000001183 hydrocarbyl group Chemical group 0.000 claims description 15
- 238000009833 condensation Methods 0.000 claims description 14
- 230000005494 condensation Effects 0.000 claims description 14
- 230000003301 hydrolyzing effect Effects 0.000 claims description 6
- 229920005645 diorganopolysiloxane polymer Polymers 0.000 claims description 5
- -1 basic metal salts Chemical class 0.000 description 51
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 21
- WGTYBPLFGIVFAS-UHFFFAOYSA-M tetramethylammonium hydroxide Substances [OH-].C[N+](C)(C)C WGTYBPLFGIVFAS-UHFFFAOYSA-M 0.000 description 20
- 239000011541 reaction mixture Substances 0.000 description 15
- 238000006243 chemical reaction Methods 0.000 description 13
- KWYUFKZDYYNOTN-UHFFFAOYSA-M Potassium hydroxide Chemical compound [OH-].[K+] KWYUFKZDYYNOTN-UHFFFAOYSA-M 0.000 description 9
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 9
- 238000005979 thermal decomposition reaction Methods 0.000 description 9
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 6
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 6
- 239000007864 aqueous solution Substances 0.000 description 6
- 229910052728 basic metal Inorganic materials 0.000 description 6
- 125000004432 carbon atom Chemical group C* 0.000 description 6
- 238000006460 hydrolysis reaction Methods 0.000 description 6
- 239000000243 solution Substances 0.000 description 6
- GETQZCLCWQTVFV-UHFFFAOYSA-N trimethylamine Chemical compound CN(C)C GETQZCLCWQTVFV-UHFFFAOYSA-N 0.000 description 6
- 125000004051 hexyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 5
- 150000005622 tetraalkylammonium hydroxides Chemical class 0.000 description 5
- 238000005481 NMR spectroscopy Methods 0.000 description 4
- 230000002378 acidificating effect Effects 0.000 description 4
- 125000000217 alkyl group Chemical group 0.000 description 4
- 239000007809 chemical reaction catalyst Substances 0.000 description 4
- 239000002904 solvent Substances 0.000 description 4
- 239000000126 substance Substances 0.000 description 4
- 239000002699 waste material Substances 0.000 description 4
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 3
- QAOWNCQODCNURD-UHFFFAOYSA-N Sulfuric acid Chemical compound OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 3
- 238000009835 boiling Methods 0.000 description 3
- 125000004122 cyclic group Chemical group 0.000 description 3
- 238000004821 distillation Methods 0.000 description 3
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 3
- 238000001914 filtration Methods 0.000 description 3
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 3
- 230000007935 neutral effect Effects 0.000 description 3
- 238000002360 preparation method Methods 0.000 description 3
- 238000007151 ring opening polymerisation reaction Methods 0.000 description 3
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 3
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 2
- BLRPTPMANUNPDV-UHFFFAOYSA-N Silane Chemical compound [SiH4] BLRPTPMANUNPDV-UHFFFAOYSA-N 0.000 description 2
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 2
- 125000003342 alkenyl group Chemical group 0.000 description 2
- 125000005210 alkyl ammonium group Chemical group 0.000 description 2
- 239000000908 ammonium hydroxide Substances 0.000 description 2
- 125000003710 aryl alkyl group Chemical group 0.000 description 2
- 125000003118 aryl group Chemical group 0.000 description 2
- 150000007514 bases Chemical class 0.000 description 2
- 239000011230 binding agent Substances 0.000 description 2
- 230000000052 comparative effect Effects 0.000 description 2
- WTLFDDHWPXQUJA-UHFFFAOYSA-N cyclopentyl(tripropoxy)silane Chemical compound CCCO[Si](OCCC)(OCCC)C1CCCC1 WTLFDDHWPXQUJA-UHFFFAOYSA-N 0.000 description 2
- 239000004205 dimethyl polysiloxane Substances 0.000 description 2
- 238000010438 heat treatment Methods 0.000 description 2
- CZWLNMOIEMTDJY-UHFFFAOYSA-N hexyl(trimethoxy)silane Chemical compound CCCCCC[Si](OC)(OC)OC CZWLNMOIEMTDJY-UHFFFAOYSA-N 0.000 description 2
- 238000006386 neutralization reaction Methods 0.000 description 2
- 230000003472 neutralizing effect Effects 0.000 description 2
- HMMGMWAXVFQUOA-UHFFFAOYSA-N octamethylcyclotetrasiloxane Chemical compound C[Si]1(C)O[Si](C)(C)O[Si](C)(C)O[Si](C)(C)O1 HMMGMWAXVFQUOA-UHFFFAOYSA-N 0.000 description 2
- 229920000435 poly(dimethylsiloxane) Polymers 0.000 description 2
- 238000006116 polymerization reaction Methods 0.000 description 2
- 125000001436 propyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])[H] 0.000 description 2
- 229910000077 silane Inorganic materials 0.000 description 2
- 239000007858 starting material Substances 0.000 description 2
- VDZOOKBUILJEDG-UHFFFAOYSA-M tetrabutylammonium hydroxide Chemical compound [OH-].CCCC[N+](CCCC)(CCCC)CCCC VDZOOKBUILJEDG-UHFFFAOYSA-M 0.000 description 2
- LFQCEHFDDXELDD-UHFFFAOYSA-N tetramethyl orthosilicate Chemical compound CO[Si](OC)(OC)OC LFQCEHFDDXELDD-UHFFFAOYSA-N 0.000 description 2
- BNHFNZHCQRZNOF-UHFFFAOYSA-N tetramethylazanium;trimethyl(oxido)silane Chemical compound C[N+](C)(C)C.C[Si](C)(C)[O-] BNHFNZHCQRZNOF-UHFFFAOYSA-N 0.000 description 2
- 125000001731 2-cyanoethyl group Chemical group [H]C([H])(*)C([H])([H])C#N 0.000 description 1
- 125000003229 2-methylhexyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])(C([H])([H])[H])C([H])([H])* 0.000 description 1
- 125000000094 2-phenylethyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000003903 2-propenyl group Chemical group [H]C([*])([H])C([H])=C([H])[H] 0.000 description 1
- GLISZRPOUBOZDL-UHFFFAOYSA-N 3-bromopropyl(trimethoxy)silane Chemical compound CO[Si](OC)(OC)CCCBr GLISZRPOUBOZDL-UHFFFAOYSA-N 0.000 description 1
- OXYZDRAJMHGSMW-UHFFFAOYSA-N 3-chloropropyl(trimethoxy)silane Chemical compound CO[Si](OC)(OC)CCCCl OXYZDRAJMHGSMW-UHFFFAOYSA-N 0.000 description 1
- KVUMYOWDFZAGPN-UHFFFAOYSA-N 3-trimethoxysilylpropanenitrile Chemical compound CO[Si](OC)(OC)CCC#N KVUMYOWDFZAGPN-UHFFFAOYSA-N 0.000 description 1
- ZCYVEMRRCGMTRW-UHFFFAOYSA-N 7553-56-2 Chemical group [I] ZCYVEMRRCGMTRW-UHFFFAOYSA-N 0.000 description 1
- WKBOTKDWSSQWDR-UHFFFAOYSA-N Bromine atom Chemical group [Br] WKBOTKDWSSQWDR-UHFFFAOYSA-N 0.000 description 1
- ZOIHDUMUNJZQLO-UHFFFAOYSA-N C1(CCCC1)[SiH2]OCCC Chemical compound C1(CCCC1)[SiH2]OCCC ZOIHDUMUNJZQLO-UHFFFAOYSA-N 0.000 description 1
- YNWOPSFREJNFFH-UHFFFAOYSA-N C1CCCC1[Si](C1CCCC1)(OCCCC)C1CCCC1 Chemical compound C1CCCC1[Si](C1CCCC1)(OCCCC)C1CCCC1 YNWOPSFREJNFFH-UHFFFAOYSA-N 0.000 description 1
- VCFXPTZTVPCFEL-UHFFFAOYSA-N CN(C)C.C[Si](C)(C)O Chemical compound CN(C)C.C[Si](C)(C)O VCFXPTZTVPCFEL-UHFFFAOYSA-N 0.000 description 1
- XMSXQFUHVRWGNA-UHFFFAOYSA-N Decamethylcyclopentasiloxane Chemical compound C[Si]1(C)O[Si](C)(C)O[Si](C)(C)O[Si](C)(C)O[Si](C)(C)O1 XMSXQFUHVRWGNA-UHFFFAOYSA-N 0.000 description 1
- BOTDANWDWHJENH-UHFFFAOYSA-N Tetraethyl orthosilicate Chemical compound CCO[Si](OCC)(OCC)OCC BOTDANWDWHJENH-UHFFFAOYSA-N 0.000 description 1
- GWFMPEXWWYANIN-UHFFFAOYSA-N [SiH4].C1(CCCCC1)P(C1CCCCC1)C1CCCCC1 Chemical compound [SiH4].C1(CCCCC1)P(C1CCCCC1)C1CCCCC1 GWFMPEXWWYANIN-UHFFFAOYSA-N 0.000 description 1
- 150000001260 acyclic compounds Chemical class 0.000 description 1
- 150000001298 alcohols Chemical class 0.000 description 1
- 150000001336 alkenes Chemical class 0.000 description 1
- 150000001412 amines Chemical class 0.000 description 1
- RQPZNWPYLFFXCP-UHFFFAOYSA-L barium dihydroxide Chemical compound [OH-].[OH-].[Ba+2] RQPZNWPYLFFXCP-UHFFFAOYSA-L 0.000 description 1
- 229910001863 barium hydroxide Inorganic materials 0.000 description 1
- 125000001797 benzyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])* 0.000 description 1
- 125000004369 butenyl group Chemical group C(=CCC)* 0.000 description 1
- HVCBWAHRVCPLEM-UHFFFAOYSA-N butoxy(triethyl)silane Chemical compound CCCCO[Si](CC)(CC)CC HVCBWAHRVCPLEM-UHFFFAOYSA-N 0.000 description 1
- NERQSDWXSSZVRP-UHFFFAOYSA-N butoxy(trihexyl)silane Chemical compound CCCCCC[Si](CCCCCC)(CCCCCC)OCCCC NERQSDWXSSZVRP-UHFFFAOYSA-N 0.000 description 1
- YTJUXOIAXOQWBV-UHFFFAOYSA-N butoxy(trimethyl)silane Chemical compound CCCCO[Si](C)(C)C YTJUXOIAXOQWBV-UHFFFAOYSA-N 0.000 description 1
- GNKRIDSIINOYIE-UHFFFAOYSA-N butoxy(tripropyl)silane Chemical compound CCCCO[Si](CCC)(CCC)CCC GNKRIDSIINOYIE-UHFFFAOYSA-N 0.000 description 1
- XGZGKDQVCBHSGI-UHFFFAOYSA-N butyl(triethoxy)silane Chemical compound CCCC[Si](OCC)(OCC)OCC XGZGKDQVCBHSGI-UHFFFAOYSA-N 0.000 description 1
- SXPLZNMUBFBFIA-UHFFFAOYSA-N butyl(trimethoxy)silane Chemical compound CCCC[Si](OC)(OC)OC SXPLZNMUBFBFIA-UHFFFAOYSA-N 0.000 description 1
- GNRBSDIBKIHSJH-UHFFFAOYSA-N butyl(tripropoxy)silane Chemical compound CCCC[Si](OCCC)(OCCC)OCCC GNRBSDIBKIHSJH-UHFFFAOYSA-N 0.000 description 1
- 238000005341 cation exchange Methods 0.000 description 1
- 239000012295 chemical reaction liquid Substances 0.000 description 1
- 229910052801 chlorine Inorganic materials 0.000 description 1
- 125000001309 chloro group Chemical group Cl* 0.000 description 1
- 239000011248 coating agent Substances 0.000 description 1
- 238000010276 construction Methods 0.000 description 1
- 238000004132 cross linking Methods 0.000 description 1
- 125000004093 cyano group Chemical group *C#N 0.000 description 1
- 125000006165 cyclic alkyl group Chemical group 0.000 description 1
- 150000001923 cyclic compounds Chemical class 0.000 description 1
- 125000000753 cycloalkyl group Chemical group 0.000 description 1
- ATGKAFZFOALBOF-UHFFFAOYSA-N cyclohexyl(triethoxy)silane Chemical compound CCO[Si](OCC)(OCC)C1CCCCC1 ATGKAFZFOALBOF-UHFFFAOYSA-N 0.000 description 1
- MEWFSXFFGFDHGV-UHFFFAOYSA-N cyclohexyl(trimethoxy)silane Chemical compound CO[Si](OC)(OC)C1CCCCC1 MEWFSXFFGFDHGV-UHFFFAOYSA-N 0.000 description 1
- OWTZOBMYFOECIQ-UHFFFAOYSA-N cyclohexyl(tripropoxy)silane Chemical compound CCCO[Si](OCCC)(OCCC)C1CCCCC1 OWTZOBMYFOECIQ-UHFFFAOYSA-N 0.000 description 1
- MGGAITMRMJXXMT-UHFFFAOYSA-N cyclopentyl(triethoxy)silane Chemical compound CCO[Si](OCC)(OCC)C1CCCC1 MGGAITMRMJXXMT-UHFFFAOYSA-N 0.000 description 1
- YRMPTIHEUZLTDO-UHFFFAOYSA-N cyclopentyl(trimethoxy)silane Chemical compound CO[Si](OC)(OC)C1CCCC1 YRMPTIHEUZLTDO-UHFFFAOYSA-N 0.000 description 1
- IRRVTIDUSZWLNF-UHFFFAOYSA-N cyclopentylsilane Chemical compound [SiH3]C1CCCC1 IRRVTIDUSZWLNF-UHFFFAOYSA-N 0.000 description 1
- 230000006837 decompression Effects 0.000 description 1
- 125000002704 decyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 238000006297 dehydration reaction Methods 0.000 description 1
- RKDSGTQHBBDPOM-UHFFFAOYSA-N dibutoxy(dicyclopentyl)silane Chemical compound C1CCCC1[Si](OCCCC)(OCCCC)C1CCCC1 RKDSGTQHBBDPOM-UHFFFAOYSA-N 0.000 description 1
- MGQFVQQCNPBJKC-UHFFFAOYSA-N dibutoxy(diethyl)silane Chemical compound CCCCO[Si](CC)(CC)OCCCC MGQFVQQCNPBJKC-UHFFFAOYSA-N 0.000 description 1
- GQNWJCQWBFHQAO-UHFFFAOYSA-N dibutoxy(dimethyl)silane Chemical compound CCCCO[Si](C)(C)OCCCC GQNWJCQWBFHQAO-UHFFFAOYSA-N 0.000 description 1
- BKGSSPASYNBWRR-UHFFFAOYSA-N dibutoxy(dipropyl)silane Chemical compound CCCCO[Si](CCC)(CCC)OCCCC BKGSSPASYNBWRR-UHFFFAOYSA-N 0.000 description 1
- DGPFXVBYDAVXLX-UHFFFAOYSA-N dibutyl(diethoxy)silane Chemical compound CCCC[Si](OCC)(OCC)CCCC DGPFXVBYDAVXLX-UHFFFAOYSA-N 0.000 description 1
- YPENMAABQGWRBR-UHFFFAOYSA-N dibutyl(dimethoxy)silane Chemical compound CCCC[Si](OC)(OC)CCCC YPENMAABQGWRBR-UHFFFAOYSA-N 0.000 description 1
- CGYGEZLIGMBRKL-UHFFFAOYSA-N dicyclohexyl(diethoxy)silane Chemical compound C1CCCCC1[Si](OCC)(OCC)C1CCCCC1 CGYGEZLIGMBRKL-UHFFFAOYSA-N 0.000 description 1
- ZVMRWPHIZSSUKP-UHFFFAOYSA-N dicyclohexyl(dimethoxy)silane Chemical compound C1CCCCC1[Si](OC)(OC)C1CCCCC1 ZVMRWPHIZSSUKP-UHFFFAOYSA-N 0.000 description 1
- FVAXOELGJXMINU-UHFFFAOYSA-N dicyclopentyl(diethoxy)silane Chemical compound C1CCCC1[Si](OCC)(OCC)C1CCCC1 FVAXOELGJXMINU-UHFFFAOYSA-N 0.000 description 1
- JWCYDYZLEAQGJJ-UHFFFAOYSA-N dicyclopentyl(dimethoxy)silane Chemical compound C1CCCC1[Si](OC)(OC)C1CCCC1 JWCYDYZLEAQGJJ-UHFFFAOYSA-N 0.000 description 1
- ZMAPKOCENOWQRE-UHFFFAOYSA-N diethoxy(diethyl)silane Chemical compound CCO[Si](CC)(CC)OCC ZMAPKOCENOWQRE-UHFFFAOYSA-N 0.000 description 1
- HZLIIKNXMLEWPA-UHFFFAOYSA-N diethoxy(dipropyl)silane Chemical compound CCC[Si](CCC)(OCC)OCC HZLIIKNXMLEWPA-UHFFFAOYSA-N 0.000 description 1
- VSYLGGHSEIWGJV-UHFFFAOYSA-N diethyl(dimethoxy)silane Chemical compound CC[Si](CC)(OC)OC VSYLGGHSEIWGJV-UHFFFAOYSA-N 0.000 description 1
- BZCJJERBERAQKQ-UHFFFAOYSA-N diethyl(dipropoxy)silane Chemical compound CCCO[Si](CC)(CC)OCCC BZCJJERBERAQKQ-UHFFFAOYSA-N 0.000 description 1
- CYICXDQJFWXGTC-UHFFFAOYSA-N dihexyl(dimethoxy)silane Chemical compound CCCCCC[Si](OC)(OC)CCCCCC CYICXDQJFWXGTC-UHFFFAOYSA-N 0.000 description 1
- JJQZDUKDJDQPMQ-UHFFFAOYSA-N dimethoxy(dimethyl)silane Chemical compound CO[Si](C)(C)OC JJQZDUKDJDQPMQ-UHFFFAOYSA-N 0.000 description 1
- JVUVKQDVTIIMOD-UHFFFAOYSA-N dimethoxy(dipropyl)silane Chemical compound CCC[Si](OC)(OC)CCC JVUVKQDVTIIMOD-UHFFFAOYSA-N 0.000 description 1
- ZIDTUTFKRRXWTK-UHFFFAOYSA-N dimethyl(dipropoxy)silane Chemical compound CCCO[Si](C)(C)OCCC ZIDTUTFKRRXWTK-UHFFFAOYSA-N 0.000 description 1
- YYLGKUPAFFKGRQ-UHFFFAOYSA-N dimethyldiethoxysilane Chemical compound CCO[Si](C)(C)OCC YYLGKUPAFFKGRQ-UHFFFAOYSA-N 0.000 description 1
- AVBCBOQFOQZNFK-UHFFFAOYSA-N dipropoxy(dipropyl)silane Chemical compound CCCO[Si](CCC)(CCC)OCCC AVBCBOQFOQZNFK-UHFFFAOYSA-N 0.000 description 1
- 125000003438 dodecyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 230000000694 effects Effects 0.000 description 1
- 238000005868 electrolysis reaction Methods 0.000 description 1
- 230000007613 environmental effect Effects 0.000 description 1
- NKSJNEHGWDZZQF-UHFFFAOYSA-N ethenyl(trimethoxy)silane Chemical compound CO[Si](OC)(OC)C=C NKSJNEHGWDZZQF-UHFFFAOYSA-N 0.000 description 1
- 125000001301 ethoxy group Chemical group [H]C([H])([H])C([H])([H])O* 0.000 description 1
- DFJDZTPFNSXNAX-UHFFFAOYSA-N ethoxy(triethyl)silane Chemical compound CCO[Si](CC)(CC)CC DFJDZTPFNSXNAX-UHFFFAOYSA-N 0.000 description 1
- MMEIWOLDAQXGAR-UHFFFAOYSA-N ethoxy(trihexyl)silane Chemical compound CCCCCC[Si](CCCCCC)(CCCCCC)OCC MMEIWOLDAQXGAR-UHFFFAOYSA-N 0.000 description 1
- RSIHJDGMBDPTIM-UHFFFAOYSA-N ethoxy(trimethyl)silane Chemical compound CCO[Si](C)(C)C RSIHJDGMBDPTIM-UHFFFAOYSA-N 0.000 description 1
- STBFUFDKXHQVMJ-UHFFFAOYSA-N ethoxy(tripropyl)silane Chemical compound CCC[Si](CCC)(CCC)OCC STBFUFDKXHQVMJ-UHFFFAOYSA-N 0.000 description 1
- SBRXLTRZCJVAPH-UHFFFAOYSA-N ethyl(trimethoxy)silane Chemical compound CC[Si](OC)(OC)OC SBRXLTRZCJVAPH-UHFFFAOYSA-N 0.000 description 1
- KUCGHDUQOVVQED-UHFFFAOYSA-N ethyl(tripropoxy)silane Chemical compound CCCO[Si](CC)(OCCC)OCCC KUCGHDUQOVVQED-UHFFFAOYSA-N 0.000 description 1
- 239000000945 filler Substances 0.000 description 1
- 229910052731 fluorine Inorganic materials 0.000 description 1
- 125000001153 fluoro group Chemical group F* 0.000 description 1
- NBVXSUQYWXRMNV-UHFFFAOYSA-N fluoromethane Chemical compound FC NBVXSUQYWXRMNV-UHFFFAOYSA-N 0.000 description 1
- 125000000524 functional group Chemical group 0.000 description 1
- 125000005843 halogen group Chemical group 0.000 description 1
- XWHJQTQOUDOZGR-UHFFFAOYSA-N hex-1-enyl(trimethoxy)silane Chemical compound CCCCC=C[Si](OC)(OC)OC XWHJQTQOUDOZGR-UHFFFAOYSA-N 0.000 description 1
- HTDJPCNNEPUOOQ-UHFFFAOYSA-N hexamethylcyclotrisiloxane Chemical compound C[Si]1(C)O[Si](C)(C)O[Si](C)(C)O1 HTDJPCNNEPUOOQ-UHFFFAOYSA-N 0.000 description 1
- UQEAIHBTYFGYIE-UHFFFAOYSA-N hexamethyldisiloxane Chemical compound C[Si](C)(C)O[Si](C)(C)C UQEAIHBTYFGYIE-UHFFFAOYSA-N 0.000 description 1
- 125000006038 hexenyl group Chemical group 0.000 description 1
- 230000007062 hydrolysis Effects 0.000 description 1
- 238000006459 hydrosilylation reaction Methods 0.000 description 1
- 150000007529 inorganic bases Chemical class 0.000 description 1
- 229910052740 iodine Inorganic materials 0.000 description 1
- 125000000959 isobutyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])* 0.000 description 1
- 125000004491 isohexyl group Chemical group C(CCC(C)C)* 0.000 description 1
- 125000001972 isopentyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 1
- 239000000463 material Substances 0.000 description 1
- 239000012528 membrane Substances 0.000 description 1
- 125000000956 methoxy group Chemical group [H]C([H])([H])O* 0.000 description 1
- POPACFLNWGUDSR-UHFFFAOYSA-N methoxy(trimethyl)silane Chemical compound CO[Si](C)(C)C POPACFLNWGUDSR-UHFFFAOYSA-N 0.000 description 1
- FUMSHFZKHQOOIX-UHFFFAOYSA-N methoxy(tripropyl)silane Chemical compound CCC[Si](CCC)(CCC)OC FUMSHFZKHQOOIX-UHFFFAOYSA-N 0.000 description 1
- RJMRIDVWCWSWFR-UHFFFAOYSA-N methyl(tripropoxy)silane Chemical compound CCCO[Si](C)(OCCC)OCCC RJMRIDVWCWSWFR-UHFFFAOYSA-N 0.000 description 1
- BFXIKLCIZHOAAZ-UHFFFAOYSA-N methyltrimethoxysilane Chemical compound CO[Si](C)(OC)OC BFXIKLCIZHOAAZ-UHFFFAOYSA-N 0.000 description 1
- 150000007522 mineralic acids Chemical class 0.000 description 1
- 238000002156 mixing Methods 0.000 description 1
- 239000003607 modifier Substances 0.000 description 1
- 125000001421 myristyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 125000004108 n-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000003136 n-heptyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000001280 n-hexyl group Chemical group C(CCCCC)* 0.000 description 1
- 125000000740 n-pentyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000004123 n-propyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000001624 naphthyl group Chemical group 0.000 description 1
- 125000005244 neohexyl group Chemical group [H]C([H])([H])C(C([H])([H])[H])(C([H])([H])[H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000001971 neopentyl group Chemical group [H]C([*])([H])C(C([H])([H])[H])(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- CXQXSVUQTKDNFP-UHFFFAOYSA-N octamethyltrisiloxane Chemical compound C[Si](C)(C)O[Si](C)(C)O[Si](C)(C)C CXQXSVUQTKDNFP-UHFFFAOYSA-N 0.000 description 1
- JRZJOMJEPLMPRA-UHFFFAOYSA-N olefin Natural products CCCCCCCC=C JRZJOMJEPLMPRA-UHFFFAOYSA-N 0.000 description 1
- 150000007524 organic acids Chemical class 0.000 description 1
- 235000005985 organic acids Nutrition 0.000 description 1
- 150000003961 organosilicon compounds Chemical class 0.000 description 1
- 125000005375 organosiloxane group Chemical group 0.000 description 1
- SBWUROCZFPLRIY-UHFFFAOYSA-N oxido(tripropyl)silane;tetraethylazanium Chemical compound CC[N+](CC)(CC)CC.CCC[Si]([O-])(CCC)CCC SBWUROCZFPLRIY-UHFFFAOYSA-N 0.000 description 1
- JYGJYPITVYQJLR-UHFFFAOYSA-N oxido(tripropyl)silane;tetramethylazanium Chemical compound C[N+](C)(C)C.CCC[Si]([O-])(CCC)CCC JYGJYPITVYQJLR-UHFFFAOYSA-N 0.000 description 1
- YAHFNXUIHPXHKP-UHFFFAOYSA-N oxido(tripropyl)silane;tetrapropylazanium Chemical compound CCC[Si]([O-])(CCC)CCC.CCC[N+](CCC)(CCC)CCC YAHFNXUIHPXHKP-UHFFFAOYSA-N 0.000 description 1
- 239000003973 paint Substances 0.000 description 1
- 125000000913 palmityl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 description 1
- DJFBJKSMACBYBD-UHFFFAOYSA-N phosphane;hydrate Chemical group O.P DJFBJKSMACBYBD-UHFFFAOYSA-N 0.000 description 1
- 239000002574 poison Substances 0.000 description 1
- 231100000614 poison Toxicity 0.000 description 1
- 239000000843 powder Substances 0.000 description 1
- 125000002572 propoxy group Chemical group [*]OC([H])([H])C(C([H])([H])[H])([H])[H] 0.000 description 1
- IEKMLKYASCBALX-UHFFFAOYSA-N propoxy(tripropyl)silane Chemical compound CCCO[Si](CCC)(CCC)CCC IEKMLKYASCBALX-UHFFFAOYSA-N 0.000 description 1
- ZMYXZXUHYAGGKG-UHFFFAOYSA-N propoxysilane Chemical compound CCCO[SiH3] ZMYXZXUHYAGGKG-UHFFFAOYSA-N 0.000 description 1
- 239000005871 repellent Substances 0.000 description 1
- 230000002940 repellent Effects 0.000 description 1
- 239000011347 resin Substances 0.000 description 1
- 229920005989 resin Polymers 0.000 description 1
- 150000003839 salts Chemical class 0.000 description 1
- 239000000565 sealant Substances 0.000 description 1
- 125000002914 sec-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 1
- 125000003548 sec-pentyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 1
- SCPYDCQAZCOKTP-UHFFFAOYSA-N silanol Chemical compound [SiH3]O SCPYDCQAZCOKTP-UHFFFAOYSA-N 0.000 description 1
- 239000000377 silicon dioxide Substances 0.000 description 1
- 125000004079 stearyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 125000001424 substituent group Chemical group 0.000 description 1
- 239000012756 surface treatment agent Substances 0.000 description 1
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 125000001973 tert-pentyl group Chemical group [H]C([H])([H])C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 229940073455 tetraethylammonium hydroxide Drugs 0.000 description 1
- LRGJRHZIDJQFCL-UHFFFAOYSA-M tetraethylazanium;hydroxide Chemical compound [OH-].CC[N+](CC)(CC)CC LRGJRHZIDJQFCL-UHFFFAOYSA-M 0.000 description 1
- NPLFJJDXEFAMBZ-UHFFFAOYSA-N tetraethylazanium;triethyl(oxido)silane Chemical compound CC[Si]([O-])(CC)CC.CC[N+](CC)(CC)CC NPLFJJDXEFAMBZ-UHFFFAOYSA-N 0.000 description 1
- KPNCAGYPCTYMBD-UHFFFAOYSA-N tetraethylazanium;trimethyl(oxido)silane Chemical compound C[Si](C)(C)[O-].CC[N+](CC)(CC)CC KPNCAGYPCTYMBD-UHFFFAOYSA-N 0.000 description 1
- FQQSPSYDVHJEHF-UHFFFAOYSA-N tetramethylazanium;triethyl(oxido)silane Chemical compound C[N+](C)(C)C.CC[Si]([O-])(CC)CC FQQSPSYDVHJEHF-UHFFFAOYSA-N 0.000 description 1
- OSBSFAARYOCBHB-UHFFFAOYSA-N tetrapropylammonium Chemical compound CCC[N+](CCC)(CCC)CCC OSBSFAARYOCBHB-UHFFFAOYSA-N 0.000 description 1
- LPSKDVINWQNWFE-UHFFFAOYSA-M tetrapropylazanium;hydroxide Chemical compound [OH-].CCC[N+](CCC)(CCC)CCC LPSKDVINWQNWFE-UHFFFAOYSA-M 0.000 description 1
- WMTLFAFCOLBFRK-UHFFFAOYSA-N tetrapropylazanium;trimethyl(oxido)silane Chemical compound C[Si](C)(C)[O-].CCC[N+](CCC)(CCC)CCC WMTLFAFCOLBFRK-UHFFFAOYSA-N 0.000 description 1
- 125000003944 tolyl group Chemical group 0.000 description 1
- DEKZKCDJQLBBRA-UHFFFAOYSA-N tributoxy(butyl)silane Chemical compound CCCCO[Si](CCCC)(OCCCC)OCCCC DEKZKCDJQLBBRA-UHFFFAOYSA-N 0.000 description 1
- XCQYKITYUMPINW-UHFFFAOYSA-N tributoxy(cyclohexyl)silane Chemical compound CCCCO[Si](OCCCC)(OCCCC)C1CCCCC1 XCQYKITYUMPINW-UHFFFAOYSA-N 0.000 description 1
- GIHPVQDFBJMUAO-UHFFFAOYSA-N tributoxy(ethyl)silane Chemical compound CCCCO[Si](CC)(OCCCC)OCCCC GIHPVQDFBJMUAO-UHFFFAOYSA-N 0.000 description 1
- TYRCLNWBTLSTJO-UHFFFAOYSA-N tributoxy(hexyl)silane Chemical compound CCCCCC[Si](OCCCC)(OCCCC)OCCCC TYRCLNWBTLSTJO-UHFFFAOYSA-N 0.000 description 1
- GYZQBXUDWTVJDF-UHFFFAOYSA-N tributoxy(methyl)silane Chemical compound CCCCO[Si](C)(OCCCC)OCCCC GYZQBXUDWTVJDF-UHFFFAOYSA-N 0.000 description 1
- WAAWAIHPWOJHJJ-UHFFFAOYSA-N tributoxy(propyl)silane Chemical compound CCCCO[Si](CCC)(OCCCC)OCCCC WAAWAIHPWOJHJJ-UHFFFAOYSA-N 0.000 description 1
- ZIGUISZVHLIELY-UHFFFAOYSA-N tricyclohexylsilane Chemical compound C1CCCCC1[SiH](C1CCCCC1)C1CCCCC1 ZIGUISZVHLIELY-UHFFFAOYSA-N 0.000 description 1
- DENFJSAFJTVPJR-UHFFFAOYSA-N triethoxy(ethyl)silane Chemical compound CCO[Si](CC)(OCC)OCC DENFJSAFJTVPJR-UHFFFAOYSA-N 0.000 description 1
- WUMSTCDLAYQDNO-UHFFFAOYSA-N triethoxy(hexyl)silane Chemical compound CCCCCC[Si](OCC)(OCC)OCC WUMSTCDLAYQDNO-UHFFFAOYSA-N 0.000 description 1
- CPUDPFPXCZDNGI-UHFFFAOYSA-N triethoxy(methyl)silane Chemical compound CCO[Si](C)(OCC)OCC CPUDPFPXCZDNGI-UHFFFAOYSA-N 0.000 description 1
- NBXZNTLFQLUFES-UHFFFAOYSA-N triethoxy(propyl)silane Chemical compound CCC[Si](OCC)(OCC)OCC NBXZNTLFQLUFES-UHFFFAOYSA-N 0.000 description 1
- HUZZQXYTKNNCOU-UHFFFAOYSA-N triethyl(methoxy)silane Chemical compound CC[Si](CC)(CC)OC HUZZQXYTKNNCOU-UHFFFAOYSA-N 0.000 description 1
- RXJWOBGGPLEFEE-UHFFFAOYSA-N triethyl(propoxy)silane Chemical compound CCCO[Si](CC)(CC)CC RXJWOBGGPLEFEE-UHFFFAOYSA-N 0.000 description 1
- JLGNHOJUQFHYEZ-UHFFFAOYSA-N trimethoxy(3,3,3-trifluoropropyl)silane Chemical compound CO[Si](OC)(OC)CCC(F)(F)F JLGNHOJUQFHYEZ-UHFFFAOYSA-N 0.000 description 1
- ZNOCGWVLWPVKAO-UHFFFAOYSA-N trimethoxy(phenyl)silane Chemical compound CO[Si](OC)(OC)C1=CC=CC=C1 ZNOCGWVLWPVKAO-UHFFFAOYSA-N 0.000 description 1
- LFRDHGNFBLIJIY-UHFFFAOYSA-N trimethoxy(prop-2-enyl)silane Chemical compound CO[Si](OC)(OC)CC=C LFRDHGNFBLIJIY-UHFFFAOYSA-N 0.000 description 1
- HQYALQRYBUJWDH-UHFFFAOYSA-N trimethoxy(propyl)silane Chemical compound CCC[Si](OC)(OC)OC HQYALQRYBUJWDH-UHFFFAOYSA-N 0.000 description 1
- PZJJKWKADRNWSW-UHFFFAOYSA-N trimethoxysilicon Chemical group CO[Si](OC)OC PZJJKWKADRNWSW-UHFFFAOYSA-N 0.000 description 1
- PHPGKIATZDCVHL-UHFFFAOYSA-N trimethyl(propoxy)silane Chemical compound CCCO[Si](C)(C)C PHPGKIATZDCVHL-UHFFFAOYSA-N 0.000 description 1
- VUWVDNLZJXLQPT-UHFFFAOYSA-N tripropoxy(propyl)silane Chemical compound CCCO[Si](CCC)(OCCC)OCCC VUWVDNLZJXLQPT-UHFFFAOYSA-N 0.000 description 1
- 125000000391 vinyl group Chemical group [H]C([*])=C([H])[H] 0.000 description 1
Classifications
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J31/00—Catalysts comprising hydrides, coordination complexes or organic compounds
- B01J31/02—Catalysts comprising hydrides, coordination complexes or organic compounds containing organic compounds or metal hydrides
- B01J31/0234—Nitrogen-, phosphorus-, arsenic- or antimony-containing compounds
- B01J31/0235—Nitrogen containing compounds
- B01J31/0239—Quaternary ammonium compounds
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07F—ACYCLIC, CARBOCYCLIC OR HETEROCYCLIC COMPOUNDS CONTAINING ELEMENTS OTHER THAN CARBON, HYDROGEN, HALOGEN, OXYGEN, NITROGEN, SULFUR, SELENIUM OR TELLURIUM
- C07F7/00—Compounds containing elements of Groups 4 or 14 of the Periodic Table
- C07F7/02—Silicon compounds
- C07F7/08—Compounds having one or more C—Si linkages
- C07F7/0834—Compounds having one or more O-Si linkage
- C07F7/0836—Compounds with one or more Si-OH or Si-O-metal linkage
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07F—ACYCLIC, CARBOCYCLIC OR HETEROCYCLIC COMPOUNDS CONTAINING ELEMENTS OTHER THAN CARBON, HYDROGEN, HALOGEN, OXYGEN, NITROGEN, SULFUR, SELENIUM OR TELLURIUM
- C07F7/00—Compounds containing elements of Groups 4 or 14 of the Periodic Table
- C07F7/02—Silicon compounds
- C07F7/08—Compounds having one or more C—Si linkages
- C07F7/0834—Compounds having one or more O-Si linkage
- C07F7/0838—Compounds with one or more Si-O-Si sequences
- C07F7/0872—Preparation and treatment thereof
- C07F7/0874—Reactions involving a bond of the Si-O-Si linkage
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07F—ACYCLIC, CARBOCYCLIC OR HETEROCYCLIC COMPOUNDS CONTAINING ELEMENTS OTHER THAN CARBON, HYDROGEN, HALOGEN, OXYGEN, NITROGEN, SULFUR, SELENIUM OR TELLURIUM
- C07F7/00—Compounds containing elements of Groups 4 or 14 of the Periodic Table
- C07F7/02—Silicon compounds
- C07F7/08—Compounds having one or more C—Si linkages
- C07F7/0834—Compounds having one or more O-Si linkage
- C07F7/0838—Compounds with one or more Si-O-Si sequences
- C07F7/0872—Preparation and treatment thereof
- C07F7/0876—Reactions involving the formation of bonds to a Si atom of a Si-O-Si sequence other than a bond of the Si-O-Si linkage
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08G—MACROMOLECULAR COMPOUNDS OBTAINED OTHERWISE THAN BY REACTIONS ONLY INVOLVING UNSATURATED CARBON-TO-CARBON BONDS
- C08G77/00—Macromolecular compounds obtained by reactions forming a linkage containing silicon with or without sulfur, nitrogen, oxygen or carbon in the main chain of the macromolecule
- C08G77/04—Polysiloxanes
- C08G77/06—Preparatory processes
- C08G77/08—Preparatory processes characterised by the catalysts used
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J2231/00—Catalytic reactions performed with catalysts classified in B01J31/00
- B01J2231/70—Oxidation reactions, e.g. epoxidation, (di)hydroxylation, dehydrogenation and analogues
- B01J2231/76—Dehydrogenation
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Polymers & Plastics (AREA)
- Engineering & Computer Science (AREA)
- Materials Engineering (AREA)
- Silicon Polymers (AREA)
- Catalysts (AREA)
Description
本願は、2006年12月28日に日本国に出願された特願2006−354812号に基づいて優先権を主張し、その内容をここに援用する。
本発明は、第4級アンモニウムイオン含有化合物からなる脱アルコール縮合反応用触媒、並びに、それを用いた脱アルコール縮合反応によるオルガノポリシロキサンの製造方法に関する。
従来、様々な塩基性物質、例えば、水酸化カリウム、水酸化ナトリウム、水酸化バリウム等の塩基性金属塩が、ケイ素原子結合ヒドロキシ基、ケイ素原子結合アルコキシ基、又は、他のケイ素原子結合官能基の縮合反応を介したオルガノポリシロキサン等の有機ケイ素化合物の製造用触媒として使用されている。
一方、特公昭46−21602号公報、特公昭47−44040号公報、特開平4−225031号公報、及び、特開平5−43694号公報には、オクタメチルシクロテトラシロキサン等の低分子量の環状シロキサンを開環重合させて、高分子量のオルガノポリシロキサンを得るための触媒として、水酸化テトラメチルアンモニウム化合物が知られている。なお、特開2006−328231号公報には、2種類のトリアルコキシシランを共加水分解・共縮合してラダー型又はランダム型構造のシルセスキオキサン誘導体を製造することが記載されており、水酸化テトラメチルアンモニウムが実施例で使用されている。
また、特開昭59−176326号公報には、低分子量の分子鎖両末端ヒドロキシ基封鎖ジオルガノポリシロキサンを、シリカ等の充填剤の存在下において、水酸化第4級ホスホニウム化合物と低分子量のジオルガノシロキサンとの反応混合物を触媒として高分子量化する方法が記載されている。
特公昭46−21602号公報
特公昭47−44040号公報
特開平4−225031号公報
特開平5−43694号公報
特開昭59−176326号公報
特開2006−328231号公報
しかし、塩基性金属塩を縮合反応用触媒として使用する場合は、反応終了後に残存する塩基性金属塩を中和し、これにより生成した塩を濾過等によって除去する工程が必要となる。更に、塩基性金属塩を完全に中和するためには、若干過剰の酸性物質を使用することが一般的であるが、この場合は、中和完了後に過剰の酸性物質を除去する工程も必要となる。このように、塩基性金属塩を触媒とした縮合反応によるオルガノポリシロキサンの製造方法は、工程が複雑となり、また、廃棄物が増加するという問題を有している。
一方、水酸化テトラメチルアンモニウム化合物を触媒として使用する低分子量環状シロキサンの開環重合では、塩基性金属塩を触媒として使用した場合の上記の問題点は回避されるものの、環状化合物の開環重合とは全く異なる脱アルコール縮合反応の触媒としての同化合物の使用はこれまで検討されていない。なお、特開2006−328231号公報の実施例で使用されている水酸化テトラメチルアンモニウムは、アルコキシシランを加水分解して得られるシラノールを脱水縮合させる反応に関与しており、脱アルコール縮合反応の触媒として使用されてはいない。
また、水酸化第4級ホスホニウム化合物と低分子量のジオルガノシロキサンとの反応混合物を触媒として、低分子量の分子鎖両末端ヒドロキシ基封鎖ジオルガノポリシロキサンを高分子量化する場合は、ケイ素原子結合ヒドロキシ基同士の縮合反応であるため高温・減圧条件が必要であり、多量の触媒を使用する必要があるために、製造工程が複雑となる。また、水酸化第4級ホスホニウム化合物は熱による活性消失後も系中に残留しその除去も困難であるので、製品の純度が低下し、高純度が要求される用途やヒドロシリル化反応を伴う用途には触媒毒になることから使用できないという問題を有している。
本発明は、このような従来技術の現状に鑑みてなされたものであり、多量に使用する必要がなく、使用後の除去が容易な脱アルコール縮合反応用触媒を提供し、それにより、複雑な製造工程を必要とせず、廃棄物が少ないオルガノポリシロキサンの製造方法を確立することをその目的とする。
本発明の目的は、第4級アンモニウムイオン含有化合物をケイ素原子結合ヒドロキシ基とケイ素原子結合アルコキシ基との脱アルコール縮合反応用の触媒として使用することにより達成される。
前記第4級アンモニウムイオン含有化合物としては、水酸化アルキルアンモニウム化合物又はそのシラノレートが好ましい。前記水酸化アルキルアンモニウム化合物としては、水酸化テトラメチルアンモニウムが好ましく、前記水酸化アルキルアンモニウム化合物のシラノレートとしては、トリメチルアンモニウム トリメチルシラノレート又は水酸化テトラメチルアンモニウム化合物とオルガノポリシロキサンとの反応混合物が好ましい。そして、前記水酸化アルキルアンモニウム化合物は水溶液又はアルコール溶液の形態にあることが好ましい。
前記脱アルコール縮合反応用触媒は、下記平均組成式(I):
(式中、
R1及びR2は、それぞれ独立して、一価炭化水素基を表し;
0≦a<4、0<b<4、0<c<4、及び、c≦bであり、但し、0<a+b+c<4である)
で示される化合物を脱アルコール縮合させて、下記平均組成式(II):
(式中、
R1、R2、a、b、及び、cは上記と同一であり;
但し、0<a+b<4である)
で示されるオルガノポリシロキサンを製造する際に好適に使用される。
R1及びR2は、それぞれ独立して、一価炭化水素基を表し;
0≦a<4、0<b<4、0<c<4、及び、c≦bであり、但し、0<a+b+c<4である)
で示される化合物を脱アルコール縮合させて、下記平均組成式(II):
R1、R2、a、b、及び、cは上記と同一であり;
但し、0<a+b<4である)
で示されるオルガノポリシロキサンを製造する際に好適に使用される。
前記平均組成式(I)で示される化合物は、下記一般式(III):
(式中、
R1及びR2は上記と同一であり;
a'は0、1、2又は3であり、b'は1、2、3又は4であり、但し、a'+b'=4である)
で示されるアルコキシシランを加水分解して得ることが好ましい。前記平均組成式(III)で示されるアルコキシシランが、テトラアルコキシシラン、モノオルガノトリアルコキシシラン、ジオルガノジアルコキシシラン、及び、これらの混合物からなる群から選択されるアルコキシシランであることが好ましい。
R1及びR2は上記と同一であり;
a'は0、1、2又は3であり、b'は1、2、3又は4であり、但し、a'+b'=4である)
で示されるアルコキシシランを加水分解して得ることが好ましい。前記平均組成式(III)で示されるアルコキシシランが、テトラアルコキシシラン、モノオルガノトリアルコキシシラン、ジオルガノジアルコキシシラン、及び、これらの混合物からなる群から選択されるアルコキシシランであることが好ましい。
また、前記脱アルコール縮合反応用触媒は、下記平均組成式(IV):
(式中、
R3、及び、R4は、それぞれ独立して、一価炭化水素基を表し;
0≦d<4、及び、0<e≦4であり、但し、0<d+e≦4である)
で示される化合物と、下記平均組成式(V):
(式中、
R5は、一価炭化水素基を表し;
0≦f<4、及び、0<g<4であり、但し、0<f+g<4である)
で示される化合物を、前記平均組成式(IV)で示される化合物に含まれるアルコキシ基のモル数が平均組成式(V)で示される化合物に含まれるヒドロキシ基のモル数以上となる比率で脱アルコール縮合させて、平均組成式(VI):
(式中、
R3、R4、及び、R5は上記と同一であり、0≦h<4、0≦i<4、及び、0≦j<4であり、但し、0<h+i+j<4である)
で示されるオルガノポリシロキサンを製造する際にも好適に使用される。前記平均組成式(IV)で示される化合物がテトラアルコキシシランであり、前記平均組成式(V)で示される化合物が分子鎖両末端にケイ素原子結合ヒドロキシ基を有するジオルガノポリシロキサンであることが好ましい。
R3、及び、R4は、それぞれ独立して、一価炭化水素基を表し;
0≦d<4、及び、0<e≦4であり、但し、0<d+e≦4である)
で示される化合物と、下記平均組成式(V):
R5は、一価炭化水素基を表し;
0≦f<4、及び、0<g<4であり、但し、0<f+g<4である)
で示される化合物を、前記平均組成式(IV)で示される化合物に含まれるアルコキシ基のモル数が平均組成式(V)で示される化合物に含まれるヒドロキシ基のモル数以上となる比率で脱アルコール縮合させて、平均組成式(VI):
R3、R4、及び、R5は上記と同一であり、0≦h<4、0≦i<4、及び、0≦j<4であり、但し、0<h+i+j<4である)
で示されるオルガノポリシロキサンを製造する際にも好適に使用される。前記平均組成式(IV)で示される化合物がテトラアルコキシシランであり、前記平均組成式(V)で示される化合物が分子鎖両末端にケイ素原子結合ヒドロキシ基を有するジオルガノポリシロキサンであることが好ましい。
本発明の脱アルコール縮合反応用触媒は多量に使用する必要がなく、使用後の除去が容易である。したがって、脱アルコール縮合反応の後処理工程の複雑化を回避することができ、製品の純度を高くすることができ、また、廃棄物の増加を抑制することができる。
これにより、本発明のオルガノポリシロキサンの製造方法は、複雑な製造工程を必要とせず、また、多量の触媒の使用を回避することができる。そして、本発明のオルガノポリシロキサンの製造方法はヒドロキシ基同士の縮合反応を介さないので、高温・減圧の反応条件が緩和され、この面からも、製造工程の複雑化を回避することができる。
したがって、本発明の脱アルコール縮合反応用触媒及びそれを用いたオルガノポリシロキサンの製造方法は実用上有利であり、また、環境負荷を低減することができる。
本発明の脱アルコール縮合反応用触媒はケイ素原子結合ヒドロキシ基とケイ素原子結合アルコキシ基との脱アルコール縮合反応を促進するものであり、第4級アンモニウムイオン含有化合物からなる。なお、ここでの「からなる」とは、第4級アンモニウムイオン含有化合物のみからなる場合に加え、第4級アンモニウムイオン含有化合物を主触媒成分として、その他の付加成分を含む態様をも包含するものである。
第4級アンモニウムイオン含有化合物としては、第4級アンモニウム基を有する限り特に限定されるものではないが、塩基性であることが好ましい。第4級アンモニウムイオンを有する塩基性化合物としては、水酸化アルキルアンモニウム化合物が挙げられる。
水酸化アルキルアンモニウム化合物を構成するアルキル基としては、炭素数1〜6のアルキル基が好ましく、メチル基、エチル基、プロピル基等が挙げられるが、炭素数は小さい方が好ましく、特にメチル基が好ましい。したがって、水酸化アルキルアンモニウム化合物としては、水酸化テトラメチルアンモニウム、水酸化テトラエチルアンモニウム、水酸化テトラプロピルアンモニウム、水酸化テトラブチルアンモニウム等が挙げられるが、特に、水酸化テトラメチルアンモニウムが好ましい。
水酸化アルキルアンモニウム化合物のシラノレートも第4級アンモニウムイオン含有化合物として使用することができる。
水酸化アルキルアンモニウム化合物のシラノレートとしては、例えば、テトラメチルアンモニウム トリメチルシラノレート、テトラエチルアンモニウム トリメチルシラノレート、テトラプロピルアンモニウム トリメチルシラノレート、テトラメチルアンモニウム トリエチルシラノレート、テトラエチルアンモニウム トリエチルシラノレート、テトラプロピルアンモニウム トリエチルシラノレート、テトラメチルアンモニウム トリプロピルシラノレート、テトラエチルアンモニウム トリプロピルシラノレート、テトラプロピルアンモニウム トリプロピルシラノレート等が挙げられるが、特に、テトラメチルアンモニウム トリメチルシラノレート{(CH3)4N−OSi(CH3)3}が好ましい。これらのシラノレートとしては、任意の方法により製造されたものを使用することができ、例えば、水酸化テトラアルキルアンモニウム化合物とシラノール化合物との脱水反応により調製することができる。
水酸化アルキルアンモニウム化合物のシラノレートとして、水酸化アルキルアンモニウム化合物とオルガノポリシロキサンとの反応混合物を使用することもできる。オルガノポリシロキサンは、水酸化アルキルアンモニウム化合物のヒドロキシ基と反応可能なものであれば特に限定されるものではなく、例えば、ヘキサメチルジシロキサン、オクタメチルトリシロキサン等の直鎖状ポリシロキサン、並びに、デカメチルシクロペンタシロキサン、オクタメチルシクロテトラシロキサン、ヘキサメチルシクロトリシロキサン等の環式シロキサン等が挙げられる。好ましい反応混合物の例は、下記式:
(式中、nは1以上の整数を表す)で表されるものである。
本発明の脱アルコール縮合反応用触媒は、一種類の第4級アンモニウムイオン含有化合物からなるものであっても、また、二種類以上を併用するものであってもよい。
第4級アンモニウムイオン含有化合物として水酸化テトラアルキルアンモニウム化合物を使用する場合は、水酸化テトラアルキルアンモニウム化合物としては、任意の方法により製造されたものを使用することができる。例えば、水酸化テトラアルキルアンモニウム化合物は、特開昭61−190085号公報に記載されるように、テトラアルキルアンモニウムハライド等のテトラアルキルアンモニウム化合物の水溶液を、フルオロカーボン系陽イオン交換膜によって陽極室と陰極室とに区別された電解槽の陽極室に供給し、当該陽極室に水を供給しながら電解して、その後、陰極室からテトラアルキルアンモニウム水酸化物の水溶液を取り出すようにした電解方法によって製造することができる。
前記水酸化テトラアルキルアンモニウムは、安定性の点で、適当な溶媒に希釈して使用することが好ましく、特に、水溶液又はアルコール溶液の形態にあることが好ましい。
本発明のオルガノポリシロキサンの製造方法では、触媒としての第4級アンモニウムイオン含有化合物、好ましくは水酸化アルキルアンモニウム化合物又はそのシラノレート、の存在下で、ケイ素原子結合ヒドロキシ基とケイ素原子結合アルコキシ基との脱アルコール縮合反応によりオルガノポリシロキサンが合成される。本発明のオルガノポリシロキサンの製造方法では、高温・減圧条件が必要なケイ素原子結合ヒドロキシ基同士の縮合反応を介さないので、より容易にオルガノポリシロキサンを製造することができる。
例えば、本発明によれば、下記平均組成式(I):
(式中、
R1、及び、R2は、それぞれ独立して、一価炭化水素基を表し;
0≦a<4、0<b<4、0<c<4、及び、c≦bであり、但し、0<a+b+c<4である)
で示される化合物を、第4級アンモニウムイオン含有化合物の存在下で脱アルコール縮合させることにより、下記平均組成式(II):
(式中、
R1、R2、a、b及びcは上記と同一であり;
但し、0<a+b<4である)
で示されるオルガノポリシロキサンを製造することができる。なお、上記式中、c<bであることが好ましい。
R1、及び、R2は、それぞれ独立して、一価炭化水素基を表し;
0≦a<4、0<b<4、0<c<4、及び、c≦bであり、但し、0<a+b+c<4である)
で示される化合物を、第4級アンモニウムイオン含有化合物の存在下で脱アルコール縮合させることにより、下記平均組成式(II):
R1、R2、a、b及びcは上記と同一であり;
但し、0<a+b<4である)
で示されるオルガノポリシロキサンを製造することができる。なお、上記式中、c<bであることが好ましい。
前記一価炭化水素基は、炭素数1〜30の、直鎖、分岐又は環式の炭化水素基であってよく、当該炭化水素基としては、炭素数1〜30の直鎖、分岐又は環式のアルキル基、炭素数2〜30の直鎖、分岐又は環式のアルケニル基、炭素数6〜30のアリール基、炭素数7〜30のアリールアルキル基等が挙げられる。
前記直鎖、分岐又は環式のアルキル基としては、例えば、メチル基、エチル基、n−プロピル基、iso−プロピル基、n−ブチル基、iso−ブチル基、sec−ブチル基、tert−ブチル基、n−ペンチル基、iso−ペンチル基、sec−ペンチル基、ネオペンチル基、tert−ペンチル基、cyc−ペンチル基、n−ヘキシル基、iso−ヘキシル基、sec−ヘキシル基、ネオヘキシル基、cyc−ヘキシル基、n−ヘプチル基、iso−ヘプチル基、sec−ヘプチル基、ネオヘプチル基、cyc−ヘプチル基、n−オクチル基、iso−オクチル基、sec−オクチル基、ネオオクチル基、cyc−オクチル基、n−ノニル基、iso−ノニル基、sec−ノニル基、ネオノニル基、cyc−ノニル基、デシル基、ウンデシル基、ドデシル基、テトラデシル基、ヘキサデシル基、オクタデシル基が挙げられる。
前記直鎖、分岐又は環式のアルケニル基としては、例えば、ビニル基、アリル基、ブテニル基、ヘキセニル基等が挙げられる。
前記アリール基としては、フェニル基、トリル基、ナフチル基等が挙げられる。
前記アリールアルキル基としては、フェネチル基、ベンジル基等が挙げられる。
前記炭化水素基は置換又は非置換のいずれであってもよく、置換炭化水素基の場合は、置換基として、例えば、フッ素原子、塩素原子、臭素原子、ヨウ素原子等のハロゲン原子、メトキシ基、エトキシ基、プロポキシ基等のアルコキシ基、シアノ基等が挙げられる。したがって、置換炭化水素基としては、例えば、3−クロロプロピルトリメトキシ基、3−ブロモプロピル基、3,3,3−トリフロロプロピル基、シアノエチル基等が挙げられる。
前記平均組成式(I)で示される非環式化合物の製造方法は、特に限定されるものではないが、例えば、下記一般式(III):
(式中、
R1及びR2は上記と同一であり;
a'は0、1、2又は3であり、b'は1、2、3又は4であり、但し、a'+b'=4である)
で示されるアルコキシシランを加水分解することによって得ることができる。前記一般式(III)で示されるアルコキシシランとしては、単一種類のものを使用してもよく、或いは、二種類以上の混合物を使用してもよい。
R1及びR2は上記と同一であり;
a'は0、1、2又は3であり、b'は1、2、3又は4であり、但し、a'+b'=4である)
で示されるアルコキシシランを加水分解することによって得ることができる。前記一般式(III)で示されるアルコキシシランとしては、単一種類のものを使用してもよく、或いは、二種類以上の混合物を使用してもよい。
前記平均組成式(I)で示される化合物としては、具体的には、例えば、前記一般式(III)中a'、b'がそれぞれ0、4であるアルコキシシラン、すなわちテトラアルコキシシラン;前記一般式(III)中a'、b'がそれぞれ1、3であるアルコキシシラン、すなわちモノオルガノトリアルコキシシラン;又は、これらの混合物、を加水分解して得たオルガノポリシロキサン;並びに、前記テトラアルコキシシラン、前記モノオルガノトリアルコキシシラン、又は、これらの混合物に、前記一般式(III)中a'、b'がそれぞれ2、2であるアルコキシシラン、すなわちジオルガノジアルコキシシラン、前記一般式(III)中a'、b'がそれぞれ3、1であるアルコキシシラン、すなわちトリオルガノモノアルコキシシラン、又は、これらの混合物を加えたものを加水分解して得たオルガノポリシロキサンが挙げられる。
一般式(III)で表されるアルコキシシランとしては、これらに限定されるものではないが、例えば、テトラメトキシシラン、テトラエトキシシラン等のテトラアルコキシシラン;メチルトリメトキシシラン、メチルトリエトキシシラン、メチルトリプロポキシシラン、メチルトリブトキシシラン、エチルトリメトキシシラン、エチルトリエトキシシラン、エチルトリプロポキシシラン、エチルトリブトキシシラン、プロピルトリメトキシシラン、プロピルトリエトキシシラン、プロピルトリプロポキシシラン、プロピルトリブトキシシラン、ブチルトリメトキシシラン、ブチルトリエトキシシラン、ブチルトリプロポキシシラン、ブチルトリブトキシシラン、ヘキシルトリメトキシシラン、ヘキシルトリエトキシシラン、ヘキシルトリプロポキシシラン、ヘキシルトリブトキシシラン、シクロペンチルトリメトキシシラン、シクロペンチルトリエトキシシラン、シクロペンチルトリプロポキシシラン、シクロペンチルトリブトキシシラン、シクロヘキシルトリメトキシシラン、シクロヘキシルトリエトキシシラン、シクロヘキシルトリプロポキシシラン、シクロヘキシルトリブトキシシラン、ビニルトリメトキシシラン、アリルトリメトキシシラン、ブテニルトリメトキシシラン、ヘキセニルトリメトキシシラン、3−クロロプロピルトリメトキシシラン、3−ブロモプロピルトリメトキシシラン、3,3,3−トリフロロプロピルトリメトキシシラン、2−シアノエチルトリメトキシシラン、フェニルトリメトキシシラン、ナフチルトリメトキシシラン、フェネチルトリメトキシシラン等のモノオルガノトリアルコキシシラン;ジメチルジメトキシシラン、ジメチルジエトキシシラン、ジメチルジプロポキシシラン、ジメチルジブトキシシラン、ジエチルジメトキシシラン、ジエチルジエトキシシラン、ジエチルジプロポキシシラン、ジエチルジブトキシシラン、ジプロピルジメトキシシラン、ジプロピルジエトキシシラン、ジプロピルジプロポキシシラン、ジプロピルジブトキシシラン、ジブチルジメトキシシラン、ジブチルジエトキシシラン、ジブチルジプロポキシシラン、ジブチルジブトキシシラン、ジヘキシルジメトキシシラン、ジヘキシルジエトキシシラン、ジヘキシルジプロポキシシラン、ジヘキシルジブトキシシラン、ジシクロペンチルジメトキシシラン、ジシクロペンチルジエトキシシラン、ジシクロペンチルジプロポキシシラン、ジシクロペンチルジブトキシシラン、ジシクロヘキシルジメトキシシラン、ジシクロヘキシルジエトキシシラン等のジオルガノジアルコキシシラン;トリメチルメトキシシラン、トリメチルエトキシシラン、トリメチルプロポキシシラン、トリメチルブトキシシラン、トリエチルメトキシシラン、トリエチルエトキシシラン、トリエチルプロポキシシラン、トリエチルブトキシシラン、トリプロピルメトキシシラン、トリプロピルエトキシシラン、トリプロピルプロポキシシラン、トリプロピルブトキシシラン、トリブチルメトキシシラン、トリブチルエトキシシラン、トリブチルプロポキシシラン、トリブチルブトキシシラン、トリヘキシルメトキシシラン、トリヘキシルエトキシシラン、トリヘキシルプロポキシシラン、トリヘキシルブトキシシラン、トリシクロペンチルメトキシシラン、トリシクロペンチルエトキシシラン、トリシクロペンチルプロポキシシラン、トリシクロペンチルブトキシシラン、トリシクロヘキシルメトキシシラン、トリシクロヘキシルエトキシシラン等のトリオルガノモノアルコキシシランが挙げられる。
一般式(III)で表されるアルコキシシランの加水分解を促進させるためには、酸性又は塩基性の触媒を使用することが好ましい。酸性触媒としては、例えば、塩酸、硫酸等の無機酸、及び、酢酸等の有機酸を使用することができる。塩基性触媒としては、水酸化ナトリウム、水酸化カリウム等の無機塩基、第4級アンモニウムイオンを含有する塩基性化合物等を使用することができる。加水分解反応の反応温度は特に限定されるものではないが、20〜80℃が好ましく、30〜60℃がより好ましい。加水分解反応の反応圧力も特に限定されるもではないが、操作性の点で常圧が好ましい。
前記平均組成式(I)で示される化合物は、同一分子内にケイ素原子結合アルコキシ基及びケイ素原子結合ヒドロキシ基の両方を有する。したがって、前記平均組成式(I)で示される化合物の縮合反応は、具体的には、同一分子内にケイ素原子結合アルコキシ基及びケイ素原子結合ヒドロキシ基の両方を有する化合物同士の脱アルコール縮合である。なお、前記平均組成式(I)で示される化合物としては、単一種類のものを使用してもよく、二種類以上の混合物を使用してもよい。
また、本発明では、下記平均組成式(IV):
(式中、
R3、及び、R4は、それぞれ独立して、一価炭化水素基を表し;
0≦d<4、及び、0<e≦4であり、但し、0<d+e≦4である)
で示される化合物と、下記平均組成式(V):
(式中、
R5は、一価炭化水素基を表し;
0≦f<4、及び、0<g<4であり、但し、0<f+g<4である)
で示される化合物とを、第4級アンモニウムイオン含有化合物の存在下で脱アルコール縮合させることにより、下記平均組成式(VI):
(式中、
R3、R4、及び、R5は上記と同一であり、0≦h<4、0≦i<4、及び、0≦j<4であり、但し、0<h+i+j<4である)
で示されるオルガノポリシロキサンを製造することができる。ここでの一価炭化水素基とは、前記平均組成式(I)のR1及びR2について説明したものと同一である。なお、上記式中、0<j<4であることが好ましい。
R3、及び、R4は、それぞれ独立して、一価炭化水素基を表し;
0≦d<4、及び、0<e≦4であり、但し、0<d+e≦4である)
で示される化合物と、下記平均組成式(V):
R5は、一価炭化水素基を表し;
0≦f<4、及び、0<g<4であり、但し、0<f+g<4である)
で示される化合物とを、第4級アンモニウムイオン含有化合物の存在下で脱アルコール縮合させることにより、下記平均組成式(VI):
R3、R4、及び、R5は上記と同一であり、0≦h<4、0≦i<4、及び、0≦j<4であり、但し、0<h+i+j<4である)
で示されるオルガノポリシロキサンを製造することができる。ここでの一価炭化水素基とは、前記平均組成式(I)のR1及びR2について説明したものと同一である。なお、上記式中、0<j<4であることが好ましい。
前記平均組成式(IV)で示される化合物はケイ素原子結合アルコキシ基を有し、前記平均組成式(V)で示される化合物はケイ素原子結合ヒドロキシ基を有する。したがって、前記平均組成式(IV)で示される化合物と前記平均組成式(V)で示される化合物との縮合反応は、具体的には、ケイ素原子結合アルコキシ基を有する化合物とケイ素原子結合ヒドロキシ基を有する化合物との脱アルコール縮合である。前記平均組成式(IV)で示される化合物に含まれるアルコキシ基のモル数が前記平均組成式(V)で示される化合物に含まれるヒドロキシ基のモル数以上となる比率、好ましくは、前記平均組成式(IV)で示される化合物に含まれるアルコキシ基のモル数が前記平均組成式(V)で示される化合物に含まれるヒドロキシ基のモル数の2倍以上となる比率で、前記平均組成式(IV)で示される化合物と前記平均組成式(V)で示される化合物との縮合を行うことで、ヒドロキシ基を実質的に含有しない前記平均組成式(VI)で示されるオルガノポリシロキサンを得ることができる。前記平均組成式(IV)及び前記平均組成式(V)で示される化合物としては、それぞれ単一種類のものを使用してもよく、或いは、いずれか一方又は両方について二種類以上の混合物を使用してもよい。前記平均組成式(IV)及び前記平均組成式(V)で示される化合物は、シラン、又は、直鎖状、若しくは、分岐状の分子構造を有するオルガノポリシロキサンである。前記平均組成式(VI)で示されるオルガノポリシロキサンとしては、例えば、前記平均組成式(IV)中d、eがそれぞれ0、4である化合物、即ちテトラアルコキシシラン;又は、前記平均組成式(IV)中d、eがそれぞれ1、3である化合物、即ちモノオルガノトリアルコキシシラン;と前記平均組成式(V)中1.95≦f+g≦2.05である化合物、即ち直鎖状または一部分岐を有する直鎖状のジオルガノポリシロキサン;とを縮合して得られるオルガノポリシロキサンが挙げられる。
本発明のオルガノポリシロキサンの製造方法における第4級アンモニウムイオン含有化合物からなる脱アルコール縮合反応用触媒の使用量は、出発物質のケイ素原子結合ヒドロキシ基又はケイ素原子結合アルコキシ基と相互作用することが可能な量であればよい。一般的には、脱アルコール縮合反応用触媒は、出発物質に対して重量単位で、0.5〜100000ppm、好ましくは10〜10000ppmの範囲の量で使用することが好ましい。0.5ppm未満の使用量の場合は、縮合反応速度が極端に遅くなるおそれがある。また、使用量が100000ppmを越えると、縮合反応後の触媒の除去に必要以上の時間を要するおそれがある。
本発明のオルガノポリシロキサンの製造方法における脱アルコール縮合反応は、第4級アンモニウムイオン含有化合物からなる脱アルコール縮合反応用触媒の熱分解温度以下で行うことが好ましい。前記触媒の熱分解温度は当該触媒の種類にもよるが、一般的には、120℃以下であり、より好ましくは100℃以下である。
前記脱アルコール縮合反応の反応圧力は特に限定されるものではないが、操作性の点で、常圧が好ましい。
本発明のオルガノポリシロキサンの製造方法においては、前記脱アルコール縮合反応後に、残存する触媒を除去することが好ましい。残存触媒の除去は、例えば、当該触媒を構成する第4級アンモニウムイオン含有化合物の熱分解温度以上に加熱して熱分解により低沸点物質とした後、これを減圧操作等によって反応系から除去することによって実施することができる。加熱温度は、例えば、120℃以上、好ましくは130℃以上である。
例えば、水酸化テトラアルキルアンモニウムは、熱分解温度以上では、下記式:
(R'はメチル基、エチル基、プロピル基等のアルキル基を示す)
に示される反応により、アミン(トリメチルアミン等)及びアルコール(メタノール等)といった低沸点化合物に熱分解する。そして、低沸点化合物は減圧操作によって容易に除去することができるので、反応系に残存する水酸化テトラアルキルアンモニウムは容易に除去可能である。なお、必要に応じて、水酸化テトラアルキルアンモニウムの熱分解反応を減圧下で行い、熱分解によって生じる低沸点化合物の除去を促進してもよい。
に示される反応により、アミン(トリメチルアミン等)及びアルコール(メタノール等)といった低沸点化合物に熱分解する。そして、低沸点化合物は減圧操作によって容易に除去することができるので、反応系に残存する水酸化テトラアルキルアンモニウムは容易に除去可能である。なお、必要に応じて、水酸化テトラアルキルアンモニウムの熱分解反応を減圧下で行い、熱分解によって生じる低沸点化合物の除去を促進してもよい。
このように、本発明では、反応後に残存する触媒の除去に中和工程を必要としないので、オルガノポリシロキサンの製造工程の複雑化、及び、廃棄物の増加を回避することができる。したがって、本発明における第4級アンモニウムイオン含有化合物からなる脱アルコール縮合反応用触媒は実用上有利である。
脱アルコール縮合反応により得られる、前記平均組成式(II)又は(VI)で表されるオルガノポリシロキサンは、直鎖又は分岐状のオルガノポリシロキサン又はオルガノシロキサンオリゴマーであり、一般的には、162〜1000000の範囲の分子量を有する。そして、前記平均組成式(II)又は(VI)で表されるオルガノポリシロキサンの外観は、分子量及び分子構造によって、オイル状、ガム状又はレジン状まで様々である。
本発明の製造方法によって得られた、前記平均組成式(II)又は(VI)で表されるオルガノポリシロキサンは、様々な用途に好適に使用できる。
特に、前記平均組成式(II)又は(VI)で表されるオルガノポリシロキサンがアルコキシ基を有するときは、当該アルコキシ基を反応点として架橋等の反応を行うことができる。したがって、前記平均組成式(II)又は(VI)で表されるオルガノポリシロキサンにより、例えば、土木・建築用途として好適な一成分型及び二成分型の硬化性シリコーン組成物;コーティング剤用途等として好適な各種粉末及び構造材料のバインダー(結着剤)、表処理剤、封止剤、撥水剤、電気絶縁用コーティング剤及び塗料組成物;オレフィン重合等における触媒成分;樹脂改質剤組成物等として有用なシリコーン組成物を得ることができる。
以下、実施例により本発明をより詳細に例証するが、本発明は実施例に限定されるものではない。
[調製例1]
温度計、滴下ロート、及び、攪拌装置を備えた500mlの四口フラスコに、ヘキシルトリメトキシシラン 412.8g(2モル)、メタノール 20g、及び、濃硫酸 0.20g(0.0020モル)を加え、攪拌した。室温下で水 27.0g(1.5モル)を20分かけて滴下した。加水分解反応及び縮合反応の進行により反応液温度が16℃上昇した。滴下後の反応混合物を60℃で30分間攪拌し、部分加水分解反応を完了させた。次いで、60℃にて1キロパスカルの減圧下で10分間攪拌し、加水分解反応及び縮合反応で生じたメタノールを除去して、室温まで冷却したところ、336.7gのヘキシル基含有オルガノポリシロキサンを得た。この部分加水分解物を以下の実施例1及び比較例1に使用した。
温度計、滴下ロート、及び、攪拌装置を備えた500mlの四口フラスコに、ヘキシルトリメトキシシラン 412.8g(2モル)、メタノール 20g、及び、濃硫酸 0.20g(0.0020モル)を加え、攪拌した。室温下で水 27.0g(1.5モル)を20分かけて滴下した。加水分解反応及び縮合反応の進行により反応液温度が16℃上昇した。滴下後の反応混合物を60℃で30分間攪拌し、部分加水分解反応を完了させた。次いで、60℃にて1キロパスカルの減圧下で10分間攪拌し、加水分解反応及び縮合反応で生じたメタノールを除去して、室温まで冷却したところ、336.7gのヘキシル基含有オルガノポリシロキサンを得た。この部分加水分解物を以下の実施例1及び比較例1に使用した。
[実施例1]
調製例1にて調製したヘキシル基含有オルガノポリシロキサン 160gに26%水酸化テトラメチルアンモニウム水溶液 0.70g(0.002モル)を添加し、室温で30分間攪拌し、60℃で30分間攪拌し、縮合反応を完了させた。この反応混合物はpH試験紙でアルカリ性を示した。
調製例1にて調製したヘキシル基含有オルガノポリシロキサン 160gに26%水酸化テトラメチルアンモニウム水溶液 0.70g(0.002モル)を添加し、室温で30分間攪拌し、60℃で30分間攪拌し、縮合反応を完了させた。この反応混合物はpH試験紙でアルカリ性を示した。
この反応混合物を100℃まで徐々に加熱したところ、縮合反応によって生じたメタノールの留出がみられた。更に130℃で1時間加熱したところ、縮合反応触媒として用いた水酸化テトラメチルアンモニウムの熱分解による塩基性ガスであるトリメチルアミンがフラスコ内の気相に発生していることを確認した。この反応混合物を、同温度にて、1キロパスカルの減圧下で10分間攪拌し、揮発分を除去したところ、pH試験紙で中性を示した。
これを減圧濾過することにより、中性のヘキシル基含有オルガノポリシロキサン 149.8gを得た。粘度は16mm2/秒であった。半年間室温で貯蔵しても粘度は変化せず安定していた。13C NMRで求めた平均組成式は、n−C6H13SiO0.70(OCH3)1.60であった。トルエンを溶媒として使用したGPCで求めた数平均分子量は375で、重量平均分子量は959であった。
[比較例1]
温度計、滴下ロート、及び、攪拌装置を備えた500mlの四口フラスコに、調製例1にて調製したヘキシル基含有オルガノポリシロキサン 160g、及び、48%水酸化カリウム水溶液 0.23g(0.002モル)を添加し、室温で30分間攪拌し、60℃で30分間攪拌し、縮合反応を完了させた。この反応混合物はpH試験紙でアルカリ性を示した。
温度計、滴下ロート、及び、攪拌装置を備えた500mlの四口フラスコに、調製例1にて調製したヘキシル基含有オルガノポリシロキサン 160g、及び、48%水酸化カリウム水溶液 0.23g(0.002モル)を添加し、室温で30分間攪拌し、60℃で30分間攪拌し、縮合反応を完了させた。この反応混合物はpH試験紙でアルカリ性を示した。
この反応混合物を100℃まで徐々に加熱したところ、縮合反応によって生じたメタノールの留出がみられた。更に130℃で1時間加熱後、1キロパスカルの減圧下で30分間攪拌し、揮発分を除去して、室温まで冷却した。この反応混合物は、pH試験紙でアルカリ性を示した。
次いで、縮合触媒を中和する目的で、酢酸 0.1g(0.0017モル)を加え、100℃で30分間攪拌し、次に、これを100パスカルの減圧下で30分間攪拌し、揮発分を除去して、室温まで冷却した。
これを減圧濾過することにより、中性のヘキシル基含有オルガノポリシロキサン 145.6gを得た。粘度は17mm2/秒であった。半年間室温で貯蔵しても粘度は変化せず安定していた。13C NMRで求めた平均組成式は、n−C6H13SiO0.74(OCH3)1.52であった。トルエンを溶媒として使用したGPCで求めた数平均分子量は408で、重量平均分子量は1062であった。
[実施例2]
温度計、滴下ロート、及び、攪拌装置を備えた500mlの四口フラスコに、分子鎖両末端ヒドロキシ基封鎖ポリジメチルシロキサン(平均重合度40) 200g、及び、テトラメトキシシラン 80gを加え、更に、26%水酸化テトラメチルアンモニウムのメタノール溶液 2.0g(0.002モル)を添加し、混合した。混合直後は無色透明の均一な溶液であった。その溶液はpH試験紙でアルカリ性を示した。室温で30分間攪拌したところ、無色透明な反応液は白濁した混合液となった。次いで、60℃で30分間攪拌し、縮合反応を完了させた。この反応混合物はpH試験紙でアルカリ性を示した。
温度計、滴下ロート、及び、攪拌装置を備えた500mlの四口フラスコに、分子鎖両末端ヒドロキシ基封鎖ポリジメチルシロキサン(平均重合度40) 200g、及び、テトラメトキシシラン 80gを加え、更に、26%水酸化テトラメチルアンモニウムのメタノール溶液 2.0g(0.002モル)を添加し、混合した。混合直後は無色透明の均一な溶液であった。その溶液はpH試験紙でアルカリ性を示した。室温で30分間攪拌したところ、無色透明な反応液は白濁した混合液となった。次いで、60℃で30分間攪拌し、縮合反応を完了させた。この反応混合物はpH試験紙でアルカリ性を示した。
この反応混合物を100℃まで徐々に加熱したところ、縮合反応によって生じたメタノールの留出がみられた。更に130℃で1時間加熱したところ、縮合反応触媒として用いた水酸化テトラメチルアンモニウムの熱分解による塩基性ガスであるトリメチルアミンがフラスコ内の気相に発生していることを確認した。この反応混合物を、同温度にて、1キロパスカルの減圧下で10分間攪拌し、揮発分を除去したところ、pH試験紙で中性を示した。
これを減圧濾過することにより、中性の分子鎖両末端トリメトキシシリル基封鎖ポリジメチルシロキサン 149.8gを得た。粘度は127mm2/秒であった。13C NMRで求めた平均組成式は、(CH3)1.91SiO0.98(OCH3)0.14であった。トルエンを溶媒として使用したGPCで求めた数平均分子量は4.7×103で、重量平均分子量は9.8×103であった。29Si NMRの分析から、分子鎖末端のヒドロキシ基が残存していないことが確認された。
Claims (5)
- 前記平均組成式(III)で示されるアルコキシシランが、テトラアルコキシシラン、モノオルガノトリアルコキシシラン、ジオルガノジアルコキシシラン、及び、これらの混合物からなる群から選択されるアルコキシシランであることを特徴とする、請求項2記載の製造方法。
- 下記平均組成式(IV):
R3、及び、R4は、それぞれ独立して、一価炭化水素基を表し;
0≦d<4、及び、0<e≦4であり、但し、0<d+e≦4である)
で示される化合物と、
下記平均組成式(V):
R5は、一価炭化水素基を表し;
0≦f<4、及び、0<g<4であり、但し、0<f+g<4である)
で示される化合物とを、第4級アンモニウムイオン含有化合物の存在下で、前記平均組成式(IV)で示される化合物に含まれるアルコキシ基のモル数が平均組成式(V)で示される化合物に含まれるヒドロキシ基のモル数以上となる比率で脱アルコール縮合させることを特徴とする、
下記平均組成式(VI):
R3、R4、及び、R5は上記と同一であり、0≦h<4、0≦i<4、及び、0≦j<4であり、但し、0<h+i+j<4である)
で示されるオルガノポリシロキサンの製造方法。 - 前記平均組成式(IV)で示される化合物が、テトラアルコキシシランであり、前記平均組成式(V)で示される化合物が、分子鎖両末端にケイ素原子結合ヒドロキシ基を有するジオルガノポリシロキサンであることを特徴とする、請求項4記載の製造方法。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2008552161A JP5356830B2 (ja) | 2006-12-28 | 2007-12-27 | 脱アルコール縮合反応用触媒及びそれを用いたオルガノポリシロキサンの製造方法 |
Applications Claiming Priority (4)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2006354812 | 2006-12-28 | ||
| JP2006354812 | 2006-12-28 | ||
| JP2008552161A JP5356830B2 (ja) | 2006-12-28 | 2007-12-27 | 脱アルコール縮合反応用触媒及びそれを用いたオルガノポリシロキサンの製造方法 |
| PCT/JP2007/075173 WO2008081890A1 (ja) | 2006-12-28 | 2007-12-27 | 脱アルコール縮合反応用触媒及びそれを用いたオルガノポリシロキサンの製造方法 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JPWO2008081890A1 JPWO2008081890A1 (ja) | 2010-04-30 |
| JP5356830B2 true JP5356830B2 (ja) | 2013-12-04 |
Family
ID=39588571
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2008552161A Expired - Fee Related JP5356830B2 (ja) | 2006-12-28 | 2007-12-27 | 脱アルコール縮合反応用触媒及びそれを用いたオルガノポリシロキサンの製造方法 |
Country Status (6)
| Country | Link |
|---|---|
| US (1) | US8030429B2 (ja) |
| EP (1) | EP2116563A4 (ja) |
| JP (1) | JP5356830B2 (ja) |
| CN (3) | CN104130414A (ja) |
| TW (1) | TW200900143A (ja) |
| WO (1) | WO2008081890A1 (ja) |
Families Citing this family (12)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2011042760A (ja) * | 2009-08-24 | 2011-03-03 | Nitto Denko Corp | 熱硬化性シリコーン樹脂用組成物 |
| JP5773131B2 (ja) * | 2011-03-02 | 2015-09-02 | 荒川化学工業株式会社 | チオール基含有シルセスキオキサンの製造方法ならびにチオール基含有シルセスキオキサンを含む硬化性樹脂組成物、当該硬化物、およびこれらから誘導される各種物品 |
| KR101738602B1 (ko) | 2011-10-17 | 2017-06-08 | 신에쓰 가가꾸 고교 가부시끼가이샤 | 축합반응 경화형 실리콘 박리 코팅 조성물 |
| JP6726061B2 (ja) * | 2016-08-19 | 2020-07-22 | 信越化学工業株式会社 | 硬化性シリコーン樹脂組成物 |
| CN112469769B (zh) | 2018-08-24 | 2022-07-08 | 美国陶氏有机硅公司 | 用于羟基封端的聚二有机硅氧烷的缩合聚合的方法 |
| MY208159A (en) | 2018-08-24 | 2025-04-19 | Dow Global Technologies Llc | Method for condensation polymerization of hydroxyl-terminated polydiorganosiloxanes |
| KR102832294B1 (ko) | 2018-09-19 | 2025-07-10 | 다우 실리콘즈 코포레이션 | 아릴-작용화된 폴리실록산에서의 아릴 절단 억제 |
| WO2020083507A1 (de) | 2018-10-26 | 2020-04-30 | Wacker Chemie Ag | Härtbare organopolysiloxanzusammensetzungen |
| JP7375044B2 (ja) * | 2019-05-06 | 2023-11-07 | ワッカー ケミー アクチエンゲゼルシャフト | ポリオルガノシロキサンを調製するための方法 |
| KR102656007B1 (ko) * | 2019-05-06 | 2024-04-08 | 와커 헤미 아게 | 폴리오르가노실록산 및 이의 열전도성 실리콘 조성물 |
| CN111333843B (zh) * | 2020-03-31 | 2022-06-24 | 橙天新材料(广州)有限公司 | 一种烷氧基封端聚硅氧烷的制备方法 |
| EP4225265B1 (de) * | 2020-10-06 | 2024-03-20 | Wacker Chemie AG | Verfahren zur herstellung von alkylsiliconharzen |
Citations (10)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPH10237175A (ja) * | 1996-11-22 | 1998-09-08 | General Electric Co <Ge> | 芳香放出性の非揮発性ポリマー状シロキサン |
| JP2001354904A (ja) * | 2000-04-10 | 2001-12-25 | Jsr Corp | 膜形成用組成物、膜の形成方法およびシリカ系膜 |
| JP2004269692A (ja) * | 2003-03-10 | 2004-09-30 | Shin Etsu Chem Co Ltd | 多孔質膜形成用組成物、多孔質膜の製造方法、多孔質膜、層間絶縁膜、及び半導体装置 |
| JP2004269693A (ja) * | 2003-03-10 | 2004-09-30 | Shin Etsu Chem Co Ltd | 多孔質膜形成用組成物及びその製造方法、多孔質膜の製造方法、多孔質膜、層間絶縁膜、及び半導体装置 |
| JP2006120783A (ja) * | 2004-10-20 | 2006-05-11 | Catalysts & Chem Ind Co Ltd | 半導体加工用保護膜形成用塗布液、その調製方法およびこれより得られる半導体加工用保護膜 |
| JP2006328231A (ja) * | 2005-05-26 | 2006-12-07 | Nagase Chemtex Corp | 光素子用封止樹脂組成物 |
| JP2006336010A (ja) * | 2005-05-02 | 2006-12-14 | Jsr Corp | シロキサン系縮合物およびその製造方法、ポリシロキサン組成物 |
| JP2006352118A (ja) * | 2000-04-10 | 2006-12-28 | Jsr Corp | 層間絶縁膜形成用組成物、層間絶縁膜の形成方法およびシリカ系層間絶縁膜 |
| JP2007056146A (ja) * | 2005-08-25 | 2007-03-08 | Nagase Chemtex Corp | 光素子用封止樹脂組成物 |
| JP2008008935A (ja) * | 2006-06-27 | 2008-01-17 | Seiko Epson Corp | 配向膜、配向膜の形成方法、電子デバイス用基板、液晶パネルおよび電子機器 |
Family Cites Families (12)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB1222357A (en) * | 1967-04-12 | 1971-02-10 | Midland Silicones Ltd | Improvements in or relating to siloxane resins |
| US4433096A (en) | 1983-03-14 | 1984-02-21 | Dow Corning Corporation | Polymerization of polydiorganosiloxane in the presence of filler |
| JPS61190085A (ja) | 1985-02-19 | 1986-08-23 | Chlorine Eng Corp Ltd | 第四アンモニウム水酸化物の電解による製造法 |
| JP3123759B2 (ja) | 1990-12-27 | 2001-01-15 | 東レ・ダウコーニング・シリコーン株式会社 | オルガノポリシロキサンの製造方法 |
| DE4128893A1 (de) * | 1991-05-03 | 1992-11-05 | Wacker Chemie Gmbh | Beschichtungen auf siliconharzbasis |
| JP3323211B2 (ja) | 1991-08-09 | 2002-09-09 | ジーイー東芝シリコーン株式会社 | シロキサンポリマーの連続的製造法 |
| US5670597A (en) * | 1995-01-31 | 1997-09-23 | Wacker-Chemie Gmbh | Process for the preparation of organopolysiloxanes containing organyloxy groups |
| JP4744040B2 (ja) | 2001-09-19 | 2011-08-10 | 日揮触媒化成株式会社 | 無機酸化物球状粒子およびその製造方法 |
| JP2004083812A (ja) * | 2002-08-28 | 2004-03-18 | Catalysts & Chem Ind Co Ltd | 透明被膜形成用塗布液および透明被膜付基材、表示装置 |
| JP2006206700A (ja) | 2005-01-27 | 2006-08-10 | Jsr Corp | ポリシロキサン組成物およびその製造方法、それから得られるフィルムおよびその製造方法、ならびに封止材 |
| JP4621602B2 (ja) | 2006-02-06 | 2011-01-26 | 株式会社東芝 | リチウム漏洩検知装置 |
| EP1995281A4 (en) * | 2006-03-16 | 2010-03-24 | Jsr Corp | OXIDE PARTICLES CONTAINING POLYSILOXANE COMPOSITION AND PRODUCTION METHOD THEREFOR |
-
2007
- 2007-12-27 CN CN201410342766.8A patent/CN104130414A/zh active Pending
- 2007-12-27 CN CN201410343166.3A patent/CN104130413A/zh active Pending
- 2007-12-27 CN CN200780048086A patent/CN101646717A/zh active Pending
- 2007-12-27 JP JP2008552161A patent/JP5356830B2/ja not_active Expired - Fee Related
- 2007-12-27 TW TW096150654A patent/TW200900143A/zh unknown
- 2007-12-27 US US12/521,057 patent/US8030429B2/en not_active Expired - Fee Related
- 2007-12-27 EP EP07860395A patent/EP2116563A4/en not_active Withdrawn
- 2007-12-27 WO PCT/JP2007/075173 patent/WO2008081890A1/ja not_active Ceased
Patent Citations (10)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPH10237175A (ja) * | 1996-11-22 | 1998-09-08 | General Electric Co <Ge> | 芳香放出性の非揮発性ポリマー状シロキサン |
| JP2001354904A (ja) * | 2000-04-10 | 2001-12-25 | Jsr Corp | 膜形成用組成物、膜の形成方法およびシリカ系膜 |
| JP2006352118A (ja) * | 2000-04-10 | 2006-12-28 | Jsr Corp | 層間絶縁膜形成用組成物、層間絶縁膜の形成方法およびシリカ系層間絶縁膜 |
| JP2004269692A (ja) * | 2003-03-10 | 2004-09-30 | Shin Etsu Chem Co Ltd | 多孔質膜形成用組成物、多孔質膜の製造方法、多孔質膜、層間絶縁膜、及び半導体装置 |
| JP2004269693A (ja) * | 2003-03-10 | 2004-09-30 | Shin Etsu Chem Co Ltd | 多孔質膜形成用組成物及びその製造方法、多孔質膜の製造方法、多孔質膜、層間絶縁膜、及び半導体装置 |
| JP2006120783A (ja) * | 2004-10-20 | 2006-05-11 | Catalysts & Chem Ind Co Ltd | 半導体加工用保護膜形成用塗布液、その調製方法およびこれより得られる半導体加工用保護膜 |
| JP2006336010A (ja) * | 2005-05-02 | 2006-12-14 | Jsr Corp | シロキサン系縮合物およびその製造方法、ポリシロキサン組成物 |
| JP2006328231A (ja) * | 2005-05-26 | 2006-12-07 | Nagase Chemtex Corp | 光素子用封止樹脂組成物 |
| JP2007056146A (ja) * | 2005-08-25 | 2007-03-08 | Nagase Chemtex Corp | 光素子用封止樹脂組成物 |
| JP2008008935A (ja) * | 2006-06-27 | 2008-01-17 | Seiko Epson Corp | 配向膜、配向膜の形成方法、電子デバイス用基板、液晶パネルおよび電子機器 |
Also Published As
| Publication number | Publication date |
|---|---|
| EP2116563A4 (en) | 2010-04-21 |
| EP2116563A1 (en) | 2009-11-11 |
| US8030429B2 (en) | 2011-10-04 |
| WO2008081890A1 (ja) | 2008-07-10 |
| CN104130413A (zh) | 2014-11-05 |
| TW200900143A (en) | 2009-01-01 |
| CN101646717A (zh) | 2010-02-10 |
| JPWO2008081890A1 (ja) | 2010-04-30 |
| US20100063236A1 (en) | 2010-03-11 |
| CN104130414A (zh) | 2014-11-05 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP5356830B2 (ja) | 脱アルコール縮合反応用触媒及びそれを用いたオルガノポリシロキサンの製造方法 | |
| JP3474007B2 (ja) | 有機官能基含有オルガノポリシロキサンの製造方法 | |
| CN103890100B (zh) | 硅氧烷系组合物及其固化物以及其用途 | |
| JP2020518686A (ja) | ヒドロシリル化硬化性シリコーン樹脂 | |
| CN114929784A (zh) | 低硅氧烷环含量的官能化q-t-硅氧烷基聚合物材料和制备方法 | |
| US11377523B2 (en) | Process for producing non-cyclic alkoxy-functional polysiloxanes | |
| JPH0784475B2 (ja) | 結晶ジメチルシランジオールの製造方法 | |
| KR101965923B1 (ko) | 실란올기 함유 폴리실록산 용액의 안정화 방법, 안정화 실란올기 함유 폴리실록산 용액의 제조 방법 및 안정화 실란올기 함유 폴리실록산 용액 | |
| KR102132813B1 (ko) | 하이드로실릴기 함유 유기 규소 수지의 제조방법 | |
| KR101651684B1 (ko) | 오르가노폴리실록산 및 그의 제조 방법 | |
| US6284859B1 (en) | Polymerization of siloxanes | |
| KR20040030717A (ko) | 액상 알콕시실릴-관능성 실리콘 수지, 이의 제조방법 및경화성 실리콘 수지 조성물 | |
| JPH0633335B2 (ja) | オルガノポリシロキサンの製造方法 | |
| KR20150110710A (ko) | 실리콘을 포함하는 경화성 조성물 및 그 경화물 | |
| JP6213123B2 (ja) | シリカ粒子を含む硬化性組成物およびその硬化物、並びにそれを用いた半導体封止材 | |
| JP3263177B2 (ja) | エポキシ基含有シリコーンレジンおよびその製造方法 | |
| CN107001638A (zh) | 用于生产具有氨基的有机硅化合物的方法 | |
| KR20130058624A (ko) | 산무수물기 함유 오르가노실록산 및 그 제조방법 | |
| KR102894692B1 (ko) | 실록산-작용화된 실리카 | |
| JP5158358B2 (ja) | 加水分解性基含有オルガノハイドロジェンポリシロキサンの製造方法 | |
| WO2013191955A1 (en) | Monofunctional organopolysiloxanes for compatabilzing polyheterosiloxanes | |
| EP2371879B1 (en) | Process for producing silicon compound having oxetanyl group | |
| JP7397558B2 (ja) | 撥水撥油膜組成物及びその利用 | |
| JP2011219647A (ja) | シラノール基を有するオルガノシラン及び低分子量オルガノポリシロキサンの製造方法 | |
| JP5533978B2 (ja) | オルガノポリシロキサンの製造方法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20120724 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20120919 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20121218 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20130829 |
|
| R150 | Certificate of patent or registration of utility model |
Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| LAPS | Cancellation because of no payment of annual fees |