JP4812166B2 - 炎症症状を治療するためのhmg1のアンタゴニスト - Google Patents
炎症症状を治療するためのhmg1のアンタゴニスト Download PDFInfo
- Publication number
- JP4812166B2 JP4812166B2 JP2000598059A JP2000598059A JP4812166B2 JP 4812166 B2 JP4812166 B2 JP 4812166B2 JP 2000598059 A JP2000598059 A JP 2000598059A JP 2000598059 A JP2000598059 A JP 2000598059A JP 4812166 B2 JP4812166 B2 JP 4812166B2
- Authority
- JP
- Japan
- Prior art keywords
- hmg1
- antibody
- sepsis
- tnf
- lps
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Lifetime
Links
- 108700010013 HMGB1 Proteins 0.000 title claims abstract description 200
- 101150091750 HMG1 gene Proteins 0.000 title claims abstract description 198
- 101100178203 Arabidopsis thaliana HMGB3 gene Proteins 0.000 title claims abstract description 190
- 101150021904 HMGB1 gene Proteins 0.000 title claims abstract description 190
- 239000005557 antagonist Substances 0.000 title claims abstract description 30
- 102000055207 HMGB1 Human genes 0.000 title claims abstract description 19
- 230000004968 inflammatory condition Effects 0.000 title 1
- 206010040047 Sepsis Diseases 0.000 claims abstract description 46
- 239000008194 pharmaceutical composition Substances 0.000 claims abstract description 26
- 239000012634 fragment Substances 0.000 claims abstract description 10
- 102000004127 Cytokines Human genes 0.000 claims description 35
- 108090000695 Cytokines Proteins 0.000 claims description 35
- 241000282414 Homo sapiens Species 0.000 claims description 25
- 230000002757 inflammatory effect Effects 0.000 claims description 21
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 claims description 20
- 201000010099 disease Diseases 0.000 claims description 19
- 230000004913 activation Effects 0.000 claims description 13
- 230000001404 mediated effect Effects 0.000 claims description 12
- 108090000765 processed proteins & peptides Proteins 0.000 claims description 6
- 108090001005 Interleukin-6 Proteins 0.000 claims description 3
- 125000003275 alpha amino acid group Chemical group 0.000 claims description 3
- 238000004519 manufacturing process Methods 0.000 claims description 3
- 102000001706 Immunoglobulin Fab Fragments Human genes 0.000 claims description 2
- 108010054477 Immunoglobulin Fab Fragments Proteins 0.000 claims description 2
- 108010021625 Immunoglobulin Fragments Proteins 0.000 claims 1
- 102000008394 Immunoglobulin Fragments Human genes 0.000 claims 1
- 239000003814 drug Substances 0.000 claims 1
- 210000002966 serum Anatomy 0.000 abstract description 34
- 238000000034 method Methods 0.000 abstract description 27
- 208000024891 symptom Diseases 0.000 abstract description 21
- 231100000225 lethality Toxicity 0.000 abstract description 17
- 230000004580 weight loss Effects 0.000 abstract description 9
- 206010001052 Acute respiratory distress syndrome Diseases 0.000 abstract description 6
- 208000013616 Respiratory Distress Syndrome Diseases 0.000 abstract description 6
- 206010040070 Septic Shock Diseases 0.000 abstract description 6
- 201000000028 adult respiratory distress syndrome Diseases 0.000 abstract description 6
- 230000036303 septic shock Effects 0.000 abstract description 6
- 238000002405 diagnostic procedure Methods 0.000 abstract description 5
- 230000001747 exhibiting effect Effects 0.000 abstract description 4
- 208000008589 Obesity Diseases 0.000 abstract description 3
- 235000020824 obesity Nutrition 0.000 abstract description 3
- 238000012544 monitoring process Methods 0.000 abstract description 2
- 102100037907 High mobility group protein B1 Human genes 0.000 description 190
- 239000002158 endotoxin Substances 0.000 description 57
- 229920006008 lipopolysaccharide Polymers 0.000 description 46
- 101000611183 Homo sapiens Tumor necrosis factor Proteins 0.000 description 44
- 102100040247 Tumor necrosis factor Human genes 0.000 description 44
- 210000004027 cell Anatomy 0.000 description 29
- 108090000623 proteins and genes Proteins 0.000 description 29
- 241000699670 Mus sp. Species 0.000 description 25
- 102000004169 proteins and genes Human genes 0.000 description 24
- 235000018102 proteins Nutrition 0.000 description 22
- 210000002540 macrophage Anatomy 0.000 description 18
- 238000001262 western blot Methods 0.000 description 15
- 238000001727 in vivo Methods 0.000 description 14
- 208000037487 Endotoxemia Diseases 0.000 description 13
- 230000000638 stimulation Effects 0.000 description 13
- MWUXSHHQAYIFBG-UHFFFAOYSA-N Nitric oxide Chemical compound O=[N] MWUXSHHQAYIFBG-UHFFFAOYSA-N 0.000 description 12
- 241000699666 Mus <mouse, genus> Species 0.000 description 11
- 239000003795 chemical substances by application Substances 0.000 description 11
- 102000000589 Interleukin-1 Human genes 0.000 description 10
- 108010002352 Interleukin-1 Proteins 0.000 description 10
- 241000700159 Rattus Species 0.000 description 10
- 238000002474 experimental method Methods 0.000 description 10
- 230000001225 therapeutic effect Effects 0.000 description 10
- 238000011282 treatment Methods 0.000 description 10
- 101710168537 High mobility group protein B1 Proteins 0.000 description 9
- 241001465754 Metazoa Species 0.000 description 9
- 230000000692 anti-sense effect Effects 0.000 description 9
- 231100000518 lethal Toxicity 0.000 description 9
- 230000001665 lethal effect Effects 0.000 description 9
- 230000000770 proinflammatory effect Effects 0.000 description 9
- 231100000419 toxicity Toxicity 0.000 description 9
- 230000001988 toxicity Effects 0.000 description 9
- 108091034117 Oligonucleotide Proteins 0.000 description 8
- 239000002299 complementary DNA Substances 0.000 description 8
- 238000000338 in vitro Methods 0.000 description 8
- 239000000047 product Substances 0.000 description 8
- 210000001519 tissue Anatomy 0.000 description 8
- 208000016261 weight loss Diseases 0.000 description 8
- 239000013543 active substance Substances 0.000 description 7
- 238000004458 analytical method Methods 0.000 description 7
- 238000003556 assay Methods 0.000 description 7
- 239000003636 conditioned culture medium Substances 0.000 description 7
- 230000034994 death Effects 0.000 description 7
- 231100000673 dose–response relationship Toxicity 0.000 description 7
- 239000000499 gel Substances 0.000 description 7
- 230000006698 induction Effects 0.000 description 7
- 230000004044 response Effects 0.000 description 7
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 6
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 6
- 241000283973 Oryctolagus cuniculus Species 0.000 description 6
- 210000004369 blood Anatomy 0.000 description 6
- 239000008280 blood Substances 0.000 description 6
- 210000003819 peripheral blood mononuclear cell Anatomy 0.000 description 6
- 230000001817 pituitary effect Effects 0.000 description 6
- 239000000725 suspension Substances 0.000 description 6
- 238000012360 testing method Methods 0.000 description 6
- 108010077544 Chromatin Proteins 0.000 description 5
- 108020004414 DNA Proteins 0.000 description 5
- 210000003483 chromatin Anatomy 0.000 description 5
- 230000000694 effects Effects 0.000 description 5
- 238000009472 formulation Methods 0.000 description 5
- 239000000523 sample Substances 0.000 description 5
- 238000002415 sodium dodecyl sulfate polyacrylamide gel electrophoresis Methods 0.000 description 5
- 238000009825 accumulation Methods 0.000 description 4
- 230000027455 binding Effects 0.000 description 4
- 230000004071 biological effect Effects 0.000 description 4
- 238000001514 detection method Methods 0.000 description 4
- 238000009396 hybridization Methods 0.000 description 4
- 230000003960 inflammatory cascade Effects 0.000 description 4
- 238000002347 injection Methods 0.000 description 4
- 239000007924 injection Substances 0.000 description 4
- 239000002609 medium Substances 0.000 description 4
- 108020004999 messenger RNA Proteins 0.000 description 4
- 239000000203 mixture Substances 0.000 description 4
- 208000011580 syndromic disease Diseases 0.000 description 4
- 238000002560 therapeutic procedure Methods 0.000 description 4
- 238000002965 ELISA Methods 0.000 description 3
- 102000018802 High Mobility Group Proteins Human genes 0.000 description 3
- 108010052512 High Mobility Group Proteins Proteins 0.000 description 3
- 108060004872 MIF Proteins 0.000 description 3
- 108091081024 Start codon Proteins 0.000 description 3
- 108060008682 Tumor Necrosis Factor Proteins 0.000 description 3
- 102000000852 Tumor Necrosis Factor-alpha Human genes 0.000 description 3
- JLCPHMBAVCMARE-UHFFFAOYSA-N [3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-hydroxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methyl [5-(6-aminopurin-9-yl)-2-(hydroxymethyl)oxolan-3-yl] hydrogen phosphate Polymers Cc1cn(C2CC(OP(O)(=O)OCC3OC(CC3OP(O)(=O)OCC3OC(CC3O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c3nc(N)[nH]c4=O)C(COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3CO)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cc(C)c(=O)[nH]c3=O)n3cc(C)c(=O)[nH]c3=O)n3ccc(N)nc3=O)n3cc(C)c(=O)[nH]c3=O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)O2)c(=O)[nH]c1=O JLCPHMBAVCMARE-UHFFFAOYSA-N 0.000 description 3
- 238000010171 animal model Methods 0.000 description 3
- 239000000427 antigen Substances 0.000 description 3
- 102000036639 antigens Human genes 0.000 description 3
- 108091007433 antigens Proteins 0.000 description 3
- 230000001580 bacterial effect Effects 0.000 description 3
- 230000008901 benefit Effects 0.000 description 3
- 238000005119 centrifugation Methods 0.000 description 3
- 239000003153 chemical reaction reagent Substances 0.000 description 3
- 238000009826 distribution Methods 0.000 description 3
- 230000006870 function Effects 0.000 description 3
- 230000004927 fusion Effects 0.000 description 3
- 230000001939 inductive effect Effects 0.000 description 3
- 230000028709 inflammatory response Effects 0.000 description 3
- 230000007246 mechanism Effects 0.000 description 3
- 230000003472 neutralizing effect Effects 0.000 description 3
- 231100001160 nonlethal Toxicity 0.000 description 3
- 150000007523 nucleic acids Chemical class 0.000 description 3
- 230000003287 optical effect Effects 0.000 description 3
- 239000000546 pharmaceutical excipient Substances 0.000 description 3
- 238000002360 preparation method Methods 0.000 description 3
- 230000001681 protective effect Effects 0.000 description 3
- 239000000126 substance Substances 0.000 description 3
- 230000004083 survival effect Effects 0.000 description 3
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 2
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 2
- 102000000584 Calmodulin Human genes 0.000 description 2
- 108010041952 Calmodulin Proteins 0.000 description 2
- FBPFZTCFMRRESA-FSIIMWSLSA-N D-Glucitol Natural products OC[C@H](O)[C@H](O)[C@@H](O)[C@H](O)CO FBPFZTCFMRRESA-FSIIMWSLSA-N 0.000 description 2
- FBPFZTCFMRRESA-JGWLITMVSA-N D-glucitol Chemical compound OC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-JGWLITMVSA-N 0.000 description 2
- ZHNUHDYFZUAESO-UHFFFAOYSA-N Formamide Chemical compound NC=O ZHNUHDYFZUAESO-UHFFFAOYSA-N 0.000 description 2
- 102100037850 Interferon gamma Human genes 0.000 description 2
- 108010074328 Interferon-gamma Proteins 0.000 description 2
- 102100026018 Interleukin-1 receptor antagonist protein Human genes 0.000 description 2
- 101710144554 Interleukin-1 receptor antagonist protein Proteins 0.000 description 2
- 102000034655 MIF Human genes 0.000 description 2
- 201000009906 Meningitis Diseases 0.000 description 2
- 101710159910 Movement protein Proteins 0.000 description 2
- 125000001429 N-terminal alpha-amino-acid group Chemical group 0.000 description 2
- 102000015636 Oligopeptides Human genes 0.000 description 2
- 108010038807 Oligopeptides Proteins 0.000 description 2
- 108700026244 Open Reading Frames Proteins 0.000 description 2
- 206010035664 Pneumonia Diseases 0.000 description 2
- 108010093965 Polymyxin B Proteins 0.000 description 2
- 206010036790 Productive cough Diseases 0.000 description 2
- 102000007056 Recombinant Fusion Proteins Human genes 0.000 description 2
- 108010008281 Recombinant Fusion Proteins Proteins 0.000 description 2
- 206010063837 Reperfusion injury Diseases 0.000 description 2
- BQCADISMDOOEFD-UHFFFAOYSA-N Silver Chemical compound [Ag] BQCADISMDOOEFD-UHFFFAOYSA-N 0.000 description 2
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 2
- 206010051379 Systemic Inflammatory Response Syndrome Diseases 0.000 description 2
- 210000001744 T-lymphocyte Anatomy 0.000 description 2
- 102100033571 Tissue-type plasminogen activator Human genes 0.000 description 2
- 108091023040 Transcription factor Proteins 0.000 description 2
- 102000040945 Transcription factor Human genes 0.000 description 2
- 208000027418 Wounds and injury Diseases 0.000 description 2
- DPXJVFZANSGRMM-UHFFFAOYSA-N acetic acid;2,3,4,5,6-pentahydroxyhexanal;sodium Chemical compound [Na].CC(O)=O.OCC(O)C(O)C(O)C(O)C=O DPXJVFZANSGRMM-UHFFFAOYSA-N 0.000 description 2
- 230000001154 acute effect Effects 0.000 description 2
- 230000001919 adrenal effect Effects 0.000 description 2
- 208000026935 allergic disease Diseases 0.000 description 2
- 235000001014 amino acid Nutrition 0.000 description 2
- 239000000074 antisense oligonucleotide Substances 0.000 description 2
- 238000012230 antisense oligonucleotides Methods 0.000 description 2
- 238000013459 approach Methods 0.000 description 2
- 210000004556 brain Anatomy 0.000 description 2
- 239000001768 carboxy methyl cellulose Substances 0.000 description 2
- 239000000969 carrier Substances 0.000 description 2
- 230000001413 cellular effect Effects 0.000 description 2
- 230000002759 chromosomal effect Effects 0.000 description 2
- 230000006378 damage Effects 0.000 description 2
- 239000012894 fetal calf serum Substances 0.000 description 2
- 102000037865 fusion proteins Human genes 0.000 description 2
- 108020001507 fusion proteins Proteins 0.000 description 2
- ZDXPYRJPNDTMRX-UHFFFAOYSA-N glutamine Natural products OC(=O)C(N)CCC(N)=O ZDXPYRJPNDTMRX-UHFFFAOYSA-N 0.000 description 2
- 230000003053 immunization Effects 0.000 description 2
- 238000002649 immunization Methods 0.000 description 2
- 230000001976 improved effect Effects 0.000 description 2
- 208000015181 infectious disease Diseases 0.000 description 2
- 208000027866 inflammatory disease Diseases 0.000 description 2
- 230000005764 inhibitory process Effects 0.000 description 2
- 208000014674 injury Diseases 0.000 description 2
- 238000007912 intraperitoneal administration Methods 0.000 description 2
- BPHPUYQFMNQIOC-NXRLNHOXSA-N isopropyl beta-D-thiogalactopyranoside Chemical compound CC(C)S[C@@H]1O[C@H](CO)[C@H](O)[C@H](O)[C@H]1O BPHPUYQFMNQIOC-NXRLNHOXSA-N 0.000 description 2
- 210000003292 kidney cell Anatomy 0.000 description 2
- 239000007788 liquid Substances 0.000 description 2
- 230000003211 malignant effect Effects 0.000 description 2
- 239000003550 marker Substances 0.000 description 2
- 239000012528 membrane Substances 0.000 description 2
- 108020004707 nucleic acids Proteins 0.000 description 2
- 102000039446 nucleic acids Human genes 0.000 description 2
- 230000008506 pathogenesis Effects 0.000 description 2
- 230000007170 pathology Effects 0.000 description 2
- VLTRZXGMWDSKGL-UHFFFAOYSA-N perchloric acid Chemical compound OCl(=O)(=O)=O VLTRZXGMWDSKGL-UHFFFAOYSA-N 0.000 description 2
- 229920000024 polymyxin B Polymers 0.000 description 2
- 229960005266 polymyxin b Drugs 0.000 description 2
- 238000011160 research Methods 0.000 description 2
- 238000012216 screening Methods 0.000 description 2
- 238000012163 sequencing technique Methods 0.000 description 2
- 229910052709 silver Inorganic materials 0.000 description 2
- 239000004332 silver Substances 0.000 description 2
- 235000019812 sodium carboxymethyl cellulose Nutrition 0.000 description 2
- 229920001027 sodium carboxymethylcellulose Polymers 0.000 description 2
- 239000000600 sorbitol Substances 0.000 description 2
- 208000024794 sputum Diseases 0.000 description 2
- 210000003802 sputum Anatomy 0.000 description 2
- 239000003381 stabilizer Substances 0.000 description 2
- 238000010561 standard procedure Methods 0.000 description 2
- 230000009885 systemic effect Effects 0.000 description 2
- 230000000699 topical effect Effects 0.000 description 2
- 239000003981 vehicle Substances 0.000 description 2
- LNAZSHAWQACDHT-XIYTZBAFSA-N (2r,3r,4s,5r,6s)-4,5-dimethoxy-2-(methoxymethyl)-3-[(2s,3r,4s,5r,6r)-3,4,5-trimethoxy-6-(methoxymethyl)oxan-2-yl]oxy-6-[(2r,3r,4s,5r,6r)-4,5,6-trimethoxy-2-(methoxymethyl)oxan-3-yl]oxyoxane Chemical compound CO[C@@H]1[C@@H](OC)[C@H](OC)[C@@H](COC)O[C@H]1O[C@H]1[C@H](OC)[C@@H](OC)[C@H](O[C@H]2[C@@H]([C@@H](OC)[C@H](OC)O[C@@H]2COC)OC)O[C@@H]1COC LNAZSHAWQACDHT-XIYTZBAFSA-N 0.000 description 1
- QFVHZQCOUORWEI-UHFFFAOYSA-N 4-[(4-anilino-5-sulfonaphthalen-1-yl)diazenyl]-5-hydroxynaphthalene-2,7-disulfonic acid Chemical compound C=12C(O)=CC(S(O)(=O)=O)=CC2=CC(S(O)(=O)=O)=CC=1N=NC(C1=CC=CC(=C11)S(O)(=O)=O)=CC=C1NC1=CC=CC=C1 QFVHZQCOUORWEI-UHFFFAOYSA-N 0.000 description 1
- FWMNVWWHGCHHJJ-SKKKGAJSSA-N 4-amino-1-[(2r)-6-amino-2-[[(2r)-2-[[(2r)-2-[[(2r)-2-amino-3-phenylpropanoyl]amino]-3-phenylpropanoyl]amino]-4-methylpentanoyl]amino]hexanoyl]piperidine-4-carboxylic acid Chemical compound C([C@H](C(=O)N[C@H](CC(C)C)C(=O)N[C@H](CCCCN)C(=O)N1CCC(N)(CC1)C(O)=O)NC(=O)[C@H](N)CC=1C=CC=CC=1)C1=CC=CC=C1 FWMNVWWHGCHHJJ-SKKKGAJSSA-N 0.000 description 1
- QRXMUCSWCMTJGU-UHFFFAOYSA-N 5-bromo-4-chloro-3-indolyl phosphate Chemical compound C1=C(Br)C(Cl)=C2C(OP(O)(=O)O)=CNC2=C1 QRXMUCSWCMTJGU-UHFFFAOYSA-N 0.000 description 1
- 241000588624 Acinetobacter calcoaceticus Species 0.000 description 1
- 201000004384 Alopecia Diseases 0.000 description 1
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 1
- 206010053555 Arthritis bacterial Diseases 0.000 description 1
- 208000006740 Aseptic Meningitis Diseases 0.000 description 1
- BSYNRYMUTXBXSQ-UHFFFAOYSA-N Aspirin Chemical compound CC(=O)OC1=CC=CC=C1C(O)=O BSYNRYMUTXBXSQ-UHFFFAOYSA-N 0.000 description 1
- 208000012657 Atopic disease Diseases 0.000 description 1
- 102100039339 Atrial natriuretic peptide receptor 1 Human genes 0.000 description 1
- 101710102163 Atrial natriuretic peptide receptor 1 Proteins 0.000 description 1
- 208000023275 Autoimmune disease Diseases 0.000 description 1
- 208000037157 Azotemia Diseases 0.000 description 1
- 102100030009 Azurocidin Human genes 0.000 description 1
- 101710154607 Azurocidin Proteins 0.000 description 1
- 208000031729 Bacteremia Diseases 0.000 description 1
- 241000894006 Bacteria Species 0.000 description 1
- 231100000699 Bacterial toxin Toxicity 0.000 description 1
- 241000606124 Bacteroides fragilis Species 0.000 description 1
- 208000008439 Biliary Liver Cirrhosis Diseases 0.000 description 1
- 208000033222 Biliary cirrhosis primary Diseases 0.000 description 1
- 208000031648 Body Weight Changes Diseases 0.000 description 1
- 206010006895 Cachexia Diseases 0.000 description 1
- 206010007559 Cardiac failure congestive Diseases 0.000 description 1
- 208000024172 Cardiovascular disease Diseases 0.000 description 1
- 101100124635 Chondrus crispus HOX gene Proteins 0.000 description 1
- 241000588919 Citrobacter freundii Species 0.000 description 1
- 108091026890 Coding region Proteins 0.000 description 1
- 206010009944 Colon cancer Diseases 0.000 description 1
- 208000001333 Colorectal Neoplasms Diseases 0.000 description 1
- 208000035473 Communicable disease Diseases 0.000 description 1
- 206010010356 Congenital anomaly Diseases 0.000 description 1
- 206010010744 Conjunctivitis allergic Diseases 0.000 description 1
- 102000012437 Copper-Transporting ATPases Human genes 0.000 description 1
- 241000699800 Cricetinae Species 0.000 description 1
- 208000028399 Critical Illness Diseases 0.000 description 1
- 201000003883 Cystic fibrosis Diseases 0.000 description 1
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 1
- 238000001712 DNA sequencing Methods 0.000 description 1
- 230000004568 DNA-binding Effects 0.000 description 1
- 206010012310 Dengue fever Diseases 0.000 description 1
- 206010012434 Dermatitis allergic Diseases 0.000 description 1
- 206010012442 Dermatitis contact Diseases 0.000 description 1
- 229920002307 Dextran Polymers 0.000 description 1
- 206010012735 Diarrhoea Diseases 0.000 description 1
- 239000006144 Dulbecco’s modified Eagle's medium Substances 0.000 description 1
- 238000012286 ELISA Assay Methods 0.000 description 1
- LVGKNOAMLMIIKO-UHFFFAOYSA-N Elaidinsaeure-aethylester Natural products CCCCCCCCC=CCCCCCCCC(=O)OCC LVGKNOAMLMIIKO-UHFFFAOYSA-N 0.000 description 1
- 206010014612 Encephalitis viral Diseases 0.000 description 1
- 241000194033 Enterococcus Species 0.000 description 1
- 208000031637 Erythroblastic Acute Leukemia Diseases 0.000 description 1
- 208000036566 Erythroleukaemia Diseases 0.000 description 1
- 241000588724 Escherichia coli Species 0.000 description 1
- 241001198387 Escherichia coli BL21(DE3) Species 0.000 description 1
- 241001646719 Escherichia coli O157:H7 Species 0.000 description 1
- 241000206602 Eukaryota Species 0.000 description 1
- 208000002633 Febrile Neutropenia Diseases 0.000 description 1
- 241000192125 Firmicutes Species 0.000 description 1
- 206010058872 Fungal sepsis Diseases 0.000 description 1
- 241000605986 Fusobacterium nucleatum Species 0.000 description 1
- 201000000628 Gas Gangrene Diseases 0.000 description 1
- 108010010803 Gelatin Proteins 0.000 description 1
- WHUUTDBJXJRKMK-UHFFFAOYSA-N Glutamic acid Natural products OC(=O)C(N)CCC(O)=O WHUUTDBJXJRKMK-UHFFFAOYSA-N 0.000 description 1
- 208000009329 Graft vs Host Disease Diseases 0.000 description 1
- 206010072579 Granulomatosis with polyangiitis Diseases 0.000 description 1
- 208000031886 HIV Infections Diseases 0.000 description 1
- 208000037357 HIV infectious disease Diseases 0.000 description 1
- 108700010012 HMGN1 Proteins 0.000 description 1
- 208000030836 Hashimoto thyroiditis Diseases 0.000 description 1
- 206010019280 Heart failures Diseases 0.000 description 1
- 208000018565 Hemochromatosis Diseases 0.000 description 1
- 208000032759 Hemolytic-Uremic Syndrome Diseases 0.000 description 1
- 208000036066 Hemophagocytic Lymphohistiocytosis Diseases 0.000 description 1
- 208000032843 Hemorrhage Diseases 0.000 description 1
- 208000002972 Hepatolenticular Degeneration Diseases 0.000 description 1
- 208000002291 Histiocytic Sarcoma Diseases 0.000 description 1
- 208000032672 Histiocytosis haematophagic Diseases 0.000 description 1
- 108010033040 Histones Proteins 0.000 description 1
- 208000017604 Hodgkin disease Diseases 0.000 description 1
- 208000010747 Hodgkins lymphoma Diseases 0.000 description 1
- 241000282412 Homo Species 0.000 description 1
- 241000701044 Human gammaherpesvirus 4 Species 0.000 description 1
- 208000037147 Hypercalcaemia Diseases 0.000 description 1
- 206010020751 Hypersensitivity Diseases 0.000 description 1
- 201000009794 Idiopathic Pulmonary Fibrosis Diseases 0.000 description 1
- 208000004575 Infectious Arthritis Diseases 0.000 description 1
- 208000022559 Inflammatory bowel disease Diseases 0.000 description 1
- 102000004889 Interleukin-6 Human genes 0.000 description 1
- 208000007766 Kaposi sarcoma Diseases 0.000 description 1
- 241000588747 Klebsiella pneumoniae Species 0.000 description 1
- WHUUTDBJXJRKMK-VKHMYHEASA-N L-glutamic acid Chemical compound OC(=O)[C@@H](N)CCC(O)=O WHUUTDBJXJRKMK-VKHMYHEASA-N 0.000 description 1
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 1
- 108091026898 Leader sequence (mRNA) Proteins 0.000 description 1
- 241000589248 Legionella Species 0.000 description 1
- 208000007764 Legionnaires' Disease Diseases 0.000 description 1
- 208000004554 Leishmaniasis Diseases 0.000 description 1
- 206010024229 Leprosy Diseases 0.000 description 1
- 206010024264 Lethargy Diseases 0.000 description 1
- 241000239218 Limulus Species 0.000 description 1
- 108091036060 Linker DNA Proteins 0.000 description 1
- 241000186779 Listeria monocytogenes Species 0.000 description 1
- 208000016604 Lyme disease Diseases 0.000 description 1
- 208000035809 Lymphohistiocytosis Diseases 0.000 description 1
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 1
- 239000004472 Lysine Substances 0.000 description 1
- 229930195725 Mannitol Natural products 0.000 description 1
- 206010027201 Meningitis aseptic Diseases 0.000 description 1
- 241001529936 Murinae Species 0.000 description 1
- 241000186359 Mycobacterium Species 0.000 description 1
- 241000187479 Mycobacterium tuberculosis Species 0.000 description 1
- 201000002481 Myositis Diseases 0.000 description 1
- BNQSTAOJRULKNX-UHFFFAOYSA-N N-(6-acetamidohexyl)acetamide Chemical compound CC(=O)NCCCCCCNC(C)=O BNQSTAOJRULKNX-UHFFFAOYSA-N 0.000 description 1
- 208000001894 Nasopharyngeal Neoplasms Diseases 0.000 description 1
- 206010061306 Nasopharyngeal cancer Diseases 0.000 description 1
- 206010029164 Nephrotic syndrome Diseases 0.000 description 1
- 208000015914 Non-Hodgkin lymphomas Diseases 0.000 description 1
- 102000011931 Nucleoproteins Human genes 0.000 description 1
- 108010061100 Nucleoproteins Proteins 0.000 description 1
- 108010047956 Nucleosomes Proteins 0.000 description 1
- 208000003435 Optic Neuritis Diseases 0.000 description 1
- 206010058461 Orchitis noninfective Diseases 0.000 description 1
- 208000001132 Osteoporosis Diseases 0.000 description 1
- 229910019142 PO4 Inorganic materials 0.000 description 1
- 102100035593 POU domain, class 2, transcription factor 1 Human genes 0.000 description 1
- 101710084414 POU domain, class 2, transcription factor 1 Proteins 0.000 description 1
- 102100035591 POU domain, class 2, transcription factor 2 Human genes 0.000 description 1
- 239000002033 PVDF binder Substances 0.000 description 1
- 206010033645 Pancreatitis Diseases 0.000 description 1
- 206010033647 Pancreatitis acute Diseases 0.000 description 1
- 208000029082 Pelvic Inflammatory Disease Diseases 0.000 description 1
- 102000007079 Peptide Fragments Human genes 0.000 description 1
- 108010033276 Peptide Fragments Proteins 0.000 description 1
- 102000004160 Phosphoric Monoester Hydrolases Human genes 0.000 description 1
- 108090000608 Phosphoric Monoester Hydrolases Proteins 0.000 description 1
- 102000001938 Plasminogen Activators Human genes 0.000 description 1
- 108010001014 Plasminogen Activators Proteins 0.000 description 1
- 208000005384 Pneumocystis Pneumonia Diseases 0.000 description 1
- 206010073755 Pneumocystis jirovecii pneumonia Diseases 0.000 description 1
- 208000005107 Premature Birth Diseases 0.000 description 1
- 206010036590 Premature baby Diseases 0.000 description 1
- 208000012654 Primary biliary cholangitis Diseases 0.000 description 1
- 241000589517 Pseudomonas aeruginosa Species 0.000 description 1
- 201000004681 Psoriasis Diseases 0.000 description 1
- 108091034057 RNA (poly(A)) Proteins 0.000 description 1
- 239000012980 RPMI-1640 medium Substances 0.000 description 1
- 101001009851 Rattus norvegicus Guanylate cyclase 2G Proteins 0.000 description 1
- 108020004511 Recombinant DNA Proteins 0.000 description 1
- 206010039085 Rhinitis allergic Diseases 0.000 description 1
- 241000283984 Rodentia Species 0.000 description 1
- 101150022483 SLC22A2 gene Proteins 0.000 description 1
- 241000277331 Salmonidae Species 0.000 description 1
- 206010053879 Sepsis syndrome Diseases 0.000 description 1
- 206010062164 Seronegative arthritis Diseases 0.000 description 1
- 208000009714 Severe Dengue Diseases 0.000 description 1
- 241000191967 Staphylococcus aureus Species 0.000 description 1
- 229920002472 Starch Polymers 0.000 description 1
- 241000193998 Streptococcus pneumoniae Species 0.000 description 1
- 229930006000 Sucrose Natural products 0.000 description 1
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 1
- 241000282898 Sus scrofa Species 0.000 description 1
- 208000004732 Systemic Vasculitis Diseases 0.000 description 1
- 108090000190 Thrombin Proteins 0.000 description 1
- 206010043561 Thrombocytopenic purpura Diseases 0.000 description 1
- 108090000373 Tissue Plasminogen Activator Proteins 0.000 description 1
- 108050006955 Tissue-type plasminogen activator Proteins 0.000 description 1
- 206010044251 Toxic shock syndrome streptococcal Diseases 0.000 description 1
- 206010052779 Transplant rejections Diseases 0.000 description 1
- 206010053476 Traumatic haemorrhage Diseases 0.000 description 1
- GLNADSQYFUSGOU-GPTZEZBUSA-J Trypan blue Chemical compound [Na+].[Na+].[Na+].[Na+].C1=C(S([O-])(=O)=O)C=C2C=C(S([O-])(=O)=O)C(/N=N/C3=CC=C(C=C3C)C=3C=C(C(=CC=3)\N=N\C=3C(=CC4=CC(=CC(N)=C4C=3O)S([O-])(=O)=O)S([O-])(=O)=O)C)=C(O)C2=C1N GLNADSQYFUSGOU-GPTZEZBUSA-J 0.000 description 1
- 108090000631 Trypsin Proteins 0.000 description 1
- 102000004142 Trypsin Human genes 0.000 description 1
- 206010046851 Uveitis Diseases 0.000 description 1
- 206010047115 Vasculitis Diseases 0.000 description 1
- 241000251539 Vertebrata <Metazoa> Species 0.000 description 1
- 208000018839 Wilson disease Diseases 0.000 description 1
- 206010000210 abortion Diseases 0.000 description 1
- 231100000176 abortion Toxicity 0.000 description 1
- 229960001138 acetylsalicylic acid Drugs 0.000 description 1
- 230000002378 acidificating effect Effects 0.000 description 1
- 208000021841 acute erythroid leukemia Diseases 0.000 description 1
- 201000003229 acute pancreatitis Diseases 0.000 description 1
- 239000002671 adjuvant Substances 0.000 description 1
- 210000004100 adrenal gland Anatomy 0.000 description 1
- 208000011341 adult acute respiratory distress syndrome Diseases 0.000 description 1
- 208000002205 allergic conjunctivitis Diseases 0.000 description 1
- 230000000172 allergic effect Effects 0.000 description 1
- 201000010105 allergic rhinitis Diseases 0.000 description 1
- 231100000360 alopecia Toxicity 0.000 description 1
- 208000006682 alpha 1-Antitrypsin Deficiency Diseases 0.000 description 1
- 238000003277 amino acid sequence analysis Methods 0.000 description 1
- 150000001413 amino acids Chemical class 0.000 description 1
- 230000003321 amplification Effects 0.000 description 1
- 230000003110 anti-inflammatory effect Effects 0.000 description 1
- 239000003146 anticoagulant agent Substances 0.000 description 1
- 239000007864 aqueous solution Substances 0.000 description 1
- CKLJMWTZIZZHCS-REOHCLBHSA-N aspartic acid group Chemical group N[C@@H](CC(=O)O)C(=O)O CKLJMWTZIZZHCS-REOHCLBHSA-N 0.000 description 1
- 208000006673 asthma Diseases 0.000 description 1
- 208000024998 atopic conjunctivitis Diseases 0.000 description 1
- 239000000688 bacterial toxin Substances 0.000 description 1
- 230000009286 beneficial effect Effects 0.000 description 1
- 238000004166 bioassay Methods 0.000 description 1
- 239000013060 biological fluid Substances 0.000 description 1
- 230000000740 bleeding effect Effects 0.000 description 1
- 230000000903 blocking effect Effects 0.000 description 1
- 230000037396 body weight Effects 0.000 description 1
- 230000004579 body weight change Effects 0.000 description 1
- 210000001185 bone marrow Anatomy 0.000 description 1
- 210000004899 c-terminal region Anatomy 0.000 description 1
- 244000309466 calf Species 0.000 description 1
- 239000002775 capsule Substances 0.000 description 1
- 230000000747 cardiac effect Effects 0.000 description 1
- 230000030833 cell death Effects 0.000 description 1
- 230000003915 cell function Effects 0.000 description 1
- 230000004709 cell invasion Effects 0.000 description 1
- 239000013592 cell lysate Substances 0.000 description 1
- 210000000170 cell membrane Anatomy 0.000 description 1
- 210000003855 cell nucleus Anatomy 0.000 description 1
- 230000003833 cell viability Effects 0.000 description 1
- 239000001913 cellulose Substances 0.000 description 1
- 229920002678 cellulose Polymers 0.000 description 1
- 210000001175 cerebrospinal fluid Anatomy 0.000 description 1
- 239000007795 chemical reaction product Substances 0.000 description 1
- 230000001684 chronic effect Effects 0.000 description 1
- 238000003776 cleavage reaction Methods 0.000 description 1
- 208000035850 clinical syndrome Diseases 0.000 description 1
- 238000010367 cloning Methods 0.000 description 1
- 238000002648 combination therapy Methods 0.000 description 1
- 230000001143 conditioned effect Effects 0.000 description 1
- 208000010247 contact dermatitis Diseases 0.000 description 1
- 238000011109 contamination Methods 0.000 description 1
- NKLPQNGYXWVELD-UHFFFAOYSA-M coomassie brilliant blue Chemical compound [Na+].C1=CC(OCC)=CC=C1NC1=CC=C(C(=C2C=CC(C=C2)=[N+](CC)CC=2C=C(C=CC=2)S([O-])(=O)=O)C=2C=CC(=CC=2)N(CC)CC=2C=C(C=CC=2)S([O-])(=O)=O)C=C1 NKLPQNGYXWVELD-UHFFFAOYSA-M 0.000 description 1
- 230000002596 correlated effect Effects 0.000 description 1
- 230000000875 corresponding effect Effects 0.000 description 1
- 239000012228 culture supernatant Substances 0.000 description 1
- 230000001186 cumulative effect Effects 0.000 description 1
- 238000005520 cutting process Methods 0.000 description 1
- 210000000805 cytoplasm Anatomy 0.000 description 1
- 230000003111 delayed effect Effects 0.000 description 1
- 210000001787 dendrite Anatomy 0.000 description 1
- 201000002950 dengue hemorrhagic fever Diseases 0.000 description 1
- 239000007933 dermal patch Substances 0.000 description 1
- 206010012601 diabetes mellitus Diseases 0.000 description 1
- 238000003745 diagnosis Methods 0.000 description 1
- 235000014113 dietary fatty acids Nutrition 0.000 description 1
- 230000004069 differentiation Effects 0.000 description 1
- 239000012895 dilution Substances 0.000 description 1
- 238000010790 dilution Methods 0.000 description 1
- 239000003937 drug carrier Substances 0.000 description 1
- 230000001804 emulsifying effect Effects 0.000 description 1
- 238000011013 endotoxin removal Methods 0.000 description 1
- 238000005516 engineering process Methods 0.000 description 1
- 210000000918 epididymis Anatomy 0.000 description 1
- 201000010063 epididymitis Diseases 0.000 description 1
- 210000002409 epiglottis Anatomy 0.000 description 1
- 210000000981 epithelium Anatomy 0.000 description 1
- 102000015694 estrogen receptors Human genes 0.000 description 1
- 108010038795 estrogen receptors Proteins 0.000 description 1
- LVGKNOAMLMIIKO-QXMHVHEDSA-N ethyl oleate Chemical compound CCCCCCCC\C=C/CCCCCCCC(=O)OCC LVGKNOAMLMIIKO-QXMHVHEDSA-N 0.000 description 1
- 229940093471 ethyl oleate Drugs 0.000 description 1
- 238000011156 evaluation Methods 0.000 description 1
- 230000007717 exclusion Effects 0.000 description 1
- 239000013604 expression vector Substances 0.000 description 1
- 239000000194 fatty acid Substances 0.000 description 1
- 229930195729 fatty acid Natural products 0.000 description 1
- -1 fatty acid esters Chemical class 0.000 description 1
- 239000010685 fatty oil Substances 0.000 description 1
- 201000008825 fibrosarcoma of bone Diseases 0.000 description 1
- 239000012530 fluid Substances 0.000 description 1
- 238000005194 fractionation Methods 0.000 description 1
- 238000004108 freeze drying Methods 0.000 description 1
- 230000002538 fungal effect Effects 0.000 description 1
- 238000001502 gel electrophoresis Methods 0.000 description 1
- 239000008273 gelatin Substances 0.000 description 1
- 229920000159 gelatin Polymers 0.000 description 1
- 235000019322 gelatine Nutrition 0.000 description 1
- 235000011852 gelatine desserts Nutrition 0.000 description 1
- 235000013922 glutamic acid Nutrition 0.000 description 1
- 239000004220 glutamic acid Substances 0.000 description 1
- 230000013595 glycosylation Effects 0.000 description 1
- 238000006206 glycosylation reaction Methods 0.000 description 1
- 239000011544 gradient gel Substances 0.000 description 1
- 208000024908 graft versus host disease Diseases 0.000 description 1
- 229920000591 gum Polymers 0.000 description 1
- 238000001631 haemodialysis Methods 0.000 description 1
- 230000000322 hemodialysis Effects 0.000 description 1
- 208000014752 hemophagocytic syndrome Diseases 0.000 description 1
- 208000006454 hepatitis Diseases 0.000 description 1
- 231100000283 hepatitis Toxicity 0.000 description 1
- 208000033519 human immunodeficiency virus infectious disease Diseases 0.000 description 1
- 210000004408 hybridoma Anatomy 0.000 description 1
- 239000001866 hydroxypropyl methyl cellulose Substances 0.000 description 1
- 229920003088 hydroxypropyl methyl cellulose Polymers 0.000 description 1
- 235000010979 hydroxypropyl methyl cellulose Nutrition 0.000 description 1
- UFVKGYZPFZQRLF-UHFFFAOYSA-N hydroxypropyl methyl cellulose Chemical compound OC1C(O)C(OC)OC(CO)C1OC1C(O)C(O)C(OC2C(C(O)C(OC3C(C(O)C(O)C(CO)O3)O)C(CO)O2)O)C(CO)O1 UFVKGYZPFZQRLF-UHFFFAOYSA-N 0.000 description 1
- 230000000148 hypercalcaemia Effects 0.000 description 1
- 208000030915 hypercalcemia disease Diseases 0.000 description 1
- 230000009610 hypersensitivity Effects 0.000 description 1
- 230000004179 hypothalamic–pituitary–adrenal axis Effects 0.000 description 1
- 230000001900 immune effect Effects 0.000 description 1
- 230000002163 immunogen Effects 0.000 description 1
- 230000016784 immunoglobulin production Effects 0.000 description 1
- 230000006872 improvement Effects 0.000 description 1
- 238000005462 in vivo assay Methods 0.000 description 1
- 239000000411 inducer Substances 0.000 description 1
- 208000000509 infertility Diseases 0.000 description 1
- 231100000535 infertility Toxicity 0.000 description 1
- 230000036512 infertility Effects 0.000 description 1
- 208000037797 influenza A Diseases 0.000 description 1
- 238000001802 infusion Methods 0.000 description 1
- 239000003112 inhibitor Substances 0.000 description 1
- 230000003993 interaction Effects 0.000 description 1
- 208000036971 interstitial lung disease 2 Diseases 0.000 description 1
- 230000003834 intracellular effect Effects 0.000 description 1
- 238000010255 intramuscular injection Methods 0.000 description 1
- 239000007927 intramuscular injection Substances 0.000 description 1
- 239000007928 intraperitoneal injection Substances 0.000 description 1
- 238000010253 intravenous injection Methods 0.000 description 1
- 230000005865 ionizing radiation Effects 0.000 description 1
- 230000007794 irritation Effects 0.000 description 1
- 208000012947 ischemia reperfusion injury Diseases 0.000 description 1
- FZWBNHMXJMCXLU-BLAUPYHCSA-N isomaltotriose Chemical compound O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@@H]1OC[C@@H]1[C@@H](O)[C@H](O)[C@@H](O)[C@@H](OC[C@@H](O)[C@@H](O)[C@H](O)[C@@H](O)C=O)O1 FZWBNHMXJMCXLU-BLAUPYHCSA-N 0.000 description 1
- 210000003734 kidney Anatomy 0.000 description 1
- 239000008101 lactose Substances 0.000 description 1
- 231100000636 lethal dose Toxicity 0.000 description 1
- 238000012454 limulus amebocyte lysate test Methods 0.000 description 1
- 239000002502 liposome Substances 0.000 description 1
- 210000004185 liver Anatomy 0.000 description 1
- 210000004072 lung Anatomy 0.000 description 1
- 210000001165 lymph node Anatomy 0.000 description 1
- 239000006166 lysate Substances 0.000 description 1
- 229920002521 macromolecule Polymers 0.000 description 1
- 201000004792 malaria Diseases 0.000 description 1
- 201000006812 malignant histiocytosis Diseases 0.000 description 1
- 239000000594 mannitol Substances 0.000 description 1
- 235000010355 mannitol Nutrition 0.000 description 1
- 239000000463 material Substances 0.000 description 1
- 230000010534 mechanism of action Effects 0.000 description 1
- 230000002503 metabolic effect Effects 0.000 description 1
- 229920000609 methyl cellulose Polymers 0.000 description 1
- 239000001923 methylcellulose Substances 0.000 description 1
- 235000010981 methylcellulose Nutrition 0.000 description 1
- 238000002156 mixing Methods 0.000 description 1
- 201000006417 multiple sclerosis Diseases 0.000 description 1
- 208000010125 myocardial infarction Diseases 0.000 description 1
- 230000001613 neoplastic effect Effects 0.000 description 1
- 230000001537 neural effect Effects 0.000 description 1
- 210000002241 neurite Anatomy 0.000 description 1
- 230000000926 neurological effect Effects 0.000 description 1
- 210000002569 neuron Anatomy 0.000 description 1
- 201000001119 neuropathy Diseases 0.000 description 1
- 230000007823 neuropathy Effects 0.000 description 1
- FSVCQIDHPKZJSO-UHFFFAOYSA-L nitro blue tetrazolium dichloride Chemical compound [Cl-].[Cl-].COC1=CC(C=2C=C(OC)C(=CC=2)[N+]=2N(N=C(N=2)C=2C=CC=CC=2)C=2C=CC(=CC=2)[N+]([O-])=O)=CC=C1[N+]1=NC(C=2C=CC=CC=2)=NN1C1=CC=C([N+]([O-])=O)C=C1 FSVCQIDHPKZJSO-UHFFFAOYSA-L 0.000 description 1
- 229940021182 non-steroidal anti-inflammatory drug Drugs 0.000 description 1
- 238000003199 nucleic acid amplification method Methods 0.000 description 1
- 210000001623 nucleosome Anatomy 0.000 description 1
- 239000002773 nucleotide Substances 0.000 description 1
- 125000003729 nucleotide group Chemical group 0.000 description 1
- 210000004940 nucleus Anatomy 0.000 description 1
- 238000005457 optimization Methods 0.000 description 1
- 210000000056 organ Anatomy 0.000 description 1
- 230000008520 organization Effects 0.000 description 1
- 201000008482 osteoarthritis Diseases 0.000 description 1
- 210000000496 pancreas Anatomy 0.000 description 1
- 238000007911 parenteral administration Methods 0.000 description 1
- 244000052769 pathogen Species 0.000 description 1
- 230000001717 pathogenic effect Effects 0.000 description 1
- 230000007918 pathogenicity Effects 0.000 description 1
- 230000001575 pathological effect Effects 0.000 description 1
- 208000033808 peripheral neuropathy Diseases 0.000 description 1
- 206010034674 peritonitis Diseases 0.000 description 1
- 210000001539 phagocyte Anatomy 0.000 description 1
- 239000010452 phosphate Substances 0.000 description 1
- 230000000704 physical effect Effects 0.000 description 1
- 239000006187 pill Substances 0.000 description 1
- 239000013612 plasmid Substances 0.000 description 1
- 229940012957 plasmin Drugs 0.000 description 1
- 201000000317 pneumocystosis Diseases 0.000 description 1
- 231100000572 poisoning Toxicity 0.000 description 1
- 230000000607 poisoning effect Effects 0.000 description 1
- 229920002401 polyacrylamide Polymers 0.000 description 1
- 229920001184 polypeptide Polymers 0.000 description 1
- 229920002981 polyvinylidene fluoride Polymers 0.000 description 1
- 239000001267 polyvinylpyrrolidone Substances 0.000 description 1
- 229920000036 polyvinylpyrrolidone Polymers 0.000 description 1
- 235000013855 polyvinylpyrrolidone Nutrition 0.000 description 1
- 238000010837 poor prognosis Methods 0.000 description 1
- 210000004986 primary T-cell Anatomy 0.000 description 1
- 230000008569 process Effects 0.000 description 1
- 102000004196 processed proteins & peptides Human genes 0.000 description 1
- 102000003998 progesterone receptors Human genes 0.000 description 1
- 108090000468 progesterone receptors Proteins 0.000 description 1
- 230000000750 progressive effect Effects 0.000 description 1
- 230000007114 proinflammatory cascade Effects 0.000 description 1
- 230000001737 promoting effect Effects 0.000 description 1
- 230000001902 propagating effect Effects 0.000 description 1
- 230000017854 proteolysis Effects 0.000 description 1
- 230000006337 proteolytic cleavage Effects 0.000 description 1
- 238000011002 quantification Methods 0.000 description 1
- 238000001959 radiotherapy Methods 0.000 description 1
- 230000007420 reactivation Effects 0.000 description 1
- 230000009257 reactivity Effects 0.000 description 1
- 239000002464 receptor antagonist Substances 0.000 description 1
- 229940044551 receptor antagonist Drugs 0.000 description 1
- 102000005962 receptors Human genes 0.000 description 1
- 108020003175 receptors Proteins 0.000 description 1
- 230000010076 replication Effects 0.000 description 1
- 239000011347 resin Substances 0.000 description 1
- 229920005989 resin Polymers 0.000 description 1
- 210000002345 respiratory system Anatomy 0.000 description 1
- 230000002441 reversible effect Effects 0.000 description 1
- 206010039073 rheumatoid arthritis Diseases 0.000 description 1
- YGSDEFSMJLZEOE-UHFFFAOYSA-M salicylate Chemical compound OC1=CC=CC=C1C([O-])=O YGSDEFSMJLZEOE-UHFFFAOYSA-M 0.000 description 1
- 229960001860 salicylate Drugs 0.000 description 1
- 201000000306 sarcoidosis Diseases 0.000 description 1
- 230000007017 scission Effects 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- 201000001223 septic arthritis Diseases 0.000 description 1
- 239000008159 sesame oil Substances 0.000 description 1
- 235000011803 sesame oil Nutrition 0.000 description 1
- 206010040560 shock Diseases 0.000 description 1
- 208000007056 sickle cell anemia Diseases 0.000 description 1
- 239000002002 slurry Substances 0.000 description 1
- 239000011780 sodium chloride Substances 0.000 description 1
- 239000012439 solid excipient Substances 0.000 description 1
- 239000000243 solution Substances 0.000 description 1
- 239000002904 solvent Substances 0.000 description 1
- 241000894007 species Species 0.000 description 1
- 210000000952 spleen Anatomy 0.000 description 1
- 239000008107 starch Substances 0.000 description 1
- 235000019698 starch Nutrition 0.000 description 1
- 150000003431 steroids Chemical class 0.000 description 1
- 230000004936 stimulating effect Effects 0.000 description 1
- 229940031000 streptococcus pneumoniae Drugs 0.000 description 1
- 238000010254 subcutaneous injection Methods 0.000 description 1
- 239000007929 subcutaneous injection Substances 0.000 description 1
- 239000000758 substrate Substances 0.000 description 1
- 239000005720 sucrose Substances 0.000 description 1
- 235000000346 sugar Nutrition 0.000 description 1
- 238000009495 sugar coating Methods 0.000 description 1
- 150000008163 sugars Chemical class 0.000 description 1
- 239000006228 supernatant Substances 0.000 description 1
- 230000008093 supporting effect Effects 0.000 description 1
- 238000001356 surgical procedure Methods 0.000 description 1
- 239000006188 syrup Substances 0.000 description 1
- 235000020357 syrup Nutrition 0.000 description 1
- 201000000596 systemic lupus erythematosus Diseases 0.000 description 1
- 239000003826 tablet Substances 0.000 description 1
- 230000008685 targeting Effects 0.000 description 1
- 210000001550 testis Anatomy 0.000 description 1
- 229960004072 thrombin Drugs 0.000 description 1
- 230000002537 thrombolytic effect Effects 0.000 description 1
- 210000001541 thymus gland Anatomy 0.000 description 1
- 230000007838 tissue remodeling Effects 0.000 description 1
- 229940100611 topical cream Drugs 0.000 description 1
- 230000008791 toxic response Effects 0.000 description 1
- 238000013518 transcription Methods 0.000 description 1
- 230000035897 transcription Effects 0.000 description 1
- 150000003626 triacylglycerols Chemical class 0.000 description 1
- YNJBWRMUSHSURL-UHFFFAOYSA-N trichloroacetic acid Chemical compound OC(=O)C(Cl)(Cl)Cl YNJBWRMUSHSURL-UHFFFAOYSA-N 0.000 description 1
- 239000012588 trypsin Substances 0.000 description 1
- 201000008827 tuberculosis Diseases 0.000 description 1
- 238000000108 ultra-filtration Methods 0.000 description 1
- 208000009852 uremia Diseases 0.000 description 1
- 230000002485 urinary effect Effects 0.000 description 1
- 210000002700 urine Anatomy 0.000 description 1
- 238000007879 vasectomy Methods 0.000 description 1
- 239000013598 vector Substances 0.000 description 1
- 201000002498 viral encephalitis Diseases 0.000 description 1
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 1
- 239000012130 whole-cell lysate Substances 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
- A61K39/39533—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/18—Drugs for disorders of the alimentary tract or the digestive system for pancreatic disorders, e.g. pancreatic enzymes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
- A61P11/06—Antiasthmatics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/02—Drugs for skeletal disorders for joint disorders, e.g. arthritis, arthrosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/02—Drugs for disorders of the nervous system for peripheral neuropathies
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/04—Anorexiants; Antiobesity agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/04—Antibacterial agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/06—Immunosuppressants, e.g. drugs for graft rejection
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/24—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against cytokines, lymphokines or interferons
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/24—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against cytokines, lymphokines or interferons
- C07K16/241—Tumor Necrosis Factors
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2866—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against receptors for cytokines, lymphokines, interferons
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/68—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving proteins, peptides or amino acids
- G01N33/6875—Nucleoproteins
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/76—Antagonist effect on antigen, e.g. neutralization or inhibition of binding
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2800/00—Detection or diagnosis of diseases
- G01N2800/06—Gastro-intestinal diseases
- G01N2800/065—Bowel diseases, e.g. Crohn, ulcerative colitis, IBS
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2800/00—Detection or diagnosis of diseases
- G01N2800/06—Gastro-intestinal diseases
- G01N2800/067—Pancreatitis or colitis
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2800/00—Detection or diagnosis of diseases
- G01N2800/12—Pulmonary diseases
- G01N2800/125—Adult respiratory distress syndrome
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2800/00—Detection or diagnosis of diseases
- G01N2800/24—Immunology or allergic disorders
- G01N2800/245—Transplantation related diseases, e.g. graft versus host disease
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2800/00—Detection or diagnosis of diseases
- G01N2800/26—Infectious diseases, e.g. generalised sepsis
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02A—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE
- Y02A50/00—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE in human health protection, e.g. against extreme weather
- Y02A50/30—Against vector-borne diseases, e.g. mosquito-borne, fly-borne, tick-borne or waterborne diseases whose impact is exacerbated by climate change
Description
(技術分野)
本発明は、炎症性サイトカインカスケードの活性化を特徴とする、特に敗血症性ショックおよびARDS(急性呼吸窮迫症候群)を含めた敗血症疾患を治療するための医薬組成物および方法であって、高移動度グループ1タンパク質(HMG1)に対する有効量のアンタゴニストを投与することを含む組成物および方法を提供する。本発明はさらに、敗血症および関連症状の重症度をモニタリングするための診断方法であって、炎症性サイトカインカスケードの活性化を特徴とする疾患の症状を示している患者におけるHMG1の血清濃度を測定することを含む方法を提供する。最後に、本発明は、体重損失をもたらすか、または肥満症を治療するための医薬組成物および方法であって、有効量のHMG1タンパク質またはHMG1遺伝子の遺伝子産物の治療的活性断片を投与することを含む医薬組成物および方法を提供する。
【0002】
[発明の背景]
敗血症は、感染または損傷後に発症するしばしば致命的となる臨床症候群である。敗血症は、入院患者における最多死因である。細菌内毒素(リポ多糖、LPS)の投与を基礎にしたグラム陰性敗血症の実験モデルは、共通した根元的炎症性サイトカインカスケードの活性化による致死的敗血症および敗血症に関連した症状の病因メカニズムの理解の改良をもたらした。宿主応答性メディエータのこのカスケードは、重症内毒素血症における終局的致死性の急性初期メディエータとして広範に研究されてきたTNF、IL−1、PAFおよびその他のマクロファージ由来因子を含む(Zhang and Tracey, In The Cytokine Handbook, 3rd ed. Ed. Thompson(Academic Press Limited, USA).515-547, 1998)。
【0003】
残念ながら、内毒素血症のこれらの個々の「初期」メディエータの阻害を基礎にした療法的アプローチは、ヒト患者における敗血症に対する大規模予測臨床試験における限定成功例にのみ応じただけである。これらの期待はずれの結果から、宿主応答における後期出現因子が、敗血症および関連疾患における病因および/または致死性を決定するのに重要であり得ると推論できる。したがって、特に内毒素血症が臨床的敗血症および関連臨床疾患を代表することから、重症内毒素血症の広範な多系病因の一部または全部に関してあるいは致死性に関して、必要なおよび/または十分なこのような推定「後期」メディエータを発見することが必要である。
【0004】
HMG1は、急に出現する高移動度群(HMG)の非ヒストンクロマチン関連タンパク質に属する30kDa染色体核タンパク質である。一群として、HMGタンパク質は、独特のDNA構造を認識し、ヌクレオソーム構造および安定性の確定を含めた多様な細胞機能に、ならびに転写および/または複製に関連づけられてきた。HMGタンパク質は、ポリアクリルアミドゲル中での高い電気泳動移動度を有するクロマチン構成成分としてJohnsとGoodwinにより最初に性状解析された(The HMG Chromosomal Proteins, E.W. Johns, Academic Press, London, 1982参照)。高等真核生物は、HMGタンパク質の3つのファミリー、即ちHMG−1/−2ファミリー、HMG−14/−17ファミリーおよびHMG−1/−Yファミリーを示す。ファミリーはサイズおよびDNA結合特性により区別可能であるが、しかしそれらはその物理的特性において類似する。HMGタンパク質は、種を通して高度に保存され、遍く分布されて、非常に豊富であり、そして0.35MのNaCl中のクロマチンから抽出可能であり、5%過塩素酸またはトリクロロ酢酸中に可溶性である。一般に、HMGタンパク質は、DNAを折り曲げて、種々の転写因子とそれらのコグネイト配列(例えばプロゲステロン受容体、エストロゲン受容体、HOXタンパク質、ならびにOct1、Oct2およびOct6)との結合を促すと考えられる。近年、いくつかの転写因子およびその他のDNA相互作用タンパク質を含めたタンパク質の大きい非常に多様な群が、HMG1に類似した1つまたはそれ以上の領域を含有する、ということが明らかになってきて、この特徴はHMG1ボックスまたはHMG1ドメインとして知られるようになった。HMG1をコードするcDNAは、ヒト、ラット、マス、ハムスター、ブタおよび仔ウシ細胞からクローン化されており、HMG1はすべての脊椎動物細胞核中に豊富に存在すると考えられる。本タンパク質は、80%範囲の種間配列同一性で高度に保存されている。クロマチン中では、HMG1は、ヌクレオソーム間のリンカーDNAと、そして種々の非β−DNA構造、例えばパリンドローム、十字形およびステム−ループ構造、ならびにシスプラチン修飾DNAと結合する。HMG1により結合されるDNAは、一般に、配列非感受性であると考えられる。HMG1は洗浄済み核またはクロマチンから最も高頻度に調製されるが、しかし、当該タンパク質はまた細胞質中でも検出されている(Landsman and Bustin, BioEssays 15:539-546, 1993; Baxevams and Landsman, Nucleic Acids Research 23:514-523, 1995で再検討)。今日まで、HMGタンパク質といずれかの臨床症状または疾患との間に関連は確立されていない。
【0005】
あるいはHMG1は、発生中の脳において豊富に発現されるヘパリン結合タンパク質として同定され、その高度な二極性配列のため「アンホテリン」と称されており、これは約80アミノ酸正荷電ドメイン(HMG1ボックス)と一続きの約30の連続したグルタミン酸またはアスパラギン酸残基を含む酸性C末端ドメインとの2つの内部反復を有する。アンホテリン/HMG1は上皮、特にニューロン細胞の形質膜の外表面に局在化されており、この場合、それは神経細胞のフィリポジア(filipodia)に特異的に局在化されている。アンホテリン/HMG1は突起(神経突起)伸長に必要であり、アンホテリン/HMG1はまたニューロン−グリア相互作用にも関与し得る、ということを阻害試験は示唆した(Merenmies et al., J. Biol. Chem. 266:16722-16729, 1991; Merenmies et al., J. Biol. Chem. 266:16722-16729, 1991; Milev et al., J. Biol. Chem. 273:6998-7005, 1998;およびSalmivirta et al., Exp. Cell Res. 200:444-451, 1992)。アンホテリン/HMG1は、化学誘導物質ヘキサメチレンビスアセトアミドによる刺激後にマウス赤白血病細胞から放出され得る(Melloni et al., Biochem. Biophys. Res. Commun. 210:82-89, 1995)。HMG1遺伝子の遺伝子産物は、α−PKCを刺激することにより分化促進因子として機能する、ということを過去の研究は示唆している(Melloni et al., Biochem. Biophys. Res. Commun. 210:82-89, 1995;およびMelloni et al., FEBS Lett. 368:466-470, 1995)。
【0006】
HMG1遺伝子産物は、プラスミノーゲンおよび組織型プラスミノーゲン活性化因子(t−PA)と相互作用し、細胞侵襲および組織再造形中の細胞外タンパク質分解に一役を演じることが知られている系である細胞表面でのプラスミン生成を有効に促進する、ということが示されている。アンホテリン/HMG1は、進行性グリコシル化最終生成物(RAGE)の受容体と相互作用することも示されている(Mohan et al., Biochem. Biophys. Res. Commun. 182:689-696, 1992; Yamawaki et al., J. Neurosci. Res. 44:586-593, 1996; Salmivirta et al., Exp. Cell Res. 200:444-451, 1992;およびVassalli et al., J. Clin. Invest. 88:1067-1072, 1991)、(Redlitz and Plow, Baillieres Clin. Haematol. 8:313-327, 1995;およびParkkinen et al., J. Biol. Chem. 266:16730-16735, 1991)。
【0007】
サイトカイン媒介性炎症カスケードを防止し、広範な種々のサイトカイン媒介性炎症性疾患における療法的活性を有し得る改良された作用物質を発見することが当業界では長きに亘って必要とされている。本発明は、敗血症および炎症性サイトカインカスケードの一般的活性化により関連づけられるその他の疾患における毒性、病因および/または致死性を媒介する作用物質を同定するための研究調査の経過中になされた。
【0008】
炎症性サイトカインカスケードにより媒介される疾患および症状は、多数ある。このような症状としては、以下に群別された疾患カテゴリーが含まれる:
全身性炎症性応答症候群、これには以下が含まれる:
敗血症症候群
グラム陽性敗血症
グラム陰性敗血症
培養陰性敗血症
真菌性敗血症
好中球減少性発熱
尿路性敗血症
髄膜炎菌血症
外傷性出血
唸音
電離放射線曝露
急性膵炎
成人呼吸窮迫症候群(ARDS)
再還流傷害、これには以下が含まれる:
後ポンプ症候群
虚血再還流傷害
心臓血管性疾患、これには以下が含まれる:
心臓性昏倒症候群
心筋梗塞
うっ血性心不全
感染性疾患、これには以下が含まれる:
HIV感染/HIVニューロパシー
髄膜炎
肝炎
敗血症性関節炎
腹膜炎
肺炎喉頭蓋炎
大腸菌O157:H7
溶血性尿毒症症候群/血栓崩壊性血小板減少性紫斑病
マラリア
デング出血熱
リーシュマニア症
らい病
トキシックショック症候群
連鎖球菌性筋炎
ガス壊疸
Mycobacterium結核(ヒト型結核)
Mycobacterium aviun Intracellulare(鳥型結核菌細胞内物質感染)
Pneumocystis Carinii(ニューモシスティスカリニ)肺炎
骨盤炎症性疾患
睾丸炎/精巣上体炎
レジオネラ
ライム病
A型インフルエンザ
エプスタイン−バーウイルス
ウイルス関連血球貪食(hemiaphagocytic)症候群
ウイルス性脳炎/無菌性髄膜炎
産科学/婦人科学的症状、これは以下を含む:
早産
流産
不妊症
炎症性疾患/自己免疫疾患、これには以下が含まれる:
リウマチ性関節炎/セロネガティブ関節症
変形性関節症
炎症性腸疾患
全身性エリトマトーデス
虹彩毛様体炎/ブドウ膜炎視神経炎
特発性肺繊維症
全身性脈管炎/ウェーゲナー肉芽腫症
サルコイドーシス
睾丸炎/精管切除反転術
アレルギー性/アトピー性疾患、これには以下が含まれる:
喘息
アレルギー性鼻炎
湿疹
アレルギー性接触性皮膚炎
アレルギー性結膜炎
過敏性肺炎
悪性疾患、これには以下が含まれる:
ALL
AML
CML
CLL
ホジキン病、非ホジキンリンパ腫
カポジ肉腫
結腸直腸癌
鼻咽頭癌
悪性組織球増殖症
新生物随伴症候群/悪性疾患の高カルシウム血症
移植片、これは以下を含む:
器官移植片拒絶
移植片対宿主疾患
悪液質
先天性、これは以下を含む:
嚢胞性繊維症
家族性血液食細胞性リンパ組織球増殖症
鎌状赤血球貧血
皮膚科学的、これは以下を含む:
乾癬
脱毛症
神経学的、これは以下を含む:
多発性硬化症
片頭痛
腎臓性、これは以下を含む:
ネフローゼ症候群
血液透析
尿毒症
毒性、これは以下を含む:
OKT3療法
抗CD3療法
サイトカイン療法
化学療法
放射線療法
慢性サリチレート中毒
代謝性/特発性、これは以下を含む:
ウィルソン病
血液色素症
α−1アンチトリプシン欠損症
糖尿病
橋本甲状腺炎
骨粗鬆症
視床下部−下垂体−副腎軸評価
原発性胆汁性肝硬変
【0009】
[発明の概要]
本発明は、炎症性サイトカインカスケードにより媒介される症状(疾患)を治療するための医薬組成物であって、有効量の、HMG1のアンタゴニストまたは阻害剤を含む組成物を提供する。好ましくは、HMG1アンタゴニストは、HMG1タンパク質と結合する抗体、HMG1遺伝子アンチセンス配列およびHMG1受容体アンタゴニストから成る群から選択される。本発明は、炎症性サイトカインカスケードにより媒介される症状の治療方法であって、有効量のHMG1アンタゴニストを投与することを含む方法を提供する。別の実施形態では、本発明の方法は、HMG1アンタゴニストと組合せて第二作用物質を投与することをさらに含み、この場合、第二作用物質は、TNF、IL−1α、IL−1β、MIFまたはIL−6のような初期敗血症メディエータのアンタゴニストである。最も好ましくは、第二作用物質は、TNFに対する抗体、あるいはIL−1受容体アンタゴニスト(IL−1ra)である。
【0010】
本発明はさらに、炎症性カスケードにより媒介される症状に伴うショック様症状を示しているかまたはその症状を示す危険性のある患者に関する敗血症および関連症状の重症度をモニタリングし、そして起こり得る臨床経過を予測するための診断および予後判定方法を提供する。本発明の診断および予後判定方法は、試料中の、好ましくは血清試料中のHMG1の濃度を測定し、その濃度を、同様の試料中のHMG1の正常濃度範囲を代表するHMG1に関する標準と比較し、それにより高レベルのHMG1が乏しい予後または毒性反応の可能性を示すことを包含する。本診断方法はまた、他の組織、または流体区画、例えば脳脊髄液または尿にも適用され得る。最後に、本発明は、体重損失をもたらすか、または肥満症を治療するための医薬組成物および方法であって、有効量のHMG1またはその治療的活性断片を投与することを含む医薬組成物および方法を提供する。
【0011】
[発明の詳細な説明]
本発明は、LPS、TNFまたはIL−1による刺激後の培養マウスマクロファージ様細胞(RAW264.7)により放出され、そしてこの細胞により調整された培地中に蓄積する高誘導性30kDaタンパク質の発見および単離に基づいている。この単離ポリペプチドの部分的アミノ酸配列は、アンホテリンとしても知られているHMG1タンパク質の配列と同一であり、このタンパク質はこれまでにいずれもの疾患の病原に連結されていない。この情報を用いてHMG1をコードするcDNAをクローン化し、その配列を発現させて、組換え体タンパク質を得て、そのタンパク質を用いて特異的抗HMG1抗体を生成した。
【0012】
一連の予測的in vitroおよびin vivo実験で、治療的および診断的効力を確定した。実験は、実施例の項に詳述する。例えば、マウスへの内毒素(LD100)の投与後、血清HMG1レベルは、敗血症の周知の「初期」メディエータ(例えばTNFおよびIL−1)より遅れて(16時間で)増大し、HMG1のプラトーレベルは16〜32時間保持された。致死的敗血症を有する患者は、正常健常有志においては検出されない高血清HMG1レベルを有した。さらに、被験動物へのrHMG1の急性実験的投与は、単独であっても亜致死量のLPSと組合せても、顕著な病理学的応答を、そして死さえも生じた。より低量のrHMG1の更なる分布投与スケジュールは、処置動物における有意の体重損失をもたらした。これらの結果は、既知の「初期」メディエータ、例えばTNFおよびIL−1と対照的に、HMG1が内毒素血症のメディエータ、特に後期メディエータであるという証拠を示す。これらのデータはさらに、敗血症および関連症状の重症度または考え得る致死性に対するマーカーとしての血清HMG1の重要性を示す。
【0013】
さらに、抗HMG1抗体による治療は、マウスにおけるLD100用量のLPSからの最大限の防御を提供した。HMG1はTNFおよびIL−1βによって誘導可能であり、huPBMCからのTNF放出を用量依存的に刺激する。TNFはマクロファージ活性化のマーカーであり、したがって(暗示されるメカニズムに限定されることなく、または理論に縛られずに)、HMG1はサイトカインカスケードの下流再活性化を促し、これが次に、前炎症性サイトカイン応答の活性化を伴う敗血症および関連症状における後期病因および致死性を媒介すると考えられる。したがって、HMG1は、感染および損傷に対する炎症性応答を媒介する場合に中心的役割を占め、HMG1のアンタゴニストは炎症性カスケード活性化の敗血症および関連症状における治療的利点を有すると思われる。炎症性サイトカインカスケードにおけるHMG1の出現は、後期の宿主応答を伝播するのに適しており、毒性および致死性に関与する。本明細書中に記載される予測データは、HMG1アンタゴニストの治療的効力を支持し、作用メカニズムに関する前記の理論に支持される証拠を提供する。in vivo治療データは、概して炎症性サイトカインカスケードにより媒介される症状を、特に敗血症症状、例えば敗血症ショック、敗血症症候群または炎症性サイトカインにより媒介されるその他の「敗血症様」症状等を治療するための、概してHMG1アンタゴニストの効力、そして特に抗HMG1抗体の効力を示した。さらに、HMG1の個々の病原性および毒性/致死性は、TNF、MIF、IL−1およびIL−6のような「初期」炎症性メディエータのアンタゴニストと同時投与した場合に、HMG1アンタゴニストが特に有効であることを示す。
【0014】
要するに、1)HMG1は細菌毒素による、または前炎症性サイトカイン(TNFまたはIL−1β)による刺激後にマクロファージおよび下垂体細胞から放出され、2)HMG1はLPSに曝露された動物の血清中および敗血症患者中に蓄積し、そして3)HMG1特異的抗体は臨床的敗血症および関連症状の予測的致死内毒素血症動物モデルにおける死亡に対して防御することから、HMG1は炎症性反応のサイトカインメディエータである。
【0015】
医薬組成物および投与方法
本発明の医薬組成物または本発明の製剤組合せは、それ自体(複合物または組合せ)で、またはそれが適切な担体および賦形剤と混合される医薬組成物中で、患者に投与され得る。本発明の医薬組成物または本発明の製剤組合せは、非経口的に、例えば静脈内注射または注入、腹腔内注射、皮下注射または筋内注射により投与され得る。本発明の医薬組成物または本発明の製剤組合せは、錠剤、ピル、カプセル、液体、ゲル、シロップ、スラリー(slurries)、懸濁液等を形成するために担体および賦形剤を用いた適切な処方物により経口的にまたは直腸に投与され得る。本発明の医薬組成物または本発明の製剤組合せは、局所的に、例えば皮膚パッチにより投与されて、活性作用物質の一貫した全身レベルを達成する。本発明の医薬組成物または本発明の製剤組合せは、局所用クリーム、皮膚または粘膜パッチ、皮膚または粘膜表面への局所適用に適した液体またはゲル中に処方され得る。本発明の医薬組成物または本発明の製剤組合せは、局所的または全身的治療のために吸入器により気道に投与され得る。
【0016】
本発明の医薬組成物または本発明の製剤組合せの用量は、本開示から当業者により確定され得る。上記医薬組成物または本発明の製剤組合せは、有効用量(投与経路および活性作用物質の薬物動態による)の本発明の医薬組成物または製剤組合せならびに、処方物の特定の投与経路(即ち、経口、非経口、局所または吸入による)に適した適切な製剤担体および賦形剤を含有する。活性作用物質は、混合、溶解、造粒、糖衣作製、乳化、カプセル封入、エントラッピングまたは凍結乾燥法によって、製剤処方物に混合される。非経口投与のための製剤処方物としては、活性作用物質の水性溶液または水溶性形態の組合せが挙げられる。さらに、活性作用物質の懸濁液は、油性注射懸濁液として調製されてもよい。適切な親油性溶媒またはビヒクルとしては、脂肪油、例えばゴマ油、または合成脂肪酸エステル、例えばエチルオレエートまたはトリグリセリド、あるいはリポソームが挙げられる。水性注射懸濁液は、ナトリウムカルボキシメチルセルロース、ソルビトールまたはデキストランのような懸濁液の粘度を増大させる物質を含有してもよい。懸濁液は、安定剤または、活性作用物質の溶解度を増大させる作用物質あるいはそれらの組合せを任意に含有して、より濃縮された溶液にさせてもよい。
【0017】
経口投与のための製剤処方物は、活性作用物質と、固体賦形剤、例えば糖(例えばラクトース、スクロース、マンニトールまたはソルビトール)、セルロース調製物(例えばデンプン、メチルセルロース、ヒドロキシプロピルメチルセルロースおよびナトリウムカルボキシメチルセルロース)、ゼラチン、ガムまたはポリビニルピロリドンとを組合せることにより得られ得る。さらに、崩壊剤が付加されてもよく、安定剤が付加されてもよい。
【0018】
アンチセンスオリゴマー
本発明は、HMG1遺伝子またはmRNA配列の発現を抑制または遮断するのに有効な配列を有するアンチセンスオリゴマーを提供する。標的遺伝子産物の発現を抑制するための特異的オリゴヌクレオチドを用いるアンチセンス技術は、ヒト疾患のための治療様式として開発中である。アンチセンスオリゴヌクレオチドアンタゴニストの最適化に寄与するいくつかの選別判断基準が利用可能である。例えば、50%またはそれ以上のGC含量を有する配列を選択するのが得策である。好ましい配列は、標的タンパク質のAUG開始コドンに及ぶが、しかしコード領域における部位および5’UTRも等しく十分に成し遂げ得る。このような配列は、一般に約18〜30ヌクレオチド長であり、タンパク質発現を抑制するためにHMG1 cDNA配列からのATG開始コドンと重複するよう選択される。より長いオリゴマーがしばしば、より大きい程度に標的を抑制するとわかっているが、これは、アンチセンス試薬として選択される一次オリゴヌクレオチドのための好ましい長さが約25マーであることを示す。これらの判断基準に関して、典型的には、3つのオリゴヌクレオチド配列が選択され、オリゴヌクレオチド配列、例えば「逆」オリゴヌクレオチドまたは、アンチセンス配列のほぼすべての第四塩基が無作為化されるオリゴヌクレオチドを制御するアンタゴニストの活性に関して比較される。したがって、HMG1に対するアンチセンスオリゴマー配列を作製するための好ましい配列は、HMG1 cDNA配列からのATG開始コドン(下線)を重複するよう選択された25マー配列:
GAGGAAAAATAACTAAACATGGGCAAAGGAGATCCTAAGAAG[配列番号5]
であり、このような好ましいアンチセンス配列は、HMG1のアンタゴニストとしてin vitro比較のためのアンチセンスオリゴヌクレオチド剤(および適切なコントロール)を構築するために用いられる。これらのin vitroデータは、匹敵する設計のアンチセンス剤を用いたヒト臨床実用性を予測する。
【0019】
HMG1特異的抗体
本明細書中に開示された抗体は、ポリクローナルまたはモノクローナルであってもよく、多数のヒト、非ヒト真核生物、細胞、真菌または細菌供給源のいずれかからのものであってもよい。抗体は、ゲノムまたはベクター保有コード配列によりコードされてもよく、アジュバントを用いても用いない場合も、生来のまたは組換え体のHMG1またはその断片に対して引き出されてもよい。抗体の作製方法は、抗体を生成および産生するための当業界で周知の方法および手法である。一般に、HMG1に対する中和抗体(即ち、特にその前炎症性サイトカイン様役割に関してHMG1の生物学的活性を抑制するもの)が、治療的適用のために好ましいが、一方、非中和抗体も診断用途に適切でありうる。このような有用な抗体の例としては、ポリクローナル、モノクローナル、キメラ、一本鎖および種々のヒトまたはヒト化型の抗体、ならびに種々のそれらの断片、例えばFab断片および特殊化発現系から産生される断片が挙げられるが、これらに限定されない。
【0020】
診断アッセイ
ここで提供される診断アッセイは、ポリクローナル若しくはモノクローナルまたはその両方であり得る抗HMG1抗体を使用する。診断手法は、生物学的流体中のHMG1遺伝子の遺伝子産物の濃度を測定するための標準抗体ベースの技術を利用することができる。好ましい標準診断手法は、ELISAアッセイおよびウエスタン技法である。
【0021】
実施例1:内毒素血症の「後期」メディエータとしてのHMG1の同定
本実施例は、敗血症において、ならびに炎症性サイトカイン活性により特性化される関連症状において一役を演じる後期放出マクロファージ由来因子を同定し、単離するための実験の結果を提供する。本実施例で報告される実験は、TNFによる培養物の刺激後のマウスマクロファージRAW264.7細胞−調整培地を試験した。マウスマクロファージRAW264.7細胞は、アメリカン・タイプ・カルチャー・コレクション(ATCC、Rockville, MD, USA)から入手し、10%ウシ胎仔血清および1%グルタミンを補充したDMEM下での培養中で増殖させた。集密性が70〜80%に達したら、培地を無血清OPT1−MEM I培地に取り換えて、培養物を前炎症性サイトカイン(例えばTNFαまたはIL−1)あるいは細菌内毒素(LPS)で刺激した。
【0022】
前記の刺激化マクロファージ培養物から放出されたタンパク質を測量した。特に、異なる時点で、遠心分離(3000rpm、10分間)により細胞および細胞調整培地を別々に回収した。10kDaのMrカットオフを用いたアミコン(Amicon)膜(Amicon Inc., Beverly, MA, USA)上での限外濾過により、調整培地中のタンパク質を濃縮し、その後、SDS−PAGEにより分別して、クーマシーブルー(30%メタノール/10%酢酸中の1.25%クーマシーブルーR250)で染色した。30%メタノール/7%酢酸で脱色して、対象タンパク質(単数または複数)(即ち、刺激化培養物の調整培地中に優先的に蓄積したもの)をSDS−PAGEゲルから切り取って単離し、N末端シーケンシング分析(Commonwealth Biotechnologies, Inc., Richmond, VA, USA)を施した。
【0023】
コントロール(TNFα刺激なし)対TNF刺激化RAW264.7細胞における蓄積タンパク質のプロフィールのSDS−PAGEゲル分析の比較で、細胞−調整培地中のその濃度が16時間の刺激後に有意に増大された強誘導性30kDaタンパク質が明示された。この単離タンパク質のアミノ酸配列分析は、そのN末端配列をGly−Lys−Gly−Asp−Pro−Lys−Lys−Pro−Arg−Gly−Lys−Met−Ser−Ser[配列番号1]として明示した。関連遺伝子データベースの検討は、HMG1のN末端アミノ酸配列との100%の同一性が見出された。
【0024】
これらのデータは、HMG1をLPS刺激化マクロファージ培養物の「後期出現」生成物として、したがって、前炎症性メディエータの候補として同定した。ヒト臨床症状を予測する細胞および動物モデルシステムにおける組換え的生成HMG1および/または抗HMG1抗体の投与により、この活性を確証した。
【0025】
実施例2:HMG1の細胞性供給源
本実施例は、細胞供給源がTNF、IL−1および/またはLPSに応答におけるHMG1放出能を示す。試験した細胞は、GH3下垂体細胞、マウスマクロファージRAW264.7細胞、ヒト一次末梢血単核細胞(huPBMC)、ヒト一次T細胞、ラット副腎PC−12細胞およびラット一次腎臓細胞を含む(表1)。ラット下垂体GH3細胞株をアメリカン・タイプ・カルチャー・コレクション(ATCC、Rockville, MD, USA)から入手して、10%ウシ胎仔血清および1%グルタミンを補充したDEME中で培養した。ヒトPBMCおよびT細胞を健常ドナーの全血から新たに単離して、前記と同様に10%ヒト血清を補充したRPMI1640中で培養した(Zhang et al., J. Exp. Med. 185:1759-1768, 1997)。集密性が70〜80%に達したら、培地を無血清OPT1−MEM I培地に取り換えて、培養を前炎症性サイトカイン(例えばTNFαまたはIL−1)あるいは細菌内毒素(LPS)で刺激した。
【0026】
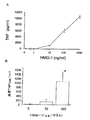
ヒトT細胞、ラット副腎(PC−12)細胞およびラット一次腎細胞は、HMG1特異的抗体を用いた全細胞溶解物のウエスタンブロット分析により実証した場合、細胞関連HMG1を含有したが、HMG1は、TNF、IL−1βまたはLPSで刺激後、これらの培養物の培地中に有意に蓄積しなかった(表1)。
【0027】
【表1】
【0028】
TNF、IL−1β(各々の最小有効濃度=5ng/ml)および細菌内毒素(LPS、最小有効濃度=10ng/ml)は、時間−および用量−依存性様式でヒトPBMCからのHMG1の放出を誘導した(表1)。IFN−γ単独(0〜200U/ml)は前記の細胞のいずれからもHMG1放出を誘導しなかったが、しかし、TNFまたはIL−1βとの組合せで付加した場合には、IFN−γはマクロファージから用量依存的にHMG1放出を増強し、100U/mlの濃度のIFN−γにより最大3倍増強した。トリパンブルー排除により判定した場合、細胞生存能(viability)はTNF、IL−1βまたはLPSによる影響を受けなかったため(コントロールに関しては90〜92±5%の生存、これに対して100ng/mlのTNF、IL−1βまたはLPSの存在下では88〜95±4%)、HMG1の放出は細胞死のためではなかった。ウエスタンブロット分析により確定した場合、下垂体細胞およびマクロファージにより放出されたHMG1の量は、HMG1の細胞内濃度と逆相関したが、これは、放出物質が、一部は、前成形の細胞関連HMG1タンパク質に由来することを示す。
【0029】
種々の正常ヒト組織から調製されたmRNAに対するHMG1特異的プローブのハイブリダイゼーション(ブロット基質は商業的供給元から入手可能)により、in vivoでの循環HMG1の考え得る供給源を査定した。その結果を図5に要約した。いくつかの冨マクロファージ組織(肺、肝臓、腎臓、膵臓および脾臓)は、最も豊富なHMG1 mRNA発現を示した。低い発現は、下垂体、骨髄、胸腺、リンパ節および副腎で観察された。HMG1発現の相対的組織分布に関する情報を提供する他に、本試験は、組織試料中のHMG1特異的核酸配列に関するアッセイの実際的可能性および実益を示す。
【0030】
実施例3:in vitroおよびin vivoでの組換え体HMG1投与
本実施例は、周知の組換えDNA技法によりHMG1を生成するための手法を詳述する。PCRによりHMG1開放読取り枠を増幅し、発現ベクター(pCAL−n)中でサブクローニングした。要するに、 以下の配列:5’−CCC GCG GAT CCA TCG AGG GAA GGA TGG GCA AAG GAG ATC CTA−3’[配列番号2]および5’−CCC GCA AGC TTA TTC ATC ATC ATC ATC TTC T−3’[配列番号3]を含有するプライマーを用いて、5ngラット脳クイッククローンcDNA(カタログ番号#7150−1、Clontech, Palo Alto, CA, USA)から、HMG1 cDNAの648bp開放読取り枠をPCR増幅した(94℃1’、56℃2’、72℃45”、30サイクル)。680bpPCR生成物(4μg)をBamHIおよびHindIIIで消化して、pCAL−nベクター(Stratagene, La Jolla, CA, USA)のBamHI/HindIIIクローニング部位にクローニングした。組換え体プラスミドを大腸菌BL21(DE3)pLysS(Novagen, Madison, WI, USA)にトランスフォームさせ、陽性クローンをスクリーニングして、ABI373A自動蛍光シーケンサー(Applied Biosystems, Foster City, CA, USA)上でのTag DyeDeoxyターミネーターサイクルシーケンシングキットを用いて、両鎖におけるDNAシーケンシングにより確証した。
【0031】
組換え体HMG1を発現するために、IPTG(1mM)を付加した場合、OD600が0.6に達するまで激しく振盪しながら(250rpm)37℃で陽性クローンを培養した。IPTG誘導の12時間後、遠心分離(6500rpm、15分間)により細菌細胞を収穫し、凍結−解凍サイクルで溶解した。水溶性分画を遠心分離(30分間、12,000rpm)後に収集し、製造元(Stratagene)の指示通りに、カルモジュリン結合樹脂カラム上で組換え体HMG1を精製した。Detoxi-Gel内毒素除去ゲル(Pierce, Rockford, IL, USA、カタログ番号#20344)を用いて細菌内毒素を組換え体HMG1から除去し、リムラス・アメボサイト細胞溶解物試験(LAL試験、カタログ番号#50−648U、QCL−1000色原性LAL、Bio-Whittaker, Inc., Walkersville, MD, USA)により、残留LPS含量を確定した。精製組換え体HMG1をヒト末梢血単核球(HuPBMC)の培養物に付加し、刺激後4時間目にELISAによりTNFに関して上清をアッセイした。LPS−中和剤ポリミキシンB(10μg/ml)を組換え体HMG1と同時に付加して、TNF放出に及ぼす如何なる夾雑LPSの作用も排除した。さらに、外因性LPSの付加的内毒素血症チャレンジを用いてまたは用いずに、組換え的に得られたHMG1を被験動物に投与して、in vivoでの高レベルのHMG1の病原可能性を調べた(図2Bおよび2C参照)。いくつかの実験では、本明細書中に詳述したように、TNFに関してアッセイされるHMG1処置動物から血清試料を確保した(図1B参照)。
【0032】
前記の手法は、HMG1ペプチド配列に見合ったアミノ酸末端延長としての3.0kDaカルモジュリン結合ドメインおよびトロンビン切断部位を包含する融合ペプチドとして組換え体HMG1を提供する。いくつかの実験では、融合タグを少量の組換え体タンパク質から除去し、完全融合タンパク質の生物活性を切断HMG1ペプチドと比較した。生物学的活性の有意差は認められず、付加的実験(特に組換え的産生HMG1の動物への投与を要するもの)を、典型的には(非切断)融合タンパク質を用いて実施した。
【0033】
図3Aおよび3Bで実証したように、組換え的に得られたHMG1のin vitroまたはin vivo投与は活発なTNF応答を誘導したが、これは、前炎症性活性を有する後期出現LPS誘導性マクロファージ由来内因性メディエータとしてのHMG1の同一性を確証する。
【0034】
実施例4:抗HMG1抗体および免疫検出
本実施例は、HMG1に対するポリクローナル抗体を作出し、使用する実験の結果を提供する。要するに、HMG1のN末端アミノ酸配列に対応するオリゴペプチドに対する、または精製組換えHMG1に対するポリクローナル抗体を当業界で周知の標準手法により、ウサギにおいて作出した。要するに、配列GKGDPKKPRGKMSSC[配列番号4]を有するオリゴペプチドの8つのコピーを、放射状分枝リシン樹状突起(小免疫原的不活性コア)に固定した。これらの大型高分子物質を、0日目の予備採血後1、2および4週間目に、皮下および皮内(0.5〜10mg/注射)の両方でウサギに3回注射した。最終免疫感作後2週間目に、ウサギを採血し、1.0mgの抗原を用いて筋内追加免疫し、その後2週間後に二次採血した。あるいは、組換え体HMG1に対するポリクローナル抗体を生成させるために、同様のプロトコールにしたがって、組換え体HMG1融合ペプチド(100μg/注射)でウサギを免疫感作した。HMG1に対して反応性である(即ち、HMG1の生物学的活性を結合し、いくつかの場合には、中和し、または相殺する)モノクローナル抗体は、本明細書中に記載したHMG1抗原、または免疫原のようなその他のHMG1ペプチド断片を用いて、当業界で周知の方法により調製するのが便利である。このようなモノクローナル抗体、および/またはそれらを生成するハイブリドーマは、HMG1に対して反応性である種々の「ヒト化」抗体(すべて、当業界で既知の方法による)を生成するのに有用であり、このヒト化抗体は本明細書中で教示されるように有用である。
【0035】
HMG1特異的抗体を用いて、ウエスタンブロッティング分析により、TNFまたはLPSでの処置後のRAW264.7細胞からのHMG1の誘導性放出を測定した(図1)。要するに、4〜20%勾配ゲル上でのSDS−PAGEによりタンパク質を分別し、PVDF膜に移して、N末端合成HMG1抗原に対して、または組換え体HMG1に対して生じたウサギ抗血清でブロットした。製造元(Amersham Life Science Inc., Arlington Heights, IL, USA)の指示通りにECLキットを用いてシグナルを検出し、精製組換え体HMG1の標準曲線を基準に、NIH1.59画像ソフトウエアを用いて分析のためにデジタル化したウエスタンブロット上の帯域の光学強度を測定することにより、HMG1のレベルを確定した。
【0036】
TNFまたはLPS処置の非存在下では、RAW264.7細胞−調整培地中にHMG1タンパク質は検出されなかったが、しかし、HMG1は、このような刺激後、高レベルで調整培地中に蓄積し、刺激後8〜28時間目にプラトーに達した(図1A)。要するに、実施例1、3および図1Aに示したデータは、マクロファージからのHMG1の放出は刺激特異的、ならびに時間−および用量−依存性で、最大蓄積は、5ng/mlという低い濃度でのTNFによる刺激後8時間以内に観察された、ということを示す。敗血症、敗血症ショックおよび関連症状は、この予測モデルに用いられる単一大量致死的LPSボーラスとは定性的または定量的に異なる刺激に応答するヒトにおいて起こり得る、ということは十分理解される。それにもかかわらず、実験的内毒素血症は、炎症性サイトカインカスケードの重要な構成成分を同定するための、そして予測される臨床的実用性を有する特定のアンタゴニストを同定するための有益且つ予測的モデル系であった。この点で、HMG1アンタゴニストはおそらく、内毒素に対する応答におけるTNFに対するHMG1の後期出現にかんがみて、TNFアンタゴニストより治療的に魅力的である。
【0037】
実施例5:in vivo動物モデルにおけるHMG1の検出
本実施例は、亜致死用量のLPS(LD50)の投与後の血清HMG1を測定する、齧歯類におけるin vivo実験を説明する。マウスまたはラットをLPSで処置し、異なる時点で血清を収集して、ウエスタンブロッティング分析によりHMG1のレベルに関してアッセイした。精製HMG1の標準曲線を基準に光学帯域強度を測定することにより、HMG1の血清濃度を概算した。LPS後16時間までに血清レベルは有意に増大し、少なくとも32時間、高い値を保持した(図1B)が、ビヒクル処置コントロール動物においては検出されなかった。これらのデータは、HMG1が、炎症性サイトカインカスケードにおける後期出現メディエータであるために、敗血症およびサイトカイン毒性の関連疾患の診断のための、ならびにそれらの病気に対する製剤的介入のための特に魅力的な標的を代表する、ということを示す。
【0038】
実施例6:HMG1に対する防御の利点
本実施例は、敗血症およびサイトカイン媒介性毒性の関連症状の治療に関連したHMG1のアンタゴニストの治療活性を測定するための予測in vivoアッセイの結果を提供する。本実施例では、HMG1アンタゴニストは抗HMG1抗体調製物であった。前免疫血清で処置したコントロールは、48時間以内に嗜眠、立毛、下痢および死亡を生じた。内毒素血症のこれらの臨床的徴候は、抗HMG1抗体の投与により有意に防止された。雄Balb/Cマウス(6〜7週、20〜23グラム)を無作為に群別し(10匹/群)、致死用量のLPS(1xPBS中で50mg/kg)の投与(腹腔内)前30分に、コントロール(前免疫)または抗HMG1血清(実施例4で作製したのと同様)で前処置した。他の実験群には、LPS投与後+12または+12および+36時間に、付加的用量の抗HMG1血清を投与した。少なくとも2週間、外観および生存に関して、動物を観察した。
【0039】
組換え体HMG1に対するポリクローナル抗体をウサギで作出し、ELISAおよびウエスタンブロッティング手法により特異性および力価に関して抗血清をアッセイした。ポリクローナル抗血清は、例えばウエスタンブロット分析における組換え体HMG1を免疫特異的に認識し(結合し)、そして粗製細菌溶解物中のおよびマウス血清中に稀釈されていた精製タンパク質としての双方で、他のタンパク質からrHMG1を区別した。ウエスタンブロッティング分析において化学発光増幅検出法を用いて、1:1000までの稀釈でのポリクローナル抗HMG1抗血清は、50pgという少ないrHMG1タンパク質を検出するのに有用であった。LPSチャレンジ(0時間)に比して、−0.5(1回投与の場合)、−0.5および12(2回投与の場合)または−0.5、12および36(3回投与の場合)時間での指示(図2A)量の抗HMG1抗血清の投与は、LPS誘導性致死性に対して防御的であり、反復投与スケジュールは良好な防御を提供した。
【0040】
図2Bは、rHMG1が内毒素マウスにおける用量依存性致死性を引き起こしたことを説明する。雄Balb/Cマウス(20〜23グラム)を10群に無作為にわけて、LPS(3.15mg/kg;非致死量)を単独でまたは精製組換え体HMG1タンパク質と組合せて投与した。指示用量でのLPS試験後2、16、28および40時間目のHMG1の投与により、根元的内毒素血症の致死性が有意に増大した。
【0041】
図2Cは、用量の一関数としてのHMG1の個々の致死性毒性を説明する。精製rHMG1を、指示用量での1回腹腔内ボーラス投与として、雄Balb/Cマウス(5匹/処置群)に投与した。少なくとも48時間マウスを観察した結果、500μg/マウスの用量でrHMG1で処置したマウスの60%がrHMG1試験の24時間以内に死亡したが、これは、500μg/マウス未満の1回投与LD50を示す。
【0042】
ウエスタンブロットでHMG1に対する免疫特異的反応性を示さなかった前免疫血清の投与は、被験者にLPS媒介性死亡を被らせなかったため、抗HMG1抗体により付与される防御は特異的であった(図2A)。さらに、HMG1特異的抗体は他のマクロファージ由来サイトカイン(例えば、IL−1およびTNF)と交差反応せず、抗体が結合により防御を付与し、それによりこれらのメディエータを中和するという可能性を排除した。前炎症性サイトカインカスケードの活性化を伴う敗血症、敗血症関連病原および敗血症関連疾患に対する防御は、サイトカインカスケードの1つよりも多い構成成分を標的とする組合せ療法により改良し得る。HMG1のアンタゴニストは、この点では、TNF、IL−1,MIFおよびその他の炎症性メディエータの特異的アンタゴニストと、または炎症性カスケードの多構成成分(例えば、アスピリン、NSAIDS、抗炎症性ステロイド等)を抑制する炎症性応答のより広範な活性アンタゴニストと併合されて、より有効な治療様式性を提供する。LPS毒性に対する防御は、抗体用量関連性であり、より多量の抗体のよる頻繁な投与は、死亡率を70%まで下げた(図2A)。すべての実験において少なくとも2週間、マウスを観察した結果、後期死亡は起きなかったが、これは、抗HMG1抗体治療がLPS致死性に対する残りの防御を付与し、死亡の時間をほとんど遅らせないことを示す。
【0043】
実施例7:ヒト疾患におけるHMG1
本実施例は、HMG1およびヒト敗血症間の関連を確立し、それにより、ヒト敗血症およびサイトカイン毒性の関連症状において一般的にHMG1アンタゴニストを、特に抗HMG1抗体を用いるための指標を支持する、というデータを提供する。rHMG1の標準曲線を基準として、ウエスタンブロットフォーマットで実施例4の場合と同様に生成したポリクローナル抗体を用いて、正常健常個体および重症患者における血清HMG1レベルを測定した。HMG1は、正常コントロールにおいては観察できなかったが、重症敗血症患者においては高レベルに蓄積した(表2)。
【0044】
【表2】
【0045】
これらのデータは、敗血症患者において血清HMG1レベルの上昇が観察され、血清HMG1の最高レベルは致死症例で観察されることを示す(表2)。これらのデータはさらに、敗血症におけるHMG1アンタゴニストの治療的重要性を示し、HMG1の血清濃度を測定することにより敗血症についてのおよび敗血症の重症度(即ち、潜在致死性)についてのアッセイの診断的実用性の証拠も提供する。この診断アッセイは、炎症性サイトカインカスケードの活性化を伴う類似の症状の重症度を診断するためにも有用である。
【0046】
致死性対非致死性敗血症に関連した血清HMG1レベルに関して、さらに被験者をスクリーニングして、図6に記載したような結果(表2と累積的)を得た。図6に要約したデータは、健常被験者8名、ならびにグラム陽性菌[バチルス属のBacillus fragilis(1名)、エンテロコッカス属のEnterococcus facecalis(1名)、連鎖球菌属の肺炎連鎖球菌(4名)、リステリア属のListeria monocytogenes(1名)またはブドウ球菌属の黄色ブドウ球菌(2名)]、グラム陰性菌[大腸菌(7名)、クレブシエラ属の肺炎桿菌(1名)、アシネトバクター属のAcinetobacter calcoaceticus(1名)、シュードモナス属の緑膿菌(1名)、フゾバクテリウム属のFusobacterium nucleatum(1名)、シトロバクター属のCitrobacter freundii(1名)]または非同定病原体(5名)に感染した敗血症患者25名から得た血清試料を代表するものである。SDS−PAGEゲル電気泳動により血清を分別し、正常ヒト血清中に稀釈した精製rHMG1の標準曲線を基準に、ウエスタンブロッティング分析によりHMG1レベルを確定した。ウエスタンブロッティングによる検出限界は、50pgである。HMG1は正常コントロールにおいては検出されないが、敗血症患者においては有意に増大した、ということに留意されたい。非生存敗血症患者の血清中のHMG1の平均レベル(N=13患者、平均HMG1レベル=83.7±22.3ng/ml)は、生存者(N=12、平均HMG1レベル=25.2±15.1ng/ml、P<0.05)より有意に高い。これらのデータは、敗血症およびサイトカイン活性化の関連疾患の存在の、そしてこのような疾患および症状の重症度およびありそうな臨床的経過の診断および予後指標として、HMG1配列(タンパク質または核酸)に対する組織(制限血液または血清なしを含む)試料のスクリーニングの実用性の直接的な証拠を提供する。
【0047】
実施例8:HMG1は前炎症性メディエータおよび重量損失を誘導する
本発明の結果は、HMG1が炎症性サイトカインカスケードの後期放出メディエータ因子であるという証拠を提供する。一次ヒト末梢血単核球への組換え体HMG1の付加は、刺激後4時間以内のTNFの用量依存性誘導をもたらした(図3A)。HuPBMCによるTNF放出の組換え体HMG1による刺激は、i)精製組換え体HMG1はLAL内毒素アッセイにより判定した場合、LPSが夾雑せず、ii)LPS中和剤ポリミキシンBの付加はHMG1誘導性TNF放出に影響を及ぼさず、そしてiii)トリプシンによる組換え体HMG1調製物のタンパク質分解的切断はPBMC培養物に対するTNF放出活性を完全に無くしたために、LPS夾雑によるものではなかった。HMG1刺激はまた、マクロファージを誘導し一酸化窒素(NO)を放出させた。
【0048】
HMG1がin vivoで血清TNF放出を誘導したことを確証するために、精製組換え体HMG1をBalb/Cマウスに腹腔内投与して、血液試料を収集して、L929アッセイによりTNFについてアッセイした。図3Bに示したように、TNFはコントロール動物の血清中では検出可能でなかったが、組換え体HMG1タンパク質の投与後2時間目に有意に増大された。
【0049】
HMG1遺伝子の組換え遺伝子産物の反復投与(100μg/マウス/日)は、マウスにおける有意の体重損失を引き起こした(図4)。メカニズムに関する限定を伴わず、理論に縛られずに、これらのデータは、HMG1が、in vitroおよびin vivoの両方の条件下で前炎症性カスケードのフィードフォワード刺激物として作用するという仮説と一致する。重量損失の予測モデルにおけるこれらのin vivoデータも、HMG1を含有する製剤処方物またはその治療的活性断片が有効な重量損失療法であるという予測的証拠を提供する。
【0050】
実施例9:HMG1のin vivo供給源
前述のようにウエスタンブロット強度の定量により、下垂体切除とコントロールとのラットにおける血清HMG1レベルも測定した。コントロール(約25ng/ml)と比較した場合、下垂体切除ラット(約75ng/ml)において、内毒素チャレンジ(1.0mg/kgでのLPS)後12時間以内に有意に高いHMG1レベルが認められた。これらの結果は、下垂体細胞は血清HMG1レベルの主要供給源ではなく、マクロファージが定量的により重要な役割を演じ得る、ということを示す。
【図面の簡単な説明】
【図1】 in vitro(図1A)およびin vivo(図1B)でのLPSによるHMG1放出の誘導をプロファイルする2つのグラフを示す。特に図1Aは、LPS(100ng/ml)で刺激後のマクロファージRAW264.7細胞の培養上清中のHMG1の蓄積を示す。挿入図は、TNFによる誘導後のRAW264.7細胞からのHMG1放出の誘導を示すウエスタンブロット(組換え体HMG1に対して生じた抗体を使用)である。図1Bは、LPS処理マウスの血清中のHMG1の誘導を示す。LPS投与後の種々の時点でBalb/Cマウスからの血清を収集し、組換え体HMG1に対して生じた抗体を用いたウエスタンブロットによりHMG1についてアッセイした。
【図2】 HMG1が内毒素血症における病因および致死性のメディエータであることを説明する。図2Aは、マウスに処置したLPS致死性に対する抗HMG1抗体の防御作用を示す。LPSチャレンジ(0時間)に比して−0.5(1回投与の場合)、−0.5および12(2回投与の場合)または−0.5、12および36(3回投与の場合)時間での指示量の抗HMG1抗血清の投与は、LPS誘導性致死性に対して防御的であり、反復投与スケジュールは良好な防御を提供した。図2Bは、rHMG1が内毒素マウスにおける用量依存性致死性を引き起こしたことを説明する。雄Balb/Cマウス(20〜23グラム)を、10群に無作為に分けて、LPS(3.15mg/kg;非致死量)を単独でまたは精製組換え体HMG1タンパク質と組合せて投与した。指示用量でのLPSチャレンジ後、2、16、28および40時間目のHMG1の投与は、根元的内毒素血症の致死性を有意に増大した。図2Cは、用量の一関数としてのHMG1の個々の致死性毒性を説明する。精製rHMG1を、指示用量での1回腹腔内ボーラス投与として、雄Balb/Cマウス(5匹/処置群)に投与した。少なくとも48時間マウスを観察した結果、500μg/マウスの用量でrHMG1で処置したマウスの60%がrHMG1試験の24時間以内に死亡したが、これは、500μg/マウス未満の1回投与LD50を示す。
【図3】 HMG1がin vitro(図3A)およびin vivo(図3B)の両方でTNF放出を誘導したことを示す。特に図3Aは、HMG1が用量依存様式でhuPPBMCsからのTNF放出を誘導することを示す。新たに単離したhuPBMC培養物を指示用量の精製組換え体HMG1タンパク質で刺激し、培地を4時間後にサンプリングして、既知の免疫学的方法(ELISA)によりTNFに関してアッセイした。図3Aは、2つの実験(3連)における誘導性TNF応答の平均±S.E.M.を示す。図3Bは、HMG1の投与が処置マウスの血清中のTNFの蓄積を誘導したことを示す。Balb/Cマウス(20〜23グラム)を指示用量の精製組換え体HMG1で腹腔内処置して、L929生物アッセイによるTNFアッセイのために、血液試料を2時間後に採取した(TNFレベルは平均±S.E.Mとして表される。N=3)。
【図4】 HMG1がマウスにおける体重損失を引き起こしたことを示す。100μg/マウス/日で3日間、精製HMG1をマウスに腹腔内投与して、体重をモニタリングした。図4は、3匹/群のマウスの正味体重変化の平均±S.E.M.を示す。
【図5】 HMG1 mRNAの組織分布を示す。種々の組織のポリ(A)+RNAを含有するヒトRNAマスターブロット(Clontech, Palo Alto, CA, USA)を、すべて、当業界で周知の方法にしたがって、HMG1 cDNAインサートを含有する組換え体プラスミドを用いたPCRにより合成された0.6kbジゴキシゲニン−1 1−dUTP標識化HMG1 cDNAプローブとハイブリダイズさせた。要するに、10ng/mlのプローブ濃度で65℃16時間、ハイブリダイゼーション緩衝液(5×SSC/2%ブロッキング試薬/0.1%SDS/50%ホルムアミド、Boehringer Mannheim, Indianapolis, IN)中でハイブリダイゼーションを実施した。ハイブリダイゼーション後、フィルターを室温で、0.5×SSC/0.1%SDSで5分間、2回洗浄して、0.2×SSC/0.1%SDSで10分間、2回洗浄した。標準的方法により、ホスファターゼに結合された抗ジゴキシゲニン抗体と、検出試薬、約4−ニトロブルーテトラゾリウムクロリド(NBT)および5−クロモ−4−クロロ−3−インドリル−ホスフェート(BCIP)(Boehringer-Mannheim)を用いて、シグナルを検出した。シルバー画像スキャナー(シルバースキャナーII、Lacie Limited, Beaverton, OR)でブロットを走査して、相対光学濃度(恣意単位AUで)をNIH1.59イメージソフトウエアを用いて定量した。最高レベルは冨マクロファージ組織で観察されたことに留意されたい。
【図6】 図6は、正常コントロール被験者の群と比較した場合、敗血症を有する入院ヒト被験者において検出された血清HMG1レベルの増大が検出し、この場合、敗血症患者は、患者が死亡したかまたは生存したかに関してさらに分類されたことを示す。
【配列表】
Claims (8)
- 炎症性サイトカインカスケードの活性化を特徴とする症状(疾患)を治療するための医薬を製造するための、炎症性サイトカインカスケードのHMG1媒介性活性化を防止するHMG1のアンタゴニストの使用であって、該アンタゴニストは、HMG1タンパクと特異的に結合する抗体もしくはその断片であり、該疾患は敗血症である、該使用。
- 前記抗体がモノクローナル抗体もしくはポリクローナル抗体である、請求項1に記載の使用。
- 前記抗体が、キメラ抗体、一本鎖抗体、ヒト抗体及びヒト化型抗体から成る群から選択される、請求項1または2に記載の使用。
- 前記抗体が、アミノ酸配列GKGDPKKPRGKMSSC(配列番号4)からなるペプチドに結合し得る、請求項1もしくは2に記載の使用。
- 前記抗体が、抗体の断片である、請求項1−4のいずれか一項に記載の使用。
- 前記抗体の断片がFab断片である、請求項5に記載の使用。
- (a)炎症性サイトカインカスケードのHMG1媒介性活性化を防止するHMG1のアンタゴニストであって、該アンタゴニストは、HMG1タンパクと特異的に結合する抗体もしくはその断片、および
(b)TNF、IL−1α、IL−1β、MIF又はIL−6の抗体
を含む、敗血病を治療するための医薬組成物。 - 前記抗体がモノクローナル抗体またはポリクローナル抗体である、請求項7に記載の医薬組成物。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US09/248,574 | 1999-02-11 | ||
| US09/248,574 US6303321B1 (en) | 1999-02-11 | 1999-02-11 | Methods for diagnosing sepsis |
| PCT/US2000/003583 WO2000047104A2 (en) | 1999-02-11 | 2000-02-11 | Antagonists of hmg1 for treating inflammatory conditions |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2011058031A Division JP5745299B2 (ja) | 1999-02-11 | 2011-03-16 | 炎症症状を治療するためのhmg1のアンタゴニスト |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2003520763A JP2003520763A (ja) | 2003-07-08 |
| JP2003520763A5 JP2003520763A5 (ja) | 2010-09-16 |
| JP4812166B2 true JP4812166B2 (ja) | 2011-11-09 |
Family
ID=22939703
Family Applications (3)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2000598059A Expired - Lifetime JP4812166B2 (ja) | 1999-02-11 | 2000-02-11 | 炎症症状を治療するためのhmg1のアンタゴニスト |
| JP2011058031A Expired - Lifetime JP5745299B2 (ja) | 1999-02-11 | 2011-03-16 | 炎症症状を治療するためのhmg1のアンタゴニスト |
| JP2013241528A Pending JP2014031386A (ja) | 1999-02-11 | 2013-11-22 | 炎症症状を治療するためのhmg1のアンタゴニスト |
Family Applications After (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2011058031A Expired - Lifetime JP5745299B2 (ja) | 1999-02-11 | 2011-03-16 | 炎症症状を治療するためのhmg1のアンタゴニスト |
| JP2013241528A Pending JP2014031386A (ja) | 1999-02-11 | 2013-11-22 | 炎症症状を治療するためのhmg1のアンタゴニスト |
Country Status (11)
| Country | Link |
|---|---|
| US (12) | US6303321B1 (ja) |
| EP (4) | EP1165110B2 (ja) |
| JP (3) | JP4812166B2 (ja) |
| AT (1) | ATE327764T1 (ja) |
| AU (1) | AU782984B2 (ja) |
| CA (1) | CA2359926C (ja) |
| DE (1) | DE60028358T3 (ja) |
| DK (1) | DK1165110T3 (ja) |
| ES (1) | ES2269118T5 (ja) |
| PT (1) | PT1165110E (ja) |
| WO (1) | WO2000047104A2 (ja) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2011168593A (ja) * | 1999-02-11 | 2011-09-01 | Feinstein Inst For Medical Research | 炎症症状を治療するためのhmg1のアンタゴニスト |
Families Citing this family (126)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6387639B1 (en) * | 1998-11-10 | 2002-05-14 | Sloan-Kettering Institute For Cancer Research | Ma family polypeptides and anti-Ma antibodies |
| US7151082B2 (en) * | 1999-02-11 | 2006-12-19 | The Feinstein Institute For Medical Research | Antagonists of HMG1 for treating inflammatory conditions |
| US20060154319A1 (en) * | 1999-04-29 | 2006-07-13 | Flodgaard Hans J | Inhibition of bradykinin release |
| US6610713B2 (en) * | 2000-05-23 | 2003-08-26 | North Shore - Long Island Jewish Research Institute | Inhibition of inflammatory cytokine production by cholinergic agonists and vagus nerve stimulation |
| US8914114B2 (en) | 2000-05-23 | 2014-12-16 | The Feinstein Institute For Medical Research | Inhibition of inflammatory cytokine production by cholinergic agonists and vagus nerve stimulation |
| ITMI20010562A1 (it) * | 2001-03-16 | 2002-09-16 | Marco E Bianchi | Inibitori o antagonisti della proteina hmg1 per il trattamento di disordini vascolari |
| US7220723B2 (en) * | 2001-05-15 | 2007-05-22 | The Feinstein Institute For Medical Research | Inhibitors of the interaction between HMGB polypeptides and toll-like receptor 2 as anti-inflammatory agents |
| BR0209689A (pt) * | 2001-05-15 | 2006-02-07 | Long Island Jewish Res Inst | Uso de fragmento de hmg como agente anti-inflamatório |
| US7304034B2 (en) | 2001-05-15 | 2007-12-04 | The Feinstein Institute For Medical Research | Use of HMGB fragments as anti-inflammatory agents |
| US7026121B1 (en) | 2001-06-08 | 2006-04-11 | Expression Diagnostics, Inc. | Methods and compositions for diagnosing and monitoring transplant rejection |
| US7235358B2 (en) | 2001-06-08 | 2007-06-26 | Expression Diagnostics, Inc. | Methods and compositions for diagnosing and monitoring transplant rejection |
| US6905827B2 (en) | 2001-06-08 | 2005-06-14 | Expression Diagnostics, Inc. | Methods and compositions for diagnosing or monitoring auto immune and chronic inflammatory diseases |
| JP5055598B2 (ja) * | 2001-07-13 | 2012-10-24 | 株式会社シノテスト | ヒトhmg−1に特異的に結合する抗体を用いるヒトhmg−1の免疫学的測定方法及び免疫学的測定試薬 |
| ITMI20011986A1 (it) * | 2001-09-25 | 2003-03-25 | San Raffaele Centro Fond | Metodo e composizione per l'attivazione di cellule presentanti l'antigene |
| US7465555B2 (en) * | 2002-04-02 | 2008-12-16 | Becton, Dickinson And Company | Early detection of sepsis |
| KR20050054907A (ko) | 2002-07-03 | 2005-06-10 | 폰다지오네 센트로 산 라파엘 델 몬테 테이보 | 조직 손상의 치료 및/또는 조직 회복의 촉진에서hmgb1 단백질의 용도 |
| EP1523578A1 (en) * | 2002-07-05 | 2005-04-20 | The University of British Columbia | Diagnosis of sepsis using mitochondrial nucleic acid assays |
| GB0226251D0 (en) * | 2002-11-11 | 2002-12-18 | San Raffaele Centro Fond | Acetylated protein |
| MXPA05005071A (es) * | 2002-11-12 | 2005-07-22 | Becton Dickinson Co | Diagnostico de la sepsis o sirs usando perfiles de biomarcadores. |
| JP2006515670A (ja) * | 2002-11-12 | 2006-06-01 | ベクトン,ディッキンソン アンド カンパニー | バイオマーカープロファイルを用いる敗血症またはsirsの診断 |
| AU2003291483A1 (en) | 2002-11-12 | 2004-06-03 | Becton, Dickinson And Company | Diagnosis of sepsis or sirs using biomarker profiles |
| US20040156851A1 (en) * | 2002-11-20 | 2004-08-12 | Critical Therapeutics, Inc. | HMGB1 combination therapies |
| US20040141948A1 (en) * | 2002-11-20 | 2004-07-22 | Critical Therapeutics, Inc. | Use of HMGB fragments as anti-inflammatory agents |
| NZ540067A (en) * | 2002-11-20 | 2007-05-31 | Critical Therapeutics Inc | A purified preparation of antibodies that specifically bind to a high mobility group box protein (HMGB) B box but do not specifically to non-B box epitopes of HMGB |
| CA2505682A1 (en) * | 2002-11-20 | 2004-06-03 | Kevin J. Tracey | Use of hmgb polypeptides for increasing immune responses |
| ES2293086T3 (es) | 2002-12-06 | 2008-03-16 | The Feinstein Institute For Medical Research | Inhibicion de la inflamacion usando agonistas colinergicos de union al receptor alfa 7. |
| WO2004079368A2 (en) | 2003-03-08 | 2004-09-16 | Auvation Ltd | Markers for colorectal cancer |
| US7892745B2 (en) | 2003-04-24 | 2011-02-22 | Xdx, Inc. | Methods and compositions for diagnosing and monitoring transplant rejection |
| US20090069227A9 (en) * | 2003-04-29 | 2009-03-12 | Capogrossi Maurizio C | Use of HMGB1 to promote stem cell migration and/or proliferation |
| FR2855832B1 (fr) * | 2003-06-03 | 2007-09-14 | Biomerieux Sa | Procede de diagnostic et/ou de pronostic d'un syndrome septique |
| US7696169B2 (en) * | 2003-06-06 | 2010-04-13 | The Feinstein Institute For Medical Research | Inhibitors of the interaction between HMGB polypeptides and toll-like receptor 2 as anti-inflammatory agents |
| CN1878793A (zh) | 2003-09-11 | 2006-12-13 | 鉴定医疗有限公司 | 拮抗hmgb1的单克隆抗体 |
| WO2005028512A1 (en) * | 2003-09-19 | 2005-03-31 | Leukotech A/S | Pro-inflammatory and anti-inflammatory antibodies against the heparin-binding protein (hbp) |
| JP2007518062A (ja) * | 2003-09-29 | 2007-07-05 | バイオサイト インコーポレイテッド | 敗血症を診断する方法および診断するための組成物 |
| US20050148029A1 (en) * | 2003-09-29 | 2005-07-07 | Biosite, Inc. | Methods and compositions for determining treatment regimens in systemic inflammatory response syndromes |
| US20050196817A1 (en) * | 2004-01-20 | 2005-09-08 | Molecular Staging Inc. | Biomarkers for sepsis |
| US10912712B2 (en) | 2004-03-25 | 2021-02-09 | The Feinstein Institutes For Medical Research | Treatment of bleeding by non-invasive stimulation |
| JP2007530586A (ja) | 2004-03-25 | 2007-11-01 | ザ ファインスタイン インスティテュート フォー メディカル リサーチ | 神経性止血法 |
| US20080305120A1 (en) * | 2004-06-17 | 2008-12-11 | Medimmune, Inc. | Immunogenic Compositions Comprising Hmgb 1 Polypeptides |
| WO2006012373A2 (en) * | 2004-07-20 | 2006-02-02 | Critical Therapeutics, Inc. | Combination therapies of hmgb and complement inhibitors against inflammation |
| BRPI0514835A (pt) * | 2004-09-03 | 2008-06-24 | Creabilis Therapeutics Spa | variante de polipetìdeo de box de domìnio de ligação por alta afinidade de hmbg1 humano e/ou não humano ou de fragmento biologicamente ativo de box-a de hmgb1, molécula de ácido nucléico, uso, composição farmacêutica e dispositivo médico |
| WO2006029184A2 (en) * | 2004-09-08 | 2006-03-16 | Expression Diagnostics, Inc. | Genes useful for diagnosing and monitoring inflammation related disorders |
| CN101132811B (zh) | 2004-10-22 | 2012-05-30 | 米迪缪尼有限公司 | 抗hmgb1的高亲和力抗体及其用法 |
| US8129130B2 (en) | 2004-10-22 | 2012-03-06 | The Feinstein Institute For Medical Research | High affinity antibodies against HMGB1 and methods of use thereof |
| US20080050832A1 (en) * | 2004-12-23 | 2008-02-28 | Buechler Kenneth F | Methods and compositions for diagnosis and/or prognosis in systemic inflammatory response syndromes |
| ATE489132T1 (de) | 2004-12-27 | 2010-12-15 | The Feinstein Inst Medical Res | Behandlung von entzündlichen erkrankungen durch elektrische stimulation des vagus-nervs |
| US11207518B2 (en) | 2004-12-27 | 2021-12-28 | The Feinstein Institutes For Medical Research | Treating inflammatory disorders by stimulation of the cholinergic anti-inflammatory pathway |
| US20060157647A1 (en) * | 2005-01-18 | 2006-07-20 | Becton, Dickinson And Company | Multidimensional liquid chromatography/spectrometry |
| ITRM20050032A1 (it) * | 2005-01-21 | 2006-07-22 | Marco E Bianchi | Inibitori ed antagonisti di hmgb1 in grado di inibire la patogenesi e la progressione della malattia aterosclerotica. |
| FR2881437B1 (fr) | 2005-01-31 | 2010-11-19 | Biomerieux Sa | Procede pour le diagnostic/pronostic d'un syndrome septique |
| JP2008538007A (ja) | 2005-04-15 | 2008-10-02 | ベクトン,ディッキンソン アンド カンパニー | 敗血症の診断 |
| WO2006124477A2 (en) * | 2005-05-13 | 2006-11-23 | The Feinstein Institute For Medical Research | Combination therapy with inhibitors of hmgb and caspase for the treatment of inflammatory diseases |
| WO2006138429A2 (en) | 2005-06-16 | 2006-12-28 | The Feinstein Institute For Medical Research | Antibodies against hmgb1 and fragments thereof |
| CA2613512A1 (en) | 2005-06-23 | 2007-01-04 | Medimmune, Inc. | Antibody formulations having optimized aggregation and fragmentation profiles |
| EP1909834A2 (en) * | 2005-07-18 | 2008-04-16 | Critical Therapeutics, Inc. | Use of hmgb1 antagonists for the treatment of inflammatory skin conditions |
| WO2007031100A1 (en) * | 2005-09-14 | 2007-03-22 | Ostini, Marco | Active immunotherapy of life-threatening systemic inflammation |
| US20100172909A1 (en) * | 2005-10-24 | 2010-07-08 | Masahiro Nishibori | Cerebral edema suppressant |
| JP3876325B1 (ja) | 2005-10-24 | 2007-01-31 | 国立大学法人 岡山大学 | 脳梗塞抑制剤 |
| WO2007076200A2 (en) * | 2005-11-28 | 2007-07-05 | Medimmune, Inc. | Antagonists of hmgb1 and/or rage and methods of use thereof |
| WO2007130725A2 (en) | 2006-02-06 | 2007-11-15 | University Of Pittsburgh Of The Commonwealth System Of Higher Education | Use of hmgb1 for protection against ischemia reperfusion injury |
| US8570881B2 (en) * | 2006-03-28 | 2013-10-29 | Advanced Micro Devices, Inc. | Transmitter voltage and receiver time margining |
| US7986727B2 (en) * | 2006-03-28 | 2011-07-26 | Globalfoundries Inc. | In-band method to configure equalization levels |
| JP3882090B1 (ja) | 2006-05-19 | 2007-02-14 | 国立大学法人 岡山大学 | 脳血管攣縮抑制剤 |
| US7993832B2 (en) | 2006-08-14 | 2011-08-09 | Xdx, Inc. | Methods and compositions for diagnosing and monitoring the status of transplant rejection and immune disorders |
| ATE533197T1 (de) † | 2006-09-20 | 2011-11-15 | Asahi Kasei Chemicals Corp | Mikroporöse polyolefinmembran und separator für batterie mit nichtwässrigem elektrolyt |
| WO2008140484A2 (en) | 2006-11-09 | 2008-11-20 | Xdx, Inc. | Methods for diagnosing and monitoring the status of systemic lupus erythematosus |
| WO2008099913A1 (ja) * | 2007-02-15 | 2008-08-21 | Kumamoto University | ヒトhmgb-1に特異的に結合する抗体を有効成分として含有する治療剤 |
| US20100216977A1 (en) * | 2007-02-15 | 2010-08-26 | Kyushu University, National University Corporation | Therapeutic agent for interstitial pulmonary disease comprising anti-hmgb-1 antibody |
| EP2123298A4 (en) * | 2007-02-15 | 2011-09-28 | Univ Fukuoka | MEANS FOR SUPPRESSING THE SLIP IN ORGAN TRANSPLANTATIONS WITH ANTI-HMGB-1 ANTIBODIES |
| US8221995B2 (en) * | 2007-03-23 | 2012-07-17 | Seok-Won Lee | Methods and compositions for diagnosis and/or prognosis in systemic inflammatory response syndromes |
| US20090004755A1 (en) * | 2007-03-23 | 2009-01-01 | Biosite, Incorporated | Methods and compositions for diagnosis and/or prognosis in systemic inflammatory response syndromes |
| US20100255513A1 (en) * | 2007-03-30 | 2010-10-07 | Denson Lee A | Serological markers of inflammatory bowel disease phenotype and disease progression |
| GB0711327D0 (en) | 2007-06-12 | 2007-07-25 | Hansa Medical Ab | Diagnostic method |
| US8470966B2 (en) | 2007-08-10 | 2013-06-25 | Protelica, Inc. | Universal fibronectin type III binding-domain libraries |
| WO2009029614A1 (en) | 2007-08-27 | 2009-03-05 | The Feinstein Institute For Medical Research | Devices and methods for inhibiting granulocyte activation by neural stimulation |
| WO2009033050A1 (en) * | 2007-09-07 | 2009-03-12 | University Of Pittsburgh-Of The Commonwealth Sys Tem Of Higher Education | Diagnostic and therapeutic uses of augmenter of liver regeneration in inflammatory conditions |
| JP5224325B2 (ja) * | 2007-10-15 | 2013-07-03 | 国立大学法人 岡山大学 | B細胞悪性リンパ腫治療薬 |
| US9662490B2 (en) | 2008-03-31 | 2017-05-30 | The Feinstein Institute For Medical Research | Methods and systems for reducing inflammation by neuromodulation and administration of an anti-inflammatory drug |
| US9211409B2 (en) | 2008-03-31 | 2015-12-15 | The Feinstein Institute For Medical Research | Methods and systems for reducing inflammation by neuromodulation of T-cell activity |
| WO2009123737A2 (en) | 2008-04-03 | 2009-10-08 | Becton, Dickinson And Company | Advanced detection of sepsis |
| AU2009316801C1 (en) | 2008-11-18 | 2015-12-24 | Setpoint Medical Corporation | Devices and methods for optimizing electrode placement for anti-inflammatory stimulation |
| US20100160171A1 (en) * | 2008-12-22 | 2010-06-24 | The Children's Research Institute | Methods For Detection Of Sepsis |
| US8996116B2 (en) | 2009-10-30 | 2015-03-31 | Setpoint Medical Corporation | Modulation of the cholinergic anti-inflammatory pathway to treat pain or addiction |
| US8886339B2 (en) | 2009-06-09 | 2014-11-11 | Setpoint Medical Corporation | Nerve cuff with pocket for leadless stimulator |
| US8788034B2 (en) | 2011-05-09 | 2014-07-22 | Setpoint Medical Corporation | Single-pulse activation of the cholinergic anti-inflammatory pathway to treat chronic inflammation |
| US9211410B2 (en) | 2009-05-01 | 2015-12-15 | Setpoint Medical Corporation | Extremely low duty-cycle activation of the cholinergic anti-inflammatory pathway to treat chronic inflammation |
| US11051744B2 (en) | 2009-11-17 | 2021-07-06 | Setpoint Medical Corporation | Closed-loop vagus nerve stimulation |
| US9833621B2 (en) | 2011-09-23 | 2017-12-05 | Setpoint Medical Corporation | Modulation of sirtuins by vagus nerve stimulation |
| US20110123483A1 (en) * | 2009-11-23 | 2011-05-26 | Deutsches Krebsforschungszentrum | Hmgb1 for cancer treatment |
| US20110217301A1 (en) * | 2009-12-22 | 2011-09-08 | The Children's Research Instute | Methods for treating or screening for compounds for the treatment of sepsis |
| EP3636314B1 (en) | 2009-12-23 | 2021-09-08 | Setpoint Medical Corporation | Neural stimulation devices and systems for treatment of chronic inflammation |
| ES2413437T3 (es) * | 2010-03-10 | 2013-07-16 | Institut Pasteur | HMGB1 y anticuerpos anti-HMGB1 en pacientes infectados por VIH especialmente con trastornos neurológicos |
| SG183816A1 (en) | 2010-03-29 | 2012-10-30 | Res Inst Nationwide Childrens Hospital | Compositions and methods for the removal of biofilms |
| WO2011129382A1 (en) | 2010-04-16 | 2011-10-20 | Abbott Japan Co. Ltd. | Methods and reagents for diagnosing rheumatoid arthritis |
| IT1406051B1 (it) | 2010-08-05 | 2014-02-06 | D M G Italia S R L | Uso di hmgb1 come marcatore biologico di infiammazione intestinale umana, metodo non invasivo per la sua rilevazione in campioni fecali e kit relativo. |
| EP2613797B1 (en) | 2010-09-09 | 2015-11-04 | University Of Southern California | Compositions and methods for the removal of biofilms |
| GB201016161D0 (en) | 2010-09-24 | 2010-11-10 | Hansa Medical Ab | Diagnostic method |
| GB201102108D0 (en) | 2011-02-07 | 2011-03-23 | Hansa Medical Ab | Diagnostic method |
| US9561274B2 (en) | 2011-06-07 | 2017-02-07 | University Of Hawaii | Treatment and prevention of cancer with HMGB1 antagonists |
| US9244074B2 (en) | 2011-06-07 | 2016-01-26 | University Of Hawaii | Biomarker of asbestos exposure and mesothelioma |
| ES2683035T3 (es) * | 2011-10-05 | 2018-09-24 | The Rockefeller University | Lisinas de bacteriófago diméricas |
| US20130171659A1 (en) * | 2011-12-28 | 2013-07-04 | Abbott Japan Co., Ltd. | Methods of prognosis and diagnosis of rheumatoid arthritis |
| US9572983B2 (en) | 2012-03-26 | 2017-02-21 | Setpoint Medical Corporation | Devices and methods for modulation of bone erosion |
| WO2014110225A1 (en) * | 2013-01-09 | 2014-07-17 | The Feinstein Institute For Medical Research | Hmgb1-binding beads and uses thereof |
| AU2013375015A1 (en) | 2013-01-28 | 2015-08-13 | Evec Inc. | Humanized anti-HMGB1 antibody or antigen-binding fragment thereof |
| US11274144B2 (en) | 2013-06-13 | 2022-03-15 | Research Institute At Nationwide Children's Hospital | Compositions and methods for the removal of biofilms |
| US9745366B2 (en) | 2013-09-23 | 2017-08-29 | University Of Southern California | Compositions and methods for the prevention of microbial infections |
| US11248040B2 (en) | 2013-09-26 | 2022-02-15 | Trellis Bioscience, Llc | Binding moieties for biofilm remediation |
| US10233234B2 (en) | 2014-01-13 | 2019-03-19 | Trellis Bioscience, Llc | Binding moieties for biofilm remediation |
| US9840555B2 (en) | 2013-11-04 | 2017-12-12 | Li-Te Chin | Method for producing human monoclonal antibodies that binds to at least one part of HMGB1 |
| US11311725B2 (en) | 2014-10-24 | 2022-04-26 | Setpoint Medical Corporation | Systems and methods for stimulating and/or monitoring loci in the brain to treat inflammation and to enhance vagus nerve stimulation |
| US11406833B2 (en) | 2015-02-03 | 2022-08-09 | Setpoint Medical Corporation | Apparatus and method for reminding, prompting, or alerting a patient with an implanted stimulator |
| JP2018528763A (ja) | 2015-07-31 | 2018-10-04 | リサーチ インスティチュート アット ネイションワイド チルドレンズ ホスピタル | バイオフィルムの除去のためのペプチドおよび抗体 |
| JP7107839B2 (ja) | 2015-12-11 | 2022-07-27 | ルプレヒト-カールス-ウニベルジテート ハイデルベルク | Pkm2モジュレーター及びhmgb1の組合せ製剤 |
| US10596367B2 (en) | 2016-01-13 | 2020-03-24 | Setpoint Medical Corporation | Systems and methods for establishing a nerve block |
| WO2017127756A1 (en) | 2016-01-20 | 2017-07-27 | Setpoint Medical Corporation | Control of vagal stimulation |
| US11471681B2 (en) | 2016-01-20 | 2022-10-18 | Setpoint Medical Corporation | Batteryless implantable microstimulators |
| WO2017127758A1 (en) | 2016-01-20 | 2017-07-27 | Setpoint Medical Corporation | Implantable microstimulators and inductive charging systems |
| US10583304B2 (en) | 2016-01-25 | 2020-03-10 | Setpoint Medical Corporation | Implantable neurostimulator having power control and thermal regulation and methods of use |
| JP2020513808A (ja) | 2017-03-15 | 2020-05-21 | リサーチ インスティチュート アット ネイションワイド チルドレンズ ホスピタル | 付随する炎症のない細菌バイオフィルムの破壊のための組成物および方法 |
| WO2019036470A1 (en) | 2017-08-14 | 2019-02-21 | Setpoint Medical Corporation | TESTING TEST FOR STIMULATION OF NERVE WAVE |
| US11260229B2 (en) | 2018-09-25 | 2022-03-01 | The Feinstein Institutes For Medical Research | Methods and apparatuses for reducing bleeding via coordinated trigeminal and vagal nerve stimulation |
| JP7313659B2 (ja) * | 2019-03-12 | 2023-07-25 | 株式会社シノテスト | 試料中のhmgb1の測定方法及び測定試薬 |
| US11524048B2 (en) | 2019-05-09 | 2022-12-13 | The Feinstein Institutes For Medical Research | HMGB1 antagonist treatment of severe sepsis |
| US11938324B2 (en) | 2020-05-21 | 2024-03-26 | The Feinstein Institutes For Medical Research | Systems and methods for vagus nerve stimulation |
| JP7207772B2 (ja) | 2021-04-23 | 2023-01-18 | 株式会社タイセン工業 | 仮設橋ユニット |
Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPS62166897A (ja) * | 1986-01-20 | 1987-07-23 | Toyo Soda Mfg Co Ltd | 核内非ヒストン蛋白質に対するモノクロ−ナル抗体 |
Family Cites Families (86)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4678772A (en) * | 1983-02-28 | 1987-07-07 | Yissum Research Development Company Of The Hebrew University Of Jerusalem | Compositions containing glycyrrhizin |
| JPS6032714A (ja) * | 1983-08-01 | 1985-02-19 | Teijin Ltd | 鼻腔粘膜に適用するための安定化された粉末状薬学的組成物 |
| US5585344A (en) | 1984-03-19 | 1996-12-17 | The Rockefeller University | Liver-derived receptors for advanced glycosylation endproducts and uses thereof |
| JPS63135351A (ja) * | 1986-11-28 | 1988-06-07 | Sanwa Kagaku Kenkyusho Co Ltd | グリチルレチン酸誘導体、その製法及び該化合物を有効成分とする抗潰瘍剤 |
| GB8823869D0 (en) | 1988-10-12 | 1988-11-16 | Medical Res Council | Production of antibodies |
| US5530101A (en) | 1988-12-28 | 1996-06-25 | Protein Design Labs, Inc. | Humanized immunoglobulins |
| US5605690A (en) | 1989-09-05 | 1997-02-25 | Immunex Corporation | Methods of lowering active TNF-α levels in mammals using tumor necrosis factor receptor |
| US5859205A (en) | 1989-12-21 | 1999-01-12 | Celltech Limited | Humanised antibodies |
| US5545806A (en) | 1990-08-29 | 1996-08-13 | Genpharm International, Inc. | Ransgenic non-human animals for producing heterologous antibodies |
| JP2998287B2 (ja) * | 1991-03-13 | 2000-01-11 | 千寿製薬株式会社 | グリチルレチン酸誘導体 |
| US5656272A (en) | 1991-03-18 | 1997-08-12 | New York University Medical Center | Methods of treating TNF-α-mediated Crohn's disease using chimeric anti-TNF antibodies |
| ES2227512T3 (es) | 1991-12-02 | 2005-04-01 | Medical Research Council | Produccion de anticuerpos contra auto-antigenos a partir de repertorios de segmentos de anticuerpos fijados en un fago. |
| IT1253431B (it) | 1991-12-02 | 1995-08-08 | Valetudo S R L | Preparati farmaceutici per uso topico destinati al trattamento della psoriasi e della dermatite atopica |
| IT1254321B (it) * | 1992-04-10 | 1995-09-14 | Kemiprogress S R L | Composizione farmaceutica per il trattamento e la prevenzione delle infiammazioni cutanee e della mucosa orale. |
| GB9217316D0 (en) | 1992-08-14 | 1992-09-30 | Ludwig Inst Cancer Res | Schwann cell mitogenic factor,its preparation and use |
| EP0727487A1 (en) † | 1995-02-17 | 1996-08-21 | K.U. Leuven Research & Development | Multiple-tumor aberrant growth genes |
| JP3472048B2 (ja) | 1995-10-09 | 2003-12-02 | 鐘淵化学工業株式会社 | 自己免疫疾患の診断薬 |
| DE19548122A1 (de) | 1995-12-21 | 1997-06-26 | Joern Prof Dr Bullerdiek | Nukleinsäuresequenzen von Genen der High Mobility Group Proteine sowie Verwendungen derselben |
| US6323329B1 (en) | 1995-12-21 | 2001-11-27 | Jorn Bullerdiek | Nucleic acid sequences of genes encoding high mobility group proteins |
| US5864018A (en) | 1996-04-16 | 1999-01-26 | Schering Aktiengesellschaft | Antibodies to advanced glycosylation end-product receptor polypeptides and uses therefor |
| US6171779B1 (en) | 1996-07-12 | 2001-01-09 | University Of Medicine & Dentistry Of New Jersey | HMGI proteins in cancer |
| US6720472B2 (en) | 1996-07-12 | 2004-04-13 | University Of Medicine And Dentistry Of New Jersey | HMGI proteins in cancer and obesity |
| DE69737870T2 (de) | 1996-07-17 | 2008-02-07 | Kaneka Corp. | Medikamente für die diagnostik von autoimmunerkrankungen |
| US7258857B2 (en) | 1996-11-22 | 2007-08-21 | The Trustees Of Columbia University In The City Of New York | Rage-related methods for treating inflammation |
| US20030032090A1 (en) | 1997-05-07 | 2003-02-13 | Schering Corporation, A New Jersey Corporation | Human receptor proteins; related reagents and methods |
| CN101486759A (zh) | 1997-05-07 | 2009-07-22 | 先灵公司 | 人Toll样受体蛋白、相关试剂和方法 |
| IT1291366B1 (it) * | 1997-05-14 | 1999-01-07 | Angelini Ricerche Spa | Composizione farmaceutica antivirale comprendente acido glicirrizico ed almeno una proteina dotata di attivita' antivirale |
| DK1887014T3 (da) | 1997-10-17 | 2010-08-02 | Genentech Inc | Humane Toll-homologer |
| US20030027260A1 (en) | 1997-10-17 | 2003-02-06 | Genentech, Inc. | Human Toll homologues |
| ES2137125B1 (es) | 1997-11-18 | 2000-08-16 | Vinyals S A Lab Dr | La utilizacion de la sal de zinc del acido glicirretico en preparados contra el acne y las composiciones que contienen dicha sal. |
| US6783961B1 (en) | 1999-02-26 | 2004-08-31 | Genset S.A. | Expressed sequence tags and encoded human proteins |
| IT1299583B1 (it) | 1998-05-19 | 2000-03-16 | Vander Way Limited | Uso di proteine hmg-i per la preparazione di medicamenti ad attivita' citotossica |
| EP1121454B1 (en) | 1998-10-06 | 2007-11-14 | The Trustees of Columbia University in the City of New York | Extracellular novel rage binding protein (en-rage) and uses thereof |
| US6303321B1 (en) | 1999-02-11 | 2001-10-16 | North Shore-Long Island Jewish Research Institute | Methods for diagnosing sepsis |
| US7151082B2 (en) | 1999-02-11 | 2006-12-19 | The Feinstein Institute For Medical Research | Antagonists of HMG1 for treating inflammatory conditions |
| US6177077B1 (en) | 1999-02-24 | 2001-01-23 | Edward L. Tobinick | TNT inhibitors for the treatment of neurological disorders |
| AU3395900A (en) | 1999-03-12 | 2000-10-04 | Human Genome Sciences, Inc. | Human lung cancer associated gene sequences and polypeptides |
| TWI221082B (en) | 1999-04-14 | 2004-09-21 | Sumitomo Chemical Co | Pesticidal compositions |
| WO2000075358A2 (en) | 1999-06-04 | 2000-12-14 | Millennium Pharmaceuticals, Inc. | Mammalian toll homologues and uses thereof |
| US6794132B2 (en) | 1999-10-02 | 2004-09-21 | Biosite, Inc. | Human antibodies |
| GB9927332D0 (en) | 1999-11-18 | 2000-01-12 | Leiv Eiriksson Nyfotek As | Novel antibody and uses thereof |
| US6677321B1 (en) | 1999-12-09 | 2004-01-13 | Bruce Levin | Methods and compositions for treatment of inflammatory disease |
| GB0001704D0 (en) | 2000-01-25 | 2000-03-15 | Glaxo Group Ltd | Protein |
| CA2404511A1 (en) | 2000-03-31 | 2001-10-04 | Mochida Pharmaceutical Co., Ltd. | Tlr/cd14 binding inhibitor |
| US6436703B1 (en) | 2000-03-31 | 2002-08-20 | Hyseq, Inc. | Nucleic acids and polypeptides |
| JP2001322276A (ja) * | 2000-05-15 | 2001-11-20 | Fuji Xerox Co Ltd | インクジェット記録ヘッド、インクジェット記録装置及びヘッド作製方法 |
| MXPA02011618A (es) | 2000-05-25 | 2003-03-10 | Schering Corp | Proteinas de receptor de humano, reactivos y metodos relacionados. |
| GB0015325D0 (en) | 2000-06-22 | 2000-08-16 | Danionics As | Electrochemical cells |
| NZ528076A (en) | 2001-03-02 | 2005-09-30 | Medimmune Inc | Methods of preventing or treating inflammatory or autoimmune disorders by administering integrin alphav beta3 antagonists with an immunomodulatory agents, anti-inflammatory agents, TNF-alpha antagonists or CD2 binding molecules |
| CN1494425B (zh) | 2001-03-05 | 2011-12-07 | 特兰斯泰克制药公司 | 用作治疗剂的羧酰胺衍生物 |
| JP2004523565A (ja) | 2001-03-05 | 2004-08-05 | トランス テック ファーマ,インコーポレイテッド | 治療因子としてのベンゾイミダゾール誘導体 |
| WO2002074301A1 (en) | 2001-03-15 | 2002-09-26 | University Of Pittsburgh Of The Commonwealth System Of Higher Education | Method of using pyruvate and/or its derivatives for the treatment of cytokine-mediated inflammatory conditions |
| ITMI20010562A1 (it) | 2001-03-16 | 2002-09-16 | Marco E Bianchi | Inibitori o antagonisti della proteina hmg1 per il trattamento di disordini vascolari |
| WO2002089743A2 (en) | 2001-05-09 | 2002-11-14 | The Regents Of The University Of Michigan | Use of compositions for treating rosacea |
| JP2004536585A (ja) | 2001-05-09 | 2004-12-09 | エール・ユニバーシティ | トル/インターロイキン−1受容体アダプタータンパク質(tirap) |
| US7220723B2 (en) | 2001-05-15 | 2007-05-22 | The Feinstein Institute For Medical Research | Inhibitors of the interaction between HMGB polypeptides and toll-like receptor 2 as anti-inflammatory agents |
| US7304034B2 (en) | 2001-05-15 | 2007-12-04 | The Feinstein Institute For Medical Research | Use of HMGB fragments as anti-inflammatory agents |
| BR0209689A (pt) | 2001-05-15 | 2006-02-07 | Long Island Jewish Res Inst | Uso de fragmento de hmg como agente anti-inflamatório |
| JP4823465B2 (ja) | 2001-07-13 | 2011-11-24 | 株式会社シノテスト | ヒトhmg−1に特異的に結合する抗体並びにこの抗体を用いるヒトhmg−1の免疫学的測定方法及び免疫学的測定試薬 |
| US20030032674A1 (en) | 2001-08-13 | 2003-02-13 | Hwang Daniel H. | Use of unsaturated fatty acids to treat severe inflammatory diseases |
| CA2459310A1 (en) | 2001-09-07 | 2003-03-20 | The Trustees Of Boston University | Method and composition for treating immune complex associated disorders |
| JP2003088388A (ja) | 2001-09-14 | 2003-03-25 | Herikkusu Kenkyusho:Kk | 新規な全長cDNA |
| EP1293566A1 (en) | 2001-09-17 | 2003-03-19 | Societe Des Produits Nestle S.A. | A soluble toll-like receptor |
| AU2002364607A1 (en) | 2001-12-28 | 2003-07-24 | The Burnham Institute | Novel ligand involved in the transmigration of leukocytes . |
| CN101597262A (zh) | 2002-03-05 | 2009-12-09 | 特兰斯泰克制药公司 | 抑制配体与高级糖化终产物受体相互作用的单和双环吡咯衍生物 |
| KR20050054907A (ko) | 2002-07-03 | 2005-06-10 | 폰다지오네 센트로 산 라파엘 델 몬테 테이보 | 조직 손상의 치료 및/또는 조직 회복의 촉진에서hmgb1 단백질의 용도 |
| GB0226251D0 (en) | 2002-11-11 | 2002-12-18 | San Raffaele Centro Fond | Acetylated protein |
| NZ540067A (en) | 2002-11-20 | 2007-05-31 | Critical Therapeutics Inc | A purified preparation of antibodies that specifically bind to a high mobility group box protein (HMGB) B box but do not specifically to non-B box epitopes of HMGB |
| US20040141948A1 (en) | 2002-11-20 | 2004-07-22 | Critical Therapeutics, Inc. | Use of HMGB fragments as anti-inflammatory agents |
| CA2505682A1 (en) | 2002-11-20 | 2004-06-03 | Kevin J. Tracey | Use of hmgb polypeptides for increasing immune responses |
| US7696169B2 (en) | 2003-06-06 | 2010-04-13 | The Feinstein Institute For Medical Research | Inhibitors of the interaction between HMGB polypeptides and toll-like receptor 2 as anti-inflammatory agents |
| CN1878793A (zh) | 2003-09-11 | 2006-12-13 | 鉴定医疗有限公司 | 拮抗hmgb1的单克隆抗体 |
| WO2005034952A2 (en) | 2003-10-07 | 2005-04-21 | The Feinstein Institute For Medical Research | Isoxazole and isothiazole compounds useful in the treatment of inflammation |
| US20080305120A1 (en) | 2004-06-17 | 2008-12-11 | Medimmune, Inc. | Immunogenic Compositions Comprising Hmgb 1 Polypeptides |
| US20090062187A1 (en) | 2004-07-20 | 2009-03-05 | Marco Bianchi | Use of Hmgb1 for Wound Healing |
| WO2006012415A2 (en) | 2004-07-20 | 2006-02-02 | Critical Therapeutics, Inc. | Rage protein derivatives |
| WO2006017647A1 (en) | 2004-08-03 | 2006-02-16 | Transtech Pharma, Inc. | Rage fusion proteins and methods of use |
| BRPI0514835A (pt) | 2004-09-03 | 2008-06-24 | Creabilis Therapeutics Spa | variante de polipetìdeo de box de domìnio de ligação por alta afinidade de hmbg1 humano e/ou não humano ou de fragmento biologicamente ativo de box-a de hmgb1, molécula de ácido nucléico, uso, composição farmacêutica e dispositivo médico |
| US8129130B2 (en) | 2004-10-22 | 2012-03-06 | The Feinstein Institute For Medical Research | High affinity antibodies against HMGB1 and methods of use thereof |
| CN101132811B (zh) | 2004-10-22 | 2012-05-30 | 米迪缪尼有限公司 | 抗hmgb1的高亲和力抗体及其用法 |
| EP1909834A2 (en) | 2005-07-18 | 2008-04-16 | Critical Therapeutics, Inc. | Use of hmgb1 antagonists for the treatment of inflammatory skin conditions |
| CA2628546A1 (en) | 2005-11-09 | 2007-05-18 | Pharmexa A/S | Therapeutic vaccines targeting hmgb1 |
| WO2007076200A2 (en) | 2005-11-28 | 2007-07-05 | Medimmune, Inc. | Antagonists of hmgb1 and/or rage and methods of use thereof |
| UA115964C2 (uk) | 2006-09-08 | 2018-01-25 | Еббві Айрленд Анлімітед Компані | Інтерлейкін-13-зв'язувальний білок |
| WO2008076758A2 (en) * | 2006-12-13 | 2008-06-26 | William Marsh Rice University | Nerolidol, terpene, and terpene derivative synthesis |
| WO2008154638A2 (en) | 2007-06-12 | 2008-12-18 | Board Of Regents, The University Of Texas System | Antagonists of the receptor for advanced glycation end-products (rage) |
-
1999
- 1999-02-11 US US09/248,574 patent/US6303321B1/en not_active Expired - Lifetime
-
2000
- 2000-02-11 DE DE60028358.5T patent/DE60028358T3/de not_active Expired - Lifetime
- 2000-02-11 ES ES00915762.9T patent/ES2269118T5/es not_active Expired - Lifetime
- 2000-02-11 EP EP00915762.9A patent/EP1165110B2/en not_active Expired - Lifetime
- 2000-02-11 AT AT00915762T patent/ATE327764T1/de active
- 2000-02-11 PT PT00915762T patent/PT1165110E/pt unknown
- 2000-02-11 DK DK00915762T patent/DK1165110T3/da active
- 2000-02-11 EP EP20100075469 patent/EP2362221A1/en not_active Ceased
- 2000-02-11 EP EP06075291.2A patent/EP1757937B1/en not_active Expired - Lifetime
- 2000-02-11 JP JP2000598059A patent/JP4812166B2/ja not_active Expired - Lifetime
- 2000-02-11 EP EP05077852A patent/EP1707214A1/en not_active Withdrawn
- 2000-02-11 WO PCT/US2000/003583 patent/WO2000047104A2/en active IP Right Grant
- 2000-02-11 CA CA2359926A patent/CA2359926C/en not_active Expired - Lifetime
- 2000-02-11 AU AU36983/00A patent/AU782984B2/en not_active Expired
- 2000-02-14 US US09/503,632 patent/US6468533B1/en not_active Expired - Lifetime
-
2001
- 2001-08-15 US US09/929,962 patent/US6448223B1/en not_active Expired - Lifetime
-
2002
- 2002-07-31 US US10/210,747 patent/US7097838B2/en not_active Expired - Lifetime
- 2002-09-11 US US10/242,056 patent/US7060504B2/en not_active Expired - Fee Related
-
2005
- 2005-12-01 US US11/292,320 patent/US7537908B2/en not_active Expired - Fee Related
-
2006
- 2006-06-29 US US11/477,835 patent/US7572446B2/en not_active Expired - Fee Related
-
2009
- 2009-04-13 US US12/386,053 patent/US8053206B2/en not_active Expired - Fee Related
- 2009-07-01 US US12/496,333 patent/US8138141B2/en not_active Expired - Fee Related
-
2011
- 2011-03-16 JP JP2011058031A patent/JP5745299B2/ja not_active Expired - Lifetime
-
2012
- 2012-02-22 US US13/402,057 patent/US8822169B2/en not_active Expired - Fee Related
-
2013
- 2013-11-22 JP JP2013241528A patent/JP2014031386A/ja active Pending
-
2014
- 2014-08-29 US US14/473,333 patent/US20150322140A1/en not_active Abandoned
-
2016
- 2016-01-21 US US15/002,688 patent/US20170129946A1/en not_active Abandoned
Patent Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPS62166897A (ja) * | 1986-01-20 | 1987-07-23 | Toyo Soda Mfg Co Ltd | 核内非ヒストン蛋白質に対するモノクロ−ナル抗体 |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2011168593A (ja) * | 1999-02-11 | 2011-09-01 | Feinstein Inst For Medical Research | 炎症症状を治療するためのhmg1のアンタゴニスト |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP4812166B2 (ja) | 炎症症状を治療するためのhmg1のアンタゴニスト | |
| US7151082B2 (en) | Antagonists of HMG1 for treating inflammatory conditions | |
| JP2021176860A (ja) | 炎症性疾患におけるil−18結合タンパク質(il−18bp)および抗体 | |
| JP2006523085A (ja) | アセチル化タンパク質 | |
| KR20090019911A (ko) | 아밀로이드 β(1-42) 올리고머, 이의 유도체, 이에 대한 항체, 이의 제조 방법 및 용도 | |
| AU2005244514B2 (en) | Antagonists of HMG1 for treating inflammatory conditions |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20070116 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20100302 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20100527 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20100603 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20100702 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20100709 |
|
| A524 | Written submission of copy of amendment under article 19 pct |
Free format text: JAPANESE INTERMEDIATE CODE: A524 Effective date: 20100802 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20101116 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20110316 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20110421 |
|
| A911 | Transfer to examiner for re-examination before appeal (zenchi) |
Free format text: JAPANESE INTERMEDIATE CODE: A911 Effective date: 20110518 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20110802 |
|
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20110823 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 4812166 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20140902 Year of fee payment: 3 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| EXPY | Cancellation because of completion of term |