JP4648317B2 - マロニル−CoAデカルボキシラーゼ阻害剤として有用なピペリジン化合物 - Google Patents
マロニル−CoAデカルボキシラーゼ阻害剤として有用なピペリジン化合物 Download PDFInfo
- Publication number
- JP4648317B2 JP4648317B2 JP2006522612A JP2006522612A JP4648317B2 JP 4648317 B2 JP4648317 B2 JP 4648317B2 JP 2006522612 A JP2006522612 A JP 2006522612A JP 2006522612 A JP2006522612 A JP 2006522612A JP 4648317 B2 JP4648317 B2 JP 4648317B2
- Authority
- JP
- Japan
- Prior art keywords
- isopropyl
- mercapto
- benzothiazol
- piperidin
- urea
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
- 0 *N(C1CCN(*)CC1)C(N(*)c1ccc2nc(S)[s]c2c1)=O Chemical compound *N(C1CCN(*)CC1)C(N(*)c1ccc2nc(S)[s]c2c1)=O 0.000 description 2
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D417/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00
- C07D417/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00 containing two hetero rings
- C07D417/12—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00 containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/445—Non condensed piperidines, e.g. piperocaine
- A61K31/4523—Non condensed piperidines, e.g. piperocaine containing further heterocyclic ring systems
- A61K31/454—Non condensed piperidines, e.g. piperocaine containing further heterocyclic ring systems containing a five-membered ring with nitrogen as a ring hetero atom, e.g. pimozide, domperidone
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/445—Non condensed piperidines, e.g. piperocaine
- A61K31/4523—Non condensed piperidines, e.g. piperocaine containing further heterocyclic ring systems
- A61K31/4545—Non condensed piperidines, e.g. piperocaine containing further heterocyclic ring systems containing a six-membered ring with nitrogen as a ring hetero atom, e.g. pipamperone, anabasine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/55—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having seven-membered rings, e.g. azelastine, pentylenetetrazole
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/04—Anorexiants; Antiobesity agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/06—Antihyperlipidemics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/08—Drugs for disorders of the metabolism for glucose homeostasis
- A61P3/10—Drugs for disorders of the metabolism for glucose homeostasis for hyperglycaemia, e.g. antidiabetics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/04—Inotropic agents, i.e. stimulants of cardiac contraction; Drugs for heart failure
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Pharmacology & Pharmacy (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- General Health & Medical Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Medicinal Chemistry (AREA)
- Life Sciences & Earth Sciences (AREA)
- Organic Chemistry (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Diabetes (AREA)
- Epidemiology (AREA)
- Obesity (AREA)
- Hematology (AREA)
- Cardiology (AREA)
- Heart & Thoracic Surgery (AREA)
- Endocrinology (AREA)
- Urology & Nephrology (AREA)
- Vascular Medicine (AREA)
- Hospice & Palliative Care (AREA)
- Child & Adolescent Psychology (AREA)
- Emergency Medicine (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Plural Heterocyclic Compounds (AREA)
- Hydrogenated Pyridines (AREA)
Description
本発明は、特定の代謝性疾患の治療法と、そのような疾患を治療する際に有用な、化合物およびそれらのプロドラッグの使用、ならびに/または薬学的に許容される塩、そのような化合物を含む薬学的組成物に関する。特に、本発明は、マロニル-コエンザイムAデカルボキシラーゼ(マロニル-CoAデカルボキシラーゼ、MCD)の阻害を通じた、心血管疾患、糖尿病、癌、および肥満の予防、管理または治療のための化合物および組成物の使用に関する。
マロニル-CoAは、体内で酵素アセチルCoAカルボキシラーゼ(ACC)によって産生される重要な代謝中間体である。肝、脂肪細胞、および他の組織において、マロニル-CoAは脂肪酸合成酵素(FAS)の基質である。ACCおよびマロニル-CoAは、脂肪酸合成酵素レベルが低い骨格筋および心筋組織で見いだされる。マロニル-CoAデカルボキシラーゼ(MCD、EC4.1.1.9)は、マロニル-CoAのアセチル-CoAへの変換を触媒し、それによりマロニル-CoAレベルを調節する。MCD活性は、原核生物、鳥類、および哺乳類を含む広範な生物において記載されている。この酵素は細菌リゾビウム・トリフォリ(Rhizobium trifolii)(Anら、J. Biochem. Mol. Biol. 32: 414-418 (1999))、水鳥の尾腺(Bucknerら、Arch. Biochem. Biophys 177: 539 (1976);KimおよびKolattukudy、Arch. Biochem. Biophys 190: 585 (1978))、ラット肝ミトコンドリア(KimおよびKolattukudy、Arch. Biochem. Biophys. 190: 234 (1978))、ラット乳腺(KimおよびKolattukudy、Biochim. Biophys, Acta 531: 187 (1978))、ラット膵β細胞(Voilleyら、Biochem. J. 340: 213 (1999))およびガチョウ(ハイイロガン)(Jangら、J. Biol. Chem. 264: 3500 (1989))から精製されている。MCD欠損症患者の同定は、ガチョウおよびラットMCD遺伝子に相同のヒト遺伝子のクローニングにつながる(Gaoら、J. Lipid. Res. 40: 178 (1999);Sackstederら、J. Biol. Chem. 274: 24461 (1999);FitzPatrickら、Am. J. Hum. Genet. 65: 318 (1999))。ノーザンブロット分析で単一のヒトMCD mRNAが観察される。筋および心臓組織で最も高いmRNA発現レベルが観察され、肝、腎および膵ではその次に高く、検査したその他の組織すべてにおいて検出可能な量が認められる。
本発明は、構造Iで示されるような化合物の使用法、これらの化合物を含む薬学的組成物、ならびに代謝性疾患およびMCD阻害によって調節される疾患の予防、管理および治療のための方法を提供する。本発明に開示される化合物は、マロニル-CoA調節グルコース/脂肪酸代謝経路に関与する疾患の予防、管理および治療のために有用である。特に、これらの化合物およびこれらの化合物を含む薬学的組成物は、心血管疾患、糖尿病、癌および肥満の予防、管理および治療において必要とされる。
式中、R1、R2、R3、n、XおよびYは、下記に定義されるとおりである。これらの化合物の範囲内には、対応する鏡像異性体、ジアステレオ異性体、プロドラッグ、および薬学的に許容される塩も含まれる。本発明の他の局面は本発明の説明を続けるうちに明らかになると思われる。したがって、前記は単に本発明の特定の局面の概要を示しているにすぎず、いかなる様式でも本発明を限定することを意図するものではなく、本発明を限定すると解釈されるべきでもない。
下記の本発明の詳細な説明は、網羅的であること、または開示する正確な詳細に本発明を限定することを意図してはいない。これは、他の当業者に本発明の詳細を十分に説明するために選択され、記載されたものである。
式中、
R1は、水素、C1〜C12置換アルキル、C1〜C12置換アルケニル、C1〜C12置換アルキニル、-COR4、-CONR4R5、-S(O)nR4、-SO2NR4R5、-P(O)(R5)2、または-P(O)(R5)2から選択され;
R2は、水素、C1〜C12アルキル、置換C1〜C12アルキル、フェニル、置換フェニル、アリール、またはヘテロアリールから選択され;
R3は、水素、C1〜C12アルキル、置換C1〜C12アルキル、フェニル、置換フェニル、アリール、またはヘテロアリールから選択され;
R4およびR5は、水素、C1〜C12アルキル、置換C1〜C12アルキル、フェニル、置換フェニル、アリール、またはヘテロアリールから独立に選択され;
nは、1または2であり;
Xは、CまたはNであり;
Yは、SまたはOである。
式中、
R1は、水素、C1〜C12置換アルキル、C1〜C12置換アルケニル、C1〜C12置換アルキニル、-COR4、-CONR4R5、-S(O)nR4、-SO2NR4R5、-P(O)(R5)2、または-P(O)(R5)2から選択され;
R2は、水素、C1〜C12アルキル、置換C1〜C12アルキル、フェニル、置換フェニル、アリール、またはヘテロアリールから選択され;
R3は、水素、C1〜C12アルキル、置換C1〜C12アルキル、フェニル、置換フェニル、アリール、またはヘテロアリールから選択され;
R4およびR5は、水素、C1〜C12アルキル、置換C1〜C12アルキル、フェニル、置換フェニル、アリール、またはヘテロアリールから独立に選択される。
R1が-S(O)nR4であり;
R2が水素であり;
R3がC1〜C6アルキルまたはC1〜C6置換アルキルである、一般式Iaで表される。
本発明の組成物は、以下の(a)および(b)を含む:
(a)安全で治療的に有効な量のMCD阻害化合物IまたはII、その対応する鏡像異性体、ジアステレオ異性体もしくは互変異性体、またはその薬学的に許容される塩、もしくはプロドラッグ;および
(b)薬学的に許容される担体。
本発明において有用な化合物および組成物は、局所または全身投与することができる。全身適用には、化合物を体の組織内に導入する任意の方法、例えば関節内、くも膜下腔内、硬膜外、筋肉内、経皮、静脈内、腹腔内、皮下、舌下投与、吸入、直腸内、または経口投与が含まれる。本発明において有用な化合物は、経口投与することが好ましい。
本明細書において用いられる「アルキル」とは、メチル、エチル、ブチル、ペンチル、ヘプチルなどの、炭素および水素のみを含む直鎖アルカン、アルケン、またはアルキン置換基を意味する。アルキル基は飽和でもよく、または一つまたは複数の位置で不飽和(すなわち、-C=C-または-C≡C-結合を含んでいる)でもよい。特定の不飽和度が好ましい場合、前記置換基は「アルケニル」または「アルキニル」と呼ばれ、それぞれ-C=C-または-C≡C-結合を含む置換基を意味する。炭素数は「Ci〜Cjアルキル」(iおよびjは炭素原子の最小および最大の数を意味する)として示すこともできる。典型的には、アルキル基は1個から12個の炭素原子、好ましくは1個から10個、より好ましくは2個から8個の炭素原子を含むことになる。
が、複数の異なる官能基を表すことを理解すると思われる。この構造で表される好ましい官能基には、アミド、ウレイド、チオ尿素、カルバミン酸塩、エステル、チオエステル、アミジン、ケトン、オキシム、ニトロオレフィン、ヒドロキシグアニジン、およびグアニジンが含まれる。より好ましい官能基には、尿素、チオ尿素、アミド、およびカルバミン酸塩が含まれる。
は明らかに同じ化合物を表しており、いずれかへの言及は明らかに他方を企図している。加えて、本発明において有用な化合物をプロドラッグとして提供することができ、下記を例として示す:
式中、Rは生物学的プロセスで除去される基(または結合)である。したがって、本発明において明らかに企図されるものは、当技術分野において理解されているとおり、生体加水分解可能なプロドラッグとして提供される化合物の使用である。本明細書において用いられる「プロドラッグ」とは、生物において生物学的プロセスに曝露されると、加水分解、代謝、誘導体化などを受けて所望の活性を有する活性物質を生じる任意の化合物である。当業者であれば、プロドラッグはプロドラッグとして任意の活性を有していてもいなくてもよいことを理解すると思われる。本明細書に記載のプロドラッグは、安全かつ有効な量で投与された場合に、治療する被検者に対して有害な作用は持たないことが意図される。これらには、例えば、生体加水分解可能なアミドおよびエステルが含まれる。「生体加水分解可能なアミド」とは、化合物の活性を基本的に妨害しないか、あるいは細胞、組織、またはヒト、哺乳動物、もしくは動物被検者によってインビボで容易に変換されて活性化合物を生じるアミド化合物である。「生体加水分解可能なエステル」とは、これらの化合物の活性を妨害しないか、または動物によって容易に変換されて活性化合物を生じる、本発明のエステル化合物を意味する。そのような生体加水分解可能なプロドラッグは、当業者には理解され、規制ガイドラインに組み込まれている。
本発明において有用な化合物を調製する際に用いる出発原料は公知であるか、公知の方法によって調製するか、または市販されている。当業者には、本明細書において特許請求されている化合物に関連する前駆体および官能基を調製する方法は、文献中に一般に記載されていることが明らかであると思われる。当業者は、文献および本開示を読めば、これらの化合物の任意のものを調製する能力が十分にあると考えられる。
マロニル-CoAからのアセチル-CoAの変換を、Kim, Y. S. and Kolattukudy, P. E. in 1978 (Arch. Biochem. Biophys 190:585 (1978))により以前に記載された改変プロトコルを用いてアッセイした。式1〜3に示すとおり、マレート/NADおよびオキサロアセテート/NADHの間の動態平衡の確立はリンゴ酸デヒドロゲナーゼによって触媒された(式2)。MCDの酵素反応生成物であるアセチル-CoAは、クエン酸合成酵素存在下でオキサロアセテートと縮合することにより平衡をシフトさせ(式3)、これによりNADからNADHが連続的に生成された。NADHの蓄積は、蛍光プレート読み取り器で460nmの蛍光発光の増大をモニターすることにより、連続的に追跡することができる。蛍光プレート読み取り器は、Sigmaからの標準アセチル-CoAを用いて較正した。典型的な96穴プレートアッセイでは、各ウェルの蛍光発光(NADH:λex=360nm、λem=460nm)の増大を用いて、hMCDの初期速度を計算した。各50μLのアッセイ溶液には10mMリン酸緩衝食塩水(Sigma)、pH7.4、0.05%トゥイーン-20、25mM K2HPO4-KH2PO4(Sigma)、2mMマレート(Sigma)、2mM NAD(Boehringer Mannheim)、0.786単位のMD(Roche Chemicals)、0.028単位のCS(Roche Chemicals)、5〜10nM hMCD、および様々な量のMCA基質が含まれていた。アッセイはMCAの添加によって開始し、速度をhMCD非存在下で求めたバックグラウンド速度で補正した。
雄Sprague-Dawleyラット(300〜350g)から摘出した拍動心に60分間の好気的灌流を行う。拍動心を95%O2、5%CO2で、5mMグルコース;100μU/mLインスリン;3%無脂肪酸BSA;2.5mM遊離Ca2+、および0.4〜1.2mmol/Lパルミテートを含む改変クレブス-ヘンゼライト(Krebs-Henseleit)液により灌流する(Kantor et al., Circulation Research 86:580-588(2000))。試験化合物を灌流期間の5分前に加える。DMSO(0.05%)を対照として用いる。
実験パラメーターの測定のために試料を10分間隔で採取した。グルコース酸化速度を、[U14]-グルコースを含む緩衝液で灌流した心臓により産生された14CO2の定量的収集によって定量する(R. Barr and G. Lopaschuk, 「Measurement of cardiovascular function」, McNeill, J. H. ed., Chapter 2, CRC press, New York (1997))。灌流後、灌流液1mLを9N H2SO4 1mLを含む密封試験管に注入して、灌流液からの14CO2を放出させる。試験管はハイアミンヒドロキシド(hyamine hydroxide)300μlで飽和させたろ紙片を含むシンチレーションバイアルに連結したゴム栓で密封した。次いで、ろ紙を含むシンチレーションバイアルを取り出し、エコライトシンチレーション液(Ecolite Scintillation Fluid)を加えた。試料を前述の標準法で計数した。各灌流段階のグルコース酸化の平均速度を、前述のとおりμmol/分/g(乾燥重量)で表す。
脂肪酸酸化の速度を、[14C]パルミテートを用いたグルコース酸化速度について前述したものと同じ方法を用いて、または[5-3H]パルミテートを含む緩衝液で灌流した心臓により生成される3H2Oの定量的収集(R. Barr and G. Lopaschuk, 「Measurement of cardiovascular function」, McNeill, J. H. ed., Chapter 2, CRC press, New York (1997))により評価した。緩衝液試料0.5mLをクロロホルム/メタノール(体積比1:2)の混合物1.88mLで処理し、次いでクロロホルム0.625mLおよび2M KCl/HCl溶液0.625mLを加えることにより、[5-3H]パルミテートから3H2Oを分離した。試料を10分間遠心分離し、水相を取り出し、クロロホルム1mL、メタノール1mLおよびKCl/HCl 0.9mL(1:1:0.9)の混合物で処理した。次いで、水層を総3H2O量について計数した。この工程によるパルミテートからの3H2Oの抽出および分離は99.7%を上回った。各灌流段階の脂肪酸酸化の平均速度を、希釈率を考慮した後に、nmol/分/g(乾燥重量)で表す。
本発明をさらに詳しく例示するために、下記の実施例が含まれる。実施例は、本発明を特に制限すると解釈されるべきではない。特許請求の範囲内でのこれらの実施例の変更は、当業者の範囲内であり、本明細書において記載され、主張されている本発明の範囲内に入ると考えられる。読者は、本開示を読み、当技術分野の技能を備えた当業者であれば、網羅的な実施例なしで、本発明を調製し、用いることができることを理解すると思われる。
Ac=アセチル
Bn=ベンジル
Bz=ベンゾイル
CDI=カルボニルジイミダゾール
CH2Cl2=ジクロロメタン
DIBAL=水素化ジイソブチルアルミニウム
DMAP=4-(ジメチルアミノ)-ピリジン
DMF=N,N-ジメチルホルムアミド
DMSO=ジメチルスルホキシド
EDClまたはECAC=塩酸1-[3-(ジメチルアミノ)プロピル]-3-エチルカルボジイミド
ESIMS=電子スプレー質量分析
Et3N=トリエチルアミン
EtOAc=酢酸エチル
HMTA=ヘキサメチレンテトラミン
LDA=リチウムジイソプロピルアミド
LHDMS=リチウムビス(トリメチルシリル)アミド
MgSO4=硫酸マグネシウム
NaH=水素化ナトリウム
NBS=N-ブロモスクシンイミド
NCS=N-クロロスクシンイミド
NH4Cl=塩化アンモニウム
Ph=フェニル
Py=ピリジニル
r.t.=室温
TFA=トリフルオロ酢酸
THF=テトラヒドロフラン
TLC=薄層クロマトグラフィ
Tf2O=トリフルオロメタンスルホン酸無水物(triflic anhydride)
アルキル基の略語
Me=メチル
Et=エチル
n-Pr=ノルマルプロピル
i-Pr=イソプロピル
n-Bu=ノルマルブチル
i-Bu=イソブチル
t-Bu=三級ブチル
s-Bu=二級ブチル
c-Hex=シクロヘキシル
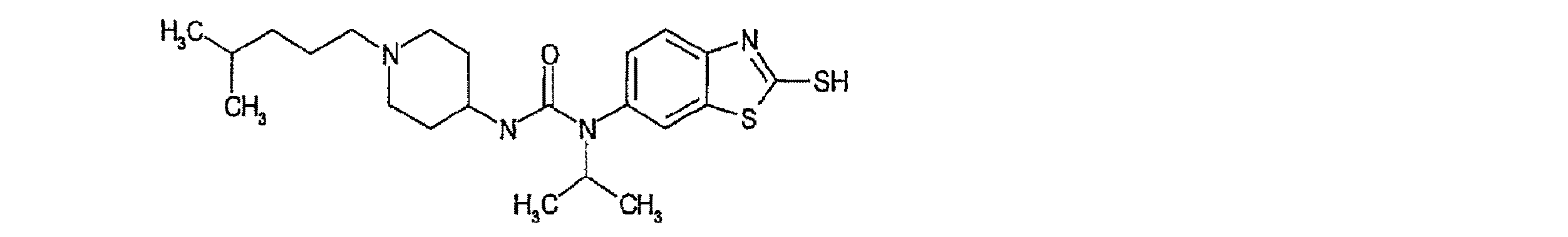
1-イソプロピル-1-(2-メルカプト-ベンゾチアゾル-6-イル)-3-[1-(4-メチルペンチル)-ピペリジン-4-イル]-尿素の調製:
段階1:
4-(N-BOC-アミノ)-ピペリジン(400mg、2.00mmol)、1-ブロモ-4-メチルペンタン(436μl、3.00mmol)、および炭酸カリウム(415mg、3.00mmol)をDMF(8ml)中で混合し、100℃で4時間撹拌した。反応混合物を冷却し、酢酸エチルに溶解し、水、次いで食塩水で洗浄した。硫酸マグネシウムで乾燥した後、有機相を減圧濃縮した。得られた固体をジクロロメタン/トリフルオロ酢酸1:1(4ml)に溶解し、周囲温度で終夜撹拌した。溶液を減圧濃縮し、酢酸エチルに溶解し、過剰の樹脂結合炭酸水素ベンジルトリメチルアンモニウムと共に3時間撹拌した。ろ過し、濃縮して、199mg(54%)を得た。
4-アミノ-N-(4-メチルペンチル)-ピペリジン(199mg、1.08mmol)およびN,N-ジイソプロピル-エチルアミン(189μl、1.08mmol)をジクロロメタン/酢酸エチル1:1(5ml)に溶解し、0℃まで冷却した。トリホスゲン(107mg、0.36mmol)を加え、混合物を半時間撹拌した。溶媒を蒸発させ、中間体を6-イソプロピルアミノ-1,3-ベンゾチアゾール-2-チオール(242mg、1.08mmol)と共にTHF(5ml)に溶解し、60℃で終夜加熱した。溶媒を蒸発させ、粗生成物を調製用TLC(10%メタノール、90%ジクロロメタン)で精製して、31mg(7%)を得た。
1-イソプロピル-1-(2-メルカプト-ベンゾチアゾル-6-イル)-3-[1-(プロパン-2-スルホニル)-ピペリジン-4-イル]-尿素の調製:
段階1:
4-(N-BOC-アミノ)-ピペリジン(200mg、1.00mmol)およびトリエチルアミン(139μl、1.00mmol)をジクロロメタン(5ml)中で混合し、-10℃まで冷却した。塩化イソプロピルスルホニル(139μl、1.00mmol)を加え、反応混合物を周囲温度で終夜撹拌した。反応混合物を減圧濃縮し、得られた固体をジクロロメタン/トリフルオロ酢酸1:1(5ml)に溶解し、30分間撹拌した。溶液を減圧濃縮し、酢酸エチルに溶解し、炭酸水素ナトリウム水溶液、水および食塩水で抽出した。有機層を硫酸マグネシウムで乾燥し、濃縮して、179mg(81%)を得た。
4-アミノ-N-(イソプロピルスルファニル)-ピペリジン(179mg、0.805mmol)およびN,N-ジイソプロピルエチルアミン(140μl、0.805mmol)をジクロロメタン(3ml)に溶解し、0℃まで冷却した。トリホスゲン(80mg、0.268mmol)を加え、混合物を20分間撹拌した。溶媒を蒸発させ、中間体を6-イソプロピルアミノ-1,3-ベンゾチアゾール-2-チオール(90mg、0.403mmol)と共にTHF(3ml)に溶解し、60℃で終夜加熱した。生成物を調製用TLC(20%アセトニトリル、80%ジクロロメタン)で精製して、16.5mg(4%)を得た。
1-イソプロピル-1-(2-メルカプト-ベンゾチアゾール-6-イル)-3-(1-(4-メチル-ペンタノリル)-ピペリジン-4-イル]-尿素の調製
段階1:
4-(N-BOC-アミノ)-ピペリジン(200mg、1.00mmol)およびトリエチルアミン(142μl、1.00mmol)をジクロロメタン(4ml)中で混合した。塩化メチルバレロイル(139μl、1.00mmol)を加え、反応混合物を周囲温度で終夜撹拌した。反応混合物を減圧濃縮し、得られた固体を酢酸エチルに溶解し、炭酸水素ナトリウム水溶液、水および食塩水で洗浄した。有機層を硫酸マグネシウムで乾燥し、濃縮した。ジクロロメタン/トリフルオロ酢酸1:1(3ml)を加え、30分間撹拌した。溶液を減圧濃縮し、次いでDCMに溶解し、(炭酸水素ポリスチリルメチルアンモニウムを加え、4時間撹拌した。樹脂をろ去した。溶媒を単純に蒸発により除去した。
1-(4-アミノ-ピペリジン-1-イル)-4-メチル-ペンタン-1-オン(133mg、0.67mmol)およびN,N-ジイソプロピルエチルアミン(140μl、0.80mmol)をジクロロメタン(3ml)に溶解し、0℃まで冷却した。DCM中のトリホスゲン(80mg、0.268mmol)を加え、混合物を20分間撹拌した。溶媒を蒸発させ、中間体を6-イソプロピルアミノ-1,3-ベンゾチアゾール-2-チオール(90mg、0.403mmol)と共にTHF(3ml)に溶解し、60℃で終夜加熱した。生成物を調製用TLC(20%アセトニトリル、80%ジクロロメタン)で精製して、68mg(23%)を得た。
Claims (3)
- 下記からなる群より選択される、請求項1記載の化合物またはその薬学的に許容される塩:
1-イソプロピル-1-(2-メルカプト-ベンゾチアゾル-6-イル)-3-[1-(プロパン-2-スルホニル)-ピペリジン-4-イル]-尿素;
3-[1-(ブタン-1-スルホニル)-ピペリジン-4-イル]-1-イソプロピル-1-(2-メルカプト-ベンゾチアゾル-6-イル)-尿素;
3-(1-ベンゼンスルホニル-ピペリジン-4-イル)-1-イソプロピル-1-(2-メルカプト-ベンゾチアゾル-6-イル)-尿素;
1-イソプロピル-1-(2-メルカプト-ベンゾチアゾル-6-イル)-3-[1-(4-トリフルオロメトキシ-ベンゼンスルホニル)-ピペリジン-4-イル]-尿素;
1-イソプロピル-1-(2-メルカプト-ベンゾチアゾル-6-イル)-3-[1-(4-トリフルオロメチル-ベンゼンスルホニル)-ピペリジン-4-イル]-尿素;
1-イソプロピル-1-(2-メルカプト-ベンゾチアゾル-6-イル)-3-[1-(3-トリフルオロメチル-ベンゼンスルホニル)-ピペリジン-4-イル]-尿素;
3-[1-(3-クロロ-ベンゼンスルホニル)-ピペリジン-4-イル]-1-イソプロピル-1-(2-メルカプト-ベンゾチアゾル-6-イル)-尿素;
3-[1-(3-シアノ-ベンゼンスルホニル)-ピペリジン-4-イル]-1-イソプロピル-1-(2-メルカプト-ベンゾチアゾル-6-イル)-尿素;
3-[1-(4-tert-ブチル-ベンゼンスルホニル)-ピペリジン-4-イル]-1-イソプロピル-1-(2-メルカプト-ベンゾチアゾル-6-イル)-尿素;
3-[1-(4-イソプロポキシ-ベンゼンスルホニル)-ピペリジン-4-イル]-1-イソプロピル-1-(2-メルカプト-ベンゾチアゾル-6-イル)-尿素;
3-[1-(3-フルオロ-ベンゼンスルホニル)-ピペリジン-4-イル]-1-イソプロピル-1-(2-メルカプト-ベンゾチアゾル-6-イル)-尿素;
1-イソプロピル-1-(2-メルカプト-ベンゾチアゾル-6-イル)-3-[1-(4-プロピル-ベンゼンスルホニル)-ピペリジン-4-イル]-尿素;
1-イソプロピル-1-(2-メルカプト-ベンゾチアゾル-6-イル)-3-[1-(3-メトキシ-ベンゼンスルホニル)-ピペリジン-4-イル]-尿素;
1-イソプロピル-3-[1-(4-イソプロピル-ベンゼンスルホニル)-ピペリジン-4-イル]-1-(2-メルカプト-ベンゾチアゾル-6-イル)-尿素;
3-[1-(4-アセチル-ベンゼンスルホニル)-ピペリジン-4-イル]-1-イソプロピル-1-(2-メルカプト-ベンゾチアゾル-6-イル)-尿素;
3-[1-(4-エチル-ベンゼンスルホニル)-ピペリジン-4-イル]-1-イソプロピル-1-(2-メルカプト-ベンゾチアゾル-6-イル)-尿素;
1-イソプロピル-1-(2-メルカプト-ベンゾチアゾル-6-イル)-3-(1-フェニルメタンスルホニル-ピペリジン-4-イル)-尿素;
3-[1-(3-クロロ-4-フルオロ-ベンゼンスルホニル)-ピペリジン-4-イル]-1-イソプロピル-1-(2-メルカプト-ベンゾチアゾル-6-イル)-尿素;
1-イソプロピル-1-(2-メルカプト-ベンゾチアゾル-6-イル)-3-[1-(4-メトキシ-ベンゼンスルホニル)-ピペリジン-4-イル]-尿素;
3-[1-(4-シアノ-ベンゼンスルホニル)-ピペリジン-4-イル]-1-イソプロピル-1-(2-メルカプト-ベンゾチアゾル-6-イル)-尿素;
3-[1-(4-フルオロ-ベンゼンスルホニル)-ピペリジン-4-イル]-1-イソプロピル-1-(2-メルカプト-ベンゾチアゾル-6-イル)-尿素;および
3-[1-(5-ブロモ-6-クロロ-ピリジン-3-スルホニル)-ピペリジン-4-イル]-1-イソプロピル-1-(2-メルカプト-ベンゾチアゾル-6-イル)-尿素。 - 下記からなる群より選択される化合物またはその薬学的に許容される塩:
4-[3-イソプロピル-3-(2-メルカプト-ベンゾチアゾル-6-イル)-ウレイド]-ピペリジン-1-カルボン酸ベンジルエステル;
1-イソプロピル-1-(2-メルカプト-ベンゾチアゾル-6-イル)-3-[1-(4,4,4-トリフルオロ-ブチル)-ピペリジン-4-イル]-尿素;
1-イソプロピル-1-(2-メルカプト-ベンゾチアゾル-6-イル)-3-[1-(4-メチル-ペンチル)-ピペリジン-4-イル]-尿素;
3-[1-(4-ブトキシ-ベンゾイル)-ピペリジン-4-イル]-1-イソプロピル-1-(2-メルカプト-ベンゾチアゾル-6-イル)-尿素;
1-イソプロピル-1-(2-メルカプト-ベンゾチアゾル-6-イル)-3-[1-(4-トリフルオロメチル-ベンゾイル)-ピペリジン-4-イル]-尿素;
1-イソプロピル-1-(2-メルカプト-ベンゾチアゾル-6-イル)-3-[1-(2-フェノキシ-アセチル)-ピペリジン-4-イル]-尿素;
4-[3-イソプロピル-3-(2-メルカプト-ベンゾチアゾル-6-イル)-ウレイド]-ピペリジン-1-カルボン酸(4-トリフルオロメチル-フェニル)-アミド;
1-イソプロピル-1-(2-メルカプト-ベンゾチアゾル-6-イル)-3-[1-(3-フェニル-プロピオニル)-ピペリジン-4-イル]-尿素;
4-[3-イソプロピル-3-(2-メルカプト-ベンゾチアゾル-6-イル)-ウレイド]-ピペリジン-1-カルボン酸プロピルアミド;
3-[1-(3-シクロペンチル-プロピオニル)-ピペリジン-4-イル]-1-イソプロピル-1-(2-メルカプト-ベンゾチアゾル-6-イル)-尿素;
4-[3-イソプロピル-3-(2-メルカプト-ベンゾチアゾル-6-イル)-ウレイド]-ピペリジン-1-カルボン酸tert-ブチルエステル;
1-イソプロピル-1-(2-メルカプト-ベンゾチアゾル-6-イル)-3-[1-(4-メチル-ペンタノイル)-ピペリジン-4-イル]-尿素;
3-(1-ブチリル-ピペリジン-4-イル)-1-イソプロピル-1-(2-メルカプト-ベンゾチアゾル-6-イル)-尿素
4-{4-[3-イソプロピル-3-(2-メルカプト-ベンゾチアゾル-6-イル)-ウレイド]-ピペリジン-1-イル}-4-オキソ-酪酸メチルエステル;
3-[1-(4-フルオロ-ベンゾイル)-ピペリジン-4-イル]-1-イソプロピル-1-(2-メルカプト-ベンゾチアゾル-6-イル)-尿素;
1-イソプロピル-1-(2-メルカプト-ベンゾチアゾル-6-イル)-3-[1-(4-メトキシ-ベンゾイル)-ピペリジン-4-イル]-尿素;
3-[1-(フラン-2-カルボニル)-ピペリジン-4-イル]-1-イソプロピル-1-(2-メルカプト-ベンゾチアゾル-6-イル)-尿素;
1-イソプロピル-1-(2-メルカプト-ベンゾチアゾル-6-イル)-3-[1-(4-トリフルオロメトキシ-ベンゾイル)-ピペリジン-4-イル]-尿素;および
1-イソプロピル-1-(2-メルカプト-ベンゾチアゾール-6-イル)-3-(1-(4-メチル-ペンタノリル)-ピペリジン-4-イル]-尿素。
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US49212203P | 2003-08-01 | 2003-08-01 | |
| PCT/US2004/024332 WO2005011693A1 (en) | 2003-08-01 | 2004-07-28 | Piperidine compounds useful as malonyl-coa decarboxylase inhibitors |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2007501234A JP2007501234A (ja) | 2007-01-25 |
| JP4648317B2 true JP4648317B2 (ja) | 2011-03-09 |
Family
ID=34115600
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2006522612A Expired - Fee Related JP4648317B2 (ja) | 2003-08-01 | 2004-07-28 | マロニル−CoAデカルボキシラーゼ阻害剤として有用なピペリジン化合物 |
Country Status (8)
| Country | Link |
|---|---|
| US (2) | US7449482B2 (ja) |
| EP (1) | EP1653957B1 (ja) |
| JP (1) | JP4648317B2 (ja) |
| AT (1) | ATE400272T1 (ja) |
| CA (1) | CA2533749C (ja) |
| DE (1) | DE602004014937D1 (ja) |
| ES (1) | ES2309563T3 (ja) |
| WO (1) | WO2005011693A1 (ja) |
Families Citing this family (18)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2002066035A2 (en) * | 2001-02-20 | 2002-08-29 | Chugai Seiyaku Kabushiki Kaisha | Azoles as malonyl-coa decarboxylase inhibitors useful as metabolic modulators |
| US7709510B2 (en) * | 2001-02-20 | 2010-05-04 | Chugai Seiyaku Kabushiki Kaisha | Azoles as malonyl-CoA decarboxylase inhibitors useful as metabolic modulators |
| AU2004212004B2 (en) * | 2003-02-13 | 2008-01-10 | Albert Einstein College Of Medicine Of Yeshiva University | Regulation of food intake and glucose production by modulation of long-chain fatty acyl-coa levels in the hypothalamus |
| EP1653944B1 (en) | 2003-08-01 | 2010-11-10 | Chugai Seiyaku Kabushiki Kaisha | Heterocyclic compounds useful as malonyl-coa decarboxylase inhibitors |
| ES2309563T3 (es) * | 2003-08-01 | 2008-12-16 | Chugai Seiyaku Kabushiki Kaisha | Compuestos de piperidina utiles como inhibidores de malonil coenzima a descarboxilasa. |
| JP4773960B2 (ja) * | 2003-08-01 | 2011-09-14 | 中外製薬株式会社 | マロニル−CoAデカルボキシラーゼ阻害剤として有用なシアノグアニジン型アゾール化合物 |
| TW200630337A (en) * | 2004-10-14 | 2006-09-01 | Euro Celtique Sa | Piperidinyl compounds and the use thereof |
| US20070026079A1 (en) * | 2005-02-14 | 2007-02-01 | Louis Herlands | Intranasal administration of modulators of hypothalamic ATP-sensitive potassium channels |
| WO2007110449A1 (en) | 2006-03-29 | 2007-10-04 | Euro-Celtique S.A. | Benzenesulfonamide compounds and their use |
| WO2007118853A1 (en) | 2006-04-13 | 2007-10-25 | Euro-Celtique S.A. | Benzenesulfonamide compounds and their use as blockers of calcium channels |
| TW200812963A (en) | 2006-04-13 | 2008-03-16 | Euro Celtique Sa | Benzenesulfonamide compounds and the use thereof |
| US7879887B2 (en) | 2006-06-29 | 2011-02-01 | Nissan Chemical Industries, Ltd. | α-amino acid derivatives and medicaments containing the same as an active ingredient |
| WO2008094862A1 (en) * | 2007-01-29 | 2008-08-07 | Arete Therapeutics, Inc. | Processes for the preparation of piperidinyl-substituted urea compounds |
| WO2008124118A1 (en) * | 2007-04-09 | 2008-10-16 | Purdue Pharma L.P. | Benzenesulfonyl compounds and the use therof |
| US8765736B2 (en) | 2007-09-28 | 2014-07-01 | Purdue Pharma L.P. | Benzenesulfonamide compounds and the use thereof |
| CA2798330A1 (en) | 2010-05-05 | 2011-11-10 | Infinity Pharmaceuticals, Inc. | Tetrazolones as inhibitors of fatty acid synthase |
| WO2011140296A1 (en) | 2010-05-05 | 2011-11-10 | Infinity Pharmaceuticals | Triazoles as inhibitors of fatty acid synthase |
| US9393221B2 (en) | 2011-07-20 | 2016-07-19 | The General Hospital Corporation | Methods and compounds for reducing intracellular lipid storage |
Family Cites Families (92)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US2863874A (en) * | 1955-05-26 | 1958-12-09 | Goodrich Co B F | Process of preparing 2-aminothiazoles |
| US3728455A (en) * | 1971-06-24 | 1973-04-17 | American Cyanamid Co | Novel compositions of matter |
| US4499103A (en) * | 1983-03-17 | 1985-02-12 | Merck & Co., Inc. | Benzothiazole-2-sulfonamide derivatives for the topical treatment of elevated intraocular pressure |
| DE3484096D1 (de) | 1983-11-30 | 1991-03-14 | Janssen Pharmaceutica Nv | Bizyklisches heterozyklyl aufveisende n-(bizyklisches heterozyklyl-4-piperidinamine. |
| JPS60202872A (ja) * | 1984-03-27 | 1985-10-14 | Kaken Pharmaceut Co Ltd | ベンゾフラン誘導体、その製法およびそれを有効成分とする降圧剤 |
| CA1281325C (en) | 1984-06-20 | 1991-03-12 | Patrice C. Belanger | Benzofuran derivatives |
| US4783443A (en) | 1986-03-03 | 1988-11-08 | The University Of Chicago | Amino acyl cephalosporin derivatives |
| GB8714537D0 (en) | 1987-06-22 | 1987-07-29 | Ici Plc | Pyrazine derivatives |
| EP0733366B1 (en) | 1988-01-07 | 1998-04-01 | E.I. Du Pont De Nemours And Company | Pharmaceutical compositions comprising angiotensin II receptor blocking imidazoles and diuretics |
| FI916130A7 (fi) | 1989-06-30 | 1991-12-27 | Du Pont | Aryylisubstituoituja imidatsoleja |
| FI916129A7 (fi) | 1989-06-30 | 1991-12-27 | Du Pont | Substituoituja imidatsoleja |
| SU1681502A1 (ru) | 1989-07-26 | 1994-06-15 | Всесоюзный Научно-Исследовательский Химико-Фармацевтический Институт Им.С.Орджоникидзе | Гидрохлорид 3-(2,5- диметоксибензоил) -4- диметиламинометил -5-окси-6- бромбензофурана, обладающий анальгетическим, местноанестезирующим, противосудорожным, противоаритмическим, стимулирующим коронарный, мозговой и почечный кровоток действиями |
| RU1743153C (ru) | 1990-06-04 | 1995-02-27 | ВНИИ химических средств защиты растений | N-[4-2'-гидроксигексафторизопропил)фенил] -n-этил-n'-фенилмочевина, обладающая рострегулирующим и антидотным действием |
| WO1992000067A2 (en) | 1990-06-22 | 1992-01-09 | E.I. Du Pont De Nemours And Company | Treatment of chronic renal failure with imidazole angiotensin-ii receptor antagonists |
| EP0480716A1 (en) * | 1990-10-12 | 1992-04-15 | Merck Frosst Canada Inc. | Saturated hydroxyalkylquinoline acids as leukotriene antagonists |
| US5470975A (en) * | 1990-10-16 | 1995-11-28 | E.R. Squibb & Sons, Inc. | Dihydropyrimidine derivatives |
| CA2053148A1 (en) | 1990-10-16 | 1992-04-17 | Karnail Atwal | Dihydropyrimidine derivatives |
| US5374615A (en) * | 1990-10-31 | 1994-12-20 | E. R. Squibb & Sons, Inc. | Indole- and benzimidazole-substituted imidazole and benzimidazole derivatives |
| SU1825496A3 (ru) | 1991-04-04 | 1994-12-30 | Всесоюзный научно-исследовательский институт химических средств защиты растений | Производные n-[4-(1-гидрокси-1-трифторметил-2,2,2-трифторэтил)фенил]мочевины, обладающие антидотной активностью к 2-хлор-n-[(4-метокси-6-метил-1,3,5-триазин-2-ил)аминокарбонил] бензолсульфамиду в посевах льна |
| JPH05124925A (ja) | 1991-04-09 | 1993-05-21 | Sansho Seiyaku Co Ltd | メラニン生成抑制外用剤 |
| US5190942A (en) * | 1991-04-22 | 1993-03-02 | E. R. Squibb & Sons, Inc. | Benzoxazole and related heterocyclic substituted imidazole and benzimidazole derivatives |
| US5177097A (en) * | 1991-07-24 | 1993-01-05 | E. R. Squibb & Sons, Inc. | Acyl amidine and acyl, guanidine substituted biphenyl derivatives |
| US5256695A (en) * | 1991-07-24 | 1993-10-26 | E. R. Squibb & Sons, Inc. | Acyl amidine and acyl guanidine substituted biphenyl derivatives |
| JPH06510763A (ja) * | 1991-08-19 | 1994-12-01 | イー・アイ・デュポン・ドゥ・ヌムール・アンド・カンパニー | アンジオテンシン2受容体遮断イミダゾリノン誘導体 |
| US5212177A (en) * | 1991-12-16 | 1993-05-18 | E. R. Squibb & Sons, Inc. | Indole and benzimidazole-substituted dihydropyrimidine derivatives |
| US5350752A (en) | 1991-12-16 | 1994-09-27 | E. R. Squibb & Sons, Inc. | Dihydropyrimidine derivatives |
| US5225408A (en) * | 1991-12-20 | 1993-07-06 | E. R. Squibb & Sons, Inc. | Biphenyl oxadiazinone angiotensin II inhibitors |
| TW297025B (ja) | 1992-02-14 | 1997-02-01 | Squibb & Sons Inc | |
| US5208235A (en) * | 1992-03-10 | 1993-05-04 | E. R. Squibb & Sons, Inc. | Indole- and benzimidazole-substituted imidazole derivatives |
| US5208234A (en) * | 1992-03-10 | 1993-05-04 | E. R. Squibb & Sons, Inc. | Substituted imidazole phosphonic and phosphinic acid derivatives |
| WO1993021168A1 (en) | 1992-04-10 | 1993-10-28 | Merck Frosst Canada Inc. | Thiazole-substituted benzyl alcohols as leukotriene antagonists |
| US5506227A (en) | 1992-04-13 | 1996-04-09 | Merck Frosst Canada, Inc. | Pyridine-substituted benzyl alcohols as leukotriene antagonists |
| US5378704A (en) * | 1992-04-15 | 1995-01-03 | E. R. Squibb & Sons, Inc. | Non-peptidic angiotensin-II-receptor-antagonists |
| US5534347A (en) * | 1992-09-04 | 1996-07-09 | Eastman Kodak Company | Fusing roll having a fluorocarbon-silicone barrier layer |
| RU2106710C1 (ru) | 1992-10-30 | 1998-03-10 | Лорд Корпорейшн | Магнитореологический материал |
| GB9226860D0 (en) | 1992-12-23 | 1993-02-17 | Leo Pharm Prod Ltd | Novel treatment |
| EP0759432A1 (en) | 1993-01-15 | 1997-02-26 | G.D. Searle & Co. | Use of medicaments containing 3,4-diaryl furans and analogs thereof for treating a skin-related condition |
| DE4302681A1 (de) | 1993-02-01 | 1994-08-04 | Hoechst Ag | Sulfonsäureester, damit hergestellte strahlungsempfindliche Gemische und deren Verwendung |
| DE4306152A1 (de) * | 1993-02-27 | 1994-09-01 | Hoechst Ag | Positiv arbeitendes strahlungsempfindliches Gemisch und damit hergestelltes Aufzeichnungsmaterial |
| JPH07188227A (ja) | 1993-12-24 | 1995-07-25 | Japan Tobacco Inc | チアゾリジン誘導体及びオキサゾール誘導体 |
| JPH09509156A (ja) * | 1994-02-03 | 1997-09-16 | ケンブリッジ・ニューロサイエンス・インコーポレーテッド | 治療用グアニジン類 |
| US5519040A (en) | 1994-04-29 | 1996-05-21 | Allergan | Substituted thiazole sulfonamides as antiglaucoma agents |
| US5637599A (en) | 1994-06-17 | 1997-06-10 | Corvas International, Inc. | Arginine mimic derivatives as enzyme inhibitors |
| US5932733A (en) | 1994-06-17 | 1999-08-03 | Corvas International, Inc. | 3-amino-2-oxo-1-piperidineacetic derivatives containing an arginine mimic as enzyme inhibitors |
| WO1995035311A1 (en) | 1994-06-17 | 1995-12-28 | Corvas International, Inc. | 3-amino-2-oxo-1-piperidineacetic derivatives as enzyme inhibitors |
| US5519143A (en) * | 1994-09-19 | 1996-05-21 | The Du Pont Merck Pharmaceutical Company | Process for the isolation and purification of an imidazole stereoisomer from a mixture of stereoisomers by selective precipitation |
| US5552437A (en) | 1994-10-27 | 1996-09-03 | Merck Frosst Canada, Inc. | Bisarylcarbinol derivatives as inhibitors of leukotriene biosynthesis |
| US5527827A (en) | 1994-10-27 | 1996-06-18 | Merck Frosst Canada, Inc. | Bisarylcarbinol cinnamic acids as inhibitors of leukotriene biosynthesis |
| US5674876A (en) * | 1995-01-20 | 1997-10-07 | Research Development Foundation | ρ-heteroatom-substituted phenols and uses thereof |
| JPH08311036A (ja) | 1995-03-14 | 1996-11-26 | Takeda Chem Ind Ltd | ピラゾール誘導体、その用途 |
| IL117534A0 (en) | 1995-03-24 | 1996-07-23 | Rhone Poulenc Agrochimie | Reagent and process which are useful for grafting a substituted difluoromethyl group onto a compound containing at least one electrophilic function |
| JPH0912585A (ja) | 1995-06-30 | 1997-01-14 | Ube Ind Ltd | 高配位典型元素錯体 |
| JPH11510814A (ja) | 1995-08-30 | 1999-09-21 | ジー.ディー.サール アンド カンパニー | インテグリンアンタゴニストとしてのメタ−グアニジン、尿素、チオ尿素またはアザ環状アミノ安息香酸誘導体 |
| JPH09124632A (ja) | 1995-10-31 | 1997-05-13 | Sankyo Co Ltd | ベンゾヘテロ環誘導体 |
| FR2756825B1 (fr) | 1996-12-10 | 1999-01-08 | Adir | Nouveaux derives [3h]-benzoxazole-2-thiones et [3h]- benzothiazole-2-thiones substitues, leur procede de preparation et les compositions pharmaceutiques qui les contiennent |
| GB2321244B (en) | 1997-01-20 | 2000-11-22 | Pharmacia & Upjohn Spa | Vitamin D3 analogues,process for preparing them,and their use as antiproliferative and antitumour agents |
| DE19716231A1 (de) | 1997-04-18 | 1998-10-22 | Studiengesellschaft Kohle Mbh | Olefinmetathese in komprimiertem Kohlendioxid |
| DE19722952A1 (de) | 1997-05-31 | 1998-12-03 | Huels Chemische Werke Ag | Verwendung von Polymeren zur Inhibierung der Denaturierung von adsorbierten Eiweißstoffen |
| US5895771A (en) * | 1997-06-05 | 1999-04-20 | Akzo Nobel Nv | Fluorinated alkoxy and/or aryloxy aluminates as cocatalysts for metallocene-catalyzed olefin polymerizations |
| US5977413A (en) * | 1997-08-04 | 1999-11-02 | Nippon Kayaku Kabushiki Kaisha | Method for producing bis(3-amino-4-hydroxyphenyl) compounds |
| AU9392898A (en) | 1997-09-11 | 1999-03-29 | Colorado State University Research Foundation | Weakly coordinating anions containing polyfluoroalkoxide ligands |
| WO1999047497A2 (en) | 1998-03-13 | 1999-09-23 | Merck Frosst Canada & Co. | Carboxylic acids and acylsulfonamides, compositions containing such compounds and methods of treatment |
| GB2337701A (en) | 1998-05-26 | 1999-12-01 | United Medical And Dental Schools Of Guys St Thomas Hospitals | Treatment of ischemia with an angiotensin II antagonist |
| DE19825182A1 (de) | 1998-06-05 | 1999-12-09 | Agfa Gevaert Ag | Reifung von Silberhalogenidemulsionen |
| ATE288904T1 (de) | 1998-06-18 | 2005-02-15 | Bristol Myers Squibb Co | Durch kohlenstoff substituierte aminothiazole als inhibitoren von zyclin-abhägigen kinasen |
| WO2000009710A2 (en) | 1998-08-11 | 2000-02-24 | The Governors Of The University Of Alberta | Compositions and methods for identifying mammalian malonyl coa decarboxylase inhibitors, agonists and antagonists |
| FR2784114B1 (fr) | 1998-09-18 | 2001-02-02 | Thomson Csf | Materiaux polymeres absorbant les composes organophosphores. procede de synthese de ces materiaux. capteurs chimiques comprenant ces materiaux |
| ID26727A (id) | 1998-10-05 | 2001-02-01 | B F Goodrich Company Cs | Katalis dan metoda untuk polimerisasi sikloolefin |
| JP2000128878A (ja) | 1998-10-28 | 2000-05-09 | Teijin Ltd | ベンゾフリル−α−ピリドン誘導体 |
| KR100739482B1 (ko) | 1998-12-09 | 2007-07-13 | 스미토모 베이클라이트 가부시키가이샤 | 제 10족 금속 착물을 사용하는 노르보르넨형 단량체의 몰드내 첨가 중합반응 |
| EP1140784A2 (en) | 1998-12-22 | 2001-10-10 | Neurosearch A/S | Ion channel modulating agents |
| TR200101869T2 (tr) | 1998-12-23 | 2002-01-21 | Smithkline Beecham Corporation | Proteaz İnhibitörleri. |
| US20030144175A1 (en) * | 1998-12-23 | 2003-07-31 | Smithkline Beecham Corporation | Protease inhibitors |
| EP1150955A2 (en) | 1999-02-04 | 2001-11-07 | Millennium Pharmaceuticals, Inc. | G-protein coupled heptahelical receptor binding compounds and methods of use thereof |
| EP1156803A4 (en) * | 1999-02-09 | 2004-03-17 | Bristol Myers Squibb Co | FXA LACTAM INHIBITORS AND METHOD |
| GB9904933D0 (en) | 1999-03-04 | 1999-04-28 | Glaxo Group Ltd | Compounds |
| US6316503B1 (en) | 1999-03-15 | 2001-11-13 | Tularik Inc. | LXR modulators |
| US6503949B1 (en) * | 1999-05-17 | 2003-01-07 | Noro Nordisk A/S | Glucagon antagonists/inverse agonists |
| PL352367A1 (en) | 1999-05-17 | 2003-08-25 | Novo Nordisk As | Glucagon antagonists/inverse agonists |
| JP2004500332A (ja) | 1999-07-08 | 2004-01-08 | テュラリク インコーポレイテッド | Hdlコレステロール値を上昇させる組成物および方法 |
| AU7320100A (en) | 1999-09-24 | 2001-04-24 | Ono Pharmaceutical Co. Ltd. | Hydroxamic acid derivatives, process for the production thereof and drugs containing the same as the active ingredient |
| BR0111693A (pt) | 2000-06-14 | 2004-04-06 | Smithkline Beecham Corp | Inibidores de protease |
| HU227197B1 (en) * | 2000-10-24 | 2010-10-28 | Richter Gedeon Nyrt | Nmda receptor antagonist carboxylic acid amide derivatives and pharmaceutical compositions containing them |
| JP4503232B2 (ja) | 2001-01-26 | 2010-07-14 | 中外製薬株式会社 | マロニル−CoA脱炭酸酵素阻害剤を用いた疾患の治療法 |
| JP4267920B2 (ja) | 2001-01-26 | 2009-05-27 | 中外製薬株式会社 | 代謝調節剤として有用なマロニル−CoA脱炭酸酵素阻害剤 |
| ATE509014T1 (de) | 2001-01-26 | 2011-05-15 | Chugai Pharmaceutical Co Ltd | Malonyl coa-decarboxylase inhibitoren als stoffwechselmodulatoren |
| US7709510B2 (en) * | 2001-02-20 | 2010-05-04 | Chugai Seiyaku Kabushiki Kaisha | Azoles as malonyl-CoA decarboxylase inhibitors useful as metabolic modulators |
| WO2002066035A2 (en) * | 2001-02-20 | 2002-08-29 | Chugai Seiyaku Kabushiki Kaisha | Azoles as malonyl-coa decarboxylase inhibitors useful as metabolic modulators |
| ES2309563T3 (es) * | 2003-08-01 | 2008-12-16 | Chugai Seiyaku Kabushiki Kaisha | Compuestos de piperidina utiles como inhibidores de malonil coenzima a descarboxilasa. |
| EP1653944B1 (en) * | 2003-08-01 | 2010-11-10 | Chugai Seiyaku Kabushiki Kaisha | Heterocyclic compounds useful as malonyl-coa decarboxylase inhibitors |
| WO2005011812A1 (en) * | 2003-08-01 | 2005-02-10 | Chugai Seiyaku Kabushiki Kaisha | Cyanoamide compounds useful as malonyl-coa decarboxylase inhibithors |
| JP4773960B2 (ja) * | 2003-08-01 | 2011-09-14 | 中外製薬株式会社 | マロニル−CoAデカルボキシラーゼ阻害剤として有用なシアノグアニジン型アゾール化合物 |
-
2004
- 2004-07-28 ES ES04779398T patent/ES2309563T3/es not_active Expired - Lifetime
- 2004-07-28 US US10/900,705 patent/US7449482B2/en not_active Expired - Fee Related
- 2004-07-28 JP JP2006522612A patent/JP4648317B2/ja not_active Expired - Fee Related
- 2004-07-28 AT AT04779398T patent/ATE400272T1/de not_active IP Right Cessation
- 2004-07-28 CA CA2533749A patent/CA2533749C/en not_active Expired - Fee Related
- 2004-07-28 EP EP04779398A patent/EP1653957B1/en not_active Expired - Lifetime
- 2004-07-28 WO PCT/US2004/024332 patent/WO2005011693A1/en not_active Ceased
- 2004-07-28 DE DE602004014937T patent/DE602004014937D1/de not_active Expired - Lifetime
-
2008
- 2008-10-03 US US12/245,558 patent/US8080665B2/en not_active Expired - Fee Related
Also Published As
| Publication number | Publication date |
|---|---|
| US20090124660A1 (en) | 2009-05-14 |
| US20050032828A1 (en) | 2005-02-10 |
| WO2005011693A1 (en) | 2005-02-10 |
| EP1653957B1 (en) | 2008-07-09 |
| US8080665B2 (en) | 2011-12-20 |
| ES2309563T3 (es) | 2008-12-16 |
| DE602004014937D1 (de) | 2008-08-21 |
| CA2533749C (en) | 2012-07-10 |
| US7449482B2 (en) | 2008-11-11 |
| JP2007501234A (ja) | 2007-01-25 |
| ATE400272T1 (de) | 2008-07-15 |
| EP1653957A1 (en) | 2006-05-10 |
| CA2533749A1 (en) | 2005-02-10 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP4842247B2 (ja) | マロニル−CoA脱炭酸酵素阻害剤を用いた代謝性疾患の治療法 | |
| US8080665B2 (en) | Piperidine compounds useful as malonyl-CoA decarboxylase inhibitors | |
| JP4727579B2 (ja) | マロニル−CoAデカルボキシラーゼ阻害剤として有用なシアノアミド化合物 | |
| JP4503232B2 (ja) | マロニル−CoA脱炭酸酵素阻害剤を用いた疾患の治療法 | |
| JP4727578B2 (ja) | マロニル−CoAデカルボキシラーゼ阻害剤として有用な複素環式化合物 | |
| US8110686B2 (en) | Azoles as malonyl-CoA decarboxylase inhibitors useful as metabolic modulators | |
| JP4773960B2 (ja) | マロニル−CoAデカルボキシラーゼ阻害剤として有用なシアノグアニジン型アゾール化合物 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20070717 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20100825 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20101019 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20101115 |
|
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20101209 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20131217 Year of fee payment: 3 |
|
| R150 | Certificate of patent or registration of utility model |
Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| LAPS | Cancellation because of no payment of annual fees |