JP2022075813A - ジクアホソル含有点眼液 - Google Patents
ジクアホソル含有点眼液 Download PDFInfo
- Publication number
- JP2022075813A JP2022075813A JP2022039183A JP2022039183A JP2022075813A JP 2022075813 A JP2022075813 A JP 2022075813A JP 2022039183 A JP2022039183 A JP 2022039183A JP 2022039183 A JP2022039183 A JP 2022039183A JP 2022075813 A JP2022075813 A JP 2022075813A
- Authority
- JP
- Japan
- Prior art keywords
- diquafosol
- sodium
- ophthalmic solution
- chelating agent
- acid
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Granted
Links
- 229950003529 diquafosol Drugs 0.000 title abstract description 113
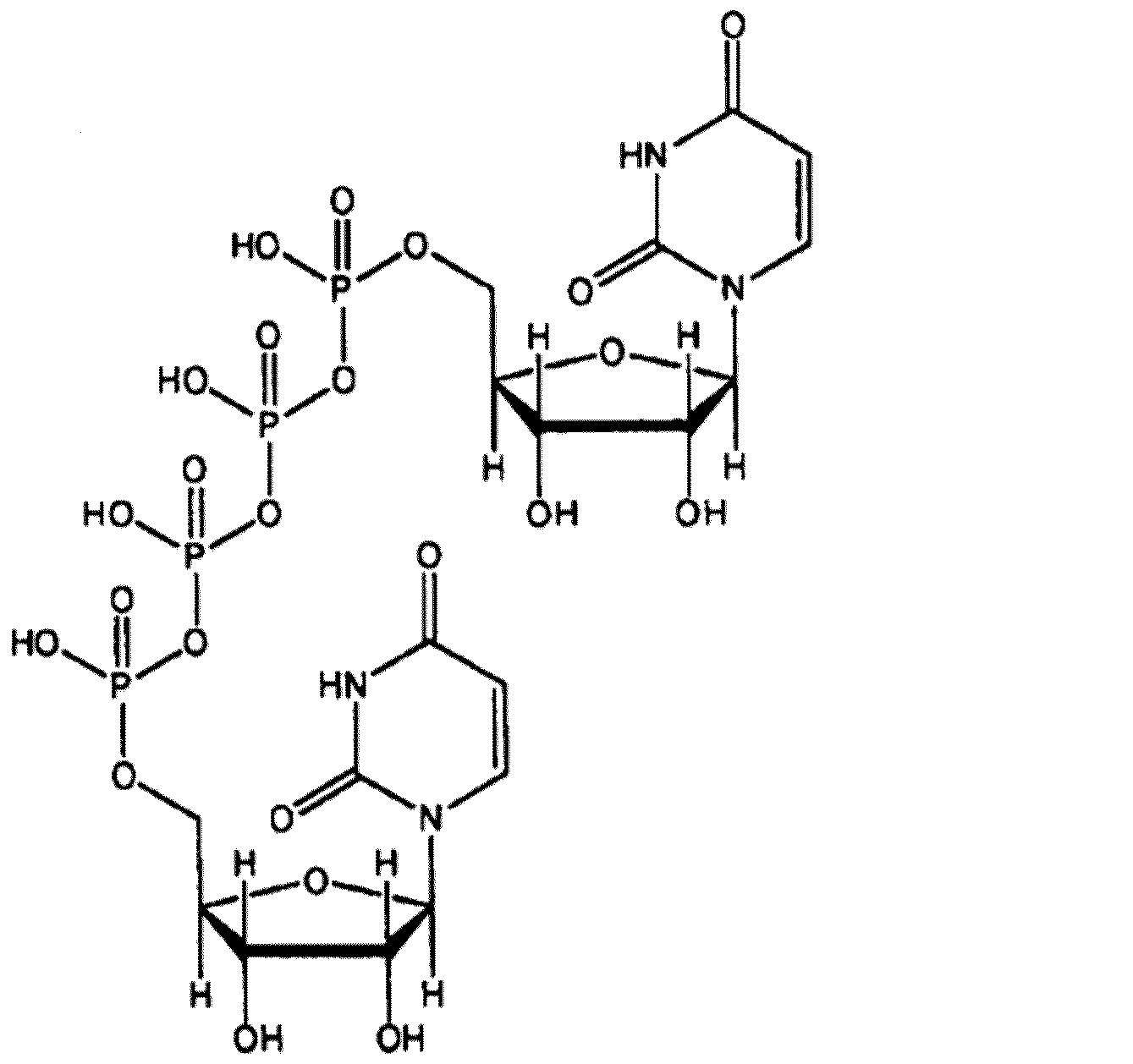
- NMLMACJWHPHKGR-NCOIDOBVSA-N P(1),P(4)-bis(uridin-5'-yl) tetraphosphate Chemical compound N1([C@@H]2O[C@@H]([C@H]([C@H]2O)O)COP(O)(=O)OP(O)(=O)OP(O)(=O)OP(O)(=O)OC[C@@H]2[C@H]([C@H]([C@@H](O2)N2C(NC(=O)C=C2)=O)O)O)C=CC(=O)NC1=O NMLMACJWHPHKGR-NCOIDOBVSA-N 0.000 title abstract description 75
- 239000003889 eye drop Substances 0.000 title abstract description 41
- 229940012356 eye drops Drugs 0.000 title abstract description 22
- 238000001914 filtration Methods 0.000 abstract description 65
- 239000002738 chelating agent Substances 0.000 abstract description 61
- 238000000034 method Methods 0.000 abstract description 41
- 238000004519 manufacturing process Methods 0.000 abstract description 36
- 238000003860 storage Methods 0.000 abstract description 30
- 239000002244 precipitate Substances 0.000 abstract description 27
- 230000001954 sterilising effect Effects 0.000 abstract description 26
- 238000004659 sterilization and disinfection Methods 0.000 abstract description 24
- 206010015946 Eye irritation Diseases 0.000 abstract description 15
- 230000000694 effects Effects 0.000 abstract description 15
- 231100000013 eye irritation Toxicity 0.000 abstract description 15
- 238000004321 preservation Methods 0.000 abstract description 9
- 238000009826 distribution Methods 0.000 abstract description 6
- 230000006866 deterioration Effects 0.000 abstract description 2
- 230000015572 biosynthetic process Effects 0.000 abstract 1
- 239000000243 solution Substances 0.000 abstract 1
- 239000002997 ophthalmic solution Substances 0.000 description 80
- 229940054534 ophthalmic solution Drugs 0.000 description 79
- 235000002639 sodium chloride Nutrition 0.000 description 73
- 150000003839 salts Chemical class 0.000 description 53
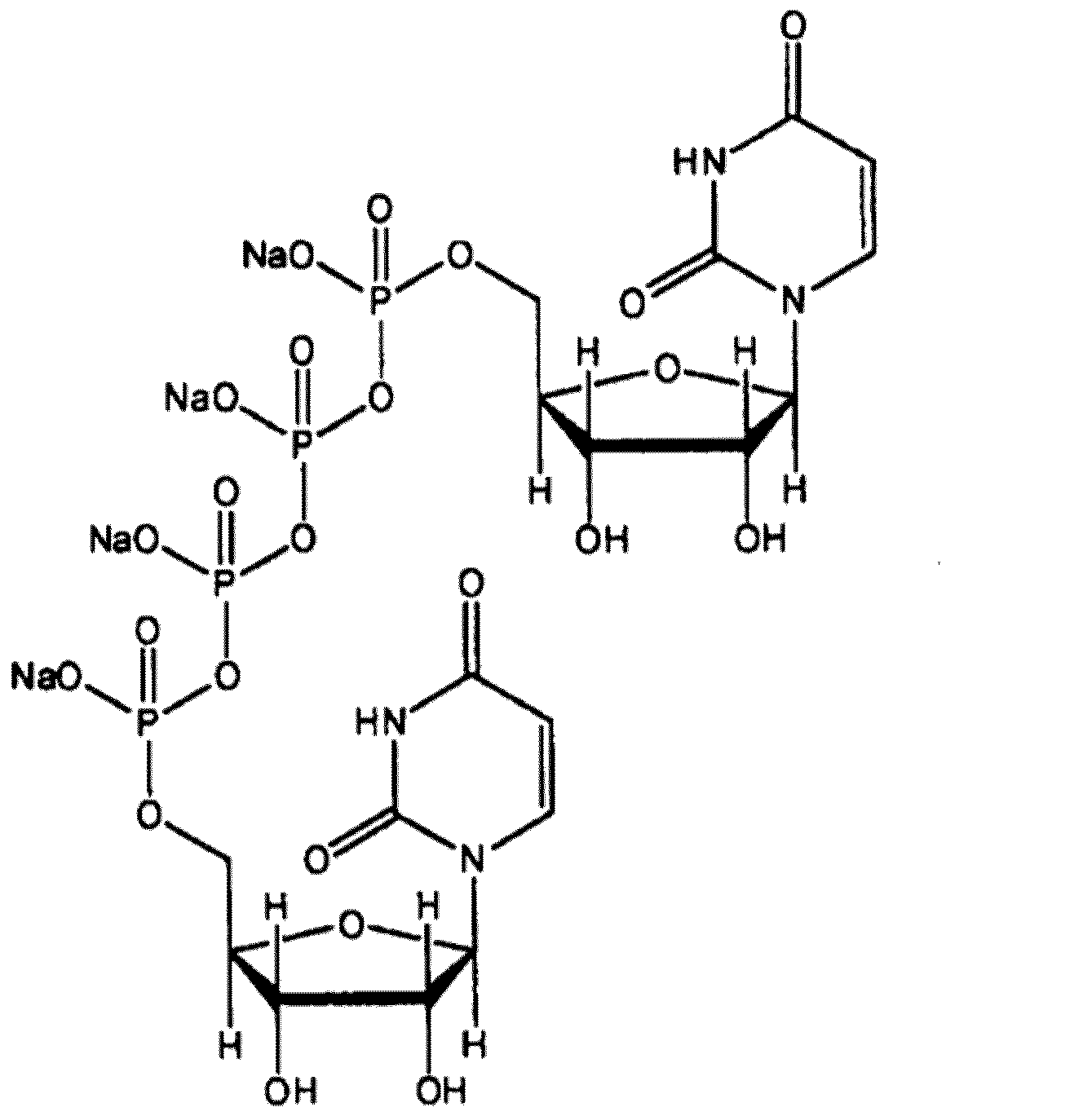
- OWTGMPPCCUSXIP-FNXFGIETSA-J tetrasodium;[[(2r,3s,4r,5r)-5-(2,4-dioxopyrimidin-1-yl)-3,4-dihydroxyoxolan-2-yl]methoxy-oxidophosphoryl] [[[(2r,3s,4r,5r)-5-(2,4-dioxopyrimidin-1-yl)-3,4-dihydroxyoxolan-2-yl]methoxy-oxidophosphoryl]oxy-oxidophosphoryl] phosphate Chemical compound [Na+].[Na+].[Na+].[Na+].N1([C@@H]2O[C@@H]([C@H]([C@H]2O)O)COP([O-])(=O)OP([O-])(=O)OP([O-])(=O)OP([O-])(=O)OC[C@@H]2[C@H]([C@H]([C@@H](O2)N2C(NC(=O)C=C2)=O)O)O)C=CC(=O)NC1=O OWTGMPPCCUSXIP-FNXFGIETSA-J 0.000 description 42
- WCUXLLCKKVVCTQ-UHFFFAOYSA-M Potassium chloride Chemical compound [Cl-].[K+] WCUXLLCKKVVCTQ-UHFFFAOYSA-M 0.000 description 40
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 40
- 238000009472 formulation Methods 0.000 description 37
- 239000000203 mixture Substances 0.000 description 37
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 36
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 34
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 27
- 229940009662 edetate Drugs 0.000 description 25
- 238000012360 testing method Methods 0.000 description 24
- LVXHNCUCBXIIPE-UHFFFAOYSA-L disodium;hydrogen phosphate;hydrate Chemical compound O.[Na+].[Na+].OP([O-])([O-])=O LVXHNCUCBXIIPE-UHFFFAOYSA-L 0.000 description 21
- 239000001103 potassium chloride Substances 0.000 description 20
- 235000011164 potassium chloride Nutrition 0.000 description 20
- 239000011780 sodium chloride Substances 0.000 description 20
- VEXZGXHMUGYJMC-UHFFFAOYSA-M Chloride anion Chemical compound [Cl-] VEXZGXHMUGYJMC-UHFFFAOYSA-M 0.000 description 16
- 230000003204 osmotic effect Effects 0.000 description 16
- 239000003002 pH adjusting agent Substances 0.000 description 16
- 230000002335 preservative effect Effects 0.000 description 16
- 239000003755 preservative agent Substances 0.000 description 14
- 229920000388 Polyphosphate Polymers 0.000 description 12
- 239000001205 polyphosphate Substances 0.000 description 12
- 235000011176 polyphosphates Nutrition 0.000 description 12
- 229960004106 citric acid Drugs 0.000 description 11
- 235000015165 citric acid Nutrition 0.000 description 11
- 125000005341 metaphosphate group Chemical group 0.000 description 11
- 239000008213 purified water Substances 0.000 description 10
- 239000002253 acid Substances 0.000 description 9
- OVBJJZOQPCKUOR-UHFFFAOYSA-L EDTA disodium salt dihydrate Chemical compound O.O.[Na+].[Na+].[O-]C(=O)C[NH+](CC([O-])=O)CC[NH+](CC([O-])=O)CC([O-])=O OVBJJZOQPCKUOR-UHFFFAOYSA-L 0.000 description 8
- 238000002360 preparation method Methods 0.000 description 8
- 208000003556 Dry Eye Syndromes Diseases 0.000 description 7
- 206010013774 Dry eye Diseases 0.000 description 7
- 229960000686 benzalkonium chloride Drugs 0.000 description 7
- CADWTSSKOVRVJC-UHFFFAOYSA-N benzyl(dimethyl)azanium;chloride Chemical compound [Cl-].C[NH+](C)CC1=CC=CC=C1 CADWTSSKOVRVJC-UHFFFAOYSA-N 0.000 description 7
- 229960001484 edetic acid Drugs 0.000 description 7
- BBMCTIGTTCKYKF-UHFFFAOYSA-N 1-heptanol Chemical compound CCCCCCCO BBMCTIGTTCKYKF-UHFFFAOYSA-N 0.000 description 6
- 239000002585 base Substances 0.000 description 6
- 239000013078 crystal Substances 0.000 description 6
- 238000011056 performance test Methods 0.000 description 6
- 229940037001 sodium edetate Drugs 0.000 description 6
- 238000010998 test method Methods 0.000 description 6
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 5
- 239000007864 aqueous solution Substances 0.000 description 5
- MOMKYJPSVWEWPM-UHFFFAOYSA-N 4-(chloromethyl)-2-(4-methylphenyl)-1,3-thiazole Chemical compound C1=CC(C)=CC=C1C1=NC(CCl)=CS1 MOMKYJPSVWEWPM-UHFFFAOYSA-N 0.000 description 4
- 241000222122 Candida albicans Species 0.000 description 4
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 4
- IMQLKJBTEOYOSI-GPIVLXJGSA-N Inositol-hexakisphosphate Chemical compound OP(O)(=O)O[C@H]1[C@H](OP(O)(O)=O)[C@@H](OP(O)(O)=O)[C@H](OP(O)(O)=O)[C@H](OP(O)(O)=O)[C@@H]1OP(O)(O)=O IMQLKJBTEOYOSI-GPIVLXJGSA-N 0.000 description 4
- 229940095731 candida albicans Drugs 0.000 description 4
- XPPKVPWEQAFLFU-UHFFFAOYSA-N diphosphoric acid Chemical compound OP(O)(=O)OP(O)(O)=O XPPKVPWEQAFLFU-UHFFFAOYSA-N 0.000 description 4
- 230000007794 irritation Effects 0.000 description 4
- 238000002156 mixing Methods 0.000 description 4
- 235000002949 phytic acid Nutrition 0.000 description 4
- 239000011148 porous material Substances 0.000 description 4
- 235000019983 sodium metaphosphate Nutrition 0.000 description 4
- 235000019830 sodium polyphosphate Nutrition 0.000 description 4
- 159000000000 sodium salts Chemical class 0.000 description 4
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 3
- 241000894006 Bacteria Species 0.000 description 3
- YASYEJJMZJALEJ-UHFFFAOYSA-N Citric acid monohydrate Chemical compound O.OC(=O)CC(O)(C(O)=O)CC(O)=O YASYEJJMZJALEJ-UHFFFAOYSA-N 0.000 description 3
- FEWJPZIEWOKRBE-JCYAYHJZSA-N Dextrotartaric acid Chemical compound OC(=O)[C@H](O)[C@@H](O)C(O)=O FEWJPZIEWOKRBE-JCYAYHJZSA-N 0.000 description 3
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 3
- IMQLKJBTEOYOSI-UHFFFAOYSA-N Phytic acid Natural products OP(O)(=O)OC1C(OP(O)(O)=O)C(OP(O)(O)=O)C(OP(O)(O)=O)C(OP(O)(O)=O)C1OP(O)(O)=O IMQLKJBTEOYOSI-UHFFFAOYSA-N 0.000 description 3
- ZLMJMSJWJFRBEC-UHFFFAOYSA-N Potassium Chemical compound [K] ZLMJMSJWJFRBEC-UHFFFAOYSA-N 0.000 description 3
- FEWJPZIEWOKRBE-UHFFFAOYSA-N Tartaric acid Natural products [H+].[H+].[O-]C(=O)C(O)C(O)C([O-])=O FEWJPZIEWOKRBE-UHFFFAOYSA-N 0.000 description 3
- 239000004480 active ingredient Substances 0.000 description 3
- 239000000654 additive Substances 0.000 description 3
- 210000004087 cornea Anatomy 0.000 description 3
- 235000011180 diphosphates Nutrition 0.000 description 3
- 210000003560 epithelium corneal Anatomy 0.000 description 3
- 238000011156 evaluation Methods 0.000 description 3
- 150000004677 hydrates Chemical class 0.000 description 3
- 239000000467 phytic acid Substances 0.000 description 3
- 229940068041 phytic acid Drugs 0.000 description 3
- 239000011591 potassium Substances 0.000 description 3
- 229910052700 potassium Inorganic materials 0.000 description 3
- 229940048084 pyrophosphate Drugs 0.000 description 3
- 235000011121 sodium hydroxide Nutrition 0.000 description 3
- 238000013112 stability test Methods 0.000 description 3
- 239000011975 tartaric acid Substances 0.000 description 3
- 235000002906 tartaric acid Nutrition 0.000 description 3
- BJEPYKJPYRNKOW-REOHCLBHSA-N (S)-malic acid Chemical compound OC(=O)[C@@H](O)CC(O)=O BJEPYKJPYRNKOW-REOHCLBHSA-N 0.000 description 2
- HZAXFHJVJLSVMW-UHFFFAOYSA-N 2-Aminoethan-1-ol Chemical compound NCCO HZAXFHJVJLSVMW-UHFFFAOYSA-N 0.000 description 2
- QGZKDVFQNNGYKY-UHFFFAOYSA-N Ammonia Chemical compound N QGZKDVFQNNGYKY-UHFFFAOYSA-N 0.000 description 2
- RGHNJXZEOKUKBD-SQOUGZDYSA-N D-gluconic acid Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@@H](O)C(O)=O RGHNJXZEOKUKBD-SQOUGZDYSA-N 0.000 description 2
- 241000588724 Escherichia coli Species 0.000 description 2
- VZCYOOQTPOCHFL-OWOJBTEDSA-N Fumaric acid Chemical compound OC(=O)\C=C\C(O)=O VZCYOOQTPOCHFL-OWOJBTEDSA-N 0.000 description 2
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 2
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 2
- AFVFQIVMOAPDHO-UHFFFAOYSA-N Methanesulfonic acid Chemical compound CS(O)(=O)=O AFVFQIVMOAPDHO-UHFFFAOYSA-N 0.000 description 2
- 241000283973 Oryctolagus cuniculus Species 0.000 description 2
- 239000002033 PVDF binder Substances 0.000 description 2
- NBIIXXVUZAFLBC-UHFFFAOYSA-N Phosphoric acid Chemical compound OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 description 2
- QAOWNCQODCNURD-UHFFFAOYSA-N Sulfuric acid Chemical compound OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 2
- KKEYFWRCBNTPAC-UHFFFAOYSA-N Terephthalic acid Chemical compound OC(=O)C1=CC=C(C(O)=O)C=C1 KKEYFWRCBNTPAC-UHFFFAOYSA-N 0.000 description 2
- 230000000996 additive effect Effects 0.000 description 2
- WNLRTRBMVRJNCN-UHFFFAOYSA-N adipic acid Chemical compound OC(=O)CCCCC(O)=O WNLRTRBMVRJNCN-UHFFFAOYSA-N 0.000 description 2
- BJEPYKJPYRNKOW-UHFFFAOYSA-N alpha-hydroxysuccinic acid Natural products OC(=O)C(O)CC(O)=O BJEPYKJPYRNKOW-UHFFFAOYSA-N 0.000 description 2
- GZUXJHMPEANEGY-UHFFFAOYSA-N bromomethane Chemical compound BrC GZUXJHMPEANEGY-UHFFFAOYSA-N 0.000 description 2
- 239000013522 chelant Substances 0.000 description 2
- OSASVXMJTNOKOY-UHFFFAOYSA-N chlorobutanol Chemical compound CC(C)(O)C(Cl)(Cl)Cl OSASVXMJTNOKOY-UHFFFAOYSA-N 0.000 description 2
- 229960002303 citric acid monohydrate Drugs 0.000 description 2
- 150000001875 compounds Chemical class 0.000 description 2
- 230000003247 decreasing effect Effects 0.000 description 2
- 229940057277 disodium edetate hydrate Drugs 0.000 description 2
- 235000011187 glycerol Nutrition 0.000 description 2
- JVTAAEKCZFNVCJ-UHFFFAOYSA-N lactic acid Chemical compound CC(O)C(O)=O JVTAAEKCZFNVCJ-UHFFFAOYSA-N 0.000 description 2
- 239000001630 malic acid Substances 0.000 description 2
- 235000011090 malic acid Nutrition 0.000 description 2
- 239000012528 membrane Substances 0.000 description 2
- 239000000825 pharmaceutical preparation Substances 0.000 description 2
- 229940127557 pharmaceutical product Drugs 0.000 description 2
- XHXFXVLFKHQFAL-UHFFFAOYSA-N phosphoryl trichloride Chemical compound ClP(Cl)(Cl)=O XHXFXVLFKHQFAL-UHFFFAOYSA-N 0.000 description 2
- 229920002981 polyvinylidene fluoride Polymers 0.000 description 2
- OQZCJRJRGMMSGK-UHFFFAOYSA-M potassium metaphosphate Chemical compound [K+].[O-]P(=O)=O OQZCJRJRGMMSGK-UHFFFAOYSA-M 0.000 description 2
- 239000000047 product Substances 0.000 description 2
- 239000011734 sodium Substances 0.000 description 2
- 229910052708 sodium Inorganic materials 0.000 description 2
- HELHAJAZNSDZJO-OLXYHTOASA-L sodium L-tartrate Chemical compound [Na+].[Na+].[O-]C(=O)[C@H](O)[C@@H](O)C([O-])=O HELHAJAZNSDZJO-OLXYHTOASA-L 0.000 description 2
- 239000001433 sodium tartrate Substances 0.000 description 2
- 239000012453 solvate Substances 0.000 description 2
- UEUXEKPTXMALOB-UHFFFAOYSA-J tetrasodium;2-[2-[bis(carboxylatomethyl)amino]ethyl-(carboxylatomethyl)amino]acetate Chemical compound [Na+].[Na+].[Na+].[Na+].[O-]C(=O)CN(CC([O-])=O)CCN(CC([O-])=O)CC([O-])=O UEUXEKPTXMALOB-UHFFFAOYSA-J 0.000 description 2
- JOXIMZWYDAKGHI-UHFFFAOYSA-N toluene-4-sulfonic acid Chemical compound CC1=CC=C(S(O)(=O)=O)C=C1 JOXIMZWYDAKGHI-UHFFFAOYSA-N 0.000 description 2
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 description 2
- IMNIMPAHZVJRPE-UHFFFAOYSA-N triethylenediamine Chemical compound C1CN2CCN1CC2 IMNIMPAHZVJRPE-UHFFFAOYSA-N 0.000 description 2
- WRIDQFICGBMAFQ-UHFFFAOYSA-N (E)-8-Octadecenoic acid Natural products CCCCCCCCCC=CCCCCCCC(O)=O WRIDQFICGBMAFQ-UHFFFAOYSA-N 0.000 description 1
- YPFDHNVEDLHUCE-UHFFFAOYSA-N 1,3-propanediol Substances OCCCO YPFDHNVEDLHUCE-UHFFFAOYSA-N 0.000 description 1
- TUSDEZXZIZRFGC-UHFFFAOYSA-N 1-O-galloyl-3,6-(R)-HHDP-beta-D-glucose Natural products OC1C(O2)COC(=O)C3=CC(O)=C(O)C(O)=C3C3=C(O)C(O)=C(O)C=C3C(=O)OC1C(O)C2OC(=O)C1=CC(O)=C(O)C(O)=C1 TUSDEZXZIZRFGC-UHFFFAOYSA-N 0.000 description 1
- WXHLLJAMBQLULT-UHFFFAOYSA-N 2-[[6-[4-(2-hydroxyethyl)piperazin-1-yl]-2-methylpyrimidin-4-yl]amino]-n-(2-methyl-6-sulfanylphenyl)-1,3-thiazole-5-carboxamide;hydrate Chemical compound O.C=1C(N2CCN(CCO)CC2)=NC(C)=NC=1NC(S1)=NC=C1C(=O)NC1=C(C)C=CC=C1S WXHLLJAMBQLULT-UHFFFAOYSA-N 0.000 description 1
- FZIPCQLKPTZZIM-UHFFFAOYSA-N 2-oxidanylpropane-1,2,3-tricarboxylic acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O.OC(=O)CC(O)(C(O)=O)CC(O)=O FZIPCQLKPTZZIM-UHFFFAOYSA-N 0.000 description 1
- LQJBNNIYVWPHFW-UHFFFAOYSA-N 20:1omega9c fatty acid Natural products CCCCCCCCCCC=CCCCCCCCC(O)=O LQJBNNIYVWPHFW-UHFFFAOYSA-N 0.000 description 1
- BMYNFMYTOJXKLE-UHFFFAOYSA-N 3-azaniumyl-2-hydroxypropanoate Chemical compound NCC(O)C(O)=O BMYNFMYTOJXKLE-UHFFFAOYSA-N 0.000 description 1
- UOQHWNPVNXSDDO-UHFFFAOYSA-N 3-bromoimidazo[1,2-a]pyridine-6-carbonitrile Chemical compound C1=CC(C#N)=CN2C(Br)=CN=C21 UOQHWNPVNXSDDO-UHFFFAOYSA-N 0.000 description 1
- FJKROLUGYXJWQN-UHFFFAOYSA-N 4-hydroxybenzoic acid Chemical compound OC(=O)C1=CC=C(O)C=C1 FJKROLUGYXJWQN-UHFFFAOYSA-N 0.000 description 1
- SLXKOJJOQWFEFD-UHFFFAOYSA-N 6-aminohexanoic acid Chemical compound NCCCCCC(O)=O SLXKOJJOQWFEFD-UHFFFAOYSA-N 0.000 description 1
- QSBYPNXLFMSGKH-UHFFFAOYSA-N 9-Heptadecensaeure Natural products CCCCCCCC=CCCCCCCCC(O)=O QSBYPNXLFMSGKH-UHFFFAOYSA-N 0.000 description 1
- CPELXLSAUQHCOX-UHFFFAOYSA-M Bromide Chemical compound [Br-] CPELXLSAUQHCOX-UHFFFAOYSA-M 0.000 description 1
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 1
- KRKNYBCHXYNGOX-UHFFFAOYSA-K Citrate Chemical compound [O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O KRKNYBCHXYNGOX-UHFFFAOYSA-K 0.000 description 1
- RGHNJXZEOKUKBD-UHFFFAOYSA-N D-gluconic acid Natural products OCC(O)C(O)C(O)C(O)C(O)=O RGHNJXZEOKUKBD-UHFFFAOYSA-N 0.000 description 1
- 239000001263 FEMA 3042 Substances 0.000 description 1
- IAJILQKETJEXLJ-UHFFFAOYSA-N Galacturonsaeure Natural products O=CC(O)C(O)C(O)C(O)C(O)=O IAJILQKETJEXLJ-UHFFFAOYSA-N 0.000 description 1
- WHXSMMKQMYFTQS-UHFFFAOYSA-N Lithium Chemical compound [Li] WHXSMMKQMYFTQS-UHFFFAOYSA-N 0.000 description 1
- FYYHWMGAXLPEAU-UHFFFAOYSA-N Magnesium Chemical compound [Mg] FYYHWMGAXLPEAU-UHFFFAOYSA-N 0.000 description 1
- UEZVMMHDMIWARA-UHFFFAOYSA-N Metaphosphoric acid Chemical compound OP(=O)=O UEZVMMHDMIWARA-UHFFFAOYSA-N 0.000 description 1
- 229910002651 NO3 Inorganic materials 0.000 description 1
- NHNBFGGVMKEFGY-UHFFFAOYSA-N Nitrate Chemical compound [O-][N+]([O-])=O NHNBFGGVMKEFGY-UHFFFAOYSA-N 0.000 description 1
- 239000005642 Oleic acid Substances 0.000 description 1
- ZQPPMHVWECSIRJ-UHFFFAOYSA-N Oleic acid Natural products CCCCCCCCC=CCCCCCCCC(O)=O ZQPPMHVWECSIRJ-UHFFFAOYSA-N 0.000 description 1
- 229910019142 PO4 Inorganic materials 0.000 description 1
- 229920002230 Pectic acid Polymers 0.000 description 1
- LRBQNJMCXXYXIU-PPKXGCFTSA-N Penta-digallate-beta-D-glucose Natural products OC1=C(O)C(O)=CC(C(=O)OC=2C(=C(O)C=C(C=2)C(=O)OC[C@@H]2[C@H]([C@H](OC(=O)C=3C=C(OC(=O)C=4C=C(O)C(O)=C(O)C=4)C(O)=C(O)C=3)[C@@H](OC(=O)C=3C=C(OC(=O)C=4C=C(O)C(O)=C(O)C=4)C(O)=C(O)C=3)[C@H](OC(=O)C=3C=C(OC(=O)C=4C=C(O)C(O)=C(O)C=4)C(O)=C(O)C=3)O2)OC(=O)C=2C=C(OC(=O)C=3C=C(O)C(O)=C(O)C=3)C(O)=C(O)C=2)O)=C1 LRBQNJMCXXYXIU-PPKXGCFTSA-N 0.000 description 1
- OFOBLEOULBTSOW-UHFFFAOYSA-N Propanedioic acid Natural products OC(=O)CC(O)=O OFOBLEOULBTSOW-UHFFFAOYSA-N 0.000 description 1
- 241000589517 Pseudomonas aeruginosa Species 0.000 description 1
- VMHLLURERBWHNL-UHFFFAOYSA-M Sodium acetate Chemical compound [Na+].CC([O-])=O VMHLLURERBWHNL-UHFFFAOYSA-M 0.000 description 1
- 241000191967 Staphylococcus aureus Species 0.000 description 1
- 235000021355 Stearic acid Nutrition 0.000 description 1
- KDYFGRWQOYBRFD-UHFFFAOYSA-N Succinic acid Natural products OC(=O)CCC(O)=O KDYFGRWQOYBRFD-UHFFFAOYSA-N 0.000 description 1
- LEHOTFFKMJEONL-UHFFFAOYSA-N Uric Acid Chemical compound N1C(=O)NC(=O)C2=C1NC(=O)N2 LEHOTFFKMJEONL-UHFFFAOYSA-N 0.000 description 1
- TVWHNULVHGKJHS-UHFFFAOYSA-N Uric acid Natural products N1C(=O)NC(=O)C2NC(=O)NC21 TVWHNULVHGKJHS-UHFFFAOYSA-N 0.000 description 1
- HCHKCACWOHOZIP-UHFFFAOYSA-N Zinc Chemical compound [Zn] HCHKCACWOHOZIP-UHFFFAOYSA-N 0.000 description 1
- FENRSEGZMITUEF-ATTCVCFYSA-E [Na+].[Na+].[Na+].[Na+].[Na+].[Na+].[Na+].[Na+].[Na+].OP(=O)([O-])O[C@@H]1[C@@H](OP(=O)([O-])[O-])[C@H](OP(=O)(O)[O-])[C@H](OP(=O)([O-])[O-])[C@H](OP(=O)(O)[O-])[C@H]1OP(=O)([O-])[O-] Chemical compound [Na+].[Na+].[Na+].[Na+].[Na+].[Na+].[Na+].[Na+].[Na+].OP(=O)([O-])O[C@@H]1[C@@H](OP(=O)([O-])[O-])[C@H](OP(=O)(O)[O-])[C@H](OP(=O)([O-])[O-])[C@H](OP(=O)(O)[O-])[C@H]1OP(=O)([O-])[O-] FENRSEGZMITUEF-ATTCVCFYSA-E 0.000 description 1
- YDHWWBZFRZWVHO-UHFFFAOYSA-H [oxido-[oxido(phosphonatooxy)phosphoryl]oxyphosphoryl] phosphate Chemical compound [O-]P([O-])(=O)OP([O-])(=O)OP([O-])(=O)OP([O-])([O-])=O YDHWWBZFRZWVHO-UHFFFAOYSA-H 0.000 description 1
- 239000012190 activator Substances 0.000 description 1
- 239000001361 adipic acid Substances 0.000 description 1
- 235000011037 adipic acid Nutrition 0.000 description 1
- IAJILQKETJEXLJ-QTBDOELSSA-N aldehydo-D-glucuronic acid Chemical compound O=C[C@H](O)[C@@H](O)[C@H](O)[C@H](O)C(O)=O IAJILQKETJEXLJ-QTBDOELSSA-N 0.000 description 1
- 125000000217 alkyl group Chemical group 0.000 description 1
- 229910000147 aluminium phosphate Inorganic materials 0.000 description 1
- 150000001412 amines Chemical class 0.000 description 1
- 229960002684 aminocaproic acid Drugs 0.000 description 1
- 229910021529 ammonia Inorganic materials 0.000 description 1
- SRSXLGNVWSONIS-UHFFFAOYSA-N benzenesulfonic acid Chemical compound OS(=O)(=O)C1=CC=CC=C1 SRSXLGNVWSONIS-UHFFFAOYSA-N 0.000 description 1
- 229940092714 benzenesulfonic acid Drugs 0.000 description 1
- UREZNYTWGJKWBI-UHFFFAOYSA-M benzethonium chloride Chemical compound [Cl-].C1=CC(C(C)(C)CC(C)(C)C)=CC=C1OCCOCC[N+](C)(C)CC1=CC=CC=C1 UREZNYTWGJKWBI-UHFFFAOYSA-M 0.000 description 1
- 229960001950 benzethonium chloride Drugs 0.000 description 1
- KGBXLFKZBHKPEV-UHFFFAOYSA-N boric acid Chemical compound OB(O)O KGBXLFKZBHKPEV-UHFFFAOYSA-N 0.000 description 1
- 239000004327 boric acid Substances 0.000 description 1
- 229960002645 boric acid Drugs 0.000 description 1
- 239000006172 buffering agent Substances 0.000 description 1
- KDYFGRWQOYBRFD-NUQCWPJISA-N butanedioic acid Chemical compound O[14C](=O)CC[14C](O)=O KDYFGRWQOYBRFD-NUQCWPJISA-N 0.000 description 1
- 239000011575 calcium Substances 0.000 description 1
- 229910052791 calcium Inorganic materials 0.000 description 1
- 125000004432 carbon atom Chemical group C* 0.000 description 1
- 239000003795 chemical substances by application Substances 0.000 description 1
- 229960003333 chlorhexidine gluconate Drugs 0.000 description 1
- YZIYKJHYYHPJIB-UUPCJSQJSA-N chlorhexidine gluconate Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@@H](O)C(O)=O.OC[C@@H](O)[C@@H](O)[C@H](O)[C@@H](O)C(O)=O.C1=CC(Cl)=CC=C1NC(=N)NC(=N)NCCCCCCNC(=N)NC(=N)NC1=CC=C(Cl)C=C1 YZIYKJHYYHPJIB-UUPCJSQJSA-N 0.000 description 1
- 239000000460 chlorine Substances 0.000 description 1
- 229910052801 chlorine Inorganic materials 0.000 description 1
- 229910001919 chlorite Inorganic materials 0.000 description 1
- 229910052619 chlorite group Inorganic materials 0.000 description 1
- 229960004926 chlorobutanol Drugs 0.000 description 1
- QBWCMBCROVPCKQ-UHFFFAOYSA-N chlorous acid Chemical compound OCl=O QBWCMBCROVPCKQ-UHFFFAOYSA-N 0.000 description 1
- 238000013329 compounding Methods 0.000 description 1
- 238000002425 crystallisation Methods 0.000 description 1
- 230000008025 crystallization Effects 0.000 description 1
- 230000002542 deteriorative effect Effects 0.000 description 1
- UZLGHNUASUZUOR-UHFFFAOYSA-L dipotassium;3-carboxy-3-hydroxypentanedioate Chemical compound [K+].[K+].OC(=O)CC(O)(C([O-])=O)CC([O-])=O UZLGHNUASUZUOR-UHFFFAOYSA-L 0.000 description 1
- KCIDZIIHRGYJAE-YGFYJFDDSA-L dipotassium;[(2r,3r,4s,5r,6r)-3,4,5-trihydroxy-6-(hydroxymethyl)oxan-2-yl] phosphate Chemical compound [K+].[K+].OC[C@H]1O[C@H](OP([O-])([O-])=O)[C@H](O)[C@@H](O)[C@H]1O KCIDZIIHRGYJAE-YGFYJFDDSA-L 0.000 description 1
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 1
- 239000002526 disodium citrate Substances 0.000 description 1
- 235000019262 disodium citrate Nutrition 0.000 description 1
- BNIILDVGGAEEIG-UHFFFAOYSA-L disodium hydrogen phosphate Chemical compound [Na+].[Na+].OP([O-])([O-])=O BNIILDVGGAEEIG-UHFFFAOYSA-L 0.000 description 1
- 229910000397 disodium phosphate Inorganic materials 0.000 description 1
- 235000019800 disodium phosphate Nutrition 0.000 description 1
- CEYULKASIQJZGP-UHFFFAOYSA-L disodium;2-(carboxymethyl)-2-hydroxybutanedioate Chemical compound [Na+].[Na+].[O-]C(=O)CC(O)(C(=O)O)CC([O-])=O CEYULKASIQJZGP-UHFFFAOYSA-L 0.000 description 1
- 208000035475 disorder Diseases 0.000 description 1
- MOTZDAYCYVMXPC-UHFFFAOYSA-N dodecyl hydrogen sulfate Chemical compound CCCCCCCCCCCCOS(O)(=O)=O MOTZDAYCYVMXPC-UHFFFAOYSA-N 0.000 description 1
- 229940043264 dodecyl sulfate Drugs 0.000 description 1
- 239000003814 drug Substances 0.000 description 1
- AFAXGSQYZLGZPG-UHFFFAOYSA-N ethanedisulfonic acid Chemical compound OS(=O)(=O)CCS(O)(=O)=O AFAXGSQYZLGZPG-UHFFFAOYSA-N 0.000 description 1
- BEFDCLMNVWHSGT-UHFFFAOYSA-N ethenylcyclopentane Chemical compound C=CC1CCCC1 BEFDCLMNVWHSGT-UHFFFAOYSA-N 0.000 description 1
- 238000004299 exfoliation Methods 0.000 description 1
- 239000012530 fluid Substances 0.000 description 1
- 239000001530 fumaric acid Substances 0.000 description 1
- LRBQNJMCXXYXIU-QWKBTXIPSA-N gallotannic acid Chemical compound OC1=C(O)C(O)=CC(C(=O)OC=2C(=C(O)C=C(C=2)C(=O)OC[C@H]2[C@@H]([C@@H](OC(=O)C=3C=C(OC(=O)C=4C=C(O)C(O)=C(O)C=4)C(O)=C(O)C=3)[C@H](OC(=O)C=3C=C(OC(=O)C=4C=C(O)C(O)=C(O)C=4)C(O)=C(O)C=3)[C@@H](OC(=O)C=3C=C(OC(=O)C=4C=C(O)C(O)=C(O)C=4)C(O)=C(O)C=3)O2)OC(=O)C=2C=C(OC(=O)C=3C=C(O)C(O)=C(O)C=3)C(O)=C(O)C=2)O)=C1 LRBQNJMCXXYXIU-QWKBTXIPSA-N 0.000 description 1
- 239000011521 glass Substances 0.000 description 1
- 239000000174 gluconic acid Substances 0.000 description 1
- 235000012208 gluconic acid Nutrition 0.000 description 1
- 229940097043 glucuronic acid Drugs 0.000 description 1
- 229910052736 halogen Inorganic materials 0.000 description 1
- -1 halogen ions Chemical class 0.000 description 1
- XMBWDFGMSWQBCA-UHFFFAOYSA-N hydrogen iodide Chemical compound I XMBWDFGMSWQBCA-UHFFFAOYSA-N 0.000 description 1
- 125000004029 hydroxymethyl group Chemical group [H]OC([H])([H])* 0.000 description 1
- XMBWDFGMSWQBCA-UHFFFAOYSA-M iodide Chemical class [I-] XMBWDFGMSWQBCA-UHFFFAOYSA-M 0.000 description 1
- INQOMBQAUSQDDS-UHFFFAOYSA-N iodomethane Chemical compound IC INQOMBQAUSQDDS-UHFFFAOYSA-N 0.000 description 1
- QXJSBBXBKPUZAA-UHFFFAOYSA-N isooleic acid Natural products CCCCCCCC=CCCCCCCCCC(O)=O QXJSBBXBKPUZAA-UHFFFAOYSA-N 0.000 description 1
- 239000007951 isotonicity adjuster Substances 0.000 description 1
- 239000004310 lactic acid Substances 0.000 description 1
- 235000014655 lactic acid Nutrition 0.000 description 1
- 229940099563 lactobionic acid Drugs 0.000 description 1
- 229910052744 lithium Inorganic materials 0.000 description 1
- 239000011777 magnesium Substances 0.000 description 1
- 229910052749 magnesium Inorganic materials 0.000 description 1
- VZCYOOQTPOCHFL-UPHRSURJSA-N maleic acid Chemical compound OC(=O)\C=C/C(O)=O VZCYOOQTPOCHFL-UPHRSURJSA-N 0.000 description 1
- 239000011976 maleic acid Substances 0.000 description 1
- 229910052751 metal Inorganic materials 0.000 description 1
- 239000002184 metal Substances 0.000 description 1
- 229910021645 metal ion Inorganic materials 0.000 description 1
- 229940098779 methanesulfonic acid Drugs 0.000 description 1
- 229940102396 methyl bromide Drugs 0.000 description 1
- JZMJDSHXVKJFKW-UHFFFAOYSA-M methyl sulfate(1-) Chemical compound COS([O-])(=O)=O JZMJDSHXVKJFKW-UHFFFAOYSA-M 0.000 description 1
- 125000000250 methylamino group Chemical group [H]N(*)C([H])([H])[H] 0.000 description 1
- 150000007522 mineralic acids Chemical class 0.000 description 1
- HWPKGOGLCKPRLZ-UHFFFAOYSA-M monosodium citrate Chemical compound [Na+].OC(=O)CC(O)(C([O-])=O)CC(O)=O HWPKGOGLCKPRLZ-UHFFFAOYSA-M 0.000 description 1
- 239000002524 monosodium citrate Substances 0.000 description 1
- 235000018342 monosodium citrate Nutrition 0.000 description 1
- 229910000403 monosodium phosphate Inorganic materials 0.000 description 1
- 235000019799 monosodium phosphate Nutrition 0.000 description 1
- ACTNHJDHMQSOGL-UHFFFAOYSA-N n',n'-dibenzylethane-1,2-diamine Chemical compound C=1C=CC=CC=1CN(CCN)CC1=CC=CC=C1 ACTNHJDHMQSOGL-UHFFFAOYSA-N 0.000 description 1
- PSZYNBSKGUBXEH-UHFFFAOYSA-N naphthalene-1-sulfonic acid Chemical compound C1=CC=C2C(S(=O)(=O)O)=CC=CC2=C1 PSZYNBSKGUBXEH-UHFFFAOYSA-N 0.000 description 1
- QIQXTHQIDYTFRH-UHFFFAOYSA-N octadecanoic acid Chemical compound CCCCCCCCCCCCCCCCCC(O)=O QIQXTHQIDYTFRH-UHFFFAOYSA-N 0.000 description 1
- OQCDKBAXFALNLD-UHFFFAOYSA-N octadecanoic acid Natural products CCCCCCCC(C)CCCCCCCCC(O)=O OQCDKBAXFALNLD-UHFFFAOYSA-N 0.000 description 1
- ZQPPMHVWECSIRJ-KTKRTIGZSA-N oleic acid Chemical compound CCCCCCCC\C=C/CCCCCCCC(O)=O ZQPPMHVWECSIRJ-KTKRTIGZSA-N 0.000 description 1
- 150000007524 organic acids Chemical class 0.000 description 1
- 235000005985 organic acids Nutrition 0.000 description 1
- WLJNZVDCPSBLRP-UHFFFAOYSA-N pamoic acid Chemical compound C1=CC=C2C(CC=3C4=CC=CC=C4C=C(C=3O)C(=O)O)=C(O)C(C(O)=O)=CC2=C1 WLJNZVDCPSBLRP-UHFFFAOYSA-N 0.000 description 1
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 description 1
- 239000010452 phosphate Substances 0.000 description 1
- 239000010318 polygalacturonic acid Substances 0.000 description 1
- 229920000137 polyphosphoric acid Polymers 0.000 description 1
- 229920000166 polytrimethylene carbonate Polymers 0.000 description 1
- AVTYONGGKAJVTE-OLXYHTOASA-L potassium L-tartrate Chemical compound [K+].[K+].[O-]C(=O)[C@H](O)[C@@H](O)C([O-])=O AVTYONGGKAJVTE-OLXYHTOASA-L 0.000 description 1
- 239000001508 potassium citrate Substances 0.000 description 1
- QEEAPRPFLLJWCF-UHFFFAOYSA-K potassium citrate (anhydrous) Chemical compound [K+].[K+].[K+].[O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O QEEAPRPFLLJWCF-UHFFFAOYSA-K 0.000 description 1
- 235000011033 potassium malate Nutrition 0.000 description 1
- SVICABYXKQIXBM-UHFFFAOYSA-L potassium malate Chemical compound [K+].[K+].[O-]C(=O)C(O)CC([O-])=O SVICABYXKQIXBM-UHFFFAOYSA-L 0.000 description 1
- 229940099402 potassium metaphosphate Drugs 0.000 description 1
- 235000019828 potassium polyphosphate Nutrition 0.000 description 1
- 229940074439 potassium sodium tartrate Drugs 0.000 description 1
- 239000001472 potassium tartrate Substances 0.000 description 1
- 229940111695 potassium tartrate Drugs 0.000 description 1
- 235000011005 potassium tartrates Nutrition 0.000 description 1
- JZRVQGVITBCZDB-UHFFFAOYSA-M potassium;3,4-dihydroxy-4-oxobutanoate Chemical compound [K+].[O-]C(=O)C(O)CC(O)=O JZRVQGVITBCZDB-UHFFFAOYSA-M 0.000 description 1
- 230000001737 promoting effect Effects 0.000 description 1
- 239000003227 purinergic agonist Substances 0.000 description 1
- 229940005657 pyrophosphoric acid Drugs 0.000 description 1
- 150000003242 quaternary ammonium salts Chemical class 0.000 description 1
- 238000011160 research Methods 0.000 description 1
- 108010038379 sargramostim Proteins 0.000 description 1
- 230000028327 secretion Effects 0.000 description 1
- 235000019265 sodium DL-malate Nutrition 0.000 description 1
- 239000001632 sodium acetate Substances 0.000 description 1
- 235000017281 sodium acetate Nutrition 0.000 description 1
- 239000001509 sodium citrate Substances 0.000 description 1
- AJPJDKMHJJGVTQ-UHFFFAOYSA-M sodium dihydrogen phosphate Chemical compound [Na+].OP(O)([O-])=O AJPJDKMHJJGVTQ-UHFFFAOYSA-M 0.000 description 1
- FQENQNTWSFEDLI-UHFFFAOYSA-J sodium diphosphate Chemical compound [Na+].[Na+].[Na+].[Na+].[O-]P([O-])(=O)OP([O-])([O-])=O FQENQNTWSFEDLI-UHFFFAOYSA-J 0.000 description 1
- WPUMTJGUQUYPIV-UHFFFAOYSA-L sodium malate Chemical compound [Na+].[Na+].[O-]C(=O)C(O)CC([O-])=O WPUMTJGUQUYPIV-UHFFFAOYSA-L 0.000 description 1
- 229910000162 sodium phosphate Inorganic materials 0.000 description 1
- 239000001488 sodium phosphate Substances 0.000 description 1
- 235000011008 sodium phosphates Nutrition 0.000 description 1
- 229940083982 sodium phytate Drugs 0.000 description 1
- 235000011006 sodium potassium tartrate Nutrition 0.000 description 1
- 229960002167 sodium tartrate Drugs 0.000 description 1
- 235000011004 sodium tartrates Nutrition 0.000 description 1
- HLWRUJAIJJEZDL-UHFFFAOYSA-M sodium;2-[2-[bis(carboxymethyl)amino]ethyl-(carboxymethyl)amino]acetate Chemical compound [Na+].OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC([O-])=O HLWRUJAIJJEZDL-UHFFFAOYSA-M 0.000 description 1
- DOJOZCIMYABYPO-UHFFFAOYSA-M sodium;3,4-dihydroxy-4-oxobutanoate Chemical compound [Na+].OC(=O)C(O)CC([O-])=O DOJOZCIMYABYPO-UHFFFAOYSA-M 0.000 description 1
- 239000002904 solvent Substances 0.000 description 1
- 239000004334 sorbic acid Substances 0.000 description 1
- 235000010199 sorbic acid Nutrition 0.000 description 1
- 229940075582 sorbic acid Drugs 0.000 description 1
- 229960002920 sorbitol Drugs 0.000 description 1
- 239000008117 stearic acid Substances 0.000 description 1
- 239000000126 substance Substances 0.000 description 1
- 208000024891 symptom Diseases 0.000 description 1
- 235000015523 tannic acid Nutrition 0.000 description 1
- 229940033123 tannic acid Drugs 0.000 description 1
- 229920002258 tannic acid Polymers 0.000 description 1
- 150000003892 tartrate salts Chemical class 0.000 description 1
- RYCLIXPGLDDLTM-UHFFFAOYSA-J tetrapotassium;phosphonato phosphate Chemical compound [K+].[K+].[K+].[K+].[O-]P([O-])(=O)OP([O-])([O-])=O RYCLIXPGLDDLTM-UHFFFAOYSA-J 0.000 description 1
- 235000019818 tetrasodium diphosphate Nutrition 0.000 description 1
- 229940124597 therapeutic agent Drugs 0.000 description 1
- ITMCEJHCFYSIIV-UHFFFAOYSA-N triflic acid Chemical compound OS(=O)(=O)C(F)(F)F ITMCEJHCFYSIIV-UHFFFAOYSA-N 0.000 description 1
- 235000015870 tripotassium citrate Nutrition 0.000 description 1
- HRXKRNGNAMMEHJ-UHFFFAOYSA-K trisodium citrate Chemical compound [Na+].[Na+].[Na+].[O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O HRXKRNGNAMMEHJ-UHFFFAOYSA-K 0.000 description 1
- 229940038773 trisodium citrate Drugs 0.000 description 1
- 235000019263 trisodium citrate Nutrition 0.000 description 1
- RYFMWSXOAZQYPI-UHFFFAOYSA-K trisodium phosphate Chemical compound [Na+].[Na+].[Na+].[O-]P([O-])([O-])=O RYFMWSXOAZQYPI-UHFFFAOYSA-K 0.000 description 1
- 229940116269 uric acid Drugs 0.000 description 1
- 229910052725 zinc Inorganic materials 0.000 description 1
- 239000011701 zinc Substances 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/08—Solutions
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7084—Compounds having two nucleosides or nucleotides, e.g. nicotinamide-adenine dinucleotide, flavine-adenine dinucleotide
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/06—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite
- A61K47/08—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite containing oxygen, e.g. ethers, acetals, ketones, quinones, aldehydes, peroxides
- A61K47/12—Carboxylic acids; Salts or anhydrides thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/06—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite
- A61K47/16—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite containing nitrogen, e.g. nitro-, nitroso-, azo-compounds, nitriles, cyanates
- A61K47/18—Amines; Amides; Ureas; Quaternary ammonium compounds; Amino acids; Oligopeptides having up to five amino acids
- A61K47/183—Amino acids, e.g. glycine, EDTA or aspartame
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/06—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite
- A61K47/24—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite containing atoms other than carbon, hydrogen, oxygen, halogen, nitrogen or sulfur, e.g. cyclomethicone or phospholipids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0048—Eye, e.g. artificial tears
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P27/00—Drugs for disorders of the senses
- A61P27/02—Ophthalmic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P27/00—Drugs for disorders of the senses
- A61P27/02—Ophthalmic agents
- A61P27/04—Artificial tears; Irrigation solutions
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Veterinary Medicine (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Epidemiology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Engineering & Computer Science (AREA)
- Oil, Petroleum & Natural Gas (AREA)
- Molecular Biology (AREA)
- Ophthalmology & Optometry (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Biophysics (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Organic Chemistry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Medicinal Preparation (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
Abstract
Description
また、本発明は、0.1~10%(w/v)の濃度のジクアホソルまたはその塩を含有する水性点眼液の製造方法であって、ジクアホソルまたはその塩および該水性点眼液中のキレート剤の最終濃度が0.0001~1%(w/v)となる量のキレート剤を混合して不溶性析出物の発生が抑制された水溶液を得るステップを含む製造方法(以下、単に「本製造方法」ともいう)についても提供する。
本発明において、「キレート剤」とは、金属イオンをキレート化する化合物であれば特に制限はされないが、例えば、エデト酸(エチレンジアミン四酢酸)、エデト酸一ナトリウム、エデト酸二ナトリウム、エデト酸三ナトリウム、エデト酸四ナトリウム、エデト酸二カリウム、エデト酸三カリウム、エデト酸四カリウムなどのエデト酸またはその塩;クエン酸、クエン酸一ナトリウム、クエン酸二ナトリウム、クエン酸三ナトリウム、クエン酸一カリウム、クエン酸二カリウム、クエン酸三カリウムなどのクエン酸またはその塩;メタリン酸、メタリン酸ナトリウム、メタリン酸カリウムなどのメタリン酸またはその塩;ピロリン酸、ピロリン酸四ナトリウム、ピロリン酸四カリウムなどのピロリン酸またはその塩;ポリリン酸、ポリリン酸ナトリウム、ポリリン酸カリウムなどのポリリン酸またはその塩;リンゴ酸一ナトリウム、リンゴ酸二ナトリウム、リンゴ酸一カリウム、リンゴ酸二カリウムなどのリンゴ酸またはその塩;酒石酸ナトリウム、酒石酸カリウム、酒石酸カリウムナトリウムなどの酒石酸またはその塩;フィチン酸ナトリウム、フィチン酸カリウムなどのフィチン酸またはその塩、などを挙げることができる。なお、本発明において、「エデト酸、クエン酸、メタリン酸、ピロリン酸、ポリリン酸、リンゴ酸、酒石酸、フィチン酸、およびそれらの塩」には、それぞれのフリー体またはそれらの塩の水和物および有機溶媒和物も含まれるものとする。
ジクアホソル点眼液の保存中の性状変化の有無を目視で確認するとともに、キレート剤であるエデト酸塩が該性状変化に及ぼす影響を検討した。
・キレート剤非含有処方
ジクアホソルナトリウム3g、リン酸水素ナトリウム水和物0.2g、塩化ナトリウム0.41g、塩化カリウム0.15gおよびベンザルコニウム塩化物0.0075gを水に溶解して100mLとし、pH調節剤を添加して、pH7.5、浸透圧比1.0とした。
ジクアホソルナトリウム3g、リン酸水素ナトリウム水和物0.2g、塩化ナトリウム0.41g、塩化カリウム0.15g、エデト酸ナトリウム水和物0.001gまたは0.1gおよびベンザルコニウム塩化物0.002gを水に溶解して100mLとし、pH調節剤を添加して、pH7.5、浸透圧比1.0とした。
上記キレート剤非含有処方および0.001または0.1%(w/v)エデト酸塩含有処方をガラス容器中で、25℃で3ヶ月間保存した後、目視によりその性状の変化の有無を確認した。
試験結果を表1に示す。
キレート剤を含有するジクアホソル点眼液については、流通過程および患者による保存過程においても、不溶性析出物が発生しないか、または該析出物の発生頻度および量が低減されることが示唆された。
ジクアホソル点眼液のろ過滅菌時のろ過性能の経時的変化を確認するとともに、キレート剤であるエデト酸塩が該変化に及ぼす影響を検討した。
・キレート剤非含有処方
ジクアホソルナトリウム30g、リン酸水素ナトリウム水和物2g、塩化ナトリウム4.1g、塩化カリウム1.5gおよびベンザルコニウム塩化物0.075gを水に溶解して1000mLとし、pH調節剤を添加して、pH7.5、浸透圧比1.0とした。
ジクアホソルナトリウム30g、リン酸水素ナトリウム水和物2g、塩化ナトリウム4.1g、塩化カリウム1.5g、エデト酸ナトリウム水和物0.01gおよびベンザルコニウム塩化物0.075gを水に溶解して1000mLとし、pH調節剤を添加して、pH7.5、浸透圧比1.0とした。
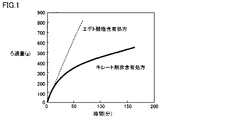
各調製物を、ろ過フィルターとして親水性PVDFメンブレンフィルター(日本ポール社製、フロロダインIIディスクフィルターφ47mm、ポアサイズ0.2μm(型式FTKDFL)を2段使用し、ろ過圧力200kPa、室温でろ過を行なった。そのときのろ過時間とろ過量を測定し、その関係をプロットした。
図1は、エデト酸塩含有処方、キレート剤非含有処方それぞれのジクアホソル点眼液でのろ過性能試験の結果を示すグラフであり、縦軸はろ過量(g)、横軸はろ過時間(分)である。図1から明らかなように、キレート剤非含有処方については、ろ過滅菌中にろ過量の低下(ろ過率の低下)が認められる一方、エデト酸塩含有処方では、ろ過率の低下が完全に抑制されることが示された。
キレート剤を含有するジクアホソル点眼液については、製造過程(ろ過滅菌過程)におけるろ過率の低下が完全に抑制されることから、キレート剤を含有しないジクアホソル点眼液と比較して、効率的にろ過滅菌できることが示唆された。なお、キレート剤を含有しないジクアホソル点眼液において認められたろ過率の低下は、不溶性析出物(目視できないものも含まれる)の目詰まりが原因であるものと考えられる。
エデト酸塩およびエデト酸塩以外のキレート剤が、ジクアホソル点眼液のろ過滅菌時のろ過性能の経時的変化に及ぼす影響を比較検討した。
・キレート剤非含有処方
ジクアホソルナトリウム30g、リン酸水素ナトリウム水和物2g、塩化ナトリウム4.1g、塩化カリウム1.5gおよびベンザルコニウム塩化物0.075gを水に溶解して1000mLとし、pH調節剤を添加して、pH7.5、浸透圧比1.0とした。
ジクアホソルナトリウム30g、リン酸水素ナトリウム水和物2g、塩化ナトリウム4.1g、塩化カリウム1.5g、エデト酸ナトリウム水和物0.1gおよびベンザルコニウム塩化物0.075gを水に溶解して1000mLとし、pH調節剤を添加して、pH7.5、浸透圧比1.0とした。
ジクアホソルナトリウム30g、リン酸水素ナトリウム水和物2g、塩化ナトリウム4.1g、塩化カリウム1.5g、クエン酸一水和物0.1gおよびベンザルコニウム塩化物0.075gを水に溶解して1000mLとし、pH調節剤を添加して、pH7.5、浸透圧比1.0とした。
ジクアホソルナトリウム30g、リン酸水素ナトリウム水和物2g、塩化ナトリウム4.1g、塩化カリウム1.5g、メタリン酸ナトリウム0.1gおよびベンザルコニウム塩化物0.075gを水に溶解して1000mLとし、pH調節剤を添加して、pH7.5、浸透圧比1.0とした。
ジクアホソルナトリウム30g、リン酸水素ナトリウム水和物2g、塩化ナトリウム4.1g、塩化カリウム1.5g、ポリリン酸ナトリウム0.1gおよびベンザルコニウム塩化物0.075gを水に溶解して1000mLとし、pH調節剤を添加して、pH7.5、浸透圧比1.0とした。
各調製物を、ろ過フィルターとして親水性PVDFメンブレンフィルター(日本ポール社製、フロロダインIIディスクフィルターφ25mm、ポアサイズ0.2μm(型式FTKDFL)を2段使用し、ろ過圧力200kPa、室温でろ過を行なった。そのときのろ過時間と有効ろ過面積あたりのろ過量を測定し、その関係をプロットした。
図2は、キレート剤非含有処方、またはエデト酸塩、クエン酸、メタリン酸塩もしくはポリリン酸塩含有処方のそれぞれのジクアホソル点眼液でのろ過性能試験の結果を示すグラフであり、縦軸は有効ろ過面積あたりのろ過量(g/cm2)、横軸はろ過時間(分)を示す。図2から明らかなように、キレート剤非含有処方については、ろ過滅菌中にろ過量の低下(ろ過率の低下)が認められる一方、クエン酸、メタリン酸塩またはポリリン酸塩含有処方では、エデト酸塩含有処方同様に、ろ過率の低下が完全に抑制されることが示された。
キレート剤を含有するジクアホソル点眼液については、製造過程(ろ過滅菌過程)におけるろ過率の低下が完全に抑制されることから、キレート剤を含有しないジクアホソル点眼液と比較して、効率的にろ過滅菌できることが示唆された。
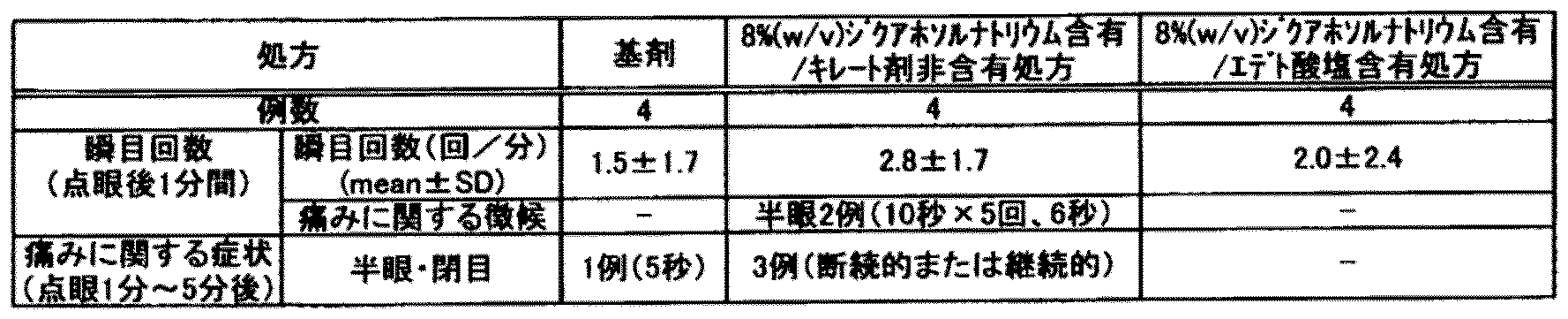
キレート剤を含有しないジクアホソル点眼液である「ジクアス(登録商標)点眼液3%」の添付文書には、同点眼液を使用したドライアイ患者の6.7%で副作用として眼刺激感が認められたことが記載されている。そこで、ドライアイ患者同様に角膜上皮が障害されたn-ヘプタノール角膜上皮剥離モデルを用いて、キレート剤の添加がジクアホソル点眼液の眼刺激性にどのような影響を及ぼすか否かを検討した。
・3%(w/v)ジクアホソルナトリウム含有/キレート剤非含有処方
ジクアホソルナトリウム3g、リン酸水素ナトリウム水和物0.2g、塩化ナトリウム0.41g、塩化カリウム0.15gおよびベンザルコニウム塩化物0.0075gを水に溶解して100mLとし、pH調節剤を添加して、pH7.2~7.8、浸透圧比1.0~1.1とした。
ジクアホソルナトリウム3g、リン酸水素ナトリウム水和物0.2g、塩化ナトリウム0.41g、塩化カリウム0.15g、エデト酸ナトリウム水和物0.01gおよびベンザルコニウム塩化物0.002gを水に溶解して100mLとし、pH調節剤を添加して、pH7.2~7.8、浸透圧比1.0~1.1とした。
ジクアホソルナトリウム8g、リン酸水素ナトリウム水和物0.2gおよびベンザルコニウム塩化物0.0075gを水に溶解して100mLとし、pH調節剤を添加して、pH7.2~7.8、浸透圧比1.0~1.1とした。
ジクアホソルナトリウム8g、リン酸水素ナトリウム水和物0.2g、エデト酸ナトリウム水和物0.01gおよびベンザルコニウム塩化物0.002gを水に溶解して100mLとし、pH調節剤を添加して、pH7.2~7.8、浸透圧比1.0~1.1とした。
リン酸水素ナトリウム水和物0.2g、塩化ナトリウム0.75g、塩化カリウム0.15gおよびベンザルコニウム塩化物0.0075gを水に溶解して100mLとし、pH調節剤を添加して、pH7.2~7.8、浸透圧比1.0~1.1とした。
ウサギの左眼の角膜にn-ヘプタノール処置(1分間)を行なった後、角膜上皮を剥離し、その16~18時間後に、基剤、3%(w/v)ジクアホソルナトリウム含有/キレート剤非含有処方、または3%(w/v)ジクアホソルナトリウム含有/エデト酸塩含有処方を1回点眼し(50μL/眼)、点眼後1分間の瞬目回数の測定および点眼時の痛みに関連する症状の観察を行なった。その後続けて、点眼5分後までの閉目および半眼などの痛みに関する徴候を観察した(1群4例)。
試験結果を表2および表3に示す。
以上のように、ジクアホソル点眼液は、ドライアイ患者同様に角膜上皮が障害されたn-ヘプタノール角膜上皮剥離モデルにおいて、痛みに関する徴候である半眼・閉目を高頻度で引き起こす一方、該点眼液にキレート剤を添加することで、これらの事象の発現頻度は基剤レベルまで軽減されることが示唆された。すなわち、キレート剤を含有しないジクアホソル点眼液をドライアイ患者に点眼した場合に一定頻度で認められる副作用としての眼刺激は、キレート剤の添加により軽減されるものと思われる。
キレート剤がジクアホソル点眼液の保存効力に与える影響を確認するため、保存効力試験を行った。
・キレート剤非含有処方
ジクアホソルナトリウム3g、リン酸水素ナトリウム水和物0.2g、塩化ナトリウム0.41g、塩化カリウム0.15gおよびベンザルコニウム塩化物0.0036gを水に溶解して100mLとし、pH調節剤を添加して、pH7.2~7.8、浸透圧比1.0~1.1とした。
ジクアホソルナトリウム3g、リン酸水素ナトリウム水和物0.2g、塩化ナトリウム0.41g、塩化カリウム0.15g、エデト酸ナトリウム水和物0.01gおよびベンザルコニウム塩化物0.0024gを水に溶解して100mLとし、pH調節剤を添加して、pH7.2~7.8、浸透圧比1.0~1.1とした。
保存効力試験は、第十五改正日本薬局方の保存効力試験法に準拠して行なった。本試験では、試験菌として、Esherichia Coli(E.coli)、Pseudomonas aeruginosa(P.aeruginosa)、Staphylococcus aureus(S.aureus)、Candida albicans(C.albicans)およびAspergillus braziliensis(A.braziliensis)を用いた。
試験結果を表4に示す。
上記の結果から、ジクアホソル点眼液にキレート剤を添加することで、その保存効力が顕著に向上することが示唆された。すなわち、本点眼液については、キレート剤を含有しないジクアホソル点眼液と比して、点眼液中の防腐剤濃度を低下させ得るものと考えられる。
製剤例を挙げて本発明の薬剤をさらに具体的に説明するが、本発明はこれらの製剤例にのみ限定されるものではない。
100ml中
ジクアホソルナトリウム 3g
リン酸水素ナトリウム水和物 0.1~0.5g
塩化ナトリウム 0.01~1g
塩化カリウム 0.01~1g
エデト酸ナトリウム水和物 0.0001~0.1g
滅菌精製水 適量
滅菌精製水にジクアホソルナトリウムおよびそれ以外の上記成分を加え、これらを十分に混合することで上記点眼剤を調製できる。
100ml中
ジクアホソルナトリウム 3g
リン酸水素ナトリウム水和物 0.1~0.5g
塩化ナトリウム 0.01~1g
塩化カリウム 0.01~1g
BAK-C12 0.1~10g
エデト酸ナトリウム水和物 0.0001~0.1g
滅菌精製水 適量
滅菌精製水にジクアホソルナトリウムおよびそれ以外の上記成分を加え、これらを十分に混合することで上記点眼剤を調製できる。
100ml中
ジクアホソルナトリウム 3g
リン酸水素ナトリウム水和物 0.1~0.5g
塩化ナトリウム 0.01~1g
塩化カリウム 0.01~1g
BAK-C12 0.1~10g
クエン酸一水和物 0.0001~0.1g
滅菌精製水 適量
滅菌精製水にジクアホソルナトリウムおよびそれ以外の上記成分を加え、これらを十分に混合することで上記点眼剤を調製できる。
100ml中
ジクアホソルナトリウム 3g
リン酸水素ナトリウム水和物 0.1~0.5g
塩化ナトリウム 0.01~1g
塩化カリウム 0.01~1g
BAK-C12 0.1~10g
メタリン酸ナトリウム 0.0001~0.1g
滅菌精製水 適量
滅菌精製水にジクアホソルナトリウムおよびそれ以外の上記成分を加え、これらを十分に混合することで上記点眼剤を調製できる。
100ml中
ジクアホソルナトリウム 3g
リン酸水素ナトリウム水和物 0.1~0.5g
塩化ナトリウム 0.01~1g
塩化カリウム 0.01~1g
BAK-C12 0.1~10g
ポリリン酸ナトリウム 0.0001~0.1g
滅菌精製水 適量
滅菌精製水にジクアホソルナトリウムおよびそれ以外の上記成分を加え、これらを十分に混合することで上記点眼剤を調製できる。
Claims (1)
- 明細書に記載の発明。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2012069157 | 2012-03-26 | ||
| JP2012069157 | 2012-03-26 | ||
| JP2019022692A JP7042762B2 (ja) | 2012-03-26 | 2019-02-12 | ジクアホソル含有点眼液 |
Related Parent Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2019022692A Division JP7042762B2 (ja) | 2012-03-26 | 2019-02-12 | ジクアホソル含有点眼液 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2022075813A true JP2022075813A (ja) | 2022-05-18 |
| JP7447176B2 JP7447176B2 (ja) | 2024-03-11 |
Family
ID=49259901
Family Applications (6)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2013062270A Active JP5625081B2 (ja) | 2012-03-26 | 2013-03-25 | ジクアホソル含有点眼液 |
| JP2014082821A Active JP6126041B2 (ja) | 2012-03-26 | 2014-04-14 | ジクアホソル含有点眼液 |
| JP2017075167A Active JP6389544B2 (ja) | 2012-03-26 | 2017-04-05 | ジクアホソル含有点眼液 |
| JP2018020154A Active JP6483299B2 (ja) | 2012-03-26 | 2018-02-07 | ジクアホソル含有点眼液 |
| JP2019022692A Active JP7042762B2 (ja) | 2012-03-26 | 2019-02-12 | ジクアホソル含有点眼液 |
| JP2022039183A Active JP7447176B2 (ja) | 2012-03-26 | 2022-03-14 | ジクアホソル含有点眼液 |
Family Applications Before (5)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2013062270A Active JP5625081B2 (ja) | 2012-03-26 | 2013-03-25 | ジクアホソル含有点眼液 |
| JP2014082821A Active JP6126041B2 (ja) | 2012-03-26 | 2014-04-14 | ジクアホソル含有点眼液 |
| JP2017075167A Active JP6389544B2 (ja) | 2012-03-26 | 2017-04-05 | ジクアホソル含有点眼液 |
| JP2018020154A Active JP6483299B2 (ja) | 2012-03-26 | 2018-02-07 | ジクアホソル含有点眼液 |
| JP2019022692A Active JP7042762B2 (ja) | 2012-03-26 | 2019-02-12 | ジクアホソル含有点眼液 |
Country Status (26)
| Country | Link |
|---|---|
| US (4) | US9486529B2 (ja) |
| EP (2) | EP2832359B1 (ja) |
| JP (6) | JP5625081B2 (ja) |
| KR (5) | KR101935484B1 (ja) |
| CN (2) | CN104203254A (ja) |
| AU (3) | AU2013241507A1 (ja) |
| BR (1) | BR112014023402B1 (ja) |
| CA (1) | CA2868390C (ja) |
| DK (1) | DK2832359T3 (ja) |
| EA (1) | EA028848B1 (ja) |
| ES (1) | ES2702575T3 (ja) |
| GE (1) | GEP20166470B (ja) |
| HK (1) | HK1204922A1 (ja) |
| HU (1) | HUE041671T2 (ja) |
| IN (1) | IN2014DN08632A (ja) |
| MX (1) | MX353874B (ja) |
| MY (1) | MY169816A (ja) |
| NZ (1) | NZ631041A (ja) |
| PH (1) | PH12014501955B1 (ja) |
| PL (1) | PL2832359T3 (ja) |
| PT (1) | PT2832359T (ja) |
| SG (2) | SG11201405799TA (ja) |
| TR (1) | TR201820073T4 (ja) |
| TW (4) | TWI692364B (ja) |
| UA (1) | UA113981C2 (ja) |
| WO (1) | WO2013146649A1 (ja) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2023165142A (ja) * | 2022-05-02 | 2023-11-15 | 株式会社三洋物産 | 遊技機 |
Families Citing this family (22)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2750229B2 (ja) | 1991-05-30 | 1998-05-13 | 信越石英株式会社 | 大型軽量化反射鏡 |
| JP2750234B2 (ja) | 1991-12-25 | 1998-05-13 | 信越石英株式会社 | シリカ質軽量反射鏡の製造方法 |
| SG11201405799TA (en) | 2012-03-26 | 2014-11-27 | Santen Pharmaceutical Co Ltd | Ophthalmic solution comprising diquafosol |
| CA2935055C (en) | 2014-01-10 | 2021-08-24 | Santen Pharmaceutical Co., Ltd. | Pharmaceutical composition containing pyridylaminoacetic acid compound |
| TWI709405B (zh) * | 2014-12-25 | 2020-11-11 | 日商參天製藥股份有限公司 | 水性點眼液及其應用 |
| KR20180014768A (ko) * | 2015-06-05 | 2018-02-09 | 산텐 세이야꾸 가부시키가이샤 | 소프트 콘택트렌즈가 착용된 드라이아이 환자의 눈에 점안되도록 이용되는 것을 특징으로 하는 드라이아이 치료제 |
| TWI711453B (zh) * | 2015-06-05 | 2020-12-01 | 日商參天製藥股份有限公司 | 抑制水性點眼液中之洛赫西定類的殘存率降低之方法 |
| HK1244489A1 (zh) * | 2015-06-29 | 2018-08-10 | 雅玛山酱油株式会社 | P1,p4-二(尿苷5′)-四磷酸晶体的保存方法 |
| JP6688057B2 (ja) * | 2015-12-01 | 2020-04-28 | 日水製薬株式会社 | グラム染色用後染色試液及びグラム染色方法 |
| US20210000844A1 (en) * | 2018-02-28 | 2021-01-07 | Santen Pharmaceutical Co., Ltd. | Ophthalmic composition comprising diquafosol and cationic polymer |
| CN108403625A (zh) * | 2018-04-11 | 2018-08-17 | 东莞解石医药科技有限公司 | 一种含有螯合剂的地夸磷索四钠滴眼液 |
| WO2020046950A1 (en) * | 2018-08-30 | 2020-03-05 | Eyevance Pharmaceuticals Llc | Ocular lubricant formulations |
| CN114286670B (zh) * | 2019-08-27 | 2024-01-16 | 参天制药株式会社 | 含有地夸磷索或其盐、及聚乙烯吡咯烷酮的水性眼科用组合物 |
| CN113720924B (zh) * | 2020-05-25 | 2025-01-10 | 南京帝昌医药科技有限公司 | 一种地夸磷索四钠的含量及有关物质检测方法 |
| WO2022107790A1 (ja) * | 2020-11-18 | 2022-05-27 | 参天製薬株式会社 | アルキルジアミノエチルグリシンまたはその塩を含有する水性点眼液 |
| JPWO2022107791A1 (ja) * | 2020-11-18 | 2022-05-27 | ||
| KR102548710B1 (ko) | 2020-12-24 | 2023-06-28 | 주식회사 종근당 | 디쿠아포솔 또는 이의 약제학적으로 허용가능한 염과 토코페롤을 함유하는 건성안 예방 또는 치료용 약제학적 조성물 |
| CN112933040A (zh) * | 2021-02-04 | 2021-06-11 | 合肥博思科创医药科技有限公司 | 一种舒更葡糖钠注射液的制备方法 |
| WO2023195718A1 (ko) * | 2022-04-04 | 2023-10-12 | 서울대학교산학협력단 | 감미 억제용 조성물 및 식품의 감미 억제 방법 |
| KR102794468B1 (ko) * | 2022-04-04 | 2025-04-14 | 서울대학교산학협력단 | 감미 억제용 조성물 및 식품의 감미 억제 방법 |
| CN116019767A (zh) * | 2023-01-12 | 2023-04-28 | 上海阿尔福斯医药科技有限公司 | 眼用制剂及其制备方法 |
| CN117838628B (zh) * | 2024-03-01 | 2024-05-28 | 广州市桐晖药业有限公司 | 一种地夸磷索钠滴眼液及其制备方法 |
Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP6389544B2 (ja) * | 2012-03-26 | 2018-09-12 | 参天製薬株式会社 | ジクアホソル含有点眼液 |
Family Cites Families (36)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPH075456B2 (ja) * | 1988-10-01 | 1995-01-25 | 参天製薬株式会社 | 点眼液 |
| JP2530491B2 (ja) | 1988-12-20 | 1996-09-04 | 参天製薬株式会社 | ヒアルロン酸点眼液 |
| TW200402B (ja) | 1990-08-13 | 1993-02-21 | Senju Pharma Co | |
| US5504113A (en) | 1994-03-02 | 1996-04-02 | Allergan, Inc. | Enhancement of benzalkonium chloride preservative activity in formulations containing an incompatible drug |
| US5900407A (en) | 1997-02-06 | 1999-05-04 | Inspire Pharmaceuticals, Inc. | Method of treating dry eye disease with uridine triphosphates and related compounds |
| NZ337225A (en) | 1997-02-06 | 2002-03-28 | Inspire Pharmaceuticals Inc | Dinucleotides useful for treating chronic pulmonary obstructive disorder |
| DK1012154T3 (da) | 1997-07-25 | 2004-07-26 | Inspire Pharmaceuticals Inc | Salte af di(uridin-5'-tetraphosphat), fremgangsmåde til fremstilling og anvendelser deraf |
| KR19990074047A (ko) | 1998-03-03 | 1999-10-05 | 김수복 | 콘택트렌즈용 세척, 소독 및 보존제 조성물 |
| JP5138128B2 (ja) | 1998-08-21 | 2013-02-06 | 千寿製薬株式会社 | 水性液剤 |
| JP4880808B2 (ja) * | 1999-11-15 | 2012-02-22 | 久光製薬株式会社 | 人工涙液型点眼剤組成物 |
| JP4003008B2 (ja) * | 2000-05-30 | 2007-11-07 | 参天製薬株式会社 | 角膜上皮伸展促進剤 |
| KR100832821B1 (ko) * | 2000-05-30 | 2008-05-28 | 산텐 세이야꾸 가부시키가이샤 | 각막 상피 신장 촉진제 |
| US6555675B2 (en) | 2000-08-21 | 2003-04-29 | Inspire Pharmaceuticals, Inc. | Dinucleoside polyphosphate compositions and their therapuetic use as purinergic receptor agonists |
| US6583181B1 (en) | 2000-11-22 | 2003-06-24 | Lonza Inc. | Antimicrobial quaternary ammonium compositions with reduced ocular irritation |
| CN1228053C (zh) * | 2001-09-11 | 2005-11-23 | 参天制药株式会社 | 含有二尿苷磷酸的滴眼液 |
| JP2003160491A (ja) | 2001-09-11 | 2003-06-03 | Santen Pharmaceut Co Ltd | ジウリジンリン酸含有点眼液 |
| US20030109488A1 (en) | 2001-10-11 | 2003-06-12 | Alcon, Inc. | Methods for treating dry eye |
| PT1468697E (pt) | 2003-04-14 | 2008-03-05 | Wyeth Corp | Composições contendo piperacilina e tazobactam úteis para injecção |
| JP4806956B2 (ja) | 2004-04-20 | 2011-11-02 | 大正製薬株式会社 | 点眼用液剤 |
| US20060073172A1 (en) | 2004-10-01 | 2006-04-06 | Schneider L W | Stabilized ophthalmic solution for the treatment of glaucoma and lowering intraocular pressure |
| HRP20100591T1 (hr) | 2004-12-02 | 2010-12-31 | Venus Remedies Limited | Smjese za suzbijanje beta-laktamazom posredovane rezistencije na antibiotike upotrebom inhibitora beta-laktamaze, korisne za injekcije |
| KR100870104B1 (ko) * | 2005-11-28 | 2008-11-26 | 주식회사 머젠스 | 안구건조증 치료 및 예방용 조성물 |
| JP4168071B2 (ja) | 2005-12-08 | 2008-10-22 | 興和株式会社 | 点眼用組成物 |
| JP2008247828A (ja) | 2007-03-30 | 2008-10-16 | Wakamoto Pharmaceut Co Ltd | ラタノプロストを含有する水性医薬組成物。 |
| JP2009040727A (ja) * | 2007-08-09 | 2009-02-26 | Towa Yakuhin Kk | ラタノプロストを有効成分とする安定な点眼液剤 |
| CN100534423C (zh) * | 2007-11-30 | 2009-09-02 | 张咏梅 | 一种保质期长的氯霉素滴眼液及其制备方法 |
| US8119112B2 (en) | 2008-01-31 | 2012-02-21 | Bausch & Lomb Incorporated | Ophthalmic compositions with an amphoteric surfactant and hyaluronic acid |
| CN101461778A (zh) * | 2009-01-06 | 2009-06-24 | 河北科技大学 | 不含抑菌剂的盐酸环丙沙星滴眼液及其制备方法 |
| EP2393355A4 (en) * | 2009-01-23 | 2012-07-25 | Inspire Pharmaceuticals Inc | METHOD FOR TREATING A DRY EYE WITH AZITHROMYCIN |
| CN102100693A (zh) * | 2009-12-16 | 2011-06-22 | 沈阳兴齐制药有限公司 | 一种含有肌肽的人工泪液及其制备方法 |
| KR20110104367A (ko) | 2010-03-16 | 2011-09-22 | 삼천당제약주식회사 | 무보존제 안과용 조성물 |
| WO2012012640A1 (en) | 2010-07-21 | 2012-01-26 | Cumberland Pharmaceuticals, Inc. | Acetycysteine compositions and methods of use thereof |
| AU2011299851A1 (en) | 2010-09-10 | 2013-04-04 | Santen Pharmaceutical Co., Ltd. | Agent for treatment of dry eye characterized by combining P2Y2 receptor agonist with hyaluronic acid or salt thereof, method for treating dry eye, and use of the P2Y2 receptor agonist and hyaluronic acid or salt thereof |
| CN103282039A (zh) * | 2010-12-28 | 2013-09-04 | 参天制药株式会社 | 含有地夸磷索的滴眼液及其制备方法、抑制不溶性析出物产生的方法 |
| CA2830896A1 (en) * | 2011-04-12 | 2012-10-18 | Yukihiko Mashima | Aqueous ophthalmic composition |
| HK1203370A1 (en) | 2012-03-26 | 2015-10-30 | 迪乐方有限责任公司 | Method for treatment of labor arrest |
-
2013
- 2013-03-25 SG SG11201405799TA patent/SG11201405799TA/en unknown
- 2013-03-25 JP JP2013062270A patent/JP5625081B2/ja active Active
- 2013-03-25 KR KR1020187018799A patent/KR101935484B1/ko not_active Ceased
- 2013-03-25 KR KR1020187037979A patent/KR20190002751A/ko not_active Ceased
- 2013-03-25 CN CN201380016616.1A patent/CN104203254A/zh active Pending
- 2013-03-25 TW TW106124911A patent/TWI692364B/zh active
- 2013-03-25 GE GEAP201313609A patent/GEP20166470B/en unknown
- 2013-03-25 CA CA2868390A patent/CA2868390C/en active Active
- 2013-03-25 US US14/386,169 patent/US9486529B2/en not_active Expired - Fee Related
- 2013-03-25 TW TW109124203A patent/TWI757799B/zh active
- 2013-03-25 DK DK13770386.4T patent/DK2832359T3/en active
- 2013-03-25 TW TW109100132A patent/TWI723722B/zh active
- 2013-03-25 SG SG10201607872PA patent/SG10201607872PA/en unknown
- 2013-03-25 TW TW102110422A patent/TWI625135B/zh active
- 2013-03-25 ES ES13770386T patent/ES2702575T3/es active Active
- 2013-03-25 EA EA201491771A patent/EA028848B1/ru unknown
- 2013-03-25 PL PL13770386T patent/PL2832359T3/pl unknown
- 2013-03-25 IN IN8632DEN2014 patent/IN2014DN08632A/en unknown
- 2013-03-25 WO PCT/JP2013/058519 patent/WO2013146649A1/ja not_active Ceased
- 2013-03-25 KR KR1020157004372A patent/KR101875845B1/ko not_active Ceased
- 2013-03-25 AU AU2013241507A patent/AU2013241507A1/en not_active Abandoned
- 2013-03-25 HK HK15105452.3A patent/HK1204922A1/xx unknown
- 2013-03-25 EP EP13770386.4A patent/EP2832359B1/en active Active
- 2013-03-25 KR KR1020207022714A patent/KR20200096708A/ko not_active Ceased
- 2013-03-25 NZ NZ631041A patent/NZ631041A/en not_active IP Right Cessation
- 2013-03-25 KR KR1020147028142A patent/KR101536885B1/ko not_active Ceased
- 2013-03-25 PT PT13770386T patent/PT2832359T/pt unknown
- 2013-03-25 HU HUE13770386A patent/HUE041671T2/hu unknown
- 2013-03-25 MX MX2014011468A patent/MX353874B/es active IP Right Grant
- 2013-03-25 MY MYPI2014002576A patent/MY169816A/en unknown
- 2013-03-25 EP EP18193430.8A patent/EP3431092A1/en not_active Withdrawn
- 2013-03-25 UA UAA201411576A patent/UA113981C2/uk unknown
- 2013-03-25 CN CN202110358504.0A patent/CN113018259A/zh active Pending
- 2013-03-25 BR BR112014023402-7A patent/BR112014023402B1/pt not_active IP Right Cessation
- 2013-03-25 TR TR2018/20073T patent/TR201820073T4/tr unknown
-
2014
- 2014-04-14 JP JP2014082821A patent/JP6126041B2/ja active Active
- 2014-09-01 PH PH12014501955A patent/PH12014501955B1/en unknown
-
2016
- 2016-02-23 AU AU2016201110A patent/AU2016201110B2/en not_active Ceased
- 2016-02-23 AU AU2016201111A patent/AU2016201111A1/en not_active Withdrawn
- 2016-10-10 US US15/289,273 patent/US10071113B2/en active Active
-
2017
- 2017-04-05 JP JP2017075167A patent/JP6389544B2/ja active Active
-
2018
- 2018-02-07 JP JP2018020154A patent/JP6483299B2/ja active Active
- 2018-08-14 US US16/103,328 patent/US10632139B2/en not_active Expired - Fee Related
-
2019
- 2019-02-12 JP JP2019022692A patent/JP7042762B2/ja active Active
-
2020
- 2020-03-16 US US16/819,974 patent/US11166974B2/en not_active Expired - Fee Related
-
2022
- 2022-03-14 JP JP2022039183A patent/JP7447176B2/ja active Active
Patent Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP6389544B2 (ja) * | 2012-03-26 | 2018-09-12 | 参天製薬株式会社 | ジクアホソル含有点眼液 |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2023165142A (ja) * | 2022-05-02 | 2023-11-15 | 株式会社三洋物産 | 遊技機 |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP7042762B2 (ja) | ジクアホソル含有点眼液 | |
| US20140221306A1 (en) | Ophthalmic solution comprising diquafosol, method for producing the same, and method for inhibiting formation of insoluble precipitate |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20220411 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20230307 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20230414 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20230623 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20230905 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20231101 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20240130 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20240228 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 7447176 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |