ES2695173T3 - Partículas de sílice modificadas con S-nitrosotiol que liberan óxido nítrico y procedimientos de fabricación de las mismas - Google Patents
Partículas de sílice modificadas con S-nitrosotiol que liberan óxido nítrico y procedimientos de fabricación de las mismas Download PDFInfo
- Publication number
- ES2695173T3 ES2695173T3 ES12752627T ES12752627T ES2695173T3 ES 2695173 T3 ES2695173 T3 ES 2695173T3 ES 12752627 T ES12752627 T ES 12752627T ES 12752627 T ES12752627 T ES 12752627T ES 2695173 T3 ES2695173 T3 ES 2695173T3
- Authority
- ES
- Spain
- Prior art keywords
- particles
- nitrosothiol
- thiol
- functionalized
- silica particles
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 0 C*C(CC(*)C(C(*)C*)N=O)C(C(C(CO)[N+](C)[O-])C1*C1)*(C)=C Chemical compound C*C(CC(*)C(C(*)C*)N=O)C(C(C(CO)[N+](C)[O-])C1*C1)*(C)=C 0.000 description 2
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L2/00—Methods or apparatus for disinfecting or sterilising materials or objects other than foodstuffs or contact lenses; Accessories therefor
- A61L2/16—Methods or apparatus for disinfecting or sterilising materials or objects other than foodstuffs or contact lenses; Accessories therefor using chemical substances
- A61L2/18—Liquid substances or solutions comprising solids or dissolved gases
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07F—ACYCLIC, CARBOCYCLIC OR HETEROCYCLIC COMPOUNDS CONTAINING ELEMENTS OTHER THAN CARBON, HYDROGEN, HALOGEN, OXYGEN, NITROGEN, SULFUR, SELENIUM OR TELLURIUM
- C07F7/00—Compounds containing elements of Groups 4 or 14 of the Periodic System
- C07F7/02—Silicon compounds
- C07F7/08—Compounds having one or more C—Si linkages
- C07F7/0834—Compounds having one or more O-Si linkage
- C07F7/0838—Compounds with one or more Si-O-Si sequences
- C07F7/0872—Preparation and treatment thereof
- C07F7/0874—Reactions involving a bond of the Si-O-Si linkage
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07F—ACYCLIC, CARBOCYCLIC OR HETEROCYCLIC COMPOUNDS CONTAINING ELEMENTS OTHER THAN CARBON, HYDROGEN, HALOGEN, OXYGEN, NITROGEN, SULFUR, SELENIUM OR TELLURIUM
- C07F7/00—Compounds containing elements of Groups 4 or 14 of the Periodic System
- C07F7/02—Silicon compounds
- C07F7/08—Compounds having one or more C—Si linkages
- C07F7/10—Compounds having one or more C—Si linkages containing nitrogen having a Si-N linkage
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07F—ACYCLIC, CARBOCYCLIC OR HETEROCYCLIC COMPOUNDS CONTAINING ELEMENTS OTHER THAN CARBON, HYDROGEN, HALOGEN, OXYGEN, NITROGEN, SULFUR, SELENIUM OR TELLURIUM
- C07F7/00—Compounds containing elements of Groups 4 or 14 of the Periodic System
- C07F7/02—Silicon compounds
- C07F7/08—Compounds having one or more C—Si linkages
- C07F7/18—Compounds having one or more C—Si linkages as well as one or more C—O—Si linkages
- C07F7/1804—Compounds having Si-O-C linkages
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08G—MACROMOLECULAR COMPOUNDS OBTAINED OTHERWISE THAN BY REACTIONS ONLY INVOLVING UNSATURATED CARBON-TO-CARBON BONDS
- C08G77/00—Macromolecular compounds obtained by reactions forming a linkage containing silicon with or without sulfur, nitrogen, oxygen or carbon in the main chain of the macromolecule
- C08G77/04—Polysiloxanes
- C08G77/22—Polysiloxanes containing silicon bound to organic groups containing atoms other than carbon, hydrogen and oxygen
- C08G77/26—Polysiloxanes containing silicon bound to organic groups containing atoms other than carbon, hydrogen and oxygen nitrogen-containing groups
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08G—MACROMOLECULAR COMPOUNDS OBTAINED OTHERWISE THAN BY REACTIONS ONLY INVOLVING UNSATURATED CARBON-TO-CARBON BONDS
- C08G77/00—Macromolecular compounds obtained by reactions forming a linkage containing silicon with or without sulfur, nitrogen, oxygen or carbon in the main chain of the macromolecule
- C08G77/04—Polysiloxanes
- C08G77/22—Polysiloxanes containing silicon bound to organic groups containing atoms other than carbon, hydrogen and oxygen
- C08G77/28—Polysiloxanes containing silicon bound to organic groups containing atoms other than carbon, hydrogen and oxygen sulfur-containing groups
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08K—Use of inorganic or non-macromolecular organic substances as compounding ingredients
- C08K3/00—Use of inorganic substances as compounding ingredients
- C08K3/28—Nitrogen-containing compounds
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08K—Use of inorganic or non-macromolecular organic substances as compounding ingredients
- C08K3/00—Use of inorganic substances as compounding ingredients
- C08K3/30—Sulfur-, selenium- or tellurium-containing compounds
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08K—Use of inorganic or non-macromolecular organic substances as compounding ingredients
- C08K3/00—Use of inorganic substances as compounding ingredients
- C08K3/02—Elements
- C08K2003/023—Silicon
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y10—TECHNICAL SUBJECTS COVERED BY FORMER USPC
- Y10T—TECHNICAL SUBJECTS COVERED BY FORMER US CLASSIFICATION
- Y10T428/00—Stock material or miscellaneous articles
- Y10T428/29—Coated or structually defined flake, particle, cell, strand, strand portion, rod, filament, macroscopic fiber or mass thereof
- Y10T428/2982—Particulate matter [e.g., sphere, flake, etc.]
Abstract
Un procedimiento de formación de partículas de sílice co-condensadas funcionalizadas con S-nitrosotiol que comprende: hacer reaccionar un silano que contiene tiol y un alcoxisilano de cadena principal en una solución de precursor de sol que comprende agua para formar partículas de sílice co-condensada funcionalizadas con tiol, en el que el silano que contiene tiol comprende un silano que contiene tiol terciario y el alcoxisilano de cadena principal es un alcoxisilano que no contiene un grupo funcional tiol y, en el que las partículas de sílice co-condensada funcionalizadas con tiol comprenden una matriz de polisiloxano y al menos algunos de los grupos tiol están presentes dentro de la matriz de polisiloxano; y hacer reaccionar las partículas de sílice co-condensada funcionalizadas con tiol con un agente de nitrosación para proporcionar las partículas de sílice co-condensada funcionalizadas con S-nitrosotiol.
Description
DESCRIPCION
Partmulas de s l^ice modificadas con S-nitrosotiol que liberan oxido mtrico y procedimientos de fabricacion de las mismas
Campo de la invencion
La presente invencion se refiere a partmulas liberadoras de oxido mtrico. Mas particularmente, la presente solicitud se refiere a partmulas de s l^ice modificadas con S-nitrosotiol.
Antecedentes de la invencion
Desde el descubrimiento de las funciones fisiologicas del oxido mtrico (NO), muchas investigaciones se han centrado en la smtesis de materiales/vehmulos que liberan NO para obtener las caractensticas del NO como agente antimicrobiano, mediador de la reparacion de heridas o cofactor angiogenico. Los S-nitrosotioles (RSNO) son una clase de donador de NO endogeno que se cree que almacena/transporta la mayor parte del reservorio natural de NO del cuerpo. Como tal, una gran cantidad de trabajo ha utilizado RSNO de bajo peso molecular (por ejemplo, S-nitroso-glutation (GSNO), S-nitroso-N-acetilcistema (SNAC) y S-nitroso-N-acetil-penicilamina (SNAP)) como donadores para liberar espontaneamente NO. Aunque es prometedor, la aplicacion clmica de donadores de NO de bajo peso molecular ha sido lenta debido a la falta de direccion espedfica de tejido y la cinetica de liberacion de NO incontrolable. Para abordar dichas deficiencias, los precursores de donadores de NO se han conjugado en armazones mas grandes (por ejemplo, protemas, dendnmeros y nanopartmulas), permitiendo asf un alto almacenamiento de NO por vehmulo de entrega y perfiles de liberacion similares a sus analogos moleculares pequenos.
Las partmulas de sflice estan entre los armazones macromoleculares mas ampliamente empleados para aplicaciones biomedicas debido a las estrategias sinteticas faciles y la citotoxicidad minima.
Anteriormente, la superficie de partmulas de sflice pirogena (7-10 nm de diametro) se ha injertado con SNAP, SNAC y S-nitrosocistema (CysNO) para crear partmulas de sflice modificadas con S-nitrosotiol. Sin embargo, el almacenamiento de NO se limito a 0,021-0,138 pmol mg-1 porque la funcionalizacion de tiol estaba restringida al exterior de la partmula. Ademas, estos sistemas no son capaces de ajustar el tamano de partmula para adaptarse a un sistema terapeutico de interes. Como alternativa, la hidrolisis y cocondensacion de los precursores de organosilano y tetraalcoxisilano mediante qmmica de sol-gel puede representar un procedimiento para preparar una red de sflice con una concentracion mas alta de funcionalidades organicas. De hecho, el procedimiento Stober (qmmica de sol-gel con un disolvente de alcohol y un catalizador de amomaco) ha demostrado ser eficaz para sintetizar partmulas de sflice modificadas con N-diazeniodiolato de diverso tamano y capacidad de almacenamiento de NO. Vease, por ejemplo, la publicacion de los EE.UU. n.° 2009/0214618 (Schoenfisch y col.). La ventaja del procedimiento Stober sobre el injerto de superficie es que la co-condensacion proporciona una incorporacion uniforme de la funcionalidad organica (es decir, donador de NO) a traves de la red de sflice resultante en oposicion a la funcionalizacion restringida solo en la superficie. Como resultado, dichas partfculas pueden mostrar un almacenamiento de NO significativamente mayor.
Riccio y col., (Biomaterials, 2009, 30, 4494-4502) describen la smtesis, caracterizacion del material y biocompatibilidad in vitro de pelfculas de xerogel modificadas con S-nitrosotiol (RSNO). Frost y col., (Journal of Biomedical Materials Research, 2005, 72A, 409-419) describen S-nitrosotioles anclados a partfculas de sflice pirogena.
Sumario de la invencion
Los aspectos de la presente invencion se definen en las reivindicaciones adjuntas.
Un primer aspecto de la presente invencion comprende un procedimiento para formar partfculas de sflice cocondensada funcionalizadas con S-nitrosotiol que comprende:
hacer reaccionar un silano que contiene tiol y un alcoxisilano de cadena principal en una solucion de precursor de sol que comprende agua para formar partfculas de sflice co-condensada funcionalizadas con tiol, en el que el silano que contiene tiol comprende un silano que contiene tiol terciario y el alcoxisilano de cadena principal es un alcoxisilano que no contiene un grupo funcional tiol, y en el que las partfculas de sflice co-condensada funcionalizadas con tiol comprenden una matriz de polisiloxano y al menos algunos de los grupos tiol estan presentes dentro de la matriz de polisiloxano; y
hacer reaccionar las partfculas de sflice co-condensada funcionalizadas con tiol con un agente de nitrosacion para proporcionar las partfculas de sflice co-condensada funcionalizadas con S-nitrosotiol.
Un segundo aspecto de la presente invencion comprende partfculas de sflice co-condensada monodispersas funcionalizadas con S-nitrosotiol que tienen un diametro medio de partfcula en un intervalo de 200 nm a 700 nm.
Un aspecto adicional de la presente invencion comprende parffculas de s l^ice co-condensada funcionalizadas con S-nitrosotiol que tienen un almacenamiento de NO en un intervalo de 0,01 pmol a 10 pmol de NO por mg de parffcula.
Otro aspecto de la presente invencion comprende una parffcula de sflice co-condensada funcionalizada con S-nitrosotiol que comprende grupos funcionales de nitrosotiol terciarios.
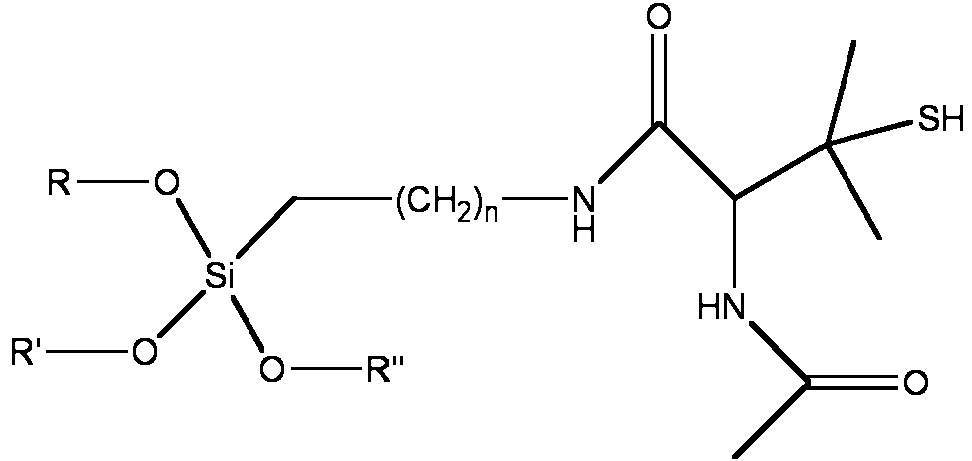
Tambien se describe en el presente documento un compuesto que tiene la siguiente estructura:
en la que R, R' y R" son cada uno independientemente alquilo y n es 0 en un intervalo de 0 a 10.
Breve descripcion de los dibujos
Los dibujos adjuntos, que se incluyen para proporcionar una comprension adicional de la invencion y se incorporan y constituyen una parte de esta solicitud, ilustran determinada(s) realizacion/es de la invencion.
La Figura 1 proporciona un esquema para la smtesis de N-acetilpenicilamina propiltrimetoxisilano (NAPTMS). La Figura 2 proporciona un espectro 1H RMN del compuesto NAPTMS.
La Figura 3 muestra un espectro 29SiRMN en estado solido por polarizacion cruzada/giro al angulo magico (CP/MAS) de sflice sintetizada con (A) 0, (B) 25, (C) 40, (D) 60, (E) 75, y (F) 85 % en moles de MPTMS (equilibrio TMOS). Las bandas Q y T han sido designadas.
La Figura 4 muestra las micrograffas electronicas de barrido de (A) 25, (B) 40, (C) 60, (D) 75 y (E) 85 % en moles de MPTMS (equilibrio TMOS) y (F) 75 y (G) 85 % en moles de parffculas MPTMS (equilibrio Te Os ) sintetizadas con 16,0 M de agua, 5,5 M de amomaco y 0,1 M de silano.
La Figura 5 muestra las micrograffas electronicas de barrido de (A) 25, (B) 40, (C) 60, (D) 75 y (E) 85 % en moles de MPTMS (equilibrio TMOS) y (F) 75 y (G) 85 % en moles de parffculas MPTMS (equilibrio Te Os ) sintetizadas a traves de un procedimiento semicontinuo con una velocidad de alimentacion de silano de 0,5 ml min-1.
La Figura 6 muestra las micrograffas electronicas de barrido de 75 % en moles de MPTMS (equilibrio TEOS) sintetizadas con (A) 47,0, (B) 42,0, (C) 40,6, (D) 36,5, (E) 32,5 y (F) 24,9 M de agua.
La Figura 7 muestra las micrograffas electronicas de barrido de (A-B) 25, (C-D) 40, (E-F) 60, (G-H) 75 y (I-J) 85 % en moles de MPTMS (equilibrio TMOS) y (K-L) 85 % en moles de parffculas MPTMS (equilibrio TEOS) sintetizadas con (A, C, E, F, G, I, K) 32,5 y (B, D, F, H, J, L) 24,9 M de agua.
La Figura 8 muestra un esquema de las vfas de descomposicion de S-nitrosotiol.
La Figura 9 muestra la liberacion de oxido mtrico a partir de 75 % de parffculas de MPTMS modificadas con RSNO (equilibrio TEOS) en presencia de (A) 0 (-), 60 (--), 100 (■■■) y 200 (- ■) W de irradiacion a 0 °C y (B) 0 (-), 10 (- -), y solucion de CuBr2/PBS 25 (■■■) pM a 0 °C. Nota: CuBr20 pM es DTPA 500 pM (pH PBS 7,4). La insercion de A proporciona una vista ampliada del perfil de liberacion de NO sin irradiacion.
La Figura 10 muestra imagenes MEB de parffculas de sflice co-condensada funcionalizadas con tiol terciario de acuerdo con algunas realizaciones de la invencion antes de los ultrasonidos.
La Figura 11 muestra imagenes MEB de parffculas de sflice co-condensada funcionalizadas con tiol terciario de acuerdo con algunas realizaciones de la invencion despues de 30 minutos de ultrasonidos seguido de nitrosacion.
La Figura 12 muestra imagenes MEB de parffculas de sflice co-condensada funcionalizadas con tiol terciario de acuerdo con algunas realizaciones de la invencion despues de 60 minutos de ultrasonidos seguido de nitrosacion.
Descripcion detallada de las realizaciones de la invencion
Los aspectos anteriores y otros de la presente invencion se describiran ahora con mas detalle con respecto a la descripcion y a las metodologfas proporcionadas en el presente documento. Debe apreciarse que la invencion puede realizarse de diferentes formas y no debe interpretarse como limitada a las realizaciones expuestas en el presente documento. En su lugar, estas realizaciones se proporcionan de modo que esta divulgacion sera minuciosa y completa, y transmitira completamente el ambito de la invencion a los expertos en la tecnica.
La terminologfa usada en la descripcion de la invencion en el presente documento tiene el fin de describir realizaciones particulares solamente y no pretende ser limitativa de la invencion. Como se usa en la descripcion de las realizaciones de la invencion y en las reivindicaciones adjuntas, las formas singulares "un", "una" y "el" pretenden
incluir tambien las formas plurales, salvo que el contexto indique claramente lo contrario. Ademas, tal como se usa en el presente documento, el termino "y/o", se refiere y abarca cualquiera y todas las combinaciones posibles de uno o mas de los artfculos enumerados asociados. Ademas, el termino "aproximadamente", tal como se usa en el presente documento cuando se refiere a un valor medible tal como una cantidad de un compuesto, dosis, tiempo, temperatura y similares, pretende abarcar variaciones del 20 %, 10%, 5%, 1 %, 0,5 % o incluso 0,1 % de la cantidad especificada. Se entendera ademas que los terminos "comprende" y/o "que comprende", cuando se usan en esta memoria descriptiva, especifican la presencia de las caractensticas, numeros enteros, etapas, operaciones, elementos y/o componentes indicados, pero no excluyen la presencia o adicion de una o mas caractensticas, numeros enteros, etapas, operaciones, elementos, componentes y/o grupos diferentes de los mismos. A menos que se indique lo contrario, todos los terminos, incluidos los terminos tecnicos y cientificos usados en la descripcion, tienen el mismo significado que entiende comunmente un experto habitual en la tecnica a la que pertenece la presente invencion. En el caso de una terminologfa conflictiva, la presente memoria descriptiva es controladora. Las realizaciones descritas en un aspecto de la presente invencion no estan limitadas al aspecto descrito. Las realizaciones tambien se pueden aplicar a un aspecto diferente de la invencion siempre que las realizaciones no eviten que estos aspectos de la invencion operen para su fin previsto.
Definiciones qû micas
Tal como se usa en el presente documento, el termino "alquilo" se refiere a cadenas de hidrocarburos C1-20 incluido, lineales (es decir "de cadena lineal"), ramificados, o dclicos, saturados o al menos parcial y en algunos casos completamente insaturados (es decir, alquenilos y alquinilos), que incluyen, por ejemplo, metilo, etilo, propilo, isopropilo, butilo, isobutilo, terc-butilo, pentilo, hexilo, octilo, etenilo, propenilo, butenilo, pentenilo, hexenilo, octenilo, butadienilo, propinilo, butinilo, pentinilo, hexinilo, heptinilo y grupos alenilo. "Ramificado" se refiere a un grupo alquilo en el que un grupo alquilo inferior, tal como metilo, etilo o propilo, esta unido a una cadena de alquilo lineal. Los grupos ejemplares de alquilo ramificado incluyen, pero sin limitacion, isopropilo, isobutilo, terc-butilo. "Alquilo inferior" se refiere a un grupo alquilo que tiene de 1 a aproximadamente 8 atomos de carbono (es decir, un alquilo C1-8), por ejemplo, 1, 2, 3, 4, 5, 6, 7 u 8 atomos de carbono. "Alquilo superior" se refiere a un grupo alquilo que tiene de aproximadamente 10 a aproximadamente 20 atomos de carbono, por ejemplo, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 o 20 atomos de carbono. En determinadas realizaciones, "alquilo" se refiere, en particular, a alquilos de cadena lineal C1-5. En otras realizaciones, "alquilo" se refiere, en particular, a alquilos de cadena ramificada C1-5.
El termino "mercapto" o "tio" se refiere al grupo -SH.
En el presente documento se proporcionan de acuerdo con algunas realizaciones de la invencion procedimientos para formar partfculas de sflice co-condensadas mediante el procedimiento Stober. Vease, por ejemplo, Stober, W.; Fink, A.; Bohn, EJ Colloid Interface Sci. 1968, 26, 62. La formacion de partfculas bajo el procedimiento de Stober se produce por hidrolisis y condensacion de precursores de silano en los que las velocidades de hidrolisis relativas para los precursores dictan tanto la velocidad del crecimiento de partfculas como la probabilidad de la incorporacion de cada silano a la red de sflice. Las disparidades excesivas entre las velocidades de reaccion de diferentes silanos pueden conducir a la ausencia de formacion de partfculas cuando se intenta la co-condensacion.
Se proporcionan de acuerdo con algunas realizaciones de la invencion procedimientos para formar partfculas de sflice co-condensada funcionalizas con S-nitrosotiol que incluyen hacer reaccionar un silano que contiene tiol y un alcoxisilano de cadena principal en una solucion de precursor de sol que incluye agua para formar partfculas de sflice co-condensada funcionalizadas con tiol, en el que las partfculas de sflice co-condensada funcionalizadas con tiol incluyen una matriz de polisiloxano y al menos algunos de los grupos tiol estan presentes dentro de la matriz de polisiloxano. Los procedimientos incluyen ademas hacer reaccionar las partfculas de sflice co-condensada funcionalizadas con tiol con un agente de nitrosacion para proporcionar las partfculas de sflice co-condensada funcionalizadas con S-nitrosotiol. En el procedimiento de acuerdo con la invencion, el silano que contiene tiol comprende un silano que contiene un tiol terciario. Tambien se pueden usar combinaciones de diferentes silanos. Un silano que contiene tiol adecuado sera un silano que permitira la formacion de partfculas y, en algunas realizaciones, la formacion de partfculas monodispersas. Por lo tanto, algunos silanos que contienen tiol pueden ser adecuados con algunos alcoxisilanos de cadena principal y no adecuados con otros. En algunas divulgaciones, el silano que contiene tiol primario es mercaptopropiltrimetoxisilano. En algunas realizaciones, el tiol alcoxisilano terciario tiene la siguiente estructura: (OR)(OR')(OR")Si(Rx), en la que R, R' y R" son cada uno independientemente H, alquilo o alquilo sustituido y Rx es un grupo funcional que comprende un grupo tiol terciario. En realizaciones particulares, el tiol alcoxisilano terciario tiene la estructura:
en la que R, R' y R" son cada uno independientemente H, alquilo o alquilo sustituido, y n es 0-10. En algunas realizaciones, R, R' y R" son cada uno independientemente alquilo y n es 0-5. Ademas, en realizaciones particulares de la invencion, el tiol terciario es un compuesto que tiene la estructura:
Se puede usar cualquier alcoxisilano de cadena principal adecuado. Tal como se usa en el presente documento, la expresion "alcoxisilano de cadena principal" se refiere a un alcoxisilano que no contiene un grupo funcional tiol. Ejemplos incluyen tetrametoxisilano, tetraetoxisilano, metiltrimetoxisilano, metiltrietoxisilano y butiltrimetoxisilano. Un silano de cadena principal adecuado sera un silano que permitira la formacion de partfculas y, en algunas realizaciones, la formacion de partfculas monodispersas.
Se puede usar cualquier concentracion adecuada de agua. En algunas realizaciones, la concentracion de agua en la solucion del precursor de sol esta en un intervalo de aproximadamente 8 M a aproximadamente 32,5 M.
En algunas realizaciones, se incluye un catalizador, tal como un catalizador de amomaco, en la solucion de precursor de sol. Se puede usar cualquier concentracion adecuada de catalizador. Sin embargo, en algunas realizaciones, se incluye un catalizador de amomaco en la solucion de precursor de sol, en algunas realizaciones, a una concentracion en un intervalo de aproximadamente 1,9 M a aproximadamente 5,5 M.
En una divulgacion, el mercaptopropiltrimetoxisilano y el tetrametoxisilano se hacen reaccionar en presencia de agua y un catalizador de amomaco para formar partfculas de sflice co-condensada funcionalizadas con tiol. En algunas realizaciones, la reaccion se produce en una solucion que incluye mercaptopropiltrimetoxisilano y tetrametoxisilano a una concentracion total de monomero de silano en un intervalo de aproximadamente 0,1 M a aproximadamente 0,4 M, en la que el monomero de silano incluye aproximadamente 25 a aproximadamente 85 % en moles de mercaptopropiltrimetoxisilano. En algunas realizaciones, el agua esta presente en la solucion a una concentracion en un intervalo de aproximadamente 8,0 a aproximadamente 32,5 M y el catalizador de amomaco esta presente a una concentracion en un intervalo de aproximadamente 1,9 M a aproximadamente 5,5 M.
En una divulgacion, el mercaptopropiltrimetoxisilano y el tetrametoxisilano se hacen reaccionar en presencia de agua y un catalizador de amomaco para formar partfculas de sflice co-condensada funcionalizadas con tiol. En una divulgacion, la reaccion se produce en una solucion que incluye mercaptopropiltrimetoxisilano y tetrametoxisilano a una concentracion total de monomero de silano en un intervalo de aproximadamente 0,1 M a aproximadamente 0,4 M, en la que el monomero de silano incluye aproximadamente 75 a aproximadamente 85 % mol de mercaptopropiltrimetoxisilano. En algunas realizaciones, el agua esta presente en la solucion a una concentracion en un intervalo de aproximadamente 8,0 a aproximadamente 32,5 M y el catalizador de amomaco esta presente a una concentracion en un intervalo de aproximadamente 1,9 M a aproximadamente 5,5 M.
En algunas realizaciones, los procedimientos para formar partfculas de sflice co-condensada funcionalizadas con tiol incluyen hacer reaccionar un silano que contiene tiol terciario y un alcoxisilano de cadena principal en las presencias
de agua y un catalizador de amomaco para formar partfculas de s l^ice co-condensada funcionalizadas con tiol. En algunas realizaciones, la reaccion se produce en una solucion que incluye silano que contiene tiol terciario y alcoxisilano a una concentracion total de monomero de silano en un intervalo de aproximadamente 0,1 M a aproximadamente 0,4 M, en la que el monomero silano incluye aproximadamente 25 a aproximadamente 85 % en moles de silano que contiene que contiene tiol terciario. En algunas realizaciones, el agua esta presente en la solucion a una concentracion en un intervalo de aproximadamente 8,0 a aproximadamente 32,5 M y el catalizador de amomaco esta presente a una concentracion en un intervalo de aproximadamente 1,9 a aproximadamente 5,5 M. La solucion de precursor de sol tambien se puede remover/agitar como conocen los expertos en la tecnica, y se pueden incluir otros aditivos o monomeros de silano usados en qmmica sol en algunas realizaciones de la invencion. En algunas realizaciones de la invencion, los procedimientos proporcionados en el presente documento se pueden usar para formar partfculas de sflice co-condensada funcionalizadas con nitrosotiol, que en algunas realizaciones, son monodispersas. Tal como se usa en el presente documento, el termino "monodispersa" se refiere a partfculas que tienen un tamano de partfcula uniforme, en algunas realizaciones, que tienen un diametro medio de partfcula ± 100 nm como se mide a partir de micrograffas electronicas; un promedio Z ± 60 nm como se mide a partir de la dispersion dinamica de la luz; y/o que tienen un mdice de polidispersidad <0,1 como se mide mediante la dispersion dinamica de la luz. En una divulgacion, los procedimientos descritos en el presente documento proporcionan partfculas monodispersas que tienen un diametro medio de partfcula de menos de 100 micrometres, y en algunas realizaciones, de menos de 1 micrometre. En una divulgacion, los procedimientos usados en el presente documento pueden proporcionar partreulas monodispersas que tienen un diametro medio de partreula en un intervalo de aproximadamente 10 nm a aproximadamente 100 pm. En algunas realizaciones, las partreulas tienen un diametro medio de partreula en un intervalo de 200 a 700 nm.
Se puede usar cualquier procedimiento adecuado para nitrosar las partreulas de sflice co-condensada funcionalizadas con tiol. Ademas, se puede usar cualquier agente de nitrosacion adecuado. Sin embargo, en algunas realizaciones, el agente de nitrosacion incluye nitrito de sodio acidificado, nitritos de alquilo, incluyendo nitrito de tercbutilo y nitrito de isopentilo, y diversos oxidos de nitrogeno que incluyen oxido nitroso, N2O3, N2O4 y NO2. Se pueden encontrar ejemplos de nitrosacion en Williamns, DLH Acc. Che. Res. 1999, 32, 869.
En algunas realizaciones de la invencion, la qmmica de nitrosacion conserva la integridad del tamano de partreula y produce partreulas de sflice co-condensada monodispersas funcionalizadas con S-nitrosotiol. No se han observado cambios en el tamano de partreula despues de la adicion de la funcionalidad del oxido mtrico a la estructura macromolecular, un inconveniente que se ha observado con otros donadores macromoleculares modificados con nitrosotiol. Ademas, como se muestra a continuacion en los Ejemplos, las partreulas de sflice co-condensada funcionalizadas con tiol pueden someterse a ultrasonidos antes de la nitrosacion sin afectar perjudicialmente el almacenamiento de NO y/o la morfologfa de las partreulas.
Las partreulas de sflice co-condensadas pueden incluir grupos S-nitrosotiol en toda la partreula y, como tales, pueden proporcionar propiedades de almacenamiento de NO potenciadas. Por ejemplo, en algunas realizaciones de la invencion, se proporcionan partreulas de sflices co-condensada funcionalizadas con S-nitrosotiol que tienen un almacenamiento de NO en un intervalo de 0,01 pmol a 10 pmol de NO por mg de partreula, y en algunas realizaciones, de 0,09 pmol a 4,40 pmol de NO por mg de partreula.
La incorporacion de los grupos S-nitrosotiol en todo el interior de la estructura de partreulas de sflice tambien puede proporcionar una estabilidad inesperada. El experto en la tecnica sabe que el glutation y otros tioles son un accionador de vial para la descomposicion de RSNO y liberan una diversidad de especies de NOx. En algunas realizaciones de la invencion, la baja porosidad de las partreulas de sflice co-condensada funcionalizadas con S-nitrosotiol protege a los donadores de RSNO de la descomposicion prematura por glutation u otros componentes sangmneos, anadiendo un nivel de estabilidad de oxido mtrico cuando se usan en aplicaciones de entrega de farmacos.
Ejemplos
Preparacion de NAPTMS
S^ntesis de N-Acetil Penicilamina (NAP) Tiolactona. Se anadio anlmdrido acetico (96 mmol, 9,80 g) gota a gota a una solucion bien agitada de D-(-) penicilamina (40 mmol, 5,97 g) en piridina (50 ml) a 0 °C. Despues de 30 minutos, el matraz se retiro del hielo y se dejo agitar a temperatura ambiente durante 15 h. La solucion naranja resultante se repartio entre cloroformo y HCl diluido y se lavo 4 veces con HCl diluido. Despues de secar sobre MgSO4, la fase organica se evaporo para producir un residuo naranja. El residuo se disolvio primero en etanol absoluto (20 ml), y luego precipito en pentano a -78 °C. El producto cristalino amarillo claro se aislo por filtracion (2,07 g, 30 %). 1HRMN (CDCl3) 81,65 (s, CH3), 1,86 (s, CH3), 2, 05 (s, NHCOCH3), 5,68-5. 70 (d, CH(CH3)2), 6,56 (NHCOCH3), 13C RMN (CDCl3) 822,52 (NHCOCH3), 26, 20 (CH(CH3)2), 30, 22 (CH(CH3)2), 51,23 (CH), 169,37 (NHCOCH3), 192,21 (SCO). Sntesis de N-Acetil Penicilamina Propiltrimetoxisilano (NAPTMS). Se anadio APTMS (10 mmol, 1,78 g) a una solucion en agitacion de NAP tiolactona (10 mmol, 1,72 g) en cloruro de metileno (20 ml). La solucion amarilla clara se agito durante 4 h a temperatura ambiente antes de la destilacion del cloruro de metileno para producir NAPTMS
en forma de un aceite transparente viscoso. 1H RMN (CDCI3) 50. 54 (t, SiCH2), 1,24 y 1,39 (s, CH(CH3)2SH), 1,54 (m, SiCH2CH2), 1,96 (s, NHCOCH3), 2, 96 y 3,21 (m, SiCH2CH2CH2), 3, 44 (s, Si(OCHa)3), 4,63 (d, CHC(CH3)2SH), 6,99 (d, CHNHCOCH3), 7,70 (t, CH2NHCOCH). 13CRMN (CDCI3) 5 ^6,59 (SiCH2), 22,42 y 22,97 (CH(CH3)2SH), 28,64 (NHCOCH3), 30, 80 (SiCH2CH2), 41, 93 (CHC(CH3)2SH), 46,23 (SiCH2CH2CH2), 50, 35 (Si(OCH3)3), 60,32 (CHC(CH3)2SH), 169,64 (CHNHCOCH3), 170,17 (CHCONH).
La preparacion de precursores basados en tiol terciario se investigo para el desarrollo de dispositivos biomedicos/terapeutica con liberacion continua y fotoactivable de NO. Por lo tanto, se sintetizo una NAP tiolactona para disenar dicho precursor para la smtesis de xerogeles liberadores de NO. La penicilamina se hizo reaccionar en presencia de anlmdrido acetico para generar NAP tiolactona in situ. Despues de la caracterizacion por 1H y 13CRMN, la NAP tiolactona se acoplo directamente con APTMS para dar lugar a un silano portador de tiol terciario, denominado NAPTMS (vease la Figura 1). La smtesis exitosa de este silano que porta tiol terciario se verifico mediante caracterizacion de 1H RMN (Figura 2).
Ejemplo 1: MPTMS
Las relaciones de mercaptosilano y alcoxisilano (25-85 % en moles de MPTMS, equilibrio TMOS o TEOS) se anadieron como una inyeccion en embolada o gota a gota a traves de una bomba de jeringa Kent Scientific Genie Plus a un caudal de 0,25-3,0 ml/min a traves de una aguja de 4,67 mm a una solucion de etanol, agua e hidroxido de amonio. La solucion se agito durante 2 h a temperatura ambiente, se recogio por centrifugacion a 4500 rpm (10 minutos), se lavo dos veces con 40 ml de EtOH, se recogio y se seco durante una noche en condiciones ambientales.
El intento inicial de los investigadores de sintetizar partmulas de sflice que contengan tiol se baso en una inyeccion en embolada de 3-mercaptopropiltrimetoxisilano (MPTMS) y alcoxisilano en una solucion de EtOH/NH4OH. Las concentraciones resultantes de amomaco, agua y silano totales fueron 3,3, 8,0 y 0,2 M, respectivamente. El tetrametoxisilano (TMOS) demostro ser un silano de cadena principal suficiente para la condensacion conjunta con MPTMS ya que su combinacion (en diversos porcentajes molares) dio como resultado la formacion de un precipitado blanco. (~300 mg de rendimiento).
Como se indica por la turbidez de la solucion, se observo un marcado aumento en el tiempo de reaccion al aumentar la concentracion de MPTMS hasta 85 % en moles. A esta concentracion, el tiempo para formar un producto visible despues de combinar los silanos fue aproximadamente de 15 minutos. No se observo formacion de producto a concentraciones de MPTMS> 85 % en moles. La incapacidad de formar partmulas a mayores concentraciones de MPTMS se puede atribuir a las velocidades de hidrolisis dispares entre los silanos, lo que sugiere que la cocondensacion requiere una concentracion minima del silano mas facilmente hidrolizable (es decir, TMOS) para iniciar el crecimiento de partmulas.
Los materiales se sintetizaron a traves de la co-condensacion de MPTMS y el tetraetoxisilano (TEOS) se formo solo en el intervalo de concentracion de 75-85 % en moles de MPTMS. A diferencia del sistema TMOS, los productos con concentraciones mas bajas de MPTMS (por ejemplo, 25 % en moles) no se formaron usando TEOS como cadena principal, incluso en tiempos de reaccion prolongados (hasta 48 h).
Ejemplo 2: MPMDMS
Otro monomero funcionalizado con tiol, el 3-mercaptopropilmetil-dimetoxisilano (MPMDMS), tambien se investigo. Desafortunadamente, el rendimiento del producto (~5 mg) formado usando MPMDMS con TMOS o TEOS fue significativamente menor que MPTMS. La sustitucion de uno de los grupos metoxi hidrolizables por un enlace metflico no hidrolizable en MPMDMS (frente a MPTMS) parece disminuir la velocidad de hidrolisis resultante en condiciones basicas, posiblemente debido al efecto inductivo de la donacion de densidad de electrones al atomo de Si. Como resultado, la reaccion con anion hidroxido para hidrolizar el silano puede inhibirse. La formacion de partmulas puede limitarse aun mas ya que cada molecula de MPMDMS es capaz de formar solo dos puentes de siloxano. En consecuencia, la formacion de partmulas usando MPMDMS no tuvo exito.
Ejemplo 3: Caracterizacion de particulas de sflice de primera generacion basadas en mercaptosilano
La espectroscopfa de resonancia magnetica nuclear en estado solido (RMN) 29Si (frecuencia de 71,548 MHz) por polarizacion cruzada/giro al angulo magico (CP/MAS) se realizo en un espectrometro Bruker 360 MHz DMX (Billerica, MA). Las particulas se embalaron en rotores de 4 mm y se centrifugaron a 8,0 kHz. Los espectros se recogieron en 5000 escaneos con la determinacion de los desplazamientos qrnmicos en partes por millon en relacion con un patron externo de TMS. Se midio la liberacion de oxido mtrico en tiempo real (intervalos de 1 segundo) usando un analizador por quimioluminiscencia de oxido nftrico Sievers 5 NOATM 280i (NOA) (Boulder, CO). La calibracion del NOA se realizo tanto con aire pasado a traves de un filtro cero Sievers de NO y 26,39 ppm de NO gas (equilibrio N2). Las particulas liberadoras de oxido mtrico se sumergieron en 25 ml de solucion desoxigenada y se burbujearon con una corriente de N2 de 80 ml min-1. Se suministro N2 adicional al matraz de reaccion para que coincidera con la velocidad de recogida del NOA en 200 ml min-1.
El control de la temperatura se mantuvo usando un bano de agua a 37 °C. Se estudio la liberacion de NO termica y
fotoiniciada realizando los experimented en DTPA 500 pM (pH PBS 7,4) para quelar trazas de cobre e iluminar el matraz de muestra con bombillas incandescentes de 60, 100 y 200 W, respectivamente. La liberacion de NO iniciada por cobre se estudio anadiendo las partteulas a 25 ml de CuBr2(ac) 10 o 25 pM. El matraz de muestra NOA se protegio de la luz con papel de aluminio para experimentos en los que la luz no era el iniciador deseado de la liberacion de NO. El tamano de partteula se determino usando un instrumento de dispersion de luz dinamica (DLS) Zetasizer Nano ZS (Malvern, R.U.) de potencial zeta y de tamano de partteula. Las muestras se suspendieron en PBS a una concentracion de 1 mg ml-1 y se sometieron a ultrasonidos durante 15 minutos antes del analisis. Las microgrartas electronicas de barrido se registraron en un microscopio electronico de barrido Hitachi S-4700 (Pleasanton, CA).
Para confirmar la incorporacion de mercaptosilano dentro de la red de sflice y comparar diversas composiciones, se uso la resonancia magnetica nuclear 29S en estado solido por polarizacion cruzada/giro al angulo magico (RMN CP/MAS) para caracterizar los productos de MPTMS/TMOS como una funcion de la concentracion de MPTMS. Los atomos de silicio de tetraalcoxisilanos aparecen en los espectros de RMN como bandas Qn mientras que los de organotrialcoxisilanos aparecen como bandas Tn. En ambos casos, n indica el numero de enlaces de siloxano unidos al atomo de Si. Cuanto mayor sea el numero de enlaces de siloxano al atomo de Si, mas lejos se desplazara la banda de RMN en el campo. La Figura 3 muestra sflice sintetizada con (A) 0, (B) 25, (C) 40, (D) 60, (E) 75, y (F) 85 % en moles de MPTMS (equilibrio TMOS). Las partteulas sintetizadas por completo de TMOS mostraron solo bandas Q. Al aumentar la concentracion de MPTMS en la solucion usada para preparar las partteulas, las bandas T aumentaron en relacion con las bandas Q, confirmando una mayor incorporacion de MPTMS en la partteula de sflice. El porcentaje en peso de azufre de cada composicion se determino usando analisis elemental y corroboro adicionalmente la incorporacion covalente del mercaptosilano. El porcentaje en peso de azufre en la sflice fue de 4,92, 7,11, 11,67, 13,56 y 17,30 para las composiciones de 25, 40, 60, 75 y 85 % en moles de MPTMS (equilibrio TMOS), respectivamente. Se encontro que las partteulas basadas en TEOS teman porcentajes en peso de azufre de 16,15 y 19,34 para 75 y 85 % en moles de MPTMS, respectivamente. Como era de esperar, el porcentaje en peso de azufre aumento linealmente al aumentar la concentracion de MPTMS en la solucion inicial.
Las mediciones de dispersion de luz dinamica (DLS) indicaron que la muestra era demasiado polidispersa para medir con precision el tamano de partteula. Las micrograffas electronicas de barrido (MEB) indicaron ademas que la sflice que contema tiol era polidispersa y mostraba una morfologfa no esferica mas indicativa de sflice coloidal que de partteulas individuales. (datos no mostrados).
Ejemplo 4: Variacion de las concentraciones de agua, amomaco y silano y velocidad de alimentacion Sistematicamente, los investigadores variaron los parametros sinteticos (es decir, concentraciones de agua, amomaco y silano) para ajustar la morfologfa de la partteula resultante y lograr una forma mas esferica. La composicion de 25 % en moles de MPTMS (equilibrio TMOS) se eligio como el sistema modelo para la comparacion debido al caracter organico mmimo.
Para partteulas MPTMS, los investigadores encontraron que aumentar el contenido de agua de 8,0 a 16,2 M promovio la formacion de partteulas esfericas y evito la agregacion/fusion. Se demostro que concentraciones mas bajas de amomaco daban como resultado partteulas que caredan de forma esferica y se agregaban. Por lo tanto, los investigadores descubrieron que la relacion de agua y amomaco a silano fue un factor cntico durante la smtesis de partteulas. Al considerar todos los datos, los investigadores determinaron que las partteulas mas esfericas y monodispersas eran las partteulas de 25 % en moles de MPTMS (equilibrio TMOS) que se formaron usando 5,5 M de amomaco, 0,1 M de silano y 16,2 M de agua. Cabe destacar que, el rendimiento del producto (~70 mg) con esta smtesis fue menor que el obtenido para la sflice coloidal polidispersa. El rendimiento disminuido se debio a la disminucion de 4 veces en la concentracion de silano usada en la smtesis optimizada.
A continuacion, se aumento la concentracion de MPTMS en la solucion para potenciar el grado de funcionalidad de tiol y el potencial almacenamiento de NO de las partteulas. La Figura 4 representa las partteulas resultantes a medida que la concentracion de MPTMS se aumento de 25-85 % en moles y el alcoxisilano de cadena principal vario entre TMOS y TEOS. Las partteulas se sintetizaron con 16,0 M de agua, 5,5 M de amomaco y 0,1 M de silano. Al igual que con el sistema de sflice coloidal polidisperso, la formacion de partteulas no se observo para 25-60 % en moles de MPTMS (equilibrio TEOS). Solo las concentraciones de 75 y 85 % en moles de MPTMS produjeron partteulas con TEOS, que ilustran como las disparidades en la hidrolisis y la cinetica de condensacion afectan y dificultan adversamente la formacion de partteulas. Las partteulas de 75 % en moles de MPTMS (equilibrio TEOS) se formaron en una distribucion de tamano estrecha y mostraron morfologfas esfericas (Figura 4F). En cambio, las partteulas de 85 % en moles de MPTMS (equilibrio TEOS) paredan partteulas agregadas (Figura 4G). Al usar TMOS, 25 % en moles MPTMS fue la untea concentracion que produjo partteulas monodispersas esfericas (Figura 4A). Las partteulas con MPTMS > 40 % en mol (equilibrio TMOS) mostraron morfologfas ideales, pero con distribuciones de tamano bimodales concomitantes (Figura 4B-E).
Para remediar la distribucion del tamano bimodal que se observo para determinadas composiciones de MPTMS, se evaluo el efecto de una velocidad de alimentacion de silano de 0,5 ml min-1 sobre las morfologfas de las partteulas
en todo el intervalo de composiciones (Figura 5). La velocidad de alimentacion mas lenta mejoro la dispersion de la distribucion de tamano ya estrecha para 25 % en MPTMS (Figura 5A). Tambien se observo una mejora pronunciada en la monodispersidad para el 40 % en moles de MPTMS (equilibrio TMOS, Figura 5B), con MEB que indica un diametro de partfcula de 293 ± 24 nm. Las velocidades de alimentacion de silano mas lentas (por ejemplo, 0,25 ml min-1) dieron como resultado ligeras mejoras de monodispersidad (datos no mostrados), pero a rendimientos mas bajos (por ejemplo, -40 frente a 70 mg para una composicion MPTMS de 40 % en moles (equilibrio TMOS). Por lo tanto, se determino que 0,5 ml min-1 era la velocidad de alimentacion optima ya que permitfa un equilibrio entre el rendimiento de partfculas suficiente y la monodispersidad. De forma similar a 25 % en moles de MPTMS (equilibrioTMOS), la monodispersidad de 75 % en moles de MPTMS (equilibrio TEOS) mejoro, mientras que el sistema de 85 % en moles de MPTMS (equilibrio TEOS) permanecio agregado (Figura 5F y 5G, respectivamente).
Ademas, el rendimiento del producto aumento a ~170 mg para estas dos composiciones y se puede atribuir a la mayor concentracion del MPTMS mayor en las partfculas. Desafortunadamente, el procedimiento semicontinuo resulto problematico para 60, 75 y 85 % en moles de partfculas MPTMS (equilibrio TMOS). Como se muestra en la Figura 5C-E, la adicion de silano ralentizada dio como resultado tanto la agregacion como la formacion de una gran red de sflice en lugar de partfculas esfericas monodispersas. Para examinar este fenomeno adicionalmente, se variaron las velocidades de alimentacion de silano (0,25-3,0 ml min-1) para 60 % en moles de MPTMS (equilibrio TMOS). Las velocidades de alimentacion <2,0 ml min-1 dieron como resultado sflice polidispersa y agregada, mientras que las velocidades de alimentacion mas rapidas (2,0-3,0 ml min-1) produjeron partfculas de tamano bimodal (datos no mostrados).
Luego, los inventores intentaron disminuir el tamano de las partfculas para mejorar la monodispersidad de las partfculas. Las partfculas de 75 % en moles de MPTMS (equilibrio TEOS) se eligieron como un sistema modelo para examinar el efecto de la concentracion de agua sobre el tamano de partfcula y la morfologfa. Como se muestra en la Figura 6, el 75 % en moles de MPTMS (equilibrio TEOS) se sintetizo con (A) 47,0, (B) 42,0, (C) 40,6, (D) 36,5, (E) 32.5 y (F) 24,9 M de agua. Las concentraciones de agua >40,6 M favorecieron la rapida hidrolisis del silano y la cinetica de condensacion, lo que condujo a una red altamente condensada en lugar de partfculas esfericas discretas. A una concentracion de agua de 36,5 M, se formaron partfculas discretas, pero con morfologfas que presentan agregacion excesiva. Las partfculas monodispersas (333 ± 48 nm) se observaron por primera vez a una concentracion de agua ligeramente inferior (32,5 M). El tamano de partfcula aumento con la disminucion de las concentraciones de agua (456 ± 68 nm y 635 ± 63 nm para 24,9 y 16,2 M, respectivamente). Ademas, los tamanos de partfcula mas pequenos se acompanaron con rendimientos ligeramente mas bajos para cada composicion. Los rendimientos para partfculas de 75 % en moles de MPTMS (equilibrio TEOS) fueron ~65, 150, y 170 mg para concentraciones de agua de 32,5, 24,9 y 16,2 M, respectivamente. Las diferencias en el rendimiento pueden ser factores de la eficiencia de la recogida de partfculas (es decir, centrifugacion rpm y duracion) para las partfculas mas pequenas en lugar de diferencias qrnmicas.
Las concentraciones de agua adecuadas (32,5 y 24,9 M) se usaron a continuacion para ajustar el tamano de partfcula y reducir la caractenstica de distribucion bimodal de las partfculas de 60, 75 y 85 % en moles de MPTMS (equilibrio TMOS). Como se muestra en la Figura 7, la concentracion intermedia de agua (24,9 M) proporciono partfculas con tamanos de 179 ± 22 y 196 ± 25 nm para las composiciones de 25 y 40 % en moles de MPTMS (equilibrio TMOS), respectivamente. La mayor concentracion de agua (32,5 M) aumento drasticamente la cinetica de reaccion para la mayona de los sistemas basados principalmente en TMOS, dando como resultado redes de sflice altamente condensadas. Al aumentar la concentracion de MPTMS (75 % en moles) se obtuvieron partfculas esfericas monodispersas de 363 ± 51 y 279 ± 49 nm usando 24,9 y 32,5 M de agua, respectivamente. Las partfculas agregadas y condensadas se formaron para la mayor concentracion de MPTMS (85 % en moles) cuando se uso agua 24,9 M. Sin embargo, se formaron partfculas monodispersas (440 ± 84 nm) cuando se sintetizaron con agua 32.5 M.
La contraparte basada en TEOS de este sistema se comporto de forma similar produciendo solo partfculas discretas (506 ± 77 nm) cuando se sintetizo con la mayor concentracion de agua. En cantidades de agua mas bajas, se observo la formacion de partfculas agregadas. La tendencia de disminucion del rendimiento de partfculas con el contenido de agua creciente que se observo para la composicion de 75 % en moles de MPTMS (equilibrio TEOS) se reflejo para todas las demas composiciones evaluadas. Los rendimientos para las partfculas de 75 % en moles (equilibrio TMOS) disminuyeron de ~120 a 60 mg al aumentar el contenido de agua de 24,9 a 32,5 M. Analogamente, el rendimiento de partfculas de 25 % en mol de MPTMS (equilibrio TMOS) disminuyo de ~90 a 20 mg mientras que el 40 % en moles del sistema MPTMS mostro una disminucion de ~50 a 9 mg al aumentar la concentracion de agua de 16,2 a 24,9 M. Los rendimientos para ambas composiciones de MPTMS 85 % en moles (es decir, equilibrio TMOS y TEOS) a una concentracion de agua de 32,5 M fueron de ~160 mg. Tal vez de mayor importancia, las elevadas concentraciones de agua usadas para sintetizar las partfculas modificadas con tiol resolvieron con exito la naturaleza bimodal de determinadas composiciones que no se pueden resolver usando solo un procedimiento semicontinuo. Cabe destacar que, el 60 % en moles de MPTMS (equilibrio TMOS) fue la unica composicion que produjo sistematicamente partfculas de naturaleza bimodal. El aumento del contenido de agua independientemente del procedimiento de adicion (embolado frente a semicontinuo) dio como resultado una red de sflice altamente condensada.
Los tamanos de partmula tambien se midieron mediante DLS para corroborar la monodispersidad de las partmulas y el tamano medido usando MEB. Como se muestra en la Tabla 1, las mediciones de DLS estuvieron de acuerdo con los tamanos calculados a partir de las imagenes MEB. Los diametros medios ligeramente aumentados observados con DLS se pueden atribuir a la hidratacion de partmulas (mediciones de DLS realizadas en solucion). Al igual que MEB, las mediciones de DLS indicaron una distribucion de tamano estrecha, como lo demuestran los bajos indices de polidispersidad para cada composicion.
TABLA 1
Composicion de partmulas Contenido de Tamano de Tamano medio Z Indice de (MPTMS % en moles) agua (M) partmula a (nm) b (nm) polidispersidad 75 % (equilibrio TEOS) 32,5 333 ± 48 416,2 ± 23,4 0,027 75 % (equilibrio TEOS) 24,9 456 ± 68 529,6 ± 23,7 0,018 75 % (equilibrio TEOS) 16,2 635 ± 63 718,0 ± 51,7 0,046 85 % (equilibrio TEOS) 32,5 506 ± 77 668,7 ± 46,0 0,040 25 % (equilibrio TMOS) 24,9 179 ± 22 258,4 ± 15,1c 0,031 25 % (equilibrio TMOS) 16,2 252 ± 20 469,0 ± 24,8c 0,025 40 % (equilibrio TMOS) 24,9 196 ± 25 240,7 ± 17,9c 0,064 40 % (equilibrio TMOS) 16,2 293 ± 24 404,8 ± 28,2 0,045 75 % (equilibrio TMOS) 32,5 279 ± 49 431,2 ± 29,5 0,043 75 % (equilibrio TMOS) 24,9 363 ± 51 507,6 ± 30,8 0,032 85 % (equilibrio TMOS) 32,5 440 ± 84 696,2 ± 44,4 0,042 a Tamano calculado a partir de micrograffas electronicas de barrido de n = 120 partmulas
b Tamanos adquiridos a partir de mediciones de dispersion de luz dinamica en pH PBS 7,4 para n = 3 smtesis c Etanol usado como dispersante
Cabe destacar que, se uso PBS como un dispersante para composiciones con una gran concentracion de MPTMS. Sin embargo, las partmulas mas pequenas con un alto grado de caracter inorganico (es decir, < 40 % en moles de MPTMS) se agregaron rapidamente en este dispersante y provocaron mediciones erraticas de DLS. Esta agregacion puede atribuirse a una gran densidad superficial de grupos silanol protonados que conducen a una interaccion de partmulas desfavorable. Mientras que las condiciones basicas dieron como resultado mediciones de DLS no uniformes debido a la disolucion de las partmulas, el etanol fue un dispersante alternativo viable como se demuestra por la correlacion entre las mediciones de DLS y MEB.
El analisis elemental se uso para caracterizar la composicion de las partmulas. Como era de esperar, los porcentajes en peso de azufre en las partmulas aumentaron en consecuencia con el % en moles de MPTMS usado para hacer que las partmulas indicaran la incorporacion de la funcionalidad tiol (Tabla 2).
TABLA 2
Composicion de partfculas (MPTMS % en
moles) Contenido de agua (M) Contenido de azufre a (% p) 75 % (equilibrio TEOS) 32,5 13,83 ±3,01 75 % (equilibrio TEOS) 24,9 16,01 ± 1,71 75 % (equilibrio TEOS) 16,2 15,62 ± 1,90 85 % (equilibrio TEOS) 32,5 20,02 ± 3,88 25 % (equilibrio TMOS) 24,9 < 0,0b
25 % (equilibrio TMOS) 16,2 0,51 ± 0,36
40 % (equilibrio TMOS) 24,9 1,09 ± 0,58
40 % (equilibrio TMOS) 16,2 3,08 ± 2,57
75 % (equilibrio TMOS) 32,5 18,29 ± 5,34 75 % (equilibrio TMOS) 24,9 15,30 ± 5,32 85 % (equilibrio TMOS) 32,5 20,55 ± 5,70 a Los porcentajes de peso medio se calculan a partir de n = 3 smtesis
b El porcentaje en peso fue inferior que el lfmite de deteccion del instrumento
Las smtesis que promueven la formacion de partmulas esfericas discretas tienden a obtenerse preferentemente de un precursor, como lo demuestra un gran hueco en la transicion de 40 a 75 % en moles de MPTMs (% en peso 3,08 ± 2,57 y 15,62 ± 1,90, respectivamente). Estos valores estaban en marcado contraste con el % en peso de azufre de la sflice coloidal. Aunque el mayor contenido % en peso de azufre era mas linealmente proporcional a la sflice
coloidal, la falta de particulas esfericas discretas no era ideal. La comparacion de los dos sistemas (coloidales frente a particulas discretas) y la smtesis revela que existe un equilibrio entre la incorporacion de silano y determinados criterios de diseno.
Ejemplo 5: Smtesis de particulas con NAPTMS
Procedimiento para el equilibrio 25 % de NAPTMS TMOS/TEOS:
1. Se disolvieron 85,4 mg NAPTMS (precursor terciario) en 3,95 ml de etanol mediante agitacion con formacion de vortice
2. A la mezcla de reaccion se le anadieron 4,09 ml de agua y luego se anadio una mezcla de TMOS/etanol (71,9 |jl de TMOS y 200 j l de etanol) mediante una bomba de jeringa a una velocidad de 1,0 ml/min.
3. Se anadieron 6 ml de HCl 5M y se dejo sometida a ultrasonidos (120 %) durante 1 hora.
4. Se anadieron 4 ml de hidroxido de amonio y se dejo sometida a ultrasonidos (120 %) durante 30 minutos.
Concentraciones finales de particulas TMOS y TEOS:
[Silano] = 0,0352 M [Etanol] = 3,85 M
[Agua] = 42,8 M [NH3] = 3,43 M
[HCl] = 1,57 M
Caracterizacion de tamano:
Ejemplo 6: Nitrosacion de particulas de sflice basadas en mercaptosilano
Los tioles dentro de las particulas se nitrosaron por reaccion con acido nitroso, 12 Particulas (~200 mg) se anadieron primero a 4 ml de metanol (MeOH). Mientras se agitaba, se anadieron 2 ml de acido clorltidrico (5 M) a la suspension. Despues se anadio a la suspension de particulas una solucion acuosa de 2 ml que contema nitrito de sodio (exceso 2 molar respecto al tiol) y DTPA (500 j M), y la mezcla se agito durante 2 h en la oscuridad y sobre hielo. Las particulas se recogieron por centrifugacion a 4500 rpm (5 min), se lavaron con 40 ml de DTPA (ac) 500 jM enfriado, se recogieron, se lavaron con 40 ml de MeOH enfriado, se recogieron y se secaron al vado durante 30 min. mientras se protegfan de la luz. Las particulas se almacenaron a -20 ° C al vado hasta su posterior estudio.
Las particulas modificadas con MPTMS se nitrosaron para permitir el almacenamiento y la liberacion de NO. En resumen, las particulas fueron tratadas con nitrito de sodio acidificado, generando acido nitroso, un agente de nitrosacion que reacciona con tioles para formar los RSNO (vease la Ec. 1).
RSH HN02 ^ RSNO H20 (1)
Dado que los S-nitrosotioles preparados a partir de tioles primarios absorben la luz a 330-350 y 550-600 nm, la formacion satisfactoria de RSNo se confirmo por el color rojo resultante de las particulas despues de la nitrosacion. Ademas, la intensidad del color aumento con el % en moles de MPTMS indicando una mayor formacion de RSNO. Como es ampliamente conocido, los S-nitrosotioles se descomponen a traves de una multitud de vfas (Figura 8). Tanto la foto como la irradiacion termica de RSNO dan como resultado la escision homolftica del enlace SN, produciendo NO y un radical tiilo. El radical tiilo puede reaccionar posteriormente con un RSNO para generar un disulfuro y un equivalente adicional de NO. Se ha demostrado que el Cu (I), que resulta de la reduccion de Cu (II) a traves de iones traza de tiolato, es activo en un mecanismo de descomposicion de RSNO cataltiico. Tambien puede producirse la transnitrosacion entre un tiol y un RSNO, lo que da como resultado la transferencia de la funcionalidad nitrosa y la formacion de una nueva especie de RSNO que puede descomponerse a traves de las vfas mencionadas anteriormente.
Para evaluar el almacenamiento y la liberacion de NO, se anadieron particulas modificadas con RSNO (~2 mg) a 500 jM de DTPA (pH PBS 7,4) a una temperatura de 0 °C, mientras que se media la liberacion de NO resultante en funcion de la descomposicion fotolftica. Como se muestra en la Figura 9A, las particulas de silice modificadas con RSNO mostraron una liberacion de NO fotoiniciada al exponerse a luz blanca de banda ancha. Los mayores niveles de irradiacion (es decir, la potencia) dieron como resultado una liberacion elevada de NO de las particulas. Cabe destacar que, se observaron bajos niveles de liberacion de NO (~15 ppb mg-1 s'1) a 0 °C y en la oscuridad (insercion de la Figura 9A). Otros han demostrado que el oxfgeno puede reaccionar con NO para formar trioxido de dinitrogeno (N2O3), un oxidante que tambien descompone los RSNO. Por lo tanto, se esperana que la eliminacion de oxfgeno del entorno de almacenamiento de las particulas modificadas con RSNO aumentara la estabilidad de almacenamiento de NO de las particulas. De hecho, no se midio ninguna perdida significativa en la capacidad de liberacion de NO al almacenar las particulas durante 2 meses a -20 °C al vado y en la oscuridad.
Debido a la rapida cinetica de la descomposicion fotoiniciada, el almacenamiento total de NO de las partmulas se evaluo exponiendo las partmulas a 200 W de luz de banda ancha. De hecho, > 95 % del NO almacenado se libero despues de 5 h de irradiacion a 200 W. Como se indica en la Tabla 3, el NO total liberado de las partmulas vario de 0,09-4,39 pmol mg-1. Estos niveles de almacenamiento de NO son un orden de magnitud mayor que las partmulas de sflice modificadas con RSNO anteriormente indicadas. Usando los porcentajes en peso de azufre medio junto con los valores medios de almacenamiento de NO, el porcentaje de conversion de tiol a RSNO para las diferentes composiciones de partmulas se calculo en 58-78 % para los sistemas de 75 y 85 % en moles de MPTMS/TMOS y MPTMS/TEOS. Se encontro que las partmulas de 25 y 40 % en moles de MPTMS teman menores conversiones de tiol a RSNO (54-63 %).
TABLA3
Composicion de particulas (MPTMS % en moles) Contenido de agua (M) Total de NO liberado a (pmol mg-1)
75 % (equilibrio TEOS) 32,5 3,24 ± 0,61 75 % (equilibrio TEOS) 24,9 3,58 ± 0,39 75 % (equilibrio TEOS) 16,2 3,15 ± 0,60 85 % (equilibrio TEOS) 32,5 3,95 ± 0,66 25 % (equilibrio TMOS) 24,9 0,09 ± 0,02 25 % (equilibrio TMOS) 16,2 0,10 ± 0,02 40 % (equilibrio TMOS) 24,9 0,34 ± 0,02 40 % (equilibrio TMOS) 16,2 0,52 ± 0,22 75 % (equilibrio TMOS) 32,5 3,31 ± 0,85 75 % (equilibrio TMOS) 24,9 3,73 ± 0,62 85 % (equilibrio TMOS) 32,5 4,39 ± 0,02 a Los promedios se calculan a partir de n = 3 smtesis y despues de 5 h de 200 W de irradiacion
El efecto del cobre en la liberacion de NO se investigo como una funcion de la concentracion de cobre. Estos ensayos se realizaron con Cu (II) a traves de CuBr2 debido a la insolubilidad de los compuestos de Cu (I) en soluciones acuosas. Como era de esperar, la liberacion de NO de las partmulas modificadas con RSNO se correlaciono con la concentracion de cobre (Figura 9B) con la mayor concentracion de cobre examinada (25 j M ) generando la liberacion maxima de NO (~45 ppb mg-1 s"1).
El uso de partmulas modificadas con RSNO para aplicaciones biomedicas probablemente requiera un accionador de liberacion de NO que no sea la luz o grandes concentraciones de iones de cobre libres. Por lo tanto, los investigadores evaluaron la liberacion de NO de las partmulas a traves de la degradacion termica a 37 °C usando 75 % en mol de MPTMS (equilibrio TEOS, 718,0 ± 51,7 nm) como un sistema modelo. Las partmulas se introdujeron en DTPA 500 j M (pH PBS 7,4), se mantuvieron a 37 °C y se protegieron de la luz externa mientras se monitorizaba la liberacion de NO durante 48 h (Tabla 4). En estas condiciones, las partmulas liberaron un total de 1,17 pmol NO mg-1 con una semivida correspondiente de 2,95 h. Cuando se compara con la cantidad total liberada despues de 5 h usando 200 W de irradiacion (3,15 pmol mg-1, Tabla 3) la discrepancia puede atribuirse a la incapacidad de medir el NO a niveles bajos mas alla de las 48 h y/o la perdida de NO a traves de su reaccion con el oxfgeno presente en las soluciones de remojo. Como es evidente por un matiz rosado, las partmulas aun conteman una porcion de su carga util de NO incluso despues de 48 h de liberacion.
TABLA 4
Tiempo (h) Liberacion instantanea de NO (ppb mg-1 s-1)a
0 1205,7 ± 22,4
0,5 481,2 ± 7,7
1 355,7 ± 7,7
6 74,9 ± 0,7
12 33,2 ± 0,4
24 12,6 ± 0,2
48 2,50 ± 0,07
a Los promedios se calculan a partir de n = 3 smtesis
Ejemplo 7: Caracterizacion de la liberacion de NO iniciada termicamente de particulas RSNO primarias y terciarias
Para cada composicion de partmulas, se anadieron aproximadamente 3 mg de particulas al matraz de recogida que contema PBS (DTPA 500 j M) y la liberacion de NO se monitorizo durante 75 minutos. Las caractensticas de
almacenamiento y liberacion de NO se muestran en la Tabla 5.
TABLA 5
Tambien se investigaron las caractensticas de almacenamiento y liberacion de NO de la muestra de 25 % NAPTMS bajo irradiacion. Usando 200 W de iluminacion, y 0,3 m de distancia, los resultados se muestran en la Tabla 6.
TABLA 6
Los resultados que se muestran en las Tablas 5 y 6 mostraron que la estabilidad de NO de las partfculas puede aumentarse significativamente usando partfculas de sflice funcionalizadas con nitrosotiol terciario.
Ejemplo 8: Influencia de los ultrasonidos de particulas antes/despues de la nitrosacion
Experimento 8A: Partfculas nitrosas sin ultrasonidos
1. Haga nitrosar 15 mg de partfculas en metanol, HCl 5 M, y 2 mol X (frente a tiol) de NaNO2/DTPA 500 uM. 2. Recoja y lave con dtpa fno y metanol fno. Seque al vacfo durante 45 minutos en la oscuridad (cubierto con papel de aluminio).
3. Anada 1 mg de particulas nitrosadas a 5 ml de PBS (DTPA)
4. Exponga a 200 W de iluminacion (30 cm desde el interior de la caja)
Experimento 8B: Nitrosacion de particulas despues de ultrasonidos
1. Haga nitrosar 15 mg de particulas en metanol, HCl 5 M, y 2 mol X (frente a tiol) de NaNO2/DTPA 500 uM. 2. Recoja y lave con dtpa fno y metanol fno. Seque al vacfo durante 45 minutos en la oscuridad (cubierto con papel de aluminio).
3. Anada 1 mg de particulas nitrosadas a 5 ml de PBS (DTPA) y someta a ultrasonidos durante 30 minutos en hielo a una amplitud = 50 %.
4. Exponga a 200 W de iluminacion (30 cm desde el interior de la caja)
Experimento 8C: Ultrasonidos de partfculas (30 minutos a una amplitud = 50 %) seguido de nitrosacion
1. Someta a ultrasonidos 15 mg de partfculas no nitrosadas en 4 ml de metanol sobre hielo durante 30 minutos en hielo a una amplitud = 50 %.
2. Haga nitrosar las partfculas sometidas a ultrasonidos en 4 ml de metanol, HCl 5 M, y 2 mol X (frente a tiol) de NaNO2/DTPA 500 uM.
3. Recoja y lave con dtpa fno y metanol fno. Seque al vacfo durante 45 minutos en la oscuridad (cubierto con papel de aluminio).
4. Anada 1 mg de particulas nitrosadas a 5 ml de PBS (DTPA)
5. Exponga a 200 W de iluminacion (30 cm desde el interior de la caja)
Experimento 8D: Ultrasonidos de particulas (60 minutos a una amplitud = 50 %) seguido de nitrosacion
1. Someta a ultrasonidos 15 mg de partfculas no nitrosadas en 4 ml de metanol sobre hielo durante 60 minutos en hielo a una amplitud = 50 %.
2. Haga nitrosar las partfculas sometidas a ultrasonidos en 4 ml de metanol, HCl 5 M, y 2 mol X (frente a tiol) de NaNO2/DTPA 500 uM.
3. Recoja y lave con dtpa frte y metanol frte. Seque al vado durante 45 minutes en la oscuridad (cubierto con papel de aluminio).
4. Anada 1 mg de partteulas nitrosadas a 5 ml de PBS (DTPA)
5. Exponga a 200 W de iluminacion (30 cm desde el interior de la caja)
Los resultados de los Experimented 8A-8D se muestran en
Las imagenes MEB de las partteulas formadas en el Ejemplo 7A se proporcionan en la Figura 10. Las imagenes MEB de las partteulas formadas en el Ejemplo 7C se proporcionan en la Figura 11. Las imagenes MEB de las partteulas formadas en el Ejemplo 7D se muestran en la Figura 12. Estos resultados muestran que la morfologfa de las partteulas y el almacenamiento de oxido nftrico no se ven significativamente influenciados por el procedimiento de ultrasonidos. Por lo tanto, las partteulas de ultrasonidos pueden usarse para estrechar la distribucion de tamanos y/o fabricar partteulas mas pequenas.
En los dibujos y la memoria descriptiva, se han desvelado realizaciones de la invencion y, aunque se emplean terminos espedficos, se usan en un sentido generico y descriptivo unicamente y no con fines de limitacion, exponiendose el ambito de la invencion en las siguientes reivindicaciones.
Claims (14)
1. Un procedimiento de formacion de partfculas de s l^ice co-condensadas funcionalizadas con S-nitrosotiol que comprende:
hacer reaccionar un silano que contiene tiol y un alcoxisilano de cadena principal en una solucion de precursor de sol que comprende agua para formar partfculas de sflice co-condensada funcionalizadas con tiol, en el que el silano que contiene tiol comprende un silano que contiene tiol terciario y el alcoxisilano de cadena principal es un alcoxisilano que no contiene un grupo funcional tiol y, en el que las partfculas de sflice co-condensada funcionalizadas con tiol comprenden una matriz de polisiloxano y al menos algunos de los grupos tiol estan presentes dentro de la matriz de polisiloxano; y
hacer reaccionar las partfculas de sflice co-condensada funcionalizadas con tiol con un agente de nitrosacion para proporcionar las partfculas de sflice co-condensada funcionalizadas con S-nitrosotiol.
2. El procedimiento de la reivindicacion 1, en el que la solucion de precursor de sol comprende un catalizador de amomaco a una concentracion en un intervalo de 1,9 a 5,5 M;
en el que la concentracion total de monomero de silano en la solucion de precursor de sol esta en un intervalo de 0,1 M a 0,4 M;
en el que la concentracion total de monomero de silano comprende 25 a 85 % en moles de mercaptopropiltrimetoxisilano; y
en el que el agua esta presente en la solucion de precursor de sol a una concentracion en un intervalo de 8,0 M a 32,5 M.
3. El procedimiento de la reivindicacion 1, en el que el silano que contiene tiol terciario comprende un tiol terciario que tiene la siguiente estructura:
en la que R, R' y R" son cada uno independientemente alquilo y n esta en un intervalo de 0 a 10, mas preferentemente, en el que el silano que contiene tiol terciario tiene la siguiente estructura:
4. El procedimiento de la reivindicacion 3, en el que el alcoxisilano de cadena principal comprende tetraetoxisilano.
5. El procedimiento de la reivindicacion 1, en el que las partfculas de sflice co-condensada funcionalizadas con tiol se someten a ultrasonidos antes de hacer reaccionar las partfculas de sflice co-condensada funcionalizadas con tiol con un agente de nitrosacion.
6. Partfculas de sflice co-condensada monodispersas funcionalizadas con S-nitrosotiol que tienen un diametro medio de partfcula en un intervalo de 200 nm a 700 nm.
7. Las partfculas de sflice co-condensada funcionalizadas con S-nitrosotiol de la reivindicacion 6, en las que las partfculas tienen al menos algunos grupos funcionales de nitrosotiol distribuidos dentro de una matriz de polisiloxano de las partfculas.
8. Las partfculas de sflice co-condensada funcionalizadas con S-nitrosotiol de la reivindicacion 6, en las que los grupos funcionales de S-nitrosotiol comprenden grupos funcionales de nitrosotiol primarios.
9. Las partfculas de sflice co-condensada funcionalizadas con S-nitrosotiol de la reivindicacion 6, en las que los grupos funcionales de S-nitrosotiol comprenden grupos funcionales de nitrosotiol terciarios.
10. Partfculas de sflice co-condensada funcionalizadas con S-nitrosotiol que tienen un almacenamiento de NO en un intervalo de 0,01 jmol a 10 jmol de NO por mg de partfcula,
preferentemente en las que las partfculas tienen un almacenamiento de NO en un intervalo de 0,09 jmol a 4,40 |jmol de NO por mg de partfcula.
11. Las partfculas de sflice co-condensada funcionalizadas con S-nitrosotiol de la reivindicacion 10, en las que las partfculas tienen al menos algunos grupos funcionales de nitrosotiol distribuidos dentro de una matriz de polisiloxano de las partfculas.
12. Las partfculas de sflice co-condensada funcionalizadas con S-nitrosotiol de la reivindicacion 10, en las que los grupos funcionales de S-nitrosotiol comprenden grupos funcionales de nitrosotiol primarios.
13. Las partfculas de sflice co-condensada funcionalizadas con S-nitrosotiol de la reivindicacion 10, en las que los grupos funcionales de S-nitrosotiol comprenden grupos funcionales de nitrosotiol terciarios.
14. Una partfcula de sflice co-condensada funcionalizada con S-nitrosotiol que comprende grupos funcionales de nitrosotiol terciarios.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201161447368P | 2011-02-28 | 2011-02-28 | |
| US201161565694P | 2011-12-01 | 2011-12-01 | |
| PCT/US2012/026960 WO2012118819A2 (en) | 2011-02-28 | 2012-02-28 | Nitric oxide-releasing s-nitrosothiol-modified silica particles and methods of making the same |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| ES2695173T3 true ES2695173T3 (es) | 2019-01-02 |
Family
ID=46758457
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| ES12752627T Active ES2695173T3 (es) | 2011-02-28 | 2012-02-28 | Partículas de sílice modificadas con S-nitrosotiol que liberan óxido nítrico y procedimientos de fabricación de las mismas |
Country Status (4)
| Country | Link |
|---|---|
| US (2) | US9713652B2 (es) |
| EP (1) | EP2681286B1 (es) |
| ES (1) | ES2695173T3 (es) |
| WO (2) | WO2012118829A2 (es) |
Families Citing this family (57)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| PL1871433T3 (pl) | 2005-03-24 | 2009-09-30 | Nolabs Ab | Zabieg kosmetyczny z tlenkiem azotu, urządzenie do wykonywania tego zabiegu i sposób jego wytwarzania |
| US9259535B2 (en) | 2006-06-22 | 2016-02-16 | Excelsior Medical Corporation | Antiseptic cap equipped syringe |
| US11229746B2 (en) | 2006-06-22 | 2022-01-25 | Excelsior Medical Corporation | Antiseptic cap |
| CN101801521B (zh) | 2007-05-14 | 2015-06-17 | 纽约州立大学研究基金会 | 生物膜中细菌细胞内的生理学分散响应诱导 |
| US9078992B2 (en) | 2008-10-27 | 2015-07-14 | Pursuit Vascular, Inc. | Medical device for applying antimicrobial to proximal end of catheter |
| EP2467127B1 (en) | 2009-08-21 | 2023-08-02 | Novan, Inc. | Topical gels |
| ES2695173T3 (es) | 2011-02-28 | 2019-01-02 | Novan Inc | Partículas de sílice modificadas con S-nitrosotiol que liberan óxido nítrico y procedimientos de fabricación de las mismas |
| EP2729131B1 (en) | 2011-07-05 | 2020-04-15 | Novan, Inc. | Topical compositions |
| WO2013006613A1 (en) | 2011-07-05 | 2013-01-10 | Novan, Inc. | Methods of manufacturing topical compositions and apparatus for same |
| CN103796704B (zh) | 2011-07-12 | 2016-12-07 | 博讯瓦勒公司 | 用于将抗微生物剂递送到经皮导管中的装置 |
| BR112014021501B1 (pt) | 2012-03-14 | 2020-12-08 | Novan, Inc | composição farmacêutica para administração tópica de um ingrediente farmacêutico ativo ativado por umidade |
| WO2013169538A1 (en) * | 2012-05-08 | 2013-11-14 | Albert Einstein College Of Medicine Of Yeshiva University | Nanoparticle delivery vehicle for s-nitroso-n-acetyl cysteine and uses thereof |
| EP2953660B1 (en) | 2013-02-07 | 2020-04-01 | The Regents Of The University Of Michigan | Thromboresistant/bactericidal s-nitroso-n-acetylpenicillamine (snap)-doped nitric oxide release polymers with enhanced stability |
| US9855211B2 (en) | 2013-02-28 | 2018-01-02 | Novan, Inc. | Topical compositions and methods of using the same |
| CA2913952C (en) | 2013-05-30 | 2021-12-07 | National Research Council Of Canada | Conductors comprising a functionalized organosiloxane network and methods for the preparation thereof |
| US10206947B2 (en) | 2013-08-08 | 2019-02-19 | Novan, Inc. | Topical compositions and methods of using the same |
| KR102321169B1 (ko) | 2013-08-08 | 2021-11-02 | 노반, 인크. | 국소 조성물 및 그의 사용 방법 |
| GB2517443A (en) * | 2013-08-20 | 2015-02-25 | Henkel IP & Holding GmbH | Improved bonding or vulcanisation compositions |
| CN103773227B (zh) * | 2013-12-23 | 2016-04-06 | 安徽省金盾涂料有限责任公司 | 一种高强耐磨涂料 |
| US10322082B2 (en) | 2014-07-11 | 2019-06-18 | Novan, Inc. | Topical antiviral compositions and methods of using the same |
| ES2807200T3 (es) | 2014-07-11 | 2021-02-22 | Novan Inc | Composiciones antivirales tópicas y procedimientos de uso de las mismas |
| WO2016010988A1 (en) | 2014-07-14 | 2016-01-21 | Novan, Inc. | Nitric oxide releasing nail coating compositions, nitric oxide releasing nail coatings, and methods of using the same |
| EP2982386A1 (en) | 2014-08-05 | 2016-02-10 | Christian Schrank | Breast implant comprising a nitric oxide releasing material |
| GB201505347D0 (en) * | 2015-03-27 | 2015-05-13 | Salupont Consulting Ltd | Sterilisation of s-nitrosothiols |
| WO2016182822A1 (en) | 2015-05-08 | 2016-11-17 | Icu Medical, Inc. | Medical connectors configured to receive emitters of therapeutic agents |
| US20160367620A1 (en) | 2015-06-19 | 2016-12-22 | Harry B. Demopoulos | Glutathione |
| WO2017019614A1 (en) | 2015-07-28 | 2017-02-02 | Novan, Inc. | Combinations and methods for the treatment and/or prevention of fungal infections |
| TWI638668B (zh) * | 2015-09-09 | 2018-10-21 | 國立中興大學 | Surface modification method and surface modification structure for improving blood compatibility of biomedical metal substrate |
| CN108271347B (zh) | 2015-09-15 | 2021-04-20 | 萨维奇医疗股份有限公司 | 用于在组织腔中锚定护套的装置和方法 |
| WO2017100629A1 (en) | 2015-12-09 | 2017-06-15 | The Research Foundation For The State University Of New York | Mixed transition metal oxides silica xerogels as antifouling/fouling release surfaces |
| JP7090549B2 (ja) | 2016-03-02 | 2022-06-24 | ノヴァン,インコーポレイテッド | 炎症のための治療用組成物およびその治療方法 |
| KR102426006B1 (ko) | 2016-04-13 | 2022-07-29 | 노반, 인크. | 감염 치료용 조성물, 시스템, 키트, 및 방법 |
| KR101888763B1 (ko) * | 2016-05-13 | 2018-09-20 | 광운대학교 산학협력단 | 일산화질소 저장 및 전달을 위한 나노섬유 |
| JP7005609B2 (ja) | 2016-10-14 | 2022-02-10 | アイシーユー・メディカル・インコーポレーテッド | 医療用コネクタのための浄化キャップ |
| WO2018191415A1 (en) | 2017-04-11 | 2018-10-18 | Colorado State University Research Foundation | Functionalization of metal-organic frameworks |
| WO2018204206A2 (en) | 2017-05-01 | 2018-11-08 | Icu Medical, Inc. | Medical fluid connectors and methods for providing additives in medical fluid lines |
| US11534382B2 (en) | 2017-06-19 | 2022-12-27 | Novan, Inc. | Topical compositions and methods of using the same |
| WO2019014348A1 (en) * | 2017-07-11 | 2019-01-17 | Colorado State University Research Foundation | CHITOSAN COMPOSITE MATERIAL AND METALLO-ORGANIC STRUCTURE |
| TW201915519A (zh) * | 2017-09-26 | 2019-04-16 | 鴻海精密工業股份有限公司 | 透氣性眼用鏡片材料及透氣性眼用鏡片 |
| WO2019169221A1 (en) | 2018-03-01 | 2019-09-06 | Novan, Inc. | Nitric oxide releasing suppositories and methods of use thereof |
| AU2019254237A1 (en) | 2018-04-16 | 2020-12-03 | Onquality Pharmaceuticals China Ltd. | Method for preventing or treating side effects of cancer therapy |
| US11541105B2 (en) | 2018-06-01 | 2023-01-03 | The Research Foundation For The State University Of New York | Compositions and methods for disrupting biofilm formation and maintenance |
| US20190365797A1 (en) * | 2018-06-05 | 2019-12-05 | Zylo Therapeutics, Inc. | Systems and Methods for Delivery of Nitric Oxide |
| US11400195B2 (en) | 2018-11-07 | 2022-08-02 | Icu Medical, Inc. | Peritoneal dialysis transfer set with antimicrobial properties |
| US11534595B2 (en) | 2018-11-07 | 2022-12-27 | Icu Medical, Inc. | Device for delivering an antimicrobial composition into an infusion device |
| US11541221B2 (en) | 2018-11-07 | 2023-01-03 | Icu Medical, Inc. | Tubing set with antimicrobial properties |
| US11517732B2 (en) | 2018-11-07 | 2022-12-06 | Icu Medical, Inc. | Syringe with antimicrobial properties |
| US11541220B2 (en) | 2018-11-07 | 2023-01-03 | Icu Medical, Inc. | Needleless connector with antimicrobial properties |
| AU2019384564B2 (en) | 2018-11-21 | 2023-11-23 | Icu Medical, Inc. | Antimicrobial device comprising a cap with ring and insert |
| EP3930690A4 (en) * | 2019-03-01 | 2023-03-22 | The University of North Carolina at Chapel Hill | POLYMERS WITH EXTENDED NITROGEN MONOXIDE RELEASE VIA FUNCTIONALIZED MESOPOROUS SILICON DIOXIDE NANOPARTICLES |
| CN114206948B (zh) * | 2019-06-10 | 2023-11-03 | 密歇根大学董事会 | 导管插入装置 |
| WO2021188651A1 (en) | 2020-03-19 | 2021-09-23 | Friedman Joel M | Novel approach to sustained production and delivery of nitric oxide and s-nitrosothiols |
| CN112341896A (zh) * | 2020-08-28 | 2021-02-09 | 四川仁智新材料科技有限责任公司 | 用于管道制备的性能调节材料及其制备方法 |
| AU2021373070B2 (en) | 2020-11-09 | 2023-08-24 | Albert Einstein College Of Medicine | Transdermal delivery formulations |
| JP2024500319A (ja) | 2020-12-07 | 2024-01-09 | アイシーユー・メディカル・インコーポレーテッド | 腹膜透析キャップ、システム、及び方法 |
| US11786712B2 (en) | 2021-08-30 | 2023-10-17 | Albert Einstein College Of Medicine | Nitric oxide-releasing device |
| WO2023205125A1 (en) * | 2022-04-20 | 2023-10-26 | Sterile State, Llc | Functionalized polymeric material for forming nitric oxide and methods therefor |
Family Cites Families (402)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4558120A (en) | 1983-01-07 | 1985-12-10 | The Dow Chemical Company | Dense star polymer |
| US4631337A (en) | 1983-01-07 | 1986-12-23 | The Dow Chemical Company | Hydrolytically-stable dense star polyamine |
| US4568737A (en) | 1983-01-07 | 1986-02-04 | The Dow Chemical Company | Dense star polymers and dendrimers |
| US4507466A (en) | 1983-01-07 | 1985-03-26 | The Dow Chemical Corporation | Dense star polymers having core, core branches, terminal groups |
| US4737550A (en) | 1983-01-07 | 1988-04-12 | The Dow Chemical Company | Bridged dense star polymers |
| US4587329A (en) | 1984-08-17 | 1986-05-06 | The Dow Chemical Company | Dense star polymers having two dimensional molecular diameter |
| US4871779A (en) | 1985-12-23 | 1989-10-03 | The Dow Chemical Company | Ion exchange/chelation resins containing dense star polymers having ion exchange or chelate capabilities |
| US4694064A (en) | 1986-02-28 | 1987-09-15 | The Dow Chemical Company | Rod-shaped dendrimer |
| US4713975A (en) | 1986-05-30 | 1987-12-22 | The Dow Chemical Company | Dense star polymers for calibrating/characterizing sub-micron apertures |
| US4857599A (en) | 1988-02-08 | 1989-08-15 | The Dow Chemical Company | Modified dense star polymers |
| US5061487A (en) | 1988-05-09 | 1991-10-29 | Dow Corning Corporation | Antimicrobial superabsorbent compositions and methods |
| US5035892A (en) | 1988-05-09 | 1991-07-30 | Dow Corning Corporation | Antimicrobial superabsorbent compositions and methods |
| US4990338A (en) | 1988-05-09 | 1991-02-05 | Dow Corning Corporation | Antimicrobial superabsorbent compositions and methods |
| US4985023A (en) | 1988-05-09 | 1991-01-15 | Dow Corning Corporation | Antimicrobial superabsorbent articles |
| US5045322A (en) | 1988-05-09 | 1991-09-03 | Dow Corning Corporation | Antimicrobial superabsorbent sanitary napkin |
| US5079004A (en) | 1990-08-06 | 1992-01-07 | Dow Corning Corporation | Antimicrobial superabsorbent compositions and method |
| US5380758A (en) | 1991-03-29 | 1995-01-10 | Brigham And Women's Hospital | S-nitrosothiols as smooth muscle relaxants and therapeutic uses thereof |
| DE69231666T2 (de) | 1991-11-14 | 2001-05-10 | Brigham & Womens Hospital | Die nitrosylierung von enzym-sh gruppen als eine therapeutische massnahme |
| US6291424B1 (en) | 1991-11-14 | 2001-09-18 | Brigham And Women's Hospital | Nitrosated and nitrosylated heme proteins |
| SE9200564L (sv) | 1992-02-26 | 1993-03-15 | Perstorp Ab | Dendritisk makromolekyl av polyestertyp, foerfarande foer framstaellning daerav samt anvaendning daerav |
| US5814666A (en) | 1992-04-13 | 1998-09-29 | The United States As Represented By The Department Of Health And Human Services | Encapsulated and non-encapsulated nitric oxide generators used as antimicrobial agents |
| US5910316A (en) | 1992-08-24 | 1999-06-08 | The United States Of America, As Represented By The Department Of Health And Human Services | Use of nitric oxide-releasing agents to treat impotency |
| US6200558B1 (en) | 1993-09-14 | 2001-03-13 | The United States Of America As Represented By The Department Of Health And Human Services | Biopolymer-bound nitric oxide-releasing compositions, pharmaceutical compositions incorporating same and methods of treating biological disorders using same |
| US5632981A (en) | 1992-08-24 | 1997-05-27 | The United States Of America As Represented By The Department Of Health And Human Services | Biopolymer-bound nitric oxide-releasing compositions, pharmaceutical compositions incorporating same and methods of treating biological disorders using same |
| US5650447A (en) | 1992-08-24 | 1997-07-22 | The United States Of America As Represented By The Secretary Of The Department Of Health And Human Services | Nitric oxide-releasing polymers to treat restenosis and related disorders |
| US5405919A (en) | 1992-08-24 | 1995-04-11 | The United States Of America As Represented By The Secretary Of Health And Human Services | Polymer-bound nitric oxide/nucleophile adduct compositions, pharmaceutical compositions and methods of treating biological disorders |
| US5525357A (en) | 1992-08-24 | 1996-06-11 | The United States Of America As Represented By The Department Of Health And Human Services | Polymer-bound nitric oxide/nucleophile adduct compositions, pharmaceutical compositions incorporating same and methods of treating biological disorders using same |
| US5691423A (en) | 1992-08-24 | 1997-11-25 | The United States Of America As Represented By The Department Of Health And Human Services | Polysaccharide-bound nitric oxide-nucleophile adducts |
| US5891459A (en) | 1993-06-11 | 1999-04-06 | The Board Of Trustees Of The Leland Stanford Junior University | Enhancement of vascular function by modulation of endogenous nitric oxide production or activity |
| US5852058A (en) | 1993-06-11 | 1998-12-22 | The Board Of Trustees Of The Leland Stanford Junior University | Intramural delivery of nitric oxide enhancer for inhibiting lesion formation after vascular injury |
| US5428070A (en) | 1993-06-11 | 1995-06-27 | The Board Of Trustees Of The Leland Stanford Junior University | Treatment of vascular degenerative diseases by modulation of endogenous nitric oxide production of activity |
| US5861168A (en) | 1993-06-11 | 1999-01-19 | The Board Of Trustees Of The Leland Stanford Junior University | Intramural delivery of nitric oxide enhancer for inhibiting lesion formation after vascular injury |
| US6087479A (en) | 1993-09-17 | 2000-07-11 | Nitromed, Inc. | Localized use of nitric oxide-adducts to prevent internal tissue damage |
| US6255277B1 (en) | 1993-09-17 | 2001-07-03 | Brigham And Women's Hospital | Localized use of nitric oxide-adducts to prevent internal tissue damage |
| DE69433478T2 (de) | 1993-09-17 | 2004-11-25 | Brigham And Women's Hospital, Boston | Verwendung von stickoxid-addukten zur verhütung von thrombosen auf artifiziellen und vaskulären oberflächen |
| US5840759A (en) | 1993-10-08 | 1998-11-24 | The United States Of America As Represented By The Department Of Health And Human Services | Use of nitric oxide releasing compounds to protect noncancerous cells from chemotherapeutic agents |
| WO1995010267A1 (en) | 1993-10-08 | 1995-04-20 | The United States Of America, Represented By The Secretary, Department Of Health And Human Services | Use of nitric oxide-releasing compounds as hypoxic cell radiation sensitizers |
| CA2175467A1 (en) | 1993-11-02 | 1995-05-11 | David A. Wink, Jr. | Use of nitric oxide releasing compounds as protective agents in ischemia reperfusion injury |
| US5786332A (en) | 1995-03-06 | 1998-07-28 | Trega Biosciences, Inc. | Cytokine restraining agents and methods of use in pathologies and conditions associated with altered cytokine levels |
| US5726156A (en) | 1995-03-06 | 1998-03-10 | Trega Biosciences, Inc. | Cytokine regulatory agents and methods of use in pathologies and conditions associated with altered cytokine levels |
| US5599984A (en) | 1994-01-21 | 1997-02-04 | The Picower Institute For Medical Research | Guanylhydrazones and their use to treat inflammatory conditions |
| US6008255A (en) | 1994-01-21 | 1999-12-28 | The Picower Institute For Medical Research | Guanylhydrazones and their use to treat inflammatory conditions |
| US6709681B2 (en) | 1995-02-17 | 2004-03-23 | Aberdeen University | Acidified nitrite as an antimicrobial agent |
| EP0746327B1 (en) | 1994-02-21 | 2004-04-21 | Aberdeen University | Acidified nitrite as an antimicrobial agent |
| US5935924A (en) | 1994-04-15 | 1999-08-10 | Genentech, Inc. | Treatment of congestive heart failure |
| US5504117A (en) | 1994-05-27 | 1996-04-02 | Neptune Pharmaceutical Corporation | Pharmacologic preparation for the treatment of anal disorders |
| PT719145E (pt) | 1994-05-27 | 2001-01-31 | Cellegy Pharma Inc | Composicao dadora de oxido nitrico para tratamento de desordens anais |
| US6190704B1 (en) | 1994-09-23 | 2001-02-20 | New York Society For The Ruptured And Crippled Maintaining The Hospital For Special Surgery | Regulation of wound healing by nitric oxide |
| US6747062B2 (en) | 1994-09-26 | 2004-06-08 | New York Society For The Ruptured And Crippled Maintaining The Hospital For Special Surgery | Regulation of wound healing by nitric oxide |
| US5519020A (en) | 1994-10-28 | 1996-05-21 | The University Of Akron | Polymeric wound healing accelerators |
| US5629322A (en) | 1994-11-15 | 1997-05-13 | Merck & Co., Inc. | Cyclic amidine analogs as inhibitors of nitric oxide synthase |
| US5700830A (en) | 1994-11-22 | 1997-12-23 | The United States Of America As Represented By The Department Of Health And Human Services | Use of nitric oxide-releasing agents for reducing metastasis risk |
| US5961466A (en) | 1995-01-03 | 1999-10-05 | Omnicorder Technologies, Inc. | Method of detection of cancerous lesions by their effect on the spatial distribution of modulation of temperature and homogeneity of tissue |
| US5999843A (en) | 1995-01-03 | 1999-12-07 | Omnicorder Technologies, Inc. | Detection of cancerous lesions by their effect on the spatial homogeneity of skin temperature |
| US6035225A (en) | 1995-01-03 | 2000-03-07 | Omnicorder Technologies | Detection of cancerous lesions by measuring nitric oxide concentrations in tissue |
| US5810010A (en) | 1995-01-03 | 1998-09-22 | Anbar; Michael | Detection of cancerous lesions by their effect on the periodic modulation of perfusion in the surrounding tissues |
| JPH10511957A (ja) | 1995-01-05 | 1998-11-17 | ザ ボード オブ リージェンツ オブ ザ ユニヴァーシティ オブ ミシガン | 表面改質ナノ微粒子並びにその製造及び使用方法 |
| US5665077A (en) | 1995-04-24 | 1997-09-09 | Nitrosci Pharmaceuticals Llc | Nitric oxide-releasing nitroso compositions and methods and intravascular devices for using them to prevent restenosis |
| US6043358A (en) | 1995-11-01 | 2000-03-28 | Merck & Co., Inc. | Hexahydro-5-imino-1,4-heteroazepine derivatives as inhibitors of nitric oxide synthases |
| DE69637676D1 (de) | 1995-11-09 | 2008-10-23 | Univ R | Verwendung von lokal verabreichten Lysine zur VERBESSERUNG DER VASKULAREN FUNKTION |
| US5821261A (en) | 1995-12-08 | 1998-10-13 | Merck & Co., Inc. | Substituted saturated aza heterocycles as inhibitors of nitric oxide synthase |
| US20020061879A1 (en) | 1996-02-02 | 2002-05-23 | Garvey David S. | Nitrosated and nitrosylated alpha-adrenergic receptor antagonist compounds, compositions and their uses |
| US20050065161A1 (en) | 1996-02-02 | 2005-03-24 | Nitromed, Inc. | Nitrosated and nitrosylated alpha-adrenergic receptor antagonist compounds, compositions and their uses |
| US6323211B1 (en) | 1996-02-02 | 2001-11-27 | Nitromed, Inc. | Compositions and methods for treating sexual dysfunctions |
| US5994294A (en) | 1996-02-02 | 1999-11-30 | Nitromed, Inc. | Nitrosated and nitrosylated α-adrenergic receptor antagonist compounds, compositions and their uses |
| US20020143007A1 (en) | 1996-02-02 | 2002-10-03 | Garvey David S. | Nitrosated and nitrosylated alpha-adrenergic receptor antagonists, compositions and methods of use |
| US6294517B1 (en) | 1996-02-02 | 2001-09-25 | Nitromed, Inc. | Compositions and kits comprising alpha-adrenergic receptor antagonists and nitric oxide donors and methods of use |
| US5932538A (en) | 1996-02-02 | 1999-08-03 | Nitromed, Inc. | Nitrosated and nitrosylated α-adrenergic receptor antagonist compounds, compositions and their uses |
| US6469065B1 (en) | 1996-02-02 | 2002-10-22 | Nitromed, Inc. | Nitrosated and nitrosylated α-adrenergic receptor antagonist, compositions and methods of use |
| IT1282686B1 (it) | 1996-02-26 | 1998-03-31 | Nicox Sa | Composti in grado di ridurre la tossicita' da farmaci |
| AU2990497A (en) | 1996-03-15 | 1997-10-01 | Yale University | Methods and means of detecting nitric oxide synthase |
| US6143037A (en) | 1996-06-12 | 2000-11-07 | The Regents Of The University Of Michigan | Compositions and methods for coating medical devices |
| US5770645A (en) | 1996-08-02 | 1998-06-23 | Duke University Medical Center | Polymers for delivering nitric oxide in vivo |
| US6232434B1 (en) | 1996-08-02 | 2001-05-15 | Duke University Medical Center | Polymers for delivering nitric oxide in vivo |
| AU3986097A (en) | 1996-08-27 | 1998-03-19 | University Of Akron, The | Lipophilic polyamine esters for the site specific delivery of nitric oxide in pharmaceutical use |
| US5797887A (en) | 1996-08-27 | 1998-08-25 | Novovasc Llc | Medical device with a surface adapted for exposure to a blood stream which is coated with a polymer containing a nitrosyl-containing organo-metallic compound which releases nitric oxide from the coating to mediate platelet aggregation |
| US20030093143A1 (en) | 1999-03-01 | 2003-05-15 | Yiju Zhao | Medical device having surface depressions containing nitric oxide releasing compound |
| DE69731758T2 (de) | 1996-09-27 | 2005-12-15 | The United States Government As Represented By The Department Of Health And Human Services | O2-arylate oder o2 glycosyiate 1-substituierte diazen-1-ium-1,2 diolate und o2-substituierte 1 (2-carboxylate) pyrolidin-1-yl diazen-1-ium-1,2-diolate |
| GB9622997D0 (en) | 1996-11-05 | 1997-01-08 | Univ St Andrews | Nitric oxide donor drugs |
| US5958427A (en) | 1996-11-08 | 1999-09-28 | Salzman; Andrew L. | Nitric oxide donor compounds and pharmaceutical compositions for pulmonary hypertension and other indications |
| US6372796B1 (en) | 1996-11-13 | 2002-04-16 | Cold Spring Harbor Laboratory | Therapeutic uses for nitric oxide inhibitors |
| US5891472A (en) | 1996-11-19 | 1999-04-06 | Meri Charmyne Russell | Treatment of equine laminitis |
| US6896899B2 (en) | 1996-12-31 | 2005-05-24 | Antioxidant Pharmaceuticals Corp. | Pharmaceutical preparations of glutathione and methods of administration thereof |
| CA2276183C (en) | 1996-12-31 | 2009-06-09 | Antioxidant Pharmaceuticals Corporation | Pharmaceutical preparations of glutathione and methods of administration thereof |
| US6070928A (en) | 1997-01-17 | 2000-06-06 | Cascade Engineering, Inc. | Mat with integrally molded door |
| EP1001677A4 (en) | 1997-02-04 | 2003-01-08 | Gen Hospital Corp | METHOD FOR TREATING EPIDERMAL OR DERMAL SKIN CONDITIONS |
| US6034752A (en) | 1997-03-22 | 2000-03-07 | Kent Displays Incorporated | Display device reflecting visible and infrared radiation |
| IL120531A (en) | 1997-03-26 | 2006-12-31 | Yissum Res Dev Co | Nitric oxide donors and pharmaceutical compositions containing them |
| US6171232B1 (en) | 1997-06-26 | 2001-01-09 | Cordis Corporation | Method for targeting in vivo nitric oxide release |
| ATE499343T1 (de) | 1997-07-03 | 2011-03-15 | Us Gov Health & Human Serv | Stickoxid freistetzende amidin- und enaminverwandte diazeniumdiolate, zubereitungen und verwendungen davon und verfahren zu ihrer herstellung |
| US6796966B2 (en) | 1997-10-15 | 2004-09-28 | Jeffrey E. Thomas | Apparatus, and kits for preventing of alleviating vasoconstriction or vasospasm in a mammal |
| JP2001519386A (ja) | 1997-10-15 | 2001-10-23 | トーマス・ジェファーソン・ユニバーシティ | 哺乳動物における血管収縮または血管痙攣を予防または緩和するための一酸化窒素供与体組成物、方法、装置およびキット |
| US5994444A (en) | 1997-10-16 | 1999-11-30 | Medtronic, Inc. | Polymeric material that releases nitric oxide |
| CA2219867A1 (en) | 1997-10-31 | 1999-04-30 | Jiangping Wu | The use of proteasome inhibitors for treating cancer, inflammation, autoimmune disease, graft rejection and septic shock |
| US6180082B1 (en) | 1997-11-24 | 2001-01-30 | Board Of Supervisors Of Louisiana State University And Agricultural And Mechanical College | Method to enhance tissue accumulation of radiolabeled compounds |
| EP1060174B1 (en) | 1997-12-23 | 2004-09-22 | Amersham Health AS | Nitric oxide releasing chelating agents and their therapeutic use |
| GB9801398D0 (en) | 1998-01-22 | 1998-03-18 | Anggard Erik E | Chemical compounds |
| IT1298338B1 (it) | 1998-03-05 | 1999-12-20 | Nicox Sa | Composizioni farmaceutiche per l'ulcera |
| US6560478B1 (en) | 1998-03-16 | 2003-05-06 | The Research Foundation Of City University Of New York | Method and system for examining biological materials using low power CW excitation Raman spectroscopy |
| US6151522A (en) | 1998-03-16 | 2000-11-21 | The Research Foundation Of Cuny | Method and system for examining biological materials using low power CW excitation raman spectroscopy |
| US5962520A (en) | 1998-04-02 | 1999-10-05 | The University Of Akron | Hydrolytically unstable, biocompatible polymer |
| US6103275A (en) | 1998-06-10 | 2000-08-15 | Nitric Oxide Solutions | Systems and methods for topical treatment with nitric oxide |
| US6207855B1 (en) | 1998-06-23 | 2001-03-27 | Duke University Medical Center | Stable no-delivering compounds |
| US20020068365A1 (en) | 1998-07-28 | 2002-06-06 | Eric H. Kuhrts | Controlled release nitric oxide producing agents |
| US20040043068A1 (en) | 1998-09-29 | 2004-03-04 | Eugene Tedeschi | Uses for medical devices having a lubricious, nitric oxide-releasing coating |
| US6379691B1 (en) | 1998-09-29 | 2002-04-30 | Medtronic/Ave, Inc. | Uses for medical devices having a lubricious, nitric oxide-releasing coating |
| US6299980B1 (en) | 1998-09-29 | 2001-10-09 | Medtronic Ave, Inc. | One step lubricious coating |
| US20070086954A1 (en) | 1998-11-23 | 2007-04-19 | Miller Christopher C | Method and apparatus for treatment of respiratory infections by nitric oxide inhalation |
| CA2254645A1 (en) | 1998-11-23 | 2000-05-23 | Pulmonox Medical Corporation | Method and apparatus for treatment of respiratory infections by nitric oxide inhalation |
| US20070275100A1 (en) | 1998-11-23 | 2007-11-29 | Miller Christopher C | Use of gaseous nitric oxide as an anti-cancer agent |
| US6261594B1 (en) | 1998-11-25 | 2001-07-17 | The University Of Akron | Chitosan-based nitric oxide donor compositions |
| US7179475B1 (en) | 1998-12-04 | 2007-02-20 | Johnson & Johnson Consumer Companies, Inc. | Anhydrous topical skin preparations |
| US6238683B1 (en) | 1998-12-04 | 2001-05-29 | Johnson & Johnson Consumer Companies, Inc. | Anhydrous topical skin preparations |
| GB9905425D0 (en) | 1999-03-09 | 1999-05-05 | Queen Mary & Westfield College | Pharmaceutical composition |
| US20050142218A1 (en) | 2000-03-09 | 2005-06-30 | Queen Mary & Westfield College | Pharmaceutical composition containing nitrate source and an acidifying agent for treating skin ischaemia |
| US6312663B1 (en) | 1999-03-19 | 2001-11-06 | Joseph V. Boykin, Jr. | Prediction of diabetes impaired wound healing by urinary nitrate assay |
| US6562785B1 (en) | 1999-03-23 | 2003-05-13 | Howard M. Shapiro | Method for overcoming bacterial antibiotic resistance |
| WO2000063462A1 (en) | 1999-04-14 | 2000-10-26 | University Of Cincinnati | Silane coatings for adhesion promotion |
| US7655423B2 (en) | 1999-06-14 | 2010-02-02 | Henry Ford Health System | Nitric oxide donors for inducing neurogenesis |
| US7135498B1 (en) | 1999-06-14 | 2006-11-14 | Henry Ford Health System | Nitric oxide donors for inducing neurogenesis |
| EP1233670B1 (en) | 1999-06-14 | 2008-09-17 | Henry Ford Health System | Nitric oxide donors for inducing neurogenesis |
| US20010012851A1 (en) | 1999-07-29 | 2001-08-09 | Kristin M. Lundy | Nitric oxide releasing oxindole prodrugs for anagesic, anti-inflammatory and disease-modifying use |
| US20020049157A1 (en) | 1999-08-25 | 2002-04-25 | Jiangping Wu | Use of proteasome inhibitors for treating cancer, inflammation, autoimmune disease, graft rejection and septic shock |
| IL143305A0 (en) | 1999-09-02 | 2002-04-21 | Rice University | Nitric oxide-producing hydrogel materials |
| US7052711B2 (en) | 1999-09-02 | 2006-05-30 | Rice University | Nitric oxide-producing hydrogel materials |
| US7279176B1 (en) | 1999-09-02 | 2007-10-09 | Rice University | Nitric oxide-producing hydrogel materials |
| US6737447B1 (en) | 1999-10-08 | 2004-05-18 | The University Of Akron | Nitric oxide-modified linear poly(ethylenimine) fibers and uses thereof |
| IL150361A0 (en) | 1999-12-20 | 2002-12-01 | Majeste La Reine Du Cheff Du C | Method and composition for treatment and/or prevention of antibiotic-resistant microorganism infections |
| US6492405B2 (en) | 1999-12-30 | 2002-12-10 | Yissum Research Development Company Of The Hebrew University Of Jerusalem | Nitric oxide donors and pharmaceutical compositions containing them |
| US20020132234A1 (en) | 2000-01-24 | 2002-09-19 | Moskowitz David W. | Nitric oxide synthase gene diagnostic polymorphisms |
| US6758214B2 (en) | 2000-01-28 | 2004-07-06 | Cyterra Corporation | Simple nitric oxide generator for ambulatory and/or bedside inhaled no treatment |
| US6699846B2 (en) | 2000-03-17 | 2004-03-02 | Corixa Corporation | Mono- and disaccharides for the treatment of nitric oxide related disorders |
| MXPA02009236A (es) | 2000-03-20 | 2004-04-05 | Novovascular Inc | Matrices que contienen donadores de oxido nitrico y agentes reductores, y su uso. |
| US20010038832A1 (en) | 2000-04-11 | 2001-11-08 | Benjamin Bonavida | Nitric oxide and analogues thereof effectuate sensitization of neoplasm and immunologically undesired tissues to cytotoxicity |
| US7678391B2 (en) | 2000-04-26 | 2010-03-16 | Queen's University At Kingston | Formulations and methods of using nitric oxide mimetics against a malignant cell phenotype |
| US20050142217A1 (en) | 2000-04-26 | 2005-06-30 | Adams Michael A. | Formulations and methods of using nitric oxide mimetics against a malignant cell phenotype |
| JP2003531179A (ja) | 2000-04-26 | 2003-10-21 | クイーンズ ユニバーシティ アット キングストン | 悪性細胞表現型に対し一酸化窒素模倣体を使用する処方および方法 |
| US20010053772A1 (en) | 2000-04-28 | 2001-12-20 | Benjamin Bonavida | Aza analogues of alkyl lysophospholipids exert immunomodulatory effects |
| US6270779B1 (en) | 2000-05-10 | 2001-08-07 | United States Of America | Nitric oxide-releasing metallic medical devices |
| AU2001264729A1 (en) | 2000-05-22 | 2001-12-03 | Nitromed, Inc. | Thromboxane inhibitors, compositions and methods of use related applications |
| US6538033B2 (en) | 2000-08-29 | 2003-03-25 | Huntington Medical Research Institutes | Nitric oxide donor compounds |
| GB0021317D0 (en) | 2000-08-30 | 2000-10-18 | Queen Mary & Westfield College | Transdermal pharmaceutical delivery composition |
| JP4841066B2 (ja) | 2000-09-01 | 2011-12-21 | ライスユニバーシティ | 酸化窒素生成ヒドロゲル物質 |
| GB0022084D0 (en) | 2000-09-08 | 2000-10-25 | Univ Aberdeen | Treatment of multiply antibiotic-resistant organisms |
| US6410622B1 (en) | 2000-09-11 | 2002-06-25 | Gregory W. Endres | Method of preventing fouling organisms in marine environments and polymer-bound nitric oxide/nitric oxide-releasing compositions usable therefor |
| EP1333823B1 (en) | 2000-10-16 | 2010-03-31 | Duke University | Therapeutic use of aerosolized s-nitrosoglutathione in cystic fibrosis |
| CA2425196A1 (en) | 2000-10-17 | 2002-04-25 | Board Of Regents, The University Of Texas System | A method to incorporate n-(4-hydroxyphenyl) retinamide in liposomes |
| US6359182B1 (en) | 2000-10-26 | 2002-03-19 | Duke University | C-nitroso compounds and use thereof |
| US7049308B2 (en) | 2000-10-26 | 2006-05-23 | Duke University | C-nitroso compounds and use thereof |
| KR100383149B1 (ko) | 2000-12-12 | 2003-05-12 | 한국생명공학연구원 | 디테르펜계 화합물을 염증질환, 면역질환 및 암 치료제로사용하는 신규한 용도 |
| DE10063937A1 (de) | 2000-12-20 | 2002-07-18 | Bayer Ag | Verfahren zur Herstellung von Trimethylolverbindungen und Ameisensäure |
| US6780849B2 (en) | 2000-12-21 | 2004-08-24 | Scimed Life Systems, Inc. | Lipid-based nitric oxide donors |
| US7329412B2 (en) | 2000-12-22 | 2008-02-12 | The Trustees Of Columbia University In The City Of New York | Antimicrobial medical devices containing chlorhexidine free base and salt |
| US20040009238A1 (en) | 2002-07-09 | 2004-01-15 | Chris Miller | Exogenenous nitric oxide gas (gNO) therapy in wound healing |
| US7122018B2 (en) | 2000-12-26 | 2006-10-17 | Sensormedics Corporation | Device and method for treatment of wounds with nitric oxide |
| US6432077B1 (en) | 2000-12-26 | 2002-08-13 | Sensormedics Corporation | Device and method for treatment of surface infections with nitric oxide |
| US7335383B2 (en) | 2001-01-16 | 2008-02-26 | The Regents Of The University Of Michigan | Generation of nitric oxide in vivo from nitrite, nitrate or nitrosothiols endogenous in blood |
| EP1357936B1 (en) | 2001-01-16 | 2008-10-01 | The Regents of The University of Michigan | Biocatalytic and biomimetic generation of nitric oxide in situ at substrate/blood interfaces |
| US7128904B2 (en) | 2001-01-16 | 2006-10-31 | The Regents Of The University Of Michigan | Material containing metal ion ligand complex producing nitric oxide in contact with blood |
| US6706274B2 (en) | 2001-01-18 | 2004-03-16 | Scimed Life Systems, Inc. | Differential delivery of nitric oxide |
| ITMI20010426A1 (it) | 2001-03-01 | 2002-09-01 | Consiglio Nazionale Ricerche | Donatori di ossido di azoto basati su centri metallici |
| US7012098B2 (en) | 2001-03-23 | 2006-03-14 | Pharmacia Corporation | Inhibitors of inducible nitric oxide synthase for chemoprevention and treatment of cancers |
| US20020138051A1 (en) | 2001-03-26 | 2002-09-26 | Hole Douglas R. | System and method for the prevention and treatment of animal wound infections using nitric oxide |
| US7122027B2 (en) | 2001-05-25 | 2006-10-17 | Medtronic, Inc. | Implantable medical device with controllable gaseous agent release system |
| ES2180446B1 (es) | 2001-07-02 | 2004-01-16 | Esteve Labor Dr | Empleo de derivados de acidos 2,5-dihidroxibencenosulfonicos en la elaboracion de un medicamento para potenciar el efecto de otros farmacos en el tratamiento de la disfuncion erectil. |
| US7122529B2 (en) | 2001-07-12 | 2006-10-17 | The Johns Hopkins University | Compounds that release nitric oxide at controlled rates upon photolysis |
| GB0119011D0 (en) | 2001-08-03 | 2001-09-26 | Univ Aberdeen | Treatment of nail infections |
| CA2459647A1 (en) | 2001-08-20 | 2003-02-27 | University Of Virginia Patent Foundation | Use of s-nitrosothiol signaling to treat disordered control of breathing |
| US6841166B1 (en) | 2001-08-21 | 2005-01-11 | The Regents Of The University Of Michigan | Nitric oxide-releasing polymers incorporating diazeniumdiolated silane derivatives |
| US7135189B2 (en) | 2001-08-23 | 2006-11-14 | Boston Scientific Scimed, Inc. | Compositions and techniques for localized therapy |
| CA2459891C (en) | 2001-09-05 | 2014-02-04 | Cyterra Corporation | Method and apparatus for nitric oxide generation |
| US6673338B1 (en) | 2001-09-10 | 2004-01-06 | The United States Of America As Represented By The Department Of Health And Human Services | Nitric oxide-releasing imidate and thioimidate diazeniumdiolates, compositions, uses thereof and method of making same |
| WO2003026717A1 (en) | 2001-09-26 | 2003-04-03 | The Government Of The United States Of America, Represented By The Secretary, Department Of Health And Human Services | Nitric oxide-releasing coated medical devices and method of preparing same |
| US6703046B2 (en) | 2001-10-04 | 2004-03-09 | Medtronic Ave Inc. | Highly cross-linked, extremely hydrophobic nitric oxide-releasing polymers and methods for their manufacture and use |
| EP1300083A1 (en) | 2001-10-04 | 2003-04-09 | Societe Des Produits Nestle S.A. | Milk-based snack |
| GB0125222D0 (en) | 2001-10-19 | 2001-12-12 | Barts & London Nhs Trust | Composition for the treatment of microbial infections |
| US6627602B2 (en) | 2001-11-13 | 2003-09-30 | Duke University | Preventing desensitization of receptors |
| US6472390B1 (en) | 2001-11-13 | 2002-10-29 | Duke University | Use of therapeutic dosages for nitric oxide donors which do not significantly lower blood pressure or pulmonary artery pressure |
| US20040110691A1 (en) | 2001-11-13 | 2004-06-10 | Stamler Jonathan S. | Thiol reactive agents as a therapeutic modality |
| CN1612804A (zh) | 2001-12-03 | 2005-05-04 | C·R·巴德公司 | 抗微生物医用器材、抗微生物聚合物涂层及其制备方法 |
| WO2003059339A1 (en) | 2002-01-15 | 2003-07-24 | Trustees Of Dartmouth College | Tricyclic-bis-enone derivatives and methods of use thereof |
| US8404665B2 (en) | 2002-03-21 | 2013-03-26 | University Of Utah Research Foundation | In vivo use of glutathione S-transferase activated nitric oxide donors |
| CA2480832A1 (en) | 2002-04-05 | 2003-10-23 | Nitromed, Inc. | Nitric oxide donors, compositions and methods of use |
| EP1501563A1 (en) | 2002-05-03 | 2005-02-02 | Duke University Medical Center | Carbon nanotubules for storage of nitric oxide |
| US7328706B2 (en) | 2002-05-06 | 2008-02-12 | Dynamic Mouth Devices Llc | Therapeutic and protective dental device useful as an intra-oral delivery system |
| EP1507526A2 (en) | 2002-05-07 | 2005-02-23 | THE GOVERNMENT OF THE UNITED STATES OF AMERICA, as represented by THE SECRETARY, DEPARTMENT OF HEALTH AND HUMAN SERVICES | Polydiazeniumdiolated cyclic polyamines with polyphasic nitric oxide release and related compounds, compositions comprising same and methods of using same |
| JP2006515859A (ja) | 2002-05-13 | 2006-06-08 | トラスティーズ オブ ダートマス カレッジ | 阻害剤およびその使用法 |
| US7070798B1 (en) | 2002-06-21 | 2006-07-04 | Advanced Cardiovascular Systems, Inc. | Coatings for implantable medical devices incorporating chemically-bound polymers and oligomers of L-arginine |
| PL375161A1 (en) | 2002-06-21 | 2005-11-28 | University Of Pittsburgh Of The Commonwealth System Of Higher Education | Pharmaceutical use of nitric oxide, heme oxygenase-1 and products of heme degradation |
| US6949530B2 (en) | 2002-07-18 | 2005-09-27 | The United States Of America As Represented By The Department Of Health And Human Services | Nitric oxide-releasing amidine diazeniumdiolates, compositions and uses thereof and method of making same |
| WO2004009253A1 (en) | 2002-07-19 | 2004-01-29 | University Of North Carolina At Chapel Hill | Surface-localized release of an anti-biofouling agent via micropatterning |
| EP1527045A1 (en) | 2002-07-26 | 2005-05-04 | Merck Frosst Canada & Co. | Nitric oxide releasing prodrugs of diaryl-2-(5h)-furanones as cyclooxygenase-2 inhibitors |
| JP2005534485A (ja) | 2002-08-02 | 2005-11-17 | アメリカ合衆国 | 架橋した一酸化窒素−放出ポリアミン被覆基質、それを含む組成物及びその製造方法 |
| US20040076582A1 (en) | 2002-08-30 | 2004-04-22 | Dimatteo Kristian | Agent delivery particle |
| US20040033480A1 (en) | 2002-08-15 | 2004-02-19 | Wong Norman C.W. | Use of resveratrol to regulate expression of apolipoprotein A1 |
| US20050080024A1 (en) | 2002-08-15 | 2005-04-14 | Joseph Tucker | Nitric oxide donating derivatives for the treatment of cardiovascular disorders |
| US20050080021A1 (en) | 2002-08-15 | 2005-04-14 | Joseph Tucker | Nitric oxide donating derivatives of stilbenes, polyphenols and flavonoids for the treatment of cardiovascular disorders |
| US6951902B2 (en) | 2002-08-16 | 2005-10-04 | Michigan Biotechnology Institute | Two dimensional polymer that generates nitric oxide |
| US7674482B2 (en) | 2002-08-27 | 2010-03-09 | Targeted Medical Pharma Inc. | Method and compositions for potentiating pharmaceuticals with amino acid based medical foods |
| US20030039697A1 (en) | 2002-09-12 | 2003-02-27 | Yi-Ju Zhao | Matrices containing nitric oxide donors and reducing agents and their use |
| CA2503063A1 (en) | 2002-10-22 | 2004-05-06 | Merck Frosst Canada & Co./Merck Frosst Canada & Cie | Nitric oxide releasing selective cyclooxygenase-2 inhibitors |
| US20080317679A1 (en) | 2002-10-25 | 2008-12-25 | Foamix Ltd. | Foamable compositions and kits comprising one or more of a channel agent, a cholinergic agent, a nitric oxide donor, and related agents and their uses |
| WO2004046309A2 (en) | 2002-11-18 | 2004-06-03 | Phoenix Pharmacologics, Inc. | Methods for inhibiting viral replication in vivo |
| AU2003293529A1 (en) | 2002-12-16 | 2004-07-29 | Nitromed, Inc. | Nitrosated and nitrosylated rapamycin compounds, compositions and methods of use |
| WO2004064767A2 (en) | 2003-01-23 | 2004-08-05 | Kahn Nighat N | Nitric oxide inducing agents |
| FR2850578B1 (fr) | 2003-02-03 | 2006-07-28 | Oreal | Utilisation de n-arylmethylene ethylenediaminetriacetates, n-arylmethyleneiminodiacetates ou n,n'-diarylmethylene ethylenediamineacetates comme donneurs de no |
| ATE432258T1 (de) | 2003-03-05 | 2009-06-15 | Merck Frosst Company | Stickstoffmonoxid freisetzende prodrugs von diaryl-2-(5h)-furanonen als inhibitoren von cyclooxygenase-2 |
| CA2518506A1 (en) | 2003-03-13 | 2004-11-18 | Nitromed, Inc. | Nitrosated and nitrosylated compounds, compositions and methods of use |
| SE0300971D0 (sv) | 2003-04-03 | 2003-04-03 | Aga Ab | Nitric oxide in treatment of inflammation |
| US20040254419A1 (en) | 2003-04-08 | 2004-12-16 | Xingwu Wang | Therapeutic assembly |
| US20050079132A1 (en) | 2003-04-08 | 2005-04-14 | Xingwu Wang | Medical device with low magnetic susceptibility |
| US7972137B2 (en) | 2003-06-30 | 2011-07-05 | Rosen Gerald M | Anti-microbial dental formulations for the prevention and treatment of oral mucosal disease |
| PL1648826T3 (pl) | 2003-07-03 | 2018-02-28 | The University Court Of The University Of St. Andrews | Zeolity do dostarczania tlenku azotu |
| US7234079B2 (en) | 2003-07-11 | 2007-06-19 | Agency For Science, Technology & Research | Method and system for enabling recovery of data stored in a computer network; a method and a system for recovering data stored in a computer network |
| US20050054714A1 (en) | 2003-07-17 | 2005-03-10 | Benito Munoz | Nitric oxide releasing drugs for Alzheimer's disease |
| EP1648527A4 (en) | 2003-07-25 | 2008-04-23 | Univ Akron | STABILIZATION AND IONIC RELEASE OF NITRIC OXIDE RELEASE |
| US7364585B2 (en) | 2003-08-11 | 2008-04-29 | Boston Scientific Scimed, Inc. | Medical devices comprising drug-loaded capsules for localized drug delivery |
| US7314857B2 (en) | 2003-08-25 | 2008-01-01 | Kane Biotech Inc. | Synergistic antimicrobial compositions and methods of inhibiting biofilm formation |
| AU2004270161A1 (en) | 2003-08-28 | 2005-03-17 | Nicox S.A. | Nitrosated and nitrosylated cardiovascular compounds, compositions and methods of use |
| JP2007518697A (ja) | 2003-09-26 | 2007-07-12 | ニトロメッド インコーポレーティッド | ニトロソ化グルタミン酸化合物、組成物、および使用方法 |
| AU2004275868A1 (en) | 2003-09-26 | 2005-04-07 | David R. Whitlock | Methods of using ammonia oxidizing bacteria |
| US7485324B2 (en) | 2003-09-29 | 2009-02-03 | Pulmonox Technologies Corporation | Use of exogenous gaseous nitric oxide in the treatment and disinfection of biofilms |
| US20050074506A1 (en) | 2003-10-02 | 2005-04-07 | Brainsgate Ltd. | Targeted release of nitric oxide in the CNS circulation for modulating the BBB and treating disorders |
| EP1691856A2 (en) | 2003-10-14 | 2006-08-23 | Cube Medical A/S | Medical device with electrospun nanofibers |
| US20060286159A1 (en) | 2003-10-17 | 2006-12-21 | Calvert Murrell George A | Treatment of persistent active tendinopathy using transdermal glyceryl trinitrate providing durability of effect |
| US20070053966A1 (en) | 2003-10-17 | 2007-03-08 | Robert Ang | Medicated orthopedic support structures for treatment of damaged musculoskeletal tissue |
| US20070059351A1 (en) | 2003-10-17 | 2007-03-15 | Murrell George A C | Transdermal patches containing a nitric oxide-donor and a second active agent and associated methods |
| US20050171199A1 (en) | 2003-10-17 | 2005-08-04 | New York Society For The Ruptured And Crippled Maintaining The Hospital For Special Surgery | Treatment of overuse tendinopathy using transdermal nitric oxide-generating agents |
| US20060286158A1 (en) | 2003-10-17 | 2006-12-21 | Calvert Murrell George A | Treatment of overuse tendinopathy using transdermal nitric oxide-generating agents |
| AU2004296174A1 (en) | 2003-12-15 | 2005-06-23 | Nitricare Hb | Device and method for administering therapeutic agents |
| CA2552735C (en) | 2004-01-07 | 2012-09-11 | Noxilizer, Inc. | Sterilization system and device |
| US8017074B2 (en) | 2004-01-07 | 2011-09-13 | Noxilizer, Inc. | Sterilization system and device |
| JP2007526911A (ja) | 2004-01-22 | 2007-09-20 | ザ ユニバーシティ オブ アクロン | 医療装置および治療のためのポリマーno供与体プレドラッグナノファイバコーティング |
| WO2005070006A2 (en) | 2004-01-22 | 2005-08-04 | Nitromed, Inc. | Nitrosated and/or nitrosylated compounds, compositions and methods of use |
| AU2005206229A1 (en) | 2004-01-27 | 2005-08-04 | Merck Frosst Company | Nitric oxide releasing prodrugs of diaryl-2-(5H)-furanones as cyclooxygenase-2 inhibitors |
| CA2554334A1 (en) | 2004-01-27 | 2005-08-04 | Merck Frosst Company | Nitric oxide releasing prodrugs of diaryl-2-(5h)-furanones as cyclooxygenase-2 inhibitors |
| US20050165452A1 (en) | 2004-01-28 | 2005-07-28 | Medtronic, Inc. | Antithrombogenic medical device |
| US7569559B2 (en) | 2004-02-09 | 2009-08-04 | Noxilizer, Inc. | Nitric oxide-releasing molecules |
| US7829553B2 (en) | 2004-02-09 | 2010-11-09 | Amulet Pharmaceuticals, Inc. | Nitric oxide-releasing polymers |
| US20070166227A1 (en) | 2004-02-10 | 2007-07-19 | Shuang Liu | Crowned dithiocarbamate metal complexes and methods for their use |
| EP1732577B1 (en) | 2004-02-23 | 2013-04-10 | Strategic Science & Technologies, LLC | Topical delivery of l-arginine to improve body and skin appearance |
| US20070191377A1 (en) | 2004-03-31 | 2007-08-16 | Nitromed, Inc. | Methods for treating blood disorders with nitric oxide donor compounds |
| CA2563678A1 (en) | 2004-04-19 | 2005-11-03 | Strategic Science & Technologies, Llc | Beneficial effects of increasing local blood flow |
| WO2005115440A2 (en) | 2004-04-29 | 2005-12-08 | Kahn Nighat N | Compositions and method for modulating insulin-activated nitric oxide synthase |
| KR20070040332A (ko) | 2004-05-03 | 2007-04-16 | 네오실 인코퍼레이티드 | 다중양이온성 항균 치료 |
| WO2005112954A1 (en) | 2004-05-14 | 2005-12-01 | William Marsh Rice University | Nitric oxide releasing compositions and associated methods |
| US8791073B2 (en) | 2004-05-14 | 2014-07-29 | William Marsh Rice University | Peptide-modified polyurethane compositions and associated methods |
| US7582623B2 (en) | 2004-05-20 | 2009-09-01 | The Regents Of The University Of California | Photoactive metal nitrosyls for blood pressure regulation and cancer therapy |
| DE602005018222D1 (es) | 2004-06-10 | 2010-01-21 | Nippon Kayaku Kk | |
| US20060008529A1 (en) | 2004-07-12 | 2006-01-12 | Meyerhoff Mark E | Use of additive sites to control nitric oxide release from nitric oxide donors contained within polymers |
| US20060039950A1 (en) | 2004-08-23 | 2006-02-23 | Zhengrong Zhou | Multi-functional biocompatible coatings for intravascular devices |
| EP1794195B1 (en) | 2004-09-27 | 2014-12-17 | Government of the United States of America, Represented by the Secretary, Department of Health and Human Services | Nitric oxide-releasing diazeniumdiolated acrylonitrile-based polymers, and compositions, medical devices, and uses thereof |
| US20070154570A1 (en) | 2004-09-29 | 2007-07-05 | Miller Christopher C | Use of nitric oxide in the treatment and disinfection of biofilms |
| WO2006041855A2 (en) | 2004-10-04 | 2006-04-20 | Nitromed, Inc. | Compositions and methods using apocynin compounds and nitric oxide donors |
| FR2877004B1 (fr) | 2004-10-21 | 2007-03-09 | Oreal | Esters et amides silaniques d'acide 2-oxothiazolidine-4- carboxylique et leurs utilisations cosmetiques. |
| US8388677B2 (en) | 2004-10-29 | 2013-03-05 | Boston Scientific Scimed, Inc. | Anti-thrombogenic and anti-restenotic vascular medical devices |
| US20080275093A1 (en) | 2004-11-15 | 2008-11-06 | Nitromed, Inc. | Diuretic Compounds Comprising Heterocyclic Nitric Oxide Donor Groups, Compositions and Methods of Use |
| EP1827332A4 (en) | 2004-11-29 | 2010-03-17 | Univ Akron | TOPICAL NITROGEN MONOXIDE DONOR DEVICES AND METHODS OF USING THE SAME FOR THERAPEUTIC PURPOSES |
| EP1681068A1 (en) | 2004-12-16 | 2006-07-19 | NOLabs AB | Anti-pathogen and anti-cancer filtering device and method comprising nitric oxide |
| WO2006064056A2 (en) | 2004-12-16 | 2006-06-22 | Nolabs Ab | Anti-pathogen and anti-cancer filtering device and method comprising nitric oxide |
| JP2008525321A (ja) | 2004-12-24 | 2008-07-17 | ザ ユニバーシティー オブ クイーンズランド | 疼痛治療法 |
| AU2006210952B2 (en) | 2005-01-31 | 2011-08-04 | Mylan Laboratories, Inc. | Pharmaceutical composition comprising hydroxylated nebivolol |
| EP1846009A2 (en) | 2005-02-11 | 2007-10-24 | NOLabs AB | Improved device for application of medicaments, manufacturing method therefor, and method of treatment |
| JP5175107B2 (ja) | 2005-02-11 | 2013-04-03 | ノーラブズ エービー | 酸化窒素による神経障害の治療デバイス、方法および使用 |
| EP1690557A1 (en) | 2005-02-11 | 2006-08-16 | NOLabs AB | Device for treatment of rectal disorders, and manufacturing process for the same |
| WO2006084913A2 (en) | 2005-02-11 | 2006-08-17 | Nolabs Ab | Device for treatment of rectal disorders, and manufacturing process for the same, involving nitric oxide |
| EP1690532A1 (en) | 2005-02-11 | 2006-08-16 | NOLabs AB | Device for gastric treatment and manufacturing process for the same |
| EP1690554A1 (en) | 2005-02-11 | 2006-08-16 | NOLabs AB | Device for treatment of infections, including dermatophytosis and onychomycosis |
| EP1690558A1 (en) | 2005-02-11 | 2006-08-16 | NOLabs AB | Device for treatment of diabetic disorders |
| PT1861130E (pt) | 2005-02-11 | 2008-12-02 | Nolabs Ab | Dispositivo e método para o tratamento de dermatomicose, e em particular de onicomicose |
| EP1757278A1 (en) | 2005-08-23 | 2007-02-28 | NOLabs AB | Device, system, and method comprising microencapsulated liquid for release of nitric oxide from a polymer |
| EP1700611A1 (en) | 2005-02-11 | 2006-09-13 | NOLabs AB | Device for treatment of disorders in the oral cavity, and manufacturing process for the same |
| WO2006084914A2 (en) | 2005-02-11 | 2006-08-17 | Nolabs Ab | Device for gastric treatment and manufacturing process for the same |
| JP2008530226A (ja) | 2005-02-16 | 2008-08-07 | ニトロメッド インコーポレーティッド | 抗微生物化合物の有機酸化窒素供与体塩、組成物、および使用法 |
| WO2006091716A2 (en) | 2005-02-24 | 2006-08-31 | Nitromed, Inc. | Nitric oxide enhancing diuretic compounds, compositions and methods of use |
| US8119840B2 (en) | 2005-03-04 | 2012-02-21 | The University Of Akron | Ethambutol based nitric oxide donors |
| JP2008533031A (ja) | 2005-03-09 | 2008-08-21 | ニトロメッド インコーポレーティッド | アンギオテンシンiiアンタゴニストの有機酸化窒素増強塩、組成物および使用法 |
| GB0505035D0 (en) | 2005-03-11 | 2005-04-20 | Insense Ltd | Improvements relating to skin dressings |
| WO2006097348A1 (en) | 2005-03-15 | 2006-09-21 | L'oreal | Use of agents such as nonpolymeric nitric oxide donors for making the lips full again and/or colouring the lips |
| BRPI0611552A2 (pt) | 2005-03-24 | 2010-11-23 | Nolabs Ab | dispositivo de acesso médico intravascular, intersticial ou intra-órgãos, processo de fabricação de um dispositivo de acesso médico intravascular, intersticial ou intra-órgãos, uso de um polìmero eluente de óxido nìtrico (no) e método terapêutico de prevenção de infecção e/ou obtenção de efeito antitrombótico |
| EP1704879A1 (en) | 2005-03-24 | 2006-09-27 | NOLabs AB | Intravascular, interstitial or intraorgan medical device comprising a nitric oxide eluting polymer |
| EP1704876A1 (en) | 2005-03-24 | 2006-09-27 | NOLabs AB | Cosmetic treatment, device for performing said treatment and manufacturing method thereof |
| PL1871433T3 (pl) | 2005-03-24 | 2009-09-30 | Nolabs Ab | Zabieg kosmetyczny z tlenkiem azotu, urządzenie do wykonywania tego zabiegu i sposób jego wytwarzania |
| EP1704877A1 (en) | 2005-03-24 | 2006-09-27 | NOLabs AB | A wound care device comprising a nitric oxide eluting polymer |
| WO2006100155A1 (en) | 2005-03-24 | 2006-09-28 | Nolabs Ab | Device for wound care, and manufacturing method thereof, involving the use of nitric oxide |
| US20080214646A1 (en) | 2005-05-16 | 2008-09-04 | Knaus Edward E | Novel Nsaids Possessing a Nitric Oxide Donor Diazen-1-Ium-1,2-Diolate Moiety |
| CA2605269C (en) | 2005-05-17 | 2012-12-18 | Syntach Ag | A device and kit for treatment of disorders in the heart rhythm regulation system |
| US20090048219A1 (en) | 2005-05-23 | 2009-02-19 | Nitromed Inc. | Organic nitric oxide donor salts of nonsteroidal antiinflammatory compounds, compositions and methods of use |
| EP1899451B1 (en) | 2005-05-24 | 2016-10-12 | NewSouth Innovations Pty Limited | Methods and compositions for regulating biofilm development |
| EP2669269B1 (en) | 2005-05-27 | 2019-05-22 | The University of North Carolina At Chapel Hill | Nitric oxide-releasing particles for nitric oxide therapeutics and biomedical applications |
| US20100016790A1 (en) | 2005-06-01 | 2010-01-21 | Tor Peters | Treatment And Pre-Treatment Device, And Manufacturing Method Therefor, Involving Nitric Oxide |
| WO2006128743A1 (en) | 2005-06-01 | 2006-12-07 | Nolabs Ab | Feedstuff |
| EP1731176A1 (en) | 2005-06-01 | 2006-12-13 | NOLabs AB | Pre-treatment device comprising nitric oxide |
| EP1728438A1 (en) | 2005-06-01 | 2006-12-06 | NOLabs AB | Feedstuff |
| US8106080B2 (en) | 2005-06-09 | 2012-01-31 | Gu-Qi Wang | Compositions and methods for enhancing nitric oxide delivery |
| WO2007005758A2 (en) | 2005-06-30 | 2007-01-11 | Mc3, Inc. | Methods , compositions and devices for promoting angiogenesis |
| CA2613108A1 (en) | 2005-06-30 | 2007-01-11 | Mc3, Inc. | Nitric oxide coatings for medical devices |
| US20080139450A1 (en) | 2005-07-01 | 2008-06-12 | Srinivasa Madhyastha | Antimicrobial Compositions and Uses Thereof |
| AU2006265707B2 (en) | 2005-07-01 | 2012-06-14 | Kane Biotech Inc. | Antimicrobial compositions for inhibiting growth and proliferation of a microbial biofilm on medical devices |
| BRPI0503201B8 (pt) | 2005-07-28 | 2021-05-25 | Sci Tech Produtos Medicos Ltda | stents revestidos com blendas poliméricas hidrofílicas, eluidoras de óxido nítrico e s-nitrosotióis |
| US20090018091A1 (en) | 2005-08-02 | 2009-01-15 | Nitromed, Inc. | Nitric Oxide Enhancing Antimicrobial Compounds, Compositions and Methods of Use |
| US8021679B2 (en) | 2005-08-25 | 2011-09-20 | Medtronic Vascular, Inc | Nitric oxide-releasing biodegradable polymers useful as medical devices and coatings therefore |
| ATE510464T1 (de) | 2005-08-26 | 2011-06-15 | Nestec Sa | ZUSAMMENSETZUNGEN UND VERFAHREN ZUR VERBESSERUNG DER FUNKTIONALEN GEFÄßINTEGRITÄT, DES ÜBERLEBENS DER ZELLEN UND DER REDUCTION DER APOPTOSE NACH EINEM ISCHÄMIEANFALL IM GEHIRN |
| US20070048344A1 (en) | 2005-08-31 | 2007-03-01 | Ali Yahiaoui | Antimicrobial composition |
| US20070053952A1 (en) | 2005-09-07 | 2007-03-08 | Medtronic Vascular, Inc. | Nitric oxide-releasing polymers derived from modified polymers |
| EP1764119A1 (en) | 2005-09-09 | 2007-03-21 | NOLabs AB | Implants with improved osteointegration |
| US20090010989A1 (en) | 2005-09-12 | 2009-01-08 | N0Labs Ab | Coating For Implants and Implants With Improved Osteointegration, and Manufacturing Method |
| US20070088345A1 (en) | 2005-10-13 | 2007-04-19 | Ust Inc. | Applications of HIFU and chemotherapy |
| US7531164B2 (en) | 2005-10-21 | 2009-05-12 | Duke University | Preventing bacterial or viral infectivity and composition containing infection preventing additive |
| AU2006309212B2 (en) | 2005-10-31 | 2011-09-15 | Government Of The United States Of America, Represented By The Secretary Department Of Health And Human Services | Polysaccharide-derived nitric oxide-releasing carbon-bound diazeniumdiolates |
| WO2007053578A2 (en) | 2005-10-31 | 2007-05-10 | Amulet Pharmaceuticals, Inc. | Multi-phasic nitric oxide and drug co-eluting stent coatings |
| EP1790335A1 (en) | 2005-11-14 | 2007-05-30 | NOLabs AB | Composition and its use for the manufacture of a medicament for treating, prophylactically treating, preventing cancer and/or infections in the urinary tract |
| WO2007059311A2 (en) | 2005-11-16 | 2007-05-24 | Nitromed, Inc. | Furoxan compounds, compositions and methods of use |
| WO2007057763A2 (en) | 2005-11-18 | 2007-05-24 | Pulmonox Technologies Corporation | Nitric oxide as an anti-viral agent, vaccine and vaccine adjuvant |
| JP2009518069A (ja) | 2005-12-02 | 2009-05-07 | ザ・リージェンツ・オブ・ザ・ユニバーシティ・オブ・ミシガン | 組成物、コーティング及びデバイス、並びにそれらの製造方法及び使用方法 |
| US20070129690A1 (en) | 2005-12-02 | 2007-06-07 | Joel Rosenblatt | Catheter with polymeric coating |
| AU2006322035A1 (en) | 2005-12-06 | 2007-06-14 | Amulet Pharmaceuticals, Inc. | Nitric oxide-releasing polymers |
| JP2009521481A (ja) | 2005-12-21 | 2009-06-04 | ナイトロックス, エルエルシー | 安定なs−ニトロソチオール製剤 |
| US9801902B2 (en) | 2006-01-17 | 2017-10-31 | The University Of Akron | Debridement method using topical nitric oxide donor devices and compositions |
| WO2007087631A2 (en) | 2006-01-26 | 2007-08-02 | Bebaas, Inc. | Cobalamin compositions for the treatment of cancer |
| EP1983975B1 (en) | 2006-02-03 | 2015-07-29 | Giulio Cossu | Method of treatment for muscular dystrophy |
| US20070202155A1 (en) | 2006-02-03 | 2007-08-30 | Cure Therapeutics, Inc. | Low dose no donor-containing transdermal patch |
| JP5745210B2 (ja) | 2006-02-03 | 2015-07-08 | ニコックス サイエンス アイルランド | 筋ジストロフィーの治療用薬剤のニトロオキシ誘導体の使用 |
| US20070219208A1 (en) | 2006-02-27 | 2007-09-20 | Balaraman Kalyanaraman | Methods for Treating Cancer |
| US20070203242A1 (en) | 2006-02-27 | 2007-08-30 | Calwood Nutritionals, Inc. | Method for treating gastric reflux |
| US7645748B2 (en) | 2006-04-03 | 2010-01-12 | Forbes Medi-Tech Inc. | Sterol/stanol phosphorylnitroderivatives and use thereof |
| US7645749B2 (en) | 2006-04-03 | 2010-01-12 | Forbes Medi-Tech Inc. | Sterol/stanol nitroderivatives and use thereof |
| AU2007244903B2 (en) | 2006-04-24 | 2012-02-02 | The Government Of The United States Of America As Represented By The Secretary Department Of Health And Human Services | Diazeniumdiolated non-steroidal anti-inflammatory drugs, compositions thereof, and related methods |
| US8241619B2 (en) | 2006-05-15 | 2012-08-14 | Medtronic Vascular, Inc. | Hindered amine nitric oxide donating polymers for coating medical devices |
| US20080171351A1 (en) | 2006-05-22 | 2008-07-17 | University Of Notre Dame Du Lac | Probes for anionic cell surface detection |
| US8455255B2 (en) * | 2006-06-08 | 2013-06-04 | The University Of Tokushima | Method for production of novel nano silica particle and use of the nano silica particle |
| US20090263416A1 (en) | 2006-06-16 | 2009-10-22 | Dawson Karl A | Reduction of antibiotic resistance in bacteria |
| WO2007149520A2 (en) | 2006-06-21 | 2007-12-27 | Albert Einstein College Of Medicine Of Yeshiva University | Compositions for sustained release of nitric oxide, methods of preparing same and uses thereof |
| US20080025972A1 (en) | 2006-07-26 | 2008-01-31 | Duke University | Treating sex steriod responsive disorders |
| EP2051935B1 (en) | 2006-07-26 | 2016-09-07 | STMicroelectronics Srl | Use of nitroaniline derivatives for the production of nitric oxide |
| GB0616350D0 (en) | 2006-08-17 | 2006-09-27 | Univ St Andrews | Adsorption and release of nitric oxide in metal organic frameworks |
| EP1895012A1 (en) | 2006-08-30 | 2008-03-05 | Universitätsklinikum Freiburg | Method for inducing tumor apoptosis by increasing nitric oxide levels |
| GB0618711D0 (en) | 2006-09-22 | 2006-11-01 | Univ Exeter | Agricultural treatment |
| GB0623531D0 (en) | 2006-11-25 | 2007-01-03 | Univ St Andrews | Nitric oxide storage and production |
| US8221690B2 (en) | 2007-10-30 | 2012-07-17 | The Invention Science Fund I, Llc | Systems and devices that utilize photolyzable nitric oxide donors |
| US7862598B2 (en) | 2007-10-30 | 2011-01-04 | The Invention Science Fund I, Llc | Devices and systems that deliver nitric oxide |
| US8642093B2 (en) | 2007-10-30 | 2014-02-04 | The Invention Science Fund I, Llc | Methods and systems for use of photolyzable nitric oxide donors |
| US20090110933A1 (en) | 2007-10-30 | 2009-04-30 | Searete Llc, A Limited Liability Corporation Of The State Of Delaware | Systems and devices related to nitric oxide releasing materials |
| US20090112197A1 (en) | 2007-10-30 | 2009-04-30 | Searete Llc | Devices configured to facilitate release of nitric oxide |
| US20080175881A1 (en) | 2007-01-18 | 2008-07-24 | Boston Scientific Scimed, Inc. | Blood-contacting medical devices for the release of nitric oxide and anti-restenotic agents |
| WO2008094275A1 (en) | 2007-01-30 | 2008-08-07 | New York University | Peptides for treatment of conditions associated with nitric oxide |
| CA2677387C (en) | 2007-02-05 | 2016-06-21 | Nicox S.A. | Nitric oxide donor compounds |
| US20080193385A1 (en) | 2007-02-08 | 2008-08-14 | Todd Maibach | Compositions and methods for treating neuropathy |
| US20080193566A1 (en) | 2007-02-09 | 2008-08-14 | Miller Christopher C | Use of high dose concentrations of gaseous nitric oxide |
| WO2008100591A2 (en) | 2007-02-14 | 2008-08-21 | The General Hospital Corporation | Modulation of nitric oxide signaling to normalize tumor vasculature |
| US7811600B2 (en) | 2007-03-08 | 2010-10-12 | Medtronic Vascular, Inc. | Nitric oxide donating medical devices and methods of making same |
| BRPI0721507A2 (pt) | 2007-03-27 | 2013-01-08 | Nolabs Ab | dispositivo de dispensaÇço de àxido nÍtrico tàpico, kit, uso de àxido nÍtrico, e, mÉtodos de dispensaÇço tàpica de àxido nÍtrico e de tratamento |
| US8598368B2 (en) | 2007-04-20 | 2013-12-03 | Duke University | Stable neutral nitric oxide source |
| WO2008150505A1 (en) | 2007-06-01 | 2008-12-11 | Amulet Pharmaceuticals, Inc. | Compounds, polymers and methods for treating gastrointestinal dysfunction |
| WO2008157393A1 (en) | 2007-06-15 | 2008-12-24 | Ikaria, Inc. | Compositions comprising sulfide alone or in combination with nitric oxide and their use to |
| US8273828B2 (en) | 2007-07-24 | 2012-09-25 | Medtronic Vascular, Inc. | Methods for introducing reactive secondary amines pendant to polymers backbones that are useful for diazeniumdiolation |
| WO2009014616A1 (en) | 2007-07-26 | 2009-01-29 | Duke University | Measuring amount of bound and combined nitric oxide in blood |
| GB0715554D0 (en) | 2007-08-09 | 2007-09-19 | Insense Ltd | Improvements relating to skin dressings |
| GB0715556D0 (en) | 2007-08-09 | 2007-09-19 | Insense Ltd | Improvements relating to skin dressings |
| CA2599082A1 (en) | 2007-08-27 | 2009-02-27 | Ping I. Lee | Supramacromolecular polymer complexes providing controlled nitric oxide release for healing wounds |
| WO2009071990A2 (en) | 2007-08-31 | 2009-06-11 | Topigen Pharmaceuticals Inc. | No-donating cordicosteroid with improved pharmacokinetic, anti-inflammatory and vasodilatory properties |
| WO2009036571A1 (en) | 2007-09-21 | 2009-03-26 | Enox Biopharma, Inc. | Antimicrobial gas-releasing ear drainage tubes |
| US8399005B2 (en) | 2007-10-12 | 2013-03-19 | University Of North Carolina At Chapel Hill | Use of nitric oxide to enhance the efficacy of silver and other topical wound care agents |
| US7897399B2 (en) | 2007-10-30 | 2011-03-01 | The Invention Science Fund I, Llc | Nitric oxide sensors and systems |
| US8877508B2 (en) | 2007-10-30 | 2014-11-04 | The Invention Science Fund I, Llc | Devices and systems that deliver nitric oxide |
| US20090112193A1 (en) | 2007-10-30 | 2009-04-30 | Searete Llc, A Limited Liability Corporation Of The State Of Delaware | Systems and devices that utilize photolyzable nitric oxide donors |
| US7846400B2 (en) | 2007-10-30 | 2010-12-07 | The Invention Science Fund I, Llc | Substrates for nitric oxide releasing devices |
| US20090112055A1 (en) | 2007-10-30 | 2009-04-30 | Searete Llc, A Limited Liability Corporation Of The State Of Delaware | Sleeves configured to facilitate release of nitric oxide |
| WO2009064861A2 (en) | 2007-11-13 | 2009-05-22 | The United States Of America, As Represented By The Secretary, Department Of Health And Human Services | Nitric oxide-releasing diazeniumdiolated polymers, compositions, medical devices, and uses thereof |
| WO2009073643A2 (en) | 2007-12-03 | 2009-06-11 | Cleveland State University | Nitric oxide release coatings incorporating nitric oxide synthase enzyme |
| JP5709292B2 (ja) * | 2007-12-06 | 2015-04-30 | 国立大学法人徳島大学 | ナノ機能性シリカ粒子およびその製造方法 |
| BRPI0705396B1 (pt) | 2007-12-12 | 2021-10-05 | Universidade Estadual De Campinas - Unicamp | Compostos derivados ftalimídicos |
| IE20070934A1 (en) | 2007-12-21 | 2009-06-24 | Trinity College Dublin | Efficient aspirin prodrugs |
| AU2008345034A1 (en) | 2007-12-27 | 2009-07-09 | Aires Pharmaceuticals, Inc. | Aerosolized nitrite and nitric oxide - donating compounds and uses thereof |
| CA2994586C (en) | 2008-01-04 | 2020-07-21 | Nestec S.A. | Compositions comprising unsaturated fatty acids and nitric oxide releasing compounds and use thereof for enhancing cognitive and related functions |
| US8720436B2 (en) | 2008-01-31 | 2014-05-13 | Genosys, Inc. | Nitric oxide gel apparatus and method |
| JP5623916B2 (ja) | 2008-01-31 | 2014-11-12 | バンダービルト・ユニバーシティVanderbilt University | 動脈瘤性くも膜下出血及び血管痙攣に対する医薬組成物 |
| WO2009098113A1 (en) | 2008-02-07 | 2009-08-13 | Nicox S.A. | Nitric oxide donor compounds |
| US20090222088A1 (en) | 2008-02-29 | 2009-09-03 | Medtronic Vascular, Inc. | Secondary Amine Containing Nitric Oxide Releasing Polymer Composition |
| US20090232863A1 (en) | 2008-03-17 | 2009-09-17 | Medtronic Vascular, Inc. | Biodegradable Carbon Diazeniumdiolate Based Nitric Oxide Donating Polymers |
| US20090232868A1 (en) | 2008-03-17 | 2009-09-17 | Medtronic Vascular, Inc. | Nitric Oxide Releasing Polymer Composition |
| WO2009124379A1 (en) | 2008-04-09 | 2009-10-15 | Enox Biopharma, Inc. | Biofilm-inhibiting catheters and tubings |
| JP2011518222A (ja) | 2008-04-21 | 2011-06-23 | スリーエム イノベイティブ プロパティズ カンパニー | 酸化窒素放出組成物、デバイス、及び方法 |
| WO2009155690A1 (en) | 2008-06-24 | 2009-12-30 | Micropharma Limited | Nitric oxide compositions and devices and methods for cosmesis |
| US8852640B2 (en) | 2008-07-03 | 2014-10-07 | Ecole Polytechnique Federale De Lausanne (Epfl) | Micelles for delivery of nitric oxide |
| US20100040703A1 (en) | 2008-08-13 | 2010-02-18 | Chris Miller | Use of nitric oxide |
| JP5495337B2 (ja) | 2008-09-19 | 2014-05-21 | ノースウエスタン ユニバーシティ | 生分解性一酸化窒素発生ポリマー及び関連医用デバイス |
| US7807716B2 (en) | 2008-09-24 | 2010-10-05 | Oral Delivery Technology Ltd. | Nitric oxide amino acid ester compound, compositions for increasing nitric oxide levels and method of use |
| US20100086530A1 (en) | 2008-10-06 | 2010-04-08 | Martinov Norman P | Cancer-tumor necrosis by artery nutrient-oxygen blocking |
| CA2740421C (en) | 2008-10-15 | 2018-08-28 | The University Of Memphis Research Foundation | Method and device for detection of bioavailable drug concentration in a fluid sample |
| US20120003293A1 (en) | 2008-10-30 | 2012-01-05 | Chris Miller | Nitric oxide-releasing dressings |
| US20100166603A1 (en) | 2008-10-31 | 2010-07-01 | Noxilizer, Inc. | Powder Sterilization |
| US8158187B2 (en) | 2008-12-19 | 2012-04-17 | Medtronic Vascular, Inc. | Dry diazeniumdiolation methods for producing nitric oxide releasing medical devices |
| US20100197702A1 (en) | 2009-02-04 | 2010-08-05 | Hellberg Mark R | Ophthalmic composition with nitric oxide donor compound and method of forming and using same |
| US8062653B2 (en) | 2009-02-18 | 2011-11-22 | Bezwada Biomedical, Llc | Controlled release of nitric oxide and drugs from functionalized macromers and oligomers |
| EP2398761A4 (en) | 2009-02-18 | 2015-11-04 | Bezwada Biomedical Llc | CONTROLLED RELEASE OF NITRIC OXIDE AND MEDICINES FROM FUNCTIONALIZED MACROMERS AND OLIGOMERS |
| US9216198B2 (en) | 2009-03-30 | 2015-12-22 | The Board Of Regents, The University Of Texas System | Compositions and medical devices for controlled release of nitric oxide and methods of production thereof |
| US8236341B2 (en) | 2009-04-02 | 2012-08-07 | Medtronic Vascular, Inc. | Poly(tetrafluoroethylene) polymer with nitric oxide donating surface |
| US8709465B2 (en) | 2009-04-13 | 2014-04-29 | Medtronic Vascular, Inc. | Diazeniumdiolated phosphorylcholine polymers for nitric oxide release |
| EP2445508B1 (en) | 2009-06-22 | 2018-11-14 | VERO Biotech LLC | Nitric oxide therapies |
| US20110059189A1 (en) | 2009-09-08 | 2011-03-10 | Cisne Enterprises Inc. | Method and composition for treating cancer, effecting apoptosis and treating retroviral infections |
| ES2695173T3 (es) | 2011-02-28 | 2019-01-02 | Novan Inc | Partículas de sílice modificadas con S-nitrosotiol que liberan óxido nítrico y procedimientos de fabricación de las mismas |
-
2012
- 2012-02-28 ES ES12752627T patent/ES2695173T3/es active Active
- 2012-02-28 WO PCT/US2012/026972 patent/WO2012118829A2/en active Application Filing
- 2012-02-28 EP EP12752627.5A patent/EP2681286B1/en active Active
- 2012-02-28 WO PCT/US2012/026960 patent/WO2012118819A2/en active Application Filing
-
2013
- 2013-08-26 US US13/975,930 patent/US9713652B2/en active Active
- 2013-08-26 US US13/975,995 patent/US8981139B2/en active Active
Also Published As
| Publication number | Publication date |
|---|---|
| US8981139B2 (en) | 2015-03-17 |
| EP2681286A4 (en) | 2015-08-05 |
| WO2012118829A3 (en) | 2014-04-17 |
| WO2012118819A3 (en) | 2014-04-17 |
| US20130344334A1 (en) | 2013-12-26 |
| US9713652B2 (en) | 2017-07-25 |
| EP2681286A2 (en) | 2014-01-08 |
| EP2681286B1 (en) | 2018-08-15 |
| US20140017121A1 (en) | 2014-01-16 |
| WO2012118819A2 (en) | 2012-09-07 |
| WO2012118829A2 (en) | 2012-09-07 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| ES2695173T3 (es) | Partículas de sílice modificadas con S-nitrosotiol que liberan óxido nítrico y procedimientos de fabricación de las mismas | |
| Shin et al. | Inorganic/organic hybrid silica nanoparticles as a nitric oxide delivery scaffold | |
| Möller et al. | Degradable drug carriers: Vanishing mesoporous silica nanoparticles | |
| US10435357B2 (en) | Tunable nitric oxide-releasing macromolecules having multiple nitric oxide donor structures | |
| ES2824532T3 (es) | Método de producción de partículas de sílice mesoporosas que liberan no mediante una reacción de intercambio iónico aminosilano-tensioactivo | |
| Riccio et al. | Nitric oxide release: Part I. Macromolecular scaffolds | |
| Shin et al. | Synthesis of nitric oxide-releasing silica nanoparticles | |
| ES2700870T3 (es) | Nanopartículas de sílice fluorescentes mejoradas a través de densificación de sílice | |
| ES2596170T3 (es) | Método para producir polirotaxano refinado | |
| John et al. | First step towards a model system of the drug delivery network based on amide-POSS nanocarriers | |
| Krings et al. | Light-responsive aggregation of β-cyclodextrin covered silica nanoparticles | |
| Chatterjee et al. | Tuning of the morphology of a riboflavin–melamine equimolar supramolecular assembly by in situ silver nanoparticle formation | |
| Cao et al. | Fabrication of autofluorescent porous silica nanoparticles for redox-responsive drug release | |
| ES2677593T3 (es) | Proceso para la preparación de sílices precipitadas, sílices precipitadas y sus usos, en particular para el refuerzo de polímeros | |
| Ghalei et al. | Nitric oxide releasing halloysite nanotubes for biomedical applications | |
| Chang et al. | Nitric oxide-releasing S-nitrosothiol-modified silica/chitosan core–shell nanoparticles | |
| CN111388747B (zh) | 一种多功能无机纳米胶水及其制备方法 | |
| US8975358B2 (en) | Compositions and methods for synthesis of organic-silica hybrid materials | |
| Pereira et al. | Novel highly luminescent amine-functionalized bridged silsesquioxanes | |
| JP5486750B2 (ja) | 金微粒子被覆体とその製造方法、およびその用途 | |
| Smet et al. | Double-four-ring [Si8O12][OH] 8 cyclosilicate and functionalized spherosilicate synthesis from [N (n-C4H9) 4] H7 [Si8O20]· 5.33 H2O cyclosilicate hydrate crystals | |
| Yang et al. | S-Nitrosothiol-modified hyperbranched polyesters | |
| JP2013185070A (ja) | パーフルオロカーボンスルホン酸ポリマー含有ナノコンポジット粒子及びその製造方法 | |
| CN111603570B (zh) | 一种碳点修饰的中空型共聚物纳米粒子及制备方法和应用、药物递送系统及应用 | |
| JP5427329B2 (ja) | 金微粒子とその製造方法 |